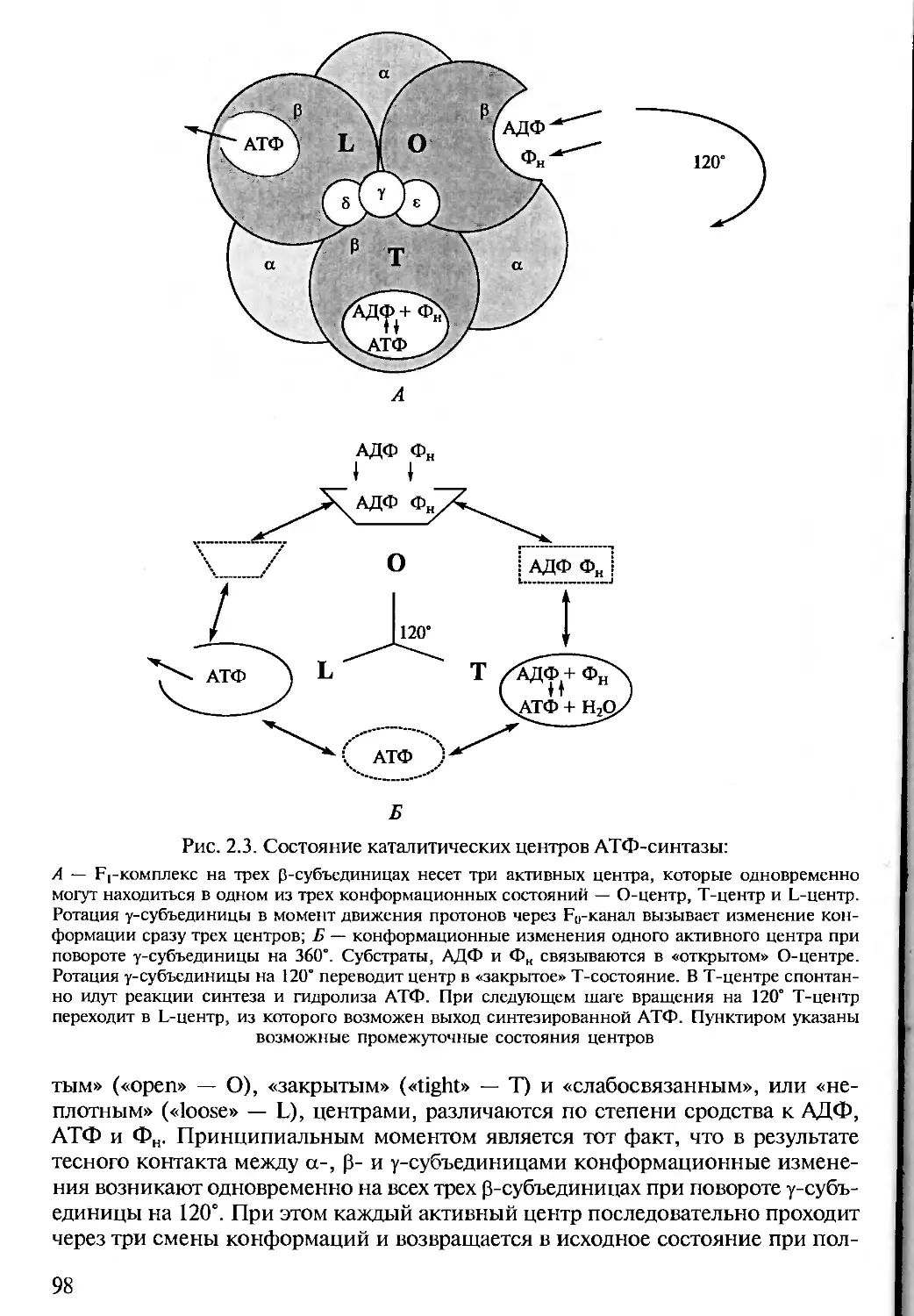
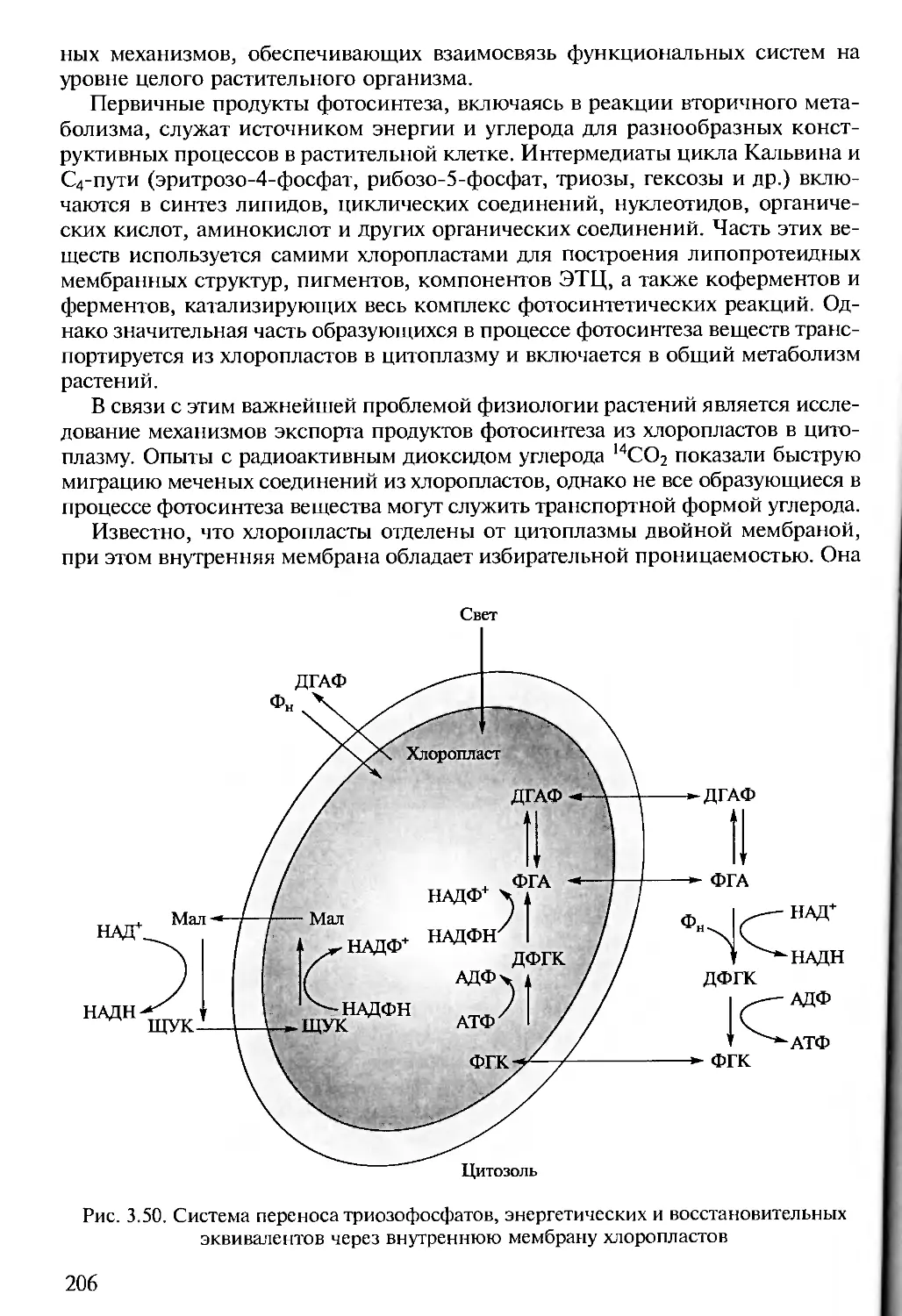
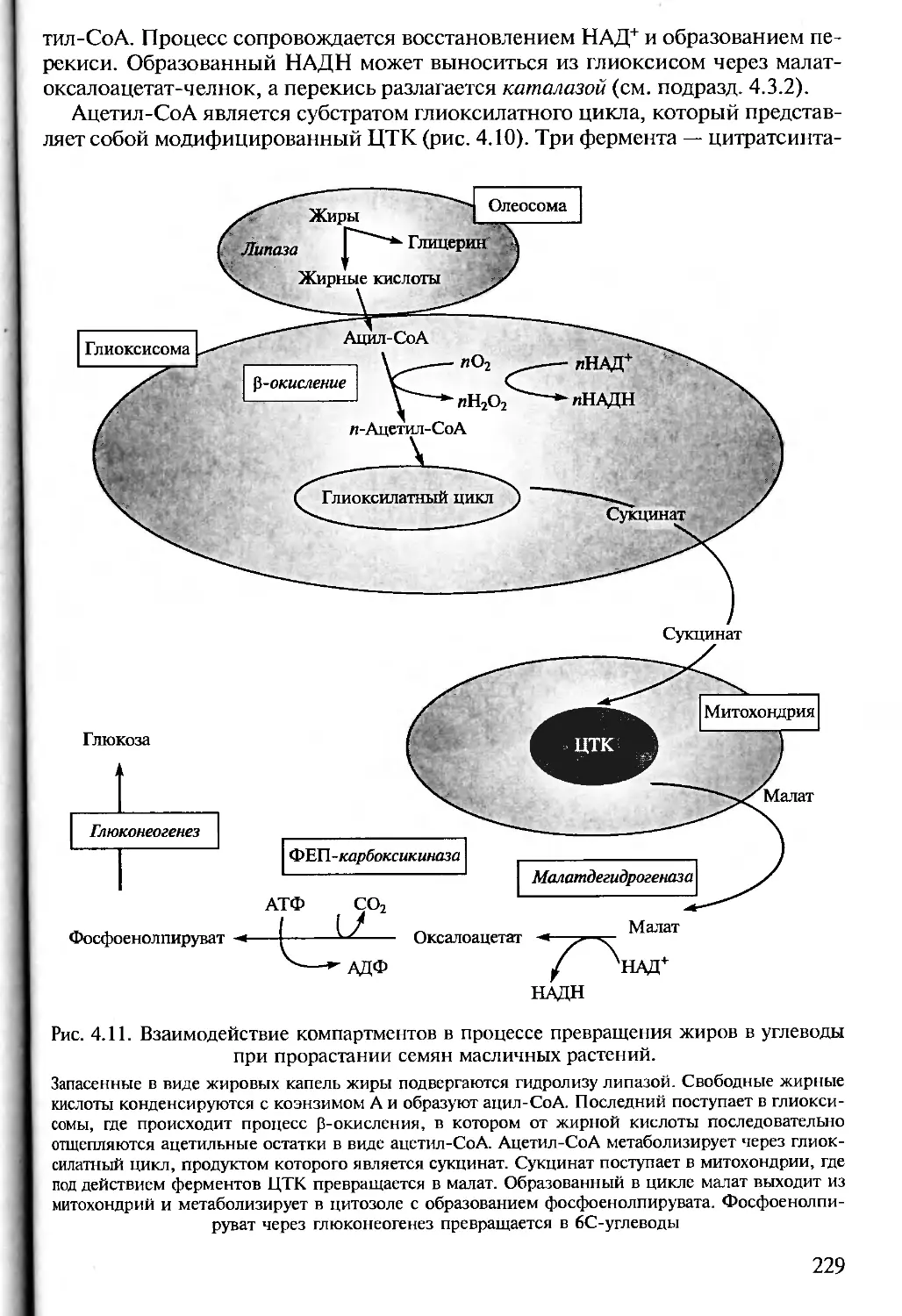
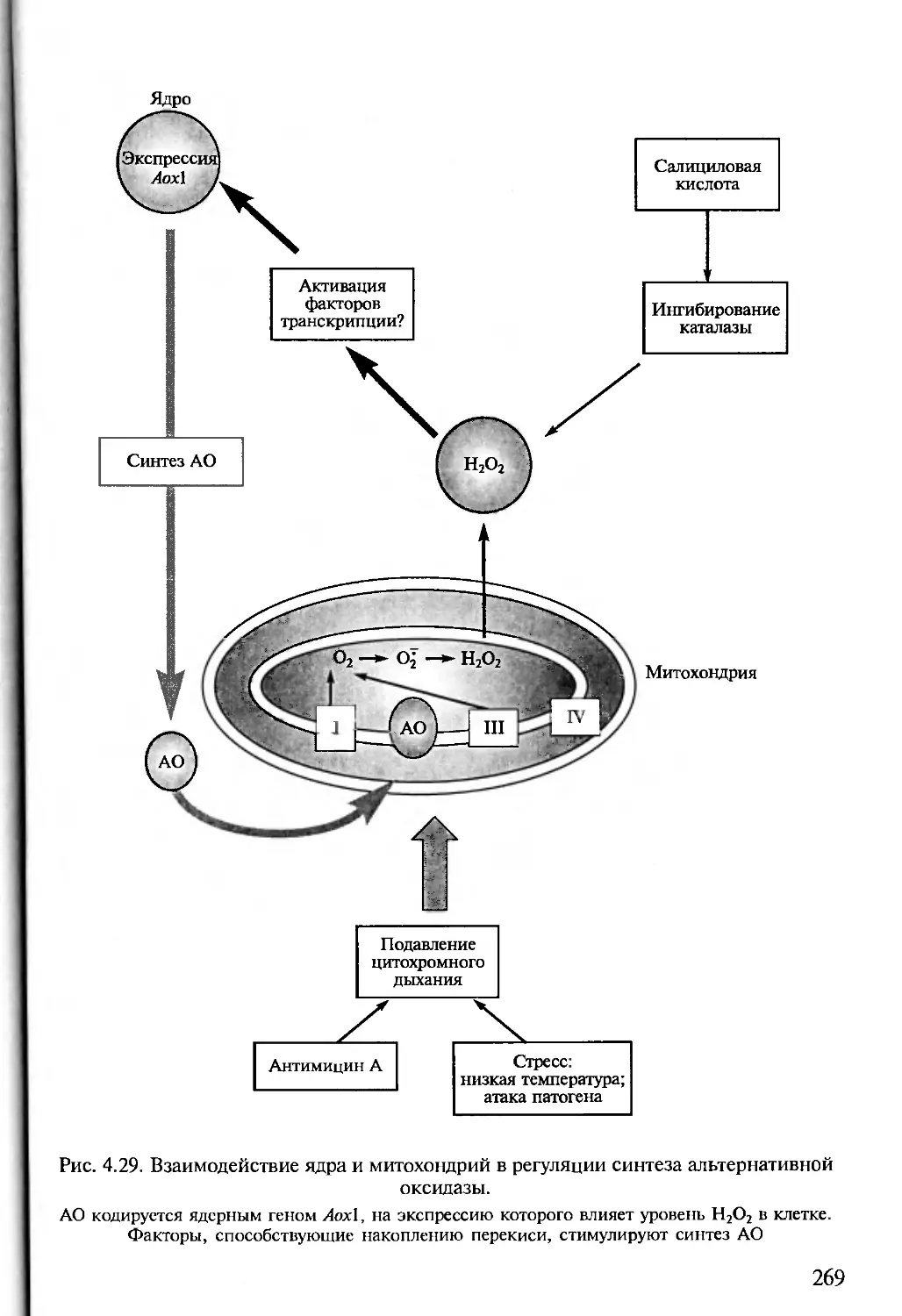
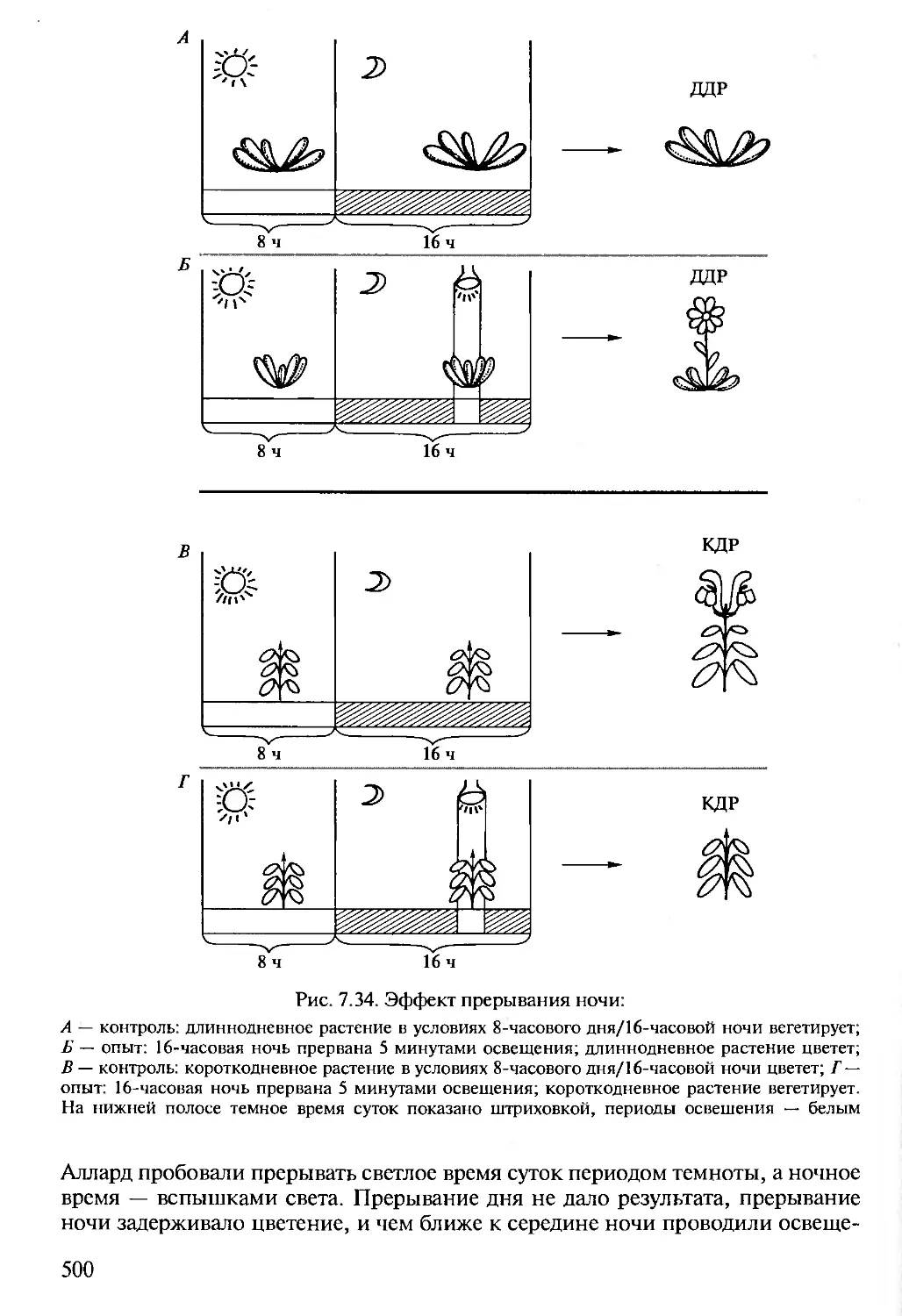
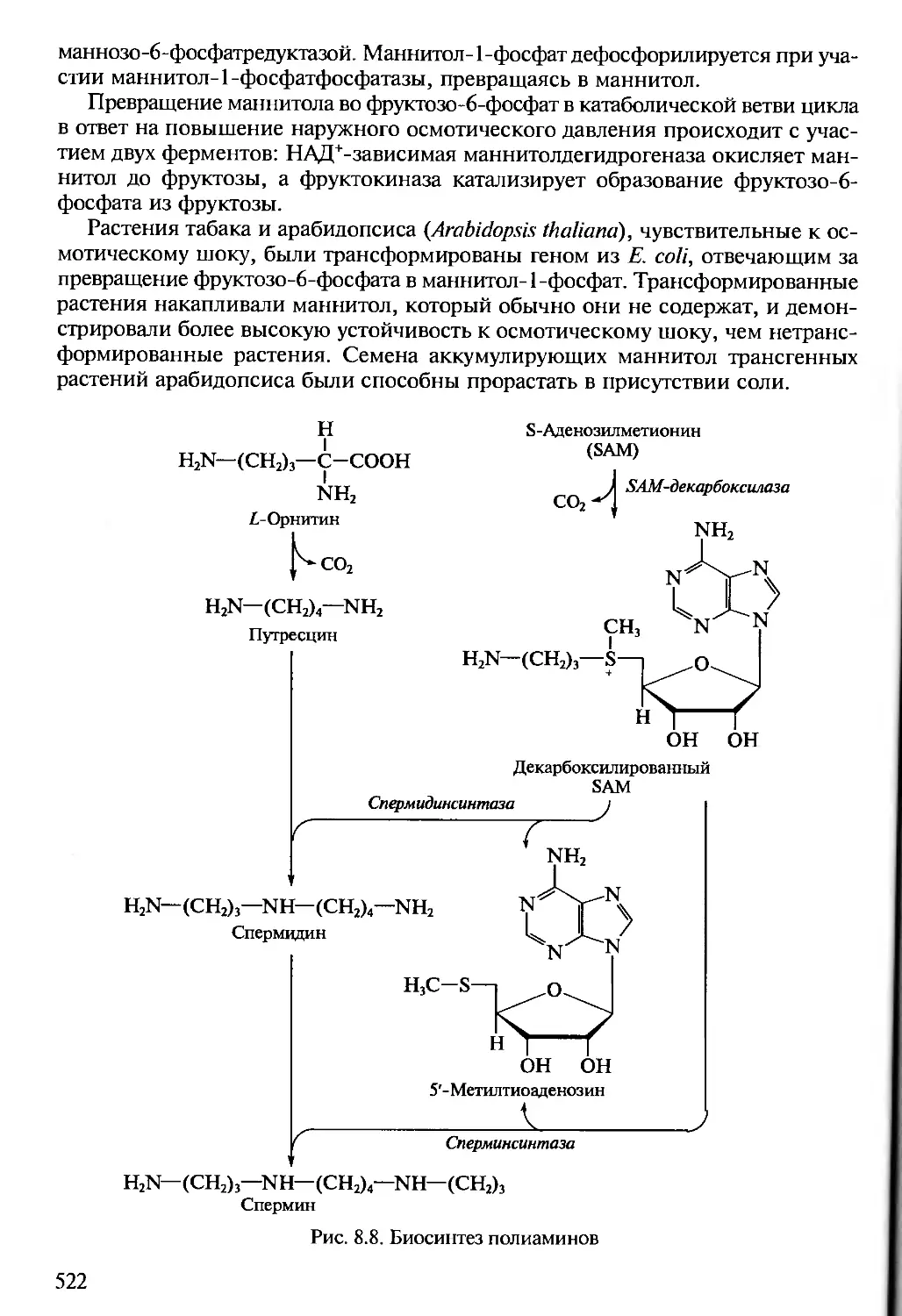
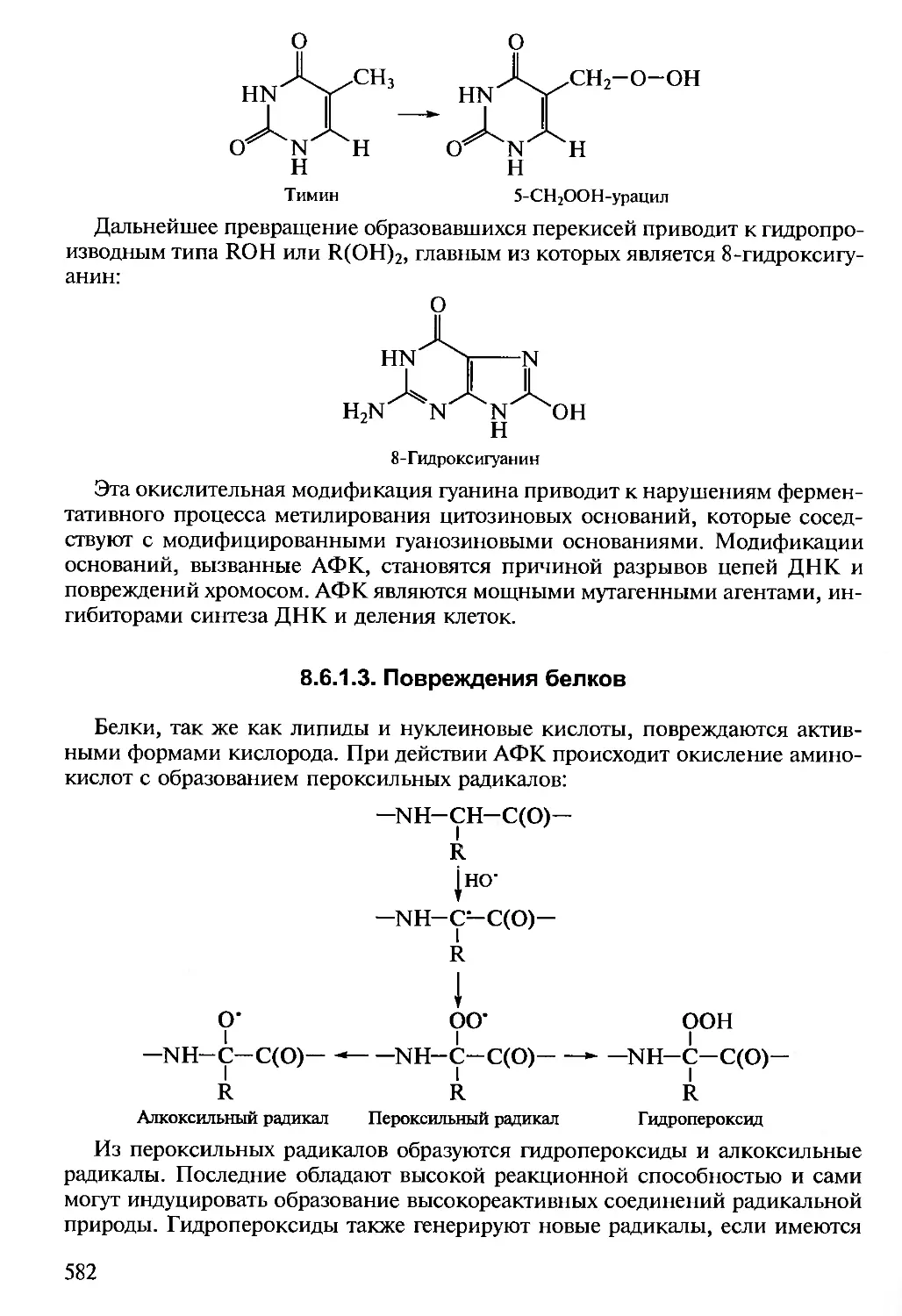
Author: Алехина Н.Д. Балнокин Ю.В. Гавриленко В.Ф. Жигалова Т.В.
Tags: физиология растений ботаника растения
ISBN: 5-7695-1669-0
Year: 2005
Text
Высшее профессиональное образование
я
Я
Я'
я
я
§
о
я
to
ВЫСШЕЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ
ФИЗИОЛОГИЯ
РАСТЕНИЙ
Под редакцией проф. И. П. ЕРМАКОВА
Допущено
Министерством образования Российской Федерации в качестве
учебника для студентов высших учебных заведений, обучающихся
по биологическим специальностям и направлению 510600 «Биология»
Москва
ACADEMA
2005
УДК 581.1(075.8)
ББК 28.57я73
Ф504
Авторы:
Н.Д.Алехина, Ю.В.Балнокин. В. Ф. Гавриленко, Т. В.Жигалова, Н.Р.Мейчик,
А. М. Носов, О. Г. Полесская, Е. В.Харитонашвили, В. В. Чуб
Рецензенты:
проф. В. В. Кузнецов (зав. кафедрой ботаники, физиологии растений
и агробиотехнологии Университета дружбы народов);
проф. С. С. Медведев (зав. кафедрой физиологии и биохимии растений
Санкт-Петербургского государственного университета)
Физиология растений: Учебник для студ. вузов / Н.Д.Алехина,
Ф504 Ю. В. Балнокин, В. Ф. Гавриленко и др.; Под ред. И. П. Ермакова. —
М.: Издательский центр «Академия», 2005. — 640 с.
ISBN 5-7695-1669-0
В учебнике на современном уровне дано описание физиологических функций и
механизмов их регуляции в онтогенезе целого растения и его взаимодействии с
факторами среды. Изложены особенности строения и работы растительной клетки,
обсуждены вопросы регуляции поступления и реализации функций элементов
минерального питания на разных уровнях структурной организации растений.
Рассмотрены физико-химические закономерности формирования движущих сил и
механизмы транспорта воды в растении. Рост и развитие растений представлены с
позиций современной физиологии, молекулярной биологии и генетики.
Для студентов биологических специальностей вузов. Может быть полезен
специалистам, работающим в различных областях экспериментальной ботаники.
УДК 581.1(075.8)
ББК 28.57я73
Оригинал-макет данного издания является собственностью
Издательского центра «Академия», и его воспроизведение любым способом
без согласия правообладателя запрещается
ISBN 5-7695-1669-0
© Коллектив авторов, 2005
© Издательский центр «Академия», 2005
СПИСОК СОКРАЩЕНИЙ
АБК
АГ
АДГ
АДФ
АЛК
АМФ
цАМФ
АТФ
АТФаза
Н+АТФаза
АФК
АФС
АЦК
БТШ
ГДГ
ГДФ
ГТФ
ГК
ГК3
ГОГАТ
ГС
ГБТ
ДГАФ(ФДА)
ДНК
кДНК
мДНК
плДНК
ИМК
ИПВК
ИУК
КаМ
КС/ДКС
КС
КсЭТ
КоА
KoQ
KoQH2
АВА
AG
ADH
ADP
SAIA
AMP
cAMP
ATP
ATPase
H+ATPase
AOS
APS
ACC
HSP
GDG
GDP
GTP
GA
GA3
GOGAT
GS
GST
DHAP
DNA
cDNA
mDNA
plDNA
IBA
IPA
IAA
СаМ
Red/Far red
CW
ХЕТ
СоА
Q(CoQ)
QH2(CoQH2) — убихинон (кофермент Q) восстановленный
— абсцизовая кислота
— аппарат (комплекс) Гольджи
— алкогольдегидрогеназа
— аденозин-5'-дифосфат
— 6-аминолевулиновая кислота
— аденозин-5'-монофосфат
— цикло-аденозин-3',5'-монофосфат
— аденозин-5'-трифосфат
— аденозинтрифосфатаза
— Н+аденозинтрифосфатаза (протонная помпа)
— активные формы кислорода
— аденозин-5'-фосфосульфат
— 1-аминоциклопропан-1-карбоновая кислота
— белки теплового шока
— глутаматдегидрогеназа
— гуанозин-5'-дифосфат
— гуанозин-5'-трифосфат
— гиббереллин
— гибберелловая кислота
— глутамин: оксоглутарат аминотрансфераза
(глутаматсинтаза)
— глутаминсинтаза
— глютатион-S -трансфераза
— дигидроксиацетонфосфат
— дезоксирибонуклеиновая кислота
— клонированная дезоксирибонуклеиновая кислота
— митохондриальная дезоксирибонуклеиновая
кислота
— пластидная дезоксирибонуклеиновая кислота
— индолилмасляная кислота
— индолилпировиноградая кислота
— индолил-3-уксусная кислота
— кальмодулин
— красный свет/дальний красный свет
— клеточная стенка
— ксилоглюкан-эндотрансгликозилаза
— кофермент А (Коэнзим А)
— убихинон (кофермент Q) окисленный
3
лдг МАП МАПК мдг НАД+ НАДН LDH МАР МАРК MDH NAD+ NADH
НАДФ+ NADP+
НАДФН NADPH
НиР NiR
HP NR
НУК NAA
ПВК pyruvate
ПМ PM
ПОЛ POL
пх PQ
пхн2 pqh2
РНК RNA
мРНК mPNA
рРНК rRNA
тРНК tRNA
РуБФ RuBP
РуБФК Rubisco
(Рубиско)
сод SOD
ССК LHC
ТПФ TPP
УДФ UDP
УТФ UTP
Ф(А) PhyA
ФАД FAD
фадн2 fadh2
ФАЛ PAL
ФАФ PAP
ФАФС PAPS
Ф(В) Phy(B)
ФД Fd
Фдкр Phyfr
Фео Pheo
ФЕП PEP
ФЕПК PE PC
Фкр Phyr
— лактатдегидрогеназа
— митоген-активированная протеинкиназа
— митоген-активируемая протеинкиназа
— малатдегидрогеназа
— никотинамидадениндинуклеотид окисленный
— никотинамидадениндинуклеотид восстановлен-
ный
— никотинамидадениндинуклеотидфосфат окис-
ленный
— никотинамидадениндинуклеотидфосфат вос-
становленный
— нитритредуктаза
— нитратредуктаза
— а-нафтилуксусная кислота
— пировиноградная кислота
— плазматическая мембрана
— перекисное окисление липидов
— пластохинон окисленный
— пластохинон восстановленный (пластохинол)
— рибонуклеиновая кислота
— матричная (информационная) рибонуклеино-
вая кислота
— рибосомальная рибонуклеиновая кислота
— транспортная рибонуклеиновая кислота
— рибулозо-1,5-бисфосфат
— рибулозо-1,5-бисфосфаткарбоксилаза/оксиге-
наза
— супероксиддисмутаза
— светособираюший комплекс
— тиаминпирофосфат
— уридин-5'-дифосфат
— уридин-5'-трифосфосфат
— фитохром А
— флавинадениндинуклеотид окисленный
— флавинадениндинуклеотид восстановленный
— фенилаланинаммиаклиаза
— 3'-фосфоаденозин-5'-фосфата
— 3'-фосфоаденозин-5'-фосфосульфат
— фитохром В
— ферредоксин
— форма фитохрома с максимумом поглощения
в дальней красной области
— феофитин
— фосфоенолпировиноградная кислота (фосфо-
енолпируват)
— фосфоенолпируват-карбоксилаза
— форма фитохрома с максимумом поглощения
в красной области
4
ФМН FMN — флавинмононуклеотид окисленный
ФМНН2 fmnh2 — флавинмононуклеотид восстановленный
Фн Pi — фосфат неорганический
ФС1 PSI — фотосистема I
ФСП PSII — фотосистема II
ФФн PPi — пирофосфат
Хл Chi — хлорофилл
Хл* Chi* — возбужденный хлорофилл
Хл+ Chl+ — катион-радикал хлорофилла
цтк TCA-cycle — цикл трикарбоновых кислот
ЭДТА EDTA — этилендиаминтетрауксусная кислота
ЭР ER — эндоплазматический ретикулум
ЭТЦ ETC — электрон-транспортная цепь
ЯМР NMR — ядерный магнитный резонанс
ФИЗИКО-ХИМИЧЕСКИЕ КОНСТАНТЫ
И ПОКАЗАТЕЛИ (ПАРАМЕТРЫ)
Е — окислительно-восстановительный потенциал
Е°' — стандартный окислительно-восстановительный потенциал при pH 7,0
F — постоянная Фарадея
A G — изменение свободной энергии
AG° — стандартное изменение свободной энергии
h — постоянная Планка
Кт — константа Михаэлиса —Ментен
Ка — константа диссоциации кислоты
рЛГд — отрицательный логарифм
Дрн+ — трансмембранный градиент электрохимического потенциала ионов
водорода
Na — число Авогадро
^н2о — водный потенциал
ПРЕДИСЛОВИЕ
Физиология растений — раздел ботаники, который занимается изучением
метаболических систем, составляющих основу жизнедеятельности раститель-
ного организма и обеспечивающих его существование в разнообразных усло-
виях среды. Такие метаболические системы находятся в сложных взаимоотно-
шениях друг с другом. Изучение координации функционирования этих систем
во времени и пространстве составляет важную цель физиологии — познание
закономерностей жизнедеятельности растений, раскрытие биохимических,
молекулярных и генетических основ взаимозависимости сложных функций и
механизмов их регуляции в системе целого организма.
Объект физиологии растений — эукариотный организм, осуществляющий
фототрофный образ жизни. Полнота знаний о нем может быть достигнута при
сочетании исследования на различных уровнях организации системы — суб-
клеточном, клеточном, организменном, биоценотическом. Разработанные в
последние годы методические подходы позволили значительно продвинуться
в понимании принципов функционирования организма как целостной систе-
мы. Важные результаты достигнуты и в понимании структуры генома, поли-
морфизма растительной ДНК, процессов модификации ДНК и их влияния на
экспрессию ядерных генов, вскрыты многие особенности регуляции экспрес-
сии ядерных генов, а также координации регуляторных систем трех генетиче-
ски автономных компартментов растительной клетки — ядерного, пластидно-
го и митохондриального.
Успехи в познании особенностей строения и работы растительной клетки,
уникальных свойств, определяемых функциями клеточной оболочки, совмест-
ной работой трех геномов, строением множественных мембранных систем,
свойствами транспортных и сигнальных механизмов, позволили многое по-
нять в организации ее онтогенеза и стали предпосылкой для разработки био-
технологических приемов управления программами развития клетки.
Обменные реакции в организме требуют значительных затрат энергии, ис-
точником которой служат универсальные для клеток бактерий, хлоропластов
и митохондрий растений и животных процессы трансформации энергии. Во
всех этих системах световая энергия или энергия окисляемых субстратов ис-
пользуются для организации электронного транспорта в мембране, сопряжен-
ного с созданием протонного градиента, который используется для синтеза
молекул АТФ.
В связи с этим важно понять общие принципы организации электрон-транс-
портных цепей в сопрягающих мембранах и дать характеристику основным
компонентам, участвующим в переносе электрона. Специфические черты ды-
хательного метаболизма растительной клетки, в том числе связанные с нали-
чием альтернативных ферментов и действием альтернативных метаболических
6
путей, обеспечивают большую гибкость и пластичность метаболизма расти-
тельного организма при частой смене окружающих условий. Вопросы метабо-
лизма, напрямую не связанные с дыханием, но протекающие с участием мо-
лекулярного кислорода, а также проблема взаимодействия клетки с актив-
ными формами кислорода и данные, свидетельствующие о сигнальной роли
активных форм кислорода, составляют важный раздел стресс-физиологии ра-
стений.
Особую роль в жизни растительного организма играют взаимодействия ми-
тохондрий и хлоропластов, во время которых между ними устанавливаются
системы прямых и обратных связей, имеющих существенное значение в под-
держании клетки как целостной функциональной единицы, гибко приспосаб-
ливающей интенсивность дыхания к действию различных эндогенных и экзо-
генных факторов.
Для понимания сущности процессов жизнедеятельности растения важней-
шей задачей является изучение современных представлений относительно фо-
тосинтеза как физиологической функции, составляющей основу биоэнерге-
тики.
В последние годы ученые, используя новейшие физико-химические техни-
ки и принципы, серьезно исследуют основные фундаментальные процессы
фотосинтеза: структурно-функциональную организацию фотосинтетического
аппарата, молекулярную структуру и физико-химические свойства пигмент-
ных систем, механизмы первичных процессов преобразования энергии, струк-
туру и функционирование реакционных центров.
Детально изучены природа компонентов и организация основных функцио-
нальных комплексов электрон-транспортной цепи, физиологические механизмы
регуляции транспорта электронов, проведен анализ основных путей фотоасси-
миляции углекислоты и фотосинтетического метаболизма углерода у разных
групп растений, исследованы вопросы энергетики фотосинтеза и значение
фотоэнергетических реакций в регуляции активности всего комплекса метабо-
лических систем в растении, рассмотрены механизмы эндогенной регуляции
фотосинтеза на уровне целого растения, физиологические основы действия
внешних факторов, вопросы фотоингибирования, взаимосвязь фотосинтеза с
дыханием, минеральным питанием, ростом и другими физиологическими
функциями, проблема фотосинтетической продуктивности растений. Важней-
ший результат этих разносторонних исследований — переоценка общих масш-
табов фотосинтетической деятельности в биосфере в прошлом и настоящем, а
также прогноз ее состояния в ближайшие периоды как функции антропоген-
ного воздействия.
Растения являются компонентами биосферы, которые выполняют огром-
ную геохимическую работу, обусловленную прежде всего их способом мине-
рального питания и водообмена.
За последние 10 лет представления о поступлении ионов и воды в растение
существенно изменились, значительно расширились знания о функциях эле-
ментов минерального питания.
Большой комплекс работ по механизмам поступления ионов и воды в апоп-
ласт, по системам их транспорта через мембраны, изучение транспорта веществ
на ближние и дальние расстояния и их круговорота по растению позволили по-
нять роль этих процессов в формировании функционально целостной системы.
7
Наряду с генной и метаболитной (биохимической) регуляцией исследуется
феномен компартментации ионов как способ пространственно-временной ре-
гуляции процессов поступления и включения элементов минерального пита-
ния в метаболизм. Новые данные о функциях элементов минерального пита-
ния, о взаимосвязи процессов минерального питания с водообменом, фото-
синтезом и дыханием в онтогенезе, о механизмах регуляции поступления и
реализации функций элементов минерального питания на разных уровнях струк-
турной организации растений составляют бурно развивающуюся область фи-
зиологии растений, тесно связанную с прикладными аспектами агрохимии.
Функции водного обмена нельзя рассматривать без связи с особенностями
молекулярного строения воды и ее физико-химических свойств. Движущие силы
и механизмы транспорта воды на клеточном уровне и уровне целого растения —
предмет новых исследований, которые позволили вскрыть количественные
зависимости потока воды от гидравлической проводимости системы, опреде-
ляемой как молекулярными, так и анатомическими особенностями корневой
системы. Последние характеризуют водный обмен у высших растений различ-
ных экологических групп. Значительный интерес для понимания механизмов
устойчивости растений к неблагоприятным условиям водообеспечения пред-
ставляют сведения о водных каналах мембран и белках водных каналов — аква-
поринах, которые выступают в качестве систем регуляции гидравлической
проводимости мембран.
Рост и развитие растений выступают как интегральные физиологические
функции, в которых через сложные системы метаболических взаимодей-
ствий и регуляторных систем раскрываются генетические возможности орга-
низма, обеспечивающие адаптивный и репродуктивный потенциал вида. Со-
временное состояние раздела физиологии растений, описывающего законо-
мерности роста и развития, демонстрирует мощь интегративного подхода,
основанного на сочетании методов классической физиологии, физиологиче-
ской и молекулярной генетики, молекулярной биологии, биохимии, цитоло-
гии и др.
Изучение принципов гормональной регуляции роста и развития растений
составляет важнейший раздел физиологии как в фундаментальном, так и в
прикладном смысле: общие принципы гормональной регуляции, представле-
ние о гормон-рецепторных отношениях, о вторичных мессенджерах и об отве-
тах на уровне мембран, генома, целой клетки, органа и целого растения, спе-
цифическая и неспецифическая компоненты ответа — это все существенные
звенья в понимании общих закономерностей реализации онтогенеза и его от-
носительной устойчивости.
И хотя сведения об основных группах гормонов (ауксины, цитокинины,
гиббереллины, абсцизовая кислота, этилен, брассиностероиды, жасмоновая
кислота, салицилат и другие фенольные соединения, олигосахариды) и их
биосинтезе и спектрах действия являются крайне важными для понимания
условий регулирования онтогенеза и широко используются в фундаменталь-
ных и прикладных работах, регуляция онтогенеза осуществляется также други-
ми (не химическими) системами, среди которых определяющее место, по-
видимому, принадлежит свету.
Современные данные описывают отличие фоторецепторных регуляторных
комплексов от энергопреобразующих и выделяют физиологически важные об-
8
ласти спектра: красную и синюю и, соответственно, фитохромную и крипто-
хромную системы, отвечающие за различные физиологические реакции. Одна-
ко участие света в регуляции развития у растений имеет более сложный харак-
тер, что проявляется в фотопериодизме — явлении, подробно изучавшимся
несколькими поколениями исследователей, но до сих пор остающимся не до
конца понятым.
Давно открыта связь между гормональным воздействием на растение и его
фотопериодическим ответом (так называемая гормональная теория цветения
Чайлахяна), но и сегодня работы показывают, что такая связь реализуется
через сложные многокомпонентные регуляторные системы, описанные еще
не полностью.
Жизнь растительного организма протекает в постоянном взаимодействии с
факторами внешней среды как абиотической природы (физическими, хими-
ческими), так и биотической (другими растениями, животными, микроорга-
низмами). И эти взаимодействия могут существенно модифицировать развитие
растения, ухудшать его физиологическое состояние и потенцию к воспроизве-
дению. Очевиден урон, который может понести производство, основанное на
использовании культивируемых растений. Очевидны и возможные изменения
в структуре ценозов, обусловленные гипервлиянием абиотических и биоти-
ческих факторов.
Эволюция выработала множество механизмов, которые позволяют расте-
нию преодолеть неблагоприятные воздействия и сохранить потенциал размно-
жения и распространения. Такие механизмы широко исследуются во многих
лабораториях.
Действие каждого стресс-фактора рассматривается как с позиций его по-
вреждающего эффекта, который стрессор оказывает на растение, так и с
точки зрения ответных реакций растительного организма, направленных на
формирование механизмов адаптации, которые позволяют преодолевать или
избегать неблагоприятные воздействия. Повреждающие эффекты и механиз-
мы адаптации образуют сложную систему, включающую изменения функ-
циональной организации растения от молекулярного уровня до уровня целого
организма.
Уникальной особенностью высших растений является их способность син-
тезировать огромное количество вторичных метаболитов — разнообразных, срав-
нительно низкомолекулярных соединений, обладающих, как правило, биоло-
гической активностью и обеспечивающих особый химический тип взаимодей-
ствия организмов в сообществах. Этот интереснейший аспект физиологии рас-
тений, включающий изучение фитохимии вторичных метаболитов (строе-
ние, распространение и классификация), характеристик основных классов
(алкалоиды, изопреноиды, фенольные соединения) и их минорных компо-
нентов (цианогенные гликозиды, тиогликозиды, небелковые аминокислоты,
необычные липиды, ацетиленовые соединения, растительные амины, ацето-
генины и др.), путей их биосинтеза и энзимологии, вскрывает механизмы
чрезвычайно высокой гибкости систем коммуникации, выживания и приспо-
собления растений.
Физиология вторичного метаболизма, анализ временной и пространствен-
ной организации их синтеза и накопления, а также анализ их функций в ин-
тактном растении значительно расширяют представления об адаптивных воз-
9
можностях растений и возможностях саморегуляции онтогенетических собы-
тий.
Предлагаемый вниманию читателей учебник написан профессорами и пре-
подавателями кафедры физиологии растений Московского государственного
университета им. М. В. Ломоносова. В нем на современном уровне и с использо-
ванием новейших данных изложены физиологические функции и механизмы
их интеграции и регуляции в целом растении в его онтогенезе и взаимодей-
ствии с факторами среды обитания.
И. П. Ермаков
ГЛАВА 1
РАСТИТЕЛЬНАЯ КЛЕТКА
Все живые существа состоят из клеток. Все клетки имеют много общих черт.
Они ограничены от внешней среды цитоплазматической мембраной, содержат
системы хранения и реализации генетической информации (ДНК, РНК, бе-
локсинтезирующий аппарат), системы получения и преобразования энергии
(прежде всего — синтеза и расходования АТФ), системы обеспечения клетки
необходимыми компонентами (перенос веществ в клетку и из нее), системы
восприятия внешних сигналов, их анализа и организации адекватного ответа.
В то же время клетки разных организмов, а также органов и тканей многокле-
точного организма имеют существенные различия. В последнем случае структур-
ные и функциональные особенности клеток обусловлены их специализацией
(дифференцировкой). Подобная специализация позволяет клеткам максималь-
но эффективно выполнять конкретную функцию, «заданную» организмом.
Наиболее сильно различаются клетки организмов, относящихся к разным
царствам. Подобные различия возникли в результате длительной эволюции
клеток и представляют общебиологический интерес. Все клетки живых орга-
низмов традиционно принято разделять на прокариотические и эукариотиче-
ские. Первоначально основой этого разделения послужил чисто морфологи-
ческий признак — наличие или отсутствие ядра. Однако позже выяснилось,
что различия между этими типами клеток гораздо существеннее.
1.1. ОБЩАЯ ХАРАКТЕРИСТИКА
ЭУКАРИОТИЧЕСКИХ КЛЕТОК
1.1.1. ОРГАНЕЛЛЫ ЭУКАРИОТИЧЕСКИХ КЛЕТОК
Прокариотическая клетка не имеет внутренних перегородок. Она состоит
как бы из одного отсека, отграниченного от внешней среды плазматической
мембраной. У эукариотической клетки таких отсеков несколько, т. е. эти клетки
разделены на различные, окруженные мембранами области (компартменты).
Компартменты эукариотической клетки называются органеллами. Органеллы спе-
циализируются на выполнении различных функций. Разделение клетки на ком-
партменты, возможно, является следствием больших размеров современной
эукариотической клетки: в среднем она больше бактериальной в 10 — 30 раз.
При этом принципиально важными оказываются два момента:
• увеличение объема клетки сопровождается существенно меньшим увели-
чением площади поверхности ее плазматической мембраны, тогда как именно
на мембранах протекают многие важнейшие метаболические процессы;
11
• с увеличением объема клетки затрудняется координация ее метаболиз-
ма, в частности рациональное распределение по объему множества катабо-
лических и анаболических процессов, «доставка» нужных веществ в нужное
место.
Формирование компартментов позволяет пространственно разделить «бло-
ки» метаболизма.
В цитозоле любой (не только растительной) современной эукариотической
клетки находятся следующие органеллы:
1) ядро — содержит основную часть генома и является местом синтеза ДНК
и РНК;
2) эндоплазматический ретикулум (ЭР) — место синтеза большинства ли-
пидов клетки, а также белков, предназначенных для органелл или секреции;
3) аппарат Гольджи (АГ)— место сортировки и модификации белков и ли-
пидов, получаемых от эндоплазматического ретикулума;
4) митохондрии — «энергетические станции клетки», основное место син-
теза АТФ, имеют собственный геном и белоксинтезирующую систему;
5) пероксисомы — здесь происходят многие окислительные процессы;
6) лизосомы (в растительных клетках — литические вакуоли) — место ком-
партментации литических ферментов.
Растительная клетка наряду с этими органеллами обязательно содержит:
1) пластиды — органеллы, выполняющие различные функции в зависимо-
сти от типа клетки, в которой находятся; основная функция — фотосинтез;
имеют собственный геном и белоксинтезирующую систему;
2) вакуоли — органеллы, выполняющие несколько функций, в том числе
литические (литические вакуоли) и запасающие (запасающие вакуоли).
Классификацию органелл эукариотической клетки целесообразно постро-
ить на предполагаемой схеме ее эволюции. Практически доказано, что мито-
хондрии и пластиды имеют симбиотическое происхождение, т.е. являются
потомками микроорганизмов, «захваченных» предшественником эукариотиче-
ской клетки. При этом внешняя мембрана пластид и митохондрий соответству-
ет плазматической мембране «хозяйской» клетки, внутренняя — плазматиче-
ской мембране захваченной бактерии, а строма пластид и матрикс митохонд-
рий — бактериальной цитоплазме (рис. 1.1).
Происхождение ядра менее ясно. Скорее всего, двухслойная ядерная обо-
лочка образовалась из глубокого впячивания плазматической мембраны. В ре-
зультате часть цитоплазмы оказалась изолированной от остального простран-
ства клетки. Следовательно, внутреннее пространство ядра происходит из ци-
тозоля и при определенных условиях эти пространства могут объединиться
(иногда для обозначения подобных пространств применяют математический
термин «топологически эквивалентные пространства»). Известно, что во время
митоза у высших эукариот ядерная оболочка разрушается и содержимое ядра
полностью смешивается с цитозолем. Этого не происходит ни с одной другой
мембранной органеллой.
Эндоплазматический ретикулум, аппарат Гольджи и вакуоли образовались,
по-видимому, также за счет впячивания плазматической мембраны с последу-
ющим «отшнуровыванием». Если это верно, то внутренняя поверхность мемб-
ран этих органелл должна быть топологически эквивалентна внешней поверх-
ности плазмалеммы. Это справедливо для ЭР, АГ, вакуолей и многих проме-
12
ДНК
Ядро
Наружная мембрана хлоропласта
(из мембраны «хозяина»)
Внутренняя мембрана хлоропласта
(из мембраны цианобактерии)
Тилакоид
(из мембраны цианобактерии)
Цианобактерия
Древняя
клетка-предшественник
Рис. 1.1. Схема предполагаемого эволюционного происхождения ядра и хлоропластов
(пластид):
А — происхождение ядра и ЭР; Б — происхождение пластид
«уточных везикул, участвующих в эндоцитозе, экзоцитозе и транспортных
процессах между этими органеллами.
Пероксисомы представляются «потомками» древних органелл, возникших
для защиты клеток от кислорода, накопившегося в атмосфере в результате
оксигенного фотосинтеза.
Исходя из сказанного основные внутриклеточные компартменты эукарио-
тической клетки можно разделить на пять групп:
1) ядро и цитозоль — разделены мембраной, выполняют разные функции,
по топологически эквивалентны;
2) митохондрии',
3) пластиды (только в растительной клетке)',
4) пероксисомы',
5) эндомембранная система клетки — остальные мембранные органеллы:
ЭР, аппарат Гольджи, вакуоли (в растительных клетках), лизосомы (в живот-
ных клетках), транспортные везикулы.
Целесообразность объединения последней группы органелл в одну систему
вытекает не только из эволюционной схемы, но и по функциональным при-
знакам, о которых будет сказано позже.
1.1.2. ТРАНСПОРТ И СОРТИРОВКА БЕЛКОВ
В ЭУКАРИОТИЧЕСКОЙ КЛЕТКЕ
С возникновением компартментов эукариотическая клетка получает не толь-
ко очевидные преимущества, но и ряд проблем. Одна из них связана с необхо-
димостью сортировки и доставки нужных соединений в определенные орга-
неллы. Прежде всего это касается белков. Судьба синтезированных белков раз-
лична и зависит от мест их последующего функционирования. Существуют два
магистральных пути транспорта белков, которые начинаются в разных местах
цитоплазмы (рис. 1.2).
13
Цитоплазматический путь
Секреторный путь
Клеточная
стенка
Рис, 1.2. Схема двух путей транспорта белков в растительной клетке.
Цифры — сигналы сортировки белков, описанные в табл. 1.1; * — путь, не требующий специ-
ального сигнала сортировки
Первая транспортная ветвь обеспечивает белками пластиды, митохондрии,
ядро и пероксисомы, т. е. все компартменты клетки, кроме органелл эндомемб-
ранной системы. Синтез этих белков происходит на свободных рибосомах ци-
тозоля. Белки, предназначенные для транспорта, содержат сигналы сортиров-
ки, направляющие их в соответствующие органеллы. Подобными сигналами
обычно служат один или несколько участков белка, которые называют сиг-
нальными или лидерными пептидами. В мембране органеллы находится специ-
альный белок-транслокатор, который «узнает» сигнальный пептид. Молекула
транспортируемого белка должна развернуться, чтобы подобно нитке развер-
нувшегося клубка «продеться» через «игольное ушко» белка-транслокатора. В
табл. 1.1 представлены некоторые характеристики различных сигналов сорти-
ровки в растительной клетке. Этот путь транспорта белков иногда называют
цитозольным. Следует отметить, что большинство белков, синтезируемых на
свободных рибосомах цитозоля, не имеют сигналов сортировки и остаются в
цитозоле в качестве постоянных компонентов.
Другая транспортная ветвь используется для секретируемых белков, а так-
же для белков, предназначенных для органелл эндомембранной системы и
плазматической мембраны. Синтез этих белков также начинается на рибосомах
цитозоля, но после инициации трансляции рибосомы прикрепляются к мемб-
ране ЭР, при этом формируется шероховатый ЭР. Образующиеся белки пере-
носятся в ЭР по мере их синтеза, т. е. котрансляционно. Это означает, что оче-
редной участок полипептидной цепи сразу после синтеза пересекает мембра-
14
Таблица 1.1. Сигнальные последовательности для транспорта белков
в растительной клетке (цифры в скобках — пути транспорта, показанные на рис. 1.2)
Целевая органелла Сигнальная последовательность Характери стика
Хлоропласты: строма (9) люмен и мембраны тилакоидов (9') Митохондрии: матрикс (8) внутренняя мембрана, межмембранное пространство (8') Пероксисомы(6) Ядро (7) Сигнальный пептид секреторного пути (/) Эндоплазматически й ретикулум (2) Вакуоль (3, 4) N-концевой лидерный пептид («стромальный») Два последовательных N-концевых лидерных пептида N-концевой пресиквенс Два последовательных N-концевых пресик- венса Сигналы пероксисо- мальной локализации PTS1 и PTS2 Сигналы ядерной локализации NLS. Не отщепляются после переноса белка в ядро N-концевой лидерный пептид Сигнал локализации в ЭР Сигналы локализации в вакуолях: NTPP, СГРР, внутрибелковый сигнал Последовательность из 40—50 аминокислот Первый пептид — «стромаль- ный», второй — «люменальный» Формирует положительно заря- женную амфипатическую а -петлю Первый пресиквенс — как для белков матрикса, второй состоит из остатков гидрофобных аминокислот PTS1 — С-концевой трипептид — Ser-Lys-Leu PTS2 локализован на N-конце NLS типа 1: Pro-Lys-Lys-Lys-Arg- Lys NLS типа 2: две последователь- ности, разделенные спейсером NLS типа 3: Lys-Ile-Pro-Ile-Lys 10—15 остатков гидрофобных аминокислот, формирующих а-спираль С-концевой тетрапептид KDEL (Lys-Asp-Glu-Leu) NTPP — N-концевой сигнал: Asn-Pro-lle-Arg СТРР — С-концевой сигнал
ну ЭР. Некоторые из белков попадают в просвет ЭР, другие закрепляются в
мембране и становятся трансмембранными белками ЭР. Эту транспортную ветвь
часто называют секреторным путем клетки.
Две ветви транспорта различаются схемой транспортировки. Пути цитозоль-
ного транспорта белков параллельны, т.е. из цитозоля белки сразу направля-
ются в нужную органеллу. С момента высвобождения белка в цитозоль до по-
ступления его в органеллу проходит не больше 1 — 2 мин.
Транспорт белков по секреторному пути происходит последовательно — от
органеллы к органелле. До достижения конечного пункта белок может побы-
вать в нескольких органеллах (ЭР, разные отделы АГ). Путь от мембраны ЭР до
места назначения может занять десятки и даже сотни минут. В процессе пере-
носа белки могут претерпевать значительные модификации (прежде всего в
АГ). На заключительных этапах транспорт может происходить параллельно: в
вакуоль, периплазматическое пространство или в плазмалемму.
15
И наконец, два пути транспорта белков различаются по механизму перено-
са молекул. Для цитозольного пути возможен только мономолекулярный меха-
низм транспорта белков, при котором каждая молекула белка индивидуально
пересекает мембрану через соответствующий транслокатор. Для секреторного
пути характерен везикулярный механизм транспорта белковых молекул, кото-
рый опосредован транспортными пузырьками (везикулами). Везикулы отшну-
ровываются от одного компартмента, при этом происходит захват определен-
ных молекул из его полости. Затем везикулы сливаются с другим компартмен-
том, доставляя в него свое содержимое. При везикулярном транспорте белки
не пересекают никаких мембран, транспорт возможен только между топологи-
чески эквивалентными компартментами. Везикулярный механизм транспорта
избирательно контролируется с помощью специальных белков, выполняющих
функции сигналов сортировки. В транспортный пузырек белок попадает, если
его сигнал сортировки связывается с рецептором на мембране везикулы. В на-
стоящее время в составе белков установлены лишь некоторые сигналы сорти-
ровки, большинство комплементарных им мембранных рецепторов остаются
пока неизвестными.
1.2. РАСТИТЕЛЬНАЯ КЛЕТКА —
РЕЗУЛЬТАТ ДВОЙНОГО СИМБИОЗА
Стратегия существования высших растений обусловлена прежде всего дву-
мя их главными свойствами — фототрофным типом питания и отсутствием
Рис. 1.3. Схема строения растительной клетки
16
активной подвижности. Эти два свойства наложили отпечаток на все уровни
организации растительного организма, вплоть до клеточного.
Помимо общих для всех эукариотических клеток признаков, клетки расте-
ний обладают рядом особенностей. Главные из них — наличие пластид, вакуо-
лей и жесткой клеточной стенки. Схема строения типичной растительной клетки
представлена на рис. 1.3.
Присутствие пластид связано прежде всего с фототрофным типом пита-
ния растений. Пластиды, как и митохондрии, имеют собственный геном. Та-
ким образом, еще одной особенностью растительной клетки является то, что
она совмещает в себе три относительно автономные генетические системы:
ядерную (хромосомную), митохондриальную и пластидную. Наличие трех ге-
номов является следствием симбиотического происхождения растительных
клеток. При этом растительная клетка, в отличие от других эукариотических
клеток, образовалась как минимум из трех исходно самостоятельных форм:
1) «хозяйского» организма, генетический аппарат которого переместился в
ядро;
2) гетеротрофной бактерии (похожей на родоспириллу), послужившей пред-
шественницей митохондрии;
3) древней бактерии с оксигенным фотосинтезом, похожей на цианобак-
терию Scinechocystis, ставшей родоначальницей пластид.
Длительная коэволюция симбионтов привела к перераспределению функ-
ций между ними и их генетическими системами, при этом многие гены мито-
хондриальной и пластидной ДНК были перемещены в ядро.
1.3. ПЛАЗМАТИЧЕСКАЯ МЕМБРАНА РАСТИТЕЛЬНОЙ КЛЕТКИ
(ПЛАЗМАЛЕММА)
1.3.1. СТРУКТУРА ПЛАЗМАЛЕММЫ
Общая характеристика. Плазматическая (цитоплазматическая) мембрана —
обязательный компонент любой клетки. Она отграничивает клетку и обеспе-
чивает сохранение существующих различий между клеточным содержимым и
окружающей средой. Мембрана служит высокоизбирательным «входным»
селективным фильтром и отвечает за активный транспорт веществ в клетку и
из нее.
Цитоплазматическую мембрану растительной клетки обычно называют плаз-
малеммой. Как и любая биологическая мембрана, она представляет собой ли-
пидный бислой с большим количеством белков. Основу липидного бислоя со-
ставляют фосфолипиды. Помимо них в состав липидного слоя входят гликоли-
пиды и стерины. Липиды достаточно активно перемещаются в пределах своего
монослоя, но возможны и их переходы из одного монослоя в другой. Такой
переход, называемый «флип-флоп» (от англ, flip-flop), осуществляется фермен-
том флипазой.
Кроме липидов и белков в плазмалемме присутствуют углеводы. Соотноше-
ние липидов, белков и углеводов в плазматической мембране растительной
клетки составляет приблизительно 40:40: 20.
17
Мембранные белки связаны с липидным бислоем различными способами.
Первоначально белки мембран разделяли на два основных типа: периферий-
ные и интегральные. Периферийные белки ассоциированы с мембраной за
счет присоединения к интегральным белкам или липидному бислою слабыми
связями: водородными, электростатическими, солевыми мостиками. Они в
основном растворимы в воде и легко отделяются от мембраны без ее разруше-
ния. Некоторые периферийные белки обеспечивают связь между мембранами
и цитоскелетом. Интегральные белки мембран нерастворимы в воде. Как мини-
мум один из доменов интегрального белка встроен в гидрофобную часть би-
слоя мембраны, поэтому интегральный белок, как правило, не может быть
удален из мембраны без ее разрушения.
В последнее время показано существование третьей группы белков, так на-
зываемых «заякоренных» в мембране белков (рис. 1.4). Эти белки фиксируются
в мембране за счет специальной молекулы, в качестве которой могут высту-
пать жирная кислота (ЖК), стерин, изопреноид или фосфатидилинозитол. Бел-
ки, связанные с изопреноидами (пренилированные белки) или жирной кис-
Рис. 1.4. Варианты фиксации «заякоренных» в мембранах белков
18
лотой, обратимо соединяются с эндоплазматической (внутренней) поверхно-
стью мембраны. Из жирных кислот чаще используется миристиновая (С14) или
пальмитиновая (С1б). В первом случае образуется амидная связь с терминаль-
ной аминогруппой глицина. К остаткам пальмитиновой кислоты белки присо-
единяются за счет тиоэфирных связей с цистеинами в С-конце полипептид-
ной цепи. Для пренилирования белков обычно используется фарнезил или
геранилгеранил, которые также присоединяются к остаткам цистеина в кар-
боксильном конце полипептида. В отличие от этих двух групп белков фосфати-
дилинозитолсвязанные белки находятся с внешней (экстрацеллюлярной, или
люменальной) стороны мембраны. Подобным образом, по-видимому, связа-
ны с плазматической мембраной большинство арабиногалактановых белков.
Холестеринсвязанные белки недавно были обнаружены в плазматической мемб-
ране животных клеток, но в растительных клетках подобные белки пока не
найдены.
Особенностью липидного состава плазмалеммы по сравнению с другими
мембранами растительной клетки является высокое содержание стеринов, но
Гидрофильная
часть мембраны
Гидрофобная
часть мембраны
Гидрофиль-
ная часть
Гидрофобная
часть
Гидрофиль-
ная часть
Гидрофобная
часть
Рис. 1.5. Структура фосфолипидов (Л) и фитостеринов (Б)
19
в отличие от плазматической мембраны животной клетки для плазмалеммы
характерна высокая вариабельность их состава в зависимости от вида расте-
ния, органа и ткани. Например, у ячменя (Hordeum vulgaris) в клетках корня
количество свободных стеринов превышает количество фосфолипидов более
чем в два раза, тогда как в листьях фосфолипидов больше, чем стеринов почти
в 1,5 раза. В листьях шпината (Spinacia oleracia) соотношение фосфолипиды:
свободные стерины почти на порядок выше — 9:1.
Структурные особенности плазмалеммы. Помимо высокой степени вариа-
бельности плазматическая мембрана растительной клетки имеет ряд структур-
ных особенностей, отличающих ее от других эукариотических клеток.
• Жирнокислотный состав. Основными жирными кислотами плазмалеммы яв-
ляются пальмитиновая (16:0), олеиновая (18:1; Д9), линолевая (18 : 2; А9,12) и
линоленовая (18:3; Д9,12,15). Практически отсутствует стеариновая кислота (18:0)
и полностью — арахидоновая (20:4; Д5,8,11,14), характерные для мембран клеток
животных и грибов. Известно, что арахидоновая кислота в очень низких концен-
трациях является мощным стимулятором фитоиммунитета для некоторых ви-
дов растений (например, обеспечивает устойчивость картофеля к фитофторе).
• Набор стероидов. В плазмалемме, как и во всех мембранах растительной
клетки, почти нет холестерина. Его заменяют фитостерины, которые являются
С-24-замещенными стеринами (рис. 1.5). Основные фитостерины — ситосте-
рин, стигмастерин и кампестерин. Помимо свободных фитостеринов присут-
ствуют значительные количества эфиров, гликозидов и ацилгликозидов сте-
ринов, что не характерно для клеток животных.
• Набор белков. Наличие специфических белков, прежде всего арабиногалак-
танов (AGPs), обеспечивающих структурное и функциональное взаимодей-
ствие плазмалеммы с клеточной стенкой.
1.3.2. ФУНКЦИИ ПЛАЗМАЛЕММЫ
Плазмалемма, будучи плазматической мембраной, выполняет все общие
для этих структур функции, однако некоторые из них она выполняет особым
образом. Кроме того, плазмалемма имеет ряд специфичных функций, харак-
терных только для растительной клетки (например, синтез целлюлозы, осу-
ществление контакта с клеточной стенкой).
Функции плазмалеммы, общие для плазматических мембран. 1. Контроль по-
глощения и секреции веществ. В плазмалемме находятся множество транспорт-
ных систем, прежде всего для транспорта ионов, — ионные каналы, ионные
переносчики и ионные насосы. Благодаря им осуществляется очень точный и
селективный транспорт ионов как внутрь клетки, так и наружу, т.е. оптималь-
ное снабжение клетки необходимыми ионами (подробнее о механизмах этого
процесса см. в гл. 6 «Минеральное питание»).
Через плазмалемму происходит также перенос макромолекул. Так, в пери-
плазматическое пространство транспортируются строительные блоки клеточной
стенки — полисахариды и структурные белки. Эти соединения обычно находят-
ся в везикулах аппарата Гольджи и высвобождаются из них путем экзоцитоза.
2. Запасание и использование энергии. Плазмалемма любой клетки является
энергизованной мембраной, т. е. на ней существует градиент электрохимиче-
20
ского потенциала Дцн+, который используется для выполнения полезной ра-
боты, прежде всего для активного переноса веществ через мембрану (подроб-
нее о механизмах см, в гл. 4 и 6).
3. Размещение и обеспечение работы ферментов. В плазмалемме находится
множество ферментов. Это ферменты построения клеточной стенки (целлю-
лозосинтаза), ферменты сигнальных систем (фосфолипазы С, А; аденилат-
циклаза) и ряд других ферментов (например, цитохром Ь5, возможно — деса-
туразы),
4. Рецепторные функции. Многие белки плазмалеммы являются рецептора-
ми различных сигналов. Можно сказать, что плазмалемма клетки — это мозаи-
ка различных рецепторов эндогенных сигналов (прежде всего фитогормонов)
и внешних воздействий. К последним относятся рецепторы элиситоров (ве-
ществ, выделяемых патогенами) и рецепторы физических факторов — темпе-
ратуры, давления и др. Температура изменяет жесткость (текучесть) мембра-
ны, т.е. ее механические свойства. Изменение этих свойств плазмалеммы при-
водит к открытию или закрытию находящихся в ней механосенсорных ионных
каналов. Таким образом, плазмалемма является местом рецепции (восприя-
тия) различных сигналов химической и физической природы.
5. Сигнальная функция. Многие компоненты плазмалеммы после восприятия
сигналов служат источником вторичных мессенджеров — молекул, которые
«передают» сигнал по эстафете и усиливают его. В качестве вторичных мессен-
джеров выступают инозитол-1,4,5-трифосфат, диацил глицерин, фосфатидная
кислота, продукты перекисного окисления липидов мембран. Все эти соедине-
ния образуются из липидов плазмалеммы под действием специальных фер-
ментов, активируемых в результате воздействия сигнала на рецепторы. Таким
образом, плазматическая мембрана является местом не только рецепции сиг-
налов, но также их усиления и дифференцирования (см. гл. 7).
Функциональные особенности плазмалеммы. 1. Градиент электрохимическо-
го потенциала плазматической мембраны создается за счет активного перено-
са сопрягающего иона с одной стороны мембраны на другую. Для плазмалем-
мы растительной клетки сопрягающим ионом выступает Н , тогда как для
цитоплазматической мембраны животной клетки это Na+. Очевидно, что фер-
мент, который за счет гидролиза АТФ активно «выкачивает» сопрягающий
ион из клетки, также другой: у растительной — Н+-АТФаза p-типа, у жи-
вотной клетки — К+/№+-АТФаза. Существует несколько изоформ фермента
Н+-АТФазы p-типа: в геномах арабидопсиса и табака обнаружено как мини-
мум по 10 генов. По-видимому, эти изоферменты работают в разных тканях на
разных этапах онтогенеза.
2. У растительной клетки одна из составляющих электрохимического потен-
циала мембраны — электрическая разность потенциалов Ду — находится в пре-
делах от 100 до 250 мВ, что существенно выше, чем у животной клетки. При
этом пассивная составляющая Ду у обеих клеток практически одинакова; раз-
ница обусловлена активной составляющей этого потенциала, т. е. различием в
работе электрогенных транспортных систем (АТФаз и переносчиков ионов).
3. Плазмалемма растительной клетки вместе со специфичным участком ЭР
образует плазмодесмы — специальные цитоплазматические каналы, пронизы-
вающие клеточную стенку и соединяющие смежные клетки. В результате плаз-
модесменных контактов большинство живых клеток растения имеют физиче-
21
ски объединенную плазматическую мембрану. Этим растения существенно от-
личаются от животных, у которых клетки большинства тканей практически
полностью отделены друг от друга плазматической мембраной.
4. Существенно различаются и условия функционирования плазмалеммы и
мембраны животной клетки. Плазмалемма в норме всегда испытывает давле-
ние как со стороны цитоплазмы, так и со стороны клеточной стенки. Живот-
ная клетка, как правило, находится в изотоническом окружении, поэтому к
ее плазматической мембране внешние силы не приложены.
1.4. ЯДРО РАСТИТЕЛЬНОЙ КЛЕТКИ
1.4.1. СТРОЕНИЕ ЯДРА
Ядро растительной клетки представляет собой органеллу, размер и форма
которой варьируют у клеток различных тканей и видов. Оно может быть сфери-
ческим (в диаметре около 10 нм), удлиненным или лопастным. Основная функ-
ция ядра — хранение и копирование генетической информации.
Содержимое клеточного ядра (нуклеоплазма) отделено от цитоплазмы ядер-
ной оболочкой, образованной двумя мембранами толщиной по 8 нм. Между
мембранами находится перинуклеарное пространство шириной 10—20 нм. Внут-
ренняя ядерная мембрана содержит специфические белки, которые контакти-
руют с хромосомами и ядерными РНК. Внешняя ядерная мембрана похожа на
мембрану эндоплазматического ретикулума, в которую она переходит в опре-
деленных местах контакта. Подобно мембранам шероховатого ЭР, внешняя ядер-
ная мембрана содержит рибосомы, участвующие в синтезе белка. Белки, обра-
зованные на этих рибосомах, переносятся в перинуклеарное пространство. Пе-
ринуклеарное пространство связано с полостью ЭР, по-видимому, через спе-
циальные «шлюзовые» участки. В клетках, подготовленных сверхбыстрым за-
мораживанием, зона контактов ядерной оболочки и ЭР проявляется как очень
узкие (наружный диаметр 25 — 30 нм), но физически непрерывные мембран-
ные области. Предполагают, что такие зоны сжатых мембранных областей не-
обходимы для ограничения движения белков (но не липидов) между перинук-
леарным пространством и ЭР, т.е. являются «пропускными шлюзами». По пред-
варительной оценке одно ядро в клетках кончика корня гороха содержит 30 —
50 подобных «шлюзов».
Ядро содержит множество белков, необходимых для обеспечения его функ-
ций. Эти белки (гистоны, ДНК- и РНК-полимеразы, белки-регуляторы раз-
личных генов и белки, участвующие в процессинге РНК) синтезируются в
цитозоле и затем попадают в ядро. Избирательный транспорт белков в ядро
обеспечивается прежде всего ядерными порами.
1.4.2. ТРАНСПОРТ МАКРОМОЛЕКУЛ МЕЖДУ ЯДРОМ
И ЦИТОПЛАЗМОЙ
У всех эукариот, в том числе и у растений, ядерная оболочка пронизана
ядерными порами. Поры окружены большими кольцевыми структурами, на-
22
Рис. 1.6. Схема строения ядерных пор
зываемыми поровыми комплексами (рис. 1.6). Плотность ядерных пор сильно
различается в зависимости от типа клетки. В растительных клетках поры зани-
мают от 8 до 20 % поверхности оболочки, плотность пор составляет от 6 до 25
на 1 мкм2. Каждая пора состоит из сложного макромолекулярного ансамбля —
порового комплекса, который имеет размеры 120 нм в глубину и около 50 нм
в диаметре. Комплекс содержит приблизительно 120 различных видов белков,
называемых нуклеопоринами. Масса всех белков комплекса составляет около
124 МДа.
Ядро порового комплекса имеет октагональную симметрию относительно
центральной оси. По периферии комплекса расположено восемь водных ка-
налов диаметром 9 нм. Они обеспечивают свободную диффузию небольших
молекул, например белков, с молекулярной массой до 40 кДа. Больший ре-
гулируемый центральный канал предназначен для активного транспорта бел-
ков и молекул РНК. Он содержит частицу диаметром около 35 нм, которую
называют «штепселем». Эта частица, по-видимому, представляет собой комп-
лекс белков-транспортеров, который управляет ядерно-цитоплазматическим
обменом.
Большинство белков из цитоплазмы могут транспортироваться в ядро толь-
ко в том случае, если они содержат сигнальную последовательность ядерной
локализации NLS (nuclear localization signals). Узнавание этого сигнала ядер-
ным поровым комплексом приводит к открыванию центрального канала. Мно-
гие ядерные белки содержат несколько сигналов ядерной локализации. Извест-
но три класса подобных сигналов (см. табл. 1.1).
Характерной особенностью сигналов ядерной локализации является то, что
они не отделяются от белка после его транслокации в ядро. Возможно, это
связано с необходимостью повторного перемещения белка в ядро после мито-
за, в ходе которого нуклеоплазма смешивается с цитозолем. Большинство им-
портированных белков остаются в ядре, даже если они находятся в раствори-
мой форме и могут свободно перемещаться по нуклеоплазме. Некоторые белки
перемещаются между ядром и цитоплазмой несколько раз.
23
1.5. ПЛАСТИДЫ
1.5.1. ОБЩАЯ ХАРАКТЕРИСТИКА ПЛАСТИД
Пластиды — органеллы, найденные исключительно в клетках высших рас-
тений и водорослей. Они ответственны за фотосинтез, хранение разнообраз-
ных продуктов метаболизма, а также за синтез многих ключевых молекул рас-
тительных клеток. Как следует из названия (от греч. plastikos — изменчивый,
пластичный), пластиды различны по размеру, форме, содержанию и функци-
ям. Пластиды обладают также замечательной способностью дифференцировать-
ся, дедифференцироваться и повторно редифференцироваться.
Всем пластидам свойствен ряд общих черт. Как уже было сказано, они име-
ют собственный геном, одинаковый у всех представителей одного вида расте-
ний, собственную белоксинтезирующую систему; от цитозоля пластиды отде-
лены двумя мембранами — наружной и внутренней. Для некоторых фототроф-
ных организмов число пластидных мембран может быть больше. Например,
пластиды эвглен и динофлагеллят окружены тремя, а у золотистых, бурых,
желто-зеленых и диатомовых водорослей они имеют четыре мембраны. Это
связано с происхождением пластид. Считается, что симбиотический процесс,
результатом которого стало формированием пластид, в процессе эволюции
происходил неоднократно (как минимум, трижды).
1.5.2. ТИПЫ ПЛАСТИД И ИХ ФОРМИРОВАНИЕ
Пропластиды являются предшественниками остальных типов пластид и всегда
присутствуют в меристематических клетках. Клетки меристем покрытосемен-
ных растений, как правило, содержат около 20 пропластид. Форма пропластид
чаще всего сферическая или эллипсоидная, размеры от 0,2 до 1,0 мкм. Внут-
ренняя среда пропластид — строма — имеет зернистую структуру и достаточно
однородна. В ней можно идентифицировать один или несколько нуклеоидов в
виде электронно-прозрачных областей с кольцевыми структурами ДНК диа-
метром около 3 нм. Пропластиды содержат гораздо меньше рибосом, чем вы-
сокодифференцированные этиопласты или хлоропласты. В пропластидах внут-
ренняя мембранная система развита слабо. Она состоит лишь из нескольких
инвагинаций внутренней мембраны и небольшого числа уплощенных мешоч-
ков, называемых ламеллами. Иногда в пропластидах присутствуют везикулы с
запасными белками. В ряде случаев в строме пропластид содержатся отложения
белка фитоферритина, основной функцией которого является хранение ионов
железа. Фитоферритин в растительной клетке находится почти исключительно
в пластидах, больше всего в пластидах запасающих органов.
Из пропластид формируются остальные типы пластид — амилопласты, лей-
копласты, этиопласты, хлоропласты, хромопласты. Набор пластид в конкрет-
ной клетке зависит от типа ее дифференцировки (рис. 1.7).
Амилопласты — неокрашенные пластиды, которые внешне похожи на
пропластиды, но содержат гранулы крахмала. Их название происходит от ами-
лозы — линейного, растворимого в воде полисахарида, состоящего из а (1 ->4)-
глюкопиранозильных единиц, основного компонента крахмала. Амилопласты
24
Рис. 1.7. Схема взаимопревращений пластид
обычно присутствуют в клетках запасающих органов. Крахмальные зерна, ко-
торые могут быть весьма массивными, располагаются в строме. В клубнях кар-
тофеля, например, зерно крахмала обычно заполняет всю пластиду, за исклю-
чением тонкого слоя стромы у внутренней мембраны. В грависенсорных клет-
ках кончика корня амилопласты выполняют функции статолитов, седименти-
рующих под действием силы тяжести и вызывающих таким образом гравитро-
пический ответ. Структура «статолитного» амилопласта отличается от запаса-
ющего наличием матрикса, который охватывает все крахмальные гранулы.
Лейкопласты — бесцветные пластиды, вовлеченные в синтез изопренои-
дов, чаще всего моно- и сесквитерпенов, составляющих основу эфирных ма-
сел. В литературе термин «лейкопласты» часто используется в качестве синони-
ма и для амилопластов, ч^о неверно. Лейкопласты представляют собой уни-
кальный тип пластид, синтезирующих изопреноиды, иногда их называют «тер-
пеноидными пластидами». Для них характерно наличие плотной стромы, не-
большого количества внутренних мембран и рибосом, а также небольших пла-
стоглобул (капель липидов). Типичный признак лейкопластов — наличие «ре-
тикулярного футляра», т.е. они обычно окружены обширной сетью трубчатых
мембран гладкого ЭР, которые также участвуют в синтезе изопреноидов.
Этиопласты — развиваются из пропластид в темноте, при освещении они
превращаются в хлоропласты. Этиопласты представляют собой специальный
вид пластид, образующихся в клетках этиолированных листьев и других, в
норме зеленых, тканях растений, выращиваемых в темноте. В этиопластах нет
хлорофилла, но зато присутствует большое количество протохлорофиллида.
25
Мембранные липиды в них хранятся в фор-
ме рельефной мембранной структуры, назы-
ваемой проламеллярным телом (рис. 1.8). Эта
структура формируется из липидов, которые
обычно составляют внутренние мембраны
хлоропластов. Образование проламеллярных
тел обусловлено отсутствием мембранных
белков, необходимых для формирования нор-
мальных тилакоидов хлоропластов. Липиды
образуют мембранные трубочки, которые
ветвятся в трех измерениях и формируют
Рис. 1.8. Строение проламеллярно- квазикристаллическую решетчатую структу-
ре тела ру После освещения этиопласты начинают
развиваться в хлоропласты. Свет вызывает
синтез хлорофилла из протохлорофиллида, а также синтез белков мембран.
Это приводит к формированию хлорофилл-белковых комплексов, при этом
липиды проламеллярного тела трансформируются в тилакоиды.
Хлоропласты — зеленые фотосинтезирующие пластиды, отвечающие за
поглощение и трансформацию энергии света. В высших растениях хлоропласты
имеют преимущественно сферическую или эллипсоидную форму, у мхов и
водорослей она может быть иной. Например, каждая клетка в нитчатой мор-
ской водоросли Spirogyra содержит единственный лентообразный хлоропласт.
У высших растений длина хлоропластов варьирует от 5 до 8 мкм при ширине
от 3 до 4 мкм. Количество хлоропластов в разных клетках неодинаковое. Клетка
палисадной хлоренхимы листьев клещевины (Ricinus communis) содержит
около 35 хлоропластов, в клетке губчатой хлоренхимы их около 20. В листе
клещевины насчитывается приблизительно 500 000 хлоропластов на 1 мм2,
из них 82 % приходится на палисадную хлоренхиму. Клетка хлоренхимы зрело-
го листа арабидопсиса (Arabidopsis thaliana) включает приблизительно 120 хлоро-
пластов (подробно структура и функция хлоропластов изложена в гл. 3 «Фото-
синтез»)
Хромопласты — желтые, оранжевые или красные пластиды. Их цвет зави-
сит от комбинации каротиноидов — единственных липофильных пигментов
высших растений. Хромопласты ответственны за окраску многих плодов (на-
пример, помидоров, цитрусовых), цветков (лютиков, бархатцев) и корней
(морковь). ХромЬпласты могут развиваться непосредственно из пропластид или
повторно дифференцироваться из хлоропластов, как, например, в созреваю-
щих плодах помидора. Хромопласты могут редифференцироваться в хлоропла-
сты, что наблюдается, в частности, в выступающих из земли и освещаемых
участках корнеплодов моркови. Развитие хромопластов сопровождается мощ-
ной индукцией ферментов, катализирующих биосинтез каротиноидов. Неак-
тивные формы этих ферментов обычно находятся в строме, активные формы
присутствуют только в мембранах пластид, где локализованы как липофиль-
ные предшественники каротиноидов, так и сами каротиноиды.
Механизмы превращения пропластид в ту или иную форму пластид полно-
стью неизвестны, однако установлено, что главную роль в регуляции этого
процесса играет ядерный геном. Ядерные мутации могут переключать развитие
с хромопластов на хлоропласты или же полностью блокировать развитие пла-
26
стид. У таких мутантов образуются либо различныё формы лейкопластов, либо
незрелые хлоропласты с аномальной пигментацией, свойственные многим
декоративным растениям.
Важнейшим фактором, определяющим развитие и функционирование пла-
стид, является свет. Свет регулирует примерно пятую часть из 100— 120 генов,
входящих в состав хлоропластного генома.
1.5.3. ОБОЛОЧКИ ПЛАСТИД
Через мембраны пластид происходит интенсивный обмен метаболитов в
обоих направлениях. В отличие от других мембран эукариотической клетки,
внутренняя и внешняя мембраны пластид, как и мембраны тилакоидов, бед-
ны фосфолипидами и обогащены галактолипидами. По мнению ряда исследо-
вателей, это может отражать эволюцию фотосинтетических организмов в мор-
ской среде, где содержание фосфора ограничено.
Внешняя мембрана оболочки содержит неспецифичный поровый белок (по-
рин), который разрешает свободный транспорт воды, разнообразных ионов и
метаболитов с размером до 10 кДа в межмембранное пространство. Внешняя
мембрана не имеет складок и никогда не сливается с внутренней мембраной.
В то же время существуют места контактов внешней и внутренней мембран.
В этих зонах осуществляется перенос пластидных белков из цитозоля в пласти-
ду. На внешней мембране пластид локализованы белки, выполняющие те или
иные функции, в частности ферменты, вовлеченные в обмен галактолипидов.
Внутренняя мембрана оболочки проницаема для маленьких незаряженных
молекул, включая О2 и NH3, а также для недиссоциированных низкомолеку-
лярных монокарбоновых кислот. Большинство метаболитов пересекают внут-
реннюю мембрану пластид при помощи специальных переносчиков. Внутрен-
няя мембрана оболочки пластид содержит также ферменты, участвующие в
формировании тилакоидных мембранных липидов
1.5.4. РАЗМНОЖЕНИЕ ПЛАСТИД
Пластиды образуются за счет деления существующих пластид, причем это
происходит независимо от деления клетки. Пропластиды способны к интен-
сивному делению, причем все гены, контролирующие этот процесс, обычно
имеют ядерную локализацию. Чаще делятся пропластиды, этиопласты и моло-
дые хлоропласты, однако способность к делению сохраняет даже полностью
развившийся хлоропласт. В апексах корня, стебля и других меристемах скорость
деления пропластид коррелирует со скоростью деления клеток, таким обра-
зом, количество пластид у дочерних и исходных клеток примерно одинаково.
Число пропластид в клетке на этой стадии невелико: около 20. В онтогенезе
растения на стадии растяжения клеток их деление останавливается, тогда как
деление пластид продолжается, что приводит к увеличению их количества в
клетке. Например, по мере развития листа шпината количество пластид в клетке
возрастает приблизительно в 10 раз и достигает 150 — 200 органелл на клетку.
Одновременно значительно увеличивается копийность пластидной ДНК. Чис-
ло копий хлоропластного генома в одной клетке мезофилла листа может варь-
27
ировать от 500 до 10000, а количество ДНК может достигать 10 — 20% всей
ДНК клетки листа.
Деление начинается с заметного сжатия пластиды в центре. Сжатие углуб-
ляется, образуя узкую перетяжку между двумя будущими дочерними пласти-
дами, после чего они полностью разъединяются. На стадии перетяжки на внеш-
ней мембране пластиды со стороны цитозоля образуется электронно-плотное
кольцо. Недавние исследования показали, что это кольцо содержит белок, близ-
кий сократительному (контрактильному) белку FtsZ бактерий, который не-
обходим для формирования перетяжки при делении бактериальных клеток.
1.5.5. НАСЛЕДОВАНИЕ ПЛАСТИД
Эндоплазматические органеллы могут переходить от одного поколения к дру-
гому через яйцеклетку (материнское наследование), через спермин (отцовское
наследование) либо обоими способами (двуродительское наследование). У боль-
шинства покрытосеменных растений пластиды и митохондрии наследуются по
материнской линии. Эти органеллы от отцовской линии либо не попадают в
спермин, либо деградируют в процессе развития мужского гаметофита или
двойного оплодотворения. Независимо от исходной локализации (в яйцеклет-
ке или спермин) в момент наследования пластиды находятся на стадии про-
пластид.
В ряде видов цветковых растений, включая герань {Pelargonium), свинчатку
{Plumbago), ослинник {Oenothera), было зарегистрировано двуродительское
наследование пластид и митохондрий. У Pelargonium «мужские» пластиды и ми-
тохондрии отличаются от «женских» по ультраструктуре. Это позволяет визу-
ально определить в развивающемся зародыше присутствие органелл от каждо-
го родителя. Наследование органелл в свинчатке своеобразно. Данный вид ха-
рактеризуется наличием диморфных спермиев: одна из мужских гамет обога-
щена митохондриями, тогда как другая — пластидами. При этом происходит
предпочтительное оплодотворение: «пластидный» спермий сливается с яйцек-
леткой гораздо чаше, чем «митохондриальный».
Некоторые растения (например, саговники, гинкго) кардинально отлича-
ются по способу наследования пластид: пластиды переходят к следующему
поколению через сперматозоид (в этом случае мужской гаметофит живет до-
вольно долго, развиваясь в женской шишке после опыления). Таким образом,
для некоторых голосеменных характерно наследование пластид по отцовской
линии.
1.5.6. ГЕНОМ И БЕЛОКСИНТЕЗИРУЮЩАЯ
СИСТЕМА ПЛАСТИД
Все пластиды имеют собственный геном и белоксинтезирующую систему.
У современных фотосинтезирующих эукариот пластидная ДНК (плДНК), как
правило, представлена многокопийной кольцевой молекулой размером от 120
до 290 тыс. п. н. У большинства видов эта молекула содержит два инвертирован-
ных повтора (IRa и IRb — от англ, inverted repeats), разделяющих ее на две
неравные области (рис. 1.9). У многих бобовых и большинства голосеменных
28
Рис. 1.9. Схема строения кольцевой ДНК пластид
растений ДНК пластид имеет всего лишь один IR-повтор и обладает изменен-
ным порядком генов.
Для некоторых видов высших растений проведено полное секвенирование
плДНК. Установлено, что ДНК пластид содержит около 100 генов, причем их
набор близок для разных видов. Все идентифицированные гены можно разде-
лить на две группы:
• гены, обслуживающие процессы транскрипции и трансляции белков пла-
стид (гены «домашнего хозяйства»);
• гены белков, обеспечивающих «полезную работу» пластид, прежде всего
процесс фотосинтеза.
Многие пластидные гены организованы в виде оперонов — блоков генов,
считывающихся с единого промотора. Ряд пластидных генов имеют мозаичную
структуру, т. е. состоят из чередующихся экзонов и интронов.
29
1.5.6.1. РНК-полимеразы пластид
Транскрипция пластидных генов обеспечивается двумя типами РНК-поли-
мераз, одна из которых кодируется в ядре растительной клетки, тогда как
другая — пластидной ДНК.
Собственная РНК-полимераза пластид обладает типичными прокариоти-
ческими чертами и очень близка соответствующему ферменту Escherichia coli
(рис. 1.10). Она состоит из четырех типов субъединиц а2РР'Р" (У эубактерий из
трех — а2рр'). Эти субъединицы кодируются в пластидном геноме. Структура
фермента а2РР'Р" характерна лишь для пропластид и этиопластов. Такая РНК-
полимераза не может узнавать премоторные области генов, для этого к ней
должна присоединиться ст-субъединица. Она кодируется ядерным геномом и
присоединяется к ферменту при освещении пластиды. У арабидопсиса выявле-
но как минимум три гена ст-субъединиц. Несмотря на ядерное кодирование,
продукты этих генов имеют высокую гомологию с ст-субъединицами циано-
бактерий и эффективно распознают типичные промоторы прокариот. Ядерная
локализация этих генов, вероятно, является результатом перемещения генети-
ческого материала пластид в ядро.
Поскольку в темноте и в пропластидах собственная РНК-полимераза пла-
стид неактивна, то в этих условиях работает другая РНК-полимераза, которая
кодируется ядерным геномом. Она представляет собой мономерный фермент,
очень похожий на РНК-полимеразу бактериофагов ТЗ и Т7. В геноме арабидоп-
сиса идентифицирован ген, кодирующий эту РНК-полимеразу. Продукт дан-
ного гена имеет сигнальную последовательность транспорта в пластиды.
Имеется своеобразное «распределение ролей» в работе двух РНК-полиме-
раз пластид, которое обеспечивается различными промоторами пластидных
генов. Все гены пластид можно разделить на три группы:
• имеющие стандартные эубактериальные промоторы — к ним относятся
почти все гены белков, участвующих в процессах фотосинтеза, их транскрип-
цию обеспечивает собственная РНК-полимераза пластид;
• имеющие нестандартные промоторы — такие промоторы свойственны лишь
немногим генам; важно, что таким промотором снабжен rif-оперон, содержа-
щий гены собственной пластидной РНК-полимеразы; их активность связана с
мономерной РНК-полимеразой фагового типа;
• имеющие универсальные промоторы — подобные промоторы характерны
для большинства генов «домашнего хозяйства» пластид; успешно распознают-
ся обеими РНК-полимеразами.
Пластидная РНК-полимераза
бактериального типа
Рис. 1.10. Схема строения пластидных РНК-полимераз:
-35; -10 — расстояние до места начала транскрипции (в парах нуклеотидов)
30
1.5.6.2. Транскрипция пластидной РНК
Можно предположить, что в пропластидах работает только РНК-полимераза
фагового типа. Этот фермент обеспечивает экспрессию лишь немногих генов, в
том числе собственной РНК-полимеразы пластид, однако она неактивна. Свет
активирует РНК-полимеразу за счет присоединения ст-субъединицы, и транс-
крипционная активность в пластидах избирательно увеличивается почти в 100 раз.
В дифференцированных хлоропластах транскрипция пластидных генов так-
же регулируется весьма эффективно. Основным регулирующим фактором и в
этом случае является свет. Для большинства пластидных генов максимальная
транскрипционная активность приходится на предрассветные часы. С началом
интенсивного освещения транскрипция ДНК хлоропластов заметно снижает-
ся, что, однако, не препятствует активной экспрессии пластидных генов.
На более поздних этапах дифференцировки пластид активность некоторых
генов может блокироваться. Например, в амилопластах клеток клена явора (Acer
pseudoplatanus) происходит неравномерное метилирование пластидной ДНК,
в результате чего одни гены (в том числе тг16, psbA) продолжают нормально
считываться, в то время как другие (rbcL, atpA, atpB, atpE, psaA) подвергают-
ся практически полной репрессии. Подобная ситуация показана для хромопла-
стов томата и перца. Таким образом, частичное метилирование пластидной
ДНК может играть существенную роль в регулировании активности пластид-
ных генов и преобразовании хлоропластов в другие формы пластид.
1.5.6.3. Созревание пластидной РНК
После транскрипции происходит процесс созревания пластидных РНК.
К нему относится сплайсинг транскриптов, у которых есть интрон-экзонная
структура; формирование зрелых концов у транскриптов; редактирование не-
которых мРНК (рис. 1.11). Пластидные интроны отличаются отядерных прежде
всего способностью к автосплайсингу. Это означает, что вырезание пластид-
ных интронов происходит автокаталитически, т. е. без участия каких-либо фер-
ментов.
Одной из своеобразных модификаций информационных РНК пластид яв-
ляется их «редактирование» — химическая модификация в мРНК некоторых
пиримидиновых оснований. В результате редактирования происходит замена
одного основания на другое, что изменяет нуклеотидную последовательность
транскрипта и кодирование соответствующей информации. Обычно остаток
цитозина заменяется на урацил. Процесс редактирования может приводить к
образованию инициаторного кодона, отсутствующего в исходной РНК, заме-
не стоп-кодонов на смысловые триплеты или превращение одних смысловых
кодонов в другие (рис. 1.12). Редактирование мРНК представляет собой мощ-
ный регуляторный механизм экспрессии пластидных генов. Важно отметить,
что до сих пор все известные случаи редактирования пластидных мРНК обна-
ружены только в хлоропластах высших растений.
Стабильность РНК рассматривается как один из основных факторов, спо-
собных регулировать экспрессию пластидных генов. Большинство зрелых пла-
стидных РНК содержат в своей З'-некодирующей области характерную шпильку.
Подобная вторичная структура предохраняет молекулу РНК от разрушающего
31
Интрон Интрон
Процессинг
Процессинг,
сплайсинг
Процессинг
23S
16S
Зрелые рРНК
Зрелые тРНК
UGC
GAU
Рис. 1.11. Схема созревания пластидных РНК
4,5S 5S
I I
Возникновение
инициаторного кодона
Замена
аминокислоты
Возникновение
стоп-кодона
Тре Ала Лиз
5' AAU ACG GCG ААА 3'
Вал Гис Сер Сер
5' GUU CAU ... UCA UCA 3'
Фен Глн Сер
5' UUC САА UCC 3'
AUG
Мет
UAU
Тир
UUA
Лей
UAA
Стоп
Рис. 1.12. Варианты редактирования пластидных мРНК
Инициаторный кодон Терминальный кодон
З'-UTR | АААААААААААА- 3'
Сар | 5'-UTR | AUG
I'UAQl
Б
Рис. 1.13. Сопоставление структуры цитозольной и пластидной мРНК:
А — схема строения цитозольной мРНК; Б — схема строения пластидной мРНК
32
действия рибонуклеаз (рис. 1.13), однако наличие З'-концевой шпильки не
гарантирует сохранность РНК. При определенных условиях (например, в тем-
ноте) такая шпилька распознается специфическими белковыми комплексами.
Они разрушают 3'-конец молекулы РНК, и молекула РНК становится доступ-
ной для рибонуклеаз.
Даже при эффективной защите своего З'-конца зрелые пластидные мРНК
подвержены быстрой деградации за счет рибонуклеазной атаки с 5'-конца. Этого
не происходит лишь при трансляции мРНК, когда она связана с пластидными
рибосомами. Таким образом, стабильность пластидных мРНК находится в тес-
ной зависимости от уровня их трансляции.
1.5.6.4. Трансляция белков в пластидах
Пластидный аппарат белкового синтеза находится под двойным генетиче-
ским контролем. Одни компоненты этого аппарата кодируются ядерными ге-
нами, другие (в том числе рибосомные и все транспортные РНК, а также
приблизительно треть рибосомных белков) кодируются пластидной ДНК.
Рибосомы пластид существенно отличаются от цитозольных рибосом рас-
тительной клетки, но близки к рибосомам эубактерий. В пластидной рибосоме
белков значительно меньше, чем в цитозольной. Это приводит к заметному
снижению ее коэффициента седиментации (70S вместо 80S). Рибосомы пла-
стид, как правило, содержат четыре типа рРНК, три из которых (23S, 5S и
16S) характерны для эубактерий. Четвертая рРНК (4.5S) гомологична З'-кон-
цу 23S-pPHK и не обнаруживается ни в одном другом типе рибосом. Пластид-
ные рибосомы близки эубактериальным и по комплексу белков. Оба типа ри-
босом имеют практически одинаковое количество белков, обладают похожи-
ми иммунологическими характеристиками и чувствительны к одним и тем же
антибиотикам (хлорамфеникол, стрептомицин). Для большинства белков пла-
стидной рибосомы показана высокая степень гомологии с соответствующими
полипептидами эубактерий.
Весь набор пластидных тРНК кодируется приблизительно 30 различными
генами trn, локализованными в пластидной ДН К. Подавляющее большинство
этих генов представлено единственной копией.
Синтез белка в пластидах эффективно регулируется различными факторами,
прежде всего светом. Показано, что у некоторых пластидных мРНК (например,
мРНК psbA хламидомонады) 5'-область имеет характерную шпильку, распозна-
ваемую крупным белковым комплексом. Входящий в него белок RB47 (мол. мас-
сой 47 кДа) в темноте находится в окисленной форме и не способен взаимо-
действовать со шпилькой мРНК. Освещение хлоропласта приводит к восста-
новлению сульфгидрильных групп белка RB47. В восстановленной форме он спо-
собен связываться со шпилькой, что является обязательным условием инициа-
ции трансляции. Таким образом, синтез белка, кодируемого геном psbA, ак-
тивно идет на свету, но останавливается с наступлением темноты.
1.5.6.5. Белки, кодируемые в пластидном геноме
Процесс фотосинтеза в хлоропластах осуществляется сложными пигмент-
белковыми комплексами, расположенными в тилакоидных мембранах. К ним
2 Физиология растений
33
относятся фотосистемы I и II, ^/-комплекс, пластидная АТФ-синтаза. Фор-
мирование этих белковых структур находится под двойным генетическим кон-
тролем, т. е. каждый белковый комплекс, обслуживающий процесс фотосинте-
за, содержит как белки, кодируемые ядерным геномом, так и белки, кодиру-
емые в геноме хлоропластов.
Хлоропласты высших растений содержат около 40 генов, кодирующие «ра-
бочие» белки пластид. У разных организмов набор генов хлоропластного гено-
ма может быть различным. В целом можно отметить следующую закономер-
ность: функциональные белки фотосинтетического аппарата чаще кодируются
в геноме хлоропластов, тогда как регуляторные или «дополнительные» — в
ядерном геноме. Например, в хлоропластном геноме кодируются основные белки
реакционных центров обеих фотосистем, апопротеины цитохромов Ь(, и/ а- и
р-субъединицы АТФ-синтазы, большая (каталитическая) субъединица рибу-
лезобисфосфаткарбоксилазы (Рубиско). Под ядерным генетическим контролем
находится весь спектр антенных хлорофиллсвязывающих белков, малая (регу-
ляторная) субъединица Rubisco.
1.5.7. ТРАНСПОРТ ЦИТОЗОЛЬНЫХ БЕЛКОВ
В ПЛАСТИДЫ
Для транспорта в хлоропласты на N-конце белков должен находиться сиг-
нальный пептид, состоящий из 40 — 50 аминокислот (табл. 1.1). Белок транс-
портируется в строму хлоропластов в местах «слипания» их мембран. Транс-
порт требует энергии в виде АТФ.
Если белок должен остаться в строме, то довольно сложный комплекс
шаперонов, составленный из больших (Hsp60, мол. масса 60 кДа) и малых
(10 кДа) субъединиц, обеспечивает его сворачивание в АТФ-зависимом про-
цессе. Наоборот, белки, которые предназначены для люмена тилакоидов либо
их мембран, поддерживаются шаперонами в развернутой форме, что необхо-
димо для их дальнейшего транспорта. Белки, направляемые к внешней мемб-
ране, не транспортируются в строму, а попадают в мембрану непосредственно
из цитозоля.
Белки, предназначенные для тилакоидов, содержат два сигнальных пепти-
да («стромальный» и «люменальный), расположенных последовательно один
за другим. Первый пептид идентичен лидерному пептиду стромальных белков
и направляет белок в строму хлоропласта. В строме протеаза удаляет «стромаль-
ный» пептид, что «открывает» второй лидерный пептид, который обеспечива-
ет дальнейший транспорт белка через мембрану тилакоида. В люмене тилакои-
да второй сигнальный пептид отщепляется протеазой, и белок либо остается в
люмене, либо встраивается в мембрану тилакоида.
Механизм встраивания интегральных белков в мембрану не совсем ясен.
Скорее всего, белки встраиваются в мембрану за счет своих гидрофобных уча-
стков.
Существует, по крайней мере, два механизма транспорта белков через ти-
лакоидную мембрану. Один путь требует для транслокации АТФ и ДрН на мем-
бране. Другой путь АТФ-независим и для его осуществления достаточно только
ДрН.
34
1.5.8. ФУНКЦИИ ПЛАСТИД
Принципиально важно, что пластиды растений — это органеллы, выполня-
ющие в растительной клетке разнообразные функции. При этом функции пла-
стид различны для клеток различных тканей. Безусловно, главнейшей функци-
ей пластидной системы является фотосинтез, происходящий в хлоропластах.
Другая важнейшая функция пластид — биосинтез многих соединений рас-
тительной клетки. Это связано с необходимостью компартментации в эукарио-
тической клетке синтезируемых веществ. Растительная клетка в этом смысле
имеет преимущества перед другими эукариотами, так как имеет два дополни-
тельных компартмента — пластиды и вакуоли, которые используются клеткой
весьма активно. В пластидах протекают промежуточные стадии многих метабо-
лических процессов. Здесь у растений, помимо образования хлорофиллов и
каротиноидов, синтезируются пурины и пиримидины, большинство амино-
кислот и все жирные кислоты (у животных эти процессы осуществляются в
цитозоле). В пластидах также происходит восстановление ряда неорганических
ионов — нитрита (МОД, который является продуктом цитозольного восста-
новления нитрата, и сульфата (SO4~). Пластиды — основное место запасания
железа: в них локализовано до 85 % фитоферритина. Пластидный компартмент
образно можно назвать «фабрикой экологически вредных и энергоемких про-
изводств» растительной клетки, связанных с токсичными интермедиатами,
свободнорадикальными процессами и высокими энергиями.
Особо следует отметить, что в пластидах часто протекают синтезы, дубли-
рующиеся в цитозоле. Например, в них обнаружен шикиматный путь синтеза
ароматических соединений, который обеспечивает синтез фенольных соеди-
нений вплоть до образования флавоноидов. Аналогичный путь известен и в ци-
тозоле, однако там работают другие изозимы (например, халконсинтазы). В пла-
стидах обнаружен также новый путь синтеза изопреноидов (см. подразд. 1.11).
Ферменты практически всех описанных биосинтетических путей хлоропла-
стов имеют ядерное кодирование и, следовательно, транспортируются в плас-
тиды из цитозоля, т. е. в данном случае пластиды используются для сегрегации
биосинтетических путей.
1.6. РАСТИТЕЛЬНЫЕ МИТОХОНДРИИ
1.6.1. СТРОЕНИЕ РАСТИТЕЛЬНЫХ МИТОХОНДРИЙ
Митохондрия — основная органелла, осуществляющая процесс дыхания в
эукариотической клетке. Растительные митохондрии представляют собой сфе-
рические или удлиненные органеллы диаметром от 0,5 до 1,0 мкм и длиной от
1 до 3 мкм. Число митохондрий в растительной клетке варьирует в зависимости
от метаболической активности соответствующей ткани, однако для клеток од-
ного типа (ткани) концентрация митохондрий в единице объема цитоплазмы
обычно достаточно постоянна. Например, небольшие клетки кончика корня
проростка кукурузы содержат приблизительно по 200 митохондрий, тогда как
гораздо более крупные клетки зрелого корня могут иметь до 2000 митохонд-
рий. В метаболически активных клетках, например клетках-спутницах ситовид-
35
ных трубок или секреторных клетках, значительная часть (до 20 % от объема
цитоплазмы) может быть занята митохондриями, сливающимися в единую «ми-
тохондриальную сеть» — хондриом. Некоторые одноклеточные водоросли (типа
Chlamydomonas) содержат всего лишь несколько небольших митохондрий.
Митохондрии, как и хлоропласты, имеют две мембраны — наружную и
внутреннюю. Поверхность внутренней мембраны больше, чем внешней. На ее
долю приходится более 90 % всех митохондриальных липидов. Существенное
увеличение поверхности внутренней мембраны митохондрий связано с нали-
чием впячиваний — крист, которые достаточно глубоко внедряются в матрикс.
На внутренней мембране расположены белковые комплексы дыхательной цепи.
В матриксе находятся растворимые ферменты (в частности, цикла Кребса),
митохондриальная ДНК (mtDNA), а также рибосомы.
Наружная мембрана митохондрий содержит белки-порины, гомологичные
бактериальным, и проницаема для небольших молекул. Внутренняя мембрана
энергизованна и практически непроницаема для ионов и органических моле-
кул. Транспорт через внутреннюю мембрану, как и у пластид, осуществляется
белками-переносчиками (транспортерами) или через специальные каналы.
Митохондрии размножаются делением. В отличие от пластид при их деле-
нии обычно не обнаруживается разделительного кольца. Подобное кольцо было
обнаружено только при делении митохондрии у одноклеточной красной мор-
ской водоросли Cyanidium caldarium.
1.6.2. ГЕНОМ МИТОХОНДРИЙ ВЫСШИХ РАСТЕНИЙ
Высшие растения, по-видимому, имеют наиболее крупный митохондри-
альный геном среди всех эукариотических организмов. Если у подавляющего
большинства эукариот (в том числе й у водорослей), размер митохондриаль-
Рис. 1.14. Кольцевые молекулы митохондриальной ДНК
кукурузы, возникающие в результате внутримолеку-
лярной рекомбинации.
Цифрами обозначены повторы, по которым может проис-
ходить рекомбинация
36
Рис. 1.15. Схема строения кольцевой ДНК («мастср»-хромосомы) митохондрий
кукурузы
ной ДНК небольшой и составляет десятки тысяч пар оснований, то у высших
растений — сотни тысяч.
Структура митохондриального генома растений также необычна. У большин-
ства высших растений и водорослей ДНК митохондрий (мтДНК) представле-
на многочисленными кольцевыми молекулами размером не более 80 тыс. п. н.,
однако у целого ряда организмов, например у хламидомонад, она имеет не
кольцевую, а линейную структуру. Крупная митохондриальная ДНК высших
растений часто содержит значительное количество протяженных повторов, а
потому способна к внутри- и межмолекулярной рекомбинации с образовани-
ем большого числа кольцевых молекул различного размера (рис. 1.14). В мито-
хондриальном геноме растений, помимо крупных кольцевых молекул ДНК,
часто присутствуют кольцевые и линейные плазмиды.
37
К настоящему времени проведено полное секвенирование митохондриаль-
ной ДНК некоторых водорослей, а также высших растений (печеночника, ара-
бидопсиса, риса). Показано, что у разных объектов в составе мтДНК содер-
жится от 25 (у хламидомонады) до 104 (у печеночника) генов. У высших расте-
ний мтДНК содержит, как правило, чуть больше 50 генов (рис. 1.15).
Подавляющая часть генома митохондрий растений состоит из некодиру-
ющих последовательностей. Гены отделены друг от друга по меньшей мере
несколькими тысячами нуклеотидных пар, поэтому каждый ген обычно счи-
тывается автономно.
1.6.3. БЕЛОКСИНТЕЗИРУЮЩИЙ АППАРАТ
РАСТИТЕЛЬНЫХ МИТОХОНДРИЙ
Транскрипцию генов осуществляет мономерная РНК-полимераза фагового
типа, кодируемая в ядре и способная эффективно мигрировать в митохондрии.
Процесс созревания митохондриальных транскриптов в общих чертах сходен с
таковым для пластид. Для ряда митохондриальных генов отмечен транссплай-
синг. У высших растений практически все мРНК митохондрий подвержены
интенсивному редактированию. Этот процесс включает не только типичное
для пластид преобразование С -> U, но и обратную химическую модификацию
U -> С.
Митохондриальные рибосомы растений заметно отличаются от цитозоль-
ных и пластидных рибосом. В частности, их малая субъединица содержит 18S
рРНК, а в большой субъединице помимо 26S рРНК присутствует 58-фрагмент
рРНК. Все типы митохондриальных рРНК кодируются митохондриальным ге-
номом. В отличие от многих эукариот, у которых белки митохондриальных ри-
босом кодируются исключительно ядерными генами, у высших растений, крип-
томонад и золотистых водорослей более десятка рибосомальных белков коди-
руются собственным геномом. Особенность митохондриальной белоксинтези-
рующей системы растений состоит в том, что не все тРНК кодируются мито-
хондриальным геномом. Недостающие варианты тРНК транспортируются в
митохондрию из цитозоля.
Молекулярный аппарат аэробного дыхания у растений также находится
под двойным генетическим контролем. У всех эукариот растворимые фермен-
ты цикла Кребса находятся под ядерным контролем. Белки электрон-транс-
портной цепи митохондрий, напротив, обычно находятся под двойным конт-
ролем. В геноме митохондрий высших растениях кодируются около 20 белков
дыхательной цепи.
1.6.4. ТРАНСПОРТ ЦИТОЗОЛЬНЫХ БЕЛКОВ В МИТОХОНДРИИ
/
Транспорт цитозольных белков в митохондрии по механизму похож на транс-
порт в хлоропласты, но основан на других сигнальных последовательностях и
других транспортных системах. Чаше всего кодируемые ядром митохондриаль-
ные белки синтезируются с N-терминальной лидерной областью, называемой
пресиквенсом. Многие пресиквенсы формируют положительно заряженную ам-
38
фипатическую а-петлю. Гидрофобные остатки аминокислот пресиквенса рас-
положены на одной поверхности петли, а заряженные остатки — на другой.
Пресиквенс обеспечивает транспорт белка в матрикс митохондрий, после чего
расщепляется эндопептидазой. Перенос белков происходит в специальных участ-
ках «слипания» внешней и внутренней мембраны митохондрий. В них мембра-
ны не сливаются, но очень тесно контактируют в области площадью 4 — 6 нм.
Эти участки занимают приблизительно от 5 до 10% поверхности наружной
мембраны. В переносе белков участвуют шапероны. Для переноса белков в ми-
тохондрию необходимы АТФ и градиент электрохимического потенциала на
мембране.
Транспорт белков во внутреннюю мембрану и межмембранное простран-
ство, как и у хлоропластов, требует двух сигналов. Такие белки обладают вто-
рым пресиквенсом — гидрофобной последовательностью аминокислот, рас-
положенной сразу после N-концевого пресиквенса.
1.6.5. ФУНКЦИИ МИТОХОНДРИЙ РАСТЕНИЙ
Митохондрии растений, аналогично пластидам, помимо своей основной
задачи — окислительного фосфорилирования — имеют ряд дополнительных
функций. Это прежде всего биосинтез некоторых соединений растительной клет-
ки: ряда аминокислот, фолата, тимидилата. В митохондриях проходят важные
метаболические процессы, например декарбоксилирование и дезаминирова-
ние аланина в системе фотодыхания.
1.7. ПЕРОКСИСОМЫ
Пероксисомы (иногда их называют микротельцами) — обязательные орга-
неллы эукариотической клетки, в основном округлой формы и размером в
пределах 0,2— 1,5 мкм. Они существенно отличаются от митохондрий и хло-
ропластов. Прежде всего пероксисомы имеют только одну мембрану и не со-
держат ДНК и рибосом. У них нет собственного генома, поэтому все их белки
поставляются из цитозоля. Функции пероксисом в значительной степени зави-
сят от типа клеток, которым они принадлежат.
Подобно митохондрии, пероксисома является одним из главных центров
утилизации кислорода в клетке Существует красивая гипотеза, согласно кото-
рой пероксисома — это древняя органелла, которая выполняла в примитив-
ных клетках все функции метаболизма кислорода. Когда в результате возник-
новения оксигенного фотосинтеза в атмосфере начал накапливаться кисло-
род, для большинства древних анаэробов он оказался весьма токсичным. В этих
условиях вполне вероятным было возникновение специальной органеллы —
предка пероксисомы, в функции которой входило снижение концентрации
кислорода в клетках. При этом представлялась возможность использовать кис-
лород для проведения целого ряда окислительных реакций. Однако появивши-
еся в результате симбиогенеза митохондрии оказались гораздо более «выгод-
ными» органеллами, так как реакции, ранее протекавшие в пероксисомах без
производства энергии, теперь за счет окислительного фосфорилирования мог-
39
ли образовывать АТФ. Таким образом, появление митохондрий сделало перо-
ксисомы в значительной мере ненужными органеллами. Несмотря на это пе-
роксисомы сохранились в современных эукариотических клетках и выполняют
целый ряд реакций, связанных с утилизацией кислорода. Механизм протека-
ющих в этих органеллах реакций достаточно уникален: пероксисомы использу-
ют в реакциях окисления молекулярный кислород с образованием перекиси
водорода (отсюда произошло их название):
RH2 + О2 —R + Н2О2
Кроме окислительных ферментов пероксисома обязательно содержит ката-
лазу. Каталаза разлагает образовавшуюся перекись водорода, поскольку она
также достаточно токсична. Разложение идет с пользой для клетки: оно ис-
пользуется для окисления множества субстратов, например фенолов, муравь-
иной кислоты, формальдегида, спирта. Этот тип окислительных реакций осо-
бенно важен для обезвреживания (окисления) ксенобиотиков (токсичных орга-
нических соединений антропогенного происхождения):
Н2О2 + R'H2 —► R' + 2Н2О
Пероксисомы представляют собой разнообразные органеллы, содержащие
сильно различающиеся наборы ферментов в разных клетках даже одного и
того же организма. В некоторых случаях в зависимости от условий изменяются
и размеры пероксисом.
У растений хорошо изучены три типа пероксисом. Пероксисомы в листьях
являются ключевыми органеллами в процессе фотодыхания (см. гл. 3). Перок-
сисомы в прорастающих семенах служат для превращения жирных кислот, за-
пасенных в липидах семян, в сахара, которые используются для роста форми-
рующегося растения. Пероксисомы этого типа носят название глиоксисом, так
как превращение жиров в сахара происходит в серии реакций, известных под
названием глиоксилатного цикла (см. гл. 3). В животных клетках глиоксилатный
цикл отсутствует, поэтому они не способны превращать жирные кислоты,
содержащиеся в жирах, в углеводы. Третий тип пероксисом характерен для
растений, использующих ризобиальный симбиоз для фиксации азота.
Все мембранные белки пероксисом поступают из цитозоля. Вероятно, ли-
пиды, требуемые для построения новой мембраны пероксисом, также посту-
пают в них за счет обмена (без процесса слияния мембран) с мембранами ЭР,
где они синтезируются. Процесс осуществляют специальные ферменты типа
флипаз.
Существует по крайней мере два разных сигнала, ответственных за транс-
порт белков в пероксисомы: PTS1 и PTS2. Первый представляет собой трипеп-
тид Ser-Lys-Leu или близкие к нему варианты. Этот сигнал имеют большин-
ство белков, предназначенных для матрикса пероксисом. В отличие от боль-
шинства других сигнальных участков, эта короткая последовательность распо-
ложена на С-конце транспортируемого белка и не удаляется после его транс-
локации в пероксисому. Удаление PTS1 прекращает импорт в пероксисому
большинства белков, однако у ряда белков он сохраняется. Для них показано
существование дополнительного сигнала транспорта PTS2, который нахо-
дится на N-конце кодирующей области белка. Чужеродные белки, соединен-
40
ные с PTS-подобными последовательностями, эффективно транспортируются
в пероксисомы. Пероксисомы содержат как минимум один уникальный белок,
расположенный на обращенной к цитозолю поверхности их мембраны, кото-
рый работает в качестве рецептора, распознающего сигнал на импортируе-
мом белке.
Новые пероксисомы всегда возникают из предсуществующих и формиру-
ются путем роста и деления органеллы, т. е. размножаются подобно митохонд-
риям и хлоропластам. Это свидетельствует в пользу гипотезы о независимом
происхождении пероксисом.
1.8. ЦИТОСКЕЛЕТ
Цитоплазма эукариотических клеток пронизана трехмерной сетью из бел-
ковых нитей, называемой цитоскелетом. В зависимости от диаметра нити раз-
деляются на микрофиламенты (6 — 8 нм) и микротрубочки (около 25 нм). Все
эти волокна представляют собой полимеры, состоящие из субъединиц особых
глобулярных белков (рис. 1.16).
1.8.1. АКТИН
Микрофиламенты (актиновые нити) состоят из белка актина, наиболее
распространенного в эукариотических клетках. Актин может существовать в
виде мономера (G-актин, «глобулярный актин») или полимера (F-актин, «фиб-
риллярный актин»). G-актин — асимметричный глобулярный белок (42 кДа),
состоящий из двух доменов. По мере повышения ионной силы G-актин обра-
тимо агрегирует, образуя линейный скрученный в спираль полимер F-актин.
Молекула G-актина несет прочно связанную молекулу АТФ, которая при пе-
реходе в F-актин медленно гидролизуется до АДФ, т. е. F-актин имеет свойства
АТФазы.
При полимеризации G-актина в F-актин ориентация всех мономеров оди-
накова, поэтому F-актин обладает полярностью. Волокна F-актина имеют два
разноименно заряженных конца: (+) и (-), которые полимеризуются с раз-
личной скоростью. В растительной клетке эти концы не стабилизированы спе-
циальными белками (как, например, в мышечных клетках), и при критиче-
ской концентрации F-актина (+)-конец будет удлиняться, а (-)-конец укорачи-
ваться. В условиях эксперимента этот процесс может быть ингибирован токсина-
ми грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-кон-
цом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из
плесневых грибов, обладающий свойством цитостатика) присоединяется к
(+)-концу, блокируя полимеризацию.
В цитоплазме клеток имеется более 50 различных типов актинассоцииро-
ванных белков, которые специфически взаимодействуют с G- и F-актином.
Эти белки выполняют различные функции: регулируют объем G-актинового
пула (профилин), оказывают влияние на скорость полимеризации G-актина
(виллин), стабилизируют концы нитей F-актина (фрагин, р-актинин), сши-
вают филаменты друг с другом или с другими компонентами (как, например,
41
(-)-конец
Движение
актина
А
F-актин
(полимерный)
Рис. 1.16. Схема строения элементов цитоскелета:
А — строение мономерного (G) и полимерного (F) актина; принцип движения актина; Б —
строение микротрубочек тубулина; принцип их сборки и разборки
42
Рис. 1.17. Актин-ассоциированпые белки:
а — разъединяющие; б — «блокировочные»; в — «скрещивающие»; г — связующие;
д — «моторные»
виллин, а-актинин, спектрин) или разрушают спираль F-актина (гель-золин).
Активность актин-ассоциированных белков регулируется ионами Са + и про-
теинкиназами (рис. 1.17).
1.8.2. ТУБУЛИН
Микротрубочки построены из глобулярного белка тубулина, представля-
ющего собой димер а- и р-субъединиц (53 и 55 кДа). Гетеродимеры аир образу-
ют линейные цепочки, называемые протофиламентами; 13 протофиламентов
образуют циклический комплекс, затем кольца полимеризуются в длинную
трубку. Как и микрофиламенты, микротрубочки представляют собой динами-
ческие полярные структуры с (+)- и (-)-концами. Конец (-) стабилизирован за
счет связывания с центросомой (центр организации микротрубочек), в то вре-
мя как для (+)-конца характерна динамическая нестабильность. Он может либо
медленно расти, либо быстро укорачиваться. Тубулиновые мономеры связыва-
ют ГТФ, который медленно гидролизуется в ГДФ. С микротрубочками ассоци-
ируют два вида белков: структурные белки МАР и белки-транслокаторы.
1.8.3. БЕЛКИ ПРОМЕЖУТОЧНЫХ ВОЛОКОН
Для цитоскелета животных клеток характерно наличие промежуточных во-
локон. Типичными представителями таких белков являются цитокератины,
десмин, виментин, кислый фибриллярный глиапротеин. Все эти белки имеют
в центральной части базовую стержневую структуру — суперспирализованную
а-спираль. Такие димеры ассоциируют антипараллельно, образуя тетрамер.
Агрегация тетрамеров по принципу «голова к голове» дает протофиламент.
43
Восемь протофиламентов образуют промежуточное волокно. В отличие от мик-
рофиламентов и микротрубочек свободные мономеры промежуточных воло-
кон едва ли встречаются в цитоплазме. Их полимеризация ведет к образованию
устойчивых неполярных полимерных молекул.
Белки подобного типа обнаружены в растительных клетках, однако форми-
рование типичных промежуточных волокон не зарегистрировано.
1.8.4. ФУНКЦИИ ЦИТОСКЕЛЕТА
Цитоскелет выполняет три главные функции:
1) формирует механический каркас, который придает клетке форму и обес-
печивает связь между мембраной и органеллами; каркас представляет собой ди-
намичную структуру, которая постоянно обновляется по мере изменения вне-
шних условий и состояния клетки. Для растительной клетки, имеющей жест-
кую клеточную стенку, формообразующая роль цитоскелета несущественна;
2) действует как «мотор» для клеточного движения: компоненты цитоске-
лета определяют деление клеток, перемещение органелл, движение цитоплаз-
мы (моторная функция цитоскелета также более важна для животных клеток);
3) служит «рельсами» для транспорта органелл и других крупных комплек-
сов внутри клетки.
1.9. ЭНДОМЕМБРАННЫЕ СТРУКТУРЫ
РАСТИТЕЛЬНОЙ КЛЕТКИ
1.9.1. ЭНДОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ (ЭР)
1.9.1.1. Общая характеристика растительного ЭР
Эндоплазматический ретикулум (ЭР) представляет собой непрерывную трех-
мерную сеть канальцев, составленную из пластинчатых и трубчатых цистерн.
Канальцы ЭР образованы одинарной мембраной (мембраной ЭР), на которую
приходится более половины общего количества всех мембран клетки. Канальцы
лежат под плазмалеммой, пронизывают всю цитоплазму и соединяются с ядер-
ной оболочкой. Несмотря на многочисленные складки и изгибы, мембрана ЭР
образует непрерывную поверхность, ограничивающую единое внутреннее про-
странство — называемое полостью, или люменом ЭР. Оно часто занимает более
10 % общего объема клетки. Таким образом, полость ЭР отделена от цитозоля
только одинарной мембраной. Обмен молекул между ЭР и цитозолем происхо-
дит через мембрану преимущественно по мономолекулярному механизму. Осо-
бенностью ЭР растительной клетки является то, что его полость простирается
не только внутри отдельной клетки, но за счет плазмодесм — и вне ее границ.
Эндоплазматический ретикулум, расположенный под плазматической мемб-
раной, носит название кортикального. Он характеризуются практически не-
подвижным фиксированным расположением спиралеобразных участков сети и
канальцев со слепыми окончаниями. Кортикальный ЭР может выполнять функ-
44
Рис. 1.18. Основные области растительного ЭР
45
ции неподвижного фиксатора для актиновых филаментов цитоскелета, кото-
рые осуществляют движение цитоплазмы. Трубчатые элементы ЭР, находящи-
еся во внутренних слоях клетки, характеризуются большей подвижностью. В от-
личие от животных клеток, где реорганизация ЭР цистерн и канальцев зави-
сит от микротрубочек цитоскелета, движение ЭР в растительных клетках, по-
видимому, зависит от актино-миозиновой системы.
Мембранная система ЭР — наиболее универсальная и адаптивная органел-
ла эукариотических клеток. Эта гибкость обусловлена большой мембранной
поверхностью, способной включать различные наборы интегральных и пери-
ферийных белков.
Основные функции ЭР — синтез, обработка и сортировка белков, глико-
протеидов и липидов. На мембранах ЭР начинается синтез белков, предназна-
ченных для транспорта по секреторному пути. Здесь же синтезируются боль-
шинство липидов для мембран митохондрий и пероксисом. ЭР является также
важным участником сигнальных систем клетки, регулируя цитозольную кон-
центрацию кальция.
Принято выделять две области ЭР — шероховатый и гладкий ЭР, однако в
последнее время в ЭР было идентифицировано несколько специализирован-
ных областей, отличных «классических». В частности, в растительных клетках
можно выделить зону «шлюза» между ЭР и оболочкой ядра, области фиксации
актиновых филаментов, формирования белковых и масляных тел, образования
вакуолей, контактов с плазмалеммой, вакуолью и с митохондриями; области
плазмодесм и рециркуляции липидов (рис. 1.18).
1.9.1.2. Функциональные области растительного ЭР
Шероховатый и гладкий ЭР существуют в динамическом равновесии. Они
различаются соответственно по присутствию или отсутствию рибосом на мемб-
ранной поверхности. Гладкий ЭР состоит из трубчатых канальцев, а шерохова-
тый ЭР — из уплощенных цистерн.
Исходной структурой ЭР являются трубчатые канальцы, характерные для
гладкого ЭР. При формировании шероховатого ЭР появляются чисто простран-
ственные ограничения, связанные с прикреплением на мембраны ЭР рибосом
(полисом). Это приводит к уплощению трубчатых канальцев. Таким образом,
различия между шероховатым и гладким ЭР обусловлены закреплением рибо-
сом на мембранах ЭР. Закрепление первой рибосомы на ЭР способствует обра-
зованию рядом дополнительных рецепторов и каналов транслокации. Это при-
водит к закреплению новых рибосом и локальному расширению шероховатого
ЭР возле данной области, т. е. фактически происходит самосборка шероховато-
го ЭР (рис. 1.19).
Шероховатый ЭР — место отправления белков по секреторному пути. Боль-
шинство растворимых белков, предназначенных для этого, синтезируются в
виде предшественников с транзиентным N-концевым сигнальным пептидом
для мембраносвязанных полисом. Полипептиды котрансляционно транспорти-
руются в полость ЭР, после чего сворачиваются и подвергаются определенным
модификациям. Прежде всего соответствующая пептидаза отщепляет сигналь-
ный пептид. Сворачивание белков в большой степени осуществляется за счет
образования дисульфидных мостиков между остатками цистеинов. Правиль-
46
Рис. 1.19. Синтез белка в шероховатом ЭР
ность положения образования этих мостиков контролирует фермент протеин-
дисульфидизомераза.
Наиболее важной модификацией белков, поступивших в ЭР, является их
N-гликозилирование. Исходно в ЭР формируются 14-членные олигосахариды
определенной структуры. Они присоединены к находящемуся в мембране ЭР
долихолу — изопреноиду, состоящему из различного (от 14 до 24) числа изо-
преновых единиц. За счет долихола олигосахариды фиксируются на мембране
и «ожидают» белки, поступающие в просвет ЭР. По мере поступления белка
специфичные трансферазы переносят олигосахаридный фрагмент от долихола
на определенный остаток аспарагина белка. Олигосахарид, используемый для
N-гликозилирования белков ЭР, в растительной и животной клетке имеет раз-
личную структуру (рис. 1.20).
Правильное сворачивание растущей полипептидной цепи обеспечивают
шапероны. Эти резидентные белки фиксируют растущий полипептид и направ-
ляют процесс сворачивания, ограничивая нежелательные взаимодействия. Наи-
более важное значение имеют люмен-связанный шаперон Bip. Белки, которые
не в состоянии сформировать правильную трехмерную структуру, в конечном
счете подвергаются деградации. Некоторые белки, не свернутые должным об-
разом в ЭР, возвращаются в цитозоль обратным переносом через мембрану ЭР.
Если белок, поступивший в ЭР, имеет С-концевой сигнальный тетрапептид
KDEL, он остается в ЭР, а при отсутствии этой последовательности отправля-
ется в аппарат Гольджи.
Функциональные свойства гладкого ЭР растительных клеток изучены недо-
статочно. По-видимому, одна из основных его функций — синтез липидных
молекул. Мембраны гладкого ЭР обогащены ферментами биосинтеза глицеро-
липидов, изопреноидов, фенилпропаноидов, флавоноидов, восков. Косвен-
ное свидетельство синтеза подобных соединений ферментами, расположен-
ными в ЭР, получено при изучении ультраструктуры железистых клеток, осу-
47
Исходный гликан N-гликозилированных
белков эукариотических клеток
-C-NH-CH-C-NH-
О N-Ацетилнейраминовая кислота
О N-Ацетилглюкозамин
О Манноза
О Галактоза
ф Фукоза
Ксилоза
Гликан N-гликозилированных
белков животных
Рис. 1.20. Различия в гликозилировании белков в ЭР растительной и животной клетки:
А — схема строения гликанов N-гликозилированных белков растительной и животной клеток;
Б — схема формирования гликана N-гликозилированных белков в ЭР растительной клетки
ществляющих синтез и секрецию масел и флавоноидов. Эти клетки содержат
обширные сети гладких ЭР мембран.
Участки формирования белковых тел. Запасные белки семян синтезируют-
ся в течение развития семени и служат основным источником аминокислот
при прорастании и развитии проростка. Этот процесс различен у разных видов
растений. Хлебные злаки синтезируют два класса запасных белков. Водораство-
римые глобулины синтезируются рибосомами шероховатого ЭР и затем транс-
портируются через АГ к запасающим вакуолям. Более гидрофобные проламины
кукурузы, сорго и пшеницы образуют белковые тела непосредственно в поло-
48
Рис. 1.21. Формирование масляных (А) и белковых (Б) тел в ЭР
сти шероховатого ЭР. При этом синтезируемые молекулы белка остаются свя-
занными с Bip в течение длительного периода времени, а затем самооргани-
зуются в большие агрегаты (рис. 1.21). Эти агрегаты могут увеличиваться за счет
«поимки» полисом, синтезирующих проламин. Полисомы, образующие другие
полипептиды, агрегатами не захватываются.
Участки формирования масляных тел. Триацилглицериды — запасающие
масла семян, которые на ранних стадиях прорастания обеспечивают их энер-
гией и липидами — строительными блоками образующихся мембран. Эти мо-
лекулы жиров синтезируются ЭР-связанными ферментами и запасаются в виде
сферических масляных тел. Размер масляных тел зависит от вида растения и
варьирует от 0,6 до 2,0 мкм.
Масляные тела возникают путем накопления молекул триацилглицеридов в
специальных местах ЭР. Эти места определены присутствием олеозинов — ин-
тегральных белков мембран массой 16 — 25 кДа. Олеозины имеют «кнопкопо-
добную» структуру и подобно кнопкам вставлены в ЭР мембраны масляных
тел. «Острие» кнопки состоит из 72 гидрофобных остатков аминокислот, орга-
низованных в форме антипараллельного p-скрученного домена, который при-
соединен своими обоими концами к «шляпке». Присутствие олеозинов, по-
видимому, заставляет вновь синтезируемые молекулы триацилглицеридов на-
капливаться между биослоями мембраны и образовывать сферические масля-
ные тела, которые затем отпочковываются от ЭР (см. рис. 1.21). Каждое масля-
ное тело окружено фосфолипидным монослоем, который содержит, помимо
плотно упакованных олеозинов, и другие характерные белки. Размер масляных
тел зависит от соотношения триацилглицеридов и олеозинов.
Область рециркуляции липидов. В плазмалемму постоянно встраиваются ве-
зикулы, отшнуровывающиеся от АГ, что приводит к увеличению ее поверхно-
сти. Обычно избыточный материал плазматических мембран возвращается внутрь
клетки за счет эндоцитоза. Однако в растительных клетках эндоцитоз значи-
тельно осложнен, так как тургорное давление препятствует впячиванию плаз-
малеммы в цитозоль и формированию везикул. Оказалось, что возврат (рецир-
49
куляция) липидов в растительной клетке происходит путем их перемещения
из плазмалеммы в ЭР. Этот процесс происходит в специальных областях, где
плазматическая мембрана образует складку и пальцеподобный контакт с ЭР.
Поскольку в этих местах не происходит слияния между ЭР и плазматический
мембраной, предполагается, что рециркуляция липидов в зоне контакта про-
исходит по мономолекулярному механизму.
Трубчатые участки ЭР являются структурной основой формирования плаз-
модесм. Плазмодесмы обеспечивают взаимосвязь между клетками растения.
Первичные плазмодесмы образуются в течение цитокинеза, когда пакеты труб-
чатого ЭР «захватываются» строящейся срединной пластинкой, которая фор-
мирует новую клеточную стенку. Вторичные плазмодесмы образуются после
формирования клеточных стенок. Механизм их образования включает ограни-
ченное растворение клеточной стенки и формирование мостов между плазма-
тической мембраной и ЭР смежных клеток.
Установлена физическая непрерывность как плазматических мембран двух
смежных клеток, так и центрального цилиндра сжатой мембраны ЭР. При ис-
пользовании флуоресцентных мембранных липидных зондов было показано,
что от ЭР одной клетки к ЭР смежной клетки быстро диффундируют только те
липиды, которые преобладают в мембранах ЭР. Липиды, характерные исклю-
чительно для наружного слоя плазматической мембраны, через плазмодесмы
не передвигаются, несмотря на физическую непрерывность плазматической
мембраны соседних клеток.
Пространство между плазматической мембраной и центральным ЭР ци-
линдром называется «эндоплазматическим кольцом». Оно содержит спице-
образные линкерные белки, ограничивающие размер молекул, которые могут
проходить по плазмодесме между клетками.
До недавнего времени плазмодесмы в целом рассматривали как функцио-
нальные эквиваленты щелевых контактов животных клеток, так как экспери-
менты с мечеными молекулами показали, что эти два межклеточных перехода
имеют сходные «пропускные» пределы для транспортируемых молекул — око-
ло 900 Да. Однако, по-видимому, правильнее сравнивать их с ядерными пора-
ми, прежде всего из-за способности достаточно быстро увеличивать степень
открытия. При этом становится возможным проход через плазмодесмы боль-
ших молекул, в том числе белков, вирусных нуклеопротеидных комплексов и
даже интактных вирионов. Транспорт вирусов через плазмодесмы — принци-
пиальный момент в инфекционном процессе. Это свойство растительных виру-
сов позволило идентифицировать и охарактеризовать вирусные белки «движе-
ния», которые обладают способностью увеличивать «пропускной» предел плаз-
модесм, позволяя вирусу распространяться по всему растению.
1.9.2. АППАРАТ ГОЛЬДЖИ
Аппарат (или комплекс) Гольджи (АГ) занимает центральную позицию в сек-
реторном пути транспорта макромолекул. Он получает вновь синтезируемые
белки и липиды от ЭР и направляет их либо к поверхности клетки, либо к
вакуолям. У растений в АГ происходит сборка сложных полисахаридов матрикса
клеточной стенки, синтез и процессинг углеводных фрагментов О- и N-гли-
50
копротеинов. Гликозилтрансферазы и гликозидазы, которые осуществляют эти
реакции, являются интегральными белками мембран АГ. Специфичные мемб-
ранные белки-переносчики поставляют нуклеотиды сахаров из цитозоля к гли-
козилтрансферазам, которые синтезируют различные углеводные продукты.
Принципиальное различие в функционировании аппарата Гольджи и си-
стемы ЭР связано с механизмом транспортировки синтезируемых и/или обра-
батываемых продуктов внутри органеллы. Эндоплазматический ретикулум пред-
ставляет собой единую полость, и молекулы имеют возможность распреде-
ляться по всей органелле. Аппарат Гольджи состоит из отдельных цистерн, и
синтезируемые им продукты последовательно перемещаются между ними пу-
тем везикулярного транспорта.
1.9.2.1. Строение растительного АГ
Функциональная единица АГ растительной клетки представляет собой стоп-
ку цистерн, ассоциированную с ними транс-Гольджи-сеть и Гольджи-матрикс,
который окружает обе структуры. Количество единиц АГ в клетке может варьи-
ровать в зависимости от ее вида, размера и стадии развития, а также от объема
и типа секретируемых клеткой молекул. Например, маленькие клетки апикаль-
ной меристемы иван-чая {Epilobium) содержат приблизительно 20 единиц АГ,
тогда как клетки хлопка {Gossipium), продуцирующие волокна, — более 10 000.
Стопки цистерн АГ носят название диктиосом, или стеков. Диктиосома
включает 5 — 8 уплощенных цистерн. Цистерны морфологически полярны и
имеют формирующуюся {цис-) и секреторную {транс-) сторону. Цис-сторона
тесно связана с переходными элементами ЭР. Транс -сторона расширяется, образуя
трубчатый ретикулум, называемый /лронс-Гольджи-сетью (рис. 1.22).
Т/и/нс-Гольджи-сеть (ТГС) — искривленная, полигональная сетчатая струк-
тура, построенная из канальцев с гладкой поверхностью. Она может иметь
контакты с несколькими единицами АГ. От ТГС отделяется множество вези-
кул, которые транспортируют различные молекулы к вакуолям или плазма-
лемме. ТГС представляет собой главный пункт разветвления секреторного пути:
в частности, белки, предназначенные для экзоцитозного транспорта, отделя-
ются от белков, направляемых в вакуоли. Размеры ТГС зависят от типа клетки.
Гольджи-матриксом называют тонкую нитевидную сетчатую структуру, ко-
торая окружает диктиосомы и ТГС. В Гольджи-матриксе нет рибосом и цито-
зольных белков. Предполагают, что в его функции входит защита диктиосом и
предотвращение потерь транспортных везикул.
Со стопками Гольджи всегда ассоциировано множество мелких (диаметром
около 60 нм), ограниченных мембраной пузырьков (везикул). Они группиру-
ются на стороне, примыкающей к ЭР, а также по периферии стопки вблизи
расширенных краев каждой цистерны. Полагают, что эти пузырьки {везикулы
Гольджи) переносят белки и липиды в АГ и транспортируют их между цистер-
нами.
В животной клетке АГ, как правило, располагается вблизи центра клетки.
В растительной клетке, напротив, комплексы Гольджи (диктиосомы + ТГС)
обычно рассеяны по всей цитоплазме — либо по одиночке, либо небольшими
группами. Подобная локализация, а также актинзависимое передвижение дик-
тиосом по цитоплазме гарантируют, что даже в большой вакуолизированной
51
Рис. 1.22. Схема строения растительного аппарата Гольджи.
Оболочки везикул: 1 — везикулы, содержащие белки оболочки СОР (Coat Protein); 2 — везику-
лы без белкового покрытия; 3 — везикулы, покрытые клатрином (окаймленные везикулы)
растительной клетке секретируемые вещества будут доставлены по назначе-
нию. Анализ характера движений диктиосом показал, что они движутся по
типу «остановились-пошли» («stop-and-go»). Это послужило основанием для
гипотезы, согласно которой диктиосомы могут делать паузу у экспортных уча-
стков ЭР, чтобы «принять груз», а также недалеко от формирующейся клеточ-
ной стенки, чтобы «разгрузиться».
В растительной клетке АГ остается структурно целостным и функционально
активным в течение митоза, что необходимо для формирования мембран и
макромолекул срединной пластинки. Новые диктиосомы образуются путем
деления, которое может начинаться как с цис-, так и с транс-стороны. Это
обычно происходит в течение фазы G2 клеточного цикла.
1.9.2.2. Транспорт продуктов в аппарате Гольджи
Стопки Гольджи состоят из морфологически неоднородных типов цистерн,
содержащих различный набор ферментов и выполняющих разные функции.
Цис-цистерны являются «станциями приемки» продуктов, транспортируемых
в везикулах от ЭР. После первого цикла обработки продукты транспортируют-
ся к промежуточным цистернам, затем — к /лронс-цистернам и, наконец, от-
правляются в ТГС. Трянс-цистерны Гольджи и ТГС имеют наиболее кислый pH
по сравнению с другими компартментами АГ. Это связано с активностью в их
52
мембранах Н+-АТФазы V-типа (см. ниже). Помимо регуляции ферментов, на-
ходящихся в этих компартментах, низкий pH, по-видимому, способствует
формированию транспортных везикул.
Большинство везикул, отпочковывающихся от цистерн Гольджи и ТГС,
имеют белковую оболочку (см. рис. 1.22). Она выполняет несколько функций:
определяет типы молекул, помещаемые в данную везикулу, контролирует про-
цесс формирования везикулы и, самое главное, определяет «место назначе-
ния» данной везикулы, так как ряд белков оболочки специфичны по отноше-
нию к мембране «назначения» везикулы.
Везикулы, участвующие в транспортных путях ЭР -> Гольджи, Гольджи ->
-> Гольджи и Гольджи -> ТГС, отпочковываются от мембран за счет механиз-
ма, использующего специальные белки оболочки — СОР (от англ, coat protein).
После завершения формирования везикулы большинство белков отделяются
от нее и могут участвовать в образовании другой везикулы.
У везикул, которые формируются в ТГС и предназначены для экспорта ва-
куолярных ферментов и запасных белков, оболочки содержат белок клатрин
(рис. 1.22). Покрытые клатрином везикулы, называемые окаймленными пузырь-
ками, транспортируют вещества исключительно в вакуоли. Молекулы, не по-
павшие в окаймленные пузырьки, впоследствии упаковываются в везикулы
другого типа, которые отправляют их к клеточной поверхности. Этот вариант
транспорта известен как «путь дефолта». Покрытые клатрином везикулы с раз-
личными «адаптерными» белками участвуют также в поглощении растворимых
и мембранных белков в процессе эндоцитоза.
1.9.2.3. Функции аппарата Гольджи растительных клеток
Аппарат Гольджи участвует в сборке углеводных фрагментов N- и О-свя-
занных гликопротеидов и протеогликанов, а также в синтезе сложных полиса-
харидов. Одна из основных функций гликозилирования — защита белков от
протеолиза. В ряде случаев углеводные группы могут участвовать во взаимо-
действии клеточной стенки с плазмалеммой, определять правильное свора-
чивание белка или регулировать образование белковых ассоциаций. Большин-
ство белков, имеющих N-гликозилирование, являются ферментами, тогда как
0-гликозилированные белки часто выполняют структурные роли. Как N-, так
и О-связанные гликаны представляют собой боковые цепи гликозилирован-
ных арабиногалактанов.
Синтез N-связанных гликопротеидов начинается в ЭР, где на поступающие
в люмен ЭР белки переносятся от долихола 14-членные олигосахариды. После-
дующая обработка олигосахарида, включающая систематическое удаление остат-
ков маннозы и введение остатков других сахаров, происходит в АГ. Ферменты,
вовлеченные в этот процесс, упорядоченно распределены по цис-, промежу-
точным и /и/л7нс-цистернам в соответствии с последовательностью реакций
формирования конкретного N-связываемого гликана.
Относительно образования О-гликозилированных белков в АГ известно мень-
ше. Гликозилирование — важный момент образования многих структурных бел-
ков клеточной стенки (см. ниже). Сахара, главным образом арабиноза и галак-
тоза, присоединяются к гидроксилсодержащим аминокислотам — гидрокси-
пролину, серину и треонину. Посттранскрипционное образование гидрокси-
53
пролина в белке происходит скорее всего в ЭР, тогда как О-гликозилирование
белка — в г<ис-цистернах АГ.
Наиболее важной функцией растительного аппарата Гольджи следует счи-
тать синтез полисахаридов. В АГ синтезируются все полисахариды клеточной
стенки, за исключением целлюлозы и каллозы. Полная картина синтеза этих
соединений не ясна, однако известен ряд интересных деталей. Установлено, в
частности, что в синтезе пектиновых соединений участвуют ферменты, распо-
ложенные во всех цистернах аппарата Гольджи, тогда как ферменты, ответ-
ственные за синтез ксилогликанов, расположены преимущественно в транс-
цистернах и ТГС.
1.9.3. ВАКУОЛИ
Вакуоли растительных клеток были обнаружены в ранних микроскопиче-
ских исследованиях. Как следует из этимологии названия («вакуоль» — от сло-
ва «вакуум»), первоначально они были определены как «пустые», т.е. свобод-
ные от цитоплазмы части клетки. Вакуоли растительной клетки весьма разно-
образны по форме, размеру, своему содержимому и функциональной роли.
Отдельная клетка может содержать несколько видов вакуолей.
Вакуолями называют органеллы, заполненные жидкостью и окруженные
одинарной мембраной — тонопластом. Вакуоли обычно занимают более 30 %
объема клетки. Клетки апикальных меристем, как правило, содержат много
маленьких вакуолей, которые сливаются в одну или несколько больших ваку-
олей по мере роста и развития клетки. В большой зрелой растительной клетке
вакуоль может занимать до 90 % ее объема.
1.9.3.1. Общая характеристика вакуолей растительной клетки
Вопрос, почему растительная клетка имеет столь значительную по разме-
рам вакуоль, является одним из наиболее интересных в физиологии растений.
Ответ на него можно искать исходя из способа существования растений —
прежде всего фототрофности. Для эффективного фотосинтеза фиксированного
в пространстве организма необходима большая площадь поглощающей свет
поверхности. Именно поэтому большинство листьев имеет плоскую форму. На
клеточном уровне также необходимо увеличение поверхности клетки. Возмож-
но, в этом и состоит главная причина увеличения объема вакуолярного ком-
партмента клетки. Такой способ увеличения размеров клеток, по-видимому,
экономически наиболее выгодный («дешевый»), так как не требует увеличе-
ния объема цитозоля — метаболически «дорогого», обогащенного азотом ком-
партмента клетки. Последнее особенно важно, так как растения «добывают»
азот с большим трудом и со значительными энергетическими затратами. Фор-
мируя большой объем клетки за счет «недорогого» вакуолярного содержимо-
го, главным образом воды и минеральных солей, растение способно карди-
нально снизить затраты на создание больших плоских структур — листьев,
эффективных солнечных коллекторов.
Увеличение размеров (растяжение) растительной клетки происходит за счет
осмотического поглощения воды вакуолью и изменения прочности клеточной
54
стенки. Вода, поглощаемая вакуолью, создает тургорное давление, которое не
только расширяет первичную клеточную стенку, но и обеспечивает тургор
клетки (см. гл. 5 «Водный обмен). Для поддержания высокого осмотического
потенциала вакуоли расширяющихся клеток в нее должны постоянно посту-
пать соли и/или другие соединения. Транспорт этих соединений происходит
активно, за счет электрохимического градиента протонов на тонопласте. Гра-
диент ионов Н в свою очередь создается и поддерживается за счет работы двух
электрогенных протонных насосов: Н+-АТФазы V-типа (от англ, vacuolar) и
вакуолярной Н -дифосфатазы (пирофосфатазы). Таким образом, тонопласт яв-
ляется энергизованной мембраной. Основные осмотические компоненты ваку-
олярного сока представлены ионами — К+, Na+, Са2+, Mg2+, СГ, SO4 , РО4 ,
NO3 и первичными метаболитами типа аминокислот, органических кислот и
сахаров. Транспорт этих веществ осуществляется через тонопласт за счет рабо-
ты специфичных транспортеров и каналов. Перемещение воды через тонопласт
происходит также через специальные каналы — аквапорины, сформированные
специфичными для тонопласта белками — TIPs (от англ, tonoplast intrinsinc proteins).
1.9.3.2. Функции вакуолей
В растительной клетке вакуоли представляют собой мультифункциональные
органеллы, которые играют ключевую роль в клеточных стратегиях развития
растения. Функционально вакуоли являются органеллами, которые находятся
в конце секреторного пути растительных клеток. Экспериментальные данные
свидетельствуют, что содержимое растительных вакуолей образуется как из
внутриклеточного материала, так и за счет эндоцитоза.
Основные функции вакуолей. Хранение. Кроме ионов, сахаров, полисахари-
дов, пигментов, аминокислот и органических кислот, в вакуолях растения
хранится также большое количество белка. Особенно это характерно для ваку-
олей семян. Все перечисленные первичные метаболиты могут быть востребова-
ны из вакуолей и использоваться в метаболизме клетки.
Лизис веществ. Вакуоли содержат те же типы кислых гидролаз, что и лизо-
сомы животной клетки. Эти ферменты — протеазы, нуклеазы, гликозидазы и
липазы — вместе способны обеспечить процесс разборки и рециклизации прак-
тически любых компонентов клетки. Подобная рециркуляция необходима не
только для нормального метаболизма клеточных структур, но и для возврата
ценных питательных веществ в течение запрограммированной смерти клетки,
связанной с развитием и старением.
Регулирование pH и ионный гомеостаз. Большие вакуоли служат резервуара-
ми для протонов и метаболически важных ионов, например кальция. Как пра-
вило, вакуоли растения имеют pH между 5,0 и 5,5, однако диапазон измене-
ния pH простирается от 2,5 (или ниже — вакуоли клеток плода лимона) до
более чем 7,0 (вакуоли, запасающие белки). Контролируя поток протонов и
других ионов из вакуолей в цитозоль, клетки могут регулировать не только pH
цитозоля, но также и работу многих ферментов, сборку и разборку структур
цитоскелета и процессы взаимодействия (слияния) мембранных структур.
Защита от патогенов и травоядных. В вакуолях растительных клеток на-
капливается удивительно разнообразное количество токсичных соединений. Осо-
бенно это характерно для специализированных клеток, расположенных в стра-
55
тегически важных тканях (типа эпидермиса листа). Такая особенность позволя-
ет растению эффективно бороться с патогенами и снижать риск быть съеден-
ным насекомыми и животными. К токсичным соединениям относятся:
• фенольные соединения, алкалоиды, изопреноиды, цианогенные глико-
зиды и другие вторичные соединения;
• ферменты, разрушающие клеточные стенки, — хитиназы, глюканазы и др.;
• полимеры (латекс, каучук, гутга и др.).
Пигментация. Еще в XIX столетии было установлено, что многие пигмен-
ты находятся в вакуолях эпидермальных клеток цветков, листьев и стеблей.
Недавние исследования показали, что мембраны таких специализированных
вакуолей содержат специальные транспортные системы — АВС-переносчики
(транспортеры) (от англ. ATP binding cassette transporters). Вакуоли, содержащие
водорастворимые пигменты (антоцианы, беталаины), найдены во многих ти-
пах растительных клеток. Окраска лепестков цветка и плодов важна для при-
влечения опылителей или «распространителей» семян соответственно. Некото-
рые водорастворимые пигменты листа поглощают УФ-излучение и видимый
свет, предотвращая тем самым фотодеструкцию фотосинтетического аппарата.
Это свойство, по-видимому, наиболее существенно для листьев вечнозеленых
растений в течение зимних месяцев.
Изолирование и обезвреживание токсичных веществ. Растения не имеют воз-
можности избегать загрязненных ядовитыми и токсическими веществами мест
обитания, но могут эффективно изолировать токсичные соединения (напри-
мер, тяжелые металлы или ядовитые метаболиты типа оксалата) от метаболи-
чески активных компартментов клетки. Для этого они используют вакуоли. На-
пример, для удаления оксалата специальные клетки формируют вакуоли, со-
держащие органический матрикс, внутри которого оксалат реагирует с каль-
цием с образованием щавелевокислого кальция. В других типах растительных
клеток из цитозоля в вакуоли переносятся различные ксенобиотики. Для этого
обычно используются белки-переносчики из семейства АВС-транспортеров.
Накопление ядовитых веществ в вакуолях листа происходит достаточно часто.
С листопадом токсичные соединения устраняются из растения полностью.
1.9.3.3. Формирование вакуолей
В отличие от других мембранных систем вакуоли — единственные органеллы,
которые могут возникать путем дифференцирования из других мембранных
систем, независимо от роста и деления клетки. Вопрос об их происхождении
окончательно не решен. Были предложены две модели формирования вакуолей
de novo. Одна модель постулирует, что вакуолярный компартмент исходно об-
разуется из транс-Гольджи-сети. Согласно другой концепции, вакуоли форми-
руются из расширения частей гладкого ЭР. К настоящему времени ряд экспери-
ментальных фактов подтверждает реальность последней модели. Показано, что
в дифференцирующихся клетках кончика корня, где первоначально большая
центральная вакуоль отсутствует, моноклональные антитела к р-субъединице
вакуолярной АТФазы овса были локализованы только в провакуолях и в глад-
ком ЭР. Из ЭР образуются автофаговые вакуоли. Существуют данные, показыва-
ющие формирование вакуолей из транс-Толъджи-сети. Не исключено, что об-
разование различных вакуолей в клетке происходит несколькими способами.
56
1.9.3.4. Автофагия — особый случай формирования вакуолей
В некоторых клетках (например, клетках семенной оболочки) вакуоли мо-
гут образоваться в результате автофагии. При формировании автофаговых ва-
куолей трубчатые участки гладкого ЭР формируют пальцеобразные выросты,
которые подобно щупальцам захватывают часть цитоплазмы. Смежные «щу-
пальца» смыкаются и образуется ранняя автофагосома — эндоплазматическая
область, ограниченная двумя мембранами ЭР. После окончательного форми-
рования автофагосомы, т.е. полного отделения от цитозоля, цитоплазма в ней
деградирует, внутренняя мембрана разрушается, а наружная становится то-
нопластом. Автофагосомы имеют кислый pH и содержат много кислых гидро-
литических ферментов. В конечном счете транспорт воды, облегченный у-Т1Р-
аквапорином, приводит к быстрому расширению вакуоли. Автофагия может
повторно происходить в уже вакуолизированных клетках в ответ на голодание
(например, в суспензионных культурах клеток, лишенных сахарозы).
1.9.3.5. Два типа вакуолей растительных клеток
До недавнего времени одной из нерешенных проблем физиологии растений
был парадокс сосуществования в вакуолях запасных веществ и литических
ферментов. Сейчас установлено, что растения имеют как минимум две различ-
ные вакуолярные системы: одну для хранения, а другую для выполнения ли-
тических функций. Эти два типа вакуолей различаются кислотностью вакуо-
лярного сока: запасающие вакуоли имеют нейтральный pH, а литические —
N-концевые сигнальные последовательности (NTPP):
спорамин батата: Н—S—R—F—N—Р—I—R—L—Р~W—W—Н—G—Р—А
спорамин ячменя: S—S—S—S—F—A—D—S—N—P—I—R—Р—V—W—N~R—A—A—S—W—L~G
С-концевые сигнальные последовательности (СТРР):
лектин ячменя: V—F—A—G—A—I—A—A—N—S—W—L—V—A—G
хитиназа табака: N—G—L—L—V— D—W~М
р-глюконаза табака: V— S—G—G—V—W—D—S—S—V— G—W— N—A—W—A— S—L~V— S—G—М
Б
Рис. 1.23. Схема строения белков, транспортируемых в вакуоли (Л), и примеры сиг-
нальных последовательностей (Л):
SP — сигнальный пептид, направляющий белок в ЭР, — (7) в табл. 1.1; NTPP — N-концевой
сигнал (пропептид) вакуолярной локализации; СТРР — С-концевой сигнал (пропептид) ваку-
олярной локализации; IPP — внутренний сигнал (пропептид) вакуолярной локализации; кон-
сервативный мотив Asn-Pro-lle-Srg в NTPP подчеркнут
57
кислый, что оптимально для работы содержащихся в них протеаз и других
гидролаз. Кроме того, вакуоли различаются составом интегральных белков,
встроенных в тонопласт (TIPs). Для запасающих вакуолей характерны а-Т1Р,
тогда как Т1Р-Ма27 (у-TIP) являются маркерами литических вакуолей. Кроме
того, в запасающих вакуолях находится аквапорин 8-TIP. Наличие в клетке
двух типов вакуолярных систем также объясняет присутствие у транспортируе-
мых в вакуоли белков нескольких типов сигналов на N- и С-концах. В частно-
сти, спорамин и алеураин содержат N-терминальный сигнал, фазеолин, лек-
тин ячменя, хитиназа табака — С-терминальный. В некоторых вакуолярных
белках (например, фитогемагглютинин и легумин) сигнал локализован во
внутренней области зрелого белка. Белки, направляющиеся к запасающим ва-
куолям, обычно имеют лидерный участок на С-конце, тогда как гидролити-
ческие ферменты литических вакуолей — на N-конце. N-терминальный сигнал
обычно содержит около 20 аминокислот с мотивом Asn-Pro-Ile-Arg. С-конце-
вая сигнальная последовательность более вариабельна и содержит гидрофоб-
ные аминокислоты (рис. 1.23).
Когда в клетке образуются большие вакуоли, два типа вакуолей могут сли-
ваться. В этом случае оба маркерных белка — а-TIP и у-TIP — обнаруживаются
в мембране некоторых областей вакуолярного компартмента одновременно.
Таким образом, для вакуолей растительной клетки характерно большое раз-
нообразие форм и функций. По-видимому, цитологическое определение ваку-
олей охватывает несколько биохимически и физиологически разных структур.
Более корректно вакуоли могут быть охарактеризованы только с учетом их
функций в клетке и в связи с динамикой развития.
1.10. КЛЕТОЧНАЯ СТЕНКА
1.10.1. ОБЩАЯ ХАРАКТЕРИСТИКА КЛЕТОЧНОЙ СТЕНКИ
Стенка растительной клетки представляет собой сложный внеклеточный
матрикс, окружающий каждую клетку. Многие животные клетки, а тем более
клетки грибов, на своей поверхности также формируют внеклеточный мат-
рикс. Однако стенка растительной клетки существенно толще, прочнее и жест-
че. Она в гораздо большей степени определяет стратегию существования как
самой клетки, так и целого растения.
Стенка растительной клетки — тонко организованный сложный комплекс
многих разнообразных полисахаридов, белков и ароматических веществ. Моле-
кулярный состав и организация полимеров клеточной стенки могут быть раз-
личными у представителей разных таксонов, клеток разных тканей одного вида,
у индивидуальных клеток и даже у разных частей стенки вокруг отдельного
протопласта.
Клеточная стенка — динамичный компартмент, который изменяется в те-
чение жизни клетки. Первичная клеточная стенка образуется при делении клетки
и быстро увеличивает свою поверхность, в некоторых случаях более чем в сто
раз. При специализации (дифференциации) большинство клеток формируют
вторичную клеточную стенку, образуя сложные структуры, идеально подходя-
щие для конкретных функций специализированных клеток.
58
1.10.2. СТРУКТУРА КЛЕТОЧНОЙ СТЕНКИ
Первичная клеточная стенка состоит из двух или трех структурно независи-
мых, но взаимодействующих сетей полимеров. Каждая из сетей выполняет свои
специфические функции. Основная сеть, образующая каркас клеточной стен-
ки, построена из линейных микрофибрилл целлюлозы и соединяющих их свя-
зующих гликанов. Вторая сеть состоит из пектиновых полисахаридов. Третья
независимая сеть построена из структурных белков или фенилпропаноидов.
Существуют два основных типа клеточных стенок — тип I и тип П. Они
различаются по строению, химическому составу и принадлежат растениям
разных таксономических групп.
1.10.2.1. Сахара, участвующие в построении клеточной стенки
Полисахариды (полимеры сахаров) формируют главный структурный ос-
тов клеточной стенки. В построении всех ее углеводных полимеров обычно уча-
ствует лишь 10—11 различных моносахаридов, причем они обязательно нахо-
дятся в циклической (фуранозной или пиранозной) форме (рис. 1.24).
Полисахариды клеточных стенок принято называть по основным сахарам,
входящим в их структуру. Большинство полисахаридов имеет основную линей-
a-L-Рамноза (Rha) a-D-Глюкоза (Glc) a-D-Манноза (Man)
a-D-Галактоза (Gal)
a-D-Апиоза (Api)
a-D-Ксилоза (Xyl)
p-L-Арабиноза (Ага)
a-D-Глюкуроновая
кислота (GlcA)
a-D-Галактуроновая
кислота (GalA)
Рис. 1.24. Сахара, участвующие в строении
клеточной стенки
59
ную цепь, и составляющий ее сахар помещается в названии полимера на по-
следнем месте. Например, ксилоглюкан имеет основную цепь из р-1 -^-4-глюко-
зильных остатков, к которым присоединены боковые ксилозные единицы. Глю-
куроноарабиноксилан имеет основную цепь из ксилозных остатков с боковы-
ми группами из глюкуроновой кислоты и арабинозы.
1.10.2.2. Первая (целлюлозная) сеть клеточной стенки
Целлюлоза является основным строительным компонентом всех типов кле-
точных стенок. Это самый распространенный растительный полисахарид. Она
составляет от 15 до 30 % сухой массы всех первичных клеточных стенок, во
вторичных клеточных стенках ее содержание выше.
Целлюлоза представляет собой линейный полимер, состоящий из нераз-
ветвленного р-1 ->4-О-глюкана. Подобная связь обуславливает поворот на 180°
каждого последующего глюкозного остатка относительно предыдущего. Та-
кая структура позволяет отдельным цепочкам полимера соединяться между
собой водородными связями. Целлюлоза существует в форме микрофибрилл —
паракристаллических ансамблей, состоящих из нескольких дюжин цепочек
Рис. 1.25. Строение целлюлозы
Целлобиоза:
Р-Ц-глюкозил-( 1 -» 4)Ц-глюкоза
60
этого глюкана. В высших растениях каждая микрофибрилла состоит в среднем
из 36 отдельных глюканов (рис. 1.25). Микрофибриллы морских водорослей
могут образовывать более широкие кольцевые филаменты или плоские ленты,
состоящие из нескольких сотен цепей глюкана.
Каждая макромолекула целлюлозы может состоять из несколько тысяч остат-
ков D-глюкозы и достигать в длину от 2 до 5 мкм. В пределах микрофибриллы
отдельные цепочки р-1 ->4-В-глюканов начинаются и заканчиваются в раз-
личных местах, что позволяет микрофибрилле достигать в длину сотен микро-
метров и содержать тысячи индивидуальных глюкановых цепочек. Структура
микрофибриллы целлюлозы подобна длинной хлопчатобумажной нити, кото-
рая состоит из тысяч отдельных хлопковых волокон длиной всего 2—3 см. Важ-
но отметить, что все индивидуальные молекулы целлюлозы в микрофибриллах
ориентированы одинаково, т. е. редуцирующие концы всех цепочек находятся
с одной стороны.
Связующие, или «сшивочные», гликаны — класс полисахаридов, которые могут
образовывать водородные связи с микрофибриллами целлюлозы. Они имеют
достаточную длину, чтобы одновременно связываться с несколькими микро-
фибриллами целлюлозы, при этом образуется сеть углеводных полимеров кле-
точной стенки. В отличие от целлюлозы связующие гликаны имеют, за редким
исключением, разветвленную структуру, что способствует их «сшивочной»
функции в клеточной стенке. Нередко связующие гликаны неудачно называют
«гемицеллюлозами» (полуцеллюлозами), поскольку первоначально их прини-
мали за недосинтезированную целлюлозу.
У всех цветковых растений в первичных клеточных стенках имеются только
два основных класса связующих гликанов — ксилоглюканы (XyGs) и глюкуро-
ноарабиноксиланы (GAXs) (рис. 1.26). Ксилоглюканы характерны для всех дву-
дольных и примерно половины однодольных растений. Глюкуроноарабинокси-
ланы в качестве главного связующего гликана в клеточных стенках имеют «ком-
мелиноидные» однодольные растения — пальмы (Агесасеае), коммелиновые
(Commelinaceae), бромелиевые (Bromeliaceae), имбирные (Zingiberalesi) и близ-
кие к ним семейства, а также большинство осок и злаков. Особая группа свя-
зующих гликанов — неразветвленных — обнаружена у злаков.
Ксилоглюканы представляют собой линейную цепочку р-1 ->4-О-глюкана,
к которой по 0-6-положению глюкозного остатка регулярно присоединены
остатки D-ксилозы. К некоторым из ксилозильных фрагментов в свою очередь
присоединяются остатки L-арабинозы или D-галактозы. В ряде позиций к га-
лактозе присоединяется L-фукоза. Ксилоглюканы построены из повторяющихся
одинаковых блоков — структурных единиц, каждая из них содержит от 6 до
11 сахаров. Строение блоков специфично для разных тканей и видов растений.
Фукозогалактоксилоглюканы характерны для всех «не-коммелиноидных» одно-
дольных и большинства двудольных видов. Арабиноксило глюканы характерны
для семейства Пасленовые (Solanaceae) и мяты {Mentha).
Глюкуроноарабиноксиланы (GAXs) — основные связующие гликаны «комме-
линоидных» однодольных. В GAXs этих видов арабинозный остаток присоеди-
нен исключительно по 0-3-положению, а остатки глюкуроновой кислоты —
по 0-2-положению.
Характерные для порядка Злаковые (Poales) неразветвленные связующие
гликаны получили название «глюканы со смешанной связью», или р(1 ->3)(1->4)
61
Фукогалактоксилоглюкан
Арабиноксилоглюкан пасленовых
I I
Xyl Xyl
I I
'~^Glc—Glc—Glc—Glc—Glc—Glc—Glc—Glcw'
Illi
Xyl 6-OAc Xy! 6-OAc
Глюкоарабиноксилан коммелиноидных
Рис. 1.26. Строение разных типов ошибочных гликанов (фоном выделена основная цепь)
глюканы. Они на 90% состоят из имеющих р( 1 ->4) связи целлотриозных и
целлотетраозных фрагментов в соотношении 2:1. Указанные фрагменты соеди-
нены между собой р(1 ->3) связью. За счет этого полимер образует складчато-
винтообразную структуру.
В первичных клеточных стенках практически всех исследованных покрыто-
семенных растений найдены также другие связующие гликаны, прежде всего
маннаны (глюкоманнаны, галактоглюкоманнаны, галактоманнаны и др), од-
нако их количество существенно меньше, чем основных связующих гликанов.
Главная функция целлюлозы и связующих гликанов — формирование ос-
новной структурной сети клеточной стенки.
1.10.2.3. Вторая (пектиновая) сеть клеточной стенки
Пектины — смесь гетерогенных, разветвленных и сильно гидратированных
полисахаридов, обогащенных D-галактуроновой кислотой. Пектины клеточ-
ных стенок состоят из двух основных компонентов — гомогалактоуронанов
(HGA), основная цепочка которых построена исключительно из остатков га-
лактуроновой кислоты, и рамногалактоуронанов I (RG I), у которых в цепочке
остатки галактуроновой кислоты чередуются с остатками рамнозы.
Гомогалактуронаны (HGAs) — гомополимеры (l->4)p-D-GalA, содержащие
как минимум 200 галактуроновых фрагментов. Их длина составляет около 100 нм
(рис. 1.27). Помимо классических гомогалактурона! юв известно два типа их струк-
турных модификаций — ксилогалактуронаны и рамногалактуронаны II (RG II).
Они представляют собой цепочку из остатков галактуроновой кислоты с раз-
личными боковыми заместителями. RG II отличаются разнообразием сахаров и
типов связей между ними. В их состав могут входить апиоза, яблочная кислота,
2-О-метилфукоза, 2-О-метилксилоза. Структура RG II очень консервативна у
всех цветковых растений. В клеточных стенках были обнаружены также димеры
RG II. Связывание в них происходит через остатки апиозы каждого мономера
путем образования двух диэфирных связей с молекулой борной кислоты.
Рамногалактуронаны I (RG I) представляют собой гетерополимеры, ос-
новная цепочка которых построена из повторяющихся дисахаридных остатков:
(l->2)-L-Rha-(l->4)-D-GalA (см. рис. 1.27). В цепочке к большинству остатков
рамнозы по О-4 положению присоединены боковые полисахариды. Они со-
ставлены главным образом из нейтральных сахаров — арабинанов, галактанов
и сильно разветвленных арабиногалактанов типа I (AGs I); AGs-I присутству-
ют только в связанном с пектинами виде. Другой класс арабиногалактанов —
арабиногалактаны II — участвует в формировании арабиногалактановых бел-
ков клеточной стенки (см. ниже).
Считается, что пектины выполняют множество функций в клеточной стен-
ке: определяют размеры пор («порозистость» — от англ porozity) клеточной
стенки (см. ниже); обеспечивают поверхностный заряд клеточной стенки, ко-
торый обуславливает ее pH и ионный баланс; участвуют в регулировании меж-
клеточной адгезии и образовании срединной пластинки; служат источниками
сигнальных молекул, участвующих во взаимодействии клетки с насекомыми,
патогенами и симбионтами. Пектины могут локализовать действие специфи-
ческих ферментов клеточной стенки путем электростатического фиксирова-
ния ферментов на заряженной сети пектинов.
64
A
Гомогалактоуронан
Рис. 1.27. Строение пектинов: галактуронаны (Л), рамногалактуронаны I (Б)
3 Физиология растений
65
Б
Рис. 1.27. Окончание
66
1.10.2.4. Третья (белковая или фенилпропаноидная) сеть
клеточной стенки
Основными структурными компонентами каркаса клеточной стенки явля-
ются углеводы, однако структурные белки могут также образовать в стенке
соответствующую сеть.
Известно четыре главных класса структурных белков клеточной стенки, три
из которых названы по преобладающей в данном белке аминокислоте, — это
гидроксипролинобогащенные гликопротеиды (HRGPs — от hydroxyprolin-rich
glycoproteins), пролинобогащенные белки (PRPs) и глицинобогащенные бел-
ки (GRPs) (рис. 1.28). Их количество зависит от типа ткани и вида растений.
Структурные белки клеточной стенки обычно кодируются большими мульти-
генными семействами. Их синтез находится под контролем развития. Все мРНК
белков клеточной стенки имеют сигнальную последовательность, направляю-
щую белки по секреторному пути.
Один из наиболее изученных гидроксипролиновых белков растений — эк-
стенсии — кодируется мультигенным семейством. Он состоит из повторяю-
Экстенсин томатов
(сильно гликозилирован)
Пролинобогащенные белки сои
(слабо гликозилированные)
Глицинобогащенные белки петунии
(не гликозилированные)
Рис. 1.28. Строение структурных белков клеточной стенки:
Ага и Gal — остатки арабинозы и галактозы соответственно
67
щихся последовательностей Ser-(Hyp)4 и Tyr-Lys-Tyr, что оказывается важным
для формирования вторичной и третичной структуры белка. Гидроксипролин в
белке образуется из пролина посттранскрипнионно.
Пролинобогащенные белки также кодируются большим мультигенным се-
мейством. Эти белки содержат более 70 % глицина и скорее всего имеют р-склад-
чатую структуру. Полагают, что GRPs играют роль в контактах клеточной стен-
ки с плазматической мембраной. В их состав входят ароматические аминокис-
лоты, функция которых не ясна.
Четвертый класс структурных белков — арабиногалакановые белки (AGPs).
Видимо, правильнее их считать протеогликанами, поскольку основная часть
молекулы (до 95 %) состоит из углеводов, а именно арабиногалактанов II
(AGs-II), которые представлены группой коротких (1->3)-(1->6)р-О-галакта-
новых цепочек с сильно разветвленной структурой. AGPs обнаруживаются в
везикулах аппарата Гольджи, плазмалемме и клеточной стенке. Клонирование
генов некоторых AGPs показало, что эти белки обогащены пролином (гидро-
ксипролином), аланином и серином/треонином.
Первичные нелигнифицированные клеточные стенки однодольных растений,
относящихся к «коммелиноидам», а также растений семейства Маревые —
Chenopodiaceae (например, сахарной свеклы — Beta vulgaris и шпината) со-
держат значительные количества ароматических веществ. Они представлены
гидроксикоричными кислотами, прежде всего феруловой и и-кумаровой. Гид-
роксикоричные кислоты присоединены сложноэфирной связью к 0-5 пози-
ции некоторых из арабинозных единиц глюкуроноарабиноксиланов (GAXs).
Некоторая часть остатков феруловой кислоты на GAXs может соединяться
фенил-фенильной или фенил-эфирной связью с соседним GAXs, объединяя
таким образом глюкуроноарабиноксиланы в сложную сеть. У растений семей-
ства Chenopodiaceae оксикоричные кислоты присоединены к галактозным или
арабинозным остаткам боковых цепей RG I. Таким образом, третья сеть кле-
точной стенки у этих видов состоит из фенилпропаноидов.
1.10.3. ТИПЫ СТРОЕНИЯ КЛЕТОЧНЫХ СТЕНОК
Тип I строения клеточных стенок характерен для большинства двудольных и
«некоммелиноидных» однодольных. Клеточные стенки этого типа содержат от-
носительно равные количества целлюлозы и ксилоглюканов. XyGs прочно свя-
зываются с поверхностными глюкановыми цепочками в целлюлозных микро-
фибриллах и фиксируют микрофибриллы в нужном пространственном поло-
жении, связываясь не только с целлюлозой, но и между собой. При этом они
заполняют пространство между смежными целлюлозными микрофибриллами.
В клеточной стенке первого типа Каракас, состоящий из целлюлозы и XyGs,
помещен в матрикс пектинов, который регулирует, помимо других физиоло-
гических свойств, размер пор клеточной стенки. У гомогалактоуронанов (HGAs),
секретируемых из цитоплазмы, большинство карбоксильных групп метилиро-
вано, т. е. HGAs попадают в клеточную стенку в виде высокометоксилирован-
ных полимеров. В клеточной стенке работает фермент пектинметилэстераза (РМЕ),
которая отщепляет некоторые из метильных групп. Освободившиеся карбок-
сильные группы могут соединяться с ионами Са +. Кальций как двухвалент-
68
Рис. 1.29. Образования «замковых зон» в пектиновой сети (Л) и формирование пор в клеточной стенке (Б)
Рис. 1.29. Окончание
ный катион может связываться с двумя карбоксильными группами двух цепей
пектинов. При этом образуются «замковые зоны», соединяющие две антипа-
раллельные цепи HGAs. Наиболее сильные связи между цепями HGAs образу-
ются, если в «замковой зоне» расположены не менее семи неэтерифицирован-
ных остатков галактуроновых кислот. Полагают, что от расстояния между «зам-
ковыми зонами» зависит, какого размера поры образуют в клеточной стенке
несвязанные участки HGAs: чем больше расстояние между «замковыми зона-
ми», тем больше размер пор (рис. 1.29).
Наряду с гомогалактоуронанами в формировании пор клеточных стенок при-
нимают участие и рамногалактоуронаны I (RG I). Во-первых, их рамнозные
остатки в основной цепи и боковые цепочки мешают образованию прочных
«замковых зон». Во-вторых, нейтральные полимеры (арабинаны или галакта-
ны), прикрепленные одним концом к RG I, имеют много степеней свободы и
достаточно подвижны. Они могут располагаться внутри пор, уменьшая их раз-
меры (рис. 1.29). На некоторых стадиях развития клетки значительно повыша-
ется активность специфичных гидролаз, при этом нейтральные полимеры от-
щепляются и размер пор увеличивается. Другие компоненты пектиновой сети
также могут участвовать в регулировании «порозистости» клеточной стенки.
Тип II строения клеточных стенок характерен для «коммелиноидных» одно-
дольных. Подобно типу I он содержат микрофибриллы целлюлозы, однако они
соединяются между собой не ксилоглюканами, а глюкуроноарабиноксиланами
(GAXs). Боковые цепочки у основной ксилановой цепи GAXs по-разному влияют
на образование связей. Ответвления, состоящие из L-арабинозы и L-глюкуро-
новой кислоты, предотвращают формирование водородных связей и блокиру-
ют перекрестное сшивание между полисахаридами. Напротив, D-ксилозные
единицы стабилизируют линейную структуру полимера и способствуют его
связыванию с глюканами.
Клеточные стенки второго типа достаточно бедны пектинами. Частично
функции пектинов могут выполнять остатки L-галактуроновах кислот, входя-
щих в состав GAXs. Порозистость и прочность клеточной стенки зависит от
интервала между боковыми Ага и GlcA единицами GAXs, которые таким обра-
зом функционально заменяют пектиновые вещества клеточных стенок первого
типа.
И наконец, клеточные стенки типа II имеют очень немного структурных
белков по сравнению с двудольными и другими однодольными растениями.
В то же время в них часто формируются обширные сети фенилпропаноидных
соединений, особенно после прекращения роста клетки.
1.10.4. БИОСИНТЕЗ КЛЕТОЧНОЙ СТЕНКИ
Клеточная стенка образуется в результате развития срединной пластинки.
Сразу после полного разделения ядра растительной клетки в телофазе митоза
поперек делящейся клетки образуется фрагмопласт. Он состоит из множества
уплощенных мембранных везикул — фрагмосом, содержащих компоненты кле-
точной стенки. В их построении участвует цитоскелет. Все полисахариды кле-
точной стенки, за исключением целлюлозы, синтезируются в аппарате Гольд-
жи. Они упаковываются в везикулы, которые транспортируются к растущей
71
срединной пластинке и сливаются с ней. Срединная пластинка увеличивается
по направлению к плазмалемме и соединяется с ней, разделяя две дочерние
клетки. Наконец, вновь образующаяся клеточная стенка соединяется с уже
существующей первичной клеточной стенкой.
Практически все «нецеллюлозные» компоненты клеточной стенки — поли-
сахариды, структурные белки, широкий спектр ферментов — образуются в
аппарате Гольджи и в его везикулах координированно направляются к клеточ-
ной стенке.
До сих пор не идентифицированы гены, кодирующие полисахаридсинтазы,
участвующие в синтезе основных цепей «нецеллюлозных» полимеров. Иденти-
фицированы гены нескольких фукозил- и галактозилтрансфераз, которые при-
соединяют отдельные сахара к главной цепочке.
Единственными полимерами, которые синтезируются с внешней стороны
плазмалеммы, являются целлюлоза и каллоза. Целесообразность этого стано-
вится очевидной, если принять во внимание большую длину образующихся
микрофибрилл целлюлозы и необходимость их филигранной укладки в кле-
точную стенку. Каллоза отличается от целлюлозы наличием р1->3-О-глюкано-
вых цепочек, которые могут образовывать спиральные дуплексы и триплексы.
Каллоза образуется в нескольких типах клеток на определенных стадиях фор-
мирования клеточной стенки, например в прорастающей пыльцевой трубке
или срединной пластинке делящихся клеток. Каллоза может также синтезиро-
ваться при стресс-реакциях или в ответе на грибную инфекцию.
Синтез целлюлозы катализируется мультимерными комплексами фермен-
тов, расположенными на концах удлиняющихся микрофибрилл целлюлозы.
Эти терминальные комплексы хорошо различимы под электронным микро-
Рис. 1.30. Схема строения и работы целлюлозосинтазы
72
скопом. В некоторых морских водорослях терминальные комплексы синтеза
целлюлозы расположены линейно; у всех покрытосеменных растений они фор-
мируют розеточные структуры. Терминальные комплексы появляются в мемб-
ране плазмалеммы в момент активации синтеза целлюлозы.
Исходным субстратом для целлюлозосинтазы является УДФ-глюкоза. Она
образуется с помощью фермента сахарозосинтазы непосредственно из сахаро-
зы. Ряд изоформ этого фермента находятся в плазматической мембране. Они
ассоциированы с целлюлозосинтазой и могут поставлять УДФ-глюкозу непо-
средственно к ее каталитическому центру (рис. 1.30).
Относительно недавно были идентифицированы несколько растительных
генов, кодирующих ферменты синтеза целлюлозы, в частности гены CesA,
которые интенсивно экспрессируются в хлопковых волокнах во время актив-
ного синтеза целлюлозы вторичной клеточной стенки. Кодируемые этими ге-
нами полипептиды имеют восемь трансмембранных доменов и массу около
110 кДа. Открытие генов CesA дало возможность идентифицировать ряд других
генов, кодирующих синтазы полисахаридов клеточной стенки.
1.11. ОНТОГЕНЕЗ РАСТИТЕЛЬНОЙ КЛЕТКИ
Под термином онтогенез (греч. он — род. падеж, ontos — существо; лат. gene-
sis — происхождение, формирование) понимают индивидуальное развитие орга-
низма, органа, клетки от момента образования до естественной гибели. Онто-
генез клетки может происходить двояко: либо от деления до ее смерти, либо от
деления до деления.
Второй вариант онтогенеза (от деления до деления) характерен для клеток
меристем, а также для каллусных клеток in vivo и in vitro. Для таких клеток
часто применяют термин пролиферирующие, т. е. постоянно делящиеся. В этом
случае клетка последовательно проходит клеточный {митотический) цикл, т. е.
период от митоза до митоза. Клеточный цикл делится на четыре периода (фазы):
собственно митоз М, пресинтетический (постмитотический) период (д (от
англ, gap — интервал), синтетический период S (происходит удвоение ДНК) и
постсинтетический (премитотический) период G2. Продолжительность клеточ-
ного цикла зависит от вида растения и типа клеток, однако в среднем состав-
ляет около суток. Длительность периодов цикла также варьирует: митоз может
длиться от 1 до 4 ч, фаза Gi — 0,5 —8 ч, S — 1,5 —12 ч и G2 — 1 —13 ч.
Онтогенез многих растительных клеток проходит по первому варианту — от
митоза до естественной смерти. В этом случае он также слагается из нескольких
этапов: деление клетки, рост растяжением, дифференцировка, активное функ-
ционирование, старение и смерть. В процессе дифференцировки формируются
различия между клетками, т. е. происходит их специализация. Деление на эта-
пы достаточно условно: дифференцировка клетки, в частности, начинается
уже на стадии роста.
Особенностью растительных клеток является возможность ее дедифферен-
цирования, т.е. перехода специализированных клеток обратно к пролифера-
ции. Это происходит in vivo при образовании каллуса (травматической ткани
двудольных), а также in vitro при получении культур клеток. Культивируемые
in vitro клетки можно получить из любой ткани любого органа растения, т. е. к
73
дедифференциации способна практически любая живая клетка растения, не-
зависимо от типа ее дифференцировки.
Дедифференцированные пролиферирующие клетки in vitro при определен-
ных условиях могут вновь дифференцироваться и привести к формированию
тканей, органов и целых растений. Таким образом, растительная клетка истин-
но тотипотентна, т.е. не только содержит полную информацию о целом орга-
низме, но из нее реально можно получить интактное растение. Напомним, что
под тотипотентностью понимают свойство соматических клеток в полной
мере реализовать находящуюся в них наследственную информацию. Получае-
мые таким образом растения носят названия регенерантов. Получение расте-
ний-регенерантов из отдельной дедиференцированной клетки и даже из от-
дельного протопласта в настоящее время является рутинной процедурой и слу-
жит основой многих биотехнологий. Заметим, что в случае животных клеток
подобные свойства сохраняют лишь немногие стволовые клетки.
Способность растительной клетки к дифференцировке и дедифференци-
ровке позволило расширить понятие клеточного цикла. Для состояния диффе-
ренцированной клетки введено понятие фаза Go клеточного цикла. В эту фазу
пролиферирующие клетки могут входить из фазы G] или G2. Клеточный цикл
пролиферирующих клеток проходит без фазы Go, с началом процесса диффе-
ренцировки клетка входит в фазу Go и может оставаться в ней до своей гибели.
При некоторых условиях (травма, условия in vitro) клетка переходит из фазы
Go в G, или G2 и опять становится пролиферирующей.
1.11.1. КЛЕТОЧНЫЙ ЦИКЛ
Регуляция клеточного цикла достаточно консервативна для всех эукариот.
Ее ключевыми фигурами являются несколько циклинзависимых протеинкиназ
CDKs (cyclin dependent kinases). CDKs представляет собой комплекс, состоящий
из двух субъединиц — каталитической и активаторной, которая называется цик-
лином. Каталитическая субъединица не активна и должна быть активирована
циклином — это первая ступень активации киназного комплекса. Многие одно-
клеточные эукариоты (например, дрожжи) имеют только одну CDK-каталити-
ческую единицу. У многоклеточных эукариот каталитических единиц несколько.
Ассоциация CDKs со специфичным циклином — ключевой момент в регу-
лировании соответствующих фаз клеточного цикла. Все эукариоты имеют мно-
го циклинов, и каждый требуется на специфичной регуляторной стадии кле-
точного цикла. При этом специфические циклины связываются со «своей» CDK.
Эти взаимосвязи определяют смену активности CDKs. Большое количество CDK
и соответствующих циклинов обеспечивает тонкую регуляцию клеточного цикла.
CDKs — очень консервативный класс протеинкиназ. В комплексе с цикли-
ном они фосфорилируют субстрат по остатку серина или треонина. На N-конце-
вом участке белка они имеют АТФ-связывающий домен, далее следует не-
большой домен PSTAIRE, который получил свое название по последователь-
ности входящих в него аминокислот в однобуквенном коде. Этот домен являет-
ся участком связывания с циклином. В последовательности аминокислот этого
домена возможны вариации, при этом CDK с одинаковыми PSTAIRE-доме-
нами связываются с одинаковыми циклинами.
74
Разные CDK играют специфичную роль на каждом этапе клеточного цикла.
Для животных клеток показано, что CDK1 контролирует переход от G2 к ми-
тозу, CDK2 и CDK3 — переход от G, к S-фазе, при этом CDK2 необходима в
течение всей S-фазы; CDK4 и CDK5 в течение С,-фазы «контролируют ре-
шение» о переходе в новый митотический цикл. В клетках растений также
показано участие различных CDK в разных фазах клеточного цикла и их ак-
тивация различными факторами, в частности, ауксином. В дополнение к CDKs
клеточный цикл контролируют как минимум еще две протеинкиназы — CDC5
(в М-фазе для регулирования «моторных» белков для сегрегации хромосом) и
CDC7.
Циклины классифицируют на две группы — митотические и G\-циклины.
Митотические циклины включают циклины В-типа (или М-циклины — от
М-фазы цикла) и A-типа (или S-циклины — от S-фазы). Циклины В-типа
характеризуются большим консервативным центральным доменом, так назы-
ваемым циклиновым боксом (cyclin box), который взаимодействует с киназ-
ной субъединицей CDK. Они имеют также «разрушающий» домен, ответствен-
ный за деградацию циклинов в позднем митозе. Циклины В-типа работают на
участке перехода клетки из фазы G2 в митоз. Циклины A-типа также содержат
разрушающий домен. Их присутствие обязательно для S-фазы клеточного цикла.
Дрожжи содержат около десятка митотических циклинов А- и В-типа. У выс-
ших растений таких циклинов существенно больше.
Gi-циклины включают прежде всего D-циклины, позже к ним были добавле-
ны циклины Е-типа. D-циклины, аналогично циклинам В-типа, содержат
центральный домен, но он менее консервативен. D-циклины нестабильны,
но «разрушающий» домен не регулирует процесс их распада. Одни из D-цик-
линов накапливаются только в Gj-фазе и быстро деградируют в течение S-фазы,
тогда как другие в низких концентрациях присутствуют в течение всего кле-
точного цикла. D-циклины регулируют переход клеток из G| в S-фазу клеточ-
ного цикла, т. е. довольно часто они участвуют в стартовой точке его запуска.
D-циклины являются одними из основных молекул, воспринимающих
внешние сигналы регуляции клеточного цикла. У животных их накопление ре-
гулируется гормонами роста. У растений циклин D3 регулируется цитокини-
ном. Это один из основных путей влияния цитокининов на пролиферацию
растительных клеток.
Активность комплекса CDK-циклин контролируется специальными кина-
зами и фосфатазами, что составляет второй уровень регуляции системы митоти-
ческого цикла.
Weel-киназа (названа по фенотипу дрожжей с мутацией по этому гену)
фосфорилирует треонин или тирозин около N-концевого участка CDK. Это
фосфорилирование Thr 14 или Thr 15 ингибирует активность CDK. Гомолог
weel+ найден у растений.
Мультифункциональная фосфатаза CDC25p убирает фосфаты с тирозина,
треонина или серина. В частности, у CDK она «снимает» фосфаты, «посажен-
ные» weel-киназой, т.е. является ее антагонистом. CDC25p — мощный регуля-
тор клеточного цикла. В частности, при дефектах ДНК или ее повреждениях
CDC25 не активируется. При этом фосфорилированные CDK не работают, что
обусловливает паузу в протекании цикла. За это время происходит реперация
поврежденной ДНК.
75
Помимо обратимого фосфорилирования, CDK может быть выключена ин-
гибитором. Идентифицированы ингибиторы CDK — CKIs. Они обратимо свя-
зываются с комплексом CDK-циклин и ингибируют его работу. Это обратимое
ингибирование активности CDK используется для контроля до прохождения
клеточного цикла.
В двух точках клеточного цикла регуляторную роль играют специфичные
протеазы. На старте цикла они нужны для инициации репликации ДНК, а при
переходе от метафазы к анафазе протеазы разрушают когезионные белки,
соединяющие две сестринские хроматиды.
1.11.2. РОСТ КЛЕТКИ
1.11.2.1. Роль клеточной стенки в росте клетки
Рост клетки, т. е. необратимое увеличение ее массы и объема, может проис-
ходить путем экспансии (увеличение размера клетки в двух или трех измерени-
ях) или удлинения (экспансия по одному измерению). Причиной разнообра-
зия форм растительных клеток может быть любой из этих двух процессов, про-
текающий в определенных областях поверхности клетки. Интенсивное удлине-
ние растительных клеток происходит в особых зонах корня и побега. Такой
рост носит название рост растяжением.
Процесс роста — один из основных этапов онтогенеза клетки, в результате
которого клетка достигает оптимальных для дальнейшего функционирования
размера и формы (механизмы, регулирующие переход клетки к росту растяже-
нием, обсуждаются в гл. 7). Основными структурами, обеспечивающими про-
цесс роста, являются вакуоль и клеточная стенка.
При росте клетки клеточная стенка должна растягиваться или деформиро-
ваться. В то же время отдельные целлюлозные микрофибриллы неспособны
растягиваться, следовательно, при подобных изменениях должно происходить
либо скольжение микрофибрилл относительно друг друга, либо расхождение
соседних микрофибрилл. Имеется достаточно экспериментальных подтвержде-
ний использования клеткой второго способа — расхождения микрофибрилл.
Движущей силой роста клетки является осмотическое давление, развиваемое
протопластом, прежде всего вакуолью. Снижение прочности, т.е. ослабление
связей между компонентами клеточной стенки, рассматривается как первич-
ный механизм роста клеток. В клетке существуют механизмы, осуществляющие
дискретное биохимическое ослабление матрикса клеточной стенки. После рас-
хождения микрофибрилл целлюлозы образовавшиеся «пустоты» заполняются
новыми полисахаридами или другими компонентами стенки.
1.11.2.2. Роль цитоскелета в росте клетки
Растительные клетки обладают множеством кортикальных микротрубочек,
связанных с плазмалеммой. Ориентация микротрубочек обычно определяет ори-
ентацию образующихся целлюлозных микрофибрилл. Механизм этого явления
до конца не установлен. Кортикальные микротрубочки могут направлять цел-
люлозосинтазные комплексы либо через опосредованный белком контакт,
76
либо определяя в мембране каналы, по которым движется синтаза. В последнем
случае микротрубочки могут выполнять роль своеобразных направляющих, ко-
торые запрещают синтазному комплексу «сворачивать» вправо или влево. Счи-
тается, что начало растущей целлюлозной микрофибриллы жестко закрепля-
ется в клеточной стенке, таким образом, вектор движения комплекса по мемб-
ране строго определен: вперед он движется за счет жесткости целлюлозной
микрофибриллы (наращивая цепочку, «отталкивается» от зафиксированного
конца), а отклонения от «правильного курса» запрещают лежащие по бокам
микротрубочки.
В свою очередь, ориентация микрофибрилл целлюлозы определяет ва-
риант роста клетки (экспансия или удлинение) и направление удлинения.
В клетках, которые растут путем экспансии, слои микрофибрилл ориентиро-
ваны в клеточном матриксе случайным образом, тогда как в удлиняющихся
клетках они выстроены в поперечной или спиральной ориентации к оси удли-
нения. Под действием осмотического давления протопласта спирально рас-
положенные микрофибриллы целлюлозы раздвигаются, и размеры клетки
увеличиваются в продольном направлении. Поскольку микрофибриллы цел-
люлозы не способны растягиваться, их спиральное расположение предотвра-
щает увеличение размеров клетки в ширину: они охватывают клетку подобно
обручам, набитым на бочку. В то же время удлинение клетки может про-
исходить весьма легко при условии слабой связи между «витками» целлюлозы.
В качестве аналогии можно привести металлическую пружинку. Она легко уве-
личивается вдоль длинной оси, но изменить ее диаметр практически невоз-
можно.
Таким образом, процесс растяжения клеточной стенки при росте клетки
растяжением можно рассматривать как раздвижение многих взаимодейству-
ющих между собой концентрических пружин в право- и левозакрученных ори-
ентациях.
Новые микрофибриллы, образующиеся на внутренней поверхности кле-
точной стенки, в основном формируются в поперечной ориентации и функ-
ционально заменяют старые микрофибриллы. Старые микрофибриллы отодви-
гаются во внешние слои клеточной стенки и пассивно переориентируются в
продольном направлении при удлинении клетки
1.11.2.3. Гипотеза «кислого роста»
Несмотря на отмеченные различия в составе и строении клеточных стенок
I и II типа, механизмы роста всех цветковых растений сходны. Одним из меха-
низмов, которым ауксин стимулирует растяжение клеток, может быть регули-
рование активности гидролаз клеточных стенок. Согласно гипотезе «кислого
роста», ауксин активирует Н-АТФазу плазмалеммы, которая подкисляет кле-
точную стенку. Низкий pH, в свою очередь, активизирует локализованные в
апопласте специфичные гидролазы, которые расщепляют связи, соединя-
ющие микрофибриллы целлюлозы с другими полисахаридами. Расщепление
этих связей ослабляет клеточную стенку. Снижение прочности клеточной стен-
ки ведет к нарушению равновесия водного потенциала клетки (осмотического
потенциала и потенциала давления — см. подробнее в гл. 5), происходит погло-
щение воды и увеличение размеров клетки. Таким образом, ослабление связей
77
клеточной стенки («сшивок» между микрофибриллами) пассивно ведет к уве-
личению размеров клетки.
Основные принципы гипотезы «кислого роста» прошли «испытание време-
нем», однако существует как минимум три нерешенных проблемы:
• во-первых, не найдено ни одного фермента, который бы гидролизовал
связи между гликанами исключительно при pH < 5,0;
Рис. 1.31. Схема растяжения клеточной стенки.
Затемненными стрелками показаны действующие на микрофибриллы силы, которые возникают за
счет тургорного давления, тонкими стрелками — степень расхождения микрофибрилл целлюлозы
78
• во-вторых, нет разумного объяснения, каким образом регулируется рост
после того, как гидролазы активизированы путем снижения pH;
• в-третьих, гидролазы, извлеченные из клеточной стенки и добавленные к
изолированным фрагментам тканей, приводят к удлинению клеток in vitro,
независимо от внешнего pH.
В настоящее время известно два фермента, которые могут играть основную
роль в снижении прочности клеточных стенок. Один из них — ксилоглюкан-
эндотрансгликозилаза (ХЕТ) — осуществляет трансгликозилирование ксило-
глюканов, при котором одна цепочка XyG расщепляется, а затем снова при-
соединяется к нередуцирующему концу другого XyG. При таких перестройках
микрофибриллы могут «скользить» относительно друг друга, однако общая
прочность ксилоглюканового матрикса не снижается.
Другие белки катализируют растяжение клеточной стенки без гидролити-
ческой или трансгликолитической активности. Подобные белки были названы
экспансинами (англ, expansins). Их функция состоит, скорее всего, в разруше-
нии водородных связей между целлюлозой и связующими гликанами, что при-
водит к ослаблению клеточной стенки. Экспансины — единственные белки,
которые могут осуществлять удлинение клеточной стенки in vitro. Они обяза-
тельно присутствуют в растущих тканях всех цветковых растений. Похоже, что
они разрушают водородные связи между целлюлозой и связующими гликана-
ми независимо от их химической структуры. Показано, что экспансины злаков
стимулируют удлинение тканей с клеточной стенкой I типа (рис. 1.31). Исходя
их этого, заманчиво предположить, что экспансины являются универсальны-
ми ферментами, которые участвуют в быстрых ростовых ответах клеточных
стенок любого типа. Однако новейшие исследования показали, что второе муль-
тигенное семейство р-экспансинов, преобладающее в травянистых растениях,
практически не активно в отношении клеточных стенок I типа.
XETs и экспансины могут быть не единственными белками, участвующими
в ослаблении клеточной стенки. Продолжается выяснение роли гидролаз в этом
процессе.
1.11.2.4 . «Фиксация» окончательных размеров
и формы клетки
Как только удлинение завершено, первичная клеточная стенка «замыкает»
клетку в соответствующую форму. Одним из компонентов подобной фиксации
в клеточной стенке I типа являются гидроксипролинобогащенные белки типа
экстенсина. Их гибкие участки могут обертывать микрофибриллы целлюлозы,
а жесткие выполнять функции «распорок». Однако до сих пор неизвестно, ка-
ким образом экстенсии встроен в клеточную стенку. Другие белки могут быть
необходимы для соединения экстенсинов. В частности, такую роль может вы-
полнять пролинобогащенный белок с молекулярной массой 33 кДа. Большие
количества этого PRP синтезируются на поздних стадиях развития клетки,
особенно в тех клетках, где накапливается и экстенсии.
Клеточные стенки II типа также фиксируют свою форму в течение диффе-
ренциации, но они не используют при этом гидроксипролинобогащенные белки.
Они содержат треонинобогащенный белок с последовательностями, напоми-
79
нающими структуру экстенсина. Кроме того, в клеточных стенках II типа при-
сутствуют фенольные соединения, которые могут выполнять «сшивочные» функ-
ции. Как и в случае с экстенсином, растворимые предшественники треонин-
обогащенного белка накапливаются на ранних фазах клеточного цикла, а в
процессе удлинения клетки и ее дифференцировки становятся нерастворимы-
ми. Однако основную связующую и фиксирующую роль в клеточных стенках
II типа, вероятно, играют фенольные соединения — прежде всего оксикорич-
ные кислоты, которые могут образовывать между собой эфирные и сложно-
эфирные связи. Формирование подобных перекрестных связей ускоряется в
конце ростовой фазы клетки. Структуры с фенольными соединениями, свя-
занные такими мостиками, достаточно прочны и укрепляют стенки закончив-
шей свой рост клетки.
1.11.3. ДИФФЕРЕНЦИАЦИЯ КЛЕТКИ
После роста растяжением растительная клетка специализируется для вы-
полнения той или иной функции. Этот процесс носит название дифференциа-
ции. Дифференциация клеток приводит как к возникновению специфичной
формы клетки, так и к специализации выполняемых функций. Процесс диф-
ференциации клетки в ее онтогенезе является составной частью дифференциа-
ции ткани и органа в онтогенезе всего растения (механизмы, вызывающие и
регулирующие процесс дифференциации, обсуждаются в гл. 7). Особенности
дифференциации растительной клетки во многом связаны с изменениями в
структуре ее клеточной стенки.
1.11.3.1. Роль вторичной клеточной стенки
в дифференциации клетки
Для многих типов клеток процесс дифференцирования связан с формиро-
ванием на первичной клеточной стенке со стороны плазматической мембраны
вторичной стенки. Независимо от химического состава первичная стенка все-
гда определяется как структура, которая участвует в росте клетки. Когда рост
клетки прекращается, первичная клеточная стенка укрепляется поперечными
сшивками и принимает свою окончательную форму. В этот момент начинается
формирование вторичной клеточной стенки. Вторичные стенки часто связаны
со сложными специализациями клеток. Хлопковое волокно, например, состо-
ит из целлюлозы почти на 98 %. Чаще вторичная стенка содержит дополнитель-
ные «нецеллюлозные» полисахариды, белки и ароматические вещества типа
лигнина. В трахеидах вторичные стенки могут формировать специальные образо-
вания (кольцевые или спиральные утолщения, сетчатые или перфорированные
пластинки). Колленхима характеризуется сильным утолщением клеточной стен-
ки по углам клетки. Многие структурные белки, специфичные для определен-
ных типов клеток, встречаются только во вторичной стенке.
Внешние слои эпидермальных клеток покрываются кутином и суберином,
что предотвращает испарение воды. Смежные боковые стенки клеток эндодер-
мы импрегнированы суберином для обеспечения передвижения воды по сим-
пласту в стелу.
80
1.11.3.2. Суберин и кутин делают вторичную клеточную стенку
водонепроницаемой
Для многих дифференцированных клеток характерно наличие кутикулы —
специального слоя, который покрывает клеточную стенку и делает ее непро-
ницаемой для воды. Кутикула состоит из сетчатого матрикса, «пустоты» кото-
рого заполнены гидрофобными кутикулярными восками.
Кутин является матриксом кутикулы надземных органов. Он представляет
собой сложный полимер, составленный из длинноцепочечных гидроксилиро-
ванных жирных кислот и спиртов. Кутикулярные жирные кислоты имеют, как
правило, 16 либо 18 атомов углерода и содержат одну, две или три гидро-
ксильные группы. В результате образования сложноэфирных связей между
карбоксильными и спиртовыми группами этих кислот получается сложная
макромолекула с нерегулярной структурой. За счет присутствия в одной кис-
лоте двух или трех гидроксилов образуется сетчатая структура, составляющая
матрикс кутикулы.
Суберин представляет собой матрикс кутикулы подземных органов расте-
ния. Он обнаруживается в пробковых клетках перидермы, раневой поверхно-
сти клеток и участках эндодермы. В целом строение кутина и суберина сходно,
однако в составе суберина присутствуют длинноцепочечные (от С16 до С22)
дикарбоновые кислоты. Второе отличие суберина — наличие фенольных ком-
понентов, которые часто составляют большую его часть.
Матрикс, образованный кутином или суберином, обычно пропитывается и
покрывается сверху кутикулярным восками. Воск представляет собой сложную
смесь гидрофобных длинноцепочечных углеводородов, кутикулярных спиртов,
альдегидов, кетонов, кислот и эфиров. Специфичными компонентами кутику-
лярного воска являются восковые эфиры. Это сложные эфиры длинноцепочеч-
ных насыщенных жирных кислот и спиртов.
1.11.3.3. Лигнин — главный компонент некоторых
вторичных клеточных стенок
Наиболее характерная отличительная особенность многих дифференциро-
ванных клеток — лигнификация их клеточных стенок. Образование лигнинов
свойственно всем сосудистым растениям. Принято считать, что появление лиг-
нинов эволюционно было связано с выходом растений на сушу. При этом
растениям необходимо было решить две принципиальные задачи: образовать
жесткую структуру для существования в воздушном пространстве и сфор-
мировать системы транспорта воды в надземные органы. Ни целлюлоза, ни
связующие гликаны, ни пектины это обеспечить не могли. Проблема была
решена благодаря включению во вторичную клеточную стенку фенольного по-
лимера лигнина.
Лигнинами называют нерегулярные трехмерные полимерные сети из фенил-
пропаноидов — ароматических фенольных соединений со структурой С6—С3.
За редкими исключениями, лигнин отсутствует в первичных клеточных стен-
ках. Его синтез строго совпадает с началом дифференциации клетки и образо-
ванием вторичной клеточной стенки. Фенилпропаноиды, входящие в состав
81
лигнина, представлены оксикоричными спиртами «монолигнолами». К ним
относятся n-кумаровый, конифериловый и синаповый спирты. Конденсация
этих трех компонентов и образует сеть лигнина. Монолигнолы мотуг связы-
ваться между собой различным образом — простой эфирной связью, сложно-
эфирной связью либо С—С-связями.
Синтез монолигнолов довольно хорошо изучен. Все его этапы происходят в
цитозоле, где образуются СоА-эфиры монолигнолов, и, кроме того, они мо-
гут быть гликозилированы. Гликозилирование может быть важно для направ-
ленного мембранного транспорта. После попадания СоА-эфиров монолигно-
лов в клеточную стенку происходит их окислительная полимеризация. В кле-
точных стенках этот процесс могут осуществлять три фермента — лакказа,
полифенолоксидаза и пероксидаза. В последнее время получены данные, сви-
детельствующие о том, что за полимеризацию лигнина ответственна прежде
всего пероксидаза.
1.11.4. СМЕРТЬ РАСТИТЕЛЬНОЙ КЛЕТКИ
Смерть растительной клетки может наступить по двум причинам: внезапно,
в результате неблагоприятных внешних воздействий — вынужденная гибель, и
по программе, определяемой онтогенезом растения, — запрограммированная
гибель — PCD (от programming cell death). В качестве примера смерти от внеш-
них факторов можно привести гибель тканей после воздействия экстремаль-
ных температур или атаки патогена. Запрограммированная гибель раститель-
ных клеток происходит, например, при образовании ксилемы, созревании пло-
дов, опадании листьев или при образовании листьев специальной формы (на-
пример, у монстеры).
По механизму (типу) гибель клеток подразделяется на некроз (внезапная
смерть) и апоптоз (программная смерть). Их принципиальное различие за-
ключается в характере воздействия на окружающие клетки и ткани. Апоптоз
проходит «незаметно» для соседних клеток. Его основная «цель» — «разобрать»
клетку на составные части и строительные материалы, которые потом можно
будет использовать для метаболизма других клеток. PCD всегда проходит по
типу апоптоза, тогда как вынужденная смерть может проходить как по типу
апоптоза, так и некроза. Типичным примером вынужденной гибели по типу
апоптоза является смерть клеток в процессе реакции сверхчувствительности
при инфекции. Таким образом, часто встречаемое в литературе отождествле-
ние PCD и апоптоза не совсем верно.
Апоптоз. Типичные признаки апоптоза — конденсация и дробление ядра,
разрыв нити ДНК на олигонуклеосомные фрагменты, формирование апоптоз-
ных телец — мембранных структур, содержащих фрагменты ДНК. При этом
цитоплазматическая мембрана остается интактной до образования апоптоз-
ных телец. В процессе апоптоза клетка резко уменьшается в объеме, прото-
пласт съеживается, а мембрана приобретает складчатость Далее разрыхляется
хроматин. Уровень ядерного гетерохроматина увеличивается, и он перемеща-
ется к краям ядра. Ядерная ДНК разрывается на фрагменты длиной приблизи-
тельно 50 тыс. пар оснований. В дальнейшем такие фрагменты под действием
Са -зависимой эндонуклеазы разрываются на олигонуклеосомные фрагменты
82
длиной около 180 пар оснований. Апоптозные тельца с фрагментами ДНК
мигрируют из центра клетки к ее периферии.
Признаки апоптоза у животных и растений сходны, однако у животных
апоптозные везикулы поглощаются соседними или специализированными клет-
ками, такими, как макрофаги. У растений фагоцитозу препятствует клеточная
стенка.
Важную роль в гибели растительных и животных клеток по типу апоптоза
играют митохондрии. Под воздействием сигналов клеточной гибели во внут-
ренней мембране митохондрий образуются поры большого размера (через них
могут проходить вещества с молекулярной массой до 1,5 кДа). Это ведет к
быстрой деполяризации мембраны и потере ею электорхимического потенциа-
ла. Указанные процессы приводят к набуханию митохондриального матрикса и
разрыву наружной мембраны митохондрии. Высвобождаются белки межмемб-
ранного пространства митохондрий, прежде всего цитохром с, что составляет
важный этап апоптоза. Хлоропласты также могут принимать участие в непо-
средственном регулировании программируемой гибели растительных клеток и
в запуске апоптоза. Возможно участие других мембранных структур, например
тонопласта.
Некроз. При некрозе объем клетки значительно увеличивается. Изменяется
проницаемость цитоплазматической и внутриклеточных мембран. Цитоплазма
вакуолизируется. Повреждается тонопласт. Органеллы набухают и разрушаются.
В дальнейшем мембраны разрываются, происходит дезинтеграция клетки. Оста-
тки органелл лизируются. Содержимое клетки попадает в межклеточное про-
странство.
Прочие различия некроза и апоптоза. При некрозе не активируется какая-
либо генетическая программа. Апоптоз, напротив, является результатом запуска
определенной генетической программы. Показано участие в этом процессе
ряда сигнальных систем. В частности, одной из основных сигнальных систем,
участвующих в индукции и разворачивании апоптоза, является НАДФН-окси-
дазная система. Стоит отметить, что многие компоненты этой системы у ра-
стительных и животных клеток достаточно близки. Мембранные белки
НАДФН-оксидаз содержат Са2+-связывающие области, что свидетельствует об
участии в этом процессе Са .
На молекулярном уровне основным признаком апоптоза считается актива-
ция ряда протеаз, прежде всего каспаз. Каспазы представляют собой семейство
эволюционно консервативных цистеиновых протеаз, которые специфически
расщепляют белки по остаткам аспарагиновой кислоты. В настоящее время иден-
тифицировано около десяти каспаз. Помимо активации каспаз, у растений
выявлено возрастание активности сериновой и аспарагиновой протеаз, каль-
паинов (Са +-зависимых протеаз) и убиквитинов. Протеазы образуют каскад
взаимосвязанных протеолитических реакций. Они последовательно активиру-
ют друг друга, участвуют в упорядоченной передаче сигнала апоптоза, могут
являться компонентами единого протеазного комплекса.
Наряду с механизмами уничтожения клетки, в ней есть несколько механиз-
мов, защищающих ее от «случайного» самоуничтожения.
Во-первых, протеазы синтезируются в клетке в неактивной форме, их про-
цессинг происходит за счет автолиза или протеолиза другими протеазами. Кас-
пазы синтезируются в клетке в виде прокаспазы — неактивного мономера с
83
молекулярной массой 30 — 50 кДа. Активные формы являются тетрамерами,
содержащими две малые и две большие субъединицы. При процессинге от про-
каспазы отделяется регуляторный N-концевой домен. Оставшаяся часть моле-
кулы разделяется на большую (20 кДа) и малую (10 кДа), после чего происхо-
дит их ассоциация с образованием активной каспазы.
Во-вторых, протеазы обратимо взаимодействуют с эндогенными белковы-
ми ингибиторами, образуя неактивные комплексы. Такие комплексы описаны
для цистеиновых, Са +-зависимых и ряда других протеаз. При действии различ-
ных индукторов апоптоза происходит диссоциация неактивных комплексов
протеаза—ингибитор.
В-третьих, протеазы обычно являются компонентами специальных сигналь-
ных систем. Путь передачи апоптозного сигнала состоит из цепочки: индукто-
ры —рецепторы — адаптеры — каспазы первого эшелона—регуляторы — каспа-
зы второго эшелона. Только полный набор компонентов, состоящий из рецеп-
тора, его лиганда, адаптера и прокаспазы, формирует специфичный комп-
лекс, в котором происходит активация каспаз. Этот комплекс называется апоп-
тосомой, или апоптозным шапероном.
До определенной стадии процесс апоптоза обратим. После активации кас-
пазами первого эшелона каспаз второго эшелона процесс становится необра-
тимым. Эти каспазы способны к самоактивации (автокатализу или автопроцес-
сингу) и активируют фактор фрагментации ДНК на нуклеосомные фрагменты.
1.12. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ
РАСТИТЕЛЬНОЙ КЛЕТКИ
1.12.1. ФУНКЦИОНИРОВАНИЕ КЛЕТКИ — КООРДИНИРОВАННАЯ РАБОТА
МНОГИХ ОРГАНЕЛЛ
Основу работы клетки составляет четко скоординированное взаимодействие
всех ее органелл. В настоящее время о механизмах, регулирующих этот процесс,
известно немного, однако отдельные примеры подобных взаимодействий, по-
казывающих их целесообразность и сложность, изучены достаточно подробно.
Типичным примером точности взаимодействия систем растительной клет-
ки является синтез основного фермента фотосинтеза — рибулезобисфосфат-
карбоксилазы — оксигеназы (Рубиско). Фермент состоит из двух типов субъ-
единиц — малой и большой — в равных пропорциях (по восемь). Малая субъ-
единица кодируется в ядерном геноме, большая — в хлоропластном. В ядерном
геноме обычно находится около 10 копий генов малой субъединицы Рубиско,
из них функционируют, как правило, 4—5. Плоидность фотосинтезирующих
клеток в основном составляет ЗС, следовательно, максимальное количество
работающих генов малой субъединицы в клетке не превышает 20 — 30. В той же
клетке находится приблизительно 50 — 60 хлоропластов, а в каждом хлоропла-
сте не менее 10 копий ДНК. Следовательно, количество генов большой субъ-
единицы в клетке около 500, т.е. на порядок больше, чем малой субъединицы.
Очевидно, что должны быть строгие системы координации синтеза субъеди-
ниц, чтобы обеспечить их близкие количества в клетке. Белок малой субъеди-
84
ницы синтезируется в цитозоле, белок большой субъединицы — в хлоропласте.
Следовательно, должны быть также скоординированы системы транспорта белка
большой субъединицы из цитозоля в хлоропласт. Таким образом, в синтезе и
сборке только одного фермента координированно работают две белоксинтези-
рующих системы, система транспорта и целый ряд других белков и ферментов
клетки.
В качестве примера согласованной работы трех органелл можно привести
процесс фотодыхания (подробно см. гл. 3). В нем участвуют хлоропласты, пе-
роксисомы и митохондрии. Образовавшийся в результате работы Рубиско (ее
оксигеназная функция) гликолат транспортируется из хлоропласта в перокси-
сому, где окисляется и аминируется. Образовавшийся глицин транспортирует-
ся в митохондрию, где образуется серин. Серин может вернуться назад в пе-
роксисому, где из него образуется глицерат. И наконец, глицерат возвращает-
ся обратно в хлоропласт, где снова вовлекается в цикл Кальвина. Таким обра-
зом, для работы одного биохимического цикла используются ферментные си-
стемы трех органелл. В процессе работы эти органеллы тесно контактируют
мембранами между собой.
1.12.2. РАБОТА РАСТИТЕЛЬНОЙ КЛЕТКИ —
ПЕРЕПЛЕТЕНИЕ «ПРОКАРИОТИЧЕСКИХ» И «ЭУКАРИОТИЧЕСКИХ»
МЕТАБОЛИЧЕСКИХ СИСТЕМ
Анализируя в целом работу растительной клетки, можно заметить, что в
ней причудливо и весьма эффективно сплелись прокариотические и эукарио-
тические системы метаболизма, приобретенные, видимо, от исходных симби-
онтов. Это касается не только систем энергетического обмена. Например, син-
тез жирных кислот в хлоропластах растений имеет много общих черт с их син-
тезом у бактерий. Субстрат синтеза — ацетил СоА — образуется из пирувата
внутри пластид за счет работы пируватдегидрогеназы, однако для некоторых
хлоропластов показана очень низкая активность этого фермента. Следователь-
но, субстраты для синтеза жирных кислот должны поступать из других ком-
партментов клетки. Их синтез возможен за счет митохондриальной пируватде-
гидрогеназы или цитозольной АТФ-цитратлиазы.
На следующем этапе образуется малонил-СоА за счет работы ацетил-СоА-
карбоксилазы (АСС). В растительных клетках существует два фермента — в пла-
стидах и цитозоле. В пластидах он обеспечивает собственно синтез жирных кис-
лот, в цитозоле — их удлинение в ЭР, а также синтез флавоноидов и некоторых
других соединений. Пластидная АСС имеет 4 субъединицы (карбоксилперенося-
щий белок, биотинкарбоксилазу и две карбоксилтрансферазы), три из которых
кодируются в ядерном геноме, а одна — в пластидном. Фермент имеет явное
сходство с прокариотической АСС. Цитозольный фермент состоит из одного
большого полипептида, в котором соответствующие домены интегрированы в
одном белке. Цитозольный фермент похож на фермент грибов и животных.
Далее в синтезе участвуют синтазы жирных кислот (FAS). Этим термином
называют все ферменты, участвующие в синтезе жирных кислот, за исключе-
нием АСС. Клетки животных и дрожжей используют FAS типа I (FAS-I), тогда
как растения и большинство бактерий — FAS типа II (FAS-II). FAS-I представ-
85
ляет собой единый мультифункциональный энзиматический комплекс, состав-
ленный из достаточно больших субъединиц (около 250 кДа), и каждая может
осуществлять несколько различных реакций. В FAS-II, наоборот, каждая реак-
ция катализируется отдельным белком и может быть отделена от других пре-
вращений жирных кислот. В FAS-II входит также ацил-переносящий белок —
АСР (acyls-transport protein). FAS-II работает как метаболическая цепочка, тог-
да как FAS-I — как большой белковый комплекс. Для формирования С18-кис-
лоты синтазой типа II требуется 48 реакций, в осуществлении которых уча-
ствуют не менее 12 различных белков. Формирующаяся жирная кислота транс-
портируется от одного фермента к другому в связанном с АСР виде. Реакцию
наращивания цепи жирных кислот (конденсации) осуществляют 3-кетоацил -
АСР-синтазы — KAS.
Таким образом, синтез жирных кислот в растительной клетке осуществля-
ется в хлоропластах по «прокариотическому» типу. Затем жирные кислоты по-
падают в цитозоль, где происходят их модификации и изменения — десатура-
ция, удлинение, образование необычных жирных кислот — за счет работы
«эукариотических» систем.
Достаточно часто в растительной клетке «прокариотические» и «эукариоти-
ческие» системы работают параллельно. В качестве примера можно привести
образование изопреноидов — «рога изобилия» химических структур клетки. Толь-
ко в растительной клетке работают две системы синтеза изопреноидов — «эука-
риотический» (мевалонатный) в цитозоле и «прокариотический» в пластидах
(подробнее см. гл. 9 «Вторичный метаболизм»).
Наконец, некоторые системы рецепции и трансдукции сигнала в раститель-
ной клетке также «заимствованы» у прокариотов. Это касается прежде всего
двухкомпонентной системы с участием гистидинкиназ. Такая система не обна-
ружена у животных клеток (там работают серин/треониновые и тирозиновые
киназы), но широко распространена у прокариот. В растительных клетках она
несколько модифицирована и тоже распространена достаточно широко: в гено-
ме арабидопсиса, например, обнаружено более 10 генов гистидинкиназ. К ги-
стидинкиназам относятся, в частности, рецепторы цитокининов и этилена.
ГЛАВА 2
ОСНОВЫ БИОЭНЕРГЕТИКИ
В этой главе, которую можно представить как введение к гл. 3 «Фотосинтез»
и гл. 4 «Дыхание растений», обсуждаются элементарные основы процессов,
дающих клетке необходимую энергию, а также рассматриваются некоторые
физико-химические понятия, связанные с механизмом энергообмена в живой
клетке.
2.1. ЖИВЫЕ ОРГАНИЗМЫ МОГУТ ИСПОЛЬЗОВАТЬ
ДВЕ ФОРМЫ ЭНЕРГИИ — СВЕТОВУЮ И ХИМИЧЕСКУЮ
Все живые организмы не могут оставаться живыми и поддерживать высо-
кий уровень организации без постоянного притока энергии извне. При этом
они могут использовать только две формы внешней энергии — световую и
химическую. Именно по способу получения энергии организмы делят на фото-
трофы и хемотрофы. Растения получают энергию в виде электромагнитного
излучения Солнца, а животные используют энергию, заключенную в ковалент-
ных связях органических молекул, которые поступают в организм с пищей.
Полагают, что первые организмы древней Земли располагали избытком орга-
нических соединений, образующихся в ходе геохимических процессов. Они
извлекали энергию, окисляя органические соединения в процессах, видимо,
сходных с различными видами брожения. Эту способность сохранили клетки
всех ныне живущих организмов, способные получать энергию при анаэробном
распаде глюкозы в процессе гликолиза. Однако по мере исчерпания запасов
органики эволюционное развитие получили фототрофы, использующие энер-
гию света в процессе фотосинтеза и способные синтезировать углеводы из
атмосферного СО2 и воды. Фотосинтез сопровождался образованием молеку-
лярного кислорода. Насыщение атмосферы кислородом привело к возникнове-
нию и эволюционному доминированию аэробных форм жизни, которые на-
учились получать необходимую им энергию в результате окисления углеводов
кислородом в процессе дыхания. Дальнейшая эволюция разделила живых су-
ществ на прокариоты и эукариоты, одноклеточные и многоклеточные, на ра-
стения и животные, но возникшие на ранних этапах эволюции механизмы
использования клеткой энергии остались в своей основе неизменными. При
всем разнообразии живых существ и условий среды, в которых они обитают,
для получения энергии ими используются три основных процесса — гликолиз,
дыхание и фотосинтез. При этом, несмотря на все различия в метаболизме
растений, животных и бактерий, способы преобразования внешней энергии,
будь то энергия света или энергия субстратов дыхания, в клеточные формы
87
энергии базируются на общих фундаментальных принципах и подчиняются
общим законам. Основой этих законов является прежде всего то, что все про-
цессы в живой клетке подчиняются законам физики и химии и могут быть
описаны с позиций термодинамики.
2.2. УПОРЯДОЧЕННОСТЬ БИОЛОГИЧЕСКИХ СИСТЕМ
И ОБМЕН ЭНЕРГИЕЙ С ОКРУЖАЮЩЕЙ СРЕДОЙ
Первый закон термодинамики — закон о сохранении энергии, согласно
которому энергия не может появляться или исчезать и переходит из одной
формы в другую. Живая клетка как раз и представляет собой систему, в кото-
рой постоянно происходит преобразование, или трансформация, одних форм
энергии в другие, и прежде всего энергии внешних источников во внутренние
энергетические ресурсы самой клетки.
Второй закон термодинамики утверждает, что в изолированной системе
самопроизвольно могут идти только те процессы, в результате которых сте-
пень неупорядоченности, или энтропия1, возрастает, и система переходит из
менее вероятного в более вероятное состояние.
В то же время очевидно, что все живые системы организованы сложным
образом — множество атомов собраны в чрезвычайно сложные молекулы, а
молекулы — в исключительно точные структуры. При этом живая клетка де-
монстрирует удивительную стабильность и, поддерживая свой внутренний
порядок, координирует в пространстве и во времени множество реакций и
процессов.
С термодинамической точки зрения поддержание внутренней организации
возможно благодаря постоянному поступлению в клетку энергии извне, часть
которой выделяется в окружающее пространство в виде тепла. Тепловая энер-
гия усиливает хаотичное движение молекул. Выделяя тепло, клетка тем самым
компенсирует внутреннюю упорядоченность, повышая энтропию окружа-
ющей среды. Постоянная потеря тепла требует ввода в клетку энергии, от-
личной от тепловой. Растения используют для этой цели поглощенную свето-
вую энергию, а животные — энергию, выделяемую при окислении органичес-
ких молекул.
2.3. НАПРАВЛЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ
ОПРЕДЕЛЯЕТСЯ ВЕЛИЧИНОЙ AG
Все реакции, протекающие в клетке, можно разделить на экзергонические и
эндергонические. Первые идут с выделением энергии, которая может быть рас-
сеяна в виде тепла в окружающую среду. Вторые требуют энергетических затрат
и, как правило, способствуют созданию сложной организации и поддержа-
нию внутреннего порядка.
1 Энтропия — мера неупорядоченности системы; измеряется в специальных энтропийных
единицах и выводится как логарифмическая функция вероятности двух состояний.
88
Изменение энергии, которое сопровождает химические реакции, можно
проанализировать количественно, используя термодинамические параметры:
Т — абсолютная температура (К); Р — давление; V — объем; Е — внутренняя
полная энергия системы; S— энтропия; И — энтальпия, или теплосодержание
системы; G — свободная энергия системы (энергия Гиббса).
При постоянных Р, Т и V изменение общей энергии системы АЕ в резуль-
тате химической реакции будет равно изменению теплосодержания системы
ДЯ, т. е. тепловому эффекту реакции. В этих условиях термодинамические пара-
метры связаны соотношением:
ДС= ЛЯ- ТЛА.
Для характеристики реакций, которые протекают при постоянных темпе-
ратуре, давлении и объеме, наиболее важным термодинамическим парамет-
ром является изменение свободной энергии Гиббса AG. Этот показатель ха-
рактеризует энергию, которая поглощается или выделяется в ходе реакции
или может быть передана другой химической реакции. Для биохимических ре-
акций в растворе при низких концентрациях веществ изменение свободной
энергии в результате реакции аА + ЬВ = сС + JD можно определить по урав-
нению:
AG = AG° + 2,ЗЯПё([С]с[О]7[А]а[В]л) [Дж-моль-1],
где R — газовая постоянная (8,31 Дж • град'1 моль-1); Т — абсолютная темпера-
тура (К); [AJ, [В], [С], [D] — молярные концентрации реагирующих веществ;
Лб° — изменение стандартной свободной энергии данной реакции.
Величина AG имеет значение стандартной AG°, если реакция протекает
при температуре 25 °C и давлении 1 атм, а концентрации субстратов и продук-
тов реакции одинаковы и равны 1 М. Для биохимических реакций использует-
ся показатель AG°', определяемый при pH 7,0.
Для данной реакции AG°' величина постоянная, тогда как AG' зависит от
концентрации реагирующих веществ и указывает, насколько данная реакция
далека от равновесия. При достижения равновесия AG' = 0, и тогда A G°' можно
определить через константу равновесия химической реакции:
AG°' = -2,3ATlg^aBH,
где A'pagn — константа равновесия химической реакции.
Значения f\G°' установлены для большого числа биохимически важных ре-
акций и приводятся в специальной литературе.
Для того чтобы оценить энергетику реакции и предсказать ее направление,
важно знать, положительное или отрицательное изменение AG' сопровождает
данную реакцию. Если AG' — величина отрицательная, то мы имеем дело с
экзергонической реакцией, которая может протекать спонтанно с выделением
энергии. Если реакция характеризуется положительным значением AG', то она
требует энергетических затрат и самопроизвольно идти не может. Такая эндер-
гоническая реакция возможна только в том случае, если существует механизм,
с помощью которого она получит энергию от экзергонической реакции с от-
рицательным AG'. Процесс, в результате которого энергия, выделяемая в ходе
экзергонической реакции, не рассеивается в виде тепла, а передается другой
89
реакции, называется энергетическим сопряжением, а сами реакции — сопря-
женными.
Каким образом происходит сопряжение множества энергодающих и энер-
гозависимых реакций в клетке, где они протекают в разных компартментах и
разделены во времени? Для интеграции метаболизма в единое целое вся посту-
пающая в клетку энергия, будь то световая энергия или энергия субстратов
дыхания, сначала преобразуется и запасается в форме универсальных энерге-
тических и восстановительных эквивалентов. Универсальными, или конверти-
руемыми, формами клеточной энергии в растительной1 клетке является транс-
мембранный градиент электрохимического потенциала ионов водорода, или элек-
трохимический протонный градиент Дцщ и АТФ. Важнейшими восстанови-
тельными эквивалентами являются никотинамидадениндинуклеотид (НАДН)
и никотинамидадениндинуклеотидфосфат (НАДФН). В фотосинтезе поглоще-
ние света сопровождается восстановлением НАДФН и синтезом АТФ в хло-
ропластах. В процессе дыхания, который имеет место в клетках растений и
животных, восстановленный НАДН и АТФ образуются в митохондриях. В обо-
их случаях синтез АТФ опосредован образованием на тилакоидной или мито-
хондриальной мембране электрохимического протонного градиента Дцн+.
2.4. ЭНЕРГОЗАВИСИМЫЕ РЕАКЦИИ СОПРЯЖЕНЫ
С РЕАКЦИЕЙ ГИДРОЛИЗА АТФ
Молекула АТФ имеет сложную структуру, основой которой являются нук-
леотид аденин, остаток рибозы и три остатка фосфорной кислоты (рис. 2.1).
Между фосфатными группами имеются две высокоэнергетические, или мак-
роэргические связи, при разрыве которых освобождается много энергии. В ре-
зультате гидролиза молекула АТФ теряет одну концевую фосфатную группи-
ровку, которая переносится на гидроксил воды, в результате чего образуется
аденозиндифосфат (АДФ) и неорганический фосфат. Последний представляет
собой стабильный ион (НРО4 ) и обозначается как Фн (Pj).
АТФ + Н2О АДФ + Фн.
Дб°' = -30,6 кДж-моль-1 (-7,3 ккал • моль-1).
В молекулах АТФ и АДФ фосфатные группы способны к ионизации, сте-
пень которой зависит от pH среды. При pH 7,0 АТФ и АДФ представлены
анионами с высоким зарядом: АТФ4' и АДФ3-. В ионизированной форме АТФ и
АДФ образуют комплексы с ионом магния, который, как правило, необходим
для протекания реакций с участием АТФ.
Величина ДСР реакции гидролиза АТФ может быть рассчитана по урав-
нению
ДС? = ДСГ + 2,3/?Т1ё([АДФ][Фн]/[АТФ]).
1 На плазматической мембране клеток животных, а также некоторых морских бактерий, в
качестве конвертируемой формы энергии используется трансмембранный градиент ионов
натрия ApNa+.
90
Концентрация воды как стандартного раство-
рителя принята за 1 М. В реальных условиях зна-
чение Л С? зависит от температуры, содержа-
ния ионов магния, концентрации реагирующих
веществ и составляет -1L ,..-13 ккал • моль-1. Для
синтеза АТФ — это та же величина, взятая с
обратным знаком.
В некоторых реакциях гидролиз АТФ идет с
отщеплением сразу двух фосфатных групп с
образованием аденозинмонофосфата (АМФ) и
пирофосфата (ФФН), который подвергается даль-
нейшему гидролизу с образованием энергии:
О
О-Р=о
Рис. 2.1. Структура АТФ
Н2О + НО—P-О—Р-О —* 2НРО4
II II
ACT' = -33,5 кДж • моль *.
АТФ представляет собой универсальное макроэргическое соединение, ре-
акция гидролиза которого сопряжена со множеством энергозависимых про-
цессов. Сопряжение осуществляется через образование общего для двух реак-
ций промежуточного продукта: отщепляемый от АТФ фосфат временно пере-
носится на молекулу одного из реагирующих веществ. В результате такого фос-
форилирования энергия молекулы повышается, и это дает возможность прой-
ти энергетически невыгодной реакции. Помимо АТФ в клетке есть и другие
соединения с макроэргической связью и высокими значениями свободной энер-
гии гидролиза (см. гл. 4), однако именно АТФ является наиболее общим и
прямым источником энергии в клетке. В то же время следует заметить, что роль
АТФ в метаболизме гораздо шире — это универсальный донор фосфатных групп
в реакциях фосфорилирования, катализируемых ферментами киназами. Такие
реакции важны не только для синтеза новых соединений, но и для регуляции
ферментативной активности, а также играют важную роль в процессах, свя-
занных с клеточной сигнализацией (см. гл. 7).
2.5. ПРЕОБРАЗОВАНИЕ ЭНЕРГИИ
НА СОПРЯГАЮЩИХ МЕМБРАНАХ СВЯЗАНО
С ОБРАЗОВАНИЕМ ЭЛЕКТРОХИМИЧЕСКОГО
ПРОТОННОГО ГРАДИЕНТА (Дцщ)
Расход АТФ на обеспечение энергозависимых реакций должен восполнять-
ся ее синтезом, который требует адекватных энергетических затрат. Каким же
образом происходит синтез АТФ в клетке и каким образом используется для
этого энергия внешних ресурсов?
Небольшая часть АТФ может быть образована при анаэробном разложе-
нии глюкозы в биохимических реакциях гликолиза (см. гл. 4). Основная же
91
часть АТФ в клетках растений, животных и многих бактерий образуется в
процессах фотосинтеза или дыхания. В основе трансформации энергии (будь
то энергия света или субстратов дыхания) в энергию молекулы АТФ лежит
общий и единый механизм, который получил название хемиосмотического со-
пряжения. Впервые хемиосмотическая теория была постулирована в 1960 г. анг-
лийским биохимиком Питером Митчеллом. Однако идеи Митчелла были столь
необычны, что стали общепризнанными лишь спустя некоторое время, когда
получили неопровержимые экспериментальные подтверждения. Впоследствии
П. Митчелл получил за свое открытие Нобелевскую премию (1978). Рассмот-
рим в общих чертах, в чем смысл хемиосмотического сопряжения и какие
события лежат на пути преобразования энергии в клетке.
В системах трансформации энергии ключевая роль принадлежит замкнутой,
сопрягающей мембране, непроницаемой для ионов. К сопрягающим относятся
тилакоидная мембрана хлоропластов, внутренняя мембрана митохондрий и
плазматические мембраны бактериальных клеток. Как правило, сопрягающая
мембрана обогащена белком и биохимически отличается от других мембран
клетки, так как содержит уникальный фосфолипид — кардиолипин, который
делает мембрану более жидкой и более непроницаемой для ионов.
Энергопреобразующие мембраны содержат электрон-транспортные цепи
(ЭТЦ). В процессах фотосинтеза и дыхания реализация энергии света или
окисляемых субстратов в тилакоидной или митохондриальной мембране свя-
зана с возникновением электронного транспорта в ЭТЦ. Перенос электрона в
фотосинтетической или дыхательной цепи неразрывно связан с векторной
транслокацией иона Н+ через мембрану против сил электрического поля и в
направлении большей концентрации. В фотосинтезе действие ЭТЦ сопряже-
но с накоплением протонов внутри тилакоидного пространства. Дыхательная
цепь перекачивает протоны из матрикса в межмембранное пространство ми-
тохондрий. Процесс транслокации протона сопровождается энергизацией мем-
браны, т.е. возникновением на ней трансмембранной разности, или градиен-
та электрохимического потенциала ионов водорода (ДцнД, или протондви-
жущей силы Др. Генерируемый на мембране Дцщ представляет собой форму
энергии, запасенную на мембране. Он используется для синтеза АТФ в про-
цессах фотофосфорилирования (см. гл. 3) и окислительного фосфорилирования
(см. гл. 4). Синтез АТФ катализируется ферментом АТФ-синтазой, также ло-
кализованным в сопрягающих мембранах хлоропластов, митохондрий или бак-
терий.
Таким образом, система трансформации энергии включает следующие ос-
новные компоненты:
• замкнутая сопрягающая мембрана;
• локализованная в мембране ЭТЦ;
• трансмембранный электрохимический протонный градиент Дцщ, генери-
руемый работой цепи;
• АТФ-синтаза, катализирующая синтез АТФ из АДФ и Фн за счет энергии
ДДн+-
Так выглядит общая схема преобразования энергии на мембране. Рас-
смотрим теперь более подробно, что представляет собой энергия Дцщ и ка-
ким образом она превращается в энергию макроэргической связи в молекуле
АТФ.
92
2.6. ТРАНСМЕМБРАННЫЙ ЭЛЕКТРОХИМИЧЕСКИЙ
ПРОТОННЫЙ ГРАДИЕНТ И ЕГО СОСТАВЛЯЮЩИЕ
Состояние вещества s в растворе можно охарактеризовать через химический
потенциал щ, который измеряется в единицах свободной энергии. При усло-
вии, что активность вещества равна его концентрации и гидростатическим
давлением1 можно пренебречь, химический потенциал вещества s равен:
щ щ + 2,3/?Tlg [Cs] [Дж моль-1],
где щ — стандартный химический потенциал вещества s при концентрации 1 М;
[Cs] — молярная концентрация вещества s.
Состояние иона i определяют через электрохимический потенциал Д, кото-
рый учитывает, что состояние иона зависит не только от его концентрации,
но и от электрического потенциала раствора:
Д; = Д° + 2,37?Tlg[Ci] + ZjFy [Дж - моль-1],
где Рц — стандартный электрохимический потенциал при концентрации иона
1 М; R — газовая постоянная (8,314 Дж моль-1 К-1); Т — абсолютная темпе-
ратура, К; [С,] — концентрация иона в молях; F — число Фарадея (96,49 кДжх
хВ-1-моль-1); z — заряд иона; у — электрический потенциал раствора.
Электрохимический потенциал оценивает свободную энергию иона и учи-
тывает все силы, способные побудить ион к движению из одной области в
другую. Спонтанное движение ионов через мембрану из области с более высо-
ким в область с более низким электрохимическим потенциалом представляет
собой пассивный транспорт, или диффузию. Движущей силой диффузии явля-
ется разность электрохимических потенциалов, или трансмембранный элект-
рохимический градиент иона ДД,-. Движение иона против градиента электрохи-
мического потенциала требует энергии и называется активным транспортом.
Если потенциалы ионов по обе стороны мембраны равны, т.е. ДД,- = 0, это
означает, что ионные потоки через мембрану находятся в равновесии.
Представим, что мембрана разделяет две области, в которых содержание
ионов Н+ разное и электрохимические потенциалы Н+ соответственно равны
Днг и Дн*.
Область 1: Дн; = Дн+ + 2,37?Tlg[H+]i + Zj^Yi-
Область 2: Дщ = Дн+ + 2,37?Tlg[H+]2 + zFy2.
йн; йн;
Н+Н+Н+Н+ н+н+он-
Н+ЕГН+Н+ FT ОН- Н+ Н+
Н+ ОН- ОН- ОН- ОН-
Н+Н+Н+Н+ он- он-
Н+Н+Н+Н+ он- он-
1 В гл. 5 «Водный обмен» показано, что химический потенциал воды зависит не только от
активности воды, но и от гидростатического давления в системе.
93
В результате неравномерного распределения иона Н+ возникает трансмемб-
ранный градиент электрохимического потенциала Ацн+, равный разности элек-
трохимических потенциалов протонов по обе стороны мембраны:
Йн( — Йн) = Лцн+= zFAvi-2 + 2,3/?Tlg[H+]1/ [Н+]2 [Дж-моль"1],
где Ацн+ ~ разность электрохимических потенциалов иона Н+ по обе стороны
мембраны; z — заряд иона Н+, равный +1; Ау,_2 — разность электрических
потенциалов между двумя водными фазами, разделенными мембраной, т. е.
электрический потенциал на мембране в вольтах; [H+]j и [Н+]2 — молярные
концентрации ионов Н+ по обе стороны мембраны (индексы 1 и 2 относятся к
растворам, находящимся внутри и снаружи замкнутой мембраны).
Частное от деления величины АДН+ на постоянную /’называется протондви-
жушей силой Ар и измеряется в вольтах. Если ввести константы и выразить
логарифм концентраций ионов Н+ в единицах pH (pH = -1g [Н+], то для темпе-
ратуры 25 °C получим простое выражение
Ар = Лр.н-//’ = A\g - 59АрН [мВ].
Как видно из уравнения, протондвижущая сила состоит из двух компонен-
тов. Первый — это градиент АрН, т.е. разность концентраций ионов Н по обе
стороны мембраны. Градиент pH заставляет ионы Н+ и ОН- концентрировать-
ся около поверхности мембраны. Это приводит к возникновению мембранного
потенциала Ау (второй компонент), созданного избытком положительного
заряда на одной стороне мембраны и отрицательного — на другой. Эффект
мембранного потенциала усиливается другими ионами разных знаков, кото-
рые также притягиваются и концентрируются около мембраны. Следует под-
черкнуть, что, хотя одна стороны мембраны заряжена более положительно по
отношению к другой, основной раствор остается в целом электронейтраль-
ным, т.е. содержит равное число катионов и анионов. Дело в том, что число
«лишних», несбалансированных ионов, формирующих слой заряда на мембра-
не, ничтожно мало в сравнении с общим числом ионов в растворе.
2.7. ЭНЕРГИЯ Дцн ИСПОЛЬЗУЕТСЯ ДЛЯ СИНТЕЗА АТФ
ИЗ АДФ И Фн ПРИ УЧАСТИИ АТФ-СИНТАЗЫ
Неравномерное распределение протонов по обе стороны мембраны по-
буждает их к диффузии по градиенту концентрации и заряда, которой
препятствует мембрана. Энергия Ацнч или Ар, является мерой свободной энер-
гии (АС = Дин'), которая запасена на мембране и может быть освобождена,
если протоны начнут проходить мембрану по градиенту своего потенциала.
Эта энергия может быть использована, если есть механизм сопряжения диф-
фузии с энергозависимой реакцией. Такой механизм представляет собой АТФ-
синтаза (F]F0 — АТФаза, или Н* АТФаза F-muna), интегрированный в сопря-
гающую мембрану ферментный комплекс, который использует энергию Ацн*
для синтеза АТФ из АДФ и Ф„. Синтез сопряжен с обратным током протонов
по градиенту своего потенциала через АТФ-синтазный комплекс, т.е. осу-
ществляется в момент разрядки мембраны при уменьшении, или диссипа-
ции Арн*.
94
Обе составляющие Др — градиент ДрН и мембранный потенциал Ду — стре-
мятся заставить протоны пересекать мембрану по градиенту концентрации и
заряда, и обе составляющие, таким образом, равноценны для синтеза АТФ,
Этот тезис подтверждается в экспериментах in vitro. АТФ-синтазы могут быть
выделены из мембраны с помощью детергентов и встроены в искусственные
мембранные пузырьки (липосомы), приготовленные из очищенных фосфо-
липидов. В этом случае синтез АТФ можно наблюдать, если искусственно
создать градиент pH или приложить к мембране разность электрических по-
тенциалов.
Хотя основная функция АТФ-синтазы — синтез АТФ, этот фермент в опре-
деленных условиях может проявлять АТФазную активность, т.е. перекачивать
протоны против градиента за счет гидролиза АТФ. Следовательно, АТФ-син-
таза (Н+-АТФаза) в принципе способна к взаимопревращению двух форм
энергии:
АТФ-синтаза
Дцн+ --------Г АТФ
АТФаза
Энергия Дцн+ может быть использована не только для синтеза АТФ, но и в
других целях. Например, в митохондриях она используется для транспорта ве-
ществ через мембрану. Кроме того, рассеивание ДДН+ имеет значение в термо-
регуляторном образовании теплоты (см. гл. 4).
2.8. СИНТЕЗ АТФ СВЯЗАН С КОНФОРМАЦИОННЫМИ
ИЗМЕНЕНИЯМИ АКТИВНЫХ ЦЕНТРОВ АТФ-СИНТАЗЫ.
РОТАЦИОННЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТА
АТФ-синтазы разного происхождения — из митохондрий, хлоропластов или
бактериальных мембран — имеют в целом схожее строение, что говорит о
несомненно древнем эволюционном происхождении фермента. На снимках,
полученных при помощи электронной микроскопии, АТФ-синтазы выглядят
как локализованные в мембранах грибовидные структуры. Хорошо видно, что
фермент состоит из двух частей — двух белковых комплексов, которые обозна-
чают как фактор Ft и фактор Fo (CF, и CF0 — для АТФ-синтазы хлоропластов).
Фактор, или комплекс, F, расположен вне мембраны и на снимках представ-
ляет собой «шляпку» гриба высотой 8 нм и шириной 10 нм. Этот гидрофиль-
ный сферический комплекс представляет собой каталитический центр, на
95
котором осуществляется синтез АТФ. Гидрофобный Р0-фактор интегрально
встроен в мембрану и формирует канал, по которому ионы Н+ могут пересе-
кать мембрану, двигаясь по градиенту своего потенциала. Более детально струк-
тура фермента была исследована с помощью рентгеноструктурного анализа с
разрешением 0,28 нм на комплексах, выделенных из митохондрий сердца быка
и мембран Escherichia coli (рис. 2.2).
Комплекс Fj состоит из пяти разных субъединиц в определенном соотноше-
нии: азРзуйе. Основу его структуры составляют гомологичные субъединицы а и
Р, чередующиеся друг с другом. Места связывания для нуклеотидов есть на
обеих субъединицах, но три активных центра, где происходит синтез АТФ,
расположены в основном на субъединицах р. Субъединицы аир расположены
поочередно вокруг у-субъединицы, которая представляет собой стержень (= 9 нм)
и, как втулка, проходит через каталитический центр, связывая факторы F, и
Fo. Субъединица 6, расположенная на внешней стороне одной из р-субъеди-
ниц, служит сайтом прикрепления двух й-субъединиц, которые заякоривают
комплекс F| в мембране. Функции e-субъединицы связаны с регуляцией: £-субъ-
единица избирательно препятствует гидролизу АТФ. Фактор Fj легко диссоци-
ирует от Fo и проявляет in vitro АТФазную активность, гидролизуя АТФ.
Комплекс Fo состоит из трех типов белковых субъединиц в следующем со-
отношении: A2c9_ |2- Он обеспечивает связывание F, с мембраной и перенос
протона. Небольшие, очень гидрофобные с-субъединицы, имеющие по два
Рис. 2.2. Модель АТФ-синтазы Р|Р0-типа.
Периферический F,-фактор состоит из пяти видов субъединиц (а3Р3у6с) и несет на |5-субъ-
единицах каталитические центры. Ргфактор заякорен в мембране с помощью у-субъединицы и
Fo-фактора. Р0-комплекс состоит из трех видов субъединиц в соотношении alb2cw_l2. Субъедини-
цы а и с формируют протонный канал, через который ионы Н' входят с одной, а выходят с
другой стороны мембраны. Движение протонов внутри кольца из с-субъединиц сопровождается
его вращением и вращением связанных с ним ус-субъединиц. Ротация сопровождается конфор-
мационными изменениями каталитических центров Ргкомплекса, в которых идет синтез АТФ.
По-видимому, а3р3-комплекс не вращается, так как удерживается в фиксированном положении
с помощью 6- и двух b-субъединиц. В митохондриях F,-комплекс обращен в матрикс
96
трансмембранных участка, формируют проводящий протоны канал, который
обеспечивает прохождение Н+ через всю мембрану. Интересно отметить, что
такой сложный ферментный комплекс, как АТФ-синтаза, находится под двой-
ным генетическим контролем: три субъединицы Р0-фактора и а-субъединицы
фактора F| кодируются геномом митохондрий или хлоропластов, тогда как
синтез остальных субъединиц контролируется ядерными генами.
Исследования АТФ-синтазных комплексов велись давно, но механизм их
действия и структурно-функциональная связь факторов F, и Fo стали понят-
ными относительно недавно. Здесь следует отметить приоритет работ Р. Boyer
и J. Walker (Нобелевская премия, 1997). Благодаря исследованиям этих ученых
стал понятным принцип работы фермента, получивший название ротационно-
го механизма. Согласно ротационному механизму, энергия, освобождаемая при
диффузии протонов через Р0-канал, используется для вращения у-субъедини-
цы. Результатом ротации у-субъединины является последовательная смена кон-
формационных состояний активных центров, расположенных на трех 0-субъ-
единицах F|-комплекса. Синтез АТФ из АДФ и Фн идет в активных центрах
спонтанно благодаря конформационным перестройкам. Энергия Д0Н+, осво-
бождаемая в результате протонного транспорта через Р0-канал, используется
не на синтез АТФ, а для освобождения АТФ из активного центра в результате
изменения его конформации. Прямое доказательство ротационного механизма
было получено японскими учеными, которым удалось продемонстрировать
вращение у-субъединицы относительно сидящего на ней фактора F(. Изолиро-
ванный комплекс F| был иммобилизован на неподвижной подложке, а к кон-
цу у-субъединицы был химически пришит флуоресцирующий фрагмент нити
актина длиной 1 мкм. С помощью флуоресцентного микроскопа в реальном
времени удалось наблюдать вращение нити актина при работе фермента, гид-
ролизующего АТФ
Часто АТФ-синтазу называют молекулярным мотором и используют механи-
ческие термины для описания ее работы. Считается, что комплекс а303-субъ-
единиц удерживается в фиксированном положении, так как за якорем в мем-
бране через субъединицы 5, 2Ь, а, выполняющие функцию «статора». Ток Н+
вызывает вращение кольца, состоящего из субъединиц с и контактирующих с
ним субъединиц у и е, которые все вместе выполняют функцию вращающего-
ся «ротора».
Известно, что субъединица а образует 5 трансмембранных а-спиралей и фор-
мирует пути для входа Н+ с одной стороны мембраны и выхода — с другой.
Движение Н+ внутри кольца из субъединиц с связано с последовательным
протонированием/депротонированием ключевого остатка аспартата (Asp-61),
расположенного на одной из двух а-спиралей с-субъединиц. Этот процесс со-
пряжен с поворотом каждой с-субъединицы и запускает пошаговое вращение
с-кольца (ротора) относительно о/ъстатора. Расчеты показывают, что синтез
одной молекулы АТФ сопряжен с транспортом 3-4Н+ через Р0-канал.
Рассмотрим подробно, в результате каких событий происходит синтез АТФ
в каталитическом центре фермента. Согласно последним данным (Р. Воуег, 2002),
в результате вращения у-субъединицы относительно а303-комплекса изменяет-
ся конформация расположенных на 0-субъединицах трех активных центров,
каждый из которых в данный момент времени может находиться в трех разных
состояниях (рис. 2.3). Эти конформационные состояния, названные «откры-
4 Физиология растений
97
Рис. 2.3. Состояние каталитических центров АТФ-синтазы:
А — Бркомплекс на трех р-субъединицах несет три активных центра, которые одновременно
могут находиться в одном из трех конформационных состояний — О-центр, Т-центр и L-центр.
Ротация у-субъединицы в момент движения протонов через Р0-канал вызывает изменение кон-
формации сразу трех центров; Б — конформационные изменения одного активного центра при
повороте у-субъединицы на 360”. Субстраты, АДФ и Фн связываются в «открытом» О-центре.
Ротация у-субъединицы на 120” переводит центр в «закрытое» Т-состояние. В Т-центре спонтан-
но идут реакции синтеза и гидролиза АТФ. При следующем шаге вращения на 120° Т-центр
переходит в L-центр, из которого возможен выход синтезированной АТФ. Пунктиром указаны
возможные промежуточные состояния центров
тым» («open» — О), «закрытым» («tight» — Т) и «слабосвязанным», или «не-
плотным» («loose» — L), центрами, различаются по степени сродства к АДФ,
АТФ и Фн. Принципиальным моментом является тот факт, что в результате
тесного контакта между а-, р- и у-субъединицами конформационные измене-
ния возникают одновременно на всех трех р-субъединицах при повороте у-субъ-
единицы на 120°. При этом каждый активный центр последовательно проходит
через три смены конформаций и возвращается в исходное состояние при пол-
98
ном повороте у-субъединицы на 360° (см. рис. 2.3). Каталитический цикл начи-
нается со связывания АДФ и Фн в О-центре: в «открытом» состоянии центр
имеет высокое сродство к АДФ и крайне низкое — к АТФ. В то же время АДФ
и Фн относительно слабо удерживаются в центре и могут выходить из него.
Поворот у-субъединицы на 120° переводит О-центр в «закрытое» Т-состояние.
В Т-центре молекулы АДФ и Фн уже прочно связаны и не могут его покинуть.
Конформация Т-центра такова, что в нем самопроизвольно идут акты образо-
вания и разрыва ковалентной связи АДФ ~ Фн, т. е. синтеза и гидролиза АТФ.
Важно, что синтез АТФ в «закрытом» центре идет спонтанно, энергетиче-
ски даром, только за счет создания особой конфигурации между активными
группами фермента и молекулами АДФ и Фн. Более того, синтез АТФ в «зак-
рытом» центре может идти даже в условиях деэнергизованной мембраны или
даже вне мембраны на изолированном F,-комплексе. Однако освобождения
синтезированной АТФ из «закрытого» центра не происходит: для этого необ-
ходим следующий этап вращения и переход в состояние L-центра. В этом со-
стоянии связи АТФ с центром ослабевают и молекула может его покинуть и
перейти в водную фазу. Следует отметить, что в момент открытия Т-центра в
нем находится именно молекула АТФ. Предполагается, что в момент перехода
равновесие АДФ + Фн АТФ сдвигается в сторону синтеза АТФ под влиянием
протондвижущей силы. Следующий этап вращения переводит центр в исходное,
«открытое» состояние, из которого, вероятно, также возможен выход АТФ.
В течение синтеза АТФ конформационные состояния активных центров после-
довательно меняются в направлении: О —* Т —► L —► О.
Таким образом, согласно ротационному механизму, энергия Дцн+ расходу-
ется не на стадии образования химической связи АДФ ~ Фн, а необходима для
смены конформаций и выхода АТФ из активных центров фермента. При нали-
чии Др для быстрого синтеза АТФ в Т-центре второй каталитический центр в
О-конформации должен содержать связанные АДФ и фосфат.
В условиях, неблагоприятных для синтеза АТФ, например при низком со-
держании АДФ или Фн или при низкой Др, возможны гидролиз АТФ и пере-
качка протонов против градиента. В этом случае происходит связывание АТФ в
L-центре и гидролиз АТФ, сопряженный с последовательной сменой конфор-
маций в обратном направлении L —* Т —► О.
В настоящее время интенсивно изучаются все аспекты работы АТФ-синтазы.
Аминокислотные остатки и функциональные группы, критичные для враще-
ния и для конформационных изменений, исследуются с помощью точечного
мутагенеза, позволяющего получать мутации, связанные с заменой в структу-
ре фермента одной единственной аминокислоты. В то же время молекулярные
механизмы сопряжения двух физически дистанцированных процессов — транс-
порта протонов и синтеза АТФ — остаются пока неясными.
2.9. ЦИРКУЛЯЦИЯ ИОНОВ ЧЕРЕЗ МЕМБРАНЫ.
ДРУГИЕ АТФазы
Синтез АТФ при использовании протонного потенциала на мембранах хло-
ропластов и митохондрий не единственный случай взаимопревращений ион-
ных градиентов и АТФ. Большинство клеточных мембран, а именно плазма-
99
лемма, тонопласт, мембраны ЭПР, содержат ферменты, действие которых
направлено на создание ионных градиентов при использовании энергии АТФ.
Эти ферменты известны под общим названием АТФаз, их называют также
ионными помпами, или насосами. АТФазы функционируют как электроген-
ные ионные насосы, эффективно перекачивая ионы через мембрану против их
электрохимического градиента за счет энергии гидролиза АТФ. В то же время в
условиях крутого градиента транспортируемых ионов in vitro некоторые из них
могут обращать свое действие, осуществляя синтез АТФ. Таким образом, среди
АТФаз есть обратимые сопрягающие системы, которые способны к взаимо-
превращению энергии ионных градиента и макроэргической связи в молекуле
АТФ.
На основе строения, локализации и механизма действия АТФазы делят на
три группы: Н+-АТФазы F-типа, Н+-АТФазы V-типа и АТФазы Р-типа.
В первую группу входят рассмотренные выше АТФ-синтазы (Р|Р0-АТФазы)
из мембран митохондрий и хлоропластов, а также сопрягающих бактериаль-
ных мембран. В физиологических условиях эти ферменты работают на синтез
АТФ, но могут функционировать как АТФазы, и поэтому рассматриваются в
общем контексте.
В клетках эукариот имеются вакуолярные АТФазы, или АТФазы V-типа,
локализованные в тонопласте, мембранах ЭПР и лизосом, которые в норме
работают на создание протонного градиента (АТФ —► Ацн+). Сопряженно с
гидролизом АТФ они переносят Н+ через мембрану из цитозоля, закисляя про-
странство вакуолей или других органелл (см. подразд. 6.2.2). По своей структуре
и составу субъединиц АТФазы V-типа сильно напоминают FjFo-АТФазы. Они
также состоят из двух компонентов — трансмембранного Vo и гидрофильного
Vj-комплексов — и работают, вероятно, по аналогичному принципу.
Клетки животных и растений содержат АТФазы, относящиеся к Р-типу.
Для АТФаз P-типа характерно, что в ходе каталитического цикла механизм
переноса ионов связан с фосфорилированием самого фермента за счет АТФ.
АТФазы P-типа имеют простое строение: большинство ферментов этой груп-
пы представляют собой единый полипептид, имеющий сходные аминокислот-
ные последовательности и молекулярную массу около 100 кДа. Исключение
составляет Иа+/К+-АТФаза, у которой есть вторая небольшая субъединица с
неизвестной функцией. Все АТФазы P-типа содержат 6, 8 или 10 трансмемб-
ранных спиральных участков и гидрофильную петлю, где и происходит обра-
тимое фосфорилирование по остаткам аспартата. Кроме того, характерной осо-
бенностью этих АТФаз является то, что все они ингибируются ортованадатом
(H2VO4) — структурным аналогом иона фосфата.
К P-типу относится хорошо изученная 1Ча+/К+-АТФаза клеток животных.
Этот фермент, локализованный в плазматической мембране, катализирует
транспорт ионов натрия и калия: на каждую молекулу гидролизованного АТФ
фермент выкачивает из клетки 3 иона Na+ в обмен на 2 иона К+. Na+/K -АТФаза
создает на мембране ApNa+ (АТФ —► ApNa*), который используется животной
клеткой для активного транспорта веществ, а также при проведении нервных
импульсов. В клетках растений 1Ча+/К+-АТФаза отсутствует. На плазмалемме кле-
ток растений, а также водорослей и грибов функционирует Н+-АТФаза Р-типа,
которая выкачивает Н+ из цитозоля в фазу клеточной стенки, осуществляя
реакцию АТФ —* Ацн* и тем самым внося основной вклад в поляризацию
100
плазмалеммы. К АТФазам P-типа относится также Са2+-АТФаза, расположен-
ная на плазмалемме и внутренних мембранах ЭПР у растений и животных.
Этот фермент откачивает Са + из цитозоля, либо выводя его из клеток, либо
закачивая внутрь компартментов. На каждую гидролизованную молекулу АТФ
через мембрану переносится 2 иона Са +. В результате работы этого фермента
концентрация Са + в цитозоле очень низкая.
Ионные градиенты на мембранах, создаваемые АТФазами, — это еще один
источник энергии в клетке. Ионные градиенты могут быть движущей силой
активного транспорта веществ через мембраны (см. гл. 6). С ними связаны такие
процессы, как рост растительных клеток и трансдукция сигнала (см. гл. 7).
2.10. НАПРАВЛЕНИЕ ПЕРЕНОСА ЭЛЕКТРОНОВ В ЭТЦ
ОПРЕДЕЛЯЕТСЯ РЕДОКС-ПОТЕНЦИАЛОМ ПЕРЕНОСЧИКОВ
Создание ДцН4 сопряжено с электронным транспортом в тилакоидной и
митохондриальной мембранах. Рассмотрим, что представляет собой ЭТЦ и какие
события в ней происходят. Прежде всего нужно сказать, что электронный транс-
порт связан с происходящими в мембране окислительно-восстановительными
реакциями.
В широком смысле слова окислением называется процесс, связанный с от-
дачей электронов (е), а восстановлением — процесс, связанный с их присо-
единением. Соединение, присоединяющее электроны, является акцептором, а
отдающее электроны — донором электронов. Окисленная и восстановленная
формы соединения, способного отдавать и принимать ё~, называется окисли-
тельно-восстановительной, или редокс-парой: донор электронов -*-*• акцеп-
тор электронов + пе~.
Способность данной редокс-пары быть донором или акцептором е опреде-
ляется на основе окислительно-восстановительного, или редокс-потенциала,
£', выраженного в вольтах:
2,3RT. [акцепторе ]
£'=£'+ ----— Ш—z--------г-’
nF [донор е ]
где R — газовая постоянная (8,314 Дж моль-1 • К-1); Т — абсолютная температу-
ра, К; п — число переносимых электронов; F— число Фарадея (96,4 кДж • В~*х
хмоль-1); [акцептор е~], [донор ё~] — концентрации в молях окисленной и
восстановленной форм редокс-пары; Е°' — стандартный редокс-потенциал.
Стандартный потенциал Е°' определяется экспериментально. Помещая элек-
трод в раствор, содержащий данную редокс-пару, можно измерить э.д.с. цепи,
составленной из данного электрода и электрода сравнения. В качестве стандар-
та используется водородный электрод (потенциал реакции Н2 = 2е" + 2Н+ при
давлении газообразного Н2 1 атм, концентрации ионов водорода 1М (pH 0) и
25 °C условно принят за нуль). В биохимии электродные потенциалы Е°' опре-
деляются при pH 7,0. Потенциал водородного электрода равен -0,42 В.
По определению, Е°' (или потенциал средней точки Ет1) равен ЭДС, воз-
никающей в полуэлементе, содержащем донор и акцептор е в равной концен-
трации (при 25 °C и pH 7,0) и находящемся в равновесии с электродом, спо-
собным обратимо принимать электроны. Значение Е°' характеризует способ-
101
ность данной редокс-пары быть донором или акцептором электронов и позво-
ляет предсказать направление переноса е от одной редокс-пары к другой при
стандартных условиях. Система с более положительным Е°' может быть окисли-
телем по отношению к системе с более отрицательным Е°'. Например, редокс-
пара НАДН/НАД+ имеет потенциал -0,32 В, что указывает на сильно выра-
женную способность НАДН к отдаче электронов. Наоборот, Е°' пары Н2О/1/гО2
составляет +0,82 В, что отражает слабую тенденцию воды к отдаче е~ и сильно
выраженную способность кислорода к их присоединению. Следует отметить,
что в этом интервале находятся редокс-потенциалы многих соединений, при-
нимающих участие в процессах фотосинтеза и дыхания.
В мембране тилакоидов и внутренней мембране митохондрий локализованы
и определенным образом ориентированы соединения, которые являются пере-
носчиками электронов и имеют разные редокс-потенциалы. Эти соединения,
реагируя друг с другом, способны обратимо окисляться и восстанавливаться,
поочередно выступая в роли доноров и акцепторов электронов. В результате
последовательных окислительно-восстановительных реакций происходит пе-
ренос е~ по цепочке от одного переносчика к другому в соответствии со значе-
ниями их редокс-потенциалов. Процесс этот называется электронным транс-
портом, а переносчики электрона формируют электрон-транспортную цепь.
Важно знать, что переносчики электрона имеют разную природу, и реакции с
их участием могут быть связаны с транспортом непосредственно электрона (е~),
атома водорода (Н‘) или гидрид-иона (Н? = 2ё~ +Н+) от донора к акцептору.
Согласно законам термодинамики, перенос ё~ в ходе редокс-реакций в ЭТЦ
сопровождается изменением свободной энергии G, которое для стандартных
условий может быть рассчитано по уравнению
AG""' = -nF-kE°' [Дж моль-1],
где AG°' — стандартное изменение свободной энергии; п — число переноси-
мых электронов; ЕЕ°' — разность стандартных потенциалов конечного акцеп-
тора и исходного донора е~ в реагирующей системе.
Редокс-потенциалы определены практически для всех участников ЭТЦ ды-
хания и фотосинтеза. В дыхательной цепи митохондрий электронный транс-
порт от НАДН на О2 идет по градиенту редокс-потенциала. В процессе фото-
синтеза энергия света используется для инициации электронного транспорта
от воды к НАДФ+ против градиента редокс-потенциала.
2.11. ОРГАНИЗАЦИЯ ЭТЦ В МЕМБРАНЕ
Электрон-транспортные цепи фотосинтеза и дыхания организованы в мемб-
ране сложным образом и представляют собой встроенные в нее суперкомплек-
сы, состоящие из многих субъединиц белка. В их составе обязательно присут-
ствуют трансмембранные белки, закрепляющие весь комплекс в мембране.
Каждый суперкомплекс содержит, как правило, несколько активных центров:
на белках в качестве простетических групп или за счет нековалентных взаимо-
действий удерживаются соединения, которые участвуют в переносе электрона.
Некоторые комплексы из тилакоидных и митохондриальных мембран удалось
выделить с помощью детергентов и получить в кристаллизованном состоянии.
102
Это позволило изучить их молекулярную организацию методом рентгенострук-
турного анализа. Связь между комплексами осуществляют подвижные пере-
носчики, которые могут перемещаться либо в липидной фазе мембраны (хи-
ноны), либо в водной фазе вблизи мембраны. Реакции в ЭТЦ идут с большими
скоростями, измеряемыми в интервалах 10~4—10“9 с.
Организация электронного транспорта такова, что перенос электрона по
цепи неразрывно связан с направленной транслокацией ионов Н через мемб-
рану и генерацией Дцн+. В тилакоидной мембране протоны переносятся внутрь
тилакоидного пространства, а в митохондриях — из матрикса в межмембран-
ное пространство. Механизмы транслокации Н+ через мембрану могут быть
разными и в ряде случаев пока остаются неясными. Общим случаем является
перенос протона через мембрану при участии подвижных переносчиков —
хинонов (см. гл. 4).
Если в процессе электронного транспорта на мембране возникает Дцщ, ко-
торый используется на синтез АТФ, то транспорт называется сопряженным.
Однако могут быть ситуации, когда работа цепи не сопряжена с генерацией
Дцн* и синтезом АТФ. Тогда электронный транспорт называется разобщенным.
Разобщение электронного транспорта с фосфорилированием имеет место in
vivo, при этом энергия электронного потока преобразуется (диссипирует) в
тепло. Разобщение имеет место в митохондриях животных и растений и пред-
ставляет особый механизм регуляции метаболизма (см. подразд. 4.3.8).
2.12. НЕКОТОРЫЕ ПЕРЕНОСЧИКИ ЭЛЕКТРОНОВ
ЯВЛЯЮТСЯ ОБЩИМИ ДЛЯ ЭТЦ ВСЕХ ТИПОВ
Никотинамидадениндинуклеотид (НАД(Н)) и никотинамидадениндинук-
леотидфосфат (НАДФ(Н)) — это близкие по структуре растворимые соедине-
ния, функциональной частью которых является ароматическое кольцо (рис.
2.4). НАД(Н) и НАДФ(Н) являются коферментами НАД(Ф)-зависимых дегид-
рогеназ. Эти ферменты катализируют реакции, связанные с отнятием или при-
соединением двух атомов водорода, при этом коферменты переносят гидрид-
ион Н7(2е“ + Н+), а недостающий протон захватывается или отдается в водную
фазу:
АН2 + НАД(Ф)+ А + НАД(Ф)Н + Н+
Большая часть НАД(Н) и НАДФ(Н) растворена в водной фазе, так как их
связи с ферментными белками непрочные и возникают только в момент фер-
ментативной реакции. Окисленные формы НАД+ и НАДФ имеют полосу по-
глощения при 260 нм, а при их восстановлении появляется полоса поглоще-
ния при 340 нм. Это позволяет регистрировать редокс-состояние коферментов
в ходе реакций. Стандартный Е°' этих соединений равен -0,32 В. Роль НАД(Н)
и НАДФ(Н) в клетке очень велика. Принимая участие во многих реакциях в
качестве доноров или акцепторов электронов, они обеспечивают взаимодей-
ствие разных процессов и в целом контролируют редокс-статус клетки.
Флавопротеиды. Компонентами ЭТЦ являются флавопротеиды — белки,
содержащие в качестве прочно связанной простетической группы флавинмо-
нонуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Функциональная
103
Рис. 2.4. Редокс-превращения в молекулах НАД(Н) и НАДФ(Н).
Окисленные формы НАД* и НАДФ* несут положительный заряд на атоме азота
никотинамидного кольца
часть этих соединений представлена системой ароматических колец (рис.’2.5),
в состав которой входит остаток рибофлавина (витамин В2). Окисление — восста-
новление флавопротеидов связано с переносом двух атомов водорода. Окислен-
Рис. 2.5. Редокс-превращения в молекулах ФМН и ФАД
104
ные формы флавинов имеют два макси-
мума поглощения — при 375 и 450 нм,
которые исчезают при восстановлении.
Редокс-потенциалы флавопротеидов ва-
рьируют в широких пределах (от -0,49 до
+0,19 В) в зависимости от структуры апо-
белка.
Цитохромы. Обязательными компо-
нентами ЭТЦ являются цитохромы —
железосодержащие белки, в составе ко-
торых присутствует гем. Основой структу-
ры гема является порфириновое кольцо,
образованное из четырех пиррольных ко-
лец, в центре которого расположен атом железа (рис. 2.6). В редокс-превраще-
ниях цитохромы функционируют как одноэлектронные переносчики, при этом
железо меняет свою валентность, переходя из состояния Fe+ в состояние Fe+ .
Восстановленные формы цитохромов имеют три характерных полосы по-
глощения в областях 545 — 600, 520 — 535, 415 — 445 нм — это полосы а, р, у.
На основе положения основного максимума a-полосы цитохромы разделяют
на три группы: цитохромы а, b и с. Если цитохромы находятся в окисленном
состоянии, то полосы аир исчезают, а у-полоса сдвигается в более коротко-
волновую область. Стандартные Е°' цитохромов варьируют в диапазоне от 0,0 до
+0,6 В.
Железосерные белки. Железосерные белки, или Fe-S-белки, содержат так
называемые Fe-S-кластеры, или центры. Центры состоят из двух или четырех
атомов железа, комплексно связанных с атомами неорганической серы или
серы в остатках цистеина в структуре белка. В основе классификации железо-
серных белков лежит структура кластера; в зависимости от этого различают
2Fe-2S- или 4Ре-48-белки (рис. 2.7).
В состав центра входят несколько атомов железа, но каждый из центров
способен принимать или отдавать только один электрон. Восстановление желе-
зосерных белков сопровождается исчезновением в спектре полосы 450 нм и
появлением сигнала ЭПР (метод электронного парамагнитного резонанса),
что указывает на появление свободного радикала. Для этой группы соединений
диапазон значений Е°' также достаточно широк: от -0,42 В до +0,35 В.
Хиноны. В качестве подвижных переносчиков, действующих в липидной фазе
мембраны, функционируют хиноны, обозначаемые буквой Q (от англ, quinoriy.
—Cys—/S—Cys—
Fe
s\ >
-Cys—SZ ^S—Cys—
—Cys—S—Fe---—;S
S-----Fe— S—Cys—
------Fe—S—Cys—
—Cys—S—Fe-----S
2Fe-2S-
4Fe-4S-
Рис. 2.7. Структура железосерных центров 2Fe-2S- и 4Fe-4S-™na
105
Рис 2.8. Структура (А) и редокс-превращения (Б) в молекуле убихинона
пластохинон в ЭТЦ фотосинтеза и убихинон в ЭТЦ дыхания. Хиноны состоят
из ароматического кольца и боковой липофильной цепи, в составе которой
может содержаться 9 (пластохинон) или 10 (убихинон) изопреноидных остат-
ков (рис. 2.8). Свободно диффундирующие в мембране хиноны осуществляют
связь между белковыми комплексами и могут переносить два атома водорода.
Хиноны обладают двумя свойствами, исключительно важными для работы ЭТЦ
по переносу протонов через мембрану. Во-первых, в ходе редокс-реакций хи-
ноны могут захватывать или освобождать 2Н+ на границе раздела двух фаз —
липид/вода с любой стороны мембраны. Во-вторых, в ходе электронного транс-
порта хиноны могут принимать или отдавать только один электрон, при этом
находясь в течение какого-то времени в форме свободного анион-радикала —
семихинона (Q7). Спектры поглощения хинонов находятся в УФ-области и
маскируются поглощением других соединений, поэтому их окислительно-
восстановительные состояния отслеживают, как правило, методом ЭПР. Ре-
докс-потенциалы хинонов близки к нулю или имеют низкие положительные
значения.
Итак, живые организмы используют энергию света и химическую энергию
органических соединений в процессах фотосинтеза и дыхания. И в том и дру-
гом случае клетка превращает внешние энергетические ресурсы в конвертируе-
мые формы клеточной энергии — АТФ и трансмембранный электрохимиче-
ский протонный градиент Дцн*. Преобразование энергии в процессах фотосин-
теза и дыхания основано на общем механизме хемиосмотического сопряжения.
Основной компонент систем трансформации энергии — сопрягающие мемб-
раны хлоропластов и митохондрий, содержащие электронтранспортные цепи.
Энергия солнечного излучения или энергия, заключенная в окисляемых суб-
стратах, реализуется таким образом, что в мембране начинает работать элект-
ронтранспортная цепь. Электронный транспорт в цепи неразрывно связан с
векторным переносом протона через мембрану против электрохимического
106
Свет
Субстраты дыхания
Электронный
Электронный
через мембрану
Рис. 2.9. Преобразование энергии в растительной клетке
потенциала. В результате работы цепи энергия внешних источников транс-
формируется и запасается на мембране в форме АЦн+- АТФ-синтазы используют
Дцн+, сопрягая обратную диффузию ионов Н+ по градиенту электрохимическо-
го потенциала с энергозависимой реакции синтеза АТФ из АДФ и Фн. В соот-
ветствии с ротационным механизмом обратный ток протонов через АТФ-син-
тазный комплекс сопровождается конформационными изменениями катали-
тических центров, в которых спонтанно идет синтез АТФ. Образованная в про-
цессах фотосинтеза и дыхания АТФ обеспечивает энергией разнообразные кле-
точные процессы, и в том числе используется для энергизации других клеточ-
ных мембран при участии АТФаз разных типов. АТФазы, или ионные помпы,
эффективно перекачивают некоторые ионы через мембрану против их элект-
рохимического градиента за счет энергии гидролиза АТФ. Создаваемые помпа-
ми ионные градиенты на мембранах служат еще одним источником клеточной
энергии (рис. 2.9).
Таким образом, общим принципом клеточной биоэнергетики является
взаимопревращение на мембранах двух форм клеточной энергии — энергии ионных
градиентов и АТФ. Благодаря этим превращениям клетка обеспечивает энергией
разнообразные процессы, протекающие как в растворе, так и на мембранах.
ГЛАВА 3
ФОТОСИНТЕЗ
В главе «Фотосинтез» изложены современные представления о механизме
преобразования в фотосинтезе солнечной энергии в химическую энергию орга-
нических соединений. Рассмотрено участие различных групп пигментных си-
стем в поглощении и миграции энергии света к реакционным центрам, орга-
низация реакционных центров и механизмы первичного преобразования энергии
света в энергию разделенных зарядов, структура электрон-транспортной цепи
фотосинтеза и ее участие в образовании НАДФН и АТФ — соединений с вы-
соким восстановительным и энергетическим потенциалом, механизмы сопря-
жения транспорта электронов с синтезом АТФ. Дан анализ механизмов асси-
миляции углерода при фотосинтезе у разных групп растений в зависимости от
генетических и экологических факторов, а также закономерностей фотосинте-
тической деятельности целого растительного организма.
3.1. ФОТОСИНТЕЗ КАК ОСНОВА БИОЭНЕРГЕТИКИ
3.1.1. КОСМИЧЕСКАЯ РОЛЬ ЗЕЛЕНОГО РАСТЕНИЯ
В ТРАНСФОРМАЦИИ ВЕЩЕСТВА И ЭНЕРГИИ
Проблема фотосинтеза представляет собой одну из наиболее важных и слож-
ных проблем общей биологии. Фотосинтезу принадлежит центральная роль в
общей энергетике растений и животных организмов, поскольку именно этот
процесс служит первичным источником всей энергии, используемой живыми
организмами в процессе жизнедеятельности.
Фотосинтез — один из наиболее мощных процессов преобразования сол-
нечной энергии (т. е. энергии термоядерных процессов, протекающих на Солн-
це), которая высвобождается в результате превращения водорода в гелий:
4Н —► Не + 2е“ + hv (фотоны высокой энергии)
Солнечная энергия при участии зеленых растений и фотосинтезирующих
бактерий преобразуется в свободную энергию органических соединений. Для
осуществления этого уникального процесса в ходе эволюции был создан фо-
тосинтетический аппарат, содержащий: 1) набор фотоактивных пигментов,
способных поглощать электромагнитное излучение определенных областей
спектра и запасать эту энергию в виде энергии электронного возбуждения, и
2) специальный аппарат преобразования энергии электронного возбуждения
в разные формы химической энергии. Прежде всего это редокс-энергия, свя-
занная с образованием высоковосстановленных соединений, энергия электро-
108
химического потенциала, обусловленная образованием электрических и про-
тонных градиентов на сопрягающей мембране (Дцн+), энергия фосфатных свя-
зей АТФ и других макроэргических соединений, которая затем преобразуется в
свободную энергию органических молекул.
Все эти виды химической энергии могут быть использованы в процессе
жизнедеятельности для поглощения и трансмембранного переноса ионов и в
большинстве реакций метаболизма, т. е. в конструктивном обмене.
Способность использовать солнечную энергию и вводить ее в биосферные
процессы и определяет «космическую» роль зеленых растений, о которой так
много и горячо говорил и писал великий русский физиолог К. А. Тимирязев.
3.1.2. ПРИРОДА ОСНОВНЫХ РЕАКЦИЙ
И ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ФОТОСИНТЕЗА
Процесс фотосинтеза представляет собой очень сложную систему по про-
странственной и временной организации. Использование высокоскоростных
методов импульсного анализа позволили установить, что процесс фотосинте-
за включает различные по скорости реакции — от 10~15 с (в фемтосекундном
интервале времени протекают процессы поглощения и миграции энергии) до
104 с (образование продуктов фотосинтеза). Фотосинтетический аппарат вклю-
чает структуры с размерами от 10“27 м3 на низшем молекулярном уровне до 105
м3 на уровне посевов.
Принципиальная схема фотосинтеза. Весь сложный комплекс реакций, со-
ставляющих процесс фотосинтеза, может быть представлен принципиальной
схемой, в которой отображены основные стадии фотосинтеза и их сущность.
В современной схеме фотосинтеза можно выделить четыре стадии, которые
различаются по природе и скорости реакций, а также по значению и сущно-
сти процессов, происходящих на каждой стадии:
I II III IV
н н н
hv П — П* — П(РЦ)£— ... — — -С-С-С-
он он он
(ССК) (РЦ) (ЭТЦ) (углеродный цикл)
I стадия — физическая. Включает фотофизические по природе реакции
поглощения энергии пигментами (П), запасания ее в виде энергии электрон-
ного возбуждения (П*) и миграции в реакционный центр (РЦ). Все реакции
чрезвычайно быстрые и протекают со скоростью 10-15—10“9 с. Первичные ре-
акции поглощения энергии локализованы в светособирающих антенных комп-
лексах (ССК).
II стадия — фотохимическая. Реакции локализованы в реакционных цент-
рах и протекают со скоростью 10-9 с. На этой стадии фотосинтеза энергия элек-
тронного возбуждения пигмента (П*РЦ)) реакционного центра используется
для разделения зарядов. При этом электрон с высоким энергетическим потен-
циалом передается на первичный акцептор А, и образующаяся система с раз-
109
деленными зарядами (П(рщ — А") содержит определенное количество энер-
гии уже в химической форме. Окисленный пигмент П<рц) восстанавливает свою
структуру за счет окисления донора (Д).
Происходящее в реакционном центре преобразование одного вида энергии в
другой представляет собой центральное событие процесса фотосинтеза, требу-
ющее жестких условий структурной организации системы. В настоящее время
молекулярные модели реакционных центров растений и бактерий в основном
известны. Установлено их сходство по структурной организации, что свидетель-
ствует о высокой степени консервативности первичных процессов фотосинтеза.
Образующиеся на фотохимической стадии первичные продукты (П+, А )
очень лабильны, и электрон может вернуться к окисленному пигменту П+
(процесс рекомбинации) с бесполезной потерей энергии. Поэтому необходи-
ма быстрая дальнейшая стабилизация образованных восстановленных продук-
тов с высоким энергетическим потенциалом, что осуществляется на следу-
ющей, III стадии фотосинтеза.
III стадия — реакции транспорта электронов. Цепь переносчиков с раз-
личной величиной окислительно-восстановительного потенциала (Е„) обра-
зует так называемую электрон-транспортную цепь (ЭТЦ). Редокс-компоненты
ЭТЦ организованы в хлоропластах в виде трех основных функциональных ком-
плексов — фотосистемы I (ФС1), фотосистемы II (ФСП), цитохром ^/-комп-
лекса, что обеспечивает высокую скорость электронного потока и возмож-
ность его регуляции. В результате работы ЭТЦ образуются высоковосстанов-
ленные продукты: восстановленный ферредоксин (ФДВОССт) и НАДФН, а так-
же богатые энергией молекулы АТФ, которые используются в темновых реак-
циях восстановления СО2, составляющих IV стадию фотосинтеза.
IV стадия — «темновые» реакции поглощения и восстановления углекислоты.
Реакции проходят с образованием углеводов, конечных продуктов фотосинте-
за, в форме которых запасается солнечная энергия, поглощенная и преобразо-
ванная в «световых» реакциях фотосинтеза. Скорость «темновых» энзиматичес-
ких реакций — 10“2—104 с.
Анализ рассмотренной выше принципиальной схемы фотосинтеза показы-
вает, что весь ход фотосинтеза осуществляется при взаимодействии трех пото-
ков — потока энергии, потока электронов и потока углерода. Сопряжение трех
потоков требует четкой координации и регуляции составляющих их реакций.
Исследование регуляторных механизмов фотосинтеза представляет собой
физиологическое направление в исследовании этого процесса, связанное с изу-
чением внутренних и внешних факторов, определяющих максимальную эф-
фективность реакций отдельных стадий и общего процесса фотосинтеза на
уровне целого растения.
Физико-химическая сущность процесса фотосинтеза. Фотосинтез можно
определить как процесс преобразования электромагнитной энергии в энергию
химических связей, сопровождающийся увеличением энергетического потен-
циала системы.
Все живые системы представляют собой термодинамически открытые си-
стемы, осуществляющие непрерывный обмен веществом и энергией с внешней
средой. Для высших растений, водорослей и некоторых бактерий источником
энергии является энергия солнечного излучения, при поглощении которой
возрастают уровни свободной энергии (Д/7) и обшей энергии (ДС/) (в послед-
110
ней значительную часть составляет электронная энергия) и снижается энтро-
пия системы (TAS);
AF = AU - TAS.
Накопление энергии при фотосинтезе сопряжено с химической и элект-
ронной перестройкой участвующих в процессе компонентов.
В химическом отношении накопление энергии в процессе фотосинтеза свя-
зано с перестройкой химических связей. В соответствии с общим уравнением
при фотосинтезе происходит разрыв связей в молекулах СО2 (О=С=О) и
Н2О (Н—О—Н) и возникает иной тип химических связей (С—С, С—Н, СН2О):
hv
6СО2 + 6Н2О — С6Н12О6 + 6О2
Разрыв связей в молекулах СО2 и Н2О требует затраты энергии +2510,4 кДж/моль
(+600 ккал/моль), в расчете на СН2О. При образовании связей (в СН2О) энер-
гия освобождается -2037,6 кДж/моль (-487 ккал/моль) и накапливается в
продуктах реакции. Следовательно, необходимо ввести дополнительные АЕ =
= 472,8 кДж/моль, чтобы из прочных, но бедных энергией СО2 и Н2О образо-
вался СН2О, или 2871,5 кДж/моль для синтеза молекулы углевода СЙН12О6, —
менее стабильного, но богатого энергией соединения. Источником дополни-
тельной энергии служит солнечная энергия, которая и накапливается в конеч-
ных продуктах фотосинтеза.
Физический смысл фотосинтеза состоит в том, что в этом процессе проис-
ходит электронная перестройка молекул. В целом фотосинтез — окислительно-
восстановительный процесс, в ходе которого электроны от воды (редокс-по-
тенциал Н2О/О2 Еи = +0,81 В) переносятся к пиридин нуклеотидам (редокс-
потенциал НАДФ+/НАДФН Ем = -0,32 В), где электроны находятся на более
высоком энергетическом уровне. Перенос электрона идет против термодина-
мического потенциала и требует энергии. Разность окислительно-восстанови-
тельных потенциалов окисления воды и восстановления НАДФ+ равна 1,2 В.
Следовательно, для переноса одного электрона термодинамически «вверх» (про-
тив термодинамического потенциала) необходимо затратить 1,2 эВ энергии. В ито-
ге электронной перестройки компонентов и образования восстановленных со-
единений (НАДФН) накапливаются электроны с высоким энергетическим
потенциалом. Таким образом, в световых реакциях фотосинтеза при поглоще-
нии энергии фотонов создается мощный восходящий поток электронов про-
тив градиента термодинамического потенциала. В результате создается большой
фонд богатых энергией электронов с запасом энергии 1,5 — 2 эВ. Эта редокс-
-0,32 В
+0,81 В
Конструктивный обмен
СО2 ---- Углеводы
ЬЮ2 ----- NH3
SO3"----- H2S
Энергетический Фоторегуляция
обмен Тиоредоксин — Активация ферментов
/ углеродных циклов
Активация CF3 и др.
НАДФН (ё*)
е~
Н2О
Рис. 3.1 Использование в метаболизме клетки энергетического и восстановительного
потенциалов, возникающих в фотохимических реакциях
111
энергия в процессах фотосинтетического и окислительного фосфорилирова-
ния преобразуется в другие виды химической энергии (электрохимический
потенциал, энергия фосфатных связей АТФ). Соединения, образующиеся в ре-
зультате работы ЭТЦ, имеют высокий восстановительный потенциал (-0,43 В,
-0,6 В). Создание мощного восстановительного потенциала в фотосинтезе имеет
решающее значение для осуществления важнейших метаболических процессов
и, прежде всего, для восстановления СО2. Образующийся восстановительный
потенциал используется также для восстановления NO2, SO3 и ряда соедине-
ний, участвующих в регуляции ферментов углеродного цикла (рис. 3.1).
Таким образом, главное значение фотосинтеза состоит в генерации элект-
ронов с высоким энергетическим и восстановительным потенциалом. Фото-
синтез находится в центре энергетического и конструктивного обмена и тесно
связан со всеми физиологическими функциями растительного организма.
3.1.3. ИСТОРИЯ РАЗВИТИЯ ПРЕДСТАВЛЕНИЙ
О МЕХАНИЗМЕ ФОТОСИНТЕЗА
Фотосинтез как физиологический процесс был открыт в 1771 г. английским
ученым Джозефом Пристли. Вся 230-летняя история изучения фотосинтеза —
это большая цепь научных исследований, в ходе которых были определены
основные контуры этого сложнейшего процесса и изучены реакции, составля-
ющие его физико-химическую основу. Можно выделить ряд периодов, кото-
рые отражают главные ступени в познании механизма фотосинтеза.
Период 1771—1850 гг. включает работы Дж. Пристли, Я. Ингенхауза, Ж. Се-
небье, Н.Соссюра, в которых были установлены основные закономерности
газообмена, зависимость фотосинтеза от интенсивности света, концентрации
углекислоты, содержания воды, т. е. был заложен фундамент учения о воздуш-
ном питании растений.
Период 1850—1900 гг. характеризуется работами в области энергетики фото-
синтеза, утверждается понимание фотосинтеза как процесса фиксации солнеч-
ной энергии. Основная идея была высказана Робертом Майером в 1842 г. и полу-
чила дальнейшее развитие в работах по изучению роли в фотосинтезе отдельных
участков спектра. Эта идея была экспериментально подтверждена блестящими
опытами К.А.Тимирязева (1867—1904), в которых была установлена прямая
связь между энергетической характеристикой отдельных лучей электромагнит-
ного спектра, активностью поглощения их пигментами и интенсивностью фо-
тосинтеза. В дальнейших работах этого периода была определена доля энергии,
усваиваемой растениями в процессе фотосинтеза от всего количества падающей
и поглощенной листом энергии (Ф.Н. Крашенинников, 1912—1915; К.А. Пу-
риевич, 1913). В связи с общим интересом к процессам поглощения энергии про-
водятся глубокие исследования химии пигментов (М.Ненцкий, 1902; М. С. Цвет,
1906; Р. Вилынтеттер, А. Штоль, 1913; Г. Фишер, 1939), которые завершились
в 1940 г. расшифровкой химической структуры молекулы хлорофилла а.
Период 1900— 1940 гг. — время расцвета физиологических исследований фо-
тосинтеза. В эти годы впервые экспериментально обосновано представление о
включении в фотосинтез двух различных по природе реакций — световых фото-
химических и темновых энзиматических реакций, составляющих две основные
112
стадии фотосинтеза и протекающих с разной скоростью: световая — 10-5 с,
темновая — 10-2 с (Ф. Блэкман, 1905; А.А. Рихтер, 1914; О. Варбург, 1920).
Работы В.Н.Любименко (1921) по определению ассимиляционного числа
(СО2/Хл) и опыты Р. Эмерсона и А. Арнольда (1932, 1943) с прерывистым
светом легли в основу современной концепции о «фотосинтетической единице»
(ФСБ) и двух фотосистемах. Изучение природы фотохимических реакций при-
вело к утверждению фундаментального положения современного фотосинтеза
о том, что кислород, образующийся в процессе фотосинтеза, освобождается в
реакциях фотоокисления воды (К.Ван-Ниль, 1931; С. Рубен и М. Камен, 1939;
АП.Виноградов и Р.В.Тейс, 1941; Р.Хилл, 1951). К этому периоду относятся
исследования С. П. Костычева с сотр. (1930), Л.А. Иванова (1946), В. А. Брил-
лиант (1949), Е. Р.Гюббенет (1951) и др., в которых были установлены основ-
ные физиологические закономерности зависимости фотосинтеза от внутрен-
них и внешних факторов, а также от уровня жизнедеятельности растения.
Период 1940—1950 гг. можно назвать временем расцвета биохимических ис-
следований фотосинтеза. Изучение химизма темновых реакций в серии работ
лаборатории М. Кальвина с использованием метода меченых атомов (14С) за-
вершилось в 1956 г. открытием восстановительного пентозофосфатного цикла
превращения углерода, известного в настоящее время как «цикл Кальвина».
В этот период активно изучаются ферментные системы хлоропластов, выделя-
ются различные коферменты и другие физиологически активные группы со-
единений. В работах Р. Хилла (1951), связанных с изучением геминовых соеди-
нений, в хлоропластах были обнаружены цитохромы Ь(. и /, что имело большое
значение для современных представлений о функционировании цитохромного
комплекса в ЭТЦ.
Период 1950—1960 гг. отмечен бурным развитием исследований различных
сторон проблемы фотосинтеза. Работы Д. Арнона показали, что хлоропласт со-
держит все каталитические системы, необходимые для транспорта электронов
с выделением кислорода из воды, синтеза восстановленных соединений
(НАДФН) и АТФ в процессе фотофосфорилирования, восстановления СО2.
В 1954 г. в лаборатории Д. Арнона было открыто циклическое, а в 1957 г. —
нециклическое фотофосфорилирование и была сформулирована «теория элек-
тронного потока». В этот период интенсивно развиваются фотохимические и
физические исследования в области фотосинтеза. Основные положения фото-
химии пигментов, механизма их окислительно-восстановительных превраще-
ний, процессов миграции энергии представляют собой итог большой серии
работ А. Н. Теренина, А. А. Красновского, В. Б. Евстигнеева и др. Работы Л. Дюй-
зенса (1951) по изучению флуоресценции хлорофилла позволили исследовать
механизмы энергетического взаимодействия молекул пигментов в возбужден-
ном состоянии и миграции энергии в биологических системах. Это послужило
основой современных представлений о процессах миграции энергии от пиг-
ментов антенного комплекса в реакционный центр.
Большое значение для дальнейшего развития исследований в области фото-
синтеза имели проведенные в этот период работы Р. Эмерсона с сотр. (1942 —
1957) по изучению спектра действия фотосинтеза. Были открыты два феноме-
на: «эффект красного падения» — резкое снижение квантового выхода фото-
синтеза при освещении хлоропластов дальним красным светом (680 — 700 нм) и
«эффект усиления Эмерсона» — значительное усиление фотосинтеза при до-
113
бавлении коротковолнового света (650 нм). В 1961 г. ряд авторов сформулирова-
ли представление о функционировании двух фотореакций в фотосинтезе
(Р.Хилл, Ф.Бендалл, 1960; Л.Дюйзенс, 1961; Б.Кок, Г.Хох, 1961; Х.Т.Витт с
сотр., 1961), что легло в основу современной двухквантовой Z-схемы фото-
синтеза. В рамках этих представлений в настоящее время проводятся детальные
исследования физических, химических и функциональных особенностей фо-
тосистемы I (ФС1) и фотосистемы II (ФСП), структурной организации их
реакционных центров.
Современный период характеризуется комплексным подходом к изучению
процесса фотосинтеза. Исследования на молекулярном уровне позволили вы-
яснить основные принципы организации и функционирования фотосинтети-
ческого аппарата, физический и биохимический механизмы его световых и
темновых стадий. Получены новые данные о функциональной организации
пигментов. Выделены и изучены светособирающие комплексы ФС1 и ФСП,
раскрыт принципиальный механизм распределения энергии между ними. Сфор-
мулированы представления о функционировании ЭТЦ как взаимодействии трех
функциональных комплексов — ФС1, ФСП, цитохром ^/-комплекса, изуче-
ны механизмы их работы, структурная организация и локализация в мембра-
нах стромальных и гранальных тилакоидов. Исследованы молекулярная орга-
низация реакционных центров и механизмы преобразования энергии. Боль-
шой прогресс в последние годы достигнут в исследовании фотоэнергетиче-
ских реакций фотосинтеза. На основе хемиосмотической теории П. Митчелла
(1961) и конформационной теории П. Бойера (1977) разработаны новые пред-
ставления о молекулярной организации АТФ-синтазного комплекса и меха-
низма синтеза АТФ в каталитических центрах АТФ-синтазы.
Таким образом, анализ истории более чем 230-летнего периода изучения
фотосинтеза позволяет проследить логику развития научной мысли и устано-
вить главные направления в развитии научных идей, которые завершились в
настоящее время построением достаточно стройной общей теории фотосинтеза.
3.2. СТРУКТУРНАЯ И БИОХИМИЧЕСКАЯ ОРГАНИЗАЦИЯ
ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
Фотосинтетический аппарат растения — сложно организованная система,
обеспечивающая поглощение света и преобразование его энергии в энергию
химических связей. Структурно-функциональная организация фотосинтетиче-
ского аппарата может быть рассмотрена на двух уровнях:
• на уровне листа как органа фотосинтеза в растении;
• на уровне хлоропласта — клеточной органеллы, где сосредоточены все
структуры, обеспечивающие фотосинтез.
3.2.1. ЛИСТ — СПЕЦИАЛИЗИРОВАННЫЙ ОРГАН ФОТОСИНТЕЗА
В РАСТЕНИИ
Лист как орган растения, приспособленный к фотосинтезу, сформировался
в результате длительного эволюционного процесса. Он представляет собой эф-
114
фективную систему для поглощения и преобразования энергии света в ходе
фотосинтеза. Структура листа обеспечивает наиболее полное поглощение квантов
света, поступление углекислого газа из атмосферы к хлоропластам, а также воз-
можность оттока ассимилятов из автотрофных клеток. Организация фотосинте-
тического аппарата на уровне листа может быть охарактеризована на основе
анализа его мезоструктуры. Понятие «мезоструктура» предложено А. Т. Мокро-
носовым в 1975 г. Оно охватывает целый ряд морфофизиологиических характери-
стик листа, позволяющих оценить ассимиляционную способность листа в це-
лом. Основными показателями мезоструктуры листа являются: площадь листа,
число клеток хлоренхимы на единицу площади листа, число хлоропластов в
клетке и их объем, площадь поверхности хлоропластов, а также содержание
хлорофилла в расчете на единицу площади листа, содержание ферментов уг-
леродного цикла фотосинтеза в листе и их активность, общая интенсивность
фотосинтеза. Показатели мезоструктуры листа могут значительно варьировать
в зависимости от внешних факторов среды, а также от физиологического со-
стояния растений.
Лист представляет собой уникальную оптическую систему — ловушку для
света. Как видно из рис. 3.2, лист поглощает значительную часть излучения в
видимой области спектра (400—700 нм). Большую часть синего и красного света
поглощают пигменты хлоропластов первых слоев клеток хлоренхимы. Свет, не
поглощенный в верхних слоях листа, обогащен лучами зеленой области спектра.
Его многократное отражение от стенок мезофильных клеток в толще листа зна-
чительно увеличивает оптический путь и повышает вероятность поглощения лучей
этой области спектра, несмотря на то
что коэффициент поглощения хлоро-
филла в зеленой области значительно
меньше, чем в синей и красной.
Структура листа обеспечивает по-
ступление углекислого газа из воздуха
для реакций фотосинтетической асси-
миляции углерода. Газообмен мезофил-
ла листа с окружающим воздухом осу-
ществляется через устьица. Количество
устьиц, их свойства (величина устьич-
ной щели, устьичное сопротивление и
др.) являются важными факторами
регуляции фотосинтеза. Значительный
объем подустьичного пространства, а
также достаточно рыхлое расположе-
ние мезофильных клеток в листе и су-
ществование больших межклетников в
ткани хлоренхимы позволяют создать
большие воздушные запасы в толще
листа для непрерывного снабжения
Рис. 3.2. Спектры отражения и пропуска-
ния листа шпината (по Merzlyak et al.
2002). Заштрихованная область соответ-
ствует величине поглощения листа
углекислым газом углеродных циклов
фотосинтеза.
Лист — донор ассимилятов в рас-
тении. Отток органических веществ,
115
образовавшихся в процессе фотосинтеза, происходит по клеткам сосудистых
пучков флоэмы. Транспорт ассимилятов из автотрофных клеток предполагает
вынос сахарозы (основного транспортного соединения фотосинтеза) из авто-
трофной клетки в апопласт и последующую загрузку флоэмы листа. Основные
закономерности донорно-акцепторных взаимодействий листа и аттрагируюших
центров растения рассмотрены в подразд. 3.10.
3.2.2. ХЛОРОПЛАСТЫ — ЦЕНТРЫ ФОТОСИНТЕЗА КЛЕТОК РАСТЕНИЙ
Фотосинтез в растительной клетке осуществляется специализированными
органеллами — хлоропластами. От других типов пластид хлоропласты отлича-
ются наличием зеленых пигментов хлорофиллов и сложно организованной
системой внутренних мембран. Хлорофилл обеспечивает поглощение и пер-
вичное преобразование энергии света при фотосинтезе, а высокая степень
организации внутренних мембранных структур хлоропластов составляет физи-
ческую основу для эффективного поглощения и преобразования энергии света
в ходе фотосинтеза. Благодаря высокой степени организации внутренней мемб-
ранной структуры хлоропластов достигаются условия, необходимые для пре-
образования энергии:
1) определенная ориентация пигментов в мембране, обеспечивающая эф-
фективное поглощение и преобразование энергии света;
2) пространственное разделение восстановленных и окисленных фотопро-
дуктов, возникающих в результате первичных актов фотосинтеза, связанных с
разделением зарядов в реакционном центре;
3) строгая упорядоченность компонентов реакционного центра, где сопря-
жены быстропротекающие (10~15—10“9 с) фотофизические и более медленные
(КГ4—10“2 с) ферментативные реакции; наличие определенных структур, где
фотовозбужденный пигмент и химический акцептор жестко ориентированы
относительно друг друга (необходимо для преобразования энергии в реакци-
онных центрах);
4) пространственная организация электрон-транспортной цепи (ЭТЦ) хло-
ропластов, основанная на определенной последовательности и строгой ориен-
тации переносчиков в мембране (необходима для быстрого и регулируемого
транспорта электронов и протонов);
5) определенным образом организованная система мембран в хлоропла-
стах, обеспечивающая сопряжение транспорта электронов и синтеза АТФ.
3.2.2.1. Основные принципы структурной организации
хлоропластов
Основные элементы структурной организации хлоропластов у высших рас-
тений представлены на рис. 3.3, где можно видеть внешнюю оболочку, строму и
хорошо развитую систему внутренних мембран.
Внешняя оболочка хлоропластов отграничивает его внутреннее содержимое
от цитоплазмы. Это барьер, осуществляющий контроль обмена веществ между
хлоропластом и цитоплазмой. Оболочка состоит из двух мембран — наружной
и внутренней. Наружная мембрана проницаема для большинства органических
116
1
3 4 2
О
V
о
2
Рис. 3.3. Внутренняя структура хлоропластов:
А — электронная фотография хлоропласта: 1 — оболочка хлоропласта; 2 — граны, состоящие из
стопок тилакоидов гран; 3 — тилакоиды стромы; 4 — строма; Б — схема организации тилакоидов
гран и стромы; В — трехмерная модель организации тилакоидов в хлоропластах высших растений
117
и неорганических молекул. Вместе с тем она содержит специальные транслока-
торы белков, через которые поступают пептиды из цитоплазмы в хлоропласт.
Внутренняя мембрана оболочки хлоропластов обладает избирательной прони-
цаемостью и осуществляет контроль над транспортом белков, липидов, органи-
ческих кислот и углеводов между хлоропластом и цитоплазмой. Внутренняя мемб-
рана оболочки участвует также в формировании внутренней мембранной си-
стемы хлоропластов.
Строма — гидрофильный, слабоструктурированный матрикс хлоропла-
стов, содержащий водорастворимые органические соединения, а также неор-
ганические ионы. В строме располагаются ферменты углеродного цикла фото-
синтеза, здесь осуществляются реакции фотосинтетической ассимиляции угле-
рода. Кроме того, строма содержит ферменты синтеза фотосинтетических пиг-
ментов, а также полярных липидов мембран хлоропластов. В строме находятся
кольцевая ДНК (может быть несколько одинаковых копий), рибосомы, фер-
менты матричного синтеза, обеспечивающие синтез белков, входящих в со-
став мультипептидных комплексов мембран тилакоидов, а также водораство-
римого белка — большой субъединицы рибулозо-бисфосфаткарбоксилазы-ок-
сигеназы — ключевого фермента углеродного цикла фотосинтеза.
Внутренняя мембранная система хлоропластов — здесь протекают световые
реакции фотосинтеза. Она хорошо развита и неоднородна. На фотографиях
зрелого хлоропласта видно (рис. 3.3, А), что внутренние мембраны (ламеллы),
занимают большую часть общего объема хлоропластов. Мембраны образуют
тилакоиды, которые либо тесно соприкасаются друг с другом и уложены в
стопки, или граны (тилакоиды гран), либо пронизывают строму, соединяя гра-
ны между собой (тилакоиды стромы). Соответственно образующие их мембра-
ны называют мембранами (ламеллами) гран и мембранами (ламеллами) стромы.
Пространство внутри тилакоидов называется внутритилакоидным простран-
ством, или люменом (рис. 3.3, Б).
Трехмерная модель структурной организации тилакоидов представлена на
рис. 3.3, В. Согласно современным представлениям, при образовании гран внут-
ренняя мембрана образует не замкнутые «мешочки», а, скорее, наслоения, склад-
ки. В результате внутри хлоропласта возникает единая внутренняя мембрана,
которая разделяет внутреннее пространство хлоропластов на два отсека (ком-
партмента) — строму и люмен. Интеграция внутреннего пространства тила-
коидов гран и стромы достигается за счет того, что тилакоиды гран пронизаны
одной или несколькими тилакоидами стромы. Тилакоиды стромы могут быть
сильно перфорированы, в результате чего образуются узкие или широкие мемб-
ранные каналы, называемые фретами, которые связывают граны между собой.
Значение столь сложной организации внутренних мембран хлоропластов
состоит в следующем.
• Внутренние мембраны хлоропластов включают мультипептидные комп-
лексы, обеспечивающие поглощение и преобразование энергии света в ходе
световых реакций фотосинтеза. Благодаря значительному мембранному про-
странству достигается увеличение числа функциональных единиц, способных осуще-
ствлять световые реакции фотосинтеза.
• Единство внутренней мембранной системы хлоропластов позволяет от-
дельным компонентам мембраны мигрировать латералъно и вступать между
собой в структурный и функциональный контакт. Это необходимо для переноса
118
энергии квантов света в реакционные центры, а также для транспорта
электронов по электрон-транспортной цепи в ходе световых реакций фото-
синтеза.
• Разделение мембраной всего внутреннего пространства хлоропластов на
два компартмента — стромальное и внутритилакоидное пространство (лю-
мен) — позволяет создавать электрохимические градиенты ионов между ними.
Создание электрохимического градиента Н' на внутренних мембранах хлоропла-
стов — важный этап в трансформации энергии квантов света в энергию макро-
эргических связей АТФ.
Образование гранальной структуры внутри хлоропластов значительно повы-
шает общую эффективность фотосинтеза и создает дополнительные возможно-
сти для регуляции световых реакций. Сегрегация (разделение) в отдельных отсе-
ках мембраны (в стромальных или гранальных тилакоидах) компонентов мем-
бран с различными функциями позволяет добиться определенной независи-
мости их функционирования. Гранальная структура хлоропластов высших рас-
тений — итог длительного эволюционного процесса. Она впервые появилась у
зеленых водорослей (эвгленовых), что было сопряжено с появлением у них
хлорофилла Ь.
3.2.2.2. Химический состав и физические свойства
тилакоидных мембран
Общий принцип организации тилакоидных мембран хлоропластов подобен
структуре любой другой мембраны клетки: основу мембраны составляет били-
пидный слой, в который погружены в большей или меньшей степени отдель-
ные белки и белковые комплексы. Вместе с тем существует определенная спе-
цифика липидного и белкового состава, а также особое распределение компонен-
тов в мембранной системе хлоропластов. Это позволяет мембранам осуществ-
лять уникальные энергопреобразующие реакции фотосинтеза и регулировать
их в соответствии с меняющимися внешними условиями.
Химический анализ внутренних мембран хлоропластов показывает, что они
включают липиды, белки и углеводы. Соотношение липидов и белков по весу
близко к отношению 1:1. С учетом того, что молекулярная масса липидов мень-
ше молекулярной массы белков, считают, что в среднем на 1 молекулу белка
приходится около 500 молекул липидов. Углеводы главным образом входят в
состав липидов (галактолипидов).
Липидный состав мембран тилакоидов (рис. 3.4). В мембранах хлоропластов
найдены две группы липидов: циклические и нециклические.
Циклические липиды составляют около 65 % липидов мембран хлоропла-
стов. К ним относятся хлорофиллы и каротиноиды — фотосинтетические пиг-
менты хлоропластов, а также хиноны — пластохиноны и филлохиноны (вита-
мин К!). Эти соединения непосредственно участвуют в реакциях фотосинтеза.
Кроме того, в мембранах хлоропластов в больших количествах присутствует
а-токоферол, который повышает структурированность мембран и их устойчи-
вость к свободнорадикальным процессам (их вероятность в хлоропластах на
свету велика — см. ниже).
Нециклические липиды в мембранах хлоропластов представлены галактоли-
пидами (нейтральными липидами), фосфолипидами и сулъфолипидами. Они фор-
119
НОН2С
НОН2С
о
но
но
О
о-сн2
HCO-CO-R1
0Н Н2со-со-R2
Моногалактозилдиглицерид
но
но
но
о-сн2
HCO-CO-R1
0Н H2CO-CO-R2
Дигалактозилдиглицерид
но
О’
о-сн2
HCO-CO-R1
0Н H2CO—СО—R2
Сульфохиновозилдиглицерид
Н2СО-Р-О-СН2
I II
но-сн о
HCO-CO-R1
н2с-он
Н2СО—СО—R2
Фосфатидилглицерин
СНз \
—сн2—сн=с-сн2—/ ,-н
Пластохинон А
О
О
СН3
сн3
сн3
сн2-сн=с-сн2-\-сн2—сн2—сн-сн2—/3-н
Витамин Ki
О
Н3С
Н3С
О
СН3
ОН
сн3 \
сн2-сн2-с-сн2-сн2—сн2—сн-сн2— /3—н
сн3
а-Токоферилхинон
Рис. 3.4. Структурные формулы липидов мембран хлоропластов
мируют липидный матрикс и участвуют в структурной организации мембран.
Особенностью мембран хлоропластов является высокое содержание в них га-
лактолипидов, в отличие от других мембран клетки, где преобладают фосфо-
липиды. В мембранах тилакоидов хлоропластов галактолипиды составляют до
75 % всех липидов мембран. Галактолипиды содержат один или два остатка
углевода, в соответствии с чем выделяют моногалактолипиды (моногалакто-
зилдиацилглицеролы — МГДГ) и дигалактолипиды (дигалактозилдиацилгли-
церолы — ДГДГ). Галактолипиды не формируют истинный бислой, однако их
120
присутствие важно для образования изгибов мембран и формирования тилакои-
дов. Кроме того, клиновидная форма молекул галактолипидов способствует
встраиванию белков в липидный слой мембраны.
Фосфолипиды и сулъфолипиды — анионные липиды, несущие отрицательный
заряд при физиологических условиях pH. Основным представителем фосфоли-
пидов в мембранах хлоропластов является фосфатидилглицерол (11 % от общего
содержания в них липидов). В фосфатидилглицерол мембран хлоропластов вхо-
дит специфичная для хлоропластов жирная кислота — транс-гексадеценовая
(транс-С^: i). Ее присутствие необходимо для сборки светособирающих комп-
лексов хлоропластов. Сульфолипиды (сульфохиновозилдиацилглицеролы), содер-
жащие серу полярные липиды, найдены только у растений. Они составляют
около 10 % от общего содержания липидов мембран. Липиды этой группы опре-
деляют поверхностный заряд мембран, а также влияют на функциональную
активность белковых комплексов тилакоидных мембран.
Жирнокислотный состав липидов внутренних мембран хлоропластов также
уникален. Он характеризуется высоким процентным содержанием ненасыщенных
жирных кислот — линолевой (С^^) и линоленовой (С1«:з). Обогащенность
липидов ненасыщенными жирными кислотами приводит к сдвигу температу-
ры фазового перехода мембран тилакоидов в область более низких температур
по сравнению с другими мембранами клетки. Кроме того, большое содержа-
ние ненасыщенных жирных кислот определяет высокую текучесть внутренних
мембран тилакоидов и способствует латеральной, ротационной и трансмемб-
ранной диффузии компонентов мембран, наблюдаемой в ходе световых реак-
ций фотосинтеза. Вместе с тем ненасыщенные жирные кислоты подвержены
перекисному окислению, что в условиях образования активных форм кисло-
рода в хлоропластах становится чрезвычайным фактором риска повреждения
мембран.
Белковые компоненты тилакоидных мембран. В мембранах хлоропластов на-
считывают более 60 различных белков. Большая их часть — интегральные белки
мультипептидных комплексов, осуществляющие процессы поглощения и транс-
формации энергии при фотосинтезе. Другая часть белков располагается на по-
верхности тилакоидных мембран либо со стороны стромы, либо со стороны
люмена. Поверхностные белки входят в периферические домены мультипеп-
тидных комплексов. Ряд поверхностных белков являются самостоятельными
компонентами мембран.
Пять основных полипептидных комплексов встроены во внутренние мембраны
хлоропластов (рис. 3.5): комплекс фотосистемы I(ФС1), комплекс фотосистемы
II (ФСП), светособирающий комплекс II (ССКП), цитохромный Ь6ф-комплекс и
АТФ-синтаза (CF0— СРГкомплекс). Комплексы ФС1, ФСП и ССКП содержат
пигменты (хлорофиллы, каротиноиды), большинство которых функциониру-
ют как пигменты-антенны, собирающие энергию для пигментов реакционных
центров ФС1 и ФСП. Комплексы ФС1 и ФСП, а также цитохромный /у/-ком-
плекс имеют в своем составе редокс-кофакторы и участвуют в фотосинтети-
ческом транспорте электронов. Белки этих комплексов отличаются высоким
содержанием гидрофобных аминокислот, что обеспечивает их встраивание в
мембрану. АТФ-синтаза (CF0—CF!-комплекс) осуществляет синтез АТФ.
Кроме крупных полипептидных комплексов в мембранах тилакоидов име-
ются небольшие белковые компоненты — пластоцианин, ферредоксин и ферре-
121
Рис. 3.5. Схема организации основных функциональных комплексов в мембране тила-
коидов (по Stachelin, van der Staay, 1996, с изменениями):
ФС1 — фотосистема I; ФСП — фотосистема И; CCKI — светособирающий комплекс I; CCKII —
светособирающий комплекс II (мобильная антенна); CF0 — сопрягающий фактор 0; CF! —
сопрягающий фактор 1
доксин-НАДФ-оксидоредуктаза, расположенные на поверхности мембран. Они
входят в электрон-транспортную систему фотосинтеза.
Вода и неорганические ионы. Вода играет структурную роль, участвуя в фор-
мировании функционально активной конформации белковых компонентов
мембран, стабилизирует мембраны, непосредственно участвует в процессах
фотосинтеза. Неорганические ионы (в первую очередь одно- и двухвалентные
катионы — К+, Na+, Са , Mg +) определяют общий поверхностный заряд мемб-
ран и возможность взаимодействия отдельных мембран друг с другом. Они кон-
тролируют образование гран в хлоропласте. Ионы важны также для сборки
комплексов белков в мембране и создания определенной функционально ак-
тивной конформации.
Ультраструктура внутренних мембран хлоропластов. Расположение отдель-
ных белковых комплексов в мембране и их ориентировочные размеры, уста-
новленные с использованием техники замораживания, скалывания и травле-
ния мембран и электронной микроскопии, представлены на рис. 3.5.
Отдельные компоненты мембран занимают положение, строго детермини-
рованное их физико-химическими свойствами. Гидрофобные аминокислоты в
белках комплексов позволяют им встраиваться в билипидный слой мембран.
Гидрофильные участки этих белков, напротив, выталкиваются из гидрофоб-
ного слоя мембран и занимают поверхностное положение. В результате гидро-
фобных, гидрофильных, а также электростатических взаимодействий на по-
верхности мембран пептиды определенным образом ориентированы относи-
тельно друг друга в комплексах и относительно поверхности мембраны. Элект-
ростатические взаимодействия между отдельными пептидами направляют и
регулируют сборку полипептидных комплексов мембран хлоропластов. С элек-
тростатическими и отчасти ковалентными взаимодействиями белков и кофак-
торов (пигментов, редокс-агентов) связано формирование активных функцио-
нальных центров в этих комплексах.
Асимметрия мембран. Различают трансмембранную и латеральную асиммет-
рию (гетерогенность) внутренних мембран хлоропластов.
122
Трансмембранная асимметрия выражается в неоднородности химического
состава и структуры внешнего и внутреннего слоя (лепестка) билипидной
мембраны. Мультипептидные комплексы определенным образом ориенти-
рованы в мембране, причем существует достаточно высокая консерватив-
ность в расположении отдельных субъединиц и связанных с ними кофакто-
ров относительно наружной и внутренней поверхностей мембраны. Первич-
ные и вторичные доноры электронов в ФС1 и ФСП всегда расположены в
доменах, приближенных к люменальной части комплексов, а акцепторы элек-
тронов — в доменах, обращенных к строме. Поверхностные белки мембран
также всегда располагаются на определенной стороне мембраны (пластоциа-
нин — со стороны люмена, ферредоксин и ферредоксин-НАДФ-оксидоре-
дуктаза — с наружной, стромальной, стороны). Неравномерно также распре-
деление липидных компонентов в мембране: с внешним липидным слоем
(лепестком) бислоя ассоциированы около 60 % всех галактолипидов и около
70 % фосфатидилглицерола, тогда как сульфохиновозилглицерол сосредото-
чен главным образом во внутреннем слое мембраны. Трансмембранная асим-
метрия внутренних мембран хлоропластов чрезвычайно важна для осуществ-
ления первичных реакций фотосинтеза, связанных с первичным разделени-
ем зарядов на мембране, а также для последующих процессов транспорта
электронов и протонов, сопряженных с реакциями трансформации энергии
при фотосинтезе.
Латеральная асимметрия {гетерогенность) состоит в том, что мембраны
тилакоидов гран и стромы существенно различаются по химическому составу,
структуре и функциям. Гранальные мембраны также различаются в зависимо-
сти от расположения в гране: мембраны торцевых (концевых) областей, боковых
(маргинальных) областей и внутригранальные мембраны, тесно контактирую-
щие друг с другом (спаренные) (см. рис. 3.3, Б).
Фотосистема I находится в стромальных тилакоидах (32 %), а также в мар-
гинальных (36 %) и торцевых (32 %) областях гран. Фотосистема II в основном
локализована в гранах, в области тесного контакта — «стэкинга» (85 %). Ци-
тохромный комплекс распределен между стромальными и гранальными тила-
коидами относительно равномерно. АТФ-синтазный комплекс располагается
главным образом в мембранах стромальных тилакоидов, а также в маргиналь-
ных и торцевых мембранах гран. Такое неоднородное распределение комплек-
сов во внутренней мембране создает структурную основу для функциональной
гетерогенности разных областей внутренней мембранной структуры и обеспе-
чивает возможность регуляции фотосинтетических процессов на уровне мемб-
раны. В зависимости от условий освещения распределение компонентов мембран
может меняться.
3.2.3. БИОГЕНЕЗ ХЛОРОПЛАСТОВ
Основные этапы образования хлоропластов. Предшественники хлоропла-
стов — пропластиды (см. гл. 1). Пропластиды образуются из инициальных частиц
(зачатков), содержащихся в меристематических клетках. Их образование свя-
зано с разрастанием внутренней мембраны оболочки и образованием из нее
нескольких складок, направленных внутрь параллельно поверхности.
123
Рис. 3.6. Биогенез хлоропластов (по Mohr, Sitte, 1971, с изменениями).
Пояснения см. в тексте
Формирование хлоропласта может осуществляться двумя путями: непо-
средственно из пропластид и опосредованно, через образование этиопластов.
Последовательность преобразования этих органелл в зрелый хлоропласт пред-
ставлена на рис. 3.6.
Первый путь биогенеза хлоропластов — непосредственное преобразование про-
пластид в хлоропласты — реализуется при росте растений в условиях нормаль-
ного соотношения дня и ночи. Пропластиды меристематических клеток листа
превращаются в хлоропласты параллельно с ростом и дифференцировкой кле-
ток листа. Биогенез хлоропластов сопровождается формированием тилакоид-
ных мембран хлоропластов при участии внутренней мембраны оболочки про-
пластиды.
Второй путь — образование хлоропластов из этиопластов. Этиопласты — орга-
неллы клеток растения, растущего в отсутствие света (этиолированного расте-
ния). Они образуются из пропластид и имеют некоторые особенности внутрен-
него строения: содержат проламелярное тело, сформированное в результате
скопления ограниченных мембраной пузырьков и разветвленных трубчатых
структур. Мембраны проламелярного тела содержат небольшие количества ка-
ротиноидов и предшественника хлорофилла — протохлорофиллида. Формиро-
124
вание тилакоидных мембран хлоропластов в этиопластах происходит при уча-
стии мембран проламелярного тела в ответ на освещение.
Таким образом, формирование хлоропласта непосредственно из проплас-
тиды или опосредованно, из пропластиды через этиопласт происходит только
на свету.
Выделяют три этапа фотоморфогенеза хлоропластов из этиопластов.
На первом этапе из трубчатых элементов проламелярных тел образуются
крупные пузырьки, располагающиеся по радиусу. Этот процесс сопровож-
дается образованием хлорофилла из имеющегося в этиопластах протохлорофил-
лида.
На втором этапе происходит накопление белков, липидов, пигментов и само-
сборка мембран тилакоидов. Свет активирует синтез белков внутренних мемб-
ран хлоропластов и фотосинтетических пигментов. Самосборка мембран идет
на основе белковых компонетов, синтезируемых как в хлоропластах, так и в
цитозоле, при скоординированной работе их белоксинтезирующих систем и
транспорте белковых компонентов из цитоплазмы в хлоропласт. В основе само-
сборки мембран лежат физико-химические процессы (гидрофобные и элект-
ростатические взаимодействия), а также «молекулярное узнавание», обуслов-
ленное конформационными взаимодействиями.
На третьем этапе происходит дифференциация гран. Эта стадия совпадает с
интенсивным синтезом хлорофилла. Для формирования гран необходим высо-
кий уровень содержания хлорофиллов в хлоропластах, при этом особенно важ-
на концентрация хлорофилла Ь. Хлорофилл b входит главным образом в состав
ССКП — антенного комплекса ФСП. Сборка ССКП в мембранах определяет
возможность образования гран в хлоропластах.
Белки ССКП, связывающие хлорофилл Ь, кодируются генами ядра, их экс-
прессия регулируется светом.
Регуляция биогенеза хлоропластов. Биогенез хлоропластов подвергается кон-
тролю и регуляции со стороны внешних и внутренних факторов. Выделяют
световую (фоторегуляция), гормональную и генетическую регуляции.
Фоторегуляция связана с активацией светом синтеза пигментов и белков,
входящих в светособирающие комплексы. Контроль синтеза фотосинтетиче-
ских пигментов (хлорофиллов и каротиноидов) основан на регуляции светом
активности осуществляющих его ферментов (подробнее см. подразд. 3.3). Фо-
торегуляция синтеза белков хлоропластов осуществляется на генетическом уровне.
В регуляции биогенеза хлоропластов участвуют сигнальные фоторецепторные
системы — фитохромная система и рецепторы синего света (см. гл. 7).
Гормональная регуляция связана с влиянием на синтез пигментов и белков
хлоропластов ряда фитогормонов. Так, цитокинины, активируя синтез хлоро-
филлов и апобелка ССКП, способствуют формированию структуры хлоропла-
ста. Этилен, напротив, ингибирует развитие листьев и дифференцировку хло-
ропластов в этиолированных проростках (подробнее о влиянии гормонов на
фотосинтетический аппарат растений см. в гл. 7).
Генетическая регуляция включает контроль биогенеза хлоропластов на всех
уровнях реализации генетической информации, включая транскрипцию, транс-
ляцию, процессинг, транспорт белков, сборку мультипептидных комплексов.
Обнаружена регуляция экспрессии ряда генов ядерной ДНК, обслуживающих
хлоропласт светом, гормонами, продуктами фотосинтеза.
125
3.3. ПИГМЕНТНЫЕ СИСТЕМЫ ФОТОСИНТЕЗИРУЮЩИХ
ОРГАНИЗМОВ
3.3.1. ПИГМЕНТНЫЕ СИСТЕМЫ КАК ПЕРВИЧНЫЕ ФОТОРЕЦЕПТОРЫ
Фоторецепторная система фотосинтеза строится на основе двух важнейших
типов химических соединений: 1) тетрапирролов, образующих циклическую
структуру хлорофиллов (магнийпорфиринов), а также открытую структуру пиг-
ментов фикобилинов; 2) полиизопреноидов, образующих большой и разно-
образный класс пигментов каротиноидов.
В каждой из этих групп пигментов путем модификации основной структуры
образуется несколько химически различных структур, имеющих максимумы
поглощения в разных частях видимой области электромагнитного спектра. Из-
вестно 10 различных структурных форм хлорофиллов (хлорофиллы a, b, с, d, е,
бактериохлорофиллы a, b, с, d и протохлорофилл), несколько форм фикобили-
нов, более 100 различных модификаций каротиноидов. Кроме того, одна и та
же химическая структура в живом листе в комплексе с белками и липидами
образует целую серию так называемых «нативных» форм. Так, для хлорофилла а
известно около 10 таких спектрально различных форм, из них 4 формы с мак-
симумами поглощения в красной части спектра считаются универсальными —
661, 670, 678, 683 нм. Для каротиноидов известно несколько различных состоя-
ний одной и той же структуры: например, максимум поглощения р-каротина
мономерного — 450 нм, в комплексе с белком — 455 — 460 нм, кристалличе-
ского — 540 нм. В итоге формируется мощная фоторецепторная система с боль-
шим набором различных спектральных форм. Это определяет поглощение боль-
шей части видимой области спектра (от 400 до 800 нм) — так называемую
фотосинтетически активную радиацию (ФАР) с энергией квантов от 1 до 3 эВ,
и высокую эффективность миграции энергии в пигмент-белковых комплексах
хлоропластов.
Физические механизмы процессов поглощения, запасания и миграции энер-
гии молекулами хлорофилла достаточно хорошо изучены.
Поглощение фотона (hv) обусловлено переходом системы в различные энер-
гетические состояния. В молекуле в отличие от атома возможны электронные,
колебательные и вращательные движения, и общая энергия молекулы равна
сумме этих видов энергий. Основной показатель энергии поглощающей систе-
мы — уровень ее электронной энергии, определяется энергией внешних элек-
тронов на орбите. Согласно принципу Паули, на внешней орбите находятся
два электрона с противоположно направленными спинами, в результате чего
образуется устойчивая система спаренных электронов. Поглощение энергии
света сопровождается переходом одного из электронов на более высокую ор-
биту с запасанием поглощенной энергии в виде энергии электронного воз-
буждения. Важнейшая характеристика поглощающих систем — избирательность
поглощения, определяемая электронной конфигурацией молекулы. В сложной
органической молекуле есть определенный набор свободных орбит, на кото-
рые возможен переход электрона при поглощении квантов света. Согласно «пра-
вилу частот» Бора, частота поглощаемого или испускаемого излучения v дол-
жна строго соответствовать разности энергий между уровнями:
126
V = (Е2 - Д)/Л,
где h — постоянная Планка, равная 6,626 • 10-34 Дж/с.
Каждый электронный переход соответствует определенной полосе погло-
щения. Таким образом, электронная структура молекулы определяет характер
электронно-колебательных спектров.
Запасание поглощенной энергии связано с возникновением электронно-воз-
бужденных состояний пигментов. Физические закономерности возбужденных со-
стояний Mg-порфиринов могут быть рассмотрены на основе анализа схемы элек-
тронных переходов этих пигментов (рис. 3.7). Известно два основных типа воз-
бужденных состояний — синглетные и триплетные. Они отличаются по энергии
и состоянию спина электрона. В синглетном возбужденном состоянии спины
электронов на основном и возбужденном уровнях остаются антипараллельны-
ми, при переходе в триплетное состояние происходит поворот спина возбужден-
ного электрона с образованием бирадикальной системы. При поглощении фото-
на молекула хлорофилла переходит из основного (50) в одно из возбужденных
синглетных состояний — 5) или S2, что сопровождается переходом электрона
на возбужденный уровень с более высокой энергией. Возбужденное состояние
S2 очень нестабильно. Электрон быстро (в течение 10"12 с) теряет часть энергии
в виде тепла и опускается на нижний колебательный уровень где может
находиться в течение 10-9 с. В состоянии 5) может произойти обращение спина
электрона и переход в триплетное состояние 7}, энергия которого ниже
Возможно несколько путей дезактивации возбужденных состояний:
— превращение энергии возбуждения в тепло (термальная диссипация энер-
гии);
Рис. 3.7. Схема электронных переходов для магнийпорфиринов в полярном
растворителе:
S'o — основное состояние; 5Ь — первое и второе синглетные возбужденные состояния;
Гь Тг — первое и второе триплетные возбужденные состояния
127
— излучение фотона с переходом системы в основное состояние (флуорес-
ценция или фосфоресценция);
— перенос энергии на другую молекулу;
— использование энергии возбуждения в фотохимической реакции.
Миграция энергии между молекулами пигментов может осуществляться по
следующим механизмам. Индуктивно-резонансный механизм (механизм Фёрсте-
ра) возможен при условии, когда переход электрона оптически разрешен и
обмен энергией осуществляется по экситонному механизму. Понятие «экситон»
означает электронно-возбужденное состояние молекулы, где возбужденный
электрон остается связанным с молекулой пигмента и разделения зарядов не
происходит. Перенос энергии от возбужденной молекулы пигмента к другой
молекуле осуществляется путем безызлучательного переноса энергии возбуж-
дения. Электрон в возбужденном состоянии представляет собой осциллиру-
ющий диполь. Образующееся при этом переменное электрическое поле может
вызвать аналогичные колебания электрона в другой молекуле пигмента при
выполнении условий резонанса (равенство энергии между основным и воз-
бужденным уровнями) и условий индукции, определяющих достаточно силь-
ное взаимодействие между молекулами (расстояние не более 10 нм).
Обменно-резонансный механизм миграции энергии Теренина—Декстера имеет
место в том случае, когда переход оптически запрещен и диполь при возбуж-
дении пигмента не образуется. Для его осуществления необходим тесный кон-
такт молекул (около 1 нм) с перекрыванием внешних орбиталей. В этих усло-
виях возможен обмен электронами, находящимися как на синглетных, так и
на триплетных уровнях.
3.3.2. ХЛОРОФИЛЛЫ
3.3.2.1. Основные элементы структуры
и их значение в поглощении
и преобразовании энергии
Из большого числа разнообразных пигментов только две структуры — хло-
рофилл а и бактериохлорофилл а — способны осуществлять преобразование
энергии, все остальные пигменты участвуют в процессах поглощения и мигра-
ции энергии. Анализ химического строения молекулы хлорофилла а показывает,
что данная структура прекрасно приспособлена для выполнения трех основных
функций в фотосинтезе — поглощения, запасания и преобразования энергии.
Главные функции хлорофиллов, представляющих собой магнийпорфири-
ны, определены спецификой химического строения молекулы, ее физико-хи-
мическими свойствами, природой электронно-колебательных спектров. Функ-
ции Mg-порфиринов формировались в процессе эволюции в тесной связи с
эволюцией фоторецепторных структур. В основе молекулы Mg-порфирина ле-
жит тетрапиррольная структура порфина, включающая 4 пиррольных кольца,
соединенных метиновыми мостиками (рис. 3.8). Пиррольное кольцо, состоя-
щее из 4 атомов углерода и атома азота, является хромофором, способным
поглощать энергию инфракрасной области спектра. Замыкание пиррольных
колец в тетрапиррольную структуру порфина, химически более устойчивую,
128
(2) (a) (3)
н н н
с с с
(1) нс' Y Y Yh (4)
C-NH N=C
(8) нс' )зн (Р)
C-N HN-C
(8) Нс' )ЗН (5)
С С с
Тетрагидропорфин
(7) (у) (6)
Порфин
Рис. 3.8. Структурная формула порфина и его производных — дигидропорфина
и тетрагидропорфина
имело решающее значение в эволюции хлорофиллов как первичных фоторе-
цепторов. Благодаря формированию циклической системы и эффекту сопря-
жения появляются интенсивные полосы поглощения в видимой области спек-
тра с более высокой энергией квантов. Образующиеся в процессе эволюции
порфирины представляют собой сложную систему с общим л-электронным
облаком, объединяющим 4 пиррольных кольца в единый цикл.
Порфириновый макроцикл обладает всеми свойствами, необходимыми для
выполнения важнейших функций в фотосинтезе:
— имеет определенный спектр поглощения в зеленой области (порфирины
красного цвета);
— проявляет активную красную флуоресценцию, что свидетельствует о фо-
тохимической активности порфиринов;
— является хелатообразователем, способным включать Mg, что позволяет
осуществлять реакции, идущие с запасанием энергии;
— обладает способностью к обратимым окислительно-восстановительным
превращениям — фотовосстановлению (может служить акцептором электро-
на, т. е. осуществлять фотоокисление органических веществ в отсутствие О2) и
фотоокислению (электрон-донорная функция при включении Mg).
В процессе эволюции пигментов изменяются свойства их полярности. Фор-
мируются порфирины, различающиеся по числу СООН-групп — от уропорфи-
рина (8 СООН) и копропорфирина (4 СООН) до протопорфирина (2 СООН).
Появляется также гидрофобный радикал фитол. Возникновение менее поляр-
ных, более гидрофобных порфиринов обеспечило возможность включения их
в мембранные структуры и образования пигмент-белковых комплексов с более
длинноволновыми максимумами поглощения, а также определенную ориен-
тацию пигментов, что необходимо для активных процессов поглощения и
миграции энергии.
Дальнейшая эволюция пигментов шла по пути все большего усложнения их
структуры. Изменяется степень восстановленности пигментов. По этому показа-
телю различают три основные пигментные системы: порфин, дигидропорфин
(хлорин) и терагидропорфин (бактериохлорин) (см. рис. 3.8). Изменение уров-
ня восстановленности Mg-порфиринов, связанное с гидрированием двух полу-
изолированных двойных связей в положениях углерода в кольце 3 — 4 и 7 — 8
5 Физиология растений
129
(3=4 и 7=8), имело большое значение для формирования оптимальной элек-
тронной структуры молекулы и сопровождалось изменением спектральных и
электрон-допорных свойств. Дополнительное гидрирование порфиринового
макроцикла у хлорофилла и бактериохлорофилла привело к уменьшению по-
тенциала ионизации и снижению количества энергии, необходимой для фото-
окисления пигментов, что имело решающее значение для процесса преобра-
зования энергии в реакционных центрах.
Усложнение общей структуры молекулы Mg-порфирина связано с форми-
рованием пятого циклопентанного кольца, т. е. с образованием системы «форби-
на». Структура форбина характерна для всех представителей группы хлорофил-
ла (рис. 3.9).
Известно 10 различных модификаций хлорофилла и бактериохлорофилла.
Рассмотрим важнейшие из них.
СН=СН2 |сн31
СООС20Н39
Хлорофилл а
СООС20Н39
Хлорофилл b
Н3С-СО
Д
н»с~ч I ?
С—N.
н< •
С—N
НзС s/jvj;
О;
Н I
сн2
сн2
о=с
I
о
С20Н39
Бактериохлорофилл а
НН3С Н
• Mgx ^сн
XN- С
^С^П}с-СНз
7с5
I ю 6 ।
НС-—„с=о
I 9
с=о
I
о
СНз
Рис. 3.9. Структура хлорофиллов а, Ь и бактериохлорофилла а\
I — IV — нумерация пиррольных колец
130
Хлорофилл а — универсальный пигмент высших растений и водорослей. У не-
которых водорослей (синезеленых, некоторых красных) он представляет един-
ственную форму хлорофилла. Максимум поглощения в органических раство-
рителях в красной области спектра находится при длинах волн 660 — 664 нм.
Хлорофилл Ь — дополнительный пигмент высших растений и водорослей,
впервые появляется у эвгленовых водорослей, заменяя фикобилины. Отлича-
ется от хлорофилла а наличием альдегидной группы вместо метильной —СН3
во II пиррольном кольце. Красный максимум поглощения в ацетоне 645 нм.
Хлорофилл с — дополнительный пигмент бурых и диатомовых водорослей. Он
содержит магний, не этерифицирован фитолом, связь 7=8 не гидрирована,
остаток пропионовой кислоты при С7 имеет двойную связь: —СН=СН—СООН.
Хлорофилл d — дополнительный пигмент красных водорослей, отличается
от хлорофилла а наличием альдегидной группы при С2 вместо —СН=СН2.
Красный максимум поглощения в органических растворителях 686 нм.
Бактериохлорофилл а — главный пигмент у фотосинтезирующих бактерий.
Красный максимум поглощения — 770—780 нм.
Предшественником хлорофиллов является пропюхлорофилл или его безфи-
тольная форма протохлорофиллид. У протохлорофилла в отличие от хлоро-
филла а двойная связь 7=8 в IV пиррольном кольце не гидрирована, восста-
новление ее осуществляется фотохимическим путем на заключительных стади-
ях биосинтеза хлорофилла.
Все рассмотренные модификации затрагивают лишь боковые группы, цент-
ральная часть молекулы остается неизменной. К числу основных элементов
структуры относятся: 1) циклическая 18-членная система сопряженных связей,
2) центральный атом магния, 3) циклопентанное кольцо, 4) фитол (у бакте-
риохлорофиллов с и d — фарнезол). Исследования последних лет позволяют
раскрыть функциональное значение отдельных элементов структуры.
Конъюгированная система сопряженных связей у всех хлорофиллов представ-
ляет собой основную хромофорную группу, ответственную за избирательное
поглощение световой энергии. Циклическая система сопряженных двойных
связей, образующая делокализованную л-орбиту, имеет ряд дополнительных
сопряжений: винильную группу в I кольце,
полуизолированную связь во II кольце, С=О
группу в V кольце. В результате возникает
сложноразветвленная конъюгированная си-
стема, которая обеспечивает высокую погло-
щающую способность Mg-порфиринов.
Спектры поглощения магнийпорфиринов
имеют два хорошо выраженных максимума
поглощения в сине-фиолетовой (полоса
Соре) и красной областях спектра (рис. 3.10).
У хлорофилла b оба максимума расположе-
ны между максимумами поглощения хло-
рофилла а, что увеличивает области погло-
щаемой энергии хлоропластами высших
растений.
Центральный атом магния определяет
важнейшие физические и химические свой-
Рис. 3.10. Спектры поглощения
хлорофиллов а (/) и b (2):
£ — удельный коэффициент экстинкции
131
ства молекулы магнийпорфирина. Включение магния в тетрапиррольную струк-
туру значительно изменяет спектральные свойства хлорофилла. Влияние маг-
ния осуществляется через атомы азота пиррольных колец — двух третичных
(—N=) и двух иминных (=NH). В щелочной среде два протона от иминных
атомов азота замещаются на магний, образующий с двумя атомами иминного
азота электровалентные связи. Два третичных атома азота стабилизируют
это соединение за счет неподеленных пар электронов посредством координа-
ционной связи. При образовании комплексного соединения порфиринов с
металлом электронная плотность по всем пиррольным кольцам выравнивает-
ся и они становятся эквивалентными. В результате этого изменяется симмет-
рия молекулы, что сопровождается изменением ее спектральных характери-
стик.
Центральный атом магния определяет уникальные функции молекулы хло-
рофилла в фотосинтезе, связанные с поглощением, запасанием и преобразо-
ванием энергии. Д. Мозеролл (1974) считает, что использование магния пер-
вичными фототрофными организмами для построения фоторецепторных си-
стем обусловлено определенными физико-химическими свойствами этого эле-
мента. Магний отличается наиболее низкой величиной электроотрицательно-
сти (по Л. Полингу, Mg = 1,3; Zn = 1,6; Си = 1,9), а магнийхелат порфирина
имеет наиболее низкое значение редокс-потенциала, т. е. отличается наимень-
шей способностью удерживать электроны. При включении магния в тетрапир-
рольную структуру снижается также величина потенциала ионизации. Поэтому
магнийпроизводные порфирина являются сильными восстанавливающими аген-
тами и в возбужденном состоянии способны восстанавливать соединения с
высоким восстановительным потенциалом (-0,9 В).
Магний определяет ряд химических свойств хлорофилла. Обладая коорди-
национным числом 6, магний способен образовать дополнительно две коор-
динационные связи с атомами кислорода и азота. Благодаря этому магний уча-
ствует в образовании ассоциатов молекулы хлорофилла с другими молекулами
пигментов (при образовании димеров в реакционных центрах), с белками,
липидами, фосфолипидами и другими компонентами хлоропласта. Образова-
ние ассоциатов обусловливает сильное смещение абсорбционного максимума
в длинноволновую область. В результате этого (по данным К. Френча, 1972 и
Ф.Ф. Литвина, 1973) образуется серия так называемых «нативных» спектраль-
ных форм хлорофилла, выполняющих различные функции. Более коротковол-
новые формы (661, 670, 678 нм) участвуют главным образом в процессах по-
глощения энергии, более длинноволновые формы (683 нм) — в процессах ее
миграции, а пигменты реакционных центров (П68о, П700) — в процессах пре-
образования энергии.
Дополнительное циклопентанное кольцо. Значение V кольца хлорофилла опре-
деляется наличием в нем двух полярных групп — кетогруппы С9=О при 9-м
атоме углерода и кетоэфирной группы при С]0. Кетогруппа при С9 участвует
в образовании водородной связи хлорофилла и молекулы воды. Через атом
кислорода вода может образовать координационную связь с магнием одной
молекулы хлорофилла и одновременно водородную связь с группой С=О дру-
гой молекулы. В результате образуются структуры Mg—О(Н)—Н—О=С. В дан-
ном случае воде принадлежит очень важная роль в образовании высокоорга-
низованных структур антенных комплексов. Неподеленные электроны ато-
132
Рис. 3.11. Схема образования
димера П700 (Ф. Фонг, 1974)
ма кислорода С9=О группы V кольца мо-
гут участвовать в поглощении световой энер-
гии и возбуждаться с переходом на л-орби-
ту, обусловливая так называемые и-> л*-пе-
реходы.
Большое значение в образовании светпо-
глощающих структур хлоропластов принадле-
жит кетоэфирной группе V кольца. В отличие
от группы С9=О, которая образует допол-
нительное сопряжение с л-электронной си-
стемой макроцикла, кетоэфирная группа при
Сю не конъюгирует с циклической л-элект-
ронной системой, вследствие чего образует более прочную связь с молекулой
воды. Кроме того, кетоэфирная группа находится в /дроне-положении по отно-
шению к плоскости порфинного кольца. Это позволило предположить участие
кетоэфирной группы в образовании димеров П700 и П68о в реакционных цент-
рах фотосистем. Согласно модели Ф. Фонга (1974), образование симметрично-
го димера в реакционном центре ФС1 осуществляется при участии централь-
ных атомов магния, кетоэфирных групп двух молекул хлорофилла а и двух
молекул Н2О с образованием структур типа (хл. а — Н2О)2 (рис. 3.11). Результа-
ты работ японских ученых показали, что П700 представляет собой димер хлоро-
филла а и хлорофилла а', у которого кетоэфирная группа находится в цис-
положении относительно плоскости молекулы (Т. Watanabe et al., 1985). Таким
образом, магний и кетоэфирная группа в молекуле хлорофилла являются глав-
ными компонентами для формирования димерных структур пигментов реак-
ционного центра.
Фитол представляет собой полиизопреноидную цепь, состоящую из 20 уг-
леродных атомов (спирт фитол — С20Н39ОН), и является гидрофобным ради-
калом молекулы хлорофилла. Фитольная цепь не находится в электронном со-
пряжении с макроциклом и поэтому практически не влияет на электронную
структуру хлорофилла в возбужденных состояниях 5, и 52. В нативной системе
взаимодействие фитола с гидрофобными белками позволяет регулировать по-
ложение макроцикла по отношению к свету и, таким образом, изменять ак-
тивность светопоглощения молекулой хлорофилла.
3.3.2.2. Метаболизм магнийпорфиринов
Современные представления о путях биосинтеза зеленых пигментов осно-
ваны на работах Д. Шемина с использованием меченых атомов углерода 14С и
азота 15N, на опытах С. Граника с мутантами хлореллы, многолетних работах
Т.Н.Годнева с сотр., А.А.Шлыка и др. Ключевым соединением в биосинтезе
порфиринов является 8-аминолевулиновая кислота (АЛК). У растений биосин-
тез АЛК идет через 5-углеродные соединения — глутаминовую или а-кетоглу-
таровую кислоту (С5-путь). Начальные реакции биосинтеза АЛК в растениях
представляют АТФ- и НАДФН-зависимые процессы. Согласно современным
представлениям, превращение глутамата в 8-АЛК по С5-пути включает учас-
тие трех ферментов:
133
Глутаминовая кислота СООН 1 Глутамил- тРНК СООН 1 Глутамат-1- семиальдегид СООН
сн2 , СН2 СН2 Пиридоксаль-
1 тРНК, АТФ, Mg2+ 1 НАДФН 1 фосфат
сн2 - СН2 • - СН2
1 Глутамил- । Глутамил- I Аминотранс-
chnh2 1 тРНК-синтетаза СНЬ1Н2 тРНК-редуктаза СНЬ1Н2 фераза
соон с=о сно
тРНК
5-Ами нолевул и-
новая кислота
соон
сн2
сн2
с=о
ch2nh2
Последующие реакции превращения АЛК в циклический пиррол и тетра-
пиррольные структуры идут согласно классической схеме (рис. 3.12). В реакции
конденсации двух молекул АЛК, катализируемой АЛК-дегидратазой, обра-
зуется первичный монопиррол — порфобилиноген, который затем при уча-
стии ряда ферментов через серию тетрапиррольных соединений с различным
числом групп СООН последовательно превращается в уропорфириноген III
(8 СООН), копропорфириноген (4 СООН) и, наконец, в протопорфирин IX
(2 СООН), который служит ключевым интермедиатом в биосинтезе Fe- и
Mg-порфиринов. Включение железа в протопорфирин IX при участии фермен-
та феррохелатазы приводит к образованию железопорфирина. Магниевая ветвь
биосинтеза пигментов начинается включением магния в протопорфирин IX
(рис. 3.13). Эта реакция требует присутствия АТФ и Mg +. Образовавшийся
Mg-протопорфирин IX этерифицируется метиловым спиртом с образованием
Mg-протопорфиринмонометилового эфира.
На заключительных этапах биосинтеза хлорофилла происходят следующие
реакции: 1) окисление пропионовой кислоты в положении 6 с образованием
кетогруппы: —СН2—СН2—СООСН3 —* —СО—СН2—СООСН3; 2) замыкание
V кольца и образование Mg-дивинилфеопорфирина а5 (дивинилпротохлоро-
филлида); 3) восстановление винильной группы (—СН=СН2) в положении
С4 до этильной (—СН2—СН3) при участии восстановленных пиридиннуклео-
тидов и образование магнийвинилфеопорфирина о5 (моновинил протохл оро-
филлида). В результате этих преобразований возникает молекула протохл оро-
филлида, непосредственного предшественника хлорофилла а в биосинтети-
ческой цепи.
На свету в процессе зеленения этиолированных растений превращение про-
тохлорофиллида а в хлорофиллид а включает реакцию фотохимического вос-
становления полуизолированной двойной связи 7=8 в IV пиррольном кольце
134
СООН
25 АЛК
-Н20
АЛК-дегидратаза
СООН сн2
+4 ПБГ
-4 NH2
ПБГ-дезаминаза
Порфобилиноген (ПБГ)
Рис. 3.12. Основные стадии биосинтеза протопорфирина IX:
6АЛК — 5-аминолевулиновая кислота; Ас — остаток уксусной кислоты (—СН2СООН); Рг —
остаток пропионовой кислоты (—СН2СН2СООН)
макроцикла. В листьях этиолированных растений протохлорофиллид накапли-
вается в виде трех основных форм с максимумами поглощения 628, 638 и 648
(650) нм. Фотоактивными являются только две более длинноволновые формы,
образующие прочные комплексы с белком. В 1974 г. В. Гриффитс изолировал из
этиопластов фермент, который катализирует восстановление протохлорофил-
лида в хлорофиллид. Фермент получил название НАДФН-протохлорофилли-
доксидоредуктаза (ПОР). Фермент связан с проламелярным телом этиопласта,
где он образует фотохимически активный комплекс с донором водорода
НАДФН и протохлорофиллидом (650 нм). При освещении этого фотоактивно-
го тройного комплекса атомы водорода от НАДФН переносятся к протохлоро-
филлиду с образованием хлорофиллида а, что сопровождается изменением
спектра поглощения. Дальнейшее превращение хлорофиллида в хлорофилл
связано с его этерификацией фитолом путем присоединения к макроциклу
135
Протопорфирин IX
^Ag-хелатаза
Мё2+-ДТФ
Mg-протопорфирин
^Ag-протопорфирин IX-
метилтрансфераза
S-аденозилметионин
(метилирование
пропионовой кислоты III кольца)
S-аденозилгомоцистеин
Mg-протопорфиринмонометиловый эфир
(Р-окисление k-пропионовой кислоты,
образование С=О, замыкание V кольца)
Дивинилпротохлорофиллид а
Винилредуктаза
НАДФН
НАДФ
(восстановление С4
винильной группы до этильной)
Моновинилпротохлорфиллид а
Протохлорфиллид-
оксидоредуктаза
(восстановление 7=8 связи)
Хлорофиллид а
Хлорофиллсинтаза
Хлорофилл а--------------Хлорофилл Ь
Хлорофилл а-
оксигеназа
(присоединение фитола)
Рис. 3.13. Схема заключительных этапов биосинтеза хлорофилла
геранилгеранилпирофосфата — полиизопреноидной структуры (С2о) с четырьмя
двойными связями. При гидрировании трех из них образуется фитольная струк-
тура — гидрофобный радикал молекулы хлорофилла.
Механизмы регуляции биосинтеза тетрапирролов включают сложную систе-
му регуляторных механизмов, обеспечивающих строгую координацию всех ре-
акций биосинтетического пути. В нормальных условиях порфирины в клетке не
накапливаются. Скорость синтеза порфиринов хорошо скоординирована со
скоростью их последующих превращений. При нарушении какого-либо проме-
136
жуточного звена накопление порфиринов идет лишь до определенного уров-
ня, находящегося под контролем регуляторных механизмов. Биологическое зна-
чение действия регуляторных механизмов состоит в том, что ими предотвраща-
ется накопление свободных порфиринов, обладающих высокой фотосенсиби-
лизирующей активностью, а также бесцельная трата исходных продуктов и энер-
гии в тех случаях, когда образующиеся порфирины не могут быть использова-
ны для биосинтеза конечных продуктов — хлорофиллов или гемопротеидов.
Система регуляторных механизмов включает метаболитный контроль — уро-
вень содержания в клетке необходимых субстратов (АЛК), кофакторов (АТФ,
НАДФН) и ферментов (АЛК-синтетаза), генетический контроль — осуществ-
ляет образование всех ферментных белков биосинтетической цепи, фитохром-
ный контроль — фоторегуляция экспрессии генов, контроль синтеза хлоропла-
стных полипептидов, кодируемых ядерным и пластидным геномами. За счет
взаимодействия названных контролирующих механизмов координируются все
звенья сложной системы процессов биосинтеза порфиринов в клетке.
3.3.3. ФИКОБИЛИНЫ
Фикобилины фикоцианин, фикоэритрин и аллофикоцианин входят в состав
пигментных систем цианобактерий и красных водорослей, где вместе с хлоро-
филлом а выполняют функции фоторецепторов в фотосинтезе. Фикобилины
представляют группу тетрапиррольных пигментов с открытой цепью (рис. 3.14).
Они не содержат металла, отдельные пиррольные кольца соединены
метиновыми (—СН=) и метиленовыми (—СН2—) мостиками и включают
различные радикалы в форме метильных (—СН3), винильных (—СН=СН2),
этильных (—СН2—СН3) групп, а также два остатка пропионовой кислоты
(-СН2~СН2-СООН).
Фикоцианобилин
Рис. 3.14. Структурные формулы фикобилинов
137
Основной пигмент этой группы фикоцианин (синего цвета) представляет со-
бой комплекс фикоцианобилина (простатическая группа пигмента) с белком и
является, таким образом, фикобилипротеидом с молекулярной массой 273 кДа.
Фикоэритрин (красного цвета) — комплекс фикоэритробилина с белком
(молекулярная масса 226 кДа). Аллофикоцианин — синий пигмент с молекуляр-
ной массой 134 кДа, состоящий из трех субъединиц.
Простетическая группа пигментов при участии двух свободных карбоксиль-
ных групп образует прочную ковалентную связь с белком, разрываемую толь-
ко при нагревании с НС1. Пигментные комплексы водорастворимы и могут
быть извлечены из клеток водорослей горячей водой.
Хромофорной группой фикобилинов является система сопряженных связей,
которая образуется при участии атомов углерода и азота пиррольных колеи и
—СН-мостиков. Молекула фикоэритробилина содержит 6 двойных связей, у
фикоцианобилина их 8. Спектры поглощения фикобилинов имеют, как прави-
ло, один главный максимум, расположенный в желто-зеленой области спект-
ра, которая слабо используется хлорофиллами (рис. 3.15). Через толщу воды
наиболее глубоко проникают зеленые лучи, активно поглощаемые фикоби-
линами.
Для фикобилипротеидов характерна яркая флуоресценция', у фикоэритрина —
оранжевая с максимумом около 575 нм, у аллофикоцианина — красная с мак-
симумом 660 нм. При денатурации белка и нарушении связей простатические
группы фикобилинов теряют способность флуоресцировать.
В клетках водорослей фикобилины находятся в специальных гранулах —
фикобилисомах, расположенных на поверхности мембран (рис. 3.16). Пигменты
в грануле образуют последовательный ряд функционально связанных пигмент-
ных комплексов. На поверхности фикобилисомы расположены коротковол-
новые пигменты (фикоэритрин, 570 нм), ближе к мембране — пигменты с
более длинноволновым максимумом (фикоцианин, 630 нм; аллофикоцианин,
650 нм и аллофикоцианин В, 670 нм). Такое расположение пигментов в фико-
билисоме позволяет с высокой скоростью и эффективностью осуществлять
процессы миграции энергии, поглощаемой фикобилинами, на хлорофилл а,
локализованный в мембране.
Фикобилины функционируют как дополнительные пигменты в составе фо-
тосистемы II. По данным ряда авторов (L.Duysens, 1951; К. French, 1952),
Рис. 3.15. Спектры поглощения
фикобилинов
Фикоэритрин (570 нм)
Фикоцианин (630 нм)
Аллофикоцианин (650 нм)
Аллофикоцианин В (670 нм)
Хлорофилл а (670 нм)
Рис. 3.16. Организация фикобилисом
в клетках водорослей
138
90 % энергии, поглощенной фикобилинами, мигрирует на хлорофилл а и ис-
пользуется в фотохимических реакциях. Для понимания физиологической роли
данной группы пигментов большое значение имеет явление хроматической
адаптации, исследованное в работах Н. М. Гайдукова, А. А. Рихтера, Т. Зигель-
мана и др. Было установлено, что содержание и состояние пигментов у водо-
рослей зависят от условий освещения, и при изменении спектрального соста-
ва света изменяется пигментный состав, увеличивается количество пигмен-
тов, поглощающих дополнительный по отношению к падающему свет. Про-
цесс хроматической адаптации позволяет водорослям оптимально использо-
вать световую энергию, проникающую через толщу воды. В процессе эволю-
ции, начиная с эвгленовых водорослей, фикобилины как дополнительные
пигменты были заменены на хлорофилл Ь, циклическая структура которого
более устойчива по сравнению с открытой цепью фикобилинов, и дальней-
ший путь эволюции фотоавтотрофных организмов происходил на основе двух
циклических тетрапирролов — хлорофиллов а и Ь.
3.3.4. КАРОТИНОИДЫ
3.3.4.1. Общая характеристика класса каротиноидов
Каротиноиды — большая и разнообразная группа желтых, оранжевых, крас-
ных пигментов, поглощающих коротковолновую часть видимой области спект-
ра (400 — 550 нм) и выполняющих ряд очень важных функции в фотосинтезе.
По химической природе каротиноиды представляют собой полиизопреноид-
ную цепь, состоящую из 40 атомов углерода, которая у большинства кароти-
ноидов замыкается по концам в два иононовых кольца. Центральная часть мо-
лекулы, состоящая из 18 атомов углерода, представляет собой систему сопря-
женных связей, образуя основную хромофорную группу молекулы пигмента.
В зависимости от содержания кислорода в молекуле каротиноида различают
каротины (например, p-каротин), не содержащие кислорода, и ксантофиллы —
содержащие кислород в форме гидрокси-группы —ОН или эпокси-группы
I
Сх
I /О. У высших растений главными представителями ксантофиллов являются
С
I
лютеин, виолаксантин, зеаксантин и неоксантин (рис. 3.17).
Большое разнообразие пигментов в группе каротиноидов в значительной мере
связано с наличием разных изомерных форм. Цис- и троис-изомеры с неоди-
наковым расположением заместителей относительно двойной связи (рис. 3.18)
различаются по спектральным и химическим свойствам и имеют разную кон-
фигурацию молекулы: транс-изомеры — линейную, цис-изомеры (9, 11, 13,
15-цнс) — изогнутую. Большая часть каротиноидов ССК представлена транс-
конфигурацией.
Каротиноиды присутствуют в мембранах у всех фотосинтезирующих организ-
мов, где они выполняют ряд важнейших функций в процессе фотосинтеза —
антенную (дополнительные пигменты в процессе поглощения солнечной энер-
гии), защитную (тушители триплетного хлорофилла и синглетного кислоро-
139
НзС СН
СНз
I н
Лк Л’Л
Н2с21^с 7 с 9 с
I з ® II Н Н
11
СНз
I н н н н н
С СНз
Н2
н 13 н 15 н 14'Т 12'
М М Г1 I
СН,
С
Н
p-Каротин
Н3С /СНз
Лк
_^7>С6.1кСН2
8^С^11® ,,1
Н /С s 4'3 СН2
СНз Н3С С
Н2
НзС СН
л^
Н2С с с
I II н
но-о
' С СНз
н н2
СНз
н
Л
с
н
СНз
н н
Л^ л
с с с
н н н
СНз
НзС СНз
Н3С СН;
СН3
Н
С;
н
. л
с
н
Н Лк
с^ сн сн2
С' I I
н Лк Л-он
СН3Н3С С '
нН
Лютеин
Лк Л^
н2с сС с
। Сон
но-ск лк
' С СНз
н н2
СНз
I н н
. /Ч лл л
с с с
н н н
Н3С СНз
Н3С ,сн
СНз
н
Л’,
с
н
Н1С'С'С
но-с с
' с сн,
н н2
СН3
Н
С;
Неоксантин
СНз
н н
Л^ л
с с с
н н н
СНз
Н
С;
Виолаксантин
н н хс.
. Л^ Л^ сн сн2
с v с' । ।
Н I Н Лк л-он
СН3Н3С I С '
но н2 Н
Н3С СНз
н н
. Л с,
с
н
Лк
. _^С сн2
с-б; । ।
н Лк л-он
СН3 ur С 4
Н2 н
н
с
н
Рис. 3.17. Структурные формулы основных каротиноидов высших растений
'Все-транс
15-цис
Рис. 3.18. Конфигурация цис- и транс-изомерных форм каротиноидов
11-цис
да) и фотопротекторную (предохраняют реакционный центр от мощных по-
токов энергии при высоких интенсивностях света и стабилизируют липидную
фазу тилакоидных мембран, защищая ее от переокисления).
3.3.4.2. Антенная функция каротиноидов
Антенная функция предполагает энергетическое взаимодействие каротино-
идов и хлорофиллов. Антенная функция имеет место в ССК и обусловлена
синглетно-возбужденным состоянием каротиноидов, которые находятся в форме
«все-транс». Возможность миграции энергии в пигмент-белковом комплексе
140
Рис. 3.19. Спектры поглощения каротино-
идов в органических растворителях:
А — р-каротип ( / — свободный; 2 — связан-
ный с белком); Б — лютеин; В — виола-
ксантин
360 440 520
380 420 460 500
Длина волны, нм
Б
от возбужденных каротиноидов к хлорофиллу доказана экспериментально ра-
ботами Л.Дюйзенса в опытах с сенсибилизированной флуоресценцией в си-
стеме p-каротин -> бактериохлорофилл и опытами Дж. Гудхира со спектром
действия, в которых установлен перенос энергии между каротиноидами и хло-
рофиллами в фотосистемах I и II. Таким образом, главная функция каротино-
идов в ССК — поглощение энергии и перенос ее на хлорофилл. Для этой цели
в эволюции были отобраны «все-транс» каротиноиды.
Каротиноиды характеризуются определенным спектром поглощения в сине-
зеленой области (400—550 нм) (рис. 3.19). Хромофорная группа различных ка-
ротиноидов может включать от 9 до 13 двойных связей, что определяет поло-
жение максимумов, энергию возбуждения и общий вид спектра поглощения.
У большинства каротиноидов спектр поглощения имеет главный максимум и
два более или менее выраженных «плеча», что отражает три колебательных
подуровня, одного электронного перехода на второй возбужденный уровень
(Уо-*^)- Переход электрона в первое синглетное возбужденное состояние
(50->У1) оптически запрещен. Однако фотофизические исследования возбуж-
денных состояний каротиноидов, проведенные в последние годы, показали,
что p-каротин (Кр) и другие каротиноиды (Кар) обладают лежащим ниже
возбужденным синглетным уровнем У), на который возможен переход элект-
рона из состояния S2 путем реакции внутренней конверсии (J. Коуата, 1991).
На рис. 3.20 представлена диаграмма энергетических уровней p-каротина и бак-
141
P-Каротин Бактериохлорофилл а
Рис. 3.20. Диаграмма уровней энергии
Р-каротина и бактериохлорофилла а
(по Коуата, 1991, с изменениями)
тер иохлорофилла а, где на оси ординат от-
ложены значения волнового числа (v), ха-
рактеризующие энергию уровней. Можно
видеть хорошее соответствие положения
энергетических уровней p-каротина и
бактериохлорофилла, что свидетельству-
ет о возможностях миграции энергии элек-
тронного возбуждения от p-каротина к мо-
лекуле хлорофилла.
При возбуждении молекулы р-кароти-
на переход на возбужденный уровень S2
(50-> S2) оптически разрешен, и этот пе-
реход определяет характер спектра погло-
щения в коротковолновой части видимой
области спектра (-500 нм). Время жизни
этого возбужденного состояния очень мало
(200 фс), обнаружена флуоресценция при
570 нм с очень низким квантовым выхо-
дом 6 • 10“5.
Переход оптически запрещен, поэтому соответствующие ему поло-
сы поглощения не обнаружены. Предполагают, что имеет место внутренняя
конверсия энергии S2-^> 5] со временем 200 фс. Положение возбужденного уровня
51 определено методом интерполяции по скорости релаксации 52->5j в опы-
тах с серией каротиноидов с различным числом двойных связей в конъюгиро-
ванной цепи.
Проведенные исследования позволяют предполагать, что положение возбуж-
денного уровня 5, для p-каротина близко 17000 см-1 (-600 нм). Квантовый вы-
ход флуоресценции от 5| к 50 с максимумом около 840 нм очень мал (2 • 10“5),
в несколько раз меньше, чем для S2. Время жизни молекулы p-каротина в
возбужденном состоянии 5] около 10 пс. Большее время жизни и лучшее со-
впадение энергетических уровней p-каротина и бактериохлорофилла позволя-
ет считать состояние Л) более удобным для переноса энергии возбуждения на
хлорофилл (см. рис. 3.20).
Механизм миграции энергии в ССК от каротиноидов к хлорофиллам изучен
недостаточно. Экспериментально доказано, что имеет место очень эффектив-
ный перенос энергии от каротина (Кр) к хлорофиллу (Хл). Поскольку пере-
ход SQ->S2 разрешен, в данном случае возможен дипольный механизм Фёр-
стера. При очень коротком времени жизни S2 (200 фс) необходим тесней-
ший контакт молекул p-каротина и хлорофилла. Время жизни 5) значитель-
но больше (10 пс) и лучше совпадение энергетических уровней, что более
удобно для переноса энергии. Однако переход 50-э 5, для p-каротина опти-
чески запрещен, и дипольный механизм миграции энергии невозможен.
В данном случае предполагается обменно-резонансный механизм Теренина-
Декстера.
Таким образом, перенос энергии может идти двумя путями:
1) 52(Кр) -> 52(Хл) и
2) 52(Кр) -> 5,(Кр) -> ^(Хл).
142
Этим можно объяснить тот факт, что в процессе эволюции для антенной
функции были отобраны каротиноиды в форме «все-транс»; они обеспечива-
ют работу двух каналов переноса энергии на хлорофилл (цмс-формы каротинои-
дов флуоресцируют только в состоянии S2).
3.3.4.3. Защитная функция каротиноидов
Каротиноиды в антенном комплексе и реакционном центре выполняют
уникальную «защитную» функцию, которая осуществляется с участием 1\-со-
стояний и связана с тушением возбужденных триплетных состояний хлоро-
филла и синглетного кислорода ('О2). Механизм фотоповреждения фотосинте-
тического аппарата в случае оксигенного фотосинтеза обусловлен фотоде-
структивным действием активных форм кислорода, главным образом синглет-
ного кислорода 'О2, образующегося при взаимодействии основной формы
кислорода в атмосфере 3О2 с триплетно-возбужденным пигментом-сенсиби-
лизатором (хлорофилл, бактериохлорофилл и др.) (рис. 3.21).
Рис. 3.21. Механизм защитного действия каротиноидов:
У — пигмент-сенсибилизатор ('5 и — соответственно синглетное и триплетное состояния);
R- — радикальные соединения. Объяснение в тексте
Образующийся синглетный кислород является сильным окислителем и
вызывает фотоокисление окружающих структур. Особенно активно эти про-
цессы протекают в реакционных центрах, где образование триплетного хлоро-
филла (3Хл) происходит в результате возможного возврата богатого энергией
электрона от первичного акцептора к пигментам реакционного центра Пб80
или П700. Каротиноиды, содержащие 9 и более двойных связей, могут эффек-
тивно тушить триплетное состояние хлорофилла и образовавшийся синглет-
ный кислород. Механизм защитного действия 0-каротина в реакционном цент-
ре включает перенос энергии от 3Хл или 'О2 к 0-каротину и диссипацию энер-
гии образующегося триплетного каротина через процесс нерадиационной ре-
лаксации в тепло с переходом 0-каротина в состояние З^. Каротиноиды спо-
собны также путем переноса электрона модифицировать структуру радикаль-
ных соединений и тушить свободные радикалы, возникающие при освещении.
3.3.4.4. Фото протекторная функция каротиноидов
Фотопротекторная функция каротиноидов состоит в защите фотосинтети-
ческого аппарата от излишка энергии возбуждения при высокой интенсивно-
сти света. Эта функция связана с каротиноидами, образующими так называе-
мый «ксантофилловый цикл».
143
Строма
(pH 7,5)
Внутритилакоидное ст~
пространство (pH 5,0) у
(Аскорбат) 4 [Н]
Мембрана
виол I виол
2Н2О
Деэпоксидаза
Эпоксидаза
2Н2О
зеа
4[Н] + 2О2
(НАДФН)
Рис. 3.22. Виолаксантиновый цикл. Объяснение в тексте
У высших растений и зеленых водорослей ксантофилловый цикл включает
энзиматическое превращение виолаксантина в зеаксантин через интермедиат
антераксантин (рис. 3.22). Процесс катализируется ферментом деэпоксидазой,
требует участия аскорбата и кислой среды (оптимум действия фермента при
pH 5,0). Такие условия pH создаются в люмене при освещении хлоропластов.
В темноте протекает обратная реакция превращения зеаксантина в виолаксан-
тин, которая катализируется эпоксидазой. Реакция эпоксидации осуществля-
ется на внешней стороне мембраны при участии НАДФН и требует присут-
ствия кислорода. Один из атомов молекулы кислорода включается в зеаксан-
тин, другой атом в присутствии НАДФН образует Н2О. Повторная реакция со
второй молекулой О2 приводит к образованию виолаксантина. Главная функ-
ция в защите фотосинтетического аппарата от повреждений высокой интен-
сивностью света принадлежит зеаксантину.
Известно несколько возможных путей протекторного действия зеаксантина.
Один из них — синглет — синглетный перенос энергии от возбужденного хло-
рофилла (УД к молекуле зеаксантина (Дж.Франк и др., 1994, 2000). Увеличе-
ние числа двойных сопряженных связей при образовании зеаксантина (11 двой-
ных связей) из виолаксантина (9 двойных связей) приводит к изменению уров-
ней энергии первых синглетных возбужденных состояний пигментов: у вио-
лаксантина — 15 200 см-1 (энергия выражена в волновых числах), у зеаксанти-
на — 14 200 см-1 и у хлорофилла — 14 700 см-1, (рис. 3.23). Тот факт, что энергия
^-состояний виолаксантина лежит выше энергии хлорофилла а, в то время
как энергия зеаксантина лежит ниже энергии ^-состояния хлорофилла а, по-
зволяет предположить прямое энергетическое взаимодействие виолаксантина
и зеаксантина с хлорофиллом, в результате чего ксантофилловый цикл выс-
ших растений и водорослей может играть важную роль в регуляции распреде-
144
—► /
—^2
у Виолаксантин
15 200 см-1""'--.^
(657 нм) 5] ^*»- ХлороФ1™1 а
14700 см-1
(680 нм) 5'1—Эк.
у Зсаксантин
14200 см-1
(704 нм)
Рис. 3.23. Энергия ^(-состояний (см-1) виолаксантина, хлорофилла а и зеаксантина
высших растений (по Frank et al., 1996):
1 — разрешенные абсорбционные переходы; 2 — внутренняя конверсия энергии. Qy — переход
•5b ->
ления энергии между виолаксантином, зеаксантином и хлорофиллом а. Ксан-
тофилловый цикл может быть активным регулятором светового потока в пиг-
мент-белковых комплексах. При низком освещении каротиноиды действуют
преимущественно как светособирающие пигменты, перенося энергию к хло-
рофиллу. При высокой интенсивности света происходит деэпоксидация вио-
лаксантина и система переносит энергию от ^-состояния хлорофилла к зеак-
сантину с более низко лежащим уровнем 5,. Таким образом, образование зеак-
сантина снижает избыточное поглощение световой энергии антенным хлоро-
филлом и защищает систему от фотоингибирования.
Увеличение числа двойных связей от 9 до 11 не только изменяет энергию
возбужденного состояния ксантофиллов, но и влияет также на конформацию
молекулы (кольцо-цепь): от перпендикулярной структуры у виолаксантина до
планарной конформации у зеаксантина. Эти конформационные изменения могут
контролировать способность каротиноидов образовывать агрегаты. Показано,
что молекулы зеаксантина образуют агрегаты легче, чем виолаксантин. По-
скольку виолаксантиновый цикл находится в минорных субъединицах ССК
ФСП, которые служат каналами для стока энергии от внешнего ССКП к реак-
ционному центру, то высокая концентрация в них зеаксантина и способность
его к агрегации могут нарушить макроструктуру пигмент-белковых ССК и бло-
кировать поток энергии электронного возбуждения к реакционному центру
ФСП. Отмечено, что с одновременным превращением виолаксантина в зеак-
сантин заметно увеличивается эмиссия тепла, что, возможно, является ре-
зультатом изменения конформационного состояния или агрегации хлорофилл-
связываюшего комплекса и ускорения перехода возбужденного хлорофилла в
основное состояние. Это позволяет предполагать, что важнейшей фотопротек-
торной функцией зеаксантина является увеличение термальной диссипации
энергии в условиях светового стресса. Связанный с зеаксантином процесс тер-
145
мальной диссипации энергии является уникальным и очень важным фотопро-
текторным действием, так как в ССК зеаксантин осуществляет превращение
избытка поглощенной энергии в тепло еще до переноса энергии возбуждения
в реакционный центр. Это защищает фотохимическую систему хлоропластов
от необратимого повреждения, связанного с притоком огромного количества
энергии в реакционный центр, которая не может быть использована в фотохи-
мических реакциях.
В последние годы установлено, что каротиноиды хлоропластов могут вы-
полнять важную структурную роль. При действии света высокой интенсивно-
сти ксантофиллы распределяются между ССК и липидной фазой мембран. Мо-
лекула зеаксантина ориентируется в липидном слое перпендикулярно к поверх-
ности мембраны. Присутствие двух полярных гидроксильных групп на кольцах
молекулы позволяет зеаксантину закрепляться на обеих сторонах мембраны,
соединяя два липидных слоя. Благодаря этому при взаимодействии зеаксанти-
на с липидами снижается свойство высокой текучести, характерное для тила-
коидных мембран, и увеличивается вязкость мембран, что уменьшает их чув-
ствительность к переокислению активными формами кислорода. Повышение
вязкости мембраны и уменьшение ее проницаемости по отношению к мо-
лекулярному кислороду при участии ксантофиллов и некоторых терпеноидов
(а-токоферол) стабилизирует и защищает липидную фазу тилакоидных мемб-
ран от фотодеструкции.
Следует отметить еще одну возможность проявления защитной функции
каротиноидов. Дж. Барбер и др. (1993) обнаружили, что в условиях, когда реак-
ции окисления воды блокированы, p-каротин может выступать в роли редокс-
активного защитного агента. В реакционном центре ФСП p-каротин может
подвергаться светоиндуцированным редокс-реакциям с образованием катион-
радикала (Кр+) с поглощением при 950 нм. В данном случае p-каротин в реакци-
онном центре ФС2 II действует как альтернативный электронный донор к П68о:
Кр + П68о —* Кр + Пб8о.
Эта функция p-каротина связана с защитой реакционного центра от фото-
повреждений, которые могут быть при фотонакоплении П^о, имеющего вы-
сокий окислительный потенциал (выше 1,1 В), в результате чего возможна
деградация пигментов и белка D1. В этих условиях p-каротин восстанавливает
Пб80 и защищает реакционный центр от повреждения. Восстановление Кр+ воз-
можно через цитохром й559.
3.3.4.5. Биосинтез каротиноидов
Биосинтез каротиноидов в хлоропластах связан с общим путем образования
полиизопреноидных соединений (стеролы, боковые цепи пластохинона, уби-
хинона, хлорофилла и др.) (рис. 3.24).
В хлоропластах высших растений обнаружен особый путь — через 1 -дезок-
сиксилулозо-5-фосфат. Этот биосинтетический путь начинается с взаимодей-
ствия глицеральдегид-3-фосфата и пирувата с образованием 1-дезокси-D-кси-
лулозо-5-фосфата. Затем следует серия реакций, которая завершается образо-
ванием изопентенилпирофосфата, главного продукта этого пути:
146
Н-ССН(ОН)СН2О(Р) + СНзСОСООН —
О Пируват
Глицералвдегид-З-фосфат
—* СН3СОСН2(ОН)СН2(ОН)СН2О® ► ► СН3-ССН2СН2О(рХр)
1 -Дезокси-D-ксилулозо-З-фосфат СН2
Изопентенилпирофосфат
Изопентенилпирофосфат и его изомер диметилаллилпирофосфат представ-
ляют собой структурную единицу изопреноидов. Конденсация этих 5-углерод-
ных единиц служит основой для образования соединений с различной длиной
цепи: фарнезилпирофосфат (С-15), геранилгеранилпирофосфат (С-20) и др.
(рис. 3.24). В результате конденсации двух молекул геранилгеранилпирофос-
фата образуется фитоен — первый интермедиат в биосинтезе С40-каротино-
идов. Молекула фитоена имеет только 3 сопряженных двойных связи. Превра-
щение фитоена в каротин осуществляется путем удаления атомов Н в реак-
циях десатурации при участии фермента фитоендесатуразы. В результате 4 по-
следовательных реакций дегидрирования фитоен превращается в ликопин. При
замыкании двух иононовых колец в структуре ликопина образуется молекула
каротина.
Изопентенил —© —© (С5)
С5
Геранил —© —© (СЮ)
С5
Фарнезил —© -© (С15)
Витамин Kj
С5
Токоферолы
Хлорофилл
Геранилгеранил —©-© (С20)
Фитол (С20)
(боковая цепь)
Рис. 3.24. Схема биосинтеза каротиноидов и других полиизопреноидных соединений
147
Ксантофиллы образуются путем энзиматического окисления а- и 0-кароти-
на с образованием эпокси-, гидрокси- и кетогрупп. Только лютеин является
производным а-каротина, все остальные ксантофиллы — производные 0-ка-
ротина. Зеаксантин образуется путем гидроксилирования 0-каротина. Другие
компоненты ксантофиллового цикла синтезируются позже через эпоксидацию
зеаксантина.
Механизм регуляции биосинтеза каротиноидов включает действие фотоак-
тивной системы с участием криптохрома. Небольшие количества каротинои-
дов образуются в темноте, но свет заметно активирует синтез каротиноидов и
других соединений, имеющих боковую полиизопреноидную цепь, путем све-
тоиндуцированной экспрессии каротиноидных генов.
3.4. ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ПИГМЕНТОВ
В ХЛОРОПЛАСТАХ
3.4.1. ОБРАЗОВАНИЕ ПИГМЕНТ-БЕЛ КОВЫХ КОМПЛЕКСОВ
Структурные изменения молекул хлорофилла в процессе эволюции и, прежде
всего, включение гидрофобных радикалов (—СН3, фитол) и обусловленное
этим изменение свойств полярности обеспечило возможность включения пиг-
ментов в мембранные белки хлоропластов с образованием разного типа пиг-
мент-бел ковых комплексов.
Впервые идею о том, что большая часть хлорофилла в живом листе связана
с белком, высказал В.Н.Любименко в 1921 г. на основании значительного
длинноволнового сдвига красного максимума поглощения в живом листе по
сравнению с раствором (660->680 нм). Систематическое изучение пигмент-
белковых комплексов началось в 1970 году, когда в лаборатории Дж.Торнбера
(1974) методом препаративного электрофореза было выделено из живых лис-
тьев три окрашенных комплекса, различающихся по составу пигментов, бел-
ков и спектрам поглощения. Позже Дж. Андерсон (1980) выделил 6 различных
комплексов и показал, что пигменты образуют с белками довольно стабиль-
ные комплексы, где пигменты связаны с определенными полипептидами и
имеют различные химические и спектральные характеристики. Эти работы
позволили заключить, что в листе все светособирающие хлорофиллы некова-
лентно связаны с белками.
Механизм образования пигмент-белковых комплексов включает электро-
статическое взаимодействие аминокислотных групп белка с С=О-группой мо-
лекулы хлорофилла, координационные взаимодействия с центральным ато-
мом магния и гидрофобные взаимодействия с фитолом. В результате в тилако-
идных мембранах хлоропластов формируются пигмент-белковые комплексы,
включающие фоторецепторные системы, что имеет решающее значение для
осуществления основных (перечисленных ниже) функций пигментов в фото-
синтезе.
• Организация пигментов фотосинтетического аппарата в виде светособи-
рающих (антенных) комплексов, функционально сопряженных с реакцион-
ным центром, обеспечивает коллективное и эффективное поглощение энер-
148
гии фотонов и передачу ее в реакционные центры, где энергия электронного
возбуждения используется для фотохимических реакций.
• Связь пигментов с белком определяет межмолекулярное расстояние меж-
ду ними (1,15 нм) и взаимную ориентацию молекул пигментов в светособира-
ющих (антенных) комплексах, что необходимо для эффективной миграции
энергии в реакционные центры.
• Стабильные условия микроокружения пигментов в белковой глобуле обес-
печивают создание устойчивых спектральных форм в ССК, в результате чего
формируется широкий, сильно перекрывающийся спектр поглощения, необ-
ходимый для эффективного экситонного взаимодействия пигментов и направ-
ленной миграции энергии.
• Образование связи пигментов с белками создает возможность участия бел-
ков в транспорте электронов в первичных процессах фотосинтеза, например,
образование «электронной тропы» между QA и QB в электронтранспортной цепи
хлоропластов, перенос энергии от тирозина (Tyrz) к П68о.
• Образование пигмент-белковых комплексов создает возможность регуля-
ции фотопоглощающей активности пигментов путем изменений конформации
белков (в зависимости от pH, ионной силы, фосфорилирования белка) и изме-
нения ориентации пигментов по отношению к направлению светового луча.
Значение ориентации пигментов в пигмент-белковом комплексе активно изу-
чается в последние годы. Установлено, что внутри антенного комплекса моле-
кулы пигментов жестко организованы и определенным образом ориентирова-
ны относительно плоскости мембраны и относительно друг друга, что имеет
большое значение для процессов поглощения и миграции энергии. Эффектив-
ность поглощения электромагнитной энергии будет максимальной, если век-
тор электрического поля световой волны будет параллелен переходному диполь-
ному моменту в молекуле пигмента (вектор, определяющий направление ди-
поля, образующегося при возбуждении и переходе электрона с основной на
возбужденную л-орбиту). Исследования ори-
ентации пигментов в антенном комплексе и
реакционном центре показали, что диполь-
ные моменты Qy-переходов (З^-»^) моле-
кул хлорофилла а лежат близко к плоскости
мембраны, образуя с ней небольшие углы
(25 — 35°). Дипольные моменты (^-переходов
у хлорофиллов реакционных центров — ди-
меров П68о, П700 и П87о — ориентируются
примерно параллельно плоскости мембраны
и электрическому вектору световой волны
(рис. 3.25). Параллельная ориентация диполь-
ных моментов (^.-переходов в молекуле пиг-
ментов антенного комплекса и реакционно-
го центра важна и для процесса миграции
энергии между ними. Поэтому образование
комплекса пигментов с белком и их упоря-
доченная организация в мембране имеют
большое значение для первичных процессов
фотосинтеза.
ССК
Рис. 3.25. Ориентация дипольных
моментов Q^-переходов молекул
хлорофилла относительно плоско-
сти мембраны:
Qy — переход Qx — переход
50-> S2; ССК — светособирающий ком-
плекс
149
3.4.2. ОСНОВНЫЕ ТИПЫ ПИГМЕНТ-БЕЛКОВЫХ КОМПЛЕКСОВ
В настоящее время выделено 4 главных типа светособирающих (антенных)
комплексов. Два из них, локализованные в реакционных центрах ФС1 и ФСП,
связывают только молекулы хлорофилла а и 0-каротин; два других — белки
внешних светособирающих комплексов — связывают хлорофиллы а и b и ка-
ротиноиды.
Фотосистема I включает центральный комплекс I (ядро комплекса), содержа-
щий димер хлорофилла а (П700), 2 молекулы 0-каротина и около 100 молекул
хлорофилла а, расположенных вокруг электрон-транспортной цепи реакцион-
ного центра (внутренняя антенна). Внешний светособирающий комплекс CCKI
(LHC I) содержит 80—120 молекул хлорофиллов а и Ь, каротиноиды и состо-
ит из 4 субъединиц: Lhca 1, Lhca 2, Lhca 3 и Lhca 4 — с молекулярными массами
17-24 кДа.
Фотосистема II включает центральный комплекс II (ядро комплекса), содер-
жащий димер хлорофилла а П680 и хлорофилл о-содсржащис белки — СР43 и
СР47 (внутренние антенны). ФСП имеет также большой внешний антенный
комплекс ССКП (LHC II), содержащий хлорофиллы а и b и каротиноиды, а
также ряд «минорных» ССК: СР24, СР26 и СР29 — расположенных между
ССКП и реакционным центром и выполняющих важную роль в регуляции
переноса энергии в реакционный центр (см. рис. 3.34).
Структурная организация всех антенных комплексов в целом подчинена ос-
новному требованию поглощения квантов света — возможности эффективной
миграции энергии возбуждения среди молекул ССК и направленному перено-
су всей энергии в реакционные центры. В связи с этим различные спектраль-
ные формы пигментов должны быть расположены определенным образом в
антенных комплексах, однако точная архитектура антенн еще мало изучена.
3.4.3. ЭНЕРГЕТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ПИГМЕНТОВ
В АНТЕННЫХ КОМПЛЕКСАХ И РЕАКЦИОННЫХ ЦЕНТРАХ
Идея коллективного функционирования пигментов, отраженная в пред-
ставлении о фотосинтетической единице (ФСБ), предполагает необходимость
их энергетического взаимодействия. В основе процессов энергетического взаи-
модействия пигментов в антенном комплексе, взаимодействия пигментов ан-
тенного комплекса и реакционного центра и взаимодействия молекул хлоро-
филла а в димере реакционного центра лежит механизм «экситонного взаимо-
действия», поскольку обмен энергией между молекулами пигментов идет по
индуктивно-резонансному механизму Фёрстера, в основе которого лежит эк-
ситонный перенос энергии (см. подразд. 3.1).
Энергия экситонного взаимодействия (J) может быть различной и определя-
ет эффективность межмолекулярного переноса энергии. Экситонное сопряже-
ние пигментов зависит от их ориентации и расстояния. На эффективность пе-
реноса энергии в ССК влияет ряд факторов: положение энергетических уров-
ней, время жизни и геометрические параметры.
В антенном (светособирающем) комплексе пигменты достаточно жестко
организованы и ориентированы относительно друг друга. Кроме того, благода-
150
ря взаимодействию пигментов с различными аминокислотами белка в антен-
ном комплексе присутствует большой набор различных спектральных форм,
поэтому пигменты имеют широкий и сильно перекрывающийся спектр погло-
щения. В результате быстро устанавливается равновесие энергии, поглощенной
пигментами антенного комплекса, между молекулами пигментов внутри ан-
тенны (в течение долей пикосекунд) и между антенной и реакционным цент-
ром. При участии серии пигментов с различными спектральными характери-
стиками энергия электронного возбуждения направленно мигрирует к наибо-
лее длинноволновым пигментам реакционного центра, где происходит захват
энергии возбуждения и преобразование ее в форму химической энергии. Эф-
фективное экситоннос сопряжение между пигментами обеспечивает очень вы-
сокую скорость переноса энергии. Так, для переноса возбуждения между моле-
кулами хлорофилла в антенне требуется в среднем 0,3 —5,0 пс, от антенны к
реакционному центру — 50—100 пс, тогда как время разделения заряда (время
между поглощением фотона и разделением заряда в реакционном центре) —
около 300 пс. Следовательно, время переноса энергии в реакционный центр
(П680) значительно меньше времени разделения заряда.
Понимание механизма переноса энергии возбуждения в антенных комп-
лексах требует знания структуры комплекса, расстояния между пигментами,
действительной ориентации молекул пигментов в антенне. Методом электрон-
ной кристаллографии показано, что в мономерах ССКП пигмент-пигментное
расстояние равно 0,9 —1,4 нм. Следовательно, экситонное сопряжение между
молекулами хлорофилла может достигать значительной силы. Однако исследова-
ния показали, что энергия экситонного взаимодействия между молекулами хло-
рофилла в ССК не превышает 100 см-1. Это может быть обусловлено не очень
строгой ориентацией молекул: дипольные моменты их (^-переходов не строго
параллельны, что подтверждает эффект деполяризации флуоресценции в ССК.
В реакционных центрах энергия экситонного взаимодействия между молеку-
лами хлорофилла в димере значительно выше. В димере реакционного центра
II (Пбво) J = 142 — 300 см-1, в димере ФС1 (П700) J = 400 см-1, а у пурпурных
бактерий (П870) / = 600— 1500 см-1. Различия энергий экситонного взаимодей-
ствия в разных реакционных центрах обусловлены неодинаковой конфигура-
цией молекул хлорофилла в димерах реакционных центров ФС1, ФСП и у бак-
терий. У пурпурных бактерий плоскости макроциклов двух молекул бактерио-
хлорофилла в димере строго параллельны и находятся на расстоянии 0,36 нм.
В димере реакционного центра ФС1 плоскости тстрапиррольных колец несколько
раздвинуты. Геометрия специальной пары ФСП (П680) существенно отличает-
ся — плоскости макроциклов в реакционном центре расположены дальше и
сдвинуты относительно друг друга, что в результате снижает энергию экси-
тонного взаимодействия двух молекул хлорофилла до 300 см-1 (рис. 3.26).
Энергетическое взаимодействие антенных комплексов ФС1 и ФСП включает
иной механизм, связанный с изменением «переходных состояний». ФС1 и ФСП
пространственно разделены в мембране хлоропластов, что определяется раз-
ной плотностью их поверхностного заряда. Согласно представлениям Дж. Ан-
дерсона (1980) ФСП локализована главным образом в районе спаренных мемб-
ран гран, в то время как ФС1 расположена в стромальных тилакоидах, в крае-
вых частях гран и поверхностных мембранах гран. Это предполагает необходи-
мость электронного и энергетического взаимодействия двух фотосистем. Пред-
151
Люмен
Рис. 3.26. Структурная модель димера П680 (по Satoh, 1988 с изменениями):
Г1 j и П2 — молекулы хлорофилла а в димере; D, Е — а-спирали белков D1 и D2
ложено несколько моделей взаимодействия — теория пакетов, теория перели-
вов (спилловер) и др.
П. Хортон (1983) и Дж. Беннет (1983) предложили принципиально новый
механизм регуляции распределения световой энергии между двумя фотосисте-
мами, основанный на обратимом фосфорилировании мембранных белков и образо-
вании «переходных состояний» 1 и 2. При возбуждении ФСП светом высокой ин-
тенсивности отдельные субъединицы ССКП (Lhcbl, Lhcb2 и Lhcb3), образу-
ющие так называемую мобильную антенну, при фосфорилировании их фермен-
том протеинкиназой получают дополнительный отрицательный заряд и в силу
электростатического отталкивания и, возможно, конформационных измене-
ний белков и механизма «молекулярного узнавания» (F. Allen, 1999) отделя-
ются от ФСП и мигрируют из района соприкасающихся мембран в зону мемб-
ран, экспонированных в строму и обогащенных ФС1 (рис. 3.27). Это увеличивает
сечение поглощения антенны ФС1 и приток энергии в реакционный центр I,
и система переходит из состояния 1 в состояние 2. Активность протеинкина-
зы и фосфорилирование белков мобильного домена ССКП регулируется слож-
ной системой, включающей редокс-контроль через пластохиноны и цитохром
/^/-комплекс, а также определенное тиоловое редокс-состояние хлоропластов.
Для перехода в состояние 2 существенное значение имеет определенная связь
мобильной антенны с ФС1, которая осуществляется при участии Н-субъеди-
ницы ФС1. При окислении пластохинона происходит обратная реакция дефос-
форилирования мобильной антенны ферментом протеинфосфатазой, возвра-
щение ее в район спаренных мембран гран и увеличение миграции энергии к
ФСП, что сопровождается переходом системы из состояния 2 в состояние 1.
Таким образом, перераспределение энергии возбуждения между двумя фо-
тосистемами в состояниях 1 и 2 достигается путем изменения процессов свя-
зывания части ССКП с каждой из двух фотосистем, что зависит от редокс-
152
Рис. 3.27. Механизм энергетического взаимодействия ФС1 и ФСП:
ССКП — светособирающий комплекс II (мобильная антенна); PQ — пластохинон окисленный;
PQH2 — пластохинон восстановленный (пластохинол); bf — цитохром />6/-комплекс, окислен-
ный и восстановленный. Объяснение в тексте
состояния переносчиков ЭТЦ, определяющих активность протеинкиназы, и
структурных изменений белков тилакоидной мембраны.
В результате определенной структурной организации пигментов в тилако-
идной мембране и их экситонного взаимодействия энергия возбуждения бы-
стро распределяется в массе пигментов светособирающего комплекса и проис-
ходит направленная миграция ее к пигменту реакционного центра с наиболее
длинноволновым максимумом поглощения. Миграция энергии возбуждения в
массе пигментов внешних и внутренних антенных комплексов ФС1 и ФСП
завершается процессом «захвата» энергии реакционными центрами, где осу-
ществляется фотохимическая реакция разделения зарядов и энергия электрон-
ного возбуждения преобразуется в химическую форму энергии.
3.5. ПЕРВИЧНЫЕ ПРОЦЕССЫ ФОТОСИНТЕЗА.
РЕАКЦИОННЫЕ ЦЕНТРЫ
Понятие «первичные процессы фотосинтеза» включает реакции первой (фо-
тофизической) и второй (фотохимической) стадий фотосинтеза — процессы
поглощения, миграции и преобразования энергии в реакционных центрах. Ра-
боты последних лет показали очень высокую эффективность первичных про-
цессов фотосинтеза благодаря специфике их структурной организации.
3.5.1. СТРУКТУРНАЯ И ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
РЕАКЦИОННЫХ ЦЕНТРОВ
Функциональная структура, обеспечивающаяся протекание первичных про-
цессов, известна как фотосинтетическая единица (ФСЕ). Она отражает взаи-
153
модействие двух пигмент-белковых комплексов — светособирающего (антен-
ного) комплекса и реакционного центра. Понятие ФСЕ было предложено в
1936 г. X. Гаффроном и К. Волем. В последующие годы идея ФСЕ была развита
в работах Л.Дюйзенса (1952) — «уницентральная модель» и в работах Р. Клей-
тона (1965) — «мультицентральная модель».
Представление о ФСЕ — одно из фундаментальных положений современ-
ного фотосинтеза. В его основе лежат две идеи: 1) о групповом функциониро-
вании пигментов (была сформулирована по итогам работ Р. Эмерсона и В. Ар-
нольда 1943 г., установивших, что в выделении одной молекулы О2 участвует
комплекс, содержащий 2400 молекул хлорофилла) и 2) о функциональной
гетерогенности пигментов. В опытах В.Н.Любименко (1930) с определением
ассимиляционного числа (СО2/Хл) показано, что не все молекулы хлорофил-
ла фотохимически активны: 99 % всех пигментов находятся в антенных комп-
лексах и выполняют функцию сборщиков энергии, и только около 1 % пиг-
ментов, локализованных в реакционных центрах, непосредственно участвуют
в процессах преобразования энергии. В результате формируется высокоэффек-
тивная система поглощения и преобразования световой энергии в первичных
процессах фотосинтеза. Вторым фактором, определяющим высокую кванто-
вую эффективность первичных процессов фотосинтеза, является структурно-
функциональная организация непосредственно самого реакционного центра.
Первые схемы строения реакционных центров были предложены в 1969 г.
Р. Клейтоном (для бактерий) и Л. Верноном (для высших растений). Активное
изучение структурной организации реакционных центров охватывает период
1972— 1977 гг. В результате было выделено четыре основных типа реакционных
центров, включающих пигменты — П870 (у пурпурных бактерий), П840 (у зеленых
бактерий), П700 (у высших растений), относящийся к ФС1, и П680 (у высших
растений) — к ФСП. Дальнейшие исследования показали сходство структур-
ной организации и механизма работы всех четырех типов реакционных цент-
ров, что позволяет говорить о высококонсервативной (в плане эволюции) орга-
низации структур фотосинтетического аппарата, осуществляющих процесс пре-
образования электромагнитной энергии в химическую. Благодаря строгой упо-
рядоченности организации фотохимических реакционных центров в них струк-
турно и функционально сопряжены быстрые первичные фотофизические про-
цессы, протекающие со скоростью 10-12—10~9 с, и более медленные энзимати-
ческие процессы, имеющие скорость 10“5—10“2 с.
Структурная модель бактериального реакционного центра. Этот центр вклю-
чает цитохром с2, 2 молекулы бактериохлорофилла, образующие димер с мак-
симумом поглощения 870 нм («специальная пара»), 2 молекулы бактериохло-
рофилла с максимумом поглощения в области 800 нм, 2 молекулы бактерио-
феофитина, 2 молекулы хинона в комплексе с Fe + и 2 молекулы р-каротина.
Пространственная организация реакционного центра пурпурных бактерий пред-
ставлена на рис. 3.28.
Компоненты бактериального реакционного центра организованы на трех
субъединицах — L (light, 21 кДа), М (medial, 24 кДа), Н (heavy, 28 кДа). Ком-
плекс L-M — минимальная единица, способная к фотохимическим реакциям.
Комплекс очень гидрофобен и содержит мало полярных аминокислот. Субъ-
единица Н более полярна и выполняет функции белкового экрана, препят-
ствуя переносу электрона к внешнему акцептору.
154
В субъединицах L и М бактериаль-
ного реакционного центра формиру-
ются две ветви переноса электронов —
L и М. На оси симметрии находится
П87о — димер («специальная пара»),
который координируется с белками
субъединиц L и М двумя молекулами
гистидина. Рядом с димером П870 вдоль
каждой ветви локализованы молекулы
бактериохлорофилла 800 (BL и Вм).
Каждая ветвь включает бактериофео-
фитин (Феоь и Феом) и хинон — Q“Q
(менахион) и QmQ (убихинон). Хотя
отдельные компоненты реакционного
центра образуют две ветви (L и М),
фотохимически активна только L-ветвь.
При возбуждении П870 электрон быст-
ро (в течение 200 пс) переносится на
первичный хинон (QA) вдоль L-ветви,
Наружная
Рис. 3.28. Пространственная организация
реакционного центра пурпурных бактерий:
L, М, Н — субъединицы; MQ — менахинон;
UQ — убихинон. Объяснение в тексте
а затем на вторичный хинон (QB) М-ветви. В настоящее время считают, что
причиной активности только L-ветви является структурная асимметрия реак-
ционного центра. Так, хинон L-ветви (Qa) представлен менахиноном (нафто-
хинон), в то время, как М-ветвь включает вторичный хинон QB — убихинон
(бензохинон). Кроме того, различен аминокислотный состав субъединиц L и
М, и в силу разного микроокружения мономеры бактериохлорофилла в диме-
ре П870 не эквивалентны. В одной молекуле бактериохлорофилла при участии
карбонильной группы (С=О) в V кольце и ацетильной группы (СН3—СО—-)
в I кольце образуются дополнительные водородные связи с ионизированными
группами белка. Это увеличивает ее редокс-потенциал на 50—120 мВ (а следо-
вательно, электрон-движущую силу) и обеспечивает движение электрона к
бактериофеофитину по L-ветви (W. Williams, 1992).
На основании изучения кинетики переноса электронов высказано предпо-
ложение об участии мономерного бактериохлорофилла П800 в перемещении
электрона между П870 и БФеоь.
Реакционный центр фотосистемы II. Этот центр высших растений наиболее
близок к реакционному центру пурпурных бактерий по структуре, составу
пигментов и коферментов.
Реакционный центр ФСП был выделен в 1971 г. в работах Л. Вернона. В изу-
чение его структурной организации особый вклад внесли исследования X. Т. Вит-
та (1969), в которых методом дифференциальной спектрофотометрии был вы-
делен пигмент Пб80, и лаборатории А.А.Красновского (В. В. Климов, В. А. Шу-
валов, А.А. Красновский, 1977), в которых методом импульсной спектроско-
пии был найден первичный акцептор реакционного центра II — феофитин.
Современная модель реакционного центра ФСП и последовательность со-
ставляющих его редокс-компонентов представлены на рис. 3.29 и 3.34. Реакци-
онный центр ФСП включает 6 молекул хлорофилла а: две молекулы образуют
димер с максимумом поглощения 680 нм (П680), две дополнительные молеку-
лы хлорофилла располагаются между ПС80 и феофитином (на рисунке не пока-
155
Рис. 3.29. Кофакторы переноса электронов реакционного центра ФСП:
(Мп)4 — Mn-содержащий кластер; Tyrz — тирозин-161 белка D1 — первичный донор электронов
для П680; цит. Z>559 — цитохром Z>559; Xnz — дополнительный хлорофилл a; QA, QB — пластохиноны
заны); две молекулы мономерного хлорофилла с максимумами поглощения
672 и 678 нм (Хл2 и Хло — сопровождающие пигменты) связаны с внутрен-
ней антенной ФСП — СР43 и СР47, через которую энергия возбуждения по-
ступает в реакционный центр. В состав первичных акцепторов входят две моле-
кулы феофитина, из которых только одна непосредственно участвует в фото-
химических реакциях. Реакционный центр ФСП включает два хинона: QA в
комплексе с железом (QA Fe2+) и QB, а также две молекулы p-каротина и
цитохром Z>559. Донором электронов для восстановления окисленного П680 слу-
жит тирозин Z (Tyrz), сопряженный с (Мп)4-комплексом фотоокисления воды.
Реакционный центр организован на двух мембранных белках — D1 и D2. По
аминокислотной последовательности они подобны L- и М-субъединицам ре-
акционного центра пурпурных бактерий. Детальное описание структуры ФСП
приведено в подразд. 3.6.2.1.
Главная функция реакционного центра ФСП — создание мощного окисли-
тельного потенциала. При возбуждении и фотоокислении П680 возникает П680
с редокс-потенциалом +1,12 В, способный индуцировать уникальный процесс
фотоокисления воды и мобилизацию электронов из молекул воды, связанных
с марганецсодержащим комплексом. Освобожденные электроны поступают в
ЭТЦ и таким образом за счет энергии, поглощенной ФСП, и работы реакци-
онного центра создается мощный восходящий поток электронов от воды к
156
последующим компонентам ЭТЦ и в итоге — к НАДФ+ с образованием НАДФН
(-0,32 В).
Структурная модель реакционного центра фотосистемы I. Реакционный центр
ФС1 по сравнению с реакционными центрами других типов построен наиболее
сложно. Это обусловлено тем, что весь комплекс ФС1 работает в области высо-
ких энергий. При возбуждении пигмента реакционного центра П700 и дальней-
шего разделения зарядов возникают соединения с высоким восстановительным
и энергетическим потенциалом. Для сохраненя и использования этого потенциала
в дальнейших процессах преобразования энергии в реакционном центре ФС1
формируется очень сложный акцепторный комплекс, включающий 5 редокс-
компонентов. Благодаря им перенос электронов с высоким энергетическим по-
тенциалом от возбужденного П700 к стабильному акцептору в цепи переносчи-
ков осуществляется с запасанием достаточно высокого количества энергии.
Состав редокс-кофакторов акцепторной системы реакционного центра ФС1
включает следующие компоненты:
+0,52 В Av -1,2 В -1,1 В -0,9 В -0,7 В
П700 —- П7*00 Ао А1(вит.ко 20_200 н; Fx 30_200 мк;
-0,6 В -0,55 В
— Fa — FB
П700 — первичный электронный донор; в основном состоянии имеет редокс-
потенциал +0,5 В, при возбуждении потенциал резко изменяется (-1,2 В); по
химической структуре — димер хлорофилла а; Ао — первичный акцептор, мо-
номер хлорофилла а; редокс-потенциал -1,1 В; Aj — вторичный акцептор;
витамин Кь филлохинон с потенциалом -0,9 В; Fx, FB и FA — терминальные
акцепторы; железосерные белки с редокс-потенциалами соответственно -0,7,
-0,6 и -0,55 В; содержат 4Fe-4S-rpynnbi.
Эти редокс-центры образуют цепь, которая пересекает организованный в
мембране комплекс ФС1 от люменальной стороны к стромальной. Расстояние
между двумя соседними редокс-центрами около 1 нм, что обеспечивает эф-
фективный перенос электронов.
Согласно новым данным, реакционный центр ФС1 подобно реакционному
центру пурпурных бактерий содержит две симметричных ветви переноса элек-
трона между П700 и Fx: ветвь А и ветвь В, соответственно с обозначением
субъединиц А и В, составляющих ядро ФС1, на которых они расположены
(рис. 3.30). В отличие от бактериального реакционного центра, где активна только
L-ветвь, в реакционном центре ФС1 обе ветви участвуют в переносе электрона
от П700 к Fx. Между П700 и Ад в обеих ветвях обнаружены дополнительные моно-
мерные молекулы хлорофилла а (А). На расстоянии 1,6 нм от П700 находятся
еще два хлорофилла, которые могут участвовать в переносе возбуждения от
антенного комплекса к реакционному центру. Присутствие двух ветвей для на-
чального разделения заряда должно удвоить скорость захвата энергии возбужде-
ния и тем самым увеличить эффективность разделения зарядов в ФС1. Редокс-
кофакторы реакционного центра ФС1 организованы на трех субъединицах —
А, В, С. Пространственная организация ФС1 изложена в подразд. 3.6.2.2.
Увеличение редокс-потенциала в цепи акцепторов обеспечивает быстрое
снижение энергии, что предотвращает обратный возврат электрона к пигмен-
157
Рис. 3.30. Организация редокс-
кофакторов реакционного цент-
ра ФС1 (по Brettel, 1997, с из-
менениями).
Пуоо — димер хлорофиллов а и а',
«специальная пара»; А — дополни-
тельный хлорофилл а; Ао — хлоро-
филл а695 — первичный акцептор
электронов; А] — витамин Кь фил-
лохинон; Fx, FA, FB — [4Fe-4S]-
центры. Цифры на стрелках — рас-
стояния между кофакторами
1,8 =.
< П?оо(1,77 эВ)
Стандартная свободная энергия, эВ
1,6
П700 Ао (1,52 эВ) — первичная
4 радикальная пара
1,4
1,2
1,0
0,8
-П700
П700
П700
П7+оо F/ (1,22 эВ)
П700 (FAFB) (1,03 эВ) — вторичная
радикальная пара
Рис. 3.31. Изменение свободной энергии при перено-
се электрона по акцепторному комплексу реакцион-
ного центра ФС1 (по Brettel, 1997, с изменениями)
158
ту и бесполезную трату энергии электронного возбуждения пигмента Щоо. Бла-
годаря этому энергия электронного возбуждения эффективно используется для
разделения зарядов. Система с разделенными зарядами содержит определен-
ное количество свободной энергии. На рис. 3.31 показано изменение свободной
энергии при переносе электрона по акцепторному комплексу. Свободная энер-
гия возбужденного П%() равна 1,77 эВ; свободная энергия первичной радикаль-
ной пары ПуооАо — 1,52 эВ; свободная энергия вторичной радикальной пары
ПтооСРдРв)" — 1,03 эВ, что составляет 60 % от энергии поглощенного фотона
(1,77 эВ). При переносе электрона по акцепторному комплексу энергия по-
следовательных состояний снижается, но при этом время их жизни возрастает
от 1 пс до 200 мкс, в результате чего энергия разделенных зарядов стабили-
зируется и запасается в конечных компонентах акцепторного комплекса.
3.5.2. МЕХАНИЗМ ПРЕОБРАЗОВАНИЯ ЭНЕРГИИ
В РЕАКЦИОННЫХ ЦЕНТРАХ
Анализ структуры реакционных центров бактерий и высших растений пока-
зывает, что общий принцип их организации в значительной степени одинаков.
Первичные процессы фотосинтеза очень консервативны. Процесс преобразо-
вания одной формы энергии в другую диктует жесткие условия к структурной
организации реакционных центров.
Особенности организации реакционных центров. Димерная структура пиг-
мента реакционного центра. Две молекулы хлорофилла а расположены на двух
субъединицах (L и М — у пурпурных бактерий; А и В — в фотосистеме I; D1 и
D2 — в фотосистеме II). Димерная структура пигмента обеспечивает сдвиг мак-
симума поглощения в длинноволновую область, что позволяет пигменту реак-
ционного центра служить эффективной ловушкой энергии возбуждения дру-
гих пигментов, используя их в качестве светосборщиков. При образовании ди-
меров в два раза увеличивается площадь поперечного сечения пигмента, что
обеспечивает эффективный захват фотона. В связи с образованием у димера
более длинноволнового максимума поглощения снижается константа скоро-
сти флуоресценции, которая обратно пропорциональна длине волны излуче-
ния. Поскольку флуоресценция — конкурирующий процесс, димерная струк-
тура ограничивает бесполезную дезактивацию возбужденного состояния и по-
терю энергии в виде флуоресценции.
Первичный акцептор во всех реакционных центрах — тетрапиррол. Это уве-
личивает константу скорости переноса электрона, которая зависит от пере-
крывания орбиталей П и А, т.е. донора и акцептора электронов. Многокомпо-
нентный акцепторный комплекс в реакционных центрах бактерий и растений
позволяет эффективно осуществлять трансмембранное разделение зарядов. Уве-
личение редокс-потенциала в цепи акцепторов обеспечивает снижение энер-
гии и увеличение электрон-движущей силы. Это позволяет быстро удалить элек-
трон от пигмента («сток» электрона) и снизить возможность рекомбинации
зарядов с бесполезной потерей энергии.
Таким образом, особенности структурной организации реакционных цент-
ров создают высокую квантовую эффективность первичных процессов и высо-
кую скорость реакций переноса электронов. За счет близкого расположения П
159
и А и сходства их химической структуры константа скорости переноса элект-
рона в реакционных центрах достигает 5 Ю"10 с.
Фотохимический механизм преобразования энергии. Все реакционные цент-
ры имеют не только общий принцип организации, но и единый фотохимиче-
ский механизм преобразования энергии. В реакционном центре происходит пер-
вичное фотохимическое разделение зарядов между фотовозбужденным пиг-
ментом реакционного центра П*Рц) и первичным акцептором А. Поскольку
П*Рц) взаимодействует с А в реакциях окислительно-восстановительного типа,
структура, осуществляющая преобразование энергии, должна быть способна к
обратимым окислительно-восстановительным реакциям. Как известно, молеку-
ла хлорофилла способна к фотовосстановлению и фотоокислению. Исследова-
ния с применением лазеров и высокоскоростной импульсной спектрофотомет-
рии показали, что в реакционном центре реализуется фотоокислительный путь.
Реакция фотоокисления хлорофилла требует особых условий: присутствия ионов
магния в центре молекулы (Дж. Гудхир, 1966) и слабокислых условий среды
(В. Б. Евстигнеев, 1967). Именно такие условия создаются в нем при освеще-
нии и векторном движении протонов во внутритилакоидное пространство.
В основе преобразования энергии лежит процесс разделения зарядов. Пер-
вичный этап включает две сопряженных окислительно-восстановительных ре-
акции:
Av
1) Хл —*- Хл+ + е (для реакции необходима затрата энергии, равная энер-
гии ионизации хлорофилла);
2) А + ё —* А (освобождается энергия, равная энергии ионизации акцеп-
тора А).
Энергия, запасаемая в процессе разделения зарядов, равна разности энергий
ионизации акцептора и хлорофилла: ДЕ = ЕА - Еы. Следовательно, чем меньше
энергия ионизации хлорофилла, тем больше величина запасаемой энергии
ДЕ. Снижение энергии потенциала ионизации Mg-порфиринов достигается:
1) включением Mg — металла с низким значением электроотрицательности
по Полингу; 2) гидрированием двух полуизолированных связей 3=4 и 7=8 и
переходом от структуры порфина к структуре хлорина или бактериохлорина —
это увеличивает энергию орбиталей движения электронов и снижает энергию
ионизации; 3) формированием димерной структуры. Поскольку две молекулы
хлорофилла в димере не эквивалентны, при возбуждении димера П*РЦ) про-
исходит внутримолекулярный сдвиг электронов (образование диполя), что
облегчает дальнейший перенос электронов на акцептор. Таким образом, в ре-
акционном центре есть ряд механизмов, направленных на снижение энергии
ионизации пигмента П*РЦ) и увеличение количеств запасаемой энергии.
Разделение зарядов в реакционном центре включает три стадии.
Первая стадия — первичное разделение зарядов. Высоко разрешающая техни-
ка в фемтосекундном интервале (10-15 с) позволила выделить два процесса на
начальной стадии преобразования энергии — перенос энергии и перенос элек-
тронов в реакционном центре:
Хл*“ ИОфГ П’»-Фео nio-Фео- П^-Фео-Q;
Специальная Первичная ради- Вторичная ради-
пара кальная пара кальная пара
160
В первые мгновенья (в пределах 100 фс) устанавливается равновесие энер-
гии возбуждения между П680 и молекулой хлорофилла а «внутренней» фокуси-
рующей антенны, т.е. перенос энергии происходит быстрее, чем перенос элек-
трона. До переноса электрона от Щ80 на Фео происходит ряд событий. Так же,
как и у пурпурных бактерий, реакционный центр ФСП асимметричен и две
молекулы хлорофилла в димере не эквивалентны. В одной молекуле хлорофил-
ла а (П]) кето-группа при С9 и кетоэфирная группа при С]0 образуют водород-
ные связи с аминокислотами белка D1, а вторая молекула хлорофилла а (П2)
на белке D2 образует только одну водородную связь за счет кетоэфирной груп-
пы (см. рис. 3.26) Поскольку П! образует большее число водородных связей, ее
редокс-потенциал выше и электрон-движущая сила больше. В связи с этим при
возбуждении димера (П*) электрон переходит с одной молекулы хлорофилла
в димере кП,и образуется диполь. Электрон локализуется на одной молекуле
хлорофилла а в димере. Возникает переходное состояние, которое представля-
ет собой состояние с переносом заряда. Образование диполя и локального элект-
рического поля вблизи П| вызывает переориентацию окружающих молекул
Н2О. Это приводит к изменению конформации специальной пары и снижению
энергии Щ80, что облегчает перенос электрона к Фео. Таким образом, внутри-
молекулярное движение электрона в димере облегчает перенос электрона к
Фео и, следовательно, сдвиг электрона в димере к П! можно рассматривать
как начальную стадию разделения зарядов (Е.Эванс с сотр., 1993).
Вторая стадия — фотоокисление пигмента П*)8(). Разделение зарядов между
возбужденным Пб80 и первичным акцептором электрона Фео осуществляется в
течение нескольких пикосекунд. В результате образуется первичная радикальная
пара (Пда-Фео ). В течение следующих 200 пс происходит перенос электрона от
Фео на Qa с образованием вторичной радикальной пары (П680-Фео-РХ) —
восстановленного QA и окисленного Пб80.
Третья стадия — восстановление пигмента. Окисленный пигмент Пб80 имеет
высокий окислительно-восстановительный потенциал (+1,12 В) и является
очень активным окислителем, который может вызвать окислительную де-
струкцию окружающих структур. Донором электрона для Пб80 в нормальных
физиологических условиях является тирозин Z, для которого источником элек-
трона служит сложная система фотоокисления воды. В ряде случаев при нару-
шении процессов фотоокисления воды в восстановлении П^о могут участво-
вать тирозин D, цитохром 6559, Хл/, р-каротин.
3.5.3. СРАВНИТЕЛЬНЫЙ АНАЛИЗ ЭНЕРГЕТИЧЕСКОЙ ЭФФЕКТИВНОСТИ
РЕАКЦИОННЫХ ЦЕНТРОВ БАКТЕРИЙ И ВЫСШИХ РАСТЕНИЙ
Механизм преобразования энергии в реакционных центрах всех фотосинте-
зирующих организмов в принципе одинаков, однако энергетическая эффек-
тивность их работы существенно различается.
По структурной и биохимической организации реакционные центры ФСП
и реакционные центры пурпурных бактерий очень близки. Аминокислотная
последовательность белков D1 и D2 высших растений подобна последователь-
ности для L и М субъединиц бактериального реакционного центра. Оба типа
реакционных центров имеют сходный пигментный состав: 4 молекулы хлоро-
6 Физиология растений
161
филла а (бактериохлорофилла а) и 2 молекулы феофитина (бактериофеофи-
тина), кроме того, они включают близкие по химической природе кофермен-
ты (Fe-Q). Однако несмотря на общее структурное сходство, они значительно
различаются в функциональном отношении.
П680 генерирует очень высокий окислительный потенциал. Редокс-потенци-
ал П68о на 600 — 800 мВ более положителен (+1,12 В), чем у П870 (+0,4 В). Это
может быть связано с существенными различиями в структуре хромофора и в
молекулярном окружении. Окисленный П^о — один из наиболее сильных окис-
лителей, генерируемых в биологических системах и поэтому может осуществ-
лять уникальный процесс фотоокисления Н2О до молекулярного кислорода.
ФСП содержит систему окисления воды, главными компонентами которой
являются 4Мп-кластер и тирозин Z.
В связи с тем, что димерная структура ФСП существенно отличается от
бактериального реакционного центра (иная геометрия специальной пары, боль-
шее расстояние между мономерами хлорофилла а в димере), энергия экситон-
ного сопряжения в димере П680 значительно меньше (300 см-1), чем у пурпур-
ных бактерий (1300— 1900 см-1); в димере ФС1 она равна 400 см-1.
Уменьшение экситонного сопряжения в ФСП снижает красный сдвиг спе-
циальной пары димера П680 относительно дополнительных хлорофиллов. Так,
у пурпурных бактерий дополнительный бактериохлорофилл поглощает при
800 нм, тогда как димер имеет максимум поглощения при 870 нм. Различия по
энергии составляют 1000 см-1, или 0,15 эВ. Для реакционного центра ФСП
максимум поглощения димера — 680 нм, дополнительного пигмента — 670 нм,
т.е. различия в энергии достигают только 200 см1, или 0,03 эВ. В результате
перенос энергии в реакционном центре пурпурных бактерий осуществляется
довольно легко («глубокая ловушка»), тогда как в реакционном центре ФСП
перенос и захват энергии затруднены («мелка ловушка») и разделение зарядов
будет ограничено захватом энергии. Медленная скорость захвата энергии поз-
воляет регулировать уровни возбужденных состояний в антенне ФСП, что за-
щищает реакционный центр от фотоингибирования. Оба явления — снижение
экситонного сопряжения и уменьшение различий в энергии дополнительных
хлорофиллов и специальной пары (димера) — отражают определенную стра-
тегию эволюции оксигенных реакционных центров.
Вследствие отмеченных различий реакционный центр ФСП в термодинами-
ческом отношении намного более эффективен реакционного центра пурпурных
бактерий. В ФСП квант при 680 нм (1,84 эВ) используется для фотоиндуцирован-
ного разделения зарядов с образованием стабильной радикальной пары Пб8О—QA.
Редокс-потенциал Пб80 равен +1,12 В, потенциал QA составляет -0,13 В. Таким
образом, из энергии поглощенного фотона 1,84 эВ в стабильной радикальной
паре сохраняется 1,25 эВ, т. е. эффективность составляет 68 %. Для реакционного
центра ФС1 эта величина составляет 58 %. У пурпурных бактерий фотоны с энер-
гией 1,44 эВ (870 нм) продуцируют стабильную радикальную пару П870— QA,
которой соответствует энергия 0,5 эВ, т.е. эффективность процесса равна 35 %.
Таким образом, реакционный центр ФСП эволюционировал так, что его
эффективность разделения зарядов оказалась вдвое выше по сравнению с реак-
ционным центром пурпурных бактерий. Следовательно, эволюция стратегии сла-
бого сопряжения создает значительное преимущество в эффективности фотохи-
мического преобразования энергии в реакционных центрах оксигенных систем.
162
3.6. ЭЛЕКТРОН-ТРАНСПОРТНАЯ ЦЕПЬ ХЛОРОПЛАСТОВ
Фотохимические процессы в реакционных центрах ФС1 и ФСП приводят к
быстрому первичному запасанию энергии квантов света в форме лабильных
соединений с высоким энергетическим потенциалом. Дальнейшие реакции
фотосинтеза направлены на преобразование энергии света в более стабильную
форму: сначала в форму восстановленного НАДФН и АТФ, а затем, при ис-
пользовании этих продуктов в реакциях углеродных циклов, — в форму угле-
водов и других стабильных органических соединений. Образование восстанов-
ленного НАДФН и АТФ в хлоропластах связано с работой электрон-транспорт-
ной цепи (ЭТЦ) фотосинтеза.
3.6.1. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
ЭЛЕКТРОН-ТРАНСПОРТНОЙ ЦЕПИ ХЛОРОПЛАСТОВ
Электрон-транспортная цепь — это цепь редокс-агентов, определенным
образом расположенных в мембране хлоропластов, осуществляющих фотоин-
дуцируемый транспорт электронов от воды к НАДФ+ (рис. 3.32, 3.33). Движу-
щей силой транспорта электронов по ЭТЦ фотосинтеза являются окислитель-
но-восстановительные реакции в реакционных центрах (РЦ) двух фотосистем
(ФС). Первичное разделение зарядов в РЦ ФС1 приводит к образованию силь-
£., В
-1,2 -
-1,0-
-0,8
(Пдоо)
-0,6
-0,4
-0,2
Qa"Qb
+0,2
ФСП
PQ
PQ
PQ
Цит. b(,L
Цит. Ь$Н
+0,4
+0,6
+0,8
н2оч
I S-компле
Цитохром
b(,f- комплекс
(Пуоо)
Fe2S2s<
Цит./-—Пц
F^/Fb
фД "-ФНР—НАДФ
сс
+1,0
- ’ +Tyrz
О2+4Н+ \
+1,2
0
Рис. 3.32. Электрон-транспортная цепь хлоропластов
(Z-схема фотосинтеза):
S — водоокисляющий комплекс; Tyrz — донор электронов
реакционного центра ФСП (тирозин-161 белка D1); Фео —
феофитин; QA, QB — пластохиноны, вторичные акцепторы электронов ФСП; PQ — пул пластохи-
нонов; цит. Ь(Н — цитохром Ьь высокопотенциальный; цит. b(iL — цитохром Ь6 низкопотенциаль-
ный; Fe2S2 — центр Риске; цит./— цитохром/; Пц — пластоцианин; Aq — хлорофилл а (первич-
ный акцептор электронов реакционного центра ФС1); А, — витамин К,; FA, F^, Ffi — железосер-
ные белки акцепторного комплекса ФС1; ФД — ферредоксин; ФНР — ферредоксин-
НАДФ+-оксидоредуктаза
163
Фотосистема I
Рис. 3.33. Схема организации ЭТЦ в мембранах тилакоидов:
CCKI — светособирающий комплекс I; ССКП — светособирающий комплекс П (мобильная
антенна); PQ — пластохинон окисленный; PQH2 — пластохинон восстановленный (пластохи-
нол); FQR — ферредоксинхинон-оксидоредуктаза. Остальные обозначения, как на рис. 3.32
ного восстановителя Ао, окислительно-восстановительный потенциал кото-
рого обеспечивает восстановление НАДФ+ через цепь промежуточных пере-
носчиков. В РЦ ФСП фотохимические реакции ведут к образованию сильного
окислителя ПбМ), который вызывает ряд окислительно-восстановительных ре-
акций, приводящих к окислению воды и выделению кислорода. Восстановле-
ние П700, образованного в РЦ ФС1, происходит за счет электронов, мобили-
зованных из воды фотосистемой II, при участии промежуточных переносчи-
ков электронов (пластохинонов, редокс-кофакторов цитохромного комплекса
и пластоцианина). В отличие от первичных фотоиндуцированных реакций раз-
деления зарядов в реакционных центрах, идущих против термодинамического
градиента, перенос электрона на других участках ЭТЦ идет по градиенту окис-
лительно-восстановительного потенциала и сопровождается высвобождением
энергии, которая используется на синтез АТФ.
3.6.1.1. Компоненты ЭТЦ хлоропластов, их природа
и физико-химические свойства
ЭТЦ хлоропластов включает ряд переносчиков, общих для всех типов ре-
докс-цепей живых организмов. К ним относятся цитохромы, железосерные
белки, хиноны, флавиновые ферменты и пиридиннуклеотиды (см. гл. 2). Вмес-
те с тем в ЭТЦ хлоропластов входят специфические переносчики электронов,
такие как циклические тетрапирролы (хлорофиллы реакционных центров,
феофитин), марганецсодержащий кластер, осуществляющий окисление воды,
некоторые аминокислотные остатки белков (тирозин в ФСП) и медьсодержа-
щий белок пластоцианин.
164
Редокс-агенты ЭТЦ хлоропластов включены в состав трех интегральных
мультипептидных комплексов, расположенных в мембранах тилакоидов, — ФС1,
ФСП и цитохромный /^/-комплекс. Кроме того, некоторые компоненты ЭТЦ
свободно перемещаются по поверхности мембраны (пластоцианин, ферредо-
ксин) или в ее толще (пластохиноны) и осуществляют связь между функцио-
нальными комплексами (см. рис. 3.33). Ниже дана краткая характеристика ре-
докс-компонентов ЭТЦ хлоропластов.
Цитохромы в ЭТЦ хлоропластов представлены двумя цитохромами группы b
(цитохром и цитохром Ь5а, или цитохром Ьь) и цитохромом группы с (ци-
тохром/). Каждый из двух цитохромов группы b найден в хлоропластах в виде
двух редокс-форм — низкопотенциальной (Е) и высокопотенциальной (Н). Ци-
тохромы Ь6 (цит. b6L с Е(',= -0,15 В и цит. Ь6Нс = -0,05 В), а также цитохром
f (Ео = +0,37 В) входят в состав цитохромного /^/-комплекса и участвуют в
окислении пластохинолов и восстановлении пластоцианина; цитохром bSS9
связан с комплексом ФСП.
Железосерные белки. В ЭТЦ хлоропластов входят 3 железосерных центра,
содержащих [4Ре-45]-кластеры F^, F^ и FB, и 2 белка с [2Ре-25]-кластерами —
ферредоксин (ФД) и центр Риске. Железосерные кластеры F^, F^ и FZj и ферре-
доксин отличаются низкими окислительно-восстановительными потенциала-
ми (от -0,7 В до -0,42 В). Они участвуют в восстановлении НАДФ+ в ФС1.
Центр Риске имеет необычно высокий для железосерных белков окислитель-
но-восстановительный потенциал (около +0,3 В). Он находится в цитохром-
ном ^/-комплексе и осуществляет окисление пластохинолов.
Хиноны. Представители двух групп хинонов — бензохиноны (пластохино-
ны) и нафтохиноны (филлохинон) включены в ЭТЦ фотосинтеза. Филлохинон
(витамин К) — переносчик электронов на акцепторной стороне ФС1 (А,),
участвует в переносе электронов от первичного акцептора электронов (АД к
железосерному кластеру Fy. Имеет очень низкий окислительно-восстановитель-
ный потенциал (около -0,8 В). Пластохиноны (PQ) осуществляют транспорт
электронов на акцепторной стороне ФСП (QA и QB), а также между комплек-
сом ФСП и цитохром ^/-комплексом в составе пула пластохинонов. Окисли-
тельно-восстановительный потенциал пластохинонов близок к нулю.
Флавинсодержащий переносчик электронов ЭТЦхлоропластов. Фермент фер-
редоксин- НАДФ оксидоредуктаза (ФНР) содержит в качестве редокс-кофакто-
ра ФАД. Восстанавливает НАДФ+ в ФС1. Электроны для восстановления полу-
чает от восстановленного ферредоксина (ФД). Окислительно-восстановитель-
ный потенциал равен -0,36 В.
Пластоцианин (Пц) — водорастворимый белок, содержащий 1 атом меди.
Осуществляет перенос электронов по одноэлектронному типу, причем атом
меди изменяет свою валентность (Си+ -** Си *). Окислительно-восстановитель-
ный потенциал Пц равен +0,37 В. Пц восстанавливает окисленный пигмент
РЦ ФС1 Пуоо и окисляет цитохром /цитохром />6/комплекса хлоропластов.
Марганецсодержащий кластер (Мп-кластер). Располагается в комплексе
ФСП и образует систему окисления воды (5). Кластер включает 4 атома мар-
ганца, валентность которых меняется в ходе индуцируемых светом окисли-
тельно-восстановительных реакций. Окислительно-восстановительный потен-
циал максимально окисленного кластера около +0,9 В. Мп-кластер окисляет
воду с образованием молекулярного кислорода.
165
Электроны от Mn-кластера передаются на П^о через промежуточный пере-
носчик электронов (Tyrz) — остаток тирозина (Туг-161) белка D1 ФСП. Окис-
лительно-восстановительные реакции идут с образованием нейтрального ра-
дикала тирозина.
Тетрапиррольные переносчики электронов — уникальные компоненты ЭТЦ
хлоропластов. Они являются первичными донорами и первичными акцептора-
ми электронов в реакционных центрах ФС1 и ФСП. Окислительно-восстанови-
тельные реакции циклических тетрапирролов сопровождаются образованием
заряженных радикалов.
3.6.1.2. Z-схема фотосинтеза. Нециклический, циклический,
псевдоциклический транспорт электронов в хлоропластах
Последовательность расположения редокс-агентов в ЭТЦ хлоропластов в
соответствии с их окислительно-восстановительным потенциалом и данными
по их локализации в комплексах отражает Z-схема фотосинтеза (см. рис. 3.32).
Согласно Z-схеме, существует последовательный перенос электронов от ФСП
к ФС1 и две фотосистемы объединяются в единую цепь переноса электронов
от воды к НАДФ+. Представление о существовании в хлоропластах двух фото-
систем и их совместной последовательной работе впервые возникло в 1940-е гг.
на основании опытов лаборатории Р. Эмерсона, обнаруживших эффект крас-
ного падения квантового выхода фотосинтеза при освещении хлоропластов мо-
нохроматическим дальним красным светом (Х> 680 нм), возбуждающим толь-
ко ФС1, и эффект усиления квантового выхода фотосинтеза при добавлении к
дальнему красному свету подсветки с длиной волны около 650 нм (возбужда-
ющей ФСП). Позднее было показано, что в хлоропластах транспорт электро-
нов возможен не только от воды к НАДФ+ с участием двух фотосистем, но и
другие альтернативные пути с участием лишь одной из двух фотосистем. Кроме
того, конечным акцептором электронов в ЭТЦ фотосинтеза вместо НАДФ+
может выступать молекулярный кислород. В настоящее время различают не-
циклический, циклический и псевдоциклический транспорт электронов в хлоро-
пластах.
Нециклический транспорт электронов — это перенос электронов от воды к
НАДФ+, осуществляемый с участием двух фотосистем, цитохромного ^/-ком-
плекса и промежуточных низкомолекулярных переносчиков — пула пластохи-
нонов (PQ), пластоцианина (Пц), ферредоксина (ФД) и ферредоксин-НАДФ-
оксидоредуктазы (ФНР). Он сопровождается выделением кислорода и восста-
новлением НАДФ+. Сопряжен с синтезом АТФ (нециклическое фотофосфори-
лирование).
Циклический поток электронов осуществляют отдельно ФС1 или ФСП.
Циклический транспорт с участием ФС1 (см. рис. 3.33) включает перенос
электронов от восстановленного ферредоксина (ФДВОССТ) обратно к окислен-
ному Пуоо- При этом участвует пул пластохинонов, цитохром ^/-комплекс и,
вероятно, особый фермент ФД-хиноноксидоредуктаза (FQR). Циклический по-
ток электронов с участием ФС1 сопряжен с синтезом АТФ (циклическое фо-
тофосфорилирование) и может обеспечивать дополнительный синтез АТФ,
необходимый для процессов ассимиляции углерода. Он может быть альтерна-
тивным путем использования энергии света при его высоких интенсивностях.
166
Рис. 3.34. Структурно-функциональная организация комплекса ФСП (по Wei-Zhong Не,
1996, с изменениями):
(Мп)4 — Mn-содержащий кластер; Tyrz — тирозин-161 белка D1 — первичный донор электро-
нов для П(’м); TyrD — тирозин-161 белка D2; цит. Ь559 — цитохром Хл7, Хлс — сопровожда-
ющие хлорофиллы а; Кар — p-каротин; QA, QB — пластохиноны; I — белок; а, р— субъединицы.
Пунктиром обозначен возможный циклический поток электронов
Циклический поток электронов в ФС//связан с обратным переносом электро-
нов от восстановленных первичных хинонов QA и (или) QB к окисленному пиг-
менту реакционного центра Пе80. При этом участвуют цитохром 6559, р-каротин
и сопровождающие молекулы хлорофилла а (Хл7 или XnD) реакционного центра
ФСП (рис. 3.34).
Циклический поток электронов в ФСП является альтернативным путем
использования энергии света. Он активируется в условиях, когда интенсив-
ность света превышает возможности ЭТЦ утилизировать его энергию или при
повреждении водоокисляюшей системы хлоропластов.
Псевдоциклический поток электронов — перенос электронов от воды на
кислород — впервые был исследован А. Мелером (Mehler, 1951) и назван его
именем — реакция Мелера.
Восстановление кислорода может происходить как в ФС1, так и в ФСП.
При этом поглощение кислорода может компенсировать его выделение в ходе
окисления Н2О. В результате единственным продуктом этого процесса, как и в
случае циклического потока электронов, будет АТФ, синтезируемая при псев-
доцикл ическом фотофосфорил ировани и.
Псевдоциклический поток электронов приводит к образованию активных
форм кислорода (супероксиданионрадикала О|, перекиси водорода Н2О2),
поэтому активация процесса может вызвать нарушения фотосинтетического
аппарата. Этот альтернативный транспорт электронов активируется при высо-
ких интенсивностях света в условиях дефицита в хлоропластах окисленного
НАДФ+.
167
3.6.2. ФУНКЦИОНАЛЬНЫЕ КОМПЛЕКСЫ ЭТЦ ХЛОРОПЛАСТОВ
ЭТЦ фотосинтеза организована в мембранах тилакоидов в виде трех от-
дельных функциональных комплексов — ФС1, ФСП и цитохромый ^/-комп-
лекс, — связанных между собой подвижными низкомолекулярными редокс-
компонентами — липорастворимыми пластохинонами и водорастворимым пе-
риферическим белком пластоцианином. Кроме того, в переносе электронов на
участке цепи от ФС1 к НАДФ+ участвуют два периферических белка — ферре-
доксин и ферредоксин-НАДФ-оксидоредуктаза (см. рис. 3.33).
К настоящему времени в основном определены полипептидный состав и
субмолекулярная организация комплексов, установлена локализация в них
редоке-кофакторов. Биохимический и генетический подходы позволили вы-
явить функциональную роль отдельных белковых субъединиц. Показано, что
комплексы ФС1 и ФСП имеют общий принцип организации: в каждом из них
можно выделить центральную часть — структурное и функциональное ядро, спо-
собное осуществлять основные, характерные для всего комплекса реакции и
периферические домены. Белки ядра присоединяют компоненты РЦ и вторич-
ные переносчики электронов, а также пигменты внутренних фокусирующих
антенн. Периферические домены комплексов включают белки, связывающие
пигменты внешней антенны комплекса, а также белки, участвующие во взаи-
модействии с подвижными переносчиками электронов или выполняющие
структурную и регуляторную роль. Как правило, белки центральной части ком-
плекса кодируются хлоропластным геномом, тогда как белки периферических
доменов кодируются в ядре.
3.6.2.1. Комплекс фотосистемы II. Механизмы фотоокисления
воды и выделения молекулярного кислорода
Комплекс ФСП осуществляет окисление воды и восстановление пластохи-
нонов, т. е. является Н2О-пластохиноноксидоредуктазой. Окислительно-восста-
новительные реакции в комплексе инициируются светом. В ходе первичных
фотохимических реакций в РЦ ФСП образуется сильный окислитель П^о с
уникально высоким редокс-потенциалом (£0' = +1,12 В), который способен
вызвать цепь окислительно-восстановительных реакций, приводящих в итоге к
окислению воды. Система окисления воды ФСП поставляет электроны в ЭТЦ
хлоропластов, которые через ряд промежуточных переносчиков (пластохино-
ны, цитохром 66/-комплекс и пластоцианин), попадают в ФС1 и используют-
ся на восстановление НАДФ+. Фотолиз воды, осуществляемый ФСП, сопро-
вождается выделением молекулярного кислорода. Благодаря этому процессу
фотосинтез растений является основным источником кислорода на Земле.
Пептидный состав, редокс-центры, структурная организация ФСП. Комп-
лекс ФСП высших растений и водорослей включает около 20 полипептидов,
большая часть которых представлена интегральными белками, и только 5 по-
липептидов располагаются на поверхности мембраны, обращенной к люмену,
формируя периферийный домен комплекса. Структурно и функционально в
комплексе ФСП можно выделить ядро, ряд низкомолекулярных интегральных
белков, примыкающих к ядру, функциональная роль которых остается до сих пор
168
не вполне ясной, и белки водоокисляющего комплекса (ВОК). Структурно-функ-
циональная организация комплекса ФСП представлена на рис. 3.34.
Редокс-агенты, участвующие в транспорте электронов ФСП, располагают-
ся в центральной части — ядре — комплекса ФСП и связаны с интегральными
белками D1 и D2. Белки D1 (38 кДа) и D2 (39 кДа) имеют высокую степень
гомологии друг с другом по первичной структуре и сходное расположение в
мембране. Аминокислотные последовательности белков D1 и D2 также очень
близки аминокислотным последовательностям L- и М-полипептидов реак-
ционного центра пурпурных бактерий. Белки образуют по 5 трансмембранных
а-спиралей, аминокислотные остатки которых и связывают компоненты реак-
ционного центра ФСП, а также редокс-кофактры вторичного транспорта элек-
тронов. На белках D1 и D2 организован димер П680. Кроме того, каждый из
белков присоединяет еще по 2 молекулы хлорофилла а (дополнительный и
сопровождающий хлорофиллы), молекулу феофитина а (Фео), p-каротин и
пластохинон (QA связан с белком D2, a QB — с белком D1). Между QA и QB
находится ион двухвалентного железа, в координировании которого участвуют
оба белка. Люменальный домен полипептида D1 присоединяет 4 иона марган-
ца и формирует Мп-кластер, осуществляющий окисление воды. По данным рент-
геноструктурного анализа, пигмент реакционного центра П680 располагается в
области ФСП, обращенной к люменальному пространству тилакоида. На про-
тивоположной стороне комплекса, обращенной к строме, находятся хиноны
Qa и Qb и негеминовое железо. Почти симметрично оси, соединяющей П68о и
негеминовое железо, на каждом из белков располагаются остальные тетра-
пиррольные кофакторы: молекулы феофитина (на белке D1 — ФеоА, на белке
D2 — Феов), сопровождающие хлорофиллы (Хлг и Хло) и дополнительные
хлорофиллы, занимающие промежуточное положение между пигментом реак-
ционного центра и Фео (ВА — на белке D1, Вв — на белке D2, на рисунке не
показаны)
Кроме белков D1 и D2 в состав ядра ФСП входят белки СР47м СР43, кото-
рые связывают около 30 молекул хлорофилла а и составляют внутреннюю,
фокусирующую антенну комплекса, цитохром bss9, включающий а- и ft-субъ-
единицы, участвующий в циклическом транспорте электронов в ФСП и наряду
с белком I (4,8 кДа) необходимый для сборки функционально активного ком-
плекса ФСП. Таким образом, ядро комплекса ФСП, способное окислять воду и
восстанавливать пул пластохинонов, составляют белки DI, D2, СР47, СР43,
а- и р-субъединицы цитохрома bw и белок I (см. рис. 3.34).
Оптимизацию работы системы окисления воды обеспечивают 3 гидрофиль-
ных белка с молекулярными массами 33, 23 и 17 кДа. Они составляют перифе-
рийный домен комплекса ФСП. Эта группа белков, называемых белками водо-
окисляющего комплекса (ВОК), располагается на люменальной стороне мемб-
раны вблизи локализованного на белке D1 марганцевого кластера и играет
структурную и регуляторную роль в системе окисления воды. Белок 33 кДа
влияет на состояние марганцевого кластера, а два других белка важны для
создания в области марганцевого кластера необходимой для окисления воды
концентрации ионов кальция и хлора.
С комплексом ФСП связаны полипептиды, составляющие внешнюю (дисталь-
ную) антенну комплекса. Одни из них (Lhcbl, 2, 3) образуют мобильную антен-
ну — светособирающий комплекс II (ССКП), другие (Lhcb4-6) представляют
169
собой группу минорных, низкомолекулярных белков {СР29, СР26, СР24), за-
нимающих промежуточное положение между ядром комплекса и ССКП. Белки
дистальной антенны присоединяют более 150 молекул хлорофилла а и около
100 молекул хлорофилла Ь, осуществляющих поглощение и передачу энергии
света в реакционные центры ФСП. В дистальную антенну входят также около
50 молекул каротиноидов, функция которых связана не только с поглощени-
ем и передачей энергии, но также с защитой комплекса ФСП от избыточной
энергии света.
Транспорт электронов в ФСП. Первичные фотохимические реакции в РЦ
ФСП запускают вторичный транспорт электронов по ЭТЦ. Акцепторная сторо-
на ЭТЦ ФСП осуществляет перенос электрона от восстановленного Фео" к
пулу пластохинонов. Донорная сторона ЭТЦ включает ряд окислительно-вос-
становительных реакций, приводящих к окислению воды. При этом электроны
воды используются для восстановления первичного донора электронов Пб8о-
Процесс сопровождается выделением молекулярного кислорода и переносом
протонов в люменальное пространство.
Рассмотрим подробно окислительно-восстановительные процессы, прохо-
дящие на донорной и акцепторной сторонах ЭТЦ фотосистемы II.
Донорная сторона ЭТЦ ФСП связана с работой системы окисления воды и
передачей электронов от воды к П^о через промежуточный переносчик элек-
тронов Tyrz — остаток тирозина белка D1 (Туг-161).
Окисление, или фотолиз, воды — уникальное свойство ФСП растений. Про-
цесс окисления воды при фотосинтезе приводит к выделению кислорода без
образования промежуточных продуктов окисления и описывается уравнением
2Н2О -* О2 + 4Н+ + 4е"
Механизм окисления воды в настоящее время еще не вполне понятен, но
можно считать экспериментально доказанными следующее. Движущей силой
окисления воды является образование в ходе первичных фотохимических ре-
акций очень сильного окислителя П^. Потенциал П^о (+1,12 В) достаточно
высок, чтобы произвести окисление воды, окислительно-восстановительный
потенциал которой около +0,8 В. Однако окисление воды осуществляет не сам
окисленный пигмент реакционного центра П^о, а особая система окисления
воды, включающая марганцевый кластер (Мп-кластер). Между Мп-кластером и
окисленным Пб80 имеется промежуточный переносчик электронов Tyrz — оста-
ток тирозина белка D1 {Туг-161). Одна из современных моделей, описыва-
ющих процесс окисления воды в марганцевом кластере, основана на метал-
ло-радикальном механизме, согласно которому существует тесное взаимодей-
ствие двух реакций — окисления тирозина и окислительно-восстановительной
реакции в марганцевом комплексе. Близость расположения Tyrz к марганцево-
му кластеру позволяет рассматривать тирозин как компонент водоокисляющей
системы ФСП.
Последовательность реакций представляется следующим образом. Первым
событием, происходящим вслед за первичным разделением заряда в РЦ ФСП,
является окисление Tyrz и восстановление Пб80. Окисление тирозина идет с
образованием нейтрального радикала (Yz), что указывает на сопряженность
процесса отнятия электрона от гидроксила тирозина с процессом передачи его
протона на акцептор.
170
В качестве акцептора протона могут выступать остатки гистидина Н190 и
глутаминовой кислоты Е189 белка D1, расположенные вблизи тирозина-161
{Y161, Yz). Далее протон может быть передан по цепочке аминокислот к люме-
нальной поверхности мембраны, где происходит либо локальное изменение
концентрации протонов, либо выброс протона в люменальное пространство.
Восстановление тирозина идет за счет работы марганцевого кластера и окис-
ления воды: образующийся нейтральный радикал Yz осуществляет отрыв ато-
мов водорода от субстратной воды, связанной с атомами Мп в кластере. Пол-
ное окисление воды и образование кислорода требует четырехкратного повто-
рения описанных событий.
Состояние системы окисления воды меняется в зависимости от уровня окис-
ленное™ атомов марганца в кластере. Представление о существовании отдель-
ных функционально различимых состояний (5-состояний) водоокисляющей
системы возникло на основе результатов работ П. Жолио с сотр. (1969). Исполь-
зуя мощные кратковременные вспышки света для индукции выделения кисло-
рода в адаптированных к темноте хлоропластах, исследователи обнаружили ос-
цилляцию выделения кислорода с периодом 4 (рис. 3.35, А). Первые две вспыш-
ки не приводили к заметному выделению кислорода. Максимальное количество
кислорода выделялось на третью вспышку, второй максимум приходился на
четвертую вспышку. После примерно 20 вспышек устанавливалась стационар-
ная величина выделения кислорода. Для объяснения этих результатов была пред-
Номер вспышки
А
Рис. 3.35. Фотоокисление воды в хлоропластах:
Mn4(II, III, IV2)
или (Ш3, IV) 50
^Mn4(III2, IV2)
А — выделение кислорода хлоропластами в ответ на
серию кратковременных вспышек (по Joliot et al.,
1969); Б — модель изменения 5-состояний системы
окисления воды при освещении (по Kok et al., 1970);
В — модель изменений степени окисленности ионов
марганца при освещении (по Robblee et al., 2001).
Mn4 (III, IV3)’
Объяснение в тексте
171
ложена модель работы еодоокисляющей системы (В. Кок et al., 1970), согласно
которой система окисления воды может находиться в различных состояниях,
обозначаемых 50, 5), 52, 53, 54 (рис. 3.35, Б). Переход из одного состояния в
следующее совершается в результате действия вспышки света и удаления элек-
трона из системы. Выделение молекулярного кислорода из двух молекул воды
происходит лишь при переходе из состояния 53 в состояние 54, причем состоя-
ние 54 нестабильное и сразу же переходит в состояние 50. Согласно современ-
ным представлениям, в ходе 5-цикла изменяется валентность двух из четырех
составляющих кластер атомов Мп. Схема возможного поэтапного изменения
валентности марганца представлена на рис. 3.35, В. В результате изменения окис-
лительно-восстановительных свойств кластера достигается высокий положи-
тельный окислительно-восстановительный потенциал (EJ около +0,9 В) и ста-
новится возможным окисление воды.
Окисление воды сопровождается выделением 4 протонов в люменальное
пространство тилакоидов, однако оно не синхронно с выделением кислорода:
по одному протону Н+ выделяется при переходе из состояния 50 в 51 и из
состояния 5| в S2, два оставшихся протона выделяются после перехода из со-
стояния 53 в состояние 50 через нестабильное состояние 54.
В организации водоокисляющей системы хлоропластов участвуют как ми-
нимум 4 атома марганца, связанных с белком D1. Кроме того, для активной
работы системы окисления воды требуются ионы хлора и кальция. Одна из моде-
лей пространственной организации Mn-кластера представлена на рис. 3.36.
Альтернативный путь восстановления Пб80. В условиях нарушения донорно-
го участка ЭТЦ фотосистемы П, например при повреждении системы окисле-
ния воды, восстановление П^о идет за счет альтернативных доноров электро-
нов (см. рис. 3.34). К ним относятся цитохром Ь559, сопровождающий хлорофилл
Хл7, и ^-каротин (Кр). При реализации этого пути транспорта электронов не-
посредственным донором электронов для окисленного Пб80 является р-каро-
Рис. 3.36. Схема организации Mn-кластера (по Tommas, Babcock, 2000)
172
тин. Его окисление приводит к окислению хлорофилла Хлг и (или) цитохрома
/>559. Восстановление этих компонентов может происходить с участием пласто-
хинона ФСП QB. Таким образом, в ФСП возможен циклический транспорт
электронов, позволяющий восстановить окисленный П^ при заблокирован-
ном потоке электронов от воды.
В ФСП обнаружены две формы цитохрома Ь559: высокопотенциальная (цит.
Ь559Н, Её = +0,37 В) и низкопотенциальная (цит. b^L, Её = +0,08 В). Высокопо-
тенциальная форма протонирована, низкопотенциальная — депротонирована.
При определенных условиях наблюдается взаимопревращение двух форм ци-
тохрома 6559, поэтому цитохром Z>559 может осуществлять не только цикличе-
ский транспорт электронов, но и трансмембранный транспорт протонов в ФСП
в ходе редокс-реакций.
Акцепторая сторона ЭТЦ ФСП включает первичный акцептор электронов
реакционного центра — феофитин (Фео) и вторичные акцепторы электро-
нов — пластохиноны QA и QB, осуществляющие перенос электронов от Фео“ на
пул пластохинонов (PQ). Пластохиноны А и В составляют так называемый «двух-
электронный затвор» на акцепторной стороне ФСП. Переход от одноэлектрон-
ного типа переноса электронов к двухэлектродному на уровне пластохинонов
Qa и Qb происходит следующим образом. Одноэлектронное восстановление QA
приводит к образованию семихинона, который сейчас же передает электроны
на QB. При этом QA окисляется и готов принять следующий электрон от Фео“,
a QB находится в форме семихинона до следующего акта передачи электронов
от Qa. Получив от Qa второй электрон, QB полностью восстанавливается, ис-
пользуя два Н+ из стромального пространства. В форме пластохинола QBH2 он
диссоциирует из комплекса ФСП в гидрофобную фазу мембран и становится
компонентом пула пластохинонов. Для передачи электрона от QA к QB необхо-
дим ион двухвалентного железа.
3.6.2.2. Комплекс фотосистемы I
Фотосистема I (ФС1) является пластоцианин-ферредоксин-оксидоредуктазой.
Окислительно-восстановительные реакции в ФС1 индуцируются светом. Фо-
тохимическое разделение зарядов в РЦ ФС1 приводит к формированию силь-
ного восстановителя Ао (Её = -1,1 В), способного через цепь переносчиков
электронов осуществить восстановление НАДФ+. Таким образом, при участии
ФС1 синтезируется НАДФН — источник электронов для последующих реак-
ций восстановления углерода в хлоропластах. Кроме того, ФС1 может осуще-
ствлять циклический транспорт электронов, сопряженный с синтезом АТФ,
обеспечивая дополнительный синтез АТФ в хлоропластах.
Пептидный состав, редокс-центры, структурная организация ФС1. Комп-
лекс ФС1 хлоропластов растений и водорослей включает 13 пептидов, из ко-
торых 8 — интегральных и 5 — периферических. В структуре комплекса выделя-
ют центральную интегральную часть (ядро) и два периферийных домена — со
стороны стромы и со стороны люмена. К комплексу ФС1 примыкают белки
внешней антенны CCKI, которые в отличие от ССКП не меняют своего распо-
ложения в мембране и всегда связаны с комплексом ФС1. Структурная органи-
зация комплекса ФС1 показана на рис. 3.37.
173
Рис. 3.37. Структурно-функциональная организация комплекса ФС1.
Буквами обозначены отдельные пептиды. Остальные обозначения, как на рис. 3.32
Кофакторы ЭТЦ, осуществляющие первичный и вторичный транспорт элек-
тронов в ФС1, связаны с двумя наиболее крупными интегральными белками
комплекса — А (83 кДа) и В (82,4 кД), а также с белком С (8,9 кДа), располо-
женным на поверхности мембраны со стороны стромы. Белки А и В присое-
диняют димер П7оо, по одной молекуле мономера хлорофилла а (Хл695) —
первичного акцептора электронов (Ао), по одному дополнительному хлоро-
филлу а (А) (на рисунке не показано), и по одной молекуле филлохинона
(А!), а также железосерный кластер Б\. Белок С содержит редокс-центры тер-
минального участка ЭТЦ ФСБ Бл и F/;.
По данным рентгеноструктурного анализа кристаллов ФС1, редокс-цепь
пронизывает комплекс от люменальной к стромальной части (П7оо располо-
жен ближе к люменальной стороне комплекса, F^- — ближе к строме). Два
набора дополнительных хлорофиллов (А), первичных акцепторов электронов
(Ао) и филлохинонов формируют две почти симметричные ветви транспорта
электронов от П700 к F^ (см. рис. 3.37). В отличие от реакционных центров бак-
терий и ФСП, где из двух ветвей транспорт электронов осуществляет лишь
одна, в ФС1 активны обе ветви транспорта электронов, хотя они неидентичны.
Белки А и В кроме редокс-центров присоединяют пигменты внутренней
антенны ФС1 (около 95 молекул хлорофилла о и 22 молекулы р-каротина, 5 из
которых находятся в гщс-конформации). Это отличает ФС1 от ФСП, где пиг-
менты внутренней антенны расположены на отдельных белках СР43 и СР47.
Пигменты внутренней антенны располагаются в виде цилиндра, окружающе-
го редокс-агенты ЭТЦ ФСБ
174
Белки А и В составляют ядро комплекса ФС1. Белок С вместе с тремя низ-
комолекулярными белками — D, Е и Н — организуют периферийный домен
комплекса со стороны стромы. Белки D, Е и Н не содержат редокс-агентов, но
участвуют в организации центра связывания ферредоксина с ФС1. Белок Н
обеспечивает также взаимодействие ФС1 с ССКП при переходе хлоропластов
из состояния 1 в состояние 2 (см. подразд. 3.4). Перифериный домен со стороны
люмена у растений и водорослей составляют периферийный белок N (9 кДа) и
большой люменальный домен интегрального белка F (15,7 кДа). Здесь форми-
руется центр связывания восстановленного пластоцианина с ФС1.
Транспорт электронов в ФС1. Работа реакционного центра ФС1 приводит к
быстрому разделению зарядов: первичный донор электронов П700 окисляется,
первичный акцептор электронов Ао (Хл695) — восстанавливается. Последующий
транспорт электронов к ферредоксину связан с работой акцепторной стороны
ФС1, а восстановление П700 — с донорной стороной ФС1.
Акцепторную сторону ФС1 составляют филлохинон {витамин Kt) и низкопо-
тенциальные [4Fe-4S]-железосерные кластеры, образующие центры F^, Ел и
Ей(см. рис. 3.37).
Филлохинон (А[), промежуточный переносчик электрона от аниона А” к
железосерному кластеру F^, имеет низкий окислительно-восстановительный
потенциал (Ем пары А]/А( находится в интервале от -0,755 до -0,785 В). Пере-
дача электрона между Ао и А, происходит за 4 —50 пс. Разная скорость восста-
новления А|, возможно, является отражением работы двух ветвей транспорта
электронов в ФС1.
Железосерный кластер F^ (Ео' = -0,700 В) окисляет восстановленный Аь Даль-
нейший транспорт электронов осуществляют железосерные кластеры FA и FB,
характеризующиеся низкими окислительно-восстановительными потенциала-
ми (соответственно -0,59 и около -0,55 В). Согласно современным представле-
ниям, происходит последовательный перенос электронов от F^ к Рл, затем к
F7j, а от него — на ферредоксин. Время переноса электронов на этом участке
ЭТЦ порядка 500 нс.
Ферредоксин восстанавливается комплексом ФС1 на стромальной стороне
мембраны. Ферредоксин (ФД) — растворимый белок, содержащий [2Fe-2S]-
кластер с низким окислительно-восстановительным потенциалом. Восстанов-
ленный ферредоксин (ФДВОССТ) — сильный восстановитель (Её = -0,43 В), может
быть источником электронов для различных реакций, происходящих в хлоро-
пластах. Так, ФДвосст поставляет электроны для восстановления нитритов и асси-
миляции серы в хлоропластах. Он восстанавливает тиоредоксин — низкомоле-
кулярный серосодержащий белок, участвующий в редокс-регуляции метаболиз-
ма хлоропластов (подробно см. подразд. 3.8). ФДвосст выполняет функцию медиа-
тора нециклического, циклического и псевдоциклического транспорта элект-
ронов и, возможно, именно через ФД происходит регуляция этих потоков. Для
транспорта электронов от ФС1 к ФД необходимо их взаимодействие за счет элек-
тростатических сил. В образовании комплекса ФС1-ФД участвуют белки D и Е.
При нециклическом потоке электронов за счет восстановленного ферре-
доксина восстанавливается НАДФ+. В реакции передачи электрона от ФДВОССт к
НАДФ+ участвует фермент ферредоксин-НАДФ+-оксидоредуктаза (ФНР). Обра-
зование комплекса ФС1 с ферредоксином и ферментом ферредоксин-НАДФ+-
оксидоредуктазой является обязательным условием восстановления НАДФ+,
175
при этом важную роль играет белок Е ФС1. Фермент ФНР — водорастворимый
белок, содержащий в качестве редокс-кофактора ФАД. Фермент имеет два центра
связывания субстратов реакции: центр связывания ФД и центр связывания
НАДФ+. Энергизация мембран хлоропластов на свету увеличивает сродство
фермента к НАДФ+ в сотни раз.
Циклический поток электронов с участием ФС1 обеспечивает перенос элек-
трона бт восстановленного ферредоксина к окисленному Пда- Вначале элект-
рон перемещается от ФДиоСст на пул пластохинонов (PQ). Затем от PQ через
цитохромный Ь(,/-комплекс и пластоцианин электрон вновь попадает в ФС1, где
используется на восстановление П700. Полагают, что существует особый фер-
мент — ферредоксин-хинон-оксидоредуктаза (FQR), окисляющий ФДВОСст и
восстанавливающий пул пластохинонов.
Донорная сторона ФС1. Восстановление П700 производит пластоцианин
(Пц) — медьсодержащий белок с молекулярной массой около 10 кДа. Этот
водорастворимый белок электростатическими силами удерживается на поверх-
ности мембраны, обращенной к люмену. Белок имеет форму, близкую к ци-
линдрической, с явно выраженной полярностью распределения зарядов. Окис-
лительно-восстановительный потенциал Пц около +0,37 В. Пластоцианин пе-
реносит электроны от цитохромного ^/-комплекса к комплексу ФС1. Восста-
новление П-^оо осуществляется по трехстадийному кинетическому механизму,
который включает формирование комплекса Пц с ФС1, его реорганизацию и
собственно транспорт электрона. Пластоцианин присоединяется к ФС1 за счет
электростатических и гидрофобных взаимодействий.
3.6.2.3. Цитохромный Ь6Лкомплекс хлоропластов
Цитохромный £>6/-комплекс осуществляет окисление пластохинолов и вос-
становление пластоцианина, обеспечивая этим электронную связь между реак-
ционными центрами ФС1 и ФСП. Наряду с подвижными переносчиками элек-
тронов — пластохинонами и пластоцианином, он функционально объединяет
две фотосистемы в единую цепь переноса электронов от воды к НАДФ+, т. е.
является участником нециклического потока электронов. Кроме того, цитохром-
ный комплекс вовлечен в циклический поток электронов, осуществляемый ФС1.
Цитохромный комплекс занимает особое стратегическое положение в ЭТЦ —
между ФС1 и ФСП. Именно здесь наблюдается наибольший перепад редокс-
потенциала и, следовательно, наибольшее выделение энергии. Поэтому глав-
ная функция цитохромного ^/-комплекса — сопряжение редокс-энергии с обра-
зованием Дцн *• В ходе окислительно-восстановительных реакций с участием ци-
тохромного комплекса происходит трансмембранный перенос протонов из
стромы в люмен и формируется электрохимический градиент протонов, энер-
гия которого используется АТФ-синтазным комплексом на синтез АТФ.
Редокс-состояние цитохромного комплекса играет важную роль в регуляции
распределения потока энергии между двумя фотосистемами, определяя переход
хлоропластов от состояния 1 к состоянию 2.
Пептидный состав, редокс-центры и структурная организация. Цитохромный
^/-комплекс включает 5 — 7 интегральных пептидов, 3 из них несут редокс-
центры, участвующие в транспорте электронов.
176
В организации функционального домена комплекса участвуют: субъединица
34 кДа, включающая гем цитохрома /(Её = +0,37 В); субъединица 23,5 кДа,
содержащая два протогема цитохрома Ь^, с различными окислительно-вос-
становительными потенциалами (цитохром Ь6Н, Её = -0,05 В, и цитохром b^L,
Её = -0,15 В), и белок Риске (20 кДа), несущий железосерный \2Ее-25]-кластер
и обладающий высоким потенциалом (Её = +0,3 В). Высокое значение редокс-
потенциала центра Риске объясняется участием в координационных связях с
железом наряду с двумя остатками цистеина двух остатков гистидина белка.
Гистидин не только влияет на окислительно-восстановительный потенциал
железосерного кластера. Его остатки могут протонироваться и депротониро-
ваться в зависимости от редокс-условий и таким образом обеспечивать закачи-
вание протонов во внутритилакоидное пространство. Это приобретает особое
значение в реакциях окисления пластохинолов, в ходе которых происходит
перенос протонов в люмен.
Комплекс погружен в тилакоидную мембрану таким образом, что функцио-
нальные группы центра Риске и цитохрома /выходят на ее внутреннюю, лю-
менальную, поверхность, тогда как два протогема цитохрома Ь6 находятся в
толще мембраны, причем один из них (цитохром bf,E) приближен к ее внут-
ренней стороне, а другой (цитохром Ь6Н) к наружной. Такое асимметричное
расположение редокс-центров в мембране обеспечивает существование двух
пространственно разделенных цепей транспорта электронов внутри одного
комплекса (рис. 3.38). Одна из них, низкопотенциальная цепь транспорта элект-
рона, формируется за счет двух цитохромов bf, — низкопотенциального Ь(/
(Ес' = -0,15 В) и высокопотенциального Z>6/7(Er' = -0,05 В). Вторая, высокопотен-
циальная, цепь включает белок Риске (Её = +0,3 В) и цитохром/(Её = +0,37 В).
При окислении пластохинолов в цитохромном комплексе реализуются два со-
пряженных потока электронов — по низкопотенциальному и высокопотенци-
альному пути.
Цитохромный комплекс примерно в равных количествах присутствует в
мембранах тилакоидов стромы и гран. В мембранах гран он участвует в нецик-
лическом транспорте электронов, а в мембранах стромы, где присутствует только
ФС1, — в циклическом.
Транспорт электронов. Цитохромный комплекс окисляет пластохиноны и
восстанавливает Пц (см. рис. 3.38). В окислительно-восстановительных реакциях
участвуют обе электрон-транспортные цепи комплекса — высокопотенциаль-
ная и низкопотенциальная. При этом восстановление Пц происходит через
высокопотенциальный путь переноса электронов и является первичным, пус-
ковым для низкопотенциального пути транспорта электронов, необходимого
для окисления пластохинолов.
Окислительно-восстановительные реакции в цитохромном комплексе за-
пускаются светом. Действие света на его работу опосредовано ФС1. После воз-
буждения светом П700 и его окисления последовательно окисляются пласто-
цианин, цитохром / и центр Риске. В свою очередь, центр Риске окисляет
пластохиноны, восстановленные фотосистемой II.
Механизм окисления пластохинола цитохромным комплексом отражает
Q-цикл, представленный на рис. 3.38. В цитохромном комплексе существуют два
центра взаимодействия с пластохинонами/пластохинолами: центр Qv располо-
женный вблизи внутренней поверхности тилакоидной мембраны, и центр Qc,
177
Рис. 3.38. Организация ЭТЦ в цитохромном £>6/^комплексе:
Q-цикл хлоропластов. В скобках указаны редокс-потенциалы переносчиков.
Обозначения, как на рис. 3.32 и 3.33. Объяснение в тексте
расположенный вблизи ее наружной поверхности. Центр Qz характеризуется
высоким сродством к пластохинолам (PQH2) и слабым сродством к пластохи-
нонам (PQ). Промежуточный продукт окисления семихинон не стабилен в этом
центре и обладает способностью отдавать электрон. Центр Qc, напротив, отли-
чается низким сродством к PQH2 и высоким сродством к PQ, семихинон в
этом центре более стабилен и обладает способностью принимать электрон.
Окисление пластохинола происходит в центре Qz. Ведущая роль при этом
принадлежит центру Риске. Высокое значение редокс-потенциала железосер-
ного кластера определяет способность центра Риске окислять пластохинолы,
индуцируя реакции Q-цикла. Центр Риске, окисленный в результате активно-
сти ФС1, отнимает от PQH2 один электрон, который через цитохром f и пла-
стоцианин переносится к ФС1. Процесс сопровождается освобождением одно-
го протона в люмен. Семихинон, образованный в результате одноэлектронно-
го окисления пластохинола, отдает свой электрон на низкопотенциальный
цитохром bf,L. При этом второй протон освобождается и поступает в люмен.
Электрон от восстановленного b(,L передается на высокопотенциальный ци-
тохром Ь6Н, а от него — на пластохинон, связанный с центром Qc. В результате
в центре Qc образуется семихинон. При окислении еще одной молекулы плас-
тохинола в центре Qz в центре Qc образуется пластохинол, который диссоци-
ирует от цитохромного ^/-комплекса. Это восстановление сопровождается про-
тонированием пластохинона с участием протонов стромы. В результате работы
178
Q-цикла на каждую пару электронов, достигших Пда, четыре протона пере-
носятся из стромального во внутритилакоидное пространство. Кроме того, при
переносе электронов по цепи двух цитохромов от центра Qz к центру Qc
поперек мембраны осуществляется электрогенная реакция, которая вместе с
протолитической вносит существенный вклад в создание трансмембранного
электрохимического градиента. Таким образом, цитохромный ^/-комплекс уча-
ствует в создании трансмембранного электрохимического потенциала, энергия
которого используется для синтеза АТФ в хлоропластах.
Цитохромный b(J-комплекс является важным регуляторным участком ЭТЦ.
Во-первых, он осуществляет координацию скорости нециклического потока
электронов и восстановления НАДФ+ с синтезом АТФ в хлоропластах. Взаимо-
связь всех этих процессов осуществляется через pH внутритилакоидного про-
странства. Во-вторых, цитохромный ^/-комплекс является редокс-сенсором ЭТЦ
хлоропластов. При повышении уровня восстановленности пула пластохинонов
(PQ) он индуцирует переход хлоропластов из состояния 1 в состояние 2 путем
активации специфической протеинкиназы, фосфорилирующей белки ССКП.
В результате фосфорилирования меняется расположение ССКП в мембране и
снижается поток энергии света в ФСП (см. рис. 3.27).
3.6.3. ПЛАСТОХИНОНЫ — ПОДВИЖНЫЕ ПЕРЕНОСЧИКИ
ЭЛЕКТРОНОВ ЭТЦ ФОТОСИНТЕЗА
Липорастворимые пластохиноны переносят электроны от комплекса ФСП
к цитохромному ^/-комплексу. Они участвуют также в переносе электронов
от ФС1 к цитохромному комплексу в ходе циклического транспорта электро-
нов. Перенос осуществляется пулом пластохинонов: на один реакционный
центр ФС1 приходится 10—14 молекул пластохинона. При циклическом транс-
порте электронов в ФС1 перенос электронов на пул пластохинонов происхо-
дит от восстановленного ферредоксина при участии особого фермента — фер-
редоксинхинон-оксидоредуктазы (FQR). При нециклическом переносе электро-
нов связь комплекса ФСП с пулом PQ осуществляет вторичный переносчик
электронов ФСП — пластохинон QB. После полного восстановления он покида-
ет центр связывания на белке D1 ФСП в форме пластохинола QBH2 и оказыва-
ется в билипидном слое мембраны, а освободившееся место занимает пласто-
хинон из пула.
Перенос электронов пластохинонами сопряжен с трансмембранным пере-
носом протонов (см. с. 178, здесь Q-цикл), поэтому пластохиноны являются своеоб-
разной «протонной помпой», осуществляющей трансмембранный перенос про-
тонов из стромы хлоропластов в люмен. Энергия сформированного при этом
электрохимического градиента протонов используется затем на синтез АТФ.
Пул пластохинонов служит электронным буфером ЭТЦ хлоропластов, спо-
собным до определенных пределов концентрировать электроны, поступающие
из ФСП. Это позволяет поддерживать функциональный баланс между двумя
фотосистемами в условиях, когда скорость поступления электронов от ФСП
превышает скорость их оттока в ФС1 (например, при световых условиях, бла-
гоприятных для ФСП, или в отсутствие достаточного количества окисленного
НДДФ+).
179
3.6.4. КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ РАБОТЫ ЭТЦ.
РЕГУЛЯЦИЯ ЭЛЕКТРОННОГО ТРАНСПОРТА
Z-схема фотосинтеза предполагает взаимодействие двух фотосистем и их
согласованную работу. Координация работы фотосистем достигается, во-пер-
вых, благодаря определенному соотношению функциональных комплексов и
низкомолекулярных компонентов ЭТЦ в мембране, а во-вторых, кинетиче-
скими закономерностями работы отдельных участков цепи.
3.6.4.1. Кратковременная и долговременная адаптация
хлоропластов к условиям освещения
Оценка содержания функциональных компонентов мембран хлоропластов
показывает, что в среднем на 1 комплекс ФС1 приходится 1,5 — 1,8 комплексов
ФСП, 8 ССКП, 1,5 цитохром /^/-комплекса, 10—14 молекул пластохинона,
6 — 8 молекул пластоцианина и около 10 молекул ферредоксина. По-видимо-
му, при таком соотношении потоки электронов через комплексы выравнива-
ются и достигается оптимальная координация их работы. Значительное превы-
шение количества подвижных компонентов ЭТЦ над мультипептидными ком-
плексами указывает на возможность взаимосвязи нескольких электрон-транс-
портных цепей через мобильные компоненты ЭТЦ и обмена электронами между
ними. Кроме того подвижные компоненты, передвигаясь латерально, объеди-
няют пространственно разъединенные в мембранах тилакоидов фотосистемы.
Электрон-транспортная система хлоропластов динамична и меняется в зави-
симости от внешних условий. Это могут быть быстрые изменения, связанные с
перераспределением компонентов в мембране, — кратковременная адапта-
ция, либо более длительные, затрагивающие стехиометрию компонентов мемб-
ран — долговременная адаптация.
Интенсивность света и его спектральный состав — важнейшие внешние фак-
торы регуляции состояния системы транспорта электронов в хлоропластах. При
адаптации к условиям освещения существуют два основных пути достижения
баланса потоков электронов между двумя фотосистемами: первый — через из-
менение размеров антенн двух фотосистем, второй — через изменение биосин-
теза и соотношения двух фотосистем в мембранах хлоропластов. При кратковре-
менной адаптации (несколько минут), как правило, изменяется размер антенн
двух фотосистем (переход хлоропластов из состояния 1 в состояние 2 и обратно).
При длительной адаптации (несколько часов, суток) изменяются число и соот-
ношение фотосинтетических комплексов. Изменения в соотношении ФС1 и ФСП
связаны главным образом с изменением количества ФС1. При изменении усло-
вий освещения меняется также количество ССКП: при низких интенсивностях
света его содержание увеличивается. Сенсором, определяющим кратковремен-
ную и, по-видимому, долговременную адаптацию растений к условиям освеще-
ния, служит цитохромный ^/-комплекс, реагирующий на редокс-состояние ЭТЦ.
Динамичный механизм адаптации дает растениям значительное эволюци-
онное преимущество над фиксированным соотношением фотосистем в тила-
коидных мембранах и позволяет осуществлять преобразование энергии света с
высоким квантовым выходом при изменении внешних условий.
180
3.6.4.2. Кинетические характеристики реакций
переноса электронов в ЭТЦ
Исследования кинетических закономерностей работы ЭТЦ показывают,
что скорость транспорта электронов на отдельных участках ЭТЦхлоропластов
варьирует в широких временных пределах. Наиболее быстрые процессы прохо-
дят в реакционных центрах, где первичное разделение зарядов достигается за
1 — 3 пс. Перенос электронов на других участках ЭТЦ идет значительно мед-
леннее, чем в РЦ (за время порядка нано-, микро- и миллисекунд). Наиболее
медленная стадия переноса электронов (5 мс) находится на участке ЭТЦ меж-
ду двумя фотосистемами, она связана с окислением пластохинолов цитохром-
ным комплексом. На втором участке цепи, где скорость переноса электронов
также оценивается в миллисекундном интервале, происходит перенос элект-
ронов от восстановленного ферредоксина к НАДФ+. В связи с этим общая ско-
рость переноса электронов в ЭТЦ хлоропластов по нециклическому пути, оче-
видно, будет определяться скоростью потока электронов именно на этих двух
участках ЭТЦ — между двумя фотосистемами и на акцепторной стороне ФС1.
Различия в скорости транспорта электронов на отдельных участках связаны
с реализацией разных физических механизмов переноса электронов. В мультипеп-
тидных комплексах наиболее вероятен резонансный механизм, когда перенос
электрона от донора к акцептору предполагает резонансные взаимодействия
редокс-центров с белковой молекулой, при которых возникает эффект тунне-
лирования электрона через энергетический барьер. Скорость переноса элект-
ронов при этом определяется физическим контактом компонентов. Особое зна-
чение в этом случае приобретают электронно-конформационные взаимодей-
ствия в комплексах, создание особого конформационного состояния белка в
ходе окислительно-восстановительных реакций. Перенос электронов между
комплексами предполагает миграцию подвижных низкомолекулярных пере-
носчиков в мембране или по ее поверхности и осуществляется по диффузион-
ному механизму. Диффузионные процессы — более медленные, чем резонанс-
ные, поэтому именно они являются скорость-лимитирующими в ЭТЦ.
3.6.4.3. Механизмы регуляции электронного транспорта
в хлоропластах
Кинетические закономерности работы ЭТЦ лежат в основе регуляции транс-
порта электронов в хлоропластах. Рассмотрим некоторые механизмы регуля-
ции скорости переноса электронов на наиболее медленных участках ЭТЦ.
• Скорость окисления пластохинолов цитохромным комплексом в значитель-
ной степени регулируется величиной pH во внутритилакоидном пространстве.
При повышении концентрации Н+ в люменальном пространстве задерживает-
ся окисление QH2. Любые воздействия, снижающие концентрацию протона во
внутритилакоидном пространстве (АДФ + Фн, разобщители), будут увеличи-
вать скорость окисления пластохинола. В условиях in vivo выход протонов из
люмена осуществляется через АТФ-синтазный комплекс и сопровождается
синтезом АТФ из АДФ и Фн, отсюда понятно, что концентрации АДФ и Фн
(субстратов реакции синтеза АТФ) играют важную роль в регуляции процесса
окисления пластохинолов в хлоропластах.
181
• Скорость транспорта электронов на акцепторной стороне ФС1 определя-
ется концентрацией окисленного НАДФ+. Содержание НАДФ+ в хлоропластах
не велико, и необходим баланс между процессами его восстановления и окис-
ления. Главным потребителем НАДФН в хлоропластах является цикл ассими-
ляции углерода углекислого газа, поэтому от активности реакций метаболизма
углерода зависит скорость потока электронов в ЭТЦ хлоропластов. При недо-
статке НАДФ+ перенос электронов с восстановленного ферредоксина может
происходить либо по циклическому, либо по псевдоциклическому пути. Таким
образом, уровень окисленного НАДФ+ в хлоропластах не только задает ско-
рость нециклического потока электронов, но и влияет на соотношение раз-
личных путей транспорта электронов в хлоропластах.
• Возможность переноса электронов в ЭТЦ в значительной степени связана
средокс-состоянием переносчиков. Полная восстановленность всех редокс-цент-
ров, так же как и их полное окисление, приводит к ингибированию окисли-
тельно-восстановительных реакций в хлоропластах. Необходим баланс между
поступлением электронов в ЭТЦ и их использованием. Поэтому активность
работы ФСП, ее водоокисляющей системы, поставляющей электроны в ЭТЦ,
и активность углеродных циклов, использующих конечный акцептор электро-
нов НАДФН, — два фактора, определяющие в конечном счете редокс-состоя-
ние цепи. Электронным буфером в хлоропластах служит пул PQ, который до
определенных пределов может накапливать избыточные электроны, поступа-
ющие от ФСП и не используемые для восстановления НАДФ+.
Регуляцию окислительно-восстановительного состояния пула PQ в хлоро-
пластах помимо изложенных выше механизмов может осуществлять хлороды-
хание. Хлородыхание — это процесс транспорта электронов в хлоропластах,
сходный с дыхательным транспортом электронов митохондрий растений. Он
связан с работой двух ферментов, недавно обнаруженных в хлоропластах, —
НАД(Ф)Н-дегидрогеназным комплексом, гомологичным бактериальному комп-
лексу I, и альтернативной оксидазой, гомологичной альтернативной оксидазе
митохондрий растений (см. гл. 4). Первый фермент способен восстанавливать
пул пластохинонов за счет окисления НАД(Ф)Н, а второй окисляет пул PQ с
участием кислорода. Таким образом, в ходе хлородыхания происходит нефото-
химическое окисление и восстановление пула пластохинонов. Хлородыхание
стимулируется в условиях высокого уровня восстановленности пиридиннуклео-
тидов и пула PQ.
Уровень восстановленности пула пластохинонов играет важную регулятор-
ную роль в хлоропластах. От редокс-состояния пула пластохинонов и цитохром
/^/-комплекса зависят положение ССКП в мембранах хлоропластов и переход
хлоропластов из состояния 1 в состояние 2 и обратно. Кроме того редокс-состоя-
ние пула PQ является ключевым звеном в регуляции таких процессов, как транс-
крипция генов, кодирующих апопротеины реакционных центров ФС1 и ФСП,
а также cab генов, кодирующих апопротеины светособирающего комплекса.
3.6.4.4. Фотоингибирование. Механизмы защиты растений
от фотодеструкции в условиях высоких интенсивностей света
Модуляция размера антенн и изменения стехиометрии ФС1 и ФСП позво-
ляют растениям сохранять высокую и практически постоянную квантовую
182
эффективность фотосинтеза в довольно широких пределах интенсивности све-
та. Однако при высокой интенсивности света, когда поток световой энергии
превышает способности хлоропластов использовать ее в фото-химических ре-
акциях, квантовый выход фотосинтеза снижается. Это явление получило наз-
вание фотоингибирование. В основе фотоингибирования лежит снижение фото-
химической активности хлоропластов — вначале без значительного разруше-
ния пигментов и белков мембран, а при длительном действии высоких интен-
сивностей света, особенно в условиях стресса (например, при низких темпера-
турах), — фотоокисление пигментов и разрушение структур хлоропластов.
Наиболее чувствительным звеном фотосинтетического аппарата к действию
высоких интенсивностей света является ФСП. Это связано с рядом особенно-
стей ее структурно-функциональной организации, способствующих протека-
нию в ФСП фотоокислительных процессов. Во-первых, ФСП отличается боль-
шим размером светособирающего комплекса, что обеспечивает мощный по-
ток солнечной энергии в реакционный центр; во-вторых, фотохимическая
активность реакционного центра ФСП приводит к образованию очень сильно-
го окислителя П^о, в-третьих, в ФСП за счет процессов фотолиза воды созда-
ется высокая локальная концентрация молекулярного кислорода. В условиях
высокой инсоляции вероятность протекания фотоокислительных процессов в
ФСП увеличивается. Начальные процессы фотоингибирования совершаются в
реакционном центре ФСП. Они могут быть вызваны нарушениями в работе
ЭТЦ как с донорной, так и с акцепторной стороны фотосистемы П. Фотоин-
гибирование ФСП возникает вследствие появления в РЦ триплетных форм
хлорофилла и (или) активных окислителей (окисленных форм пигментов,
синглетного кислорода, свободных радикалов). Повреждение белков РЦ и фо-
тодеградация пигментов нарушают фотохимическую активность ФСП, иници-
ируют процессы фотодеструкции белка D1.
Кроме того, при высоких интенсивностях света на уровне ФС1 и ФСП уве-
личивается вероятность сброса электронов на кислород в ЭТЦ, что приводит к
образованию активных форм кислорода, способных вызвать повреждение пиг-
ментов и мембран.
Так, в комплексе ФС1 электроны от восстановленных [4Fe-4S] кластеров F^-,
и F£ могут быть направлены или на восстановление ФДОК с последующим
образованием НАДФН или, в случае недостатка НАДФ+ и окисленного ферре-
доксина, на восстановление О2 с образованием супероксиданион-радикала (О2),
перекиси водорода (Н2О2) и других активных форм кислорода, вызывающих
процессы оксидативной деструкции компонентов ЭТЦ и липидов мембран.
В растениях существует ряд механизмов защиты фотосинтетического аппа-
рата от повреждения в условиях высоких интенсивностей света.
1. Процессы дезактивации активных форм кислорода. Быстрое удаление О; в
центре его генерации достигается при участии фермента супероксиддисмутазы
(СОД) с образованием перекиси водорода, которая восстанавливается до Н2О
аскорбатспецифичной пероксидазой, при этом донором электронов является
аскорбат. Восстановление окисленного аскорбата (дегидроаскорбата) осуществ-
ляет фермент дегидроаскорбатредуктаза с использованием восстановленного глу-
татиона.
2. Тушение триплетных возбужденных состояний хлорофилла и выскореактив-
ного синглетного кислорода ,О2 каротиноидами (см. с. 143).
183
3. Процессы, предотвращающие поступление избыточной энергии света в реак-
ционные центры.
• рассеивание избыточной энергии в виде тепла с участием зеаксантина,
образующегося в реакциях виолаксантинового цикла (см. с. 144);
• переход хлоропластов из состояния 1 в состояние 2 и активация цикличе-
ского потока электронов в ФС1 (с. 153);
• активация циклического транспорта электронов в ФСП с участием цито-
хрома 6559.
4. Репарация поврежденных комплексов. Благодаря системе репарации белка
D1 возможно восстановление поврежденных комплексов ФСП.
3.7. ФОТОЭНЕРГЕТИЧЕСКИЕ РЕАКЦИИ ХЛОРОПЛАСТОВ
Важнейшей функцией ЭТЦ хлоропластов является ее энергетическая функ-
ция — накопление солнечной энергии в форме соединений с высоким энерге-
тическим потенциалом. Свободная энергия, освобождаемая в реакциях фото-
синтетического транспорта электронов, запасается частично в форме восста-
новленных кофакторов (ФДВОССТ, НАДФН), большая часть поглощенной энер-
гии используется для синтеза АТФ. Процессы образования этих соединений
составляют основу биоэнергетики живых систем.
В 1954 г. Д.Арнон впервые показал, что хлоропласты при освещении спо-
собны синтезировать АТФ. Этот процесс, сопряженный с транспортом элект-
ронов в хлоропластах, получил название «фотосинтетическое фосфорилирова-
ние». Количество энергии, необходимой для синтеза молекулы АТФ, опреде-
ляется потенциалом переноса фосфорильной группы и может быть описано
уравнением
АТФ
А бдтФ = A G° +1,361g-,
(АДФ)(ФН)
где AG° — стандартная свободная энергия гидролиза АТФ, равная -30,4 кДж/моль,
или -0,34 эВ на молекулу. В хлоропластах, по данным ряда авторов, А(7атф =
= 56,4 кДж/моль.
Источником свободной энергии для синтеза АТФ в хлоропластах является
изменение свободной энергии в окислительно-восстановительных реакциях ЭТЦ.
Энергия фотовозбужденного пигмента в реакционных центрах используется
для разделения зарядов и запасается в форме окислительно-восстановитель-
ной энергии (Клейтон, 1984). В системе с разделенными зарядами электрон,
удаленный от ядра при поглощении энергии кванта, обладает более высоким
энергетическим потенциалом, который может быть реализован при обратном
движении электрона через ряд переносчиков в сторону более электроположи-
тельных компонентов (по градиенту редокс-потенциала). При этом освобожда-
ется энергия, количество которой определяется разностью редокс-потенциа-
лов реагирующих систем и может быть рассчитано по формуле
А(7° = -nF&Е
где AG” — стандартное изменение свободной энергии (кДж/моль); п — число
электронов, участвующих в реакции; F— число Фарадея (96,4 кДж • В-1 • моль-1),
184
&Eq — разность стандартных окислительно-восстановительных потенциалов
реагирующих систем.
Расчеты показывают, что для образования макроэргической связи АТФ до-
статочна разность окислительно-восстановительного потенциала донора и ак-
цептора электрона в 0,25 В.
3.7.1. ФОТОСИНТЕТИЧЕСКОЕ ФОСФОРИЛИРОВАНИЕ.
ОСНОВНЫЕ ТИПЫ, ИХ ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Различают два основных типа фотофосфорилирования — циклическое, со-
пряженное с циклическим потоком электронов в ЭТЦ, и нециклическое, сопря-
женное с нециклическим потоком электронов от Н2О к НАДФ+. Разновидно-
стью нециклического типа является псевдоциклическое фотофосфорилирование, при
котором акцептором электоронов, мобилизованных из воды, служит кислород.
Физиологическое значение отдельных типов фотофосфорилирования различно.
Циклическое фотофосфорилирование — один из наиболее древних процессов
запасания солнечной энергии в форме АТФ. Система включает циклическую
редокс-цепь, сопряженную с ФС1 (см. рис. 3.33). Электроны от возбужденного
П700 и восстановленного Fe-S-центра с высоким отрицательным потенциалом
(-0,7 В) через отдельные переносчики (ФД, PQ, цитохром /^/-комплекс и
пластоцианин) возвращаются обратно к Пда (+0,52 В), и в итоге вся освобож-
даемая при этом окислительно-восстановительная энергия запасается в форме
АТФ. Процесс циклического фотофосфорилирования не сопровождается ни
выделением О2, ни синтезом восстановленных кофакторов (НАДФН) и может
быть представлен уравнением
Av
АДФ + Н3РО4 АТФ + Н2О
Естественными кофакторами циклического фотофосфорилирования явля-
ются ФД, ФМН, хиноны. Искусственным кофактором циклического фото-
фосфорилирования, широко применяемым в современных исследованиях,
служит феназинметосульфат (ФМС), растворимый в липидах переносчик элек-
тронов и протонов. ФМС, восстановленный на наружной стороне мембраны
компонентами акцепторного комплекса ФС1 и протонированный, передвига-
ется через липидный матрикс мембраны во внутритилакоидное пространство,
где отдает электроны на пластоцианин или непосредственно на П700, при этом
протоны освобождаются и участвуют в генерации протонного градиента.
Циклическое фотофосфорилирование играет важную роль в различных ме-
таболических процессах клетки. Оно служит источником дополнительного снаб-
жения АТФ для восстановления СО2 в цикле Кальвина и ассимиляции ионов
NH4, требующих высокого отношения АТФ/НАДФН, а также источником
энергии для процессов синтеза белков и полисахаридов. У группы С4-растений
в клетках обкладки циклическое фотофосфорилирование является единствен-
ным источником АТФ. Исследования с использованием акустических методов
показали увеличение активности циклического фотофосфорилирования и его
защитную роль в стрессовых условиях (тепловой и солевой стрессы, фотоинги-
бирование).
185
Нециклическое фотофосфорилирование, открытое Д.Арноном в 1957 г., со-
пряжено с нециклическим потоком электронов от воды к НАДФ+. Нецикли-
ческий тип фотофосфорилирования — эволюционно более поздний процесс,
требующий совместного действия ФС1 и ФСП. Энергия света, поглощаемая
двумя фотосистемами, преобразуется не только в форму макроэргических свя-
зей АТФ, но также в химический потенциал восстановленного НАДФН и
молекулярного кислорода:
Av
АДФ + Н3РО4 + НАДФ+ + Н2О — АТФ + НАДФН + Н+ + ’/2О2
Определение нециклического фотофосфорилирования позволяет учесть ко-
личество не только молекул АТФ, образующихся в ходе опыта, но и количество
перенесенных при этом электронов. Величина отношения Р/2е_ — важный по-
казатель при исследовании процесса нециклического фотофосфорилирования,
позволяющий судить о степени сопряжения процессов фотофосфорилирова-
ния с транспортом электронов в ЭТЦ в зависимости от условий эксперимента.
Физиологическое значение нециклического фотофосфорилирования опре-
деляется его ведущим вкладом в общую энергетику клетки. Нециклическое
фотофосфорилирование является не только основным источником энергии
для эндэргонических реакций, протекающих в растительной клетке. В ходе это-
го процесса образуются другие очень важные метаболиты и в первую очередь
высоковосстановленные соединения — Fe-S-белки (-0,7 В), ФДВОССТ (-0,43 В),
НАДФН (-0,32 В), необходимые для восстановления СО2 в углеродных циклах
и образования ряда регуляторных систем (ФД-тиоредоксин-регуляторная си-
стема, медиаторы действия света).
3.7.2. МЕХАНИЗМ СОПРЯЖЕНИЯ ЭЛЕКТРОННОГО ТРАНСПОРТА
С ФОРМИРОВАНИЕМ ТРАНСМЕМБРАННОГО ГРАДИЕНТА
ЭЛЕКТРОХИМИЧЕСКОГО ПОТЕНЦИАЛА
Важнейшим интермедиатом в реакциях превращения энергии в биологи-
ческих системах является трансмембранный градиент электрохимического по-
тенциала. В соответствии с хемиосмотической теорией П. Митчелла и развивае-
мой в настоящее время ротационной теорией П. Бойера АТФ синтезируется в
хлоропластах в результате сложного комплекса сопряженных процессов: транс-
порта электронов, генерации электрохимического потенциала и преобразова-
ния его энергии в серии конформационных изменений отдельных субъединиц
сопрягающего комплекса, передачи конформационных сигналов в каталити-
ческие центры.
Механизм сопряжения электронного транспорта с генерацией электрохи-
мического потенциала рассматривается в настоящее время в рамках хемиосмо-
тической теории Митчелла (теории протонного сопряжения), сформулирован-
ной в 1961 г. и развитой в последующие годы (1966). Теория Митчелла включает
два основных положения: 1) энергия, освобождаемая в редокс-реакциях, пер-
вично запасается в форме протонного градиента (АрН); 2) признается необхо-
димость сопрягающей мембраны, непроницаемой для Н+. При работе ЭТЦ
сопряженно с транспортом электронов происходит энергозависимый перенос
186
протонов через гидрофобный слой мембраны из стромы в люмен, направлен-
ный против электрического и концентрационного градиента.
Сопрягающей мембране в теории Митчелла отводится ведущая роль в про-
цессе фотофосфорилирования. Благодаря тому, что мембрана непроницаема
для протонов, может быть создана разность свободных энергий в двух водных
фазах, разделенных мембраной. Тилакоидная мембрана ориентирует комплек-
сы, участвующие в транспорте электронов, таким образом, что создается век-
торный поток электронов и протонов через мембрану. В результате сопряжен-
ных процессов переноса электронов (на стромальную поверхность мембраны)
и Н (внутрь тилакоидов) возникает градиент протонов (ДрН), который слу-
жит источником энергии для синтеза АТФ. Значительный вклад в суммарное
значение разности энергий двух фаз, разделенных мембраной (строма, лю-
мен), дает образующийся при работе ЭТЦ электрический мембранный потен-
циал. Электрическое поле на мембране образуется в течение 10 мс при первич-
ном фотохимическом разделении зарядов.
В результате определенного расположения и взаимодействия участников
редокс-реакций в мембране редокс-энергия непосредственно преобразуется в
энергию электрохимического потенциала (Дцн+), который представляет собой
сумму электрической (Ду) и осмотической (ДрН) энергии и является источ-
ником свободной энергии для клетки:
Дцщ = -2,37?ТДрН + ТДу.
Электрохимический трансмембранный градиент Дцщ формируется в резуль-
тате сопряжения электрогенных и протолитических реакций при работе ЭТЦ.
В нециклическом фотофосфорилировании известны три электрогенные реак-
ции, в результате которых происходит перенос электронов с внутренней на
наружную, стромальную поверхность мембраны с запасанием энергии в фор-
ме электрического мембранного потенциала. Две реакции имеют место в реак-
ционных центрах ФС1 и ФСП. Они связаны с быстрым переносом электрона
от фотовозбужденного пигмента к конечному компоненту акцепторного ком-
плекса, локализованному на стромальной поверхности мембраны. Одна, мед-
ленная электрогенная реакция связана с работой Q-цикла, с переносом элек-
трона от молекулы PQH2, окисляемой Fe-S-белком Риске, к высокопотенци-
альному цитохрому bf,.
При работе ЭТЦ электрогенные реакции сопряжены с протолитическими.
В реакциях трансмембранного переноса протонов из стромального простран-
ства в люменальное значительная роль принадлежит цитохромному ^/-комп-
лексу. При окислении пластохинола в центре Qz цитохромного комплекса уда-
ление двух электронов из молекулы PQH2 сопряжено с освобождением двух
Н , которые поступают в люмен, а окисленный пластохинон может быть сно-
ва восстановлен в QB центре (ФСП) или Qc-центре (цитохромный ^/-комп-
лекс) на стромальной стороне мембраны с использованием двух протонов из
стромы. Другая реакция образования протонного градиента обусловлена про-
цессом фотоокисления воды ФСП, в результате которого при разложении двух
молекул Н2О выделяется молекулярный кислород, электроны поступают в ЭТЦ,
а в люменальное пространство высвобождаются четыре протона. Перенос про-
тонов через мембрану происходит также при циклическом транспорте элект-
ронов вокруг ФСП при участии цитохрома д559.
187
Таким образом, энергия, освобождаемая при переносе электронов в от-
дельных участках ЭТЦ, преобразуется в осмотическую и электрическую энер-
гию градиента электрохимического потенциала.
Градиент электрохимического потенциала, согласно ротационной теории
П. Бойера (1993, 1997), служит источником энергии для конформационных
изменений белков АТФ-синтазного комплекса СРо-СРь в результате которых
в каталитическом центре сопрягающего фактора I (CFi) образуется молекула
АТФ из АДФ и Фн.
3.7.3. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
И МЕХАНИЗМ РАБОТЫ АТФ-СИНТАЗНОГО КОМПЛЕКСА
Рентгеноструктурные и генетические исследования, проведенные в послед-
ние годы, позволили выяснить пространственную организацию АТФ-синтаз-
ного комплекса, предполагаемая структура которого дана на рис. 2.2 (см. гл. 2).
АТФ-синтаза хлоропластов представляет собой мембранно-связанный бел-
ковый комплекс, который можно разделить на две части — CF0 и CF,. Сопря-
гающий фактор CF0 — это интегральный гидрофобный белок мембраны, вы-
полняющий функцию протонного канала. У высших растений CF0 состоит из
4 типов субъединиц: субъединица I осуществляет связь CF0 с CF,; субъеди-
ница II организует 12 копий субъединицы III, которые образуют олигомерное
кольцо и, взаимодействуя с субъединицей IV, обеспечивают транслокацию Н
из люмена в строму. Стехиометрический состав CF0:Ib IIb III12, ГУ, У Escherichia
coli Fo (гл. 2, рис. 2.2) состоит из трех типов субъединиц: а,, Ьь Ь'ь С9_12.
Сопрягающий фактор 1 (CF,), водорастворимый белковый комплекс на
стромальной поверхности мембраны, состоит из 5 типов субъединиц в соотно-
шении а3, р3, у, б, е. CF] содержит три каталитических центра синтеза АТФ,
расположенных на трех Р-субъединицах, и выполняет также структурную функ-
цию, закрывая протонный канал мембраны. При удалении CFi с поверхности
мембраны (обработкой растворами ЭДТА, бромида натрия) хлоропласты те-
ряют способность к фосфорилированию, что обусловлено не только удалени-
ем структур, несущих каталитические центры, но также увеличением протон-
ной проводимости мембран и потерей их способности сохранять протонный
градиент.
Три пары субъединиц аир образуют гексамер (ар)3, который содержит
каталитические и регуляторные центры. Субъединицы у и е формируют «ствол»
АТФ-синтазы и играют ведущую роль в энергетическом сопряжении процес-
сов транслокации протонов и работы каталитических центров. При вращении
субъединиц у и е в ходе катализа конформационные сигналы передаются на
пары субъединиц ар. В результате этого происходит захват нуклеотидов (АДФ),
синтезируется АТФ и высвобождается ранее синтезированная молекула АТФ.
Центральную роль в каталитическом процессе играет у-субъединица. Регу-
ляция каталитической активности фермента осуществляется при участии ре-
докс-механизма, включающего обратимое окисление и восстановление дисуль-
фидной связи в у-субъединице CFj. Субъединица е выполняет также регулятор-
ную функцию: будучи ингибитором АТФазной активности CFb она осуществ-
ляет кинетический контроль активности фермента. Субъединица 8 участвует в
188
связи CF0 и CFp она ассоциирована с парой субъединиц а и р и с субъедини-
цами I и II.
В соответствии с ротационной теорией Бойера (ротационный механизм де-
тально описан в гл. 2, рис. 2.3) для нормального функционирования АТФ-
синтазы необходимо прочное сопряжение процессов транслокации протонов,
вращательного движения субъединиц в и у и взаимодействия их с (сф)3-гекса-
мером.
Согласно ряду исследований (М. Futai et al., 2000), субъединицы III и IV
(в CF0) образуют единый комплекс, в котором субъединица IV совместно с
субъединицами I, II и 8 функционирует как статор, удерживающий (оф)3-
гексамер, а 12 субъединиц III служат основанием ротора, сопряженным с субъ-
единицами у и е. При транслокации протонов через каналы субъединицы IV и
последовательном протонировании и депротонировании карбоксильной груп-
пы аминокислоты (аспарагин-61) в каждой из 12 субъединиц III происходит
вращение олигомера III с последующим переносом протона в стромальное про-
странство. Движущей силой движения Н+ является трансмембранная разность
протонных потенциалов в люмене (высокий) и строме (более низкий). Враща-
тельное движение олигомера III благодаря аминокислотным контактам сопря-
жено с вращением субъединицу и в. Это вызывает их конформационные изме-
нения с последующей передачей конформационных сигналов в каталитиче-
ские центры субъединиц р благодаря взаимодействию а-спиралей субъединиц
у с тремя субъединицами р.
Таким образом, в результате взаимодействия CF0 и CF, осуществляется
передача конформационных сигналов, индуцированных транслокацией про-
тонов через мембрану при участии субъединиц III и IV. Функциональное со-
пряжение между субъединицами осуществляется за счет ионизированных остат-
ков аминокислот.
Структурная организация каталитических центров CF, исследована мето-
дом рентгеноструктурного анализа. Показано, что три р-субъединицы имеют
неодинаковую конформацию и их каталитические центры связывают разные
нуклеотиды. Один из центров содержит АТФ (ртф), другой — АДФ (Рдф), а в
третьем нуклеотида нет (рЕ). Каталитические центры р-субъединиц, связанных
с нуклеотидами (АТФ и АДФ), находятся в закрытой конформации, а центры
р-субъединиц, не связанных с нуклеотидами, — в открытой конформации.
При функционировании фермента имеет место переход от закрытой к откры-
той конформации рЕ.
Основу гипотезы Бойера составляет идея кооперативности работы катали-
тических центров, согласно которой каждый из трех каталитических центров
последовательно проходит через три различных конформационных состояния
втечение каталитического цикла (П. Бойер, 1993). Нуклеотидсвязывающие цент-
ры р-субъединиц в ходе катализа взаимодействуют сопряженно и кооператив-
но. Последовательная передача конформационных изменений от одних цент-
ров к другим осуществляется путем изменения ориентации боковых цепей
аминокислот в каждом каталитическом центре.
Механизм работы каталитических центров включает ряд этапов. Фермент
содержит три кооперативно функционирующих каталитических центра. Кон-
станта связывания субстратов (АДФ + Фн) и продуктов реакции (АТФ) в каж-
дом центре изменяется в ответ на энергозависимые конформационные изме-
189
Треонин-156
НО—Р-гО О—Р„-О—Р—О—Аденозин
। V___Р г
оч zo о
'н н'
N
Лизин-155
Рис. 3.39. Синтез АТФ в каталитическом центре АТФ-синтазы
на р-субъединипс CF[ (по Futai et al., 2000, с изменениями)
нения фермента. Изменения идут последовательно: первый этап — непрочное
связывание АДФ и Фн (L-состояние), второй этап — прочное связывание суб-
стратов с образованием АТФ и выделением Н2О (Т-состояние), третий этап —
энергозависимое освобождение прочносвязанной молекулы АТФ и свободная
диссоциация АТФ (О-состояние) (см. рис. 2.3, гл. 2).
Главными участниками в реакциях синтеза АТФ в каталитических центрах
являются фосфатная группа АДФ, неорганический фосфат и ион магния,
образующий координационную связь с одной из аминокислот каталитиче-
ского центра (рис. 3.39) В реакции синтеза АТФ р-фосфат АДФ и неоргани-
ческий фосфат образуют связь с аминогруппой лизина-155, а также с магнием
при участии треонина-156. В ходе катализа в результате конформационных
изменений каталитического центра между р-фосфатом молекулы АДФ и
неорганическим фосфатом возникает фосфоэфирная связь и синтезируется мо-
лекула АТФ. Ангидридная связь при синтезе АТФ не требует специальных
затрат энергии и образуется в результате резкого уменьшения константы рав-
новесия реакции, обусловленного изменением микроокружения активного
центра.
Согласно теории Бойера, энергия Ацщ используется для конформационных
преобразований структур каталитического центра АТФ-синтазы, в результате
которых изменяются константы связывания нуклеотидов. Это завершается син-
тезом АТФ из АДФ и Фн и освобождением молекулы АТФ из активного центра
фермента.
3.8. МЕТАБОЛИЗМ УГЛЕРОДА ПРИ ФОТОСИНТЕЗЕ
Фиксация углерода углекислого газа и восстановление его до уровня орга-
нических соединений — заключительный этап фотосинтеза. Реакции ассими-
ляции углерода получили название темновых реакций фотосинтеза. Однако в
настоящее время установлено, что для их прохождения необходим свет, по-
этому заключительный этап фотосинтеза принято сейчас называть метаболиз-
мом углерода при фотосинтезе, или углеродными циклами фотосинтеза. При ас-
190
симиляции углерода используются продукты световой стадии фотосинтеза —
АТФ и НАДФН.
Фиксация углекислого газа из атмосферы и включение его в органические
соединения у разных групп растений может происходить по-разному. В соответ-
ствии с механизмом первичных реакций фиксации углекислого газа и приро-
дой образующихся при этом первых стабильных продуктов различают: С3-путь
фотосинтеза, С4-путь фотосинтеза и фотосинтез по типу толстянковых —
САМ-фотосинтез (от crassulacea acid metabolism). Восстановление углерода уг-
лекислого газа до уровня углеводов практически у всех фотосинтезирующих
организмов происходит по единому пути, называемому восстановительным пен-
тозофосфатным циклом (ВПФ-цикл). ВПФ-цикл — основной путь ассимиля-
ции углерода в растениях.
3.8.1. Сз-ПУТЬ ФОТОСИНТЕЗА (ЦИКЛ КАЛЬВИНА, ВПФ-ЦИКЛ)
С3-путь фотосинтеза был открыт в лаборатории М. Кальвина (1946—1956)
при изучении фотосинтеза у одноклеточных зеленых водорослей с использо-
ванием меченого углерода и фосфора. Анализ динамики включения метки в
органические соединения показал, что первыми органическими соединения-
ми, содержащими меченый углерод, являются трехуглеродные соединения —
3-фосфоглицериновая кислота (3-ФГК) и 3-фосфоглицериновый альдегид
(3-ФГА) (отсюда название «С3-путь фотосинтеза»). Позже метка обнаружива-
ется в углеводах, содержащих от 4 до 7 атомов углерода. М. Кальвину с сотр.
удалось установить последовательность превращения углеводов в хлоропластах.
На основании этого был открыт восстановительный пентозофосфатный цикл
углерода, названный в честь исследователей циклом Кальвина.
Химизм цикла Кальвина. Выделяют три стадии ассимиляции углерода в цик-
ле Кальвина: карбоксилирование, восстановление и регенерацию (рис. 3.40). Все
ферменты, осуществляющие фиксацию углерода углекислого газа и его вос-
становление до сахаров в цикле Кальвина, находятся в строме хлоропластов.
1. Стадия карбоксилирования. Молекулы углекислого газа воздуха присое-
диняются к 5-углеродному сахару — рибулозо-1,5-бисфосфату (РуБФ). В ре-
зультате карбоксилирования РуБФ образуется нестойкое 6-углеродное соеди-
нение, которое распадается на 2 молекулы 3-фосфоглицериновой кислоты
(3-ФГК) (рис. 3.41). Реакцию карбоксилирования осуществляет фермент рибуло-
зобисфосфаткарбоксилаза (РуБФ-карбоксилаза). Фермент кроме карбоксилаз-
ной активности может проявлять оксигеназную активность (см. ниже), поэто-
му полное название фермента — рибулозобисфосфаткарбоксилазаоксигеназа
(4.1.1.39), или сокращенно Рубиско.
Рубиско высших растений и зеленых водорослей — один из наиболее
высокомолекуляных белков на Земле: его молекулярная масса 560 кДа. Он со-
стоит из 8 больших (L) (55 кДа) и 8 малых (S) (15 кДа) субъединиц. Большие
субъединицы кодируются геном хлоропластов (rbcL), малые — ядерным геном
(rbcS). Сборка белка проходит в хлоропластах с участием «белка-няньки» (бе-
лок 60 кДа), который кодируется в ядре. Поэтому для сборки функционально
активного фермента в хлоропластах необходима согласованная работа двух ге-
номов.
191
З-Фосфоглицериновая 1,3-Дифосфоглицериновая
кислота (3-ФГК)
зн2о СООН
I
ЗСО2 6НС-ОН
6АТФ
З-Фосфоглицериновый
н2с—о©
с=о
з X нс-он
нс-он
ЗАТФ
н2с-он
с=о
Рибулозо-
1,5-бисфосфат
3 X нс-он
нс-он
6 НАДФН
нс=о
нс-он
нс-он
кислота
соо©
6НС-ОН
нс-он
н2с-о@
Рибозо-5-фосфат
нс-он
Н2О
нс-он
нс-он
н2с-он
2 X С=О
Н2С-О©
н2с-он
с=о
Рибулозо-5-фосфат
н2с-он
с=о
2 X НС-ОН
нс-он
н2с—о©
Ксилулозо-5-фосфат
альдегид (3-ФГА)
нс=о
6НО-СН
н2с- о©
Дигидроксиацетон-
фосфат (ДГАФ)
нс-он
н2с-о©
Седогептулозо-
7-фосфат
Метаболический пул
нс-он
н2с-о©
с=о
нс=о
нс-он
нс-он
нс-он
н2с-о©
Эритрозо-4-фосфат
н2с-о©
с=о
нс-он
н2с-о©
Фруктозо-
1,6-бисфосфат
Н2О
нс-он
нс-он
нс-он
нс-он
н2с-о@
Седогсптулозо-
1,7-бисфосфат
нс-он
нс-он
нс-он
н2с-о©
Фруктозо-
6-фосфат
н2с-он
с=о
Рис. 3.40. Восстановительный пентозофосфатный цикл (цикл Кальвина)
Н2С-ОРО2’
с=о
нс-он
нс-он
Н2С-ОРО32
РуБФ
Оксигеназа
COO
Mg
Фосфогликолат
Н2С-ОРОз"
coo
Гликолат
н2с-он _
СОО _
Фотодыхание
Mg
14co2
Карбоксилаза
нс-он
Н2С-ОРО2-
14 coo
Фотосинтез
нс-он
Н2С-ОРО32’
3-ФГК
Рис. 3.41. Основные функции РуБФ-карбоксилазы-оксигсназы
Каталитический центр фермента формируют аминокислотные остатки С- и
N-концов полипептидов двух больших соседних субъединиц. Таким образом,
функционально активной структурной единицей фермента является димер
больших субъединиц. В Рубиско высших растений имеется 8 каталитических
центров, сформированных 8 большими субъединицами. Малые субъединицы
играют регуляторную роль, влияя на каталитическую активность больших субъ-
единиц фермента.
Субстратом карбоксилазной активности фермента является СО2. Присоеди-
нение молекулы углекислого газа требует ионов Mg +. Оптимум pH реакции
карбоксилирования около 8,0. Оксигеназная активность Рубиско заключается в
окислении РуБФ путем включения в сахар кислорода. В результате образуются
3-ФГК и фосфогликолат (см. рис. 3.41). Эта реакция лежит в основе процесса
фотодыхания (см. далее), снижающего синтез углеводов при фотосинтезе
Карбоксилазная и оксигеназная реакции связаны с работой одних и тех же
каталитических центров фермента, вследствие чего существует конкуренция
между кислородом и углекислым газом за каталитический центр. При обычном
содержании кислорода и углекислого газа в воздухе в среднем на три реакции
карбоксилирования приходится одна реакция оксигенирования. Увеличение
относительного содержания углекислого газа способствует карбоксилазной
активности фермента. Рубиско является ключевым ферментом цикла Кальви-
на, поэтому регуляция его активности — важнейший фактор регуляции цикла
Кальвина в целом (см. ниже).
2. Стадия восстановления. Восстановление 3-фосфоглицериновой кислоты
(3-ФГК) до 3-фосфоглицеринового альдегида (3-ФГА) — вторая стадия цик-
ла Кальвина. Она осуществляется в два этапа. На первом этапе происходит
фосфорилирование 3-ФГК и образование 1,3-бисфосфоглицериновой кисло-
ты. Реакцию осуществляет фермент фосфоглицерокиназа (ЕС 2.4.2.3) при ис-
пользовании АТФ. На втором этапе при участии НАДФН и фермента глице-
ральдегид 3-фосфатдегидрогеназы (ЕС 1.2.1.13) идет восстановление 1,3-бис-
фосфоглицериновой кислоты до 3-ФГА. В стадии восстановления достигается
восстановленность углерода до уровня углеводов. 3-ФГА и его изомер дигид-
7 Физиология растений
193
роксиацетонфосфат (ДГАФ), в который он легко превращается под действием
фермента 3-ФГА-изомеразы (ЕС 5.3.1.1), являются первыми моносахарами,
образующимися при фотосинтезе в ходе цикла Кальвина.
Молекулы 3-ФГА (или его изомера ДГАФ) могут быть использованы для
регенерации РуБФ — акцептора углекислого газа и экспортированы из хло-
ропластов в цитоплазму. В цитоплазме автотрофной клетки из триоз синтезиру-
ются гексозы (глюкоза и фруктоза) и дисахарид сахароза — главная транспорт-
ная форма углеводов в растении.
3. Стадия регенерации. На этой стадии происходит регенерация акцептора
углекислого газа РуБФ. В ходе реакций образуются различные углеводы с числом
углеродных атомов 4, 5, 6 и 7. Чтобы проследить весь цикл преобразования
углеродных скелетов в цикле Кальвина, необходимо представить фиксацию как
минимум трех молекул СО2 с использованием трех молекул рибулозо-1,5-бис-
фосфата. В этом случае после стадии карбоксилирования получаются 6 молекул
3-ФГК, а после их восстановления — 6 молекул 3-ФГА. При этом используют-
ся 6 молекул АТФ и 6 молекул НАДФН. Пять молекул 3-ФГА используются
для регенерации трех молекул РуБФ, а шестая молекула 3-ФГА может быть
выведена из цикла и транспортирована в цитоплазму автотрофной клетки.
В реакциях регенерации РуБФ одна молекула 3-ФГА взаимодействует с ДГАФ
с образованием фруктозе-1,6-бисфосфата (фермент фруктозобисфосфатальдо-
лаза, 4.1.2.7), который дефосфорилируется с образованием фруктозо-6-фос-
фата (фермент фруктозобисфосфатаза, 3.1.3.11). Последний взаимодействует с
3-ФГА с образованием ксилулозо-5-фосфата и эритрозо-4-фосфата (фермент
транскетолаза, активный только в присутствии тиаминпирофосфата — ТПФ).
Эритрозо-4-фосфат реагирует с ДГАФ, образуя седогептулозе-1,7-бисфосфат
(фермент альдолаза), который затем дефосфорилируется до седогептулозо-7-
фосфата (фермент седогептулозобисфосфатаза), который далее взаимодействует
с 3-ФГА с образованием ксилулозо-5-фосфата и рибозо-5-фосфата (фермент
транскетолаза). Две молекулы ксилулозо-5-фосфата подвергаются эпимериза-
ции по третьему атому углерода (фермент эпимераза) и превращаются в 2 моле-
кулы рибулозо-5-фосфата. Рибоза-5-фосфат изомеризуется также в рибулозо-
5-фосфат (фермент рибозофосфатизомераза). Таким образом, в ходе трансаль-
долазных и транскетолазных реакций углеродные скелеты перестраиваются и в
результате образуется 3 молекулы рибулозо-5-фосфата. Заключительная стадия
регенерации акцептора углекислого газа — фосфорилирование трех молекул
рибулозо-5-фосфата с образованием трех молекул рибулозо-1,5-бисфосфата.
Реакцию катализирует фермент фосфорибулокиназа (2.7.1.19). При этом ис-
пользуются 3 молекулы АТФ. В итоге вновь образуются 3 молекулы РуБФ. Три-
оза, не использованная для регенерации РуБФ, является продуктом фотосин-
теза, который может пойти на синтез гексоз и более высокомолекулярных
углеводов как в самом хлоропласте, так и в цитоплазме автотрофной клетки.
Итак, фиксация трех молекул СО2 и синтез одной молекулы триозы в цик-
ле Кальвина потребовали 6 молекул НАДФН и 9 молекул АТФ, т. е. для асси-
миляции одной молекулы углекислого газа по С3-пути фотосинтеза необходи-
мо 2 молекулы НАДФН и 3 молекулы АТФ.
Регуляция цикла Кальвина. Система регуляции цикла Кальвина сложно
организована и включает метаболический, энергетический и генетический
контроль. В основе регуляции лежит возможность изменения направления и
194
скорости протекания биохимических реакций цикла. Это реализуется, во-пер-
вых, за счет изменения каталитической активности ферментов, а во-вторых,
за счет влияния метаболитов и коферментов на протекающие процессы по
принципу действия масс. Транспорт метаболитов из хлоропластов становится
при этом важнейшим фактором регуляции метаболизма углерода.
Регулируемыми, как правило, являются ферменты, катализирующие «не-
обратимые» реакции, т.е. реакции, в ходе которых имеет место значитель-
ный отрицательный перепад свободной энергии. В цикле Кальвина «необрати-
мыми» являются 4 реакции: 1) карбоксилирование, катализируемое Рубиско
(РуБФ —*- 3-ФГК, Д(? =-41 кДж); 2 и 3) две реакции, связанные с работой
фосфатаз — фруктозе-1,6-бисфосфатазы (ФБФ —*- Ф6Ф, Дб' =-27,2 кДж) и
седогептулозе-1,7-бисфосфатазы (СБФ —*- С7Ф, Д(Р =-29 кДж); 4) фосфори-
лирование Ру5Ф, катализируемое фосфорибулокиназой (Ру5Ф —► РуБФ, &G' =
=-15,9 кДж). Кроме того, две реакции восстановительной стадии, катализируе-
мые ФГК-киназой и трифосфатдегидрогеназой (ФГК —*- 1,3-ДФГК —► ФГА)
при суммарной небольшой потере энергии в значительной степени подверже-
ны действию метаболитов и зависят от действия масс. Концентрации АДФ,
АТФ и ФГК оказывают значительное влияние на прохождение первой из этих
реакций и определяют направление ее протекания.
Важной особенностью «регулируемых» ферментов цикла Кальвина являет-
ся зависимость их активности от света. По крайней мере 5 ферментов цикла
Кальвина активируются светом: рибулозобисфосфаткарбоксилаза, триозофос-
фатдегидрогеназа, фруктозобисфосфатаза, седогептулозобисфосфатаза и фос-
форибулокиназа.
Контроль реакций цикла Кальвина светом включает ряд механизмов:
1) световые реакции фотосинтеза обеспечивают синтез АТФ и НАДФН —
соединений, непосредственно используемых в цикле Кальвина;
2) создание на свету в строме хлоропластов оптимальных для активности
ряда ферментов цикла Кальвина условий pH и концентрации ионов Mg +;
3) светозависимая ковалентная модификация ферментов цикла Кальвина
через систему тиоредоксина (см. рис. 3.1).
Своеобразная ковалентная и конформационная модификация светом про-
исходят в Рубиско:
1) на свету благодаря повышению концентрации магния в строме облегча-
ется присоединение молекулы СО2 и магния к регуляторному центру Рубиско;
карбамилизация фермента необходима для проявления его карбоксилазной
активности;
2) свет вызывает присоединение к Рубиско низкомолекулярного белка-ре-
гулятора активазы, который вытесняет из каталитического центра Рубиско
рибулозо-1,5-бисфосфат и его изомер ксилулозо-1,5-бисфосфат, прочно свя-
занные с каталитическим центром фермента в темноте и препятствующие при-
соединению к нему молекул углекислого газа и магния в отсутствие света.
Таким образом, световая активация цикла Кальвина включает ряд механиз-
мов, изменяющих каталитическую активность ферментов. Одни из них связаны
с ковалентными модификациями ферментов за счет восстановления дисуль-
фидных связей или карбамилизации аминогрупп, другие — вызывают некова-
лентные, конформационные изменения ферментов, обусловленные присое-
динением метаболитов или созданием оптимальных условий для активности
195
ферментов. Помимо этого свет контролирует содержание ферментов цикла
Кальвина на генетическом уровне. Установлено, что свет активирует экспрес-
сию генов малой субъединицы РуБФ-карбоксилаз-оксигеназы через фоторе-
цепторы красного и синего света (см. гл. 7).
3.8.2. С4-ПУТЬ ФОТОСИНТЕЗА (ЦИКЛ ХЭТЧА—СЛЭКА—КАРПИЛОВА)
С4-путь фотосинтеза был впервые обнаружен у двух тропических злаков —
кукурузы и тростника. В работах Ю. С. Карпилова (1965), М. Хэтча и К. Слэка
(1966) с использованием меченого углерода (14СО2) было показано, что пер-
выми продуктами фотосинтеза у этих растений являются органические кисло-
ты щавелевоуксусная и яблочная — соединения, содержащие 4 атома углерода
(отсюда название «С4-путь фотосинтеза»). Позже метка обнаруживалась в фос-
фоглицериновой кислоте и фосфоглицериновом альдегиде. Анализ динамики
включения метки в продукты фотосинтеза позволил определить последова-
тельность происходящих реакций и выявить цикл превращения углерода, от-
личный от цикла Кальвина, названный впоследствии циклом Хэтча—Слэка.
В цикле Хэтча—Слэка растения осуществляют первичную фиксацию углекисло-
ты через карбоксилирование фосфоенолпирувата (ФЕП) при участии фер-
мента ФЕП-карбоксилазы. Вслед за этим происходит синтез малата (или аспар-
тата) — промежуточных продуктов фиксации СО2, которые затем становятся
источниками углекислого газа для восстановительного пентозофосфатного цикла.
В цикле Кальвина у С4-растений, как и у С3-растений, восстанавливается угле-
род СО2 и синтезируются углеводы.
Для С4-растений характерна особая структура листа, так называемая кранц-
структура (рис. 3.42). В нем структурно и функционально различают клетки
обкладки и клетки мезофилла. Клетки обкладки крупные, плотно прилегают к
сосудам листа, хлоропласты в них могут не иметь гран, часто содержат зерна
крахмала. Клетки мезофилла мелкие, расположены рыхло; хлоропласты в них
всегда имеют граны, редко содержат крахмал. Клетки обкладки связаны с клет-
ками мезофилла множеством плазмодесм, благодаря чему между ними возмо-
жен активный обмен метаболитами. Рубиско — карбоксилирующий фермент
цикла Кальвина, найден в основном в хлоропластах клеток обкладки, тогда
Рис. 3.42. Анатомия листа
у С4-растений
как в клетках мезофилла обнаружен другой
карбоксилирующий фермент — ФЕП-кар-
боксилаза. В клетках мезофилла проходит
цикл Хэтча—Слэка, в клетках обкладки —
цикл Кальвина.
Существует ряд модификаций С4-пути
фотосинтеза, связанных с химической при-
родой продуктов-переносчиков углекислого
газа в клетки обкладки (транспортным сое-
динением может быть малат или аспартат),
а также с характером последующих декар-
боксилирующих реакций. В соответствии с
ферментом, осуществляющим декарбоксили-
рование в клетках обкладки, различают сле-
196
дующие три группы С4-растений, использующие для декарбоксилирования раз-
ные ферменты:
1) НАДФ-малатдегидрогеназу (например, кукуруза — Zea mays, сахарный
тростник — Sacharum officinarum)',
2) НАД-малатдегидрогеназу (амарант — Amarantus retrophlexus, портулак —
Portulaca oleaceae и др.);
3) ФЕП-карбоксикиназу (например, просо — Panicum maximum, хлорис —
Chloris gay an o').
Химизм НАДФ-малатдегидразного типа С4-фотосинтеза, характерного для
растений первой группы, представлен на рис. 3.43. Как видно из рисунка, в
клетках мезофилла происходит первичная фиксация СО2 через присоединение
его (в форме НСО3) к ФЕП с образованием щавелевоуксусной кислоты (ЩУК).
Карбоксилирующий фермент ФЕП-карбоксилаза (4.1.1.31), локализованный в
цитозоле клеток мезофилла, отличается высоким сродством к НСО3. Исполь-
зование ферментом в качестве субстрата бикарбоната значительно увеличивает
скорость фиксации углерода, поскольку содержание в клетке НСО3 выше, чем
углекислого газа. Синтезированная ЩУК переносится в хлоропласты клеток
мезофилла и там восстанавливается до малата с использованием НАДФН. Реак-
цию катализирует фермент малатдегидрогеназа (1.1.1.8.2). Образовавшийся ма-
лат по плазмодесмам транспортируется в клетки обкладки. В клетках обкладки
происходит реакция окислительного декарбоксилирования малата. Она катали-
зируется ферментом НАДФ-малатдегидрогеназой (декарбоксилирующей) (1.1.1.40).
В ходе реакции образуется пируват, выделяется углекислый газ и восстанавлива-
ется НАДФ+. СО2 и НАДФН используются в цикле Кальвина, а пируват по
плазмодесмам возвращается в клетки мезофилла. В клетках мезофилла пируват
Клетка
мезофилла
СООН
АТФ АМФ I
Рис. 3.43. С4-путь фотосинтеза (НАДФ-малатдсгидрогеназный вариант)
197
превращается в высокоэнергетическую форму ФЕП в реакции, катализируе-
мой ферментом пируватортофосфатдикиназой (2.7.9.1). При этом используют-
ся АТФ и неорганический фосфат. Пирофосфат, образующийся в реакции,
гидролизуется до ортофосфата ферментом неорганической пирофосфатазой
(6.6.1.1), а образовавшийся АМФ фосфорилируется за счет АТФ под действи-
ем аденилаткиназы. В итоге превращение ПВК в ФЕП требует 2 молекул АТФ.
Расчет затрат АТФ и НАДФН на фиксацию одной молекулы СО2 в С4-пути
фотосинтеза показывает, что для этого пути ассимиляции углерода необходи-
мо большее количество АТФ, чем для С3-пути фотосинтеза. Если принять, что
в цикле Кальвина у С4-растений, так же как и у С3-растений, для фиксации
одной молекулы СО2 используется 3 молекулы АТФ и 2 молекулы НАДФН, то
для превращения ПВК в ФЕП в цикле Хэтча—Слэка требуются дополнитель-
ные 2 молекулы АТФ. В итоге для осуществления фиксации 1 молекулы СО2 в
ходе С4-пути фотосинтеза необходимы 5 молекул АТФ и 2 молекулы НАДФН.
Регуляция С4-пути фотосинтеза. Регуляция включает метаболитный, генети-
ческий и световой контроль активности ферментов цикла Хэтча—Слэка. Осо-
бое значение при этом имеет регуляция ФЕП-карбоксилазы — ключевого фер-
мента цикла Хэтча—Слэка. Установлено, что ФЕП-карбоксилаза ингибирует-
ся органическими кислотами (в первую очередь малатом). Фосфорилирование
ФЕП-карбоксилазы повышает устойчивость фермента к малату. Свет активи-
рует специфическую киназу ФЕП-карбоксилазы, которая фосфорилирует ФЕП-
карбоксилазу и тем самым защищает фермент от аллостерического ингибиро-
вания малатом. В результате активность ФЕП-карбоксилазы на свету повыша-
ется. Кроме того, свет активирует НАДФ-зависимую малатдегидрогеназу через
тиоредоксиновую систему и фермент пируватортофосфатдикиназу (ПФДК) —
путем активации системы дефосфорилирования фермента.
Таким образом, существует ряд механизмов регуляции С4-пути фотосинте-
за на уровне специфических для цикла Хэтча—Слэка ферментов. Вместе с
тем, все регуляторные механизмы, отмеченные для С3-пути фотосинтеза в
ВПФ-цикле (см. подразд. 8.2.2), реализуются и в С4-растениях.
Растения с С4-типом фотосинтеза отличаются от С3-растений: 1) световое
насыщение фотосинтеза достигается у них при более высоких интенсивностях
света; 2) у С4 значительно выше скорость фотосинтеза при насыщающих ин-
тенсивностях света (40 — 80 мг СО2/дм2 листа в час по сравнению с 15—40 мг
СО2/дм2 листа в час у С3-растений); 3) температурный оптимум фотосинтеза
смещается в область более высоких температур (около 30 —35 °C); 4) значи-
тельно меньшие потери воды при синтезе органических веществ в ходе фото-
синтеза (250 — 350 г воды при увеличении сухого веса на 1 г по сравнению с
450 — 950 г воды/г сухой массы у С3-растений); 5) очень низкий уровень фото-
дыхания; 6) высокая скорость роста и высокая продуктивность.
3.8.3. МЕТАБОЛИЗМ УГЛЕРОДА ПО ТИПУ ТОЛСТЯНКОВЫХ
(САМ-ФОТОСИНТЕЗ)
Фотосинтез по типу толстянковых — САМ осуществляют, как правило,
растения-суккуленты из жарких, засушливых регионов. САМ-фотосинтез, так
же как и С4-фотосинтез, связан с обменом органических кислот. Однако в
198
отличие от С4-растений, у которых реакции синтеза органических кислот и
ВПФ-цикла разделены в пространстве (первые проходят в клетках мезофилла,
вторые — в клетках обкладки), у толстянковых эти реакции разделены во вре-
мени (рис. 3.44). Первичная фиксация углекислоты у суккулентов происходит
ночью, когда устьица открыты, а днем, уже при закрытых устьицах, осуще-
ствляются реакции цикла Кальвина.
Химизм CAM-фотосинтеза. При CAM-фотосинтезе первичная фиксация уг-
лекислоты (в форме НСО3), как и у С4-растений, осуществляется ФЕП-кар-
боксилазой. Используемый для карбоксилирования ФЕП образуется в ходе ре-
акций гликолиза в цитоплазме клеток. В результате карбоксилирования ФЕП
образуется оксалоацетат (щавелевоуксусная кислота), который затем восста-
навливается до малата с участием фермента НАД-малатдегидрогеназы. Синте-
зированный ночью малат переносится в вакуоли клетки путем активного транс-
порта и там накапливается, а днем, когда устьица закрыты, идет обратный
транспорт малата в цитоплазму, где происходит его декарбоксилирование.
Таким образом, CAM-фотосинтез связан с суточной ритмичностью цикла
Кальвина и цикла органических кислот. Это позволяет растениям жить в жар-
ких, засушливых условиях, когда во избежание больших потерь воды их усть-
ица должны быть закрытыми и могут открываться только ночью. Производя
первичную фиксацию углекислоты из атмосферы ночью, растения уже на внут-
ренних запасах углерода в виде малата могут осуществлять восстановление уг-
лерода за счет АТФ и НАДФН, синтезируемых в хлоропластах на свету. Регуля-
ция CAM-фотосинтеза в течение суток связана с суточным ритмом активно-
сти ключевого фермента САМ-фотосинтеза — ФЕП-карбоксилазы.
3.8.4. ФОТОДЫХАНИЕ
Фотодыханием называют поглощение растениями кислорода и выделение
углекислого газа на свету. У С3-растений его интенсивность может составлять
до 50 % от интенсивности фотосинтеза. У С4-растений фотодыхание практи-
чески отсутствует. Начальный этап фотодыхания связан с оксигеназной актив-
ностью фермента РуБФ-карбоксилаза и осуществляется в хлоропластах, по-
следующие реакции проходят в пероксисомах и митохондриях.
199
Фотодыхание имеет ряд отличий от «темнового» дыхания клеток, связан-
ного с процессами окисления органических соединений в ходе цикла Кребса и
работы ЭТЦ митохондрий. Во-первых, фотодыхание активируется светом вы-
сокой интенсивности, тогда как процессы «темнового» дыхания митохондрий
на свету ингибируются. Во-вторых, фотодыхание усиливается в присутствии
высоких концентраций кислорода, что связано с активацией в этих условиях
оксигеназной функции фермента РуБФ-карбоксилазы; максимум «темнового»
дыхания наблюдается при концентрации кислорода около 2 %. В-третьих, фо-
тодыхание требует совместного функционирования хлоропластов, перокси-
сом и митохондрий; «темновое» дыхание связано исключительно с митохонд-
риями. В-четвертых, первичными продуктами фотодыхания являются фосфо-
гликолат, гликолат и глиоксилат — двухуглеродные органические кислоты,
дальнейшее преобразование которых приводит к образованию аминокислот
глицина и серина.
Химизм фотодыхания. Процесс фотодыхания требует совместной работы трех
органелл клетки — хлоропластов, пероксисом и митохондрий (рис. 3.45). На-
чальный этап фотодыхания проходит в хлоропластах. Ключевой реакцией фо-
тодыхания является окисление РуБФ при участии кислорода с образованием
фосфогликолата и 3-ФГК (см. рис. 3.41). Реакция осуществляется благодаря ок-
сигеназной активности фермента Рубиско и сопровождается поглощением кис-
лорода. В результате оксигеназной активности образуется лишь одна молекула
3-ФГК (а не две, как при карбоксилазной активности этого фермента), кото-
рая может быть включена в реакции цикла Кальвина. Второй продукт оксиге-
назной реакции — фосфогликолат. Под действием фермента фосфогликолат-
фосфатазы (3.1.3.18) он превращается в гликолат, который покидает хлоро-
пласты и поступает в пероксисомы. Здесь гликолат окисляется до глиоксилата
с использованием кислорода. Реакцию осуществляет флавинсодержащая окси-
даза — гликолатоксидаза (1.1.3.1). Второй продукт реакции, перекись водоро-
да, благодаря высокому содержанию в пероксисомах фермента каталазы рас-
щепляется до воды и кислорода. В пероксисоме происходит реакция аминирова-
ния глиоксилата с образованием глицина. Фермент глицинаминотрансфераза
осуществляет реакцию переноса аминогруппы с глутаминовой кислоты на гли-
оксилат. При этом образуется 2-оксоглутаровая кислота. Глицин из пероксисом
переносится в митохондрии, где происходит реакция конденсации двух моле-
кул глицина с образованием одной молекулы L-серина и выделением одной
молекулы аммиака и молекулы углекислого газа. Реакция идет в две стадии и
катализируется ферментами глицинсинтазой и серингидроксиметилтрансфе-
разой. Реакция сопровождается восстановлением НАД. Окисление НАДН в мито-
хондриях сопряжено с дополнительным поглощением клеткой кислорода.
Таким образом, в ходе фотодыхания происходят реакции, связанные с
поглощением кислорода (в хлоропластах и пероксисомах) и выделением СО2
(в митохондриях). Общий баланс газообмена в листьях на свету складывается
из двух процессов — фотосинтеза и фотодыхания.
Дальнейший метаболизм серина, образующегося при фотодыхании (см.
выше), может быть связан с его включением в белки или превращением в
глицерин. Реакции преобразования серина в глицерин показаны на рис. 3.45.
Регуляция фотодыхания. Поскольку фотодыхание связано с работой фер-
мента РуБФ-карбоксилазыоксигеназы, соотношение двух путей использова-
200
Хлоропласт
АТФ
Глицерат-
киназа
— РуБФ'*'' СООН 1 3-ФГК Цикл СНОН Кальвина СН2ОР . ♦ х СООН ’ 1 СНОН СН2ОН
СООН Фосфогликолат
СН2ОР
СООН Гликолат
СН2ОН
Г со Пероксисома 1 ОН
Глицерат
СООН
О2
СН2ОН
НАДФН f
СООН
СН2ОН
Оксидаза
гликолевой
кислоты
СООН
со
СН2ОН
сно
Гидрокси-
пируват
Н2О2
Глиоксилат
Амино- 1 Амино- трансфераза
трансфераза
СООН
1 СООН Глицин
CHNH2 Серин 1 ch2nh,
СН2ОН
Митохондрия
СООН
'ч- chnh2
Серин СН2ОН
„ СООН
2* I
ch2nh2
Рис. 3.45. Фотодыхание: последовательность превращений гликолата
(объяснение в тексте)
ния РуБФ будет зависеть от соотношения карбоксилазной и оксигеназной ак-
тивности этого фермента. Поэтому такие факторы, как кинетические свойства
фермента, температура и субстраты реакций (СО2 и О2), определяющие на-
правление ферментативной активности Рубиско, будут модулировать скорость
фотодыхания. Повышение температуры, снижение парциального давления уг-
лекислого газа и повышение интенсивности света активирует фотодыхание.
Физиологическая роль фотодыхания до сих пор не вполне ясна. С одной сто-
роны, у С3-растений до 50 % продуктов фотосинтеза может использоваться на
201
фотодыхание, а это значительно снижает продуктивность фотосинтеза. С дру-
гой стороны, снижение интенсивности фотодыхания в результате генетиче-
ских нарушений его отдельных реакций сопровождалось снижением интенсив-
ности фотосинтеза. Возможно, фотодыхание важно для метаболических реак-
ций, связанных с аминокислотам у глицином и серином. Возможно, оно необ-
ходимо для переориентации пути преобразования органических молекул с
синтеза углеводов на синтез аминокислот или глицерина.
3.9. ЭКОЛОГИЯ ФОТОСИНТЕЗА
Фотосинтетическая деятельность растений зависит от многих внешних фак-
торов, и главные из них — условия освещения (интенсивность, спектральный
состав света), доступность и концентрация углекислого газа, температура сре-
ды, водоснабжение и минеральное питание. Факторы внешней среды (экзо-
генные, экологические, факторы), воздействуя на отдельные реакции фото-
синтеза, вызывают изменение активности фотосинтетического аппарата в це-
лом, что в конечном итоге определяет общую продуктивность растений. Влия-
ние на фотосинтез основных экзогенных факторов рассматривается здесь раз-
дельно, но следует помнить, что в природе они действуют на растение одно-
временно, и его продуктивность является, таким образом, интегральной фун-
кцией совокупности экологических факторов.
3.9.1. ВЛИЯНИЕ НА ФОТОСИНТЕЗ ИНТЕНСИВНОСТИ
И СПЕКТРАЛЬНОГО СОСТАВА СВЕТА
Зависимость фотосинтеза от интенсивности света выражается световой кри-
вой фотосинтеза (рис. 3.46). Как видно из рисунка, она имеет логарифмиче-
ский характер: при низких интенсивностях света существует прямая пропор-
циональная зависимость между интенсивностью падающего на растение све-
та и фотосинтеза. По мере увеличения интенсивности света нарастание фото-
синтеза становится все менее выраженным, и, наконец, при достижении
определенного уровня освещенности наступает насыщение фотосинтетиче-
Интенсивность света,
кал/см2-мин
Рис. 3.46. Световые кривые фото-
синтеза С4- (7) и С3-растений (2)
(по А. А. Ничипоровичу, 1973)
ской активности листа (плато световой кри-
вой фотосинтеза). Анализ световой кривой фо-
тосинтеза послужил основанием для представ-
ления о существовании в этом процессе све-
товых, фотохимических, реакций, прямо про-
порционально зависящих от интенсивности
света, и «темновых», энзиматических, реак-
ций, скорость которых становится лимитирую-
щей при высоких интенсивностях света (F. Black-
man, 1905).
Зависимость световых реакций фотосинтеза
от интенсивности света отражает прямолиней-
ный участок световой кривой. На этом этапе
интенсивность света является лимитирующим
202
фактором фотосинтеза. Угол наклона прямолинейного участка световой кри-
вой характеризует эффективность использования световой энергии в ходе фо-
тохимических реакций.
Стационарный уровень фотосинтеза достигается у разных групп растений
при разной интенсивности света (см. рис. 3.46). Фотосинтетическая активность
в области насыщающих интенсивностей света зависит главным образом от ра-
боты систем поглощения и ассимиляции углекислого газа. Чем выше положе-
ние кривой в области насыщения, тем больше мощность системы ассимиля-
ции углекислого газа у растения. Условия внешней среды, активирующие угле-
родные циклы растения (такие, как температура и концентрация СО2), позво-
ляют ему более эффективно использовать высокие интенсивности света. На
световой кривой фотосинтеза обычно отмечается световой компенсационный
пункт (СКП) — наименьшая интенсивность света, при которой активности
фотосинтеза и дыхания растений уравновешены по газообмену. Положение
СКП зависит от соотношения фотосинтеза и темнового дыхания и меняется в
зависимости от температуры и концентрации углекислого газа в среде.
Интенсивность света влияет на характер фотохимических и метаболических
процессов в хлоропластах. При низких интенсивностях света в первую очередь
активируется нециклический поток электронов. Увеличение интенсивности света
стимулирует циклический поток электронов и повышает долю циклического
транспорта электронов в общем потоке электронов по ЭТЦ хлоропластов. В ус-
ловиях избыточной освещенности циклический транспорт электронов может
играть защитную роль в хлоропластах, а также служить источником энергии
для дополнительного синтеза АТФ и тем самым способствовать активации про-
цессов ассимиляции углерода. С интенсивностью света связано образование
различных продуктов фотосинтеза. Так, при слабой освещенности образуются
главным образом аминокислоты, тогда как синтез углеводов в хлоропластах
требует высокой интенсивности света.
Спектральный состав света определяет общую интенсивность фотосинтеза,
активность его отдельных реакций и набор синтезируемых продуктов. Кривая
зависимости интенсивности фотосинтеза от качества света при выровненном
количестве квантов (спектр действия фотосинтеза) демонстрирует два отчет-
ливых максимума — в синей и красной области спектра, совпадающих со спек-
трами поглощения фотосинтетических пигментов (рис. 3.47). Максимумы по-
глощения отражают наиболее эффективное
использование этих лучей при фотосинтезе.
В опытах Н. П. Воскресенской было пока-
зано специфическое действие синего света
на фотосинтетический аппарат растений. При
выравнивании синего и красного освещения
по квантам на синем свету у растений уве-
личивалась общая активность ассимиляции
СО2, что было обусловлено активацией в этих
условиях транспорта электронов в ЭТЦ хло-
ропластов и ферментов углеродного цикла.
Качество света определяло и состав продук-
тов, образующихся при фотосинтезе. Так, на
синем свету преимущественно синтезирова-
Длина волны, нм
Рис. 3.47. Спектры действия фото-
синтеза (/) и поглощения пигмен-
тов (2)
203
лись органические кислоты и аминокислоты, а позднее — белки, тогда как
красный свет индуцировал сначала синтез растворимых углеводов, а в даль-
нейшем — крахмала.
3.9.2. ВЛИЯНИЕ НА ФОТОСИНТЕЗ КОНЦЕНТРАЦИИ УГЛЕКИСЛОГО ГАЗА
Содержание СО2 в окружающей среде является одним из важнейших фак-
торов, определяющих скорость фотосинтеза. Как видно из рис. 3.48, зависи-
мость интенсивности фотосинтеза от концентрации СО2 имеет логарифмиче-
ский характер, т.е. увеличение концентрации СО2 приводит к быстрому увели-
чению интенсивности фотосинтеза. При концен-
трации СО2 0,06 — 0,15 % у большинства расте-
ний достигается насыщение фотосинтеза. Уве-
личение интенсивности фотосинтеза при повы-
шении концентрации СО2 обусловлено реализа-
цией в этих условиях потенциальной карбокси-
лазной активности Рубиско и созданием в хло-
ропластах большого пула акцептора СО2 — ри-
булозобисфосфата.
Концентрация СО2, при которой его погло-
щение в процессе фотосинтеза уравновешено
выделением углекислоты в ходе дыхания (тем-
нового и светового), называется углекислотным
компенсационным пунктом (УКП). Положение
УКП может существенно зависеть от вида расте-
Рис. 3.48. Кривая зависимости фо-
тосинтеза от концентрации СО2
ния. Особенно выражены различия между С3- и С4-растениями. Так, у С3-рас-
тений УКП находится при довольно высоких концентрациях СО2 (около 0,005 %).
Это связано с наличием у них активного фотодыхания. С4-растения, облада-
ющие способностью фиксировать СО2 через фермент ФЕП-карбоксилазу, про-
изводят рефиксацию углекислого газа при слабом фотодыхании, поэтому у
них УКП приближается к нулевой концентрации СО2.
3.9.3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ФОТОСИНТЕЗ
Интегральный ответ фотосинтетического аппарата на изменения темпе-
ратуры может быть представлен графически в виде, как правило, одновер-
шинной кривой (рис. 3.49), причем вершина со-
ответствует области оптимальных для фотосин-
теза температур. Для большинства С3-растений
умеренной климатической зоны оптимальная для
фотосинтеза температура находится в интервале
20 — 25 °C. У растений с С4-путем фотосинтеза и
CAM-фотосинтезом температурный оптимум
Рис. 3.49. Зависимость фотосинтеза от температуры
у С3- (7) и С4-растений (2)
204
приходится на 30 — 35 °C. При дальнейшем повышении температуры фиксация
СО2 уменьшается вследствие снижения тургора в листьях и закрывания устьиц.
В растениях наибольшую термозависимость проявляют реакции углеродных
циклов. Весьма чувствительны к температуре также транспорт электронов и
синтез АТФ. Первичные реакции фотосинтеза, связанные с поглощением све-
та, миграцией энергии возбуждения в реакционные центры и разделением
зарядов в реакционных центрах, от температуры практически не зависят.
3.9.4. ВЛИЯНИЕ ВОДНОГО РЕЖИМА НА ФОТОСИНТЕЗ
Значение водного режима для фотосинтеза определяется в первую очередь
действием воды на состояние устьиц листа: до тех пор, пока устьица остаются
оптимально открытыми, интенсивность фотосинтеза не изменяется под влия-
нием колебаний водного баланса. Частичное или полное закрывание устьиц,
вызванное дефицитом воды в растении, приводит к нарушению газообмена и
снижению поступления углекислого газа к карбоксилируюшим системам лис-
та. Вместе с тем, при водном дефиците снижается активность ферментов ВПФ
цикла (цикла Кальвина), обеспечивающих регенерацию рибулозобисфосфата,
и в значительной степени ингибируется фотофосфорилирование. В результате в
условиях водного дефицита наблюдается ингибирование фотосинтетической
активности растений. При длительном дефиците воды возможно снижение
общей фотосинтетической продуктивности растений, в том числе и за счет
уменьшения величины листьев, а сильное обезвоживание может в итоге выз-
вать нарушение структуры хлоропластов и полную потерю их фотосинтетиче-
ской активности.
3.10. ФОТОСИНТЕЗ КАК ОСНОВА
ПРОДУКТИВНОСТИ РАСТЕНИЙ
Крупные успехи последних лет в области молекулярной биологии, физио-
логии и генетики определили глубокий интерес исследователей к познанию и
раскрытию внутренних взаимосвязей физиологических функций и регулятор-
ных механизмов, определяющих высокий уровень продуктивности раститель-
ного организма.
3.10.1. ХЛОРОПЛАСТЫ — ИСТОЧНИК АССИМИЛЯТОВ И АТФ
Фотосинтезу принадлежит ведущая роль в продукционном процессе. В хло-
ропластах в ходе фотохимических и последующих энзиматических реакций ас-
симиляции и восстановления СО2 образуются органические вещества и актив-
ные метаболиты, необходимые для энергетического и пластического обмена
растений, для осуществления его физиологическх функций. Образующиеся в
первичных процессах фотосинтеза соединения с высоким энергетическим
(АТФ) и восстановительным потенциалом (НАДФН, ФДВОССТ) служат регуля-
торами важнейших метаболических систем и составляют основу интегратив-
205
ных механизмов, обеспечивающих взаимосвязь функциональных систем на
уровне целого растительного организма.
Первичные продукты фотосинтеза, включаясь в реакции вторичного мета-
болизма, служат источником энергии и углерода для разнообразных конст-
руктивных процессов в растительной клетке. Интермедиаты цикла Кальвина и
С4-пути (эритрозо-4-фосфат, рибозо-5-фосфат, триозы, гексозы и др.) вклю-
чаются в синтез липидов, циклических соединений, нуклеотидов, органиче-
ских кислот, аминокислот и других органических соединений. Часть этих ве-
ществ используется самими хлоропластами для построения липопротеидных
мембранных структур, пигментов, компонентов ЭТЦ, а также коферментов и
ферментов, катализирующих весь комплекс фотосинтетических реакций. Од-
нако значительная часть образующихся в процессе фотосинтеза веществ транс-
портируется из хлоропластов в цитоплазму и включается в общий метаболизм
растений.
В связи с этим важнейшей проблемой физиологии растений является иссле-
дование механизмов экспорта продуктов фотосинтеза из хлоропластов в цито-
плазму. Опыты с радиоактивным диоксидом углерода |4СО2 показали быструю
миграцию меченых соединений из хлоропластов, однако не все образующиеся в
процессе фотосинтеза вещества могут служить транспортной формой углерода.
Известно, что хлоропласты отделены от цитоплазмы двойной мембраной,
при этом внутренняя мембрана обладает избирательной проницаемостью. Она
Рис. 3.50. Система переноса триозофосфатов, энергетических и восстановительных
эквивалентов через внутреннюю мембрану хлоропластов
206
практически непроницаема для конечных продуктов фотосинтеза (сахарозы,
фруктозофосфатов) и хорошо проницаема для фосфоглицериновой кислоты,
фосфоглицеринового альдегида, дигидроксиацетонфосфата и ряда соедине-
ний с короткой углеродной цепью — гликолата, малата и др. Это обусловлено
функционированием специальных переносчиков триозофосфатов через мемб-
рану хлоропластов. Во внутренней мембране локализованы специальные «пе-
реносчики ортофосфата», осуществляющие сопряженный транспорт ФГК и
триозофосфатов в обмен на неорганический фосфат (рис. 3.50). Органические
кислоты — малат, оксалоацетат (ЩУК на рис. 3.50) и др., а также аминокис-
лоты (аспартат, глутамат) переносятся через внутреннюю мембрану хлоро-
пластов при помощи специального переносчика дикарбоновых кислот.
Обмен энергетическими и восстановительными эквивалентами между хло-
ропластами и цитоплазмой обеспечивается специальной транспортной (шун-
товой) системой (рис. 3.50). Она включает транспорт дигидроксиацетонфосфа-
та (ДГАФ) в цитоплазму. Здесь ДГАФ окисляется в ФГК при участии НАД-
зависимой обратимой глицеральдегид-3-фосфатдегидрогеназы с образовани-
ем НАДН и АТФ. Возникающий в результате реакций 3-фосфоглицерат воз-
вращается в хлоропласт, замыкая шунт.
Таким образом в ходе описанных превращений богатые энергией соедине-
ния (ФГА, ДГАФ) переносятся из хлоропластов в цитоплазму, где преобразу-
ются в ФГК с образованием НАДН и АТФ. В итоге благодаря работе ряда транс-
локирующих механизмов хлоропластные и цитоплазматические реакции объ-
единяются в высокоинтегрированную метаболическую систему.
3.10.2. ДОНОРНО-АКЦЕПТОРНЫЕ ВЗАИМОДЕЙСТВИЯ
КАК ФАКТОР ЭНДОГЕННОЙ РЕГУЛЯЦИИ ФОТОСИНТЕЗА
В СИСТЕМЕ ЦЕЛОГО РАСТЕНИЯ
Донорно-акцепторная система включает донор (source) и акцептор (sink),
соединенные канализированными системами транспорта веществ и передачи
информационных сигналов.
Согласно А. Т. Мокроносову (1981, 1983), элементарная донорно-акцептор-
ная единица объединяет следующие основные структурно-функциональные и
регуляторные единицы.
• Донор ассимилятов — первичным донором является, как правило, зеле-
ный лист.
• Акцептор — функции акцептора выполняют структурные зоны растения
(аттрагирующие центры), способные ориентировать на себя поток ассимиля-
тов. Выделяют три основных типа аттрагируюгцих систем: а) ростовые зоны,
связанные с активными ростовыми процессами (меристемы, зоны морфоге-
неза); б) запасающие центры, связанные с синтезом запасных соединений и
отложением веществ в запас (семена, клубни, плоды и др.); в) метаболитные
центры с интенсивным метаболизмом, сопряженным с поглощением веществ
(корни) или вторичным метаболизмом.
• Аттрагирующий фактор неизвестной природы — определяет способность
ориентировать на себя поток ассимилятов против концентрационного гради-
ента.
207
• Транспорт ассимилятов из листа включает ближний транспорт, загрузку
флоэмы, дальний (флоэмный) транспорт и разгрузку флоэмы. Главная транс-
портная форма — сахароза.
• Система сигналов гормональной, электрофизиологической, метаболитной или
осмотической природы, поступающих от акцептора к донору. Сигналы несут на
ассимиляты информацию о «запросе» аттрагирующего центра и составляют
основу обратной связи в эндогенной регуляции фотосинтеза.
• Исполнительные механизмы эндогенной регуляции фотосинтеза. «Запрос»,
поступивший от акцептора, служит сигналом к изменению интенсивности
фотосинтеза. Это достигается быстрой регуляцией активности ЭТЦ и фермен-
тов углеродных циклов, обеспечивающей поддержание фотосинтеза на необ-
ходимом уровне.
• Фонды ассимилятов выполняют резервную функцию — поддерживают бу-
ферность и надежность донорно-акцепторной системы.
Весь комплекс донорно-акцепторных взаимодействий составляет основу
эндогенной регуляции фотосинтеза в системе целого растительного организма.
Доноры и акцепторы ассимилятов образуют хорошо согласованную систему.
Ведущая роль в ней принадлежит процессам эпигенеза, определяющим актив-
ность аттрагирующих центров.
3.10.3. ТЕОРИЯ ФОТОСИНТЕТИЧЕСКОЙ ПРОДУКТИВНОСТИ
Основные положения теории фотосинтетической продуктивности были
сформулированы в 1950-х гг. А. А. Ничипоровичем. Теория фотосинтетической
продуктивности включает анализ количественных взаимосвязей между вели-
чиной солнечной радиации, приходящейся на единицу поверхности фитоце-
ноза, с общим уровнем продуктивности сельскохозяйственных растений. Этот
анализ предполагает проведение глубоких исследований продукционного про-
цесса — физико-химической организации и активности фотосинтетического
аппарата на уровне хлоропластов, листа и целого растения, а также взаимо-
связи интенсивности фотосинтеза, роста и развития растений с процессами
минерального питания, дыхания, транспорта веществ и формированием гене-
ративных и запасающих органов.
Исследования ставили своей задачей повышение коэффициента исполь-
зования солнечной энергии в аграрном производстве, где КПД использова-
ния фотосинтетической активности радиации (ФАР) достаточно низок: всего
0,5 — 2%. Согласно теории фотосинтетической продуктивности, имеется не-
сколько способов интенсификации продукционных процессов:
• создание ценозов с максимально возможным ассимиляционным потенци-
алом (производное площади листьев в посеве и длительности функционирова-
ния растений);
• формирование оптимальной пространственной организации (архитекто-
ники) фитоценоза (общего габитуса растений, размеров и формы листовых
пластинок, их ориентации), что определяет эффективное распределение ФАР
в толще ценозов и обеспечивает энергией все ярусы листьев;
• обеспечение продукционного процесса основными ресурсами — углекис-
лотой, водой, азотом и необходимыми элементами минерального питания;
208
показана возможность математического моделирования продукционного про-
цесса с учетом времени и количества введения каждого элемента, от которых
зависит формирование урожая.
Исследования физико-химической организации фотосинтеза и сопряжен-
ных с ним физиологических функций, образующих систему донорно-акцеп-
торных связей, позволят увеличить КПД фотосинтеза. В последнее время тео-
рия первичной биопродуктивности развивается не только с целью повышения
урожайности сельскохозяйственных растений, но и в связи с оценкой биоло-
гических ресурсов биосферы и природных экосистем. Ведутся широкомасштаб-
ные международные исследования, позволяющие получить представление о
глобальной первичной биопродуктивности различных типов природных цено-
зов. При определении общих масштабов фотосинтетической деятельности рас-
тений в биосфере большое значение имеет применение дистанционных ме-
тодов сканирования хлорофиллсодержащих систем на планете. По современ-
ным оценкам, глобальная фотосинтетическая продуктивность составляет 300 —
400 млрд т углекислоты, связываемых ежегодно в процессе фотосинтеза, что
эквивалентно образованию 160 — 200 млрд т органического вещества и 100 —
150 млрд т кислорода. Из них на долю Мирового океана приходится 30 —35 %,
а на долю континентов 65 — 70% первичной продукции фотосинтеза.
ГЛАВА 4
ДЫХАНИЕ РАСТЕНИЙ
В этой главе рассматриваются процесс аэробного дыхания, в котором осво-
бождаемая при окислении углеводов свободная энергия преобразуется в энер-
гию, заключенную в молекулах АТФ, а также механизмы, позволяющие рас-
тению контролировать энергетический статус клетки. Особое внимание уделе-
но особенностям растений, связанным с наличием альтернативных путей в
дыхательном метаболизме. Кроме того, обсуждаются вопросы, связанные с
генерацией клеткой активных форм кислорода.
В процессе фотосинтеза растения синтезируют углеводы, которые транс-
портируются из листьев в другие органы. На свету и в темноте клетки растения
«дышат», окисляя углеводы молекулярным кислородом с образованием СО2 и
воды. При этом освобождается большое количество свободной энергии:
+ 6О2 = 6СО2 + 6Н2О + энергия;
AG”' =-2882 кДж/моль (-686 ккал/моль)
Эта формула в общем виде отражает чрезвычайно сложный, а главное, кон-
тролируемый процесс, который условно можно разбить на три этапа: гликолиз,
цикл трикарбоновых кислот и окислительное фосфорилирование в дыхательной
цепи (рис. 4.1).
Гликолиз и цикл трикарбоновых кислот — это биохимические пути окисле-
ния глюкозы, протекающие соответственно в цитозоле и матриксе митохонд-
рий. В биохимических реакциях синтезируется небольшое количество АТФ, и
главный их результат — образование соединений с высоким восстановитель-
ным потенциалом — НАДН и ФАДН2. На заключительном этапе восстанови-
тельные эквиваленты окисляются в электрон-транспортной цепи, локализо-
ванной во внутренней мембране митохондрий. Перенос электрона в цепи за-
вершается восстановлением кислорода до воды. В процессе электронного транс-
порта на мембране образуется электрохимический протонный градиент Ацн+,
энергия которого используется для синтеза АТФ из АДФ и Фн. Процесс, в
котором работа дыхательной цепи сопряжена с синтезом АТФ, получил на-
звание окислительного фосфорилирования. Именно в этом процессе синтезиру-
ется основная масса АТФ, образуемого при дыхании.
И у растений, и у животных дыхание выполняет три основные функции.
Во-первых, освобождаемая при окислении углеводов энергия преобразуется в
конвертируемые формы клеточной энергии — Ацн+ и АТФ. Вторая, не менее
важная функция — снабжение клетки метаболитами, которые образуются в
ходе окисления глюкозы и используются в разнообразных биосинтезах. Третья
функция связана с термогенезом, т.е. рассеиванием энергии в виде тепла. Про-
цесс дыхания принципиально сходен у животных и растений, но у последних
210
Крахмал
Сахароза
Глюкоза
Рис. 4.1. Основные этапы дыхания.
Окисление глюкозы в процессе гликолиза сопровождается восстановлением двух молекул НАД+,
синтезом двух молекул АТФ и завершается образованием двух молекул пирувата. В митохондриях
пируват подвергается полному окислению до СО2 в реакциях, катализируемых пируватде-
гидрогеназным комплексом (ПДК) и ферментами цикла трикарбоновых кислот (ЦТК). В этих
процессах образуются 4НАДН, 1ФАДН2, а также одна молекула АТФ. Восстановительные эквива-
ленты окисляются, отдавая электроны в электрон-транспортную цепь, локализованную во
внутренней митохондриальной мембране. Электронный транспорт приводит к восстановлению
кислорода до воды и сопряжен с синтезом основной массы АТФ в процессе окислительного
фосфорилирования
имеет свои особенности. Все вместе они отражают пластичность растительного
метаболизма и связаны с функционированием, наряду с основными, альтер-
нативных ферментов и реакций. Наличие альтернативных путей расширяет адап-
тивные возможности растений, но усложняет (с точки зрения исследователя)
систему регуляции метаболических процессов.
211
4.1. БИОХИМИЧЕСКИЕ ПУТИ ОКИСЛЕНИЯ ГЛЮКОЗЫ
4.1.1. СТРУКТУРА МИТОХОНДРИЙ
Основные события, связанные с дыханием, происходят в митохондриях.
Растительные митохондрии, как правило, сферической или цилиндрической
формы, их число может сильно варьировать в зависимости от метаболической
активности клетки. Две мембраны, наружная и внутренняя, делят митохонд-
рию на два функциональных компартмента — межмембранное пространство и
матрикс (рис. 4.2). Особые белки, называемые поринами, образуют в наружной
мембране крупные гидрофильные каналы, или поры, через которые в меж-
мембранное пространство из цитозоля свободно могут проникать соединения
Межмембранное
пространство
Рис. 4.2. Структура митохондрий
с молекулярной массой не более 10 кДа. Это практически все основные мета-
болиты клетки. Внутренняя мембрана образует многочисленные складки, кри-
сты, которые увеличивают ее поверхность. Во внутреннюю мембрану интегри-
рованы электрон-транспортная цепь (ЭТЦ) и АТФ-синтаза. В отличие от дру-
гих клеточных мембран внутренняя мембрана митохондрий обогащена белком
(75 %) и содержит особый фосфолипид (дифосфатидилглицерол) — кардио-
липин. Она пропускает газы, воду и небольшие липофильные молекулы, но
непроницаема для заряженных молекул и ионов, что является обязательным
условием ее функционирования как сопрягающей мембраны. Однако в мемб-
ране есть белки — транспортеры, с помощью которых возможен обмен мета-
болитами между матриксом и цитозолем (см. подразд. 4.1.8 и 4.2.11). Матрикс,
т.е. окруженное внутренней мембраной пространство, содержит ферменты цикла
трикарбоновых кислот.
4.1.2. ГЛЮКОЗА — ОСНОВНОЙ СУБСТРАТ ДЫХАНИЯ У РАСТЕНИЙ
Основным субстратом дыхания у растений являются глюкоза и ее произ-
водные, хотя в особых случаях дыхание могут поддерживать белки и жиры,
запасенные в семенах. Глюкоза образуется в клетках растений при гидролизе
крахмала и сахарозы — продуктов фотосинтеза. Крахмал представляет собой
смесь двух полисахаридов — амилозы и амилопектина. Молекулы амилозы —
это длинные, неразветвленные цепи a-D-глюкопиранозных остатков, соеди-
ненных гликозидными а(1-»4)-связями. Молекулы амилопектина также пред-
212
ставлены цепями a-D-глюкопиранозных остатков, которые в точке ветвления
образуют о.(1^6)~связь. Крахмал как запасный полисахарид накапливается в
хлоропластах и пластидах гетеротрофных тканей. Некоторые растения — топи-
намбур (Heliantus tuberosus), георгин {Dahlia sp.) в качестве запасных углеводов
могут использовать инулин и гемицеллюлозы. Сахароза — это дисахарид, обра-
зованный остатками глюкозы и фруктозы. Она синтезируется в цитозоле, из
фотосинтезирующих клеток по апопласту листа и сосудам флоэмы транспор-
тируется в другие органы растения.
Крахмал расщепляется до моносахаридов при участии ряда ферментов (а- и
р-амилазы, а-1,6-глюкозидазы, крахмалфосфорилазы и др.) с образованием
D-глюкозы или D-глюкозо-1 -фосфата. Распад сахарозы может идти при обра-
щении реакций ее синтеза, но в основном происходит в результате гидролиза
при участии фермента инвертазы-.
сахароза + Н2О —► фруктоза + глюкоза
В геноме таких растений, как томат {Lycopersicon esculentum), кукуруза {Zea
mays), арабидопсис {Arabidopsis thaliana), морковь {Dancus carota), обнаружено
целое семейство ядерных генов, кодирующих разные изоформы инвертазы.
Например, у моркови кислые инвертазы (оптимум pH 4,5 —5,0) в пяти разных
изоформах присутствуют в вакуоли и клеточной стенке. В цитозоле есть нейт-
ральная инвертаза (оптимум pH 7,0—8,0), которая также может иметь несколько
изоформ. Таким образом, у растений гидролиз сахарозы может идти в разных
клеточных компартментах и контролируется сложным образом через актив-
ность инвертаз, обладающих разными свойствами.
4.1.3. ГЛИКОЛИЗ — ПЕРВЫЙ ЭТАП ДЫХАНИЯ
Гликолиз — это универсальная последовательность реакций, общая для всех
известных науке организмов, в ходе этих реакций глюкоза последовательно
окисляется до пирувата. Окисление сопровождается образованием двух моле-
кул НАДН и синтезом 2 молекул АТФ. Несомненно, что гликолиз — эволюци-
онно самый ранний из известных способов получения энергии, и единствен-
ный для многих анаэробных бактерий. В аэробный метаболизм гликолиз вклю-
чен как начальный этап окисления глюкозы.
Реакции гликолиза (рис. 4.3) протекают в цитозоле и катализируются фер-
ментами, легко экстрагируемыми из клеток. Вначале богатая энергией, но ста-
бильная молекула глюкозы фосфорилируется за счет АТФ в реакции (7), ката-
лизируемой гексокиназой. Образованный глюкозо-6-фосфат изомеризуется во
фруктозо-6-фосфат (2) и еще раз фосфорилируется до фруктозе-1,6-бисфос-
фата с использованием еще одной молекулы АТФ (5). Эта необратимая реак-
ция, ключевая в регуляции гликолиза (см. подразд. 4.1.7), имеет у растений
следующую особенность. Если у животных данную реакцию катализирует толь-
ко один фермент — АТФ-зависимая фосфофруктокиназа {3), то в клетках рас-
тений на этой стадии действуют сразу два фермента. Помимо АТФ-зависимой
фосфофруктокиназы растения содержат также пирофосфатзависимую фосфо-
фруктокиназу, которая катализирует фосфорилирование фруктозо-6-фосфата,
используя не АТФ, а пирофосфат {4). Впервые этот фермент был обнаружен у
213
Фруктозо-6-фосфат
Фрукгозо-1,6-бисфосфат
СН2ОН
С=О
СН2О®
Фосфодиок-
сиацетон
СН2О®
снон <
о=с-о~®
1,3-Фосфоппщерат
СНОН <
соо
З-Фосфоглицерат
СН2ОН
I
—+ СНО(Р)
СОО-
2-Фосфоглииерат
СОО-
I
с=о
I
сн2
соо-
соо-
I
носн
I
сн2
соо-
соо-
I
с=о
I
сн2
соо-
Оксалоацетат
Малат
Оксалоацетат
214
Рис. 4.3. Реакции гликолиза.
Реакции 1—17 катализируют следующие ферменты: 1 — гексокиназа; 2 — фосфоглюкоизомера-
за; 3 — АТФ-зависимая фосфофруктокиназа (АТФ: D-фруктозо-б-фосфат-!-фосфотрансфера-
за); 4 — ФФн-зависимая фосфофруктокиназа; 5 — фруктозо-1,6-бисфосфат альдолаза; 6 — трио-
зофосфатизомераза; 7 — глицеральдегид-3-фосфат дегидрогеназа; 8 — фосфоглицераткиназа; 9 —
фосфоглицеромутаза; 10— енолаза; 11— пируваткиназа (АТФ:пируват-фосфотрансфераза); 12 —
пируваткарбоксилаза; 13, 14 — НАД-зависимая малатдегидрогеназа; 15 — ФЕП-карбоксикина-
за; 16— фруктозо-1,6-бисфосфатаза; 17 — глюкозо-6-фосфатаза; »- — необратимая реакция;
<—► — обратимая реакция; —— обходные реакции при обращении гликолиза; (Р) —
О
о 11
фосфатная группа: (Р) = —Р—О
О'
пропионовокислых бактерий в начале 1980-х гг. в листьях ананаса (Ananas
comosus), а затем и в других растительных объектах.
Цитозоль растительных клеток содержит пирофосфат (ФФН) в довольно
высокой и устойчивой концентрации, который в ряде случаев выступает как
энергетический эквивалент, или как донор фосфатных групп. ФФн-зависимая
фосфофруктокиназа способна катализировать реакцию фосфорилирования
фруктозо-6-фосфата в обоих направлениях, работая либо на синтез ФФН, либо
на его удаление. Предполагается, что таким образом контролируется пул ФФН
в цитозоле.
Отрицательно заряженные фосфатные группы в молекуле фруктозо- 1,6-бис-
фосфата облегчают ее распад при участии альдолазы на 3-фосфоглицериновый
альдегид (3-ФГА) и фосфодиоксиацетон (ФДА) (5). Последний легко изоме-
ризуется в ФГА (6). На этой реакции завершается первая стадия гликолиза:
при использовании двух молекул АТФ глюкоза фосфорилируется и расщепля-
ется на две половинки — фосфотриозы, которые в дальнейшем подвергаются
одинаковым превращениям.
Вторая стадия гликолиза включает окислительно-восстановительные реак-
ции, в которых образуются НАДН и АТФ. Окисление 3-фосфоглицеринового
альдегида (7) катализирует глицеральдегид-3-фосфат дегидрогеназа. В ходе этой
сложной реакции, которая идет через образование фермент-субстратного ком-
плекса, восстанавливается НАДН и образуется 1,3-дифосфоглицериновая кис-
лота (1,3-ФГК). Последняя представляет собой высокоэнергетическое соеди-
нение, в молекуле которого есть макроэргическая фосфатная связь. Синтез
АТФ осуществляется при переносе фосфатной группы от 1,3-ФГК на АДФ в
реакции (8), катализируемой фосфоглицераткиназой. Таким образом, АТФ син-
тезируется в результате совместного действия двух реакций, в первой из кото-
рых макроэргическая связь образуется на молекуле окисляемого субстрата. По-
этому такой способ синтеза АТФ получил название субстратного фосфорилиро-
вания. В следующей реакции (9) 3-фосфоглицериновая кислота превращается в
2-фосфоглицериновую кислоту, от которой при участии енолазы отщепляется
молекула воды (10). В результате этой реакции вновь образуется высокоэнерге-
тическое соединение — фосфоенолпируват (ФЕП). Второе субстратное фосфо-
рилирование связано с переносом фосфатной группы от ФЕП на АДФ, ката-
лизируемом пируваткиназой (11). Образованный пируват является конечным
продуктом гликолиза.
215
У растений обнаружены ферменты, при участии которых возможен «обход»
некоторых реакций гликолиза. Так, в клетках растений есть НАДФ-зависимая
глицеральдегид-3-фосфат дегидрогеназа, катализирующая реакцию
3-ФГА + НАДФ+ + Н2О 3-ФГК + НАДФН + 2Н+
В вакуолях некоторых растений (у Catharanthus roseus, Cupinus albus, Brassica
nigra, Allium сера) обнаружена ФЕП-фосфатаза, катализирующая реакцию
ФЕП-фосфатаза
ФЕП + Н2О ---------------► Пируват + Фн
Оба альтернативных фермента активируются при фосфорном голодании.
Энергетический выход гликолиза небольшой. Если учесть, что на первом
этапе активация глюкозы связана с расходом двух молекул АТФ, суммарный
баланс можно выразить через уравнение
Глюкоза + 2НАД+ + 2ФН + 2АДФ —* 2Пируват + 2НАДН + 2Н+ + 2АТФ + 2Н2О
У растений гликолиз протекает не только в цитозоле, но и в пластидах.
Пластидные и цитозольные изоформы кодируются разными ядерными генами
и могут существенно различаться по своим свойствам. Пластидный гликолиз,
связанный с мобилизацией крахмала, имеет место в гетеротрофных и фото-
синтезирующих тканях. Однако в хлоропластах процесс, по-видимому, проте-
кает только в темноте. Считается, что на свету активность пластидной изофор-
мы АТФ-зависимой фосфофруктокиназы подавлена из-за высокой концентра-
ции АТФ (см. подразд. 4.1.7). Пирофосфатзависимая фосфофруктокиназа не
обнаружена в хлоропластах и пластидах.
Предполагается, что образованные в гликолизе пируват, АТФ и НАДН ис-
пользуются в синтезе жирных кислот, который у растений протекает в пласти-
дах. Следует также иметь в виду, что пластидный гликолиз может идти не до
конца, так как такие соединения, как ФГА и ФГК, могут выходить из хлоро-
пластов и включаться в гликолиз, протекающий в цитозоле.
При прорастании семян, если еще достаточно прочная наружная оболочка
препятствует доступу кислорода, или при затоплении корней растений глико-
лиз завершается реакциями спиртовою или молочнокислого брожения. При
этом образованный ранее НАДН вновь окисляется при восстановлении пиру-
вата соответственно до этанола или молочной кислоты. Обычно сначала при
участии лактатдегидрогеназы образуется молочная кислота:
+ Лактатдегидрогеназа +
Пируват + НАДН + Н -------------------► Лактат + НАД
При накоплении молочная кислота подкисляет цитозоль, что необходимо
для активации пируватдекарбоксилазы, которая при pH > 7,0 находится в неактив-
ной форме. При участии этого фермента на конечном этапе синтезируется этанол:
Пируватдекарбоксилаза
Пируват--------------------► Ацетальдегид + СО2;
Алкогольдегидрогеназа
Ацетальдегид + НАДН + Н+---------------------► Этанол + НАД+
Этанол в отличие от молочной кислоты способен выходить из клеток в меж-
клеточники, что менее опасно, чем накопление в цитозоле лактата. Брожение
216
обеспечивает выживание растений ограниченное время в условиях недостаточ-
ного снабжения кислородом, т. е. при аноксии. По устойчивости к этому стрессу
растения могут сильно различаться. Если некоторые болотные растения выжи-
вают в условиях аноксии в течение месяцев, то проростки ячменя или пшеницы
не выдерживают и нескольких часов. Следует отметить, что в развивающихся
пыльцевых зернах кукурузы {Zea mays) и табака {Nicotiana tabacum) спиртовое
брожение имеет место в аэробных условиях и протекает наряду с дыханием.
4.1.4. СИНТЕЗ САХАРОВ ПРИ ОБРАЩЕНИИ ГЛИКОЛИЗА
Реакции гликолиза могут идти в обратном направлении, в результате чего
из пирувата вновь будут синтезированы углеводы. Такой обращенный гликолиз
носит название глюконеогенеза:
_ Гликолиз
Глюкоза Пируват
Глюконеогенез
Большинство реакций гликолиза близки к равновесию и легко обратимы.
Только три реакции, катализируемые киназами (гексокиназой, фосфофрукто-
киназой и пируваткиназой), необратимы. На этих участках гликолиз идет в
обратном направлении с помощью других ферментов и реакций (см. рис. 4.3).
Для обращения реакции, катализируемой пируваткиназой, и получения ФЕП
из пирувата необходим обходной путь, в котором участвуют ферменты цито-
золя и митохондрий. Сначала пируват поступает в митохондрии, где при уча-
стии пируваткарбоксилазы карбоксилируется в энергозависимой реакции (12)
с образованием оксалоацетата (ОАА). В митохондриях ОАА восстанавливается
за счет НАДН с образованием малата (13) при участии НАД-зависимой ма-
латдегидрогеназы. Этот фермент катализирует легко обратимую реакцию, ко-
торая идет в направлении синтеза малата, так как соотношение НАДН/НАД+
в митохондриях высокое. Далее малат выносится в цитозоль и вновь окисляется
до ОАА (14). И наконец, оксалоацетат превращается в ФЕП в энергозависи-
мой реакции, катализируемой ФЕП-карбоксикиназой (15). Далее фосфоенол-
пируват легко превращается во фруктозе-1,6-бисфосфат за счет обращения
реакций гликолиза. Обращение реакций (16 и 77), катализируемых гексокина-
зой и фосфофруктокиназами, достигается при действии соответствующих фос-
фатаз. Из 6С-сахаров, образованных в результате глюконеогенеза, возможен
синтез сахарозы при участии сахарозофосфатсинтазы. Таким образом, в мета-
болизме растений существует способ синтеза сахаров из пирувата. Наиболее
активно глюконеогенез протекает в прорастающих семенах тех растений, в
которых запасными соединениями являются жиры (см. подразд. 4.1.9).
4.1.5. ОБРАЗОВАНИЕ ВОССТАНОВИТЕЛЬНЫХ ЭКВИВАЛЕНТОВ,
АТФ И СО2 В ЦИКЛЕ ТРИКАРБОНОВЫХ КИСЛОТ
В процессе гликолиза освобождается лишь незначительная часть той энер-
гии, которая потенциально заключена в такой сложной молекуле, как глюко-
за. В аэробных условиях пируват поступает в митохондрии, где подвергается
окончательному окислению с образованием СО2.
217
Сначала окисление пирувата катализирует сложный пируватдегидрогеназ-
ный комплекс (ПДК) (рис. 4.4). В его состав входят три фермента (пируватде-
гидрогеназа, дигидролипоилтрансацетилаза, дигидролипоилдегидрогеназа) и
пять коферментов (тиаминпирофосфат — витамин Вь липоевая кислота, НАД+,
ФАД и коэнзим А).
В реакции окисления пирувата участвует коэнзим А (СоА—SH) — сложная
молекула, в составе которой есть активная SH-группа. Коэнзим А функциони-
рует как универсальный переносчик ацетильных групп в разных ферментатив-
ных реакциях. Это соединение способно связывать остатки уксусной кислоты с
образованием макроэргической тиоэфирной связи в молекуле ацетил-СоА.
Окислительное декарбоксилирование пирувата (7) пируватдегидрогеназным
комплексом сопровождается восстановлением НАД+ до НАДН, отщеплением
СО2 и образованием ацетил-СоА. Ацетил-СоА вступает на путь дальнейших
превращений в цикле трикарбоновых кислот (ЦТК), известным также как цикл
Кребса, или цикл лимонной кислоты. Цикл был открыт в результате блестя-
щих работ, выполненных в лаборатории английского биохимика Г. А. Кребса в
30-х гг. XX в. на летательных мышцах голубя. Как выяснилось впоследствии,
ЦТК — универсальный путь окисления остатков уксусной кислоты, включен-
ный как обязательный компонент в дыхательный метаболизм аэробных орга-
низмов. У животных и растений все ферменты цикла кодируются ядерными
генами, обладают несомненным сходством и, за единственным исключением,
локализованы в матриксе митохондрий.
Первой реакцией цикла можно считать реакцию конденсации ацетил-СоА
с оксалоацетатом с образованием цитрата (2), катализируемую цитратсинта-
зой (см. рис. 4.4).
Изомеризация цитрата в изоцитрат включает две реакции, связанные сна-
чала с отщеплением, а затем присоединением воды (5). Обе реакции катализи-
руются одним ферментом — аконитазой. Далее следуют две реакции окисли-
тельного декарбоксилирования, каждая из которых связана с восстановлением
НАД+ и выделением СО2. Сначала НАД-зависимая изоцитратдегидрогеназа окис-
ляет изоцитрат (4) с образованием а-кетоглутарата, СО2 и НАДН. Эта самая
медленная реакция определяет скорость оборота всего цикла. Образованный
а-кетоглутарат подвергается дальнейшему окислению а-кетоглутаратдегидро-
геназным комплексом, который по своей структуре и механизму действия явля-
ется аналогом ПДК. В результате реакции (5) образуются НАДН, СО2 и сукци-
нил-СоА. Далее сукцинил-СоА-синтетаза катализирует превращение сукцинил-
СоА в сукцинат (6), что сопровождается фосфорилированием АДФ за счет
энергии тиоэфирной связи в молекуле сукцинил-СоА. Это единственная реак-
ция цикла, в которой за счет субстратного фосфорилирования синтезируется
АТФ (растения) или ГТФ (животные).
Сукцинат окисляется до фумарата (7) сукцинатдегидрогеназой. Этот фер-
мент локализован не в матриксе, а во внутренней мембране митохондрий и
представляет собой один из компонентов дыхательной цепи — комплекс II.
В ходе окисления сукцината электроны передаются на молекулу ФАД, кото-
рая является простетической группой в составе комплекса. Электроны с ФАДН2
прямо уходят в дыхательную цепь. Таким образом, сукцинатдегидрогеназа —
это общий компонент ЦТК и дыхательной цепи (см.‘ подразд. 4.2.3). Далее
фумараза гидратирует фумарат с образованием малата (5). И наконец, цикл
218
СНз
с=о
COO-
Пируват
CoA-SH
НАД
CO2
СН3—C~S—CoA
| НАДН
НАД
COO"
HOCH
НАДН |
COO-
c=o
CoA-SH
H2O
CH2
coo-
Оксалоацетат
Ацетил-СоА
СН2
НО-<р-СОО"
СН2 '
СОО"
Цитрат
СОО" н>°
H2O
COO-
H2O
COO"
CH2
coo-
Малат
HCOH
сн-соо-
6н2
СОО"
CH
CH
coo-
Фумарат
ФАДН
coo-
ФАД
CH2
CH2
coo-
Сукцинат
О
II
C-S-CoA
I
сн2
сн2
СОО"
Сукцинил-СоА НАДН
сн2
сн2
CoA-SH QOO-
а-Кетоглутарат
Изоцитрат
COO-
c=o
НАД
НАДН
co2
НАД
АТФ
АДФ
Фн
CoA-SH
О
Рис. 4.4. Окисление пирувата в матриксе митохондрий через пируватдегидрогеназный
комплекс и цикл трикарбоновых кислот.
Окислительное декарбоксилирование пирувата сопровождается выделением СО2, восстановле-
нием НАДН и синтезом ацетил-СоА. В реакции, катализируемой цитратсинтазой, ацетил-СоА
конденсируется с оксалоацетатом с образованием цитрата. В ЦТК цитрат окисляется с выделе-
нием двух молекул С02, в результате вновь синтезируется оксалоацетат. В реакциях ЦТК образу-
ются 3 НАДН и 1 ФАДН2, а также синтезируется 1 АТФ. Образованный оксалоацетат вновь
реагирует с ацетил-СоА, запуская следующий оборот цикла. Реакции 1—9 катализируют следу-
ющие ферменты: 1 — пируватдегидрогеназный комплекс; 2 — цитратсинтаза; 3 — аконитаза; 4 —
НАД-зависимая изоцитратдегидрогеназа; 5 — а-кетоглутаратдегидрогеназный комплекс; 6 —
сукцинил-СоА-синтетаза; 7 — сукцинатдегидрогеназа; 8 — фумараза; 9 — НАД-зависимая ма-
латдегидрогеназа
219
замыкается реакцией окисления малата в оксалоацетат (9) при участии НАД-
зависимой малатдегидрогеназы. Это третья реакция цикла, в которой генери-
руются НАДН. Хотя данная реакция легкообратима, in vivo ее равновесие
сдвинуто в сторону образования оксалоацетата. Сдвиг происходит потому,
что продукты реакции быстро используются: оксалоацетат вновь реагирует с
очередной молекулой ацетил-СоА и вступает в следующий оборот цикла, а
НАДН окисляется в дыхательной цепи. Хотя большинство реакций цикла об-
ратимы, две из них, катализируемые цитратсинтазой и а-кетоглутаратде-
гидрогеназным комплексом, физиологически необратимы и контролируют на-
правление цикла.
Таким образом, в матриксе митохондрий завершается процесс окисления
глюкозы, начавшийся в цитозоле. В результате действия ПДК и одного оборота
ЦТК молекула пирувата полностью окисляется с образованием 3 молекул СО2.
Окисление пирувата сопровождается образованием 4 молекул НАДН, восста-
новлением ФАД и синтезом одной молекулы АТФ.
Энергетический выход при окислении глюкозы принято приравнивать к
36 молекулам АТФ. Эта цифра базируется на том, что окисление в дыхатель-
ной цепи НАДН, образованного в ЦТК, связано с синтезом трех молекул
АТФ, а ФАДН2 — двух. Образованный в цитозоле НАДН также может быть
окислен в цепи с образованием двух молекул АТФ (см. подразд. 4.2.6 и 4.2.9).
При полном окислении глюкозы 2НАДН образуются при гликолизе в цитозо-
ле, 8НАДН и 2ФАДН2 — в матриксе при окислении двух молекул пирувата.
При окислении всех восстановленных эквивалентов в дыхательной цепи в сум-
ме может быть получено 32 АТФ. Если учесть 4 молекулы АТФ, образованных
на уровне субстратного фосфорилирования (2 АТФ в гликолизе и 2 АТФ в
ЦТК), общий итог составит 36 молекул АТФ. Следует отметить, что эта цифра
достаточно приблизительна и скорее всего завышена. Ряд данных указывает на
то, что число молекул АТФ, синтезированных при окислении НАДН, может
быть меньше трех (см. подразд. 4.2.7).
4.1.6. ОСОБЕННОСТЬ РАСТИТЕЛЬНЫХ МИТОХОНДРИЙ —
ПРИСУТСТВИЕ МАЛИК-ЭНЗИМА
Стабильная работы ЦТК во многом зависит от концентрации промежуточ-
ных соединений, а значит, и от процессов, связанных с их удалением или,
наоборот, вовлечением в цикл. Многие интермедиаты цикла активно из него
уходят и используются в различных реакциях в цитозоле (см. подразд. 4.1.8).
В связи с этим важное значение имеют так называемые анаплеротические реак-
ции, которые катализируют взаимопревращение продуктов гликолиза и ЦТК,
и при необходимости «подкармливают» цикл, пополняя пулы промежуточных
соединений.
Так, ФЕП-карбоксилаза катализирует синтез оксалоацетата из ФЕП:
ФЕП + НСОз
ФЕП-карбоксилаза
ОАА + Фн
Как уже было показано (см. подразд. 4.1.4; рис. 4.3), оксалоацетат может быть
также синтезирован из пирувата при участии пируваткарбоксилазъг.
220
Рис. 4.5. Альтернативные пути образования пирувата в растительной клетке.
Образованный в гликолизе фосфоенолпируват (ФЕП) может метаболизировать с образованием
пирувата или малата. ФЕП-карбоксилаза катализирует взаимодействие ФЕП с НСО3 с образова-
нием оксалоацетата, который превращается в малат. Малат, как и пируват, поступает в митохонд-
рии и может поддерживать ЦТК, превращаясь в пируват при участии малик-энзима. Реакции 1—
/катализируют ферменты: 1 — пируваткиназа; 2— ФЕП-карбоксилаза; 3— малатдегидрогеназа
в цитозоле; 4 — малатдегидрогеназа в митохондриях; 5 — малик-энзим; 6 — пируватдегид-
рогеназный комплекс; 7 — цитратсинтаза
221
Нируваткарбоксилаза
Пируват + СО2 + АТФ-----------------► ОАА + АДФ + Фн
Малатдегидрогеназа катализирует легко обратимое взаимопревращение ок-
салоацетата и малата:
НАД-зависимая малатдегидрогеназа ,
Малат + НАД+----------------------------- ОАА + НАДН + Н
Особый интерес вызывает функционирование в растительной клетке малик-
энзима, который катализирует окислительное декарбоксилирование малата:
НАД'-зависимый малик-энзим .
Малат + НАД+-------------------------*- Пируват + СО2 + НАДН + Н
У растений малик-энзим присутствует не только в цитозоле, но и в митохон-
дриях (НАД+-зависимая изоформа) и хлоропластах (НАДФ+-зависимая изофор-
ма). Наличие этого фермента в митохондриях делает возможным получать пиру-
ват из малата и тем самым обходить последнюю реакцию гликолиза (рис. 4.5).
Действительно, образованный в гликолизе ФЕП является субстратом сразу
двух реакций. При участии пируваткиназы он превращается в пируват (7), а
при участии ФЕП-карбоксилазы — в оксалоацетат (2). Последний легко вос-
станавливается до малата (5). Поступив в митохондрии, малат либо сразу вклю-
чается в ЦТК, либо окисляется малик-энзимом до пирувата (5). На самом деле
не совсем понятно, насколько этот альтернативный способ образования пиру-
вата из малата используется in vivo в нормальной физиологической ситуации.
Сообщалось, что этот путь активируется у некоторых растений при фосфор-
ном голодании. Возможно, он включается при регуляторном подавлении актив-
ности пируваткиназы (см. подразд. 4.1.7). Тем не менее дублирование реакций,
связанных с синтезом пирувата, отражает пластичность растительного метабо-
лизма и, безусловно, расширяет их адаптивные возможности. Так, трансген-
ные растения табака (Nicotiana tabacum), лишенные пируваткиназы, выживали
и поддерживали нормальный метаболизм за счет этого обходного пути.
4.1.7. РАСПАД ГЛЮКОЗЫ РЕГУЛИРУЕТСЯ КЛЮЧЕВЫМИ
МЕТАБОЛИТАМИ И ПОДЧИНЕН КОМПЛЕКСНОЙ СИСТЕМЕ КОНТРОЛЯ
В гликолизе и ЦТК действуют несколько ключевых реакций, благодаря ко-
торым весь процесс окисления глюкозы от начала до конца является контро-
лируемым. Наиболее важная точка контроля — реакции гликолиза, связанные с
превращением фруктозо-6-фосфата во фруктозо-1,6-бисфосфат и обратно. Все
ферменты, участвующие в прямой и обратной реакциях, подвержены аллосте-
рической регуляции (рис. 4.6). В клетках животных АТФ-зависимая фосфофрук-
токиназа активируется АДФ и подавляется АТФ, тогда как в клетках растений
этот фермент активируется ионом фосфата, а ингибируется ФЕП. Обратная
реакция, катализируемая фосфатазой, в обоих случаях активируется АТФ и
цитратом и подавляется АДФ. Такая система регуляции означает, что накопле-
ние в клетке нереализованного АТФ и фосфоенол пирувата на фоне низкого
уровня АДФ и Фн приведет к подавлению активности фосфофруктокиназы и
активации фосфатазы, т.е. к торможению скорости распада глюкозы.
222
фр-1,6-ф
фр-6-ф
Рис. 4.6. Регуляция гликолиза у растений на уровне реакции фосфорилирования фрук-
тозо-6-фосфата:
Фр-6-Ф — фруктозо-6-фосфат; Фр-1,6-Ф — фруктозо-1,6-бисфосфат; Фр-2,6-Ф — фруктозо-
2,6-бисфосфат; АТФ-ФФК — АТФ-зависимая фосфофруктокиназа; ФФ„-ФФК — пирофосфат-
зависимая фосфофруктокиназа; фосфатаза — фруктозо-1,6-бисфосфатаза; ff — активирование;
1 — ингибирование
В регуляцию этих реакций включен еще один фактор — фруктозо-2,6-бис-
фосфат, регуляторная молекула у всех эукариот. Фруктозо-2,6-бисфосфат дей-
ствует как активатор прямой и ингибитор обратной реакции, т. е. стимулирует
гликолиз и подавляет глюконеогенез. У животных фруктозо-2,6-бисфосфат ак-
тивирует АТФ-зависимую фосфофруктокиназу и подавляет активность фосфа-
тазы. У растений в отличие от животных фруктозо-2,6-бисфосфат не действует
на АТФ-зависимый фермент, но четко активирует ФФн-зависимую фосфо-
фруктокиназу и ингибирует фосфатазу. Пластидная изоформа АТФ-зависимой
фосфофруктокиназы, как и цитозольная, активируется фосфатом и подавля-
ется ФЕП, а также АТФ. О способах регуляции пластидной фосфатазы извест-
но мало.
Фруктозо-2,6-бисфосфат образуется и деградирует при участии двух фер-
ментов: фруктозо-6-фосфат 2-киназы и фруктозо-2,6-бисфосфатазы:
2-киназа
АТФ АДФ
Фруктозо-6-фосфат -, * Фруктозо-2,6-бисфосфат
Фн Н2о
2-фосфатаза
Активность 2-киназы активируется ионом фосфата и фруктозо-6-фосфатом
и ингибируется трехуглеродным продуктом гликолиза — ФГА и ФГК. Таким
образом, синтез самой регуляторной молекулы сложным образом зависит от
соотношения Сб/СЗ-сахаров в растительной клетке. На это соотношение будут
влиять интенсивность синтеза сахарозы и транспорт в хлоропласт Фн в обмен
на триозофосфат (см. гл. 3).
Второй регуляторный фермент гликолиза, пируваткиназа, аллостерически ин-
гибируется метаболитами ЦТК, цитратом и малатом и активируется АДФ и Фн.
Следующая точка контроля на пути окисления глюкозы — ПДК, на приме-
ре которого можно видеть, как иногда сложно регулируется активность клю-
223
чевых ферментов. Одним из способов «быстрого реагирования» в клетке явля-
ется изменение активности ферментов за счет их обратимого фосфорилирова-
ния—дефосфорилирования при участии специальных протеинкиназ и фосфа-
таз. Именно такому способу регуляции подвержен и ПДК: АТФ-зависимое
фосфорилирование комплекса по остатку серина подавляет его активность, а
при отщеплении фосфатной группы активность восстанавливается (рис. 4.7).
Состояние комплекса зависит от активности киназы, которая в свою очередь
подвержена аллостерической регуляции. Киназа активируется АТФ и ионом
аммония и ингибируется субстратом комплекса — пируватом. Регуляторные
свойства фосфатазы остаются пока неясными. Кроме того, ПДК ингибируется
по типу обратной связи НАДН и ацетил-СоА.
Регуляторные ферменты ЦТК — цитратсинтаза и НАД-зависимая изоцит-
ратдегидрогеназа. Активность цитратсинтазы аллостерически подавляется АТФ
и НАДН. Изоцитратдегидрогеназа активируется АДФ и цитратом и ингибиру-
ется АТФ и НАДН. Кроме того, работа дегидрогеназ цикла зависит от соотно-
шения НАД+/НАДН в матриксе. Следовательно, ключевую роль в управлении
ЦТК играет соотношение НАДН/НАД+ и АТФ/АДФ в матриксе митохондрий.
При высоком содержании АТФ и НАДН работа цикла будет тормозиться.
Итак, на всем пути окисления глюкозы действуют ферменты, активность
которых сложным образом зависит от многих факторов. В то же время в системе
регуляции прослеживается общий принцип: ключевые реакции регулируются
«снизу вверх», т. е. метаболитами, которые образуются в последующих реакци-
ях, и прежде всего на заключительной стадии, когда в процессе окислитель-
ного фосфорилирования синтезируется основная масса АТФ из АДФ и Фн. Во
всех случаях ключевые ферменты реагируют либо на абсолютное содержание,
либо на соотношение АДФ, АТФ и Фп. Такая система регуляции очень логична
и направлена на поддержание в клетке режима экономии, при котором ско-
Пируват
1
Киназа
НАДН
Ацетил-СоА
АТФ
NH4
Рис. 4.7. Регуляция пируватдегидрогеназного комплекса за счет обратимого фосфори-
лирования/дефосфорилирования.
Киназа катализирует АТФ-зависимое фосфорилирование одного из белков комплекса, переводя
его в неактивное состояние. Киназа активируется АТФ и ионами аммония, ингибируется пиру-
ватом. Дефосфорилирование при участии фосфатазы восстанавливает активность комплекса. Кроме
того, активность ПДК подавляется продуктами реакции — НАДН и ацетил-СоА; i — ингибиро-
вание; d — активирование
224
рость распада глюкозы соответствовала бы потребностям клетки в АТФ и дру-
гих продуктах дыхания. При высоком уровне АДФ и Фн, который отражает
быстрый расход в клетке синтезируемой АТФ, ключевые реакции гликолиза и
ЦТК активируются, а при накоплении АТФ тормозятся. Благодаря такой си-
стеме регуляции скорость окисления глюкозы и дыхания в целом координиру-
ется в соответствии с энергетическим статусом клетки.
4.1.8. ОБМЕН МЕТАБОЛИТАМИ ЦТК
МЕЖДУ МИТОХОНДРИЯМИ И ЦИТОЗОЛЕМ
Цикл трикарбоновых кислот — это не только необходимый этап энергообме-
на, но и источник соединений, необходимых для многих биосинтезов, проте-
кающих в цитозоле и других компартментах. Благодаря интенсивному обмену с
цитозолем в митохондриях пересекается обмен трех групп важнейших соеди-
нений — углеводов, белков и липидов (рис. 4.8). Например, ацетил-СоА —
исходное соединение для синтеза жирных кислот и полиизопреноидных со-
единений, необходимых при биосинтезе липидов, каротиноидов, раститель-
ных гормонов. Важнейшей функцией цикла является экспорт так называемых
Глюкоза
Гликолиз
Липиды
Аланин
Пируват
Ацетил-СоА
Жирные кислоты
Изопреноидные
соединения
Аспартат
Порфирины
Глутамат
Другие
аминокислоты
Белки
Цитохромы
Фитохромы
Хлорофиллы
Другие
аминокислоты
Белки
Рис. 4.8. Цикл трикарбоновых кислот как центр метаболизма.
Интермедиаты ЦТК активно используются как исходные субстраты при образовании аминокис-
лот, липидов и во многих других биосинтезах. Предлагаемая схема не является полной, она лишь
демонстрирует активный отток метаболитов с основного пути дыхания
8 Физиология растений
225
«углеродных скелетов» в виде кетокислот, необходимых для синтеза амино-
кислот в реакциях переаминирования.
Интеграция митохондрий в общий метаболизм возможна благодаря интен-
сивному обмену метаболитами между матриксом и цитозолем. Наружная мемб-
рана благодаря наличию пор не препятствует такому обмену. Транспорт со-
единений через внутреннюю мембрану осуществляется с помощью интегри-
рованных в нее белков-транспортеров. Транспортеры переносят кето- и амино-
кислоты, адениннуклеотиды, НАД+, коэнзим А и многие другие соединения
(см. также подразд. 4.2.11). Так, во внутренней мембране есть целое семейство
похожих по своей структуре белков, которые осуществляют транспорт анио-
нов ди- и трикарбоновых кислот, участвующих в ЦТК (рис. 4.9). Особенно ин-
тенсивно из митохондрий идет вынос а-кетоглутарата, который необходим
для ассимиляции аммония и синтеза аминокислот в хлоропластах. В мембране
обнаружены два обменных переносчика, которые выносят в цитозоль а-кето-
Рис. 4.9. Обмен метаболитами между матриксом и цитозолем.
Внутренняя мембрана митохондрий содержит белки-переносчики. Пируват и оксалоацетат по-
ступают в митохондрии в обмен на ион ОН или фосфат и метаболизируют в ЦТК с образова-
нием цитрата. Вынос цитрата или а-кетоглутарата в цитозоль в обмен на малат обеспечивает
углеродными скелетами синтез аминокислот в пластидах, в том числе в хлоропластах. В цитозоле
цитрат может превращаться в а-кетоглутарат при участии цитозольной НАДФ-зависимой изо-
цитратдегидрогеназы. Малат/оксалоацетат шаттл обеспечивает обмен НАДН между матриксом и
цитозолем. Шаттл работает благодаря переносчику (известному как ОАА-транспортер), который
осуществляет обменный транспорт через мембрану малата и оксалоацетата в ту и другую сторону.
Важным транспортером является АТФ/АДФ-транслокатор и переносчик фосфата (см. подразд. 4.2.11)
226
глутарат и/или цитрат в обмен на малат. В цитозоле цитрат превращается в изо-
цитрат (при участии аконитазы), а затем окисляется с образованием а-кето-
глутарата в реакции, катализируемой Н АД Ф+-зави симой изоцитратдегидроге-
назой. В обмен на а-кетоглутарат или цитрат в митохондрии поступает малат,
тем самым возмещая углеродные потери ЦТК.
Между митохондриями и цитозолем возможен также обмен восстанови-
тельными эквивалентами. Образующийся в ЦТК НАДН не только окисляется в
дыхательной цепи, но и выносится в цитозоль, где используется как восста-
новитель в разных реакциях, например при восстановлении нитрата (см. гл. 6).
И, наоборот, в ряде случаев НАДН из цитозоля может доставляться в матрикс.
В то же время белок-переносчик для НАДН неизвестен. Обмен НАДН между
матриксом и цитозолем осуществляется с помощью так называемых «челноч-
ных систем», или «шаттлов». Наиболее важная из них — малат/оксалоацетат-
шаттл (рис. 4.9), оперирующий при участии НАД-зависимой малатдегидроге-
назы, изоформы которой есть и в матриксе, и в цитозоле. В митохондриях, где
содержание НАДН высокое, оксалоацетат за счет НАДН восстанавливается до
малата. В мембране присутствует белок-переносчик, обменивающий малат на
оксалоацетат. Оказавшись в цитозоле, малат может быть вновь окислен в обрат-
ной реакции с образованием НАДН. Этот простой челнок в принципе может
работать в двух направлениях в зависимости от соотношения НАДН/НАД+ по
обе стороны митохондриальной мембраны. В то же время есть данные, что in
vivo он работает в основном «на экспорт»: около 25 — 50 % НАДН, образован-
ного в матриксе, окисляется в цитозоле благодаря малат/оксалоацетат-шаттлу.
Цикл трикарбоновых кислот не только поставляет метаболиты, необходи-
мые для синтеза белков и липидов, но также включен в деградацию этих со-
единений. Хотя растения «дышат» в основном углеводами, в некоторых случа-
ях дыхание поддерживают белки или жиры. Например, при развитии пророст-
ков образованные при распаде запасных белков аминокислоты через реакции
переаминирования превращаются в кетокислоты — интермедиаты ЦТК и вклю-
чаются в цикл. Использование жиров при прорастании семян масличных рас-
тений представляет собой особый случай, связанный с функционированием
глиоксилатного цикла.
4.1.9. КОНВЕРСИЯ ЖИРОВ В УГЛЕВОДЫ. ГЛИОКСИЛАТНЫЙ ЦИКЛ
В семенах некоторых растений жиры являются доминирующими запасными
соединениями. К их числу относятся клещевина (Ricinus communis), арахис
(Arachis hypogaea), рапс (Brassica napus), подсолнечник (Helianthus annuus), тыква
(Cucurbita pepo), соя (Glycine max), арабидопсис (Arabidopsis thaliana), пальма
(Elaeis guineensis) и др.
В зависимости от вида растения жиры могут накапливаться в клетках семя-
долей (подсолнечник, рапс, арахис, соя) или в эндосперме (клещевина), т. е.
в тканях, предназначенных «кормить» развивающийся проросток. При прора-
стании таких семян действует особый путь метаболизма, через который жиры
превращаются в сахарозу, и она транспортируется в органы развивающегося
проростка, где используется как субстрат дыхания и как источник углеводов
для биосинтезов (например, клеточной стенки).
227
На пути превращения жиров в углеводы в тканях эндосперма или семядо-
лей действует глиоксилатный цикл, ферменты которого локализованы в осо-
бых органеллах — глиоксисомах.
Глиоксисомы принадлежат к пестрому семейству микротелец, которое у
растений представлено глиоксисомами и пероксисомами. По мере развития
проростка глиоксисомы либо исчезают вместе с эндоспермом, либо превра-
щаются в типичные пероксисомы при зеленении семядолей.
Уникальная конверсия жиров в углеводы включает три этапа: окисление
жирных кислот, глиоксилатный цикл и глюконеогенез. Все три этапа связаны
между собой через взаимодействие четырех компартментов — жировых телец,
глиоксисом, митохондрий и цитозоля (рис. 4.10, 4.11). Обычно растения запа-
сают триацил глицеролы, которые в клетке находятся в виде жировых телец,
или олеосом. Олеосомы отделены от водной фазы мембраной, состоящей из
одного слоя фосфолипидов. Такая необычная структура возникает при образо-
вании олеосом: жиры синтезируются в полостях ЭПР, откладываются между
двумя монослоями мембраны, а затем отщепляются в виде капель. Специаль-
ные белки, олеозины, покрывают их поверхность и предотвращают слипание.
При прорастании семян жиры подвергаются гидролизу при участии липазы с
образованием жирных кислот и глицерола. Глицерол может превращаться в
триозофосфат и участвовать в гликолизе, а свободные жирные кислоты посту-
пают в глиоксисомы, которые как правило находятся с олеосомами в тесном
контакте. Здесь начинается процесс ^-окисления, в результате которого от жир-
ной кислоты последовательно отщепляются 2С-фрагменты с образованием аце-
Н3С—CO-S-CoA СоА
Ацетил-СоА
соо-
।
сн2
с=о
I
СОО“
СОО-
I
сн2
но-с-соо-
I
сн2
соо-
Цитрат
нс-соо-
нсон
соо-
Оксалоацетат
Рис. 4.10. Глиоксилатный цикл.
Реакции 1— 5 катализирут ферменты: 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратлиаза;
4 — малатсинтаза; 5 — НАД-зависимая малатдегидрогеназа. Все ферменты, участвующие в цик-
ле, локализованы в глиоксисоме, за исключением, возможно, аконитазы. Есть данные, что
аконитаза в прорастающих семенях клещевины и тыквы является цитозольным ферментом
228
тил-СоА. Процесс сопровождается восстановлением НАД+ и образованием пе-
рекиси. Образованный НАДН может выноситься из глиоксисом через малат-
оксалоацетат-челнок, а перекись разлагается каталазой (см. подразд. 4.3.2).
Ацетил-СоА является субстратом глиоксилатного цикла, который представ-
ляет собой модифицированный ЦТК (рис. 4.10). Три фермента — цитратсинта-
Рис. 4.11. Взаимодействие компартментов в процессе превращения жиров в углеводы
при прорастании семян масличных растений.
Запасенные в виде жировых капель жиры подвергаются гидролизу липазой. Свободные жирные
кислоты конденсируются с коэнзимом А и образуют ацил-СоА. Последний поступает в глиокси-
сомы, где происходит процесс р-окисления, в котором от жирной кислоты последовательно
отщепляются ацетильные остатки в виде ацетил-СоА. Ацетил-СоА метаболизирует через глиок-
силатный цикл, продуктом которого является сукцинат. Сукцинат поступает в митохондрии, где
под действием ферментов ЦТК превращается в малат. Образованный в цикле малат выходит из
митохондрий и метаболизирует в цитозоле с образованием фосфоенолпирувата. Фосфоенолпи-
руват через глюконеогенез превращается в бС-углеводы
229
6 X
СН2О®
J—-—о.
6НАДФ+ 6НАДФН 6Н2О
СООН
\ ОН
он4—
он
он
Глюкозо-6-фосфат
снон
носн
6НАДФ+ 6НАДФН 6СО2
снон
снон
СН2О®
6-Фосфоглюко-
новая кислота
СН2ОН
с=о
снон
6 х
СНОН
СН2О®
Рибулозо-5-
фосфат
СН2ОН
с=о
носн
снон
СН2О®
Ксилулозо-5-
фосфат
нс=о
снон
I
снон
нс=о
СНОН
СН2О®
3- Фосфоглицери-
новый альдегид
СНОН
СН2О®
Рибозо-5-
фосфат
СН2ОН
с=о
носн
2 X СНОН
снон
сн2о®
с=о
СН2ОН
З-Фосфодиокси-
ацетон
СН2ОН ““1
с=о
6 Седогептулозо- —»• 7-фосфат 7
нс=о
снон
снон
сн2о®
Эритрозо-
4-фосфат
СН2ОН
с=о
СН2ОН
с=о
носн
2 X СНОН
снон
СН2О®
Фрукгозо-
6-фосфат
СН2О®
с=о
носн
снон
снон
I
СН2О®
Фруктозо-
1,6-дифосфат
н20
СН2ОН
с=о
носн
снон
нс=о
носн
СНОН
СН2О®
Ксилулозо-5-
фосфат
2 X СНОН
сн20®
З-Фосфоглицери-
новый альдегид
носн
2 X СНОН
СНОН
СН2О®
Фруктозо-
6-фосфат
12
нс=о
НОСН
X снон
СНОН
СН2О®
Фрукгозо-
6-фосфат
снон
СНОН
сн2о®
Глюкозо-
6-фосфат
из
Рис. 4.12. Пентозофосфатный цикл.
Первые три реакции цикла необратимы и сопровождаются образованием НАДФН и рибулозо-5-фосфата. Последующие реакции обратимы и
представляют собой рекомбинацию 6 молекул 5С-сахаров с образованием 5 молекул глюкозо-6-фосфата. Реакции 1—12 катализируют следу-
ющие ферменты: 1 — глюкозо-6-фосфатдегидрогеназа; 2 — глюконолактоназа; 3 — фосфоглюконатдегидрогеназа; 4 — пентозофосфатэпимераза;
5 — пентофосфатизомераза; 6 — транскетолаза; 7 — трансальдолаза; 8 — транскетолаза; 9 — триозофосфатизомераза; 10 — альдолаза; 11 —
фосфатаза; 12 — глюкозофосфатизомераза
за, аконитаза и малатдегидрогеназа, общие для глиоксилатного цикла и ЦТК,
представлены в глиоксисомах другими изоформами. Две первые реакции гли-
оксилатного цикла идентичны двум первым реакциям ЦТК. Ацетил-СоА кон-
денсируется с оксалоацетатом с образованием цитрата, который затем превра-
щается в изоцитрат при участии аконитазы. Последующие две реакции специ-
фичны для глиоксилатного цикла и катализируются двумя ферментами, уни-
кальными для растений. В первой из них изоцитратлиаза катализирует расщеп-
ление изоцитрата с образованием сукцината и глиоксилата. Сукцинат уходит из
цикла, а глиоксилат в реакции, катализируемой малатсинтазой, вновь конден-
сируется с еще одной молекулой ацетил-СоА с образованием малата. Замыкает
цикл реакция окисления малата до оксалоацетата, идентичная аналогичной за-
мыкающей реакции ЦТК. Таким образом, в результате пяти реакций из двух мо-
лекул ацетил-СоА (ацетильных остатков) синтезируется сукцинат, который
уходит из глиоксисом и используется в синтезе углеводов. Согласно простей-
шей схеме сукцинат поступает в митохондрии, где включается в реакции ЦТК
и восстанавливается до малата. Малат выносится из митохондрий в цитозоль и
окисляется до оксалоацетата при участии малатдегидрогеназы. ФЕП-карбокси-
киназа катализирует реакцию, в которой оксалоацетат превращается в ФЕП.
Фосфоенолпируват, ключевой метаболит гликолиза, может быть превращен в
глюкозу и сахарозу в процессе глюконеогенеза (см. подразд. 4.1.4).
Глиоксилатный цикл функционирует не только в прорастающих семенах
масличных растений, но и в стареющих листьях, а также при созревании пыльцы.
Предполагается, что гены, кодирующие ферменты глиоксилатного цикла,
имеются у всех растений, но экспрессируются не во всех тканях и не на всех
стадиях онтогенеза. При старении листьев пероксисомы, вероятно, трансфор-
мируются в глиоксисомы, и в них начинает функционировать глиоксилатный
цикл, с помощью которого метаболизирует ацетил-СоА, образованный при
деградации липидов мембран. Образующиеся сахара в дальнейшем уходят из
стареющих листьев в другие органы.
4.1.10. ОКИСЛИТЕЛЬНЫЙ ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ
В клетках растений и животных существует еще один способ окисления глю-
козы, не связанный с энергообменом, но играющий важную роль в конструк-
тивном обмене, — окислительный пентозофосфатный цикл (оПФЦ). В ПФЦ
можно выделить два этапа (рис. 4.12). На первом из них первые три реакции
цикла необратимы и связаны с последовательным окислением глюкозо-6-фос-
фата при участии глюкозо-6-фосфатдегидрогеназы и 6-фосфоглюконатдегидро-
геназы. В результате этих двух реакций теряется СО2, восстанавливаются две
молекулы НАДФ+ и образуется рибулезо-5-фосфат. Второй этап включает ре-
акции, связанные с рекомбинацией 5С-сахаров, в результате которых образу-
ется исходный субстрат — глюкозо-6-фосфат. Для того чтобы цикл был замк-
нут, необходимо участие 6 молекул глюкозо-6-фосфата и образование соот-
ветственно 6 молекул рибулезо-5-фосфата. Перегруппировка молекул сопро-
вождается превращением 6 молекул х 5С-сахаров в 5 молекул х бС-сахаров.
У растений ферменты оПФЦ обнаружены как в цитозоле, так и в пластидах.
Пластидные и цитозольные изоформы кодируются разными ядерными генами.
232
В гетеротрофных тканях корня оПФЦ в пластидах протекает достаточно актив-
но, но функционирование оПФЦ в хлоропластах вызывает много вопросов.
Дело в том, что на свету в хлоропластах действует цикл Кальвина, многие
ферменты которого (фосфатазы, транскетолазы, альдолаза, триозофосфати-
зомераза) являются также ферментами оПФЦ. Поэтому полагают, что в хло-
ропластах оПФЦ действует только в темноте. «Выключение» цикла на свету
связано с механизмом регуляции пластидной изоформы глюкозо-6-фосфатде-
гидрогеназы. Как уже говорилось, активность ферментов может изменяться в
результате их обратимого фосфорилирования. Еще один распространенный
способ регуляции — это окисление или восстановление фермента по особой,
регуляторной дисульфидной связи. На свету глюкозо-6-фосфатдегидрогеназа
переходит в неактивное состояние в результате восстановления по дисульфид-
ной связи (—S—S ► —SHHS—), тогда как в темноте происходит спонтан-
ное окисление фермента. Полагают, что в восстановлении участвует ферредок-
син или тиоредоксин, восстановленные в ходе фотосинтеза. Основная функ-
ция оПФЦ — это генерация НАДФН, который требуется во многих биосинте-
зах, а также синтез углеводов с разным числом углеродных атомов. Образу-
ющиеся в цикле 5С- и 4С-углеводы активно уходят из цикла, так как необхо-
димы для синтеза нуклеотидов, ароматических соединений, витаминов, фла-
воноидов, полисахаридов клеточной стенки и т. д. ЗС- и бС-сахара также могут
покидать цикл и включаться в процесс гликолиза, который протекает в тех же
компартментах. С учетом этого функционирование полного и замкнутого оПФЦ
in vivo как в цитозоле, так и в хлоропласте представляется маловероятным.
4.2. ЭЛЕКТРОННЫЙ ТРАНСПОРТ И СИНТЕЗ АТФ
В МИТОХОНДРИЯХ РАСТЕНИЙ
4.2.1. ЭЛЕКТРОН-ТРАНСПОРТНАЯ ЦЕПЬ ДЫХАНИЯ.
ПЕРЕНОС ЭЛЕКТРОНА ОТ НАДН НА КИСЛОРОД
В предыдущем разделе были рассмотрены окислительные превращения глю-
козы в биохимических реакциях, в результате которых образуются небольшое
количество АТФ и восстановительные эквиваленты в виде НАДН и ФАДН2.
Заключительный этап дыхания связан с трансформацией энергии на сопряга-
ющей мембране и синтезом основной массы АТФ. Образованные в ЦТК НАДН
и ФАДН2 окисляются в ЭТЦ дыхания, локализованной во внутренней мемб-
ране митохондрий. Окисление сопровождается транспортом 2е~ по цепи пере-
носчиков на О2, который восстанавливается до воды. Переносчиками электро-
нов (кроме убихинона) в дыхательной цепи служат белки, содержащие про-
стетические группы. Это флавопротеиды, в составе которых есть ФМН или
ФАД, цитохромы и железосерные белки (см. подразд. 2.2). Способность этих
соединений отдавать или принимать электроны может быть охарактеризована
через стандартный редокс-потенциал Е°'. В дыхательной цепи перенос электро-
на от НАДН {Е°’ = -0,32) на О2 (Е°' = +0,82) идет через цепь переносчиков по
градиенту, т. е. от соединений с более отрицательным к соединениям с более
положительным редокс-потенциалом (рис. 4.13). Последовательность располо-
233
+0,25
+0,3
+0,82
Е°', В
-0,3-
0,0-
соответствии со значениями редокс-потенциала
жения в цепи переносчиков впервые была определена в начале 50-х гг. XX в.
Б. Чансом. Дело в том, что многие компоненты дыхательной цепи имеют разные
спектры поглощения в окисленном и восстановленном состояниях. При исполь-
зовании высокочувствительной спектрофотометрии удалось определить их пере-
ходы из окисленного в восстановленное состояние и обратно во времени. Об-
наружение ингибиторов, избирательно блокирующих электронный транспорт
на разных участках, оказалось чрезвычайно полезным в этих исследованиях.
В митохондриальной мембране ЭТЦ организована сложным образом. В соста-
ве основной цепи, т.е. общей для животных, растений и грибов, есть четыре
трансмембранных белковых комплекса (I —IV) и АТФ-синтаза (комплекс V)
234
Межмембранное
пространство
Рис. 4.14. Электрон-транспортная цепь внутренней мембраны растительных
митохондрий.
В состав основной цепи, общей для митохондрий животных и растений, входят комплексы I —
IV, связь между которыми осуществляют подвижные переносчики электронов — убихинон (Q)
и цитохром с. Для каждого комплекса известен специфический ингибитор: ротенон, антимицин
A, KCN и СО. Комплексы I, 111 и IV работают как протонные помпы: стрелками указана транс-
локация Н+ из матрикса в межмембранное пространство. Энергия Дщ,+ обеспечивает работу АТФ-
синтазы, катализирующей синтез АТФ из АДФ и Фн. Дыхательная цепь растений дополнительно
содержит четыре ротеноннечувствительные НАД(Ф)Н-дегидрогеназы и альтернативную оксида-
зу (АО). НАД(Ф)Н-дегидрогеназы расположены на внешней (ДГСХ) и внутренней (ДГ/Л) сторо-
нах мембраны. Альтернативная оксидаза является второй терминальной оксидазой растений и
восстанавливает О2 до воды в обход комплексов III и IV. Специфическим ингибитором альтерна-
тивной оксидазы является салицилгидроксамовая кислота (SHAM). I — комплекс I: НАДН-
дегидрогеназа; II — комплекс II: сукцинатдегидрогеназа; III — комплекс III: цитохром ЬС]-ком-
плекс; IV — комплекс IV: цитохромоксидаза
(см. рис. 4.13, 4.14). Каждый из комплексов состоит из многих субъединиц бел-
ка, часть которых кодируется митохондриальной ДНК, а часть ядерным гено-
мом. Переносчики электронов входят в состав комплексов: их простетические
группы, или редокс-центры, формируют пути переноса электрона. Связь меж-
ду комплексами осуществляют подвижные переносчики: убихинон и цитохром
с. Участники транспорта могут функционировать как двухэлектронные (фла-
вопротеиды и убихинон) и одноэлектронные (цитохромы и Fe-S-белки) пе-
реносчики.
Общая схема работы основной дыхательной цепи (далее ДЦ) такова (рис.
4.14). Образованный в матриксе в ходе ЦТК НАДН окисляется на комплексе I,
который представляет собой НАДН-дегидрогеназу. Окисление НАДН сопровож-
дается переносом 2е~ на убихинон или просто хинон (Q — от англ, quinori). Как
было показано в гл. 2 «Биоэнергетика», для полного восстановления Q необхо-
димо два атома водорода. Поэтому, принимая 2е~, убихинон захватывает недо-
стающие 2Н из матрикса и переходит в восстановленную форму убихинола
235
(QH2). Убихинон может быть также восстановлен в результате окисления сук-
цината на комплексе II, который представляет собой сукцинатдегидрогеназу и
является также компонентом ЦТК. Окисление сукцината до фумарата в ЦТК
сопровождается восстановлением ФАД — простатической группы комплекса II,
с которой е~ передаются на убихинон.
Убихинон в виде пула Q и QH2 растворен в липидном бислое мембраны. С пула
QH2 электроны уходят на комплекс III, или цитохром Ь/с{-комплекс, с кото-
рого передаются на цитохром с, локализованный в межмембранном простран-
стве. Этот небольшой водорастворимый белок действует как одноэлектронный
переносчик между комплексами III и IV, перемещаясь путем диффузии вдоль
мембраны. Комплекс IV, или цитохромоксидаза, — последний комплекс ДЦ,
терминальная оксидаза всех аэробных организмов. Комплекс акцептирует элек-
троны с цитохрома с и передает их на О2, который в итоге восстанавливается
до Н2О.
Для полного восстановления О2 необходимо 4е“, поэтому 4 цитохрома с
должны быть окислены на комплексе IV, чтобы произошла реакция
О2 + 4Н+ + 4е" = 2Н2О
Перенос е~ в цепи по градиенту редокс-потенциала представляет собой эк-
зергонический процесс с отрицательным значением Дб°'. Освобождаемая при
этом свободная энергия запасается на мембране в форме Дцн+- Электронный
транспорт сопряжен с генерацией АЦН+, так как неразрывно связан с направ-
ленным переносом ионов Н+ через мембрану. Три комплекса цепи — I, III, IV —
функционируют как протонные помпы, перекачивая протоны из матрикса в
межмембранное пространство. Энергия Дцн* реализуется для синтеза АТФ из
АДФ и Фн на АТФ-синтазных комплексах (Р0Р|-АТФазах), также интегриро-
ванных во внутреннюю мембрану митохондрий.
Сопряженный с электронным транспортом синтез АТФ получил название
окислительного фосфорилирования. Такой является основная, или «стандартная»,
дыхательная цепь, общая для животных и растений, но у растений в отличие
от животных дыхательная цепь организована сложнее: помимо комплексов I —
IV она содержит пять дополнительных ферментов: четыре НАД(Ф)Н-дегидроге-
назы, способные наряду с комплексом I окислять НАДН, а также и НАДФН.
Но наиболее интересная и удивительная особенность дыхания растений связа-
на с присутствием во внутренней мембране растительных митохондрий аль-
тернативной оксидазы. Альтернативная оксидаза (АО) окисляет QH2 и восста-
навливает О2 до воды и является, таким образом, второй терминальной окси-
дазой в дыхательной цепи растений. С пула QH2 электроны могут идти по двум
направлениям — по цитохромному пути через комплексы III и IV, или по
альтернативному пути через альтернативную оксидазу (рис. 4.14). Электрон-
ный транспорт по альтернативному пути не сопровождается генерацией Дцн*,
поэтому большая часть энергии электронного потока рассеивается в виде тепла.
Рассмотрим подробно события, которые происходят на комплексах ДЦ и
которые являются предметом интенсивного изучения во многих лабораториях
мира. Все комплексы удалось выделить из мембран и исследовать (за исключе-
нием комплекса I) их трехмерную молекулярную структуру с разрешением
0,29 нм с помощью ренгеноструктурного анализа. В то же время события на
комплексах нельзя считать до конца установленными, и полученные факты
236
только приближают нас к истине. При этом следует признать, что исследова-
ний на растительных объектах было мало, и во многом наши знания базируют-
ся на аналогиях с другими, более изученными системами животного или бак-
териального происхождения.
4.2.2. КОМПЛЕКС I, ИЛИ НАДН-ДЕГИДРОГЕНАЗА. ЭЛЕКТРОННЫЙ
ТРАНСПОРТ В КОМПЛЕКСЕ СОПРЯЖЕН С ГЕНЕРАЦИЕЙ Дрн*
Комплекс I (НАДН-убихинон-оксидоредуктаза), был выделен из ряда объек-
тов: митохондрий сердца быка, из митохондрий сахарной свеклы (Beta vulgaris),
картофеля (Solatium tuberosum), бобов (Vicia faba), арабидопсиса и риса (Oryza
sativa), а также митохондрий гриба Neurospora crassa и мембран Escherichia coli.
Исследования показали, что по своим свойствам он существенно не отличает-
ся у объектов животного и растительного происхождения. У эукариот этот круп-
ный комплекс с молекулярной массой 700 — 900 кДа состоит из 24—43 (в за-
висимости от объекта) белковых субъединиц. У прокариот комплекс I состоит
из 14 субъединиц: семи чрезвычайно гидрофобных, локализованных в мембра-
не, и семи относительно гидрофильных, расположенных вне мембраны. У эука-
риот этот эволюционно-консервативный кор-комплекс обрастает «шубой» из
многих дополнительных субъединиц, функции которых по большей части не-
известны. Электронная микроскопия показала, что комплекс имеет характер-
ную L-образную форму, напоминающую башмак. Гидрофобная «подошва» пред-
ставлена белками, встроенными в мембрану, а гидрофильная часть — «лодыж-
ка» — обращена в матрикс (рис. 4.15). У растений девять субъединиц, входящих
в состав гидрофобной части комплекса, кодируются митохондриальной ДНК,
а остальные компоненты находятся под контролем ядерных генов. Интересно,
что мутации, затрагивающие комплекс I, возникают при некоторых заболева-
ниях человека, например в случае болезни Альцгеймера. У растений мутации
по комплексу I описаны у табака (Nicotiana silvestris) и кукурузы (Zea mays)-.
мутации сопровождались патологией пыльцы и приводили к такому явлению,
как цитоплазматическая мужская стерильность.
В качестве редокс-центров в комплексе действует один ФМН, расположен-
ный в гидрофильной части комплекса, а также 6—7 железосерных центров
(2Fe-2S- и 4Ге-48-кластеры), обозначаемых как Nl, N2, N3 и т.д. (рис. 4.15).
Кроме того, в гидрофобной части комплекса есть по крайней мере два сайта
связывания для Q, в одном из которых, по-видимому, находится прочно свя-
занный убихинон, фиксированный в структуре комплекса.
Классическими ингибиторами комплекса I являются ротенон, амитал на-
трия и пиерицидин А. Ротенон — флавоноид, эстрагируемый из корней неко-
торых тропических растений, блокирует электронный транспорт между одним
из Fe-S-кластеров и пулом убихинона. Ротенон давно используется как инсек-
тицид и рыбный яд, так как митохондрии насекомых и рыб особенно к нему
чувствительны. Амитал натрия представляет производное барбитурной кислоты.
Пиерицидин А — антибиотик, продуцируемый Streptomyces, является структур-
ным аналогом убихинона и конкурирует с ним за места связывания. Комплекс
окисляет «внутренний», т.е. образованный в матриксе НАДН (Е°' =-0,32 В), и
восстанавливает убихинон (Е°' = +0,09 В). (Комплекс I имеет низкое сродство
237
Рис. 4.15. Организация в мембране и функционирование комплекса 1, НАДН убихи-
нон оксидоредуктазы.
Комплекс состоит из гидрофобного компонента, встроенного в мембрану, и гидрофильной
части, обращенной в матрикс. Комплекс действует как НАДН-дегидрогеназа, т.е. окисляет НАДН
и восстанавливает убихинон. В комплексе транспорт электрона идет через ФМН, несколько Fe-
S-центров и фиксированный в структуре комплекса убихинон (Q,). Транспорт двух электронов
сопровождается восстановлением Q с использованием 2Н+, а также транслокацией из матрикса
в межмембранное пространство предположительно 4Н+ за счет плохо изученного механизма
к НАДФН и не вносит существенного вклада в его окисление.) При этом
комплекс работает как протонная помпа: на каждый окисленный НАДН и
восстановленный Q через мембрану из матрикса (in) в межмембранное про-
странство (out) перекачивается как минимум 4Н+:
НАДН + Н+ + Q + 4Htn — НАД+ + QH2 + 4H*ut
Известно, что НАДН при окислении отдает 2<?“ на ФМН (Е°' —0,30 В), с
которого электроны поочередно уходят на Fe-S-центры (Е°' ~-0,25...-0,05 В),
функционирующие как одноэлектронные переносчики. При этом точный путь
е~ в комплексе не установлен: есть данные, что восстановление Q идет с N2-
кластера. В конечном итоге хинон принимает 2е~ и полностью восстанавливает-
ся до QH2, захватывая из матрикса 2Н+. Транспорт электрона в комплексе со-
пряжен с направленным переносом протонов и генерацией на внутренней
мембране Дцщ. Механизм этого процесса не установлен. Обсуждаемые модели
(P.L. Dutton et al., 1998) основаны на предположении, что в комплексе опе-
рирует система, похожая на Q-цикл (см. подразд. 4.2.4). Дело в том, что в ком-
плексе методом ЭПР (электронно-парамагнитного резонанса) обнаружены сай-
ты, в которых связанные хиноны могут находиться в разных редокс-состояни-
238
ях: окисленном (Q), восстановленном (QH2) и в состоянии семихинона (Q').
Предполагается, что электронный транспорт в комплексе связан с обратимым
восстановлением и окислением связанных хинонов. Процесс организован так,
что при восстановлении Q протоны захватываются из матрикса, а при окисле-
нии — освобождаются в межмембранное пространство.
4.2.3. КОМПЛЕКС II, ИЛИ СУКЦИНАТДЕГИДРОГЕНАЗА
Комплекс II (сукцинат-убихинон-оксидоредуктаза) функционирует как часть
ЦТК и как компонент дыхательной цепи. Комплекс был выделен из митохонд-
рий картофеля (Solatium tuberosum), батата (Ipomoea batatas), маша (Vigna radiata),
а также из объектов животного происхождения и бактерий. Его кристаллическая
структура была определена у ряда бактерий. Комплекс (мол. масса ~ 125 кДа)
состоит из четырех крупных полипептидов (А, В, С, D), кодируемых ядерным
геномом (рис. 4.16). Субъединицы С и D — трансмембранные белки; А и В —-
представляют гидрофильную часть, обращенную в матрикс. С основной частью
могут быть также ассоциированы мелкие гидрофобные белки, функции кото-
рых остаются неизвестными.
Редокс-центрами комплекса являются ФАД (Е°' ~ 0,0 В) и три железосер-
ных центра: 2Fe-2S-, 4Fe-4S- и ЗЕе-45-кластеры (Е°’ —0,12...0,0 В). Кроме
того, в комплексе обнаружен гем й-типа (цитохром ^о), который не участвует
Межмембранное
пространство
Цит. Й56о
Матрикс
Рис. 4.16. Организация в мембране и функционирование комплекса II.
Комплекс состоит из 4 крупных полипептидов. Две гидрофильные субъединицы комплекса (А и
В) обращены в матрикс и проявляют сукцинатдегидрогеназную активность. Две гидрофобные
субъединицы (С и D) встроены в мембрану. При окислении сукцината электроны передаются на
ковалентно связанный ФАД, затем на Fe-S-центры, обозначаемые как SI, S2 и S3, и далее на
Q, точное место связывания которого остается неизвестным. Транспорт двух электронов сопро-
вождается восстановлением Q с использованием 2Н+ из матрикса. В комплексе обнаружен гем
/>5бо, с неясной функцией
239
в электронном транспорте и функция которого неясна. Специфическими ин-
гибиторами комплекса II являются щавелевоуксусная кислота и структурный
аналог сукцината — малонат.
Комплекс окисляет сукцинат (Е°' = -0,025 В) до фумарата и восстанавлива-
ет убихинон (Е°' = +0,09 В):
Сукцинат + Q —*• Фумарат + QH2
Электроны, отнимаемые от сукцината, переносятся сначала на ФАД, а затем
через Fe-S-кластеры на Q. Электронный транспорт в комплексе не сопровож-
дается генерацией Ацц*- Образующиеся при окислении сукцината 2Н остаются
на той же стороне мембраны, т. е. в матриксе, и затем поглощаются при вос-
становлении хинона. Таким образом, комплекс II не вносит вклад в энергиза-
цию мембраны и работает только как переносчик е от сукцината к убихинону.
4.2.4. КОМПЛЕКС III, ИЛИ ЦИТОХРОМ ЬсгКОМПЛЕКС. ЭЛЕКТРОННЫЙ
ТРАНСПОРТ В КОМПЛЕКСЕ СОПРЯЖЕН С ГЕНЕРАЦИЕЙ Арщ
Комплекс III (убихинол-цитохром с-оксидоредуктаза) выделен из мито-
хондрий сердца быка, цыпленка, кролика и митохондрий дрожжей. В состав
комплекса из митохондрий сердца быка (мол. масса -248 кДа) входит порядка
11 белковых субъединиц, 8 из которых представляют собой мелкие гидрофоб-
ные мембранные белки с неизвестной (возможно, структурной) функцией.
Известно, что комплекс образует в целом 13 белковых петель, пересекающих
мембрану. Из всех белков комплекса только цитохром b кодируется митохонд-
риальным геномом.
Функциональными компонентами комплекса, несущими редокс-центры,
являются:
— цитохром Ь, в составе которого есть два гема й-типа с разными редокс-
потенциалами: гем bL с низким (Е°’ —0,075.. 0,09 В) и гем Z>H с высоким
(Е°' - +0,05 В) потенциалом;
— железосерный белок Риске, в составе которого есть 2Ге-25-центр (Е°' -
- +0,28 В);
— цитохром С] (Е°' -+0,23...+0,25 В);
— центры связывания для убихинона: Qin-ueHTp и РоиГцентр.
Известно, что in vivo комплекс функционирует как димер. Ингибитором
комплекса является антибиотик антимицин А, который связывается и блокиру-
ет Р1П-центр. Кроме того, места связывания хинонов блокируются антибиоти-
ками, получаемыми из миксобактерий, — миксотиазолом и стигмателлином.
Цитохром Ьс\-комплекс окисляет восстановленный убихинон и восстанав-
ливает цитохром с (Е°' - +0,25 В) согласно уравнению
QH2 + 2 цит. с+3 + 2Н*П —Q + 2 цит. с+2 + 4HoUt
Электронный транспорт в комплексе сопряжен с переносом протонов из
матрикса (in) в межмембранное пространство (out) и генерацией на мембране
Ацн+. События, которые при этом происходят, известны как Q-цикл, который
был постулирован П. Митчеллом (1976). Принцип Q-цикла состоит в том, что
перенос Н+ через мембрану происходит в результате окисления и восста-
240
новления хинонов на самом комплексе. При этом хиноны соответственно от-
дают и забирают 2Н+ из водной фазы избирательно с разных сторон мембраны
(рис. 4.17, А, Б).
В структуре комплекса III есть два центра, или два «кармана», в которых
могут связываться хиноны. Один из них, Qout-neHTp, расположен между 2Fe-
25-центром и гемом вблизи внешней (out) стороны мембраны, обращен-
ной в межмембранное пространство. В этом кармане связывается восстановлен-
ный QH2. Другой, Qip-карман, предназначен для связывания окисленного уби-
хинона (Q) и расположен вблизи внутренней (in) стороны мембраны, кон-
тактирующей с матриксом. Транспорт электрона в комплексе организован сле-
дующим образом. Сначала первый QH2 связывается и окисляется в Qout-neHT-
ре, освобождая при этом 2Н в межмембранное пространство. При этом один
е~ уходит на 2Ре-25-центр белка Риске и далее на цитохром и цитохром с
(рис. 4.17, Л). В результате в Qoilt-nempe остается анион-радикал — семихинон
Q‘ (см. подразд. 2.12 и рис. 2.8). В Qout-neHTpe Q7 крайне нестабилен и быстро
отдает второй электрон на гем Z>L и далее на гем Z>H. Расположение этих гемов в
комплексе перпендикулярно плоскости мембраны, в результате чего электрон
пересекает мембрану в направлении к Qin-neHTpy. В этом «кармане» уже связан
окисленный Q, который принимает один е~ с гема Z>H и восстанавливается до
семихинона (Q'), находящегося здесь в более стабильном состоянии. Затем все
события повторяются при окислении второго QH2 (рис. 4.17, Б). Один е~ ухо-
дит на 2Ре-28-центр и далее на цитохромы с, и с, а второй е~ передается через
два гема в Р,п-карман; здесь семихинон Q‘ принимает второй электрон и полно-
стью восстанавливается до QH2 захватывая 2Н+ из матрикса. Восстановленный
таким образом QH2 покидает Qin-центр, уходит в мембранный пул и может
быть вновь окислен в 0О11(-центре комплекса. Таким образом, при окислении
двух QH2 в Qollt-центре каждый раз 2Н+ уходят в межмембранное пространство.
Из 4е , отданных в комплекс, 2е" идут на восстановление цитохрома с, т.е.
уходят по цепи, а два других последовательно восстанавливают Q до QH2 в Qin-
центре, что сопровождается захватом из матрикса еще 2Н+. Написав общее
уравнение, а затем сократив его, получим выражение, приведенное выше:
2QH2 + 2 цит. с3+ + 2Н* + Q = 2Q + QH2 + 2 цит. с2+ + 4HoUt,
или QH2 + 2цит.с3+ + 2Н^П = Q + 2цит.с2+ + 4HoUt
В итоге на каждый е~, уходящий по цепи, 2Н+ переносятся из матрикса в
межмембранное пространство (2е“/4Н+).
Необходимым и парадоксальным условием работы Q-цикла является тот
факт, что время жизни и состояние семихинонов в двух центрах связывания
разное. В Qout-neHTpe Q’ нестабилен и действует как сильный восстановитель,
способный отдать е~ на низкопотенциальный гем Z>L. В Q^-центре образуется
относительно долгоживущий Q7, потенциал которого позволяет ему действо-
вать в качестве окислителя, принимая электроны с гема Z>H- Еще один ключе-
вой момент Q-цикла связан с расхождением двух электронов, входящих в ком-
плекс, по двум разным путям. Механизм такой транспортной «развязки» ин-
тригует исследователей. Изучение кристаллической структуры комплекса пока-
зало, что позиция 2Ре-25-центра относительно других редокс-центров может
смещаться. Оказалось, что белок Риске имеет подвижный домен, на котором
241
A
Рис 4.17. Организация в мембране комплекса III и работа Q-цикла.
В электронном транспорте участвуют: 2Ре-28-центр белка Риске, гемы Z>L и />н цитохрома Ь,
цитохром С], а также убихиноны, связанные в Q,- и Qo-центрах.
А — первый QH2 связывается в Qo-центре и окисляется, отдавая 2Н+ в межмембранное про-
странство. При этом 1 е~ уходит на 2Ре-28-центр и далее на цитохром с( и цитохром с. В Qo-центре
остается нестабильный семихинон Q', который отдает второй электрон на гем bL и далее на гем
/>н. В итоге второй электрон попадает в Q,-центр и восстанавливает окисленный хинон с образо-
ванием более стабильного семихинона Q‘; Б — при окислении второго QH2 один электрон опять
уходит на 2Ре-28-центр и последовательно восстанавливает цитохромы с, и с. Второй электрон
через гемы bL и Ьн попадает в Q,-центр и восстанавливает Q' с образованием QH2. При этом 2Н*
захватываются из матрикса. Образованный в Q,-центре QH2 уходит в мембранный пул и может
быть вновь окислен на комплексе. Транспорт двух электронов через комплекс сопровождается
восстановлением двух цитохромов с и переносом 4Н+ через мембрану за счет работы Q-цикла
242
собственно и расположен 2Ре-28-центр. Принимая электрон и восстанавлива-
ясь, 2Fe-2S центр меняет свое положение, отдаляясь от QO[)t-центра и гема Z>L
на 1,64 нм (2,12 нм) и тем самым приближаясь к цитохрому с(. Отдав электрон
цитохрому, 2Ре-28-центр, наоборот, сближается с ОоШ-центром для установ-
ления более тесного контакта. Таким образом, функционирует своеобразный
челнок (шаттл), гарантирующий уход второго электрона на гемы Ь{ и Ьц. Пока
это единственный пример, когда электронный транспорт в комплексах связан
с подвижным доменом в структуре белка.
Данные рентгеноструктурного анализа, позволяющие определить положе-
ние активных групп относительно друг друга, дают основание думать, что элект-
ронный транспорт возможен не только между двумя гемами комплекса, но и
между двумя гемами Ь[, расположенными на разных комплексах, ассоцииро-
ванных в димер.
Комплекс III полифункционален. Недавние исследования на митохондриях
пшеницы {Triticum aestivum), картофеля (Solatium tuberosum) и шпината (Spinacia
oleracea) показали, что одна (две) из субъединиц комплекса, обращенных в мат-
рикс, обладает MPP(Mitochondrial Processing Рерйба8е)-пептидазной активностью
и принимает участие в транспорте белков в митохондрии (см. подразд. 4.2.11).
Следует сказать, что среди комплексов, способных генерировать Ацн+, ком-
плекс III наиболее универсальный. Он присутствует не только в митохондри-
альной мембране, но и в мембранах хлоропластов и хроматофоров. В ЭТЦ фо-
тосинтеза функционирует цитохром />6/-комплекс, аналогичный цитохром
Ьс\-комплексу дыхательной цепи.
Итогом сложной работы комплекса III является восстановление цитохрома с.
Цитохром с — это небольшой (мол. масса - 12,5 кДа) белок, единственный
белок цепи, не интегрированный в мембрану. Цитохром с курсирует вдоль
мембраны в межмембранном пространстве и переносит по одному е~ на следу-
ющий и последний комплекс дыхательной цепи — цитохромоксидазу
4.2.5. КОМПЛЕКС IV, ИЛИ ЦИТОХРОМОКСИДАЗА. ЭЛЕКТРОННЫЙ
ТРАНСПОРТ В КОМПЛЕКСЕ СОПРЯЖЕН С ГЕНЕРАЦИЕЙ Арщ
Комплекс IV {цитохром с-кислород-оксидоредуктаза) или цитохромоксида-
за, был выделен и изучен на таких объектах, как митохондрии сердца быка и
мембраны бактерии Paracoccus denitrificans. Комплекс из митохондрий быка (мол.
масса -125 кДа) состоит из 13 белковых субъединиц.
Три большие трансмембранные субъединицы кодируются митохондриаль-
ной ДНК и окружены 9—10 более мелкими, синтез которых контролируется
ядерными генами.
Редокс-центры комплекса расположены на двух крупных субъединицах I и
II, интегрально встроенных в мембрану (рис. 4.18). На субъединице II располо-
жен СиА-центр (Е°‘ - +0,24 В). В его составе есть два атома меди, лигандами
которых являются остатки гистидина, метионина, глутамата и цистеина. Не-
смотря на присутствие двух атомов меди, СиА-центр функционирует как одно-
электронный переносчик, при этом медь меняет свою валентность Cu2+ *-*- Си1+.
Известно, что субъединица I образует 12 трансмембранных петель и содержит
три редокс-центра: гем а (Е°' = +0,22 В) и так называемый биядерный центр
243
Межмембранное
пространство
Рис. 4.18. Организация в мембране и функционирование комплекса IV, цитохром с-ки-
слород-оксидоредуктазы.
На рисунке изображены две крупные субъединицы комплекса (I и II), на которых расположены
редокс-центры. Комплекс последовательно окисляет четыре цитохрома с. Акцептируемые элект-
роны сначала поступают на CuA-центр, затем на гем а и биядерный центр гем а3-СиВ. В биядер-
ном центре происходит акт восстановления О2 с образованием двух молекул Н2О. При этом 4Н*
захватываются из матрикса. Электронный транспорт в комплексе сопряжен со встречным движе-
нием протонов: на каждый электрон, поступивший в комплекс, один ион Н+ выкачивается из
матрикса в межмембранное пространство. Пути, по которым протоны пересекают комплекс,
получили название D-, К- и Н-каналов
гем а3-СиВ (Е°’ = +0,38 В), в состав которого входит гем а3 и атом меди. Атом
Fe в составе гема а3 и атом Си связаны с остатками гистидина в структуре
белка. Кроме того, недавно в комплексе обнаружены ионы Mg2+ и Zn2+. Извес-
тно, что комплекс IV проявляет наибольшую активность в форме димера. Клас-
сические ингибиторы комплекса — цианид, азид и СО.
Комплекс IV последовательно окисляет 4 цитохрома с (Е°' = +0,25 В) и,
принимая 4е“, восстанавливает О2 до Н2О (Е°' = +0,82 В). Электронный транс-
порт сопряжен с генерацией на мембране Дцн+- Два различных механизма вно-
сят вклад в образование Дцн+: при восстановлении О2 четыре Н+ захватываются
из матрикса для образования 2 молекул Н2О и еще 4Н+ активно перекачива-
ются из матрикса в межмембранное пространство, пересекая через комплекс
мембрану:
4 цит. с2+ + 4Htn + 4Н^П + О2 = 2Н2О + 4HoUt + 4цит.с3+
Путь электрона в комплексе известен. Цитохром с связывается на субъеди-
нице II и восстанавливает CuA-центр, расположенный вблизи поверхности
мембраны. С Си А-центра е уходит на гем а и далее на биядерный центр гем а3 —
СиВ, расположенные в толще мембраны. В биядерном центре происходит свя-
зывание О2 и его восстановление до Н2О. Механизм восстановления кислорода
уже давно является предметом интенсивного изучения, но ясен не до конца.
Известно, что необходимые для восстановления О2 электроны поступают в
биядерный центр последовательно. При этом фиксируются разные редокс-со-
стояния, которые возникают при переходе окисленного центра [Fe3+—Cu2+] в
полностью восстановленное [Fe2+—Cu1+] состояние.
244
Помимо того, что комплекс IV захватывает из матрикса 4Н+ для образова-
ния двух молекул воды, он еще работает как протонная помпа, перекачивая
1Н+ из матрикса наружу на каждый электрон, входящий в комплекс (4е“/4Н+).
Механизм захвата и транслокации ионов Н+ точно не установлен. Рентгено-
структурный анализ, а также данные, полученные с помощью метода сайт-
специфичного мутагенеза, выявили в структуре субъединицы I пути, по кото-
рым протоны могут проникать и через комплекс пересекать мембрану. Эти
пути получили название D-, К- и Н-каналов. В каналах, выстланные полярными
аминокислотными остатками, по-видимому, удерживаются молекулы воды. Об-
наруженный недавно в комплексе ион Mg2+, возможно, как раз и нужен для
стабилизации этих молекул. Предполагается, что К-канал связывает водную фазу
матрикса с биядерным центром и служит для доставки «субстратных» прото-
нов, необходимых при образовании воды. D-канал, по-видимому, формирует
сквозной путь, и по нему могут проходить как «субстратные» протоны, так и
протоны, перекачиваемые через мембрану. У эукариот обнаружен еще Н-ка-
нал, который, вероятно, также является сквозным. Несмотря на то что моле-
кулярная структура комплекса IV достаточно полно расшифрована, механизм
его работы остается непонятным. Предполагается, что встречный транспорт
Н+ и электронов в комплексе тесно сопряжен с редокс-реакциями в биядер-
ном центре. Данные, полученные методом сайт-специфичного мутагенеза,
доказывают, что активную роль в этом играют определенные аминокислотные
остатки, мутации по которым блокируют те или иные стадии в работе комп-
лекса. Речь идет прежде всего об остатках гистидина-284, тирозина-288 и глута-
мата-286, расположенных вблизи биядерного центра, а также остатках лизина-
362 и аспартата-132, играющих ключевую роль в функционировании каналов.
4.2.6. ЭЛЕКТРОННЫЙ ТРАНСПОРТ СОПРЯЖЕН С СИНТЕЗОМ АТФ
С точки зрения термодинамики, транспорт двух электронов по градиенту
потенциала от НАДН (£°' = -0,32 В) к кислороду (Е°' = +0,82 В) сопро-
вождается отрицательным изменением стандартной свободной энергии, вели-
чина которого может быть рассчитана по формуле А (7°' = -nFkE°' и составляет
-52,7 ккал. Освобождаемая свободная энергия используется для синтеза АТФ
из АДФ и Фн. Известно, что для этой реакции необходимо около 11—13 ккал,
так что теоретически окисление НАДН может быть сопряжено с синтезом как
минимум трех молекул АТФ. Возникает вопрос, а сколько молекул АТФ обра-
зуется реально? В начале 1950-х гг. были проведены опыты по определению
коэффициента P/О, равного числу молекул ортофосфата, используемого для
фосфорилирования АДФ в расчете на каждый атом поглощенного кислорода.
Оказалось, что отношение P/О зависит от природы окисляемого субстрата и
при окислении НАДН может приближаться к трем (2,5 —2,7), а при окисле-
нии сукцината — к двум (1,5 —1,8). Отсюда возникло представление, основан-
ное также на величинах перепада свободной энергии на разных участках цепи,
что в самой дыхательной цепи существуют три места, или пункта сопряжения,
где происходит синтез АТФ. Транспорт е может идти через три или два пун-
кта сопряжения и сопровождаться соответственно синтезом трех или двух мо-
лекул АТФ.
245
Теперь мы знаем, что эти представления оказались не совсем верными: синтез
АТФ происходит не в дыхательной цепи. Работа цепи состоит лишь в перекачке
через мембрану протонов для образования градиента Дцн+, который необхо-
дим для работы АТФ-синтазы. Исследователи продолжают использовать тер-
мин «пункты сопряжения», но теперь под ними подразумевают те участки
цепи, на которых возникает Дцн+, т.е. комплексы I, III и IV. Если при окисле-
нии НАДН электроны идут по полной цепи, т. е. через три пункта сопряже-
ния, величина генерируемого Дцн+ будет максимальной. Окисление сукцината
на комплексе II сопряжено с транспортом е~ только через два пункта сопряже-
ния. В итоге величина генерируемого цепью Дцн+ будет меньше, и меньше будет
число синтезируемых молекул АТФ. У растений альтернативный путь дыхания
через АО потенциально имеет только один пункт сопряжения (комплекс I) и
диссипирует большую часть энергии в тепло. Следовательно, в зависимости от
преобладания того или иного пути окисления субстрата in vivo величина ЛЦН+,
а значит, и число синтезируемых молекул АТФ будут варьировать.
Итак, работа трех протонных помп в цепи приводит к неравномерному рас-
пределению протонов по обе стороны мембраны и ее энергизации. (Энергиза-
ция мебраны сопровождается изменением ее свойств. В энергизованном состоя-
нии мембрана становится визуально тоньше. Давно замечено, что в условиях
активного дыхания митохондрии становятся более компактными, а при по-
давлении дыхания разбухают.) Возникающий на мембране электрохимиче-
ский протонный градиент Дцн+, который может быть также представлен как
протондвижущая сила Др, имеет две составляющие:
Дцш/Е = Др = Ду - 59ДрН (мВ).
Из-за «дырявости» наружной мембраны митохондрий pH в межмембран-
ном пространстве такой же, как и в цитозоле, поэтому градиент ДрН склады-
вается небольшой (ДрН = 0,2 —0,5) и не вносит существенного вклада в вели-
чину Др. Основной вклад вносит электрическая составляющая — мембранный
потенциал Ду. В результате концентрации ионов Н+ на внешней, а ионов ОН
на внутренней поверхности мембраны, одна ее сторона заряжается более по-
ложительно, а другая более отрицательно. Возникающий заряд способствует
концентрации по обе стороны мембраны и других ионов: любой отрицатель-
ный ион будет стремиться покинуть, а положительный — вернуться в мат-
рикс, что усиливает составляющую мембранного потенциала. На мембране
растительных митохондрий Др обычно составляет -150 — 200 мВ.
Величина Дцн+, или протондвижущей силы Др, является мерой свободной
энергии, запасенной в трансмембранной разности электрохимических потен-
циалов иона Н+. Эта энергия может быть реализована в результате движения
протонов в обратном направлении по градиенту электрохимического потен-
циала. АТФ-синтаза сопрягает диффузию протонов обратно в матрикс с син-
тезом АТФ. Обратный ток протонов через Е0-канал приводит в движение АТФ-
синтазные комплексы, катализирующие синтез АТФ из АДФ и Фн.
Следовательно, работа АТФ-синтаз приводит к уменьшению, или диссипа-
ции Дцн+, и разрядке мембраны. Подробно процесс синтеза АТФ при работе
АТФ-синтазных комплексов рассмотрен в гл. 2 (подразд. 2.7 и 2.8).
Во внутренней мембране митохондрий локализована F0F|-АТФ-синтаза
(Е0Е|-АТФаза), ориентированная своей каталитической частью (Егфактор) в
246
матрикс (рис. 4.14). В отличие от СЕ0СЕгАТФазы хлоропластов, митохондри-
альные АТФ-синтазы проявляют высокую чувствительность к антибиотику оли-
гомицину, который блокирует транспорт Н+ через Р0-канал и тем самым за-
прещает синтез АТФ. Общее число протонов, переносимых через мембрану
при работе дыхательной цепи, точно не установлено, так как до конца не ясен
механизм их транслокации на комплексах I и IV. Считают, что это число равно
как минимум 10Н+ на каждые 2е“, переносимых от НАДН на О2 по полной
цепи (см. рис. 4.14 и 4.20). Если считать, что данный процесс может привести к
синтезу трех молекул АТФ, то для синтеза одной молекулы может быть доста-
точно ЗН+, проходящих через Р0-канал. Однако эти расчеты не принимают во
внимание побочные затраты, также связанные с использованием Дцн+. Напри-
мер, транспорт в матрикс фосфата (необходим для синтеза АТФ) идет в сим-
порте, т. е. совместно с Н+ и, следовательно, связан с определенной диссипа-
цией протонного градиента (см. подразд. 4.2.11).
4.2.7. СКОРОСТЬ ЭЛЕКТРОННОГО ТРАНСПОРТА.
ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Скорость электронного транспорта обычно измеряют по скорости погло-
щения О2 суспензией митохондрий при наличии субстрата дыхания, напри-
мер НАДН или сукцината.
Если митохондрии удалось выделить без существенного повреждения мемб-
ран, то скорость поглощения О2 будет четко зависеть от присутствия в реакци-
онной среде АДФ (рис. 4.19). Если в среде содержится фосфат, то добавление
АДФ даже в незначительной концентрации сразу же доводит скорость погло-
щения О2 до максимальной, и она остается таковой до тех пор, пока весь АДФ
не превратится в АТФ. Тогда скорость дыхания падает вплоть до 10 — 15 % от
максимальной и может снова возрасти при внесении АДФ. Этот эксперимен-
тальный факт получил название дыхательного контроля.
Каков же механизм лежит в основе дыхательного контроля? В нормально
функционирующих митохондриях электронный транспорт сопряжен с синте-
зом АТФ. При сопряженном транспорте дыхательная цепь работает на создание
Рис. 4.19. Дыхательный контроль.
Поглощение кислорода суспензией митохондрий реги-
стрируется полярографически кислородным электродом
и характеризует скорость электронного транспорта. В от-
сутствие субстрата поглощение О2 практически не ре-
гистрируется (7). При добавлении субстрата скорость ды-
хания возрастает (2), достигает максимальных значе-
ний при внесении АДФ (3) и снижается, когда весь
добавленный АДФ превратится в АТФ (4). Соотноше-
ние скоростей поглощения О2 в присутствии АДФ и без
(3/4) является важным показателем степени сопряжен-
ности электронного транспорта с фосфорилированием
247
Межмембранное
пространство
Матрикс
Рис. 4.20. Образование и диссипация Арн+ на внутренней мембране митохондрий.
Комплексы I, III и IV работают на создание Дцн+, или протондвижущей силы Др, энергия
которой используется АТФ-синтазами для синтеза АТФ из АДФ и Ф„. Энергизованное состояние
мембраны контролируется действующими АТФ-синтазами и через механизм разобщения. Работа
АТФ-синтаз, для которой необходим АДФ, сопровождается диссипацией Дцн+> что стимулирует
работу трех протонных помп и электронный транспорт в цепи. Рассеивание Дцн+ в виде тепла
может быть достигнуто в результате разобщения, вызванного утечкой ионов Н+ обратно непо-
средственно через мембрану. В системе in vitro разобщение наступает при действии разобщителей.
В системе in vivo разобщение возможно с помощью жирных кислот и разобщающего UCP-белка
АДн+, работающие АТФ-синтазы рассеивают Дцн+, и оба процесса находятся в
динамическом равновесии (рис. 4.20).
При наличии АДФ и фосфата АТФ-синтазы функционируют бесперебой-
но, но, если возникнет дефицит АДФ, их работа будет блокирована из-за
недостатка субстрата. Это значит, что прекратится обратный ток протонов в
матрикс через Е0-канал и величина Дцщ начнет расти. При достаточно высо-
ких значениях Дцн' неизбежно возникнут трудности в работе трех протонных
помп в цепи, что автоматически приведет к торможению электронного транс-
порта. Если в эксперименте создать очень высокий градиент Дцн+, то электрон-
ный транспорт может прекратиться полностью. Если в систему вновь добавить
АДФ и тем самым активировать АТФ-синтазы, то величина Дцн+ снизится и
скорость электронного транспорта вновь возрастет.
Таким образом, механизм дыхательного контроля основан на прямом ин-
гибирующем влиянии Дцн+ на электронный транспорт. Отсюда следует важный
вывод: in vivo скорость переноса электрона в цепи прямо зависит от работы
АТФ-синтаз, а значит от соотношения АТФ/АДФ в матриксе. В свою очередь,
это соотношение определяется скоростью расхода АТФ в клетке и отражает ее
энергетический статус.
Итак, дыхательный контроль — это часть уже рассмотренной нами фунда-
ментальной системы регуляции дыхания через содержание АТФ и АДФ. Эта
система контролирует скорость окисления глюкозы, начиная с гликолиза, ЦТК
и кончая электронным транспортом в дыхательной цепи.
Следует отметить, что в литературе обсуждается «второй» механизм дыха-
тельного контроля. Некоторые экспериментальные факты, полученные при
работе с митохондриями животных, указывают, что на комплексе IV есть сай-
ты (расположенные на одной из обращенных в матрикс субъединиц), в кото-
248
рых прямо могут связываться АТФ и АДФ- Предполагается, что, связываясь с
комплексом, АТФ его ингибирует, а АДФ вытесняет АТФ из сайтов связыва-
ния. Таким образом, возможно, существует еще одна возможность контроля
скорости дыхания: при высоком соотношении АТФ/АДФ в матриксе АТФ ал-
лостерически ингибирует активность цитохромоксидазы.
4.2.8. РАЗОБЩЕНИЕ ЭЛЕКТРОННОГО ТРАНСПОРТА
С ФОСФОРИЛИРОВАНИЕМ
Электронный транспорт в дыхательной цепи может быть не только сопря-
женным, но и разобщенным. Мы знаем, что непременным условием создания и
поддержания Ацн * является непроницаемость сопрягающей мембраны для ионов.
Разобщение — это моментальная диссипация создаваемого цепью Ацн+ в Ре“
зультате увеличения ионной проницаемости мембраны. Впервые явление ра-
зобщения электронного транспорта с фосфорилированием было показано при
изучении соединений, которые впоследствии стали называть разобщителями*.
Разобщители делают мембрану проницаемой для Н+ или других ионов, а значит
либо полностью снимают Ацн+, либо снижают его величину (рис. 4.20). В при-
сутствии разобщителей цепь работает вхолостую: перекачка протонов через
мембрану не приводит к созданию Ацн+, так как ионы быстро возвращаются
обратно. В этих условиях АТФ-синтазы прекращают работу, а электронный транс-
порт идет с максимальной скоростью из-за отсутствия «сдерживания» со сто-
роны Ацн+. В этом случае электронный транспорт разобщен с синтезом АТФ и
называется разобщенным.
Разобщители разных типов представляют собой чрезвычайно удобный ин-
струмент для исследования энергетики мембран. Благодаря их специфичности
можно избирательно влиять на две составляющие Ар: АрН и мембранный по-
тенциал. Как правило, функцию разобщителей выполняют небольшие гидро-
фобные молекулы, легкорастворимые в липидном бислое. Некоторые из них,
например антибиотики грамицидин, нонактин, аламетицин, встраиваются в
липидный бислой и формируют каналы, по которым ионы Н и К и Na
могут свободно проходить мембрану. Другой случай, когда разобщители (ионо-
форы) образуют с ионом подвижный комплекс. Например, антибиотик вали-
номицин связывает ион К+ координационными связями в центре молекулы и
в таком виде пересекает митохондриальную мембрану, двигаясь по градиенту
заряда в более отрицательную область. Перенос положительно заряженного К+
снимает на мембране заряд, т. е. составляющую Ау, не влияя на величину ДрН.
Наоборот, протонофоры, будучи слабыми гидрофобными кислотами, пересе-
кают мембрану в протонированной форме и снимают градиент pH. К числу
протонофоров относятся такие широко используемые разобщители как 2,4-
динитрофенол, нигерицин, моненсин, FCCP (карбонилцианид-л-трифторме-
токсифенилгидразон). Следует также отметить, что сопряжение электронного
транспорта с фосфорилированием легко нарушается в процессе выделения
* Действие разобщителей, увеличивающих проницаемость биологических мембран для Н+, в
свое время послужило убедительным доказательством правоты хемиосмотической теории П. Мит-
челла.
249
митохондрий, особенно из растительных объектов (из-за жестких клеточных
стенок гомогенизация растительного материала часто сопровождается повреж-
дением митохондриальных мембран).
Однако не следует считать, что разобщение представляет собой лишь част-
ный случай, наблюдаемый в эксперименте. Разобщение электронного транс-
порта с синтезом АТФ играет важную роль в метаболизме как животных, так и
растений. Дело в том, что помимо запасания энергии в конвертируемой форме
Дцш и АТФ, одной из важных функций клеточного дыхания является рассеи-
вание энергии в виде тепла. У животных разобщение — это один из способов
повышения температуры тела. В митохондриях бурого жира (особая ткань мле-
копитающих, вырабатывающая дополнительное тепло при охлаждении) энергия
Дцн+ может использоваться не на синтез АТФ, а рассеиваться в виде тепла.
Рассеивание Дцн+ происходит в результате повышения протонной проводимо-
сти мембраны на фоне резкого увеличения содержания в клетке свободных
жирных кислот, образующихся при гидролизе жиров. Свободные жирные кис-
лоты представляют собой природные протонофоры: циркулируя через мемб-
рану, они способны оказывать разобщающее действие. Это выглядит так: ани-
он жирной кислоты (пальмитиновой, линолевой, олеиновой) связывает ион
Н+ на внешней поверхности мембраны и пересекает ее в протонированной
форме, двигаясь по градиенту pH (рис. 4.21). На внутренней стороне мембраны
наступает обратная диссоциация, однако чтобы система работала, необходимо
вернуть анион жирной кислоты обратно. И здесь в процесс включаются специ-
альные белки-переносчики, при помощи которых анион жирной кислоты диф-
фундирует через мембрану в обратном направлении, двигаясь уже по градиен-
ту заряда. Во внутренней мембране митохондрий бурого жира и других тканей
млекопитающих обнаружено семейство так называемых разобщающих UCP
(uncouple рго1с1п)-бслков, выполняющих именно эту функцию (см. рис. 4.20 и
4.21). Не так давно стало ясно, что разобщение электронного транспорта с
фосфорилированием имеет место in vivo и у растений. Растительные митохонд-
рии содержат аналоги UCP-белков. Так, иСР5-белок обнаружен в митохонд-
риях картофеля и арабидопсиса. У арабидопсиса показано наличие нескольких
ядерных генов, кодирующих изоформы иСР5-белка, экспрессия которых сти-
мулировалась на холоду. Таким образом, растения, как и животные, с помо-
щью жирных кислот и UCP-белков способны ликвидировать Дцн+, освобождая
энергию в виде тепла.
Если животные через разобщение могут значительно повысить температуру
тела, то растения к этому не способны. Физиологическая функция разобщения
Рис. 4.21. Механизм разобщающего
действия жирных кислот.
На внешней поверхности мембраны ани-
он жирной кислоты RCOO” присоеди-
няет Н+ и в протонированном виде
(RCOOH) пересекает мембрану. Внутри
митохондрий наступает диссоциация на
RCOO” и Н+. В обратном направлении
анион пересекает мембрану с помощью
UCP-белка
250
в растительном метаболизме связана, видимо, только с регуляцией электрон-
ного транспорта. Иногда на фоне избытка нереализованного АТФ необходимо
быстро окислить НАДН в дыхательной цепи, чтобы поддержать работу ЦТК.
Для этого необходимо увеличить скорость электронного транспорта, который
заторможен под действием высоких значений Дцн+. Снизив величину ДЦН+ на
мембране через механизм разобщения, можно увеличить скорость электрон-
ного транспорта даже при высоком соотношении АТФ/АДФ в матриксе, т.е.
«обмануть» систему дыхательного контроля.
Функцией разобщения может быть также защита от окислительного стресса.
Дело в том, что при работе комплексов I, II и III часть электронов сбрасыва-
ется на кислород. Даже в норме в цепи идет прямое одноэлектронное восста-
новление О2 с образованием супероксидрадикала OJ (см. подразд. 4.3.1). В свою
очередь О2 быстро нейтрализуется супероксиддисмутазой с образованием более
стабильного продукта — перекиси водорода:
20 \ + 2Н+ = Н2О2 + 02
Супероксидрадикал и Н2О2 представляют опасность для клетки, так как
обладают большой окислительной способностью. В то же время угроза их на-
копления в клетке вполне реальна, особенно при насыщении цепи электрона-
ми. При высоком Дцн+ торможение электронного транспорта способствует пе-
ревосстановлению редокс-центров цепи, электроны с которых начинают ин-
тенсивно сбрасываться на кислород. В этих условиях можно снизить интенсив-
ность образования супероксидрадикала, если увеличить скорость транспорта и
разгрузить цепь через разобщение. Данный вывод подтвержден эксперимен-
тально. Так, ингибирование UCP-белка в митохондриях клубней картофеля
сопровождалось чрезмерным накоплением Н2О2. И, наоборот, при активации
разобщения жирными кислотами уровень этого опасного соединения в клетке
был низким.
4.2.9. АЛЬТЕРНАТИВНЫЕ НАД(Ф)Н-ДЕГИДРОГЕНАЗЫ
Дыхательная цепь растений содержит четыре дополнительные НАД(Ф)Н-
дегидрогеназы (НАД(Ф)Н-убихиноноксидоредуктазы), способные окислять
НАДН и НАДФН, восстанавливая пул убихинона. Альтернативные дегидроге-
назы кодируются ядерными генами и представлены одним небольшим поли-
пептидом (мол. масса 26 — 43 кДа), содержащим ФАД в качестве кофермента.
Общим свойством этих ферментов является то, что их активность не подавля-
ется ротеноном, «классическим» ингибитором комплекса I. В то же время спе-
цифические ингибиторы для них четко не установлены. Между собой дегидро-
геназы различаются по кинетике, степени чувствительности к ингибитору ди-
фенилениодиду и по потребности в ионах Са2+.
Ротеноннечувствительные НАД(Ф)Н-дегидрогеназы расположены по обе
стороны внутренней митохондриальной мембраны (см. рис. 4.14). На обращен-
ной к матриксу стороне есть две дегидрогеназы (НАДН-ДГ!п и НАДФН-ДГ!п),
одна из которых специфична к НАДН, а другая к НАДФН. Они способны
окислять эндогенный НАДН и НАДФН и в какой-то мере конкурируют с
комплексом I, объективно снижая величину Дцн+. В то же время НАДН-ДГ1п
251
обладает значительно меньшим сродством к НАДН, чем комплекс I, и, веро-
ятно, включается в работу только при достаточно высоком уровне НАДН в
матриксе. Две другие, НАДН-ДГех и НАДФН-ДГех, расположены на внешней
стороне внутренней мембраны. Их присутствие объясняет тот факт, что мито-
хондрии растений в отличие от митохондрий животных способны окислять
цитозольный НАД(Ф)Н, проникающий в межмембранное пространство че-
рез поры наружной мембраны. Присутствие внешних НАД(Ф)Н-дегидрогеназ
в дыхательной цепи растений делает излишним использование некоторых
челночных механизмов, работающих на доставку НАДН в митохондрии жи-
вотных. В то же время следует учесть, что три альтернативные дегидрогеназы
являются Са2+-зависимыми, а это значит, что они, вероятно, активируются
только при увеличении цитозольной концентрации Са2+, которая в норме очень
низка.
Физиологическая роль альтернативных НАД(Ф)Н-дегидрогеназ в ДЦ расте-
ний остается не совсем ясной. Очевидно, что она связана с контролем пулов
НАДН и НАДФН в цитозоле и матриксе митохондрий. Следует отметить, что
наличие нескольких ферментов, выполняющих одну и ту же функцию, в дан-
ном случае еще раз подтверждает свойства пластичности растительного мета-
болизма.
4.2.10. АЛЬТЕРНАТИВНАЯ ОКСИДАЗА В МИТОХОНДРИЯХ РАСТЕНИЙ
Изучение особенностей дыхания растений, связанных с альтернативной
оксидазой (АО), имеет давнюю и интересную историю. Еще в XIX в. ботаники
описали явление, которое впоследствии назвали термогенезом ароидных рас-
тений'. при цветении некоторых видов температура цветка резко повышается,
иногда превышая температуру окружающего воздуха на десятки градусов. Этот
феномен ярко выражен при цветении таких растений, как Arum maculatum,
Symplocarpus foetidis, Sauromatum guttatum, Philodendron selloum. Так, температу-
ра цветка лилии Arum italium может достигать 51 °C при температуре воздуха
15 °C, а початок (цветка) скунсовой капусты {Symplocarpus foetidis) нагревает-
ся до 30 °C при температуре воздуха всего лишь 5 °C. Гиперпродукция тепла в
цветке ароидных лилий необходима для испарения пахучих (иногда, неприят-
но пахнущих) соединений, привлекающих насекомых-опылителей.
В определенных температурных пределах скорость поглощения О2 и продук-
ция тепла повышается при понижении и, наоборот, снижается при повыше-
нии температуры воздуха. При этом температура цветка может поддерживаться
на высоком и постоянном уровне от нескольких часов до нескольких дней.
Таким образом, хотя терморегуляция считается функцией теплокровных жи-
вотных, в случае термогенеза у ароидных природа не была столь догматична.
При исследовании этого феномена оказалось, что повышение температуры
тканей сопровождается вспышкой дыхательной активности, при этом погло-
щение О2 не подавляется цианидом и СО — классическими ингибиторами
дыхания животных. Вскоре выяснилось, что и другие ткани высших растений
имеют в процессе поглощения О2 компоненту, не подавляемую цианидом. Так
было открыто цианидрезистентное дыхание, характерное для всех семенных
растений, а также грибов, водорослей и даже некоторых простейших. Если
252
цианид (1 мМ) полностью подавляет дыхание животных, то у растений циа-
нидрсзистентное дыхание варьирует от 10 до 90 % в зависимости от вида и
физиологического состояния. Целенаправленное изучение этого явления при-
вело к открытию в дыхательной цепи растений альтернативной оксидазы (АО)
и связанного с ней альтернативного пути переноса электрона. Активность АО
не подавляется цианидом, а также другими ингибиторами комплекса IV — СО
и азидом. Специфическими ингибиторами АО признаны соли гидроксамовых
кислот (SHAM — Salicylhydroxamic acid — салицилгидроксамовая кислота) и
л-про пил галлат.
Альтернативная оксидаза — убихинол-кислород-оксидоредуктаза — пред-
ставляет собой один полипептид (мол. масса ~ 32 кДа), синтез которого коди-
руется ядерным геном — Аох\. У растений Sauromatutn guttatum, сои (Glycine
max) и арабидопсиса обнаружено три ядерных гена, кодирующих изоформы
АО, экспрессия которых зависела от типа ткани*.
Во внутренней мембране растительных митохондрий АО может находиться
в мономерной или димерной форме (рис. 4.22). В структуре белка АО есть два
остатка цистеина, при окислении которых образуется дисульфидная связь,
ковалентно связывающая два мономера. При восстановлении фермента по ди-
сульфидной связи активность АО возрастает в несколько раз.
Альтернативная оксидаза прямо восстанавливает О2 до Н2О за счет одного
акта, связанного с отнятием от двух молекул QH2 4е~ согласно реакции
2QH2 + О2 — 2Q + 2Н2О
Механизм восстановления О2 точно не установлен. Известно, что в катали-
тическом центре АО есть два атома железа, для связывания которых лигандами
служат остатки глутамата, аспартата и гистидина. Точечный мутагенез по этим
остаткам сопровождается инактивацией фермента. Реакция, катализируемая
АО, не сопряжена с транслокацией протонов и не вносит вклад в создание на
мембране Дрн4-
В дыхательной цепи растений реализуются два возможных пути, или две
цепи, по которым отнимаемые от субстратов дыхания электроны переносятся
на О2. Эти пути не автономны: они имеют общий участок, на котором работа-
ют комплексы I и II, а также альтернативные НАД(Ф)Н-дегидрогеназы, сбра-
сывающие электроны в пул убихинона (см. рис. 4.14, 4.23). Однако с пула уби-
хинона электронные потоки могут разветвляться и идти по основному цито-
хромному или альтернативному пути. Электронный транспорт по цитохромно-
му пути включает комплексы III и IV, а значит, связан с работой протонных
помп и синтезом АТФ. Если с пула убихинона электронный поток сворачивает
на альтернативный путь через АО, значительная часть его энергии теряется в
виде тепла и не используется для синтеза АТФ. В этом случае при окислении
* Следует отметить, что в тилакоидной мембране хлоропластов обнаружены НАД(Ф)Н-де-
гидрогеназа (Ndh-комплекс), гомологичная бактериальному комплексу I (субъединицы комп-
лекса кодируются хлоропластным геномом), и терминальная оксидаза (кодируется ядерным
геном), гомологичная альтернативной оксидазе растительных митохондрий. Предполагается, что
ЭТЦ фотосинтеза функционально связана с короткой дыхательной цепью: в темноте пул плас-
тохинона может быть восстановлен НАД(Ф)Н через Ndh-комплекс и окислен терминальной
оксидазой с восстановлением О2 до воды. Значение такого процесса, названного хлородыханием,
остается дискуссионным.
253
Межмембранное
пространство
Аллостерически
активирует АО
Восстановленный тиоре-
доксин восстанавливает
дисульфидную связь
НАДФН
Пируват
Рис. 4.22. Регуляция активности альтернативной оксидазы.
АО может находиться в димерной и мономерной форме. Переход связан с образованием дисуль-
фидной связи (—S—S—), образованной остатками цистеина, или с ее восстановлением (—SH
HS—). Восстановление дисульфидной связи сопровождается активацией фермента и наоборот.
Восстановителем является НАДФН или белок тиоредоксин, предварительно восстановленный
НАДФН. Пул НАДФН в митохондриях поддерживается за счет окисления изоцитрата НАДФ-
зависимой изоцитратдегидрогеназой. В восстановленном состоянии фермент аллостерически ак-
тивируется пируватом
НАДН генерация Дцн+ потенциально возможна только на комплексе I, т.е. как
минимум два из трех пунктов сопряжения теряются. При окислении сукцина-
та или, если в окислении НАДН участвуют альтернативные НАДН-дегидроге-
назы, вся заключенная в субстратах дыхания энергия рассеивается в виде теп-
ла. Таким образом, вклад альтернативного пути в энергетический баланс в
лучшем случае составляет треть от возможного*. Поэтому в случае преоблада-
ния альтернативного дыхания клетки для получения АТФ должны использо-
* Есть мнение, что альтернативное дыхание, снижая термодинамическую эффективность
запасания энергии, в определенном смысле убыстряет генерацию дрн+ и процесс синтеза АТФ.
254
Рис. 4.23. Альтернативные пути переноса электронов в дыхательной цепи растений.
Перенос электрона по цитохромному пути (темная стрелка) идет через комплексы I —IV и
проходит через три пункта сопряжения (комплексы I, III и IV). У растений с пула убихинона
электроны могут идти по альтернативноу пути (светлая стрелка) на альтернативную оксидазу
(АО), минуя два из трех пунктов сопряжения. Кроме того, у растений ротеноннечувствительные
дегидрогеназы могут пополнять пул QH2, окисляя НАДН и НАДФН по обе стороны митохонд-
риальной мембраны
вать в три раза больше субстрата. Избыточное тепло, образуемое из-за необхо-
димости сжигать большее количество субстрата для получения того же количе-
ства АТФ, лежит в основе термогенеза. Можно сказать, что альтернативное
дыхание представляет собой вид несопряженного электронного транспорта,
который не зависит от дыхательного контроля.
В митохондриях растений цитохромный и альтернативный пути дыхания
конкурируют за электроны, а их вклад в общее поглощение О2 объективно
зависит от активности каждого. В первую очередь их соотношение будет зави-
сеть от содержания и активности альтернативной оксидазы. Определить вклад
альтернативной оксидазы в общее поглощение О2 in vivo достаточно трудно.
Долгое время считали, что электроны идут преимущественно по цитохромно-
му пути и переключение потока е на альтернативный путь наступает только в
условиях «сверхпотока», т.е. при насыщении основного пути. Полагали, что
«диспетчером» в этом процессе выступает пул убихинона: при переходе 40—
60 % пула в восстановленное состояние цитохромный путь насыщается и из-
быточные электроны начинают уходить, можно сказать «переливаться» на аль-
тернативную цепь. Основываясь на этом допущении, вклад цитохромного и
альтернативного пути в общее поглощение О2 определяли с помощью ингиби-
торного анализа, используя цианид как ингибитор цитохромоксидазы и SHAM
как ингибитор АО. Считалось, что подавление поглощения О2 SHAM отражает
реальный вклад альтернативного дыхания в общую дыхательную активность.
Однако оказалось, что все обстоит гораздо сложнее. Дело в том, что цитохром-
255
ный путь дыхания in vivo практически не достигает насыщения. АО включается
при достижении определенного уровня восстановленности пула Q, после чего
активно конкурирует с цитохромной цепью за электроны. Стало ясно, что в
норме электроны с пула убихинона сразу перераспределяются по двум путям в
соответствии с активностью каждого из них. Отсюда следует, что при подавле-
нии одного из путей ингибитором, электронный поток быстро сворачивает в
другое русло, что может привести даже к усилению дыхания. Например, при
подавлении АО SHAM эффект ингибитора будет компенсирован усилением
электронного потока по цитохромной цепи и не отразится на общем поглоще-
нии кислорода. В настоящее время реальный вклад АО определяют довольно
сложным и малодоступным методом масс-спектрометрии. Метод основан на
разном дифференциальном фракционировании АО и цитохромоксидазой изо-
топов кислорода О18 и О16 в составе образующейся воды. Следует отметить, что
даже в присутствии KCN и SHAM поглощение кислорода растительной клет-
кой полностью не подавляется. Так называемое «остаточное» дыхание может
варьировать от 5 до 30 % от общего и обусловлено поглощением О2 в реакциях,
прямо не связанных с дыханием и протекающих в цитозоле и пероксисомах.
Активность АО прежде всего определяется тем, в каком состоянии находит-
ся фермент — окисленном или восстановленном. В то же время непосредствен-
ный восстановитель дисульфидной связи фермента точно не установлен (см.
рис. 4.22). Им скорее всего является НАДФН, образованный в матриксе при
участии НАДФ-зависимой изоцитратдегидрогеназы. По-видимому, НАДФН
сначала восстанавливает белок тиоредоксин*, который в свою очередь прямо
восстанавливает дисульфидную связь в составе АО. Кроме того, активность
АО зависит от уровня пирувата, который аллостерически активирует фер-
мент.
Соотношение цитохромного и альтернативного дыхания варьирует доста-
точно широко и зависит как от стадии онтогенеза, так и от физиологического
состояния растения. Наиболее впечатляющий тому пример — резкое увеличе-
ние интенсивности альтернативного дыхания при цветении ароидных. Но ак-
тивация альтернативной оксидазы наблюдается и во многих других случаях:
при прорастании семян, при старении листьев и цветков, при формировании
пыльцы. Вспышка дыхательной активности (так называемый климактериче-
ский подъем дыхания) при созревании плодов также связана с усилением
альтернативного дыхания. Интересно, что стимуляция альтернативного дыха-
ния, связанная с экспрессией гена Лох1 и синтезом АО de novo, часто наблю-
дается в неблагоприятных условиях. Стрессы разной природы, такие, как низ-
котемпературный стресс, засоление, засуха, поранение или внедрение патоге-
на, сопровождаются увеличением активности АО.
Физиологическая роль АО понятна только в случае термогенеза в цветках
ароидных. В других случаях интенсивность дыхания и активность АО не столь
велики, чтобы вызвать заметное повышение температуры тканей. Тогда зачем
же у растений существует этот способ дыхания, в котором энергия дыхатель-
* Тиоредоксин — небольшой (мол. масса 12—14 кДа) регуляторный белок с двумя остатками
цистеина в активном сайте, которые могут окисляться с образованием дисульфидной связи. В вос-
становленном состоянии тиоредоксин способен восстанавливать регуляторную дисульфидную связь
в составе других белков. Тиоредоксин включен в регуляцию активности многих ферментов, на-
пример ферментов цикла Кальвина. Недавно тиоредоксин обнаружен в митохондриях растений.
256
ных субстратов рассеивается и не используется для синтеза АТФ? На этот воп-
рос существует несколько ответов, и возможно, все они правильные.
Есть мнение, что альтернативное дыхание — это эволюционно возникший
способ, позволяющий растениям поддерживать дыхание при подавлении ос-
новной цитохромной цепи цианидом. Дело в том, что многие виды (около
2500 видов, принадлежащих к разным семействам) в естественных условиях в
качестве продуктов вторичного метаболизма образуют цианкогенные гликозиды,
распад которых может сопровождаться образованием HCN. К таким растениям
относятся, например, клевер {Trifolium repens}, лотос {Lotus comiculatus}, кас-
сава {Manihot esculenta), Vicia sp., многие виды акаций.
Растения, накапливающие цианкогенные гликозиды, иногда становятся при-
чиной массовых отравлений скота. Есть мнение, что причиной одного из забо-
леваний, распространенного среди населения Африки, является перманент-
ное отравление организма цианидами из-за употребления в пищу клубней кас-
савы. Биологическая роль этих соединений может быть защитной, направлен-
ной против патогенных микроорганизмов или травоядных животных. В свою
очередь цианид может продуцировать и некоторые патогенные бактерии и грибы.
Так, грибок Stemphylium loti, поражающий растение Lotus comiculatus, спосо-
бен к образованию цианида, и инфекция сопровождается активацией АО в
клетках растения. Однако образование в ряде случаев цианида некоторыми ра-
стениями не объясняет, почему АО есть у всех растений и какую роль она
выполняет в нормально функционирующей клетке.
Впервые подобное объяснение было предложено X. Ламберсом (Lambers,
1985). Гипотеза «сверхпотока» предполагала, что альтернативное дыхание —
это своего рода «выхлопной клапан», через который «сжигается» избыток уг-
леводов, если клетка не в состоянии эффективно использовать их или запасти.
Сейчас эта гипотеза трансформировалась: альтернативное дыхание рассмат-
ривают как механизм поддержания баланса между углеводным метаболизмом
и скоростью электронного транспорта. Понять смысл этого утверждения помо-
жет следующий пример. Известно, что скорость электронного транспорта кон-
тролируется через систему дыхательного контроля и снижается при высоком
соотношении АТФ/АДФ в матриксе (см. подразд. 4.2.7). Предположим, что элек-
тронный транспорт по цитохромной цепи заторможен действием дыхательно-
го контроля. В этих условиях уровень НАДН в матриксе возрастет. Мы знаем,
что ключевые ферменты ЦТК регулируются через соотношения АТФ/АДФ и
НАДН/НАД+. При высоком уровне НАДН и АТФ работа ЦТК будет блокирова-
на, что должно привести к накоплению пирувата. Но пируват является аллосте-
рическим активатором АО, и его накопление приведет к увеличению активно-
сти АО. Это в свою очередь стимулирует электронный транспорт по альтернатив-
ной цепи, который, с одной стороны, не будет сопряжен с синтезом АТФ, а с
другой стороны, приведет к быстрому окислению избытка НАДН. Тем самым
будет снят тормоз с ЦТК, интермедиаты которого активно используются в раз-
личных биосинтезах. Следовательно, функция АО может заключаться в том, что-
бы в нужный момент стимулировать быстрое окисление НАДН в дыхательной
цепи и тем самым снять с ЦТК «аденилатный контроль», т.е. разрешить работу
цикла в условиях, когда концентрации АТФ в матриксе достаточно велики.
Вторая важная функция АО заключается в защите клетки от окислительно-
го стресса. Как уже упоминалось, митохондрии являются местом образования
9 Физиология растений
257
супероксидрадикала и Н2О2 (см. подразд. 4.2.8). Интенсивному образованию и
накоплению этих опасных соединений способствуют торможение электронно-
го транспорта и «перевосстановление» цепи при высоких значениях Ацн+- В этой
ситуации повышение активности АО и увеличение скорости транспорта при-
ведет к «разгрузке» цепи за счет быстрого сброса электронов на кислород с
образованием «безопасной» воды. Существуют убедительные доказательства в
пользу того, что альтернативная оксидаза препятствует генерации в цепи О2 и
накоплению в митохондриях перекиси. Одно из них было получено при ис-
пользовании трансгенных растений табака {Nicotiana tabacum). К культурам
клеток с низкой (линия AS8) и супервысокой (линия S11) активностью АО
добавляли антимицин А, ингибитор комплекса III. В результате блокирования
электронного потока сброс е~ на кислород с комплексов I, II, III резко возра-
стал. В клетках с низкой активностью АО это приводило к чрезмерной генера-
ции Of и накоплению перекиси, что в итоге заканчивалось их гибелью. В клет-
ках с высокой активностью АО уровень перекиси был не столь высоким, и они
выживали. Эти опыты доказывают, что действие альтернативной оксидазы пре-
пятствует развитию окислительного стресса. Однако наиболее убедительным
доказательством защитной функции АО служит тот факт, что перекись водо-
рода является вторичным мессенджером в сигнальном каскаде, приводящем к
экспрессии гена Аох{ и синтезу АО de novo (см. подразд. 4.3.4).
4.2.11. ЭНЕРГИЯ Д£н* ИСПОЛЬЗУЕТСЯ ДЛЯ ТРАНСПОРТА МЕТАБОЛИТОВ
ЧЕРЕЗ ВНУТРЕННЮЮ МЕМБРАНУ МИТОХОНДРИЙ
Внутренняя мембрана содержит множество белков-транспортеров, которые
переносят метаболиты и ионы через мембрану в обе стороны. Все они имеют
небольшую молекулярную массу (30—34 кДа) и общий тип строения, харак-
терной чертой которого является наличие шести трансмембранных «-спира-
лей. Некоторые из них показаны на рис. 4.24. Переносчик может переносить
через мембрану только одну молекулу или ион — такой вид транспорта назы-
вается унипорт. Однако большинство транспортных белков митохондрий дей-
ствуют как портерные системы, способные одновременно перетаскивать через
мембрану два соединения в одном {симпорт) или в противоположных {анти-
порт) направлениях. При этом транспорт заряженных молекул и ионов так
или иначе связан с АЦц‘ на мембране и идет с использованием его составля-
ющих АрН и Av- Если перенос заряженных молекул влияет на величину Av, то
такой транспорт называют электрогенным. Электронейтральный транспорт не
вносит изменений в заряд мембраны.
Движущей силой транспорта может быть градиент pH в том случае, если
соединение переносится совместно с ионом Н+ или ОН . Например, в мемб-
Рис. 4.24. Белки-транспортеры во внутренней мембране митохондрий.
Транспорт заряженных молекул или ионов прямо или косвенно связан с использованием со-
ставляющих Дрн+ на мембране — Ду или ДрН. Белок-переносчик может транспортировать соеди-
нение в симпорте или антипорте с ионами Н+ или ОН , используя в качестве движущей силы
градиент pH. При электрогенном транспорте белок-переносчик транспортирует заряженную
молекулу по градиенту Д\р и тем самым изменяет заряд мембраны. Множество переносчиков
осуществляют электронейтральный обмен транспортируемых соединений
258
Межмембранное
пространство
Катион*"
Н+ --- ЭТЦ
ОН"
ОН"
АТФ4"
НРО|"
Оксалоацетат2
Цитрат3 /Н+
Н2РО4
Пируват
Н2РО4
Н+
АДФ3"
Малат2
Малат2
Малат2
Матрикс
ЭТЦ формирует Дцн+
на мембране
Унипорт катиона
по градиенту Ду
Антипорт
по градиенту ДрН
Антипорт
по градиенту ДрН
Симпорт
по градиенту ДрН
Антипорт
по градиенту Ду
Электронейтральный
обмен
Электронейтральный
обмен
Электронейтральный
обмен
259
ране локализованы переносчики, которые осуществляют электронейтральный
транспорт в матрикс фосфата и пирувата в антипорте, т.е. в обмен на ион
ОН , который при этом выносится из митохондрий по градиенту pH. Движу-
щей силой электрогенного транспорта является потенциал на мембране Ду.
Ионы или несущие заряд молекулы с помощью транспортеров пересекают
мембрану, двигаясь согласно заряду на мембране, внутренняя сторона кото-
рой заряжена отрицательно, а внешняя — положительно. По такому принципу
действует, например, очень важный белок-транспортер — АТФ/АДФ-трансло-
катор. Этот переносчик выносит в цитозоль АТФ в обмен на АДФ, тем самым
обеспечивая субстратом АТФ-синтазные комплексы. Адениннуклеотиды пере-
носятся через мембрану в виде ионов АТФ4- и АДФ3- согласно градиенту Ду:
заряд молекул таков, что в результате их обмена один избыточный отрица-
тельный заряд выносится со стороны матрикса.
АТФ/АДФ-транслокатор имеет специфические ингибиторы. Это бонгкреко-
вая кислота и антрактилозид — яды соответственно бактериального и расти-
тельного происхождения.
Как уже говорилось (см. подразд. 4.1.8), в митохондриальной мембране функ-
ционируют транспортеры анионов ди- и трикарбоновых кислот, участвующих
в ЦТК. Хотя карбоксильные группы кислот в физиологических условиях несут
отрицательный заряд, их транспорт электронейтральный, так как идет по типу
антипорта в обмен на ион фосфата или другую дикарбоновую кислоту. Харак-
терно, что в подобном обмене участвуют транспортные каскады, когда транс-
порт одного соединения из митохондрий зависит от транспорта другого в ми-
тохондрию. К примеру, транспорт в митохондрии малата идет в обмен на фос-
фат, который перед этим поступил в матрикс в обмен на ион ОН- при ис-
пользовании градиента pH.
Генерируемый работой цепи Ду используется при транспорте не только
небольших молекул и ионов, но и белков. Известно, что большинство мито-
хондриальных белков кодируются ядерными генами и синтезируются в цито-
золе. Некоторые из них синтезируются в форме предшественников и наряду со
структурной основой содержат особую N-концевую аминокислотную последо-
вательность, которая называется сигнальной, или транзитной. Обычно сигналь-
ный пептид содержит около 80 аминокислотных остатков, среди которых мно-
го положительно заряженных остатков аргинина и лизина. От сигнальной по-
следовательности зависит связывание белка с рецептором во внешней мемб-
ране и его проникновение в матрикс, где сигнальный пептид отрезается МРР-
пептидазой (Mitochondrial processing peptidase). В растительных митохондриях
МРР-пептидаза ассоциирована с цитохром Ьсл-комплексом, тогда как у живот-
ных этот фермент локализован в матриксе. В то же время белки-переносчики
внутренней мембраны не имеют характерной N-сигнальной последовательно-
сти, а содержат «внутренние сигналы», которые не отрезаются. Оба типа белков
проникают в митохондрии через крупные белковые комплексы — транслока-
зы, одна из которых находится во внешней (ТОМ-комплекс — translocase outer
membrane), а две — во внутренней мембране митохондрий (TIM22- и TIM23-
комплексы — translocase inner membrane). В составе транслоказ есть белки-ре-
цепторы и белки, формирующие каналы для протаскивания транспортируемых
белков. Транслоказы «узнают» и сортируют белки, либо обеспечивая их встраи-
вание во внутреннюю мембрану (TIM22), либо пропуская их в матрикс (TIM23).
260
И в том, и в другом случае процесс протекает успешно только при наличии Ду
на мембране. При рассеивании мембранного потенциала разобщителями типа
валиномицина белки в момент прохождения застревают в мембране.
4.3. КЛЕТКА И АКТИВНЫЕ ФОРМЫ
КИСЛОРОДА
В предыдущем подразделе речь шла о том, что функции альтернативной
оксидазы и механизма разобщения могут быть направлены на то, чтобы сни-
зить интенсивность образования в дыхательной цепи супероксидрадикала 0'2.
В настоящем подразделе рассмотрены процесс генерации в клетке активных форм
кислорода и роль, которую играют эти соединения в метаболизме растений.
4.3.1. ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА
В ПРОЦЕССЕ НОРМАЛЬНОЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ
РАСТИТЕЛЬНОЙ КЛЕТКИ
Аэробные организмы и растения в особенности сталкиваются с постоянной
опасностью: многие процессы, в которых участвует молекулярный кислород,
сопровождаются образованием так называемых активных форм кислорода (АФК).
Под этим термином подразумевают соединения, которые возникают в резуль-
тате неполного восстановления О2. Постоянное образование АФК в раститель-
ной клетке является нормой и происходит главным образом в хлоропластах,
митохондриях и пероксисомах. Наиболее значимые АФК — супероксидради-
кал (0$), пероксид водорода Н2О2 и гидроксилрадикал ОН'. Кроме того, к
АФК можно отнести синглетный кислород *О2, возникающий при взаимодей-
ствии О2 с возбужденным светом хлорофиллом (см. подразд. 3.6.4):
>О2 — О2 О; — Н2О2 — ОН'
Первым продуктом восстановления кислорода является супероксидрадикал
(0|), который образуется в результате захвата молекулой О2 одного электрона.
Одноэлектронное восстановление происходит при взаимодействии О2 с вос-
становленными компонентами электрон-транспортных цепей. У растений О2
образуется в норме в ЭТЦ дыхания и фотосинтеза. Донорами электрона могут
быть восстановленные Fe-S-кластеры и редоке-центры, содержащие семихи-
нонрадикал. Например, в дыхательной цепи даже в физиологических условиях
2—5% электронов идет на образования О2 в сайтах, расположенных на комп-
лексах I, II и III. В нефотосинтезирующих клетках митохондрии являются основ-
ными сайтами образования 02. При фотосинтезе приоритет в образовании 02,
возможно, принадлежит хлоропластам, хотя вопрос этот практически не изу-
чен. Кроме того, образование супероксидрадикала возможно в коротких ЭТЦ,
локализованных в мембранах пероксисом, функция которых связана с синте-
зом или, наоборот, деградацией некоторых соединений (рис. 4.25). Образова-
ние 02 связано также с катаболизмом ксантина (соединения, которое обра-
зуется при разрушении нуклеотидов) в реакции, катализируемой ксантинок-
сидазой.
261
Рис. 4.25. Образование Oj в мембранах пероксисом.
В мембранах пероксисом из эндосперма клещевины и листьев гороха функционируют короткие
ЭТЦ, использующие кислород как акцептор электронов в НАД(Ф)Н-зависимой реакции. Эти
цепи состоят из двух (или трех) интегральных белков с молекулярной массой 32, 18 и 29 кДа.
Один из белков (32 кДа) представляет собой флавопротеид (ФП), а белок с молекулярной
массой 18 кДа — цитохром />$. Цепь устроена так, что генерация супероксидрадикала осуществ-
ляется на цитозольной стороне мембраны
Супероксидрадикал имеет короткое время жизни (1()“6 с) и быстро нейтра-
лизуется при участии супероксиддисмутазы (СОД) с образованием перекиси
водорода:
О| + О| + 2Н+ = Н2О2 + О2
Супероксиддисмутаза — жизненно важный фермент всех аэробных орга-
низмов, в составе которого есть атомы металлов. В клеточных компартментах
СОД присутствует в разных изоформах. У растений это три изоформы: Мп-
СОД (митохондрии, пероксисомы), Cu-Zn-СОД (цитозоль, хлоропласт, пе-
роксисомы) и Fe-СОД (хлоропласт).
Перекись водорода образуется не только в результате нейтрализации О2 су-
пероксиддисмутазой, но и в других реакциях, особенно интенсивно протека-
ющих в пероксисомах. В зеленых тканях Н2О2 образуется в фотодыхательном
цикле при участии гликолатоксидазы (см. гл. 3), а также при окислении амино-
кислот, пуринов и других соединений в реакциях, катализируемых так назы-
ваемыми флавиновыми оксидазами Перекись является более стабильным про-
дуктом, чем OJ, и может диффундировать в клетке на значительные расстоя-
ния и даже пересекать мембраны через аквапорины.
Третий и самый опасный продукт неполного восстановления молекулы кис-
лорода — гидроксилрадикал (ОН‘) — образуется в реакции Фентона при уча-
стии ионов железа:
О- + Fe3+ Fe2+ + О2,
Н2О2 + Fe2+ Fe3+ + QH~ + ОН'
О; + Н2О2 — ОН" + ОН' + О2
262
Образование гидроксилрадикала фиксируется при патологических состоя-
ниях. Он очень реакционноспособен и может окислять практически все. Его
появление связано с существенным накоплением перекиси. Однако время жизни
ОН' мало (109 с), и он не может диффундировать на значительные расстояния
от мест своего образования. Таким образом, реальными АФК в клетке являют-
ся О| и Н2О2, образующиеся в нормальных физиологических условиях в раз-
ных процессах и реакциях.
Супероксидрадикал и перекись, будучи химически активны, способны реа-
гировать с разными соединениями, что может привести к деградации липи-
дов и белков, вызывать повреждение ДНК и дезорганизацию цитоскелета
(см. подразд. 8.6). Так, АФК могут вступать в реакцию с полиненасыщенными
жирнокислотными цепями в составе фосфолипидов, формирующих бислой
мембраны, и тем самым спровоцировать процесс перекисного окисления липи-
дов. В результате цепной реакции окисления, идущей с образованием свобод-
норадикальных продуктов, нарушаются гидрофобность липидного бислоя и
его проницаемость. Именно это приводит к разрушению мембран при старе-
нии клеток. Особенно остро проблема, связанная с образованием АФК, имеет
место у растений в связи с фотосинтезом. Образование синглетного кислорода
и супероксидрадикала в хлоропластах может сопровождаться разрушением фо-
тосинтетического аппарата в результате фотоингибирования и деградацией
хлорофилла (см. подразд. 3.5.4).
4.3.2. АНТИОКСИДАНТНЫЕ СИСТЕМЫ
Если растения и животные образуют АФК в процессе нормальной жизнедея-
тельности и при этом остаются живыми, значит, они контролируют их содер-
жание, избегая накопления опасных молекул. В хлоропластах нейтрализация
*О2 связана с эффективной защитой каротиноидных пигментов (см. гл. 3 «Фо-
тосинтез»), В митохондриях действие альтернативной оксидазы и механизма
разобщения с помощью UCP-белков снижает вероятность генерации в дыха-
тельной цепи супероксидрадикала (см. подразд. 4.2.8 и 4.2.10). Вторую линию
защиты в клетках аэробных организмов создают эффективно действующие
соединения и ферменты-антиоксиданты, работающие на ликвидацию АФК и
репарацию возможных повреждений. Важнейшими антиоксидантами являют-
ся аскорбиновая кислота (витамин С), глутатион, а-токоферол (витамин Е)
(рис. 4.26). Последний локализован в мембранах и способен неферментативно
взаимодействовать с АФК, предотвращая процесс перекисного окисления
липидов (рис. 4.27). Ткани растений в больших количествах содержат аскорби-
новую кислоту, которая присутствует во всех клеточных компаргментах, вклю-
чая апопласт. Окисление аскорбата сопровождается образованием моно- или
дегидроаскорбата. Глутатион — это небольшой пептид, имеющий активную
SH-группу. При окислении две молекулы глутатиона образуют дисульфидную
связь: 2Г—SH = Г—S—S—Г + 2Н'. Аскорбиновая кислота и глутатион активно
участвуют в защитных ферментативных реакциях.
Содержание О| и Н2О2 в клетке контролируется ферментами — антиокси-
дантами: супероксиддисмутазой, каталазой, гваяколовой пероксидазой, аскор-
батпероксидазой, глутатионпероксидазой, а также ферментами аскорбат-глу-
263
СООН
I
hc-nh2
(CH2)2
c=o
I
NH
I
CH-CH2-SH
c=o
I
NH
I
CH2
COOH
Глутатион (Г—SH)
Г
О=( 3 о=с
НО( 3 ( 1 а о II -п- -о-
НО( 2 • о=с
1 ИС
НС । ИС
носн носн
। ।
CH2OH CH2OH
Аскорбиновая
кислота (АК)
Дегидроаскорбиновая
кислота (ДГА)
НО
Н3С
сн3
СН3 СН3 СНз
1 I Ъ(СН2)з— СН— (СНг)з— СН— (СН2)3—СН-СНз
"^^р'Ю^ХНз
CHj
а-Токоферол (витамин Е)
Рис. 4.26. Молекулы-антиоксиданты.
При окислении 2 молекулы восстановленного глутатиона Г—SH образуют дисульфидную связь:
-2Н*
2Г—SH Г—S—S—Г При окислении аскорбиновой кислоты до дегидроаскорбиновой кисло-
ты (АК н» ДГА) в качестве промежуточного продукта может быть образован монодегидроас-
корбат (АК МДГА)
татионового цикла. Каталаза — это гемсодержащий фермент, локализованный
в пероксисомах и, по некоторым данным, в митохондриях, эффективно раз-
лагает перекись в реакции:
2Н2О2 — 2Н2О + О2
Пероксидаза — это также гемсодержащий гликопротеид, который в разных
изоформах присутствует практически во всех клеточных компартментах, включая
и клеточную стенку. Пероксидазы способны восстанавливать перекись до воды,
окисляя различные соединения. Так называемая гваяколовая пероксидаза, уча-
ствующая в биосинтезе лигнина (компонент клеточных стенок), окисляет фе-
нольные соединения. Аскорбатпероксидаза и глутатионпероксидаза использу-
ют аскорбат и восстановленный глутатион для удаления перекиси в реакции:
АН2 + Н2О2 — А + 2Н2О,
где АН2 — аскорбат или восстановленный глутатион.
Для постоянного удаления перекиси необходимо, чтобы уровень восста-
новленных аскорбиновой кислоты и глутатиона был достаточно высоким. Для
этого совместно действуют нескольких ферментов в так называемом аскорбат-
264
липид
алкилпероксил-
радикал
липид
Рис. 4.27. Защитное действие а-токоферола в мембране.
АФК атакуют липиды мембран, провоцируя цепные реакции перекисного окисления. При этом
образуются свободнорадикальные продукты, которые могут быть нейтрализованы а-токоферо-
лом, который отдает атом водорода. Тушение свободного радикала а-токоферола связано с окис-
лением пула аскорбата. АК — аскорбат; МДГА — монодегидроаскорбат; МДГАР — моноде-
гидроаскорбатредуктаза
глутатионовом цикле, целью которого является ликвидация перекиси. Цикл
включает взаимосвязанные окислительно-восстановительные реакции с уча-
стием аскорбата, глутатиона и НАДФН (рис. 4.28). Поддержание пула восста-
новленных аскорбата и глутатиона зависит от содержания НАДФН. Последний
активно образуется при фотосинтезе в хлоропластах, при работе оПФЦ в ци-
тозоле, а также в митохондриях с участием НАДФ-зависимой изоцитратдегид-
рогеназы. Аскорбат-глутатионовый цикл активно действует в хлоропластах и
цитозоле. Вопрос о наличии цикла в растительных митохондриях, где актив-
ность глутатионпероксидазы высокая, остается дискуссионным.
Таким образом, образование АФК в клетке и их ликвидация системами
защиты находятся в состоянии динамического равновесия. При серьезной раз-
балансировке этих процессов уровень АФК будет расти, что может привести к
окислительному стрессу и повреждению клеточного содержимого. Именно это
и происходит в неблагоприятных условиях, при действии на организм стрес-
сов разной природы.
Подобно тому, как многие болезни человека сопровождаются увеличением
в клетках активных форм кислорода, у растений накопление АФК наблюдает-
ся при старении тканей, а также при стрессах, вызванных засухой, высокой
интенсивностью света, повышенным содержанием озона и УФ-облучением,
низкой температурой, внедрением патогена, засолением, действием гербици-
дов, высокими концентрациями кадмия, алюминия и т.д. Стресс сопровожда-
ется на только чрезмерной генерацией АФК, но и изменением активности
ферментов-антиоксидантов в ту или другую сторону. Полагают, что уровень
антиоксидантной защиты и способность быстро среагировать на опасную си-
туацию увеличением активности определяют устойчивость растений к стрессу.
265
Рис. 4.28. Образование и нейтрализация супероксидрадикала.
Супероксидрадикал образуется при функционировании ЭТЦ в мембранах хлоропластов и
митохондрий и быстро превращается в перекись при участии супероксиддисмутазы. Нейтрализа-
ция перекиси может быть связана с функционированием аскорбат-глутатионового цикла в стро-
ме хлоропластов, цитозоле и, возможно, в матриксе митохондрий. СОД — супероксиддисмута-
за; АПер — аскорбатпероксидаза; АК — аскорбат; МДГА — монодегидроаскорбат, МДГАР —
монодегидроаскорбатредуктаза; ДГА — дегидроаскорбат; ДГАР — дегидроаскорбатредуктаза;
Г- SS—Г — глутатион окисленный; Г—SH — глутатион восстановленный; ГР — глутатионре-
дуктаза
К настоящему моменту получены трансгенные растения с оверэкспрессией
ряда ферментов-антиоксидантов, локализованных в тех или иных клеточных
компартментах. Растения табака (Nicotiana tabacum) с оверэкспрессией Cu-Zn-
СОД или глутатионредуктазы в цитозоле проявляли большую устойчивость к
высоким концентрациям озона; растения риса (Oryza sativa) с оверэкспресси-
ей каталазы проявляли большую устойчивость к низкотемпературному стрессу.
В то же время оверэкспрессия хлоропластной изоформы аскорбатпероксидазы
у табака не влияла на устойчивость растений к озону. Следует заметить, что
исследования, связанные с получением трансгенных растений с более высо-
кой антиоксидантной активностью, начались недавно и представляют боль-
шой интерес как в практическом отношении, так и для теоретической стресс-
физиологии растений.
266
4.3.3. АФК ЗАЩИЩАЕТ РАСТЕНИЕ ПРИ ВНЕДРЕНИИ ПАТОГЕНА
АФК являются опасным и неизбежным следствием аэробного образа жиз-
ни, однако они выполняют и другие функции, в частности защитную. И здесь
существует удивительная аналогия между растениями и животными. Давно из-
вестно, что фагоциты животных поглощают О2 с большой скоростью, что со-
провождается интенсивным образованием О| и Н2О2. Эти соединения как раз и
являются тем оружием, которым фагоциты убивают чужеродные клетки.
Дыхательный «взрыв» у растений, связанный с чрезмерной генерацией АФК,
был впервые зарегистрирован в ответ на внедрение патогена в реакции «сверх-
чувствительности»*.
В клетках растений сверхгенерация супероксидрадикала, так же как и у фа-
гоцитов, происходит в результате реакции:
НАДФН + 2О2 — НАДФ+ + 2Oj + Н+
Как и в фагоцитах, данная реакция катализируется НАДФН-оксидазой, рас-
положенной в плазмалемме растительных клеток. Есть данные, что в реакцию
сверхчувствительности вовлекаются пероксидазы клеточной стенки, которые
способны катализировать образование 02 и Н2О2 при избытке НАДН в Мп2+-
зависимой реакции.
4.3.4. СУПЕРСЖСИДРАДИКАЛ И ПЕРЕКИСЬ ВОДОРОДА
ДЕЙСТВУЮТ КАК СИГНАЛЬНЫЕ МОЛЕКУЛЫ
Как выяснилось, в клетках животных и растений 0J и Н2О2 в низких кон-
центрациях могут действовать как сигнальные молекулы, влияющие на эксп-
рессию генов. Показано, что в клетках животных они стимулируют накопление
цАМФ и цГМФ, вход в клетку ионов Са2+, вызывают активацию протеинки-
наз и т.д. Регуляторная роль этих молекул в жизни растений стала понятной
при исследовании ответных реакций на действие стрессовых факторов. Давно
было замечено, что некоторые стрессы сопровождаются у растений повыше-
нием клеточного уровня 0| и Н2О2. В этом случае роль этих опасных молекул
двойственная. С одной стороны, они провоцируют окислительные реакции,
способные привести клетку к гибели, с другой — выступают как участники
сигнальных каскадов, в результате которых происходит экспрессия генов, кон-
тролирующих синтез компонентов защитных систем. Выше (см. подразд. 4.2.10)
было показано, что альтернативная оксидаза препятствует развитию окисли-
тельного стресса и часто ее активность увеличивается в неблагоприятных для
растения условиях. В эксперименте синтез АО de novo в растении можно стиму-
лировать действием таких стимулов, как низкая температура, атака патогена,
обработка салициловой кислотой и антимицином А. Во всех случаях наблюда-
ется четкая корреляция между экспрессией гена Аох\ и накоплением перекиси.
Так, в культурах клеток табака подавление цитохромного дыхания антимици-
ном А сопровождалось интенсивным образованием О| и накоплением переки-
* Реакция сверхчувствительности связана с образованием некрозов и гибелью клеток расте-
ния в месте внедрения патогена. Таким способом, т.е. ценой гибели собственных клеток, расте-
нию удается избавиться от инфекции.
267
си. В этих условиях уже через 60 мин резко возрастало содержание мРНК Aoxl,
а через несколько часов увеличивались содержание и активность АО. Отсюда
следует важный вывод: сигнал для синтеза АО de novo возникает в митохонд-
риях и передается в ядро (рис. 4.29). Как было показано на культурах клеток
табака и петунии {Petunia sp.), транскрипцию гена Aoxl и синтез АО можно
вызвать обработкой клеток экзогенной перекисью водорода или салициловой
кислотой. Известно, что салициловая кислота связывает и блокирует каталазу,
что, естественно, приводит к повышению внутриклеточного содержания пе-
рекиси. На основании этих данных исследователи вполне справедливо пришли
к выводу, что Н2О2 действует как сигнальная молекула, вторичный мессенд-
жер в цепи сигнальной трансдукции, результатом которой являются экспрес-
сия гена Aoxl и синтез АО.
Перекись является также звеном в цепи передачи сигнала, включающего
экспрессию генов, кодирующих синтез ферментов аскорбат-глутатионового
цикла. Например, добавлением перекиси можно инициировать синтез аскор-
батпероксидазы в культурах клеток риса (Oruza sativa). Известно, что салици-
ловая кислота, которая синтезируется в растении, обладает гормональной ак-
тивностью и участвует в индукции ответных реакций растения на внедрение
патогена. Оказалось, что в этом случае эффект объясняется способностью са-
лициловой кислоты блокировать активность каталазы. Именно накопление пе-
рекиси влияет на транскрипцию генов, контролирующих синтез PR (pathoge-
пе815-ге1а1еб)-белков. Таким образом, при внедрении патогена появление в клетке
Н2О2 является сигналом для экспрессии генов, включенных в системную ус-
тойчивость.
Однако наиболее интригующей является роль АФК в апоптозе, т. е. генети-
чески программируемой клеточной смерти. Апоптоз в клетках животных связан
с деградацией белков, конденсацией хроматина и сопровождается характер-
ными цитологическими изменениями. Специфические протеазы (caspases) и
эндонуклеаза, которые в норме присутствовали в цитозоле в неактивной фор-
ме, вовлекаются в апоптоз и участвуют в разрушении белков и фрагментации
ДНК. Известно, что активация каспаз связана с их протеолитическим расщеп-
лением. Долгое время считали, что митохондрии не вовлекаются в апоптоз,
так как не подвергаются видимым изменениям. Однако оказалось, что именно
митохондрии — главные участники активной программы клеточной смерти.
Внутреннее пространство митохондрий содержит особые белки, которые при
выходе в цитозоль вызывают активацию каспазы и эндонуклеазы, тем самым
инициируя апоптоз. Прежде всего, это так называемый AIF-фактор (apoposis-
induced factor) и цитохром с, локализованные в межмембранном пространстве.
Однако что же заставляет эти соединения выходить из митохондрий и как они
это делают? Еще до наступления видимых изменений, характерных для апоп-
тоза, в митохондриях фиксируется повышенный уровень О2. Супероксидради-
кал, действуя прямо или косвенно, инициирует формирование специальных
mtPTP-nop (permeability transition роге). Они представляют собой комплекс бел-
ков, формирующий в месте контакта внутренней и наружной мембран широ-
кий канал, или пору, через которую в цитозоль выходят AIF-фактор и цитох-
ром с (рис. 4.30). В образовании mtPT-nop принимают участие белки, которые в
норме выполняли в митохондриях другие функции. Точный состав mtPT-nop
неизвестен, но есть основания думать, что в их состав входят:
268
Ядро
Митохондрия
Рис. 4.29. Взаимодействие ядра и митохондрий в регуляции синтеза альтернативной
оксидазы.
АО кодируется ядерным геном Аох\, на экспрессию которого влияет уровень Н2О2 в клетке.
Факторы, способствующие накоплению перекиси, стимулируют синтез АО
269
CD (циклофилин D) — белок матрикса,
Рис. 4.30. Формирования mtPT-nop:
А — нормальное состояние митохондрий. Во
внутренней мембране работает дыхательная
цепь и синтезируется АТФ. Цитохром с нахо-
дится в межмембранном пространстве и уча-
ствует в работе дыхательной цепи. Обмен ЛТФ
на АДФ осуществляется через АТФ/АДФ транс-
локатор, локализованный во внутренней мемб-
ране. AIF-фактор присутствует в матриксе.
VDAC-канал формирует крупные поры в на-
ружной мембране; Б — интенсивное образова-
ние в дыхательной цепи супероксидрадикала
на комплексах 1 и 3 провоцирует формирова-
ние mtPT-nop в месте контакта внутренней и
наружной мембраны. Поры формируются при
участии АТФ/АДФ-транслокатора, VDAC-ка-
нала и белков матрикса и цитозоля. Выход в ци-
тозоль через mtPT-поры цитохрома с и AIF-фак-
тора необходим для инициации апоптоза в клет-
ке. ANT — АТФ/АДФ-транслокатор; цит. с —
цитохром с; VDAC — потенциалзависимый
анионный канал; Вах — белок цитозоля, необ-
ходимый для формирования mtPT-nop; х —
точно не установленные белки из цитозоля;
1имый для формирования mtPT-nop; 1, 3, 4 —
комплексы цепи
• АТФ/АДФ-транслокатор — (ANT — adenylate translocator) в нормально
функционирующих митохондриях этот транспортный белок интегрально встроен
во внутреннюю мембрану и осуществляет обмен АТФ и АДФ;
• VDAC (voltage dependent anion channel)— потенциал-зависимый анион-
ный канал внешней мембраны;
• циклофилин D (cyclophilin D) — белок, в норме присутствующий в мат-
риксе митохондрий;
• неизвестные белки из цитозоля.
На формирование и открытие mtPT-nop оказывают влияние многие факто-
ры, такие, как величина Ду на мембране, концентрация Са2+, уровень АТФ и
АДФ в матриксе и цитозоле. Кроме того, косвенным образом состояние mtPT-
nop зависит от эффективности антиоксидантных систем, нейтрализующих О2.
Открытие mtPT-nop приводит к цепи необратимых событий, заканчивающих-
ся гибелью клетки. Выход из митоходрий в цитозоль AIF-фактора и цитохрома с
сопровождается активацией специфической протеазы и запуском каскада про-
теолитических реакций, результатом которых является разрушение белков и
деградация ДНК (рис. 4.31). Помимо этого, нарушение замкнутости внутрен-
ней мембраны приводит к коллапсу Др и энергетическому кризису, что также
ускоряет гибель клетки.
У растений программируемая клеточная смерть (ПКС) является неотъем-
лемой частью нормального роста и развития. Старение листьев и цветков, от-
мирание клеток при формировании сосудов ксилемы и корневого чехлика,
гибель клеток в реакции «сверхчувствительности» — примеры, когда смерть
клеток является генетически детерминированной. Апоптоз растений сопровож-
дается несколько иной, чем у животных, цитологической картиной, но мож-
но предполагать, что сценарий этого процесса у тех и других включает общие
270
п
DFF
Рис. 4.31. Инициация апоптоза.
Выход из митохондрий в цитозоль факторов апоп-
тоза запускает каскад событий, результатом которо-
го является разрушение белков и ДНК. Из митохон-
дрий через mtPT-поры выходят цитохром с и AIF-
фактор (apoptosis-induced factor). В цитозоле цитохром
с в комплексе с белком apafl и АТФ активирует
протеазы, специфически разрушающие белки. AIF-
фактор активирует еще один белок — DFF (DNA-
fragmentation factor) — фактор, необходимый для
активации эндонуклеазы и фрагментации ДНК
Протеаза
I
Разрушение
белков
элементы. Показано, что смерть клеток, формирующих сосуды ксилемы у цин-
нии (Zinnia sp.), клеток табака, в реакции сверхчувствительности сопровожда-
лась активацией специфических протеаз и эндонуклеаз, а также фрагментаци-
ей ДНК. Сигнал, индуцирующий ИКС у растений, неизвестен. Однако им вполне
вероятно являются О; и Н2О2, накопление которых предшествует гибели кле-
ток, например при старении листьев и цветков. При этом АФК, видимо, не
только разрушают клеточные структуры как окислители. Есть данные, что при
старении листьев Н2О2 вызывает экспрессию генов, включенных в процесс
разрушения хлорофилла, однако вопрос о роли митохондрий в ПКС у расте-
ний остается пока неизученным. Существуют лишь единичные и косвенные
данные, подтверждающие, что апоптоз у растений также связан с событиями
в митохондриях. Так, выход в цитозоль цитохрома с и фрагментация ДНК
наблюдались при гибели клеток огурца (Cucumis sativa) в результате теплового
шока. Трансгенные линии табака (AS8), лишенные альтернативной оксидазы,
погибали при обработке экзогенной перекисью водорода. При этом наблюдали
выход в цитозоль цитохрома с и фрагментацию ДНК. На примере клеток жи-
вотных известно, что Са2+ на фоне низкого содержания АТФ способствует
открытию mtPT-nop и развитию апоптоза. Аналогично этому на клетках куку-
рузы было показано, что вход в клетку кальция при низком уровне АТФ может
спровоцировать их смерть по типу апоптоза.
4.4. ДЫХАНИЕ В ФОТОСИНТЕЗИРУЮЩЕЙ КЛЕТКЕ
В зеленых тканях растений фотосинтез и дыхание протекают в одной клетке.
В темноте дыхание является основным источником АТФ. Однако что случается
с дыханием на свету, когда мощным энергодающим процессом в клетке ста-
новится фотосинтез? Известно, что на свету митохондрии вовлекаются в про-
271
цесс фотодыхания, а у некоторых С4-видов — в процессы, связанные с асси-
миляцией СО2. Продолжается ли в этих условиях собственно дыхание и если
да, то с какой интенсивностью? На этот вопрос пока нет четкого ответа. Дело
в том, что определить скорость дыхания на фоне идущего фотосинтеза очень
сложно, так как выделение О2 при фотосинтезе по интенсивности во много
раз перекрывает поглощение О2 при дыхании. До недавнего времени полагали,
что дыхание на свету полностью подавлено. Считалось, что в результате фото-
синтеза уровень АТФ в цитозоле возрастает, и это ведет к торможению глико-
лиза (см. подразд. 4.1.7), а значит, к подавлению митохондриального дыхания
ввиду нехватки субстрата. Но в последнее время изучение газообмена фотосин-
тезирующих клеток с применением методов масс-спектрометрии во всех слу-
чаях показало, что дыхание на свету продолжается. Однако разные объекты,
условия и возможные ошибки приводят к неоднозначным выводам о степени
этого дыхания: по разным оценкам, интенсивность дыхания на свету состав-
ляет от 100 до 30 % от темновой. При этом, если эффект света на поглощение
О2 сильно варьирует, то выделение СО2 однозначно снижается и составляет
30—40 % от темнового уровня. Следовательно, на свету цикл трикарбоновых
кислот функционирует гораздо медленнее, чем в темноте. Этому факту можно
дать следующее объяснение. На свету митохондрии участвуют в фотодыхатель-
ном цикле и окисляют глицин с очень большой скоростью (см. подразд. 3.7.4).
При окислении глицина в матриксе образуется ион аммония, который спо-
собствует инактивации пируватдегидрогеназного комплекса. Аммоний, как было
показано выше, активирует протеинкиназу, которая фосфорилирует ПДК,
переводя его в неактивное состояние (см. подразд. 4.1.7, рис. 4.7). Возможно,
именно по этой причине снижается активность ЦТК.
Тем не менее работа цикла трикарбоновых кислот на свету продолжается,
хотя и с меньшей интенсивностью. Какое значение это может иметь для фото-
синтезирующей клетки? Прежде всего, цикл продолжает поставлять НАДН
для восстановления в цитозоле нитрата и углеродные скелеты для синтеза ами-
нокислот. Важнейшей функцией митохондрий остается экспорт а-кетоглута-
рата, необходимого для светозависимой ассимиляции азота в хлоропластах. Дис-
куссионным остается вопрос, как изменяется (или не изменяется) интенсив-
ность окислительного фосфорилирования и каков вклад митохондрий в энер-
гообмен фотосинтезирующей клетки? Ранее преобладала точка зрения, что
все энергопотребности клетки на свету обеспечивает фотосинтез. Сейчас так
уже не думают. Показано, что даже на свету синтезируемая в митохондриях
АТФ используется в энергозависимых процессах, протекающих в цитозоле,
например при синтезе сахарозы и в белковом синтезе. Некоторые исследовате-
ли даже полагают, что образованный при фотосинтезе АТФ в основном расхо-
дуется в хлоропласте на фотоассимиляцию СО2, тогда как пул АТФ в цитозоле
поддерживается митохондриальным дыханием.
Долгое время процессы фотосинтеза и дыхания изучались автономно, и
вопрос о их взаимодействии в фотосинтезирующей клетке остается, пожалуй,
наименее изученным. В то же время появляются факты, доказывающие, что
фотосинтез и дыхание более интегрированы, чем это полагали ранее. Удиви-
тельным доказательством такой интеграции стали опыты, проведенные на
протопластах листьев ячменя (Hordeum vulgaris). Выяснилось, что при подавле-
нии митохондриальной АТФ-синтазы олигомицином (в концентрации, кото-
272
рая не действует на АТФ-синтазу в хлоропластах) скорость фотосинтеза пада-
ет на 30—40 %. Этот факт неожиданно продемонстрировал, что синтез АТФ в
митохондриях необходим для поддержания нормального фотосинтеза. Пока
этому факту можно дать следующее объяснение. Возможно, между хлороплас-
тами и митохондриями на свету идет активный обмен метаболитами, и дыха-
ние участвует в окислении избытка восстановительных эквивалентов, выноси-
мых в цитозоль из хлоропластов. Восстановленные НАДН и НАДФН могут
поступать в митохондрии с помощью челночных систем или непосредственно
окисляться в дыхательной цепи через внешние альтернативные дегидрогеназы.
Удаляя избыток НАД(Ф)Н, митохондриальное дыхание тем самым снижает
вероятность фотоингибирования (см. подразд. 3.5.4). Возможно, наличие аль-
тернативной оксидазы и альтернативных дегидрогеназ в дыхательной цепи ра-
стений объясняется именно необходимостью сбалансировать фотосинтетиче-
скую активность с потребностями метаболизма.
4.5. ДЫХАНИЕ ЦЕЛОГО РАСТЕНИЯ
Дыхание на уровне целого растения является интегральным показателем,
значение которого может сильно варьировать в зависимости от объекта, ста-
дии онтогенеза, физиологического состояния и действия факторов окружа-
ющей среды. Наиболее высока интенсивность дыхания этиолированных пророст-
ков, но при переходе к фотосинтезу она снижается. Характерно, что скорость
дыхания различных органов и тканей растений не одинакова. Наиболее интен-
сивны дыхательные процессы в меристематических и недифференцированных
тканях, по мере достижения зрелости скорость дыхания снижается и далее
остается относительно постоянной. По дыхательной активности могут разли-
чаться молодые и зрелые листья, лепестки и ткани пестика, цветки и листья и
т.д. Особые случаи связаны со вспышками дыхательной активности тканей.
Такие случаи имеют место при термогенезе ароидных, при созревании плодов
(климактерический подъем дыхания при созревании яблок, авокадо, бана-
нов), при старении срезанных цветов и листьев. Интенсивность дыхания может
изменяться в условиях стресса, вызванного засухой, засолением, понижением
или повышением температуры, однако ответная реакция растений не одно-
значна и варьирует в зависимости от вида растения и его устойчивости к дей-
ствующему фактору.
Интенсивность и эффективность дыхания во многом определяют рост и
накопление растением биомассы. Эти показатели, во многом определяющие
продуктивность растений, зависят от количественных затрат дыхательного суб-
страта, с одной стороны, на рост, а с другой — на обновление, или поддержа-
ние, биомассы. С этой точки зрения в физиологии растений существуют такие
понятия, как дыхание роста и дыхание поддержания. Дыхание поддержания снаб-
жает метаболитами и энергией процессы, связанные с обновлением и органи-
зацией уже существующей биомассы, тогда как дыхание роста обеспечивает
энергией и метаболитами новообразование биомассы, т.е. рост. Количественно
оценить вклад обоих составляющих в общее дыхание довольно сложно. Для
этой цели сравнивают интенсивность дыхания растения в условиях оптималь-
ного роста и при условиях, когда рост экспериментально подавлен. Например,
273
варьируют условия освещения: выращенные в оптимальных условиях растения
затем выдерживают в темноте. После того как дыхание в темноте стабилизиру-
ется, его уровень принимают за дыхание поддержания. Близок по смыслу и
другой способ, когда растения с полной питательной среды переносят на сре-
ду, лишенную азота. В таких условиях рост растений прекращается из-за отсут-
ствия азота, и уровень дыхания принимается за дыхание поддержания. При
стрессах разной природы рост растений, как правило, тормозится, однако
интенсивность дыхания остается прежней или даже усиливается. Это говорит о
том, что при адаптации к стрессу увеличиваются энергозатраты на поддержа-
ние биомассы и выживание. В то же время экофизиологические исследования
растений показали, что между величиной дыхания поддержания и условиями
обитания растений нет четкой корреляции. Так, растения, адаптированные к
стрессовым условиям (засоление, засуха), не отличались по этому критерию
от растений, растущих в благоприятных условиях. В то же время ряд авторов
отмечали, что у арктических растений компонента дыхания поддержания выше
по сравнению с видами умеренных широт.
Аэробное дыхание — это контролируемый процесс окисления восстанов-
ленных органических соединений до СО2 и воды. Все живые клетки растения
«дышат», окисляя в процессе дыхания углеводы, образованные при фотосин-
тезе. Процесс дыхания можно разбить на три этапа — гликолиз, цикл трикар-
боновых кислот и окислительное фосфорилирование. В процессе окисления
глюкозы в реакциях гликолиза и ЦТК образуются ключевые метаболиты клет-
ки, необходимые для разнообразных биосинтезов, и восстановительные экви-
валенты. Протекание гликолиза и цикла трикарбоновых кислот в клетках рас-
тений имеет свои особенности. Они связаны с функционированием дополни-
тельных ферментов и альтернативных реакций, дублирующих основные, об-
щие для растений и животных, пути. Кроме этого, гликолиз в растениях про-
текает не только в цитозоле, но и в пластидах. Восстановленные НАДН и ФАДН2
отдают электроны в электрон-транспортную цепь, по которой они переносят-
ся на кислород. Интегрированная во внутреннюю мембрану митохондрий ды-
хательная цепь включает четыре трансмембранных комплекса и АТФ-синтазу.
Три комплекса цепи — НАДН-дегидрогеназа, цитохром Ьс\-комплекс и ци-
тохромоксидаза — работают как протонные помпы, преобразуя энергию элек-
тронного потока в энергию Дцн+- Структура комплексов в общих чертах извест-
на, однако механизм работы этих замечательных молекулярных машин остает-
ся во многом загадочным. Создаваемый работой цепи Дцн+ используется АТФ-
синтазой для синтеза АТФ, а также в процессах транспорта заряженных моле-
кул через митохондриальную мембрану с участием белков-транспортеров.
Гибкость и многообразие, свойственные метаболизму растений, проявля-
ются и в организации дыхательной цепи, в которой существуют альтернатив-
ные пути для переноса электрона. Эти пути являются нефосфорилирующими, т. е.
в основном не сопряжены с генерацией Дцн+ и синтезом АТФ. Наряду с комп-
лексом I митохондриальная мембрана растений содержит еще четыре роте-
ноннечувствительные НАД(Ф)Н-дегидрогеназы. Эти ферменты расположены
так, что могут окислять НАДН и НАДФН по обе стороны мембраны, сбрасы-
вая электроны в пул убихинона в обход комплекса I. Фундаментальным отли-
274
чием растений является наличие в дыхательной цепи двух терминальных окси-
даз и двух конкурирующих путей переноса электронов на кислород. Наряду с
основной, цитохромной цепью у растений действует альтернативный путь элек-
тронного транспорта, связанный с функционированием альтернативной ок-
сидазы. Электронный поток с пула убихинона на альтернативную оксидазу
обходит два из трех пунктов сопряжения и теряет большую часть энергии в
виде тепла. Таким образом, эффективность трансформации энергии в расти-
тельных митохондриях зависит от соотношения цитохромного и альтернатив-
ного дыхания, активность которых контролируется экзогенными и эндоген-
ными факторами.
Растительные митохондрии поддерживают свой восстановительный и энер-
гетический статус с помощью дыхательного контроля, разобщения и альтер-
нативной оксидазы. Дыхательный контроль устанавливает связь между элект-
ронным транспортом, величиной A(iH' и работой АТФ-синтазных комплексов.
Скорость переноса электронов в цепи контролируется величиной Дцн+ на мемб-
ране и замедляется, когда эта величина достигает высоких значений. Работа
АТФ-синтаз сопровождается диссипацией Дцн+ и объективно способствует ус-
корению электронного транспорта. В условиях высокого соотношения АТФ/
АДФ в матриксе АТФ-синтазы замедляют или прекращают свою работу, что
ведет к росту ЛцН' и торможению электронного транспорта по цитохромной
цепи. У растений существуют два способа «обойти» систему дыхательного кон-
троля и сделать электронный транспорт независимым от работы АТФ-синтаз.
Во-первых, электронный транспорт и фосфорилирование могут быть разоб-
щены с помощью жирных кислот и разобщающих UCP-белков. Разобщенный
транспорт идет с высокой скоростью и не сопровождается синтезом АТФ. Во-
вторых, альтернативное дыхание также можно рассматривать как способ раз-
общения электронного транспорта с фосфорилированием. Быстрый сброс элек-
тронов с пула убихинона на альтернативную оксидазу также ускоряет элект-
ронный транспорт и позволяет снизить эффективность синтеза АТФ. Физиоло-
гический смысл разобщения тем и другим способом — ускорение электронно-
го транспорта в условиях высокого отношения АТФ/АДФ в матриксе, когда на
электронный транспорт по цитохромной цепи наложен тормоз со стороны
дыхательного контроля. Иногда быстрая разгрузка цепи необходима для быст-
рого окисления избытка НАДН и снижения вероятности генерации в цепи
активных форм кислорода. Оба способа разобщения приводят к рассеиванию
энергии окисляемых субстратов в тепло, но между ними есть принципиальная
разница. Альтернативная оксидаза, объективно снижая эффективность запаса-
ния энергии, не влияет на величину Дцн+, тогда как механизм разобщения
связан с ликвидацией протонного потенциала и тем самым прямо влияет на
энергизованное состояние мембраны и величину Дцн+.
В последнее время появились доказательства того, что роль митохондрий не
ограничивается традиционными функциями синтеза АТФ и полезных соедине-
ний. По-видимому, происходящие в клетке события каким-то образом интегри-
руются в митохондриях. Возникающие ответные изменения могут провоциро-
вать чрезмерную генерацию в дыхательной цепи активных форм кислорода. Ре-
зультатом этого может быть экспрессия ядерных генов или активация програм-
мы клеточной смерти. В этом плане изучение роли митохондрий в растительном
метаболизме — новое и интересное направление в физиологии растений.
ГЛАВА 5
ВОДА В ЖИЗНИ РАСТЕНИЙ
5.1. ФУНКЦИИ ВОДЫ
В главе рассмотрены общие принципы организации водного обмена у расте-
ний. Изложение закономерностей движения воды на уровне клетки, тканей и
целого растения базируется на термодинамическом подходе.
Жизнь на Земле зародилась в первичном океане и для первых организмов
вода стала не только средой обитания, но и основой их внутренней среды. По-
следующее эволюционное развитие жизни также происходило в водной среде.
С возникновением суши и появлением наземных растений и животных огром-
ное значение воды в процессах жизнедеятельности не было утрачено. Существо-
вание современных организмов мы тоже не можем представить себе без воды.
Среди химических соединений, входящих в состав клеток растений, живот-
ных и прокариот, вода в количественном отношении доминирует. Ее содержа-
ние в клетках мезофитов (растений зоны умеренного климата) составляет 85 —
99 % (в расчете на сырую массу) в зависимости от вида растения, ткани и
условий окружающей среды.
Вода, содержащаяся в растениях в столь больших количествах, выполняет
множество функций:
• водная фаза в системе почва—корень—стебель—лист—атмосфера обра-
зует непрерывную среду, благодаря и при участии которой осуществляется
перенос веществ между различными частями этой системы;
• вода для реагирующих веществ является растворителем, взаимодействие
веществ в реакциях метаболизма происходит в водной среде;
• вода образует гидратные оболочки биополимеров и участвует в формиро-
вании их молекулярной структуры;
• вода подвергается химическим превращениям в некоторых жизненно важ-
ных процессах, например окислению и образованию молекулярного кислоро-
да при фотосинтезе;
• обладая высокой удельной теплоемкостью, вода сглаживает колебания
температуры растительных тканей при резких колебаниях температуры окру-
жающей среды;
• вода препятствует перегреву растений за счет ее испарения с поверхности
надземных органов, главным образом листьев, — процесса, получившего на-
звание транспирации;
• благодаря явлению осмоса и наличию у растительных клеток относитель-
но жестких клеточных стенок (КС), вода поддерживает в клетках положитель-
ное тургорное давление, придавая им нужную форму, и отвечает за их растяже-
ние при росте.
Можно сказать, что вода является «матрицей» жизни. Это образное выраже-
ние А. Сент-Дьёрди полностью отражает многообразие тех функций, которые
вода выполняет в организме.
276
5.2. ОТНОСИТЕЛЬНОЕ СОДЕРЖАНИЕ ВОДЫ В КЛЕТКАХ —
ВАЖНЫЙ ПАРАМЕТР ВОДНОГО ОБМЕНА
Чтобы вода могла выполнять свои функции, все части растения должны
быть в достаточной степени оводнены. Степень оводненности клеток тканей и
органов растений определяется относительным содержанием воды (ОСВ).
__ iri^yX
ОСВ = —--------------------100,
^сыр.нас _ ^сух
где /лсыр и /лсух — соответственно сырая и сухая масса ткани, /лсь1р нас — сырая
масса в состоянии полного насыщения водой. Когда потребление и потери
воды у растения сбалансированы, ОСВ поддерживается на постоянном уровне.
У большинства мезофитов ОСВ составляет 85 — 95%. Если ОСВ падает ниже
некоторого критического значения, ткань отмирает. Критическое значение ОСВ
зависит от вида растения и ткани; для тканей мезофитов оно близко в среднем
к 50 %.
В течение вегетационного периода содержание воды в почве сильно колеб-
лется. Основная задача водного обмена в условиях изменяющегося водоснаб-
жения состоит в регуляции потоков воды в растении и поддержании в клет-
ках, органах и тканях ОСВ в пределах, необходимых для обеспечения процес-
сов жизнедеятельности.
5.3. КЛАССИФИКАЦИЯ РАСТЕНИЙ
ПО ИХ СПОСОБНОСТИ РЕГУЛИРОВАТЬ ВОДНЫЙ ОБМЕН
Различные виды растений по-разному реагируют на изменяющиеся условия
водоснабжения. Одни приспособлены к резким колебаниям содержания воды в
среде и при этом сохраняют способность к поглощению воды из почвы, поддер-
живая оводненность клеток и тканей на должном уровне. Для других губитель-
ным оказывается даже незначительное снижение содержания воды в среде.
Согласно классификации X. Вальтера, основанной на способности расте-
ний регулировать водный обмен, весь растительный мир можно разделить на
пойкилогидрические и гомойогидрические растения (рис. 5.1).
Рис. 5.1. Классификация растений по их способности регулировать водный обмен
277
Пойкилогидрические растительные организмы не способны сами регулиро-
вать водный обмен. К ним относятся эпифитные и почвенные водоросли, ли-
шайники, некоторые мхи и папоротникообразные, а также некоторые покры-
тосеменные растения. Для подавляющего большинства этих организмов нужна
водная среда или высокая влажность воздуха. В засушливый период они теряют
воду и погибают. Некоторые представители этой группы при дегидратации со-
храняют жизнеспособность, благодаря снижению интенсивности метаболизма
и последующего перехода в состояние анабиоза (криптобиоза). С окончанием
засушливого периода они поглощают воду и возвращаются к активной жизнеде-
ятельности, восстанавливая рост и другие функции. К таким организмам, в ча-
стности, относятся красные водоросли Bangia и Porphyra, мох Funaria, а из выс-
ших растений различные виды рода миротамнус, например Myrothamnusflabellifolia.
Гомойогидрические растения обладают способностью регулировать водный
обмен, поддерживая ток воды в системе почва—растение —атмосфера, а так-
же надлежащую оводненность клеток, тканей и органов. Они составляют боль-
шинство обитателей суши, однако в эту группу входят и водные растения.
К гомойогидрическим растениям относятся наземные папоротникообразные,
все голосеменные и подавляющая часть покрытосеменных растений. Различия
в водоснабжении и других условиях среды привели в процессе эволюции к
формированию нескольких типов (экологических групп) гомойогидрических
растений, различающихся по характеру и эффективности регуляции их водно-
го обмена. Современные гомойогидрические растения подразделяют на три
экологические группы.
1. Гигрофиты — растения, обитающие в местах с высокой влажностью поч-
вы и воздуха. В умеренном климате к ним относятся, в частности, тонколист-
ные папоротники, например кочедыжник женский (Athyrium felix-femina), пу-
зырник ломкий (Cystopteris fragilis), а из высших растений кислица (Oxalis
acetosella), чистяк (Ficaria vema), калужница (Calthapalustris). У гигрофитов нет
приспособлений, ограничивающих расход воды. Их листья содержат мало устьиц,
которые почти всегда открыты, а кутикула на поверхности листьев слабораз-
вита, поэтому доля транспирации через кутикулу у них велика. Поглощенная в
избытке вода выделяется гигрофитами наружу с помощью специальных при-
способлений на листьях — видоизмененных устьиц, называемых гидатодами.
Этот процесс называется гуттацией. При недостатке воды гигрофиты очень
быстро завядают и гибнут. К гигрофитам близки гидрофиты (водныерастения) —
растения, полностью или частично погруженные в воду. К ним относятся,
например, валлиснерия (Vallisneria spiralis), кувшинка (Nuphar alba) и стрело-
лист (Sagittaria sagittifolia). У полностью погруженных в воду гидрофитов транс-
пирация отсутствует. Движение воды осуществляется только за счет корневого
давления, которое клетки корня развивают в сосудах ксилемы, накачивая туда
воду. Если растения не полностью погружены в воду, то некоторая транспира-
ция у них наблюдается. Основная стратегия регуляции водного обмена у гидро-
фитов состоит в ограничении поступления воды, которую они поглощают всей
или почти всей поверхностью.
2. Мезофиты — наземные растения умеренного климата, осуществляющие
жизненный цикл при резких колебаниях влажности почвы и воздуха. В эту группу
входят многие древесные растения, лесные и полевые травы, подавляющее
большинство сельскохозяйственных растений. Мезофиты эффективно регули-
278
руют водный ток через свое тело с помощью устьичного аппарата и путем
сбрасывания листьев. У них хорошо развита корневая система, обеспечива-
ющая во многих случаях высокое корневое давление.
3. Ксерофиты — растения аридного (сухого) климата, очень неоднородны
по способам адаптации к засухе. Среди них есть сильно- и слаботранспирирую-
щие формы, а также формы, способные и неспособные переносить большой
водный дефицит.
Одной из характерных групп ксерофитов являются суккуленты, утолщен-
ные мясистые органы которых удерживают большой запас воды. К типичным
представителям суккулентов относятся кактусы, например (Parodia chrysacanthion
и Pachycereuspringlei), молодило (Sempervivum sobohferum) и очиток (Sedum acre).
Поглощенная ими вода экономно используется и хранится в клетках водоудер-
живающей ткани, поэтому вакуоли клеток этой ткани сильно увеличены в
размерах. Благодаря низкому отношению площади поверхности растения к его
объему потери воды при транспирации у суккулентов значительно снижены.
Наличие волосков и толстой кутикулы на поверхности, а также небольшое
число устьиц, почти всегда закрытых, также способствует сохранению воды в
растениях.
Многие виды ксерофитов приспособились к засушливому климату за счет
развившейся способности их клеток переносить значительную дегидратацию,
сохраняя при этом жизненно важные функции. Эта группа ксерофитов полу-
чила название эуксерофитов, т. е. настоящих ксерофитов. Для них, как прави-
ло, характерна ксероморфная структура. Ксероморфизм выражается в умень-
шении размеров листьев и клеток, увеличении числа клеток, а также в при-
способлениях эпидермиса к снижению транспирации (толстая кутикула, опу-
шение).
К эуксерофитам относятся, например, вероника сизая (Veronica incana),
некоторые виды полыней (Artemisia glauca) и астр (Aster uillosus).
Другим широко распространенным способом приспособления растений к
засушливому климату является развитие глубоко проникающей корневой си-
стемы. Ксерофиты, обладающие этим свойством, получили название гемиксе-
рофитов. С помощью такой корневой системы они добывают грунтовую воду,
залегающую на глубине до нескольких десятков метров. Для гемиксерофитов
характерны тонкие листья с большим числом устьиц и высокая скорость транс-
пирации, так как их водоснабжение не лимитировано. Глубоко проникающая
корневая система позволяет избегать засухи, поэтому их нельзя считать истин-
ными ксерофитами. К этой группе растений относятся многие виды полыней,
кустарники, такие, как белый саксаул (Haloxylon persicum) и джузгун голова
Медузы (Calhgonum caput-medusae), а из древесных форм — черный саксаул
(Haloxylon ammodendron).
К растениям зоны аридного климата относятся также эфемеры. Эти растения,
как и гемиксерофиты, нельзя считать истинными ксерофитами, поскольку они
избегают условий, приводящих к развитию водного дефицита. Стратегия при-
способления к аридному климату у эфемеров состоит в ускоренном жизненном
цикле и использовании влаги, в обилии содержащейся в почве сразу после ве-
сеннего таяния снега. Все фазы жизненного цикла они успевают пройти за очень
короткий период до наступления засухи. Примеры растений такого типа —
мятлик луковичный (Роа bulbosa) и осока толстостолбиковая (Carexpachystylis).
279
5.4. ОБЩИЕ ЗАКОНОМЕРНОСТИ ТРАНСПОРТА ВОДЫ
ЧЕРЕЗ МЕМБРАНЫ РАСТИТЕЛЬНЫХ КЛЕТОК
Для описания закономерностей транспорта воды используют такие поня-
тия, как химический потенциал воды, осмотическое давление, водный и мат-
ричный потенциалы.
5.4.1. ХИМИЧЕСКИЙ ПОТЕНЦИАЛ ВОДЫ
Любое вещество, в том числе вода, движется в направлении уменьшения ее
свободной энергии, или (что то же самое) в направлении ее более низкого
химического потенциала. В соответствии с законами термодинамики, химиче-
ский потенциал воды (pw) при изменяющемся давлении можно представить
уравнением
И» = И» + RTlnaw + VWP, (5.1)
где ц° — стандартный химический потенциал воды [Дж/моль]; R — газовая
постоянная (8,314 Дж/(моль-град К); Т — абсолютная температура; aw — ак-
тивность воды; Vw — парциальный молярный объем воды; Р — давление. Рас-
смотрим отдельные составляющие уравнения 5.1.
Химический потенциал, как и другие виды потенциальной энергии, явля-
ется относительной величиной, поэтому в выражение химического потенциа-
ла включен стандартный химический потенциал ц°. Поскольку при расчетах
движущих сил транспорта воды используют разность химических потенциалов
в двух рассматриваемых точках системы, а не их абсолютные значения, то
сокращаются при вычитании и не фигурируют в выражении градиента хими-
ческого потенциала, определяющего направление перемещения воды. Величи-
на соответствует стандартному состоянию системы, определение которому
будет дано ниже.
Влияние концентрации воды в системе на ее химический потенциал пред-
ставлено в выражении (5.1) членом RT\naw. Концентрация воды связана с
фигурирующей в этом выражении активностью aw соотношением aw = ywxw, где
yw — коэффициент активности воды, безразмерная величина, характеризу-
ющая отклонение системы от идеального состояния при наличии в ней ра-
створенных веществ; х„ — концентрация воды в системе, выраженная в моль-
ных долях. При исследовании транспорта воды в растениях, как правило, не
учитывают отклонение системы от идеального состояния, принимая, что yw
близка к 1, a RT\naw « 7?Tlnxw. Из уравнения (5.1) следует, что химический
потенциал воды тем выше, чем больше ее активность (концентрация). Раство-
ренные вещества снижают активность воды, так как уменьшают ее мольную
долю в системе и соответственно концентрационную составляющую ее хими-
ческого потенциала.
Член VWP в уравнении (5.1) отражает влияние давления на химический
потенциал. Развивающееся в биологических системах давление по своей при-
роде гидростатическое, по величине оно может быть как больше, так и мень-
ше атмосферного. Примером гидростатического давления, больше атмосфер-
ного, является давление протопласта на клеточную стенку, называемое тур-
280
горным давлением. Пример гидростатического давления, меньше атмосферно-
го — давление в сосудах ксилемы при транспирации. Следует обратить внима-
ние на то, что в физиологии растений при исследовании влияния давления на
транспорт воды за нулевую точку отсчета принимается давление, равное ат-
мосферному. В соответствии с этой шкалой гидростатическое давление прото-
пласта на КС является величиной положительной, а гидростатическое давле-
ние в сосудах ксилемы при транспирации — отрицательной. Величина Vw —
парциальный молярный объем воды — является частной производной объема
системы по числу молей воды при постоянных значениях температуры, давле-
ния и постоянном содержании других компонентов в системе. Vw показывает,
насколько увеличивается объем системы с увеличением в ней количества воды
на 1 моль. Данное определение можно записать уравнением
V 1
У W ~ I д I J
)nitPtТ= const
где V — объем системы; nw — число молей воды; и, — число молей всех других
веществ, присутствующих в системе. Поскольку объем жидкости слабо изменя-
ется с давлением, можно принять для воды Vw « 18 см3/моль. Таким образом,
величина химического потенциала воды зависит от ее активности (концентра-
ции) и давления в системе.
Величина — химический потенциал воды в стандартном состоянии. За
стандартное состояние принимают состояние чистой воды при атмосферном
давлении и фиксированной температуре. Если концентрацию и активность воды
выражают в мольных долях, то в стандартном состоянии xw = 1; yw = 1; aw = 1;
RT\naK = 0 и, согласно выбранной нами нулевой точке отсчета давления,
Р = 0 и VWP=O. Отсюда следует, что в стандартном состоянии pw = (уравне-
ние 5.1).
Как отмечалось в начале этого раздела, вода движется по градиенту своего
химического потенциала, т.е. из области более высокого в область менее высо-
кого потенциала. Зная разность химических потенциалов воды в двух точках,
например в двух компартментах клетки, разделенных мембраной, можно пред-
сказать направление самопроизвольного движения воды через мембрану.
5.4.2. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Чтобы понять природу осмотического давления и вывести выражение, опи-
сывающее взаимосвязь между осмотическим давлением и активностью воды,
обратимся к рис. 5.2. Два отсека камеры разделены полупроницаемой мембра-
ной, пропускающей молекулы растворителя, но не пропускающей молекулы
растворенного вещества. В левом открытом отсеке находится чистая вода (aw = 1),
в правом отсеке, который герметически закрыт, — раствор низкомолекуляр-
ного вещества, например сахарозы. Молекулы воды будут диффундировать че-
рез мембрану из отсека, где содержится чистая вода, в отсек с раствором
сахарозы. Диффузия воды будет осуществляться по градиенту ее химического
потенциала (химический потенциал чистой воды выше химического потенци-
ала воды в растворе сахарозы). В то же время движение молекул сахарозы в
обратном направлении, т.е. из правого отсека в левый, окажется невозмож-
281
(2) Манометр
Полупроницаемая
мембрана
Рис. 5.2. Осмотическая ячейка. Стрелками
указано направление движения воды
дексы «л» и «пр» относятся к левому
ным, так как мембрана не проницае-
ма для растворенного вещества. При
диффузии воды через мембрану дав-
ление в правом отсеке будет возрас-
тать, и при достижении им некоторо-
го значения система придет в равно-
весное состояние (рй = ц£р, где ин-
и правому отсеку соответственно), и
поток воды через мембрану прекратится. На основании этого и в соответствии
с уравнением 5.1 можно записать
+ Ни,/’71 = Цн- + ЯТ1па"р + KwPnp. (5.2)
Так как после установления равновесия а” остается равным 1, а Рл, в соот-
ветствии с выбранной нами точкой отсчета давления, равным 0, то 7?Т!пд£ = О
и VwPn = 0. Тогда в соответствии с равенством (5.2)
/?Т1пд"р + VwPnp = 0. (5.3)
Осмотическое давление — это давление, избыточное по отношению к ат-
мосферному, которое необходимо приложить к раствору вещества, чтобы при-
вести его в равновесие с чистым растворителем (или с раствором этого веще-
ства иной концентрации), отделенным от него полупроницаемой мембраной.
В соответствии с этим определением, осмотическое давление раствора сахаро-
зы (ппр) равно избыточному гидростатическому давлению (Рпр), которое оста-
навливает ток воды через мембрану. Заменив на этом основании в уравнении
(5.3) />пр на лпр, получим
RT
лпр =-^1па"р,
V
r W
или для общего случая
л =—=—1пди,. (5.4)
VW
Следует подчеркнуть, что явление осмоса имеет место только в том случае,
если два раствора (или раствор и чистая вода) отделены друг от друга полу-
проницаемой мембраной. При описании процессов водного обмена часто пользу-
ются термином «осмотическое давление раствора» применительно к системам,
в которых отсутствуют мембраны. Следует иметь в виду, что, используя его,
подразумевают осмотическое давление, которое развивал бы раствор, нахо-
дясь в осмотической ячейке.
Осмос и осмотические явления играют особую роль в жизни растений. Ос-
мос приводит к возникновению тургорного давления в клетках. Тургорным
282
называется гидростатическое давление, возникающее в клетках при поглоще-
нии ими воды в результате осмоса. Это давление придает форму и упругость
растительным тканям. Часто используемый в физиологии растений термин «тур-
гор» является качественной характеристикой клеток, указывающей на нали-
чие в них тургорного давления.
Представленная на рис. 5.2 осмотическая ячейка может служить моделью
клетки, находящейся в водной среде, например клетки пресноводной микро-
водоросли, которая лишена крупной центральной вакуоли. Роль полупроницае-
мой мембраны при этом выполняет ПМ. Поскольку растительные клетки име-
ют центральную вакуоль, которая занимает подавляющую часть клеточного
объема, то в модельных системах КС, ПМ цитоплазму и тонопласт рассматри-
вают как одну мембрану, а роль внутреннего компартмента осмотической ячейки
отводят вакуоли.
5.4.3. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ КАК ФУНКЦИЯ КОНЦЕНТРАЦИЙ
РАСТВОРЕННЫХ ВЕЩЕСТВ
В 1877 г. В.Пфеффер, используя сконструированный им осмометр, исследо-
вал влияние концентрации растворенных веществ на осмотическое давление
растворов. Основываясь на этих данных, Я.Х. Вант-Гофф в 1886 г. показал, что
концентрация раствора и его осмотическое давление связаны уравнением
k = RTXcj, (5.5)
J
где Cj — молярная концентрация вещества в растворе; суммирование произво-
дится по концентрациям всех растворенных веществ.
Таким образом, для выражения осмотического давления раствора мы име-
ем два уравнения. В уравнении (5.4) л является функцией активности воды,
тогда как в уравнении (5.5) — функцией суммарной концентрации растворен-
ных веществ. В соответствии с этими уравнениями при увеличении концентра-
ции веществ в растворе его осмотическое давление возрастает, тогда как ак-
тивность воды снижается.
Из уравнения (5 5) следует, что вклад в осмотическое давление могут вно-
сить вещества разной химической природы. Величина осмотического давления
раствора определяется суммарной концентрацией всех имеющихся в водном
растворе осмотически активных частиц (молекул и ионов), которая носит на-
звание осмолярности. Осмолярность клеточного сока мезофитов в среднем со-
ставляет 0,3 моль/л. Из них около 0,1 моль/л приходится на долю ионов К+,
столько же на долю ионов СГ, остальные 0,1 моль/л составляют сахара, орга-
нические кислоты и другие соединения. Для перевода осмолярности в осмоти-
ческое давление ее нужно умножить на произведение RT, которое составляет
2,437 л МПа/моль при 20 °C (293 К) Для приведенного примера с клеточным
соком мезофитов, имеющим осмолярность 0,3 моль/л, осмотическое давление
составляет 0,73 МПа. В физиологии растений давление выражают в мегапаска-
лях (МПа) или в барах, но возможно использование и других единиц. Соотно-
шения между единицами давления приведены ниже:
1 МПа = 10 бар = 9,88 атм = 107 дин/см2.
283
5.4.4. ВОДНЫЙ ПОТЕНЦИАЛ
Заменим в уравнении (5.1), согласно уравнению (5.4), /?Т1паи, на - Тог-
да выражение для химического потенциала воды примет вид
М» =Mw+ Vwn. (5.6)
Величина (pw - р°) определяет способность воды в растворе, находящемся
при некотором давлении, производить работу по сравнению с подобной спо-
собностью чистой воды, находящейся при атмосферном давлении. Различие в
значениях разности (pw - ц°) в одной точке по сравнению с другой показыва-
ет, что вода между ними не находится в состоянии равновесия. Поэтому она
будет перетекать из области с большим значением в область меньшего значе-
ния (ци, - ц°). При исследовании процессов движения воды в растениях ис-
пользуют величину, пропорциональную разности (pw - ц“), которая получи-
ла название водного потенциала (Ч7). Водный потенциал определяют как вели-
чину, равную разности химических потенциалов воды в системе (pw) и чистой
воды (ц°) при той же температуре и том_же давлении, отнесенную к величине
парциального молярного объема воды (Vw), что можно записать в виде соотно-
шения
(5.7)
В соответствии с определением и уравнением (5.6) водный потенциал
можно выразить соотношением
У= Р- л (5.8)
Так же, как Рил, водный потенциал выражается в единицах давления.
Согласно определению осмотического давления, Р не может быть больше л,
поэтому в соответствии с уравнением (5.8) водный потенциал не может при-
нимать положительные значения. Поскольку активность чистой воды при ат-
мосферном давлении равна 0 (уравнение (5.4)), то ее водный потенциал при
этих условиях тоже равен нулю. Это максимально возможное значение водного
потенциала. По мере увеличения концентрации растворенного вещества Т
снижается и принимает все более отрицательные значения.
Химический потенциал паров воды в воздухе определяется через давление
пара воды. Допуская, что пары воды ведут себя подобно идеальному газу, т.е.
парциальное давление паров воды определяет химическую активность паров
воды в воздухе, получаем
Pwv _ относительная влажность
где Pwv — наблюдаемое парциальное давление паров воды в воздухе; Р°„ —
давление насыщенных паров, находящихся в равновесии с чистой водой при
той же температуре. Если принять во внимание эту зависимость, выражение
водного потенциала для паров воды в воздухе будет иметь вид
Vw
RT. RT.
= In aw = - In
V V
' w ' w
относительная влажность
(5-9)
100
284
В соответствии с уравнением (5.9) при относительной влажности, равной
100 %, водный потенциал паров воды в воздухе будет равен 0. Снижение отно-
сительной влажности всего лишь на 1 % приводит к уменьшению Ч'до -1,36 МПа.
Средние значения водного потенциала зеленых листьев, например овощных
растений, составляют -0,5 Мпа. Согласно уравнению (5.9), такое значение Ч7
соответствует относительной влажности 99,6 %. Даже во время проливного дождя
влажность воздуха редко превышает 99 %. Следовательно, листья, водный по-
тенциал которых составляет -0,5 МПа, постоянно теряют воду. В листьях боль-
шинства наземных растений водный потенциал колеблется от -0,4 до -0,3 МПа.
У некоторых растений пустынь водный потенциал растений может снижаться
до -5,0 МПа.
5.4.5. МАТРИЧНОЕ ДАВЛЕНИЕ
В водном обмене растений большое значение имеет взаимодействие воды с
биомолекулами. Такое взаимодействие осуществляется как внутри клеток, так
и в апопласте и происходит в основном за счет образования водородных связей
между молекулами воды и биополимерами. Водородные связи постоянно рас-
падаются и образуются вновь. Связывание части молекул воды функциональ-
ными группами биополимеров понижает ее термодинамическую активность.
Таким образом, биомолекулы наряду с низкомолекулярными растворенными
веществами участвуют в снижении активности воды и вносят вклад в сниже-
ние ее химического потенциала. В связи с этим фактически измеряемое в экс-
RT.
периментах осмотическое давление в клетках, равное —— lnaw, можно пред-
ставить в виде суммы л = 7ts + т, где ns — осмотическое давление, вызываемое
присутствием низкомолекулярных растворенных веществ; т — матричное дав-
ление, являющееся результатом взаимодействия воды с биополимерами. При-
нимая во внимание наличие двух составляющих осмотического давления, мы
можем переписать выражение (5.8) следующим образом:
Ч* = Р - ns - т. (5.10)
Часто в физиологии водного обмена водный потенциал представляют в виде
суммы потенциалов:
Ч' = Ч'р + Ч'5 + Ч'Прим1, (5.11)
где Ч^р — потенциал давления, равный Р; 4/s — осмотический потенциал дав-
ления, равный -ks; Ч'„ — матричный потенциал, равный -т.
Направление движения воды из наружной среды в клетку или обратно бу-
дет определяться направлением градиента водного потенциала. Условием по-
ступления воды в клетку является более высокий водный потенциал наружной
среды, чем водный потенциал клетки. Направление движения воды в системе
целого растения также определяется направлением градиента водного потен-
циала.
Примечание 1. В древесных растениях вода может подниматься по сосудам ксилемы
на большую высоту. Поднимаясь вверх, она приобретает в гравитационном поле Земли
потенциальную энергию, которую следует учитывать при определении химического
285
потенциала воды. Вклад земного притяжения в водный потенциал учитывается как
давление, оказываемое столбом воды, равным по высоте расстоянию, на которое пе-
ремещается вода в гравитационном поле. В связи с этим в выражение водного потен-
циала (уравнение (5.11)) для клеток, находящихся на большой высоте, вносят еще
одну составляющую, получившую название гравитационного потенциала (Ч'гр) и рав-
ную pwgh, где рн, — плотность воды; g — ускорение свободного падения; Л — расстоя-
ние, на которое перемещается вода в гравитационном поле. Расчет в соответствии с
выражением для гравитационного потенциала показывает, что при перемещении воды
по вертикали на расстояние 10 м вклад гравитационной составляющей в водный по-
тенциал приблизительно равен 0,1 МПа.
5.5. СООТНОШЕНИЕ МЕЖДУ ОСМОТИЧЕСКИМ ДАВЛЕНИЕМ
И ГИДРОСТАТИЧЕСКИМ ДАВЛЕНИЕМ В КЛЕТКЕ
Познакомившись с понятиями химического и водного потенциалов, а так-
же с явлением осмоса, рассмотрим некоторые закономерности водного обме-
на на уровне клетки. Главным барьером, отделяющим клетку от наружной сре-
ды, является ПМ, которую в первом приближении можно считать полупрони-
цаемой мембраной. В то же время наличие относительно жесткой КС ограничи-
вает объем протопласта при поступлении воды в клетку и этим способствует
развитию внутриклеточного гидростатического (тургорного) давления. Клетку
вследствие этого можно рассматривать как осмотическую ячейку.
Согласно уравнению (5.8), гидростатическое давление и осмотическое дав-
ление — главные составляющие водного потенциала клетки. В зависимости от
ее оводненности соотношение между этими двумя составляющими различно.
Помещая клетки растений (кусочки тканей), находящиеся в состоянии турго-
ра, т. е. в состоянии высокой оводненности, в растворы нейтрального осмоти-
чески активного вещества, например сахарозы, можно изменять внутрикле-
точное содержание воды (рис. 5.3).
Вода будет входить в клетки или выходить из них в зависимости от концен-
трации сахарозы, т.е. в зависимости от направления градиента водного потен-
циала на границе раздела клетка—среда:
дур — урср _ урКЛ
где AH' — градиент водного потенциала между наружной средой и клеткой;
Ч'ср — водный потенциал среды; Ч'кл — водный потенциал клетки. При инку-
бации клеток в растворах за определенное время достигается состояние равно-
весия. Приведенные ниже рассуждения относятся к равновесному состоянию.
В общем случае водный потенциал клеток можно выразить как Н'кл = Р™ - л™,
а водный потенциал среды как Тср = -лср, поскольку в соответствии с выбран-
ной нами точкой отсчета давления Рср = 0. В состоянии равновесия Ч'кл = Ч'ср и,
следовательно, Р™ - л*01 = -лср.
Рассмотрим сначала предельный случай, когда клетки находятся в чистой
воде. Активность чистой воды максимальна, она равна 1, и в соответствии с
уравнением (5.4) для воды, не содержащей растворенных веществ, лср = 0. Из
этого следует, что в чистой воде Ркл =лкл. Тургорное давление Р™ при этом
достигает максимально возможного значения, так как клетки содержат макси-
286
Рис. 5.3. Соотношение между водным потенциалом % гидростатическим давлением Р
и осмотическим давлением л в клетке
мально возможное количество воды, т.е. находятся в предельно тургесцентном
состоянии. Максимальное количество воды в клетках означает предельное раз-
бавление внутриклеточных веществ, и осмотическое давление внутриклеточ-
ной среды (л1^1) поэтому минимально. В этих усло-
виях в силу равенства Ркл и л™ водный потенциал
клетки 'Ркл равен 0, т. е. имеет свое максимально
возможное значение. По мере увеличения концен-
трации сахарозы лср возрастает и соответственно
'Рср снижается, что усиливает тенденцию к оттоку
воды из клеток, к уменьшению их объема и сни-
жению тургора. Концентрирование внутриклеточ-
ных веществ при этом приводит к повышению л™.
При некоторой достаточно высокой концентра-
ции сахарозы в среде будет достигнуто состояние,
при котором Р'~‘ = 0. Иными словами, клетки по-
теряют тургесцентность. Осмотическое давление п™
при этом примет некоторое высокое значение, а
'Ркл будет представлено только его осмотической
составляющей. Дальнейшее увеличение концент-
рации сахарозы в среде (на графике не показано)
приведет к еще большему выходу воды из клеток,
что будет сопровождаться уменьшением объема
протопласта и отделением его от КС (рис. 5.4, А).
Этот процесс получил название плазмолиза. Нару-
шение связи ПМ с клеточными стенками обус-
ловлено их ограниченной эластичностью. Счита-
ется, что пространство между КС и ПМ при плаз-
молизе заполняет наружный раствор.
Б
Рис. 5.4. Вид растительных кле-
ток при их обезвоживании в
гипертонических растворах
(растворах высокой осмоляр-
ности):
А — плазмолиз; Б — циторриз
287
Точку начального плазмолиза, т.е. концентрацию осмотика, при которой
Т5101 = 0, можно использовать для оценки осмолярности и осмотического дав-
ления внутриклеточной среды. Это определение основано на следующих допу-
щениях: при инкубации клеток в растворах осмотика вещества, содержащиеся
в клетках, не выходят наружу; объем клеток не зависит от изменения наруж-
ной концентрации осмотика. В действительности некоторый обмен осмотиче-
ски активными веществами между клетками и средой происходит. Изменяется
также и клеточный объем, так как КС некоторой эластичностью все-таки об-
ладают, однако для грубой оценки осмотического давления внутриклеточной
среды эти процессы можно не принимать во внимание. Учитывая указанные
допущения, для точки начального плазмолиза, когда Р™ = 0, можно записать:
= л101, где индекс «пл» означает начальный плазмолиз. Оценка внутрикле-
точной осмолярности в этом случае сводится к определению концентрации ос-
мотически активного вещества в среде, при которой плазмолиз едва начинает-
ся. Зная осмолярность, по уравнению (5.5) можно рассчитать л101.
В некоторых случаях плазмолиз протекает без отделения протопласта от КС,
свидетельствуя о высокой прочности их связи. В этом случае сокращающиеся
протопласты тянут за собой КС и заставляют их прогибаться внутрь. За счет сил
упругости КС тургорное давление Т5101 приобретает отрицательное значение,
что приводит к еще большему снижению водного потенциала Ч'кл и усилению
тенденции к поглощению клеткой воды. Такая разновидность плазмолиза на-
зывается циторризом (рис. 5.4, Б). Явления плазмолиза и циторриза можно на-
блюдать не только в лабораторных условиях, но и в природе, например в усло-
виях засухи или почвенного засоления.
5.6. ВОДНЫЕ КАНАЛЫ МЕМБРАН: АКВАПОРИНЫ
Молекулы воды могут преодолевать биологические мембраны двумя путя-
ми: (7) через липидный бислой и (2) через поры, образуемые специфически-
ми белками — аквапоринами. Хотя молекула воды является диполем, она элек-
тронейтральна и вследствие этого может в отличие от ионов диффундировать
через липидную фазу мембраны. Долгое время путь воды через липидный би-
слой рассматривался как единственный. Однако наличие в мембранах пор,
пропускающих молекулы воды, стали предполагать начиная уже с 1960-х гг.
Позднее существование таких пор было доказано, и они получили название
водных каналов.
Одним из критериев участия водных каналов в транспорте воды является
высокое отношение осмотического коэффициента водной проницаемости (//)
к диффузионному коэффициенту водной проницаемости мембраны (Pd). Pf ха-
рактеризует общую водную проницаемость мембраны, когда ток воды осуще-
ствляется как через водные каналы, так и через липидный бислой. Значение 7}
определяют при наложении на мембрану градиента водного потенциала (гра-
диента осмотического или гидростатического давления). Pd характеризует про-
ницаемость мембраны, связанную только с диффузией, т. е. с движением мо-
лекул воды, которое происходит даже в отсутствие градиента водного потен-
циала. Соответственно, его определяют в условиях, когда Д'? на мембране ра-
вен нулю. Значения Р/И Pd приблизительно равны, если транспорт воды осу-
288
ществляется только через липидный бислой, что, в частности, наблюдается на
искусственных липидных бислоях, а также на биологических мембранах, в
которых водные каналы отсутствуют или инактивированы. Показано, что для
ПМ клеток многих растений Pj намного превосходит Pd. Это свидетельствует
об участии водных каналов в транспорте воды через эту мембрану.
В отличие от диффузионной водопроницаемости осмотическая водопрони-
цаемость оказалась чувствительной к соединениям ртути. Последняя ковалент-
но связывает сульфгидрильные группы. Ингибирование транспорта воды со-
единениями ртути в условиях наложенного на мембрану Д'? позволило пред-
положить, что водные каналы образованы белками, содержащими остатки ци-
стеина. Чувствительность транспорта воды к ртутьсодержащим соединениям
используется в качестве другого критерия участия в нем водных каналов.
Еще одним критерием вовлечения водных каналов в транспорт воды явля-
ется его низкая энергия активации {Еа <21 кДж/моль). В отличие от движения
воды через каналы диффузия воды через липидный бислой характеризуется
намного более высокими значениями энергии активации (Еа = 58 — 70 кДж/моль).
На основании вышеприведенных критериев исследователи пришли к выво-
ду, что водные каналы отвечают за основной поток воды через мембраны.
Использование молекулярно-биологических подходов в исследованиях по-
зволило идентифицировать белки водных каналов — аквапорины. Первым иден-
тифицированным белком с выраженной водно-транспортной активностью был
белок мембраны эритроцитов CHIP28 (channel-forming integral protein), пере-
именованный затем в AQP1. На основании гомологии с AQP1 позже были
идентифицированы аквапорины у представителей различных систематических
групп, в частности у бактерий, грибов, растений и животных. В растительных
клетках аквапорины обнаружены в плазматической мембране и тонопласте.
Аквапорины ПМ входят в семейство интегральных белков PIP (plasma membrane
intrinsic protein), аквапорины тонопласта — в семейство интегральных белков
TIP (tonoplast intrinsic protein). Для многих идентифицированных на основании
гомологии с AQP1 растительных белков была продемонстрирована водно-транс-
портная активность. С этой целью кДНК идентифицированных белков (пред-
полагаемых аквапоринов) были транскрибированы in vitro. Полученная РНК
была введена в ооциты африканской травяной лягушки Xenopus laevis. Через
некоторое время, необходимое для синтеза белка и встраивания его в плазма-
тическую мембрану, ооциты переносили на гипотонический раствор и регис-
трировали скорость их набухания (скорость входа воды). Набухание происходи-
ло значительно быстрее у ооцитов, ПМ которых содержала продукт внедрен-
ной РНК, свидетельствуя, что исследуемый белок является аквапорином. Та-
кого рода доказательство наличия водно-транспортной активности было полу-
чено для гомологов AQP1 ПМ и тонопласта из арабидопсиса {Arabidopsis thaliana),
растений табака (Nicotiana tabacum), хрустальной травки {Mesembryanthemum
crystallinum), бобов (Vicia faba), подсолнечника (Helianthus annus), шпината {Spina-
ciaa oleracea) и кукурузы {Zea mays).
Молекулярная масса аквапоринов варьирует от 23 до 31 кДа. На рис. 5.5
представлена гипотетическая структура аквапорина, образующего канал в мемб-
ране. Полипептидная цепь аквапорина 6 раз пересекает липидный бислой. До-
мены, погруженные в липидный бислой, гидрофобны и образуют а-спирали.
С- и N-концы аквапоринов ПМ и тонопласта расположены с цитоплазмати-
10 Физиология растений
289
4
Рис. 5.5. Структура аквапоринов и схема, иллюстрирующая транспорт воды через вод-
ные каналы и липидный бислой мембраны (по S.D.Tyerman et al., 1999):
А — вторичная структура мономера аквапорина AQP1. Цилиндры, обозначенные цифрами 1 —6,
отражают а-спирали, пересекающие липидный бислой мембраны. N, Р, А — аминокислотные
остатки аспарагиновой кислоты, пролина и аланина; Б — предполагаемый способ, посредством
которого два N, Р, A-мотива формируют в мембране водный канал (показан стрелками); В —
четыре полипептида формируют в мембране тетрамерную структуру. Ток воды осуществляется
через каждый из четырех мономеров
ческой стороны мембраны. Гидрофильные домены полипептидной цепи со-
единяют а-спирали. Между 2-й и 3-й, а также между 5-й и 6-й а-спиралями
гидрофильные домены включают небольшие гидрофобные петли. Последние,
как и а-спирали, погружены в липидный бислой. Каждая из этих двух петель
содержит высококонсервативный мотив Asp-Pro-Ala, так называемый NPA-
бокс. Две петли, содержащие этот мотив, совмещаются в центре липидного
бислоя и формируют две полусферические поры, которые вместе создают уз-
кий водный канал. Полагают, что такого рода двухосевая симметрия обеспечи-
вает ток воды через мембрану в обоих направлениях, в зависимости от направ-
ления градиента водного потенциала, а также отвечает за селективность вод-
ного канала по отношению к молекулам воды.
Содержание белков PIP- и TIP-семейств в мембранах растительных клеток
сильно варьирует. Оно зависит от вида растения, ткани, условий водного ре-
290
жима и в некоторых случаях может достигать очень высоких значений. Было
показано, например, что в плазматической мембране листьев шпината на долю
белков PIP-семейства приходится до 20 % от общего содержания белков в этой
мембране.
Аквапорины не только отвечают за быстрый транспорт воды через мембра-
ны, но также дают организму возможность регулировать водные потоки как
между клетками, так и внутри клеток. Эта регуляция осуществляется как путем
изменения числа водных каналов в мембране, так и путем изменения их ак-
тивности. Содержание водных каналов в мембране зависит от биосинтеза аква-
поринов, который находится под контролем транскрипционных факторов. Ре-
гуляция активности уже сформированных водных каналов осуществляется пу-
тем фосфорилирования. Водная проводимость мембран меняется в онтогенезе,
изменяя потоки воды в соответствии с запросами роста и развития растения.
Установлено, что при росте, когда происходит растяжение клеток, активность
генов TIP-семейства возрастает. Экспрессия генов тонопластных аквапоринов
и повышение транспортной активности последних в условиях роста растяже-
нием необходимы для обеспечения усиленного притока воды в вакуоли и под-
держания тургора в клетках.
Контролирование водных потоков в растении имеет большое значение и в
условиях водного дефицита. Регуляция водно-транспортной активности ПМ пу-
тем фосфорилирования — дефосфорилирования аквапоринов и общие принци-
пы регуляции экспрессии генов при водном дефиците рассмотрены в гл. 8 (см.
подразд. 8.2).
5.7. ПОТОК ВОДЫ В КЛЕТКУ
Когда водный потенциал клетки отличается от водного потенциала среды,
вода не находится в состоянии равновесия и движется в направлении от боль-
шего потенциала к меньшему. При этом объемный поток воды Jw, т.е. объем
воды, протекающий через единицу площади мембраны в единицу времени,
пропорционален разности водных потенциалов по обе стороны мембраны:
Jw = £рДТ = £Р(ТС₽ - Г), (5.12)
где Jw — объемный поток воды [см3- см-2- с-1] или [см с-1]; Lp — коэффициент
гидравлической проводимости [см с"1 МПа-1]; Д'? — градиент водного потен-
циала; 'Рс₽ — водный потенциал наружного раствора; — водный потенци-
ал клетки.
Если величина гидравлической проводимости известна, то, используя при-
веденное уравнение, можно рассчитать разность водных потенциалов, необхо-
димую для обеспечения того или иного потока воды. Так, например, показа-
но, что коэффициент водной проводимости у клеток междоузлий харовых во-
дорослей Nitella и Chara равен 10-5 см с-1 МПа-1. Можно принять, что эти
гигантские клетки имеют форму цилиндра длиной 10 см и диаметром 1 мм.
Площадь поверхности, через которую проходит вода, равна 2-nr^l, где —
радиус клетки; / — ее длина; nr^l — объем клетки. Подставляя значения и I
в эти выражения, получим численные значения площади поверхности —
2л 0,05 • 10 = л см2 и объема — л 0,052-10 = л/40 см3. Установлено, что ско-
291
рость прироста этих клеток составляет приблизительно 1 % от их объема в сут-
ки. Соответственно содержание воды в них возрастает тоже на 1 % в сутки.
Следовательно, суточный приток воды в такую клетку составляет 0,01л/40 см3,
или Зл 10“9 см3 - с"1. Этот приток воды осуществляется через поверхность л см2,
так что объемный поток поступающей воды составит 3 - 10-9 см с-1. Используя
полученное значение для объемного потока и известную величину коэффи-
циента гидравлической проводимости для клеток междоузлий, находим, что
ДТ = З Ю-5 МПа. Эти расчеты показывают, для поддержания притока воды,
сопровождающего рост клетки на I % в сутки, должен быть всего лишь на
3 10-5 МПа меньше 'Рср.
Уравнение Jw = £р(АР - Дл) справедливо, если единственным веществом,
движущимся через мембрану, является вода. Если через мембрану переносятся
также и растворенные вещества, например ионы, то градиент осмотического
давления, одна из движущих сил транспорта воды, уменьшается. В этом случае
уравнение потока будет иметь вид
Jw = £р(АР - оДл), (5.13)
где о — коэффициент отражения, характеризующий селективность мембраны
по отношению к воде, является величиной безразмерной, изменяется в диапа-
зоне от 0 до 1. Уравнение (5.13) показывает, что вклад осмотического давле-
ния в движущую силу транспорта воды изменяется в о раз, когда через мемб-
рану проходят как вода, так и растворенные вещества. Если избирательность
по отношению к воде отсутствует полностью, т.е. мембрана одинаково хорошо
проницаема для воды и растворенных веществ, то о = 0 и £ = £рАР. Если
мембрана представляет абсолютный барьер для растворенных веществ и про-
пускает только воду, то о = 1 и Jw = £р(АР - Дл). Изменения коэффициента
отражения in vivo связаны с модификациями свойств мембран. Предполагают,
что коэффициент отражения изменяется под действием факторов окружающей
среды и таким образом вносит вклад в регуляцию тургорного давления и осмо-
тического водного потока.
Коэффициент отражения и гидравлическую проводимость мембран опреде-
ляют с помощью клеточного зонда давления. У клеток высших растений значе-
ния £р лежат в области 10“6—10-9 м с_| МПа-1, а значения о по отношению к
ионам минерального питания близки к 1.
Методом корневого зонда давления измеряют гидравлическую проводимость
(£р) и коэффициент отражения (ок) целого корня. Величина £р, как правило,
одного порядка с величиной гидравлической проводимости клеток, а значе-
ния ок чаще всего лежат в интервале от 0,2 до 0,8.
5.8. ДВИЖЕНИЕ ВОДЫ В ЦЕЛОМ РАСТЕНИИ
Вода образует непрерывную фазу в системе почва—корень—стебель—лист—
атмосфера. Поглощенная корнями из почвы вода транспортируется по стеблю
в листья. Лишь незначительная доля всей поглощенной воды потребляется клет-
ками растения. Подавляющая часть воды, оказавшейся в растении, достигнув
листьев, испаряется. В глобальном масштабе растения возвращают обратно в
атмосферу до половины того количества воды, которое ежегодно выпадает на
Землю в виде осадков.
292
5.8.1. ТЕОРИЯ КОГЕЗИИ И НАТЯЖЕНИЯ
Более 100 лет назад Дж. Бём разработал теорию когезии и натяжения, ко-
торая легла в основу современной модели транспорта воды в целом растении.
В середине прошлого столетия Т. X. Ван ден Хонерт, основываясь на физико-
химических свойствах воды, в рамках этой теории разработал термодинами-
ческие принципы дальнего транспорта воды (транспорт между органами рас-
тений и в целом растении). Основные положения теории когезии и натяжения
формулируются следующим образом.
1. За счет водородных связей между молекулами воды возникают большие
силы сцепления (когезии). В связи с этим вода может подвергаться натяжению
величиной от десятков до нескольких сот МПа, прежде чем столб воды, нахо-
дящейся в капилляре, в частности в сосуде ксилемы, разрушится.
2. Вода в растениях формирует непрерывную водную систему, идущую от
почвы к поглощающей поверхности корня и далее через корень и стебель к
испаряющей поверхности листьев. За некоторым исключением, ток воды в
этой непрерывной системе является гидравлическим по происхождению, и
система может быть описана как цепь сопротивлений, размещенных последо-
вательно и параллельно.
3. Испарение воды листьями приводит к снижению их водного потенциала
и тем самым заставляет воду двигаться из ксилемы к испаряющим клеткам
листьев. Это в свою очередь снижает давление в ксилеме до значений, меньших
атмосферного давления (Р < 0).
4. Вдоль транспирирующего растения устанавливается градиент давления. Это
является причиной тока воды из почвы в корни и далее через стебли к испаря-
ющим воду листьям. Разность в водном потенциале между атмосферой и поч-
вой достаточна для подъема воды даже у самых высоких деревьев.
5. Когда натяжение в сосудах ксилемы достигает некоторой критической
величины, через поры в стенках сосудов проникают пузырьки воздуха. Объеди-
няясь, они могут сформировать пузырек достаточной величины, чтобы разор-
вать столб ксилемного сока в сосуде, т. е. привести к эмболии.
Рассмотрим в общих чертах ток воды в растении, приняв за основу выше-
приведенные положения.
По аналогии с законом Ома поток воды (J„) в гидравлической цепи пред-
ставляют как произведение гидравлической проводимости (£р — величина,
обратная гидравлическому сопротивлению R) на градиент водного потенциа-
ла (Jv = ЕрАЧ7). В соответствии с этой аналогией, если цепь состоит из несколь-
ких сопротивлений, расположенных последовательно, в цепи течет гидравли-
ческий ток, величина которого может быть определена уравнением
Уач7,
V ' _ АЧ7
(5.14)
где Jv — поток воды через гидравлическую цепь; АЧ7,- — разность водных по-
тенциалов между концами z-го элемента цепи; Л, — сопротивление элемента /;
R — сопротивление всей цепи. Если элементы соединены параллельно, суммар-
ный поток воды может быть описан следующим образом: Jv = ХДАЧ7,- = ЕрАЧ7,
где Lj — гидравлическая проводимость /-го элемента цепи; Lp — гидравличе-
293
Атмосфера
Почва
Рис. 5.6. Упрощенная модель уста-
новившегося тока воды по растению.
Стрелка указывает направление
движения воды в системе почва—
растение — атмосфера
ская проводимость всей цепи; ЛТ — разность
водных потенциалов между концами цепи.
В гидравлической цепи целого растения
выделяют три основных последовательно со-
единенных сопротивления: (R\) сопротив-
ление на участке от поверхности клеток эпи-
дермиса до сосудов ксилемы; (Л2) сопротив-
ление, которое оказывают элементы ксиле-
мы; (/?3) сопротивление при испарении воды
в атмосферу из листьев (рис. 5.6). В цепи це-
лого растения ксилема характеризуется наи-
меньшим сопротивлением, тогда как самое
большое сопротивление возникает при диф-
фузии воды из листьев в атмосферу. В каж-
дом из трех участков цепи целого растения
можно выделить более дробные элементы,
соединенные между собой последовательно
или параллельно. Последовательно соедине-
ны ткани, которые вода пересекает, пере-
двигаясь от периферии корня к центру; па-
раллельно соединенные элементы — апоп-
ластный и симпластный пути движения воды.
Испарение воды с поверхности листьев в атмосферу определяет направле-
ние движения воды во всей системе почва—корень—стебель—лист—атмо-
сфера и генерирует движущие силы для поглощения воды корнями. Снижение
водного потенциала листьев при транспирации увеличивает градиент водного
потенциала на участке ксилема — листовая пластинка, что приводит к усиле-
нию поглощения воды клетками листа из ксилемы и соответственно к стиму-
ляции поглощения воды корнями из почвы. Падение водного потенциала на
каждом участке системы происходит в соответствии с величиной его сопро-
тивления. Рассмотрим весь путь движения воды по отдельным элементам гид-
равлической цепи. Ради удобства изложения этапы водного пути будем рас-
сматривать в обратном порядке, т.е. от атмосферы к почве.
5.8.2. ДВИЖЕНИЕ ВОДЫ В ЛИСТЬЯХ И ТРАНСПИРАЦИЯ
Вода поступает из корней в сосуды ксилемы, движется по ним вверх к
листьям, а затем попадает в отдельные клетки листа, где движение осуществ-
ляется в основном по клеточным стенкам.
Процесс испарения воды растением получил название транспирации. По-
скольку листья растения формируют большую часть его поверхности, транс-
пирация происходит в основном через листья. Вода, попав в листья, испаряет-
ся из ксилемных окончаний и клеточных стенок. Пары воды, диффундируя
через межклеточные воздухоносные полости, достигают устьиц и оттуда про-
никают в атмосферу. Замыкающие клетки устьиц, изменяя ширину устьичной
щели, регулируют скорость транспирации так же, как и газообмена растения в
целом. Открытые на свету устьица не только обеспечивают приток СО2 в ли-
294
стья, но и создают благоприятные условия для транспирации. Чем интенсив-
нее транспирация, тем выше скорость движения сока по ксилеме, а следова-
тельно, и скорость доставки фотосинтезирующим клеткам необходимых ве-
ществ. Одним из наиболее важных аспектов устьичной регуляции является пря-
мая зависимость ширины устьичной щели от водного потенциала почвы. Когда
водный потенциал почвы снижается (условия водного дефицита или почвен-
ного засоления), клетки растения, в том числе замыкающие клетки устьиц,
теряют воду. Снижение оводненности замыкающих клеток приводит к утрате
их тургора, закрытию устьиц, что предотвращает избыточную потерю воды
растением (о регуляции работы устьичного аппарата см. гл. 6 и подразд. 8.3.1.2).
У большинства растений транспирация осуществляется в основном через
устьица и лишь незначительная доля воды испаряется с поверхности листьев.
Процесс испарения воды через устьица называется устьичной транспирацией,
а с поверхности листа — кутикулярной транспирацией. Испарение воды с по-
верхности листа — процесс нерегулируемый, поэтому растения избегают ку-
тикулярную транспирацию. В связи с этим эпидермис листьев мезофитов и
ксерофитов покрыт хорошо развитой кутикулой, которая образована воскопо-
добными веществами, непроницаемыми для молекул воды.
Поскольку транспирация является генератором градиента водного потен-
циала, ее называют верхним концевым двигателем транспорта воды в растении.
5.8.3. ДВИЖЕНИЕ ВОДЫ ПО КСИЛЕМЕ И КЛЕТОЧНЫМ СТЕНКАМ
Поглощенная корнем вода транспортируется в радиальном направлении к
проводящим пучкам и оказывается в конце концов в сосудах ксилемы. Даль-
нейшее движение воды происходит в восходящем направлении последователь-
но по ксилеме корня, стебля и листьев.
Ксилема специально приспособлена к выполнению функции водопроведе-
ния. Проводящие элементы этой ткани имеют одревесневшие, т.е. пропитан-
ные лигнином, клеточные стенки и лишены протопластов. Сосудистые расте-
ния формируют два типа проводящих клеток ксилемы — членики сосудов (об-
наруживаются преимущественно у покрытосеменных) и эволюционно более
примитивные трахеиды (встречаются у покрытосеменных, голосеменных и
папоротникообразных). И членики сосудов, и трахеиды вытянуты вдоль оси
растения. Концы трахеид заострены, тогда как концы члеников сосудов име-
ют, как правило, тупую форму. Членики сосудов, соприкасаясь друг с другом
перфорированными концами, образуют водопроводящие сосуды. Трахеиды со-
прикасаются боковыми стенками или заостренными концами. Контакт между
ними осуществляется с помощью так называемых окаймленных пор. Окаймлен-
ная пора одной проводящей клетки точно совпадает с такой же порой сосед-
ней клетки, образуя водопроводящий путь между двумя клетками. Окаймлен-
ные поры, строго говоря, не являются порами, так как в них сохраняются
перегородки, состоящие из первичной КС и срединной пластины. Вода, пере-
двигаясь от клетки к клетке, вынуждена вследствие этого просачиваться через
указанный барьер. Сосуды представляют собой более совершенную водопрово-
дящую структуру, чем трахеиды. Гидравлическое сопротивление сосудов мень-
ше, чем у трахеид, поскольку диаметр первых больше, чем диаметр вторых, а
295
наличие перфораций на концах члеников делает движение воды более свобод-
ным по сравнению с ее движением через окаймленные поры. Влияние диамет-
ра ксилемного элемента на его гидравлическую проводимость рассмотрено ниже.
Важную роль в движении воды по проводящей системе играет взаимодей-
ствие молекул воды друг с другом и с внутренними поверхностями элемен-
тов ксилемы и КС. Непрерывность водного тока в этих структурах обеспечи-
вается силами адгезии и когезии. За адгезию отвечают водородные связи, обра-
зующиеся между молекулами воды и полярными группами соединений, вхо-
дящих в состав ксилемы и КС, тогда как за когезию — водородные связи,
образующиеся между молекулами самой воды. Силы когезии обеспечивают не-
прерывность и высокую прочность водных нитей в условиях интенсивной
транспирации, когда нити растягиваются и испытывают высокую нагрузку на
разрыв.
Внутри ксилемных окончаний и в порах КС при транспирации формируется
газовая фаза. В трехфазной системе имеет место поверхностное явление, назы-
ваемое смачиванием. Оно заключается во взаимодействии жидкости (транспор-
тируемого раствора) с твердым телом (КС) при их одновременном контакте с
воздухом. Степень взаимодействия воды со стенками капилляра (воды с кле-
точными стенками в сосудах ксилемы) характеризуется величиной косинуса
угла смачивания (cos0). Если Z0 < 90° (cos0 > 0, рис. 5.7, слева), жидкость
хорошо смачивает поверхность (гидрофильная поверхность). Если Z0 > 90°
(cos0 < 0, рис. 5.7, справа), поверхность не смачивается данной жидкостью
(гидрофобная поверхность). Е1оверхность клеточных стенок, несущих большое
число полярных групп, относится к гидрофильным поверхностям, так как для
нее Z0 -> 0°, a cos0 -> 1.
В сосудах ксилемы (капиллярах) адгезия воды к КС и смачивание стенок
водой приводят к капиллярным явлениям. Они возможны тогда, когда диаметр
капилляров соизмерим с радиусом кривизны поверхности жидкости в них,
что характерно для ксилемных элементов и КС. Кривизна поверхности, возни-
кающая благодаря адгезии жидкости к стенкам, приводит к изменению свойств
ее поверхностного слоя.
Особенность капиллярных явлений заключается в том, что с появлением
кривизны поверхности давление жидкости внутри капилляра изменяется. В за-
висимости от свойств поверхности капилляра (угла смачивания) давление
жидкости в нем может быть больше или меньше атмосферного. Возникающий
Рис. 5.7. Иллюстрация капиллярных яв-
лений:
ДР — избыточное давление; г' — радиус кри-
визны; г — радиус капилляра; h — высота
поднятия или опускания жидкости в капил-
ляре, cos 6 — косинус краевого угла. Слева
и справа — капилляры с гидрофильной и
гидрофобной поверхностью соответственно
296
градиент давления между жидкой и газовой фазами в капилляре (ДР) выража-
ется уравнением Лапласа
АР =
28*
г'
(5.15)
где г' — радиус кривизны поверхности жидкости; 8* — поверхностное натяже-
ние жидкости; ДР — капиллярное, или лапласовское давление.
Возникающее вследствие кривизны поверхности капиллярное давление всегда
направлено к центру кривизны (рис. 5.7). Центр кривизны может находиться
вне жидкости (отрицательная кривизна) и внутри жидкости (положительная
кривизна), в первом случае ДР уменьшает внутреннее давление жидкости, а во
втором — увеличивает его, т.е. в одном случае происходит растягивание жид-
кости, а во втором — сжатие.
Существованием капиллярного давления объясняется поднятие или опу-
скание жидкости в капилляре. Рассмотрим изменение уровней в двух погру-
женных в воду капиллярах, один из которых имеет гидрофильную поверхность
(рис. 5.7, слева), а другой — гидрофобную (рис. 5.7, справа). В левом капилляре
поверхность жидкости имеет отрицательную кривизну, поэтому лапласовское
давление стремится растянуть воду (давление направлено к центру кривизны)
и поднимает ее вверх. Кривизна поверхности в правом капилляре положитель-
на, лапласовское давление направлено внутрь воды и поэтому происходит ее
опускание. Высота капиллярного поднятия воды (или опускания) определяет-
ся уравнением Жюрена
, 28й’ cos 0
h =---------,
<?(рИ-Ро)
где р"', ро — плотности жидкости и воздуха соответственно; g — ускорение
2 5^ cos О
свободного падения. Так как pw » ро и pw близко к 1, h =-------. Уравне-
rg
ние Жюрена показывает, что при отсутствии смачивания (0 > 90°, cos0 < 0)
уровень жидкости в капилляре опускается на величину h (рис. 5.7, справа). При
полном смачивании (0 -> 0°, cos 0 -> 1) уровень жидкости поднимается (рис. 5.7,
слева). Вода хорошо смачивает стенки сосудов ксилемы и поры клеточных сте-
нок, поэтому искривленная поверхность на границе стенка—вода будет вогну-
той. Поскольку стенки элементов ксилемы гидрофильны, то вода будет подни-
маться по ним вверх, и высота поднятия будет определяться выражением h =-.
rg
Расчеты показывают, что величина h в тонких капиллярах может достигать
весьма больших значений (табл. 5.1). Таким образом, капиллярные силы могут
обеспечить подъем воды на нужную высоту даже у древесных растений.
Поток воды в системе равен произведению ее гидравлической проводимо-
сти на градиент водного потенциала в
этой системе. Поскольку осмотическое
давление ксилемного сока, как прави-
ло, не превышает 0,2 МПа, основной
вклад в АТ ксилемы вносит АР. Осмо-
тической составляющей градиента вод-
ного потенциала в этом случае можно
Таблица 5.1. Расчетные значения
высоты поднятия воды (А) в капилляре
в зависимости от его радиуса (г)
Г 1 мм 20 мкм 1 мкм 0,1 мкм 1 нм
h 1,5 см 75 см 15 м 150 м 15 км
297
пренебречь. Объемный поток воды для ксилемы вследствие этого можно выра-
зить как: Jw = LpAP. Согласно закону Пуазейля, гидравлическая проводимость
(£р) цилиндрических труб (такими в грубом приближении можно считать эле-
менты ксилемы) равна —— (ламинарное движение), где г — внутренний
радиус трубы; ц — вязкость раствора. Соответственно объемный поток воды в
ксилемном элементе будет равен Jw =-----АР. Знак «минус» в уравнении
8т;
потока Пуазейля означает, что положительный объемный поток (Jw > 0) на-
правлен в сторону уменьшения гидростатического давления (АР < 0). Градиент
гидростатического давления в элементах ксилемы и КС создается в основном
благодаря транспирации. При интенсивной транспирации в ксилеме некото-
рых растений может развиваться большое натяжение (отрицательное гидроста-
тическое давление) вплоть до -10 МПа, которое поддерживается за счет по-
верхностных явлений на границе ксилемный сок—стенка. Когда транспирация
прекращается или ослабевает, что происходит ночью или при высокой влаж-
ности воздуха, гидростатическое давление в ксилеме падает до значений, близ-
ких к 0, а в некоторых случаях может принимать положительные значения (т. е.
выше атмосферного). Экспериментально показано, что изменения гидростати-
ческого давления в ксилеме (от положительного до отрицательного) на протя-
жении суток приводят к заметным колебаниям в диаметре дерева. При поло-
жительном давлении вода выделяется из растения через гидатоды листьев (ви-
доизмененные устьица).
Приведенное выше уравнение Пуазейля показывает, что диаметр проводя-
щего воду канала имеет огромное влияние на его гидравлическую проводи-
мость, а следовательно, и на величину потока воды. У растений поперечные
размеры проводящих элементов ксилемы сильно колеблются. Например, око-
ло кончика корня кукурузы диаметр сосудов протоксилемы равен 5—10 мкм.
На расстоянии 25 мм от кончика средний диаметр сосудов ранней метаксиле-
мы составляет 23 мкм, а на расстоянии больше 250 мм от кончика сосуды
поздней метаксилемы достигают в диаметре 100 мкм. Вследствие такого разли-
чия в диаметре сосуды поздней метаксилемы обладают значительно более вы-
сокой гидравлической проводимостью, чем сосуды ранней метаксилемы. Рас-
четы по уравнению Пуазейля показывают, что проводимость одного зрелого
сосуда поздней метаксилемы с диаметром 100 мкм эквивалентна 357 сосудам
ранней метаксилемы с диаметром 23 мкм. Созревание поздней метаксилемы
имеет большое значение для зрелой части основного корня, который собирает
воду, поступающую из многочисленных боковых корней, и транспортирует ее
в стебель.
5.8.4. ДВИЖЕНИЕ ВОДЫ В КОРНЕ '
Движение воды в радиальном направлении из почвенного раствора в про-
водящие элементы ксилемы осуществляется как непосредственно через клет-
ки, так и по апопласту тканей корня (рис. 5.8). Напомним, что под термином
апоплаап у растений понимают единую систему клеточных стенок и межкле-
точных полостей. Транспорт воды через клетки получил название движение
298
воды от клетки к клетке («cell to cell»).
В этом случае, преодолевая последова-
тельно расположенные в радиальном
направлении ткани корня, вода при
движении от клетки к клетке может
пересекать мембраны или идти по не-
прерывному цитоплазматическому пути
через соединяющие соседние клетки
плазмодесмы. Единая система, объеди-
няющая с помощью плазмодесм про-
топласты растительных клеток, назы-
вается симпластом. В соответствии с
этим путь движения воды от клетки к
клетке подразделяется на трансмемб-
ранный и симпластный (рис. 5.8). При
трансмембранном движении вода в пре-
делах одной клетки дважды пересекает
плазмалемму и клеточную стенку, а
если заходит в вакуоль, то дважды пе-
ресекает и тонопласт. В трансмембран-
ном движении воды важную роль игра-
ют образованные аквапоринами водные
каналы, которые характеризуются вы-
сокой водопроницаемостью (см. подразд.
5.6). Таким образом, движение воды от
клеток эпидермиса к сосудам ксилемы
может осуществляться по трем парал-
лельным направлениям: 1) через кле-
точные мембраны (трансмембранный
путь); 2) по цитоплазме и плазмодес-
мам (симпластный путь); 3) по клеточ-
Рис. 5.8. Направления водного тока в рас-
тительных тканях (по Е. Steudle and С. A. Pe-
terson, 1998)
ным стенкам и межклетникам (апоп-
ластный путь). Эти три пути движения
воды не автономны: вода может пере-
мещаться по комбинированным траек-
ториям, например пройти некоторый путь по апопласту, затем пересечь ПМ и
далее передвигаться от клетки к клетке по симпласту.
В настоящее время отсутствуют экспериментальные подходы, которые по-
зволили бы количественно оценить трансмембранный и симпластный потоки
воды в корне. Тем не менее имеющиеся данные уже сейчас позволяют предпо-
ложить, что при движении воды от клетки к клетке трансмембранные потоки
значительно превосходят симпластные. Из-за отсутствия возможности разли-
чать транспорт воды через мембраны и по симпласту, как правило, использу-
ют упрощенную транспортную модель, в которой рассматривают два парал-
лельных пути — путь от клетки к клетке, включающий потоки трансмембран-
ного и симпластного путей, и апопластный путь. Оба потока существуют в
растении одновременно. Вклад того или иного пути в суммарный поток воды
определяется многими факторами, такими, например, как вид растения, его
299
возраст, условия выращивания, действие неблагоприятных факторов среды и
т.д. Однако главным фактором, определяющим относительный вклад клеточ-
ного и апопластного путей в общий поток воды в корне, является интенсив-
ность транспирации.
При апопластном транспорте от поверхности клеток корня до просвета в
элементах ксилемы и далее в восходящем направлении в побеги вода ни разу
не пересекает мембраны, а сам апопласт не обладает свойством полупроница-
емости. Все это означает, что осмотические явления не вовлечены в формиро-
вание движущих сил апопластного транспорта воды. В этой связи ток воды
через апопласт имеет гидравлическое происхождение, так как движущей силой
для него служит преимущественно градиент гидростатического давления, и
ток воды по апопластному пути также называют гидравлическим. Основным
процессом, приводящим к формированию АР, при апопластном (гидравли-
ческом) транспорте является транспирация, что и определяет ее влияние на
соотношение потоков воды через клетки и апопласт. При отсутствии водного
дефицита в дневное время, когда устьица открыты и интенсивность транс-
пирации высока, поток воды через апопласт в значительной степени превы-
шает поток через клетки. При низкой интенсивности транспирации преобла-
дающим становится движение воды от клетки к клетке.
При движении воды от клетки к клетке, когда вода на своем пути пересека-
ет мембраны, явления осмоса играют определяющую роль. Ток воды в этом
случае называют осмотическим, хотя градиент водного потенциала для него
включает не только осмотическую, но и гидравлическую составляющую. Гра-
диент водного потенциала между двумя клетками описывается уравнением
АТ = - оАл, (5.16)
где АР, Ал — разности тургорного и осмотического давления между двумя
клетками соответственно; о — коэффициент отражения мембран. С учетом того,
что о для мембран стремится к единице, выражение для АТ принимает вид
АТ = АР - Ал.
Следует обратить внимание на то, что при апопластном транспорте воды и
транспорте воды через клетки генерация АР обусловлена в целом разными
процессами. Как обсуждалось выше, апопластный транспорт связан в основ-
ном с градиентом гидростатического давления, создаваемым натяжением жид-
кости в проводящих элементах ксилемы. Основной вклад в АР при транспорте
воды через клетки вносит градиент тургорного давления, развивающегося в
клетках корня.
В условиях пониженной транспирации поток воды через клетки преоблада-
ет над ее потоком через апопласт. Поскольку клеточные мембраны высокопро-
ницаемы для воды, градиент водного потенциала между клетками и апопла-
стом быстро уравновешивается, создавая локальные равновесия между двумя
указанными потоками.
Так как для апопласта коэффициент отражения стремится к нулю, а для
мембран — близок к единице, коэффициент отражения целого корня состав-
ляет некоторую промежуточную величину. Если вышеприведенное уравнение
(5.16) использовать для целого корня, в котором вода движется как по апо-
пласту, так и через клетки, то оно примет вид
300
АЧ7 = АР - окАл,
(5.17)
где АЧ7, АР, Ал — градиенты соответственно водного потенциала, гидростати-
ческого давления и осмотического давления между почвой и ксилемным со-
ком в корне; ок — коэффициент отражения корня. Величина окАл в приведен-
ном уравнении выражает эффективную составляющую осмотического гради-
ента водного потенциала при движении воды через целый корень. Экспери-
ментальное определение коэффициента отражения показывает, что для цело-
го корня эта величина изменяется в пределах 0,2 —0,8.
Поддержание необходимых концентраций осмотически активных частиц в
клетках и формирование АР и Ал в радиальном направлении корня, вызыва-
ющее движение воды от клетки к клетке и далее к проводящим элементам
ксилемы, осуществляется за счет (7) поглощения ионов клетками корней из
почвы и (2) биосинтеза в цитоплазме клеток низкомолекулярных органиче-
ских соединений, которые получили название осмолитов (см. подразд. 8.2.2).
К основным функциям осмолитов относятся поддержание осмотического рав-
новесия между внутриклеточными компартментами и осморегуляция клеток
при водном дефиците (см. подразд. 8.2.2).
Поглощение ионов из почвы и биосинтез осмолитов в клетках корня могут
обеспечить движение воды от клетки к клетке в радиальном направлении в
отсутствие транспирации или при ее очень низкой интенсивности, т.е. когда
гидравлический поток по апопласту мал. В этом случае движение воды к эле-
ментам ксилемы обусловлено процессами, протекающими преимущественно
в клетках корня. Силы, под действием которых вода перемещается из почвен-
ного раствора в сосуды ксилемы корня в отсутствие транспирации, называют
корневым давлением, а механизм, который его осуществляет, — нижним конце-
вым двигателем транспорта воды.
Корневое давление можно наблюдать при удалении надземной части расте-
ний. Истечение из перерезанных сосудов ксилемы сока, получившего название
пасоки, является результатом транспорта воды из почвы в ксилему, который
осуществляется без участия надземных органов и, следовательно, транспирации.
Корневое давление проявляется в весеннем движении сока у березы и клена,
когда листья на растениях еще не сформировались, т.е. транспирация практи-
чески отсутствует. Упоминавшийся выше процесс гуттации, наблюдаемый при
закрытых устьицах, также возникает вследствие корневого давления. Считается,
что корневое давление создается за счет транспорта воды по градиенту водного
потенциала. При этом предполагается наличие такого процесса, как загрузка
ионами или другими веществами ксилемы корня, — процесса приводящего к
повышению осмотического давления ксилемного сока (понижению его водно-
го потенциала) и формированию АЧ7, направленного из почвы в ксилему.
Вода, двигаясь в радиальном направлении корня к проводящим элементам
ксилемы, проходит через разные последовательно расположенные ткани: эпи-
дермис, кору, эндодерму, перицикл, стелярную паренхиму и стенки сосудов
(рис. 5.9). Поэтому ток воды в радиальном направлении корня можно рассмат-
ривать как движение воды в гидравлической цепи через разные по величине и
последовательно расположенные гидравлические сопротивления. Рассмотрим
путь воды в радиальном направлении по апопласту корня с учетом гидравли-
ческой проводимости разных типов тканей и начнем со стенок сосудов.
301
Центральный цилиндр
Среда
Эндодерма
Эпидермис +
кора
Зрелый
сосуд
ксилемы
Эндодерма
Эпидермис+,
кора
Среда
Низкая
осмолярность
Высокая
осмолярность
Низкая
осмолярность
Пояски Каспари
Протоплазма
)О^ГОООООООООООО
гюоооооооооооооо
ооооооооооооооооо/
юооооооооооооооооо/
\ooooooooooooooooooq/
\рооооооооооооооооооо/
\оооооооооооооооооооо/
\pooooooooooooooooooo/
Хюооооооооооооооооооа/
\pooooooooooooooog/
ХООООООООООООО/'
х^ооооооооо/'
Рис. 5.9. Транспортная модель корня (пояснение в тексте)
(по Е. Steudle and С. A. Peterson, 1998)
Вода, чтобы попасть в просвет сосудов, должна пройти через их стенки.
Полагают, что основной ток воды идет через окаймленные поры, а не через
утолщенные и лигнифицированные части стенок. В корнях кукурузы такие поры
имеют диаметр 2 мкм и занимают до 14 % от общей площади поверхности
сосудов ранней метаксилемы. Вклад стенок сосудов в общее сопротивление
транспорту воды в корне кукурузы оценен экспериментально. Показано, что
стенки сосудов отвечают не более чем за 10 — 30 % общего сопротивления дви-
жению воды в радиальном направлении. У других видов растений эта величина
может быть еще меньше.
Апопласт эндодермы корня включает пояски Каспари (рис. 5.9). Последние
представляют собой отложения лигнина, а в некоторых случаях и суберина. До
недавнего времени полагали, что движение воды по апопласту в радиальном
направлении корня прерывается на уровне эндодермы, так как пояски Каспа-
ри представляют для нее непреодолимую преграду. В соответствии с этой точ-
кой зрения вода и растворенные в ней вещества, достигнув по апопласту эндо-
дермы, должны перейти в симпласт, чтобы продолжить свое движение в ради-
альном направлении корня. Если основной ток воды осуществляется по апо-
пласту, а пояски Каспари — главный барьер на пути ее движения, то повреж-
302
дение эндодермы должно значительно увеличить гидравлическую проводимость
корня. Было, однако, показано, что в молодых зонах корня кукурузы гидрав-
лическая проводимость заметно не увеличивается при повреждении эндодер-
мы. Результаты этих опытов привели к заключению, что эндодерма с ее пояс-
ками Каспари не может быть главным препятствием на пути движения воды к
сосудам ксилемы.
Сделанный вывод был подтвержден биохимическими исследованиями, ко-
торые показали, что основным химическим компонентом поясков Каспари
является не суберин, как полагали ранее, а лигнин. Поскольку в отличие от
суберина лигнин — гидрофильное соединение, содержащие его структуры не
могут быть препятствием на пути движения воды. Если пояски Каспари содер-
жат не только лигнин, но и суберин, который встречается в КС корня у многих
видов растений, то гидравлическая проводимость может заметно снизиться.
Таким образом, по крайней мере, у молодых корней стенки проводящих эле-
ментов ксилемы и эндодерма без субериновых отложений не создают суще-
ственного препятствия на пути водного тока. Следует подчеркнуть, что при
относительно низком сопротивлении апопласта эндодермы водному току апоп-
ласт является препятствием для движения ионов. При всех условиях транспорт
ионов по апопласту корня прерывается на уровне эндодермы, и они переходят
в симпласт, чтобы продолжить свое движение в радиальном направлении к
сосудам ксилемы.
В экспериментах на молодых корнях кукурузы было показано, что повреж-
дение эндодермы приводит к резкому падению корневого давления, которое
свидетельствует о выходе ксилемного раствора через повреждение из компарт-
мента с высоким осмотическим давлением (центральный цилиндр) в компарт-
мент с низким давлением (внешняя среда). Эти результаты подтвердили давно
предполагавшуюся роль эндодермы как барьера для обратной диффузии ионов
из центрального цилиндра в апопласт тканей коры. Эндодерма удерживает ионы
в центральном цилиндре, обеспечивая, с одной стороны, высокую эффектив-
ность снабжения надземных органов элементами минерального питания, а с
другой — формирование корневого давления. Таким образом, транспортные
свойства корня оптимизированы как для воды, так и для ионов. Поглощенные
корнем ионы удерживаются в центральном цилиндре, в то время как низкое
гидравлическое сопротивление эндодермы позволяет в достаточной мере обес-
печивать водой надземные органы.
Движение воды от поверхности корня к эндодерме лежит через клетки эпи-
дермиса и коры. Исследование гидравлической проводимости этих тканей по-
казало, что в корне главное сопротивление водному току оказывают ткани
коры. Удаление некоторой части коры уменьшает его приблизительно пропор-
ционально числу удаленных слоев этой ткани.
Выше, при рассмотрении тканей, через которые вода движется от перифе-
рии корня к центру, основное внимание было сфокусировано на апопластном
пути. Однако путь от клетки к клетке играет не менее важную роль в транспор-
те воды к проводящим элементам ксилемы. У всех растений такой путь воды от
клетки к клетке доминирует в отсутствие градиента гидростатического давле-
ния, создаваемого транспирацией. У некоторых видов, например у гороха (Pisurn
sativum) и ячменя (Hordeum vulgare), путь от клетки к клетке преобладает при
всех условиях.
303
5.8.5. ДВИЖЕНИЕ ВОДЫ ИЗ ПОЧВЫ В КОРЕНЬ
Условием поглощения воды растением является более высокий водный по-
тенциал почвы (Ч7™4), чем водный потенциал корня. Почва — это многофаз-
ная система, состоящая из четырех главных компонентов: (7) твердых мине-
ральных частиц; (2) образующих коллоиды сложных органических соедине-
ний, получивших название гумуса; (3) почвенного раствора; (4) смеси газов,
близкой по составу воздуху. Первые две составляющие образуют почвенный
скелет и формируют пористую структуру почвы, два других заполняют пусто-
ты, или поры, внутри этого скелета.
Величина водного потенциала почвы определяется выражением: Ч71104 = Р -
- лП04 - г™4, где Р, л1104, тПО4 — гидростатическое, осмотическое и матричное
давление в почве соответственно. Давление (Р) оказывает заметное влияние на
крп°ч только ПрИ глубоком залегании почвенных горизонтов; лПО4 отражает влия-
ние на Ч7ПО“ осмотических сил. Этот компонент водного потенциала определяет-
ся, в основном, набуханием коллоидных частиц и в меньшей степени — кон-
центрацией осмотически активных частиц в почвенном растворе; т“°ч отражает
влияние поверхностных явлений в капиллярах почвы на границах раздела фаз
вода—твердое тело —газ. Значение Ч7™4, равное 0, — это максимально возмож-
ное значение водного потенциала почвы. Все указанные взаимодействия воды с
почвенной структурой приводят к снижению ее водного потенциала, поэтому
даже в насыщенной водой почве его величина имеет отрицательное значение.
Величина Ч7™4 сильно варьирует в зависимости от окружающих условий и
типа почвы. В насыщенной водой почве водный потенциал может составлять
всего -0,01 МПа, тогда как устойчивое завядание растений часто происходит,
когда Ч7™4 падает ниже -1,5 МПа. Можно считать, что мезофиты хорошо обес-
печены водой, если Ч7™4 не опускается ниже -0,5 МПа. В природных условиях,
а также при выращивании культурных растений без полива в средней клима-
тической зоне Ч7™4 колеблется в диапазоне от -0,5 до -1,2 МПа. В этих условиях
вода остается доступной для растений без заметного снижения скорости ее
поглощения и подавления роста. При более низких значениях водного потен-
циала почвы наблюдаются, как правило, снижение скорости поглощения воды
растением и подавление роста.
5.8.6. РЕГУЛЯЦИЯ ТРАНСПОРТА ВОДЫ В ЦЕЛОМ РАСТЕНИИ
Регуляция водного режима растений осуществляется комплексом взаимо-
связанных внешних и внутренних факторов. Внешние факторы, контролиру-
ющие водные потоки, включают влажность воздуха, содержание в почве воды,
химический состав и структуру почвы, температуру, освещенность, скорость
ветра и др. Неблагоприятные условия внешней среды, такие как, например,
водный дефицит, почвенное засоление, низкие температуры, некоторые па-
тогены и недостаток элементов минерального питания, могут существенным
образом повлиять на транспорт воды и снизить оводненность клеток и тканей
в растении. К внутренним факторам относят эффективность работы ион-транс-
портных систем и систем биосинтеза осмолитов, водный потенциал клеток,
тканей и органов, функционирование устьичного аппарата, гормональный
статус растения и др. Водные потоки зависят как от градиента водного потен-
304
циала, так и величины гидравлической проводимости тканей (клеток). В соот-
ветствии с этим различные факторы, контролирующие водные потоки в рас-
тении (внешние и внутренние), изменяют либо градиент водного потенциала,
либо гидравлическую проводимость, либо оба параметра вместе.
В условиях достаточного увлажнения почвы и при отсутствии неблагоприят-
ных внешних воздействий важную роль в регуляции водного тока в растении
играет интенсивность транспирации и, следовательно, работа устьичного ап-
парата. Поток воды в растении многократно усиливается в условиях интенсив-
ной транспирации, т. е. при открытых устьицах. При интенсивной транспира-
ции растет натяжение воды в ксилеме и увеличивается градиент водного по-
тенциала за счет его гидростатической составляющей. Натяжение жидкости в
ксилеме «включает» гидравлический апопластный транспорт в дополнение к
осмотическому (от клетки к клетке). Следует отметить, что при возрастании
интенсивности транспирации увеличивается гидравлическая проводимость
корня. При малой интенсивности транспирации она низкая. Это препятствует
избыточной потере воды клетками корня при возможном в этих условиях об-
ращении градиента водного потенциала между почвой и корнем. Регуляция
водного тока в растении посредством изменения натяжения жидкости в ксиле-
ме считается «грубой» регуляцией в отличие от «тонкой» регуляции, которая
обеспечивается изменением активности водных каналов. Она ярче выражена и
более эффективна, если имеются апопластные барьеры, другими словами, если
происходит суберинизация клеточных стенок и движение воды через апопласт
ограничено. Такого рода барьеры часто развиваются в апопласте растений, про-
израстающих при неблагоприятных условиях. Полагают, что образование барье-
ров в апопласте корня на пути движения воды представляет собой фундамен-
тальную адаптивную стратегию растений при действии неблагоприятных фак-
торов окружающей среды. Преимущественное в этих условиях движение воды
по клеткам, а не через апопласт, позволяет осуществлять метаболический кон-
троль водных потоков более эффективно.
Важная роль в регуляции водного режима растений принадлежит абсцизо-
вой кислоте (АБК) — гормону, синтез которого стимулируется водным дефи-
цитом (см. гл. 7). АБК синтезируется в цитоплазме всех клеток корня, но больше
всего ее образуется в невакуолизированных клетках кончика этого органа. АБК
распределяется между апопластом и симпластом в соответствии с разностью
pH между ними. Увеличение pH в апопласте корня до слабощелочных значений
происходит при водном дефиците за счет снижения активности Н-АТФазы
ПМ. При защелачивании апопласта в нем повышается содержание АБК и сти-
мулируется перенос АБК с транспирационным током к листьям. При возрас-
тающей концентрации АБК в листьях закрываются устьица (см. гл. 6). Закрытые
в условиях водного дефицита устьица сокращают потери воды растением. При
сниженной интенсивности транспирации или в ее отсутствие повышение кон-
центрации АБК в клетках корня приводит к увеличению активности водных
каналов и усилению водопоглотительной способности корней растений за счет
активирования водного пути от клетки к клетке. АБК вовлечена также в пути
передачи сигналов, активируемых водным дефицитом и приводящих к вклю-
чению биосинтеза защитных белков. К числу последних относятся ферменты,
катализирующие биосинтез осмолитов — веществ, включенных в регуляцию
осмотического и тургорного давления клеток.
ГЛАВА 6
МИНЕРАЛЬНОЕ ПИТАНИЕ
В главе* рассматриваются структура и рост корневой системы в связи с
поступлением и перемещением в надземные органы элементов питания. Изло-
жены современные данные о системах транспорта и механизмах, обеспечива-
ющих перемещение ионов через мембраны клеток и на дальние расстояния в
тканях и между органами. В разделах, посвященных роли элементов минераль-
ного питания, описаны особенности их транспортных систем, формы, в виде
которых они присутствуют в тканях, механизмы ассимиляции и образования
комплексов с органическими молекулами. Рассмотрены функции элементов в
процессах жизнедеятельности и особенности их накопления, компартмента-
ции и распределения в клетке, тканях и между органами.
6.1. ЗНАЧЕНИЕ РАСТЕНИЙ В ЦИРКУЛЯЦИИ
МИНЕРАЛЬНЫХ ЭЛЕМЕНТОВ В БИОСФЕРЕ.
ОСОБЕННОСТИ МИНЕРАЛЬНОГО ПИТАНИЯ РАСТЕНИЙ
Автотрофность — свойство целостного растительного организма, которое
определяется не только способностью синтезировать органическое вещество
из углекислого газа и воды, используя энергию Солнца, но также способно-
стью растений (в отличие от животных) извлекать и метаболизировать мине-
ральные элементы почвенной или водной среды. Растения как первичные про-
дуценты служат для животных и человека источником не только углеводов, но
и минеральных элементов, поступающих в гетеротрофные организмы в соста-
ве органических молекул и комплексов, а также в виде ионов в сбалансиро-
ванных концентрациях. После гибели организмов и разложения их остатков
минеральные элементы вновь могут использоваться растениями. Растения и
микроорганизмы — центральное звено, обеспечивающее циркуляцию в био-
сфере элементов минерального питания, необходимых для жизнеобеспечения
всех организмов планеты. Каждый из элементов минерального питания под-
вергается круговороту, но биогеохимические циклы отдельных элементов вклю-
чают разные компартменты биосферы, разные пулы соединений и характери-
зуются разными скоростями превращений.
Цикл азота (рис 6.1) затрагивает воздушную зону и литосферу и включает
все формы этого элемента от газообразных до ионных с областью валентности
от +5 (NO3) до -3 (NH3). Для растений доступны две формы азота — нитратная
и аммонийная. Значительная часть азота Земли (4 1015 т) находится в воздухе в
* Е.В.Харитонашвили написаны подразд. 6.3.1, 6.3.3 и в соавт. с Н.Д. Алехиной подразд. 6.3.2.
306
Рис. 6.1. Упрощенная схема цикла азота в биосфере.
Цифры указывают последовательность превращений азота: 1 — биологическая и химическая
фиксация; 2 — нитрификация; 3 — поглощение и ассимиляция азота аммония и нитрата; 4 —
использование растений животными и отмирание организмов; 5 — разложение остатков, мине-
рализация азота; 6 — денитрификация
виде N2. В литосфере предполагаемые запасы азота составляют 18 -1015 т, но большая
часть находится в недоступной для растений форме (органические остатки,
гуминовые и фульвокислоты, гумин). Минерализация органических остатков —
стадия, лимитирующая пополнение запасов минерального азота почвы. По-
глощаемые растениями нитрат и аммоний составляют только 0,2 — 5 % от об-
щего азота почвы. Круговорот серы подобно азоту включает превращение со-
единений, где сера находится в самой высокой степени окисленности +6, как
у сульфата (SO4 ), через самородную серу S с нулевой валентностью до восста-
новленного состояния с валентностью -2 у сероводорода (H2S). В биосферной
циркуляции серы, как и азота, участвуют газообразные соединения — H2S, а
также оксиды серы (SO2, SO3).
Круговороты других элементов (Р, К, Mg, Са и т.д.) не затрагивают атмо-
сферу и осуществляются в системе литосфера—организмы, но и в этом случае
почвенные микроорганизмы, грибы и растения являются компонентами, с
помощью которых циклы запускаются и функционируют. Для цикла фосфора
(рис. 6.2) характерно, что при всех превращениях и в разных компартментах
(биологические объекты или среда) он остается в окисленной форме. В поч-
венном растворе концентрация Р чрезвычайно низкая, и значительные его
количества присутствуют в литосфере в виде труднорастворимых минералов.
В масштабе Земли наблюдаются очень медленное вымывание Р с суши в вод-
ную среду морей и океанов и осаждение на дне в форме труднорастворимых
минералов.
Наука о минеральном питании растений как самостоятельное направление
зародилась во второй половине XIX—начале XX в. Тогда решались две основ-
ные проблемы: I) какие элементы минерального питания необходимы для
растений; 2) каким способом эти элементы попадают в растительный орга-
низм. В первой половине XX в. начала разрабатываться третья кардинальная
проблема — как происходит ассимиляция поглощенных элементов минераль-
ного питания и каковы их функции в процессах обмена.
Окончательное становление науки о минеральном питании связано с раз-
работкой вегетационного метода, который стал основным в физиологии рас-
тений. Искусственные питательные смеси (чаще водные растворы солей), раз-
работанные немецким физиологом В.Кнопом (1817—1900), стали инструмен-
том для изучения потребности растений в минеральных элементах, их накоп-
307
Рис. 6.2. Упрощенная схема основных потоков неорганического (Фн) и органического
(Форг) фосфора в системе почва —растения—животные —почвенные организмы, обес-
печивающих доступность фосфора растениям (по Stewart, Me Kercher, 1982, моди-
фикация)
пении и функциях в тканях и клетках. Хотя в растениях можно обнаружить
почти все элементы таблицы Менделеева, к началу XX в. было выяснено, что
им необходимы 7 элементов: N, Р, S, К, Са, Mg и Fe. Далее была установлена
потребность растений еще в 5 элементах — Си, Мп, Mo, Zn и В. На основе
количественной потребности и содержания в растении минеральные элемен-
ты были разделены на макроэлементы и микроэлементы. Дополнительно была
выделена группа «полезных» элементов, куда были отнесены Na, Cl, Si, Со.
Для некоторых видов растений эти элементы необходимы в больших количе-
ствах (Na и О для галофитов, Si — для хвощей). Кроме того, натрий, хлор и
кобальт (для бобовых) необходимы в качестве микроэлементов. Критерии не-
обходимости, введенные Арноном и Стоутом (1937), предполагают, что эле-
мент должен быть включен в процессы обмена и при его отсутствии в среде
растение не может пройти весь цикл развития.
Особенность минерального обмена растений — накопление элементов в тка-
нях в концентрациях значительно более высоких, чем во внешней среде. Для
калия и фосфора характерно наибольшее концентрирование. Вместе с тем рас-
тение может накапливать и ненужные ему вещества. Например, концентрация
кадмия в тканях культурных растений в 2—16 раз выше, чем в почве (рис. 6.3).
Другая характерная черта минерального питания — специфичность в по-
требности, накоплении и распределении по органам отдельных элементов у
разных растений. Это касается и токсических элементов (рис. 6.3): репа (Brassica
rapd) накапливает кадмий в 4 раза больше, чем морковь (Daucus sativus), но в
корнеплоде (съедобной части) репы его концентрация вдвое ниже, чем в кор-
неплоде моркови. Специфичность в накоплении элементов, в том числе ток-
сичных для человека и животных (тяжелых металлов, нитрата и др.), учитыва-
ется при оценке качества сельскохозяйственной продукции. В то же время спо-
собность растений извлекать и накапливать ионы-загрязнители может быть
308
полезна. В настоящее время некоторые виды растений используются в такой
технологии очистки окружающей среды, как фиторемедиация.
Способность растений накапливать и поддерживать высокую концентрацию
минеральных элементов в тканях должна обеспечиваться соответствующими
механизмами. Вплоть до 40-х гг. XX в. господствовала обоснованная В. Пфеффе-
ром (1845—1920) диффузионно-осмотическая теория поступления ионов из
среды. Развитие теории переносчиков (см. подразд. 6.2.2.2, Е. Epstein et al., 1966)
и хемиосмотической теории Митчела (см. гл. 2) позволило обосновать новые,
принятые теперь механизмы транспорта веществ. В настоящее время наука о
минеральном питании растений имеет три генеральных комплексных направ-
ления: 1) исследование поступления ионов из среды в интактное растение и
их включение в обмен веществ, транспорт ионов в клетке, тканях и между
органами; 2) изучение функций элементов и их ассимиляции; 3) выяснение
систем регуляции минерального питания и взаимодействия органов.
Элементы, которые названы минеральными, составляют в сумме всего около
4% от массы сухого вещества растения (S — 0,1; Р — 0,2; Mg — 0,2; Са — 0,5;
К — 1; N — 1,5 %), на органогенные элементы углерод, кислород и водород
приходится 45, 45 и 6 %, соответственно. Но благодаря минеральным элементам
молекула хлорофилла улавливает свет, работают электрон-транспортные цепи
фотосинтеза и дыхания, синтезируются такие классы соединений, как белки,
нуклеиновые кислоты, высокоэнергетические биомолекулы и др. В конечном
итоге такое количественно небольшое включение элементов в состав клеток
является неотъемлемой частью того, что называется жизнедеятельностью.
6.2. ПОГЛОЩЕНИЕ ЭЛЕМЕНТОВ МИНЕРАЛЬНОГО ПИТАНИЯ
6.2.1. КОРЕНЬ — ОРГАН ПОГЛОЩЕНИЯ МИНЕРАЛЬНЫХ ВЕЩЕСТВ
Источником практически всех элементов (кроме углерода и частично азота,
поступающих из воздуха), необходимых для жизнедеятельности наземных рас-
тений, является почва. Из почвы минеральные элементы и вода поглощаются
высокоспециализированным органом — корневой системой растения. Помимо
309
поглощения корни выполняют и другие важнейшие функции: снабжение над-
земных частей элементами минерального питания, синтез ряда специфиче-
ских веществ (алкалоиды и фитогормоны); усвоение азота и синтез транспор-
тных форм органического азота; синтез и выделение некоторых веществ, необ-
ходимых для взаимодействия с другими организмами (фитоалексины) или
видоизменения свойств окружающей среды (органические кислоты, фитоси-
дерофоры, кислые фосфатазы); накопление и запасание веществ; наконец,
закрепление растения в почве, определяющее неподвижный образ жизни.
6.2.1.1. Рост корня как основа добывания веществ из почвы
Строение и распространение корней в почве — важный фактор, обеспечи-
вающий поглощение веществ. Типы корневых систем различны у однодольных
и двудольных, у древесных и травянистых, у наземных и водных растений. Но
практически у всех видов растений суши надземная часть превосходит корне-
вую систему по массе вдвое и более раз, тогда как поверхность корней неизме-
римо (в 50—150 раз) больше, чем поверхность надземных органов.
Рост в длину и новообразование дополнительных корней (придаточных и/
или боковых разного порядка в зависимости от вида) обеспечивают, помимо
закрепления растения в почве, возможность эффективно использовать запасы
минеральных элементов. Например, при истощении верхнего слоя и зоны поч-
вы вокруг оси растения, растущие корни добывают из более глубоких слоев и
отдаленных участков почвы все большее
Рис. 6.4. Соотношение массы сухого ве-
щества корней и побегов и морфологи-
ческие изменения у 21-дневных расте-
ний пшеницы (водная культура) в за-
висимости от условий азотного питания
(Е. И. Каширина, Н.Д.Алехина, 2000)
количество элементов.
Доступность элементов минерального
питания — важное условие роста корней
и растения в целом. У пшеницы ( Triticum
aestivum), росшей при нитратном и ам-
монийном питании или дефиците азота,
меняется масса (интегральный показатель
роста) корней и их морфология (рис. 6.4).
На нитратном фоне активно образуются
придаточные корни с большим числом
боковых, а при аммонийном питании фор-
мируются короткие и визуально утолщен-
ные придаточные корни с небольшим чис-
лом боковых. Дефицит питания приводит
к образованию длинных, относительно
тонких придаточных корней с незначи-
тельным числом боковых, но тоже длин-
ных корней. При этом у голодающих по
азоту растений увеличивается как абсолют-
ная, так и относительная масса корней.
У ячменя (Hordeum vulgaris), росшего
при дефиците азота, в ответ на локаль-
ное увеличение концентрации нитрата в
среде (1 мМ) корни реагируют образова-
нием большого числа боковых корней и
310
Рис. 6.5. Рост боковых корней у растений
ячменя, индуцированный высокой локаль-
ной концентрацией нитрата ([NO]]) в сре-
де (по Drew et al., 1975).
Основной корень ячменя находился в трехка-
мерной системе с проточным питательным ра-
створом. Средняя часть корня находилась в ка-
мере, где концентрация нитрата была в 100 раз
выше, чем в двух других камерах. Такой же эф-
фект условий снабжения NO] был получен на
корнях Arabidopsis (по Zhang, Forde, 1998)
их ветвлением (рис. 6.5). При этом рост
основного корня мало зависит от на-
личия зоны высокой концентрации
аниона. У растений, развивающихся
при нормальном снабжении азотом,
подобных изменений в росте боковых
корней не происходит.
Другой тип реакции на дефицит элементов питания в среде — образование
так называемых «протеоидных корней». Необычная морфология корней была
описана около 100 лет назад для растений семейства Proteaceae. Протеоидным
называют корень, на котором образуются плотные кластеры корешков огра-
ниченного роста (корень выглядит подобно бытовому ершу), покрытых в свою
очередь корневыми волосками. В настоящее время появление протеоидных кор-
ней обнаружено у растений и других видов при дефиците элементов минераль-
ного питания в среде, особенно фосфора и железа. Увеличение поверхности
контакта с почвенными частицами при образовании протеоидных корней так-
же является стратегией максимального извлечения фосфора и железа, которые
находятся в почве в составе малорастворимых соединений. Экстраполируя ситу-
ацию на рост корней в почве (в естественных условиях), можно сделать вывод,
что корневые системы адаптированы «проводить разведку» в пространстве на
бедных почвах (длинные, распространяющиеся на большие расстояния корни)
и «эксплуатировать» встречающиеся участки с высокой концентрацией эле-
ментов (образование большого числа боковых корней). Длительный рост кор-
ней практически на протяжении всего периода до старения и гибели и измене-
ние их морфологии необходимы для выполнения функции поглощения.
6.2.1.2. Структурно-функциональные особенности корня
и поглощение веществ
Поглощающая апикальная часть каждого отдельного корня обычно не пре-
вышает нескольких сантиметров, хотя общая длина корня может достигать
очень больших значений. Растущая часть состоит из клеток разных типов, ко-
торые формируют так называемые зоны роста. Самый кончик представлен тка-
нью из делящихся клеток меристемы, которая покрыта корневым чехликом,
выделяющим полисахаридную слизь (рис. 6.6). За меристемой следует зона рас-
тяжения, в которой клетки достигают своей окончательной длины, удлиняясь
311
Рис. 6.6. Схема распределения зон роста
(А — поверхность; Б — продольный срез)
и последовательность дифференцировки
тканей в кончике корня:
КЧ — корневой чехлик; Мр — зона меристе-
мы; РК и ПД — зона растяжения клеток и пер-
вичной дифференциации корня; КВ — зона
корневых волосков и первичной эндодермы;
ОКБ — зона отмирания КВ и образования вто-
ричной эндодермы; ФЛК — зона формирова-
ния латеральных корней, образования гипо-
дермы и третичной эндодермы; 1 — перицикл;
2 — незрелые элементы флоэмы; 3 — зрелые
элементы флоэмы; 4 — эндодерма без поясков
Каспари; 5 — незрелые элементы ксилемы; 6 —
ризодерма; 7 — первичная кора; 8 — эндодер-
ма с поясками Каспари; 9 — зрелые элементы
ксилемы; 10 — корневые волоски; // — цент-
ральный цилиндр
за несколько часов в 10—20 раз. Следующий участок корня — зона дифференци-
ровки, или корневых волосков. Часть эпидермальных клеток этой зоны (трихо-
бласты) образуют корневые волоски, которые многократно увеличивают кор-
невую поверхность. Выше начинается образование боковых корней и отмирание
эпидермальных клеток, происходит образование гиподермиса, его лигнифика-
ция и суберинизация. Незрелые элементы флоэмы (протофлоэма) (рис. 6.6, Б)
формируются уже в зоне меристемы, а в начале зоны растяжения флоэмные
сосуды сформированы и активно участвуют в обеспечении клеток зон растя-
жения и меристемы необходимыми веществами. Клетки эндодермы, но еще
без поясков Каспари, также появляются в меристематической зоне. Ксилема
формируется только в конце зоны растяжения — в начале зоны корневых во-
лосков (рис. 6.6, Б), хотя протоксилемные элементы присутствуют уже в зоне
растяжения. Структура корня на поперечном срезе в зоне корневых волосков
представлена на рис. 6.7. Кора в этой зоне состоит из эпидермиса, нескольких
слоев паренхимных клеток и заканчивается эндодермой, образованной одним
слоем клеток, у которых радиальные и орбитальные стенки лигнифицированы
и суберенизированы, образуя пояски Каспари. Такая структура непроницаема
для воды и растворенных веществ, вследствие чего апопласт стели (централь-
ного цилиндра) изолируется от апопласта коры и их взаимодействие возмож-
но только через симпласт. Стель — «система коммуникаций», включающая
проводящие ткани флоэмы (нисходящий ток), ксилемы (восходящий ток) и ок-
ружающие их клетки паренхимы.
Зоны корня различаются не только структурно. Они неравнозначны также
по своей метаболической и функциональной активности, в частности в отно-
шении поглощающей и проводящей функций. Разная роль зон корня в погло-
щении ионов была обоснована Д. А. Сабининым и его учениками О. М.Тру-
бецковой, Н. Г. Потаповым — сотрудниками кафедры физиологии растений
биологического факультета МГУ им. М. В. Ломоносова. В обеспечении растений
минеральными элементами особая роль принадлежит зоне корневых волос-
ков, где поверхность взаимодействия корня со средой наибольшая и полно-
312
Рис. 6.7. Схема структуры корня на поперечном срезе в зоне корневых волосков:
1 — корневой волосок; 2 — эпидермис, 3 — кора; 4 — эндодерма; 5 — пояски Каспари; 6 —
перицикл; 7 — пропускная клетка; 8 — ксилема; 9 — флоэма; 10 — плазмодесмы
стью сформированы проводящие структуры. Корневые волоски, увеличивая
поверхность корня, позволяют освоить объем почвы, в 10—15 раз превыша-
ющий тот, из которого идет поглощение безволосковыми корешками. Частич-
ки почвы буквально прилипают к поверхности корня, покрытой корневыми
волосками (рис. 6.8). Этому способствует покрывающая эпидермис слизь, ко-
торая увеличивает возможность поглощения ионов за счет обменной адсорб-
ции с ионами твердых частиц почвы.
Основная масса воды поглощается также в зоне корневых волосков. Поэтому
кроме фактора увеличения контакта и увеличения осваиваемого объема почвы
поступлению ионов в этой зоне способствует «массовый ток», обусловленный
поглощением воды и доставляющий растворенные ионы к поверхности корня.
Преимущества в поглощении зоной корневых волосков проявляются глав-
ным образом в условиях дефицита питательных элементов (часто это — есте-
ственное свойство среды обитания). Так, при наличии корневых волосков у пле-
Рис. 6.8. Корневые волоски и их взаимо-
действие с почвенными частицами у про-
ростков белой горчицы (/, II, III по Пос-
ту, 1914; IV по Schmidt, Schikora, 2001):
1 — проросток, извлеченный из земли, с чех-
лом из приставших почвенных частичек в зоне
корневых волосков; II — то же после отмыва-
ния корешков водой; /// — кончик корневого
волоска с прилипшими частичками почвы;
II' — формирование корневых волосков: а —
обычное (нормальное), за счет асимметрич-
ного деления клеток эпидермиса; б — при об-
разовании из клеток эпидермиса и субэпидер-
миса в условиях дефицита Р и Fe
313
вела (Lolium perenne L.) поглощение калия из среды с низкой концентрацией
увеличивается на 50 —70 %, а поглощение фосфора возрастает в 2 — 3 раза. Де-
фицит фосфата или железа в среде индуцирует изменения в программе диффе-
ренциации эпидермальных клеток кончика корня Arabidopsis'. в обоих случаях
увеличиваются длина и частота расположения корневых волосков (рис. 6.8, IV).
Корневые волоски дополнительно располагаются в местах, которые обычно
занимают безволосковые клетки, или образуются даже у лежащих под эпидер-
мисом клеток коры.
Для полноценного обеспечения растения минеральными элементами боль-
шое значение имеет не только то, на каком участке корня происходит наи-
большее поглощение ионов, но и откуда они наиболее эффективно переме-
шаются в надземные органы. Так, у кукурузы (Zea mays) наибольшее поглоще-
ние 32Р приходится на участок корня на расстоянии 30 см от кончика, но из
этой зоны фосфор практически не перемещается. Наибольший отток как в
абсолютных величинах, так и относительно поглощенного Р, идет из апикаль-
ных участков кончиков корня.
Для разных ионов приуроченность степени поглощения и перемещения к
одной зоне корня могут не совпадать в связи с их различными физико-хими-
ческими свойствами (коэффициент растворимости соли, степень диссоциа-
ции, гидратация иона, его диффузии и т.д.) и функциями в растении. Так, из
зоны кончика (12—16 мм) корня проростка кукурузы поглощаемый калий
перемещается в нижележащие растягивающиеся клетки и в меньшей степени —
вверх по корню. В кончике уже развиты флоэмные элементы, и подвижный ион
К+ активно транспортируется к клеткам, где формируются вакуоли и происхо-
дит рост растяжением. Из зоны поглощения, расположенной выше (90 мм), К+
поступает как в надземные органы, так и в кончик корня. Малоподвижный
кальций плохо транспортируется по флоэме. Он поступает в ксилему и обеспе-
чивает потребности побегов лучше, если поглощается зрелыми участками кор-
ня. В апикальную часть 45Са2+ не транслоцировался независимо от места его
поступления в корень.
Эффективность поглощения в естественных условиях обеспечивается также
благодаря образованию микоризы и развитию микрофлоры в ризосфере. Сим-
биоз с микоризой — универсальное явление, присущее всем наземным расте-
ниям, в том числе сельскохозяйственным. Воздействие микоризы на поступле-
ние ионов наиболее четко проявляется в увеличении доступности и скорости
поглощения фосфора и железа корнями. Предполагается, что гифы активно
выделяют кислые фосфатазы, способствующие высвобождению ионов фосфа-
та из органических остатков и минералов, а также органические кислоты, хе-
латирующие Fe+3, что делает эти элементы доступными для поглощения сим-
биотической системой микориза — растение. Но главным образом эффект ми-
коризы связывают с увеличением площади контакта растения с почвой.
В целом, можно заключить, что степень участия разных зон корня в погло-
щении ионов и снабжении элементами минерального питания других органов
или отдельных частей растения значительно варьирует в зависимости от видо-
вой принадлежности растения, типа корневой системы и расположения по-
глощающей зоны на первичном, придаточном или боковом корне, а также от
возраста растения, условий питания, влажности почвы и многих других фак-
торов среды.
314
6.2.2. ПОСТУПЛЕНИЕ ИОНОВ ИЗ СРЕДЫ В КЛЕТКУ
И КОРЕНЬ
Перемещение ионов из среды в корень — комплексный и многоэтапный
процесс, который обозначают такими терминами, как поступление, поглоще-
ние, транспорт, вход, выход, а также приобретение, захват и добывание, когда
описываются возможности корневых систем адаптироваться к условиям огра-
ниченной доступности ионов в среде.
В связи с особенностями строения растительной клетки поступление ве-
ществ из среды в корень связано с преодолением двух барьеров: клеточной
стенки и плазмалеммы. Наличие клеточной стенки определяет существование
двух структурных и функциональных континиумов — апопласта и симпласта,
объединяющих все элементы растения. Апопласт включает клеточные стенки с
их межмицеллярными и межфибриллярными просветами, межклетники, со-
суды ксилемы, а в корне также слизи, покрывающие его поверхность. Сим-
пласт состоит из протопластов клеток, соединенных плазмодесмами, его внеш-
ней границей служат плазматические мембраны. В силу особенностей расти-
тельной клетки он имеет и вторую внутриклеточную границу — тонопласт,
отделяющий цитозоль от вакуоли. Транспорт минеральных веществ из среды в
растение включает: поступление ионов в апопласт и симпласт, накопление в
вакуолях, радиальный транспорт в корне и загрузку ксилемы, дальний транс-
порт по ксилеме, циркуляцию и перераспределение минеральных элементов
по органам и тканям.
6.2.2.1. Поступление ионов в апопласт
Апопласт корней выполняет многочисленные функции, и важнейшие из
них — поглощение воды и минеральных веществ. Питательные вещества не
просто проходят через этот компартмент на пути к плазмалемме, но благодаря
физико-химическим свойствам этой структуры включаются в создание «внут-
ренней физиологической среды» организма. Минеральные ионы попадают в
апопласт корня из почвенного раствора путем диффузии либо в результате
конвекционных потоков (массового тока), связанных с перемещением воды
по градиенту водного потенциала.
Поступление в апопласт, а точнее в его часть, названную клеточным сво-
бодным пространством (СП), структурно представляющим собой систему меж-
мицеллярных и межфибриллярных пор и межклетников, исчисляется минута-
ми. Проводимость клеточной стенки для воды по сравнению с плазмалеммой
значительно выше. Коэффициент проницаемости Р свободного пространства
для ионов также значительно выше (»10“5—10“4 м • с-1), чем у клеточной мемб-
раны (»1О“10—10“9 м с-1). Высокая проводимость обеспечивается тем, что поры
в клеточной стенке имеют диаметр на порядок больше (3—4 нм), чем гидра-
тированные ионы (диаметр К+ — 0,54 нм). Но пропитывание матрикса клеточ-
ной стенки суберином или лигнином уменьшает проводимость для воды и
ионов до величин, которые соответствуют или даже ниже проницаемости плаз-
малеммы.
С позиций физической химии СП корня представлено двумя составля-
ющими: «водным свободным пространством» (ВСП) и «доннановским сво-
315
Рис. 6.9. Поглощение К+ (использован его аналог 86Rb*) и его выход из свободного
пространства корней кукурузы (Sutcliffe, Baker, 1974, цит. по Baker, Hall, 1988):
ВСП — водное свободное пространство; ДСП — доннановское свободное пространство; /, // —
см. в тексте
бедным пространством» (ДСП) (рис. 6.9). Доннановское СП обусловлено на-
личием фиксированного отрицательного заряда клеточной стенки, который
взаимодействует с поступающими катионами и определяет возникновение
доннановского потенциала. Количественная оценка СП, его составляющих,
а также поступление в ВСП и ДСП могут быть получены в экспериментах с
корнями, когда оценивается динамика поступления (входа) и выхода иона.
Кривую поступления, например, 86Rb+ (аналог К+) в корни растения можно
разделить на две составляющие (рис. 6.9): I — быстрое начальное поглоще-
ние, которое заканчивается в течение »10 мин, 77 — последующее стационар-
ное поглощение, которое может продолжаться много часов. Быстрое погло-
щение обратимо, малоизбирательно и практически не зависит от метаболиз-
ма (не меняется под действием ингибиторов и в отсутствие О2). Если расте-
ние переместить на воду, то большая доля от поглощенного в начальную
фазу 86Rb+ будет быстро вымыта из корней. Эта часть составляет «водную об-
менную фракцию», а поступление иона в корни, равное его выходу, — по-
ступление в ВСП. Из корней, перенесенных затем на раствор КО, будет выхо-
дить 86Rb+, который относится к ионной обменной фракции. В этом случае
поступающий К+ замещает 86Rb+, адсорбированный клеточной стенкой, и равная
вышедшему 86Rb+ доля К+ соответствует поступлению в ДСП клеточной стен-
ки. Считается, что оставшаяся в корне фракция — ионы, поступившие в
симпласт.
Оценив количество К+ (86Rb+), вымытого из корней в воду, и допустив, что
концентрация иона во внешнем растворе и в растворе клеточной стенки рав-
ны, можно рассчитать объем СП корня. При таком способе расчета не учиты-
вается количество иона, которое находится в адсорбированном состоянии,
поэтому полученные величины объема СП завышены. В связи с этим процент-
ные величины объема стали рассматривать как оценку размеров «кажущегося
СП» (КСП). Его относительная величина составляет 5 — 7 % (не более 10 %) от
общего объема тканей корня. В настоящее время такого рода оценка СП ис-
пользуется редко, и современные исследователи предпочитают для характери-
стики ВСП и ДСП использовать единицы количества (рис. 6.9) либо концент-
316
Клеточная стенка
— ©
слои
Поливалентные
катионы
Моновалентные
катионы
Рис. 6.10. Эффективность нейтрализации от-
рицательного заряда клеточной стенки
(КС) моно- и поливалентными катиона-
ми (по Haynes, 1980)
__ Отрица-
тельные
заряды
КС
рации иона, а не единицы объема.
Считается, что в среднем отношение
ВСП: ДСП составляет 4:1.
Количественные параметры ВСП и
ДСП позволяют более точно и пра-
вильно оценить функции клеточной
стенки и в целом апопласта. Присут-
ствие фиксированных отрицательно
заряженных групп в клеточной стенке
влияет на поступление ионов в апо-
пласт и их накопление. Благодаря за-
ряженным группам стенка обладает ка-
тионно-обменной способностью (КОС).
При этом 70 — 90% КОС связано с
карбоксильными группами галактоу-
роновых кислот пектина, а вклад дру-
гих полисахаридов матрикса и белков
составляет 10 — 30 %. Аминогруппы белков определяют способность обмена с
анионами; безусловно, она более слабая, чем возможность обмена с катио-
нами.
Модель поступления ионов в апопласт корня учитывает существование двой-
ного электрического слоя (рис. 6.10) и описывает клеточную стенку как систе-
му отрицательно заряженных пор, на поверхности которых адсорбируются
подвижные катионы и образуется двойной заряженный слой. Распределение
поступающих ионов внутри порового пространства зависит от плотности их
электрического заряда, размера поры, а также от знака и величины заряда
иона. Поливалентные катионы экранируют отрицательный заряд КС более эф-
фективно, чем моновалентные, и насыщение СП двух- и поливалентными
катионами способствует сохранению большого свободного просвета в поре для
перемещения других ионов.
При диффузии ионов в системе с фиксированным зарядом, подобной КС,
возникает градиент электрического потенциала (рис. 6.11). Когда ионы диссо-
циированной соли «К+А » перемещаются в водной фазе системы, где имеется
фиксированный заряд (X ), катион К^ будет перемещаться в направлении за-
ряда X , нейтрализуя его и оставляя сопутствующий анион А,. Катион К2 бу-
дет диффундировать так, чтобы сбалансировать заряд А1; однако в своем дви-
жении он будет ограничен А2. В результате происходит разделение зарядов и
возникает градиент электрического потенциала ED. Его величина при равновес-
ном распределении может быть рассчитана по уравнению Доннана (рис. 6.11).
При доннановском равновесии фаза, содержащая недиффундирующий заряд
(в данном случае КС), имеет более высокую концентрацию ионов, чем вне-
шняя фаза (раствор), и будет обладать более высоким осмотическим давлени-
ем (или более низким водным потенциалом Ч'н2о)> что важно для поступления
воды в апопласт корня.
Модель двойного слоя — большое упрощение комплексной системы СП. В кор-
невом волоске ион от поверхности корня до следующей клетки коры проходит
через КС по системе пор диаметром 3—3,5 нм путь длиной в 100000 нм. Сопро-
тивление диффузии в этом пути для одновалентных катионов в 100—1000 раз,
317
Неуравновешенный ион
Рис. 6.11. Возникновение доннановского потенциала (£D) в системе клеточная стен-
ка— раствор:
X! — фиксированный отрицательный заряд клеточной стенки; К( и К2 — одновалентные ка-
тионы; А! и А2 — одновалентные анионы диссоциированной соли. Стрелки указывают на пере-
мещение ионов; большая стрелка отражает возникновение градиента электрического потенциа-
RT ( СА- '
ла. Еи =---In ——
Fz 1Са- J
г — число Фарадея;
RT
=----In
Fz
Z — заряд иона; СК. (А- ) и СК;ш1(А-ц|) — концентрации ионов А” и К‘ в
Kflul
СКГ„
, где R — газовая постоянная; Т — абсолютная температура;
клеточной стенке (in) и в растворе (out)
а для одновалентных анионов в 10 раз больше по сравнению с сопротивлением
в слое раствора такой же толщины. Поскольку клеточная стенка заряжена от-
рицательно, перемещение катионов в ней может быть уподоблено движению
по хроматографической колонке за счет их ассоциации-диссоциации на об-
менных местах. Но обычно КОС клеточных стенок корня полностью реализова-
на, и большинство отрицательно заряженных мест занято Са2+. Тогда по анало-
гии с колонкой поступление новых ионов с одной стороны стенки (из среды)
должно приводить к их высвобождению с другой. Однако подобная модель
также является упрощением, так как «удаление» ионов из клеточной стенки со
стороны, граничащей с протопластом, определяется их транспортом через
плазмалемму. Внешняя сторона этой мембраны — не только граница симпла-
ста, но и зона отделения от апопласта. И плазмалемма вносит «метаболиче-
скую» компоненту в пассивное, в целом, поступление ионов в КС и их пере-
мещение в ней.
Итак, поступление ионов в СП корня и их перемещение в нем происхо-
дит с конвекционным потоком вместе с водой, а также с помощью диффу-
зии. При наличии фиксированного заряда ионы концентрируются преиму-
щественно в растворе апопласта коры корня (или только КС эпидермиса при
низкой концентрации в среде) по сравнению с раствором. Эти процессы
происходят по тем же физико-химическим законам, как и в капиллярах почвы
вблизи отрицательно заряженных глинистых минералов или органических ве-
ществ. Однако апопласт — это внутренняя «физиологическая среда», подвер-
гающаяся изменениям, связанным с обменом веществ, не только в период
формирования клеточных стенок, но и в зрелых тканях (особенно при ме-
ханических, химических, биологических воздействиях). Как модифицирует-
ся этот компартмент в разных физиологических ситуациях и в какой мере по-
ступление, перемещение и накопление ионов в апопласте корня определяют
интенсивность и характер поглощения ионов интактным растением, пока
неясно.
318
6.2.2.2. Механизмы транспорта через мембрану
Поверхностная клеточная мембрана (плазмалемма) — основной барьер для
транспорта молекул в клетку и из клетки. Строение и состав мембраны обуслов-
ливают ее универсальные свойства: полупроницаемость и асимметричность. Транс-
порт растворенных веществ через мембрану практически полностью происходит
с участием интегральных белков. Кроме того, свойства мембраны обеспечивают
возникновение и поддержание электрического мембранного потенциала. Изуче-
ние процесса поглощения ионов и понимание того, как вещества переносятся
через мембрану, включает две основные проблемы: первая — каковы движущие
силы, источники энергии для транспорта; вторая — что из себя представляют
сами системы переноса через мембраны, как они действуют и регулируются.
Движущие силы транспорта. Движущая сила переноса ионов на расстояние
х — градиент электрохимического потенциала Др (или djl/dx) (см. гл. 2).
Существует два основных типа транспорта через мембрану: пассивный, при
котором растворенное вещество движется по градиенту электрохимического
потенциала без использования дополнительной энергии; и активный, сопря-
женный с тратой энергии (например, АТФ или пирофосфата), которая ис-
пользуется для перемещения ионов против градиента электрохимического по-
тенциала.
Ион пассивно входит в клетку, если pout > pin, где индексы out и in указывают
на внешнюю и внутреннюю стороны мембраны соответственно. Когда pin > poul,
то ион движется пассивно из клетки. Движение продолжается до установления
равновесия, когда pin = poul.
Если в равенство pin = pout поставить уравнение электрохимического потен-
циала (E71nC0Ut + zF(pout = /?7"1п Cin + zE<pin) и преобразовать его, то получим
уравнение Нернста:
(<POut-<Pin) = ^N-^ln^!, (6.1)
ZF Cin
где разность потенциалов наружной и внутренней стороны мембраны (tpout -
-cpin) представляет потенциал Нернста (EN). При выражении символами урав-
нение Нернста аналогично уравнению Доннана (рис. 6.11). В уравнении Нер-
нста EN предсказывает величину электрического потенциала (мВ), когда его
градиент уравновешивает различия в химическом потенциале по обе стороны
мембраны. Ионы могут двигаться пассивно в результате действия движущих
сил, возникающих из разниц химического потенциала (Дц), обусловленного
концентрационной асимметрией, и/или разниц электрического потенциала
(-ДЕ). В соответствии с принципами термодинамики градиент электрическо-
го потенциала энергетически может перекрывать градиент химического и тог-
да поступление иона внутрь будет идти пассивно, даже если Cin > Cout.
Уравнение Нернста можно использовать как критерий оценки характера
транспорта некоторых катионов и анионов. У корней гороха (Pisum sativum),
которые поглощали ионы из питательного раствора с известной концентраци-
ей, были измерены мембранный потенциал и концентрация ионов в тканях
(табл. 6.1). Подставив значения измеренного ДЕи концентрации ионов в среде
в уравнение Нернста, можно найти «равновесную» концентрацию ионов в
тканях.
319
Таблица 6.1. Измеренные и предсказанные как равновесные концентрации
ионов (мМ л1) в тканях корней гороха (Р. sativum), имеющих мембранный
потенциал -ПО мВ (по Higinbotham et al., 1967)
Кати- он Концентрация в растворе (См) Внутренняя концентрация (С1п) Ани- ОН Концентрация в растворе (См) Внутренняя концентрация (Сп)
рассчи- танная измерен- ная рассчи- танная измерен- ная
К+ 1 74 75 NO; 2 0,0272 28
Na+ 1 74 8 ci- 1 0,0136 7
Mg2+ 0,25 1340 3 Н2РО; 1 0,0136 21
Са2+ 1 5360 2 so42- 0,25 0,00005 19
Из сравнения рассчитанных (равновесных) и действительных (измеренных)
концентраций ионов в тканях были сделаны следующие выводы: 1) распределе-
ние К+ между раствором и корнями гороха практически равновесное; 2) Са ,
Mg +, Na+ транспортируются пассивно, но их концентрация в тканях значитель-
но ниже (особенно, для Са +), чем равновесная, рассчитанная по уравнению
Нернста; это предполагает либо исключительно низкую проницаемость мембра-
ны для этих ионов, что маловероятно, либо активный механизм их выкачива-
ния из клетки; 3) анионы транспортируются активно, а поскольку различия
мембранного потенциала отрицательны относительно внутреннего компартмента
и концентрация анионов в корне выше, чем снаружи, их поглощение идет
активно, против градиентов и электрического, и химического потенциалов.
Основной вклад в создание электрического потенциала на клеточных мем-
бранах (плазмалемме, тонопласте, мембране ЭР) вносят диффузионный по-
тенциал (Ed), который является результатом пассивного транспорта ионов, и
электрогенный потенциал (ЕР), возникающий вследствие активного (с ис-
пользованием энергии) выкачивания протона.
Диффузионный потенциал обусловлен разницей в проницаемости мембра-
ны (Р) для катионов и анионов, что приводит к различиям в величине пото-
ков ионов через мембраны. Если по обе стороны мембраны (в отсеках «А» и
«Б») находится раствор с разной концентрацией КО (рис. 6.12) и мембрана
более проницаема для К+, чем для С1‘ (Ек+ > ЕС1), то диффузия К+ из отсека
«А» (концентрация КО 100 мМ) в отсек «Б» (концентрация 1 мМ) будет
происходить быстрее, чем СГ. В течение короткого времени быстрое переме-
щение К+ и относительно медленное О” приведет к небольшому разделению
зарядов и накоплению на поверхности мембраны в отсеке «А» слабо диффун-
дирующего аниона, а на поверхности в отсеке «Б» — катиона. Вследствие этого
на мембране возникает отрицательный электрический потенциал (-ДЕ). В жи-
вой клетке количество заряда, которое должно разделиться для возникнове-
ния ДЕ -100 мВ (типичная величина для плазмалеммы), ничтожно мало по
сравнению с суммой положительных и отрицательных зарядов в цитоплазме:
по расчетам достаточно присутствия одного лишнего аниона снаружи на каж-
дые 100 000 в клетке. Образование ДЕзамедляет перемещение К и даже приво-
дит к некоторому обратному выходу К в отсек «А». Когда градиент электри-
ческого потенциала достигает некоего постоянного уровня, нетто-перемеще-
ние К+ из «А» в «Б» прекратится. Разность концентраций, которая может со-
320
Рис. 6.12. Возникновение диффузионного потенциала (Erf) при разной проницаемости
(Р) мембраны для катиона и аниона (РК’ > Ра)'
а — исходная система электронейтральна; б — возникает -ДЕ; при равновесии потоков через
мембрану между ее наружной (Л) и внутренней (Б) поверхностью электрический потенциал
мембраны соответствует диффузионному потенциалу Ed; стрелки — градиенты химических и
электрического потенциалов и их направления
храниться ([Кд] > [Kg]), уравновесится градиентом электрического потенциа-
ла, названного диффузионным — Ed. Поскольку С1 также перемещается через
мембрану, то стационарный градиент концентрации К' (Д[К+]) и Ed будут ниже,
чем в случае, когда диффузии аниона не происходит. Величина Ed может быть
рассчитана из уравнения Гольдмана, где Р — коэффициент проницаемости:
[К4 ]Б + Рс, [СГ ]А
F Рк.[К']А + Рсг[С1 ]Б’
(6.2)
Итак, величина Ed является функцией концентрации ионов в растворе и
проницаемости мембраны, и уравнение Гольдмана позволяет описать вклад
пассивных ионных потоков и Ed в общий мембранный потенциал.
Поддержание трансмембранного электрического потенциала обеспечивает-
ся также процессом активного переноса через мембрану протона (Н ). Выкачи-
вание Н+ осуществляют протонные помпы — интегральные белки мембран,
проявляющие гидролитическую активность. Работа Н+-помпы сопряжена с ис-
пользованием энергии, которая поставляется главным образом за счет гидроли-
за АТФ. В этом случае выкачивание Н+ и создание электрогенного потенциала Ер
связаны с функционированием Н+-АТФаз (рис. 6.13). Обычно у растений на плаз-
Рис. 6.13. Образование
электрогенного потен-
циала (£,,) на плазма-
лемме (ПМ) и тонопла-
сте (ТП) с участием Н+-
АТФазы
Цитозоль
-120 до -160 мВ
-ДЕ цит.—»-апо.
+30 мВ
ДЕ вак,—► цит
11 Физиология растений
321
малемме поддерживается градиент (цитозоль -> апопласт) отрицательного элек-
трического потенциала в пределах от -120 до -160 мВ (возможны вариации от
-100 до -300 мВ), и на внутренней (цитозольной) стороне мембраны потенци-
ал более отрицательный, чем на внешней. На тонопласте ДЕ (вакуоль —> цито-
золь) в среднем составляет +30 мВ (меняется от 10 до 70 мВ), и внешняя сторона
тонопласта, так же как у плазмалеммы, имеет более отрицательный заряд.
Электрогенный потенциал (Ер) вместе с диффузным (Е(1) обеспечивают со-
здание на плазмалемме суммарного градиента электрического потенциала (АЕ).
При этом вклад Ер в суммарную величину мембранного потенциала у растений
составляет более половины, что гораздо больше, чем у животных, у которых
основной вклад в АЕ плазмалеммы вносит диффузионный потенциал (90—95 %).
У всех биологических мембран потенциал регулируется внутри ограничен-
ных пределов, что важно по ряду причин. Обычный цитозоль-отрицательный
потенциал плазмалеммы обеспечивает движущую силу для пассивного (элект-
рофоретического) транспорта ионов против их химического потенциала. Мем-
бранный потенциал играет ключевую роль в некоторых системах клеточной
сигнализации. Деполяризация мембраны (сдвиг -АЕ в сторону более положи-
тельных значений), вызванная некоторыми воздействиями, приводит, напри-
мер, к активации Са +-каналов, являющихся компонентами путей передачи
информации (см. подразд. 3.4.3). Кроме того, уровень потенциала на мембра-
не должен поддерживаться в пределах, активирующих электрогенную помпу
(Н -АТФазу), которая удаляя из цитозоля метаболически продуцируемый Н+,
стабилизирует pH цитозоля и обеспечивает движущую силу для активного по-
ступления ионов. При активации Н -АТФазы мембрана может гиперполяризо-
ватъся, т.е. ее потенциал станет еще более отрицательным. Некоторые ионные
каналы активируются в этих условиях, выполняя определенные функции в тех
или иных физиологических процессах (см. подразд. 3.5.3).
Н+-помпы мембран растительной клетки. У растений наиболее весомый вклад
в энергизацию мембран вносят три типа помп: Н+-АТФаза плазмалеммы (ПМН+-
АТФаза), выкачивающая Н+ из клетки, и Н+-АТФаза (УН+-АТФаза) и пиро-
фосфатаза (Н+-ПФаза) на тонопласте, которые вытесняют Н+ из цитозоля в
вакуоль (рис. 6.14).
Н+-помпы могут быть идентифицированы по их гидролитической активно-
сти, связанной с использованием АТФ или пирофосфата (ФФН). Белок Н+-помп
составляет 1 — 5 % от очищенного белка мембран, что выше, чем для каких-
либо других транспортных белков. Возможно, их обилие в мембранах компен-
сирует низкую скорость транспорта протонов, которая составляет около 100
ионов в секунду или менее (котранспортеры переносят 300—1000 ионов/с, а
через каналы могут переносится 106— I08 ионов/с).
Н -АТФаза плазмалеммы. Этот комплекс представлен единственным поли-
пептидом с молекулярной массой 100 кД и относится к P-типу АТФаз, обра-
зующих в ходе реакции промежуточный фосфорилированный продукт (аспар-
тил фосфат). Субстратом для ПМН+-АТФазы служит MgATФ и константа Ми-
хаэлиса Кт варьирует у растений от 0,3 до 14 мМ; оптимум pH около 6,6. Моно-
мер образует 10 интегрированных в мембране доменов, а с цитозольной сто-
роны между 4-м и 5-м доменами — гидролитическую петлю, на которой нахо-
дится АТФ-связывающий участок (рис. 6.14). Стехиометрия удаления Н и гид-
ролиза АТФ (Н+/АТФ) равна единице.
322
Рис. 6.14. Предполагаемые структурные модели Н+-помп растительной клетки (моди-
фикация по: Sze et al., 1999; Morsommc, Boutry, 2000; Rutajczak, 2000; Maeshima, 2001):
/— Н+-АТФаза плазмалеммы (ПМН+-АТФаза): 1 — 10 — участки полипептидной цепи, пересе-
кающие ПМ; D — каталитический участок, содержащий аспартатный остаток, связывающий
Mg-АТФ; AID — автоингибиторный домен С-конца, который вследствие фосфорилирования
(®) протеинкиназой и присоединения 14-3-3-белка переводит ПМН+-АТФазу из неактивной
(НАк) в активную (Ак) форму; //— вакуолярная Н+-АТФаза (VI Г-АТФаза): V, — цитозольная,
Vo — мембранная части комплекса; A—G — субъединицы V,; a—d — субъединицы Vo. Детали
пространственного расположения субъединиц С, Е, F, G, Н и d у VI 1+-АТФазы не выяснены
(по Maeshima, 2001); III — вакуолярная пирофосфатаза (Н+-ПФаза): 1 — 14 — участки полипеп-
тидной цепи Н+-ПФазы, пересекающие мембрану (домены 3, 4 и 8—13 не представлены); ГП —
гидрофильная цитозольная петля между 5-м и 6-м трансмембранными доменами с консерватив-
ным сегментом (CS1) и местами связывания субстрата (Mg-ФФн), К+ и Mg +
Механизм протонного транспорта с участием этой помпы еще окончатель-
но не выяснен. Каталитический цикл, обеспечивающий выкачивание Н ,
предполагает следующую ступенчатую последовательность: связывание Н+ и
на участке D — Mg-АТФ, затем образование высокоэнергетического продукта
(аспартил фосфата) и высвобождение АДФ; как следствие этих реакций про-
исходят конформационные изменения фермента, которые приводят к высво-
бождению Н+ с наружной стороны плазмалеммы; возвращение фермента пос-
323
ле высвобождения Фн в исходное состояние. Работу этой помпы ингибирует
ванадат. Предполагают, что он имитирует Фн, и связывание ванадата в актив-
ном центре блокирует переход фермента в исходное активное состояние.
На посттрансляционном уровне ПМН+-АТФаза регулируется с участием
протеинкиназы/протеинфосфатазы и 14-3-3-белка (рис. 6.14,I). В состоянии низ-
кой активности реакционный центр фермента блокирован автоингибиторным
доменом, расположенным на С-конце полипептида. Активация Н -АТФазы
осуществляется при последовательных реакциях фосфорилирования и присо-
единения 14-3-3-белка на автоингибиторном участке. В результате происходят
конформационные перестройки, вызывающие перемещение С-конца, и реак-
ционный центр становится доступным для присоединения Mg-АТФ и протона.
Давно известен эффект активации ПМН+-АТФазы фузикокцином (токсиче-
ское соединение, продуцируемое грибом Fusicoccum amigdali). Оказалось, что и
в этом случае полная активация Н+-АТФазы достигается, если к С-автоинги-
биторному домену присоединяются не только фузикокцин, но и 14-3-3-белок.
Н+-АТФазы плазмалеммы растительных клеток кодируются мультигенным
семейством: идентифицировано 10 генов у арабидопсиса (Arabidopsis), 9 у та-
бака (Nicotiana), 7 генов у томата (Lycopersicori) и 5 у бобов (Vicia faba). В ряде
случаев разные гены кодируют отдельные изоформы, и высокий уровень их
экспрессии коррелирует с накоплением Н+-АТФаз в специфических типах
клеток, например клеток корневого волоска (aha2), или флоэмы (aha3), где
Н-помпы участвуют в выполнении специфических физиологических функций
(поглощение ионов, транспорт сахаров). Другие Н+-АТФазные гены экспрес-
сируются в клетках многих тканей. Например, ген рта4 табака экспрессирует-
ся в клетках эпидермиса корня, в сопровождающих клетках флоэмы и замыка-
ющих клетках устьиц. При действии факторов среды (солевой стресс, низкий Ч'н2о,
темнота) уровень экспрессии генов ПМН+-АТФаз также может меняться.
Вакуолярная Ff -АТФаза (УН+-АТФаза) присутствует не только в тонопла-
сте, но и в мембранах эндоплазматического ретикулума (ЭР), аппарата Гольд-
жи, везикулах. УН+-АТФаза отличается от Н+-помпы плазмалеммы по всем
основным параметрам, характеризующим свойства и структуру. Прежде всего,
это не мономерная полипептидная цепь, а самый большой многосубъединич-
ный белковый комплекс тонопласта с молекулярной массой, по разным ис-
точникам, от 650 до 750 кДа. Величина Кт для Mg-АТФ у УН+-АТФазы со-
ставляет от 0,1 до 0,2 мМ, т. е. ниже, чем у ПМН+-АТФазы, а соотношение
Н+/АТФ, наоборот, выше (от 2 до 3), что свидетельствует о различии их кине-
тических параметров. Специфические ингибиторы УН -АТФазы — бафиломи-
цин А, конканамицин С и нитрат. При связывании АТФ и выкачивании прото-
на в вакуоль не образуется промежуточного фосфорилированного интермеди-
ата и, таким образом, УН+-АТФаза не относится к АТФазам Р-типа. По своей
четвертичной структуре УН+-АТФаза сходна с АТФ-синтазой F-типа мито-
хондрий и хлоропластов (см. гл. 2) и представлена двумя функциональными
частями: цитозольной (V]) и мембранной (Уо) (рис. 6.15, II). Ансамбль Уь
где происходит гидролиз АТФ, состоит из 5 — 8 типов субъединиц, а инте-
гральная часть (Уо) представлена 3 — 5 типами субъединиц и функционирует,
как Н+-канал. У разных видов растений выявлено разное количество типов
субъединиц и некоторые субъединицы Vr и У0-частей присутствуют в несколь-
ких копиях.
324
Vj-комплекс включает по три повторности субъединиц А и В, которые соот-
ветствуют а- и р-субъединицам F-АТФаз и осуществляют каталитическое (А)
и некаталитическое (В) связывание АТФ (рис. 6.14, II). Субъединица D, соот-
ветствующая у-субъединице F-АТФазы, выполняет роль связующего стержня
между периферийной (VJ и мембранной (Уо) частями. Остальные субъедини-
цы Угкомплекса (от С до Н) выполняют функции стабилизации, поддержа-
ния активности, обеспечения контакта и сопряжения работы Уг и У0-частей.
Точное пространственное расположение субъединиц С —Н в общем мультиге-
терогенном ансамбле УН+-АТФазы пока не установлено.
Интегральный У(1-комплекс содержит большую (100 кД) субъединицу а, шесть
или более субъединиц с (их молекулярная масса равна 16 кД, т. е. вдвое выше,
чем у с-субъединиц F-АТФазы) и субъединицу d (32 — 36 кД) (рис. 6.14, II).
Как установлено на дрожжах, взаимодействие между а- и с-субъединицами
обеспечивает путь для транспорта протона через мембрану. Данные о связи
субъединицы а с комплексом У,—Vo и ее функциях противоречивы. Возмож-
но, она имеет отношение к агрегации комплекса, а не к транслокации Н+,
или er-субъединица функционирует как статор в относительно слабой ассоциа-
ции с гексамером из с-субъединиц.
Хотя УН+-АТФаза растений, как и других организмов, ингибируется специ-
фическим токсином бафиломицином Аь субъединица, которая его связывает,
не выявлена (у бычьего фермента это субъединица а). Так что, модели структуры
растительной УН+-АТФазы, которые имеются в настоящее время, в значитель-
ной мере гипотетичны (рис. 6.14, II), а функции отдельных субъединиц часто
предположительные. К настоящему времени большинство субъединиц УН+-
АТФазы Arabidopsis (кроме F-13 кД, Н-51 кД, а-100 кД и d~45 кД) клонированы.
Предполагают, что механизм превращения одной формы энергии в другую
(АТФ <> Ацн*) у УН+-АТФазы и F-АТФ-синтазы сходен, но реакции, связан-
ные с АТФ, идут в противоположных направлениях. Ротационный механизм
катализа сопрягает проводимость протона через Уо (или Fo) с гидролизом АТФ
в У।-комплексе и с синтезом в F,.
Пирофосфатаза (Н+-ПФаза) — помпа, альтернативная УН+-АТФазе, пере-
качивающая протон из цитозоля в вакуоль (рис. 6.14, III). Источником энергии
для Н+-ПФазы служит пирофосфат (ФФ„) — простейшее высокоэнергетиче-
ское соединение, и стехиометрия реакции Н+/ФФн равна 1, а скорость транс-
порта протона ниже, чем у двух других Н+-помп. Н-ПФаза имеет молекуляр-
ную массу 80—81 кДа и представлена единственной полипептидной цепью из
14 мембранных доменов и нескольких гидрофильных петель (на рис. 6.14, III
представлены не все домены и только одна петля). N- и С-концы находятся на
вакуолярной стороне тонопласта. Функциональный участок находится на ци-
тозольной петле между 5-м и 6-м доменами и включает один из консерватив-
ных мотивов (указан как консервативный сегмент CS1), где происходит свя-
зывание и гидролиз Mg-ФФ,,, а также транспорт Н+. Механизм сопряжения
этих реакций неясен, но установлено, что важную роль в связывании и гид-
ролизе играют кислые остатки аминокислотной последовательности участка
CS1. Активность фермента ингибируется Са + и стимулируется К и Mg , для
которых имеются сайты связывания. Предполагается, что Са блокирует реак-
цию гидролиза пирофосфата магния (Mg-ФФн), заменяя его на пирофосфат
кальция (Са-ФФ„). Н+-ПФазы клонированы из многих организмов (высших на-
325
земных растений, водорослей, фотосинтезирующих бактерий и простейших),
но в клетках млекопитающих и дрожжей они отсутствуют.
Функции Н+-помп в растительной клетке. Электрогенные помпы благодаря
поддержанию и регуляции электрохимического протонного градиента обеспе-
чивают движущую силу для перемещения веществ через мембрану. Выкачива-
ние Н+ (иначе, первичный транспорт) и генерация Дцн+ ведет к образованию
альтернативной к АТФ форме энергии (см. гл. 2), которая может быть исполь-
зована для активного вторичного транспорта других ионов. Возвращение Н+
через мембрану по градиенту Дрн+, сопряженное с перемещением через мемб-
рану других веществ (минеральных, органических ионов и нейтральных моле-
кул), обеспечивает их активный транспорт против градиента электрохимиче-
ского потенциала (рис. 6.15).
С участием Н+-помп поддерживается гомеостаз pH в цитозоле, подкисляют-
ся вакуолярный сок и среда в клеточной стенке (рис. 6.13 и 6.15), что необхо-
димо для протекания целого ряда процессов, активности ферментов и функ-
ционирования транспортных систем. Реализуя свои функции, Н+-АТФазы уча-
ствуют в таких физиологических процессах, как устьичные движения, осмо-
регуляция, устойчивость к солевому стрессу и низким значениям pH среды,
поступление сахаров и аминокислот из апопласта в клетки, загрузка флоэмы,
клеточный рост и др.
Общая характеристика белков, транспортирующих минеральные вещества.
Своеобразный по количеству и качеству состав минеральных элементов в рас-
тительных клетках — результат активности специфических интегральных бел-
ков мембран, транспортирующих ионы, исходным источником которых явля-
ется окружающая среда. По своим биохимическим, термодинамическим и мо-
лекулярным характеристикам, а также механизмам регуляции системы транс-
порта ионов могут быть разделены на несколько основных групп: АТФазы,
переносчики, или котранспортеры, и каналы (рис. 6.15).
Особая группа АТФаз Р-типа — Са ‘ -АТФазы. Они присутствуют в плазма-
лемме, тонопласте и других мембранах растительной клетки (рис. 6.15). Основ-
ная функция Са +-АТФаз — поддержание низкой концентрации Са + в цитозо-
ле, что необходимо для реализации его роли вторичного мессенджера (см. под-
разд. 3.4.2). Кальциевые помпы плазмалеммы включены в радиальный транс-
порт Са в корнях (см. подразд. 2.3.1).
У животных в создании и регуляции электропотенциала на клеточной мемб-
ране большая роль принадлежит №+/К+-АТФазе. У фотосинтезирующих одно-
клеточных водорослей (но не у высших растений) обнаружена На+-АТФаза,
которая удаляет Na+ из клетки (см. гл. 8) и так же, как Са +-АТФаза, не
вносит существенного вклада в поддержание А£ на плазмалемме.
Таким образом, для активного перемещения Са и Na из цитозоля против
их градиентов электрохимического потенциала энергия АТФ используется не-
посредственно при работе Са - и Na -АТФаз.
Переносчики, или транспортеры. Концепция переносчиков (carrier) была
разработана в 1960-е гг. на основании ставших классическими исследований
Э. Эпштейна с соавт. и других научных групп кинетики поглощения ионов клет-
ками водорослей и отсеченными, так называемыми «обессоленными», корня-
ми растений, выращенных на воде или временно перенесенных на воду. По-
глощение «обессоленными» корнями рассматривается как поглощение клет-
326
Помпы: (-•-) Н+-, Na+-, Са+-АТФазы; (-•-) — VH4- АТФаза вакуолярного типа;
(-*) — Н+-ПФаза-пирофосфатаза; (ХХ;-о) — транспортеры; (S-) — каналы
Рис. 6.15. Схема основных систем транспорта ионов через плазмалемму (ПМ), мембра-
ны вакуоли (В) и эндоплазматического ретикулума (ЭР) в растительной клетке.
Справа представлены помпы и транспортеры ('А — анионы; 2С — катионы; JS — органические
вещества: сахара, аминокислоты, органические кислоты); слева — каналы (4РУ — рецептор-
управляемые каналы; 5БВ и 6МВ — быстрые и медленные вакуолярные каналы; 7VD — потенци-
алзависимый канал; in и out — входной и выходной каналы; макси «кат» — неспецифический
Са2+, К+ входной канал). Пунктиром показана связь транспорта иона с транспортом Н+ и рабо-
той Н‘-АТФазы
кой, при этом проводится аналогия между механизмами поддержания ионно-
го баланса клеткой и целым корнем, в котором апопласт уподобляется стенке
клетки, симпласт — цитозолю, а вакуом корня — вакуоли одиночной клетки.
Результаты таких исследований были использованы для разработки клеточной
модели корня (см. подразд. 6.2.4.2; рис. 6.32). Позднее исследование кинетики
поглощения проводили также на выделенных протопластах и сконструирован-
ных мембранных везикулах.
Скорость поглощения К+ отсеченными корнями ячменя меняется при из-
менении концентрации КС1 в растворе, и изотерма поглощения имеет вид
327
гиперболической кривой подобной кривой кинетики насыщения для реак-
ции, катализируемой ферментом (рис. 6.16, А). Поэтому, как и кинетика фер-
ментативной реакции, зависимость скорости поглощения от концентрации иона
соответствует уравнению Михаэлиса—Ментен:
К,ах[С]
out
^т, каж + [Qoul
(6.3)
где V — наблюдаемая скорость поглощения при концентрации иона [C]out в
растворе; Итах — скорость, достигаемая при выходе на плато, когда увеличение
Рис. 6.16. Скорость поглощения как функция концентрации иона в растворе:
А — изменение скорости поглощения К+ отрезанными корнями ячменя при низких (7) и высо-
ких (2) концентрациях КС1 в среде (Epstein, 1966); Б — многофазная (фазы 7—4) кинетика
скорости поглощения К+ по механизму II (пунктирная линия — Итах поглощения по механизму 1)
(Epstein, Hains, 1965); В — скорость поглощения нитрата диким типом (7) и chel мутантом В1
(2) Arabidopsis в зависимости от концентрации NO3 в среде (по Daddema, Telkamp, 1979); Г —
многофазная кинетика (фазы 1—5) скорости поглощения фосфата из растворов с разной кон-
центрацией; фосфатом снабжали только участок корня кукурузы (по Nandi et al., 1987); Кт —
константа Михаэлиса
328
[Clout не приводит к увеличению скорости поглощения (вследствие насыще-
ния связующих мест переносчика); Кт каж — кажущаяся константа Михаэли-
са—Ментен, соответствующая [C]out при достижении '/гИпах-
По аналогии с ферментной реакцией Кт каж характеризует сродство транс-
портера к иону: чем ниже Кт каж, тем эффективнее работает переносчик при
низких концентрациях ионов в растворе. Итах отражает (условно) число мест
переноса (количество фермента в ферментативной реакции) и определяет воз-
можности системы транспортировать ион при его высоких концентрациях.
При исследовании кинетики поступления были получены двухфазные и
даже многофазные кривые, на основании которых были постулированы, а за-
тем и выявлены системы транспорта, достигающие насыщения в разных диа-
пазонах внешних концентраций и с разным сродством к иону (рис. 6.16): меха-
низм I — с небольшой Ктах и высоким сродством (низкая Кт) к иону (высоко-
афинные переносчики) и механизм II — с низким сродством (высокой Кт) и
высокой Ртах (рис. 6.16, Л), а в ряде случаев (рис. 6.16, Б) с несколькими
точками насыщения.
Переносчики перемещают растворенные вещества либо против, либо по
градиенту электрохимического потенциала со скоростями 102— 104 ионов в се-
кунду. Однако в зависимости от условий, при которых они исследуются, транс-
портеры иногда ведут себя как каналы, или, наоборот, каналы ведут себя
подобно транспортерам (особенно это касается К+), поэтому различия между
ними в настоящее время не совсем ясны. Активное перемещение, или вторич-
ный транспорт, ионов и других веществ происходит одновременно (или в ко-
транспорте) с Н+ и обеспечивается конформационными изменениями транс-
портирующего белкового комплекса. Котранспорт протона и иона может идти
в одном {симпорт) или в противоположном {антипорт) направлениях (см.
рис. 6.15). В симпорте с протоном через плазмалемму транспортируются анио-
ны, К+ (при низких концентрациях), а также сахара и аминокислоты. В анти-
порте с Н+ переносятся Na+ через плазмалемму и тонопласт, а Са +, сахароза и
гексоза через тонопласт. Некоторые переносчики функционируют на плазма-
лемме в системе унипорта.
Исследование кинетики поглощения К+ отрезанными корнями ячменя из
раствора КС1 в широком диапазоне концентраций (Е. Epstein et al., 1963) по-
казало, что при поступлении К+ как в области низких (<1 мМ), так и высоких
концентраций (> I мМ) изменение скорости следует кинетике Михаэлиса-
Ментен (рис. 6.16). При низкой концентрации поглощение происходит актив-
но {механизм I) и, видимо, в симпорте с Н+ (см. рис. 6.15), а при высокой
{механизм II) — пассивно. Первый высокоафинный К+-транспортер НКТ1 (high-
affinity К+ transporters 1) был идентифицирован в корнях пшеницы. Другой
транспортер К+ из корней AtKUPl {Arabidopsis taliana К+ uptake) функциониру-
ет в зависимости от предшествующих условий выращивания растений (голода-
ние или обеспечение К+) как переносчик с высоким {Кт 44 мкМ) и низким
{Кт 11 мМ) сродством к К+ (см. подразд. 6.3.5).
По градиенту электрохимического потенциала в системе унипорта через
мембрану переносится цинк (см. рис. 6.15). Его транспортер идентифицирован
у Arabidopsis (ZIP 1—4). Экспрессия ZIP1 и ZIP3 в корнях растений, голода-
ющих по цинку?, дает основание считать, что эти транспортеры участвуют в
поглощении Zn + из почвы.
329
Анионы транспортируются против градиента химического потенциала, и
концентрация NO3 и РО4” в тканях в десятки и даже сотни раз превышает
равновесную, предсказанную из уравнения Нернста (см. табл. 6.1). Поглоще-
ние анионов имеет ту особенность, что не только низкоафинные, но и вы-
сокоафинные переносчики электрогенны, т. е. функционируют в сопряжении
с Н -помпой.
Поглощение NO3 осуществляется транспортерами высокого и низкого срод-
ства и в обоих случаях происходит симпорт 2H+/NOj. При низкой концентра-
ции скорость поглощения NO3 соответствует кинетике Михаэлиса—Ментон,
достигая насыщения при 0,1 — 0,5 мМ (рис. 6.16, В). При дальнейшем увеличе-
нии концентрации скорость опять возрастает. Но у дикого типа Arabidopsis за-
висимость скорости V как функции от [NO3] в среде гиперболическая, а у
мутанта chel — линейная, что является ярким примером генетического конт-
роля транспортных систем.
Фосфор транспортируется активно в виде иона Н2РО4 в симпорте с Н+.
Концентрация Р в почвенном растворе чрезвычайно низкая (см. рис. 6.2), но
может сильно возрастать, например, после внесения удобрений. Растения при-
способились использовать фосфор как при низкой, так и при высокой кон-
центрации. Функционируют две системы поглощения Н2РО4: система I с вы-
соким сродством (Кт 3 — 7 мкМ), которая экспрессируется или деэкспрессиру-
ется при голодании по фосфору, и система II, представленная конститутив-
ными переносчиками с низким сродством (Кт изменяется от 50 до 350 мкМ),
проявляющими многофазность кинетики насыщения в зависимости от кон-
центрации (рис. 6.16, Г).
Ионные каналы — большая и разнообразная группа интегральных белковых
комплексов, которые присутствуют во всех клеточных мембранах (см. рис. 6.15).
Одна из основных функциональных характеристик каналов — их способность
распознавать и достаточно селективно, с высокой скоростью (106—108 ион/с)
транспортировать ионы. Перемещение ионов по каналу происходит по гради-
енту ц, т. е. пассивно, и основной составляющей движущей силы часто является
разность концентраций иона по обе стороны мембраны. Другая особенность
каналов — регуляция их пропускной способности в ответ на специфические
стимулы. Активность каналов модулируется мембранным потенциалом, pH,
концентрацией ионов, внутриклеточными сигнальными молекулами и рядом
других эндогенных и экзогенных факторов.
Большой прогресс в исследовании функциональной активности и регуля-
ции ионных каналов был достигнут благодаря разработке метода «пэтч-кламп»
(patch clamp). Метод основан на локальной фиксации потенциала на мембране
и измерении проводимости тока, которая отражает проницаемость иона через
одиночные ионные каналы с использованием протопластов клеток, изолиро-
ванных вакуолей или везикул выделенных мембран. По признаку ионной спе-
цифичности каналы классифицируются по видам переносимых катионов (ка-
лиевые, кальциевые) и анионов (хлоридные, малатные) (см. рис. 6.15). При
более детальной функциональной систематизации каналов учитываются про-
водимость и селективность каналов, направление транспорта иона, принад-
лежность к разным мембранам, способы регуляции, электрические и фарма-
кологические характеристики. При этом основные характеристики, используе-
мые для классификации каналов, транспортирующих тот или иной ион, могут
330
быть разными. Калиевые каналы плазмалеммы подразделяются на входные
(inward) и выходные (outward), а калиевые каналы тонопласта — на быстрые
(fast) и медленные (slow) в зависимости от скорости их активации (см. рис. 6.15).
Кальциевые каналы, участвующие в передаче информации и определяющие
специфику кальциевого сигнала (см. подразд. 6.3.4), делятся на потенциал- и
рецептор-управляемые и классифицируются по местоположению в мембранах
(плазмалемма, тонопласт, эндоплазматический ретикулум) и характеру регу-
ляции. Важные характеристики анионных каналов (исследованы, главным об-
разом, хлорные каналы) — их селективность, направление движения ионов (in,
out) и кинетика (быстрые, медленные), а также локализация в мембранах.
Свойство селективности, как правило, не является абсолютным, а отражает
преимущественную проводимость определенного иона (при физиологических
концентрациях часто близкую к абсолютной). В настоящее время выявлена це-
лая группа неселективных катионных каналов (НСКК — английская аббреви-
атура NSCC). Среди них наибольший интерес представляют К+/Са +-«макси»-
катионный канал замыкающих клеток устьиц Vicia faba (см. рис. 6.15), потен-
циал нечувствительный IC/NH4-канал корней A. taliana и К+/Ка+-канал кор-
ней пшеницы. Вакуолярный анионный входной канал пропускает СГ, NO3 и
малат2+.
Сложность при классификации каналов связана также с необходимостью
совмещать известные электрофизиологические и биохимические характери-
стики с результатами их идентификации на молекулярном уровне. Например,
К -каналы, согласно их молекулярно-структурным характеристикам (число
доменов и гидрофильных петель и др.) (см. рис. 6.18), разделены на четыре
типа (семейства). К так называемому «шейкерному» семейству (Shaker family)
относят идентифицированные у A. taliana К+-каналы с разными функциями:
AKTI (Arabidopsis thaliana К+ transporters) экспрессируется в эпидермисе и коре
корня и связан с поступлением К+ из среды; КАТ1 (К+ Arabidopsis transporters)
переносит К+ в замыкающие клетки устьица, a SKOR (stellar К+ outward rectifier)
осуществляет загрузку ксилемы (см. подразд. 2.3.2; 3.5.1).
Ионная специфичность, пропускная способность, характер регуляции и
другие свойства канала определяются его структурой. По модели, разработан-
ной главным образом на базе исследования Na+/K+- и К+-каналов животных,
ионы перемещаются по специальной структуре — поре, которая имеет по-
лость, заполненную водой, и множество мест связывания (рис. 6.17). Пора фор-
мируется отдельными участками полипептидных цепей гомологичных «.-субъ-
единиц. Часть поры канала, находящаяся на внешней стороне плазмалеммы,
достаточно широкая (не менее I нм в диаметре), названа «устьем». Централь-
ная часть гидрофильной поры имеет меньший диаметр (~0,7 нм), величина
которого варьирует в разных местах. Зона, где находится, так называемый се-
лективный фильтр, — самая узкая часть поры (0,4 —0,5 нм). Благодаря селек-
тивному фильтру пропускная способность калиевого канала для К+ в 100 и
более раз выше, чем для Na+. Механизм, который контролирует активность
канала, был объяснен с помощью английского слова «gate», для которого в
русском варианте был выбран термин «ворота». Управление активностью осу-
ществляется благодаря переходу канала в состояния «открытый—закрытый»
(через открывание/закрывание или отпирание/запирание канала) при помо-
щи воротного механизма (рис. 6.17). Регуляция активности потенциалзависи-
331
Рис. 6.17. Структурно-функциональные элементы условной модели
потенциалзависимого ионного канала.
Изменение положения «воротных» доменов а-субъединиц указано стрелками;
(-) и (+) — заряды на участках селективного фильтра и сенсора
мых каналов обеспечивается по крайней мере двумя системами: сенсором по-
тенциала, индуцирующего открывание ворот канала, и системой, которая инак-
тивирует воротный механизм, приводя к закрыванию канала. В обоих случаях
происходит обратимое изменение конформации субъединиц на участках поры,
составляющих структуру ворот и обеспечивающих функционирование ворот-
ного механизма.
Исследования К+-каналов Shaker-типа, проведенные на дрозофиле {Drosophila)
и арабидопсисе, стали базой для моделирования механизма активации канала
в зависимости от изменения мембранного потенциала и для выяснения взаи-
мосвязи между структурой и функцией. У растений К+-канал Shaker-типа (АК.Т1,
КАТ1, SKOR) представляет собой гомотетрамер (рис. 6.18, В), у которого
полипептидная цепь каждой из четырех а-субъединиц имеет 6 трансмембран-
ных участков (segments): SI — S6 (рис. 6.18, А). Сегмент S4 отвечает за восприя-
тие потенциала и контролирует активность канала. Его сенсорные свойства
связаны с семью положительно заряженными остатками аминокислот. В субъ-
единице этот домен (S4), реагирующий на изменения мембранного потенциа-
ла, окружен другими трансмембранными участками, которые изолируют по-
ложительный заряд (рис. 6.18, Б). Между 5-м и 6-м сегментами расположен
особый домен — Н5 (helix), или Р (роге). Эта петля формирует часть водной
поры и отвечает за проницаемость канала. Но мутации, затрагивающие струк-
туру S6- и S4-S5-nerenb, показали, что эти участки цепи полипептида тоже
связаны с К+-проницаемостью и/или чувствительностью канала к блокиру-
ющим ионам. Функциональные участки находятся также на цитозольных N- и
С-концах полипептидной цепи (рис. 6.18, А). Одна из моделей регуляции ак-
тивности Shaker-канала предполагает наличие на N-конце домена («мяча»),
осуществляющего открывание/закрывание канала (рис. 6.18, Г). Модель, на-
званная «мяч на привязи», исходит из существования трех состояний канала:
покой — R (rest); открытое — О (open) и инактивированное — I. При измене-
332
Рис. 6.18. Структура калиевого канала Shaker-типа:
А — трансмембранная топология полипептидной цепи: S1 — S6 — трансмембранные сегменты;
S4 — сенсорный участок; Н5(Р) — гидрофильная петля; «мяч» — участок с МН3-концевой
группой; цНМФ — домен С-конца, связывающий циклический нуклеотид (например, цГМФ);
К на — домен, обогащенный гидрофобными (Н) и кислотными (А) остатками; Б — тетрамер из
четырех а-субъединиц (вид сверху); В — модель тетрамера: стабилизация с помощью КНА-доме-
на; Г — схема активации/инактивации К+-канала Shaker-типа по модели «мяч на привязи»: R
(rest) — состояние покоя, О (open) — открытое состояние, I — инактивированное состояние
нии потенциала в положительную сторону канал открывается О), что
сопряжено с конформационными перестройками, а затем инактивируется вслед-
ствие того, что МН3-терминальная группа «мяча» перемещается в пору между
S5 и S6 сегментами субъединиц. На С-конце полипептида имеются домен цНМФ
(cNMP), связывающий циклический нуклеотид монофосфат (цГМФ — воз-
можный вторичный мессенджер, регулирующий активность канала), и домен
взаимодействия КНА, обогащенный гидрофобными (Н — hydrophobic) и кис-
лыми (А — acidic) остатками. КНА-домены а-субъединиц отдельного канала
или двух соседних каналов могут взаимодействовать, что будет стабилизиро-
вать тетрамер (рис. 6.18, В) или приводить к образованию на мембране класте-
ров из тетрамеров калиевых каналов.
333
Каналы вносят большой вклад в поступление ряда минеральных веществ,
радиальный и дальний транспорт ионов в корне и распределение минеральных
элементов в клеточных структурах, тканях и органах. Кроме того, каналы —
неотъемлемые участники многих комплексных физиологических процессов,
таких, как поддержание и регуляция потенциала на мембране, осморегуляция
и солеустойчивость, устьичные движения, а также передача сигнала и ответ-
ные реакции на разные внешние воздействия и др.
6.2.3. РАДИАЛЬНЫЙ И ДАЛЬНИЙ ТРАНСПОРТ ИОНОВ ПО РАСТЕНИЮ
6.2.3.1. Пути радиального транспорта
Корни переносят в надземные органы более 80 % поглощенных ионов. Это
перемещение включает радиальный транспорт, загрузку ксилемы и дальний
транспорт веществ по сосудам ксилемы. От эпидермиса, где ионы поглощают-
ся из среды, к сосудам ксилемы ионы могут транспортироваться по симпласту
и апопласту (рис. 6.19). Соотношение потоков по этим двум компартментам
различается для разных ионов и зависит от их концентрации в растворе. При
низкой доступности элементов минерального питания, обычной для почвен-
ной среды, большинство ионов, поглощенных в зоне корневых волосков, сра-
зу в ризодерме поступает в симпласт. При высокой концентрации в среде зна-
чительная часть ионов (до 50 % от поглощенных) перемещается по апопласту
(кальций и бор транслоцируются преимущественно по апопласту). Апопласт-
ный радиальный транспорт в корне возможен только до эндодермы, у которой
клеточные стенки имеют пояски Каспари (см. подразд. 6.2.1, рис. 6.6, Б и 6.7) и
не пропускают воду и растворенные вещества. Поэтому, достигнув эндодермы,
все ионы загружаются в симпласт (рис. 6.19). Однако непроницаемость клеточ-
ных стенок эндодермы не является абсолютной, так как в этой ткани имеются
пропускные клетки с тонкими стенками. Развитие боковых корней выше зоны
корневых волосков также создает участки, где ионы могут перемещаться из
коры в стель по апопласту, поэтому часть ионов и воды может достигать кси-
лемы, не поступая в симпласт. Симпластная транслокация ионов из клетки в
клетку происходит по плазмодесмам, и эффективность перемещения зависит
от плотности плазмодесм, пронизывающих клеточную стенку. Число плазмо-
десм на единице площади поверхности клетки меняется в зависимости от тка-
невой принадлежности клетки и ориентации стенки (рис. 6.20). В эпидермисе
Пасока
Стелярная
Симтитаст
Ризо-
Наружный I дерма
раствор
Эндо- Стелярная
дерма паренхима
Кора
Апопласт
*-Апопластныи путь
Симпластныи путь
Рис. 6.19. Упрощенная схема путей радиального транспорта ионов по симпласту
и апопласту в зоне корневых волосков
334
1
Г i т г
0,6 0,21 0,14
^2,06-^-0,1^-0,1^—
Тангенциальное
распределение
Рис. 6.20. Плотность плазмодесм
(число/мкм2) в стенке разных
клеток корня:
А — клетки на поперечном срезе
эпидермиса: 1 — Trianea bogotensis',
2 — Raphanus sativus (Д. В. Вах-
мистров и др., 1979; 1981); Б —
распределение плазмодесм в ради-
альных и тангенциальных стенках
на стыках клеток коры, эндодер-
мы и перицикла семинального
Радиальное
распределение
корня ячменя (Hordeum vulgaris)
(по Robards, 1975)
Направление
потока
____i____
Кора — кора:
Эндодерма—
эндодерма:
Перицикл—
перицикл:
/_____I____
/ Кора—кора:
Кора — эндодерма:
Эндодерма—
перицикл:
Перицикл—стелярная
паренхима:
0,28
0,37
0,75
0,25
больше всего плазмодесм находится в стенках трихобластов. При этом на тан-
генциальной стороне плазмодесм больше, чем на радиальной, у трианеи в 3
раза, а у редиса в 1,7 раз (рис. 6.20, А). У безволосковых клеток число плазмо-
десм в стенках уменьшается по мере удаления от трихобласта.
По направлению от поверхности корня к центру площадь цилиндрической
поверхности каждого последующего ряда клеток, а в коре и их число в ряду,
уменьшаются (см. рис. 6.7). Для того чтобы скорость симпластного потока не
снижалась, число плазмодесм должно возрастать. Действительно, количество
и распределение плазмодесм в клеточных стенках меняется таким образом,
чтобы обеспечить необходимую скорость радиального перемещения ионов. У корня
ячменя плотность плазмодесм на тангенциальном стыке двух клеток коры мень-
ше, чем на стыке кора/эндодерма (рис. 6.20, Б). Но особенно большое число
плазмодесм находится на внутренней тангенциальной стороне эндодермы на
границе с перициклом. Такое значительное увеличение плотности плазмодесм
(двукратное по сравнению с границей кора/эндодерма) необходимо для обес-
печения перемещения ионов из двух слившихся потоков — симпластного и
апопластного (рис. 6.19). В радиальных стенках перицикла также сосредоточено
большое число плазмодесм. Это может быть связано с функцией распределения
веществ по периметру стели — ионов, поступающих из коры, и ассимилятов
из флоэмы — для более успешного транспорта к местам назначения.
Строение плазмодесмы таково, что она не просто связывает протопласты
соседних клеток, но и объединяет через десмотрубочку эндоплазматический
ретикулум клеток в единую систему. Наличие подобного отдельного компарт-
мента в симпластном континиуме позволяет объяснить существование пото-
ков веществ, идущих в двух противоположных направлениях: ионов — от по-
верхности корня к сосудам ксилемы и ассимилятов — из флоэмы в клетки
коры и эпидермиса.
335
Рис. 6.21. Схема радиального транспорта нитрата в корнях кукурузы при низкой
коцентрации NO7 (0,2 мМ) в питательном растворе (по Rufty et al., 1986):
ЭР — эндоплазматический ретикулум; В — вакуоль; АНР — активная нитратредуктаза;
ПК — пояски Каспари
Использование того или иного пути для радиального перемещения от по-
верхности корня до ксилемы зависит от специфики иона, его накопления и
распределения в клетке и тканях, а также от его функций. Отдельным компарт-
ментом, по которому осуществляется радиальный транспорт, по крайней мере,
некоторых ионов, могут быть эндоплазматический ретикулум и десмотрубочки.
В качестве теста на радиальное перемещение веществ по эндоплазматическому
ретикулуму использовали активность нитратредуктазы (АНР) — цитозольного
фермента, который индуцируется собственным субстратом, когда нитрат по-
ступает в клетку через плазмалемму. У растений, выращенных без нитрата, а
затем помещенных на среду с низкой концентрацией нитрата, нитратредукта-
за индуцируется только в эпидермисе корня, где анион поступает в симпласт
(рис. 6.21). Никакой индукции фермента в клетках коры или стели не происхо-
дит, хотя значительное количество нитрата обнаруживается в ксилемном экс-
судате, а, следовательно, нитрат радиально перемещался через корень. Этот
транспорт должен идти по симпласту, но очевидно, что потоки нитрата и
нитратредуктаза цитозоля каким-то образом изолированы друг от друга. Если
корни снабжать нитратом в высокой концентрации (20 мМ), то активная нит-
ратредуктаза обнаруживается в клетках коры и стели, поскольку значительная
часть иона движется радиально по апопласту и поступает в клетки всех тканей,
индуцируя цитозольную нитратредуктазу (HP). Такие результаты означают, что
симпластный транспортный компартмент — это нечто иное, чем вся цито-
плазма, а именно эндоплазматический ретикулум. На проростках пшеницы
было выяснено, что нитрат, предназначенный для перемещения в побеги,
составляет «15 % от общего количества нитрата в корнях. Этот пул, названный
«подвижным», представляет собой поток со скоростью обновления «2,5 ч или
меньше (см. рис. 6.38).
Возможно, что путь по ЭР используется и для радиального транспорта каль-
ция, концентрация которого в цитоплазме поддерживается чрезвычайно низ-
кой, а в мембране ЭР имеются два типа Са +-АТФаз, с участием которых в
люменах ЭР изолируется значительное количество этого иона (см. подразд. 6.3.4.1
и 6.3.4.2). Большее признание получила модель апопластного радиального транс-
порта кальция по коре и его поступления в симпласт по кальциевому каналу
336
Рис. 6.22. Транспорт Са2+ из
апопласта коры в стель через
эндодерму с участием на внеш-
ней (коровой) стороне Са-
каналов и Са -АТФаз, выка-
чивающих катион на внутрен-
ней (стелярной) стороне клетки
только на уровне клеток эндодермы, откуда он выкачивается в апопласт стели
с участием Са +-АТФазы плазмалеммы (рис. 6.22). Клетки эндодермы при этом
функционируют аналогично эпителиальным клеткам животных: среда по обе
стороны данной ткани различается по ряду параметров (концентрации веществ,
метаболической активности и т.д.), а поток Са + на входе и выходе обеспечи-
вается разными системами транспорта и регулируется разными механизмами.
Известно, что поглощенный анион фосфата в пасоке присутствует также в
минеральной форме, перемещаясь исключительно по симпласту. При этом уже
в коре фосфор активно включается в состав метаболитов с большими скоро-
стями обновления (см. подразд. 6.3.1.4). Радиальный транспорт фосфора иссле-
довали на растениях кукурузы с использованием методов двойной метки (33Р и
32Р), хроматографии сахаров, ядерно-магнитного резонанса (ЯМР)3|Р, гисто-
химии фермента глюкозо-6-фосфатазы и с применением ингибиторов. По мо-
Рис. 6.23. Модель радиального
транспорта фосфора и загруз-
ки ксилемы в корнях кукуру-
зы (по Sasaki et al., 1987):
— глюкозо-6-фосфатаза; В —
вакуоль
дели, разработанной на основе результатов, фосфат перемещается через корень
в составе глюкозо-6-фосфата (ГлбФ), а загрузка ксилемы происходит с участи-
ем глюкозо-6-фосфатазы, локализованной в плазмалемме клеток ксилемной па-
ренхимы (рис. 6.23). Фермент расщепляет глюкозо-6-фосфат на глюкозу, кото-
рая возвращается в клетку, и неорганический фосфат, который переносится в
ксилему. Другие фосфорилированные сахара, вероятно, также транспортиру-
ются радиально, но их количества незначительны. Быстрое включение в корне
поглощенного фосфата в АТФ, а затем в различные органические соедине-
ния — факт хорошо известный (см. подразд. 6.3.1.4). Но способ радиального
транспорта, специфичный только для фосфата, и особый характер загрузки
ксилемы, установленные в результате комплексного исследования на корнях
кукурузы, позднее, на других объектах, не были ни подтверждены, ни опро-
вергнуты. В настоящее время идентифицирован транспортер, участвующий в
загрузке фосфора в ксилему (см. подразд. 6.3.1.3).
6.2.3.2. Движущие силы радиального транспорта ионов
и загрузка ксилемы
Конечный пункт радиальной симпластной транслокации — сосуды ксиле-
мы, составляющие важную часть апопласта стели. В ксилему ионы поступают
из клеток ксилемной паренхимы, и существует специальный термин — «за-
грузка ксилемы». Движущая сила транскорневого транспорта ионов — гради-
ент их электрохимического потенциала (Ац) между границами симпласта: на
входе в него (плазмалемма клеток ризодермы) и при выходе (плазмалемма
клеток ксилемной паренхимы) (рис. 6.24).
В соответствии с принципами термондинамики для активного передвиже-
ния ионов через корень в ксилему достаточно, чтобы активный мембранный
транспорт имел место только в одном из пунктов — либо на входе, либо на
выходе из симпласта.
Измерения электрических потенциалов и концентраций ионов в клетках
тканей корня (кукурузы, подсолнечника (Heliantus) и др. растений) демонст-
рируют, что из среды в симпласт анионы и калий поступают активно против
электрохимического градиента, что обеспечивается работой протонной пом-
пы на плазмалемме клеток ризодермы (рис. 6.24, Б). Ионы Са2+ и Mg2+ посту-
пают в симпласт пассивно. Эти результаты соответствуют оценке, сделанной с
использованием уравнения Нернста (см. табл. 6.1). В то же время выход из сим-
пласта для всех исследованных ионов происходит пассивно (рис. 6.24, Б). Ре-
зультаты этих экспериментов, ставших классическими, легли в основу кон-
цепции пассивного радиального перемещения и пассивного выхода в ксилему
катионов и анионов.
Гипотеза об активном выходе ионов из клеток стелярной паренхимы в со-
суды ксилемы по типу секреции (A.Lauchli et al., 1971, 1978) была обоснована
результатами оценки мест накопления поглощаемых ионов в клетках разных
тканей корня. Концентрация ионов в клетках ксилемной паренхимы оказалась
выше, чем в коровых клетках корня. Косвенным свидетельством работы насоса
в плазмалемме стелярных клеток служат данные по их ультраструктуре. Клет-
ки, окружающие ксилему, имеют относительно большой объем цитоплазмы,
многочисленные митохондрии и везикулы, разветвленную сеть эндоплазмати-
338
Рис. 6.24. Перемещение ионов по симпласту (Л) и механизм загрузки ксилемы (Б):
А — Кат+ — катионы; Ан” — анионы; Пд — плазмодесма; ПМ — плазмалемма клеток коры и
стели. Каналы ксилемной паренхимы корня ячменя: K„ut — селективный выходной калиевый
канал; Кат*ш1 — неселективный выходной катионный канал; К*п — селективный входной калие-
вый канал; БАн”и1 — быстроактивируемый выходной анионный канал; МАно,„ — медленноакти-
вируемый выходной анионный канал; Ан7п — входной анионный канал (по Wegner, Raschke,
1994; Kohler, Raschke, 2000); Б — профиль электрохимических потенциалов некоторых ионов
вдоль радиуса корня подсолнечника (по Dunlop, Bowling, 1971; Bowling, 1973)
ческого ретикулума, что указывает на высокую метаболическую активность и
способность обеспечить выкачивание протонов. Работа помпы на выходе из
клеток стелярной паренхимы подтверждается и тем, что pH пасоки, имеющей
кислую реакцию, активно регулируется. Через сегмент корня лука {Allium сера)
прокачивали растворы фосфатного буфера pH 8,0 разной концентрации. Про-
пущенный через ксилему раствор собирали и измеряли его pH. Оказалось, что
339
в протекающий по ксилеме буфер выделяются протоны, подкисляющие его до
pH 6,5 —7,5. При этом чем больше концентрация буфера, тем больше скорость
выделения протонов, что свидетельствует об их активном выкачивании из клеток
паренхимы с участием «стелярной помпы».
Убедительным доказательством существования двух насосов и, как теперь
выясняется, систем транспорта с различающимися характеристиками на внеш-
ней и внутренней границах симпласта стали данные о дифференцированном
действии фитогормонов и ингибиторов на поступление и транслокацию ионов.
Гормоны абсцизовая кислота и цитокинин (бензиладенин) не оказывали или
оказывали очень малое воздействие на поступление ионов в корень, но инги-
бировали транслокацию. Циклогексимид (ингибитор синтеза белка) также не
влиял на поглощение, но на 90 % ингибировал транслокацию. Такое же изби-
рательное действие оказывал аналог фенилаланина — парафторадениналанин:
поступление ионов в корень не угнеталось, но на 50—90 % снижался их транс-
порт в ксилему. Ингибитор синтеза РНК (6-метилпурин) также действует на
транслокацию избирательно.
Итак, оценка транскорневых химических потенциалов свидетельствует, что
загрузка ксилемы ионами происходит пассивно (рис. 6.24, Б), но при этом на
выходе из симпласта работает Н -помпа. Кроме того, системы, транспортиру-
ющие ионы из симпласта в ксилему, находятся под строгим метаболическим
контролем и более чувствительны к разного рода воздействиям.
Важным является вопрос о том, какие транспортеры обеспечивают загруз-
ку ксилемы. Результаты исследования на корнях ячменя (Hardens vulgaris) сви-
детельствуют, что выход ионов в ксилему происходит пассивно через ионные
каналы. В плазмалемме клеток стелярной паренхимы методом пэтч-кламп вы-
явлено три типа катионных и три типа анионных каналов (рис. 6.24, А), кото-
рые различаются по селективности, проводимости и характеру потенциал-за-
висимости. Выходной селективный КО1й-канал стелярной паренхимы KORC
(К+ outward rectifying conductance) — основной путь поступления К+ из сим-
пласта в ксилему. KORC проницаем для Na почти так же, как для К+, но мало
проницаем для других моновалентных катионов (Cs+, Li+) и может функцио-
нировать как фильтр, ограничивающий поступление токсичных металлов в
надземные органы. Селективный выходной К+-канал shaker-типа (см. рис. 6.18)
SKOR (stelar К+ outward rectifier) был идентифицирован на молекулярном уров-
не в клетках корня Arabidopsis thaliana. Установлено, что функциональные ха-
рактеристики SKOR и KORC-каналов очень сходны.
Роль неселективного выходного катионного канала Kai\)Ut (рис. 6.24, А)
(NORC — nonselective outward rectifying cation conductance), видимо, сводится
к регуляции мембранного потенциала (предотвращает сдвиг в положительную
область). Участие NORC в загрузке ксилемы катионами, очевидно, незначи-
тельно.
Селективный входной К^-канал KIRC (К+ selective inward-rectifying conduc-
tance) обеспечивает поступление К+ из ксилемы снова в окружающие ее клет-
ки. Канал К-п малопроницаем для Na+, но проявляет значительную проницае-
мость для Cs+. Гиперполяризация мембраны вследствие выкачивания протонов
Н+-АТФазой клеток стелярной паренхимы активирует K4in канал и увеличива-
ет пассивное поступление К+ из ксилемы в клетки паренхимы в местах, распо-
ложенных выше места загрузки, обеспечивая циркуляцию К+ и его распреде-
340
ление по органам (см. далее рис. 6.29). Возможно, подобным образом могут
ресорбироваться и токсичные ионы (во всяком случае, Cs+), что предотвраща-
ет их поступление в побеги.
Загрузка ионами солей ксилемы — процесс электронейтральный, поэтому
проницаемость плазмалеммы для анионов должна быть сопоставимой с про-
ницаемостью для катионов. Анионные каналы, обнаруженные в клетках сте-
лярной паренхимы корней ячменя, различаются по своим свойствам и обеспе-
чивают как выход анионов из симпласта, так и их поступление из ксилемы
обратно (рис. 6.24, А). Быстрый анионный выходной канал БАн“и1, или XQUAC
(xylem quickly activating anion conductance), имеет характеристики, типичные
для анионных каналов плазмалеммы клеток разных тканей у разных видов ра-
стений. Канал проницаем для СГ и NO3, активируется при гиперполяризации
плазмалеммы и низкой концентрации Са + в цитозоле. Медленный анионный
канал (рис. 6.24, А) МАнм, или XSLAC (xylem slowly activating anion conduc-
tance), проявляет меньшую проницаемость, и, видимо, число таких каналов в
мембране меньше, чем XQUAC.
Входной анионный канал Ан7п, или XIRAC (xylem inwardly rectifying anion
chanal), также относится к медленным анионным каналам (время открытости
~ 1 с). Он активируется при гиперполяризации и, возможно, работает в сопря-
жении с БГ-помпой, обеспечивающей регуляцию pH в ксилемном соке. Таким
образом, электронейтральный выход К+, NO3 и СГ происходит пассивно, и
основные потоки идут через каналы K^ut (KORC) и BAnout (XQUAC) (рис. 6.24).
Итак, радиальная транслокация ионов связана с функционированием двух
Н+-помп и двух различающихся совокупностей переносчиков и каналов, обес-
печивающих транспорт ионов через плазмалемму из среды в симпласт и из
симпласта в ксилему. Ансамбли транспортных белков контролируются разны-
ми механизмами. Ограниченность данных, о системах транспорта и регуляции
транспортных процессов на уровне органа пока не позволяет разработать обос-
нованную в деталях модель, включающую «поглощение — радиальный транс-
порт — загрузка ксилемы». Сведения о том, что отдельные ионы могут транс-
портироваться разными путями (см. рис. 6.21, 22, 23), усложняют задачу разра-
ботки единой схемы поглощения и транспорта веществ через корень.
6.2.3.3. Дальний транспорт ионов
Сосуды ксилемы и флоэмы — основные коммуникационные системы, обес-
печивающие транспорт веществ в целом растении и взаимодействие его орга-
нов (рис. 6.25). По ксилемным сосудам из корней в надземные части растений
поступают вода, ионы и ряд органических веществ, синтезируемых в корнях.
Раствор сосудов называется ксилемным соком. Его количественный и каче-
ственный состав был исследован методом сбора и анализа ксилемного эксуда-
та или пасоки. Пасока выделяется из сосудов ксилемы после срезания надзем-
ной части благодаря «нижнему концевому двигателю», обеспечивающему транс-
порт воды (см. гл. 5). Большой вклад в разработку этого метода и исследование
функций корневых систем внесли Д. А. Сабинин и его ученики (1971). Было
показано, что, хотя поступление и перемещение воды и ионов у растений
тесно взаимосвязаны, скорости этих потоков и распределение воды и ионов
по органам не одинаковы и изменяются по-разному в течение суток и в зави-
341
Рис. 6.25. Схема циркуляции
элементов минерального пи-
тания в растении:
В — основные пункты взаимо-
действия; Зг, Рг — основные
места загрузки и разгрузки (со-
ответственно) систем дальнего
транспорта; А — области асси-
миляции некоторых минераль-
ных элементов; Пк — места рас-
положения передаточньгх клеток.
Стрелками указано направле-
ние потоков (по Pate, 1975)
симост!) от факторов среды. Исследования, проведенные методом сбора и
анализа пасоки, позволили обосновать синтетическую функцию корня, свя-
занную с ассимиляцией в корнях аммонийного и нитратного азота (А. Д. Са-
бинин, 1971). Модифицированные методики сбора ксилемного сока и анали-
за массовых потоков минеральных веществ по ксилеме и флоэме активно
используются и в настоящее время.
В пасоке содержание сухого вещества может составлять от 1 до 20 мг на 1 мл,
и большинство элементов присутствует в виде ионов в концентрациях, как
правило, превышающих их концентрацию в почве, но ниже, чем в клетках
или во флоэмном экссудате (табл. 6.2). Азот представляет исключение, поскольку
присутствует в пасоке как в минеральной (NO3), так и в органической форме
(рис. 6.26).
Перемещение железа, меди, цинка, марганца происходит, очевидно, в виде
комплексов с органическими хелатирующими кислотами, например лимонной.
Ксилемный сок имеет pH < 7. Его величина может существенно варьировать
(табл. 6.2), что обусловлено видовой специфичностью и изменениями ионного
состава и специфического селективного поступления ионов в ксилему и/или
выхода ионов из нее в клетки паренхимы (см. рис. 6.24).
Состав ксилемного сока (качественный, но особенно количественный)
варьирует и зависит от вида и возраста растения, статуса минеральных элемен-
тов в тканях, состава и концентрации ионов в среде, их циркуляции в расте-
нии, а также времени суток. Как правило, существует положительная корреля-
ция между концентрацией иона в наружном растворе и в ксилемном соке. Но
степень концентрирования различается в зависимости от иона и его концент-
рации в среде. Так, если концентрация ионов в растворе 0,1 мМ, то в пасоке,
собранной с декапитированных растений кукурузы, концентрации К+, Са + и
Na+, составляют соответственно 14,7; 1,4 и 0,8 мМ (для К* степень концентри-
рования — в 147 раз!). При 1 М концентрации этих ионов в растворе возрастает
342
Таблица 6.2. Концентрации и форма макроэлементов, присутствующих в почвенном
растворе, ксилемном и флоэмном соке (по A. D. Robson, M.G. Pitman, 1983)
Почвенный раствор Ксилема Флоэма
питательный элемент концентрация, мМ форма концентрация, мМ форма концентрация, мМ
среднее значение область
Кальций 1,5 0-5 Са2* 0,4-4,5 нд 0,25-2,65
Калий 1,3 0-5 К+ 0,5-11,5 К* 20-85
Магний 4 0-6 Mg2* 0,08-1,125 НД 2,1-23
Натрий 0,125 нд Na* 1,6-2,6 нд 0,06-19
Фосфор 0,001 0-0,002 н2ро4- 0,03-1,5 нд 10
Сера 0,5 0-2 SO42- 1,4 нп, S ’ орг 0,9-1,2
Азот 1,5 0-3 NO;, аминый азот 0,7-30 нп, аминый азот
Хлор 0,2 нд ci- 1,3-3,3 ci- 7,9-11,9
Железо <0,00003- 0,003 Fe-комплекс 0,015-0,03 нд 0,075-0,22
pH 4-8 pH 4,9-6,3 pH 7,9-8,2
Примечание, нд — нет данных; нп — не присутствует.
их концентрация в пасоке (19,4; 3,3 и 1,2 мМ для К+, Са2+ и Na+ соответствен-
но), но степень концентрирования уменьшается.
Количество минеральных веществ, поступающих из корней в надземные
органы, зависит не только от их концентрации в ксилемном соке, но и от
скорости потока раствора. Существенный вклад в транслокацию ионов из кор-
ней в надземные органы может вносить градиент водного потенциала. У расте-
Рис. 6.26. Соотношение органических и неорганических соединений азота в пасоке
(% от общего количества азота в пасоке) у разных видов с/х культур.
Данные полевых опытов (Н. Г. Потапов, 1936; А.Д. Сабинин, 1971)
343
Рис. 6.27. Взаимосвязь между транспираци-
ей, потоком СГ (1С1) и концентрацией СГ
<[С1 ]) у растений ячменя (питательный
раствор содержал 50 мМ NaO) (графики
построены поданным Greenway, 1965)
Рис. 6.28. Взаимоотношение между ско-
ростями транспорта Са2+ и Mg2+ и водно-
го тока транспирации при высокой и низ-
кой концентрации ионов в растворе (из
LazarofF, Pitman, 1966; по Sutcliffe, 1976)
ний ячменя при возрастании скорости транспирационного потока с 2,2 до
35,0 мм3 - м“2- с1 (т.е. в 16 раз) концентрация хлора в ксилемном соке снижает-
ся почти в 8 раз (рис. 6 27). Тем не менее общее поступление хлора в побеги
увеличивается, так как вдвое возрастает скорость его потока в побег. Однако
возрастание транслокации как эффект транспирационного тока проявляется
только при высокой концентрации иона в среде (концентрация СГ в растворе
в экспериментах с ячменем, результаты которых показаны на рис. 6.27, превы-
шала норму). При низкой внешней концентрации ионов увеличение транспира-
ционного тока воды не приводит к увеличению скорости поглощения ионов и
их транслокации из корней в надземные органы. Наиболее четко эта закономер-
ность проявляется для Са + и Mg ' (рис. 6.28). На проростках ячменя было проде-
монстрировано два типа взаимодействий между поступлением и перемещением
по растению воды и двухвалентных катионов: линейное увеличение скорости
поступления ионов в зависимости от увеличения транспирации при высокой
концентрации Са + и Mg ‘ в растворе (15 мМ) и отсутствие какого-либо возра-
стания скорости потока ионов при их низкой (0,5 мМ) концентрации в раство-
ре. В этих экспериментах поступление К+ и Na+ не зависело от транспирации не
только при низкой, но даже и при высокой концентрации ионов в растворе.
Отсутствие корреляции между перемещением воды и ионов свидетельству-
ет о различии в движущих силах, механизмах контроля и организации транс-
порта молекул воды и минеральных элементов в системе целого растения. Транс-
локация катионов по ксилеме (так же, как при транспорте по клеточной стен-
ке) может рассматриваться как их перемещение по катионно-обменной ко-
лонке с фиксированным отрицательным зарядом. Катионно-обменная способ-
ность стенок сосудов ксилемы достаточно высокая и, например, для томата
составляет 1000 молей мл-1. Степень торможения транслокации ионов зависит
от валентности иона (Са +> К+), его собственной активности и поверхностно-
го заряда, а также плотности заряда фиксированных анионов, активности дру-
гих конкурирующих ионов, pH ксилемного сока и, наконец, от проводимости
ксилемных сосудов, связанной с их структурными особенностями.
344
Рис. 6.29. Изменение концентрации К+ в пасоке подсолнечника в зависимости от уров-
ня места среза на стебле, где ее собирали (Л), и схема рециркуляции калия в расте-
нии (Б) (по Зялалову, Газизову, 1989).
Время сбора пасоки: / — утром; 2 — в полдень; 3 — вечером; *а) — перемещение ионов из
ксилемы во флоэму еще в корне отражено на основании других данных литературы и схемы рис. 6.25
и загрузка в зону роста
ксилемы корня
По мере передвижения ионов из корней в надземные органы концентрация
некоторых ионов (особенно К , Na+) в ксилемном соке падает. Это происхо-
дит вследствие того, что на отдельных участках пути в верхние части растения
ионы выгружаются из ксилемы в ткани различных органов (самого корня,
стебля, листьев) и могут включаться в процесс циркуляции по растению. В па-
соке, которую собирали со срезов стебля подсолнечника, сделанных на раз-
ной высоте, концентрация К+ была тем меньше, чем выше была высота пень-
ка (рис. 6.29, Л). При этом картина изменений концентрации зависела от вре-
мени суток, когда собирали пасоку; в утренние часы резкого падения концен-
трации по длине стебля не наблюдали.
Исследование поглощения, транслокации и распределения К+ по органам
у разных видов растений позволило разработать схему рециркуляции этого
иона в растении. Калий, покидающий ксилему, не накапливается в парен-
химных клетках стебля, а через передаточные клетки (см. рис. 6.25) переме-
шается во флоэму и возвращается в корень, где вновь включается в акропе-
тальный ксилемный транспорт (рис. 6.29, Б). Акропетальная транслокация К+
по флоэме также возможна, но этот поток значительно меньше базипеталь-
ного. Калий — преобладающий минеральный элемент во флоэмном соке, так
же как и в ксилемном (см. табл. 6.2). В рециркуляцию вовлекается значитель-
ное количество К+ (до 50 % и более от поглощенного). Этот процесс выявлен
345
у разных видов растений и составляет часть общефизиологического процес-
са круговорота минеральных элементов в растении, связанного с реализаци-
ей их функций (см. рис. 6.25). Например, рециркуляция К+ поддерживает вы-
сокий уровень концентрации осмотически активного иона в ксилемном соке
(вклад К+ вместе с противоионным в осмотический потенциал пасоки дости-
гает 60 %), что может повышать поглощение и транспорт по ксилеме воды.
Основные различия потоков веществ, перемещаемых по флоэмным и кси-
лемным сосудам, можно свести к следующему:
• по ксилеме, как правило, не переносятся сахароза и другие сахара (ис-
ключение — зимний и весенний транспорт у деревьев или у кукурузы после
выметывания пестичных столбиков);
• по флоэме не переносятся ионы нитрата и сульфата (см. табл. 6.2);
• концентрация фосфора, органического азота (аминного и амидного) и
многих других ионов во флоэмном соке выше, чем в ксилемном (исключение
составляет кальций) (см. табл. 6.2);
• флоэмный сок имеет слабощелочную реакцию, и уровень его pH колеб-
лется незначительно, ксилемный сок кислый (см. табл. 6.2);
• скорость флоэмного потока значительно ниже ксилемного.
Максимальная скорость потока по ксилеме черешка белого люпина состав-
ляла 147 см ч-1, а по флоэме 22 см ч-1. При этом отдельные минеральные
элементы по скорости перемещения сильно различаются и могут быть разде-
лены на три группы: с высокой (К, Mg, Р, S, N, Cl, Na), низкой (Fe, Zn, Си,
В, Мо) и очень низкой (Са, Мп) подвижностью. Взаимодействие коммуника-
ционных систем в растении — составная часть комплексной системы регуля-
ции поглощения минеральных элементов.
Круговорот минеральных веществ в системе целого растения обеспечивает
реутилизацию и рациональное перераспределение минеральных элементов в
онтогенезе растения, особенно при формировании репродуктивных органов,
а также в периоды действия неблагоприятных факторов, что определяет воз-
можности дальнейшего роста и развития.
6.2.4. ПОГЛОЩЕНИЕ ИОНОВ ИНТАКТНЫМ РАСТЕНИЕМ
СТАЦИОНАРНОГО СОСТОЯНИЯ
Успех изучения поступления ионов на модельных системах (клетки водо-
рослей, протопласты, везикулы, обессоленные отсеченные корни) не вызы-
вает сомнений: выявлены транспортеры, включенные в перенос разных ионов,
выяснены молекулярные, электрофизиологические и кинетические характе-
ристики многих переносчиков и каналов.
Однако исследования подобного рода не дают возможности получить отве-
ты на ряд важных вопросов:
• Как происходит поступление ионов в естественной среде, где действуют
многие факторы, некоторые из которых могут достаточно быстро меняться
(доступность воды и ионов, температура и другие факторы)?
• Каким образом взаимодействуют надземные и подземные органы, обеспе-
чивая поглощение ионов, и как регулируется процесс поступления элементов
минерального питания в целостном организме?
346
• Какова взаимосвязь между доступностью элементов минерального пита-
ния, их накоплением в тканях, ростом организма и реализацией программы
полного цикла развития?
Исследования на интактных растениях, которые находятся в стационарном
состоянии, т. е. имеют определенный статус минеральных элементов (содержа-
ние или концентрация отдельных элементов и их соотношение) и приспособ-
лены к тем или иным условиям среды, позволяют частично понять некоторые
особенности функционирования систем поступления в целом организме.
6.2.4.1. Кинетика поглощения ионов интактным растением
Для интактных растений, которые находятся в стационарном состоянии,
изотерма поглощения имеет вид типичной кривой зависимости поступления
от концентрации иона в растворе (рис. 6.30) и аналогична изотермам, полу-
ченным на модельных системах (гигантские клетки харовых водорослей или
отрезанные, обессоленные корни), где отсутствует взаимодействие корень—
побег (транслокация ионов из корней и поступление ассимилятов).
В экспериментах, более приближенных к естественным условиям, для опи-
сания изотермы поглощения часто используют иные параметры. Это связано с
тем, что поступление минеральных элементов в необессоленные корни, из
которых ионы перемещаются в побеги, представляет собой чистый (нетто)
поток 1п (расчет на поглощающую поверхность или на корни одного растения).
Нетто-поток складывается из двух потоков: входа I (от influx) в корни и выхо-
да Е (от efflux) из них. Именно величину 1„ измеряют, когда поглощение оце-
нивают по изменению концентрации наружного раствора. В связи с этим пока-
затель Ктах в уравнении кинетики поглощения (6.3) заменяют на /тах — макси-
мальный нетто-поток ионов в корни растений. Поэтому, когда поступление
оценивается как поток ионов, 1„ может быть определен по модифицированно-
му уравнению Михаэлиса—Ментен (рис. 6.30). /тах отражает число мест пере-
носа, включая рабочую поглощающую поверхность корня. Величина Кт
показывает, какие системы переноса (высоко- или низкоафинные) включены
в транспорт иона; Е„ и Cmin дают представление о соотношении входа и вы-
хода. Следует подчеркнуть, что соотношение вход/выход при более высоких
концентрациях может быть иным. Однако для характеристики поглощения
интактными растениями из растворов питательных смесей в эксперименталь-
ных условиях по-прежнему используют кинетические параметры «классичес-
кого» уравнения Михаэлиса—Ментен — Ктах и Кт каж.
Рис. 6.30. Поток фосфора 1п в корни 18-днев-
ных растений кукурузы в зависимости от его
концентрации в растворе ([Р]) (по Барберу,
1988):
Сах — максимальный нетто-поток; Е„ — нетто-
выход при низкой концентрации иона в раство-
ре; Стоп — концентрация, при которой потоки
иона в корни и из корней равны; [Cout] — кон-
центрация иона в растворе; Кт — константа Ми-
хаэлиса
347
Рис. 6.31. Изменение скорости поступления ионов К+(И) в зависимости от их концен-
трации в растворе ([К+]) при кратковременной экспозиции 10-дневных проростков
ячменя, предварительно выращенных в водной культуре с концентрацией К+, мкМ:
1-5; 2— 10; 3- 50; 4- 100.
Пунктирные линии от каждой кривой на ось ординат указывают на скорость поступления К+ в
условиях, когда его концентрация в экспериментальном растворе совпадала с концентрацией в
среде выращивания (по Siddiqi, Glass, 1983)
Концентрация ионов в растворе — один из наиболее важных факторов,
определяющих характер поступления ионов в корни. Растения, произраста-
ющие при разной доступности иона в среде, адаптируются к условиям среды,
изменяя не только морфологию растущих корней (см. рис. 6.4), но и качествен-
ные характеристики транспортных систем. Так, скорость поглощения К+ про-
ростками ячменя, росшими при низкой концентрации К+ в среде (5 мкМ),
возрастает почти в восемь раз, если в растворе, из которого шло поглощение в
эксперименте, она составляла 100 мкМ (рис. 6.31). Проростки, росшие при
более высокой концентрации, тоже реагировали на увеличение [К+] в «экспе-
риментальном» растворе, но изменение скорости поступления было тем мень-
ше, чем больше была концентрация иона в среде при выращивании. Оценка
кинетических параметров свидетельствует, что системы транспорта К+ у кор-
ней проростков, росших при 5 мкМ, имеют наибольшую поглотительную спо-
собность (самая высокая Ктах) и наибольшее сродство к К+ (самая низкая Кт каж)
(рис. 6.31, величины Ктах и Кт даны справа от графиков). У корней ячменя,
росшего при более высоких концентрациях К+ в среде, Ктах снижается, а Кт, каж
возрастает. При этом скорости (К) поглощения К+ проростками разных групп
при той концентрации, которая соответствуют условиям выращивания (рис. 6.31,
экстраполяция на ось ординат), практически одинаковы и близки к величине
2 мкМ г-1 • ч-1 (за исключением растений, росших при 5 мкМ). Следовательно,
растения приспосабливаются поглощать «требуемое» количество К+ независи-
мо от его концентрации в среде.
Таким образом, транспортные системы растения адаптируются к условиям
произрастания, что обеспечивается синтезом и функционированием перенос-
чиков и каналов с разными кинетическими характеристиками (сродством к
иону и скоростями переноса). При поглощении ионов из почвенного раствора
348
множество других факторов определяют зависимость «скорость поглощения —
концентрация в среде»; такие, например, как перемешиваемость раствора,
массовый ток, истощение в ризосфере, скорость диффузии ионов, процессы
адсорбции на почвенных частицах и десорбции в раствор и т.д.
6.2.4.2. Модель корня и регуляция поступления ионов
в интактном растении
Изменения кинетических параметров систем поглощения у интактных ра-
стений отражают возможности регуляции поступления ионов. Однако адаптив-
ные изменения (Итах и Кт каж) не могут быть связаны только с этапом транс-
порта из среды в корень, поскольку поступление в целостное растение вклю-
чает: /„ (т.е. вход и выход), радиальный транспорт и загрузку ксилемы, а также
поток по ксилеме. Все этапы поглощения учитывает одноклеточная трехком-
партментная (апопласт, цитоплазма, вакуоль) модель корня (рис. 6.32). Она
также предусматривает возможность регуляции по принципу обратной связи
систем транспорта ионов при поступлении в симпласт (цитозоль) и при за-
грузке ксилемы. Согласно этой схеме, важным элементом регуляции является
концентрация иона в цитоплазме, которая поддерживается на определенном
(постоянном) уровне. Модель учитывает также перераспределение иона в клетках
корня между цитозолем и вакуолью, а следовательно, включение переносчи-
ков тонопласта в регуляцию общего транспортного процесса.
Нетто-поступление (/,,) — суммарная величина двух разнонаправленных
потоков, поэтому возникает вопрос: на этапе входа (/ос) или выхода (£со)
осуществляется регуляция поглощения? Чтобы ответить на этот вопрос, не-
обходимо выяснить, как меняются все три параметра в разных условиях.
Нетто-поступление, вход и выход могут меняться в зависимости от вида
поглощаемого иона и/или от действия факторов иной природы, а также от их
сочетаний. Так, у пшеницы стационарного состояния, росшей при 25 или 12 °C
в зоне корней, скорости нетто-поступления и входа нитрата уменьшаются при
низкой температуре, а скорость выхода увеличивается (рис. 6.33). У быстрора-
Рис. 6.32. Эмпирическая модель по-
ступления ионов и регуляции транс-
портных систем в интактных корнях:
/„ — нетто-поступление; /ос — вход из
среды в цитозоль (симпласт); £со — вы-
ход из клеток в среду; /cv, /< х, £\с. £хс —
вход и выход, соответствующие цитозоль-
ному (С), вакуолярному (V) и ксилем-
ному (X) компартмеитам; |АБК| — кон-
центрация абсцизовой кислоты; [Иоп|с,
|Ион|у — концентрации иона в цитозоле
и вакуоли соответственно; — регу-
ляция по принципу обратной связи в кор-
не; —»- — регуляция через сигнал из над-
земных органов;----»- — АБК регуляции;
/(С) — поток по симпласту; /(А) — поток
по апопласту; /(Х) — поток по ксилеме в
надземные органы
349
--------------»- Вход 15NO3
| > Нстго-поступленис
i________i_________i________I________I________I________i_________
1,0 2,0 3,0 4,0 5,0 6,0
15NO7, mkM • г-1 сыр. массы корней • ч-1
Выход
Транслокация 15NO3
in situ восстановление 15NO3
Рис. 6.33. Вход, нетто-поступление, транслокация и восстановление нитрата в зоне
корней у проростков пшеницы, росших при 25 и 12 °C.
Нетто-поступление определяли по убыли аниона из раствора питательной смеси (K15NO3,
3,0 мМ), вход и транслокацию — на основании содержания l5N—NO3 в тканях, выход — по
разнице между входом и нетто-поступлением, in situ восстановление — по количеству восста-
новленного ISN в тканях корней (Е. В.Харитонашвили, Н.Д.Алехина, 1997)
стущих растений при низкой концентрации ионов в среде, нетто-поступление
К , СГ и Н2РО4 регулируется главным образом через скорость входа, хотя это
не означает, что скорость выхода незначительна и/или не подвержена измене-
ниям. Таким образом, скорость нетто-поступления обусловлена величиной со-
отношения вход/выход и вклад каждого из потоков (/qc и £со) либо их сочета-
ние могут быть определяющими в регуляции поглощения (см. рис. 6.32).
Цитоплазма (симпласт), куда из среды поступают минеральные элементы, —
место интенсивных метаболических превращений; поддержание гомеостаза в
цитозоле, в том числе концентрации отдельных ионов и катионно/анионного
баланса, — основной клеточный приоритет. При обильном снабжении элемен-
тами минерального питания и избыточном поступлении их в симпласт, поми-
мо того, что ионы могут активнее переноситься в побег и выходить из корня,
увеличивается их поступление в вакуоль (занимает 90 % от объема клетки), где
концентрация многих ионов (Са +, Н2РО4, NO3, Na+, СГ) значительно выше
их концентрации в цитоплазме. Эти ионы служат запасным фондом и в услови-
ях их дефицита в среде могут выходить из вакуоли, включаясь в транслокаци-
онный поток (см. рис. 6.32).
Модель регуляции поступления по принципу обратной связи постулирует,
что сигналы, включенные в механизм управления транспортным потоком,
поступают из цитозоля, и основным эффектором служит кратковременное
изменение концентрации поглощаемого иона в этом компартменте (рис. 6.32).
Однако поступление NO3 может ингибироваться одновременно поглощаемым
ионом NH4, а также глутамином (продукт ассимиляции NH4 и NO3), который
рассматривается как эффектор переносчиков NO3.
Реальная картина регуляции поглощения сложнее. Системы управления
процессом поступления так же комплексны, как и сам многоэтапный процесс
поглощения элементов минерального питания. В системе in vivo этап загрузки
ксилемы может быть лимитирующим и определить как поступление ионов,
так и дальний транспорт. У проростков пшеницы, росших при 12 °C в зоне
350
корней, масса корней не менялась и, хотя нетто-поступление NO3 снижалось
(рис. 6.33), происходило накопление нитрата в тканях корней (62 и 49 мкМ/г
сырой массы при 12 и 25 °C, соответственно). Восстановление нитрата в кор-
нях было одинаковым (рис. 6.33). Поэтому можно заключить, что основная
причина накопления нитрата в тканях корней при 12 °C — снижение трансло-
кации 15NO3 в побеги. События, которые определяют поглощение NO3 проро-
стками, росшими при 12 °C, выстраиваются в следующую последовательность:
снижение скорости транслокации инициирует накопление нитрата в корнях,
это приводит к уменьшению нетто-поступления за счет уменьшения скорости
входа и возрастания скорости выхода (рис. 6.33). Таким образом, транспорт
NO3 в ксилему — основной этап в регуляции поступления нитрата в интактное
растение при разных температурных условиях.
Какова природа сигнала и механизма ингибирования загрузки NO3 в ксиле-
му? Возможно, регуляция транслокации NO3 связана с К1 — катионом, ко-
транспортируемым по ксилеме с NO3. Вероятным кандидатом на роль сигнально-
го вещества может быть гормон абсцизовая кислота (АБК). Она синтезируется в
корнях и листьях, быстро передвигается по флоэме и ксилеме и распределяется
между разными компартментами в клетках и тканях. Изменение водного потен-
циала тканей, вызванное, например, засухой и возникающее как следствие
изменения pH и концентрации ионов, приводит к модификации потоков АБК,
которые можно рассматривать как сигналы стресса. Под контролем АБК наря-
ду с устьичными движениями, ростом листьев и ответными реакциями на
стресс находится и дальний транспорт (см. рис. 6.32). Добавление АБК тормо-
зит загрузку К+ в ксилему корней и не влияет на поступление К+ из почвы в
корни. АБК ингибирует выходной К+ канал клеток стелярной паренхимы кор-
ней кукурузы, т.е. /сх — см. рис 6.32 (см. подразд. 6.3.5.4). Тем не менее наши
представления о том, как регулируется этап загрузки ксилемы и транслокации
ионов в надземные части растения, остаются неполными. Так, АБК ингибирует
загрузку К в ксилему только у растений, росших при его низкой концентрации
в среде. У «высокосолевых» растений ингибирующий эффект гормона отсут-
ствует. Неясно также, в какой мере изменение концентрации АБК в корнях in
vivo обусловлено синтезом гормона в самих корнях и какой вклад вносит АБК,
синтезируемая в листьях и транспортируемая в корни по флоэме.
Скорость поглощения некоторых ионов, видимо, регулируется системами
контроля побегов, а не корней. Об этом свидетельствуют результаты экспери-
ментов с «разделением» корневой системы, когда часть корней растения нахо-
дится в камере вегетативного сосуда со всеми элементами минерального пита-
ния, а другая часть — в камере без одного из элементов (К, Р или N). Умень-
шение доли корней, которые снабжались калием, приводит к уменьшению
содержания К+ в побегах, но не в самих поглощающих калий корнях (табл. 6.3).
При этом Гтах становится тем выше, чем меньшая доля корней участвует в
поглощении К+. Таким образом, снижение содержания К в листьях передается
как сигнал в корни и инициирует повышение их поглотительной способности
(см. рис. 6.32).
В подобных, но более комплексных экспериментах с фосфатом и нитратом
было установлено, что скорость поглощения ионов и их дальнейшее переме-
щение в ксилему корня зависят от «потребности» в данном элементе, которая
существует в листьях или других органах побега. «Потребность», или «запрос»,
351
Таблица 6.3. Содержание К+ в корнях и побегах растений кукурузы
и изменение И„|ах поступления К в зависимости от доли корней, которые
обеспечивались калием (эксперименты с разделением корней) (по J. Barber, 1979)
Доля корней, снабжаемых К+, % Содержание К+, мкМ/г сухой массы Иглах, пкМ -см~2-с_|
надземные части корни
100 2,05 1,48 15,8
50 1,64 1,41 28,0
25 1,10 1,28 33,8
15 1,05 1,41 36,8
в данном случае означает количество данного элемента, необходимое для под-
держания определенной скорости роста, когда в надземных органах скоорди-
нированы фотосинтетическая ассимиляция СО2 и доставка элементов мине-
рального питания и воды корневыми системами. При дефиците какого-либо
элемента, когда он становится фактором, лимитирующим рост побегов, про-
исходит целый ряд изменений в росте и развитии корней, а также в процес-
сах поступления ионов и распределении минеральных элементов по органам
(см. подразд. 6.2.1). Для решения проблемы, связанной с регуляцией процессов
транспорта в интактном растении, важны следующие экспериментально уста-
новленные факты: 1) увеличение поглощающей способности корней в отноше-
нии иона, дефицитного в надземных органах (повышение Ктах поглощения это-
го иона) (см. табл 6.3; рис. 6.31); 2) возрастание сродства систем транспорта к
дефицитному иону (уменьшение Кт >каж) (см. рис. 6.31); 3) возможное изменение
доли иона, транслоцируемого в побег, от нетто-поступления из среды (рис. 6.33).
Вопрос о природе сигнала, поступающего в корни из листьев, где возника-
ет «потребность» в том или ином элементе, наименее ясен. Предполагают, что
сигналами могут быть сами высокоподвижные ионы (К+, Mg +, Рн) и/или ка-
кие-то их производные, которые транспортируются по флоэме. Нитрат инду-
цирует в корнях и в листьях ряд генов, которые кодируют: NOj — переносчики,
нитрат- и нитритредуктазу, ферменты ассимиляции азота, углеводного мета-
болизма и обмена органических кислот. Сам ион NO3 по флоэме не транслоци-
руется и какое-то неидентифицированное соединение, связанное с NO3-ста-
тусом в листьях (возможно, индолилуксусная кислота), может быть включено
в регуляцию роста боковых корней (см. рис. 6.5), образования корневых волос-
ков и изменения потоков нитрата. То, что разные ионы могут выступать ин-
дукторами систем, обеспечивающих адаптацию растительного организма к ус-
ловиям минерального питания, — важное открытие последних лет.
Передвижение веществ — одна из наиболее важных функций, присущая
всем живым организмам. В растении через транспортные потоки веществ (асси-
милятов, воды, элементов минерального питания) осуществляется интегра-
ция физиологических процессов корней и побегов. За счет поглощения корня-
ми и транслокации воды и ионов по ксилеме минеральные элементы распреде-
ляются в тканях надземных органов, обеспечивая их рост. Но минеральные ве-
щества перемещаются также по флоэме. Циркуляция минеральных веществ —
физиологический процесс, связанный с выполнением таких важных функ-
ций, как реутилизация минеральных элементов из вегетативных частей при
352
созревании семян и плодов, запасание в специализированных органах, пере-
распределение минеральных веществ при стрессовых воздействиях. Процессы
передвижения минеральных элементов зависят не только от внешних условий
и эндогенных факторов, но также от той специфической биологической роли,
которую выполняет данный минеральный элемент. Часто функция элемента
может быть непосредственно связана с транспортом данного иона через мемб-
раны (транспорт К+ поддерживает потенциал на клеточной мембране, а транс-
порт Са + приводит к возникновению Са + сигнала и передаче информации).
В других случаях функции минеральных элементов реализуются через их переме-
щение и компартментацию (осморегуляция, запасание, устьичные движения).
6.3. ВКЛЮЧЕНИЕ В ОБМЕН ВЕЩЕСТВ
И ФУНКЦИИ ЭЛЕМЕНТОВ МИНЕРАЛЬНОГО ПИТАНИЯ
Деление минеральных питательных веществ на группы макро- и микроэле-
ментов в соответствии с потребностью в них и содержанием в тканях удобно и
широко принято, но несет мало информации о роли, которую они выполняют.
Поэтому были предложены иные типы классификаций, которые в какой-то
мере отражают функции минеральных элементов в растительном организме.
Наиболее лаконичная классификация делит необходимые высшим растениям
элементы на две группы в соответствии с формой, в виде которой они выпол-
няют свои функции. Азот, фосфор и сера являются ковалентно-связанными со-
ставляющими органических веществ растений, в которых азот присутствует только
в восстановленной форме, фосфор — в окисленной, а сера — ив восстанов-
ленной, и в окисленной. Эти элементы входят как неотъемлемые компоненты
в такие классы соединений, как аминокислоты, нуклеиновые кислоты, фос-
фолипиды, макроэргические молекулы, пептиды, белки и другие вещества.
Остальные макро- и микроэлементы находятся в тканях в виде ионов (иногда
солей) или в форме металл-белковых комплексов с органическими молекула-
ми и составляют пол и функциональную группу. Они определяют конформацию
и структурную стабильность макромолекул, свойства мембран и управление их
проницаемостью, поддержание гомеостаза, катализ реакций и окислительно-
восстановительные превращения.
Содержание отдельных элементов и их соотношение в тканях значительно ва-
рьируют у разных видов и в зависимости от условий произрастания. Однако один
и тот же основной набор минеральных элементов необходим всем зеленым расте-
ниям и каждый элемент используется разными растениями в одинаковых целях.
6.3.1. ФОСФОР
6.3.1.1. Характерные особенности фосфорного питания
Растения поглощают фосфор из почвенного раствора в форме однозаме-
щенных или двузамещенных солей ортофосфорной кислоты:
н3ро4 н++ н2ро4 2н+ + нро4_ зн+ + ро43“
12 Физиология растений
353
Следует выделить две наиболее характерные особенности фосфорного пи-
тания. Во-первых, дефицит доступного для растений неорганического фосфата
(Фн) в почвах. Как правило, концентрация Фн в почвенном растворе на боль-
шинстве почв составляет от 1 до 10 мкМ (см. рис. 6.2). Специальную помощь в
поглощении труднодоступного для растения Фн оказывают микориза и корне-
вые выделения. Во-вторых, неизменность степени окисленности этого элемен-
та в метаболических реакциях, в отличие от N и S. Биохимия фосфора ограни-
чивается главным образом присоединением или переносом остатка ортофос-
форной кислоты на различные субстраты.
6.3.1.2. Основные типы фосфорсодержащих соединений
Содержание фосфора в растительных тканях составляет 0,04 % от сырой мас-
сы или 0,3 % от сухого вещества. Обычно немногим более 50 % фосфора пред-
ставлено в тканях в виде фосфата Фн и пирофосфата ФФН. С органическими
соединениями ионы ортофосфата образуют моноэфиры, диэфиры и ангидриды.
Можно выделить пять основных типов фосфорсодержащих соединений:
1) ДНК и РНК; 2) фосфолипиды; 3) фосфорные эфиры (С—О—Р); 4) нукле-
озидфосфаты АТФ, АДФ, НАДФН; 5) Фн и ФФН. В составе двух первых типов
соединений фосфор выполняет структурную функцию, в остальных — метабо-
лическую. В структуру нуклеиновых кислот фосфат входит в форме стабильного
диэфира. Фосфатные группы в составе фосфолипидов обуславливают гидрофиль-
ность молекулы с одного конца, в то время как остальная часть молекулы липо-
фильна. Двойственность свойств фосфолипидов лежит в основе структуры всех
биомембран (см. гл. 1). Фосфор играет особо важную роль в энергетике клетки.
Энергия запасается в клетке в виде пирофосфатных связей (ФФН, АТФ, АДФ)
или в форме высокоэнергетических эфирных связей фосфора (С—О~Р) (см. гл. 2).
У растений основной запасной формой фосфора является фитин — Са +-
Mg +-соль инозитолфосфорной кислоты (инозитолгексафосфат). Значительные
количества фитина накапливаются в семенах.
Фитиновая кислота
Фосфатный метаболизм включает: транспорт ионов фосфата через мембра-
ны, химическую и пространственную компартментацию Фн, транспорт на дальние
расстояния и реутилизацию, участие в регуляции метаболических процессов.
6.3.1.3. Транспорт фосфата через мембраны
Транспорт Фн через плазмалемму. Поступление в клетку через плазмалем-
му, или вход, происходит против «крутого» электрохимического потенциала
354
на мембране и обеспечивается белками-транспортерами. Выход Фн из клетки
происходит пассивно через канал.
Идентифицированы два подсемейства фосфатных транспортеров плазма-
леммы: 1) РТ — индуцируемые, с высоким сродством к переносимому аниону
(Кт = 3 — 7 мкМ); 2) Pht — конститутивные, с низким сродством к фосфату
(Кт = 50—330 мкМ). Механизм транспорта: симпорт с 2Н+ или 4Н+. Транспорт
Фн через плазмалемму зависит от ДрН и не зависит от д£ (рис. 6.34).
Фосфатные транспортеры — интегральные мембранные белки с молеку-
лярной массой около 58 кДа. Каждый белок образует 12 гидрофобных внутри -
мембранных доменов в конфигурации 6 + 6 (рис. 6.35). Две области, по 6 доме-
нов каждая, соединены большой гидрофильной «петлей», ориентированной
внутрь клетки.
Такой тип строения присущ многим транспортным белкам, которые объе-
диняют в одно большое семейство MFS (major facilitator super family) — одно
из самых больших семейств переносчиков, образованных одиночной полипеп-
Рис. 6.34. Схема распределения транспортных систем Фн в мембранах растительной
клетки:
О — ЬГ-АТФазы плазмалеммы; А — Н+-АТФаза тонопласта; О — пирофосфатаза тонопласта;
РТ — фосфатный транспортер высокого сродства; Pht — фосфатный транспортер низкого срод-
ства; 1,2— системы транспорта Фн из клетки (2 — предположительно канал), 3, 4 — системы
входа и выхода на тонопласте; 5— 8 — фосфатные транслокаторы внутренней мембраны хлоро-
пласта- (5 — ТФТ; 6 и 7 — ФФТ; 8 — ГФТ)
355
Рис. 6.35. Модель фосфатного транспортера.
В состав белка входях 12 мембраносвязанных доменов в конфигурации 6 + 6. Две области, по 6
доменов каждая, соединены большой гидрофильной «петлей», ориентированной внутрь клетки.
Такой тип строения присущ многим транспортным белкам, которые объединяют в большое се-
мейство MFS (Major Facilitator Super Family)
тидной структурой, осуществляющих транспорт через мембраны небольших
молекул за счет энергии хемиосмотического ионного градиента. Это семейство
включает переносчики сахаров, нуклеозидов, фосфата, нитрата, фосфорили-
рованных органических соединений и других небольших молекул.
Множество фосфатных транспортеров высокого сродства обеспечивает транс-
порт Фн через мембраны в различных тканях. В первую очередь, гены РТ эксп-
рессируются в корнях растений, испытывающих дефицит по фосфору. Индук-
ция наблюдается в клетках корневых волосков, эпидермальных клетках внеш-
него слоя по всей длине корня и в поверхностных клетках протеоидных корней.
Таким образом, фосфатное голодание приводит корни растений в состояние
высокой готовности поглощать неорганический фосфат из среды после перио-
да голодания даже при его ничтожных концентрациях. Гены РТ экспрессиру-
ются также в клетках других органов: листа, стебля, пыльцевой трубки, цветка
(данные для томатов и картофеля).
О подсемействе транспортеров Фн низкого сродства известно пока немно-
го: идентифицированы гены Pht, конститутивно экспрессированные в клетках
корней и листа арабидопсиса.
Транспорт фосфата через тонопласт. Основной клеточный компартмент
накопления свободного фосфата — вакуоль, где концентрации Фн достигают
25 мМ. Транспорт иона фосфата через тонопласт, так же как и через плазма-
лемму, осуществляется в двух направлениях: в и из вакуолярного компартмен-
та (см. рис. 6.34). Движущей силой для транспорта ортофосфата в вакуоль явля-
ется электрический градиент ДЕ и в значительно меньшей степени — протон-
ный градиент Ацн+- В этом принципиальное отличие механизма транспорта Фн
через тонопласт от транспорта через плазмалемму. Фосфатные транспортеры
тонопласта еще предстоит идентифицировать и выделить.
Потоки фосфата через мембраны пластид. Особого внимания заслуживает
транспорт Фн между цитозолем и пластидами. Пластиды содержат группу раз-
личных по структуре белков «фосфатных транслокаторов», для переноса через
мембрану в антипорте с Фн низкомолекулярных соединений: триозофосфа-
тов, ФЕП и гексозофосфатов. Внутренняя мембрана хлоропласта высокоселек-
тивна и содержит, в частности, триозофосфат/фосфат-транспортер (ТФТ) (см.
рис. 6.34, 5). Этот белок присутствует исключительно в фотосинтезирующих
356
тканях. У мутантных растений с низким содержанием ТФТ в хлоропластах про-
исходит избыточное накопление крахмала. В норме большая часть фиксирован-
ного углерода на свету экспортируется из хлоропласта в виде фосфотриоз в
обмен на Фн.
Еше один «фосфатный транслокатор» пластид — ФЕП/фосфат-транспор-
тер (ФФТ) (см. рис. 6.34, 6). Транспорт ФЕП из цитозоля в хлоропласт необхо-
дим для дальнейших реакций биосинтеза аминокислот, жирных кислот или
предшественников шикиматного пути, так как хлоропласты и незеленые пла-
стиды у большинства растений не содержат полный набор гликолитических
ферментов для превращения гексозофосфатов и/или триозофосфатов в ФЕП.
ФФТ высоко селективен: переносит только ФЕП и фосфат. В хлоропластах ме-
зофилла С4-растений, вероятно, ФФТ-подобный белок (см. рис. 6.34, 7) рабо-
тает на вынос ФЕП из хлоропластов в цитозоль. В хлоропластах, где представ-
лены и ТФТ, и ФФТ, в результате их совместной деятельности фосфотриозы
обмениваются на ФЕП без видимого нетто-транспорта фосфата (см. рис. 6.34,
5 и 6).
Незеленые пластиды в гетеротрофных тканях для импорта углерода содер-
жат также гексозофосфат/фосфат-транслокатор (ТФТ) (см. рис. 6.34, 8). В ами-
лопласты запасающих тканей транспортируется и Гл-6-Ф и Гл-1-Ф, которые
идут затем на биосинтез крахмала.
Загрузка ксилемы. Для загрузки ксилемы существует специальный меха-
низм транспорта Фн через мембраны клеток ксилемной паренхимы. Хорошо
известен мутант арабидопсиса phol, который не способен транспортировать
фосфат в надземные органы. Другой, не менее известный, мутант арабидопси-
са pho2, наоборот, аккумулирует фосфаты в надземной части в избыточных
количествах. Примечательно, что ни один из девяти известных сегодня генов
фосфатных транспортеров не является аллельным кphol иpho2. Это подтверж-
дает особый характер транспортных процессов при загрузке ионов в сосуды
ксилемы, которые до сих пор наименее изучены в физиологии минерального
питания.
6.3.1.4. Метаболизм фосфата
Главный биохимический путь включения фосфата в органические соедине-
ния идет через АТФ: неорганический фосфат вовлекается в реакции углевод-
ного обмена (см. гл. 3 и 4) и биосинтеза фосфолипидов. В состав нуклеиновых
кислот АТФ входит как ключевое соединение. Поскольку химическая форма
фосфора не меняется, можно говорить о «химической» компартментации фос-
фата или распределении Фн между различными типами органических соедине-
ний. В табл. 6.4 приведены величины времени обновления различных химиче-
ских Р-пулов.
Уже через 30 с поглощенный Фн включается в состав АТФ в у-положении:
а Р у
аденозин—Р~Р~Р
Далее имеет место быстрая обменная реакция между АТФ и УТФ, катали-
зируемая нуклеозиддифосфаткиназой, поэтому следует говорить о быстро об-
новляемом пуле (АТФ + УТФ). Высокая скорость обновления р-Р в этом пуле
357
Таблица 6.4. Время обновления и скорость синтеза различных типов
фосфорсодержащих органических соединений (по R. L. Bieleski, I. В. Ferguson, 1983)
Тип соединения Время обновле- ния, мин Скорость синтеза, нмоль Р г1 мин 1 Тип соединения Время обновле- ния, мин Скорость синтеза, нмоль Р • г-1 мин1
АТФ + УТФ(уР) 0,50 340 Аденозин аР 160 1
АДФ + УДФ (РР) 3,5 85 Уридин аР 160 2
Гл-6-Ф 7 95 РНК 2800 2
3-ФГА 6,5 50 ДНК 2800 0,2
Фосфатидилхолин 6 12 фн 5 650
Фосфолипиды 130 20
свидетельствует, что примерно 1 из 4 молекул нуклеотидфосфатов окисляется
до мононуклеотида. В стационарном состоянии до 45 % поглощаемого фосфата
проходит через нуклеотидный пул. Второе место по интенсивности вовлечения
фосфата в метаболизм занимают реакции фосфорилирования глюкозы и триоз
в гликолизе. Менее быстрые реакции включения Р — через фосфатидилхолин в
состав фосфолипидов биомембран. Обновление «структурного» фосфата в со-
ставе нуклеотидов, где АТФ — ключевое соединение, идет чрезвычайно мед-
ленно, и содержание Р в ДНК достаточно стабильный показатель для вида.
Доля Р в других формах фосфорсодержащих соединений от общего содержа-
ния Р меняется в зависимости от типа ткани, возраста и фосфорного питания.
После заполнения пулов быстро обновляемого органического фосфата в
клетке начинается накопление неорганического фосфата. За исключением стро-
гого фосфорного голодания, цитозольная концентрация Фн поддерживается
на постоянном уровне (5—10 мМ) независимо от экзогенной концентрации
Фн. Постоянство концентрации Ф„ в цитозоле необходимо для обновления и
поддержания химических пулов Р и протекания множества ферментативных
реакций. Вакуолярная концентрация, напротив, широко варьирует: быстро воз-
растает в ответ на улучшение фосфатного питания и снижается вплоть до нуля
при фосфатном голодании. Максимальная концентрация в запасном пуле обычно
не превышает 25 мМ.
Наиболее значительный прогресс в картировании внутриклеточных пулов
Р был достигнут с применением ЯМР-спектроскопии. На рис. 6.36 представлен
достаточно типичный спектр распределения Р между различными клеточными
пулами, полученный для суспензионной культуры клеток моркови in vivo.
Фосфорилирование и дефосфорилирование белковых молекул — важней-
ший способ регуляции их активности. Включение фосфата в молекулу белка
приводит к перераспределению в ней электрических зарядов, модификации
структуры и функций. Фосфорилирование белков регулирует активность мно-
гих ферментов, синтез РНК и белка, как следствие — деление и дифференци-
ровку клеток. Это способ быстрой регуляции метаболической активности на
уровне клетки и тканей.
Активности ферментов синтеза сахаров, аминокислот и изопреноидов, а также
ферментов расщепления сахарозы и Н+-АТФаза P-типа в цитозоле регулиру-
ются обратимым фосфорилированием белковых молекул по серину/треонину.
358
Рис. 6.36. Типичный спектр распределения фосфата между различными клеточными
пулами, полученный для суспензионной культуры клеток моркови in vivo (по Carrol et
al., 1994)
Рассмотрим пример пост-трансляционного контроля за распределением
потоков С между сахарами и аминокислотами в ответ на действие факторов
среды. Активность сахарофосфатсинтазы (СФС) может модулироваться разны-
ми типами фосфорилирования. Если фотосинтез заингибирован, СФС инакти-
вируется фосфорилированием по серину в положении 158. В ответ на водный
стресс СФС активируется фосфорилированием по серину-424 через Са2+-зави-
симую киназу. Пул сахарозы и растворимых сахаров при этом увеличивается.
Известен механизм более тонкой регуляции активности ферментов путем
фосфорилирования, в котором принимает участие низкомолекулярный белок
14-3-3. Белки, фосфорилированные по серину, становятся мишенью для при-
соединения 14-3-3-белка, который связывается с определенным фосфопепти-
дом: Арг-Сер-Х-фосфоСер-Х-Про. После связывания белок-мишень меняет свои
свойства: активность, стабильность, субклеточную локализацию и характер
взаимодействия с другими белками. Такой тип регуляции — фосфорилирова-
ние по серину с последующим связыванием с 14-3-3-белком — установлен для
многих ферментов: HP, ГС, СФС, ФЕПК, 3-ФГА-дегидрогеназы, Н+-АТФа-
зы плазмалеммы и др.
У хорошо обеспеченных Фи растений большая часть поглощенного корня-
ми фосфата транспортируется по ксилеме в более молодые листья. Радиальный
транспорт по корню идет в виде фосфорных эфиров сахаров. В ксилему фосфат
загружается после дефосфорилирования ГлбФ и по ксилеме транспортируется
в виде Фн (см. рис. 6.23). Использование меченого фосфата показало, что он
достигает ксилемы примерно за 8 мин. В зависимости от доступности в среде
концентрация Фн в ксилеме варьирует от 1 до 7 мМ.
359
Наблюдается также быстрая ретранслокация Фн по флоэме. В экспериментах
на растениях фасоли с разделенной корневой системой было показано, что
через 6 ч после внесения меченого фосфата под одну часть корня он появляет-
ся в другой части. Приблизительно половина Фн, ретранслоцированного из
надземных органов в корни по флоэме, затем переносится в ксилему и возвра-
щается обратно в листья. Если в ксилеме Р всегда транспортируется исключи-
тельно как свободный фосфат, то во флоэме обнаруживаются значительные
количества органического фосфора.
6.3.1.5. Ответные реакции растительного организма
на дефицит фосфата
Ответные реакции растения на дефицит фосфата могут наблюдаться на мор-
фологическом, физиологическом, биохимическом или молекулярно-биологи-
ческом уровнях.
На уровне морфологии отмечаются: усиленный рост корня и увеличение его
относительной массы в целом растении, преимущественное развитие боковых
корней по сравнению с главным, повышенная пролиферация корневых во-
лосков (на их долю в среднем приходится 63 % поглощения фосфатов), растя-
жение корневых волосков, образование протеоидных корней, более интенсив-
ное формирование микоризы.
Изменение структуры корневой системы сопровождается изменениями на
уровне физиологических реакций. Отмечаются повышенное выделение органи-
ческих кислот (малата и цитрата) корнями и подкисление почвы, выделение
хелатирующих веществ для удаления двухвалентных катионов, образующих не-
растворимые соли ортофосфорной кислоты и, наконец, выделение фосфатаз в
среду обитания корней. Увеличивается скорость поглощение Фн из почвы и
уменьшается отток Фн из корней. Увеличивается скорость ретранслокация Фн
из более старых листьев и мобилизация вакуолярного запаса Фн вплоть до ис-
черпания. За этим следует драматическое снижение концентрации фосфата в
цитозоле вплоть до 0,01 мМ. Это сказывается на размере аденилатного пула Р
(АТФ, ГТФ, ЦТФ и УТФ), который снижается до 20 — 30% и менее от нор-
мального уровня. В противоположность этому пул пирофосфатов (ФФН) не
зависит от снабжения Фн. При остром фосфорном голодании ФФН может выпол-
нять функции автономного донора энергии в цитозоле, что во многом определяет
метаболическую или биохимическую адаптацию.
В целом на биохимическом уровне изменения при дефиците Р выражаются в
увеличении количества фосфатаз, рибонуклеаз и органических кислот; изме-
няется уровень фосфорилирования белков и активируется гексозомонофос-
фатный путь дыхания. На уровне гликолиза подключаются альтернативные
шунтирующие реакции: 1) ФФн-зависимое фосфорилирование фруктозо-6-фос-
фата, катализируемое пирофосфатзависимой фосфофруктокиназой (см. гл. 4);
2) нефосфорилирующее (необратимое) окисление ФГА до ФГК НАДФ-зави-
симой ФГА-дегидрогеназой, которое шунтирует гликолитические реакции,
катализируемые НАД-зависимой ФГА-дегидрогеназой совместно с 3-ФГА-ки-
назой. Активность двух вышеназванных ферментов при фосфорном голодании
увеличивается примерно в 20 раз.
360
На молекулярном уровне активируются гены рибонуклеаз, фосфатаз, бел-
ков-транспортеров фосфата, Са -АТФаз, вегетативных запасных белков, р-
глюкозидаз, ФЕПК и др. Экспрессия семейства генов, кодирующих белки-
транспортеры Фн плазмалеммы или тонопласта, увеличивается с течением
времени от начала голодания. У арабидопсиса по крайней мере три гена, коди-
рующих фосфатные транспортеры, экспрессируются в корнях и находятся под
контролем фосфатного голодания. Аналогично у растений картофеля (Solatium
tuberosum) идентифицирован один ген в корнях и столонах, который специ-
фически индуцируется при голодании, и второй ген, который экспрессирует-
ся и при высоких, и при низких концентрациях фосфата.
Если снабжение фосфором адекватное (достаточное) и Фн поглощается в ко-
личествах, превышающих запрос, начинают работать процессы, предотвраща-
ющие накопление токсических концентраций Фн. К ним относятся: превращение
Фи в запасные фосфорсодержащие соединения (фитин), ограничение скорос-
ти поглощения Фн из внешней среды (белок-транспортер высокого сродства
РТ репрессируется высокими экзогенными концентрациями фосфата), потери
Фн через увеличение его выхода, который достигает от 8 до 70 % входа.
Растительные клетки отвечают на изменения Фн в среде или в вакуоли из-
менениями на уровне экспрессии генов. Тем не менее внутриклеточные сигна-
лы и факторы, которые влияют на экспрессию генов в ядре, остаются неизве-
стными, в то время как концентрация Фн в цитозоле сохраняется относитель-
но постоянной.
6.3.2. АЗОТ
6.3.2.1. Формы азота, используемые растением
В среде обитания растений азот представлен в виде газообразного азота ат-
мосферы N2 (~78 %) и в составе органических и неорганических соединений в
почве, пресной и морской воде (см. рис. 6.1). Растениям недоступны напрямую
огромный запас азота в воздухе и органический азот почвы, на долю которого
приходится 99% общего азота почвы. Они поглощают азот из почвы в виде
минеральных ионов нитрата и аммония.
Азот почвы происходит из атмосферы в результате процессов химической и
биологической азотфиксации. Биологическая азотфиксация — уникальная спо-
собность некоторых прокариот (цианобактерий, актиномицетов, зеленых сер-
ных бактерий, бактерий родов Azotobacter и Clostridium и др.) восстанавливать
N2 до NH4 при обычных температуре и давлении. Органический азот почвы
может быть превращен в NH4 в процессе аммонификации — разложения орга-
нического вещества гетеротрофными бактериями. Пополнение пула нитратно-
го азота почвы обеспечивают бактерии нитрификаторы, которые используют
для жизнедеятельности энергию окисления аммония до нитрата. Процессы де-
нитрификации, осуществляемые анаэробными микроорганизмами, приводят
к потерям почвенного минерального азота и его переходу в атмосферный N2
(см. рис. 6.1).
Биологическая азотфиксация вносит наиболее значительный вклад в круго-
ворот азота в биосфере. Азотфиксирующие организмы можно разделить на две
361
группы: свободноживущие и симбиотические формы. Существует три основ-
ных типа азотфиксирующих симбиозов микроорганизмов с растениями: ризо-
бий с большой группой бобовых растений (Fabaceae), цианобактерий с голо-
семенными и актиномицетов с небобовыми покрытосеменными растениями.
Бобовые — самая большая группа растений, образующих «товарищество» с
бактериями-азотфиксаторами рода Rhizobium. В симбиотические отношения
вступают арахис {Arachis hypogaea), маш {Vigna radiata), соя {Glycine max), че-
чевица {Lens culinaris), горох {Pisum sativum), фасоль {Phaseolus vulgaris), лю-
церна {Medicago sativa), клевер {Trifolium acer), люпин {Lupinus), бобы {Vicia
faba) и другие. Растение-хозяин снабжает бактерии углеводными компонента-
ми и получает зафиксированный атмосферный N2 в виде аминокислот, ами-
дов или уреидов.
6.3.2.2. ПОГЛОЩЕНИЕ И УСВОЕНИЕ НИТРАТА
Нитрат считают основным источником минерального азота для растений,
хотя для его усвоения необходимо высокое содержание углеводов и большие
запасы энергии. На хорошо аэрируемых не очень кислых почвах большая часть
минерального азота представлена именно нитратом, который находится в вод-
ной фазе. Анион легко перемещается с током воды в почве. Особенно быстро
происходит его вымывание из поверхностного слоя, в котором расположены
корни растений. В силу высокой подвижности концентрация NO3 в почвенном
растворе изменяется в широких пределах: от 5 мкМ до 2 мМ и выше и во
многом зависит от климатических факторов.
Усвоение нитрата — сложно организованная система последовательных
биохимических и физиологических процессов, включающая поступление аниона
в корень, его восстановление и накопление в корнях, радиальный транспорт,
загрузку NO3 в сосуды ксилемы и транслокацию в надземные органы, восста-
новление и накопление нитрата в листьях (рис. 6.37). У некоторых растений
доля нитрата, транспортируемого в побег, достигает 80 — 90 %. Из листьев же в
ЛИСТЬЯ
no;
nh4+
Аминокислоты
Белки
ФЛОЭМА
Аминокислоты
КСИЛЕМА
no;
Аминокислоты
no;
КОРНИ
NH4 —
Аминокислоты
Белки
ПОЧВЕННЫЙ РАСТВОР
no;
Рис 6.37. Общая схема поступления и усвоения нитрата в растении
362
корни NO3 не перемещается. Азот нитрата, восстановленный в корнях, в виде
аминокислот, амидов или уреидов поступает в побеги. На уровне целого расте-
ния происходит довольна интенсивный круговорот аминокислот и амидов между
надземными органами и корнями. Содержание N в ксилеме достигает 0,01 —
0,21 % (масса/объем), во флоэме оно в 10—20 раз ниже.
Усвоение нитрата генетически детерминировано, что выражается в видо-
вой и сортовой специфике поглощения NO3, распределения по органам, вос-
становления и накопления. Накопление нитрата в тканях, достигающее при
определенных условиях высоких значений, — одна из особенностей азотного
обмена растений. С одной стороны, в условиях возникшего азотного дефицита
накопленный ранее NO3 служит эндогенным источником N для новых азот-
потребляющих синтезов. С другой, стороны, нитрат, местом накопления кото-
рого служит вакуоль, выполняет осморегуляторную функцию.
Поглощение нитрата. Механизмы транспорта через плазмалемму. Движущей
силой транспорта через плазмалемму является протонный градиент. Это вто-
ричный активный транспорт в симпорте с протоном.
Кинетически в растительной клетке идентифицированы две системы транс-
порта NO3: 1) высокого сродства — HATS (high-affinity transport system), или
механизм I, 2) низкого сродства — LATS (low-affinity transport system), или
механизм II.
Работа HATS описывается кинетической кривой Михаэлиса—Ментен: ско-
рость поглощения нитрата достигает насыщения при концентрациях 0,2 —
0,5 мМ NO3; Кт обычно колеблется в диапазоне от 10 до 100 мкМ. Система
транспорта высокого сродства может быть конститутивной, которая индуци-
руется в отсутствие нитрата, и индуцибельной, индуцируемой нитратом.
Поглощение нитрата через LATS наблюдается при концентрациях NO3 выше
0,5 мМ и не достигает насыщения. Считается, что система транспорта нитрата
низкого сродства является конститутивной, однако последние работы с му-
тантными формами Arabidopsis выявили индуцируемую нитратом форму LATS.
Идентифицированы два семейства мембранных белков, которые могут осу-
ществлять активный транспорт нитрата через плазмалемму в симпорте с про-
тоном: нитрат-нитритные портеры — NNP (nitrate-nitrite porters) и пептидные
транспортеры — PTR (peptide transporter). Оба семейства представлены у про-
кариот и эукариот и относятся к главному суперсемейству транспортных бел-
ков MFS. К нему же относятся и фосфатные транспортеры, о которых речь шла
выше (см. подразд. 6.3.1.3).
Методами молекулярной биологии были идентифицированы два семейства
генов: NRT1 (nitrate reductase transporter) — кодируют переносчики с двойст-
венными свойствами (с высокими и низким Кт), или переносчики низкого срод-
ства, и NRT2 — кодируют индуцируемые переносчики NO3 высокого сродства.
При изучении и описании поглощения нитрата растениями обязательно
следует принимать во внимание, что это результат двух разнонаправленных
потоков: входа (influx) и выхода (efflux). Транспортная система выхода нитрата
индуцируется самим нитратом и стимулируется аммонием. Однако, в отличие
от индуцируемых систем транспорта входа, система выхода, будучи индуциро-
ванной один раз, остается стабильной в присутствии ингибиторов РНК и син-
теза белка в период до тех пор, пока нитрат и нитрит имеются в наличии в
цитозоле. Возможно, это белок с большим периодом полуобновления, кото-
363
рый работает как селективный канал. Транспортная система оттока кинетиче-
ски описывается кривой насыщения с Кт = 5 мМ, что близко к значениям
концентрации нитрата в цитозоле.
Транспорт нитрата через мембраны может быть важным звеном в регуляции
усвоения нитрата в растении. На уровне плазмалеммы контролируется погло-
щение нитрата из среды, на уровне тонопласта — накопление и ремобилиза-
ция запасенного ранее NO3, на уровне транспорта через мембрану ЭР — сим-
пластный транспорт на средние расстояния и, наконец, выход нитрата из кле-
ток стелярной паренхимы определяет загрузку ксилемы — наименее изучен-
ный транспортный поток нитрата.
Накопление и компартментация нитрата в растительных тканях. Накоплен-
ный в растительных тканях нитрат асимметрично распределен между двумя
основными клеточными компартментами: цитозолем и вакуолью (рис. 6.38). По
мере накопления сперва заполняется доступный для восстановления метабо-
лический пул (МП) в цитозоле, затем формируется запасной, или вакуоляр-
ный, пул (ЗП). Различия по содержанию нитрата (мкМ NO3/r сырой массы) у
растений, выращенных при разной его доступности, связаны в первую оче-
редь с размерами ЗП. Однако на уровне клетки нитрат еще и перемещается по
симпласту. Поэтому более достоверно компартментацию нитрата отражает трех-
компартментная модель, которая учитывает, наряду с метаболическим и за-
пасным, подвижный пул (ПП) нитрата (рис. 6.38).
Восстановление нитрата. Характеристика нитратредуктазы. Восстановление
нитрата в растениях (а также в водорослях, грибах и микроорганизмах) осуще-
ствляется в две стадии: первая — двухэлектронное восстановление нитрата до
нитрита, катализируемое нитратредуктазой (HP), вторая — шестиэлектрон-
ное восстановление нитрита до аммония, катализируемое нитритредуктазой
Рис. 6.38. Схема компартментации нитрата на уровне клетки:
МП — метаболический пул; ЗП — запасной пул; ПП — подвижный пул нитрата;
HP — нитратредуктаза
364
Рис. 6.39. Функциональная модель мономера HP
(НиР). Далее аммоний включается в состав аминокислот в реакциях первично-
го аминирования и амидирования:
_ 2е" _ 6е~ +
NO3 —•- NO2 —► NH4 —► аминокислоты
HP НиР
Первая реакция самая медленная и лимитирует весь процесс в целом. Нит-
рит и аммоний токсичны для растения и в норме не накапливаются. Их кон-
центрации в листьях составляют ~ 15 нМ и ~ 10 мкМ на 1 г сырой массы соот-
ветственно.
По структуре HP (ЕС 1.6.6.1) — металлофлавопротеин, образующий гомо-
димеры с молекулярной массой 100 кДа, и гомотетрамеры. Каждая субъедини-
ца состоит примерно из 1000 аминокислот и включает три кофактора: ФАД,
гем-Fe (цитохром Ь5) и молибдоптерин, которые обеспечивают передачу элек-
тронов от НАДН на NO3 (рис. 6.39). Их окислительно-восстановительные по-
тенциалы (Е°') соответственно равны -272, -160 и -10 мВ. Фермент имеет
центры связывания с НАДН и нитратом. Большинство форм HP у растений
используют в качестве восстановителя НАДН, но некоторые (соя, кукуруза,
ячмень, рис) биспецифичны и связываются либо с НАДН, либо НАДФН.
Электроны от восстановителя передаются на ФАД, затем через геминовое же-
лезо на молибден и далее на нитрат (рис. 6.39).
HP локализована в цитозоле. У большинства видов она обнаружена как в
корнях, так и в листьях. У клюквы, белого клевера, цикория HP локализована
только в корнях, а у Cocklebur — исключительно в листьях. На схеме (рис. 6.40)
представлены данные по распределению ассимиляции нитрата между корнями
и листьями у разных видов растений.
В корнях при низких экзогенных кон-
центрациях нитрата HP обнаруживается в
эпидермальных и кортикальных клетках
ближе к поверхности корня. При высоких
концентрациях NO3 в среде HP есть во
всех клетках коры и стели. В листьях С4-
растений HP локализована в клетках ме-
зофилла, но не в клетках обкладки, так
как хлоропласты мезофилла в большей
степени продуцируют восстановитель при
нециклическом фотосинтетическом транс-
порте электронов.
Древесные (хвойные, листопадные) |
Lupinus |
Pisum |
Zea |
Triticum |
| Heliantus
| Oryza
| Xanthium, Gossipium
Рис. 6.40. Вклад корней и листьев в усво-
ение нитрата у разных видов растений
365
Регуляция активности HP. Регуляция активности HP может осуществляться
на стадии транскрипции, трансляции и на пост-трансляционном уровне.
Транскрипционный уровень. HP — фермент, индуцируемый субстратом, со
временем полуобновления /1/2 ~ 4—5 ч. Индукция нитратом зависит от консти-
тутивного «нитрат-сенсорного» белка неизвестной природы, который предпо-
ложительно связывается с регуляторной областью гена HP. Регуляторная пос-
ледовательность, или «нитратный бокс», в промоторе HP идентифицирована. В
ответ на поступление нитрата уровень мРНК (HP) быстро увеличивается в
течение минут и достигает стационарного состояния в течение нескольких ча-
сов. Чувствительность индукционной системы регуляции: 50 мкМ NO3 в те-
чение 10 мин. Изменения в уровне мРНК (HP) наблюдаются в ответ и на
другие сигналы: свет, углеводы (сахароза), глутамин. Действие света опосредо-
вано через фитохром. Наиболее четко индукция HP светом проявляется у этио-
лированных проростков. В темноте накопление сахаров коррелирует с повыше-
нием уровня мРНК (HP). Увеличению концентрации Глу—NH2 соответствует
снижение количества транскриптов HP. У растений в стационарном состоянии
с индуцированной HP количество мРНК демонстрирует суточную периодич-
ность с максимумом в предрассветные часы. Возможно, в премоторной облас-
ти гена HP есть места связывания с разными регуляторными белками, воспри-
нимающими свет, концентрацию Глу—NH2, водный и углеродный статус, ско-
рость фотосинтеза и другие лимитирующие условия, которые модулируют вос-
становление нитрата на транскрипционном уровне.
Этап трансляции генетической информации также может быть местом регу-
ляции ассимиляции нитрата, но этот вопрос изучен недостаточно.
Пост-трансляционный уровень. Потенциальная активность HP зависит от:
1) количества функционально активного белка HP; 2) уровня активности белка
HP и 3) доступности субстратов в цитозоле.
Доступность отдельных структурных компонентов не лимитирует количе-
ство функционально активного белка HP. Однако у растений в условиях опти-
НАД(Ф)Н -х s' NO3
>ФАД “ЕДГ МоСо. НРаетивная
НАД(Ф) у Гем । I4— NO£
мального роста и достаточного
снабжения нитратом потенциальная
возможность его восстановления
(количество функционально актив-
ного белка, активность HP in vitro)
больше, чем реальная активность HP
{in vivo).
В основе механизма управления
активностью фермента лежит про-
цесс быстрой и обратимой инакти-
вации HP, который происходит в
два этапа (рис. 6.41): первый — фос-
Рис. 6.41. Регуляция активности нитрат-
редуктазы (HP) путем фосфорилиро-
вания и последующим связыванием с
белком 14-3-4:
ПК — протеинкиназа; ПФ — пирофосфа-
таза
366
форилирование активной HP Са2+-зависимой протеинкиназой по серину «пер-
вой петли»; второй — связывание 14-3-3-белка с фосфорилированной HP и
переход HP в неактивное состояние. На втором этапе необходимо наличие
ионов Mg + или Са +. Сродство фермента к субстратам в неактивном состоянии
не меняется, но блокируется поток электронов от гема на молибдоптерино-
вый домен фермента.
Регуляция на уровне транскрипции и обратимая инактивация фермента
совместно позволяют растениям точно настраивать интенсивность ассимиля-
ции нитрата в соответствии с конкретным состоянием. Например, транскрип-
ция HP в фотосинтезирующих тканях подчиняется циркадному ритму. Гены
HP наиболее интенсивно транскрибируются в предрассветные часы, но синте-
зируемый белок HP в это время обратимо ингибируется темнотой и низкой
доступностью СО2.
Метаболитная регуляция на пост-трансляционном уровне определяется со-
держанием свободного Глу—NH2 и отношением Глу—ЫН2/Глу. Когда уровень
Глу—NH2 низкий и нитрат доступен, скорость восстановления нитрата возра-
стает, в то время как высокий уровень Глу—NH2 тормозит его восстановление.
Предполагается, что регуляторная область связывания Глу—NH2 расположена
на N-конце фермента. У трансгенных растений с конститутивно экспрессиро-
ванной мРНК (HP) и белком, у которого пост-трансляционный контроль по-
терян в результате делении N-конца, регуляторная роль Глу—NH2 утрачивает-
ся и восстановление контролируется только доступностью НАДН.
Нитритредуктаза. Нитрит, образующийся при восстановлении нитрата,
транспортируется в хлоропласты или пластиды в нефотосинтезирующих тка-
нях, где восстанавливается до аммония. Нитритредуктаза (НиР) (ЕС 1.7.7.1),
катализирующая эту реакцию, использует в качестве донора 6е~ восстановлен-
ный ферредоксин:
NO2 + 6Фдвосст + 8Н+ —* NH4 + 6Фд0К + 2Н2О
В хлоропластах восстановление нитрита через ферредоксин обеспечивается
за счет нециклического потока электронов в ЭТЦ фотосинтеза, в нефотосин-
тетических тканях — за счет НАДФН из окислительного пентозофосфатного
пути при участии ферредоксин-НАДФ+-редуктазы:
НАДФН + 2Фдок(Ее3+) НАДФ+ + 2Фдвосст(Ее2+) + Н+
НиР — мономер с молекулярной массой 60—70 кДа, состоит из двух доме
нов и кофакторов, которые передают
электроны от ферредоксина на нитрит.
Ферредоксин связывается с N-терми-
нальной последовательностью белковой
молекулы. На второй половине белка на
С-конце локализовано место связыва-
ния с нитритом. Это два железосерных
центра [4Fe—4S] и сирогем (рис. 6.42).
Активность НиР на порядок выше
активности HP, поэтому нитрит в обыч-
ных условиях не накапливается и ско-
рость ассимиляции нитрата лимитиру-
Рис. 6.42. Функциональная модель
нитритредуктазы
ет первая реакция. НиР, так же как и HP, индуцируется нитратом (а не нитри-
том) и светом.
6.3.2.3. Поглощение и ассимиляция аммония
Следующий этап ассимиляции азота — собственно реакции превращения
аммония в азот органических соединений. Помимо аммония — продукта вос-
становления нитрата — растения усваивают NH4, поглощенный из почвы и
образующийся эндогенно в реакциях распада азотсодержащих соединений и
при фотодыхании (см. гл. 3).
Поглощение аммония высшими растениями обеспечивается двумя различ-
ными транспортными системами: высокого и низкого сродства. Транспорт с
низким сродством происходит через канал. Система транспорта высокого срод-
ства представлена аммонийным транспортером (Кт ~ 10—200 мкМ) с низким
сродством к калию. Перенос NH4 осуществляется в антипорте с Н+.
Семейство аммонийных транспортеров. У прокариот и эукариот аммоний-
ные транспортеры представлены большим семейством АМТ (ammonium tran-
sporter family). Все белки АМТ имеют 11 трансмембранных доменов и N-ko-
нец, обращенный в экстраклеточный матрикс. Идентифицировано 8 аммо-
нийных транспортеров у арабидопсис, а также у других видов, например то-
матов.
Усвоение аммония. Независимо от происхождения, NH4 включается в орга-
нические соединения через синтез аминокислот. В процессах усвоения аммо-
ния наиболее значимы реакции биосинтеза глутамата и глутамина (рис. 6.43).
Хронологически раньше было установлено, что усвоение аммония идет
через восстановительное аминирование 2-оксоглутаровой кислоты, катали-
зируемое глутаматдегидрогеназой (ГДГ), с образованием глутаминовой кис-
лоты (Глу):
Рис. 6.43. Главные пути ассимиляции аммония у растений.
Пояснения в тексте
368
2-оксоглутаровая + NH3 + НАД(Ф)Н + Н+ Глутамат + НАД(Ф)+ + Н20.
Фермент работает в обе стороны, и соотношение аминирующей и дезами-
нирующей активности зависит от доступности субстрата и восстановителя. ГДГ
обнаружена практически у всех высших растений. В корнях и листьях фермент
локализован преимущественно в митохондриях (НАДН-зависимая ГДГ), хотя
в листьях обнаруживается хлоропластная (НАДФН-зависимая ГДГ). Первона-
чально ГДГ считали главным ферментом ассимиляции аммония, однако его
сродство к NH4 невелико: Кт = 10—80 мМ. В норме концентрация аммония в
тканях таких значений не достигает. С другой стороны, активность ГДГ увели-
чивается при прорастании семян и старении, т. е. в те периоды развития, когда
ускорены процессы распада, в том числе аминокислот. Количество мРНК (ГДГ)
и активность фермента увеличиваются в темноте при снижении уровня угле-
рода. В результате образующийся после дезаминирования а-кетоглутарат до-
полнительно включается в цикл Кребса. В целом эти факты свидетельствуют о
важной функции ГДГ в катаболизме аминокислот и в реассимиляции больших
количеств аммония, образующегося при фотодыхании в митохондриях.
В 1974 г. Р.Ли и Б. Мифлином был описан глутаматсинтазный цикл, кото-
рый включает две последовательные сопряженные реакции (рис. 6.44). NH4
сначала включается в глутамин в реакции, катализируемой глутаминсинтета-
зой — ГС (ЕС 6.3.1.2). Далее глутаматсинтаза (глутаминоксоглутаратамино-
трансфераза — ГОГАТ) катализирует взаимодействие глутамина с 2-оксоглу-
таровой кислотой. В результате образуются две молекулы глутамата, одна из
которых может быть использована в качестве субстрата для ГС, а другая — для
Н2\ //О
С
I
сн2
сн2
*H3N—С—СОО’
Н
СОО’
I
СН2
сн2
с=о
I
СОО’
АДФ + Ф„
АТФ
15nh;
Глутамин
СОО’
I
сн2
сн2
+ H3N- с- СОО’
н
сн2
+ H3N-C-COO’
н
Глутамат
Глутамат
Рис. 6.44. ГС/ГОГАТ путь ассимиляции аммония
369
Рис. 6.45. Внутриклеточная локализация ГС1 и ГС2
Листья
Корни
Аминокислоты
А
Аминокислоты
А
Поглощение из почвы
Рис. 6.46. Внутриклеточное распределение ферментов ГС/ГОГАТ циклов в корнях и
листьях высших растений
370
транспорта, запасания или дальнейшей метаболизации. Восстановителями для
этой реакции могут быть ферредоксин (Фдвосст) или НАДФН (Фд-ГОГАТ; ЕС
1.4.7.1 и НАДФН-ГОГАТ; ЕС 1.4.1.14 соответственно). Обе реакции формиру-
ют ГС/ГОГАТ-цикл с чистым преобразованием одной молекулы а-кетоглута-
рата и аммония в одну молекулу глутамата. Этот цикл является важнейшим
механизмом первичной и вторичной ассимиляции аммония — «входными во-
ротами» для N в азотный метаболизм растений.
ГС представлена двумя изоформами, обнаруженными у большинства видов и
отличающимися по субклеточной локализации: цитозольной — ГС1 и пластид-
ной — ГС2 (рис. 6.45). Обе формы кодируются гомологичными, но отдельными
ядерными генами. ГС1 и ГС2 по биохимическим характеристикам in vitro зна-
чительно не различаются. Сродство ГС к NH4‘ очень высокое (Кт = 3 — 5 мкМ).
Различия отчетливо проявляются in vivo: ГС2 преобладает в листьях, работая
на первичную ассимиляцию и реассимиляцию аммония при фотодыхании.
ГОГАТ также представлена двумя изоформами. Фд-ГОГАТ выявлена исклю-
чительно у фотосинтезирующих организмов, НАДФН-ГОГАТ — у растений и
бактерий. Последняя иногда более активна в присутствии НАДН, чем НАДФН,
и поэтому называется НАДН. Обе формы локализованы в пластидах (рис. 6 46).
6.3.2.4. Интеграция азотного метаболизма
на уровне целого растения
С и N — два главных конструктивных элемента, обеспечивающих рост и
развитие растений. Фиксация СО2 за счет световой энергии происходит ис-
ключительно в хлоропластах. Усвоение минерального азота — процесс «дело-
кализованный». Весь поглощаемый аммоний и часть нитрата превращается в
азот органических соединений в корнях, но энергией и органическими суб-
стратами ассимиляцию N обеспечивает фотосинтез в виде притока сахаров по
флоэме. Азотный обмен на основе продуктов фотосинтеза составляет наиболее
развитую сторону метаболизма корней: здесь синтезируются аминокислоты и
амиды, уреиды, никотин, нуклеиновые кислоты, цитокинины и другие азот-
содержащие органические соединения.
Нитрат ассимилируется как в корнях, так и в листьях. При усвоении в лис-
тьях только первая реакция восстановления нитрата до нитрита локализована
в цитозоле. Азот нитрита включается в состав аминокислот и амидов в строме
хлоропластов и обеспечивается энергией за счет световых реакций фотосинте-
за. Общая субклеточная компартментация азотного и углеродного метаболизма
на уровне хлоропласта ставит в первую очередь вопрос о распределении энер-
горесурсов между обменом С и N в хлоропласте.
После ассимиляции СО2 восстановление и включение азота нитрита в со-
став аминокислот — наиболее значимый энергопотребляемый процесс в хло-
ропласте. Редукция 1 моль СО2 до уровня восстановленности сахаров требует
приблизительно 4е~ или 8 квантов света (2 моль НАДФН и 3 моль АТФ) (рис.
6.47). Для превращения NO2 в NH4 с использованием восстановленного Фд в
хлоропласте требуется 6е~ (12 квантов) и еще 2е~ (4 кванта) требуется для
превращения Глу—NH2 в Глу. Дополнительно к этому 1 моль АТФ нужен для
синтеза Глу—NH2. Если принять во внимание, что нитрат в цитозоле может
371
цитозоль
ХЛОРОПЛАСТ
Рис. 6.47. Распределение восстановительных и энергетических эквивалентов фотосин-
теза на ассимиляцию одного моля углекислоты и нитрата.
Пояснения в тексте
быть восстановлен также за счет энергии фотосинтеза в виде челночного вы-
носа и превращения триоз в цитозоле, общий расход будет больше на 2е~, или
4 кванта. Таким образом, на усвоение нитрата в фотосинтезирующей клетке
расходуется по меньшей мере 20 квантов. Кроме того, необходимо учесть за-
траты энергии на реассимиляцию в хлоропласте аммония фотодыхания, при-
ток которого на порядок превышает приток нитрита.
Хотя энергозатраты на ассимиляцию 1 моль нитрата в 2,5 больше, чем на
ассимиляцию 1 моль СО2, величина ассимиляции СО2 в 5 — 20 раз выше, чем
величина светозависимой ассимиляции нитрата, и можно думать, что актив-
ность электронного транспорта в хлоропласте используется предпочтительно
на ассимиляцию углерода. Однако в стационарных условиях пул Фд (2 мМ),
как правило, восстановлен даже в темноте, и его достаточно, чтобы обеспе-
чить электронами все взаимодействующие с ним ферментные системы (Фд-
НАДФ-оксидоредуктазы, НиР, ГОГАТ, сульфитредуктазу и тиоредоксинре-
дуктазу). Более того, нитрит, будучи акцептором электронов, участвует в под-
держании редокс-статуса компонентов ЭТЦ, стимулируя нециклический элек-
тронный транспорт. Кроме того, нитрит конкурирует за электроны с кислоро-
дом и, вероятно, препятствует появлению токсических активных форм кисло-
рода. Возможно также, что увеличение чувствительности к фотоингибирова-
нию у хлоропластов растений, испытывающих азотное голодание, обусловле-
но отсутствием значительного стока электронов на восстановление NO2.
Таким образом, процессы фотоассимиляции СО2 и NO2 не конкурируют за
восстановительные эквиваленты в хлоропластах. Отсутствие конкуренции между
двумя этими базовыми процессами находится в полном соответствии с тем,
что обычно наблюдается в естественной среде: снабжение азотом усиливает
рост и, следовательно, общую фиксацию СО2.
372
Взаимодействие и регуляция процессов ассимиляции углекислоты и азота в
хлоропласте существует также на уровне притока субстратов (СО2, NOJ,
а-кетоглутаровая кислота) и удаления продуктов ассимиляции (глутаминовая
кислота, ФГА). Одним из главных факторов регуляции образования нитрита в
цитозоле выступает доступность восстановителя в виде НАДН (см. выше). Если
источником восстановителя служат фотосинтетические реакции, то восстано-
вительная сила поступает в цитозоль из хлоропласта за счет выноса ФГА или
дигидроксиацетонфосфата и их окисления до ФГК с образованием НАДН и
АТФ. У С4-видов растений особое значение имеет челночный транспорт окса-
лат (ЩУК) — малат.
Транспорт нитрита из цитозоля в хлоропласт регулируется через светоза-
висимые изменения pH, концентрации Mg + и образование АТФ в ФС1, а
также через редукцию NO2; вероятно, это и есть то самое место, где контро-
лируется процесс усвоения окисленного азота в хлоропласте.
Данных о сколь-либо существенном синтезе а-кетоглутаровой кислоты в
хлоропласте нет. Транспорт а-кетоглутарата в хлоропласт происходит одно-
временно с экспортом глутамата и с участием двух транслокаторов. Перенос
а-кетоглутарата активируется в присутствии NH4, NO2 и дикарбоновых кис-
лот (малата, сукцината, фумарата). Большая часть метки |4С-а-кетоглутарата
включается в глутаминовую кислоту, экспортируемую из хлоропласта. При этом
только незначительное количество глутамина выходит из хлоропласта.
Таким образом, взаимодействие фотосинтеза и азотного обмена в хлоро-
пласте может опосредованно регулироваться доступностью образующихся вне
хлоропласта нитрита и а-кетоглутарата, возникновение которых в цитозоле
связано с реакциями дыхания.
Нитрат — регуляторная молекула. Нитрат проявляет свойства сигнальной
молекулы для многих ферментов и процессов. Сигнальная функция нитрата
проявляется в быстром (в течение 0,5 — 1 ч) увеличения уровня мРНК инду-
цируемых генов при низких концентрациях нитрата порядка 10 — 250 мкМ даже
в присутствии ингибиторов белка. Так у Arabidopsis идентифицировано более 40
генов, индуцируемых нитратом. В табл. 6.5 приведен далеко не полный перечень
генов, индуцируемых нитратом.
Таким образом, на физиологическом уровне ион NO3 выступает индукто-
ром путей ассимиляторного усвоения нитрата и перепрограммирует метабо-
лизм С на создание восстановительного потенциала и углеродных субстратов
для путей ассимиляции.
Нитрат также влияет на формирование и рост боковых корней. Локальные
аппликации нитрата к корню при его дефиците индуцируют локальную про-
лиферацию боковых корней. Данный эффект сохраняется у мутантных по HP
растений, т. е. не связан с метаболизацией NO3. С другой стороны, постоянно
высокие концентрации NO3 в среде приводят к уменьшению частоты боковых
корней. Наиболее вероятно, что это обусловлено неидентифицированным фак-
тором, поступающим из надземных органов, где нитрат преимущественно на-
капливается (рис. 6.48). Таким образом, NO3-сигнал экзогенной или эндоген-
ной природы «модулирует» рост и морфологию корня.
О путях восприятия и передачи Г4О3-сигнала известно мало. Действие сиг-
нальной молекулы обычно начинается со взаимодействия с рецептором. Такой
белок-рецептор для нитрата не выявлен. Предполагается, что в передачу сиг-
373
Таблица 6.5. Некоторые гены, регулируемые нитратом
(механизм передачи сигнала неизвестен)
Физиологическая функция Гены Белок Регуляция в листьях Регуляция в корнях
Поглощение нитрата NRT1 ЬЮз~-транспортер высокого сродства +
NRT2 1\Юз~-транспортер низкого сродства +
Ассимиляция нитрата NIA Нитратредуктаза + +
NIR Нитритредуктаза + +
Ассимляция аммония DLN1 Пластидная ГС + +
GLN2 Цитозольная ГС + +
GLU ГОГАТ + +
Метаболизм РРС ФЕП + +
органических кислот PKs Цитозольная пиру ватки наза + +
СС Цитратсинтаза НАДФ” + +
ICDH1 Изопитратдегидрогеназа + +
Окисл ител ьно- восста- PGD 6 -фосфоглюконат ? +
новител ьный потенци- дегидрогеназа
ал (метаболизм) FNR Ферредоксин: НАДФ-оксидоредуктаза ? +
FD Ферредоксин ? +
Биосинтез крахмала AGPS АДФ-глюкоза пирофос- форилаза (регуляторная субъединица) — ?
Плазмалемма
рецептор нитрата
Системное
ингибирование
, т стимуляция ____
►Неизвестные —-—*- ANRI-—►
гены ч
\ стимуляция
\
Другие гены
Формирование
и рост боковых корней
у
/ Локальная стимуляция
Гены /
вторичного
ответа
первичного ответа
(например, HP и НиР)
Рис. 6.48. Схема регуляции нитратом формирования боковых корней
374
нала включены ионы Са2+, фосфатазы и киназы. Был идентифицирован также
ген ANR1, гомологичный фактору транскрипции MADS-box. Этот ген быстро
и специфично индуцируется ионом NO3 в корнях растений, голодавших по
азоту. Если экспрессия этого гена заблокирована, то образование латеральных
корней под действием нитрата не происходит.
6.3.3. СЕРА*
Растения, как первичные продуценты серосодержащих органических со-
единений, наряду с микроорганизмами, играют ключевую роль в круговороте
серы в биосфере. Поглощение серы растениями происходит в основном из
почвы в виде иона SO^-. После поглощения сульфат-ион может накапливаться
в тканях корней и надземных органов в невосстановленном виде. Восстановле-
ние сульфата, необходимое для включение серы в состав органических соеди-
нений, происходит в пластидах, преимущественно в хлоропластах.
6.3.3.1. Серосодержащие органические соединения
Сера в первую очередь необходима для синтеза и регуляции количества и
качества производимого растениями белка, так как входит в состав двух серо-
содержащих аминокислот: цистеина и метионина, различающихся по положе-
нию серы в молекуле.
СООН
I
hc-nh2
сн2
SH
Цистеин
СООН
I
hc-nh2
сн2
сн2
S
I
СН3
Метионин
Цистеин — главный продукт ассимиляторного восстановления серы и клю-
чевой компонент биосинтеза белка, глутатиона и фитохелатинов. SH-группы
цистеиновых остатков участвуют в образовании ковалентных, водородных, мер-
каптидных связей, поддерживающих трехмерную структуру белковой молеку-
лы. Свободные тиоловые группы определяют каталитическую активность мно-
гих ферментов, например взаимодействие белка с коферментом. Четыре SH-
группы, хелатируя атом железа, формируют железосерные центры в белках-
компонентах электрон-транспортных цепей энергопреобразующих мембран.
Метиониновые остатки придают молекуле белка гидрофобные свойства, что
важно при стабилизации активной конформации белковой молекулы. S-адено-
зилметионин участвует в реакциях трансметилирования. Метионил-тРНК вы-
ступает инициатором роста полипептидных цепей. Донором S для биосинтеза
метионина является цистеин.
* Автор — Е.В.Харитонашвили.
375
Из наиболее функционально важных серосодержащих органических моле-
кул следует назвать ацетилкоэнзим А (ацетил-СоА), липоевую кислоту, био-
тин, тиаминпирофосфат (витамин BJ. SH-группа коэнзима А образует высо-
коэнергетическую тиоэфирную связь с ацильными группами кислот. В частно-
сти, ацетил-СоА служит переносчиком ацетильной группы в реакциях био-
синтеза жирных кислот, углеводов и аминокислот. Ряд вторичных соединений
образуется из цистеина при замещении и окислении сульфгидрильной груп-
пы, например аллиины и а-аминоакриловая кислота. Серу содержат многие
растительные масла, в том числе горчичное и чесночное. У растений серосо-
держащие вторичные метаболиты широко представлены в семействах Liliaceae,
Brassiaceae, Mimosaceae.
6.3.3.2. Поглощение и транспорт сульфата
Поглощение сульфата корнями в широком диапазоне концентраций опи-
сывается двухфазной кривой. Механизм транспорта — симпорт с протоном со
стехиометрией 3H+/SO4 . При диссипации протонного градиента поглощение
SO4" снижается.
Молекулярно-генетический анализ выявил семейство генов транспортеров
сульфата на плазмалемме. Белки семейства сульфатных транспортеров разли-
чаются по сродству к SO4- и различным образом экспрессируются. По край-
ней мере, можно говорить о двух типах транспортных систем: высокого срод-
ства — Sultrl, или ST1 (Кт ~ 10 мкМ), и низкого сродства — Sultr2, или ST2
(Кт ~ 100 мкМ), с молекулярной массой 69—75 кДа. ST1 экспрессируются
исключительно в корнях, ST2 — как в корнях, так и в листьях. Предполагаемая
структура белков сульфатных транспортеров — 12 мембраносвязанных доме-
нов, типичных для катионных симпортеров, С- и N-концы обращены в цито-
золь. В отличие от фосфатного транспортера центральная аминокислотная пет-
ля, обращенная в цитозоль, отсутствует. Время полуобновления белков суль-
фатных транспортеров невелико — примерно 2,5 ч, и это делает возможным
контроль за поглощением на уровне транскрипции. Главным фактором индук-
ции ST1 выступает сульфатное голодание, а синтез de novo ST2 в этой ситуа-
ции выражен слабо или отсутствует.
Хотя транспорт сульфата в вакуоль значителен, сульфатные транспортеры
на тонопласте пока не идентифицированы. Известно, что поток SO4 в вакуоль
зависит от электрохимического потенциала на тонопласте, механизм транс-
порта в этом случае — унипорт, а движущей силой выступает электрический
градиент на этой мембране. Таким образом, транспорт SO^- через плазмалем-
му и тонопласт принципиально различается.
6.3.3.3. Ассимиляторное восстановление сульфата
Активация сульфата. АТФ-сульфурилаза. Первоначально относительно инерт-
ный сульфат активируется: пирофосфорильная группа АТФ под действием
фермента АТФ-сульфурилазы замещается сульфатом, в результате чего обра-
зуются аденозин-5'-фосфосульфат (АФС) и пирофосфат (ФФН) (рис. 6.49, ре-
акция 7). АТФ-сульфурилаза представлена двумя сходными по структуре и ки-
376
АФС-сульфо-
трансфераза
или АФС-редуктаза
Аденозин-5'-фосфосульфат (АФС)
Г-SH 5'-АМФ
4а
о
О
II
O-S-O-P-O-CH
II
о
О’
Нефермента-
тивная стадия
Сульфит -
редуктаза
АФС-киназа
2 /I
АТФ
О"
NH,
nh2
АДФ
N'
t О
Сульфо-
трансферазы
3
Н Г
О ОН
О’-Р=О
I
О’
3' -Фосфоаденозин -
5'-фосфосульфат (ФАФС)
О Г—SH r-ss-r 0-
11 V у ।
G-S—S-о -► o=s
II 46 I
О О’
о=с-сн-сн2—ОН -
Серин q
Серинацетил-
трансфераза
6
О’
СоА—SH
СоА— S— С-СН3
Ацетил-СоА
О
II
R-O-S-O’
о
R-OH З'-Фосфо-
аденилат О-Сульфатированные
соединения
Сульфит
- s2-
Сульфид
О-Ацетил-
серинлиаза
О
. . II
О=С-СН-СН2—О-С-СН;
О-Ацетилсерин
Ацетат
NH2
О’ NH2
I I
о=с-сн-сн2—S’
Цистеин
Рис. 6.49. Реакции (7— 7) ассимиляторного восстановления сульфата
Рис. 6.50. Схема строения и работы АФС-редуктазы.
Две молекулы восстановленного Г—SH передают 2е“ на тиоредоксинподобный домен. Электро-
ны по градиенту окислительно-восстановительного потенциала переходят на редуктазный до-
мен и затем передаются на АФС. В результате выделяются свободный сульфит и окисленный
глутатион. Пояснения в тексте
нетике реакции изоформами: пластидной и цитозольной. Обе формы есть и в
листьях, и в корнях. В тканях корня активность фермента всегда ниже, чем в
листьях. В пластидах образование АФС предшествует ассимиляторному восста-
новлению серы. В цитозоле АФС в дальнейшем может быть использован в реак-
циях сульфатирования. Реакциям сульфатирования предшествует образование
3'-фосфоаденозин-5'-фосфосульфата (ФАФС), катализируемого АФС-киназой
(рис. 6.49, реакция 2). Именно ФАФС является донором SO^- в реакциях сульфа-
тирования (рис. 6.49, реакция 3), катализируемых сульфотрансферазами, лока-
лизованными преимущественно в цитозоле. Но ФАФС наряду с АФС может
быть и субстратом для ферментативного восстановления.
Первый этап восстановления сульфата до сульфита до сих пор не считается
окончательно установленным. По доминирующей гипотезе восстановление (рис.
6.49, реакции 4а, 46) проходит две стадии: перенос сульфата с АФС на глута-
тион Г—SH с образованием S-сульфоглутатиона, катализируемый АФС-суль-
фотрансферазой (4а), и неферментативное восстановление S-сульфоглутатио-
на за счет Г—SH с образованием Г—SS—Г и выделением сульфита (46).
Комплементарная ДНК (кДНК) пластидной АФС-сульфотрансферазы была
выделена и клонирована у зеленых морских водорослей и арабидопсис. По струк-
туре фермент оказался близок к тиолзависимым редуктазам (но не к сульфот-
рансферазам) и был назван АФС-редуктаза. Он состоит из трех доменов: на
N-конце локализован транзитный пептид, который удаляется после транспор-
та белка в хлоропласт; далее следует собственно редуктазный домен, гомоло-
гичный ФАФС-редуктазам бактерий; на С-конце расположен тиоредоксинпо-
добный домен (рис. 6.50). Однако в тиоредоксинподобном домене последова-
тельность аминокислот между двумя функционально активными молекулами
цистеина типична для глутаредоксина. Именно эта последовательность опреде-
ляет окислительно-восстановительный потенциал системы. Поэтому С-домен
АФС-редуктазы функционирует как глутаредоксин, а не тиоредоксин. Уста-
новленный факт объединения редуктазы и кофактора в одном белке позволил
сформулировать новую гипотезу: реакция восстановления сульфата до сульфи-
та катализируется белком АФС-редуктазой и состоит в переносе двух электро-
нов от двух молекул восстановленного глутатиона через тиоредоксинподоб-
378
ный домен на АФС, при этом выделяются свободный сульфит и окисленный
глутатион:
АФС + 2F-SH — SO3 + 2Н+ + T-SS-Г + АМФ
Таким образом, АФС-сульфотрансфераза и АФС-редуктаза — названия од-
ного и того же фермента.
Второй этап восстановления. Сульфитредуктаза. На втором этапе сульфит
восстанавливается до сульфида (6е“) под действием сульфитредуктазы (см.
рис. 6.49, реакция 5). Донором электронов служит ФдВОСст
SO2’ + 6Фдвосст —*• S2’ + 6Фдок
Фермент локализован в пластидах и кодируется одним геном, который эк-
спрессируется как в зеленых, так и в гетеротрофных тканях. Сульфитредуктаза
растений — гемопротеин, состоящий из 2 или 4 идентичных субъединиц с мол.
массой 64—71 кДа каждая. Подобно нитритредуктазе каждая субъединица суль-
фитредуктазы содержит один сирогем и один железосерный кластер (4Fe-4S).
В отличие от АФС-редуктазы количество мРНК сульфитредуктазы в клетке
практически не меняется и не зависит от доступности сульфата или количе-
ства восстановленных соединений серы в клетке. Сродство фермента к SO2’
очень высокое (Кт = 10 мкМ), и это позволяет не накапливать токсичный для
клетки сульфит.
Различают две изоформы сульфитредуктазы: в листьях — ферредоксинзави-
симую, в корнях — ферредоксин-НАДФ+-зависимую. Восстановление сульфи-
та в хлоропластах обеспечивается энергией света, а в пластидах корней восста-
новителем служит НАДФН из пентозофосфатного окислительного цикла
Биосинтез цистеина. Совместная работа серинацетилтрансферазы и О-аце-
тилсеринлиазы обеспечивает превращение серина в цистеин. Включение S2” в
цистеин — последний этап ассимилятор но го восстановления серы. Сульфид
передается на О-ацетилсерин при участии фермента О-ацетилсеринлиазы (см.
рис. 6.49, реакция 7). О-Ацетилсерин образуется из серина и ацетил-СоА в реак-
ции, катализируемой серинацетилтрансферазой (см. рис. 6.49, реакция 6). Цис-
теин — первый продукт восстановления сульфат-иона. Его концентрация в
растительных тканях поддерживается на постоянном и довольно низком уров-
не (10 мкМ). Считается, что Г—SH играет главную роль в регуляции размеров
пула свободного цистеина.
В упрощенном виде последовательность реакций ассимиляторного восста-
новления сульфата представлена на рис. 6.51.
Регуляция ассимиляции сульфата осуществляется на разных уровнях и раз-
личными путями, которые сильно отличаются от регуляции нитратного и уг-
леродного метаболизма. Восстановление сульфата преимущественно обеспечи-
вается энергией фотосинтеза, но строго от света не зависит. Восстановление
Фдок может обеспечивать окислительный пентозофосфатный цикл. Пул вос-
становленного глутатиона, необходимый для работы АФС-редуктазы в пласти-
дах, обычно не меняется. Более того, хотя активность восстанавливающих серу
ферментов увеличивается в несколько раз после освещения растущих в темно-
те растений, эти же ферменты активны и в этиолированных растениях, тогда
как нитратредуктаза и Рубиско не экспрессируются в этиолированных расте-
ниях. И наконец, в отличие от ферментов ассимиляции нитрата и углерода
379
ферменты ассимиляции сульфата не проявляют суточных колебаний актив-
ности.
Более значимый фактор регуляции ассимиляции серы — стадия развития
растения. Все ферменты ассимиляции серы активны в молодых листьях и кон-
чике корня, и их активность заметно падает в более старых тканях. Ассимиля-
торное восстановление идет там, где велика потребность в цистеине и метио-
нине для белкового синтеза.
Распределение SO^" между двумя клеточными компартментами (вакуолью
и хлоропластом) — важный этап в регуляции усвоения сульфата. Концентра-
ция сульфата в хлоропласте строго контролируется. При выращивании ячменя
на среде с концентрацией сульфата 200 — 250 мМ концентрация SO4 в листь-
ях увеличивалась в 10 раз: с 5 —10 до 60—70 мМ. Концентрация же сульфата в
хлоропластах листьев ячменя увеличивалась при этом только в два раза: с 4 —
5 до 10— 12 мМ. Избыток поступающего в листья сульфата эффективно транс-
портируется в вакуоль — основной сульфатзапасающий компартмент, где его
концентрация может достигать 100 мМ.
При сульфатном голодании увеличивается активность всех ферментов, во-
влеченных в последовательность реакций усвоения сульфата, особенно — АФС-
редуктазы. Количество мРНК для этих ферментов повышается параллельно с
повышением активности. Индукция АФС-редуктазы хорошо выражена в кор-
нях и в меньшей степени в листьях.
6.3.3.4. Глутатион и его производные
Глутатион — один из главных небелковых тиоловых продуктов ассимиля-
торного восстановления сульфата в растительной клетке. Его содержание дос-
тигает миллимолярных значений, что значительно превышает микромоляр-
380
ные концентрации цистеина. Г—SH — трипептид, состоящий из остатков глу-
таминовой кислоты, цистеина и глицина (у-глутамилцистеинилглицин). В от-
личие от животных у растений химические формы глутатиона разнообразнее: у
некоторых бобовых это гомоглутатион (у-глутамилцистеинил-р-аланин), а у
злаковых — у-глутамилцистеинилсерин и у-глутамилцистеинилглутамат.
Биосинтез глутатиона. Г—SH синтезируется в двух последовательных АТФ-
зависимых реакциях, катализируемых у-глутамилцистеинсинтетазой (7) и глу-
татионсинтетазой (2) (рис. 6.52).
Эти ферменты обнаружены в цитозоле и хлоропластах и обладают пример-
но одинаковой активностью. Регуляция биосинтеза осуществляется на первой
стадии. С одной стороны, скорость реакции I зависит от доступности цистеина,
с другой — у-глутамилцистеинсинтетаза ингибируется Г—SH по принципу об-
ратной связи.
Функции глутатиона. Глутатионовый пул восстановленной серы в количе-
ственном отношении самый большой, а в функциональном — разноплановый.
Г—SH — запасная и транспортная форма серы у растений. Например, Г—
SH транспортируется из щитков кукурузы в развивающиеся корни и побеги,
из зрелых листьев в молодые листья и корни у растений Ricinus, при созрева-
нии плодов грейпфрута идет перераспределение глутатиона из листьев в пло-
ды и т.д. Происходит обмен Г—SH между ксилемой и флоэмой.
Система 2Г—SH/Г—SS—Г работает на поддержание окислительно-восста-
новительного потенциала в клетке за счет взаимопревращений дитиол
дисульфид. В норме глутатионовый пул на 95 % представлен восстановленной
СООН соон
I I
h2n-c-h + h2n-c-h
сн2 сн2
СН2 SH
соон
у-Глутамилцисте-
инсинтетаза
1
АТФ АДФ + Фн
Глутамат Цистеин
н н н О н соон
I I I II I I
— HOOC-C-C-C-C-N-C-COOH + h2n-c-h
III II I
h2n h h h ch2 h
SH
у-Глутамилцистеин Глицин
Глутатион-
синтетаза
АТФ АДФ + Фн
н н н О но н
I I I II I II I
—- HOOC-C-C-C-C-N-C-C-N-C-COOH
III II II
H2N н н н сн2 н н
SH
Глутатион
Рис. 6.52. Схема биосинтеза глутатиона.
Г—SH синтезируется в двух последовательных АТФ-зависимых реакциях, катализируемых
у-глутамилцистеинсинтетазой (/) и глутатионсинтетазой (2)
381
Активная форма
Неактивная форма
Рис. 6.53. Редокс-контроль, или поддержание окислительно-восстановительного
потенциала, в клетке за счет взаимопревращений дитиол/дисульфида
формой. Баланс ферментативно сдвинут в сторону Г—SH за счет активности
глутатионредуктазы (ЕС 1.6.4.2), донором е~ служит НАДФН (рис. 6.53). Пул
восстановленного глутатиона поддерживает в активном состоянии многие белки-
ферменты в разных клеточных компартментах: цитозоле, строме хлороплас-
тов, матриксе митохондрий. Когда баланс сдвигается в сторону окисленного
глутатиона, ферменты переходят в неактивное состояние в результате образо-
вания дисульфидных связей по цистеиновым остаткам.
Защитная функция Г—SH и некоторых глутатионзависимых ферментов (глу-
татионтрансферазы (ГТазы), формальдегиддегидрогеназы, глиоксилазы, глу-
татионпероксидазы, глутатионэстеразы, глутатионизомеразы и др.) проявля-
ется в детоксикации электрофильных низкомолекулярных соединений эндо-
генного происхождения и ксенобиотиков, в первую очередь гербицидов. Глу-
татионтрансферазы катализируют конъюгацию электрофильных и часто гид-
рофобных токсических соединений с глутатионом, образуя нетоксичные про-
изводные пептида, которые изолируются в вакуоли:
R-X + Г-SH -* Г-S-R + НХ
При стрессовых ситуациях увеличиваются биосинтез и содержание восста-
новленного глутатиона. И злаки, и широколиственные древесные растения с
высоким содержанием и активностью ГТаз более устойчивы к действию гер-
бицидов.
О производных Г—SH в вакуоли на основе субстратов эндогенного проис-
хождения известно мало. Ими могут быть антоциановые пигменты, флавоно-
иды, растительные гормоны.
Фитохелатины. Г—SH является предшественником фитохелатинов (ФХ) —
защитников растений от высоких концентраций тяжелых металлов: Cd, Zn,
Pb и др. Фитохелатины — семейство низкомолекулярных пептидных лигандов
(у-Глу-Цис)„-Гли (п = 2 — 5), которые образуют комплексы с ионами тяжелых
металлов и в таком виде транспортируются в вакуоль.
Например, чувствительность к кадмию проявляется в неспособности на-
капливать фитохелатины. У неустойчивых к кадмию мутантов арабидопсиса
cad2 с мутацией по гену у-глутамилцистеинсинтетазы концентрация Г—SH
снижена на 70 — 85 %, хотя растения при нестрессовых условиях выглядят нор-
мальными. При экспозиции на Cd2+ мутанты cad2 могут синтезировать фитохе-
латины в количестве только 10 % по сравнению с диким типом в тех же усло-
382
виях и в итоге погибают. Другой чувствительный к кадмию мутант арабидоп-
сис — cadi — не способен к синтезу фитохелатинов (не обнаруживается ак-
тивность ФХ-синтазы), но синтез глутатиона у него не нарушен. Таким обра-
зом, устойчивость к высоким концентрациям тяжелых металлов обусловлена
именно ФХ. Фитохелатирование служит механизмом удаления тяжелых метал-
лов в вакуоль или биоминерализацией.
6.3.4. КАЛЬЦИЙ
Содержание кальция в растениях составляет 0,5 —1,5 % от массы сухого ве-
щества, но в зрелых тканях кальциофильных растений может достигать 10%.
Надземные части накапливают на единицу массы больше кальция, чем корни.
Химические свойства кальция таковы, что он легко образует достаточно проч-
ные и в то же время лабильные комплексы с кислородными лигандами макро-
молекул. Кальций может связывать внутримолекулярные сайты белков, приво-
дя к изменению конформации, и образовывать мостики между лигандами ли-
пидов и белков в мембране или пектиновыми соединениями в клеточной стенке,
обеспечивая стабильность этих структур. Физиология обмена ионов Са2+, реа-
лизация его функций имеют ряд особенностей по сравнению с другими кати-
онами. К ним относятся: низкая цитоплазматическая концентрация Са2+, огра-
ниченная уровнем ~10~7 М; низкая метаболическая подвижность, что выража-
ется в низкой скорости накопления, транспорта из клетки в клетку, ограни-
ченного флоэмного транспорта и слабой реутилизации; безусловная и значи-
мая необходимость Са2+ для функционирования апопласта; ограниченная роль
Са2+ как непосредственного энзиматического кофактора; исключительная роль
Са2+ как вторичного посредника в регуляции сложных метаболических взаимо-
действий, связанных с ростом и развитием, и ответных реакций растительно-
го организма на различные воздействия. Описания нарушений в этих процес-
сах, вызванных дефицитом Са2+, относятся к классическим исследованиям
физиологии растений.
6.3.4.1. Распределение Са2+ в структурах клетки.
Функциональное значение компартментации
У растений кальций распределяется между большим числом компартмен-
тов клетки, чем у животных. Но подобно другим организмам, у растений кон-
центрация Са2+ в цитоплазме ([Са2+]цит) и ядре поддерживается на уровне,
который на 3—4 порядка величин ниже, чем в других клеточных структурах
(табл. 6.6). Предполагают, что низкая концентрация Са2+ в цитозоле — след-
ствие работы возникшего на самых ранних этапах эволюции приспособитель-
ного механизма «выкачивания», который обеспечивал поддержание в клетке-
организме уровень Са2+ ниже, чем в морской воде.
Наибольшая часть Са2+ запасается в клеточной стенке и вакуоли (табл. 6.6),
где его концентрация варьирует от 1 до 10 мМ. В апопласте кальций клеточной
стенки образует мостики между карбоксильными группами и таким образом
участвует в создании эффективного двойного слоя зарядов и способствует об-
разованию доннановского потенциала (см. рис. 6.10 и 6.11). Буферные свойства
383
Таблица 6.6. Распределение Са2+
в растительной клетке
Компартмент клетки Концентрация
Цитоплазма Ядро Вакуоль Клеточная стенка Эндоплазматический ретикулум Хлоропласт, пластида Митохондрия 100-200 нМ 10-20 нМ 1 — 10 мМ 1 — 10 мМ ~1 мМ ~1,5 мМ ~1 мМ
апопласта, поддержание pH в клеточ-
ной стенке, проницаемость и структур-
ная стабильность плазмалеммы также в
значительной мере связаны с Са2+. Доля
Са2+ апопласта от общего содержания в
тканях может достигать 50 % и при
уменьшении доступного кальция в сре-
де его доля в апопласте обычно возрас-
тает. В вакуоли Са2+ находится в виде
солей фосфата, карбоната, органичес-
ких кислот или в соединении с танни-
нами. При повышенном снабжении по-
ступление Са в вакуоль увеличивается.
Поскольку вакуоль занимает 90 — 95 %
клеточного объема, подавляющая часть
кальция может находиться именно в этом компартменте. Фактор концентри-
рования Са2+ в вакуоли может достигать величины порядка 105 по сравнению с
цитозолем. Один из способов выведения Са2+ из цитозоля и в целом из обмена —
образование в вакуоли и апопласте кристаллов оксалата кальция, нераствори-
мых в воде.
Хранилищем, из которого Са2+ вновь поступает в цитозоль, является и эн-
доплазматический ретикулум (ЭР), где его концентрация составляет, по кос-
венным данным, 1 мМ (табл. 6.6). Цистерны аппарата Гольджи и везикулы
также могут быть местом накопления и высвобождения кальция. В митохондри-
ях и хлоропластах концентрация кальция значительно превышает концентра-
цию в цитозоле, что не связано с функцией изоляции Са2+, но необходимо
для протекания в этих органоидах окислительно-восстановительных процессов
и фотохимических реакций.
6.3.4.2. Системы транспорта кальция
Содержание кальция в отдельных структурах клетки регулируется с участи-
ем Са2+-помп и Са2+-каналов (рис. 6.54). Градиент электрохимического потен-
циала для Са2+ на плазмалемме (ПМ), тонопласте (ВМ) и мембране ЭР таков,
что поступление Са2+ в цитозоль происходит по каналам пассивно, а удаление
с участием помп — с затратой энергии.
Низкая концентрация кальция в цитозоле — необходимое условие для функ-
ционирования Са2+ в качестве универсального посредника при передаче инфор-
мации. Реализация функций мессенджера связана с очень малыми его потоками
через мембраны. Разнообразные стимулы (гормоны, свет, механические воздей-
ствия, гипоосмотики и окислители, засуха, низкая и высокая температура, Nod-
фактор, сигналы межклеточных взаимодействий, гравиотропизм и др.) через
быстрое изменение потенциала клеточной мембраны приводят к открыванию
Са2+-каналов и возрастанию его концентрации в цитозоле. Возвращение кон-
центрации Са2+ к стационарному уровню покоя обеспечивается работой Са-
АТФаз. Такое изменение концентрации Са2+ в цитозоле названо нестационар-
ным, или переходным (transient), состоянием. Локальное и часто кратковре-
менное увеличение концентрации Са2+ в цитозоле действует как сигнал,
384
Са2+-АТФаза ПМЗ
cd
О
Са2+-АТФаза ПМ1
Са2-АТФаза ЭР
ЭР
[Са2+] = 1мМ
ЭРУОСа2+-кан
ИФ3 Са2+-кан
Цитозоль
[Са2+]=100-200нМ [ИФ3]
VD-мех Са2+-кан
VD Са2+-кан
Макси «Кат»-кан
Са2+-АТФаза ПМ2
Вакуоль ВИФ3 Са? ‘-кап
S
S
н
ФЛ «С»
S
ж
5
ж
пм
Н+-АТФаза
Са
Са2+/Н+-АП
цАДФРиб Са2+-кан
[Са2+] = 1-10мМ
SVD Са2+-кан
BVD
[Са2+]цит
Са2+-кан
С
Стимул |
пм
е
к
е
Н
Рис. 6.54. Основные системы транспорта Са24 в мембранах растительных клеток. Слева
представлены Са2+-помпы (по Evans, Williams, 1998; Geisler et aL, 2000; Hirschi, 2001);
справа — Са2+-каналы (no Fox, Guerinot, 1998; Sanders et aL, 1999; White, 1998, 2000;
Blatt, 2000):
ПМ — плазмалемма; В — вакуоль; BM — вакуолярная мембрана; ЭР — эндоплазматический
ретикулум; АП — антипортер; кан — канал; VD (voltage-dependent) — потенциалзависимый
(потенциалуправляемый); Рец — рецептор; G-бел — регуляторные G-белки плазмалеммы, со-
стоящие из субъединиц а, р, у; ФЛ «С» — фосфолипаза «С»; ФИФ2 — фосфоинозитол-4,5-
бисфосфат\ИФ3 — инозитол-(1,4,5)-фосфат; цАЦФРиб — циклическая АДФ-рибоза; (+) —
активация соответствующими лигандами. Са2+-помпы: Са24 АТФазы P-типа (ПМ1, ПМ2 и ПМЗ)
и ЭР-типа; антипортер — Са2+/Н+-АП. Потенциалзависимые (кальциевые каналы) (VD Са2+-кан):
на ПМ: макси «Кат»-кан — неспецифичный макси-катионный канал; VD Са24-кан — Са2+-спе-
цифичный; VD-MexCa24-KaH — механочувствительный канал (активируется гиперполяризаци-
ей); на вакуолярной мембране: BVD Са24-кан — потенциалуправляемый (активируется гиперполя-
ризацией), SVD Са +-кан — медленно (slowly) активируемый деполяризацией; на мембране ЭР
локализован 3PVD Са2+-кан. Лигандо-управляемые кальциевые каналы: на ВМ: ИФ3-активируе-
мый ВИФ3 Са +-кан; цАДФРиб-активируемый, предположительно имеющий рецептор риано-
дина цАЦФРиб Са +-кан; на ЭРМ: рецептор-управляемый канал — ИФ3Са2+-кан (более подроб-
ную характеристику см. в тексте)
передающий информацию от поверхности клетки внутрь. Кальциевый сигнал
может усиливаться за счет дополнительного выхода Са2+ в цитозоль из вакуоли
или ЭР.
Са2+-помпы. Выкачивание Са2+ из цитозоля осуществляют Са2+-АТФазы,
которые принадлежат к большому семейству АТФаз P-типа, и Са2+/Н-анти-
портеры.
13 Физиология растений
385
Са2+-АТФазы растений и животных подразделяют на помпы: ПМ (или ПВ)-
типа, стимулируемые кальмодулином (КаМ), и ЭР (или ПА)-типа, которые
непосредственно КаМ не стимулируются. У растений в отличие от животных
Са2+-АТФазы ПМ-типа локализованы не только на плазмалемме (Са2+-АТФаза
ПМ1), но и на эндомембранах (Са2+-АТФаза ПМ2 и ПМЗ) (рис. 6.54). Са2+-
АТФазы ЭР-типа также присутствуют как на мембране ЭР, так и на тонопла-
сте. На тонопласте, помимо Са2+-помпы, функционирует Са2+/Н+-антипортер.
Выкачивание Са2+ из цитозоля с участием антипортера сопряжено с работой
вакуолярной Н+-АТФазы, для которой гомеостатирование кальция считается
конститутивной функцией. Более того, вакуолярная Н+-АТФаза, пирофосфа-
таза (Н+-ПФаза) и Са2+/Н+-антипортер совместно участвуют в поддержании
pH и ионного гомеостаза в цитозольном и вакуолярном компартментах. Неко-
торые Са2+-АТФазы и Са2+/Н+-антипортеры идентифицированы на генном
уровне.
Итак, Са2+-помпы выполняют несколько важных функций. Наряду с цент-
ральной — поддержание низкой концентрации кальция и создание фона для
возникновения кальциевого сигнала — они обеспечивают создание пулов Са2+
в апопласте, вакуоли, ЭР, откуда он может контролируемо возвращаться в
цитозоль. Функционирование Са2+-АТФаз, связанное с восстановлением [Са2+]цит
до уровня покоя, одновременно обеспечивает завершение переходного состо-
яния и, таким образом, формирование Са2+-сигнала (см. подразд. 6.3.4.3).
Са2+-каналы. Кальциевые каналы подразделяют на две группы: потенциал-
зависимые (VD — voltage-dependent) и рецепторуправляемые, или лигандоза-
висимые. К настоящему времени изучены электрические и биохимические свой-
ства, регуляция и физиологическая роль ряда кальциевых каналов из разных
мембран растений, но пока не осуществлена их идентификация на генетиче-
ском уровне.
В плазмалемме клеток, главным образом корней и замыкающих клеток ус-
тьица, обнаружено несколько VD Са2+-каналов, которые могут быть подразде-
лены на каналы, активируемые при деполяризации и при гиперполяризации
плазмалеммы. К первому классу относится так называемый «макси-катионный
канал» (рис. 6.54), который имеет высокую проводимость единичного канала,
но малоселективен. Он пропускает К+, Na+, Ва+, Mg2+, Мп+ и некоторые дру-
гие ионы, хотя вход Са2+ через этот канал при физиологических концентраци-
ях ионов, видимо, доминирует. Другой Са -канал, также активируемый при
деполяризации (VD Са2+-канал), более селективен для Са2+, но имеет мень-
шую проводимость. Неселективные каналы, очевидно, служат основными во-
ротами поступления кальция в клетку из внешней среды, например в кор-
нях, или из апопласта в устьичные клетки листа. В класс VD Са -каналов
плазмалеммы, активируемых при гиперполяризации, входят механочувстви-
тельные (stretch-activated) каналы разных типов, в том числе и Са -канал
замыкающих клеток устьица, который регулируется АБК, — VD-мех Са -ка-
нал (рис. 6.54). У других клеток подобные каналы также могут иметь большое
значение в восприятии тургора, например при удлинении корневого волоска
и пыльцевой трубки.
На тонопласте функционируют потенциалзависимые каналы, активирую-
щиеся при гиперполяризации — BVD Са2+-канал и при деполяризации — мед-
ленный (slowly) SVD Са2+-канал (рис. 6.54). Оба типа VD-каналов не являются
386
строго специфичными для Са2+ и проницаемы также для Mg2+, К+; SVD Са2+-
канал проницаем также и для Na+, Rb+, Cs+. Выход Са2+ через SVD Са2+-
канал активируется, помимо потенциала, при увеличении [Са2+]цит и регули-
руется другими факторами (pH, концентрацией других ионов, соотношением
[Са2+]цит/[Са2+]вак, КаМ, 14-3-3-белками и, возможно, состоянием фосфори-
лированное-дефосфорилированное). Функции SVD Са2+-канала связывают с
осморегуляцией и поддержанием гомеостаза. Кроме того, через этот канал про-
исходит Са2+-индуцируемое высвобождение Са2+ из вакуоли (CICR — Са2+
induced Са + release), что приводит к увеличению его концентрации в цитозоле
и вносит вклад в специфичность сигнала (см. подразд. 6.3.4.3).
Из вакуоли Са2+ выходит также через рецепторуправляемые каналы, которые
открываются при рецепции вторичных мессенджеров: инозитол-1,4,5-фосфата
(ИФ3 — инозитолтрифосфат) или циклической АДФ-рибозы (цАДФриб)
(рис. 6.54). С активацией этих вакуолярных каналов связаны ответные реакции на
гиперосмотический (ВИФ3 Са2+-кан) и холодовой (цАДФриб Са2+-кан) шок.
В ответ на действие АБК при закрывании устьиц активируются оба эти канала.
В мембране ЭР также присутствуют потенциал- и лигандозависимые Са2+-
каналы. Одним из первых каналов ЭР мембраны растений был охарактеризован
потенциалзависимый механочувствительный канал (3PVD Са2+-кан) (рис. 6.54)
из усиков переступня двудомного {Bryonia dioica) (назван ВСС1 — Bryonia calcium
channal). Предполагают, что ВСС1 регулируется через изменение концентрации
кальция в люмене ЭР, хотя pH цитозоля также влияет на его активность. С ИФ3
Са-каналом ЭР мембраны связывают увеличение [Са2+]цит и передачу инфор-
мации в растущей пыльцевой трубке.
Итак, в растительной клетке в ответ на действие разных стимулов увеличи-
вается концентрация кальция в цитозоле, что является Са2+-сигналом для пе-
редачи информации. Первичными источниками изменений концентрации яв-
ляются Са -каналы с разными пропускными характеристиками, разными спо-
собами регуляции и расположенные на плазмалемме и эндомембранах. Разно-
образие путей входа Са2+ в цитозоль вместе с разнообразием путей выхода
(Са +-помпы) создают большую гибкость в контроле за его потоками как в
пространстве клетки, так и во времени, и обеспечивают возникновение спе-
цифического Са -сигнала, локализованного в связи с участием каналов раз-
ных типов в определенных участках клетки.
6.3.4.3. Са2+ и системы внутриклеточной сигнализации
Изменение программ роста и развития, контроль метаболизма и формиро-
вание ответных реакций на действие условий среды происходят вследствие
передачи сигналов на белки-мишени или в геном по сложной сети информа-
ционных (сигнальных) путей. В клетке информация передается цитозольным
структурам и компартментам через изменения концентраций множества вто-
ричных мессенджеров (посредников), которые действуют в той или иной сиг-
нальной системе вместе с кальцием или самостоятельно. Однако Са2+ в комп-
лексной сети передачи информации (transduction) служит универсальным по-
средником, поскольку ни один вторичный мессенджер не реагирует на столь
большое число стимулов, как свободный Са2+ цитозоля. Включение Са2+ в
широкую сеть сигнальных путей, которые передают послания от разных сти-
387
мулов (внешних и внутренних) и заканчиваются соответствующими ответны-
ми реакциями, поднимает вопрос о том, каким образом в растительной клет-
ке с участием одного и того же мессенджера достигается специфичность со-
пряжения стимула и ответа.
Специфичность Са2+-сигнала. Исходно в основе специфичности кальциевой
сигнализации лежит компетентность клетки, ее функциональное предназна-
чение. Способность реагировать на определенные стимулы и формировать со-
ответствующий ответ зависит от экспрессии генов, кодирующих компоненты
каскадного пути передачи конкретного сигнала в соответствующих клетках.
Комплекс характерных свойств клетки, определяющий особенность ее сиг-
нальной системы, получил название «физиологического адреса», который раз-
личается у разных клеток (например, у замыкающих клеток устьиц и трихо-
бластов корня). Информация от стимулов, включая силу их воздействия, пер-
воначально кодируется в кальциевом сигнале, отражающем характер возраста-
ния концентрации Са + в цитозоле ([Са2+])цит. Это переходное (транзитное) со-
стояние может иметь вид всплесков, волн, пульсаций или осцилляций, плато,
градиента или быть сочетанием этих проявлений (рис. 6.55). Основные варьиру-
ющие параметры Са -сигнала, которые могут быть оценены количественно,
это: уровень увеличения [Са2+]цит; продолжительность лаг-периода от момента
воздействия до начала подъема [Са2+]; продолжительность подъема, нахожде-
ния на высоком уровне и возвращения к уровню покоя. Сигнальная информа-
ция может быть закодирована в амплитуде и частоте осцилляций (пульсаций),
а также их регулярности. Даже самое общее сравнение характера Са2+-сигналов
при действии разных стимулов (рис. 6.55) свидетельствует об их разнообразии:
кратковременное (холодовой шок) или очень продолжительное (красный свет)
увеличение [Са +]цит; появление двухфазной кинетики переходного состояния
(гипоосмотический шок) или образование градиента концентрации Са2+ (рас-
тущий корневой волосок). Кинетика изменения концентрации Са2+ может ме-
няться в зависимости от силы и продолжительности действия стимула. Однако
только в редких случаях величина изменения [Са2+]цит и конечная ответная
реакция на стимул коррелируют со степенью его воздействия. Это обусловлено
множеством причин, в частности тем, что стимул (фактор) в своем действую-
щем начале имеет две составляющие: само воздействие (физическое, химиче-
ское или комплексное) и параметры времени. При холодовом шоке, например,
увеличение уровня [Са2+]цит (которое начинается сразу) (рис. 6.55, 1) зависит
не от абсолютного значения низкой температуры, а от скорости ее снижения.
При действии многих стимулов увеличение [Са2+] в цитоплазме связано с ос-
цилляциями (пульсациями), которые имеют определенную амплитуду и час-
тоту и могут повторяться через менее или более регулярные интервалы (рис.
6.55, 4, 6). Характер осцилляций также определяет специфику Са-сигнала.
Разнообразие свойств и способов регуляции Са2+-каналов является осно-
вой, обеспечивающей взаимодействие путей передачи сигналов с участием
разных посредников. Идентифицирован ряд вторичных мессенджеров, которые
связаны с возникновением и спецификой Са2+-сигнала (ИФ3, цАДФриб, Н+ и
др.). Инозитол-1,4,5,-фосфат — конечный продукт превращения минорного
компонента плазмалеммы фосфатидилинозитола (ФИ), но непосредственным
предшественником ИФ3 является ФИФ2 (ФИ-4,5-бисфосфат) (см. рис. 6.54).
При рецепции определенных стимулов активируются регуляторные G-белки
388
Стимул Ответная реакция Характер возрастания [Са2+]цит (подъем—высокий уровень—спад)
1. Холодовой шок Экспрессия генов COR, KIN-1; синтез пролина; изменения состава липидов; акклимация к холоду \ Кратковременное X. увеличение: 0—(4—5)—30(c)
2. Гипоосмоти- ческий шок Осмоадаптация Двухфазная Г\ / \ динамика: / Су 30—60 —150(c) 1 1 мин
3. Красный свет Фотоморфогенез / Продолжительное стацио- 1 / нарное состояние: 30-150—420 (мин) " сигнал
4. АБК и потенциал на мембране Закрывание устьиц . Осцилляции с большим периодом (мин) и центро- У \ |WA У стремительная волна Г \(не указана), которая рас- J пространяется 5—10 с и 11 ми[) релаксируется за 40—50 с
5. Сигналы межклеточного взаимодействия Полярный рост кончиком корневого волоска . Са2+-АТФаза —Са2-канал У Продолжительный ' и устойчивый градиент с максимумом у кончика
6. Nod-фактор Скручивание корневых волосков, образование клубеньков Продолжительное \ увеличение через 5 мин Т и осцилляция в области 1 q) т ад₽а ядро
Рис. 6.55. Особенности переходного состояния [Са2+]цнт в зависимости от стимулов (по
данным: 1 — Malho et al., 1998; Plieth et aL, 1999; 2 — Malho et aL, 1998; Cessna et aL,
1998; 3 — Malho et aL, 1998; Legue et aL, 1997; 4 — Grabov, Blatt, 1998; Staxen et aL,
1999; Blatt, 2000; Hamilton et aL, 2000; 5 — Bibikova et aL, 1997; Wymer, Bibikova, 1997;
6 — Cardenas et aL, 1999, 2000).
Время в секундах (с) или минутах (мин) указывает па продолжительность:
подъема —высокого уровня —спада [Са2+]цит; стрелкой отмечен момент воздействия
плазмалеммы, в результате этого диссоциирует их а-субъединица, активирую-
щая фосфолипазу С (ФЛ «С»)*. Активированная ФЛ «С» гидролизует ФИФ2 с
* Активированные G-белки передают сигнал и другим фосфолипазам плазмалеммы, а также
циклазам и каналам, которые в свою очередь участвуют в образовании вторичных мессенджеров.
389
образованием двух вторичных мессенджеров: 1,2-диацетилглицерола (ДАГ*) —
активатора протеинкиназы С и ИФ3 — регулятора активности Са2+-каналов
эндомембран (его считают основным участником формирования Са2+-волны).
Другой распространенный вторичный мессенджер животных и растительных
клеток — цАДФриб также действует как сигнальная молекула, активирующая
выход Са2+ из эндогенных депо.
Поступление кальция в цитозоль через рецепторуправляемые Са2+-каналы
эндомембран вносит дополнительный (к притоку Са2+ извне) вклад в увеличе-
ние [Са2+]цит и приводит к возникновению и поддержанию осцилляций (на-
пример, в базальной части растущей пыльцевой трубки, при осмотическом
стрессе, при действии АБК в замыкающих клетках устьица) (рис. 6.55, 4). Та-
ким способом сигнальная информация не только кодируется по амплитуде и
частоте всплесков, но с помощью осцилляции сигнал усиливается и меняется
по продолжительности, что обеспечивает регуляцию его передачи во времени.
Специфичность Са2+-сигнала обусловлена также его локализацией в клетке
и, если это касается такой формы сигнала как градиент или волна, — векто-
ром их распространения. Разный характер увеличения концентрации Са2+ в
цитозоле может быть результатом его поступления из разных депо (апопласт,
вакуоль, ЭР) через разнообразные Са2+-каналы, а снижение [Са2+]цш при воз-
вращении к уровню покоя (новый уровень может не совпадать с исходным) за
счет работы Са2+-АТФаз разных мембран (см. рис. 6.54). В клетках, растущих
кончиком (трихобласт, пыльцевая трубка и др.), сигналом ориентированного
роста служит градиент с высокой концентрацией Са2+ в растущем кончике
(см. рис. 6.55, 5). Основой поддержания этого градиента является простран-
ственное разделение входа Са2+ в цитозоль по Са2+-каналам плазмалеммы в
зоне активного роста кончика и выкачивания Са2+-АТФазами плазмалеммы и
эндомембран в базальной части клетки корневого волоска. При воздействии
Nod-фактора, вызывающего образование азотфиксирующих клубеньков у бо-
бовых, кальций также поступает извне через Са2+-каналы кончика корневого
волоска (см. рис. 6.55, 6). Но Са2+-сигнал проявляется как быстро нарастающее
увеличение [Са2+]цит и всплески в области ядра, что приводит к скручиванию
корневого волоска и смене программ дифференциации и функционирования.
Образование всплесков, осцилляций, волн, градиентов концентрации Са2+
цитозоля, их разнообразных субпроизводных и сочетаний, а также различия в
динамике и локализации изменений [Са2+]цит отражают комплексность систе-
мы формирования Са2+-сигнала в каждой отдельной клетке. Возникающий в
ответ на определенный стимул Са2+-сигнал настолько специфично кодирует
информацию, что получил название Са+ -подписи (Са2+ signature). Подобный
специфичный Са2+-сигнал — первый этап возникновения специфичной ответ-
ной реакции.
Пути передачи Са2+-сигнала. Зашифрованная информация для достижения
нужных белков-мишеней, определяющих ответ на стимул, передается по сиг-
нальным путям благодаря образованию комплексов кальция со специальными
белками. К группе регуляторных белков растений, связывающих Са2+, относят-
* ДАГ и продукты активации ФЛ «С» и «А», вероятно, остаются в плазмалемме, где могут
добавочно модифицировать функции мембранных белков. ФИФ2 и другие фосфолипиды могут не-
посредственно связываться с компонентами цитоскелета, изменяя их конформацию и функции.
390
ся: кальмодулин — КаМ (СаМ — calmodulin); Са2+-зависимые протеинкиназы —
Са2+-завПК (CDPKs — calcium dependent protein kinases) и Са2+/КаМ-зависи-
мые протеинкиназы — Са2+/КаМ ПК (CCaMKs — calcium and calmodulin
dependent protein kinases) (рис. 6.56). Эти белки имеют специальные места
связывания Са2+, называемые EF-руками. Термин возник из обозначения двух
а-спиралей, Е и F, являющихся частью Са2+-связывающего центра. Часто бел-
ки, имеющие подобные домены связывания кальция, называют, как группу
регуляторных белков, «EF-рука».
Са +-завПКзы принадлежат к одной из групп суперсемейства протеинкиназ
(ПК) эукариотических клеток. ПКазы катализируют обратимый перенос фос-
фата с АТФ на боковые участки аминокислот белковой цепи. Функции ПК
могут быть обращены действием протеиновых фосфатаз (ПФФ). Реакции фос-
форилирования-дефосфорилирования оказывают значительное воздействие на
активность белков и их взаимодействие с другими белками. Са2+-завПКазы имеют
три функциональных домена — каталитический, автоингибиторный и С-тер-
минальный кальмодулинподобный регуляторный домен с четырьмя EF-рука-
ми, связывающими Са2+. Это позволяет считать Са2+-завПКазы (как и КаМ)
первичными сенсорами путей передачи Са2+-сигнала (рис. 6.56, 4а, 46). Впер-
вые Са +-завПКзы были обнаружены у растений и простейших и пока не най-
дены в клетках дрожжей и животных. Считают, что у растений большая часть
киназной активности, которая стимулируется кальцием, связана именно с Са2+-
завПКазами (меньшая — с Са2+/КаМ ПКазами и КаМ). Обнаружено множество
изоформ Са -завПКаз (у Arabidopsis идентифицировано более 40 изоформ). Это
ставит вопрос о функциях этих изоформ. Есть основание полагать, что разные
изоформы могут «специализироваться» на узнавании Са2+-сигналов. Постоян-
но пополняемый список белков-мишеней для Са2+-завПК включает транспорт-
ные белки мембран (Н+АТФазу ПМ, калиевые и анионные каналы замыкаю-
щих клеток устьиц, аквапорины и др.), ферменты (сахарофосфатсинтазу (СФС),
фосфоенолпируваткарбоксилазу (ФЕПК), нитратредуктазу (HP), фосфатиди-
линозитолкиназу и др.), факторы транскрипции, элонгации, белки цитоске-
лета и другие мишени (рис. 6.56, 5). Таким образом, Са2+-завПК включены в
передачу Са2+-сигнала, связанную с поддержанием мембранного потенциала,
регуляцией углеводного и азотного обмена, устьичными движениями, ответа-
ми на стрессовые воздействия, формированием архитектуры клетки и т.д.
Однако, по-видимому, полная активация фермента при фосфорилирова-
нии с участием Са -завПКаз возможна, если к регуляторному участку одно-
временно присоединяется 14-3-3-белок. Оба компонента включены в передачу
сигнала и функционируют как адаптеры, шапероны, активаторы и репрессо-
ры. Они участвуют в регуляции активности СФС, HP, ФЕПК, что обеспечива-
ет согласованное функционирование этих ферментов в условиях дня и ночи.
14-3-3-белкам приписывается также роль обеспечения взаимосвязи между раз-
личными путями передачи сигналов, которые вызываются разными, действу-
ющими одновременно стимулами (экзогенными и эндогенными).
Кальмодулин (КаМ) относится к семейству белков «EF-рука» и является
наиболее распространенным Са2+-связывающим белком, который играет цен-
тральную роль у всех организмов. Растительные КаМ — высококислые белки с
молекулярной массой 14 кДа, локализованные в цитозоле (обнаружены в ядре
и, возможно, прикреплены к плазмалемме). КаМ эукариотных организмов
391
обладает большой консервативностью: аминокислотные последовательности
белка растений идентичны КаМ позвоночных и дрожжей на 90 и 60 % соответ-
ственно. Но у растений, в отличие от животных, обнаружены мультигенные
семейства КаМ-родственных генов, экспрессия которых индуцируется физи-
ческими (касание, тепловой и холодовой шок, темнота-свет) и химическими
(ауксин, NaCl) стимулами. Индуцированная экспрессия некоторых из этих
КаМ-генов опосредована увеличением [Са2+]цит (рис. 6.56, 4в). Предполагает-
ся, что характер их экспрессии, заканчивающийся появлением изоформ КаМ
(рис. 6.56, 6), и/или конечные мишени сигнального пути (рис. 6.56, 5, 5а, 5в)
392
Рис. 6.56. Общая схема путей передачи Са2+-сигнала на мишени и ответная реакция
растительной клетки на разные стимулы (Н.Д. Алехина, 2004):
Рев: — рецепторы на плазмалемме и эндомембранах; [Са2+] — концентрация Са2+; КаМ и
Са +-КаМ — кальмодулин и его комплекс с Са +; Са +-завПК и ПФФ — Са +-зависимые проте-
инкиназы и протеинфосфатазы; Са '/КаМ ПК, ПФФ — кальций и кальмодулинзависимая про-
теинкиназа, ПФФ; (+++) — деполяризация мембран; 1—6 — последовательность событий при
восприятии стимула, возникновении Са '-сигнала и путей его передачи (downstream transduction):
1 — рецепция различных абиотических (свет, холод, температура, гипоксия, засуха, ветер,
механические воздействия и др.) и биотических (фитогормоны, патогены, симбионты и др.)
стимулов, изменение мембранного потенциала (+ + +) и активация Са '-каналов; 2 — инфлакс
Са ' через каналы в цитозоль из внешней среды и внутриклеточных депо и кратковременное
увеличение [Са ']цит; 3 — выкачивание Са ' благодаря работе Са '-помп, окончание переходного
состояния [Са ']цит; 4 — связывание Са ' с первичными сенсорами (4а — Са +-завПКазами и
ПФФазами; 46 — образование комплекса Са '-КаМ; 4в — индукция синтеза КаМ); 5 — активация
белков-мишеней: 5а, 56 — при каскадной передаче через активацию Са '/КаМ ПК или ПФФ; 5в —
регуляция экспрессии генов через Са '-КаМ-комплекс или с участием Са '/КаМ ПФФ; 6 —
общие ответные реакции на стимул (быстрые или более медленные, если включается геном)
различаются в зависимости от стимула. Таким образом, наличие изоформ КаМ
значительно расширяет возможности адресной доставки сигнала. КаМ и комп-
лекс Са2+-КаМ не обладают свойствами фермента и включаются в передачу
сигнала и регуляцию клеточных процессов, присоединяясь к белкам-мишеням.
Связывающий кальций центр КаМ имеет структуру спираль—петля — спираль.
Петля, где связывается Са2+, состоит из 12 аминокислот и ограничена с С- и
N-концов а-спиральными участками, состоящими также из 12-14 аминокис-
лот и обозначенными буквами Е и F. Разные Са2+-связывающие белки могут
иметь разное число центров для связывания Са2+. Кальмодулины растений имеют
четыре функциональные «EF-руки» с Са2+-связывающими доменами. Связы-
вание Са2+ при увеличении его концентрации в цитоплазме вызывает про-
странственную переориентацию аминокислот в петле и а-спиралях и пере-
упаковку этих центров, связывающих Са2+, в структуре всего КаМ-белка. Пе-
редача сигнала становится возможной, если эти конформационные перестрой-
ки «узнаются» белками-мишенями, которые, в конечном итоге, преобразуют
изменения концентрации Са2+ в цитозоле в ответ на специфический сигнал
(рис. 6.56, 5).
Концентрация КаМ в цитозоле может составлять 5 — 20 мкМ и варьирует в
разных типах клеток. Это предполагает вероятность конкуренции за КаМ меж-
ду КаМ-связывающими белками, что может играть роль в детерминировании
клеточного ответа на увеличение [Са2+]цит. Взаимодействие между Са +-КаМ и
КаМ-регулируемыми белками главным образом гидрофобное, и даже незна-
чительные модификации последовательностей на гидрофобном прикрепля-
ющем участке КаМ могут лишить его возможности активировать белки-ми-
шени.
Важное отличительное свойство Са2+-КаМ-комплекса — способность свя-
зываться с большим числом разнообразных белков-мишеней. Са -КаМ-комп-
лекс активирует непосредственно или через модификацию реакций фосфори-
лирования-дефосфорилирования много больше 100 белков. У животных иден-
тифицировано более 30 ферментов и других белков, которые регулируются
Са-КаМ. В растительной клетке таких белков идентифицировано и охаракте-
ризовано значительно меньше. Са2+-КаМ-зависимыми являются: Са +-АТФазы
393
II В-типа; SV — вакуолярный катионный канал; НАД-киназа, глутаматдекар-
боксилаза, супероксиддисмутаза; миозин V, киназин; ПКазы и ПФФаза 2В,
белки кончика корня и некоторые другие (см. рис. 6.56, 5, 5а).
Мишенями, на которые передаются Са2+-сигналы, часто являются транс-
портные системы, в том числе Са2+-помпы. Са2+-АТФазы II В-типа обеспечи-
вают регуляцию [Са2+]цит, необходимую для возникновения Са2+-сигнала, оп-
ределяют характер переходного состояния, связанный с завершающей стади-
ей, и в то же время сама их активность регулируется с участием Са2+-КаМ.
Са2+-АТФазы II В-типа являются компонентами не только плазмалеммы, но и
эндомембран (см. рис. 6.54), и, возможно, локализованы в оболочке ядра. КаМ
регулирует активность Са2+-помпы, связываясь на автоингибиторном домене
С-конца, что меняет пространственное расположение этого участка и снимает
его блокирующее действие. У растительных Са2+-АТФаз (по крайней мере у не-
которых: АСА2 — Arabidopsis Са2+-АТФазы, локализованной на мембране ЭР,
и SCA1 — soybean Са2+-АТФазы, локализованной на ПМ) КаМ-связывающий
домен находится не на С-конпе, а на N-терминале. У растений, как и у живот-
ных, КаМ-зависимые Са2+-АТФазы эндоплазматического ретикулума могут
быть ведущими в регуляции и поддержании осцилляций и волны [Са2+]цит.
Комплекс Са2+- КаМ может включаться в каскадную передачу Са2+-сигнала,
взаимодействуя с киназами, относящимися к группе кальций/кальмодулинза-
висимых протеинкиназ (Са2+/КаМ ПК) (см. рис. 6.56, 5а). Эти ПК имеют не
четыре, как Са2+-завПК и КаМ, а три «EF-руки» на регуляторном домене. Са2+-
КаМ связывается на сайте автоингибиторного домена, вследствие чего, как
предполагают, происходит активирование Са2+/КаМ-протеинкиназы, которые
могут выполнять специальные функции в каскадной передаче сигнала. Это обус-
ловлено их субстратной специфичностью, субклеточной локализацией и чув-
ствительностью к кальцию, которые не совпадают с подобными характерис-
тиками у Са2+-завПК. Параллельно с митогенактивируемыми протеин киназа-
ми (МАПК) Са2+/КаМ-протеинкиназы регулируют экспрессию гена, фосфо-
рилируя фактор транскрипции при получении Са2+-сигнала (см. рис. 6.56, 5в).
Действие протеинкиназ может быть нейтрализовано или обращено проте-
инфосфатазами. По существу, именно баланс фосфорилирования—дефосфо-
рилирования белков регулирует многочисленные реакции и процессы в клетке
и включен в систему передачи сигналов. ПФФазы (как и ПКазы) подразделя-
ют на две большие группы по субстратной специфичности аминокислот (се-
рин/треонин либо тирозин) в сайте, где связывается и отщепляется фосфат-
ная группа. В группу Сер/Тре ПФФ входит четыре семейства, среди которых
ПФФазы 2В-типа являются Са2+-КаМ-зависимыми. Сведений о ПФФазах зна-
чительно меньше, чем о ПКазах. Установлено, что они не только выполняют
функции контрагентов киназ, но также играют ведущую роль во многих сиг-
нальных каскадах: при передаче сигнала от АБК на ионные каналы в замыка-
ющих клетках устьиц, при стрессовых ответах на патогены, при регуляции
роста корневого волоска, при свето- и гравиотропизмах и т.д.
У животных наиболее изучена Са2 ' -КаМ ПФФаза кальцийнейрин (КН). В клетках
A. taliana также обнаружена ПФФаза, подобная КН. Она взаимодействует с
Са2+-КаМ и активируется при возникновении Са2+-сигнала. КН — гетероди-
мер, состоящий из консервативной каталитической субъединицы A-типа (объе-
динена с одной из вариабельных субъединиц) и регуляторной субъединицы
394
В-типа (КНВ, где В — буква латинского алфавита). В корнях и стебле арабидоп-
сиса присутствует 6 изоформ КНВ, синтез одной из них активируется при
действии засухи, холода, ветра. Наличие изоформ у КНВ и КаМ значительно
увеличивает число возможных комбинаций при их совместном регулировании
активности белков-мишеней, расширяя спектр специфичности ответов.
Функция КНВ может быть связана с прикреплением фермента к цитоскеле-
ту или мембране: это определит место в пространстве, где будет проявляться
дефосфорилирующая активность. Предполагают, что КН может являться од-
ним из компонентов трансдукона — большого комплекса разнообразных бел-
ков плазмалеммы, включенных в каскад стимул-ответ. Например, трансдуксон
может служить системой поддержания и регуляции тургора и объединять ре-
цепторы, вторичные мессенджеры, К+- и Са2+- и анионные каналы, Са-ПКазу
и КН, Са2+-АТФазу и КаМ, если помпа активирована. Подобный трансдукон
может быть включен в разнообразные двигательные реакции растений (усть-
ичные движения, тропизмы, настии и т.д.). Возможно, КН — один из компо-
нентов механизма контроля ионных потоков из среды в корни.
С реакцией дефосфорилирования связывают еще одну важную функцию —
декодирование информации, зашифрованной в виде пиков и осцилляций каль-
циевого сигнала. Модель дешифровки этой информации предполагает совмес-
тное функционирование ПКаз и ПФФаз, имеющих разную кинетику Са -
зависимой активации.
Итак, передача Са2+-сигнала на белки-мишени может происходить разны-
ми путями с участием первичных сенсоров (Са2+-ПКазы, КаМ) либо по более
длинным каскадным путям (см. рис. 6.56). При этом через КаМ, ПК и ПФФ,
имеющих множество изоформ, осуществляются специфическое декодирова-
ние Са2+-сигнала и передача информации к нужному белку-эффектору (мише-
ни). Часто белками-мишенями становятся Са -каналы, Са -АТФазы и другие
ионные каналы и помпы. Мишенями для сигналов, передаваемых по различным
Са2+-зависимым сигнальным путям, могут быть отдельные ферментные систе-
мы, цитоскелетные белки, белки факторов транскрипции и др. (см. рис. 6.56).
Ответные реакции, связанные с Са-сигнализацией, ранее подразделяли
на быстрые, происходящие на пост-трансляционном уровне, и медленные,
связанные с экспрессией генома. В настоящее время быстрый и медленный
ответы рассматриваются как разные стадии одного общего процесса адаптив-
ной модификации метаболизма. Связанная с экспрессией генома Са +-сигна-
лизация часто сочетается с гормональной регуляцией процессов, это еще больше
осложняет расшифровку сети разных путей передачи сигнала в клетке.
6.3.5. КАЛИЙ
Условия внешней среды, в которых существуют растения, часто меняются
и могут вызывать дисбаланс их внутренней среды. Однако для протекания ме-
таболических процессов необходимо поддерживать относительно постоянны-
ми клеточный объем, осмотическое давление, трансмембранный потенциал,
равновесие зарядов, катионно-анионный баланс, pH — все то, что составляет
гомеостаз клеток и тканей. В поддержании гомеостаза исключительная роль
принадлежит калию.
395
Неизвестно ни одного органического соединения, куда К+ входил бы как
составляющий элемент, но в ионной форме он присутствует во всех органах,
тканях и структурах клетки в концентрациях, превышающих концентрацию других
ионов. Свойство нетоксичности высокой концентрации К+ является определя-
ющим в выполнении его функций, но еще не получило своего объяснения.
Накопление К+ в растении зависит от его концентрации в среде, но в надзем-
ных органах его содержание выше, чем в корнях (см. табл. 6.3 — контроль).
Концентрация калия в цитозоле, хлоропластах и митохондриях составляет
100—250 мМ. Калий этого пула не может быть замещен другими катионами,
например Na+. В вакуоли он выполняет роль осмотика; его концентрация варь-
ирует от 10 до 200 мМ и может достигать 300—500 мМ в замыкающих клетках
открытого устьица, в клетках, связанных с тургорными движениями, а также
в клетках в фазе роста растяжением. Осмотическая функция калия в какой-то
мере может быть заменена накоплением в вакуоли других осмотиков. В апопла-
сте концентрация К+ низкая за исключением апопласта специализированных
клеток устьица, листовых подушечек и др
6.3.5.1. Системы транспорта IC и их характеристика
Реализация функций калия возможна благодаря его высокой подвижности
и активному распределению по клеточным и тканевым компартментам и меж-
ду различными частями растения. Поддержание высокой концентрации К' и
доставка к местам действия связана с его транспортом через клеточные мемб-
раны, радиальным и дальним перемещением и циркуляцией по растению (см.
рис. 6.29). Поглощение калия из среды может происходить с участием перенос-
чиков и каналов по механизму / (активный транспорт высокого сродства к К+),
действующему при его низкой наружной концентрации, и по механизму II,
осуществляющему пассивный перенос транспортерами с низким сродством к
К+ (см. рис. 6.16, А). Использование метода пэтч-кламп позволило установить
наличие в плазмалемме входящих К+-каналов, активируемых при гиперполяри-
зации мембраны, т.е. при Е, более отрицательном, чем потенциал покоя. Это
предполагает, что вход К+ может происходить при его микромолярной концен-
трации в среде по градиенту цк+ против очень большого концентрационного гра-
диента и не сопряжен с энергизацией мембраны и выходом Н+. Это не соответ-
ствует прежним представлениям о переносчиках как системах, которые осу-
ществляют активный транспорт при низкой внешней концентрации К+, и кана-
лах, переносящих калий пассивно при более высоком его содержании в среде.
Исходя из важной роли систем поступления калия для обеспечения растений
этим элементом многие исследования были сфокусированы на выяснении ме-
ханизмов и молекулярной основы высокоаффинных (High-affinity) и низко-
аффинных (Low-affinity) транспортных систем. Выяснено, что транспортеры
типа переносчиков и К+-входящие каналы типа KIRC (IC inwardly rectifying
conductance) могут иметь как высокое, так и низкое сродство к К+, проявлять
разную степень специфичности к иону и быть конститутивными или индуци-
руемыми. Ряд переносчиков и каналов растительных мембран, включенных в
поглощение К+, идентифицирован на генном уровне.
Белок HvHAKl (Hordeum vulgare high-affinity К*) из корней ячменя имеет 12
трансмембранных участков и относится к большому консервативному семей-
396
ству высокоселективных К+-переносчиков с некоторыми свойствами канала (или
наоборот), имеющих высокое сродство к К+. HvHAKl транспортирует К+, веро-
ятно, в симпорте с Н+. Кроме ячменя, гомологичные HvHAKl-2 транспортеры
найдены в корнях пшеницы, риса и арабидопсиса, что дает основание считать
этот переносчик основной системой поглощения К+ при низкой концентрации
в среде. У Arabidopsis thaliana изолировано несколько изоформ переносчика К+.
Один из них — AtKUPl (A. taliana 1С uptake), экспрессируемый в корнях,
имеет высокое и низкое сродство к К+. Следовательно, этот транспортер вно-
сит вклад в поглощение К+ не только при низких, но и при высоких концен-
трациях. HAK/KUP-транспортеры найдены также в бактериях, грибах и у че-
ловека.
Другой класс переносчиков — НКТ1 (high-affinity 1С transporter), исходно
клонированный из пшеницы, осуществляет транспорт по механизму очень
высокого сродства (Кт = 3 мкМ) в симпорте К+: Na+ (при внешней концентра-
ции Na+ в мкМ) или симпортирует только натрий Na+:Na+ (при внешней
концентрации Na+ в мМ). Гомологи НКТ1 найдены у ячменя, риса и A. thaliana.
Возможно, функцией НКТ1 скорее всего является поступление Na+, а не К+.
К каналам, участвующим в поступлении К+ из среды, относят селективный
канал АКТ1 (Arabidopsis К+ transporter) из корней A. thaliana. Этот KIRC-канал
экспрессируется преимущественно в зрелых клетках эпидермиса, коры и эн-
додермы. Интересным свойством АКТ1 является высокое сродство к К+ в при-
сутствии иона NH4. Уровень экспрессии АКТ1 не меняется при калиевом голо-
дании и, очевидно, он вносит вклад в конститутивное поступление К+. При
высокой внешней концентрации К+ АКТ1 функционирует по механизму II
низкого сродства, но, видимо, не является основной системой входа К+ в этих
условиях. Таким образом, один и тот же переносчик AtKUPl или канал АКТ1
могут функционировать при разных внешних концентрациях К+ как транспор-
теры высокого и низкого сродства.
АКТ1, так же как идентифицированные в стелярной паренхиме A. thaliana
(выходной) SKOR (см. рис. 6.18) и в замыкающих клетках устьица входной
КАП (IU Arabidopsis transporter) (см. рис. 6.60), относятся к членам суперсе-
мейства калиевых каналов Shaker-типа, которые у животных функционируют
только как потенциалзависимые входные Ktn-каналы.
Многообразие систем транспорта К+, в том числе связанных с поглощени-
ем из среды, может быть важным свойством, необходимым для выживания
растений при большом разнообразии концентраций ионов в почве и апоплас-
те и при наличии конкуренции с другими ионами, в том числе токсическими.
Конститутивные и индуцибельные системы поступления высокого сродства также
могут реагировать на изменения доступности и обеспечения ионами. В разных
мембранах клетки (плазмалемме или тонопласте) и тканях (корневые волоски
эпидермиса или ксилемная паренхима) для обеспечения многочисленных фун-
кций К+, видимо, должны экспрессироваться разные транспортеры.
6.3.5.2. Регуляция мембранного потенциала
Основная роль К+-каналов в животных клетках — регуляция и кратковре-
менная реполяризация мембранного потенциала. В растительных клетках ка-
лий, перемещаемый через К|„- и КоиГканалы (см. рис. 6.15), также включен в
397
контроль мембранного потенциала. Обычно на плазмалемме поддерживается
отрицательный потенциал £в пределах 100—160 — 200 мВ (см. рис. 6.13 и 6.15).
Участие К+ в регуляции потенциала плазмалеммы определяется тем, что рав-
новесный потенциал для К+ (£ю) находится в границах общего мембранного
потенциала Е (см. табл. 6.1). £к+ можно рассчитать, ориентируясь на концентра-
ции К+, которые обычно бывают внутри клетки и снаружи (в почве или в
апопласте). Обычно в цитозоле высших растений концентрация калия [K‘]jn
находится в пределах 80 — 200 мМ. В почве и апопласте колебания концентра-
ции калия ([K+]out) более значительные: от 0,5 до 10 мМ. Используя уравнение
Нернста для К+ £к+ = 59 • log([K+]out/[K']in), получим, что при таких вариациях
наружных и внутриклеточных концентраций калия будет меняться в преде-
лах от -60 до -150 мВ. Если при работе Н+-АТФазы мембрана гиперполяризует-
ся и Е мембраны становится более отрицательным, чем £к+, потенциалзависи-
мые Ktn-каналы открываются, К+ поступает внутрь, предотвращая дальней-
ший сдвиг потенциала мембраны в отрицательную сторону.
Некоторые физиологические воздействия индуцируют быструю деполяри-
зацию мембраны, например, через активацию анионных и кальциевых кана-
лов. Если заряд мембраны при этом станет позитивнее £к+, то это будет стиму-
лировать открывание КоШ-каналов и выход К+ из клетки, чтобы ограничить
степень деполяризации. Добавочная (с участием Са2+-завПК) активация KoUt-
канала постепенно восстановит £ мембраны до более отрицательного уровня.
Свойство Kour и К|п-каналов стабилизировать мембранный потенциал уни-
версально и является их конститутивной функцией у эукариот.
6.3.5.3. Регуляция активности ферментов и синтез белка
Активность ферментов может регулироваться изменением конформации
белковых структур. Белки гидратированы, и благодаря гидратному слою под-
держивается определенная стабильность конформации. Катионы, и особенно
К+, при цитозольной концентрации 100— 150 мМ могут сильно менять гидрат-
ный слой, тем самым вызывая изменения конформации и активацию фермен-
та. Известно большое количество ферментов, активность которых зависит от
К+, но число энзимов, для которых показана прямая необходимость К+, неве-
лико. Наиболее известна роль калия в активации пируваткиназы. Она катализи-
рует последнюю реакцию гликолиза — превращение фосфоенолпирувата в
пируват, связанное с образованием АТФ. Другой К+-активируемый фермент —
крахмалсинтаза, осуществляющая перенос АДФ-глюкозы и присоединение
глюкозы к крахмалу, что обеспечивает удлинение полисахаридной цепочки.
На вакуолярной Н+-ПФазе имеется место для связывания К+ и, очевидно, он
может регулировать этот фермент (см. рис. 6.14).
Такую же роль поддержания пространственной организации белков К+ вы-
полняет на некоторых этапах их синтеза белков. Калий необходим для поддер-
жания требуемого пространственного объединения тРНК и рибосомы при транс-
ляции иРНК. Он нужен для проявления максимальной активности пептидилт-
рансферазы, с участием которой наращивается полипептидная цепь. Изменяя
через гидратацию структурную организацию мембраны, а через К+-каналы мем-
бранный потенциал, К+ становится «ответственным» за функционирование
многих белковых структур мембраны.
398
6.3.5.4. Осморегуляция и катионно-анионный баланс
Роль К+ в поддержании катионно-анионного баланса и осморегуляции может
быть продемонстрирована на клеточном и тканевом уровне. В реакциях обмена
синтезируется много органических кислот и веществ с отрицательно заряжен-
ными группами и очень мало органических веществ с щелочными свойствами
(некоторые аминокислоты). Калий, преобладающий катион, вносит большой
вклад в нейтрализацию как минеральных, так и органических анионов.
Дальний транспорт ионов и воды по ксилеме и флоэме связан с реализаци-
ей обеих функций калия: создания и поддержания осмотического потенциала
и регуляции катионно-анионного баланса. Стель, и особенно клетки ксилем-
ной паренхимы, — место накопления калия (рис. 6.57). Эндодерма — граница,
которая делит ткани растения на две зоны: 1) кору и ризодерму, клетки кото-
рых находятся в низкосолевой среде, и 2) все остальные ткани растений, вклю-
чающие стель корня и далее до листовой паренхимы, клетки которых функци-
онируют в высокосолевом окружении апопласта (см. подразд. 6.2.3). Из симпла-
ста ксилемной паренхимы (см. рис. 6.24) калий поступает в ксилему. В клетках
корня A. thaliana был идентифицирован селективный, выходной К+-канал
Shaker-типа (возможно, идентичен KORC, см. подразд. 6.2.3.2). Ген этого Кот-
канала, названного SKOR (Stelar К* outward rectifier), экспрессируется в сте-
лярной паренхиме корня, и у мутантов, дефицитных по этому гену, поступле-
ние К+ из корней в надземные органы сильно снижается. АБК может регулиро-
вать активность SKOR, так как установлено, что увеличение этого гормона в
апопласте снижает высвобождение К+ в ксилему и его транслокацию в побеги.
Рис. 6.57. Распределение К+ в корне кукурузы (по Lauchli et al., 1971).
Представлено относительное количество К+, измеренное с помощью рентгеновского
микроанализа
399
Хлоропласт
NH2 + НАД + ОН-
НАДН
NO3 + К
КСИЛЕМА
К+КОз
NO3 + К
NO3 К
NO3 Кн
АТМОСФЕРА С°2
лист
со2
НСО3
К++ Малат
ФЛОЭМА
Малат
калия
К++ Малат
Митохондрия
Пировиноградная
кислота
КОРЕНЬ
НАРУЖНЫЙ РАСТВОР
Рис. 6.58. Циркуляция К+ при поглощении NO3 и поддержании pH
при восстановлении NO3 в листе (по Ben-Zioni et al., 1971)
Это в свою очередь приводит к увеличению концентрации К+ в клетках стели,
способствует снижению водного потенциала Тц2О и удержанию воды клетками
при водном стрессе. Среди ионов ксилемного и флоэмного эксудата концент-
рация калия самая высокая (см. табл. 6.2). Но, как и в тканях, в ксилемном соке
должен сохраняться катионно-анионный баланс и, следовательно, электро-
нейтральность. Основным котранспортируемым анионом для К+ часто являет-
ся NO3. В пасоке декапитированных растений концентрация К+ и NO3 возрас-
тала одинаково при увеличении снабжения корней этими ионами.
Но К+ не только сопровождает NO3 и другие анионы при их дальнем транс-
порте. Он участвует в поддержании pH в листьях. При восстановлении NO3 в
цитозоле клеток листа образуются ионы ОН-, и К+ остается неуравновешен-
ным. В результате происходит подщелачивание цитозоля, которое активирует
ФЕП-карбоксилазу и синтез малата (рис. 6.58). По схеме, разработанной на
растениях, у которых восстановление NO3 происходит в основном в листьях,
К+ и малат* возвращаются по флоэме в корни, где малат- используется как
субстрат, а К+ может вновь возвращаться в ксилемный поток или перемещать-
ся по флоэме в кончики корней (см. рис. 6.29), обеспечивая их рост.
Таким образом, калий обеспечивает создание и поддержание эндогенной
«комфортной среды» — гомеостаза, необходимой для протекания всех физио-
лого-биохимических процессов.
400
6.3.6. ДВИЖЕНИЯ УСТЬИЦ: ТРАНСПОРТ ИОНОВ И РЕГУЛЯЦИЯ
Наиболее ярко роль К+ как регулятора осмотического потенциала и тургора
проявляется в движениях замыкающих клеток устьица. У растений С3-видбв
при условиях в пределах нормы процесс устьичных движений имеет циркад-
ный ритм: днем устьица открыты, а ночью закрыты (или полузакрыты). Но в
полдень, когда возникает дефицит воды в листе, устьица могут быть частично
закрыты и днем. Устьичные движения связаны с ионными потоками К+, О и
воды из апопласта в вакуоль при открывании, и в обратном направлении — из
вакуоли в апопласт при закрывании (рис. 6.59). Все потоки из апопласта идут
через плазмалемму, поскольку зрелые устьичные клетки не имеют плазмодесм.
У некоторых видов растений в качестве котранспортируемого с К+-аниона,
либо дополнительно к СГ, либо преимущественно, используется малат, син-
тезируемый на свету и окисляемый при закрывании устьиц. При открывании
устьичной щели поступающие в вакуоль ионы калия, концентрация которых
достигает уровня 300 мМ, понижают водный потенциал, и из апопласта (час-
тично из соседних клеток) в вакуоль по ДЧ'що поступает вода. В понижении
Ч'нгО участвуют также сахара. При закрывании устьиц потоки ионов и воды
направлены из клетки в апопласт. При поверхностной оценке можно посчи-
тать, что процесс открывания и закрывания утьиц различается только по на-
Стимулы
Синий свет,
низкая [СО2] в ЗКУ,
внешняя ПУК,
гиперполяризация ПМ
АБК,
высокая [СО2],
деполяризация ПМ
ОТКРЫВАНИЕ (2-3 ч)
ЗАКРЫВАНИЕ (30 мин)
Хлоропласт
Крахмал
ФГА
ВАКУОЛЬ
Н2О
Малат" t к(к+)(СГ
Хлоропласт
Крахмал
ФЕП
Малат
СО2+Н2О
АТФ? АДФ
ПМ
Малат
Н,О.
H2O(K+Ycr
Апопласт
\ | Сахара |
у Митохондрия) I,
Пируват
Рис. 6.59. Потоки ионов, воды и сигналы, вызывающие открывание и закрывание за-
мыкающих клеток устьица (ЗКУ):
АБК — абсцизовая кислота; ФГА — фосфоглицериновый альдегид; ФЕП — фосфоенолпируват;
ЩУК — щавелевоуксусная кислота; ПМ — плазмалемма; [CO2J — концентрация СО2; ПУК —
индолилуксусная кислота
401
правлению потоков. На самом деле и системы транспорта, и механизмы регу-
ляции, и сигналы, запускающие эти два вида движений устьичных клеток, а
также временные параметры совершенно разные. Общим у них является то,
что как открывание, так и закрывание устьиц связаны с событиями, которые
развиваются во времени и происходят на плазмалемме, в цитозоле, тоноплас-
те и в вакуоли замыкающих клеток, затрагивая также апопласт и соседние
клетки мезофилла.
6.3.6.1. Открывание устьиц
Существует иерархия стимулов, запускающих процессы устьичных движе-
ний (открывание-закрывание). Она основана на значимости стимулов и степе-
ни их воздействия. Главный стимул — Ч'н.,о клеток листа, и при недостатке
воды устьице закрывается или не открывается полностью. Расширение устьич-
ной щели вызывают синий свет, низкая концентрация СО2 в самой замыка-
ющей клетке, индолилуксусная кислота (ИУК), действующая как внешний
стимул, цитокинин (см. рис. 6.59). При естественном ходе событий утром синий
свет приводит к открыванию устьиц. Устьичная щель увеличивается в ответ на
единственный импульс синего света, который воспринимается зеаксантином
Рис. 6.60. Регуляция светом ионных каналов при открывании устьица:
ССв — синий свет; * — сегмент тилакоида; ЗеКс — зеаксантин; ВиКс — виолаксантин; ПК —
протеинкиназа (Ser/Tre-группы или фототропин); НАк — неактивная и Ак — активная формы
Н+-АТФазы; ПФаза — пирофосфатаза; 14-3-3 — белок;® — фосфатная группа; ПМ — плазма-
лемма; ТП — тонопласт; ' — гиперполяризация ПМ;(+) — активация; [К+] — концентрация К+;
УОК^п-кан — потенциалзависимый входной калиевый канал, идентифицированный у араби-
допсис как КАТ1, а у картофеля — K.ST1; БВК+, MB(Ca2t, К+) и ВК+ — быстрые, медленные,
вакуолярные калиевые каналы соответственно; А-кан — неспецифичный анионный вакуоляр-
ный канал
402
(ЗеКс), входящим в состав пигментов светособирающего комплекса (рис. 6.60).
Виолаксантин (неактивная форма) и зеаксантин (активная форма) — основ-
ные составляющие ксантинового цикла. Соотношение их концентраций зави-
сит от pH в люмене тилакоида, величина которого модулируется работой ЭТЦ,
потреблением АТФ и НАДФН, фиксацией СО2. Начинающийся на свету про-
цесс фотосинтеза, включающий световые и темновые реакции, имеет след-
ствием снижение pH в тилакоиде и снижение концентрации СО2 в строме. Низ-
кий pH способствует сдвигу реакции в сторону образования рецептора синего
света зеаксантина. Возможно, такая многоступенчатая связь и лежит в основе
механизма открывания устьица под действием низкой концентрации СО2.
Уровень ответа на синий свет зависит от концентрации ЗеКс и числа погло-
щенных квантов синего света. Возбуждение ЗеКс является сигналом, который
по неизвестному пока пути с участием вторичных мессенджеров передается в
цитоплазму, где в результате активируется протеинкиназа «Сер-Тре»-типа.
Активированная протеинкиназа фосфорилирует Н+-АТФазу плазмалеммы (см.
рис. 6.14, /). К автоингибиторному участку С-конца неактивной Н+-АТФазы
присоединяются фосфатная группа и 14-3-3 — белок. Н+-АТФаза становится
активной и, выкачивая протоны, гиперполяризует плазмалемму. Поступление
калия идет через селективный потенциалзависимый входной канал (VDK|ri-
кан), который активируется при гиперполяризации мембраны (см. рис. 6.60).
Такой канал идентифицирован у арабидопсиса (КАТ1) и картофеля (KST1 —
K+Solanum tuberosum transporter). Оба канала высокоселективны, сходны по
своей активности в замыкающих клетках и электрофизиологическим харак-
теристикам и относятся к большому семейству К+-каналов Shaker-типа (см.
рис. 6.18).
Кроме механизма сопряжения работы Н+-АТФазы с активаций входного
К+-канала через гиперполяризацию может действовать другой механизм регу-
ляции, связанный с подкислением среды в апопласте за счет выкачивания Н+.
В исследованиях на замыкающих клетках устьица (протопласты и снятый с
листа эпидермис) показано, что снижение pH активирует входные К+-каналы
плазмалеммы. Подкисление цитозоля в ответ на действие ИУК также активи-
рует поступление К+ в замыкающие клетки. Таким образом, сенсор входного
К+-канала (положительно заряженные гистидиновые остатки четвертого сег-
мента белка канала — см. рис. 6.18) реагирует на изменение апопластного и
цитозольного pH. Вход СГ может идти через хлорный канал (С17п-кан), но
вероятнее осуществляется через механизм Н+/СГ-симпорта (см. рис. 6.60).
Параллельно с поступлением в цитозоль ионы транспортируются в ваку-
оль. На тонопласте имеются неспецифичный анионный канал, пропускающий
СГ, малат- и NO3 (см. рис. 6.15), и несколько катионных каналов, которые в
большей или меньшей степени специфичны к иону К+. Они одновременно
пропускают Na+, Са2+, Mg2+ и др. ионы и могут работать в режиме как «in», так
и «out». О регуляции транспорта ионов в вакуоль при открывании устьиц пока
известно мало. Можно предполагать, что эти каналы осуществляют поступле-
ние ионов из цитоплазмы в вакуоль в соответствии со своими электрофизио-
логическими характеристиками, степенью специфичности и потенциалом на
мембране и становятся объектом регуляции только при закрывании устьиц.
Поступление воды, по крайней мере в вакуоль, происходит через аквапорины
(см. гл. 5).
403
6.3.6.2. Закрывание устьиц
Закрывание устьиц индуцируется понижением возрастанием концен-
трации АБК, увеличением концентрации СО2 в клетке и деполяризацией плаз-
малеммы (см. рис. 6.59). Механизм закрывания устьица разработан главным об-
разом при изучении его ответа на АБК. Совокупность «участников» и последова-
тельность событий, которые включены в процесс закрывания устьиц, являются
сложным комплексом, состоящим из двух систем: той, которая обеспечивает
собственно выход из клеток К+, СГ и Н2О, и той, которая регулирует этот
выход. При закрывании устьица основная роль в передаче сигнала и регуляции
активности KoUt- и Clout-каналов принадлежит Са2+, однако протон также вклю-
чен в регуляцию ионных потоков как независимый вторичный мессенджер. Управ-
ление через обе сигнальные системы, где мессенджерами служат Са2+ и Н+, ско-
ординировано между собой и с регуляцией каналов посредством фосфорилиро-
вания-дефосфорилирования. События на плазмалемме, тонопласте и в цитоп-
лазме могут следовать друг за другом (рис. 6.61, 7— 8) или совпадать по време-
ни, но общая продолжительность закрывания устьица составляет около 30 мин.
АБК (вне- или внутриклеточная — не установлено) связывается с неиден-
тифицированным рецептором плазмалеммы и/или внутренних мембран (7) и
индуцирует увеличение концентрации Са2+ в цитозоле, открывая механочув-
ствительный Са2+-канал, который активируется при гиперполяризации плаз-
Рис. 6.61. Модель закрывания устьица в ответ на абсцизовую кислоту (АБК).
Предполагаемая последовательность событий: 1 — рецепция АБК на вне- и/или внутриклеточ-
ном рецепторе; 2 — поступление Са2* из апопласта и увеличение [Са2+]цвт; 3 — активация Са2*-
каналов эндогенных мембран, дополнительное увеличение [Са2+] и кодирование сигнала; 4а —
открывание Са2'-зависимого СГ-канала ПМ; 46 — ингибирование ПМН+-АТФазы; 4в — увели-
чение pH цитозоля; 4г — активация вакуолярной Н+-АТФазы; 5 — инактивация УОК|п-канала
ПМ; 6 — деполяризация ПМ и открывание К„и,-канала; 7 — открывание вакуолярных ВК+- и
БВК*-каналов; 8— открывание СГ-канала ТП.
ПМ — плазмалемма; ТП — тонопласт; ЭР — эндоплазматический ретикулум; МВ Са +, К+ —
медленный вакуолярный неспецифичный канал; ВК+, БВК* — вакуолярный и быстрый вакуо-
лярный калиевые каналы; ИФ, — инозитол-1,4,5-трифосфат; ® — рецептор АБК; (--------) —
гиперполяризация; (+++) — деполяризация
404
малеммы ПМ (2). Связывание АБК приводит также к активации G-белков и
образованию инозитол-1,4,5-трифосфата (ИФ3), который активирует ИФ3Са2+-
каналы тонопласта и мембран эндоплазматического ретикулума (5). Но, веро-
ятно, более значительная часть кальция вакуоли поступает через канал, регу-
лируемый цАДФРиб, который также актив1ууется АБК (5). Это вызывает до-
полнительное увеличение концентрации Са2+ в цитозоле (возможно возраста-
ние до 1 мкМ) и появление осцилляций (см. рис. 6.55, 4). Возможен выход Са2+
через медленный вакуолярный канал (МВСа2+, К+-канал), открывающийся
при деполяризации тонопласта ТП и активируемый Са2+-КаМ (5) (см. под-
разд. 4.3.2). Этот неспецифичный канал пропускает также калий.
Высокая концентрация Са2+ в цитоплазме активирует открывание Са2+-за-
висимых медленных хлорных каналов плазмалеммы (С1ощ-канал) (4а), кото-
рые регулируются через фосфорилирование-дефосфорилирование, и ингиби-
рует Н+-АТФазы плазмалеммы (46). Параллельно, но независимо увеличивает-
ся pH цитозоля (4в) (от величины покоя pH 7,3 до pH 7,5 —7,7), чему способ-
ствует активация вакуолярной Н+-АТФазы (4г). Еще одно следствие увеличе-
ния [Са2+]цит и возрастания pH цитозоля — инактивация входного калиевого
канала плазмалеммы (УОК-Г1-кан) (5). Это не оказывает существенного влия-
ния на закрывание устьица, но, видимо, ускоряет процесс. Подщелачивание
цитоплазмы и активация С1о1|Гканала плазмалеммы деполяризуют мембрану,
результатом чего является активация К()11(-канала ПМ (6), причем выход К+
поддерживается в течение продолжительного времени.
Основная часть К+ и СГ, которые «покидают» замыкающие клетки, — это
ионы вакуолярного компартмента, которые транспортируются через цитоплазму
к выходным каналам плазмалеммы. Очевидно, основной поток К+, индуциру-
емый АБК, осуществляется через Са2+-активируемый потенциалзависимый
вакуолярный К+-канал тонопласта ВК+ (7). Быстрый К+-канал БВК+ вносит
меньший вклад в выход калия из вакуоли (7). Выход хлора через анионный
канал тонопласта (С1оиГкан) (8) регулируется Са2+-зависимой протеинкина-
зой. Высвобождение К+ и СГ из вакуоли, а затем выход из замыкающей клетки
изменяет в системе протопласт—апопласт и приводит к потере воды,
падению тургорного давления в замыкающих клетках и закрыванию устьица.
Другие стимулы, такие, как СО2 и окислительный стресс, также быстро
индуцируют увеличение концентрации Са2+ в цитозоле замыкающих клеток и,
видимо, механизм, обеспечивающий закрывание отдельного устьица, будет
похожим.
До недавнего времени считали, что все устьица одного листа ведут себя
одинаково в одних условиях: все открываются утром или закрываются при
водном дефиците. Но оказалось, что в интактном листе устьица часто демонст-
рируют поразительную пространственную и временную гетерогенность состо-
яния открытости — закрытости. Это явление, названное «пятнистостью устьич-
ной проводимости», заключается в том, что небольшие «пятна» (участки по-
верхности листа) устьиц реагируют на стимул не так, как устьица на соседнем
участке. Во времени те устьица, которые были закрыты, открываются и наобо-
рот, но предсказать их поведение невозможно. Такое кооперативное поведение
пока не нашло удовлетворительного объяснения. Возможно, в его основе ле-
жит механизм гидролитических взаимодействий, связанный с распределением
в эпидермальных клетках воды, поступающей в лист по сосудам.
405
6.3.7. ХЛОР
Хлор относили сначала к полезным элементам, но в настоящее время его
относят к микроэлементам. Из поглощаемых минеральных анионов только СГ
не ассимилируется и остается в клетках и тканях в ионной форме. В цитозоле
концентрация СГ (~3— 10 мМ) превышает концентрацию нитрата (~1 — 5 мМ)
и органического аниона — малата (~1 — 5 мМ). В вакуоли, наоборот, концент-
рация NO3 (10 — 80 мМ) и малата (5—100 мМ) значительно выше, чем СГ
(7—40 мМ). В клетках при регуляции тургора концентрация хлора в вакуоли
может достигать 50—150 мМ.
На плазмалемме и тонопласте имеются входные и выходные СГ-каналы, и
этот анион очень подвижен (см. рис. 6.15). Транспорт анионов через плазма-
лемму вносит существенный вклад в реализацию нескольких важных функций:
1) электрической и Са2+-сигнализации; 2) контроль мембранного потенциала
и градиента pH; 3) осморегуляция. Хлор не просто участвует в выполнении
этих функций наряду с другими анионами, а играет ведущую роль. Есть дан-
ные, что СГ специфически активирует вакуолярную Н+-АТФазу. Хлор вместе с
калием включен в механизм устьичных движений и, если может быть заменен
малатом (см. рис. 6.59), то лишь частично и не у всех видов растений. При
открывании устьиц у растений, у которых малат не участвует в устьичных дви-
жениях (лук — Allium сера, кокосовая пальма — Cocos nucifera L.), перемеща-
ются значительные количества хлора, и между потоками К+ и СГ существует
строгая связь. Поэтому у СГ-дефицитных растений этих видов полное откры-
вание устьица растягивается на несколько часов. Для выполнения осморегуля-
торной функции в замыкающих клетках и для поддержания ТН2О в клетках
корней СГ должен накапливаться в вакуолях в больших количествах и не мо-
жет быть отнесен в группу микроэлементов.
Накапливаясь в вакуолях зрелых клеток корней и надземных частей, СГ как
осмотически активный ион может заменить NO3, активируя его выход в цито-
золь и ассимиляцию в клетке.
Концентрация СГ в хлоропласте значительна — 80—90 мМ, но для реак-
ции фотолиза Н2О он требуется в микроколичествах (на этом основании его
относят к микроэлементам). Хлор присутствует в кислородвыделяющем комп-
лексе ФС II, где наряду с Мп2+ он необходим в процессе фотолиза Н2О. Хлор
может действовать либо как лиганд-мостик, стабилизирущий окисленное со-
стояние Мп , либо как структурный компонент других белков ФС II.
Таким образом, хлор, как и калий, участвует в общефизиологических про-
цессах поддержания гомеостаза, где он скорее необходим, а не полезен. Как
необходимый (уже без оговорок) микроэлемент, хлор требуется для реакции
фотолиза Н2О в ФС II.
6.3.8. МАГНИЙ
Содержание магния при оптимальном росте обычно находится в пределах
0,15 — 0,35 % от сухой массы растений. Ионная концентрация Mg2+ в растительных
тканях достаточно высокая, и ~ 70 % от общего содержания (~80 мМ на г сухо-
го вещества) свободно диффундирует в растении. По подвижности этот двух-
406
валентный катион сравним с К+. От других биологически важных катионов
Mg2+ отличается своими уникальными характеристиками. Он имеет наимень-
ший ионный радиус, большую плотность заряда, самый большой гидритный
радиус (по сравнению с К+, Са2+ и Na+) и особый характер взаимодействия с
водой и другими лигандами. Он образует 6 координационных связей, в основ-
ном с кислородом анионных групп белков, нуклеиновых кислот и фосфоли-
пидов (т.е. с О -лигандами, где О является «трудным» слабополяризованным
основанием). Реже лигандом для связывания служит N, с которым наряду с
координационными Mg2' может образовать ковалентную связь, как, напри-
мер, в порфириновом кольце хлорофилла (см. рис. гл. 3).
Эти свойства магния предполагают специфику систем переноса и функций
этого двухвалентного катиона. Исходя из величин обычного мембранного по-
тенциала плазмалеммы и среднестатической концентрации магния в цитозоле
(3—4 мМ), его транспорт происходит пассивно (см. табл. 6.1). Но до самого послед-
него времени не было известно, какие транспортные системы ответственны за
поступление и перемещение магния у растений (так же как и у животных). Счи-
талось, что неспецифичные Са2+-каналы (см. рис. 6.54) участвуют в переносе
через плазмалемму не только кальция, но и магния. Наконец, в 2001 г. (Zi et al.)
у арабидопсиса было идентифицировано 10 членов генного семейства, коди-
рующих Mg2+-TpaHcnopTHbie белки (AtMGT). Показано, что AtMGTl локали-
зован в плазмалемме и, видимо, участвует в поступлении Mg2+ из среды. AtMGT5
и AtMGT6 экспрессируются главным образом в митохондриях. Очевидно, раз-
личные белки AtMGT семейства имеют разные транспортные характеристики
и выполняют разные функции. Ранее в тонопласте клеток арабидопсиса был
обнаружен транспортер AtMHX, функционирующий как электрогенный об-
менник (Mg +/Н exchanger) протонов Mg2+ и Zn2+. AtMHX присутствует в ос-
новном в центральном цилиндре стебля, и большая часть AtMHX мРНК лока-
лизована в клетках паренхимы, окружающей ксилему. Это предполагает учас-
тие AtMHX в распределении Mg2+ и Zn2+ между органами. Радиальный транс-
порт Mg2+ в корне так же, как кальция, происходит в основном по апопласту.
Диффундирующий в цитозоле Mg2+ образует лабильные связи, нейтрализуя
наряду с калием определенные органические соединения (группы сахаров,
нуклеотидов, органические и аминокислоты). В клеточной стенке находится
-2,5% от общего содержания магния. Здесь Mg2+ координационно связан с
карбоксильными группами пектиновых веществ по типу Са2+ и участвует в
создании внутренней физиологической среды растения.
Самое известное магнийсодержащее соединение в растении — хлорофилл.
В его молекуле Mg2+ находится в составе порфиринового ядра, соединенный
двумя координационными и двумя ковалентными связями с азотом пирроль-
ных колец (см. гл. 3). В хлоропласте сосредоточено 15 % Mg2+ листа, до 6 % Mg2+
может находиться в составе хлорофилла При дефиците магния (голодании)
доля Mg2+ в пигменте может достигать даже 50 % от общего содержания в листе.
Участие Mg2+ в процессах, идущих в хлоропласте, связано не только с функци-
ями в составе хлорофилла. При освещении Mg2+ транспортируется из тилакои-
дов в строму, компенсируя Н+, закачиваемый в тилакоид, и обеспечивая под-
держание (наряду с К+) катионно-анионного баланса в этом компартменте хло-
ропласта. За счет разнонаправленного перемещения Н+ и Mg2+ в строме созда-
ются благоприятные условия для фиксации СО2: pH 8,0 и высокая концентра-
407
ция Mg2+. Ионы Mg2+ являются аллостерическим регулятором активности Ру-
биско (см. гл. 3), неактивной в темноте. Щелочные значения pH (8,0) и высо-
кая концентрация магния — оптимальные условия для глутаминсинтетазы
(ГС) — фермента, локализованного в строме хлоропласта и катализирующего
ассимиляцию NH4 (см. рис. 6.45, 6.46).
Значительная часть АТФ (до 90 %) находится в клетках растений и живот-
ных в виде комплекса с Mg2+:
Этот магний связан координационными связями с кислородом фосфатной
группы и азотом аденина. В комплексе с магнием как АТФ, так и фосфоинози-
тол (фитин) запасаются в семенах (см. подразд. 6.3.1.2).
Магний активирует практически все киназные реакции, в которых требует-
ся АТФ и происходит фосфорилирование субстрата. В реакциях переноса фос-
фата (фосфатазы, киназы, АТФсинтазы) или карбоксильных групп (карбо-
ксилазы) Mg + образует координационные связи между кислородом фосфат-
ных групп и лигандами фермента. Эти стабильные комплексы имеют в сайте
связывания Mg2+ регулярную структуру, поэтому Mg2+ является незаменимым
кофактором ферментных реакций, когда требуется сформировать в реакцион-
ном центре тройной комплекс между субстратом и определенными лигандами
без искажения конформации. Помимо активации большого числа ферментов,
включенных в реакции переноса фосфата и карбоксильных групп, магний ак-
тивирует некоторые дегидрогеназы, мутазы и лиазы (ГС обсуждалась выше).
Для функционирования некоторых ферментов (глутатионсинтаза) его необхо-
димость абсолютна, в других случаях Mg2+ значительно увеличивает активность
ферментов (ФЕП-карбоксилаза). В терминальной реакции гликолиза (образо-
вание пирувата из ФЕП) Mg2+ активирует пируваткиназу дополнительно к
калию. Mg2+ необходим для сохранения целостности рибосом и поддержания
их структуры при синтезе белка. Кроме того, на стадии связывания аминокис-
лоты с тРНК магний активирует аминоацил-тРНК синтетазу.
Таким образом, у растений Mg2+ включен в активацию генеральных про-
цессов ассимиляции СО2 и азота. Не менее важна его роль в реакциях синтеза
и использования АТФ. Координационная связь Mg2+ с фосфорсодержащими
соединениями (АТФ, фитиновая кислота и др.) переводит их в форму, удоб-
ную для запасания. Перераспределение магния между компартментами (цито-
золь-вакуоль или строма—тилакоид), а также его участие в нейтрализации
органических анионов, вносят большой вклад в регуляцию pH и поддержание
катионно-анионного баланса.
6.3.9. ЖЕЛЕЗО
Железо относят к группе микроэлементов, и обычно с него начинают обсуж-
дение их функций. В отличие от макроэлементов, которые выполняют широ-
кий спектр функций «общеорганизменного» уровня, микроэлементы реализу-
408
ют свои функции в конкретных процессах и реакциях, как правило, в локаль-
ных клеточных структурах. Здесь микроэлементы определяют пространственную
конформацию, активность некоторых ферментов или участвуют в окислитель-
но-восстановительных реакциях.
В почве содержание железа больше, чем любого другого элемента, но дос-
тупного железа так мало, что даже при относительно малой потребности рас-
тения часто страдают от его недостатка (хлороз). При физиологических вели-
чинах pH концентрация соединений трех- и двухвалентного железа ниже, чем
10-5 мМ, и для поглощения его нужно сначала растворить. Чтобы обеспечить
себя железом (концентрация в тканях составляет 10-6 М), растения развили
механизмы, позволяющие добывать Fe3+/2+ из почвы. Эти механизмы активиру-
ются в ответ на еще больший, чем обычно, дефицит Fe3+ и различны у двудольных
и однодольных растений (рис. 6.62). У двудольных и незлаковых однодольных
видов реализуется стратегия I, связанная с интенсификацией дыхания. Акти-
вация дыхания корней способствует работе Н+-помпы (за счет увеличения дос-
тупности АТФ) и обеспечивает дополнительный синтез органических кислот,
которые хелатируют железо (например, лимонная кислота). Выкачивание про-
тонов способствует растворению железа почвенных частиц, а вышедшие хела-
торы образуют хелатные комплексы с Fe3+. Хелатированное Fe3+ восстанавлива-
ется расположенной на ПМ Ре3+-хелатредуктазой (этот фермент, видимо, спо-
собен также восстанавливать Си2+ до Си4). Двухвалентное железо (Fe2+) перено-
сится через мембрану специфическим Ре2+-транспортером — IRT1, который,
видимо, осуществляет также транспорт Мп , но Си подавляет его актив-
ность. Перенос осуществляется одновременно с активацией Н+-АТФазы. Счи-
тают, что именно переносчик IRT1 отвечает за поступления железа из почвы.
У однодольных злаков адаптация, обеспечивающая поглощение железа
(стратегия II), связана с синтезом специальных хелатирующих веществ —
фитосидерофоров. Фитосидерофоры — низкомолекулярные соединения, от-
носящиеся к непротеиногенным аминокислотам, — синтезируются (в ответ на
дефицит железа) из метионина с образованием на первом этапе никотинами-
на, который затем превращается в мугеновую кислоту. Последняя является
хелатором железа. Железо (Fe3+) в составе комплекса переносится специфи-
ческой, пока неохарактеризованной транспортной системой. Никотинамин
также может быть хелатором, принимающим участие в транспорте металлов
по механизму стратегии II. Кроме того, комплекс металла с никотинамином
может участвовать в дальнейшем транспорте Си, Zn по ксилеме и Си, Zn,
Fe2+ — по флоэме.
Дефицит железа вызывает также изменения морфологии корней, индуци-
руя рост корневых волосков, которые обильно покрывают поверхность корня.
Это способствует лучшему контакту с почвой и почвенным раствором, увели-
чивая поглощение железа (см. подразд. 6.2.1.1).
В клетках железо находится либо в комплексе с тетрапирольным кольцом
(гемопротеины), либо в комплексе с сульфидной серой многочисленных же-
лезо-серных белков. И те и другие соединения железа входят в состав фермен-
тов ЭТЦ дыхания и фотосинтеза (см. гл 2, 3, 4). Железогемопротеины в сумме
составляют до 8,5 % от общего белка клетки. К гемопротеинам относятся пе-
роксидаза и каталаза, связанные с антиоксидантной защитой (см. гл. 3). Перок-
сидаза участвует также в синтезе лигнина. Лег-гемоглобин связывает кислород
409
СТРАТЕГИЯ I
СТРАТЕГИЯ II
Рис. 6.62. Ответная реакция корней на дефицит железа.
Стратегия I — у двудольных и однодольных незлаковых растений (1 — активация протонной
помпы; 2 — увеличение выхода восстановителей/хелаторов); ОК — органические кислоты; ред-
за — индуцируемая хелатредуктаза; IRT1 (Iron reduced transporter) — транспортер Fe11. Стратегия
Il — синтез фитосидерофоров у однодольных злаков; ФСД — фитосидерофоры; ПМ — плазма-
лемма; Ув — увеличение синтеза и выхода ФСД; Тр — транспортеры комплексов металла с ФСД
и служит защитным барьером от его проникновения в клубеньки бобовых,
поскольку О2 инактивирует нитрогеназу, фиксирующую N2.
Первым из белков, содержащих негеминовое железо, был открыт ферредок-
син. В хлоропласте этот железосерный белок является донором электронов
для НАДФ оксидоредуктазы, ферментов сульфитредуктазы и нитритредуктазы
(у двух последних ферментов простетической группой является Fe-содержа-
410
щий сирогем) (см. рис. 6.42 и 6.49). Соотношение Fe и S в кластере железосер-
ных белков может различаться и составлять 2Fe—2S, как у ферредоксина, или
4Fe—4S, как у многих других ферментов (см. гл. 2).
К железосерным белкам помимо белков ЭТЦ хлоропластов и митохондрий
относятся аконитаза, ксантиноксидаза, липоксигеназа, нитрогеназа и ключе-
вой фермент азотного обмена — нитратредуктаза. В сумме железо белков, свя-
занное с серой, составляет 18,5 % общего содержания железа; на митохондри-
альные комплексы приходится 9 %, на ферредоксин 2,5 %. Одна из суперок-
сиддисмутаз (СОД), присутствующая в хлоропласте, также включает Fe.
Запасной формой железа в растительной клетке является ферритин — мно-
гомерный белок, состоящий из 24 полипептидов. Отдельные полипептиды пред-
ставляют собой полые сферы, разграничивающие внутреннюю полость чет-
вертичной структуры ферритина, которая заполнена железом (Fe2O3 лН2О).
Каждая молекула может запасать до 4500 атомов железа в растворимой, неток-
сичной и доступной форме. Основная масса ферритина находится в строме
хлоропласта. В целом до 60 % железа, содержащегося в листе, приходится на
хлоропласты.
6.3.10. МЕДЬ
Растения в норме накапливают медь в количестве 5 — 20 мкг/г сухой массы.
В почве ее концентрация колеблется от 10~4 до 10“9 М и до 98 % меди почвы
находится в комплексе с низкомолекулярными органическими соединениями.
Пока неизвестно, существует ли индивидуальный транспортер, обеспечиваю-
щий поглощение меди из почвы (см. рис. 6.62).
Особенность восстановленной формы меди — способность легко передавать
электрон прямо на кислород, а окисленной формы — легко восстанавливаться.
Медь имеет высокий редокс-потенциал и вместе с железом входит в состав
терминальной оксидазы ЭТЦ дыхания — цитохромоксидазы (см. гл. 4). Более
50% меди, локализованной в хлоропластах, связано с пластоцианином. Си-
Zn-супероксиддисмутаза присутствует в хлоропластах, митохондриях, перок-
сисомах и цитозоле, где она участвует в детоксикации супероксида. Аскорба-
токсидаза содержит по крайней мере 4 атома Си, которые участвуют в четырех-
электронном восстановлении О2 до Н2О. Аскорбатоксидаза цитозоля может
действовать, как терминальная оксидаза, самостоятельно или в комбинации с
полифенолоксидазой. Полифенолоксидаза включена в синтез такого комплек-
сного полимера, как лигнин. Высокая реакционная способность меди, полез-
ная в редокс-реакциях, делает ее токсичной даже при не очень высоких кон-
центрациях.
Например, медь разрушает тиоловые связи в белках, что приводит к их
деструктуризации. Поэтому транспорт поглощенной меди к местам использо-
вания или реутилизации, где она будет включена в специфические медьсодер-
жащие белки, осуществляется в виде комплекса со специальными цитоплаз-
матическими белками-шаперонами. Шапероны переводят медь в нереактив-
ную форму и при участии транспортных белков доставляют медь к местам, где
благодаря шаперонам обеспечивается сборка необходимой пространственной
структуры фермента, включающего медь.
411
6.3.11. МАРГАНЕЦ
В биологических системах Мп находится в состоянии окисленности П, III и IV.
Содержание марганца в вегетативных частях растений (побеги, листья) колеб-
лется от 25 до 40 мкг/г сухого вещества, но у цитрусовых достигает 125 мкг.
Концентрация марганца в разных структурах клетки варьирует от 0,01 до 50 мкМ,
и в листьях ~90 % Мп находится в хлоропластах, где марганец выполняет осо-
бую функцию, связанную с фотохимическим разложением воды и выделени-
ем О2 кислородвыделяющим комплексом (КВК) ФСП (см. гл. 3). Марганец —
кофактор более 35 ферментов, и в системах /л vitro может с успехом заменять
магний. В тканях концентрация Мп2+ значительно ниже, чем Mg2+, поэтому
именно магний становится основным активатором таких ферментов, как ки-
назы, фосфатазы, глутаминсинтетаза и др. В клетках in vivo марганец при высо-
ких концентрациях может вытеснить магний из Mg-АТФ комплекса, но для
активации некоторых реакций (как и в КВК) потребность в Мп2+ абсолютна.
Например, у С4-растений в хлоропластах обкладки, где оксалат действует как
углеродный челнок и где карбоксилирование катализируется ФЕП-карбокси-
лазой, Мп2+ не может быть заменен на Mg2+, который ингибирует активность
фермента.
Активацию ИУК-оксидазы, разрушающей индолилуксусную кислоту, также
осуществляет Мп. Изоцитратдегидрогеназа митохондрий активируется Mg2+ и
Мп , но только Мп активирует цитозольную форму этого фермента. Изоцит-
ратдегидрогеназа катализирует превращение вышедшего из митохондрий в
цитозоль изоцитрата в 2-оксоглутарат, который затем используется в реакции
ассимиляции азота в хлоропластах. Мп2+ вместе с Mg2+ активирует малик-эн-
зим, несколько ферментов шикиматного пути, ведущего к образованию аро-
матических аминокислот, и супероксиддисмутазу. Mn-СОД распространена
менее широко, чем другие супероксиддисмутазы, и присутствует только в
митохондриях и пероксисомах. В активации РНК-полимеразы хлоропластов Мп2+
действует эффективнее, чем Mg2+, даже если концентрация последнего во много
раз выше.
6.3.12. МОЛИБДЕН
Молибден в водных растворах существует как МоО2 , т.е. в его наиболее
окисленной форме — Mo(VI). Как компонент ферментов он может быть в фор-
ме Mo(VI) и Mo(V). Поглощается молибден, видимо, в комплексе с фитоси-
дерофорами (см. рис. 6.62).
Потребность в молибдене у растений меньше, чем в других микроэле-
ментах, и его концентрация в тканях очень низкая. Однако у растений Мо
является компонентом ключевого фермента — нитратредуктазы (HP) (см.
подразд. 3.2.3); у нитрогеназы, осуществляющей фиксацию N2, в одной из
субъединиц также присутствует Мо. Кроме того, в растениях Мо входит в со-
став ксантиноксидазы. Во всех этих ферментах молибден выполняет каталити-
ческую и структурную функции. У нитратредуктазы и ксантиноксидазы молиб-
ден присутствует в составе молибдоптерина, или молибдокофактора (Мо-Со)
(см. рис. 6.41):
412
Структурную основу Мо-Со составляет производное птерина с боковой
цепью в шестом положении. Четырехуглеродная боковая цепь содержит дити-
ольную (связывающую Мо), гидроксильную и фосфатную группы. МоСо всех
молибденсодержащих ферментов растений, бактерий, грибов и животных (ас-
симиляторные и диссимиляторные нитратредуктазы, алкогольдегидрогеназа,
сульфитоксидаза, ксантиноксидаза/дегидрогеназа) сходны и близки по свой-
ствам. МоСо нековалентно связан с белком фермента и в связанном виде ус-
тойчив к окислению. У нитратредуктазы МоСо является активным центром,
где с участием молибдена NO3 восстанавливается до NO2. Кроме того, он вы-
полняет структурную функцию, связывая две субъединицы. При отщеплении
МоСо от апофермента HP инактивируется и может переходить в латентное со-
стояние. «Разборка» фермента может происходить под действием неблагоприят-
ных факторов, например засоления Однако четвертичная структура Мо-Со-фер-
мента собирается так же легко, как и разрушается. В системе in vitro восстанов-
ление структуры HP активируется добавлением молибдена.
6.3.13. ЦИНК
Цинк поглощается как двухвалентный катион, в клетках он не окисляется и
не восстанавливается. Обнаружен переносчик Zn2+, который функционирует в
системе унипорта (см. рис. 6.15), обеспечивая поглощение цинка из среды. Роль
цинка как двухвалентного катиона основана на его свойстве формировать тет-
раэдрические комплексы:
Н ””Й;
L \ у
zZn\
Асп
Известно около 300 ферментов из разных организмов, где цинк является
стабилизатором. У растений цинк — компонент карбоангидразы (см. гл. 4),
щелочной фосфатазы, алкогольдегидрогеназы. В клетках листа наряду с Mg2+-
зависимой пирофосфатазой, обнаружен Zn24-зависимый изоэнзим. В суперок-
сиддисмутазе Zn + ассоциирован с Си2+. В этом антиоксидантном изоэнзиме
медь, очевидно, представляет каталитический, а цинк — структурный компо-
нент. Cu-Zn-СОД локализована во всех компартментах цитоплазмы.
Цинк играет важную роль в метаболизме ДНК и РНК, в синтезе белка и
клеточном делении. Выделен класс Zn-зависимых белков, которые включены
в репликацию ДНК, транскрипцию и, следовательно, в регуляцию экспрес-
сии генома. Включение цинка в эти белки необходимо для связывания со спе-
цифическими генами. Он встраивается в структуру белка, образуя тетраэдраль-
413
ные комплексы с аминокислотными остатками полипептидной цепи. Таким
образом, полипептидная цепь формирует петли, или «цинковые пальцы», со-
стоящие из 11 — 13 аминокислотных остатков. Структура типа «цинковые паль-
цы» присутствует у многих факторов транскрипции. «Цинковые пальцы» взаи-
модействуют с двойной спиралью ДНК, что позволяет белковой молекуле,
несущей эту структуру, узнавать и специфически связываться с определенны-
ми последовательностями нуклеотидов в геноме клетки. Такое связывание в
свою очередь приводит к активации или ингибированию транскрипции дан-
ного гена. Кроме этого, структура типа «цинковые пальцы» может участвовать
в белок-белковом узнавании, и поэтому играет важную роль в процессах пере-
дачи сигнала внутри клетки.
6.3.14. БОР
Бор входит в группу металлоидов и в водных растворах при концентрации
менее 25 мМ присутствует в мономерной форме — В(ОН)3 или в ионной —
Первичные последствия
Вторичные последствия
Изменение в химическом
составе и ультраструктуре КС
Накопление некоторых
фенолов
Изменения в структурной
целостности (ПМ)
Ингибирование синтеза
лигнина
Активация ИУК оксидазы
Уменьшение уровня ИУК,
поступающего в КС
Морфологические
и физиологические
изменения --------------
во взаимосвязи КС-ПМ
_ Уменьшение уровня
(транспортируемой) ИУК
Усиление образования
” свободных радикалов О’
Повреждения ПМ
Нарушения
в метаболизме
РНК и ДНК
Индукция
дефицита Са2+
Ингибирование
АТФаз, транс-
портеров, сдвиги
потенциала ПМ
I
Ингибирование
роста растяже-
нием и дифферен-
циации ксилемы
Изменения в распре-
делении углеводов и т.д.
Рис. 6.63. Физиолого-биохимические нарушения в тканях при дефиците бора
(по Marschner, 1995)
414
В(ОН)4. Поглощение бора сильно зависит от pH, а его распределение по расте-
нию происходит преимущественно с транспирационным током. По флоэме
бор также может транслоцироваться и ретранслоцироваться в относительно
больших количествах. Необходимость бора для растений установлена очень дав-
но, но до сих пор неясно, каким образом реализуются его функции: в какие
конкретные реакции он включен и каков механизм его участия в отдельных
процессах. Бор присутствует в растениях в большей концентрации, чем другие
микроэлементы (по крайней мере у двудольных), и значительное его количе-
ство находится в клеточной стенке (КС). У бор-дефицитных растений почти
весь бор (90—95%) находится в апопласте. До 70% бора клеточной стенки
приходится на комплекс с пектином:
==с—о. ОН
I /в\
=с—о он
=с-ох .о—с=
I /Ч
=с-о о—с=
При недостатке бора физические свойства клеточной стенки значительно
изменяются, что сопровождается быстрым ингибированием растяжения кле-
ток. Эти нарушения в синтезе клеточной стенки, как предполагают, приводят
к «каскадному эффекту» и к последовательным (иногда одновременным) из-
менениям в комплексе взаимосвязанных процессов. Последствия дефицита бора
можно разделить на первичные и вторичные; они затрагивают образование
клеточной стенки и функционирование плазмалеммы (рис. 6.63).
Таким образом, конкретные пути включения бора в процессы обмена и
механизмы реализации его функций неизвестны. Однако можно составить длин-
ный список процессов, где бор необходим: синтез и структура клеточной стенки,
лигнификация, метаболизм углеводов, РНК, ИУК, фенолов, дыхание, транс-
порт сахаров, функционирование плазмалеммы.
ГЛАВА 7
РОСТ И РАЗВИТИЕ РАСТЕНИЙ
В главе изложены основные принципы регуляции процессов роста и разви-
тия на разных уровнях организации. Особое внимание уделено интеграции ро-
стовых процессов. Подробно рассмотрены химические вещества-регуляторы
роста и роль световых стимулов в развитии растений. Процессы цветения, пло-
доношения, перехода в стояние покоя, листопада и др. рассматриваются с
точки зрения адаптации растения к факторам внешней среды: климату, фито-
ценотическому окружению, а также патогенов и вредителей. Многие из про-
блем, возникающих при действии этих факторов, растения решают комплекс-
но. Спектр физиологических реакций растения на тот или иной сигнал тесно
связан с первоочередными задачами, которые растение должно решить на каж-
дом этапе онтогенеза.
7.1. ОБЩЕЕ ПРЕДСТАВЛЕНИЕ О РОСТЕ
И РАЗВИТИИ
7.1.1. ПАРАМЕТРЫ РОСТА
В слове растение заключено фундаментальное свойство растений — способ-
ность к росту в течение всей жизни. Если роста нет — значит растение находит-
ся в условиях стресса или погибло.
Казалось бы, о росте можно судить по увеличению общей (сырой) биомас-
сы растения. Однако сырая биомасса может не только увеличиваться, но и
уменьшаться: при засухе ткани теряют воду, а при поливе вода поглощается,
сырая масса увеличивается (здесь, очевидно, увеличение сырой биомассы го-
ворит о выходе из стресса, а не о росте). При росте синтезируются новые
вещества, поглощаются элементы минерального питания, т.е. увеличивается
сухая биомасса. Взятый в отрыве от других критериев роста и этот показатель
может оказаться ошибочным. Так, при прорастании семян сухая биомасса умень-
шается (запасные органические вещества расходуются при дыхании), хотя рост
происходит. Еще один показатель роста — увеличение числа клеток. Если число
клеток растет, можно уверенно говорить о росте, но постоянное число клеток
еще не говорит об отсутствии роста: в зоне растяжения увеличение числа клеток
незначительно, тем не менее рост идет. О росте можно судить по увеличению
линейных размеров — высоты растения, длины корня, ширины листа и т.д.
Таким образом, ростом можно назвать необратимое увеличение растения
хотя бы по одному из параметров: по числу клеток, линейным размерам, сы-
рой и/или сухой биомассе. Самый быстрый и экономичный способ роста —
416
растяжение, при котором происходит сильная вакуолизация клеток. Для рас-
тяжения основными «строительными материалами» являются вода и углеводы
(целлюлоза, пектин и др.), тогда как для обеспечения деления клеток нужен
приток минеральных веществ, прежде всего — азота, фосфора и др.
7.1.2. КРИВАЯ РОСТА
Хорошей модельной системой для изучения роста является культура расти-
тельных клеток in vitro. В среду добавляют сахара, минеральные соли и росто-
вые факторы, самые важные из которых — ауксины и цитокинины (см. под-
разд. 7.2.2, 7.2.3, 7.2.4). При перемешивании в жидкой среде растительные клетки
образуют небольшие агрегаты (по 5 — 25 клеток). Такой способ выращивания
клеток называют суспензионной культурой', клетки находятся в ней примерно в
одинаковых условиях. В суспензии легко измерять число клеток, сырую и сухую
биомассу. Питательную среду со временем приходится заменять: клетки пери-
одически пересаживают в новую среду. Такой способ выращивания называют
периодической культурой.
График изменения параметров роста от времени называют кривой роста
(рис. 7.1). На этой кривой выделяют несколько характерных участков. На на-
чальной стадии (рис. 7.1,I) клетки не растут, их число и биомасса не изменя-
ются — это так называемая лаг-фаза. В течение лаг-фазы клетки адаптируются
к новым условиям и происходит изменение химического состава среды (кон-
диционирование). За лаг-фазой идет фаза экспоненциального роста (II). Боль-
шинство клеток вовлекается в процесс деления. Клетки слабо вакуолизирова-
ны, интенсивно используются ресурсы питательной среды. В фазе замедления
роста (III) число клеток, участвующих в митозах, постепенно уменьшается,
нарастает вакуолизация. Иногда между фазой экспоненциального роста и фа-
зой замедления роста выделяют фазу линейного роста. Вследствие исчерпания
ресурсов среды наступает стационарная
фаза (IV) — кривая роста выходит на пла-
то, число клеток и их биомасса меняется
слабо, митотический индекс падает. Обыч-
но на этой стадии периодическую суспен-
зионную культуру пересаживают. Если это-
го не сделать, наступает фаза деградации
(Г) — клетки начинают погибать.
Кривая роста, полученная для перио-
дической суспензионной культуры, дос-
таточно показательна. Аналогичные кри-
вые можно получить и на целых растени-
ях. Например, у однолетников лаг-фаза
соответствует периоду покоя семени, на
начальных этапах рост идет медленно,
усиливаясь по мере развития листьев (эк-
споненциальный рост). Замедление роста
связано с формированием цветков и пло-
дов, в конце жизни растение больше не
14 Физиология растений
Рис. 7.1. Кривая роста в периодиче-
ской суспензионной культуре:
/ — лаг-фаза; II — фаза экспоненциаль-
ного роста; /// — фаза замедления роста;
IV — стационарная фаза; V — фаза дегра-
дации
417
растет (фаза стационара) и после плодоношения погибает (деградация). Полу-
чение кривых роста для деревьев более трудоемко (трудно точно оценить био-
массу и количество клеток, фаза деградации иногда затягивается на 400 лет и
более и т.д.), но общий характер кривой роста сохраняется.
В природе растение подвергается действию внешних факторов, которые из-
меняют характер кривой роста. Даже в благоприятных условиях скорость роста
различна днем и ночью (различаются температура, испарение, поступление
воды и минеральных веществ, доступность фотоассимилятов). При этом в тече-
ние суток наблюдаются кратковременные периоды интенсивного роста и «ста-
ционары». Для деревьев характерны сезонные колебания роста. Наиболее изве-
стный пример — различная скорость отложения древесины. Каждая почка рас-
тет в соответствии с S-образной кривой роста. И в этом случае внешние факто-
ры обусловливают чередование интенсивного роста с фазой «стационара», ко-
торая стыкуется с лаг-фазой следующего ритма роста. Общая кривая роста ока-
зывается составленной небольшими (разномасштабными) S-образными участ-
ками. Таким образом, кривая роста целого растения обычно имеет более слож-
ную форму, чем кривая роста в периодической суспензионной культуре.
7.1.3. ДИФФЕРЕНЦИРОВКА
Термин дифференцировка (от лат. differentia — различие) был введен для обо-
значения процесса приобретения различий между клетками (тканями, органа-
ми, системами органов и т.д.). Предполагается, что есть начальное недифферен-
цированное состояние, когда наблюдатель не может установить различий между
клетками, затем появляются видимые различия клеток и они становятся диф-
ференцированными. Традиционно недифференцированными считают: делящи-
еся клетки эмбриона; меристематические клетки апексов корня и стебля, кам-
бия, феллогена, интеркалярных меристем; клетки, неорганизованно делящиеся
в экспериментальных условиях (суспензионная и каллусная культура in vitro).
Клетки, покинувшие зону деления, приступают к дифференцировке. Ре-
зультат этого процесса можно увидеть, например, при образовании проводя-
щей системы: возникает прокамбий, который дифференцируется на флоэму,
ксилему и камбий. Во флоэме дифференцируются ситовидные элементы и клет-
ки-спутницы, в ксилеме — паренхимные клетки и трахеиды. Проводящий пу-
чок может быть усилен дифференцирующимися механическими тканями и т. д.
В данном примере клетки поэтапно приобретают анатомические различия в
связи с выполняемыми функциями, многообразие клеток растет.
Анатомической дифференцировке предшествует биохимическая дифференциров-
ка, когда видимых различий между клетками мало, но они не одинаковы по
содержанию тех или иных веществ. Удобнее следить за дифференциальной эк-
спрессией генов: появлением новых или снижением уровня старых мРНК,
белков. Эти данные позволяют зарегистрировать различия между клетками рань-
ше, чем они станут видимыми на анатомическом уровне. Таким образом, диф-
ференцировка начинается с изменения активности генома, экспрессии одних
генов и подавления активности других.
При таком подходе делящиеся клетки меристемы придется считать диффе-
ренцированными, так как для прохождения клеточного цикла нужна опреде-
418
ленная активность генома, которая и будет отличать эти клетки от других. Ана-
томы давно обратили внимание на неоднородность клеток меристемы. Можно
сказать, что апикальная меристема корня дифференцирована на каллиптроген
(инициали чехлика), дерматоген (инициали эпидермальной ткани), инициали
коры, покоящийся центр и инициали осевого цилиндра. Для каждой из групп
делящихся клеток характерны определенная локализация, направление вере-
тена делений и тип производных клеток. Исследование меристемы методами
молекулярной генетики показывает, что обнаруженная анатомами дифферен-
цировка меристемы на зоны совпадает с зонами дифференциальной экспрес-
сией определенных генов. Более того, саму меристему в целом можно доста-
точно четко выделить по зонам дифференциальной экспрессии. Таким обра-
зом, меристема является биохимически дифференцированной тканью.
Дифференциальная экспрессия генов — фундаментальное проявляение диф-
ференцировки, и, как это ни парадоксально, недифференцированных клеток
вообще не существует. Понятие «недифференцированный» хорошо работает
только там, где в соответствии с задачами исследования исходные различия
между клетками не учитывают (или нет методов их обнаружить).
Итак, дифференцировкой можно назвать процесс изменения профиля ген-
ной активности, приводящий к дальнейшему изменению функции клеток.
7.1.4. ТОТИПОТЕНТНОСТЬ. ТЕРМИНАЛЬНАЯ ДИФФЕРЕНЦИРОВКА
В эмбриологии животных процесс дифференцировки изображают как слож-
ный «ландшафт», по которому катится «шар». Шар — это символ клетки, даю-
щей начало новому организму. В развилках шар «совершает выбор» и скатыва-
ется по одной из нескольких возможных траекторий. Так и клетки, возникшие
при делении зиготы, направляются по одному из возможных путей дифферен-
цировки. При этом клетки теряют «морфогенетический потенциал». Все «тра-
ектории» заканчиваются в «море», символизирующем смерть организма. Если
в начале пути у «шара»-клетки много потенциальных возможностей, то по
мере приближения к «морю» их становится все меньше (рис. 7.2). По имени
Рис. 7.2. Морфогенетический
ландшафт Уоддингтона.
Развилки на траектории обознача-
ют выбор путей дифференцировки,
крестики — нереализованные пути.
При «скатывании» шара к «морю»
возможностей выбора становится все
меньше
419
ученого, предложившего такую аналогию, ее называют морфогенетическим
ландшафтом Уоддингтона. Процесс дифференцировки равносилен потере мор-
фогенетического потенциала.
В отличие от клеток животных большинство клеток растений после анато-
мической дифференцировки легко переходят к делению. Такой процесс назы-
вают дедифференцировкой (потерей специализации). При механическом повреж-
дении растения, а также в условиях эксперимента дедифференцировка приво-
дит к образованию каллуса — ткани, обладающей быстрым ростом, и без стро-
гой пространственной организации веретен деления.
В каллусной культуре можно вызвать образование новых органов: корней,
побегов, эмбриоидов (см. подразд. 7.2.3). При отсутствии видимого порядка кал-
лусная ткань частично сохраняет профиль генной активности, характерный
для исходных тканей. Так, каллусы, полученные из тканей листа, при соответ-
ствующей обработке развивают вегетативные побеги, каллусы из цветоножек
образуют цветки, а каллусы из стенок завязи — рыльца. Из большинства кле-
ток можно получить новый организм (для клеток животных это невозможно).
Практически любая клетка многоклеточного организма содержит полный
набор генов, необходимый для формирования организма, однако не каждая
клетка может дать начало целому организму. Свойство клетки реализовать
имеющуюся генетическую информацию и дать начало целому организму назы-
вают тотипотентностью (лат. totalis — общий, целый; potentia — способность).
Тотипотентность клеток растения сравнительно легко реализовать, тогда как
большинство животных клеток не могут образовать новый организм. Таким
образом, понятие дифференцировки как снижения морфогенетического по-
тенциала, заимствованное из эмбриологии животных, не применимо к тоти-
потентным растительным клеткам, так как их морфогенетический потенци-
ал долго остается высоким. Тотипотентную клетку можно уподобить путнику,
путешествующему в горах, которому так и не суждено увидеть море.
В растениях есть клетки, не вступающие в клеточный цикл, — это мертвые
клетки ксилемы или живые клетки ситовидных элементов, потерявшие ядро.
В более мягких случаях за счет эндоредупликации без деления клетка увеличи-
вает плоидность. Так, у Arabidopsis в растягивающихся клетках гипокотиля со-
держание ДНК повышается до 8с, у одноклеточных волосков — до 32с, а в
клетках суспензора — до 1024с. Все эти клетки выполняют присущие им функ-
ции и не могут дедифференцироваться. К ним применимо понятие терминаль-
ной дифференцировки (необратимый процесс, после которого клетка не может
дедифференцироваться и реализовать свою тотипотентность). Для клеток с тер-
минальной дифференцировкой аналогия Уоддингтона оказывается справедли-
вой: вместе с потерей тотипотентности снижается морфогенетический потен-
циал клеток, и они гибнут.
7.1.5. ПЕРИОДИЗАЦИЯ ИНДИВИДУАЛЬНОГО РАЗВИТИЯ
Если рост можно охарактеризовать как количественное явление, то разви-
тие — это качественное явление. В процессе развития растение приобретает
новые структуры. В развитии растения выделяют эмбриональный, ювенильный,
(иногда — виргинильный), генеративный и сенильный этапы. Нетрудно видеть
420
параллели как с кривой роста (лаг-фаза, экспоненциальный рост, замедление
роста, стационар, деградация), так и с периодизацией жизни человека (внут-
риутробный, детство, юность, зрелость, старость).
Эмриональный период начинается со слияния яйцеклетки и спермия (т.е. с
образования зиготы). У цветковых растений зигота делится поперек, образуя
материнскую клетку суспензора (нижняя клетка) и будущий проэмбрио (верхняя
клетка). В суспензорной части деления ориентированы в плоскости первого
деления зиготы, в результате образуется суспензор (подвесок), продвигаю-
щий зародыш в глубь эндосперма. В верхней части два деления происходят в
меридианальной плоскости, и одно — в экваториальной. Дальнейшие деле-
ния приводят к дифференцировке протодермы (покровная ткань зародыша)
и внутренней паренхимы. На стадии глобулы зародыш имеет шаровидную
форму.
Далее сценарий развития зависит от систематической группы. У двудольных
синхронно растут две семядоли, что приводит к стадии сердечка, а затем —
Торпедо. У голосеменных семядолей больше двух, а у однодольных — одна,
поэтому форма зародыша отличается от сердцевидной. У некоторых растений
на эмбриональной стадии формируются уникальные органы (например, щи-
ток, колеоптиль и колеориза у злаков или гаустория на верхушке семядоли у
лука). Эмбриональный этап заканчивается переходом в состояние покоя, ко-
торое наступает как на ранних стадиях (например, на стадии глобулы у ор-
хидных и заразиховых), так и после формирования примордиев настоящих
листьев.
После периода покоя начинается ювенильный период. Его можно разделить
на стадию проростка (пока функционируют семядоли и другие зародышевые
органы) и собственно ювенильный этап (растет вегетативная масса). Иногда
выделяют отдельную виргинильную стадию, когда растение по всем признакам
не отличается от генеративного, но еще не цветет.
Генеративный этап роста — это период цветения и плодоношения.
Длительность этапов, как и число стадий, на которые разбивают индивиду-
альное развитие, зависит от жизненной стратегии. У однолетников ювениль-
ный этап бывает коротким, его трудно разделить на отдельные фазы. У много-
летников, напротив, ювенильный этап может занимать несколько лет: у коло-
кольчиков (Campanula spp.) — 2 года, у тюльпанов (ТиИра spp.) — 4—5 лет, у
пионов (Paeona spp.) — 7 — 9 лет и т.д. Чем длиннее ювенильный период, тем
больше отдельных стадий в нем можно выделить. Генеративный период про-
должителен только у поликарпиков (растений, способных цвести многократ-
но). У монокарпиков после цветения наступает программированная гибель,
деградация идет очень быстро. Так, у бамбуков (подсем. Bambusoidae) юве-
нильный и виргинильный периоды продолжаются 100—150 лет, а генератив-
ный период и программированная гибель происходят за один сезон. Иногда
многолетний поликарпик оказывается угнетенным (например, из-за внезап-
ного похолодания гибнет значительная часть растения), тогда растение не цве-
тет один или несколько сезонов. Такое состояние интерпретируется как что-то
похожее на «старость» (квазисенильное). На деле временное ослабление расте-
ния не означает, что оно состарилось и не может цвести.
Классический объект для изучения перехода из ювенильного состояния в
генеративное — плющ (Hedera). Молодой плющ имеет лопастные или рассе-
421
ченные листовые пластинки, у цветущего — листья цельные. Длительность
ювенильной стадии определяется тем временем, которое необходимо плющу,
чтобы подняться по опоре. Пока побеги растут горизонтально, они образуют
рассеченные листья, а если побег растет вертикально, появляются цельные
листья и цветки. При потере опоры побеги вновь примут горизонтальное поло-
жение и плющ образует рассеченные листья. Считается, что при горизонталь-
ном росте происходит «реювенилизация» (повторное омолаживание), а цель-
ные листья — признак генеративного состояния, «старения». Однако цикл та-
кого «старения—омоложения» можно повторять в условиях эксперимента до
бесконечности, и гибель растения «от старости» не наступит. Этот пример по-
казывает, что понятие «старение» необходимо применять к растению с боль-
шой осторожностью.
7.2. ГОРМОНАЛЬНАЯ СИСТЕМА РАСТЕНИЙ
7.2.1. ОБЩИЕ ПРИНЦИПЫ ГОРМОНАЛЬНОЙ РЕГУЛЯЦИИ
7.2.1.1. Регуляторные молекулы растений
Клетка должна не только поддерживать собственную целостность, но и
функционировать согласованно с другими клетками организма растения, по-
этому между клетками происходит обмен информацией. Одна группа клеток
при этом становится «отправителями» сигнала, а другая воспринимает его. Если
сигнал химической природы, молекулу с сигнальной функцией называют пер-
вичным мессенджером (от англ, message — послание).
Растительная клетка воспринимает разнообразные химические стимулы и
реагирует на них. Физиологический ответ вызывают изменение концентрации
сахаров во флоэмном токе, олгигомерные сахара и фрагменты хитина, индо-
лилуксусная кислота, брассиностероиды и др. Среди обширного списка пер-
вичных мессенджеров можно выделить гормоны растений.
Вещество можно отнести к гормонам, если оно обладает следующими свой-
ствами:
• вызывает специфический физиологический ответ; особенность раститель-
ных гормонов в том, что они запускают крупные программы развития не толь-
ко на уровне клеток, но и на уровне тканей, органов, целого растения;
• синтезируется в растении одной группой клеток, а отвечает на него другая
группа (разобщено место синтеза и место действия, т. е. сигнальное вещество
транспортируется). К синтезу гормонов потенциально способна любая клетка
растений; как правило, фитогормоны являются низкомолекулярными соеди-
нениями (не более 2 кДа);
• практически не играет роли в основном метаболизме клетки, а использу-
ется лишь для сигнальных целей.
Иногда эти свойства расширяют:
• вещество действует в низкой концентрации — не более 10"5 моль/л.
Перечисленные свойства позволяют ограничить круг веществ, традицион-
но считающихся растительными гормонами (в научной литературе их принято
называть фитогормонами): ауксины, цитокинины, гиббереллины, абсцизины,
422
этилен. Часто к ним добавляют брассиностероиды, жасминовую кислоту*, сали-
циловую кислоту, некоторые фенольные соединения и др. Однако всеми класси-
ческими свойствами обладают немногие гормоны, например ауксины. Абс-
цизины обычно действуют в точке синтеза, распространяясь лишь на неболь-
шое расстояние. Этилен транспортируется только в виде предшественника; фе-
нолы, салициловая и жасминовая кислоты действуют в концентрациях более
10"5 моль/л.
К сигнальным молекулам можно также отнести олигосахарины (олигосаха-
риды с физиологической активностью), лектины (белки, взаимодействующие
с полисахаридами) и короткие пептиды. Их действующая концентрация может
быть очень низкой: 10"12—10"15 моль/л.
7.2.1.2. Рецепция и усиление сигнала
Первичные мессенджеры, воспринимаемые клеткой как сигналы, специ-
фически взаимодействуют со многими белковыми молекулами. Так, ауксин с
высокой аффинностью связывается с рецепторами, транспортными белками,
ИУК-оксидазой, ИУК-гликозидазой, но не каждое взаимодействие приводит
к физиологическому ответу. Чтобы клетка ответила на стимул, нужно вклю-
чить внутриклеточную систему вторичных мессенджеров. Одна из функций вто-
ричных мессенджеров — усиление сигнала (один G-белок активирует более 10
молекул фосфолипазы С; одна молекула ауксина приводит в движение до 104
протонов).
Для поиска рецепторов применяют следующие правила:
1) рецептор взаимодействует с гормоном и его аналогами; чем больше фи-
зиологический ответ, вызываемый аналогом, тем выше аффинность;
2) при взаимодействии рецептор не должен менять химическую структуру
гормона (так, исключают белки, метаболизирующие гормоны);
3) взаимодействие гормона с рецептором приводит к включению системы
вторичных мессенджеров.
Кроме биохимического выделения белков-рецепторов применяют генети-
ческие методы. У мутантов с нарушенной чувствительностью к гормонам часто
оказываются поврежденными гены белков-рецепторов. Далее ген клонируют и
путем экспрессии в кишечной палочке {Escherichia coli) или дрожжах {Saccharo-
myces cerevisiae) получают много белкового продукта.
Большинство систем вторичных мессенджеров, изученных у животных, в
настоящее время обнаружены и у растений. Каскад усиления сигнала называют
по характерным мессенджерам. Наиболее известны фосфатидилинозитольная,
аденилатциклазная и гуанилатциклазная системы, MAP-киназный каскад и др.
Рецепторы обычно локализованы на плазмалемме, но не исключена их ло-
кализация в других компартментах клетки. Рецептор при этом связан с разны-
ми вторичными мессенджерами. Так, при его локализации в цитоплазме пер-
востепенную роль играют белок-белковые взаимодействия, активирующие кас-
кад фосфорилирования/дефосфорилирования, что приводит к изменению ме-
* В переводной литературе часто применяют транслитерацию с английского — жасмоновая
кислота. В отечественной литературе принято название жасминовая кислота, но: жасмонат
(анион).
423
таболизма и работы цитоскелета. При внутриядерной локализации рецептор
взаимодействует с белками ядра так, чтобы включить одни и выключить дру-
гие промоторы, обеспечивая специфический ответ на уровне генома.
7.2.1.3. Фосфатидилинозитольная система
вторичных мессенджеров
Принципы работы вторичных мессенджеров в данном подразделе показаны
на примере фосфатидилинозитольной системы (рис. 7.3). Фосфатидилинози-
тол — один из липидов плазмалеммы, поэтому фосфатидилинозитольная си-
стема работает с рецепторами, расположенными на внешней мембране.
При связывании с гормоном белок-рецептор меняет конформацию и пере-
дает сигнал на G-белок. G-белки названы так за способность связывать и гидро-
лизовать ГТФ. Конформация белкового комплекса рецептора влияет на спо-
собность G-белка связывать и удерживать ГТФ.
Пока молекула ГТФ остается связанной с G-белком, он успевает активи-
зировать до 10 молекул фосфолипазы С, входящей в состав мембранных бел-
ков. После этого происходит гидролиз ГТФ, ГДФ и фосфат освобождаются,
G-белок переходит в неактивное состояние, пока не захватит новую молекулу
ГТФ. Работа G-белка регистрируется в первые 1 — 5 с после обработки рецеп-
тора гормоном (рис. 7.3, Б).
Активизация фосфолипазы С приводит к гидролизу фосфатидилинозитолди-
фосфата. При этом в мембране остается гидрофобный остаток диацилглицери-
на, а в цитоплазму поступает инозитол-1,4,5-трифосфат (ИФ3). Именно это
событие и дало название всему каскаду вторичных мессенджеров. Уменьшение
доли фосфатидилинозитолтрифосфата и поступление инозитолтрифосфата в
цитоплазму наблюдается уже через 10—15 с после получения сигнала, дости-
гая максимума к 60 с.
Инозитолтрифосфат может взаимодействовать с Са -каналами на мембра-
не. Через 2 мин после обработки гормоном в цитоплазму начинает поступать
кальций. Этот процесс имеет характер осцилляций (так называемые «каль-
циевые волны»). Концентрация кальция в клетке изменяется приблизительно
с 1 до 100 ммоль/л. Дальнейшее повышение концентрации кальция может выз-
вать автолиз клетки: активизируются Са +-зависимые фосфолипазы (напри-
мер, фосфолипаза А), что приведет к разрушению мембраны. Чтобы избежать
автолиза, клетка модулирует уровень кальция через концентрацию инозитол-
трифосфата. Так, при превышении уровня ИФ3 может происходить дополни-
тельное фосфорилирование, а инозитолтетрафосфат (ИФ4) уже не взаимо-
действует с Са +-каналами. При этом инозитолтетрафосфат используется как
депо, из которого можно «изъять» новую порцию активного инозитолтрифос-
фата. После достижения максимума инозитолтрифосфат поэтапно гидролизу-
ется до инозитола. Далее инозитол включается в состав фосфатидилинозитола,
и только в составе мембраны фосфорилируется до фосфатидилинозитолди-
фосфата и используется еще раз. Фосфатидилинозитолдифосфат является важ-
ным модулятором при взаимодействии мембран с цитоскелетом. Так, повыше-
ние его доли в составе мембран провоцирует сборку актиновых филаментов, а
дефосфорилирование приводит к разборке цитоскелета.
424
Инозитол в растительных клетках может полностью фосфорилироваться,
превращаясь в инозитолгексафосфат {фитин). Обычно это соединение рассмат-
ривают как депо фосфора в семенах и запасных тканях. У дрожжей инозитол-
гексафосфат необходим для транспорта РНК из ядра в цитоплазму. Возможно,
похожие явления будут обнаружены и у растений.
Кроме фосфатидилинозитольной системы у растений обнаружены еще не-
сколько сигнальных систем. Например, аденилатциклазная система похожа по
действию на аналогичную систему животной клетки. В липоксигеназной систе-
ме в регуляцию сигнального каскада вовлечена также фосфолипаза А, активи-
руемая кальцием. После ее активизации в мембране появляются свободные
жирные кислоты. Кроме того, кальций активизирует липоксигеназу, которая
включает кислород в состав полиненасыщенных жирных кислот с образовани-
ем пятичленных углеродных колец. Одним из результатов работы липоксигена-
зы является синтез жасминовой кислоты, блокирующей Са +-каналы, что пре-
дотвращает избыточное поступление кальция. Есть сведения о работе в расти-
тельной клетке NO-системы, системы фосфатидной кислоты, НАДН-окси-
дазной системы, пероксидазной системы, MAP-киназного каскада (Mitogene
activated proteinkinase).
Следующими по времени активируются функциональные системы клетки,
происходит активация/инактивация генов, изменяется мембранный потенци-
ал. Так, активация фосфатидилинозитольной системы ауксином вызывает выб-
рос протонов из цитоплазмы за счет активизации Н+-помпы. Через 5 — 7 мин
после воздействия гормона наблюдается закисление матрикса клеточной стен-
ки. Ответ этого компартмента на закисление зависит от состава клеточной стен-
ки, в частности от присутствия кислых гидролаз, инвертазы, доли пектиновых
веществ и т.д. Увеличение размеров клетки начинается через 10—12 мин после
обработки ауксином.
При закислении клеточной стенки из пектина освобождается кальций, свя-
занный с кислотными группировками. Таким образом, растительная клетка
использует клеточную стенку как депо Са +. Уровень Са + в цитоплазме зави-
сит от концентрации инозитолтрифосфата и жасминовой кислоты, состоя-
ния матрикса клеточной стенки, работы Са +-каналов и Са +-АТФаз. Эти фак-
торы действуют не одновременно, причем приток кальция в клетку провоци-
рует процессы, приводящие к снижению его концентрации и наоборот. В ре-
зультате поток кальция оказывается неравномерным во времени, возникают
волны поступления/удаления кальция. Динамика волн кальция существенно
различается для разных внешних сигналов (см. подразд. 6.3.4.3). До 70 % посту-
пившего в клетку кальция связывается с цитоскелетом, активизируя его
работу.
Важным вторичным мессенджером в передаче сигнала являются небольшие
белки — кальмодулины. Кальмодулин имеет 4 центра, связывающихся с Са +, и
его конформация различается в зависимости от числа занятых кальцием цент-
ров. От активности кальмодулинов, в частности, зависит работа Са -АТФаз:
полностью заполненный кальцием кальмодулин усиливает выкачивание каль-
ция из клетки. Гидрофобный диацилглицерин также является вторичным мес-
сенджером. Он взаимодействует с протеинкиназой С, повышая ее фосфорили-
рующую активность. Далее запускается каскад фосфорилирования белков. Вто-
ричными мессенджерами в приведенном примере выступают G-белки, фос-
425
через ядерную
мембрану
Система II мессенджеров
О 1 2 3 4 5 6 7 8 9 10 И 12 13 14 15 16 17 18 19 20 120
Время, мин
Рис. 7.3. Фосфатидилинозитольная система вторичных мессенджеров:
А — последовательность активизации вторичных мессенджеров в пространстве; Б — последовательность событий на шкале времени. И — инози-
тол; ИФ — инозитолфосфат; ИФ2 — инозитолдифосфат; ИФ3 — инозитолтрифосфат; ИФ4 — инозитолтетрафосфат; ИФ5 — инозитолпентафос-
фат; ИФй — инозитолгексафосфат (фитин); ДАГ — диацилглицерин
фолипазы С и А, инозитолтрифосфат, жасминовая кислота, кальций, диа-
цилглицерин, протеинкиназа С. При добавлении в клетку какого-либо из этих
мессенджеров даже без первичного сигнала можно наблюдать физиологиче-
ский ответ (обычно такой ответ бывает неполным).
7.2.1.4. Взаимодействие сигналов
Несмотря на большое многообразие первичных сигналов, при ответе клет-
ка часто активизирует одни и те же механизмы, которые можно назвать неспе-
цифическим ответом. Так, при действии ауксинов, гиббереллинов, абсцизовой
кислоты, красного света и даже при оказании механического давления на клетку
уже через 1 мин можно зарегистрировать гидролиз фосфатидилинозитолди-
фосфата со всей цепочкой последующих событий. Активизируются и другие
системы вторичных мессенджеров. Один и тот же компонент может входить в
несколько каскадов усиления сигнала. Так, многие системы вторичных мес-
сенджеров включает Са +. Часто происходит изменение редокс-статуса клетки
и увеличивается концентрация активных форм кислорода.
Протеинкиназы и факторы транскрипции изменяют активность в ответ на
несколько воздействий. Оказывается, что участники одного каскада вторичных
мессенджеров вовлечены и в другие реакции ответа. Тогда говорят о «перегово-
рах» путей передачи сигнала (от англ, signaling path cross-talk). При повреждении
узловых точек в перекрестной регуляции нарушается физиологический ответ
на несколько стимулов одновременно. Так, мутант nph 4 (non-phototropic hypocotyl)
не чувствителен ни к свету, ни к силе тяжести. Очевидно, белковый продукт
гена NPH 4 участвует в «переговорах» между каскадами мессенджеров фото- и
гравитропизма (см. подразд. 7.2.2.4). Если бы на каждом этапе передачи сигнала
происходило только усиление, ответ слишком быстро охватил бы все молеку-
лы в клетке. Этого не происходит благодаря «переговорам»: если один сигнал
«противоречит» другим, в результате «переговоров» число его мессенджеров
уменьшается Востребованный сигнал в результате «переговоров» усиливает-
ся. Таким образом, одна из функций «переговоров» между сигнальными путя-
ми — модуляция сигнала.
Специфический ответ клетки предполагает, что 1) разные клетки в одном
организме отвечают на стимул не одинаково; 2) одна и та же клетка отвечает
на разные стимулы по-разному. Это достигается за счет того, что в ядре экс-
прессируется разный набор мРНК, в клетке вырабатываются новые белки, что
позволяет развить адекватную реакцию на стимул. Восприятие сигнала зависит
от состояния, в котором находилась клетка перед его получением, — от набо-
ра рецепторов, экспрессированных в данный момент, наличия вторичных мес-
сенджеров, результатов «переговоров» между сигналами и т.д.
В организме растения существует позиционная информация, т.е. клетки «уме-
ют оценивать» свое положение. Это позволяет им интегрироваться в единый
организм и давать адекватный ответ на внешние и внутренние стимулы. Про-
граммированная гибель клеток — это ответ растения как единого целого, иду-
щий вопреки «интересам» отдельных клеток. Запрограммированная гибель ха-
рактерна для элементов ксилемы, пробковой ткани, при реакции сверхчув-
ствительности (ответ на внедрение патогена).
428
7.2.2. АУКСИНЫ — ГОРМОНЫ АПЕКСА ПОБЕГА
7.2.2.1. История открытия ауксинов
В 1880 г. Ч. и Ф. Дарвины решали проблему воспринимающего свет органа.
Растения изгибаются к боковому источнику света, причем изгиб происходит в
субапикальной зоне (ниже апекса побега). Исследователи защищали от света
субапикальную область — зону изгиба — светонепроницаемой тканью (рис. 7.4)
и наблюдали при этом, что растения все-таки изгибались. Когда незакрытую
верхушку (стеблевой апекс) проростка накрыли черным колпачком, изгиб в
сторону света не происходил, хотя зона изгиба была хорошо освещена. По-
видимому, направление света воспринималось апексом стебля, откуда сигнал
передавался в нижележащую зону изгиба. Ч. и Ф. Дарвины предположили, что
апекс стебля вырабатывает вещество, транспортирующееся вниз и вызываю-
щее неравномерный рост, и это гипотетическое вещество они назвали аукси-
ном (от греч. аихо — расту).
Гипотеза Ч. и Ф. Дарвинов — не единственное объяснение. Сигнал мог пере-
даваться в виде электрических импульсов и приводить к тому же эффекту. Аук-
синовая гипотеза нуждалась в экспериментальной проверке. Через 50 лет наш
соотечественник Н. Г. Холодный и немец Ф.В. Вент независимо друг от друга
провели эксперименты для изучения природы этого сигнала. Вещество, пере-
дающее сигнал из апекса в зону изгиба, должно растворяться в воде. Значит,
при помещении побеговых апексов в воду в раствор перейдут и гипотетиче-
ские ауксины. Затем нужно создать несимметричное распределение «ауксина»:
верхушку с собственными ауксинами удалить, а на срез несимметрично нане-
сти водный экстракт апексов. По техническим причинам опыт видоизменили:
апексы располагали на агаровом геле, а растение декапитировали и сбоку на-
кладывали на срез кубик агара с экстрактом. В таких условиях растения изгиба-
лись в сторону, противоположную наложенному агаровому блоку. Контролем
служил агаровый блок, не пропитанный экстрактом побеговых апексов, —
изгиба не было (рис. 7.5).
Рис. 7.4. ОпытЧ. и Ф. Дарвинов:
А — отрицательный контроль (темнота): нет изгиба; Б — положительный контроль (свет справа):
есть изгиб; В — опыт (свет справа, закрыта зона изгиба): есть изгиб; Г — опыт (свет справа,
закрыт апекс): нет изгиба
429
Рис. 7.5. Опыт Ф. В. Бента:
А — начало опыта: ауксин из апексов колеоптилей диффундирует в агар (затемненные участки);
Б — продолжение опыта: наложенный сбоку кубик агара с ауксином вызывает изгиб; £ —
контроль: агар без ауксина не вызывает изгиба
Н. Г. Холодный и Ф. В. Вент доказали, что ростовое вещество существует и
вызывает растяжение клеток. Можно предположить, что при одностороннем
освещении ауксин перетекает на затененную сторону и вызывает изгиб к свету.
Не имея препарата выделенного ауксина, исследователи изучили его основ-
ные свойства. Если зону изгиба вырезать и блок с экстрактом ауксина накла-
дывать на базальную сторону, изгиба не будет. Отсюда следовало, что ауксин
движется по растению полярно — от апекса побега к его основанию, а затем —
к апексу корня. Была измерена скорость транспорта ауксинов: на участок
заданной длины помещали сверху агар с ауксином, а снизу — агаровый блок
без ауксина. Верхний агаровый блок служил донором ауксинов, а нижний —
коллектором. Нижний блок через равные промежутки времени заменяли но-
вым. Полученную серию нижних блоков анализировали на проростках на на-
личие ауксинов. Таким способом удалось определить, что скорость транспорта
ауксинов составляет от нескольких миллиметров до нескольких сантиметров
в час.
Немецкий химик Ф. Кёгль в 1939 г. выделил из мочи вегетарианцев индолил-
уксусную кислоту {ИУК). Для определения ее малых количеств Кёгль испробо-
вал ИУК в разных живых системах. Выяснилось, что ИУК усиливает рост про-
ростков с отрезанной верхушкой подобно ауксину. При асимметричном нало-
жении агарового блока с ИУК наблюдается характерный изгиб в субапикаль-
ной зоне.
Вскоре ИУК была выделена из верхушек побегов, тем самым было показа-
но, что ИУК является одним из естественных акусинов. Известен ряд веществ,
обладающих ауксиновой активностью (фенилуксусная кислота, индолилпи-
ровиноградная кислота), но их активность ниже, чем ИУК, и они менее рас-
пространены.
Кроме того, удалось синтезировать вещества, вызывающие такой же физи-
ологический эффект, как и природные ауксины. Поскольку такие вещества
не встречаются в растениях, их называют синтетическими аналогами ауксинов.
К ним относятся 2,4-дихлорфеноксиуксусная кислота (2,4-Д), а-нафтилуксус-
ная кислота (НУК) и др. Синтетические аналоги эффективно связываются с
рецепторами ауксина, но слабо взаимодействуют с системами транспорта и
окислительной деградации.
430
7.2.2.2. Биосинтез и деградация ауксинов
Ауксины синтезируются в растениях разными путями. Ранее считалось, что
ИУК образуется единственным путем — из триптофана. Синтез ИУК идет как
минимум в три стадии: декарбоксилирование (удаления СО2); дезаминирова-
ние (удаление ЫН2-группы); окисление (рис. 7.6).
Для исследования метаболических путей, ведущих от триптофана к ИУК, по-
лучены мутанты, не способные к синтезу триптофана, тем не менее у мутантов
синтез ауксина не менялся. Очевидно, есть и другие пути синтеза ИУК, в кото-
рых триптофан не участвует. В некоторых растениях таких путей несколько: трип-
тофановый и «нетриптофановые». После образования ИУК может связываться
с сахарами, аминокислотами или небольшими белками, образуя неактивные
(запасные) формы. При необходимости ИУК освобождается из конъюгатов.
В упомянутых выше опытах Ч. и Ф. Дарвинов с проростками злаков ауксин в
апексе колеоптиля не синтезируется! ИУК образуется в период роста зароды-
ша, а при созревании накапливаются ИУК-гликозиды. В проростках они транс-
портируются в апекс колеоптиля, где активный ауксин высвобождается и пе-
рераспределяется по колеоптилю в зависимости от освещенности. Колеоп-
тиль — временный орган проростка злаков, необходимый для пробивания почвы.
Внутри него заключена апикальная меристема побега, образующая стебель и
листья. Именно в апикальной меристеме, а не в верхушке колеоптиля сосредо-
точен синтез ауксинов. ИУК может необратимо разрушаться. Это происходит
либо специфически (с помощью ИУК-оксидазы), либо неспецифически (по-
лифенолоксидазой) (см. рис. 7.6).
Таким образом, по мере удаления от точки синтеза концентрация ауксинов
падает за счет необратимого окисления и связывания в неактивные формы.
7.2.2.3. Транспорт ауксинов
Гипотеза транспорта ауксинов была разработана для клеток субапикальной
паренхимы в 1950-х гг. и с тех пор почти не изменилась. Считается, что клетка
получает ауксин из внешнего пространства (апопласта), где ИУК протониро-
вана. ИУК° (нейтральная) через белок-переносчик {influx carrier) проникает в
клетку по градиенту концентрации. Предполагают, что «каналом» для ИУК°
служит белок AUX 1 (рис. 7.7).
В цитоплазме среда более щелочная, чем снаружи, поэтому ИУК диссоци-
ирует и становится ИУК“-анионом. Выход ИУК" из клетки активный — с по-
мощью трансмембранных переносчиков, работающих с затратой энергии. «На-
сосы» {efflux carrier) расположены в нижней части клетки, что обеспечивает
полярный транспорт. Переносящий белок конкурентно ингибируется трииод-
бензоатом (ТИБК). Получены мутанты, не чувствительные кТИБК, у которых
изменены белки-переносчики ИУК". Таким белком оказался PIN. При мутации
pin полярный транспорт ауксина сильно снижается, что приводит к изменени-
ям в морфологии растений, связанным с нарушением пространственного рас-
пределения ауксина. С белком PIN, выносящим ИУК" из клетки, ассоцииро-
вана регуляторная субъединица, которая связывается с нафтилфталаминовой
кислотой (НФК) — еще одним блокатором транспорта ИУК.
431
Триптамин
Индолилацетальдегид
Индолилацетонитрил
О
АВР1
Рецептор
Фосфолипаза С
Инозитолтрифосфат
Диацилглицерин
Активная форма
—СН2—СН2—СН2—-СООН
N
Н
Индолилмасляная кислота
Активная форма
сн2-соон
N
Н
Индолилуксусная
кислота
г/ иук-
ПФО /оксидаза
СН2 ДЕПО, транспорт
Гликозиды ИУК,
конъюгаты
с белками
и аминокислотами
Рис. 7.6. Биосинтез, деградация и рецепция ауксинов:
Al, А2, АЗ — варианты путей биосинтеза индолилуксусной кислоты (ИУК) из триптофана,
реализуемые у разных растений; Б1, Б2 — «нетриптофановые» пути биосинтеза ИУК; В — ре-
цепция и передача сигнала; Г — необратимая деградация; Д — депонирование ИУК в виде
неактивных форм
432
/Г\
Рис. 7.7. Транспорт ауксинов через клетку:
ТИБК — трииодбензойная кислота, конкурентный ингибитор транспорта ауксина; НФК —
нафтилфталаминовая кислота; ингибирует транспорт ауксина, связываясь с регуляторной субъ-
единицей комплекса белков-переносчиков
Из синтетических аналогов ауксинов некоторые участвуют в транспорте (НУК
взаимодействует с переносчиками ИУК), а другие не участвуют (2,4-Д прони-
кает путем диффузии). Очевидно, ИУК -насосы связаны с цитоскелетом и при
изменении освещения передвигаются на теневую сторону. Ауксин очень быст-
ро перераспределяется: через 10— 15 мин наблюдается ответ клеток на его не-
равномерное распределение.
Цитохолазин D, разрушая актиновые филаменты, нарушает полярный транс-
порт ауксинов. Транспорт ауксинов в зоне вторичного утолщения у древесных
растений изучен недостаточно. По-видимому, здесь ауксины транспортируют-
ся по флоэме (симпласту).
433
7.2.2.4. Физиологические эффекты ауксинов
На роль рецептора ауксина претендует белок АВР 1 (auxin binding protein).
В больших количествах он обнаруживается в эндоплазматическом ретикулуме,
откуда путем встраивания мембран ЭПР попадает в плазмалемму. Присутствие
АВР 1 в плазмалемме показано с помощью специфических антител. При обра-
ботке протопластов эти антитела экранируют сайт связывания ауксина на
АВР 1, ответы на ауксины блокируются. Через 60—120 с после связывания
ауксина с рецепторами (АВР 1) и включения системы вторичных мессендже-
ров регистрируются токи Са + через мембрану, а через 5 — 7 мин активируется
Н+-помпа и заметен эффект закисления апопласта (Н+ выходят из клетки).
После первичной реакции на ауксин дальнейший ответ зависит от положения
клетки в целом растении. Ауксины — гормоны, вырабатываемые в апикальных
меристемах побегов. Для растения в целом ауксиновый сигнал означает, что
побег интенсивно растет и нужно обеспечивать его потребности. Образно аук-
син можно назвать «гормоном благополучия апекса побега».
1. Самый первый эффект ауксинов — аттрагирующий (от лат. attractio —
привлечение). Клетки меристемы «привлекают» к себе питательные вещества.
Аттрагирующий механизм ауксинов не установлен, но наиболее вероятен сле-
дующий сценарий. Способность клетки к поглощению зависит от Ацщ на мем-
бране (см. подразл. 6.2.2.2). Так, сахароза проникает в клетку в симпорте с Н+,
и чем больше Ар.н • на плазмалемме, тем больше сахарозы клетка может захва-
тить. Активизация работы Н+-помпы идет на усиление трансмембранного транс-
порта веществ. Таким образом, клетки, нуждающиеся в питательных веще-
ствах, создают больший Ацщ на мембране, увеличивающий поглотительную
способность. Кроме сахарозы, клетки апикальной меристемы побега аттраги-
руют аминокислоты, нуклеотиды, неорганические ионы, воду и др. Аттраги-
рующий эффект проявляется в зоне делений клеток. Совместно с цитокинина-
ми ауксины вызывают деление клеток в определенной зоне апекса побега.
2. В субапикальной зоне ауксин вызывает растяжение клеток, которое так-
же активизируется через Н+-помпу.
Клеточная стенка — прочная экстрацеллюлярная структура. При растяже-
нии прочность снижается, силы тургорного и осмотического давления прихо-
дят в дисбаланс. Протопласт, не сдерживаемый клеточной стенкой, поглощает
воду, образует крупные вакуоли и за счет этого его объем увеличивается, а
клеточная стенка растягивается. Активный перенос ионов Н+ из цитоплазмы в
матрикс клеточной стенки приводит к так называемому «кислому росту» и
растяжению клетки (см. подразд. 1.10).
С растяжением клеток в субапикальном районе связаны более сложные яв-
ления — тропизмы. Главная задача растягивающихся клеток — правильно ори-
ентировать растущую верхушку побега в пространстве. При боковом освеще-
нии ауксины перераспределяются на теневую сторону, вызывая неравномер-
ное растяжение и наклон в сторону света. Это явление называют фототропиз-
мом (гелиотропизмом). Если побег изменил положение в пространстве (накло-
нился, повален ветром и т.д.), ауксины перераспределяются на физически
нижнюю сторону. Субапикальная зона стремится вновь направить рост по вер-
тикали. Это явление получило название гравитропизма (геотропизма). Обычно
для побегов характерен отрицательный геотропизм — побег растет по направ-
434
лению от центра Земли. Корни обладают положительным геотропизмом (к цен-
тру Земли).
Иногда побеги растут диагеотропно (плагиотропно), т. е. перпендикулярно
силе тяжести, например боковые ветви ели (Picea abies), подземные корневи-
ща многих растений.
У лиан имеется тигмотропизм — ростовой изгиб в сторону прикосновения.
Тигмотропизм важен для растений, нуждающихся в опоре: вьюнка (Convolvulus),
фасоли (Phaseolus), ипомеи (Ipomoea), повилики (Cuscuta) и др.
3. Ниже зоны растяжения начинается дифференцировка проводящей систе-
мы и механических тканей: клетки лигнифицируются и после этого теряют спо-
собность к растяжению. Более того, если начнут растягиваться окружающие
клетки, то происходит разрыв проводящих сосудов. Таким образом, ниже зоны
дифференцировки сосудов побеги не могут изгибаться. Ауксин важен для регу-
ляции анатомической дифференцировки. Потоки ИУК определяют положение
прокамбия. В связи с тем, что стеблю необходим приток питательных веществ
от корня, под действием ауксина и сахаров формируются проводящие пучки, в
основном ксилема. На фоне ауксина в каллусной культуре in vitro формируется
ксилема, если сахарозы менее 2 %, или флоэма, если сахарозы 4 % и более.
Ауксин влияет на расположение листьев. Каждый молодой лист, пока рас-
тет, служит источником ауксинов. Если нарушить транспорт ауксина из при-
мордия листа в окружающие клетки (сделать надрез), то следующий лист
закладывается у края надреза. У мутантов pin с нарушением транспорта аукси-
на (см. подразд. 7.2.2.3) листья располагаются в беспорядке, соседние примор-
дии сливаются, образуя уродливые органы. Дефекты затрагивают все листья,
начиная от семядолей — их число доходит до 6 (в норме 2) — и заканчивая
органами цветка. Такой же эффект вызывают ингибиторы транспорта ИУК
(ТИБК, НФК). Меристема листа, как и меристема побега, «привлекает» пита-
тельные вещества и обеспечивает себя правильной сетью жилок. Закладка со-
судистых элементов в листьях также находится под контролем ауксинов и рас-
согласуется при нарушениях транспорта ИУК.
4. В пазухах листьев создаются благоприятные условия для закладки и разви-
тия боковых побегов (почек). У большинства растений боковые побеги не раз-
виваются, пока активно растет главный побег. Подавление роста боковых по-
чек в пользу апикальной меристемы получило название апикального доминиро-
вания.
Роль ауксинов в апикальном доминировании показана экспериментально
(рис. 7.8). Удаление апекса побега стимулирует рост боковых побегов. Если на-
ложить на срез агаровый блок с ИУК, боковые почки не пробудятся. Растение
воспринимает агар с ауксином как активно растущий апекс побега и ингиби-
рует рост новых побегов. Дефицит ауксина — сигнал о повреждении побегово-
го апекса: апикальное доминирование снимается и боковые почки идут в рост.
Утрата апекса побега в природе может быть вызвана как абиотическими
(ураган, молния, гибель от заморозков), так и биотическими факторами (ин-
фекция, нападение насекомых, травоядных или вмешательство человека). При
потере апекса растение регенерирует побеговую систему, снимая апикальное
доминирование.
Интересно снятие апикального доминирования по эндогенным причинам.
При этом важна ориентация главного побега в пространстве. Различают два
435
Рис. 7.8. Апикальное доминирование:
А — контроль: растущий апекс побега доминирует над боковыми почками; Б — при удалении
апекса доминирование снимается; В — агаровый блок с ауксином вызывает апикальное доми-
нирование; Г — контроль: агаровый блок без ауксина, апикальное доминирование снято; Д —
изменение направления роста с горизонтального на вертикальное снимает апикальное домини-
рование с плагиотропных боковых побегов; Е — изменение направления роста с вертикального
на горизонтальное снимает апикальное доминирование с ортотропных боковых побегов. Стрел-
ки — рост побега; крестики — остановка роста
основных направления роста — вертикальное {ортотропное) и горизонтальное
{плагиотропное). Главный ортотропный побег не дает образовать новые верти-
кальные побеги и не мешает расти плагиотропным ветвям, но стоит повредить
ортотропный побег, как из пазух листьев вырастут замещающие вертикальные
побеги. Это наблюдается у кофе {Coffea arabica), араукарии {Araucaria), ели.
Чтобы снять апикальное доминирование, достаточно изменить направле-
ние роста. Этим приемом часто пользуются в интенсивном плодоводстве, сги-
бая ортотропные побеги и подвязывая их к опоре горизонтально. У роз и ши-
повника главный ортотропный побег наклоняется под собственной тяжестью
(изменяет направление роста). Видимо, в зоне перегиба создается механиче-
ское напряжение, что приводит к синтезу этилена, замедлению транспорта и
ускорению деградации ауксинов (см. подразд. 7.2.7).
Если главный побег плагиотропный, он доминирует над боковыми плагио-
тропными побегами, но не мешает росту боковых вертикальных. Так, у расте-
ний с горизонтальным подземным корневищем есть две фазы роста: первая —
летний рост в горизонтальном направлении, апекс плагиотропного побега не
дает расти боковым горизонтальным корневищам; вторая — зимой происходит
«разворот» и верхушка корневища становится вертикальной, весной из нее
развивается ортотропный побег. «Разворот» позволяет снять апикальное доми-
нирование с боковых плагиотропных почек, развиваются новые горизонталь-
436
ные звенья корневища. При экстремальных обстоятельствах «разворот» апи-
кальной меристемы происходит раньше (при утрате надземных ортотропных
побегов). Эта форма роста характерна для тысячелистника (Achillea), вербей-
ника обыкновенного (Lysimachia vulgaris), отчасти — картофеля (Solatium
tuberosum) и др. Цветение также снимает апикальное доминирование. Если по-
бег образует верхушечный цветок или соцветие, то ниже начинают расти бо-
ковые побеги.
5. В зоне вторичного утолщения у большинства деревьев умеренных широт
возникает кольцо делящихся клеток — камбий. Для работы камбия нужен аук-
син, поступающий через флоэму. Чем интенсивнее растет побег, тем сильнее
утолщается нижележащая ось, и наоборот. Напомним: для делений клеток не-
обходимы одновременно ауксины и цитокинины, причем ауксин обеспечива-
ет закладку преимущественно ксилемы.
6. Ауксин влияет на рост корневой системы. Большое количество ауксинов —
это сигнал о росте побегов: растению требуется больше воды и минеральных
веществ, т.е. оно должно образовать большее число корней. Ауксины стимули-
руют ризогенез — закладку придаточных корней на стебле и боковых корней на
главном корне. Этим пользуются в сельском хозяйстве, обрабатывая черенки
раствором ИУК для укоренения.
7.2.2.5. Ауксины и неоднородность внешней среды
Суммируя эффекты ауксинов, следует отметить адекватность ответов расте-
ний на внешние стимулы, которая достигается за счет прераспределения един-
ственной группы гормонов — ауксинов. По теории тропизмов Холодного—
Вента, концентрация ауксинов повышается на теневой (при фототропизме)
или на нижней (при отрицательном геотропизме) стороне побега (рис. 7.9).
Апекс побега воспринимает внешние стимулы и перераспределяет ауксины.
В субапикальной зоне более интенсивно растут нижние (теневые) клетки, что
приводит к тропизму (т. е. наилучшей ориентации верхушки побега в простран-
стве). В зоне ветвления стекающий по теневой стороне ауксин не дает разви-
Ауксина меньше,
снятие апикального
доминирования
Клетки
растягиваются
меньше
Клетки
растягиваются
больше >
Ауксина больше
Ауксина больше апикальное
=> образование боковых доминирование
и адвентивных корней
Рис. 7.9. Неоднородное распределение ауксинов
437
ваться боковым почкам, а на более освещенной части стебля боковые почки
«просыпаются» раньше. В итоге побеговая система занимает малейшее хорошо
освещенное пространство. Если побег упал на землю, стекающий вниз ауксин
не дает развиваться нижним боковым почкам — побеги растут на верхней сто-
роне. На нижней стороне, контактирующей с почвой, образуются придаточ-
ные корни, позволяя стеблю укорениться.
7.2.2.6. Ауксин и плоды
Ауксин стимулирует развитие бессемянных плодов. В норме плоды с много-
численными семенами лучше обеспечены питательными веществами, чем те,
в которых семян нет. В силу аттрагирующего эффекта ауксинов чем больше
семян образовалось в плоде (чем больше точек синтеза ауксинов), тем лучше
плод обеспечивается питательными веществами. При обработке бессемянных
плодов ИУК у растения создается «иллюзия», что семена в них есть. Туда на-
правляются питательные вещества, стимулируя развитие плодов.
7.2.2.7. Ауксин как гербицид
о-сн2-соон
Если ауксинов слишком много, то начинается синтез гормона-антагониста
этилена. Этилен угнетает рост побегов и корней в длину и вызывает листопад
(см. подразд. 7.2.7). При обработке естественными ауксинами (ИУК, ИПВК и
др.) начинается их окисление и/или образование
конъюгатов. Систем инактивации синтетических
аналогов (НУК, 2,4-Д) у растений нет (рис. 7.10).
При обработке растений 2,4-Д синтезируются ан-
тагонисты (в основном этилен), рост угнетается,
листья желтеют и опадают и т.д. У двудольных
под действием 2,4-Д отмирают кончики корней,
и это позволяет использовать 2,4-Д как селектив-
ный гербицид. На плантациях пшеницы {Triticит
aestivum), ржи {Secale cereale) или кукурузы {Zea
mays) 2,4-Д используют ограниченно (2,4-Д —
канцероген, мутаген и яд). Газоны состоят из од-
нодольных (злаков), которым 2,4-Д не причиня-
ет вреда, а одуванчики {Taraxacum officinale), мар-
гаритки {Bellis perennis) и другие двудольные по-
гибают. Низкие дозы 2,4-Д применяют в посадках
декоративных луковичных растений.
Гербицидные свойства ауксинов могут проявиться при укоренении черен-
ков: превышение дозы препарата или времени обработки ведет к синтезу эти-
лена, что неблагоприятно для растений.
С1
2,4-Дихлорфеноксиуксусная
кислота
Рие. 7. (0. Примеры синтети-
ческих аналогов ауксинов
а-Нафтилуксусная
кислота
7.2.2.8. Гравитропизм
Как модель для изучения гравитропизма обычно используют корни. Во мно-
гих клетках растения есть крупные крахмальные зерна (амилопласты). Под дей-
438
станем силы тяжести они опускаются на нижнюю сторону клетки. Была выд-
винута гипотеза, что крахмальные зерна отвечают за восприятие силы тяжес-
ти, а амилопласты назвали статолитами.
В центрифуге растения воспринимают центробежную силу, что коррелиру-
ет с оседанием статолитов. Однако корреляция не дает права утверждать, что
статолиты действительно играют роль в восприятии силы тяжести. При хирур-
гическом удалении ткани с крахмалом (корневого чехлика) гравитропизм корня
нарушается, но чехлик важен для ростовых процессов в корне, нарушение
тропизма может быть вызвано с травмой, а не удалением клеток с крахмалом.
Более корректный эксперимент был поставлен в середине 1970-х гг. У му-
тантов по синтезу крахмала скорость изгибания корня при гравистимуляции
составила около 70 % ответа нормальных растений. Отсюда следовало, что крах-
мал отвечает не более чем за 30 % чувствительности к силе тяжести. По совре-
менным данным, значительную роль в восприятии силы тяжести играет рас-
пределение органелл в клетке и состояние цитоскелета.
После восприятия первичного стимула (изменение положения растения
относительно вектора силы тяжести) потоки ауксинов перераспределяются.
У всех мутантов с пониженной чувствительностью к ауксинам гравитропизм
нарушен. Возможно, что у них восприятие силы тяжести и перераспределение
ауксинов происходят нормально, но клетки, не чувствительные к ауксинам,
не в состоянии на это ответить. В гравитропизме участвует Са + как вторичный
мессенджер ответа на ауксин. Хелатирование ионов Са + в апопласте с помо-
щью ЭДТА нарушает гравитропический ответ. Без направленных потоков ка-
тионов через корневой чехлик гравитропизм невозможен. Удаление чехлика
нарушает ответ, а при замене чехлика агаровым блоком с раствором солей
калия происходит гравистимулированный изгиб.
7.2.3. ЦИТОКИНИНЫ — ГОРМОНЫ КОРНЕВОГО АПЕКСА
7.2.3.1. История открытия
Первые стерильные культуры клеток животных были получены в начале
XX в., но до 1950-х гг. получить культуры растительных клеток не удавалось.
Над этой проблемой работал американец Ф. Скуг. Полученную из стеблей та-
бака (Nicotiana tabacum) сердцевинную паренхиму помещали на искусствен-
ные среды, содержащие минеральные вещества, сахар, витамины, аминокис-
лоты, а также ИУК. Клетки паренхимы приступали к делениям, но рост быс-
тро останавливался. В лаборатории Ф. Скуга перепробовали различные добавки:
экстракт дрожжей, томатный сок, сок листьев табака, и все безрезультатно.
Небольшого успеха удалось добиться только при добавлении в среду кокосово-
го молока, В 1950-х гг. ученые обнаружили, что наследственная информация
передаете^ от родителей к потомкам с помощью ДНК (механизм этого явле-
ния был не известен). Ф. Скуг предположил, что растительным клеткам не
хватает ДНК. В среды начали добавлять ДНК из молок сельди (самый дешевый
источник ДНК), но клетки не делились.
Открытие цитокининов состоялось благодаря ошибке, допущенной в ходе
эксперимента. По методике флаконы со средой помещали в автоклав, где ра-
439
н
н
Рис. 7.11. Примеры естественных цитокининов и их синтетических аналогов
створ нагревается выше 100 °C. Случайно режим автоклавирования был нару-
шен, и среда вместе с ДНК перегрелась. Именно на этой среде сердцевинная
паренхима табака начала интенсивно расти. Выяснилось, что в перегретом
препарате ДНК есть вещество, которое на фоне ауксина вызывает деление
клеток, — фурфуриладенин (рис. 7.11). По физиологическому эффекту это веще-
ство назвали кинетином (от греч. kinesis — деление). Вскоре из эндосперма ку-
курузы выделили аналогичное природное вещество — зеатин {Zea — кукуруза).
Так была открыта новая группа фитогормонов — цитокинины.
Первые неудачи Ф. Скуга объяснялись разрушением природных цитокини-
нов при нагревании. В растительных экстрактах содержались природные цито-
кинины, но они разрушались при автоклавировании.
7.2.3.2. Биосинтез и инактивация цитокининов
В клетке цитокинины образуются из аденина: к нему присоединяется боко-
вая изопентильная группа и это приводит к образованию цитокининового ске-
лета. Далее происходит дефосфорилирование и отщепляется рибоза. Самый
простой из цитокининов — изопентениладенин, который проявляет большую
физиологическую активность, чем изопентениладенинрибозид, или изопен-
тенил-АМФ. Другие цитокинины образуются при модификации изопентиль-
ного фрагмента (гидроксилирование, окисление, восстановление).
Цитокинины в клетке присутствуют в активной и неактивной форме. Неак-
тивные формы цитокининов — Н9-гликозиды и гликозиды по гидроксилам
изопентенильного фрагмента (рис. 7.12). Присоединяя или отсоединяя сахара,
клетка регулирует концентрацию активных цитокининов. Возможно необрати-
мое разрушение цитокининов, поэтому по мере удаления от точки синтеза их
концентрация падает.
440
N'
nh2
CH2O-©
он он
АМФ
Н,С\ хн
с=с
Н3С" "'CHj-O-©-®
Изопентеиилпирофосфат
сн3
СНЭ
Активные формы
hn-ch2-ch=c:
СН2О-®
ДЕПО
Изопентинил-
аденинрибозид
Н. ^CHj
~;с=с
HN-CH, CHj
ОН о СН2ОН
Рибоза
Изопентенил аденин
Н.
HN-CHa
он он
Изопентениладенинриботид
^СН2-ОН
есС
сн,
ОН ОН
Транс-зелтинриботвд
н. ^сн2-он
с=с
HN-CH, "СН3
Транс-
зеатинрибозид
Рибоза
Рибоза
N
Н
Транс-зеатин
HN-CH3
N
N
Н. ^СН2-ОН
Рс=сС
сн2-он
Ы^-гликозиды
Дигадрозеатин-
рибозид
ОН ОН
Дигидрозеатинриботид
Рибоза
Гликозили-
рование.
HN- СН3
N
N
Рибоза
Дегра-
дация* Изопенте-
нильная
н. ^сн2-он
j:c=c
HN-CH2 СН2-ОН
н. ^сн2он
Рс=с ______________
^~СН2—О(Сахар^
Аденин
Н
Дигидрозеатин
о
N
о
N
Н
CRE1
Рецептор
Рис. 7.12. Биосинтез, инактивация, дегра-
дация и рецепция цитокининов:
1 — ключевой этап биосинтеза цитокининов
присоединение изопентенильной группиров-
ки к адениновому ядру; 2а, 26 — гидроксилирование изопентенильной группировки создает
многообразие природных цитокининов; За, 36, Зв — дефосфорилирование, приводящее к неак-
тивным (запасным) М9-гликозидным формам; 4а, 46, 4в — удаление/присоединение рибозы
контролирует баланс активных и неактивных форм цитокининов; 5 — депонирование при гли-
козилировании изопентенильной группировки; 6 — рецепция цитокининов, 7 — необратимая
деградация цитокининов путем отсоединения изопентенильной группировки
441
Выделены гены растений, белковые продукты которых связываются с ци-
токинином и имеют характерную для рецепторов структуру. Так, у белка CRE 1
(от cytokinine receptor) есть фрагмент, выступающий на наружную поверхность
плазмалеммы и связывающийся с молекулой цитокинина. Ближе к С-концу в
белке расположены гистидинкиназный домен и два домена, участвующие в
переносе фосфатной группы (REC — Receiver domains). Предполагают, что ре-
цептор цитокинина взаимодействует с MAP-киназной системой трансдукции
сигнала.
Цитокинины способствуют синтезу ДНК в клетке, контролируют S-фазу
клеточного цикла у растений. Аденин с заместителями, похожими на радикал
цитокининов, входит в состав тРНК. Если брать синтетические аналоги цито-
кининов (бензиламинопурин — БАП), то радикал-бензил появляется в тех же
тРНК в характерном положении. По-видимому, цитокинин не встраивается в
тРНК, происходит лишь «переброска» радикала с молекулы цитокинина на
аденин тРНК.
7.2.3.3. Эффекты цитокининов от апекса корня
до апекса побега
Цитокинины оказались во многом похожими на ауксины, но между ними
есть и существенные различия. Главное отличие — у цитокининов иная точка
синтеза. Если ауксины синтезируются в апексе побега, то цитокинины — био-
химический маркер апекса корня. Ауксин транспортируется по растению сверху
вниз и активно, а цитокинин — снизу вверх и пассивно.
Цитокинины образно можно назвать «гормонами благополучия апекса корня».
1. Аттрагирующий эффект. Апекс корня для своего роста нуждается в пита-
тельных веществах. Минеральных солей и воды у корня в достатке, поэтому
необходимо «притягивать» органические вещества. Этот эффект проявляется в
зоне деления корня.
Иногда цитокинины называют гормонами «омоложения» растительных тка-
ней. При обработке цитокинином листа, готовящегося к листопаду, он долго
остается зеленым. Это настолько впечатляло, что физиологи считали «омоло-
жение» главным эффектом цитокининов. При более пристальном рассмотре-
нии окажется, что так проявляется аттрагирующий эффект. Перед листопадом
все белковые молекулы листа разрушаются, и аминокислоты перетекают в
корень (т. е. к источнику цитокининов). К листопаду в листьях почти нет азота.
Оттекают из осеннего листа и другие органические вещества. Таким образом,
происходит не старение, а запрограммированная гибель листа (вечнозеленые
листья в тропиках остаются живыми в 3 — 5 раз дольше, чем листья листопад-
ных растений умеренной зоны).
Если ввести в лист меченый глицин и обработать часть листа цитокинином,
глицин соберется в обработанной половине.Так как источником цитокининов
была соседняя половина листа, метка переместилась именно туда. Таким обра-
зом, лист не омолаживается, цитокинин не дает ему погибнуть от истощения,
притягивая и удерживая питательные вещества.
2. Цитокинин и дифференцировка клеток. В зоне дифференцировки корня
цитокинины отвечают за образование проводящей системы. Так как корень
442
нуждается в продуктах фотосинтеза, транспортируемых флоэмой, цитокини-
ны стимулируют закладку элементов флоэмы.
Цитокинин — это запрос на фотоассимиляты. Если ткань способна образо-
вать хлоропласты, то под действием цитокинина синтезируется хлорофилл. Даже
при недостатке света семядоли тыквы (Cucurbitapepo), обработанные цитоки-
нином, приобретают зеленый цвет, появляются хлоропласты.
Распространяется цитокинин вверх с ксилемным током. Ксилема — мертвая
ткань, поэтому она не может обеспечить ни активного транспорта, ни поляр-
ности: для этого нужны живые мембраны. Цитокинины транспортируются
пассивно и неполярно.
О том, что цитокинины содержатся в ксилеме, догадывался еще Ф.Скуг.
Если сердцевинную паренхиму стебля не отделить от ксилемы, то некоторое
время клетки паренхимы делятся (это было известно до открытия цитокини-
нов). При вторичном утолщении цитокинины стимулируют работу камбия и
образование флоэмных элементов.
3. Повышенная концентрация цитокининов «говорит» растению о благопо-
лучном развитии корневой системы. Это означает, что нет необходимости в
новых корнях. Цитокинины подавляют рост боковых корней.
4. Вместе с тем нужны побеги, которые образуют новые листья и позволят
лучше снабжать растущие корни. Под действием цитокининов развиваются
боковые почки на побегах. Таким образом, цитокинины снимают апикальное
доминирование, вызванное ауксинами.
Следует отметить, что ауксины и цитокинины — антагонисты в процессе
регуляции развития боковых почек. В другом процессе — регуляции клеточных
делений — они синергисты.
5. Характерна реакция устьичных клеток на цитокинин: если вода поступает
из корня (обогащена цитокининами), устьица открываются. Если вода посту-
пает из других органов, она бедна цитокининами и богата абсцизовой кисло-
той, устьица закрываются (см. подразд. 7.2.6.4).
6. Цитокинины стимулируют рост бессемянных плодов. Этот эффект напо-
минает действие ауксина. В зародыше появляется корневой полюс, который
синтезирует цитокинины, т.е. чем больше в плоде семян, тем выше концент-
рация. цитокининов. При обработке цитокининами растение «считает», что в
бессемянном плоде есть зародыши, работает аттрагирующий эффект.
7.2.4. ВЗАИМОДЕЙСТВИЕ АУКСИНОВ И ЦИТОКИНИНОВ
7.2.4.1. Физиологическое действие ауксинов
и цитокининов в культуре in vitro
С открытием цитокининов началось культивирование растительных клеток
in vitro. Первым типом ткани, полученным из паренхимы табака, был каллус.
В природе каллусы образуются в местах повреждения: растению необходимо бы-
стро зарастить шрам, заполняя его бесформенной массой клеток. Поврежден-
ная проводящая система (сосуды), покровные и механические ткани восста-
навливаются позже. Клетки каллуса быстро делятся, веретено деления распо-
лагается в случайном направлении. При этом получается рыхлая клеточная масса.
443
Рис. 7.13. Действие ауксинов и цитокининов на каллусную ткань:
А — физиологическая активность ауксинов и цитокининов приблизительно равны — развивает-
ся каллусная ткань; Б — ауксины преобладают над цитокининами — ризогенез (образование
корней); В — цитокинины преобладают над ауксинами — геммагенез (образование побегов)
Для стимуляции деления клеток in vitro в среду добавляют и ауксины, и
цитокинины. Показано, что ауксины активируют CDK-протеинкиназы клеточ-
ного цикла (cycline dependent kinases), а цитокинины — соответствующие цик-
лины. Комплекс CDK-циклин необходим для запуска клеточного деления. Из-
менение соотношения ауксин/цитокинин приводит к морфогенезу in vitro. При
преобладании ауксинов начинается ризогенез (от греч. rhiza — корень; genesis —
рождение). Если же преобладают цитокинины, то образуются меристемы по-
бегов, т.е. начинается геммагенез (от греч. gemma — почка) (рис. 7.13).Такое
поведение культуры клеток хорошо согласуется с функцией ауксинов и цито-
кининов как «гормонов благополучия» побегов и корней соответственно. Не-
достаток ауксинов воспринимается клетками как недостаточное развитие по-
бегов и служит сигналом для их образования. В дифференцированных побегах
синтезируется ауксин и баланс гормонов восстанавливается. Аналогичный ме-
ханизм работает при недостатке цитокининов, тогда формируются корни. При
удалении из среды и ауксинов, и цитокининов в культуре клеток иногда обра-
зуются биполярные структуры — эмбриоиды {embryo — зародыш; eidos — похо-
жий). У каждого эмбриоида есть свой источник цитокининов (корневой по-
люс) и ауксинов (побеговый полюс). Культуру клеток используют в технологи-
ях ускоренного размножения растений.
7.2.4.2. Баланс между ауксинами и цитокининами
в интактном растении
Итак, для нормальной жизни в растении всегда должен существовать баланс
между ауксинами и цитокининами. Процесс вегетативного роста растений можно
моделировать, рассматривая только полярный транспорт и взаимодействие
ауксинов и цитокининов. Если главный стебель отделить от корня, то в верхней
части останется точка синтеза ауксинов и возникнет дефицит цитокининов.
ИУК из апекса транспортируется к основанию черенка, где создается избыток
ауксинов. Для восстановления баланса нужны цитокинины, т. е. формируются
корни. У оставшейся нижней части растения есть точки синтеза цитокининов,
444
но не хватает ауксинов. Цитокинины транспортируются вверх и накапливаются
около среза. Это также вызывает нарушение баланса и ведет к синтезу ауксинов:
пробуждаются спящие почки или из каллусной массы возникают новые побеги.
В интактном растении активные деления клеток происходят в апексах корня
и побега. Согласно модели, чем дальше находится орган от кончика корня, тем
меньше в нем цитокинина. Апексом побега транспорт заканчивается, и проис-
ходит накопление цитокинина. Ауксин синтезируется в апексе побега. Таким
образом, в меристеме побега концентрация цитокининов и ауксинов оказыва-
ется достаточной для поддержания клеточных делений.
Обратная ситуация в апексе корня. Ауксин накапливается, так как апекс
корня — конечный пункт транспорта ИУК. Вместе с синтезируемыми в корне
цитокининами ауксины вызывают клеточные деления в меристеме корня. Чем
больше расстояние от кончика корня до верхушки побега преодолевают гор-
моны, тем меньше их содержание в меристеме. Наконец, наступает момент,
когда цитокининов, поступающих в апекс побега, недостаточно для делений.
Рост стебля вверх останавливается. Аналогично регулируется рост корня вглубь.
Таким образом, полярный рост растения можно моделировать на основании
баланса ауксинов/цитокининов.
Расположение камбия в растении также не случайно. По флоэме вниз дви-
жется ауксин, а по ксилеме вверх — цитокинин. Между ними на «перекрестке»
потоков ауксинов и цитокининов (а также фотоассимилятов и минеральных
веществ), необходимых для деления, находятся делящиеся клетки камбия. Ра-
бота камбия также моделируется исходя из теории баланса фитогормонов: если
ауксин преобладает, камбий откладывает больше ксилемы, обеспечивая при-
ток цитокининов из корней, избыток цитокининов ведет к закладке флоэмы
(по ней поступят новые порции ауксина, снова возникнет равновесие между
двумя типами гормонов). Поврежденные корни и ветви утолщаются гораздо
хуже. Причина этого — в низкой способности к синтезу гормонов. Однако чем
больше потоки гормонов через ветку или корень, тем сильнее работа камбия,
больше флоэмы и ксилемы, выше механическая прочность.
7.2.4.3. Цитокинины и паразиты растений
Образно говоря, грибы и бактерии за миллионы лет совместного существо-
вания с растениями гораздо лучше усвоили физиологию растений, чем чело-
век. У них возникли блестящие приспособления для «эксплуатации» организма
растений: достаточно подать запросы на питательные вещества, и растение
само направит вещества к месту инфекции. Многие фитопатогенные грибы
вырабатывают цитокинины. В местах инфекции возникает опухоль, из которой
растут многочисленные побеги — так называемая ведьмина метла.
Бактерии Pseudomonas savastanoi синтезируют не только цитокинин, но и
ауксин. Они поражают сирень (Syringa), бирючину (Ligustruni), оливу (Olea
europaed) (сем. Маслинные). Пораженная псевдомонадами ткань интенсивно
делится, образуя каллус, питательные вещества аттрагируются к месту инфек-
ции, но при обработке антибиотиками рост опухоли прекращается.
Высокоспециализированный механизм нарушения гормонального баланса есть
у Agrobacterium tumefaciens и др. видов агробактерий. Фрагмент ДНК (Т-ДНК),
445
содержащий гены синтеза ИУК, цитокининов и опинов, переносится из агро-
бактерий в ядра растительных клеток — происходит трансформация. Транс-
формированные клетки растений начинают опухолевый рост и синтезируют
опины, которые не утилизируются растениями, но служат источником угле-
рода и азота для агробактерий. При обработке антибиотиками опухоль продол-
жаем расти, так как клетки продолжают производить ауксины и цитокинины
за счет встроенной Т-ДНК.
7.2.5. ГИББЕРЕЛЛИНЫ — ГОРМОНЫ ЛИСТА
7.2.5.1. История открытия
В Японии распространено заболевание риса (Oryza saliva) баканоэ (в пер. с
яп. — бешеный рис). Больные растения опережают в росте здоровый рис, но
больные колосья уродливые и зерна не бывает. В 1926 г. Э.Куросава выделил
возбудителя болезни — гриб Gibberella fujikuroi (сейчас его перенесли в род
Fusarium). Выяснилось, что симптомы баканоэ вызываются культуральной жид-
костью этого гриба, т.е. Gibberella fujikuroi выделяет вещество, усиливающее
рост риса. Гипотетическое вещество было названо гиббереллином.
В 1930 г. японские химики выделили гиббереллин в кристаллическом виде и
предложили структурную формулу. Эту работу прервала война, и до 1950 г. о
гиббереллине знали мало. Исследования возобновили в Англии и США, и к
1955 г. структура первого гиббереллина была окончательно установлена. Оказа-
лось, что растения вырабатывают похожие вещества — эндогенные гибберелли-
ны. Это — самый обширный класс растительных гормонов, их известно уже
более 100.
Поскольку большинство гиббереллинов — кислоты, их принято обозначать
ГК (гибберелловая кислота) с соответствующим индексом, например: ГК24,
ГК53 и т.д. Наиболее часто в экспериментах используют ГК3.
7.2.5.2. Биосинтез гиббереллинов
Биосинтез гиббереллинов начинается в пластидах: из дезоксиксилулозо-5-
фосфата образуются изопентенилпирофосфат, геранилпирофосфат и геранил-
гераниолпирофосфат. Ключевая стадия биосинтеза — циклизация последнего
продукта с образованием энт-копалилдифосфата и энт-каурена, предшествен-
ника гиббереллинов (рис. 7.14). Энт-каурен покидает пластиду, и дальнейший
синтез идет в ЭПР и цитозоле: он последовательно окисляется до энт-кауре-
новой кислоты, энт-гидроксикауреновой кислоты, ГК12-альдегида и ГК12-кис-
Рис. 7.14. Биосинтез гиббереллинов:
1 — общая часть биосинтеза терпеноидов в пластидах; 2 — образование энт-каурена — универ-
сального предшественника гиббереллинов; 3 — окисление энт-каурена в эндоплазматическом
ретикулуме; 4 — разветвление путей биосинтеза гиббереллинов, большинство предшественни-
ков имеет слабую физиологическую активность; 5 — образование активных форм гибберелли-
нов; 6 — превращение в неактивные формы (ГК8, ГК34); 7— депонирование в форме гликозидов
446
Активные формы
СН2
но
сн2-о®@
сн-0®©
сн.
ГК34
соон
СН,
о
ГК,
СН,
ГКм
S?
Энт-кауреналъ
Энт-кауреновая кислота
Энт-каурен
Энт-каурен
Энт-7а-твдрокси-
кауреновая кислота
< н он
Н,с^ I I
о^С-С—с-сн2-сн2-о®
он н
1-Дезоксиксилулозо-5-фосфат
Н,С. ,н /
С=С I
Н,С ''СН-О®® \
Изопентенилпирофосфат
'— Геранилгераниолпирофосфат
Копалилдифосфат
СООН ге4
О.
сн,::
соон
сн.
сн2
Неактивные
ГК-гликозиды
ДЕПО ГК
гк20 но
соон ге8
ОН —L
НО
СН2
сн,
сн,
СООН
Энт-кауренол
гк19
ГК44
ГК 15
СН;
СООН С00Н
СН2
СООН СООН
ГК53
ГК]2
СН2
СООН у
Н
ГК 12 -альдегид
лоты. Далее биосинтез гиббереллинов разделяется на параллельные ветви, ко-
торые путем модификации радикалов и замыканием дополнительных циклов
внутри молекул приводят ко всему разнообразию гиббереллинов. Физиологи-
чески активны далеко не все гиббереллины. Активны, в частности, ГКЬ ГК3,
ГК4, ГК7 и др. Физиологическая активность зависит от вида растения: один и
тот же гиббереллин может быть активен у одного вида, но не вызывает физи-
ологического эффекта других.
Биосинтез гиббереллинов контролируется многими факторами. Начальные
стадии находятся под контролем развития (т.е. включаются на определенных
этапах развития и дифференцировки). Переходы ГК|2 -> ГК9 и ГК53 -> ГК20
зависят от продолжительности светового дня и уровня ауксинов. В этой точке
метаболизма регулируется переход к цветению под действием гиббереллинов.
На переход от ГК9/20 к активным ГК4/1 влияют как ауксины, так и красный
свет. Эта стадия биосинтеза находится под контролем при прорастании семян.
Рецепция гиббереллинового сигнала приводит к замедлению синтеза актив-
ных ГК, усиливает превращение активных ГК4/1 в неактивные ГК34/8.
Как и большинство растительных гормонов, гиббереллины образуют с са-
харами неактивные гликозиды (запасные формы гиббереллинов). Кроме того,
в растениях есть специфические оксидазы, необратимо разрушающие гиббе-
реллины до неактивных соединений. Пути передачи гиббереллинового сигнала
изучены мало. Рецепторы, связывающиеся с гиббереллинами, еще не охарак-
теризованы Показано, что в трансдукции сигнала участвует цГМФ.
Был выделен мутант арабидопсис spy (spindly) с конститутивным ответом на
гиббереллин: мутанты сильно вытягиваются, семена преждевременно прораста-
ют и т. п. Вероятно, белок SPY работает как N-ацетилглюкозаминтрансфераза,
и гликозилирование является важным для репрессии ответа на гиббереллин.
У мутантов spy репрессия снимается, и наблюдается постоянный ответ на гиб-
береллин, не зависящий от добавления ГК. Еще один белок гиббереллинового
ответа был выделен благодаря мутации gai (GA-insensitive). Он оказался транс-
крипционным регулятором Мутанты gai не чувствительны к гиббереллинам.
Гиббереллины вызывают синтез специфических факторов транскрипции,
которые обозначены как GAMyb. GAMyb-белки узнают последовательности в
промоторах многих генов, например узнают промотор а-амилазы (см. под-
разд. 7.2.5.4).
7.2.5.3. Основные физиологические эффекты гиббереллинов
Образно гиббереллины можно назвать «гормонами благополучия зеленого ли-
ста». Гиббереллины вырабатываются в основном в фотосинтезирующих листь-
ях, но могут синтезироваться и в корнях. Действуют гиббереллины прежде
всего на интеркалярные меристемы, расположенные в непосредственной бли-
зости от узлов, к которым прикреплены листья. Это можно наблюдать при
обработке гиббереллинами злаков: растения сильно вытягиваются, механи-
ческая прочность соломины понижается, стебель полегает. Кроме того, при
действии ГК у риса и кукурузы не образуется фертильная пыльца, поэтому
при болезни баканоэ рис не дает урожая.
Если наблюдать за ростом побегов деревьев, выяснится, что апикальная
меристема активна только во второй половине лета (при закладке почки). Ви-
448
димый рост побега идет весной: из почки образуется длинный побег. Весенний
рост целиком происходит за счет интеркалярных меристем. Почки растений не
одинаковы. Так, почки конского каштана (Aesculus hippocastanea), тополя (Populus
tremula), яблони (Malus domestica), березы (Betula pendula) покрыты почечными
чешуями (катафиллами). Это видоизмененные листья, в которых идет фотосин-
тез. Междоузлия между почечными чешуями сохраняются короткими, а в ос-
новании побега остается почечное кольцо (близко расположенные рубцы ката-
филлов). Выше лежат фотосинтезирующие листья, и чем больше их площадь,
тем длиннее междоузлие под ними. Видимо, крупный лист производит гиббе-
реллина больше и дает более мощный сигнал в интеркалярную меристему.
Клетки активнее делятся и растягиваются там, где больше гиббереллина. Меж-
доузлие оказывается длиннее. Чешуевидные катафиллы почти не вырабатывают
ГК, интеркалярная меристема не работает, образуется почечное кольцо.
У крушины (Frangula alnus), дёрена (Cornus albus), облепихи (Hippophae
rhamnoides) почечных колец нет. Их почки прикрыты листьями, которые вес-
ной становятся хорошо развитыми и зелеными. Они подают ГК-сигнал вста-
вочным меристемам, междоузлия растягиваются, возникает листовая мозаика.
У ясеня (Fraxinus excelsa) весной катафиллы зеленеют, но они меньше типич-
ных фотосинтезирующих листьев. Вставочные меристемы получают слабый
сигнал, расстояния между катафиллами несколько увеличивается.
Сложнее реагируют на гиббереллины розеточные растения. В начале сезона
они образуют прикорневую розетку крупных листьев, однако междоузлия не
увеличиваются. Гиббереллиновый сигнал направляется к апексу побега, и, когда
уровень ГК превышает некоторый порог, меристема образует соцветия. Меж-
доузлия в соцветии гораздо длиннее, чем между листьями розетки. Таким об-
разом, ГК-сигналы могут поступать в интеркалярные меристемы из нижеле-
жащих листьев.
Биосинтез ГК ингибируется паклобутразолом (промышленный ретардант).
Его используют в растениеводстве, когда высокие стебли нежелательны (мно-
гие цветки на коротких цветоножках эффектнее, чем на длинных). При обра-
ботке паклобутразолом получаются «искусственные карлики». Из Голландии,
например, экспортируют «карликовые» хризантемы (Chrysanthemum), калан-
хоэ (Kalanchoe) и другие растения. Они пользуются большим спросом, но пос-
ле продажи ретардант перестает действовать, синтезируется ГК и рост норма-
лизуется.
7.2.5.4. Гиббереллины и прорастание зерна
Гиббереллины мобилизуют запасные питательные вещества при прораста-
нии семян. Детально этот процесс изучен у злаков (ячменя (Hordeum vulgare),
ржи, пшеницы), так как имеет практическое значение в производстве пива.
Зерновка злаков состоит из зародыша, эндосперма и семенной кожуры. За-
пас питательных веществ сосредоточен в эндосперме в виде крахмала (рис. 7.15).
К моменту созревания зерна крахмалистый слой уже не содержит живых кле-
ток. На периферии эндосперма остается слой живых клеток с запасными бел-
ками — алейроновый слой. Зародыш злаков контактирует с эндоспермом щит-
ком. При прорастании щиток выделяет ГК. Гиббереллины диффундируют че-
рез крахмалистый эндосперм к алейроновому слою. В живых клетках алейро-
15 Физиология растений
449
нового слоя синтезируются мРНК амилаз — ферментов, разрушающих крах-
мал. Промоторы амилаз содержат консенсус, узнаваемый GAMyb-факторами
транскрипции (см. подразд. 7.2.5.2). Белковые гранулы (алейрон) растворяются:
запасной белок разрушается до аминокислот, из которых синтезируются ами-
лазы. Амилазы поступают из алейронового слоя к крахмальным зернам. Крах-
мал разлагается до мальтозы и глюкозы, их впитывает щиток и передает тка-
ням зародыша. Таким образом, гиббереллины обеспечивают аттрагирующий
эффект.
Гидролиз крахмала в зерновках злаков важен для пивоварения. По техноло-
гии ячмень проращивают, выжидают, когда крахмал разрушится, варят про-
ростки в воде. Экстракт упаривают и получают темную сладкую массу — солод.
Качество солода зависит от жизнеспособности зародышей (и от синтеза ГК):
чем ниже всхожесть, тем хуже солод.
Качественный солод можно получать из плохо прорастающих семян, если
обработать их раствором ГК, способствующих разрушению крахмала. Наличие
зародыша не обязательно: обломки семян пригодны для производства солода.
ГК, ускоряя процесс получения солода, широко используется в пивоварении.
Еще один пример аттрагирующего действия гиббереллинов — стимуляция
развития бессемянных плодов (например, бескосточковых сортов винограда
(Vitis vinifera)). Применение ГК повышает урожай.
Гиббереллины стимулируют прорастание не только злаков, но и других ра-
стений. У подсолнечника (Helianthus annuus) и тыквы ГК запускают разруше-
Рис. 7.15. Зерновка злаков при прорастании:
1 — вода поступает в зародыш; 2 — ткани зародыша синтезируют/освобождают из депо актив-
ные гиббереллины; 3 — гиббереллины транспортируются к алейроновому слою эндосперма; 4 —
в алейроновом слое синтезируется амилаза (4а — тот же процесс при большом увеличении); 5 —
амилаза поступает в крахмалоносную ткань эндосперма и деполимеризует крахмал; 6 — глюкоза
поступает к зародышу
450
ние запасных жиров и их окисление до сахаров, у бобовых мобилизуют грану-
лы запасных белков и т.д. Перед посадкой рекомендуют обрабатывать гиббе-
реллином семена, клубни и луковицы: увеличивается процент прорастания,
рост становится более активным.
7.2.5.5. Гиббереллин и проявление пола у растений
Гиббереллины контролируют проявления пола у растений. В 1970-х гг. под
руководством М.Х.Чайлахяна исследовали регуляцию пола у огурца (Cucumis
sativus) и конопли (Cannabis sativa). Огурцы образуют мужские и женские
цветки на одном растении, а конопля — двудомное растение (есть мужские и
женские экземпляры). Обработка ГК вызвала увеличение процента мужских
растений у конопли и увеличила закладку мужских цветков на огурцах. Гор-
моном-антагонистом был цитокинин, вызывающий феминизацию. Опыты,
проведенные в США на кукурузе, показали обратный эффект: при обработке
ГК3 за 8 — 9 дней до мейоза в мужской метелке образовались женские цветки и
семена, а обработка за 3 дня до мейоза приводила к мужской стерильности.
Мужскую стерильность можно вызывать гиббереллином и у риса (при болезни
баканоэ'. см. подразд. 7.2.5.1). Проявление пола зависит не только от вида, но и
от генетической линии, к которой принадлежит растение. Так, обработка ГК
томатов (Lycopersicon esculentum) дикого типа вызвала образование избыточно-
го числа гнезд в завязях (стимулировала женское развитие). У мутантов томата
stamenless, лишенных тычинок, ГК вызывала нормализацию андроцея (стиму-
лировала мужское развитие).
Несомненно, уровень гиббереллинов влияет на пол растений, но результат
зависит от вида и генетической линии.
7.2.5.6. Гиббереллин и цветение растений
Гиббереллины стимулируют цветение ряда растений. Обычно уровень эндо-
генных ГК повышается при увеличении длины дня. У многих растений цветение
контролируется фотопериодом. Виды, цветущие на длинном дне, можно зас-
тавить цвести с помощью гиббереллинов. В опытах М. Х.Чайлахяна к ГК оказа-
лись чувствительными рудбекия (Rudbeckid), каланхоэ, морковь (Daucus carota),
другие виды не цвели. Участие гиббереллина в регуляции цветения очевидно,
хотя результат зависит от частной физиологии объекта (см. подразд. 7.4.2).
7.2.6. АБСЦИЗОВАЯ КИСЛОТА — СИГНАЛ ВОДНОГО СТРЕССА
7.2.6.1. Открытие абсцизовой кислоты
В 1949 г. были проведены эксперименты с покоящимися почками березы.
Водный экстракт почек замедлял рост гипокотилей, а при нанесении совмест-
но с ауксинами ингибировал растяжение. Когда покой почек заканчивался,
экстракт не угнетал рост. Исследователи предположили, что в почках содер-
жится ростовой регулятор — дормин (от англ, dormancy — покой).
451
В 1962—1964 гг. в США Дж. Лью и Г.Р. Карнс изучали созревание и опаде-
ние коробочек хлопчатника {Gossypium hirsutum). Они предположили, что в хлоп-
чатнике накапливается вещество, стимулирующее обезвоживание плода, его
растрескивание и формирование отделительного слоя. Гипотетический гормон
назвали абсцизином (от лат. abscisio — опадение). В 1965 г. абсцизин был выделен
и были изучены его основные свойства. Выяснилось, что абсцизин и дормин —
одно и то же соединение. Из-за приоритета сегодня установилось название,
данное Лью и Карнсом, — абсцизовая кислота {АБК). Заметим, что АБК редко
регулирует опадение плодов и листьев (обычно за это отвечает этилен: см. под-
разд. 7.2.7.7). АБК нужна для регуляции покоя, поэтому название «дормин»
гораздо лучше отражает суть регулируемых процессов.
7.2.Б.2. Биосинтез абсцизовой кислоты
АБК является изопреноидом с 15 атомами углерода, соединенными в изо-
преновые С5-звенья (см. подразд. 9.6.2). Обычно изопреноиды синтезируются в
пластидах из общего предшественника — изопентенилпирофосфата. В ранних
работах было высказано предположение, что АБК синтезируется сразу после
конденсации трех С5-звеньев, т.е. эта гипотеза предполагает прямой синтез
АБК из более простых предшественников. В дальнейшем прямой синтез АБК
был показан только для фитопатогенных грибов (для возбудителя серой гнили
Botrytis).
Гипотеза прямого синтеза доминировала до 1990-х гг., пока не выясни-
лось, что у мутантов по биосинтезу каротиноидов нарушен и биосинтез АБК.
На сегодня получены мутации по ферментам почти всех этапов биосинтеза
АБК. Таким образом, АБК синтезируется через более сложные предшествен-
ники, можно рассматривать ее как продукт специфической деградации каро-
тиноидов.
Первые этапы биосинтеза АБК связаны с ксантофилловым циклом (см. под-
разд. 3.3.4.4). Зеаксантин через промежуточный продукт антераксантин превра-
щается в всс-/ир<2/ус-виолаксантин. Дальнейшие превращения включают 9-цис-
изомеризацию каротиноидного предшественника (на эту роль претендуют ви-
олаксантин и неоксантин). В конечном итоге 9-цис-предшественник расщепля-
ется на два неравных фрагмента: Ci5 (ксантоксин) и С25. С25-фрагмент быстро
деградирует, а ксантоксин превращается в абсцизовый альдегид (рис. 7.16). Для
последнего этапа биосинтеза необходим молибденсодержащий белок, катали-
зирующий окисление АБ-альдегида до АБК. Молибденовый кофактор этого
фермента общий с нитратредуктазой и ксантиндегидрогеназой. При мутациях
по синтезу молибденового кофактора растение не может восстанавливать нит-
рат и окислять АБ-альдегид.
Рис. 7.16. Биосинтез, инактивация и деградация АБК:
1 — виолаксантиновый цикл в пластидах; 2 — ключевой этап биосинтеза АБК — цис-изомери-
зация каротиноидов; 3 — расщепление каротиноидов на С15- и С25-фрагменты и выход ксантокси-
на в цитозоль; 4 — превращение ксантоксина в абсцизовый альдегид, стрелками показаны связи
в молекулах, которые претерпевают модификацию на каждом этапе; 5 —окисление АБ-аль-
дегида до физиологически активной АБК; 6 — депонирование АБК; 7 — необратимая деграда-
ция АБК
452
7.2.6.3. Передача АБК-сигнала
Белки-рецепторы АБК еще недостаточно охарактеризованы. Один из них —
белок RPK 1 (receptor-like protein kinase) — является трансмембранным, свя-
зывается с АБК и содержит протеинкиназный цитоплазматический домен.
Известны некоторые компоненты системы трансдукции АБК-сигнала. Так,
сразу после действия АБК в замыкающих клетках устьиц из НАД+ синтезиру-
ется циклическая АДФ-рибоза, которая может активизировать Са -каналы
(рис. 7.17). Са + поступает в цитоплазму из внутриклеточных депо, цитозоль
подщелачивается. Высокий pH активизирует протеинфосфатазы ABI 1 и ABI 2,
дефосфорилирующие гипотетический белок-репрессор АБК-сигнала. Пока реп-
рессор фосфорилирован, он не дает проявляться ответам на АБК. Потеря фос-
фата инактивирует репрессор, и клетка отвечает на АБК. Если протеинфосфа-
тазы не активны, репрессор постоянно подавляет ответ на АБК, растение те-
ряет чувствительность (ABA-insensitive — abi). Мутации Arabidopsis по этим фос-
фатазам идентифицированы как нечувствительные к АБК, а соответствующие
гены названы ABI 1 и ABI 2.
Предполагают, что в развитии ответа на АБК играют роль Са2+-волны, рас-
пространяющиеся с интервалом около 1 — 2 мин. В ответ на АБК у замыкающих
клеток устьиц на плазмалемме открываются быстрые К+-каналы и медленные
анионные каналы, через которые К+, СГ и малат выходят из клетки. Осмоти-
Рис. 7.17. Схема рецепции и передачи сигнала АБК:
1 — взаимодействие АБК с мембранным рецептором; 2а, 26, 2в — возможные пути передачи
сигнала по системе вторичных мессенджеров; 3 — активизация фосфатидилинозитольной систе-
мы (см. рис. 7.3), ИФ3 — инозитолтрифосфат; 4 — открывание Са2+-каналов; 5— белки-продукты
генов ABI 1 и ABI 2 передают сигнал в ядро; 6 — взаимодействие транскрипционных факторов
с промоторами и экспрессия АБК-зависимых генов; 7а, 76, 7в — синтез веществ-протекторов,
защищающих клетку от стресса; 8 — синтез запасных белков при переходе в состояние покоя
454
ческое давление понижается, выходит вода и теряется тургор, устьичная щель
закрывается. Закрывание устьиц — очень быстрый ответ на АБК, и геномная
регуляция не успевает включиться.
Для активизации/инактивации генов в ядре важен белок ABI 3 у Arabidopsis
(VP 1 у кукурузы), содержащий домены, характерные для активаторов транс-
крипции. Без ABI 3 или VP 1 не экспрессируются ЕЛ/-гены (от англ, embryo
maturation), не идет синтез антоцианов, не накапливаются запасные белки в
семенах и т.д. В соответствующих промоторах найден достаточно консерватив-
ный мотив — АБК-регулируемый консенсус (ABRC). Впрочем, одного белка
ABI 3 или VP 1 недостаточно для активации транскрипции через ABRC-мотив.
Необходим довольно сложный транскрипционный комплекс, в который могут
входить ЕМВ-белки (димерные транскрипционные факторы типа «лейцино-
вой застежки»). Повреждение белков ABI 3 или VP 1 в результате мутации
ведет к нарушению процессов формирования зрелого семени и преждевремен-
ному прорастанию.
7.2.Б.4. АБК — гормон осмотического стресса
Абсцизовая кислота появляется в клетке в ответ на изменение состояния
воды, вызванный тремя факторами: подсушиванием, повышением концент-
рации веществ в клетке, охлаждением. В этих случаях вода для клетки менее
доступна, т.е. наблюдается водный дефицит.
Для нормальной жизнедеятельности все молекулы должны находиться в
определенных условиях овод нения. Белки и нуклиновые кислоты удерживают
воду с помощью водородных связей. В клетке поддерживается также опреде-
ленная ионная сила, что не менее важно для поддержания конформации био-
полимеров. Нехватка воды и повышение ионной силы приводят к денатурации
биологически активных молекул. При повторном увлажнении вернуть им ак-
тивность сложно. При стрессе клетка должна «принять меры» по сохранению
конформации ДНК, РНК и белков. Этим и обусловлены эффекты АБК. В ответ
на АБК в клетке повышается уровень оксипролина, сахарозы и других осмо-
тически активных веществ. Осмотическое давление увеличивается, что пре-
пятствует потере воды. Кроме этого в клетках появляется небольшой крайне
гидрофильный белок осмотин, повышающий матричный потенциал воды (см.
подразд. 5.4.5). В клетках можно увидеть даже появление гранул, состоящих из
осмотина.
АБК усиливает синтез полиаминов (спермидина, путресцина). Полиамины
несут положительный заряд (азот аминогрупп протонирован). Молекулы ДНК
и РНК заряжены отрицательно, они легко ассоциируются с молекулами по-
лиаминов, а в комплексах с полиаминами ДНК и РНК более устойчивы и к
изменению ионной силы, и к обезвоживанию. Синтез новых ДНК и РНК под
действием АБК прекращается, клетка переходит в состояние покоя.
При холодовом стрессе главная задача клетки — не допустить кристаллиза-
ции воды, так как кристаллы льда нарушают структуру мембран. Опасен также
эффект «вымораживания»: растворенные в воде вещества не включаются в кри-
сталлы льда и в незамерзшем растворе их концентрация повышается, т.е. уве-
личивается ионная сила. При охлаждении АБК останавливает синтез белков,
ДНК и РНК, накапливаются полиамины, оксипролин, сахара и осмотин. Ос-
455
мотически активные вещества препятствуют кристаллизации воды: вода ста-
новится аморфной и не повреждает мембраны. От АБК зависит биосинтез ан-
тоцианов, т.е. при понижении температуры растения становятся красными
(фиолетовыми), но физиологический смысл этой реакции пока не ясен. Му-
танты по синтезу АБК гибнут при легкой засухе и слабых заморозках. Хотя все
защитные механизмы имеются, они не включаются без абсцизовой кислоты.
Если перед стрессом такие мутанты обработать АБК, их устойчивость повыша-
ется.
Для предотвращения водного дефицита нужно закрыть устьица. Действи-
тельно, в ответ на АБК устичные щели закрываются за 10—15 мин. При по-
чвенной засухе корень синтезирует АБК, передает этот сигнал листьям, и ус-
тьица закрываются. В сильную засуху растение сбрасывает часть листьев, чтобы
избавиться от лишней испаряющей поверхности. АБК отвечает за листопад
только при засухе. При водном дефиците должны остановиться процессы рос-
та (на 95 —98 % органы растений состоят из воды): АБК ингибирует транспорт
ауксина и растяжение клеток.
Абсцизины синтезируются при увеличении концентрации осмотически ак-
тивных веществ, например сахаров, образующихся в листьях активно расту-
щих веток. В молодых ветках яблони содержание АБК повышается, и деревья в
середине лета впадают в состояние физиологического покоя. Мы не наблюдаем
видимого роста, но меристемы продолжают работать. На насыщенном АБК
побеге развиваются почки. Из физиологического покоя растение сложно выве-
сти внешними факторами. Высокий уровень АБК не дает транспортироваться
ауксинам из апекса побега, т.е. нет апикального доминирования и боковые
почки развиваются в пазухах всех листьев.
АБК действует на почки все лето, но заканчивается ее действие в разное
время. У большинства деревьев умеренной зоны действие АБК прекращается
зимой, а у конского каштана — осенью (в теплую осень почки, освободивши-
еся от АБК, открываются, каштан цветет повторно). У других растений высо-
кое содержание АБК держится до заморозков, и даже до января — февраля.
Только тогда АБК может начать разрушаться.
Разрушению АБК препятствует низкая температура воздуха. Это — фаза
вынужденного покоя, вызванного неблагоприятными факторами (низкая тем-
пература, дефицит воды). Как только стресс закончится, АБК разрушается и
начинается видимый рост.
7.2.Б.5. Регуляция покоя семян АБК
Когда зародыш семени достигнет окончательного размера, синтезируется
АБК. У кукурузы синтез АБК стимулирует сахароза, которую зародыш аттраги-
рует в большом количестве. АБК через белки VP 1 (ABI 3) активизирует син-
тез ЕМ-белков или белка LEC 1 (leafy cotyledon), которые регулируют дальней-
ший переход в состояние глубокого физиологического покоя.
Абсцизовая кислота вызывает синтез крахмала в эндосперме и белков в
алейроновом слое. Запасной белок алейроновых гранул функционирует как
осмотин. ДНК и РНК упаковываются белками-шаперонами и полиаминами,
рост прекращается и начинается обезвоживание. Зародыш теряет воду, ее кон-
центрация падает от 95 — 97 до 14 % и ниже. Сухой плод (как у хлопчатника)
456
теряет воду вместе с зародышем. В створках вскрывающихся плодов есть меха-
нически ослабленные слои клеток, при усыхании эти слои лопаются и плод
вскрывается. Если плод сочный, а семена уже прошли стадию обезвоживания,
дальнейшее созревание регулирует этилен (см. подразд. 7.2.7.8).
Глубина подсушивания семян и концентрация в них накопленной АБК ва-
рьируют. Так, у лесных растений (пролески {Scilld), хохлатки {Corydalis) и др.)
обезвоживание слабое, семена не приспособлены к сильному подсушиванию.
Накопленная АБК действует в течение всего лета и часто осени, мешая им
прорастать. У степных и пустынных растений (ковыли {Stipd), тюльпаны и др.)
семена усыхают очень сильно, а АБК разрушается лишь после сезона дождей и
зимней прохлады (см. подразд. 7.4.4.2). Часто АБК вымывается из семян весен-
ними талыми водами. Чтобы прорастить такие семена, достаточно промыть их
проточной водой. У культурных растений (пшеница, горох {Pisum sativum))
период действия АБК очень краткий: достаточно предоставить зародышу вла-
гу, как АБК разрушится, и семя пойдет в рост. Зарегистрировано прорастание
семян осенью в промокших колосьях или бобах.
7.2.6.6. Синдром дефицита АБК
Абсцизовая кислота — важный фитогормон, хотя он не является необходи-
мым. Если отсутствие ауксина или цитокинина летально, то при недостатке
АБК растения жизнеспособны, но хуже переносят стрессы. Этим можно вос-
пользоваться для отбора мутантов по биосинтезу АБК. После мутагенеза расте-
ния второго поколения высаживают, не поливают и наблюдают, какие подви-
нут первыми. (Без АБК растение не может закрыть устьица и завядает при
малейшей засухе.) Мутантов помечают, отсаживают и «отпаивают» водой. Они
почти не отличаются от нормальных растений, но семена не накапливают пи-
тательные вещества, состояния покоя нет, и семена прорастают тут же, еще в
плоде. Такое явление получило название вивипарии. У кукурузы мутации с та-
ким фенотипом называют viviparous (vp). Оказалось, что ген VP 8 отвечает за
превращение АБ-альдегида в АБК, а ген VP 1 — за передачу АБК-сигнала на
уровне транскрипции.
7.2.Б.7. АБК и форма листьев
У многих водных растений есть два типа листьев. Подводные листья тонкие,
с неразвитой механической тканью, без устьиц и кутикулы. Газообмен с вод-
ной фазой происходит по всей поверхности. Оказавшись в воздушной среде,
подводный лист гибнет. Надводные листья более прочные, покрыты кутику-
лой и имеют устьица для газообмена с воздухом. Под водой эти листья не
справляются с газообменом: устьица в таких условиях сжаты окружающими
клетками эпидермиса.
Условия воздушной среды воспринимаются водными растениями как засу-
ха, поэтому как только апекс побега оказывается над водой, повышается уро-
вень АБК и меристема формирует надводные листья. Если поместить растение
в аквариум с раствором АБК, меристема «решит», что ее «вынули» из воды и
образует воздушные листья (рис. 7.18). Более 50 проанализированных видов
457
Рис. 7.18. Регуляция формы листьев
АБК:
А — под водой синтез АБК низкий, расте-
ния развивают подводные листья; Б — при
росте в воздушной среде синтез АБК уси-
ливается, развиваются надводные листья;
В — при добавлении АБК в водный раствор
растения развивают надводные листья
в
водных растений продемонстрировали одинаковый механизм регуляции типа
листьев. Смена генераций листьев у полупустынных растений также контроли-
руется АБК: во влажный сезон развиваются С3-, а в сухой — С4-листья. Эти
листья различаются анатомически (см. подразд. 3.8.2). При засухе под действием
АБК наблюдается листопад Су-листьев, а на смену им развиваются более при-
способленные к водному дефициту С4-листья.
У луковичных растений АБК по-разному действует на подземную и надзем-
ную части листа. У лука (Allium сера) обработка АБК вызывает перестройку
цитоскелета в клетках подземной части: продольное расположение кортикаль-
ных микротрубочек меняется на поперечное. Клетки утолщаются и запасают
сахара (концентрация сахаров достигает 7 —10 % от сырой массы!). Надземная
часть листа под действием АБК увядает, вещества перемещаются в подземную
чешую. Луковица переходит в состояние покоя.
7.2.7. ЭТИЛЕН — СИГНАЛ МЕХАНИЧЕСКОГО СТРЕССА
7.2.7.1. Открытие физиологической роли этилена
В 1901 г. в Санкт-Петербурге Д. Н. Нелюбов при выращивании гороха обна-
ружил, что в лаборатории проростки были укороченные, искривлялись, вер-
хушка была согнута в апикальную петельку. В теплице и на свежем воздухе про-
ростки были ровные, рослые, апикальная петелька на свету распрямлялась.
. Апикальная
петелька
А Б В
Рис. 7.19. Тройной ответ проростка на этилен:
А — при низкой концентрации этилена происходит
сгибание апикальной петельки; Б — при повыше-
нии концентрации этилена побег утолщается в су-
бапикальной зоне, рост в длину замедляется; В —
при высокой концентрации этилена изменяется на-
правление роста с вертикального на горизонтальное
458
Нелюбов предположил, что фактор, вызывающий такой эффект, находится в
воздухе лаборатории.
В те годы помещения и улицы освещали газом. Было замечено, что при
аварии в газопроводе ближайшие деревья преждевременно желтели и сбра-
сывали листья. Для удаления примеси светильного газа Нелюбов пропускал
воздух через нагретый оксид меди. В «очищенном» воздухе проростки гороха
развивались нормально. Добавляя компоненты светильного газа по очереди,
Нелюбов установил, что экзогенный этилен вызывает: 1) замедление роста в
длину и утолщение проростка (рис. 7.19, Б); 2) «не разгибающуюся» апикаль-
ную петельку (рис. 7.19, Л); 3) изменение ориентации проростка в простран-
стве (рис. 7.19, В).
Наблюдаемая физиологическая реакция была названа тройным ответом на
этилен. Оказалось, что растения «чувствуют» этилен уже в концентрации
>0,0001 %. Этилен вызывает листопад, созревание плодов и другие ответы. Эти-
лен при этом синтезируется в растениях, т. е. является гормоном.
7.2.7.2. Биосинтез этилена
Синтез этилена в растениях начинается с метионина (рис. 7.20), который,
взаимодействуя с АТФ, образует S-аденозилметионин. (Этот интермедиат ис-
пользуется также в синтезе полиаминов и других соединений как донор ме-
тильных группировок.) S-аденозилметионин превращается в 1-аминоциклоп-
ропан-1-карбоновую кислоту {АЦК) с помощью АЦК-синтазы. АЦК рассмат-
ривают как неактивную транспортную форму этилена. Образование этилена
зависит от экспрессии гена АЦК-синтазы.
Циклопропановая группировка напряжена (между атомами углерода неха-
рактерный угол в 60°), тем не менее, разрушение АЦК с образованием этиле-
на — ферментативный процесс, нуждающийся в О2. При аноксии (например,
при затоплении) АЦК, синтезированная в корнях, транспортируется в сте-
бель и там превращается в этилен. В итоге надземная часть страдает от избытка
этилена. После образования этилен может окисляться в растительных клетках,
что, вероятно, нужно для модуляции физиологического эффекта. Процесс окис-
ления этилена изучен слабо.
7.2.7.3. Рецепция и передача сигнала
У Arabidopsis есть небольшое генное семейство белков-рецепторов этилена.
По фенотипическому проявлению гены были названы ETR1, ETR2 {ethylene-
resistant), EIN4 {ethylene-insensitive), ERS1 и ERS2. Белки-рецепторы высоко-
гидрофобны, т. е. входят в состав мембран. Для связывания этилена необходим
атом меди, который входит в состав рецепторного комплекса. Рецепторы эти-
лена похожи на двухкомпонентные гистидинкиназы, они участвуют в авто-
фосфорилировании и фосфорилируют другие белки. Рецепторный белок обра-
зует комплекс с серин/треонинкиназой CTRL Ближайшим мессенджером яв-
ляется мембранный белок EIN2 с еще не выясненной функцией. В каскаде
усиления участвуют MAP-киназы и некоторые транскрипционные факторы
(например, EIN3).
459
соон
MAP-киназный каскад
Рис. 7.20. Биосинтез и рецепция этилена:
1 — начальный этап биосинтеза этилена: активизация метионина путем присоединения к адено-
зину; 2 — разветвление путей биосинтеза полиаминов и этилена; 3 — окислительная деградация
АЦК до этилена; 4а, 46, 4в, 4г, 4д — рецепция этилена, показана множественность рецепторов
на этилен в клетке; 5 — включение системы вторичных мессенджеров; 6 — передача сигнала в
ядро; 7 — взаимодействие транскрипционных факторов с промоторами и экспрессия этиленза-
висимых генов
460
Пути восприятия этилена в растении продублированы несколькими рецеп-
торами, поэтому получить полностью нечувствительные к нему растения дос-
таточно трудно. Для этого необходимо, чтобы растение оказалось мутантным
по 4 — 5 генным локусам одновременно.
7.2.7.4. Этилен как гормон механического стресса
Выделение этилена связано с механическим воздействием на клетки расте-
ний. Рассмотрим это на примере тройного ответа (см. подразд. 7.2.7.1). Пока
росток не достиг поверхности, нужно защищать нежные клетки верхушечной
меристемы от повреждения. Поэтому происходит изгиб и образуется апикаль-
ная петелька. Сквозь почву растет не меристема, а более прочный нижележа-
щий участок (см. рис. 7.19).
При появлении на пути проростка механического препятствия (камень)
растение выделяет больше этилена, рост в длину приостанавливается и начина-
ется утолщение. Проросток стремится преодолеть препятствие, усилив давление.
Если это удалось, концентрация этилена падает и рост в длину восстанавлива-
ется, но если препятствие слишком крупное, продукция этилена усиливается.
Проросток отклоняется от вертикали и огибает камешек. В воздушной среде
концентрация этилена падает и апикальная петелька проростка разгибается.
7.2.7.5. Этилен и прикосновение
До 1991 г. у физиологов были отрывочные сведения о механизмах ответа
растений на прикосновение. Методом вычитания кДНК-библиотек было уста-
новлено, что при опрыскивании водой Arabidopsis синтезируются новые мРНК.
Опрыскивание действует как комплексный фактор: меняется влажность, созда-
ется тень водяных брызг, листья подвергаются механической нагрузке. Каждый из
факторов был исследован отдельно. Выяснилось, что влажность не играет роли,
но если растение потереть палочкой, оно почувствует это и через 10—15 мин
ответит экспрессией новых генов (уровень мРНК возрастает на 2 порядка). Эти
гены были обозначены ТСН (от англ, touch — прикосновение).
Если, не касаясь растения, внезапно накрыть его черным колпаком, уровень
ТСН-матриц также повышается. Мощные звуковые эффекты не привели к же-
лаемому результату: мРНК ТСЯ-генов не появились. Гены ТСН1, ТСН2к ТСНЗ
похожи на связывающие кальций белки — кальмодулины. Вместе с Са + эти
белки активизируют цитоскелет, способствуют переходу из золя в гель и т.д.
Растения при частом механическом беспокойстве отстают в росте от тех, к кото-
рым не прикасались, но становятся механически более прочными. Белковый
продукт гена ТСН4 оказался ксилоглюкан-эндотрансгликозилазой. Ее синтез мож-
но вызвать и брассиностероидами (см. подразд. 7.2.8.1). Похожие эффекты вызы-
вает этилен. При этом также происходит синтез Са +-связывающих ТСН-белков.
7.2.7.6. Этилен и заживление ран
Многие растения образуют млечники, которые содержат латекс (натураль-
ный каучук). Каучук не «застывает» внутри млечников, но при повреждении
461
латекс выступает на поверхность и быстро твердеет, закупоривая рану. Латекс
склеивает споры грибов и бактерий; в ротовом аппарате насекомых он засты-
вает или приклеивает их к капельке выступившего каучука. На плантациях ге-
веи (Hevea brasiliensis) затвердение латекса — вредный процесс: приходится
вновь делать насечки на стволах, подставлять сосуды для сбора каучука в но-
вые места, что создает лишнюю работу. Выяснилось, что латекс застывает под
действием этилена. Важную роль при этом играет минорный белок латекса
гевеин. С застыванием латекса можно бороться, обрабатывая гевею ингибитора-
ми синтеза этилена (наиболее известный ингибитор — Ag+, но есть и более
дешевые). Таким образом, у каучуконосов этилен способствует заживлению
механических повреждений.
Этилен активизирует раневую перидерму. Образуется пробковый камбий,
который формирует суберинизированную пробку, отделяющую здоровую (жи-
вую) ткань от больной (мертвой). Пробка — гидрофобный барьер, предохра-
няющий раны от чрезмерного испарения и препятствующий проникновению
инфекции в поврежденном месте. Размеры и место образования раневой пери-
дермы отличаются у разных растений. Так, медуница (Pulmonaria obscura) об-
разует раневую перидерму вокруг зоны повреждения грибами. Участок листа
вместе с мицелием гриба выпадает. У фасоли (Phaseolus vulgaris) раневая пери-
дерма расположена в основании листовой пластинки, и растение жертвует
поврежденной частью сложного листа для безопасности целого растения.
При нападении насекомых и клещей выделяется этилен, в основании листа
активизируется перидерма, происходит локальный «листопад»: поврежденный
лист опадает на землю вместе с вредителем. Шансы вновь добраться до кроны
у вредителей уменьшаются.
7.2.7.7. Регуляция листопада в умеренных широтах
Этилен регулирует явление листопада, поэтому его иногда считают гормо-
ном старения растений. Ежегодный листопад — это не совсем старение: ведь в
тропиках отдельные листья живут 3—4 года и больше. Сокращение сроков жизни
листа связано с защитой от механического стресса.
При опадании листьев в местах их прикрепления образуется очень много
раневых поверхностей. Чтобы лист отделился без вреда для целого растения, в
его основании формируется отделительный слой (фактически — та же раневая
перидерма). Место будущего повреждения закрывается пробкой, вышележа-
щая ткань разрыхляется и становится непрочной, лист опадает. Чтобы разрых-
лить клеточную стенку, выделяются пектиназы, расщепляющие пектин. При
этом высвобождаются физиологически активные вещества олигосахарины (см.
подразд. 7.2.8.4), стимулирующие дальнейшее размягчение клеточных стенок.
Таким образом, листопад и защита раневых поверхностей тесно связаны.
Зимой листья повреждаются морозом, на них падает снег, вызывая усиление
механической нагрузки на ветки. В случае листопада в умеренных широтах мы
видим опережающую физиологическую реакцию: растения как бы «предус-
матривают» будущий механический стресс и заранее освобождаются от листь-
ев. Листопад в районах со снежной зимой контролирует этилен — гормон меха-
нического стресса.
462
7.2.7.8. Формирование и созревание плодов
Развитие плода начинается с оплодотворения завязи. На рыльца попадают
пыльцевые зерна, они прорастают и механически давят на проводниковую
ткань столбика. При этом ткани столбика начинают выделять этилен. Разные
части цветка по-разному отвечают на сигнал этилена. Все органы, привлекаю-
щие опылителей, отмирают или меняют окраску. У ипомеи лепестки быстро
теряют тургор и увядают. В основании листочков околоцветника лилии (Lilium)
активизируется отделительный слой, и они опадают (см. подразд. 7.2.7.7). У ме-
дуницы меняется pH вакуолярного сока, цветки из розовых превращаются в
синие. У белокрыльника (Calla palustris) этилен изменяет цвет покрывала соц-
ветия с белого на зеленый. Покрывало служит дополнительным источником
фотоассимилятов для развивающихся плодов. Подчеркнем, что этилен обычно
вызывает разрушение хлорофилла, пожелтение и опадание листьев, но у аро-
идных после опыления он усиливает фотосинтез. Тычинки при действии эти-
лена увядают, а завязи начинают активно расти, привлекая новые питатель-
ные вещества.
Особенно важен этилен на последнем этапе созревания сочных плодов. Здесь
«играют» практически все рассмотренные эффекты. Плод перестает расти, на-
чинается выделение пектиназ в апопласт (плоды размягчаются), образуются
физиологически активные олигосахарины (см. подразд. 7.2.8.4). В ножках плодов
активизируется отделительный слой и образуется раневая перидерма (как при
листопаде), меняется pH — плоды становятся менее кислыми, а также меняется
их окраска с зеленой на желтую или красную (как у лепестков некоторых расте-
ний). Поврежденные плоды созревают и опадают раньше. Механический стресс
вызывают птицы, личинки насекомых или фитопатогенные грибы. Как в слу-
чае поврежденных листьев, растение сбрасывает некачественный плод, чтобы
остальные остались здоровыми. Созревание плодов под действием этилена — это
такая же упреждающая физиологическая реакция, как листопад. Сочные пло-
ды распространяют птицы и млекопитающие, которые повреждают плоды при
поедании, а растение продуцирует этилен заранее (до механического стресса).
Ускорение созревания плодов этиленом изучено в 1920-х гг. С тех пор это
явление широко используют. При транспортировке плоды должны оставаться
прочными и зелеными: их перевозят в проветриваемой таре, оберегают от ме-
ханических повреждений, вызывающих синтез этилена. Биосинтез этилена за-
медляется при пониженной температуре и при высокой концентрации СО2.
Ингибиторы синтеза этилена токсичны для человека, их применяют только
при транспортировке букетов. Торговцы ставят цветы в специальный раствор
ингибиторов синтеза этилена с минеральными солями, сахаром и антисепти-
ками. Эти добавки позволяют сохранять букеты в течение многих дней.
При нарушении биосинтеза этилена плоды не дозревают. На основе мутан-
тов по биосинтезу этилена уже получены сорта томатов, которые очень долго
хранятся и выдерживают дальние перевозки. Перед продажей для ускорения
созревания плодов обрабатывают этиленом, однако эта технология снижает их
вкусовые качества. Существует поговорка: «одно гнилое яблоко портит бочку
яблок». Гнилое яблоко — источник этилена, который вызывает размягчение
остальных яблок. Каждый плод синтезирует свой этилен по мере созревания, и
в бочке начинается «цепная реакция» производства этилена.
463
7.2.7.Э. Биотический стресс
Самый распространенный из механических стрессов вызывают травоядные
животные. В ответ растения выделяют этилен, который запускает синтез ве-
ществ, препятствующих поеданию биомассы.
С этим столкнулись, в частности, на Африканском континенте, когда ре-
шили приручить антилоп (антилопы более приспособлены к местным услови-
ям, чем европейский скот). Для них построили загоны вокруг зарослей ака-
ции, природного корма антилоп. Хотя корма явно хватало, животные в загонах
погибали. Оказалось, что антилопы гибнут от отравления.
Химический анализ листьев акации в загоне показал, что они богаты
полимерными фенольными соединениями — таннинами, ядовитыми для ан-
тилоп. В природе акации содержат мало таннинов. Выяснилось, что образова-
ние таннинов можно вызвать этиленом. Антилопы повреждают акации, при
этом выделяется этилен, что приводит к синтезу таннинов. Этиленовый сиг-
нал передается по воздуху (этилен — газ). У акаций, которые росли рядом с
загоном, «на всякий случай» повысилась концентрация таннина. В природе
антилопы не живут на одном месте, меняя пастбища, и когда таннины накап-
ливаются, они уже пасутся на другом месте.
Еще один класс защитных соединений — ингибиторы протеиназ. Для пере-
варивания пищи необходимы протеиназы, разрушающие белки (например,
компонент желудочного сока трипсин). Некоторые растения вырабатывают
вещества, инактивирующие трипсин и другие протеиназы. Под действием ме-
ханического стресса растения вырабатывают этилен, этилен вызывает синтез
ингибиторов протеиназ, они попадают в желудок теплокровных или насеко-
мых, вызывая сильные нарушения пищеварения.
Под действием этилена растения вырабатывают фитогемагглютины — ве-
щества, склеивающие эритроциты. При поедании растительной биомассы фи-
тогемагглютины попадают в желудок и кишечник, а оттуда всасываются в кровь.
Эритроциты склеиваются, образуются тромбы, происходит закупорка крове-
носных сосудов. Высокие дозы фитогемагглютинов смертельны.
В природе механические повреждения вызываются разнообразными причи-
нами (например, ветром, градом и т.п.). Растение должно точно различать
абиотические повреждения и нападение фитофагов. Для этого под действием
этилена клетки выделяют в апопласт хитиназу и fi-глюканазу. Напомним, что
хитин содержится в насекомых и грибах, а глюкан — компонент растительной
клеточной стенки. Хитиназа до некоторой степени разрушает хитин. Казалось
бы, полное разрушение хитина может спасти растение от нападения, но хити-
назы вырабатывается очень мало. Перечисленные ферменты образуют олиго-
мерные фрагменты хитина и гликана. Эти фрагменты воспринимаются расте-
нием как сигнал опасности. Тогда начинается второй этап ответа на поврежде-
ние. Если хитиназа и 0-глюканаза не обнаруживают в зоне повреждения гри-
бов, то токсичные вещества перестают вырабатываться.
В случае инфекции самый сильный ответ — реакция сверхчувствительности.
Пораженная клетка «отключает» систему защиты от активных форм кислоро-
да, образуется очень много перекисей, супероксид-анионов и других свобод-
ных радикалов, в результате чего клетка гибнет. Но вместе с ней гибнет и
попавший в растение паразит. В развитии реакции сверхчувствительность важ-
464
ную роль играют салициловая и жасминовая кислоты (см. подразд. 7.2.8.2, 7.2.8.3),
которые синтезируются в том числе и при действии этилена. Клетки, окружа-
ющие зону инфекции, синтезируют токсичные вещества. Если эти вещества
синтезируются в процессе инфекции de novo, их называют фитоалексинами.
Химическая природа фитоалексинов зависит от систематического положения
растения. Так, картофель образует сесквитерпеноидные фитоалексины, у бо-
бов (Vicia faba) фитоалексины синтезируются на основе фенольных соедине-
ний и т. п.
К высокомолекулярным защитным веществам растений можно отнести лек-
тины (белки и гликопротеиды, способные связывать полисахариды). Некото-
рые лектины связываются с хитином в клеточных стенках грибов. При росте
гиф ослабляются связи между хитиновыми волокнами. Но эти волокна прочно
склеены лектинами, и клеточная стенка гриба не может растягиваться. То же
самое происходит и с бактериями, которые оказываются склеенными другой
группой лектинов.
Кроме перекисей, фитоалексинов и лектинов к месту инфекции транспор-
тируются и ингибиторы протеиназ. Это позволяет остановить разрушение бел-
ков растительных клеток в месте инфекции.
Немаловажную роль в защите играет непосредственно этилен. Так, грибы,
вызывающие ржавчину, для своего роста нуждаются в полиаминах — путресци-
не и спермидине (эти вещества продуцируют растения). Полиамины имеют
общее звено биосинтеза с этиленом: S-аденозилметионин (см. подразд. 7.2.7.2).
Продукция этилена вызывает остановку синтеза полиаминов. Грибы оказыва-
ются лишенными фактора роста и гораздо хуже инфицируют растения. Подав-
ление биосинтеза этилена ведет к усилению инфекции, а если ингибировать
синтез полиаминов, ржавчина почти не развивается.
7.2.7.10. Этилен и цветение ананасов
Цветение ананасов (Ananas sativus) (как и других растений из сем. бромели-
евых (Bromeliaceae)) можно вызвать обработкой этиленом. В природе бромели-
евые цветут, когда им удается набрать некоторый «критический» размер. Но в
промышленной культуре это свойство не очень полезно: растения цветут и
плодоносят не одновременно.
Цветение ананасов можно регулировать. В оранжереях Санкт-Петербурга
царские садовники использовали для этого специальный прием: ананасы вы-
нимали из горшка и на несколько дней подвешивали корнями кверху. Механи-
ческий стресс (подвешивание) вызывал синтез этилена и ананасы начинали
цвести. Вопрос лишь в том, как добыть этилен и массово обработать им анана-
сы на плантациях, чтобы они зацвели одновременно. На Гавайских островах
среди ананасов расставляют плошки с нефтепродуктами и поджигают. При
неполном сгорании получаются небольшие порции этилена, но вполне доста-
точные для стимуляции цветения. На Кубе ананасы поливали карбидной водой.
Карбид кальция при взаимодействии с водой дает ацетилен, микрофлора по-
чвы восстанавливает его до этилена. Можно рекомендовать помещать горшок с
ананасом в полиэтиленовый пакет вместе со спелым бананом, плотно завязав
его. В настоящее время существуют более совершенные технологии. В частно-
сти, применяют химические агенты (например, этрел), которые сами разру-
465
шаются в организме растения с образованием этилена. Именно этими препа-
ратами обрабатывают ананасы.
Стимуляция образования цветков не характерна для этилена. Скорее дело
не в этилене, а в эволюционных связях и экологии бромелиевых. Представите-
ли этого семейства распространены в тропиках и субтропиках Нового Света.
Подавляющее большинство бромелиевых — эпифиты. Их листья собраны в
плотную розетку, в которой скапливаются дождевая вода, пыль и листовой
опад; здесь же выводят свое потомство комары и лягушки. Таким способом
бромеливые создают резервуары воды на большой высоте от земли с уникаль-
ной развивающейся в них биотой. Из резервуара листья впитывают минераль-
ные соли, отсюда же растения «пьют» в засушливое время. Главный поглоща-
ющий орган не корень, а лист, и без воды в розетке бромеливые существовать
не могут (рис. 7.21).
Когда растение вырастает достаточно крупными, в самом центре розетки
образуется цветонос. Это происходит в сухой сезон. Розетка, в которой развил-
ся цветонос, после плодоношения отмирает и вокруг нее появляются вегета-
тивные потомки — детки.
У всех бромелиевых этилен вызывает цветение в нехарактерное время года.
Уникальный механизм регуляции цветения объясняется следующей гипотезой.
Если по какой-то причине растение потеряло вертикальную ориентацию ро-
зетки (например, ее наклонило животное, растение упало вместе с веткой),
это становится фатальным: розетка из листьев не может накапливать воду. Ме-
ханический стресс вызывает образование этилена. При угрозе гибели бромели-
евые стремятся как можно быстрее образовать семена. В этой ситуации этилен
служит сигналом к ускоренному зацветанию. Представители бромелиевых цве-
тут и одновременно образуют боковые побеги (молодые розетки будут ориен-
тированы правильно). Хотя у ананасов вода в розетках не задерживается и они
освоили наземный образ жизни, этилен по-прежнему вызывает такой же от-
вет, какой был у эпифитных предков ананаса.
Рис. 7.21. Эпифитные бромелиевые и регуляция цветения
466
7.2.8. ДРУГИЕ ГОРМОНАЛЬНЫЕ ВЕЩЕСТВА РАСТЕНИЙ
7.2.8.1. Брассиностероиды
Еще в 1930—1940 гг. была высказана догадка о том, что у растений есть
стероидные регуляторы роста (по аналогии с животными). В многочисленных
биотестах растения подвергали обработке тестостероном или эстрогеном, ко-
торые оказывали физиологическое действие. Так, эстрогены вызывали деле-
ние клеток в зародышах гороха, а тестостерон изменял пол у шпината (с
женского на мужской) и стимулировал дифференцировку архегониев на за-
ростках хвоща. Однако животные гормоны приходилось использовать в слиш-
ком высоких концентрациях (до 0,1 %), и вряд ли их действие было специ-
фичным.
Попытки выделить фитогромоны стероидной природы не прекращались.
В 1979 г. М.Д. Гроув с соавт. обнаружили, что масляный экстракт из пыльцы
рапса стимулировал рост проростков в длину. Из 10 кг пыльцы удалось выде-
лить всего 4 мг действующего вещества! Это оказалось стероидное соединение.
Вещество было названо брассинолидом (от лат. Brassica napus — рапс), а все
похожие на него вещества с физиологической активностью называют брасси-
ностероидами. Вскоре из настоящего каштана {Castanea satiua) был выделен
кастастерон, из рогоза (Typha) — тифастерол, из чая (Thea) — теастерон, из
катарантуса {Catharanthus) — катастерон и т.д. В настоящее время известно
более 60 брассиностероидов.
Биосинтез брассиностероидов включает общие для других терпеновых со-
единений стадии: изопентенилпирофосфат, геранилпирофосфат, фарнезил-
пирофосфат, сквален. Первым специфическим продуктом, из которого синте-
зируются остальные брассиностероиды, является 24-метиленхолестерол, пре-
вращающийся в кампестерин и кампестанол (рис. 7.22). От кампестанола рас-
ходятся две параллельные ветви биосинтеза, часто одновременно сосуществую-
щие в растениях: с ранним и с поздним окислением в С-6-положении. В итоге
обе ветви биосинтеза заканчиваются брассинолидом — физиологически ак-
тивным брассиностероидом.
Ферменты биосинтеза брассиностероидов были выделены и охарактеризо-
ваны благодаря мутациям, приводящим к карликовости, которая восстанав-
ливается брассинолидом. Так, у арабидопсис мутации dwf 1 (от dwarf — кар-
лик) и dwf 6 нарушают ранние этапы биосинтеза (до разделения на «раннее» и
«позднее» окисление) и наиболее сильно проявляются фенотипически — му-
танты достигают не более 1/30 высоты растений дикого типа. Мутация dwf 4
затрагивает более поздние этапы (после развилки в метаболизме), поэтому
проявление карликовости мягче.
Брассиностероиды — гидрофобные молекулы, но зарегистрировано обра-
зование гидрофильных гликозидов, сульфатов и ацил производных брассинос-
тероидов. Только гидрофильные формы могут быть транспортными. Хотя фер-
менты биосинтеза брассиностероидов обнаружены почти во всех тканях расте-
ния, концентрация этих гормонов более высока в молодых тканях: этиолиро-
ванных проростках, меристемах, флоральных примордиях, развивающейся
пыльце. По-видимому, неравномерное распределение брассиностероидов вы-
звано процессами дальнего и ближнего транспорта.
467
468
Рис. 7.22. Биосинтез брассиностероидов:
/ — ранние этапы биосинтеза, общие с другими терпеноидами; 2 — образование стероидов; 3 —
путь раннего бС-окисления; 4 — путь позднего бС-окисления, оба пути протекают параллельно
с участием одних и тех же ферментов; звездочкой отмечено бС-положение в молекуле; 5 —
схождение путей раннего и позднего бС-окисления на кастастероне; 6 — образование брассино-
лида — активной формы брассиностероидов; 7 — гликозилирование делает брассиностероиды
более гирофильными и снижает их физиологическую активность
469
Реакции на брассиностероиды отсутствуют у мутанта bri 1 (brassinosteroid
insensitive). Анализ аминокислотной последовательности белка BRI 1 показал
ее гомологию с трансмембранными рецепторными киназами (у белка BRI 1
есть лигандный, трансмембранный и протеинкиназный домены). Однако до
сих пор не показано, что брассиностероиды непосредственно связываются с
BRI 1, т.е. проблема рецептора брассиностероидов не решена окончательно.
Брассиностероиды (как и ауксины) действуют на проростки, усиливая рас-
тяжение. Однако если для ауксинов характерно быстрое растяжение с актива-
цией Н+-помпы через 10 мин и максимумом растяжения через 30—45 мин, то
для брассиностероидов типична более замедленная реакция, которая начина-
ется через 30 мин после воздействия и продолжается 1,5 —2 ч. Если добавлять
брассиностероиды вместе с ауксинами, то они вызывают гораздо больший
эффект, чем при разделенном применении.
На молекулярном уровне эффект растяжения по-видимому обусловлен ак-
тивацией генов ксилоглюканэндотрансгликозилаз (КсЭТ) — это ген ТСН 4 ара-
бидопсис, ген BRU 1 сои и др. Активация таких генов обнаружена в разных
растительных объектах. Белки КсЭТ после биосинтеза направляются в апо-
пласт и при взаимодействии с ксилоглюканами размягчают матрикс клеточ-
ной стенки. Таким образом, ауксины запускают процесс растяжения, а брас-
синостероиды важны для его длительного поддержания. Брассиностероиды вза-
имодействуют и с гиббереллинами, усиливая растяжение клеток.
При недостаточном синтезе брассиностероидов наблюдается частичная и
полная мужская стерильность. У мутантов по генам биосинтеза брассиностеро-
идов тычиночные нити не достигают длины, достаточной для самоопыления.
Даже если пыльцевые зерна попадают на рыльца, рост пыльцевой трубки су-
щественно замедлен. Проростки мутантов в темноте не удерживают апикаль-
ную петельку в согнутом состоянии, семядоли преждевременно раскрываются
и начинается биосинтез хлорофилла. Все эти реакции не характерны для расте-
ний, выращенных без света. Поэтому обсуждают участие брассиностероидов
при передаче световых сигналов и «перекрестный разговор» путей фоторецепции
и брассиностероидов (см. подразд. 7.3.2.3).
Брассиностероиды регулируют процессы клеточной дифференцировки. У му-
тантов bri 1 нарушено формирование столбчатого мезофилла и уменьшено ко-
личество проводящих элементов ксилемы. Как и в случае растяжения, акусины
запускают процесс дифференцировки, а брассиностероиды поддерживают его.
В дифференцировке ксилемных элементов можно выделить три стадии: 1) пер-
вичная экспрессия генов, приводящая к накоплению фенилаланинаммикали-
азы (ФАЛ) и гидроскилазы коричной кислоты (ГКК); 2) остановка экспрессии
этих генов и переориентация актиновых филаментов; 3) вторичный запуск
синтеза ФАЛ и ГКК с сильной лигнификацией и программированной гибе-
лью клеток. Переход от стадии 2 к стадии 3 контролируют брассиностероиды.
Действие брассиностероидов и ауксинов на корневую систему противопо-
ложно: ауксины стимулируют ризогенез, а брассиностероиды ингибируют об-
разование корней.
В больших дозах брассиностероиды сдерживают рост и повышают устойчи-
вость к неблагоприятным внешним факторам: перегреву, заморозкам, засухе,
инфекции. Препарат «Эпин» (сельскохозяйственный эпибрассинолид) помо-
гает вырастить более крепкие и здоровые растения.
470
7.2.8.2. Жасминовая кислота
Впервые жасминовая кислота (жасмонат) была выделена в 1962 г. из эфир-
ного масла жасмина крупноцветкового (Jasminum grandiflorum), где она при-
сутствует в виде летучего эфира метилжасмоната. Это достижение фитохимии
осталось бы незамеченным, если бы в 1980-х гг. не было обнаружено физиоло-
гическое действие этого вещества на растения. Жасмонат и метилжасмонат
ингибировали рост проростков, прорастание пыльцевых трубок, образование
каллуса, способствовали закрытию устьиц, стимулировали образование клуб-
ней и луковиц, влияли на цитоскелет, переориентируя его.
Синтез жасминовой кислоты начинается с гидролиза фосфолипидов фосфо-
липазой А (см. подразд. 7.2.1.3). Освободившаяся из липидов линоленовая кис-
лота под действием липоксигеназы превращается в перекисное производное
и далее формирует пятичленный цикл, служащий основой для жасмоната
(рис. 7.23, 1—6). После синтеза жасминовая кислота может метилироваться,
переходя в физиологически активный метилжасмонат, но возможно и глико-
зилирование, и тогда жасмонат переходит в неактивную (запасную) форму.
У Arabidopsis обнаружены два гена, ответственные за синтез липоксигеназы:
один из них (ATLOX 1) экпрессируется в листьях, корнях, проростках при
нормальном развитии и не зависит от внешних условий, тогда как экспрессия
ATLOX2 повышается в ответ на механическое повреждение и патогенез. Инте-
ресно, что жасмонаты повышают активность липоксигеназы, стимулируя свой
собственный биосинтез.
Кроме жасминовой кислоты найдены другие вещества этого класса, выпол-
няющие те же функции: кукурбиновая кислота из тыквы и тубероновая кислота
из картофеля. У животных близкими по структуре и биосинтезу являются про-
стагландины.
Очевидно, жасмонаты участвуют в двух приниципиально различных регу-
ляторных процессах: 1) сдерживают вегетативный рост и способствуют пере-
ходу в состояние покоя; 2) усиливают иммунный ответ.
Во многих тестах АБК и жасмонаты вели себя как синергисты. Так, при
воздействии жасмонатами до суток подавляется синтез РБФК и разрушается
хлорофилл. За подавление биосинтеза белка отвечает Jip60 (Jasmonate-induced
protein, мол. масса 60 кДа). Появление Jip60 в клетках вызывает разрушение
полисом и общее подавление трансляции. Обработка клеток 10-5 М жасмино-
вой кислотой в течение 48 ч и более вызывает их гибель.
Жасмонаты вызывают в зародышах синтез белков позднего эмбрионального
развития — Lea (Late embryogenesis abundant proteins). К уникальной физиоло-
гической реакции, запускаемой жасмонатами, относится синтез вегетатив-
ных запасных белков — VSP (Vegetative storage proteins). У некоторых растений
эти белки совпадают по структуре с запасными белками семян, но у других
заметно отличаются. Синтез VSP наблюдается только при хорошем снабже-
нии азотом, а при голодании VSP не откладываются. Очевидно, жасмонаты
регулируют депонирование нерастворимых азотных соединений и донорно-
акцепторные отношения. Параллельно с VSP и Lea синтезируются белки, ха-
рактерные для водного дефицита (перекрывающаяся реакция с АБК). Появле-
ние этих белков сопровождается ослаблением флоэмного тока и закрытием
устьиц.
471
(СН2)^
СООН
Линоленовая кислота
9,13,12-Оксофитодиеновая кислота
биосинтеза жасминовой кислоты; 3 — заключительные эта-
пы биосинтеза с укорочением углеродного скелета; 4 — об-
разование кукурбиновой и тубероновой кислот — физиологически активных аналогов жасмино-
вой кислоты; 5 — депонирование в форме неактивных гликозидов; 6 — этерификация позволяет
увеличить летучесть жасмоната, что важно для передачи сигнала другим растениям
472
Если в растениях ингибировать работу липоксигеназы, жасминовая кислота
не образуется и теряется иммунитет к фитопатогенам. В иммунном ответе жас-
миновая кислота вызывает синтез экстенсинов (происходит упрочнение клеточ-
ной стенки и замедление роста, что неблагоприятно для патогенов), синтез
белков тионинов (небольшие богатые цистеином белки, связывающиеся с мем-
бранными структурами патогена с токсическим эффектом), синтез фитоалек-
синов (индуцибельных защитных соединений), салициловой кислоты (см. под-
разд. 7.2.8.3) и короткого пептида системина (см. подразд. 7.2.8.5).
Этерификация жасминовой кислоты придает ей летучесть. Предполагают,
что метилжасмонат (как и этилен) через воздух действует на соседние расте-
ния, «информируя» их о «нападении» патогенов. Растительное сообщество «за-
ранее узнает» об инфекции и «принимает защитные меры».
7.2.8.3. Салициловая кислота
Салициловая кислота, выделенная из ивы (Salix) еще в XIX в., нашла ши-
рокое применение в медицине. Самое известное производное — ацетилсали-
циловая кислота (аспирин).
Биосинтез салицилата начинается с активизации фенилаланинаммиаклиазы
(ФАЛ): она превращает фенилалланин в транс-коричную кислоту, которая при
дальнейшем окислении дает бензоат. Бензоатгидроксилаза окисляет его до са-
лицилата. Салицилат может депонироваться в виде неактивного гликозида.
Физиологический эффект салицилатов в растениях открыт в 1980-х г. при
изучении термогенеза у ароидных. Sauromatum guttatum — субтропическое расте-
ние с типичной для ароидных стратегией опыления (рис. 7.24). Женские цветки
собраны на початке у основания в камере, образованной покрывалом. Выше
расположены щетинки, прилегающие к покрывалу, а также тычинки. Початок
венчает утолщенный стерильный придаток. Покрывало отогнуто и образует
посадочную площадку для опылителей.
Первый термогенный эпизод начинается в середине ночи с нагревания сте-
рильного придатка и длится около 7 ч (рис. 7.24, А). Разница температур (ДГ)
между початком и окружающей средой достигает 12 °C. При этом испаряются
вещества, имитирующие запах гниющего мяса. На запах слетаются насекомые-
опылители и забираются по покрывалу в нижнюю камеру. Их обратному выхо-
ду препятствуют щетинки. Насекомые остаются на день в камере, а вечером их
ожидает второй (14-часовой) термогенный эпизод: разогревается нижняя часть
початка (перепад температур ДГ = 10 °C) (рис. 7.24, Б). Пыльники раскрывают-
ся и осыпают насекомых пыльцой. Щетинки к этому времени усыхают, и опы-
лители свободно покидают камеру.
Термогенные эпизоды распределены в течение суток так, что начало перво-
го эпизода у одних растений в данной популяции совпадает с освобождением
насекомых после второго эпизода у других. В верхнем придатке за день до цве-
тения салициловая кислота накапливается с 12.00 и достигает максимума в
17.00 часов. Концентрация салицилата повышается в 100 раз. В середине ночи
уровень салицилата повышается в нижней части початка. После термогенеза
уровень салицилата возвращается к исходному (около 10—15 ммоль).
В вырезанном из растения початке термогенез можно вызвать экзогенным
салицилатом, причем в темноте салицилата нужно добавить больше, чем на
473
Рис. 7.24. Термогенез у Sauromatum guttatum (ароидные) (А, Б)
и салициловая кислота (В).
Q — выделение тепла
свету. Очевидно, Sauromatum не склонен к термогенезу, если соцветие нахо-
дится в почве и не доступно для опылителей. По-видимому, салициловая кис-
лота индуцирует синтез мРНК альтернативной оксидазы (см. подразд. 4.3.10).
Под действием салицилата в придатке повышается содержание летучих ве-
ществ, привлекающих насекомых.
Вряд ли салициловая кислота является непосредственным триггером пото-
ка электронов в ЭТЦ митохондрий, так как повышение ее уровня наблюдают-
ся не у всех термогенных видов. Так, при развитии стробила саговников (Сусах),
цветка виктории королевской (Victoria regia) или соцветия у пальм температу-
ра повышается, но термогенез не связан с салицилатом. Уровень салицилата в
листьях риса повышен, но рис почти не способен к термогенезу. Таким обра-
зом, регуляция термогенеза салициловой кислотой характерна для ароидных и
некоторых других растений. У ряски (Lemna gibba) добавление салицилата сти-
мулирует цветение.
Салициловая кислота регулирует ответ при действии патогенов. Например,
при обработке салицилатом повышается устойчивость табака к вирусу табач-
ной мозаики. При механическом повреждении активизируется начальный фер-
мент биосинтеза салицилата — фенилаланинаммиаклиаза (ФАЛ). Если расте-
ние не может синтезировать салицилат (блокированы гены ФАЛ или бензоат-
гидроксилазы), его иммунная реакция снижается.
При обработке салициловой кислотой синтезируются PR-белки (pathogenesis
related) различных классов. PR-1-класс отвечает за системную устойчивость
(т. е. устойчивость всего растения, далеко от непосредственного места контакта
с патогеном). Белки PR-1 токсичны для грибов.
474
Белки PR-2 — р-1,3-глюканазы, расщепляющие глюканы клеточной стенки.
Фрагменты глюканов также способны вызывать иммунную реакцию раститель-
ных клеток. Класс белков PR-3 — хитиназы, они расщепляют хитин клеточных
стенок грибов. К классу PR-4 относят гевеинподобные белки, отвечающие за
застывание латекса. Эти физиологические ответы частично перекрываются с
ответами на этилен и жасминовую кислоту (см. подразд. 7.2.7.6, 7.2.7.9, 7.2.8.2).
Салициловая кислота вызывает синтез ФАЛ, усиливая собственный био-
синтез. Кроме того, салициловая кислота может связываться с некоторыми Fe-
содержащими белками (например, с каталазой). При взаимодействии с сали-
цилатом активность каталазы падает, концентрация перекиси водорода и дру-
гих активных форм кислорода растет. К этому же эффекту приводит взаимо-
действие салицилата с аскорбатоксидазой. Повышение концентрации актив-
ных форм кислорода стимулирует образование новых порций салициловой
кислоты, что также усиливает эффект. Высокие дозы салицилата вызывают
гибель клеток (запускается реакции сверхчувствительности).
Таким образом, салицилат не только регулирует процессы через рецептор-
ные системы, но и непосредственно участвует в аллостерической регуляции
работы ряда ферментов, т. е. для развития физиологического ответа необходи-
ма сравнительно высокая концентрация салицилата (до 10“3—10-5 моль/л). Это
не характерно для «типичных» гомонов (см. подразд. 7.2.1.1), поэтому включе-
ние салицилата в список фитогормонов дискуссионно.
7.2.8.4. Олигосахарины
В регуляции физиологических процессов у растений участвуют короткие уг-
леводы — олигосахариды. В 1980-х гг. обнаружено, что продукты деградации клеточ-
ной стенки Phytophthora вызывают специфичную иммунную реакцию. Даже неболь-
ших перестроек углеводного скелета было достаточно, чтобы этот эффект исчез,
т.е. большинство олигосахаридов не обладает активностью. Олигосахариды, вы-
зывающие физиологический эффект, называют олигосахаринами. (Каждый оли-
госахарин — олигосахарид, но не каждый олигосахарид — олигосахарин!)
Они образуются как продукты расщепления полисахаридов клеточной стенки.
Расщепление вызывают как собственные ферменты, так и ферменты грибов/
бактерий. В состав олигосахаринов могуг входить ксилоза, рамноза, галактоза и
остатки уроновых кислот. Из гликолипидов, входящих в состав мембран, обра-
зуются олигосахарины, содержащие инозитол (см. подразд. 7.2.1.3). Короткие
фрагменты хитина, образующиеся под действием растительных хитиназ, так-
же относят к олигосахаринам, хотя они происходят из чужеродного объекта.
Обнаружено, что олигосахариды суспензионной культуры клена стимули-
руют деление клеток в культуре in vitro. Это говорит о том, что в экстрактах есть
и олигосахарины.
В физиологической регуляции созревания плодов также участвуют олигосаха-
рины. Ферменты, разрушающие гликаны клеточной стенки, высвобождают
активные олигосахарины, стимулирующие дальнейшее созревание. Важную роль
играют пектолитические ферменты и образующиеся фрагменты пектина. Спе-
цифические олигосахарины являются сигналами при узнавании симбионтов в
системе Rhizobium—растение — хозяин. Без обмена олигосахаринами клубень-
ки у бобовых не образуются.
475
7.2.8.5. Короткие пептиды
Сигнальные короткие пептиды растений, как правило, синтезируются в
виде крупных белков-предшественников, а затем в результате протеолиза про-
исходит их «созревание». Короткие пептиды выходят в апопласт и действуют
на другие клетки.
Один из первых пептидов, выделенный из томатов, отвечал за системный
ответ на механическое повреждение и внедрение патогена (индукция ингиби-
торов протеиназ и фитоалексинов). В результате иммунный ответ наблюдается
не только в месте повреждения, но и во всем растении (системная устойчи-
вость). Этот короткий пептид, состоящий из 18 аминокислот, назван системи-
ном. Предшественник системина содержит 200 аминокислотных остатков. Био-
синтез системина контролирует жасмонат. У томатов найден белок-рецептор
(мол. масса 160 кДа), связывающийся с системином. Системин специфичен
для томатов и картофеля, но не вызывает системного ответа у табака (из таба-
ка был выделен другой системин, не похожий на томатный).
Из суспензионной культуры аспарагуса (Asparagus) был выделен еще более
короткий пептид (всего 4—5 аминокислот), в состав которого входил суль-
фатированный тирозин, названный фитосульфокином. Он стимулирует деле-
ние клеток in vitro, повышает митотический индекс. Фитосульфокин обнару-
живается в местах активного деления клеток, способствуя органогенезу (обра-
зованию листьев, боковых корней и т.д.). По-видимому, фитосульфокин —
Центральная
зона
Рис. 7.25. Контроль размера меристемы коротким пептидом CLV3 у Arabidopsis thaliana
(крестоцветные):
А — в покоящемся центре активен ген WUSHEL, что приводит к появлению сигнала, стимулиру-
ющего деления клеток; Б — делящиеся клетки центральной зоны синтезируют и выделяют в апо-
пласт короткий пептид-продукт гена CLAVATA 3', В — в покоящемся центре короткий пептид
CLAVATA 3 взаимодействует с мембранным рецептором CLAVATA 1. что приводит к инактивации
экспрессии гена WUSHEL-, Г — в центральную зону не поступает сигнал о делении клеток, пеп-
тида CLAVATA 3 становится меньше. Создаются условия для повышения экспрессии гена WUSHEL
476
универсальный регуляторный пептид — он вызывает деление клеток у риса и
других не родственных растений.
Другие короткие пептиды регулируют специфичные функции. Так, пептид
CLAVATA 3 (состоит из 78 аминокислот), синтезируется в верхних слоях цен-
тральной зоны меристемы (делящихся клетках). Он регулирует размер апи-
кальной меристемы побега у Arabidopsis. Пептид CLAVATA 3 связывается с
белком-рецептором CLAVATA 1, причем рецептор сосредоточен в покоящем-
ся центре меристемы (рис. 7.25). Короткий пептид CLAVATA 3 служит сигна-
лом о количестве делящихся клеток в центральной зоне меристемы: высокая
концентрация «говорит» покоящемуся центру о том, что делящихся клеток
много, а низкая — что их мало. Покоящийся центр посылает обратно сигналь-
ные молекулы, стимулирующие (или ингибирующие) клеточные деления.
Интенсивное взаимодействие короткого пептида CLAVATA 3 с CLAVATA 1
означает, что число делящихся клеток чрезмерно, и из покоящегося центра
направляется сигнал, уменьшающий число делящихся клеток. Концентрация
CLAVATA 3 закономерно уменьшается, после чего покоящийся центр вновь
стимулирует деление клеток в центральной зоне. Механизм обратной связи с
участием CLAVATA 3 и его рецептора CLAVATA 1 поддерживает объем мери-
стемы на определенном уровне. При мутации, как в гене рецептора civ 1, так и
в гене короткого пептида clv3, меристема становится очень крупной (иногда в
1000 раз больше, чем у дикого типа), а стебель плоским (фасциированным).
Короткий пептид SCR (53 — 57 аминокислот) выделяется прорастающим
пыльцевым зерном у капусты. Для каждой линии капусты характерен свой ва-
риант SCR-пептида. Рецепторы к SCR-пептиду находятся в тканях рыльца, и
при узнавании развитие пыльцевой трубки останавливается. Таким способом
капуста избегает самоопыления.
7.3. РЕЦЕПЦИЯ СВЕТОВЫХ СИГНАЛОВ
7.3.1. ПРИНЦИПЫ ФОТОРЕЦЕПЦИИ
Чтобы растение «почувствовало» квант света, необходимы пигмент-белко-
вые комплексы (фоторецепторы), поглощающие в данной части спектра и
преобразующие квант в биохимический сигнал, т. е. должна произойти фото-
химическая реакция. Энергия поглощенного кванта преобразуется двумя путя-
ми (в зависимости от фоторецептора): 1) изменяется конформация белка и
запускается каскад фосфорилирования (рецептор красного света); 2) идут ре-
акции восстановления вторичных мессенджеров (рецептор синего света). Да-
лее активизируется система вторичных мессенджеров, передающих световой
сигнал.
Как в световой фазе фотосинтеза, так и при сигнальной фоторецепции
энергия квантов света преобразуется в энергию химических связей. Но при
этом в фотосистемах хлоропластов конформация белковых комплексов изме-
няется мало, низкая чувствительность к свету и высокий КПД энергопреобра-
зования. В отличие от фотосистем фоторецепторы сильно изменяют конформа-
цию белковых комплексов, очень чувствительны к свету, имеют низкий КПД
энергопреобразования, локализованы в ядре и в цитоплазме (см. подразд. 3.3.1).
477
Рис. 7.26. Фотоконверсия форм фитохрома:
1 — свет с длиной волны 660 нм (пригодный для фотосинтеза) приводит к превращению крас-
ной формы фитохрома в дальнюю красную; это аналогично переключению выключателя в поло-
жение «ON» (слева); 2 — свет с длиной волны 730 нм (не пригодный для фотосинтеза) приводит
к переходу дальней красной формы фитохрома в красную; это аналогично переключению вык-
лючателя в положение «OFF» (справа). Обратите внимание, что промежуточные короткоживу-
щие формы фитохрома для «красного» перехода (Prelumi-R, lumi-R^^, meta-Ra663, meta-Rc725)
отличаются от промежуточных форм для «дальнего красного» перехода (Prelumi-F, lumi-F675,
meta-F66S); 3 — темновой самопроизвольный переход аналогичен выключению красного
света («OFF»)
Физиологически важные области спектра. Поскольку жизнь растений зави-
сит от фотосинтеза, они должны оценивать количество и качество света. Со-
гласно физическим принципам, есть предел энергии кванта для преобразова-
ния в световых реакциях фотосинтеза: фотосистема I поглощает и преобразует
кванты из красной области спектра при X < 700 нм, а фотосистема II — при
X < 680 нм. Если зеленые растения освещать более длинноволновыми квантами
(Х> 700 нм), растение погибнет: энергии этих квантов недостаточно для свето-
вой стадии фотосинтеза (см. подразд. 3.4 и 3.5). Таким образом, красные лучи
можно разбить на две резко отличающиеся области — собственно красную,
пригодную для фотосинтеза (Х< 700 нм)*, и дальнюю красную, для фотосинте-
за не пригодную (Х> 700 нм). Дальний красный свет и темнота должны приво-
дить к похожим ответам — это сигнал, что условий для фотосинтеза нет.
Фитохром и криптохром. Для оценки качества и количества квантов в крас-
ной области у растений есть фоторецептор фитохром, состоящий из фитохро-
мобилина (пигмент, аналогичный фикобилинам) в комплексе с белком.
Фитохром может находиться в двух основных формах: красной Фкр(660) и
дальней красной Фдкр(730) (рис. 7.26). «Красные кванты» (Х = 660) поглощают-
ся красной формой фитохрома, и происходит переход Фкр -> Фдкр. Появление
Фдкр под действием света с Х= 660 нм — сигнал о том, что свет пригоден для
фотосинтеза. Дальняя красная форма фитохрома Фдкр переходит в Фкр (1) при
действии света с Z = 730 нм, и (2) самопроизвольно в темноте (этот переход
* Эту и более коротковолновую область спектра называют фотосинтетически активной ради-
ацией (ФАР).
478
медленнее). Появление Фкр под действием света с Х= 730 нм или в темноте —
сигнал о том, что условий для фотосинтеза нет. Фитохромная система похожа
на переключатель: если есть кванты с/.= 660 нм, то система ожидает сигнала
от Х= 730 нм, и наоборот. В полной темноте чувствительность растений к свету
возрастает: содержание фитохрома увеличивается. Как только растения пере-
носят на свет, концентрация фитохрома уменьшается.
На основании сигналов фитохромной системы растение изменяет страте-
гию роста: готовится к фотосинтезу или все силы расходует на рост; приступа-
ет к цветению или к листопаду; семена прорастают или дожидаются более
благоприятного освещения и т.д.
Максимумы поглощения каротиноидов, флавинов, хлорофиллов и др. пиг-
ментов находятся в синей области спектра, она также физиологически важна.
У растений синий свет воспринимают криптохромы, фототропин. Фоторецеп-
торы синего света работают иначе: происходят окислительно-восстановитель-
ные реакции. Поступающие сигналы «помогают принять локальные решения»:
определить направление максимальной освещенности при фототропизме, от-
крыть устьица и т.д. Рецепторы красного и синего света функционируют взаи-
модействуя друг с другом. У растений есть системы, «чувствующие» ультрафиолет
и активирующие защитные механизмы, но фоторецепция в УФ-части спектра
изучена недостаточно.
7.3.2. ФОТОРЕЦЕПЦИЯ В КРАСНОЙ ОБЛАСТИ СПЕКТРА:
ФИТОХРОМНАЯ СИСТЕМА
7.3.2.1. История открытия фитохрома
В 1952 г. американец Г. А. Бортвик изучал прорастание семян салата, В пол-
ной темноте набухшие семена не прорастали, но прорастали после нескольких
секунд освещения. Семена были настолько чувствительными к свету, что при-
ходилось работать с ними как с фотоматериалами, обертывая образцы свето-
непроницаемой бумагой или фольгой. Был получен спектр физиологической
реакции: график зависимости процента проросших семян от длины волны.
Оказалось, что дальний красный свет (л = 730 нм) тормозит реакцию прорас-
тания. При последовательном освещении красным (660 нм) — дальним крас-
ным (730 нм) — красным (660 нм) семена прорастают, но если последнюю
вспышку света заменить на дальнюю красную (730 нм), то прорастание замед-
лялось. Наблюдается К/ДК — обратимость, т.е. физиологический ответ при
низкой интенсивности освещения можно обратить. В итоге растения дают тот
ответ, который вызывает последняя вспышка света.
Была выдвинута гипотеза, что в семенах есть пигмент-рецептор, который
обладает свойством «переключаться» при действии внешнего стимула: красно-
го или дальнего красного света. Этот фоторецептор был назван фитохромом
(phyton — растение; chromos — краска, пигмент).
Спектр физиологической реакции прорастания семян позволил начать по-
иски и выделение пигментов, обладающих таким же спектром поглощения.
Из растений выделяли очередной пигмент, его спектр сравнивали с физиоло-
гическим спектром. Эта стратегия поиска увенчалась успехом: всего через 7 лет
479
и
К
К
и
а
о
g
о
К
Длина волны, нм
Рис. 7.27. Спектр поглощения фитохрома
ФббО И ®730-
Для сравнения показаны положения макси-
мумов поглощения Р68о и Р70о. ФАР — область
фотосинтетически активной радиации
У. Л. Батлер и С. Б. Хендрикс выделили фитохром в чистом виде и охарактери-
зовали его (рис. 7.27).
Физиологические ответы фитохромной системы были разделены на три груп-
пы: 1) ответ на сверхнизкую интенсивность света (0,1 — 1 мкмоль квантов/м2);
2) ответ на низкую интенсивность (1—1000 мкмоль квантов/м2); 3) высоко-
энергетический ответ (более 1000 мкмоль квантов/м2).
7.3.2.2. Фотоконверсия фитохрома. Фитохромы А и В
Фитохром представляет собой димер белка с ковалентно связанной хромо-
форной группировкой из четырех пиррольных колец (А, В, С и D). Молекула
хромофора синтезируется сначала как замкнутый тетрапиррол (гем), а затем
размыкается и встраивается в белок. Хромофор имеет структуру, близкую к
фикобилинам (см. подразд. 3.3.3).
Как и ожидалось, хромофор фитохрома (фитохромобилин) существует в
двух основных спектральных формах, которые переходят друг в друга. Форма
Ф660 (красная) улавливает «красные кванты» света и переходит в Ф730 (даль-
нюю красную). Это объясняет эффект К/ДК-обратимости: при освещении крас-
ным светом форма Фьео исчезает (форма Ф730 накапливается). Если после этого
осветить растение светом с длиной волны 730 нм, форма Ф73о перейдет в Фбео-
Последовательные вспышки приводят к тому, что сначала весь фитохром пе-
реходит в одну форму, а потом в другую и т.д. Для физиологической реакции
важна именно последняя форма фитохрома, т. е. последняя короткая вспышка,
которой освещали растение.
Главным событием, приводящим к фотоконверсии форм фитохрома, явля-
ется поворот кольца D относительно кольца С (цис-транс-изомеризация в ме-
тановом мостике) (рис. 7.28). Эта реакция приводит к изменению конформа-
ции белкового окружения хромофора и димера в целом. Первичная форма воз-
бужденной хромофорной группировки оказывается недостаточно стабильной
и самопроизвольно через ряд этапов переходит в более стабильные формы,
причем промежуточные формы для перехода из Фбщ в Ф73о отличаются от
промежуточных форм для обратного перехода (см. рис. 7.26).
У арабидопсис известны 5 генов, отвечающих за биосинтез белкового ком-
понента фитохрома. По количеству белка преобладают фитохром А и фито-
480
домен
Рис. 7.28. Структура фитохрома:
А — структура хромофорной группировки и ее изменение при фотоконверсии форм фитохро-
ма (см. также рис. 7.26); Б — функциональные домены белковой части фитохрома
хром В, различающиеся не только белковой частью, но и спектром поглоще-
ния (эффект различного окружения хромофора). Фитохромы С, D и Е — ми-
норные. В белковой части всех фитохромов ближе к N-концу есть консерватив-
ный домен, ковалентно связывающий фитохромобилин. При его повреждении
хромофор не встраивается в фитохром. С-концевые участки отвечают за пере-
дачу сигнала (обычно есть два гистидинкиназных домена).
По сравнению с Ф(В) в спектре поглощения фитохрома А более широкие
пики, у Ф(А)660 максимум поглощения — 660, однако широкое плечо выходит
в дальнюю красную область. Это означает, что Ф(А)ббо переходит в Ф(А)730 не
только при облучении квантами с А. = 660 нм, но и при освещении дальним
красным светом высокой интенсивности. Следовательно, у реакций, вызывае-
мых Ф(А), нет К/ДК-обратимости. Фитохром А отвечает как за ответы на сверх-
16 Физиология растений
481
низкие интенсивности красного света (А = 660 нм), так и за высокоэнергети-
ческий ответ на дальний красный (А= 730 нм). В спектре поглощения фитохрома
В пики более узкие, у формы Ф(В)660 плечо не заходит в дальнюю красную об-
ласть. Фитохром В отвечает за ответы на низкую интенсивность и обеспечивает
К/ДК-обратимость. Наличие фитохромов А и В, отличающихся спектрами
поглощения, «позволяет» растению различать (1) полную темноту, (2) свет,
обогащенный ДК-квантами, и (3) освещение, пригодное для фотосинтеза.
Растения, выращенные в темноте, «стараются» повысить чувствительность
к свету, повышая содержание фитохрома А (именно Ф(А) отвечает за воспри-
ятие света любого качества). При освещении (независимо от того, К или ДК),
концентрация Ф(А) снижается примерно в 100 раз.
Киназная активность фитохромов зависит от состояния хромофора. Форма
Ф730 является активной (она получила красный свет с А = 660), а Ф^ (образу-
ется в темноте или на ДК) не активна как киназа. Фосфорилирование фито-
хромов также меняет их активность. Возможно, фитохромы могут автофосфо-
рилироваться. В число возможных вторичных мессенджеров фитохромного сиг-
нала входят гетеротримерные G-белки, циклическая ГМФ и кальций.
У растений, выращенных в темноте, фитохромы обычно находятся в цито-
золе. Для перемещения фитохромов А и В в ядро нужны разные световые сти-
мулы. Так, в конформации Ф^^о фитохром В не может пересекать ядерную мем-
брану, а после фотоконверсии красным светом аккумулируется в ядре. Ф(А)
переходит в ядро при освещении как ДК высокой интенсивности, так и крас-
ным светом. Интересно, что на С-концевом участке у фитохромов есть два
PAS-домена*, которые встречаются в транскрипционных факторах. PAS-доме-
ны важны для ДНК-белковых и для белок-белковых взаимодействий. Повреж-
дение PAS-доменов нарушает функционирование фитохрома. Это означает,
что, проникая в ядро, фитохром участвует в геномной регуляции, связываясь
в комплексы с факторами транскрипции.
7.3.2.3. Этиоляция и деэтиоляция
У цветковых растений в отсутствие условий для фотосинтеза хлорофилл не
образуется, не происходит сборка светособирающих комплексов, пластиды
имеют агранальную структуру (этиопласты) (см. подразд. 3.2.3). Растения, вы-
росшие в темноте, становятся белыми или желтоватыми, междоузлия удлине-
ны, а листовые пластинки часто превращаются в чешуи. Процесс «обесцвечи-
вания» растений при недостатке света называют этиоляцией. Этиоляция — адек-
ватная реакция на недостаток света: фотосинтетическая функция сведена к
минимуму, рост происходит за счет растяжения (форма роста, требующая
минимум пластических веществ) (рис. 7.29). Растение «экономит» органичес-
кие вещества, «отказавшись» от роста пластинок листьев.
Отсутствие света при прорастании является сигналом, что растение, веро-
ятно, находится под землей, и проросток формирует апикальную петельку,
защищающую меристему от возможных механических воздействий. В отличие
от тройного ответа на этилен, гипокотиль при этиоляции интенсивно растет.
* PAS-домен назван по первым буквам названий генов, в которых он был впервые обнару-
жен: PER, ARNT, SIM.
482
Рис. 7.29. Синдром этиоляиии:
А — этиолированное растение; Б — процесс деэтиоляции, регулируемый светом через фито-
хромную систему; В — деэтиолированное растение; Г — этиоляция возникает при недостатке
света; сигнал поступает через фитохромную систему
В результате усиленного роста растение может оказаться в зоне с благоприят-
ным освещением. Как только оно получит сигнал, что свет пригоден для фото-
синтеза, у листьев появляется развитая пластинка (что контролирует фито-
хром С), рост междоузлий ингибируется, синтезируется хлорофилл и пласти-
ды превращаются в хлоропласты, разгибается апикальная петелька, а рост ги-
покотиля тормозится. Цепь этих процессов называют деэпгиоляцией. Деэтиоля-
ция характеризуется не только синтезом хлорофилла, но и экспрессией генов
белков светособирающего комплекса (хлорофилл а/й-связывающего белка).
Благодаря гидрофобным свойствам хлорофилл а/й-связывающего белка тила-
коиды, содержащие ССК, собираются в граны.
7.3.2.4. Избегание тени
Ситуация, когда растение попадает на свет, обогащенный ДК-лучами, за-
метно отличается от полной темноты. С одной стороны, дальний красный свет
(как и просто красный) вызывает переход фитохрома А в форму Ф(А)730 (это
означает, что растение почувствовало свет). С другой стороны, дальним крас-
ным светом невозможно перевести Ф(В)660 в Ф(В)730. Растение получает два
противоречащих друг другу сигнала: от фитохрома А — о том, что свет есть, а
от фитохрома В — о том, что этот свет не пригоден для фотосинтеза. Ответ
зависит от «интегрирования» этих взаимно противоположных сигналов.
В природе интенсивный свет, обогащенный ДК, бывает под пологом расте-
ний. В нижних ярусах много дальнего красного, так как листья поглощают крас-
ные кванты в процессе фотосинтеза. Много дальнего красного — это сигнал о
том, что рядом есть более высокие соседи. Однако есть надежда, что рядом
обнаружится свободное светлое «окно», не занятое другими растениями.
483
Если растение получило положительный сигнал от фитохрома А и отрица-
тельный от фитохрома В, развивается «синдром избегания тени». Для этого
синдрома характерны черты как этиоляции, так и нормального развития на
свету. Хлорофилл синтезируется, но его содержание меньше. Листовые плас-
тинки формируются, но они не такие крупные, как при полном освещении.
Удлинение междоузлий менее интенсивно, чем в темноте, но все же скорость
роста выше, чем на прямом солнце. В результате образуются длинные побеги со
слабо развитыми механическими тканями. Они легко полегают, при этом ме-
ристема побега оказывается на новом месте. Происходит новая «оценка ситуа-
ции», если по-прежнему в спектре много дальнего красного и мало красного,
снова развивается побег с «синдромом избегания тени».
Полное развитие фотосинтетического аппарата возможно только в том слу-
чае, когда на растение падает много красного света (и он не обогащен дальним
красным). Тогда и от фитохрома А, и от фитохрома В приходят одинаковые
сигналы о том, что свет есть и он пригоден для фотосинтеза.
Образно можно назвать фитохром А «оптимистическим» рецептором, а фи-
тохром В — «критиком», или «пессимистом».
Интересно, что поведение растений в тени заметно отличается у мутантов
по фитохрому А и В. Если в растении поврежден фитохром В, оно развивает
нормальный «синдром избегания тени» и в конечном итоге выживает. Мутан-
ты по фитохрому А при интенсивном дальнем красном освещении сильно
вытягиваются и погибают. Этот пример показывает, что отсутствие «оптимиз-
ма» бывает очень опасным, и даже смертельным при определенных внешних
обстоятельствах. Растению нужно не только «уметь правильно и критически
оценить ситуацию» с освещением (функция Ф(В)), но и «почувствовать поло-
жительные тенденции — понять», что свет все-таки есть и «жить стоит» (фун-
кция Ф(А)). Кроме того, синдром избегания тени регулируется фитохромами
D и Е.
7.3.2.5. Регуляция прорастания семян
Семена примерно 50 % рудералов*, среди которых немало сорняков, про-
растают только после кратковременного освещения. Эти растения в природе
занимают нарушенные места, поэтому зародышу важно определить, свободно
ли место от растений-конкурентов. Если травостой сомкнут (место занято),
семена не прорастают. В агроценозах основной экологический фактор — пере-
копка почвы. При этом семена сорняков могут оказаться как глубоко под зем-
лей, так и близко к поверхности. Семена, находящиеся глубоко в почве, не
получают светового стимула и впадают в состояние покоя, образуя семенной
фонд. Но стоит вынести такое семя на поверхность, как оно прорастает.
В регуляции прорастания заметную роль играет фитохромная система. Для
восприятия светового сигнала необходимо набухание семян (если семя мета-
болически не активно, фитохром не может передать информацию в ядро). Как
это и следует из свойств фитохрома А и В, прорастание можно вызвать не-
большим количеством «красных квантов» (через Ф(В) и минорный Ф(Е)),
* От лат. nidus, ruderis — строительный мусор, развалины. Рудералы — растения, обитающие
на свалках, откосах железных дорог и т. п.
484
тогда можно наблюдать К/ДК-обратимость. Освещение интенсивным ДК-све-
том также приводит к прорастанию (через Ф(А)), причем обратить этот эф-
фект не удается.
На чувствительность семян к свету влияют условия выращивания материн-
ского растения. Если арабидопсис вырастить на ярком свету, семена прорастут
и в полной темноте. В зародыше при развитии на материнском растении фито-
хромная система получает достаточно красных лучей, и фитохромы переходят
в форму Ф73о (сигнал к прорастанию). После периода покоя семя прорастает
без света. Если материнское растение выросло в тени других растений (или при
недостатке света), фитохромы в зародышах остаются в форме Ф^о и «ожида-
ют» красных лучей — свет нужен для прорастания. Свойства фитохромной си-
стемы позволяют предложить приемы, снижающие прорастание сорняков на
полях. Например, можно вспахивать и засевать поле ночью, чтобы свет не
попадал на семена сорняков (большинство культурных растений прорастают
без света). Вспашка поля ночью показала, что засоренность снижается на 30 —
60 % по сравнению с участком, вспаханным днем.
7.3.2.6. Внутренние часы и фитохромная система
В растениях важную роль играют циркадные процессы, связанные со сменой
дня и ночи (от лат. circa — вокруг, dies — день). У растений существуют «внут-
ренние часы», которые отмеряют время. Чтобы обнаружить их, использовали
растение Pharbitis nil (сем. Вьюнковые). Цветение фарбитис зависит от длины
светового дня: если день короче определенного интервала, то растение цветет,
если длиннее — вегетирует. Уникальность физиологических свойств фарбитис
в том, что цветение можно вызвать единственным днем «удачного» освещения.
Проростки фарбитис, растущие в темноте, обрабатывали вспышками красно-
го света. Если вторая вспышка света следовала через короткий промежуток
после первой, то растения переходили к цветению. Как только интервал между
двумя вспышками превышал критическую величину, растение не давало цвет-
ков. Однако если дать вторую вспышку более чем через 24 ч, оно снова цвело
(рис. 7.30).
Вероятно, у фарбитис есть «эндогенные часы», которые «запускаются» пер-
вой вспышкой света. С этого момента растение «отмеряет сутки». «Внутренние
сутки» разбиты на фотофильный (photos — свет) и скотофильный (skotos —
темнота) периоды. Если вторая вспышка приходится на фотофильный пери-
од, фарбитис цветет, а если на скотофильный — вегетирует. Фитохромная
система взаимодействует с внутренними часами растения. Растение «подстраи-
вает» циркадные ритмы по сигналам фитохромной и криптохромной (см. под-
разд. 7.3.3) систем. Эндогенный ритм часов и внешний ритм освещения ин-
тегрируются в единый сигнал, на который растение должно ответить адек-
ватно (в частности, фарбитис запускает программу цветения или вегетатив-
ного развития).
В течение суток условия освещения меняются из-за того, что солнце нахо-
дится под разными углами к горизонту. Когда оно в зените (угол, близкий к
90°), спектр падающих лучей искажается незначительно. Однако при малых
углах (раннее утро или поздний вечер) спектр оказывается обогащенным К- и
ДК-квантами. Утром и Ф(А), и Ф(В) активизируются, растение «просыпает-
485
Рис. 7.30. Опыт (варианты), демонстрирующий наличие часов у Pharbitis nil (вьюнковые):
I, 2 — вторая вспышка приходится на 1 фотофильную фазу, растение цветет (цв.); 3—5 —
вторая вспышка приходится на скотофильную фазу, растение вегетирует (вег.); 6, 7 — вторая
вспышка приходится на 11 фотофильную фазу, растение цветет; 8 — схематическое изображение
внутренних часов (эндогенного циркадного осциллятора); Av — вспышки света; длительность
темного времени показана штриховкой
486
ся». Вечером растения получают большую дозу дальних красных лучей, активи-
зируется только Ф(А), тем самым фитохромная система «говорит» растению о
времени суток. Часто ночью температура воздуха заметно ниже, чем днем,
поэтому, получив фитохромный сигнал и «сверив» его с часами, растение «пред-
принимает превентивные меры» (о механизмах защиты от холода см. в гл. 8).
Если растения вовремя не получат сигнал о наступлении ночи, они не успева-
ют адаптироваться к суточным колебаниям температуры и хуже растут.
Важность фитохромов для циркадной температурной адаптации выяснили
случайно. В целях повышения продуктивности лесных насаждений были полу-
чены трансгенные осины {Populus tremula), в геном которых был встроен ген
фитохрома А под сильным промотором. Это привело к снижению эффекта
«избегания тени» (растениям «казалось», что они постоянно получают ДК-
свет высокой интенсивности). Ученые предложили высаживать осину более
плотно, чтобы получить больше древесины с той же площади. При посадке в
грунт осины с измененной активностью фитохрома А не могут адаптироваться
к суточным колебаниям температуры, страдают от ночных заморозков.
Таким образом, фитохромная система важна для восприятия растениями
чередования дня и ночи. «Сверяя» фитохромные сигналы с «внутренними ча-
сами», растения «определяют» длительность дня и ночи (иногда с точностью
до 10 минут!).
7.3.3. ФОТОРЕЦЕПЦИЯ В СИНЕЙ ОБЛАСТИ СПЕКТРА:
КРИПТОХРОМ И ФОТОТРОПИН
7.3.3.1. История изучения фоторецепции
в синей области спектра
В 1881 г. Ч. Дарвин в опытах с фототропизмом у канареечной травы {Phalaris)
показал, что экран из раствора бихромата калия, не пропускающий синий
свет, полностью снимает эффект фототропизма. В 1883 г. немецкий физиолог
растений Ю. Сакс провел опыты с применением цветных стекол и различных
растворов, чтобы более полно оценить спектральные характеристики света,
вызывающего реакцию фототропизма. В итоге стало понятным, что растение
«чувствует» синий свет (красный не вызывал фототропизма).
В дальнейшем эта часть спектра была сужена до 400 — 500 нм. Было показа-
но, что от синего света зависят и другие физиологические ответы: синтез ка-
ротиноидов, антоцианов, устьичные движения. Вызванный синим светом от-
вет невозможно было обратить квантами света с другой длиной волны. Значит,
у растений есть еще один фоторецептор, отвечающий за восприятие синей
части спектра. Методы, которые применяли для изучения фитохрома, оказа-
лись почти неприемлемыми для нового рецептора, выделить и охарактеризо-
вать его не удавалось вплоть до конца XX в. Гипотетический фоторецептор был
назван криптохромом (от греч. cryptos — скрытый).
Наложение физиологического спектра действия при фототропизме на спек-
тры поглощения пигментов давало расплывчатые результаты: на роль крипто-
хромов претендовали флавины, птерины и производные каротиноидов. Более
того, в синей части спектра есть максимумы поглощения и у фитохромобили-
487
на, и у хлорофиллов. По объективным причинам изучение восприятия синего
света оказалось сложной проблемой.
В 1993 г. проблему криптохрома смогли решить А. Р. Кашмор и М. Ахмад. Они
отобрали среди мутантных растений арабидопсис те, которые давали удлинен-
ный гипокотиль как в темноте, так и на свету. Оказалось, что часть мутантов
не реагирует на синий свет (гипокотиль длинный), а на красном свету гипоко-
тили этих мутантов короткие. Очевидно, что фитохромная система работает
нормально, а мутанты имеют нарушения в криптохромной системе. Удалось
выделить мутации как по биосинтезу хромофора, так и по белковой части
криптохрома, клонировать эти гены и получить их полную последовательность.
7.3.3.2. Криптохром — рецептор синего света, локализованный
в ядре и цитоплазме
У Arabidopsis криптохромная система представлена двумя белковыми комп-
лексами: CRY 1 и CRY 2. У папоротника Adiantum capillus-veneris обнаружено 5
генов, кодирующих различные криптохомы. Судя по последовательности нук-
леотидов, белки криптохромов родственны ДНК-фотолиазам. Эти ферменты
позволяют репарировать сшивки, возникающие в ДНК вследствие облучения
ультрафиолетом. ДНК-фотолиаза несет две хромофорные группы: флавин и
птерин (или деазафлавин). Восстановление ДНК фотолиазами возможно толь-
ко в присутствии света.
Криптохромы обладают консервативным участком с двумя карманами для
хромофорных группировок и дополнительным участком на С-конце. По-види-
мому, именно С-концевой домен приводит к изменениям свойств фотолиазы
и превращению в фоторецептор (рис. 7.31).
Рис. 7.31. Структура криптохрома:
/ — получение кванта синего света птериновым ядром; 2 — передача возбуждения на ядро
флавина; 3 — ответ в форме редокс-реакции; 4 — функциональные домены белковой части
криптохрома
488
Криптохром не может непосредственно восстанавливать ДНК, но первич-
ные акты захвата света у него такие же, как у фотолиазы. Птерин (метенилтет-
рагидрофолат) функционирует как светособирающий хромофор. При попада-
нии «синего кванта» света возбуждение передается в «реакционный центр»
криптохрома — на молекулу ФАД. Наличие двух хромофоров объясняет тот
факт, что физиологический спектр действия криптохрома совпадает как со
спектром флавинов, так и со спектром птеринов. ФАД в составе криптохрома
1 находится в стабильной семихинонной форме (он частично восстановлен и
легко отдает электроны). Семихинон ФАД поглощает не только в синей, но и
в зеленой части спектра. Таким образом, физиологический ответ вызывает не
только синий, но и интенсивный зеленый свет.
Получив квант света, электрон флавинового ядра возбуждается, т. е. перехо-
дит на более высокую орбиталь, и редокс-потенциал резко изменяется. Воз-
бужденный флавин — сильный восстановитель. В настоящий момент существу-
ет три гипотезы работы криптохрома. 1. Происходит самовосстановление моле-
кулы криптохрома с изменением ее конформации, что активизирует вторич-
ные мессенджеры. 2. В систему передачи сигнала вовлечен промежуточный ре-
докс-партнер. 3. Партнеру передается не электрон, а возбуждение квантом си-
него света, и этот квант приводит в действие еще одну хромофорную молекулу.
Если эффективного взаимодействия не состоялось, возбужденное флавиновое
ядро теряет энергию (флуоресцирует).
На свету криптохром 1 (CRY 1) связывается с фитохромом А, и криптох-
ром фосфорилируется. Очевидно, без фосфорного остатка криптохром не ак-
тивен. Фитохром А, получив из окружающей среды сигнал о том, что «свет в
принципе есть», активизирует систему синего света. Криптохром in vitro взаи-
модействует с некоторыми фосфатазами, изменяя их активность. Возможно,
каскад фосфорилирования/дефосфорилирования — один из механизмов пере-
дачи сигнала. Криптохром локализован в ядрах, что неудивительно: он очень
похож на ДНК-фотолиазы, которые, по определению, имеют внутриядерную
локализацию. Предполагают светозависимый транспорт криптохрома через
ядерную мембрану. Вторичные мессенджеры криптохромной системы также
располагаются в ядре и участвуют в регуляции экспрессии генов.
Криптохром 2 пока еще недостаточно изучен. Белковая часть молекулы на
N-концевом участке похожа на криптохром 1 (соответствует доменам, связы-
вающим хромофоры), отличаются только С-концевые участки. Белок CRY 2
связывает ФАД. При мутациях cry 2 повреждаются ответы на синий свет низ-
кой интенсивности, а если нарушена работа криптохрома 1, то растения не
реагируют на высокую интенсивность синего света. Как и в системе фитохро-
мов, у криптохромов есть разделение по функциям: криптохром 1 дает «при-
близительный» сигнал (есть много света в синей и соседней зеленой облас-
тях), а криптохром 2 сигнализирует более точно (низкая интенсивность синего).
Благодаря спектральным свойствам дополнительного пигмента — птерина,
криптохромы поглощают кванты не только синей области, но и из ближнего
ультрафиолета (UV-А), поэтому криптохромы рассматривают как возможные
УФ-фоторецепторы. Одним из механизмов, защищающих организм от жесткого
излучения, является биосинтез антоцианов и каротиноидов. Неудивительно, что
их синтез контролируется криптохромами. От криптохромного сигнала зависит
экспрессия генов халконсинтазы, халконизомеразы, дигидрофлавонолредук-
489
тазы и других ферментов биосинтеза антоцианов. Заметим, что для биосинтеза
антоцианов необходимы как фитохромная, так и криптохромная системы.
Криптохромная система участвует в «настройке» внутренних часов в расте-
нии и получении фотопериодического стимула, однако она не является глав-
ной. Интересно, что у животных (мыши, дрозофилы) также обнаружены крип-
тохромы. У животных криптохромы играют основную роль в фотопериодичес-
кой регуляции сезонных форм поведения. Криптохромный сигнал замедляет
рост гипокотиля (или междоузлий) на свету, помогает фитохрому контроли-
ровать процессы деэтиоляции. Обе фоторецепторные системы, действующие в
ядерном компартменте, — криптохром и фитохром — в заметной мере допол-
няют друг друга. Пути передачи сигнала от этих систем, по-видимому, сходят-
ся и взаимодействуют, что приводит к интеграции информации о физиологи-
чески важных областях спектра — синей и красной.
7.3.3.3. Фототропин — мембранный рецептор синего света
В 1995 г. был изучен первый мутант арабидопсис из серии non phototropic
hypocotyl — nphl. У мутанта нарушен только фототропический ответ (как поло-
жительный, так и отрицательный), но не нарушены другие светозависимые
реакции (деэтиоляция, циркадные ритмы и т.д.). Белок был назван фототро-
пином 1 — PHOT 1, или NPH 1 — по названию мутации.
Фототропин — ассоциированный с мембраной белок, хотя в его аминокис-
лотной последовательности нет протяженных гидрофобных участков. Очевид-
но, он входит в мембранные белковые комплексы. В последовательности фото-
тропина 1 можно выделить два LOV-домена (light—oxygen —voltage) (рис. 7.32).
Они встречаются в рецепторных белках, ответственных за фототропизм, хе-
Рис. 7.32. Структура фототропина:
1 — фотоактиваиия синим светом одного из двух флавиновых ядер; 2 — передача возбуждения в
форме изменения конформации на киназный домен; 3 — фосфорилирование вторичных мес-
сенджеров; 4 — функциональные домены белковой части фототропина
490
мотропизм (по градиенту кислорода или редокс-потенциала) и потенциалза-
висимые мембранные процессы. In vitro фототропин 1 связывает ФМН, при-
чем каждый LOV-домен связывает только одно флавиновое ядро. Очевидно, в
клетке также происходит связывание ФМН. По-видимому, фототропин 1 яв-
ляется протеинкиназой, т. е. участвует в каскаде фосфорилирования. После крат-
ковременного освещения белок PHOT 1 на освещенной стороне фосфорили-
руется больше, чем на теневой. Это ведет к быстрому первичному изгибу.
У Arabidopsis найден и другой белок — фототропин 2 (PHOT 2). Он немного
короче, чем PHOT 1, но при нарушении его работы фототропизм также про-
падает. Предполагают, что в мембране оба фототропина образуют гетероди-
мер, и нарушение работы как PHOT 1, так и PHOT 2 вызывает распад актив-
ного комплекса и нарушение фототропизма.
Мутанты по криптохромной системе (cry] и/или cry 2) обладают первичными
реакциями фототропизма, однако у них снижена амплитуда фототропическо-
го ответа. Того же эффекта можно добиться нарушением гена фитохрома А. Это
означает, что фито- и криптохромная системы нужны на поздних стадиях фото-
тропического ответа, но направление изгиба определяют фототропины 1 и 2.
7.3.3.4. Суперхром — «кентавр с головой фитохрома
и туловищем фототропина»
У папоротника Adiantum capillus-veneris был найден ген, гомологичный как
фитохромам, так и фототропинам. Выделенный in vitro белковый продукт это-
го гена связывает фитохромобилин и показывает К/ДК-обратимость. Наличие
LOV-доменов заставляет предположить, что он связывается также и с ФМН.
«Двойной» фоторецептор был назван суперхромом. Как и фототропин, супер-
хром обладает протеинкиназной активностью.
Таким образом, если у одних растений фототропин взаимодействует с фи-
тохромами опосредованно, то у Adiantum проблема взаимодействия красного и
синего световых сигналов решена на уровне «гибридного» фоторецептора.
7.4. РЕГУЛЯЦИЯ РОСТА И РАЗВИТИЯ РАСТЕНИЙ
7.4.1. ЭНДОГЕННЫЕ ФАКТОРЫ РАЗВИТИЯ
7.4.1.1. Образование листьев
Апикальная меристема побега растет неравномерно. Один из периодических
процессов, который можно наблюдать, — это закладка листовых примордиев.
Промежуток времени от закладки одного примордия до закладки следующего
называют пластохроном. Каждый пластохрон обозначен определенными собы-
тиями. Например, синтез ауксинов в апексе побега осциллирует во времени,
что вызывает волны транспорта ауксинов. При анализе содержания ауксинов
вдоль побегов сосны участки с повышенным и пониженным содержанием аук-
сина чередуются. Место закладки примордия листа определяется вектором транс-
порта ауксина, причем у зон будущих примордиев наблюдается явление до-
491
минирования: на соседних участках закладка примордиев не происходит, лис-
тья максимально удалены друг от друга.
Нарушение транспорта ауксинов химическими агентами (НФК, ТИБК)
или генетическими методами (мутация pin 1 — см. подразд. 7.2.2.3) приводит к
нарушениям как в расположении листьев, так и в закладке проводящей систе-
мы. В одном узле может закладываться несколько слившихся листьев, обеспе-
ченных несколькими главными жилками, или образуется единый кольцевой
примордий. В этом случае осцилляции в биосинтезе ауксинов происходят, а
положение примордиев определяется простой диффузией.
После поступления ауксинов в зоне будущего примордия изменяется эксп-
рессия генов. Главную роль в «разбиении» пространства на примордии и меж-
доузлия играют гены, содержащие гомеобокс (транскрипционные регулято-
ры, часто используемые при эмбриогенезе животных). Первым геном из этой
серии был ген KNOTTED 1 {KN 7) кукурузы, наиболее активный в меристе-
ме, в будущих примордиях он «выключается». Полосы экспрессии гена KN 1
обнаруживаются до того, как начались первые периклинальные деления, обо-
значающие примордий. Аналогичные гены были выделены из арабидопсис
{STM — shootmeristemless) и других растений. Гены с гомеобоксом позволяют
контролировать различия между развивающимся листом и боковой осью. У то-
матов нарушения в работе гомеобокссодержащих генов приводят к тому, что
листья теряют дорсовентральное строение и приобретают черты боковой оси.
Активность промотора гена KN 1 зарегистрирована только во внутренних слоях
(клетках L2), а белковый продукт и мРНК обнаруживаются в слое L1. Клетки
обмениваются по плазмодесмам крупными информационными молекулами
(белками, мРНК). Транспорт этих молекул — еще одна возможность регуляции
роста и развития. Некоторые гены, наоборот, экспрессируются в будущих при-
мордиях листьев, но не в меристеме. Так, ген NFL 1 табака появляется в при-
мордиях листьев до начала морфологической дифференцировки.
Более позднее событие, приводящее к морфологическим эффектам, — био-
синтез белков экспансинов (от англ, expansion — расширение). Экспансины вы-
деляются в апопласт и размягчают клеточную стенку, нарушая водородные
связи в гликанах (при созревании плодов, листопаде, прорастании пыльцы и
т.д.). Размягчение клеточной стенки изменяет механические свойства апекса,
давление слоя L1 ослабевает, и в слое L2 начинаются периклинальные деления,
т.е. изменяется направление веретена деления, образуется новый «вектор рос-
та». Агаровый блок с экспансином можно поместить рядом с заложенным при-
мордием, что вызовет аномально близкое расположение нового листа.
При изменении положения веретена деления меняется и общая поляризация
клеток, элементы цитоскелета располагаются вдоль новых осей. Это приводит
к таким изменениям направления целлюлозных фибрилл, что растяжение и
рост примордия оказываются возможными только в одном направлении. На-
правление фибрилл целлюлозы определяет форму будущего листа.
Далее лист становится дорсовентральным. Этот процесс контролируют гены
FANTASTICA (львиный зев {Antirrhinum majus)) и FILAMENTOUS FLOWER (ара-
бидопсис). На начальных стадиях эти гены экспрессируются во всем объеме
примордия. Вероятно, апикальная меристема посылает «дорсовентральный»
сигнал (природа его еще не выяснена), и в верхней части примордия экспрес-
сия генов FANTASTICA и FILAMENTOUS FLOWER ослабевает. Зона их эксп-
492
рессии определяет будущую нижнюю (абаксиальную) поверхность листа. При
мутациях fantastica и filamentous flower лист становится цилиндрическим и вся
поверхность приобретает свойства адаксиальной.
7.4.1.2. Переход к цветению
Апикальная меристема побега участвует в более сложных ритмах, связанных
с образованием листовых серий, или цветением. Ярче всего ритмические процес-
сы выражены у растений тропического климата. Так, гевея бразильская {Hevea
brasiliensis) за один ритм роста образует листовую серию, состоящую из почечных
чешуй и зеленых листьев. Далее следуют период покоя и закладка новой почки.
За 1 год меристема гевеи образует до 7 листовых серий, причем покой и актив-
ный рост не связаны с внешними условиями! Итак, у растений есть эндогенные
ритмы развития. В примере с гевеей чередуются ритмы вегетативного роста.
Не менее примечательно явление «подсчета» листьев. Так, гиппеаструм
(Hippeastrum X hybridum) закладывает соцветие ровно через 4 вегетативных ли-
ста (закладка листьев у гиппеаструма не зависит от внешних обстоятельств:
примерно 1 лист в месяц). Подснежник-галантус (Galanthus nivalis} «отсчиты-
вает» ровно 3 листа, хотя многие другие растения довольствуются лишь при-
близительной их оценкой. Растению «важно знать», сколько листьев имеется,
чтобы «приступить к цветению».
Были предложены две модели «расчета»: 1) меристема не способна образо-
вать другое количество листьев (детерминирована); 2) меристема получает сиг-
нал от листьев и по нему «оценивает» их число. До образования верхушечной
метелки меристему кукурузы отделяли и укореняли. Оказалось, что меристема
«восстанавливает» необходимое число листьев и только после этого формирует
цветки. Если меристему лишь надрезать, но оставить связь с листьями, то про-
исходит укоренение, однако листья «сверх нормы» не образуются. Таким обра-
зом, меристема у кукурузы компетентна к образованию большего числа листь-
ев, а в «подсчете» опирается на сигналы от листьев.
Мутант id 1 (indeterminate) кукурузы обладает длительным вегетативным
ростом, образует аномальные соцветия с вегетативными чертами. Очевидно,
мутация затрагивает ген системы «подсчета» листьев. Продукт гена ID 1 сосре-
доточен в кончиках листовых примордиев. Предполагают, что сам продукт не
является сигнальным, но важен для «отправки» сигнала в меристему.
Другой механизм «подсчета» у Arabidopsis: переход к цветению зависит от
экспрессии гена LEAFY (LFY). При мутации соцветие несет многочисленные
листья, а цветки обладают вегетативными чертами. (У мутанта львиного зева
по гомологичному гену FLO цветков нет вообще.) В норме экспрессия гена
LFY начинается у молодых растений и постепенно усиливается. При опреде-
ленном уровне экспрессии меристема закладывает соцветие. Белковый продукт
LFY — транскрипционный фактор, содержащий MADS-бокс, его гомологи
найдены у многих растений.
При повреждении системы оценки числа листьев все же наблюдается пере-
ход к цветению. Это означает, что сигнал к цветению — не единственный, он
дублирован другими генами. Для Arabidopsis это ген АР 1 (APETALA 1), «запус-
кающий» программу образования цветков. АР 1 — транскрипционный фактор
того же типа, что и LFY.
493
Итак, меристема получает сигнал, что «накопилось» достаточное количество
листьев, и после этого начинается переход к цветению. Покоящийся центр,
характерный для вегетативных меристем, исчезает, все клетки вступают в кле-
точный цикл. Меристематические клетки вакуолизуются, происходят биохими-
ческие перестройки, которые М.Х.Чайлахян называл «эвокацией цветения» (т.е.
скрытой, самой ранней стадией развития цветков). Изменяется и расположение
примордиев на меристеме. У гиппеаструма и галантуса происходит поворот ли-
стовой серии на 90°, у лилии — переход от филлотаксиса 3/8 к филлотаксису
2/5, а у львиного зева — смена супротивного листорасположения на очередное.
У растений с терминальным цветком должна произойти перестройка листорас-
положения вегетативной оси на мутовчатое (круговое), характерное для цветка.
При эвокации цветения меристема на время «замирает»; образуется зона,
отделяющая соцветие от вегетативной части; снимается апикальное домини-
рование.
7.4.1.3. Образование цветка
На ранних этапах в меристеме цветка происходит экспрессия специфиче-
ских генов. Повреждение этих генов в результате мутации приводит к замене
одних органов цветка на другие и (часто) к нарушению в расположении ор-
ганов. При закладке цветка можно выделить два взаимовлияющих процесса:
1) пространственную разметку флорального примордия на отдельные органы
цветка; 2) определение судьбы заложенных органов (developmental fate). Хотя
эти процессы находятся в тесной корреляции, иногда возникает несогласо-
ванность, и тогда из примордия развиваются органы мозаичного строения (с
тканями, характерными для органов двух соседних кругов).
Наиболее подробно исследованы гены, определяющие судьбу органов в раз-
витии. Условно эти гены делят на три группы: А, В и С. Поэтому существую-
щую модель развития цветка называют АВС-моделъю (рис. 7.33). У Arabidopsis к
генам с функцией А относится АРЕТ ALA 2 {АР 2), продукт которого является
транскрипционным фактором. В зоне экспрессии этого гена развиваются чаше-
листики и лепестки (при мутации лепестки исчезают: apetala — безлепестко-
вый). Функцией В «заведуют» гены APETALA 3 {АР 3) и PISTILLATA {РГ). Их
продукты образуют гетеродимер, связывающийся с промоторами других генов.
У АР 3 и PL обнаружен MADS-бокс. Эти гены экспрессируются в зоне закладки
лепестков и тычинок. При мутациях ар 3 или pi лепестки превращаются в чаше-
листики, а тычинки приобретают черты пестиков. Функция С контролируется
геном AGAMOUS (XG) — транскрипционным фактором с MADS-боксом. Ген
A G определяет судьбу тычинок и плодолистиков, а также отвечает за остановку
роста во флоральном примордии. При мутации ag тычинки заменяются на ле-
пестки, плодолистики — на чашелистики и далее процесс образования цветка
повторяется несколько раз.
По ABC-модели исходным состоянием является вегетативный лист, а гены
из групп А, В и С только модифицируют его развитие. Это подтверждается тем,
что у тройных мутантов, где затронуты все три группы генов, вместо цветка
образуется укороченный побег со спиральным листорасположением. Для обра-
зования чашелистиков достаточно генов группы А. Двойной мутант agpi обра-
зует «бесконечный» цветок из одних чашелистиков. У растений повреждаются
494
Рис. 7.33. ABC-модель развития цветка у Arabidopsis thaliana (крестоцветные):
1 — цветок дикого типа с полным набором органов (чашелистики, лепестки, тычинки, плодо-
листики); 2 — мутант с нарушением функции В (pistillata): вместо лепестков — чашелистики,
вместо тычинок — плодолистики; 3 — мутант с нарушением функции С (agamous): вместо
тычинок — лепестки, вместо плодолистиков — чашелистики. Рост оси цветка не детерминиро-
ван; 4 — мутант с нарушением функции A (apetala 2): вместо чашелистиков — плодолистики,
вместо лепестков — органы, похожие на тычинки; 5 — двойной мутант с нарушением функций
В и С (agamous pistillata): все органы цветка являются чашелистиками, рост оси цветка не детер-
минирован; А — гены, контролирующие развитие чашелистиков или (в сочетании с В) лепест-
ков. Пример: ген APETALA 2; В — гены, контролирующие развитие лепестков (в сочетании с А)
или тычинок (в сочетании с С). Пример: гены PISTILLATA и APETALA 3; С — гены, контроли-
рующие развитие плодолистиков или (в сочетании с В) тычинок. Пример: ген AGAMOUS;
Чшл — чашелистик; Лп — лепесток; Тч — тычинка; Пл — плодолистик. Стрелкой вверх показан
недетерминированный рост
функции В и С, активными остаются только гены группы А. Чтобы в цветке
осуществилась закладка плодолистиков, нужна активность генов только С-класса.
У соответствующих мутантов ар 2pi, где повреждены функции А и В, цветок
состоит из одних плодолистиков. Гены А и С являются антагонистами (взаимно
ингибируют экспрессию друг друга). При повреждении генов группы А во всем
примордии цветка образуются продукты генов С и наоборот. Генов группы В
недостаточно для строгого определения типа органов, они работают в комби-
нации с другими классами. Во флоральном примордии в зоне, где перекрыва-
ется экспрессия А и В, образуются лепестки. Там, где одновременно экспрес-
сируются гены В и С, образуются тычинки.
495
Модель АВС получила подтверждение на большом экспериментальном ма-
териале. Гены, гомологичные АР2, АРЗ, Р1и AG, обнаруживают у все больше-
го числа растений. Анализ экспрессии показывает то же пространственное рас-
пределение продуктов этих генов в примордии цветка, что и у арабидопсис.
Более того, перенос генов из арабидопсис в табак или петунию (Petunia hybrida)
методами генетической инженерии вызывает изменения в строении цветка,
предсказанные ABC-моделью. Таким образом, генетическая регуляция заклад-
ки органов цветка консервативна у цветковых растений.
Меньше известно о разметке флорального примордия на отдельные орга-
ны. С одной стороны, гены ABC-модели заметно влияют на количество и по-
ложение органов в цветке. Мутации с сильным выражением по этим генам
изменяют структуру цветка. Специфических генов, изменяющих только струк-
туру цветка, обнаружено сравнительно немного: у арабидопсиса это ген PENTA-
MEROUS ANTHER (PAN). У мутанта pan цветок пентамерный: 5 чашелистиков,
5 лепестков, 10 тычинок (в норме цветок с типичной для крестоцветных сим-
метрией: 4 чашелистика, 4 лепестка, 6 тычинок и 2 плодолистика).
За образование зигоморфного цветка у львиного зева отвечает ген
CYCLOIDEAKAI)IAUS (CYC}. Ген влияет на верхнюю (ближнюю к главной оси)
тычинку, превращая ее в стаминодий*, модифицирует развитие лепестков. При
мутации по генам A-класса лепестки превращаются в тычинки. Они оказыва-
ются под действием гена CYC, и вместо одного стаминодия возникает три. При
мутации сус цветок радиально-симметричен, все тычинки одинаково хорошо
развиты.
Еще одним фактором разметки является объем флоралъной меристемы. Если
он увеличивается, то в цветке закладываются дополнительные органы. У му-
тантов арабидопсиса из серии clavata (см. подразд. 7.2.8.5) меристема более круп-
ная, что приводит к закладке плода с 4 гнездами вместо типичного двухгнезд-
ного стручка. Аналогичное явление приводит к закладке дополнительных кру-
гов плодолистиков у апельсинов (Citrus sinensis). Мутации, уменьшающие объем
меристемы, приводят к потере органов (обычно тычинок и лепестков).
Развитие растения можно представить как последовательный каскад внут-
ренних регуляторных стимулов. Некоторые регуляторные события происходят
на протяжении всего морфогенеза: неоднородный синтез и транспорт аукси-
нов, «включение» и «выключение» генов, содержащих гомеобокс, выделение
экспансинов, периклинальные деления в L2, определение «верхней» и «ниж-
ней» поверхности примордия.
Другие события в регуляторном каскаде приводят к образованию цветков.
Меристема побега, образующая примордии, «оценивает» число образовавшихся
листьев по концентрации фотоассимилятов, гиббереллинов, других низко-
молекулярных веществ и по экспрессии генов (LFY). По достижении порого-
вого значения наступает эвокация цветения. В меристеме исчезает покоящийся
центр, меняется листорасположение, появляются продукты новых генов. Для
образования цветка необходимы гены с функциями А, В и С и гены, определи-
* От лат. stamen — тычинка, eidos — похожий. Орган тычиночной природы, лишенный пыль-
ника.
496
ющие расположение органов внутри цветка (отвечающие за позиционную ин-
формацию).
Повреждение регуляции ранних этапов отражается на структуре цветка: при
нарушении транспорта ауксинов боковые цветки не развиваются, а верхушеч-
ный состоит из слившихся органов; повреждение «системы определения дор-
совентральной симметрии» (мутация filamentous flower) приводит к превраще-
нию всех органов цветка в цилиндрические структуры; с помощью агарового
блока с экспансином можно создать «лишний» лепесток или тычинку и т.д.
Нарушение поздних этапов в этом каскаде затронет только цветок.
7.4.2. ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ НА РОСТ И РАЗВИТИЕ
7.4.2.1. Пищевые ресурсы экотопа. Регуляция цветения элементами
минерального питания
Прежде чем приступить к цветению, растение «оценивает» доступность
минеральных веществ, в первую очередь азота. Когда азота много, все силы
растения расходуются на вегетативный рост и накопление азотных соедине-
ний, а цветение наступает позже, чем при умеренном питании. Это явление
было замечено достаточно давно. В конце XIX в. возникло предположение, что
для вегетации необходимо высокое содержание азота в растениях, а для цвете-
ния — много сахаров (продуктов фотосинтеза). Экспериментальную проверку
этой гипотезы в 1904 г. провел немецкий физиолог растений Г. Клебс. Часть
растений лобелии (Lobelia), будры (Glechoma) и молодила (Sempervivum) обильно
удобряли нитратами и поливали, другие высаживали в почву, бедную азотом.
Чтобы повлиять на процесс фотосинтеза, листья затеняли или освещали яр-
ким светом. Оказалось, что цветение ускоряется на ярком свету. Это коррели-
рует с высоким содержанием сахаров в растениях и низким содержанием азота.
При затенении или удобрении нитратами накапливается больше азота и мень-
ше углеводов, что коррелирует с быстрым вегетативным ростом и задержкой
цветения.
Г. Клебс выдвинул азотно-углеродную (трофическую) теорию регуляции цве-
тения. Если в растении много соединений азота и мало соединений углерода,
оно будет расти, а если углеводы преобладают над азотом, то растение цветет.
По концентрации азота растение «оценивает работу» корневой системы, а по
сахарам — «работу» листового аппарата. Если листовой аппарат «работает хо-
рошо», то возможно плодоношение, а если работа корня слишком интенсив-
на, то нужно восстановить баланс между активностью корневой системы и
площадью листового аппарата. Растение образует много листьев (вегетирует), а
когда баланс восстановится, образует цветки и плоды.
Теория Клебса нашла отклик в сельском хозяйстве. Были разработаны мето-
ды интенсивного плодоводства, основанные на обрезке. Для ускорения цвете-
ния на молодые ветви деревьев накладывали плодовый пояс; ветку перетягива-
ли проволокой так, чтобы сосуды флоэмы оказались сжатыми, или часть фло-
эмы удаляли. Это замедляло отток сахаров из кроны и ускоряло закладку цвет-
ков. Теория Клебса стимулировала изучение потребностей растений в элемен-
тах минерального питания, был накоплен материал по частной физиологии
497
растений. Выяснилось, что избыток азота препятствует переходу в состояние
покоя, запас крахмала снижается, покой менее глубокий, растение менее ус-
тойчиво к инфекции и к климатическим факторам.
7.4.2.2. Фотопериодизм и климатические факторы
В каждой точке планеты существуют сезонные колебания влажности и тем-
пературы, определяющие климат той или иной местности. Виды растений долж-
ны быть адаптированы к климату.
Многообразие климатов достаточно высоко. На территории России один из
самых важных климатических факторов — зимнее снижение температур. В Сред-
ней и Центральной Азии к этому добавляется летняя засуха. Растения «вынуж-
дены рассчитывать» время развития так, чтобы цветение, образование плодов
и семян приходилось на благоприятный сезон. Наступление неблагоприятных
факторов обычно коррелирует с изменением длины дня. Самые заметные ко-
лебания длительности светлого времени суток наблюдаются в высоких широ-
тах: за полярным кругом бывают полярный день (24 ч света/сут) и полярная
ночь (0 ч света/сут). Чем ближе к тропическим областям, тем'незначительнее
изменение длины суток. И, наконец, на экваторе день всегда равен ночи (12 ч
света/сут), т. е. на экваторе растения не могут оценить изменение длины дня.
В тропических районах длина дня меняется незначительно, и отсюда происхо-
дят растения, наиболее чувствительные к изменениям длины дня. Этим расте-
ниям приходится «оценивать» время с точностью до 1 — 3 %! Растения умерен-
ных широт оценивают длину дня менее точно, но она играет более заметную
регуляторную роль в развитии.
Закономерное изменение длины дня в течение'года называют фотоперио-
дизмом. Физиологический ответ на этот внешний стимул — это фотопериоди-
ческая реакция растений. Так, в умеренных широтах уменьшение длины дня
говорит о надвигающемся похолодании. Растения готовятся к состоянию по-
коя: происходит листопад, питательные вещества перемещаются из надземной
части в подземную, рост останавливается. В Средиземноморье сокращение длины
дня говорит о наступлении зимы — самого влажного сезона года с приемле-
мыми для роста температурами. Растения дают противоположный физиологи-
ческий ответ: усиливают рост. Кроме того, существуют климатические зоны,
где влажный период приходится на осень или весну. Растениям приходится
«оценивать» не общую тенденцию, а точно «измерять» длину дня. Если день
соответствует «внутреннему эталону», то сезон благоприятный, а если дни
длиннее или короче «эталона», условия неблагоприятны и растение готовится
к покою. Бывает и «симметричная» ситуация, когда климат в целом благопри-
ятен, но весной или осенью наблюдается засуха. Тогда измеренная «эталон-
ная» длина дня говорит об условиях, неблагоприятных для роста.
По отношению к длине дня выделяют несколько групп растений.
Нейтральные растения (HP) — длина дня не оказывает заметного влияния,
растения цветут по достижении определенного возраста или размера. Обычно
нейтральные растения происходят из экваториальных областей.
Длиннодневные растения (ДДР) — зацветают только в том случае, если дли-
на дня больше некоторой критической величины. ДДР происходят из умерен-
ных областей с равномерным увлажнением по сезонам.
498
Короткодневные растения (КДР) — зацветают только при длине дня, мень-
шей некоторой критической величины. Они происходят из субтропических и
тропических областей с зимним максимумом увлажнения.
Длиннокороткодневные растения (ДКДР) — для цветения необходима опре-
деленная последовательность: сначала длинные дни, а затем короткие. Эти
растения «настроены» на благоприятный осенний период.
Короткодлиннодневные растения (КДДР) — для цветения необходима смена
коротких дней на длинные (но не наоборот). Благоприятный период у этой
группы «ассоциируется» с весенним сезоном.
Среднедневные растения (СДР) — для цветения необходим определенный
интервал длины дня: ни при увеличенной, ни при уменьшенной длине дня
эти растения не цветут. Это — сравнительно редкий тип регуляции цветения.
Амфифотопериодичные растения (АФПР) — для цветения неблагоприятен
узкий интервал, а при большей или меньшей длине дня цветение наступает.
Этот тип физиологических ответов также достаточно редок.
Под контролем фотопериодизма находятся многие процессы. Так, от длины
дня зависит перестройка работы меристемы: образование цветков, летний по-
кой и формирование почек у деревьев. Земляника {Fragaria vesca) образует
расселителъные побеги (усы) при наступлении длинных дней. Сбрасывание лис-
тьев у репчатого лука и тюльпанов происходит на длинном дне, а у березы и
осины — на коротком. Образование запасающих органов (кочанов у капусты
{Brassica oleracea), клубней у диких видов картофеля {Solanum) и топинамбу-
ра {Helianthus tuberoses)) также зависит от длины дня. Растения пустынь могут
изменять листья С3 типа на С4 и наоборот, а водные растения сменяют подвод-
ные листья на надводные, получая из внешней среды фотопериодический
сигнал.
Фотопериодические ответы бывают не только у растений. У птиц и крупных
млекопитающих с фотопериодизмом связана сезонная миграция. Не менее важна
сезонная половая активность. Фотопериод влияет на пищевое поведение: под
влиянием коротких дней животные умеренных широт начинают искать более
калорийную пищу. Человек также подвержен фотопериодическому воздействию,
которое часто не осознается, а действует на уровне инстинктов. Фотопериодом
регулируются сезонные эмоциональные состояния, изменения пищевых пред-
почтений и связанные с ними летне-зимние колебания веса.
7.4.3. ФОТОПЕРИОДИЗМ
7.4.3.1. История открытия фотопериодизма
В двадцатые годы XX в. американские исследователи У. У. Гарнер и Г. А. Ал-
лард изучали влияние длины светового дня на табак. Объектом их исследова-
ний был табак сорта «Maryland Mammoth». Этот сорт отличался более крупны-
ми размерами и поздним цветением, поэтому для сбора семян приходилось
доращивать растения в теплице. Гарнер и Аллард выяснили, что этот сорт цве-
тет только при коротком дне, экспериментальное укорочение длины дня так-
же вызывало цветение, т.е. табак «Maryland Mammoth» — типичное растение
короткого дня (большинство сортов табака — нейтральные растения). Гарнер и
499
Рис. 7.34. Эффект прерывания ночи:
А — контроль: длиннодневное растение в условиях 8-часового дня/16-часовой ночи вегетирует;
Б — опыт: 16-часовая ночь прервана 5 минутами освещения; длиннодневное растение цветет;
В — контроль: короткодневное растение в условиях 8-часового дня/16-часовой ночи цветет; Г—
опыт: 16-часовая ночь прервана 5 минутами освещения; короткодневное растение вегетирует.
На нижней полосе темное время суток показано штриховкой, периоды освещения — белым
Аллард пробовали прерывать светлое время суток периодом темноты, а ночное
время — вспышками света. Прерывание дня не дало результата, прерывание
ночи задерживало цветение, и чем ближе к середине ночи проводили освеще-
500
ние, тем эффективнее была обработка. Для предотвращения цветения доста-
точно нескольких минут ночного освещения (рис. 7.34).
Изученный феномен получил название эффекта прерывания ночи. Был сде-
лан вывод, что для оценки длительности дня важно не светлое (дневное) вре-
мя, а продолжительность ночи. Условно каждое короткодневное растение можно
было назвать «растением длинной ночи», а каждое длиннодневное — «расте-
нием короткой ночи». (Впрочем, такой вывод оказался преждевременным.)
7.4.3.2. Опыты М.Х.Чайлахяна
В 1935 г. в Институте физиологии растений АН СССР начались исследова-
ния М.Х.Чайлахяна. Для большинства экспериментов он использовал про-
стейшее оборудование: темную плотную ткань и скальпель. Для решения воп-
роса об органе, воспринимающем длину дня, были взяты хризантемы (КДР).
В летнее время, чтобы вызвать цветение, достаточно было в течение 10—15
дней в строго определенное время накрывать и открывать растения черной
тканью. Если ткань снимали на 10 ч и менее, хризантемы цвели (положитель-
ный контроль). Если растения оставались на естественном 16-часовом дне, то
они вегетировали (отрицательный контроль).
На свету оказывались листья и апикальные меристемы побегов, поэтому
нужно было выяснить, какой из этих двух органов воспринимает световой
сигнал. Чайлахян оставил на каждом растении по одному крупному листу и по
одной точке роста. Чтобы избежать влияния листьев, образуемых меристемой,
каждые 2 дня молодые листья удаляли (рис. 7.35). Накрывая черным футляром
Рис. 7.35. Опыт М.Х.Чайлахяна с короткодневным растением Chrysanthemum indicum
(Сложноцветные), показывающий роль листьев в восприятии длины дня:
А — хризантема в условиях 16-часового дня вегетирует (отрицательный контроль); Б — хризан-
тема при 8-часовом дне цветет (положительный контроль); В — меристема получает 8 часов
света, лист — 16 часов света ежедневно: хризантема вегетирует; Г — меристема получает 16
часов света, лист — 8 часов света ежедневно: хризантема цветет
501
меристему, Чайлахян добивался того, чтобы листья оказывались на длинном
дне (16 ч), а меристема получала короткий день. В другом варианте футляром
закрывали лист: меристема оставалась на длинном дне, а лист освещался 8 ч.
В результате меристемы образовали соцветия только там, где для листьев со-
здавался короткий день. Ученый сделал вывод, что длина дня воспринимается
листьями, далее преобразуется в сигнал и передается в меристему побега, где
вызывает переход к состоянию цветения. Опыты с другими группами растений
(ДДР, ДКДР, КДДР) подтвердили этот вывод.
Один из самых изящных экспериментов был проведен с периллой (Perilla
nankensis) (очень живучее КДР из сем. губоцветные (Labiatae)). М.Х. Чайлахян
вырастил периллу на длинном дне (неиндуктивные условия), затем отрезал
листья и поместил их во влажной камере на короткий день (индуктивные ус-
ловия), а затем привил эти листья на нецветущие растения. Несмотря на низ-
кий процент приживаемости листьев, в удачных вариантах листья стимулиро-
вали цветение периллы! Это означало, что даже отрезанные от растения лис-
тья могут воспринимать длину дня, вырабатывать и накапливать сигнальные
вещества, вызывающие цветение. Оставляя почки в нижней части растения, а
листья в верхней, М.Х.Чайлахян выяснил, что сигнал может распространять-
ся сверху вниз, т.е. нельзя говорить о полярном распространении флорального
стимула. Более того, периллу удалось аккуратно разрезать почти до кончика
корня. Листья одной половины растения, получавшие день нужной длины,
передавали сигнал цветения к почкам в другой половине. Этим опытом было
доказано, что сигнал передается не только по стеблям, но и через корневую
систему. Была измерена скорость распространения сигнала, и выяснилось, что
она зависела от температуры: при 5 °C скорость сигнала падала.
Опыты с надламыванием ксилемных пучков и удалением наружного слоя
флоэмы со стебля показали, что сигнал от листьев к меристеме передается по
флоэме, т.е. по живым клеткам.
Чтобы растение восприняло длину дня как стимул к цветению, оно должно
достигнуть определенного возраста. М.Х.Чайлахян называл этот возраст цве-
точно-спелым состоянием, т.е. внутренние факторы развития должны привести
растение к определенному состоянию. После получения сигнала меристема не
сразу образует видимые органы цветка. Этому предшествует период «скрытой
подготовки» к цветению (эвокация по Чайлахяну).
7.4.3.3. Гормональная теория цветения Чайлахяна
Гипотетический стимул, вызывающий цветение, М.Х.Чайлахян назвал фло-
ригеном (Jlore — цветки, genesis — рождение). По теории М.Х.Чайлахяна, у
нейтральных растений флориген образуется постоянно и не зависит от длины
дня, у ДДР флориген образуется на длинном, у КДР — на коротком дне.
В конце 1950-х гг. А.Ланг (бывший аспирант М.Х.Чайлахяна, который уехал
в США) прислал в Москву только что открытые гормоны — гиббереллины.
Чайлахян исследовал влияние гиббереллинов на цветение. Оказалось, что у
рудбекии, укропа (Anethum graveolens), салата-латука (JLactuca sativa) и других
ДДР гиббереллин ускоряет образование цветков даже на коротком дне. К гиб-
береллину оказались отзывчивыми и КДДР (каланхоэ и др.). Таким образом,
гиббереллин мог заменить длинный день для ДДР. Измерение уровня гиббе-
502
реллинов в листьях показало, что на длинном дне содержание гиббереллина
выше, чем на коротком. М.Х.Чайлахян сделал вывод, что для цветения необ-
ходим гиббереллин. Однако обработка гиббереллинами КДР в условиях длин-
ного дня не вызывала цветения: растения сильно вытягивались, но продолжа-
ли вегетировать.
На основании полученных результатов М.Х.Чайлахян разработал гормональ-
ную теорию цветения растения. Флориген (стимул, вызывающий образование
цветков) он «разбил» на два компонента: гиббереллины и гипотетические анте-
зины. Для цветения необходимо одновременное присутствие обоих компонен-
тов (рис. 7.36). У HP и гиббереллин, и антезин синтезируются конститутивно.
У ДДР антезин все время присутствует в растении, а уровень гиббереллина
повышается на длинном дне и происходит цветение. У КДР, наоборот, гиббе-
реллина всегда достаточно для цветения, а антезин синтезируется только на
коротком дне. Более сложное объяснение было предложено для переходных
групп растений: у них гиббереллин синтезируется на длинном дне, а антезин —
на коротком. Различия между группами состоят в способности длительно депо-
нировать гиббереллины и антезины. ДКДР образуют гиббереллины на длинном
дне и могут их долго хранить. Антезины у них синтезируются на коротком дне,
и быстро разрушаются. КДДР, в отличие от ДКДР, запасают антезины, но
быстро разрушают гиббереллины.
Предложенная М.Х.Чайлахяном гормональная теория цветения не охваты-
вает амфифотопериодичные и среднедневные растения (см. подразд. 7.4.2.2).
Усилия ученых по выделению антезинов до сих пор не увенчались успехом. В пос-
ледние годы, тем не менее, интерес к гормональной теории цветения Чайла-
хяна возрос в связи с открытием процессов транспорта высокомолекулярных
веществ в растениях (мРНК, белков, включая транскрипционные факторы,
факторы сайленсинга и т.д.). Возможно, попытки найти антезин не привели к
успеху потому, что поиск был направлен на низкомолекулярное вещество.
Отметим, что гиббереллины не играют универсальной роли стимуляторов
цветения, какая отводится им в гормональной теории Чайлахяна. Так, при
цветении ДДР сурепки (Raphanus) решающим является накопление ауксинов
на длинном дне. Многие озимые и двулетние ДДР (пшеница, колокольчик
средний) нельзя заставить цвести с помощью гиббереллинов. Отсюда следует,
что вопрос о числе компонентов флорального стимула и о том, насколько эти
компоненты похожи у разных растений, остается открытым.
«Эффект прерывания ночи» позволил Г. А. Бортвику, С. Б. Хендриксу и
М. У. Паркеру (см. подразд. 7.3.2.1) получить физиологический спектр действия
света. Для этого была построена установка, в которой яркий белый свет разла-
гался с помощью призмы, а спектр был спроецирован на полосу 14 м длиной!
Вдоль линии спектра были выставлены вазоны с короткодневным табаком. Длин-
ную ночь прерывали световой вспышкой через призму. Оказалось, что зависи-
мость процента растений, у которых цветение стимулируется соответственно
длине волны X, совпадает с физиологическим спектром прорастания семян
салата-латука. Последовательное освещение красным и дальним красным све-
том показало типичную К/ДК-обратимость (см. подразд. 7.3.2.1). При прерыва-
нии ночи важна последняя вспышка: если она была «красной», ночь «преры-
вается», если «дальней красной», то эффект отсутствует. Из этих данных следу-
ет, что эффект прерывания ночи обусловлен фитохромом.
503
A — const
Антезин
Гиббереллин
Флориген
var — синтез зависит от фотопериода
const — синтез конститутивный
504
Рис. 7.36. Гормональная теория цветения М.Х.Чайлахяна.
По Чайлахяну, цветение наступает, когда в растении присутствует гормональный комплекс
цветения флориген, состоящий из гиббереллина (G — показано штриховкой) и гипотетическо-
го антезина (А — показано серым цветом). А — нейтральное растение: конститутивный синтез
гиббереллинов и антезинов, цветение при произвольной длине дня; Б — длиннодневное расте-
ние; конститутивный синтез антезина, гиббереллин синтезируется на длинном дне; флориген
возникает на коротком дне; В — короткодневное растение: конститутивный синтез гибберелли-
на, антезин синтезируется на коротком дне; флориген возникает на коротком дне; Г — длинно-
короткодневное растение: антезин синтезируется на коротком дне, но быстро разрушается; гиб-
береллин синтезируется на длинном дне и депонируется; цветение при смене длинных дней на
короткие; Д — короткодлиннодневное растение: антезин синтезируется на коротком дне и депо-
нируется; гиббереллин синтезируется на длинном дне и разрушается; цветение при смене ко-
ротких дней на длинные
Вывод о том, что длительность светлого времени суток не имеет значения
для цветения, оказался преждевременным. Если поместить КДР в условия
длинного дня и длинной ночи (при этом суммарная длина суток заметно боль-
ше 24 ч), растения не цветут. Это означает, что длинной ночи недостаточно
для цветения.
В опытах с фарбитис (см. подразд. 7.3.2.6) показано, что у растений суще-
ствуют внутренние часы — осциллятор с 24-часовой периодичностью — позво-
ляющие «различать» две фазы: фотофильную и скотофильную. Длина дня оце-
нивается при сравнении фазы осциллятора и сигналов от фоторецепторов. При
прерывании ночи сигнал фитохрома попадает на скотофильную фазу осцил-
лятора, растению «кажется», что оно находится в условиях длинного дня. При
увеличении суток (более 24 ч) внутренний и внешний ритм не совпадают,
растения не цветут.
7.4.4. ТЕРМОПЕРИОДИЗМ. СТРЕСС-ПЕРИОДИЗМ
7.4.4.1. Сезонная специализация растений
В мягком субтропическом климате зима не бывает холодной, и осень плав-
но переходит в весну. Растения вегетируют с осенних дождей до летней засухи.
Из-за генетической неоднородности среди одного вида попадаются растения,
начинающие вегетацию позже или раньше.
По мере продвижения растений в более высокие широты в середине влаж-
ного периода появляется сезон низких температур. Начинается специализация:
одни растения прорастают весной (после холодов) и цветут в том же теплом
сезоне (т.е. сроки вегетации сокращаются), другие растения прорастают осе-
нью и приспосабливаются к вынужденному покою в течение зимы. У них сро-
ки вегетации более растянуты, влажное время года используется более полно.
Но за это приходится «платить» новой адаптацией: пока не окончились холо-
да, цветение не наступает.
В мягком умеренном климате специализация не заходит глубоко, расы рас-
тений, взятые из этих мест, физиологически пластичны. В начале XX в. их на-
зывали «двуручками». Они могут цвести и в теплые, и в холодные зимы. В более
суровом умеренном климате механизмы адаптации более устойчивы. Выделяют
505
две расы: озимую (вегетация начинается осенью, а для цветения нужно охлаж-
дение) и яровую (растения не нуждаются в холоде для цветения). У злаков
морфологические различия между озимыми и яровыми расами невелики. Сре-
ди рас капусты имеется большое разнообразие форм: кочанная, брюссель-
ская, кольраби — это «озимые» капусты (для цветения нужен холод), а цвет-
ная капуста и брокколи — это «яровые» капусты. В последние годы получены
озимые формы цветной капусты и брокколи, образующие съедобные соцветия
только после периода зимнего охлаждения (растут в мягком умеренном кли-
мате). В более сухих континентальных районах, где за летней засухой следует
длительная зима, озимые формы не могут существовать, и остаются только
яровые (более приспособленные). На территории Якутии или в горном Памире
растут только скороспелые яровые сорта хлебных злаков.
Параллельные изменения происходят по мере географического распростра-
нения родов растений из Средиземноморья в более суровые районы. Среди-
земноморские виды крокусов, галантусов, безвременников цветут и вегетиру-
ют с осени до весны. На Кавказе, т. е. в зоне с более суровым климатом, часть
видов осваивают нишу осеннего цветения (вегетация и созревание семян при-
ходятся на следующую весну), а другие сдвигают ритм развития на весеннее
время. В Средней Азии с сухой осенью осеннецветущие виды не выживают,
распространяться могут только весеннецветущие виды. Интересно, что безвре-
менники (Colchicum), цветущие осенью (родина — Кавказ), при пересадке на
Кольский полуостров «сдвигают» цветение на весну: листья и цветки развива-
ются одновременно, что говорит о физиологической пластичности ритмов
цветения. Чем больше селективное давление климата, тем жестче физиологи-
ческие механизмы, позволяющие выжить в этих обстоятельствах.
7.4.4.2. Термопериодизм: стратификация
и яровизация
У многих растений есть механизмы, позволяющие оценить, миновала ли
угроза длительного понижения температур. Температурные явления законо-
мерно меняются в течение года и называются термопериодизмом. Для весеннего
прорастания семена растений умеренной зоны нуждаются в воздействии низ-
ких температур {стратификация). Температурный диапазон стратификации от
0° до 10 °C, причем интервал от 2 до 5 °C оказывается наиболее эффективным.
Для восприятия температурного стимула семена должны получать достаточно
влаги, иначе их чувствительность к стратификации резко падает. Аналогичное
явление было отмечено для образования цветков у двулетних растений (без
понижения температур они не цветут). Стимуляцию цветения низкими поло-
жительными температурами называют вернализацией, или яровизацией. Ярови-
зация была открыта в 1918 г. Г.Гасснером.
Растяжение междоузлий у подснежников, нарциссов (Narcissus), тюльпа-
нов приводит к появлению над почвой цветоносов. Растяжение, как и рост
листьев, можно вызвать низкими положительными температурами. Таким об-
разом, прерывание покоя клубней и луковиц некоторых растений контроли-
руется термопериодизмом. Это явление было изучено голландскими исследо-
вателями под руководством проф. А. X. Блау в 1930-х гг. и положило начало
промышленной выгонке луковичных растений в зимнее время.
506
Естественная вернализация происходит в конце зимы — начале весны. Дли-
тельность низкотемпературной обработки зависит от привычных (естествен-
ных) для растения экологических условий. При продолжительной суровой зиме
растения нуждаются в обработке в течение 1 — 2 месяцев (например, озимые
сорта пшеницы, районированные в Нечерноземье). Если период низких поло-
жительных температур короткий (оттепель среди зимы), активизации роста не
происходит. В зонах с мягкой короткой зимой для вернализации достаточно
1—2 недель (например, ирис голландский (fris hollandica), альстремерия
(Alstroemeria) и др.).
К яровизации растения чувствительны в разном возрасте: у пшеницы пони-
женную температуру воспринимает уже зародыш в зерне, а у двухлетних рас-
тений должна развиться крупная розетка листьев или корнеплод (до этого яро-
визация не эффективна). Двухлетники — крайнее выражение озимой стратегии
роста: вегетация начинается в начале лета, к осени накапливается запас пита-
тельных веществ, а для цветения нужна вернализация. Обычно необходимость
в вернализации коррелирует с фотопериодической реакцией: в вернализации
нуждаются ДДР и КДДР (см. подразд. 7.4.2.2), что совпадает со световым режи-
мом весны и начала лета умеренных широт.
7.4.4.3. Опыты М.Х.Чайлахяна
Чтобы выяснить, какие органы чувствительны к пониженным температу-
рам, М.Х.Чайлахян использовал тот же подход, что и при изучении фотопе-
риодизма. У корнеплодов свеклы {Beta vulgaris) перед холодовой обработкой
срезали листья, у контрольной группы оставили. Даже без листьев растения
восприняли температурный стимул (это естественно, так как в районах с су-
ровой зимой листья обычно отмирают). Далее Чайлахян яровизировал одну
Рис. 7.37. Опыт с прививкой яровизированных почек, показывающий роль меристе-
мы побега в восприятии холодового стимула:
А — охлаждение корня с почкой (яровизация); Б — неохлажденное растение; В — прививка
почки с охлажденного растения на неохлажденный корень, и наоборот; Г — побег, выросший из
неохлажденной почки, вегетирует; Д — побег, выросший из охлажденной почки, цветет
507
группу растений, а другую содержал при высоких температурах. Затем он при-
вил почки от яровизированных растений на неяровизированные корни, и на-
оборот. Зацвели только растения с яровизированными почками (рис. 7.37).
М.Х.Чайлахян сделал вывод, что чувствительным органом является меристе-
ма побега.
Обработка гиббереллинами при высоких температурах у моркови, рудбе-
кии, золотарника {Solidago) вызвала цветение, а свекла, колокольчик сред-
ний и пшеница не образовали цветков (но междоузлия были вытянутыми, что
говорит об активности выбранных доз ГК). Вероятно, под действием низких
температур происходит сдвиг гормонального баланса, который приводит к
цветению. Часто одной температурной обработки недостаточно, и растения
нуждаются в последующем фотопериодическом стимуле.
7.4.4.4. Стресс-периодизм
Если самым важным климатическим фактором является засуха, то расте-
ния выходят из состояния покоя только после того, как «убедятся», что опас-
ность водного дефицита миновала. Для стимуляции роста им необходима опре-
деленная «порция засухи». Некоторые пустынные растения «связывают» ее с
термопериодизмом. У многих кактусов (сем. Cactaceae) и литопсов (сем. Aizoaceae)
период сухого низкотемпературного покоя стимулирует цветение. Воздействие
засухи в комбинации с высокой температурой оказывается важным фактором
для закладки цветков у тюльпанов и гиацинтов {Hyacinthus orientalis).
У многих амариллисовых (сем. Amaryllidaceae) температура не оказывает за-
метного влияния на удлинение цветоноса. Этим растениям для цветения ну-
жен водный дефицит, причем длительность стимула зависит от продолжитель-
ности засухи в природе. Эухарису {Eucharis amazonica), растущему в увлажнен-
ных местах тропической Америки, достаточно 1 месяца, а гиппеаструму
{Hippeastrum), происходящему из полупустынь, нужно от 2 до 6 месяцев засухи.
Без засухи заложенный в луковице цветонос не удлиняется и через некоторое
время погибает. Явление стресс-периодизма хорошо известно в садовой прак-
тике, однако физиологические механизмы изучены слабо.
Поскольку растение ведет прикрепленный образ жизни, важной стратегией
существования является опережающая физиологическая реакция на климатичес-
кие стрессы. Например, листопад должен совершиться до того, как снег со-
здаст реальную механическую угрозу для растения. Листья С3-растений долж-
ны смениться на С4 до наступления засухи. Клубни и луковицы эфемероидов в
дубравах должны перейти в состояние покоя до того, как освещенность под
пологом леса упадет ниже критического уровня. Растение «вынуждено рассчи-
тывать» сроки цветения так, чтобы плоды успели созреть во время благоприят-
ного периода и т.д.
Чтобы осуществить превентивную реакцию, растение «оценивает» инфор-
мацию из внешней среды. Наиболее значимы для растения спектральный со-
став и интенсивность света, колебания температуры и увлажненности, меха-
ническое давление, направление вектора силы тяжести, доступность элемен-
тов минерального питания и др. Каждый из факторов воспринимается с помо-
508
шью рецепторов, превращаясь в сигнал. Далее сигнал трансформируется и пе-
редается в виде «возмущения» гормональной системы, системы вторичных
мессенджеров, активности генома, изменений метаболизма, поведения ци-
тоскелета и т. п.
Разные группы клеток также служат сигналами внутри растения. Для того
чтобы рост был пропорциональным, развитие шло через определенные ста-
дии и удовлетворялись первоочередные потребности каждого органа, растение
также использует различные соединения в качестве сигналов. Разнородные
сигналы интегрируются в растении так, чтобы его ответ стал максимально
адекватным в создавшихся обстоятельствах. «Оценить» все «за» и «против» на
биохимическом уровне позволяет взаимосвязь потоков информации, «пере-
крестный разговор» сигнальных систем. В одних случаях сигналы от разных си-
стем подтверждают друг друга (например, длина дня и понижение темпера-
тур), и тогда стимулы действуют как синергисты, усиливая друг друга. Если
растение оказывается в противоречивой, непривычной ситуации, между сиг-
налами возникает антагонизм.
ГЛАВА 8
РАСТЕНИЯ В УСЛОВИЯХ СТРЕССА
Растения часто подвергаются действию стрессоров — неблагоприятных фак-
торов окружающей среды. Состояние, в котором находится растение под дей-
ствием того или иного стрессора, называется стрессом. Стрессоры бывают био-
тического и абиотического происхождения. К биотическим стрессорам отно-
сятся патогены — болезнетворные грибы, бактерии и вирусы, а также расти-
тельноядные насекомые. Стрессоры абиотической природы — это недостаток
влаги (засуха), экстремальные температуры (высокие и низкие), высокое со-
держание в почве ионов (почвенное засоление), гипоксия (недостаток кисло-
рода), очень высокая или очень низкая освещенность, ультрафиолетовая ра-
диация, повышенное содержание токсичных газов (SO2, NO2, О3) в атмосфе-
ре и ряд других. В этой главе рассматриваются механизмы устойчивости расте-
ний к действию некоторых, наиболее распространенных стрессоров абиоти-
ческой природы. Под устойчивостью понимают способность растений сохра-
нять постоянство внутренней среды (поддерживать гомеостаз) и осуществлять
жизненный цикл в условиях действия стрессоров.
8.1. СТРАТЕГИИ ПРИСПОСОБЛЕНИЯ РАСТЕНИЙ
К ДЕЙСТВИЮ СТРЕССОРОВ
Наиболее общим проявлением действия стрессоров является подавление
роста и развития растений, а на уровне фитоценозов — снижение продуктив-
ности. Стрессоры приводят к уменьшению скорости роста до уровня более
низкого, чем уровень, обусловленный генетическим потенциалом растения.
Силу вредного действия различных стрессоров можно оценить, если сравнить
рекордные урожаи сельскохозяйственных культур со средними урожаями, рас-
считанными за много лет. Если рекордный урожай принять как продуктив-
ность культуры в идеальных условиях (100 %), то потери от стрессоров в мире
составят от 65 до 87 % в зависимости от культуры. Случается, что несколько
стрессоров действуют в комбинации друг с другом, и тогда их вредное дей-
ствие усиливается. Например, действие засухи часто сочетается с действием
высоких температур.
Явления, которые наблюдаются в растениях при действии стрессоров, мо-
гут быть разделены на две категории: 1) повреждения, проявляющиеся на раз-
личных уровнях структурной и функциональной организации растения, на-
пример денатурация белковых молекул, нарушения метаболизма и торможе-
ние роста растяжением при обезвоживании клеток в условиях засухи или поч-
венного засоления; 2) ответные реакции, позволяющие растениям приспосабли-
510
ватъся к новым стрессовым условиям', они затрагивают изменения в экспрессии
генов, метаболизме, физиологических функциях и гомеостазе. Совокупность
такого рода реакций называется акклимацией. В процессе акклимации растение
приобретает устойчивость к действию стрессора. Акклимация происходит при
жизни организма и не наследуется. Вместе с тем она осуществляется на основе
тех возможностей, которые заложены в генотипе, т. е. в пределах нормы реак-
ции — наследственно обусловленной амплитуды возможных изменений в реа-
лизации генотипа. Примером акклимации растений является закаливание. Не-
которые растения, в частности озимые злаки, приобретают способность пере-
живать низкие отрицательные температуры в зимний период, так как осенью
подвергаются закаливанию — действию низких положительных и близких к
О °C отрицательных температур. Биохимические изменения в тканях, происхо-
дящие осенью, придают озимым злакам способность переживать морозы. Если
же осень была теплой, то озимые злаки зимой вымерзают.
Важную роль в устойчивости растений к действию стрессоров играют адап-
тации. В отличие от акклимации адаптация — наследственно закрепленный
конститутивный признак, присутствующий в растении независимо от того,
находится оно или нет в стрессовых условиях. Адаптации делают популяцию
организмов приспособленной к соответствующим условиям окружающей сре-
ды. Пример адаптации растений к засухе — морфологические особенности сук-
кулентов, в частности кактусов. Мясистый стебель, листья, превращенные в
иголки, незначительное число устьиц, глубоко погруженных в ткань, толстая
кутикула и ряд других признаков позволяют кактусам осуществлять жизнен-
ный цикл в режиме экономии влаги и таким образом выживать в условиях
засушливого климата. Адаптации проявляются также на биохимическом уров-
не — это, например, биосинтез стеройдных псевдоалкалойдов (гликоалкалой-
дов) у некоторых видов пасленовых, в частности у картофеля (Solanum tubero-
sum), токсичныхдая травоядных животных и насекомых-фитофагов. Биосинтез
гликоалкалойдов — конститутивный признак этих растений, сформировавшийся
в процессе эволюции как защита от поедания.
Защитные механизмы как конститутивные (адаптации), так и формирую-
щиеся в ходе акклимации, могут быть разделены на две основные категории.
1. Механизмы избежания. Они дают возможность растениям избегать дей-
ствия стрессоров. Ярким примером таких механизмов служит поглощение воды
глубоко проникающей в грунт корневой системой растений. У некоторых ксе-
рофитов (растений засушливых мест обитания), например у черного саксаула
(Haloxylon ammodendrori), длина корневой системы достигает нескольких де-
сятков метров, что позволяет растению использовать грунтовую воду и не ис-
пытывать недостатка влаги в условиях почвенной и атмосферной засухи. К этой
же категории относятся механизмы ионного гомеостатирования цитоплазмы у
растений, устойчивых к почвенному засолению. Способность поддерживать
низкие концентрации Na+ и СГ в цитоплазме при почвенном засолении дает
возможность этим растениям избегать токсического действия ионов на цито-
плазматические биополимеры.
2. Механизмы резистентности (выносливости). Посредством этих механиз-
мов растения, не избегая действия стрессора, переживают стрессовые условия.
К таким механизмам относится, в частности, биосинтез нескольких изофер-
ментов, осуществляющих катализ одной и той же реакции, при этом каждая
511
изоформа обладает необходимыми каталитическими свойствами в относитель-
но узком диапазоне некоторого параметра окружающей среды, например тем-
пературы. Весь набор изоферментов в целом позволяет растению осуществлять
реакцию в значительно более широком температурном диапазоне, чем это
делал бы только один изофермент, и, следовательно, приспосабливаться к
изменяющимся температурным условиям (см. подразд. 8.4.1.1).
Изменения в метаболизме, физиологических функциях и ростовых процес-
сах при стрессах связаны с изменениями в экспрессии генов. Ответ на действие
стрессора происходит, если растение «распознает» стрессор на клеточном уровне.
Распознавание стрессора, т.е. рецепция сигнала, приводит к активации пути
передачи сигнала. Последний поступает в геном, индуцируя или подавляя син-
тез тех или иных белков. Связанные с экспрессией генов ответные реакции
клеток на действие стрессора интегрируются в ответ целого растения, выража-
ющийся в наиболее общем случае в ингибировании роста и развития растения
и одновременно в повышении его устойчивости к действию стрессора.
Подавляющая часть клеточных механизмов устойчивости сформировалась
на ранних этапах эволюции, поэтому защитные системы, проявляющиеся на
клеточном уровне у высших растений, и защитные системы более примитив-
ных организмов имеют общую основу. В связи с этим исследование механизмов
устойчивости к действию стрессоров у бактерий, дрожжей и одноклеточных
водорослей проливает свет и на клеточные механизмы устойчивости у высших
растений. Значительная часть знаний о рецепции сигнала и путях его передачи,
так же как и о клеточных механизмах устойчивости в целом, исследователи
получили, опираясь на базовые работы, выполненные на бактериях Esherichia
coli и дрожжах Saccharomyces cerevisiae. Механизмы рецепции и пути передачи
сигнала непосредственно у растений начинают изучаться только сейчас. Пока-
зано, что в регуляцию ответа растения на стрессорные воздействия вовлечены
гормоны, особенно абсцизовая кислота (АБК), этилен и жасмоновая кислота.
В ответ на действие стрессоров экспрессия некоторых генов усиливается, тогда
как экспрессия других генов подавляется. Часто образуются новые белки, ко-
торые не обнаруживаются в клетках в нестрессовых условиях. Хотя значитель-
ная часть исследований сфокусирована на активации транскрипции генов,
данные, полученные в последнее время, показывают, что образование про-
дуктов стрессовых генов, а также активность этих продуктов в клетках регули-
руется и на посттранскрипционном уровне. К таким механизмам относятся:
активация трансляции, посттрансляционная стабилизация, изменение фермен-
тативной активности уже синтезированных белков и др.
8.2. ВОДНЫЙ ДЕФИЦИТ
Растения испытывают водный дефицит, когда скорость транспирации пре-
восходит скорость поглощения воды корневой системой. Такая ситуация воз-
никает не только при засухе, но и в условиях почвенного засоления, а также
при низких температурах. В двух последних случаях дегидратация является ком-
понентом стрессов «неводной» природы и развивается в растениях, когда ко-
личество воды в почве чаще всего не ограничено, однако эта вода недоступна
для растения. Например, при почвенном засолении вода не поглощается кор-
512
невой системой из-за высокого осмотического давления (низкого водного по-
тенциала) почвенного раствора.
Снижение содержания воды в клетках при водном дефиците и сопутствую-
щее обезвоживанию увеличение концентрации ионов в цитоплазме вызывают
различного рода нарушения в структуре и функциях биополимеров, в частно-
сти происходит денатурация белков и подавляется их ферментативная актив-
ность, изменяется структура липидного бислоя мембран и нарушается их це-
лостность. Деструктивные изменения в мембранах в свою очередь приводят к
нарушению внутриклеточной компартментации веществ и подавлению элект-
рогенеза. На клеточном уровне водный дефицит выражается в потере тургора.
На уровне целого растения водный дефицит часто проявляется в обращении
градиента водного потенциала в системе почва —корень—побег и ингибиро-
вании роста. Способность растения адекватно отвечать на водный дефицит и
выживать в условиях водного дефицита зависит от эффективности защитных
механизмов растения. Некоторые ответные реакции растения на водный дефи-
цит могут наблюдаться уже через несколько секунд после начала действия стрес-
сора. К ним относятся, например, изменения в фосфорилировании белков.
Другие ответы требуют более длительного времени — от нескольких минут до
нескольких часов, как в случае изменений в экспрессии генов.
В результате индукции механизмов устойчивости к водному дефициту рас-
тение становится способным пережить действие стрессора. Развитие устойчи-
вости может быть результатом индукции как механизмов избежания, так и
механизмов резистентности. Обе категории реакций, вовлеченные в процесс
акклимации растений к водному дефициту, более детально рассмотрены ниже.
8.2.1. ПОНИЖЕНИЕ ВОДНОГО ПОТЕНЦИАЛА РАСТИТЕЛЬНЫХ КЛЕТОК
КАК СТРАТЕГИЯ ИЗБЕЖАНИЯ ОБЕЗВОЖИВАНИЯ
Вода движется пассивно по градиенту водного потенциала АТ из области,
где водный потенциал выше, в прилегающую область, где он ниже (см. под-
разд. 5.7 и 5.8).
Растение не может извлекать воду из почвы, если водный потенциал кле-
ток корня выше водного потенциала почвы 'Рср. Для того чтобы вода пере-
двигалась из почвы в клетки корня, Т1"1 должен быть доведен до более низкого
уровня, чем Тср. Некоторые растения высокочувствительны к водному дефи-
циту и завядают (теряют тургор), когда 'Рср становится слишком низким. Дру-
гие могут переносить засуху или высокие концентрации соли в почвенном
растворе без очевидной потери тургора. Клетки засухоустойчивых и солеустой-
чивых растений способны снижать свой водный потенциал за счет повышения
внутриклеточного осмотического давления л1"1 — процесса, получившего на-
звание осморегуляции. Повышение л1"1 осуществляется за счет увеличения сум-
марной концентрации осмотически активных веществ в клетках (рис. 8.1). Дос-
тигаемые при этом внутриклеточные осмолярности превосходят те, которые
получаются в результате пассивного концентрирования веществ при дегидра-
тации. Благодаря повышению л1"1 вода поступает в корни по градиенту водного
потенциала. Процесс осморегуляции играет важнейшую роль в акклимации
растений к засухе и почвенному засолению.
17 Физиология растений
513
Осморегуляция
Водный
дефицит
Р= 0 МПа
л = 1,2 МПа
V =-1,2 МПа
Почва
у =-1,2 МПа
Без осморегуляции
Рис. 8.1. Осморегуляция при водном дефиците (E.Bray et al., 2000).
В условиях водного дефицита осморегуляция осуществляется за счет накопления в клетках низко-
молекулярных веществ. В цитоплазме синтезируются осмолиты, а в вакуолях аккумулируются ионы.
Внутриклеточное осмотическое давление при этом повышается (снижается водный потенциал),
что приводит к току воды, направленному в клетки. В клетках растений с низкоэффективным
механизмом осморегуляции вещества при дегидратации концентрируются пассивно, однако овод-
ненность клетки и тургор не восстанавливаются, так как низкомолекулярные соединения не
накапливаются. Р — тургорное давление; п — осмотическое давление; Я7 — водный потенциал
Так как осмотическое давление является функцией общего числа частиц,
растворенных в данном объеме, в повышении л1"1 участвуют как низкомолеку-
лярные органические соединения, так и неорганические ионы. Регуляция ос-
мотического давления в цитоплазме клеток при водном и солевом стрессах
осуществляется преимущественно за счет биосинтеза низкомолекулярных орга-
нических соединений, которые получили название осмолитов, тогда как в ва-
куолярном компартменте главную роль в регуляции осмотического давления
играет аккумуляция неорганических ионов.
8.2.2. ОСМОЛИТЫ
8.2.2.1. Свойства и функции осмолитов
Осмолиты образуют сравнительно небольшую группу химически разнооб-
разных низкомолекулярных органических соединений. Они хорошо раствори-
мы в воде, нетоксичны и в отличие от неорганических ионов не вызывают
изменений в метаболизме, отчего и получили свое второе название совмести-
мых веществ (compatible solutes). Синтез и накопление осмолитов органиче-
ской природы в цитоплазме клеток — широко распространенное явление в
растительном мире, однако в распределении разных осмолитов по видам рас-
тений наблюдаются значительные вариации. У совместимых веществ существу-
514
ет тенденция быть нейтральными при физиологических значениях pH. В цито-
плазме они находятся в недиссоциированной форме либо в форме цвиттерио-
нов, т. е. молекул, несущих положительный и отрицательный заряды, которые
пространственно разделены. Некоторые осмолиты являются амфифильными
соединениями. Молекулы амфифильных веществ несут как неполярные (гид-
рофобные), так и полярные (гидрофильные) группы. К осмолитам относятся
также некоторые полигидроксильные соединения. Химическая структура наи-
более широко распространенных осмолитов показана на рис. 8.2.
Общая функция осмолитов — участие в процессе осморегуляции. Многие
неорганические ионы, такие, например, как Na+ и СГ, в высоких концентра-
циях токсичны, поэтому не могут быть использованы растительной клеткой в
регуляции осмотического давления цитоплазмы. В то же время совместимые с
биополимерами осмолиты могут аккумулироваться в цитоплазме до концент-
раций в несколько сот микромоль на грамм без видимых токсических эффек-
тов. Вследствие этого именно осмолиты, а не неорганические ионы клетка
использует для регуляции осмотического давления цитоплазмы. Роль осмоли-
тов особенно важна в условиях засухи и засоления, когда необходимо скон-
центрировать в клетках осмотически активные вещества. Различия растений по
устойчивости к дегидратации связаны со степенью эффективности у них сис-
тем биосинтеза осмолитов. Ксерофиты и галофиты — растения, обитающие
соответственно при низком содержании влаги в среде и на засоленных почвах,
Аминокислоты
Третичные соединения сульфония
Н3С.
>S-CH2-CH2-COO“
Н3С
S-диметилсульфониопропионат
Четвертичные соединения аммония
п = 1 — глицин-бетаин
п = 2 — аланин-бетаин
Н3с
Н3С—N—(СН2)—СОО“
Н3С
Пролин-бетаин
ОН он
Пинитол
н3сх у
н3с—n-ch2-ch2-o-s=o
Н3С '
Холин-сульфат
Многоатомные спирты
СН2ОН
но-с-н
I
но-с-н
I
н-с-он
I
н-с-он
I
СН2ОН
Маннитол
Рис. 8.2. Химические структуры некоторых наиболее распространенных осмолитов
515
синтезируют осмолиты с более высокой скоростью и аккумулируют их в клет-
ках до более высоких концентраций по сравнению с растениями, обитающи-
ми в условиях нелимитированного водоснабжения и при отсутствии почвен-
ного засоления.
В вакуолях, которые занимают приблизительно 90 % объема созревших кле-
ток, осморегуляция осуществляется в основном путем аккумуляции неоргани-
ческих ионов — К , Na+ и О . За счет осмолитов достигается осмотическое
равновесие цитозоля с вакуолями и всеми остальными органеллами клетки.
Наряду с осморегуляцией совместимые вещества выполняют еще одну, очень
важную при дегидратации функцию. Эта функция может быть определена как
защитная (протекторная) по отношению к цитоплазматическим биополиме-
рам. Подчеркивая двойную функциональную роль осмолитов, их часто называ-
ют осмопротекторами. К настоящему времени накопилось много эксперимен-
тальных фактов, свидетельствующих об их защитных свойствах. Следует, одна-
ко, отметить, что доказательства защитного действия совместимых веществ
получены в основном в экспериментах in vitro. Например, на препаратах из
листьев растений показано, что глицин-бетаин предотвращает NaCl-индуци-
рованную инактивацию рибулозобисфосфаткарбоксилазы и дестабилизацию
выделяющего О2 комплекса фотосистемы II.
Считается, что осмолиты не разрушают гидратные оболочки биополимеров.
На рис. 8.3 показана гидратная оболочка белка, состоящая из упорядоченных
молекул воды. Ионы, например Na+ и СГ, могут проникать через гидратную
оболочку и влиять на нековалентные связи, которые поддерживают структуру
белковой молекулы. В отличие от Na+ и СГ осмолиты, такие, как пролин и
глицин-бетаин, не проникают через гидратную оболочку и не вступают в пря-
мой контакт с белком, но создают препятствие для разрушения ионами гид-
ратной оболочки белка и его денатурации.
Некоторые низкомолекулярные органические соединения, синтез которых
индуцируется стрессорным воздействием, образуются в клетках в количествах,
явно недостаточных для выполнения осморегуляторной функции. Тем не ме-
нее они играют важную роль при стрессах как протекторы биополимеров. К таким
соединениям относятся диамин путресцин и образующиеся из него полиамины
спермидин и спермин (см. далее рис. 8.8). Полиамины широко распространены в
растениях. Они стимулируют реакции, вовлеченные в синтез ДНК, РНК и
белков. Как поликатионы, полиамины обладают высоким сродством к биомо-
лекулам, несущим отрицательные заряды, в частности к ДНК, РНК, фосфо-
липидам и кислым белкам, а также к анионным группам компонентов мемб-
ран и клеточных стенок. В растениях полиамины вовлечены во многие физио-
логические процессы, включая клеточное деление, формирование цитоскеле-
та, инициацию роста корней, эмбриогенез и созревание плодов.
Полиамины предотвращают повреждения биомолекул, вызываемые засу-
хой, засолением, низкими температурами и озоном. Структуры ДНК, РНК,
рибосом, а также мембран, находящихся в комплексе с полиаминами, стаби-
лизируются. Снижая активности РНКаз и протеаз, увеличенные в стрессовых
условиях, полиамины повышают точность считывания информации при син-
тезе белков и тормозят лизис клеточных структур.
Механизм стабилизирующего действия полиаминов может быть рассмотрен
на примере ДНК, являющейся сильной многоосновной кислотой. Она полнос-
516
Интактный белок
(высокоупорядоченная
структура молекул воды,
окружающих белок)
Денатурированный белок
(дезорганизованная структура
гидратной оболочки
молекулы белка)
Рис. 8.3. Протекторная функция пролина (Про). Пролин препятствует денатурации
белка, вызываемой ионами Na+ и СГ (Е. Bray et al., 2000)
тью ионизирована при pH выше 4. При цитоплазматических значениях pH от-
рицательно заряженные фосфатные группы, расположенные на периферии
двойной спирали, образуют ионные связи с положительно заряженными ами-
ногруппами спермидина и спермина, что предохраняет ДНК от повреждений.
8.2.2.2. Биосинтез некоторых наиболее распространенных
осмолитов
Пролин. Осмолит пролин широко распространен в растениях. Эта амино-
кислота может синтезироваться двумя путями, в которых исходным веществом
для синтеза является либо глутамат, либо орнитин (рис. 8.4). Ключевой фер-
мент глутаматзависимого пути синтетаза Л'-пирролин-5-карбоновой кислоты
обладает двойной функцией. Сначала благодаря свойственной этому ферменту
у-глутамилкиназной активности происходит АТФ-зависимое фосфорилирова-
517
00
н2с-------сн2
СОО’ /СИ
H3N СОО’
Z-Глутамат
Синтетаза
Д'-Пирролин-5-карбоновой
кислоты (у-глутамил
киназная активность)
АТФ
АДФ
н2с------сн2
I I
СОО®/СН
H3+N СОО’
Z-Глутамил-у-фосфат
НАДФН
Синтетаза
Д'-Пирролин-5- i
карбоновой кислоты НАДФ1
(ПАГ-дегидрогеназа) Л^ф,
к
н2с--------сн2
СНО /СН
H3N СОО’
у-Полуалвдегид
глутаминовой
кислоты (ПАГ)
Орнитин-а-
аминотрансфераза
Спонтанно^ Н2С СН2
НС* ♦
Н2о N СОО’
2 н
Д'-Пирролин-5-
карбоновая кислота
(П5К)
П5К-редуктаза Н2С СН2
~ \ Н2С^ ♦ хсх
НАДФН \ N СОО’
НАДФ+ Н2
Z-Пролин
П2К-редуктаза
н2с-------сн2
H2CNH3+ /СН
H3+N СОО’
Z-Орнитин
Кето- \
кислота Амино-
кислота
Н2с--------сн2
h2cnh3+ с
О СОО’
а-Кето-5-амино-
валерьяновая кислота
Спонтанно Н2С СН2
* ” Н2С^ ♦ <С^.
N СОО’
Н
Д'-Пирролин-2-
карбоновая кислота
(П2К)
Рис. 8.4. Биосинтез пролина
ние £-глутамата. Образующийся £-глутамил-у-фосфат превращается далее в у-
полуальдегид глутаминовой кислоты (ПАТ) с помощью этого же фермента,
функционирующего как НАДФН-зависимая ПАГ-дегидрогеназа. Далее ПАГ
подвергается спонтанной циклизации с образованием Д'-пирролин-5-карбо-
новой кислоты (П5К), восстанавливающейся затем до пролина при участии
НАДФН-зависимой П5К-редуктазы.
В орнитинзависимом пути биосинтез пролина из орнитина начинается с ре-
акции переаминирования, катализируемой орнитин-а-аминотрансферазой.
Образующаяся а-кето-8-аминовалерьяновая кислота спонтанно превращается
в Д'-пирролин-2-карбоновую кислоту (П2К), которая далее с помощью П2К-
редуктазы восстанавливается до пролина.
В катаболическом превращении пролина ключевую роль играет пролинде-
гидрогеназа, которая катализирует окисление пролина до Д'-пирролин-5-кар-
боновой кислоты.
Глицин-бетаин образуется в клетках многих водорослей и высших растений.
Метаболический путь биосинтеза глицин-бетаина обнаружен у всех исследован-
ных представителей семейства маревые (Chenopodiaceae), однако в клетках ра-
стений других семейств глицин-бетаин синтезируется лишь у отдельных видов.
В отличие от пролина и других осмолитов, внутриклеточные концентрации
которых регулируются путем баланса скоростей их синтеза и катаболизма, од-
нажды образовавшийся глицин-бетаин не подвергается катаболическим пре-
вращениям. Считается, что внутриклеточные концентрации глицин-бетаина
зависят от скорости его биосинтеза и скорости оттока через флоэму к расту-
щим тканям.
Глицин-бетаин образуется в хлоропластах из холина. Процесс протекает в
две стадии (рис. 8.5). Первый фермент, холинмонооксигеназа, катализирует окис-
ление холина до бетаинальдегида, используя фотосинтетически восстановлен-
ный ферредоксин и молекулярный кислород. Второй фермент, бетаиналъде-
гиддегидрогеназа, катализирует окисление бетаинальдегида до глицин-бетаина.
Оба фермента выделены, очищены и получены клоны их кДНК. Как показали
эксперименты с мечеными предшественниками глицин-бетаина, активность
обоих ферментов увеличивается в несколько раз при повышении осмотическо-
го давления наружного раствора, при этом возрастают количества их транс-
криптов. При последующем снабжении растений пресной водой содержание
транскриптов снижается.
Холин, предшественник глицин-бетаина, образуется в разных растениях
неодинаково (рис. 8.5). В шпинате {Spinacia oleracea) и сахарной свекле {Beta
vulgaris) синтез холина осуществляется путем метилирования этаноламинфос-
фата с образованием холинфосфата. Последний гидролизуется, образуя холин.
В шпинате активность ферментов, вовлеченных в этот путь биосинтеза холина,
возрастает при повышении наружной концентрации соли. В ячмене (Hordeum
vulgare) холин образуется через обмен фосфатидилхолина — фосфолипида, вхо-
дящего в состав мембран (рис. 8.5).
Накопление глицин-бетаина в клетках способствует повышению засухо- и
солеустойчивости растений. Растения, накапливающие глицин-бетаин при вод-
ном дефиците и солевом стрессе, поддерживают относительное содержание
воды (ОСВ) и тургорное давление на более высоком уровне, а также осуще-
ствляют фотосинтез с большей скоростью, чем растения, не накапливающие
519
h3n-ch2-ch2oh
Этаноламин
Этаноламин
, киназа
АДФ<|
H3N- CH2— CH2O(g)
Этаноламинфосфат
трансферазы
О
II
Н2с-о-с-R
н г О HC-O-C-R'
+ II I II
h3c-n-ch2-ch2-o—р—о—сн2 о
Н.С i
Фосфатидилхолин
Фосфатидная . Фосфолипаза D
кислота
ЗБ-аденозил-
метионин
ЗБ-аденозил-
гомоцистеин
Холинфосфат-
“зС\ + фосфатаза Н3С.
H3C-N-CH2-CH2O®----------X------- н3с—n—сн2—сн2он
н3с * н3с
Холинфосфат гп Холин
О2 + 2Н++ 2Фд
2Н2О + 2Фд >
Холинмоно-
оксигеназа
Н’Сх+
h3c-n-ch2-c<
Н3С н
Бетаин-альдегид
Бетаин-альдегид-
Нддц дегидрогеназа
н3с
H3C-N-CH2-COO
Н3С
Глицин-бетаин
Рис. 8.5. Биосинтез глицин-бетаина
его. Подавляющее большинство сельскохозяйственных культур не аккумулиру-
ет глицин-бетаин. Были сделаны попытки повысить засухо- и солеустойчи-
вость ряда растений путем получения трансформантов с генами ферментов,
отвечающих за биосинтез глицин-бетаина. Растения табака (Nicotiana tabacum),
трансформированные геном бактериальной холиндегидрогеназы, отвечающей
за превращение холина в бетаин-альдегид, демонстрировали более высокую
скорость роста при солевом стрессе, чем исходные растения.
Маннитол. Многоатомный спирт маннитол представляет собой восстанов-
ленную форму сахара маннозы. Он встречается у многих растений, а у некото-
рых из них на его долю приходится большая часть всех углеводов, образую-
щихся при фотосинтезе. Концентрации маннитола возрастают в клетках в от-
вет на гиперосмотический шок. В отличие от глицин-бетаина содержание ман-
нитола в клетках регулируется не только скоростью его биосинтеза, но и ак-
тивностью ферментов, которые отвечают за утилизацию маннитола, а также
ферментов, осуществляющих его катаболизм. Например, у злаков осмотиче-
ский шок приводит к снижению активности НАД+-зависимой маннитолдегид-
рогеназы — фермента, окисляющего маннитол.
520
®ОСН2 .(У ОН
H I I CH2OH
он н
Маннозофосфат-
изомераза
Н Н
Маннозо-6-фосфат
НАДФН
Маннозо-6-фос-
фатредуктаза
Фруктозо-6-фосфат
СН2О®
НО
НО
Н
н
н
и
он
он
Маннитол-1-фос-
фатфосфатаза
СН2ОН
но----н
но----н
СН2ОН
н---он
н---он
СН2ОН
Маннитол-1 -фосфат
Маннитол
Рис. 8.6. Биосинтез маннитола
На рис. 8.6 показан путь биосинтеза маннитола. В условиях осмотического
стресса три фермента осуществляют превращение интермедиата цикла Каль-
вина и гликолиза — фруктозо-6-фосфата — в маннитол. Фруктозо-6-фосфат с
помощью маннозо-6-фосфатизомеразы превращается в маннозо-6-фосфат,
который затем восстанавливается до маннитол-1-фосфата НАДФН-зависимой
Н ОН
Миоинозитол-1-
фосфатсинтаза
НАД*
Глюкозо-6-фосфат
он он
н он
Миоинозитол-1 -фосфат
Миоинозитол-1-
фосфатфосфатаза
Фн
ОН ОН
н он
Миоинозитол
Миоинозитол-6-о-
метилтрансфераза
он он
н он
Ононитол
Ононитол-
эпимераза
S-Адено-
зилме- S-Адено-
тионин зилгомо-
цистеин
ОН он
н он
Пинитол
Рис. 8.7. Биосинтез пинитола
521
маннозо-6-фосфатредуктазой. Маннитол-1-фосфатдефосфорилируется при уча-
стии маннитол-1-фосфатфосфатазы, превращаясь в маннитол.
Превращение маннитола во фруктозо-6-фосфат в катаболической ветви цикла
в ответ на повышение наружного осмотического давления происходит с учас-
тием двух ферментов: НАД+-зависимая маннитолдегидрогеназа окисляет ман-
нитол до фруктозы, а фруктокиназа катализирует образование фрукгозо-6-
фосфата из фруктозы.
Растения табака и арабидопсиса {Arabidopsis thaliana), чувствительные к ос-
мотическому шоку, были трансформированы геном из Е. coli, отвечающим за
превращение фруктозо-6-фосфата в маннитол-1 -фосфат. Трансформированные
растения накапливали маннитол, который обычно они не содержат, и демон-
стрировали более высокую устойчивость к осмотическому шоку, чем нетранс-
формированные растения. Семена аккумулирующих маннитол трансгенных
растений арабидопсиса были способны прорастать в присутствии соли.
Спермин
Рис. 8.8. Биосинтез полиаминов
522
Пинитол. D-пинитол — циклический многоатомный спирт, основной ос-
молит многих растений семейств сосновые (Pinaceae), бобовые (Leguminosae)
и гвоздичные (Caryophyllaceae). Концентрации пинитола, как правило, более
высоки у видов, адаптированных к засухе и почвенному засолению. Пинитол
накапливается в клетках факультативного галофита хрустальной травки (Mesem-
bryanthemum crystallinum), если растение поливают раствором, содержащим NaCI.
При поливе раствором NaCI в концентрации 400 мМ доля пинитола в клетках
М. crystallinum достигает 70 % от всех растворимых карбогидратов и лишь 5 % —
в клетках контрольных растений, не обработанных NaCI. В клетках пинитол
локализован в хлоропластах и цитозоле, но не обнаруживается в вакуолях.
Пинитол образуется из глюкозо-6-фосфата (рис. 8.7). Главное событие в цепи
реакций биосинтеза пинитола — о-метилирование миоинозитола, которое осу-
ществляется миоинозитол-6-о-метилтрансферазой. В этой реакции донором
метильной группы служит S-аденозилметионин. Образующийся ононитол под-
вергается далее эпимеризации с образованием пинитола.
При выращивании М. crystallinum в присутствии NaCI возрастание концен-
трации пинитола в клетках сопровождалось почти 60-кратным увеличением
активности миоинозитол-6-о-метилтрансферазы. Показано, что активность этого
фермента регулируется на транскрипционном уровне, т.е. увеличение актив-
ности фермента, вызванное высоким осмотическим давлением среды, связано
с возрастанием количества его мРНК в клетках.
Полиамины спермидин и спермин. Предшественником спермидина и спер-
мина является диамин путресцин, образующийся из аминокислоты орнитина,
(рис. 8.8). Спермидин образуется в результате конденсации молекулы путрес-
цина и пропиламинного остатка декарбоксилированного S-аденозилметиони-
на. Реакция осуществляется с помощью спермидинсинтазы за счет богатой
энергией метил-сульфониевой связи декарбоксилированного S-аденозилмети-
онина. Другой фермент, сперминсинтаза, переносит на спермидин еще один
пропиламинный остаток декарбоксилированного S-аденозилметионина с об-
разованием спермина.
8.2.3. БЕЛКИ, ОБРАЗУЮЩИЕСЯ В КЛЕТКАХ РАСТЕНИЙ
ПРИ ДЕГИДРАТАЦИИ
В формирование механизмов устойчивости растений к водному дефициту
вовлечены белки, выполняющие различные функции. Многие из них синтези-
руются de novo как ответная реакция растения на дегидратацию.
8.2.3.1. Lea-белки
Часть индуцируемых водным дефицитом белков защищает цитоплазматиче-
ские биополимеры и формируемые ими клеточные структуры от повреждений,
вызываемых дегидратацией (рис. 8.9). К ним относятся Lea (late embryogenesis abun-
с!ап1)-белки, которые сначала были идентифицированы как продукты генов LEA,
экспрессирующихся в семенах в фазе их созревания и высушивания. Позже
некоторые Lea-белки были обнаружены в вегетативных тканях растений в пе-
риод потери ими воды при водном, солевом и низкотемпературном стрессах.
523
Связывание ионов
Рис. 8.9. Протекторные функции белков, индуцируемых водным дефицитом
(Е. Bray, 1993).
Образующиеся белки поддерживают метаболизм и физиологические процессы в период потери
клеткой воды и последующего восстановления оводненности в ходе осморегуляторного процесса
Lea-белки в подавляющем большинстве гидрофильны, что согласуется с их
цитоплазматической локализацией. Многие из них обогащены аланином и гли-
цином и лишены цистеина и триптофана. Lea-белки в соответствии с их ами-
нокислотными последовательностями и структурой объединяют в пять групп
(1 — 5). Существуют предположения о специфических функциях белков каждой
группы. Lea-белки группы 1 характеризуются высоким содержанием заряжен-
ных аминокислот и глицина, что позволяет им эффективно связывать воду.
Наличие Lea-белков этой группы в цитоплазме придает ей высокую водоудер-
живающую способность.
Предполагается, что Lea-белки группы 2 выполняют функции шаперонов.
Образуя комплексы с другими белками, они предохраняют последние от по-
вреждений в условиях дегидратации клетки. Некоторые Lea-белки (группы 3
и 5) участвуют в связывании ионов, которые концентрируются в цитоплазме
при потере клетками воды. Наличие гидрофобной области у этих белков при-
водит к формированию гомодимера с гидрофобными последовательностями,
обращенными друг к другу, тогда как заряженные области на наружных поверх-
ностях белка участвуют в связывании ионов. Lea-белки группы 4 могут заме-
шать воду в примембранной области и этим поддерживать структуру мембран
при дегидратации. Lea белки играют важную роль в устойчивости растений к
водному дефициту. На ряде видов растений показана корреляция между выжи-
524
ваемостью при водном дефиците и накоплением в их клетках Lea-белков. На-
пример, сверхэкспрессия генов, кодирующих Lea-белки в трансформантах риса
(Oryza sativa), коррелировала с высокой устойчивостью растений к водному
дефициту.
8.2.3.2. Шапероны и ингибиторы протеаз
Шаперонами называют белки, которые связывают полипептиды во время их
сворачивания (folding), т.е. при формирования третичной структуры, и сборки
белковой молекулы из субъединиц, т. е. при формировании четвертичной струк-
туры. Взаимодействуя с полипептидами, шапероны предотвращают ошибки в
сворачивании и сборке и этим препятствуют аггрегации полипептидных цепей.
Некоторые шапероны играют роль «ремонтных станций», исправляющих не-
верное сворачивание. Одна из главных функций шаперонов — сворачивание и
разворачивание (unfolding), а также сборка и разборка белков при их транспор-
те через мембраны. Полипептидная цепь может пройти через пору в мембране
лишь в развернутом виде. Некоторые содержащиеся в цитозоле шапероны вза-
имодействуют с вновь синтезированными полипептидными цепями и поддер-
живают их линейную структуру, так что полипептидные цепи могут сразу транс-
портироваться в нужный компартмент клетки. Другие шапероны связываются
с аминокислотами полипептидной цепи, как только она покажется на другой
стороне мембраны, и осуществляют сворачивание. При дегидратации клеток
тенденция к повреждениям и денатурации белков усиливается, поэтому за-
щитная роль шаперонов в этих условиях возрастает. Стрессовые условия акти-
вируют биосинтез шаперонов в клетках (см. рис. 8.9).
При осмотическом стрессе происходит также индукция биосинтеза инги-
биторов протеаз, препятствующих протеолитическому расщеплению белков,
которые при дегидратации клетки сохраняют свою структуру и функциональ-
ные свойства (см. рис. 8.9).
8.2.3.3. Протеазы и убиквитины
При обезвоживании клеток, несмотря на действие протекторных соедине-
ний и шаперонов, часть клеточных белков подвергается денатурации. Денату-
рированные белки должны быть гидролизованы. Эту функцию выполняют про-
теазы и убиквитины, экспрессия генов которых также индуцируется стрессо-
выми условиями. Убиквитины представляют собой низкомолекулярные (8,5 кДа)
высококонсервативные белки. Присоединяясь к N-концу денатурированного
белка, они делают белок доступным для действия протеаз (см. рис. 8.9). Таким
путем осуществляется селективная деградация денатурированных белков.
8.2.3.4. Аквапорины
Трансмембранное движение воды происходит в основном через водные ка-
налы, образованные белками аквапоринами (см. рис. 8.9, а также подразд. 5.6).
За счет изменения числа водных каналов в мембране и их проводимости осу-
ществляется быстрая регуляция трансмембранных потоков воды, это особенно
525
важно при водном дефиците. Показано, что поглощение воды клетками в от-
вет на увеличение внутриклеточных концентраций осмолитов, сопровождаю-
щееся восстановлением ОСВ и тургора при засухе, происходит через водные
каналы. В A. thaliana водный дефицит индуцировал экспрессию гена RD28, ко-
торый кодирует аквапорин, локализованный в плазматической мембране. Гены,
кодирующие аквапорины, идентифицированы в М. crystallinum. Показано, что
количество транскриптов этих генов коррелирует с тургорным давлением в
клетках листьев М. crystallinum при действии на растение соли в высоких кон-
центрациях. После обработки растений хлористым натрием число транскрип-
тов в период снижения тургорного давления уменьшалось. В последующем оно
увеличивалось по мере того, как в клетках накапливались осмолиты и восста-
навливался тургор. Возросшая концентрация транскриптов в клетках активи-
ровала трансляцию. Увеличение содержания аквапоринов в мембране и их пос-
ледующая активация приводили к возрастанию водной проводимости ПМ и,
соответственно, к увеличению потока воды в клетку в период восстановления
тургора. Во время засухи содержание аквапоринов возрастает не только в ПМ,
но и в тонопласте Это способствует увеличению водной проводимости тоноп-
ласта, что также, по-видимому, необходимо для восстановления ОСВ и тур-
горного давления.
Изменение активности уже существующих в мембране водных каналов иг-
рает важную роль в регуляции водной проводимости мембран при стрессах.
Одним из механизмов такой регуляции является фосфорилирование и де-
фосфорилирование аквапоринов. Фосфорилирование приводит к активации,
а дефосфорилирование соответственно к снижению активности водных ка-
налов.
8.2.4. ЗАЩИТНЫЕ И РЕГУЛЯТОРНЫЕ ФУНКЦИИ БЕЛКОВ,
ИНДУЦИРУЕМЫХ ВОДНЫМ ДЕФИЦИТОМ
Из множества белков, появление которых в клетках растений вызвано вод-
ным дефицитом, одни вовлечены в формирование механизмов устойчивости
непосредственно, тогда как другие участвуют в регуляции экспрессии генов,
индуцируемых стрессором. В соответствии с этим гены, экспрессируемые в ра-
стениях при водном стрессе, подразделяют на функциональные и регуляторные.
Первая группа включает гены, которые отвечают непосредственно за форми-
рование механизмов устойчивости, т.е. биосинтез аквапоринов, образующих
водные каналы, ферментов, требующихся для биосинтеза осмолитов (проли-
на, глицин-бетаина, многоатомных спиртов и др.), белков, которые защища-
ют макромолекулы и мембраны (Lea-белков, шаперонов и др.), протеаз и убик-
витинов, ускоряющих белковый обмен в стрессовых условиях, а также фер-
ментов, участвующих в детоксикации (супероксиддисмутаза, аскорбатперок-
сидаза, глутатион-8-трансфераза и др., см. гл. 4 и подразд. 8.6.2).
Вторая группа содержит гены белков, которые участвуют в передаче сигна-
ла при экспрессии других генов, формирующих механизмы устойчивости, та-
ких, например, как гены протеинкиназ, фосфолипазы С и 14-3-3-белков. К этой
группе относятся гены транскрипционных факторов, которые «узнают» ДНК-
элементы в генах, экспрессируемых при стрессе.
526
8.2.5. РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ,
ИНДУЦИРУЕМЫХ ВОДНЫМ ДЕФИЦИТОМ
Рецепция сигнала
Первым этапом в регуляции экспрессии генов при водном дефиците явля-
ется рецепция сигнала. Воспринятый клеткой сигнал приводит к включению
систем сигнальной трансдукции и активированию белков, образующих цепь
передачи сигнала. Имеются данные, свидетельствующие о том, что у растений
рецепция сигнала при водном стрессе осуществляется аналогично тому, как
это происходит у Е. coli и дрожжей. У этих организмов восприятие изменений
осмотического давления наружной среды совершается с помощью сенсорной
системы, состоящей из локализованного в мембране осмосенсора (сенсорной
киназы) и находящегося в цитоплазме регулятора ответа (рис. 8.10). Эта систе-
ма воспринимает изменения в натяжении ПМ при водном дефиците. В ПМ
дрожжей осмосенсор, трансмембранный белок Slulp, при высокой осмоляр-
ности среды активируется путем автофосфорилирования, приводя затем к пос-
ледовательному фосфорилированию белков цитоплазмы Ypdl и Ssklp, кото-
рые образуют регулятор ответа.
MAP-киназный каскад. У дрожжей фосфорилированный белок Ssklp акти-
вирует различные пути передачи сигнала, в частности MAP (mitogen activated
рго1еш)-киназный каскад, состоящий из трех последовательно фосфорилируе-
мых в присутствии АТФ протеин-киназ: Ssk2p (МАРККК) — МАРКК-кина-
зы, Pbs2p (МАРКК) — МАРК-киназы и Hoglp (МАРК) — МАР-киназы
(рис. 8.11).
Активированная фосфорилированием MAP-киназа индуцирует экспрес-
сию многих генов дрожжевой клетки при водном и солевом стрессах, в част-
ности генов, кодирующих ферменты биосинтеза глицерина — главного осмо-
лита у дрожжей. Гомологи некоторых компонентов MAP-киназного каскада
дрожжевых клеток обнаружены у растений. Экспрессия генов этих компонен-
Водный дефицит
Рис. 8.10. Двухкомпонентная сенсорная система, воспринимающая изменения осмо-
тического давления наружной среды (A.Trewavas, 2000).
Система состоит из локализованного в мембране осмосенсора и находящегося в цитозоле регу-
лятора ответа. Сигнал возникает при изменении натяжения плазмалеммы в ответ на изменение
осмотического давления наружной среды. При получении сигнала осмосенсор, подвергаясь ав-
тофосфорилированию, активируется. С гистидинового остатка молекулы осмосенсора фосфатная
группа затем переносится на остаток аспарагиновой кислоты регулятора ответа. Фосфорилирован-
ная молекула регулятора ответа приводит к включению MAP-киназного пути передачи сигнала
527
Водный
Промотор Ген
Рис. 8.11. МАР-киназный путь пере-
дачи сигнала (по A.Trewavas, 2000,
с изменениями).
Фосфорилированные белки регулятора
ответа (РО) активируют МАР-киназный
каскад, состоящий из МАРККК (МАРК.К-
киназы), МАРКК (МАРК-киназы) и
МАРК (MAP-киназы). Последняя осуще-
ствляет прямую регуляцию транскрипци-
онных факторов (ТФ), вовлеченных в ин-
дукцию стрессовых белков при водном
дефиците
I
тов индуцируется стрессовыми условиями.
В частности, у A. thaliana ген МАР-киназы
(АТМРКЗ) и ген МАРККК (АТМЕКК1)
индуцируются засухой, низкими темпера-
турами и высокими концентрациями соли.
Вторичные мессенджеры. В регуляции
тургорного давления растительной клетки
участвуют вторичные мессенджеры (рис.
8.12). Локализованный в мембране фосфа-
тидилинозитол-4,5-дифосфат расщепляет-
ся активируемой при осмотическом стрес-
се фосфолипазой С, освобождая вторич-
ный мессенджер инозитол-1,4,5-трифосфат.
Последний индуцирует выход Са +, друго-
го вторичного мессенджера, из вакуоли и
эндоплазматического ретикулума в цито-
золь и соответственно концентрация Са + в
нем возрастает. Концентрация Са2' в цито-
золе может увеличиваится также за счет его
поступления в клетку через потенциалза-
висимые Са ‘-каналы плазмалеммы при ин-
дуцируемой стрессором деполяризации
этой мембраны. Возросшие концентрации
Са + активируют Са +/кальмодулинзависи-
мые протеинкиназы (CDPK), что в свою
очередь стимулирует биосинтез стрессовых
белков.
АБК-зависимые и АБК-независимые гены.
Важную роль в регуляции экспрессии ге-
нов при осмотическом стрессе играет гор-
мон АБК. Экспрессия многих генов в усло-
виях засухи, засоления или низких темпе-
ратур требует предварительного накопле-
ния в тканях эндогенной АБК, тогда как
экспрессия других генов происходит без
участия АБК. На основании этого и анали-
за действия АБК на экспрессию индуци-
руемых водным дефицитом генов в АБК-
дефицитном (aba) и АБК-нечувствитель-
ном (abi) мутантах A. thaliana был сделан
вывод, что существуют АБК-зависимые и
АБК-независимые пути передачи сигнала
в ответной реакции растений на водный
дефицит (рис. 8.13).
Несколько транскрипционных факторов
и специфических нуклеотидных последова-
тельностей в генах идентифицированы для
обоих путей. АБК-индуцируемые гены со-
528
Рис. 8.12. Участие вторичных мессенджеров, инозитол-1,4,5-трифосфата и ионов Са2+ в
путях передачи сигналов, приводящих к индукции стрессовых белков при водном
дефиците:
ФЛС — фосфолипаза С; ФИФ2 — фосфатидилинозитол-4.5-дифосфат; ИФ3 — инозитол-1,4,5-
трифосфат; ТФ — транскрипционные факторы
АБК-независимые гены
АБК-зависимые гены
Рис. 8.13. Индукция АБК-зависимых и АБК-независимых генов водным дефицитом.
Промоторная область АБК-независимых генов содержит специфическую последовательность нук-
леотидов DRE, которая связывается с транскрипционными факторами, белками DREBP и АР2.
Промоторная область АБК-зависимых генов содержат нуклеотидную последовательность ABRE,
которая связывается с транскрипционным фактором — белком ЕтВР. Помимо ABRE промотор-
ная область АБК-зависимых генов включает сопрягающий элемент СЕ1, взаимодействующий с
белком СЕВР
529
держат в премоторной области специфическую последовательность нуклеоти-
дов, получившую сокращенное название ABRE (ABA-responsive element). АВ RE
функционирует как цые-элемент ДНК, вовлеченный в АБК-регулируемую эк-
спрессию генов Такого рода элемент был сначала идентифицирован в Ет-
гене пшеницы {Triticum aestivum), а затем обнаружен в АБК-индуцируемых
генах кукурузы {Zea mays), ячменя, риса, табака и арабидопсиса. Для индукции
экспрессии генов необходимо, чтобы ABRE связался с белком EmBPl. В боль-
шинстве случаев ABRE достаточен для АБК-регулируемой экспрессии генов,
но в некоторых генах ABRE ассоциирован с еще одной нуклеотидной последо-
вательностью, которая называется сопрягающим элементом (СЕ). Например,
в гене HVA22 ячменя сопрягающий элемент СЕ1 требуется для экспрессии
наряду с ABRE. Для экспрессии таких генов требуется еще один ДНК-связыва-
ющий белок, специфичный к СЕ, — СЕВР (coupling element binding protein).
ABRE, СЕ и оба белка EmBPl и СЕВР образуют комплекс, индуцирующий
экспрессию АБК-зависимого гена. Однако до настоящего времени не ясно,
как АБК активирует EmBPl, вызывая его последующее взаимодействие с ABRE
и инициацию транскрипции. В ряде генов, регулируемых с участием АБК, об-
наружены другие цис-элементы, отличающиеся от ABRE. Индукция таких ге-
нов происходит при специфическом связывании этими элементами транскрип-
ционных факторов МУС и MYB.
Премоторная область АБК-независимых генов содержит последовательность
нуклеотидов DRE (drought-responsive element). DRE вовлечен в регуляцию ге-
нов, индуцируемых непосредственно водным дефицитом и не требующих АБК
для экспрессии. Транскрипционные факторы для таких генов — DRE-связыва-
ющие белки DREBP и АР2 — обнаружены в ядерном экстракте из A. thaliana.
8.3. СОЛЕВОЙ СТРЕСС
Согласно современным оценкам, одна пятнадцатая часть земной суши, вклю-
чая территории, используемые в сельскохозяйственном производстве, занята
засоленными почвами. Приблизительно 5 % земель мировых сельскохозяйствен-
ных угодий и почти 20 % орошаемых земель в той или иной степени засолены.
Если содержание суммы неорганических ионов в почве в расчете на ее сухую
массу не превышает 0,2 %, то такие почвы считаются незасоленными, от 0,2 до
0,4 % — слабозасоленными, от 0,4 до 0,7 % — среднезасоленными и от 0,7 до
1,0% — сильнозасоленными. При содержании неорганических ионов свыше
1,0 % почвы называют солончаками. В засоленных почвах из катионов преобла-
дает по массе, как правило, Na+, однако встречаются почвы с высоким содер-
жанием Mg + и Са +. Из анионов наибольший вклад в почвенное засоление
чаще всего вносят СГ и SO4 , но встречается также засоление карбонатного
типа.
Растения, эволюционно сформировавшиеся на засоленных почвах и адап-
тированные к высоким концентрациям солей в почвенном растворе, называ-
ют галофитами (от греч. galos — соль, phyton — растение), а сформировавшиеся
на незасоленных почвах — гликофитами (греч. glycos — сладкий, phyton — рас-
тение). Подавляющее большинство видов сельскохозяйственных культур отно-
сится к гликофитам. Гликофиты выдерживают лишь слабое засоление и только
530
некоторые из них, такие как хлопчатник (Gossipium hirsutum), овес (Ovena cativa),
рожь (Secale sereale) и пшеница, — среднее. При высоком содержании солей в
почве снижается продуктивность посевов. Галофиты в отличие от гликофитов
способны осуществлять жизненный цикл на сильнозасоленных почвах и со-
лончаках. К типичным галофитам относятся растения семейства маревые
(Chenopodiaceae), такие, как солерос европейский (Salicomia еигораеа), кохия
распростертая (Kochia prostrata), петросимония трехтычинковая (Petrosimonia
triandra) и др. Высокое содержание солей в почве не только не подавляет, но
даже стимулирует их рост.
8.3.1. ПОВРЕЖДАЮЩЕЕ ДЕЙСТВИЕ СОЛЕЙ
При повышенном содержании солей в почве у гликофитов нарушается вод-
ный и ионный гомеостаз как на клеточном уровне, так и на уровне целого
растения. В свою очередь это ведет к различным токсическим эффектам, кото-
рые выражаются в повреждениях биополимеров цитоплазмы. В целом почвен-
ное засоление затормаживает рост и может вызвать гибель растений.
8.3.1.1. Эффекты, проявляющиеся на клеточном уровне
Первым был открыт эффект соли, связанный с дегидратацией клеток. В нача-
ле XX в. А. Ф. Шимпер показал, что в условиях засоления растения теряют воду
вследствие высокого осмотического давления почвенного раствора. Выражаясь
современным языком, можно сказать, что дегидратация клеток при засолении
происходит в результате снижения водного потенциала почвенного раствора.
Осмотическое действие соли при этом не зависит от того, какими ионами оно
вызвано, важна суммарная концентрация ионов и других осмотически актив-
ных веществ в почвенном растворе (см. подразд. 5.4.3).
В 50-х гг. XX в. Б. П. Строгонов обратил внимание на различие симптомов
поражений, вызванных у растений хлоридным и сульфатным засолениями. На
основе этого была выдвинута концепция токсического действия ионов, согласно
которой разные ионы вызывают нарушения метаболизма, приводящие к спе-
цифическим токсическим эффектам. В настоящее время осмотическое и токси-
ческое действия солей признаны главными повреждающими факторами на кле-
точном уровне.
Природа токсического действия ионов, особенно первичных молекулярных
повреждений, изучена мало. Известно, что ионы в высоких концентрациях
могут дезинтегрировать клеточные мембраны, подавлять активность фермен-
тов и приводить к нарушениям таких жизненно важных функций, как клеточ-
ное деление, ассимиляция углерода, поглощение элементов минерального
питания и др. NaCl в концентрациях выше 0,4 М ингибирует многие ферменты
вследствие нарушения гидрофобно-электростатического баланса сил, поддер-
живающих структуру белковых молекул. Однако токсические эффекты прояв-
ляются уже при гораздо более низких концентрациях соли (меньше 0,1 М),
указывая на специфические мишени действия ионов. Практически ничего не
известно о мишенях токсического действия ионов хлора. О может конкуриро-
вать с РНК и анионными метаболитами, такими, как бикарбонат, карбокси-
531
латы и фосфаты сахаров, за анионные сайты связывания. Ион Na+ может вза-
имодействовать с катионными сайтами, вовлеченными в связывание К+, Са2+
и Mg2+.
Молекулярно-генетические исследования, проведенные на дрожжах 5. cerevisiae,
выявили две мишени токсического действия Na+: протеинфосфатазу На12 и
рибонуклеазу MRP. Ионы Li+ и Na+ являются сильными ингибиторами На12.
Фосфатаза На12 относится к семейству инозитол-фосфатаз, которые требуют
для катализа Mg +. Она нужна для превращения в АМФ 3'-фосфоаденозин-5'-
фосфата (ФАФ), образующегося при утилизации так называемого активиро-
ванного сульфата — 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) (см. гл. 6).
В дрожжевых клетках, обработанных Li+ или Na+ в токсических концентраци-
ях, вследствие ингибирования На12-фосфатазы накапливается ФАФ. Это в свою
очередь ингибирует ФАФС-утилизирующие ферменты, ФАФС-редуктазу и
сульфотрансферазы, а также экзорибонуклеазы Rati и Xrnl, осуществляющие
процессинг РНК. Общее свойство сайтов мишеней токсического действия Na+
у этих ферментов, — слабая связь с Mg + (константа Михаэлиса Кт, находится
в миллимолярном диапазоне концентраций Mg +). Сайты образованы фосфат-
ными группами субстратов и карбоксильными группами аминокислот актив-
ных центров. При высокой плотности ионов Li+ или Na+ в микроокружении
названных выше ферментов происходит вытеснение ионов Mg +, которые не-
обходимы для их функционирования. Ионы К+ противодействуют ингибирова-
нию фермента На12 ионами Na+. Эффект ионов К+ может быть общим для всех
мишеней токсического действия Na+.
Факторами, повреждающими макромолекулы, являются активные формы
кислорода (АФК) — синглетный кислород, супероксидный радикал, гидро-
ксил-радикал, пероксид водорода и ряд других форм. Их концентрации в клет-
ках растений при почвенном засолении и засухе возрастают. Наблюдающиеся в
этом случае токсические эффекты не связаны с непосредственным действием
ионов на молекулярные мишени. Они возникают в результате вторичных про-
цессов — взаимодействий биополимеров с накапливающимися при стрессе
АФК. Процессы, приводящие к образованию АФК, их действие на биополи-
меры клетки и защитные механизмы, снижающие концентрации АФК в клет-
ках, рассмотрены в гл. 4, подразд. 8.6.
8.3.1.2. Эффекты, проявляющиеся на уровне целого растения
Высокие концентрации солей, как уже отмечалось, подобно многим другим
стрессорам ингибируют рост растений. Ингибирование опосредовано уменьше-
нием содержания в растениях гормона цитокинина, стимулирующего рост, и
увеличением содержания ингибирующей рост абсцизовой кислоты (АБК). В ус-
ловиях стресса в растениях увеличивается также содержание 1-аминоциклоп-
ропан-1-карбоновой кислоты — предшественника рост-ингибирующего гор-
мона этилена. Изменения в гормональном статусе растений стимулируют ме-
ханизмы устойчивости. Многие исследователи считают, что подавление роста
при солевом стрессе обусловлено не столько повреждающим действием соли,
сколько адаптивными гормональными ответами растения. Такой взгляд под-
крепляется тем, что в природе степень устойчивости к действию стрессора
часто характеризуется обратной корреляцией со скоростью роста. Медленный
532
рост позволяет растениям выживать при стрессе, так как освобождает множе-
ство ресурсов (строительных блоков и энергии), необходимых для реализации
защитной программы.
Один из главных механизмов ингибирования роста — снижение устьичной
проводимости. Низкий водный потенциал почвенного раствора при засолении
и водном дефиците приводит к потере воды клетками, в частности замыка-
ющими клетками устьиц, что в свою очередь уменьшает апертуру устьичных
щелей и, следовательно, снижает скорость поступления в листья СО2, а также
транспирационного тока воды. В снижении тургорного давления замыкающих
клеток в этих условиях наряду с непосредственным действием соли участвуют
процессы, индуцируемые АБК. При накоплении гормона в замыкающих клет-
ках изменяется активность ион-транспортирующих белков ПМ. АБК ингиби-
рует Н+-АТФазу, что вызывает деполяризацию ПМ. При этом инактивируются
входные и активируются выходные К -каналы, активируются также выходные
анионные каналы (см. гл. 6 и подразд. 8.3.3). Отток К+ и СГ из замыкающих
клеток сопровождается потерей тургора и закрытием устьиц. Последний эф-
фект сберегает воду для растения, но снижает скорость фотосинтеза и ингиби-
рует рост.
Высокие концентрации соли и водный дефицит могут ингибировать рост,
влияя на процессы деления и дифференцировки клеток. Подавление роста со-
пряжено с экспрессией некоторых генов, индуцируемых стрессорным воздей-
ствием и не экспрессирующихся в нормальных условиях. К ним относятся,
например, гены CBF1, DREB1 и ICK1 у A. thaliana. Продукты этих генов инги-
бируют процессы клеточного деления и растяжения и таким путем подавляют
рост. В частности, продукт ICK1 ингибирует циклинзависимые протеинкина-
зы, вовлеченные в индукцию клеточного цикла.
8.3.2. АДАПТАЦИИ, ПРОТИВОДЕЙСТВУЮЩИЕ
ОСМОТИЧЕСКОМУ ЭФФЕКТУ СОЛЕЙ
К осмотическому действию солей растения приспосабливаются теми же
способами, что и к обезвоживанию в условиях засухи. В основе приспособи-
тельных процессов лежит биосинтез осмолитов в цитоплазме (см. подразд. 8.2.2)
и накопление неорганических ионов в вакуолях. Механизмы аккумуляции ионов
в вакуолях обсуждаются в следующем подразделе.
8.3.3. ИОННОЕ ГОМЕОСТАТИРОВАНИЕ ЦИТОПЛАЗМЫ
РАСТИТЕЛЬНОЙ КЛЕТКИ КАК СТРАТЕГИЯ ИЗБЕЖАНИЯ
ТОКСИЧЕСКОГО ДЕЙСТВИЯ СОЛЕЙ
В условиях солевого стресса токсическое действие ионов наблюдается при
их накоплении в цитоплазме. У растений, различающихся по устойчивости к
солям, эффективность механизмов, поддерживающих ионный гомеостаз, раз-
лична. В норме концентрации Na+ и СГ в цитоплазме клеток гликофитов и
галофитов поддерживаются приблизительно на одинаковом уровне. Этот уро-
вень, как правило, не превышает нескольких ммоль/кг сырой биомассы. У гало-
533
фитов способность поддерживать такие низкие концентрации Na+ и СГ в ци-
топлазме выработалась при росте на засоленных почвах. В отличие от галофитов
гликофиты не в состоянии справиться с задачей поддержания низких концен-
траций ионов в цитоплазме в условиях засоления. Способность солеустойчивых
растений поддерживать при засолении цитоплазматические концентрации ионов
на низком уровне подтверждается, в частности, высокой чувствительностью к
Na+ и СГ биополимеров цитоплазмы их клеток. Показано, например, что in vitro
гомологичные ферменты, выделенные из пресноводных и галотолерантных (со-
леустойчивых) водорослей, а также их органеллы проявляют практически оди-
наково высокую чувствительность к NaCI (рис. 8.14).
Стратегия избежания токсического действия солей, основанная на ионном
гомеостатировании цитоплазмы, сформировалась на ранних этапах эволюци-
онного развития органического мира. Из организмов, обитающих в наше вре-
мя на засоленных субстратах, только у галофильных (солелюбивых) бактерий
адаптация к токсическому действию солей строится не на основе регуляции
цитоплазматических концентраций ионов, а на основе специфической струк-
туры их белков, позволяющей белкам функционировать в микроокружении с
высокой концентрацией Na+. Примером таких бактерий является Halobacterium
halobium. Водорастворимые белки цитозоля, а также мембраносвязанные и ри-
босомальные белки клеток галофильных бактерий характеризуются повышен-
ным содержанием дикарбоновых аминокислот (глутаминовой и аспарагино-
вой), вследствие чего изоэлектрические точки этих белков смещены в кислую
Концентрация NaCI, М
А
I______I______1_____I______________1__
0,25 0,5 0,75 1,0 1,5
Концентрация NaCI, М
Б
Рис. 8.14. Зависимости скорости выделения О2 от концентрации NaCI у интактных кле-
ток водорослей при фотосинтезе (Л) и у выделенных из этих же водорослей хлоропла-
стов в реакции Хилла (Б) (Ю. В.Балнокин, 1995).
Три вида водорослей различаются по солеустойчивости: 1 — пресноводная водоросль Chlorella
pyrenoidosa', 2 — морская водоросль Dunaliella maritime-, 3 — водоросль Dunaliella salina, обита-
ющая в водоемах с предельно высокими концентрациями NaCI. При измерении скорости выде-
ления О2 клетки и выделенные из них хлоропласты были освещены светом насыщающей интен-
сивности. Несмотря на резкие различия в солеустойчивости этих организмов, о чем свидетель-
ствуют различия в оптимальных концентрациях NaCI для фотосинтеза интактных клеток,
выделенные из них хлоропласты характеризуются одинаковой чувствительностью к соли
534
Белок, активный в присутствии
высоких концентраций ионов натрия
При отсутствии ионов натрия белок неактивен
Рис. 8.15. Кислые белки галофильных бактерий.
Водорастворимые, мембраносвязанные и рибосомальные белки галобактерий характеризуются
высоким содержанием дикарбоновых аминокислот. Для поддержания структуры таких белков
необходимы высокие концентрации ионов Na+ или К+, нейтрализующих ионизованные карбо-
ксильные группы
область (рис. 8.15). В нейтральной среде цитоплазмы кислые белки несут отри-
цательные заряды, которые должны быть нейтрализованы катионами. Наличие
ионов в высоких концентрациях в цитоплазме не только допустимо, но даже
необходимо для таких белков. В противном случае за счет электростатического
отталкивания неизбежна денатурация. В клетках галофильных бактерий сум-
марная концентрация Na+ и К+ измеряется молями. По-видимому, столь высо-
кие концентрации ионов в клетках галобактерий нужны также для стабилиза-
ции гидрофобных взаимодействий в белках. Клетки всех прочих современных
организмов, включая остальные прокариоты, клетки животных, растений и
грибов, поддерживают низкие концентрации Na+ (и СГ) в цитоплазме.
Поддержание цитоплазматических концентраций того или иного иона на
определенном уровне основывается на балансе входящих и выходящих пото-
ков этого иона. В частности, цитоплазматические концентрации Na+ определя-
ются балансом скоростей пассивного поступления Na+ в цитоплазму и его ак-
тивного выведения (экспорта) из цитоплазмы.
Для простоты рассмотрим сначала клетку без крупной центральной вакуо-
ли (рис. 8.16, А). Такое строение типично для меристематических клеток выс-
ших растений, а также для многих морских и пресноводных одноклеточных
водорослей. Наличием компартмента, образованного микровакуолями, можно
пренебречь, так как они занимают незначительную часть клеточного объема.
Поступающие в цитоплазму такой клетки ионы Na+ по градиенту электрохи-
535
[Na+] 500 мМ
Рис. 8.16. Потоки Na+ через плазмалемму и тонопласт у морских водорослей:
А — клетка морской микроводоросли, лишенная крупной центральной вакуоли. Ионы Na4 по-
ступают пассивно из наружной среды в цитоплазму через ионные каналы плазмалеммы. Низкие
концентрации Na4 в цитоплазме поддерживаются благодаря работе локализованного в ПМ Na4-
насоса. Транспорт Na4 наружу происходит с затратой метаболической энергии; Б — клетка мор-
ской водоросли с крупной центральной вакуолью. Ионы Na4 поступают пассивно в цитоплазму
не только из наружной среды, но и из вакуоли. Активный транспорт Na4 осуществляется как в
наружную среду, так и в вакуоль. Градиенты электрохимического потенциала Na4 формируются
на ПМ и тонопласте
мического потенциала ApNa+, т.е. пассивно, откачиваются обратно в окружаю-
щий клетку раствор. Ионные насосы, экспортирующие Na+, локализованы в
этом случае в ПМ.
Клетки высших растений (за исключением меристематических), много-
клеточных морских водорослей (макрофитов) и некоторых одноклеточных
водорослей имеют крупную центральную вакуоль. Помимо экспорта Na+ из
цитоплазмы в наружную среду они могут осуществлять активный транспорт
этого иона в вакуоль, что приводит к генерации AjiNa+ также и на тонопласте
(рис. 8.16, Б). Необходимо отметить, что физиологическая роль Na+-Hacoca то-
нопласта и осуществляемого им активного переноса Na в вакуоль не сводится
к поддержанию низких концентраций Na+ в цитоплазме. Натриевый насос то-
нопласта обеспечивает также накопление Na+ в вакуоли, благодаря чему повы-
шается осмотическое давление вакуолярного сока. Это в свою очередь вносит
вклад в формирование градиента водного потенциала между окружающим клетку
раствором и клеткой и обеспечивает таким образом ток воды, направленный
внутрь клетки. Особенно ярко выражена двойная физиологическая роль актив-
ного транспорта Na+ через тонопласт у соленакапливающих галофитов. При-
мерами могут служить S. еигораеа, сведа высокая (Suaeda altissima), К. prostrata
и др. Этим растениям в условиях экстремально высоких концентраций Na+ в
почвенном растворе приходится не только поддерживать цитоплазматичес-
кие концентрации Na+ на нетоксическом уровне, но и решать задачу погло-
щения корнями воды из почвенного раствора, водный потенциал которого за
счет растворенных солей может достигать -5 МПа и меньше. Эти растения для
536
поддержания водного потенциала в клетках на более низком уровне, чем в
почвенном растворе, аккумулируют Na+ и Cl в вакуолях до концентраций
1,0-1,5 М.
8.3.3.1. Поступление Na+ и Cl в клетки корня
из почвенного раствора
Ионы поступают в цитоплазму клеток эпидермиса и коры корня из почвен-
ного раствора по градиенту электрохимического потенциала. Градиент элект-
рохимического потенциала иона J выражается соотношением
Сср
^j = RTln-^-ZjFEM, (8.1)
где R — газовая постоянная; Т — абсолютная температура; F— число Фарадея;
j ~ концентрация иона j в почвенном растворе; С, — концентрация иона
j в цитоплазме; Zj — элементарный заряд иона у; Еы — трансмембранный элек-
трический потенциал.
При высокой солености среды Сс^а+ > С^а+, поэтому концентрационная со-
ставляющая градиента электрохимического потенциала Na+ положительна, т. е.
направлена из почвенного раствора в клетку. Член, отражающий электроста-
тические взаимодействия, в уравнении (8.1) стоит со знаком «минус». Так как
Ем отрицателен («минус» внутри клетки) и zNa+ равен +1, выражение (-ZNa+FEM) в
уравнении (8.1) также принимает положительное значение. Это означает, что
и электрическая составляющая градиента ApNa+ тоже является движущей силой
переноса Na+ из среды в цитоплазму. При отсутствии засоления, когда концен-
трация Na+ в почвенном растворе не превышает 1 мМ, в жидкой среде цито-
плазмы она может достигать нескольких мМ, т. е. С^а+ < С №* Концентрацион-
ный член в уравнении (8.1) в этом случае становится отрицательным, однако
за счет электрической составляющей градиент электрохимического потенциа-
ла Na+ в целом может оказаться положительным, означая, что и в отсутствие
засоления Na+ будет пассивно поступать в клетки.
Ион хлора несет отрицательный заряд (zcr = -1), поэтому электрическая
составляющая его электрохимического градиента Лцсг всегда направлена из
клетки в среду. Другими словами, отрицательный внутри клетки Ем создает
препятствие для входа СГ в цитоплазму. Отсюда следует, что только концент-
рационная составляющая электрохимического градиента СГ может обеспечить
пассивное поступление СГ в клетки корня. Необходимые для этого условия
создаются при засолении почвы хлористым натрием. При этом Ссг > С ст и
Сср
концентрационный член RT\n-^ положителен. Противодействие для входа
Ccr-
Cl в клетки со стороны отрицательного внутри электрического потенциала в
этих условиях ослабляется NaCl-индуцированной деполяризацией плазмалем-
мы (ПМ).
Скорости поступления иона J (его потоки) в цитоплазму из наружной сре-
ды и вакуоли (рис. 8.16, Б) прямо пропорциональны движущим силам (Ац,-) и
коэффициентам ионной проницаемости плазмалеммы и тонопласта (Pj). Урав-
нение (8.2), известное как уравнение потока Гольдмана, связывает поток иона
537
j (Jj) через мембрану (количество иона j, переносимое через единицу площади
мембраны в единицу времени) с концентрационной и электрической состав-
ляющими ЛДу, а также с Рр
т - г _ Т" - 1 (Сср _rYJ'p7iFEvlp'1\ с» эх
Jj-Jj Jj- RT ZjFEK/RT J e /’
где Jj — приток иона в клетки; J" — его отток; их разность составляет суммар-
ный поток Jj; Pj — коэффициент проницаемости мембраны для иона j.
Анализ уравнения (8.2) приводит к важному практическому выводу, что
ионная проницаемость мембран в значительной мере определяет степень соле-
устойчивости растительного организма, поскольку концентрация того или иного
иона в цитоплазме, а, следовательно, и сила его токсического действия в зна-
чительной степени зависит от пассивного потока этого иона через мембрану
из среды в клетку. Исследования транспорта Na+ через ПМ на модельной сис-
теме одноклеточных микроводорослей, у которых механизмы регуляции ци-
топлазматических концентраций Na+ находятся в основном в ПМ, показали,
что /ка+ плазмалеммы тем ниже, чем выше концентрация NaCI в среде обита-
ния, т.е. чем выше устойчивость организма к соли (табл. 8.1).
У Dunaliella salina, обитающей в водоемах с предельно высоким содержани-
ем NaCI и способной осуществлять жизненный цикл даже в насыщенном ра-
створе NaCI, PNa+ на два порядка ниже, чем у пресноводной водоросли Chlorella
pyrenoidosa и приближается к PNa+ искусственных липидных пленок. При аккли-
мации Ch. pyrenoidosa к среде, содержащей 340 мМ NaCI, PNa* ПМ снижался
почти на порядок, свидетельствуя о том, что NaCI индуцирует перестройки в
химическом составе и микроструктуре мембраны, направленные на ограниче-
ние ионных потоков в цитоплазму при высокой солености среды.
Следует отметить, что ионная проницаемость плазматической мембраны и
других мембран может быстро изменяться в ответ на изменение ионного со-
става среды. Это связано с изменением активности ионных каналов. Измерения
Д|а+ ПМ водорослей (табл. 8.1) были проведены при постоянных концентра-
циях NaCI и других ионов в средах культивирования. Установленная на микро-
водорослях закономерность, выражающаяся в обратной корреляции между ве-
личиной PNa' и уровнем засоления среды обитания, не может быть безогово-
рочно перенесена на высшие растения. Организация транспорта ионов в целом
Таблица 8.1. Коэффициент проницаемости плазматической мембраны для ионов Na+
(Рма+) у различающихся по устойчивости к NaCI водорослей* (Ю.В.Балнокин, 1995)
Параметр Chlorella pyrenoidosa Dunaliella maritima Dunaliella salina
Концентрация NaCI в среде культивирования, мМ 0 340 500 2000
Коэффициент проницаемо- сти PNat, М- С’1 8,5- ПУ12 1,1 IO12 5,4- IO'14 1,6- IO14
* Chlorella pyrenoidosa — пресноводная водоросль; Dunaliella maritime — морская планктонная
водоросль; Dunaliella salina — экстремально галотолерантная водоросль, обитающая в водоемах
с предельно высокими концентрациями NaCI.
538
растении выдвигает в отношении ионной проницаемости мембран клеток раз-
ных органов и тканей разные требования. Ответ на вопрос, как связана величи-
на PNa+ той или иной мембраны с солеустойчивостью растения, осложняется
тем обстоятельством, что разные виды растений, даже близкие между собой
по степени солеустойчивости, имеют свои особенности организации дальнего
транспорта ионов.
8.3.3.2. Транспортные белки плазматической мембраны,
вовлеченные в перенос Na+ и СГ из наружной среды в цитоплазму
Na+ и другие ионы не проникают в клетки через липидный бислой мембра-
ны. Вход ионов в клетки осуществляется через ионные каналы, а также с помо-
щью переносчиков. Ка+-селективные каналы, подобные №+-селективным ка-
налам животных клеток, в растительных клетках не найдены. Применение элек-
трофизиологических методов, и особенно метода регистрации токов одиноч-
ных ионных каналов (patch clamp), в сочетании с молекулярно-биологически-
ми подходами позволило обнаружить в ПМ клеток корней несколько белков,
через которые Na+ входит в клетки, и в ряде случаев идентифицировать их на
молекулярно-генетическом уровне. К таким белкам относятся К -каналы плаз-
малеммы, обладающие низким сродством к ионам К+ (Кт в миллимолярном
диапазоне концентраций К ), низкоселективные ионные каналы и высокоаф-
финные переносчики К+ (Кт в микромолярном диапазоне концентраций). Ниже
приведена более подробная информация об этих белках (рис. 8.17).
1. Входные {inward rectifying) К каналы — активируются при гиперполяри-
зации ПМ, т. е. при смещении Еы к более отрицательным значениям. Они обна-
руживают высокую K+/Na+ селективность при физиологических концентраци-
ях К+ и Na+ в наружной среде, однако при высоких концентрациях солей на-
трия в среде могут вносить существенный вклад в поглощение Na+ клетками.
Такие каналы обнаружены во многих растениях, их транспортные свойства
хорошо изучены электрофизиологическими методами. Из корней A. thaliana
выделен ген входных К+-каналов — АКТ1.
2. Выходные (outward rectifying) ^-каналы — активируются в ответ на депо-
ляризацию ПМ, т. е. при смещении Еы к более положительным значениям. При
деполяризации ПМ через выходные К+-каналы может осуществляться диффу-
зия К+ из цитоплазмы в наружную среду. Через эти же каналы Na+ может диф-
фундировать из среды в цитоплазму. Несколько каналов этого типа было иден-
тифицировано на молекулярно-генетическом уровне, например, КСО1 в клетках
A. thaliana. Один из них, известный как NORC, обладает слабой избиратель-
ной способностью по отношению к транспортируемым катионам и активиру-
ется возрастающими концентрациями Са + в цитозоле.
3. Потенциалнезависимые катионные VIC (voltage-independent channel)-ка-
налы — обладают относительно низкой K+/Na+ селективностью и, в отличие
от потенциалзависимых входных и выходных К+-каналов, не изменяют ионной
проводимости при изменении трансмембранного электрического потенциала.
4. Из высокоафинных К+-транспортирующих механизмов в поглощении Na
принимает участие HKTl-переносчик — К+,№+-симпортер. Этот транспорт-
ный белок переносит два иона в одном направлении (симпорт). НКТ1 был
539
выделен из корней пшеницы. Была показана тканеспецифическая экспрессия
гена НКТ1 в клетках коры корня. Переносчики, подобные НКТ1, обнаружены
также в A. thaliana и ячмене. Первоначально НКТ1 был описан как К ,Н+-
симпортер, при участии которого корни осуществляют поглощение иона К+
из среды с его микромолярными концентрациями. Ионы калия при этом транс-
портируются в клетки за счет градиента электрохимического потенциала Н+.
Позже было показано, что при высокой солености среды для энергизации
поглощения К+ вместо Ацщ используется ApNa+, и ионы К+ в этом случае по-
глощаются клетками вместе с ионами Na+.
Исследования транспорта Na с помощью радиоактивного изотопа 22Na+ и
электрофизиологических методов показали, что из вышеперечисленных транс-
портных белков ПМ наибольший вклад в поглощение Na клетками корней
вносят VIC-каналы. Результаты этих экспериментов имеют важное практиче-
ское значение, поскольку обнаруживают одну из потенциальных молекуляр-
ных мишеней для манипуляций с геномом растений методами генетической
инженерии в целях повышения солеустойчивости растений. VIC-каналы, од-
нако, до настоящего времени не идентифицированы на молекулярно-генети-
ческом уровне. Существенно, что Са +, конкурируя за места связывания с Na+,
блокирует VIC-каналы и ингибирует поглощение Na+ корнями. Это согласует-
ся с известной способностью солей кальция повышать урожайность некоторых
культур на засоленных почвах.
Поступление ионов СГ в клетки растений при высоких концентрациях NaCl
в почвенном растворе происходит через анионные каналы ПМ по градиенту
электрохимического потенциала (рис. 8.17; см. рис. 8.20). Когда наружная кон-
центрация NaCl повышается, более быстрая диффузия в клетки Na+ по срав-
нению с СГ приводит к диссипации Еы на ПМ. Градиент электрохимического
потенциала СГ смешается вследствие этого к более положительному значе-
нию, способствуя пассивному входу СГ в клетки корня.
Анионные каналы обнаружены в мембранах высших растений, водорослей
и грибов. Методом регистрации токов одиночных ионных каналов в ПМ и
рНцит7,0 — 7,4
Рис. 8.17. Транспортные белки плазмалеммы (ПМ) через которые осуществляется
вход Na+ и СГ в клетки.
Различные К+-транспортирующие белки ПМ вовлечены в перенос Na*: входные К+-каналы,
АКТ1; выходные К+-каналы, NORC; потенциалнезависимые VIC-каналы и К'.На'-симпортер,
НКТ1. Вход СГ осуществляется через анионные каналы и Н+,СГ-симпортер, энергизуемый
который генерируется Н+-АТФазой. Еы — потенциал мембраны
540
тонопласте растительных клеток было выявлено несколько типов каналов с
различной избирательностью по отношению к анионам, разными свойствами
и кинетическими характеристиками. До настоящего времени твердо не уста-
новлено, какой тип анионных каналов вовлечен в перенос СГ в клетки при
почвенном засолении. В ПМ клеток корней пшеницы обнаружены анионные
каналы, активирующиеся при деполяризации мембраны, а также в ответ на
повышение концентрации Са в цитоплазме и анионов в наружной среде. Та-
кие условия возникают при увеличении наружной концентрации NaCI. Эти
каналы относятся к группе так называемых «быстрых» анионных каналов, ха-
рактеризующихся миллисекундной кинетикой транспорта СГ. Предполагает-
ся, что именно через них С1 поступает в клетки корня при повышении кон-
центрации соли в среде. На основании гомологии с СГ-каналами животных
клеток некоторые анионные каналы идентифицированы на молекулярно-ге-
нетическом уровне, в частности CLC-Ntl и CLC-Nt2 — в растениях табака,
AtCLC-a-d — у арабидопсиса, St-CLC — у картофеля. При этом, однако, лока-
лизация, функциональные характеристики и физиологическая роль продуктов
идентифицированных генов остаются нераскрытыми.
Через некоторое время после возрастания наружной концентрации соли и
входа Na+ и СГ в клетки обмен веществ и ионный гомеостаз клеток перехо-
дят в новое стационарное состояние. Считается, что после достижения ново-
го стационарного состояния и реполяризации ПМ СГ транспортируется в
клетки против градиента электрохимического потенциала с помощью СГ,
Н -симпортера, который использует Дцн+ как движущую силу для входа СГ в
клетки.
8.3.3.3. Экспорт Na+ и СГ из цитоплазмы
Низкие концентрации Na+ и СГ в цитоплазме при высокой солености сре-
ды поддерживаются не только за счет ограничения входных потоков этих ионов,
но и благодаря их энергозависимому экспорту из цитоплазмы. Экспорт может
осуществляться в двух направлениях: обратно через ПМ в экстрацеллюлярное
пространство и в вакуоль через тонопласт. Ниже рассмотрены Na+- и СГ-экс-
портирующие механизмы плазмалеммы и тонопласта.
Na /H -антипортер плазматической мембраны — представляет собой меха-
низм ион-обменной диффузии, который осуществляет перенос Na+ из ци-
топлазмы в наружную среду в обмен на Н+ (рис. 8.18). Экспорт Na+ происходит
против градиента электрохимического потенциала этого иона за счет энергии
АцН' и является вторично активным видом транспорта. Генерация Дцн+ осуще-
ствляется Н+-АТФазой ПМ. На функциональном уровне 1Ча'/Н+-антипортер
обнаружен в ПМ высших растений, водорослей и дрожжей. Недавно ген SOS1,
кодирующий №+/Н'антипортер ПМ, выделен из A. thaliana.
Первичный Na+-Hacoc (Na -АТФаза). В плазматической мембране некоторых
дрожжей и галотолерантных водорослей обнаружен первичный Na+-насос, ко-
торый является Na -транспортирующей АТФазой (рис. 8.18). №+-АТФазы транс-
портируют Na+ из цитоплазмы в наружную среду за счет энергии фосфатных
связей АТФ. Эти ферменты относятся к семейству АТФаз P-типа, образующих
в каталитическом цикле фосфорилированный интермедиат. Na^-АТФаза из дрож-
жей S. cereuisiae исследована на молекулярно-генетическом уровне. Экспрессия
541
Ем =-140 мВ
рНцит 7,0 —7,4
Рис. 8.18. Экспорт Na+ из цитоплазмы в наружную среду.
Перенос Na+ в среду осуществляется №*/Н*-антипортсром плазмалеммы (SOS1) против гради-
ента электрохимического потенциала. Источником энергии для переноса Na' является Дцн+>
генерируемый Н*-АТФазой плазмалеммы (ПМ). В плазмалемме некоторых водорослей и грибов
наряду с Na+/H+-aHTHnopTepoM и Н' АТФазой функционирует первичный Na*-Hacoc, которым
является Na*-транспортирующая АТФаза
гена ENA1, кодирующего Na-АТФазу из этого организма, существенно сти-
мулирует экспорт Na+, а также Li+ из цитоплазмы и вносит заметный вклад в
солеустойчивость этого организма. Na+-АТФазы из галотолерантных водорос-
лей подробно исследованы на функциональном уровне. Установлено, что Na+-
АТФаза Tetraselmis viridis осуществляет перенос Na+ в обмен на Н+, тогда как
фермент из Heterosigma akashivo по своим свойствам близок Na .K -АТФазе
животных клеток. Подобного рода Na‘-транспортирующие АТФазы в клетках
высших растений не обнаружены
Na /H -аптипортер тонопласта. Подобно тому, как №+/Н+-антипортер плаз-
малеммы переносит Na из цитоплазмы в экстрацеллюлярное пространство,
снижая цитоплазматические концентрации Na , Na /Н -антипортер тонопла-
ста переносит Na+ в вакуоль, выполняя ту же самую физиологическую функ-
цию (рис. 8.19). Наряду с №ч/Н+-антипортером тонопласта ключевым транс-
Рис. 8.19. Депонирование Na+ в вакуоли.
Транспорт Na* в вакуоль осуществляется №'/Н*-антипортером тонопласта (NHX) против гра-
диента электрохимического потенциала. Источником энергии для переноса Na* является Дцц1,
генерируемый Н*-АТФазой и Н*-пирофосфатазой (ФФ„) тонопласта (Т). Через катионные кана-
лы тонопласта, характеризующиеся низкой избирательной способностью, происходит утечка
Na* из вакуоли в цитоплазму
542
портным механизмом в этом процессе является локализованная в тонопласте
Н -АТФаза. Напомним, что последняя относится к АТФазам V-типа, ее функ-
ция состоит в переносе Н+ из цитоплазмы в вакуоль и генерации таким обра-
зом Ар.н+ на тонопласте. В генерации на тонопласте Ацн+ принимает участие
также Н -транспортирующая пирофосфатаза этой мембраны. Ка+/Н+-антипор-
тер и Н -АТФаза тонопласта играют чрезвычайно важную роль в солеустойчи-
вости высших растений, так как образуют у них главную систему экспорта Na+
из цитоплазмы. Как детерминанты солеустойчивости они привлекают особое
внимание исследователей. Использование молекулярно-биологических подхо-
дов позволило идентифицировать ген №+/Н -антипортера тонопласта (AtNHX)
в A. thahana.
Системы экспорта СГ, локализованные в плазматической мембране и тоно-
пласте. При солевом стрессе поступающие в клетки корня ионы СГ, так же как
ионы Na , должны выводиться назад в экстрацеллюлярное пространство или
депонироваться в вакуолях (рис. 8.20). Экспорт СГ из цитоплазмы через ПМ
или тонопласт, как и его вход, происходит через анионные каналы. Направле-
Клеточпая
стенка
Рис. 8.20. Транспортные белки плазмалеммы и тонопласта, вовлеченные в поглощение
и экспорт СГ в клетках растений.
Перенос СГ через плазмалемму (ПМ) и тонопласт (Т) осуществляется через анионные каналы.
Направление движения СГ (в цитоплазму или из цитоплазмы) определяется направлением гра-
диентов электрохимических потенциалов СГ на этих мембранах. При солевом стрессе происхо-
дит NaCl-индуцированная деполяризация ПМ. В этих условиях градиент электрохимического
потенциала СГ (Дрсг) на ПМ направлен из наружной среды в цитоплазму и СГ поступает в
клетки. При отсутствии засоления СГ может поглощаться клеткой с помощью Н+,СГ-сим-
портера, использующего для этого Дцн+ как движущую силу. Экспорт СГ из цитоплазмы через
анионные каналы происходит при гиперполяризации ПМ и тонопласта. Гиперполяризация про-
исходит при включении Н'-ДТФаз ПМ и тонопласта, а также Н+-ФФ„азы тонопласта. При ги-
перполяризации градиент электрохимического потенциала СГ на этих мембранах приобретает
такое направление, что СГ транспортируется из цитоплазмы в наружную среду и вакуоль
543
ние движения ионов С1 (вход в цитоплазму или выход из нее) определяется
направлением градиентов электрохимических потенциалов СГ на ПМ и то-
нопласте. В связи с этим Н+-АТФаза ПМ, Н+-АТФаза тонопласта и Н+-пиро-
фосфатаза тонопласта — генераторы электрических потенциалов на этих мем-
бранах (минус на цитоплазматической стороне для обеих мембран) — играют
важнейшую роль в экспорте СГ из цитоплазмы. Включаясь, эти транспортные
белки приводят к гиперполяризации ПМ и тонопласта и соответственно к
изменению электрохимического градиента ионов СГ, так что последние транс-
портируются из цитоплазмы наружу и в вакуоль. Предполагают, что анионные
каналы, осуществляющие экспорт СГ, активируются в ответ на гиперполяри-
зацию мембран. Эти анионные каналы до настоящего времени остаются неизу-
ченными.
8.3.3.4. К7Ма+-селективность — индикатор солеустойчивости
растений
Калий как макроэлемент необходим для роста и развития всех растений.
Напротив, натрий важен для сравнительно небольшого числа видов. Во всех
живых клетках цитоплазматические концентрации К+ относительно велики,
тогда как концентрации Na+ относительно низкие. У растений концентрации
К+ в цитоплазме составляют от нескольких десятков до 200 ммоль/кг, тогда
как концентрации Na+ не превышают нескольких ммоль/кг, а чаще составля-
ют несколько сот мкмоль/кг. В почвенном растворе К+ и Na конкурируют за
поглощение клетками корня. Эта конкуренция может иметь серьезные нега-
тивные последствия для растений при засолении, когда концентрация Na в
почвенном растворе существенно превышает концентрацию К . В связи с этим
способность клеток сохранять высокое отношение К /Na в цитоплазме при
высокой солености среды рассматривают как одно из свидетельств высокой
солеустойчивости растения. Низкие концентрации Na+ и высокие концентрации
К+ в животных клетках поддерживаются благодаря функции Na , К -АТФазы.
В цитоплазме клеток растений преимущественное содержание К по сравне-
нию с содержанием Na+ в нормальных условиях обусловлено, во-первых, ион-
ной избирательностью транспортных систем ПМ, через которые К и Na про-
никают в клетки, и, во-вторых, экспортом Na+ (но не К ) из цитоплазмы. При
высокой солености среды сниженная активность ионных каналов и перенос-
чиков, через которые Na+ поступает в клетки, и повышенная активность сис-
тем, экспортирующих Na+, могли бы затормозить накопление Na в цитоплаз-
ме и этим повысить K+/Na+ отношение. Активность и/или количество молекул
этих белков в расчете на единицу площади мембраны определяют отношение
K+/Na+ в цитоплазме.
Как отмечалось выше, VIC-каналы ПМ — главные «ворота» для входа Na в
клетки корня при засолении, однако о регуляции активности VIC-каналов
известно очень мало. Некоторая информация имеется по поводу регуляции ак-
тивности систем, экспортирующих Na+ из цитоплазмы. Показано, что у A. thaliana
экспрессия генов S0S1 и AtNHX, кодирующих №+/Н+-антипортеры ПМ и
тонопласта соответственно, возрастает в ответ на внесение в почву NaCI. Мута-
ции по S0S1 делали растения чувствительными к NaCI. Известно также, что
544
при действии на растение NaCl возрастает активность Н+-АТФаз ПМ и тоноп-
ласта. NaCl-индуцированная стимуляция активности АТФаз происходит за счет
увеличения числа молекул фермента в мембранах.
8.3.4. ИНТЕГРАЦИЯ КЛЕТОЧНЫХ МЕХАНИЗМОВ УСТОЙЧИВОСТИ
К ВОДНОМУ ДЕФИЦИТУ И ВЫСОКИМ КОНЦЕНТРАЦИЯМ СОЛЕЙ
В ЗАЩИТНУЮ СИСТЕМУ ЦЕЛОГО РАСТЕНИЯ
В предыдущих подразделах рассматривались функции отдельных клеток, на-
правленные на противодействие осмотическому и токсическому эффектам
солей. В этом подразделе показано, как защитные механизмы отдельных кле-
ток складываются в единую систему, позволяющую решать эти задачи в стрес-
совых условиях на уровне целого организма. Как указывалось выше, одна из
основных стратегий в адаптации к высоким концентрациям солей, проявля-
ющаяся на клеточном уровне, состоит в поддержании низких концентраций
Na+ и СГ в цитоплазме и создании таким путем благоприятного микроокруже-
ния для функционирования цитоплазматических биополимеров. Одновремен-
но за счет биосинтеза осмолитов в цитоплазме и депонирования этих ионов в
вакуолях клетки поддерживают ОСВ на необходимом для жизнеобеспечения
уровне.
С появлением в ходе эволюции многоклеточных организмов, дифференци-
рованных на органы и ткани, наряду с прежней появилась новая стратегия в
водном обмене и ионном гомеостатировании. Стало важным, во-первых, под-
держивать водный ток в системе: почва —корень—побег, во-вторых, избегать
накопления ионов, присутствующих в среде в высоких концентрациях, в мо-
лодых, активно метаболизирующих частях растения, прежде всего в меристе-
матических тканях и генеративных органах. Известно, что в меристематических
клетках, цветках, семенах и плодах содержание Na+ и СГ в расчете на сырую
биомассу не превышает нескольких ммоль/кг даже при сильном почвенном
засолении.
Вода и растворенные в ней вещества движутся из почвенного раствора в
клетки эпидермиса и коры. Далее они транспортируются в радиальном направ-
лении к центру корня и затем по ксилеме вверх, в листья. Движение ионов в
радиальном направлении корня, также как и движение воды (см. гл. 5), может
осуществляться по апопласту (апопластный путь), и через клетки (путь от клетки
к клетке). За счет функционирования локализованных в ПМ и тонопласте ион-
транспортирующих белков формируется ионный состав цитоплазмы клеток
корня, в котором содержание Na+ и СГ ограничено, а К доминирует над Na .
Значительная часть ионов, передвигающаяся в радиальном направлении кор-
ня, достигнув эндодермы, вынуждена из-за поясков Каспари пересекать ПМ и
входить в цитоплазму клеток этой ткани, однако наличие обходных путей (про-
пускные клетки эндодермы и незрелые ткани кончика корня) позволяет ионам
передвигаться и через апопласт. Эндодерма, таким образом, не может быть
абсолютным барьером для ионов, хотя мембраны ее клеток вносят существен-
ный вклад в регуляцию ионных потоков через корень. В связи с этим, когда
интенсивность транспирации высока, апопластный путь играет заметную роль
в транспорте Na+ и СГ. Ионы движутся в этом случае с массовым потоком
18 Физиология растений
545
воды и растворенных веществ по градиенту гидростатического давления (гид-
равлический поток). При низкой интенсивности транспирации движение Na+
и С1 осуществляется преимущественно от клетки к клетке. В этот путь движе-
ния ионов вовлечены ионные каналы, переносчики и ион-транспортирующие
АТФазы. Для транспорта ионов в растении очень важен этап загрузки ионами
ксилемы. Функцию загрузки выполняет плазматическая мембрана паренхим-
ных клеток, окружающих ксилему. Показано, что у гликофитов в норме основ-
ным по массе катионом, транспортируемым в ксилему, является К+, а пере-
нос К из клеток обкладки в ксилему осуществляется через активируемые при
деполяризации ПМ выходные К+-каналы. У галофитов, а также при высокой
солености среды и у гликофитов из транспортируемых в ксилему катионов
доминирует Na . Установлено, что у A. thaliana перенос ионов Na+ из парен-
химных клеток обкладки в ксилему осуществляет №+/Н+-антипортер ПМ этих
клеток, кодируемый геном SOS1. У ячменя в паренхимных клетках, прилегаю-
щих к сосудам ксилемы корня, идентифицированы анионные каналы, через
которые происходит загрузка ксилемы ионами СГ. Исследование транспорта
О через эти каналы показало, что они относятся к анионным каналам так
называемого «медленного» типа. Кинетика транспорта СГ через них характе-
ризуется секундным диапазоном.
При движении ксилемного сока вверх между ним и клетками, прилегаю-
щими к ксилеме, происходит обмен ионов, в результате которого ионный
состав раствора, достигающего клеток листьев, существенно отличается от
ионного состава первичного ксилемного сока в корне. Оказавшись в листьях,
ионы Na и С1 проникают в клетки и там депонируются в вакуолях, повышая
осмотическое давление вакуолярного сока. Процесс депонирования Na+ и СГ в
вакуолях наиболее ярко выражен у галофитов. Следует отметить, что депони-
рование Na и О наблюдается также и у гликофитов, которые характеризуются
относительно высокой устойчивостью к водному дефициту и высоким концен-
трациям солей.
Согласованное функционирование ион-транспортирующих систем в отдель-
ных клетках обеспечивает при стрессах поддержание низких концентраций Na+
и Cl в цитоплазме самих клеток, низкое содержание Na+ и О” в генеративных
органах и активно метаболизирующих тканях и вносит вклад в формирование
градиентов водного потенциала в системе: почва—корень—побег, путем на-
копления Na+ и СГ в вакуолях.
Как уже отмечалось, стратегия ионного транспорта и осморегуляции, ос-
нованная на накоплении ионов в вакуолях надземных органов, характерна
для большинства галофитов, в том числе и тех, чьи листья снабжены соле-
выводящими, как у кермека (Limonium gmelinii), и солелокализующими, как у
М. crystallinum, железами. Соль в вакуолях, занимающих большую часть клеточ-
ного объема, является «дешевым» осмотиком, тогда как «дорогие» осмолиты
органической природы поддерживают осмотическое давление в цитоплазме. В
связи с функцией накопления ионов в вакуолях важное значение у галофитов
имеет баланс потоков Na и СГ из почвенного раствора в корни, с одной
стороны, и из корней в побеги, с другой. Количество ионов, переносимое в
побеги, должно быть достаточным для поддержания осмотического давления в
вакуолях на нужном уровне. Если скорость аккумуляции ионов в вакуолях кле-
ток надземных органов галофитов высока, т.е. высока активность Na+/H+-aH-
546
типортера тонопласта, доставка ионов из корней в побеги в достаточных коли-
чествах приводит к стимуляции их роста.
Гликофиты в условиях почвенного засоления не способны поддерживать
низкие концентрации Na+ и СГ в цитоплазме и аккумулировать ионы в вакуо-
лях своих клеток столь эффективно, как это делают галофиты. Большое значе-
ние в формировании признака солеустойчивости у гликофитов (в целом более
низкой, чем у галофитов) имеет ограничение входящих потоков Na+ и С1 в
корни. При этом осморегуляция их клеток, даже в вакуолярном компартменте,
осуществляется в значительной степени за счет осмолитов органической при-
роды. Однако способность гликофитов синтезировать осмолиты весьма ограни-
чена. Распределение поступающих из почвенного раствора ионов между корне-
вой системой и надземными органами у гликофитов определяется, как и у
галофитов, функцией паренхимных клеток обкладки ксилемы корня, которые
могут ограничивать поступление ионов в надземные органы. Различные виды и
сорта растений различаются по эффективности этой функции. У сои {Glycine
max) и пшеницы {Triticum aestivum) различия между сортами в ограничении
ионных потоков из корней в побеги определяются одним геном. Генетиче-
ский анализ показал, что такой ген KNA1 у пшеницы локализован в хромо-
соме 4D.
Согласованное действие ион-транспортирующих белков в мембранах клеток
различных органов и тканей, поддерживающих ионный гомеостаз и формиру-
ющих ионные градиенты в системе целого растения, подразумевают орган- и
тканеспецифическую экспрессию ион-транспортирующих белков. Биосинтез
осмолитов в растении также регулируется органо- и тканеспецифическим об-
разом. Тот или иной белок, индуцируемый стрессом, должен появиться не
только в нужном месте, но и в нужное время. Важную роль в пространственной
и временной регуляции экспрессии стрессовых генов играют гормоны и орган-
и тканеспецифические промоторы.
К механизмам адаптации к засолению и водному дефициту, которые про-
являются на уровне целого растения, относятся С4- и CAM-пути фиксации
углерода (см. гл. 3). Транспирационный ток воды многократно ускоряет поступ-
ление в растения ионов Na+ и С1 , в избытке содержащихся в почвенном ра-
створе при засолении. Полностью открытые устьица, поддерживающие высо-
кую интенсивность транспирации, создавали бы не только угрозу потери воды
растением, но и ускоряли бы накопление Na+ и СГ в цитоплазме клеток. При
высоких концентрациях соли в среде и водном дефиците апертура устьичных
щелей, однако, уменьшается, что делает СО2 менее доступным для растений и
приводит к подавлению фотосинтеза. В связи с этим у многих представителей
флоры в зоне аридного климата, обитающих при недостатке влаги и избытке
солей в почве, фотосинтез идет по С4- или CAM-пути. Преимущество С4- и
CAM-метаболизма в условиях водного дефицита и почвенного засоления состо-
ит в возможности осуществлять фотосинтез при высоком устьичном сопротив-
лении. Можно считать поэтому, что С4- и САМ-пути — это такие способы
фотосинтеза, которые не только экономят воду при низком водном потенци-
але почвенного раствора, но и препятствуют избыточному поглощению рас-
тениями Na+ и Cl . У некоторых растений, в частности у галофита М. cristallinum,
высокие концентрации NaCl в почве приводят к индукции ферментов САМ-
пути.
547
8.3.5. РЕГУЛЯЦИЯ ГЕНОВ УСТОЙЧИВОСТИ К NaCI
Пути передачи сигналов, индуцирующих экспрессию генов при солевом
стрессе, только начинают изучаться. В подразд. 8.2.5 был рассмотрен путь сиг-
нальной трансдукции, включающий гистидинкиназу и МАР-киназный каскад
и ответственный за биосинтез осмолитов при осмотическом стрессе. Эти же
механизмы участвуют в нейтрализации осмотического эффекта солей, так как
включаются неспецифически в ответ на действие любого осмотика. При соле-
вом стрессе помимо индукции синтеза белков, вовлеченных в биосинтез осмо-
литов, активируются системы ионного гомеостатирования. Поглощенные клет-
кой ионы Na+ должны быть выведены обратно в наружную среду или компар-
тментализованы в вакоули. Это требует активации Ка+-насосов ПМ и тонопла-
ста. Показано, что экспрессия SOS1 — гена Ка+/Н+-антипортера ПМ, и NHX —
гена Na /Н -антипортера тонопласта, у A. thaliana индуцируются специфиче-
ски высокими концентрациями солей. Для путей передачи сигнала, индуциру-
ющих экспрессию генов при солевом стрессе, идентифицировано несколько
транскрипционных факторов и промоторных элементов.
Недавно у A. thaliana был открыт специфический для Na+-CTpecca АБК-
независимый SOS-путь передачи сигнала, приводящий к экспрессии гена
Na /ЬГ-антипортера ПМ SOS1 (рис. 8.21). SOS-путь включает белок кальци-
нейрин (SOS3), который является Са +- и кальмодулинзависимой протеин-
фосфатазой. Этот фермент состоит из каталитической А-субъединицы (СпА) и
регуляторной В-субъединицы (СпВ) и имеет три EF-лиганда, связывающих
Са . Полная активация фермента нуждается в образовании комплексов Са +-
СпВ, и Са -кальмодулин. В состав SOS-цепи передачи сигнала входит также
серин/треонин-протеинкиназа, кодируемая геном SOS2. При функционирова-
нии SOS-пути рецептор неизвестной природы воспринимает сигнал (высокие
концентрации Na+), что приводит к возрастанию концентрации свободного
Са + в цитозоле. SOS3 связывает Са + и активирует протеинкиназу SOS2, обра-
зуя протеинкиназный комплекс SOS2 —SOS3. Активированная протеинкиназа
фосфорилирует белки, непосредственно вовлеченные в экспрессию SOS1, а
также других генов, в том числе ответственных за транспорт К+. SOS-путь мо-
жет также регулировать активность других транспортных белков на посттранс-
ляционном уровне.
Следует отметить важную роль в сигнальной трансдукции при NaCl-стрес-
се цитоплазматического Са '. Наряду с участием в передаче сигнала через
SOS-путь ион Са + выполняет функцию вторичного мессенджера в сигналь-
ных путях, включающих протеинкиназы, которые содержат Са ^связываю-
щий домен, подобный Са -связывающему домену в молекуле кальмодулина.
Один из механизмов, приводящих к возрастанию концентрации Са в цитоп-
лазме, связан с образованием инозитол-1,4,5-трифосфата, который освобож-
дает Са + из вакуолярного компартмента. Другой механизм основан на акти-
вации потенциалзависимых Са -каналов при NaCI-индуцированной деполя-
ризации ПМ и входе в клетку содержащегося в апопласте свободного Са .
Экспрессия генов NaCI-индуцируемых белков и регуляция транспортной ак-
тивности продуктов этих генов обеспечиваю т поддержание ионного гомеоста-
за при стрессе, что наряду с другими механизмами повышает устойчивость
растения к NaCI.
548
Рис. 8.21. SOS-путь передачи сигнала при индукции биосинтеза №+/Н+-антипортера
высокими концентрациями Na+ в среде (по J.-K.Zhu, 2000, с изменениями).
Высокие концентрации Na+ приводят к увеличению концентрации Са2+ в цитозоле. Са2+-зави-
симая протеинфосфатаза, кальцинейрин (SOS3) связывает Са2' и активирует протеинкиназу,
кодируемую геном SOS2. Образующийся комплекс SOS2—SOS3 индуцирует экспрессию гена Na'/
Н'-антипортера SOS1. SOS-путь, по-видимому, отвечает также за регуляцию активности SOS1
и, возможно, других ион-транспортирующих систем при солевом стрессе на пост-трансляцион-
ном уровне. Экспрессия гена SOS1 и регуляция ион-транспортной активности обеспечивают
поддержание ионного гомеостаза при стрессе и вносят вклад в солеустойчивость растений
Хорошо изучена индукция гена Na+-АТФазы плазмалеммы (ENA1) у дрож-
жей 5. cerevisiae. Индукция осуществляется двумя независимыми механизмами.
При относительно низких концентрациях NaCl (0,1—0,3 М) сигнал передает-
ся через MAP-киназный путь — систему, активируемую неспецифически раз-
личными осмотиками (см. подразд. 8.2.5). Недавно транскрипционный фактор
Scol был идентифицирован как репрессор ENA1. Инактивируя Scol, осмо-
тик через MAP-киназный путь индуцировал экспрессию ENA1. Этот случай
интересен как пример негативной регуляции, при которой стрессор снимает
действующую в дострессовых условиях репрессию. Предполагается, что такого
рода негативная регуляция осуществляется при экспрессии многих защитных
генов.
Индукция ENA1 при высоких концентрациях NaCl (0,6—1,0 М) осуществ-
ляется через Са -активируемый SOS-путь с участием кальцинейрина (рис. 8.22).
Последний представляет собой важный детерминант солеустойчивости дрож-
жей, так как осуществляет положительную регуляцию гена Na -транспортиру-
ющей АТФазы ENA1, а также гена высокоафинного транспортера К Trkl.
Как отмечалось выше, степень устойчивости растений к действию стрессо-
ра характеризуется обратной корреляцией со скоростью роста. Антагонисти-
ческие отношения между процессами роста и акклимации реализуются через
549
Рис. 8.22. Пути передачи сигналов при экспрессии генов, отвечающих за (7) поддержа-
ние ионного гомеостаза, (2) оводненности клеток, (3) детоксикацию и (4) регуляцию
ростовых процессов (по J.-K.Zhu, 2001, с изменениями).
Через SOS-путь передаются сигналы, активирующие биосинтез ион-транспортирующих белков,
например №+/Н+-антипортера ПМ (S0S1). MAP-киназный путь отвечает за индукцию биосин-
теза осмолитов и соответственно за регуляцию осмотического и тургорного давления. Первич-
ные стрессы, ионный и осмотический, индуцируют вторичные стрессы, связанные с образова-
нием токсичных соединений, например АФК. Некоторые белки, индуцируемые засухой, засо-
лением или низкими температурами, обеспечивают устойчивость к вторичным стрессам. К ним
относится, в частности, белок Lea-типа, кодируемый геном RD29A. Эти белки участвуют в
детоксикациии и предотвращают повреждения биополимеров. Транскрипционные факторы CBF/
DREB регулируют экспрессию генов, вовлеченных в детоксикацию. Регуляция ионного гомеос-
таза, осмотического гомеостаза и детоксикации сопряжена с регуляцией клеточного деления и
роста растяжением
сеть путей сигнальной трансдукции. Такого рода сеть в упрощенном виде пред-
ставлена на рис. 8.22.
Из многообразия ответных реакций растения на высокие концентрации соли
виден полигенный характер солеустойчивости. Согласованное функциониро-
вание защитных систем, которые включаются в ответ на повышение наружной
концентрации соли, следует рассматривать в трех взаимосвязанных аспектах:
1) гомеостаз должен быть восстановлен в новых стрессовых условиях; 2) моле-
кулярные повреждения должны быть устранены; 3) рост должен быть возоб-
новлен, хотя и с меньшей скоростью.
8.3.6. РАЗЛИЧИЯ МЕЖДУ ГЛИКОФИТАМИ И ГАЛОФИТАМИ
Различия между защитными механизмами устойчивых и не устойчивых к
солевому и водному стрессам растений проявляется как на клеточном уровне,
так и на уровне целого организма. Клетки солеустойчивых растений по сравне-
550
нию с солечувствительными обладают более эффективными системами под-
держания водного и ионного гомеостаза. Скорости биосинтеза осмолитов и
уровни их аккумуляции в цитоплазме клеток галофитов выше, чем у гликофи-
тов, поэтому галофиты могут регулировать внутриклеточное осмотическое дав-
ление в более широком диапазоне водного потенциала почвенного раствора.
Локализованные в мембранах клеток устойчивых растений белки-экспортеры
Na из цитоплазмы обладают, по-видимому, более высокой активностью, чем
гомологичные транспортные системы у неустойчивых растений. В первую оче-
редь это относится к №+/Н+-антипортсру тонопласта и вакуолярной Н+-АТФазе,
поставляющей энергию для транспорта Na+ через тонопласт. За счет более высо-
кой активности системы (Ка+/Н+-антипортер + Н+-АТФаза тонопласта) вакуо-
лярные концентрации Na+ и градиенты электрохимического потенциала Na+ на
тонопласте у галофитов достигают более высоких значений, чем у гликофитов.
Между устойчивыми и неустойчивыми растениями существуют также раз-
личия и в ионной проницаемости (селективности) мембран, через которые
Na пассивно входит в цитоплазму. Проницаемость плазмалеммы для Na+ зави-
сит в основном от свойств ионных каналов и транспортеров, через которые он
пассивно поступает в клетки, однако в сравнительном аспекте ионные каналы
и транспортеры различающихся по солеустойчивости растений на молекуляр-
ном уровне практически не исследованы.
Устойчивые к NaCI растения, по-видимому, отличаются от неустойчивых
еще в одном аспекте: они имеют более эффективные системы детоксикации
ядовитых соединений, в том числе АФК, содержание которых при стрессе
возрастает.
Итак, солеустойчивые растения обладают более эффективными системами
биосинтеза осмолитов, ионного гомеостатирования и детоксикации. Этот вы-
вод подкрепляется недавними успехами в получении устойчивых к NaCI транс-
генных растений со сверхэкспрессией генов, вовлеченных в вышеперечислен-
ные функции. Приведем несколько примеров.
1. Чувствительные к высоким концентрациям солей и водному дефициту
растения табака были трансформированы геном пирролин-5-карбоксилатсин-
тетазы — лимитирующего звена в биосинтезе пролина. Ген был выделен из
засухоустойчивого растения маша (Vigna radiata). Сверхэкспрессия этого гена
увеличивала содержание пролина в клетках и повышала устойчивость расте-
ний табака к NaCI.
2. При сверхэкспрессии гена №+/Н+-антипортсра тонопласта, ответствен-
ного за депонирование Na+ в вакуоли, увеличивалась вакуолярная концентра-
ция Na+ и повышалась устойчивость к NaCI растений A. thaliana.
3. Защитное действие системы детоксикации ядовитых веществ при NaCl-
стрессе проявилось в трансформантах табака со сверхэкспрессией гена фер-
мента, обладающего комбинированной активностью глутатион-5-трансфера-
зы и глутатионпероксидазы. Более высокая ферментативная активность у транс-
формантов по сравнению с исходными растениями коррелировала при дей-
ствии NaCI с их более быстрым ростом.
Различия между солеустойчивыми и солечувствительными растениями на
уровне целого растения рассматривались в подразд. 8.3.4 в связи с обсуждением
вопроса об организации транспорта воды и ионов в системе почва—корень—
побег.
551
Физиологические функции и биохимические процессы у солеустойчивых и
солечувствительных растений (галофитов и гликофитов) различаются скорее в
количественном отношении, чем в качественном. За исключением солевых
желез, имеющихся лишь у некоторых видов, какие-либо особые признаки у
галофитов отсутствуют. Для осуществления жизненного цикла в условиях засо-
ления галофиты в целом используют те же самые исполнительные механизмы,
которые обнаружены у гликофитов. Типичный гликофит арабидопсис, соглас-
но проведенным исследованиям, содержит большинство генов (если не все),
найденных у галофитов. Считается, что высокая вариабельность растений по
чувствительности к засолению и степени их солеустойчивости обусловлена лишь
различиями в регуляции экспрессии их генов.
8.4. ИЗМЕНЕНИЯ ТЕМПЕРАТУРНЫХ УСЛОВИЙ
Важная роль температуры во взаимоотношениях организма и среды прояв-
ляется на всех уровнях его структурной и функциональной организации. Тем-
пературные сдвиги вызывают изменения структуры биополимеров, а следова-
тельно, и скоростей биохимических реакций и физиологических процессов. От
температуры в конечном счете зависит выживаемость организма, а географи-
ческое распределение видов на Земле происходит в соответствии с темпера-
турными градиентами.
8.4.1. ПОДДЕРЖАНИЕ МЕТАБОЛИЧЕСКОЙ АКТИВНОСТИ
И СТРУКТУРНОЙ ЦЕЛОСТНОСТИ БИОПОЛИМЕРОВ
ПРИ ИЗМЕНЕНИИ ТЕМПЕРАТУРНЫХ УСЛОВИЙ
Растения относятся к эктотермным (пойкилотермным) организмам, не спо-
собным поддерживать температуру своих органов и тканей на постоянном уровне.
Этим они отличаются от эндотермных (гомойотермных) организмов, сохраня-
ющих постоянство температуры тела (млекопитающие и птицы). Отсюда сле-
дует, что у растений приспособления к изменяющимся температурным усло-
виям не связаны со стратегией избежания, а основаны на механизмах резис-
тентности. Вместе с тем эндотермные механизмы в растительном мире могут
встречаться в зачаточной форме (см. подразд. 8.4.3).
Эктотермные организмы, в том числе растения, способны модифицировать
биополимеры своих клеток таким образом, чтобы компенсировать изменения
метаболизма, вызываемые температурными сдвигами. Новые разновидности
макромолекул появляются в ходе акклимации растений к изменившейся темпе-
ратуре. Модификации макромолекул могут происходить также в эволюцион-
ном масштабе времени, т.е. при адаптации к новым температурным условиям.
За счет модификаций биополимеров, происходящих в ходе эволюции, расте-
ниям различных климатических зон удается поддерживать относительно оди-
наковую интенсивность метаболизма. К такого рода модификациям биополи-
меров относится образование новых разновидностей ферментов с измененной
каталитической активностью. Изменения в эффективности катализа направле-
ны на компенсацию температурозависимых изменений скоростей реакций.
552
Поддержание скорости реакции на должном уровне может быть связано не
только с появлением новой разновидности молекулы фермента, но и с изме-
нением его содержания в клетке.
Помимо температурозависимых модификаций ферментов известны темпе-
ратурозависимые модификации липидов, связанные с изменениями их теку-
чести. От состояния мембранных липидов зависит каталитическая активность
локализованных в мембранах ферментов.
8.4.1.1. Компенсация температурных эффектов путем
изменения свойств ферментов
С увеличением температуры скорости ферментативных реакций возрастают.
Зависимость скорости реакции от температуры носит экспоненциальный ха-
рактер, что описывается уравнением Аррениуса:
к = Ае~Е^т, (8.3)
где к — константа скорости реакции; Еа — энергия активации реакции; R —
газовая постоянная; Т — абсолютная температура; А — коэффициент пропорцио-
нальности.
Из уравнения (8.3) следует, что энергия активации наряду с температурой
определяет скорость реакции. Скорость реакции тем выше, чем ниже энергия
активации. Функция ферментов состоит в снижении энергии активации фер-
ментативных реакций. Чем выше эффективность фермента, тем до более низ-
кого значения снижается энергия активации.
У эктотермных организмов, обитающих при пониженных температурах, фер-
менты характеризуются более эффективным катализом, т.е. более низкими зна-
чениями энергия активации реакций. У эктотермных организмов, обитающих
в условиях теплого климата, наоборот, ферменты менее эффективны, т.е. энер-
гия активации катализируемых ими реакций имеет более высокие значения.
Энергии активации ферментативных реакций изменяются также при аккли-
мации организмов к новым температурным условиям: при понижении темпера-
туры они снижаются, а при повышении возрастают. Таким образом, энергия
активации той или иной ферментативной реакции не является величиной посто-
янной: она изменяется в соответствии с температурными условиями среды оби-
тания. Это положение получило обоснование при изучении каталитических свойств
ферментов, выделенных из холодоустойчивых и теплолюбивых организмов, а
также организмов, акклимированных к различным температурам.
Изменения каталитических свойств ферментов, т. е. их энергий активации,
являются одним из важнейших типов приспособительных реакций организмов к
изменяющимся температурным условиям и происходят в результате модифика-
ций молекул ферментов.
Конформационные изменения фермента в ходе каталитической реакции
сопровождаются разрывом или образованием слабых связей (водородных, элек-
тростатических, ван-дер-ваальсовых и гидрофобных), при этом освобождается
или поглощается энергия. Энергетические сдвиги, связанные с изменением
конформации, лежат в основе различий в величинах энергий активации фер-
ментативных реакций.
553
Для конформационных изменений ферментов с более гибкой структурой
при катализе требуется меньше энергии. У фермента с жесткой структурой
конформационные изменения невозможны. Он был бы стабильным и долго-
вечным, но нереакционноспособным. Фермент может сохранять свою струк-
турную целостность и в то же время функционировать, когда между его ста-
бильностью и гибкостью существует равновесие. Ферменты организмов, при-
способленных к высоким температурам, для сохранения структурной целост-
ности и функциональной активности должны иметь более жесткую структуру.
Для ферментов организмов, приспособленных к низким температурам, необ-
ходима повышенная гибкость.
Стратегия приспособления к тому или иному температурному диапазону
состоит в изменении числа (или типа) слабых взаимодействий в молекуле фер-
мента. Приспособление к более высоким температурам связано с приобретени-
ем одной или нескольких дополнительных слабых связей. Дополнительные связи
повышают термостабильность белка и в то же время снижают его каталитиче-
скую эффективность (увеличивают энергию активации). Разновидности фер-
ментов, осуществляющих эффективный катализ при изменении температур-
ных условий, появляются в результате модификаций их первичной структуры.
Другим типом приспособительных реакций растений к изменяющимся тем-
пературным условиям является поддержание относительно постоянного соот-
ношения между константой Михаэлиса (Кт) и концентрацией субстрата [S].
Константа Михаэлиса для субстрата должна поддерживаться в пределах, при-
близительно соответствующих середине диапазона физиологических концент-
раций субстрата. При таком соотношении Кт и [S] используется значительная
часть каталитического потенциала фермента, и в то же время фермент далек
от состояния насыщения субстратом, т.е. сохраняет резерв для ускорения ре-
акции в ответ на повышение концентрации субстрата или регуляторные сиг-
налы.
Как показали эксперименты на выделенных ферментах, изменения темпе-
ратуры приводят к изменениям Кт. Константа Михаэлиса растет при повыше-
нии температуры. Вместе с тем и у растительных, и у животных организмов,
обитающих при различных температурных условиях, Кт ферментов и концен-
трации их субстратов в клетках различаются очень мало. Относительное посто-
янство Кт и [S] поддерживается и при акклимации организма к изменившейся
температуре.
Известно два пути поддержания постоянства Кт: 1) за счет изменений пер-
вичной структуры белка; 2) за счет изменения среды, в которой фермент функ-
ционирует.
Изменения первичной структуры белка, приводящие к изменениям Еа и
Кт, могут происходить в эволюционном масштабе времени и приводить к по-
явлению новых форм белка и соответственно новых конститутивных призна-
ков (адаптация). Новые разновидности фермента с кинетическими свойства-
ми, отвечающими новым температурным условиям, могут появляться также в
результате индукции стрессовых генов при акклимации растения к темпера-
турному сдвигу. Они могут появляться даже тогда, когда температура среды
колеблется в пределах всего лишь 6—8 °C. Поскольку многие растения обитают
в средах, где сезонные и даже суточные колебания температуры превышают
6—8 °C, фермент, представленный только одной формой, не мог бы функци-
554
онировать во всем диапазоне температур. Нужны две или больше разновидно-
сти фермента. Такие разновидности называются изоферментами. Изоцитратде-
гидрогеназа, например, существует в виде целого семейства изоферментов,
каждый из которых функционирует в узком температурном диапазоне. Извест-
на сезонность в появлении множественности форм ферментов.
Поддержание относительно постоянного отношения A"m/[S] часто связано с
изменением pH среды, в которой фермент функционирует. Хорошо известно,
что при повышении температуры в клетках растений снижается pH цитоплаз-
мы. У ряда ферментов это компенсирует изменения Кт, индуцированные тем-
пературными сдвигами.
8.4.1.2. Компенсация температурных эффектов путем
изменения внутриклеточного содержания ферментов
Многие растения способны компенсировать влияние температуры на ско-
рость биохимических реакций путем изменения содержания ферментов в клет-
ках. В первую очередь это относится к ферментам, которые лимитируют ско-
рость ключевых процессов метаболизма, таких, например, как фотосинтез и
дыхание. Так, активность фруктозо-1,6-бисфосфатазы в листьях коррелировала
со скоростью фотосинтеза при акклимации олеандра (Nerium oleander) к тем-
пературным сдвигам. У олеандра этот фермент — главное лимитирующее звено
в углеродном цикле и соответственно главный лимитирующий фактор в тем-
пературной компенсации фотосинтеза. Электрофорез показал, что число изо-
ферментов фруктозо-1,6-бисфосфатазы при акклимации оставалось постоян-
ным, но при этом изменялось количество фермента. При акклимации к низ-
ким температурам оно возрастало, а при акклимации к высоким — снижалось.
8.4.1.3. Термофильные бактерии — модель
для изучения механизмов термостабильности
Существуют организмы, способные жить в среде с температурой около 100 °C.
К таким организмам относятся термофильные бактерии, обитающие в тер-
мальных источниках. Thermus aquaticus, например, сохраняет жизнеспособность
при температурах до 95 °C. Белки термофильных бактерий необычайно устой-
чивы к тепловой денатурации. In vitro они выдерживают длительный прогрев
при 90 °C, сохраняя функциональную активность. Высокая структурная и фун-
кциональная устойчивость белков термофильных бактерий объясняется осо-
бенностями их аминокислотного состава. Повышение термостабильности обес-
печивается всего одной или двумя дополнительными электростатическими свя-
зями. Увеличение числа солевых мостиков служит универсальным механизмом
повышения термоустойчивости.
Сравнительные исследования трехмерной структуры белков (лактатдегид-
рогеназы, ферредоксина и др.), проведенные с помощью рентгеноструктур-
ного анализа, показали, что термоустойчивость белкам термофильных бакте-
рий придают также некоторые другие особенности их структуры. Гидрофоб-
ность внутренних частей белка у термофилов больше, чем у мезофилов (мик-
роорганизмов, обитающих при умеренных температурах). Поскольку при по-
555
вышении температуры гидрофобные взаимодействия стабилизируются, струк-
тура такой белковой молекулы становится более прочной. У белков термофи-
лов боковые цепи алифатических аминокислот удлинены, что усиливает гид-
рофобные взаимодействия. Кроме того, найдены замены аминокислот, повы-
шающие стабильность a-участков и p-слоев в молекулярной структуре. Таким
образом, устойчивость белков термофильных бактерий связана с изменениями
их первичной структуры.
Изменение суммарной свободной энергии, требуемой для стабилизации
белков термофилов, составляет 130—210 кДж/моль. Это соответствует энергии
лишь нескольких слабых связей, т. е. лишь несколько слабых связей требуется
для превращения мезофильного белка в термофильный. Для большинства ами-
нокислотных замен, необходимых для этой цели, достаточно заменить лишь
одно основание в триплете. Из этого следует, что образование термофильных
белков может легко осуществляться в процессе эволюции.
Устойчивость к высоким температурам придают термофилам также протек-
торные соединения. Аппарат белкового синтеза у Thermus thermophilus защищен
от денатурации полиаминами. У термофилов обнаружены также структурные
модификации тРНК и рибосомальных РНК. Они содержат больше Г-Ц-пар
оснований, чем гомологичные РНК мезофилов. Пары оснований Г—Ц более
термостабильны, чем пары А—У. У термофилов тРНК содержат также 5-ме-
тил-2-тиоуридин. Производные тиоуридина усиливают взаимодействия осно-
ваний в спиральной структуре тРНК.
8.4.1.4. Роль белков теплового шока в акклимации растений
к высоким температурам
Растения часто испытывают тепловой шок (ТШ), который может повреж-
дать органы и ткани, задерживать рост и даже вызывать гибель растений. ТШ
обычно возникает в результате действия высоких температур при недостаточ-
ной скорости транспирации. Растения могут стать толерантными к ТШ, если
предварительно на протяжении нескольких часов подвергнуть их действию
нслетальных высоких температур. В провесе акклимации вовлекаются белки теп-
лового шока (БТШ), синтез которых индуцируется предварительной тепловой
обработкой.
Некоторые из основных БТШ консервативны: показана высокая степень их
гомологии среди представителей прокариот и эукариот. Многие из БТШ фун-
кционируют как шапероны. Они восстанавливают структуру других белков,
денатурированных при тепловом воздействии. Некоторые БТШ синтезируются
в клетках в ходе развития растений и не индуцируются тепловым воздействи-
ем, однако их относят к БТШ на основании гомологии аминокислотных пос-
ледовательностей с БТШ, индуцируемых теплом.
БТШ подразделяют на пять семейств в соответствии с их молекулярными
массами.
БТШ-100 выполняют функцию шаперонов (см. подразд. 8.2.3.2). Они осуще-
ствляют распад белковых агрегатов, образующихся вследствие денатурации
белков при тепловом воздействии, и предотвращают ошибки в сворачивании
(folding) полипептидной цепи при формировании третичной структуры белко-
вых молекул.
556
БТШ-90 обнаружены в цитозоле, ядре и эндоплазматическом ретикулуме
(ЭР). Считается, что они тоже могут функционировать как молекулярные ша-
пероны, однако в отличие от типичных шаперонов, высокоспецифичны по
отношению к определенным белкам и вступают с ними в длительное взаимо-
действие.
БТШ-70 — АТФ-зависимые молекулярные шапероны. Некоторые члены этого
семейства экспрессируются конститутивно, другие индуцируются тепловым
или холодовым шоком. БТШ-70 обнаруживаются в цитозоле, ЭР, митохонд-
риях, пластидах и других органеллах. БТШ-70 участвуют в сворачивании и раз-
ворачивании (unfolding) полипептидных цепей, сборке и разборке четвертич-
ной структуры белка. Во время теплового шока БТШ-70 находятся в ядрышке
и мигрируют в цитоплазму после окончания теплового воздействия. N-терми-
нальная область БТШ-70, содержащая АТФ-связывающий домен, высококон-
сервативна, тогда как их С-концевая последовательность у различных организ-
мов вариабельна и определяет субстратную специфичность.
БТШ-60, по-видимому, также являются молекулярными шаперонами. Они
обнаруживаются в митохондриальном матриксе и строме хлоропластов. БТШ-60
не только индуцируются ТШ, но присутствуют в растениях также и при нор-
мальных температурах. Их главная функция состоит в сборке белковых молекул,
состоящих из субъединиц. Один из БТШ-60, кодируемый ядерным геномом,
представляет собой хлоропластный белок, который участвует в сборке рибуло-
зобисфосфаткарбоксилазы. In vitro БТШ-60 предотвращают белки от агрегации.
Низкомолекулярные БТШ с молекулярными массами от 15 до 30 кДа обна-
руживаются в клетках растений в больших количествах. Они распределяются
по различным компартментам клетки. Низкомолекулярные БТШ формируют
комплексы с молекулярными массами от 200 до 800 кДа. Хотя их роль во мно-
гом остается неясной, предполагается, что они вносят существенный вклад в
термотолерантность растений. Нет сведений о том, что они требуются для нор-
мальных клеточных функций, т.е. в отсутствие ТШ. Низкомолекулярные БТШ
не требуют АТФ. Показано, что БТШ-18,1 из гороха (Plsum sativum) предотв-
ращает агрегацию белков при высоких температурах.
Экспрессия генов многих БТШ контролируется транскрипционным факто-
ром HSF (heat shock factor), который взаимодействует с консервативной пос-
ледовательностью HSE (heat shock element) премоторной области генов БТШ
(рис. 8.23). HSF у A. thaliana (ATHSF1) мо-
жет связывать ДНК, только находясь в
форме тримера. ТШ требуется для триме-
ризации. ДНК-связывающий домен HSF
и тримеризация консервативны среди раз-
личных организмов. Механизм, контроли-
рующий тримеризацию, не ясен, однако
показано, что образование тримера HSF,
его связывание с ДНК и транскрипцион-
ная активность подавляются при снятии
ТШ. Растения, которые экспрессируют
HSF, демонстрируют повышенную теп-
лоустойчивость в отсутствие предвари-
тельной тепловой обработки.
ATHSF1
[ ] ] тример
|hSE| | Кодирующая область |
Рис. 8.23. Контроль экспрессии генов
белков теплового шока.
Экспрессия генов БТШ у растений конт-
ролируется транскрипционным фактором
HSF1, который взаимодействует с консер-
вативной последовательностью HSE про-
моторной области БТШ. HSF у Arabidopsis
thaliana (ATHSF1) может связывать ДНК,
находясь только в форме тримера
557
8.4.1.5. Температурозависимые модификации
липидного бислоя мембран
Как обсуждалось выше, при рассмотрении влияния температуры на белки
(подразд. 8.4.1.1), фермент может функционировать и в то же время сохра-
нять свою структурную целостность, если существует равновесие между гиб-
костью и стабильностью молекулы. Такое равновесие характерно и для мемб-
ранных структур, основу которых составляют липиды. Мембранным липидам
в нормальных условиях присуще жидкокристаллическое состояние (жидким
кристаллом называют анизотропную жидкость с признаками упорядоченнос-
ти). В этом состоянии мембрана сохраняет свою структурную целостность, но в
то же время липиды мембраны и локализованные в ней белки достаточно под-
вижны, чтобы осуществлять свои функции. Жидкокристаллическому состоя-
нию отвечает определенная вязкость липидного бислоя. Она выше, чем вяз-
кость липидов в состоянии их крайней текучести, когда исчезают признаки
упорядоченности, характерные для жидкого кристалла, и ниже вязкости ли-
пидов, находящихся в твердом гелеобразном состоянии. Переход липидов из
жидкокристаллического в гелеобразное состояние (La Lp) (см. подразд. 8.4.2.2;
рис. 8.28) и сопутствующее этому переходу возрастание вязкости бислоя про-
исходят при снижении температуры.
Вместе с тем поддержание мембраны в жидкокристаллическом состоянии с
соответствующей этому состоянию вязкостью имеет решающее значение для
функционирования локализованных в ней белков: ферментов, водных и ион-
ных каналов, различного рода переносчиков, компонентов электрон-транс-
портных цепей и пр. Особенно чувствительны к изменениям вязкости липидов
транспортные АТФазы. В связи с этим сохранение бислоя в жидкокристалли-
ческом состоянии при снижении температуры — одна из важнейших стратегий
приспособления растений к холоду. Эта стратегия состоит в снижении темпе-
ратуры фазового перехода мембранных липидов (La -> Lp). Обитание при высо-
ких температурах выдвигает задачу поддержания структурной целостности мем-
бран. Повышение температуры до некоторых критических пределов приводит
к сверхвысокой текучести липидов и дезинтеграции мембран, поэтому у тер-
моустойчивых растений модификации липидов направлены на повышение
структурной прочности бислоя и повышение температуры фазового перехода
липидов.
Температура фазового перехода и сопровождающее его изменение вязкости
зависят от длины углеводородных цепей и числа двойных связей жирных кис-
лот (ЖК), входящих в состав липидов. При наличии двойных связей, которые
находятся почти всегда в гщс-положении, в цепях образуются изгибы, и это
уменьшает энергию стабилизации бислоя, т.е. делает мембрану более текучей.
На прочность бислоя оказывают влияние и содержащиеся в нем стероиды, а
также ионный состав прилегающей к мембране жидкой фазы.
Основной механизм регуляции температуры фазового перехода, а следова-
тельно и поддержания нужной вязкости бислоя при изменении температурных
условий, состоит в изменении жирнокислотного состава липидов. Известны
два типа изменений химического состава липидов, которые вовлечены в тем-
пературозависимые модификации мембран: 1) изменение длины углеводород-
ных цепей в остатках ЖК и 2) изменение числа двойных связей в них. Для того
558
Таблица 8.2. Содержание линоленовой кислоты (С 18:3) в мембранных
препаратах из листьев озимой пшеницы Triticum aestivum, прошедшей
и не прошедшей закалку (% от суммарного содержания жирных кислот)
Общая микросомальная фракция Плазмалемма Тилакоиды
контроль закалка контроль закалка контроль закалка
4,8 9,4 18,2 28,3 6,8 9,9
Примечание. Растения выращивали при 20 °C. Закалку (акклимацию к низким температурам)
проводили при 2 °C (Г. В. Новицкая, Т. А. Суворова, 1994)
чтобы мембрана не затвердевала при понижении температуры, липиды долж-
ны содержать ЖК с меньшим числом углеродных атомов и с большим числом
двойных связей. Приспособление к повышенным температурам связано, на-
против, с включением в липиды ЖК с более длинными углеводородными
цепями и с меньшим числом двойных связей. Указанные способы сохранения
надлежащей вязкости мембран при адаптации и акклимации к изменяющимся
температурным условиям обнаружены не только у растений, но и у животных,
а также у прокариот. Иллюстрацией повышения степени ненасыщенности ЖК
в липидах мембран при акклимации растений к низким температурам являют-
ся данные, представленные в табл. 8.2.
Линоленовая кислота несет три двойные связи. Ее доля в общем содержа-
нии ЖК, входящих в состав липидов мембран, достаточно высока и может
служить показателем общего уровня ненасыщенности мембранных липидов.
При акклимации к холоду во всех фракциях мембран относительное содержа-
ние линоленовой кислоты возрастало.
Изменение степени ненасыщенности жирных кислот (ЖК) и длины ациль-
ных цепей в липидах контролируется с помощью ряда ферментов. К ним отно-
сятся десатуразы, тиоэстеразы и элонгазы.
Десатуразы жирных кислот. Десатуразы ЖК образуют семейство фермен-
тов, катализирующих превращение одинарной связи между атомами углерода
—СН2—СН2— в двойные связи —СН=СН— в ацильных цепях ЖК. Предпола-
гается, что десатуразы связывают трехвалентное железо, которое формирует
активный комплекс с атомами кислорода Fe—О—Fe. Реакции, катализируе-
мые десатуразами, называют реакциями десатурации, образующиеся двойные
связи между атомами углерода — ненасыщенными связями, а жирные кислоты с
несколькими ненасыщенными связями — полиненасыщенными жирными кисло-
тами (ПНЖК). Десатурация требует молекулярного кислорода и протекает в
аэробных условиях.
Десатурация осуществляется через сложную цепь биохимических превраще-
ний, в котором десатураза подключается на конечной стадии (рис. 8.24). Суть
происходящих превращений состоит в сопряжении окисления ЖК с восста-
новлением О2. Процесс десатурации можно представить следующим образом.
Из 4 электронов, требующихся для восстановления О2 и образования 2Н2О,
два электрона поставляются молекулой ЖК, которая при этом окисляется, а
источником двух других является НАДФН. Перенос электронов от НАДФН к
О2 происходит через цепь переносчиков, включающей флавопротеин и ферре-
доксин. Участвующие в десатурации переносчики электронов локализованы в
559
Фотосинтез
2HjO
Рис. 8.24. Реакции, вовлеченные в процесс десатурации жирной кислоты с участием
фермента десатуразы.
Окисление жирной кислоты и образование двойной связи в ацильной цепи, катализируемое
десатуразой, сопряжено с восстановлением молекулы О2. Из четырех электронов, необходимых
для восстановления молекулы О2, два электрона поставляются молекулой жирной кислоты (ЖК),
а два других поступают от НАДФН (НАДН) через цепь переносчиков электронов, локализован-
ных в мембранах пластид или эндоплазматического ретикулума. ФП — флавопротеид
мембранах эндоплазматического ретикулума или пластид. При этом десатураза
может находиться в свободной или мембраносвязанной форме.
Десатуразы подразделяют на несколько типов, в зависимости от того, осу-
ществляют ли они превращение ЖК, находящейся в свободной форме или в
составе липида, и от того, какая ЖК используется в качестве субстрата. Деса-
туразы, использующие в качестве субстратов свободные ЖК, позволяют регу-
лировать липидный состав мембран и, следовательно, их текучесть еще до
образования липидов и формирования самой мембраны. Иными словами, те-
кучесть мембраны может определяться уже на стадии предварительного синте-
за ЖК. Синтезированные в этом случае ЖК с определенным числом ненасы-
щенных связей транспортируются затем к местам встраивания в мембраны. Де-
сатуразы различаются также специфичностью по отношению к положению
остатка ЖК на глицериновой молекуле и к позиции десатурации в ацильной
цепи.
Липидный состав мембран и степень ненасыщенности ЖК варьируют в
широких пределах при изменении температуры, а также других условий, на-
пример интенсивности освещения, водного потенциала и ионного состава среды.
Десатуразы у растений играют важную роль в адаптации и акклимации к изме-
няющимся условиям среды. В настоящее время клонированы гены некоторых
десатураз растительного происхождения. Клонирование сделало возможным
изучение экспрессии генов и роли модификаций липидного состава мембран в
приспособительных реакциях. Экспрессия генов ряда десатураз у растений за-
висит от температуры, что позволяет говорить об участии десатураз в процес-
сах акклимации к изменяющимся температурным условиям. Экспрессия генов
других десатураз у растений не зависит от температуры, т. е. является конститу-
тивной. Регуляция экспрессии генов десатураз осуществляется на транскрип-
ционном уровне. Активация десатурации при снижении температуры сопряже-
на с накоплением мРНК генов тех десатураз, которые отвечают за синтез ПНЖК.
Накопление мРНК этих генов приводит в свою очередь к повышению уровня
синтеза соответствующих белков и, как следствие, к индукции синтеза ПНЖК.
560
Продукты десатуразных реакций ПНЖК регулируют посредством обратной
связи активность десатураз.
У высших растений устойчивость к низким температурам коррелирует со
способностью клеток синтезировать ПНЖК. Так, у A. thaliana мутанты fad5 и
fad6, дефицитные по синтезу локализованных в хлоропластах десатураз паль-
митиновой и олеиновой ЖК соответственно, характеризуются хлорозом лис-
тьев, замедленным ростом и измененной формой хлоропластов при понижен-
ных температурах. Экспрессия Fad7, гена десатуразы A. thaliana, отвечаюшего
за синтез триеновых (с тремя ненасыщенными связями) ЖК в хлоропластах,
в N. tabacum приводит к повышению устойчивости семян растений табака к
низким температурам. В то же время блокирование экспрессии Fad7позволяет
растениям легче приспосабливаться к повышенным температурам. При наруше-
нии функций соответствующих десатураз изменяются физические свойства мем-
бран, что выражается в смещении температуры фазового перехода из жидко-
кристаллического в гелеобразное состояние в область более высоких температур.
Молекулярные механизмы регуляции экспрессии генов десатураз при изме-
нении температурных условий в значительной степени остаются нераскрыты-
ми, однако общие принципы такой регуляции понятны уже сейчас (рис. 8.25).
При снижении температуры уменьшается текучесть мембраны. Клетка воспри-
нимает это изменение с помощью сенсора, расположенного, по-видимому, в
мембране. Сигнал от сенсора передается к регуляторным молекулам или не-
посредственно воспринимается регуляторными последовательностями генов
десатураз. Вследствие этого индуцируется экспрессия генов, что приводит к
усиленному синтезу десатураз в клетке и ускорению синтеза ПНЖК в мембран-
ных липидах. В конечном счете восстанавливаются исходная текучесть мембран
и биохимическая активность связанных с ними систем, в частности актив-
ность ФС1 и ФСН в хлоропластах, а также АТФ-синтезирующих комплексов.
Итак, растения, способные синтезировать ПНЖК в повышенных количе-
ствах, оказываются более устойчивыми к холодовому стрессу. Напротив, сниже-
ние доли ПНЖК в мембранных липидах, приводящее к снижению молекуляр-
Рис. 8.25. Индукция десатуразных генов при акклимации растений к холоду.
Десатурация необходима для поддержания надлежащей вязкости липидного бислоя и функци-
ональной активности мембраны при изменившихся температурных условиях (Д. А. Лось, 2001)
561
ной подвижности липидного бислоя, должно вносить вклад в термотолерант-
ность растений. Последнее предположение подтверждается получением транс-
генных растений табака, в которых снижена экспрессия хлоропластной деса-
туразы, отвечающей за образование триеновых ЖК. Полученные растения ока-
зались более устойчивыми к высоким температурам, чем исходные растения.
Тиоэстеразы и элонгазы жирных кислот. Как отмечалось выше, текучесть
липидного бислоя определяется не только степенью ненасыщенности ЖК, но
и длиной углеводородных цепей. Число углеродных атомов в цепи зависит от
функций тиоэстераз и элонгаз ЖК. Тиоэстеразы отвечают за терминацию уд-
линения ацильной цепи и обеспечивают преимущественное накопление С8_10,
С12, С14 и С16_18 ЖК. Элонгазы осуществляют удлинение цепи ЖК до 20, 22 и
24 углеродных атомов. Гены некоторых тиоэстераз и элонгаз из различных ви-
дов растений клонированы.
8.4.1.6. Энергия активации ферментативных реакций,
протекающих в мембранах
Функционирование белков, связанных с мембраной, часто зависит от ло-
кальной вязкости их липидного микроокружения. Активность многих мемб-
ранных ферментов снижается при возрастании вязкости (снижении текучес-
ти) липидов мембраны. Как обсуждалось в подразд. 8.4.1.1, ферментный белок
должен иметь возможность изменять свою конформацию во время катализа.
Для этого нужно, чтобы могли перемещаться и окружающие его молекулы
липидов. Если липидная фаза обладает низкой вязкостью, то изменения кон-
формации фермента не требуют больших затрат энергии. При высокой вязкос-
ти липиды необходимо локально расплавить, для чего требуется дополнитель-
ная энергия. Температура плавления липидов должна устанавливаться на та-
ком уровне, при котором поддерживается их оптимальная текучесть в физио-
логическом диапазоне температур. Следует, однако, помнить, что текучесть
мембраны не должна быть чрезмерной, так как в слишком жидком липидном
бислое может произойти дезинтеграция многокомпонентной системы.
Связь температурной зависимости активности локализованного в мембране
фермента с температурой плавления липидного бислоя мембраны может быть
продемонстрирована с помощью графика Аррениуса — зависимости логариф-
ма константы скорости ферментативной реакции от обратной величины абсо-
лютной температуры 1/Т (рис. 8.26). Такая зависимость выражается отрезком
прямой линии, так как
F 1
1пЛ = 1пА- ——,
R Т
что следует из уравнения (8.3). Точки перегиба на графиках отражают измене-
ния свойств липидов. При температуре фазового перехода наклон прямой ли-
нии резко меняется. Из наклона для данного температурного диапазона может
быть рассчитана энергия активации ферментативной реакции. При температу-
рах более низких, чем температура фазового перехода, энергия активации выше,
так как для конформационных изменений белка необходимо дополнительно
разорвать некоторые слабые химические связи в липидах, находящихся в геле-
образном состоянии. При температурах более высоких, чем температура фазо-
562
Рис. 8.26. Кривые Аррениуса (зависимость логариф-
ма константы скорости реакции от величины, об-
ратной абсолютной температуре) для локализо-
ванного в мембране фермента (по П.Хочачка,
Дж.Сомеро, 1988, с изменениями).
Точки перегиба на кривых (Тпл) отражают температуры
фазовых переходов мембранных липидов. У организмов,
адаптированных (аккпимированных) к холоду (7), фазо-
вый переход липидов происходит при более низкой тем-
пературе, чем у организмов, адаптированных к теплу (2).
Различия в температурах фазовых переходов связаны с раз-
личиями в липидном составе их мембран, например, в
степени ненасыщенности жирных кислот или в длине
ацильных цепей и т.д. Из наклона отрезков прямых линий
можно рассчитать энергии активации Еа ферментативной
реакции выше и ниже температуры фазового перехода
вого перехода, липиды находятся в жидкокристаллическом состоянии и тре-
буется меньше энергии для конформационных изменений белка. При аккли-
мации к холоду происходит сдвиг точки перегиба на графиках, отражающий
смещение температуры фазового перехода к более низким значениям. Это свя-
зано с изменением химического состава мембраны — с включением в состав
липидов ЖК, имеющих меньшее число углеродных атомов и большее число
ненасыщенных связей. Повышение устойчивости к теплу обусловлено возрас-
танием вязкости (снижением текучести) липидного бислоя и стабилизацией
взаимодействий между компонентами мембран.
Тепловые повреждения приводят к дезорганизации процессов, протекаю-
щих в мембранах. В частности, в тилакоидах нарушается механизм переноса
энергии: блокируется перенос энергии от хлорофилла а к хлорофиллу b и из-
меняется распределение энергии между ФСП и ФС1. В этих условиях возрастает
Рис. 8.27. Влияние температуры выращивания и температуры проведения эксперимента
на скорость фотосинтеза при нелимитирующем освещении (А) (по Bjorkman et al., 1980)
и интенсивность флуоресценции листьев (Б) (по Raison et al., 1980) у Nerium oleander.
Растения были акклимированы к 20 и 45 С°. Скорость фотосинтеза выражена в наномолях по-
глощенного СО2 на 1 см2 поверхности листа в 1 с
563
флуоресценция хлорофилла, что объясняется следующим образом. Свободный
хлорофилл флуоресцирует очень сильно. В интактных хлоропластах флуорес-
ценция низка, так как энергия возбуждения хлорофилла улавливается реакци-
онными центрами. Наблюдаемые in vivo при тепловом воздействии усиление
флуоресценции и тесно коррелирующее с ним подавление фотосинтеза связа-
ны с распадом хлорофилл-белковых комплексов и переходом хлорофилла в
свободное состояние (рис. 8.27). Температурный диапазон, в котором происхо-
дит усиление флуоресценции и снижение скорости фотосинтеза, зависит от
того, к какой температуре были акклимированы или адаптированы растения.
Пустынные растения сверхустойчивы к высоким температурам. Они характе-
ризуются также высокой термоустойчивостью процесса фотосинтеза и термо-
стабильностью тилакидных мембран, что в первую очередь связано с особен-
ностями химического состава и структуры их липидного бислоя.
8.4.2. УСТОЙЧИВОСТЬ РАСТЕНИЙ К ЗАМОРАЖИВАНИЮ
Растениям, обитающим в зоне отрицательных температур, приходится не
только поддерживать внутриклеточные биополимеры в функционально актив-
ном состоянии, но и регулировать процессы образования льда в тканях. Внут-
риклеточное образование льда неизбежно приводит к гибели как теплолюби-
вых, так и морозоустойчивых растений, так как образующиеся внутри клеток
кристаллы льда разрывают мембраны, приводя к нарушениям функций кле-
точных органелл. Теплолюбивые растения погибают даже тогда, когда лед об-
разуется в межклетниках. Растения холодного климата, а также мезофиты (ра-
стения умеренного климата) выдерживают образование льда в межклеточной
среде. У морозоустойчивых растений выработались механизмы, которые пре-
пятствуют образованию льда внутри клеток. Это можно рассматривать как важ-
нейшую стратегию приспособления растений к отрицательным температурам.
8.4.2.1. Дегидратация клеток как механизм,
предотвращающий внутриклеточное образование льда
Один из механизмов, предотвращающих внутриклеточное образование льда,
сопряжен с выходом воды из клеток в экстрацеллюлярное пространство. При
падении температуры до отрицательных значений в экстрацеллюлярной среде
образуются кристаллы льда. Лед формирует градиент водного потенциала, на-
правленный из клеток в межклетники. Выход воды из клеток по градиенту вы-
зывает дальнейшую дегидратацию клеток и рост кристаллов льда в межклетни-
ках, в то же время снижается вероятность образования внутриклеточного льда.
Образование внеклеточного льда и связанный с этим отток воды из клеток
стимулируются специальными веществами, которые клетки экскретируют в
апопласт. Являясь центрами кристаллизации воды, они повышают температур-
ный порог зародышеобразования льда. Такие соединения называются гетеро-
генными нуклеаторами, а стимулируемый ими процесс зародышеобразования
льда — гетерогенной нуклеацией. Гетерогенные нуклеаторы могут быть белко-
вой, фосфолипидной или полисахаридной природы. Гетерогенными нуклеато-
рами становятся различные твердые включения, выполняющие роль «затра-
564
вок» для образования кристаллов. Часто такими «затравками» служат эпифит-
ные бактерии, населяющие межклеточную среду.
От гетерогенной отличают гомогенную нуклеацию. Она происходит в среде,
не содержащей нуклеаторов, и характеризуется гораздо более низкой порого-
вой температурой зародышеобразования льда, чем гетерогенная нуклеация. При
гомогенной нуклеации кристаллы льда не формируются и не растут до тех
пор, пока достаточное число молекул воды не сформирует зародыш льда.
Гомогенную нуклеацию можно получить, если чистую воду диспергировать
на мелкие капли. В этом случае вода замерзает только при -38 °C. При гомоген-
ной нуклеации водные растворы низкомолекулярных веществ, например со-
лей, сахаров и полиспиртов, за счет их криоскопического действия замерзают
при еще более низких температурах. Благодаря гетерогенным нуклеаторам лед
в межклетниках образуется при более высоких температурах, чем те, которые
требуются для замерзания внутриклеточной среды (как отмечалось выше, об-
разование льда в клетках более губительно, чем в межклетниках).
Выход воды наружу при внеклеточном образовании льда хотя и предотвра-
щает образование внутриклеточного льда, тем не менее сопровождается не-
благоприятными для клеток эффектами дегидратации. В связи с этим адапта-
ция и акклимация растений к низким температурам включает формирование
механизмов, которые повышают резистентность клеток к обезвоживанию. Счи-
тается, что морозоустойчивость мезофитов в первую очередь определяется спо-
собностью их клеток выдерживать дегидратацию. Защита клеток при дегидра-
тации, вызываемой отрицательными температурами, так же, как при засухе и
солевом стрессе, связана с биосинтезом осмопротекторов, прежде всего низ-
комолекулярных сахаров и полиспиртов. Одна из основных функций этих ве-
ществ состоит в защите внутриклеточных биополимеров. Специфической фун-
кцией осмопротекторов при дегидратации клеток, вызванной низкими темпе-
ратурами, является понижение температуры замерзания внутриклеточной среды.
Остается неясным, как соотносится выход воды из клеток при образовании
льда с увеличением внутриклеточного осмотического давления, происходя-
щего в результате накопления осмопротекторов.
8.4.2.2. Последствия обезвоживания клеток
Потеря воды клетками при внеклеточном образовании льда приводит к умень-
шению объема протопластов и концентрированию содержащихся в них веществ,
некоторые из них при повышенных концентрациях становятся токсичными
для клеток. К таким веществам относятся неорганические ионы, например Na+
и С1 , активные формы кислорода и ряд органических соединений. Увеличение
внутриклеточных концентраций ионов и накопление токсичных соединений в
свою очередь приводит к изменениям конформации биополимеров, а в наибо-
лее острых случаях — к денатурации белков. При этом может происходить об-
разование или разрыв ковалентных связей в белках. Одним из наиболее часто
встречающихся эффектов такого рода является окисление SH-групп и образо-
вание дисульфидных связей между различными участками полипептидной цепи
или различными цепями.
Дегидратация клеток оказывает непосредственное действие на структурное
состояние липидов мембран. Мембраны в норме связывают до 30 —50 % воды
565
Рис. 8.28. Фазовые переходы липидов мембран при изменениях температуры и содержа-
ния воды в клетках:
La — ламеллярная форма в жидкокристаллическом состоянии; £() — ламеллярная форма в твер-
дом, гелеобразном состоянии; Нп — гексагональная форма
Смешанная форма
(в расчете на их сухую массу). Взаимодействуя с заряженными и полярными груп-
пами белков и фосфолипидов, вода стабилизирует структуру мембран. Дегидра-
тация вызывает обратимые и необратимые (в зависимости от степени дегидрата-
ции) нарушения мембранных структур (рис. 8.28). На начальной стадии потери
воды мембраной липиды переходят из жидкокристаллического в гелеобразное
состояние (£а-> £р). При более сильной дегидратации, когда остается не более
20 % воды, липиды переходят в гексагональную форму (£р -> Яи). В мембранах
клеток, устойчивых к высушиванию, гексагональная форма не образуется даже
когда остается 2—11% воды. Изменения структуры мембран в ответ на потерю
ими воды при внеклеточном образовании льда могут накладываться на эффек-
ты, вызванные непосредственными температурными сдвигами. Дегидратация
липидов повышает температуру фазового перехода La^> Lp, т.е. термотропный
переход из жидкокристаллического состояния в гелеобразное при дегидратации
мембраны осуществляется при более высокой температуре. Можно сказать, что
неблагоприятное действие низкой температуры при дегидратации усиливается.
При быстром замораживании выделенных протопластов ржи при -10 °C,
которое сопровождалось потерей ими воды, в липидах мембран происходило
образование Яи-фазы. При медленном снижении температуры до -10 °C вода в
протопластах сохранялась, и они переходили в переохлажденное состояние
(см. подразд. 8.4.2.3). Образования Яц-фазы при этом не наблюдалось. Повыше-
ние осмотического давления среды, в которой находились переохлажденные
протопласты, путем внесения в нее сорбитола сопровождалось выходом воды
из протопластов и образованием Яп-фазы. При этом утрачивалась осмотичес-
кая реакция протопластов. Процент гибели протопластов коррелировал с чис-
лом участков мембраны, находящихся в гексагональной фазе. Следует отме-
тить, что акклимация растений к отрицательным температурам (закалка) сни-
жает температуру перехода мембранных липидов в гексагональную фазу. У про-
топластов, выделенных из закаленных растений, даже при -35 °C в мембранах
почти не было участков, содержащих Яц-фазу.
566
Сильная дегидратация может стать причиной нарушения связи между ли-
пидами и белками мембран. При внеклеточном образовании льда, особенно у
неустойчивых к замораживанию растений, в мембранах появляются участки,
не содержащие белков. В переохлажденных клетках лишенные белков участки
отсутствуют (см. подразд. 8.4.2.3), указывая на то, что потеря белков связана не
столько с влиянием низкой температуры, сколько с дегидратацией клеток.
К наиболее общим эффектам обезвоживания клеток, наблюдаемым у многих
растений при действии низких температур, засухи и почвенного засоления, от-
носится деградация фосфолипидов мембран вследствие активации фосфолипа-
зы D. Роль активатора играют ионы Са2+, концентрация которых в клетках не-
контролируемым образом повышается при деструктивных изменениях клеточ-
ных мембран. Расщепление фосфолипазой D фосфатидилхолина стимулирует
образование перекисных соединений липидов свободнорадикальной природы,
накопление малонового диальдегида и других токсичных соединений (см. под-
разд. 8.6).
Перечисленные выше изменения в белках и липидах вызывают различного
рода нарушения метаболизма и один из них — подавление биохимической и
фотохимической активности хлоропластов. В частности, снижается скорость
ассимиляции углерода и фотофосфорилирования. Подавление фотофосфори-
лирования связано с увеличением протонной проводимости тилакоидов и сни-
жением АТФ-синтазной активности. Сниженное содержание воды и высокие
концентрации ионов в клетках ведут к потере тилакоидами сопрягающего фак-
тора АТФ-синтазы CFj и пластоцианина. При отделении CFj открывается АТФ-
синтазный канал; это ведет к увеличению Непроводимости мембраны, сни-
жению генерируемой в ходе переноса электронов Дцн* и соответственно к сни-
жению уровня синтезируемого АТФ. Такой эффект наблюдается при отрица-
тельных и низких положительных температурах, а также при засухе и почвен-
ном засолении. Следует отметить, что осмолиты, в частности сахара и поли-
спирты, защищают тилакоиды. Они предотвращают отделение CF] от CF0,
поддерживая этим низкую Непроводимость тилакоидов и, следовательно, вы-
сокий уровень сопряжения переноса электронов и фотофосфорилирования.
При дегидратации клеток, вызванной образованием внеклеточного льда, и
последующем оттаивании возрастает проницаемость плазмалеммы для ионов
и ряда органических веществ. Тонопласт при этом тоже, как правило, повреж-
дается. Об этом свидетельствует возросший экзоосмос веществ, содержащихся
в вакуоли.
8.4.2.3. Механизм переохлаждения
Выход воды из клеток и образование внеклеточного льда, стимулируемое
гетерогенными нуклеаторами, происходит при относительно высоких отри-
цательных температурах. Для тканей многих древесных пород пороговые тем-
пературы внеклеточного образования льда лежат в диапазоне от -2° до -5 °C.
В листьях высокоустойчивой к морозу озимой ржи (Secale cereale) нуклеация
льда в межклетниках происходит при -5°...-12 °C, тогда как нижний темпера-
турный предел выживаемости этого растения составляет -30°...-35 °C. Остав-
шаяся в клетках вода после образования льда в межклеточной среде не замер-
зает при последующем снижении температуры. Такая вода называется переох-
567
лажденной. Температура образования льда в клетках, выше которой вода нахо-
дится в переохлажденном состоянии, приблизительно совпадает с нижним
температурным пределом выживаемости растения.
В основе способности растений сохранять воду в клетках в жидком состоя-
нии при очень низких отрицательных температурах лежит так называемый ме-
ханизм переохлаждения. Он чрезвычайно важен в обеспечении резистентности
растений к замораживанию.
Для исследования способности клеток к переохлаждению используют тер-
мический дифференциальный анализ. Ткань или орган растения постепенно
охлаждают и с помощью термопар регистрируют разность температур между
охлаждаемым и котрольным образцами. Образование льда — процесс экзотер-
мический, т. е. происходит с выделением тепла, и на термограмме ему соответ-
ствует экзотермический пик, который называется низкотемпературной экзо-
термой {НТЭ). Дифференциальный термический анализ был сделан для мно-
гих растений. Рекордно низкая температура замерзания клеток была установле-
на для таких растений холодного климата, как черный ясень {Fraxinus nigra)
(-47 °C) и виргинский можжевельник (Juniperus virginiana) (-52 °C). У растений
теплого климата НТЭ лежат в области -10°...-20 °C. Низкие температуры за-
мерзания внутриклеточной среды характерны для цветочных почек древес-
ных и травянистых растений, а также зародышей семян. Переохлаждение
характеризуется температурным гистерезисом, т.е. различием в температуре
замерзания и последующего оттаивания. Например, если НТЭ выявляется при
-30°...-40 °C, то оттаивание может происходить при -20°C.
Чтобы понять, на чем основана способность клеток к переохлаждению,
необходимо ответить на два вопроса: 1) почему внутриклеточная вода не за-
мерзает до НТЭ, т. е. что препятствует образованию льда в клетках и 2) почему
не замерзающая до НТЭ вода не выходит из клеток?
Ответ на первый вопрос следует искать в необычных свойствах внутрикле-
точной воды, в наличии в клетках низкомолекулярных криопротекторов и в
отсутствии гетерогенных нуклеаторов. Значительная часть внутриклеточной воды
находится в связанном состоянии. В связывании воды участвуют как биополи-
меры клетки, так и осмопротекторы, особенно те из них, которые содержат
большое число гидроксильных групп. Гидратная оболочка маннитола содер-
жит, например, 200—250 молекул воды. Необычные свойства внутриклеточ-
ной воды связаны также с наличием в клетках многочисленных поверхностей
раздела фаз. Вода вблизи этих поверхностей может сильно переохлаждаться.
Моделью такой системы являются тонкие кварцевые капилляры, вода в них
замерзает при -34 °C. В ионообменных смолах ячеистого строения вода также
переохлаждается, замерзая при -30 °C. Остается неясным, участвуют ли в пре-
дотвращении образования внутриклеточного льда высокомолекулярные анти-
фризы (см. подразд. 8.4.2.4).
Ответ на второй вопрос связан прежде всего с анатомическими особеннос-
тями тканей, способных к переохлаждению. Отсутствие оттока воды в меж-
клетники в таких тканях нельзя объяснить низкой водной проницаемостью
плазмалеммы. Препятствие для миграции воды из клеток создают анатомиче-
ские барьеры.
Отсутствие оттока воды из клеток в тканях цветочных почек у древесных
растений обусловлено лигнификацией и суберинизацией клеточных стенок. Нео-
568
бычно жесткие и упругие стенки паренхимных клеток древесины препятству-
ют сжатию связанных с ними протопластов. За счет этого водоотнимающие
силы развивают в клетках отрицательное тургорное давление, понижающее
водный потенциал клеток. Важная роль в удержании воды клетками отводится
также осмолитам, концентрация которых в клетках морозоустойчивых расте-
ний высока и повышается при акклимации к отрицательным температурам.
Высокое содержание в клетках осмолитов полигидроксильной природы не толь-
ко отвечает за повышение внутриклеточного осмотического давления (сниже-
ние водного потенциала), но и приводит, как уже отмечалось, к увеличению
уровня связанной воды.
Механизм переохлаждения имеет ряд преимуществ по сравнению с меха-
низмом, основанным на внеклеточном образовании льда. При обезвоживании
клеток наблюдаются различного рода нарушения структуры макромолекул,
биохимических процессов и физиологических функций. При переохлаждении
потери воды минимальны, что важно для активно метаболизирующих тканей,
например тканей развивающегося из почки побега. Наблюдаемые весной бур-
ный рост и развитие побега из почки при дегидратации потребовали бы пред-
варительной репарации меристематических клеток, на что необходимо вре-
мя. В случае механизма переохлаждения растения при повышении температуры
могут сразу перейти к активной вегетации, так как в этом случае все структу-
ры остаются неповрежденными. Состояние переохлажденных клеток можно
охарактеризовать как физиологический покой. В этом состоянии отсутствуют рост
и дифференцировка, но идут процессы поддержания. С процессами поддержа-
ния связано сохранение дыхания и фотосинтеза. У ели (Picea abies), например,
фотосинтез наблюдается при -14 °C. У многих морозоустойчивых растений ды-
хание сохраняется при -18°...-20°C. Механизм переохлаждения типичен для
жизненно важных тканей и органов, которые переходят в активное состояние
сразу при весеннем потеплении. К ним относятся почки, генеративные орга-
ны, паренхимные клетки древесины, клетки проводящих пучков. У хвойных
механизм переохлаждения типичен для тканей листьев. В этих органах и тканях
образование льда крайне нежелательно не только внутри клеток, но и в меж-
клетниках. В то же время процесс образования внеклеточного льда, начавший-
ся в каком-то одном месте, быстро распространяется по растению и может
захватить жизненно важные части растения. Как защита от этого, у зимостой-
ких растений сформировались механизмы, регулирующие образование и рас-
пространение льда по межклетникам и сосудам ксилемы.
8.4.2.Д. Биологические антифризы
В клетках некоторых растений синтезируются высокомолекулярные соеди-
нения, тормозящие процессы нуклеации и роста кристаллов льда. Эти соеди-
нения получили название биологических антифризов. Их биосинтез и экскреция
в межклеточную среду являются ткане- и органоспецифическими. Антифризы
можно выделить экстракцией из апопласта. Сведения об антифризной актив-
ности внутри клеток отсутствуют, поэтому считается, что они препятствуют
внеклеточному образованию льда, особенно в тех органах и тканях, чьи клет-
ки должны сохранить максимальное количество воды и находиться в переох-
лажденном состоянии. У зимующих растений антифризная активность обнару-
569
жена в клеточных стенках всех органов. Она меняется в зависимости от сезона
и возрастает при акклимации растений к отрицательным температурам. В осен-
ний период при закалке экскреция антифризов в межклеточную среду усили-
вается.
Известны антифризы белковой, гликопротеиновой и полисахаридной при-
роды. У озимой ржи обнаружено шесть полипептидов с молекулярными масса-
ми 13, 19, 26, 32, 34 и 36 кДа, обладающих антифризной активностью. Из
паслена горько-сладкого {Solarium dulcamara) выделен антифризный глико-
протеин (молекулярная масса 67 кДа), содержащий в качестве углеводного
компонента остатки галактозы. Из антифризов полисахаридной природы изве-
стны арабиноксиланы. Они выделены из клеточной стенки прошедшей закал-
ку озимой ржи. Арабиноксиланы состоят из основных ксилановых цепей с бо-
ковыми цепями, образованными остатками арабинозы. Считается, что дей-
ствие антифризов основано на наличии в их молекулах большого числа поляр-
ных группировок. В соответствии с гипотезой А. де Фриза, в гликопротеиновых
антифризах полярные ОН-группы углеводных остатков образуют сплошной пра-
вильный фронт, располагаясь в одной плоскости вдоль линейной молекулы
антифриза. Такая геометрия молекулы способствует ее сильному взаимодей-
ствию с молекулами Н2О в кристалле льда. За счет образующихся водородных
связей молекула антифриза прочно адсорбируется на кристалле, что создает
термодинамический барьер для присоединения к кристаллу новых молекул
Н2О. Таким образом осуществляется блокада роста кристаллов льда.
8.4.2.5. Анатомические барьеры
Важная роль в резистентности к замораживанию принадлежит анатомиче-
ским барьерам, которые препятствуют распространению процесса образования
льда по сосудам ксилемы. Эту роль можно оценить в полной мере, если учесть,
что именно по ксилеме процесс нуклеации и роста кристаллов распространя-
ется с наибольшей скоростью. Одним из типов анатомических барьеров для
распространения образования льда является сегментация сосудов ксилемы:
сосуды прерываются зонами, состоящими из трахеид. Сегментация сосудов
обнаружена у многих зимостойких злаков и древесных растений. В почках неко-
торых растений сосуды ксилемы отделены от прилегающих к ним паренхим-
ных клеток слоем аморфного вещества пектиновой природы, создающим не-
преодолимую преграду для распространения нуклеации льда в меристему.
8.4.2. Б. Роль белков холодового шока в акклимации растений
к замораживанию
Растения отвечают на низкотемпературную обработку экспрессией ряда ге-
нов. Продукты этих генов получили название белков холодового шока (БХШ).
Значительная часть этих белков идентифицирована, однако функциональная
роль большинства из них остается неясной. Низкотемпературной обработкой
индуцируются Lea-белки, относящиеся ко второй и пятой группам (см. под-
разд. 8.2.3.1). Индукция этих белков происходит в ответ на водный дефицит,
который является составной частью холодового шока (ХШ). К БХШ относятся
570
также продукты некоторых уникальных генов, экспрессирующихся в растени-
ях при отрицательных температурах. Один из генов, COR15a, входит в состав
ядерного генома. Продуктом этого гена является гидрофильный белок, кото-
рый транспортируется в хлоропласт и там подвергается процессингу, превра-
щаясь в зрелый белок COR15am (мол. масса 9,4 кДа). Протопласты не прошед-
ших акклимацию трансгенных растений A.thaliana, которые конститутивно эк-
спрессируют ген COR15a, характеризуются повышенной резистентностью к
замораживанию.
Многие гены белков ХШ содержат в премоторной области DRE-элемент,
который связывается с активатором транскрипции DREBP (см. подразд. 8.2.5).
Сверхэкспрессия DREBP в протопластах трансгенных растений A. thaliana,
обладающих повышенной устойчивостью к низким температурам, вызывала
увеличение количества транскриптов всех генов COR, причем устойчивость
повышалась в большей степени, чем при сверхэкспрессии одного гена COR15a.
Это указывает на важную роль генов регуляторных белков в формировании
толерантности к низким температурам.
8.4.3. МЕХАНИЗМЫ ТЕРМОРЕГУЛЯЦИИ У РАСТЕНИЙ
8.4.3.1. Теплопродукция при дыхании
Растения в целом являются эктотермными организмами, тем не менее у
холодоустойчивых растений отдельные ткани и органы способны к терморегу-
ляции. Исследования процесса дыхания свидетельствуют о наличии у них тер-
могенеза, т. е. производства тепла.
При снижении температуры у холодоустойчивых растений повышается уро-
вень дыхательного газообмена при одновременном разобщении транспорта
электронов и фосфорилирования. У растений, чувствительных к холоду, реак-
ция дыхания на низкие температуры иная: скорость дыхательного газообмена
понижается, тогда как дыхательный контроль остается на прежнем уровне или
даже возрастает, указывая на поддержание высокого уровня сопряжения пере-
носа электронов и фосфорилирования. Переход митохондрий в низкоэнерге-
тическое состояние у толерантных растений связан с необходимостью выра-
ботки тепла. Разобщение переноса электронов и фосфорилирования происхо-
дит за счет повышения содержания в митохондриях свободных жирных кислот.
Они увеличивают проводимость внутренней мембраны митохондрий для Н+,
что приводит к диссипации протонного градиента, который генерируется при
окислении дыхательных субстратов. Аналогичные процессы происходят в ми-
тохондриях бурой жировой ткани у адаптированных к холоду, а также впадаю-
щих в зимнюю спячку животных. В этой ткани энергия химических связей ды-
хательных субстратов используется только для теплопродукции. Через имею-
щийся в цепи синтеза АТФ шунт протоны транспортируются через мембрану в
обход АТФ-синтазы. У растений к эндогенным разобщающим агентам, уча-
ствующим в выработке тепла, относятся также некоторые белки.
Одним из способов превратить энергию химических связей дыхательных
субстратов в тепло является переключение дыхательного пути с цитохромного
на альтернативный цианидрезистентный путь, который ответвляется от цито-
571
хромного пути на уровне убихинона (см. гл. 4). Цианидрезистентный путь не
связан с генерацией трансмембранного градиента электрохимического потен-
циала протонов (Дцн+) и> следовательно, с синтезом АТФ, но его включение
приводит к термогенезу. Альтернативный путь дыхания, по-видимому, имеется
у всех растений, но его доля особенно велика в тех организмах, органах и тка-
нях, которые осуществляют теплопродукцию. Выделение тепла свойственно в
большей степени генеративным органам. Теплопродукция была зарегистрирова-
на у цветков симплокарпуса (Sytnplocarpus foetidus), филодендрона (Philodendron
selloum), ароника (Arum maculatum) и многих других растений.
8.4.3.2. Теплопродукция при замораживании
Превращение воды в лед является экзотермическим процессом, поэтому
замерзание межклеточной жидкости сопровождается локальным повышением
температуры. На этом основана приспособительная стратегия к резким суточ-
ным колебаниям температуры воздуха у некоторых растений рода лобелия
(Lobelia telekii и L. deckenii). Они обитают в горах, где ночью температура воз-
духа опускается до -10 °C, тогда как днем температуры плюсовые. Днем расте-
ния должны активно метаболизировать, а ночью необходима толерантность к
замораживанию. Суточную терморегуляцию у этих растений обеспечивает боль-
шая межклеточная полость в соцветии, которая содержит раствор полисахари-
дов и других карбогидратов. Растворенные вещества выполняют функцию гете-
рогенных нуклеаторов. Лед образуется в полости при близких к 0 °C отрицатель-
ных температурах. Выделяющееся при этом тепло обогревает соцветие. При
колебаниях наружной температуры в диапазоне от -8° до +12 °C температура
соцветия не опускается ниже 0 °C. Такая же стратегия обнаружена у некоторых
видов опунций, например у Opuntia humifusa и О. ficusindica. Эти растения оби-
тают в пустынях, тем не менее выдерживают снижение температуры до -10 °C.
В их межклетниках находится вязкая жидкость, содержащая полисахариды,
масса которых достигает 45 % в расчете на сухую массу ткани. Полисахариды
выступают в роли гетерогенных нуклеаторов.
8.5. КИСЛОРОДНЫЙ ДЕФИЦИТ
Растения, как облигатные аэробы, используют молекулярный кислород в
качестве терминального акцептора электронов в митохондриальной элект-
рон-транспортной цепи (ЭТЦ). При нормальных аэробных условиях окисление
1 моля гексозы в реакциях лимоннокислого цикла приводит к образованию
30—32 молей АТФ (см. гл. 4). В отсутствие кислорода окислительный распад
гексозы ограничен реакциями гликолиза, а количество образующегося при
этом АТФ составляет лишь 2 моля.
Концентрация кислорода в газовой фазе хорошо дренированной пористой
почвы почти равна его концентрации в атмосфере и составляет 20,6 %, что
соответствует парциальному давлению кислорода 0,0206 МПа. Концентрация
кислорода в почве снижается чаще всего из-за избыточного содержания в ней
воды. Затопление водой существенно снижает скорость кислородного обмена
572
между почвой и воздухом, так как коэффициент диффузии О2 в воде на 4 по-
рядка ниже, чем в воздухе. Снабжение кислородом корней зависит не только
от содержания в почве воды, но и от таких факторов, как пористость почвы,
температура, густота корней и глубина, на которую они проникают в почву,
от метаболической активности корней, а также присутствия в почве конкури-
рующих за кислород микроорганизмов. Дефицит кислорода испытывают также
озимые культуры, которые часто оказываются под ледяной коркой. Такая си-
туация возникает, когда период зимней оттепели сменяется морозами. Дефи-
цит О2 в среде приводит к кислородной недостаточности растений.
В зависимости от степени кислородной недостаточности различают гипоксию
и аноксию. Гипоксия наблюдается при неполном удалении О2 из среды, так что
аэробное дыхание сохраняется, хотя и с пониженной скоростью. По мере сни-
жения концентрации О2 в почве и подавления аэробного дыхания отношение
АТФ/АДФ в цитоплазме становится меньше, доля участия окислительного фос-
форилирования в синтезе АТФ снижается, а доля участия в этом процессе
гликолиза возрастает. При гипоксии процессы, приводящие к акклимации рас-
тений к дефициту О2, стимулируются. Условия аноксии создаются при практи-
чески полном отсутствии О2 в почве. Такая ситуация возникает чаще всего при
затоплении почвы и растений водой. При аноксии АТФ синтезируется лишь
гликолитическим путем, аэробное дыхание полностью выключается. Концент-
рация АТФ и отношение АТФ/АДФ в цитоплазме снижаются в большей степе-
ни, чем при гипоксии. Синтез белка, рост и развитие растений подавляются.
Чтобы выжить в условиях дефицита кислорода, растения должны не только
поддерживать концентрацию АТФ в клетках надостаточном для жизнеобеспе-
чения уровне, но и регенерировать НАД+ и НАДФ+, поскольку при кислород-
ной недостаточности равновесия НАД+/НАДН и НАДФ+/НАДФН смещаются
в сторону восстановленных форм. Необходимо устранять также накапливаю-
щиеся в клетках токсические соединения.
В зависимости от способности выдерживать временное затопление водой ра-
стения подразделяют на чувствительные и резистентные к О^-дефициту. К пер-
вым относятся, в частности соя, горох и томаты (Licopersicon esculentum), ко
вторым — арабидопсис, овес, картофель, пшеница, кукуруза (Zea mays). В тре-
тью группу включают самые устойчивые к кислородному дефициту растения
водных и влажных (заболоченных) мест обитания. К ним относятся, напри-
мер, рис, кубышка (Nuphar luteum), стрелолист (Sagittaria sagittifolia) и валлис -
нерия (Vallisneria spiralis). У растений второй и третьей групп в процессе эволю-
ции сформировались биохимические механизмы, а также разнообразные мор-
фологические и анатомические приспособления, позволяющие противостоять
дефициту кислорода в среде.
8.5.1. АНАТОМО-МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ,
ПОЗВОЛЯЮЩИЕ РАСТЕНИЯМ ПОДДЕРЖИВАТЬ АЭРОБНЫЙ ОБМЕН
В УСЛОВИЯХ ДЕФИЦИТА КИСЛОРОДА
Рост в водной и влажной средах способствует формированию толстой гипо-
дермы в корнях, снижающей поток кислорода из тканей в почву, бедную кис-
лородом. Многие водные и устойчивые к временному затоплению растения
573
Рис. 8.29. Аэренхима в коре стебля водного
растения Myriophyllum (по К. Даддингтону,
1972)
формируют специфическую структу-
ру — аэренхиму, представляющую со-
бой непрерывную межклеточную по-
лость, которая обеспечивает транспорт
О2 от находящихся в воздушной среде
структур к погруженным в воду час-
тям растения и этим поддерживает в
них аэробный обмен (рис. 8.29). Функ-
цию снабжения растений кислородом
при их росте в водной среде часто вы-
полняют боковые корни, отходящие от
гипокотиля или стебля, воздушные кор-
ни, в том числе пневматофоры — воз-
душные корни, характеризующиеся
отрицательным геотропизмом (расту-
щие по направлению из залитой во-
дой почвы вверх). Все эти разновидности корней снабжены аэренхимой. Аэроб-
ному метаболизму при О2-дефиците способствуют также чечевички на стеблях,
открывающиеся в перидерму.
Наличие аэренхимы у риса является конститутивным признаком, а бескис-
лородные условия способствуют ее более сильному развитию. Затопление рас-
тений риса, относящихся к глубоководным сортам, ускоряет рост междоузлий
стебля (ускоряет удлинение клеток). Вследствие этого верхняя часть побега
постоянно находится над поверхностью воды. Хотя в условиях затопления уль-
траструктура митохондрий клеток корня у риса изменяется, их функциональ-
ная активность поддерживается на высоком уровне. Развитие аэренхимы не
воссоздает полностью те условия обеспечения тканей кислородом, которые
наблюдаются в норме, поэтому при дефиците О2 даже при наличии хорошо
развитой аэренхимы в тканях растений активируется гликолиз. Таким образом,
. способность расти в анаэробных условиях связана и с активированием глико-
лиза, и с аэробным метаболизмом, который поддерживается благодаря дос-
тавке кислорода из верхней части побега в корни через аэренхиму. У резистен-
тных к затоплению растений (вторая группа) развитие аэренхимы не является
конститутивным признаком и происходит только в ответ на дефицит О2.
У некоторых водных растений, таких, например, как аир (Acorus calamus),
способность переживать кислородный дефицит связана с подавлением метабо-
лизма и переходом в состояние покоя, который может длиться несколько ме-
сяцев. При этом процессы, поддерживающие жизнедеятельность, идут за счет
запасного крахмала.
8.5.2. АКТИВИРОВАНИЕ АНАЭРОБНОГО МЕТАБОЛИЗМА
В УСЛОВИЯХ ДЕФИЦИТА КИСЛОРОДА
Устойчивые к затоплению (аноксии) растения, т.е. растения второй груп-
пы, могут выдерживать его лишь ограниченный период времени. При затопле-
нии они синтезируют АТФ за счет анаэробного метаболизма. В это время росто-
вые процессы в корне (удлинение клеток) подавляются. Общая скорость син-
574
теза белка снижается, а в экспрессии генов происходят заметные изменения.
Проростки устойчивых к затоплению сортов кукурузы могут выдерживать анок-
сию на протяжении 3 — 5 дней в зависимости от генотипа и возраста растений.
Устойчивость к затоплению возрастает, если молодые растения предваритель-
но подвергнуть гипоксической обработке. Гипоксия активирует гликолиз, а
также способствует формированию боковых корней, несущих аэренхиму в коре.
У чувствительных растений (первая группа), как и у резистентных, ско-
рость гликолиза в ответ на затопление возрастает, однако они быстро повреж-
даются, поскольку активирование гликолиза у них приводит к закислению
цитоплазмы. Скорость синтеза белка в этих условиях снижается, митохондрии
подвергаются деструктивным изменениям, процессы деления и растяжения
клеток подавляются, нарушается транспорт ионов, а клетки корневой меристе-
мы отмирают. В условиях аноксии у чувствительных растений аэренхима не
образуется. Они способны выдержать затопление на протяжении не более су-
ток. Таким образом, непродолжительное затопление активирует в растениях
гликолитический путь, независимо от степени их устойчивости к дефициту О2.
Простые сахара, субстраты гликолиза, транспортируются из листьев по флоэ-
ме в затопленные органы. В затопленных колеоптилях риса происходит гидро-
лиз крахмала, дополнительно снабжающий растения гликолитическими суб-
стратами.
В результате гликолиза 6-углеродная молекула глюкозы расщепляется на две
3-углеродные молекулы пировиноградной кислоты (ПВК); образуются две
молекулы АТФ, а НАД+ восстанавливается до НАДН (рис. 8.30). Чтобы глико-
лиз продолжался в отсутствие митохондриального дыхания, необходимо по-
стоянно регенерировать НАД+. Регенерация осуществляется в последующих
реакциях ферментации. Существует два основных пути превращений ПВК, ве-
дущих к регенерации НАД+. Первый путь связан с декарбоксилированием ПВК
и последующим восстановлением
продукта декарбоксилирования —
ацетальдегида. В этих превращени-
ях участвуют два фермента: пи-
руватдекарбоксилаза (ПВД) и ал-
когольдегидрогеназа (АДГ) соот-
ветственно. Конечным продуктом
этих двух реакций является эти-
ловый спирт. Второй путь осуще-
ствляется лактатдегидрогеназой
Пируват-
декарбоксилаза
Гликолиз
Глюкоза
2НАД
2 НАДН
Пируват
СОСГ
с=о
сн
Лактат-
дегидрогеназа
Рис. 8.30. Образование этанола и мо-
лочной кислоты из конечного продук-
та гликолиза — пировиноградной
кислоты в условиях кислородного
дефицита.
Образование обоих продуктов сопряже-
но с регенерацией НАД*. Образование
этанола не приводит к изменениям pH
цитозоля, тогда как образование молоч-
ной кислоты вызывает ацидоз
со2
<Го
сн3
Ацетальдегид
Алкоголь- — НАДН
дегидро-
геназа 4 * НАД *
НАДН НАД* C^q-
нс-он
СН3
Молочная
кислота
СН2ОН
сн3
Этанол
575
(ЛДГ), которая восстанавливает ПВК до молочной кислоты (МК). Доли двух
путей в превращениях ПВК различны в зависимости от вида растения, его
устойчивости к недостатку кислорода, ткани, а также от продолжительности и
степени О2-дефицита. Оба пути ведут к регенерации НАД+, однако образова-
ние молочной кислоты связано с нежелательным явлением — закислением
цитозоля, тогда как при образовании этилового спирта pH цитозоля не изме-
няется. Говоря иначе, накопление молочной кислоты может вызвать вторич-
ные токсические эффекты в результате ацидоза цитоплазмы. В связи с этим
можно считать, что важная роль в устойчивости растений к О2-дефициту при-
надлежит способности клетки предотвращать закисление цитозоля.
Согласно гипотезе Дэвиса—Робертса, регуляция pH цитозоля при анаэ-
робном метаболизме зависит от соотношения активностей лактатдегидрогена-
зы и пируватдекарбоксилазы (см. рис. 8.30). Образующаяся при гликолизе ПВК
превращается в МК в реакции, катализируемой ЛДГ. Этот фермент имеет оп-
тимум активности при физиологических значениях pH цитоплазмы. При обра-
зовании МК цитоплазма закисляется. По мере снижения pH ЛДГ прогрессив-
но ингибируется, тогда как ПДК, включенная в путь образования этилового
спирта, активируется, поскольку ее оптимум активности смещен в кислую
область. Таким образом, аккумуляция МК стимулирует превращение ПВК в
ацетальдегид, который далее восстанавливается алкогольдегидрогеназой до
этилового спирта. В отличие от МК молекула этилового спирта не несет заряда
и может легко диффундировать через плазмалемму в среду. В результате вклю-
чения пути, ведущего к образованию этилового спирта, pH цитозоля стабили-
зируется на уровне слабокислых значений. О таком регуляторном механизме
свидетельствуют эксперименты с трансгенными растениями табака со сверхэк-
спрессией пируватдекарбоксилазы. Повышенная активность ПДК у трансфор-
мантов по сравнению с растениями дикого типа стимулировала ферментацию
этанола и приводила к подавлению образования МК в цитозоле. Роль фермен-
тации этанола в предотвращении ацидоза и в обеспечении устойчивости рас-
тений к недостатку О2 была продемонстрирована на мутанте кукурузы, дефи-
цитном по АДГ. Нормальные растения кукурузы характеризуются резистент-
ностью к затоплению. Мутант, дефицитный по алкогольдегидрогеназе, кото-
рая не требуется для роста в аэробных условиях, оказался более чувствитель-
ным к затоплению, чем растения дикого типа. В анаэробных условиях накопле-
ние ацетальдегида в его клетках и закисление цитоплазмы было сильнее, чем у
растений дикого типа. Таким образом, резистентные к затоплению растения
обладают способностью переключать ферментацию молочной кислоты, при-
водящей к ацидозу, на ферментацию этилового спирта — нейтрального соеди-
нения. Чувствительные к затоплению растения, например горох, хотя и накап-
ливают этанол в условиях О2-дефицита, не способны избежать закисления
цитоплазмы. У них ферментация этанола осуществляется параллельно с фер-
ментацией МК.
При физиологических значениях pH цитозоля значительная часть образую-
щейся МК находится в анионной форме и вследствие этого не может транс-
портироваться через плазмалемму. При ацидозе доля недиссоциированных, т. е.
способных пересекать мембрану, молекул молочной кислоты возрастает и она
может диффундировать из цитозоля наружу. Считается, что выход образую-
щейся при дефиците О2 МК в наружную среду является одним из механизмов,
576
останавливающих закисление цитоплазмы. Полагают, что клетки толерантных
к дефициту О2 растений по сравнению с клетками чувствительных растений
более эффективно экспортируют МК наружу.
8.5.3. АККЛИМАЦИЯ РАСТЕНИЙ К АНОКСИИ
В природных условиях аноксии (затоплению растений водой) часто пред-
шествует гипоксия. Если проростки резистентных к О2-дефициту растений,
например риса или кукурузы, подвергнуть гипоксической предобработке, то
это приведет к индукции процессов, направленных на повышение их устойчи-
вости к создаваемым затем условиям аноксии. Гипоксическая предобработка
стимулирует при последующей аноксии ростовые процессы и значительно
снижает процент погибших растений.
Акклимация к аноксии достигается во многом за счет активирования гли-
колиза и сопряженного с гликолизом синтеза АТФ. Гипоксические условия
приводят к индукции гликолитических ферментов: гексокиназы, фосфофрук-
токиназы, пируваткиназы, глюкозофосфатизомеразы, глицеральдегид-3-фос-
фатдегидрогеназы, фруктозе-1,6-дифосфатальдолазы, енолазы и др.; фермен-
тов, приводящих к образованию этанола, — пируватдекарбоксилазы и алко-
гольдегидрогеназы; ферментов, расщепляющих крахмал, в частности а-ами-
лазы. Гипоксическая предобработка способствует мобилизации субстратных ре-
зервов и транспорту субстратов из надземных органов в аноксические корни.
Считается также, что у резистентных к кислородному дефициту растений пред-
варительные гипоксические условия стимулируют выведение МК из цитозо-
ля, что повышает способность клеток к устранению ацидоза. Низкая эффек-
тивность экспорта МК из клеток у чувствительных к О2-дефициту растений
сохраняется при гипоксической предобработке, что не способствует устране-
нию ацидоза во время последующей аноксии. Внутриклеточный ацидоз у рас-
тений можно рассматривать как главный повреждающий фактор кислородной
недостаточности.
8.5.4. ИЗМЕНЕНИЯ В ЭКСПРЕССИИ ГЕНОВ ПРИ ПЕРЕХОДЕ
ОТ АЭРОБНОГО МЕТАБОЛИЗМА К ГЛИКОЛИЗУ
Вопрос о последовательности событий, приводящих к запуску ответной
реакции растения на О2-дефицит, и о природе рецептора сигнала до настоя-
щего времени остается нерешенным. В анаэробных условиях быстро снижается
уровень АТФ, увеличивается содержание НАДН (НАДФН) и происходит за-
кисление цитозоля. Любой из этих факторов может принимать участие в про-
цессах сигнальной трансдукции. Как будет показано ниже, в пути передачи
сигналов, отвечающих за образование аэренхимы при О2-дефиците, вовлечен
гормон этилен. Возможно, что этилен, а также АБК участвуют в запуске и
других процессов, индуцируемых О2-дефицитом.
Вторичным мессенджером в путях сигнальной трансдукции, активируемых
аноксией, является Са . его содержание в протопластах кукурузы при анаэ-
робных условиях возрастает. Повышенные концентрации Са необходимы для
инициации транскрипции гена алкогольдегидрогеназы Adhl.
19 Физиология растений
577
При аноксии в корнях проростков кукурузы происходят существенные из-
менения в экспрессии генов и метаболизме. Они обнаруживаются уже через
несколько часов после создания анаэробных условий. Общий синтез белков
подавляется на 70 %. Гипоксия приводит к аналогичному эффекту, однако он
выражен в значительно меньшей степени.
Изменения в синтезе белка при аноксии связаны с регуляцией экспрессии
генов на транскрипционном и посттранскрипционном уровнях. Большая часть
генов, активных в присутствии О2, при аноксии репрессируется. В то же время
некоторый набор генов, не экспрессирующихся до создания анаэробных усло-
вий, в условиях аноксии активируется. Экспрессия этих генов чрезвычайно
важна для выживания растений в бескислородных условиях. Подавляющая их
часть относится к генам ферментов, которые осуществляют (см. подразд. 8.5.3)
процессы деградации крахмала, гликолиза и ферментации этанола. Некоторые
из этих ферментов, в частности АДГ и глицеральдегид-3-фосфатдегидрогена-
за, представлены в клетках несколькими изоформами. Одни изоформы образу-
ются в клетках в аэробных условиях, т.е. характеризуются конститутивным син-
тезом и участвуют в нормальном метаболизме, другие индуцируются в ответ
на О2-дефицит. Гены, кодирующие эти две группы изоформ, различаются по
нуклеотидным последовательностям промоторов. Гены, экспрессирующиеся в
ответ на О2-дефицит, называются анаэробными генами, а их продукты анаэроб-
ными белками. Некоторые анаэробные гены клонированы, в частности гены
алкогольдегидрогеназы Adh из кукурузы и арабидопсиса, а также гены пируват-
декарбоксилазы Pdc из арабидопсиса. Были охарактеризованы гены Adh. Их про-
моторные области содержат специфические дцс-элементы, которые необходи-
мы для экспрессии в условиях кислородного дефицита (рис. 8.31). Известны две
такие специфические последовательности: ARE (anaerobic response element) и
так называемый G-бокс. Идентифицированы два транскрипционных фактора,
взаимодействующих с G-боксом гена Adhl из арабидопсиса: GBP (G-box-binding
protein) и GF14 (G-factor). Для индукции транскрипции Adhl GF14 должен
сформировать комплекс с GBP, чтобы последний мог вступить в непосред-
ственное взаимодействие с нуклеотидной последовательностью G-бокса.
Как отмечалось выше, биосинтез многих белков нормального метаболизма
в бескислородных условиях ингибируется. Хотя гены этих белков при переходе
к анаэробному метаболизму продолжают транскрибироваться с той же ин-
тенсивностью, которая наблюдается в аэробных условиях, трансляция их мРНК
в значительной степени подавляется. Напротив, эффективность трансляции
CGFlj)
(GBP7_______________________
ГЛ | I. ] | Кодирующая область |
ARE G-бокс
Рис. 8.31. Гены алкогольдегидрогеназы АДГ из кукурузы и Arabidopsis.
Эти гены содержат в промоторной области специфические цис-элементы, которые необходимы
для экспрессии в анаэробных условиях, — ARE (anaerobic response element) и G-бокс. Два транс-
крипционных фактора взаимодействуют с G-боксом гена Adhl из Arabidopsis: GBP (G-box-binding
factor) и GF14 (G-factor). Для индукции транскрипции GF14 должен сформировать комплекс с
GBP, чтобы последний мог вступить в непосредственное взаимодействие с нуклеотидной по-
следовательностью G-бокса
578
мРНК анаэробных генов, в частности Adhl, при аноксии резко возрастает.
Таким образом, регуляция экспрессии генов на уровне трансляции играет важ-
ную роль не только в подавлении синтеза белков нормального метаболизма,
но и в индукции анаэробных белков.
8.5.5. В ПРОЦЕСС ОБРАЗОВАНИЯ АЭРЕНХИМЫ ПРИ ДЕФИЦИТЕ О2
ВОВЛЕЧЕН РАСТИТЕЛЬНЫЙ ГОРМОН ЭТИЛЕН
Синтез этилена в растениях стимулируют низкие концентрации кислорода
в среде (0,003 — 0,012 МПа), т.е. условия гипоксии. Этот гормон индуцирует
образование аэренхимы в коре корня. Аноксия по сравнению с гипоксией в
меньшей степени способствует образованию аэренхимы, так как для синтеза
этилена требуется кислород. Предшественник этилена — 1-аминоциклопро-
пан-1-карбоновая кислота (АЦК). Количества АЦК-синтазы и АЦК-оксидазы
(ферментов, вовлеченных в биосинтез этилена) существенным образом возра-
стают в ответ на гипоксию в корнях кукурузы. В пути передачи сигнала, кото-
рый запускается этиленом и приводит к формированию аэренхимы, участву-
ют в качестве вторичного мессенжера ионы Са . Переданный сигнал индуци-
рует процессы, приводящие к гибели клеток в центральной части коры корня
кукурузы и к их последующему лизису. Наиболее вероятно, что гибель клеток в
этом случае — результат апоптоза, т.е. запрограммированной смерти. В лизисе
клеток участвуют ферменты, осуществляющие деградацию клеточных сте-
нок, — целлюлазы и ксилоглюканазы, синтезируемые в больших количествах
в гипоксических корнях.
Этилен вовлечен также в ответ на затопление у глубоководных сортов риса.
Такие сорта могут расти в воде, уровень которой достигает 4 м.
Затопление молодых растений приводит к усиленному образованию этиле-
на, за которым следуют увеличение содержания в клетках АБК и возрастание
отзывчивости растений на гибберелин. В результате скорость деления клеток в
интеркалярной меристеме возрастает, а также усиливается растяжение клеток
в междоузлиях. Благодаря этому соревнование в скорости между ростом и за-
топлением выигрывает рост растения, так что верхняя часть побега оказывает-
ся над поверхностью воды, снабжая кислородом затопленные части растения
через аэренхиму.
Поддержание аэробного метаболизма в корнях при затоплении за счет фор-
мирования О2-проводящих путей, наряду с переходом на анаэробный метабо-
лизм, можно рассматривать как важнейшую стратегию устойчивости растений
к кислородному дефициту.
8.6. ОКИСЛИТЕЛЬНЫЙ СТРЕСС
Окислительный стресс в растениях возникает в условиях, способствующих
формированию активных форм кислорода (АФК). Напомним, что к АФК от-
носят анион-радикал О;, пероксид водорода Н2О2, гидроперекисный радикал
НО2, гидроксил-радикал НО’, а также синглетный кислород *О2 и озон О2.
Высокое содержание АФК в клетках приводит к повреждению биомолекул и
579
может вызвать гибель растений. Процессы, приводящие к образованию АФК,
роль АФК в растениях и антиоксидантные системы, снижающие их концентра-
ции в клетках до нетоксического уровня, уже рассматривались в гл. 3 и 4 в связи
с функционированием электрон-транспортных цепей в различных клеточных
органеллах и защитой клеток от избыточного освещения, приводящего к фо-
тоингибированию фотосинтеза. В связи с этим в этом разделе мы остановимся
в основном на АФК-индуцируемых повреждениях биомолекул, на процессах
детоксикации вторичных продуктов взаимодействия АФК с биомолекулами, а
также на эффектах озона, которые не рассматривались в других разделах.
Окислительный стресс в растениях возникает в результате действия прак-
тически всех неблагоприятных факторов внешней среды, включая засуху, по-
чвенное засоление, загрязнение воздуха токсическими соединениями, таки-
ми, например, как озон, оксиды серы и азота, тяжелые металлы, низкие и
высокие температуры, свет высокой интенсивности, ультрафиолетовое излу-
чение, недостаток элементов минерального питания, некоторые гербициды, в
частности паракват (метил-виологен), патогены различной природы и др. Можно
сказать, что окислительный стресс входит как компонент в большинство других
стрессов. Такая универсальность в индукции окислительного стресса при дей-
ствии на растения самых разнообразных неблагоприятных факторов внешней
среды указывает на принципиально важную роль антиоксидантных систем,
снижающих внутриклеточные концентрации АФК, а также систем, ликвидиру-
ющих токсические продукты взаимодействия АФК с биополимерами и повы-
шающих устойчивость растений к неблагоприятным факторам среды вообще.
8.6.1. ПОВРЕЖДЕНИЯ БИОМОЛЕКУЛ
АКТИВНЫМИ ФОРМАМИ КИСЛОРОДА
В норме концентрации АФК в клетках не высоки: концентрация Of состав-
ляет порядка 10-11 М, Н2О2 — 10“8 М, НО" — меньше 10-11 М. Возрастание
внутриклеточных концентраций АФК при стрессах, и особенно НО", ведет к
повреждениям молекул липидов, нуклеиновых кислот и белков. Взаимодей-
ствуя с ними, АФК вызывают образование органических гидропероксидов типа
ROOH. Изменения макромолекул под действием АФК называются окислитель-
ными модификациями (ОМ) макромолекул. Органические гидропероксиды ROOH
по своей структуре подобны Н2О2 (ср.: R—О—О—Н и Н—О—О—Н) и харак-
теризуются высокой реакционной способностью. При последующих превраще-
ниях они переходят в спирты, альдегиды, эпоксиды и другие окисленные орга-
нические соединения. Образование ROOH называют перекисным окислением.
Ниже рассматривается действие АФК на молекулы трех классов наиболее
важных биомолекул.
8.6.1.1. Повреждения липидов
АФК приводят к перекисному окислению липидов {ПОЛ), вызывая в остатках
полиненасыщенных жирных кислот (ПНЖК) цепные реакции с образовани-
ем липидных радикалов L", пероксилов LOO", гидропероксидов LOOH и ал-
коксидов LO":
580
+HO’ +O2 . +LH
LH * L ---------------* LOO L
-Н20
LOOH LO’ L’
~Fe3+ -LOH
-HO’
Первые три превращения (верхняя строка) представляют собой начало и
ход цепной реакции. В ходе третьего превращения наряду с липидным радика-
лом L" образуется гидропероксид LOOH. Последний, взаимодействуя с иона-
ми металлов переменной валентности, находящихся в восстановленной фор-
ме, например с Fe + или Си+, создают разветвления цепи (нижняя строка).
Накапливающиеся в результате цепной реакции гидропероксиды жирных кис-
лот, входящих в состав липидов, подвергаются распаду по следующей схеме:
-сн2-снч-сн=сн-------*
о-он
Гидропероксид
-сн2-<Х + ^с-сн2-
Ч) н
Карбонильные соединения
Продукты расщепления, несущие двойную связь, под действием радикалов
подвергаются дальнейшему перекисному окислению и распаду. В результате
ЖК образуют целый спектр соединений. Многие из них представляют собой
альдегиды, которые обладают высокой биологической активностью и часто
высокотоксичны. При распаде жирных кислот, сопровождающем ПОЛ, снача-
ла образуются диеновые конъюгаты, а затем такие метаболиты, как малоно-
вый диальдегид
Н^
с-сн2-сС
2 н
Продуктами ПОЛ могут быть и более про-
стые соединения, например такие, как пентан и этан. ПОЛ прежде всего по-
вреждает клеточные мембраны, что в свою очередь приводит к нарушениям
функций мембранных белков и нарушению внутриклеточной компартмента-
ции веществ. Продукты ОМ липидов (4-гидроксиалкенали, соединения типа
С5Н9—СНОН—СН=СН—СНО и малоновый диальдегид) вызывают мутации
и блокируют клеточное деление.
Прежде ПОЛ считали исключительно спонтанным процессом, протекаю-
щим без участия ферментов. Затем было показано, что важную роль в ПОЛ
играют и ферментативные реакции, в частности реакции, катализируемые
липоксигеназами. Окисление липидов с помощью этих ферментов приводит к
образованию специфических веществ — эйкозаноидов, выполняющих функ-
цию сигнальных молекул при экспрессии генов.
8.6.1.2. Повреждения нуклеиновых кислот
АФК вызывают окислительную модификацию нуклеотидов и нуклеиновых
кислот, особенно ДНК. Наиболее заметное действие оказывает НО", который
модифицирует все четыре основания в молекуле ДНК, образуя множество
производных форм. ‘О2 избирательно атакует гуанин, а 0$ и Н2О2 не реагируют
с основаниями ДНК вообще. Под действием АФК нуклеотиды подвергаются
перекисному окислению. Так, из тимина образуется 5-СН2ООН-урацил:
581
о
о
Тимин
5-СН2ООН-урацил
Дальнейшее превращение образовавшихся перекисей приводит к гидропро-
изводным типа ROH или R(OH)2, главным из которых является 8-гидроксигу-
анин:
8-Гидроксигуанин
Эта окислительная модификация гуанина приводит к нарушениям фермен-
тативного процесса метилирования цитозиновых оснований, которые сосед-
ствуют с модифицированными гуанозиновыми основаниями. Модификации
оснований, вызванные АФК, становятся причиной разрывов цепей ДНК и
повреждений хромосом. АФК являются мощными мутагенными агентами, ин-
гибиторами синтеза ДНК и деления клеток.
8.6.1.3. Повреждения белков
Белки, так же как липиды и нуклеиновые кислоты, повреждаются актив-
ными формами кислорода. При действии АФК происходит окисление амино-
кислот с образованием пероксильных радикалов:
-NH-CH-C(O)-
R
|но'
-NH-C-C(O)-
R
О' 00* ООН
I I I
-NH-C-C(O)- -------NH-C-C(O)------* —NH-C-C(O)-
R R R
Алкоксильный радикал Пероксильный радикал Гидропероксид
Из пероксильных радикалов образуются гидропероксиды и алкоксильные
радикалы. Последние обладают высокой реакционной способностью и сами
могут индуцировать образование высокореактивных соединений радикальной
природы. Гидропероксиды также генерируют новые радикалы, если имеются
582
ионы металлов переменной валентности. Производными пероксидных групп
(—С—О—ОН) являются группы —СОН (о- и ти-тирозины), —С(ОН)2, карбо-
нилы и другие соединения. Образуются также димеры (дитирозины) и проис-
ходит окислительное гликозилирование белков. АФК-индуцированные окис-
лительные модификации аминокислот приводят к нарушению третичной струк-
туры белков, к их денатурации и аггрегации с сопутствующей потерей функ-
циональной активности.
8.6.2. ДЕТОКСИКАЦИЯ ПРОДУКТОВ ОКИСЛИТЕЛЬНОЙ
МОДИФИКАЦИИ БИОМОЛЕКУЛ
Наряду с ферментами, осуществляющими ликвидацию АФК (супероксид-
дисмутазой, аскорбатпероксидазой, глютатионредуктазой и др.) — (см. гл. 4),
большое значение в устойчивости растений к окислительному стрессу имеют
ферменты, включенные в детоксикацию продуктов взаимодействия АФК с
биомолекулами, т.е. продуктов окислительной деградации липидов, белков и
нуклеиновых кислот. К таким ферментам относятся глиоксалаза I (Гл I) и
глиоксалаза II (Гл II), образующие глиоксалазную систему. Кофактором реак-
ций, осуществляемых глиоксалазами, является восстановленный глютатион
(Г-SH). Глиоксалазная система осуществляет превращение многих кетоальде-
гидов в органические кислоты по следующей схеме:
RCOCHO
Кетоальдегид
r-SH
Спонтанно
RCOCH(OH)-Sr
| Гл I
RCH(OH)CO-Sr
Н2О-х
Гл II
Г-SH ,
RCH(OH)COOH
Органическая кислота
Важная роль в детоксикации продуктов окислительной модификации био-
молекул принадлежит также глютатион-5-трансферазам (TST). Эти ферменты
осуществляют превращение самых разнообразных химических соединений,
имеющих электрофильную природу, т.е. способных принимать электрон от
нуклеофильного донора. Функцию нуклеофильного донора электронов в реак-
циях, катализируемых TST, выполняет атом серы восстановленного глутатио-
на. В rST-реакции электрофильные продукты окислительной модификации
биополимеров (R—X) взаимодействуют с восстановленным глутатионом, фор-
мируя конъюгат:
583
Глу
I TST
Цис-SH+ R—X-------->
Гл
Глутатион Токсичный
продукт ОМ
Глу
Цис—S—R + X—Н
Гл
Конъюгат
Здесь X означает химическую группу, которая, восстанавливаясь в ходе
ферментативной реакции, отделяется от молекулы токсичного вещества (как
это показано на схеме) или остается в его составе. И в том и в другом случае
продукты ферментативной реакции подвергаются дальнейшим превращениям
с участием других ферментов, образуя в конце концов нетоксичное соедине-
ние. Следует отметить важную роль TST в детоксикации не только продуктов
окислительной модификации биомолекул, но и ксенобиотиков.
8.6.3. АТМОСФЕРНЫЙ ОЗОН ВЫЗЫВАЕТ
ОКИСЛИТЕЛЬНЫЙ СТРЕСС В РАСТЕНИЯХ
Озон, так же как и синглетный кислород, и Н2О2, не является радикалом,
однако, обладая высокой реакционной способностью, он при взаимодействии
с химическими компонентами клетки продуцирует кислородные радикалы. На
основании этого его можно отнести к АФК.
В последние годы вследствие интенсивного развития промышленности на-
метилась стабильная тенденция к росту концентрации озона в тропосфере (ниж-
них слоях атмосферы). Концентрация тропосферного озона колеблется от 0,02—
0,05 мкл/л в не затронутых развитием промышленности районах до 0,40 мкл/л
в загрязненной воздушной среде больших городов. По мере роста концентра-
ции озона в воздухе проблема устойчивости растений к нему будет обострять-
ся, поэтому окислительный стресс, индуцируемый озоном, заслуживает спе-
циального рассмотрения.
Подавляющая часть (90 %) атмосферного озона находится в стратосфере
(верхних слоях газовой оболочки Земли), остальные 10 % распределены в тро-
посфере. Увеличение содержания О3 в тропосфере происходит за счет накопле-
ния в воздухе продуктов сгорания нефти, газа и угля. При взаимодействии с
кислородом под действием ультрафиолетового излучения Солнца они превра-
щаются в О3:
hv
СО + 2О2 — СО2 + О3
hv
RH + 4О2 RCHO + 2Н2О + 2О3
hv
NO2 + О2 —► NO + О3
Образование озона в этих реакциях и его приток в тропосферу усиливаются
также за счет интенсификации ультрафиолетовой радиации, поскольку стра-
тосферный озон, формирующий защитный экран от УФ-излучения Солнца,
все больше разрушается. Это связано с действием радикалов СГ и Вг’, которые
возникают при облучении О- и Br-содержащих промышленных фреонов, аэро-
золей и растворителей:
584
hv
CCl2Br2(CCl3Br) — СГ, Br‘
СГ, Br'
2O3------ 3O2
Накапливающийся в воздушной среде О3 повреждает растения. Отрицатель-
ное действие озона проявляется в снижении скорости фотосинтеза, поврежде-
нии листьев, подавлении роста корней и побегов, ускорении старения и сни-
жении урожая. Растения различаются по их способности противостоять дей-
ствию озона. Устойчивость к озону обеспечивается как механизмами избежа-
ния, так и механизмами резистентности. Подавляющее действие озона на рас-
тения, индукция процессов защитной программы и участие этилена в запуске
этой программы отражены на схеме (рис. 8.32).
Одним из механизмов избежания действия озона у растений является зак-
рытие устьиц — главного канала, через который он проникает в организм.
Рис. 8.32. Схема, описывающая процессы повреждения растений, включения программы
антиоксидантной защиты и участие этилена в передаче сигнала при действии озона
585
В основе другого механизма избежания действия О3 лежат повреждения ли-
стьев, которые развиваются по типу реакции сверхчувствительности при по-
ражении растений несовместимыми расами (штаммами) патогенов. При высо-
ких дозах О3, как и в случае поражения патогенами, в листьях образуются
некрозы. Гибель клеток в некротизированных тканях — это запрограммирован-
ная реакция (апоптоз). Вокруг погибших клеток живая ткань формирует барь-
ер, препятствующий дальнейшему распространению окислительного процес-
са, аналогично тому, как в реакции сверхчувствительности окружающие не-
кроз ткани не позволяют патогену распространяться дальше. В клетках, приле-
гающих к некрозу, происходит «взрыв» активности антиоксидантных систем и
наблюдается лигнификация клеточных стенок. При относительно низких дозах
О3 некрозы не образуются, происходит системное распространение процессов
ОМ и ускоряется старение растений.
Реакции резистентности основаны прежде всего на индукции антиоксидан-
тных систем клетки, ликвидирующих АФК, систем детоксикации и,возмож-
но, на процессах репарации. Озон, проникающий через устьица в межклеточ-
ные полости листьев, вступает во взаимодействие с компонентами клеточных
стенок и образует АФК — НО', Oj и Н2О2. Молекула озона полярна и поэтому
плохо проникает в клетки через плазматическую мембрану. Первичные по-
вреждения растений озоном связаны с АФК-индуцированным перекисным
окислением липидов и белков ПМ и с их окислительной модификацией. По-
врежденная в результате атаки АФК плазмалемма становится более проницае-
мой для озона. Попадая в цитоплазму, он вызывает образование АФК внутри
клеток. Вызываемые озоном повреждения ПМ сопровождаются нарушениями
ее функции, в частности, ингибированием Н+-АТФазы, диссипацией элект-
рического потенциала, усилением поглощения Са из апопласта и др.
Среди клеточных органелл наиболее чувствительны к разрушительному дей-
ствию озона хлоропласты. Повреждающее воздействие на них проявляется в
торможении фотосинтеза, падении активности ферментов и подавлении син-
теза хлоропластных белков. Один из наиболее общих эффектов О3 — подавле-
ние активности ФС1 и ФСП. У многих растений при обработке озоном умень-
шается содержание РБФ-карбоксилазы в хлоропластах. Это происходит как за
счет О3-индуцированной деградации уже синтезированного фермента, так и
вследствие торможения его синтеза. Деградация фермента происходит, как
правило, в созревших листьях и связана с их ускоренным старением при дей-
ствии О3.
Торможение синтеза РБФ-карбоксилазы связано со снижением уровня транс-
криптов малой субъединицы фермента rbcS. Уменьшение содержания мРНК,
вызванное озоном, было обнаружено и у других хлоропластных белков, коди-
руемых ядерными генами, в частности у хлорофилл(о/й)-связывающего белка
cab и глицеральдегид-3-фосфатдегидрогеназы (gapA и gapB). Снижение содер-
жания мРНК в значительной степени обусловлено деградацией уже синтези-
рованных мРНК активируемыми при действии О3 РНКазами. Вклад в умень-
шение содержания транскриптов вносит также подавление транскрипции, ин-
дуцируемое этиленом. Продукция этого гормона в тканях при обработке расте-
ний озоном существенно возрастает.
Таким образом, О3-индуцированное образование АФК, с одной стороны,
повреждает биополимеры клетки, а с другой — приводит к индукции антиок-
586
сидантных систем. В пути сигнальной трансдукции, активирующие защитные
системы, включен этилен. Биосинтез этилена активируется сразу после обра-
ботки клеток озоном. Возросшая продукция этилена связана с ускорением био-
синтеза его предшественника 1-аминоциклопропан-1-карбоновой кислоты
(АЦК) за счет индукции АЦК-синтазы. Активация экспрессии АЦК-синтаз-
ных генов при действии О3 осуществляется на транскрипционном уровне. При
больших дозах озона или высокой чувствительности к нему растений окисли-
тельная модификация биомолекул клетки может принять масштабы, приводя-
щие к непрограммируемой гибели клеток.
ГЛАВА 9
ВТОРИЧНЫЙ МЕТАБОЛИЗМ
Растения синтезируют огромное количество разнообразных веществ, ко-
торые не участвуют в основном обмене клеток. Традиционно такие соедине-
ния называют вторичными, а их обмен — вторичным метаболизмом. По спо-
собности образовывать вторичные метаболиты растения являются «рекордс-
менами», оставляя далеко позади представителей других царств живых су-
ществ. Наряду с фотосинтезом, вторичный метаболизм — характеристиче-
ское свойство растительного организма, его «визитная карточка». Парадок-
сально, но биологи достаточно долго оставляли этот важнейший аспект жиз-
недеятельности растений без должного внимания. Гораздо больше знали о вто-
ричных метаболитах провизоры, фармацевты и криминалисты, поскольку
лекарственные и ядовитые свойства растений чаще всего обусловлены именно
этими соединениями. В последние годы наметился значительный прогресс в
изучении вторичного метаболизма, при этом основными являются три на-
правления. Фотохимия изучает строение вторичных метаболитов и их распрос-
транение по царству растений, биохимия вторичного метаболизма — пути син-
теза и энзимологию процесса, физиология вторичного метаболизма исследует
локализацию вторичного метаболизма в растении, его изменение в процессе
онтогенеза и, главное, — роль вторичных метаболитов в жизнедеятельности
растения.
9.1. ОБЩАЯ ХАРАКТЕРИСТИКА ВТОРИЧНЫХ МЕТАБОЛИТОВ
В 1891 г. немецкий биолог Альбрехт Коссель в лекции «О химическом соста-
ве клеток», которую он прочел для Берлинского общества физиологов, впер-
вые ввел понятие «первичных» и «вторичных» компонентов клетки: «Я пред-
лагаю называть соединения, имеющие важность для каждой клетки, первич-
ными, а соединения, не присутствующие в любой растительной клетке, —
вторичными. ... В то время как первичные метаболиты присутствуют в любой
растительной клетке, способной к делению, вторичные метаболиты присут-
ствуют в клетках только “нечаянно” и не необходимы для жизни растения».
Отсюда становится понятен термин «вторичные метаболиты» — второстепен-
ные, «случайные», некоторые «чудачества» растительного метаболизма, допу-
стимые «излишества». Такие соединения в литературе иногда даже называли
«веществами роскоши клеток».
Ситуация радикально изменилась в последние десятилетия с возникнове-
нием новых методов анализа и идентификации веществ: прежде всего высоко-
эффективной хроматографии высокого давления (ВЭЖХ) и хромато-масс-спек-
трометрии (ГЖХ-МС). Выяснилось, что растения содержат десятки, если не
588
сотни тысяч различных вторичных метаболитов, и их структура чрезвычайно
разнообразна. К настоящему времени на предмет присутствия вторичных мета-
болитов исследовано около 20 — 30 тыс. видов растений, т.е. 10—15 % от всей
флоры Земли. Несмотря на это уже идентифицировано около 100000 индиви-
дуальных соединений вторичного метаболизма, и ежедневно в мире иденти-
фицируют около десятка новых. Очевидно, что при таком широком представи-
тельстве в мире растений считать вторичные метаболиты синтезированными
«случайно» не корректно. Также маловероятно, что такое количество разнооб-
разных соединений не имеет функциональной роли в жизни растения.
Наиболее аргументирована к настоящему времени гипотеза, согласно кото-
рой соединения вторичного метаболизма в отличие от первичных метаболитов
имеют функциональное значение не на уровне клетки, а на уровне целого
организма. Скорее всего эти вещества выполняют «экологические» функции,
т.е. имеют значение для защиты растения от различных вредителей и патоге-
нов; они участвуют в размножении растения (окраска и запах цветков, пло-
дов), во взаимодействии растений между собой и другими организмами в эко-
системе. Условия окружающей среды для разных видов растений весьма разно-
образны, более того, каждый вид растения может «решать» сходные задачи
по-своему. Отсюда становится понятным огромное разнообразие соединений
вторичного метаболизма растений и уникальность их набора для вида расте-
ния, зависимость от фазы развития растения, условий его выращивания. Из
«экологических» задач также следует, что многие вторичные метаболиты дол-
жны обладать биологической активностью. Действительно, большинство ле-
карственных и ядовитых растений обязаны своими свойствами присутствию
вторичных метаболитов. Выделение и химический анализ действующих веществ
из таких растений показали еще одну особенность вторичных метаболитов: эти
соединения, как правило, имеют относительно низкую молекулярную массу
(у большинства она не превышает 2,0 —3,0 кДа).
И, наконец, еще одна черта вторичных метаболитов — они синтезируются
из очень небольшого числа предшественников: 7 — 8 аминокислот для алкало-
идов, фенилаланин или тирозин для фенольных соединений, мевалоновая кис-
лота или 5-оксиксилулоза для изопреноидов.
9.2. ПРИЗНАКИ ВТОРИЧНЫХ МЕТАБОЛИТОВ
По химической структуре молекулы отличить вторичные метаболиты от
первичных можно далеко не всегда. На рис. 9.1 приведены некоторые примеры
первичных и вторичных метаболитов. Фитостерины (ситостерин, кампестерин,
стигмастерин) — обязательные компоненты мембран растительной клетки, и,
следовательно, — типичные первичные соединения. Экдистероиды (гормоны
линьки насекомых) — вторичные метаболиты, они присутствуют лишь у не-
которых видов растений. Эти вещества, как полагают, участвуют в защите ра-
стений от насекомых. Протопанаксатриол является агликоном гинзенозидов —
вторичных метаболитов женьшеня, присутствующих только в роде Рапах и в
большой степени отвечающих за его биологическую активность. В то же время
структуры молекул этих соединений похожи и отличаются только числом и
расположением метильных и гидроксильных групп. Структуры белковых ами-
589
Рис. 9.1. Структуры кампестерина (первичный метаболит), экдизона
и протопанаксатриола (вторичные метаболиты)
нокислот (первичные метаболиты) и небелковых аминокислот (типичные вто-
ричные метаболиты) часто отличаются лишь наличием или отсутствием ме-
тильной, гидроксильной либо другой функциональной группы.
На основе анализа литературы можно сформулировать четыре признака вто-
ричных метаболитов:
1) присутствие не во всех растениях;
2) наличие биологической активности;
3) относительно низкий молекулярный вес;
4) небольшой набор исходных соединений для их синтеза.
Это именно признаки вторичных метаболитов, поскольку каждый из них, в
общем-то, не обязателен. Ряд вторичных метаболитов найден практически во
всех растениях (например, многие фенилпропаноиды); достаточно много вто-
ричных метаболитов без выраженной биологической активности (хотя не ис-
ключен вариант, что ее просто не обнаружили); известны высокомолекуляр-
ные вторичные метаболиты (например, каучук и гуттаперча). Однако совокуп-
ность указанных признаков достаточно четко очерчивает круг вторичных мета-
болитов растений.
Наиболее обоснованно отнести соединение к первичным или вторичным
метаболитам можно только после выяснения его роли в жизнедеятельности
растения, т.е. на основе его функциональной значимости. Функциональное
определение вторичного метаболизма в первом приближении можно дать как
метаболизм соединений, имеющих значение на уровне целого организма, но не на
уровне клетки.
590
9.3. ПРИНЦИПЫ КЛАССИФИКАЦИИ
ВТОРИЧНЫХ МЕТАБОЛИТОВ
Принципы классификации вторичных метаболитов, как и названия инди-
видуальных соединений, изменялись по мере их изучения. Сейчас можно встре-
тить элементы по крайней мере четырех вариантов классификации.
Эмпирическая (тривиальная) классификация. Самый «древний» принцип
классификации, основанный на определенных свойствах вторичных метабо-
литов. Например, алкалоиды — соединения, имеющие щелочные свойства;
сапонины — вещества, образующие при встряхивании пену (от Saponaria —
мыльнянка); горечи — соединения с горьким вкусом; эфирные масла — аро-
матные летучие вторичные метаболиты. Подобный принцип классификации
имеет много недостатков, однако его элементы встречаются до сих пор в силу
традиции и длительного употребления.
Вторичные метаболиты получали (и получают) свои названия, как прави-
ло, также эмпирически. Чаще всего названия происходят от растения, из кото-
рого впервые было выделено соединение. Например, алкалоиды папаверин
(Papaver — мак), берберин (Berberis — барбарис), кокаин (Erythroxylum coca —
кокаиновый куст). Довольно часто названия связаны с мифологией, историей,
личностями и т.д. Например, алкалоид морфин получил свое название в честь
бога сна Морфея, алкалоид тебаин — от египетского города Тебаис, рядом с
которым в древности был центр по производству наркотиков, каучук в пере-
воде с индейского — «слезы дерева».
Подобный способ классификации и формирования названий соединений
часто приводит к недоразумениям. Например, биологически активные тритер-
пеновые гликозиды женьшеня практически одновременно начали изучать в
Японии и в России. Японские исследователи предложили их называть гинзено-
зидами — по видовому названию женьшеня (Panax ginseng), тогда как русские
исследователи — панаксозидами, т. е. по родовому названию. Позже, когда ста-
ло ясно, что одни и те же соединения называются по-разному, пришлось пуб-
ликовать «таблицы соответствия» гинзенозидов и панаксозидов.
Химическая классификация. Этот вариант классификации основан на при-
знаках химической структуры вторичных метаболитов и на данный момент
времени наиболее разработан и распространен. Однако и эта классификация
не лишена недостатков. Например, алкалоиды по такой классификации — со-
единения, имеющие атом азота в гетероцикле. По этому признаку гликоалка-
лоиды картофеля или томатов — типичные алкалоиды, однако по способу
синтеза, структуре и ряду свойств эти соединения являются изопреноидами.
Биохимическая классификация. Эта классификация базируется на способах
биосинтеза вторичных метаболитов. Например, согласно этой классификации
упомянутые выше гликоалкалоиды относятся к тритерпеновым псевдоалкало-
идам, так как синтезируются, как и стероидные гликозиды, по изопреноид-
ному пути. Это, по-видимому, наиболее объективный вариант классификации.
Однако поскольку биохимия вторичного метаболизма еще недостаточно раз-
работана, такая классификация находится в периоде становления.
Функциональная классификация. Основана на функциях вторичных метабо-
литов в интактном растении. Этот вариант принципиально отличается от пре-
591
дыдущих и должен существовать параллельно с ними. Согласно функциональ-
ной классификации в одну группу соединений могут попадать химически раз-
ные структуры. Например, фитоалексины (вторичные метаболиты, имеющие
защитные функции и синтезирующиеся в ответ на атаку патогена) представ-
лены в разных видах фенольными соединениями, изопреноидами, полиацети-
ленами и др. Разработка функциональной классификации вторичных метабо-
литов только начинается, но она имеет принципиальное значение для физио-
логии растений.
Наличие разных вариантов классификации вторичных метаболитов приво-
дит к определенным сложностям. В частности, при использовании разных при-
знаков, используемых при химической классификации, возможно «перекры-
тие» групп вторичных метаболитов. Например, в «фармакогнозии» в качестве
действующих веществ многих лекарственных растений выделяют гликозиды
(соединения, молекула которых состоит из агликона и углеводного фрагмен-
та) в отдельную группу. В то же время по структуре агликона эти гликозиды
могут быть отнесены к фенольным соединениям, изопреноидам или другим
группам вторичных метаболитов. Еще больше проблем возникает, когда соеди-
нение содержит ряд признаков, характерных для разных групп вторичных ме-
таболитов (например, пренилированные фенольные соединения). В ряде слу-
чаев появляющиеся проблемы можно снять, корректируя химическую класси-
фикацию биохимической.
9.4. ОСНОВНЫЕ ГРУППЫ ВТОРИЧНЫХ МЕТАБОЛИТОВ
В настоящее время известно более десятка групп (классов) вторичных мета-
болитов. При этом некоторые группы насчитывают по несколько тысяч индиви-
дуальных соединений, тогда как другие — лишь единицы. Также неравномерно
распределены группы в растительном мире. Например, изопреноиды и феноль-
ные соединения присутствуют во всех видах растений, тогда как некоторые группы
(например, тиофены или ацетогенины) характерны лишь для единичных видов.
Хорошо известны три самые большие группы вторичных метаболитов —
алкалоиды, изопреноиды {терпеноиды) и фенольные соединения. Каждая из этих
групп состоит из несколько тысяч соединений и подразделяется на многочис-
ленные подгруппы. Известно также около десятка менее многочисленных групп
вторичных метаболитов: растительные амины, небелковые аминокислоты,
цианогенные гликозиды, глюкозинолаты, полиацетилены, беталаины, алкил-
амиды, тиофены и др. Количество соединений, входящих в эти группы, колеб-
лется от единиц до нескольких сотен.
Вторичные метаболиты в растении практически никогда не присутствуют в
«чистом виде», они, как правило, входят в состав сложных смесей. Такие сме-
си в зависимости от их состава и нахождения в растении часто носят собствен-
ные, исторически сложившиеся названия.
Эфирные масла, как правило, представляют из себя смесь легко испаряю-
щихся изопреноидов (моно- и сесквитерпенов).
Смолы представлены главным образом дитерпенами.
Камеди состоят преимущественно из полисахаридов, но в их состав часто
входят алкалоиды, фенольные соединения.
592
Слизи — это смесь водорастворимых олиго- и полисахаридов, сахаров, а так-
же небольших количеств фенольных соединений, алкалоидов или изопреноидов.
9.5. ЗАКОНОМЕРНОСТИ СТРОЕНИЯ
ВТОРИЧНЫХ МЕТАБОЛИТОВ
При анализе структур вторичных метаболитов создается впечатление, что
их огромное разнообразие происходит по определенной схеме. Как правило,
имеется определенная «базовая» структура, на основе которой образуются мно-
гочисленные варианты. При этом можно отметить несколько способов возник-
новения таких вариантов.
• Модификации базовой структуры: обычно это либо присоединение, либо
замена функциональных групп, изменение степени окисленности молекулы; в
качестве функциональных групп часто используются гидроксильные, метиль-
ные либо метоксильные группы.
• Образование конъюгатов: присоединение к базовой структуре «унифици-
рованных блоков»; чаще всего различных сахаров (моно- или олигосахариды),
органических кислот или некоторых групп вторичных метаболитов.
• Конденсация: объединение нескольких одинаковых или различных базо-
вых структур, например образование пренилированных фенольных соедине-
ний или димерных индольных алкалоидов.
Для разных групп вторичных метаболитов характерны специфические изме-
нения структуры. Например, для алкалоидов характерно метоксилирование,
но не гликозилирование; для изопреоидов, наоборот, типично гликозилиро-
вание, но не метоксилирование; у фенольных соединений наблюдаются оба
типа этих модификаций.
Определенные модификации молекул, по-видимому, имеют существенное
функциональное значение. Многие из них (в частности, гликозилирование)
значительно изменяют биологическую активность молекулы. Очень часто гли-
козилирование является универсальным способом перевода активной (функ-
циональной) формы вторичного метаболита в неактивную (запасную). По этой
причине, видимо, нецелесообразно выделять все гликозиды в отдельную груп-
пу вторичных метаболитов.
9.6. ФИТОХИМИЯ ВТОРИЧНОГО МЕТАБОЛИЗМА
9.6.1. АЛКАЛОИДЫ — АЗОТСОДЕРЖАЩИЕ ВТОРИЧНЫЕ МЕТАБОЛИТЫ
Название этой группы веществ происходит от арабского alcali — щелочь и
греческого eidos — подобный. В настоящее время известно около 10 000 инди-
видуальных алкалоидов.
В случае алкалоидов достаточно удачно совпали эмпирическая и химиче-
ская классификация. Согласно химической классификации, алкалоиды — это
соединения, содержащие один или несколько атомов азота в молекуле, что и
придает им щелочные свойства. По химической структуре алкалоиды обычно
593
разделяют на две подгруппы: протоалкалоиды, которые содержат азот не в
гетероцикле, и истинные алкалоиды, содержащие азот в гетероцикле. В распре-
деление алкалоидов на подгруппы внесла коррективы биохимическая класси-
фикация. Гликоалкалоиды, а также ряд других алкалоидов (например, алкало-
иды аконита) по типу синтеза и по структуре фактически являются изопрено-
идами. Поэтому было решено выделить их в особую группу — изопреноидных
псевдоалкалоидов. Таким образом, по «модифицированной» химической клас-
R = СОСН3 — Колхицин
R = СН3 — Колхамин
Группа
пиперидина
Группа
пиридина
Рис. 9.2. Структуры некоторых протоалкалоидов
Группа
пирролизидина
Группа
изохинолина
Группа
хинолина
Группа
пирролизидина
Группа
хинолизидина
Группа
имидазола
акридина
Рис. 9.3. Основные группы истинных алкалоидов
Группа
хиназолина
Группа Группа Группа
пурина
тропана
594
сификации сейчас принято разделять алкалоиды на три подгруппы: протоал-
калоиды (азот не в гетероцикле); истинные алкалоиды (азот в составе гетеро-
цикла); псевдоалкалоиды (синтез не из аминокислот). Каждая подгруппа разде-
ляется в свою очередь на 3—10 классов.
По биохимической классификации алкалоиды подразделяются на подгруппы
в соответствии с исходной для их синтеза аминокислотой: алкалоиды, синте-
зирующиеся из L-орнитина (простые пирролидиновые алкалоиды, тропано-
Рис. 9.4. Структуры некоторых истинных алкалоидов
595
а-Соланин
Рис. 9.5. Структура соланина — тритерпенового псевдоалкалоида
вые алкалоиды, пирролизидиновые алкалоиды); L-лизина (пиперидиновые ал-
калоиды, хинолизидиновые алкалоиды); L-триптофана (сложные индольные
алкалоиды, p-карболиновые алкалоиды); L-фенилаланина (сложные изохино-
линовые алкалоиды); антраниловой кислоты (протоалкалоиды, хинолиновые
алкалоиды, хиназолиновые алкалоиды); L-тирозина (сложные изохинолино-
вые алкалоиды); гистидина (пуриновые алкалоиды) и алкалоиды, синтезиру-
ющиеся по изопреноидному пути (изопреноидные или псевдоалкалоиды).
Наиболее широко алкалоиды распространены среди покрытосеменных рас-
тений. Особенно богаты ими семейства маковых, пасленовых, бобовых, кутро-
вых, мареновых, лютиковых. Во мхах, папоротниках, голосеменных алкалои-
ды встречаются относительно редко.
Разные органы и ткани растения могут содержать разные алкалоиды. Обыч-
но их концентрация невелика и составляет десятые и сотые доли процента.
При содержании алкалоидов около 1 — 3 % растение считается богатым алка-
лоидами (алкалоидоносным). Только немногие растения, например культиви-
руемые формы хинного дерева, могут накапливать до 15 — 20% алкалоидов.
Протоалкалоиды встречаются довольно часто в растениях разных семейств,
но, как правило, не накапливаются в значительных количествах. Примеры не-
которых из них приведены на рис. 9.2. Истинные алкалоиды классифицируют в
зависимости от химической структуры гетероциклического кольца. На рис. 9.3
представлены основные группы алкалоидов и характерный для них тип гетеро-
цикла, а на рис. 9.4 — структуры некоторых из известных алкалоидов. Из псев-
доалкалоидов наиболее известны стероидные гликоалкалоиды пасленовых,
структура одного из них представлена на рис. 9.5.
9.6.2. ИЗОПРЕНОИДЫ (ТЕРПЕНОИДЫ)
Изопреноиды — обширная группа соединений, имеющих общую формулу
(C5Hg)n. С5Н8 — это единица изопрена, таким образом изопреноиды являются
соединениями, «составленными» из нескольких изопреновых единиц. Их био-
596
синтез действительно идет соединением пятиуглеродных фрагментов, поэтому
название этой группы веществ совпадает с их биохимической классификацией.
Второе название изопреноидов — «терпеноиды» — берет начало от немецкого
Рис. 9.6. Структура некоторых монотерпенов
Акоран Абиетовая кислота Стевиол
Рис. 9.7. Структура некоторых сесквитерпеноидов и дитерпеноидов
597
Фуростаноловые
Сапонины стероидные
Cym-p-D-Glc-a-D-Glc
Цимарин
К-строфантин-р
К у_______________>
К-строфантозид
Сердечные гликозиды
Рис. 9.8. Примеры структур тритерпеноидов
слова Terpentin (скипидар), так как скипидар представляет собой смесь легких
изопреноидов. «Терпенами» называют соединения, содержащие целое число
С5 единиц, независимо от присутствия в молекуле функциональных групп (гид-
роксильных, карбонильных и др.). Название «терпеноиды» применяют для со-
единений с различным числом углеродных атомов, но биосинтез которых явно
598
прошел из С5 единиц. В настоящее время известно более 30 000 различных изо-
преноидов.
Классификация изопреноидов основана на количестве изопреновых еди-
ниц, входящих в состав молекулы. Соединения на основе только одной изо-
преновой единицы в растениях обнаружили лишь сравнительно недавно. По-
этому исторически сложилось, что монотерпенами назвали соединения, со-
держащие две изопреновые единицы и, следовательно, имеющие общую фор-
мулу (С5Н8)2, т.е. Ct0Hi6. Изопреноиды, содержащие три изопреновые едини-
цы, назвали сесквитерпенами {«полуторатерпенами»), общая формула С15Н24.
Соответственно дитерпены построены из четырех, тритерпены — из шести и
тетратерпены — из восьми пятиуглеродных фрагментов. Когда же обнаружили
соединения, состоящие из одного и пяти изопреновых единиц, то их при-
шлось назвать соответственно гемитерпенами и сестертерпенами. Политерпено-
иды каучук и гута имеют в своем составе от 100 до 5000 единиц изопрена.
Моно- и сесквитерпеноиды — как правило, легкоиспаряющиеся жидкости,
часто с разнообразным запахом. Известно более 3000 этих соединений. Их клас-
сификация основана на наличии или отсутствии кольцевой структуры в моле-
। куле, типе кольца, а также наличии и количестве двойных связей в молекуле.
Моно- и сесквитерпены могут быть алифатическими (углеводород с незамкну-
той цепочкой атомов), циклическими с различным количеством циклов (от
одного до трех), а также содержать различные функциональные группы (гид-
рокси-, карбокси-, кето-группы). Они составляют основу эфирных масел. Моно-
и сесквитерпеноиды часто обладают бактерицидным действием.
Дитерпеноиды также насчитывают несколько тысяч структур. Они являются
главными компонентами смол у голосеменных (ель, сосна, пихта, кедр). Часто
дитерпеноиды смол обладают бактерицидными свойствами.
Структуры некоторых моно-, сескви- и дитерпеноидов показаны на рис. 9.6
и 9.7.
Тритерпеноиды представлены несколькими группами соединений. Прежде всего
это соединения первичного метаболизма — фитостерины, однако большинство
тритерпеноидов являются типичными вторичными метаболитами. Тритерпе-
ноиды обладают широким спектром биологической активности. К ним относят-
ся сердечные, стероидные, тритерпеновые гликозиды, экдистероиды (рис. 9.8).
Тетратерпеноиды представлены в растениях главным образом каротиноида-
ми, некоторые из них участвуют в основном обмене (фотосинтез), однако
большинство (около 500) — это типично вторичные метаболиты.
9.6.3. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ (РАСТИТЕЛЬНЫЕ ФЕНОЛЫ)
Фенольные соединения — вещества ароматической природы, содержащие
одну или несколько гидроксильных групп у ароматического кольца. Фенолами
называют соединения с одним атомом гидроксила, полифенолами — с двумя и
более. Многие фенольные соединения участвуют в основном обмене (в частно-
сти, в процессах фотосинтеза и дыхания), однако большинство из них — ти-
пичные представители вторичного метаболизма.
Фенольные соединения классифицируются в зависимости от числа арома-
тических колец и количества присоединенных к ним атомов углерода. Феноль-
599
ные соединения принято разделять на три большие подгруппы: с одним и
двумя ароматическими кольцами, а также полимерные фенольные соедине-
ния. Иногда в особую группу выделяют димерные фенольные соединения.
Фенольные соединения с одним ароматическим кольцом в зависимости от
дополнительных атомов углерода разделяются на:
— соединения Сб-ряда (без дополнительных атомов углерода); к ним отно-
сят простые фенолы, а иногда также и бензохиноны, хотя у них ароматическое
кольцо почти всегда соединено с длинной изопреноидной цепочкой;
— соединения С6-С1-ряда (один дополнительный атом углерода) — произ-
водные оксибензойной кислоты, которые часто называют фенольными кисло-
тами, или фенолокислотами',
— соединения С6-С2-ряда (два дополнительных атома углерода), включаю-
щие фенолоспирты, фенилуксусные кислоты, ацетофеноны,
— соединения Сб-СЗ-ряда (три дополнительных атома углерода); эту наи-
более многочисленную и важную группу веществ часто называют фенилпро-
паноидами', она включает: оксикоричные кислоты (по международной номенк-
латуре — гидроксикоричные), оксикоричные (гидроксикоричные) спирты,
фенилпропены, а также кумарины, изокумарины и хромоны — соединения, у ко-
торых дополнительные атомы углерода замыкаются в конденсированное лак-
тонное кольцо; некоторые фенилпропаноиды образуют димеры, т. е. соеди-
нения типа (С6-С3)2, и такие вещества называют лигнанами',
Ri = R2 = Н — и-Оксикоричная кислота
(и-кумаровая)
R( = ОН, R2 = Н — Кофейная кислота
R( = ОСН3, R2 = Н — Феруловая кислота
R, = R2 = ОСН3 — Синаповая кислота
R] = Н, R2 = ОН — Протокатеховая кислота
Ri = R2 = Н — и-Оксибензойная кислота
Ri = Н, R2 = ОСН3 — Ванилиновая кислота
Ri = R2 = ОСН3 — Сиреневая кислота
Ri = R2 = ОН — Галловая кислота
Рис. 9.9. Оксибензойные (А), оксикоричные (Б) кислоты и кумарины (В)
600
— соединения С6-С4-ряда (четыре дополнительных атома углерода), к ко-
торым относятся нафтохиноны.
На рис. 9.9 представлены некоторые из фенольных соединений с одним
ароматическим кольцом.
Б
Rj = R2 = Н — Пиносильвин
Ri = ОН, R2 = Н — Резвератрол
Ri = R2 = ОН, R3 = R4 = Н — Хризацин
Rj = R2 = Rj = ОН, R4 = СН3 — Реум-эмодии
R] = R2 = OH, R3 = H, Rj = CH2OH — Алоэ-эмодии
R] = R2 = OH, R3 = H, Rj = CH3 — Хризофанол
Ri = R2 = OH, R3 = H, Rj = СООН — Рейн
Флаванон
Халкон
Антоцианидин
ОН
R = ОН, Rj = Н — Цианидин
R = Rj = Н — Пеларгонидин
R = Rj = ОН — Дельфинидин
R = ОСН3, Rj = Н — Пеонидин
R = ОН, Rj = ОСН3 — Петунидин
R = Ri = ОСН3 — Мальвидин
Рис. 9.10. Фенольные соединения с двумя ароматическими кольцами: стильбены (А),
антрахиноны (Б), основные группы флавоноидов (В), антоцианидины (Г)
601
Фенольные соединения с двумя ароматическими кольцами. Эти соединения
подразделяются на:
— соединения С6-С1-С6-ряда (два ароматических кольца соединены мости-
ком из одного углеродного атома), к ним относятся бензофеноны и ксантоны;
— соединения С6-С2-С6-ряда (два ароматических кольца соединены двумя
атомами углерода), к ним относятся стильбены (два кольца соединяются це-
почкой из двух атомов углерода) и антрахиноны (два ароматических кольца
соединяются двумя атомами углерода с образованием центрального конденси-
рованного третьего кольца);
— соединения Сб-СЗ-Сб-ряда (два ароматических кольца соединены тремя
атомами углерода) — наиболее многочисленная группа фенольных соедине-
ний, представленная прежде всего флавоноидами, которые в свою очередь вклю-
чают целый ряд подгрупп; к этой же группе соединений относятся изофлавоно-
иды и неофлавоноиды, также состоящие из нескольких подгрупп.
На рис. 9.10 представлены некоторые из фенольных соединений с двумя
ароматическими кольцами.
Полимерные фенольные соединения. Эти вещества принято подразделять на
четыре подгруппы: гидролизуемые дубильные вещества (таннины — сложные
эфиры глюкозы и галловой кислоты), конденсированные дубильные вещества
(танниды — полимеры флавоноидов), лигнины (полимеры оксикоричных спир-
тов) и меланины.
Отличительной чертой фенольных соединений является формирование ог-
ромного числа соединений за счет модификаций молекулы и образования конъ-
югатов с разнообразными структурами. Из модификаций для фенольных со-
единений характерны образование гликозидов, метилирование и метоксили-
рование. За счет гидроксильных и карбоксильных групп фенольные соедине-
ния могут связываться с сахарами, органическими кислотами, растительными
аминами, алкалоидами. Помимо этого растительные фенолы могут соединять-
ся с изопреноидами, образуя большую группу пренилированных фенолов. Такие
свойства фенольных соединений обеспечивают огромное разнообразие струк-
тур, характерное для растительных фенолов.
9.6.4. МИНОРНЫЕ ГРУППЫ ВТОРИЧНЫХ МЕТАБОЛИТОВ
Растительные амины. В высших растениях присутствует большое количество
аминов — первичных, вторичных, третичных и четвертичных. Многие из них
структурно представляют собой декарбоксилированные аминокислоты, при-
чем как белковые, так и небелковые. Растительные амины подразделяют на
моноамины (с одной аминогруппой), диамины (с двумя аминогруппами) и
полиамины.
Беталаины. Так называются водорастворимые азотсодержащие пигменты
высших растений. Они присутствуют только в растениях порядка гвоздичные
(Caryophyllalles). До сих пор не найдены растения, где две группы водораство-
римых пигментов — антоцианы и беталаины — встречаются одновременно.
Группу беталаинов составляют бетацианины и бетаксантины — соответствен-
но красно-фиолетовые и желтые соединения. Бетацианины представляют со-
бой гликозиды и ацил гликозиды всего двух агликонов.
602
Цианогенные гликозиды. Цианогенные гликозиды являются р-гликозидами
2-гидроксинитрилов (цианогидринов). К настоящему времени в высших расте-
ниях обнаружено несколько десятков подобных соединений. Основные струк-
турные вариации обусловлены природой заместителей Rj и R2. В качестве угле-
водного фрагмента как правило, выступает D-глюкоза. При гидролизе циано-
генных гликозидов специфичной гликозидазой выделяется синильная кислота.
Небелковые аминокислоты. Под этим термином подразумеваются природ-
ные аминокислоты, их амиды, иминокислоты, которые в норме не входят в
состав белков. Сейчас известно более 400 небелковых аминокислот. Многие из
них можно рассматривать как модификации белковых. Наиболее часто встреча-
ются варианты удлинения или сокращения углеродной цепи (добавление или
удаление СН2- или СН3-фрагментов), гидрирование и дегидрирование, гид-
роксилирование, аминирование. Встречаются и необычные (например, селен-
содержащие) аминокислоты. Небелковые аминокислоты преимущественно
весьма токсичны, поскольку могут включаться в белки вместо «нормальных»
аминокислот и нарушать их функции.
Необычные липиды. К ним относятся прежде всего «необычные» жирные кис-
лоты, которые отличаются от «обычных» длиной углеродной цепи, иным рас-
положением и количеством двойных связей, наличием дополнительных функ-
циональных групп и циклов. Чаще всего необычные жирные кислоты обнару-
живаются в масле семян. Во многих видах высших растений обнаружены соеди-
нения с одной или несколькими тройными связями. Такие соединения полу-
чили название ацетиленовых производных, или полиацетиленов. Известно не-
сколько сотен таких структур. В отличие от необычных жирных кислот, ацети-
Б R2 О-0-Сахар
Ri ON
В
R-C-SGlc
II
N- ОСОзХ*
Общая формула
Н3С. O-P-G1C
Общая формула
Н3СЧ O-p-Glc
Н3СГ ON
Линамарин
(/?)-Амигдалин (Я)-Вицианин
Рис. 9.11. Некоторые минорные классы вторичных метаболитов: растительные
амины (А), цианогенные гликозиды (Б), гликозиды горчичных масел (В)
Лотаустралин
603
леновые производные могут находиться во всех органах и частях растения. К
необычным липидам относятся также цианолипиды, при гидролизе которых
выделяется синильная кислота.
Серосодержащие вторичные метаболиты. К ним относятся прежде всего ти-
огликозиды (S-гликозиды). Наиболее известны гликозиды горчичных масел (глю-
козинолаты). Эти гликозиды характерны для растений семейства кресто-
цветных. Они обладают сильным антимикробным действием и обуславливают
острый или жгучий вкус горчицы, хрена, редьки. Механизм действия глюко-
зинолатов весьма сходен с действием цианогенных гликозидов: после отщеп-
ления сахара мирозиназой образуются изотиоцианаты, обуславливающие жгу-
чий вкус и раздражающее действие. Другую группу серосодержащих вторичных
метаболитов составляют аллицины чеснока и лука, которые синтезируются из
цистеина. Они также ответственны за жгучий вкус и антимикробные свойства
этих растений.
На рис. 9.11 представлены структуры некоторых минорных вторичных мета-
болитов.
9.7. БИОХИМИЯ ВТОРИЧНОГО МЕТАБОЛИЗМА
9.7.1. ПУТИ БИОСИНТЕЗА ВТОРИЧНЫХ МЕТАБОЛИТОВ
Пути синтеза большинства вторичных метаболитов установлены достаточно
хорошо. В настоящее время интенсивно изучается энзимология вторичного ме-
таболизма. На основании имеющейся информации можно сформулировать не-
которые закономерности биосинтеза этих соединений. Предшественниками
синтеза служит относительно небольшое количество первичных метаболитов.
Многие группы вторичных метаболитов могут синтезироваться несколькими
путями. Часто этапы синтеза дублированы в разных компартментах клетки (на-
пример, пластиды — цитозоль). Синтез четко спланирован и обслуживается
набором специальных ферментов, в большинстве случаев весьма специфичных.
Биосинтез алкалоидов. Образование этих веществ тесно связано с общим
обменом азота клетки. Для большинства алкалоидов показано, что схемы их
синтеза унифицированы, т. е. имеют сходную последовательность реакций. Пред-
шественниками синтеза протоалкалоидов и истинных алкалоидов являются
аминокислоты, список которых приведен на с. 595 и 596. В процессе биосинтеза
молекула аминокислоты практически полностью включается в структуру алка-
лоида. Синтез алкалоидов разных групп включает одинаковые типы реакций:
декарбоксилирование, окислительное дезаминирование, альдольная конденса-
ция, но для каждой группы алкалоидов эти реакции осуществляют «собствен-
ные» ферменты. На первом этапе синтеза происходит декарбоксилирование
аминокислоты при участии соответствующей декарбоксилазы. Образовавшие-
ся биогенные амины подвергаются окислительному дезаминированию с учас-
тием аминооксидаз. Полученные в результате аминоальдегиды или аминокето-
ны в результате серии последовательных реакций образуют ключевые гетеро-
циклические соединения. Затем происходит модификация базовой структуры
с участием разнообразных реакций — гидроксилирования, метилирования и
др. В формировании окончательной структуры алкалоида могут принимать уча-
604
стие дополнительные углеродные единицы, например ацетат (в виде ацетил-
СоА) или монотерпеновая единица (для сложных индольных алкалоидов). В
зависимости от сложности алкалоида его биосинтез включает от трех-четырех
до десяти—пятнадцати реакций.
Для целого ряда алкалоидов не только установлена схема синтеза, но оха-
рактеризованы и выделены ферменты. Оказалось, что некоторые ферменты
синтеза не очень специфичны (в качестве субстратов могут использовать раз-
личные соединения), однако в цепочке синтеза обязательно присутствуют
высокоспецифичные ферменты, которые используют только один субстрат (или
ряд очень близких субстратов) и выполняют очень специфичную реакцию.
Например, при синтезе изохинолинов гидроксилирование базовой структуры
по каждому положению выполняют разные ферменты. По мере продвижения к
заключительным этапам синтеза сродство ферментов к субстрату обычно по-
вышается: например, для ряда ферментов синтеза бербериновых алкалоидов
Кт составляет менее 1 мкМ. В качестве примера на рис. 9.12 представлена схема
синтеза изохинолиновых алкалоидов.
Биосинтез изопреноидов. Если при синтезе алкалоидов сходная цепочка пре-
вращений используется для различных исходных соединений (аминокислот),
то синтез колоссального числа изопреноидов происходит из единственного
предшественника — изопентенилдифосфата (ИПДФ). Под действием фермен-
та изопентенилдифосфатизомеразы, которая сдвигает двойную связь, ИПДФ
превращается в диметилаллилдифосфат (ДМАДФ). Далее ИПДФ присоединя-
ется к ДМАДФ по двойной связи и образуется Сю-соединение — геранилди-
фосфат. Он служит источником всех монотерпеноидов. Затем к геранилди-
фосфату присоединяется еще один ИПДФ и образуется С ^-соединение
фарнезилдифосфат — исходное вещество для синтеза сесквитерпеноидов. Да-
лее фарнезилдифосфат может либо присоединить еще одну молекулу ИПДФ с
образованием геранилгеранилдифосфата (С2о-соединение — источник дитер-
пеноидов), либо димеризоваться с образованием сквалена (С30-соединение —
исходное соединение для всех тритерпеноидов). Наконец, геранил геранилди-
фосфат может димеризоваться с образованием фитоина — С40-соединения,
источник тетратерпеноидов. Кроме того, к геранилгеранилдифосфату может
последовательно присоединиться большое количество ИПДФ, формируя в
конечном итоге полиизопреноиды — каучук и гуттаперчу. В результате описан-
ных реакций образуется полный гомологический ряд С5-соединений разной
длины. Далее эти алифатические молекулы могут «свернуться» в циклические
структуры, причем количество циклов, их размер и типы сочленения могут
быть самыми разными. На рис. 9.13 представлена общая схема синтеза изопре-
ноидов.
Синтез базовых изопреноидных структур осуществляют всего два типа фер-
ментов — пренилтрансферазы, которые «наращивают» длину изопренои-
дов, и циклазы, которые формируют соответствующий циклический скелет
молекулы. При этом каждый тип структуры формирует специфическая цик-
лаза. Так как типов циклических структур изопреноидов довольно много, то и
количество циклаз должно быть внушительным. К настоящему времени их из-
вестно более ста. После формирования базовой структуры (или одновремен-
но с этим), происходит ее модификация и «оснащение» функциональными
группами.
605
Фенолоксидаза
(5) -Нор ко-
кл аурин-
синтаза
(S) -Норкоклаурин
SAM Норкоклаурин-
б-О-метил-
SAH трансфераза
(8)-3'-Гидрокси-М-
метилкоклаурин
(8)-Н-метил-коклаурин-
3'-гидроксилаза
NADP+ NADPH
(8)-М-метил-Коклаурин
Коклаурин-N-
метилтрансфереза
SAH SAM
(8)-Коклаурин
SAM л
SAH
3' -Гидрокси-N-
метилкоклаурин-4-О-
метилтрансфераза
NADPH Канадин-
02 синтаза
Рис. 9.12. Схема биосинтеза изохинолиновых алкалоидов
Гемитерпены
| Димеризация
Каротиноиды
Б
НО
СОО“
/ТРР-®
с
•сн20®
н-с-он
•сн2о®
Н-С-ОН NADPH
С=О
•СНз
•СНз | СО2
Пируват трр—Q
у----- но-с-н
СН2О® HO-C—ТРР—©
н-с-он .сн3
с ГАФ
/Ц,
н о .
2Ацетил-СоА
О. /S—СоА
С
О^ ZS—СоА
С
СООН
с=о
•СН3
Пируват
•СН3
А
О S-CoA
Ацетил-СоА
н-о-с
NADP
О=С
1 -Дезокси-П-ксилу-
лозо-5-фосфат
сн2
2 CoASH
•сн2
О-С-СНз
•сн2
СООН
HMG-CoA
2NADPH
2NADP
CoASH
СН2ОН
•СН2
но-с-СНз
•сн2
СООН
Мевалоновая
кислота
Н3С- /ОН
/С. >ол2
Н2С .С. О®
6нн он
2-С-метил-П-
эритритол-4-фосфат
О®®
4
ИПДФ
5
1
4 2
ИПДФ
О®®
Рис. 9.13. Общая схе-
ма биосинтеза изо-
преноидов (Л) и два
пути синтеза изопен-
тенилдифосфата (£)
в растениях.
Точками показаны ме-
ченые атомы в исходных
соединениях и в образо-
вавшихся ИПДФ
Таким образом, биосинтез изопреноидов можно представить себе как свое-
образный биохимический «моделист-конструктор». Вначале из унфицирова-
ных С5-модулей изготовляются гибкие линейные конструкции разной длины.
Они представляют собой практически идеальный материал для «биохимичес-
кого конструирования» и формирования множества вариантов циклических
структур.
Долгое время считалось, что во всех организмах исходное соединение для
образования изопреноидов — ИПДФ — формируется единственным спосо-
бом, а именно из мевалоновой кислоты, которая в свою очередь синтезирует-
ся из трех молекул ацетил-СоА. Недавно было установлено, что разные орга-
низмы используют различные способы синтеза ИПДФ. В клетках животных и
грибов все изопреноиды синтезируются по «классическому» мевалонатному
пути. Целый ряд микроорганизмов, в том числе многие цианобактерии и зеле-
ные водоросли, используют другой вариант образования ИПДФ. В этом случае
его предшественником является 1-дезоксиксилулозо-5-фосфат, который син-
тезируется из пирувата и глицеральдегид-3-фосфата. Такой путь синтеза был
назван «альтернативным», или «немевалонатным». Оказалось, что растения
используют оба варианта образования изопреноидов: в цитозоле синтез идет
по классическому пути, а в пластидах — по альтернативному (рис. 9.13). При
этом возможно не только дублирование синтеза изопреноидов в разных ком-
партментах клетки, но и разделение по типу синтезируемых структур. Тритер-
пеноиды (включая стероиды) синтезируются в цитозоле из мевалоната, тогда
как дитерпеноиды (включая фитол хлорофилла) и тетратерпеноиды (прежде
всего каротиноиды) — в пластидах по альтернативному пути. Моно- и сескви-
терпены, вероятно, могут образовываться разными вариантами в зависимости
от структуры молекулы и вида растения.
Биосинтез фенольных соединений. К настоящему времени известно два пути
образования фенольных соединений — шикиматный (через шикимовую кисло-
ту) и ацетатно-малонатный. Основной путь шикиматный, это практически
единственный способ формирования ароматического кольца. В качестве исход-
ных соединений для синтеза выступают фосфоенолпируват (ФЕП) и эритрозо-
4-фосфат. При их конденсации возникает семиуглеродная кислота (2-кето-З-
дезокси-7-фосфоарабогептановая), которая затем циклизуется в 5-дегидрохин-
ную кислоту. Из дегидрохинной кислоты образуется шикимовая кислота, кото-
рая имеет шестичленное кольцо, одну двойную связь, и ее легко перевести в
соединения ароматического ряда. Из шикимовой кислоты возможно образова-
ние оксибензойных кислот — n-оксибензойной, протокатеховой, галловой. Од-
нако основной путь использования шикимовой кислоты — образование через
префеновую кислоту ароматических аминокислот фенилаланина и тирозина.
Фенилаланин (возможно, в ряде случаев и тирозин) — основной предшествен-
ник синтеза фенольных соединений. Дезаминирование фенилаланина осуще-
ствляет фермент фенилаланинаммиаклиаза (ФАЛ). В результате образуется ко-
ричная кислота, гидроксилирование которой приводит к образованию пара-
кумаровой (оксикоричной) кислоты. После дополнительного гидроксилиро-
вания и последующего метилирования из нее образуются остальные оксико-
ричные кислоты.
Оксикоричные кислоты представляют центральное звено синтеза всех фе-
нольных соединений клетки. Одтео-кумаровая кислота является предшествен-
20 Физиология растений
609
ником кумаринов. После ряда реакций укорочения алифатической части моле-
кулы образуются Сб-Сг- и Cg-C]-соединения — это второй путь образования
оксибензойных кислот (первый — непосредственно из шикимовой кислоты).
Оксикоричные кислоты могут образовывать различные конъюгаты, прежде всего
с сахарами, однако основная масса оксикоричных кислот активируется путем
взаимодействия с СоА. Два магистральных пути использования СоА-эфиров
оксикоричных кислот — синтез лигнинов и синтез флавоноидов. Для синтеза
лигнинов СоА-эфиры оксикоричных кислот восстанавливаются до спиртов,
которые выступают в качестве мономеров синтеза. При синтезе флавоноидов
СоА-производное оксикоричной кислоты взаимодействует с тремя молекула-
ми малонил-СоА с образованием халкона. Реакцию катализирует фермент хал-
консинтаза. Образовавшийся халкон легко преобразуется в флаванон. Из фла-
ванонов за счет реакций гидроксилирования, окисления —восстановления об-
разуются другие группы флавоноидов. Затем может происходить модификация
молекулы — гликозилирование, метоксилирование и др.
Ацетатно-малонатный путь синтеза фенольных соединений широко распро-
странен у грибов, лишайников и микроорганизмов. У растений он является
минорным. При синтезе соединений по этому пути ацетил-СоА карбоксилиру-
ется с образованием малонилацетил-СоА. Затем происходит каскад аналогич-
ных реакций, в результате наращивается углеродная цепь и возникает поли-р-
кетометиленовая цепочка. Циклизация поликетидной цепи приводит к образо-
ванию различных фенольных соединений. Таким способом синтезируются фло-
роглюцин и его производные, некоторые антрахиноны. В структуре флавонои-
дов кольцо В формируется по шикиматному пути (из оксикоричной кислоты),
тогда как кольцо А — по ацетатно-малонатному.
В клетке работают два шикиматных пути синтеза флавоноидов — один в
пластидах, другой в цитозоле. В этих компартментах находится полный набор
изоферментов шикиматного пути, а также ферментов фенольного метаболиз-
ма, в том числе ФАЛ и халконсинтазы. Таким образом, в растительной клетке
существует две параллельные цепочки синтеза фенольных соединений (анало-
гично изопреноидам).
Синтез минорных классов вторичных соединений. Образование этих веществ
также изучено достаточно полно. Для многих азотсодержащих соединений ис-
ходными веществами являются аминокислоты. Например, синтез цианоген-
ных гликозидов начинается с декарбоксилирования соответствующей амино-
кислоты, затем последовательно формируются альдоксим, нитрил и а-гидро-
ксинитрил. На последнем этапе синтеза образуется цианогенный гликозид за
счет гликозилирования а-гидроксинитрила при помощи УДФ-глюкозы. Син-
тез обычно осуществляет комплекс ферментов: например, для дуррина этот
комплекс состоит из четырех ферментов. Гены ферментов клонированы. Транс-
генное по двум генам растение арабидопсиса приобрело способность к синтезу
цианогенных гликозидов. Синтез беталаинов начинается от тирозина, который
гидроксилируется и образуется диоксифенилаланин (ДОФА). ДОФА служит
источником для двух фрагментов молекулы бетацианинов — беталамовой кис-
лоты и цикло-ДОФА. Объединение этих двух соединений приводит к форми-
рованию бетацианинов. При синтезе бетаксантинов беталамовая кислота кон-
денсируется с пролином. Серосодержащие вторичные метаболиты обычно син-
тезируются из серосодержащих аминокислот.
610
9.7.2. ЭНЗИМОЛОГИЯ ВТОРИЧНОГО МЕТАБОЛИЗМА
Изучение энзимологии вторичного метаболизма привело к открытию уди-
вительно большого количества различных ферментов, участвующих в этом
процессе.
Модификация вторичных метаболитов — источник их поразительного раз-
нообразия. Модификация происходит прежде всего в реакциях замещения (их
осуществляют ацилтрансферазы), метилирования, гликозилирования. В геноме
арабидопсиса обнаружены гены 43 различных ацилтрансфераз. Несколько струк-
турно близких ацилтрансфераз используют в качестве субстратов ацил-СоА, в
их активном центре содержится консервативный гистидин. Гены ацилтрансфе-
раз в геноме собраны в кластеры. Метилтрансферазы представляют собой су-
персемейство ферментов, в которое входят О-, С-, N-, S-метилтрансферазы.
Они используют в качестве метилирующего субстрата S-аденозинметионин
(SAM) и осуществляют метилирование фенилпропаноидов, флавоноидов,
алкалоидов, поликетидов, сахаров. С-, N-, S-метилтрансферазы структурно
(и, видимо, эволюционно) не связаны, тогда как О-метилтрансферазы имеют
сходную первичную структуру и консервативный SAM-связывающий мотив.
Гликозилирование осуществляют гликозилтрансферазы, причем существуют
три типа ферментов: О-, С-, S-гликозилтрансферазы. Гликозилирование су-
щественно изменяет свойства молекулы, прежде всего увеличивает ее раство-
римость и снижает токсичность.
Окислительно-восстановительные превращения кардинально изменяют свой-
ства молекулы. Эти реакции катализируют окислительно-восстановительные
(редокс) ферменты вторичного метаболизма — «метаболические волшебные
палочки». У растений обнаружили более 300 цитохром-Р450-оксигеназ и более
100 диоксигеназ; при этом следует учесть, что диоксигеназы обычно мульти-
субстратны и образуют несколько продуктов.
9.8. ФИЗИОЛОГИЯ ВТОРИЧНОГО МЕТАБОЛИЗМА
9.8.1. ЛОКАЛИЗАЦИЯ ВТОРИЧНЫХ МЕТАБОЛИТОВ В РАСТЕНИИ
Вторичные метаболиты могут находиться в различных частях клетки, тка-
ни, органа растения.
Внутриклеточная локализация. Вторичные метаболиты, как правило, на-
капливаются в «метаболически неактивных» компартментах клетки — вакуо-
лях и периплазматическом пространстве (клеточной стенке), но синтез их про-
ходит обычно в других компартментах — чаще всего в цитозоле, ЭР и хлоро-
пластах. Таким образом, в клетке синтез и накопление вторичных метаболитов
пространственно разобщены; после синтеза должен происходить их транспорт
по секреторному пути.
Места синтеза и накопления вторичных метаболитов различны для разных
классов соединений. Алкалоиды накапливаются, как правило, в вакуолях, а в
периплазматическое пространство практически не поступают. Возможно, это
является следствием «бережного отношения» растения к азотсодержащим со-
611
единениям. Транспорт алкалоидов в вакуоли проходит с участием специфич-
ных переносчиков (видимо, ABC-транспортеров). Во всяком случае в изолиро-
ванные вакуоли эффективно поступают только «собственные» алкалоиды, т.е.
характерные для данного растения. В вакуолях алкалоиды обычно находятся в
виде солей. Синтез алкалоидов проходит преимущественно в пластидах (на-
пример, хинолизидновых) либо в цитозоле (чаще всего ЭР).
Изопреноидные вторичные метаболиты, в отличие от алкалоидов, обычно
после синтеза выводятся из клетки. Помимо клеточной стенки, они могут иногда
накапливаться в вакуолях. Синтез изопреноидов может проходить в двух ком-
партментах — в пластидах или в цитозоле. При этом существуют два независи-
мых пути синтеза изопреноидов: мевалонатный — в цитоплазме, альтернатив-
ный — в пластидах. «Пластидный» синтез изопреноидов часто осуществляется
в лейкопластах — специализированных «изопреноидных» пластидах, которые
имеют ряд морфологических особенностей (например, отсутствие рибосом,
особое расположение внутренних мембран). Для них характерны тесные кон-
такты с ЭР («ретикулярный футляр»), что косвенно указывает на взаимодей-
ствие пластид и ЭР при синтезе изопреноидов.
Фенольные соединения накапливаются как в вакуолях, так и в периплазма-
тическом пространстве. При этом в вакуолях обычно содержатся гликозилиро-
ванные фенольные соединения, тогда как в периплазматическом простран-
стве — метаксилированные соединения или агликоны. Синтез фенольных со-
единений происходит в хлоропластах и цитозоле. Показано существование двух
независимых путей синтеза ароматических соединений (шикиматные пути) —
в цитозоле и в пластидах.
Многие соединения других классов вторичных метаболитов также накапли-
ваются в вакуолях. Подобную локализацию имеют, например, цианогенные
гликозиды, глюкозинолаты, беталаины.
Локализация в тканях. Вторичные метаболиты могут быть равномерно рас-
пределены по клеткам ткани, однако это бывает достаточно редко. Гораздо
чаще они накапливаются в ткани неравномерно, при этом для их локализации
могут быть использованы разные структуры. В наиболее простых случаях соеди-
нения накапливаются в специализированных клетках — идиобластах. Идиобла-
сты, накапливающие разные вторичные метаболиты, могут иметь характерные
особенности. Например, идиобласты, накапливающие алкалоиды у руты (Ruta
graveolens) содержат большое количество мелких вакуолей. В идиобластах, со-
держащих таннины, вакуоль занимает почти весь объем клетки. Изопреноидсо-
держащие идиобласты часто характеризуются сильно развитым гладким ЭР.
Идиобласты, накапливающие вторичные метаболиты, могут находиться в раз-
личных тканях растения, однако чаще всего они присутствуют в покровных
тканях. Например, в эпидермальных тканях листа и стебля разных видов най-
дены идиобласты, накапливающие фуростаноловые гликозиды, стероидные
гликоалкалоиды, хинолизидиновые алкалоиды.
Довольно часто вторичные метаболиты локализуются в тканях в специали-
зированных структурах — ходах, каналах, млечниках. Эти структуры разделя-
ются на две группы — производные внеклеточного пространства и производ-
ные вакуоли. Можно сказать, что на уровне тканей сохраняется «клеточный»
принцип накопления вторичных метаболитов — в периплазматическом про-
странстве и в вакуолях.
612
Смоляные ходы, камедиевые и масляные каналы (протоки) представляют
собой внеклеточные структуры. Они могут образовываться схизогенно (за счет
увеличения межклетников) либо лизогенно (за счет гибели и лизиса некото-
рых клеток). Вторичные метаболиты (например, терпеноиды — компоненты
эфирных масел и смол) синтезируются в клетках, выстилающих ходы и кана-
лы, а затем и секретируются в них.
Млечники, производные вакуолярной системы растений, имеются как ми-
нимум у представителей 20 семейств высших растений. Содержимое млечни-
ков — латекс — фактически является вакуолярным соком и представляют со-
бой эмульсию, содержащую алкалоиды, изопреноиды и ряд других соедине-
ний вторичного и первичного метаболизма.
Таким образом, на уровне тканей можно проследить закономерность, ана-
логичную клеточной: разделение мест синтеза и накопления вторичных метабо-
литов.
Установить общие закономерности локализации вторичных метаболитов по
органам растений, по-видимому, невозможно. Она зависит от вида растения,
условий окружающей среды, типа вторичного метаболита и, вероятно, глав-
ное — от его физиологической функции. Вторичные метаболиты могут синте-
зироваться и накапливаться во всех органах растений. Например, эфирные масла
могут накапливаться в лепестках цветков (роза), плодах (анис, кориандр), корнях
(валериана, девясил), листьях (мята, шалфей). Сердечные гликозиды могут
находиться в листьях (олеандр, наперстянка), коре (обвойник), семенах (стро-
фант), цветках (ландыш). В то же время закономерность разделения мест синте-
за и накопления вторичных метаболитов часто наблюдается и на уровне орга-
нов и целого растения. Например, стероидные гликозиды диоскореи (Dioscorea
deltoidea) синтезируются в листьях интактного растения и с флоэмным током
транспортируются по растению преимущественно в эпидермальные ткани и
корневище. В эпидермисе листьев и стеблей они локализуются в идиобластах.
Основная масса гликозидов накапливается в корневище (до 8 % от сухой мас-
сы). Похожая ситуация наблюдается для хинолизидиновых алкалоидов.
Достаточно часто вторичные метаболиты выделяются растением в окружа-
ющую среду. Для этого существуют различные механизмы и морфологические
структуры. Простейшей системой выделения вторичных метаболитов можно
считать железистый эпидермис с железистыми пятнами. Железистые пятна ис-
пользуются для выделения эфирных масел и представляют собой его скопле-
ния под кутикулой. Моно- и сесквитерпеноиды, составляющие основной ком-
понент эфирного масла, синтезируются отдельными группами клеток, моза-
ично расположенными в железистом эпидермисе. Образовавшееся эфирное
масло скапливается под кутикулой в виде железистого пятна, а затем выделя-
ется в окружающую среду. Такой способ выделения эфирных масел характерен
для розы, ландыша, почек тополя.
Более сложными секреторными структурами являются железистые волоски
(трихомы) и железки. Они состоят из базальной клетки, одно- или многокле-
точной ножки и головки. Одноклеточная головка характерна для трихом, мно-
гоклеточная — для железок. Количество железистых волосков может достигать
десятков тысяч на лист.
По-видимому, все клетки трихом и железок способны к синтезу и выделе-
нию эфирных масел. Трихомы и железки являются достаточно универсальными
613
выделительными структурами и могут использоваться для выделения не толь-
ко эфирных масел. В различных видах растений они могут осуществлять выделе-
ние дитерпеноидов, фенольных соединений и некоторых других вторичных
метаболитов. Выделение в наружную среду для алкалоидов не характерно.
9.8.2. ИЗМЕНЕНИЕ ВТОРИЧНОГО МЕТАБОЛИЗМА
В ОНТОГЕНЕЗЕ РАСТЕНИЙ
Синтез и накопление вторичных метаболитов зависит от стадии развития
растения. В то же время общих закономерностей изменений вторичного мета-
болизма в онтогенезе, по-видимому, не существует. Разворачивание вторично-
го метаболизма во времени зависит от вида растения, типа вторичного метабо-
лита и его физиологической роли и — очень сильно — от внешних воздействий.
Например, максимальный уровень накопления многих изопренилов (эфирных
масел, стероидных гликозидов) часто приходится на период бутонизации и
цветения. Синтез алкалоидов закономерно разворачивается в процессе онтоге-
неза. Например, в семенах и всходах мака алкалоидов нет. Через две недели
появляется наркотин, а когда проростки достигают в длину 5 —7 см — кодеин,
морфин, папаверин, сангвинарин. К моменту цветения к ним прибавляются
тебаин и нарцеин. В млечном соке коробочек мака присутствует уже до 25 алка-
лоидов. В чистотеле на третьи сутки после прорастания появляется аллокрипто-
пин, на четвертые — протопин, причем его сразу больше, чем аллокриптопи-
на. Хинолизидиновые алкалоиды в период от прорастания до цветения посте-
пенно накапливаются во всех органах растения, но к моменту созревания пло-
дов появляются в них, исчезая из всех других органов. Приведенные примеры
и целый ряд других фактов показывают, что процесс вторичного метаболиз-
ма — четко работающая система, отслеживающая как внутренние факторы
(этапы онтогенеза растения), так и внешние воздействия.
9.8.3. ФУНКЦИИ ВТОРИЧНЫХ МЕТАБОЛИТОВ
В процессе изучения вторичных метаболитов было выдвинуто несколько
гипотез о функциональной значимости этих соединений. Однако поразитель-
ное разнообразие вторичных метаболитов и практически полное отсутствие
корректных подходов к доказательству выдвигаемых гипотез оставляют этот
вопрос предметом острых дискуссий до настоящего времени.
Первой появилась гипотеза об отсутствии какой-либо роли вторичных ме-
таболитов в жизни растений. Она существовала со времен А. Косселя, кото-
рый, собственно, и определил вторичные метаболиты как «нечаянно» синте-
зируемые растительной клеткой. Исходя из этой гипотезы, вторичные метабо-
литы считаются «отбросами» жизнедеятельности растений, «тупиками метабо-
лизма», возможно, продуктами детоксикации ядовитых первичных метаболи-
тов (например, свободных аминокислот). В настоящее время подобный взгляд
на роль вторичных метаболитов не пользуется успехом и подвергается критике.
Основные аргументы «против» — слишком большое количество вторичных
метаболитов (растение «могло бы придумать» более рациональные способы
614
утилизации отходов). Кроме того, процесс вторичного метаболизма слишком
хорошо организован во времени и пространстве, чтобы быть «случайным».
Вторая гипотеза утверждала запасающую роль вторичных метаболитов. В ряде
случаев концентрация вторичных метаболитов в органах может достигать зна-
чительного уровня. Показано, что многие из них действительно утилизируются
клеткой: при определенных условиях алкалоиды могут служить источником
азота, фенольные соединения — субстратами дыхания. По всей видимости,
ряд вторичных метаболитов выполняет эту функцию, однако в большинстве
случаев после образования они не реутилизируются, а накапливаются в клет-
ках или специальных структурах, либо экскретируются.
Довольно своеобразной стала гипотеза относительно «первичности» всех
вторичных метаболитов. Согласно этому представлению мы просто еще не зна-
ем, в каких важных процессах они участвуют. Исходной точкой для такой идеи
было открытие шикиматного пути синтеза ароматических соединений. С его
открытием много «типично вторичных» соединений — например, хинная,
дегидрохинная, шикимовая кислоты — автоматически перешли в разряд пер-
вичных. Очевидно, что если эта гипотеза и справедлива, то лишь для очень
немногих веществ, так как основной признак вторичных метаболитов — не
обязательное присутствие в каждой растительной клетке — справедлив для
большинства соединений.
Наибольшее признание в настоящее время получила гипотеза о защитной
роли вторичных соединений. Систему зашиты растения от биотических стрессов
образно можно представить в виде «кругов обороны» и, в зависимости от опас-
ности патогена, растение последовательно использует соответствующие «круги».
Все защитные соединения можно разделить на три группы — конститутивные,
полуиндуцибельные и индуцибельные. Конститутивные соединения постоянно
присутствуют в тканях и органах растения и относятся к «первому кругу» оборо-
ны. Они, как правило, обладают широким спектром активности (антимикроб-
ной, фунгицидной, инсектицидной), но уровень активности невысок. Эти со-
единения не могут накапливаться в больших количествах прежде всего из-за
своей токсичности и часто локализуются в мертвых тканях (например, корке).
Полуиндуцибельные соединения находятся в тканях в виде неактивного
предшественника и после соответствующего сигнала или воздействия быстро
превращаются в активные вещества. Эти соединения часто работают на «вто-
ром круге» обороны, образующиеся соединения, как правило, более токсич-
ны, чем конститутивные. Поскольку предшественник нетоксичен, его кон-
центрация в тканях может быть достаточно высокой. Система получения ак-
тивного соединения, как правило, основана на компартментации процесса.
Неактивный предшественник обычно располагается в вакуоле клетки или пе-
риплазматическом пространстве, тогда как фермент, осуществляющий его пе-
ревод в активную форму, — в цитозоле. Возможна компартментация на уровне
ткани. В этом случае предшественник может находиться в идиобластах, а фер-
менты его активации — в соседних клетках. При нарушении целостности клет-
ки или ткани (за счет прямого повреждения «агрессором» либо в процессе
патогенеза) субстрат становится доступным для фермента и быстро образуется
токсичное соединение.
Наконец, индуцибельные соединения обычно участвуют в работе «третьего
круга» обороны. Они характеризуются очень высокой токсичностью и форми-
615
руются de novo в результате разворачивания процесса патогенеза. Их образова-
ние обычно запускается в результате работы сигнальных систем клетки, кото-
рые включают гены ферментов их синтеза. Многие вторичные метаболиты яв-
ляются важнейшими участниками каждого из «кругов обороны» растения.
Среди вторичных метаболитов практически любого класса можно обнару-
жить конститутивные защитные соединения. Например, монотерпены камфен
и мирцен представляют собой инсектициды, ментол и а-пинен — реппеленты.
Многие дитерпеноиды, входящие в состав смол, обладают бактерицидной и
фунгицидной активностью. Карденолиды и многие алкалоиды — мощные яды
для травоядных животных. Экдистериоды относятся к инсектицидам. Гликоал-
калоиды пасленовых обладают широким спектром активности. Основная про-
блема для накопления ощутимых количеств ядовитых веществ — их токсич-
ность для самого растения. Небелковые аминокислоты в этом аспекте — почти
идеальные конститутивные защитные соединения («почти» — поскольку белок-
синтезирующая система некоторых насекомых «научилась» различать белко-
вые аминокислоты от их небелковых аналогов). Следовательно, для них расте-
ния, содержащие соответствующие небелковые аминокислоты, перестают быть
ядовитыми. Более того, такие насекомые эффективно используют эти амино-
кислоты против своих врагов, поэтому питаются только такими растениями.
Избежать токсичности конститутивных защитных соединений можно, напри-
мер, если «хранить» их в специальных структурах либо выделять на поверх-
ность растения или в окружающую среду. Видимо этим объясняется высокая
концентрация вторичных соединений в идиобластах, смоляных ходах, масля-
ных и камедиевых каналах, млечниках. Предельный случай — выделение лету-
чих соединений, что характерно для эфирных масел. Большинство их компо-
нентов обладает антимикробными, фунгицидными или реппелентными свой-
ствами. Подобная стратегия позволяет создавать «защитный ореол» вокруг рас-
тения (эффективнее — вокруг группы близкорастущих растений, как в хвой-
ном лесу) и «обезвреживать» патогены на «дальних подступах». Однако такой
подход требует больших энергетических и конструктивных затрат.
Достаточно часто вторичные метаболиты выступают в роли полуиндуци-
бельных соединений. В этой системе часто используются характерные модифи-
кации молекул вторичных метаболитов, связанные с изменением их биологи-
ческой активности. Обычно неактивными предшественниками являются глико-
зилированные формы соединений. К полуиндуцибельным защитным веществам
относятся, например, цианогенные гликозиды, глюкозинолаты, гликозиды
о-коричных кислот. Для них характерно присутствие гликозида в вакуоле, а гид-
ролизующего фермента — в цитоплазме или клеточной стенке. После наруше-
ния целостности тонопласта происходит гидролиз и быстро образуется токсич-
ное или активное соединение — синильная кислота, нитрил или кумарин.
В растениях встречается целая система конститутивных и полуиндуцибель-
ных защитных соединений. Например, спиростаноловые стероидные гликози-
ды действуют как конститутивные защитные вещества; они нерастворимы в
воде и обладают фунгицидной, атимикробной активностью, а также цитоток-
сическими свойствами. Фуростаноловые гликозиды растворимы в воде и не
токсичны. Перевод фуростаноловых гликозидов в спиростаноловые осуществ-
ляется одностадийной реакцией — отщеплением глюкозного фрагмента при
С26 с участием специфичной р-гликозидазы. Стероидные гликозиды синтези-
616
руются в листьях растения в фуростаноловой форме. Затем они транспортиру-
ются по всему растению и накапливаются в идиобластах эпидермиса листьев и
стеблей. Основная масса гликозидов транспортируется в корневище, где гли-
козидаза переводит их в спиростаноловую (активную) форму. В надземных орга-
нах фуростаноловые гликозиды находятся в идиобластах, а специфичная гли-
козидаза располагается поблизости (обычно в мезофилле листа). При повреж-
дении ткани очень быстро образуются спиростаноловые гликозиды. Этот при-
мер иллюстрирует принцип пространственной дифференциации защитных
механизмов: в корневище (органе вегетативного размножения) в большом
количестве присутствует активная форма соединения, тогда как в надземных,
активно работающих органах эффективнее оказывается стратегия с использо-
ванием полуиндуцибельных защитных соединений.
Вторичные метаболиты, участвующие в работе третьего «круга обороны»,
где происходит индукция синтеза мощных защитных веществ, носят название
фитоалексинов. Их образование — важнейшая стадия реакции сверхчувстви-
тельности. Фитоалексины никогда не присутствуют в здоровом растении, и их
синтез начинается только в ответ на инфекцию. Развивающиеся события мож-
но представить следующим образом.
Любой организм, в том числе патоген, выделяет множество экзометаболи-
тов — продуктов нормальной жизнедеятельности. На ряд экзометаболитов па-
тогена (например, патогенного гриба) у растений в процессе коэволюции
выработались специальные рецепторы. Такие экзометаболиты патогена полу-
чили название элиситоров. Они могут иметь разную химическую природу, но
обязательно должны быть специфичными для данного патогена. К элиситорам
относятся фрагменты клеточной стенки гриба, ферменты, выделяемые им для
разрушения растительной клеточной стенки или кутикулы. Связывание элиси-
торов с соответствующими рецепторами запускает ряд сигнальных систем ра-
стительной клетки — прежде всего пероксидазную, NO-оксидазную и липокси-
геназную. Их работа приводит к парадоксальному на первый взгляд эффекту —
гибели клетки. Эта реакция получила название реакции сверхчувствительности
(так как клетки погибают не от прямого воздействия патогена, а только при
получении информации о его приближении). В результате гибели клеток разру-
шаются полимеры клеточных стенок, ряд образовавшихся фрагментов оказы-
ваются олигосахаринами, т.е. сигнальными молекулами. В частности, олигоса-
харинами являются фрагменты ксилоглюканов, содержащие 7 — 9 углеводных
остатков, из которых один обязательно должен быть фукозой. Клетки, распо-
ложенные рядом с погибшими, имеют рецепторы к олигосахаринам. После
связывания олигосахаринов с рецепторами в этих клетках также включаются
сигнальные системы. Благодаря им активируются гены, отвечающие за синтез
фитоалексинов. Однако фитоалексины в силу своей чрезвычайной токсичнос-
ти не накапливаются в живых клетках, а сразу транспортируются в мертвые
клетки очага сверхчувстительности. Таким образом, к «приходу» патогена в
мертвых клетках должны накопиться высокие концентрации сильных ядов. Если
растение успевает это сделать, гриб погибает. Таким образом, стратегия реак-
ции сверхчувствительности — гибель части во имя целого — оказывается впол-
не целесообразной.
Фитоалексинами могут быть соединения различных классов вторичных ме-
таболитов. К сесквитерпеноидным фитоалексинам относятся ришитин и лю-
617
Фитоалексины
Сесквитерпены
СНО ОН ОН СНО
Gossypium herbaceum
Изофлавоноиды
Орхинол
Orchidaceae
Стильбены
Полиацетилены
СН3СН=СН(С=С)зСН=СН-СН-СН2СО
ОН
Сафинол
Asteraceae
Рис. 9.14. Структура некоторых фитоалексинов
бимин (пасленовые, в частности картофель), гемигоссипол (мальвовые), ипо-
меамарон (вьюнковые), к дитерпеноидным фитоалексинам — касбен (клеще-
вина). Довольно часто фитоалексины представлены фенольными соединения-
ми, такими как стильбены, изофлавоноиды. Последние почти исключительно
используются в семействе Бобовые. Фитоалексинами являются ацетиленовые
производные сложноцветных сафинол и виероновая кислота (рис. 9.14).
Таким образом, многие вторичные метаболиты выполняют функции кон-
ститутивных, полуиндуцибельных или индуцибельных защитных соединений,
и хотя они представляют только часть сложной системы защиты растений, но
эта часть довольно важная.
618
Роль вторичных метаболитов в жизни растения далеко не исчерпывается
защитными функциями. Хорошо известно, что многие из них активно участву-
ют в размножении растений. Флавоноиды, прежде всего антоцианы, беталаи-
ны, каротиноиды, обеспечивают окраску цветков и плодов, привлекающую
опылителей цветков и распространителей семян. Метилбензоат (метилирован-
ная бензойная кислота) — аттрактант для насекомых. Ряд вторичных метабо-
литов растения могут использовать в качестве «нападающих факторов». Напри-
мер, находящиеся среди экзометаболитов корней бархатцев тиофены останав-
ливают прорастание семян конкурирующих видов. Юглон, который образуется
в опавших листьях грецкого ореха за счет гликозидаз почвенных микробов,
достаточно токсичен. Он подавляет развитие патогенной микрофлоры почвы и
прорастание семян других видов. Ряд флавоноидов используются бобовыми
растениями как сигналы при формировании ризобиольного симбиоза и арбус-
кулярной микоризы.
В целом можно сказать, что основная функция вторичных метаболитов в
растениях — экологическая в широком смысле. Это те биохимические «рычаги»,
которыми прикрепленный организм — растение — решает множество эколо-
гических проблем на протяжении всей своей жизни.
СПИСОК ЛИТЕРАТУРЫ
ГЛАВА 1
1. ДеДюв К. Путешествие в мир живой клетки. — М.: Мир, 1987.
2. Генетика развития растений / Л.А.Лутова, Н. А. Проворов, О. Н.Тиходеев и др.
Подред. С. Г. Инге-Вечтомова. — СПб.: Наука, 2000.
3. Маргелис Л. Роль симбиоза в эволюции клетки. — М.: Мир, 1983.
4. Молекулярная биология клетки / Б. Альбертис, Д. Брей, Дж.Льюис и др. В 3 т. —
М.: Мир, 1994.
5. Общая и молекулярная фитопатология / Ю. Т. Дьяков, О. Л. Озерецковская, В. Г. Джа-
вахия и др. — М.: Изд-во «Общество фитопатологов», 2001.
6. Саламатова Т. С. Физиология растительной клетки. — Л.: Изд-во ЛГУ, 1983.
ГЛАВА 2
1. Геннис Р. Биомембраны. Молекулярная структура и функции. — М.: Мир, 1997.
2. Гудвин Т., Мерсер Э. Введение в биохимию растений. — Т. 1. — М.: Мир, 1986.
3. Молекулярная биология клетки / Б.Альбертис, Д. Брей, Дж.Льюис и др. В 3 т. —
Т. L-М.: Мир, 1994.
4. Скулачев В.П. Биоэнергетика. Мембранные преобразователи энергии. — М.: Выс-
шая школа, 1989.
5. Скулачев В.П. Энергетика биологических мембран. — М.: Наука, 1989.
6. Скулачев В. П. Законы биоэнергетики // Соросовский образовательный журнал,
1997. — № 1. — С. 9—14.
7. Рубин А. Б. Биофизика. В 2 т. — Т. 2. Биофизика клеточных процессов. — М.: «Уни-
верситет», 2000.
8. Boyer Р. D. The ATP-syntase: A splendid molecular machine // Ann. Rev. Biochem.
1997. -V. 66. - P. 717-749.
9. Boyer P.D. Catalytic site forms and controls in ATP synthase catalysis 11 В BA, 2000. —
V. 1458. - P. 252-262.
10. Capaldi R.A., Aggeler R. Mechanism of the FIFo — type ATP Synthase, a biological
rotary motor 11 Trends in Biochem. Sci., 2002. — V. 27. — P. 154—160.
ГЛАВА 3
1. Андрианова Ю. У., Тарчевский И. А. Хлорофилл и продуктивность растений. — М.:
Наука, 2000.
2. Владимиров Ю.А., Потапенко А. Я. Физико-химические основы фотобиологиче-
ских процессов. — М.: Высшая школа, 1989.
3. Гавриленко В. Ф., Гусев М. В., Никитина К. А., Хоффман П. Избранные главы физи-
ологии растений. — М.: Изд-во МГУ, 1986.
4. Гудвин Т., Мерсер Э. Введение в биохимию растений. В 2 т. — М.: Мир, 1986.
5. Клейтон Р. Фотосинтез. Физические механизмы и химические модели. — М.: Мир,
1984.
6. Кочубей С. М. Организация фотосинтетического аппарата высших растений. — Киев:
Изд-во «Альтерпрес», 2001.
620
7. Мокроносов А. Т. Онтогенетический аспект фотосинтеза. — М.: Наука, 1981.
8. Мокроносов А. Т, Гавриленко В. Ф. Фотосинтез. Физиолого-экологические и биохи-
мические аспекты. — М.: Изд-во МГУ, 1992.
9. Николас Д. Биоэнергетика Введение в хемиосмотическую теорию. — М.: Мир, 1985.
10. Полевой В. В. Физиология растений. — М.: Высшая школа, 1989.
11. Рубин А. Б. Биофизика. В 2 т. — М.: Книжный дом «Университет», 1999, 2000.
12. Фотосинтез / Под ред. Говинджи. В 2 т. — М.: Мир, 1987.
13. ХоллД., Рао К. Фотосинтез. — М.: Мир, 1983.
14. Эдвардс Дж., Уокер Д. Фотосинтез С3- и С4-растений: механизмы и регуляция. —
М.: Мир, 1986.
15. Futai М., Omote Н., Sambongi К, Wada Y. Synthase (H'-ATPase): coupling between
catalysis, mechanical work and proton translocation // Biochim. Biophys. Acta, 2000. —
V. 1458.-P. 276-288.
16. Hugent J.H.A., Rich A.N., Evans M. C. W. Photosynthetic water oxidation: towards a
mechanism // Biochim. Biophys. Acta, 2001. — V. 1503. — P. 138—146.
17. Robblee J. H., CincoR.M., Yachandra V.K. X-ray spectroscopy-based structure of Mn
cluster and mechanism of photosynthetic oxygen evolution. // Biochim. Biophys. Acta, 2001.—
V. 1503.-P. 7-23.
18. Wollman F.-A., Minai L., Nechushtai R. The biogenesis and assembly proteins in thylakoid
membranes. // Biochim. Biophys. Acta, 1999. —V. 1411. — P. 21 — 85.
ГЛАВА 4
1. Головко T. К. Дыхание растений. Физиологические аспекты. — СПб., Наука, 1999.
2. Гудвин Т., Мерсер Э. Введение в биохимию растений. В 2 т. — М.: Мир, 1986.
3. Ленинджер А. Основы биохимии. В 3 т. — М.: Мир, 1985.
4. Скулачев В.П. Кислород в живой клетке: добро и зло // Соросовский образователь-
ный журнал, 1996. — № 3. — С. 4—10.
5. Breusegeni van Е, Vranova E., Dat J.F., Inze D. The role of active oxygen species in
plant signal transduction // Plant Sci., 2001. — V. 161. — P. 405 — 414.
6. Dutton P.L., Moser С. C., Sled V.D. et al. A reductant-induced oxidatin mechanism for
Complexl. Ц BBA, 1998. — V. 1364. - P. 245-257.
7. Jones A. Does the plant mitochondrion integrate cellular stress and regulate programmed
cell death? // Trends in plant science, 2000. — V. 5. — N 5. — P. 225 — 229.
8. Kerscher S.J. Diversity and origin of alternative NADH: ubiquinone oxidoreducrases. //
BBA, 2000. - V. 1459. — P. 274-283.
9. Mackenzie S., McIntosh L. Higher plant mitochondria. // Plant Cell, 1999. — V. 11. —
P. 571-585.
10. Matsuno- Yagi A., Yagi T. Complex 1 — an L-Shaped Black Box. // J. Bioenergetics and
Biomembranes, 2001. — V. 33. — P. 155—157.
11. Rasmusson A. G., Heiser V, Zabaleta E. et al. Physiological, biochemical and molecular
aspects of mitochondrial complex I in plants // BBA, 1998. — V. 1364. — P. 101—111.
12. Siedow J. N., Day D.A. Respiration and photorespiration. // Biochemistry and Molecular
biology of plants. B. Buchanan, W.Gruissem, R. Jones, eds.: Amer. Soc. of Plant Physiologists,
2000.
13. Skulachev VP. Uncoupling: new approaches to an old problem of bioenergetics. //
BBA, 1998.-V. 1363.-P. 100-124.
14. Vanlerberghe G. C., McIntosh L. Alternative oxidase: From Gene to function. //Ann. Rev.
Plant Physiol. Plant Mol. Biol., 1997. - V. 48. - P. 703-734.
15. Wikstrom M., Verkhovsky M.J., Hummer G. Water—gated mechanism of proton
translocation by cytochrome c oxidase // BBA, 2003. — V. 1604. — 61 — 62.
16. Zaslavsky D., Gennis R. В Proton pumping by cytochrome oxidase; progress, problems
and postulates. — BBA, 2000. — V. 1458. — P. 164—179.
621
ГЛАВА 5
1. Жолкевич В. Н. Транспорт воды в растении и его эндогенная регуляция: LXI Тими-
рязевские чтения. — М.: Наука, 2001.
2. Нобел П. Физиология растительной клетки. — М.: Мир, 1973.
3. Слейчер Р. Водный режим растений. — М.: Мир, 1970.
4. Фролов Ю.Г., Белик В. В. Физическая химия. — М.: Химия, 1993.
5. Фролов Ю.Г. Курс коллоидной химии. — М.: Химия, 1982.
6. Steudle Е. The cohesion-tension mechanism and the acquisition of water by plant roots //
Ann. Rev. Plant Physiol. Plant Mol. Biol., 2001. — P. 847 — 875.
7. Steudle E., Peterson C.A. How does water get through roots? // J. Exp. Botany, 1998. —
V. 49. - N 322. — P. 775-788.
8. Tomos A. D., Leigh R.A. The pressure probe. A Versatile Tool in Plant Cell Physiology //
Ann. Rev. Plant Physiol. Plant Mol. Biol., 1999. — V. 50. — P. 447—472.
ГЛАВА 6
1. Алехина Н.Д., Кренделева T.E., Полесская О. Г. Взаимосвязь процессов усвоения
азота и фотосинтеза в клетке листа С3-растений // Физиология растений, 1996. — Т. 43. —
С. 136-148.
2. Вахмистров Д. Б. Пространственная организация ионного транспорта в корне: LXI
Тимирязевские чтения. — М.: Наука, 1991.
3. Гусев Н.Б. Внутриклеточные Са-связывающие белки. — Ч. 1. Классификация и струк-
тура. — Ч. 2. Структура и механизм функционирования // Соросовский образователь-
ный журнал, 1998. — № 5. — С. 2—16.
4. Измайлов С. Ф. Азотный обмен в растениях. — М.: Наука, 1986.
5. Люттге У, Хигинботам Н. Передвижение веществ в растениях. — М.: Колос,
1984.
6. Островская Л. К. Железо в растительном мире и карбонатный хлороз. — Киев:
Наука, 1983.
7. Сабинин Д. А. Избранные труды по минеральному питанию растений. — М.: Наука,
1971.
8. Ткачук И. А. Мембранные рецепторы и внутриклеточный кальций // Соросовский
образовательный журнал, 2001. — Т. 7. — № 1. — С. 10—15.
9. Campbell IV. Н. Nitrate reductase structure, function and regulation: Bridging the Gap
between Biochemistry and Physiology//Ann. Rev. Plant Physiol. Plant Mol. Biol., 1999. —
V. 50,-P. 277-303.
10. Gilroy S. G., Jones D. U. Through form to function: root hair development and nutrient
uptake // Trends in plant sci., 2000. — V. 5. — N 2. — P. 56—60.
11. Leustek T., Saito K. Sulfate Transport and Assimilation in Plants 11 Planr Physiology,
1999. -V. 120. - P. 637-643.
12. Maathuis F. G.M. et al. Roles of higher plant K+ channels // Plant Physiol, 1997. — V. 114. —
P. 1141-1149.
13. Miflin B.J., Lea P.J. Ammonia assimilation 11 Miflin BJ, ed. The biochemistry of
plants. — V. 5. — Toronto: Acad. Press., 1980.
14. Raghothama K. G. Phosphate transport and signaling // Curr. Opinion in Plant Biol.,
2000.-V. 3.-P. 182-187.
15. Sanders D. et al. Calcium at the crossroads of signaling 11 The Plant Cell. Supl., 2002. —
S. 401-417.
16. Schachtman D.P., Reid R. J., AylingS.M. Phosphorus Uptake by Plants: From Soil to
Cell 11 Plant Physiol., 1998. - V. 116. - P. 447-453.
17. Sze H, Li X., Palmgen M.G. Energization of plant cell membranes by H+-pumping
ATP-ases: regulation and biosynthesis // The Plant Cell, 1999. — V. 1. — P. 677 — 689.
622
18. Flugge Ulf-Ingo. Metabolite transporters in higher plastids // Curr. Opinion in Plant
Biol., 1998. — V. 1. - P. 201-206.
19. White P. Y. Calcium channels in higher plants // BBA, 2000. — V. 1465. — P. 171 — 189.
20. Williams L.E., Miller A. J. Transporters responsible for the uptake and partitioning of
nitrogen solutes//Ann. Rev. Plant Plant. Physiol. Plant. Mol. Biol., 2001. —V. 52. — P. 659—688.
21. Zimmermann S., Sentenac H. Plant ion channels: from molecular structures to
physiological functions // Curr. Opinien in Plant Biol., 1999. — V. 2. — P. 477 — 482.
ГЛАВА 7
1. Гэлстон А., Девис П., Сеттер Р. Жизнь зеленого растения. — М.: Мир, 1983.
2. Дутова Л. А., Проворов Н.А., Тиходеев О.Н. и др. Генетика развития растений. —
СПб.: Наука, 2000.
3. Тарчевский И.А. Сигнальные системы клеток растений. — М.: Наука, 2002.
4. Уоринг Ф., Филипс И. Рост растений и дифференцировка. — М.: Мир, 1984.
5. Чайлахян М.Х. Регуляция цветения высших растений. — М.: Наука, 1984.
ГЛАВА 8
1. Балнокин Ю.В. Ионный гомеостаз и осморегуляция у галотолерантных микрово-
дорослей // Физиол. раст., 1993. — Т. 40. — С. 567 — 576.
2. КашнерД. (ред.) Жизнь микробов в экстремальных условия. — М.: Мир, 1981.
3. Косулина Л.Г., Луценко Э.К., Аксенова Б. А. Физиология устойчивости растений к
неблагоприятным факторам среды. — Ростов-на-Дону: Ростовский университет, 1993.
4. Красавцев О. А. Усп. совр. биол., 1985. — Т. 100. — Выл. 3 (6). — С. 450.
5. Кулинский В. И. Активированные формы кислорода и оксидативная модификация
макромолекул: польза, вред и защита // Соросовский образовательный журнал, 1999. —
№ 1.-С.2-7.
6. Мерзляк М.Н. Активированный кислород и окислительные процессы в мембранах
растителы юй клетки // Итоги науки и техники. — Сер. Физиология растений, 1989. — Т. 6.
7. Мерзляк М. Н. Активированный кислород и жизнедеятельность растений // Соро-
совский образовательный журнал, 1999. — № 9. — С. 20—26.
8. Нобел П. Физиология растительной клетки. — М.: Мир, 1973.
9. Скулачев В. П. Кислород в живой клетке: добро и зло // Соросовский образова-
тельный журнал, 1996. — № 3. — С. 4—10.
10. Тарчевский И. А. Метаболизм растений при стрессе. — Казань: Фэн, 2001.
11. Тарчевский И А. Сигнальные системы клеток растений. — М.: Наука, 2002.
12. Хочачка П., СомероДж. Биохимическая адаптация. — М.: Мир, 1988.
13. Чиркова Т.В. Физиологические основы устойчивости растений. — СПб.: Изд-во
Санкт-Петербургского университета, 2002.
14. Alsher R.G., Donahue J.L., Cramer C.L. Reactive oxygen species and antioxidants:
relationships in green cells // Physiol. Plant., 1997. — V. 100. — P. 224—233.
15. Vartapetian B.B. Plant adaptation to anaerobic stress // Ann. Botany, 1997. — V. 79. —
P. 3-20.
ГЛАВА 9
1. Ботанико-фармакогностический словарь / Под ред. К.Г. Блиновой, Г.П.Яковле-
ва. — М.: Высшая школа, 1990.
2. Гудвин Т, Мерсер Э. Введение в биохимию растений. В 2 т. — Т. 2. — М.: Мир, 1986.
3. Запрометов М. Н. Фенольные соединения. — М_: Наука, 1993.
4. Лукнер М. Вторичный метаболизм у микроорганизмов, растений и животных. —
М.: Мир, 1979.
623
5. Райс Э. Природные средства защиты растений от вредителей. — М.: Мир, 1986.
6. Рощина В Д., Рощина В. В. Выделительная функция высших растений. — М.: На-
ука, 1989.
7. Фитоалексины / Под ред. Дж. А. Лейли, Дж. В. Мансфильда. — Киев: Наукова Дум-
ка, 1985.
8. Харборн Дж. Введение в экологическую биохимию. — М.: Мир, 1985.
9. Secondary Plant Products / Ed. E. A. Bell and B.V.Charlwood. Encyclopedia of Plant
Physiology. New Series. —V. 8. — 1980: Springer-Verlag.
ОГЛАВЛЕНИЕ
Список сокращений......................................................3
Физико-химические константы и показатели (параметры)..................5
Предисловие............................................................6
Глава 1. РАСТИТЕЛЬНАЯ КЛЕТКА (А. М. Носов)
1.1. Общая характеристика эукариотических клеток..................... 11
1.1.1. Органеллы эукариотических клеток......................... 11
1.1.2. Транспорт и сортировка белков в эукариотической клетке... 13
1.2. Растительная клетка — результат двойного симбиоза............... 16
1.3. Плазматическая мембрана растительной клетки (плазмалемма)....... 17
1.3.1. Структура плазмалеммы.................................... 17
1.3.2. Функции плазмалеммы.......................................20
1.4. Ядро растительной клетки.........................................22
1.4.1. Строение ядра.............................................22
1.4.2. Транспорт макромолекул между ядром и цитоплазмой..........22
1.5. Пластиды........................................................ 24
1.5.1. Общая характеристика пластид..............................24
1.5.2. Типы пластид и их формирование............................24
1.5.3. Оболочки пластид..........................................27
1.5.4. Размножение пластид.......................................27
1 5.5. Наследование пластид......................................28
1.5.6. Геном и белоксинтезирующая система пластид................28
1.5.6.1. РНК-полимеразы пластид.............................30
1.5.6.2. Транскрипция пластидной РНК........................31
1.5.6.3. Созревание пластидной РНК..........................31
1.5.6.4. Трансляция белков в пластидах......................33
1.5.6.5. Белки, кодируемые в пластидном геноме..............33
1.5.7. Транспорт цитозольных белков в пластиды...................34
1.5.8. Функции пластид...........................................35
1.6. Растительные митохондрии.........................................35
1.6.1. Строение растительных митохондрий.........................35
1.6.2. Геном митохондрий высших растений.........................36
1 6.3. Белоксинтезирующий аппарат растительных митохондрий....38
1.6.4. Транспорт цитозольных белков в митохондрии................38
1.6.5. Функции митохондрий растений..............................39
1.7. Пероксисомы......................................................39
1.8. Цитоскелет.......................................................41
1.8.1. Актин.....................................................41
1.8.2. Тубулин...................................................43
1.8.3. Белки промежуточных волокон...............................43
1.8.4. Функции цитоскелета.......................................44
1.9. Эндомембранные структуры растительной клетки.....................44
1.9.1. Эндоплазматический ретикулум (ЭР).........................44
625
1.9.1.1. Общая характеристика растительного ЭР................44
1.9.1.2. Функциональные области растительного ЭР..............46
1.9.2. Аппарат Гольджи.............................................50
1.9.2.1. Строение растительного АГ............................51
1.9.2.2. Транспорт продуктов в аппарате Гольджи...............52
1.9.2.3. Функции аппарата Гольджи растительных клеток..........53
1.9.3. Вакуоли.................................................... 54
1.9.3.1. Общая характеристика вакуолей растительной клетки....54
1.9.3.2. Функции вакуолей.....................................55
1.9.3.3. Формирование вакуолей................................56
1.9.3.4. Автофагия — особый случай формирования вакуолей..... 57
1.9.3.5. Два типа вакуолей растительных клеток................57
1.10. Клеточная стенка..................................................58
1.10.1. Общая характеристика клеточной стенки......................58
1.10.2. Структура клеточной стенки.................................59
1.10.2.1. Сахара, участвующие в построении клеточной
стенки.......................................................59
1.10.2.2. Первая (целлюлозная) сеть клеточной стенки.........60
1.10.2.3. Вторая (пектиновая) сеть клеточной стенки..........64
1.10.2.4. Третья (белковая или фенилпропаноидная) сеть
клеточной стенки.............................................67
1.10.3. Типы строения клеточных стенок............................ 68
1.10.4. Биосинтез клеточной стенки.................................71
1.11. Онтогенез растительной клетки.....................................73
1.11.1. Клеточный цикл.............................................74
1.11.2. Рост клетки................................................76
1.11.2.1. Роль клеточной стенки в росте клетки...............76
1.11.2.2. Роль цитоскелета в росте клетки....................76
1.11.2.3. Гипотеза «кислого роста»...........................77
1.11.2.4. «Фиксация» окончательных размеров и формы клетки...79
1.11.3. Дифференциация клетки......................................80
1.11.3.1. Роль вторичной клеточной стенки в дифференциации
клетки.......................................................80
1.11.3.2. Суберин и кутин делают вторичную клеточную стенку
водонепроницаемой............................................81
1.11.3.3. Лигнин — главный компонент некоторых вторичных
клеточных стенок.............................................81
1.11.4. Смерть растительной клетки.................................82
1.12. Особенности функционирования растительной клетки..................84
1.12.1. Функционирование клетки — координированная работа многих
органелл ........................................................... 84
1.12.2. Работа растительной клетки — переплетение «прокариотических»
и «эукариотических» метаболических систем...........................85
Глава 2. ОСНОВЫ БИОЭНЕРГЕТИКИ ( О. Г. Полесская)
2.1. Живые организмы могут использовать две формы энергии — световую
и химическую............................................................87
2.2. Упорядоченность биологических систем и обмен энергией
с окружающей средой.....................................................88
2.3. Направление химической реакции определяется величиной AG...........88
2.4. Энергозависимые реакции сопряжены с реакцией гидролиза АТФ.........90
2.5. Преобразование энергии на сопрягающих мембранах связано
с образованием электрохимического протонного градиента (Дйн+)...........91
626
2.6. Трансмембранный электрохимический протонный градиент
и его составляющие.....................................................93
2.7. Энергия Дрн* используется для синтеза АТФ из АДФ и Фн при участии
АТФ-синтазы............................................................94
2.8. Синтез АТФ связан с конформационными изменениями активных
центров АТФ-синтазы. Ротационный механизм действия фермента............95
2.9. Циркуляция ионов через мембраны. Другие АТФазы....................99
2.10. Направление переноса электронов в ЭТЦ определяется редокс-
потенциалом переносчиков............................................. 101
2.11. Организация ЭТЦ в мембране..................................... 102
2.12. Некоторые переносчики электронов являются общими для ЭТЦ
всех типов........................................................... 103
Глава 3. ФОТОСИНТЕЗ (В. Ф. Гавриленко, Т. В. Жигалова)
3.1. Фотосинтез как основа биоэнергетики............................. 108
3 .1.1. Космическая роль зеленого растения в трансформации вещества
и энергии....................................................... 108
3.1.2. Природа основных реакций и физико-химические основы
фотосинтеза..................................................... 109
3.1.3. История развития представлений о механизме фотосинтеза... 112
3.2. Структурная и биохимическая организация фотосинтетического
аппарата ............................................................ 114
3.2.1. Лист — специализированный орган фотосинтеза в растении... 114
3.2.2. Хлоропласты — центры фотосинтеза клеток растений......... 116
3.2.2.1. Основные принципы структурной организации
хлоропластов............................................... 116
3.2.2.2. Химический состав и физические свойства тилакоидных
мембран.................................................... 119
3.2.3. Биогенез хлоропластов.................................... 123
3.3. Пигментные системы фотосинтезирующих организмов................. 126
3.3.1. Пигментные системы как первичные фоторецепторы........... 126
3.3.2. Хлорофиллы............................................... 128
3.3.2.1. Основные элементы структуры и их значение
в поглощении и преобразовании энергии..........'........... 128
3.3.2.2. Метаболизм магнийпорфиринов....................... 133
3.3.3. Фикобилины............................................... 137
3.3.4. Каротиноиды.............................................. 139
3.3.4.1. Общая характеристика класса каротиноидов.......... 139
3.3.4.2. Антенная функция каротиноидов..................... 140
3.3.4.3. Защитная функция каротиноидов..................... 143
3.3.4.4. Фотопротекторная функция каротиноидов............. 143
3.3.4.5. Биосинтез каротиноидов............................ 146
3.4. Функциональная организация пигментов в хлоропластах............. 148
3.4.1. Образование пигмент-белковых комплексов.................. 148
3 4.2. Основные типы пигмент-белковых комплексов............. 150
3.4.3. Энергетическое взаимодействие пигментов в антенных комплексах
и реакционных центрах........................................... 150
3.5. Первичные процессы фотосинтеза. Реакционные центры.............. 153
3.5.1. Структурная и функциональная организация реакционных центров.... 153
3.5.2. Механизм преобразования энергии в реакционных центрах.... 159
3 5.3. Сравнительный анализ энергетической эффективности
реакционных центров бактерий и высших растений.................. 161
3.6. Электрон-транспортная цепь хлоропластов......................... 163
627
3.6.1. Структурно-функциональная организация электрон-транспортной
цепи хлоропластов............................................... 163
3.6.1.1. Компоненты ЭТЦ хлоропластов, их природа
и физико-химические свойства................................ 164
3.6.1.2. Z-схема фотосинтеза. Нециклический, циклический,
псевдоциклический транспорт электронов в хлоропластах........ 166
3.6.2. Функциональные комплексы ЭТЦ хлоропластов................ 168
3.6.2.1. Комплекс фотосистемы II. Механизмы фотоокисления
воды и выделения молекулярного кислорода............... 168
3.6.2.2. Комплекс фотосистемы 1............................ 173
3.6.2.3. Цитохромный /^комплекс хлоропластов............... 176
3.6.3. Пластохиноны — подвижные переносчики электронов ЭТЦ
фотосинтеза..................................................... 179
3.6.4. Кинетические закономерности работы ЭТЦ. Регуляция электронного
транспорта...................................................... 180
3.6.4.1. Кратковременная и долговременная адаптация хлоропластов
к условиям освещения........................................ 180
3.6.4.2. Кинетические характеристики реакций переноса электронов
в ЭТЦ....................................................... 181
3.6.4.3. Механизмы регуляции электронного транспорта
в хлоропластах.............................................. 181
3.6.4.4. Фотоингибирование. Механизмы защиты растений
от фотодеструкции в условиях высоких интенсивностей
света................................................ 182
3.7. Фотоэнергетические реакции хлоропластов......................... 184
3.7.1. Фотосинтетическое фосфорилирование. Основные типы,
их физиологическое значение..................................... 185
3.7.2. Механизм сопряжения электронного транспорта с формированием
трансмембранного градиента электрохимического потенциала.......... 186
3.7.3. Структурно-функциональная организация и механизм работы
АТФ-синтазного комплекса........................................ 188
3.8. Метаболизм углерода при фотосинтезе............................. 190
3.8.1. С3-путь фотосинтеза (цикл Кальвина, ВПФ-цикл)............ 191
3.8.2. С4-путь фотосинтеза (цикл Хэтча—Слэка—Карпилова)......... 196
3.8.3 Метаболизм углерода по типу толстянковых (САМ-фотосинтез)... 198
3.8.4. Фотодыхание.............................................. 199
3.9. Экология фотосинтеза.............................................202
3.9.1. Влияние на фотосинтез интенсивности и спектрального
состава света................................................... 202
3.9.2. Влияние на фотосинтез концентрации углекислого газа.......204
3.9.3. Влияние температуры на фотосинтез.........................204
3.9.4. Влияние водного режима на фотосинтез......................205
3.10. Фотосинтез как основа продуктивности растений...................205
3.10.1. Хлоропласты — источник ассимилятов и АТФ.................205
3.10 2. Донорно-акцепторные взаимодействия как фактор эндогенной
регуляции фотосинтеза в системе целого растения..................207
3.10.3. Теория фотосинтетической продуктивности..................208
Глава 4. ДЫХАНИЕ РАСТЕНИЙ ( О. Г. Полесская)
4.1. Биохимические пути окисления глюкозы.............................212
4.1.1. Структура метохондрий.....................................212
4.1.2. Глюкоза — основной субстрат дыхания у растений............212
4.1.3. Гликолиз — первый этап дыхания............................213
628
4.1.4. Синтез сахаров при обращении гликолиза.................... 217
4.1.5. Образование восстановительных эквивалентов, АТФ и СО2
в цикле трикарбоновых кислот......................................217
4.1.6. Особенность растительных митохондрий — присутствие
малик-энзима......................................................220
4.1.7. Распад глюкозы регулируется ключевыми метаболитами
и подчинен комплексной системе контроля...........................222
4.1.8. Обмен метаболитами ЦТК между митохондриями и цитозолем....... 225
4.1.9. Конверсия жиров в углеводы. Глиоксилатный цикл.............227
4.1.10. Окислительный пентозофосфатный цикл.......................232
4.2. Электронный транспорт и синтез АТФ в митохондриях растений.......233
4.2.1. Электрон-транспортная цепь дыхания. Перенос электрона от НАДН
на кислород.......................................................233
4.2.2. Комплекс Т, или НАДН-дегидрогеназа. Электронный транспорт
в комплексе сопряжен с генерацией Дрн+............................237
4.2.3. Комплекс II, или сукпинатдегидрогеназа.....................239
4.2.4. Комплекс III, или цитохром Ьс|-комплекс. Электронный транспорт
в комплексе сопряжен с генерацией ДЦН+............................240
4.2.5. Комплекс IV, или цитохромоксидаза. Электронный транспорт
в комплексе сопряжен с генерацией Дрн+............................243
4.2.6. Электронный транспорт сопряжен с синтезом АТФ..............245
4.2.7. Скорость электронного транспорта. Дыхательный контроль.....247
4.2.8. Разобщение электронного транспорта с фосфорилированием.......249
4.2.9. Альтернативные НАД(Ф)Н-дегидрогеназы.......................251
4.2.10. Альтернативная оксидаза в митохондриях растений...........252
4.2.11. Энергия Дрн+ используется для транспорта метаболитов
через внутреннюю мембрану митохондрий.............................258
4.3. Клетка и активные формы кислорода................................261
4.3.1. Образование активных форм кислорода в процессе нормальной
жизнедеятельности растительной клетки.............................261
4.3.2. Антиоксидантные системы....................................263
4.3.3. АФК защищает растение при внедрении патогена...............267
4.3.4. Супероксидрадикал и перекись водорода действуют
как сигнальные молекулы...........................................267
4.4. Дыхание в фотосинтезирующей клетке...............................271
4.5. Дыхание целого растения..........................................273
Глава 5. ВОДА В ЖИЗНИ РАСТЕНИЙ (//. Р. Мейчик, Ю. В. Балнокин)
5.1. Функции воды.....................................................276
5.2. Относительное содержание воды в клетках — важный параметр
водного обмена.......................................................277
5.3. Классификация растений по их способности регулировать водный обмен.277
5.4. Общие закономерности транспорта воды через мембраны
растительных клеток..................................................280
5.4.1. Химический потенциал воды..................................280
5.4.2. Осмотическое давление......................................281
5.4.3. Осмотическое давление как функция концентраций
растворенных веществ..............................................283
5.4.4. Водный потенциал...........................................284
5.4.5. Матричное давление.........................................285
5.5. Соотношение между осмотическим давлением и гидростатическим
давлением в клетке...................................................286
5.6. Водные каналы мембран: аквапорины................................288
629
5.7. Поток воды в клетку.............................................291
5.8. Движение воды в целом растении..................................292
5.8.1. Теория когезии и натяжения................................293
5.8.2. Движение воды в листьях и транспирация....................294
5.8.3. Движение воды по ксилеме и клеточным стенкам..............295
5.8.4. Движение воды в корне.....................................298
5.8.5. Движение воды из почвы в корень...........................304
5.8.6. Регуляция транспорта воды в целом растении................304
Глава 6. МИНЕРАЛЬНОЕ ПИТАНИЕ (Н.Д. Алехина, Е. В. Харшпонашвили)
6.1. Значение растений в циркуляции минеральных элементов в биосфере.
Особенности минерального питания растений........................... 306
6.2. Поглощение элементов минерального питания.......................309
6.2.1. Корень — орган поглощения минеральных веществ.............309
6.2.1.1. Рост корня как основа добывания веществ из почвы....310
6.2.1.2. Структурно-функциональные особенности корня
и поглощение веществ........................................311
6.2.2. Поступление ионов из среды в клетку и корень..............315
6.2.2.1. Поступление ионов в апопласт.......................315
6.2.2.2. Механизмы транспорта через мембрану................319
6.2.3. Радиальный и дальний транспорт ионов по растению..........334
6.2.3.1. Пути радиального транспорта........................334
6.2.3.2. Движущие силы радиального транспорта ионов
и загрузка ксилемы..........................................338
6.2.3.3. Дальний транспорт ионов............................341
6.2.4. Поглощение ионов интактным растением стационарного состояния... 346
6.2.4.1. Кинетика поглощения ионов интактным растением......347
6.2.4.2. Модель корня и регуляция поступления ионов
в интактном растении....................................... 349
6.3. Включение в обмен веществ и функции элементов минерального питания .. 353
6.3.1. Фосфор....................................................353
6.3.1.1. Характерные особенности фосфорного питания.........353
6.3.1.2. Основные типы фосфорсодержащих соединений......... 354
6.3.1.3. Транспорт фосфата через мембраны...................354
6.3.1.4. Метаболизм фосфата.................................357
6.3.1.5. Ответные реакции растительного организма
на дефицит фосфата......................................... 360
6.3.2. Азот......................................................361
6.3.2.1. Формы азота, используемые растением............... 361
6.3.2.2. Поглощение и усвоение нитрата..................... 362
6.3.2.3. Поглощение и ассимиляция аммония.................. 368
6.3.2.4. Интеграция азотного метаболизма на уровне
целого растения.............................................371
6.3.3. Сера......................................................375
6.3.3.1. Серосодержащие органические соединения.............375
6.3.3.2. Поглощение и транспорт сульфата....................376
6.3.3.3. Ассимиляторное восстановление сульфата.............376
6.3.3.4. Глутатион и его производные........................380
6.3.4. Кальций...................................................383
6.3.4.1. Распределение Са2+ в структурах клетки. Функциональное
значение компартментации....................................383
6.3.4.2. Системы транспорта кальция.........................384
6.3.4.3. Са2+ и системы внутриклеточной сигнализации........387
630
6.3.5. Калий........................................................395
6.3.5.1. Системы транспорта К+ и их характеристика.............395
6.3.5.2. Регуляция мембранного потенциала......................396
6.3.5.3. Регуляция активности ферментов и синтез белка.........398
6.3.5.4. Осморегуляция и катионно-анионный баланс..............399
6.3.6. Движения устьиц: транспорт ионов и регуляция.................401
6.3.6.1. Открывание устьиц.....................................402
6.3.6.2. Закрывание устьиц.....................................404
6.3.7. Хлор.........................................................406
6.3.8. Магний.......................................................406
6.3.9. Железо.......................................................408
6.3.10. Медь........................................................411
6.3.11. Марганец....................................................412
6.3.12. Молибден....................................................412
6.3.13. Цинк........................................................413
6.3.14. Бор.........................................................414
Глава 7. РОСТ И РАЗВИТИЕ РАСТЕНИЙ (В. В. Чуб)
7.1. Общее представление о росте и развитии.............................416
7.1.1. Параметры роста..............................................416
7.1.2. Кривая роста.................................................417
7.1.3. Дифференцировка..............................................418
7.1.4. Тотипотентность. Терминальная дифференцировка................419
7.1.5. Периодизация индивидуального развития........................420
7.2. Гормональная система растений......................................422
7.2.1. Общие принципы гормональной регуляции........................422
7.2.1.1. Регуляторные молекулы растений........................422
7.2.1.2. Рецепция и усиление сигнала...........................423
7.2.1.3. Фосфатидилинозитольная система вторичных мессенджеров ... 424
7.2.1.4. Взаимодействие сигналов...............................428
7.2.2. Ауксины — гормоны апекса побега..............................429
7.2.2.1. История открытия ауксинов.............................429
7.2.2.2. Биосинтез и деградация ауксинов.......................431
7.2.2.3. Транспорт ауксинов....................................431
7.2.2.4. Физиологические эффекты ауксинов......................434
7.2.2.5. Ауксины и неоднородность внешней среды................437
7.2.2.6. Ауксин и плоды........................................438
7.2.2.7. Ауксин как гербицид...................................438
7.2.2.8. Гравитропизм..........................................438
7.2.3. Цитокинины — гормоны корневого апекса........................439
7.2.3.1. История открытия......................................439
7.2.3.2. Биосинтез и инактивация цитокининов...................440
7.2.3.3. Эффекты цитокининов от апекса корня до апекса побега...442
7.2.4. Взаимодействие ауксинов и цитокининов........................443
7.2.4.1. Физиологическое действие ауксинов и цитокининов
в культуре in vitro............................................443
7.2.4.2. Баланс между ауксинами и цитокининами
в интактном растении..........................................444
7.2.4.3. Цитокинины и паразиты растений........................445
7.2.5. Гиббереллины — гормоны листа.................................446
7.2.5.1. История открытия......................................446
7.2.5.2. Биосинтез гиббереллинов...............................446
7.2.5.3. Основные физиологические эффекты гиббереллинов........448
631
7.2.5.4. Гиббереллины и прорастание зерна.....................449
7.2.5.5. Гиббереллин и проявление пола у растений.............451
7.2.5.6. Гиббереллин и цветение растений......................451
7.2.6. Абсцизовая кислота — сигнал водного стресса.................451
7.2.6.1. Открытие абсцизовой кислоты..........................451
7.2.6.2. Биосинтез абсцизовой кислоты.........................452
7.2.6.3. Передача АБК-сигнала.................................454
7.2.6.4. АБК — гормон осмотического стресса...................455
7.2.6.5. Регуляция покоя семян АБК............................456
7.2.6.6. Синдром дефицита АБК.................................457
7.2.6.7. АБК и форма листьев..................................457
7.2.7. Этилен — сигнал механического стресса.......................458
7.2.7.1. Открытие физиологической роли этилена................458
7.2.7.2. Биосинтез этилена....................................459
7.2.7.3. Рецепция и передача сигнала..........................459
7.2.7.4. Этилен как гормон механического стресса..............461
7.2.7.5. Этилен и прикосновение...............................461
7.2.7.6. Этилен и заживление ран..............................461
7.2.7.7. Регуляция листопада в умеренных широтах..............462
7.2.7.8. Формирование и созревание плодов.....................463
7.2.7.9. Биотический стресс...................................464
7.2.7.10. Этилен и цветение ананасов..........................465
7.2.8. Другие гормональные вещества растений.......................467
7.2.8.1. Брассиностероиды.....................................467
7.2.8.2. Жасминовая кислота...................................471
7.2.8.3. Салициловая кислота..................................473
7.2.8.4. Олигосахарины........................................475
7.2.8.5. Короткие пептиды.....................................476
7.3. Рецепция световых сигналов........................................477
7.3.1. Принципы фоторецепции.......................................477
7.3.2. Фоторецепция в красной области спектра: фитохромная система..479
7.3.2.1. История открытия фитохрома...........................479
7.3.2.2. Фотоконверсия фитохрома. Фитохромы А и В.............480
7.3.2.3. Этиоляция и деэтиоляция..............................482
7.3.2.4. Избегание тени.......................................483
7.3.2.5. Регуляция прорастания семян..........................484
7.3.2.6. Внутренние часы и фитохромная система................485
7.3.3. Фоторецепция в синей области спектра: криптохром и фототропин.... 487
7.3.3.1. История изучения фоторецепции в синей области спектра.487
7.3.3.2. Криптохром — рецептор синего света, локализованный
в ядре и цитоплазме............................................488
7.3.3.3. Фототропин — мембранный рецептор синего света........490
7.3.3.4. Суперхром — «кентавр с головой фитохрома
и туловищем фототропина».....................................491
7.4. Регуляция роста и развития растений...............................491
7.4.1. Эндогенные факторы развития.................................491
7.4.1.1. Образование листьев..................................491
7.4.1.2. Переход к цветению...................................493
7.4.1.3. Образование цветка...................................494
7.4.2. Влияние внешних факторов на рост и развитие.................497
7.4.2.1. Пищевые ресурсы экотопа. Регуляция цветения
элементами минерального питания..............................497
7.4.2.2. Фотопериодизм и климатические факторы................498
7.4.3. Фотопериодизм...............................................499
632
7.4.3.1. История открытия фотопериодизма....................499
7.4.3.2. Опыты М.Х.Чайлахяна................................501
7.4.3.3. Гормональная теория цветения Чайлахяна.............502
7.4.4. Термопериодизм. Стресс-периодизм...........................505
7.4.4.1. Сезонная специализация растений....................505
7.4.4.2. Термопериодизм: стратификация и яровизация.........506
7.4.4.3. Опыты М.X.Чайлахяна................................507
7.4.4.4. Стресс-периодизм.................................. 508
Глава 8. РАСТЕНИЯ В УСЛОВИЯХ СТРЕССА (Ю. В. Балнокин)
8.1. Стратегии приспособления растений к действию стрессоров........ 510
8.2. Водный дефицит..................................................512
8.2.1. Понижение водного потенциала растительных клеток как стратегия
избежания обезвоживания..........................................513
8.2.2. Осмолиты...................................................514
8.2.2.1. Свойства и функции осмолитов.......................514
8.2.2.2. Биосинтез некоторых наиболее распространенных
осмолитов.................................................. 517
8.2.3. Белки, образующиеся в клетках растений при дегидратации....523
8.2.3.1. Lea-белки..........................................523
8.2.3.2. Шапероны и ингибиторы протеаз......................525
8.2.3.3. Протеазы и убиквитины..............................525
8.2.3.4. Аквапорины........................................ 525
8.2.4. Защитные и регуляторные функции белков, индуцируемых водным
дефицитом........................................................526
8.2.5. Регуляция экспрессии генов, индуцируемых водным дефицитом..527
Рецепция сигнала........................................... 527
8.3. Солевой стресс............................................... 530
8.3.1. Повреждающее действие солей...................J............531
8.3.1.1. Эффекты, проявляющиеся на клеточном уровне.........531
8.3.1.2. Эффекты, проявляющиеся на уровне целого растения...532
8.3.2. Адаптации, противодействующие осмотическому эффекту солей..533
8.3.3. Ионное гомеостатирование цитоплазмы растительной клетки
как стратегия избежания токсического действия солей..............533
8.3.3.1. Поступление Na+ и СГ в клетки корня из почвенного
раствора....................................................537
8.3.3.2. Транспортные белки плазматической мембраны,
вовлеченные в перенос Na+ и СГ из наружной среды
в цитоплазму................................................539
8.3.3.3. Экспорт Na+ и СГ из цитоплазмы.....................541
8.3.3.4. К+/№+-селективность — индикатор солеустойчивости
растений.................................................... 544
8.3.4. Интеграция клеточных механизмов устойчивости к водному
дефициту и высоким концентрациям солей в защитную систему
целого растения..................................................545
8.3.5. Регуляция генов устойчивости к NaCI....................... 548
8.3.6. Различия между гликофитами и галофитами....................550
8.4. Изменения температурных условий.................................552
8.4.1. Поддержание метаболической активности и структурной
целостности биополимеров при изменении температурных
условий..........................................................552
8.4.1.1. Компенсация температурных эффектов путем изменения
свойств ферментов...........................................553
633
8.4.1.2. Компенсация температурных эффектов путем
изменения внутриклеточного содержания ферментов.............555
8.4.1.3. Термофильные бактерии — модель для изучения
механизмов термостабильности................................555
8.4.1.4. Роль белков теплового шока в акклимации растений
к высоким температурам......................................556
8.4.1.5. Температурозависимые модификации липидного
бислоя мембран..............................................558
8.4.1.6. Энергия активации ферментативных реакций,
протекающих в мембранах.....................................562
8.4.2. Устойчивость растений к замораживанию.....................564
8.4.2.1. Дегидратация клеток как механизм, предотвращающий
внутриклеточное образование льда............................564
8.4.2.2. Последствия обезвоживания клеток..................565
8.4.2.3. Механизм переохлаждения.......................... 567
8.4.2.4. Биологические антифризы...........................569
8.4.2.5. Анатомические барьеры............................ 570
8.4.2.6. Роль белков холодового шока в акклимации растений
к замораживанию.............................................570
8.4.3. Механизмы терморегуляции у растений...................... 571
8.4.3.1. Теплопродукция при дыхании.........................571
8.4.3.2. Теплопродукция при замораживании...................572
8.5. Кислородный дефицит............................................572
8.5.1. Анатомо-морфологические особенности, позволяющие
растениям поддерживать аэробный обмен в условиях
дефицита кислорода...............................................573
8.5.2. Активирование анаэробного метаболизма в условиях дефицита
кислорода....................................................... 574
8.5.3. Акклимация растений к аноксии............................ 577
8.5.4. Изменения в экспрессии генов при переходе от аэробного
метаболизма к гликолизу..........................................577
8.5.5. В процесс образования аэренхимы при дефиците О2 вовлечен
растительный гормон этилен.......................................579
8.6. Окислительный стресс...........................................579
8.6.1. Повреждения биомолекул активными формами кислорода........580
8.6.1.1. Повреждения липидов................................580
8.6.1.2. Повреждения нуклеиновых кислот.....................581
8.6.1.3. Повреждения белков.................................582
8.6.2. Детоксикация продуктов окислительной модификации
биомолекул.......................................................583
8.6.3. Атмосферный озон вызывает окислительный стресс в растениях.584
Глава 9. ВТОРИЧНЫЙ МЕТАБОЛИЗМ (А. М. Носов)
9.1. Общая характеристика вторичных метаболитов.....................588
9.2. Признаки вторичных метаболитов.................................589
9.3. Принципы классификации вторичных метаболитов.................. 591
9.4. Основные группы вторичных метаболитов......................... 592
9.5. Закономерности строения вторичных метаболитов................. 593
9.6. Фитохимия вторичного метаболизма...............................593
9.6.1. Алкалоиды — азотсодержащие вторичные метаболиты...........593
9.6.2. Изопреноиды (терпеноиды)..................................596
9.6.3. Фенольные соединения (растительные фенолы)................599
9.6.4. Минорные группы вторичных метаболитов.....................602
634
9.7. Биохимия вторичного метаболизма...................................604
9.7.1. Пути биосинтеза вторичных метаболитов......................604
9.7.2. Энзимология вторичного метаболизма.........................611
9.8. Физиология вторичного метаболизма.................................611
9.8.1. Локализация вторичных метаболитов в растении...............611
9.8.2. Изменение вторичного метаболизма в онтогенезе растений.....614
9.8.3. Функции вторичных метаболитов..............................614
Список литературы......................................................620
Учебное издание
Алехина Наталия Дмитриевна,
Балнокин Юрий Владимирович,
Гавриленко Вероника Феодосьевна и др.
Физиология растений
Учебник
Редактор Г.Г.Есакова
Технический редактор Н. И. Горбачева
Компьютерная верстка: Л. А. Вишнякова
Корректоры: В. А. Жилкина, Г. Н. Петрова
Диапозитивы предоставлены издательством.
Изд. № A-1086-I. Подписано в печать 24.12.2004. Формат 70х 100/16.
Бумага тип. № 2. Печать офсетная. Гарнитура «Таймс». Усл. печ. л. 52,0.
Тираж 5100 экз. Заказ № 14300.
Лицензия ИД № 02025 от 13.06.2000. Издательский центр «Академия».
Санитарно-эпидемиологическое заключение № 77.99.02 953.Д.004796.07.04 от 20.07.2004.
117342, Москва, ул. Бутлерова, 17-Б, к. 360 Тел./факс: (095)330-1092, 334-8337.
Отпечатано на Саратовском полиграфическом комбинате,
410004, г. Саратов, ул. Чернышевского, 59.