Author: Иванов В.В.
Tags: геохимия материальные основы жизни биохимия молекулярная биология биофизика геологические науки гидрогеология издательство недра минеральные ресурсы геоэкология
ISBN: 5-247-03176-8
Year: 1994
ЭКОЛОГИЧЕСКАЯ
ГЕОХИМИЯ
ЭЛЕМЕНТОВ
В. В. Иванов
ЭКОЛОГИЧЕСКАЯ
ГЕОХИМИЯ
ЭЛЕМЕНТОВ
СПРАВОЧНИК
В шести книгах
Книга 1
s- элементы
Под редакцией
члена-корреспондента РАЕН
ЭК. Буренкова
МОСКВА „НЕДРА" 1994
ББК 26.301
И 20
УДК 550.4:577.4
Федеральная целевая программа книгоиздания России
Иванов В. В.
И 20 Экологическая геохимия элементов: Справочник:
В 6 кн. Под ред. Э. К. Буренкова.—М.: Недра, 1994.—
Кн. 1: л-элементы.—304 с.: ил.
ISBN 5-247-03176-8
Впервые оценено поведение химических элементов в различных
природных и техногенных средах на количественной основе. Выявлены
наиболее характерные и опасные природные и антропогенные объекты
и среды. Рассмотрено поведение элементов в раз шчных i солея ических,
климатических, гидрохимических, атмосферных, агрохимических, биохи-
мических и промышленных условиях на глобальном, региональном
и локальном уровнях в сопоставлении с гигиеническими, агрохимиче-
скими, биологическими нормативами и новыми геоэкологическими
параметрами. Охарактеризованы главные типы минеральных ресурсов
каждого элемента, масштабы и сферы их использования, экогеохимичес-
кие параметры минералов, руд, продуктов их переработки.
Дня специалистов, занимающихся вопросами экологии, геологии, исполь-
зования природного и техногенного сырья, охраны окружающей среды
1804020100-151
И 043(01 )-93 *** °бЪЯВЛ- Ь1>К 26Jni
СПРАВОЧНОЕ ИЗДАНИЕ
Иванов Владимир Васильевич
ЭКОЛОГИЧЕСКАЯ ГЕОХИМИЯ ЭЛЕМЕНТОВ
В шести книгах
Книга 1
s-э te менты
Заведующая редакцией Л. С. Дмитриева, редактор издательства Т. П. Мыскина,
обложка художника В. А. Смирнова, художественный редактор М. П. Виноградова,
технические редакторы Н. В. Жидкова, Л. Н. Фомина, коррекюр Е С. Пу.ховска.4
ИБ №9537
Лицензия ЛР № 010145 от 24 декабря 1992 г
Сдано в набор 21.04.93. Подписано в печать 20.10.93. Формат 60x88' 16. 1арнитура Таймс
Печать офсетная. Усл. печ. л. 18,62. Уч.-изд.-л. 19,17. Тираж ТОО экз. Заказ 503 ,4147-3
Издательство «Недра» 125047 Москва, Тверская застава, 3
Набрано в Государственном ордена Октябрьской Революции, ордена Трудового Красного
Знамени Московском предцрияши «Первая Образцовая шпография» Министерства печати
и информации Российской Федерации 113054 Москва, Валовая, 28
Отпечатано в московской типографии № 9 НПО Министерства печати и информа-
ции Российской Федерации.
109033 Москва, Волочаевская ул., 40
ISBN 5-247-03176-8 (кн. 1) < В. В. Иванов, 1994
ISBN 5-247-03175-Х
ОТ РЕДАКТОРА
Экологическая геохимия - относительно новое, интенсивно разви-
вающееся направление геохимии, возникшее в нашей стране на рубеже
60 80-х гг. в связи с наступлением глобального экологического кризиса
окружающей среды от неконтролируемых огромных антропогенных пе-
регрузок природных систем. В практическом плане она призвана решать
проблемы экологии геохимическими методами.
История экологической геохимии еще не составлена, лишь позд-
ние ее этапы (60 90-е годы.) нашли отражение в предлагаемом читателю
издании. Предтечи экологической геохимии и основоположники общей
геохимии - российские ученые естествоиспытатели академики В.И. Вер-
надский и А.Е. Ферсман создали эту науку для изучения истории хими-
ческих элементов Земли и ее геосфер, что охватывало и задачи будущей
экологической геохимии. Подходы В.И. Вернадского и А.Е. Ферсмана
стали фундаментальной основой экологической геохимии. Среди биоло-
гов следует выделить крупных отечественных ученых К.А. Тимирязева.
В.В. Докучаева. В.Н. Сукачева, Н.И. Вавилова, М.М. Шемякина и других,
которые первыми начали разработку основ региональной биологии. Од-
нако эти исследования не получили у нас надлежащего развития. При-
мерно к середине столетия наступило время наибольшего противостоя-
ния экологического и индустриально-сырьевого направлений в науке и
практике, которое решилось не в пользу экологической парадигмы. Од-
нако геохимические и биогеохимические исследования все же продолжа-
лись. ВСЕГИНГЕО, ГЕОХИ, ИГЕМ, ИГ, МГУ и другие разработали ос-
новы экологии. ИМГРЭ впервые составил методические рекомендации и
инструкции; эколого-геохимические карты ряда городов, а также районов
экологического бедствия и т.д.
«Экологическая геохимия элементов» В.В. Иванова — наиболее
полное и первое в стране статистическое количественное обобщение и
синтез информации по различным отраслям знаний в плане единой зада-
чи — создания обшей картины химического состава, пространственной и
временной эволюции различных геосфер и их частей для каждого хими-
ческого элемента, приложения методов и законов геохимии к природным
и техногенным системам и структурам с использованием токсикологиче-
ских, эпидемиологических, экологических, медицинских, биогеохимиче-
ских, антропологических и других знаний для оценки состояния и про-
гнозов развития окружающей среды и типов месторождений полезных
ископаемых.
Президент Российской экологической академии А.Л. Яншин и пре-
зидент Российской академии естественных наук О.Л. Кузнецов писали:
справочник «Экологическая геохимия элементов» - это уникальный на-
3
учный труд, охватывающий все проблемы экологии природных ресурсов
и охраны геологической среды (А. Л. Яншин), а О Л. Кузнецов квалифи-
цировал справочник как всеобъемлющий, актуальный монографический
геолого-экологический труд. Выходу в свет издания помогал Председа-
тель Межведомственной комиссии по экологической безопасности чл,-
корр. РАН А.В. Яблоков, который отмечал, что первые тома этого изда-
ния были встречены как большое событие в геологии и биологии.
Как редактор могу добавить, что «Экологическая геохимия эле-
ментов» в целом огромный творческий труд, который по затраченным
усилиям и упорству можно охарактеризовать как личный подвиг. Чита-
тель может составить собственное представление о состоянии знаний по
экологии Земли и ее регионов, по всем типам минеральных ресурсов ка-
ждого элемента для России и мира.
Автор «Экологической геохимии элементов», Владимир Василье-
вич Иванов. - известный геолог-геохимик, доктор геолого-минералоги-
ческих наук, профессор, член нескольких общественных академий. Кро-
ме горно-геологического образования, у него есть еще архитектурно-
строительное с санитарно-медицинским уклоном. Он с отличием окончил
Московский строительный техникум с дипломом «Оборудование город-
ской больницы» (1948 г.) и, несмотря на увлечение геологией, сохранил
на всю жизнь внимание к своей первой специальности. По окончании
МГРИ (1953 г.) распределен в ИМГРЭ АН СССР, где проводил первые в
стране комплексные исследования по химическим элементам-суперток-
сикантам (кадмию, таллию и др.), что требовало медико-экологических и
санитарно-токсикологических знаний. Эти работы легли в основу созда-
ния сырьевых баз соответствующих полезных ископаемых и первой в
стране работы по редким элементам, авторы которой и В.В. Иванов в
1967 г. были отмечены Государственной премией СССР по науке.
У В.В. Иванова есть характерные особенности, которые должны
быть отмечены, так как сыграли не малую роль в завершении поставлен-
ной им сверхзадачи. Он человек, силы которого становятся буквально
безграничными в экстремальных ситуациях. Знакомство с его биографи-
ей показывает, что это был уже не первый случай, когда он превзошел
самого себя. Первый относится к 40-м годам в то время он, обучаясь в
техникумах, осуществил свою мечту и стал студентом геологоразведоч-
ного института, второй - к 60-м годам, когда работая ученым секретарем
ИМГРЭ, защитил одну за другой кандидатскую (1963 г.) и докторскую
(1965 г.) диссертации. Но пожалуй самыми напряженными были для него
70 80-е годы. Он совмещал должность заместителя директора по науке
ИМГРЭ с завершением исследований по экологической геохимии. Вы-
брав научную работу и с 1988 г. полностью занявшись подготовкой изда-
ния «Экологическая геохимия элементов», сумел в короткий срок завер-
шить этот шест итомный труд.
4
И еще об одном. В.В.Иванов представитель широко известной в
стране родственной династии, в которую в годы ее расцвета (50-80-е годы)
входило более 30 геологов и до 12 медиков. Это не могло не отразиться
на уникальном геолого-экологическом мировоззрении автора, что и отра-
жено в его работе.
В заключение подчеркну, что все от замысла до издания «Эколо-
гической геохимии элементов» это личная заслуга В.В.Иванова, талант,
невероятные жажда познания и трудоспособность которого неиссякаемы.
Завершая эти работы, проводя комплексное многоцелевое карти-
рование территории России, ИМГРЭ надеется внести свой вклад в реше-
ние назревших задач геологической и экологической науки и практики.
Они должны работать вместе, чтобы предотвратить дальнейшее разрас-
тание экологического бедствия, и главным связующим звеном в этом, не-
сомненно, будет экологическая геохимия.
9. К. Буренков
5
ПРЕДИСЛОВИЕ
Личный интерес автора к экологии появился в сороковых годах, а подго-
товка к опубликованию шеститомного издания «Экологическая геохимия эле.мен-
|ов» началась в конце 70-80-х. Тогда возник особенно высокий накал обществен-
ного недовольства разрозненной деятельностью отраслевых ведомств и научных
организаций, игнорировавших необходимость сохранения среды обитания и при-
родных ресурсов. Большинство людей среди общих проблем страны главной счи-
тали экологическую.
Автор под влиянием предшественников учителей и стремления к прак-
тическому использованию знаний всегда удивлялся невниманию исследователей
к окружающей среде для достижения всеобщих целей. Первые факты у видел, по-
лучая среднетехническое образование в строительстве, сани1арии и архитектуре
(1943 1948 гг.); татем в институте по геологии в практике разведки, разработки,
получения и использования полезных ископаемых (1948-1953 гг.) и так далее.
После этого активно занимался научной, организационной и практической рабо-
той в нашей стране и ближайшем зарубежье, продолжая обучение на практике и
теоретически во mhoihx направлениях во все увеличивающемся темне. Главные
причины: 1) Необходимость познания, беспрецедентно прибывающих действую-
щих экологических факторов, среди которых наряду с техническими проявляются
все остальные (естественные, гуманитарные, промежуточные); 2) Поиск пока от-
сутствующих в традиционной общей практике наиболее вероятных и эффектив-
ных предложений по устранению опасных явлений: 3) Личная привычка и жела-
ние передать дальше опыт, отобранный за десятилетия сравнительного анализа
методических разработок, являющихся самыми удачными сейчас и на ближайшее
время. ’
Материал е1руппирован в шесть книг с учетом наиболее адекватной эко-
геохимическим задачам классификации элементов по особенностям их элек1 рой-
ного строения (s-, р-. d-,f-элементы):
Книга 1. Эколо! ическая геохимия ^-элементов (22 л.) - Н, Li. Na, К, Rb,
Cs, Fr. Be, Mg, Ca, Sr, Ba. Ra.
Кнша 2. Экогеохимия главных p-элементов (18 л.) - В, Al, С, Si, N, Р, О.
S, F, Cl.
Книга 3. Экогеохимия редких р-элементов (20 л.) - Ga. In, 1'1, Ge, Sn, Pb,
As, Sb, Bi, Se, Ге, Po, Br, J, At, He. Ne, Ar, Kr, Xe. Rn.
Книга 4. Экогеохимия главных ^-элементов (21 л.) Гь V, Cr. Мп. Fe, Со.
Ni, Си. 7п.
Книга 5. Экогеохимия редких «/-элементов (27 л.) Sc. 7r, Ilf, Nb, Га, Мо,
W. Тс. Re, Ru. Os. Rh, Ir, Pd. Pt, Ag. Au. Cd, Hg.
Книга 6. Экогеохимия /-элементов (28 л.) — Y, 1 а, Се, Pr, Nd, Pm. Sm, Eu,
Gd, 1 b, Dy, Ilo, Er, Tm, Yb, Lu, Ac, Th, Pa, U, Np, Pu, .Am, Cm.
Во всех книгах соблюдался единый план: 1. Атом: а) эколо! ические нор-
мативы, б) свойства, в) глобальная геохимия. 2. Минералы: а) собственные глав-
ные и промышленные, б) породе- и рудообразующие с примесью элемента. 3. Ме-
сторождения: а) минеральные ресурсы, б) геохимическая систематика, в) промыш-
ленные тины месторождений элемента, г) комп тексные руды в месторождениях
других металлов. 4. Породы: а) магматические, б) осадочно-вулкансменные,
6
в) метаморфические. 5. 11очво-, биогеохимия: а) почвы, б) растения, в) животные,
г) человек. 6. Атмо-, гидрогеохимия, техногенез: а) воздух, б) аэрозоли, в) воды
океанические, речные и др., г) подземные воды, д) техпогеохимия. 7. Общий эко-
геохимический цикл.
Список литературы включает несколько тысяч избранных работ, для -
удобства пользования он помещен в первой книге с продолжением в остальных.
В целом издание дает представление о закономерностях распределения каждого
элемента и его известных ассоциаций во всех перечисленных средах и процессах.
Работа предназначена для широкого круга специалистов, интересующихся
проблемами состояния и будущего окружающей среды, особенно в области гео-
логических и эколо! ических проблем, а также горнотехнологических, агробиоло-
гических, природоохранных, гео|'рафических. геоэкономических вопросов. Ее
цель - дать возможность взглянуть на проблему сохранения окружающей среды и
человека, имея, но возможности, полный набор статистических оценок о естест-
венном составе природных объектов, экологически уравновешенном за длитель-
ное геологическое время, а также о современном антропогенном их загрязнении.
Хотелось, чтобы устоявшиеся за миллионы лет геохимические и экогеохимичсс-
кие закономерности состояния и развития природной среды, выявленные для ка-
ждого элемента, сделались прогностическими для геоэкологии.
Собрать и систематизировать эти сведения воедино было сложно, но еще
труднее издать его. Грудности преодолены благодаря помощи директора ИМГРЭ
академика МАМР, чл.-корр. PAFII Э.К. Буренкова, академика РАЕН, министра
В.Н. Орлова, чл.-корр. РАН, советника Президента А.В. Яблокова, вице-прези-
дента РАН академика РАН А.Л. Яншина, президента РАЕН О.Л. Кузнецова, чл.-
корр. РАЕН М.В. Толкачева, министра Госкомэкологии В.И. Данилова-
Данильяна, руководителей ведомств Минприроды Н.В. Милитснко, Л.В. Отне-
ся па. М.В. Кочеткова, В.Р. Морозова, В.И. Морозова, А.Ф. Морозова. Решающую
роль сыграли А А. Кременецкий, А.А. Волох, А.А. Ганзеев, С.М. Кравченко,
И.А. Морозова, Е.С. Мейтов, А.К. Мигута, Е.И. Семенов, Б.И. Омельянснко,
А.И. Перетьман, Е.П. Янин, O.F. Юшко-Захарова, любезно передавшие свои но-
вые материалы. Реальную помощь оказали В.В. Демидов, Н.Ф. Челищев, Б. А. Ре-
вич, Ю.Е Сает, К.В. Яблоков. Завершили работу издатели Л.С. Дмитриева,
В.И. Кичин. Т П. Мыскина, Т.И Нефедова, Т.А. Руденко, выпустившие книги в свет
Особою роль в позднем периоде авторской биографии сыграл академик
РАН, математик Н.Н. Моисеев, направивший исслетования на использование си-
нергетического синтеза.
Всем им огромная благодарность и уважение автора
Предлаз аемый шеститомник Экоз еохимии элементов рассматривает зако-
номерности для каждого из них в духе В И Вернадского и был завершен к его
130-летпю. С тех пор он пополняется. Краткие наметки завершающего исследо-
вания «Комплексный геоэкологический подход к снижению противошояния лю-
дей и человечества с природой» (Иванов В.В., М.: ИМГРЭ. 2003) опубликованы к
140-летию. Оба эти исследования выполнены в преддверии приближающегося
150-летнего юбилея. В целом они весьма оптимистичны. Их общий вывод созву-
чен Вернадскому: необходимо научиться ценить и любить каждый день, принес-
ший счасзье. А счастье - взаимодействие всего со всем с у'четом «несуществен-
ных» факторов, которые мозут оказаться решающими.
В. В. Иванов
7
СОСТОЯНИЕ ВОПРОСА
Проведенное исследование основано на концепции В. И. Вернад-
ского о ноосфере Земли как сфере разумного взаимодействия все более
равновеликих геологических и антропологических процессов и о воз-
можности научно обоснованного регулирования природопользования
и жизнедеятельности [100]. Однако, как отмечал Б. С. Соколов
в 1988 г., пока развитие идет по мрачному прогнозу французского
биолога Ж. Ламарка, который считал, что «Человеку суждено ис-
требить самого себя после того, как он сделает. Землю непригодной
для обитания». Огромные, все нарастающие, часто необоснованные
темпы добычи и переработки минерального сырья, несовершенные
технологии и слабое знание геохимической и экологической* инфор-
мации делают многие районы опасными, непригодными для дальней-
шего индустриального и аграрного развития из-за их техногенного
загрязнения. В связи с этим, несмотря на то, что многие химические
элементы являются жизненно необходимыми компонентами для
растений, животных и человека, начинают явно преобладать от-
рицательные моменты.
Экологическое небла! ополучие особенно обострилось в нашей
стране. Как писал А. А. Арбатов (1989 г.), чем больше мы производим
энергии и материалов, тем меньше мы потребляем благ. Из
колоссальной перемещенной породной массы в нашей стране в конеч-
ные продукты попадает не более первых процентов. У нас расходуется
недопустимо много сырья и энергии на единицу национального
продукта. Б. Е. Патон (1988 г.) подсчитал, что если бы удалось достичь
показателей развитых стран, то, к примеру, на Украине эго дало бы
возможность сэкономить столько электроэнергии, сколько ее выраба-
тывают семь электростанций, каждая по мощности равная Чернобыль-
ской АЭС. В конечном счете, достижение рациональных уровней
добычи, производства и потребления ресурсов, близких к передовым
странам, позволило бы решить не только эко по i ические, но и обостри-
вшиеся социальные проблемы. Но это невозможно без полной
перестройки экономики, отказа от так дорого обошедшегося первен-
ства в мире по добыче и сжиганию нефти и газа, добыче
и полупереработке железной руды и других традиционных природных
ресурсов, по производству некачественных чугуна и стали, цемента,
минеральных удобрений и т. д.
В нашей стране ежегодно образуется не менее 10” 16 т твердых
и более 30 км3 жидких отходов, в атмосферу выбрасывается более
100 млн т загрязняющих веществ. В 1986 г., вероятно, по далеко не
полным официальным данным, выбросы некоторых компонентов
* Экология—наука, изучающая взаимодействие живого мира и окружа-
ющей среды, условия существования человека.
8
оценивались (в млн т): оксиды серы 6,4 (1989 г.—диоксид серы 16,8
[537]), оксиды азота 13,5, оксиды углерода 26,4, углеводороды 12,7.
Для США в экологически наиболее неблагополучные 60-е годы
выбросы в атмосферу составляли (в млн т): оксиды серы 34 (Западная
Европа—4 [911]), оксиды углерода 142, оксиды азота 23, ядовитые
металлы 0,3, хлор 0,07 [876, 905]. Если в США достигнуто с тех пор
существенное снижение выбросов вредных веществ, то в нашей стране
их количество возрастает и, по-видимому, близко или превышает
вышеуказанные для США Наиболее обобщенно тенденции регресса
отечественной практики видны по увеличению энергоемкости наци-
онального дохода, которая почти в 1,5 раза выше, чем в США,
и продолжает увеличиваться, хотя во всех развитых странах она
снижается [497 ].
В 1990 г. впервые за всю историю страны Госкомприродой СССР
издан официальный доклад «Состояние природной среды в СССР
в 1988 г.» [722]. В воздухе городов, где ведутся постоянные
наблюдения, ПДКСС были превышены по пыли (400 городов), диоксиду
серы (410), сероуглероду (27), аммиаку (113), бензапирену (267), фенолу
(410), формальдегиду (130). Среднегодовые концентрации в воздухе
городов токсичных металлов, по этим же данным, не превышают
ПДКСС, но довольно близки к ним (в мкг/м3): Ni — 0,31 (196 городов),
РЬ—0,15 (196), Си—0,51 (190), Сг—0,26 (179), Zn —0,47 (198),
V—0,12 (41). В некоторых городах содержание токсичных металлов
в воздухе превышало ПДКСС: Со в Одессе в 3 раза, Днепродзержинске,
Зестафони, Рустави в 3—5 раз; Мп в Рустави — в 42 раза; Ni
в Алма-Ате, Лениногорске, Усть-Каменогорске > 1 ПДК, Витебске,
Нижнем Новгороде, Дзержинске, Лениногорске, Ярославле — 3 ПДК;
РЬ в Зыряновске, Ереване, Курске, Лениногорске, Магадане, Орд-
жоникидзе— 2—3 ПДК, в Комсомольске-на-Амуре—до 15 ПДК,
а в Балхаше и Чимкенте — 9—13 ПДК. Еще выше концентрации этих
элементов в промзонах многих городов. Отмечалась повышенная
заболеваемость в этих городах и зонах. В 1989 г. [537] максимальные
концентрации (в ПДКСС) в атмосфере городов составили: NO„ до
29—40 в Комсомольске, H2S до 20—70 — Тубахе, Хабаровске и др.
Напряженной является экологическая обстановка рек и водоемов.
Наиболее загрязнены (>10 ПДК) Западный Буг, Днестр, Дунай, Дон,
реки Сахалина, Кольского п-ова, нижнее течение Амура, большие
участки Иртыша, Волги, Кубани, а также (1—4 ПДК) Лены. Западной
Двины, Онеги, Северной Двины, Печоры, Яны, Индигирки, Колымы,
Аму-Дарьи, Сыр-Дарьи и многих малых рек, которые испытывают
наибольшие нагрузки. Еще сложнее обстановка для Каспийского,
Балтийского, Белого, Баренцева, а также дальневосточных морей.
По данным Госкомстата СССР, в 1990 г. более 50 млн чел.
проживало в городах, ‘где загрязнение воздушной среды составляло
10 ПДКСС и более. К наиболее неблагополучным (до 1,5 млн т выбро-
сов в атмосферу) относятся Норильск, Кривой Рог, многие районы
других городов, в частности Москвы. По данным Б С. Прохорова,
9
Б. А. Ревича (1990 г.), ежегодно в атмосферу Москвы выбрасывается
1,3 млн т загрязняющих веществ, из которых 73% приходится на
транспорт и 27%—на стационарные источники; в водоемы сбрасыва-
ется 2,2 млн м3 грязных стоков; количество твердых бытовых
и промышленных отходов достигло ~9 млн т в год; сокращаются
площади, свободные от промышленной застройки, озелененных и лес-
ных зон. Например, в 1992 г. Моссоветом принято решение об изъятии
из Гослесфонда более 2000 га земель (Измайловский, Сокольнический,
Филевский парки). Такое экологическое состояние Москвы привело
к тому, что величина удельной смертности в ней на 30% выше, чем
в других крупных городах страны; число умерших москвичей в 1990 г.
по сравнению с 1989 г увеличилось более чем на 10%, а превышение
смертности над рождаемостью достигло ~22%. В Новокузнецке,
который в несколько раз меньше Москвы, количество годовых
атмосферных выбросов (млн т) составило 0,9, в Кривом Роге ~1,5,
а в Норильске — более 2,5. Соответственно повышаются показатели
заболеваемости и смертности.
Огромны отходы в горнодобывающих отраслях По данным
ВНИИГеолнеруд, к 1985 г. только на 300 обследованных ГОКах
скопилось 60 млрд т перемещенной, раздробленной и не используемой
горной массы. Ее количество для Казахстана составляет 15 млрд т
и ежегодно увеличивается на 0,9 млрд т [825], для Украины — более
10 млрд т. Такое же разорительное состояние типично для агропромы-
шленной, воднохозяйственной, лесной, металлу pi ической, энергетиче-
ской, оборонной и других отраслей нашей «госплановой» деятельности.
Массовый опрос общественного мнения, проведенный в 1989 г.
ВЦИОМ в семи регионах страны, показал, что среди 10 острейших
социальных проблем (таких, как нехватка жилья, продовольствия
и др.) загрязнение окружающей среды поставлено на первое место
у 87% респондентов. Аналогичное исследование в июле 1992 г. дало те
же результаты (42%). Зная это, государство за последние годы приняло
несколько специальных постановлений программ, создало «Государ-
ственный комитет по охране природы», затем ВООП; появился также
ряд независимых общественных организаций. Однако все эти ор-
ганизационные и пропагандистские мероприятия не подкреплены
достаточным финансированием и при существующем аварийном
подходе не могут быть эффективными. О необходимых масштабах
затрат на улучшение состояния окружающей среды свидетельствуют
данные по США, которые в 1987 г. направили на эти цели почти
80 млрд дол.; в СССР же было выделено только 10 млрд руб. Притом
надо учитывать, что полнота и направленность использования ассигно-
ваний у нас далеки от запланированных.
В 1990 г. И. Абдурагимовым проведено сопоставление общих
расходов на охрану окружающей среды, исходя из принятого в стране
в то время искаженного отношения доллара к рублю (~0,6), которое
показало пятикратное отставание финансирования на эти цели в нашей
стране а для воздушной среды в 15 раз. Если учесть более реальное
10
отношение доллара к рублю на то время (~ 6), то это отставание
составит 50 и 150 раз (США—ежегодно ~ 100 млрд дол.). Еще больше
мы отстаем от Японии, где на природоохранные цели гратится
порядка 3—5% общего валового национального продукта.
Показательно, что на Всемирной международной экологической
конференции, проходившей в Рио-де-Жанейро (май, 1992 г.), на
правительственном уровне было заявлено, что для реализации главных
экологических проектов в мире сегодняшнего дня требуется ~620 млрд
дол. в год. Современные финансовые ресурсы ограничены и не
позволяют завершить начатые проекты, хотя странами рыночной
экономики за- 30 лет работ по улучшению состояния окружающей
среды затрачены многие триллионы долларов. Мы же пока не вложили
сумм, необходимых для начала улучшения экологического состояния
страны. В этом главное.
Если сопоставить государственные перспективные программы охра-
ны окружающей среды США и нашей страны, то они во многом
сходны. Но точки отсчета (сегодняшнее состояние) и соответствующее
финансирование, оборудование и технологии совершенно несравнимы.
План радикального улучшения воздушной среды, переданный
Дж. Бушем в 1989 г. в конгресс США, предусматривал снизить
загрязненность воздуха до санитарных норм к 1995 г. в 60% городов,
к 2000 г. сделать это в остальных, а к 2010 г. в самых крупных
городах—Нью-Йорке, Хьюстоне и Лос-Анжелесе; уменьшить к 1995 г.
на 75% выбросы в атмосферу промышленными предприятиями
примерно 280 химических канцерогенных веществ; к 2000 г. примерно
вдвое сократить промышленные выбросы в атмосферу химических
соединений, вызывающих кислотные дожди. «Проект Государственной
программы охраны окружающей среды и рационального использова-
ния природных ресурсов СССР» на XIII пятилетку и на перспективу до
2005 г., разработанный в 1989 г. Госкомприродой СССР, ГКНТ, АН
СССР, Госкомгидрометом СССР и ВНИИ системных исследований,
общая стоимость которого оценивалась примерно в 135 млрд руб.,
предусматривал к 2000 г. полностью прекратить сброс загрязненных
сточных вод в природные водоемы, довести к 2005 г. качество воды
в основных водоемах страны до экологических нормативов. Намеча-
лось к 2005 г. снизить в 2 раза выбросы в атмосферу от стационарных
источников, на 80% — выбросы специфических загрязняющих веществ
на предприятиях, расположенных в 276 городах с повышенным
уровнем загрязнения воздуха, и увеличить почти в 3 раза ввод
газопылеочистных сооружений. Предусматривались мероприятия по
уменьшению на 48% загрязнения атмосферы автомобильным транс-
портом.
Выполнение поставленных задач, наряду с финансовыми и техниче-
скими причинами, зависит также от экологической культуры и знаний
населения, которые пока не обеспечены необходимой доступной
обобщающей информацией, хотя в литературе появляются тысячи
публикаций по различным проблемам природопользования. Несмотря
11
на большие усилия и затраты в последние десятилетия в наиболее
развитых индустриальных странах на охрану окружающей среды,
общие успехи пока незначительны. Это связано с трансграничным
и даже трансконтинентальным мировым воздействием антропогенных
и техногенных выбросов. Несомненно, что для сохранения окружа-
ющей среды требуются еще большие общемировые усилия ученых,
хозяйственников, политиков и всего населения. Объемы требуемых
природоохранных мероприятий даже в передовых промышленных
странах еще недостаточны. Прогнозы проблематичны, но возможны,
так как каждый человек потребляет в среднем известное количество
сырьевых материалов. В 70—80-х годах, по данным Г. Люттш
(1984 г.), потребление сырья на одного гражданина ФРГ, подсчитанное
для средней продолжительности жизни 70 лет, составило (в т): песка
и гравия 460, нефти 166, прочных пород 146, угля 145, известняка 99,
стали 39, цемента 36, глины 29, промышленного пбека 23, каменной
соли 13, гипса 6, доломита 3,5, фосфатов 3,4, серы 1,8, торфа 1,8,
природного песчаника 1,8, калиевых солей 1,6, алюминия 1,4, каолина
1,2, цветных и других металлов 2; итого—1180 т. Учитывая демогра-
фические прогнозы для стран с различным уровнем технического
развития, можно подсчитать, сколько горного сырья потребуется на
определенное количество населения. Если иметь данные о количестве
выбросов вредных веществ при получении единицы электроэнергии,
металлов и других материалов, то с учетом численности населения
и уровня совершенства технологий можно рассчитать масштабы
природоохранных мероприятий. В области энергетики, народонаселе-
ния, водопользования и некоторых других такие прогнозы предложены
в трудах Института всемирного наблюдения (Вашингтон, США).
Исследования по многочисленным международным биосферным про-
граммам. начатым на рубеже 80-х и 90-х годов, еще не завершены,
однако они однозначно показывают, что антропогенные нагрузки на
природные системы превысили допустимый уровень, а состояние
окружающей среды близко к потере равновесной стабильности и биота
из регулятора глобальных экогеохимических балансов превращается
в деструктивный фактор. В. Г. Горшковым, К. Я. Кондратьевым,
К. С. Лосевым, А. С. Мониным. Г. Лебел и другими исследователями
на основании обобщения данных глобального мониторинга сделан
вывод о том, что сама разрушаемая человеком биосфера стала
источником дестабилизации природной экологической системы и для
выживания необходимо срочное снижение антропогенных нагрузок.
С середины нашего столетия мировой общественный продукт вырос
в 5 раз, численность населения — более чем в 2 раза, производство
промышленной продукции в 3—4 раза. Человек стал потреблять
~40% первичной биологической продукции суши, включив в хозяйст-
венную деятельность ~63 млн км2 земель, и, вероятно, значительно
превысил допустимые пределы. Хотя абсолютные пределы нагрузок
пока не установлены, огромные масштабы потерь природных ресурсов
и загрязнений при антропогенной деятельности за последние 40 лет
12
говорят сами за себя. В настоящее время более 2 млрд человек пьют
опасную для здоровья загрязненную воду, ежегодно для получения 2 т
конечного полезного продукта, потребляемого в среднем одним
человеком, расходуется 20 т ресурсов (минеральных, сельскохозяйст-
венных, лесных и т. д.), ~ 1,5 • 103 Вт электроэнергии и ~800 т воды;
в атмосферу и гидросферу поступает ~12 Гт СО2 (всего в атмосфере
700 Гт СО2), что в 10 раз выше, чем в доиндустриальную эпоху.
Защитный озоновый слой ежегодно уменьшается на 2%, в 2 раза
снижена величина транспирации и т. д. Сейчас ежесуточно исчезает
более 100 видов организмов, а прогноз на ближайшие 20—30 лет—
полное вымирание около 1 млн видов; значительно снизилась биопро-
дуктивность океана и др. [83, 115, 214, 215, 354, 423, 509, 859, 870, 919,
896]. Эти показатели превысили характерные для главных глобальных
биотических природных кризисов прошлого, когда за относительно
короткий для геологии промежуток времени (2—10 млн лет) вымирало
до 20—30% общего числа видов [523].
К сожалению, ни одна из многочисленных предлагаемых професси-
ональных концепций устранения новой, теперь уже антропогенной
глобальной экологической катастрофы не может быть признана
достаточной, хотя каждая из них имеет рациональное зерно [354, 537,
722, 741, 742]. В результате антибиосферной технократической деятель-
ности человека слишком далеко зашел процесс деградации биосферы;
на весьма низком уровне находятся также экологическое образование
и мышление. Выход один — сделать экологические знания не только
общедоступными, но и самыми приоритетными среди естественных
наук, всеми способами привлечь к ним всеобщее внимание.
Гёологи находились среди первых специалистов, занимавшихся
исследованиями окружающей среды. Из наиболее известных имен
отмечались Г. Агрикола и А. Вернер. Первый обращал внимание на
имевшиеся ранее его эпохи акты о запрещении горнорудных работ
в богатых сельскохозяйственных районах, второй писал об осторожном
обращении со сточными шахтными водами горных разработок
Саксонии.
Ранние научные исследования и обобщения по распространенности
химических элементов в гео- и биосфере принадлежат В. И Вер-
надскому, А. Е. Ферсману, В. ГЪльдшмидту, А. П. Виноградову,
Б. Б. Полынову, а также В. И. Бгатову, А. А. Беусу, М. И. Будыко,
М А. Глазовской, Н Ф. [лазовскому, В. В. Добровольскому, В. А. Ко-
вде, В В. Ковалевскому, В. В. Ковальскому, А. Кабата-Пендиас,
В. К. Лукашеву, К И Лукашеву, Ю. И. Москалеву, X. Пендиас,
А. И. Перельману, А. Б. Ронову, С. Г. Неручеву, Ю. Е. Саету и мно-
гим другим; среди выдающихся российских экологов чаще других
упоминаются В. В. Станчинский, В. Н. Беклемишев, А. Н. Формозов,
Д. Н. Кашкаров, В А. Алматов, Г. Ф. [аузе, а среди геоэкологов —
А. П. Виноградов, Д. Вуд, Е. Гольдберг, Н. Н. Моисеев, А. В. Си-
доренко, Ю. А. Израэль, Ф. Я„ Ровинский, И. Ферстнер, А В. Яблоков,
А. А. Яншин. В отличие оз ранних работ В. И. Вернадского
13
и некоторых других перечисленных исследователей, большинство
современных публикаций касается какой-либо одной стороны гео-,
лито-, гидро-, атмо- или биоэкологии. Между тем обе части
проблемы имеют общее начало—и в той, и в другой все
зависит от степени, масштабов и типов концентрации и рассеяния
металлов; они обладают единой химической природой, подчиняются
сходным физико-химическим закономерностям и должны рассмат-
риваться в единых структурах менделеевской системы. Как показали
В. И. Вернадский, А. П. Виноградов, В. В. Ковальский, А. И. Пере-
льман, В. Шоу, Ю. И. Москалев, А. Кабата-Пендиас и др., законы
распределения элементов в лито- и биосфере имеют одно начало —
химический состав среды и физико-химические свойства атомов.
Хорошим примером единой направленности эволюции содержаний
химического элемента в гео- и биохимических системах является
магний, для которого А. П. Виноградов в ЗО-е годы установил
снижение концентраций в крови у беспозвоночных во все более
высоких (поздних) классах их систематики, а в 60—70-е годы
А. Б. Ронов показал аналогичную временную зависимость для
осадочных пород.
14
ТОКСИЧНОСТЬ, БИОЛОГИЧНОСТЬ
И ГЕОЭКОЛОГИЧНОСТЬ ЭЛЕМЕНТОВ
В 1973 г ООН был принят список наиболее опасных для человека 15
веществ, среди которых значились сернистый газ, оксид и диоксид
углерода, оксид азота, углеводороды, хлор-органические соединения
(ДДТ, ПХБ и др.), микотоксины, нитраты, нитриты, нитрозамины,
аммиак, ртуть, свинец, кадмий, а также взвешенные в воздухе пылевые
частицы, концентрирующие различные металлы [52, 626].
В СССР содержание химических веществ начали контролировать еще
в 1925 г., когда были определены первые ПДКрэ*, в настоящее время
установленные почти для всех элементов и многих соединений; ПДК1С
и ПДКмр** впервые введены в 1949 г., а ПДК для воды — в 1950 г.
ПДК для токсичных элементов, утвержденные Минздравом СССР,
в настоящее время действуют для > 1300 веществ в воздухе и >1100—
в воде [611, 727]. Они уточнялись, дополнялись и в настоящее время
приобрели достаточную стабильность, являясь наиболее жесткими
в мире. Часть из них приведена в табл. 1. Общее количество веществ,
отнесенных к токсичным, в настоящее время близко к 3000, большин-
ство— органические соединения [231, 556, 571, 612, 727, 857, 859]. За это
же время Всемирной организацией здравоохранения (ВОЗ) в рамках
Международной программы химической безопасности опубликованы
«Гигиенические критерии состояния окружающей среды» для Hg Be, Pb,
Sn, Мп, As, Ti и других Металлов, которые также использованы в работе.
В 1956 г. при ООН был создан Научный комитет по действию
атомной радиации (НКДАР), который периодически опубликовывал
данные о мощностях доз облучения от различных источников и их
критические значения, приведенные в. табл. 2.
Данные по токсичности и биологичности химических элементов пока-
заны в перио,щческой системе Д. И. Менделеева с выделением трех бло-
ков элементов (рис. 1)—непереходных $-, р- (верхний), переходных <1-
(средний) и f- (нижний). Различаются высокотоксичные элементы, имею-
щие I и II классы опасности, обще токсичные (III и более низкие классы
опасности) и слабо изученные с неясной токсичностью (см. табл. 1).
* ПДКр1 (рабочей зоны)—предельно допустимая концентрация вредного
(загрязняющего) вещества в воздухе рабочей зоны—это такая концентрация,
которая не вызывает у работающих при ежедневном вдыхании в пределах 8 ч
в течение всего рабочего стажа заболеваний или отклонений здоровья, обнаружива-
емых современными методами. ПДКР, известны для 1381 вещества [727].
** ПДК с — среднесуточная концентрация вредного (загрязняющего) веще-
ства в воздухе, которая нс оказывает прямого или косвенного вредного
действия в условиях неопределенно долгого круглосуточного вдыхания;
ПДКмр— максимальная разовая концентрация вредного (загрязняющего) веще-
ства в воздухе, которая не вызывает рефлекторных (субсенсорных) реакций
в организме человека. ПДКРС и ПДКмр известны для 298 веществ [727].
ОБУВ — ориентировочные безопасные уровни воздействия в атмосферном
воздухе населенных мест; получены для 202 веществ [727].
15
Таблица I
ПДК металлов и их соединений
К часе опас- ности Элемент, соединение Воздух— ПДК^, мг'м3 Вода*, мг/л Почва, мг/кг*2
— Ag — 0,05 (1) —
—— Al — 0,5 (2); 0,5 (3) —
II Alb 0,2 *3 —. —-
— АЬ О3 0,04 — —
— A1(NO3)-9H2O — 0.1 (I) —
— Ba (растворимые — 0,1 (2) —
соединения)
I BaCO3 0,004 — —
I Be (растворимые 0,00001 0,0002 (1—3) —
соединения)
I V 0,02 (0,005—США) 0,1 (1, 2) 150
г V?Ps 0,002 — ——-
— Bi3 + — 0,5 (2) —
— Bi54 —— 0,1 (2) —
— W — 0,1 (1); 0,05 (2) —
— W5 + — 0,1 (2) —
III Ge 0,04 (оксид) 100 (1)
—— Fe (растворимые — 0,5 (1, 3); 0,3 (2) -—
соединения)
—— In 0,005 — —
I Cd и соединения — 0,01 (1); 0,001 (2) —
—— Св(РО4)2 0,004 — —
1 Co 0,001 — 5
— Li ОН — 5 (1) —
— LiH — 0,03 (2) —
— MgCO3 — 50,0 (2) —
II Mn 0,01 I (1); 0,1 (2) 1500 (вал.)
II Cu2+ и соединения — 0,1 (1); 1 (3) 3 (подв.)
— Mo и соединения — 3,5 (1); 0,25 (2, 3)
II As и соединения 0,003 0,05 (1—3) 2 (вал.)
II Ni (нерастворимые 0,001 2,5 (2, 3) —
соединения)
II NiCO3 0,0005 — —-
I Ni (растворимые 0,0002 0.1 (1, 2) 4 (подв.)
соли)
— NbO 0,001 — —
— NbN — 0,01 (2) —
III Sn2+ и соединения 0,02 — —
III Sn4 + 0,05 — —
I Hg 0,0003 0,005 (1) 2,1 (вал.)
— HgSO4 — 3,005 (1); 0,0005 (2)
I Pb и соединения 0,0003 3,01 (1); 0,03 (2, 3) 32 (вал.);
20 (обще-
санит.)
I SeO2 — 0,001 (1—3) —
— Sb и соединения —— 0,05 (1) 4,5 (вал.)
II , Sr — 7 (2, 3) —
I T1 — 0,0001 (2, 3) —
II Те — 0.01 (2, 3) —
16
Продолжение табл. 1
Класс опас- ности Элемент, соединение Воздух— ПДКсс, мг/м3 Вода*, мг/л Почва, мг/кг*2
— TiO, — 0,1 (2, 3) —
I Th (нерастворимые соединения) — 0,1 (1) —
I U (растворимые соединения) — 0,05 (I) —
1 Сг 0,0015 0,1 (2) Сг6+; 0,5 (1) Сг3+ 6 (подв.)
III Zn -— 5 (2, 3) 23 (подв.)
— ZnO 0,05 — —
* ПДК в воде водоемов: неутвержденные значения по [6111—(1) , ПДК„-(2)
и ПДК -(3) [216, 231, 246, 558. 611—613, 686, 727]. *2 Вал.— валовая, подв.— подвижная формы. •Зпдк . мр
Таблица 2
ПДК радиоактивных веществ, Бк/л. По В. А. Барабой [27]
Изотоп Источники водоснаб- жения Воздух
рабочих помещений санитарио- защитных зон населенных пунктов
140 Ва 18,9 0,10 0,01 1,0-10“3
1311 1,6 0,24 2,4 10“3 2,4-10 “4
42 К 16,2 0,27 0,027 0,005
45 Са 8,1 8,1 0,008 0.8 10“3
133Хе — 0,002 2,7 0,27
24Na 21,6 0,27 0,027 0,002
95 Nb 81,0 0,27 0,027 0,002
239Pu 0,13 510-’ 0,54-10 “6 0,5 10“7
21°Ро 0,05 0,27-10 “4 0,27 10“5 0,27-10 “6
226 Ra 0,13 0,8110-* 0,81 10“5 0,8-10 “6
222 Rn — 0,08 0,027 0.002
86 Rb 18,9 0,189 0,018 1,8 -10~3
106 Ru 8,11 0,016 1,62 -10“3 1,6-10“4
90Sr 0,08 0,81 10“3 0,81 10 4 0,8 10“5
89 Sr 8,1 8,1 0,008 0,8-10 “3
35S 18,9 0,081 0,081 0,008
3H 81,0 0,0005 5,4 0,18
I4C — 0,081 0,81 0,08
U (естеств.) 0,05 0,02 2 10 3 210“4
'37Cs 2,7 0,027 0,002 0,002
144Ce 8,1 0,016 1,62 10“3 1,6-10 “4
95 Zr 54,0 0,081 ч0,008 0,8-10 “3
32 P 13,5 0,189 0,018 1,8 10“3
2 2138
17
IA ПА Ш6 НБ 16 П6 HI Б 0
1 Н □ He
г чУ/ L (Be) L ® D © o © □ □ ® □ Ne
3 ® □ □ & L L © □ ©□ ® □ Ar
4 □ & L L (As) L & L Kr P
5 Rb |_ ®L In ? Sn ? ® ? © □ Xe
6 ^5 ? ®L ® ? ® ? At ®
1 Fr @?
ША HA IA ИА ША HIT IB ПБ
4 ^с, ? й l ©L @ L Й □ @ □ @L (§)□ ^Zn, □
5 Nb L ® □ Tc— ® ? © » L’ (Cd) L
6 La ? & ? Ta ? (w) L Re ? ® 7 Ir 1 S, ? Au 7
7 Ac LO
Лантаноиды Се 7 Рг 7 Nd 7 Pm 9 Sm 7 Eu 7 54 7 Tb 7 Ho 7 Er 7 Tm 7 Yb 7 Lu 7
Актиноиды 7 © 7 (Cf) Es Fm Md No Lr
Рис. 1. Токсичность и биологичность s-, р-, d- и /-элементов:
1 — высокотоксичные, 2—общетоксичные, 3—исясной токсичности и биологичности,
4—жизненно необходимые, 3—возможно жизненно необходимые
Экологическое значение химических элементов обычно многоплано-
вое. В частности, среди токсичных металлов по биологической
важности выделяются главные жизненно необходимые Mg, Са, Мп, Fe,
Na, К, Со, Си, Zn, Мо [312, 336], а также возможно жизненно важные,
но слабо изученные (см. рис. 1), среди которых известны металлы
с уже установленными полезными функциями для некоторых растений
и животных (Al, As, Li, Ni, Rb*, Se, Sr, Ti, V и др.) и с прогнозиру-
емыми (Be, Cd, Si, Cr, Sc, Ba, Cs) [328, 860].
Имеются данные [312, 336] по нормальным и экстремальным
недостаточным и избыточным содержаниям некоторых элементов
в почвах и растениях (табл. 3), а также для сельскохозяйственных
животных (табл. 4). Эти оценки изменчивы и показывают лишь
возможный примерный уровень содержаний.
18
Наиболее сложной и слабо изученной проблемой является медико-
санитарное нормирование воздействия элементов на жизнедеятель-
ность. ПДК и другие нормы выведены эмпирически, при отсутствии
общей теории вопроса. Они не учитывают даже главные особенности
химизма природных и техногенных систем, 'для которых предназ-
начены, и не всегда привязаны к определенным соединениям или
формам нахождения элементов. Не решены вопросы суммарного
влияния нескольких элементов—эффектов их антагонистического
(снижающегося) или синергетического (увеличивающегося) взаимодей-
ствия. Эта проблема наиболее остра, так как обычно в экоге-
охимических системах присутствуют ассоциации большого числа
элементов. А. Кабата-Пендиае, X. Пендиас [312] обобщили имеющие-
ся данные по этому вопросу для растений (микроорганизмов). Они
сделали вывод, что наиболее полно антагонизм изучен для Fe, Мп, Си,
Zn, а также для Сг, Mo, Se; антагонизм и синергизм нередко сменяют
друг друга. Синергизм между микроэлементами в растениях обычно не
доказан. В частности, упомянутые авторы подвергают сомнению
данные о синертизме Cd с Pb, Fe, Ni [312]. Для животных таких
обобщений еще не выполнено, за исключением исследований по
совместному действию различных радионуклидов [381, 511, 633, 634].
При совместном присутствии в экологической системе нескольких
токсичных веществ (1, 2, ..., п) сумма их концентраций не должна
превышать единицы при расчете по формуле:
С1/ПДК1+С2/ПДК2 + ... + С„/ПДК„<1, где Ci,2.....—фактические
концентрации токсиканта, ПДК112 „—предельно допустимые кон-
центрации тех же веществ в соответствующей экосистеме.
Поскольку одним из основных регулирующих факторов экологиче-
ской роли элементов является степень их подвижности и время
присутствия в конкретной среде (лито-, гидро-, атмо-, био-), это
необходимо учитывать во всех геоэкологических построениях.
Впервые научное значение разделения геосфер и физико-химических
сред Земли установил В. И. Вернадский, который показал, что их
различия имеют большее значение, чем сходства [100]. О главном
сходстве уже говорилось, а различия становятся очевидными, если
обратиться к составу и свойствам объектов: твердой среды—лито-
сферы (минералов, руд, пород, почв), жидкой—гидросферы (типов
вод), газовой — атмосферы.
Биосфера, объединяющая всюду проникающим живым веществом
все перечисленные косно-минеральные составляющие верхней части
Земли, также специфична по составу, состоянию и времени обращения
химических элементов и их соединений. Не только биос, но и мине-
ральное вещество проникает во все различные физические среды
поверхности Земли, определяя микроэлементный состав воды (взвесь)
и воздуха (аэрозоль), и это также объединяет различные геоэкологичес-
кие среды. Наиболее комплексным и реагирующим на изменение соста-
ва всех составляющих объектов являются почвы. В их составе отмеча-
ются все циклические главные компоненты и многие микроэлементы,
2* 19
Таблица 3
Нормальная и экстремальные концентрации элементов в листьях растений
Элемент Концентрация, мг,кг (с.) [312, 336]
f критический недостаток достаточная— нормальная избыточная— токсичная
Си2 + Мо4+ Zn2+ Со2+ Cd2+ Ni2+~ Сг3 + V5+ Т1 Sb Se Pb Be Ag As Li Hg Al Fe F В Mn Sr J — 5-30 30-100
6-15 0,01-6 До 1,5 1-8 15-60 1,5-4 27-150 >60 >4 150-400
До 30 30-70 0,02-1 * >70 15-50
<2-7 0,04 5-30 7-30 0,05-0,2 0,1-5 0,1-0,5 0,2-1,5 7-50 0,01-2 5-10 <1-7 0,5 1-1,7 3 10-200 >30 5-30 10-100 5-30 5-10 20 150 5-30 30 - 300 10-50 5-10 5-20 5-50 1-3 >200
<3-6 15-25 6-30 20-300 >30 300-500
До 400? 400 - 3000 >3000
2-5 До 600 40 600-1000 >40
степень накопления—выноса которых показана в табл. 5 £198]. Видно,
что для одного и того же элемента величина привноса—выноса
меняется и зависит от условий среды. Многочисленные факты
большого влияния различных геохимических, геоморфологических,
климатических, ландшафтных и других факторов на эндогенную
и экзогенную миграцию элементов приведены в работе далее.
20
рыклитель) и почвах (знаменатель) и ИДК в вещевых црадуктах
ПДК в продуктах, мг/кг [128, 130, 131, 727]
рыбных МЯСНЫХ МОЛОЧНЫХ хлебно- зерновых овощей фруктов СОКОВ
10 40 0,2 0,5 0,3 0,5 1 1 1 0,3-0,6 30 30' 10 2 5 40 0,05 0,5 0,2 0,1 1 0,5 0,5 0,03 10 50 2,5 1 0,5 5 0,02 0,1 0,1 0,05 0,5 0,1-0,3 0,05 0,05 1 3 2,5 0,3 5 25 0,02 0,5 0,2 0,1 0,5 0,3 0,2 0,01-0,03 20 50 2,5 1 10 10 0,03 0,5 0,2 0,3 0,5 0,5 0,2 0,02 30 50 2,5 1 10 10 0,03 0,5 0,1 0,3 0,5 0,4 0,2 0,02 20 50 2,5 1 5 10 0,002 0,3 0,1 0,2 0,5 0,2 0,005 10 15 2,5 1
В свое время В. И. Вернадский [100] для количественного выраже-
ния геохимических зависимостей использовал понятие кларк концент-
рации элемента (отношение конкретного содержания элемента
в объекте или системе к кларку элемента). Это понятие широко вошло
в отечественную литературу [574 и др. ] и в память о В. И. Вернадском
и для краткости названо нами вернад. В качестве оценок кларков
21
Таблица 4
Пороговые концентрации некоторых химических элементов ,щя сельскохозяйст-
венных растений и животных, мг/кг (с.)
Элемент Среднее содержание в пастбищных растениях Концентрация
недостаточная (нижняя пороговая) нормальная (пределы для различных видов животных) избыточная (верхняя nopoi овая)
Со 0,32 До 0,1-0,25 0,25 — 1 и более 1 и более
Мо 1,25 До 0,2 0,2-2,5 2,5-3 »
Си 6,4 До 3-5 3—12 и более 20 - 40 »
Zn 21 До 20-30 20-30 » 60-100 »
Мп 73 До 20 20—60 » 60 - 70 »
Fe 190 До 25 24 - 30 » —
Таблица 5
Подвижность элементов в различных почвенно-
геохимических барьерах
Типы барьеров Элементы
слабо подвижные, накапливаю гея умеренно подвижные, накапливаются, частично выносятся легко подвиж- ные, выносятся
Окислительные:
КИСЛЫЙ Мп Мо РЬ As Se Ni Cr V Cd Hg Cu Zn
нейтральный РЬ Cd Hg Zn Mo Cu As Se
и щелочной Co Ni Cr
испарительный Восстановительные: РЬ Cd Hg Zn Mo Cu Ni Cr As Se
кислый As Se Мо V Pb Cd Hg Ni Cr Cu Zn Co —
нейтральный и щелочной РЬ Cd Си Zn Со As Sc Mo V U Ag Hg Ni
сероводородный РЬ Cd Hg As Se Zn Co Ni Cr Ag V U Mo —
земной коры для большинства элементов в работе приняты средние
значения, полученные Л. Н. Овчинниковым [546] из всех имеющихся
оценок кларков (табл. 6). Приведенные в табл. 6 кларки биосферы
выведены М. А. [лазовской и Н. Ф. [лазовским [198], кларки гидрос-
феры—по А. П. Виноградову, В В [ордееву, В. Н. Иваненко,
А. П. Лисицину [857], биоса—по А. П. Виноградову, Н. Боуэну,
В. В. Добровольскому [857, 860].
В настоящей работе введены новые понятия, характеризующие
экогеохимические и геоэкологические особенности элементов: их
22
Таблица 6
Кларки химических элементов в эемиов коре, гидросфере*,
биосфере 2* и биосе3*
Элемент Литосфера Гидросфера Биосфера Биос
И 0,11 10,8 4,5 10,0
Не 6 10“ 5 10“° 2 10“ —
Li 2,5 10“ 1.7 10“ 1,9 10“ 6-10“
Be 2-10“ 1 10“° 1 10 4 4 10“
В 9 10 4 1,5 10“ 5 10“ 1 10 3
С 2- 10“ 2,8 10 3 0,44 18,0
N 2-10“ 5 10“ 0,12 0,3
О 46,5 85,8 63,2 70,0
F 6,4 10“ 1,3 10“ 3,5 10 2 1 10“
Ne 7,7 10 8 n 10’8 1,9 10 8 — ,
Ng 2,38 1,07 1.9 0,02
Mg 2,26 1,31 10“ 0,9 0,07
Al 8,07 3 10 6,1 0,02
Si 27,99 2,5 - 10“ 16,5 0,15
P 0,1 7 10“ 5 10“ 7 10 2
S 3,3 10 2 8,9 10"2 0,17 5 10“
Cl 1,810“ 1,94 0,69 2-10"2
Ar 2.2 10“ n 10“ — —
К 2,13 3,9 10“ 1,6 0,3
Ca 3,81 4,2 10’2 1,6 0,5
Sc 1,7 10“ 8 10"10 7 10“ —
Ti 0,53 1 10“ 0,26 n-10“
V 1,2-10“ 1,5- 10“ 7 10“ л-IO"4
Cr 9,2 IO"3 1 10“ 5 10 3 n 10“
Mn 9- 10“ 8 - I0"8 4,4 10 2 n 10“
Fe 5,33 3-10“ 2,2 2 • 10“
Co 2,3-10“ 7-10“° 2,2 10“ 2 10“
Ni 7,0-10“ 510“ 1 10“ 5 10“
Cu 5.3 10“ 7- 10“ 310“ 2 10 4
Zn 6,8 IO’3 1 10“ 4,6 -10“ 2 10“
Ga 1,7-10“ 4 10“ 1,7 10 3 n-10 8
Ge 1,4 10“ 3 IO"9 1 IO’4' n 10“
As 1,8 10 4 3 10’7 3 10 4 n 10“
Se 7,3-10“ 7 10“ 2,8 10 5 n-10 8
Br 2,4 10 4 6,6 10“ 2,6 - 10“ 1,5 10“
Kr 4,2 10’9 n-10“ 4- 10“ —
Rb 1,1 10“ 1,2 10“ 3,3 10 6 2 10“
Sr 3,7 10“ 7,8 10“ 4 10 3 2 10“
Y 3,2-10“ 1 IO”9 2 10“ 3 10“
Zr 1,6 10“ 2,8 10 9 1 10“ 3 10 4
Nb 2,1 10“ 5 10’10 1 10“ —
Mo 1,2 10“ 1 10 8 110 4 n-10“
Tc 1,0-10“ — — —
Ru 4- 10“ n 10“ — —
23
Продолжение табл. 6
Элемент Литосфера Гидросфера Биосфера Биос
Rh 5 10'7 6-IO'7 —
Pd 9 10'7 — — —
Ag 7,3 IO'6 2-Ю'8 5-10'6 n-10'6
Cd 1,7 - 10'5 8-IO'9 1,6-10'5 n-10 7
In 1,5 -10 s 5 10'11 6 -10'6 —
Sn 2,3 10-4 n-10'10 5 -10'4 n-10'3
Sb ЗЮ'3 n-10'9 2,5-IO'5 n-lfl'7
Те 310“7 — 6-IO'7 —
I 4,7 10'5 5-10'6 5-10'3 1 -10'5
Xe 3,4 -IO'10 И Ю'8 5-10'8 —
Cs 4,3 10 4 1 10'8 6 IO'4 n-10'3
В 4,7-IO" 2 2 -10'6 3,6 IO'3
La ЗЮ'3 5 - IO'10 1IO'3
Ce 6,1 IO'3 31O'10 ЗЮ'3
Pr 7,6 10'4 610'11 3-10 4
Nd 3 10'3 3-1O'10 —
Sm 7,3 10'4 610" —
Eu 1,2-10“4 5-10'11 —
Gd 7,2 10'4 810'" 5 - 10'4 n-10'3
Tb 1,9 10'4 1 10 11 —
Dy 4,7-10“4 910 11 3 - IO'4
Ho 1,5 10 4 5 • IO'11 7 IO'5
Er 3 10'4 8 10“" 2-10 4
Un 3,6-10'4 1 10" 2-10'3
Yb 3,1-IO'4 810'" 2-10 4
Lu 9 10'3 1 10" 4-10 5
Hf 2,4 IO'4 71O”10 2-10 4 n-10'7
Ta 2,2 1O'A n-IO'10 2 - IO'4 —-
W 1,4 10 4 1 IO'8 1,3 -10'4 и IO'6
Re BIO'8 n-10 10 5-Ю'8 —
Os 2 10 7 n-10'10 3-10'6 —
It 6,5 IO'8 — — —
Pt 5,7 IO'7 — — —
Au 3,5-IO'7 4-1O'10 7-Ю'8 И Ю'8
Hg 7,2-10'6 1 IO'9 2 10'3 5 IO'7
T1 9-10'3 1 10 9 8 IO'5 —
Pb l,3-10'3 210'8 8 10' n-10'4
Bi 1,9 10'5 2-10 9 6-10 7 —
Th 1 IO'3 61O’10 8 • 10 4 —
U 2,6 -10'4 3-10'7 2-IO'4 8-10'7
* Соотношение пресных и соленых вод 1:200.
24 Ra 1,3-10“*°; Ac 2-Ю'10; Ро 1-10-1*; Pu 1 1016; Pm
7-Ю'21; At 2-Ю'21.
3* Кларк растительности суши.
4* С учетом данных А. Б. Ронова. А. П. Лисицина и др.
7-10'1в; Rn 1 10~19; Fr
[178, 186].
24
литотоксичность (табл. 7), а также гидротоксичность—атмоток-
сичность (табл. 8), геоэкофильность * и показатели геоэкологичности**.
На основе коэффициентов литотоксичности Тл подсчитаны значения
литоэкологичности различных объектов. Элементарный экогеохимиче-
ский параметр литоэкологичности элемента ГЭ = ВТЛ, где В—кларк
концентрации (вернад) элемента. Для глобальных построений ис-
пользуется кларк элемента земной коры или биосферы, для региональ-
ных—ферсм, для локальных—фон. Суммарный экогеохимический
показатель литоэкологичности минерала ГЭМ рассчитывается следу-
ющим образом:
гэм=1 £ (ГЭ),-=ГЭ1+...+ГЭл,
где Y—показатель устойчивости минерала, учитывающий химичес-
кую, механическую и гвдроаэродинамическую устойчивость [40] и' име-
ющий три градации: высокую (У=10), среднюю (У=5) и низкую (У=1).
Этот показатель дает представление об относительной потенциальной
экологической неблагоприятности минерального литообъекта или терри-
тории. Средние значения могут быть подсчитаны для всех минералов,
месторождений и т. д. Для минералов самый высокий ГЭМ ртути
самородной 1 10®, киновари 5 Ю6, теллуридов и селенидов п 10б,
галхаита 7 • Ю5, галенита и арсенопирита 5 • Ю5, акташита 3 • Ю5,
халькопирита и сфалерита 5 • Ю4, антимонита и блеклых руд З Ю4,
молибденита 2 Ю4; среди минералов классов оксидов и солей кислород-
ных кислот наиболее неблагоприятны хризоберилл 5 - 10б, бертрандит
5 • 106, уранинит 8 • 104, торианит 5 • 104, торит 4 • Ю4, берилл 4 104,
целестин, стронцианит, барит, витерит и флюорит З Ю4, шеелит, лопарит
и эвдиалит 2 • Ю4, пирохлор 1 • Ю4 и т. д.; для кальцита ГЭМ=1—5.
Аналогичные средние оценки получены для типов пород и месторо-
ждений (как суммы минералов), а также площадей—аномальных
геохимических и рудных районов разных типов и масштабов (для
пород и месторождений показатели ГЭЛ приведены в соответствующих
разделах).
Гигиенические оценки токсичности химических элементов (ПДК
и др.), используемые при экологических исследованиях, не учитывают
* Показатель геоэкофильности ГЭФ—отношение кларка Кл (ферсма, фона)
элемента в системе к его ПДК или другому эколого-гигиеническому показателю
(ВДК, ОБУВ) в этой системе.
Различаются: гидроэкофильность ГЭФг = Клг/ПДКг; атмоэкофильность
ГЭФа = Кл,/ПДК,; почвоэкофильность ГЭФл = Клп/ПДКо; биоэкофильность
ГЭФ6 = Клв/ПДК.
** Показатели геоэкологичности: общая геоэкологичность элемента
ОГЭ=ВТср, где Т(:р=(Тл+Т,_г)/2 (см. табл. 6, 7), В—вернад элемента
биосферы; геоэкологическая опасность ГЭО = ВТсрП, где П — показатель
патологичности (П избытка + П недостатка; см. ряды патологичности);
гидроэкологичность элемента ГЭг = ВТгЭ (Э—см. ряд гидроэкофильности);
атмоэкологичность ГЭ, = ВТ,Э (Э—см. ряд атмоэкофильности).
25
26
Таблица 8
Коэффициенты атмо-, гидротоксичности элементов,
соединений Тьг
Класс опасности
Т.,г
Элемент, соединение
Супертоксичные
и I класс
100
Hg, Be, Pb и др. (см. табл. 1. 7), Na-метилди-
тиокарбомат, озон, СС14, хлоранилин (F), ангидрит-
Cr, С1; хроматы; линдан, метилнитрофос. метафос,
хлороксид-Р, циаихлорид, диэтилсвинец, хлориидан,
диэтилртуть, бенз(а)пирен, хлорфин, этилмсркур-
фосфат, нафтохинон, формальдегиды, и-иитроани-
лин; 3, 4, 7, 8-диоксин, дихлорэтилен, трихлорбифе-
нил, тстраэтилолоно
II класс
50
S, H2S, As, Sb и др. (см. табл. 1, 7), нафтолы,
фенилы, бензолы; газообразные фториды, HF, хло-
роформ, хлорэтилен, метан; ацетилацетаты Fe, Со,
Ст; ферроцианиды, трихлорэтилен, ДДТ?, ГХЦГ?,
БПХ?, циклогексан, фториды (слаборастноримые),
нитрохлорбензолы
Ill класс и обще-
токсичиые
10
NO2, СО2, СО, метиловые эфиры, сероуглерод, SO2,
сульфаты, аммиак, аммоний, фенолы, этилены и др.
(см. табл. 1, 7)
Примечание. Подчеркнуты наиболее распространенные токсиканты производств.
геохимические параметры (кларки, ферсмы и др ).При сопоставлении
имеющихся значений ПДК и степени токсичности металлов (I,
II классы опасности, общетоксичные) с их положением в периодической
системе и значениями кларков в земной коре общих зависимостей не
обнаружено. В менделеевской системе супер- и высокотоксичные
металлы (Be, Со, Hg, Tl, Pb, U и др.) соседствуют с общетоксичными,
а распространенные металлы нередко имеют ПДК близкие или даже
более низкие, чем редкие. Можно лишь отметить, что особенно
насыщена наиболее токсичными металлами II группа периодической
системы (Be, Mg, Са, Sr, Ba, Ra, Cd, Hg), а также длинные периоды
(4-й и 6-й) и актиноиды (возможно, лантаноиды), где установлена
высокая токсичность V, Cr, Со, Ni, Th, U и др.
Обращает внимание факт наибольшей токсичности микроколичеств
ряда редких металлов. Возможно, это связано не с геохимическими
особенностями самих металлов, а со слабой адаптацией живых
организмов к редким металлам, техногенные концентрации которых
относительно недавно появились в окружающей с]3бде.
Были подсчитаны величины отношений генеральных оценок сред-
них содержаний токсичных металлов (соединений) Кл в определенных
природных средах к их ПДК в соответствующих средах—воздухе
27
пдксс, воде ПДК», а также коэффициенты геоэкофильности элементов
(ГЭФ), представляющие собой отношение Кл: ПДК. Оценки получены
для токсичных металлов, охарактеризованных соответствующими
величинами в атмосферной и (или) водной средах. Кларки для водной
среды приняты по оценкам С. Тейлора и других исследователей
в реках, для атмосферы подсчитаны нами по данным Ф. Я Ровинского
с соавторами [653], С. Г. Пушкина, В. А. Михайлова [626], А. Кабата-
Пендиас [312], А. А. Волох и других исследователей для различных
индустриальных территорий (Северная и Западная Европа, Япония,
Северная, Южная, Центральная Америка, бывш. СССР).
По снижению значений ГЭФГ в водной среде (гидроэкофильность)
получен следующий ряд: Li 0,1; Mg, Fe 0,08; Мп, Си 0,07; Se 0,06;
Be 0,05; As 0,04; Sr 0,035; Ti, Pb 0,03; AJ, Tl, Ba 0,01; Cr 0,01—0,002;
V 0,009; Ag 0,007; Ni 0,005; Zn 0,004; Nb 0,003; Mo 0,002; Hg, Cd,
Sb 0,001; Th<0,001; W 0,0006; Co 0,0001; для атмосферного воздуха
(атмоэкофилыюсть) ряд такой: Ni 0,28; Be 0,18; Сг 0,066; Си 0,023;
РЬ 0,018; Мп 0,016; As 0,009; Hg 0,004; Zn 0,0037; V 0,0027; Со 0,0012.
Параметры гидро- и атмоэкофильности позволяют перейти к соот-
ветствующим коэффициентам степени экотоксичности (Тг и Та), которые
можно использовать для определения относительной суммарной оценки
состояния геоэкологичности воздушных и водных сред. Элементы
с высокими значениями ГЭФ (0,01—0/1—см. табл. 8) вносят больший
вклад, поэтому для них условно приняты высокие показатели—
Эг= 100 -20: Li 100; Mg, Al 90; Fe, Mn, Be 80; Си 70; Se, As, S 60; Sr,
Ra 50; Pb 40; Ti, Cr 30; Ba, Tl 20; Э. = 100 - 40: Be 100; Ni 90; Си 80; Pb 70;
Cr 60; Mn 50; As, Ca 40. Для элементов с меньшими ГЭФ (<0,01) принят
Эг = 10 (Fe, Ba, Mn, Cr, V, Ti, Th, Nb, Sn, Mo, As, Pb, Zn, Sb, Hg, Cd, V,
Co, U) и Э»=10 (Ca, Cr, Zn, As, V, Co, Hg, F).
В отличие от ГЭЯ (литоэкологичности) объектов и систем соот-
ветствующие показатели гидроэкологичности ГЭг и атмоэкологичности
л
ГЭ, подсчитываются по следующим формулам: ГЭг= £ (ГЭ Э)( =
i-i
= ГЭ1Эг + ... + ГЭ»Эг; ГЭ.= f (ГЭ Э)|=ГЭ1Э» + ... + ГЭлЭ». При рас-
1= 1
четах ГЭ, значения В берутся для соответствующей среды—водной или
воздушной, значения Тг и Т, из табл. 8, а Эг.»—из приведенного ряда.
Для геоэкологической характеристики микроэлементов существен-
ное значение имеют сведения о их патологичности П при избытке
и недостатке в окружающей среде [116, 177, 484, 910]. В первом
приближении такое понятие дают ряды снижающейся относительной
патологичности П микроэлементов при их избытке или недостатке,
составленные исходя из количества установленных типов заболеваний
и патологий для каждого элемента: при его избытке — Hg (21), Ва (20),
As (19), Tl (17), Ni (15), Be, Cd, Pb (no 14), F (13), Co (12), Br (11), Fe,
Cu (10), Se, Al (9), V, Cr, Mo, В (8), Mn (7), Li (6), Si (5), I, Bi, Sr, Pt (4),
In (3), Zn, Ag (2), W, Sn (1?); при недостатке—Zn (14), Fe, Cu (no 13), I,
28
Se (10), Co, Mn (8), Mo (5), Ni (4), F, Pb (3), Cd, Si (2), В, Br (1), Al (?)...
Для макроэлементов детальные обобщения отсутствуют, однако
известно огромное значение как недостатка, так и избытка главных
биоэлементов—Ca, Na, К, С, S, Mg, Р, N и др. (см. рис. 1).
Приведенные выше первые оценки коэффициентов геоэкологич-
ности элементов являются полуколичественными, но дают общее
представление о состоянии соответствующих сред. Одновременно они
заставляют обратиться к данным по геохимии токсичных веществ,
чтобы использовать их для расширения рядов ГЭ, Т, ГЭФ и других
и выявления главных экогеохимических свойств элементов. Исходя же
из приведенных данных можно сказать, что важным, вероятно,
окажется сочетание нескольких свойств, среди которых, кроме значи-
тельного превышения или недостатка по сравнению с кларковой
распространенностью В, будут геоэкологические особенности и миг-
рационная способность элементов и соединений.
29
ГЕОХИМИЧЕСКИЕ СИСТЕМАТИКИ,
АНАЛИТИЧЕСКИЕ ДАННЫЕ И СТАТИСТИЧЕСКИЕ
ПАРАМЕТРЫ РАСПРЕДЕЛЕНИЯ ЭЛЕМЕНТОВ
ГЕОХИМИЧЕСКИЕ СИСТЕМАТИКИ
Известные геохимические и некоторые биохимические закономер-
ности верхней части и поверхности Земли наилучшим образом
согласуются с периодическим законом Д. И. Менделеева. Поведение
элементов в природных системах объясняется в первую очередь
электронным строением атомов, которое наиболее четко выражено
в одном из вариантов периодической системы [799]. По структуре
активного электронного слоя элемента выделяются три самостоятель-
ных блока: I—5- и р-, II—d-, III—/-элементов (см. рис. 1) В верхнем
I блоке s- и /7-элементов находятся все главные элементы геологиче-
ских, биологических и экологических систем (1—3-й ряды) Электрон-
ная конфигурация внешних оболочек у всех элементов каждой
вертикальной подгруппы в этом блоке одинаковая IA—-s1, ПА—$2,
ШБ—р1, IVB—р2.. VIIE—р5, с чем и связано наибольшее осново-
полагающее физико-химическое сходство элементов по вертикали.
Одновременно наблюдается закономерное однонаправленное измене-
ние химических свойств элементов в каждой группе [6—10, 14—30, 34,
36, 105, 135].
В среднем II блоке d-металлов разница в энергии между ns-
и d-лодуровнями электронов невелика, орбитали могут заполняться
поочередно, и при ионизации атомов их свойства определяются лишь
числом d-электронов; Например, в горизонтальном ряду V2 + , Сг5 + ,
Mn4t общим является электронная конфигурация из трех d-электро-
нов, - у Fe2 + , Со3 + , Pt4+—из шести d-электронов и т. д. Это
определяет сходство 3d-MerannoB по горизонтали, и для 4d- и 5d-
металлов имеется также сходство и по вертикали. Еще полнее
горизонтальное сходство проявлено для нижнего блока /'-металлов
(лантаноиды, актиноиды).
Обоснование этих и других геохимических закономерностей приве-
дено в литературе [22, 26, 84, 100, 137, 203—206, 213, 223, 281, 402, 455,
458, 468, 531, 693, 700, 777, 793, 841, 926].
В соответствии с вышеизложенной систематикой и принята
основная рубрикация планируемой к изданию серии книг «Экологиче-
ская геохимия элементов» и, в частности, данной работы, а также
последовательность расположения элементов в тексте: для s- и р-
элементов — по вертикальным группам, для 3d-MeTannoe (Sc—Zn) — по
горизонтальным рядам (также для Y, лантаноидов и актиноидов),
а для остальных 4d- и 5d-MerannoB — по вертикали в парах Zr—Hf;
Nb—Та; Мо—W; Re—металлы платиновой группы.
Рис. 2. Атомные объемы элементов (график Мейера — Ферсмана)
30
31
Рис. 3. Минералого-геохи-
мическая группировка
месторождений:
Группы: С—садсрофильная,
X—халькофильная, Л—ли-
тофильная, О—органофиль-
ная; главные классы минера-
лов: о—оксиды, сл—сили-
каты, су—сульфиды, сф —
сульфосоли, фт—фториды,
к—карбонаты, фо—фосфа-
ты
В каждом из блоков геохимические свойства элементов закономер-
но меняются. Наиболее контрастно они изменяются для блока s-
и р-элементов: в левой части размещаются s-элементы металлы (IA,
ПА), затем идут р-элементы металлы — полуметаллы (ШБ, IVB, VB,
VIB) и p-элементы неметаллы (VIIB, 0). В начале и середине блока
расположены породообразующие литофильные элементы, а в правой
верхней части—атмофильные.
Блок переходных d-элементов также начинается литофильными
металлами (ША, IVA, VA), затем следуют преимущественно сидеро-
филыгые (VIA, VIIA, VIIIA) и далее халькофильные (IB, НВ). Блок
/^элементов состоит из редкоземельных и радиоактивных металлов
литофильной геохимической специфики.
Наиболее наглядно основополагающее различие элементов видно
на графике атомных объемов (рис. 2). В пиках и правых нисходящих
участках кривой расположены литофильные, в книксах—сидерофиль-
ные, а на восходящих ветвях—халькофильные элементы. Промежуточ-
ное положение характерно для элементов с переходными свойствами.
Фундаментальная . гольдшшмидтовско-ферсмановская систематика
элементов на литофилы — оксифилы, сидерофилы — металлы, халько-
филы — сульфофилы имеет общее значение и использована в этой
работе как для описания эндогенной геохимической миграции элемен-
тов, так и для разделения других геологических таксонов: минералов,
руд, пород.
По Г Штрунцу (1984 г.), литофильно-оксифильной группе эле-
ментов соответствуют в минералогической систематике классы оксидов
и силикатов, сидерофильной-металлофильной — такие минеральные
классы, как элементы, интерметаллиды, карбиды, нитриды (фосфиды),
а халькофильно-сульфофильной — сульфиды, селениды, теллуриды,
антимониды, сульфовисмутиды. Экзогенные минералы не поддаются
такой группировке. В работе учтены наиболее полные сведения
32
%‘Ог>*Ог*>Н
3 2138
33
о минералах на 1989 г. включительно по данным Е. И. Семенова,
О. Е. Юшко-Захаровой, М. Флейшера, Г. Штрюбеля, 3. Циммера
и других исследователей в рубрикации минералов В Г. Фекличева
|776, 488].
Принятая в работе авторская группировка месторождений также
основана на их разделении по отмеченным геохимическим свойствам
атомов [285, 672], а в пределах этих геолого-геохимических групп
(лито-, халько-, сидерофильной и промежуточных — рис. 3) — с выделе-
нием геолого-промышленных типов.
Петрографическая систематика пород, используемая в работе,
является общепринятой и составлена в координатах SiO" (Na2O + K2O)
(рис. 4). В вышеупомянутой геолого-геохимической системе ультраос-
новные породы в какой-то мере отвечают сидерофильной или
сидеролитофильной группам месторождений, основные и средние —
сидеролитофильнои, а кислые и щелочные—литофильной.
Систематики природных вод, хотя и имеют гидрогеохимическую
основу [6, 350, 366, 430, 538, 579 и др.], лишь в малой степени
сопоставимы с принятыми для твердых минеральных объектов. То же
относится к почвам, а также к газовым системам атмосферы.
Геохимический подход к этим объектам еще не разработан, хотя,
вероятно, возможен. Во всяком случае, при систематиках атмо-
и гидросферных минеральных взвесей все больше получают фактов,
свидетельствующих о наличии зависимостей состава от размера
частиц, что позволяет перейти к литогеохимическим сопоставлениям.
Б. Б. Полыновым предложен коэффициент водной миграции элеме-
нтов К.: К„=100тх/аКх, где т—содержание элемента в воде, г/л,
а—минерализация (принята 0,43 г/л [577]), Кх—содержание элемента
в породах (кларк литосферы или ферсм, фон). По этому же принципу
рассчитывается коэффициент атмосферной миграции К,: К,— 100пх/аКх,
где п (нг/м3) = В (среднее содержание в воздухе над южным полю-
сом)-!-Л (среднее содержание в аэрозоле); а—средняя запыленность
атмосферы (принята 0,05 мг/м3; [626]).
Поведение элементов в экзогенных — гипергенных процессах во мно-
гих случаях может быть охарактеризовано в геохимических координатах,
однако большое значение приобретают свойства биофильности Бф и та-
лассофильности Т элементов. По А. И. Перельману, эти свойства харак-
теризуют отношения элемента в живом веществе Бф и в морской воде
Т к кларку этого элемента в литосфере. Биофильность самая высокая для
p-элементов (С 780; N 160; 0 1,5; S, Cl, В~1; Р 0,75, Вг 0,7) и для
некоторых s-элементов (Н 70, Са —0,2, К~0,1), для остальных—0,0л—
0,00л. Талассофильность также наиболее высокая у p-элементов (Cl 111;
Вг 30; S 1,8), а среди s-элементов у Н.—71, для остальных она варьирует
от 0,n (Na, В, I) до 0,0л (С, Mg, Se, Sr, К, Са) и ниже [577—580].
Установлена зависимость между ионным потенциалом ц и фитоакти-
вностью— чем он ниже (Ва, Са, К, Cs, Rb, Na, Li), тем активнее элемент
накапливается в растениях, а по мере увеличения р (Be. В, V, Cr, Р, Мо)
эта активность снижается (хотя Р и Мо являются исключениями).
34
Биохимическое поведение элементов, наиболее полно изученное
в организме человека, среди многих концентрационных покавателей
характеризуется двумя важнейшими динамическими параметрами —
коэффициентом (долей) всасывания элемента из кишечно-желудочного
тракта Вс и периодом биологического полувыделения элемента
Те (время, в течение которого содержание элемента в органе или
организме уменьшается вдвое): Г6 = 0,693 : X, 1де X—постоянная
выведения Г-1, сут [512]. По данным Ю. И. Москалева, наиболее
полным всасыванием, равным 1,0, обладают 5- и p-элементы. Среди
s-элементов это Н и все меэаллы группы IA, среди р-элементов—все
неметаллы 2-го ряда (В, С, N, О, F), а также С1 и полуметаллы As,
S (0,8), Se (0,9). С увеличением степени металличности и атомного
номера элемента величина всасывания в общем снижается, однако
у таких супертоксичных металлов, как Hg (0,4), Tl (0,4), Cd (0,1),
а также у сильнотоксичных Мо (0,8), Мп (0,1), Сг (0,1), Со (0,3)
остается высокой [512].
Техногенная мш рация элемента во многом связана со степенью его
промышленного использования по сравнению с кларком и характери-
зуется коэффициентом технофильности Тф: Тф = О/Кл, где О—годовая
добыча элемента, т, Кл — его кларк в земной коре [576]. Технофиль-
ность элементов меняется от п 10*1 для наиболее используемого С до
и-105 и менее для еще не нашедших широкого применения редких
металлов (Ga, Tl, Rb, Sc и др.). Для целей экологии важное значение
имеет также количество элемента, которое добывается из недр, но
в процессе передела выбрасывается в окружающую среду. Самые
высокие показатели в этом плане характерны для редких рассеянных
элементов (Rb, Cs, Tl, Ga, In, Ge, Cd f др.).
M. А. Глазовская [198] считает, что чем больше технофильность
и меньше биофильность элемента, тем он на данном этапе опаснее для
живых организмов, тем больше его деструктивная активность. В каче-
стве показателя деструктивной активности предложено использовать
отношение массы элемента в годовой добыче плюс поступление от
сжигания горючих ископаемых к массе этого элемента в биологической
продукции наземных растений за год. По этому показателю
Ад в. глобальном плане некоторые элементы располагаются так (по
убыванию): п 105—п 104 Hg; п 103 Cd, F; л 102 Sb, As, Pb, U; л 10
Se, Be, Ba, Sn. Для территории европейской части нашей страны этот
показатель имеет другие величины (в связи с малой абсолютной
технофильностью), но не менее напряжен: л 10—л-102 Hg, As; л-10
Be, V, Pb, Мо, Со; л —л • 10 Си; 0, л—10 Ni; л В 0,л—л Zn, Ge, Sn; 0,л
Sr; особенно неблагополучен он для Донецко-Приднепровского регио-
на: Hg 575, As 130, Мо 100, Be 78. V 63, Pb 25.
Н. Ф. (лазовским [198] предложен ряд коэффициентов для техноге-
неза. Коэффициент техногенности элемента Тх показывает степень
общего вовлечения элемента в 1ехногенную миграцию во всех формах;
он меняется следующим образом: 1011 — Au; Ю10 — Ni, Bi, U;
109 — Cd, W, Pb, Cu, Ag, I. Zn, As, Se, Mo; 10®—Cl, Ba, S, Na, Cr, Sn,
3‘ 35
Са, Р, Fe, Be, В, Ge, F, Ti; 107—Br, Mn, Hg, Co, V, Ga, К; 106 —Mg,
Li, Al, TI, Sc. Коэффициент техногенного использования элемента
Н—отношение (в %) количества специально добытого элемента к его
общему количеству, вовлеченному в техногенез; Н меняется так (%):
98—С1; 91—Na, Си, Ag, Ва; 88 —Li, Fe, Pb; 87—86—Sn, Ni;
83—81 —Cr, Zn, Ca; 77—Hg; 71 —Br; 55—54 —P, Mn; 45 —Mo, F;
43 — W, 38 —Cd; 31 —B, Co; 25 —Bi; 22 —K; 20—S; 17 —As, N, Al, U;
7 — Se; 2 — Be; n—Si, V, I; 0,8—Ge; 0,4—Sc; 0,02—Ga. Выведены
также глобальные и региональные модули техногенного воздействия
Тд—отношение общего количества мобилизованного элемента (веще-
ства) к площади воздействия. Получены следующие значения глобаль-
ных модулей (кг/км2): 1000—500 Na, Cl, Са, Fe; 500—200 S; 200—100
N, К; 100—50 Al; 50—20 P; 20—10 Ti, Mn; 10—1 B, F, Mg, Cu, Zn, Zr,
Ba, Pb; 1—0,1 V, Cr, Ni, As, Br, Sr, Mo, Cd, Sn, I, U; 0,1—0,01 Be, Sc,
Co, Ga, Ge, Se, Bi; 0,01—0,001 Li, Ag, W, Au, Hg, TI; 0,001—0,0001 Cs.
Он же предложил показатель биотехногенности элемента Бг —
отношение содержания элемента в живом веществе организма к кларку
биосферы (ноосферы)—см. табл. 6. Анализ Бг показал, что в разных
природных зонах использование одного и того же химического
элемента растением может значительно отличаться. Так, Р наиболее
интенсивно накапливается в растениях тундры и степей, N, Мп, Ва
и Zn—в растениях лесной и степной зон, К и Сг—в степной зоне, Na,
S, Cl, Sr, Си, Fe — в пустынной. В общем, в тундровой и лесной зонах
в растениях концентрируются преимущественно катионогенные элемен-
ты, а в степной и пустынной — анионогенные.
АНАЛИТИЧЕСКИЕ ДАННЫЕ И ПАРАМЕТРЫ РАСПРЕДЕЛЕНИЯ
ЭЛЕМЕНТОВ
В настоящей работе в основном использованы обобщенные
аналитические данные различных исследователей, полученные со-
временными методами в известных лабораториях, качество анализов
которых подтверждено метрологическими характеристиками.
Для надежного сопоставления аналитических данных необходимо
знание аналитических возможностей соответствующих методов. По
этому вопросу за последние десятилетия достигнут коренной прогресс,
особенно в инструментальных методах анализа; имеется огромная
специальная литература и краткие полезные рекомендации [13, 516,
563]. Вопрос о сопоставимости аналитических данных по параметрам
воспроизводимости и правильности анализов, особенно низких содер-
жании, с которыми чаще имеет дело экогеохимия, также подробно
рассмотрен в литературе Из главных факторов—межлабораторной
правильности, внутрилабораторной воспроизводимости и временного
фактора — преобладающими для всех элементов и видов анализа
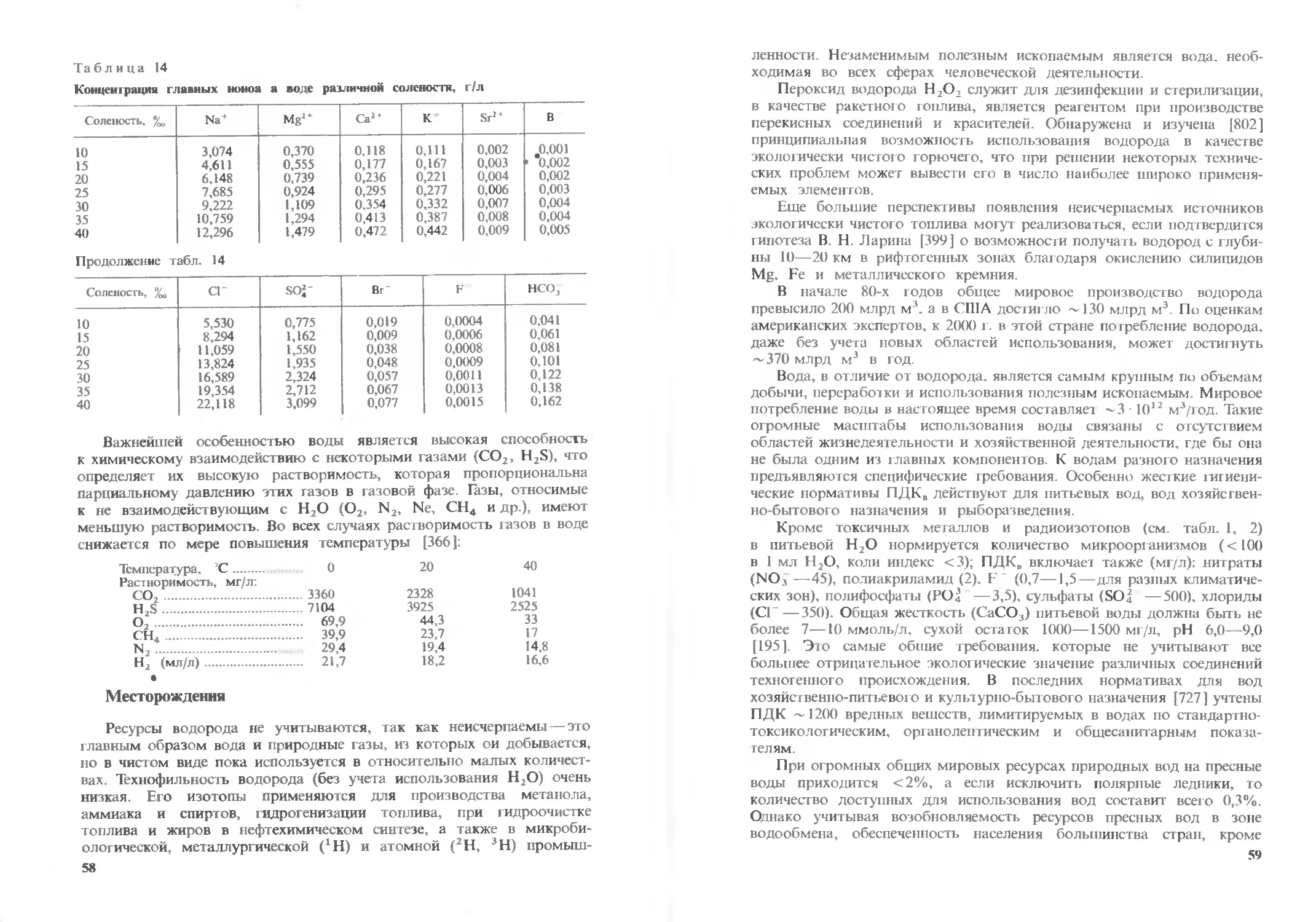
является первый, его вес составляет 90% для главных элементов и 98%
для микрокомпонентов [516].
36
Установлено, что представительность анализа а нередко снижается
по мере уменьшения содержания элемента в пробе; для приближенно
количественного анализа эта зависимость выражается следующим
образом: а = 0,07—0,12 1g С, % [516]. Ранее сходная зависимость была
показана Л. Аренсом для стандартов G-1 и W-1 В связи с этим,
в практике подсчета запасов редких элементов предельно допустимые
средние погрешности химического анализа (в % к содержанию
определяемого) при содержаниях 0,00«—0,000л % даже ГКЗ СССР
были приняты в 30—35%. Сопоставление результатов эмиссионного
спектрального анализа стандарта G-1, проведенного в различных
зарубежных лабораториях, показало следующие значения коэффициен-
тов вариации для отдельных элементов: Ва 15; Be 23; Cr—36; La — 64;
Mn —43; Mo—26; Nb —8,5; Pb —35; Sr—32; Sc—43; V—31; Y —27;
Zr — 24. В то же время погрешность единичных определений большин-
ства элементов этим анализом ниже; например, в лаборатории
ВСЕГЕИ она составила (%): W — 7; Мо, Си—10; Sn—4; Zn — 20. При
сопоставлении межлабораторных средних содержаний микрокомпонен-
тов в породах, полученных количественными методами, установлено,
что расхождение составило около 25%.
Важно подчеркнуть, что широкое внедрение межлабораторных
стандартных образцов и организация.метрологической службы значи-
тельно улучшают качество аналитической информации. Так, аттестация
данных количественных анализов одних и тех же лабораторий нашей
страны, проведенная с десятилетним перерывом, показала, что за
прошедшее время межлабораторные дисперсии снизились по главным
компонентам в 3,6 раза, а по микрокомпонентам—в 5,2 раза, причем для
первых оценки средних содержаний расходятся совсем мало (2,3%), а для
вторых более существенно (18%), независимо от методов анализа [516].
Таким образом, при прочих равных условиях более надежными
являются более поздние аналитические данные, причем зарубежные
лаборатории в целом примерно на 10—20 лет раньше перешли на
систему межлабораторных стандартов по сравнению с отечественными.
В 1950 г. X Файрбайрн (США) приготовил первые широкоизвестные
стандарты пород—гранита G-1 и базальта W-1. К 1965 г. они были
проанализированы в 105 лабораториях 22 стран* на 74 элемента.
В настоящее время в зарубежной практике используется около 200
геологических стандартов, в отечественной пока около 100 [422]. Для
улучшения качества аналитической службы в геологии в ВИМСе
разработана и внедрена система управления качеством аналитических
работ. В то же время для биогеохимических и природоохранных целей
такие системы еще отсутствуют, не создано разветвленной системы
стандартов [13].
Значительно улучшило качество аналитической информации широ-
кое внедрение инструментальных физико-химических методов анализа.
* С 1958 г. эти стандарты использовались и лабораториях ИМГРЭ при
анализе широкого круга редких элементов в породах.
37
Наибольшими аналитическими возможностями, наряду с традицион-
ными химическими и спектральными, для целей геохимии обладают
нейтронно-активационный, атомно-абсорбционный, индуктивно-плаз-
менный, рентгеноспектральный. Эти новые методы стали ведущими
в последние 25 лет, что видно из сопоставлений Р. Брукса (1975,
1983 гг.) в основном зарубежных литературных источников [650],
опубликованных в различных областях аналитической химии. Преиму-
щества этих методов—высокие экспрессность, чувствительность, до-
статочная воспроизводимость, доступность для специалистов-аналити-
ков обычной квалификации—буквально совершили переворот в анали-
тической химии, геохимии и биогеохимии. Вместе с тем, не снижается
значение аналитической информации, полученной традиционными
количественными химическими и физико-химическими методами при
специальном избранном изучении геохимии отдельных элементов или
их групп, выполненных в более ранний период (60—70 гг). Результаты
таких исследований также широко использованы в этой работе.
Вообще необходимо подчеркнуть, что более надежны при прочих
равных условиях работы специального гео- и биохимического назначе-
ния, выполненные соответствующими опытными специалистами. Дело
в том, что различно не только качество аналитических данных, но
и точность, например, геологической диагностики объектов анализа.
Так, специальное сопоставление качества петрографической диагности-
ки пород, выполненное в рамках международного проекта (Когеодата,
1977 г.), дало неутешительные результаты по большинству широко
распространенных типов пород. В среднем каждая из 23 зашифрован-
ных одноименных пород получала от 6—7 до 12 петрографически
различных названий, причем правильное определение дали всего
20—35% исследователей и только гранит правильно назвали 94%.
Учитывая все сказанное относительно качества аналитической,
геологической и другой специальной информации, еще раз отметим,
что принятое в повседневной практике сравнение содержаний ком-
понентов в однотипных объектах должно делаться с тщательным
отбором и большой осторожностью. Это сильно затрудняет решение
главной из поставленных задач—сопоставление данных по геохимиче-
ской и биогеохимической распространенности элементов в различных
природных образованиях.
Не менее важной проблемой любого геохимического исследования
и надежности сопоставлений является рациональная математическая
обработка данных [64, 67, 656, 830].
Основные параметры распределения элементов в различных природ-
ных образованиях — оценки средних содержаний элементов д- разного
уровня—для разных объектов и элементов имеют различный уровень
приближения. Имеющийся аналитический материал еще не всегда
достаточен для вывода надежных генеральных оценок средних содержа-
ний. Истинное содержание изученного элемента в исследуемом объекте
при зкогеохимических исследованиях всегда остается неизвестным и во
всех случаях приходится иметь дело с приближенными его оценками.
38
Известно, что наиболее вероятна та оценка содержания, которая
получена с учетом: 1) правил отбора образцов, обеспечивающих
представительность проб, 2) возможностей методов анализа; 3) требо-
ваний статистической обработки результатов. Каждому из этих
вопросов посвящена специальная литература, приведем только самые
краткие ее комментарии. Рекомендации по пробоотбору и правильной
первичной обработке проб и результатов анализа содержатся в рабо-
тах В В. Ляховича (1963 г ), Д. М Шоу (1969 г.), О. Д. Риверс,
Р. Р. Брукс [650], С. В. Лонцих, Л. Л. Петрова [422], в Инструкции по
геохимическим методам поисков рудных месторождений [307] и дру-
гих, а для руд—в соответствующих инструкциях ГКЗ
В геохимической практике обычно выбирается 5%-ный уровень
значимости оценок (/=1,96) и уровень погрешности среднего арифме-
тического + 20%, в связи с чем необходимое число проб и составляет:
л=(/,/ё/100Х) = 0,01у2. Дисперсия содержаний большинства элементов
для однородных- объектов обычно невелика и выражается коэффициен-
том вариации v~30—60%, в связи с чем даже для максимального
v достаточно (0,01 -60 2 = 36) относительно небольшое число проб.
Для получения наиболее вероятных параметров распределения
элементов необходимо пользоваться самыми действенными и просты-
ми математическими моделями и методами. В качестве модели
характера распределения значений признака в объекте, наиболее
удовлетворяющей всему изучаемому их множеству, условно принято
нормальное распределение*, для которого наиболее точной оценкой
среднего содержания является среднее арифметическое. Выбор среднего
арифметического в качестве универсальной оценки математического
ожидания вызван тем, что она является наиболее вероятной среди всех
других, лишена систематической ошибки и имеет наименьшую диспер-
сию [67, 516]. Кроме того, даже для однотипных объектов раз-
нородность имеющейся аналитической информации как по методам ее
получения, так и по совокупности процессов, обусловивших распре-
деление элементов (т. е. неоднородность выборок), делает выяснение
моделей распределения вообще излишним. То же справедливо для
выборок малого объема, с которыми в большинстве случаев имеют
дело исследователи геохимии пород и минералов.
Наряду с этим многие исследова гели (Б. Л. Ван дер Варден,
1960 г., В В. Богацкий, 1962 г., Л. И. Четвериков, 1963 г. и др.)
отмечали, что увеличение объема проб, в которых производится
определение элемента, приближает распределение его содержаний
к нормальному с одновременным уменьшением дисперсии [656],
что также свидетельствует о целесообразности в геохимии применения
нормального распределения.
В настоящей работе изучение параметров распределения элементов
в выборках малого объема проводилось по формулам, приведенным
* Известно, что нормальное распределение особенно типично для элемен-
тов с кларками от и-10 до 0,00 л % в породах и рудах.
39
в работах Л. Н. Большева, Н. В. Смирнова [64] и В. Н. Бондаренко,
Р. И. Когана, П. Г. Чолакяна [67]. Для выборок самого малого
объема (и<10) стандартное отклонение х определялось по рекоменду-
емым наилучшим линейным оценкам среднеквадратичного отклонения
[67], а для выборок малого объема (и= 10 — 20) дисперсия содержаний
подсчитывалась по формуле
s2
где d„—табличное значение [64]. Доверительный интервал оценки
среднего определялся так:
±х=4^-
Для получения наиболее эффективной оценки среднего содержания
в условиях неопределенного распределения, при сопоставлении данных
различных исследований, когда имеются сведения о среднем разбросе
содержаний и количестве анализов, предложена оценка среднего
содержания, которая является наиболее правдоподобной [656]. Она
подсчитывается по формуле
" л.х,
е=ч4-
для выборок, которые признаны однородными по критерию х2 [656].
Этот метод позволяет с наименьшей затратой времени получить оценки
средних содержаний элементов обладающие наибольшей точностью из
всех возможных оценок для данной совокупности анализов, несмотря
на то, что используются данные различных исследователей, полученные
при различных методах опробования и анализа.
При сопоставлении частных оценок средних содержаний с генераль-
ными Q их отличие считается значимым, если х + Х.„ больше или
меньше Q: если Q<(x — ХД то среднее содержание элемента существен-
но выше, а если 6>(л + Х.а), то существенно ниже.
В работе использованы различные единицы измерения содержаний
элементов, принятые в гео-, биохимических, экологических и, других
работах. Для твердых и жидких сред геохимики обычно пользуются
при высоких концентрациях элементов—процентами по массе, иног-
да— по объему или атомными, а при низких содержаниях (обычно
<0,01%) применяют г/т. Сопоставление разных систем приведено
ниже 1 г/т=1 10 4% = 1 млн-1= 1 ррт=1 мкг/г=1 у/г=1 10 6 =
= 1000 млрд ~1 — 1000 мг/т = 1 мкг/мл = 1 мг/л = 1000 мкг/л = 1000 нг/г =
= 1000 нг/мл -1 000000 пг/г; выбор т;ого или другого обозначения
нередко В' ..раткостью написания размерности, например:
40
10000 I т = 1 %
1000 г/т = 0,1% = 1000 мг/л=10"3
100 г'т = 0,01%
10 г/т = 0,001 %
1 г'т = 0,0001% = 1 мг л=10“6
0,1 г/т = 0,00001 %
0,01 г/т = 0,000001 %
0,001 г/т = 0,0000001%= 1 мкг/л=10’9
Для отражения содержания веществ в воздухе используются дт
обозначения: mi,'m3 и млн-1 (10 4%), переход между которыми (дл
нормальных Put) можно производить с достаточной надежностью п«
М
формуле 1 мг/м3=^24 млн \ где М—молекулярная масса вещества
[130].
Основные обозначения радиоактивности [634]: Бк (беккереЛ1
единица активности нуклида — один распад в 1 с (единица/
входящая в СИ,— Ки — кюри; 1 Ки = 3,7 Ю10 Бк); Зв (зиверт)—едини-
ца дозы ионизирующего излучения (1 бэр = 0,01 Зв).
41
ГЕОХИМИЧЕСКИЕ И ЭКОЛОГИЧЕСКИЕ
ОСОБЕННОСТИ «ЭЛЕМЕНТОВ
Элементы «-электронного строения характеризуются энергетической
выгодностью участия в реакциях ионизации «-электронов и относятся
к непереходным элементам, свойства которых с увеличением атомных
номеров контрастно изменяются по горизонтальным периодам перио-
дической системы и проявляют гораздо большее сходство в вертикаль-
ных группах. Элементы «- и р-электронной конфигурации отличаются
от d- и /- не только структурой электронной плотности атомов, но
и фундаментальными физико-химическими свойствами. Элементы
«-блока по сравнению с остальными характеризуются гораздо мень-
шими величинами энергии образования изолированных атомов, мень-
шими термическими и энергетическими показателями для соответству-
ющих периодов и групп, меньшей энергией металлической связи
в атомах и большей ионностью связи в соединениях. Все эти свойства
являются определяющими в общей i еолого-геохимической миграции
элементов.
Для всех «-элементов типичны металлические свойства. Эти
элементы в целом наиболее сходны с p-элементами (см. рис. 1).
Преимущественное изменение свойств «- и р-злементов по горизонтали
и более постепенное в пределах вертикальных групп определяет
периодичность их свойств, что видно на рис. 2. На графике Мейера —
Ферсмана показаны величины атомных объемов элементов, с ко-
торыми коррелируются закономерности образования эндогенных
концентраций элементов и состав геолого-геохимических групп ме-
сторождений полезных ископаемых.
По горизонтали в пределах периодов коренным образом изменяют-
ся кислотно-основные свойства элементов: от щелочных — катионов
в левой части до ангидридов и кислотных компонентов—анионов—в
правой. Наилучшим образом для «- и p-элементов это видно при
сопоставлении силовых (/—потенциал ионизации) и размерных
(г,—эффективный ионный радиус) характеристик элементов (рис. 5).
Ранее для этих целей пользовались обратной величиной — ионными
потенциалами—отношением валентности (заряда) к ионному радиусу.
Использование уг"+ (см. рис. 5) позволило показать, что кислотные
свойства одного и того же элемента в соединениях возрастают
с уменьшением координационного числа [205].
Наряду с общими чертами (непереходные элементы) «- и р-
злементы характеризуются существенными различиями. Все «-элементы
имеют сферические структуры электронной плотности, отвечающие
минимальным энергетическим показателям, а р-элементы—структуры
в виде простой гантели, с более высокими энергиями атомных орбит
(однако более низкими, чем у d- и /-элементов). С этим связаны
существенные химические отличия «- и р-элементов.
42
Рис. 5. Зависимость между потенциалом ионизации /„ и эффективным ионным
радиусом г"+ для полновалентных катионов s- и р- элементов [205]
К 5-элементам принадлежат щелочные и щелочноземельные метал-
лы подгрупп IA и ПА (см. рис. 1)*. К щелочным металлам подгруппы
IA относятся Li, Na, К. Rb, Cs, Fr. Здесь же расположен Н, который по
свойствам принципиально отличается от щелочных металлов и больше
сходен с р-элементами (F, С1 и др.). Характерно, что для s-металлов не
типично общее правило — снижение распространенности в земной коре
с увеличением атомного номера в пределах группы, и Li и Вс резко
уступают по распространенности Na и Mg. Среди s-элементов
А. А. Годовиков выделяет две подгруппы: s'—с предвнешними кай-
носимметричными электронами—Li, Be, Na, Mg, s"— остальные
некайносимметричные элементы.
Щелочные металлы, особенно К, Rb, Cs, Fr, обладают наибольшим
групповым сходством но сравнению с элементами любой другой
менделеевской группы. Они характеризуются минимальными значени-
ями плотностей атомов, потенциалов ионизации, электроотрицатель-
ности и термических показателей среди металлов и наибольшими
размерами (объемами) атомов (см. рис. 2, 5). Li и Na, в отличие от К,
Rb, Cs, Fr, дают кайносиммстричные Kai ионы и имеют несколько
более высокие термические и энергетические показатели и меньшие
размерные, приближаясь в этом отношении к щелочноземельным
металлам II группы. Щелочные металлы в процессах кристаллизацион-
ной дифференциации относятся к несовместимым элементам. Особенно
* s-элсмент Не рассмотрен вместе с остальными благородными газами.
43
это типично для К, Rb, Cs, коэффициенты распределения Л*р которых
в ультрабазит-базитовых расплавах для главных минералов <0,01—
0,001. для гранитоидных 0,5—0,01 и только для флогопита и биотита
>1 [15, 675, 793]. По данным И. Татсуми, Cs, Rb, К. обладают
наибольшей способностью среди редких металлов переходить в вод-
ный флюид и обогащать расплавы в зонах субдукции при гидратации
океанической плиты В экологическом отношении 5-элементы подгруп-
пы IA относятся к биологически очень важным (особенно Н, К, Na),
а по вредности стабильные атомы и их соединения—к токсичным
и общетоксичным (см. рис. 1, табл. 1 и 2). Li и, возможно, остальные
щелочные г металлы характеризуются наибольшим коэффициентом
гидроэкофильности. Для всех щелочных металлов отмечается мак-
симальная величина всасывания в организм из желудочно-кишечного
тракта [512].
В экогеохимической классификации элементов по масштабам
воздействия на окружающую среду все 5-элементы отнесены к I груп-
пе—глобального значения. Они являются основой минерального
состава пород литосферы и солевой составляющей гидросферы.
Одновременно они представляют существенную часть аэрозолей
(особенно океанических). Важной групповой особенностью следует
считать глобальное и региональное техногенное экологическое действие
радионуклидов 5-элементов. Токсичность их от очень высокой до
средней (см. табл. 1, 2, 7).
Щелочноземельные 5-металлы — Be, Mg, Са, Sr, Ba, Ra (ИА
подгруппа—см. рис. 1) значительно отличаются от щелочных. Они
имеют меньшие размерные показатели и гораздо более высокие
энергетические, термические и плотностные, более прочные связи
в металлах, большее число труднорастворимых соединений и прин-
ципиальную разницу между самым легким Вс, отчасти Mg (5'-
элементы) и остальными представителями этой группы элементов. Все
металлы данной подгруппы характеризуются повышенной токсично-
стью, особенно Be., Ba, Sr, Ra (см. табл. 1, 2) и одновременно являются
важными биологически, особенно Са (см. рис. 1). Кроме того, Be имеет
высокий коэффициент гидро- и атмоэкофильности.
Щелочные и щелочноземельные элементы в природных условиях
моновалентны; их валентность соответствует групповому номеру (+1
для IA и +2 для ПА). Они относятся к наименее устойчивым в водной
среде, что видно из электрохимического ряда напряжений:
Li — пе —3,04 s-Li+ Cs -3,01 s-Cs + К — 2 92 5-К + Са -2,87 5-Са2 + Na -2,71 j-Na + Mg -2,37 5-Mg24
AI Мп Zn Cr Fe
—пе — 1,66 -1,18 -0,76 -0,74 -0,44
р-А13 + J-Mn2 + <AZn2 + J-Cr3 + J-Fe2+
При этом интенсивность миграции щелочных метачлов выше, чем
щелочноземельных.
44
ВОДОРОД —1
Главный элемент солнечной галактики (Солнце—4 1010 атомов
при Si 110 6), распространенный в земной коре (кларк 0,11%),
возможно, в ядре и особенно в гидро- [857], биосфере [198] и биосе
[726] (кларки 10,80, 4,5 и 10,50% соответственно); неметалл, основной
жизненно необходимый, токсичный элемент. Для пероксида Н2О2
ПДКрэ 0,3 мг'м3, ПДКВ 87 мг/л (25 мг/л—рыбохозяйственный), для
циановодорода (синильная кислота—HCN) ПДКР, 0,3 мг/м3, ПДК’С
0,01 мг/м3, ПДК„ 0,1 мг/л (1 класс); для водорода бромистого,
мышьяковистого, фосфористого, фтористого, хлористого ПДКр, соот-
ветственно 2, 0,1, 0,1, 0,05, 5 мг/м3 [231]; для хлоридводорода ПДКСС
и ПДКмр 0,2 М1,м3; нормированы тысячи углеводородных соединений
[130, 727]. Водород является 1лавной составляющей основного
минерального подвижного компонента Земли—воды Н2О, занима-
ющей 75% ее поверхности.
Атом
Атом (1л' ) самый легкий (всего один 5-электрон) среди элементов.
Состоит из двух стабильных изотопов: ’Н—протий и 2Н—дейтерий
(D), имеющих наибольшую разницу масс среди всех элементов —
D/H = (158 + 2) 10 ~6; искусственный тяжелый нуклид 3Н — тритий Т*
(Г1/2= 12,3 года), превращающийся в 3Не [785]. Соотношение атомов
(1Н2Н):3П = (99,9852:0,0148) :4 10 15.
Водород имеет наибольшие вариации изотопного состава—до 70%
в земных образцах. Для испаряющегося оксида водорода—воды —
увеличивается содержание D, а также 18О ( + 8D), для океанической
воды 8 л 0, в атмосферном водяном паре над океанами значения
8 отрицательные ( —8D) и далее уменьшаются с выпадением осадков.
8D и 8,8О используются для определения солености морской воды
и палеотемператур земной поверхности; последняя составляла ( С):
3,4 млрд лет назад — 70; 1,3 млрд лет — 52; в PZ 34-»20; триасе 35—40;
третичном периоде ~17. В ювенильных водах 8D меньше, чем
в метеорных, в метеоритах 8D близко к 0%„, что используется для
выявления (вместе с 818О) генезиса рассолов, пород и руд [785].
Водород расположен в 1-м периоде таблицы Менделеева в I или
VII группе**. В поверхностных условиях Земли имеет жидкое или
твердое (Н2О) и газообразное (обычно в виде молекул Н2) состояние;
среди газов наиболее легко проходит через самые мелкие поры
металлов и других элементов, особенно при высоких температурах.
* Содержание Т (в %): в атмосфере 4-1015, в осадках З Ю'18,
в поверхностной океанической воде 1 10 . До 1954 г. содержание Т на Земле
оценивалось в 12 кг, к 1958 г. оно удвоилось за счет ядерных испытаний [574].
Обладает мягким P-излучением. ПДК (Бк/л): ПДК „,0,0005, в воздухе санитар-
но-защитных зон 5,4; населенных пунктов 0,18; ПДКвп81 (27].
** По химическим свойствам Н более сходен с />-элементами VII группы.
45
Наиболее теплопроводный из всех газов. В большинстве соединений,
как и щелочные металлы, имеет валентность +1, иногда — I (гидриды,
галогены и др.). В отличие от щелочных металлов I группы обладает
кислотными свойствами. Образует воду с О2 с выделением тепла
(143,3 МДж/кг при 25 °C и 0,1 МПа), при />550 С со взрывом,
а также соединения с С1 и F. Восстанавливает металлы из их оксидов,
растворим в Н2О (18 г/л при 25 °C), одновременно все металлы (от
U до Си) с отрицательными электродными потенциалами вытесняют
водород из разбавленных кислот, анионы которых не проявляют
окислительных свойств.
В природе в основном находится в виде соединений: оксида
водорода — воды Н2О, гидроксила ОН, аммиака NH3, аммония NH4,
сероводорода H2S, кислот (НС1 и др.), метана СН4 и прочих
органически^ соединений (С2Н4, НСНО, СН3ОН и др.), а также
радикалов НО2 и НО, пероксида Н2О2, галогенов и гидридов многих
металлов. Во флюидных системах Н является главным и аномально
наиболее подвижным компонентом, перемещаясь вверх даже в замкну-
тых системах. Он создает водородный фронт (потоки), особенно
в нижних частях коры и мантии за счет дегазации возможного
водородно-металлического гидридного ядра [397, 398]. Геохимически
к Н наиболее близки S, Cl, F и 3/7-металлы (рис. 6).
В газообразном (флюидном) состоянии водород образует устойчи-
вые атомарные группировки с различными элементами, с чем связано
их поведение в эндогенных процессах. По М. И. Новгородовой, для
двухатомных молекул теоретический ряд снижения сродства (от
наиболее устойчивых соединений в начале ряда и к отсутствию
взаимодействия в конце), выведенный по величинам энергий диссоци-
аций, таков: Cl, S, Р, С, Pt. Se, As, Si, Au, Ir, Ti, Те, Ni, V, Al, Pd, Sb,
Cr, W, Rh, Os, Co, Re, Cu, Ru, Fe, Sn, Bi, In, Mn, Pb, Ca, Zn, Cd, Hg,
благородные газы [532]. Подробно относительное сродство элементов
к водороду и взаимодействие его с О2, С и другими проанализированы
А А. Маракушевым [457].
Самым устойчивым соединением водорода в обычных услови-
ях земной поверхности и самым крупным по потреблению
(>3000 км ’/год) среди минеральных соединений является вода (Н2О).
Она содержит по формуле 11,19% Н и 88,81% О, количество которых
в природе всегда ниже (на 1—3%) за счет примесей. Свойства воды
весьма многообразны, зависят от температуры, давления, состава
примесей и особенностей взаимодействия с породами, газами, биосом
(и т. д.) и, несмотря на многочисленные исследования, недоизучены.
Большое значение имеют уникальные и аномальные свойства воды:
самые высокие среди известных веществ теплоемкость (кроме NH3),
теплота плавления (кроме NH3), тепловое расширение, поверхностное
натяжение, растворяющая способность, диэлектрическая проницае-
мость, что определяет высочайшую способность к теппопереносу,
теплорегуляции систем, термостатированию, обусловливает большин-
ство химических реакций и биологических явлений [802].
46
Энергия диссоциации (КДж/моль)
Рис. 6. Разделение металлов по величинам их химического сродства к водороду
и кислороду, определяемому по энергиям диссоциации двухатомных молекул:
Металлы с высоким сродством: I—к водороду относительно сродства к кислороду, II—к
кислороду относительно сродства к водороду
Геологи больше знакомы с различными свойствами природных
вод [247] и воды в гидротермальных растворах [135]. По А. М. Ма-
саловичу, Л. Н. Овчинникову, они связаны с полиморфизмом Н2О,
дискретным изменением ее структуры и плотности в определенных
«температурных точках», а также количества разрушенных водородных
связей. Это определяет дискретный (стадийный волновой) характер
47
минералообразования и кислотность—щелочность растворов В этих
особых точках потенциальная кислотность переходит в активную
(например, NaHCO3 + HClr±NaCl + CO2 + Н2О), а затем снова в по-
тенциальную и так далее до новой особой точки. Эмпирические
значения этих переходов, зафиксированные в статистических ма-
ксимумах образования минералов, выявлены для температур ~400,
350, 270, 160 и 70 С [540].
По А. М Блох, природные глубинные воды имеют диссипативную
структуру (ионная система с молекулами воды), способны растворять
очень высокие количества металлов (в г,'л: Na2O 400 FeO до 360,
Rb2O5 5,6, Nb2O5 0,6, U 0,56) и неметаллов (F 520 г/л и т. д.) По
мнению А А. Маракушева [457], по отношению к силикатным
расплавам вода может рассматриваться в одном ряду со щелочными
металлами (К2О...Н20) и основными летучими (NH3 и др.), сильно
влияя на кислый магматизм и являясь индифферентной к ультраоснов-
ным и щелочным магмам.
Общий баланс Н2О в геосферах Земли, по X. Холленд [803], таков
(и 1021 г): гидросфера 1400; кора 600; биосфера 1,6; атмосфера <0,2.
Баланс Н2О в гидросфере, по М. И. Львовичу [430], следующий (1021 г
и %): океаны и моря 1420 и 86,48; озера и реки 0,5 и 0,03, лед 22 и 1,33;
атмосфера 0,013 и <0,01; стратисфера 201 и 12,16.
В I еоэкологическом плане природная вода представляет сложную
систему, гигиенические свойства которой в химическом отношении -
зависят от содержания примесных компонентов. Суммарный фоновый
показатель гидроэкофильности близок к 1, т. е. к пределу. При этом
каждый элемент вносит свой вклад и по данному значению изученные
в отношении ПДК„ элементы образуют следующий ряд снижения
насыщенности ими речной воды (ГЭФГ): Li, Al?, Mg, Fe, Mn, Cu, Se.
Be, As, Sr, Ti, Pb, Tl, Ba, Cr и т. д. В кислых водах накапливаются
растворимые формы катионогенных элементов, в щелочных—ани-
оногенных [577].
Минералого-геохимическая формула Н для шдогенных объектов
верхней земной коры 099Со,5мо.2 (оксифильный), для верхней мантии
Л97С2Х! (литофильный). В то же время большое количество Н перено-
сится в виде серных, углеродных и других соединений; ему свойственна
повышенная халькофильность, и особенно гидро- и био-, а также
атмофильность и др.
В метеоритах Н накапливается (%) только в углистых хондритах —
х=1,23; С1 = 2,21, СП=1,43, (^111 = 0,23; в обыкновенных хондритах
х = 0,02, в том числе Н = 0,023, L = 0,03, LL = 0,011; в энстатитовых 0,038
(Е5 6). Содержание Н2О (при Н2О Н2<1) в породах Луны составляет
0,01—0,1%, т е. гораздо меньше, чем на Земле [107], а по данным
«Аполлона-11»—в среднем 0,55%.
Для Земли кларки Н следующие (г/т): литосфера 900, пиролитовый
слой 780, кристаллический фундамент 1400, осадочный слой 1400 [898].
По А. А. Ярошевскому [725], содержание в верхней части континен-
тальной коры 1600 г/т.
48
По А. П. Виноградову, содержание Н2О (%): гидро- и атмосфера
97,0; осадочные породы 5,0, изверженные 0,6, мантия 0,5 [107].
Континентальная кора содержит Н 1,46%, континентальная осадочная
оболочка 3,0%, то же океаническая 4,9% [725].
По А. И. Перельману [574], вернады Н для литосферы 1, гидросферы
71, живого вещества 70, углей 20—33, горючих сланцев—5, нефти 73.
В настоящее время, по мнению С. Р. Крайнова и В. М Швец [366],
наблюдается прогрессирующее увеличение содержания свободного
Н2 в подземных водах верхних юризонтов земной коры. Фоновое
содержание его оценивается примерно в п 10“5 мл/л на контакте
с атмосферой и п—100л мл/л на более глубоких горизонтах. Чаще
всего высокие концентрации отмечаются в районах с повышенным
содержанием органического вещества (угольные, газовые районы),
а также в промышленных районах (до 20 мл/л).
Основным естественным источником Н является деятельность
микроорганизмов. Главное значение имеют анаэробные микроорганиз-
мы. Максимальное количество Н2 (от 15 до 54%) выделяется при
взаимодействии их с глюкозой Выделяется Н2 и при анаэробном
микробиологическом окислении сульфидной серы и т. д.
В космических лучах (к. л.), по И. Н. Толпыгину с соавторами,
главное значение имеет *Н — протий, количество которого по сравнению
с 8О, принятым за 1, составляет в солнечных к. л. 4600, в галактических
к. л. 685; на третьем месте после 8 О идет 6 С (соответственно 0,5 и 1,8),
затем 7N (~0,2 и 0,8), 12Mg 6 — 0,18 и 0,32), 10Ne (-0,16 и 0,30), 14Si (0,13
и 0,12), 26Fe ( — 0,15 и 0,14), а также 3Li (? и 0,3), 5Ве (0,02 и 0,8) и т. д.
' Водороду придается все большая роль в общей эволюции Земли.
Основываясь на работах В. Н. Ларина [397, 398], предложившего
и обосновавшего «гидридную модель Земли», можно считать, что
Н был одним из главных виновников «глобальных катастроф». Он
считается главным «флюидом» в самый ранний, докислородный
период (>4 млрд лет) и мог явиться разрушителем озонового слоя по
реакции Н2 +О3-*Н2О + О2 в более поздние эры [738].
По Ф. А. Летникову [409, 410], история Н глубинного земного
происхождения также менялась. От AR1 к AR2 и PR в общем
происходило увеличение доли Н в Н„С„-флюидах и повышение
степени окисленности флюидов. Для астеносферного слоя наибольшие
количества Н-флюида типичны для рифейских и более молодых плит.
Противопоставляются С- и Н-флюидные системы. Последние характе-
ризуются высокой активностью Н2О и широким развитием водосодер-
жащих минералов—амфиболов, слюд и т. д. Эти структуры кон-
тролируют размещение зон гранитизации, амфиболитизации, ос-
люденения и других метасоматитов и обладают рассеянным
характером рудной минерализации.
Характер дегазапии Н претерпел изменения в истории Земли [399].
От AR к Ph все более локализовывалась, а следовательно, увеличива-
лась мощность флюидных потоков при одновременном увеличении их
протяженности. Количество поступающего Н прямо зависит от
4 2138 49
геотектонической активности Земли; оно максимально при раскрытии
рифтогенных зон или при столкновениях с крупными космическими
телами. Одновременно с нарушением озонового слоя и проникновени-
ем в биосферу Земли мощного потока космической радиации
существенное влияние на жизненные условия на Земле могла оказывать
вода, которая формировалась при водородной «продувке» озонового,
слоя и количество которой за миллионы лет было весьма значитель-
ным. По некоторым оценкам [738] по этому механизму за 1 млн лет
образовывалось количество воды, способное поднять уровень мирово-
го океана примерно на 20 м. На этапах интенсивной дегазации
Н2 происходил резкий разогрев внутренних частей Земли, сменяющий-
ся охлаждением в связи с расширением дегазированной сферы ядра.
Возможно, что это, наряду с внешними причинами, влияло на
глобальные изменения биосферной температуры, имеющие многоуров-
невый цикличный характер.
Все больше появляется косвенных данных, свидетельствующих
о максимальной обогащенности водородом ядра Земли. Впервые на
такую возможность обратил внимание В. И. Вернадский, позднее зто
было обосновано с геолого-геохимических [397, 410] и петрографо-
металлогенических позиций [398].
Большое значение придается водородным флюидам для развитая
геотектонических и металлогенических [398, 410] процессов.
Основные глобальные природные объемы Н2О, годовой баланс
и активность водообмена показаны, по данным М. И. Львовича [430],
в табл. 9. Важно, что величина годового баланса максимальна для Н2О
атмосферы, как и активность водообмена (9 дней). Имеется несколько
рангов циклов (круговоротов) Н2О, сбалансированных в природе:
океан—речной сток, суша—атмосфера и т. д.
Таблица 9
Динамика природного водообмена
Часть гидросферы Объем, 103 км3 Баланс, тыс. км3/год Активность водообмена, лет
Океан 1 370000 452 3000
Подземные воды 60000 12 5000*
в том числе зоны активного водо- 4000 12 300 ••
обмена
Полярные ’ ледники 24000 3 8000
Поверхностные воды суши 280 40 7
Реки * 1.2 40 0,03
Почвенная влага 80 80 1
Пары атмосферы 14 525 0,027
• С учетом подземного стока в океан без рек—4200 лет.
•• То же—280 лет
50
Большое значение океанической НгО для рудообразования выявля-
ется в процессе рециклинга и выщелачивания рудных компонентов из
базитов океанического дна, а также придается флюидному перерас-
пределению рудного вещества в рудообразовании [546]. Но главное
значение для геоэкологии имеют быстрое истощение запасов чистых
питьевых и вообще пресных вод и огромные масштабы потребления
вод для техногенных целей. Если недавно было справедливым
выражение «Вода—это жизнь», то теперь надо добавлять — и источ-
ник экологической опасности.
Минералы
Водород стоит на втором месте {вслед за кислородом) по числу
содержащих его в качестве минералообразующего элемента минералов
верхней части Земли—на 1990 г. их было более 1800*, в том числе
550 силикатов, 288 гидрофосфатов, 211 гидросульфатов, 213 гидроар-
сенатов, 189 гидроксидов, 87 гидрокарбонатов, 81 гидроборат и борат,
48 гидрохлоридов, 28 органических минералов, 26 оксидов, 14 теллури-
тов, 11 гидрофторидов, 10 арсенатов, 8 молибдатов, по 7 селенатов
и нитратов, 5 сульфатов, 4 хромата, по 3 фосфата и йодата, по
2 оксихлорида, фторида и сульфида, 1 сульфат, хлорид, и нитрид.
Огромная и многообразная роль водорода в минералогии подчеркива-
ется тем, что примерно половина известных природных неорганических
соединений и все органические содержат его в качестве необходимого
элемента. Самым же главным минералом водорода, но В. И. Вернад-
скому, является HzO. Огромна также роль природных органических
соединений [304]. Некоторые исследова i ели считают, что в верхней
мантии широко распространены гидриды различных металлов, кото-
рые, по мнению В Н. Ларина, не устойчивы в условиях низких
давлений и температур, а в определенных условиях глубоководных
океанических бассейнов и материковых зон образуются твердые
газогидратные скопления.
В минералах водород (Н2О) находится в свободном и связанном
состоянии, входя в состав многих гидратированных минералов (гид-
росиликаты, кремнезем гидратированный и т. д.) в виде (ОН) “, реже Н+.
Кристаллохимические функции Н2О и ОН подробно изучены [628], тогда
как роль Н+ —протона начала познаваться недавно. Ю. А. Пятенко
[627—630] рассматривает Н+ как один из катионов, который обладает
уникально малым размером и координационными числами (1, 2).
Показано, что Н+ определяет возможность существования ультраагпа-
итовых соединений (уссингит, литосит и др.), замещая К+ и Na + . Протон
проявляет подвижность в кристаллических постройках. Осцилляция его
* Без учета гидридов и других его соединений, которые могут быть
распространены во внутренних частях Земли (410], а также сотен разновид-
ностей вод, которые В. И. Вернадский и его последователи относят к жидким
Минералам водорода и кислорода.
4* 51
известна для льда и предполагается Ю. А. Пятенко для других минера-
лов, в которых он выступает в роли компенсатора валентности
и стабилизатора структуры при изоморфизме.
Кроме «формульного» в минералах установлен газообразный водо-
род. По данным М М. Элинсон и В. Д Сазонова, среди газов, обнару-
женных в минералах, высокие его относительные концентрации (в % от
суммы компонентов газа) выявлены в кварце (~43), гранате (23), мень-
шие—в сфалерите (~5—12), галените (~ 12), барите (7), кальците (4).
Вода является самым распространенным и весьма подвижным
минералом, ее свойства и состав взаимосвязаны и сильно изменчивы
в зависимости от конкретных геологических и физико-химических
условий. Природная вода представляет собой наиболее сложную
многокомпонентную систему, в состав которой входят различные
минеральные вещества, газы, а также коллоидные и крупнодисперсные
взвешенные частицы, в том числе микроорганизмы. Вода, как
отмечалось, обладает аномальными физическими свойствами: плавле-
ние льда (при атмосферном давлении) сопровождается уменьшением
объема на 9%, при этом почти вдвое возрастает теплоемкость СР,
которая затем в интервале 0—100 С почти не зависит от температу-
ры, вязкость воды с ростом давления падает. Благодаря высоким
значениям Ср, Д/7пл, ДТ/ясп вода является регулятором климата
и стабилизирует температуру на поверхности Земли [796].
По изотопному составу выделяется девять разновидностей НгО (на
1Нг1бО приходится 99,73%); по величине минерализации (солености 5,
г/л) различаются четыре типа: пресные 0,5солоноватые 1 —10,
соленые 10—50, рассолы 50 - > 150. Соленость воды (г/л, кор-
релируется с показателем хлорности—по формуле М Кнудсена
5=0,03+1,80500. Анионный состав вод океана в среднем таков (мг/л):
СГ 19 353, SO1 2700, НСОз 143, СО Г 70, Вг‘ 66, F 1, НзВгз 26;
для других водоемов—морей (Черное, Каспийское), озер (Байкал,
Онежское, Женевское, Мичиган) и рек (СНГ н другие страны,
15 объектов) он следующий [796, 705]:
СГ soj- НСО3
моря 5710—9630 1310—3010 80—200
озера 0,8—2,7 1,3—40,5 20,4—59,2
реки 3,1 — 159 3.6—199 13,9—108
Соотношение главных анионов и катионов положено в основу
гидрохимических классификаций вод. Наиболее полная геохимическая
систематика природных вод разработана Л. С. Балашовым (табл. 10).
Различаются воды чистого (А) и смешанного (Б) профиля. По
анионному составу выделены типы, по катионному — подтипы, по
соотношению катионов—классы вод. Общее представление о генераль-
ном среднем содержании химических элементов в составе поверхност-
ных природных вод дает табл. 11, по С. Тейлор [749 ]
и А. П. Виноградову [726], а подземных—-табл. 12, по А. И. Пе-
рельману [578, 579] и табл. 13, по П. Брюеру, Д. Спенсеру [726].
52
Таблица 10
Химическая классификация природных вод чистого профили
Tku Подтип Класс1 Критерий класса
I. НСО3 a) HCOj-Na 1. HCOj-Ca-Na3* Na>Ca>Mg
НСОз >90% ЭК. 2. НСОз-Mg-Na 3. HCOj-Na* Na > Mg > Ca Na >90% эк.
б) НСОз-Са 4. HCOj-Na-Ca 5. HCOj-Mg-Ca 6. НСОз-Са Ca>Na>Mg Ca>Mg>Na Ca > 90% эк.
в) НСОз-Mg 7. HCOj-Na-Mg 8. НСОз-Са-Mg 9. НСОз-Mg Mg> Na >Ca Mg>Ca>Na Mg>90% эк.
II. СО3 a) COj-Na 1 СОз-Na Na >90% эк.
СО3>50% эк. б) СОз-Са 2. СОз-Mg-Ca2* Ca>Mg>Na
III. SO4 a) SO4-Na 1. SO4-Ca-Na* Na>Ca>Mg
SO4^90% эк. 2. SO4-Mg-Na2* 3. SO4-Fe-Na2* 4 SO4-NH4-Na2* 5. SO4-Na Na>Mg>Ca Na > Fe > др. Na>NH4> др. Na >90% эк.
б) SO4-Na-Ca 6 SO4-Na-Ca 7 SO4-Mg-Ca* 8. SO4-Fe-Ca 9. SO4-Al-Ca 10. SO4-H-Ca2* Ca > Na > др. Ca>Mg> др. Ca > Fe > др. Ca > Al > др. Ca > H > др.
в) SO4-Mg 11. SO4-Na-Mg Mg>Na>Ca
г) SO4-Fe 12. SO„-Ca-Fe 13. SO4-Mg-Fc 14. SO4-Al-Fe 15. SO4-H-Fe4‘ 16. SO4-Fe Fe > Ca > др. Fe>Mg> др. Fe>Al> др. Fe>H> др. Fe>90% эк.
д) so4-ai 17. SO„-Ca-Al* 18. SO4-Mg-AI 19. SO4-Fe-Al 20. SO4-NH4-AI2* 21. SO4-H-A1* 22. SO4-A1 Al > Ca > др. Al>Mg> др. Al>Fe> др. A1>NH4> др. Al > H > др. Al >85% эк.
е) SO4-Zn 23. SO4-Al-Zn Zn > Al > др.
ж) SO4-NH4 24. SO4-Na-NH42* 25. SO4-Ca-NH42* 26. SO4-Fe-NH42* 27. SO4-NH4 я Я В £ .0 z 4 " Л Л Л-? z и л л л л Z Z ZZ
з) SO4-H 28. SO4-Na-H2* 29. SO4-Ca-H4* 30. SO4-Fe-H2*'4* 31. SO4-A1-H2' H>Na> др. Н>Са> др. H>Fe> др. Н>А1> др.
iv. ci a) Cl-Na 1. Cl-Ca Na'3* Na > Са > др.
Cl >90% эк 2. Cl-K-Na"-3* 3. Cl-Mg-Na 4. Cl-Na' Na>K> др. Na>Mg> др. Na^95% эк.
б) С1-Са 5. Cl-Na-Ca3*-4’ 6. Cl-Mg-Ca 7. Cl-Ca3*4* Са > Na > Mg Ca>Mg> др. Са>85% эк.
в) Cl-Mg 8. Cl-Na-Mg Mg>Na>Ca
53
Продолжение табл. 10
Тйп Подтип Класс1 Критерий класса
/ г) Cl-Fe Д) С1-Н 9. Cl-Ca-Mg 10. Cl-K-Mg 11. Cl-Mg 12. Cl-Fe 13. Cl-H Mg>Ca> др. Mg>K> др. Mg >85% эк. Fe>95% эк. H>95% эк.
V. F F> др. a) F-Na 1. F-Al-Na3' Na>Al> др.
’ Классы: * в которых имеются также термальные воды; 2" известны только
термальные воды; 3" известны в жидких включениях минералов; “’ обнаружены в конден-
сатах горячих и перегретых вод.
Таблица 11
Состав природных поверхностных вод, %
Элемент Речная вода Океаническая вода lgr* ig*;-**
Li 3-10~7 1,7-10"® 6,4 -2,1
Be 1 -10~’ 2-Ю"11 1,8 -7,2
В 1- 10“б 4,5-10"“ 7,2 -0,52
F 1-10-7 1,3-10"“ 5,9 —
Na 6,3-10-“ 1,08 8,3 -0,43
Mg 4,1-10-“ 1,29 -10"1 7,7 -1,0
Al 5-Ю-® 8-10-8 0,85 -8,0
Si 6,5-10-“ 2,8-10-“ 3,9 -5,0
P 2-Ю-® 7,1 IO"6 4,6 —
S 3,7-10-“ 9,0 IO'2 8,7 —
Cl 7,8-10"“ 1,95 8,8 —
к 2,3-10"“ 3,99 10"2 7,1 -1,8
Ca 1,5 Ю"3 4.13-10-2 6,1 -1,9
Sc 4-1O"10 6,7 JO-10 1,4 -7,3
Ti ЗЮ-7 9,6-10" 8 2,2 <-6,5
V 9 - IO-8 1,2-10"7 3,9 -4,7
Cr 1 -10~7 2-10"8 3,2 -5,2
Mn 7-10-7 ЗЮ"8 1,5 -6,3
Fe 4-10"® 6-10"’ -0,16 -8,9
Co 1-10"8 2-IO"10 1,3 -6,7
Ni ЗЮ’8 5-IO"8 3,2 -4,6
Cu 7-10"7 3-10"8 3,0 -4,9
Zn 2-10"7 4-IO"8 3,1 -5,2
Ga 9-10“’ 2- 10"’ 2,9 -5,9
Ge 5-1O-10 5 - IO"10 3,3 -5,5
As 2-10"7 1,7 -10"7 5,0 -2,9
Se 6-IO"8 1,3 IO"8 5,8 -2,6
Br 210-® 6.7-10-3 8,9 —
Rb 1-10-7 1,2 - IO"5 5,9 -3,0
Sr 7- 10"® 7,6-10"“ 6,7 -1,7
Y 4-10"8 7-IO"10 2,1 -6,5
Zr — ЗЮ-9 2,2 -6,8
Nb — 5- IO"10 <2,4 <-6,7
Продолжение табл. 11
Элемент Речная вода Океаническая вода lgr* IgA:;"**
Mo б-Ю-8 1,1 10"® 5,5 -2,1
Ag ЗЮ"8 2,7-IO'5 4,3 -4,3
Cd 1 ю-’ 8-IO-’ 4,9 -3,1
In — 1-Ю-*1 3,0 -5,7
Sn 4-10"’ 5-Ю-*1 2,1 -7,0
Sb 710"’ 1,5-10~8 5,1 -3,1
I 7-Ю"7 5,6-10-® «6,6
Cs 2-10"’ 2,9 • IO-’ 4,6 -4,1
Ba 2-10"® 1,4 10"® 3,7 -4,8
La 4,8-10"’ 4,5-10"*° 1,9 -6,8
Ce 7,9-10" 8 3,5-10-*° 1,5 -7,3
Pr 7,3-IO"10 1,о-ю-*0 1,9 -6,9
Nd Sm 3,8-Ю"8 7,8-10"10 4,2-10-*° 8,0-10'11 1,9 1,9 -6,8 -6,8
Eu 1,5-10"10 1,5-10"** 1,8 -6,8 -6,6
Gd 8,5-10"10 1,0-IQ-*0 2,0
Tb Dy 1,2 IO-10 7,2-10"10 1,7-Ю-*1 1,1 10"*® 2,0 2,0 -5,5 -6,5
Ho 1,4-10"*° 2,8-10“10 2,1 — 6.5
Er 4,2 -10-10 9,2-10"10 2,2 Illi Os OS OS OS (
Tm 5,1 -Ю"10 1,3- ю-*1 2,3
Yb Lu 3,6 - ю-10 6,4-10"*° 9,0-IO-11 1,4 Ю-*1 2,3 2,3
Hf — 7- Ю"10 <3,1 <-5,9
Ta —— 2,5 - Ю"10 <3,3 <-5,9
W 3-10"’ 1 -Ю"8 4,9 -4’3
Re —— 4-10-*° 6,5 — 2 1
Au 2-Ю"10 4,9-10"*° 6,2 -2,6
Hg TI 7-10"’ 1 Ю"10 1-10"’ 3,9 3,8 -4,9
Pb 1 Ю'7 2 - Ю"10 1,7 -7,0
Bi —— 2- Ю"’ 4,4 -3,8
Th <1 • Ю’8 6-ю-*0 0,53 -8,3
U 4 10’ 3,1 -Ю"7 6,0 -3,0
Rn — 6- ю~2°
Ra 1 10"**
Ac — 1-10-3°
Pa — 5 - Ю"15 — —
Шчп .Лт“орость “лиментации (г/год): терригенного материала 1,73-10”, карбоната
’ кРемнсзема 0,172-101 . Масса океана (без шельфовых вод) 1,3 -10" г.
• Коэффициент распределения между морской водой и верхней континентальной
<0рои.
Наиболее стабилен состав океанической (морской) воды, а измен-
подземных материковых вод. Минимальной минерализацией
характеризуются атмосферные осадки, не загрязненные техногенными
веществами. В целом по главным компонентам океанические (1)
и материковые (2) воды отличаются наиболее значительно: 1)
Na+ >Mg2+ >.Са2+; СГ>8О2~>НСОз-; 2) Mg2+<Na +<Са2 + -
Cl~<SOi" сНСОз .
54
55
Таблица 12
Средний химический сослав подземных вод зоны гипергсиеза районов разных ландшафтов
№ п/п Компо- нент * Тропики, суб- тропики Мерзлота много- летняя Умерен- ный климат Гор- ные районы Зоны выщела- чивания Области конти- ненталь- ного за- соления Зона ги- пергенеза в целом
1 pH 6,40 6,68 6.82 7,11 6,75 7,50 6,92
2 нсог 96,5 98,8 212 120 132 344 174
3 SO* 8,87 5,88 14,7 19,3 11,9 328 75,1
4 сг 10,6 5,58 10,9 6,13 8,30 202 47
5 NOj 1,87 0,61 1,43 2,76 1.67 10,4 3,41
6 F 0,42 0,19 0,37 0,29 0,32 0,97 0,45
7 no2 0,07 0,03 0,08 — 0,06 0,50 0,14
8 Na+ 13,9 9,46 23,8 9,85 13,9 172 45,5
9 Са2' 16,6 20,8 37,3 29,8 26,1 115 43.9
10 Mg2 + 8,07 6,36 10,5 8,54 8,37 59,4 18,6
11 К* 2,25 1.15 3,04 1,20 1,94 15,2 4,59
12 Nil* 0,06 0,79 0,44 0,37 0,42 1,11 0,56
13 SiO2 21,9 9,63 14,3 15,2 15,3 26,0 17,4
14 Fe 302 290 759 559 482 825 547
15 Al 225 300 247 304 289 317 279
16 Sr 54,4 23,8 245 109 108 493 185
17 Br — 50 206 100 101 509 183
18 Mn 40,1 15,1 42,0 29,7 31,7 120 49,4
19 P 71,6 24,1 68,2 80,0 61,0 43,4 57,5
20 В 37,7 10,0 45,2 20,1 28,2 95,8 41.8
21 Zn 37,6 27,4 25,2 14.4 28.0 57,6 34.0
22 Ba 7,8 9,55 16,7 14,1 12,0 50,1 19,6
23 I 12,0 0,75 9,39 2,0 6,02 56.5 16,1
24 Li 2,2 5,03 16,4 16,03 7,41 40,3 14,0
25 Ti 3,30 3,99 12.0 8 63 6,98 25,4 10,7
26 Cu 5,02 2,34 4,85 6,83 4,78 8,88 5,58
27 CO2 (св.) 63,1 12,4 20 8,11 25,9 26,3 26,0
28 Copr (нел.) 0,5 0,1 0,8 0,16 0,62 0,43 0,58
• Содержание компонентов № 2—13 и 17—28 даны в мг,л. остальных —в мкг/л.
Содержания компонентов в конкретных случаях зависят от
генетического и химического типа вод, их класса, /, pH, Eh и других
факторов. Наиболее четкая прямая корреляция установлена для
содержания главных компонентов и солености вод, что видно, по
данным Дж. Рейли, Г. Скирроу, из табл. 14. Во многих подземных
природных водах содержатся высокие концентрации токсичных метал-
лов. Например, по С. В. Крайнову, В. М. Швец [366], в углекислых
56
подземных водах содержания некоторых элементов достигают (мг/л):
Li 320; Rb 100; Cs 20; В 1200; As 120; Sb 20; Ge 0,2; Hg 0,2; F 1000;
в рассолах глубоких структур: Fe2+ 1475; Fe3+ 25; Al 0,05; Mn 800; Cu
8,3; Zn 20; Pb 9; Cd 1; Tl 0,9; Co 0,2; F 15; в кислых водах сульфидных
месторождений: Fe2+ 12 923; Fe3 + 3984; Al 1092; Mn 24; Cu 1920; Zn
0,3; Pb 0,1; Co 0,08; F 1,4; в щелочных водах глубоких горизонтов
Ловозерского массива редкометальных нефелиновых сиенитов: А1 1000;
Си 0,93; Zn 0,55; Ti 1,5; Nb 0,40; Y 0,03; Yb 0,003; La 0,45; Ce 0,42; Cl
75; F 12500; SiO2 13 000; Na + K 24260.
Та б л и ц a 13
Химический состав подземных вод в районах развития
магматических и метаморфических пород, мг/л*
Компо- ненты Граниты Граноди- ориты Сиениты не- фелиновые Гранито- гнейсы Граниты и метамор- фические сланцы
pH 5,5—7,3 6,5 7,4 10,4 5,5—7,2 6^5~ 6,7
нсо3 6—129 19,4 19,4 33—96 110
65 66
SO? 6,5—11 4,7 12,5 0,7 0—6 2,8 4,8
Cl 3—22 6 5,1 5,5 4,2—6,8 5,3 7,3
SiO2 8—58 12,4 4,0 10—22 17,4
20 12
Na 0,5—37 11 6 7.9** 8,3—15*’ 10,6 9,4 *•
Ca 0.8 30 35,4 0,5 0,7—20 23
9 12,2
Mg 0,1 — 18 5,4 0,47 0,15—5,3 6,2
4 2,8
к 0,5—4,2 Т.б" 1,4 — — —
0,03—0,2 0,07 0,03—0,42 0,62
0,08 0,3
Al 0,007—0,12 0.04 ~~ — 0,29 0,007—0,13 0,04 0,86
* Здесь и далее в таблицах (если специально не отмечено) в числителе—предельные
значения, в знаменателе—среднее содержание и число анализов (в скобках).
57
Таблица 14
Концентрация главных ноноа а воде различной солености, г/л
Соленость, %,, Na+ Mg2" Ca2" К Sr2" в
10 3,074 0,370 0,118 0,111 0,002 .0,001
15 4,611 0,555 0,177 0,167 0,003 • 0,002
20 6,148 0,739 0,236 0,221 0,004 0,002
25 7,685 0,924 0,295 0,277 0,006 0,003
30 9,222 1,109 0,354 0,332 0,007 0,004
35 10,759 1,294 0,413 0,387 0,008 0,004
40 12,296 1,479 0,472 0,442 0,009 0,005
Продолжение табл. 14
Соленость, СГ SO( Вг F нсо;
10 5,530 0,775 0,019 0,0004 0,041
15 8,294 1,162 0,009 0,0006 0,061
20 11,059 1,550 0,038 0,0008 0,081
25 13,824 1,935 0,048 0,0009 0,101
30 16,589 2,324 0,057 0,0011 0,122
35 19,354 2,712 0,067 0,0013 0,138
40 22,118 3,099 0,077 0,0015 0,162
Важнейшей особенностью воды является высокая способность
к химическому взаимодействию с некоторыми газами (СО2, H2S), что
определяет их высокую растворимость, которая пропорциональна
парциальному давлению этих газов в газовой фазе. Газы, относимые
к не взаимодействующим с Н2О (О2, N2, Ne, СН4 и др.), имеют
меньшую растворимость. Во всех случаях растворимость газов в воде
снижается по мере повышения температуры [366]:
Температура, ’С....
Растворимость, мг/л:
СО2..............
H2S..............
О2...............
сн4 .............
N2...............
Н2 (мл/л)........
0 20 40
. 3360 2328 1041
. 7104 3925 2525
69,9 443 33
39,9 23,7 17
29,4 19,4 14,8
. 21,7 18,2 16,6
Месторождения
Ресурсы водорода не учитываются, так как неисчерпаемы — это
главным образом вода и природные газы, из которых ои добывается,
но в чистом виде пока используется в относительно малых количест-
вах. Технофильность водорода (без учета использования Н2О) очень
низкая. Его изотопы применяются для производства метанола,
аммиака и спиртов, гидрогенизации топлива, при гидроочистке
топлива и жиров в нефтехимическом синтезе, а также в микроби-
ологической, металлургической (1Н) и атомной (2Н, 3Н) промыш-
58
ленности. Незаменимым полезным ископаемым является вода, необ-
ходимая во всех сферах человеческой деятельности.
Пероксид водорода Н2О, служит для дезинфекции и стерилизации,
в качестве ракетного топлива, является реагентом при производстве
перекисных соединений и красителей. Обнаружена и изучена [802]
принципиальная возможность использования водорода в качестве
экологически чистого горючего, что при решении некоторых техниче-
ских проблем может вывести его в число наиболее широко применя-
емых элементов.
Еще большие перспективы появления неисчерпаемых источников
экологически чистого топлива могут реализоваться, если подтвердится
гипотеза В. Н. Ларина [399] о возможности получать водород с глуби-
ны 10—20 км в рифтогенных зонах благодаря окислению силицидов
Mg, Fe и металлического кремния.
В начале 80-х годов общее мировое производство водорода
превысило 200 млрд м3. а в США достигло ~ 130 млрд м3. По оценкам
американских экспертов, к 2()(Х) г. в этой стране потребление водорода,
даже без учета новых областей использования, может достигнуть
~370 млрд м3 в год.
Вода, в отличие от водорода, является самым крупным по объемам
добычи, переработки и использования полезным ископаемым. Мировое
потребление воды в настоящее время составляет ~3 • 1()12 м3/год. Такие
огромные масштабы использования воды связаны с отсутствием
областей жизнедеятельности и хозяйственной деятельности, где бы она
не была одним из главных компонентов. К водам разного назначения
предъявляются специфические гребования. Особенно жесткие гигиени-
ческие нормативы ПДКВ действуют для питьевых вод, вод хозяйсгвен-
но-бытового назначения и рыборазведения.
Кроме токсичных металлов и радиоизотопов (см. табл. 1, 2)
в питьевой Н2О нормируется количество микроорганизмов (<100
в 1 мл Н2О, коли индекс <3); ПДКВ включает также (мг/л): нитраты
(NO, —45), полиакриламид (2). F" (0,7—1,5—для разных климатиче-
ских зон), полифосфаты (РО4 —3,5), сульфаты (SO 1 —500), хлориды
(СГ — 350). Общая жесткость (СаСО3) питьевой воды должна быть не
более 7—10 ммоль/л, сухой остаток 1000—1500 мг/л, pH 6,0—9,0
[195]. Это самые общие требования, которые не учитывают все
большее отрицательное экологические значение различных соединений
техногенного происхождения. В последних нормативах для вод
хозяйственно-питьевого и культурно-бытового назначения [727] учтены
ПДК ~ 1200 вредных веществ, лимитируемых в водах по стандартно-
токсикологическим, органолептическим и общесанитарным показа-
телям.
При огромных общих мировых ресурсах природных вод на пресные
воды приходится <2%, а если исключить полярные ледники, то
количество доступных для использования вод составит всего 0,3%.
Однако учитывая возобновляемость ресурсов пресных вод в зоне
водообмена, обеспеченность населения большинства стран, кроме
59
европейских, вполне достаточна. По И. М. Львовичу [430], годовая
обеспеченность на душу населения в 1979 г. составляла (в тыс. м3/год):
в СССР 16,6, Западной Европе 4,8, Азии 5,4, Африке 9,3, Северной
Америке 17,3, Южной Америке 25,6, Австралии 7,1.
Несмотря на высокую общую потенциальную обеспеченность
России и стран СНГ водными ресурсами, огромный среднегодовой
речной сток ( — 4700 км3) и в среднем значительное водопотребление
(—1тыс. м3 в год на человека), быстрый вывод вод как самого
уязвимого компонента окружающей среды в результате хозяйственной
деятельности не вселяет надежд на благоприятное развитие проблемы
водоснабжения [722, 537, 528 ]. Среди природных факторов неблагопри-
ятным для нашей страны является неравномерноеть распределения
речного стока по территории. Средняя удельная обеспеченность стоком
для нашей страны и сопредельных стран составляет 213 тыс. м3 на
1 км2 при максимальной в Грузии (877), Таджикистане (667), Латвии
(501) и минимальной в Туркменистане (145), Центрально-Черноземном
районе (125), Казахстане (46). Дефицит водных ресурсов особенно
ощутим в бассейнах рек Средней Азии и Казахстана, Днепра, Дона,
Кубани, Урала, Тобола, Ишима, Томи, Чулыма. Особенный урон
природному распределению водных ресурсов нанесло гидротехническое
строительство 50—70-х годов.
В 1988 г. из водных объектов СССР, включая моря, было забрано
—365 км3 воды (промышленность — 112. сельское хозяйство —223,
коммунальное хозяйство —24, прочие отрасли —6 км3). Использовано,
по данным Госкомприроды [722], 286 км3 свежей воды (в том числе на
производственные нужды —99,5%—без водопотребления для поддер-
жания пластового давления и рыбоводства), из них па хозяйственно-
питьевые пели —26,4, регулярное орошение 140, сел1>скохозяйственное
водоснабжение 9,6, на прочие нужды 11 км3. Общие потери составили
— 51 км3, безвозвратно изъято для промышленных целей в 1988 г.
— 182 км3, причем —61% общего водозабора пришлось на сельское
хозяйство.
Все более сложной становится проблема сохранения качества вод,
которое быстро ухудшается. Даже по официальным данным [722],
которые составлены по сильно заниженным отраслевым данным,
общий сброс совершенно неочищенных сточных вод в 1988 г. составил
в СССР 28 км3. Если учесть, что единица сточных вод выводит из
строя —13 единиц чистых, го поступление такого количества неочи-
щенных сточных вод вывело из разряда кондиционных —364 км3 вод,
что равно годовому забору.
В бывшем СССР в общем балансе маломинерализованпых вод
хозяйственно-питьевого назначения —70% приходилось на подземные
воды, что составляло всею —10% от учтенных запасов пресных
подземных вод. Всего у нас за год отбирается —30 км3 подземных вод,
из которых почти 20 км3 расходуется на водоснабжение. Все чаще
в процессе эксплуатации месторождения кондиционных вод превраща-
ются в некондиционные как из-за наличия в пределах месторождений
6(1
изначально некондиционных вод, так и в результате антропогенного
влияния. Последний фактор особенно усиливается в последнее время
и требует заблаговременного предупреждения и регулирования качест-
ва вод [366 ].
Месторождения маломинерачизованных вод, используемые для
водоснабжения, делятся на несколько геолого-гидрогеологических
типов. По Л. С. Язвину, Б. В. Боревскому (1977 г.), более 60% запасов
приходится на месторождения двух типов: 1) речных долин; 2) артези-
анских бассейнов платформ; более 38% — на месторождения; 3) кону-
сов выноса предгорных шлейфов и межгорных впадин; 4) структур или
массивов трещиноватых и трещинно-карстовых пород и зон тектониче-
ских нарушений; 5) артезианских бассейнов складчатых областей.
Месторождения 1-го типа связаны с современными или древними
речными руслами и их состав в высокой степени зависит от состава
поверхностных вод. В естественных условиях состав поверхностных
вод гидрокарбонатный (НСОз) с высоким Eh (за исключением
северных гумидных районов); в промышленных районах, а также при
водозаборе воды чаш о теряют кондиционность за счет снижения Eh,
увеличения содержаний Fe, Мп, органических веществ и т. д.
Месторождения 2-го типа наиболее устойчивы по качеству, но их
состав тесно связан с геохимическими особенностями территорий,
особенно в отношении Sr, F, Mn, Fe, Se, Li, что проявляется прежде
всего при интенсивном водозаборе. Негативное значение имеют
процессы перетекания загрязненных вод из выше- и нижележащих
горизонтов. В этих месторождениях и артезианских бассейнах других
типов (краевых прогибов, горно-складчатых областей) наблюдается
вертикальная зональность.
Месторождения 3-го типа (предгорных и межгорных районов)
особенно типичны для аридных зон и тесно связаны с фильтрующими-
ся водами оросительных систем. При продвижении подземных вод
в сторону предгорной зоны происходит увеличение минерализации от
и -100 мг'л до и -10 г/л в верхних горизонтах. Характерна обратная
вертикальная зональность. Подземным водам кор выветривания
массивов аридной зоны свойственна особенно высокая минерализация
(Sor, Cl-, Sr, F). В случае нахождения в районах месторождений вод
сульфидных проявлений, а также горно-обогатигельных предприятий
воды легко обогащаются Fe, Zn, Си, Pb, As, Mo, W, Cd, Ni, Co, Se
и др., а при наличии повышенных концентраций в породах редких
элементов—такими сильнейшими токсикантами, как Be, TI, Li,
F и др., а также элементами-гидролизатами — Al, Ti, V, Ga и др.
Повышенной минерализацией (до 10 г/л), накоплением F, Fe, Мп,
высокой щелочностью (pH до 9) и сульфатным, хлоридным, гидрокар-
бонатным и карбонатным составом отличаются месторождения под-
земных вод в зонах многолетней мерзлоты. Пресные воды в песчаных
массивах пустынь и полупустынь обычно тесно связаны с солонова-
тыми и солеными, обычно имеют высокое качество, но могут быстро
терять его за счет перетекания. Воды межморенных отложений
61
отличаются тем, что могут накапливать особенно значительные
количества нитратов (до 100 мт л и более) при интенсивной сельскохо-
зяйственной деятельности (Беларусь).
Более ограничены запасы известных месторождений минеральных
лечебных вод. Среди них Г. В. Куликов и др. [389] выделяют
месторождения с дебитом источников и скважин от 0,1 до 50 л/с
и несколько типов по различным признакам (табл. 15). Для минераль-
ных вод разработаны ПДКВ (ГОСТ 13273—88); максимальные
содержания нормируемых компонентов таковы (мг/л): As 1,5—2; РЬ
0,1; Se 0,05; Sr 25; F 10—15; Cl6+ 0,5; Hg2+ 0,02; U 1,8; NO2“ 2; фенолы
0,001; другие органические вещества (на Сорг) 10—15' Ra 18,5 Бк/л.
Важной инжеперно-гидроэкологической проблемой является обвод-
ненность месторождений полезных ископаемых. По данным
Г. Н. Каменского, П. П. Климентова, А. М. Овчинникова и других
исследователей, первым фактором, определяющим состав таких вод,
является общая гидрохимическая зональность конкретного участка.
В верхней зоне это обычно пресные гидрокарбонатные воды, в сред-
ней—сульфа гно-натриево-кальциевые или гидрокарбонатно-натриевые,
переходящие в хлоридно-гидрокарбоиатно-натриевые, в глубинной
(> 1 км)—высокоминерализованные хлоридно-кальциево-нат риевые.
Сформулированы типичные гидрогеологические характеристики раз-
личных классов минерального сырья. Месторождения нефти и газа
сопровождаются высококонцентрированными сероводородными и йо-
до-бромными (Cl/Вг 300) водами хлоридно-кальциево-натриевого
(бессульфатные) или гидрокарбонатно-на гриевого состава, обогащен-
ные I, Вг, Ra, В, NH4, V, Ni, Со, Re, нафтеновыми кислотами,
метаном, тяжелыми углеводородами и др. На соляных месторождени-
ях присутствуют соленые воды и рассолы хлоридно-натриевого состава
(в кровле сульфатно-кальциевые), содержащие повышенные количества
Na, К, Mg, Fe, В, Вг, Sr, метана, азота, кислорода; С1/Вг>300. На
сульфидных месторождениях воды мышьяковые, железистые, купорос-
ные, сульфатные кальниево-магниевые, магниевые с pH <6, с избыточ-
ными концентрациями Fe, Al, Cu, Ni, Zn, As, Co, Pb, N, О, CO2 и др.
В настоящее время для водоснабжения используется почти ис-
ключительно жидкая вода, находящаяся на поверхности Земли или
около нее (атмосферные осадки). Для питьевой волы ГЭ может быть
принята за 1. В среднем на одного человека из этих источников сейчас
в мире приходится 30 тыс. л ресурсов пресной воды в сутки.
Фактически же расходуется населением в зависимости от культурно-
бытовых потребностей (л/сут): >1000 в Нью-Йорке, >500 в Париже,
>260 в Лондоне, ~ 100 в Москве, всего до .3 жителями африканских
засушливых зон.
Основное количество пресной воды (>80%) расходуется для
трригации в сельском хозяйстве (в засушливом климате на 1 т зерна
расходуется ~ 1000 м3 Н2О) и в различных отраслях промышленности
(на 1 г стали ~120м3 Н2О). Пока все эти потребности с трудом, но
покрывались имеющимися ресурсами. Однако при современных темпах
62
63
увеличения поступления ядовитых сточных вод, которые загрязняют
в 13 раз больший объем чистой воды, к 1995—2000 г. ожидается
загрязнение и вывод из прямого потребления всех легко доступных вод
земной поверхности [135]. Положение можно исправить за счет более
глубокой очистки сточных вод и использования альтернативных
источников пресной воды. К таким крупным источникам могут быть
отнесены опресненные морские—океанические воды. Путем испари-
тельного опреснения на энергии АЭС ежегодно с 1968 г. получают
~ 100 тыс. м3/сут воды для г. Шевченко (Казахстан), >250 тыс. м3/
сут—в Кувейте, что полностью обеспечивает потребности. В конце
80-х годов общая мировая производительность опреснительных устано-
вок составила 40 млн м3 'сут, на 2000 i. предполагалось получить
~ 1300 млн м3/сут. Совершенствование этого способа позволило Кувей-
ту снизить стоимость 1 т пресной Н2О до 10 центов (вместо 2 дол.
в 50-х годах и 36 центов в 70-х). Для сравнения: стоимость природной
пресной воды в США в 70-х годах составляла 0,05 дол/м3 [802].
Разработаны и другие методы опреснения соленых вод.
Еще одним крупномасштабным источником пресной воды являют-
ся ледники. Общая масса только антарктических плавучих ледников
~5,2 1014т—почти в 300 раз больше, чем количество воды во всех
реках мира. Разработанный во Франции для Саудовской Аравии
проект по транспортировке айсберга с последующим использованием
его в качестве источника пресной воды предполагал себестоимость
1 м3 Н2О 50—60 центов [135].
Кроме воды, особенно высокие концентрации водорода характерны
для каустобиолитов, особенно для горючих газов (до 85—90% СН„,
соответственно до 22,5% Н2). Для нефтей содержание водорода
обычно колеблется от 9,5 до 14,5% (на сырую массу; х=10,9); для
твердого минерального топлива оно составляет (%): горючие сланцы
6—10; древесина 6,23; торф 5—6,5 (х = 6,28); лигнин 5,24; уголь —
бурый 4,5—6,5, битуминозный 5,55, каменный 3,5—6,3, антрацит
1,3—3,0 (х = 2,81); сапропель 0,75 [574, 726].
Подробно состав природных газов нефтяных и газовых месторож-
дений СССР и зарубежных стран рассмотрен В. И. Ермаковым и др.
[151]. В. И. Старосельский, использовав для классификации газов
содержание одного из основных компонентов—этана, составил обо-
бщенную классификацию. Кондиционными для переработки в качестве
газохимического сырья являются А2, А3 и А4, в которых его
содержание 3% и более. По соотношению метана М и его гомологов
газ газовых залежей имеет индекс М^! (Т—тяжелые углеводороды),
газоконденсатных и газонефтяных — М4Т2 и М3Т2, нефтяных — М3Т3,
М2Т4, М(Т4 При более полной характеристике используется и состав
неуглеводородных компонентов (N2, СО2, Н2). По содержанию
углеводородных компонентов (в %) газы делятся на метановые
(М 90—100; этана—Э до 3; Т до 5); этановые (Э 6—9; Т 10—30);
пропан-бутановые (Т>30; Э>9) и др. Этановые и этан-бутановые
типичны для газоконденсатных и нефтегазоконденсатных залежей,
64
а пропан-бутановые—для нефтяных залежей. По химической сис-
тематике кроме углеводородных (СН4>50%), азотных (N2>50%),
углекислых (СО, >50%) выделяются водородные (Н2>50%) тазы,
которые делятся на подтипы — водородный (Н2>75%) и водородно-
азотный (Н2>50%) [151].
Водород — идеальный источник энергии будущего. Теплота сгора-
ния Н2 (1,17 ГДж/Ki) почти втрое выше, чем у нефти, и вчетверо, чем
у каменного угля, а при ст орании выделяется только дистиллированная
вода. По прогнозам первые промышленные установки по получению
энергетического водорода из воды будут созданы к концу нашего
столетия. Пока же он потребляется в других отраслях в количестве
>200 млрд м3/год (80-е годы), в основном при производстве аммиака
(43 млрд м3 год), метанола (17), переработки нефги (37), металлургии
(14), синтетического топлива (17 млрд м3/год). В 1983 г. в США
использовано 128 млрд м3 Н2, прогноз на 2000 г.— 368 млрд м3.
Рассматривая водородные и водные минеральные ресурсы, необ-
ходимо кратко остановиться па проблеме морских месторождений
полезных ископаемых Конкретные сведения о месторождениях тех или
иных элементов, добываемых из тидросферы, приведены в соответству-
ющих разделах, здесь же ограничимся данными по общим ресурсам
минеральных веществ гидросферы. В ранних работах отмечалась
неисчерпаемость вод мирового океана для прямого получения mhoi их
химических элементов [471 ]. Выдвигались проекты получения золота,
урана и других ценных металлов и соединений, но опытные работы
установили большие энергетические и прочие затраты и технологичес-
кие трудности. Только в Японии, вероятно, удалось наладить
получение урана из морской воды [135], но эти данные засекречены.
В настоящее время непосредственно из морской воды экономически
доступно получать только некоторые соли (Са, Мо, Na, К), галогены,
редкие щелочные металлы и серу, используя для этих целей в основном
их природные концентрации в Н2О—рапы, рассолы, термы и т. д.
[135]. Вместе с гем, прежние проекты промышленного получения
наиболее распространенных элементов морской воды [471 ] в перспек-
тиве moiут найти свое воплощение, особенно для Cl, Na, Mg, S, Са, К,
Вт, С, Sr, В, Si, F.
Океаническая вода может также служить основным источником для
получения свободного водорода, дейгерия и трития.
Друт ими минеральными ресурсами, которые образуют собственные
месторождения в гидросфере, являются нефть, тазы, в том числе
газогидраты и различные металлы. Несмотря па короткое время
изучения (по сравнению с континентальными) океанических акваторий
на сегодняшний день уже открыто большое число месторождений.
Например, запасы метана в виде кристаллогидратов в пределах
океанического ложа оцениваются примерно в 106 трлн м3, в пределах
материковою склона и подножья — в 103 200 трлн м3, в пределах
шельфа—3900 трлн м3 [471]. На шельфах морей и океанов уже
выявлено около 2000 месторождений нефти и газа с общими запасами
5 2138 65
~40 млрд т нефги и 20 трлн м3 газа. С 1960 по 1980 г за рубежом
добыча морской нефти возросла в 15 раз, тогда как материковой
только в 2,5 раза [135].
На дне океанических акваторий обнаружены огромные запасы
Fe-Mn конкреций, превышающие (Mn, Со, Ni. Т1, Те и др.) известные
запасы па суше, а также фосфоритовые конкреции, запасы которых
оценивались в 70-х годах в М0пт [471]. Все большее значение
приобретают металлоносные подводные и ты (NaCl, Zn, Си, Au, Ag,
Pb, Cd и др.) морских и океанических впадин, а также рудные корки,
близкие по составу к Fe-Mn конкрециям, и массивные руды Си —
Zn — Аи—Ag состава, связанные с подводным вулканизмом.
Крупными запасами Zr, Ti, TR и ряда других полезных ископаемых
(Sn, Au, алмазы и др.) обладают прибрежно-морские и другие россыпи;
выявлены залежи строительных материалов (песок, 1равий, ракушечник
и I. д.), перспективна также добыча глауконита, тлин, известковистых,
кремнистых илов и др. [135]
Необходимо отметить, что водород вместе с С1 и S создает
восстановительную обстановку в глубинных зонах и способствует
концентрации металлов платиновой группы, Au, Ag, Си, Со, Ni, Hg, Cr
и др. [459].
11ороды
Кларки водорода в породах земной коры (%) впервые подсчитал
А. А. Беус [50]: ультрабазиты ?, базиты 0,12, средние породы 0,11,
гранодиориты 0,09, граниты 0,06, сланцы 0,40, песчаники 0,25,
карбонатные породы 0,09, что значите тьно отличается от более ранних
оценок А. П. Виноградова (%): основные породы 0,01, средние 0,02,
кислые 0,03. Позднее А. А. Беус [53] сумел отделить структурную,
связанную Н2О от гироскопической, которая в ранних стандартных
анализах пород составляла л%, и вывел оценки средних содержаний
для различных типов пород. Эндогенные породы характеризуются
следующими средними содержаниями Н2(%) и v: 1) интрузивные
перидотиты (28 регионов) 0,11 и 0,40; пироксеннты (35) 0,11 и 0.40;
габбро (45) 0,12 и 0,37; диориты (41) 0,11 и 0,40; кварцевые диориты
(25) 0,12 и 0,50; гранодиориты (30) 0,09 и 0,30; граниты (65) 0,058 и 0,10;
сиениты (40) 0,08 и 0,31; нефелиновые сиениты (48) 0,065 и 0,26;
2) эффузивные базальты платформ (25 регионов) 0,1; базальты
океанические (24 острова) 0,1; андезиты (54 региона) 0,11; дациты (31)
0,13; кислые эффузивы (50) 0,11; трахиты (28) 0,11; фонолиты 0,17.
Видно, что в интрузивной ветви содержание связанною Н2 снижается
оз основных и средних пород к кислым и щелочным, а в эффузивных
при близких содержаниях для пород различной кислотности соответст-
вующие по кислотности разности имеют несколько более высокие
оценки содержаний Н2. Это объясняется, вероятно, большей возможно-
стью потери Н2О из расплава в процессе кристаллизации интрузивных
гранитоидов. Содержание водорода и его соединений в эндо- и экзоген-
66
ных породах, I идро- и атмосфере зависит от физико-химических
условий их образования и подробно охарактеризовано в литературе
[37, 409, 410].
Для изверженных пород, по данным А. П. Виноградова,
Н. И. Хитарова, А. А. Кадика, А. А. Маракушева и др., считается, что
в недегазированных силикатных расплавах базальтового состава
содержание Н2О составляет 2—3% и не менее половины этого
количества удаляется в процессе кристаллизации и дегазации. Такое же
содержание принимается для гранитоидных пород и более низкое —
для ультрабазитов. Множество геологических и физико-химических
факторов определяют величину концентрации водорода в конкретных
массивах. Это и состав маз ма газируемого субстрата, особенности
тектонической обстановки, глубина становления магматических масс,
обводззенносзь вмешазощих пород, состав, температура и давление
системы и флзоидных фаз, особенности постмагма зической эволюции
магматитов, степень метаморфизма и т. д. Способность растворяться
в гранитоидных мазмах (возможный фактор снижения температуры их
кристаллизации) ззарастает в ряду H2S— НС1 - NH3 — Н2О — НЬ,
в этом же направлении снижается способность отделяться от расплавов
[455]. По И. Д. Рябчикову (1976 г.), главным летучим компонентом
кислых магм является Н2О, которая во многом определяет их
рудоносность зз детально изучезза, в том числе на изотопном уровне
[785 ]. Дейтерий (D) ювенильных вод (вероятно, с участием метеорных)
имеет диапазозз 5D от -50 до -85%,,.
Водородный (с гелием) флюид признан злавным энергомассоноси-
телем в процессе генеразхии магм. Для полной нейтрализации
О2 в силикатном веществе соотнозпение протонов ко всем атомам
системы должно составлять ~ 1: 1 при наиболее высоком его значении
в аномально текучих коматиитах, траппах, игнимбритах. Преобразова-
ние водородного флюида и экзотермические эффекты обеспечивают
термостатирование магмогенерируюгцих систем на температурных
эвтектических минимумах (базальтовом, андезитовом, гранитном).
Энерз овыделение при преобразовании водородного флюида составляет
(кДж/моль): Н+-Н° 1300; Н°->Н2 434,3; Н4+ОН > Н2О 192;
4Н2О > Н8О4 30,7 [236]. По Н. И. Хитарову, А А. Кадику и др.,
способность магм обогащаться соединениями водорода определяет их
рудообразующую способное зь.
Имеются данные по распределению в породах углеводородных
газов [151] Высокое содержание (см3/кг) газов обнаружено
И. А. Петерсилье во флогопитовых породах при самой высокой
концентрацизз свободного Н2 (99,93%) среди других газовых составля-
ющих; столь же значительная доля Н2 (от 85,8 до 96,6%) отмечается
для апатит-оливиновых, оливинитовых и пироксенитовых пород при
очень низкой общей конзгентрации газов (0,29—0,75 см3/кг), а также
для пироксенит-габбро-аноргозитовой ассоциаций (Н2 ~ 79%, га-
за ~ 0,8 см 3/кг). Низкие относительные содержания Н2 (от 3,6 до
11,57%) выявлены в ийолит-уртитах, хибинитах, фойяитах и апатит-
5* 67
нефелиновых породах Кольского полуострова при повышенном содер-
жании газов в первых трех (от ~17,4 до ~ 39,5 см’/кг), а также
в сходных породах Иллимаусакского массива в Гренландии (Н2 от 5 до
12,6%, газа от ~6 до ~60 см’,'кг). Высокое относительное содержание
Н2 (51%) установлено Н С Бескровным в породах вулканических
трубок взрыва. Содержание свободною водорода в метановых газах
угольных бассейнов СНГ не превышает 9%, составляя в среднем
~2±4%. По А. И. Фридману, для вольфрам-молибденовых, медноко-
лчеданных и золоторудных месторождений в молодых геосинклиналях
и зонах активизации платформ характерны углекисловодородные газы, •
для ртутных руд краевых зон геосинклиналей —углекисло-утлеводо-
родные.
В осадочных и метаморфических породах содержание водорода
более изменчиво. Повышенные концентрации его в виде Н2 (°о)
находятся в глинах (х = 0,51), слабо метаморфизованных глинистых
сланцах (0,39) и других породах, а самые низкие — в глубинных (0,09)
и осадочных карбонатных (0,09) породах, кристаллических сланцах
(0,24) и породах высоких ступеней метаморфизма (гнейсы 0,09) [53].
Содержание Н2О в осадочных породах следующее (%): пески
и песчаники 3,21, глины и сланцы 3,93, карбонаты 2,46, кремнистые
породы 1,88, соли, гипсы, ангидриты 1,61 [725].
При рассмотрении осадочных и метаморфических пород особое
значение имеет поведение поровых вод. Общая масса этих вод
оценивается в 23,5% от массы Мирового океана. В процессе
уплотнения осадков и метаморфизма поровые воды покидают породы
уже гга ранних стадиях погружения геосинклина ги. Среди осадочных
пород средние содержания Н2 составляют (%): глины 0,51; глинистые
станцы 0,39; пески и песчаники 0.25; карбонаты 0,09; эвапориты 0,07
(поровый раствор 11,1). Формы связи Н2О в глинах и других породах
различны. При уплотнении глин первой отжимается поровая вода,
с увеличением глубины захоронения от ~1,2—1,3 до 3—4 км идет
выделение связанной Н2О (стадия дегидратации). При повышенных
температурах этот процесс ускоряется. Среди метаморфических пород
повышенные концентрации Н2 (%) характерны для кристаллических
сланцев—0.25 и амфиболитов—0,17, а также песчаников и кварцитов
~0.11; самое низкое значение в гнейсах — 0,09. Аналогичным образом
концентрация Н2 и других летучих закономерно снижается по мере
увеличения степени метаморфизма углей (сумма летучих и содержание
Н2, %): длиннопламенные 40—50 и 5.31—5.34; газовые 30—40
и 5,21—5,31; жирные 25—30 и 4,81—5.10; коксовые 15—25 и 4,60—
4,81; тощие 5—15 и 3,75—4,30; антрациты 0—5 и 1,93 [726].
Особым состоянием углеводородов в криолитозоне лито- и гидрос-
феры являются кристаллогидраты (клатраты), которые заключают
огромные количества водорода в виде метагга. Отметим также, что
лишь малая доля (1 —15%) растворенных в речной воде элементов
гидролизатов преодолевает мощный геохимический барьер река —
море и поступает в океан Доля растворенных форм элементов
68
в речном стоке описывается уравнениями СА <₽„„)= Ю 3,4 • СА^<жаи)
[356].
При метаморфизме происхождение и поведение воды меняется.
Например, проведенный А. А. Кременецким [371, 372] анализ перерас-
пределения металлов, выносимых с водой из зоны разуплотнения
земной коры в мегабазитах, позволил оценить их количество (п • 10” т):
Li 0,86—2:5, Sn 0,18—0,35, Мо 0,17—0.2, Sr 9,3—10. Zr 3,3—4,9. Со
6,3—6.9, Ni 4.6—7.6, Zn 12—32, Cu 20—40. Происхождение этих вод
метеорное в верхней части разреза (5D= —100%,,) и метеорно-морское
(6D от —20 до - 40°оо) [545].
В высокотемпературных магматических процессах также проис-
ходит перераспределение Н2О. Как экспериментально показал
Н. И. Хигаров (1961, 1965 и.), процесс отщепления воды существенно
отличается для кислых и основных расплавов. От базальтоидных
расплавов значительная часть Н2О (~2%) отщепляется при изменении
t от 1000 до 900' С уже в глубоких частях магматических резервуаров,
тогда как i ранит оидные расплавы выносят Н;О в верхние части коры
и могут выделять ее в небольших количествах только в поздние фазы.
В то же время изменение термических градиентов около интрузивной
зоны вызывает зональное перераспределение воды в процессе как
повышения, гак и снижения температуры.
Почвы, растения, животные
Водород в составе Н2О является главным биологическим ком-
понентом и составляет основной объем живого вещества.
В почвах содержание воды-весьма изменчиво и зависит от многих
причин, в первую очередь климатических и сезонных, а также от
состава почв и рельефа местности В нормальной почве, независимо от
ее состава, содержится ^20% Н2О, в растениях и животных >50%,
в организме взрослого человека 60—65%. Потеря организмом
человека >10% Н2О может привести к смерти, полное отсутствие
поступления воды человеческий организм выдерживает всего несколько
суток [52].
Снижение содержания воды в почве (аридизация), как и ее
излишнее накопление (оглеение, заболоченность) являются важней-
шими негативными факторами для жизнедеятельности большинства
организмов и приводит к изменению видового состава растительных
сообществ. При годовом количестве осадков ~ 250 мм и менее
возникают пустыни. Нс останавливаясь на детально изученных
вопросах пространственной и временной зональности распределения
воды в почвах, отметим только, что по окислительно-восстановитель-
ным условиям почвенных вод, важным для формирования геохимиче-
ского состава почв, А. И. Перельманом различаются два главных
геохимических класса вод: кислородные (засушливые аридные условия,
черноземы, буроземы, красноземы, почвы пустынь и т. д.) и глеевые
(увлажненные гумидные условия) [578, 579].
69
Исключительно важное значение для круговорота воды на суше
имеет поглощение атмосферных осадков биотой — транспирация. На нее
раньше приходилось ~ 2/3 испарения осадков на суше, что обеспечивало
замкнутость круговорота воды. Антропогенное воздействие — замена
лесов агроценозами—почти вдвое сокращает транспирацию. В част-
ности, показатели регулирования водообмена (отношение изменчивости
осадков к изменчивости суммарного испарения за вегетационный
период) для России в настоящее время составляет: леса и болота 2,5—3,
луга и степи 1,5—2, агроценозы (Поволжье и Северный Кавказ) 0,8—1,1.
Представление об абсолютных масштабах траггспират ивного переноса
воды из почвы в атмосферу дают такие примерные опенки (мтн г Н2О
на 1 га за вегетационный период): пшеница ~2, капуста ~8 [423. 215J.
Не менее важным показателем является содержание в почвенной
воде ионов Н+ (pH), так как для большинства растений благоприятны
близнейтральные почвы. Вместе с тем, во многих случаях pH соляной
вытяЗкки из почв может снижаться до 5,5 и менее или повышаться, что
ведет к деградации растительности и требует нейтрализации. Повы-
шенная кислотность в первую очередь касается подзолистых, дерново-
подзолистых и некоторых торфяных, реже серых лесных почв
и красноземов и обычно проявлена в гумидных областях. Наоборот,
незагрязненные почвы аридных областей обычно имеют повышенные
значения pH. Основным регулятором pH почв являются карбонаты
кальция (магния).
По величине биофильности (Бфл 70) водород занимает третье месю
среди' химических элементов, уступая только углероду и азоту [579].
В среднем • составе живого вещества содержание водорода, по
А. П. Виноградову, 10,5%—также третье место после кислорода
и углерода. Распространенность свободного водорода в биосфере еще
не изучена, однако он продуцируется многими путями: от эндогенного
земного, которому придается все большее значение [397, 398, 738]
и биогенного—результат бактериального разложения органического
вещества до продукта окисления Fe, Мп и других металлов и радиоли-
за Н2О, а также водорода, поступающего из космического прост ран- •
ства и т. д.
Содержание водорода. при подсчете на сухое вещество в общем
увеличивается от растений к животным и бактериям [336, 915]. Средние
содержания оценены следующим образом (г кг): растения морские 41.
наземные 55, животные морские 52, наземные 70, бактерии 74; для
океанического планктона, по В. С. Савенко [677], среднее — фито- 50,
зоопланктон 70 г/кг (х = 60). Содержание его в среднем в гумусе 4,5%.
Типичное содержание водорода в живом веществе, по
С. М. Манской, Т. В. Дроздовой [726], следующее (%): лигнин 5,
углеводы 6, протеины 7, липиды (жиры) 10. органическое вещество ОВ
современных морских осадков 8, ОВ осадочных пород 9, торф 6—7,
лигнит 5—6, битуминозный уголь 5—6, антрацит 4—5, нефть 9—15.
А. А. Успенский определил среднее содержаггие водорода в составе ОВ
различных организмов (%): древесина 6.1, правы и растения-торфооб-
70
разователи 6,1, водные, цветковые растения и донные водоросли 6,2,
водоросли планктонные 7,7, зообентос и наземные беспозвоночные
(моллюски, насекомые, черви, ракообразные) 8, зоопланктон, рыбы,
наземные позвоночные 7,9 [726]; человек — 9,31.
Содержание воды в живом веществе преобладает над всеми
компонентами и находится в некоторой зависимости от влажности
окружающей среды и почв. У растений пустынь и степей оно 35—65%,
лесостепей'70—85%, хвойных лесов до 90%. У животных суши в целом
содержание воды ниже, чем у водных (%): домашние животные 60,
человек 64, водоплавающие птицы 70, рыбы до 75, медузы до 99.
В клетках бактерий и млекопитающих оно близко к 70% общей массы.
Все живые организмы чувствительны к изменению концерн рации
водорода в воде в виде Н + (pH). Активность фитопланкюна снижается
при pH ^6, зоопланктона при pH «5, особенно при повышенном
содержании А1. В эюм же интервале pH (5—6) снижается численность
популяций бентоса. При рН~5 зеленые водоросли вытесняются
синезелеными и резко снижается популяция рыб. Наоборот, при
снижении в воде содержания пероксида водорода Н2О2 до значений
<(1—3) • 10" моль л, происходящем, например, при избытке SO2,
резко снижается выживаемость рыбной молоди. Нормальной концент-
рацией Н2О2 для рыбных рек считается п- К) 6—К)5 моль/л. Скорость
образования Н2О2 в незаз рязненных реках составляет в летнее время
и-10-4 моль л-сут, а в среднем и-10~5 моль л-сут [265]. Не менее
опасен и газообразный Н2О2— при повышенном его содержании
в облаках (3—5 млрд ') подвергаются повреждению хвойные и лист-
венные, а в наибольшей степени — высокогорные леса.
В организм человека, по Ю. И. Москалеву [512], водород поступа-
ет в виде воды, газа и различных органических и неорганических
соединений — пищи и жидкостей, в среднем 350 г Н2 в сутки.
Содержание Н2 (в виде Н2О, %) заменю снижается с возрастом:
эмбрион 97, новорожденные 77, взрослые мужчины 61, женщины 54,
старики 50. Больше всего воды в крови (~83%), легких и сердце
(--79%), меньше всего в костях (20%) и зубной змали (—10%).
Величина всасывания воды (1,0) и скорость всасывания из желудочно-
кишечною тракта (20—25 мин) одни из самых высоких. Основная роль
в переносе в организме Na + и Cl и других элементов принадлежи з
воде. Г6 воды у человека 6—12 сут, водорода 14—7 сут. Установлена
зависимость между массой тела и скорошью обновления воды.
Процесс пищеварения в значительной мере связан с величиной pH
в орзанах человека, которое меняется от близнентральной и щелочной
в ротовой полости до сильно кислой в желудке и щелочной
в поджелудочной железе.
Для органических соединений водорода кинетика в организме
существенно отличается и во всех случаях 76 выведения выше, чем для
воды, особенно для тимидина (272 сут) [312].
Всасывание трития, как и водорода, в организме человека 100%-ное
как из пищи, так и из воздуха; Г6—12 суг.
71
Воздух, i идросфера, техногенез
В современном атмосферном воздухе тропосферы (до 8—18 км) —
основного нместилища Н2О земной атмосферы—-содержание Н2 по
массе ~7,7 10-s%, до высоты 900 км оно составляет в среднем
0,5 10-5%, общая масса его 0.2 1015 г (без Н2О) [444]; в вулканиче-
ских и других газах содержание Н2 иногда достит ает 50%.
В отличие о г планет земной группы, современная атмосфера
планет-гигантов, более удаленных от солнца, является водородной.
Такой состав атмосферы, по данным И А. Резанова [236], был
характерен для ранней Земли (С4 млрд лет). В это время произошла
катастрофическая диссипация ранней первичной атмосферы. Ее уход
снизил давление в недрах Земли на 500—600 МПа, в результате чего
резко расширились области плавления в верхней мантии и началось
интенсивное выделение Н, СН4, NH4 и др. Эю привело к формирова-
нию вторичной углеводородной атмосферы
В современной атмосфере водород легко соединяется с О2 и нахо-
дится в динамическом равновесии с ним при стремлении к уходу за
пределы атмосферы. Кроме Н;О в ней фиксируются и другие формы
водорода. Диссоциация Н2 типична для высоты >80 км, и в верхних
слоях атмосферы находятся свободные радикалы—ОН + , НО2 и др.
В атмосфере также присутствует 3Н (Т) в количестве 4 10 15% (от
общего числа атомов водорода), который образуется в результате
воздействия космических лучей: 14К+и-»С12+Т, а также при ядерных
взрывах в атмосфере. После запрещения испытаний этот источник
поступления трития исчез [52]. Кроме того, водород присутствует
в атмосфере в виде метана СН4 и других газообразных углеводородов,
оксидов углерода и прочих соединений, которые преобладали в земной
атмосфере на ранних этапах (~3000 млн лет). Основным источником
поступления водорода в настоящее время являются природные
процессы разложения органического вещества и образования минераль-
ных топлив, а также техногенные выбросы. В месторождениях газа
содержание метана в среднем составляет 90%. в газах нефтяных
месторождений ^75,5%, в угольных—96%. Тазы нефтяных месторож-
дений, кроме того, обогащены (до 17%) паном, пропаном и другими
тяжелыми углеводородами, тогда как в газовых месторождениях их
содержание оценивается в среднем в 3%. Высокие содержания
водорода характерны для вулканических (I) и фумарольных (II) тазов
Камчатки (в % по объему, до); пары Н2О 70 (1) и 98 (II); Н2 1,2 (I)
и 13,8 (II). НС1 0,1—0,6 (I) и 1,1—68 (II); (I) и 0,5—23 (11) [151].
По отношению к другим компонентам газовых смесей содержание
водорода и его соединений колеблется в широких пределах (в "« от
суммы по объему); газы термальных источников Тихоокеанского
вулканического пояса 20—60; газы вулкана Килауэа 37—68; газы
фумарол Камчатки 25—65 [726], причем доля свободного водорода
и углеводородов достигает в фумаролытых газах 40,5%. Таким
образом, дегазация лито- и биосферы выводит из недр Земли
72
огромные количества водорода. Особенно интенсивно этот процесс
должен протекать в эпохи высокой тектонической активности при
максимальном раскрытии рифтовых систем. Такие условия были
характерны прежде всего для рубежей различных тектонических эпох,
смена которых знаменовалась особенно значительными изменениями
уровня мирового океана и изменениями в развитии групп и классов
организмов. Исходя из этого автор и независимо В. Л. Сыворогкин,
Н. А. Садовский [236] выдвинули гипотезу о роли Н2 в развитии древних
«экологических катастроф». Вступая в реакцию с О3(Н2 + Оз-»Н2О+О2),
водород разрушает озоновый слой и одновременно образует Н2О.
Учитывая скорость регенерации озонового слоя за год, получим, что за
1 • Ю6 лет по этому механизму могло образоваться количество воды,
способное поднять уровень мирового океана примерно на 20 м.
Большое экологическое значение имеет распределение в атмосфере
паров Н2О, так как они в основном определяют парниковый эффект,
почти в 3 раза превышая таковой от СО2. Общее содержание’ Н2О
в стратосфере оценивается в среднем в 20%. Важнейшим химически
активным компонентом тропосферы является гидроксил—ОН, количе-
ство которого очень низко (10-5—10 6 мол/см3), как и короткое время
жизни ( ~ 1 с) из-за взаимодействия с СО и СН4 [354].
Ежегодно на территорию бывшего СССР поступает с атмосферны-
ми осадками 8750 км3 воды, из них ~27% расходуется в поверхност-
ном стоке, ~18% в подземном и ~40% на транспирацию, испарение
и создание биомассы. Количество осадков различно (мм/год): горные
районы 800 (за исключением внутренних нагорий); равнины запада
России 700—600; Тихоокеанские нагорья 500—400; средняя часть
Западной Сибири 500—400; Казахстан; Средняя Азия—север 350—
200, юг 100; Восточная Сибирь 300—250; Якутия и северные районы
200—150.
Гидросфера — водная оболочка Земли—является важнейшей экоси-
стемой, регулирующей распределение химических элементов между
глубинными и поверхностными процессами, гео- и биообъектами,
главным аккумулятором солнечной энергии. Начало формирования
гидросферы относят к АГС |893]. Ее средняя мощность в настоящее
время превышает среднюю мощность осадочною слоя Земли — 3,8
и 1,8 км соответственно [52].
Гидрогеологический цикл Н2О в биосфере определяет ее геохими-
ческие особенности. Наиболее существенным природным изменениям
подвержены подземные и атмосферные воды. В частности, атмосфер-
ные осадки в прибрежных районах, особенно крупных морских
бассейнов, на порядок богаче Na, Cl и другими компонентами по
сравнению с удаленными, в которых в свою очередь существенно
меняется концентрация Cl-, SOi , NO3 и др. В техногенезе состав
воды существенно меняется и техногенное поступление оксидов N, S,
С, а также других веществ стало сопоставимым с природным [877].
По современным представлениям вода находится в постоянном
динамическом обмене между континентальной и океанической корой
73
[803], между зонами разуплотнения и уплотнения в земной коре [371,
372], Огромные количества воды (~2,5—3 км^ год или за все время
~ 14 млрд км3 = 1,4 • 1025 г) фильтруются из гидросферы в зонах
поддвига литосферных плит. За геологическую историю Земли вода
гидросферы многократно прошла через зоны поддвта пли г, частично
фиксируясь в континентальной коре (~3,1 1023 г связанной Н2О}, но
в основном вновь поступая в гидросферу и океаническую кору При
этом максимум гидротермальной деятельности зон поддвига пред-
полагается в раннем протерозое [803] и, вероятно, в периоды наиболее
интенсивной перестройки тектоносферы (распад Пангеи, Гондваны
и т. д ),
В земной коре в результате низкотемпературных метаморфических
процессов, дегидратации зеленосланцевых пород, в зонах разуплотне-
ния происходит выделение свободной воды за счет связанной Н2О 1
Так, в породах разреза сверхглубокой скважины ГС-1 (Кольский п-ов)
в зоне разуплотнения содержание воды снизилось с 4 до 2,1%, причем
освободившиеся воды имели повышенную минерализацию (200—
300 г/л) [371).
Геохимическая эволюция накопления Н2О во времени обобщенно
показана Л С. Мониным и О. Г. Сорохтиным (рис. 7). Установлено,
что морские и океанические воды имеют закономерности изменения
солености и pH в пространстве. При средней солености современного
Мирового океана 34,7% в тропической зоне она приближается к 37%,
в арктической—к 32%, а также уменьшается с глубиной (неравномер-
но); pH также уменьшается с глубиной: 0 м—8,13—8,23; 1000 м —
7,98—8,14, и увеличивается к экватору [52].
Круговорот Н и Н2О проявлен также в региональном и локальном
масштабах, в геохимии ландшафтов [577]. Л. И. Перельман [577] по
особенностям водной миграции в автономных ландшафтах выделяет
и подробно характеризует следующие их классы по Н + как зипоморф-
ному элементу. Для маломинерализованных вод с органическим
веществом: Н + —Fe2 + , Н + —кислый и кислый глеевый; Н+ —
Fe2+—кислый глеевый, Н*—кислый, Нт—SOj-—сернокислые юж-
нотаежные и др. Для слабо- и среднеминерализованных гидрокарбона-
тно-кальциевых вод: Н + —Са—переходный от кислою к кальциевому,
Н + —кислый в сочетании с глеевым (Н '—Fe, Са).
Химический состав воды детально изучен О. А. Алехиным [6, 7],
А П. Виноградовым [106], М Г. Валяшко [09], В В. Ивановым,
Е. В. Посоховым [609, 610], В А. Сулиным и др. С i еохимическим
и эко1 еохимическим уклоном гидрогеохимические данные рассмотрены
А. А. Беусом и др. [52], Г А. Голевой [207, 208], В В. Ивановым,
А И. Перельманом [579], С. Р Крайновым, В. М Швец [365, 366]
и многими другими исследователями [801 ]. Отсылая к этим работам
и табл. 9—15, здесь только отметим, что по О. А. Алекину и Е. В. По-
сохову принято выделять три класса вод (гидрокарбо натные—С.
сульфатные—S, хлоридные—С1), каждый из них делится на зри группы
(кальциевая, магниевая, натриевая), а они в свою очередь на четыре типа:
74
Рис. 7. Зависимость массы
воды в гидросфере и земной
коре от времени накопления
[508]:
Масса воды: 1—дегазированной
из мантии, 2—содержащейся
в гидросфере, 3 — поровой и свя-
занной в континентальной коре,
4 — в океанической коре
1 НСО3 >Са2+ч Mg2 + , II НСО3 <Ca2" + Mg2d <НСО3+SO|“; III
НСОз + SOi <Ca2++Mg2 + . Cl>Na+ или Cl ' <Na ++Mg2+; IV
HCO3 =0. По величине минерализации H. И. Толстихин (1966 г.) выделя-
ет шесть типов вод (в г л): ультрапресные <0,2; пресные 0,2—0,5;
повышенной минерализации 0,5—1,0; солоноватые 1,0—3,0; соленые
3,0—10,0; повышенной солености 10,0—35,0.
Распределение различных компонентов солевого состава воды (см.
табл. 11, 14, 22—24, 73, 77) кратко рассмотрено для каждого из них
раздельно.
Средние показатели солености, температуры и другие отличаются
для Тихого, Атлантического и Индийского океанов на одних и тех же
широтах. По С С. Лаппо, разница средней плотности—солености
и температуры в Тихом (34,62°^, и 3,7° С) и Атлантическом (34,90%,,
и 4 С) океанах сохраняется уже не менее 100 лет и определяет
глобальный климат Земли [814]. Стационарность 1лобальных характе-
ристик Мирового океана поддерживается межокеанской циркуляцией
вод, которая связана с их разными физико-химическими параметрами.
В. В. Шулейкин показал, что Мировой океан и атмосфера работают
как природная тепловая машина нулевого рода (всего пять родов)—на
тепловом контрасте экватор—полюса.
На поверхности океана в тропиках и умеренных широтах распро-
странен тонкий (п 10 м) теплый слой (далее холодный), что обеспечи-
вает стратификацию океана и соприкосновение с атмосферой относи-
тельно 1еплой водной массы, температура которой, в отличие оз
атмосферы, меняется гораздо медленнее (затушеваны даже годовые
колебания [354]). Изменение температуры поверхности океана можез
приводить к изменению климата. Океаны являются главным источни-
ком влаги для атмосферы.
75
Мировой океан играет основную роль в формировании и изменении
климата и погоды, что определяется гигантской тепловой (x„ = 3,5'J С,
хжовт= 14,9е' С; теплоемкость океана в десятки раз выше, чем атмосфе-
ры) и механической инерцией, тепловой и химической стратификацией
[354]. Он является сложной системой, охватывающей >70% поверх-
ности Земли, в которой постоянно возникают и исчезают циркуляции
разного масштаба, формирующие мощные планетарные течения
и противотечения, обеспечивающие перенос тепла и солей. Все эти
процессы, взаимно адаптирующиеся на основе законов гидротермоди-
намики, протекают в условиях постоянного взаимодействия океан —
атмосфера [354] с учетом эндогенного взаимодействия и с литосферой.
Для характеристики водной миграции химических элементов почв
М. А. Тлазовской [198] использовался индекс сухости (соотношение
испаряемости и осадков). Выделено две группы: 1) индекс <1 —
промывной режим (тундра, лесотундра, тайга, отчасти лесостепи); 2)
индекс>1, в пустынях >3—с сильной концентрацией полютантов на
испарительных барьерах. Годовой поверхностный сток на территории
бывшего СССР изменяется в сотни раз: наибольший он — 800—
1000 мм—на Камчатке, Кольском п-ве, во всех горных областях; на
равнинах европейской части России, Западной Сибири, в Казахстане,
Средней Азии сток (мм) уменьшается с севера на юг от 500—400
в подзоне северной тайги до 200—100 в лесостепной, 50—30 в степной,
30—10 в полупустынной, до 0 в пустынной и бессточной подзонах.
В экологическом плане с этим связано уменьшение скорости самоочи-
щения ландшафтов и водоемов от водорастворимых веществ с севера
на юг, а также от гор к равнинам [198].
Важнейшим регулятором природных процессов является количе-
ство в воде водородных ионов—гидроксония Н3О, обозначаемого Н
Роль (активность) гидроксония повышена в кислых (pH 1—6;
Ю“*—10'6 водородных ионов) и понижена в щелочных (pH 8—14;
1()-8—10*14 водородных ионов) средах. По значению pH пресные
подземные воды разных типов значительно отличаются, их состав
меняется от кислых (дождевые, грунтовые гумидных зон) до щелочных
(артезианские и др.— рис. 8).
Распределение величин pH в океане, по X. Харвей, 1955 г.
и Р. Хорну [806], как и солености, снижается от поверхности на
глубину, составляя в среднем: 0 м — 8,19 + 0,05; 1000 м — 8,03+0,08;
2000 м—7,95—8,07. В зоне «ипергенеза в кислых условиях, где
интенсивно разлагаются opi анические вещества, сульфиды, хлориды (и
т. д.) и образуются кислоты, Н+ замещает катионогенные металлы
(Fe, Мп и др.) в поглощающем комплексе, и они выносятся (глеевые
обстановки, гумидные зоны) преимущественно в виде органических
соединений. В то же время на кислых барьерах (увеличение кисло-
тности системы) осаждаются анионогенные элементы (Si, Мо, Se и др.).
В океанической воде и современных осадках распространены различ-
ные углеводороды (мг на . 1 л осадка): метан 0,05—241; этан
0,004—0,02 и др. [151].
76
Рис. 8. Карта-схема распределения значений pH вод
77
Нс менее важным, но слабо изученным общим геохимическим
показателем является окислительно-восстановительный показатель Eh.
Здесь же отметим, что ГЭ природных вод разной солености и состава
колеблется в широких пределах—-от близкой к 1 для пресных
и ультрапресных вод до 5 103 и более для рассолов и хлоридных
подземных вод. Исследованиями Гбскомт идромета и Госкомитета по
охране природы [722] представлены данные мониторинга по значениям
pH поверхностных вод для территории СССР (см. рис. 8). Видно, что
высокая кислотность (рН<5) свойственна ряду индустриальных районов
Северо-Запада, Центра, Урала, тогда как большая часть территории
характеризуется значениями pH, близкими к нейтральным.
Начиная с работ Н. К. Игнатовича, Г Н. Каменского и других,
установлена горизонтальная и вертикальная гидрогеохимическая зо-
нальность. Горизонтальная зональность обусловлена климатическим
распределением зон выщелачивания и континентального засоления.
Первый тип вод (зон выщелачивания) формируется в областях
избыточного увлажнения или в районах высокой проницаемости пород
и дренажа и характеризуется увеличением минерализации с севера на
ни от < 10 мг/л до 1 г/л. Второй тип вод возникает на равнинах
с сухими степями, полупустынями и пустынями и отличается пес i рой
минерализацией — от пресных до соленых вод (в зависимости от
геохимии и геоморфологии районов).
Главные отличительные черты вод зон выщелачивания, по
С. Р. Крайнову, В. М. Швец [366], следующие: I) высокие абсолютные
и относительные концентрации СО2 (aipecc.); в гумидных районах
северной и центральной зон СО2 (агресс.) >СО2 (равнов.); при этом доля
СО2 (агресс.) растет с уменьшением pH, и воды имеют высокую
агрессивность по отношению к карбонатным, силикатным и другим
минералам; 2) высокий дефицит насыщения СаСО3 и CaSO4 и высокая
способность к растворению карбонатных пород, но не гипсовых (стелет»
насыщения CaSO4 п 10 4—л10~6); 3) интенсивное комплексообразова-
ние элементов с органическими веществами гумусового ряда, особенно
с фульвокислотами, что особенно благоприятно для накопления железа;
4) в южных районах—высокая концентрация НСО3 и СО3 (>300 mi л),
pH 7—8, резкое снижение СО2 (агресс.), насыщенность СаСО3, малая
активность органических веществ и концентрация железа.
Воды зон континентального засоления отличаются превышением
испарения над количеством осадков и испарительной концентрацией
многих анионогенных элементов, образованием засоленных почв,
карбона!ньгх кор выветривания, содовых вод и солонцов, чередованием
высокой и более низкой (< 1,5 г/л) минерализации при минимальной
концентрации СО2 и высоких содержаниях НСО3, СО3 (>300—
500 мг/л), наличием при околонейтральной и слабощелочной обычной
реакции вод значительных масс кислых грунтовых вод, малым
содержанием в водах органических веществ, особенно гуматов и высо-
кими значениями pH (~ 10) в аридных зонах, слабым переходом
катионогенных (Fe, Be, Zn, Pb, Си и др.) компонентов из пород в воды
78
и, наоборот, обогащенностью вод анионогенными элементами (F, As.
Mo, Se и др.) за счет выщелачивания из пород.
Вертикальная зональность грунтовых вод связана с геотектониче-
скими, гидродинамическими и гидрогеохимическими особенностями
территорий. По общей и частной зональности (окислительно-восстано-
вительная, микробиологическая и т. д.) выделяются разные обстановки
и зональность.
1. Артезианские бассейны платформ, краевых прогибов и межгорных
впадин обычно характеризуются прямой зональностью, существенным
влиянием вертикального инфильтрационного питания (речные долины,
выходы водоносных горизонтов) и сменой сверху вниз следующих зон:
HCO3-Ca->HCO3-Na, а при наличии в водоупоре засоленных глин
HCO3-Ca-»(SO4-Ca, SO4-Na, Cl-Na)-»C1-Na; для них типично также
уменьшение F.h (<250 мВ), особенно в заболоченных территориях при
высоких значениях Сорг (до 20 мг/л) и высокое содержание Fe и Мп
(например, ₽ — N артезианские горизонты Белорусского Полесья). Этим
объясняется мозаичный химический состав вод верхних горизонтов.
Разные артезианские структуры обладают разным составом зон. На
платформах это обычно HCO3-Ca-*SO4-Ca-*SO4-Ca-Na->SO4-Cl-Na->
♦Cl-Na, сульфидным водам свойствен состав SO4-Ca. В краевых проги-
бах и межторных впадинах зональность следующая: НСО3-Са->
->HCOJ-Ca-Na-»HCO3-Na-»HCO3-Cl-Na->Cl-HCO3-Na; сульфидные во-
ды чаще имеют HCO3-Na и HCO3-Cl-Na состав; особенно широко рас-
пространены воды HCO3-Na состава, часто обогащенные F. Кроме пря-
мой в гаких структурах возможна обратная и переметшая зональности,
которые наиболее распространены в аридной зоне. В этом случае солоно-
ватые и даже соленые воды развиты в верхних горизонтах и сменяются
с глубиной пресными. Для аридной зоны (Кызылкумы, Фергана и другие
районы Средней Азии) наиболее гипична такая зональность: (SO4-Ca,
SO4-Na, Cl-Na)-»(HCO3-Ca, HCO3-Ca-Na, HCO3-Na-Ca, HCO3-Na,
HCO3-SO4-Na)->(SO4-Na, SO4-Cl-Na, Cl-SO4-Na, Cl-Na).
2. Вертикальная зональность подземных вод в горно-складчатых
областях изменяется в зависимости от времени заложения гидроге-
ологических структур, дислокации и геохимии пород. В молодых
(Q —Т) зонах тектонического дробления НСО3-Са и HCO3-Na высоко-
кислородные воды могут распространяться до глубин п -100м (пес-
чано-сланцевые породы)—1км (кристаллические породы—Кавказ,
Тянь-Шань); происходит быстрое уменьшение Eh и нарастание хлорид-
ности при трехчленной зональности: НСО3-Са-+НСО3-
Na»HCO3-Cl-Na В структурах древнего заложения уже на глубине
п • 10 м формируются HCO3-SO4-Ca-Na и SO4-C'l-Na воды повышенной
минерализации с минимальными значениями Eh и высоким содержани-
ем Fe и Мп (Украинский кристаллический массив); в областях
повышенной сульфидоносности этот процесс еще более интенсифициру-
ется Характерна достаточно простая общая гидрогеохимическая
зональность: HC03-Ca~*HC03-Na->HC03-S04-Na-»-S04-Na при преоб-
ладающ первых членов ряда
79
В зависимости от геолого-гидрогеохимического типа вод и состава
зон воды могут быть обогащены теми или иными вредными
компонентами [366 ].
Наиболее дискуссионным является вопрос об общей гидроге-
охимической эволюции гидросферы в истории Земли [100]. Такая
эволюция не могла не происходить в силу взаимодействия с лито-
и атмосферой, которые не оставались неизменными [610], но
выражаются сомнения в возможности оценивать хронологически такие
подвижные фазы, как вода и газы. Они всегда гетерогенны и гетерох-
ронны и требуют динамического анализа, который еще не проведен
[705 ], но должен выполняться с учетом времени пребывания компонен-
тов в гидросфере, которое, например, в океане составляет от
сотен—тысяч (Al, Fe, SiO2) и первых миллионов (Са) до десятков (Mg,
К) и сотен (Na) миллионов лет [770]. Так, X. Холленд [803] на
основании изучения древних эвапоритов (3,5 млрд лет) показал, что
состав океанической воды в то время был близок, вероятно,
к современному, что подтверждает ранний вывод В. И. Вернадского,
несмотря на предполагаемое другими исследователями (Е. С. Гаврилен-
ко и др.) отличие состава древней гидросферы и атмосферы от
современной. Поэтому более надежны выводы по конкретным ситуаци-
ям. Например, установлено, что в зонах спрединга донные океаничес-
кие растворы в базит-ультрабазитовых породах характеризуются
высокими концентрациями Fe, Мп, SO2 и низким Eh за счет реакций
окисления, с восстановлением воды и освобождением свободного
водорода [247 ].
Важное экологическое значение имеет баланс Н2О на поверхности
Земли в системах океан—атмосфера—суша и суша — атмосфера —
биос. В общем речной сток на суше пропорционален количеству
испаренной океанской воды, поступившей через атмосферу. Кругово-
рот воды на суше зависит от степени урбанизации и агро-тбхно-
измененности территорий. Показателем регулирования водообмена
является отношение изменчивости осадков к изменчивости суммарного
испареггия за вегетационный период. Для России он колеблется от
максимального—2,5—3 для лесов и болог до 1,5—2 для степей
и лугов и 0,8—1,1 для агроценозов Поволжья и Северного Кавказа. За
последнее столетие этот показатель для суши в целом уменьшился
в 1,6 раза за счет антропогенной деятельности [215].
Техногенез водорода в общем специально не изучался. Большие
успехи достигнуты только в очистке питьевой воды [556, 657]. Выше
отмечалась возможность попадания H2S, СН4, Н2О2 и других
соединений в окружающую среду при сжигании угля, работе двига-
телей внутреннего сгорания, химических и прочих производств.
Особенно негативное экологическое значение имеез загрязнение вод
морей и рек различными вредными веществами из трупп СН„
и хлорорганических соединений [52, 528], а также снижение pH
атмосферных осадков и водоемов в результате образования кислотных
компонентов [265]. Наибольший забор воды характерен для химиче-
80
ской, цел.гюлозно-бумажной промышленности, нефтедобычи, обраще-
ния полезных ископаемых, текстильною и пищевого производств.
Среди всех активных веществ атмосферы Н г оказывает наибольшее
разрушающее действие на металлические конструкции.
Многие химические производства, в гом числе переработка каменного
угля без доступа воздуха и другие, приводят к образованию H2S.
В результате антропогенной деятельности в атмосферу могут также
попадать аммиак, пергидроль и другие его токсичные соединения
[727].
Поведение Н k и кислотность (pH) выпадающей в виде кислотных
дождей влаги в загрязненной атмосфере изучена для США и Канады
[265]. По данным на 1987 т. в большинстве районов годовое выпадение
катиона И составляет в среднем 0,6 кг/га (максимальное в Западной
Вир1инин ~ 1 кг'га). Максимально кислые дожди характеризуются
pH <4,2 (табл. 16).
Не менее интенсивно, особенно для низкокарбонатных ’почв,
техногенные соединения водорода влияют на их кислотные свойства,
а следовательно, на урожайность При pH почв <5,5, что характерно
на территориях, подверженных влиянию производств с крупными
объемами выбросов кислотных компонентов, для нормальною функ-
ционирования растительности часто требуется нейтрализация.
С другой стороны, на водород возлагаются наибольшие надежды
по оздоровлению атмосферы. Еще в 1963 г. в СССР В. В. Сгруминский
и А. И. Люлька июбрели водородный двитатель, который стал
прототипом реактивных космических систем (ракета Энергия и др ),
а главное—будущих автомобильных двигателей. Использование по-
следних сдерживается некоторыми психолот ическими и техническими
трудностями. Переход на водородные энергетические установки внесез
коренной переворот в техно- и экогеохимию ^тодорода [802].
Таблица 16
Количество Н ', NH4 и величина pH для атмосферных осадков Северной Америки
Районы * Число наблю- дений Н ' NH4 pH Н
зима весна лею осень
I 2 63 280 58,07 56,58 86,76 44,90
— 4,20 — —
0,77 2,59 0,15 0,23 0,28 0,12
51 250 34,58 43,94 86,04 42,24
11 2 4,29
0,53 2,72 0 10 0,21 0,25 0,11
40 180 26,11 36,93 7.3,53 34,68
III 4 4,39 - - —
0,47 1,72 0,06 0,15 0,19 0,09
* Районы: I -промышленные, II—близко к ним расположенные, III—сельскохозяйст-
венные.
Примечание. В чистителе значения даны в мкг'Л, в тнаменагеле—в кг,ла.
6 2138
81
Промышленное потребление Н2О, как отмечалось, значительно
превосходит бытовое. На получение 1 кВт-ч электро.энертии ее
расходуется 3 л, на выплавку 1 т чугуна — 300 м3, никеля —4000 м3, на
производство 1 т бумаги — 250 м3, 1 т синтетическою каучука и синте-
тического волокна—3500 м3 (до 5000 м3), на орошение 1 га посевов
12—14 тыс. и3, а некоторых сельхозпродуктов до 400 м3 на 1 т
продукции [556, 739]. Огромен объем сточных вод. В Китае в 1987 г. он
составил 34,8 млрд т, в том числе промышленных 26,4 млрд т, в 1988 г.
37 и 27 млрд т соответственно [739]. В бывшем СССР в этом же году
для использования было забрано -365 км3 воды (промышленность
— 112, сельское и бытовое хозяйства 223 и 25 соответственно) [722].
Осадки сточных вод характеризуются самым высоким коэффициентом
ноосферной концентрации элементов К„ (см. С), составляющим от 250
до 3000, и гидротоксичности ГЭг—до 5-103 — 1 • 108, к ним по
тначениям К„ и ГЭг приближаются нефтяные пластовые (100—800 и от
1 104 до 5 105) и дренажные воды (2—5UU [198] и до 2 • 104—5 105).
Как отмечалось, стандарты на воды разного назначения, гигиени-
ческие требования к качеству питьевой воды (ГОСТ 2874—82
и указания № 3143—84) [528, 727] и ПДК„ (табл. 1, 2 и др.), хотя
и охватывают часть вредных компонентов, все же не являются
всеобъемлющими. Соответствующие нормативы в США разработаны
для гораздо большего числа соединений [366]. По более поздним
данным С. Р. Крайнова, Е. А. Палшкова (1990 г.), стандарты США на
питьевую воду ужесточены. Нормируются (мг/л): As 0,05, Ag 0,05, Ba
1,0, Cd 0,01, Cr (VI) 0,05, F 1,4—2,4, Hg 0,002, NO3 45, Pb 0,05,
токсафен 0,005. Каждый штат может иметь свой стандарт, но не менее
жесткий, чем общенациональный. Кроме того, имеется перечень
органических и неорганических веществ (> 1300), которые подлежат
определению в подземных водах, в первую очередь 120 наименований.
Техногенное затрязнение воды идет все более быстрыми темпами.
Например, в США за период 1910—1940 гг. зат рязненность водоемов
увеличилась в 2 раза, а в последующие 30 лет более чем в 7 раз, что
и заставило предпринять меры к улучшению состояния водных
бассейнов. Положение в мире с чистой пресной водой оказалось
настолько утрожающим, что ООН период с 1981 по 1940 г. был
объявлен «десятилетием борьбы за чистую питьевую воду». К сожале-
нию, наша страна реально не приняла участия в >гом движении.
И ныне положение с техногенным загрязнением воды у нас все
ухудшается, тогда как во многих наиболее высокоразвитых странах
такое затрязнение затормозилось или уменьшилось.
Загря-зпение вод поверхностных водоемов связано с жидким
и атмосферными техногенными выбросами (см. С, N, S и др.). Для
непроточных водоемов особо неблагоприятно воздействие Р, который
вместе с N, С и другими веществами вызывает эвтрофирование
(умирание) озер; число таких озер (только крупных) приблизилось к 70
(Северная Америка, Западная Европа, Южная Африка, Япония и др.).
Если в прежние геологические периоды этот процесс длился тысячи —
82
миллионы лет, го в наше время—десятилетия и менее, в зависимости
от интенсивности антронотеннот о поступления биогенных веществ.
В США и Канаде работы по спасению эвтрофных озер начались
в 70-х годах, и только па очистку вод бассейна Великих озер было
затрачено 6,6 млрд дол. В 80-х годах утроза была устранена. В нашей
стране с 1972 т. ведутся систематические наблюдения за качеством
поверхносI ных вод (в 1990 г. контролировалось 2258 водных объектов).
Мнотие объекты имеют высокую степень загрязнения—10. некоторые *
до 650 ПДК — по соединениям металлов, нефтепродуктам, фенолам
и другим ор!аническим, аюгным, серным и прочим соединениям [537].
Показателем степени загрязнения водных бассейнов является распре-
деление и количество планктона, который развивается в участках
повышенного стока био1енных веществ антропогенного происхожде-
ния. Высокое количество планктона четко фиксируется на космических
снимках. По ному показателю среди акваюрий Европы наиболее
загрязненным является Черное море [814].
Особенно большой урон нашим i идроресурсам нанесли гидрострои-
тельные, мелиоративные и другие хозяйственные мероприятия. В самом
тяжелом состоянии оказались южные моря, дельты, лиманы и озера
(Аральское, Азовское, Черное, Каспийское. Севан и др.) [537, 814].
Экологическая катастрофа уже произошла на Арале, на очереди
Азовское и Черное моря. Последнее особенно уязвимо, так как с глубины
100—150 м начинается бескислородная сероводородная зона, которая
при современной структуре и балансе Н2О пока находится в стабильном
состоянии. Однако при увеличении недопотребления до размеров более
50—70 км3 юд и нарушении баланса речного и морского притоков (в
настоящее время 360 и 200 км3тод соответственно) возможно наступле-
ние глубокой конвекции. Примером является Мертвое море в Иордании,
в котором в 80-х годах сероводородные соленые водЬт вышли на
поверхность и оно стало действительно мерт вым. Произошло это очень
быстро, за время 80—90 мин (один оборот спутника «Landsat») |814].
Совершенно новой технотенной проблемой являются выбросы Н2О
и друт их веществ в ионосферу космическими системами. Это вызывает
изменения электронной структуры и плотности ионосферы по водоро-
ду, последствия чего еще не определены.
По официальным данным Госкомитета но охране природы, на
1988 г. в СССР в водные объекты было отведено 152 км3 сточных,
коллекторно-дренажных и других вод, в том числе промышленностью
79,4, сельским хозяйством ~53. коммунальным хозяйством ~20,
друтимн отраслями -0,7 км3. Общее количество неочищенных или
недостаточно очищенных сточных вод составило 30 млн м3, они
содержали (тыс. т): орт аттических соединений 1752; взвешенных веществ
2090 ( — 24 поверхностно-активных веществ); нефтепродуктов 57 и т. д.
И так ежегодно, в результате чего наши поверхностные водоемы
продолжают интенсивно загрязняться. Наиболее высокие превышения
ПДКВ типичны для нефтепродуктов, фенолов, метилмеркаптана,
соединений Cu, Zn, Ст, а также N, H2S и др. [537].
6‘ 83
По данным В. 3. Рубейкина, Б А. Колотова и других исследова-
телей [177], воды зоны техногенеза оказываются практически безза-
щитными о г за1рязнения и получают высокие количества полют антов,
во много раз превышающие значения ПДК (см табл. I). Например,
при разработке рудных (I) и угольных (II) месторождений концент-
рации примесей (в мг/л) для вод повышенной кислогности (а — pH <
<6,5) и щелочности (б — pH >7,5) достшают (в алфавитном порядке
элементов): Ag la 0.12, 16 0.06, Ila 0.02, Пб 0.005: Al la 13106, Тб 1000,
Па 938; As la 1500, 16 0,36. Па 0,01, Пб 0,1; Au la 0,005, 16 0.001, Па
0,0003, Пб 0,0005; В la 1,4, 16 5, Па 1,2, Пб 5: Ва Та 0,2, Па 1,2, Пб 26,4;
Be la 0,5, 160,3, Па 0,15, Пб 0,001; Bi la 0,7, 16 0.009, Па 0,007, Пб 0,04;
Вт 1а 125, 16 44. Па 3,5, 116 151; Cd 1а 41, 1b 0.3, Па 0,03, Пб 0,04; Се 1а
?, 16 0,4, Па 2,3, Пб 0,18; Со 1а 3600, 16 0,02, Па 3.4. Пб 0,14; Cr 1а 2,6,
16 ?, Па 9.2, Пб 0,3; Cs la 0.01; Cu la 45633. 16 1,1, Па 2,2, Пб 0.18; Eu la
0,17; F la 47030, 16 25, Ila 5480; Ga la 0.04. Ila 0.13, Пб 0,17; GO Па
0,98; Ge la 0,1, 16 0,05, Ila 0,001, 116 0,01; Hg la 0,07, 16 0,08. 116 0,03;
J la 2, 16 4,3, Ila 1.1. П6 4,2; La 16 0,2, Ila 0,4, 116 0,02; Li la 0,21, 16
18,6, Ila 0.25, Пб 5; Mn la 1690, 16 1,4. Ila 54,5, 116 1,3; Mo la 0,7, 16
0,07, Ila 0.08. 116 0,05; Nd la 0,73; Ni la 30000. 16 0,2. Ila 4,7, 116 0,16; Pb
la 1377, 16 0,2, Ila 0,02, 116 0,04; Rb la 0,14. 16 6,6, Ila 0,02, 116 0,16; Re
16 0.03, 116 0.007; Sb la 2,4, 16 0,02. 116 0,03; Sc la 0,7, 16 0,04; Se la 0,3,
16 0,05, 116 0,01; Sm Ila 0,7; Sn la 0,3, Ila 0,06, П6 0,02; Sr la 1,9. Ila
25,4, 116 212; Tb Ila 0,2; Ti la 23, 16 2, Ila 0.9. 116 4.7; T1 Ila 0.002. 116
0,01; V la 2, Ila 0,67, 116 0,09; W la 0,07, 16 0,3, Ila 0,001; Y 16 0,03, Ila
0,7, 116 0,08; Yb Ha 0,3. 116 0.02; Zn la 50300. 16 1,5, Ila 5, П6 0.9; Zr la
0,05. Ila 0,7, П6 0,12. Для сравнения приведем средние содержания
некоторых элементов в близнейтральных фоновых водах (низконоряч-
ковые водотоки) рудных районов Сихотэ-Алиня (мы/л): ('и 1,7; РЬ 0.7;
Cd 0,05; Zn 9.1; Fe 10,5; Mn 2.5: Al 10; As 2 [177].
Основной вопрос экологии—-определение критических парамшров
состояния окружающей среды. Впервые дчя тдросред они были
разработаны большим коллективом представителей разных ведомств'
и организаций под руководством Н. Г. Рыбальского, В. Н. Кузьмич,
Н. П. Морозова в работе «Критерии оценки экологической обстановки
территорий для выявления зон чрезвычайной жологической ситуации
и зон экологического бедствия» (1992 г.), утвержденной Министерство^
охраны окружающей среды и природных ресурсов РФ.
Для питьевой воды централизованного назначения ни параметр^
следующие. Экологическое бедствие: 1) патогенные микроорганизмы
>10% положительных проб; 2) коли-индекс >50 в 1 дм3 воды; 3) индекс
колифага >10 в 1 дм3 воды; 4) чрезвычайно опасные токсиканты — I
класс: Be, Hg. бензапирен, линдан, 3,4,7,8-диоксин—0,02 hi,л; ди-
хлорэтйлен, диэтилртуть, Ga?, тетраэтилсвинец, гетраэтилолово. три-
хлорбифенил >3 ПДК; 5) высокоопасные вещества—II класс: А1, Ва, В.
Cd. Мо, As, нитриты, Pb, Se, Sr, цианиды > 10 ПДК; 6) опасные
и умеренно опасные—III, IV классы: NH4, Mn, Zn. фенолы, нефтепродук-
ты, фосфаты >15 ПДК; 7) рН<4; 8) БПК >2 mi л; 9) ХПК > 16мг л: 10)
84
растворенный О2 < 1 мг/л. Эти же параметры при чрезвычайной
экологической ситуации: 1) единичная встречаемость (е. в.); 2) >50; 3)
<10; 4) 2—3; 5) 5—10; 6) 10—15; 7) 4—5,2; 8) 8—10; 9) 60—80; 10) 1—2.
Те же параметры в случае относительно удовлетворительной ситуации
должны находиться в пределах ПДК.
Показатели химического загрязнения поверхностных вод таковы.
Эко логическое бедствие. Основные показатели: 1) токсиканты I—11 класса
> 10 ПДК; 2) III—IV класса > 100; 3) ПХЗ I—II класс >80, Ill—IV класс
>500; дополнительные показатели: 4) темная пленка нефтепродуктов 2/3
площади; 5) pH 5—5,6; 6) растворенный О2 10—20%; 7) биогенные
вещества—NO2 >10 ПДК, NO3 >20, NH4 >10, фосфаты К)4 0,6 мг/л;
8) минерализация—превышение регионального уровня в 3—5 раз. То же
для условий чрезвычайной жологической ситуации: 1) 5—10; 2) 50—100; 3)
35—80 и 500; 4) яркие полосы и пятна; 5) 5,7—6,5; 6) 10—20%; 7) >5,
>10, >5, 0,3—0,6; 8) 2—3. Те же показатели для относительно
\дов lemeopume 1ьной ситуации: 1) 1; 2) 1; 3) 1, 10; 4) отсутствие; 5) >7; 6)
>80; 7) <1, <1, <0,05.
Водород (Н ') в атмосфере определяет состояние лесных и водных
гкосисгем. Показатели для Н * таковы (г/м2 год): 1) бедствие >300; 2)
чрезвычайная ситуация 200—300; 3) норма <20. То же для HF
(мкг/м’): 1) >20; 2) 10—20; 3) <2—3.
Как отмечалось, наибольший урон окружающей среде наносят
технические сточные воды, которые характеризуются исключительно
высокими концентрациями самых различных токсичных компонентов
и агрессивностью. Наиболее типичные загрязнители сточных вод
различных отраслей промышленности следующие [366, 787]: хими-
ческая—СГ, SO2", H2S, COj", НСО3, NO3, NO2, PO1 , H4SiO4,
NH3, NH4. F", Na, Ca, Mg, Fe (II, III), Co (II), Hg (II), Pb (11), As (111),
Zn (II), Cu (II), Ni (II), Mn (II, IV), сульфиды, пиридины, анилины,
фенолы, амины, формальдегиды, бензолы; рудообогатительные (чер-
ные и цветные металлы) — SO4 , H2S, F , H4SiO4, Na \ Ca2 + , As
(HI), Cu (II), Zn (II), Fe (II, III), Ni (II), Pb (II), Mo (VI), Ti (IV), Hg (II),
сульфиды, цианиды, фенолы, нефтепродукты, дитиофосфаты, ксан-
тогенаты; машиностроительная и металлопсрерабатывающая—О ,
SOi", F , H4SiO4, Н4ВО4, РО^ ’, NH4\ Ni (11), Cu (II), Cd (II), Pb (II),
Zn (II), Mo (VI), Fe (II, III), цианиды; металлургическая—SOI , Cl",
|l4SiO4, Na. K, Ca, Mg, Cu, As, Al, Fe, Ni, цианиды; нефтехимиче-
ская—Cl , PO4 , Na, Pb, Cu, H2S, сульфиды, нефтепродукты,
ароматические углеводороды, фенолы; целлюлозно-бумажная — SO4",
82Оз“, СОз , Cl РО4‘, Na, Са, органические соединения; горно-
и нефтедобывающая—SO4 , Cl , Na, Са, Mg, Fe, Cu, нефтепродукты;
теплоэнергетика—Cl", SOj", Na, K, Ca, Cu, Pb, Fe, Вт, 1,
нефтепродукты; сельское хозяйство —NH4. NO2, NO3, Cl", H3BO3,
H2PO4, К. хлор-орт анические (гексахлоран, ДДТ, альдрин и’др.)
и фосфор-органические соединения, карбаматы, нитропроизводные
фенолов и др. Большую опасность представляют различные органичес-
кие соединения, число которых во много раз превышает число
85
определяемых в водах [366], многие супертоксичные элементы (Hg, Cd.
Cr, Ni. Co, Sb, Bi, TI, Se, Те, Ag, Be, l'). а также Al и диоксины,
которые пе упомянуты в приведенных перечнях.
Выводы. Водород—первый по распространенности элемент Сол-
нечной 1алактики и, возможно. Земли. Эко- и техногеохимия свободно-
го водорода еще не изучены, но он может иметь отромное значение
в зндо-, экзо-, био- и антропогенных процессах. Это же относится
к теолотической истории Н2 и ек> соединений, за исключением Н2О
т идрохимический цикл и экогсохимия которой в современных условиях
наиболее полно исследованы. В лито- и биосфере вода является
основой—ретулятором всех природных и большинства техногенных
процессов, растворителем — переносчиком соединений элеменюв, опре-
деляет существование живых организмов. Она находится в постоянном
круговороте—от глобального (лито-гидро-атмосфера — биосфера) до
регионального (ли го-водно-воздушное — фито-зоо-почвенное конкрет-
ное пространство). ГЭ, природных вод колеблется от 1 до 5-105.
Техногеохимия воды интенсивно изучается в последнее время и вызыва-
ет все более серьезные опасения, как и обеспеченность водными
ресурсами — по количеству пресной воды и ее составу. ГЭг техноген-
ных вод может достигать и106- и-108.
Не меньшее экологическое значение имеют углеводороды, которые
составляют основу всех природных шергоносителей и вносят главный
вклад в состояние окружающей среды на глобальном, региональном
и локальном уровнях. Самым экологически чистым среди энерюноси-
телей является сам водород (Т,= 1), который может оказаться
доступным для рентабельной добычи и в этом случае полностью
изменит энергетическую обеспеченность и безопасность окружающей
среды от отходов традиционных топлив. Возможно, в палеогеотогиче-
ской истории Н2 являлся одним из главных регуляторов озоновой
защиты Земли и виновником глобальных геоэкологических катастроф.
Вода как главный критически важный компонент окружающей
среды требует дальнейшего всестороннего международного экологиче-
ского изучения, так как она служит единой объединяющей средой для
гидро-атмо-литосферы и биоса, обеспечивает биосферный батане
и жизнедеятельность организмов, но становится все более экологически
небезопасной.
ЛИТИЙ—3
Литий—редкий (кларк 0,0025%*), самый легкий, самый ги тро-
экофилытый (ГЭФг=100), токсичный (1 , = 5). литофильный металл,
единственный источник трития — ядерного топлива. ПДКР, LiF
* Li, как Be и В, в отличие от других элементов 1-го и 2-го периодов
Менделеевской системы является дефицитным в Солнечной системе, что связано
с сто термоядерным превращением в 4 Не (и + ” Li •4 Не г Г 4,8 MjB; p+6Li->
► 4Не + 5Не = 4,0 МэВ и др.).
86
1 мг/м3. LiH 0.025 мг/м3; ВДКр1 LiCl 0,5 мг/м3 (1 класс опасности);
ПДК„ общею пользования LiOH 5 мг/л, Li 0,03 мг,л (II класс)
[128 j.
Атом
Атом имеет два стабильных изотопа—6Li (7,52%) и 7Li (92,48%)
и радионуклиды 8Li, '3Li с Ть2 0,84 и 0,17 с. Расположен в 1 ipymic
периодической системы элементов и соседствуег с Na по вертикали и Mg
по диагонали. Обладает сферическим строением атома 1л22е1 и нехарак-
терными для щелочных металлов небольшим размером иона (близок
к Mg2*) и значительной плотностью (4,6• 1022 ат/см3), приближающейся
к плотности серебра. В отличие от остальных г- и особенно р-элементов,
для Li типичны высокие парами! нетизм, лито- и птдрофильность.
Химически весьма активен, имеет постоянную валентность (I)
и наименьшую щелочность по сравнению с дру! ими s-металлами
1 группы (см. рис. 5). Активно (но менее чем остальные щелочные
металлы) реаюрует с О2, Н, S, галогенами, обладает высокой
гидратацией, растворимостью соединений, окислительными потенци-
алами (табл. 17) и некоторой способностью к образованию соединений,
напоминающих комплексные фториды, хлориды, бромиды и иодиды
Li, а также Na, К, Rb (хелаты), кристаллизуется в кубической
гранецентрированной решетке NaCl. Ряд солей Li3 кристаллизуется
в виде гидратов; легко образуются Li2O, Li3N, Li3P, Li3As, Li3Sb,
Li3Bi, Li2Hg. Li3Al, LiTl. Li2Zn, Li2Cd, Li3Ga, Li3ln, а также
металлоорганические соединения, растворимые в бензоле (за исключе-
нием LiCH3). Наиболее растворимыми являются некоторые простые
галогениды, сульфид, тидрид; растворимы также хлорат, нитрат (75%),
оксид, тидроксид, сульфат (25%), перхлорат (60%), бромат (60%),
хлорид и ip.; нерастворимы ортосиликат Li4SiO4 и метасиликат,
Таблица 17
Кислотно-основные свойства Li н ,ф)гнх s-мегаллов
Ион Диаметр I идра тирован- ного иона, нм АН , к Дж/моль* -AS°, Дж/моль*
Li + 0,6 507 119
К * 0,3 314 52
Na + 0,45 398 87
Cs - 0,25 255 37
Rb* 0,25 289 40
Са2 + 0,6 I579 209
Mg21 0,8 19)0 268
Sr5 + 0.5 1433 205
Ва2 + 0,5 1290 159
* Значения oKpyi лены.
87
слабо—диалюминат Li20-2A1203, фосфат (0,02%), фторид (0,13%),
карбонат (1,2% — минерал дзабуалит Li2CO3, Пр* 1,7 10“3) [716].
Многие из этих соединений токсичны [231]. В габл. 17 приведены
некоторые параметры гидратации ионов Li и других .s- (щелочных)
и р-(щелочноземельных) металлов.
Минералого-т еохимические формулы для глубинных Л95х5 и верхне-
коровых О98С2 условий характеризуют Li как преимущественно
литофильный элемент. Это же типично для метеоритов, среди которых он
преимущественно распространен в хондритах (среднее содержание
1,4 г 1т), особенно в ахондритах, богатых Са и полевыми шпатами (в
эвкритах—3 г/т), углистых хондритах (1—2,4 г/т) и говардитах (2 г,'т),
менее—в бедных Са бесполевошпатовых отритах. В лунных породах
содержание Li 16 г/т («Аполлон-11»), в реголите—10 г/т («Луна-16»).
Оценки ет о средних содержаний в различных сферах Земли, по моделям
С. Тейлора [749 ], таковы (г, т): примитивная мантия 0,83 (по Д. Андерсену
2,1); кора—нижняя континентальная 11, верхняя 20, общая континенталь-
ная 13 [749]; континентальная протокора 10 [372]. Фактическое
содержание для коры крупных регионов от 22 до 34 г/i. В осадочном слое
Li больше (45 г/т), чем в кристаллическом (19 г/т) [898].
Теоретическое исследование глобальных моделей геохимической
миграции Li дало следующие соотношения масс элемента для верхних
частей Земли (в гг1016 т): изверженные породы 940, осадочные породы
21, осадки 15, морская вода 0,14 [85].
По данным А. И. Перельмана [574], относительная подвижность Li
во всех обстановках низкая, а в восстановительных условиях—очень
низкая. Среди различных осади гельных геохимических барьеров
осаждение Li из подземных вод отмечается только на сорбционном
глинистом (особенно монтмориллонитовом) барьере вместе с Be, Sr,
Ba, Fe и дру! ими ^-элементами.
Минералы
Литий — минералогенный элемент, собственные минералы которою
имеют сложный химический состав и небольшое содержание Li2O (в
основном <5—10% — от 0,1 атомного количества в формуле), а также
низкую плотность—от 2,3 до 3,5 г/см3 [716]. Общее число минералов
Li достигло 62, m них 40 силикатов, 12 фосфатов, 4 фторида, сложные
оксиды, гидроксид, карбонат, ванадат, борат, сульфоант имони г.
Наиболее часто в минералах Li ассоциирован кроме О2 с F, РО4 и ОН,
а из катионов—с Si, Na, Al, К, Mg. Наиболее обычная шестерная
координация, .редко встречается четверная (петалит).
Главным рудным минералом Li является сподумен LiAlSi2O6
(5,9—7,9% Li2O) из труппы пироксенов; иногда промышленное
значение имеют петалит LiAlSi4O10 (3,4—4,7% Li2O), литиевые
слюды—лепидолит K2Li3Al5Si6O20(F, ОН) (4.1—5,5%), полилитионит
* Пр — произведение растворимости.
88
KLi2AlSi4O10(l, OH)2 (5,5—8,8°o), проiолитиониi KLiMgFeAlSi3O10
(F, OH)2 (1,5—2,8%), тайниолит KLiMg2Si4O10F2 (2,4—3,8%), циннва-
льдит KLiFeAl2Si3OitlF2 (2,9—4,5%), фосфаты—амблигонит LiAlPO4F
(7,9% Li2O) и монтебразит LiAl(PO4)(OH) (до 9% Li2O), а также
холмквистит Li2(Mg, Fe)3Al2SibO22(OH)2 (2,1—3,5% Li2O). Самое
высокое содержание Li2O характерно для литиофосфата (37,1%),
либерита (23,4%) и фторида криолитионита (11 —12%) [716]. Доля
промышленной добычи минералов в 70-е годы, по Н. А. Солодову,
составляла (в %): сподумен 86, петалит 4, лепидолит 4, криофиллиг 3,
циннвальдит 2, амблигонит и др 1. В основном собственно литиевые
минералы принадлежат к редко встречающимся.
Большинство литиевых слюд относится к триок гаэдрическим
и промежуточным разностям с общей формулой АЭ'2 ,Z4Ol0(OH)2,
где А—К, Na, Rb, Cs (в том случае, когда межслоевые катионы
представлены Са. выделяется труппа хрупких слюд), Y—Li, Mg, Fe,
Al, Ti; Z—Si, Al; во флогопите экспериментально Li может замещать
К в межслоевом пространстве, в лепидолите и протолитионите Li
распределен в трех позициях различной степени упорядоченности (1М,
2М и ЗМ) при полном отсутствии Mg [703]. К иному выводу о месте
Li в структуре гриокталирических слюд пришел Ж. Робер (1978 г.),
изучавший взаимодействие растворов LiCl (/ = 400 — 900' С,
/*=200 МПа). Он показал, что в образующихся слюдах—гайниолиге
и полилитионите — Li в межслоевом пространстве не взаимодействует
с К, а занимает пустоты в VI координации, что объясняет его
аномальное поведение в реакциях ионного обмена.
Главный промышленный минерал лития сподумен и его полудраго-
ценные ра зновидпости кунцит (розовый), нурисганит (голубой) в от-
ношении попутных компонентов изучены слабо: установлены Be
и в несколько больших количествах Sn и Cs (табл. 18). ГЭ сподумена
в среднем 2 103.
Сподумен из петматоидных гранитов редкоземельных и берилли-
евых пегматитов, по Н. А. Акелину (1984 г.), содержит несколько
меньше Li и А1 по сравнению с таковыми из сподуменовых
и комплексных пегматитов (5,9—6,3 и 6,6—7,88% Li2O соответствен-
но). По содержанию Cs сподумен из поллуцитсодсржащих пегматитов
< богаче, чем из других; преобладание Cs над Rb характеризует
комплексность пегматита, а при содержании Cs>0,04% и Cs/Rb>10
можно говорить о наличии поллуцита.
Большое количество Li заключено в слюдах. Содержание его
в полилитиониге, который вошел в число главных литиевых слюд,
несколько отличается в различных типах месторождений [703]:
в сподумен-микроклин-а.тьбитовых пегматитах 5,40—8,15% Li2O
(х = 6,6+1,2%), щелочных гранитах 5,21 —6,79% (х = 6,2 + 0,6%), калиш-
пат-нефелиновых сиенитах и ме гасоматит ах 7,18—7,50%
(x=7,3 + 0,3%Li2O), полили г иоиит-флюоритовых метасомагигах
5,97%. Различается в них и концентрация элементов-примесей
(табл. 19).
89
Содержание элементов-примесеи в сподумене из пегматитовых
Таблица 19
Срешне содержания ьтементов-ирнмесеи (i/т) в по лили 1 нонил е (I), лепило лиге (2),
флогопите (3), циннвальанге (4)
Тип пород и руд Ми- не- рал Ag Rb Cs Be Pb Sn Zn n
Щелочные 1раниты 1 4 0,30 0,5 — 150 87 450 820 50 220 930 1600 22
1рейзены Гранитные пегматиты 2 1 0,42 9530 — 21 28 6 230 41 1930 68 18 26
(сподумен-мик роклин- альбитовые) Редкомстальные 2 9400 178 45 33 270 1930 18
граниты (Li-F) Карбонатиты Щелочно-гранитные 3 1 0,5 2110 1582 3,5 3 8 142 —
пегматиты
Продолжение табл. 19
Тип пород И рул Ми- не- Si (Ga) Га Nb Zr Hf La F, % Th
рал
Щелочные граниты 1 4 — 170 530 842 4300 270 1230 19 200 1,3 180 — 3000 1460
Грейзены Гранитные пет маги гы 2 1 23 (135) 1100 73 290 49 24 100 —
(своду мен-ми крокл ин- альбитовые) Редкометальныс 2 23 73 49 24 100 6 —
граниты (Li-F) Карбонатиты Щелочно-гранитные 3 1 (17) — 0340 98 4 46 8 —
пегматиты
Основное количество Li заключено в минералах других элементов
и минерализованных водах. Среди минералов — концентраторов лития —
широкораспространенные породообразующие (кларки, г/т): биотит,
флогопит (1700), мусковит (1000), амфиболы (800), нефелин (35), а также
пироксены, полевые шпаты (по 15), кварц (5). Самые высокие концентрации
Li установлены (в %): в мусковите (7), берилле (1,2), рубеллите (0,7),
биотите (0,6), флоюпите (0,4). Содержание Li (и других элементов) меняется
в разных типах пород и руд, особенно оно высоко в редкомет алльных
сподуменовых пегматитах (табл. 20, см. табл. 19). Существенное значение
имеет комбинация вертикальных геотектонических движений области
магматизма (||—высокие содержания, Ц — низкие)* [622].
Наиболее типичен гетеровалентный изоморфизм Li в эндогенных
силикатных минералах с Mg2 + , Al3 + , Fe34 (в VI координации).
Наблюдается корреляция Li с F в биотитах и Li с А1 в кварце.
* П и П—направленность движений.
90
91
Таблица 20
Средние содержания Li, Rb. Cs (соответственно первое—зренье тначения)
в некоторых породообразующих минералах, i/1
Тип пород И руд Микрок 1ИН Нефелин Амфиболы щелочные
Гранитоиды Пегматиты: хрусталеносные 20; 550; 7
слюдоносные 2; 270; 34 — —-
микроклин-альбитовые — — —
своду мен-микроклин- альбитовые ал вбит-своду меновые Грейзены 230; 9900; 1400 230: 11300: 500
Щелочные граниты — 68; 320; — 1340; 52; 96
Щелочно-габброидные — 11; 150; — —
породы К-ба *аль I оилы — 62; 210; 230
Нефелиновые сиенюы Не обн. 6; 300; ? 3120; 160; 190
Щелочные сиениты — 1410; 1700; 2910
Продолжение табл. 20
Тип пород и руд Ьнотит Мусковит Кварц
1ранитоиды 2500; 2530; 230 800; 1500; 100 7; 2,5; 0,2
Пегматиты:
хрусталеносные 2100; 2800; 70 270; 3600: 560
слюдоносные 480; 520; 30 210; 820; 22 —
микроклин-альби говые — 140; 2800; 250 24: 0.7; 0,3
сподумен-микроклин- 4200; 3800; 6100 1300: 5700; 32; 12,6; 9.6
альбитовые 1120
альбит-своду меновые — 1700. 4000; 200 71; 60.9; 80
Грей зоны 2500: 3120; НО 800: 1500; 230 —
Щелочные граниты — —
Щелочно-габброидные — —
породы i
К-базальтоиды — —
Нефелиновые сиениты 1200: 1230; 230 —
Щелочные сиениты — —•
Кроме основных минералов-носителей лиши выявлен (в г т);
в солях калия (карналлит 0,5, сильвин 2). флюорите (32), поли!алите
(10), барите (3), гипсе (8), ангидрите (10), кальците (40). а также (по
единичным данным) в некоторых сульфидах (пирит 2,3. сфалсрт 2,5,
арсенопирит 6,7, пирротин 9, мотибдени! 2) [716].
Повышенные содержания Li и друтих элементов-нримссей и ин-
дикаторное значение Li установлено для главною минерала сподуме-
новых и друшх пегматитов — кварца. Генеральное среднее содержание
Li в кварце различных типов пегма гитов, по данным Т. Т. Ляхович,
приведено в табл. 20.
92
Для минералов Li установлен следующий ряд снижения их
устойчивости и .<* в коре выветривания: летали! (1,350), холмквистит
(0,730). полилитионит (0,575), лепидолит (0,500), циннвальдит (0,480),
эвкриптит (0,370). За исключением петали!а с высоким Ас все
эти минералы интенсивно изменяются в зоне окисления с выносом
Li и образованием гидрослюд, таллуазита, каолинита, монтмо-
риллонита [88 ].
Месторождения
Среди редких щелочных металлов Li является наиболее рудоген-
ным и образует различные типы собственных и комплексных месторо-
ждений. Мировой металлогепический потенциал Li оценен примерно
в 250 млн т. Общие запасы за рубежом составляют ~ 30 млн г,
ресурсы Pi и Р2 ~10 млн т (1989—1990 и.). Из запасов за рубежом
>75%. а из ресурсов ~ 50% приходится на экзот енпые месторождения
[716]. Технофильность высокая (—2 10"). Зарубежное производство Li
в конце 80-х годов составляло 6—7 !ыс. г, на 2000 г. прогнозировалось
удвоение производства, к 2010 г.— новое удвоение, в связи с перспек-
тивами разви гия ядерной тнергетики и др. [340 ].
Главным источником добычи Li с давних времен являются
редкометалльные т рапитные пегматиты ли i иевого ряда со сподуменом.
Сподуменовые пегматиты отличаются от остальных рядом принципиаль-
ных геолого-геохимических особенностей и могут иметь крупные
запасы—до 1—2 млн т при содержании Li2O 1—2% (до 15—25%
сподумена) [375]. С учетом минерального состава Н. А. Солодовым они
подразделяются на два типа: альбит-сподуменовые (АС) и сподумен-
микроклин-альбиговые (('МА) [716]. Пегма!иты типа СМА имеют
меньшие средние содержания Li2O (0,5—0.9%) по сравнению с типом АС
(1,1 —1,5%) и более комплексный сослав (в %): Rb2O 0,2—0,5, Cs2O
0,1—0,6, Ta2Os 0,015—0,<13, ВеО 0,04—0,06, содержат поллуцит. Являясь
важным источником получения Li, Rb, Cs, они, однако, уступают липу АС
по добыче Li. В обоих титлах Li. Rb и Cs в- виде примеси присутствуют (%):
в альбите (0,005—0,01 Li; 0,01 Rb; 0,005 Cs), микроклине (0,005 Li;
0,5—1,5 Rb; 0,1 Cs), мусковите (0,04—0,06 Li; 0,8—1,8 Rb; до 1,5 Cs),
лепидолите (2,5 Li: 1.5 Rb; 0,5 Cs), берилле (0,3 Li; 0,15 Rb; 2 Cs), кварце
(0,003 Li; 0.005 Rb; 0.002 Cs). Кроме этих элементов в альбите, микроклине
и слюдах содержатся примеси (г/т): Be 1—5, Sn 5—30, Tl 5—69.
В сподумене выявлены (%): Rb 125, Cs 1300, Be 5, Sn 200, Rb 5—540, Zn
100—950 и др. [829, 847]. ГЭ сподуменовых пег маги гов в среднем 2 104.
Кроме сподуменовых пегматитов значительные количества Li
заключены в холмквислиг-цезий-биотиговых околопет мал и говых мета-
соматитах и особенно в слюдитах [714, 716]. Среди последних
установлены титиеносные породы разного происхождения — глинис-
тые, углистые сланцы, гуфогенные образования, околоинтрузивные
Коэффициент основности Л. С . Бородина [75].
93
метасома i иты. Детально изучены околопегматитовые Li-Cs слюдяные
метасомати i ы [714].
Высокие концентрации Li (0,1—0,6%) в 1екторите установлены
в вулканогенных образованиях кальдер (Макдермит и другие в США),
максимальные содержания приурочены к опализированным туфам
с ртутным оруденением, где встречается и U. В дру1их случаях Li
ассоциирует с В, Sr, Be, Ag. Нередко литием среди туфогенных
образований особенно обогащены пропластки глин (Невада, США). Во
многих штагах США повышенные и очень. высокие (до 0,5%)
количества Li отмечаются в окремнелых глинах, в которых он
приурочен к кукситу [714]. Куксит, содержащий 2,5% Li2O, известен
в глинистых породах Донбасса. Наряду с ним присутствует донбассит-
судоит (0,0—0,78% Li2O) и литийсодержащие каолинит, диккит,
гидрослюды, серицит (до 0,02—0,15% Li2O). Кроме этих минералов
часть Li находится в сорбированном состоянии в глинистом и ор-
ганическом веществе. Литиевая (с цезием—до 0,0и% Cs2O) минерали-
зация связывается с гидротермальной аргиллизацией пород и имеет
метасоматическое происхождение.
Детально изучены углисто-глинисто-карбонатные литийсодержащие
породы Средней Азии [714]. Высокие содержания Li приурочены
к глинистым разностям этих пород: туфоалевролитам, алевропелитам,
глинистым известнякам; кроме Li в глинистой сосiавляюгцей присут-
ствуют Rb (до 0,16%), Cs (до 0,1%), F (4—8%), Мо, As (В до 100),
В (В до 30), Be (В до 5). Установлены корреляции Li, Mg, Rb, Cs, К,
приуроченность Li к слюдам изоморфного ряда полилитионит-тайны-
олит и ь Идротермально-метасоматический генезис литиеносных об-
разований (температура газово-жидких включений в полилитионит-
тайниолите до 660 С).
Выявлены Li-Rb-Cs метасоматиты, связанные с месторождениями
Sn. Редкомет ально-щелочные ореолы (0,5—1% Li2O, Cs2O, Rb2O)
имеют значительное площадное распространение в зкзокоптактной
зоне рудоносных массивов и приурочены к yi листо-глинистым и дру-
гим породам (Саха, Россия; Кацерос, Испания). Широко известны
также околоинтрузивные и околожильные циннвальдитовые грейзены
(Li, Rb, Cs), сопровождающие минерализацию Sn [716].
Перспективными источниками Li могут также явиться комплексные
редкометачытые щеточные граниты с политигионитом-циннвальдиюм.
Содержание литиевых слюд в одном из полно изученных массивов
Тувы составляет 2—2,6%. Породы-руды, по Н. А. Акелину,
В. А. Павловой, содержат широкий комплекс элементов в высоких
концентрациях—Li, Rb, Та, Nb, Zr, Hf, Y и др. (табл. 21). ГЭ ьтих
месторождений в среднем 1 • 104.
Широко распространен Li в природных водах; он участвует
в аридной испарительной концентрации и осолонении вод, а также
оботащает вулканогенные термальные и глубинные рассолы [574].
Наиболее полно поведение лития в различных классах и типах
природных вод рассмотрено Т. Ф. Бойко [60] и Л. С. Балашовым
94
(табл. 22—24) [713]. Особенно высокие концентрации его типичны для
некоторых озерных, пластовых артезианских и термальных вод.
Именно они мснут иметь или уже имеют практическое значение. ГЭ
этих вод в среднем 5 105. Среди различных высокоминерализованных
хлоридных вод, в которых установлены литий и рубидий, их поведение
изучено в нескольких классах.
В Cl-Mg-Na водах среднее содержание Li (по 35 озерам) составляет
всего 3,7 мг л. а максимальное о i мечено в Большом Соленом озере
(шт. Юта, США) — 56 М1,л; среднее содержание Rb 0,5 мг/л,
максимальное — 4,7 мг,л— в оз. Индер (Казахстан). Кроме Li н Rb
может присутствовать большое количество Na, К, Mg, Вт, В, I.
В Большом Соленом озере воды смешанного сульфа i но-хлоридного
типа содержат от 20 до 80 mi 'л Li; запасы LiCl ~4 млн т.
Cl-Na-Mg озерные воды, возникающие при испарительной концент-
рации вод предыдущею типа, а также при разгрузке подземных
рассолов по разломам, изучены на примере Мертвого моря, которое
приурочено к рифтовой впадине. Они имеют высокие содержания Rb
(60 мг л) и меньшие Li (20 мг/л) и запасы 6 млн т Rb и 2 млн т Li.
Среди озер с водами смешанного состава наиболее интересны
высокомннерачизованные карбонатно-хлоридные высокощелочные во-
Таблица 21
Средние содержания Na, К (%), Li н других редких и
малых элементе (г/т) в рудоносных щелочных граннтоидах
Улуг-Танэека
Элемен] Пороты* Элемент Породы *
рибекито- вые с ли- тиевыми слюдами литиево- слюдис- тые с поздни- ми слюд- ками рибекито- вые с ли- тиевыми слюдами литиево- слюдис- гые с поздни- ми слюд- ками
Na 3,45 3,45 3,52 Ве 7,6 4,8 1,6
К 3,29 3,33 3,18 Ti 59 86 76
Li 624 570 61 Мп 190 250 180
Rb 1150 1158 1063 СТ 3,8 4,2 4,6
Cs 6,3 7,5 7,8 Ni 3,2 3,3 3,1
Та 117 130 136 Со 0,5 0,5 0,5
Nb 936 1099 1157 Си 5,2 6 6,5
Zr 2316 2790 2976 Zn 435 295 243
Ilf 140 158 187 Pb 533 2260 910
Y 134 116 160 Sn 124 9) 82
Th 344 470 650 Мо 0,5 0,5 0,7
U 137 120 113 В 6 6 7
Ga 78 83 109 F 4800 1800 600
Для всех разностей пород п >50.
95
Таблица 22
Содержания редких щелочных элементов в различных
генетических видах природных вод, мг/л
Волы Li Rb Cs
Океанические Речные Озерные Грунтовые редкометальных месторождений Углекислые горно-складча- тых областей Термальные современных вулканических областей Пластовые артезианских бассейнов 0,17-0,20 0.0004 -0,4 0,11-0,13 0,12 0.001 -0,0021 0,0003 - 0,0006 0,0005 0,00005 -0.0002
0,0036 0,01-100 0,00 0,2 0,1 100 0,1 60 0,0016 0,01-60 0,00 0,3 0,01-10 0,01 10 2,6 0,01-80 ~ ДГ 0,00014 0.000 - 0,5 0.00-0,01 0,01-5 0,01 -6
7,4 0,1-700 10,2 1,2 0,01 -20 —0,2
Таблица 23
Изменение ере (них содержаний* л-элементов по инэервазам
минерализации в отдельных классах хлоридных артезианских вод
К пасс воды Минера- низания М. г я рн Са Mg Na К Li Rb Cs
Cl-Ca-Na 0—100 7,П 3,44 0,96 20,5 0.26 5,7 0.42 0,29
100—200 6,48 9.28 1,76 42,6 0.70 10,8 0,94 0,38
200—300 6,02 18,28 3,03 69,9 0,94 16,6 1.15 0,57
300—400 5,72 29,74 4,89 82,8 2,76 33,5 3,45 0,92
Cl-Na-Ca 250—300 5,84 45,0 6,20 40,5 3,69 22,5 5,4 0,60
300—350 5,64 47,0 7,78 41,3 4,72 67,0 9,2 1.56
350—400 5,31 74,4 8,92 37,0 5,78 78,8 16,1 1,78
400—500 4,13 85,0 9,38 35,0 7,75 103,3 32,5 2,83
Cl-Mg-Ca 300—400 4,81 83,3 16,4 18,0 7,0 86,5 15,5 0,55
400—500 4,58 102,0 22,2 15,2 11,9 113,8 15,0 1,44
500—600 4,18 152,3 15,1 5,5 15,3 195,0 14,4 Го.11
* Содержание Li, Rb, Cs—в mi л, остальных эчеменгов—в Г/л.
ды классор СО3-С1-К Na и CO3-Cl-Na с низким (~0,05 i л) содержани-
ем Mg и Са. К этому типу относятся оз. Клайтон (Невада, США)
с максимальным содержанием Li (400 мт,л) и соленосное бывшее оз.
Серзл (Калифорния, США) — наиболее крупный известный источник
96
многих металлов. Сухое оз. Серзл расположено в бессточной
котловине. Соляная толща имеет площадь 82 км2, мощность 30—40 м
и состоит из двух соляных пластов (галит и другие соли), между
которыми находится пласт соляных илов, последние также подстилают
и перекрывают соль — высокопористую, пропитанную рапой с минера-
лизацией >450 г,'л. pH 9,4. В верхнем пласте Содержание Li
96—115 мг/л, в нижнем 40 мг/л. Кроме Li, содержание которого
составляет в среднем 81 мг/л, в соли концентрируются ( в г/л): Na 110,
К 23, В 3,4, С1 121, SO4 46, СО 27, а также (в мг/л): Са 16, Вг 198, As
850, W 5,4, F 70, Sb 6, Мо 0,7, Ge 0.3, S2 386, РО4 922. Оз. Серзл
существует 30 млн лет. Интересно, что в аналогичном по типу
и составу рассолов оз. Катве (Уганда) установлен только Rb (25 мг/л)
при отсутствии Li и Cs.
Большое значение как возможный источник щелочных и ряда
других металлов, по Л. С. Балашову [714], имеют хлоридные артези-
анские воды, в отдельных типах которых зти металлы находятся
в высоких концентрациях (см. табл. 15, 16). Концентрация Li, а также
Rb и Cs возрастает с увеличением степени минерализации и идет
в Cl-Na-Ca и Cl-Mg-Ca водах для Li Гораздо интенсивнее, чем рост
общей минерализации. Слабо изучены, но наиболее литиеносны
(х=148м1/л при минерализации 320—450г/л) воды Cl-Mg типа (см.
табл. 24). Охарактеризована литеносносгь и других типов вод [714].
Технология извлечения щелочных металлов из самоизливающихся
артезианских минерализованных вод разработана и близка к экономи-
чески выгодной.
В целом литиеносность водоемов конечного стока контролируется
не столько их гидрохимическим типом, сколько обогащенностью
литием питающих вод, степенью минерализации рассолов, тектониче-
ским и климатическим режимом, который мог приводить к неоднок-
ратной садке легкорастворимых солей в водоемах и соответственно
к обогащению литием их рассолов. Наиболее перспективны [60]
длительно существующие высокоминерализованные озера, занима-
ющие впадины тектонического происхождения; обычно они приуроче-
ны к районам молодого гекгогенеза и в их питании участвуют
глубинные воды, отличающиеся гораздо большей литиеносностью, чем
океан
В осадочных рудах дру!их типов, кроме талолитов и эвапоритов, Li
не концентрируется.
По В. А. Тенякову [751], в бокситах разных типов Li при
генеральном среднем содержании 30 г'т присутствует в различных
количествах (в г/т): в платформенных 8, в геосинклинальных 17,
в «осадочных» терригенных 80, в осадочно-элювиальных терригенных
118. В примере, приводимом А. А. Кременецким. в исходных слюдис-
тых сланцах установлено 53 г/т Li, в глинистой зоне 112, в зонах
аллитов 242, а бокситов—169 г/т [714]. Во временном разрезе
распределение Li следующее (г/т): PZ 147, MZ 38, KZ 1,6, т. е.
значительно снижается.
7 2138 97
Таблица 24
Минерализация М, аемпература t, pH и содержание щелочных >лементов (Na,
вод артезианских бассейнов
Класс Под- класс M, i л t, "C pH
3,9 -94 15-170 6-9,3
I. Cl-Ca-Na* a —
32.6(312) 54(104) 7,13(127)
6 4,4 -417 2- 115 3,9-8,8
— —
185(1440) 45 (258) 6,21 (691)
5,3 -93 15-148 6,6-8,0
III. Cl-Mg-Na2’ a —— — —
29.7(95) 37(34) 7,46(34)
6 8,4 420 0,2-62 4,5-7,4
192(138) 16(10) 6,67(40)
3,7-97 15-183 6,9-8,4
IV. Cl-Na2*
7,40(47)
32,7(127) 66(39)
6 11,5-331 0,5-38 5,5-8,3
253(190) 14(40) 6,64(52)
16-476 15-133 2,6-6,8
V. Cl-Na-Ca2’ — —
353(284) 50(38) 5,30(107)
112-643 15- 102 2,5-6,2
VII. Cl-Mg-Ca3’ —-— ... 46(30) —
444(122) 4,61 (32)
57-500 6-42 4,0-6,2
IX. CI-Na-Mg3* — ——— - —
346(54) 17(8) 5,35(13)
159-605 20 96 3,8-6,0
XI. Cl-Ca-Mg3*
380(33) 42(7) 4,79(6)
121 -451 18- 23 3,8-5,2
XII. CI-Mg3’ —— —
406(7) 21(3) 4,42 (6)
0,7-72 10-143 6,8-8,5
IlCO3-Cl-Na2*
16,2(193) 52(76) 7,65(52)
0,7- 94 2-65 5,5 8,3
SO4-Cl-Ca-Na2 - — — —
26(238) 24(81) 7.35(72)
* Широко распространенные воды, 2 распространенные, 5 мало распространенные
Примечание Здесь и в табл. 49—хлоридные воды классов 11 (Cl-K-Na), VI
В Fe-Mn океанических конкрециях оценка среднего содержания Li
80 г/т [34] при разбросе от 2 до 1055 т,г. В стандартной пробе та-
ких конкреций радиоляриевой зоны Тихого океана среднее 129 г/т.
Конкреции из южной части океана беднее (х = 40 г.'т), а самые бед-
ные (2—5 г/т)—рудные корки с поднятий Мид Пасифик. Обнаруже-
на тенденция повышения содержаний в нижних частях, соприкаса-
ющихся с осадком, и в наружных сферах конкреций. В металлоносных
98
К — в г/л, I i, Rb, Cs—в mi /л) в различных I еохимических классах хлоридных
Na К I !* Rb Cs
1,2-32,2 0,01 —0,96 0,01 -22,5 0,1 II 0.01 -12
13,7(196) 0,19(96) 5,3(150) 0,78 (55) 0,54(195)
1,8-116 0,10-7,3 0,1 -140 0,1 -21 0,01 5
51,8 (799) 0,99(171) 12,4(463) 1,46(255) 0,39(91)
2,2-27,8 0,02-0,76 0,2- 4,4 0,04-3,5 0,01 -0,35
. - 1 — _ - . . - — —
8,33 (60) 0,16(25) 1,5(12) 0,19(11) 0,19(5)
2,4 115 0,06 11,2 0,03-5,9 0,01-4,3 0,01-0,34
58,6 (.72) 2,27 (34) 1.2(28) 0,64(12) 0,18(8)
1,6 33,3 0,02 0,66 0,2-9,5 0,03-4,4 0,01—0,69
13,7(96) 0,11 (34) 2,1(25) 0,79 (37) 0,32(17)
15- 135 0,02 3,82 0,2-2,7 0,06-0,82 0,01-0,32
97,9(119) 0,35(79) 1,1(39) 0,35(16) 0,18(8)
4-48 0,50-37,85 15-350 2,2-65,7 0,1 -4,3
37,5(128) 5,52(152) 83 (96) 15,8 (65) 1,79(31)
3- 30 1.2-35,92 15 480 4,5-62 0,1 -3,2
13.7(70) 11,1(91) 122(38) 15,0(26) 0,78(10)
12,2-51 0,74 39,75 16-390 5-90 0,3-3
30,8(21) 15.9(16) 87(14) 16,4(16) 1.65(2)
6-34,9 1,08-50,0 34-170 12- 21
15,8(22) 22,3(16) 85(7) 16,7(2)
0.7-7.5 1,0-9.9 30 - 390 8-12,4
2,8(6) 3,9(4) 148(5) 10,2(2)
0,3-22,5 0,05-0,36 0,2-9 0.01 1,9 0,01-0,8
6,25(98) 0,06(45) 2,2(38) 0,23 (45) 0,14(27)
0,1 -24,2 0,02- 1,70 0,2-6,5 0.01-1,3 0.01-0,55
2,1(372) 0,11(111) 1,2(94) 0,14(20) 0,23(15)
(Cl-K-Ca), VIII (Cl-Са) и X (Cl-K-Mg) не рассматриваются (очень редки в природе).
осадках южной чаС1и Тихого океана среднее содержание Li- 32 г/т
(п > 100) при более высоком среднем в глубоководных красных
глинах—45,6 г т.
В фосфоритах содержание Li обычно составляет 1— 10 г/т.
В каустобиолитах Li обнаружен в незначительных количествах:
среднее 7 + 2 г/т в углях нашей страны при более низких содержаниях
в бурых углях — 2г,т; в «черных» сланцах оно немного выше —
7* 99
Таблица 25
Редкоэлеметпный состав |ранитоидов различных геохимических типов
Основные и средние магмы Палишенные
Элемент wiai ио- грани- палинтенные плюмазито-
граниты толеито- вого ряда тоиды андези- тового ряда граниты лагитово- ю ряда агпаитовые редкомет аль- ные граниты граниты известково- ше лонного ряда вые редко- метальные лей кот ра- ниты
к 0,3 2,0 3,5 3,6 3,3 3,9 ♦
Na 3,1 3,0 3,4 4,0 2,8 2,8
F 0,015 0,07 0,06 0,20 0,08 0,27
В — — 23 — 22 27
Li 4,7 18 21 104 50 180
Rb 2,6 100 125 270 175 440
Cs —- —- —- 1,9* — 17,5
TI — — 1,0 1,7* 0.9 2,9
Вс 0,5 1,5 2,2 11,8 3,0 8.8
Sr 139 260 700 12 330 70
Ba 57 550 1700 40 830 175
Sn 2,7 2 5 17,7 6,2 22
W — — 3,0 1,1 2,5 8.4
Mo 1,5 1 1,7 1,8 1,1 1.5
Pb 2,8 10 23 46 27 28
Zn 75 43 70 300 51 40
Nb 2,4 8 — 320 19 33
Ta 0,4 0,4 —- 18,5 2 9* 7
Zr 89 115 — 2170 190 140
Hf 3 4 —- 63 — 9
ETR + Y —- 135 —— — 330 (350)
Cu (1,5) (40) 31 —- (23) —
Ga 17 — — (27) 17 (23)
Распростра- ненность, % 2 8 5 2 40 5
* Мало данных.
* * В числителе по А. П. Виноградов) [105], в знаменаге ге—по Л. В Лаусонч [744].
Примечание. Содержания К, Na, F—в “о, остальных зчеменгов—в i
10—35 i'л. В законтурных водах газо-нефтяных месторождений
В. И. Петренко установлено 18 мг/л Li, в конденсационных — 0,11 мг, л.
Не установлено повышенных концентраций Li в рудах марганца, хотя
среднее содержание в них (14 г т) и максимальное (69 г г) значительно
выше, чем в оксидных рудах железа (0,4—14 г т) [714]. В единичных
случаях высокие концентрации Li установлены в гидроксидах Мп (до
0,6%), глауконитах (0,12%), фосфатах (сиклерит до 3,8 ° о Li_>O).
Породы
В изверженных породах концентрация Li увеличивается по мере
повышения содержания SiO, и щелочности [732, 714]. Для ульграос-
100
магмы Уль граметаморфические породы Средний гранит **
палинген- ные грани- гоиды ще- лочного ряда редкометаль- ные гра- нитоиды щелочного ряда ультра- мета- морфиче- ские гранилы чарно- киты эндер- биты рапа- киви
4,1 3,8 4,6 3,3 1.1 4.5 3,3/3,3
3,5 3,1 2,3 2,4 2,4 2,0 2,8/2,9 0,08/0,08
0,05 0,09 0,018 0,1 0,05 0,17
27 52 11 15 12 30 1 -ч 40/40
140 270 140 90 22 250 200/160 5/- 1,5/-
0,9 — — -— — —
2,8 4,8 0,6 -— — —- 5,5/-
650 170 280 300 280 по 300/340
1550 550 2800 1000 450 1400 830/1020
3,8 5,7 2,8 2,5 2 7 3/6
1,7* 2,1 —— — — 2,2 L5/-
1,5 1,8 1,2 — —- 2,7 1/-
19 20 14* 10 3 40 20/22
64 43 43* 50 50 90 60/60
22 —— —- —- —- —- 20/—
1,4* — — —— —• —- 3,5/-
410* 837 90 — — — 200/ —
480* — — — — — V 190/—
(П) (98) (17) — — — 20/— 20/— 100
15 3 8 3 4 5
ионных пород приводятся наиболее расходящиеся оценки кларков (%):
от 0,000/г [882, 924] до 0,0026 (Е. Хорстман, 1957 I.). Среднее по более
поздним данным [546, 714, 716, 732, 749, 857] составляет 4,3 + 0,5 г/т;
дуниты и перидотиты в кома! матичных сериях обычно в 1,5—2 раза
беднее перидотитов. Самыми высокими содержаниями характеризуют-
ся щелочные ультрабазиты (r/т): мсланефелиниты 17, кимберлиты 20
[75] и 35 [305], нефелиниты 78, лейцититы 90 [714].
Для габброидов Урала, Украины, Кавказа и Монголии общая
оценка содержаний Li 12,7 + 4,9 г/т [428, 716], для тералита 11,
эссексита 17, шонкинита 15 i т [439]. Для базальтоидов оценки таковы
(г/т): толеитовые базальты 20, щелочные оливиновые 80, фонолиты-
базаниты 46,5, лейцитофиры 90 [714]. По другим данным кларки Li
101
для базигов ниже (1 г): 15 [546], базалыы континентапьные—10.
океанические—10 [857].
В. В Мотаровским с соавторами показано избирательное выщела-
чивание Li (85%), F (до 70%) и РЬ из мантийных ксенолитов
в щелочных базальтоидах, что сви тетельствует о нахождении их
в состоянии атомарного рассеяния в мантийных базитах (амфиболи-
тах) и гипербазитах.
Для средних пород опенки среднего содержания Li (г г) — 27 [546],
22 [714] и 10 [857].
В гранитоидах • содержание Li, по Ю. Б Марину [460, 461 ],
увеличивается по мере увеличения SiO2 и щелочности; к чарки
следующие (в г'т): габбро-диоритовая формация 12, диориi -нлагиш -
ранитовая 15, iранодиоритовая 18, гранитная 33, аляскитовая 80, Li-F
траниты 210, щелочные граниты 80.
В. С. Поповым (1991 г.) для тех же типов 1ранитоидов варисцнд
Центральной и Западной Европы приводятся более высокие ферсмы Li,
чем указанное генеральное среднее При ферсме для i ранитоидов всей
территории 141 + 65 т т (без Li-F (ранитов) среднее но типам такое (г т):
биотитовые адамеллиты 130, биотиговыс граниты стандартные 156,
двуслюдяные граниты 130, лейкократовые двуслюдяные 269, гранит-
порфиры 92, аляскиты 72, лейкогранигы и Li-F граниты 1800. Эги
данные ближе к оценкам, полученным для М/. гранитоидов областей
преимущественных поднятий Восточною Забайка тья — в целом
74+16 г/т [622], и, возможно, к среднем) для геохимических типов
палингенных i ранитоидов. по Л. В. Таусону [745 | 80 + 65 г i (габл. 25).
В MZ Li-F гранитах Монголии ферсм лития 878 гг, кварц-
лепидолитовых трейзепах 985 т т; в рудоносных массивах редкомстальных
щелочных гранитов Саудовской Аравии ±=329 it. Нигерии—480 г т.
С. М. Бескиным с соавторами [375] приводятся следующие минера-
лого-геохимические особенности гранитоидов районов проявления споду-
меновых пиматитовых месторождений. Характерно наличие среди них
большого объема платно!ранитов. высокие количества AI (слюды,
альмандин) в породах и Na в предпегмати iовых дайках. Акцессорные
минералы рантах фаз гранитоидов—ортит, сфен, апатит, шеелит,
касситерит при отсутствии флюорита; наличие акцессорною сподумена
(±=0.87 г, т ферсм для СССР), а среднее для районов со сподуменовыми
пегматитами 2,9 r/т. Грашггы районов развитя сподуменовых пегматитов
(I) отличаются от районов с редкометальными пегматитами бессподуме-
нового типа (И): СаО. %—I 1,20, II 1,0; Na2O, % — I 3,6, И. 3,5; К2О,
% —I 4,75, II 4,6; F, % —I 0,12, II 0,2; Li, г/т—1 150, II 80; Rb, 1 т—1
300, II 250; Be, т т—I 9, II 15; Та, г т—I 5, II 10. Видно более высокое
содержание в первых Са, Na. К. Li, Rb и низкие F, Be, Та.
В щелочных грацитах разных формационных типов генеральное
среднее для Li и Rb следующее (I ,т): нефелиновой ассоциации 55 и 320;
щелочно-сиени говой К) и 110; грани гоидпой 65 и 120; бимодальных
серий 35 и 120 [496]. В нефелиновых щелочных породах оценки
генеральных средних содержаний Li таковы (i. i) щелочной сиенит 38,
102
миаскитовый нефелиновый сиенит 44, псевдолейцитовый сиенит 17,
агпаитовый нефелиновый сиенит 107 [393, 394].
В осадочных породах общий кларк Li 40 г/т [716], для отдельных
типов пород его содержания будут (г т): глины 54,7, среди них
каолинитовые 187 (л = 7), монтмориллонитовые 49 (29), полиминераль-
пые 54 (689), гидрослюдистые 52 (126), красные глубоководные 45;
песчаники 29; карбонатные породы 17,4, среди них известняки 19 (109),
мергели 34 (78) и др. [714]. Кларк для глин и сланцев континентов
60 г/т [857]. В отличие от других щелочных металлов, Li не участвует
в хемогенной седиментации осолоняютцихся водоемов и накапливается
в конечных рассолах [61], причем сорбция его идет более интенсивно
из пресных и соленых вод по сравнению с рассолами [60].
При метаморфитме Li ведет себя неоднозначно или изохимически —
перераспределяется [586, 714, 716], иногда выносится из расплавленных
метапелитовых пород амфиболитовой и гранулитовой фаций, накапли-
ваясь в пегматитовых и околопегматитовых зонах [714].
Существенное влияние на концентрацию Li в гранитоидах, как
отмечалось, оказывают геотектонические условия [285, 622]. Повышен-
ные его концентрации в породах устанавливаются только в блоках,
испытывавших в пред- и синмат мат ические этапы устойчивые восходя-
щие движения. Например, для Восточного Забайкалья выявлены
следующие изменения содержаний (г/т): П * 72; И 89 (центр блока);
И 50 (край блока); Ц 34; jj 8. Так же распределен Li и в породооб-
разующих минералах гранитоидов (см. табл. 30). Эти выводы
подтверждены и для других провинций нашей страны [755].
Почвы, растения, животные
При выветривании пород Li легко высвобождается и попадает
в растворы, из которых большая его часть захватывается глинистыми
и в какой-то степени органическими образованиями. Считается, что Li
наиболее подвижен в начале почвообразования, затем подвижность
снижается. Отмечается, что ею содержание в растворимых формах
достигает 5% общего содержания, а содержание обменного Li, по
Б. Деви, коррелируется с таковыми Са и Mg [312]. Фактические
данные по распределению Li в почвах нашей страны, полученные
Т. Ф Боровик-Романовой с соавторами, свидетельствуют о повышен-
ных его содержаниях в почвах лугов—73 мт па 1 кг сухой массы (с.).
Самые низкие количества Li (мт кт) установлены в почвах на
ледниковой морене (6,2—Дания) и в органических почвах (1,2—
1,6—Дания, Новая Зеландия); самые высокие — в аллювиальных
образованиях (в США—до 120; в других странах содержания во
флювисолях 98, репдзинах 80, глейсолях 68); высокие его концентрации
отмечаются в лёссовых и пылеватых почвах (95—Новая Зеландия при
* Генеральная направленность вертикальных геотектонических движений
(см. табл. 30).
103
ферсме 59 + 15) и в аридных зонах—солончаках, солонцах (42—СССР,
55—Новая Зеландия), а также каштановых и бурых (57 — Новая
Зеландия, 37—СССР), суглинистых и глинистых (45— Новая Зеландия)
[312] и коричневых (Кавказ) [176] почвах.
Изучение почв США показало более равномерное распределение
Li—от 13 мг/кг в органических легких почвах и 18 мг кг на моренах
и ледниковых отложениях до 34 mi кг в а элювиальных почвах [914]
при ферсме для США 22 + 2,8 мг кг. Кларк Li в почвах, по
Д. П. Малюго и А. П. Виноградову [104], 30 мг'кг; ферсм его в почвах
нашей страны [176] составляет 28,6+1,5 мг кг
Возрастание количества Li в почвах токсично для некоторых видов
растений. Токсичными для растений считаются его содержания (г 'л):
хлорида 1,2—4, сульфата 0,2—0,5. Нормальной считается концент-
рация Li в листьях растений 3 мг кг (с.), избыточной — 5—50 мг'кг (см
табл. 3). Наиболее чувствительны цитрусовые, которые болеют при
концентрации Li в листьях от 4—40 до 140—220 mi кг. Повреждение
корней наблюдалось у кукурузы. Токсичность Li понижает Са, который
ингибирует поглощение Li из почв. Небольшие количества Li, по П А.
Власюк, увеличивают урожайность, качество картофеля, гоматов.
перца, сахарной свеклы, табака [109].
В организмах содержание Li, в отличие от других щелочных
металлов, ниже, чем в морской воде, на основании чего он был оценен
как элемент с низкой биофильностью [574, 578]. Однако после работ
М. Анке (1980 г.), который впервые показал жизненную необходимость
Li для развития животных, биологическая индифферентность этого
элемента не подтвердилась. Li давно широко используется в психиат-
рической практике, нормализуя обмен медиаторов в центральной
нервной системе. Он особенно эффек тивен при лечении маниакальных
психозов и не оказывает влияния на психически здоровых людей, если
не считать токсичного воздействия, которое может наступать при
довольно низких концентрациях в плазме крови (1,6 ммоль/л) [484].
Данные, обобщенные А. П. Авцыным с соавторами [484], свидетельст-
вуют о разностороннем биологическом действии Li на организм,
которое проявляется физиологическими, фармаколо! ическими и токси-
ческими признаками. Первые обнаруживаются при концентрации Li
(ммоль/л) в плазме крови от 0,14 до 1,4, вторые—при 1 и 1ретьи —
при 2. Высокие дозы (2—3 ммоль/л в плазме крови) вызывают
светобоязнь, нефро- и тиреопатию, диарею, гиперпаратиорез, нейро-
патию и т. д. Летальная доза для человека 4—5 ммоль/л; особен-
но много случаев летального исхода имелось в США при примене-
нии LiCl.
Токсичными для животных (мыши — в желудок) являются содержа-
ния хлорида лития 1 мг/кг, а сульфата—1.5 мг/кг. Летальные дозы Li
приведены в табл 26.
Признаки недостаточности Li в рационе питания, установленные
только у коз и крыс, выражались в нарушении репродуктивной
функции и повышенной смертности.
104
Таблица 26
Летальная юза сое именин щелочных металлов, вызывающая
гибель 50% подопытных животных ЛДЗД г/кг
Элемент Хлориды, хлораты Карбонат Цианид Селенит Селенат
Na 1,2—ОД — — 0,003 0,004
Li, (К) 1,1 53 (0,002) — —
Cs (Rb) (L2) — — — —
Продолжение 1абл. 26
Элемент Нитрит, цитрат С ульфид Бромат, броми 1 Ази i (N3) Арсенит, арсенат Би хро- мат
Na 0,5 х 10 5 0,006 0,14 0,04 0,001 —
Li, (К) — — — — (Сильно ЮКСИЧеН) (0,008)
Cs (Rb) 1,2 — 1,4 — — —
Кларк Li дня живого вещества оценен величиной 6 10 s%
[725, 857].
Растения поглощаю] Li в различной степени. Т. Ф. Боровик-
Романова с соавторами подсчитали показатели биологического погло-
/ зола \
щения I — I. Высокое его значение—0,8 установлено для семейства
\почва/
Solanaceae, некоторые виды которою, растущие в аридной зоне,
накапливают >1 i кг Li; для Rosaeeae он 0.6, для Polygonaceae—всего
0,04. Больше всего Li в растениях, произрастающих на солончаках
и других почвах повышенной солености. Средние содержания этого
элемента для наиболее толерашных к нему семейств растений для вашей
страны таковы (mi кг с.): Rosaeeae 2,9; Panunculaceae 2,0; Solanaceae 1,9;
Viojaceae 1.3; остальные <0,7. Характерными концен!рагорами Li
являются табак, белена, дурман, дереза и некоторые другие пасленовые;
среди лютиковых — василистник и др. Основное количество Li в расте-
ниях находится в листьях, но нередко и в корнях, что связывается
с действием экологических барьеров [312]. В расти тельных пищевых
продуктах Li содержится в среднем (мг/кг): сельдерей 6,6; свекла 6,2;
кукуруза — початки и солома 0,8, зерно 0,05; капуста — листья 0,5;
морковь — корнеплоды 0,2; салат-ла тук 0,3; лук 0,06; апельсины 0,2;
отмечается возможность и более высоких содержаний [312, 913].
Оценки средних содержаний Li таковы (мг/кг): в растениях суши
0,1, моря 5, в животных суши <0,002, моря 1, в океанском планктоне
40 (фито- 50, зоопланктон 30), взвеси 20. Среди морских водорослей Li
особенно концентрируется в бурых и красных.
В организме человека и животных соли Li полно (Вс = 1,0) и быстро
всасываются в кровь и сравнительно равномерно распределяются но
105
разным органам: в свежей ткани его концентрация 4 мт, кт, в крови —
19 мкг/л, в основном в плазме. Ежедневно в организм человека
поступает от 100 мкг до 2 мг Li и, вероятно, столько же выводится
(95% с мочой). Больше Li поступает в рацион с черным, чем с белым,
хлебом [512]. Т6 выведения Li 1—2 сут. По Е. Хамильтон (1981 г.),
суточное количество Li в рационе человека составляет (в мкмоль):
в Англии 24,5 + 7,6, США 288, Индии 14,4.
Содержания Li, по обобщенным данным до 1977 г. [931 ], в различ-
ных органах человека следующие (ж.— на живую массу, с.— на сухую;
в скобках число анализов): кровь (мг'л) общая 0,016 (>200),
эритроциты 0,028 (?), плазма 0,03 (?, ~40% в спинномозговой
жидкости), сыворотка 0,009—0,027 (60); остальные значения—и 10 6:
мозг 0,001—0,04 (?, ж.); сердце 0,01 (66, с.); почка 0,01 (16, ж ), 0,01—76
(>200, с.); печень 0,007—0,15 (15, ж ), 0,026 (67, с ); легкие 0,06 (11, ж.),
0,14 (68, с.); мускулы скелетные 0,005 (6, ж.), 0,29 (15, с.); селезенка
0,03—75 (183, с.). Видна наибольшая концен грация Li в селезенке
и почках, а также в печени Основным накопителем его является
скелет, содержание в котором ~0,7—3 мкмоль/л при дефиците
и 14—29 мкмоль/л при избытке.
Воздух вода, техногенез
Данных по содержанию Li в атмосфере в литературе не приводит-
ся. В пылевых выпадениях содержание его для урбанизированных зон
составляет 33,8 мг'кг [176] при принятом фоновом содержании
0,5 мг/кг. ОБУВ для хлористого лития в атмосферном воздухе
населенных мест в нашей стране 0,02 мг/м3 [727].
Для бассейна Верхней Волги содержание Li в атмосферных осадках
в 1970-е годы было следующим (мкг/л): в растворенной форме 0,3, во
взвеси 1,7 при плотности выпадения 1,1 кг,м2-год (растворенных форм
0,17, взвеси 0,95) [590].
По сравнению со всеми остальными изученными токсичными
металлами Li имеет самый высокий показатель гидротоксифилыгости.
В океанической воде среднее содержание его 0,17 • 10-4% (при суммарном
содержании солей 4,9-10 4%), в речных водах (1,6—3)10 6%, а по
данным В. В. Гордеева и А П Лисицина—180 и 2,6 мкг/л, что близко
к ранней оценке А. П. Виноградова —150 мкг,л. Время пребывания Li
в океанической воде оценивается в 5,8 • 106 лет, т. е. больше, чем
у остальных щелочных металлов. Он сорбируется из морской воды
илами, глауконитом и биогенным веществом.
Несмотря на относительно высокие концентрации в некоторых видах
природных вод, Li не включен в число нормируемых в водах элементов
и мало изучен. По единичным данным X. Хокса и Дж. Уэбба (1962 г),
пределы его содержаний в природных водах от 0,3 до 3 мг/л, по
П. А. Уцодову, Е. Е. Беляковой, А. А. Бродскому и другим, Li типичен
среди пресных вод только для окислительной обстановки (5—10 мг 'л)
и обычно не обнаруживается в глеевых, восстановительных условиях. По
106
Б. А. Колотову с соавторами [350], среднее содержание »того элемента
в водах зоны гипергенеза более низкое—0,016 мг/л, а в водах рудных
месторождений оно изменяется от 0,21 мг/л в кислых водах (pH < 6,5) до
18,6 mi'л в щелочных (pH>7,5).
Повышенные содержания Li характерны для подземных материко-
вых вод. Самыми высокими его концентрациями отличаются глубин-
ные воды артезианских бассейнов (среднее 10,2 мг/л), термальные
воды современных вулканических областей (7,4 mi / л) и законтурные
воды нефтяных месторождений (до 18,3 mi /л). В термальных источ-
никах Курильских о-вов, по К. К. Зелснову. содержание его колеблется
от «Не обн.» до 2 mi , л, а максимальная концентрация в углекислых
подземных водах, по С. В. Крайнову, В М. Швец [366], достигает
320 мг/л; по их данным преобладающее состояние его в углекислых
водах Li24. LiCl0, LiSO4.
Распределение Li в различных типах артезианских вод показано
в табл. 23, 24.
Среднее содержание (мкт / л) в грунтовых водах зоны гипергенеза
определено А. И Перельманом в 14,0 при более высоком содержании
в водах континентального засоления (40,3) и низком в грунтовых водах
выщелачивания (7,41 ±4,7); минимальное фиксируется в областях
тропического и субтропического климата (2,2), многолетней мерзлоты
(5,03) и горных районах (6,03), а среднее (12,0) — в областях умеренного
климата [726 ].
Содержания Li (мкг/л) в поверхностных водах изучены для
бассейна Верхней Волги в 1970-е годы: водохранилища 1,5, реки —
Москва 2,2, Вазуза 2,0, Волга 1,5 (мировая оценка 1,0 [883]);
в грунтовых и подземных водах этой территории содержание 4,6
и 5,2 мкг/л; в речных взвеси 40 и илах 2, в золе водных растений
2,7 мкг/л (с.) [590].
Литий не относится к основным элементам-индикаторам при
геохимических методах поисков, однако отмечается при биогеохимиче-
ском опробовании А. А Ковалевским в шишках и коре сосен, а среди
элементов-индикаторов при поисках гранитных редкометальных пег-
матитовых месторождений и апогранигов он указывается в конце ряда
вертикальной зональности W—Nb—Na—Sn—Cs—Rb—Li—As [725].
В техногенезе, на предприятиях, выпускающих соединения Li, его
концентрации в воздухе рабочей зоны составляли от 0,01—0,46 до
0,7—0,8 мг, м3, а в условиях производства синтетических волокон
достигали 25—40 mi / м3, что превышает ПДКР, в десятки раз.
Применение Li в качестве ядерною топлива также может вызывать
экологические проблемы в соответствующих производствах. При
попадании обогащенных им природных и промышленных вод в источ-
ники и на поля растения, произрастающие на них, не пригодны для
использования.
Отмечается, что особенно крупные выбросы Li в атмосферу
происходят при сжигании твердого минерального топлива.
Я. М Грушко [231 ] выявил его также в выбросах при получении
107
керамики, стекла, эмалей, пластмасс, алюминия, продуктов opiэпичес-
кого синтеза, аккумуляторов, смазочных масел, ситаллов, бороводоро-
дов, фармацевтики, кондиционеров.
Выводы. Экогеохимически Li слабо изучен, хотя и является
активным полютантом. Он имеет самую высокую гидро экофи чьность
(ГЭФг=0,1) и может играть существенную роль в т идроэкосистемах.
Этот металл относится к среднетоксичным (Тл = 5. Тг= 10); LiCl —
высокотоксичсн (Т,= 10. Тг=100). Отт является микроэлементом со
слабо изученной биофильностью (Бф % 0.004?). высокой биоэкофиль-
постью, особенно морских организмов (ГЭФйлг10), и почвоэкофиль- •
ностью (ГЭФл=100).
Представляя собой лито- и тидрофильный элемент, он накапливается
в гранитоидах (Li-F и другие типы) и тинистых породах и образует
рудные концентрации в Li-углист о-т л инистых гидро гермалитах, ред-
кощелочнометальньтх околот тегматитовых мегасоматитах, Li-сподумено-
вых (В до 2700) и других редкомсталытых гранитных пегматитах,
грейзенах и гранитах, а также в подземных материковых водах, особенно
в глубинных Cl-Mg-Ca и угтекислых, а также в редкометально-соляных
рассолах и рапах озер (В до 16). ГЭЛ этих месторождений от 1 • 103 до
5-105; М = 250 млн т и Тх=2-107—высокие.
В глобальном геохимическом пикте концентрации Li в основном
связаны с процессами породо-рудообразования континентальной земной
коры и континентальной гидросферы. В магматическом цикле он
накапливается к концу процессов (В до 180—2700), в осадочном —
тесно ассоцтшрован с глинистой, особенно вулканогенно-осадочной
составляющей (В до 6). В гидрогеолотттческом цикле Li слабо участвует
в испарительной концен грации (В>0,1). В общегеологическом историче-
ском плане известна смена его рудных концентраций от самых древних
сподуменовых пегматитов докембрия, ли гиеносных грейзенов и идротер-
малитов фанерозоя (Ph) до современных Li-содержащих вод и рассолов.
Техногеохимия Li не изучена, а его наиболее высокие и подвижные
концентрации можно ожидать в продуктах и отходах некоторых
редкометальных (особенно при переработке гидротермальных руд)
и марганцевых ГОКов, а также в цементном, строительном, ядерно-
ракетном, микроэлектронном, химическом, алюминиевом и друтих
производствах. Общие геоэкологические показатели для Li — ОГЭ 30,
ГЭг 125 и ГЭС) >180—т. е. высокие.
НАТРИЙ—11
Самый распространенный среди щелочных металлов (кларк
2,3%*), общетоксичный (ПДКрз 0.5 мг м3, для NaCl ПДКВ 20 мт л;
всего нормируется >15 соединений; Т,= 1), главный биологически
важный, жизненно необходимый элемент.
* Литосфера без осадочною чехла [53]; кларк биосферы—1.9% [198 ].
биоса—0,02%.
108
Атом
Atom (2s2p',.3sl). Легкий щелочной металл, имеет один стабильный
изотоп 23Na, наиболее известны короткоживущие изотопы 22Na
(Т12 = 2,62 года) и 24Na. Содержание радиоизотопа 22Na в биосфере
незначительное (8 1013 Бк). как и общее количество 22Na на земном
шаре (1014 Бк).
В периодической таблице находится в 1 группе под Li и над К, по
горизонтали траничиг с Mg, по диаюнали с Са и Be, с которыми
проявляет большое 1 еохимическое сходство. Литофильный элемент,
близок также к К. но обладает более высокими энергетическими
и меньшими размерными показателями и щелочностью. Как и Li, Na
является кайносимметричиым иол нова лентным элементом, чем отлича-
ется от остальных щелочных металлов. Активно реагирует с О2, Н, S,
SO3, СО2, ОН. галот енидами, имеет высокую гидролизуемое! ь,
растворимость и степень ионности соединений, окислительные потен-
циалы и восстанови!ельные свойства. Характеризуется единственной
валентностью (I), средним для I периода размером катиона и большим
химическим сходством с Li (см. табл. 17), чем с К, Rb и Cs. Как ион
блатородногазового сферического строения с трудом замещается
халькофильными металлами. Типичны высокая гидро- и биофильность,
повышеная атмо- и ли гофильность, является одним из главных
элементов петро- и рудогенеза в эндо- и экзогенных условиях.
Минералого-геохимическая формула натрия Л97х3 для мантии
и O9UC] для верхней коры. Самое низкое количество его оценено для
моделей мантии (верхняя первичная протомантия 0,8% Na2O [53],
примитивная мантия 0,27—0,34% Na2O [749]); для протокоры Земли
содержание Na составляет 2,32% [53], Na2O—4,70% [372]; другие
оценки его содержаний (Na2O, %) таковы: для континентальной
гранитной оболочки 3,0, «базальтовой» 2,75, осадочной 1,8, общей
коры (литосферы) без осадочной оболочки 2,8—3,1 [53], общей коры
архейской 3,0 (верхней 3,3), гюслеархейской континентальной 3,1
(верхней 3.9. нижней 2,8%) [749] при близости оценок содержаний для
океанической (2,6) и континентальной 2,5% Na2O кор [793]. Более
поздние данные существенно отличаются (Na2O, %): континентальная
кора—гранитно-метаморфическая оболочка 2,71, грапулит-базитовая
3,32; океаническая кора — базальтовая оболочка 2,42; осадочная обо-
лочка континентальной коры 1,95, океанической 2,43 [857]. По
сравнению с литосферой (В=1) вернад гидросферы 0.4, живого
вещества 0,008, глинистых пород ~0.2. галолитов (NaCl) 8.
По основным глобальным природным и техногенным потокам
в биосфере Na распределяется следующим образом (г'год): выносится
с речным стоком /г-108, ассимилируется биологической продукцией
суши /г-108, мировая добыча и-107, выбросы от горючих ископаемых
/г-107 [198].
Динамика обмена Na и других щелочных металлов но У. Файфу
и другим исследователям [770] приведена в табл. 27. Видно, что
109
Таблица 27
Круговорот главных растворенных л-меэаллов в океане
Вещество Содовой привнос реками, л 1()24 г Общая масса вещества в океане, 1024 г Время накопле- ния общей мас- сы за счет рек, п 106 лет (с уче- том кру I сворота) Время пребыва- ния в океане, л • 106 лет (по осаждению)
Na+ 2,07 144 108 260
К’ 0,74 5 8 11
Mg2 + Са* + 1,33 19 15,4 45
4,88 6 1,24 8
Н2О 325 000 13 550 — —
время накопления Na до современной концентрации в океане за счет
речного стока составляет 70 млн лет, а время пребывания в океане
~260 млн лет.
Теоретическое исследование моделей глобальных геохимических
циклов Na, Са и Mg, проведенное Я. Шимадзу исходя из эмпирических
оценок распределения элементов Т. Барта и П. Поддерварга, показало
лишь суммарную подвижность элемента в соответствующих системах
и дало противоречивые результаты по направлениям геохимических
потоков и массам перемещаемого элемента [85].
В метеоритах Na сидеролитофилен; его среднее содержание (I г):
хондриты обыкновенные—Н 5700, L 6500, LL 6600, энстатитовые —
Е4 8200, Е516 5200, углистые—CI 5100, СП 3800, СП1 3500, ахондри-
ты— накдиты 2967, эвкриты 2800, ангриты 1929, говардиты 1900,
обриты 890, шассиньеты 816, уреилиты 300, диогениты 30; железо-
каменные мезосидериты 1558, палласиты 519 [668]. В лунных породах
его содержание таково (Na2O, %): реголит (среднее) 0,23, базальт 0,34,
анортозит 0,48 [107].
Минералы
Минералы Na широко распространены. На 1989 1. их было
известно 445: 247 силикатов, 31 карбонат и 1идрокарбонат, по
27 фосфатов и гидросульфатов, 14 сульфатов, по 13 фторидов
и оксидов, 17 боратов и гидроборагов, 7 сульфидов и гидросульфидов,
6 ванадатов, по 5 арсенатов, гидрофторидов, гидроксидов и другие
виды, в том числе 3 органических соединения, по 2 нитрата и хлорида
и др. Среди минералов Na много наиболее широко распространенных
породообразующих (Na2O, %): амфибол, полевые шпаты, нефелин,
t пункт (11,37), галит, криолит (32,8), глауберит, трона, Na-селитра,
тенардит, нитронит (селитра), мирабилит, давсонит, цеотиты, содалит,
а также ультращелочные уссингит, натрит, натросилит, олимпит,
натрофосфат, виллиомит и многие другие.
НО
Таблица 28
Главные минералы месторождений солен Na, К, Mg
Минерал Плот ность, г см3 Содержание, % Формула
Na К Mg
А' ю^иды
Галит 2,1—2,2 39,4 — — NaCl
Гйлрогалит 1,6 24,09 — — NaCl 2Н2О
Бишофит 1,6 — — 11.96 MgCl2-6H2O
Сильвин 2,0 — 51,17 — KCI
Карналлит 1,6 — 14,1 8,7 MgCI2 KCI 6Н2О
Тахгидрит С Т лъфаг пы и 5,8 х юрид CaCI2 MgCI2 12H2O о-сульфаты
Каинит 2,1 — 15,6 9,8 KCI • MgSO4 3H2O
Кизерит 2,6 — — 17,6 MgSO4 H2O
Лангбейнит 2,8 — 18,8 11,7 2MgSO4 K2SO4
Полигалит 2,7 — 13,0 4,2 MgSO4 • K,SO4 2CaSO4 2H2O
Глауберит 2,8 16,5 — — Na2SO4 • CaSO4
Астраханит 3 13,8 — 7,3 Na,SO4 MgSO4 4H2O
Гпазерит 2,6—2,7 6,9 35,3 — Na2SO4 3K2SO4
Мирабилит 1,5—2 14,3 — — Na,SO4 10H2O
Тенардит 2—3 32,4 — — Na2SO4
Эпсомит 2—2,5 — — 9,9 MgSO4-7H2O
Карбонаты, гидрокарбонаты. хлоридо-карбонаты
I анксю — 36,03 — —. 2Na2CO3 • 3Na2SO4
Нортупит — 27,73 — 9,76 Na2CO3 NaCl2 MgCO3
Нагрон (сода) 1,4—1,5 16,0 — — Na2CO3 • 10H2O
Трона — 30,5 — — Na2CO3 - NaHCO3 2H2O
Термонатрит 1,5 37,1 — — Na2CO3H,O Na6(CO3)(SO4)2
БеркСИт 2,6 35,4 — —
Нахколит — 27,37 — — NaHCO3
В группе соляных минералов наиболее легко растворимы (г/л)
галит (358,5), гидрогалит, нахколит, тенардит (190*), трона, аст-
раханит, а также сода природная (928) и мирабилит (НО; при
Г =30'С—1920); глауберит растворяется с выделением шпса. Состав
важнейших солей Na. К и Mg из современных и ископаемых
месторождений приведен в табл. 28 [256].
В силикатах Na наиболее часто является минералообразующим для
групп с низким отношением О/Si (2—2,8): в группе каркасных
силикатов 42 его минерала, сложных (неясной структуры)—41,
цепочечных, ленточных—40; несколько менее характерен он для
остальных групп: диортосиликаты—34, кольцевые—27, ортосилика-
ты— 15, слюдоподобные—24. хлоритоподобные—4 Наиболее часто
Растворимость Na2SO4 уменьшается с повышением температуры.
111
(кроме SiO) в силикатах встречается сочетание Na с А1 (каркасные,
сложные и др.), а также с Са, К, Mg, в гидрофосфатах—с А1, Са;
в гидросульфатах—с Mg, Al, К; гидрокарбона гак- с Са, Mg; фтори-
дах—с А1 [776]. Для силикатов типичен гетеровалентпый компен-
сационный и посреднический изоморфизм: Na + r±Ca2 + или
Mg2'=Al3 (Fe3 +) <* Si4 (татиоклазы, многие другие силикаты
и карбонаты) и изовалентный изоморфизм Na3<±K (К-Na полевые
шпаты и др.) [445]. При этом Na' согласно эмпирическому правилу
полярное!и как менее крупный ион должен охотнее замещать К'
в К.С1, чем наоборот; это же относится к паре Na«-Ca. Количественные
данные, основанные на критических температурах распада Na-K
твердых растворов в бинарных системах, свидетельствуют об увеличе-
нии взанмозамещений (с ростом радиуса общего аниона) в ряду
NaF — KF, NaCl — КС1, NaBr — KBr, NaT — KI. Экспериментально
доказано, что пределы изоморфизма увеличиваются с повышением
температуры и снижаются с увеличением давления, что установлено
для систем альбит NaAlSi,Os— ортоклаз KAlSi3OR и NaCl — КС1
[768].
Наиболее широко распространены (~ 50% массы верхней земной
коры) минералы группы полевых шпатов, которые являются членами
тройной системы Na [AlSi3OR]—Са [A12Si2Or]—K[AlSi3O8]
с крайними членами альбит (АЬ), анортит (Ап) и ортоклаз (Or).
Выделяют два изоморфных ряда: альбит — анортит (платиоклазы)
и альбит—ортоклаз (K-Na полевые шпаты). Минералы первого из
них—альбит (100—90 АЬ), олигоклаз (90—70 АЬ), андезин (70—50
АЬ), лабрадор (50—30 АЬ), битовнит (30—10 АЬ), анортит (10—
0 АЬ)—могут содержать не более 10% Or. Исключение составляет
альбит с широким изоморфизмом Na — К.
Полевые шпаты и плагиоклазы (ГЭл = п 10) содержат большое
число элементов-примесей (табл. 29,30). Геохимия этих минералов для
различных типов пород и месторождений подробно изучена [15, 77,
434, 436, 482, 622, 731 и др.]. Здесь сошлемся только на одну сводную
таблицу [731] величин кларков наиболее характерных элементов-
примесей КПП! (микроклина) и полевых шпатов из всех типов пород
(см. табл. 29). Необходимо также подчеркнуть, что с уменьшением
основности плагиоклаза в общем в них уменьшается содержание
элементов, близких к Са (Sr, В), и увеличивается — близких к Na
и К (Be, Rb, Cs, Pb, TI и др.).
По данным В. И. Кузьмина, В. В. Ляховича и других исследова-
телей, изоморфная емкость неупорядоченных минералов больше, чем
упорядоченных КПШ; в частности, значительно больше емкость
неупорядоченною КПШ в отношении Pb, W, Мо, Ва; при равных
условиях моноклинные разности будут обогащены тлементами-приме-
сями по сравнению с триклинными. Часто имеется связь с плотностью
минерала (Si О2)—чем она больше, тем меньше в минерале примесей,
а плотность чаще увеличивается к концу магматического процесса.
Большой фактический материал, подтверждающий большую емкость
112
Таблица 29
Генеральные оценки средних содержаний (г/т) малых и редких
элементов в плагиоклазах (I) н калиевых нолевых шла)ах (II)
Элемент I И Элемент 1 11
Li 15 15 TI 2 5
Rb 200 700 Pb 20 40
Cs 5 15 в 65 8
Ва 900 5000 Mo L5 0,5
Sr 1800 1500 Sn 1,7 1,5
Ga 40 30 U 10 9
Be 9 4 Th 4 —
неупорядоченных минералов, имеется по Ва, Sr, Pb, Cs. В ряде случаев
в породах, содержащих в основном упорядоченные полевые шпаты,
увеличивается содержание собственных минеральных форм W, РЬ.
Этим же объясняется потеря стеклами большей части элементов-
примесей при их кристаллизации. В плагиоклазах и полевых шпатах
гранитоидов содержание Li, Rb, Cs, Be, Pb, TI, F, Ga значительно
увеличивается с повышением кислотности пород от средних транито-
идов к биотитовым, аляскитовым и лейкократовым гранитам и от
автохтонных к интрузивным; для содержаний Sr, Ва, Мо, В, Sn
в плагиоклазах обычно отмечается обратная закономерность. Не
одинаково количество примесей и для неизмененных и измененных
(двуслюдяных и альбитовых) разностей, а также для ранних и поздних
комплексов гранитоидов и генераций плагиоклазов и полевых шпатов
[345, 731].
Полевые шпаты по химической устойчивости занимают обширное
поле от группы высокой устойчивости (анортоклаз), средней (альбит,
олигоклаз) до низкой (андезин) и очень низкой (анортит, битовнит),
тогда как по гидроаэродинамической устойчивости все они являются
самыми неустойчивыми в условиях поверхносгното выветривания
(группа весьма низкой устойчивости) [40].
Изучение коэффициентов распределения Кр элементов [15, 793]
между нолевыми шпатами и основной массой породы показало, что
для плагиоклазов и щелочных полевых шпатов их значения колеблют-
ся в широких пределах, а Кр>1 характерны для небольшого числа
преимущественно 5-мета л лов. Кроме основных минералообразующих
элементов это Sr в плагиоклазах (пл.) и щелочных полевых шпатах
(пш.) из основных, средних (хк =1,8 — пл.) и кислых пород (х = 6—
пл.; х = 9,4—K-Na пш.); Ва (х=б,6—K-Na пш. из кислых пород); Ей
(х=1,2—K-Na пш.; х = 2— пл. из кислых пород), а также иногда-РЬ
(Кр от 0,8 до 1,4; х=1 — K-Na пш. из кислых пород).
Среди других минералов Na отметим цеолиты, а среди них (по
мере снижения Si/Al): клиноптилолит Na6 (АЮ2)6 ’ (SiO2)30 24Н2О,
морденит NaIB(A102)B(Si02)4o'24H20, анальцим NaI6(AlO2)16 х
x(SiO2)32 • 16Н2О, филлипсит (К, Na)10 (А1О2)10 (SiO2)22-20Н2О
8 2138 113
= Таблица 30
Средние содержания элемеитои-примессй в полевых шпатах и других породообразующих минералах
мезозойских гранитоидных пород различных зон Восточного Забайкалья, г/т
Структурно-метал- логеническая зона4 Минерал Li Вс V Сг Со Ni Си Zn Rb Sr
Центр зоны
г Полевой шпат 30 8.5 2 8 0.1 1 5 0,4 140 —
(Sn. W) Биотит** 941 2,5 138 24 12 5 11 351 1241 —
Кварц 1 0,8 0,4 4,2 0,4 3 10 4 — —
Край зоны
Полевой шпат 30 2,9 3 6 0,5 4 25 Не обн. 139 545
Биотит 603 1,4 300 350 45 120 46 49 975 —
Кварц — 1 2 8 Не обн. 12 11 10 — —
п Полевой шпат 7 4 1 5 0.6 2 5 Не обн 199 —
(F) Ьиотиг 3164 1 50 10 7 Л 10 55 3148 —
Кварц — 1 1 4 0,01 3 7 10 — —
Полевой шпат 8 0.7 0,7 3 Не обн. 0.1 3 Не обн. 125 —
(Sb. Hg) Биотит 286 . 1 100 152 20 6 7 214 534 —
Кварц — 0.7 Не обн. 4 Не обн 0.4 3 Не обн. — —
и Полевой шпат 14 1 0,5 2 0,1 0,3 6 11 179 1591
(Pb, Zn. As) Биозит 397 0.3 114 41 23 32 5 418 720 894
Кварц — 1 Не обн. 2 0.5 0,3 3 Не обн. — —
* Здесь и далее стрелками показана направленность дорудных геотектонических перемещений земной коры_ ([—опускания.
[—поднятия). Зоны / переменного знака движении (опускания сменяются полня1ием); м устойчивые поднятия; Ц устойчивые прогибы;
переменного знака (поднятие сменяется опусканием) [285, 622].
* * Биотит может содержать до 4% Na.
• Продолжение табл. 30
Структурно-метал- логеническая зона* Минерал Zr Nb Мо Sn Cs Ва Та W РЬ
Центр зоны
Полевой шпат 3 8,2 0,5 2.1 44 220 0.9 1,1 66
(Sn, W) Биотит** 17 150,2 0,7 98,6 168 162 31.5 3 21
Кварц 14 — 0.1 6.2 — Не обн. — 1.5 4
Край зоны
Полевой шпат 10 10 1,7 3 15 1439 2.8 — 58
Биотит 20 66 3 9,2 90 200 10 — 10
Кварц 30 — 0,6 1,8 — Не обн. — — 3
г Полевой шпат 1 10 1.2 4 20 3 2,2 79
(F) Биотит 0,6 567 1 197 228 4 45 — 20
Кварц 10 — 0,5 1 — Не обн. — — 2
1. Полевой шпат 1 0,2 Не обн. Не обн. 3.5 166 Не обн. — 17
(Sb, Hg) Биотит 4 48,6 То же 8 32 166 7 — 5
Кварц 1 — » Не обн. — Не обн. — — Не обн.
u Полевой шпат 3,7 0,1 » 1,4 7,2 898 Не обн. 19
(Pb, Zn, As) Биотит 16 150 0,4 15 46,5 318 8 — 16
Кварц 3 — Не обн. Не обн. — Не обн. — — Не обн.
и комплексный (Mg, Са, Na, К) эрионит. В этом ряду, по Б. Беку [256],
объем пустот (%), способность к ионному обмену (мэкв/г) и от-
носительная кислотоустойчивость (В — высокая, С—средняя, Н — низ-
кая) соответственно составляют: 34, 2,54, В; 28, 2,29, В 18, 4,54, Н; 31,
3,87, Н; 35, 3,12, С. Все эти минералы состоят из тетраэдров [(Si,
А1)О4], объединенных в кольца. Из элементов-примесей для двух
первых характерны Са, К, Mg, для анальцима — К и Н, филлипсита —
Са, Ва, Sr, Mg, эрионита — Mg, NH4. Все упомянутые цеолиты
образуются при реакции поровых вод с вулканическим стеклом —
клиноптилолит и морденит в кислых породах, анальцим и филлип-
сит— в основных. ГЭМ первых п 10, вторых «102.
Как уже отмечалось, для плагиоклазов, а также биотита, мусковита
и других минералов, сформировавшихся в одноименных породах, но
в условиях различного геотект онического режима, установлены сущест-
венные различия в степени концентрации элементов-примесей (табл. 30).
Во всех случаях в блоках, возникших в условиях наиболее устойчивых
длительных вертикальных положительных дорудных и рудных (доинт-
рузивных и интрузивных) перемещений в PZ и MZ (| [) или при
комбинации поднятий и опусканий ([ |), концентрация Li, Rb, Cs, Be,
Sn, Ta, Pb в отмеченных минералах оказалась выше, чем в блоках
земной коры, формировавшихся с преобладанием опусканий (j j и | [)
В последних в этих же минералах преимущественно концентрировался
другой комплекс металлов (см. табл. 30) [285, 622]. Еще нагляднее это
видно при рассмотрении анализов породообразующих минералов из
конкретных одноименных типов пород из блоков земной коры
различного геотектонического развития [622]. Экзогенные, даже
промышленные минералы Na слабо изучены, обычно концентрации
элементов-примесей в катионной части для них не типичны (NaCl и др.).
Месторождения
Различают месторождения солей Na и его отдельных технических
минералов [256].
Ресурсы Na весьма значительны (» 150000 млн т.) Среди соляных
месторождений наиболее крупными масштабами запасов и переработ-
ки характеризуются Na-Cl минеральные (каменные) соли. Современная
мировая добыча галита превысила 150 млн т,’ в том числе в США >35
млн т и в нашей стране >23 млн т [256, 781 ]. Кроме того,
в значительных количествах (>2,5 млн т) добываются мирабилит,
тенардит, сода, трона. Добывают также натриевую селитру NaNO3,
а попутно—эндогенный криолит (NaAlF6).
Соли Na используются в самых различных отраслях. Например, из
галита получают более 1500 различных продуктов. Основное количе-
ство каменной соли идет в пищевую (~65%) и химическую промыш-
ленность. Для пищевой соли ГОСТами регламентируется наличие
влаги (до 0,5—6%), SO4 (до 1,5%) и других примесей. Нормируется
содержание следующих компонентов (%):
116
Сорт
NaCl ...........
Нерастворимые примеси
Са
Mg
Fe2O3
Экстра
>99,2
«0,05
Нет
<0,03
<0,005
Высший
>98,0
«0,2
<0,6
<0,1
Не
1
>97,5
«0,5
<0,6
<0,1
нормируется
II
>96,5
«1,0
<0,8
<0,5
Широко применяются искусственные Na-соединения— хлорат, карбо-
нат, сульфит и другие, а также металлический Na [128]. Цеолиты,
несмотря на новизну промышленного использования, весьма эффектив-
ны для дезактивации, очистки различных газов и жидкостей, получения
газов из воздуха, металлов из различных сред переработки нефти,
производства бумаги, цемента и т. д. Тф Na средняя (п-107).
Месторождения Na 'относятся к нерудным, в основном (соли)
имеют осадочный хемогенный генезис и принадлежит к гидро-
и литофильной геохимической группе, к ее щелочной подгруппе.
Запасы крупных месторождений измеряются миллиардами тонн;
запасы современных месторождений сезонно возобновляемы.
[алитовые руды связаны с древними соленосными бассейнами
(ископаемые залежи) и современными образованиями, к которым
относятся природные рассолы, соли солевых бассейнов и соляные
подземные воды. Наиболее мощное накопление солей приурочено
к эпохам тектонических движений платформенного типа, к завер-
шающим тектоническим фазам геологических циклов и происходит
при относительно Низком уровне мирового океана. Галогенные
формации образуются в условиях длительного неравномерного
прогибания, аридного климата и затрудненного обмена вод прибреж-
ных бассейнов с открытыми морскими бассейнами [735]. Солеоб-
разование началось в докембрии, но древние месторождения раз-
рушены. Наиболее интенсивное галогенообразо.вание отмечено толь-
ко в северном полушарии в перми (галит, соли К) и триасе (суль-
фаты Na).
В. С. Попов сформулировал геолого-генетические связи галогенных
месторождений Na, Mg, К с газово-нефтяными залежами — и те
и другие приурочены к некомпенсированным впадинам. Галогенные
месторождения образуются в регрессивную стадию в аридных услови-
ях [720]
Разработана геохимическая теория солеобразования и исследованы
особенности распространения редких металлов [61, 99, 735]. Современ-
ное солеобразование идет в жарком аридном климате в бассейнах двух
типов питания — морского и континентального. Соленосные бассейны
состоят из рапы, рассола и твердой соли, находящихся в подвижном
равновесии и относящихся к самосадочным возобновляемым полезным
ископаемым. Галит кристаллизуется после карбонатов и хлоридов Са
и Mg, а также ангидрида и гипса, а сульфаты и карбонаты
Na — последними, перед бишофитом (табл. 31). Важно, что чем меньше
и труднее растворимость соли, тем больше она распространена
в соляных толщах
117
Таблица 31
Нормальная стратиграфическая колонка океанических соляных
отложений и минеральный состав зон.
Составлена А. И. Перельманом [574] с использованием материалов Н. М. Стра-
хова, М. Г. Балтика
Зона Породообразующие, периодичес- кие и сопровождающие их постоянные минералы 11родукты диагенеза
6. Бишофитовая Бишофит, эвтонический бора т, карналлит, гексаг идрит- гстра- гидрит, галит, гипс, основные карбонты Mg Борацит, кизерит, ам ид- рит, магнезит
5. Карналлитовая Карналлит, гексагидрит (и другие гидраты до тетрагид- рата), галит, гипс, (иолига- лит), основные карбонаты Mg Кизерит (каинит), ангид- рит, магнезит
4. Снльвинитовая Сильвин, гексагидрит, (эпсо- мит), полигалит, галит, основ- ные карбонаты Mg Каинит, лангбейнит, ки- зерит, магнезит
3. Сульфатов магния Эпсомит, (гексагидрит), (ас- траханит), (поли! алит), галит, гипс, основные карбонаты Mg Галит, гипс, кальцит, основ- ные карбонаты Mg Кизерит, ангидрит, маг- незит
2. Галитовая Ангидрит, доломит, маг- незит .
1. 1йпс-ангидритовая Гипс, кальцит (араюнит) Ангидрит, доломит, кальцит
Примечание. В скобках—минералы, образование которых возможно на ограничен
ном участке развития данной зоны. * В
В соляных отложениях галит обычно ассоциирован с хлоридами
и сульфатами К, Mg, Са, бромидами, йодидами, боратами в разных
соотношениях (ГЭ от Г-102 до 2 -103>.
На примере галогенеза J3 Средней Азии установлено, что сульфаты
натрия (мирабилит, астраханит) доминируют (до 80%) для континен-
тального солеобразования.
Мирабилит образуется в современных рассолах и является сезон-
ным минералом.
В соляных залежах могут присутствовать ангидрит, гипс, карбо-
натно-глинистый материал, реже доломит, анкерит, магнезит, биту-
мы, оксиды и гидроксиды железа (и т. д.), а из редких токсичных
металлов — в основном Sr. В отличие от галита, элементы-при-
меси широко распространены в соленосных глинах (Li, Rb, Be,
В, Sc, TR, Zr, Nb, Та и др.) и в рапе (Li, Rb, Cs, Sr, W, В
и др.) [61].
Большое значение имеют давсонитовая и троновая минерализация.
Давсонит и другие содовые минералы, по А. А. Озол, формируются
в гидротермально-экзогенных условиях при выветривании алюмосили-
катов вулканических пород и наложении на них гидротерм, несущих
118
NaHCO3 и Na2CO3, в рифтогенную или континентально-орогенную
стадии: Залежи троны, термонатрита и сопровождающих их других
содовых минералов образуются при выветривании щелочных маг-
матитов, переходе Na в раствор и осаждении из него минералов
в условиях, сходных с таковыми для давсонита.
Кроме разработки собственно натриевых месторождений попутно
добывается эндогенное керамическое полевошпатовое сырье (керами-
ческие пегматиты и др. полевошпатовые руды), а также криолит
(щелочные граниты и другие образования).
Цеолиты, считавшиеся еще в 40—50 х годах слабо распространен-
ными минералами, в настоящее время имеют собственные месторож
дения (запасы крупных >100 млн т, мелких—до 10 млн г). Основ-
ная мировая добыча (~0,5 млн т) приходится на США, Японию
и страны ЕС. Наиболее широко распространены диагенетически-
осадочные цеолитовые руды MZ и KZ возраста. В морских кис-
лых туфах образуются клиноптилолит и морденит, которые могут
при повышении температуры переходить в анальцим. В условиях
аридного климата в соляных озерах, содержащих СО2 и НСО3
(pH >9), возникают филлипсит, клиноптилолит. Морские место-
рождения широко развиты в Японии, Италии, Венгрии, Мекси-
ке, Германии, открыты в Закарпатье (Сокирница) и Закавказье
(Айдагское, Дзегви и др.); озерные миоцен-плейстоценовые выяв
лены в западных штатах США, а также в странах Восточной Афри
ки [256 ].
На территории России и сопредельных стран соленакопление
началось в раннем докембрии и продолжается в настоящее время
Вначале (D, и ранее) соленакопление шло преимущественно на
Сибирской платформе (площадь 5 2500—3000 км2, мощность галоген-
ной формации //>2000 м). В дальнейшем распространенность галоген-
ных формаций различного возраста, по А. А. Иванову, Н. Л. Вороно-
вой (1972 г.), были следующими (5, км2; //, м): D2— Московская
синеклиза (S 15, h 75—85); D3— Припятский про!иб (5 26, h 3500—
4000); Pj — Прикаспийский (5 800, h до 2000), Южно-Предуральский
(.S’> 100, h до 1000) и другие бассейны; J3 — Среднеазиатский (5 200,
//>800) и др.; N — Предкарпатье (S 4—5, h 2000—2500), Тянь-Шань (S
до 25, h до 1000). Чем мощнее соленосные толщи, тем более полно
в них представлен соленосный комплекс: от Ca-Na гипс-ангидрит-
доломиговых до К карналлиг-бишофитовых [198]. Степень участия
солей древних галогенных формаций в процессе четвертичного
галогенеза зависит от глубины их залегания и других факторов
Выходы на поверхность соляных залежей в виде куполов и сопровож-
дающих гипс-аш идритовых пород особенно типичны для Прикаспий-
ской низменности. Обычно на 90—98% они сложены NaCl и перекры-
ты гипсовой шляпой — кепроком. По подсчетам В. А. Ковды, соляные
купола Прикаспия ежегодно отдают в окружающую среду ~3,5 млн
т солей, что сопоставимо со всем речным стоком солей в этот район
и вызывает засоление [198].
119
Рис. 9. Распределение и формы проявления галогенеза в различных чаидшаф-
тах:
/—11—соленакоплсние: 1—3—остаточное в пара- и неотпювиальных ландшафтах
денудационных и эрозионных равнин и птато (/—слабое, 2—умеренное, 3—интенсивное),
4—9— остаточное в сочетании с активным в неоэ иовиальных и супсраква вьпых
ландшафтах: 4—6—в областях транзита солей на пролювиальных и аллювиальных
равнинах, 7—9—на равнинах (4, 7—слабое, 5, 8—умеренное, 6. 9—интенсивное),
10—11 — активное в областях конечного стока (10— умеренное, 11—интенсивное); 12—
15 — преобладающий состав солей 12—гипс. 13—сульфаты натрия. 14— сульфаты
магния, 15—сода; 16 — массивы песков с локальным остаточным и акт ивным сотенакопле-
нием
Главные закономерности и формы галогенеза, по данным
М. А. (лазовской [198]. показаны на рис. 9 для разных ландшафтов.
Породы
Систематическое обобщение по распределению Na в породах
выполнил А. А. Беус [53]. Для пород нормального ряда oi ультраос-
новных к основным, средним, кислым и щелочным разностям его
содержание значительно увеличивается (табл. 32): от 0,06—0,18
(ультрабазиты) до 6,15% (нефелиновые сиениты).
Наименее надежны оценки для ультрабазитов в целом—кларк
2,0% по [857] и 0,7% по [546], а также дунитов—0,06% и перидотитов
0,18% (v=l,5—0,6), более обоснованы—для пироксенитов
0,53 + 0,10%; среднее для кимберлитов 0,30 + 0,08%, пикритов
120
Таблица 32
Распределение Na в породах континентальной семной коры, %
Магматические породы V V Метаморфические породы А V
Граниты 2,70 0,15 Кристаллические сланцы 1,43 0,31
Гранодиориты 2,74 0,10 Гнейсы (парагнейсы) 2,40 0,19
Кварцевые диориты 2,60 0,17 Амфиболиты 1 85 0,28
Диориты 2,54 0.15 Кварциты и песчаники 0,34 0,32
Сиениты Нефелиновые сиениты Базальты Габбро Пироксениты Перидотиты Дуниты 3,85 6,15 1,91 1,80 0,53 0,18 0,06 0,18 0,18 0,23 0,17 0,50 0,64 1,53 Карбонаты 0,15 Не опр.
Среднее Среднее дгя «г ракитной 2,63 > обо) 0,14 ючки Среднее 1 80 2,24 0,26 0,20
0,71+0,19% [53]; оценки для щелочных пород иконы (Na2O, %)*:
меймечиты до 0,2; щелочные пикриты до 2,5, среднее 1; мелилититы от
1,5 до 5; нефелиниты от 5 до 10 [439], щелочные ультрабазиты
карбонатитовых формаций — ийолигы 7,20, мельтейгиты 5,13.
В основных породах содержание Na также завися с от петрографи-
ческого типа (щелочности) и геологического тина пород. В целом, по
А А. Беусу, для базальтов и габбро генеральные средние оценки его
соответственно (Na, %): 1,91+0,14 (v=O,23) и 1,8 + 0,09 (v = 0,17) при
сходстве базальтов платформенных (1,87 + 0,14), гсосинклинальных
(1,95+0,13) и океанических 2,07 [53], по А. А. Ярошевскому базальты
океанов несколько беднее Na (1,8%), чем континентов (1,98%) [857].
По типам базитов среднее содержание также различается (Na2O, %):
континенты — толеиговые 1,81, известково-щелочные 2,87, K-Na субщс-
лочныс 4,02, шошанитовые 2,44; океаны и зоны растяжения—толе-
итовые 2,8, К Na субщелочные 3,5; щелочные основные породы 7,75;
спилиты 4,35.
В средних породах кларк 2,68% [857]; для диоритов и андезитов
генеральные оценки составляют 2,54 + 0,12 и 2,7 + 0,13% Na соответст-
венно, при этом в андезитах океанических областей 3,42%, а в трондье-
митах ~6,7%.
Индикаторное значение имеет отношение К — Na [427].
В гранитоидах по петрохимическим типам пород распределение Na
довольно равномерное (Na, %): т ранодиориты 2,74 + 0,09, кварцевые
диориты и тоналиты 2,60 + 0,16, граниты 2,70 + 0,04; то же отмечается
и для эффузивов: риолиты, липариты 2,60 + 0,06, дациты 2,70 + 0,06 [53].
Более контрастно распределение Na, по Л. В. Таусону, для геохи-
мических типов г ранитоидов (см. табл. 25). Почти во всех типах,
Na2O = 0,7419 Na.
121
Таблица 33
Средний минеральный состав (%) и отношения Na/К
в мезозойских гранигондах различных зон Восточного Забайкалья
Структурно-мета 1- яогеническая зона Породы Пла> ио- клазы КПШ Кварц Темноцвет- ные породо- образующие минералы Na/K
Граниты:
ТТ (F) нормальные 25,1 33,1 29,0 1,9 1,1
лейкократо- вые 30,8 38,1 29,3 1,4 1,2
IT (Sn, W) нормальные 25,4 37,5 30,0 5,5 1,1
лейкократо- вые 21,4 43.8 28,9 3,8 1,2
TI (Pb, Zn, As) Сиениты 53,9 17,9 0,7 23,8 1,5
Кварцевые сиениты 45,8 27,3 5,8 17,8 1,4
Граносиениты 42,1 29,8 16,9 8,5 1,3
11 (Sb, Hg) Кварцевые диориты 53,8 14,2 11,2 19,1 1 5
отнесенных к дифференциатам основных и средних магм, его среднее
содержание (в %) выше (трондьемиты 4,1, плагиограниты толеитовые
3,1, гранитоиды андезитовые 3,0, латитовые 3,4, агпаитовые ред-
кометальные граниты 4,0), чем в палингенных (плюмазитовые ред-
кометальные лейкограниты 2,8, граниты известково-щелочные 2,8,
палингенные щелочные 3,5, редкометальные щелочные 3,1) и ультраме-
таморфических (ультраметаморфические 2,8, чарнокиты 2,4. эндербиты
2,4, рапакиви 2).
Во времени в основных эффузивах содержание Na2O увеличивается
(ARt 1,7, PRi-2 2,0, Ph 3,7%), в гранитоидах—снижается (ARj 5,2,
PR! _2 3,8, Ph 3.4) [663].
В гранитоидах рудно-магматических систем, характеризовавших-
ся в пред-синмагматический период нисходящим режимом геотек-
тонических движений (Ц и Ц), содержание плагиоклазов — как
абсолютное, так и относительно КПШ — увеличивается, что наилуч-
шим образом видно для Восточного Забайкалья (табл. 33, см.
табл. 30) по минеральному составу пород и по отношению Na, К
[622]. Особенно интенсивно увеличивается кальциевость плагиок-
лазов.
В интрузивных массивах (кроме гранитоидных) Na почти исключи-
тельно накапливается в эволюционирующих расплавах и поздних
минеральных фазах [589].
В щелочных породах нефелиновой группы содержания Na более
высокие (в %): сиениты 3,35 + 0,22, трахиты 4,0 + 0,31, нефелиновые
сиениты 6,15 + 0,35, фонолиты 6,16 + 0,48, при этом для двух последних
концентрация его ниже в породах геосинклинального типа (соответст-
венно 5,54 и 5,3), чем в кратонах (6,70 и 6,2) [53]. В агпаитовых
122
нефелиновых сиенитах оно достигает 8—10%. В сиенитоидах различ-
ных типов среднее содержание Na существенно различается (Na2O, %):
псевдолейцитовые сиениты 3,20. миаскитовые 7,52, агпаитовые 12,0
[394]. В гранитоидах Na имеет отрицательную корреляцию с Si (см.
табл. 33), иногда с К, и положительную с Al, FeJ + , Мп [53]. В этом
отношении он противоположен К и имеет гораздо большую склон-
ность к солеобразованию и накоплению в водах и рассолах различного
происхождения. В огличие or остальных щелочных металлов, Na
наряду с силикатной нерастворимой формой нахождения в осадках
(55—69%) образует значительное количество (до 43%) ионно-обмен-
ных форм, наибольшее в морских осадках по сравнению с прибреж-
ными (29%) [570].
Осадочные породы большинства типов содержат гораздо меньше
Na по сравнению с распространенными магматигами и метамор-
фитами (Na, %): глины 0,84 + 0,16. глинистые сланцы 0,98 + 0,20 (кларк
глин и глинистых сланцев континентов 0,78% Na [857], пески
и песчаники 0,92 ±0,24, известняки 0,25 + 0,08, доломиты 0,27; современ-
ные океанические пелатические глины (включая поровый раствор) 3,30,
терригенные морские—лагунные глины 1,68, пески 0.77 [53]. В то же
время исключительно высокие концентрации его характерны для
эвапоритов и их поровых растворов (табл. 34). Концентрация натрия
(Na2O, %) в осадочных породах (сланцах) снижается от PRj (2,47) до
MZ (1,17 для Ph) [663].
Метаморфические породы имеют сложное распределение Na (в %):
в амфиболитах (среднее 1,85 + 0,10) оно соответствует габбро, в гнейсах
(среднее 2,40 + 0,16)—гранодиоритам; эклогитам (среднее 1,55 + 0,43)
и кристаллическим сланцам (среднее 1,43+0,15) свойственно бимодаль-
ное распределение: нслогиты из глубинных кимберлитовых выплавок
0,90, а из метаморфических пород 1,78; сланцы кристаллические от 0,58
до 2,0%, причем распределение Na подчиняется региональным, а не
временным зависимостям [53 ].
Таблица 34
Распределение Na в оса точных и эффузивных породах, %
Осадочные породы V V Эффузивные породы V V
Глинистые сланцы [лины Пески и песчаники Карбонаты Эвапориты [888 ] Поровый раствор [888] 0,98 0,84 0,92 0,25 31,2 1,05 0.52 0,44 0,59 0.72 Не опр. То же Базальты: платформенные геосинклинальные Андезит ы Дациты Кислые эффузивы Трахиты Фонолиты 1,87 1,95 2,74 2,70 2,60 4,00 6,16 0,18 0,12 0,20 0.17 0,20 0,21 0,17
Среднее 1.09 0.60 Среднее 2,42 0.17
123
Почвы, растения, животные
Натрий относится к подвижным катионам биосферы сильною
биологического накопления и повышенной биогенност и (Б,-= 0,54) [198].
Среднее генеральное содержание натрия в почвах 0,62% [574].
Поведение натрия в экзогенных процессах 1есно связано с О и SO4.
В аридных холодных районах (высокогорные пустыни Средней Азии,
Тибета, Якутии, Забайкалья) растворимость соды и сульфата Na
снижается и они остаются в почвах, в результате в депрессиях
накапливаются NaCl и MgCl2. При натриевом засолении Na+
вытесняет Са2+ и Mg2 + , и поглощающий комплекс приобретает Na
состав. Этот процесс называется осолонцеванием и характерен для
многих солончаковых почв, в то время как элювиальные почвы степей
и пустынь имеют существенно Ca-Mg поглощающий комплекс.
В солонцах поглощающий комплекс также имеет существенно Na
состав, и в почвах содержится сода (pH >8,5). Щелочная среда вредна
для многих растений (кроме черной полыни и других типично
солонцовых растений). В депрессиях солонпов концентрируется еще
больше соды. Типична она для лесостепей, северных степей, саванн.
Солонцы образуются не только при рассолении солончаков и при
формировании почв на морских глинах с Na поглощающим комплек-
сом. Сульфатжх: засоление и гипс уничтожают соду: Na2CO3 +
+ CaS()4«iCaCOa 4-Na2SO4. Взаимодействие натрия обменного ком-
плекса в засоленных почвах и корах выветривания с НСО3—Са
водами приводит к десорбции Na и формированию содовых вод
и солонцов. Поэтому орошение пустынь, сухих степей и др. засушли-
вых районов нередко приводит к вторичному засолению [574]
Кроме солонцов с преобладающим Na комплексом в нашей стране
много солонцеватых почв, в которых в обменном комплексе всего от
5 до 30% Na. Это солонцеватые черноземы, каштановые и другие
почвы, распространенные шире, чем типичные солонцы. Между
почвами и растениями происходит постоянный обмен Na, засоление
периодически сменяется рассолением. В общем, чем суше климат, тем
интенсивнее идут процессы современного соленакопления и тем
в большей степени сохраняются в континентальных отложениях
и в почвах реликты — гипсоносные, соленосные и солонцовые юризон-
ты, не связанные с современным уровнем грунтовых вод [198].
В пустынях и полупустынях со среднегодовым количеством осадков
100—250 мм при испаряемости 1000—2500 мм галогенез проявляется
повсеместно.
На примере Белорусского Полесья (тумидиые кислые почвы)
К. И. Лукашовым показано распределение Na в разных типах почв
и соотношение с ею содержанием в породах (%): дерново-подзолистые
почвы на морене 0,43 (морена 0,46), такие же на песках 0.22 (пески
0,24). а на эоловых песках 0,18 (эоловые отложения 0,18), перегнойно-
глеевые 0,30, торфяно-болотные 0,13, аллювиально-лхтовые 0,33. Для
полупустынных ландшафтов по И. В Иванову и др. [293] содержание
124
водно-растворимых солей в 2-метровом почвенном слое (%): светло-
каштановые 0,4. серо-бурые 0,5, солонцы серо-бурой зоны 0,9.
Натрий—биолотически незаменимый элемент, содержание его
в ортанизме млекопитающих, так же как К, Р, Cl, S, весьма высокое
и уступает только О, С, Н, N, Са. Кларк Na для биосферы 1,9% [198},
биоса 0.02% [726].
Биофилытосгь Na А. И. Перельманом определена как формально
низкая — 0,008 (К 0,12, Са 0,17). В живом веществе его содержится
в среднем 2 10 2 % (с.) [574]; несколько больше Na в организмах
живот ных (морские 40—480, наземные 40 мт /кг), чем в растениях
(морские 330, наземные 12 мг/кг), а в морском биосе намного больше,
чем в наземном; в бактериях среднее содержание 46 мг/кт. В планктоне
в среднем содержится 3,5% Na (Na/K = 3,5), в том числе в фито- 3,0%,
зоопланктоне 4,0%; во взвеси 4,0% [6771. Особенно много Na
в растениях-голофитах — водорослях, солянках (~0,5—2% на живую
массу, в золе бурых водорослей 12,3%, в лебедовых 19,5%). Среднее
для органики водорослей, по В. А. Ковалеву [329]—26,3 мг/кг.
В обычных сухопутных растениях содержание Na чаше составляет
п • 10“2% на живую массу. Данные по золе сильно расходятся (%): по
В А. Ковде — грибы 2,7, кустистый лишайник 3,5, лехи 2,5, хвощи 1,5,
плауны 0,9, дикие злаки 3,1, культурные злаки 1,8, крестоцветные 7,7,
бобовые 3,4; по В. А. Ковалеву [329]—лишайники 3 (и=112), мхи 4,6
(29), папоротники 2,4 (9), хвощи 2,4 (40), плауны 0,7 (4), голосеменные
0,6 (22), покрытосеменные 1,7 (282), двудольные 2,2 (660).
Зола растений по сравнению с почвами значительно обогащена Na,
поэтому им особенно богат гумусовый слой, из которого Na быстро
переходит в подвижное состояние. В связи с этим во влажном климате
почво-биокругооборот Na не имеет значения [574].
Биогенность Na при среднем значении 0,54 варьирует в разных
природных зонах: тундровая зона 0.038, лесная ~0,5 (древесная
растительность 0,13, травянистая 0,02; среднее для лесотундры 0,07);
степная 0,14; пустынная 2,4. В общем биотенность Na увеличивается
с севера на юг [198].
В пищевых растениях и продуктах средние содержания Na и К в це-
лом для нашей страны [797] следующие (мг/кг): пшеница 80 и 3230. рожь
40 и 4240, тритикале 50 и 3680, овес 370 и 4210, ячмень 320 и 4530, просо
280 и 3280, гречиха 40 и 3250, рис 300 и 3140, сорго 280 и 2460, кукуруза
270 и 3400, горох 330 и 8730, фасоль 400 и 11 000, чечевица 490 и 6330, нут
720 и 9680, соч 60 и 16070; мука 30—70 и 1220—3100, крупы—до 150,
в овсянке 350 Na, хлеб—от 2800 и ~ 1200 (сдобные пшеничные изделия)
до 6200 и 2020 (серый), 6100 и 2450 (ржаной). В молоке содержание Na
и К колеблется в незначительных пределах (мг/кг): коровье 500 и 1460,
овечье 260 и 198, верблюжье 700 и 1800; в цельномолочных продуктах то
же от 500 и 1460, в стерилизованном молоке до 320 и 950, гораздо выше
содержание в молочных консервах, в сыворотке сухой 11000 Na,
казеинате 15 000 Na, молоке сухом 4000 и 12000, сухом обезжиренном
4420 и 12240, сгущенном без сахара до 1240 и 3180; высокое содержание
125
в кашах молочных детских с рисовой мукой (644Х)—6800 и 4500—5600),
в сырах (Na — рокфор 19000, голландский 11000, сусанинский 7200).
В овощах и фруктах количество Na (мг'кг) невелико—60—300,
К—среднее—обычно 1000—2000, до 5680 (картофель). В мясных
и рыбных продуктах содержания Na таковы (мг/кг): говядина 730,
свинина 650, баранина 1010, телятина 1080, крольчатина 570; субпродук-
ты: мозги 1670, почки говяжьи 1040, то же бараньи 2000; более
высокие—в мясных полуфабрикатах: котлеты 500—5500, колбаски 6300;
в рыбе свежей 1000—2000, соленой 39000—48000. Для минеральных вод
его концентрации (мг'кг) следующие: Ессентуки № 4 2900, Арзни 2100,
Боржоми 2000, Нарзан 200, остальные 50—100. Отношение Na/K
в продуктах меняется в широких пределах—от 0,01—0,5 в злаках, муке
и крупах до 0,5—10 в хлебе, молочных и мясных продуктах.
У растений Na регулирует рост и развитие, у человека и животных
находится во внеклеточном пространстве, определяет химизм организ-
ма и крови и обеспечивает уровень осмотического давления внеклеточ-
ных жидкостей, нормальную работу сердечной мышцы, нервно-
мышечной возбудимости и др. [512]. При его избытке (>6г/сут)
повышается хрупкость сосудов, нарушается водный баланс организма
[109]. При недостатке (<1 г/сут) наиболее чувствительной оказывается
вначале нервная система, затем ухудшается общее состояние (слабость)
[574]. У животных Na антагонист К, антагонизма с микроэлементами
не установлено [312]. В отличие от К, Na является основным
элементом внеклеточной среды, составляя 90% всех катионов плазмы
и определяя химическое водно-солевое равновесие K. + ?±Na + в организ-
ме. В организм взрослого человека поступление Na с пищей
и жидкостями составляет ~ 4,4 г/сут, т. е. немного выше, чем
К (3,3 г/сут). Всасывание Na у человека в 5 раз больше, чем К. что
обеспечивает постоянный обмен между кишечником и кровью. Na и С1
равномерно распределяются по внеклеточным жидкостям, легко
диффундируя через оболочки капилляров, общее содержание Na
в организме ~ 100 г (0,14% массы тела). Значительная часть Na
у взрослого человека (~30%) находится в костной ткани
В различных средах и органах человека Na, по обобщенным
данным [931 ], распределен так (в скобках — число анализов; ж.— на
живую массу, с.—сухую): кровь (мг/л) — общая 1969 + 5 (> 1000), в том
числе эритроциты 284 + 0,2 (1217), тазма .3162 + 5 (3480), сыворотка
3251 1 Ю (2298); молоко 400 мг/л (>500); друтне оценки (п 10 6): кость
6970—14100 (> 20); моз! 1660—1800 (20, ж.): волосы 18—1720
(>1500), сердце 1700—1212 (15, ж ); почка 2000 (ж.), 10000 (135, с.);
печень 564—1735 (20, ж.), 5880 (92, с.); мышцы 730—1770 (60, ж );
ноггн 332—3010 (700); кожа 69—2039 (ж.), 3000—4000 (20, с.); зубы
5300—7500 (21). Основное выведение—с мочой и потом; Гб=11 сут
(99,9%).
В отечественной норме взрослый человек потребляет 4—6 г Na
в день: 2,5 г с хлебом, 0,5—1г с друтими продуктами. 1—3 г при
подсаливании пиши NaCl.
126
Воздух, вода, гехногснез
Содержание Na в чипом атмосферном воздухе над океанами самое
высокое среди всех металлов—3,5 мкг/м3 (Na/K = 20), как и в оке-
анических аэрозолях — or 0,6 до 2,4%, по С. Л. Шварцеву [7261,
а в среднем 2,3% (Na К = ~2), по В. С. Савенко [670], и коррелируегея
с С1. В воздухе над Южным полюсом содержание Na (нг/м3) 7 ±4,
в воздухе континентальных фоновых станций 140, крупных городов
мира 300. В промышленных аэрозолях оно достигает 8200 мкг/т,
в фоновых (для городов Сибири) 100 нг'м3 [481, 626, 654, 900|.
В средней океанической воде (соленость *> = 35%О, Cl = 19,37%,,)
содержание Na 1,08% (Na/K = 2,7) и уступает только количеств} Mg,
в речной воде—6,3-10 3% (Na/K = 2,7). Концентрация Na в морской
воде (г/кг) прямо коррелируется с соленостью (.S’, %„): 3,07 г/кг и 10%,,;
4,61 и 15; 6,15 и 20; 7,68 и 25; 9,22 и 30; 10,76 и 35; 12,3 и 40. Если
в морской воде соотношение элементов Na>Mg>Ca, то в континен-
тальных Mg < NacCa. Галассофильность Na самая высокая среди
металлов (Н~71, 1,8, Na~0,4) [574—578].
Существенное значение в биосферном круговороте Na, других
щелочных и щелочноземельных металлов и особенно NO,, НСО3, SO4,
Cl, NH4 имеют атмосферные осадки. По В. 11. Звереву, 1974 г., модули
поступления Na для нашей страны равны (т/км2 год): сухой климат
3,15 (Na + K), высокогорный 1,1—2,1 (Na), слегка влажный 1,5,
влажный 0,9, а общее поступление растворимых солей составляет
257,9 106 т/год [198]. Еще большую роль играет ионный гид-
рохимический сток солей. Его величина для океанов и внутренних
морей нашей страны, но О А. Акелину и Л. В. Бражниковой, 1964 г.,
составляет 514,4 10ь т/год, для Na +К ~37,8 • 106 г/год при общем
модуле стока всех солей ~ 24,8 т/км2 год [198].
Содержание Na в аэрозольной составляющей континентальных
фоновых территорий, по А. А. Волоху, 1991 г., таково (нг/м3): Восточ-
ная Сибирь 100, оз. Глубокое (Московская обл.) 250, Крым 330.
Интересно, что максимальное количество Na+ в атмосферных
осадках наблюдается под елями—0,13 г/м2, на полянах 0,11 г/м2,
а при прохождении осадков через покров озимой пшеницы достигает
2,2—4,7 кг/га [198].
Подсчитан [726] глобальный вынос Na и других металлов
в атмосферу с океанической поверхности (табл. 35). Происходит
постоянный круговорот Na между океаном и континентом, так как
приносимый океанскими ветрами Na в условиях влажною климата почти
полностью поступает в реки и доставляется обратно в оксан. Временно
выбывает из этого оборота Na, осаждающийся в лагунах, заливах (NaCl,
Na2SO4 и др ), а в аридных сухих зонах—в солончаках, солонцах,
соленых глинах, а также в поглощающем комплексе морских отложений
и т. д. По данным А. И Перельмана, в геохимическом цикле Na часть
его из тидрогенной и осадочной оболочек вновь поступает в зоны
зндогенеза, где образуются его гипогенные минералы (альбит и др.).
127
Таблица 35
Поступление металлов в атмосферу с новерхнос i и морской воды
Э теме» 1 х в морских брыз- >ах, мг/л Вынос в тропо- сферу брызг. Г/год Вынос в зерршен- ном веществе, т/год
Na 10500 5,25 106 6,3 106
К 1100 5,5 105 13,8 -106
Rb 8.2 4,1 I03 92 103
Cs 2,8 1,4 103 3,6 103
В поверхностных пресных водах содержание Na 4 К, по
О А. Алекину, составляет (мг/л): реки —oi 1,5 (Енисей, Красноярск)
до 18,8 (Лена, о. Кюсюр), а в среднем для шести крупных рек пашей
страны и Америки — 8,6+ 4,9.
Считается, что влияние морских бассейнов на состав атмосферных
осадков сказывается на расстоянии 200—250 км. На территории
бывшего СССР ежегодно выпадает 45—50 тыс. т солей океанического
происхождения [198]. Еще большая масса солей вовлекается в воздуш-
ную миграцию на суше в прямой зависимости от ландшафтных
особенностей и степени минерализации атмосферных осадков, которая
изменяется следующим образом (мг/л). лесные зоны 17—20, степные
40—50, полупустынно-пустынные 180. В областях современного вулка-
низма минерализация в среднем оценивается ~65 мг/л, но может
достигать 2000 мг/л (Na/Ca = 7), в промышленных районах 120—
160 мг/л. Средний модуль поступления Na с атмосферными (кадками
в пашей стране, по В. П. Звереву [198], составляет 1,29 т/км2 в год; для
различных климатических зон он таков (т'км2): зоны достаточного
увлажнения 0,92, недостаточного 1,50, сухие 3,15, высокогорные—от
1,13 (Средняя Азия) до 2,12 (Кавказ).
Наибольшее значение для перераспределения Na и других солевых
компонентов имеет гидрохимический сток. Суммарный солевой гид-
рохимический сток на территории бывшего СССР оценивается
в 514,4 -106 т/год, из них ~ 10% аккумулируется во внутренних
бессточных бассейнах. Для Na и К сток следующий (я -106 т/год):
общий 37,8, северо-западные моря (Балтийское, Баренцево, Белое) ~2,
северо-восточные ~20, восточные (Берингово, Охотское, Японское)
~3, южные ~8, Аральское и бессточные районы Средней Азии
и Казахстана 4,55 [189]. Общий баланс превышения выноса Na+ + К +
над поступлением составляет для бывшего СССР 6,6 106тгод;
коэффициент водной мобилизации Км (отношение массы солей в стоке
к массе солей, поступающих с атмосферными осадками) 1,2 [1981.
В подземных водах содержание Na более высокое, чем в поверх-
ностных, особенно в глубинных артезианских водах (табл. 36, см.
также табл. 10—13). В тектонических прогибах известны SOi-Na
(минерализация М до 70 г/л и более) и Cl-Na (М до 150 г/л и более)
рассолы, содержащие п • 10 г/л Na. Очень широкое распространение
128
Таблица 36
Содержание Na и К в различных типах глубинных вод, г/л
Район Na К Общая минерализа- ция, г/л
Украинский кристаллический массив (г. Хмель- ник) Волыно-Подольский артезианский бассейн, зоны вод: 0.049 0.018 5,31
умеренно подвижных (г. Черновцы) 1,4 0,24 5,6
малоподвижных (с. Фалемичи) 5,5 0,029 17,8
Молдавский артезианский бассейн (с. Мирное) 17,3 0,024 53,9
Прикаспий (Тарханская площадь), Cl-Na воды 82,4 0,95 246,3
Иркутский амфитеатр (Тангуйская скважина), С1-Са рассолы 101,7 2,64 311,9
имеют содовые воды (1 —1,5 г/л), обладающие НСОз (COj)-Na
составом (pH до 10) и образующиеся при выветривании альбита
и другими путями. Типичны реакции Сар.р + 2Na^ = Ca„ + 2Napl.p,
CaSO4TB+Na2CO3(p-p) = CaCO3TB + Na2SO4(p-p) и т. д. [366]. Содовые
воды, по А. И. Перельману, производят интенсивные катагенетические
изменения и обеспечивают миграцию SiO2, иногда Al, Cu. Be, Y, Zr, Se,
U, Мо и др. При изменении pH вод может формироваться анальцим
(4SiO2Al2OjNa2O-2Н2О), в также появляться концентрации Cu, U, Мо,
Y, TR, Zr, Be, Sc, Ag гидрогенного происхождения [574].
Основные формы нахождения характеризуемого элемента в подзем-
ных водах — Na+(96—99%), NaSO4(0,2—1,6%), а также NaHCO°
и NaCOJ [366].
По А Е. Бабинцу и К Е. Питьевой, самые высокие содержания Na
и К в подземных водах некоторых районов характерны для
хлоридно-натриевых и хлор-кальциевых вод с высокой общей минера-
лизацией (см табл. 36). Более подробные данные по распределению Na
и других щелочных металлов в различных типах хлоридных подземных
вод (см. табл. 23, 24) дают полное представление о влиянии химизма,
степени минерализации, температуры, pH на концентрацию Na.
Среднее содержание Na в подземных водах зоны гипергенеза
составляет, по А. И. Перельману, 45,5 мг/л при более высоком
(142 мг/л) в грунтовых водах континентального засоления по сравне-
нию с водами областей выщелачивания (14 мг/л). Для последних
повышенные содержания (в мг/л) типичны для умеренного климата
(~24) по сравнению с субтропическим (14) и полярным (~10) [726].
Техно- и экогеохимия Na изучены неполно, хотя известна его
определяющая роль в химизме окружающей среды и развитии
сердечно-сосудистых и других заболеваний (летальные дозы для
животных—см. табл. 26).
По модулю техногенного давления на биосферу Na вместе с Са, Fe,
Cl занимает самое высокое место—500—1000 кг/км2 в год, а по
9 2138 129
показателю общего техиозенного использования относится к третьей
(высокой) группе (Тх п 10я) [198].
По М. А. Ечазовской 1198], в последнее столетие к основным видам
человеческой деязельпости, которые в течение тысячелетий оказывают
влияние на концентрацию Na и других солевых компонентов (Са, Mg,
К и др.), прибавилось поступление их при добыче руд, угля, нефти,
а также искусственном синтезе солей для минеральных удобрений. При
этом самым мощным техногенным фактором галогенеза является
орошение почв, которое наряду с временным положительным воздей-
ствием па бионродукгивность вызывает вторичное засоление и осолон-
цевание почв, приводящее к образованию сульфатов, хлоридов Na
и соды за счет нарушения водно-солевого обмена и резкого снижения
биопродуктивности почв. По данным Н. Н Розонова с соавторами,
засолением в СССР было охвачено ~37% пастбищных земель,
~ 18,5% сенокосов и ~11% пашен. Большинство из них требуют
специального мелиоративного улучшения. Вторичное соленакопление
приводит к увеличению концензрации солей в речной воде. Гак, за
20—40 лет поливного земледелия в Средней Азии концентрация солей
в реках увеличилась с 0,2—0,4 г/л в 30-х годах до I —1,5 г/л в 70-х,
причем воды из НСОз-Са превратились в SO2-Ca-Na с высоким
содержанием хлоридов (Амударья, Сырдарья, Зеравшан и др.) [1981.
Увеличение забора речных вод привело к резкому понижению уровня
Аральского моря и образованию обширных солончаков. М. Ф. [лазов-
ский показал, что до широкого орошения земель в аридных областях
СССР соленакопление составляло ~290 млн т/год, а в 70-х годах по
мере его развития достигло 365 млн т/год [198].
Серьезную опасность может представлять радионуклид 24Na.
который особенно радиотоксичен в первые часы образования. Его ПДК
следующие (Ки/л): ПДК,„ 1 • 10 10, в воздухе санитарно-защизных зон
1 10 **, населенных пунктов 1 10 |2, ПДКвп 8 10 9 Он легко
всасывается организмом как из пищи (100%), так и из воздуха (75%)
и имеет биолоз ический ззериод полувыделения Ге 11 сут, эффективный
0,6 сут [27, 511]. Изотопы 22Na и 24Na возникают в верхних частях
атмосферы под воздействием космических частиц, при этом выделяются
высокоэнергетические частицы, представлязозцие вторичное космическое
излучение |381 ]. Установлено увеличение мощности космического
облучения (поток нейтронов, см'2-с ') с вьзеотой местности (в км):
0—0,5 км (прибрежные зоны и равнины) 8 10 3, 0,5—1,5 (предгорья)
1,7 102; 1,5 — 2,5 (альпийские луз а) 6,4 10 3; 2,5—4 (места обитания птиц
и растений) 1,8 -10“1; 10 км (микроорз анизмы. человек в ззолете) 1.4 [381 |.
Натрий и его соединения являются обычными для большого числа
производств и всех экогеохимических Na систем. Г1ДК„, 200 мг/л Na,
20 мг/л хлората. Хотя Na относится к общетоксичным металлам, ззо
Na2Cr2O7, NaAsO2, NaHF2, Na2O, Na2S, Na2O2, Na2SeO3, NaF —
сильнотоксичны, а цианистый Na — яд.
Показатели смертности (ЛД крыс, мг/кг), ПДК и ОБУВ (мг/м3),
другие показатели имеюзея для следующих соединенгзй Na: NaNj
НО
ЛДзо 45; NaAsO2 (сильнотоксичен) ЛД5() 1,17; NaHCOi (сода) ЛД5о 4420;
NaHF2 ЛД 2000 (морские свинки); Na2Cr2O? (хромпик) ПДКСС 0,0015, (I
класс опасности); NaBH4 ЛД50 160; Na2B4O7 ЛД$о 2660; NaBrO3
ЛДso 140; NaBr ЛД5о 3500: Na2WO4 ЛД50 1152, ПДК,.С 0,1 (III класс
опасности); NaOH (сода каустическая) ОБУВ 0,01; NaCO3 ПДКР, 2,
ОБУВ 0,04. ПКОС, 4,9 мг,м3; Na2S ПДКр10,2, ЛДюо 6; NaNO2
JlKso 0,0055 мг/л (при вдыхании), ПК„Р 0,00012 мг/л; NaSeO4 ЛДюо 4;
Na2SeO3 ЛД50 3: NaF ПДКмр 0.03. ПДКСС 0,05 (II класс опасности),
ПДКр10,2; Na3 [А11-«, ] ПДКмр 0,2, ПДКС<; 0,3 (II класс опасности);
Na2 [SiFoj ПДКмр0.03, ПДКи, 0,01 (II класс); NaClO3 ЛД50 596; NaCl
ПКяр 10 мг/м3 [231, 431]. Гибель гидробионтов (рыб и др.) наступает при
ЛК (г/л). Na2CO3 0,25; метасиликаг 3,2; фосфат 4; нитрит 10; сульфат 1.5;
хлорат 18 [128].
ПДК„ утверждены для многих других соединений Na для водоемов
хозяйственно-питьевого и культурно-бытового назначения (мг/л: в скоб-
ках— класс опасности): адипат Г (III): алкиламидомстансульфонат 0,5
(III); дибугилдитиофосфат 0,2 (II); и-диизопропилбепзола Na соль 0,5 (II);
монохлорацетат Na 0,05 (11); фосфорнокислый Na 3,5 (IV); фосфонагы
Na 0,5 (111); олефинсульфонат Cts- Си 0,2 (II), грихлорпропионат 1 (III);
другие соединения >1 (IV). ПДКрз (мг/м3; класс опасности) определены
для следующих соединений: хлорат 5 (111); хлорит 1 (111); сульфат 10 (IV);
роданистый 50 (IV); перборат 1 (11); метилдитиокарбомат (пи метилизоци-
анагу) 0,1 (1) [727]. Имеются также данные по ОБУВ в агмосферном
воздухе населенных мест (мг/м3): Na соль дихлоризоциануровой кислоты
0,03; оловянно-кислый Na (гидрат) 0,05; хлористый (поваренная соль) 0,15;
перборат 0,02; сульфат 0,10; триполифосфат 0,50 [727].
Высокие концентрации этих веществ к ержатся в выбросах многих
производств (получение Na, синтетических моющих средств, бумаги,
пестицидов, стекла, текстиля, органических соединений, свинца, цемен-
та, мыла, кожи, в химическом, металлургическом производстве и др.).
Особенно большие количества Na помимо природных процессов,
поступают в окружающую среду при добыче и переработке солей,
а также при сжигании твердых минеральных топлив и с городскими
и производственными стоками. Например, в талых водах снежного
покрова на окраине Москвы установлено до 5 мг/л Na, в центре города
на два порядка выше за счет использования NaCl против обледенения
дорог. Применение осадков промышленно-бытовых сточных вод как
удобрений повышает содержания Na в овощах в 2—3 раза.
Особенно большие массы NaCl выбрасываются при переработке
K-Mg солей, которые, попадая в водоемы, увеличивают концентрацию
Na до н(1()0 1000) мг/л. Использование Na для смягчения природных
вод значительно увеличивает уровень его содержаний в питьевой воде.
Выводы. Экогеохимически Na важен как главный жизненно необ-
ходимый (Бг среднее 0,54, до 2,4 в пустынях), общетоксичньш (Тл=1)
элемент, определяющий особенности многих гео- и биохимических
систем. Он относится к поцвижным в большинстве обстановок элементам
лито-, гидро- (ГЭФ, =0.4). биофильного (ГЭФ6=460) профилей, обще-
9* 131
токсичного (иногда сильно токсичного) влияния на организмы. Геохимиче-
ский круговорот его в значительной мере идет в растворимой форме
и охватывает все экогеохимические системы, а по времени обмен
наиболее краткосрочен в живом организме. Характерен уравновешенный
полный эндогенно-экзогенный цикл миграции и концентрации Na: породы
(почвы)—воды—атмосфера, магматиты—гидротермалиты В магма-
тическом цикле концентрации он характерен для шелочных, особенно
агпаитовых пород и руд и процессов альбитизации (В до 7), в экзоген-
ном—для процессов галогенеза (В до 20) и аридного испарительного
засолонения (Вги) Последний процесс типичен и для гидрогеологиче-
ского цикла Na, в котором предельные его концентрации создаются
в виде галита, тенардита, и других минералов (ГЭЛ 100—500)
В геоисторическом плане геохимический цикл Na тесно связан
с эволюцией гидросферы и активностью Cl, S и О2; в осадочных
породах его содержания от С до MZ снижаются, в почвах — зависят ог
ландшафтно-климатических условий. В региональном пространствен-
ном распределении эндогенные концентрации Na и К расходятся.
В техногенезе показатели Н и Тф самые высокие, Тх—средний. Во
многом Na определяет экологическое состояние экосистем особенно
агрохимических и образует крупные природные и антропогенные
концентрации и деконцентрации, влияющие на жизнедеятельность
растений и животных.
КАЛИЙ —19
Широко распространенный в земной коре (кларк 2,13%) и биосфере
(1,6%) щелочной металл, главный биологически важный, жизненно
необходимый, общетоксичный элемент—Тл=1 (см. табл. 1, 2, 8).
Атом
Атом К состоит из грех изотопов (распространенность, %):
стабильные 39К (93,08) и 41К (6,91) и радиоактивный 40К (0,0119).
Последний неустойчив (Т'1/2= 1,3 109 лет) и, захватывая 40Аг, превра-
щается в стабильный 40Са, что сопровождается 0- (1,32 МэВ)
и у-излучением (1,46 МэВ). Из короткоживущих радионуклидов в каче-
стве радиоактивных индикаторов используются 45 К и 43 К (Г1/2
соответственно 13 и 24 ч), а 42К (71/2=12,5 лет)—в химии, биологии
и др. Радиоизотопы 40К и 42К занимают второе место после Ra как
источники природного радиоактивного фона [381 ] и являются радио-
токсичными [27] (см. табл. 2).
Основное количество 40К поступает на Землю с метеоритным
веществом (частицы массой до 10“14 г), возможно также за счет
мантийного источника
В периодической таблице К (3J°2p6s*) расположен в I группе под
Na, в 4-м периоде, граничит с Са, а по диагонали—с Mg и Sr. Являясь
элементом 5-типа, он несколько отличается от Na и Li (см. табл. 17)
132
и особенно близок к Rb и Cs. Литофилен, валентность I, обладает
высокой щелочностью и большим размером катиона, типичными для
1 группы. Имеет высокие гидролизуемость и окислительные потенци-
алы, восстановительную реакцию (см. табл. 17). Активно реагирует
(более активно, чем Li и Mg) с О2 (оксиды, гидроксиды и др.), Н,
S (сульфиды, полисульфиды), галогенами, образует соединения с Р,
металлами (K.Pb2, KHg18, KZn13 и др.), а также хелатные, металлоор-
ганические соединения и др. Типичные комплексные соединения
неизвестны. Весьма характерны сульфаты, карбонаты и гидроксиды, но
особенно галогениды. Сферическое строение аниона препятствует
изоморфизму К с халькофильными металлами. Большинство соедине-
ний легко растворимы в воде. Свойственна высокая гидрофильность.
Однако в отличие от Na, растворимость большинства солей К не
является столь определяющей в его геохимии, для которой первосте-
пенное значение приобретает биологический круговорот, сорбция
и вхождение в сосз ав глинистых минералов и вообще легкое
сорбирование коллоидами [574].
Минералого-геохимическая формула для мантии Л93х7, для верх-
ней земной коры О96с4. Для моделей Земли самое низкое количество
К. определено в первичной мантии (верхняя мантия 0,3% К2О [53]),
примитивной мантии—0,018—0,02% К2О [749], в континентальной
протокоре Земли—0,175% К [53] или 0,62% К2О; другие оценки его
содержания таковы (К2О, %): в континентальной литосфере 1,8,
гранитной оболочке 3,2, базальтовой 1,9, осадочной 2,1 [53]; архейской
общей коре 0,9, верхней 1,8, послеархейской континентальной общей
коре 1,1, верхней 3,4, нижней 0,28 [749]; максимальные различия
предполагаются между океанической (0,6% К2О) и континентальной
(2,4% К2О) корами [793]. Установлена сходная направленность
изменений содержаний К2О (%): океаническая базальтовая оболочка
0,19; континентальная кора верхняя 2,89, нижняя 0,63; осадочная
оболочка континентальная 2,22, океаническая 1,29% [857].
В гидросфере К значительно уступает Na по всем параметрам (см.
табл. 6, 11 —13), а время его полного обмена в океане оценивается
в 11 млн лет. Кларковые отношения Na/K в оболочках Земли снижаются
от океанской гидро- (~29) и атмосферы (20) к океанической (4,3)
и континентальной коре (2.8), осадочному слою (0,9) и биосу (~0,06).
В метеоритах К также литофилен; его средние содержания (г/т):
хондриты обыкновенные—Н 1065, L 1080, LL 1580; энстатитовые—Е4
870, Es t( 710; углистые CI 510, СП 432, CI1I 500 [668]. В лунных
породах содержания гаковы (К2О, %): реголит (среднее) 0,16; базальт
0,10; анортозит 0,47 [107].
Минералы
Относительно слабо минералогенный элемент, вдвое уступающий
Na по числу минеральных видов—для К известно 222 минерала; среди
них 124 силиката, 20 гидросульфатов, 14 сульфатов, 10 гидрофосфа гов.
133
8 оксидов, 6 карбонатов и гидрокарбонатов, по 5 гидроксидов,
сульфидов, хлоридов и гидрохлоридов, по 4 фторида и ванадата, по
3 бората и гидробората, 3 арсената и гидроарсената, по 2 нитрата,
хромата, органических минерала. В их число входят многие наиболее
широко распространенные породообразующие силикаты (К2О, %):
полевые шпаты (ортоклаз и др.), глауконит (К, Na, Са)<| (Al, Fe, Mg)2 х
xSi4O10 (4,5—9,5), слюды, гидрослюды, лейцит К [AISi2O6 ] (21,5),
алунит КА13 (SO4)2 (ОН)6 (11.4), К-селитра KNO3, карналлит
MgCl2 КС1-6Н2О (~14,1), полигалит K2MgCa (SO4 ]4 2Н2О, каинит
KMg(SO4)Cl ЗН2О, лангбейнит K2Mg2(SO4)3, сильвин КО (51,2 —
см. табл. 28). Хлориды, нитраты и сульфаты служат промышленными
источниками металла, а некоторые силикаты — нерудного агро- и поле-
вошпатового сырья.
Повышенные количества 4ОК (Бк/кг) установлены в апатитах (44—
170), фосфоритах (230), а особенно в N-P-K (1200—5900) и Р-К (5900)
удобрениях [381 ].
Среди минералов К наиболее легко растворимы солевые.
Самый легко растворимый — карналлит; легко растворимы каинит,
сильвин (343,2 г/л).
Являясь сильно несовместимым элементом, К имеет низкие
Кр (<0,01) для большинства минералов, кроме биотита и флогопита
(> 1). Кр элементов-примесей в биотиге могут быть высокие для Sc. Сг,
Zn (> 10), Мп, Rb, Cs, Ва, In (2—8 — по единичным пробам из даци тов
и риолитов) [793].
Среди силикатов К особенно характерен для мног их слюд
и слюдистоподобных минералов (O/Si ~ 2,5, [Si2O.s ], в более половине
силикатов этой группы), в которых он ассоциирует (кроме Si) с Al, Mg,
Са, Na, Fe, Li и др. Характерен как гетеровалентный изоморфизм —
K + <±Mg2+ (Fe2 + ) или Са2+=А13 + (Fe3 + )<=rSiO4, так и изовалентный —
K + ?±Na + . В сульфиде К—джерфишерите установлен С1.
Особенности химического состава КПШ и плагиоклазов полнее
охарактеризованы без разделения на отдельные минералы лих групп
[437, 519, 731 и др. | (см. табл. 29, 30). При систематическом изучении
КПШ установлено [519], что Al/Si упорядоченность в пределах единых
комплексов возрастает от безрудных к рудоносным породам; для
микроклинов рудоносных пород характерны несколько повышенные
количества Мп (> 50 г/т) и пониженные РЬ, для ортоклаза соотноше-
ния обратные (Мп 10—40 г/т, РЬ>100гг). Ga и 11 накапливаются
в КПШ гидротермальной стадии (>50 и >10 г/т), часто в них
Sr/Ba>l; повышенные концентрации Ва (>0,2%) и Sr (>0,03%)
отмечаются в КПШ, развитом по породам основного и среднего
состава, минимальные—в перекристаллизованных породах. Показано
также, что в кристаллах КПШ при больших увеличениях выявляются
включения слоистых силикатов. Экспериментально установлена от-
носительно высокая устойчивость ортоклаза в сухих системах (вплоть
до Р 10000 МПа) и способность образовывать при высоких давлениях
твердый раствор с альбитом.
1.34
Наиболее обтащен элементами-примесями биотиг (ГЭ=1-10’),
состав и структура которого весьма благоприятны для вхождения
различных элементов. В особенно высоких количествах в нем (кроме
минералообразующих элементов) могут содержаться TiO2 (до 13% —
ферривотанит), ZnO (до 23% — хендриксиг), а также Cs. F, Li, Cr, TR,
Ba [344, 437, 519, 731. 836]. Генеральные оценки средних содержаний
элементов в биотите, Fe-K и Mg-K слюдах для разных типов пород
и гранитоидов приведены в габл. 37—40, по В. В. Ляховичу,
Т Т. Ляхович [437] и др. К этому аналитическому материалу
необходимо добавить, что все выводы, сделанные относительно
закономерностей распределения элементов-примесей в Na «.-содержа-
щих силикатах, относятся и к биотиту (см. также табл. 20,30). Кроме
того, для биотита гранитоидов установлено, что с повышением
химического потенциала К увеличивается концентрация F и снижается
глиноземистость, параллельно росту железистости и глиноземистости
повышается содержание Sn, а количество Си и Sc прямо пропорци-
онально железисюсти и обра!но—магнезиальиости, содержание Rb,
Cs обратно пропорционально железистости, a Li — прямо пропорци-
онально [437]. Выявлено также, что биотиты рудоносных гранитов
часто имеют меньшее количество флогопитовой молекулы, а иногда
повышенную глиноземистое 1 ь [437, 344].
Таблица 37
Среднее содержание редких н рудных элементв в бишиге
из пород различного состава, г/ г
Элемент Гранит ииды Щелочные породы Основные породы С’ ганцы Параг пейсы
Ni 27,0(555) 209,0(31) 296,4(32) 249.0(101) 279.5(145)
Li 776,3(1255) 452,7(3) 76,0(4) 279,5 (58) 263,0(52)
Сг 40,8(220) — 942,7(26) 425,5(71) 850,0(167)
Sc 46,8 (412) 11,8(10) 25.0(10) 39.8(70) 390,0(149)
Cs 79,0(634) 219,7(62) 23,6(1) 24,3(11) 17,9(4)
Со 34.5(580) 13.8(49) 55,3(30) 94,2(87) 88,9(145)
Sn 42,6(2180) 46,6(116) — 13,6(4) —
V 135,4(250) — 320,0(30) 437,5(70) 878,2(164)
F 8620.3 (887) 8929.3 (82) — 4531,8(22) 2503,5(28)
Nb 164.3(1502) 375,3 (29) 99,3 (4) 52,3(58) 88.6(142)
Zn 378.2(995) 470.2(5) 168.4(29) 62,9(7) —
Ta 17,0(798) 22.7(24) 7,3(3) 5,5(4) 4.1(1)
Rb 906,2(1329) 1014.5(103) 420,0(4) 437,0(80) 491,0(106)
Au 0,02(568) — 0,0116(8) — 0.0086(5)
Mo 4,2(743) 5.4(36) 3,2(15) — —
'W 5,0(489) 2,1(5) 0,8(2) — —
U 8,3(74) 10,0(5) 6,8(1) — —
Cu 43,0(933) 3.0(4) 49,0(37) 42,2(69) 26,7(139)
Ag 0,1(302) — 0.06(1) — 0,12(1)
Ba 1554,6(177) 3419,6(31) 1010,0(22) 787,6(70) 2343,0(159)
В 30,6(117) 14,9(3) — — —
Ga 39,5(835) 338.1 (15) 60,2(23) 18,7(76) 20,2(155)
135
Продолжение табл. 37
Элемент Гран итои ды Щелочные породы Основные породы Сланцы Парагнейсы
РЬ 38,1(699) 69.8(30) 26,9(12) 150 0(16) —
Вс 5,6(1113) 3.7(76) 0,3(1) 3,2(7) 0.7(142)
Zr 175,3(154) 377,6(15) 88,7(23) 132,0(70) 165.9(164)
Sr 124,7(149) 1042,1(16) 106,7(15) — —
Y 28,2(33) — 15,0(2) 39.5(54) 34.8(141)
Примечание Здесь и далее в скобках указано число анализов, из которых
выведено среднее.
Таблица 38
Средние содержания редких и рудных элементов в биотите
гранигоидов, г/т
Элемент Диориты—гранодио- риты Граниты биоти- говые 1раниты лейкократо- вые, аляскиты
Li 330,3(297) 887,7(894) 1289,1(64)
Cs 34.0(64) 81.9(537) 118,0(33)
Sc 50,3(32) 45,7(373) 86.3(7)
Sn 33,0(87) 41,7(1892) 69,4(101)
F 354,89(76) 7470,4(701) 21659.2(110)
Nb 97.1(102) 167,1(1346) 222,5(54)
Co 40,5(23) 34,2(556) 50,0(1)
Zn 218,0(91) 372,2(865) 884,3(39)
Ta 9,4(43) 17,4(711) 17,7(44)
Rb 509,0(325) 998.1(959) 1811,3(45)
Au 0,0326(203) 0.0130(325) 0,0081(40)
Mo 2.8(80) 4.2(637) 8,0(26)
Ni 32,3(25) 28,0(459) 19,5(71)
V 208.8(14) 131,0(235) 140.0(1)
Th 82.0(2) 55,1(52) 190,0(2)
W 3,5(62) 5,2(335) 6.4(22)
TR2O3 1011,8(33) 812,8(154) 1050.0(2)
Ge 1,9(25) 4,6(190) 3.5(2)
U 6,5(4) 7,9(67) 21.7(3)
Tl 4.6(6) 3.2(144) 4,4(2)
Cu 33,0(52) 43,8(872) 11,8(9)
Ag 0,1341(87) 0.1009(202) 0,0984(14)
Ba 1647,2(9) 1678.5(135) 1022,5(33)
В 12,1(10) 32,9(105) 4,0(2)
Ga 43,7(33) 39,5(800) 2,4(2)
Pb 28.1(76) 38,8(591) 50,0(32)
Cr 47,3(12) 40,5(207) 3.0(1)
Be 2,3(29) 5,6(1058) 8,1(26)
Zr 157,0(10) 178,2(142) 63,0(2)
Y • 28,2(33) —
Sr 75,0(8) 172,5(141) —
136
Таблица 39
Средние содержания некоторых длемеитов-примесей в биотите
выеокомс! аморфитованных пород амфиболитовой (I)
и грану лит овон (11) фации
Компонеш Кристаллические сланцы 1нейсы
I II I II
MnO 0,08 0,03 0,07 0,02
TiO2 1,55 2,95 2,7 ±0,1 3,9+ 0,8
BaO 0,24 0,44 0,3+ 0,1 1,3+ 0,5
Co 86 82 78±2 77±6
Ni 279 308 240 + 7 287 ±7
Cr 410 455 381 + 12 543 + 8
V 311 460 448 + 25 730+190
Zr 65 47 103 ±20 84 ±25
Sc 15 16 34±19 24±2
Y 26 43 33 ±15 24± I
Nb 91 83 97 ±8 123 + 95
Cu 21 11 23 + 7 21 + 10
n 26 29 91 125
Примечание. Содержание Мп, Ti, Ва — в %, остальных тлементов— в г/т
Таблица 40
Средние содержания элемен гов-лримесей в K-Fc и K-Mg слюдах — лепидомелане
из карбона гигов щелочного комплекса (I) я ф.ниппиге из карбона гигов
в п.загиогнейсах и серпентинитах (11), г/т
Элемент 1 («=51) II (n 13) Элемент (n = 51) II («=13)
Ti 22 504 3023 Rb 538 621
Mn 2908 6160 Cs 7 14
Ba 3352 — Zr 94 207
V 325 115 Nb 321 55
Cr 72 532 Zn 347 348
Ni 28 458 Pb 8 6
Co 18 .30 Ga 53 32
F 4681 34950 Sn 4 9
Li 76 97
При изучении состава биотитов из высокометаморфизовалных
пород России (четыре провинции) установлены различия содержаний
элементов-примесей. связанные как с породным субстратом, так и со
степенью метаморфизма [379]. В общем во всех породах гранулитовой
фации по сравнению с амфиболитовой увеличивается количество Ti,
Ni, Cr, V, Ва и снижается — Zn, Sc, Y (см. табл. 39).
Для карбонатитов Е. М. Еськовой (1986 г.) выявлено закономерное
увеличение средних содержаний в биотите Mn, Li, Rb, Cs, Nb, Zr, Zn,
137
Таблица 41
Содержание элементов-примесей* в мусковите, г/т
Тип пород, руд Li Rb Cs Т1
Гранш оиды 5—6348 400—8400 Си,—564 6—40
Гранит: мусковитовый 977(100) 230—4500 1987(99) 1480—6100 109(85) 50—400 23(3)
двуслюдяной грей ионизированный 1164(14) 173—4500 1168(22) 400—1100 2041(12) 520—8300 1614(20) 1600—1850 167(12) 5—400 87(19) 5—250 —
редкометальный (апогранит) Грейзен 840(5) 497—6348 2189(38) 10—2530 1750(3) 550—8190 4274(38) 120—4730 138(3) Q -564 218(33) 0—376 2—10 5 3—27
Пегматит В том числе: керамический и слюдяной редкометальный Жилы кварцевые Сланцы 562(47) 0—6780 609(509) 0—1075 142(37) 23—6800 992(163) 40—3540 735(128) 19—950 2077(47) 90—25840 "2500(675) 45—5900 1900(45) 400—26000 3935(159) 35—6000 1920(124) 50—2000 45(39) 0—7614 291(302) 0—7614 118(200) ' 12—7614 353(88) 3—140 56(Г19) 77—180 10(20) 2—58 12(41) 3—6 4(3? 4—30 17(10) 3—16 10(12)
Гнейсы 333(15) 0—206 100(38) 726(5) 35—2000 567(38) 142(3) 0—800 338(6) —
Са и уменьшение—Ti, Ва, V, Cr, Ni, Со от ранних типов к поздним.
Флогопит из карбонатитов, залегающих в серпентинитах, по сравне-
нию с находящимися в щелочном комплексе характеризуется более
высокими содержаниями F, Li, Rb, Cs, Mn, Cr, Ni, Zr и значительно
более низкими—Ti, V, Nb, Ga (табл. 40).
Состав биотитов зависит не только от типов пород, но и от
истории геотектонического развития районов их распространения (см.
табл. 30).
Биотит кор выветривания довольно легко изменяется. По
Л. А. Матвеевой, вынос К2О, Na2O, MgO при воздействии на биотит
разными растворителями за 1 сут следующий (мг/л): вода 8.9, 2,9, 1,0;
фульвокислота 16,8, 4,3, 10,0; гуминовая кислота 9,0, 5,5, 2,7; соляная
12,7, 2,5, 8,0; винная 9,4, 2,2, 12,6; лимонная 9,4, 4,3, 13,4. Процессы
разложения биотита и других минералов усиливаются во влажном
138
Ga Та Nb Be Sn Mo Sr
29—280 2—53 9—281 5 — 100 0— юоо C'i.—4 0 -840
166(7) 20(87) 114(80) 23(57) 210(68) 1 -5 36(53)
6—46 60—250 10—50 18—600
22(11) 132(12) 28(10) 140(8)
2—49 9—230 5—12 20—600 1
17(31) 107(31) 12(9) 175(24) 1(2)
10—53 100 250 9—60 70—1000 1
21(10) 167(3) 22(167) 416(6) 1(2)
210—280 8—43 60—281 17—100
250(5) 19(16) 109(16)
20—700 1—38 4—1280 5—500
173(20) 11(30) 224(10) 50(19)
30—430 0—295 10—708 1 — 100 1—3960 1 2—150
168(24) 35(182) 147(184) 27(214) 360(189) 1(2) 25(170)
30—160 0—140 10—250 1—30 1—800 2—150
85(15) 18(44) 85(45) 5(195) 89(84) 25(161)
200—430 8—295 35—708 14—60 40—1700 10
338(7) 58(139) 245(137) 31(19) 490(66) 10(5)
40—150 15—17 3—130 60—200 6—60 10—40
92(20) 16(19) 20(8) 198(60) 23(19) 18(9)
1 — 16 6—1600
4(16) 245(15)
5—9 10—70 3—12 7—23 3—200
• 7(7) 30(7) 7(14) 13(7) 58(23)
климате, при свободном поступлении растворителей, органики и при-
водят к образованию остаточных каолинит-гидрослюдистых кор
выветривания, лишенных почти всех подвижных компонентов [198].
Мусковит и его мелкозернистая разновидность серицит также
являются концентраторами многих элементов-примесей [344, 437, 731,
836]. Известны хромовые (до 4,8—6% Сг2О,— фуксит), марганцевые
(2,3—3% МпО). бариевые (до 10% ВаО—эллахерит), магнезиальные
(гюмбелит), литиевые (3—4% Li2O—трилитионит), ванадиевые (до
28% V2O3— раскоэлит) разности, а также ферримусковиг, богатый
железом [359], теоретическое содержание К?()— 38,5%. Для калиевых
триоктаэдрических слюд М. Ридер установлены главные типы замеще-
ний октаэдрических казионов: Mg—Fe2 + и Fe3 +—(Li, Al); изоморфизм
снижается при росте содержаний Fe2"1 и благоприятен при увеличении
количеств Mg и Li, Al, причем (Li, Al);Fe2+= 1:1. Генеральные^оценки
.139
Продолжение табл. 41
Гии пород, руд Ва Сг Си Rb Zn
Гранитоиды Сл.— 890 Сл.—500 3—100 0—80 80—450
Гранит: 57(59) 119(9) 18(23) 37(83) 275(29)
мусковит овый — — 3—30 14(4) 30 300—450 387(4)”
двуслюдяной — — 3 — 100 34(6)” 0—70 50(5) 200—450 362(6)”
I рейзенизированный — — — — —
редко метал ьи ы й (апогранит) ~— — — — —
Грейзен — — — — —
Пегматит В том числе: 10—9800 741(163) 2—146 Тб(14) — 7—390 50(94) 38—300 148(23)"
керамический и слюдяной 10—10000 ”882(156) 2—10 4(6) 7—390 51X94) 38—190 72(22)
редкометальный — — — - 300
Жилы кварцевые Сланцы 120—140 ”271(20) 390—1180 13—32 24(3) 10—330 — 9—100 38(20? 100—600 442(19)
Гнейсы 990(10)” 300—2000 131(14) 5—200
1020(11) 81(27)
♦ Кроме тою, установлены (среднее, г'т): Ge—грейзены 12 пегматиты 6; In —
граниты 0,06, грейзены и пегматиты 3; Sc пег Мп 122—2036 [133]. матиты 81; сланцы — Zr 99 —208; Ni 8—28.
средних содержаний остальных элсмснтов-примесей в мусковите
приведены в табл. 41. В отдельных типах месторождений (для
мусковита) наряду с изоморфной формой типична примесь микрофаз
собственных минералов некоторых элементов (Sn, Мо и др.). На
.широкий круг элементов-примесей проанализированы слюды Cr-V-Li
метасома I итов Онежского прогиба [482] (табл. 42). При выветривании
мусковита многие элементы, и в частности Be (см. табл. 53).
выносятся.
Широкораспрост раненные слюдистые минералы из i руппы гидро-
слюд (иллит, глауконит и др.) практически не охарактеризованы на
элементы-примеси. И. В. Николаевой (1978 г.) для высококремнистых
слюд типа глауконита (Si —K«=>R3+- R2+) установлен изоморфизм
3R3+ — 2R2 + , общий для слюд в целом. В отличие от слюд группы
мусковита, в этих минералах проявляется совершенный изоморфизм
Fev/ —► Alvi*, двухвалентные катионы образуют мипал (Mgo.? Еео.зН.о.
тогда как в гидротермальных слюдах они легко замешают друг друга:
Mg2 + ->Fe2 + . По преобладающему октаэдрическому катиону выделе-
140
Таблица 42
Содержание г.тсмсн овч1рнмееей в светлых слюдах
CT-V -Li-слюдитов, г/т
Минерал п Rb Li Cs Zr Nb Y Yb Be
Тайниолит 3 390 11450 2 4,5 1,7 — 0,5 3,5
Хромовый фен гит 5 500 3700 20 84 4 23 12 70
Роскоэлит 4 535 1900 20 80 5 1,6 13 28
Продолжение табл. 42
Минерал В Sn Rb Bi Ag In Cu Zn
Тайниолит — 1,5 4 0,25 3,1 0,3 260 200
Хромовый 140 2,2 95 5 2 0,6 80 700
фею и г Роскоэлит 70 3,2 140 1,4 3 0.8 65 340
Продолжение табл. 42
Минерчл Ga Ge Sc Ti V Cr Mn Co Ni
Гайниолит <1 <1 <1 130 370 890 70 6,0 10
Хромовый феш ит 33 7 34 1900 3000 5 - 104 190 8 160
Роскоэлит 27 5 22 2070 5 10“ 3000 260 12,5 210
Примечание. Содержания Rb, Li, Cs определялись методом пламенной фотомет-
рии, остальных лементов — методом атомно-эмиссионного количественного спектрального
анализа.
ны: Ье3 +—тлауконит, AJ—сколит, MgFe2 +—булайит, Mg—селадо-
нит. Fe21 (без названия). Теоретический состав — катионы R3 +
1,7—2ф. е.. R2 + 2,5 ф.е.
Сульфиды К, например джерфишери!, по данным М. И. Нов-
городовой (1978 г.), содержат п % Си (до 22,4%), Ni (до 20%), Fe и др.
Солевые жзогенные минералы К характеризуются мономе-
галльным или комплексным (K-Mg или K-Mg-Ca) составом (см. табл.
28). Из элементов-примесей наиболее типичны Rb, Sr, TI [61 |.
Мес г о рож тения
Минеральные ресурсы К весьма значительны, вероятно
>150 000 млн т, хотя во многих солеродных бассейнах отношение
запасов К-солей к Na- и Mg-солям оценивается как 0,0п:1. Общие
запасы К-солей ~40 млрд т К2О. в том числе в нашей стране
~25 млрд т. Производство этих солей за рубежом оценивалось в 80-е
годы в ~15—16 млн т К2О. Выпуск калийных удобрений в СССР
141
с 1965 по 1988 i. увеличился почти в 5 раз и достиг 11,3 млн г. Доля
нашею экспорта подобных удобрений составила в 1988 г. около 20%
мировою. В 1990 г. производство снизилось до ~ 10 млн т и продол-
жает падать, как и экспорт, несмотря на благоприятную ситуацию
па мировом рынке. Технофильность средняя (Тф = I07); техноген-
ность низкая (Тх~107). Запасы отдельных месторождений (бассей-
нов) К-солей составляют п -100 млн г, уникальных п 1 млрд т.
мелких < 100 млн г; содержание К2О зависит от типа минерали-
зации.
Для К в нашей стране И. Л. Шаманским с соавторами (1991 г.) <
О1мечается низкая эффективность геологоразведочных работ. Среди
разведанных месторождений низка доля разрабатываемых (для хлорис-
тых К-солей 30%, сульфатных 15%), запасы хлористых солей
обеспечивают добычу (по уровню добычи 1985 г.) на 79 лет, сульфат-
ных— на 151 год. При лом потери К-солей при добыче и последу-
ющей переработке составляют 60%, а добываемый попутно NaCl
практически не используется.
Кроме К-солей все большее значение для сельского хозяйства
(удобрения, мелиоранты и т. д.) приобретают i лауконитовые пески
(потребность на 1995 i. >250 гыс т), лейцитовые породы (сынныри-
ты—17—21% К2О) и др. [636].
Месторождения относятся к экзогенному типу (за исключением
полевошпатового технического сырья) нерудных полезных ископаемых,
к литофильной геохимической группе, ее щелочной подгруппе, а также
к гидрофильной группе. Минеральный состав месторождений показан
в табл. 28, 31.
Возраст месторождений от позднедокембрийского-кембри Некого до
плейстоценового. Для всех эпох характерно образование вначале
KCI-солей, а позднее (для перми и неогена)— хлоридных, сульфатных
и смешанных (см Na). Геодинамические условия двойственны —
месторождения образуются как в деструктивной (рифтогенной), так
и в оршенных обстановках, на пассивных или активных окраинах
континентов. Из тектонических структур перспективны авлакогены,
синеклизы, краевые прогибы и впадины, в том числе внутриплатфор-
менные [61 ]. Условия образования солей наиболее полно разработаны
в моделях М. Г. Валяшко [99]. Стандартная общая схема образования
показана в габл. 31.
Выделяются руды: 1) хлоридные (52,4%К; полезным компонентом
является сильвин); 2) сульфатные (сульфаты К); 3) сульфатно-хлорид-
ные. Для сильвиновых руд вреден MgCI2 и для всех руд—ашидрит,
кизерит, глинисто-карбонатный и герршенный материал. Каинит (14%
К), лангбейнит (18,8% К) и бишофит могут добываться попутно. Более
ограничено распространение карналлита, который образуется в неболь-
ших котловинах, куда попадают рассолы после садки мирабилита
и других солей. Соли К ассоциируют с минералами Na, Mg, Са.
а также В и др.; в качестве примесей в них прису гствуют Rb, Sr, Tl.
Особенно высокие количества Rb типичны для карналлита (35,8% К2О).
142
О1ложение солей К происходило в условиях непрерывного про1ибалия,
в галнтовой обстановке; источником их, по Н. М. Страхову [735],
являлась межкристальная рана галитовых залежей, непосредственно не
связанная с другими водоемами. Такого же мнения придерживается
М Г. Валяшко [99]. Остальные источники К имеют определенные
геолого-геохимические особенности [256, 636, 659]. В частности,
глауконитовые пески часто ассоциируют с фосфатными породами,
а сынныригы, содержащие от 17 до 21% К2О, тесно связаны
с лейцитовыми и псевдолейциз овыми расслоенными щелочными
породами.
* Породы
Систематический анализ распределения К в различных породах
провел А А Беус [53] (табл. 43, 44). Наиболее полные данные по
распределению этою элемента в эндогенных породах свидетельствуют
о том. что его содержание увеличивается по мере возрастания
кремнекисло гности и щелочности пород [53, 426, 441]. Слабее'других
изучены ультраосновные породы (кларк 0,03% К [857], 0,02% [546]),
для которых установлен наиболее высокий коэффициент вариации
(v = 1,1 —1,2) и самые низкие средние содержания (К, %): дуниты 0,014,
перидотиты 0,05, пироксенигы 0,23, пикриты 0,17 (v=0,51), наиболее
глубинные породы — кимберлиты 1,06 (v=0,54) [53] Для щелочных
ультрабазитов оценки таковы (К2О, %)*: генеральное среднее 3,25,
щелочной пикрит 0,3—3, мелилититы 1—5, меланефелинит 1—3
(среднее 1,43), нефелиниты 2—8 [439], лампроиты 4—12 при К,О/
Na2O=30 [318].
Таблица 43
Оценкв средних содержаний К в магматических
н метаморфических породах, %
Магматические породы X V Метаморфические породы А V
Граниты 3,60 0,11 Кристаллические сланцы 2,65 0,28
Гранодиориты 2,52 0,23 Гнейсы (парагнейсы) 2,40 0,32
Кварцевые диориты 1,63 0,47 Амфиболиты 0,70 0,37
Диориты 1,40 0,36 Кварциты и песчаники 0,83 0,40
Сиениты 4,23 0.17
Нефелиновые сиениты 4,50 0,19
Габбро 0,75 0,30
Перидоти гы 0,05 1,20
Дуниты 0,014 1,Ю
Среднее 3,01 0,17 Среднее 2,24 0,31
* К 2О = 0,8301 к.
143
Таблица 44
Оценки средних содержаний К в осадочных и
эффузивных породах, %
Осадочные породы X V Эфф} зивные породы К V
Глинистые сланцы Глины Пески и песчаники Эвапориты * Карбонаты 2,70 2,33 1,24 0,35 0.25 (0,45) ** 0,55 0,51 0,40 Не опр. 0.18 Базальты: пла 1 формен ныс геосинклинальные Андезиты Дациты Кислые эффузивы Трахи гы Фонолиты 0,72 0,81 1.80 2.24 3,65 4.25 4,52 0,32 0,42 0,31 0,35 0,15 0,24 0,18
Среднее 1,65 0,40 Среднее 1,83 0.31
* Но данным М. Хорна.
♦* По данным Л. Б. Ронова, А А. Мнгдисова и А. А. Ярошевского.
Основные породы изучены полнее и, также различаются по
содержанию К в зависимости от щелочности, а также геолот ическон
позиции. Генеральное среднее (К, %): для базатьгов 0,75 (v=O,55) (40К
от 290 до 400 Бк кг-1). для габбро также 0,75 (v = 0.3); при этом
А. А. Бсусом различаются: 1) габбро континентальное (без регионов,
бедных К) 0,83; базальт платформенный 0,72, геосинклинальный 0,80;
J2) габбро континентальное (бедное К) 0,4; габбро океаническое 0,35;
базальт толеитовый 0,31; 3) базальт срединных океанических хребтов
0,22, габброиды крупных расслоенных массивов 0.2 [53 ]. Другие данные
свидетельствуют о близких содержаниях калия в базитах континентов,
зон сжатия (среднее 1,1% К2О) и растяжения (среднее 0,94 + 0,08%)
океанических областей и о существенных различиях для базальтов
разною петрохимического типа (К2О. % — среднее): континентальные
базиты (кларк 0,77% К [857]), по типам: толеитовые 0,33, известково-
щелочные 0,89, K-Na субщелочные 2,1, шошонитовые 2,64; океаничес-
кие базиты (кларк 0,15% К [857]), по типам: толеитовые 0,58, K-Na
субщелочные 1,4 [441]; щелочные базиты — генеральное среднее 2,15,
базальт щелочной 0,9—2,6, трахитовый 2,9—3,0, трахит 3,7—5,8 [75].
В средних породах (кларк 1,52% К [857]) генеральные средние
содержания К следующие (%): диориты 1,40 + 0.10, кварцевые диори-
ты—тоналиты 1,63 + 0,17, андезиты 1,80 + 0.15, при значительных
колебаниях средних для материковых пород разных регионов от 1,0
(Центральная Америка) до 2,3 (Казахстан [53 ]). Среднее из кларков (К,
%): андезиты и диориты 1,71, гранодиориты 2,52 [546].
В гранитоидах и щелочных породах установлены самые высокие
концентрации (К, %); гранодиориты—генеральное среднее 2,52 + 0,19;
граниты—генеральное среднее 3,60 + 0,12 (4 К от 925 до 1200 Бк кг-1
[381]), платформенные 3,65 + 0,14, геосинклинальные 3,32 + 0,14; ри-
144
олиты и липариты в целом 3,65 ±0,15; дациты 2,24 ±0,28. По
геохимическим типам (см. табл. 25) оценки средних содержаний, по
Л. В. Таусону, таковы (К, %): дифференциаты основных — средних
магм — плагиограниты толеитовые 0,3, гранитоиды андезитовые 2,0,
латитовые 3,5, редкометальные агпаитовые 3,6; палингениые магмы —
граниты известково-щелочные 3,3; плюмазиговые редкометальные
лейкограниты 3,9, палингениые гранитоиды щелочного ряда 4,1,
редкометальпые щелочные граниты 3,8, ультраметаморфические грани-
тоиды 4,6, эндербиты 1,1, чернокиты 3,3, рапакиви 4,5. В щелочных
сиенитовых породах калия обычно еще больше (К, %): генеральное
среднее 4,3; сиениты 4,23 ±0,23, нефелиновые сиениты 4,50 ±0,24,
трахиты 4,25 ±0,38, фонолиты 4,52 ±0,35 [53]; по другим данным (К2О,
%): миаскитовые нефелиновые сиениты 5,47, агпаитовые нефелиновые
5,69, пссвдолейциговые сиениты 10,83 [394]; высокие в некоторых
породах щелочно-сиенитовой формации (см. габл. 48). Наиболее
высокие концентрации К2О (до 19%, K2O/Na2O= 12) установлены
в псевдолейцитовых породах (нефелин-калишпатовых)—сынныритах,
залегающих в виде обособленных участков и полос в нефелиновых
сиенитах Сыннырского массива (Забайкалье).
Во времени концентрация К2О в основных эффузивах и гранито-
идах увеличивается (%): AR, 0,41 и 2,14; AR2 0,55 и 2,94; PR1-2 0,73
и 3,91: Ph 0,90 и 4,24 [663].
Поведение К, относящегося к несовместимым элементам в маг-
матической эволюции, по данным Б. Г. Лутца [428], характеризуется
отчетливой двойственностью (выявлена на диаграммах К-Ti). Первый
тренд—прямое симба гное увеличение и К, и Тт (связывается с увеличе-
нием глубины магмообразования) от толеитов к щелочным базальтам
(тренды различны для океанических, островодужных и континенталь-
ных базитов). Вторая линия—отрицательная корреляция K-Ti, харак-
терная для кристаллизационной дифференциации, в процессе которой
содержание К во все более кислых дифференциатах увеличивается, a Ti
снижается. Корреляция К — Na весьма изменчива—для офиолитов она
положительная [428], для гранитоидов отрицательная, как и с Mg, Са
[53 ]; К и Si имеют положительную зависимость для нормального ряда
дифференциации (дунит-перидотит-габбро (континентальный ба-
зальт) —диорит — (андезит) — кварцевый диорит — гранодиорит—г ра-
нит (риолит), независимое поведение при дифференциации базальтов
и близкую к обратной зависимость для щелочных сиенитовых пород
[53]. Расчеты показывают, что глубинные высококалиевые породы
(жадеитовые) расположены в мантии ниже натриевых, что приводит
к К илн Na специфике магматизма [675].
Факторный анализ поведения К при формировании массивов
магматических пород показал его преимущественную концентрацию
в поздних фазах в более щелочных породах. Максимальное накопление
К характерно для лейцитофиров, нйфслиновых, псевдолейцитовых,
щелочных сиенитов, щелочных базальтов и габброидов, лампроитов
и псевдолейцит-нефслиновых сиенитов [589].
10 2138 145
Осадочные породы содержат меньше К. чем гранигоиды; распре-
деление его в этих породах кон грае 1 но (К, %): глины 2,33, глинистые
сланцы 2,70 (40К 85—850 Бк кт '*), меньше в песках и песчаниках —
1,40 (40К 300—400 Бк кт *) и самое низкое в эвапоритах 0,35
и карбонатах 0.25—0,45 (4<’К 30—40 Бк-кт ')• Солеобразование для
К, по М. Г. Валяшко [99], имеет место только в солеродных бассейнах
с составом рапы, о1вечаюгцим океанической воде—0,74 г.'кт KCI.
Концентрация К2О в осадочных породах (сланцах) растет в докембрии
(ARI 2,1%, PR3 3,5%) и несколько снижается в фанерозое (3.2%) [663].
Метаморфические породы, по А. А. Бсусу [53], содержат различное
количество К и имеют различное ею распределение. В амфиболитах
и эклоги гах оно напоминает базтповое. а средине содержания низкие
(эклогиты 0.31% К. амфиболиты 0.70%), в тнейсах и кристаллических
сланцах распределение сходно с гранодиоритами, а содержания выше
(гнейсы 2,40 + 0,27%, кристаллические сланцы 2,65 + 034%, парагнейсы
и кристаллические сланцы 2,28%) [857]. Характерны более высокие
коэффициенты вариации во всех метаморфических породах по сравнению
с магматитами и осадками, что свидетельствует о перераспределении
и значительном привносе К в процессе анатектической транитизации.
Наиболее четко петрохимическая зональность проявлена в распре-
делении К., В рифтотенных структурах этот элемент, как правило
вместе с Na, обогащает периферические части магматическото ареала,
что отражает систематические изменения глубины и полноты плавле
ния субстрата. В зонах субдукции К концентрируется в тытовых
частях, что связано с его латеральной миграцией вместе с флюидом из
области с максимальным избыточным давлением, г. е. из фронтальной
части тоны субдукции в сс тылы. Локальное снижение избыточного
давления происходит в ряде случаев в зонах трансформных разле.мов.
На раннем этапе развития Земли существенно более высокая темпера-
тура тлубнн и меныпие вязкость и мощность литосферы препятство-
вали возникновению структур со значительными градиентами избыточ-
ною давления, что исключало благоприятные условия устойчивого
перераспределения и аккумуляции флюидов, обогащенных К. Na
меньше зависит от избыточного завчения. и он обнаруживает
отчетливое стремление к митрации в области пониженных темперачур
(инотда расходится с К.). Высокие его концентрации наблюдцдэтся
только в «холодном» тылу субдукции. Применение У К + Na для
геотектонических реконструкций нецелесообразно.
Почвы, растении, живот ные
Генеральное среднее содержание К в почвах оценивается в 1,25%.
В зоне гипергенеза он относится (вместе с Rb, Li, Cs) к слабоподвиж-
ным компонентам сильного биологическою накопления [574]. Обога-
щены калием почвы гумидных, обеднены — аридных зон.
Генеральное среднее содержание калия в почвах нашей страны
1,36% (в золе растений 3%). В европейской части страны, но
146
С А Кудрину [726]. в тундровой и лесной зонах оно выше в сидро-
вых почвах (2.07%, но в торфяных 0.3%), а среди подзолистых — в
глинистых (2,04%), содержания в других почвах (%): песчанистые
0,33—1,81. серая лесная 1,6, перегнойная 1,18, а в различных типах
подзолистых почв таковы: nepeiпойпо-глеевая 2,64, подзолисто-глеевая
2,50, силыюпоцзолистая 2, среднеподзолистая 1,84; данные для
черно темов следующие, типичный и предкавказский 1,7, выщелоченный
1,38, обыкновенный 1,32, южный 0.97, приазовский 1,53; для почв
южных районов: чернозем 1,36, каштановая 1.58, коричневая 1,67,
бурая лесная 1,4, серозем 1.8, бурая нустынно-степная песчаная 0,27,
красно тем 0,23.
По A II Виноградову, в большинстве случаев К относительно
накапливается в почвенном горизонте А. При формировании почв на
гранитах и друтих обогащенных щелочами породах происходит вынос К2О
и Na2O. С учетом плогжтети первичной породы и почвы элювиалитого
ландшафта до.тя выноса К2О и Na,6) из гранита следующая (%):
серо-бурая высокоторная пустынная почва 51 и 41; темный серозем 67 и 33;
чернозем 63 и 14 [198]. Вынос К особенно типичен для кор вывет ривания
и почв влажных тропиков, где К попадает в группу наиболее лет ко
подвижных катионов (Na>Ca>Mg>K) и удаляется из верхних горизон-
тов. В лесных ландшафтах умеренного и холодного климата К мигрирует
значительно слабее, но характерен его дефицит дтя растений. Кислотное
выщелачивание с выносом К распространяется здесь лишь на горизонты А,
и Л, подзолистых почв, тогда как из аллювиального горизонта В вынос
ослаблен. В тидрослюдах кор выветривания его содержания достигают
I—2%, а в торфах только 0,0» % [574]. По К. И. Лукашову (1966 т.),
содержания К (%) в перет нойпо-аккумулятг'шом горизонте почв Беларуси
составляют 1,37, в дерново-подзолистых почвах на моренном суглинке 0,97
(морена 1,55). на песках 0,51 (пески 0,63), на толовых песках 0,68 (пески
0,52—0,69). в перст нойно-т леевых О торфяно-болотных 0,22, аллювиаль-
но-луговых 0,70. В аридных зонах вынос К менее интенсивен, чем
в гумидных, и валовое содержание сто в почвах может быть вьппе.
особенно в легкодоступной для растений форме (в поглощающем
комплексе). Особенно много свободного К в солонцах, однако при
испарении и заеолонснии резко увеличивается роль Na.
Содержание К и друтих элементов различно в разных фракциях почв
(табл. 45) и значительно увеличивается от песчаных к глинистым.
Доступен для растений в основном обменный К почв, количество
которого не превышает 0,04%. обычно составляет ~0,004%, столько же
водорастворимого К. чем вызван его дефицит для культурных растений.
Калий - жизненно важный, биологически необходимый элемент
почти самой широкой распространенности в организме млекопита-
ющих. У растений он регулирует поступление утлекислогы из воздуха,
фотосинтез, водный, азотный, фосфорный обмен, принимает участие
в синтезе и перемещении углеводов из листьев к корням, влияет на
синтез и накопление белков, образование хлорофилла, сахарозы,
фруктозы, крахмала
10* 147
Таблица 45
Распределение главных ночвообраззющих каз иннов в различных
фракциях почв, %
Фракция (размер частиц, мм) Si Al Fe Са Mg К Р
Песчаная (1—2) 43,4 0,8 0,8 0,3 0,3 0,7 0,02
Пылеватая (0,2—0,04) 43,8 1.1 0,8 0,4 0,1 1.2 0,04
То же (0,04—0,01) 41,6 2,7 1,0 0.6 0,2 1,9 0,09
Мелкопылеватая (0.01 —0,002) 34,6 7,0 3,6 1,1 0,2 3,5 0,04
Глинистая ( <0,002) 24,8 11,0 9,2 1,1 0,6 4,1 0,18
Биофильное! ь К в целом высокая (0,012), как и остальных
щелочных металлов (кроме Na) Его кларк в живом веществе 0,3%
[574], т. е, в 15 раз выше, чем у Na; К входит в триаду наиболее
биологически дефицитных элементов (N, Р, К). В морских растениях
(кларк 500 г/т) его больше, чем в наземных (140 г/т), так же как
в морских животных (до 3000 г/т) по сравнению с наземными (х = 74 г/т,
на сухую массу—с.). В планктоне содержания таковы (%, с.): среднее
1,0, фито-1,2, зоо-1,0 [677]. Морские организмы обогащены также и 4ОК
(Бк кг *): микроорганизмы 330—6(Ю, водоросли 570—700 [381]
При довольно высокой средней биогенности (0.63). ее проявление
в разных природных зонах нашей страны различно: тундровая 0,42.
лесная 0,53 (лес 0,68, растения 0,38), степная 0,9. пустынная 0,77 [198].
Большая часть К в растениях находится в ионной форме, меньшая
непрочно связана в плазме; он легко выщелачивается из листьев,
теряющих во время дождей до 30—50% К. В морских водорослях
(макроцисгис и др.) и голофитах его содержание достигает 1—2%.
В золе растений очень много К (максимальные содержания, %): грибы
28,4, папоротники 6,9—35,4, хвощи 19, из высших растений—лилейные
30,7, зонтичные 28,4. бобовые 27, крестоцветные 23, гречишные 25,
злаковые 23. Относительно бедна К зола лишайников, плаунов,
голосемянных, вересковых, мхов (8%), хвощей (11%), лебедовых (12%).
В органическом веществе, по В А Ковалеву [329]. количество
К следующее (%): бактерии 1, водоросли 3.9, папоротники 2.4
покрытосемянные 1.6, двудольные 2,2, Картофель, гречиха, кукуруза,
подсолнечник, травы, сахарная свекла, фасоль, соя. нут содержат
К в 8—12 раз больше, чем Na, и особо нуждаются в калийных
удобрениях. Значительное количество К в почвы поступает с листвен-
ным опадом (луговые степи—до 116 кг/га), часть К поглощается
глинистыми минералами, в результате в воды его переходит меньше,
чем Na [574, 578]. Концентрация 40К в растениях такова (Бк кг-1):
зерновые 18—159, зернобобовые 177—299, свежие овощи 40—174,
плоды 7—355, грибы 277 [381 ]. Из продуктов калием наиболее богаты
крупы (фасоль, соя и др.), молочные и хлебные продукты (см. Na).
Установлена биологическая необходимость 40К, который, концент-
рируясь в норме внутри клеток в непосредственной близости от ДНК
148
и давая каскад низкоэнергетических электронов распада с очень малым
пробегом, вызывает усиленную мутагенную активность (спонтанный
мутагенез), необходимую для эволюционного развития, отбора и ново-
го видообразования [381 ].
Человеку К необходим для поддержания pH и Eh организма,
нервной восприимчивости клеток, процессов обмена в них, для
фосфорилирования адениловой кислоты, активизации других фермен-
тов и прочих функций [109, 512].
Человек ежедневно потребляет с продуктами питания 3,3 г К.
Среднее суточное потребление его с пищей в разных странах, по
Е. Хамильтон (1981 г.), следующее (ммоль): США 76,7, Англия
71,6 ±0,8, Индия 105, ФРГ 61,4.
Содержание К в организме максимально у молодых мужчин
и минимально (в 2 раза меньше) у пожилых женщин. Среднее содержание
для взрослого организма 2 г на 1 кг массы тела (~0,2% массы тела).
В различных средах и органах человека К, по обобщенным данным
[931]. распределен следующим образом (в скобках—число анализов)
кровь (мг,л) — общая 1622 ±15 (1275), эритроциты 3546 ±1 (1236),
плазма 157±1 (4880), сыворотка 191 ±2; молоко 700 мг/л (>200);
другие данные (л -10 6); кость 1470 (10); мозг 2,3—2,8 (12, ж.); волосы
150—633 (>300); сердце 1,5—2,5 (10, ж.), 9 (9, с), 210—280 (>100, з.);
почка 1,4—2,4 (41, ж.), 179 (261, з.); печень 2,2 (45, ж.), 7,2—9,3 (100, с),
207 (264. з.); легкие 1,5—2 (>40, ж.). 6,5 (68, с.), 193 (260, з.); ногти
357—2400 (>80); кожа 0,8—1,7 (> 30, ж.), 2,5—9,2 (20, с.); селезенка
3000 (28, ж.), 250000 (277, з.). Обычно К полностью всасывается
в кровь и преимущественно выносится через почки; Г6 = 58 сут.; 98,5%
его находится внутри клеток и в мышцах при четком саморегулирова-
нии накопления и выделения.
Очень важны биологически радиоизотопы К, они определяют
внугреннюю радиоактивность организмов. Серьезную опасность как
радио токсиканты представляют 40 К и 42 К; ПДК для них (Ки/л; ПДКр1
1-10 10, ПДК сашпарно-защитных зон 1 • 10 “, населенных пунктов
1 • 10 12; ПДКвп 6 -10 9. Эти изотопы довольно равномерно распределя-
ются в орг анах человека, несколько концентрируясь (как Rb и Cs)
в мышцах; 40 К легко всасывается с пищей (100%) и из воздуха (75%);
имеет период полувыделения (сут.): Г658, эффективный 0,52 [27, 511].
Среднее содержание 40К в органах человека (г-га *) и радиоактивность
(Бк кт ’) таковы: кровь 1,6 и 48; эритроциты 3,4 и 102; красный костный
мозг 4 и 121; головной мозг 3 и 90; легкие 1,9 и 57; сердце 2 и 63;
селезенка 3 и 93; печень 2,5 и 75; кишечник 1.2 и 36; тонкий кишечник 1,3
и 39; щитовидная железа 1,2 и 36; тимус 0,6 и 18; кожа 0,8 и 24.
Воздух, вода, техногенез
В эталоне чистого воздуха над Антарктидой содержание К 0,3—
0,6 нг м3, фон крупных юродов зарубежного мира 400 нг/м3 [626,
900]. В океаническом воздухе конценграция его одна из самых высоких
149
среди металлов — (1,1—1,7) 10' мкг'м3, как и в океаническом
аэрозоле—1,1%. В атмосферном воздухе фоновых хозяйственных
территорий (аэрозольная составляющая), средние оценки содержаний
К, по А. А. Волох (1991 г). 1аковы (нг'м3): Восточная Сибирь 300,
Московская обл. 190, Крым (зал. Голубой) 445.
Средний модуль поступления К с атмосферными осадками в быв-
шем СССР 0,27 т'км2 в год (максимальный в горных районах Кавказа
0,57 т/км2 в год); общий гидрохимический сток К Л Na 37.8-106 т год
[198] (см. Na).
Среднее содержание К в морской и океанической воде 0,03%,
в речной воде 0,0023%, что ниже содержаний Na. 4,1 К в морской воде
12—15 Бк кг 1 [381].
Концентрация К в морской воде (г/кг) и ее соленость (X) прямо
коррелируются: 0,11 г/кг—10 (цифры округлены); 0,16—15; 0,22—
20; 0,27—25; 0,33—30; 0,38—35; 0,44—40 (см. табл. 14).
Основное количество К остается на континентах, а попавший в океан
пог лощаегся живым вещеегвом, илами, и соотношение K/Na в океаниче-
ской воде снижается (0,037). Важнейшим осадителем К из морской воды
в условиях шельфа и небольших глубин является глауконит (i идрослю-
дистые минералы типа иллита, содержащие 3,2—7.6% К).
Содержание К+ (мг/л) в талых водах снежного покрова в Антарк-
тиде 0,008—1.0, на Северном и Южном полюсах 0,03—0,32, на
окраине Москвы 0,4—1,0.
В поверхностных водоемах поведение описываемого элемента подчи-
няется определенным закономерностям. Постоянной и повышенной
калиеносностью отличаются бассейны, питаюхпиеся в основном морской
водой (сульфатный гип). В континентальных водоемах максимальные
содержания К характерны для содовых вод, промежуточные для
сульфагных и низкие для хлоридных. Максимальной калиеносностью
отличаются озера из районов молодого тектогенеза.
Содержание К в подземных водах гораздо выше, чем в поверхност-
ных, но на порядок и более ниже содержаний Na (см. табл. 24). По мере
роста солености подземных вод относительная роль К (по сравнению
с общей минерализацией) в них снижается; аналогичные зависимости
выявлены для засоленных почв и соленых озер. Тем нс менее самые
высокие количества К характерны дтя Cl-Na и С1-Са высокоминерали-
зованных растворов (см. габл. 23, 24—приведенные п них фактические
данные дают полное представление о распределении К по разным
типам минерализованных вод различных геохимических классов).
Средние содержания К в разных г инах грунтовых вод зоны
гипергенсза (д=4,59 мг/л), по А. И Перельману [726]. составляют
(мг/л). континентального засоления 15,2; выщелачивания 1,9: умерен-
ного климата 3.0; полярного 1,1—2,2; горные районы 1.2.
Техно- и экогеохимия К и ею изотопов изучены недостаточно.
Значения ПДК для некоторых соединений приведены в табл. 46 (см.
также табл. 1, 2). Кроме того, нормированы содержания других
соединений К (мг/м3; в скобках—класс опасности): ксагггогенаты —
15(1
Таблица 46
Гигиенические нормативы дли соединений К*, мг/м3
Соединение К пдкр, вдк Соединение К ПДКИ вдк
Карбонат 2,0 0,05 Цианоферрат 4,0 —
Ниграг 5,0 — Гидроксид 3,4) —
Сульфат 10,0 — K-Mg сульфат 5,0 —
Хлорид 5,0 0.1
Для всех соединений определен III класс опасности
бутиловый 10 (III), изоамиловый, изобутиловый и изопропиловый—1
(II), этиловый 0,5 (II), а также сильвинит 5 (III) и др.; для водоемов
хозяйсгвешю-питьевого и кулыурно-быт oboi о назначения нормированы
(ПДКв, мг/л): дибутилдитиофосфат 0,1 (III), диизоппропилдитиофосфаi
0,02 (IV), диэгилдитиофосфат 0,5 (III), 1-изомилксантогенат 0.005 (IV),
изобутилксантогенат 0,005 (IV), диоксалим 1 (II), персульфат 0,5 (II),
этилксаш огенат 0,1 (IV) и др. [727]. ОБУВ в воздухе населенных мест
определен для KCI в 0,1 мг/м3. Широко распространен К в сырье,
полупродуктах, продуктах и отходах различных производств. Некоторые
его соединения являются сильно токсичными: это растворимые в воде
цианистый калий — сильнейший яд, цианид KCN (ЛДюо для собак 1,6
мг/кг) хлорат КСЮз, арсенат KH2ASO4 [231], которые содержатся
в выбросах производства пестицидов, красителей, взрывчатых веществ,
бумаги, химических, текстильных, обувных и др. Известно острое
отравление людей КОН (ЛД 10—20 мг), а животных — КОН, KF, КСОз,
КС1; ЛД50 (мг/кг) от 245 для KF до 1870 для КСОз [112]. Повышенные
количества КО, KNO3, KNO2 содержатся в выбросах производств
удобрений, химико-фармацевтических, стекольных, солей калия и др.
Остальные менее распространенные вредные соединения К имеют еще
более широкий круг загрязняющих источников [231]. Многие ею
соединения в концентрациях всего 1—10 мг/л при попадании в водоемы
вызываю! тбель гидробионтов [128].
Большие количества вредных выбросов соединений К попадают в ок-
ружающую среду при разработке месторождений калиевых, иногда магни-
евых и натриевых руд, а также в процессе их переработки (теряется >60%
КгО). В частности, на K-Mg перерабатывающих предприятиях образуются
гг 10000 м3 твердых солевых остатков и глинистых шламов, которые со-
держат 11—19% К.С1. При производстве КС1 расход не утилизируемой
калийсодержащей воды составляет 45—94 кт на 1 г переработанной руды.
Эта вода может проникав в открытые водоемы и артезианские воды. Так,
в источниках, расположенных ниже подобного производства, содержание
К в воде 0, п—п г/л при фоновом 3 мг/л, а в водоеме, находящемся
в 100—300 м от солеотвала и шламонакопителя КС1, содержание
К составило 19—26 г/л. К интенсивному накоплению К в почвах приводит
орошение полей промышленно-бытовыми водами; отмечается также
151
значительный естественный смыв к в центральной лесостепной sone России
(кг/км2): в сельских районах до 500, городах до 1600 [112].
Значительные количества к (>60° о оз добытого) попадаю!
в окружающую среду не только при добыче и переработке солей к, но
и с твердыми выбросами металлургических и ряда друзнх заводов; так,
в металлурзии в радиусе 1—3 км в почву попадает 4—12 мг'кг К (фон
О,8мз/кг) [112].
При производстве бесхчорных калийных удобрений — K2SO4.,
(К, Mg)_>SO4 — загрязненность воздуха на многих стадиях переработки
и на складах хранения продукции на порядки превышает ПДК
и достигает 470 мг'м3 (>40 ПДКрз). Характерна высокая степень
дисперсности соединений К (до 4,4 мкм для 60° о частиц) и они легко
попадают в организм. Заболеваемость на таких производствах по
числу дней* нетрудоспособности в 1,6 раза выше средней [112, 128].
Калий цмеет довольно высокий пока за гель территориального техноген-
ного давления, оцениваемый для производств в бывшем СССР в п 105
т/год; нефть 88, удобрения 28, зерно 1—2, древесина 0,1—0,4. Общий
глобалызый модуль техногеззного воздействия (давления) для К высокий:
Тд=0,1—0,2 т/км2. Для бывшего СССР он часто гораздо выше, особеззно
для Центрального региона: Прибалтззка 2,1, Беларусь 1,6, Юго-Запад 1,3,
Центрально-Черноземный район 0,9, Северо-Западный 0,7 и т. д. [198].
Коэффициент техногенного использования К невысок (/7=22%).
Выводы. Калий — главный биофильный (Бф = 0,1), биогенный
(Бг=0,63), общетоксичный (Тл=1) элемент, в геохимическом кругово-
роте которого роль биологической составляюзцей весьма велика Он
лито- и биофилен. в основном сохраняется на континентах, быстро
выводится из гидрогеологического цикла миграции и часто дефицитен
в биосфере. ГЭЛ природных солей К при наличии примесей (1—2) 103.
В магматическом цикле концентрация К особенно характерна для ще-
лочных пород и минералов (В до 14). мантийных и поздних производных,
увеличиваясь во времени от AR к PR, в гипергенезе—для солеродных
бассейнов (В до 29). Распределение в верхней земной коре и почвенном
покрове четко регулируется тектоническими, климатическими и литологи-
ческими факторами. Считается, что промышленное накопление калийных
солей характерно только для некомпенсированных прогибов фанерозоя.
Показатель Тф—средний, П — низкий. В техногенезе К общетоксичсн, но
некоторые его соединения сильно ядовиты: Болыиие массы его поступают
в окружающую среду не только в качестве выбросов различных
производств, но и как агрохимические удобрения (Тд—очень высокий),
которые могут нарушать экологическую обстановку.
РУБИДИЙ—37
Распространенный (кларк земной коры 0,011%, К Rb = 2()0) среди
редких-рассеянных элементов, не выясненной биологической и эколоз и-
ческой важности. Токсичен: ПДКрз гидрокеззда, сульфата, хлорида,
низрата, карбоната 0,5 мг м3 (II класс опасносзи) [128, 727].
152
Атом
Агом Rb—тяжелого щелочною металла представлен двумя
изотопами — стабильным 85 Rb и радиоактивным 87 Rb — [3-излуча-
телем (0,275 МэВ, у0,394 М тВ. 7 1/26,1 • 1О10 лет); распространенность
этих изотопов 72,15 и 27,85%. Средн искусственных радиоактивных
изотопов наиболее известен в геохимии и жологии короткоживущий
радионуклид 86 Rb — 712 18 сут (см. габл. 2).
В периодической таблице Rb (4J° 4рь 4.v2 5л1) расположен под К (см
рис. 1), с которым наиболее близок геохимически, и соседствует с Cs (по
вертикали), Sr (по горизонтали), Ва и Са (по диагонали). По физическим
и химическим свойствам очень сходен с К (см. табл. 17). но проявляет
еще более высокую литофилытоегь и химическую активность, бурно
реагируя с О2 (воспламеняясь), галогенидами, серой, СО2 и CCU; при
нагревании реагирует с Р, С, SiO2; образует ингерметаллы со многими
металлами. В отличие от остальных щелочных металлов структура
NaCl не является для Rb наиболее характерной и требует повышенного
давления и температуры (кроме RbCl). Большинство соединений имеют
высокую растворимость в воде (г/100 г) [716]: гидроксид 64,2, сульфат
48,2, алюмоквасцы 1,5, нитрат 68,9, дит идрофосфа г 78,9, карбонат 249.3,
фторид 289,8, хлорид 94,4, бромид 114.1. йодид 163.
Минералого-геохимическая формула Rb для мантии Лщо, для
земной коры О10о, в водной среде гидрофилен. В метеоритах
литофилен и накапливается в хондритах (г г), обыкновенных Н 1.6.
L 3, LL 2,3; энстатитовых Ед — 2,1. Е5,б—1.4; углистых HI —1,8*,
НИ—1,24. HIII—1,18: в ахондригах-урсилигах 0.035 [115]. В лунных
породах его содержания таковы (г/т): «Лупа 20» — реголит 1, анорто-
зит 3,7; «Луна 16» — реголиг (среднее) 1,3, базальт 1,9 [107].
Концентрации для различных сфер Земли следующие (г т): примитив-
ная мантия 0.55 [749] и 0.39 (по Д. Андерсону, 1983 г.); протокора 2;
архейская общая кора 28. верхняя 50, посгархейская нижняя 5,3,
верхняя 112; общая континентальная 32 [749]. В осадочной оболочке
Rb немного больше, чем в кристаллической — 95 и 77 г/т [898].
Фактическое содержание для пород крупных регионов о г 60 до 110 г/т.
Минералы
Минералы Rb неизвестны, за исключением его высоких концент-
раций в высокорубидиевых мусковите (до 3.93% Rb2O), лепидоли ге (до
4,93% Rb2O), протолитионите (до 3,37% Rb2O) [703]. Он является
наиболее типичным рассеянным элементом, вес атомы которого
заключены в минералах других элементов.
Данные по свойствам и составу рубидиевых слюд полно представ-
лены в литературе [703]. Известны рубидиевые слюды пока только
в редкометальных сподумен-микроклин-альбитовых и комплексных
По более поздним данным—3,4 г, г [749].
153
Li-Ta-Cs пегматитах. Для рубидиевого мусковита отмечается изомор-
физм Kfc»Rb и их обрашое соотношение, увеличение параметров
ячейки (в нм — полизип 2Mi :ао=0,517 —0,519, Ьо =0,895 0,899, со=2,0,
наличие Мн31 и Fe3 + (что указывает на сильноокислительные условия)
и повышенные содержания А!2О3 (34,5—38,44%) и F (0,12—0,96%).
Рубидиевый лепидолит концентрирует оз 3,6 до 4,93% Rb2O и значи-
тельно обогащен Cs (0,8—1,19% Cs2O) по сравнению с рубидиевым
мусковитом (0,19—0,31% Cs2O), а также F (6.1—8.7%). содержит
меньше А12О3 (19,28—28,84%), кристаллизуется в основном в политипе
2М2 (>>2Mi); параметры ячейки (нм): оо=0,518—0,521,
7>о = 0,898 —0,902, со = 2,018 — 2,02 [703]. Известен также рубидиевый
полилитионит с содержанием Rb 2.18%. Из других элементов-примесей
в рубидиевых мусковите (I) и лепидолите (II) установлены (г/т; от—до,
в скобках—среднее): Ag I—0,1—1 (0,4; м = 5), 11(0,37; и = 3); Bel —
31—39 (35); Sr 1 — 60—120(81). 11 — 70—110 (90); Ва I —10—55 (14),
И —(80); Zn I — 160—530 (270), 11—100—350 (217); Rbl—4—18 (8).
11—4—12(8); Sn I —250—500 (370), 11—118—250(193); Ca 1—250—
800 (460), 11 — 62—500 (270); Ge J —5—31 (16). 11 — 16—24 (19); Tl I —
40—100 (67), 11—65—450 (305); Sb I—15O—75O (219) [534, 574]. Счита-
ется, что рубидиевый полевой шпаз (>2%Rb2O) требует IX или
X координации с участием О2 и является моноклинным [77].
Изучение мусковитов из пегматитов с обычными содержаниями
Rb показывает, что слюдоносные пегматиты по сравнению с ред-
кометальными обеднены им — 0.03—0.13 и 0.2—0,64% Rb соот-
ветственно, как и генерации мусковита из краевых частей жил
(0,25—0,32%) по сравнению с центральными (0,64% в кварц-
клевеландитовой зоне, 0,74%—для гнезд лепидолита) [703]. В глау-
коните содержание Rb в среднем 0,055%. Соответствующие за-
кономерности выявлены и для друтих рубидийсодержащих силикатов
(см. табл. 19, 20). Высокие содержания Rb характерны также
для астрофиллита (х = 5200 + 300 г/т), особенно в редкометальных
щелочногранитных массивах (0,7—2,13% Rb).
Среди минералов-носителей Rb следует выделить нефелин, хотя
и содержащий невысокие концентрации Rb (х = 220 г/т), но являющийся
минералом, из которого при переработке на А1 попутно получают Rb.
Карналлит (К, Mg)Cl3-6Н2О не относится к минералам, сильно
обогащенным Rb, но представляет практический интерес. Среднее
содержание, по данным Т. Ф. Бойко [61], 170 + 32 г/т при колебаниях
от 20 до 1820 т/т. Максимальные концентрации типичны для вторич-
ного карналлита. Остальные калиевые минералы — сильвин и другие
(см. табл. 28)—не концентрируют Rb.
Месторождения
Как отмечалось, Rb не образует собственных минералов и месторо-
ждений и добывается или может добываться попутно из руд щелочных
и редких металлов, если это позволяв! технология их переработки.
154
Имея широкое распространение в земной коре, Rb обладает крупным
мегаллогеничсским потенциалом (>] млн т). но запасы сто, как не
основною компонента, учитываются в редких случаях. Учтенные
ресурсы за рубежом составляли всего 27 тыс. i [641 ]. Rb еще не нашел
и широкою промышленною применения (за рубежом ею производство
в 1990 i. не превышало 1,5 т). Перспективы этою металла как
промышленного неясны, хотя имеются положительные результаты по
его использованию в МГД- и термоэмиссионных генераторах, турбоге-
нераторных установках и ионных двигателях |641 ]; имеет самую
низкую Тф (м -1()-) [574] и Н (<]%) [198].
Рубидийсодержатцие руды сосредоточены в лтпо-(петматиты, грани-
тоиды) и гидрофильной теохимических труппах месторождений.
К основным крупным источникам Rb относятся эндогенные гранит-
ные пегматиты сподумен-микроклин-альбитовот о типа и околопегматито-
вые метасомагиты, экзогенные месторождения карналлита и высокоми-
нерализованныс воды [716]. Перспективны Rb-Li-Cs слюдистые мстасо-
матигы, сопровождающие оловянную и олово-танталовую минерали-
зацию и многие другие типы месторождений редких мега плов: снедения
о распределении Rb в них приведены в обобщающих работах [714. 716].
По поведению в пегматитах Rb мало отличается от Li (см. Li),
однако промышленным источником Rb является не сподумен, а лепи-
долит и поллуцит (см табл. 18, 19). На месторождении Берник Лейк
(Канада) лепидопит в 1975—1982 гг. специально добывался как руда
на Rb, а из поллуцита Rb получали попутно при переработке на Cs.
Аналог ичное производство (лепидолит, поллуцит) было налажено на
месторождении Бикита (Зимбабве).
В слюдистых мегасоматитах различного типа и происхождения,
обогащенных щелочными мег а зла ми, распределение Rb сходно с таковым
Li и отличается от Cs гем. что его концентрации приурочены не к темным
(см. Cs), а к светлым слюдам (мусковит; лепидолит, протолитионит' и др.).
Перспективны па попутное получение Rb нефелиновые руды
и отходы. Его распределение в нефелине достаточно однородное
в различных типах пород. Первые оценки (731) показали возможность
некоторого увеличения средних содержаний Rb (т/т) от нефелиновых
сиенитов шелочно-габброидной формации (121+22) к тцелочно-грани-
тоидной (155 + 25) и К-щслочно-базальтоидпой (169). Самые высокие
концентрации (до 800 г/т) установлены в нефелине из сынныри гов
(Северное Прибайкалье), нефелиновых сиенитов и ийоли г-уртитон
агпаитовых пород (Кольский п-ов). Однако перспективы попутною
извлечения Rb не определяются его концентрацией Например, интерес
может представить нефелин отходов апатитового производства Хибин,
имеющий мепее высокие содержания Rb—148 + 3, т/г, но попадающий
в отходы [535]. По Е. А. Каменеву, Д. А. Минееву и другим исследова-
телям [535], распределение Rb, Cs и Ga в нефелине Хибинских
месторождений зависит от положения в разрезе ин грузни (табл. 47).
Несколько повышенные содержания Rb и Cs установлены в нефелине
из урзитов, что имеет место и в Илпмаусакеком массиве [190. 19)]
155
Таблица 47
Средние содержании элементов-примесей в
нефелинах Партомчорра, г/т
- Субфаза Rb Cs Ga
Пострудная Рудная: 165 1,6 49
РУДЫ 130 0,8 36
уртиты 177 1,8 35
Дорудная 138 4,0 36
Поведение Rb в природных минерализованных водах связывается
с К и в какой-то мере сходно с поведением Li (см. табл. 22—24);
в отличие от последнего изменение концентрации Rb в различных
гипах вод более значигельное. Более высокое отношение К Rb
характерно для артезианских подземных вод Cl-Na-Ca (620) и С1-
Mg-Ca (630) типов (714]. Рубидий накапливается в рассоле вплоть до
образования карналлита, который осаждает этот элемент. Самое
высокое отношение K7Rb (1500—3700) характерно для вод районов
калийных месторождений. Показательно оз. Индер, обогащенное Rb,
но пе содержащее карналлита. Максимальное содержание Rb (до
10 г/т) отмечается в водах древних водоемов сульфатного и хлорид-
ного типов перед садкой карналлита, особенно в тех, которые
питаются глубинными водами в областях молодого тектогенеза [60].
Особенно высокая концентрация Rb (х = 60 мг/л; запасы ~6 млн т)
характерна для минерализованных вод Мертвого озера (Израиль),
приуроченного к молодой рифтовой впадине [714].
Традиционный источник Rb — калиевые карналлитовые соли,— по
Т. Ф. Бойко [61], содержат в среднем 170 + 32 i т Rb при колебаниях
от 20 до 1820 г/т, a K/Rb от 89 до 3320. В первично седиментационных
карналлитах среднее содержание близко к 100 г г и не зависит от
временных геологических и гидрохимических условий образования.
Богаче Rb карналлиты из пластов большей мощности, а также из
подошвы пластов по сравнению с верхними их частями. Это
характерно для Предуралья и Стасфурского района (Германия).
Гораздо более высокая рубидиеносность — в среднем 600 + 320 г/т
— типична для диагенетических карналлитов, вне зависимости от их
формационной принадлежности. Кроме К, Mg и Rb, в карналлите
содержатся: Т1 (~0,05 г/т), Г’е2 + , NH4. Сильвин (КО) не концентриру-
ет Rb (до lOi/T), так же как полю алит цо 10 г т) и остальные
седиментационные минералы К [61] Это обусловлено более высоким
коэффициентом распределения Rb в карналлите (11—22) по сравнению
с сильвином (0.2—0,4). С этим связаны, по Т. Ф. Бойко, все
особенности поведения Rb в седиментогенных минералах К, в том
числе и приуроченность рубидиеносных карпаллиiов к нижним частям
пластов.
156
По Ф. X. Исмаилову и другим исследователям, распределение Rb
и Cs в жидкости (I) и твердых фазах (II) Аральского моря таково
(мг/кг): вода исходная 0,019 и 0,001; вода + гипс + кальцит: I 0,22
и 0,004, II 0,03 и 0,004; вода + мирабилит + галит: I 0,42 и 0,005, II 0,07
и 0,003; галит + астраханнт: I 1,3 и 0,006, II 0,047 и 0.005; га-
лит + эпсомит + гексагидрит: 13,8 и 0,05, 110,008 и 0,007; то
же + каинит + карналлит: I 0,01 и 0,001, II 2,23 и 0,04.
Другие осадочные месторождения, за исключением охарактеризо-
ванных галолитов и эвапоритов, не концентрируют Rb. В бокситах его
мало: общее среднее 23 г/т при довольно равномерном распределении
(г/т): платформенные 25, геосинклинальные 15, терригенные 20 [751].
Fe-Mn океанические конкреции также обеднены этим элементом:
среднее содержание 17 г/т (осадки—100 г/т) [34]. В каустобиолитах
среднее содержание Rb такое же—16 г/т при разнице в бурых (8 г/т)
и каменных (18 г/т) углях [714]; в горючих сланцах оно более
высокое — от 62 до 140 г/т.
В фосфоритах (10—12 г/т) и железных окисленных рудах (16—
35 г/т) Rb не концентрируется В марганцевых рудах среднее содержа-
ние оценено в 40 г/т; установлено высокое содержание (200 г/т) ‘в пробе
браунит-псиломелановой руды, связанное со слюдистой составляющей
[714].
Породы
Последние табличные значения кларков Rb шковы (г/т): ультрабази-
ты 5, базиты 50, мезиты ПО, гранодиориты 160, граниты 210. Слабее
других изучены ультрабазиты* для которых выполненные по немногочис-
ленным анализам подсчеты средних содержаний дают наибольший
разброс от 0,7 [546] и 2 [924] до 23 г/т [338]. Полное обобщение
анализов ультрабазитов (в основном данных зарубежных исследователей)
проведено Б. Г. Лутцем [428, 4291. Установлен весьма широкий разброс
содержаний; гак, для гипербазитов Анабарского щита (перидотиты,
пироксениты) количество Rb варьирует от 1,5 до 20 г/т при более
равномерном отношении K/Rb—от 266 до 120 и прямой зависимости
между содержаниями К и Rb. По Л. В. Дмитриеву, ультрабазита
срединно-океанических хребтов обеднены Rb (г/т): средний лерцолит 0,5
(K/Rb 1160), средний 1арцбургит 0,7 (K/Rb 160). Гипербазиты оке-
анических островов обогащены им: 5—30 г/т при х= 17,7±6,5 г/т (K/Rb
390); офиолитовые ультрабазиты материковых островов и островных дуг,
наоборот, обеднены Rb (г/т): Новая 1винея — перидотит 0,9, (K/Rb 660),
дунит 0,5 (460), гарцбуршг 0,8 (500); Камчатка—дунит 0,3 (133 при
отношении для Камчатки Rb/Li<l); р. Анадырь, хр. Усть-Бельский—
дунит 0,2 (350), лерцолит 0,3 (550), гарцбургит 0,2 (350); хр. Пикульней —
дунит 0,2 (300). 'Такие же низкие содержания (г/т) установлены: для
массивов островов Троодос—1 (K/Rb 180) и Пиндос—0,2 (300);
Стандарты ультрабазитов на Rb ие аттестованы
157
содержания для некоторых других районов (1 г): офиолиты Северо-
Акеринской зоны Армении — 0,38 (770), Полярного Урала 0,26 (270),
Монголии 1 (140 при отношении Rb Li<l) [428]. Генеральное среднее, по
Б. Г. Лугцу [427], следующее (г'т): гранатовый перидотит 3.4, эклогит 3,7,
шпинелевый перидотит 0,75, альпиногипный 0,24. океанический 0,5,
мантия под континентами 2,3. В тлубтпптых включениях |ранаговых
перидотитов Якутии среднее 3,3 + 0,5 г, г (К Rb 310), птпилелевых
перидотаюв 8,3 + 3,9т,т (184) Для эффузивных ультрабазитов содержа-
ния Rb таковы (г/т): пикриты 8, (К,Rb 300). коматииты 2—3.
В щелочных ультрабазитах содержания Rb более высокие (г/т):
мелатгефелинит 52 (К Rb 50), кимберлит 26 (46) [75], лейцетит 268,
нефелинит 76 (К Rb ~ 18). Систематическое изучение гппербазитов
Украинского щита показало, что их ферсм равен 3,1+0,2 т г при
отсутствии существенных отличий для интрузивных и тффузивных
разностей, по все же повышенных содержаниях в пикритах- 5 г г
и коматиитах — 8 г'т (дуниты 2, перидотиты 4,3 г г). При амфиболига-
зации перидотитов количество Rb увеличивается (+=16 г/т) [784]
Основные породы* достаточно полно изучены на Rb, который
используется как геохимический индикатор (К Rb) [363]. В таблицах
кларков генеральное среднее принято (г'т): 30 [924], 28 [50], 60 — по
Н. А. Солодову с соавторами; для зффузивов 38 [714]. Полное
обобщение фактических данных по Rb проведено в ряде работ [427,
428, 441, 714 и др.]. Выявлено отчетливое увеличение содержания Rb
и снижение отношения К Rb по мере увеличения щелочности
базальтов. Абсолютные значения составляют (т т): голейговые 8.5+ 2,5
(K/Rb 800), известково-щелочные 15,6 (470), К Na-субщелочныс 62 + 5
(250), шошонитовые 68.5 (350) [441]. Намечается различие по
содержанию Rb (г/т) для базитов областей сжатия — материков,
островных дуг (29) и растяжения — океанических областей и рифтов
(48) как в целом, так и для толеитов 3,3 и 13,7 и субщелочнык пород
31,5 и 62 [441]. Противоположные данные приводятся в целом для
кларков базальтов континентов 0,77 и океанов 0.15" о К [857]. Дтя
К-базальтоидов установлена зависимость рубидисностгости (г/т) от
степени калневости серий и рядов [197]: калиевый ряд 290, калий
натриевый 41, натриевый 60: ультракалисвая серия 422 (К Rb 163),
высококачиевая 374 (185), умереннокалисвая 88 (273). Для отдельных
разновидностей щелочных габброидов средние содержания равны (г'т):
гералит 14.. тешенит 20, эссексит 83, шонкинит 218 [439].
.П. В. Гаусон [745] использовал Rb для типизации базитов и под-
считал оценки средних для пород разной щелочности, совпадающие
с приведенными ниже, однако отличающий я от указанных для
континентальных (16 г/т) и океанических (3 г/т) толеитов, вероятно, за
счет различия понятий базальтов «океанически,'.» и «зон растяжения».
Для траппов Сибирской платформы среднее содержание Rb 27 т г
(K/Rb ~280), в расслоенных дифференцированных интрузиях оно
Аттестованный на Rb стандарт +1IJA щиабаз Wj I—20i,i.
Рис. 10. Соотношения К и Rb в удыраоснонных и основных породах;
Л—кимберлит; ?—средний хондрит. 3— транаювый перидотит, 4 мантийный эклогит;
5-—шпинелевый перидотит, в-—л тьштнотипный типербазит; 7—ахондрит: 8— океанический
ипербатит; 9—И)—толеит: 9—океанический. 10-—континента тьный, II — 12 — базальт:
//—щелочной оливиновый. 12—качиевын; Н—14—линии средних составов: 13—
мантийных пород, /4—ба талы ов. Поля' I— гранатовых перидотитов, II — шпинелевых
перидотитов, III — ачьпиногилных титтербазигов, IV — мантийных эклогитов
увеличивается к концу процесса с максимальным содержанием Rb
в более кислых разностях (диорит-neiматитах, габбродиоригах) [526].
То же характерно для i абброидов Ура ца (I' г); габбро 11+6, диориты
35 + 10, граниты 123 + 35 [732].
Высокоинформативной для рассмотрения ассоциаций магмати-
ческих ультрабазит-базиговых пород является анаграмма К Rb
(рис. 10), составленная С. М. Кравченко [ЗбЗ | я Б. Г. Лугцем
[427]. Средние породы с учетом интрузивных и эффузивных
159
разностей содержат 95 г/т Rb [724], гранодиориты 160, кислые
граниты 210 [52].
В гранитоидах Rb еше более зависим от SiO, и в определенных
пределах от К. Влияют и ряд других факторов — генезис (формация),
глубина становления, фаза формирования, геохимический тип, геотек-
тоническое положение. Зависимости от SiO2 и К четко выявляются при
формационном сопоставлении гранитоидов [460]: в породах габбро-
диоритовой формации 45 г i Rb, в Li-F гранитной 550 г/т, а также при
геохимической их группировке с учетом происхождения магм (см.
табл. 25). Самые высокие генеральные средние содержания характерны
для пород максиальной кремнекислотности (440 и 550 г т) и щелоч-
ности (300 и 270 г/т). Это же типично для отдельных районов
и массивов. Например, содержание Rb (г г) в Li-F гранитах Монголии
в среднем 511 —1639, в гипабиссальном массиве 118—235, в субвул-
канических онюнитах 438—1876 [108], щелочных 1ранитах Кольского
п-ова 81—400 г'г, рудоносных щелочных 1ранигоидах Саудовской
Аравии 123—919 [715].
Для изученных массивов i ранит оидов содержание Rb увеличивается
от 1 фазы (130—190 г/т) ко II (250—360 г i) [732].
В сиенитовых щелочных породах оценки его средних содержаний
близки к таковым в щелочных гранитоидах (см. табл. 25). Особенно
высоки они для псевдолейцитовых высококалиевых сиенитов—среднее
686 г/т; высоки и для других массивов калиевого типа нефелиновых
пород щелочно-нефелиновой палин!енной формации (по Л. С. Бороди-
ну и Е. Д. Осокину, 1977 г. — табл. 48).
Установленная для Восточного Забайкалья зависимость [622]—
более высокие содержания Rb и других щелочных металлов отвечают
транитоидам, формировавшимся в условиях восходящих геотектониче-
ских перемещений по сравнению с нисходящими (ff 350 г/т, 250,
И 167, Д 54 г/т—см. табл. 30),— выявлена и для других регионов
[755]. В целом для нашей страны гранигоиды, образовавшиеся
в обстановке преобладающих поднятий, имеют среднее содержание Rb
254 г/т, а опусканий—только 156 г т.
На примере Украинского щита установлено некоторое различие
по отношению К Rb для гранитоидов, формировавшихся в плат-
форменной и геосинклина тьной обстановках [645], что также
требует проверки. Изучение распределения Rb в одноименных
породах различных геотектонических этапов развишя Центрального
Казахстана [178] показало, что для базальтов, андезигобазальтов,
андезитов и кислых эффузивов низкие средние содержания (i / г)
типичны для геосинклинальных условий (14—56), а 1акже суб-
платформенпых и платформенных (18—20), а более высокие—для
орогенных (42—155).
В историческом разрезе содержание Rb в коматиитах, основных
эффузивах и гранитоидах закономерно увеличивается (г/i): ARt 2,
9 и 61; AR, з 3, 11 и 119; PRt 4, 15 и 175; PR, 3 ?, 20 и 179; Ph ?, 26
и 171 [664].
160
Таблица 48
Средние содержания редких и рассеянных элементов в главных
формациях нефелиновых сиенитов СССР, л 10 4%
Элемент Среднее содер- жание (70—115)* Щелочно-габброидная (ба- за чьтоидная) формация Щелочно-сиенитовая палин- генная формация
калиевая (12) натриевая (16—33) калиевая (9) натриевая (28—45)
Na, % 5,49 3,64 5,88 3,04 5,61
К, % 4,86 6,41 4,48 7,98 4,84
Li 40 29 30 30 60
Rb 200 225 146 430 195
Cs 7 6 3 20 6
Th 13,3 15 11,2 23 Н,4
и 4,0 4,9 3,1 5,5 3,7
Be 4,5 4 2 7 6
Mo 4 2 3 5 6
Sn 5 3 5 3 6,3
P 23 28 12 44 21
Zn 85 89 90 48 92
Sr ИЗО 1750 1100 940 1000
Ba 1600 2800 1600 2100 350
Nb 110 34 117 22 96
Ta 7,2 1,3 8,2 2 7,2
Zr 390 270 465 280 400
TR 340 295 570 145 330
V 54 205 54 55 10
Cr 28 78 21 18 17
Ni 8 20 6 4 1,5
Co 7 9 6 3 1,8
Cu 42 48 27 29 17
* В скобках — число массивов, по которым вычислялись средние содержания.
Содержания редких элементов в нефелиновых сиенитах натриевой ветви и в среднем типе
нефелиновых сиенитов приведены по Е. Д Осокину (1970 г.). Eh, U, Be, Мо, Zn, Sr, Ва,
Cu — по Л С. Бородину. Е. Д. Осокину (1972 г.).
Осадочные породы в целом содержат 92 г/т Rb [714], а отдельные
их разности (i т; в скобках — число анализов): глины 134, каолиновые
27 (7), монтмориллонитовые 83 (29), полимннеральные 140 (688),
гидрослюдис гые 118(127); песчаные породы 68, алевроли гы 81 (246),
песчаники 64 (930), пески 71 (35); карбонатные образования 22,
известняки 26 (105), мергели 22 (66), эдафогенные известковые илы 6,3
(59). Данные по различным районам [178] подтверждают приведенный
ряд снижения содержаний. Для Центрального Казахстана установлено
[178], что более низкие содержания Rb в песчаниках, алевролитах
и аргиллитах типичны для геосинклинальных, субплатформенных
и платформенных условий их образования (29—64 r/т), высокие—для
орогенных (37—115 г'т). В глинистых юрских отложениях Таджикской
депрессии континентальные разности содержали несколько больше Rb
И 2138 161
(192—218 г, т), по сравнению с морскими (148—190 иг) [178].
Изучение форм нахождения Rb в верхнемеловых О1ложениях этой
депрессии показа то, что основное его количество связано с не-
растворимой силикатной фаэой (87—93,5%) при наибольшей роли
труднораетворимой формы (5%-ный раствор НС1) в осадках лагун
со слабосоленой водой (7,7%) и морских (8,5%). а легкорастворимой
(~3,6%)— в отложениях лагун повышенной солености. Увеличение
прочности связи щелочей с силикатами (глинами) идет в ряду
Na-»K~>Rb »Cs, соответствующем увеличению гидратации их ионов
и сорбционной способности глин. В морских осадках в более
глубинных зонах содержание ионно-обменных форм выше, а со-
отношение Rb с К, Cs ниже
Палеотидрохимические условия осадкообразования оказывают су-
щественное влияние на распределение подвижных форм (пф) щелочных
металлов в глинистых породах. Максимальное содержание Кпф, RbII(1>
и Csn(j, выявлено в глинистых осадках солоновато-водных лагун
и эаливов, минимальное — в морских осадках и отложениях лагун
с повышенной соленостью вод. В противоположность этому содержа-
ние Ма„ф увеличивается с ростом соленое!и седиментационных вод.
Относительное содержание MenF (поглощенного комплекса) в глинис-
тых осадках опресненной прибрежно-моской зоны увеличивается в ряду
Na-»K-»Pb ->Cs. и условиях же повышенной солености вод этот ряд
изменяйся: К -»Cs->Pb ->Na
В метаморфических породах, по А А Кременсцкому [714] среднее
содержание Rb составляет 56 4 i т, а поведение, как и для Cs, с учетом
данных Е. В. Петрова, В А Мокрыгиной (1975 г.), харакгеризустея
двойственностью: изохимическим состоянием при низко-среднстем-
перагурных стадиях (зеленосланцевая, эпидог-амфиболиговая. частич-
но амфиболитовая) и перераспределением с существенным выносом
в высокотемпературные стадии (амфиболитовую и i рапулиговую).
Причем для Патомского наюрья ферсм пород амфиболитовой фации
(176±19г/т) выше, чем гранулитовой (1144 28 г. г). В условиях
аллохимической стадии регионального мегаморфизма метапелиговые
породы могут служить источником редких щелочных металлов,
а метабазиты—благоприятной вмещающей средой.
Почвы растения, животные
В почвах и растениях Rb ведет себя близко к К, но интенсивность
ею водной ми! рации ниже и накопления этого элемента в почвах не
происходит; биофильность Rb также ниже, чем К [574].
По А. П. Виноградову, кларк Rb в почвах 0,015 i 'т, К Rb = 80.
В ходе почвообразовательных процессов отношение К Rb снижается.
Самое высокое содержание Rb (мг'кг) в почвах на траншах и i пейсах
(100—120). а также в аллювиальных почвах (55—140 среднее для
США 100): низкие содержания в песчанистых (30—50) и органических
жгккх почвах (.<=30—США). Ферсм Rb (мг/кг) для США 82+13
Ml
(913], для Болгарии, по М Найденову с соавторами (1977 з.),— 179,
для суглинистых почв Польши, по И. Добровольски (1981 г.),— 66.
Для растений также характерно K-Rb взаимодействие, но указыва-
ется на невозможность заменять К в процессах метаболизма и на
токсичность Rb в связи с этим в высоких концентрациях для растений
[312]. А. Воллее (1970 г.) также О1мечал различия в накоплении
и перемещении Rb в растениях.
Кларки Rb для биосферы 90 i т [198]. биоса — 5i/t. Средние
содержания Rb в сельхозрастениях таковы (мг'кг): зерно пшеницы 4,
кукурузы 3; лук 1; сала! латук 14; капуста 12; бобы (стручки) 51; соя
(бобы) 220; плоды— яблоки 50, авокадо 20; наземная часть клевера 44,
люцерны 98; кормовые !равы 1Ю [312]; генеральные средние
содержания Rb (мг кг): растения морские 7.4. наземные 20; морские
и наземные животные 20 и 17 соответственно, чем Rb отличается от
К [860] В океанском планктоне и во взвеси его 3 и 50 мг'кг [677]
В организме человека Rb обнаружен в органах, богатых К.
Суточное содержание Rb в пище человека, по Е. Хамильтон (1981 г),
такое (ммоль): ( ША 25,7, Великобритания 51.5 ± 17,5, ФРГ 22.2, Индия
31,6. Распределение ею по разным средам и органам человека по
обобщенным данным следующее (в скобках — число анализов): кровь
(мг'л) — общая 2,54-0,3 (243), эритроциты 4,2—5,3 (22); другие
данные — в л-К)-6: кость 0.1—5.1; мозг 1,5—12 (35, ж.), 100 (6, з.);
волосы 0,2—0,5 (619); сердце 2,8—4.1 (30, ж.), 450 (23, з.); почка
3,9—12 (42, ж ), 20 (65. с.), 550 (25, з.); печень 7—12 (29, ж.), 5—50 (80.
с.), 500 (24, з.) легкие .3.5—14 (33. ж.). 24 (68, с.), 500 (23, з.); мышцы
5—14 (30, ж ), 350—500 (20, з.); ногти 3,1 (3); кожа 22 (12, ж.), 8,3 (5,
с). 250 (16, з.); селезенка 4,8—11 (19, ж.) 4 (67, с.), 500 (22, з.) [931].
Он полностью всасывается из желудочно-кишечного тракта В крови
Rb концентрируется в эритропитах, наибольшее его количество
заключено в мышцах и других органах.
По другим данным [512] средняя концентрация Rb в легких
9,2 мкг г, в костях 26,7 мкг/г, в мягких 1канях 7,8 мкг/кг для Rb
общее 45 сут., вычисленное—100 сут., кратность накопления 145, т. е.
значительно выше, чем у К, Na и Li [512]. Содержание 87 Rb в тканях
организмов ~ 8,5 Бк к! 1 [381].
Радио токсичное! ью обладает радионуклид 86 Rb (см. табл. 2),
который так же легко, как 40~42к, всасывается в организм из
желудочно-кишечною тракта (100%) и легких (75%) и имеет 77, биоло-
гический 45 сут и Г эффективный - 1.3 сут ПДК 8t’Rb (Ки/л)- ПДКР,
7 10 ПДК сани!арно-защитных зон 7 10~’2, населенных пунктов
7 10 13; ПДК„„ 7 -10 9 [27. 511].
Воздух, вода, техногенез
В океаническом воздухе среднее содержание Rb 1,8 10мкг/м1,
в атмосфере над Южным полюсом 2 10~3 нг/м3, над крупными
зарубежными городами 2 нг/м3, над городами Сибири — 5 ш/м3 |626],
11 * 16.3
в океаническом аэрозоле 12 мг/ki; среднее содержание в атмосферных
осадках 0,15 мкг/л в растворе и 0,24 мкг л во взвеси.
Изучение выпадений Rb (мг/м2-год) из атмосферы на снеговой
покров в Томске и Кемерово показало, что в первом оно составляет
4,5±0,7, во втором 14 + 4,4, а вне городов (50 км) 6 + 0,3 по розе ветров
и от 1,7+ 0,2 до 3,1+0,2 — в противоположном направлении [845].
В бассейне Верхней Волги выпадение Rb с атмосферными осадками
составило 0,21 Г/м2-год (0,08 раствор, 0,13 взвесь) или 0,39 мкг л
(раствор 0,15, взвесь 0,24); в атмосферном аэрозоле—18 мкг,г (с.)
[590].
В океанической воде содержится 0,12-10 4 % Rb, в речных гораздо
меньше—1-10 6%. Талассофильность этого элемента гораздо ниже,
чем К, чго связано с более интенсивной ею сорбцией из воды
(глинистыми илами) [312]. Время пребывания Rb в океане ~3,9 106
лет. Для морской компоненты (4,1 • 103 т/год) по сравнению с терриген-
ной (92-103 т/год) в атмосфере ниже [726]. Данные по разным типам
и классам подземных артезианских вод приведены в табл. 22—24.
Среднее содержание Rb в поверхностных водоемах мира 0,7 мкт л
[590]. В бассейне Верхней Волги [590] содержание его (растворенная
форма) в реках и водоемах составляет ( мкг/л): Москва 1,1, Вазуза 0,6,
Волга 1; водохранилища 0,7; грунтовые и подземные воды этого
региона 0,5 и 0,6; другие оценки ( мкт/г; с.): речная взвесь 12, илы 26,
почвы 35, зола растений 15, фитопланктон 4,0.
Техногенное поведение Rb изучено неполно. Несмотря на значи-
тельную токсичность некоторых его соединений ПДК для атмосферы
и воды не разработаны. Весь Rb, содержащийся в минеральном сырье,
в настоящее время выбрасывается в окружающую среду. По
Г. С. Межуевой, М. Г. Егоровой, В. М. Роговому (1990 г.), его извлече-
ние из апатит-нефелиновых и калийных руд составляет (%): при
добыче 92 и 32, при обогащении и переделе 0 и и10 6. При
производстве Rb в воздухе — аэрозолях помещений—содержания его
солей достигали "25,4 мг/м3 за счет уноса с поверхности горячих
растворов; при промывании и выпаривании солей Rb концентрация ст о
в воздухе помещений составляла до 96 мг'м3, а в воздухе рабочей зоны
22—41 мг/м3. Источником загрязнения рубидием окружающей среды
считаются ТЭЦ, работающие на минеральном топливе. Ут ольная пыль
содержит 9—22 мкг/г Rb [128]. Большие количества его могут
попадать в воды при разработке, переработке и хранении минеральных
солей.
Токсическое действие RbCl для водорослей ктасса Scendesmns
и простейших Microregma составляет 14 мг/л [230]. Наблюдалось
острое отравление животных при содержании (мг'кг) гидроксидов Rb
840—900, хлоридов 3800, иодидов 4700 [128]. Радионуклид 87 Rb
распространен в окружающей среде в микроколичествах, имеет мягкое
излучение и не представляет повышенной опасности.
Выводы. Рубидий—редкий, общетоксичный (Т,= 1—5) металл
средней распространенности и неопределенной технофи чьност и и тех-
164
ногенности, не изученный экогеохимически. Он геохимический анало!
К, рассеян в калийсодержащих породах, не образует крупных
концен! раций ни в одной из геологических и экологических систем
и следует за К в месторождениях, организмах и техногенезе.
Практически весь Rb, вынимаемый из недр в значительных количест-
вах с различными полезными ископаемыми, выбрасывается в окружа-
ющую среду и пока не приносит пользы.
ЦЕЗИЙ —55
Редкий (кларк Земной коры 0,0004%*) щелочной металл, не
выясненного биологического значения и токсичности**. ПДКрз Cs3As
0,03 мг'м3 (I класс опасности), гидроксида 0,3 mi/м3 (11 класс) [727].
Атом
Атом Cs представлен одним стабильным изотопом 133Cs; распро-
страненные сильнотоксичные радионуклиды имеют следующие перио-
ды полураспада, годы: 137Cs 30; 134Cs 2,3; ,35Cs З Ю6.
В периодической таблице Cs(4j °5d°5p65s26sl), как и Rb, является
полным гомологом К и Fr и соседствует по горизонтали и диагонали
е Ва, Sr, Ra. Очень сходен с К и Rb. По сравнению с ними имеет еще
более высокие показатели химической активности и размера иона, что
определяет не только шестерную, но и более высокую координацию
в ряде соединений, а также другие отличия (см. табл. 17). Метал-
лический Cs диамагнитен. Cs и Rb—самые реакционноспособные
металлы. На воздухе Cs воспламеняется с образованием оксидов
и пероксидов, бурно реа1ирует с водой, давая CsOH, со взрывом
взаимодействует с галогенами, S, СО2, СС14, при надевании— с Р, С,
Si и металлами. Самыми растворимыми (г на 100 г Н2О) являются;
некоторые галогениды—CsF 530, CsCl 191,9 (меньшую растворимость
имею| CsBr 55,2 и Csl 46,1), а также карбонат 308,3, сульфат 178,7,
диги । ч>ртофосфа1Ы 147,5; затем идут гидроксид—79,4, нитрат 28,8,
алюмоквасцы 0,46 [716].
Минералого-геохимическая формула Cs для глубинных и поверх-
ностных условий Л юо и О юо — лито- и оксифильный металл.
В метеоритах он также литофилеи и накапливается в хондритах (мг/т):
обыкновенные — Н 59, L 231, LL 202; энсга1итовые Е4 232, Е5 6 81;
углистые С1 191***, СП 131, СШ 81; ахондриты 3,5 [668]. Содержания
Cs в лунных породах таковы (мг/т): «Луна-16»—реюли! 60—260
(х = 90), базалы 750; «Луна-20»—реголит 100—200 [107]. Для модель-
ных составов Земли оценки для Cs следующие (мг/т): примитивная
* Литосфера без осадочного чехла 0,0002% [50]; кларк осадочного чехла
0.0005% [714. 716], биосферы 0.0006% [198], биоса 0,00001%.
** Ра тионуклиды представляют наибольшую опасность (см. табл. 2).
*** Дтя расчетов С Тейлор принял 279 мг/т [749].
165
мангия 18; общая континентальная кора 1000, верхняя 3700, нижняя
100 [ 749]; протокора 500 [372]. В осадочной оболочке Земли оценка
кларка Cs выше, чем в кристаллической,— 64 и 35 г/т [898 |.
Фактическое содержание для Украинского кристаллического щита
в целом составило 2000 мг/т [501 ].
Минералы
Минералы с более высокими содержаниями Cs2O, чем 5—7 ат. %,
неизвестны. Собственным минералом Cs (~5—7 аг. % Cs2O) считает-
ся поллуцит CsNaAlSi2O6-иН2О (до 32,7% Cs2O по массе: ГЭ 2-104).
К обогащенным им разновидностям минералов относятся цезиевый
биотит (содержание Cs2O по массе до 7,1%), цезиевый протолитионит
(до 4,2%) и очень редкие минералы — авогарди г (К. Cs) BF4 (5.37%
Cs2O), воробьевит (Cs, Ве)3 Al2 [Si6OiB] (до 7,5%). цезиевый—астро-
филлит (10,8%), родицит (К, Cs) Si4Al4Be3BlnO2.7, цезплюмгантит (Cs,
Na)2 (Pb, Sb3 *)3ТавО24, цезиевый куплегскит Cs2Na(Mn4Fc2)-Ti2SiB х
xO27(OH)2F.
Цезий является рассеянным элементом, атомы которого в основ-
ном заключены в минералах друг их элементов, среди которых
выделяются цезиевые разновидности биотита и протолит ионита.
Изучен цезиевый биотит из редкометальных пегматитов и околопег-
матитовых мегасоматитов, развитых в контакте сподумен-микроклин-
альбитовых жил и биотит-роговообманковых пород (гранит оиды,
амфиболиты). Минерал характеризуется также высоким содержанием
(%) Rb2O (до 1,5), А12О3 (15,20—16,85), FeO (15.13—20.06). MgO
(7,54—11,42) и пониженным К2О (4,47—6,24); кристаллизуется он
в политипе 1М [703]. Повышенные содержания Cs установлены
в лепидолитах (0,4—1,2% Cs2O) и протолит ионитах (0,05—0,23%
Cs2O) редкометальных плюмазитовых гранитов (см. табл. 19). а также
в литиевом мусковите (0.2—0.4% Cs2O при обычном содержании
в нем 0,002—0,11% Cs и среднем 0,016%). Среднее содержание (%):
в биотите 0,01, полевых шпатах 0,0015, нефелине 0,002 (см. табл. 20),
карналлите 0,0006.
По Н А. Солодову (1977 г.), доля промышленной цобычи Cs
из поллуцита составляла в 70-е годы '-70%, а из цезиевого
биотита ~25%.
Мес горождеиия
Цезии не образует собственных месторождений, добывается попут-
но (за рубежом в количестве всего - 20 т/год) и используется в новой
технике. Общий сырьевой потенциал его оценивается не менее чем в 20
млн г. Технофильность низкая (Тф~1()’).
Рудные концентрации Cs известны только в литофильной тндоген-
ной и гидрофильной группах месторождений Добывается он вместе
с Li и Rb из нгдогенных редкометальггых гранитных пегматитов;
166
перспективны также около: раннтные и околопегматитовые слюдиты
и вообще темные слюды (биогш—флогопит, криофилли:), а также
нефелиновые породы, а среди ткзогенных источников,— возможно,
высоко термальные воды [716].
В паматикп кларки Cs составляю! (%): Cs 0,04; Rb0,13; Li 0,30
[716. 714]. За счет поллуцита и Cs-слюд содержание Cs в отдельных
петматитовых жилах микроклин-альби товых пегматитов может дости-
гать 0,5% при среднем для этою типа (%): Cs 0,10. Rb0.18, Li 0,11
(K/Rb ~ 18, К Cs~32) Для остальных типов редкометальных [ракит-
ных пегматитов генеральное среднее ниже (%): микроклиновые
Cs 0,005, Rb 0,091. Li 0,003; альбитовые Cs 0.016, Rb 0,09, Li 0,014;
альбит-споду меновые Cs 0,01, Rb 0,10. Li 0,55 [714]. По мощности жил
содержание Cs и Rb примерно пропорционально содержанию К и воз-
растает от краев к центру жил при значительном снижении отношения
Rb/Cs. Поллуцит, для которого не характерна K-Cs ассоциация, либо
связан с зоной мелкопластинчатою альбита—самой поздней из’всех
альбитовых зон, либо образует собственные участки в центральной
части жил вместе с лепидолитом, сподуменом, амблигонитом, Li-
Cs-бериллом Li-турмалином и др. По падению жил содержание Cs
и Rb снижается [714].
Обогащенные щелочными редкими металлами околопе! матиговые
метасоматиты (холмквист и т-цезийбиотитовые слюдиты) содержат до
0,1—0,5% Cs2O в био гиговых зонах и крупные ресурсы этого металла,
определяемые в отдельных объектах как достигающие 100 тыс. т.
Состав биотита колеблется от аннита до флогопита и наиболее
обогащен Cs (0,25—0,9%) и Rb (0,39—0,7%) в экзокон тактовых зонах
пегматитов [714—7161.
Повышенными концентрациями Li. Rb и Cs характеризуются
и грейзен-гидротермальные образования [714], в которых Cs также
приурочен к темным слюдам (флоюпи!, биогит) и наиболее типичен для
руд Fe, Be, Sn, в которых ею содержание колеблется от 0,02 до 0,6%.
Зиачигельные концентрации Cs установлены в кислых вулканиче-
ских стеклах. А. А. Кременецкий выделяет среди них по содержанию
Cs (%) три группы: 1) х = 0,021, ,vmax = 0,04; II) л1пак=-0,088 —0,12 (I,
II—стекла нервичномат матическо! о генезиса в эндоконтактах и купо-
лах магматических тел, а также лавовых покровов или эффузивных
потоков, игнимбригов или вигрокластических !уфов; 111) т = 0,0566%,
vmax = 0,315 (гидротермально измененные стекла 1 и II трупп). Более
благоприятны для накопления Cs и Rb перлиты, a Li — обсидианы.
Основное количество Cs содержится в стекле. Такие стекла установлены
во многих районах, нередко их цезиеносность определяется связью
с тектоническими нарушениями (III группа) и сопровождается тдрага-
цией (до 10% Н2О). Корреляционный анализ показал, что К — Rb, Cs
положительная связь характерна только для стекол 1 и 11 групп, а для
111 — связь либо незначима, либо отрицательная [714].
Среди гидрофильной i руппы концентраций редких щелочных
мщаллов повышенная цезиепоспосгь отмечалась для термальных вол
167
Таблица 49
Содержания редких щелочных металлов в Платовых
хлоридиых во «ах, м« /л
Класс Под- класс Минерализация Mco, t/n Li Rb Cs
I. Cl-Ca-Na a 0—50 3.72 0,75 0,21
50—100 5,80 0.86 0,37
100—200 7,39 1 36 0,44
>200 8,20 2,8 2,1
6 0—100 5,7 1 04 0,29
100—200 10,8 1,80 0,355
200—300 16,6 2,00 0,536
300—400 33.6 5,60 0,788
III. Cl-Mg-Na a 30 1,5 0,19 0.19
6 192 1,9 0 64 0.19
IV. Cl Na a 32,7 2,6 0 79 0,30
6 253 1,48 0.38 0,18
V. Cl-Na-Ca — 200—300 22.5 4 5 0,60
300—400 76,0 16,1 1,56
400—500 104 32,5 2,83
VII. Cl-Mg-Ca — 300—400 87 15,5 0,55
400—500 114 15,0 1,44
500—600 195 14,4 0,12
IX Cl-Na-Mg — 346 87 16.4 1,65
XI. Cl-Ca-Mg — 380 93 16,7 —
XII. Cl-Mg —— 407 148 10,2 —
HCO3-Cl-Na — 16,2 2,2 0,21 0,14
SO4-Cl-Ca-Na — 25.6 1,2 0,14 0,19
вулканических областей (х= 1,2 мг/л Cs) и глубинных хлоридных
артезианских существенно натриевых, кальциевых или магниевых вод
(_х=0,2 мг/л Cs). По данным Л. С. Балашова, обогащение вод Cs не
может идти через стадию галогенеза, т. е. путем прямой концентрации
его из морской воды. Предполагается, что существенное значение
могут иметь растительные и животные организмы, а также выщелачи-
вание из цезийсодержащих минералов. Средние содержания Cs изучены
Л. С. Балашовым для всех типов подземных артезианских хлоридных
вод, они не превышают 0,0009 мг/л и не всегда связаны с увеличением
степени общей минерализации (табл. 49, см. табл. 23, 24).
Термальные воды молодых вулканических областей, хотя и от-
носятся к перспективным источникам редких щелочных металлов,
содержат незначительные их концентрации (мг/л): углекислые гид-
рокарбонат ные воды C-HCOj-Na класса — Cs 2—3, Li до 30, В до 200;
хлоридные Cl-Ca-Na— Cs до 2,4, иногда присутствуют В, F, As
(Япония, Исландия и др.); углекислые Cl-Ca-Na — Cs до 6 [714].
В осадочных рудах (кроме солей Na и Na-Mg рассолов) Cs не
концентрируется.
В бокситах его кларк 1,4 г/т [751] при отсутствии разницы между
геосинклинальными и платформенными; среднее содержание, по
168
А. А. Кременецкому.—7гт (и = 30). K'Cs — 300, Rb'Cs—5. Изучение
профиля бокситового месторождения показало отсутствие изменений
концентрации Cs (г г) от исходных слюдистых сланцев (7) к глинистой
зоне (7), аллитам (7) и бокситам (7,1) [714].
В углях нашей страны средние содержания Cs составляют 1,4 г.т,
в каменных 1,4, бурых 1 г т (по более поздним данным—2,4+1,9 г'т).
Для нефтей имеются тайные только для Канады (сырая нефть
0,0043 г/т), а для «черных» и горючих сланцев—отрывочные сведения
только для США (Огайо, Кентукки—среднее 10 г/т).
Железо-марганцевые конкреции слабо изучены на Cs и оценки
среднего, по данным разных авторов и единичным анализам,
варьируют от 0,6 до 2,6 г/т; среднее, для Тихого океана по Б. Хайнес
(1986 г.),— 0,75 г'т, по О. А. Дворецкой, Т. Ф. Бойко для северной
зоны—1 г/т при равенстве содержаний для центральных и пери-
ферических частей конкреций и связи Cs с обломочной составля-
ющей. Если учесть, чго в глубоководных осадках содержание Cs
оценивается в 4,2—10 г'т, то В цезия, вероятно, <0,1 [34]. По
Н. Ф. Челищеву и другим исследователям (1983 г.), среди всех
металлов сорбционная емкость Fe-Mn конкреций дтя Na, К и Cs
наименьшая [811, 812].
Анализы окисленных железных руд показали отсутствие (<5 г'т) Cs
[714]. Марганцевые руды слабо изучены, но в браунит-псиломелаио-
вых рудах отмечались высокие его концентрации—60 г/т, Rb/Cs~3
[714]. В фосфоритах накопление цезия не отмечаюсь.
В соленосных отложениях при нижней чувствительности анализа
1—5г/т Cs не обнаружен, только в карналлите из Гаурдакского
месторождения установлено 2 г/т Cs [61].
Породы
Породы в отношении Cs изучены недостаточно*, особенно
ультрабазиты и базиты, для которых характерен наибольший разброс
оценок средних содержаний (г/т)—от 0, и О. Хорстман, 1959 г.) и 0,1
[105] до 11 (интрузивные) и 0,6 (эффузивные) [714]. Для Mg-
эффузивов протерозоя Балтийского щита среднее 4,5 Ст [439]. Для
ультрабазитов Украинского шита А. Б. Фомин [784] установил от 0,1
до 1 г/т Cs и не обнаружил разницы для пород разных формаций
ультрабазитов. Для эффузивных ультрабазитов содержания Cs тако-
вы (г/т): кимберлиты 3, пикриты 0,6, щелочные пикриты 2, базаниты
3—как будто с некоторой тенденцией увеличения с повышением
щелочности.
* Стандартные пробы ультрабазитов на Cs не аттестованы, других
пород—таковы (г/т): 1) основные породы—диабаз W-1 (США) 1,2; базальт ВМ
(Германия) 2 + 0,4; трапп СТ-1А (СССР) 0,9+0,1; габбро эссекситовое СТД-1А
3,8±0,4; 2) граниты—С-Л (США) 3,0; СМ (Германия) 8,1+0,5; альбитизирован-
ный СГ-1А (СССР) 12+1; аляскитовый СТ-2 (СССР) 4,5+0,5; щелочной СГ-3
(СССР) 4,5 + 0,5; 3) грейзен СП(Германия) 46±6.
169
Основные породы также охарактеризованы единичными анализами.
8 таблицах кларков последний принят 1 т/г [50, 52, 107, 924];
Н. А. Солодов с соавторами [716J считают, что он на порядок выше и,
нехо тя из содержаний в минера тах пород и основных эффузивах,
оценивают среднее для базитов в 6,7 т,т. В базальтах и ан-
дезит обазалыах содержания Cs (т 'т) колеблются от 0,05 до 33 (среднее
3), в андезитах—от 0,05 до 90 (среднее 5), при этом связи со
щелочностью не устанавливается [714]. По более ранним единичным
данным океанический толеит содержит меньше Cs (0,016 т т), чем
континентальный (0,5 г т) [427]; то же по [857]—0,05 и 1 г'г
соответственно. Щелочно-оливиновый базальт (2 т, т) и калиевый
щелочной (50 г, г) по более ранним данным [427] имеют повышенные
концентрации Cs, чем по поздним [714].
Для интрузивных средних пород содержания, ио Н. Л. Солодову,
оз 3 до 12 г/т, по А. А. Ярошевскому, 1,7 т/т. Повышенное количество
Cs [725, 827] установлено в табброанортозигах Украинского щита
(8—14 г/г) [645].
В гранитоидах табличные кларковые оценки для гранитов 5 г т, д тя
гранодиоритов 2 г/т [52]. Для формаций гранитоидов оценки средних
содержаний увеличиваются по мере повышения количества SiO2, по
наиболее полным данным [714], следующим образом (г т); от 1,1 для
плат иогранитов (дифференциалов основною мат магизма) до 66 в Li-1
гранитах; ниже ли оценки для щелочных гранитов — Ют г [460].
Ферсм Cs в щелочных гранитах Кольского п-ова 3.6+0.2 т,'т. Отсутст-
вие преобладающей связи степени цезиепосности пород с их щелочно-
стью отметил и Л. В. Таусон на примере редкоме галытых гранитов
(агпаитовые 1,9 г'т Cs, миаскитовые 17,5 г, т — см. табл. 25). Етце более
четко основная роль кислотности пород в накоплении Cs установлена
А. А. Кременецким [724] на примере эффузивных пород. Для пород
щелочноземельного тренда содержание Cs (г'г) от пикритов (0.4)
к толеитам (3), андезитам и андезитодацигам (5), дацитам (9),
риодацитам (30) и кислым стеклам (56) резко увеличивается, тогда как
в породах повышенной щелочности и щелочною тренда значительного
увеличения цезиепосности не отмечается.
Особенностью Cs, отличающей его от К, Li и Na, является
способность концентрироваться в самых кислых конечных (ифференци-
атах магматического расплава (до 16Х г/г, .v = 7), максимально прояв-
ленная в кислых вулканических стек чах (до 410, г = 30). Показано, что
при гидротермальном изменении стекол содержание Cs (и Rb) может
достигать 3150 г/т (среднее для известных случаев 250 т г) [7141.
В некоторых случаях концентрации Cs в этих породах не
устанавливаются. Например, в перлитах и игнимбритах Сихотэ-Алиня,
по А. О. Соболеву с соавторами (1989 т.), содержания Cs, Li, Со, V, Ni,
Be, Th, U (табл. 50) близки к кларку, а Мо, Sr, Rb, Cr — выше.
Интересно, что как и все перлиты (Забайкалье, Армения, запад США),
они обогащены Pb, Мо. Sn и отличаются от перлитов мира
пониженными содержаниями U, Th, Вс.
170
Таблица 50
Содержания К,О (%), Cs и других элементов (т/т)
в вулканических стеклах Сихои-Алиия
Пороча (число анлизов) К,О Cs Си Мо Sn Pb У Ni с<> Cr
Перлит (31) 4 8 28 4,5 4,2 32 13 27 3.3 22
Ви гроигнибрит (150) 3,6 9 14 .3,5 3.5 23 21 13 4 44
Вигродацит (3) 3,7 4 22 4,3 4 23 38 13 3.5 40
Вптрориолиг (52) 3,2 6 13 3 3.7 25 14 7 3,6 10
Продолжение табл. 50
Порода (число аназилов) Не Sr Ва Ag Hg Th 11 Li Rb
Перлит (31) 5,5 141 160 .3 0,9—112 12 3 9 132
Витроигнибрит (150) 4,2 150 130 3,5 1,1 11 3 25 121
Витродациг (3) 4,2 417 128 3,5 8,7 7,1 2,8 9 77
Вигрориолит (52) 4 200 93 1,6 1 11 1,2 20 120
Изучение кислых эфорузивов (пантеллеритов) на ионном микрозон-
де позволило непосредственно в шлифах определить содержания Cs,
Rb и Li в стекловатой породе (соответс i венио 8, 320 и 45 i/t и Х’р,
которые составили для Cs: расплавное включение 0,4, анортоклаз 0,33,
энигматит 0,8, геденбер!ит 1,0, кварц 1 -10 4. При пом содержание Cs,
Rb, I i, Hf и TR оказалось в стекле выше, чем в породе [614].
В дифференцированных комплексах от 1 ко II фате содержание Cs
увеличивается [732].
Существенное влияние на степень цезиепосности ма) ма гических
пород и их минералов оказывают геотектонические условия форми-
рования гранитоидов (см. табл. 30). что впервые было установлено для
Восточного Забайкалья [622]. Эта зависимость заключается в более
высоком содержании Cs в одноименных минералах областей предынт-
рузивных поднятий и jj) по сравнению с породами блоков
преимущественных нисходящих перемещений (Ц и ]|); например,
среднее содержание Cs (г/т) в гранодиоритах этих областей 45 и .3,
в гранитах И и .3, лейкогранитах 25 и 3. Сходные гео 1 екiонические
закономерности установлены для эффузивных пород [622, 714].
В частности, от теосипклинальной стадии к орогенной и активизацион-
ной концентрация Cs в группе кислых вулканических пород увеличива-
ется от 4 до 49 г'т [714].
По В. 14. Коваленко [332] и Н. В. Владыкину [108], Li-F граниты,
которые образуются в результате длительной дифференциации гранит-
ной магмы с накоплением F, Li и других редких элементов,
значительно обогащены Cs. Особенно богаты им (х= 155 г/т) аль-
бититы гнпабнссалытых массивов, меньшие концентрации отмечаются
в мезоабиссальных (28 гг); в остальных породах эта зависимость
171
в целом сохраняется, а содержание Cs в среднем колеблется от 13
(онгониты) до 28 г/т (микроклин-альбитовые аляскиты).
Цезиеносность осадочных пород нашей страны изучена довольно
полно [714]; эти породы характеризуются увеличением средних
содержаний Cs (г т) от карбонатных образований, в том числе
глинистых (2,9; эдафогенные карбонатные илы 1,6) к мергелям (5,2) при
.среднем для этой группы 4,7, далее к песчанистым разностям (среднее
9,32) и к глинам (среднее 13,9 (15 [857]); каолинитовые 5,6,
монтмориллонитовые 10,8, гидрослюдистые 11,6, полиминеральные
14,7). Содержания Cs имеют обратную корреляцию с i ранулометриче-
ским составом пород. По этим данным кларк Cs в осадочном слое
Земли 10,6 г/т; соотношения K 'Cs 1827, Rb,Cs 9 В глинистых породах
Таджикской депрессии содержание Cs оказалось выше в тех разностях,
которые образовались в контииентатьных условиях (7,4—7,5 г/т) по
сравнению с возникшими в морской обстановке (6,5—6.8 г т) [178].
Метаморфические породы, по данным А. А. Кременецкого [714],
в среднем содержат 3,4 г/т Cs, распределение которого зависит от типа
субстрата и стадии метаморфизма. При прогрессивном региональном
метаморфизме выделено две ветви поведения Cs — изохимическая при
низко-среднетемпературном режиме (зеленосланцевая, эпидот-амфибо-
литовая и частично амфиболитовая фации) и аллохимическая с его
перераспределением и значительным выносом (высокотемпературные
амфиболитовая и гранулитовая фации).
Почвы, растения, животные
Почвы слабо изучены на Cs. Биофильность его (0,026) близка
к таковой Rb. Mg и ниже, чем у К [574] В почвах, по ранним данным
К. Ведеполя (1976 г.), пределы содержания Cs 3,6—26 мг кг (для
Канады и Болгарии 0,3—5,1 и 2,2—16,7 мг/кг): накапливается он
в почвах, богатых органикой, и в гумусовом горизонте [312].
В гумусовых горизонтах почв Русской платформы, по Д. Н. Иванову
(1956 г.), его количество достигает 40 мт кг. что выше, чем в материн-
ских породах А И. Перельман считает, что Cs при низких концент-
рациях выщелачивается из почв слабее, чем К и Rb
В растениях в целом кларк Cs (г'т) для сути 0,2, для океана 0.07,
что коррелируется с кларком Rb. но не К. Na и Li Среднее содержание
(г/т) в животных суши 0.06 (см. табл. 8). в океаническом планктоне 0,04
(фито-0,03, зоопланктоне 0,04), во взвеси 2, пеллетах 5 [677].
В организм человека Cs поступает с пншей (—0.01 мг сут.)
и быстро всасывается из желулочно-ктплечною тракта: сравнитетьно
равномерно распределяется он в органах и тканях (всею содержится
1,5 мг).
Суточное содержание Cs в пишс человека, по Е. Хамильтон
(19R1 I.). следующее (ммоль). США 0.75; Великобритания 0,098 + 0.053,
ФРГ 0,098. Он быстро попадает в кровь и также быстро (5—10 мин)
перераспределяется. После внугривенного введения накапливается
172
в мышцах (52% на четвертые сутки). в почках (13% через 10 мин),
печени (8%). желудочно-кишечном тракте (18%). скелете (4%). Из
скелета выделяется так же быстро, как и из других органов. 92.8% Cs
выводится из организма с Тл. равным ><9 сут Сходно поведение
и радионуклида ’ Cs (см. табл 2).
Проведенные В В Степаненко с соавторами (1991 г ) специальные
исследования шитовидной железы у 39 тыс. человек, проживающих
в Калужской обл. и получивших сравнительно небольшие дозы
облучения после Чернобыльской аварии (<ПДК). показали индивиду-
альные отличия последе г вий вот лейст вия облучения. В частности,
наиболее уязвимы дети и подростки, затем мужчины, что связывается
как с биологическими отличиями, так и с особенностями поведения,
питания и т. д. В результате изучения влияния облучения на животных
установлено, чго чем ниже частота пульса и артериальное давление
и выше устойчивость к острой гипоксии, тем выше их радиоустой-
чивость [219].
Распределение Cs в различных средах и органах человека, по
сводным данным [931], таково (в скобках — число анализов): кровь
(мгл)— обшая 0.003 (108). плазма 0,003 (11). сыворотка 0,001—0.06.
среднее 0,02 (>290): другие данные—в н 10 6: кость 0.04—0.009
(27, ж.). 0.09 (44, з.); мозг 0.0007 (15, ж.); волосы 0,37—1,1 (728); сердце
0.013 (21, ж.); почка 0.006—0.01 (38, ж.); печень 0.01 (21. ж); легкие
0,02—0,1 (18. ж.) 0.04 (1. с.): мышцы 0.01—0.34 (83. ж ); ногти 6 6 (1);
кожа 0,1 (1.С.); селезенка 0.016 (3. ж)’.
Воздух, вода, техногенез
В атмосфере нал Южным полюсом содержится 1 10 4 нг м3 Cs.
в воздухе нал океанами 4,6 10 6 мкг м3. в атмосфере крупных
зарубежных городов 0.2 нг м3. в океаническом аэрозоле 0,3 мг л.
в аэрозоле сибирских городов 0.3 нг м3 [626] Над материками
в воздухе его содержание (пг м3) от 20 (Норвегия) до 60—1500 (ФРГ)
[312]. 16—1500 (Япония). 70—300 (США. Канада), над островами — 20
(Шотландские). 40 (Гренландия).
В океанской воде среднее содержание Cs 0.5 10 7 %. в речной—
2 10 8%. в поверхностных водах мира — 0,035 мкг.л. в бассейне
Волги—0.1 мкг л. а с атмосферными осадками в этом районе
выпадает 0.36 кг м Cs в год (раствор 0.02, взвесь 0.01) Среднее
содержание в речных осадках бассейна 0,04 мкг л [590]. Талас-
софильность Cs гораздо ниже, чем других щелочных металлов,
вследствие чего он легче извлекается из морской воды илами: меньше
и время пребывания Cs в океанической воде—1,5-105 лет [574].
Среднее содержание Cs для поверхностных вод мира 0,1 мкг/л
[883].
Среднее содержание его в растворенной форме в поверхностных
водах изучено для бассейна Верхней Волги (мкт л), водохранилища
0.012; реки—Москва 0.03. Вазуза 0,04 Волга 0,03; в грунтовых
173
и подземных водах района 0,008 и 0,01; содержания в друз их средах
(мкг, кг; с.): в речной взвеси 1, илах 2,8, почвах 1,8, золе водных
растений 2,2, фитопланктоне 0,4 [590].
В подземных водах содержание Cs выше, чем в поверхностных,
и колеблется (mi л) от 0,01 в артезианских водах (увеличивается по
мере повышения степени их минерализации—см. табл. 23, 24) до 1,2
в термальных водах вулканогенных областей и до 20 в yi чекислых
подземных водах [366]. В современных [идротермах его содержание
60—378 мкг/л (Байкальско-Тихоокеанская провинция) [726].
Р. Команс с соавторами (1989 г.) установили легкий переход
радионуклида 1S7Cs из глин, которыми он интенсивно адсорбировался,
в водный бассейн та счет выноса поровых осадков с Cs.
Цезий все больше участвует в гехногенезе и все чаще относится
к токсичным металлам ПДКрэ установлен для Cs мышьяковистого —
0,03 мг/м3 (I класс опасности) и гидроксида — 0,3 мг м3 (II); большин-
ство других его соединений не нормированы, но относятся
к токсичным — ЛД5о (мг/кг): CsI и CsBi 1400, Cs^COj 2300,
CsNO3 1200; ПКхр CsCl 30 мг м3 [310]. Для гидроксида Cs ЛДч>
570—760 мг 'Ki, доза острого ингаляционного воздействия на подопы г-
ных животных 42 mi /кг, раздражающего действия 20,5 mi м3; верхний
порот для человека 5,0 мг/м3.
Технотенное распределение Cs интенсивно изучается радиолотами,
но эти работы до недавнего времени были недоступны В окружающую
среду попадает Cs разными способами: в воды при разработке
и хранении солей К, Mg и т. д.; в а!мосферу при сжигании
минерального топлива и с угольной пылью на угольных, редкометаль-
ных, полевошпатовых и других производствах; радионуклиды Cs — в
результате ядерного распада. Общие потери стабильного изотопа Cs
при обогащении и переработке сырья составляют (кроме Cs-nci-
матитов) 100%. Содержание Cs в угольной пыли достигаетЗ мкг/г,
а в слюдяных и полевошпатовых отходах — п г т, его воздействие на
окружающую среду не выяснено, но имеющаяся низкая оценка
техногенного воздействия Cs [198] должна быть уточнена.
Наиболее опасны среди срсдиеживущих радионуклидов ядерных
взрывов ,34—137Cs. Во время ядерных испытаний в атмосфере США
установлена корреляция между содержанием Cs в пищевых продуктах
(Бк кг) и мощностью ядерных взрывов (Мт):1 Бк/кг—10 Мт, 3—30,
7— 70 [481 ]. В Дании изучены содержания l3 Cs в разных продуктах
в связи с ядерными испытаниями в атмосфере. Наиболее восприимчи-
вы оказались зерновые продукты, затем мясные молочные, а наи-
менее—фрукты и овощи [481 |. Концентрация Cs, приводящая к дозе
10 мкЗв в критической группе, принята следующей (Бк/л): молоко 0.5;
рыба 5; раки 70 [654]. На Чернобыльской АЭС территориями
с повышенной загрязненностью считались такие, где доза l37Cs
составляла 0,2 мР/ч (эта площадь достигала в первые дни аварии
200 тыс. км2), отселению подлежали площади е дозой >5 мР,ч.
фоновые значения были приняты 0,015—0.03 мР'ч [722].
174
Заметые выпадения l37Cs (~1 Ки/км*) зарегистрированы после
аварии на ЧАЭС в Австрии, Италии, Норвезии, Польше, Румынии,
Финпяндии, Германии, Швеции, а в нашей стране, кроме основной зоны
заражения, в Белоруссии, на Украине и в Центральных районах,
участки зазрязненззя отмечены на Кольском п-ове и Кавказе.
Но данным О. В. Сзсп men (1992 i.) после аварии на ЧАЭС в 1986 т
уровень *’ Cs в Черноморском резиоззе подия зз.я с 5—8 до ->400 Ьк/м'
a затем закономерно снижался, составляя в среднем (Бк/м?); 1987 з.—
180, 1988 г.— 140, 1989 I.— 80, 1990 т. — 70; появился l34Cs. Изучение
пространственного распределения ,3( s в 1990 г. покатало, зто участки
высоких его концентраций (Ьк/м *1 сохранились в Черноморском бассейне
около западного побережья ( > 4о у берегов Болт арии, Румынии) и в ряде
других районов (от 20 до 40), а также в Т. рсдиземном море
ИДК для l37Cs составляют (Бк,л): ПДКр, 0,027, в воздух*
сан и гарно-защитных зон 0,002, населенных пунктов 0,002, 1ГДКВП 2,7.
Период полувыдслсния (сут.) биолотический 70, эффективный от 65
[27] до 100 сут. Считается. что блатодаря равномерному распределе-
нию в организме опухолевое воздействие ,37Cs наиболее широкое
[511]. Попадая в почвы, ”7Cs образует труднораггворимые соедине-
ния однако под влиянием повышения кисит ноети (кислотные дожди)
вновь переходит в растворимую форму Рациоканцерогенными свойст-
вами обладает и l34( s с мепыним периодом иоиураспад-i, чем у l37Cs
Выводы. Цезий—редкий токсичный металл (Тл=5). слабо изучен
ный жогеохимически. ГЭ поллуцита 2 104 В издогепных зоохимиче-
ских системах Cs литофилен и накапливается в наиболее кислых
породах Cs-легмагитах (В до 25 000—полпуцитовые руды), окодопез-
мазиювых редкомстальных метасома гитах (В до 14000), редкощелоч-
нометалытых зидро термальных и кислых вулканических стеклах;
в ткзогенных процессах связан с пластовыми хиоридными Na, Na-Mg
и различными термальными водами, а также K-Mg солями. Наиболее
полно Cs сорбируется глинами. Гидро- (Вл 1 • 10 4), атмо-, по«во-
(В== 1,4), а также биофилыюегь (B=l,2) Cs среди других щелочных
металлов считалась низкой, что требует уточнения. В гехпогеохммиче-
ском цикле Cs пе изучен и пока не вызывал негативных проблем, за
исключением токсичности радионуклидов, которые пределаззняюг боль-
шую опасность, даже через мшно лет после радиоактивных выбросов.
ФРАНЦИЙ—87
Франций Рг—сверх!>едктзй, радиоактивный у-металч
Хгом (7т1) стабильных изотоззов не имеет и является цочепимм
продуктом радиолктинного ряда 23,П; наиболее известен радиоизотоп
223Г’г (Г|/2 = 21 мин). Находясь в 1 группе периодической забляцы,
проявляет сходство со те точными металлами калиевой группы,
особенно с Cs. Степень окисления +1, потенциал ионизации 'гг >рг*
3,98 эВ, обладает щелочными свойствами. Большинство солен хорошо
растворимы в ззоде.
175
Собственных природных концентраций не образует В искусствен-
ных соединениях изоморфен с Cs. Общее содержание Fr в земной коре
составляет всего ~400 г; в урановых рудах 1 атом Fr приходится на
З Ю18 атомов U. Используется в основном в научных целях как
индикатор биохимии щелочных металлов и т. д. [213]
БЕРИЛЛИЙ—4
Очень редкий (кларк земной коры 0,0002%)*, легкий, высокотоксич-
ный (Т,= 15, Тг=100, Тв = 100?) и патологичный, канцерогенный,
биологически активный металл. Для Be и его соединений (I класс
опасности) ПДКр, 0.001 мг м3, ПДКсе 0,00001 мг-м' (см. табл. 1). ООН
11972 т.) предлагала принять ПДКр1 0,004 мкг, м3, а в США с 1970 г.
принят 0,01 мкт м3 [43]; ПДК водоемов 0.2 мкг/л [686, 727 J
Растворимые соединения (BeCl, BeF, BeSO4) токсичнее нерастворимых
ЛДя, для BeSO4 80—82 мг/кг, для BeCl 86—92 мг/кг — через желудок
для мышей и крыс) [128] Избыточное содержание в растениях
составляет 10—50 мт кг (см. табл. 3)
Атом
Атом полностью состоит из стабильного изотопа 9 Вс; среди
радионуклидов—н’Ве (7'1,2 = 25 лет), Be (Г1/2=54 сут), ‘’Be и 6Ве—
два первых участвуют во вторичном космическом излучении Земти
(см. Na).
Это самый легкий щелочноземельный металл II труппы, от-
личающийся от остальных ее представителей (особенно Са, Ва, Sr) по
многим свойствам (табл. 51, 52)—размерным, термическим, энергети-
ческим и др. Он является как бы промежуточным между Mg
*и соседним по диагонали А1 — элементом III группы, к которому он во
многом ближе. Металлический Be больше сходен с Mg. В ионизирован-
ном состоянии формирует не свойственную щелочноземельным метал-
лам двухэлектронную «гелиевую» структуру. Отличается также ам-
фотерностью, большей ковалентностью соединений, способностью
к комплексообразованию и образованию многоядерных соединений,
характерна тетраэдрическая координация. Слабее реагирует с анионами
и гораздо сильнее гидролизуется по сравнению с остальными
металлами II группы. Устойчивая валентность, как и у остальных
щелочноземельных металлов, только II (2s~). Особенно близок Вс к AI
по pH осаждения гидроксидов (4.1 и 5,7 из кислых растворов
соответственно), ионному потенциалу и кислотно-основным свойствам
и в этом отношении не похож на Mg и Са [481. Отмечалось сходство
• Бериллий, как Li и В. в отличие от других элементов 2-го периода
Менделеевской системы, является дефинитным в Солнечной системе, что
связано с его термоядерным превращением в *Не lp-‘-9Bc->2‘lH ^D=6,56 МэВ
+ — 4Не=2.1 МэВ,.
176
Be c Zn по криеталлохимическим особенное!ям (тетраэдрические связи
в сульфидах и др.). Некоторые соединения Be — ВсС12, BeF2 (846 г/л), ВеО4
(860 г,л), сульфид (350 г/л)—хорошо растворимы в воде; в щелочной среде
си 1Ьнорастворимы фторкомплексы т ипа BeF \ ВеЕ4 и др. (см. табл. 58).
Оксид (10 4—10 5 г/л), фосфа!, основной карбонат (ВеОН)2СО3, а также
Be2Al2(SiO4), ВеА12О4. Ве(ОН)2 (2-10 3 г/л)—труднорастворимы, однако
в щелочной сретф при избьике NaC'O, карбонат может растворяться,
образуя комплексы типа Na2 [Ве(СО3)2] [796]. Порошок Be пироморфен
при нагревании в воздухе Все перечисленные соединения Be токсичны [127,
231 ]. Осадителями его являются глинистые минералы, гидроксиды железа
и органическое вещее:во.
В природе Вс проявляет только литофильные геохимические
свойства [48]. Его минералого-геохимическая формула и для земной
коры, и для мантии Л|00. В метеоритах, по единичным данным, он
также литофилен (Са-ахондриты 0,1 г/т, хондриты 0,04т/т, углистые
0,04 г/т); в лунных породах («Луна-16») установлен в среднем реголите
(2,5 + 0,4 г/т) и базальте (2 i т).
Таблица 51
Характеристики атомов щелочноземельных Meia.i.ioB
Эле- мент Атом- ный номер Элекз ров- ная кон- фигура- ция Пол енциалы ионизации, )В Элек г- роотри- цатель- ность, по По- 1ИН1 у Температура, С Плот- ность, 1 см3 Электропровод- ность, п 104 ом 1 • см 1
плав- ления кипе- ния
Ве 4 25 2 9.32; 153.8 18,2; 1,5 1287 2471 1,86 —
Mg 12 35 2 7.64; 80,1 15.0; 1,2 1280 1500 1.86 18
Са 20 45 2 6,11; 51,2 11.9; 1,0 650 1100 1,74 25
Sr 38 5.Т2 5,69; 11,0 1,0 810 1300 1.55 23,5
Ва 56 6л2 5,21. 10,0 0.9 800 1300 2,6 3,3
Ra 88 75 2 5,28; 10,1 0.9 850 1500 3,6 1,7
Таблица 52
Свойства ионов щелочноземельных Mei ал лов
Ион Окис >ш тель- ный noieii- циач, В кДж моль ДУ11 Г1|др, Дж/моль 1рад Ионный ра- диус. нм te K-tnup
Ве2 + 1,85 2476 0,035 6,5
Mg2" 2,37 1911 268 0,066 -12
С;? 1 2 87 1580 209 0.099 12,5
Sr2’ 2,89 1433 205 0,112 - 13,2
Ва2 + 2,90 1290 159 0,134 - 13,4
12 2138
177
Кларк Be (г/т) в земной коре в целом 1,5, в верхней 3, в нижней
1 [749]; в осадочной оболочке его больше (2,1 i/t), чем в кристалличе-
ской (1,2 г/т) [89« |
Минералы
Бериллий — минерало! енный элемент. Известно 62 его минерала,
среди которых 35 силикатов, 14 фосфатов и гидрофосфатов, 6 оксидов,
3 бората и 1идробората, 2 i идроарсената, 1 гидроксид, I гидрокар-
бонат. Больше половины минералов Be содержат Н2О или ОН, многие
минералы —другие минерализаторы — F, С1, РО4, В, S В силикатах Be,
чаще всего в катионной форме, ассоциирован с Са и Л1, а также с Na
реже с Li, Ва, К, Fe, Mg, Zn, Y [716] В ряде минералов он выполняет
анионную функцию, как и AI (бериллийалюмосиликаты). Комплекс
[ВеО4]6- взаимодействует с [AlO4j и [SiO4J4 . Особенности изомор-
физма Вс рассмотрены А. А. Беусом [48, 172, 489], который большое
значение отводил радикалу (BemSi„ mO2„) 2m, где т^0,5, а парагене-
зис— А. А. Беусом и Ю. П Диковым [49], А. И. Гинзбургом,
И. И Куприяновой и М . П. Новиковой [489]. Обращалось внимание
на отсутствие для Be петрогенного элемент а-анало! а, что не способст-
вует широкому рассеянию ею в силикатах и алюмосиликатах
В минералах Be по мере изменения соотношения Na:Al меняется
и отношение Be: Si; наиболее обогащены Be безнатриевые минералы,
образующиеся в субщелочных гранитоидах и сходных с ними
метасоматитах [489 ]
Многими исследователями отмечается возможность ограниченного
изоморфизма (ВеО4)й на (SiO4)4 или (А1О4)5 (в щелочной среде),
затрудненного энергетической невытодносгью компенсационного изо-
морфизма этого типа [48].
Ставными минералами Be, которые мотут иметь промышленное
значение, являются (ВеО, %); берилл Be,Al2(Si6Ol8)—40 (ГЭ 5 104),
фенакит Be2SiO4—40- 44, бертрандит Be4Si2O-. (ОН)2— 39,6—42
(ГЭ5 106), лейкофан CaNaBeSi2O6F—9,8—12, юнтгельвин
Zn4(BeSiO4)jS — 8—12, эпидидимит Na [BeSi3O7(OH)], бавенит
Ca4Be2Al2Si4O26(OH)—6,3—7,7, барилит BaBe2Si2O7—15,7—16,0, чка-
ловит Na2BeSi2O6—12,9, таафеит ВеМоА1408—11, хризоберилл
А12ВеО4 — 18—20,9 (ГЭ5106), гадолинит FeBe2Y2Si,O10—10—11,
эвклаз Be2Al2(SiO4)2(OH)2—40—44. бехоит Ве(ОН)2 — 55,6. Доля
мировой добычи, приходящаяся на тот или иной минерал в 70-е годы,
по Н А. Солодову (1977 г.). такова (%): берилл 66, фенакит 11,5,
бертрандит 10. бехоит 2, гельбертрандит 8, гентгельвин 1, барилит 1,
эвклаз 0,5. Позднее все более увеличивалась доля силикатов Be [489].
Берилл и его драгоценные разновидности (изумруд, аквамарин,
гелиодор, воробьевит) — один из главных рудных минералов Вс кислой
ранигоидной ветви магматизма, образующийся в алюмосиликатной
среде. Он содержит повышенные концентрации Na, К а также Li, Cs
(до 7%—Cs-воробьевит), Sc (баццит), Cr, Fe, Mg, Ca, Mn, Ga, Ge.
178
Для многих минералов Вс типично повышенное содержание Не,
который образуется при распаде радионуклида кВе.
В породе- и рудообразующих минералах допускается нахождение
Be в виде изоморфной примеси но нескольким схемам: Na+(Ca2+)
Sr+«-TR3+ (Sr2*)Be2 + (i, i г: в нефелине 12, олигоклазе 2(1, Na-
плагиоклазе 7): К.' (Са2 + )А134 Ва2 * (Са2+ )Ве2+ (л в микроклине 2,
биотите 6); 2Al3 + «-Be2f (v в мусковите 26); Mg24Si41«-Ti4 + Вс2 1 (л
в амфиболах Ю, эгирине 15. арфведсоните 27, роговой обманке I0)
и г. д. [716]. Наиболее высокие содержания Вс (г/т) установлены
в касситерите (44), циртолите (138), ортите (300), везувиане (300—5400),
Ca-Na слюдах, тортвейтите, маргарите (4300—6700, до 3,2%), возмож-
но, во многих случаях, за исключением везувиана [48], за счет
микровключеннй его собственных минералов. Повышенные концент-
рации Be отмечены также (г/г) в сподумене (6), лепидолите (37),
поллуците (10). Несмотря на высокие концентрации, из несобственных
минералов Вс попу iпо не извлекается, что может создавать экологичес-
кую опасность.
Для ратных пород концентрации Вс в одних и тех же минералах
меняется так, в кварце его содержание меньше в гранитах (д =0,2 г/т),
чем в гранитных пегматитах (х = 2); то же происходит в биотите (6
и 30 т/т), микроклине (2 и 4 г, г). Выявлено, что в литиевых и светлых
слюдах содержание Be обычно выше, чем в темных (биотите и др.),
а в амфиболах и щелочных амфиболах выше, чем в пироксенах
и щелочных пироксенах [716].
Главные минералы Вс образуют следующий ряд по снижению их
устойчивости (и А,)* в коре выветривания: берилл (1,300), эпидидимит
(0,980), бертрандит (0.600). фенакит (0,575‘, гельвин (0,395), гадолинит
(0,335) [88 ]. Берилл хотя и является наиболее устойчивым минералом,
но в присутствии флюорита подвержен изменению с формированием
гинергенных фосфатов. Факгическое изменение берилла, по
Н. А Григорьеву [221], в пегматитах обычно незначительное; то
же, вероятно, относится и к фенакиту, а гельвин, наоборот,
разрушается уже на начальных стадиях коалинизации альбита,
а в развивающихся по нему охрах содержание Be снижается почти
в 5 раз и 80—85% ею выносится. Изменение гадолинита, как
и гельвина, идет с образованием гидроксидов и карбонатов. Заметно
также выветриваются хризоберилл, бавенит, бертрандит, но динамика
этого процесса не изучена.
Имеются данные [221 ] и по поведению Be при выветривании
породообразующих минералов-носителей (табл. 53), свидетельствую-
щие о том. что наиболее интенсивно он может выноситься при
разложении мусковита и иногда КПШ, а преимущественно накаплива-
ется при изменении плагиоклаза. При этом доля выноса Be (%)
уменьшается с уменьшением его содержания в ггороде; 40% — 5 г/т,
25% — 3 г/т, 0% — 0, п г г
Индекс кислотности магматических пород [76].
12
179
Таблица 53
Изменение содержаний Be при выветривании полевых
шпатов и мусковита
Минерал Содержание Be в минерале. п-10 4 %
исходный образующийся исходном образующемся
Андезин Каолинит 0,6 4,3
Альбит № 3 Meiai аллуазит, каолинит 6,8 9,0
Альбит № 5 Каолинит 41 41
Олигоклаз » 86 72
Калиевый полевой шпат Метаг аллуазвт 4.7 4,7
То же » 5,0 2,9
» » 9,7 13
» » 47 47
» Гйдромусковит 40 27
Мусковит Каолинизированный мус- 30 17
К ОВИТ
» Гйдромусковит 120 70
Месторождения
Бериллий — редкий, уникальный, легкий и устойчивый стратегиче-
ский металл ограниченного производства, использующийся только
в новой технике (атомной, аэроракетно-космической, машино- и прибо-
ростроительной) и имеющий большие перспективы в термоядерном
синтезе, суперсплавах, оптоэлектронике и др. Мировое зарубежное
производство в 1987 I. составило около 320 т, потребление 350 т
металла; к 2000 т. намечалось удвоение потребностей. Цена металличе-
ского Вс в 1988 т. была ~500 дол/кг. Общие запасы зарубежных стран
оценивались в конце 80-х годов в ~ 1 мтн г, а возможный мировой
металлогснический потенциал — в 20 млн т. Технофильность Be относи-
тельно низкая — 2-106. Основным производителем его стали США, где
в 1980 г. только из одного месторождения Спер-Маунтин добыли
~ 7 тыс. т концентрата, содержащего 11 % ВеО.
В геолого-геохимической систематике месторождения Be находя 1ся
в лито- и литохалькофильной группах, в 1енетической—среди маг-
матогенных пегматитовых, скарновых, грейзеновых, гидротермальных
и остаточных месторождений. Бериллий — один из тех металлов,
сырьевая база которых за последние десятилетия претерпела коренные
изменения: в настоящее время вместо небольших (0, п — 20 т ВеО)
месторождений редкометальных гранитных пегматитов с бедными
рудами (0,00и—0, п % ВеО), из которых беритл добывается попутно,
открыты низкотемпературные гидротермально-метасоматические бога-
тые и крупные собственные месторождения Вс [782, 523]. Важно
отметить, что возможность обнаружения гидротермальных коицент-
180
раций Be, образующихся за счет его переноса фторсодержащими
и углекислыми растворами, была предсказана А. А. Беусом [48, 49].
К крупнейшим месторождениям Be относятся (запасы ВеО, тыс.
т и содержание ВеО, %): Кинс-Маунтин, ОША (пегматиты, > 120
и 0,3); Бао Виста, Бразилия (пегматиты, > 40 и 0,2—0,3); Редекин
шток, США (грейзены, > 50 и 1); Спер-Маунтин, США (метасоматиты,
> 38 и 0.5—0,7) [472. 725].
В формационной и промышленно-парагенетической классификации
Н. А. Солодова [716] выделяется три группы формаций: две эндоген-
ные с кислыми и щелочными породами и экзогенная.
В первую входят следующие формации (в скобках—содержание
ВеО. %): 1) гранитных пегматитов (ГЭ= 1 • 104 — 5 • 104)—микроклино-
вых (0,005—0,01), микроклин-альбитовых (0,04—0,05), альбитовых
(0,08—0,25); 2) эпискарновых метасоматитов флюорит-шпинель-цин-
нвальдитового состава с таафеитом, хризобериллом и сянхуалитом (до
0,3) и др.; 3) редкометальных грейзенов (ГЭ=1 104 —5-104) с восьмью
парагенетическими типами месторождений—кварц-молибденитовых,
кварц-вольфрамитовых, кварц-касситеритовых с бериллом (0,1—0,4),
олигоклаз-флогопитовых с бериллом и изумрудом (0,1—0,15) и др.; 4)
редкометальных слюдисто-флюоритовых метасоматитов (ГЭ = 5-106)
— пять типов с бериллом, фенакитом, хризобериллом, эвклазом,
бромеллитом (до 1 %).
Щелочная группа объединяет формации: I) бериллиеносных флю-
оритовых метасоматитов (гидротермалитов). включающие семь типов,
в том числе наиболее богатые (0,5—3,0% ВеО) и очень крупные (до
150 тыс. т ВеО) месторождения; 2) редкометальных щелочных метасо-
матитов— четыре типа с комплексными (TR, Zr, Be), иногда богатыми
(0,1—3%) рудами и крупными (до 100 тыс. т) запасами; 3) ред-
кометальных щелочных метасоматитов в связи с нефелин-альбит-
калишпатовыми (миаскитовыми) массивами с аминовитом, лейкофа-
ном (0,2—0,4%); 4) нефелин-калишпатовых (агпаитовых) массивов
с чкаловитом. гакманитом (0.1—0.3%); 5) редкомегальных фенитов
с барилитом (0,3—0,5% ВеО).
В экзогенной г руппе выделены две формации: бериллиеносная
вулканогенно-осадочная, представленная монтмориллонитовыми гли-
нами с бехоитом, гельбертрандитом и сферобертрандитом (0,3—3,0%
ВеО, запасы п 10 гыс. т), и редкометальных кор выветривания
с касситеритом, тапгалатами, бериллом, с бедными (0,005—0,03%
ВеО) рудами и небольшими (0, п тыс. т), но высокорентабельными
запасами.
Примерно такое же большое число типов месторождений Be
выделено А. И. Гйнзбургом, И. П. Заболотной, И. И. Куприяновой,
Е. П. Шпановым и др. (1965, 1975 гг.). Особенно детально ими, а также
И. Н. Говоровым (1963, 1966 гг.), изучены различные типы гидротер-
мально-метасоматических месторождений, для которых установлены
главные геолого-геохимические факторы рудообразования [145]. Учи-
тывая высокую устойчивость фторидных и гидроксилфтористых
181
комплексов Be (pH =4—12), большую устойчивость К, чем Na
комплексов, 'а также то, что растворы, связанные с субщелочными
и щелочными гранитами, будут становиться кислыми при большем
удалении от источника и при меныпих температурах, чем растворы,
связанные с аляскитами сделан вывод о том. что с щелочными
породами должны ассоциировать наиболее удаленные и низкотем-
пературные руды с фенакитом, бертрандитом, гельвином барилитом,
гадолинитом, с аляскитами — руды, содержащие берилл, хризоберилл,
эвклаз, а с наиболее щелочными — руды с эвдидимитом, лейкофаном,
мелинофаном, чкаловитом.
Образование бериллиевой минерализации обусловлено, помимо
ре гкого подкисления растворов, распадом фт оркомплексов Be и формиро-
ванием флюорита, что возможно при наличии карбонатных пород
и определяет комплексный флюориг-бериллиевый состав руд. Наиболее
крупные и богатые месторождения Вс связаны с субщелочными
и щелочными гранитоидами. возникающими в зонах активизации
относительно поднят ых устойчивых блоков земной коры (щиты, срединные
массивы, горсты); они приурочены к краевым частям предрудных
поднятий, на стыке с наложенными впадинами. При этом, чем более
древнюю консолидацию имеет поднятие, тем оно более перспективно [284,
285 J. В связи с этим наиболее рудоносны мезо-кайнозойские зоны
активизации стабильных массивов докембрийского возраста.
Для гидротермально-метасоматических руд выявлена вертикатьная
зональность бериллиевой минерализации. Для месторождегшй, связан-
ных с субщелочными гранитоидами, залегающими в карбонатных
породах, она такова: лейкофан (мслипофан) -» фенакит -+ бертрандит,
для объектов, связанных с аляскитами- берилл -»эвклаз ► фена-
кит -»берграндит или хризоберилл.
Наибольший практический интерес имеют руды Вс бертран-
дитового (Спер-Маунтин, США и др ), флюорит-бертрандит-фенакито-
вого, флюорит-слюдисто-бериллового типов и щелочных бериллиенос-
ных мегасоматитов. Эти месторождения по многим параметрам не
уступают месторождениям Sn, W, Мо соответствующих типов.
Кроме собственных месторождений Be, он широко распространен
в комплексных редкометальных рудах Mo, Sn W, Li, Zr и др., в них Be
может иметь попутное значение, особеггно в связи с необходимостью
экологической защиты окружающей среды от его токсиколог ического
влияния
В наиболее крупных месторождетшях других металлов Be распре-
делен следующим образом.
В Fe-Mn океанических конкрециях содержания его меняются от 1.3
до 24,5 г/т, в стандартном образце конкреций Атлантики среднее
содержание составило ~5,6 г/т, генеральное среднее для конкреций
Мирового океана принято 2,5 г'т, среднее для глубоководных оке-
анических осадков 2,6 г/т |34].
В фосфоритах фоновые содержания Be обычно гот о же порядка —
1 —10 г/т, однако в отдельных случаях превышают 50 г'т. Высокие
182
содержания независимо от генезиса фосфоритов обычно встречаются
в их континентальных окисленных разностях алюмофосфатного соста-
ва. По данным В. 3. Близковского (1969 г.). Be может образовывать
устойчивые Be-Са фосфаты, изострукгурные с Al-Са фосфатами,
и в таких случаях его локальные концентрации могут досгигать 0, и%.
По В. Н Холодову (1973 г.), осадочные фосфориты содержат повышен-
ные количества Be по сравнению с вмещающими породами. Для
Кара-Тау содержания его таковы (г/т): кремнистые породы 1,0—1,6;
карбонатные 2,3; гравелиты, песчаники, алевролиты 2,8; Fe-Mn руды
3,0; фосфориты 3,7. В морских фосфоритах содержание Be в целом
нарастает к береговой зоне.
В бокситах Be встречается постоянно в количествах от 0,3
до 17 г/т. По В А. Тенякову (1974 г.), для месторождений платформ
его содержание составляет 0,3—4 г/т (х = 1,5 г/т). Это почти со-
ответствует концентрации Be в исходных породах. Гёосинклинальные
бокситы относительно обогащены Be (1,6—15, в среднем 8 т/т).
А. К. Гпадковская с соавторами считают, что бокситы морского
происхождения образовались за счет давсонитовой Na А1 [(ОН)2СО3 ]
минерализации. По А. К Шаровой и другим исследователям, 1966 г.,
распределение Be в бокситах Вьетнама следующее (г/т): диаспор
3—6, бёмиг 3, магнитная фракция 0—3, гидрослюды 3. Для
разных месторождений корреляционные связи Be меняются [222] —в
одних это А1, в других Fe.
Бериллий—типичный элемент каустобиолитов, иногда устанавли-
вается в горючих сланцах и очень редко в нефтях [221, 222, 474, 624,
849 и др. ]. Сланцы морского происхождения содержат < 1 г/т Be
(Прибалтийские, Волжские и др.); по В. Р. Клер [474], концентрация
его такова (г/г): в сланцах Болтышского месторождения ~1, в менили-
товых сланцах Карпат ~ 10, в Байсунских 20, Кендырлыкских 10.
Предварительная оценка среднего содержания для «черных» сланцев
3,6 г/т (В. В. Ляхович и др., 1989 г.). Во всех случаях концентрации Be
имеют вторичное происхождение и локальное распространение [474].
Для углей имеются генеральные оценки средних содержаний Be,
которые колеблются от 0,9 до 5,6 г/т; по И. Д. Башаркевич с соав-
торами (1984 г.), эти оценки таковы (г/т): бурые утли 1,9, каменные 0,9;
по Ф. Я. Сапрыкину (1973 г.) — 5,6 (з. 37); по Э. Я. Юдович (1972 г.):
бурые 3,2 (з. 26), каменные 1 (з. 22); по В. Р. Клер для СССР [474]. 2,5
(з. 20). Для мира кларк Be в углях 1,2+ 0,4 г/т. При низких фоновых
содержаниях Вс в неко горых случаях были выявлены очень высокие его
концентрации в низкометаморфизованных углях—для США, по
старым данным В Кук (1938 г.) 1 —10 кг на 1 г золы, для СССР—
0,0л—0,/i кг на 1 т угля при обратной корреляции Be—зольность
[234]. При этом отмечается эпигенетическое происхождение концент-
раций Be. Довольно часто содержание Вс в углях самое низкое среди
осадочных пород района. Например, это выявлено В. П Сапрыкиным
с соавторами для угленосной толщи С2 Донбасса: угли 2,6 г/т,
вмещающие породы—от 4,2 (карбонатные) до 10,9 г/г (алевролиты).
183
Большинство исследователей считают, что Be входит в органичес-
кую составляющую углей и сходен с Ge. Ф. Я. Сапрыкин и другие
исследователи отметили высокую подвижность Be в углях и установи-
ли его распределение по составляющим (г'т): гуминовые кислоты
0,3—1,2 (среднее 0,7), фульво- и органические кислоты 0,2—0,8 (0,5);
в тех же веществах из вмещающих пород 0,2—0,5 (0,4). При
перераспределении преобладает миграция Be в угли из вмещающих
пород. Об этом, по Н. А. Григорьеву [222], свидетельствует увеличение
его содержания от современных растений (среднее 0,4 г т) к торфу
(0,9 г'т) и ископаемым углям, а также от более молодых угольных
бассейнов нашей страны к древним. По Ф. Я. Сапрыкину с соавторами
(1975 г.), содержания Be в углях разного возраста таковы (г т):
палеогеновых и неогеновых 2,4, мезозойских 4,2, пермских 5,3,
карбоновых 7,9. В некоторых случаях, по П. Зубовик с соавторами, до
50% Be в углях может быть связано с минеральной фракцией.
Особенно типичен Be для некоторых германий-угольных синвул-
канических месторождений [624].
Бериллиеносность торфов более низкая, чем углей [474],—0*1—
5 г/т (средние фоновые содержания), среднее содержание в гррфах
нашей страны 0,9 г/т; наиболее низкие содержания (г'т) отмечаются
в торфах низинного (0,1), переходного (0,2) и верхового типов (0,1).
Для нефтей известно несколько определений [20], которые показали,
что для Каспийского бассейна содержание его в сырой нефти
оценивается в 4 г/т, а в золе—только в 0,7 г г (вероятно, за счет
улетучивания).
По единичным данным Г. А. Ботнева в нефтях Балтийской
провинции установлено всего 0,01 г г [726].
В осадочных железных рудах Be встречается спорадически и в не-
значительных концентрациях (<4—20 r/т, по К. Краускопф, 1958 т.);
более поздние данные подтвердили зги выводы). Низкие содержания
бериллия типичны для железистых кварцитов [139]; среднее для
месторождений КМА 0,4 г/т. В других типах месторождений оно
может быть повышенным. Это отмечалось для осадочных сидеритовых
руд Птазовской синеклизы В. П. Наборщиковым и другими исследова-
телями (среднее 15 г/т), для железистых фракций современных морских
глинистых (9,8—18 г/т) и песчано-глинистых (до 8,7 г/т) отложений
залива Пария-П Д. Херстом (1962 г.). Данные Н. А. Григорьева [221 ]
свидетельствуют, что в относительно молодых железорудных месторо-
ждениях Зауралья содержание выше, чем во вмещающих породах,
и что основное количество бериллия заключено в минералах железа.
Породы
Кларки Be в породах, по данным А. А. Беуса [52], составляют
(г/т): магматические—ультрабазиты 0,2, основные 0,4, средние 1,8,
гранодиориты 2,5, граниты 3,5; осадочные—сланцы 3,0, песчаники
и карбонатные 0,п. В наиболее полно изученных гриппах Сибирской
184
платформы оценка среднею содержания 1,1 +0,4 г т [716], для
щелочных базальтов она составляет 1,4 (Камчатка) и 2,4 г/т (Ислан-
дия), для субщело«ных 0,95 г т. Более низкие концентрации Be (т т)
характерны дтя голеитовых пород (0.48 Камчатка. Курилы; 0,98
Сибирская платформа). В общем содержание Вс несколько увеличива-
ется по мере увеличения в породах количества SiO2 и щелочности.
Например, для тффу швных пород установлены следующие его
концентрации (г'т): Камчатка —андезиты 0,73, дациты 0,88, кварцевые
трахиты 3,9, комендиты 8; Забайкалье—латиты 3, риолиты 3,8,
риодациты 5,6, оигониты 14; западные районы США—латиты 4,6,
пантелериты до 60 [716].
В гранитоидах характер распределения Be изучен полнее и в общем
сохраняется. По Ю. Б. Марину [460], содержания для разных фор-
мационных типов таковы (г г): габбро-диоритовый 0,9, диорит-
плагиотракитовый 1,9. гранодиопитовый 2,2, гранитовый 3,3, аляскито-
вый 7, Li-гранитный 9, щелочно-гранитный > 10. По Л В Таусону,
самые высокие концентрации Be свойственны редкометальным ат па-
нтовым (11,8 г'т) и п.люмозитовым (8,8 г'т) гранитам, наименьшие—
ультраметаморфическим (0,8 г'т).
Щелочные породы охарактеризованы дово льно полно, (ёнеральные
оценки содержаний Вс. по Л. Д Гуголесову. Е. Д. Осокину [763]
следующие (г'т): щелочно-ультраоеиовные породы и карбонатиты 5(16
объектов); щелочные габброиды и нефелиновые сиениты 4 (10);
агпаитовые сиениты 7 т2); миаскиговые нефелиновые сиениты и карб-
онатиты 3 (5); щелочные и нефелиновые сиениты 3 (21); траносиенигы,
щелочные и нефелиновые сиениты 5 (20); калиевые щелочные габбро-
иды. щелочные габброиды и щелочные сиениты 5 (71); калиевые
фельдшпатондные н щелочные сиениты и монцониты 10 (6 объектов —
Сандык, Бурпала, Мурун, Дежпевский и др.). Самые высокие
концентрации Be установлены в щелочных гранитах (43 т т), луявритах
(35 т г) и кокортокитах Ильмаусакското массива агпаитовых пород,
содержащих чкаловш (4,5% Be), бериллнг (13,9), бертрандит (14,8),
гентгельвин (4,3), серенсит (2,9) и тейкофан (3.6).
Бериллиеносность гранитоидов связана с историей вертикальных
тектонических движений [285, 622]. Например, для Восточного
Забайкалья содержания Вс в блоках, характеризующихся преимущест-
венными дорудными воздыманиями ([[) или опусканиями ([]), таковы
(г'т): П 5,0; || 3.5 (центральная часть), 1,8 (краевая часть); fj 1,1;
0,2. Эга же закономерность прослеживается и по породооб-
разующим минералам (см. табл. 30).
В осадочных породах содержание Be (т г) выше в тонкодиснерсиых
глинистых породах (до 10.9), чем в песчанистых (до 7,9) и карбонатных
(до 5,5), причем в платформенных отложениях оно возможно
несколько выше, чем в т еосинклинальных [221 ]. В глубоководных
глинах содержание Be достигает 3 г'т, в карбонатных илах 1,2 г'т.
В метаморфических процессах Be считается мало подвижным, но
А А. Кременецкий установил для терригенных пород Приладожья сто
185
вынос при региональном метаморфизме. Высокие содержания Be
отмечались в кордиерите (до 40 г/т) и ставролите (до 12 г/г). При
контактовом метаморфизме Е. П. Сапрыкиным [687] отмечался неко-
торый привиос Be в контактовую зону одного из массивов Приморья.
Почвы, растения, животные
Бериллий широко распространен в почвах в количествах, сходных
с содержанием в коренных породах. Хотя больших отклонений его
концентраций в почвах, не подвергшихся загрязнению, не отмечалось —
они колеблются от 1 до 15 мг/кг (с.), среднее фоновое содержание Be
часто выше, чем в исходной породе. Эго дало возможность
Н. А. Григорьеву [222 ] сделать вывод о кумулят ивном накоплении Be не
юлько в эндогенных, но и в экзогенных, и почвенных процессах. Первый
кларк Be в почвах, подсчитанный А. П. Виноградовым, оказался
завышенным; по более поздним данным различных исследователей он
может быть принят 1,7±0,5 г/т (СССР 2,3±0,7, США 1,6, Канада 0,35,
Великобритания 2,7 г/т). По А. А. Беусу, средние содержания для почв
нашей страны таковы (мг/кг): подзолистые 1,5; озерные лесные 3,0;
черноземы 3,2; каштановые 4; сероземы 1,0. Для США, по X. Шаклегт
[914], относительно высокие средние содержания Be (мг/кг) установлены
в светлых почвах пустынь (2,1), лесных, глинисто-суглинистых, песчаных
и лигосолей на песчаниках (по 1,9), а также почвах на глинистых
и эффузивных породах (1,7); самые низкие содержания его типичны для
лмких органических почв (1,2). А. Кабата-Пендиас [312] считает, что им
должен быть обогащен органический горизонт почв. По Ф. Хедриху.
с соавторами (1977 г.), концентрация Be в почвенных растворах
составляет 0,4—1,0 мкг/л, что выше, например, чем ПДК водоемов
(0,2 мкг/л), и обусловлено легкой растворимостью ВеС12 и BeSO4.
Детальное исследование поведения Be в почвах Урала провел
Н. А. Григорьев [222] в связи с разработкой геохимических методов
поисков месторождений по вторичным ореолам. Установлено, что
первым фактором является первичное содержание Be, вторым —
степень дренирования почв. Для почв вне участков, обогащенных Be,
в автономных ландшафтах (подбуры, бурые, буро-подзолистые серые)
преобладают профили распределения элювиального типа, в которых
содержание Be увеличивается сверху вниз для хорошо дренированных
почв следующим образом (мг/кг); горизонт Ло0,45±0,1; At 2±0,3;
AfA2 2,3±0,8; А2 1,7±0,3; В 5,7 ±0,8; ВС 1,9 + 0,3; С 3,1 ±0,7; CD 3 + 0,1.
С другой стороны, содержание растворимо! о Be в этом же направлении
снижается (мг/ki ): бурая гумусовая почва на cyi линке—At 80, В 64,
С 58; бурая на щебне—А, 37, А^З!, В 33, CDS; горная лесная
оподзоленная на суглинке— At 32, А2 46, В 50, С 34 и т. д. Своеобраз-
ное распределение Be характерно для почв на карбонатных породах, где
в юризонте CD происходит резкое увеличение ею концентрации.
Среди слабо дренированных автоморфных почв содержание Be
близко для всех горизонтов. Для гидроморфных почв характерно
186
обилие реакционноспособных форм Be и близкое в разных горизонтах
их количество, за исключением гумусового слоя, где оно наибольшее
(до 80%). Однако К. Лукашев и другие исследователи [424 ] определи-
ли, чго растворимый Be образует комплексы в основном с наиболее
подвижной частью гуминовых и фульфокислот, следовательно, эта
часть Be не может накапливаться в почве. Это же показано
Н. А. Григорьевым [222], установившим, что в торфянистой глеевой
почве растворимый бериллий коррелируется с минеральной составля-
ющей (Be24 -»Са2+ -♦ Mg24), что связано с его вхождением в монт-
мориллонитовые минералы. Часто распределение Be24 коррелируется
с РэО5, хотя этот комплекс легко растворим.
Таким образом, в хорошо дренированных почвах содержание
прочно связанного Be снижается снизу вверх, что объясняется
увеличением в этом направлении растительных остатков. Реакционные
формы Be в таких почвах образуются слабо, в умеренно дренируемых
они заметно накапливаются в горизонте В. в слабо дренированных —
по всему профилю, однако в почвах на карбонатных породах они могу г
существенно накапливаться в горизонте В хорошо дренированных почв.
В почвах вблизи редкометальных месторождений концентрация Вс
увеличивается (табл. 54), как и вариации содержаний. Для Польши
А. Падцик установил, что в техногенно загрязненных почвах вблизи
Металлургических предприятий и угольных электростанций концент-
рация Be достигает 15—50 мг/кг при фоновой 1 мг/кг.
Находящийся в почвах растворимый Be, несмотря на имеющиеся
представления о его слабом биохимическом захвате, по-видимому,
легко поглощается растениями, в которых в природных условиях
концентрация меняется в широких пределах—-от 0,001 до 0,4 мг/кг (с.)
или от 2 до 100 mi/ki (з.) [312]. Особенно высокие его содержания (до
250 мг/кг—з.) установлены [882] для растения-концентратора Be —
litccinium myrtillus. Среди других накопителей этого элемента отмеча-
ются некоторые представители семейств бобовых и крестоцветных,
особенно их корневые ткани |312]. Повышенные количества Вс
Таблица 54
Содержание бериллия (л!0~4%) в почвенных гори юнгах (А,, В) в учасэках
расположении первичных ореолов, связанных с редкоме1альиыми провидениями
Тип проявлений Ai В
1. Редкометально-вольфрамовыс грейзеновыс и квар- 0,6—11 0,8 -33
цевожильные 5.1(31) 5,1(34)
2. Изумрудоносные грейзены 1,4—18 2,0—36
8.7(7) 11(11)
3. Коры выветривания танталоносных пегматитов 0,8—22 1.5—27
5.9(11) 7,5(38)
187
выявлены Г. Крампицом (1980 г.) в листьях салата (0,033 мг/кг—с.)
и плодах томатов (0,24 мг'кг—с.) По X. Бове [860], Be накапливается
в лишайниках и мхах (0,04—0,9 мг'кг—с.). В промышленной зоне, по
А. Падцик (1979 г.), в траве обнаружено 0,19 мг кг (с.) Be. Искусс1вен-
ное внесение Be в почву (~100мг/К1) привело, по данным X. Бон
с соавторами (1979 г.), к возрастанию его содержания в растениях до
20 мг/Ki (с.). Содержание Вс в пищевых продуктах Австралии
составляет (мг'кг—с.): в мясе и рыбе до 5,7, картофеле 0,78, бобах
0,65, гоматах 1,05, яйцах 0,78, молоке 0,83, дрожжах 1,62 [43].
Механизм поглощения Be растениями до конца не ясен [312], однако,
возможно, сопоставим с таковым Mg2+ и Са2 + , а при антаюнисгических
взаимоотношениях между ними Ве2+ замещает Mg24. Установлено
также стимулирующее действие разбавленного раствора Be(NO3)2 на
рост некоторых видов растений, в частное! и. микроорганизмов
(Aspergillus niger). но биохимические механизмы еще нс выяснены.
По данным А. Кабата-Пендиас [312], В. Гриффитс и других
исследователей. Be токсичен для растений. Содержания его 2—16 mi/кг
(10 3- 10 4 моль Ве2 + ) в растворе ядовиты для растений, а токсичны-
ми в созревших листьях некоторых ращений считаются содержания
10—50 мг'кг (с.). Он тормозит прорастание семян и потребление Са,
Mg и Р корнями разрушает протеины и энзимы. Специфические
симптомы поражения растений неизвестны, чащные — бурые, недораз-
витые корни и чахлая листва. Не выяснена также опасность
повышенных количеств Be в растительное!и для человека.
По П В. Иванову [294] и А. К Ковалевскому с соавторами
(1979 т ), для Сибири установлены высокие концентрации Be—до 100
и даже 5000 г'т в золе некоторых растений — березы бородавчатой,
сосны обыкновенной, пшеницы, патринии сибирской, папоротника-
орляка, астрагала, таволги, стеллеры карликовой, вики однопариой,
черники, багульника, полыни, ковыля. Среди растений — концент-
раторов Be называются (его содержание, г т) патриния (20), стел iepa
(10), остролодочник (10) [52]. Установлена также способность растений
отторгать Вс, который накапливается в интенсивно обновляемых
корнях и отмирающих тканях [222]. А. В. Пономаренко с соавторами
(1974 г.) выявлено также наличие Be в золе почвенных насекомых —
имаго 3,5—5 mi кг и т. д.
Кларк Be в биосе 4 10 6%. Оценки средних содержаний Be, по
В. Шоу [915] и X. Бове [860], в организмах 1аковы (мг кг): растения
морские 0,00001. наземные 0,001; животные морские ?, наземные
2 10~5 — 3 • 10~б. Для океанского планктона оценки, по В. С. Савенко
[677], следующие (mi,кг— с.]: фито- 0,6, зоо- 0.2, тотальный 0,5,
среднее 0,4, взвесь 1. Среднее содержание бериллия в золе наземных
растений 2 г/т [52].
Высокая токсичность Be для животных и человека объясняется гем,
что он является сильным ингибитором некоторых ферментов, ак-
тивируемых Мо, в юм числе щелочной фосфатазы, угнетает АТ фазу,
фосфоглюкомутазу, R- и £)-нуклеотидазы, образование фосфора и ам-
188
миака при распаде нуклеинов кислот. Добавление 0.1—0,5% ВеСО3
к пищевому рацион) животных вызывает бериллиевый рахит
Обобщение данных по влиянию Be на возникновение болезней
у человека позволяет отнести его к высокопагологичпым элементам (14
типов патологий) и поставить вместе с Cd и РЬ в ряду снижающей
патологичности после TI: Hg(21 )> Ва (20)>Со(19)>Т1 (17)>Ве(14)~
~Cd(14)~Pb(14)...
Важно подчеркнуть, что повышенные концентрации Be в окружа-
ющей среде могут вызвать раковые заболевания у человека. По
данным НИИ канцерогенеза онкологическою центра РАМН, принятые
в настоящее время ПДК для ттою элемента не обеспечивают полной
безопасности. В то же время дефицит Be может приводить к гипобер-
риллиозу, который, однако, для человека не известен [484].
Поступление Be с пищей и жидкостями, по предварительным
данным, равно ~ 12 mki сут. Он плохо всасывается из желудочно-
кишечного тракта (в зависимости от степени растворимости соединений
всасываемость колеблется от 0,002 до 0,00001) и быстро удаляется из
крови (через 2 ч остается 2,5% поступившего Вс). Перепое в крови
происходит в виде сыворотки (фосфат, цитрат). Распределение Be
в организме и его выделение зависит от формы нахождения. Например,
ВеГ задерживается в костной ткани (Гб от 890 до 1770 сут. для разных
животных), а ВеС1 относительно быстро выводится из печени (Г6 15 ч).
Баланс Be для условною человека следующий (мкг/сут): поступле-
ние с пищей и жидкостями 12, с воздухом <0,01, выделение с мочой 1,
с фекалиями 10, другими путями I. Содержание его в организме
36 мкг, в том числе в мягких тканях 27 mki. Г6 для всего организма
определен Ю. И Москалевым в ~ 1040 сут. [512]. В табл. 55, 56
Таблица 55
Естественное содержание Be (] — среднее, 11 — максимальное) в opiauax человека,
л 10 6 1
Орган 1 II
Легкие 1,18 2,5
Лимфатические узлы корней ле1 ких 0,06 0,20
11счень 2,05 4,25
Почки 0,20 0,45
Костная I кань 2,87 10,00
Селезенка 0,05 0,22
Мышцы 4,60 30,00
М озг го тонной 0,31 2,25
Тонкий кишечник 0,06 0,20
Толстый » 0,02 0,25
Желчный пузырь Кожа, г дм'’ 0,03 0,20
0,71 15,00
Кровь 0.50 1,50 (до 3,8 мкг/л)
Организм в целом 16,50 87,04
189
Таблица 56
Есгесгвеииое содержание Be (1—среднее, II — максимальное)
в бносредах человека
Биосреда 1 II
Моча, мкт/су г 0,024 0,253
Кал, мкг/суг 0,078 0,291
КрОВЬ, MKI • % 0,014 0,030
Желчь, мкг % 0,032 0,074
представлены (по [43] и др.) содержания Вс в opiaHax и биосредах
людей, не имеющих контактов с производством и потреблением
данного элемента. Эти значения рекомендованы в качестве предела
естественного содержания Вс для человека. Количество 7 Be, посту-
пающего ежегодно в организмы животных и человека, составляет
50 Бк ]381 ].
Воздух, вода, техногеиез
Бериллий установлен в атмосферном воздухе высокоиндустриаль-
ных стран (нг/м3): ФРГ 0,9—4, Япония 5—100, Северная Америка
0,1—0,3 [312] при ПДКСС 100 нг/м3. Для атмосферного воздуха
приводятся следующие данные (мкг/м3): Англия—города до 0,0009,
села 0,00006 [43]; США 0,3—3. Содержание радиоизотопа 7 Be
в подземном воздухе ~3 10 3 Бк/м3 [43].
Содержание бериллия над территорией Ладожского озера (чистый
район) по Л. Н. Вавилину и др. составило 0,6 мкг/м3, аномальные
концентрации в Ленинградской зоне типичны для районов ТЭС (радиус
— 15 км) и достигали 8,0 мкг/м3 [845].
В водах содержание Be оценивается в среднем (%): океанские
2-10 9, речные 1 10 8. Известны также [43] следующие оценки его
содержаний для вод (мг/л): океанские 0,00005, морские 0,0001, речные
0,00003. В США содержание Be в водопроводной воде составляет
0.00003—0,00006 мг/л, в нашей стране оно не должно превышать
0,0002 мг/л [43].
В отличие от большинства элементов II группы (кроме Mg), Be
относится к комнлексообразователям и формирует труднорастворимые
гидроксилы (Пр «10 18-и-10 22) при рН$5,7. При этом устойчи-
вость галогенсодержащих комплексов Вс снижается в ряду
F>C1>B>J; не менее типичными аддепдами (кроме F) для Be
являются ОН , СО2 и органические соединения [366]. К раство-
римым в воде наиболее распространенным соединениям бериллия
относятся ВеС12, K2BeF4, Na2BeF4, Be(NO3)2 4Н2О, Be3N2, BcF2,
BcSO4, BeSO4-4H2O, ВеС12-4Н,О; слабо растворяется BeCO, 4H.O
В подземных водах содержание Be, по Р. С. Крайнову [366],
записи! от бериллиеносности пород (руд) и pH вод (табл. 57).
190
Таблица 57
Параметры распределения Не в грунтовых вотах мес i орож гений
Вл 1ы мест орождепии pH Содержа иие. МК1 1 i А, V, *•
Сучьфидных 4 0.1 100 46(2.3) 58 355
[рейзетювых релкоме г алытых -6 0.01 — 1,0 0.31(11) 0,05 130
Пегматитовых -6—7 0,05—0,5 0,20( 55) 0,05 105
11ефе типовых сиенитов >7 0,05 0,5 0.27(47) 0.06 85
В ореольных водах вольфрамовых месторождений кварц-кас-
сигерит-вольфрамиIово1 о типа содержание Вс до 0,7 мг,'л.
Установлено, что вынос Be из руд и пород зависит or типа вод. Гак
если грунтовые волы выносят в сутки с 1 км2 месторождений
0,005—0,008 кт Be, го при >гом углекислые — до 0,5 ki, а азотные
термальные только 0.0005—0,001 ki |365].
Выделяются гидрогеохимичеекие провинции бернллийсодержаши \
подземных вод, которые гяюгсктг к соответствующим мегаллогениче
ским зонам и содержат от 0,/т до и 100 мкг 'л Вс при высоком v
Высокие концентрации ею приурочены только к самым верхним
горизонтам грунтовых вод и быстро снижаются с глубиной за счет его
сорбционного соосаж гения на гидроксидах и глинистых барьерах.
Особенно высокие концентрации Вс типичны для зон сульфид
и флюоритсодержащей бериллиевой минерализации, самые низкие —
для трегцинно-жильных напорных зон (кроме вод с высоким содержа-
нием СО2) и вод повышенной щелочности (pH>7,5), в которых его
миграция исключена. Ьериллийсодержащие подземные воды имеют
НСОз-Са, HCO.i-Ca-Na. SO4-Ca. SO4-Ca-N« состав, пониженные
значения pH и часто повышенные коаценграции К Блатоприягноегь
для водной миграции Be снижается по мерс перехода от маломинера
лизованных. обогащенных органикой грунтовых вод тумидпой зоны,
к более минерализованным водам аридной зоны континентальною
засоления, особенно в кальциевых средах |366).
Бериллийеодержатцис воды нс пригодны для хозяйственно-питьево
го водоснабжения По С Р Крайнову, В М. Швец [360], наиболее
опасными могут являться подземные воды в следующих условиях
гумидные районы кислых — щелочных интрузивно-эффузивных пород
с повышенными концентрациями Вс и I; районы с редкомедальни
сульфидной минерализацией
Поведение Be в гехногенезе легально изучено только для берилл»
свых производств, которые являю гея весьма опасными в связи
141
с чрезвычайно активным негативным воздействием >того элемента
и его соединений на различные органы человека [43, 128, 484].
Особенно опасны аварийные ситуации. Так, при загорании бериллиевой
пыли и взрывах на Ульбинском мс1аллургическом заводе, пыле-
газовые выбросы, в 60—890 раз превышающие норму, распростра-
нились над большой территорией, на которой проживает около
120 тыс. жителей. Последствия этой аварии непредсказуемы.
1орно-г еологические добычные бериллиевые нредприягия. а также
редкомстальпые ГОКи и месторождения, где Be получают попутно,
экологическими исследованиями не охвачены, что является ближайшей
задачей экогеохимии. Поведение Вс при использовании минеральных
топлив в энергетике также не изучено, однако считается, что здесь
скрывается основной источник загрязнения Вс окружающей среды [43].
Проведенное обобщение магериалов по бериллиеносности угольных
тепловых станций не показало наличие его концентраций, превыша-
ющих ПДК, в каких-либо средах [681 I. В г о же время гакие
концентрации установлены при производстве сплавов в цветной
мсталлурзии, пластмасс, химических веществ (В-6,7), огнеупорных
изделий (В-2), при сборке тяжелого бурового оборудования (В-2,0),
в машиностроении, на предприятиях стройматериалов. Концентрации
Be, превышающие ПДК, отмечены также для глсктро- и радиотехниче-
ского приборостроения, прецизионного машиностроения, ядерной
энергетики, рэкете- и самолетостроения, в стекольной промыш-
ленности [681]. Кроме того, имеются данные о его высоких
концентрациях (4—13 мг/кг с.) в сточных промышленных водах,
используемых для орошения [312]
Экоз еохимические исследования для Be находятся в начальной
стадии и должны форсироваться, особенно в районах бериллиевых
и флюоритовых ГОКов, цементных и угольных производств.
Отравление соединениями Be подопытных животных (мышей)
при введении в желудок наступает при дозах (ЛД50, мг'кг): для
оксида 2062. ортофосфата (внутривенно) 1270, сульфата 80, хлорида
92 [128].
Выводы. Бериллий — редкий, супертоксичный (Г,= 15, Тга=100),
высокопатологичный металл, характерный в основном для материко-
вой суши и концентрирующийся только в процессах позднего кислого
(Ве-пегматиты. грейзены) и щелочною (агпаитового и миаскитового)
магматизма и связанных с ними гидро терма лигах. Для минералов Be
наиболее высокие значения ГЭ отмечаются для силикатов — 5106 (В
до 2,8 10'’). берилла 5 104 (В до 2,9 10э); для месторож гений Be
значения ГЭ и В находятся в этих же пределах; Тф — низкая (2-10°),
М — значизелызый, как и перспективы использования. Гидро-, атмо-
и биофильноезь Be относительно низкие. В зоне гипергенеза он иногда
относительно подвижен, в почвах обладает кумулятивным эфз])ектом.
В зехпогенезе его избыток (особенно в пылевой фракции воздуха)
очень опасен. Экологически Be относится к элементам наибольшей
деструктивной активности
192
МАГНИЙ —12
Главный (кларк 2,26% *) легкий породообразующий общетоксичный
(Тл=1, Тг= 10) металл. ПДК (мг/м3; для воды — мг/л) для разных
соединений Mg таковы: для MgO ПДКмр 0,4, ПДК„ 0,05, ПДКрз 5; для
Mg(CIO3)2 ПДК„ 0,3, ПДКр1 5, ПДК„ 20 [128, 231, 727]; ПДКР, для
асбестов—природных 2, асбесто-породных пылей 2 (>10% асбеста)
и 4 (<10%), асбестоцемента 6, асбестобакелита, асбесторезины
8 (IV класс опасности) [128]; для тальковой пыли ПДКР, 4 (IV класс)
[727].
Атом
Атом состоит из трех изотопов: 24Mg (78,6%), 25Mg и 26Mg;
радиоизотоп 2sMg имеет Г1/2 21 ч.
В периодической таблице расположен в 3-м периоде, во II группе
(валентность II), в окружении Be, Са, Na, К и «/-металлов — Sc и других
металлов группы Fe. Важно, что по размерам орбитальных радиусов
среди s-металлов Mg ближе всего к Fe, Mn, Ni, Со и Си; близок он
к ним и по энергетическим, и по окислительно-восстановительным
свойствам, и по относительной подвижности ионов в водных раство-
рах. Особенно сходен он с Fe24, Ва2 + , Sr2+ по значениям ионных
плотностей. По химическим свойствам является промежуточным
между Са2 + , Al3 + , Fe2+ и Fe3 + . При низких температурах хорошо
растворимы MgSO4, MgCl2 (548 г/л), Mg(ClO3)2 (867 г/л)
и Mg[SiF6]-6Н2О; MgCO3 слабо растворим, Пр=Г10-5 (как СаСО3); .
все эти соединения относятся к токсичным [231 ]. Магний интенсивно
адсорбируется и имеет более прочную связь, чем Са, с отрицательно
заряженными коллоидами; pH осаждения Mg(OH2) 9,4—10,9. Главные
свойства Mg в сопоставлении с другими щелочноземельными элемен-
тами приведены в табл. 51, 52, а растворимость солей — в табл. 58.
В условиях земной коры и верхней мантии Mg ведет себя как
литофильный элемент, характерный для ранних высокотемпературных
процессов кристаллизации в эндогенной обстановке и, наоборот, для
поздних процессов—в экзогенной. ’Его минералого-геохимические
формулы для верхней земной коры О98с2 для нижней коры и мантии
Л97х, [292].
Содержание Mg (%) в земной коре в целом оценено в 3,20,
в верхней коре 1,33, нижней 3,80, архейской общей 2,83, в примитивной
мантии 21,15% Mg [749]. По другим данным [857] (% MgO):
базальтовая оболочка океанов 7,7, верхняя кора континентов 2,96,
нижняя 6,41, осадочная оболочка океанов 2,36, континентов 5,31.
В океанской гидросфере среднее содержание лишь немного уступает
таковому в литосфере, а время его полного обмена составляет
45-К)6 лет; В колеблется от 0,07 до 2 [574].
* Кларк биосферы 0,9%, биоса 0,04%.
13 2138 193
Таблица 58
Растворимости солен щелочноземельных элементов
(молярное >> насыщенных растворов при 25 °C)
Соль Mg Сл Sr Ва Be*
MSO4 4,8 0,015 7,4 10 1 1,1 10 5 29,7
М (ОН)г MF, 2.0 10 444 1.3 10 3 0,021 2,2 10 4 0,082 9.7 10 4 0.27 8.3 10 3 42.2
мей 5,7 7,4 3.5 1,8 —
МВ, 5,6 7.5 4.2 3.4 —
MI, 5.3 7,0 5,4 5.2 —
M(NO,). 5,0 8,4 3.3 0.41 51,2
М(СЮ4), 4,5 7,9 10.8 5.9
МСО3 0.011 1,2-10 4 6,8 10 1,1 10 4 —
* Растворимость в Н,О, %.
** П„ Mg(OH)25 10 " , pH 10,5.
Кларк Mg (%) в хондритах 9,9 +1,2, в железо-каменных метеоритах
8,6+3, в железных 0,03. По типам хондритов средние содержания
составляют (%): углистые С1, 9,56, СП 11,8, CI11 14,53; обыкновенные
Н 14,2, L 15,19, LL 15,29; энстатитовые Ел 10,70, Es.o 13.31; ахондриты,
богатые Са (полевошпатовые) эвкригы 0,94, бедные Са обриты 21,71,
шассиньиты 19,42, говардиты 9,4, уреилиты 22,6; железо-каменные
палласиты 11,9, мезосидериты 3,82; силикатная фаза хондритов 16,7
|107. 668]. Содержания Mg (%) в лунном реголите 5,2+ 0,5, базальте
4,2, анортозите 8.0, в оливине 16,5 [107].
Минералы
Минералы Mg во многих случаях относятся к числу широко
распространенных породо- и рудообразуклцих (табл. 59). Обшее их
число па 1988 1 составило 364 [292]; преобладают силикаты—161,
затем идут борагы и гидробораты — 39, фосфаты и гидрофосфаты —
36, сульфаты и гицросульфаты—33, карбонаты и гидрокарбонаты —
30, арсенаты и гидроарсенаты—13. хлориды и гидрохлориды—8,
фториды и гидрофториды — 3, сульфиды — 3, ванадшы и органические
соединения—по 2, нитрат 1. Среди силикатов больше всего минералов
Mg в цепочечных, ленточных, слюдах, хлоритах и им подобных,
а также в ортосиликатах, 1. е. во всем диапазоне O;Si—от 2,5 до 4;
неизвестны минералы Mg среди каркасных силикатов (О Si = 2) и мало
их среди диортосиликатов (О Si = 3,5). В цепочечных и ленточных
силикатах, слюдах и хлоритах наиболее часто Mg совмещен с Al, (А1
Fe) и Fe часто к ним прибавляются Са, К, Na, иногда Мп; для многих
минералов, особенно для диортосиликатов, типична ассоциация MgCa.
Для гидроксидов обычна ассоциация MgFe (10 минералов) и MgAl
(7 минералов), для карбонатов и i идрокарбонатов MgCa и MgNa (по
194
4 минерала), для 1 идроарсенатов MgCa (4 минерала) |776]. Многие
силикаты и алюмосиликаты Mg (особенно вторичные серпантин, тальк
и др.) оботащены Н2О.
Экспериментально доказан широкий изоморфизм Mg2 + ₽»Fe2 +
(оливины, пироксены, слюды, шпинели, людвигиты и др); по
Е. С. Макарову (1968 г.), изоморфизм Mg2+r+Ca2+ отраничен (кар-
бонаты. пироксены и др.); маловероятным или весьма отраниченным
он считает изоморфизм Mg2 + r*Als + (мелилит) и Mg2 + *±Mn3h,
поскольку в згой системе образуются промежуточные стехиометричес-
кие фазы. Широкий ряд твердых растворов в слюдах, амфиболах,
гранатах характерен для Mg2 + ₽iLi’1
Таблица 59
Главные минералы Mg
‘ Минерал Химическая формула Химический секла» n содержание ттемен та. % Класс
Ашарит MgHBO3 MgO 47,9; В,О3 41,38; Н2О 10,71 Борат ы
Брусит Mg(OII)2 MgO 69; 11,0 31 Гидроксиды
Карналлит KCIMgCl, 6Н2О Mg 8,7; К 14,1. Cl 38.3; H,O 38,9 Хлориды
Бишофи । MgCO, 6H2O — —
Кизери i MgSO4 11,0 MgO 29,0; SO., 58; ICO 13 Сульфаты
Эпсомит Mg.SO4-7H,O MgO 16,3; SO, 32,5; H,O 51,2 »
Магнезит MgCO., MgO 47,6; CO, 52,4 Карбонаты
Доломит MgCa [CO, J, CaO ),4; MgO 21,7; CO2 47,9 »
Оливин (Mg, Fe),SiO4 MgO 50—45, FcO 8—12 Силикат ы
Пироксены AT[Si2Oj; A =Mg, Fe. Ca; F=Si, Al До 40 MgO »
Амфиболы JC.T, (OH, f )[Z4Oll]2; Af-Ca. Na, K. Mg; F= = Mg, Fe, A). Ti, Mn; Z-Al, Si Непостоянный »
Сапонит Mg,[Si4OloJ [OH],x x H,O MgO 21—25; SiO, 46—56 »
Серпентин Mg6[Si4OI0J |ОН|Й MgO 43,0; SiO2 44,1; H.O 12,9 »
Тальк Mg.,[Si4OI((J |OH]2 MgO 31,7; Sio2 63,5; H2O 4.8 »
Неннии (Mg. Fe)5AIIAJSi.O,,,]> xfon]» MgO 17—35,9; FcO 0,7—17,4; Fc2O, 0—5,7; AI2Oj 13,8—21,3; SiO2 29,8—33,7; H,O 11,5— 14,6 »
Вермикулит (Mg. Fe2*. FcJ+)3x xHSi. AI)4O10 )(OH),x x41I2O MgO 14—23; Fe2O3 5—17; FeO 1—3; SiO2 37—42; AI,O3 10 13; 11,0 8—18' »
13*
195
Продолжение табл. 59
Минерал Химическая формула Химический состав и содержание элемен- та, % Класс
Флогопит KMg3 [AlSi3O10] [ОН]2 MgO 21,4—29,4; К2О 7—10; А12О3 10,8—17; SiO2 38,7—45; Н2О 0,3—5,4; F до 6 Си тикаты
Биотит К (Mg, Fe)3[AlSi3O10]x x[F, ОН] 2 MgO 0,28—28,34; К2О 6,18—11,43; FeO 2,74— 27,60; Fe,O3 0,13— 20,65; А12О3 9,43— 31,69; SiO2 32,83—44,94; Н2О 0,89—4,64 »
Шпинель MgAl,O4 MgO 28,2; А12О3 71,8 Оксиды
К наиболее широко распространенным породо- и рудообразующим
минералам Mg относятся: эндогенные—оливин (форстерит), серпен-
тин, пироксены, амфиболы, шпинели, флогопит, био гит, хлорит;
экзогенно-эндогенные—доломит, магнезит, брусит, бишофит и др. (см.
табл. 59).
Наиболее легко растворимы бишофит (1670 г/л) и эпсомит
(710 г/л), легко растворимы каинит и карналлит, медленно растворяет-
ся кизерит (см. табл. 58). Кр элементов-примесей в магнезиальных
темноцветных минералах—оливинах, пироксенах и амфиболах из
основных пород высокие (> 1), характерны для многих «/-металлов,
причем в амфиболах и клинопироксенах они обычно выше, чем
в ортопироксенах [793]. Для клинопироксенов Кр группы тяжелых
редкоземельных элементов (Sm, Eu, Dy, Yb), а также Sc, Hf могут
подниматься до 1,2—1,3 и более. Еще выше Кр для амфиболов
и клинопироксенов дацитовых и риолитовых пород [793].
В гипогенных процессах поведение Mg и соотношения Mg—Fe
и Mg — Al зависят от составов оливинов и пироксенов, амфиболов,
слюд. Mg-оливин — форстерит Fo (100—90% Fo) и Mg-Fe разновид-
ности оливина — хризолит (90—70% Fo) и гиалосидерит (70—50% Fo),
более магнезиальные из которых типичны для наиболее глубинных
и метаморфизованных пород, содержат относительно повышенные
количества Ni, Со и меньшие (по сравнению с Fe-фаялитами)
количества Ti и Sc [731J; содержания Сг в основном меньшие, но
иногда и более высокие.
Систематическое изучение оливинов из ультрабазитов Сибирской
платформы, проведенное Ю. Р. Васильевым, А. В. Соболевым и дру-
гими исследователями (1978 г.), показало, что содержание Ti и А1
в них не превышает 0,04—0,07%, а других элементов изменяются
в широких пределах (%): Мп 0,05—0,49 (х = 0,2 + 0,06); СаО 0,01—0,79
(0,36 ±0,15); Ni 0,0—0,46 (0,22 ±0,05); Сг2О3 0,0—0,18 (0,04 ±0,03).
Выделено две группы оливинов: 1) из дунитов, меймечитов, пикритов,
196
коматиитов, кимберлитов, в которых перечисленные элементы кор-
релируются с FeO и между собой и 2) из оливинитовых массивов
щелочно-ульзраосновных пород без значимых связей с FeO и други-
ми, кроме MgO. Д. Ягуц с соавторами (1978 г.) при изучении
оливинов из различных нодулей и архейских коматиитов установлена
обогащенность последних Ni, Cr, Sc и равномерное распределение Со,
Zn, Мп.
Образующийся по оливину серпентин, по Д. С Штейнбергу и дру-
гим исследователям (1978 г.), состоит из двух
минералов—H4Mg3Si2O9 и H4Mg2Fe 2' Si2O4; количество последнего
(молекулярная доля) меняется от 16 до 75% при вариации степени
серпентинизации от 25 до 90%; снижается и железисзость брусита —
от 25 до 10%.
Н. Моримото (1988 г.), рассматривая пироксены в тройной
диаграмме Mg2Si2O6 (Еп)—Ее2Б12Оь (Fs)—Ca2Si2O6 (Dy), выделяет
среди них магниево-железистые — энстатит (Mg2Si2O6), клиноэнстатит
(Mg, Fe)2Si2Ob, пижонит (Mg, Fe, Ca)2Si2O6, авгит (Ca, Mg, Fe)7Si2O6,
диопсид (Ca, Mg)Si2O6, а также маложелезистые (<5OFs) и малокаль-
циевые (<50 Dy) разности. Аналитические данные по составу
минералов этой группы приведены в работах В. В. Ляховича,
А. Ф. Ефимова и других исследователей [259. 260. 434, 731]. Более
поздние данные по пироксенам в целом приведены в табл. 60 для
разных типов пород; при этом видна значительная разница для
пироксенов из табброидов, гранитоидов и щелочных пород практиче-
ски по всем элемензам-примесям. Количество одних элементов
в данном ряду увеличивается (Li, Zr, TR, Nb, Ta, Be, V, Cr),
других — снижается (Rb, Sc, В, Ni, Co, Cu); распределение Sr и Pb
неопределенно. Различаются по содержанию элементов-примесей
пироксены, выделенные по структурно-генетическому признаку, кли-
нопироксены от ортопироксенов. В первых, с учетом типа пород,
меньше Ni, Со, Zn и больше V, Cr, Sn, Sc, Hf, La, Zr. Данные
табл. 61. содержащей материалы Л. Ф. Борисенко (1973 i.) по Уралу
и Ю. А Мартынова (1986 г.) по Нижнему Амуру, подтверждают эти
выводы по всем элементам, золько Sn оказалось больше в орто-,
чем в клинопироксене. Для пироксенов из метаморфических комплек-
сов М Рейс (1978 1.) установил, что с ростом температуры и увеличе-
нием количества А1 упорядоченность в распределении Ее21—Mg
снижается.
Сравнение поведения элементов-примесей в пироксенах различной
магнезиальноети—знсзатиге и диопсиде—проведено [166] по включе-
ниям в щелочных базальтоидах Сихотэ-Алиня (табл. 62). Видна
большая или меньшая разница в содержании этих элементов, связанная
с различием в содержаниях Mg. Энстазиз содержит больше Ni, Со, Zn,
меньше Zr, Cr, V, Ti, Ag; количество Sn, Cu, Pb и Ca близко в обоих
минералах. Для образцов Mg-пироксена из ультрабазизов интрузии
Рум Лаурид, незначительно отличающихся по степени железистости,
также установлено некоторое различие. Менее мат незиальные (Fe>5%)
197
g Таблица 60
Среднее содержание редких и рассеянных элементов в главных породообразующих темноцветных минералах
некоторых типов горных пород, I /т
Порода, минерал Li2O Rb:O Cs2O SrO BaO ZrO2 TR2O3 Sc2O3 Nb2O, Ta2O5 Zn
Габброиды 30 50 — 440 300 100 117 24 20 0,5 —
пироксен 15 215 -— 198 94 130 140 121 3 0.4 —
амфибол 5 90 — 310 27 47 70 80 30 2 —
слюда 80 1100 — сл. 1600 35 30 15 78 13 -—
Гранитоиды 80 220 5 300 830 200 295 3 20 3,5 60
пироксен 38 15 -— — —— —— 40 31 1 ——
амфибол 15 118 5 197 51 120 500 132 40 6 500
слюда 1100 1250 140 250 1880 120 40 14 148 12 640
Щелочные породы 80 210 7 ИЗО 1600 384 370 — 100 8 85
пироксен 180 81 20 170 —— 2870 300 11 310 40 150
амфибол 1340 101 29 960 570 800 200 23 340 50 2700
фпода 1110 1200 103 600 3700 60 200 22 300 40 3300
।
1 • Продолжение габл 60
Порода, минерал РЬ Be В V Сг Ni Со Си Мо и Ga Tl Ge In
Габброиды — 0,4 5 200 200 160 45 100 — — — — — —
пироксен 6 3 116 250 420 140 70 110 - — ——. -— -— —
амфибол — 2 74 — 20 70 40 40 — — — — — —
слюда —— — — — —— 1
Гранитоилы 18 — 15 40 25 8 50 20 — — — — — —
пироксен -— — —— — — — —— ——- 2 2 -— ——- 2 0,3
амфибол 9 —— 48 190 56 23 30 30 -— 4 18 0.7 2 0,8
слюда 19 — 14 300 80 22 35 — 4 47 49 6 —- 0,5
Щелочные породы 20 4,5 17 70 38 19 5,5 42 — — — — — —
пироксен 7 11 20 700 810 29 18 22 -— — -— — — ——
амфибол 7 24 30 1200 70 80 30 20 —— —— — — — —
слюда 2 8 10 130 200 60 60 — — — — — — —
Таблица 61
Среднее содержание элементов-примесей в фемических минералах вулканогенных пород Нижнеамурской вулканической зоны
и ультрабазит-базитов Уральской провинции, г/т
Порода Минерал fl Ni Со Сг V РЬ Sn Zr Zn Sc Ag Ni/Co
Оливинит Оливин 10 400 /рал 100 610 14 3 4
Диопсид 10 120 30 1160 170 — — — — 78 — 4
Ксенолиты базальтов Оливин 5 3200 160 200 ___ 20
Экстатит 5 660 60 1000 — — — — — — — 11
Диопсид хромовый 3 330 40 9100 250 — — — — — — 8
Нижнеам грская зона
Андезитодацит Клинопироксен 4 27 29 25 228 4 1 51 54 169 0,05 0,93
Ортопироксен 6 47 30 10 70 2 5 27 22 38,5 0,12 1,60
Амфибол 5 39 36 13 352 7 6 73 315 142,3 0,36 1,11
Субпгелочной плагио- Биотит 3 2,0 / 9 30 6 7 245 210 32 0,10 0,30
гранит
Базальт, андсзитоба- Оливин 5 858 196 108 138 2 5 23 — 215 0,13 4.4
зальт
Клинопироксен 3 98 52 458 345 1 0,1 64 150 215 0,15 1,9
Андезитобазальт Оливин 2 720 117 365 44 0,1 6 21 350 69 0,18 6,1
Андезит Клинопироксен 3 41 56 71 443 0,1 5 90 458 300 0,21 0,73
Ортопироксен 4 25 74 25 79 3 8 5 788 58 0,21 0.32
Амфибол 3 43 53 47 677 9 4 103 190 132 0,14 0.81
Риолитовый игнимбрит Биотит 4 14 27 4 181 26 4 104 445 36 0,3 0,5
661
Содержание микроэлементов в минералах лерцолитовых ксенолитов, г/т
по сравнению с магнезиальными несколько обеднены (г/т) Сг (3700
и 4975 + 800), 1г (0,0004 и 0,0021), Sc (88,7 и 97 ±2,4), Yb (1,1 и 1,4)
и обогащены Со (38,5 и 33 +1,5); для Ей разница оценок оказалась
статист ически незначимой.
Наиболее полное исследование состава пироксенов и амфибо-
лов метаморфических пород выполнено М. Д. Крыловой с соав-
торами [379]. Данные по содержаниям некоторых элементов-
примесей свидетельствуют о го.м, что наиболее информативным
элементом во всех случаях является П, а для пироксенов — Ni, Со, Сг
и V (табл. 63, 64).
Во многих случаях в литературе приводятся высокие содержания
того или иного элемента в пироксенах, что обычно связано
с наличием микровключений минералов этого элемента. Например,
К. Ваэнер (1988 1.) в Fe-клинопироксенах (Маруроа, Полинезия)
установил от 4 до 10% ZrO2, до 10% Nb2O5, до 1,2%
ZnO, но микрозондовые исследования показали, что пироксен
обогащен микровключениями ильменорутила, титаномагнетита, ма-
гнетита и др.
Амфиболы сходны с пироксенами, достаточно изучены по составу
и номенклатуре, но на злементы-примеси исследованы только в целом
(табл. 65, 66) независимо от их магнезиальности. Выделяются Mg-Fe
разности — от преимущественно Mg антофиллита (Mg,
Fe)7SigO22(OH)2, более железистого (Mg, Fe)6(Al, Fe)(Si, А1)8О22(ОН)2
(ромбические ортоамфиболы), Fe-Mg кумингтони га (Fe,
MO)-,SigO22(OH)2 до 1рюнерига Fe7SigO22(C)H)2 (моноклинные), а так-
же Ca-Mg разности — обогащенный Mg iремолит CaMg5Si8O22(OH)2
и более бедный им актинолит Ca2(Mg, F‘e)sSigO22(OH)2; известны
и Na-Ca, и Na-Mg—г ыукофан Mg3Na2Al2SigO22(ОН)2, и Na-Fe
(рибекит) и Mg — холмквистит Mg2Li2Al2SigO22(OH)2—амфиболы.
Между амфиболами и пироксенами сходного состава имеется струк-
турное сходство: антофиллит—энстшит, тремолит—диопсид (и т. д.),
но амфиболы харакгеритуются удвоенной величиной параметра
Ьо [359]. В группе амфиболов всего приводи юя 67 минеральных
разновидностей [832 ].
Среди элементов, наиболее часто встречающихся в роговых
обманках в высоких концентрациях (и — 0, л%), кроме минералооб-
разующих элементов отмечались Mn, Ti, К, F. Остальные элементы
обычно присутствуют в более низких количествах (0,0 и% и менее—
см. табл. 65). Более магниевые амфиболы характерны для глубинных
и метаморфических пород, в ультрабазитах они относительно обогаще-
ны Сг (среднее 0,238%) и Sr (0,019%), в мезаморфитах и 1абброидах —
V, в щелочных породах — Nb (0,015%) и др. (см. табл. 65, 66).
В щелочных роговых обманках из щелочных гранитов содержание Li,
Rb, Zn, Мо гораздо выше, чем в тех же минералах из известково-
щелочных гранитов, a Sn—ниже (табл. 67); для Монголии гораздо
выше содержание (Г'т) Zn (1468). Pb (48), Nb (219), Zr (1223), Li (741),
F (1,1%), а также Sn (76) и ниже Sr (49), Ba (741), Rb (16).
201
200
Таблица 63
Содержание малых элемент ов-лримессй в ортопвроксенах
из различных пород (1—5)*
Элемент ** 1 2 3 4 5
Т1О2 0,17 0,21 0,17 0,10 0,13
МпО 0,38 0,24 0,16 0,05 0.45
Со 134 95 135 51 151
Ni 128 121 569 219 134
Cr 119 186 904 92 87
V 124 183 94 43 72
Zr 56 87 26 57 32
Sc 34 45 25 22 25
Y 38 48 — 54 42
Cu 15 18 16 8 31
Be 1,7 3 — — —
n 50 33 21 7 7
* 1—кристаллические сланцы, 2—гнейсы, 3-—основные ортопороды, 4—магнези-
ально-глиночемистые породы, 5—интрузивные чарнокиты.
* * Здесь и в табл. 64, 68 содержания ТЮ2 и МиО даны в %, остальных
элементов—в г/т.
Таблица 64
Содержание элемевтов-првмесев в клинопироксенах
пород амфиболитовой (I) и гранулвтовон (II) фации
Элемент Кристаллические сланцы Гнейсы
I II I II
TiO2 0,25 0,14 0,25 0,41
MnO 0,17 0,38 0,10 0,23
Co 62 67 52 62
Ni 133 86 53 162
Cr 200 192 65 519
V 159 280 140 170
Zr 93 128 120 115
Sc 127 116 23 130
Y 42 87 50 75
Yb 144 — 6 8
Cu 18 15 8 23
Be 3,5 4 3 2,5
n 24 9 14 21
Наибе iee полно состав актинолита в сравнении с рибекитом
и др\ । ими минералами изучен Е. В. Румянцевым, С. Т. Лапшиным
(1986 г.) в щелочно-амфиболовых метасоматических пропилитах
(Онежский прогиб). Все изученные злементы-примеси, кроме Мп,
202
* По О. И. Матковскому. 1960 г.
Примечание. Здесь и в табл. 66, 67 в скобках — число анализов.
203
I б л н ц a 66
Содержание микроэлементов в роговых обманках, г/т
Со 43(5) 38(4) 87(2) 1 45(1) 85(2) (1)061 190(2)
р? ГЛ ГЛ '— ГЛ
О О о 40 1 О' СС о ел ОО
г
сч ГЛ —— с*?
сл чо с о О сч гг О 40 оо
S О' сч о 3 1 1
— ел О о гч
о рз' г—' fry'
S Tj" СП V) 1/э О 1 1
О О о О —’
ГЛ fry
о 40 40 о 5 40 О' 40 оо 40
Массив Нижнеарминский Приисковый Среднеарминский зь Ловлягинский Дальнеарм инский Белогорский Горный
Порода Гранодиорит Адамеллит Гранит-порфир Диорит Адамеллит -
о
40
S
ж
<□
и
с
ч
о
а.
С
К N 30(1) 50(1) 150(1) 98(1) 77(2)
X) сц 5,0(1) 579(1) 16(1) 11(1) 14(2)
N 52(5) 60(4) 540(1) 25(1) 450(1) 430(1)
й 49(5) 42(4) 285(2) 45(1) 180(2) 250(1) 140(2)
<3 14,3(5) 12(4) 12(1) 5,0(1) 1
> 212(5) 140(4) 97,5 (2) 320(1) 155(2) 150/1' 160(2)
О 213(5) 228 (4) И(2) 830(1) 16(2) 35 m 32(2)
Массив Нижнеарминский Приисковый Среднеарминский » Ловлягинский Дальнеарминский Белогооский Горный
1 1 Порода Гранодиорит в Адамеллит Гранит-порфир Диорит Адамеллит »
М
S
Таблица 67
Среднее содержание (г/т) рудных н редких элементов
в амфиболах из пород разной щелочности (Восточный Саяв).
По Л. Н. Морозову, 1972 г.
Порода Минерал Мо Sn Zn Be Li Rb
Сиенит порфиро- вый Сиенит щелочной Гранит щелочной Гранит известко- во-щелочной Роговая об- манка (3) Гастингсит (3) Казафорит (з) Рибекит (3) Роговая об- манка 1,5 2,5 7,4 6,9 1,9 9,7 16,2 16,0 7,1 27,9 332,5 610,0 661,7 335,8 10,8 11,7 13,1 26,7 5,3 49,7 258,3 24,0 2356,7 39,4 25.0 48,3 30,0 106,7 64,0
содержатся в рибеките- в больших количествах, чем в актинолите.
Детальное исследование состава амфиболов с учетом /о провела
А. А Стрижкова [482] для позднемеловых гранитоидов Центрального
Сихотэ-Алиня (см. табл. 66). По мере уменьшения магнезиальности
(увеличения /о) содержание большинства элементов-примесей увеличи-
вается, за исключением Сг и Ni; неясно поведение V. Изучение
корреляционных взаимоот ношении Mg в амфиболах показало наличие
близких к 1 отрицательных связей с. Ti, Al(vi), F, а в породах—с SiO2,
Кг О и положительных с СаО.
Распределение элементов-примесей в амфиболах из пород разной
степени метаморфизма сходно с таковым в пироксенах (табл. 68)
Таблица 68
Содержание некоторых малых элементов в амфиболах
из пород гранулитовой (1), амфиболитовое (2)
в зеленосланцевой (3) фаинн [379 [
Элемент Кристаллические сланцы 1нейсы
1 2 3 1 2
T1O2 1,59 1,21 0,58 2,0 1,2
MnO 0 13 0 11 0 17 0,20 0,32
Co 104 96 109 100 90
Ni 225 265 309 201 111
Cr 398 416 450 246 173
V 578 393 363 593 333
Zr 106 87 80 217 143
Sc 93 64 49 111 115
Y 94 73 54 274 179
Yb 9 9 6 18 —
Cu 14 28 55 13 18
Be 6 7 6 9 12
И 47 43 11 14 11
205
Наряду с отмеченными факторами, на состав минералов влияют
условия их образования, определяющие структурные особенности
этих минералов, в частности удельную плотность. А И. Белковским
(197b i.) отмечалась роль высоких давлений в увеличении ма-
гнезиальности гранатов (альмандин) при процессах деэклогигизации
в диафторитах. Для Сибирской платформы Э. Б. Наливкиной (1978 т.)
установлено, что нижняя часть разреза докембрия представлена
более высокомагнезиальными (с меныпей ячейкой) темноцветными
минералами.
Из других эндогенных минералов Mg отметим шпинель и магнезит
MgCO3, состав которых изучен в основном в отношении минералооб-
разующих компонентов. Для магнезита наиболее часто выявляется
примесь FeO (до 7,5%), вероятно, за счет ограниченного изоморфизма
MgCO3<±FeCO3.
Для магнетита (магномагнетита) из ультраосновных пород среднее
содержание MgO составляет 6,27%.
Изучение А. Неевой (1978 г.) химических превращений при воздей-
ствии гранитного массива на хлоритовые филлиты и перехода хлорита
в биотит выявило общее увеличение содержания таких элементов, как
Si, Ti, Мп, К, F, W, NB, Li, Sn, Ba, Rb, Cs и понижение содержания Al,
Fe2+ (Fe3+ + Fe2 + ), Mg, H2O+ (H2O++C1 + F), Cr, V, Zn, Ni, Co, Sc.
Er, Ni, Co в последовательности: хлориг ♦биотигизированный хло-
рит >биотит.
Из элеменгов-примесей для некоторых магниевых минералов из
солевых отложений, по Т. Ф. Бойко [61 ], наиболее характерны Sr и В:
среднее содержание (г/т) Sr в ашарите 1650, кизериге 10—70;
В в кизериге 465—1000 и более, в эпсомите 93; нередки примеси (г'т)
Са (карналлит 80—790, кизерит 1410—4000), иногда Т1 (карналлит до
1), часто Rb, Cs (за счет К). Остальные изученные элементы для этих
минералов не типичны (г'т): Li, Be, Cd<5, TR<10, Ge, Nb. Ta. Sc<l.
Zr, Ga, Se, Те, Re<0,5, In<0,01 [61].
Многие минералы Mg (как эндогенные, гак и особенно экзогенные)
обогащены И2О и ОН. Б. М. Чиковым с соавторами (1989 г.)
установлено, что серпентин (хризотил и лизардит) образуется при
относительно низких температурах (400—450 С) и давлениях
(500 МПа), а также в морской воде по продуктам смектитовой фации.
Детально изучены условия образования доломита и магнезита.
Существенно магниевыми являются минералы типа асбеста— водные
силикаты Mg, Fe, Са, Na, отличающиеся тонковолокнистым строением,
определяющим их практическое значение в качестве огнестойких матери-
алов и наполнителей (пластмассы, асбоцементы и т. д.). Различаются
хризогил-асбеег Mg6 [(OH)sSi4O10]—тонковолокнистый минерал группы
серпентина и амфибол-асбеста—тонковолокнистые крокидолит, антофил-
,.ит, амозит, родуст, тремолит, актинолит и др.
При гидротермальных процессах происходит изменение первичных
магнезиальных силикатов изверженных пород. В этом случае имеет
месго гидратация, приводящая к образованию серпентина и талька. За
206
счет Mai незиальных пироксенов формируется тальк, а за счет
диопсида—серпентин и тальк, иногда—тремолит.
При выветривании все породообразующие темноцветные минералы
Mg находятся в самом начале ряда увеличивающейся устойчивости.
Наименее устойчив к химическому выветриванию, по П. Райхе
и Ф. Лфнену, оливин и особенно Mg-член ряда форстерит (первый
в ряду), далее идут волластонит, энстатит, диопсид, тремолит,
авгит и амфиболы, затем тальк, эпидот, биотит. Роговая обманка
и пироксены имеют также низкую гидроаэродинамическую ус-
тойчивость—следуют за кварцем, полевыми шпатами и турмалином
[40]. Тальк, кроме того, обладает самой низкой физико-механической
устойчивостью.
При химическом выветривании магнийсодержащих минералов
возникают новые минералы и совершается вынос Mg. Первым
продуктом выветривания оливина является серпентин, а пироксена —
тальк. При дальнейшем выветривании из силикатных минералов под
воздействием углекислых растворов освобождается ион Mg. При
осаждении его карбонатным ионом образуются магнезиты, а в присут-
ствии кальция—доломиты. Значительные количества оливинсодер-
жащих коренных пород превращаются в магнезиты [115].
Месторождении
В конце 80-х годов мировая добыча магнезита и брусита составила
— 20 мтн т. Основное количество MgCO., (80—90%) используется
в качестве огнеупоров, остальное в цементной, бумажной, керамиче-
ской промышленности и сельском хозяйстве.
Широко используются тальковые породы (6 млн т), имеющие
метасоматическое происхождение. Около 1,7 млн т Mg получено из
морской воды и рассолов. Технофильность Mg низкая—п • 106,
энергоемкость получения металла очень высокая. Чистая каустическая
магнезия и металлический Mg идут в химическую, фармацевтическую,
резиновую и металлургическую промышленность (черных, легких
и редких металлов). В асбоцементной и других отраслях промыш
ленности широко применяются асбесты [256, 659].
Ресурсы Mg неограниченны, особенно в морской воде, из которой
производится — 40% мирового магния (без нашей страны), а в США
-90% MgO и -50% Mg [135].
По генезису месторождения Mg относятся к классам выветривания
(коры на ультрабазитах) и неясного происхождения — магнезиты,
бруситы, а также к осадочным—эвапоритовые (галогенные) и мор-
ским Масштабы месторождений весьма велики (до 500 млн т и более),
содержания MgO достигают 48% (желваковые озерные магнезиты
Квинсленда, Австралия), a MgCl — 30% (рассолы Мертвого моря).
В гипербазитовых месторождениях магнезит и брусит являются
единственными рудными минералами. Соляные магнийсодержащие
руды часто комплексные — K-Mg и др. [256]. Бруситовые руды
207
залегают в мраморах и доломитах и более редки. Среди лимитиру-
емых компонентов отмечен бор. Наиболее крупными являются
осадочные стратиформные магнезитовые и эвапоритовые месторожде-
ния. Последние нередко распространены на огромных площадях—до
w 105 км2 и образовались в условиях некомпенсированных прогибов
и засушливого климата, тогда как магнезитовые — влажного. Главные
месторождения магнезита имеют докембрийский возраст; эвапорито-
вые— фанерозойский (С, Р, Т) и связаны, по Н. М. Страхову [735],
с регрессивными циклами. Магниевые соли выпадают из испаряющей-
ся морской и озерной воды после образования гипс-ангидритовой
и галитовой зон (см. табл. 31). Среди солей Mg, по М. Г. Валяшко [98,
99], вначале осаждаются сульфаты (эпсомит-кизерит-сильвинитовая
ассоциация), затем хлориды (карналлитовая ассоциация) и бишофит.
Крупнейшие ресурсы Mg сосредоточены в доломитовых породах,
которые образуются из морских и лагунных вод повышенной
солености, а также в глинистых и ультрабазит-базитовых породах.
Все они используются в качестве строительно-конструкционных
материалов.
Специфическим минеральным сырьем, применяющимся без химиче-
ского разложения (индустриальное сырье), являются асбесты—тонко-
волокнистые хризотил- и амфибол-асбест. Особенно широко использу-
ется (~4 млн т/год) хризотил-асбест, образующийся в процессе
гидротермального изменения оливинсодержащих пород. Менсе распро-
страненные амфибол-асбесты обладают особенно высокой кислото-
теплотостойкостью. Производительность крупных рудников в нашей
стране достигает 180 млн т горной массы [659].
Среди магнезиальных технических минералов существенное значе-
ние имеет добыча тальковых и пирофиллитовых руд (~ 10 млн т).
В России крупные (> 1 млн т) и наиболее ценные месторождения
(маложелезистые руды) приурочены к Южно-Сибирской (Восточный
Саян, Кемеровская обл. и др.), а также (железистые) — к Уральской
провинции (Миасские, Сыростанское, Сысертское и др.).
Породы
Являясь одним из наиболее распространенных элементов Земли,
Mg составляет основу ультраосновных и основных, а также карбонат-
ных (доломиты, магнезиты) и метаморфических (амфиболиты) пород.
Кларки Mg, по А. А. Беусу [53], в породах земной коры следующие
(%): ультраосновные породы 20.5; основные 4,5; средние 2,2; кислые
0,33; глинистые сланцы 1,5; песчаники 0,73; карбонатные 4,6. Эти
данные получены в результате статистического обобщения материала
по всем изученным регионам мира (их число от 40 до 60) и показали
следующее. Самое высокое содержание Mg установлено в ультрабази-
тах (кларк 27,3% [857]) при обратных соотношениях Fe/Mg и Si/Mg
[53]. В дунитах геосинклинальных областей оно достигает 27,2 + 0,26%
(Fe Mg=0,26, Si/Mg = 0,72), платформенных — 25% (Fe Mg=0,45, Si
208
Mg = O,75); в геосинклинальных и плаiформенных перидотитах—22,7
(0,32 и 0,83) и 18,3% (0,55 и 1,10) соответственно, в океанических
перидотитах 25,3 (хребты) и 23,3% (дно Атлантики). Генеральное
среднее содержание такое (%): дуниты 24,5+1,1 (v = 0,10), перидотиты
20,8+1,4 (0,19), пироксениты 11,5+1,0 (0,28). В кимберлитах среднее
содержание Mg 13,5 + 2,65 (v = 0,30), в пикритах 14,7 + 1,6 (0,19) при
близких соотношениях Fe/Mg (0,56 и 0,65) и Si/Mg (1,6 и 1,3) [53].
Основные породы по сравнению с ультраосновными беднее Mg
более чем в 3 раза. Средние содержания в габбро 4,2%; в платформен-
ных габбро оно выше (4,7 + 0,20%), чем в геосинклинальных (4,2%);
такая зависимость не выявлена для базальтов (3,90 + 0,27%). Самое
высокое для основных пород среднее содержание Mg установлено
в океанических (4,60 + 0,24%), особенно в островных (5,0%) базальтах.
Толеитовые базальты океанов по содержанию Mg (среднее 4,67%) не
отличаются от щелочных (4,61%). В целом океанические базальты
несколько обогащены Mg по сравнению с континентальными—4,57
и 4,08% соответственно [725].
В исгорическом плане содержание Mg в базальтах такое (%): AR|
0,6; AR2-3 4—6; PR, 3,87; PR2-3 4,0; Ph 3,6; сходная картина
установлена для коматиитов: ARr 16,5; AR2-3 12,6; PRr 9,6; Ph 10,2
[663]
В диоритах и андезитах среднее содержание Mg составляет
2,56 + 0,15 и 1,90 + 0,12% при прямой корреляции Fe/Mg и более
высоких концентрациях в платформенных андезитах (2,45%) по
сравнению с океаническими (2,0%) и геосинклинальными (1,7 + 0,13%).
Гранодиориты содержат 1,1+0,07% Mg, а кварцевые диориты и тона-
литы 1,57 + 0,19%.
В гранитах генеральное среднее для Mg составляет 0.33%,
в эффузивах (риолиты, липариты, обсидианы, фельзиты, кварцевые
порфиры) 0,24%, т. е. несколько ниже (кроме дацитов—1,1%).
Закономерное увеличение магнезиальности средних — кислых вулкани-
тов во времени для opoi енных ритмов, вероятно, отражает смену более
дифференцированных пород менее дифференцированными в ходе
подьема базитовых магм к поверхности и в процессе их смешения
с коровыми расплавами. С этим связано более высокое содержание Mg
в контаминированных дацитах (4,5%) и латитах (4,9%) [168].
А. А. Беусом установлено отчетливое снижение концентрации Mg
(%): в редкометальных (0,12 + 0,02), грейзенизированных (0,22 + 0,006)
и пегматигоносных (0,36 + 0,06) гранитах по сравнению с безрудными
для гех же территорий (0,48 + 0,06).
Невысокое содержание Mg характерно и для щелочных пород при
более высоких его концентрациях в интрузивных разностях по
сравнению с эффузивными (%): сиениты 0,84, трахиты 0,55, нефелино-
вые сиениты 0,36 + 0,05, фонолиты 0,28. В гранитоидах содержание
MgO (%) снижается от AR3 (1,28) к PR, 2 (0,87) и Ph (0,62) [663].
Осадочные породы значительно различаются по содержанию Mg
(%): средняя карбонатная порода 4,6+1,2; дэломигы от 7,66 (Канада)
14 2138 209
до 9,0 (о. Мадагаскар); известняки 0,95 + 0,22: пески и песчаники
0,75 + 0,18: глины 1,50 + 0.26; глинистыс сланцы 1,57 [53]. От AR до KZ
наблюдается постепенное снижение содержаний Mg, например, для
сланцев (%): AR, 2,5: AR, 3 1,79; PR1 1,67; PR, 3 1,67: Ph 1,5 [663].
Еще более эта зависимость характерна для карбонатных пород.
Образование доломитов, столь характерное для докембрия и про-
должавшееся в палеозое, в конце палеозоя прекратилось в морских
бассейнах, в мезозое ослабло и в лагунах, а в современную эпоху
сохранилось только в некоторых конiипентальпых озерах [581].
Среднее содержание Mg в современных океанических осадках
составляет 1,8% [53], в Fe-Mg океанических конкрециях—1,6% [341,
а в фосфоритах—от 0,0 до 1,15% (Калифорния).
В метаморфических породах содержания Mg, по А. А. Беусу,
таковы (%): зклотиты 5,70 ±1,15; амфиболиты 4,3 + 0,48; гнейсы
1,25 + 0,18; кристаллические сланцы 1,56 (кристаллические сланцы
и парагнейсы 1,96 [725]). Отмечается сходство эклогитов с ультрабази-
тами, а амфиболитов с базальгоитами.
В глобальном геолого-геохимическом плане максимальные концен-
трации Mg и Са в породах, как правило, наблюдаются в осевых частях
рифтогенных структур и во фронтальных частях магматических
ареалов над зонами субдукцип. Реже они обогащают те участки
магматических ареалов, которые характеризуются наибольшей интен-
сивностью магматических проявлений, что обычно служит прямым
следствием большой полноты плавления субстрата.
Почвы, растения, животные
Магний является одним из главных компонентов почв; содержание
его зависит в основном от состава исходного породного субстрата: по
Т. Вест, почвы на основных породах содержат в среднем 1,4% Mg, а на
кислых—только 0,14% [13]. По А. П Виноградову [104], кларк Mg
в почвах равен 0,63%. Имея одно иг самых высоких значений pH
осаждения гидроксидов (10.5). Mg должен обладать наибольшей
подвижностью в почвах, близкой к таковой Са [312], Среди разных
типов почв нашей страны наиболее высокие содержания Mg по
отрывочным данным характерны для черноземов (1,5, до 2.2% MgO),
а также каштановых почв (1,1, до 2,5%), красноземов (до 2,27%)
и сероземов пустынь (0,8. до 2,2%); более низкие сто содержания,
нередко дефицитные для растений, установлены в легких под золистых
(0,23 —1,74%) и тундровых (0,38—1,61% MgO) почвах [104].
Для почв европейской части страны, по более полным данным
С. А. Кудрина |726], содержания следующие (%), для тундровой
и лесной зон—перегнойная 1,83. серая лесная 1,02, тундровая 0.9,
глинистая 0,70, торфяная 0,30, песчанистая 0,09—0,7; для южных
районов—серозем 1,44, каштановая 1,09, бурая лесная 1,08, чернозем
0,95, коричневая 0,8, бурая пустынно-степная 0.18; черноземы в целом
± = 0,9 + 0,1 (южный 1,19, выщелоченный 0,82); подзолистые v = 0,7+ 0.1.
210
Распределение Mg по разрезу почв распинается: в сероземах, каш-
тановых почвах и черноземах его больше в горизонтах В и С,
а в тундровых почвах и красноземах — в горизонте .4.
Годовые по।ери Mg из почв при их эрозии, по П. С. Трегубову
(19X0i.). составляю! (кг,та): под зерновыми культурами 85, на
парующих землях 230. Избыточным для растений счигается содержа-
ние Mg >2,5% [128].
Роль Mg в жизнедеятельности растений определяется его вхождени-
ем в состав хлорофилла и других сред.
В среднем показатель биогенностн Mg имеет среднюю величину (0,28)
по сравнению с остальными главными з-ме галлами. По природным
зонам этот показатель меняется гак: 1ундровая 0,18, лесная 0,35 (лес 0,29,
травяная растительность 0,41); степная 0,32; пустынная 0,21 [198].
Биохимическая активность Mg может подавляться Ве2 + , коюрый
способен замещать его в некоторых растениях. Особенно 1ипично
взаимодейщвие Mg—Zn; пи элементы, по-видимому, выполняют
близкие функции, однако их конкурирующее значение в почвах не
изучено' [312]. В растениях Mg взаимодействует со многими элемен-
тами—синергегически с А1 и Zn, антагонистически с А1, Вс, Ва, Сг,
Мп. Г. Ni. Со, Cu, Fe [312].
В растениях кларк Mg составляет 4200 мг/кг (с.) и довольно близок
для морской (~5000 мг кг) и континентальной (3200 мг/кг) флоры
[860]. В океаническом планктоне содержание Mg следующее (мг/кг с.):
среднее 8000, тотальный 11000, фито-8000, зоо-бООО [677] В беспозво-
ночных организмах моря А. П Виноградов впервые отметил снижение
концентрации Mg в крови особей классов, стоящих па более высоких
уровнях систематики, что впоследствии установлено и для неживой
материи. В животных кларк Mg — 3000 Mi / кг (с.) и в морских среднее
значительно выше (5000 мт /кг), чем в наземных (1000 мг/кг). В процес-
се биохимической эволюции содержание Mg во времени, так же как
и для пород, снижалось (°о): оакгерии 0,7, покрыюсемянные растения
0,3, млекопитающие 0,1 [860]
Средние содержания Mg в сельскохозяйственных культурах таковы
(%): картофель 0,095 + 0,002, зерно пшеницы 0,14 + 0.01, злаковая смесь
0,03 ±0,01 [797].
Для нашей страны приводятся следующие оценки содержаний
в пищевых продуктах (мг'кг ж.): пшеница 1110, гречиха 2600, хлеб
140— 620, сухое молоко 1200. молочные продукты 140—250, мясные
150—200, рыбные 350—600 [797].
Для животных Mg является одним из важнейших активаторов
различных ферментативных процессов. Он входит в состав пукле-
иновых кислот, АТФ. щелочной фосфот азы и г. д Дефицит Mg2 * резко
тормозит процессы фосфорилирования в метахопдриях клеток, об-
разование оксидазы, фосфотазы и активность РНК, ингибирует
миозитг, АТ фазу и действует на состояние нервной и костной
мышечной систем. Этот элемент — незаменимый компонент костей,
мягких тканей и биологических жидкостей.
14
211
С недостатком Mg связывается высокий уровень заболеваемости
злокачественными опухолями, а его избыток уменьшает риск подобных
заболеваний [484].
Суточое потребление Mg с пищей в разных странах, по Е. Хамильтон
(1981 г.) следующее (ммоль): США II —14. Англия 10.3 + 0,8, Индия 30,4.
Наиболее высокое значение всасывания Mg характерно для
молодых телят (до 0,9 — глюконат, лактат и др.), тогда как у коров —
0,2.
Для человека величина всасывания из желудочно-кишечного тракта
составляет 0,3. Всасывание усиливается (до 0.4) под воздействием
белков, алкоголя и антибиотиков. В организме взрослого человека
содержится 21—28 г Mg (или около 430 mi кг) при ежедневном
поступлении 0,31—0,34 г (мужчины) и 0,272 г (женщины): 1 2 всего
количества Mg находится в костях. 1/3 — в мышцах, остальное — в
биологических жидкостях, в основном в плазме крови. Наибольшая
концентрация Mg характерна для внутриклеточных сред—в 3—15 раз
выше, чем во внеклеточной (например, для плазмы крови — инграцел-
люлярная жидкость 13 ммоль/л, экстрацеллюлярная 1 ммоль л).
Содержание Mg в плазме крови человека в норме строго постоянно
и у взрослых составляет 17—28 мг/л, в среднем 21,2 + 1,0 мг л [931]:
в эритроцитах его в 2,5 раза больше—х = 57,2+ 0,2, в сыворотке крови
21,7 + 0,5 мг/л. Самые высокие концентрации Mg в человеческих
органах установлены (и10~6) в зубах (6180—8700) и костях (980—
9370), повышенные—в волосах (19—163) и ногтях (16—125). В осталь-
ных opiaHax содержания Mg следующие (л-10~6): моз! 0.18—0,7 (ж ),
9—И (з.); сердце 0,15—0,28 (ж.). 16 (з.): почка 0,17—0,22 (ж ), 0,6—1,4
(с.), 13 (з.); печень 0,1—-0,2 (ж.), 0,5 (с.), 13 (з.); легкие 0.06—0,18 (ж ),
9,8 (з.); мускулы 0,19—0,27 (ж), 1,16 (с.). 16 (з ); кожа 0.87 (з),
в молоке — 35 мг/л. Mg выводится с калом (~2 3) и мочой (~1 3).
а также с потом и волосами (—1/20). Т6 выведения для организма
в целом 120 сут. из костей 180 сут.. кратность накопления в организме
~56, с учетом доли всасывания—186 [512].
Воздух, вода, техногеиез
Воздух над Южным полюсом содержит 0.7 нг 'м3 Mg, над
океанами в среднем 0,48 мкг/л (аэрозоль—0.31%) над городами
зарубежных стран и Сибири ~400 нг/м3 [626]. В атмосферных осадках
содержание Mg изменяется от 0,14 до 0,50 мг'л [52].
В атмосферном воздухе различных хозяйственных терри торий фон
Mg, по А. А. Волох (1991 г.), таков (нг/м3): Восточная Сибирь 400,
Московская обл. 490. Крым (зал. Голубой) 700.
Магний является одним из самых гидротоксифильных металлов
Воды характеризуются следующим его распределением [52]: кларк
океанических вод—0,12% (г/л), речных 4,1 • 10 4% (мг/л).
Концентрация Mg (г/кг) в морской воде коррелируется с ее
соленостью (%0): 0,37 г/кг—10%о, 0,55—15, 0,74—20, 0,92—25, 1,11 —
212
30, 1,29—35, 1,48—40. Соошошение катионов в океанической (I)
и пресной материковой (II) водах различно: INa>Mg>Ca,
II Mg < NacCa.
Птдрокарбонатные воды рек нашей страны имеют ферсм Mg
8,4+1,5 мг/л. В районах соленосных отложений (р. Кама, пермь) его
содержание значительно увеличивается (37 мг/л). Для сульфатных
и гидрокарбонатно-сульфатных вод рек земного шара содержание Mg
колеблется в более широких пределах—от 0,5 до 101 мг/л
(л = 22+10 мг/л). В озерных водах содержание Mg связано со степенью
их солености (мг/л): пресные озера от 6—16 (США, Европа) до 473
(СССР, Африка), среднее 192 + 217; соляные озера—от следов до 34200
(США, СССР), среднее для соляных озер карбонатного типа (содовые)
0,17 + 0,13. сульфатного 5,5+ 2,4 мг/л.
В грунтовых водах концентрации Mg колеблются в широких
пределах (мг/л): сульфатные и хлоридные соленые 1612, пресные 24;
гидрокарбонатно-кальциевые 8, гидрокарбонатно-крсмнеземные 3,3.
Установлено, что воды гумидных областей богаче Mg (18 мг/л
в районах развития гранитов, 51 мг/л — серпентинитов) по сравнению
с аридными (1,0—1,6—граниты).
В общем поведение Mg в воде прямо зависит от концентрации СО2
и для вод, равновесных с СО2 атмосферы, составляет 1—40 мг/л; при
контакте с магнийсодержащими породами его концентрации знчитель-
но увеличиваются. Большая растворимость в воде MgSO4
и Mg(HCO3)2 по сравнению с кальциевыми аналогами приводит
к относительному накоплению Mg в океанической воде. Преобладает
Mg над Са также в водах с повышенной минерализацией.
Средний модуль поступления Mg с атмосферными осадками для
нашей страны 0,29 т; км2-год; гидрохимический ионный сток следую-
щий (и 106 т/год): средний 19, для отдельных морей и районов —
северо-западные ~2, северо-восточные 9,2, восточные 1,7, южные ~4,4,
Арал и смежные бессточные территории ~1,6 [198]. Баланс превыше-
ния выноса над поступлением 12,87 • 106 т/год, коэффициент водной
мобилизации Км 3,1 (см. Na).
В техногенезе Mg так же широко распространен, как и в природе
[128, 198, 231], хотя показатели его техногенности (Тх=106) и модуль
техногенною давления (Тд = л- п- 10) очень низкие [198]. Избыточные
экологические нагрузки Mg характерны для всех горных добывающих
предприятий, а также перерабатывающей магниевой промышленности.
Это же относится к асбесту. Особенно концентрированным источником
поступления техногенного Mg являются выбросы магнезитовых заво-
дов и доломитовых производств, около которых ею концентрация
в воде вдвое превышает фоновую, например, 78 и 36 мг/л соответст-
венно при пороге ощущения привкуса в воде 195 мг/л и ЛД50 для
мышей при внутрибрюшинном введении 1040 mi /л (хлорид Mg)
и 150 мг/л (сульфат). Влияние высоких концентраций Mg за счет
техногенного подкисления пресных вод на гидробионты не изучено,
хотя может оказаться весьма существенным.
213
Для животных пороговые концентрации таковы (мг'м3): пыль
металлического Mg ~7, оксид—1000 магнезит ~500. У человека
магнезит вызывает побочные явления в результате длительного
вдыхания пыли при ее концентрации 5—796 мг м3, а металлический
магний и его сплавы с А1 (электрон), Hg, Li, TI, F особенно токсичны
[128]. При опрыскивании хлопчатника хлоридом Mg (0,03—0,04 мг л)
наблюдались болезненные явления у рабочих. Хлорат и сульфат Mg
вызывает у рабочих основных цехов титано-маг ниевого производства
кожные ожоги и другие заболевания Высокие концентрации Mg
отмечались [231 ] в выбросах при производстве цементных, металлур-
гических, пиротехнических, взрывчатых, кожевенных, от нестойких,
керамических и текстильных изделий, удобрений, дефолиантов, пес-
тицидов, консервантов древесины и др.
Выводы Магний—главный породообразующий общетоксичный
металл (Тл= 1) с многообразными геохимическими свойствами и слож-
ной эволюцией в природе. ГЭЛ магнезита 1 • К)3, магнезитовых
месторождений (1—3) • 103. Главное значение Mg имеет в процессах лито-
и гидросферы, гораздо меньшую роль играет в биосфере, где он иногда
дефицитен. В магматическом цикле он проявляет литофилыю-сидеро-
фильные тенденции, концентрируясь в ультрабазитах и их производных,
в осадочном—связан с морским аридным карбонатным осадконакопле-
нием, рассоло- и солеобразованием (В до 21). В глобальном
геохимическом цикле Mg характеризуется снижением концентраций
в более молодых породах, геологических формациях и биологических
видах. В техногенезе является одним из наиболее гидроэкофильньгх
металлов (ГЭФ,=0,08), не менее токсичны и его пылевые выбросы;
показатели гехнофильност и, техногенност и и модуль техногенною
воздействия оценены как низкие, что требует уточнения. Экологическое
значение изучено очень слабо, но может оказаться весьма существенным.
КАЛЬЦИЙ —20
Главный (кларк 3.81%) породообразующий, биологически необ-
ходимый, обще токсичный металл. ПДК для его соединений следующие
(мг/м3). CaF2, СаО, СаВ4О7 ПДКМГ 0,2; ПДКеи 0,02—0,03; Ca3(AsO4),
и Са3(РО4)2 ПДКрз 0,04 (I класс опасности), ПДКМГ 0.009. ПДКСС 0,004;
СаСО3 ПДКрз 6 [128, 231 ].
Атом
Атом состоит из нескольких стабильных изотопов: 4,,Са (96, 97).
42Са, 43Са, 40Са, 48Са и радионуклида 45Са (7'1,2= 164 сут.). Кальций
(3</°4л-2) находится во II группе (j" -подгруппе) в 3-м периоде системы
элементов Менделеева в окружении Mg, К, Rb, Sr, Na (s-металлы). Cu,
Zn, Sc, Y (тАметаллы) и Al (д-мсталл). Он является наиболее типичным
щелочноземельным металлом (см. табл. 51. 52). Валентность II; имеет
214
низкие и средние термические, энсрге гические, плотностные свойства, но
более высокие, чем у Na. К. Rb, Cs, и более высокие, чем у этих
элементов, энергию гидратации и повышенную склонность к 1идролизу
(см. табл. 17), однако близок к ним по окислительному потенциалу,
ионизации, нетипичное™ комплексных и преобладанию ионных соедине-
ний. Все соединения Са (как и Mg, Sr, Ва) с О2, S, Se имеют структуру
NaCl; характерно высокое значение (11) pH осаждения Са(ОН)2.
Многие соединения Са при низких температурах слабо растворяют-
ся в воде—СаСО3 (1,5-10’2 г/л, Пр 4,8 10 9), Ca(SO4)2 (1 10 4 г/л,
Пр 6,1 10 5), СаО, СаВ4О7 и другие, некоторые хорошо — Ca(NO3)2
(1146 i,л), Са3Р2, Ca(ClOj)2 (630 т/л—см. табл. 58) и относятся
к токсичным [231 ].
Минералого-геохимическая сущность Са выражена формулами
Л,)9.2х 0,8 для мантии и литосферы и ОЧ96с04 для верхней земной
коры. Обладает высокой биофильност ью (В живого вещества до >3)
[574].
Оценки кларков Са таковы (%): общая континентальная кора 5,29.
верхняя 3,00, нижняя 6,07, архейская кора 4,43, примитивная мантия
2,07 [749]; континентальная нротокора содержит 5,1% СаО [372],
осадочный слой 13,2%, кристаллический фундамент 3,5% СаО. По
типам коры он распределен, по данным А. Б. Ронова и А. А. Ярошев-
ского, следующим образом (СаО, %): общая корая в среднем 8,12,
континентальная 6,98, субконтинентальная 7,14, океаническая 12,19.
Наибольшее количество СаО (%) характерно для осадочной (22,50)
и базальтовой (11,69) оболочек океанической коры, континентальной
коры (9,94), а также гранул и i-базитовой оболочки земной коры (8,74)
по сравнению с гранитной (3,79) [857]. Имея высокую степень
подвижности, Са является главным элементом ионного стока (для
материковых вод Ca>Na>Mg), третьим среди основных катионов
океанической воды и первым среди них по времени полного никла
смены в океане (~8 млн лет) [726]. Общая масса его в Мировом
океане 6 102ог
Средние содержания Са (%) близки в хондритах (1,47 + 0,5)
и железо-каменных мег соритах (1.29); низкие значения (0,02) в желез-
ных метеоритах. Распределение его в отдельных типах следующее (%):
хондриты углистые CI 1,06, СП 1,34, CI11 1,70, обыкновенные Н 1,19,
L 1,28, LL 1,25, лгетагиговые Е4 0,84, Е5-6 0,90; ахондриты-эвкриты
7,65, наклиты-ангри г ы 10,8—17,3, говардиты 4.47, уреилиты 0,62,
обриты 0,94, шассиньиты 0,08 [668].
В лунных породах содержания таковы (СаО, %); реголиг 12,53,
базальт 10,8, анортозит 17,3 («Луна 16—20» и «Аполлон 11 —17») [107].
Минералы
Для Са известно большое число минеральных видов—643 минера-
ла всех классов и типов, кроме самородных и им подобных
соединений, а также оксихлоридов, йодидов и бромидов. Больше всею
215
силикатов—279, фосфатов и гидрофосфагов 83, арсенатов и гидроар-
сенатов 45, карбонатов 9, гидрокарбонатов 42, боратов и гидроборатов
45, оксидов 24, гидроксидов 25, сульфатов и гидросульфатов 25,
ванадатов 20, фторидов и гидрофторидов 15, хлоридов и 1идро-
хлоридов 9, молибдатов и органических соединений по 4, йодатов,
теллуратов, вольфраматов по 3, сульфидов, хроматов и нитратов по 1.
В силикатах Са наиболее часто сочетается е Na, Mg, Fe, Ti, Al,
иногда с К, в фосфатах и гидрофосфатах—с Al, Na, Fe, Mn, Mg,
в карбонатах и гидрокарбонатах—с U, TR, Na, Ва, Mg, в гидро-
ксидах—с U, Мп, в гидросульфатах—с Си [776].
Характер связи между главными минералообразующими компонен-
тами— от стехиометрического до изоморфного—зависит от условий
образования и химического типа минерала. Наиболее изучен изомор-
физм Са — Na и Са—TR в гипогенных минералах (полевые шпаты,
пироксены, амфиболы), а также Са—Sr, Са — Мп в различных
минералах; изоморфизм Са—Mg, Са—Cd считается маловероятным
из-за более выгодного образования стехиометрических соединений.
Наиболее широким распространением среди кальциевых и сущест-
венно кальциевых минералов пользуются полевые шпаты (табл. 69)—
анортит Ап — Ca[Al2Si2Os] (20,1% СаО), битовнит (70—90% Ап),
лабрадор (70—50% Ап), андезин (50—30% Ап—см. Na). Известны
редкие бариевые разновидности плагиоклазов — целыиан Ba[Al2Si2OgJ
и гиалофан. Обогащенные Са минералы известны среди клинопирок-
сенов (диопсид, авгит и др.—см. Mg) и клиноамфиболов (тремолит,
актинолит, роговые обманки и др.) [832]. Изучение Р. Хови с со-
авторами (1978 г.) Са щелочных пироксенов показало, что содержание
Mg + Fe2 + + Мп изменяется прямо пропорционально содержанию Са,
a Na + K обратно пропорционально его количешву. Для Са авгигов
и субкальциевых пироксенов Ф. О. Силаевым и другими исследователя-
ми (1986 г.) установлено, что с уменьшением количества Са понижается
содержание А12О3, МпО и повышашея TiO2 и FeO, а концентрация
MgO практически не изменяется.
Среди карбонатов главными по распространенности являются
кальцит СаСО3 и доломит CaMg(CO3)2. Для кальцита наиболее
характерны Ва, Sr (до 4% Sr), Zn (до 4% ZnO), Мп и Со раз-
новидности, для доломита — Pb, Zn, Mn, Ва, Fe (анкерит Ca(Mg, Fe)x
х [СО3]2).
Кальциты и доломиты осадочных формаций слабо изучены
в отношении элементов-примесей; кроме Zn, Pb. Sr, Ва установлено
наличие метана. Последний был обнаружен в кальците из черных
сланцев iриаса Сицилии в количестве 200 mi/кг [557]; возможна
примесь РЬ. Несколько более полно изучены эндогенные кальциты
[752]. Показано, что содержание в них Fe и Mn(Mg) зависит от
содержания их в растворах (уменьшается с понижением температуры),
а также от кислотности-щелочности (повышается с ее увеличением).
В результате изучения большого числа типов месторождений Н. А. Ве-
лиховой выделено пять групп эндогенных кальцитов: 1) содержащие
216
Класс Сульфаты » Фосфаты Карбонаты » » Силикаты » » - & a a St a Л S- * » Вольфраматы Оксиды Фтопиды
Химический состав удержание элемента, % СаО 41,2; SO3 58,8 СаО 32,5; SO3 46,6; Н2О 20,9 СаО 55,5; Р2О5 42,3 СаО 56,0; СО2 44 СаО 30,4; MgO 21.7; СО2 47,9 СаО 56; СО, 44 Непостоянный Na2O, СаО, А12О3, SiO2 Непостоянный MgO 18,5; SiO2 55,6 , FeO 29,4; SiO2 48,4 ; A12O3 24,1; Fe2O3 12,6; ; H,O 1,9 ; TiO2 40,8; SiO, 30,6 ; MgO 24.6; SiO2 58.8; 48; СаО 3—8; А12О3 22—24; 11; Н2О 15—17 А12О3 16,8; FeO2 59.2 яный ; А12О3 33,9; SiO2 39,5; Непостоянный СаО 19,4; WO, 80,6 Непостоянный Са 51,2; F 48,8
а JS - ox c4 vS ox (NCNCiri СООЛ КС oo II- OO<-7°° I 1 «W СЧ — еч J "* O' ~~ OOO^OCQ Непостоя! СаО 24,6 Н,0 2.0
Химическая формула Caso4 CaSO4 2НгО CaJPO4]3tF. Cl] СаСОз CaMg(CO3)2 СаСО3 (Са, С1)г(А1, Fe)3Si3O12[O, ОН] nNa[AiSi3Os] +»Са[А1Д>12О8] Ca,Na(Mg, Fe2+L(A1, Fe3 + )x xf(Si. AlLOnHOH, F] Л51 Si2O6J. где A — Ca. Mg, Na, Li..., 5—Fe. Al... CaMgrSi,OJ CaFeTsi2O6] Fe,Ca2Al3Si3O12[OH] CaTifSiOjO Са2^е5[514Ои]3[ОН] С К гм О С4 < и ГМ ч о к ГМ со О й < ""с? Z СО О СазРе2(51О4)3 — CasAlfSiO^)^ Ca2Al3Si3O12[OH] (Са, Na)rAlSi2O6] -6H2O CaW04 (Се, Са. Th...)(Ti. Nb)2O6 CaF,
s co X s KO f— Главнейшие минералы Са Минерал X X и «J 31 О X X S x t Woo CL ь Й 2 x , 0 310 X, b L. 0 Д5 S u. 044 u л 03 e; h я ° x £ c cl 0 cs cl 55 0 > < 1® < < ti « 0 E <£ S Пироксены Диопсид Геденбергит Эпидот Сфен Тремолит Филлипсит Гейландит Андрадит-гроссуляр Цоизит Шабазит Шеелит Эшинит Флюорит
217
0,2—0.3% FeO + MnO—наиболее высокотемпературные (600—450 С),
кальциты карбонатитов I — (I стадий, скарнов и диопсидовых жил;
2) 3,2% Е’сО фМпО—ранние тидротерма тьпые кальциты (400—250 С),
кальциты карбонатитов III—IV стадий. миаскитов; 3) 1,6%
FeO + MnO—кальциты сульфидных стадий (250—150 С); 4)0,5%
FeO + MnO—поздние кальциты (150—50 С), иногда с флюоритом
и цеолитами; 5) до 3,5% FeO + MnO—самые поздние (50 С), частично
гипергенные кальциты. Имеются также данные [364] по распределению
элемеигов-примесей в кальците из карбонатитов Якутии (т т): La 23.
Се 42, Sm 2, Ей 0,8, ТЬ 0,4, Yb 1,0, Lu 0,26, Th 0,6, Sr 4600, Sc 11, Co 1,
Tall, Hf 26. E. M. Еськовой обобщены материалы по содержанию
Sr, Mn, La+Ce (табл. 70). Л. С. Бородин с соавторами [74] привели
состав редких земель в кальцитах из камафоригов (% от XTR):
La 18—24,6; Се 40— 50; Рг 3,3—7,4; Nd 17—24.6; Sm 1,4—4,8;
Eu 0.2—1,5; Gd 1—3,6; Tb 0,3; Dy 0,1 —1; Ho 0,1; Er 0.1—0.6;
Yb 0,1—0,2 (ETR = 0,02 —0,2%).
Для лкзотенных катагснетических кальцитов из осадочных пород
Белоруссии А. А. Махнач (1986 г.) установил, что талассогенные
условия приводят к значительному увеличению содержаний Sr (140 г т)
и Мп (980 г/т), по сравнению с ат мот енными (Sr 18 г ,'т. Мп 270 г ,'т).
Ангидрит, по Л. С. Бершову. А. С. Марфунину, несет большое
число изоморфных примесей —Cu2+ , Y2 ‘ Y3h. Gd3 + , Sm21. Sm3',
Mnz + ,B3l,Na + и др. Фосфат-апатит из примесей содержит по-
вышенные количества Y, сульфаты — гипс и ангидрит—обогащены Sr
(1835 + 490 и 1600 г'т соответственно), а также В (1—26 и 1 —120 г г).
Из обобщенных данных, полученных ИМГРЭ по злементам-
примесям в апатитах (табл. 71), видно, что более высокие содержания
Na, Sr, Ва, Nb, Та, TR и F характерны для нефслин-сиенитовых
пород. Для апатитов Алдана из метаморфигов (I) и апатитового
оруденения селигдарского и ханинского типов (II) В Н. 1улий
с соавторами (1986 г.) установили наличие (%): Cl 1 0,17 и 11 0.34, Sr
0,11 и 0,38, F 2,67 и 2,36, S 0,91 и 0,28, Се2О 0,75 и 0,27, La2O3 0,33
и 0,11.
3,1 2.3 11.43 3.3
J 0.008 0.003 0,1
Yb 0,5 0,2 0.003 0,2 8,0 0,1
0,3 0.04 0,3 0,8 0,1
Ho 0.24 0,2 0,1 0,6 0,15
Dy 0.9 0,4 1,2 1,0 1,2 1.4
Gd 2.3 2.1 2.7 1,5 2,8 3,2
2 0,3 0.5 0.5 0.5 0,5 0,9
Sm 1.9 1.6 2.6 2.1 3.1 4.1
Nd 12.4 13.7 17.8 15,0 15.8 22.6
£ 3.6 3,5 3.8 4.0 3.7 5.7
Формация Нефелин-сиенитовая Ультраосновная-щелочная Щелочно-га бброидная Калиевая щелочная базальтоидная Щелочно-гранитная Камафориты (Ковдор)
Примечание. Апатит из нефелиновых сиенитов также содержит 0,046% Nb,Os и 0.001
Таблица 70
Среднее спдержание элементов в карбона!ах, /т
Минерал Л Mg Fe Sr Mn (La. Ce),O2
Кальцит из карбонатитов щелочного комплекса 57 2337 4795 12718 7632 2502
Кальцит из карбона1итов в пла1 йог нейсах и сер* пентинитах 36 15028 9042 11497 14626 2579
Доломит там же 11 144682 20200 5982 10 745 1570
Кальцит из метаморфи- зованных известняков 4 14 575 1050 375 400 50
Доломит гам же 2 118950 5100 500 800 200
218
219
Данные о составе флюорита из различных месторождений нашей
страны имеются для наиболее типичных элементов-примесей этого
минерала — Sr, U, Th, К, Pb, Rb (работы А. Р. Файзиева с соавторами,
1986 I.). Для других распространенных минералов Са надежные данные
по составу элементов-примесей отсутствуют, только гранаты, благода-
ря работам В. И. Кузьмина (1975 г.), В В. Ляховича (1987 г),
М. Д. Крыловой и др. (1991 г.) изучены довольно полно.
Кальций относительно легко выщелачивается природными водами
из породообразующих минералов: плагиоклаз < кальциевый авги г < ка-
льциевый амфибол. В ряду плагиоклазов кальциевые разности вывет-
риваются скорее, чем натриевые.
По увеличению физико-механической устойчивости минералы Са
образуют следующий ряд; гипс > кальцит > флюорит > шеелит >апа-
тит > плагиоклазы > гранаты; по гидромеханической устойчивости: кар-
бонаты > полевые шпаты > апатиты >амфиболы > пироксены. Ряд увели-
чения растворимости минералов Са такой; кальцит >доломит >ангид-
рит> гипс> амфиболы % пироксены (40]. Кроме того, полевые шпаты
обладают наименьшей гидроаэродинамической уст ойчивост ью.
Растворимость соединений Са снижается в ряду: Ca(NO3)2>
>Са(С1О4)2>Са (OH)2>CaSO4>CaCO3 (см. табл 58). Абсолютная
растворимость гипса, кальцита и флюорита (Г=20" С) составляет 2,4;
1,5 -10 —2 и 0,016 г/л соответственно.
Некоторые минералы Са встречаются в живых организмах. Среди
них наиболее часто отмечаются [726] кальцит, арагонит (жгутиковые
водоросли, фораминиферы, черви, мшанки) и их гидроразновидности
(синофеи, мохообразные сосудистые растения, мшанки, членистонот ие,
иглокожие, моллюски, хордовые), различные Са-фосфаты—франколит,
даллит, брушит, а также флюорит, уэделлит и гипс.
Месторождения
Единой кальциевой отрасли горной промышленности не существу-
ет. Предприятия разрабатывают карбонатные породы отдельно как
кальци т-доломитовое сырье (производство цемента, извести, в качестве
строительных и облицовочных материалов, флюс в металлургии) и как
гипс-ангидритовое сырье (цемент, вяжущие вещества, удобрения и др.);
эксплуатируются также месторождения поделочных камней (оникс),
оптического сырья (исландский шпат), фосфатных удобрений (апатит,
фосфориты), индустриального сырья (флюорит). Общая ежеюдная
добыча кальцийсодержашего минерального сырья не учитывается, но,
вероятно, измеряется миллиардами юнн. Так мировая годовая добыча
гипса и ангидрита в 80-х годах составляла ~ 100 млн т, фосфатного
сырья—более 120 млн т и т. д.
Типы месторождений минералов Са, относящихся к неметатличе-
ским полезным ископаемым, весьма разнообразны: от типично
осадочных кальпит-доломи 1 овых и фосфоритовых пород, эвапорито-
вых гипсов и ангидритов до гидротермальных ангидритов, карбонатов
220
и магматических апатитов из карбонатитов и г. д. Химический состав
руд определяется их минеральным составом. Ресурсы большинства
минералов Са либо пеограничены. зибо очень велики, за исключением
месторождений оникса и исландскою шпата [256, 659].
Породы
Генеральные средние содержания Са в породах подсчитаны
А. А. Беусом [53] в результате ста тистической обработки аналитического
материала по всем изученным регионам темного шара (%): ультрабазиты
3,4, базиты 7,3, средние породы 4,6, гранодиориты 2,4, граниты 1,12.
Ультрабазиты (кларк 0,57% [857] или 2,28% [546]) обеднены Са по
сравнению с основными и средними породами; кларк для дунитов
0,6 + 0,16% (v = 0,7); больше его в перидотитах (кларк 2,85 + 0,12%,
v=0.6), особенно в платформенных (ферсм для Европы 4,67 + 0,21%,
v = 0,4), но в океанических содержание низкое (Срединный океанический
хребет Атлантики 0,78 + 0,15%), то же в лерцолитах (1,85 + 0,49%);
самое высокое содержание для ультрабазитов в пироксенитах (кларк
9,70 + 0,99%), кимберлитах (7,10+1,0%) и пикритах (5,22+1,0%).
Базиты наиболее o6oi ащены кальцием (кларки, %): габбро
7,60 + 0,27, базальты 7,1 + 0,04. Габбро особенно обогащены в зонах
глубинных разломов (Урал — 9,30 + 0,39%) и океанических островов
(9,80 + 0,89% — Тихий, Индийский, Атлантический океаны).
Базальты различаются в отношении Са как по геологическим
(кларки—океанические 8,44%, континентальные 7,10% [857]), так и по
тектоническим петрографическим типам (кларки, %): платформенные
7,10 + 0,33, геосинклинальные 7,00 + 0,24, океанические 7,60 + 0,03; оке-
анические толеитовые 7,56+0,09, щелочные 7,14+1,9. По другим
данным [441], кларки таковы (%); толеитовые 7,3 ±0,5, известково-
щелочные 5.37 + 0,35, K-Na субщелочные 5,25 + 0,3, щелочные 4,15 + 0,2.
Глобальное распределение Са в базальтах (I) в историческом плане
противоположно коматиитам (II), что не характерно ни для одного
металла (СаО, %): AR, 10,7 (I) и 5,71 (ГГ), AR2 3 9,86 и 7,74, PRi 9,15
и 9,18, PR2.j 8,76 (1), Ph 8,92 и 10,11 [664].
Диориты имеют кларк Са 5,0 + 0,15%, близкий к базальтам
повышенной щелочности; то же можно сказать про андезиты, кларк
которых 4,35 + 0,19%, а ферсмы следующие (%): Европа 4,3+0,7,
Африка 5,5+ 0,3, Северная Америка 3,9+ 0,2, Цен1ральная 4,3+0,3,
Новая Зеландия 5.0+ 0.4.
Гранодиориты (2,40+0,15% Са) и кварцевые диориты (3,90 + 0,23%)
близки по содержанию Са к средним породам, гот да как граниты
относительно обеднены им (1,12 + 0,06%) и еще более низкие содержа-
ния фиксируются в их эффузивных аналогах (0,70 + 0.1%); относитель-
но повышенные содержания в дацитах $,56+0,19%) при незначитель-
ных колебаниях для разных регионов (т<1) [53]. Для гранитов
отмечается снижение содержания Са по мере повышения кислотности
пород [53]; особенно >то характерно для лейкократовых гранитов
221
с широким развитием послемагматического метасоматоза. Л. С. Боро-
дин (1992 I.) по величинам отношения (Na + K)/Ca подразделяет
«нормальные» граниты на субизвестковые (3,5—9), известково-щелоч-
ные (7—20) и субизвестково-щелочные (10—25).
Более высокое содержание Са характерно для древних платформен-
ных гранитоидов; статистически оно различается с более низким для
молодых геосинклинальных для уровня значимости 10% [53]. По
А. Б. Ронову [663], оценки для различных возрастов следующие (СаО
%): ARi 3,51, AR2 3 2,36, PR, 1,93, PR, 3 1,68, Ph 1,50.
Щелочные породы имеют другой тренд Ca:Si по сравнению
с обычными дифференциа гами и обеднены Са для пород большинства
типов кислотности — как континентальных, так и океанических. Осо-
бенно низки содержания в среднем (СаО, %), для тгирин-арфвед-
соиитовых редкометальных 1ранигов (0,57), миаскитовых нефелиновых
сиенитов и сиенитов (0,70), гораздо выше они для щелочных
ульт раосновных пород с карбонатитами (12,39), миаскитовых нефели-
новых сиенитов и ia66po (10,0), псевдолейцитовых сиенитов—шон-
кинитов (10,20) и промежуточные для остальных щелочных фор-
маций— нефелиновых сиенитов миаскитовых (2,56), атпаитовых (1,62)
и г. д. [394]. В эффузивных щелочных породах средние содержания Са
следующие (%): трахиты 1,70 + 0,3, фонолиты 1,30 [53].
Поведение Са в процессах магматизма имеет отчетливые закономер-
ности [589]. Содержание его в эволюционирующих расплавах мафит-
ульграмафитовых интрузий последовательно возрастает, достигая
максимума в мафических выплавках, и убывает в мафическо-салических
и салических. В первых он ведет себя как легкоплавкий элемент, во
вторых как тугоплавкий, входя в ранние минеральные фазы. Максималь-
ная концентрация Са свойственна щелочным ультраосновным расплавам
и их производным по сравнению с разностями нормальной щелочности.
В осадочных породах распределение Са специфично (Са, %): самые
богатые им породы—известняки (кларк 32,5+1,66) и доломиты
(Польша, Канада—21,1), известковые глубоководные осадки (25,5;
среднее для пелагических глин 0,93, карбонатов 40%) [749]; в мергелях
содержится 30—90% кальцита, реже доломита. По Ф. Петтиджон
[591], среднее содержание СаО (%) в известняках зарубежных стран
колеблется от 42,6 до 53,8, в писчем меле (Канзас, США) 52,5,
травертине (Вайоминг) 55,37, доломитовом известняке 46,65, глинис-
том известняке (мертель—натуральный цемент, Огайо) 38,35. Между
известняками и доломитами имеются промежуточные разности пород,
которые, по С. Г. Вишнякову, делятся следующим образом:
И звестттяк
Доломитовый известняк
1Ь же
ИзВССТКОВЫЙ доломит
Го же
Доломит
222
СтСО?. %
95- 100
75-95
50 — 75
25-50
5 -25
0-5
CaMg(CO,)2, %
5-0
25-5
50-25
75- 50
95 -75
100-95
Низкие количества Са характерны для терригенных пород, причем
его содержание зависит or величины примеси карбонатной составля-
ющей. В глубоководных глинистых океанических осадках содержание
СаСО3 достигает 10%; а концентрация Са (т, %) составляя:
в океанических глинах 1.88, (пелагические глины Гихого оксана среднее
2.40). глинах континентов 2.20, Русской платформы 3,60, Канады 1,73.
в глинистых сланцах в целом 2.00, США 2,39. Пески и песчаники
содержат Са (%): в среднем 2,68, Русской платформы 2,2, современные
пески залива Пария 1,75 (глины 1,1).
Во времени содержание ('а в карбонатных породах значительно
увеличивается (PR~20% Са, PZ и MZ—KZ~30%) при значительном
снижении отношения Са Mg [53]. То же самое, но циклично
происходит в сланцах (СаО, %): ARj 1,89, AR2-j 2,78, PR( 2.16,
PR2 j 1,54, Ph 2,90 [664]. Среди карбонатных пород AR мачо
известняков, а в отложениях с во трастом >3 млн лез они вообще нс
встречены, в Ph процессы карбонагообразования имели широкое
распространение при увеличении во времени биогенной составляющей
по отношению к хемогенной [581, 843]. По А. П. Виноградову, на
русской платформе максимум карбонатообразоваиия пришелся на
Т и первую половину I, что совпало с максимальным развитием
гигантских рептилий с кальциевыми скелетами.
Игучеиие химического состава фракций различной ра «мерности
[749] не дало чезких различий в содержаниях СаО (%): Баренцево
море—песок 0,84, ил 1,88, глина 1,02; залив Пария—песок 4,06, глина
3,17; труппа Грикленд—граувакка 0,90, арт иллит 0,56.
Для MZ песчаников Таджикской депрессии установлено [366], что
самые низкие содержания Са характерны для аллювиальных отложе-
ний, более высоки они в прибрежно-морских фациях, причем в породах
тумидной зоны (1% Са) значительно ниже, чем аридной (2,87%), но
самые высокие концентрации обнаружены в опресненных заливно-
лагупиых фациях (3,5—8.8%). Еще более контрастна разнила в со'дер-
жании Са в тлинистых отложениях этою региона (%): континенталь-
ные 0,17—0,19, прибрежно-морские 0.7—0,8, морские 2,5—3,4; в этом
же ряду увеличивается содержание Са в пелитовой фракции (0,09, 0,36
и 0.62% соответственно), а также количество Са, переходящего
в 5%-ную НС1 вытяжку (62, 89 и 100%). Для известняков данною
региона выявлено, что в тумидных тонах среднее содержание Са выше,
чем в аридных (%); прибрежно-морские 32,6 и 29,6, тапивно-лагуниые
34,8 и 31,6.
В большинстве экзогенных ландшафтов идет процесс образования
СаСО3 (кальцит, арагонит), который Формируется за счет Са(НСС),)-
и друтими путями в коре выветривания, наносах, почвах, донных
отложениях водоемов, живых органитмах и в растительных остатках.
Этот процесс по аналогии с галогенезом назван кальцитогенезом
и охватывает многие территории страны. Формы проявления каль-
циготенеза в различных ландшафтах показаны, по данным
М. А. Глазовской [1981, на рис. 11.
223
Рис. 11. Распространение и формы проявления кальпито!енеза в различных
ландшафтах:
7—2—кальцитогенез в орто- и параэлювиальных ландшафтах: 1 — остаточный лизоген-
ный, частично вторичным кальцит в элювио-делювиях и почвах на плотных карбонатных
породах, '2—оста гочно-аккумулятивныи кальцит в элювио-делювиях и почвах на плотных
силикатных породах (а—криолитогеиный, б—ксероли тотемный); 3—4—кальциютенез
в неоэлювиальных ландшафтах: 3—остаточный литогенный качьциз в обломочной
фракции рыхлых отложений и почв, 4 — остаточно-аккумутятивный каэьциз, гидропедоген-
ный в рыхлых отложениях и иллювиальных горизонтах почв (а — в нижней части
почвенного профиля и в породах, о—в подгумусовой части почвенного профиля,
локально—с поверхности, в — над постоянномерзлым горизонтом в почвах и в мерзлых
породах); 5—6—аккумулятивный кальцит: 5-—аз мопедогенный по всему профи зю
с максимумом на поверхности, 6—фитогенный (аккырши); 7—зоогенный кальцит
в супераквальных ландшафтах (ракушечник); 8—гидрогенный локальный казьцитогенез — в
тидроморфных почвах (луювой мергель, шох); 9—гидрокриот енный кальцитогенез— на
поверхностях наледей, выходах подмерзлотных вод, в гидроморфных почвах; 10—граница
вечной мерзлоты
Метаморфические породы разных типов имеют различные оценки
средних содержаний (%); эклогиты 7,80 + 0,66, амфиболиты 7,10 + 0,63,
гнейсы 2,45 + 0,33, кристаллические сланцы 1,72 + 0,5 при более высоких
коэффициентах вариации, чем в первичных породах [53]. В докембрий-
ских парагнейсах древних платформ содержание Са 2,98%, в парат ней-
сах геосинклинальных регионов—1,64%.
Содержание Са, по В. А. Буряку, в известняках различной степени
метаморфизма (Восточная Сибирь) почти не меняется или снижается
(СаО, %): зеленосланцевая фация (I) — 45,9, альмандин-ставролитовая
(II)—48,1. дистеновая (III)—46,4, силлиманитовая (IV) — 46,4; в мер-
гетях оно снижается I—15,3, II—12,3, III—9,3, IV—9,6.
224
По А. А. Предовскому, содержание СаО в мраморах Кольского
п-ова 36 + 5%, кальцифирах 38,5 + 0,4%.
При спилитизации базальтов, по А. А. Маракушеву, содержание
его значительно снижается—10,8 и 5,5% СаО соответственно [726].
Почвы, растении, животные
Кларк Са в почвах 1,37% [104], а средние содержания в разных
типах почв и районах колеблются в широких пределах и зависят от
химического и гранулометрическою состава почв и пород первичного
субстрата. Самыми богатыми Са являются почвы на карбонатных
породах. Например, карбонатный серозем (стандарт почвы ССК)
содержал 11,47+0,10% СаО, карбонатсодержащий чернозем (воронеж-
ский) 9,38 —11,68%, светло-каштановые карбонатсодержащие почвы
(Северный Кавказ) до 11,44% [104]. Большие количества Са поступают
в почву в виде CaSO4 и СаСО, при испарительном концентрировании
из вод в аридных условиях. Содержание СаО в стандартах типичных
почв следующее (%): курский чернозем (СП-1) 1,63+0,05; московская
дерново-подзолистая (СП-2) 0,81 +0,04, дерново-подзолистая (СДПС)
0.27+0,03, прикаспийская светло-кашгановая (СП-3) 2,86 + 0,06, красно-
зем (СКР) 0,17±0,04, бурая пустынно-степная 0,28. Видно, что во всех
случаях содержания Са низкие, что небла! оприя i но для сельскохо-
зяйственной деятельности. Это особенно характерно для подзолистых
почв европейской части бывшего СССР, содержание Са в которых, по
С. А. Кудрину, колеблется от 0,65 до 1,15%. Среди черноземов этого
региона самое низкое содержание Са в выщелоченном, самое высокое
в южном [726]. Важно, чго, по А. П. Виноградову, содержание Са
в черноземах и сероземах увеличивается в горизонтах В и С (от 1 —1,8
до 9—11%) по сравнению с А (от 0,9 до 5 — 8%).
Большие количества Са (от 7 до 515 кг/га) теряю гея при арозии
почв [688], чго значительно снижает урожайность. Широко применяет-
ся в агрохимии искусственное известкование кислых почв и рекуль-
тивация почв. Значительное количество Са вносится в почвы с некото-
рыми фосфоритовыми удобрениями, сапропелями, золами углей
и горючих сланцев [688]. Характерно взаимодействие Са со многими
минеральными компонентами почв—Zn, Cu, Sr, Ва, TR, F и др.
Кальций является главным элементом биосферы, в том числе
живого вещества (кларк биосферы 1,6%, биоса 0,5% Са (см. табл. 8),
оп имеет высокую биофильность (Бф-0,2) и бишенность (Бг-0,53).
Биогенность Са мепящея для растений в зависимости от природных
зон, например, в нашей стране: тундровая зона 0,31, лесная 0,65,
(деревья 0,82, травянистая растительность 0,49), степная 0,37, пустын-
ная 0,67 [198].
В течение истории Земли миграция Са в биосфере заметно
менялась, приобретая все более биогенный характер [114]. На рубеже
V и е [ возникли разнообразные скелетные животные, представляющие
новые типы и классы (трилобиты, брахиоподы, моллюски, губки,
15 2138 225
тхнподерма гы, археоциаты). Они широко расселились в раннекемб-
рийских морях. Снижение парциального давления СО2 в атмосфере,
по-видимому, уменьшило растворимость Са и Mg в океанической во те,
что привело к насыщению этими элементами и создало возможность
построения известковых скелетов у беспозвоночных, которые ранее их
не имели |114. 115|
Кальциевый скелет характерен и для позвоночных, причем в конце
PZ - MZ возникли их самые крупные представители — рептилии,
достигшие расцвета и максимальной величины особей в MZ и вымер-
шие (динозавры) в конце MZ.
Оценки средних содержаний Са в организмах, по В Шоу [915]
и И. боне |860 | составляют (% с.)- растения наземные 0,18, морские
0,10, для различных классов животных пределы содержаний следующие
(%): наземные 0 02—8,5, морские 0,15—2,0, бактерии 0,51. Содержания
Са для океанского планктона составляют (%): среднее 1,9, фито- 0.45,
зоо- 2,0, тотальный 1.9 (для сравнения—взвесь 4,0, пеллеты 15,0) [677 ]
Многие организмы строят свой скелет и раковины целиком из СаСО3
(известковые водоросли, кораллы, моллюски, иглокожие и др.) иди
СаРО4 (известковые фосфатные трубки и др.); при их отмирании
образуются органогенные известняки и фосфориты.
В растениях Са проявляет синергизм с Cu Mn, Zn и антагонизм
с Л1, В, Ва, Be, Со, Cd, Cr, Cs, Си, F, Ре, 1л (табл. 72).
Кларк Са в золе растении 3%. В стандартных пробах растений
содержание его составляет (%): картофель 0,08 ±0,003, зерно пшеницы
0,053 40,001, злаковая травосмесь 0.88±0,02.
Имеются данные |797] по содержаниям Са в пищевых продуктах
для нашей страны (мг/кт): пптепица 500, овес 1170, соя 3500, гречиха
2000, молочные продукты 1200—1500. сухое молоко 10000, хлеб 200
мясо и мясопродукты 80—120 рыбопродукты 500—1200, мак 17000
минеральные воды 400—450 (Нарзан, Арзни), 50 (Миргородская)
Таблица 72
Взаимо м'мствие между макро- и микроэлементами в растениях |312|
Макроэлемент Антагонизм Синс-pi И IM
Са А1 В Ва Be Cd Go Cr Cs С и Ь Fe Li Си Mn Zn
Мр Al Вс Ва Cr Mi F Zn Ni* Co* Fe* Al Zn
р Al Лч В Be Cd Cr Cu F Fe Hg Mo Mn Ni Pb Rb Se Si Zn Al В Cu Fe Mo Mn Zn
к Al В Hg Cd Ci F Mo Mn Rb
S As Ba Fc Mo Pb Se F** Fe
N В F Cu В Cu Fe Mo
С1 В 1 —
* Микроор! анизмы.
** Совмеспюе действие вызывает существенное повреждение.
2/Ъ
Значение нолей Са в жизнедеятельности животных не ограничивает-
ся участием в построении скелета (дефицит Са у молодняка вызывает
рахнг), ОН(Са21) влнчет на течение многих физиологических и биохи-
мических процессов (нервная система, мышечная деягспьность, фермен-
ты и др.), является I тлвным элементом функционирования клеточных
мембран благодаря высокому мембранному градиенту Са2* (относи-
тельно высокое ето содержание ь клетках- белках плазмы и др,
низкое—в клеточной цитоплазме). Са;‘ реагирует на различные
раздражители (информационные сигналы) и подается мембранными
насосами в к тетку с изменением отношения Na/Сл. При снятии
внешнего раздражительно! о импульса моментально происходит обрат
ный процесс [4071 Мишенями для ('а в клетке являются как
«растворимые». гак и интстра-тытые мембранные бешен Взаимодейст-
вие Са2* с первыми обычно обеспечивает регуляцию различных
метаболических процессов в клетке, мембранные катытийсслективные
каналы и (. а-насосы регулируют его внутриклеточную концентрацию.
Концентрация Са в крови человека меняется не более чем из 3%
и поддерживается в основном с помощью парат гормона, витамина
D и тирочалытитонига, которые обеспечивают регуляцию Са в ор-
ганизме и основное поступление его в кости. Нс менее половины Са
в крови связана с белками плазмы (в основном с альбумином).
В покоящихся клетках (не воспринявших специфического внешнего
сит нала) концентрация Са *, который является основным регулятором
внугрпклеточных процессов, чрезвычайно мала—0,01—0,1 мкмоль/л
(мкм), во внеклеточной среде гораздо выше—1.x—2,5 мкмоль/л
Регуляторами циклическою изменения концентраций Са2+ являются
белки (известно >100 Са-содержаших , елков), которые способны
активизироваться в диапазоне изменения ето содержаний от 0,1 до 10
мкмоль/л. Особенно чувствительны к концентрации Са2+ и изменению
отношения Na Са деятельность мозга, мышц, сердца и процессы
оплодотворения [407J.
У человека суточное потребление Са варьирует ст 11 г у мужчин,
и 0.9 т у женщин до 0,36 т у грудных детей. Всасывание из пищи
в кровь — от 0.25 до 0,80—находится в обратной зависимости от
степени обот ащепнос ти рациона Са— при 0,6 г/сут оно составляет 0,35,
при 1 г/сут—0,28, среднее всасывание для нормального человека
принято 0.3, ето увеличивают витамин D фосфаты, лактоза, белки,
пшеничная мука, тогда как жиры, алкоголь, кортизон снижают.
Особенно велико всасывание у новорожденных, молодых животных
и у беременных. У людей уменьшение всасывания начинается после
60 лет и увеличивается жскрекция через кишечник, а также при
заболеваниях почек, гастроэктомии тонкой кишки. Основное количе-
ство Са содержится в костной ткани (мг/кг): 108—166 (ж), 309—356
(з.). х = 351+7. Высокое его содержание (мг/л) установлено в крови —
общая 60,5±0,2, плазма 96+0,7, сыворотка 9740,1— и в материнском
молоке 150—481 В остатытых органах человека содержания следую-
щие (мг/кг): мозг 7,6 + 0,1. волосы 1,1 ±0,49; сердце 0,05 0,15 (ж.), 5.6
15* 227
(з.), почка 0,1—0,17 (ж.), 7,4—17 (з.); печень 0,05—0,1 (ж.), 0,22 (с.), 5,1
(з.); легкие 0,09—0,15 (ж.), 10,5 (з.); мышцы 0,04—0,05 (ж.), 2,5—3,5
(з.); hoi ги 0,37—3,1; кожа 0,03—0,25 (ж.), 16—20 (з.); селезенка 0,25
(ж.), 5,4—7 (з.). Кратность поступления в организм 910 [512], с учетом
всасывания 0,3—3000, а для скелета 10000; Т6 выведения из скелета
и всего организма 7000 и 2100 сут.
Сходно в организме и поведение радионуклида 45 Са, который
хорошо усваивается (всасывание с пищей 60%, из а!мосферы 75%)
и имеет длительный период полувыделения (сут.): биологический
16400, эффективный 152. Он накапливается в злаковых растениях и,
попадая в организм, в основном концентрируется в костях и может
вызвать образование остеосарком [27].
Воздух, вода, техногенез
В атмосферном воздухе среднее содержание Са над Южным
полюсом—0,5 нг/м3, над океанами 0,44 мкг/м3, в крупных городах
зарубежья ~600 нг'м3, Сибири—400 нг/м3 [626]; в океаническом
аэрозоле 2,-9%, что близко к содержанию Mg. В дождевой воде его
содержание оценивается (мг/л): около океана 0,4; в 2 км от океана 6,5,
в 660 км — 3,8, 1050 км—2,2 [394].
В атмосферном воздухе фоновых территорий страны, по
А. А. Волох (1991 г.), содержание Са следующее (нг/м3): Восточная
Сибирь 400, Московская обл. (оз. Глубокое) 650, Крым (зал.
Голубой) 640.
Средний модуль выпадения кальция с атмосферными осадками для
СССР 1,37 т/км2 в год (максимальный в районах недостаточного
увлажнения 2,2 и сухих 3,6; общий гидрохимический сток 81 х 106
т/год, распределяется по отдельным морям и территориям: северо-
западные ~ 10, северо-восточные ~36, восточные 6,6, южные 36,7,
Аральское море и бессточные районы Средней Азии и Казахстана 7,1
[198]. Баланс превышения выноса над поступлением 51,6х 106 г/год,
Л», = 2,8 (см. Na).
В гидросфере Са является легко подвижным элементом со средним
содержанием в океанической воде 4,13-10 2%, в речной 1,5-10“3%.
Содержание Са в водах регулируется в основном ее соленостью (см.
табл. 14), температурой и концентрацией СО2—при уменьшении
последней оно снижается за счет образования СаСО3. Время пребыва-
ния Са в океанической гидросфере (8 • 106 млн лет) самое короткое
среди главных катионов. Поверхностные воды при равновесии с атмо-
сферным СО 2 могут иметь содержание Са 20—30 мг/л, увеличивающе-
еся до 40—50 мг/л при более высокой концентрации СО2- Например,
в океанической воде на поверхности содержание Са значительно выше,
чем на глубине.
Содержание иона Са2+ (%) в морской воде увеличивается по мере
увеличения солености (%,): 0,118% —10°^,, 0,236—20. 0,354—30. 0,472—
40; кроме Са21 в морской воде, по Э. Гольдбергу, присутствуют
228
CaSO4 и Ca(HCO3)2. Самое высокое относительное содержание Са
(г/л) характерно, по П. Рилею, для поровых вод (до 5,7) по сравнению
с морской водой (0,55) и иловой (0,52) [726].
Геохимическая история Са в морской воде связана с температурой
I, pH и биосом [844]. В высоких широтах при низких t и pH воды
недосыщены Са, а СаСО3 донных отложений растворяется, в эквато-
риальной зоне (~30 с. ш. и ~30‘ ю. ш.) воды пересыщены СаСО3
и образуются кальцийсодержащие организмы.
Кдльций является ведущим компонентом во всех гидрохимических
типах природных вод гидрокарбонатных, сульфатных и хлоридных,
среди которых выделяется кальциевая группа (см. табл. 10). Самое
высокое его содержание характерно для кальциевого хлоридного типа
глубинных рассолов (п 10 г/л), затем идут сульфатные воды (до 600
мг/л и более). Региональным широким распространением пользуются
гидрокарбонатные кальциевые воды. Много Са поступает в подземные
воды не только за счет карбонатов СаСО3 (Пр 4,8-10 9), но и за счет
гипса (Пр 6,1 • 10"5); при экспериментах в дистиллированной воде
растворилось 6,9-10 3 СаСО3, а самыми легкорастворимыми являют-
ся СаС12 (745 г/л) и Са(НСО3)2.
В реках содержание Са (мг/л) колеблется в широких пределах —
6,2—186 в гидрокарбонатных водах (Канада и США 5—50; реки севера
нашей страны 21+4,5) и 3—402 (х = 79,0+10) в сульфатных и гид-
рокарбонатно-сульфат ных водах; концентрация Са прямо коррелирует-
ся с количеством НСО3 и С1“ [52].
Озерные воды также постоянно содержат Са (мг/л): пресные—от
2,0 до 54, х= 19,4 + 8,9 (СССР, США, Европа, Австралия, Африка),
Ca>Mg; соленые оз следов до 2823 (южные засушливые районы
многих стран).
Подземные воды имеют следующие средние концентрации Са
(mi/л): сульфатные и хлоридные соленые 938, пресные 95, гидрокар-
бонатно-кремнеземные 17,7.
Максимальные содержания некоторых металлов в подземных Са
углекислых водах следующие (мг/л): В 1200, Li 320, Rb 100, Cs 20, As
120, F 1000, Sb 10 ’[366]. ГЭ таких вод очень высок (>и-105).
Содержание Са в подземных водах зоны гипергенеза, по
А. И. Перельману [726], меняется в зависимости от ландшафтных
условий (мг/л): среднее 43,9, воды областей континентального засоле-
ния 115, выщелачивания 26 (районы умеренного климата 37, горные 30,
зоны мерзлоты 21, субтропики 17).
В целом для подземных вод, по С. Р. Крайнову, В. М. Швец [366],
характерна зональность типов (по катионам и анионам), зависящая от
состава вмещающих пород, в которой Са занимает определенное место
(см. Н).
Техногеохимия Са весьма многообразна [128, 231], а его экология
почти не изучена, как и техногенез (Н 108) [198].
В техногенезе Са занимает одно из ведущих мест по положительной
роли в агропроизводстве—мелиорации. Кальцинирование (известкование
229
и др.) почв снижает их кислотность, чго особенно актуально при
интенсивном техногенном воздействии для подзолистых, дсрново-
ПОДЗОПИС1ЫХ и некоторых торфяных почв, а среди сельскохозяйственных
культур—для пшеницы, ячменя, фасоли, кукурузы, люцерны, клевера,
свеклы, капусты, огурцов, лука, чеснока, яблонь, вишни, смородины и др.
Количество вносимой извести изменяеюя or 2 до 6 т/ia в зависимости от
pH солевой почвенной вытяжки, механическою сое шва почв и Шубины
внесения [198].
Являясь главным жизненно важным элементом, Са обладает
сильным воздействием па состояние всех экосистем. В воздухе рабочих
помещений несколько его специфических соединений имени I класс
опасности, нормировано также содержание аэрозоля фосфорита —
апатита (ПДКр., 6 мг/м3). Для некоторых соединений установлены
ПДК атмосферного воздуха, а для нескольких соединений— ПДК„
водоемов любою назначения (mi л): цианамид Са 1,0 (III класс),
цикло! ексиламин карбонат 0,01 (II класс), фосфат кальция (по
фосфору) 3,5 (IV класс) [727]. Но главное значение имеет не столько
избыюк, сколько недостаток Са, на что пока обращают внимание
преимущественно в агрохимии.
Для биогеохимической оценки экологическою сосюяния террито-
рий используют в качестве дополнительных пока lare.iieii отношения
Са:Р и Ca.Sr; Са;Р 1) экологическое бедствие <0,1 или >10 в кормах;
2) чрезвычайная экоситуация 0,4—0,1 или 5—10; 3) относительно
удовлетворительная обстановка 1—2; C.a:Sr 1) < 1; 2) <10—1; 3) >100.
В промышленности большие количества Са пос i у паю i в окружа-
ющую среду во всех добывающих его горных производствах, а 1акже
в многочисленных дробильных и нерерабашвающих предприятиях,
особенно стройматериалов, стройиндустрии. цементной, известковой,
флюсовой, химической, стекольной, пищевой, керамической и многих
дру! их отраслей промышленности.
Специальное изучение токсичности избытка соединений Са необ-
ходимо провести в условиях, когда он совмещен с фосфатной, борной
и мышьяковой составляющими.
Значительную радиогоксичносгь и опасность могут представить
ядерные выбросы 4 Са.
Выводы Кальций—основной породе-, органитмообразующттй
и жизнерегулирующий элемент и в то же время токсичный металл
(T,= l, TJ-r=10) повышенной геоэкофильносги I ЭФг = 40). Главное
самостоятельное значение он имеет в осадочном карбонате-, фосфато-
и гипсообразовании, отчасти в эндогенных пироксеновых, анортозито-
вых улырабазит-базитовых комплексах, в андезиновых i рашиоидных
ма1 магических породах и в некоторых маюриковых водах. В общем
Iеохимическом цикле Са менял свои тенденции, становясь с течением
времени вес более биофильным (В>3); показатели Бф (0.2)
и Б, (0,53) — высокие. В магматическом цикле его концентрации
в базитах и i ранит оидах в общем снижались во времени, а в оса годных
породах, наоборот, они периодически повышались, особенно в кар-
230
бонатных отложениях в PZ и MZ В лит осферно-гидросферно
атмосферном цикле ('а 1есно связан с СО2. Быстрый хемогениый
и биотенный вывод сто из круговорота главных элементов и переход из
пород в воды и обратно приводи! к нежелательному дефициту Са
в зонах гумидного климата. На клеточном уровне недостаток Са2+.
как и избы юк. недопустим для организмов. В техногенезе Са —
главный элемент повышенной технотенности (Тх=108), недостаток
которого сильно влияет на урожайность и продуктивность животно-
водства; по отношению к человеку слабо изучен.
СТРОНЦИЙ —38
Распространенный (кларк 0.037%*), токсичный (Г, =5, Тг = 50),
слабо изученный металл, относимый к редким элементам. НДК„ Sr
7 мг'л (11 класс опасности), ПДКр1 Sr(NO.,)2> SiO 1 мг/м3 (II класс;,
SrCO3, SrF2, SrPO4, SrSO4 6 mi'm3 (III—IV класс) [128, 727].
Агом
Atom состоит из чегырех изотопов — 88Sr (82,56%), 8tSr. 8bSr. 8 Sr
и 14 искусственных; радионуклид 90Sr имеет 7\ 2 28 лет. считается
одним из наиболее биологически опасных радиоактивных элементов
[785]. 86Sr и 87Sr используются в качестве индикаторов связи пород
и месторождений с различными ис> очниками (рис 12).
В периодической таблице Si (Ф/° 4л2) находится во II группе
(валентность П) в окружении Са, К, Ва. Ra, Cs (л-металлы), Zn, Cu, Ag,
Cd Y («-/-металлы), с которыми может встречаться в геохимических
системах. По многим основным свойствам (см. табл. 51, 52, рис. 5,6)
он наиболее близок к Са, но имеет несколько большие размеры иона.
Наиболее важные кислородные соли Sr (SrCOj, SrSO4) относятся
к труднорастворимым в воде (11,4 мг/л), химически сходны с анало!ич-
ными солями Са. Хорошо растворимы в воде (г/л) Sr(NO3)2 (708),
SrCl2 (599), SrBr2 (1024), Srl2 (1777) и Sr(HCO3)?. Sr(OH)2 в отличие от
Са(ОН)2 растворяется в воде слабо — 8 г/л при / = 20 С. Большинство
из перечисленных соединений Sr токсичны [231].
А И Перельман [574] по соотношению Ca/Sr выделяет два типа
распределения Sr. В метеоритах, основных породах, живом веществе
Ca/Sr>l, в гидросфере и осадочных породах Ca/Sr<1.
В условиях Земли Sr проявляет литофильные и литохалькофильные
минералого-геохимические свойства—его формула Л100 (?)• Среднее
содержание Sr (г т) в континентальной коре 260, в верхней 350 нижней
230, архейской 240, в примитивной мантии 17,8 [749], земной
протокоре 220 [372]; в осадочном слое его несколько меньше (410), чем
в кристаллическом фундаменте (480) [898].
* По данным В. В. Буркова [716] — 0,03% (при соотношении пород по
А. А Беусу [52]); кларк биосферы 0,004% [H8J.
2,31
г-। ।—।—।--------1--------
|| ♦ f )
I Глубоководные С — —--------——
| океанические осадки г
Осадки,снесенные
с континентов
Осадки геосинклиналей
„Меланж ”
гВазалыы
1офиолитовык____ _
\комулрксов “ ”1
{мзыгнеинь е J
;
I океанические базальты
?
•>
____I______т
~| Мантия j
16
/4
< 12
о
О*
« 'О
8
6
0,702 0,704 0,706 0,708 0710 0,712 0,714 0,716
"sr/gBSr
Рис. 12. Корреляция значений 5180 и отношений 87Sr/86Sr в изверженных
и осадочных породах
В метеоритах Sr также литофилен и накапливается в хондритах
(среднее 11 г/т) и особенно в полевошпатовых ахондритах (40—60 г т,
но в бедных Са—только 7,0—7,5 г/т); содержание его в углистых
хондритах и железо-каменных патласитах 1,0 г,т; для лунных пород:
реголит 142 + 49, базальт 382 + 67 г/т («Луна-16, 20»),
Минералы
Число минералов Sr па 1988 г. составило 56. Все они, кроме целестина
SrSO4, стронцианита SrCO3 и лампрофиллита (Na, К), (Sr, Ва)2
Ti3O2Si4Oi2 • Fz, относятся к редким и очень редким. Известно 13 силика-
тов, 10 фосфатов и гидрофосфатов, 11 карбонатов и гидрокарбона гов.
7 боратов и гидроборатов. 4 оксида, 3 арсената и гидроарсената, 3 фтори-
да и гидрофторида, по 2 ванадата и сульфата, I гидрохлорид. Чаще всего
Sr в этих минералах изоморфен с Са, в нескольких случаях с Ва, реже
с Се, La, Y и РЬ; из других катионов в стехиометрических соотношениях
с ним в основном встречаются Na, Al. Наиболее разнообразен состав
силикатов Sr, в которых кроме перечисленных катионов в качестве
минералообразующих установлены Fe2+, Fe34, Ti, Мп, Zn, Zr, V4+;
девять силикатов относятся к диорто- и кольцевой группам (0: Si = 3 — 3,5).
Для эндо- и экзогенных минералов Sr особенно характерно наличие Н2О
или ОН-, а также преобладание TRce [716]. По Г. Ловенстаму [726],
целестин обнаружен в радиоляриях.
По данным В. В. Буркова [716] и друтих исследователей, Sr часто
встречается в различных минералах друтих элементов, особенно
232
в минералах Са, Ва, К, общее число коюрых превысило 100.
Самые высокие его количещва обнаружены (максимум, %) в фосфатах
(апатит 14, флоренсит 9, крандаллит 5,3, бриюлит 3,1, другие
0,05—1%), сульфатах (барит 10, апглезит 6, ашидрит 3,6, ярозиг
1, глауберит 0,8, гипс 0,5, полиголит 0,12, алунит 0,2), карбонатах
(арагонит 6, бенсгонт 4,2, кальцит 3,7, альстонит 4,2, церуссит
3,1. витерит 1,5, хуанхит 0.2, паризи! 0,1), оксидах (пандаит
6,4, лопарит 4,38, пирохлор 1,4, марииьякш 1,0, давидит 0,6,
криптомелан 0,7, бетафит 0,5), силикатах (томсонит 5,76, ловчоррит
3,56, гейландит 3,6, эвдиалш 2,45, барсановит 2,5, волластонит
1,16, эпидот 2, ханконит 3.9, цоизит 2,5, чароит 2,2. сфен 1,4.
канкринит 1, апофиллит 1,7, ломоносовит 0,5, биотит 0,3, амфиболы
0,1, мусковит 0,2, пироксены 0,2, плагиоклазы 0,8, десмин 0,63,
КПП! 0,5, ортит 0,5, монтмориллонит 0,33, нефелин 0,2).
В магматогенных условиях наибольшее значение имеет изомор-
физм SrfcjCa. Получен стронциевый аналог анорти га (синтетический).
Природные основные плагиоклазы (70—90% Ап) могут бьпь обогаще-
ны им по сравнению с кислыми (21% Ап)—соответственно 0,13—0,1
и 0.014% SrO2 (Калифорния), получен также синiетический стронци-
евый аналог КПШ, нзоструктурный е последним, и показана возмож-
ность изоморфизма K*+Si4+t»Sr244 Al33 [726]. Изоморфизм SrtrBa
особенно характерен для гидро i ермальных и осадочных условий
(BaSO4t»SrSO4); отмечается также возможность изоморфизма
Pb2fc»Sr2 ' (церуссит, аш лезит и др.}. Наряду с изоморфным вхождени-
ем в решетки минералов для Sr типична сорбция глинистыми
минералами, а также наличие микровключений собственных его
минера лов, чем moi у г быть объяснены иногда встречающиеся высокие
концентрации Sr в галогенидах и боратах [726].
По данным И А. Киселева (1992 I.), высокое содержание стронци-
онитовою минала (6—15%) и особенно витеригового (27—31%)
характерно для карбонатов из карбонатитов. Автором эксперименталь-
но установлен ограниченный изоморфизм Sr и Ва:—максимум Sr
в витерите (молекулярная доля) до 11%. а Ва в сгронционите до 3%
при тенденции неустойчивости в системе стронцианит — витерит.
Из общего количества Si более 95%, по В. В. Буркову, в извержен-
ных породах приходится на плагиоклазы (х= 1350 г, г) и полевые
шпаты (1344 г/г), а в мафических и метаморфических породах на
пироксены (.т= 150 г'т) и амфиболы (217-1/т) По данным
А. И. Альмухамедова с соавторами, стронциеносность плагиоклазов
возрастает по мере увеличения их основности. Кроме того, установле-
но, что в ранних генерациях минералов содержание Sr выше, чем
в поздних, гак же как отношение Sr'Ca.
Единственным промышленно освоенным собственным минералом
Sr до сих пор является целестин (ГЭМ = 5- 10 3), а для комплексною его
извлечения наиболее перепекiивен апатит из нефелиновых пород,
среднее содержание Sr в котором составляет 3,96% (в апатите из
кимберлитов, по И. А. Сафронову с соавторами, от 0,1 до 1,41%).
233
У целом стронциеносиость апатита зависит о г формационной принад-
лежности пород. То же характерно для нефелина—среднее содержание
в нем Sr для пород щелочно-габброидной формации 590 (68 проб),
щелочно-базальгоидной 340, щелочно-г рани гоидной 140 [726]. Кроме
гог о, возможно попутное извлечение стронцианита.
Месторождении
Месторождения Sr делятся на собственно стронциевые и комплекс-
ные редкометалыго-фосфагные; все они, кроме целестиновых эпигенети-
ческих руд, слабо освоены. Несмотря на высокий кларк и весьма
значительный металлогенический потенциал (~7 млрд т), Sr относится
к редким металлам. У нас он еще не нашел широкого применения,
несмотря на большое количество отраслей, готовых использовать его по
более низким ценам (металлургия — низкотемпера гурноустойчивые
стали, модификаторы чугуна, легкие сплавы, магнитотехника, стеклоде-
лие, электроника — основной потребитель в США и Японии в 80-х годах,
керамика, в том числе сверхпроводимая, светотехника, утяжелитель
буровых и других растворов, цветное телевидение и др.). В настоящее
время годовое потребление Sr за рубежом составило ~60 гыс. т;
прогноз на 2000 г.— 70 тыс. г; зарубежные запасы руд —12 млн г
(1986 г., целестиновый концентрат). Тсхнофилытость низкая — 2 106.
Собственное и комплексное стронциевое оруденение относится
к литохалько-, литосидеро- и литофильной щелочной группам,
а в генетических систематиках — к магматической, гидротермальной,
гидрогенной, гидрогенно-, вулканотенно- и синг епетически-осадочной.
При этом около 35% руд связано с щелочно-ультраосновными,
щелочно-основными и базальтоидпыми породами [726].
Месторождения Sr охарактеризованы в ряде работ [172, 726].
К крупным относятся объекты с запасами целестина несколько
миллионов тонн; богатые руды содержат >35% целестина, промыш-
ленные— обычно >15%; запасы средних месторождений >100 тыс. г.
Наиболее перспективны стра гиформные цечестиновые месторожде-
ния (П5= 1 • 103 5 103), расположенные в стронциеносных провинциях
и приуроченные к сульфатным, сульфатно-карбонатным и карбонатно-
терригенным дислоцированным отложениям определенных страти-
графических горизонтов [726]. Возраст стронциеносных органогенно-
детритовых и органогенных известняков — KZ — Q (СССР, Централь-
ная Азия), пелитоморфных, доломитизированных и загипсованных —
PZ (Канада) и MZ (Италия).
Руды эпигенетические, монометапьные целестиновые, иногда барит-
целес г иновые, переходящие в баритовые (Мангышлак, Аргентина).
Барит (количество его в целеетиновых рудах 2—10%) считается
вредной примесью; кроме этих минералов в состав руд входят кальцит,
доломит, гипс, в меньших количествах отмечаются галенит, сфалерит,
халцедон, гринокит [726]. Иногда форма рудных тел жильная, такие
руды содержат 50—80% целестина при низких запасах.
234
Значительные концентрации Si содержатся в сходных по генезису,
но более бедных (и% Sr) серных месторождениях (Предкарпатье,
Средняя Азия). Отношение Sr'Ba убывает or подошвы (18—-66)
к кровле серной залежи (2—4), а максимальное содержание SrO
в барите и ВаО в целестине нс превышает 2% [726].
Целестиновое оруденение в сульфатно-терригенных (тпсово-пссг-
роцветных) породах (Средняя Азия) аридной зоны имеет содержание
SrO в рудах 7—9%, в эпигенетических конкрециях нелестна —
60— 90%, во вкрапленном оруденении до 6%. Оруденение хемогенно-
эвапоритового типа.
Целестиновые иногда стронцианитовые руды известны также
в вулканогенно-осадочных породах (туфы андезиюбазальтов, кон-
седиментационные и озерные глины и песчаники); они интенсивно
окремнены, содержат 20—40% целестина или стронцианита и Fe-Mn
гидроксиды, количество которых увеличивается с ростом количества
пирокластического материала. Характерна пространственная ассоциа-
ция с концентрациями В, обогащенными Sr.
Вероятно, сходное происхождение имеют обогащенные стронцием
Pb-Zn етрагиформные месторождения, иногда с обособленной Sr-Ba
минерализацией (Тунгусская синеклиза). Содержание целест ина в брекчи-
рованпых породах до 14%, барита до 30%, присутствует целееiинобари г.
Стропциеносные минерализованные воды глубоких гори гонгов
платформенных областей содержат до 10000 мг/л Sr (Ангаро-Илим-
ский артезианский бассейн), чаще до 700 мг/л (Приуралье, Поволжье)
(ГЭ=1104). Запасы таких вод весьма велики, как и их распростра-
ненность— п-10 м -100 км2 (Восточно-Европейская, Сибирская и дру-
гие гидрохимические Sr-провинции). Гидрохимия Sr таких бассейнов,
вероятно, сходна с таковой солеродных бассейнов, в которых Sr, по
Л. С. Балашову [714], накапливается на глубоких горизонтах (до
2530 мг/л) в Cl-Mg-Ca типе вод (табл. 73).
В эндогенных месторождениях Sr обычно является попутным
компонентом, в первую очередь, в редкометальных нефслин-сиенито-
вых и карбонатитовых месторождениях.
Особенно большие количества Sr в агпаитовых нефелиновых сиенитах
заключены в апатите (1,9—11,5% SiO). Для Хибинского массива
Д. А. Минеевым с соавторами [535] получено следующее уравнение
зависимости (при 1% TR):P,O5 = 41,94- 0,192 SrO, %. Содержание SrO
в апатите руд меньше (3,5%), чем в акцессорном апатите из ийолит-уртитов
(внутрирудные 4,5%, надрудные 5,4%), Это связано с масштабами рудных
тел и содержанием апатита и в более бедных им апатиг-магнеТитовых
и апатит-сфеновых рудах оно повышено (л = 5,4% SrO). Особенно богаты
Sr. по Т. Н. Ифантопуло (1985 г.), поздние пострудпые апатиты и апатиты
из верхних горизонтов рудных тел, тогда как рашше апати гы нижней серии
им обеднены. То же характерно для сфенов, содержание SrO в которых
0,32—0,70%. Кроме тою, Sr накапливается в пироксенах и нефелине (0,21
и 0,11 % — Портамчорр) и содержи гея в полевом шпате и титаномагнегит е
(460 и 254 г/т—там же) |535].
235
Схема геохимических классов рассолов в вертикальном разрезе одного из солеродных бассейнов
1,16 0,98 0,78 0,34 0,13
1ЦИИ, мг/л 72 303 2360 6030 7470
СЛ 27 48 740 2170 2530
е- § я сЛ и 0,09 0,17 0,79 1,28 1,06
«j S X £ 0,15 0,30 6,6 21,9 17,1
К о 1,3 1,3 15 56 95
Средний состав по формуле Курлова |м 12 2 I - 5 1 во я во во 1 то S S «>”• о. m о. ° S * "пГ п я п я П’я1 ° Л по и ° и z ° 2 О г- ОО Т. Г г-7 ОС О' v' о св Я св св « z z и и ЯЛ Г- м ЯП ОО О о «ч «ч г*> ? S > S
Класс Z _ £ > > Я £ т 'х Ч £ Z о и Я я Я “ z и z Z to и и о о
Средняя глубина горизонта, м 703 1300 2240 2990 3100
236
Таблица 74
Содержание редких >леменюв и F в апатитах
Ловозерско! о массива, %
Серия, горизонт SrO TR,O3 F
I 7.50(1) 4,88(1) —
Н-4 7,87(3) 6,83(3) 2,44(4)
П-7 5,56(45) 7,30(63) 2,18(11)
IV-1 3,62(4) 8,91 (2) 1,05 (1)
Для апатитов Ловозерского массива, по Т. А. Ифантопуло с соав-
торами (1985 г.), содержание SrO в апатите, как и F, также повышается
в расслоенном горизонте от IV к I серии при обратном распределении
TR2O3 (табл. 74). Кроме того, Sr содержится и в лопарите (%):
горизонт П-7 2,16±0,19; П-4 3,1+0,2; 1-4 3,4 (Э. М. Коваль и др.,
1987 г.)
Крупные скопления Sr характерны для поздних (анкеритовых,
анкерит-доломитовых, сидеритовых и др.) карбонатитов, где он связан
с кальцитом, апатитом, баритом, а также образует собственные,
обычно акцессорные минералы. В отдельных случаях запасы SrO
в стронцианите и целестине превышают 3 млн г (Маунтин-Пасс,
США). Иногда стронцианит (до 11 % SrO) ассоциирует с монацитом,
бастнезитом, баритом (Малави). Среднее содержание Sr в карбо-
натитах линейного типа (0,70%) выше, чем в зональных (0,54% Sr),
а в поздних фациях выше, чем в ранних.
Осадочные месторождения различных металлов слабо изучены на
Sr, особенно баритовые руды, в которых могут отмечаться наиболее
высокие его содержания [29, 153],— от 0,14 до 1,77% SrO, составляя
в среднем для баритов месторождений нашей страны 0,90 + 0,32%
и изменяясь в зависимости от их происхождения. Сингенетические
бариты содержат SrO (%): от 0,14 до 0,89 (г = 0,43±0,08), эпигенетичес-
кие (жильные) — от 0,8 до 1.77 (+=1,37 + 0,25).
Повышенные концентрации Sr характерны для Fe-Mn океанических
конкреций и фосфоритов—кларки 830 и 750 г/т соответственно.
Наиболее полно изучена стронциеносность Fe-Mn конкреций.
Оценки средних содержаний Sr (г/т) близки для Тихого (840),
Атлантического (940) и Индийского (790) океанов (при разбросе
от 100 до 3000). Г. Н. Батурин [34] пришел к выводу, что
климатическая зональность не является определяющей для рас-
пределения Sr и оно, по Мак Келви (1983 г.), больше зависит
от глубины залегания конкреций—более 3000 м — 750 г/т, менее—
1220 г/т. В конкрециях Sr коррелируется отрицательно с Мп
и положительно с Fe и Ti и переходит (57%) вместе с Fe
(65%) в уксуснокислую выгяжку. Изотопные исследования показали,
что отношение 87Sr'86Sr в конкрециях очень близко к таковому
в морской воде. В Mn-минералах гидротермального происхождения
237
установлены повышенные содержания Sr — в юдорокитс 4100 г/г
(Атлантика), гетите 320 г/г.
Фосфориты также относительно обогащены Sr, содержание которо-
го колеблсгся or 25 до 2370 г/т. Для морских фосфоритов Калифорнии,
которые, по М Муллинс с соавторами (1985 г.), содержат его от 1837
до 2367 1 'т (х = 2060 ±24 г/т), выделяются более глубоководные фации,
не подвергавшиеся вторичным изменениям. Фосфаты обогащены Р2О5,
Fe, Mg и обеднены Mn. a Sr концентрируется радиоляриями
и фторапатитом. Морские фосфориты Центральных Кызылкумов
содержат в среднем 1320 ±65 г/т Sr [59]. Выявлена положительная
корреляция SrO с Р2О5 и Са (при более высокой связи в неокисленных
рудах) и отрицательная с Са, Mg и СО2. Отмечается, что в окисленных
рудах Sr часто образует целестин. Для ракушияковых осадочных
фосфоритов Прибалтики, содержащих, по М. Н. Белянкиной [39],
1)004 65 г/т Sr, характерна его прямая корреляция нс только с Р2О5,
но и с Fe и TR.
Для фосфоритов Каратау, в которых Sr постоянно присутствует
в количествах от 0,02 до 0,36%, В А. Красноперовым и другими
исследователями (1988 г.) количественно оценена возможность опреде-
ления содержаний Р2О5 и Sr по уравнению регрессии:
Р2О5= (44,55 ±0,29) lg Sr ±(63,77 ±1,19). Установлено, что Sr изоморфно
замещает Са только фосфатного происхождения. Максимальное
количество Sr для пород установлено в ракушниках и детригбрахи-
оподпых конгломератах (в створках брахиопод ±=4250 т 'т). В выветре-
лых ракушниках оно резко снижается до 600 г/т при том же
содержании Р2О5. В хвостах флотации руд содержание Sr составляет от
140 (Кишисеп) до 500 г/т (Моорду). ,
В. 3. Блисковский [57], обобщив материалы по стронциеносности
фосфоритов России и сопредельных стран, пришел к заключению, что
концентрация Sr в них прямо зависит от содержания Р2О5 и соотноше-
ния Sr/Ca; наибольшая она в рудах, не содержащих сингенетических
карбонатов Са. В этом отношении осадочные фосфориты сходны
с эндогенным апатитом, который обогащен Sr в случае дефицита (.’а
(Хибины и др.). Для 10%-ных концентратов (по P2OS) первично-
осадочных фосфоритовых руд количество Sr 400—1200 ют, для
20%-ных—600—2400 г/г. Для вторичных фосфоритов роль Са еще
более отчетлива и при высоком ею содержании количество Sr обычно
нс превышает 300—500 г/г, редко 600—800 г'г
Высокой стронциеносностыо, по Т. Ф. Бойко [61 ], от тичатотся
гипсы разного происхождения (х, г/т): седиментационные котпипен-
тальные 2087 (Ca/Sr=190), седиментационные морские 1207 ±356.
эпит енетические 405 ±200, гипсовые шляпы 2220 ±350, ангидриты
1580 ±240, причем она ма ю изменяется от возраста, региона, типа
формаций и состава вод и имеет блиткот Ca/Sr отношение (~ 190).
В каустобиолитах, осадочных железных, марганцевых рудах и бок-
ситах концентрации Sr нс происходит В углях кларк стронция 80 i i (в
бурых 63), в торфе 50 г т [36, 474, 843], для отдельных районов
238
ферсмы колеблются or SO до /5 гм. В горючих и черных сланцах
содержание Sr для разных районов варьирует or 50 до 100 г/т. Нефти
почти не изучены. но, по Ф. М. Багпр-Заде с соавторами [20], в сырых
неф1ях Азербайджана оно составило 0,25 г/т, а по Г Л. Ботнсву,
в нефтях Балтийской провинции максимально—19 i/т. В бокситах
кларк стронция 68 i г. >ю согласуется с данными В. В. Буркова
(1980 г.) о низкой runepi синей устойчивости Sr (К, 0,1—0,5), завися-
щей от типа первичной породы Вынос Sr при выветривании составляет
(% к исходному содержанию): iранты 50—65, диоригы 50—60,
базиты 60-—70, ультрабазиты 50—60, сланцы 20—40; особенно
интенсивен вынос при лаюритнои выветривании (%): граниты до 80,
базальты 70 —90, амфиболиты 90. При изменении апатита Sr тишь
частично переходит в штаффс нит
Породы
Оценки для Sr в ранних (1)- к Гурскьян [924] и А. П. Виноградов
и поздних (II) [52] таблицах кларков для мнозих типов пород близки,
а самые поздние (III) оценки В В. Буркова [715], основанные на
наиболее полном обобщении данных, значительно оз дичаю гея; эти
оценки таковы (i i): улырабазиты 1(1), 1(11) и 17(111), базисы 465, 470
и 375. средние породы 440 , 450 и 460. гранодиориты 440(H); кислые
породы 100, 110 и 270. щелочные 2и0(1), 510(111), клипы, сланцы 300,
300 и 260, песчаники 20. 20 и 250, карбона пзые породы 2000, 610 и 379,
метаморфические 265(111). Видим большие изменения последних
кларков Sr для улыраосновных, кислых, щелочных пород, песчаников
и капбонагов. Распределение Sr, с учетом данных В. В. Буркова [716],
следующее.
Ультраосновные породы, по Г. Б. Лутцу |427] и В. В. Буркову
[716], разделяются на две группы (Sr, г/т): I) низкостронциевые
гипербазиты — алытинотипные реститовые (2,8, до 30), Срединно-
Атланзическою хребта (8,7—15) и океанические (\ 13,6): 2) высоко-
стронциевые ультрабазиты базальтоидных формаций—габбро-пиро-
ксенит-дунитовой (240+85. Урал. Восточный Саян), iаббро-норитовой
(197 + 32, Урал), габбро-перидотмговой (151 ±2, Кольский п-ов), габ-
бро-моннонит-сиениговой (170 + 49, Кавказ). Повышенные конценз
рации Sr характерны для коматиитов 38 + 9 г/г |664]. В первичном
мантийном перидотите, по Д. Шоу (1980 1.), расчетное содержание Sr
27 г/г, а в глубинных включениях ультрабазитов в кимберлитах оно
следующее (i/i): шпинелевый перидотит (8, гранатовый перидотит 43,
эклогит 81. кимберлит 600 [89, 427, 716]. При эюм в кимберлитах
минералами-концентраторами Sr являются автомстасомятичсски-гид-
ротермальпые серпентин, серпофит и кальцит, ицогяр целестин
и в меныней шепеви стронциант [716|. Для однотипных повод самые
низкие содержания Sr (г/ г) характерны для дунитов (1,5—72.
+ = 22 3 20), а самые высоки!—для иироксенито з (НО—459,
+ =187 + 78).
239
Основные и средние породы значительно обогащены Sr. В плутони-
ческих основных породах (габбро, диабазы) среднее содержание его
составляет 390 г/т, в эффузивных (базальты, траппы) 360 при среднем
генеральном для базитов 375 г/т [716]. Океанические базальты (405 г/т)
обогащены Sr по сравнению с континентальными (285 г/т) [716], хотя
по более ранним данным Г. Б. Лутца [427 ] и самым поздним
А. А. Ярошевского [857]. наоборот: океанический толеит 123 и 120 г, т,
кон । инсн гальный 450 и 300 г/т. Такое расхождение, по-видимому,
связано с зависимостью стронциеносиости пород от типа щелочности.
По Б. Г. Лутцу [427], концентрация Sr меняется так (г'г): толеит 286,
щелочно-оливиновый базальт 670. К-щелочной базальт 1500. Эта
зависимость прослежена для всех геодинамических обстановок [441].
В базитах разных серий областей сжазия (I) и растяжения (11)
содержания Sr следующие (г т): толеитовая серия—198(1)
и 285 + 98(11), известково-щелочная 435(1), K-Na субщелочная 638(1)
и 1040 + 640(11), шошонитовая 873(1). Высокие концентрации Sr
установлены в щелочных базальтах ультракалиевого ряда—до 3400 г'т
(+=1400 г/т) [716]. Еще более высокая оценка среднею дается для
субщелочных пород океанических островов (+ = 2000 гАг; для сравне-
ния—толеиты + = 230 г/т) [441]. Устойчиво повышенными являются
содержания Sr в базитах континентальных рифтовых областей (толе-
иты 415 г/т), субщелочные 735 г/т.
По В. С. Гладких [197], базиты содержат Sr (г т): толеиты
океанических островов 305, континентов 331, щелочные оливиновые
базальты океанических островов 612, континентов 561, базальты
островных дуг 409. Оценки средних содержаний для щелочных базитов
следующие (г/т): генеральное среднее для шошонит-лаз итовой серии
базальтов (по М. Н. Захарову)—трахибазальт 1154, абсарокит 1233,
шошонит 830, латит 1016, кварцевый латит 671; для щелочных
габброидов—тералит 2120. тешенит 1030, эссексит 1519, шонкинит
1060 [439]. В. С. Гладких показал, что наиболее высокая стронци-
еносность (г/т) типична для базальтоидов высококалиевой серии
(х= 1757), ниже она в K-Na высокощелочной с модальным лейцитом
(+=1437) и особенно низка в Na серии с модальным лейцитом
(+=1086) и без нею (+=1016) [197]. Изучение изотопов Sr показало,
что наиболее высокое отношение 87Sr/86Sr среди базитов характерно
для траппов (толеиты 0,7030—0.7150, субщелочная серия 0,7052—
0,7178 и шошониты 0,7032—0,7100), а самое низкое—для голеигов
океанического дна (0,7024—0,7035) и областей сжазия (0.7028—0,7038),
что свидетельствует о более глубинном поступтении Sr. Ушановлена
зависимость 8nSr/86Sr и 818О в изверженных и осадочных породах
[896]. Земная кора обогащена 87Sr по сравнению с мантией (см.
рис. 12).
Зависимость стронциеносиости толеитовых (Т) и известково-
щелочных (И) пород (Sr, г/т) от щелочности сохраняется для
различных значений SiO2(%): SiO2 48 — Sr Т 295, И 457; 56 — Т 251,
И 457; 64 —Т 214, И 398 [748].
240
Средние породы также значительно различаются по содержанию Sr
при среднем 460 г/т [716]. Плутонические породы (диориты, кварцевые
диориты, сиени1ы, монцониты) имеют оценку 570 г/т, вулканические
350 г/т. Ферсмы Sr (г/т) меняются в диоритах (+ = 418 + 245 г/т), от 220
(Европа) до 890 (Урал); в сиенитах 700 (Европа); в андезитах
(+ = 365 + 98) от 167 (Северная Америка) до 635 (Коста-Рика) и 790 (Перу)
при самых низких значениях для океанических андезитов (Восточно-
Тихоокеанское поднятие 106, Исландия 180), а самых высоких—для
андезитов активных континентальных окраин (635—790 Южная Амери-
ка); в трахитах от 75 (Новая Зеландия) до 240 (о-в Святой Елены).
Кислые породы охарактеризованы наибольшим количеством анали-
зов; им свойственно общее снижение стронциеносиости по мере
увеличения кремнекислотности и снижения концентрации Са [716].
Кларки (г/т): 1ранитов 200, гранодиоритов 495, кислых эффузивов 275.
По Л. В. Таусону, самыми высокими концентрациями обладают
граниты латитовою ряда (700 г'т) и палингенные грапитоиды щелоч-
ного ряда (650 г/т—см. габл. 25), по Ю. Б. Марину, грапитоиды
габбро-диоритовой (450 г/т и диорит-плагиогранитовой (650 г/т) фор-
маций. Низкие содержания Sr (г/т) типичны для ультраметамор-
фических гранитов (81), редкометальных плюмазитовых (70), щелочных
(40) и особенно Li-F гранитов (38). Для эффузивных пород содержания
Sr следующие (г/г): риолиты от 78 (Исландия) до 240 (Забайкалье),
риодациты 283 (Малая Антильская дуга), дациты от 180 (Исландия) до
450 (Камчатка), х = 316 + 65 (7 регионов); липариты 220 (Охотско-
Чукотский пояс); пантеллериты от 3 (Нигерия) до 50 (Южная Африка),
+ =18+15; комендиты от 2 (Новая Зеландия) до 20 (Африка), + = 9,6 + 8
(3 региона).
От AR (AR! 402 г/т, AR2_3 432 г/т) к PR (PR! 224 г/г, PR2_3
196 г/т) и к Ph (183 г/т) содержание Sr в гранитоидах снижается [664].
Сопоставление отношений 87Sr/86Sr в гранитоидах и связанном
с ними оруденении позволило Л. Н. Овчинникову [544] выделить типы
палингенных гранитоидов (I—V), для которых по мере увеличения
этого отношения и снижения времени образования, по-видимому,
происходит нарастание числа циклов рециркуляции и литофильной
редкометальной минерализации (Sn, Та, U, Be).
Щелочные породы отличаются самой высокой стронцисносностью.
По В. В. Буркову [716], полное обобщение аналитических данных
приводит к следующим оценкам средних содержаний Sr (г/т): средняя
щелочная порода 510, карбонатиты 4410, щелочно-ультраосновные
комплексы 1625, щелочно-габброидные 1150, нефелин-сиенитовые 755,
щелочно-гранигные 25. По В. Г. Лазаренкову [394], оценки заковы
(г/г): карбонатиты 3400, ийолиты 1946, лейцититы 1997 и т. д. В этих
породах-рудах содержатся промышленные эндогенные концентрации
Sr. Изотопные исследования показали низкие значения отношения
87Sr/86Sr (0,703—0,705).
Высокие концентрации Sr характерны, по В. С. Самойлову [685],
для всех геохимических типов карбонатитов (табл. 75). Более высокие
16 2138 241
Таблица 75
Среднее содержание ряда элементов в магматических щелочных
породах и карбонатитах разных формационных типов, г/т
Элемент Щелочные породы Карбонатиты
1 2 3 1 2 3
Sr 1240 2700 1780 6300 7000 6700
Ва 990 2500 1600 2800 8300 800
Nb 220 96 176 290 92 730
Та 23 6 16 13 3 14
Zr 490 530 460 320 260 200
Hf 7,3 9,6 7,5 1,9 2,2 2,3
V 198 140 64 НО 107 84
Pb 9 82 10 52 196 54
Zn 96 80 72 270 76 100
TR+Y 660 1190 240 2560 5700 1240
P 2300 1600 12 600 3100 5700
Sr/Ba 1,3 1,1 1,1 2,3 0,8 8,4
Примечание. I—3-—комплексы пород: 1—магматических щелочных с натриевой
спецификой, 2—магматических субщелочных (основных—средних) с калиевой спецификой,
3 — щелочных метасоматитов и сопряженных с ними палингенных сиенитов.
его концентрации и в общем низкие отношения Sr/Ba типичны для
формации карбонатитов с калиевой спецификой, по сравнению
с натриевой и с комплексом щелочных метасоматитов с палингенными
сиенитами. Наиболее стронциеносны поздние карбонатиты всех фор-
маций и фаций глубинности. Ранние и поздние карбонатиты комплек-
сов 1—3, охарактеризованных в табл. 75, имеют следующие оценки
средних содержаний Sr (%): 1) 0,51 и 1,2 (йриповерхностная фация);
2) 0,65 и 1,18 (приповерхностная фация); 3) 0,67 и 1,31 (абиссальная
фация). -»
Повышенные концентрации Sr установлены и в эффузивных
карбонатитах: в Na излившихся карбонатитах Восточного Рифта
(Африка) 1275—5100 г/т, в Са карбонатитах Западного Рифта 1150—
1605 г/т. ,
По данным Ю. Л. Капустина (1982 г.), в ранних карбонатитах (I
и II стадии) содержания Sr (г/т) более низкие, равномерные и в основ-
ном связаны с кальцитом I и II (среднее: I — 5200, II—6000), апатитом
(I — 3360, II — 3330) и другими минералами Са; в поздних кар-
бонатитах содержание увеличивается (кальцит III—5946), большое
значение имеет Sr-барит (11130) и пирохлор (8174), появляются
минералы Sr — целестин (преобладает на верхних уровнях) и более
редкие карбонаты Sr гояцит, сванбергит и др.
В агпаитовых нефелиновых сиенитах при среднем содержании Sr
905 г/т, что значительно ниже, чем в карбонатитах, он накапливается
в рудообразующих минералах (%): апатит 3,1, нефелин 0,12 (Sr),
лопарит 2,9 (SrO), ринколит 0,34 (SrO). Установлено, что в ийолит-
242
уртитовых горизонтах содержание в апатите возрастает от подошвы
к кровле и он может извлекаться попутно [535]. Характерно, что
сходные по типу агпаитовые нефелиновые сиениты в разных массивах
характеризуются различной величиной ферсма Sr (г/т): Хибины
1476+196, Ловозеро 752 + 49, Илимаусак 124 + 28.
Во времени содержание стронция (г/т) для основных эффузивов от
AR!-(113) к AR2j (305) увеличивается (PRj 271, Ph 289); в гранито-
идах—снижается (ARt 444, AR2 305, PRt 276) [663].
Осадочные породы разных главных типов и обстановок образова-
ния значительно отличаются по стронциеносности. По данным
В. В. Буркова [716], кларки Sr составляют (г/т): сульфатолиты (гипсы
и ангидриты) 1900, карбонатные породы 370, глины 260, пески и пес-
чаники 250, галолиты <30. При осадконакоплении Sr концентрируется
и аккумулируется в результате: 1) хемогенного осаждения в эвапорито-
вых бассейнах; 2) биохемогенного осаждения; 3.) сорбции глинистыми
минералами, 4) осаждения терригенных минералов, обогащенных им.
Хемогенное осаждение Sr в эвапоритовых бассейнах начинается при
насыщении рассола гипсом (плотность рассола 1,12 г/см3, соленость
8—15% NaCl) с образования целестина в доломитах и доломитизиро-
ванных известняках, обычно подстилающих гипсоносные толщи.
Благоприятны для появления целестина аридные условия терригенного
породообразования, наличие подстилающих толщ сульфатных пород.
В этих условиях могут возникать седиментационно-диагенетические
целестиновые месторождения в красно- и пестроцветных формациях.
На сульфатной стадии галогенеза Sr осаждается вместе с гипсом
и ангидритом, а в количественном отношении его садка идет на убыль. «
При гидратации ангидрита (наиболее емкого для изоморфного
замещения стронцием—х=2317 + 490) Sr выделяется в жидкую фазу
и осаждается в виде целестина, ассоциируя с вторичными гипсами. При
максимальном осолонении Sr, по Т. Ф Бойко (1973 г.), не накапливает-
ся в солях Na и К (NaCl — 8—30 г/т, КО <5 г/т), а переходит в воды
водоемов хлоридного типа.
Большое значение В. В. Бурков придает хемо- и биогенному
осаждению Sr с карбонатами, в первую очередь с арагонитом.
Концентрация Sr в пелагических осадках происходит в илах, обогащен-
ных органогенными компонентами (г/т): фораминиферовые илы 1200—
1300, пелагические глины 120—800, радиоляриевые 100^—225. Он
накапливается в скелете организмов прямо пропорционально отноше-
нию Sr/Ca в воде. Рост солености может оказывать благоприятное
действие, а понижение температуры вод—отрицательное.
Среди карбонатных пород в соответствии со сказанным на-
ибольшие количества Sr характерны для органогенных известняков
(до 1030 г/т—ферсм для плейстоценовых известняков Италии) и пер-
вично седиментационных доломитов с примесью целестина (эва-
поритовые бассейны). По содержанию Sr доломиты образуют
следующий ряд: седиментационные > диагенетические > эпигенетичес-
кие. По А. Б. Ронову с соавторами, количество Sr в известняках
16* 243
значительно увеличивается для Русской платформы снизу вверх
по мере омоложения возраста (PR 33 r/т. третичные 1500 г'т).
То же характерно, по его данным, и для Северо-Американской
платформы. Е. Уздовски (1973 г.) связывает это с преимущественным
образованием арагонита в MZ—KZ, а по В. В. Буркову, это
может быть обусловлено усилением биологического фактора [716].
Более высокие концентрации Sr характерны и для более молодых
сланцев по сравнению с древними (г/т): AR( 66, AR2_3 190, PRf 167,
PR2_3 146, Ph 223 [663]: аналогичная зависимощь установлена для
Канадского и Австралийского щитов: сланцы раннеархейских зете-
нокаменных поясов 56 + 32, позднеархейских 135 + 65, постархейских
450 [749].
Изучение фракций терригенных пород показало, что содержание Sr
увеличивается по мере снижения их размерности (г'т): Баренцево
море—ил 280, глина 177; залив Пария—песок 147, глина 203. Содер-
жание во взвеси рек меняется в широких пределах (г/т): Амазонка 309,
Конго 61, Гаронна 164, Меконг 92. По способности сорбировать Sr
В. В. Бурков приводит следующие ряды глинистых минералов: ка-
олинит > диккит > галлуазит или монтмориллонит > галлуазит > каоли-
нит > диккит; присутствие больших количеств (СО3)2 и (SO4)2
снижает количество сорбированного Sr. В современных океанических
и морских осадках имеет место прямая корреляция Sr—СаСО3, а доля
глинистой фракции в балансе Sr не превышает 20% [716].
Содержание Sr в породах регулируется фациальными условиями,
которые, однако, действуют не однозначно. По данным В. В. Буркова,
обобщившего данные по стронциеносности континентальных (К),
морских (М) и лагунных (Л) пород Ферганы, концентрация его
значительно увеличивается в ’этом порядке (г т): глины 160 (К), 218
(М), 1645 (Л), песчаники 170, 244, 1770, известняки 218 (М), 277 (Л).
В то же время для глинистых отложений Таджикской депрессии
приводятся [178] разноречивые данные (г/т): юрские континентальные
341—371, морские 302—349, прибрежно-морские 225—273, меловые
континентальные 200, морские 248, причем основное количество Sr
приурочено к пелитовой фракции. В 5% НС1 вытяжку из этих пород
наибольшее количество Sr (66—83%) выщелачивается из морских глин,
наименьшее (7—34%) из континентальных; самое неустойчивое поведе-
ние Sr—для пород заливно-лагунной фации (9—63%). Для извест-
няков этой территории установлена тенденция повышенных концент-
раций Sr (г/т) для гумидных (I) обстановок по сравнению с аридными
(II): прибрежно-морские I — 502, II—440; заливно-лагунные 1 — 523,
II—486.
Изучение форм нахождения Sr в глинистых отложениях Таджикской
депрессии [570] показало, что доля различных форм нахождения Sr
зависит от фациальных условий; повышенное количество (г/т) водора-
створимой формы и поглощенного комплекса установлено для
морских (~9 и 31) и мелководно-морских (6,3 и ~21) фаций, меньшее
для лагунных (2,4—2,6 и 16—17); содержание (г/т) труднорастворимой
244
формы выше для лагунных глин (30,1) по сравнению с морскими (14),
силикатной—для прибрежно-морских (65%) по сравнению с морскими
(46). С другой стороны, имеются данные [178] для Алтае-Саянской
складчатой области, свидетельствующие о более высоких средних
содержаниях Sr в континентальных известняках С! (1000 г/т), по
сравнению с морскими Р2_з (600 г/т).
Большинство исследователей отмечали ограниченное вхождение Sr
в доломит [716]. Однако, по Т. Ф. Бойко [61 ], для различных районов
нашей страны в осадочном доломите его содержание колеблется от 465
до 8200 г/т (±=550 ±45). Изучение известняков Тасмании Р. Прасадом
(1989 г.) показало обратное соотношение Sr и Mg, что связывается
с незначительной ролью пресных метеорных вод в процессе доломити-
зации, которая происходила в морских условиях.
При изучении изотопного отношения 87Sr/86Sr в карбонатах
установлено, что оно увеличивается от ARi (0,700) к PR (0,707)
параллельно с увеличением АК, уменьшением AMg и AFe (для
сланцев), а на рубеже PR3 и Ph отмечается инверсия (от 0,710 до 0,708).
Особенно отчетливо приток мантийного вещества имел место в MZ—
KZ [664].
Метаморфические породы мало отличаются по стронпиеносности,
которая в первую очередь зависит от состава первичных пород. По
В. В. Буркову, генеральные оценки средних содержаний Sr в главных
типах метаморфических пород статистически не различаются (г/т):
сланцы 285 ±49, гнейсы 275 ±98, амфиболиты 260 ±80, гранулиты
280 ±50; самая низкая оценка характерна для кварцитов (30), самая
высокая для мраморов (495, Канада). Кларк Sr в кристаллических
сланцах и парагнейсах 160 г,'т [725, 857]. По данным А. А. Кременец-
кого и Н. К. Дмитренко, в процессе метаморфической эволюции
метапелитов происходит некоторое накопление Sr в средне- и высоко-
температурных зонах, а для метабазитов, наоборот, выявлен неболь-
шой вынос его из высокотемпературных зон. По Б. В. Петрову,
изменение степени метаморфизма пелитовых и карбонатных пород на
Патомском нагорье почти не влияет на уровень содержания Sr, а также
на закономерности его взаимоотношений с Са и Ва. В основном Sr
приурочен к плат иоклазам и карбонатам.
В то же время, по исследованиям Б. В. Петрова, В. А. Макрыгиной
[726], средние содержания Sr в плагиомигматитах, мигматитах
и I ранитогнейсах гранулитовой фации метаморфизма Патомского
нагорья в 4—5 раз выше, чем в тех же породах амфиболитовой фации,
в связи с чем ферсм метаморфических пород гранулитовой фации
(336±78 г,т) выше, чем амфиболитовой (203±39г/т). Содержания Sr
в минералах метаморфических пород следующие (i /т): в кальците
метаморфизованных известняков 4100—7800, известково-силикатных
метаморфитов 1250—4200, в Fe-доломите 1160, анкерите 620—4330,
клиноцоизите 2600; в плагиоклазе гнейсов 560—1580. В условиях
высокотемпературных фаций минералы Sr (фосфаты, бора гы, суль-
фаты) неустойчивы [716].
245
Почвы, растения, животные
В почвах Sr распространен широко, по А. П. Виноградову, его
кларк 3 10-2%, а содержание колеблется от 18 до 3500 г/т и кор-
релируется с Са, в меньшей степени с Mg. При выветривании Sr легко
мобилизуется, особенно в кислой окислительной среде. Он легко
осаждается при осадконакоплении в виде биогенных карбонатов,
а в зоне гипергенеза захватывается глинистыми минералами и ор-
ганическим веществом. Содержание Sr в почвах коррелируется с их
составом, климатическими условиями [312] и ландшафтами (табл. 76).
Кларк Sr в почвах по А П. Виноградову (300 г/т) отражает повышен-
ную стронциеносность русских сероземов и солончаковых пдчв.
Средние содержания Sr в почвах бывшего СССР, по А. А. Беусу
с соавторами, таковы (мг/кг): подзолы 238, лесные 675, озерные лесные
258, черноземы 260 (СОСП-1 курский 130), каштановые 289, сероземы
305, солончаки 335. Фон для Московской обл. 28 г/т [682].
По Т. Вест (1979 г.), содержание Sr в почвах на базальтоидах
(340 г/т) выше, чем на гранитоидах (160 г/т). В почвах США [914] оно
в среднем составляет (мг/кг с.): светлые почвы пустынь, почвы на
вулканитах 445, гранитах 420, лёссовые на алевролитах 305, пылеватые
прерии 215, черноземы 170, лесные 150, легкие супесчаные 175,
литосоли на песчаниках 125, органические легкие ПО. Почвы гумид-
ного климата северных районов очень бедны Sr (~17 мг/кг—Дания),
самые высокие его содержания в лесных (Россия) и пустынных (США)
почвах. Стронциеносность почв, по В. В. Буркову, записи! от субстра-
та, климата и гидрохимических условий и составляет для нашей
страны (г/т): таежно-лесная почва нечерноземной зоны 320; лесостеп-
ная и степная черноземная—серые и лесные почвы 100, черноземы 90;
сухостепная, полупустынная и пустынная—горные 260, пойменные 680.
В кислых почвах Sr активно вымывается вниз по профилю, в извест-
ковых может замещаться различными катионами [312]. В лесных
почвах М. А. Глазовской (1967 г.) установлено обогащение горизонта
Ai по сравнению с А2 и даже с первичной породой.
Радиоактивный изотоп 90Sr наиболее биологически опасен и его
круговорот в основном связан с Са и 88Sr. Он максимально подвижен
в легких почвах, из которых легко переходит в растения. Установлено
соосаждение 90 Sr и гидроксидов Fe, что ведет к аккумуляции этого
изотопа в богатых Fe почвенных горизонтах, а также в тяжелых
гумусовых почвах [312]; сорбентами 90 Sr являются такие ионообмен-
ники, как цеолиты и Fe-Mn конкреции [811, 812].
В почвах над месторождениями Sr содержание его колеблется от 0,2
до 1,0%, в золе коры сосны в основном от 0,3 до 3,0% (максимальное
в золе коры 15%) [331 ]. В. В. Ковальский отмечал, что в Таджикистане
в районах месторождений Sr среднефоновое содержание составляет
9500 г/т, а максимальное 9,5%; здесь в почвах выявлены минералы Sr
(гояцит, сванбергит). Продукты жизнедеятельности почвенных организ-
мов способствуют растворению его* минералов и выносу Sr [716].
246
Место элемента в геохимическом ряду подвижности о ° ® ° ° о о ° ° ° о .с о с . ГТ X <0 о . га О N Z > га га га О й
о _ о ° о ГТ и. ° U ° ОД ° 3° С N Д N Д Д Д Д О и S
оо О о ° VT) , VS IZ7 С СЗ с я О 3 з д Z N И и и О
Г- О — <3 о S о ° ° о о ггчЗ - ’Г гл о о еч СС U й N Рч Й > S Z сц
ко ° О ~ » 2 ЧТ g g Z > О U со Z ZZS и
кП 5Q 04 1/1 Е с S о ° СЧ с ~ *2 с з ° °° > Z S N N S «О w S N
-г ° ° ° £ = о *3 О q Г- О СЧ о 3 ГЧ О О' О О- СТЗ ОО О S S > О > и CQ сс со
о U-, О 5 ° Й ЧТ ЧТ 2 ю ® е з п о £ оо оо ТО ь-, О ша ОО Ьч rrj и и га S и и S > n га
сч о <5 So S S £ о «ч— *3 »- ц-< c k- Ox О z га и и 2 n и n га >
— goo о о g о о _ о о о ° 'g ° S 2 ° § о N N Z S Z <5 N га > Z
Гео- хими- ческий округ •— 04 П —> 04 m г— 04 СП —.
1 >• и почвенного покрова Водно-ледниковая озерно-равнинная область, сложенная озерно-ледниковы- ми глинами. Дерново-подзолисто-гле- еватые и глееватые почвы поверх- ностного увлажнения Конечно-моренная возвышенная рав- нинная область. Холмистый и поло- говолнистый рельеф Слабодренируемые моренные абради- рованные равнины Моренно-равнин- ная пониженная область. Значитель- ная заболоченность почвенного пок- рова Гляциально-эрозионно-цокольная по- ниженная область. Сельговый рельеф
Примечание. Рядом с символом химического элемента приведена его подвижность, %; для элементов, расположенных слева от
двойной линии ||, характерен процесс рассеяния, справа — накопления.
247
Биогенность Sr высокая (0,97), наибольшая в пустынных районах
(до Ь), меньшая в степных (0,6), лесных (0,15; деревья 0,05, травы 0,15)
и тундровых (0,036) [198].
Кларки Sr следующие (мг/кг с.): растения морские 260—1400,
наземные ~30; животные морские 20—500, наземные ~ 14: [860].
В бактериях содержание 2,7—300 г т. Оценки для планктона таковы
(г/т): фито- 390, зоо- 120, татальный 330 (взвесь 300, пелле гы 500). В золе
наземных растений среднее содержание Sr, по А. Л. Ковалевскому, 0,2%.
В растениях Sr обычно накапливается в корнях и стеблях (но не
в листьях) в прямой пропорции с Са. Нормой для почв считается
содержание Sr 600 мг/кг, избыточным 600—1000 мт,кг—при таких
условиях создается возможность уровской болезни [312, 335, 336].
Содержание Sr в растениях варьируют в широких пределах—от
<1 до 10000 мг/кг, обычно 10—1500 мг'кг (с.). Более высокое оно
(мг/кг) в бобовых (клевер 219, люцерна 662), луке (50), салате (74),
низкое—во фруктах (0,5—0.9), зерне (пшеница 1,5, овес 2,5, кукуру-
за <1), картофель 2,6, повышенное в кормовых травах (наземные части
24). По другим данным [335] наиболее богаты Sr (%) растения
семейства зонтичных (0,044), лоховых (0,036), винот радовых (0,037),
затем идут розоцвегные (0,024), бобовые (0,023), перечные, (0,012).
злаковые (0,011) и пасленовые (0,009).
Средние содержания Sr в растительном пищевом сырье для нашей
страны следующие (мкт /кг ж.): пшеница 1500—2300 (выше в мягкой
озимой), овес 1210, гречиха 3040. горох 800. соя 670 [797]. Взаимодей-
ствие Sr-Ca и Sr-P противоречиво [312].
Токсичность Sr для растений различна; по X. Шаклетг (1978 г ),
токсичный уровень составляет 30 мг/ki (з.), хотя примеров Sr
поражений не установлено [312]. Наоборот, радиоактивный 00Sr легко
поглощается растениями. И. В. Гулякиным и другими исследователями
(1975 г.) экспериментально установлены следующие его концентрации
(нКи г с.): бобы до 565, овес—зерно 1 —11, солома 17—137; особенно
он накапливается в бруснике. Активность 90Sr может быть снижена
внесением в почву Са, Mg, К, Na.
В живых орт анизмах Sr выступает как аналог Са, но менее активно
транспортируется через мембраны. Радиолярии, акантарии строят
скелет с участием SrSO4; до 0,5% Sr содержат кораллы, арагонитовые
раковины, до 1,5% моллюски, до 1—2% мшанки [574]. Содержание Sr
в органитме человека, по Ю. И. Москалеву [512], 0,32 г (почти весь.
>99% — в скелете), суточное поступление с пищей 1,9 мт. всасывание
высокое—0,3 (0,1—0,6 для хорошо растворимых соединений).
Суточное содержание Sr в пище человека разных стран, по
Е. Хамильтон (1981 т.), следующее (ммоль):. США 21,7, Англия
9,8 ±1,6, Индия 45,6.
В различных средах и органах человека Sr распределен следующим
образом (в скобках число анализов): кровь (мг л)—общая 0,031+0,005
(256), эритроциты 0,007 (15), плазма 0,028—0,044, ±=0,035; сыворотка
0,03—0,04; молоко 20 мкг/л; прочие органы (zz -10 *’): кость 55—96 (3,
*248
ж.), 100—160 (>300, з.); мозг 0,08 (10, ж), 0,07—3,5 ( 70, с.); волосы
0,05—0,9 (700); сердце 3,5—7,7 (>200, з.); почка 0,1 (16, ж.), 0,15—1,5
(180, с.), 7,6—16 (>200, з.); печень 0.1 (11. ж.), 0,05—0,18 (116, с.), 4 (315,
з.); легкие 0,12—0,2 (13, ж.), 0,4 (68, с.), 9,8—14 (>200, з.); мышцы 0,05 (6,
ж.), 3—21 (140, з.); ногти 0,017—0,65 (23); кожа 0,02 (18, с.), 8,8—13 (35,
з.); селезенка 0,08 (67, с.), 4,4 (300, з.); зуб 70—100 [931 ]. При избытке Sr
у растущих животных развивались нарушения обмена и стронциевый
рахит. С увеличением возраста всасываемость снижается (до 0,05—0,25),
так же как и для труднорас творимых соединений (<0,01). Снижается
с возрастом и отложение Sr в скелете. При уровской болезни содержание
Sr в костях в 5—8 раз выше нормы. Выведение Sr из организма
происходит быстрее, чем 90 Sr, Г6 для которого составляет 980 сут [512],
а эффективный период его полувыделения определен в 5700 сут.
Радиотоксичностью обладает также 89Sr, имеющий эффективный период
полувыделения ~50 сут., биологический 13000 сут. и характеризующийся
довольно полным всасыванием в орт анизм (с пищей 30—80%, из воздуха
40—50%). ПДК для радионуклидов 9°Sr и 89Sr таковы (Ки,'л): ПДК_3
3-10-13 и 3-10 ", в воздухе санитарно-защитных тон 3-10“14 и 3-10 ,
населенных пунктов 3-10 15 и 3-10 13, ПДКВХ 1ВП 3-10 11 и 3-10 9
[511]. 89Sr опасен в ранние периоды ядерных выбросов, 9,1 Sr—в более
отдаленные сроки. Отт хорошо растворим в воде и легко проникает
в организм. Подобно Са. он накапливается в сене и в зерне злаковых
н с хлебом попадает в организм человека, концентрируясь в основном
в костной ткани, и крайне трудно извлекается. Особенно интенсивно он
концентрируется в растущем оргатгазме [27, 511].
Sr также преимущественно накапливается в организме детей—до
четырехлетие! о возраста. Рабочие стронциевых и, возможно, бариевых
производств заболевают сердечно-сосудистыми болезнями; заболева-
емость прямо пропорциональна стажу их работы. Отмечалась слабая
прямая корреляция между частотой онкологических заболеваний
и содержанием в почве валовых количеств Sr, а также уровская болезнь
костей при обогащении вод [128, 861].
На этом перечень патологий, связанных с избытком стабильных изо-
топов Sr, ограничивается. Эго не относится к высокопатологичным 90Sr
и 89Sr. 88Sr расположен в условном ряду относительно низкопатологич-
ных тлемеш ов (при избыточном содержании); Si > I ~ Bi ~ Sr ~ Pt > In;
данные о патологиях при его недостаточности отсутствуют [484].
Воздух, вода, техногенез
В атмосферном воздухе над южным полюсом установлено
5-10*2 нг/м3 Sr, над океанами 4,6• 10~3 мкг/м3, а аэрозоле 300 г/т.
Фоновое содержание над крупными городами от 4 до 5 нг/м3 [626].
Содержание Sr (1970-е годы) в атмосферных осадках района
бассейна Верхней Волги следующее (мкг/л): в растворе 12, во взвеси 5;
плотность выпадения такова (кг/м2-год): раствор 6,7, взвесь 2,8, всего
9,5 [590].
249
Кларки Sr составляют (%): океаническая вода 7,6- 10 4, речная
7 10 5. В реках аридных зон (Пяндж, Ангрен), но В. В. Ковальскому
с соавторами, содержатся (3,2—3,5)10 3% Sr. в США—до 8-10 3%.
В морской воде концентрация Sr прямо связана с соленостью.
Минимальные содержания Sr установлены в озерах гидрокарбонат-
ного, а максимальные—хлоридного и сульфатного типов (Индер,
Эльтон—0,5—29,5 мг/л). Повышенные концен 1 рации характерны для
озер районов молодого тектогенеза и вулканивма (0,7—5,3 mi /л).
Максимальные содержания типичны также для хлоридных вод, солевое
питание которых осуществляется подземными водами (mi/л): Баскун-
чак 247, Уштаган 164, Экибастуз 37, Туз 58 [716]. По Н. Ниссенбаум
(1977 I.), в рапе Мертвою оз. (Израиль) с общей минерализацией
310 I/л и Cl-Na-Mg составом содержание Sr достшает 308—330 мг/л.
Нередко высокое!ронциевые Cl-Ca-Mg, Cl-Ca-Na-, Cl-Mg-Ca воды
ассоциированы с породами, обобщенными целестином.
В маломинерализованных гидрокарбонагных и сульфатных водах
распределение Sr, по В. В. Буркову, рыулируется произведением
растворимости SrCO3 (1,1 • 10 10—5 Ю-10) и SrCO4 (2,1 10 J. В гид-
рокарбона гных водах содержание Sr уменьшается с ростом концент-
рации (СО3)2, в сульфатных водах наличие (SO4)2“ стимулирует
осаждение целестина. Воды этих классов обычно обеднены Sr [716].
В хлоридных водах содержание Sr возрастает с содержанием Са.
Л. С. Балашовым показана обратная взаимосвязь Sr (mi /л)—Na
(%экв): 45—95, 113—93, 137—91, 169—89, 192—87, 253—85,
257—83, а содержание Sr увеличивается с повышением общей
минерализации и глубины залегания (см. табл. 73).
С. Р. Крайнов [365] и М. С. Галицин сопоставили распределение Sr
в разных типах грунтовых вод (забл. 77) и показали, что основной
формой является Sr2 + , тогда как SrSO4 и SrCO3 присутствуют только
при pH >7,5 и в незначительных количествах. Для маломинерализован-
ных подземных вод содержания Sr обычно изменяются оз <1 мг/л
в тумидной зоне до превышающих ПДК в аридной. При этом
увеличение содержаний Sr и Са происходил одновременно, что
обусловлено в основном испарительным концентрированием и выщела-
чиванием из вмещающих пород сульфатов -и других минералов Са и Sr.
М. С. Галициным [366] выделены гидрогеохимические провинции
сгронцийсодержащих подземных вод (рис. 13). Они оконтурены по
площади распространения НСО3-Са и SO4-Ca вод с повышенной
минерализацией и жесткостью. Для i рунтовых вод они тяготеют
к аридной зоне, а для напорных—к артезианским бассейнам с гипсо-
носными породами. Типичными примерами являются Казахстанская
провинция, в которой при незначительной общей минерализации
(и г/л) количество Sr досзигаег 10 мг/л, Молдавская (тортон—сармат-
ский горизонт)—25 мг/л. Московская (верхнефаменский гипсоносный
горизонт)—цо 20 мг/л. Повышенные (5—15 мг/л) концентрации Sr
известны также в подземных водах пермских гипсоносных пород
Русской платформы и Предуральско! о прогиба.
250
Таблица 77
Распрос।ранение Sr в разных iHiiax грунтовых вод
Тип вод Хи ми чески и coci а в; м и пера - лизацня М, I *л Содержание Si МКГ I
1. Грунтовые зоны выщелачи- вания НСОз-Са; М<1 100- -2000
2. Грунтовые юны континен- «азьного засоления Cl-SO4-Na; М до 5 500—7000
3. Углекислые пластово-тре- щинные и трещинно-жильные горносктадчатых областей HCO,-Na. НСО,-Cl-Na, Cl-HCOj-Na; М до 30 п 100--п- 10000
4. Пластово-трещинные арте- Cl-Na; М то 300 (5—200)- К )1'
зианских бассейнов Cl-Ca-Na; М до 600 (8 10) 10 s
5. Озер аридной зоны Cl-SO4-Na; М до 320 (1—30) 104
Важнейшее биохимическое значение придается и i ношению Са'Sr
в подземных водах [726]. Сравнительно низкие отношения (< 100)
могут явиться источником уровской эндемии. Очень низкие отношения
Са Sr свидетельствуют об увеличении роли целее гиповой мине-
рализации.
КонценIрапия
А. Е. Перельману
(мкг /л): средний
Sr в подземных водах поверхношной. по
[726]. зоны лан щтафгных условий следующая
общий состав 185; области континентальною
Рис. 13. Схема распространения Sr в маломинерализованных подземных водах
первою от поверхности водоносною горизонта [366]:
Вероятные п|коблалак>щие содержания Sr, mi, i: 1 — менее 0,5, 2—от 0,5 ю 2, 3—oi 2 до
7. 4—более 7
251
засоления 493; зоны выщелачивания—среднее 108, умеренного кли-
мата 245, горные 109, субтропики 54, полярные 24.
В термальных водах гейзеров вулканических областей содержание
Sr от 0,002 до 14 мг/л, вне проявления гейзеров—до 0,06 mi /л [770],
в рудных термальных рассолах впадин Красного моря от 0,01 до
0,08 мг/л [726].
Среднее содержание Sr, по В. А. Петрухину [590], в поверхностных
водах (растворенная форма) бассейна Верхней Волги (1970-е юды)
составляло (мкг/л): водохранилища 100, реки — Москва 100, Вазуза
170, Волга 120 (для мира 100 [883]). Другие оценки для этого района
(мкг/кг; с.): в речной взвеси 56, илах 22, почвах 20, золе водных
растений 440 [590 ].
В сточных водах городов содержание Sr колеблется от 0,018 до
0,033%, а в осадке сточных вод—0,033% [13].
Техногенная геохимия Sr изучена слабо [127, 160, 682], несмотря
на то, что этот элемент имеет один из самых высоких коэффициентов
гидротоксичности (Тг = 50). В техногспезе имеет высокий показатель
деструктивного воздействия. В общеэкологическом плане существен-
ное негативное значение принадлежит как стабильным, так и особен-
но радиоактивным изотопам Sr. Показатель деструктивного воздей-
ствия стабильных изотопов Sr оценен довольно высоко (0, п) [198].
Особенно опасны экологически сточные и грунтовые воды районов
добычи и переработки стронциевых и апатитовых руд, фосфоритов,
Fc-Mn конкреций, некоторых типов редкоземельных руд (кар-
бонатиты, нефелиновые сиениты). Во всех случаях концентрация Sr
в водах этих объектов превышает ПДК„. Большое количество Sr (i i)
поступает в почвы, а затем в грунтовые воды с ai рохимическими
добавками (фосфатные удобрения 25—500 и более, известняки до 600,
ор!анические удобрения до 80), а также с оросительными сточными
водами (40—360; осадки сточных вод до 300—500) [312, 681].
В продуктах мусоропереработки содержание Sr достшает 0,1% [160].
Концентрации Sr установлены при обследовании пылей, твердых
и жидких отходов [681] в цветной металлургии и химии (завод
масляных красок, цех печатных форм), электро-, радиотехнической,
аккумуляторной промышленности, в цементном, керамическом, сте-
кольном, сахарном и других производствах, на предприятиях ор-
ганического синтеза. Он также накапливается в выбросах пиротех-
нических, фармацевтических, спичечных и антисептических произ-
водств [231 ].
Изучение населенных пунктов показало [682], что фоновое содер-
жание составляет 28 г'т Si, а максимальное содержание в почвах
крупных городов 44 г т.
После начала ядерных испытаний, ядерных взрывов и катастроф
наиболее опасным является 90Sr.* Имеются О1раниченные данные по
* По образному выражению Р Лапп (1959 г), «одна чайная ложка 90Sr
может умертвить все население Земли».
252
распределению радионуклида 90Sr в разных средах в периоды ядерных
испытаний и катастрофических выбросов на АЭС [634, 722]. Об-
наружена прямая корреляция между ядерными испытаниями в атмо-
сфере США (1953—1978 гг.) и количеством 90Sr в пищевых продуктах.
Так, опреде лена следующая зависимость между суммарной мощностью
ядерных взрывов (мет а тонны — Мт) и средним содержанием Sr (Бк/кг):
10 Мт~0,1 Бк/кг; 30—0,2; 70—0,5 [634]. При этом концентрация,
приводящая к дозе 10 мкЗВ, в критической труппе составляет для 9 Sr
(Бк/кг): молоко 0,3, рыба 4 [874]. На Чернобыльской АЭС после
аварии повышенным уровнем радиоактивности по 90Sr (зона отселе-
ния) принималось значение 3 Ки/км2 [722]. По А. И. Ильенко
с соавторами (1991 г.), ВДУ 90Sr и 137Cs (Ки/кг) для зараженных
территорий 110 8, для фоновых 5 • 10“ 8 (мясо, рыба, овощи) и 2 - 10'8
(картофель). Дезактивация проводится раствором NaCl в Н2О.в про-
точном режиме. В 1960 г. В. А. Книжниковым было впервые установ-
лено, что радиотоксичность и накопление в живом веществе 90Sr
снижаются с увеличением потребления F*.
Захоронение отработанных радионуклидов (АЭС) в естественных
долговременных хранилищах по расчетам отечественных исследова-
телей безопасно при наличии в породах кровли хранилища толщи
среднезернистого песка мощностью >10 м и при стабильных геологи-
ческих параметрах. Эти допуски не могут считаться надежными
и требуют более осторожного и комплексного подхода с учетом
геолого-гидрогеологических и геотехнологических особенностей терри-
торий.
Выводы. Среди щелочноземельных элементов Sr имеет повышен-
ную биофильноезь и особенно биогенность (Бг = 97), лито- и гид-
ротоксичность (Тл = 5, Тг = 50), высокую гидроэкофильность
(ГЭФг = 50) и преимущественно концентрируется в гипергенных
и низкотемпературных гидрогенных процессах, ГЭМ целестина 5 103,
стронцианита З-IO3; ГЭ литофильных месторождений Sr 5-103,
гидрофильных—1 104. В магматическом цикле он накапливается
только в щелочных высококальциевых породах, в осадочно-гидротер-
мальном образует собственные и Sr-Ba месторождения, попутные
концентрации в некоторых типах подземных хлоридных вод, хемоген-
ные сульфатные и карбонатные руды в эвапоритах и примесь
в стратиформных полиметаллических и синвулканических германий-
угольных месторождениях. Существенное значение в осадочном
накоплении Sr играет испарительный фактор, меньшее—биогенный.
Отмечалось обогащение Sr осадочных пород по мере омоложения их
геологического возраста, а также почв. В техногенезе и экологии
имеет высокий показатель деструктивного воздействия; существенная
негативная роль принадлежит как стабильным, так и особенно
радиоактивным изотопам Sr.
* Ю. П. Конюшая. Открытия советских ученых.— М Изд-во МГУ, 1988.—
С. 174.
253
БАРИЙ — 56
Распросграненный (кларк 0,047%), сильно токсичный (Т„ = 10).
патологичный металл. Для соединений Ва ПДК и воздухе следующие
(мг/м3): для ВаСО3 ПДКр1 0,5, ПДКСС 0,004 (I класс опасности);
Ва(ОН)2. ВаР ПДКрз 0,1 (11 класс); Ba(NO,)2 ПДК,,. 0,5 (11); BaSO4
ПДКР> 6 (III) и др. [674]. ПДК„ — 0,1 мг л. В США ПДК для Ва
в воздухе 0,01 мг/м3 [231]. Избыточное содержание в почвах 600—
1000 мг/кг (см. табл. 3).
Атом
Атом состоит из семи изотопов (А—130—138), преобладает ,зьВа
(71,66%); радионуклид 140Ва имеет Т1/2 13 сут. Этот короткоживущий
изотоп радиотоксичеп с ПДК (Ки'л): ПДКр1 4-10 1 *, в воздухе
санитарно-защитных зон 4 10-12, населенных пунктов 4 10 |3;
ПДК.ХВП 7 10 9 [27].
Барий (6.s2) является самым тяжелым элементом 11 группы
(валентность II). По многим свойствам он очень близок к Sj
и особенно к Ra (см. табл. 51, 52) и значительно отличается ог Са,
а также Cs, Ag, Cd, Au, Hg, La. TI, которые окружают его
в периодической таблице и иногда встречаются с ним в геохимических
системах. Свойства Ва типичны для щелочноземельных металлов.
Химическое сходство и различие с остальными представителями 11
группы видно из положения элементов в рядах растворимости,
составленных А. И. Перельманом [574]: сульфаты — MgSO4 (легко
растворим) > CaSO4 (трудно) > SrSO4 > BaSO4 > RaSO4; карбонаты —
RaCO3>BaCO3>SrCO3>CaCO3>MgCO3 (см. также табл. 58) Ряд
энергии поглощения щелочноземельных металлов различными адсор-
бентами таков; Ba>Sr>Ca>Mg; особенно характерна для Ва сорбция
марганцевыми образованиями. Слабо растворимы в воде ВаСО3 (Пр
8 10 °), BaSO4 (2,3 10 3 г/л, Пр 1.1 10 1П) и Ва3(РО4)2 (Пр
1,3- 10 29); более растворимы BaF2, BaO, ВаО2, BaS, BaSeO4, Ba[SiF6];
растворяются в воде и токсичны ВаОН2 (38,9 г л), Ва(Н >РО2)2
(286 г/л), ВаВг (1040 г/л), ВаУ (2044 г 'л). ВаС12, Ba(NO3)2, В.г(С1О352*
Ba(CN)2 [231].
Минералого-геохимические свойства Ва в эндогенезе только чиго-
(Л,о0) и оксифильные (О|00), в экзогенезе—сочетаются с халькофн.чь-
ными. Средние содержания его (г'т) в континентагьной земной коре
250, в верхней 550, нижней 150. архейской 26/, в примитивной мантии
5,1 [749], в земной протокоре 150 [372]. Осадочный слой богаче Ва
(460 г'т), чем кристаллический фундамент (390 г г) [898].
Оценки среднего содержания Ва в мегсоритах следующие (г'г):
хондриты 5, углистые хондриты 1, ахондриты 2, Са-ахондригы 35,
Fe-Мп палласиты 5 [107]. Содержания в лунных породах (г г): реголит
96 («Луна 20»), 185 («Луна 16»), баыльт 238 («Луна 16»); океанические
базальты 148 + 65, материковые 302 («Аполлон 11-—17») [107].
254
Минера. ты
Минералы Ва многочисленны, но в подавляющем большинстве
встречаются довольно редко. На 1988 I. было известно 102 минерам:
51 силикат, 13 фосфатов, 12 карбона гов и гидрокарбонатов, ио
6 гидроарсенатов и оксидов. 4 гидроксида. по 3 фторида и ванадата, по
I вольфрамату, борату, сульфату и гидросульфату. Интересно, что
в силикатах Ва обычно (42 минерала) не встречается совместно со
сходными с ним геохимически Са и Sr, в восьми силикатах совместно
с ним присутствует Ti и в одном —К
К главным минералам Ва относятся: барит Ba.S()4—65.7% ВаО
(I Эм = 5 10’), который является его единственным промышленным
минералом; витерит ВаСО3— 77,7% ВаО; баритокальцит
BaCa(COj)2—состав неременный; бариевые нолевые Игнаты — тиало-
фан [К Ва | [Al(Al, Sr)Si2O8]—состав переменный и цельзиан
Ba|Al2Si2OB]— 34—42%ВаО Во флогопитах Сибири 3. И Петровой
с соавторами (1978 г.) уставов гены высокие концентрации ВаО (до
8,5%) и возможность изоморфизма по схеме Ba-t-Al(IV) »K)Si.
Показано, чго в слюдах более поздних стадий и внутренних зон
метасоматитов содержание Ва. а также Rb, I- и некоторых других
элементов увеличивается.
Многие исследователи отмечали более высокие концентрации Ва
в биотите и амфиболах из щелочных пород (см. табл. 60). По
С. М Кравченко, КрВа для биотита—флогопита увеличивается от
щелочного андезита (6) к дациту (8) и риодациту (15); для КИШ
Х'р в риодаците 6, в лейците щелочных вулканитов 0.5. Одновременно
показано, что Лр Ва для плагиоклаза в целом увеличивается
е увеличением кремнекисло г нос г и (базальт 0,1. андезит 1.2, риолит
10,0), но не щелочности (К-базальг 0,4) [363|.
В барите установлены высокие концентрации РЬ—до нескольких
процентов, максимум 22%РЬО — хокутолиг (BaSO4?iPbSO4), до 15%
SrO—стронциобарпг (BaSO4<*SrSO4—до баритопелесгина и целе-
стобарита, в котором Sr>Ba); баритокальцит ВаСа(СО,)2 имеет
переменный состав; пнгичны повышенные содержания Ra. Высокие
концентрации Ва установлены в лампрофиллите, хлоритоиде —
баритофиллиге, минералах Мп (бсрнессит и другие — 3,2—5,4%;
псиломелан, литиофорит, пиролюзит—11^-12,8%, по Р. Мак Копци,
1978 г., Г. Вагнер с соавторами, 1979 г.) и других минералах [359
487, 832].
В главных породообразующих минералах, в которых заключено
90% Ва в земной коре, средние содержания его составляют (г/т)
микроклин 393(1, плагиоклазы 687, пироксены 66, амфиболы 151,
биотит, фчоготгит 1670, мусковит 660; они зависят от петрографиче-
ского типа пород и условий их образования (см. табл 60).
Барит.устойчив в зоне окисления и образует в коре выветривания
вторичные остаточные руды. (Эн установлен Г. Ловетте гамом также
в Жаровых водорослях и корненожках [726].
255
Месторождения
Месторождения Ва представлены рудами барита, иногда с приме-
сью витерита. Основные области использования барита — в качестве
утяжелителя глинистых растворов в бурении (концентрат
>80%BaSO4), в химической и лакокрасочной (литопон) промыш-
ленности, сельском хозяйстве и при производстве бумаги, электроваку-
умного стекла и керамик, резины (90—95%BaSO4); BaSO4 непроницаем
для рентгеновского излучения. Баритовая отрасль производства и по-
требления наиболее развита в нашей стране и США.
Металлогенический потенциал Ва весьма велик (> 10 млрд г),
запасы барита за рубежом >300 млн т, производство в начале 80-х
годов составляло ~4 млн т, в 1987 г. ~2,6 млн т. В настоящее время
общая мировая добыча превышает 8 млн т барита (США >2,5 млн т,
Китай > I млн т). Технофильность высокая — 2 108.
Месторождения Ва имеют крупные масштабы (обычно 1 млн т)
и высокое содержание барита (витерита) п -10% (ГЭ = 5-103). Руды
либо монометальные (мономинеральные), либо комплексные и извест-
ны для лито-, халько- и сидеролитофильной геохимических групп.
В литофильную группу попадают наиболее важные баритовые место-
рождения, в которых Ва часто ассоциирует со Sr или F; они
образуются в сингенетических экзогенных, а также переходных
к эпигенетическим и эпигенетических гидрогенных, гидротермальных
и остаточном типах. Содержания барита нередко достигают 60—80%.
Кроме него в рудах содержатся SiO2, флюорит, доломит, кальцит,
ангидрит, гипс, сульфиды (FeS2, ZnS, PbS, CuFeS2).
Иногда баритовые стратиформные и жильные гидрог енно-гид-
ро термальные месторождения пространственно сопряжены с месторож-
дениями F, Fe, Mn, Zn, Си (Средняя Европа и др.), иногда с Pb-Zn
(Sr, Ag) стратиформными (Казахстан, шт. Джоржия, Миссури в США).
Часто все они совмещены в пространстве [154]. Л. Бауман, О. Леедер
(1975 г.) связывают крупные F-Ba стратиформные и жильные месторо-
ждения Средней Европы с платформенными флюидно-магматическими
системами, что характерно и для стратиформных Pb-Zn месторожде-
ний. Изотопический состав серы сульфидов баритовых месторождений
колеблется в широких пределах—634S от 3 до 16%, а в барите 534S
20—25 и 28—33%.
В потоках рассеяния баритового месторождения Кавказа содержа-
ние Ва и Sr составило по 3% [725].
Кроме того, барит может добываться попутно из стронциевых
и колчеданно-полиметаллических месторождений.
Осадочные месторождения различных металлов могут содержать
повышенные количества Ва. Наиболее высоки они в Fe-Mn рудах (г т):
Мировой океан 2300, Тихий 2350 (зона Кларион-Клиппертон 2400).
Атлантический 2280, Индийский 2100. Несколько более низкие содер-
жания (г/т) установлены в гидроiермальных Мп корках (530—2000,
v=1150 + 390), нонтроните Аденского залива (40—120, v = 74 + 39);
256
L. Слунер, 1980 г., в тодорокнтовых (1700) и смектитовых (250) осадках
Галапагосского рифта (Д. Мейнард, 1985 г.).
Высокие концентрации Ва характерны для руд Мп. Так, для
Чиатурского месторождения содержание ВаО составляет в среднем
1,9%, в Мп рудах Бразилии 1,3—2,5%. Он также накапливается
в Fe-Mn рудах, например, в озерных рудах Финляндии—0,74% [153].
Для каустобиолитов Ва не характерен. Кларк Ва (г/т): в углях 160
(в том числе в бурых 100), в торфах 70 [256, 688]. Наиболее высокий
ферсм установлен для углей Британской Колумбии (270 г/т), самые
низкие—для Казахстана, Средней Азии и Урала (18 г/т при генераль-
ном среднем 115 + 49 г'т). В черньГх и углистых сланцах, которые
слабее изучены на Ва, средние содержания его колеблются от 100 до
440 г,т. В нефтях Прикаспия содержание Ва в золе достигало в среднем
0,14%. в сырой нефти 0.24 г/т; в нефтях Балтийской провинции — до
54 i/т.
В фосфоритах разброс оценок средних содержаний для разных
провинций более значительный—от 100 до 642 г/т при среднем
генеральном 350+ 150 г/т. В железорудных месторождениях содержа-
ния Ва такого же порядка. Так, в железистых кварцитах Канады оно
составляет в среднем (г/т): Верхнее озеро 160, Алгома 190 при
наиболее высоких в карбонатных фациях Алгомы (400) и одновременно
самых низких в этих же фациях Верхнего озера (40). В бокситах кларк
Ва 41 г/т при несколько более высоких содержаниях в «осадочных»
разностях, особенно карстовых геосинклинальных (90 г/т) [370 ].
Породы
В поздних таблицах кларков [52] приводятся оценки кларков Ва
в различных типах пород по данным 60-х годов с небольшими
уточнениями (г/т): ультрабазиты 0,4, базиты 300, средние породы 300,
гранодиориты 450, граниты 840, щелочные 1600, сланцы 580, карбонат-
ные 10. Близкие данные получены как среднее из оценок кларков
разных авторов [546].
Ультрабазиты охарактеризованы значительным количеством новых
данных. Многие из них обобщены Б. Г. Лутцем [427 ], средние
составляют (г/т): альпинотипный гипербазит 2,6, океанический 7,6,
перидотиты (из включений—шпинелевый 7,5, гранатовый 33; эклогит
65). В гипербазитах Монголии (Хантайширский офиолитовый ком-
плекс) содержания следующие (г/т): низ разреза—15, верх 17, пиро-
ксениты 13 [652], что всего в 2 раза ниже по сравнению с диабазами
(22—38) и выше, чем в габбро (9). Гипербазиты из офиолитов Саксонии
(Германия) содержат Ва (г/т): дуниты 10, гарцбургиты 30 + 9, пироксе-
ниты 11, что значительно ниже по сравнению с габбро (125 + 30),
А1-габбро (92 + 35) и диабазами (180 + 40).
Ферсмы Ва для ультрабазитов Украинского щита следующие
(г/т): дуниты 19, оливиниты 415, перидотиты 27, гарцбургиты
140, лерцолиты 320, пироксениты 51, коматииты 17; для щелочных
17 2138 257
гиперба гигов: меаьтейгиты 600, щелочные пироксениты 300, бефорсигы
440, севигы 400 1501]. В кимберлитах содержание Ва в среднем
оценено в 920 г 'т [427 ]. Во времени кларк Ва (г'т) для коматиитов
самый высокий в AR] (45) и меньше в AR2_3(8) и РИД 15) [664].
Приведенные данные свидетельствуют о том, что кларк Ва для
ультрабазитов на 1ва порялка выше принятого и составляет 46 + 24 пт.
Основные пороты гораздо лучше изучены; по сравнению с ультра-
базитами они обогащены Ва. Базальтоиды континентальных областей
содержат 400+117 г г Ва, океанических 194+163 г т. В габброидах
офиолитовых комплексов содержания Ва колеблются от 7 до 260 г/т,
составляя в среднем для разных районов 62 + 65 г'т [441]. Для
Украинского щита содержания (i/т) в габброидах габбро-апертозито-
вой формации 623+217, г аббро-верлитовой 317+200, габбро-норит-
гипербазит овой 140+39 [501] Для базальтоидных пород установлены
зависимости бариеносностн от типа щелочности и геологического
положения. Для областей сжатия (континентальные и периокеанические
обстановки) значимо различаются разные серии базитов (г'т): топе-
итовые 97, известково-щелочные 370, K-Na субщелочные 497, шошони-
товые 942; для областей растяжения (океанические обстановки,
континентальные рифты, траппы): толеитовые 28—415 (+ = 238+196),
K-Na субщелочные 653—800 (+ = 733 + 65) [441].
Л. В. Таусогг [745] Ва использовал для геохимической типизации
базигов. Самое низкое содержание Ва, по его данным, характерно для
коматиитовых базальтов (35 г/т), самое высокое—для шошонитов
(среднее 1920 г г); содержание в анортозитах 220 г'т. Средние содержа-
ния Ва (г'г) ио наиболее представительным данным для пород
шошоггит-ла гиг овой серии подсчитал М. Н. Захаров (1987 г.): трахиба-
зальт 937, абсорокиг 1173, шошонит 1082, латит 1653, кварцевый латит
1138 (генеральное среднее 980 + 65 для 58 регионов). Оценки средних
содержаний для щелочных габброидов следующие (г т): тералит 580,
гешениг 280, эссексит 1510, шонкинит 1470 [439]. Установлено также,
что К-шелочньге базальты более чем вдвое (970 г'т) обогащены Ва по
сравнению с Na-нтелочными базальтами [745]. Отмечена также
зависимость концентрации Ва от железистости базальтов [501]. Для
Сибирской платформы с ростом КГс возрастает концентрация Ва (г 'т):
51,5—330; 63,2—720; 67,8—900. В то же время для отдельных
дифференциалов расслоенных интрузий прямой зависимости количест-
ва Ва от £Fe тге наблюдается, хотя общая тенденция сохраняется
н самые высокие концентрации Ва установлены в геденбергитовом
гранофировом габбро (400 г т) гг гранофире (800 г/т). Для интрузии
Норильск-1 высокие содержания Ва (г/т) отмечены в такситовых (520)
и контактовых (600) габбро-долеритах, а для Черногорской—в
оливин-биотитовых (600) и контактовых (520) [526].
Содержание Ва увеличивается не только по мере увеличения
щелочности, но н кислотности пород. Например, для толеитовых (Т)
и известково-щелочных (И) пород по мере увеличения содержания SiO2
(%) содержание Ва (г г) увеличивается: SiO248—Т 100, И 158; 56 —
258
T 158, И 295; 64—Т 251, И 339 [748]. Однако концентрация SiO2 не
является определяющей, что видно из значений ферсмов Ва в средних
и кислых эффузивах Центральной Европы, по Е. Экхардт, 1979 г.
(SiO2, % — Ва, г т): андезиты 58,7—514; латиты 62,7—z1076; трахиты
63,6—688; трахидациты 66,5—702; трахириодациты 69,6—646; ри-
одациты 68,1—753. Во времени содержания Ва (з,т) в основных
эффузивах. возможно, увеличивазогся; ARj 59, AR2 150, PR 320, [663].
В гранит оидных плутонических породах распределение Ва подчиня-
ется сходным закономерностям. Для гранитоидов различных формаци-
онных типов, по Ю. Б. Марину [460], оценки средних содержаний Ва
следующие (з т): габбро-диоритовый тип 400, диорит-плагиогранито-
вый 600, гранодиоритовый 850, гранитовый 840, аляскитовый 300,
Li-гранззтовьзй 50, щелочззо-граззитовый 100. Для отдельных геохимиче-
ских типов гранитоидов, по Л. Б. Таусону [744], кларки Ва составляют
(г/т): основные и средние магмы — плагиограниты толеитовые 57,
гранодиориты андезитовые 550, зразизты латитовые 1700, агпаитовые
редкометальные граниты 40; палинзенпые магмы — граниты извест-
ково-щелочные 830, плюмазитовые редкометальные лейкограниты 175,
зранитонды щелочного ряда 1550, редкометальные граниты щелочного
ряда 500; ультраме з аморфические мазмы— граниты 2800, рапакиви
1400, чарнокиты 1000, эндербиты 450. Для онгоннтов Монголизз
содержазпзе Ва (г/т) низкое (15—90, ± = 39+14), в онзориолитах оно
выше (23—315, ±=123±39) [439].
Щелочные породы нередко наиболее обогащены Ва. Это относится
в первузо очередь к дифференциатам глубинных магм. По
В. Г. Лазаренкову [394], самая высокая оценка генерального среднего
среди них характерна для лейцитите —4057 г/т; другие оценки
(з/т); псевдолейцит овые сиениты 2700 (псевдолейцититы Сыннырского
и Сусамырского массивов 4150); карбонатиты 2340, щелочные
габброиды 3017, щелочные сиениты 1567; миаскитовый нефелиновый
сиенит 1388, ийолит 1172, агпаитовый нефелиновый сиенит 430,
щелочной грани г 205.
Типизация щелочных пород весьма сложна зз различается у разных
авторов, в связзз с чем различаются и оценки средних содержаний. Так,
среднее (г'т) дня ийолитов 778 + 292, в том числе с агпаитовыми
фойяитамзз 2268 ±750, щелочных основных пород 419+196, щелочных
ультраосновных пород 346 + 98, мельтейгитов щелочных ультраоснов-
ных пород 219 + 89; сиенитов агпаитовых зз миаскитовых нефелиновых
сиенитов 1200. В некоторых щелочТзых гранитах зверем Ва достигает
1200 г'т [393, 394].
Для карбонатитов разных типов и зцелочных пород, с которыми
они связаны, средние содержания Ва, по В. С. Самойлову [685],
значительно различаются. Более высокие концентрации (г/т) характер-
ны для карбонатитов, связанных с магматическимзз основными
и среднимзз породами К-спегщфики (8300 при содержании в маг-
матических породах комплексов 2500), ниже они для карбонатитов,
ассоциирузощих с щелочззыми ульграосззовными породами Na-специ-
17* 259
Таблица 78
Среднее содержание ряда элементов (г/т) в ранних (1—3)
и поздних (4—6) карбонатитах, формировавшихся а разных
услоннях Iлубинности и температуры
Элемент 1 2 3 4 5 6
Sr Ва Nb Pb Zn TR + Y Примечание. 1 — ультраосновных (1, 3 — х метасоматитов (абиссаль фация). 5100 510 720 8 112 1720 6—карбон гезоабиссал ная фация 6500 780 790 50 НО 1200 атиты раз ьная, 4—г 1, 5—кали 6700 715 531 121 317 4380 ЛИЧНЫХ К( триповерхн евых щелс 12000 6000 76 137 428 6290 змплексов зстная фан чных поре 11 800 14900 31 310 104 8360 1, 3, 4- ии), 2, 6 — )д (прилов 13 100 900 115 139 148 2450 —щелочно- - щеточных срхносгная
фики (2800 и 990 соответственно), и для карбонатитов комплекса
щелочных метасоматитов и палингенных сиенитов (800 и 1600). Самые
высокие концентрации типичны для поздних карбонатитов, а из
них—для приповерхностных фаций карбонатитов из К-щслочных
пород и щелочно-ультраосновных комплексов (табл. 78). Основными
минералами-носителями Ва в карбонатитах, по Ю. А. Капустину
(1982 г.), являются (г/т): кальцит I генерации — 536. И—665, 111 — 618;
апатит-1 — 433, II — 388; концентраторами—флогопит-1 6031, II 3768;
пирохлор-1 3605, II 19362; циркелит 5436. В поздних карбонатитах
(III стадия) появляются барит и стронцианит (3155 г,т Ва).
Осадочные породы разных типов значительно отличаются по
бариеносности. Кларки: глубоководные глины 0,23%, глинистые
сланцы 0.06, песчаники 0,018, карбонатные породы 0,005% [546].
Самые высокие оценки средних содержаний, по Н. Н. Богданову
(1979 г.), характерны для глубоководных металлоносных осадков
южной части Тихого океана —1,23%. Главные химические типы
осадков — силикатные (сланцы 580 г/т) и карбонатные (10 г'т) —
различаются наибольшим образом.
Бариеносность терригенных пород мало зависит от размерности
фракций. Например, содержания Ва в осадках следующие (г/т):
Баренцево море—ил 769, глина 671; залив Пария — песок 301,
глина 371. Ордовикские граувакки группы Гривленд содержат 409 г г
Ва, аргиллиты 702 г/т [749]. Данные изучения распределения Ва
в обломочном материале, переносимом крупнейшими реками, до-
вольно сходны (г/т): Амазонка 700, Конго 790, Ганг 490, Гаронна
419, Меконг 600.
Систематическое изучение различных провинций нашей страны
свидетельствует о том, что в целом песчаники и пески беднее Ва, чем
сланцы и глины [178]. Так, по В. Д Алексеенко с соавторами, для
Восточного Казахстана ферсм бария следующий (г/т): песчаники 370,
260
глинистые сланцы 460, известняки 80. При этом среднее содержание
в песчаниках и сланцах изменяется так (i/т). протоплатформенные
песчаники PR3— V НО, сланцы 540; фосфатоносные песчаники 510;
геосинклинальные песчаники и сланцы О — D 245 и 440; субплатфор-
мснные D3— Р 500 и 730 (углеродистые); платформенные К3—₽3—Ni
350 + 98 и 470 + 80; современный ороген — песчаники и пески N3—Q
450 и 550, пески и рыхлые песчаники Q 750 и 870.
По Ю. В Ильинскому и другим исследователям, для PZ Алтае-
Саянской складчатой области (Минусинская и Тувинская впадины)
распределение Ва противоположное для всех фациальных обстановок
(г/т): С — Р, J континентальный режим — песчаники 310—500, извест-
няки 300, алевролиты 150; переходный—алевролиты 600, песчаники
730; ₽2 - 3 — морской — известняки 150, мергели 330, песчаники 180;
переходный — алевролиты 280—480, алевропесчаники 370, песчаники
550, аргиллиты 300; континентальный—алевропесчаники 260, песча-
ники 310, гравелиты 750. Для морских терригенных отложений MZ
Западно-Сибирской плиты В. М. Гаврилиным с соавторами максималь-
ные концентрации Ва (г/т) установлены в высокоуглеродистых поро-
дах—«бажсновитах» (2264 + 31), затем идут песчаники и алевролиты
К (1013+15; в алевропелитах и аргиллитах 767 + 23) и алсвропелиты
и аргиллиты J (830+ 15; в песчаниках и алевролитах 674+14).
Для MZ пород Таджикской депрессии Д. Н. Пачаджанов,
И. П. Адамчук [178 ] выявили влияние на распределение Ва фациальных
и климатических условий породообразования. Глинистые отложения
континентальных К обстановок богаче, чем прибрежно-морских ПМ
и морских М: юра — К 681—689, ПМ 570—612. М 493—475;
мел—К 544, ПМ 494. Распределение Ва в других породах следующее
(г'т): песчанистые отложения — ПМ гумидные 362, аридные 190,
аллювиальные 300—306, заливно-лагунные ЗЛ 151—237; известняки —
ПМ 250,5 (аридные 250, гумидные 251), М 186, ЗЛ 231 (аридные 220,
(умидные 243). Изучение перехода Ва в 5%-ную НС! вытяжку из
глинистых отложений не показало единых зависимостей для юры и мела;
из юрских пород в вытяжку попало (%): К 13, М 14, ПМ 5, ЗЛ 8; из
меловых — К 12, ПМ 26, М 16, ЗЛ 18. При изучении форм нахождения Ва
в 1 линистых осадках установлено, что в разных обстановках величина
разных форм (%) отличается мало: поглощенный комплекс ПМ 7, М 4,4
мелководные 4.6, ЗЛ 3,3 (соленые 4,5); (руднорастворимые формы
ПМ 10,5, ММ (мелководные морские) 9, 4, М 14, ЗЛ 15,4 (соленые ~ 10,8).
Для Афгано-Таджикской зоны Ю. Я. Валиевым и друшми ис-
следователями (1989 г.) микрозондовым анализом изучено распределе-
ние Ва В аридных условиях его содержание резко возрастает
и составляет (г т). песчаники 1287, аргиллиты 1000, алевролиты
614—740. Это связано с выпадением в аридных водоемах барита, что
приводит к его накоплению в терригенных осадках. Особенно им
обогащены прибрежно-морские пестроцветные терригенно-карбонатные
отложения, что свидетельствует о возможности образования в этих
условиях осадочных месторождений барита.
261
В региональном временном плане сопоставление бариеносностн
глинистых сланцев Американской, Русской платформ и других регио-
нов Евразии показало [663, 664] увеличение его содержаний (г/т):
ARt 418, AR2 3 487, PRi 694, PR2-3 717, Ph 637. В го же время при
обобщении материалов по глинистым сланцам Австралийской, Канад-
ской и Африканской платформ не выявлено различий (г /т): зеленока-
менные пояса 643+196, позднеархейские 583+163, постархейские по
разным оценкам 650 и 580 [749].
Метаморфические породы различаются по содержанию Ва в зависи-
мости от состава субстрата и фации метаморфизма [372]. Например,
для Миннибаевской сверхглубокой скважины самые высокие содержания
Ва (г/т) отвечали кристаллическим сланцам и плагиогнейсам с высоко-
глиноземистыми минералами (3500), а самые низкие—амфибол-двупирок-
сен-плагиоклазовым сланцам (50); содержания в мезократовых гнейсах—
1300. По А. А. Кременецкому (1986 г.), для Кольской сверхглубокой
скважины самое высокое содержание Ва (г/т) установлено для аркозовых
метапесчаников (794), затем следуют гнейсы (416+196) и амфиболиты
(135 + 78). Содержания Ва в метабазитах в разных зонах про!рессивного
регионального метаморфизма следующие (г/т): Пр-Пум 20, Эп-Хл 82,
Би-Амф 106, Ро-Олг 192, Ро-Ан 5. При прогрессивном метаморфизме
метапелитов Ва незначительно (г/т) накапливается в зонах Би-Гр
(300—333) и Ст-Анд (197—439), а также Сил-КПШ (256—880). Для
двуслюдяных сланцев и гнейсов содержание Ва в палеосоме несколько
выше (274—546 г/т), чем в мелано- (283—460 г/т) и лейкосоме
(162—260 г/т), однако в лейкократовом биотитовом плагиогнейсе самое
высокое оно в лейкосоме плат иомигматита (857 г/т). Для Печенгской
структуры Колького п-ова содержание Ва в параамфиболитах 840 г т,
тогда как в ортоамфиболитах всего 21 г/т, вследствие чего Ва
использован в качестве индикаторного элемента для их разделения [370].
Данные по распределению Ва в метаморфической оболочке Азии
свидетельствуют, что его содержание в метаморфических породах
станового комплекса составляет 340 г/т. В интрузивных породах эогея
оно 552 г/т, а в сутамском метаморфическом комплексе эогея 803 г/т [159.
835]. Для метаморфических пород Патомского нагорья Б. В. Петровым
показано, что Ва ведет себя противоположно Sr и Са: накапливается (г, г)
в железистых пелитах (760—890) и мергелях (470—540) и меньше
в известковых алевролитах (240—380) и известняках (220—320).
Высокие концентрации Ва установлены в плагиомигма гитах и миг-
матитах, прежде всего гранулитовой фации — соответственно 370—
3100 и 120—3300 г/т (плагиомигматиты амфиболитовой фации 560—
2100, мигматиты 560—1900 [726].
Почвы, растения, животные
Современные оценки средних содержаний Ва в почвах значительно
выше (кларк 554 + 25 г/т), чем первый к ларк А. П. Виноградова (50 г г).
В почвах на основных породах, по Т. Вест (1979 г.), концентрация его
262
несколько ниже (560 г'т), чем на кислых (660 г/т). В зоне гипергеггеза Ва
малоподвижен, гак как легко осаждается в виде сульфа зов и карбонатов
или легко сорбируется глинистыми, марганцевыми и возможно фосфат-
ными минералами и в то же время лез ко мобилизуется [312]
в зависимости oi ландшафгно-теохимических условий (см. габл. 76).
По данным П. Г. Адерихина, К. И. Лукашева и других
исследователей, содержание Ва в различных гиззах почв нашей страны
колеблется в широких пределах (мг/кг): зистосоли и друзие органичес-
кие почвы 84; подзолы и песчаные почвы 220; суз лиззисзые и глинистые
240; флювисоли 240; черноземы 525; лесные 560; лесззые и пылеватые
960. В США оно сходно (мг/кг): органические лез кие почвы 265,
черноземы 595, лесные 505, глинистые и суглзнзисзые 535, лёссовые 675,
пылеватые прерий 765 зза гранитоидах и знейсах 780, светлые почвы
пустынь 835 [914]. В аридном климате в корках зза поверхности почв
количество Ва зззачительно увеличивается. В США усзаззовлены почвы
с его содержанием до Зо/о. Для черноземов Крыма содержания
несколько различаются для разных зон (г/т): равнинно-степной 270,
горно-степной 190, степной зза вулканитах 170 [682]. Понижение
концентрации Ва в почвах достигается внесением Са, Mg, S.
Барий имеет очень высокий показатель биозепносззз (х= 1,5) [198],
меняющийся следующим образом: пустыни 1,6 до 35, сгспзз 1,4, лесные
зоны 2,1 (деревья 21, травы до 11) зугздра 1,5.
Для растений токсичность Ва слабо изучена. Ф. Чаупдри с соав-
торами (1977 г.) считают токсичными 1—2% Ва (с.); по X. Шаклетг
(1978 г.), это 220 мг/кг (з.). Сведений о биологической зззачимосги Ва
для растений гзет, хотя озз присутствует в шзх в значительных
количествах [312]. Е. Уэйбергом (1977 г.) отмечалась способность Ва2 +
к связыванию клеток дрожжей. Наиболее высокие содержания Ва
обнаружены X. Шаклегз в некоторых деревьях и кустарниках США
(> 10 000 мг/кг с.) зз А. Л. Ковалевским [331 ] в коре деревьев Сибири
(10%, з.). В пищевых и кормовых растениях Ви концентрируется
в надземных их частях (мг/кг): злакзз 160 (зерно 5,5), клевер 170,
люцерна 100, фасоль—стручкзз 7, бобы 8, капуста 5, салат 10, морковь
13, лук 12, картофель 5, помидоры 2. яблоки 2
Сопоставление материалов по наземным и морским растениям
показало, что первые в 2 раза беднее вторых—14 зз 30 мг'кз с. [860];
для океанического планктона данные следузощие (мг кг): фито- 80, зоо-
100, тотальный 100; во взвеси 400, пеллетах 200 [677]. Токсичны для
водяных растений концентрации Ва 10 мг/л.
Для наземных животных кларк составляет 0,75 мг 'кг, для морских
0,2—3 мг/кг. Подпороговая концентрация в воде (мг л) ВаС12 — 4,
ВаСО3 и Ba(NO3)2— 5, не влиязогцая на санитарный режим 10; 50 мг/л
ВаС12 вызывает отравление, а 150 мз/л — гибелг> лососевых (для
корюшки 500 мг/л) [128]. Смертельные дозы ЛД50 таковы (мг/кг):
гидроксид (в желудок/внут рибрюшинпо) 308/255; карбонат 200/50
(мыши), 418,50 (крысы); нитраг 390/290 (крысы); оксид 300; хлорид
150/56 (мыши).
263
Для человека соединения Ва очень токсичны—смертельная доза
ВаС12 0,8—0,9 г, ВаСО2 2—4 г; токсичны и многие другие соединения
(алюминат, титанат, феррат, фторид) [128].
При избытке Ва возникают баритозы. Острый баригоз вызывает
летальный исход в первые сутки, хронический нарушает различные
функции организма, в том числе с ним могут быть связаны бронхиты,
пневмонии и т. д. [484].
Для стабильных изотопов Ва установлено наибольшее количество
случаев участия избытка концентраций в возникновении различных
патологий (20 видов). Он стоит на втором месте в условном ряду
снижения патологичности (21 Hg>20 Ва> 19 As> 17 Т1...) и может
быть отнесен к высокопатологичным элементам. Данные по патологии
недостатка Ва для животных и человека нс приводятся.
Для животных и человека коэффициент всасывания Ва из желудоч-
но-кишечного тракта ~0,06, что значительно ниже, чем Са и Sr;
выводится Ва из организма гораздо быстрее их. Более высокое
всасывание характерно для радиоизотопа ,40Ва (с пищей 100%, из
воздуха 75%) с биологическим периодом полувыделения 70 сут.
и эффективным — 65 сут. [27].
Общее содержание Ва в организме человека составляет в среднем
22 мг (в скелете 20 мг), суточное поступление 0,75 мг, кратность
накопления ~29, т. е. в 1,7 раза ниже, чем Sr; выносится с калом 40%.
Установлена повышенная концентрация Ва в глазах, почках и г. д.
[512]. Содержания Ва в разных органах и средах следующие (в
скобках —число анализов): кровь (мг/л)—общая 0,04—0,09,
х = 0,06 ±0,005 мг/л (162), плазма 0,05 (23), сыворотка 0,07 ±0,01
(>200); моча 89 мкг/л (64); другие органы (и 10 6): кость 13 ±3,9
(>500, з.); мозг 0,006 (61, ж.), 0,63 (10, с.), 0,2—9 (134, з.); волосы
0,5—4,2 (22); сердце 0,02 (11, ж.), 0,3—7,4 (77, с.), 7,7±4,5 (280, з.);
почки 0,01 (16 ж.), 0,28—0,96 (190, с.), 9,6±8,1 (>250, з.); легкие
0,03—0,12 (13, ж), 1,5 (68, с.), 23 ±8 (304, з.); мышцы 0,02 (6, ж), 7,1 (14,
с.); ногти 7,5 (17); кожа 14—17 (36, з.); селезенка 0,27—2,4 (183, с.),
0,6—12, х = 5,5 (>300, з.); шитовидная железа 5,8—24 (36, з.) [931].
Воздух, вода, техногеиез
Кларк Ва над южным полюсом 1,6 10 2 нг/м3 [900], над океанами
7,6 Ю~4 мкг/м3, над крупными зарубежными городами 9 нгм3,
в океаническом аэрозоле 50 10'4%, в аэрозоле сибирских городов
20 нг/м3 [626].
Содержание Ва в атмосферных осадках района Верхней Волги
составляло в 1970-е годы (мкг/л): в растворе 11, во взвеси 15,
плотность азмосферных выпадений для Ва 14,6 кг/м2-год (взвесь 8,4.
раствор 6,2) [590].
По С Л Шварцсву [726], содержание в аэрозоле над Атлантиче-
ским океаном 180—487 г/т, над Тихим — до 490 г/т. Содержание Ва
в воздухе (аэрозольная составляющая) фоновых континентальных
2Ы
территорий оценивается А А Волох (1991 г.) гак (hi < Носю .нал
Сибирь 20, Московская обл. 4, Крым (Голубой залив) 10. глооальный
поток Ва (т/год) за счет терригенной составляющей континентов
28 -10*, за счет океанической 18 • 104.
В океанической воде в среднем установлено 1,4-10 ”% Ва, в речной
2- 10 6% Имеются и другие данные (мкг/л): морская вода 18, речная
20 [726], поверхностные воды (фон) 10, воды зоны гипергенеза
(среднее) ~20, подземные воды 60 (чго очень близко к ПДКв»100);
воды зоны активного водотока (среднее) ~7.
Концентрация Ва в подземных водах поверхностной зоны, по А. Е,
Перельману [726], зависит от климатически-ландшафгных условий
(мкг/л): общее содержание 19,6, области континентального засоления
50,1, зоны выщелачивания (среднее) 12, области умеренного климата
16,7, горные 14.1, мерзлотные 9,5. субтропики 7,8.
Значительное количество Ва может содержаться в современных
термальных водах. В частности, вклад в пела!ическую седиментацию
в Тихом океане составляет (млн т/1000 лег): гидротермы ~59,
экзогенный источник (речной сток) 92.
Среднее содержание Ва (в растворе) в водах бассейна Верхней
Волги следующее (мкт,л): водохранилища НО, реки — Москва 100,
Вазуза 130, Волга 130 (для мира — 30 [883], грунтовые и подземные
воды 280 и 400 [590]. Концентрация Ва (мкг/кг с.) в этом же районе
в речной взвеси 650, илах 420, почвах 420, золе водных растений 960,
фитопланктоне 76 (с.) [590].
Технот еохимия Ва изучена слабо при повышенных оценках техно-
генности (Тх=10я) и модуля техногенного воздействия (Гд> 1) [198].
Особенно высок показатель деструктивной жологической активности
[198]. На бариевых производствах прежде всего опасны пыли [128],
а также сточные и технические воды, которые, однако, не изучены.
Установлен Ва в пылях некоторых производств: коксохимического
(В= 1,3), механического (цех литья и обработки чугуна) (5,8), цементно-
го (мельницы (В 2.6; цех обжига—2,6). а также при производстве
вторичною алюминия [681, 682]. В прудах-отстойниках в донных
осадках содержание Ва (г/г) варьирует от 250 до 3000 (В=12),
в устьевых частях водотоков — от 20 до 250 (х= 152 + 65). В США ПДК
Ва в осадках сточных вод, используемых в сельском хозяйстве, принята
100 мг,кг [380]. В оросительных сточных водах содержание Ва (мт/кт
с) составляет 150—4000, в фосфатных удобрениях 200, известковых
120—250, органических 270.
Особенно экологически неблагоприятны в отношении Ва, кроме
производств по его переработке, ГОКи по добыче и обогащению
баритовых, Pb-Zn стратиформных, Sr, Мп руд, а также гипсов,
ангидритов, Fe Мп конкреций. Кроме гою, Ва содержится в выбросах
многих промышленных производств [231]: металлургических, полигра-
фических, химических, резинотехнических, сахарных, жировых, дерево-
обрабатывающих, кожевенных, фармацевтических, при получении
иодидов, фосфатов, бромидов, серной кислоты, щелочей, стекла,
265
пестицидов, эмалей, стекла, мраморных изделий, пигментов, алкало-
идов, пергидроля, отбеливателей, продуктов органическою синтеза,
целлофана, фотобумаги. полимерных волокон, люминофоров и др.
Выводы. Экогеохимически Ва изучен слабо, xoih и является
металлом’ широкой распространенности, высокой гоксичнос1и (Тл=10,
Та,г=100) и патологичности (П = 20). Он весьма подвижен, особенно
в водной и воздушной гумидных средах. В магматических процессах
в основном рассеивается, в осадочно-т идрот енных может образовывать
рудные концентрации в сульфа гной, реже карбонатной обстановках.
М>10 млрд т, Тф — высокая ~2108; ГЭ, oapnia и витерита
(1—5) 103, ГЭ, баритовых месторождений (3—5) 103. Накапливается
в подземных водах хлоридною, тидрокарбонатного состава и в различ-
ных типах почв. Тсхногеохимия Ва почти не изучена.
РАДИЙ—88
Один из самых редких (кларк 1 10 10%), высокорадиоактивных
(1 г 22<’Ra = 2,8 т U), сильно радио токсичных металлов (ПДКр1, 226Ra
2,8 10 ,0. 228Ra 4,4 10 *°, 233Ra 2,4 10 ’°), Т,= 15, 1,-100?.
Т„=100?; биологически весьма активен; продукт ею распада—Rn
(растворимость 4,49 г/л), ПДК 222Rn— 3-10 9 Ku м3 [525, 833, 834].
Атом
Атом Ra (5/°6г/°7х2) представлен нес1абильпыми радиоактивными
изотопами. Наиболее распространены 224Ra, 226Ra и 228Ra. 226Ra
имеет самый большой период полураспада (Т112= 1,62 • 103 лег)
и является а- (4,76 МэВ) и у-излучателем (0,187 МэВ), продукюм
стадийного распада 238Ra, вероятно, через ионий 23ОТЬ (7,8 • 104 лег)
В свою очередь 226Ra переходит в 222Rn (Т1/2 = 3,8 сут.). 223Ra«- 235U;
227Ra—радиоактиний: 228Ra— радиоторий (Т1/2 = 6,7 года) [574];
228Ra«- 232Th, 224Ra«- 232Th. Известные изотопы Ra обозначаются
символами Ra(A), Ra(C), С', С", D Е, F, G |149] Конечным
нсрадиоакгивным продуктом превращений Ra служит РЬ. Радий
в значительной мере определяет естественный радиационный фон
Земли. Он обладает наиболее мощным т.-радноизлучением и дает
много дочерних нуклидов (табл. 79).
Радий расположен во II группе периодической системы под Ва,
между Ft и Ас. Он наиболее сходен с Ва но химически гораздо более
активен. Валентность II С водой образует сильное основание Ra(OH)2.
на воздухе интенсивно окисляется (RaO), образует нитриды, цитраты
и другие соединения. RaSO4, RaCOb RaC2O4, Ra3(PO4)2, Ra(CrO)4,
RaF2, RaBeF4, Ra(YO2)2, Ra(WO4) нерастворимы. Растворимость
RaSO4 составляет 2,1 10"3 г/л (при 26 С), ниже, чем у Ва$О4.
Галогениды (кроме фторида), нитрат и сульфид растворимы в воде.
Комплексные соединения более устойчивы, Ra дает комплексы с рядом
органических кислот (молочной, лимонной и др.) [834].
266
Таблица 79
Основные продукты распада 226Ra (222Rn) [3811
Нуклкя Излучение и энергия, МэВ Нуклид 1, Излучение и энергия. М эВ
22oRa 1602 лег а 4,78 у 0.18 2,°Т1 1 32 мин Р 1,9—2,3 у 0,79
222Рп 3.82 сут а 5,49 у 0,51 2’0рь 20,4 лет Р 0,01 у 0.04
2!8ро 3.05 мин а 6,00 21uBi 5.01 сут Р 1.1
2“‘РЬ 214В> 26.8 мин 19,7 мин Р 0.72 у 0,35 а 5,45 Р 1,51 у 0,6—1,7 210ро 20<гр| 2ОЬрЬ 138,4 сут 4,19 мин Стабиль- ный ст 5,3 Р 1.53
Литофилен в породах и минералах часто находится в равновесии
с L (Ra, LJ = 3,36 • 10 '). Это равновесие в земной коре может
нарушаться в пользу как LJ (чаще), так и Ra [574]. Относительно
накапливается в каменных метеоритах (5,4 - 1013%) и в земной коре
(п-10 11%) по сравнению с мантией.
Минералы, месторождении, породы
Собственных минералов и месторождений Ra не образует [574].
Среди минералов других элементов, относительно обогащенных
Ra. отмечались радиобарнт и хокутолит—Ra-барит [794] Минералы
содержат повышенные количества LJ и Th и встречены среди
минералов термальных источников (Япония, Тайвань, Колорадо.
Оклахома, Чехия), а также в урановых рудах (Тюя-Мутон, Средняя
Азия). Содержание U низкое—от 7 10 6 до 1,5 • 10 2% В Тюя-Муюне
радиобарит отмечался в верхних частях рудной зоны в ассоциации
с ванадатами уранила и радиокарбона том состава (Са, RaJCO, [794]
Считается, что Ra из растворов может входить в состав вторичных
минералов, в частности указываются PbjfPO^Cl и ВаСО3 [834];
отмечается сорбция Ra тидроксидами Ре и Мп [574].
Радий — типичный рассеянный металл попутной добычи, тесно
связанный с урановыми рудами. Исходя из радиоактивного равновесия
в 1 т LJ содержится 0,366 т Ra [574]. Радий был первым сильно
радиоактивным источником и сыграл выдающуюся роль в истории
отечественной и мировой радиохимии [597]. К 1940 г. за рубежом ето
было добыто 2,3 кг. Этот элемент обладает терапевтическим действием
как противоопухолевый препарат. Однако в связи с обнаружением новых
источников радиоактивной энергии и медицинских препаратов значение Ra
значительно снизилось и достигнутая к 40-м годам низкая технофильность
(1,6-10s). вероятно, к настоящему времени не увеличилась [574].
Ra сотержится в месторождениях (J и Th. В рудах U содержание
22ORa составляет ~0,3 г'т [12]. Показателен состав руды упоминавше-
267
i ося месторождения Тюя-Муюн, из которого добывался Ra; среднее
содержание (%): SiO2 12,02; СаО 32,01; ВаО 4,63; Fe2O3 7,06; А12О3 4,41;
СиО 3,1; Bi2O3 сл„ РЬО 0,08; П3О8 1,49; Na2O + K2O 0,21; V2O5 3,29;
Р,О5 0,12; As2O3 0,02; SO3 2,40; СО2 25,49; ThO, сл. [811 ]; содержание
Ra ~0,00001 %. В рудах Th содержатся также изотопы 224Ra, 228Ra.
П. Нук и Р. Джон (1989 I.), изучая отвалы U рудников Канады
(Рио-Алгом и Амок), показали, что основным носителем Ra является
барит, составляющий 65—75% отвалов; уровни активности 226Ra
составляют в нем от 690 до 1360 Бк/г, кроме того, содержится
и-100 —и -1000 г т Sr, К, Mg, Mn, 7п, В, Си, РЬ. В окислительных
условиях Ra и Ва выщелачиваются слабо, в восстановительных,
наоборот; (Ва, Ra)SO4 неустойчив и при низком содержании сульфатов
в поровых водах и наличии сульфатбактерий Ra выщелачивается.
Вокруг оруденения U образуется ореол Ra с содержанием 10—
15 млн 1 уранового эквивалента [149].
Кларки Ra не подсчитаны, единичные данные приводятся
А. И. Перельманом (%): в ультраосновных породах 1 • 10 12, основных
2,7-Ю”11, кислых 1,2-1О-10, в донных осадках 5-10 1‘, 1линах
1 • 10“10, известняках 0,5-10* 10 [574], На примере лав вулкана Везувий
было показано, что отношение 226Ra/238U достигает 10, в лейците 65,
что объясняется флюидным привнесем радиоактивных элементов из
метасоматизированной мантии в очень короткие сроки [149].
По оценкам НКДАР (1962 г.), пределы содержаний 22bRa в породах
следующие (Бк/кг): граниты 96—114, базальты 18—41, песчаники
И—26, известняки ~15—26, сланцы 15. Самое высокое содержание —
2200 Бк'кг установлено в глиноземистых сланцах Швеции.
По А. И. Перельману [574], за время геологической истории
количество Ra в биосфере снизилось в 2 раза в связи с понижением
содержания урана. Содержание Ra в ландшафтах зависит от тектониче-
ских и климатических условий и сходно с распределением U и Rn.
В обстановке спокойного режима, геплог о и влажного гумидного
климата (например С3, Т3 — J и др.) происходит интенсивный вынос
Ra из пород зоны гипергенеза; наоборот, в периоды интенсивных
тектонических движений и аридной обстановки осуществляема накоп-
ление Ra и общее увеличение радиоактивности в окружающей среде.
Кроме гранитоидов, Ra относительно обогащены углеродистые слан-
цы, фосфориты, травертины (л10“8%). возможно, нефти и др.
Отношение 22bRa/238U итучено для вулканогенных пород кон-
тинентальных районов (США 1.28 + 0,039), Мексика 1,31, Коста-Рика
1,05 + 0,052) и островов (Килауэа, Гавайи 1.120 + 0,108, Мауиа-Кэа,
Гавайи 1,126 + 0.084, Галапагосские о-ва 0.952 + 0.207) [785].
Почпы, раст енин, живот ные
В почвах содержание Ra ~0,8 .мг/кг. что близко к содержанию
в исходных породах (0,6—1.1 мг/кг); в растениях оно 0,03—1,6 нт кг
(с.). К. Мегуми и другие исследователи (1977 г.) установили, что
268
концентрация радионуклидов радия в почвах увеличивается с уменьше-
нием размера частиц. Выявлены устойчивость комплекса 22bRa
в нормальных почвах (36—351 ш г) и увеличение его подвижности
(1 —10% от общего содержания) в кислых почвах, а также большие
содержания в поверхностном слое почв та счет антропогенных
источников. Е. Мартел (1975 г.) показал, что внесение К и Р удобрений
повышает содержание 226Ra [312].
По В. И. Баранову (1964 г.) и другим исследователям [227,381],
наибольшие концентрации Rn наблюдаю гея в почвах и подземных
источниках и зависят от содержания Ra и Th. Среднее содержание Rn
в почве на глубине 10 см принято 136—158 кБк-м“3. Из почв он легко
поступает в приземную атмосферу, в которой его содержание
обусловлено концентрацией в почве, скоростью эксталяции, высотой
и метеоусловиями.
Среднее содержание Ra в живом веществе оценивается в п- 10' 12,
но его содержание в золе растений достигает 1 10 7%, составляя
обычно 2 10 9—5 10 11%, в расчете на живую массу—1 10 11 —
2 10 13. Коэффициент биологичсскот о поглощения Ra, по
А. И. Перельману (от 0,1 до 30, среднее 2,6) имеет гот же
порядок, что и у других щелочноземельных металлов. Этот же
автор отмечает, что у -растений нет биологических барьеров
против Ra и его содержание в них может превышать содержание
в питающей среде в сотни раз. Так, В лого элемента в ряске
пресных водоемов варьирует о г 14 до 477 По отношению
к воде количество Ra в наземных частях растений составляет
300—3000 [330]. а в корнях 3000—30000; при расчете на почву
относительное накопление Ra обычно не превышает 1—3 и,
по А. Л. Ковалевскому, мало зависит от содержания его в почве,
поскольку содержание Ra в органах растений является постоянным
для данного вида, независимо от района произрастания. Для
Сибири эти оценки (содержание в березе принято за единицу)
следующие: рододендрон даурский 2, батульник болотный 1,6,
ерник 1,4, лиственница сибирская 1,2, лиственница, пихта, таволга,
кизильник, жимолость 1.1, осина, ива, вяз. ольховник можжевельник,
рожь 0,3, травы летние 0,1—0,2, хвощ 0,15, пырей 0,1 [330].
Вместе с тем, А. И. Перельман указывает, что радиофильность
растений должна быть связана со степенью урано- и радиспосности
провинций, так как имеет длительную эволюционную природу;
максимальна она в урановых провинциях, районах развития гра-
нитоидов, фосфоритов н др, особенно в гумидных зонах.
Радий используется при геохимических поисках радиоактивных руд.
В таежных ландшафтах при кислом выщелачивании Ra и U выносятся
из верхних горизонтов почв, вторичные ореолы ослаблены и в этих
условиях поиски по ним нс эффективны. Более того, в таких условиях
вторичные концентрации Ra и U могут быть разобщены в простран-
стве (Ra в глинистых отложениях, U—в болотных). В безрудных
лесных ланлшафтах содержание Ra в почвах связано с его раснростра-
269
ценностью в материнских породах, глинистые почвы обычно богаче
им, чем песчанистые. В разрезе почв Ra может выноситься из
горизонтов Л( и Аг и аккумулируется в иллювиальном горизонте В на
сорбционном барьере; в других случаях (Беларусь) Ra накапливается
в горизонте А в результате биогенной аккумуляции [574].
В организме человека содержится 2,6-10 11 г Ra. из них 80%
в скелете, 7% в печени и кишечнике; 1,5% в мышцах. Поступление
в организм с воздухом составляет I фг/сут (1 10 *5), с пищей гораздо
больше—от 0,1 до 5 мг/кг, с водой ~ 10%; всего 2,3 пг/суТ. Особенно
много Ra в бразильских орехах и тихоокеанском лососе, в мидиях
(В~70) и моллюсках (В~210), увеличено оно в чернике, бруснике.
Всасывание в кровь у крыс составляет 0,8 у молодых особей. 0,05
у взрослых. Величина всасывания 226Ra из желудочно-кишечного
тракта принята 0,2, кратность накопления 13,5, а с учетом всасывания
67,5, т. е. значительно меньше, чем для Са и Sr, а для скелета в 34 paia
ниже, чем Са [512]. По другим данным [27], с пищей всасывается
~30% 226Ra, 40% из воздуха; период полувыделения (сутки) биологи-
ческий 8100 сут., эффективный 1800 cyi.; ПДК (Ки'л): ПДКр,3-10 ,4.
в воздухе санитарно-защитных зон ЗЮ*15, населенных пунктов
3 10 16, ПДКвкнп5 10
Содержание Ra в основных органах и средах человека следующее (в
скобках число анализов): кровь (я 10 6 мг/л) — общая 6,6 (1), плазма
16,6 (3), сыворотка 0,20 (361); другие значения (w 10 Is): волосы 19
(188); сердце 0,07 (11); почки 0,12 (11); печень 0,18 (21); мышцы 0,05 (21.
ж.); кожа 0,12; селезенка 0,1 (11); зубы 9—86 [931].
Воздух, пода, зехногенез
Наибольшая степень эксгаляции Rn в атмосферу из почв зафикси-
рована (мБк м2 с) в США 18—53. Ирландии 27, Австрии 8—21. СССР
4—19, Японии 3—9 и т. д. В прибрежных районах содержание Rn
|Бк м3) в приземном воздухе падает, особенно иад океанами (Тихий
и Индияскш 0 07, острова Тихого океана 0.02—0.2), па материках оно
выше (Европа 2.2—9. Америка 0,1—9.6, Индия 3,7; Япония 2,1,
Великобритания 3 3) На высоте 1м от Земли содержание Rn
евгжжется вдвое, наблюдаются суточные и сезонные колебания [381 ].
В гидросфере по данным НКДАР (1962 1), содержания Rn
- к;.»сж (Бк -1) океан 7 4 10 *4—1,1 • 10 2, реки 1.8 • 10 4—3 10'
тэемиые источники 2.6 10 3—5, водопроводная вода 3.7-10* 3—
-О
В во_»ах гидросферы в целом содержание Ra (%) оценивается
в I -10 14, в водах рек и в подземных водах из зоны активною
водообмена 2-Ю*13, в подземных глубинных водах затрудненного
вудообыена и-Ю** В * 10, в водах урановых месторождений 2 10 ,0.
иногда п- Ю“. Несколько обогащены R;; углекислые трещинные воды
гргнигоидов (10 10—10 11 г/л). Сульфатные воды, особенно при
выпадении барита, обедняются R.a. Наибольшее содержание его
270
наблюдается при низком количсс1вс сульфата и высоком Са, Ва
(хлоридно-кальциево натриевые глубинные рассолы артезианских бас-
сейнов, а также нефтеносные воды); В до 100—1000.
В США (Луизиана) нсфгеводная смесь из скважин в 5—30 раз
более ратиоакгивна, чем дезактивированные воды атомных электро-
станций Однако никто не контролирует радиоактивность подобных
вод, так как на это потребуются миллиарды долларов. Районы слива
нефтяных вод оказываются биологически мертвы. Наибольшая угроза
для людей исходит от разносимой ветром Ra-содержащей ныли,
а также от радиоактивного газа—Rn. Считается, что даже после
дезактивации люди будут подвергаться воздействию Rn (рак легких).
В Луизиане 70 тыс. действующих и 120 тыс. недействующих скважин
и не известно, какие из них наиболее заражены. В Калифорнии,
Пенсильвании, на Аляске слив нефтяных вод запрещен давно из-за
вредности ядовитых солей на основе углеводородов и идет их
закачивание обратно в землю. В Луизиане этот вопрос еще не решен.
Радиоактивное равновесие U/Ra в воде (~0,5- 10 7) отличается or
равновесною средне! о (~ 3,3 • 10”'%) В результа те происходит обогаще-
ние Ra океанических илов и других осадков из-за соосаждения с ионием
[574]. Содержание Ra в верхних горизонтах глубоководных осадков выше,
«ем в нижних. Так в верхнем горизонте красных тлии его содержится
1.1 10 ч%, а на глубине 250 см 8 10 11 %, что связано с распадом иония
и установлением с глубиной равновесия 11 —Ra [106, 574]. Интенсивное
поглощение Ra известковыми скелетами и гидроксидами Fe и Мп
сДвигает равновесие вправо. В глубоководных т лобит ериновых и радиоля-
рневых илах содержание Ra 8 • 10” 1О%, в терригенных 9 -10 10%, в Fe-Mn
конкрециях 2 10 ,0— 3 • 10 ’% [574]. В питьевой воде концентрация Ra
следующая (иг,л): США 3—8, ФРГ 0,3, Англия 0,03.
В сгроительных материалах содержание 226Ra, по данным НКДАР
(1962 т ). таково (Бк/кг): кирпич 23 152, известковый кирпич 6—25,
бетон 11—80, цемент 9—168, газобетон из глиноземистых сланнев
(Швеция) 320—2620, дерево 0,3— 0,5. ПДК 226Ra приведены в табл. 2
В окружающую среду, по X. Мур с соавторами (1976 г.), основное
количество Ra и его спутников попадает при производстве урана,
тория, фосфатных удобрений, цемента, а также при сжигании
минеральных топлив.
Очень высокие дозы облучения—более 300 мЗв/т, что в 6 раз выше
международного стандарта, принятого з атомной промышленности,—
получает персонал курортов и лечебных лабораторий, где применяются
радоновые ванны.
Выводы. Радий одни из редких, радиоактивных, суперрадио токсин
ных (Гл= 15, Т. и Т, 1007), возможно, особо биологически глобально
важных элементов. Геохимически сходен с Ва и L). Имеет изменчивую
во времени и по масштабам проявления геологическую, биологическую
и техногенную роль, определяя в основном естественный радиацион-
ный фогт Земли и техногенную радиоактивность. Постоянно воздей-
ствует на биосферу, организмы и экологию Земли.
271
СПИСОК ЛИТЕРАТУРЫ
1. Абрамович И. И. Клушин И. Г Геодинамика и металчогения складчатых
облапей.—Л.: Недра, 1987.
2. Агес П. Ключи к эколотии.— Л.: Сгройиздат, 1985.
3. Агрохичическая химия Под ред. А. Г. Шестакова.— М.: Сельхозиздат,
1954.
4. Айдиньян Н. А'., Троицкий А. И., Баловская Г. А. Распретеление ртути
в ра «личных почвах СССР и Вьетнама / Геохимия.— 1964.—№ 7,—С. 654—662.
5. Актуальные проблемы изменения природной среды за рубежом.— М.:
Изд-во МГУ. 1976.
6. А гекин О. А Основы гидрохимии.— Л.: Гйдрометеоиздат, 1970.
7. Алекин О. А.. Ляхин Ю. И. Химия океана.— Л.: Гйдрометеоиздат. 1984.
8. Алексиев Е. Геохимия редкоземельных элементов.— София: БАН, 1974.
9. Александров И. В. К геохимии редких и рудных элементов в «ранито-
идах.— М.: Наука. 1980.
10. Александров С. М., Барсуков В. Л.. Щербина В. В Геохимия эндогенного
бора.— М.: Наука. 1968.
11. Альберт Р. Торий: Промышленно-гигиенические аспекты.— М Медици-
на, 1971
12. А гьтгаузен М. Н. Уран, радий, торий Металлы в осадочных толщах.—
М . Наука, 1966 i—С. 102 —165.
13. Анашз объектов окружающей среды'И. И. Назаренко. Ю. П. Сотсков.
И. В. Кислова и др.— М.: изд. ВИЭМС, 1989.
14. Аношин Г Н. Золото в магматических горных породах.— Новосибирск:
Наука, 1977.
15. Антипин В. С., Коваленко В. И., Рябчиков И. Д. Коэффициенты распре-
деления редких элементов в магматических породах.— М.: Наука, 1984
16. Антропова Л. В. Формы нахождения элементов в ореолах рассеяния
рудных месторождений.— М.: Недра, 1975.
17. Антропозкологическая оценка и формирование оптимальной юродской
среды.—Л.: Гйдрометеоиздат, 1988.
18. Артюшкин А. М., Державин Л. М. Краткий справочник ио удобрени-
ям.— М., 1984.
19. Афанасьев М. И., Вузых И. К, Загрузина А. Н. Мониторинг фоновою
затрязнения природных сред.— Л.: Гйдрометеоиздат, 1989.
20. Багир-Заде Ф. М.. Нариманов А. А., Бабаев Ф. Р. Геолою-геохимические
особенности месторождений Каспийского моря.— М. Недра, 1988.
21. БадаювС. Т., Голованов И. М.. Дунин-Барковская 3. А Геохимические
особенности рудообразующих и редких элеменгов эндогенных месторождений
Чаткало-Кураминских гор.—Ташкент: Фан, Г971.
22. Бада юв С. Т. Геохимические свойства главнейших породо- и рудооб-
разующих элементов.— Ташкент: Фан, 1987.
23. Бабинец А. Е.. Mumpvno зыкий А. Ю , Ольшанский С П Гйдрогсоло! и-
ческие и геохимические особенности глубоководных отложений Черного
моря.— Киев: Наук, думка, 1973.
24. БашшовЮ. А. Геохимия редкоземельных эчеменгов.— М_: Наука. 1976.
25. Балашов Ю. А. Изотопно-геохимическая эволюция мантии и коры
Земли.— М. Наука, 1985.
26. Барабанов В- Ф. Геохимия.— Л.: Недра, 1985.
27 Барабой В. А. Ионизирующая ра /нация в нашей жизни.— М.:
Паука, 1991.
28. Баратов Р. Б.. Могоровский В. В., Лутков В. С. Петрология и петрохи-
мия магматических пород Памира и Гйссаро Алтая.— Душанбе Дониш, 1978.
29. Бариты Каратау /ТГ. Т. Блоха, Г'. Г. Ахманов. 4. Г. Кузнечевский и др.—
М : изд. ВИЭМС, 1988.
272
30. Барсуков В. Л. Некоюрые вопросы эеохимии бора//
Геохимия,— 1961,—№ 7,—С. 561—572.
3]. Барсуков В. Л. Основные черты эеохимии олова.— М.: Паука. 1974
32. Барсуков В. Л. Сравнительная п-танетология и ранняя история Земли/
Геохимия.—1981.— № 11.— С. 1603—1615.
33. Батурин Г. Н. Уран в современном морском осадкообразовании.— М.
Агомиздат, 1975.
34. Батурин Г. Н. Геохимия железомарганцевых конкреций океана.— М.:
Наука, 1986.
35. Батурин Г. Н. Распределение химических элементов в современных
фосфоритах и вмещающих осадках Геохимия.— 1989.—№5.—С. 747—751.
36. Башаркевич И. Л.. Костин Ю. П. Млитое Е. С Геохимические особен-
ности ископаемых углей//Редкомстальные месторождения в осадочных и вулка-
ногенно-осадочных формациях.— М изд. ИМГРЭ 1984.— С. 68—80.
37. Бгатов В. И История кислорода земной атмосферы.— М.: Недра,
1985.
38. Белевцев Я. Н., Егоров Ю. II., Олейник О А. Содержание малых элемен-
тов в главнейших типах пород Украинского шита//Геол, журнал.— Т. 36.—
1985,—С. 56—75.
39. Белянкина М. Н. Редкоземельные элементы и стронций в фосфоритах
Прибалтики Редкометальные месторождения в осадочных и вулканогенно-
осадочных формациях.— М.: изд. ИМГРЭ. 1984.— С. 29—40.
40. Бергер М. Г. Терриэенная минералотия.— М : Недра, 1988
41. Бердоносов С. С. Астат//Химическая энциклопедия. Т. 1.— М. Сов.
энциклопедия, 1988.— С. 211.
42. Берзина И Г. и др Определение концентраций U в минералах и юрных
породах / Атомная энергия.— Т. 23.— 1967.— Вып. 6.— С. 520—527.
43. Бериллий: Токсикология, гигиена, профилактика/Под ред. А. И. Бурна-
зян и др.— М : Эисргоатомиздат, 1985.
44. Белкин С. М. Основные типы потенциально редкометальных гранитовых
формаций мира; Типизация структур и магматических формаций при металло-
геническом районировании.— М. изд. ИМГРЭ, 1976 г.— С. 19—39.
45. Бескин С М . Ларин В. Н., Марин Ю. Б. Редкомета чьные гранитовые
формации.— Л.: Недра, 1979.
46. Бескин С. М.. Денисенко В. К., Марин Ю. Б. Петрологические особен-
ности гранитоидных серий как критерии оценки провинций и узлов на
редкометальное оруденение//Зап. ВМО, 1985,—Вып. 2—С. 155—167.
47. Беспамятное Г П.. Кротов Ю. А. Предельно допустимые концентрации
веществ в окружающей среде.— Л.: Химия, 1985.
48. Беус А. А Геохимия бериллия и генетические типы бериллиевых
месторождений.— М : Изд-во АН СССР, 1960.
49. Беус А. А.. Диков Ю. II. Геохимия бериллия в процессах эндогенного
минервлообразования.— М ГГедра, 1967.
50. Беус А. А., [ригорян С. В. Геохимические методы поисков и разведки
месторождений твердых полезных ископаемых.— М.: Недра, 1975.
51. Беус А. А. Происхождение и геохимическая эволюция земной коры//
Проблемы минеральною сырья.— М: Наука, 1975.— С. 116—132.
52. Беус А. А., [рабовская Л. И., Тихонова Н. В. Геохимия окружающей
среды.— М. Недра, 1976.
53. Беус А. А. Геохимия литосферы.—М. Недра, 1981.
54. Биогеохимические методы при изучении окружающей среды/Под ред.
Э. К. Буренкова. Н. Ф Челищева —М.: изд. ИМГ'РЭ, 1989.
55. Биогеохимическое районирование и геохимическая экология.— М.: На-
ука, 1981. (Тр. биогеохим. лаборатории. Т. 19).
56. Био югичелкач активность соединений германия/Э. Я. Луксвиц,
Т. К. lap, Л М Игнатович и др —Рига: Зинатне 1990.
57. Блисковский В. 3. Геохимия и особенности концентрации элементов-
примесей в фосфоритах: Автореферат канд. дис.—М., 1969.
273
18 2138
58. Богатиков О. А., Цветков А. А. Магматическая эволюция островных
дут.—М.: Наука, 1988.
59. Бойко Б. С., Журив лев Ю П., Юлдашев А 3. Вещественный состав эоце-
новых зернистых фосфоритов Средней Азии.— М.: изд. ВИЭМС. 1986.
60. Бойко Т. Ф. Мезатлоносиость поверхностных вод и рассолов.— М.:
Наука, 1969.
61. Бойко Г. Ф. Редкие элементы в галогенных формациях.— М
Наука, 1973.
62. Бойко Т. Ф. Лисицына И. А. Бутузова Г. Ю. Редкоземельные элементы
и литолого-фациальная зональность//Литология и полезные ископаемые.—
1988,—№ 3,—С. 3—14.
63. Большаков К. А. Химия и технология кобальта.— М.: Химия, 1981.
64. Большее Л. Н.. С мирное Н В. Таблицы математической статистики.—
М.: Наука, 1965.
65. Большое трещинное Толбачинское извержение / Под ред. С. А. Федото-
ва.— М.: Наука, 1984.
66. Бондарев Л. Г. Микроэлементы, благо и зло — М.: Знание, 1984.
67. Бондаренко В. И.. Коган Р. И., Чошкчн II. Г. Методические рекомен-
дации по первичной математической обработке данных при геохимических
поисках месторождений.— М.: изд. ИМГРЭ, 1984.
68. Борбат В. Ф., Волков В. И., Казанский Л. А. Производство кобальта из
сульфидных руд.— М.: Металлургия, 1983.
69. Борисенко Л. Ф. Скандий.— М.: Изд-во АН СССР, 1961.
70. Борисенко Л. Ф. Редкие и малые элементы в гипербазитах Урала.— М :
Наука, 1966.
71. Борисенко Л. Ф. Ванадий.— М.: Недра, 1973.
72. Борисенок Л. А Геохимия 1аллия.— М.: Изд-во МГУ, 1971.
73. Боришанская С. С, Виноградова Р. А.. Крутов Г. А. Минералы никезя
и кобальта.— М.: Изд-во МГУ, 1981.
74. Бородин Л. С.. Лапин А В Харченков А. Г. Редкометальные камафори
ты.— М.: Наука, 1973.
75. Бородин Л. С. Геохимия главных серий изверженных пород— М
Недра, 1981.
76. Бородин Л. С. Петрохимия магматических серий.— М. Наука, 1987.
77. Боруцкий Б. Е. Породообразующие минералы высокощелочных ком-
плексов.— М.: Наука, 1989.
78. БраунюуА.Х. Геохимия.— М.: Недра, 1984.
79. Бримбгкумб П. Состав и химия атмосферы.— М.: Мир, 1988.
80. Бродский А. А. Основы гидрогеохимичеекого метода поисков сульфид-
ных месторождений.— М.. Недра, 1964.
81. Броневой В. А.. Зильберминц А. В.. Теняков В. А Средний химический
состав бокситов и его эволюция во времени / Геохимия.— 1985.—№ 4.—
С. 435—446.
82. Брызги iuh О. В. Геохимия вольфрама в гидротермальном процессе.—
М.: Наука, 1976.
83. Будыко М. И , Ронов А. Б., Яншин А. Л. История атмосферы.—Л.: Гид-
рометеоиздат, 1985.
84. Булкин Г. А. Введение в статистическую геохимию.— Л.: Недра, 1972.
85. Булкин Г. А., Неженский И А Модели для количественного прогно-
зирования минерального сырья.—Л.. Недра, 1991.
86. Буренков Э. К., Кравченко Э С. Геохимическая зональность апатит
магнетиг-редкометальных месторождений.— М.: Наука, 1989.
87. Буренков Э. К., Сает Ю Е. Эколого-геохимические проблемы и методы
изучения урбанизированных терризорий// Гёоэколоз ические исследования
в СССР — М : Наука, 1989.—С. 19—28.
88. Бурков В. В. Оценка устойчивости минералов в процессе выветривания I/
Редкометальные месторождения в осадочных и вулканогенно-осадочных форма-
циях,—М.: изд. ИМГРЭ, 1984.—С. 60—68.
274
89. Бурков В. В.. Цодпорина Е. К. Фракционирование редких земель в корах
выветривания / Геолого-геохимические критерии экзо!енных редкометальных
месторождений.— М: изд. ИМГРЭ. 1988.— С. 74—79.
90. Буршн Ю. К.. Конюхов А. И.. Корнюшина Е Е. Литология нефтегазо-
носных голщ.— М: Недра, 1991.
91. Бурмин Ю. А. Геохимия рудоносных кор выветривания.— М.. Недра,
1987.
92. Буслаева Е. К).. Новгородова М. И. Элементно-органические соединения
в проблеме миграции рудною вещества — М,- Наука, 1989.
93. Бупювецкий В С Охрана природы при обогащении углей.— М .
Недра, 1991.
94. Бутузова Г. Ю. К вопросу о генезисе гидротермально-осадочных
образований Мирового океана;/Осадочная оболочка Земли в пространстве
и времени.— М Наука, 1989.— С. 120—131
95. Быбочкнн 4. М., Быховский Л. Козлов Ф. В Нетрадиционные источ-
ники танталового сырья Разведка и охрана недр. 1989.— № 3.— С. 30—34.
96. Быховер И. А. Распределение мировых ресурсов минерального сырья по
эпохам рудообразования.— М.: Недра, 1984.
97. Ваганов П. А. Содержание тяжелых металлов в продуктах пчеловод-
ства//Прикладная геохимия в геоэкологии и экологии.—Л.: Изд-во ЛГУ,
1990,—С. 30—32.
98. Ватшко М. Г. Геохимия брома в процессах галотенсза и использование
содержаний брома в качестве генетического и поискового критерия//Геохи-
мия.— 1956.— №6,—С. 34—41.
99. Валяшко М. Г. Закономерности формирования месторождений солей.—
М : Изд-во МГУ, 1962.
100. Вернадский В- И. И (бранные сочинения. 1. I.— М.. Изд-во АН
СС( Р, 1954
101. Вершковскач О. В . Краснова В. С Салтыкова В. С Галлий.— М.: Изд-
во АН СССР, 1961.
102. Виноградов А. П. Геохимия живого вещества.— Л.: Изд-во АН
СССР, 1932
103. Виноградов А. II. Химический элементарный состав организмов и пе-
риодическая система Д И Менделеева//Тр. Ь.Г >ГЕЛ АН СССР.— 1935.— № 3
104 Виноградов А П. Геохимия редких и рассеянных химических элементов
в почвах.— М.: Изд-во АН СССР, 1957.
105. Виноградов А. П. Среднее содержание химических элементов в главных
типах изверженных горных пород земной коры // Геохимия.— 1962.—№7.—
С. 555—571
106. Виноградов 4. П. Введение в геохимию океана.— М. Изд-во АН
СССР, 1967.
107. Виноградов А. П. Проблемы геохимии и космохимии.— М.: Наука,
1988.
108. Владыкин Н. В. Минералого-геохимические особенности редкометаль-
ных гранитоидов Монголии.— Новосибирск: Наука, 1983
109. Власюк II. А. Шкварук Н. М.. Сапатов С. Е. Химические элементы
и аминокислоты в жизни растений, животных, человека.— Киев: Наук,
думка, 1979
НО. Воган Д.. Крейг Дж. Химия сульфидных минералов.— М.: Мир, 1981.
111 Вйдковская И. К.. Лукашев К. П. Геохимические основы охраны биосфе-
ры.— Минск. 1977.
112 Водная токсикология, В. В. Метелев и др.— М.. 1971.
113 Войнар А И. Биологическая роль микроэлементов в организме живот-
ных и человека.— М.. Высшая школа, 1960
114. Войткевич Г. В., Кизильштейн Л. Я., Холодков Ю. И. Роль органиче-
ского вещества в концентрации металлов в земной коре.— М.: Недра, 1983.
115. Войткевич Г В.. Бессонов О. А. Химическая эволюция Земли.— М.:
Недра, 1986.
18
275
116. Полков И. И. Глобальный биогеохимический цикл серы и влияние на
него деятельности человека,—М.: Наука, 1983.
117. Во лков И И. геохимия серы в осадках океана.— М : Наука, 1984.
118 Во юх А. А. Оценка уровня загрязнения атмосферного воздуха террито-
рии хозяйственного освоения.— М.: изд. ИМГРЭ, 1992.
119. Волохин К). Г. 1еохимические критерии при корреляции кремневых
толщ и палеогеографических реконструкциях , Литология и полезные ископа-
емые,— 1988.—№ 3.—С. 64—81.
120. Вольфсон Ф. И., Дружинин А. В. Главнейшие типы рудных месторож те-
ний—М.: Недра, 1975.
121. Вопросы гигиены труда на урановых рудниках и обогатительных
предприятиях / А. М Булыгина, А В Быховский, А. Н. Корнилов и др,—М
1971.
122. Воронков М. Г. Металлатраны — новый класс физиологически актив-
ных веществ//Вести. АН СССР.— 1988.—№10.— С. 48—53.
123. Воронков М. Г., Зе лиан Г. И Миронов В. Ф. Кремний и жизнь.— Рига:
Зинатне, 1978.
124. Воронков А. А.. Шумяцкая Н. Г., Пятенко Ю. А Кристаллохимия ми-
нералов циркония и их искусственных аналогов.— М Наука, 1978.
125. Воротников Б. А. Водные потоки рассеяния сульфидного оруденения
Алтая и их поисковое значение.— М.: Недра, 1974.
126. Воссоевич Н. Б. геохимия органического вещества и происхождение
нефти.— М . Наука, 1986.
127. Вредные вегцества в промышленности—Л.: Химия, 1977.
128. Вредные химическиес вегцества: Неорганические соединения А. Л. Бан-
дман, Б. А. Ивин и др.; Под рсд. В. А. Филова,—Л.: Химия, 1988—1989.
129. Вредные химические вещества: Радиоактивные вещества В А Ба-
женова, Л. А. Булдаков, И. Я. Василенко и др.; Под ред. В. А. Филова.— Л
Химия, 1990.
130. Вредные химические вегцества: Углеводороды Под ред. В А. Фило-
ва.—Л.: Химия, 1990.
131. Временные гигиенические нормативы содержания некоторых хими-
ческих элементов в основных нишевых продуктах—М.. 1982.
132. Вулканические пояса Востока Азии/Под ред. А. Д ГЦег лова,— М
Наука, 1984.
133. Высоцкий Н. Б. Геохимия органического вегцества и происхождение
нефти. -—М.: Наука. 1986.
134. Гавриленко В. В., Сахоненок В. В. Основы геохимии редких литофиль-
ных металлов.— Л.: Изд-во ЛГУ. 1986.
135. [авриюв В. IJ. геология и минеральные ресурсы Мирового океана.—
М.. Недра, 1990.
136. Гавришин А. И. 1йлрогеохимические исследования с применением мате-
матической статистики и ЭВМ.— М: Недра. 1974
137. /аврусевич Б. А. Основы общей геохимии.— М : Недра, 1968.
138. Галибин Г. II., Новиков Ю. В Токсикология промышленных соединений
урана.— М., 1976.
139. Ганзеев А. А., Соболев С. Ф., Бельков В. И. Редкие элементы в крупных
промышленных месторождениях докембрийских железистых кварцитов Редкие
элементы: Сырье и экономика.—М изд. ИМГРЭ. 1977
140. lap Т. К. Миронов В. Ф. Биологическая акт ивность соединений герма-
ния,—М., 1982.
141. Гви лдис В К)., Кременецкий А. А., Ридов В. В Методические рекомен-
дации по применению способа анализа серы.—-М.: изд. ИМГРЭ. 1991.
142. 1енезис эндогенных рудных месторождений Под ред В. И. Смирно-
ва,—М.: Недра, 1968.
143. Генезис рудных месторождений Под ред. Б. Скиннера - М : Мир, 1984.
144. Iдиетические модели эндогенных рудных формаций Под ред.
В. А. Кузнецова и др.— Новосибирск: Наука, 1983.
276
145. Теистические типы гидротермальных месторождений бериллия Под
ред. А И. Гинзбурга.—М.: Недра, 1975.
146. Теодинамические и пстрогеохимические принципы прогноза рудонос-
ности Дальнего Востока/В. Л. Барсуков, Ю. И Бакулин, А. Г. Волосов и др.//
Геохимия.— 1985.—№8.— С. 1078—1089.
147. Теологический справочник по сидерофильным и халькофильным редким
металлам В. В. Иванов, О. Е. Юшко-Захарова, Л. Ф. Борисенко, Л. Н. Овчин-
ников; Под ред. Н П. Лаверова.— М.: Недра, 1989.
148. Теологическое строение СССР. Т. 5, Под ред. Л. И. Боровикова,
А. И. Семенова.— М.: Недра, 1969.
149. Теология, геохимия, минералогия и методы оценки месторождений
урана/Под ред Б. Де Виво и др.— М.: Мир, 1988.
150. Геоюгия и генезис оловорудных месторождений Якутии/Б. Л. Флеров,
Л. Н. Индолев, Я В. Яковлев и др.— М.: Наука, 1971.
151. Теология и геохимия природных горючих газов/В И. Ермаков,
Л М. Зорькин. В. А. Скоробогатов и др.— М.. Недра, 1990.
152. Теология и радиогеохимия Средней Сибири/Под ред. В. А Куз-
нецова.— Новосибирск: Наука, 1985.
153. Геология месторождений и обогащение баритовых руд/Под ред.
А. С. Соколова и др.— М.: изл. ГИГХС, 1977.
154. Теология месторождений и обогащение баритовых руд.— М.:
Недра, 1977.
155. Теоюгия месторождений уран-молибденовой рудной формации/
Б. П. Власов, И М Воловикова, И М Гладышев и др.— М.: Атомиздат. 1966.
156. Теология окраин континентов' Под ред. Г. Б. Левашова и др.—
Владивосток: изд. ДВНЦ АН СССР, 1979.
157. Тео юго-генетические модели главных эндогенных редкометальных
месторождений Казахстана/Г. Н. Щерба, Т. М. Лаумулин, А. В. Кудряшов
и др.//Генетические модели эндогенных рудных месторождений.— Новосибирск:
Наука, 1983.
158. Тёоргиевский В. И. Минеральный обмен//Физиология сельскохозяйст-
венных животных.— Л., 1978.— С. 217—255.
159. Тёохимическая модель Тихоокеанской окраины Азии/Под ред.
И. Н. Говорова.— М.: Наука, 1984.
160. Теохимическая оценка влияния бытовых и промышленных отходов на
окружающую среду Ю. Е. Сает, Л. И. Алексинская, И. Л. Башаркевич и др.//
Региональная геохимия и рудообразование.— М. Наука, 1980.
161. Геохимические критерии поисков месторождений бора/Э. К. Буренков,
А. Д. Гаршенин, И П. Заревич и др.— М.: Недра, 1979.
162. Геохимические особенности распределения золота в породах Ти-
хоокеанского пояса/В. Г. Моисеенко, С. Л. Щека, И. И. Фатьянов и др.— М :
Наука, 1971.
163. Теохимические поиски эндогенных месторождений редкйх элементов/
А. А. Беус, В. В. Берешилова, Л. И. Грабовская и др.— М.: Недра, 1968.
164. Теохимич архея, X. Венке, Г Дрейбус, Э. Ягоутс и др.— М.: Мир, 1987.
165. Теохимич гидротермальных рудных месторождений / Под ред. X. Бар-
нса.— М.: Мир, 1970.
166. Геохимия глубинных вулканических пород и ксенолитов/И. Н. Говоров,
И. П. Илупин, А. Д. Харькив и др.— М.: Наука, 1980.
167. Теохимия и петрология редкометальных плюмазитовых <ранитов —
Новосибирск. Наука, 1983.
168 Теохимич континентального вулканизма / Л. С. Бородин, В. С. Попов,
В. С. Гладких и др.— М.: Наука, 1987.
169. Теохимич кремнезема / Под ред. Н. М. Страхова.— М.: Наука, 1966.
170. Теохимич ландшафтов рудных провинций/А И. Перельман. Е. Н. Бо-
рисенко. Н. С. Касимов и др.— М.: Наука, 1982.
171. Теохимия магматизма/Л Н. Овчинников, Л. С. Бородин, В. С. Попов
и др —М.: Наука, 1982.
277
172. Геохимия, минералогия и генетические типы месторождений редких
элементов. Т. 1. Геохимия ' Под. ред. К А. Власова.— М.: Наука. 1964.
173. Геохимия, минералогия и генетические типы месторождений редких
элементов. Т. 2. Минералогия Под ред. К. А. Власова.— М.: Наука, 1966.
174. Геохимия, минералогия и методы определения элементов группы
платины/О. Е. Юшко-Захарова, В. В Иванов. И. С. Разина и др.— М.:
Недра, 1970.
175. Геохимия молибдена и вольфрама / Пол ред. В. В. Щербина.— М.:
Наука, 1971.
176. Геохимия окружающей среды Ю. Е. Сает, Б. А. Ревич. F. П. Янин
и др.— М.: Недра, 1990.
177. Геохимии питьевых вод в условиях техногенеза, В. 3. Рубейкин.
Б А. Колотов, Е. А. Киселева и др. И Гидрогеолог ичсские аспекты в экологии.—
М : изд. ВСЕГИНГЕО, 1991.
178. Геохимия платформенных и геосинклинальных осадочных пород
и руд/Под ред. А.А. Мигдисова.— М. Наука, 1983.
179. Геохимия радиоактивных элементов и золота Забайкалья Под ред.
Ф. П. Крендслсва.— Новосибирск: Наука, 1979.
180. Геохимия редких элементов/Под ред. А Б Ронова,—М: Изд-во
иное гр. лит., 1959.
181. Геохимия редких элементов в магматических комплексах Восточной
Сибири/Под ред. Л. В. Таусона.— М.: Наука, 1972.
182. Геохимия редкоземельных элементов в гипербазитах— Новосибирск.
Наука, 1985.
183. Геохимия редкоземельных элементов в эндоэенных процессах / Поз ред.
В. С. Самойлова.— Новосибирск: Наука, 1982.
184. Геохимия селена, теллура, висмута в медно-колчеданных месторожде-
ниях Урала и некоторые вопросы колчеданного рудообразования / О Е. Юшко-
Захарова, В. В Иванов, М. С. Воробьева и др. Геохимия.— 1978.—№ 9.—
С. 1368—1378.
185. Геохимия тяжелых металлов в природных и техногенных ландшафтах
Под ред. М. А. Глазовской.— М. Изд-во МГУ, 1983.
186. Геохимия элементов-гидролизатов Под ред. А. Б. Ронова. М.
Наука, 1980.
187. Геохимия элементов группы железа в эндогенном процессе
О. М Глазунов, А. С. Мехоношин, М. Н. Захаров и др.- Новосибирск:
Наука, 1985.
188. Геохимия элементов группы железа при дифференциации щелочных
серий океанических островов/Л. Н. Коэарко, В. Л. Барсуков, А. М. Асавин
и др.//Геохимия.— 1985.— №8.— С 1124—1139.
189. Геохимия элементов-примесей коматиитов Воронежскою кристалличе-
скою массива/А. В. Гирнис, П . Саддеби, И. Д. Рябчиков и др. Геохимия.—
1989.— № 8.— С. 1145—1152.
190. Герасимовский В. И., Восков В. И.. Когарко Г II Геохимия Ловозср-
ского щелочного массива.—М . Наука. 1966.
191. Герасимовский В. И. Геохимия Илимаусакского щелочною массива.—
М : Наука. 1969.
192. Герасимовекий В. И. Геохимия щелочных базальтов Геохимия.—
1978,—№ 3,—С. 350—358.
193. Гёцева Р. В.. Саве свева К. Т. Руководство ио определению урановых
минералов.— М.: Госгеолтехиздат. 1956.
194. Гигиенические аспекты оценки и оздоров тения окружающей срезы,—
М„ 1983
195. Гигиенические требования и контроль за качеством вод: [Сборник]:
ГОСТ 2874—82 и ГОСТ 3143—84 —М.: Изд-во стандарте. 1985.
196. Гладких В. С. Геохимические особенности щелочных оливиновых ба-
зальтов и щелочных базальтоидов различных тектонических структур континен-
тов и океанических островов Геохимия.-—1987.—Ке 7.—С. 928—945
278
197. Гладких В. С Калиевые щелочные базальтоиды.— М.: изд. ИМГРЭ,
1988.
198. Пазовская М. А. Геохимия природных и техногенных ландшафтов
СССР.— М.: Высшая школа, 1988.
199. Глазунов О. М Геохимия и рудоносность габброидов и гипербазитов.—
М Наука, 1981.
200 Глазунов О М Геохимическая типизация ультрамафитов // Проблемы
рудоносности магматических пород.— Иркутск, 1987.— С. 43—50.
201. Гюбальный биогеохимический цикл серы и влияние на него дея-
тельности человека 'И. И. Волков, В. А. Гриненко, М. В. Иванов и др.— М.:
Наука, 1983.
202. Годовиков А. А. Висмутовые сульфосоли.— М.. Наука, 1972.
203. Годовиков А. А. Особенности состава, систематика и некоторые черты
генезиса природных оксидов и силикатов//Изв. АН СССР. Сер. геол.—
1977.—№ I —С. 14—36.
204. Годовиков А. А Орбитальные радиусы и евойс!ва злеменгов.— Новоси-
бирск: Наука, 1977.
205. Годовиков А. А. Химические основы систематики минералов.— М.:
Недра, 1979.
206. Годовиков А.А. Периодическая система Д. И Менделеева и силовые
характеристики элементов.— Новосибирск: Наука, 1981.
207. Голева Г. А. Гидрогеохимические поиски скрытого оруденения.— М.
Недра, 1968.
208. Голева Г. А. Гйдрот сохимия рудных элементов,— М._ Недра, 1977.
209. Голованов И. М Меднорудные формации Западною Тянь-Шаня.—
Ташкент: Фан, 1978.
210. Гольдберг В. М.. Гозда С. Гидрогеологические основы охраны подзем-
ных вод от затрязнения.— М.: Недра, 1984.
211. Гончарук Е. И Сидоренко Г. И Гигиеническое нормирование хими-
ческих веществ в почвах.— М.: Медицина, 1986.
212. Гордеев В. В. Речной сток в океан и черты его геохимии.— М.:
Наука, 1983.
213. Горная энциклопедия. Т. 1—5.— М.: Сов. ищикл., 1984—1991
214. Горшков В. Г. Энергетика биосферы и устойчивость состояния окружа-
ющей среды.— М.. изд. ВИНИТИ, 1990.
215. Горшков В. Г.. Кондратьев К. Я., Лосев К. С. Глобальные экологические
перспективы/ Вести. РАН.—-1992.—№5.— ('.70—81.
216. ГОСТ 17.4.1.02—83. Охрана природы. Почвы. Классификация хими-
ческих веществ для контроля затрязнения.— М.: Итд-во стандартов, 1983.
217. Грант В. Эволюционный процесс.— М.: Мир, 1991.
218. Грибанова Н. К.. Кук шна Н. Ф. Сорбция микроколичеств цветных ме-
таллов железомарганцевыми океаническими конкрециями//Методы исследова-
ния технологических свойств.— М.. изд. ИМГРЭ, 1987.
219. Григорьев А. ГО. Индивидуальная радиочувствительность.— М.: Энерго-
атомиздат, 1991.
220. Григорьев В М Момд.жи Г С. Редкие тлементы в железных рудах.—
М.: Недра, 1966.
221. Григорьев II. 4. Бериллий в экзогенном цикле.— М.: Наука, 1978.
222. Григорьев Н. А Распределение бериллия на земной поверхности.— М.:
Наука, 1984.
223. Григорович В. К. Электронное строение и термодинамика сплавов
элементов.— М.: Наука, 1970.
224. Григорян С. В Первичные геохимические ореолы при поисках и развед-
ке рудных месторождений.— М. Недра, 1987.
225. Григорян С В.. Сает Ю. Е. Геохимические методы при решении некото-
рых экологических задач//Сов. геология —1980.—№11
226. Гриненко В. А Гриненко Л. Н. Геохимия изотопов серы.— М : Наука,
1974.
279
227. Гродзинский Д. М. Естественная радиоактивность растений и почв.—
Киев: Наук, думка, 1965.
228. Громов Б. В. Америций//Химическая энцикчонедия. Т. 1.— М., 1988.—
С. 226—228.
229. Грушко Я. М. Ядовитые металлы и их неорганические соединения
в промышленных сточных водах.— Л.: Химия, 1972.
230. Грсшко Я. М. Вредные неорганические соединения в промышленных
сточных водах.— Л : Химия. 1979.
231. Грушко Я М Вредные неорганические соединения в промышленных
выбросах в атмосферу.— Л.: Химия, 1987.
232. ГумеваЛ.А., Иткина Е. С. Микроэлементы углей, горючих сланцев
и их битуминозных компонентов.— М.: Наука, 1974
233. Гусельников В. Н. Теистические проблемы железорудных формаций
КМА,— М.: Наука, 1972.
234. Данчев В. И., Лапинская Т. А. Месторождения радиоактивного
сырья.— М.: Недра, 1980.
235. Дворников А. Г., Лирики лица С. И. Ртутоносность утлей Донецкого
бассейна.— М.: Недра, 1987.
236. Дегазация земли и геотектоника/Под рсд. П. Н. Кропоткина.— М.:
Наука, 1991.
237. Денисенко В. К. Месторождения вольфрама.— М.: Недра, 1978.
238. Динамика внутрикамерной дифференциации базитовых магм
М. Я. Френкель, А А Ярошевский, А. А Арискин и др.— М.: Наука, 1988
239. Дир У. А., Хауи Р. А. Зусман Дж. Породообразующие минералы.—
М_: Мир, 1965.
240. Дмитренко Н К. Докембрийские углеродистые сланцы и их редко-
метальность//Экзогенные месторождения-редких элементов.— М.: изд. ИМГРЭ,
1980.
2.41 . Добрецов Н. Л. Введение в глобальную петрологию.— Новосибирск:
Наука, 1980.
242. Добровольский В. В. География микроэлементов. Глобальное рассея-
ние.— М.: Мысль, 1983.
243. Добродеев О. П. Опыт количественной оценки глобальной геохимиче-
ской деятельности живого вещества//Вести. МГУ.—1974.— № 1.— С. 26—28.
244. Докембрийские железорудные формации мира/Под. ред В. М. Григо-
рьева.— М Мир, 1975.
245. Долобовская А. С. Характер биогенной аккумуляции микроэлементов
в лесных подстилках//Почвоведение.—1975.— № 3.— С. 63.
246. Дополнение № 3 к списку ПДК № 3086—84: Утв. М3 СССР № 5158
89.—М., 1989.
247. Дривер Дж. Геохимия природных вод.— М Мир, 1985.
2. 48. Дунин-Барковская Э. А., Айзенштат В. И. К распределению Bi, As, Sb
и Sn в некоторых гранитоидных интрузивах и породообразующих минералах
Чаткало-Кураминских гор//Зап. ВМО УзбССР.— Вып. 27.— 1974.— С. 77.
249. Дымков Ю. М. Урановая минерализация рудных гор.— М.: Атомиздат,
1960
250. Дьячков С. А. Титан и цирконий как неметаллические полезные
ископаемые.— М.: изд. ВИЭМС. 1988.
251. Евпатьевский П. В., Аржанова В. С. Баланс и трансформация миграци-
онных форм тяжелых металлов в техногеосистеме//Миграция загрязняющих
веществ в почвах и сопредельных средах.— Л.: Гидрометеоиздат, 1985.— С. 89.
252. Евсеева Л С.. Перельман А. И. Геохимия урана в зоне гипергенеза. М
Атомиздат, 1962.
253. Евстигнеева Т. Л., Некрасов И. Я. Лапутина И П. О фазовых отноше-
ниях в системе Pt—Fe—SO /'/ Докл. АН СССР.—Т. 308.— 1989.—№2.—
С. 440—444.
254. Емельянов Н. П. Динамика концентрирования редких и благородных
элементов в углеродистых сланцах//Геохимия.— 1989.— № 10.— С. 1379—1385.
280
255. Емлин Ф.. Ры юва Л. II. Геохимическая миграция цинка и кадмия при
промышленном освоении колчеданных месторождений.— Свердловск, 1986.
256. Еремин Н И. Неметаллические полезные ископаемые.— М.: Изд-во
МГУ, 1991.
257. Ермаков В. И.. Скоробогатов В. А. Образование углеводородных газов
в угленосных и субугленосных отложениях.—-М.: Недра, 1984.
258. Ершова 3. В.. Волгин А. Г. Полоний и его применение.— М., 1974.
259. Ефимов А. Ф. Типохимизм породообразующих темноцветных минера-
лов щелочных пород.— М.: Наука, 1983.
260. Ефимов А. Ф. Кларки породообразующих минералов — фундаменталь-
ная основа геохимии Минеральные кларки и природа их устойчивости.—
Душанбе, 1986,—С. 41—43.
261. Жабин А. Г., Самсонова Н. С., Исакович И. 3. Минералогические
исследования околорудных ореолов.— М.: Недра, 1987.
262. Жариков В. А., Маракушев А. А. К проблеме рудоносности маг-
матических серий / Магматизм и эндогенное рудообразование.— М.: Наука,
1976 —С 5 — 12.
263. Журавлев В. Ф. Токсикология радиоактивных веществ.— М., 1982.
264. Загрязнение воздуха и жизнь растений.— Л.: Гидрометеоиздат,. 1988.
265. Зайков Г. Е.. Маслов С. А., Рубай до В. Л. Кислотные дожди и окружа-
ющая среда.— М.: Химия, 1991.
266. Закономерности концен|рации рудных элементов в гранитоидных
формациях Карело-Кольского региона/Под ред. А Н Вино:радова и др.—
Апатиты: изд. ГИ АН СССР, 1985.
267. Закономерности распределения редкоземельных элементов в осадочной
оболочке и земной коре /А Б Ронов, Ю. А. Балашов, Ю П. Гирин и др.//
Геохимия.—1972.— № 12.- С. 1483—1514.
268. Закономерности распространения и формирования металлоносных
рассолов/Г. А. Голева, М. В. Торикова, Л. Н. Алексинская и др.— М.: Недра,
1981.
269. Захаров Е. II Об учете летучести и сорбции ртути при геохимических
поисках месторождений попетых ископаемых/ Геохимия.— 1989.— № 10.—
С 1428—1436.
270. Защита атмосферы от промышленных загрязнений/Под ред.
А. Г. Сугутина.— М.: Металлургия, 1988.
271. Зе.шкман А. М.. Меерсон Г. А. Металлургия редких металлов.— М.
Металлургия, 1973.
272. Земская И. П.. Ляпунов С М. Типохимические особенности кварца из
гранитных пегматитов' Типохимизм минералов гранитных пима гитов.— М.
изд. ИМГРЭ, 1984 —С. 46—52.
273. Зенин А. А., Бе юусова И. В. Гидрохимический словарь.—Л.: Гидромете-
оиздат, 1988.
274. Злобинскчй Б. М.. Иоффе В. Г., Зюбинский В. Б. Воспламеняемое!ь
и токсичность металлов и сплавов.— М.: Металлургия, 1972.
275. Заюто и редкие элементы в геохимических процессах/Под ред.
Ю. Г. Щербакова.— Новосибирск: Наука, 1976.
276. Зонн С. В. Железо в почвах.— М.: Паука, 1982.
277. Зубатарева Л. И. Иванкин П. Ф.. Балашова С. П. Промышленно-
генетические типы месторождений МПГ развитых капиталистических и развива-
ющихся стран и их геолог о-экономическое значение.— М изд. ВИЭМС, 1980.
278. Зубков Л. Б., Галецкий Л С.. Металиди С. В. Минералы гельвиновой
I руппы и их месторождения.— Киев: Наук, думка, 1976.
279. Иваницкий Т. В., Джанджгава М. И. Геохимия сульфидных месторож-
дений Грузии.—Тбилиси: Мецниереба, 1980.
280. Иванов В. В. Минералого-геохимические черты и индиеносность
оловорудных месторождений Якутии.— М.: Наука. 1964.
281. Иванов В. В. Геохимия рассеянных элементов в гидротермальных
месторождениях.— М.: Недра, 1966.
281
282. Иванов В. В. О геохимической группировке тигенетических рудных
месторождений//Докл. АН СССР.— Т. 176.— 1967.—№ 6.— С. 1400—1402.
283. Иванов В. В., Поплавко Е. М., lopoxoea В. Н. Геохимия рения.— М.:
Наука, 1969.
284. Иванов В. В. Геохимические особенности и условия образования
главных типов рудных районов//Международный геохимический конгресс. Тез.
докл.— М.: изд. ГЕОХИ, 1971.— С. 143—154.
285. Иванов В. В. Металлогения редких элементов//Закономерности раз-
мещения полезных ископаемых.— М.: Наука, 1973.—С. 279—288.
286. Иванов В. В., Панфилов Р. В. О геохимической корреляции минераль-
ных ресурсов//Докл. АН СССР—Т. 249 —1979,—№ 1,—С. 193—196.
287. Иванов В. В. Геохимическое прогнозирование сырьевых источников
халькофильных редких элементов//Региональная геохимия и рудообразова-
ние.— М.: Наука, 1980.— С. 32—48.
288. Иванов В. В., Поплавко Е. М., Тимофеева О. С. Особенности распределе-
ния элементов-примесей в углеродистых сланцах Эстонии//1еохимия.—1984.—
№ 6,—С. 903—912.
289. Иванов В. В., Панфи юв Р. В. О зависимости между рассеянием
и концентрацией в общем геохимическом цикле mhi рации элементов в земной
коре//Геохимия.—1985.— № 9.— С. 1250—1259.
290. Иванов В. В., Клаповская Л. И., Комин М. Ф. Технико-экономические
и сырьевые возможности редких металлов в научно-техническом процессе//
Роль редких металлов в ускорении научно-технического прогресса.—М.- изд.
ИМГРЭ, 1986,—С. 120—124.
291. Иванов В. В.. Юшко-Захарова О. Е. Соотношение распространенности
химических элементов и числа их минералов в континентальной земной
коре//Докл. АН СССР.—Т. 308.—1989.—№ 2.—С. 448—451.
292. Иванов В. В., Юшко-Захарова О. Е. Геохимическая систематика элемен-
тов и минералогическая статистика//Докл. АН СССР.— Т. 310.—1990.— № 5.—
С. 1213—1216.
293. Иванов И. В., Глазовский Н. Ф. Геохимический анализ почвенного
покрова степей и пустынь.— М., 1979.
294. Иванов П. В. Теоретические основы биогеохимическою метола поисков
рудных месторождений.— Новосибирск: Наука, 1976.
295. Иванов Ю. Г. Геохимические и минерало! ические критерии поисков
вольфрамового оруденения.— М.: Недра, 1974.
296. Иванова Г. Ф., Максимюк И. Т. Тантал и ниобий в вольфрамитах
Монголии//Геохимия.— 1972.—№ 2.— С. 67—77.
297. Иванова Г. Ф. Геохимические условия образования вольфрамитовых
месторождений.— М.: Наука, 1972.
298. Иванова Г. Ф. Минералогия и геохимия вольфрамовою оруденения
Монголии.— М.: Наука, 1976.
299. Иванова Г. Ф„ Наумов В. Б. Основные параметры гидротермальных
растворов, формировавших вольфрамовые месторождения//Геохимия.— 1989.—
№ 7.—С. 925—935.
300. Иванова Г. Ф., Коровайков П. А., Черкасов Е. В. Геохимические
особенности стратифицированных шеелитсодержащих карбонатных пород (Ав-
стрийские Альпы)//Геохимия.— 1989.— № 9.— С. 1293—1306.
301. Игнатьев А. В., Евсеев Г. А. Биогеохимия морских беспозвоночных.—
Новосибирск.: Наука, 1979.
302. Изоитко В. М. Техноло! ическая минералогия вольфрамовых руд.— Л..
Наука, 1989.
303. Изох Э. П. Оценка рудоносности гранитоидных формаций в целях
прогнозирования.— М.: Недра, 1978.
304. Израэль Ю. А. Экология и контроль состояния природной среды.—Л.:
Тидрометеоиздат, 1984.
305. Иlynun И. П., Каминский Ф. В., Францессон Е. В. Теохимия кимбер-
литов.— М.: Недра, 1978.
282
306. И 1ъин И. Б. Биогеохимия и агрохимия микроэлементов (Мп, Си, В, Мо)
в южной части Западной Сибири.— Новосибирск. Наука, 1973.
307. Инструкции по геохимическим методам поисков рудных месторожде-
ний.— М Недра, 1986.
308. Инструкция по изучению и оценке попутных твердых полезных
ископаемых и компонентов при разведке месторождений угля и горючих
сланцев.— М.: Наука, 1987.
309. Исследование строения и фазового состава минеральных обьектов
комплексом физических методов для решения технологических задач // Под ред.
Г. К. Кривоконсва.— М.: изд. ВИМС, 1981.
310. Источники и условия мобилизации рудною вещества/В. И. Рехарский,
В. И. Коваленко, Н В. Петровская и др.//27 МГК. Докл. Т. 12- М., 1984.—
С. 20—27.
311. Кабанова Е. С.. Скосырева М. В, Солодов И. А. Теохимия и минерагения
тантала и ниобия.— М.: изд. ВИНИТИ, 1982.
312. Кабата-Пендиас А., Пендиас X. Микроэлементы в почвах и растени-
ях.— М.: Мир, 1989
313. Кабри Л.. Haidpemm А. Природа распределения и концентрации
элементов планитовой группы в различных геологических средах//27 МГК.
Докл. Т. 10,—М., 1984,—С. 10—26.
314. Kateepm С., Инглунд Г. М. Защиза атмосферы от промышленных
загрязнений.— М.: Мезаллурзия, 1988
315. Каледонский комплекс ультраосновных-щслочных пород и кар-
бонатитов Кольского полуострова и Северной Карелии/А. А. Кухаренко,
М. П. Орлова, А. Г. Булах и др.— М.: Недра, 1965.
316. Ка синин СК.. Файн Э Я.. Егизбаева К. Е. Стабильный иэотозз
осмий-187.— А зма-Ага: Наука, 1975.
317. Каменский И. Л.. В. II. Якуцени, Б. А. Мамырин и др. Изотопы зелия
в природе//Геохимия.— 1971.— № 8.— С. 914—931.
318. Каминский Ф. В. Новый генетический тип промышленно-алмазо-
носных пород—лампроиты Западной Австралии.— М.: изд. ВИЭМС,
1987.
319. Канищев А. Д. Менакер Г. И. Средние содержания 15 рудообразующих
химических элементов в земной коре Забайкалья//Геохимия.—1974.—№ 2.—
С. 187—202.
320. Капустине кий А. Ф. К теории Земли//Вопросы зеохимии и минерало-
гии.— М.: Изд-во АН СССР, 1956.
321. Капустин Ю. Л. Минералогия карбонатитов.— М : Наука, 1971.
322. Капустин Ю. Л. Геохимия стронция и бария в карбонатитах //
Геохимия,—1982—№ 3.—С. 369—380.
323. Караюва 3. К., Мясоедов Б. Ф. Актиний.— М., 1982.
324 Карпенко С. Ф. Протактиний, полоний//Горная энциклопедия. Т. 4.—
М., 1989,—С. 261.
325. Катченков С. М. Малые химические элементы в осадочных породах
и нефтях.— Л.: Тостонтехиздаг. 1959.
326. Каюпова М. М. Минералогия железных и марганцевых руд Западного
Атасу.— Алма-Ата. Наука, 1974.
327 Келсер К. Химия трансурановых элементов.— М., 1976.
328. Кист А. А. Фсноменалогия биоюохимив и бионеорганической химии.—
Зашкент: Фан, 1987.
329. Кова сев В. 4. Болотные минералого-геохимические системы.— Минск:
Наука и техника, 1985.
330. Ковасевский А. Л. Естественные радиоактивные элементы в растениях
Сибири.— Улан-Удэ: Бурят, кн. изд-во, 1966.
331. Коваяевский А. Л. Биогеохимические поиски рудных месторождений.—
М.. Недра, 1984.
332. Ковасснко В. И Петрология и геохимия редкомстальных гранито-
ицов.— Новосибирск: Наука, 1977.
283
333. Коваленко В. И.. Наумов В. Б., Богатиков О. А. Потенциальная
рудоносность кислых магматических пород//27 МГК Докл. Т. 9.— М.. 1984.—
С. 94—103.
334. Коваль П. В. Петрология и геохимия а тьбитизировапных гранитов.—
Новосибирск: Наука, 1975.
335. Ковальский В. В., Андрианова Г. А. Микроэлементы (Cu, Со, Zn. Мо.
Мп, В, 1, Sr) в почвах СССР.— Улан-Удэ: Бурят, кн. изд-во, 1968.
336. Ковальский В. В. Геохимическая экология.— М.. Наука, 1974.
337. Ковда В. А.. Брошевская И. В.. Тюрюканов А. II. Микроэлементы
в почвах Советского Союза.— М.: изд. МГУ. 1959.
338. Коган Б. И.. Названова В. А., Солодов Н. А. Рубидий и цезий.— М.:
Наука, 1971.
339. Коган Б. И.. Всршковская О. В., С чавиковская И Т. Галлий.— М
Наука, 1973.
340 Коган Б И. Редкие металлы. Состояние и перспективы.— М
Наука, 1979.
341. Когарко Л. Н.. ГЪччева Л. А. Геохимия талотенидов в щелочных породах
на примере Ловозерского массива//Геохимия.—1965.—№ 2.— С. 1011 —1023.
342. Когарко Л. Н , Криг чан Л. Д. Геохимия фтора в магматическом
расплаве.— М.: Наука, 1981.
343. Когарко Л. II. Условия концентрации циркония в магматических
процессах.— М.: Наука, 1988.
344. Козлов В. Д.. Свадковская Л. Н. Карпов И. К. Слюды магма гитов
Забайкалья.— Новосибирск: Наука, 1978.
345. Козлов В. Д. Геохимия и рудоносность гранитоидов редкометатьных
провинций.— М.: Наука, 1985
346. Козлов В. Д. Геохимическая типизация, формационный апатит и оценка
рудопосвосги гранитоидов в прогнозировании редкометального оруденения
Проблемы рудоносности гранитоидов.— Иркутск, 1987.— С. 3—28.
347. Козырев В В.. Ежков Ю. Б.. Левченко И. В и др. Редкие элементы
и акцессорные минералы в интрузивных комплексах Срединного Тянь-
Шаня,- -Ташкент: Фан, 1972.
348. Колодяжная А. А. Режим химического состава атмосферных осадков.—
М.: Изд.-во АН СССР, 1963.
349. Ко юнин Г. Р., Птицын А. Б. Термодинамический анализ условий
гидротермального рудообразования.— Новосибирск: Наука. 1974.
350. Ко ютов Б. А.. Крайнов С. Р., Рубейкнн В. 3. Основы гидрохимических
поисков рудных месторождений.— М. Недра, 1983.
351. Кольская сверхглубокая/Под ред. А. Козловского.— М.: Недра, 1984.
352. Комаров П. В. К геохимии фтора.— М.: изд. ВИНИТИ. 1969.
353. Комплексные месторождения халькофи тьных редких элементов/
В. В Иванов, О Е. Юшко-Захарова, Э Ф. Минцер и др.— М Недра, 1982.
354. Кондратьев К Я Глобальный климат.— C.-П.: Наука, 1992.
355. Конев А. А. Нефелиновые породы Саяно-Байкальской горной об-
ласти.— Новосибирск: Наука. 1982.
356. Корж В Д. Закономерности формирования элементного состава
гидросферы // Докл. АН СССР.— Т. 303.— 1988.—№2.— С. 467.
357. Косаче Я. А. Геохимия амазонитов апогранигов.— М Наука, 1976.
358. Космическое всшество/Под ред. Э. В Сотовича.— Киев: Наук
думка, 1986.
359. Костов И Минералогия.— М.: Мир. 1971.
360. Костов И., Минчева-Стефанова И. Сучьфидные минера ты.— М.
Мир, 1984.
361. Котегов К. В.. Павлов О. Н.. Шведов В. П. Технеций.— М.. 1965.
362. Кравченко С. М . Берзина И. Г. Уран в базальтах и долсритах по
данным /-радиографии.— М.: Недра, 1975.
363. Кравченко С. М. Фракционирование малых элементов при дифференци-
ации базитовых магм.— М : Наука, 1977.
284
364. Кравченко С. М., Богдасаров Ю. А. Геохимия, минералогия и генезис
апатитоносных массивов.— М. Наука. 1987.
365. Крайнов С. Р. Геохимия редких элементов в подтемных водах (в связи
с геохимическими поисками месторождений).— М.: Недра, 1973.
366. Крайнов С. Р.. Швец Б. М. Основы геохимии подтемных вод.— М/
Недра, 1980.
367. Красавин А. П. Защита окружающей среды в угольной промыш-
ленности.— М.: Недра, 1991.
368. Краткий справочник по геохимии Г. В. Войткевич, Л. F. Мирошников,
А. С. Поваренных, В. Г. Прохоров.— М.: Недра, 1977.
369. Краускопф К. Осадочные месторождения редких металлов//Проблемы
рудных месторождений.— М.: Итд-во иностр, лит.. 1958.
370. Кременецкий А. А. Метаморфизм основных пород докембрия и генезис
амфиболитов.— М.. Наука, 1979.
371. Крененецкий А. А., Боревский Л. В. Природа глубинных неоднород-
ностей фундамента Восточно-Европейской платформы//27 МГК. Докл. Т. 4.—
М.: Наука, 1984,—С. 122—123.
372. Кременецкий А. А., Овчинников Л. Н. Геохимия глубинных пород.— М.:
Наука, 1986.
373. Кривцов А. И. Гео динамические обстановки и рудообразугошис процес-
сы Геодинамический анализ и закономерности размещения полезных ископа-
емых,—М изд. ВСЕГЕИ, 1987.
374. Кривцов А. И. Месторождения платиноидов (геология, генезис, законо-
мерности размещения).— М.: изд. ВИНИТИ, 1988.
375. Критерии прогноза и оценки литиеворудных сподуменовых пег
матитовых районов и полей С. М Бескин, Л. Н Россовский, Э. Н. Лишневский
и др.— М., 1990.
376. Критерии прогнозной оттенки скарново-шеелитовых месторождений.—
М.: изд. ВИМС, 1985.
377. Критерии санитарно-гигиенического состояния окружающей среды:
Ртуть.— М : Медицина. 1979.
378. Крутов Г. А. Месторождения кобальта.— М Гост солтехиздат, 1959.
379. Крылова М. Д., 1а зубин В. А., Крылов Д. П. Главные темноцветные
минералы высокомегаморфизованных комплексов.— М.: Недра’ 199).
380. Ксенофонтов Б. Н. Использование отходов производства в народном
хозяйстве Мир науки.— Т. 32.— 1988.— № 3.- С. 14—17.
381. Кузин А. М. Природный радиоактивный фогг и его значение для
биосферы Земли.— М.: Наука, 1991
382. Кузнецов И. Е., Троицкач Т. М. Защита воздушного бассейна от за-
грязнения вредными веществами химических предприятий.— М : Химия,
1979.
383. Кузьменко М. В.. Еськова Е. М. Тан газ и ниобий.— М.: Наука, 1968.
384. Кузьменко М. В Геохимия тантала и генезис эндогенных танталовых
месторождений.— М . Наука. 1978.
385. Кузьменко М. В. Типохимизм минералов группы колумбит-тан галита //
Геохимические особенности минералов.—-М.: изд. ИМГРЭ, 1978.
386. Кузьменко М. В. Типохимизм минералов гранитных пегматитов.— М.:
изд. ИМГРЭ, 1984.
387. Кузьмин М. И. Геохимия магматических пород фанерозойских подвиж-
ных поясов.— Новосибирск. Наука, 1985.
388. Ку зиков Б. Ф., Зуев В. В., Вайнштенкер И. А. Минералогический спра-
вочник технолога-обогатителя.— М.: Недра, 1978.
389. Кутков Г. В., Жевлаков А. В. Бондаренко С . С. Минеральные лечеб-
ные воды СССР.— М.: Недра, 1991.
390 Кутолин В. А Проблемы петрохимии и петрологии базальтов.—
Новосибирск: Наука, 1972.
391. Лаврухина А. К., Позднчков А. А. Аналитическая химия технеция, про-
метия, астата и франция.— М., 1966.
285
392. Лаврухина А. К. Дифференциация химических элементов в фотопланет-
ном облаке и первичное вещество Земли//Космическое вещество.— Киев: Наук,
думка, 1986.— С. 21—34.
393. Лазаренков В. Г. О распределении микроэлементов в щелочных инт-
рузивных породах//Зап. ВМО.— Ч. 107.— 1978.— Вып. 1.— С. 55—64.
394. Лазаренков В. Г. Формационный анализ щелочных пород континентов
и океанов.—Л.: Недра, 1988.
395. Ландшафтно-геохимическое районирование и охрана среды.— М
изд. МГУ, 1983.
396. Лапин А. В. Лазеритные коры выветривания карбонатиюв и их
промышленное значение.— М : изд. ВИЭМС, 1990.
397. Ларин В. Н. О роли водорода в строении и развитии Земли '
1 Международный геохимический конгресс: Докл.— М 1971.— С. 38—40.
398. Ларин В. Н. Гипотеза изначально гидридной Земли.— М.. Недра.
1975.
399. Ларин В. Н. Гипотеза изначально гидридной Земли.— М.: Недра, 1980.
400. Ларичкин В. А., Лугов С. Ф.. Макеев Б. В. Геологические основы поис-
ков и оценки оловорудных месторождений.— М.: Недра, 1981.
401 Лебедев Б. А. Геохимия эпигенетических процессов.—Л.: Недра, 1992.
402. Лебедев В. И. Ионно-атомные радиусы и их значение для геохимии
и химии.— Л.: изд. ЛГУ, 1969.
403. Лебедев В. И. Кайносимметрия — один из важнейших закономерностей
периодической системы элементов и ее значение для геохимии и химии
Геохимия.— 1989.— № 7.—С. 915—923.
404. Лебедева С. И., Беляева И. Д., Дубакина Л. С. Микронеоднородность
тантало-ниобатов.— М.: Наука, 1985.
405. Левина Э. Н. Общая токсикология металлов.— Л.. Медицина, 1972.
406. Левинсон А. Введение в поисковую геохимию.— М Мир, 1976.
407. Левицкий Д. О. Биохимия мембран. Кальций и биологические мемб-
раны.— М Высшая школа, 1990.
408. Леонова Л. Л. Геохимия четвертичных и современных вулканических
пород Курильских о-вов и Камчатки//Геохимия.— 1979.— № 2.— С. 179—197
409. Летников Ф. А., Жатнуев Н С., Лашкевич В. В, Флюидный режим
гермоградиентных систем,-—Новосибирск: Наука, 1985.
410. Летников Ф. А. Флюидный режим литосферы и проблема рудонос-
ности магматических пород//Проблемы рудоносности магматических пород.—
Иркутск: изд. СО АН СССР, 1987.— С. 15—19.
411. Летуиова С. В., Ковальский В. В. Геохимическая экология микроор-
ганизмов.— М.: Наука, 1978.
412. Линник П. Н., Набиванец Б. И Формы миграции металлов в пресных
поверхностных водах.— Л.: Гидрометеоиздат, 1986.
413. Лисицын А. Е., Хитрое В. Г. Распределение бора в минералах пород
Среднего Ура за//Геохимия.—1962.— № 3.— С. 259—268
414. Лисицин А. Е., Малинко С. В., Орлова Е. В. Геологические особенности
и поисковые критерии промышленных месторождений бора.— М.: Недра, 1966.
415. Лисицин А. Е. Теологические основы поисков эндогенных месторожде-
ний бора.— М.: Недра, 1974.
416. Лисицин А. К. Гидрогеохимия рудообразования.— М.: Недра, 1975.
417. Лисицин А П. Процессы океанской седиментации.— М.: Наука, 1978
418. Лисицин А. П. Биогеохимия океана.— М. Наука, 1983.
419. Лисицин А. П. Тектоника плит и рудообразованис в океанах//Гео дина-
мический анализ и закономерности размещения полезных ископаемых.— Л
изд. ВСЕГЕИ, ИМГРЭ, 1987.
420. Листова Л. П., Бондаренко Г. П. Осаждение и дифференциация меди,
„винца и цинка в условиях зоны осадкообразования.— М Недра. 1978.
421. Лихачев А. П. Рудоносные магмагические формации месторождений
никеля и металлов платиновой группы//Тр. ЦНИГРИ.— Вып. 197.— 1985.—
(’ 36—41.
286
422. Лонцих С. В., Петров Л. Л. Стандартные образцы состава природных
сред.— Новосибирск: Наука, 1988
423. Лосев К. Я. Социально-экономические и экологические последствия
использования воды/'Изв. АН СССР. Сер. геол.— 1988.—№ 6.— С. 44—56.
424. Лукашев К. И., Лукашев В К Геохимические поиски элементов в зоне
гипергенсза.— Минск: Наука и техника, 1967.
425. Лутков В С.. Могаровский В В Геохимическая модель гранито-гнейсо-
вого слоя земной коры Южного Тянь-Шаня и Памира, Докл АН СССР. -
Т. 257.—1981.—№ 2 —С. 471—476.
426. Лутков Р И . Бондаренко В. Н. Математические модели зависимости
геологических объектов.— М.: Наука. 1989.
427. Лутц Б. Г. Химический состав кон гинентальной коры и верхней
мантии Земли.— М.: Наука, 1975.
428. Лутц Б. Г. Геохимия океанического и континентального магматизма.—
М.. Недра, 1980.
429 Лутц Б. Г. Магматизм подвижных поясов Земли.— М Наука. 1985.
430. Львович М. И. Вода и жизнь.— М.: Мысль, 1986.
431. Любшна Е И , Дворкин Э. Л. Гигиеническая токсикология металлов.—
М 1983.
432. Люттиг Г В. Влияние горнодобывающей промышленности на' окру-
жающую среду//27 МГК Докл. Сводный том.— М.. 1987.—С. 189—198.
433. Ляхович В В. Акцессорные минералы в гранитоидах Советского
Союза.— М. Наука, 1967.
434. Лчхович В. В. Редкие элементы в породообразующих минералах
гранитоидов.— М.: Недра, 1972.
435. Ляхович В. В. Редкие элементы в акцессорных минералах гранито-
идов.— М.: Недра, 1973.
436. Лчхович В. В. Связь оруденения с магматизмом (Тырныауз).— М.:
Наука, 1976.
437. Лчхович В В, Лчхович Т. Т. 1еохимическис особенности биотита
1еохимия.— 1987.— № 3.— С. 339—349.
438. Ляхович Т. Т., Ляхович В. В Новые данные о составе акцессорных
минералов, Геохимия.— 1983.— № 11.— С. 1616—1633.
439 Магматические горные породы. Т. l./Под ред. О. А. Богатикова,
В. 14. Гбпьшаковой.— М.. Наука, 1983.
440 Магматические горные породы. Т. 2. / Под ред. О. А Богатикова,
В. А. Кононовой.— М.: Наука, 1984.
441. Магматические горные породы: Основные породы/Нод ред.
О А. Богатикова, Е. В. Шаркова.— М : Наука, 1985.
442. Магматические горные породы: Кислые и средние породы/Под ред.
О. А Богатикова, В. В Ярмолюка, В. И. Ковалева.— М.: Наука, 1987.
443. Магматические горные породы/Под ред. В. 14. Коваленко.— М.. На-
ука, 1987.
444. Мак Ивсн М., Фитине Л. Химия атмосферы.— М Мир, 1978.
445. Макаров Е. С. Фактор взаимной химической индифферентности
атомов при изоморфных замещениях в кристаллах//Геохимия.—1968.—
№ 8,—С. 906—913.
446. Макаров Е. С. Изоморфизм атомов в кристаллах.— М.: Агомигдат,
1973.
447. Маккелви В. Е., Райт Н. Л., Боузн Р. В. Распределение богатых метал-
лами марганцевых конкреций в Мировом океане//27 МГК. Докл. Т 12.— М/
Наука, 1984 —С. 170—184
448. Макогон Ю. Ф. Газовые гидраты, прогноз их образования и ис-
пользование.— М Недра, 1985.
449. Макрыгина В. А. Геохимия регионального метаморфизма и улырамега-
морфизма умеренных и низких давлений.— Новосибирск: Наука, 1981
450 Максимюк И. Е. Касситериты и вольфрамиты.— М.: Недра, 1973.
451. Манн А. У. Химия окружающей среды.— М., 1982.
287
452. Манская С. М., Дрозоова Т. В. Геохимия орт анического вещества.— М.
Наука, 1964.
453. Маракушев А. А., Безмен Н. И. Термодинамика сульфидов и окислов
в связи с проблемами рудообразования.— М ; Наука, 1972.
454. Маракушев А. А.. Перчук Л. Л. Термодинамическая модель флюидного
режима Земли//Очсрки физ.-хим. петрологии. Т 4.— М.: Наука, 1974.—
С 102—130.
455. Маракушев А. А. Физико-химические условия генерации рудоносных
флюидов и проблема источников рудного вещества Источники рудного
вещества эндогенных месторождений.— М.: Наука. 1976.— С. 145—164.
456. Маракушев А. А. Термодинамические фактоРь| образования рудной
зональности//Прогнозирование скрытого оруднсния.— М Наука, 1976.
457. Маракушев А. А Петрогенезис и рудообразование.— М.: Наука, 1979
458. Маракушев А. А. Периодическая' система экстремальных состояний
химических элементов.— М.: Наука, 1987.
459. Маракушев А. А., Безмен Н. И. Минералого-петрологические критерии
рудоносности изверженных пород.— М.: Недра, 1992.
460. Марин Ю. Б. Грапитоидные формации малых и умеренных глубин.—
Л., изд. ЛГУ, 1976.
461. Марин Ю. Б., Скублов Г. Т., Бакштейн Б. Г. Петрохимическая эволю-
ция фансрозойских гранитоидных формаций.— Л.. Недра, 1983.
462. Марре I Дж., Кеттл С., Теддер Дж Химическая связь.—М.: Мир,
1980.
463. Медно-порфировые месторождения Алмалыка.—Ташкент: Фаи, 1974.
464. Меднорудные месторождения — типы и условия образования Под ред.
А. И. Кривцова, Ю. В. Ботданова, М. Б. Бородаевской и др.— М.: Недра, 1987.
465. Медь в системе гранат — флюид/И. Д. Рябчиков, Г. П. Орлова,
А. С. Ефимов и др.//Геохимия.—1980.— № 9.— С. 1320—1326.
466. Международный геохимический конгресс: Тез. докл.— М : изд. АН
СССР, 1971.
467. Мейнард Дж. 1еохимия осадочных рудных месторождений.— М.:
Мир, 1985.
468. Мейсон Б. Основы геохимии,—М.: Недра, 1971.
469. Мелконян Р. Л. Петрология палеоостроводужных габбро-грани т оид-
ных формаций//Кристаллическая кора в пространстве и времени.— М.: Наука.
1989,—С. 166—176.
470. Мельников Н. Н., Швиндлерман Г. С. Инсектициды// Химическая энцик-
лопедия. Т. 2.— М., 1990
471. Меро Дж. Минеральные богатства океана.— М Прогресс, 1969.
472. Месторождения литофильных редких металлов / Под ред. Л. Н. Овчин-
никова, Н. А. Солодова.— М.: Недра, 1980.
473. Месторождения урана и редких металлов, И. М. Баюшкин,
Н. Н. Железняк, Ю. Л. Капустин и др.— М. Атомиздаг, 1976.
474. Металлогения и геохимия угленосных и сланцесодержащих толщ
СССР/Под ред. Н. А Созинова.— М.: Наука, 1987.
475. Металлогения Казахстана. Рудные формации. Элементы-спу1ники
в рудах/Под ред. А. К. Каюпова и др.— Алма-Ата: Наука, 1980.
476. Метал гы в осадочных толщах, Под ред. Л. В. Пустовалова.— М
Наука, 1964.
477. Металлы. Гигиенические аспекты оценки и оздоровления окружающей
среды.— М.: Изд. ИОКГ, 1983.
478. Методические рекомендации по литохимическим методам при поисках
и разведке ртутных месторождений Под ред. С. В. Григоряна, В П Федорчука,
В М Рогового.— М.- изд. ИМГРЭ, 1979.
479. Методические рекомендации по установлению ПДК химических ве-
ществ в почвах.— М.: Медицина, 1976.
480. Методы количественного прогнозирования ресурсов редких металлов
В В Иванов, С. М. Бескин, В. Н. Бондаренко и др.— М Недра, 1985.
288
481. Микроэлементы в атмосфере фоновых районов суши и оксана/
А. X. Остромогильский, Ю. А. Анохин, В. А. Ветров и др.— Обнинск изд.
ВНИИГМИ—МЦД, 1990.
482. Микроэ лементы в минералах / Под ред. Г. Б. Левашева и др.— Влади-
восток, изд. ДВНЦ АП СССР, 1976.
483. Микроэлементы в питании человека: Доклад Комитета экспертов
ВОЗ.— Женева, 1975 г.
484. Микроэ ле пентозы человека/А. П. Авцын, А А. Жаворонков,
М А. Риш, J1. С. Строчкова.— М : Медицина, 1991.
485. Минеев Д. А. Лантаноиды в минералах.— М.: Недра, 1969.
486. Минеев Д. А. Лантаноиды в рудах.— М.: Наука, 1974.
487. Минералогические таблицы/Е. И. Семенов, О. Е. Юшко-Захарова,
И. Е. Максимюк и др.— М.: Недра, 1981.
488. Минералогия 27 МГК. Докл. Т. 10.— М.. Наука, 1984.
489. Минералогия гидротермальных месторождений бериллия/А. И Гинз-
бург, И. И. Куприянова, М. И. Новикова и др.— М.' Недра, 1976.
490. Минералогия и геохимия вольфрамовых месторождений/Под ред.
В. Ф. Барабанова.— Л.: Изд-во ЛГУ, 1975.
491. Минералогии медно-никелсвых месторождений Кольского п-ова/
Ю Н. Яковлев, А. К. Яковлева, Ю. Н. Нсрадовский и др.— Л.: Наука, 1981.
492. Минера ня благородных металлов / О. Е. Юшко-Захарова, В В. Иванов,
Д. К. Щербачев и др.— М.: Недра, 1986.
493. Минералы бора С В. Малинко, И. И. Халтурина, А. А. Озол,
В М. Бочаров.— М.' Недра, 1991.
494. Минералы улыраосновных парагенезисов в кимберлитах и условия их
образования/Под ред. Н. П. Похиленко.— Новосибирск: Наука, 1988.
495. Минера гьные ресурсы промышленно развитых капиталистических
и развивающихся стран/В. Н. Полуэктов, А. Г. Воробьев, А. И. Попова и др.—
М.: изд. Союзгеолфонда, 1981.
496. Минин В. А., Довга и> В. Н. Петрохимические особенности щелочных
гранитоидов различных формаций//Геол, и геофизика.—1990.—№ 4.— С. 23—
28.
497. Мир 80-х годов: Сб. обзор, статей.— М.: Прогресс, 1989.
498. Мирлин Г. А. Современные проблемы минеральных ресурсов//Разви-
тие минералогии и геохимии и их связь с учением о полезных ископаемых.— М.:
Наука, 1983,—С. 192—214
499. Миронов А. Г., Ножкин А Д. Золото и радиоактивные элементы
в рифейских вулканогенных породах (Енисейский кряж).— Новосибирск:
Наука, 1978.
500. Митряева Н. М Минералогия баритово-цинково-свинцовых месторож-
дений Атасуйского района.— Алма-Ата: Наука, 1979.
501. Мицкевич Б. Ф. Редкие элементы Украинского щита и проблемы их
прогнозирования,'/Геохимия и рудообразование.— Киев: Наук, думка, 1978.—
С. 3—9.
502. Мозгова Н. И., Бородаев Ю. С.. Органова Н. И. Полифазность выделе-
ний франкеитов и цилиндритов // Неоднородность минералов и тонкие мине-
ральные смеси.— М.: Наука, 1977.— С. 43—65.
503. Мозгова Н Н., Цепин А. И. Блеклые руды.— М.: Наука, 1983.
504. Мозгова Н. Н. Нестехиометрия и гомологические ряды сульфосолей.—
М.: Наука, 1985.
505. Моисеенко В. Г., Михайлов М А , Сахно В Г. Поведение золота и серебра
при осадконакоплении, вулканизме и метаморфизме.—Новосибирск: Наука, 1974.
506. Моисеенко В. Г. Геохимия и минералогия золота рудных районов
Дальнего Востока.— М.: Наука, 1977.
507. Момджи Г. С., Чистякова Н. М Геохимические типы железорудных
формаций "Геохимия.— 1979.— № 6.— С. 840—853.
508. Монин А. С., Сорохтин О. Г. Эволюция океанов и геохимия континсн-
тов//27 МГК. Докл. Т. 3.—М., 1984—С. 22—34.
19 2138
289
509. Минин А. С Глобальная экологическая безопасность Вести. АН
СССР,— 1986. - № 8,—С. 84—89.
510. Мониторим.' фонового загрязнения природных сред/Под ред.
Ю А. Израэля. Ф. Я. Ровинского. — Л.: Гйдромстеоиздаг, 1992
511. Маски сев К) И., Стресьцова В. Н. Лучевой канцерогенез в проблеме
радиационной защиты.—М.: Медицина, 1982.
512. Москалев Ю. И. Минеральный обмен.— М.. Медицина, 1985.
513. Mvp Дж.. Рамамурти С Тяжелые металлы в природных водах.— М.:
Мир, 1987.
514. Мюлеер Ю. Время осаждения и траектория перемещения химически
активных веществ в атмосфере//Атомохимия.—Л.: Гйдрометеоиздат, 1983.—
С. 73—195.
515. Набоко С. И. Металлоносное гь современных тидротерм в областях
гектономатматической активности.— М: Наука, 1980.
516. Надежиоеть анализа горных пород В Г Хитров, Г F Белоусов.
Н А Ьожевочьнова и др.— М : Наука, 1985
517 Нарке ион Л. Ф. Геология и оруденение Джезказганского месторожде-
ния,— М.: изд. АН СССР, 1962.
518. Наумов Г. Б.. Рыженка Б. Н„ Ходаковский И. Л. Справочник термоди-
намических величин (для геологов).— М.. Атомиздат, 1971
519. Научные основы и практическое использование типоморфизма минера-
лов: Нсъетд ММА. Гез. докл.— М Наука, 1980.
520. Надумав И. Б. Генезис гранитов и грани г степная метазлогения— М
Наука, 1988
521. Некрасов И. Я. Геохимия олова н редких элементов Всрхояно-Чукот-
ской складчатой области.— М. Наука, 1966.
522. Некрасов И. Я. Фазовые соотношения в оловосодержащих системах.
М.: Наука, 1976.
52). Наручев С. Г. Уран и жизнь в истории Земли.— Л.- Недра, 1982.
524. Несвижская Н. И., Саепс IO. Е Геохимические принципы выделения
предельно допустимых концентраций химических элементов в почвах Миг-
рация загрязняющих веществ в почвах и сопредельных средах.— Л.: Птдрометсо-
излат, 1985.— С. 10.
525. Несмеянов А. Н. Радиохимия.— М., 1978.
526. Нестеренко Г. В.. Альмухамедов 4. И. Геохимия дифференцированных
траппов.— М.. Наука, 1973
527. Нефтега юное шесть Мирового океана.—М . изд. СЭВ, 1984.
528. Никитин Д. П . Новиков К). В. Окружающая среда и Человек.— М
Высшая школа. 1986.
529. Никитин К. К., Гсазовский А А. Никеленоспые коры выветривания
ультрабазитов и методы их изучения.— М Недра, 1970.
530. Никольский А. 11., Руденка С. А. Особенности комплексного жслето-
vp.iH-циркопиевото оруденения//Зап. ВМО.— Ч 117.— 1988.— Вып. 5.— С —
602—608.
531. Новгородова М. И. Самородные металлы в гидротермальных рудах.—
М. Наука. 1983.
532 Новиков Г В.. Егоров В К Соколов Ю А. Иирротины.— М.
Наука, 1988.
533. Новиков К). В. Гигиенические вопросы изучения содержания урана во
внешней среде и его влияния на организм. -М , 1974.
534. Новые данные о типоморфизме минералов 1'. Н. Шурига.
А. П. Жухлистов, Б. Б. Звягин и др.— М.. Наука, 1980.
535. Новые хибинские апатитовые месторождения Пол ред. F. А. Каменева.
Д. \. Минеева.— М_: Недра, 1982.
536. Нолдрсохина Л. Р. Биологическая роль микроэлементов в организмах
животных и человека.— М.: Наука. 1977.
537. Обзор загрязнения окружающей природной среды Пот ред.
ГО. А. Израэля, Ф. Я. Ровинского.— М.: Птдрометеоитдат, 1991.
290
538. Овчинников А. М 1йдрогеохимия.— М.: Недра, 197,.
539. Овчинников Л. Н. Бородин Л. С., Лч\ович Б Б. Геохимия маг-
матических пород Геохимия. 1970.— № 4.— С 446—458.
540. Овчинников Л. Н.. Миеа.ювич А. М. Эксперимента )ьныс исследования
гидротермальною ру гообразования.— М. Наука. 1981.
541. Овчинников Л. Н. Современное состояние прикладной геохимии//
Ратвитие минералогии и геохимии и их связь с учением о полезных
ископаемых.— М. Наука, 1983.— С. 131—152.
542. Овчинников Л Н.. Лутков Р. И. Геохимические типы и тональность
колчеданного оруденения Урала.— М.: Наука. 1983.
543. Овчинников Л. Н. Некоторые общие закономерности рудного процесса '/
Эндогенное рудообразование.— М.. Наука. 1985.— С 56—69.
544. Овчинников Л II Образование рудных месторождений—М.: Недра, 1988.
545. Овчинников Л Н. О роли метаморфизма в рудообра говании //
Процессы и зональность метаморфизма. — Киев: Наук, думка, 1988.— С. 5—9.
546. Овчинников Л. Н. Прик гадная геохимия.— М.: Недра, 1990.
547. О г(о\ииичг.ки\ особенностях и условиях образования медистых
песчаников и сланцев'Г М Поплавко, В. В Иванов, К). Г. Ссркнс и др.//
Геохимия.—1977.--№ 8.— (.. 1217—1233.
548. Odin 1О. Основы экологии.— М.: Мир, 1975
549. Озерова ГГ. А.. Ггшнова Б. Л Груздев М. А. Поведение ртути при
метаморфизме колчеданных руд Особенности геологии гидротермальных
месторождении.— М.: Наука, 1978.- С 57—78
550. Озерова //. А. Ртуть и эндогенное рудообразование.— М.: Наука, 1986.
551. О кыщешнрауни рения в нефтях, битумах и горючих сланцах/
Е. М Поплавко. В. В. Иванов, Г. Г. Карасик и тр., Геохимия.— 1974.— № 9.—
С. 1399—1402.
552. Окружающая среда. Споры о будущем.— М.: Мысль, 1983.
553. О ийников Б. В. 1еохимия и рудогенез пла гформенных базитов.—
Новосибирск: Наука. 1979.
554. Описи X . Сандса ') Геохимия мышьяка//Геохимия редких элементов.—
М.: Изд-во иностр, лиг., 1959.— С 435—491.
555. Онтаев Д. О. Геохимия комплексных редкоземельных месторожде-
ний— М . Недра. 1984.
556. Оназовский А. А. Планега Земля главами химика.— М.: Наука, 1990.
557. Органическая геохимия.— М.. Недра. 1970
558 Ориентировочные безопасные уровни воздействия (ОБУВ) загрязня-
ющих вегцеств в атмосферном воздухе населенных мест. Угв М3 СССР,
№ 4414—87: Утв. М3 СССР, № 6159—90,—М„ 1990.
559. Ораов 7. С Химия почв.— М . Изд-во МГУ, 1985.
560. Основные закономерности распределения серебра в породах Охотско-
Чукотского вулканогенного пояса'В И. Найбороднп, И Н. Котляр,
П. П. Колисниченко и др. Металлогения Тихоокеанского пояса.— Владивосток.
1982,—С. 192—213.
561. Основные типы о.говорудпых районов/Под ред. С. Ф. Лугова.— М.
Недра, 1976.
562. Особенности геохимической специализации докембрийских гранито-
идов южной части Украинскою щита М. И. Голстой, Б. С. Панов,
Е. М. Шеремет и гр. ' Вест. Киевского ун-та.— Г. 13.— 1980.— С 3—9.
563. Острог мои Г. В. Определение рудных и рассеянных элементов
в минеральном сырье.— М.: Недра, 1982.
564. Осущсств зенпс н СССР системы мониторинга загрязнения природной
среды,Ю. А. Израьгь, Н К. Гасилина. Ф Я. Ровииский, Л. М. Филиппова.— Л.:
Гйдрометеоиздат, 1978.
565. Охрана природы/Под ред. К П. Митрюшкина.— М : Агропромигдаг,
1987.
566. Очерки геохимии ртути, молибдена и серы в гидротермальном
процессе Под ред. К. М. Феодогьсва. — М : Наука, 1970.
19
291
567. Павлоцкая Ф И Миграция радиоактивных продуктов глобальных
выпадений в почвах.— М : Атомиздат, 1974.
568. Панфилов Р. В.. Иванов 8. В. О достоверности оценок ко >ффициснтов
металлогенического накопления элементов//Докл. АН СССР.—Т. 293,—1987.—
№ 4,—С. 969—972.
569. Пачаджанов Д. Н. [сохимия красноцветных меловых отложений
Таджикской депрессии.— М.: Наука, 1981.
570. Пачаджанов Д. Н., Базарова А. Н., Адамчук И. П. Палеогидрохимия
и формы миграции элементов в зоне гипергенеза.— Душанбе, 1988.
571. ПДК загрязняющих веществ в атмосферном воздухе населенных мест:
Утв. М3 СССР, № 3086—84 —М.. 1985.
572. Пеньков Ф. В. Уран и углеводороды.— М.: Недра, 1989.
573. Перельман А. И Геохимия ландшафта.— М Высш, шк., 1966.
574. Перегьман А. И Геохимия элементов в зоне гипергснсза.— М :
Недра, 1972.
575. Перельман А. А. Кларки концентрации и их роль в геохимии (на
примере урана)//Очерки геохимии отдельных элементов.— М.: Наука, 1973.—
С. 106—129.
576. Перельман А. И. Геохимия техногенеза//Проблема минеральною
сырья.— М.: Наука, 1975.— С. 199—208.
577. Перельман А. И. Геохимия ландшафта.— М.: Высш, шк., 1975.
578. Перельман А. И. Геохимия.— М.: Высш, шк., 1979.
579. Перельман А. И. Геохимия природных вод.— М.. Недра. 1982.
580. Перельман А. И., Мырлян Н. Ф. О геохимических принципах сис-
тематики антропогенных ландшафтов//Вести. МГУ. Сер. География.—1984.—
№ 2,—С. 44—49.
581. Перельман А. И. Атомы спутники.— М.: Наука, 1990.
582. Перечень ПДК загрязняющих веществ в атмосферном воздухе населен-
ных мест. Утв. М3 СССР в 1985—87 гг.//Гигиена и санитария.—1988.—
№ 2,—С. 95—96.
583. Перечень загрязняющих веществ в воздухе рабочей зоны № 29 и № 30.
Утв. М3 СССР в 1987 г.//Гигиена труда и проф. заболевания.—1989.—
№1.-С. 38.
584. Перцов Л. А. Ионизирующие излучения биосферы.— М.: Атомиздат,
1975.
585. Петерсилье И. А. Геология и геохимия природных юзов и дисперсных
битумов некоторых геологических формаций Кольского полуострова.— М.
Наука, 1964
586. Петров Е. 8., Макрыгина 8. А. Геохимия регионального метаморфизма
и ультраметаморфизма.— Новосибирск: Наука, 1975.
587. Петровская И. 8. Самородное золото.— М.. Наука, 1973.
588. Петрохимические и геохимические особенности недифференцированных
щелочных оливиновых базальтов Северо-Восточной Тувы/В. С. Етадких, Н. И.
Конова и др.//Геохимия.—1980.—№8.—С. 1198—1206.
589. Петрохимия магматических формаций 'Д. М. Орлов, Г 11 Липнер,
М П. Орлова и др.— Л.: Недра, 1991.
590. Петрухин В. А. Фоновое загрязнение тяжелыми металлами природных
сред в бассейне Верхней Волги//Мониторинг фонового загрязнения природной
среды.—Л.: Гидрометеоиздат, 1982.— С. 147—165.
591. ПеттиджонФ. Осадочные породы.— М.: Наука, 1981.
592. Пихлак А. О загрязняющем влиянии Маардуского фосфоритовою
карьера на воду//Изв. АН СССР. Сер. Биол.— 1984.—№ 3.— С. 170.
593. Плаксенко А. Н. Типоморфизм акцессорных хромшпинелидов ультра-
мафит-мафитовых магматических формаций.— Воронеж: изд. ВГУ, 1989.
594. Плющев Е. В., Шатов В. В. Геохимия и рудоносность гидротермально-
метасоматических образований.— Л.: Недра, 1985.
595. Поведение радиоактивных элементов в геологических процессах/Под
ред. А П. Тугаринова.— М.: Недра, 1978.
292
596. Повигейко Р. П. Каистрофа.— М.. Недра. 1990.
597. Погодин С. А., Либман Э. П. Как добыли советский радий.— М.
Атомиздат, 1977.
598. Подпорина Е. К. Редкоземельные элементы в корах выветривания.— М.:
Наука, 1985.
599. Покачав В. Т. Условия образования эндогенных месторождений молиб-
дена в СССР.— М : Недра, 1964.
600. Покачав В. Т. Генетические типы и поисковые критерии эндогенных
месторождений молибдена.— М: Недра. 1972.
601. Пока юв В. Т. Сеченова Н. В., Горбунова 3. М К геохимии молибдена
в гранитоидах Геохимия.— 1982.— №8.— С. 1137—1143.
602. По шкарпоч'-чи В. В. Вторичные ореолы и потоки рассеяния.— Новоси-
бирск: Наука. 19"<'
603. Поп гавко Л. .!•/., Иванов В. В., Орехов В. С Особенности металлонос-
ности горючих сланцев и некоторые предположения об их генезисе //
Геохимия.— 1978.—№ 9.— С. 1411 — 1418.
604. Попов В. С. Геология и генезис медно- и молибденпорфировых
месторождений.— М.: Наука. 1977.
605. Попов В. С., Ье чевитип В. В.. Семина В. А. Металлогения гидротер-
мальных редкометальных месторождений.— М.: Наука, 1981.
606. Попов В. С. О магматических источниках рудного вещества молибден-
и медно-порфировых месторождений//Геол, рудных м-ний.— 1988.— №4.—
С. 38—47.
607. Попова Т. Д. Очерки о гомеопатии.— Киев: Наук, думка, 1988.
608. Портнов А. М. Радиохимическая специализация горных пород по
калию и торию и се связь с оруденением//Изв. Ан СССР. Сер. геол.—
1987.—№ 3,—С. 101 —121.
609. Посохов Е. В Общая гидрогеохимия.—Л.: Недра, 1975.
610. Посохов Е. В. Химическая эволюция гидросферы.—Л.: Гидрометсоиз-
дат. 1981.
611. Преде 1ьно допустимые концентрации вредных веществ в воздухе
и воде. Справочное пособие для выбора и гигиенической оценки методов
обезвреживания промышленных отходов.— Л.: Химия, 1975.
612. Преде гьно допустимые концентрации (ПДК) и ориентировочные
безопасные уровни воздействия (ОБУВ) вредных веществ в воде водных
объектов хозяйственно-питьевого и культурно-бытового водопользования: Утв.
М3 СССР, № 2932—83.—М.. 1984.
613. Предельно допустимые концентрации химических веществ в почве: Утв.
М3 СССР. № 2546—82.—М., 1982.
614. Применение ионного микрозонда при анализе редких элементов и воды
в пантеллеритах В. И. Коваленко, Р. Л. Хервиг, В. Б. Наумов и др.//Геохи-
мия.—1989.—№ 9,—С. 1307- 1319
615. Природный и обогащенный уран: радиационно-гигиенические аспек-
ты.— М., 1979.
616. Проблемы геохимической типизации магматических пород.— Иркутск:
изд. ИрГБОХИ, 1987.
617. Проб гемы осадочной зеовоши докембрия Под ред. А.В. Сидорен-
ко. Вып. 10. Биогенные и осадочные отложения в докембрии.— М.: Недра,
1985.
6)8. Проб гемы радиобиологии 23RPu.— М.: Энергоатомиздат, 1990.
619. Проб к мы экологического мони торинга и моделирования экосистем/
Под ред. Ю. А. Израэля.— Л.: Гидрометеоиздат, 1989.
620. Проб гемы эндогенных месторождений: Сб. статей; Пер. с англ./Под
ред. В. И. Смирнова.— М.: Мир, 1966.
621. Прогнозирование и поиски месторождений i орнохимического сырья/
А. А. Озол, А. А Михайлов, И. Н. Тихвинский и др.— М.. Недра, 1990.
622. Прогнозирование рудоносных площадей/Под ред. В. В. Иванова,
Г. М Мейтува.— М.: Наука, 1976.
293
623. Проект концепции программы биосферных и эколог ичсских исследова-
ний АН СССР на период до 2015 г //Вести. АН СССР.—1988.—№11.
624. Промышленные типы рудных концентраций германия, В. В. Иванов,
А. Я. Кац, Ю. П. Костин и др.— М: Негра, 1984.
625. Протодьяконов М. М., Гер швин И. Л. Электронное строение и физичес-
кие свойства кристаллов.— М.: Наука, 1975.
626. Пушкин С. Г, Михайлов В. А. Комттараторный нейтронно-активацион-
ный анализ. Изучение атмосферных аэрозолей.— Новосибирск: Наука, 1989.
627. Пятенко Ю. А., Воронков А. А., Пудовкина 3. В. Минералогическая
кристаллохимия титана.— М.: Наука, 1976
628. Пятенко Ю. А. О крисгаллохимических функциях гидроксила в мине-
ралах 'Геохимия.— 1979.— № 6.— С. 869—875
629. Пятенко Ю. 4. Успехи и некоторые вопросы минералогической
кристаллохимия водороды Методические аспекты изучения редкометальных
месторождеямй— М Наука 1981 С ИЗ—124
• Ч । Пимго Ю 4 6 специфической группе водородсодержащих алюмоси-
— _~ог гтабиьаых в природной х тьтращеточной обстановке ' Геохимия.—
«* — М4-С -.V*—1213
»- Ю 4 Kfotoea Н. Г. Минералогическая кристаллохимия рсд-
мг инти И та АН СССР. Сер геол.—1988.—№11.- С. 75—86.
* С Лважхвв Ф Я Егоров В. И. Озон, окислы азота и серы в нижней
• «мсфере — Л Гйдрометеоиздат. 1986.
»<’• Радиационная коммунальная гигиена/А. Н. Марей и гр.— М., 1984.
*34 Радиация. Дозы, эффект, риск.— М.: Мир, 1990.
635 Радиоактивные г немей гы в горных породах Пол ред. В. А. Кузнецова
и тр.— Новосибирск: Наука, 1975.
636. Развитие и использование ресурсов минерального сырья для сельского
хозяйства.— М.: Недра, 1991.
637. Розенкова Н И.. Самой юва Ю. С. Ртуть в зоне окисления — М.:
Недра, 1975.
638. Распределение меди, серебра и золота в глубинных включениях
и кимберлитах Якутии/В. В. Иванов, И П. Илупин. М. И. Сторожицкая,
Ю. И. Гессе//Геохимия.— 1977.—№7.— С. 1038—1051.
639. Распределим редких земель в литосфере н космосе'Л А Хескин.
Ф. А. Фрей, Р. А. Шмитт и гр.— М. Мир, 1968.
640. Редкие и благородные элементы в рудных формациях Армянской
ССР/И. Г. Магакьян, Г. О. Пиджан, А. С. Фарамазян, А. И. Карапетян.—
Ереван: Изд-во АН АрмССР, 1972.
641. Редкие мегаллы-спутники: состояние и тенденции развития, потребле-
ния. производства и сырьевой базы за рубежом В В. Иванов, Л. Ф. Борисенко,
М. Ф. Комин и др.— М.: изд. ВИЭМС, 1988.
642. Редкие щелочные металлы в породах Украины Б. Ф. Мицкевич,
Н. А. Беспалько, А. П. Заяц и др.— Киев: Наук, думка, 1976.
643. Редкие элементы и акцессорные минералы в интрузивных комплексах
Срединного Тянь-Шаня/B. В. Козырев, Ю. Б. Ежков, И. В. Левченко и др.—
Ташкент: Фан, 1972.
644. Редкие элементы в рудах колчеданных месторождений Урала/В. В.
Иванов, О. Е. Юшко-Захарова, М. С. Воробьева и др. Геохимия.—1978.—
№ 10.—С. 1492—1504.
645. Редкие элементы Украинского ши га.— Киев: Наук, думка, 1986.
646. Редкоземельные и редкие тлсменлы кайнозойских основных вулканитов
Забайкалья и МонголишВ. А. Кононова, В. А. Нервов, В. И. Дрынкин
и др. Геохимия.— 1987.— №5.— С. 644—659.
647. Редкоземельные элементы и их месторождения/А. И Гинзбург, Л. Н.
Журавлева, И. Б. Иванов, В. В. Щербина.— М.. Госгеолтсхиздат, 1959.
648. Рехарский В. И. Интенсивность накопления U, W, Мо и Си в маг-
матических дифференниатах и послемаг матических растворах // Очерки геохи-
мии отдельных элементов - М.: Наука, 1973.— С. 130—146.
294
649. Рехарский В. И Геохимия молибдена в эндогенных процессах.— М.:
Наука. 1973.
650. Ривес Р. Д.. Брукс Р. Р. Анализ 1сологичсских материалов'элементов.—
М Недра, 1983.
651. Рипп Г. С. Геохимия эндогенного оруденения и критерии прогноза
в складчатых областях.— Новосибирск: Наука, 1984.
652. Рифейско-нижнепа icojouckuc офиолиэы Северной Евразии/Нод ред.
Н. Л. Добрецова.—Новосибирск: Наука, 1985.
653. Ровинский Ф. Я.. Петрухин В А. Фоновые содержания металлов
в приземном слое атмосферы//Контроль состава объектов окружающей среды
(атмохимия).— Л. Гидромстеоиздат, 1983.— С. 8—18.
654. Ровинский Ф. Я., Петрухин В. А Фоновые содержания металлов
в приземном слое атмосферы // Ядсрно-физическис методы анализа в контроле
окружающей среды.— Л., 1985.— С. 8—19.
655. Роговой В. М. Ртутоносныс провинции СССР.— М.: Наука, 1989.
656 Родионов Д. А., Иванов В. В. Статистические оценки средних содержа-
ний по совокупности наблюдений разной представительности // Геохимия.—
1967.—№ 1— С. 109—117.
657. Родионов А. И.. К/ушин В. Н., Торочешников Н. С. Техника защиты
окружающей среды.— М.: Химия, 1989.
658. Розен Б Я. Геохимия брома и йода.— М.: Недра, 1970.
659. Романович И. Ф. Месторождения неметаллических полезных ископа-
емых—М. Недра, 1986.
660. Ронов А. Б., Мигдисов А. А Основные черты геохимии элементов
гидролизатов в процессах выветривания и осадконакопления//Геохимия.—
1965,—№ 2,—С. 131 — 158.
661. Ронов А. Б.. Мигдисов А. 4. Эволюция химического состава пород
щитов и осадочного покрова Русской и Североамериканской платформ //
Геохимия.— 1970.— N’ 4.— С. 403—438.
662. Ронов 4. Б. Ярошевский А. А. Новая модель химическою состава
земной коры//Геохимия.— 1976.— № 12.— С. 89—121.
663. Ронов А. Б., Мигдисов А. А., Ярошевский А. А. Источники вещества
и проблема гволюции осадочной оболочки и гемной коры//27 МГК. Докл.
Т. II.—М.: Наука, 1984,—С. 137—148.
664. Ронов А Б. Бреданова Н. В., Мигдисов А. А. Общие тенденции
в эволюции химического состава осадочных и магматических пород земной
коры континентов/'Геохимия.— 1988.— №2.— С. 180—198.
665. Ростков Н. А. Геохимия золота в зоне гипергенеза.— Новосибирск:
Наука, 1981.
666. Ртгтоносность углей Донецкого бассейна/А. Г Дворников,
С. И. Кирикилица и др. — М.: Недра,1987.
667. Рудашевский И. С. Новая модель дифференциации элементов платино-
вой группы в литосфере/'Зап. ВМО.— 1984.— Вып. 5.— С. 521—539.
668. Рудник В. А..' Собопювич Э. В Ранняя история Земли.— М.:
Недра, 1984.
669. Рудные месторождения СССР. Т. 1—З/Под ред. В. И. Смирнова.— М.:
Недра. 1978.
670. Рудообразование и генетические модели эндогенных рудных формаций/
Под ред. А. А. Оболенского и др.— Новосибирск: Наука, 1988.
671. Руководство по контролю качества питьевой воды. Том 2. Гигиеничес-
кие критерии и другая релевантная информация.—Женева: изд. ВОЗ, 1987.
672. Рундквист Д В.. Неженский И. А. Зональность эндогенных рудных
месторождений.— Л.: Недра, 1975.
673. Рябчиков И Д Термодинамика флюидной фазы гранитоидных магм.—
М.: Наука, 1965.
674. Рябчиков И. Д., Рехарский В. И.. Кудрин А. В. Мобилизация молибдена
магматическими флюидами в ходе кристаллизации гранитных расплавов//
Геохимия.— 1981.— № 8.— С. 1243—1246.
295
675. Рябчиков И. Д. 1еохимичсская эволюция Земли.—М.: Наука, 1988.
676. Савенко В. С. Средний элементарный химический состав океанского
аэрозоля//Докл. АН СССР.—Т. 299,—1988 —№ 2,—С. 465—468.
677. Савенко В. С Средний состав океанского планктона' геохимия.—
1988.— № 8.—С 1084, -1089.
678. Саенко Г. И Металлы и галогены в морских организмах.— М
Наука, 1992.
679. Сает Ю. Е., Игумнов Н. Я., Несвижская Н. И. геохимические поиски
эндогенных месторождений бора—М.: Наука, 1973.
680. Сает Ю. Е. Вторичные геохимические ореолы при поисках рудных
месторождений.— М Наука, 1982.
681. Сает Ю. Е., Башаркевич И. Л., Ревич Б. /1 Методические рекомен-
дации по геохимической оценке источников загрязнения окружающей среды.—
М.: изд. ИМГРЭ, 1982.
682. Сает Ю. Е., Онищенко Т. Л., Янин Е. П. Методические рекомендации
по геохимическим исследованиям рудных месторождений при проведении
геологоразведочных работ для оценки воздействия на окружающую среду
горнодобывающих предприятий.— М.: изд. ИМГРЭ. 1986.
683. Самана Ж. К. Выветривание и рудные поля.— М.: Мир. 1989.
684. Самойлов В. С. геохимия карбонатитов.— М.: Наука, 1984.
685. Самой юв В. С. геохимическая специализация карбонатитов Пробле-
мы геохимической специализации магматических пород.— Иркутск, 1987.—
С. 66—79.
686. Санитарные нормы допустимых концентраций химических веществ
в почве: СанПиН 42—128—4433—87,—М 1988.
687. Сапрыкин Е. II Метаморфогенно-гилротермальное рулообразование.—
М.: Наука, 1980.
688. Сапрыкин Ф. Я геохимия почв и охрана природы,—Л.. Недра, 1984.
689. Сауков А. А., Айдиньян Н. X., Озерова II А. Очерки геохимии
ртути.— М.: Наука, 1972.
690. Сахно В. Г. Вулканические зоны среднего Приамурья.— Новосибирск:
Наука, 1976.
691. Свинец в окружающей среде/Под ред. В. В. Добровольского.— М.
Наука, 1987.
692. Свойства неорганических соединений.—Л., 1983.
693. Свойства элементов//Т. В Андреева. А. С Болгар, М. В. Власова
и др.— М.: Металлургия. 1976.
694. Семенов Е. Й Минералогия редких земель.— М.: изд. АН СССР. 1963.
695. Семенов Е. И Типохимизм минералов щелочных массивов.— М.:
Недра. 1977.
696. Семенов Е. И. Минералогические заметки Новые данные по минера-
логии редких элементов.— М.: изд. ИМГРЭ, 1984.
697. Сиборг Г. Т., Кац Дж. Д. Химия актинидных элементов.— М.
Мир, I960.
698. Сидоренко Г. А. Кристаллохимия минералов урана.— М. Атомиздат.
1978.
699. Сидоренко Г. И. Ицкова А. И. Никель.— М : Медицина, 1980.
700. Сиенко М., П lean Р., Хестер Р. Структурная неорганическая химия.—
М.: Мир, 1968.
701. Скиннер Б Хватит ли человечеству земных ресурсов? — М.: Мир, 1989.
702. Скосырева М. В., Солодов Н. А. геохимия и минерагения циркония
и гафния.— М изд. ВИНИТИ. 1983.
703. Скосырева М. В, Солодов Н. А (еохимия и минерагения слюд.— М
изд ВИНИТИ, 1989
704. Смыс юв А. А. Уран и торий в земной коре.—-Л.. Недра, 1974
705. Смирнов С. И. Историческая гидрогеология.— М.: Недра, 1991.
706. Соболев И В. Глубинные включения в кимберлитах и проблема состава
верхней мангии.— Новосибирск: Наука, 1974.
296
707. Соболева M. В., Пудовкина И. А Минералы урана.— М.: Госгеолтсхиз-
дат, 1957.
708. Соботович Э. В. Изотопы свинца в геохимии и космохимии.— М.:
Атомиздат, 1970
709. Соботович 3. В. О метеоритном составе планет земной группы //
Космическое вещество.— Киев: Наук, думка. 1986.— С. 5—20.
710. Современные гидротермы и минералообразование/Под ред.
Л М. Лебедева.— М Наука. 1977.
711. Современные проблемы теоре1ической и прикладной геохимии/Под ред.
Б М. Шмакина.— Новосибирск: Наука, 1987.
712. Сокоюв В. А. Геохимия природных газов.— М., 1971.
713. Сокоюв О. А., Бубнова Т В. Атлас распределения нитратов в растени-
ях.— Пущино: изд. Ин-та почвоведения и фотосинтеза, 1989.
714. Солодов Н. А., Балашов Л. С., Кременецкий А. А. Геохимия дитя,
рубидия, цезия.— М.: Недра, 1980.
715. Солодов Н. А., Усова Т. Ю. Рудоносность щелочных гранитов.— М.:
изд. ВИЭМС, 1986.
716. Солодов Н. 4., Бурков В. В , Овчинников Л Н. Геологический справоч-
ник по легким литофильным редким металлам.— М.: Недра, 1986.
717. Солодов Н. А.. Семенов Е. И., Бурков В. В. Геологический справочник
по тяжелым литофильным редким металлам.— М. Недра, 1987.
718. Сорокин В. И. Покровский В. Л., Дадзе Т. П. Физико-химические
условия образования Sb-Hg оруденения.— М_: Наука, 1988.
719. Соскинд Д. М. Астат 11 Химическая энциклопедия. Т. 1.— М., 1988.—
С 397—398.
720. Состав и условия образования морских и континентальных галогенных
формаций/Под ред. М А Жаркова, Г А Мерзлякова.— Новосибирск: Наука, 1991.
721. Состояние задачи и основы локального прогноза неметаллических
полезных ископасмых/Н. И. Ведерников, К). В. Баталин, А. С. Михайлов
и др —М изд ВИЭМС, 1987.
722. Состояние природной среды в СССР в 1988 г./Под ред.
В. Г. Соколовского и др,—М.: Лесн. пром-сть, 1990
723. Справочная книга по химизации сельского хозяйства/Под ред.
В. М. Борисова.— М , 1980.
724. Справочник-опрсде панель рудных минералов в отраженном свете/
Т. Н Чвилева, М. С. Бсзсмертная, Э. М. Спиридонов и др.— М Недра, 1988.
725. Справочник по геохимическим поискам полезных ископаемых/Под ред.
А. П. Солодова.— М.: Недра, 1990.
726. Справочник по гсохимии/Г В. Войткевич, А. В. Кокин, А. Е. Мирошни-
ков, В. Г. Прохоров.— М Недра, 1990
727. Справочник помощника санитарного врача и помощника эпидемиолога
Д. П. Никитин, ГО. В. Новиков, А. В. Рощин и др.— М.. Медицина, 1990.
728. Справочник по поискам и разведке месторождений цветных металлов/
А. И. Кривцов, И. 3. Самонов, Е. И. Филатов и др.— М: Недра, 1985.
729. Справочник по рулам черных металлов для геологов/В. М. Григорьев,
Л. Ф. Борисенко, Г. Г. Кравченко и др.— М.: Недра, 1985.
730. Средние содержания некоторых малых элементов в главных типах
гранитоидов Центрального Казахсгана/В. Н. Казмин, Ю. А. Чернопольский,
В. М Шульга и др.' Изв. АН КазССР. Сер. геол.— 1977.— № 4.— С. 16—38.
731. Средние содержания элементов-примесей в минералах/В. В. Иванов.
В. В Белевший, Л. Ф. Борисенко и др.— М.: Недра, 1973
732. Ставров О. Д. Геохимия лития, рубидия и цезия в Mai матическом
процессе.— М.: Недра, 1978.
733. Стадницкий Г. В , Родионов А. И. Экология.— М: Высш, шк., 1988.
734. Стефанова М. О специфике геохимии как фундаментальной науки//
Геохим., минер, и neip.— 1988.— № 25.— С. 85—95.
735. Страков Н. М. Основы теории литогенеза.: В 3 т.— М : изд.
АН СССР, I960.
297
736. Су льфидные медно-никелсвые руды норильских мссторождений/А. Д. Пан-
кин, В. В. Диетлср и др.— М_: Наука, 1981.
737. Сутурин А. Н. (ёохимия гипербазитов Восточного Саяна.— Новоси-
бирск: Наука, 1978.
738. Сывороткин В. Л., Садовский Н. А. Дегазация Земли и экологичес-
кие катастрофы//Дегазация Земли и геотектоника.— М.: Наука, 1991.—
С 126—127.
739. Сюй Дисииь. Экологические проблемы Китая.— М.: Прогресс, 1990.
740. Тадмсибаев Г. Т. Среднеглобальные содержания редких и рудных
элементов в главных породообразующих минералах гранитоидов//Минераль-
ные кларки и природа их устойчивости.—Душанбе, 1986.— С. 52—53.
741. Тарко А. М., Богатырев Б. Г., Кириленко А. П. Роль стран и регионов
в формировании глобального бюджета СО2 атмосферы//Докл. АН СССР.—
Т 322,—1992.—№ 3.—С. 610—613.
742. Тарноградский В. Д., Кстлянская Ф. А. Глобальные изменения прошло-
го//Сов. геология.—1992.—№ 6.—С. 3—11.
743. TavcoH Л. В. 1еохимия редких элементов в гранитоидах.— М.: изд. АН
СССР, 1961
744. Таусон Л. В. 1еохимические типы и потенциальная рудоносность
гранитов.— М.: Наука, 1977.
745. Таусон Л. В. Типизация магматитов и их потенциальная рудоносность /
27 МГК. Докл. Т. 9.—М. 1984,—С. 221—229.
746. Таусон Л. В., Самойлов В. С., Смирнова Е. В. Редкоземельные элементы
в остатках динозавров в пустыне 1оби (МНР)//1еохимия.—1991.—№ 1.—
С. 515—526.
747. Твалчре.шдзе Г. А. Рудообразование низких степеней метаморфизма
Процессы и закономерности метаморфогенного рудообразования.— Киев: Наук,
думка, 1988,—С. 9—14.
748. Тейлор С. 1ёохимия андезитов//Распространенность элементов в зем-
ной коре.— М.: Мир, 1972.— С. 16—39.
749. Тей юр СР., Мак-Леннан С. М Континентальная кора.— М_:
Мир, 1988.
750. Текшоиосфера Земли/Под ред. В. В. Белоусова.— М.: Наука. 1978.
751. Теняков В. А., Ясаманов Н. А Палеогеографические и геохимические
критерии прогнозирования месторождений боксиюв.— М. Недра, 1985.
752. Типо морфизм минералов и его практическое значение/Под ред.
Ф В. Чухрова и др.— М.: Недра, 1972.
753. Типы и поисковые критерии редкометальных и редкоземельных
месторождений щелочно-граниговых формаций/С. М. Бескин, И. А. Нечаева.
Т. Ю. Усова и др.— М.: изд. ВИЭМС, 1987.
754. Типшн. Гигиенические критерии состояния окружающей среды.— Жене-
ва: изд. ВОЗ, 1986.
755. Тихомирова Н. И. Распределение лития, рубидия и цезия в главнейших
формационных типах гранитоидов в зависимости от их тектоническою
положения.— М.. изд. -ВИЭМС, 1975.
756. Тишкин А. И., Тарханов А. В., Стрельцов В. С. Урановые месторожде-
ния древних щитов.— М.: Недра, 1990.
757. Трифонов Д. Н. Проблема редких земель.— М.: Госатомиздат, 1962.
758. Трондьемиты, дациты и связанные с ними породы/Под ред.
Ф. Баркера.— М.: Мир, 1983.
759. Троцюк В. Я. Нефтемал еринские породы осадочных бассейнов ак-
ваторий.— М.: Недра, 1992.
760. Трошин Ю. П.. 1ребенщикова В. И., Кочеткова Л. Ф. 1ёохимические
аспекты магматизма и золотого оруденения, Проблемы рудоносное™ маг-
матических пород.— Иркутск: изд. ИРГЕОХИ, 1987.— С. 51—86.
761. Трухин Ю. П., Степанов И. И., Шувалов Р. А. Ртуть в современном
гидротермальном процессе.— М.: Наука, 1986.
762. Тугаринов А. И. Общая геохимия.— М.: Атомиздат, 1973.
298
763. Тугокеов Л. Д.. Осокин Е. Д. Распределение редких элементов в глав-
ных формационных гипах нефелиновых сиенитов СССР 1сохвмия.—1981.—
№ 6—С. 904—910.
764. Тюремное С. II. Торфяные месторождения.— М.: Недра. J976.
765. Тяжелые металлы в окружающей среде.— М.: Изд-во МГУ. 1980.
766. У орк К.. Уорнер С За1рязнение воздуха.— М.: Мир, 1980.
767. Урунбасв К. Потенциальная рудоносность магматических формаций
верхнего PZ Восточного Узбекистана.— Ташкент: Фан, 1978.
768. Урусов В. С. Теоретическая кристаллохимия.— М.: Изд-во МГУ. 1987.
769. Усова Т. А.. Солодов II. 4. Формационпо-парагсггсгическая ктассифика-
ция редкоземельных месюрождений Перспективная оценка редкометальных
гранитогенных месторождений.— М.: изд. ИМГРЭ, 1987.— 107.
770. Файф У.. Прайс Н.. Томпсон А. Флюиды в земной коре.— М.:
Мир, 1981.
771. Федоров II. И Химия и технология малых металлов: Висмут и кад-
мий.— М„ 1986.
772. Федорчук В. П. [оология ртути.- М.: Недра, 1983.
773. Федорчук В. П. Теология сурьмы.— М.: Недра, 1985.
774. Федорчук В. II., Минцер 3. Ф. Геологический справочник по ртути,
сурьме и висмуту.— М.: Недра. 1990.
775. Федюшкин Б. Ф.. Овчинникова К. Н. Состояние и рагвитис производства
минеральных удобрений с микроэлементами.— М.: изд. ВИЭМС, 1984.
776. Фек.шчев В Г.. Титова Л. С. Исследование распределения видообразу-
ющих элементов и их сочетаний в минералах 'Диагностика и диагностические
свойства минералов.— М.: Наука, 1981.— С. 101 —118.
777. Ферсман А. Е. 1еохимия. Т. 4.— Л.: Гос науч.-техн, изд-во хим.
лиг.. 1939.
778. Физико-химические модели в геохимии Под ред. А. И. Киселева,
И. К. Карпова.— Новосибирск: Наука, 1988.
779. Физико-химические основы теории мегаморфогенного рудообразова-
ния/Под ред. В. Б. Коваля.— Киев: Наук, думка, 1985.
780. Филатов Е. И.. Ширин Е. II. Формационный анализ.— М.: Недра, 1980.
781. Фи /ько А. С Минерально-сырьевая бага отраслей промышленности
СССР, использующей немега глические полезные ископаемые.— М_: изд. ВИЭМС,
1983.
782. Фиоиднач миграция платины при магматическом сульфидообразо-
вании/Г. П. Орлова, И. Д. Рябчиков, В. В. Дистлср и др.//Геол, рудных
м-ний,—1987. № 1.—С. 106—108.
783. Флюидный режим земной коры и верхней ман гии/Ф. А. Летников,
И. К. Карпов, А. И. Киселев, Б. О. Шкандрий.— М.: Наука, 1977.
784. Фомин А. Б. Геохимия гипербазитов Украинского щита.— Киев: Наук,
думка, 1984.
785. Фор Г. Основы изотопной геологии.— М.: Мир, 1989.
786. Фосфор в окружающей среде,'Под ред. Э. Гриффита и др.— М.:
Мир, 1977.
787. Фрид Ж. Загрязнение подземных вод.— М.: Недра, 1981.
788. Фурсов В. 3. Ртуть — индикатор при геохимических поисках рудных
месторождений.— М : Недра, 1977.
789. Фурсов В. 3. Газор'гугный метод поисков месторождений полезных
ископаемых.— М.: Наука. 1983.
790 Хакимов А. А., Татарская А. 3. Периодическая система и биологическая
роль элементов.— Ташкент: Фан, 1985.
791. Хаит Дж. Геохимия и геология нефти и газа.— М.: Мир, 1983.
792. Хардер Г. Геохимия бора.— М.: Недра, 1965.
793. Хендерсон II. Неорганическая геохимия.— М.: Мир. 1985.
794. Хейнрих >. у. Минералогия и геология радиоактивного минеральною
сырья.— М.: Изд-во иностр, лит., 1962.
795. Хефс Й. Геохимия стабильных изотопов.— М.: Мир, 1983.
299
796. Химическая энциклопедия. Т. I, 2.,Под ред. И. Л. Кнунянц и др.— М.:
Сов. энцикл., 1988—1990.
797. Химический состав пищевых продуктов. Под ред. И. М. Скурихина,
М. Н. Волгарева.— М.: Агропромиздат, 1987.
798. Химия актиноидов/ Под ред. Дж. Каца, Г. Сиборта, Л. Морсса.— М.:
Мир, 1991.
799. Химия и периодическая таблица/Под ред. К. Сайто.— М_: Мир, 1982.
800. Химия и технология редких и рассеянных элементов/Под ред.
К. А. Большакова.—М.: Высш. шк„ 1978.
801. Химия океана. Т. 1.— М.: Наука, 1971.
802. Химия окружающей среды/Под ред. Дж. О. Бекриса.— М.: Химия.
1982.
803. Холленд X. Химическая эволюция океанов и атмосферы,— М.:
Мир, 1989.
804. Холодов В. Н. Осадочный рудогенез и металлогения ванадия.— М.:
Наука, 1973.
805. Холодов В. Н., Лубченко И. Ю. Проблемы геохимии современных
осадков Каспийского и Черного морей'/Генезис осадков и фундаментальные
метал, проблемы литологии.— М., 1989.— С. 109—150.
806. Хорн Р. Морская химия.— М.: Мир, 1972.
807. Хэскин Л. А., Фрей Ф. А.. Шмитт Р. А. Смит Р. X. Распределение
редких земель в литосфере и космосе.— М. Мир, 1968.
808. Цамбел Б., Ярковский Я. Геохимия никеля и кобальта в пирротинах
различных генетических типов//Распространенность элементов в земной коре.—
М.. Мир, 1972,—С. 122—137.
809. Цибульчик В. М., Пономарчук В. А.. Грунова В. А. Ниобий, тантал,
цирконий, гафний в корах выветривания Кокчетавского поднятия 1еохимия
рудных элементов в процессах выветривания, осадконакопления и катагенеза.—
Новосибирск, 1979,—С. 19—50.
810. Чвилева Т. Н. Минералогическая характеристика и диагностика суль-
фоантимонитов свинца.— М.: Наука, 1973.
811. Челищев Н. Ф., Грибанова Н. К. Сорбционные свойства железомарган-
цевых океанических конкреций//1еохимия.— 1983.—№5.—С. 770—777.
812. Чечшцев И. Ф., /рибанова Н. К. Обменные реакции и формы нахожде-
ния металлов в океанических железомарганцевых конкрециях Минер, жур-
нал—Т. 7.— 1985. № 4,—С. 3—10.
813. Человек и природа: геохимические и экологические аспекты рациональ-
ною природопользования,'К. И. Лукашев и др.— Минск, 1984.
814. Чечовек и стихия.— Л.: Гидрометеоиздат, 1991.
815. Черепнин В. К. Геохимия и типы месторождений урана.— Томск: изд.
ТГУ, 1972.
816. Черницин В. Б. Металлогения Большого Кавказа.— М : Недра. 1977.
817. Чернышева Л. В., Смелянская Г. А., Зайцева Г. М. Типоморфизм
магнетита и его использование при поисках и оценке рудных месторождений.—
М.:. Недра, 1981.
818. Чирков И. В. Минерально-сырьевые ресурсы тория Торий и ею
сырьевые ресурсы, химия и технология.— М.: Аюмизтат, I960.
819. Швайкова М. J Токсикологическая химия.— М., 1975.
820. Шварц С. С. Эволюция биосферы и экологическое прогнозирование
250 лет АН СССР. Документы и материалы.— М.. 1977.
821. Шварцев С. Я. Гидрогеохимия юны гипергенеза.— М.: Недра, 1978.
822. Шведов В. П.. Патин С 1. Радиоактивность океанов и морей.— М .
1968.
823. Швей И. В Основные вопросы геохимии редкоземельных элементов
и иттрия в эндогенных процессах.— М.: Гостеолтехиздат, 1962.
824. Шестаков В. А. Рациональное использование недр.— М.: Недра, 1990.
825. Ширай Г. И. Зёхногенные месторождения Изв. АН КазССР —1990.—
№ 3—С. 81—95.
300
826. Шишкин Н. И. Кобальт в рудах месторождений СССР.— М.:
Недра, 1973.
827. Шишкина О. В. Химия морских и океанических иловых вод.— М.:
Наука, 1972.
828. Шкопник М. Я. Микроэлементы в жизни растений.— Л.: Наука, 1974.
829. Шмакин Б. М. Топунова Г. А. Гранитные пегматиты США.— М.:
Наука, 1981.
830. Шоу Д. М. Геохимия микроэлементов кристаллических пород.— Л.:
Недра, 1969.
831. Шпирсп М. Я., Keep В. Р.. Перциков Г/. 3. Неорганические компоненты
твердых топлив.— М.: Химия, 1990.
832. Шпсрюбегъ Г.. Циммер 3. X. Минералогический словарь.— М.:
Недра, 1987.
833. Шукопокое Ю. А.. Левский Л. К. Геохимия и космохимия изотопов
благородных газов.— М.: Наука, 1972.
834. Шуколюков Ю. А. Радий//Горная шциклонедия. Т. 4.— М., 1989.—
С. 284—285.
835. Щеглов А. Д.. Говоров И. Н. Нелинейная металлогения и глубины
Земли.— М.: Наука, 1985.
836. Щербак Н М. Гранитоидные формации Украинскою шита.— Киев:
Наук, думка, 1984.
837. Щербаков А. В. Гидрогеохимичсские исследования при поисках и раз-
ведке подземных бороносных вод.— М.: Госгеолтехиздат, 1961.
838. Щербаков А. В. Геохимия термальных вод.— М.: Наука, 1968.
839. Щербаков Ю. Г. Геохимия золоторудных месторождений в Кузнецком
Алатау и Горном Алтае.— Новосибирск: Наука, 1974.
840. Щербина В. В. К геохимии титана//Геохимия.— 1971.—№ 3.— С. 302—
309.
841. Щербина В. В. Основы геохимии.— М_: Недра, 1972.
842. Щербина В. В. Геохимическая эволюция различных типов зон окисления
сульфидных месторождений 'Особенности геологии гидротермальных рудных
месторождений.— М.. Наука. 1978.
843. Эво нация осадочного рудообразования в истории Зсмли/Под ред.
В. Н. Холодова.— М.: Наука, 1984.
844. Эколого-геохимический анализ техногенного загрязнения.— М.: изд.
ИМГРЭ. 1992.
845. Эколого-геохимическая оценка городов различных регионов страны/
Под ред. Э. К. Буренкова, Н. Ф. Челитцева.— М.: изд. ИМГРЭ. 1991.
846. Экспериментальные исследования форм и процессов гипертенной
миграции элементов/К И. Лукашев, В. К. Лукашев, И. Д. Добровольская.—
Минск: Наука и техника, 1977.
847. Элементы-примеси в минералах как индикаторы геохимической
специализации гранитных псгматитов/Под ред. М. В. Кузьменко.—М.: изд.
ИМГРЭ, 1980.
848. Элементы-примеси медпо-никелсвот о оруденения Тачнахской интрузии/
О. Е. Юшко-Захарова, М. С. Воробьева, В. В. Иванов и др.// Геохимия.—1973.—
№ 4 — С. 516—528.
849. Юдович Я. Э., Кетрис М. П.. Мерц А. В. Элементы-примеси в ископа-
емых углях.— Л.: Наука, 1985.
850. Юровский А. 3. Минеральные компоненты твердых горючих ископа-
емых.— М.: Недра, 1968.
851. Юшкин Н. П. Минералогия и парагенезисы самородной серы в экзо-
генных месторождениях.— Л.: Наука, 1968.
852. Юшко-Захарова О. Е. Платиноносность рудных месторождений.— М.:
Недра, 1975.
853. Яков сев Я. В. Типохимизм вольфрамитов оловорудных месторож-
дений//Минералы эндогенных образований Якутии.— Якутск, 1977.— С. 55 —
301
854. Якуцени В. II. (ёология гелия.—Л.: Недра, 1968.
855. Якуцени В. П. Мировые ресурсы гелия Сов. 1ео.югия.—1982.—№ 8.—
С. 15—20.
856. Яншин А. Л., Жарков М. А. Фосфор и калий в природе- Новоси-
бирск: Наука. 1986.
857. Ярошевский А. А. Кларки геосфер 'Справочник по геохимическим
поискам полезных ископаемых.— М. Недра, 1990.— С. 7—14.
858. Andersen D. L. A global geochemical model for the evolution of the
mantle//Evolution of the Earth. Wash., 1981.— V. 5.— P. 6—18.
859. Boden T. A., Kanciruk P.. Farrell M P. Trends 90. A compendium
of Data on global change.—The carbon Dioxide Inform. Anal, center
Oav Ridge Nat. Lab., 1990.
860. Bowen H. J. M Trace elements in biochemistry.— Ld.— N. Y.: Acad.
Press, 1966.
861. Bowen II. J. M. Enwironmental Chemistry of the Elements.— N. Y_: Acad.
Pi ess, 1979.
862. Boyle R. W., Jonasson J. R. The geochemistry of antimoni and its as an
indicator element in geochemical prosp."Y. geochem explor.— V 20.—1984.—
P. 223—302.
863. Broecker W. S.. Peng T.-H. Tracers in the sea. Lamont—Doherty Geol
Obs., 1982.
864. Burns R. G., Burns V. M. Marine minerals.— Wash.: Miner. Soc. Amer.. 1979.
865. Cambe! B., Jarkovsky J. Cheochemistry of pyrrohotite of Various genesis
types.— Bratislava, 1969.
866. Commission of the European Communities. Criteria for cadmium —
Oxford: Pergamon Press, 1978.
867. Davis G., Tredox M. The platinum—group element and gold contents ot
marginal rocks and sills the Bushveld Complex//Econ. Geol.— V. 80.— 1985.—№
4.—P. 838—848.
868. Dawis A.. Adams C.G. The chemistry of clorine. bromine, iodine and
estate.—Oxf., 1975.
869. Ehnian W. D.. Lovering J. F. The abundance of mercury in
meteorites and rocks by activation analysis' Geoch. et Cosmochim acta.—
V. 17.—1959.—№ 1/2.
870. Esser G. Sensitivity of global carbon pools and fluxes to human and
potential climatic impacts'/ Tellus.—1987.— V. 333.— № 39 B.— P. 246—260.
871. Ewurt A. The mineralogy and petrology of Tertiary—recent orogenic-
volcanic rocks//Andesites.— Wiley, 1982.— P. 25—98.
872. Foriborz Gaodazzi. Elemental distribution coal seains at the Fbrdind coal
mine. British Columbia. Canada.//Chcm. G.— V. 68.—1988.— P. 129—154.
873. Fronde! C. Sustematic mineralogy of uranium and thorium / Bull.
U.S. Geol. Surv. Prof. — V. 1064,—1958,—P. 400.
874. Fry F. A.. O’Riordan M. C. Nuclear .Instruments a. Methods Phvs.
Res.—V. 223,—1984.
875. Fuchs W. A., Rose А. И'., The Geochemical bechavior of platinum and
palladium in weathering cycle in the Stillwater Complex, Montana 'Econ.
Geol.—V. 69.— 1974.
876. Fuller E. C. Chemistry and mans environment - Boston: Mutflin. 1974.
877. Garrels R. M., Mackenzie F T.. Hunt C. Chemical Cycles and
the Global Environment: Assessing Human .Influence.— Los Altos. Calif:
William Kanfmann. 1975.
878 Geological environments of sandstone—tope uranium deposits.— Vienna,
TEC ДОС-328, 1985.
879. Gerz H. Microprobe studies of inclusions in zircons and compilation of
riinor and trace elements in zircons from the literature Chem. Erde.— V. 33.—
1974.—№ 4,—P. 326-357.
880. Global biogeochemical cyclas of carbon and sulfur and atmospheric O2 ever
phancrosoic time//Chem Geol.— V. 84.—1990—№ 1—4.
302
881. Handbueh iter Anorganischen C'hcniie. Bb 1—28.— Weinchcim.: Verlg
Chemie. 1954— 1956.
882. Handbook ol' Geochemistry. V. 1—3., Ed. R. 11. Wedepohl.— Spnenger-
Vfcrlag, 1970—1972.
883. Handbook of environmental data and ecological paiamcters Fd. S. Jorgen-
sen.— Oxford. Pcrgamon Press, 1979.
884. Handbook on the Toxicology of Mctals.’L. Fiiberg etal.— Elsivir, 1979.
885. Herrmann A. G. Yttrium and the hinthaiiides/Ed. К. II. Wedepohl ,
Handbook of Geoch.. 1976.—P. 57—71.
886. Hevnes R. W., Stephen L. L. An Elemental Description of Pacific
Manganese Nodules//Marine Mining.— V. 5.— 1986.— № 3.— P. 5—276.
887. Holds J. Ein Beitrag aur Geoehemie des Kohlenstolfs in magmatischen und
metamorphen Gestcinen // Gcoeh. et Cosm. Acta.—Bd. 29.—1965.
888. Horn M. K. Acomputer method for the geochemical balance of the
elements.— Hauston, Texas, 1964.
889. Johns H £>.. Huong W. IL Distribution of chloiinc in lerres trial
rocks/,'Geoch. et Cosm Acta.— I9t>7.—№ 1.
890. Jakes P., White A. IL Major and trace elements abundances in volcanic
rocks of orogenic areas//Geol. Soc. Am. Bull.— V. 83.— 1972.—№ I.— P. 29—39.
891. Jakubick A. T. Geochemistry and physic of plutonium migration,
Origin and Distribution of the elements. V. 11.— Oxford: Pergamon Press, 1979.
892. Kabata-Pendiii.s A.. Pendias-H. Trace Elements in the Biological Fnviron
ment—Warsaw: Wyd. Geol, 1979.
893. Kershaw .S’. Evolution of the Earth’s atmosphere and its geological
impact "Geol. Today.— V. 6.—№ 2.— P. 55—60.
894. Krctneneisky A. A., Ovchinnicov H The precambrian continental crust:
its structure composition and evolution as revealed by deep drilling in the
USSR Precambrian Rcserch.— V. 33. -1986.— P. 11—43.
895. Laid J. C , Hehnei W C.. Ranciletti I. A. Biogeochemical destribution of
rare earths and other trace elements m plants and soil II Origin and Distribution of
the Elements. V 11.— Oxford: Pcrgamon Press, 1979.
896. Lebel G. G.. Kane If. Sustainable Development.— Oxford: Univ.
Press, 1990.
897. lee Tan. Yao-Chi-Lung. Abundance of chemical elements in the Earth’s
ciust and its major tectonic unitsInt. Geol. Rev. — V 12.— 1970.— №7.—
P 778—786.
898. Li long. T he abundance of chemical Elements in the Lilosphcrc and its
structural Lages,. Acta geol. sinica.— V. 59.-- 1985.— № 3.
899. Li Y.-H. A brici discussion on the mean oceanic residence time of
elements/1GSA — V. 46. —1982.
900. Macnhaut W., Zoller W. Determination ot the chemical composition of the
South Pole aerol bv instrumental neutron activation analysis//!. Radioanal. Chem.—
V. 37-1977,- P. 637—650.
901. Martin J. M.. Meybeck. Elemental mass-balance of material carried by
major World rivers , M. Chem.— V. 7.—1979.— P. 173 —206.
902. Moor G. И . Geologic significance in the minor element composition of
marine salt deposits Feon. Geol.— V. 66. - 1971.
903. Nesbitt R. W.. Sun S. S., Purvis A. C„ Komatiites Geochemistry and
genesis Canadian. Mineral.— V. P.— 1979. -№ 12.- —P. 165 -186.
904. Pan у Susan J. Abidance and distribution of palladium, platinumiridium
and gold oxide minerals /Chem. Geol.—V 43.- 1984.—Ny 1 -2. P. 115—125
905. Perkins 11. C. Air pollution.— NY.: McGraw-Hill book company, 1974
906. Prinz M. Geochemistry of basaltic rocks/' Basalls/Fd II. 11. Hess and
A. Poldervaart. 1967,—P. 271 -233.
907. Reed G. M. Mercury (80). Handbook of Elemental Abundances in
Meteoritic Matter, 1971.
908. Rosenblum S., Elvin M. Mineralogy and Occutrence of Europium— Rich
Dark Monazite Geol. Sciv Prof.—№ 1181. —1983,—P. 67.
лоз
909. Saupe F. La geologie du gisement de mercure d’Almaden // Sci Terre.—
1973.—№ 9.—P. 342.
910. Schmidt M.. Sibert W., Bognal K. W. The Ghemistry of Sulphur, Selenium
and Polonium.—N.Y.: Perg. Press, 1975.
911. Semb A. Atmospheric environment.— 1979.—№1 — 3.—P. 455—460.
912. Shacklette H. T., Erdman J. A., Harms T. F. Trace elements in plant
foodstuffs//Toxicity of Heany Metals in the Environments. Pt. 1.— N.Y., 1978.
913. Shacklette H. T., Elements in fruits and vegetable from areas of commercial
prodaction in the Conterminous United States//U. S. Geol. Surv. Prof. P.—
V. 1178.—1980.
914. Shacklette H. T.. Buernger J. G. Element concentration in soils and other
surficial materials of the Conterminous United States/ U.S. Geol. Surv. Prof.
Pap.—V. 1270.—1984.
915. Shaw W. H. R. Studies in biogeochemistry. A. biogeoch. period table//
Geoch. et Cosm. Acta.—V. 19.—I960.—№ 3.
916. Silver L. T., Schultz P. H. (Eds.) Geological implications of impacts of
large asteroids and comets on the earth.'/Geol. Soc. Amer. Spc. Paper.—
V. 190 —1982.
917. Slobodans. Tataru Sever. Uraniul si thoriul.— Bucuresti, 1988.
918. Spurenelemente. Gryndlagen — Atiologie-Diagnose-Therapie'H. von
H. Zumkley.—Stuttgart: G. Thieme, 1983.
919. State of the World 1990: Worldwatch INST/Ed. L. Starke.—N.Y.— Ld.:
W. W. Norton and Co, 1990.
920. Sugiura T., Mizutani Y., Oana S. Fluerine chlorine, bromine and iodine in
volcanic gases//J. Earth Sci. Nagoya. Un. 11, 272, 1963.
921. Sugiura T. Bromine tho chlorine ratios in igneous rocks./ Bull. Chem Soc.
Japan.—41, 1133, 1968.
922. Surficial uranium deposits. Report of the Group on Uranium.— Vienna:
I AEA— TECDOC-322, 1984.
923. Trudinger P. A., Swaine D. J. Biogeochemical Cycling of Mineral Forming
Elements.— Amsterdam: Elsiver, 1979.
924. Turekian К. K., Wedepohl К. H. Distribution of the elements in some major
imts of the earth’s crust//Bull. Geol. Soc. Am.— V. 72.— 175.— 1961.
925. Underwood E. C. Trac elements in human and animal nutrition — N Y.:
Acad. Press, 1987.
926. Waher J. T.. Cromer D. T. Orbital radii of atoms and ions // J. Chem.
Phys —V. 42.—1965 —№ 12 —P. 4116—4123.
927. Weinberg E. D. Microorganisms and Minerals.— N.Y.: Marcel Dekker,
1977.
928. Wilding R. E.. Garland T. R. The relationship of microbial processes to the
fate and behavior of transuranic elements in soel and plant,, Transuranic Elements in
the Environment/Ed. W. C. Hauson—Springfield, 1980.
929. World Metal Statistics: Year Book, 1988.
930. World Metal Statistics.—V. 41 —1988,—№ 7.
931. Yyengar G. V.. Kollmer W. E., Bawen H. J. M. The Elemental Composition
of Humman Tissues and Body Fluids.— Minheim — N.Y., 1978.
304
СПИСОК СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
Бг—биогенность элемента
Бф—биофильность элемента
В—вернад—кларк концентрации
Вс—коэффициент всасывания
элемента из кишечно-желудочного
тракта человека
ВДК—временно допустимая кон-
центрация (то же, что ОБУВ)
ГЭ—геоэкологичность объектов
ГЭа—геоэкологичность объектов
атмосферы (атмоэкологичность)
ГЭг—то же гидросферы (гидро-
экологичность)
ГЭЛ—то же литосферы (литоэко-
логичность)
ГЭМ — то же минерала
ГЭФ—геоэкофильность элемен-
тов
ГЭФа—атмоэкофил ьность
ГЭФ6—биоэкофильность
[ЭФ, — гидрозкофильность
ГЭФ„—почвоэкофильность
ж.—живая масса (вещество)
з.—зола
Кл—кларк элемента
ЛД, ЛК—летальные дозы и кон-
центрации
М — металлогенический по генци-
ал
ОБУВ—ориен гировочный безо-
пасный уровень воздействия (то
же, что ВДК)
ОГЭ—общая геоэкологичность
элементов
П—патологичность
ПДК—предельно допустимая
концентрация
ПДКМ—предельно допустимая
концентрация в водоемах хозяйст-
венного и бытового назначения
ПДК.п—то же питьевого на-
значения
П ДКмр—предельно допустимая
концентрация в атмосферном воз-
духе (разовая)
ПДКр1—то же в воздухе рабочей
зоны (помещений)
ПДКСС—то же среднесуточная
концентрация в атмосферном воз-
духе
с.—сухая масса (вещество)
Т—геотоксичность элементов
Та—то же для атмосферы
Тг—то же для гидросферы
Тл —то же для литосферы
Тд—модуль техногенного воз-
действия
Тф—технофильность элемента
Тх—техногенность элемента
Ф—ферсм (региональная оценка
среднего содержания)
Н—коэффициент техногенного
использования элемента
Q—наиболее вероятная оценка
среднего содержания
Р—дисперсия содержаний
Т6—время снижения содержания
элемента в организме человека
наполовину
х—оценка среднего содержания
+ Х—возможная ошибка средне-
го содержания для 95%-ной степе-
ни надежности
v—коэффициент вариации
СОДЕРЖАНИЕ
От редактора.....................................................
11рсдисловис ..........г.........................................
Состояние вопроса ...............................................
"Токсичность, биологичность и геоэкологичность элементов ........
Геохимические систематики, аналитические данные и статистические
параметры распределения элементов ................................
Геохимические и экологические особенности s-элемснтов ...........
Нолород .........................................................
Литий ...........................................................
Натрий ..........................................................
Калий ...........................................................
Рубидий .........................................................
Цезий ...........................................................
Франций .........................................................
Бериллии ........................................................
Магний .................... .....................................
Кальций ............................................. L.........
Стронций ........................................................
Барий ...........................................................
Радий ...........................................................
Список литературы ...............................................
30
42
45
86
108
132
152
165
175
176
193
214
231
254
266
272