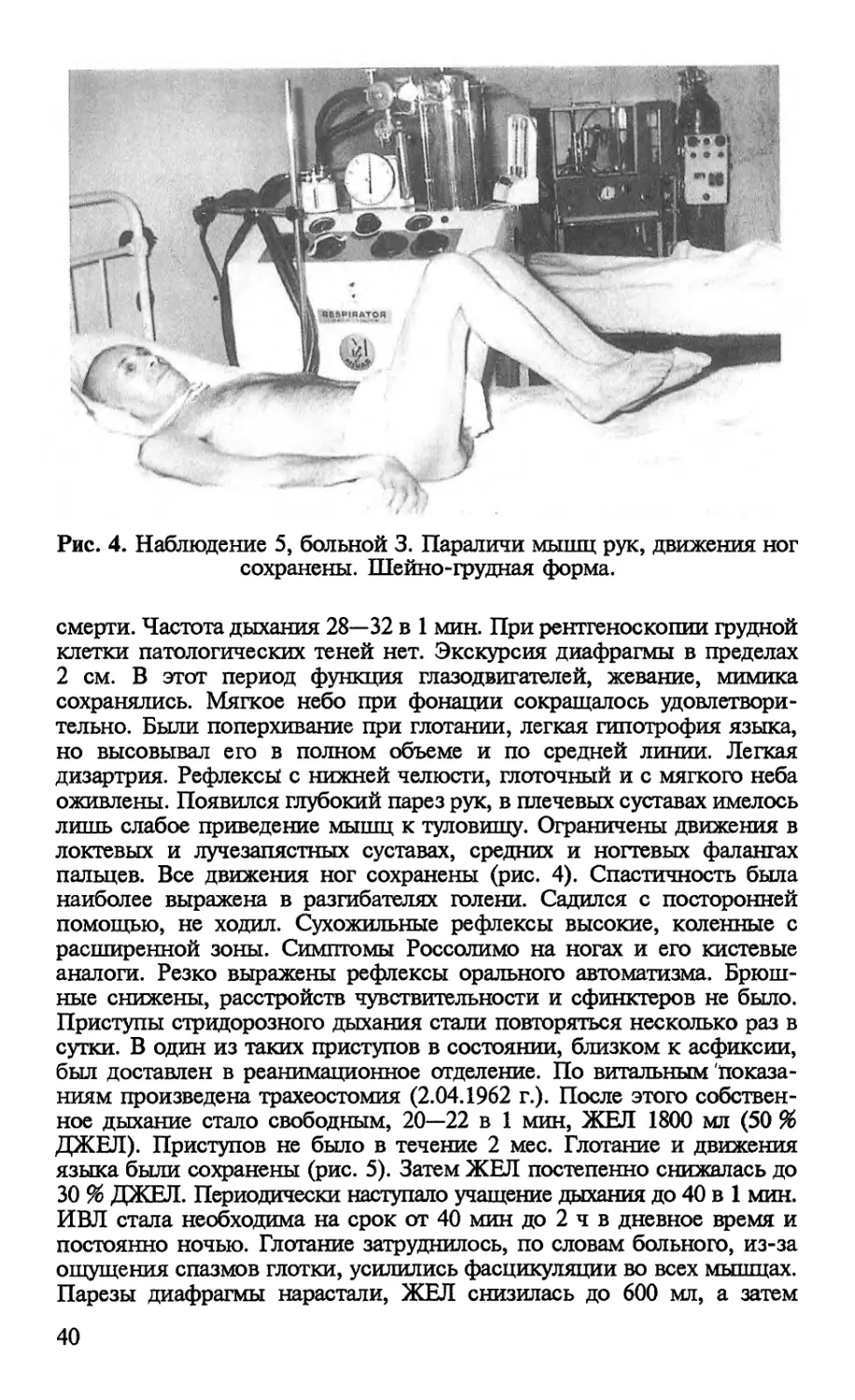
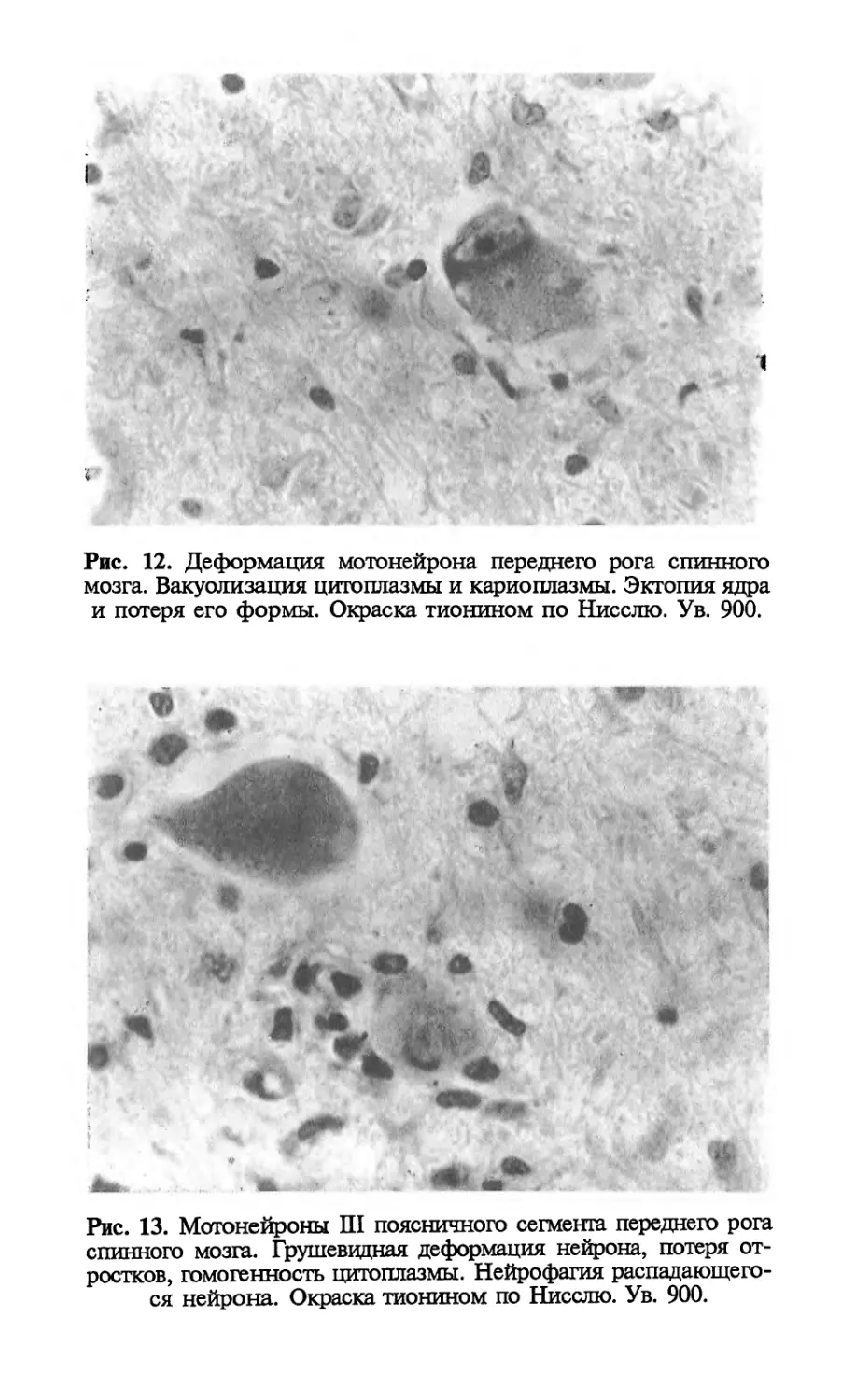
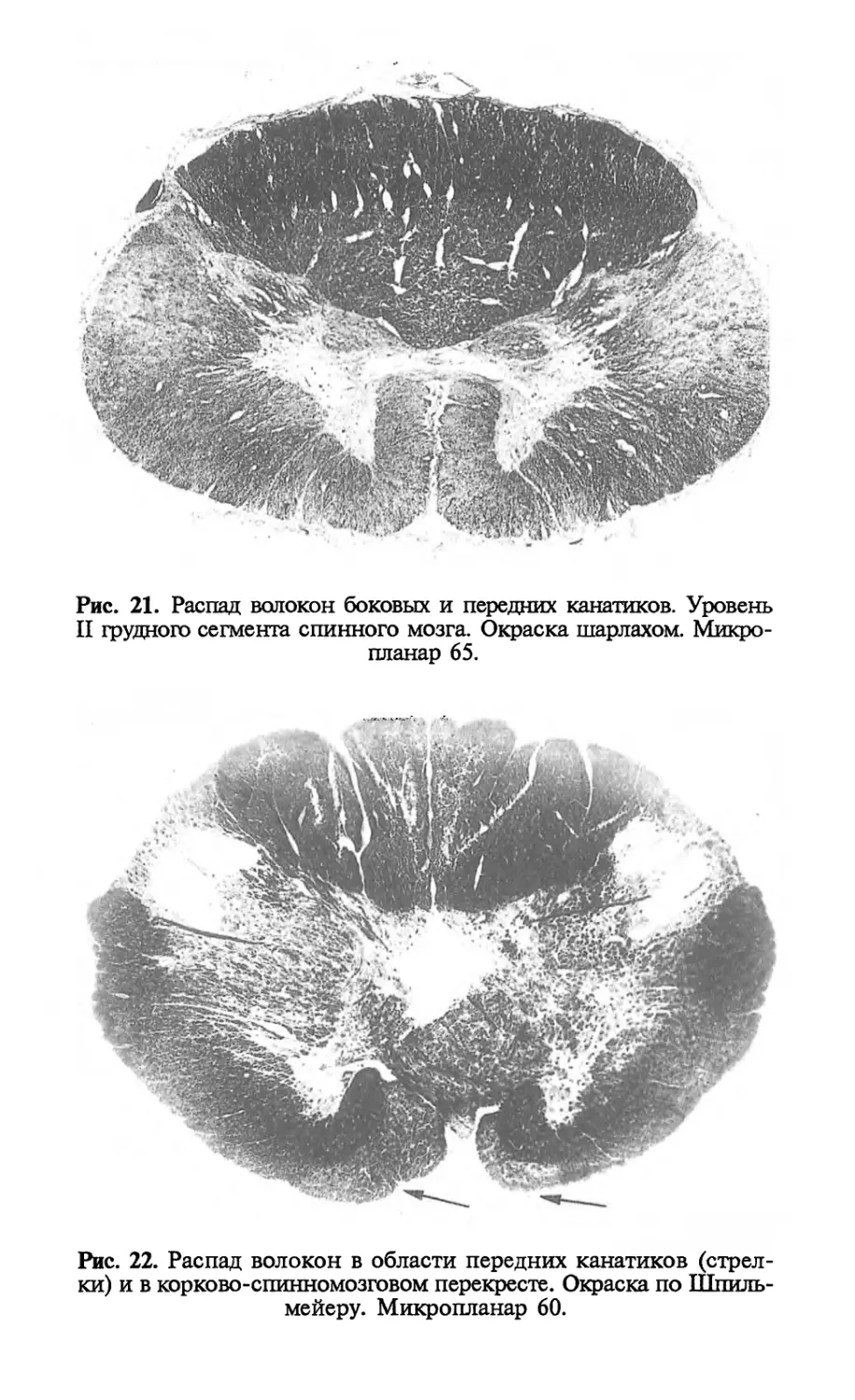
Author: Попова Л.М.
Tags: нервная система невропатология неврология алкоголизм как болезнь нейрохирургия психиатрия медицина
ISBN: 5-225-04440-9
Year: 1998
Text
Л.М.Попова
Амиотрофический
боковой склероз
в условиях
продленной жизни
Москва
'Медицина"
1998
УДК 616.832.522
ББК 56.1
П57
Попова Л.М.
П57 Амиотрофический боковой склероз в условиях про-
дленной жизни. — М.: Медицина, 1998. — 144 с: ил.
ISBN 5-225-04440-9
В условиях использования длительной искусственной венти-
ляции легких прослежена клиника амиотрофического бокового
склероза. Специальное значение имеет развитие знаний по кли-
нической физиологии дыхательной недостаточности. Получены
новые сведения о патологии верхнего и нижнего мотонейронов,
наступающей в разные периоды продленной жизни.
Для неврологов, анестезиологов, реаниматологов, нейрофи-
зиологов и нейрогистологов.
ББК 56.1
ISBN 5-225-04440-9 © Издательство "Медицина",
Москва, 1998
Все права автора защищены. Ни одна часть этого издания не может быть
занесена в память компьютера либо воспроизведена любым способом без предва-
рительного письменного разрешения издателя.
Оглавление
Список сокращений 4
Предисловие 5
Глава 1. Обзор основных научных направлений в изучении
амиотрофического бокового склероза 7
Глава 2. Клиника амиотрофического бокового склероза
в условиях продленной жизни 21
Глава 3. Клиническая физиология дыхательной
недостаточности при амиотрофическом боковом
склерозе и методы искусственной вентиляции
легких 66
Глава 4. Патоморфоз амиотрофического бокового склероза,
обусловленный продлением жизни больных методом
дыхательной реанимации (ЛЖПопова, В.А.Моргунов,
АВ. Сахарова) 86
Глава 5. Клинико-морфологическое сопоставление 126
Список литературы 138
Список сокращений
АБС — амиотрофический боковой склероз
АД — артериальное давление
БЕ ± — буферные основания, дефицит или излишек
БДН — болезнь двигательного нейрона
БМН — болезнь мотонейрона
ВИЧ — вирус иммунодефицита человека
ВМН — верхний мотонейрон
ГФЛП — глоссофаринголарингеальный парез либо паралич
Д — должная (величина), проставляемая перед показателями
легочных объемов и емкостей
ДМ — дыхательные мышцы
ДН — дыхательная недостаточность
ДО — дыхательный объем
ДР — дыхательная реанимация
ЖЕЛ — жизненная емкость легких
ИВЛ — искусственная вентиляция легких
КОС — кислотно-основное состояние
МВЛ — максимальная вентиляция легких
МН — мотонейрон
МОД — минутный объем дыхания
МОС — максимальная объемная скорость выдоха (цри 75, 50, 25 %
ЖЕЛ)
— нижний мотонейрон
— общая емкость легких
— остаточный объем легких
— объем форсированного выдоха за 1 с
— пиковая объемная скорость форсированного выдоха
— постполиомиелитический синдром
— отрицательный логарифм концентрации водородных
ионов
РОвд — резервный объем вдоха
РОВЬ]Д — резервный объем выдоха
Явд — бронхиальное сопротивление на вдохе
RBb™ — бронхиальное сопротивление на выдохе
ФОБ — функциональная остаточная емкость
ЦНС — центральная нервная система
ЧД — частота дыхания
ЭМГ — электромиография
НЬ02 — насыщение крови кислородом
РкС02 — парциальное напряжение углекислого газа в капиллярной
крови
Рк02 — парциальное напряжение кислорода в капиллярной крови
4
...много надобно времени для того, чтобы
иная быль отстоялась в прозрачную думу —
неутешительную, грустную, но примиряющую
пониманием.
АИ.Герцен. Былое и думы
Предисловие
Настоящее исследование посвящено проблеме лечения
больных амиотрофическим боковым склерозом (АБС) в конеч-
ной фазе болезни. Толчком к разботке послужили достижения
медицинской технологии, использованные для лечения дыха-
тельной недостаточности (ДН) во время эпидемий острого
полиомиелита, благодаря чему летальность снизилась с 93 до
22 %. Совершенно ясно, что внешнее сходство клинических
проявлений неврогенной ДН при остром полиомиелите и АБС
является обманчивым феноменом. Неудержимое прогрессиро-
вание симптомов при АБС, даже если используется искусст-
венная вентиляция легких (самых высоких технологий), может
привести к отрицанию всяких попыток продолжать жизнь.
Смертельный финал неизбежен, и срок его наступления от
прогрессирующей ДН прогнозируется достоверно. Регистрация
приближающегося конца болезни неизвестной этиологии всег-
да трагична.
Нигилизм врачей к продолжению жизни больных АБС
сродни пассивной эйтаназии, но, вероятно, имеет право на
дискуссию при современных непредсказуемых социальных ка-
таклизмах и обнищании медицины. Вместе с тем философская
категория понимания гуманности бесконечна и вряд ли при-
емлет пассивность, особенно в медицинских действиях. Имен-
но эти размышления и прогресс реаниматологии способство-
вали нашей практической деятельности, и в этом нам очень
помогли сами больные.
Впервые в 1956 г. к нам обратился врач-невролог, заболев-
ший АБС, уже близким к финалу. Естественно, больной был
хорошо ориентирован во всех проблемах болезни и понимал
трагизм своего положения, усугублявшийся мучительными
приступами удушья. Лишенный вследствие этого сна, имея
единственное желание избавиться от асфиксических присту-
пов, он обратился в "дыхательный центр" (так называлась
нейрореанимационная служба, организованная в те далекие
времена для лечения ДН при остром полиомиелите). Второй
больной, 28-летний инженер, длительно наблюдавшийся нев-
рологами института, был хорошо знаком с методами лечения
АБС, в том числе с использованием ИВЛ. При возникновении
5
ДН больной настойчиво просил применить ему методы реани-
матологии. Наши советы в откровенной беседе отказаться от
этих мероприятий не убедили больного. Его решение было
твердым: "Пока я буду жить, используя ИВЛ, этот срок будет
достаточным для раскрытия причин болезни и, следовательно,
адекватного лечения". Он стойко прожил еще почти 14 лет и
весь этот срок находился на непрерывной ИВЛ.
В историях больных, длительно страдавших АБС, есть
много удивительного. В прологе книги Handbook of Amyotro-
phic Lateral Sclerosis (1992) больной рассказывает о своей жизни
и сделанных им интереснейших открытиях в космической фи-
зике, которые были вьшолнены в процессе бесконечно для
него продолжавшейся болезни с использованием ИВЛ. В по-
пулярной литературе, специально издаваемой для больных
АБС, имеются сведения о кругосветном путешествии на само-
лете больного АБС, в прошлом врача, летчика-любителя. Самолет
был изготовлен для него друзьями. Цель путешествия — привлечь
внимание к АБС и увеличить финансирование научных иссле-
дований. Ни один из наших больных не отвергал методы реани-
матологии. У нас есть публикации по теоретической физике,
подаренные нам и написанные в условиях ИВЛ. Мы испыты-
вали постоянную поддержку больными наших усилий, порою
нелегких, но ставших достаточно привычными для них.
Можно по-разному оценить этот труд с позиций этических
проблем, но его необходимо было проделать, поскольку накоплен
большой опыт как по теоретическим проблемам неврогенной
ДН, так и многолетней ИВЛ в экстремальных условиях прогрес-
сирующего, фазного течения пока еще неизлечимой болезни.
Наша работа затянулась на длительный срок, хотя ряд кол-
лективных исследований был частично опубликован. Замед-
ленный процесс научного рассмотрения проблемы, как нам
кажется, извинителен. Потребовалось осмысление многих кли-
нических, патофизиологических проблем дыхательной недо-
статочности, а также проведения трудоемких морфологических
исследований.
Автор выражает искреннюю признательность академику
РАМН, заслуженному деятелю науки РФ, директору НИИ
неврологии РАМН, профессору Н.В.Верещагину за постоян-
ную поддержку научных исследований. Приношу благодар-
ность медицинскому персоналу, служившему физической и
психологической опорой для больных в экстремальных усло-
виях их жизни. Горячо благодарю Елену Евгеньевну Сабодахо,
морально и материально поддержавшую создание книги с пол-
ным пониманием роли науки в судьбах и жизни больных,
страдающих крайне тяжелыми, порою неизлечимыми болезня-
ми нервной системы.
6
Глава 1
Обзор основных научных направлений
в изучении амиотрофического бокового
склероза
В последнее время многие авторы [Brooks В. et al., 1990;
Williams D. et al., 1991; Brooke M., 1996] поддерживают выде-
ление болезней двигательных нейронов (БДН) в отдельную
группу. По материалам Всемирной федерации неврологов
(1990), к болезням мотонейрона относят спорадический АБС
и семейный АБС, прогрессирующую мышечную дистрофию,
прогрессирующий бульварный паралич, семейные болезни
двигательного нейрона, комплекс паркинсонизм — деменция,
первичный боковой склероз, амиотрофии при наследственных
атаксиях АБС. По своей природе и клинической физиологии
болезни мотонейрона являются гетерогенными. АБС входит в
состав этой группы, но занимает особое место из-за редкости,
крайней тяжести течения и неизбежного летального исхода.
Продолжительность болезни в среднем достигает 3 лет [Tandan
R. et al., 1985]. Менее 3 лет болезнь продолжается у 50 %
больных, более 3 лет — у 20 %, более 10 лет — у 10 % [Mitsu-
moto H. et al., 1988].
Наиболее длительное течение АБС отмечено [Bozek С. et
al., 1985] в молодом возрасте. Примерно 10 % [Mulder D., 1976]
болеют более 10 лет. Причины неизвестны.
Эпидемиология АБС
АБС встречается в среднем с частотой 1,8 на 100 000 [Mit-
sumoto H. et al., 1980]. В последние годы отмечена тенденция,
хотя и не вполне достоверная, к росту распространенности
болезни: в небольших регионах Англии [Mitchel J. et al., 1990]
число заболевших в отдельные годы колебалось от 1,856 до
3,314 на 100 000. АБС чаще страдают мужчины. При анализе
9000 смертей от АБС за 15-летний срок во Франции [Durrleman
S. et al., 1989] на 100 000 населения было 1,9 мужчин и 1,19
женщин. Возрастной пик роста болезни приурочен к 65—74
годам. Факты, свидетельствующие об увеличении числа забо-
левших, надо рассматривать критически, поскольку в статис-
тический анализ могут включаться не только АБС, но и другие
болезни мотонейрона пожилого возраста. По мере уточнения
диагностических критериев АБС и усовершенствования меж-
7
дународных классификаций эти недостатки должны учитывать
[Kurtzke J., 1982]. АБС становится все более известным, веро-
ятно, из-за абсолютно безнадежного прогноза, связанного с
прогрессирующим и неудержимым распадом двигательного
нейрона. Речь идет о спорадических заболеваниях, поражаю-
щих самым неожиданным образом людей различных слоев
общества и профессий. Ее жертвами были известные люди
(вице-президент, актер, сенатор США). Самый крупный чем-
пион по бейсболу всех времен Loi Gering погибал от АБС в
течение 2 лет. В США в публике этот пока еще загадочный
процесс назван болезнью "Loi Gering" [Gutman L. et al., 1996].
Среди наших больных, которым удалось продлить жизнь,
были также люди различных профессий, как связанные с боль-
шими физическими нагрузками (уборщица, колхозница), так
и занимающиеся умственным трудом (физик — лауреат Нобе-
левской премии, врач, учителя, инженеры).
Со времени первого описания болезни прошло 120 лет, но
до сих пор знания о природе АБС полны гипотез и неопреде-
ленности. Вместе с тем интенсивность научных исследований,
как и осведомленность самих заболевших, быстро нарастает. В
течение последних десятилетий каждые 2 года в разных странах
проводятся международные конгрессы, посвященные этой
проблеме. Имеется устойчивое увеличение числа научных пуб-
ликаций, охватывающих различные аспекты АБС и посвящен-
ных прежде всего этиологии. Привлекательность гипотез, не-
которая новизна в стратегии лечения этой трагической болезни
особенно стимулируют исследовательскую активность.
Этиология АБС
Вирусная теория АБС. В 60—70-е годы текущего столетия
главенствующее место занимала теория вирусного происхож-
дения болезни. Первые опыты по экспериментальному воспро-
изведению АБС были сделаны Л.А.Зильбер в 1956 г. В обезь-
яньем питомнике г. Сухуми 7 обезьянам Macacus rhesus вво-
дились экстракты из продолговатого и спинного мозга
больных, умерших от АБС. Спустя год у обезьян были обна-
ружены амиотрофии, повышение рефлексов, потеря массы
тела, нараставшие в течение 2 лет 6 мес. Одна из обезьян была
убита, и гомогенат спинного мозга был введен еще 2 обезь-
янам. Пассажи мозга от этих обезьян поддержать не удалось.
На втором пассаже обе обезьяны погибли от интеркуррентных
заболеваний. У 2 обезьян была отмечена легкая неврологичес-
кая симптоматика, отсутствующая при последующих пассажах.
Обезьяны, получившие инокуляцию мозга, наблюдались
8
свыше 5 лет, некоторые из них погибли от туберкулеза [Бу-
нина Т., 1977].
В рамках сотрудничества России и США, обезьяны, нахо-
дившиеся в Сухумском питомнике, были осмотрены невроло-
гами и вирусологами обеих стран. У обезьян были отмечены
симметричные амиотрофии, слабость нижних конечностей. Ат-
рофии, фасцикуляций в языке не было. Подобные симптомы
обнаруживались у других обезьян, не подвергавшихся иноку-
ляции. Материал спинного мозга и ствола был послан в лабо-
раторию C.J.Gibbs в 1962 г. Инокуляция была сделана 10 обезь-
янам Macacus rhesus. Наблюдения производились в течение 38
мес после инокуляции. Пять обезьян погибли от интеркуррент-
ных заболеваний с различной симптоматологией (тяжелый
паразитизм, диарея, дегидратация). Остальные 5 остались здо-
ровыми [Gibbs С, 1964].
Ни в одном случае не обнаруживались признаки заболева-
ния АБС. Однако эксперименты вновь производились [Brody
J. et al., 1965], но уже на приматах, путем инокуляции им мозга
от больного, погибшего от спорадического АБС. Никаких при-
знаков заболевания отмечено не было, а также не было изме-
нений в ЦНС.
В экспериментах на шимпанзе [Johnson R., 1969] вновь не
подтвердилась возможность заболевания животных, а также
перевиваемость мозга от больных АБС. На этом попытки
трансмиссии АБС обезьянам были закончены. Гистопатологи-
ческие исследования спинного мозга обезьян, заболевших
после инокуляции материала от больных АБС [Зильбер Л. и
др., 1962], были произведены ТЛ.Буниной (1964—1975). В
спинном мозге обезьян мотонейроны передних рогов спинного
мозга были сохранены, в некоторых из них в цитоплазме
обнаруживались оксифильные включения. В белом веществе
от перекреста пирамид до уровня Тущ был распад миелина в
пучках Голля с накоплением жиросодержащих продуктов. Надо
заметить, что корешки и периферические нервы у этих живот-
ных не исследовались. Этот же материал был переслан в США
для гистопатологических исследований, которые не подтверди-
ли [Hirano A. et al., 1968] исследования Т.Л.Буниной, поскольку
не было найдено различий в гистопатологической картине
между спинным мозгом экспериментальных и контрольных
обезьян.
Во время экспериментов с перевивкой мозга, проводивших-
ся в Сухумском питомнике для обезьян, обследовали спонтан-
но заболевших обезьян, содержащихся по соседству с экспе-
риментальными животными [Попова Л., 1967]. Две заболевшие
спонтанно обезьяны не подвергались каким-либо инокуляци-
ям. Основными признаками болезни были вялые параличи, но
9
с наличием гиперрефлексии. При гистопатологическом иссле-
довании у животных был обнаружен распространенный деми-
елинизирующий процесс в спинном мозге и периферических
нервах. Демиелинизация определялась в задних канатиках и в
меньшей степени в церебеллярном и боковом корково-спин-
номозговых путях. В периферических нервах была сегментар-
ная демиелинизация. Наряду с поражением нервной системы
были обнаружены язвенный колит, атрофия слизистой оболоч-
ки тонкого кишечника и кахексия. Как известно, демиелини-
зирующие заболевания у обезьян, содержащихся в неволе (зоо-
парки, питомники), изучаются с начала текущего столетия
[Ruch Т., 1959]. Клиническая картина демиелинизирующих
заболеваний у животных полиморфна. Как и у человека, вы-
деляют спинальный, церебральный, оптический типы болезни.
Возможно, что в морфологических исследованиях, проведен-
ных ТЛ.Буниной, демиелинизирующее поражение задних ка-
натиков, вовсе не характерное для спорадического АБС, оши-
бочно отнесено к проявлениям этой болезни, чему способст-
вовало отсутствие морфологического исследования перифери-
ческих нервов и корешков. Невоспроизводимость дальнейших
пассажей на обезьянах и отрицательные проверочные опыты на
разных видах обезьян и приматах [Brody J. et al., 1965; Gibbs С.
et al., 1969], а также нехарактерные изменения ЦНС при гис-
топатологическом исследовании не подтвердили вирусную
природу АБС.
Подробный анализ опытов по трансмиссии АБС животным
приведен потому, что перевивка мозга больных, погибших от
АБС, производилась большому количеству обезьян и наблюде-
ния продолжались около 20 лет. Последнее было теоретически
оправдано, поскольку АБС включался в разряд медленных
вирусных заболеваний, имеющих длительный инкубационный
период, по аналогии с другими вирусными инфекциями, пере-
вивающимися животным, например скрепи.
Поиски вируса в спинном и головном мозге погибших от
АБС пока безуспешны [Weiner L. et al., 1980]. Тем не менее
вирусная природа болезни еще не отвергнута: имеются пред-
положения о роли полиомиелита в механизме развития АБС
[Bartfeld H. et al., 1982; Miller R. et al., 1986]. Выдвинута теория
инфекции персистирующим вирусом острого полиомиелита,
когда спустя много лет после перенесенного полиомиелита
развивается АБС. Носительство персистирующего вируса
может быть распространенным, поскольку соотношение пара-
литического и непаралитического полиомиелита при тяжелых
эпидемиях составляет 2:5, при легко протекающих эпидемиях
10:25 и даже 1:100 [Gsell Q., 1949].
Таким образом, число инфицированных полиомиелитом в
10
соответствии с проведенными расчетами будет достигать 90—
99 % [Агтоп С. et al., 1990]. Взаимосвязь между перенесенным
полиомиелитом и последующим заболеванием АБС изучается
до сих пор [Dalakas M., 1990]. Как сообщил K.Zilka (1962),
среди 121 заболевшего АБС у И в анамнезе был острый полио-
миелит в детстве. Расчеты [Poskanzer D. et al., 1969] показали,
что 1 из 353 пациентов, перенесших острый полиомиелит в
детстве, имеет шанс в дальнейшем заболеть АБС, о чем сви-
детельствуют единичные, но хорошо документированные на-
блюдения типичного АБС после перенесенного в детстве ост-
рого полиомиелита. Высказаны предположения [Martyn С.,.
1969] о возможном росте числа больных АБС по мере старения,
что рассматривается как позднее следствие субклинической
персистирующей инфекции вирусом полиомиелита. Предпола-
гают, что к концу настоящего столетия число заболевших АБС
должно увеличиться, поскольку к этому времени больные,
перенесшие полиомиелит в детстве, в период эпидемических
вспышек 40—50-х годов, постареют до того возраста, когда
АБС наиболее часто встречается. И напротив, к 2010 г. число
заболеваний АБС снизится, поскольку основная масса населе-
ния в 60-е годы текущего столетия и позже вакцинирована
против вируса острого полиомиелита.
Надо признать, что эти предположения пока не подтверди-
лись. Столетие уже кончается, но особого роста и тем более
каких-либо вспышек АБС не выявлено.
Развитие прогрессирующих амиотрофий у больных, перене-
сших острый полиомиелит в детстве, было поводом рассмат-
ривать постполиомиелитический синдром как поражение со-
хранившихся мотонейронов персистирующим полиовирусом.
Однако попытки выделить полиовирус из ткани головного
мозга больных классическим АБС [Ciemer N. et al., 1973] и от
больных АБС, перенесших в прошлом полиомиелит [Roos R.
et al., 1980], оказались безуспешными.
Рецидив латентной вирусной инфекции маловероятен, по-
скольку специфические антитела к вирусу полиомиелита при
АБС редки. Связь между полиовирусом и АБС остается невы-
ясненной. Исследования полиовируса с помощью чувствитель-
ной молекулярной техники, такие как реакция цепочки поли-
мераз [Salazar-Grueso E. et al., 1992], могут помочь определить,
находится ли полиовирусныи геном у здоровых людей и у
больных АБС.
Длительный след в форме атрофических парезов и парали-
чей остается в жизни больных после полиомиелита, перенесен-
ного в детстве. В США имеется около 300 000 перенесших
полиомиелит во время эпидемий 40—50-х годов. В настоящее
время они живут с различной степенью резвдуальных явлений.
11
В ряде недавних обзоров [Halstead L. et al., 1985] показано, что
свыше 87 % больных после перенесенного полиомиелита стра-
дают прогрессирующими атрофиями и слабостью мускулатуры.
Эти клинические проявления названы постполиомиелитичес-
ким синдромом (ППС). Развитие его нарушает установивший-
ся "стиль жизни" и привлекает неврологов с давних пор.
Одной из причин считаются физические нагрузки и функци-
ональная декомпенсация оставшихся двигательных нейронов.
У здоровых людей число моторных единиц по мере старения
постепенно снижается [McComas A. et al., 1973], но парезов и
параличей не обнаруживается, поскольку имеется реиннерва-
ционное замещение сниженного числа моторных единиц
[Brown W., 1973] и с возрастом продолжается способность к
ветвлению [Bradley W. et al., 1982].
На ЭМГ подтверждается увеличение плотности мышечных
волокон. При АБС, напротив, способность к ветвлению сни-
жена и реиннервация мышц, хотя и доказана, но не компен-
сирует нейрональную потерю. Другой характерной чертой ста-
рения является накопление липофусцина в нейроне, однако
доказать количественную разницу в содержании его у нормаль-
но стареющих людей и больных АБС [McHolm G. et al., 1984]
не удалось.
Снижение потенциалов двигательных единиц, по данным
Л.Ф.Касаткиной (1991), происходит у всех обследованных
больных ППС. По данным этого автора, сохраняющиеся в
течение длительного срока (35—38 лет, 29—59 лет) мотонейро-
ны еще способны осуществлять компенсаторную реиннерва-
цию, но затем происходит их функциональное истощение,
наступают дегенерация и гибель мышечных волокон. Об этом
свидетельствует появление спонтанных фасцикуляций, поло-
жительных острых волн.
Постполиомиелитическая атрофия мышц клинически мо-
жет напоминать АБС, но темп прогрессирования болезни и
редкость поражения верхнего мотонейрона иные. ЭМГ позво-
ляет дифференцировать эти различные процессы.
Теория медленных вирусных инфекций при АБС имела
доминирующее значение почти 3 десятилетия. Затем значи-
мость этого направления ослабела из-за отсутствия обнадежи-
вающих результатов. Иногда исследования снова оживлялись,
чему способствовали сведения о БМН при заведомо вирусных
перевиваемых инфекциях, как, например, болезнь Крейтц-
фельда—Якоба [Salazar-Grueso E. et al., 1992], хотя неврологи-
чески имеются резкие отличия этих заболеваний от АБС. Воз-
можность ассоциации АБС с другими вирусными инфекциями,
концепция взаимодействий генов, вирусов и временных фак-
торов обсуждаются до настоящего времени [Messer A., 1992].
12
Отдельные признаки АБС встречаются при вакуолярной мие-
лопатии у больных СПИДом [Rowland L., 1994]. Этот вирус
имеет определенную нейротропность, но все же ясных доказа-
тельств, подтверждающих эту связь с АБС, нет, а клинические
различия слишком разительны. В природе встречаются естест-
венные заболевания, напоминающие по клиническим прояв-
лениям АБС. Одной из моделей является наследственная спи-
нальная мышечная атрофия у британского спаниеля [Cork L.
et al., 1979]. Другой моделью являются "качающиеся мыши".
Эта болезнь наследуется по зутосомно-рецессивному типу.
Неврологические симптомы включают слабость, атрофию и
преобладание контрактур в мышцах передних конечностей.
Морфологические изменения концентрируются в переднерого-
вых нейронах шейного отдела спинного мозга [Messer А., 1992].
В них отмечена вакуолярная дегенерация в зернистом эндо-
плазматическом ретикулуме. Дегенерация начинается в теле
нейрона, в процесс вовлекается проксимальный аксон вент-
ральных корешков, что характерно для первичной аксонопатии
со снижением скорости медленного аксонального транспорта
и потери нейрофиламентов [Mitsumoto Н. et al., 1982]. Пред-
полагается, что эти процессы определяют прогрессирующую
дегенерацию мотонейронов.
Иммунные факторы при АБС. Значимость аутоиммунных
механизмов при болезнях мотонейрона (БМН) становится все
более доказательной. Типичные признаки АБС встречаются
при заболеваниях раком различных органов [Norris R, 1992],
но чаще при лимфомах и синдромах моноклональных гаммо-
патий. Парапротеины найдены у 4,8—9,0 % больных, имеющих
БМН [Shy M. et al., 1986; Youngner D., 1990]. Обе цифры были
выше, чем в контрольных группах. Лимфомы и БМН нередко
обнаруживают при ретровирусных болезнях [Gardner M., 1985].
Связь с клеточным иммунитетом к полиовирусу найдена у 21
из 33 больных АБС [Kott E. et al., 1976]. У здоровых людей и
больных другими заболеваниями эта связь отсутствовала: Гу-
моральные ответы к вирусным антигенам полиомиелита, Кок-
саки, инфлюэнцы А, краснухи, свинки, простого герпеса, ци-
томегаловируса, опоясывающего лишая не отличались при
АБС от контроля [Bartfeld H. et al., 1982].
Антитела могут появляться в ответ на антиген опухоли и
перекрестных реакций с мотонейронами, аналогично тому ме-
ханизму, который имеется при синдроме Ламберта—Итона при
злокачественной миастении. Иммуноглобулиновые депозиты,
иммуноглобулин G и СЗ компонент комплемента обнаружены
в глиальных клетках, мотонейронах спинного мозга и двига-
тельной коры у Уз больных АБС, а также у людей, перенесших
инфекционные болезни [Donnenfeld H. et al., 1984].
13
Таким образом, имеются определенные доказательства от-
ветственной роли аутоиммунных механизмов при БМН, а
также идентификации возможных антигенных мишеней для
формирования антител. Создание животных моделей также
может пролить свет на способы воздействия антител, получе-
ние диагностических тестов для установления правильного
диагноза и лечения.
Трофические факторы при АБС. Недавние успехи в молеку-
лярной биологци привели к идентификации возможных фак-
торов роста мотонейронов. Выделено несколько семей факто-
ров роста, являющихся модуляторами выживания мотонейро-
нов у взрослых особей.
Семья нейтрофинов объединяет фактор роста нервов
(NGF), нейротрофины, выделенные из мозга (BDNF), нейтро-
фины мышц и глиальных клеток. В эксперименте испытаны
инсулиноподобный и многие другие факторы, стимулирующие
рост нейронов в разных фазах развития млекопитающих. При-
менительно к АБС факторы роста могут иметь значение в
клиническом испытании как потенциальные способы лечения
[Elliott J. et al., 1996]. Так, комбинированная терапия нейро-
трофинами, выделенными из мозга, и цилиарный нейротрофи-
ческий фактор по сравнению с другими факторами роста ус-
пешно замедляют процесс потери мотонейронов при наслед-
ственной форме "качающихся мышей" [Mitsumoto H., 1996].
Кроме положительного трофического влияния на мотонейро-
ны, выяснена потенциальная токсичность некоторых факторов
роста. Например, нейротрофин, выделенный из мозга в ком-
бинации с NT-3, NT-4, заметно усиливает токсичность глюта-
мата посредством повышения действия его на глютаматные
рецепторы [Koh J. et al., 1995].
Метаболические расстройства. Одна из гипотез патогенеза
АБС основана на дефиците энзимов, участвующих в восста-
новлении дезоксирибонуклеиновой кислоты (ДНК) в мотоней-
роне. Проблема этих нарушений неясна. Не выяснен вопрос о
том, почему мотонейроны больных АБС функционируют нор-
мально, а затем быстро погибают в течение 1—2 лет.
W.Bradley (1982) предполагает генетически обусловленное
уменьшение активности одного из энзимов восстанавливаю-
щих ДНК. В результате происходит скопление поврежденной
ДНК, которая не осуществляет нормальную транскрипцию
РНК. Наступает дефицит синтеза структурного и энзиматичес-
кого белка. Последнее еще более способствует ухудшению вос-
становления ДНК. Замкнутый круг, относящийся к ненор-
мальному синтезу энзима, может объяснить и гибель нейронов
с возрастом. В гипотезе об изменении синтеза ДНК содержится
множество причинных факторов, относящихся к происхожде-
14
нию АБС. Токсины, металлы тормозят многие энзимные сис-
темы, включая энергетический метаболизм. Предшествующие
атаки полиовируса увеличивают необходимый для усиленного
ветвления аксоплазматический объем оставшихся непоражен-
ными мотонейронов. В результате возрастают метаболические
потребности перикариона мотонейрона с последующим нару-
шением энзиматической активности. В мотонейронах больных
АБС и у животных, например у "качающихся мышей", разви-
ваются сходные метаболические расстройства вследствие энзи-
матических дефектов [Tandan R. et el., 1985], которые также
упоминаются при старении, хронических дегенеративных за-
болеваниях, таких как болезнь Альцгеймера и др.
Влияние факторов окружающей среды в патогенезе АБС. Наи-
большее значение принадлежит особенностям питания людей
и эндемическому распространению болезни мотонейронов.
Среди многих исследований, касающихся патологического
влияния металлов, рассматривается избыточное или недоста-
точное содержание металлов в почве, воде. Высокая концент-
рация алюминия, марганца, низкая концентрация кальция и
магния наблюдались в Гуаме, западной части Новой Гвинеи,
где отмечено эндемическое распространение АБС в комплексе
с деменцией [Yase Y., 1972].
Накопление кальция и кремния обнаружено в мотонейро-
нах в форме гидрооксиапатитов алюминия [Yanagihara R.,
1982], которые ухудшают аксональный транспорт белков ней-
рофиламентов. Антитела к нейрофиламентам образуются
вследствие лизиса и исчезновения пораженных клеток. Метал-
лические комплексы в нейронах могут находиться в течение
многих лет до выраженного заболевания. Затем по неясным
причинам у одних больных развиваются признаки АБС, а у
других — синдром паркинсонизма с деменцией. Приматы, у
которых была диета с низким содержанием кальция и магния
и высоким содержанием алюминия, как было в Гуаме, обна-
руживали признаки заболевания мотонейронов.
Коррекция кальция в диете, модернизация источников пи-
тьевой воды снизили распространение заболеваний мотоней-
рона [Perl D. et al., 1982]. Избирательным токсическим воздей-
ствием на мотонейроны передних рогов спинного мозга, пи-
рамид Беца обладают семена ложной саговой пальмы.
Употребление их в пищу аборигенами Гуамы вызывало син-
дром АБС. В семенах содержится p-N-метиламин-Ь-аланин
(ВМАА), который у обезьян также вызывает клинические про-
явления БМН [Carruto R. et al., 1988].
Хроническое употребление в пищу семян чины (Lathyrus
sativus) вызывает латиризм, проявляющийся у человека спас-
тической параплегией без признаков заболевания НМН [Row-
15
land L., 1994]. После кормления обезьян семенами чины, со-
держащими токсин p-N-оксалил-амин-Ь-аланин (ВОАА), раз-
вивались спастические параличи вследствие поражения ВМН
[Spencer P. et al., 1986].
Токсические свойства ВМАА и ВОАА являются сходными
по химической структуре с глютаминовой кислотой [Weiss J. et
al., 1980], которая оказывает влияние на ВМН и НМН.
В последние два десятилетия произошло существенное из-
менение подходов к исследованиям патогенеза и этиологии
АБС, которые оценены как прорыв знаний в теоретических
проблемах. Сюда относятся прежде всего генетические иссле-
дования по созданию модели трансгенных мышей, открытие
гена АБС при семейных формах. Существенное значение при-
обрело расширение знаний о механизмах смерти нейронов и
состояния апоптоза, роли токсичности некоторых возбуждаю-
щих нейротрансмитгеров, трофических и аутоиммунных фак-
торов, гипотезы "аксостаза". Большинство этих направлений
имеет, по-видимому, стратегическое значение.
Теория "аксостаза" основана на анализе патологических
процессов, происходящих в аксональном транспорте мотоней-
ронов [Chou S., 1992]. Наибольшими нейронами организма
являются двигательные мотонейроны передних рогов спинного
мозга и пирамиды Беца. Они должны поддерживать интегра-
цию дендритов, часто протяженностью более 1 см, и аксон,
достигающий 100 см. В аксоне имеются непрерывные потоки,
через которые клеточное тело направляет структурные и функ-
циональные белки на периферию и получает обратные сигналы.
Ортоградный транспорт бывает 2 видов: а) быстрый — 400 мм в
день, идущий в обоих направлениях и транспортирующий свя-
занные с мембраной белки и гликопротеиды, б) медленный —
несколько миллиметров в день, транспортирующий сети
микрофиламентов, микротрубочек, нейрофиламентов, как
компонент "а" (0,1—2 мм в день), а также большой комплекс
растворимых белков, как компонент "б" (2—4 мм в день).
Ретроградный аксональный транспорт несет эндогенные (ами-
нокислоты, фактор роста нервов) и экзогенные (токсин столб-
няка, вирус полиомиелита, простого герпеса, бешенства, лек-
тан цсроксидазы хрена и др.) субстанции от терминальных
аксонов к клеточному телу со скоростью свыше 75 мм в день.
Морфологические исследования аксонального транспорта в
биоптатах двигательных веточек периферических нервов боль-
ных АБС выявили уменьшение скорости ретроградного аксо-
нального транспорта и, следовательно, связи терминального
аксона с перикарионом [Breuer A. et al., 1987]. В межреберных
нервах больных АБС еще до развития признаков нейройальной
Гб
дегенерации появляются изменения белков микротрубочек
[Binet S. et al., 1988].
Ультраструктурные исследования проксимального аксона и
аксонального бугорка мотонейронов переднего рога спинного
мозга больных, умерших от АБС [Sasaki S. et al., 1996], показали
нарушение быстрого аксонального транспорта. Гладкий эндо-
плазматический ретикулум теряет структуру: происходит скоп-
ление митохондрий, лизосом, Леви-подобных телец, эозино-
фильных и гиалиновых включений, липофусциновых гранул,
особенно в аксональном бугорке. Присутствие этих необычных
структур является отражением дисфункции аксонального
транспорта. Применительно к возможной этиологии АБС еще
ранее выдвинута концепция "аксостаза" [Chou S., 1992]. Ней-
ротоксические факторы путем ретроградного транспорта изби-
рательно поражают нейрон, создавая феномен "суицидального
транспорта". Ухудшение медленного транспорта в аксоне со-
провождается скоплением нейрофиламентов, набуханием про-
ксимального аксона и последующей дистальной аксональной
атрофией, а также вторичной демиелинизацией, характерной
для центральной дистальной аксонопатии или "ретроградного
умирания" — "dying back".
Определенную значимость в развитии ранних морфологи-
ческих изменений мотонейронов при АБС имеет теория ауто-
иммунитета [Smith R. et al., 1996], основанная на появлении
антител к зарядам входа кальциевых каналов. Пассивный пере-
нос фракций, содержащих иммуноглобулин, мышам вызывает
изменения нервно-мышечных соединений, сходные с таковы-
ми при спорадическом АБС. У животных эти изменения отра-
жают расстройства внутриклеточного Са2+ гомеостаза, и ран-
нее повреждение пластинчатого комплекса в мотонейронах в
форме набухания и фрагментации. Иммуноглобулины от боль-
ных спорадическим АБС вызывают зависимый от Са2+ апоптоз
клеток вследствие оксидативных повреждений. Апоптоз, обу-
словленный иммуноглобулином от указанных больных, регу-
лируется присутствием связанных белков, которые могут мо-
дулировать избирательную ранимость нейронов при споради-
ческом АБС.
Токсические свойства нейротрансмитгеров. Воздействие воз-
буждающих аминокислот глютамата и аспартата на мотоней-
роны основано на повышении их содержания в цереброспи-
нальной жидкости у больных АБС в 2—3 раза [Rothstein J. et
al., 1992]. Процесс воздействия этих нейротрансмитгеров в
условиях патологии, по-видимому, связан с активацией "ре-
цепторов нейрональной смерти", из котоцых^шШолее значи-
мым является N-Methyl-D-Aspartate (NMOAs)*,
Затем присоединяется серия внутри?леіочнілхі«ейррвгок<й»«'
ческих изменений: избыточное поступление кальция, актива-
ция оксидантных энзиматических путей, включающих увели-
ченное образование окиси азота, пероксинитрита, анионов су-
пероксидазы [Choi D., 1988]. Даже нормальная глютаминерги-
ческая синаптическая передача при нарушении метаболизма в
нейроне может вести к его дегенерации. Типичными признаками
ее являются набухание цитоплазмы, вакуолизация митохонд-
рий и эндоплазматического ретикулума, приводящих к апоп-
тической форме нейрональной дегенерации [Rothstein J., 1996].
Гипотеза о нейротоксических свойствах глютамата послужила
поводом для разработки новой терапевтической стратегии
АБС. В качестве тормозящего действия предложен антиглюта-
матный агент рилютек (рилюзол). Нейрофармакологической ос-
новой его является 2-aMHHo-6(trifluoromethoxy)BenzotMazol PP
54276 как возможный антагонист возбуждающих аминокислот
с антиконвульсивными свойствами. Препарат относится к ней-
ропротекторам, задерживающим освобождение глютамата. Ри-
люзол оказался наиболее эффективным при бульбарных фор-
мах АБС [Bensimon G. et al., 1994].
Молекулярная генетика в проблеме АБС. Механизмы изби-
рательной гибели мотонейронов при АБС до настоящего вре-
мени остаются невыясненными, но в последние 2 десятилетия
наступил большой прогресс в молекулярной генетике, в рас-
крытии причин возникновения семейного АБС и приближении
к пониманию механизмов смерти мотонейронов.
Спорадические формы АБС, как известно, составляют 90 %
всех случаев, 10 % относятся к семейным формам. Передача
болезни осуществляется аутосомно-доминантным и аутосом-
но-рецессивным способами. Доказано, что 20 % аутосомно-до-
минантного семейного АБС связано с хромосомой 21q21 [Sid-
dique Т. et al., 1991] и ассоциируется с мутацией в гене метал-
лоэнзима Си—Zn супероксид дисмутазы [Rosen D. et al., 1993].
Генетический локус для оставшихся 80 % доминантно насле-
дуемого семейного АБС не идентифицирован. СОД 1 (супе-
роксид дисмутазы) является группой энзимов, которые ката-
лизируют конверсию аниона супероксидазы (02-~) в перекись
водорода и кислород. СОД 1 обеспечивает защиту клеток про-
тив (02~) и его токсических производных [Pardo A. et al., 1995,
цит. Siddique et al., 1996]. СОД 1 присутствует в цитоплазме
большинства клеток, включая эритроциты, и в изобилии — в
мотонейронах. Прорыв знаний в генетической теории семей-
ного АБС впервые был достигнут на модели трансгенных
мышей воспроизведением параличей и доказательствами изби-
рательной смерти мотонейронов. Поражение нейрофиламентов
мотонейронов получило экспериментальное обоснование кон-
струкцией трансгенных мышей. Нейрофиламенты в мотоней-
18
ронах в 3—4 раза превышают нормальные уровни, что приво-
дит к прогрессирующей потере их кинетической активности,
мышечной атрофии и параличам.
В патогенезе болезней мотонейрона процессы в нейрофи-
ламентах у мышей напоминают патологию, обнаруживаемую
при болезни человека [Cleveland D. et al., 1996]. К числу ранних
патологических изменений мотонейронов спинного мозга от-
носят фрагментацию пластинчатого комплекса. Этим измене-
ниям предшествуют микровезикуляция больших переднерого-
вых нейронов и появление больших вакуолей, происходящих
из грубого эндоплазматического ретикулума и дегенерирующих
митохондрий.
В конце процесса микровезикулярные изменения исчезают
и наступает атрофия передних рогов вследствие потери нейро-
нов [Hirano A., 1996].
Таким образом, впервые получены прямые доказательства,
что в патогенезе семейного АБС (доминантное наследование)
имеет значение мутагенный ген СОД 1 [Siddique Т. et al., 1996].
Анализ генетической связи, идентификация мутаций в
СОД 1 открывают новую серию исследований патогенеза АБС.
Модели трансгенных мышей, воспроизводящих мутантную
СОД 1, могут быть использованы для поисков защитных тера-
певтических агентов, воздействующих на нейродегенеративный
процесс при АБС, а также модификации моделей трансгенных
мышей для развития патогенетических исследований споради-
ческого АБС.
Заключение
История научных исследований, посвященных АБС, с мо-
мента первого описания, свыше 120 лет назад, и до настоящего
времени состоит из разных подходов к изучению патогенеза и
поиску причин этой крайне тяжелой болезни. Главным явля-
ется раскрытие причины и механизма избирательной смерти
мотонейронов.
В последние годы наблюдается прорыв знаний в генетичес-
кой теории семейного АБС. Впервые получены прямые дока-
зательства значимости мутантного гена Си—Zn супероксид
дисмутазы, открывающие новую серию исследований дегене-
рации мотонейронов на модели трансгенных мышей. Все это
существенно важно и для спорадического АБС.
Выдающееся значение имеют работы, посвященные токсич-
ности глютамата, неконтролируемому поступлению Са++ в
нейрон, свободным радикалам, нейротрофическим факторам,
изменениям цитоскелета и апоптозу.
Вместе с тем клиническая неврология пока еще не распо-
19
лагает нейрофармакологическими препаратами, замедляющи-
ми процесс болезни. Попытки в этом направлении сделаны,
но все же болезнь остается некурабельной. Серьезной задачей
является создание доступной для больных функциональной
независимости с помощью различных устройств, организации
домашнего ухода, связи с окружающим миром, психологичес-
кой поддержки. Существенное значение приобретает исполь-
зование различных приборов и аппаратов ИВЛ, облегчающих
жизнь больных в критических ситуациях.
Глава 2
Клиника амиотрофического бокового
склероза в условиях продленной жизни
Неврологический симптомокомплекс АБС на протяжении
более чем столетнею срока достаточно точно определился как
сочетание амиотрофий, параличей и спастичности. Слагаемые
указанной триады дополнены множеством патогномоничньїх
признаков. Казалось бы, теперь не должно оставаться сомне-
ний в конструкции диагноза, однако продолжается большой
поток обзоров, посвященных АБС, когда клинические прояв-
ления рассматриваются в комплексе с другими болезнями мо-
торного нейрона, иногда сходными синдромологически.
Точность дефиниций различных болезней, включенных в
группу болезней мотонейрона, особенно необходима потому,
что только однородность материала может обеспечить прогресс
в развитии знаний.
В программу исследований теперь включаются многие ме-
тоды, которые прежде не могли быть использованы из-за от-
сутствия специальных подходов, связанных с патологией гено-
ма, иммунопатиями, вирусными болезнями. Все эти исследо-
вания крайне трудоемки и дороги, поэтому однозначность
материала, направленного на проведение профилированных
разработок, мбжет послужить для прогресса фундаментальных
исследований этиологии болезней мотонейрона.
Под эгидой Всемирной федерации неврологов (1990) иссле-
довательской группой по нейромышечным болезням разрабо-
таны наиболее точные диагностические критерии АБС. Они
должны обеспечить правильный диагноз и гарантировать еди-
нообразие клинических понятий, что необходимо при выпол-
нении научных экспериментов, особенно в молекулярной ге-
нетике.
Диагноз АБС основывается на следующих представлениях:
1. Сочетанное поражение функции нижнего мотонейрона
(НМН) и верхнего мотонейрона (ВМН) при обязательном про-
грессирующем течении болезни.
2. Должны отсутствовать расстройства чувствительности,
сфинктеров, болезнь Паркинсона, болезнь Альцгеймера, нару-
шения зрения.
3. Диагноз подтверждается наличием фасцикуляций в раз-
ных мышечных группах; тестами, определяющими силу мышц;
21
показателями легочных функций; тестами, выявляющими на-
рушения речи, расстройства глотания; биопсией мышц. В диф-
ференциальном диагнозе используются данные ЭМГ, особенно
в ранних стадиях, обязательно проведение рутинных клиничес-
ких, радиологических исследований позвоночника, миелогра-
фии, компьютерной томографии и магнитно-резонансной то-
мографии, как "золотого стандарта". Все это повышает досто-
верность диагноза, позволяет избегать частых госпитализаций
и дискомфортных процедур.
Главной причиной летальных исходов при АБС является
ДН, наступающая вследствие параличей дыхательных мышц,
глоссофаринголарингеального паралича (ГФЛП) или бульвар-
ных расстройств. Современное интенсивное лечение ДН со-
стоит в искусственном поддержании жизни с помощью аппа-
ратов искусственной вентиляции легких (ИВЛ), санации тра-
хеобронхиального дерева, искусственного питания. Комплекс
упомянутых мероприятий объединен в понятие дыхательной
реанимации (ДР), подчеркивающей необходимость поддержи-
вать жизнь больных непрерывно.
Клинические представления о прогрессирующей гибели
НМН и ВМН при АБС сформировались в условиях естествен-
ного течения болезни, но в статическом состоянии, в рамках
периодических осмотров, вплоть до финала болезни. Продле-
ние жизни ИВЛ развернуло отличительные свойства прогрес-
сирования болезни с неповторимым развитием синдрома де-
эфферентации, как выражение крайней степени гибели всего
двигательного нейрона.
Длительная ИВЛ при АБС впервые стала проводиться нами
с 1956 г. [Попова Л., 1967] и в отдельных случаях применялась
до 1990 г. В литературе подобного рода наблюдения отмечены
спустя 30 лет [Hayashi H. et al., 1988].
Исторически подобного рода наблюдения при АБС законо-
мерно должны были появиться, поскольку во время эпидемий
острого полиомиелита был накоплен опыт длительной ИВЛ,
показавший драматическое снижение летальности до непред-
сказуемо низких цифр [Lassen H., 1953]. Затем высокая эффек-
тивность ИВЛ была много раз доказана при других заболева-
ниях, связанных с поражением НМН, но при другой локали-
зации процесса (полинейропатии, злокачественная миастения
и др.). Описаны случаи многолетнего продолжения жизни
таких больных [Попова Л., 1975; Christensen М. et al., 1975], но
при этом никогда не было описано тотальной гибели НМН на
всем его протяжении в условиях сохранности интеллекта и
функции глазодвигателей.
Тесная кооперация с больными, фактически перешедшими
черту естественной жизни, в условиях полной интеллектуаль-
22
ной дееспособности имела существенное значение для пони-
мания развертывания неврологического симптомокомплекса.
Полнота информации и достоверность ее дополнялись еще и
тем, что больные многократно поступали в клиники с надеж-
дой получить адекватное лечение, иногда задолго до угрожаю-
щих жизни параличей дыхательных мышц и бульбарных рас-
стройств. Редкие, единственные в своем роде наши наблюде-
ния, серьезные и понятные трудности в такого рода исследова-
ниях позволяют представить клиническую картину АБС в ус-
ловиях продленной жизни в форме кратких, но обстоятельных
сведений о каждом больном. Использовано общепринятое и
целесообразное клиническое разделение АБС на отдельные
формы по принципу первоначального развития двигательных
нарушений на бульбарную, шейную, шейно-грудную и пояс-
ничную. Выделение полинейритической формы нецелесооб-
разно, поскольку она включала в себя первоначально локали-
юванные двигательные нарушения в пояснично-крестцовом
отделе спинного мозга с восходящим течением и отсутствием
признаков поражения ВМН, которое, естественно, в этих ус-
ловиях не могло проявиться.
Перечень рассматриваемых наблюдений, их общая характе-
ристика и развитие параличей приведены в табл. 1 и на рис. 1.
Бульбарная форма АБС
Наблюдение 1. Больной Б., 59 лет; поступил в реанимационное
и іделение 28.09.1962 г. с жалобами на затруднение глотания, речи и
• и раничение движений правой руки.
Анамнез: отец и мать умерли в преклонном возрасте от рака. Жена
и взрослый сын здоровы. Работает авиаинженером. В прошлом ничем
не- болел. В 1920 г..был ушиб головы без потери сознания. Заболевание
і мчалось в марте 1962 г. с затруднения в произношении слов. Спустя
І мес речь стала неразборчивой, поперхивался при глотании. Вскоре
«илабела правая рука, отмечалась гипотрофия мышц кисти, появились
мышечные спазмы, фасцикуляции в мышцах туловища и ног. В тече-
ние 3 мес возникали приступы удушья, спазмы в глотке, одышка при
ц( большой физической нагрузке. Симптомы прогрессировали.
Неврологический статус. Сокращение мягкого неба при фонации
«нраничено. Глоточный рефлекс высокий, голосовые связки смыка-
инея полностью, голосообразование не нарушено. Подвижность
і «ыка в полости рта резко ограничена, речь смазанная, неразборчи-
1чя. Непрерывные фасцикуляции мышц языка, в полости рта много
< ионы и слизи. Нарушилась оральная фаза глотания: формирование
і илком пищевого комка невозможно. Мучительные приступы кашля
i.< исдствие затекания и аспирации содержимого рото- и носоглотки в
іріхею. В течение 3 мес снизилась сила в правой руке и ослабели
ишжения пальцев. Выраженная гипотрофия надостных, подостных
мышц, мелких мышц кисти и возвышения большого пальца. Фасци-
23
^ Таблица 1
Общие сведения, сроки ИВЛ и продленной жизни больных АБС
№ на-
блю-
дения
1
2
3
4
5
6
7
Больной,
профессия
Б.
инженер
г.
физик
Т.
физик
П.
инженер
3.
инженер
и.
служащий
Тр.
колхозница
Воз-
раст
при
по-
ступ-
лении
59
55
71
27
56
42
27
Пол
м
м
м
м
м
м
ж
Дата
заболевания
Март 1962
Август 1961
Первоначаль-
ная локализа-
ция
Бульбарная
(язык)
Шейная
(диафрагма)
Октябрь 1966 Шейная
Апрель 1956
Январь 1961
Ноябрь 1955
Май 1957
(диафрагма)
Шейно-груд-
ная (левая
рука)
Шейно-груд-
ная (руки)
Поясничная
(левая нога)
Поясничная
(правая
нога)
Срок
появ-
ления
ДН от
на-
чала
паре-
зов,
мес
6
8
11
100
10
11
18
Срок
жизни
на
ИВЛ,
мес
10
87
38
172
15
1,5
4
Общая
про-
ДОЛ-
жи-
тель-
ность,
мес
16
99
53
272
29
«12
28
Дата
смерти
Причина смерти
17.07.1963 Гнойный медиасти-
нит (трахеоэзофаге-
альный свищ)
29.10.1969 Случайное отклю-
чение от аппарата
12.04.1971 Абсцедирующая
пневмония
6.10.1978 Спонтанная гипо-
термия
10.06.1963 Ателектазы легких
18.10.1956 Ателектатическая
бронхопневмония
3.08.1959 Кровотечение из
трахеоваскулярной
фистулы
8
9
10
11
12
E.
врач
Ш.
учительница
физкультуры
А.
служащий
Ж.
уборщица
К.
учительница
музыки
39
47
56
44
32
м
ж
м
ж
ж
Июнь 1956
Март 1958
Декабрь 1958
Январь 1957
Март 1977
Поясничная
(левая стопа)
Поясничная
(правая
стопа)
Поясничная
(стопы)
Поясничная
(ноги)
Поясничная
(ноги)
11
12
9
44
40
23
18
26
35
108
39 13.10.1959 Уросепсис
33 17.12.1960 Технический дефект
аппарата ИВЛ
35 22.09.1961 Сердечная слабость.
Бронхоэктатическая
болезнь
79 19.09.1963 Абсцедирующая
пневмония
156 21.11.1990 Вскрытие не произ-
водилось
Обозначения: |ооо| — локальная утомляемость; 1XXI — боли;
ІЛЛЛІ — судороги, мышечные спазмы, фасцикуляции;
I—— -I — потеря массы тела; ^yj — одышка; Mill — парезы;
II I II — глубокие парезы; ■■ — параличи; ->о —трахеостома;
Д — ИВЛ нательными аппаратами; I I — общая продолжительность болезни.
Рис. 1. Развитие парезов и параличей в различные периоды АБС и в
процессе продленной жизни. Цифрами обозначена продолжитель-
ность в месяцах.
куляция дельтовидных, грудных мышц. Сухожильные и периосталь-
ные рефлексы на руках оживлены. D>S. Нижнечелюстной рефлекс
высокий.
Рентгенологически — явления деформирующего остеохондроза
шейных позвонков. Легочные поля прозрачны. Экскурсия диафрагмы
в норме.
К 6-му месяцу от начала болезни резко выражена дисфагия, уста-
лость при жевании, одышка в покое. Глубокий парез мышц правой
руки, особенно пальцев кисти, не может удержать ложку. Симптом:
Бабинского слева, выражены симптомы орального автоматизма.
Спустя еще 2 нед откашливание мокроты невозможно. Одышка по-
стоянная. Появились болезненные судороги мышц, рук, бедер, туло-
вища. Вследствие постоянного непереносимого удушья лишился сна.
Анартрия, афагия, дисфония, кожные покровы цианотичыы. Откаш-
ливание скопившейся слизи, слюны невозможно. В легких дыхание
ослаблено. Диафрагма справа неподвижна, слева 1,5 см. 29.09.1962 г.
по витальным показаниям произведена трахеостомия с последующим
ИВЛ и кормлением через назогастральный зонд. В последующие 10 мес
неуклонное прогрессирование болезни: двусторонний глубокий парез
мимических мышц, нижняя челюсть отвисает, паралич диафрагмы,
ослаблена конвергенция, усилилась саливация. Появилось нарастание
тонуса в мышцах языка, который стал выдвигаться вперед и зажи-
маться зубами. Нарушилось голосообразование. При ларингоскопии
грубый парез голосовых связок. Функция глазодвигательных мышц
сохранена, объясняется с помощью азбуки. Движения в мышцах шеи
резко ограничены во всех проекциях. Не может поднять голову от
подушки. В руках и мышцах туловища все движения исчезли, напря-
жение мышц живота при кашле, особенно во время санации дыха-
тельных путей, ослаблено. Парезы мышц ног, больше справа. Фасци-
куляции во всех группах мышц туловища рук, ног, включая мимичес-
кие. Тонус повышен в пронаторах обеих предплечий, больше слева.
Рефлекс с двуглавой мышцы справа отсутствует. Коленные ахилловы
рефлексы живые. Резко выражены рефлексы орального автоматизма.
Усиление спастического тонуса в ногах с периодическим югонусоидом
мышц ног, усилились судорожные сведения их, генерализованные
фасцикуляции, незатухающие клонусы надколенных чашек, стоп,
симптом Бабинского с двух сторон, коленные и ахилловы рефлексы
повышены. К концу 16-го месяца от начала болезни (10 мес приме-
нения ИВЛ) произвольные движения рук отсутствовали, а ног резко
ограничены. Объяснение с больным происходило по азбуке, движе-
ниями глаз. В последние 5 мес пребывания на ИВЛ отмечались
бронхолегочная патология, язвенный трахеит, осложнившийся тра-
хеоэзофагеальным свищом и медиастинитом. 17.07.1963 г. больной
скончался.
Резюме. У 59-летнего больного Б. без явных предвест-
ников болезни, кроме некоторого затруднения в произноше-
нии отдельных слов, развились прогрессирующая дизартрия,
дисфагия, дисфония, постоянные фасцикуляции мышцы
языка, переходящие в диффузное и непрерывное зыбление его.
Затем присоединились слабость правой руки, гипотрофии
28
мышц кисти, парез правой половины диафрагмы. К 6-му ме-
сяцу от начала болезни сформировались ГФЛП, вялые пара-
личи мышц рук, спастический парез ног, а также все признаки
вовлечения ВМН. Произведена трахеостомия и начаты непре-
рывная эндотрахеальная ИВЛ, кормление через назогастраль-
ный зонд. К 7-му месяцу генерализация процесса была развер-
нутой. ДН была выражена в наиболее тяжелом варианте: ГФЛП
сочетался с параличом диафрагмы. Наблюдались распростра-
ненная бронхолегочная патология и признаки эзофагита вслед-
ствие длительного пребывания назогастрального зонда. В конце
10-ю месяца от начала ИВЛ появились признаки трахеоэзофа-
геальной фистулы. Смерть наступила от гнойного медиастини-
та. ИВЛ проводилась в течение 10 мес. Общая цродолжитель-
ность болезни 16 мес.
Шейная форма АБС
Локализация в шейных сегментах (Сш—Cv) в условиях
естественного течения болезни отличается от всех остальных
форм АБС первоначальным прогрессирующим парезом диа-
фрагмы и развитием симптомокомплекса ДН.
Больные Г. и Т. поступили с выраженными признаками
гипоксемии и гиперкапнии. Больной Г. был доставлен .в сопо-
розном состоянии. Диагноз паралича диафрагмы в обоих слу-
чаях не был поставлен до критическою состояния. В литера-
туре и до настоящего времени имеются сообщения [Fromm G.
et al., 1977; НШ R. et al., 1983] о ДН, возникающей при АБС
в связи с первоначальным параличом диафрагмы. Эти больные
доставлялись в отделения интенсивной терапии с диагнозом
ДН неясной этиологии. Нередко ИВЛ проводилась эндотрахе-
ально. Как правило, наступало улучшение, и тогда больных
экстубировали и выписывали из стационара. Через 2—3 нед
такие больные вновь поступали с ДН. Диагноз АБС в этих
случаях ставился с опозданием по мере появления характерно-
го неврологического дефицита [Meyrignac С. et al., 1985].
Наблюдейие 2. Больной Г., 55 лет, физик. Поступил в неврологи-
ческое отделение с жалобами на одышку, общее похудание. Считает
себя больным с августа 1961 г., когда после гриппа развились общая
слабость, сонливость, снижение трудоспособности, судорожные по-
дергивания в мышцах ног, преимущественно бедер. До заболевания
вел активный образ жизни, занимался спортом. В 1959 г. дважды был
подъем АД до 150/80—160/90 мм рт. ст. С апреля 1962 г. стала
возникать одышка в положении лежа. С июля 1960 г. по май 1962 г.
(в течение 18 мес) потерял 17 кг массы тела. Постоянно состоял на
диспансерном наблюдении. Врачи объясняли одышку, которая осо-
бенно беспокоила больного, сердечной слабостью.
29
В анамнезе перенес корь, скарлатину, дизентерию, ветряную оспу,
малярию, около 30 лет назад был случайный контакт с ртутью.
Соматический статус. Кифосколиоз в грудном отделе. Рост 155 см,
масса тела 49 кг. Легкий цианоз слизистых, ЧД 24—32 в 1 мин в
положении сидя, 52—54 в 1 мин в положении лежа. Тип дыхания
грудной с участием вспомогательной мускулатуры шеи, ритм правиль-
ный. ДО 400—350 мл сидя, 150 мл лежа. ЖЕЛ — 1100 мл сидя и 600 мл
лежа, МОД от 7,5 до 11,2 л, НЬ02 91 %, рН 7,35, РкС02 60 мм рт.
ст., BE —8,0 мэкв/л. При рентгеноскопии грудной клетки легочные
поля прозрачны, эмфизематозны, диафрагма в акте дыхания не уча-
ствовала, левая граница сердца по среднеключичной линии. Тоны
сердца приглушены. Пульс 70 в 1 мин, АД 115/75. Печень, селезенка
не пальпировались.
Неврологический статус. Черепные нервы без особенностей. На
фоне похудания всей мускулатуры отмечалась гипотрофия мелких
мышц кисти. В этих же мышцах была частичная реакция перерожде-
ния. Сохранялся полный объем движений во всех суставах. Сила
мышц удовлетворительная. Фасцикуляции мышц туловища и ног.
Сухожильные рефлексы на руках высокие. D=S. Кистевые аналоги
симптомов Россолимо, Жуковского. Брюшные рефлексы не вызыва-
лись. Больной был выписан домой 14.08.1962 г. Постоянно беспокои-
ли одышка и сонливость, но продолжал работать. По ночам возникали
мучительные приступы удушья, ЧД 60 в 1 мин, сердцебиение, цианоз,
отеки стоп. Применялись ингаляция 02, сердечные препараты.
20.11.1962 г. доставлен в реанимационное отделение. Сопор, судо-
рожные подергивания мускулатуры туловища и бедер. Распространен-
ные фасцикуляции. Цианоз кожных покровов и слизистых оболочек.
Собственное дыхание поверхностное, осуществлялось вспомогатель-
ными мышцами шеи, участвовали мышцы лица и гортани, ЧД 40—50
в 1 мин. Дыхание при аускультации проводилось до II ребра. Тоны
сердца глухие, границы расширены, пульс 112 в 1 мин, аритмичен.
АД 160/100 мм рт. ст. Отеки голеней и стоп. Печень выступала из
подреберья на 2 см. Паралич диафрагмы и межреберных мышц. По
витальным показаниям была произведена операция трахеостомии и
начата эндотрахеальная ИВЛ, ЧД 20 в 1 мин, МОД 8—9 мин. К концу
вторых суток появилось ясное сознание. Постепенно исчезли призна-
ки сердечной недостаточности. В течение 2х/2 мес проводилась не-
прерывная ИВЛ, сначала аппаратом Энгстрема-150, затем аппаратом
Гульбера. Отключение от ИВЛ было возможно от 20—40 мин до 2—4 ч
в дневное время. В июле перенес паранефральный абсцесс, который
был вскрыт. Заживление произошло без осложнений, В течение 8 мес
от начала использования ИВЛ продолжалось медленное прогрессиро-
вание парезов лопаточной мускулатуры, ограничивалось отведение
рук в плечевых суставах, заметнее стала слабость мышц кистей, боль-
ше справа, появилась легкая слабость мышц живота при откашлива-
нии. Сухожильные рефлексы были высокие. Сохранялись кистевые
патологические рефлексы. Отмечалась легкая болезненность икро-
ножных мышц. При ходьбе использовал ручной дыхательный аппарат.
Спустя 11 мес после применения ИВЛ был выписан домой. Стереотип
предшествующей жизни сохранялся. Продолжал работать по 6—8 ч,
занимался теоретической физикой. Выпускал по 5—6 научных статей
в год, руководил аспирантами, научными сотрудниками, активно ин-
30
тересовался окружающими событиями, использовал дистанционное
управление ТВ, радио. В течение первых 2 лет пребывания в домаш-
них условиях мог передвигаться и выходить на прогулки продолжи-
тельностью до 1—2 ч, ИВЛ производилась ручным аппаратом АМБУ.
Без ИВЛ мог обходиться в туалете, гигиенической ванне. Угасание
двигательных функций прогрессировало: к концу 1-го года от начала
ИВЛ (спустя 27 мес от начала болезни) собственное дыхание стало
невозможным. Во время работы за письменным столом по 6—7 ч мог
удерживать голову. Сила и объем движений в мышцах шеи сохраня-
лись наиболее длительно. Снижение силы началось спустя 48 мес от
начала болезни. Ограничение движений пальцев кистей и резкое
снижение силы до 1—1,5 баллов происходило в течение 72 мес. К этому
сроку вынужден был укреплять карандаш от II к IV пальцу во время
письма. В проксимальных отделах рук угасание происходило в более
замедленном темпе: сохранялись движения в локтевых и лучезапяст-
ных суставах, в плечевых приведение и отведение со снятием силы
тяжести руки. Мышцы туловища и живота ослабели спустя 5 лет от
начала болезни. В течение первых 35 мес болезни больной мог пере-
двигаться, но в голеностопных суставах движения были ограничены
и сила снижена до 2 баллов. Примерно к 6-му году от начала болезни
появились глубокие тетрапарезы. Сохранилась ротация в тазобедрен-
ных суставах. Сухожильные рефлексы на руках были оживлены в
течение первых 60 мес болезни, затем стали низкими; коленные и
ахилловы рефлексы не вызывались. Патологических стопных рефлек-
сов не было. Функции глазодвигательных, мимических и жевательных
мышц были в полном объеме, но круговые мышцы глаз ослабели до
3 баллов. Оскаливание зубов сохранялось; показывал по 5 зубов с
каждой стороны. Глотание также сохранялось, однако удлинилось
время приема пищи. Ел полужидкую пищу, часто поперхивался, иног-
да происходила аспирация в трахею и возникала необходимость от-
сасывания ее содержимого. Уставал при жевании, появилась диза-
ртрия. Последние 8 мес жизни сила мышц лица снизилась, резко
усилилась фасцикуляция в мышцах языка. Из-за слабости его ораль-
ная фаза глотания оказалась особенно расстроенной, поэтому каждое
кормление затягивалось до 1 ч — 1 ч 30 мин. Поперхивание было
постоянным, но от кормления через назогастральный зонд воздержи-
вался. Речь была неразборчива: говорил на цикле вдоха аппарата ИВЛ
по 2—3 слова. В течение 84 мес движения мышц туловища угасли,
фактически был прикован к постели. Если его переносили, мог сидеть
только при фиксации туловища к спинке кресла, пытался писать,
прикрепляя карандаш к пальцам правой кисти и толчками передвигая
предплечье по плоскости. Проводилась разнообразная медикаментоз-
ная терапия. По мнению больного, некоторое увеличение силы паль-
цев отмечалось при использовании рибонуклеиновой кислоты, иногда
антихолинэстеразных препаратов.
Больной постоянно находился под наблюдением врачей реанима-
ционного отделения. Уход в дневное время осуществляли медицин-
ские сестры поликлиники, в ночное время — родственники больного.
29.10.1969 г. около 7 ч утра проснулся, чувствовал себя удовлетворитель-
но, разговаривал с женой, которая вышла из комнаты больного и,
возвратившись спустя 20 мин, обнаружила больного мертвым. Конне-
31
кторы, соединяющие трахеостомическую трубку с аппаратом ИВЛ,
случайно разъединились, так как движения в руках отсутствовали.
Патологоанатомический диагноз. Амиотрофический боковой
склероз. Атрофия спинного мозга с западанием переднероговых отде-
лов.
Состояние после 87 мес ИВЛ. Эмфизема легких. Умеренно выра-
женный атеросклероз. Мелкоочаговый кардиосклероз. Мелкоузлова-
тый цирроз печени. Дистрофия миокарда. Персистирующая вилочко-
вая железа.
Резюме. Предвестники болезни у 55-летнего больного
появились примерно за 1 год до явных симптомов АБС (по-
вышенная утомляемость, потеря массы тела, одышка, судороги
в мышцах). Локальная фаза состояла из выраженных призна-
ков ДН и продолжалась около 8 мес. Паралич диафрагмы и
нарастающий компенсированный газовый ацидоз наблюдались
в течение последних 2 мес локального периода. В реанимаци-
онное отделение доставлен в сопорозном состоянии. При по-
ступлении — тахипноэ, участие в дыхании вспомогательной
мускулатуры, респираторный ацидоз, гипоксемия. С этого вре-
мени в локальной фазе уже начата ИВЛ. В течение 36 мес
происходила начальная генерализация процесса, но больной
еще мог заниматься умственным трудом и ходить. Затем на-
ступил период развернутой генерализации, характеризующийся
углублением парезов до параличей, на протяжении 43 мес.
Сначала выключилась функция мышц рук, туловища, ног.
Затем появились парезы мимических мышц, дизартрия, дис-
фагия, дисфония, которые прогрессировали особенно интен-
сивно в последние 2—3 мес до конца жизни. Фактически в эти
сроки было необходимо кормление через назогастральный
зонд.
Больной скончался вследствие случайного разъединения с
аппаратом ИВЛ. Общая продолжительность болезни достигла
99 мес, включая период предвестников. ИВЛ проводилась в
течение 87 мес.
Наблюдение 3. Больной Т., 71 год, физик. Поступил в реанима-
ционное отделение 6.02.1968 г. с жалобами на резкую одышку, огра-
ничение движений в мышцах плечевого пояса, общую слабость.
До октября 1966 г. был здоров, активно занимался спортом, аль-
пинизмом, много путешествовал, участвовал в конгрессах. С октября
отметил непривычно быструю утомляемость. Пришлось отказаться от
спорта, поездок за границу. Систематически стала беспокоить одыш-
ка, которая расценивалась врачами как проявление эмфиземы и пнев-
москлероза, связанного с курением. С марта 1967 г. стало трудно
поднимать руки вверх. До сентября продолжал работать, лечился в
Кисловодске. К январю 1968 г. одышка резко увеличилась, спал
только сидя в кресле, часто пользовался ингаляцией 02. В покое ЧД
40 в 1 мин. Последнюю неделю из-за приступов удушья почти не спал.
32
В анамнезе с 1958 г. частые пневмонии. Курит с 14 лет. В 1964 г.
гнойный парапроктит. С тех пор свищ прямой кишки.
Неврологический статус. Функция двигательных черепных нервов
в пределах нормы. Нижнечелюстной рефлекс оживлен. Ограничение
движений, снижение силы и умеренно выраженная атрофия дельто-
видных, надостной, подостной и межкостных мышц. Сухожильные
рефлексы живые. Вызывались рефлексы орального автоматизма. На
ЭМГ были отмечены грубые нарушения функции мотонейронов шей-
ного и поясничного отделов спинного мозга. На рентгенограмме
остеохондроз шейного отдела позвоночника.
В реанимационное отделение пришел сам 6.02.1968 г. с выражен-
ными признаками ДН. Кожные покровы сероватого цвета, слизистые
синюшны. Возбужден, почти на каждом слове делает дополнительный
вдох. ЧД 42 в 1 мин. Дыхание осуществлялось вспомогательными
мышцами шеи, на выдохе участвовали мышцы живота. Дыхание пе-
риодически всхлипывающее. При аускультации дыхательные шумы
ослаблены, прослушиваются только в верхних отделах грудной клет-
ки. Тоны сердца приглушены. Пульс 98 в 1 мин, АД 110/70 мм рт. ст.
Живот умеренно вздут. Печень, селезенка не пальпируются. При
рентгеноскопии паралич диафрагмы. В положении сидя ЖЕЛ 1,2 л,
ЧД 42 в 1 мин, МОД 20 л/мин, НЬ02 90 %, РкС02 53,2 мм рт. ст.,
рН 7,39, BE —0,5 мэкв/л.
С согласия больного произведена трахеостомия и начата ИВЛ
аппаратом Энгстрема-150. МОД 12—14 л, ЧД 20—24 в 1 мин. В
течение 3 мес находился в стационаре. Хорошо адаптировался к
аппарату ИВЛ в условиях полной зависимости от него. 7.05.1968 г.
выписан домой. Аппараты ИВЛ использовались во время сна, в про-
цессе работы, при ходьбе.
В конце 23-го месяца от предвестников болезни появились при-
знаки начальной генерализации процесса: углубились парезы в про-
ксимальных отделах, резко выражены гипотрофии и фасцикуляции,
которые носили генерализованный характер. На кистях отмечались
мозаичные атрофии, более выраженные в межкостных и приводящих
большой палец мышцах. Коленные и ахилловы рефлексы высокие,
D=S, периостальные снижены, с двуглавой и трехглавой не вызыва-
лись. Выражены патологические кистевые рефлексы. В ногах сила
снижена диффузно, но с посторонней помощью хорошо передвигал-
ся, выезжал на дачу, совершал прогулки. На 3-м году болезни появи-
лось поперхивание, увеличилась слабость в ногах, туловище, хотя
движения в них были в полном объеме. Ослабели мышцы живота и
механизм кашлевого рефлекса. В последние 6 мес откашливаться не
мог.
При отсасывании было большое количество гнойной мокроты.
Продолжал вставать, работал за письменным столом, играл в шахма-
ты, читал. Функция ядер черепных нервов сохранена, несколько уве-
личилось поперхивание, но аспирации не было. Смерть наступила от
абсцедирующей пневмонии после 38 мес пребывания на ИВЛ. Общая
продолжительность болезни 53 мес.
Резюме. У больного Т. началом предвестников являлись
повышенная утомляемость и небольшая одышка, которые про-
должались около 6 мес. В течение последующих 9 мес одышка
33
прогрессировала, появились легкая слабость и ограничение
движений в плечевых суставах. К 15-му месяцу от начала
болезни наступила локальная фаза — параличи диафрагмы, и
была необходима эндотрахеальная ИВЛ. Начальная генерали-
зация процесса продолжалась свыше 20 мес, увеличивалась
слабость в руках, ослабели мышцы живота. Выраженная сте-
пень развернутой генерализации наблюдалась около 10 мес,
тетрапарез, поперхивание при глотании, рефлексы орального
автоматизма, кистевые патологические рефлексы, стали угасать
рефлексы на руках. В соматическом статусе отмечались при-
знаки вялотекущей абсцедирующей пневмонии. ИВЛ продол-
жалась 38 лет. Смерть наступила от абсцедирующей пневмонии
спустя 53 мес от начала предвестников болезни.
Шейно-грудная форма АБС
Наблюдение 4. Больной П., 27 лет, инженер, житель г. Новоси-
бирска. Поступил в реанимационное отделение 15.05.1964 г. с жало-
бами на слабость в руках и ногах, распространенные подергивания
мышц, затруднения при глотании, дыхании, речи. Первые признаки
болезни появились в 18-летнем возрасте в виде жжения в межлопа-
точной области и утомляемости левой руки, замеченной при занятиях
боксом. Спустя год присоединилось похудание мелких мышц левой
кисти. Сила справа 42 кг, слева 32 кг. В 1958—1959 гг. стало трудно
выполнять тонкие движения пальцами левой кисти: застегивать пуго-
вицы, чистить овощи, брать гири. Вскоре присоединилось похудание
мышц левой руки. При этом сохранял обычную активность: продол-
жал занятия спортом, но в облегченном варианте, учился в институте.
К 1960 г. глубокий парез мышц левой кисти, предплечья слева,
диффузная гипотрофия и слабость мышц правого плеча, генерализо-
ванные мышечные подергивания в разных частях мускулатуры тела и
конечностей. В июле 1961 г. впервые госпитализирован. Предполага-
лась прогредиентная форма клещевого энцефалита — синдром АБС.
Дважды был получен отрицательный результат крови на антитела к
вирусам клещевых энцефалитов. Реакция связывания комплемента
диагностически незначима. Однако проводилось лечение вакциной
против клещевого энцефалита. Эпидемиологическое подтверждение
не установлено: в тайге не был, клещей с себя не снимал. В течение
3 лет вел активный образ жизни и энергично лечился: ездил на
курорт, принимал сероводородные ванны, окончил институт и до
конца 1962 г. работал инженером. К январю 1963 г. к параличу мышц
левой руки присоединился парез правой, наросла диффузная гипо-
трофия рук. Появились гипотрофия левого бедра, слабость мышц
голени, при ходьбе степпаж. Стало трудно вставать. Фасцикуляции
охватили мышцы языка, шеи, груди, живота, ноги. Сухожильные и
периостальные рефлексы на руках слева отсутствовали, справа ожив-
лены. Коленные и ахилловы рефлексы живые. Патологических реф-
лексов не было.
Спустя 8 лет от начала болезни произошло бурное прогрессиро-
34
вание парезов всех групп мышц, включая туловище, в связи с чем
дважды был госпитализирован в Институт неврологии. С мая по
октябрь 1964 г. наблюдалось стремительное прогрессирование:
мышцы левой руки парализованы, в правой — слабые движения во
всех суставах, незначительное шевеление пальцев кисти, повышен
тонус сгибателей голени, больше справа. В тазобедренных и коленных
суставах слабые движения при снятии силы тяжести; в голеностопных
суставах ограничены, больше слева; движения пальцев левой стопы
отсутствовали, поворачивался в постели самостоятельно, садился с
посторонней помощью. Сильно беспокоили фасцикуляции. Быстро
нарастали бульбарные расстройства: мышцы языка стали атрофичны-
ми, подвижность ограничена, речь невнятная, поперхивался при гло-
тании, подвижность мягкого неба ограничена; рефлексы глоточный и
с мягкого неба живые. Все движения мимических мышц были сохра-
нены: при оскаливании показывал по 6 зубов, ослаблены свист и
надувание щек. Приподнять голову от подушки не мог. Функции
глазодвигательных и жевательных мышц нормальные. Вызывались все
рефлексы орального автоматизма. Сухожильные рефлексы и карпора-
диальный рефлекс слева отсутствовали, справа оживлены, коленные
с расширенной зоны. S>D. Брюшные отсутствовали, кистевые пато-
логические рефлексы, симптомы Бабинского и Росоолимо с обеих
сторон. При небольших физических нагрузках появилась одышка.
К концу августа 1964 г. выражены расстройства глотания: в ротоглотке
большое скопление слизи, дизартрия, дисфагия, вялая тетраплегия,
паралич мышц живота. Появилась одышка в покое с участием вспо-
могательной дыхательной мускулатуры. Стал просыпаться от чувства
удушья, жара, сердцебиения. Появился страх смерти, "боялся уснуть
и задохнуться". Слюна, скапливающаяся в полости рта, особенно
затрудняла дыхание, так как откашливание стало невозможным, от-
сасывание приносило облегчение на короткий срок, глотал только
жидкую пищу в незначительном объеме. В последние 2 нед ноября
перестал спать, приступы удушья стали появляться через короткие
интервалы, боялся умереть от асфиксии, требовал ИВЛ. Собственное
дыхание в покое 32 в 1 мин осуществлялось вспомогательной муску-
латурой и мимическими мышцами. Дыхание прослушивалось до III
ребра спереди. ЖЕЛ уравнялось с ДО, АД 120/80 мм рт. ст., пульс 120
в 1 мин, НЬ02 95 %, РкС02 68 мм рт. ст. Таким образом, спустя 100
мес с момента появления первых признаков болезни развились угро-
жающие жизни симптомы, и смерть больного к этому сроку была
неминуема. Больной был осведомлен о неизвестной этиологии болез-
ни, отсутствии эффективных средств лечения, но упорно настаивал
на применении ИВЛ, которая была начата 2.11.1964 г. С этого вре-
мени производилось кормление через назогастральный зонд. Больной
прожил в условиях непрерывной ИВЛ 172 мес. Прогрессирование
продолжалось: в первые 4 мес от начала ИВЛ исчезли те минимальные
движения, которые еще отмечались в правой руке и мышцах тулови-
ща. Наступила вялая тетраплегия, мышечные фасцикуляции были
особенно выражены в больших грудных мышцах и мускулатуре бедер.
Движения языка угасали на протяжении 3 лет от начала фасцикуля-
ции и признаков гипотрофии. Тонус языка повышен, что проявлялось
штыкообразным подтягиванием его вверх и обнажением подъязычной
области. На 48-м месяце пребывания на ИВЛ форма языка измени-
35
Рис. 2. Наблюдение 4, больной П. Отвисание нижней челюсти, вы-
падение языка. Движения глаз, внимание взгляда сохранены.
лась: мускулатура почти исчезла, язык стал тонким, лепесткообраз-
ным и выпадал из полости рта (рис.2), чему в значительной степени
способствовали парезы жевательных мышц, отвисание нижней челюс-
ти. Функция глотания стала расстраиваться спустя 60 мес от начала
болезни, и в конце 100-го месяца было необходимо кормление через
назогастральный зонд. Угасание функции мимических мышц нача-
лось со слабости щечных мышц, в течение 48 мес исчезли движения
круговых мышц рта, глаз, а затем мышц лба. Спустя 68 мес мимичес-
кие мышцы были неподвижны, лагофтальм стал постоянным. Фасци-
куляции в почти неподвижных мимических мышцах продолжались
около года. Длительная сохранность функции жевательных мышц
отмечена около 80-го месяца от начала ИВЛ, что облегчало связь с
больным с помощью сигнального устройства, установленного между
зубами. Слабый нажим на него при смыкании челюстей был доста-
точен для громкого звука, вызывавшего персонал. После развития па-
ралича жевательных мышц нижняя челюсть стала отвисать, и связь с
больным сюуществлялась только движениями глаз. Сохраняющиеся дви-
жения глаз и мигание век позволяли общаться с больным по азбуке,
находившейся перед его глазами. Эти движения не угасали до смерти.
Отмечалось легкое отставание правого глаза при конвергенции на 192-м
месяце от первых признаков болезни, а на 252-м месяце — легкое огра-
ничение при отведении глазных яблок кнаружи, а также замедление
ответа на просьбу сомкнуть глаза. В течение последних 96 мес отмеча-
лось полное прекращение всех функций нижнего нейрона, кроме дви-
жения глаз (см. рис. 2). Неврологическая симптоматика соответствовала
синдрому деэфферентациц, или тотальному параличу (рис. 3).
Интеллектуальные функции сохранялись в течение всей болезни.
Движения глаз, мигание век допускали общение по азбуке и выпол-
36
Рис. 3. Наблюдение 4, больной П. Тотальный паралич.
нение разных просьб. Сохраняя интерес к общественной жизни, еже-
дневно смотрел ТВ, никогда не пропускал спортивных передач. Всегда
был коммуникабелен, доброжелателен, уравновешен и терпелив, по-
стоянно надеялся на выздоровление. С помощью медицинских сестер
составил коллекцию марок для своего родственника. Питание осу-
ществлялось через зонд, который ежедневно в соответствии с жела-
нием вводили через нос в желудок от 3 до 5 раз в сутки. В зависимости
от консистенции питательных кашиц использовались 2 размера зонда
(наружный диаметр 5 и 10 мм). Суточный калораж 2500 ккал. Кишеч-
ник очищали с помощью клизм, а также механически. Мочеиспуска-
ние полностью контролировал. Суточный диурез колебался от 2500
до 2000 мл. Функции сфинктеров сохранялись. Систематически при-
нимал общие ванны, во время которых ИВЛ поддерживалась ручным
аппаратом (АМБУ). Ежедневно производились общий массаж и пас-
сивные движения конечностей. Масса тела в 1-й год увеличилась с
55 до 59 кг, а затем до конца жизни была равна 50—49,5 кг.
Сердечно-сосудистая система. На протяжении многолетней ИВЛ
сохранялись устойчивые показатели: АД колебалось в пределах
110/60—130/80 мм рт. ст. На ЭКГ отмечалось отклонение электричес-
кой оси влево. Периодически наблюдалась синусовая тахикардия.
Недостаточность питания миокарда в различных участках и умерен-
ная перегрузка правого предсердия.
Спустя 3 года от начала ИВЛ стали появляться трофические на-
рушения кожи: сухость, атрофия ее, отслойка эпидермиса. По пери-
ферии волосяных луковиц, преимущественно на туловище, отмеча-
лась гиперемия в виде ореола. Явления дерматита устранялись кор-
тикостероидными мазями и УФО. Кожа шеи, надплечий была
красной в форме воротника синюшной окраски. Лицо округлилось,
имело цветущий вид. Гормоны больной никогда не получал. Кожа
37
волосистой части головы вместе с апоневрозом в затылочной области,
на границе с теменной, сдвинулась в виде кругового вала. По боковой
поверхности грудной клетки подкожная жировая клетчатка сформи-
ровалась в виде двух параллельных пластов. Отмечался распростра-
ненный остеопороз костей конечностей, позвонков, тазовых костей.
Постепенно расшатывались все зубы, появились гингивит, парадон-
тоз, достигшие наибольшей степени на 120-м месяце продлеішой
жизни. Изредка наблюдались поверхностные трофические язвы, ис-
тончение кожи, синюшность на пятках и на крестце.
Смерть наступила 06.10.1978 г. при явлениях "спонтанной" гипо-
термии. В связи с ремонтом помещения окружающая температура
снижалась до 14 °С. Возможно, это обстоятельство и было причиной
смерти.
Патологоанатомический диагноз. АБС. Замещение скелетных
мышц жировой и фиброзной тканью. Атрофия спинного мозга.
Камни в лоханках и мочевом пузыре, хронический трахеобронхит.
Состояние после трахеостомии и длительной ИВЛ: трахеостома с
рубцами в стенке трахеи.
Резюме. Заболевание началось в возрасте 18 лет. Предвестники
болезни продолжались около 16 мес в виде жжения в межлопаточной
области, неловкости и утомляемости. В последующие 36 мес разви-
валась локальная мышечная слабость в руках при асимметричном и
мозаичном выпадении двигательных функций, сначала мелких мышц
кисти с гипотрофиями, а затем и проксимальной мускулатуры рук,
отмечались болезненные судороги в ногах. Все эти четко определив-
шиеся чрезвычайно медленно прогрессирующие двигательные нару-
шения мало отражались на жизненном стереотипе: больной предпри-
нимал интенсивные попытки разнообразного медикаментозного ле-
чения, а также реабилитационных воздействий на прогрессирующий
двигательный дефицит. На 50-м месяце болезни стала прослеживаться
начальная генерализация: в тех мышцах, где были парезы, сформи-
ровались параличи, а затем на протяжении 48 мес произошло вовле-
чение Почти всех двигательных систем мышц рук, ног и туловища до
глубокого тетрапареза. Спустя 100 мес от начала болезни, в период
развернутой генерализации, в различной степени выключались все
двигательные функции, в том числе дыхательная мускулатура. ДН с
признаками гиперкапнии и гипоксии завершила естественное течение
болезни. Применение ИВЛ и остальных методов отодвинули срок
смерти почти на 172 мес. Из них в течение первых 84 мес ИВЛ
продолжалось ослабление функции мотонейронов ядер черепных нер-
вов. Сохранялась восходящая последовательность развития парезов и
параличей мускулатуры; после дизартрии, дисфагии, дисфонии посте-
пенно угасали движения мимических мышц. Последней прекратилась
функция жевательной мускулатуры. Движения глаз были сохранены.
Общая продолжительность болезни достигла 272 мес. Основной осо-
бенностью было исключительно медленное нарастание двигательных
расстройств в течение первых 72 мес болезни. Ускорение их наступи-
ло на 84-м месяце, и в течение 16 мес развилась тетраплегия, насту-
пило критическое состояние, обусловленное ДН с прогрессирующими
бульбарными расстройствами. ИВЛ была начата спустя 100 мес от
начала болезни, затем в последующие 76 мес произошло полное
38
прекращение всех двигательных функций, кроме глазодвигательных.
Наступил синдром двигательной деэфферентации, или тотальный па-
ралич, наблюдавшийся в течение 96 мес при полной сохранности
чувствительной сферы, функции глазодвигателей и интеллектуальной
полноценности. ИВЛ продлила жизнь больною на 172 мес. Общая
продолжительность болезни достигла 272 мес.
Наблюдение 5. Больной 3., 56 лет, инженер. Поступил в реанима-
ционное отделение 2.04.1962 г. с жалобами на приступообразную
одышку, ограничение движений в руках и ногах.
Заболевание началось в январе 1961 г. В течение 2 мес беспокоили
боли в левом плече. В марте ослабела левая, а спустя 2 мес и правая
рука, с марта стало трудно ходить, изменился голос. В неврологичес-
ком статусе сглаженность левой носогубной складки, глухой голос,
легкая гипотрофия левой половины языка, активные движения в
обоих плечевых суставах ограничены, сила рук снижена больше слева.
Невозможно противопоставление I и V пальцев левой кисти. В ногах
сила была слегка снижена, больше в голеностопных суставах, но
передвигался без особых затруднений. Тонус мышц рук снижен, ног
слегка повышен. Фасцикуляции мышц туловища и конечностей. Су-
хожильные рефлексы на руках D=S. Коленные и ахилловы рефлексы
высокие с расширенной зоны D=S. Брюшные рефлексы живые,
симптомы Россолимо и Бабинского слева. Выражены рефлексы
орального автоматизма. Все виды чувствительности сохранены. Коор-
динаторные пробы вьшолнял удовлетворительно. В течение 3 мес
заболевание прогрессировало: фасцикуляции распространились на
мышцы шеи, лица. Двусторонние симптомы Бабинского и Россоли-
мо. В спинномозговой жидкости белок 0,33 г/л, цитоз 3 в 1 мл.
Производилось многократное эндолюмбальное введение витамина В12
по 200 мкг. Лечение переносил плохо: менингеальные явления, го-
ловные боли, повышение температуры. На протяжении последующих
5 мес находился дома. Прогрессирование неуклоннно продолжалось:
стал плохо ходить, поперхивался при глотании, лучше глотал жидкую
пищу. Временами стало возникать чувство острой нехватки воздуха.
При повторной госпитализации отмечались слабость мимических
мышц, гнусавость, стал поперхиваться почти при каждом глотке,
питание растягивалось до 1 ч. При ларингоскопии подвижность чер-
паловидных хрящей ограничена. Голос глухой, трудно сделать глубо-
кий вдох, язык дряблый, маргинальное западание его слева при вы-
совывании по средней линии. Сохранялись слабые движения пальцев
рук. Спастический парапарез ног. Атрофия мышц плечевого пояса,
распространенные фасцикуляции. Периостальные и сухожильные
рефлексы на руках низкие, коленные и ахилловы рефлексы высокие.
Симптом Бабинского с двух сторон. Все виды чувствительности были
сохранены. Функция сфинктеров оставалась нормальной. Передви-
гался с посторонней помощью. Спустя 10 мес от начала болезни
спонтанно, а также при малейшем раздражении задней стенки глотки
стали возникать приступы стридорозного дыхания. На вдохе и на
выдохе появлялся высокий дрожащий звук, яремная ямка втягива-
лась, платизма напрягалась, отмечены движения гортани и вспомога-
тельной дыхательной мускулатуры. Приступы удушья, продолжавшие-
ся от 30 мин до 1 ч, сопровождались цианозом, тахикардией, страхом
39
Рис. 4. Наблюдение 5, больной 3. Параличи мышц рук, движения ног
сохранены. Шейно-грудная форма.
смерти. Частота дыхания 28—32 в 1 мин. При рентгеноскопии грудной
клетки патологических теней нет. Экскурсия диафрагмы в пределах
2 см. В этот период функция глазодвигателей, жевание, мимика
сохранялись. Мягкое небо при фонации сокращалось удовлетвори-
тельно. Были поперхивание при глотании, легкая гипотрофия языка,
но высовывал его в полном объеме и по средней линии. Легкая
дизартрия. Рефлексьї с нижней челюсти, глоточный и с мягкого неба
оживлены. Появился глубокий парез рук, в плечевых суставах имелось
лишь слабое приведение мышц к туловищу. Ограничены движения в
локтевых и лучезапястных суставах, средних и ногтевых фалангах
пальцев. Все движения ног сохранены (рис. 4). Спастичность была
наиболее выражена в разгибателях голени. Садился с посторонней
помощью, не ходил. Сухожильные рефлексы высокие, коленные с
расширенной зоны. Симптомы Россолимо на ногах и его кистевые
аналоги. Резко выражены рефлексы орального автоматизма. Брюш-
ные снижены, расстройств чувствительности и сфинктеров не было.
Приступы стридорозного дыхания стали повторяться несколько раз в
сутки. В один из таких приступов в состоянии, близком к асфиксии,
был доставлен в реанимационное отделение. По витальным Показа-
ниям произведена трахеостомия (2.04.1962 г.). После этого собствен-
ное дыхание стало свободным, 20—22 в 1 мин, ЖЕЛ 1800 мл (50 %
ДЖЕІІ). Приступов не было в течение 2 мес. Глотание и движения
языка были сохранены (рис. 5). Затем ЖЕЛ постепенно снижалась до
30 % ДЖЕЛ. Периодически наступало учащение дыхания до 40 в 1 мин.
ИВЛ стала необходима на срок от 40 мин до 2 ч в дневное время и
постоянно ночью. Глотание затруднилось, по словам больного, из-за
ощущения спазмов глотки, усилились фасцикуляции во всех мышцах.
Парезы диафрагмы нарастали, ЖЕЛ снизилась до 600 мл, а затем
40
Рис. 5. Наблюдение 5, больной 3. После трахеостомии функция че-
репных ядер сохранена. Маргинальная гипотрофия языка, высовыва-
ние его в полном объеме.
уравнялась с ДО; спустя 6 мес после трахеостомы стала необходима
круглосуточная ИВЛ. Появились почти симметричные парезы мими-
ческих и жевательных мышц (рот открывал на 1 см), были выражены
дизартрия и дисфагия. Исчезли движения рук, шеи (рис. 6). При снятии
силы тяжести — слабый намек на движения в коленном и тазобедрен-
ных суставах. Отмечались ограничение движений пальцев левой
стопы, повышение тонуса в разгибателях предплечья., приводящих
мышцах плеча, разгибателях голени и стопы. Сохранялись высокие
ахилловы, коленные рефлексы с расширенной зоной. Рефлексы с рук
угасли, были выражены рефлексы орального автоматизма, появился
клонус надколенной чашки. Брюшные поверхностные и глубокие
рефлексы вызывались. Нервные стволы и мышцы были безболезнен-
ными. В анализах крови умеренно выраженный лейкоцитоз, СОЭ
12 мм/ч, в газовом составе крови НЬ02 96 %, РкС02 23,8 мм рт. ст.
В последующие 3 мес развилась атрофия мускулатуры туловища и
конечностей. Отключение от аппарата стало возможно только на
несколько минут. Периодически отмечались гиповентиляция отдель-
ных легочных долей, сердечная слабость, артериальная гипотензия,
тахикардия. 10.06.1963 г. больной умер.
Патологоанатомический диагноз. Атрофия извилин полушарий го-
ловного и спинного мозга. Атрофия дыхательной и скелетной муску-
латуры. Трахеостомия. Ателектаз нижних долей легких. Подострая
41
Рис. 6. Наблюдение 5, больной 3. Развернутая генерализация парали-
чей. ИВЛ постоянно.
гиперплазия селезенки. Умеренный коронарокардиосклероз. Дегене-
рация паренхиматозных органов. Истощение. Гипертрофия предста-
тельной железы.
Резюме. У больного 3., 56 лет, предвестниками были
боли в левом плече, продолжавшиеся около 2 мес. Локальная
фаза проявлялась парезами сначала левой, а затем и правой
руки, нараставшими около 6 мес. Начальная генерализация
характеризовалась углублением парезов обеих рук, распростра-
ненными фасцикуляциями, признаками поражения корково-
спинномозговых и корково-ядерных путей. Особенностью те-
чения в этом периоде было возникновение бульбарных рас-
стройств: приступообразный спазм голосовых связок со
стридорозным дыханием и асфиксическим симптомокомплек-
сом. В один из таких приступов трахеостомия, сделанная по
витальным показаниям, восстановила свободное дыхание. ИВЛ
не требовалась. Больной еще мог с посторонней помощью
менять положение в постели, садиться. В фазе развернутой
генерализации, которая наступила спустя 16 мрс от начала
болезни, наблюдались паралич мышц обеих рук, глубокие па-
резы мышц туловища и ног.
ЖЕЛ снизилась до 20—30 % ДЖЕЛ, сформировался ГФЛП.
Потребовались постоянная ИВЛ, кормление через назога-
стральный зонд. ИВЛ продолжалась 15 мес. Общая продолжи-
тельность болезни достигла 29 мес. Смерть наступила от рас-
пространенных ателектазов и сердечной слабости.
42
Поясничная форма АБС
У всех 7 больных, имевших первоначальную поясничную
локализацию, обнаруживались сначала асимметричные парезы
мышц ног, распространенные фасцикуляции и судороги в
мышцах голени и бедер, а затем восходящее, прогрессирующее
развитие болезни. Заболевания АБС с подобным течением
были отнесены Н.В.Коноваловым в ряде совместных работ
(1962, 1964) к подострому переднему полиомиелиту. В 40—50-е
годы такой диагноз был распространенным.
Подострый полиомиелит в тот период рассматривался как
"полиомиелитическая" или "псевдополиневритическая" форма
АБС. Концепция эта основывалась на полном сходстве пато-
морфологических изменений "подострого полиомиелита" и
"полиомиелитической" формы АБС. Н.В.Коновалов с соавт.
(1962) одним из главных отличий "подострого полиомиелита"
от АБС считали наличие цитоплазматических включений в
мотонейронах переднего рога спинного мозга и обозначили
описанную форму как "мотоневраксит с цитоплазматическими
включениями и ретроградным перерождением двигательных
путей". Как уже частично упоминалось в первой главе, Н.В.Ко-
новалов (1964) допускал вирусное происхождение мотоневрак-
сита, но относить его к "полиомиелитической" форме АБС
считалось возможным только в том случае, если будет доказано
вирусное происхождение АБС. Прошло свыше 30 лет, но до-
казательств вирусного происхождения АБС так и не получено.
Клинические и морфологические проявления АБС и так на-
зываемого подострого полиомиелита одинаковы.
Наблюдение 6. Больной И., 42 лет, служащий. Поступил 19.07.1956 г.
с жалобами на ограничение движений в ногах, слабость в руках, боли
в правой половине грудной клетки.
Считает себя больным с ноября 1955 г. В течение 2 мес беспокои-
ли болезненные судороги в икроножных мышцах, затем появилась
постоянная боль в левой икроножной мышце, стал прихрамывать на
левую ногу. Хирургом был поставлен диагноз сначала тромбофлебита,
а затем радикулита. Левая нога ослабела, появились атрофии голени
и бедра. Предполагалась опухоль конского хвоста. Был госпитализи-
рован в нейрохирургическое отделение.
Черепно-мозговая иннервация без особенностей. Движения рук
сохранились в полном объеме, сила их достаточная. Имелись слабые
движения в коленном суставе и пальцах левой ноги. В правом тазо-
бедренном суставе движения были ограничены. Гипотония мышц ног.
Сухожильные рефлексы на руках D=S. Коленные и ахилловы рефлек-
сы отсутствовали. Патологических рефлексов не было. В спинномоз-
говой жидкости: белок 0,49 г/л, реакции Панди, Нонне—Апельта —
положительные.
В течение 1,5—2 мес все более слабели мышцы ног, появились
слабость левой руки, распространенные фасцикуляции. Больной мог
43
передвигаться с помощью костылей, спустя месяц был прикован к
постели, а еще через 2 мес ослабела правая рука.
Спустя 8 мес от начала болезни функция черепных нервов сохра-
нялась. В руках сила диффузно снижена, ограничены движения в
плечевых суставах, больше слева, слабость мышц кисти. Паралич
мышц левой ноги, парез правой. Диффузное похудание мышц обеих
ног, глубокий парез мышц брюшного пресса. Самостоятельно не
поворачивался. Отмечались онемение и болезненные судороги в ногах
и руках. Нервные стволы на руках и ногах болезненны. Сухожильные
рефлексы с двуглавой мышцы и карпорадиальной D>S, с трехглавой
равномерны. Коленные рефлексы справа низкие, слева не вызыва-
лись, ахилловы рефлексы отсутствовали. На 10-м месяце от начала
болезни перенес правостороннюю плевропневмонию. С этого време-
ни постоянно тахипноэ до 32—40 в 1 мин с участием вспомогательных
мышц шеи. Пульс 120 в 1 мин, АД 110/80 мм рт. ст. Проводилась
непрерывная ИВЛ кирасовым респиратором. Во время ИВЛ был
периодически несинхронен, испытывал недостаток воздуха, не мог
откашливать мокроту. В течение 2 мес происходило быстрое прогрес-
сирование парезов: появились глубокий вялый парез мышц обеих рук,
паралич мышц ног. Рефлексы на руках стали низкими, D>S. Колен-
ные и ахилловы рефлексы не вызывались. Гипотрофия мышц ног.
При рентгеноскопии отмечен глубокий парез диафрагмы, экскурсия
ее в пределах 2 см. С 20.09.1956 г. в течение месяца наблюдались
скопление мокроты, одышка, ателектаз левого легкого, приступы сер-
дечной слабости. Собственное дыхание не синхронизировалось с ап-
паратом: выявилась неадекватная ИВЛ нательным респиратором.
ИВЛ проводилась 48 дней. 18.10.1956 г. больной умер.
Патологоанатомический диагноз. АБС. Жидкое состояние крови,
переполнение кровью правой половины сердца, венозное полнокро-
вие внутренних органов. Ателектаз правого легкого. Паренхиматозная
дистрофия внутренних органов.
Резюме. У больного И., 42 лет, первыми симптомами
были болезненные судороги в икроножных мышцах, повышен-
ная утомляемость. Судороги и фасцикуляции продолжались
около 2 мес. Период локальной слабости мышц левой ноги
наблюдался 2 мес. Начальная генерализация проявилась пара-
личом мышц левой ноги, глубоким парезом мышц правой ноги
и левой руки, фасцикуляциями в мышцах всего тела. В течение
последующих 4 мес происходила развернутая генерализация:
парезы мышц обеих рук, больше слева, параличи мышц ног.
Функция черепных нервов оставалась нормальной. Вследствие
глубоких парезов мышц туловища, особенно живота, нарушил-
ся механизм кашлевого рефлекса, наблюдалось скопление мок-
роты. Применявшийся кирасовый респиратор не создавал аде-
кватной ИВЛ. Больной умер. Продолжительность ИВЛ соста-
вила 1,5 мес. Общая продолжительность болезни 12 мес.
Наблюдение 7. Больная Т., 27 лет, колхозница. Поступила в реа-
нимационное отделение 8.04.1959 г. с жалобами на слабость в ногах.
Заболевание началось смая 1957 г. в возрасте 25 лет с распростра-
44
ненных фасцикуляций, тянущих болей в икроножных мышцах и
утомляемости ног. Продолжала работать в колхозе, выполняла боль-
шую физическую работу и в этот же период кормила грудного ребен-
ка. Спустя 5 мес стала слабеть левая нога. При подъеме тяжестей не
могла стоять на ногах, появились боли в руках, но сила в них и в
туловище была достаточной. В сентябре — октябре стало трудно ходить,
но работу в колхозе не прекращала. В ноябре 1957 г. впервые обратилась
к врачу. Опираясь на палку, могла пройти около 5 км до районной
больницы. Свыше 3 мес лежала в больнице. Отмечались ломящие
боли в руках и мышцах туловища, слабость в ногах резко возросла до
глубоких парезов. Спустя 14 мес от начала заболевания уже не могла
ходить, резко ослабели мышцы спины и живота, стало трудно пово-
рачиваться и садиться, кашель стал слабым, беззвучным. Еще через
2 мес ослабели руки, особенно правая. Спустя 1 год 6 мес перенесла
двустороннюю пневмонию. Наследственность не отягощена.
Госпитализирована спустя почти 2 года от начала болезни. При
поступлении функции черепных нервов без особенностей. Все дви-
жения левой руки сохранились в полном объеме. Сила в мышцах
плеча и предплечья была слегка снижена. Все движения правой руки
резко ограничены, особенно в плечевом суставе. Сила мышц отсут-
ствовала. Сгибательная контрактура III, IV, V пальцев, сжать пальцы
в кулак не могла. Диффузная гипотрофия мышц туловища и конеч-
ностей. Паралич мышц живота, спины, обеих ног.
Сухожильные рефлексы на руках слева вызывались, справа были
снижены. Ахилловы, коленные, брюшные и подошвенные рефлексы
отсутствовали. Расстройств чувствительности не было. Симптом Ла-
сега с двух сторон и небольшая болезненность мышц и нервных
стволов на ногах.
Анализ спинномозговой жидкости: белок 0,26 г/л, цитоз У3, Ре"
акция Панди слабоположительная. PW в крови и ликворе отрицатель-
ная. Спустя 18 мес от начала болезни систематически испытывала
приступы удушья, особенно ночью. Дыхание стало поверхностным,
ЧД 28—30 в 1 мин, ЖЕЛ=ДО. Спустя 1 год 11 мес от начала болезни
доставлена в реанимационное отделение. Начата ИВЛ в железных
легких. Без ИВЛ могла дышать не более 2 ч в сутки. При рентгено-
графическом обследовании купола диафрагмы были неподвижны.
Правый расположен на уровне III ребра, левый — на IV ребре. Легоч-
ные поля прозрачны. Парезы мышц углублялись. Фасцикуляций охва-
тили мышцы лица, языка и в резкой степени туловища и конечностей.
Испытывала утомление при жевании твердой пищи; глотание, речь были
сохранены. ИВЛ продолжалась в железных легких 3 мес, но больная
испытывала нехватку воздуха. Спустя 24 мес от начала болезни про-
изводилась эндотрахеальная ИВЛ аппаратом Энгстрема-150. Через
месяц стала поперхиваться, речь сохранялась. Сильно беспокоили
распространенные фасцикуляций. Паралич обеих ног, правой руки,
диафрагмы, глубокие парезы мышц левой руки, живота, спины.
На 28-м месяце от начала болезни произошло диффузное артери-
альное кровотечение из плечеголовной артерии. Наступила смерть.
Патологоанатомический диагноз. АБС. Атрофия спинного мозга.
Атрофия скелетных мышц, диафрагмы, межреберных мышц. Трахе-
остомия в нижней трети трахеи. Затек крови в верхние дыхательные
пути. Жидкая кровь в полости желудка.
45
Резюме. У больной Т., 27 лет, около 5 мес наблюдались
предвестники болезни в виде распространенных фасцикуляций
и тянущих болей в икроножных мышцах. Затем в течение 6 мес
постоянно отмечалась локальная утомляемость ног, сначала
левой, а затем и правой. Начальная генерализация продолжа-
лась 7 мес, развились глубокие парезы мышц обеих ног, осла-
бели руки, особенно правая. В периоде развернутой генерали-
зации развились паралич мышц обеих ног, диафрагмы, правой
руки и глубокий парез мышц левой. Функция черепных нервов
сохранялась. ИВЛ применялась 4 мес, сначала в железных
легких, а затем 1 мес аппаратом Энгстрема-150. Больная по-
гибла от фатального кровотечения из трахеоваскулярной фис-
тулы плечеголовной артерии.
Наблюдение 8. Больной Е., 39 лет. Поступил в реанимационное
отделение 16.11.1957 г., врач-невролог. При поступлении жалобы на
затруднение дыхания, отсутствие движений ног и ограничение дви-
жений рук.
Анамнез. До весны 1956 г. был здоров. Наследственность без
патологии: отец, мать, 2 брата, сестра здоровы, имеет 2 здоровых
детей. В течение 2 мес весны 1956 г. появились потливость, утомля-
емость при ходьбе. В июне заметил отвисание левой стопы. Ахиллов
рефлекс не вызывался, коленный снижен. В течение 3 мес слабость
быстро нарастала. Мышцы левой ноги атрофичны. Фасцикуляций
отмечались только в этой области, затем распространились на осталь-
ные мышцы туловища, ног и лица. Больной продолжал работать; был
главным врачом больницы, много ходил пешком. Интенсивно лечил-
ся амбулаторно витаминами, ионофорезом, торфяными аппликация-
ми, массажем. Спустя 6 мес от начала болезни слабость распростра-
нилась на правую стопу, стало трудно ходить и стоять. Характер
фасцикуляций изменился: они стали мелкими и непрерывными и
вызывали неприятные ощущения "жующихся" мышц. К концу 2-го
года мышцы ног парализованы, стали ослабевать руки.
Неврологический статус. Функция черепных нервов сохранена,
слегка оживлен рефлекс с нижней челюсти. Глубокий парез прокси-
мальных отделов мышц обеих рук. В лучезапястных суставах полный
объем движений, сила снижена. Ограничено разгибание IV и V паль-
цев, атрофия мелких мышц кисти, "когтистая лапа". Сила пальцев
кистей снижена. Движения туловища, кроме легкого разгибания
мышц спины, отсутствовали. Мышцы живота дряблые и при кашле
не напрягались. Движения ног отсутствовали. Диффузная атрофия
мышц туловища, обеих ног. Периостальные рефлексы и с трехглавых
мышц оживлены, с двуглавой слева отсутствовали, справа низкий.
Коленные и ахилловы рефлексы отсутствовали. Больной еще пере-
двигался с помощью костылей до августа 1957 г., затем из-за слабости
мышц рук не мог пользоваться костылями. Почти постоянно нахо-
дился на стационарном лечении, где проводилось интенсивное лече-
ние разнообразными препаратами, физиотерапией, гормонами, пере-
ливаниями крови, гипербарической оксигенацией. Спустя 11 мес от
начала болезни появилась одышка. Положение вынужденное. Посто-
46
янно сидел, опираясь руками на бедра. Засыпал на короткие сроки,
пробуждался от приступов удушья, испытывал страх и свинцовую
тяжесть в голове. Дыхание было поверхностное, с участием мышц шеи
и слабым движением верхних отделов грудной клетки. Частота дыха-
ния 44 в 1 мин. Эпигастральная область на высоте вдоха втягивалась.
ЖЕЛ 600 мл. Кожные покровы бледные. Отеки на ногах до верхней
трети голени. В легких укорочение перкуторного звука справа от
нижнего угла лопатки. Дыхание ослаблено, справа крепитирующие
хрипы. Границы сердца расширены влево на 0,5 см. Тоны сердца
глухие, усилен II тон на аорте, АД 150/100 мм рт. ст.
При рентгеноскопии диафрагма неподвижна. Движения грудной
клетки выражены слабо. В легочной ткани инфильтративных измене-
ний не отмечалось. Пульсация сердца вялая и поверхностная.
В течение 4 мес после госпитализации проводилась ИВЛ в боксо-
вом респираторе и качающейся кровати. Собственное, резко ослаб-
ленное дыхание хорошо синхронизировалось с ритмом работы бок-
сового аппарата и частотой качания кровати. Состояние больного
улучшилось: исчезли отеки на ногах, АД снизилось до 130/95, частота
собственного дыхания без ИВЛ колебалась в пределах 28—32 в 1 мин.
С 21.11.1957 г. по 10.04.1958 г. больной непрерывно находился в
качающейся кровати и боксовом аппарате.
Отключение от аппаратов ИВЛ стало невозможным. ЖЕЛ=ДО.
Развился трахеобронхит с вязкой мокротой, откашливание было не-
возможно. Цианоз, тахикардия, АД 145/115. 10.04.1958 г. произведена
трахеостомия и начата эндотрахеальная ИВЛ аппаратом Энгстрема-
150. Собственное дыхание исчезло, ИВЛ неадекватна. К этому вре-
мени сохранились только слабые движения в пястно-фаланговых и
межфаланговых суставах пальцев. Арефлексия. Резкая мышечная ат-
рофия, фасцикуляция уменьшились. Парез мышц шеи. Снизилась
сила мимических мышц, однако движения были еще возможны. На
протяжении 18 мес сформировались параличи мышц рук, ног, туло-
вища, появились гипофония, дисфагия, дизартрия, лагофгальм во
сне, стала свисать голова. Слабость жевательной мускулатуры, вялая
подвижность языка, мягкого неба нарушили оральную фазу глотания.
Кормление жидкими смесями растягивалось до 2 ч, затем стало про-
изводиться через назогастральный зонд. ГФЛП сочетался с отвисани-
ем нижней челюсти. Вызывались ладонно-подбородочный, хоботко-
вый и губной рефлексы. Контакт с больным осуществлялся с помо-
щью азбуки движениями глаз. Иногда жаловался на двоение.
Отмечались слабость конвергенции, анизокория. После самостоятель-
ного мочеиспускания в мочевом пузыре была остаточная моча, отсут-
ствовало натуживание мышц живота. Периодически производилась
катетеризация. Стул после клизмы.
Больной стал вялым, апатичным, но сознание всегда было ясным,
интеллектуальные функции адекватными. Подбирая по азбуке буквы
движениями глаз, достаточно точно высказывал свое мнение о тече-
нии болезни, уходе, методах лечения. К концу 39-го месяца от начала
болезни стало трудно объясняться по азбуке из-за пареза мимических
мышц, слабо смыкал веки. Язык в полости рта был неподвижен,
складчат, мягкое небо также неподвижно, лежало на корне языка.
Рото- и носоглотка заполнены слизью, слюной. Тотальная вялая тет-
раплегия в сочетании с ГФЛП, параличами мимических, жевательных
47
мышц наблюдались в течение 4 мес. 13.10.1959 г. больной скончался
на 39-м месяце от начала болезни.
Патологоанатомический диагноз. АБС. Резко выраженная атрофия
спинного мозга. Атрофия всей мускулатуры. Ателектаз нижних отде-
лов легких. Пролежень на задней стенке трахеи. Трахеоэзофагеальный
свищ. Катарально-геморрагический цистопиелит. Восходящий гной-
ный нефрит. Дистрофия паренхиматозных органов. Отеки в области
поясницы.
Резюме. Больной Е., 39 лет. Заболевание началось с
повышенной утомляемости при ходьбе, потливости. Период
предвестников продолжался около 2 мес. Локальный период
болезни начался с парезов мышц левой ноги, угасания ахил-
лова рефлекса. Появилась слабость мышц правой ноги. Про-
должительность локального периода около 3 мес. Период на-
чальной генерализации продолжался около года и характери-
зовался распространенными фасцикуляциями и быстро
прогрессирующими парезами, охватившими почти все мышцы
тела и дыхательные мышцы. ДН сопровождалась постоянной
одышкой и приступами удушья в ночное время. ИВЛ произ-
водилась нательными респираторами. В период развернутой
генерализации процесса быстро прогрессировали парезы всех
мышц туловища, рук, дыхательных мышц, ГФЛП, парезы ми-
мических и жевательных мышц. Производилась эндотрахеаль-
ная ИВЛ. К концу 18-го месяца этого периода отмечался
тотальный паралич, характерный для состояния деэфферента-
ции, которая продолжалась около 4 мес. Общая продолжитель-
ность болезни достигла 39 мес.
Наблюдение 9. Больная Ш., 47 лет, преподавательница физкуль-
туры. В реанимационное отделение поступила 19.05.1959 г. С середи-
ны марта 1958 г. отмечала повышенную утомляемость, особенно при
силовых нагрузках. На уроках физкультуры делала 12 прыжков через
веревку вместо 32—40. Спустя месяц ослабели пальцы ног, перестала
подниматься на носки, затем исчезли движения правой стопы. На-
следственность не отягощена. В конце апреля произведено удаление
фибромиомы матки, послеоперационный период без осложнений.
В течение 2 мес отмечала подергивания в мышцах, развилось отвиса-
ние правой и слабость левой стопы. Походка изменилась. Передвига-
лась с посторонней помощью. Затем ослабела левая рука, больная не
могла поднимать ее вверх. Проводились интенсивное электролечение,
инъекции витаминов, физиотерапия. В течение года происходило
быстрое црогрессирование болезни.
В течение 4 мес появились парезы мышц рук, распространившиеся
затем на мышцы живота. Больная не могла откашляться, поворачи-
ваться, была прикована к постели. Неоднократно госпитализирова-
лась, доставлялась домой на носилках из-за параличей мышц ног.
Могла брать легкие предметы руками. Слабость правой руки более
выражена: во время еды придерживала правую руку левой. 2.04.59 г.
произведена аппендэктомия, после которой появились приступы уду-
48
піья, повторяющиеся несколько раз в сутки, в связи с чем неодно-
кратно теряла сознание. Переведена в реанимационное отделение.
При поступлении ЧД 22 в 1 мин, ЖЕЛ 1200 мл, АД 130/80 мм рт. ст.,
пульс 90 в 1 мин. Функция черепных нервов без изменений. В мышцах
туловища и конечностей распространенные фасцикуляции. В плече-
вых суставах движения отсутствовали, в локтевых — резко ограниче-
ны. Движения в лучезапястных суставах и пальцах рук ограничены,
сила отсутствовала. Паралич мышц ног. Сила мышц туловища резко
снижена, имелся только намек на разгибание длинных мышц спины.
Сидеть без поддержки не могла. Мышцы живота при кашле не на-
прягались. Сухожильные и периостальные рефлексы на руках были
снижены, коленные и ахилловы не вызывались. Все виды чувстви-
тельности сохранены. Патологических рефлексов не было. Приступы
удушья участились, и с конца мая 1959 г. стала необходима ИВЛ,
проводившаяся сначала качающейся кроватью, в ночное время —
боксовым респиратором. Без аппаратов могла дышать только 10—15
мин. Дыхание учащалось до 40 в 1 мин и осуществлялось вспомогатель-
ными мышцами. На 39-й день после применения ИВЛ в нательных
респираторах ЖЕЛ=ДО. На рентгенограмме легких ателектаз нижней
дали справа. Диафрагма неподвижна. 19.07.1959 г. произведена трахеос-
томия. Непрерывная эндотрахеальная ИВЛ проводилась аппаратом
Энгстрема-150. С августа 1959 г. отмечалась вялая тетраплегия, кроме
слабых движений лучезапястных суставов и пальцев рук. Не могла под-
нять голову от подушки. Диффузная гипотрофия, гипотония всей мус-
кулатуры туловища. Фасцикуляции распространились на мимическую
мускулатуру и язык. Собственное дыхание отсутствовало. В конце 2-го
года от начала болезни появились рефлексы орального автоматизма.
Спустя 31—32 мес от начала болезни развились дисфагия, дизартрия и
гипофония. Срок каждого кормления удлинился до 1 ч — 1 ч 30 мин,
вследствие утраты оральной фазы, хотя жевание также было ослаб-
лено, от питания через назогастральный зонд воздерживалась. При
глотании вытягивала голову вперед и кивательными движениями ее
как бы помогала продвижению пищи. Слюна в свободное от питания
время постоянно вытекала из полости рта. Требовалось почти посто-
янное отсасывание. Периодически наблюдалась аспирация в трахею.
Речь с каждым днем становилась неразборчивее, голос — тихим, гну-
савым. Мягкое нёбо было неподвижным, лежало на корне языка.
Язык удавалось слегка доводить до зубов, которые оставляли отпечат-
ки на нем. Язык был распластан в полости рта, резко атрофичен,
беспокоили грубые фасцикуляции. Появились глубокие парезы ми-
мических мышц: слабое наморщивание лба, брови не нахмуривала,
лагофтальм. При оскаливании показывала по два зуба с каждой сто-
роны, щеки надуть не могла. 16.12.1960 г. в течение дня состояние
больной обычное. Тоны сердца приглушены. Пульс 100 в 1 мин,
ритмичный, удовлетворительного наполнения. АД 130/80 мм рт. ст.
17.12.1960 г. больная внезапно скончалась. Предполагался техничес-
кий дефект аппарата ИВЛ. Общая продолжительность болезни соста-
вила 33 мес, из них 18 мес с применением аппаратов ИВЛ.
Патологоанатомический диагноз. АБС. Атрофия скелетной муску-
латуры, диафрагмы. Асфиксия, жидкая кровь в сердце и сосудах.
Кровоизлияние под эндокард и слизистую желудка. Застойное пол-
нокровие органов. Почечнокаменная болезнь. Гнойный холецистит.
49
Резюме. Больная ПІ., 47 лет. В течение 1,5—2 мес
наблюдался период предвестников болезни в форме повышен-
ной утомляемости во время физических упражнений с детьми.
Симптомами локальной фазы были паралич мьппц правой и
парез левой стопы, продолжавшиеся 2 мес. Начальная генера-
лизация проявлялась параличами ног, парезами мьппц обеих
рук, распространенными фасцикуляциями во всех мышцах. В
период развернутой генерализации параличи охватили мышцы
ног и туловища, развились параличи мьппц рук, появились
приступы удушья, расстроился механизм кашлевого рефлекса.
ИВЛ проводилась около 1,5 мес нательными респираторами
(качающаяся кровать, боксовый респиратор), затем эндотрахе-
ально. На протяжении 3 мес формировался ГФЛП, дисфагия
достигла крайней степени. От питания через назогастральный
зонд больная воздерживалась. По состоянию неврологических
функций больная находилась на грани перехода в период то-
тального паралича. Продолжительность полной зависимости от
ИВЛ достигла 18 мес. Общая продолжительность болезни со-
ставила около 33 мес.
Наблюдение 10. Больной А., 56 лет, поступил 4.07.1959 г. В 1958 г.
около 1 мес отмечал судороги мьппц ног. В декабре 1958 г. парез
мышц левой стопы, которая свисала при ходьбе. Фасцикуляции мышц
ног, туловища, рук. Диффузное похудание мышц, сначала левой ноги,
а затем и правой, быстро нарастало. Лечился амбулаторно инъекция-
ми витаминов. Спустя 5—7 мес от начала болезни оставил работу,
ходил медленно, появилась слабость в мышцах туловища, руках, не
мог поднять легкий груз, стал испытывать затруднения при одевании.
Анамнез. Страдает бронхоэктатической болезнью. Курит с 17 лет.
Ранение и контузия мягких тканей головы во время войны. Наслед-
ственность не отягощена: имеет здоровых братьев, сестер и здоровых
детей (в возрасте 27 и 30 лет). В возрасте 15 лет перенес малярию.
В начале заболевания с декабря по март 1959 г. дважды гриппоподоб-
ные состояния. При поступлении черепно-мозговая иннервация была
без нарушений. Сохранялся полный объем движений шеи, туловища,
рук. Сила по динамометру составила 29 кг. Больной имел полный
объем движений в тазобедренных и коленных суставах, но сила мышц
снижена. Стопы свисали. Самостоятельно передвигался, опираясь на
палку и наклоняя туловище вперед. Отмечались диффузная гипотро-
фия всех мышц, особенно ног, и распространенные фасцикуляции.
Сухожильные рефлексы с рук были снижены, коленный D>S. Ахил-
ловы рефлексы не вызывались. Брюшные рефлексы отсутствовали.
Патологических рефлексов не было. При электромиографии мускула-
туры рук и ног выявлены типичные переднероговые нарушения с
мозаичным распределением процесса. Спустя 9 мес от начала болезни
внезапно появился приступ удушья. ЧД достигла 32—34 в 1 мин, в
дыхании участвовали вспомогательные мышцы шеи, наблюдалось
втяжение межреберных промежутков. При рентгеноскопии: подвиж-
ность левого купола диафрагмы 0,5 см, правый купол диафрагмы
неподвижен. Справа в нижнем легочном поле бронхоэктазы. ДН стала
50
нарастать: ЧД достигла 58—60 в 1 мин, пульс 120—150 в 1 мин,
слабого наполнения, временами нитевидный. По витальным показа-
ниям произведена трахеостомия. Из трахеи и бронхов отсасывалось
большое количество слизисто-гнойной мокроты. Эндотрахеальное
дыхание производилось непрерывно в течение 2 мес, затем периоди-
чески аппарат отключали на 1—2 ч, ЖЕЛ=ДО. Спустя 1 год 10 мес
от начала болезни ИВЛ производили непрерывно. В течение после-
дующих 8 мес быстро нарастали парезы мышц рук, туловища, пере-
стал поворачиваться и самостоятельно садиться. Возникла арефлек-
сия. Фасцикуляции распространились на мимические мышцы, сни-
зилась сила в круговых мышцах глаз. Были выражены рефлексы
орального автоматизма.
К концу 2-го года болезни появились признаки дисфагии, попер-
хивался, но твердую пищу глотал хорошо. Беспокоили фасцикуляции
мышц языка. Спустя 2 года 2 мес у больного были тетраплегия и все
признаки ГФЛП, он глотал только жидкую пищу, иногда наблюдалась
аспирация, плохо глотал слюну — потребовалось частое отсасывание.
Голос глухой, выражена дизартрия. Язык атрофирован и подвижен
только до края зубов. Рефлексы с мягкого неба и глотки не вызыва-
лись. Мягкое небо и надгортанник неподвижен. Смыкание голосовых
связок было ограничено. Выявился парез мимических мышц, больше
слева. Резко ослабела сила жевательных мышц. С 14.03.1961 г. пита-
ние начали производить через зонд, резко повысилась саливация,
из-за которой требовалось почти непрерывное отсасывание. Нараста-
ла слабость мимических и жевательных мышц с обеих сторон, больше
слева. Спустя 31 мес от начала болезни единственными движениями
становятся слабое смыкание рта и полный объем движений глазных
яблок. Мимические мышцы парализованы с двух сторон, лагофтальм
больше слева. У больного возникли афагия, анартрия и афония. ИВЛ
производили непрерывно. В течение последних 2 мес болезни наблю-
дался тотальный паралич (синдром деэфферентации). Появилось рас-
стройство сфинктеров мочевого пузыря и прямой кишки. Кахексия.
Умер 22.09.1961 г.
Патологоанатомический диагноз. АБС. Атрофия спинного мозга,
скелетной мускулатуры. Кардиосклероз. Бронхоэктазы, гнойный цис-
топиелит.
Резюме. У больного А. заболевание началось в возрасте
55 лет, когда около 1 мес наблюдались судороги мышц ног,
затем появились парезы и параличи обеих голеней. Локальная
фаза продолжалась около 8 мес. В течение последующих 8 мес
происходила начальная генерализация парезов, разлитых фас-
цикуляции, угасания сухожильных рефлексов. Поскольку боль-
ной много лет страдал бронхоэктатической болезнью, разви-
лась ателектатическая бронхопневмония, возникла ДН, начата
ИВЛ. В течение первых 5 мес периодически дышал самостоя-
тельно. В период развернутой генерализации процесса, продол-
жавшейся около 18 мес, наступила полная обездвиженность,
сформировался ГФЛП, сохранилось слабое смыкание нижней
челюсти и движения глаз. Состояние деэфферентации при
51
сохраняющихся сознании и движениях глазных яблок (объяс-
нение по азбуке) продолжалось 2 мес. Продолжительность пре-
бывания на ИВЛ достигла 26 мес. Общая продолжительность
болезни составила 35 мес.
Наблюдение 11. Больная Ж., 44 лет, инвалид І гр., в прошлом
уборщица. Поступила в реанимационное отделение 9.09.1960 г. с
жалобами на затруднение глотания, речи, дыхания, отсутствие движе-
ний рук и ног. Считает себя больной с января 1957 г., когда появились
тянущие боли в поясничной области с иррадиацией в левую ногу. К
апрелю боли уменьшились, ослабела левая нога. Спустя 7 мес посту-
пила в клинику нервных болезней.
Неврологический статус. Парез мышц левой ноги, преимущест-
венно разгибателей стопы, гипотрофия и гипотония мышц левой
голени. Редкие подергивания в мышцах туловища и рук. Сухожиль-
ные и надкостничные рефлексы высокие. Коленные S>D, ахилловы
D>S. Брюшные рефлексы живые, симптом Бабинского с двух сторон.
Больная находилась в клинике 3 мес. Увеличилась слабость в ногах,
появился клонусоид обеих стоп, исчезли средние и нижние брюшные
рефлексы. Электровозбудимость выявила полную реакцию перерож-
дения передней болыиеберцовой, малоберцовой мышц и разгибателей
пальцев стопы. В спинномозговой жидкости белок 0,66 г/л, цитоз 6/3.
Спустя 8 мес от начала двигательных нарушений поставлен диагноз
миелорадикулоневрит. Больная переведена на инвалидность II груп-
пы. В течение последующих лет находилась в домашних условиях. В
это время продолжалось прсгрессирование болезни. К концу 3-го года
активные движения ног исчезли, кроме слабого намека на ротацию в
тазобедренных и сгибание в колейных суставах. Отмечались глубокие
парезы рук. Самостоятельно питаться не могла. Появились признаки
ГФЛП, гипофония, дизартрия, дисфагия. Больная глотала только
жидкую пищу. На 4-м году болезни уставала при жевании, снизилась
сила круговых мышц глаз, усилились фасцикуляции в мимических
мышцах, особенно подбородочных, были выражены рефлексы ораль-
ного автоматизма. Подвижность голосовых связок сохранялась, вы-
явился паралич правого купола диафрагмы. ЖЕЛ снизилась до 1 л.
Ночью беспокоили приступы удушья. Переведена в реанимационное
отделение. Глубокий тетрапарез. Слабые движения были сохранены
лишь в локтевых и коленных суставах, ротация в тазобедренных
суставах, удавались незначительные сгибательные движения пальцев
рук и в лучезапястных суставах. Сгибательная контрактура III—V
пальцев с обеих сторон. Повысился тонус в пронаторах. Мимические
движения сохранялись, но силовая функция резко снижена, особенно
круговых мышц, глаз, рта. При сохранности движений мышц лба
сохранялась функция жевательных мышц. Глоточный рефлекс и реф-
лекс с мягкого неба живые, рот открывала на 2 см. Мягкое небо
оставалось подвижным, глоточный рефлекс и рефлекс мягкого неба
сохранны, язык слабо подвижен, деформирован, корень подтянут к
твердому небу. Гипотрофия передней части и горбовидное выпячива-
ние задней части языка сопровождались его контрактурой с фикса-
цией к задней стенке глотки. Подтянуть язык и осмотреть гортань, а
также ввести назогастральный зонд было невозможно. Рефлексы
орального автоматизма были выражены. Собственное дыхание малой
52
амплитуды, ЖЕЛ=ДО. Появились частые признаки удушья. Наблю-
дались постоянная аспирация слюны и слизи в ларингоглотку и
резкое ослабление кашлевого рефлекса. При клинических проявлени-
ях ДН, обусловленной парезами дыхательных мышц и мышц живота,
а также бульбарными нарушениями 10.09.1960 г. (на 44-м месяце от
начала болезни) была произведена трахеостомия и начата ИВЛ. Из-за
невозможности введения назогастрального зонда произведена опера-
ция гастростомии. В дальнейшем кормление производилось через
гастростому.
К концу 4-го года от начала локального развития параличей соб-
ственное дыхание было возможно при отключении аппарата на 20—30
мин. В течение 35 мес больная находилась на ИВЛ. Сознание всегда
было ясным, объяснялась по азбуке движениями глаз. На фоне пол-
ного обездвиживания, при снятии силы тяжести, сохранялись мини-
мальный намек на приведение плеча, сгибание в лучезапястном сус-
таве справа и слабая ротация в тазобедренных суставах. Движения
шеи ограничены, периостальные рефлексы оживлены, слабый клоно-
ид правой кисти. Постоянно отмечались тянущие боли в руках и
ногах, спине, рефлексы на ногах исчезли. Патологических рефлексов
не было. До конца болезни (79 мес) сохранялась функция глазодви-
гательных, жевательных, мимических мышц, кроме требующих сило-
вого напряжения (надувание щек, вытягивание губ хоботком, зажму-
ривание глаз). Появилась обильная саливация в связи с афагией и
полной неподвижностью языка, мягкое небо вяло свисало, но глоточ-
ный рефлекс еще сохранялся. С начала мая 1963 г. развилась ателек-
татическая пневмония и затем абсцесс левого легкого. С конца июля
лихорадка гектического типа. Нарастающая кахексия. 19.10.1963 г.
больная скончалась.
Патологоанатомический диагноз. АБС. Атрофия спинного мозга.
Атрофия скелетной мускулатуры, кахексия. Эмфизема легких. Абс-
цесс левого легкого. Хронический нефрит. Хронический катаральный
пиелит. Атрофия миокарда. Кардиосклероз. Хронический атрофичес-
кий гастрит.
Резюме. Больная Ж., 44 лет, первоначально страдала
болевым синдромом по типу поясничного радикулита с ирра-
диацией в ногу и судорожными подергиваниями. Период пред-
вестников продолжался около 7 мес. Локальная фаза характе-
ризовалась атрофическим параличом мышц левой и парезом
правой ноги в сочетании с пирамидными нарушениями. Про-
должительность ее составила 10 мес. Предположительный диа-
гноз — миелополирадикулоневрит. Была переведена на инва-
лидность II группы. В течение последующих 27 мес происхо-
дила начальная генерализация двигательных расстройств,
охватившая все мышцы туловища, рук, ног, языка в сочетании
с распространенными фасцикуляциями. В этот период еще
могла передвигаться с посторонней помощью. Развернутая ге-
нерализация продолжалась свыше 35 мес. В течение этого
срока наступила тетраплегия, произошли вовлечение корково-
спинномозговых и корково-ядерных путей, дыхательных
53
мышц, ГФЛП и реализация ДН. ДР проводилась в течение 35
мес. Общая продолжительность болезни достигла 79 мес.
Наблюдение 12. Больная К., 32 лет, учительница музыки, житель-
ница г. Владимира. Поступила 30.12.1981 г. в городскую больницу с
жалобами на одышку и сердцебиение.
Анамнез. Считала себя здоровым человеком. Наследственность не
отягощена. В 24-летнем возрасте были первые роды недоношенным
ребенком, сопровождающиеся сильным кровотечением, несколько
часов находилась без сознания. Вторые нормальные роды в 27 лет.
В дальнейшем оба ребенка развивались нормально. На фоне уже
начавшейся слабости в ногах в 28-летнем: возрасте была третья бере-
менность с явлениями токсикоза, закончившаяся абортом.
Вскоре появились судороги икррножных мышц, повышенная
утомляемость при ходьбе. Спустя 8 мес заметно ослабела левая нога,
к врачам не обращалась, вела активный образ жизни. В последующие
полтора года ослабела и правая нот, стало трудно передвигаться.
Неоднократно госпитализировалась в неврологический стационар.
Спустя 2 года от начала болезни был поставлен диагноз АБС. Пере-
ведена на инвалидность I группы. Постепенно слабели руки. Движе-
ния ног сохранялись в ограниченном объеме. Могла есть, обслужи-
вать себя. К концу 48-го месяца от начала болезни развилась ДН.
Доставлена в реанимационное отделение. По витальным показаниям
произведена срочная трахеостомия и начата эндотрахеальная ИВЛ
респиратором РО-5.
Неврологический статус. Вялые глубокие парезы ног, парезы
мышц туловища и рук, распространенные фасцикуляции, включая
мышцы языка и мимические мышцы. Слегка повышен тонус в про-
наторах рук. Карпорадиальные рефлексы оживлены, с двуглавой и
трехглавой мышц снижены. Коленные, ахилловы рефлексы не вызы-
вались. Патологические рефлексы отсутствовали. Возникли поперхи-
вание, дисфония, дисфагия и дизартрия. Периоральные рефлексы
были резко выражены. В течение 5 мес самостоятельное дыхание
было возможно не более 10—15 в 1 мин. До октября 1983 г. могла
глотать полужидкую пищу. В дальнейшем питалась через назога-
стральный зонд. Ограничилось открывание рта, возник глубокий
парез мимических мышц, появились анартрия и афония. Движения
глаз сохранялись в полном объеме, общение осуществлялось по азбу-
ке миганием век и движением глаз. Удавались слабые движения шеи
в стороны, легкая ротация в плечевых суставах и сгибание в локтевых.
Отсутствие кашлевого толчка. В течение 1984—1988 гг. развилась
тетраплегия. Движения мимических мышц стали ограниченными.
Движения глазных яблок сохранялись в полном объеме. С 1989 г.
тотальный паралич. Сохранялось ясное сознание, набор букв по аз-
буке осуществлялся движениями глаз и миганием век. В таком состо-
янии больная прожила еще около двух лет. Умерла 21.11.1990 г.
Вскрытие не производилось.
Резюме. Заболевание началось в возрасте 28 лет. Около
8 мес беспокоили судороги икроножных мышц. Затем в тече-
ние 26 мес наблюдалась локальная слабость мышц ног. Период
начальной генерализации проявился распространением паре-
54
зов и параличей. Примерно на 40-м месяце от начала болезни
наступила ДН. В течение 60 мес постепенно развилась тетра-
плегия, сформировался ГФЛП. Производилась непрерывная
ИВЛ, питание проводилось через назогастральный зонд. На
132-м месяце болезни развился синдром тотального паралича.
Сознание, движения глазных яблок, объяснение по азбуке со-
хранились до последних дней жизни. Общая продолжитель-
ность болезни достигла 156 мес. ИВЛ продолжалась 108 мес.
Обсуждение клинических проблем в условиях
продленной жизни
АБС развивался в возрасте от 18 лет до 71 года. У всех
наблюдаемых нами больных, заболевших спорадическим АБС,
отсутствовали доказательства наследственного происхождения
болезни, не было профессиональных вредностей и виды тру-
довой деятельности были различными. Болезнь развивалась по
сходному сценарию с различными периодами, отражающими
систему гибели мотонейронов от начальных признаков до тех
сроков, когда жизнь зависела от работы аппаратов ИВЛ и
фактически продлевалась за черту естественного течения бо-
лезни (см. рис. 1).
Первый период — период предвестников четко был уста-
новлен у И из 12 больных, у каждого из которых прослежи-
вались слабовыраженные неспецифические признаки заболе-
вания. У одного больного изменилось только произношение
звуков.
Больные трудоспособны, ведут обычный образ жизни, но
их уже начинают тревожить общая и локальная утомляемость
мышц, подергивание и судороги, иногда болезненные спазмы,
потливость, потеря массы тела. Обычные физические нагрузки
становятся обременительными. Больные сокращают сроки
спортивных тренировок, ограничивают профессионально не-
обходимые поездки. Существенное беспокойство вызывает
одышка, значимость которой постоянно недооценивалась вра-
чами. Наиболее простым объяснением ее возникновения были
эмфизема, курение, сердечная слабость. Как правило, не про-
изводилась оценка легочных функций и подвижности диафраг-
мы. Ретроспективный анализ дальнейшего развития парезов и
параличей показал, что перечисленные признаки относились
именно к тем мышцам, которые в дальнейшем ослабевали
первыми.
Правильнее рассматривать предвестники как скрытое нача-
ло заболевания мотонейронов. Отсутствие клинических прояв-
лений двигательного дефицита объясняется сохранностью ос-
55
новной популяции двигательных нейронов. На примере остро-
го полиомиелита в эксперименте на обезьянах доказано
[Bodian D., 1948], что парезы возникали вследствие гибели или
функциональной бездеятельности примерно 50 % мотонейро-
нов. Можно предполагать, что в периоде предвестников забо-
левание мотонейронов, хотя и состоялось, но диагностическое
значение признаков еще невелико, поскольку в основном по-
пуляция мотонейронов сохранена. Вместе с тем надо признать,
что продолжительность АБС с учетом фазы предвестников
более длительна, чем это принято считать на практике, когда
начало болезни определяется появлением парезов.
Продолжительность фазы предвестников колебалась у боль-
шинства больных от 1 до 8 мес. В 3 наблюдениях (Г., Т., П.)
предвестники продолжались от 13 до 15 мес. К этому сроку,
видимо, надо относиться с доверием, поскольку в случае П.
занятия спортом задолго выявили утомляемость мышц. В слу-
чае Г. и Т. появление одьппки и большая потеря массы тела
были достаточно определенными. Фактически у них уже была
ДН.
Второй период — локальный. Двигательный дефицит отра-
зил традиционный принцип разделения АБС в зависимости от
первоначальной локализации парезов на бульбарную, шейную,
шейно-груцную, поясничную формы.
При бульбарной форме у больного Б. (наблюдение 1) ло-
кальные симптомы развивались стремительно: в течение 3 мес
прогрессировали дизартрия, дисфагия и слабость правой руки.
Приступы удушья объяснялись нарушением глотания, скапли-
вающейся в ротоглотке слизью, слюной и возникающей поэ-
тому закупоркой дыхательных путей.
При шейной локализации (наблюдения 2, 3) была нарас-
тающая одышка в покое и при небольшом физическом напря-
жении. Так, больной Т. мог спать только сидя. Больной Г. был
доставлен в коматозном состоянии с угасающим дыханием,
гипоксемией и газовым ацидозом. Такие больные с парезами
диафрагмы, несомненно, погибли бы в локальном периоде
АБС, если бы им не были произведены трахеостомия и ИВЛ.
Поражение мышц рук отмечено в наблюдении 4 (больной
П.). Снижение силы и гипотрофия мышц левой руки развива-
лись в течение 3 лет. Весь этот срок он продолжал учебу,
интенсивно занимался спортом, но было необходимо постоян-
ное лечение. У больного 3. (наблюдение 5) появились прогрес-
сирующая слабость мышц обеих рук, гипотрофия.
Первоначальная поясничная локализация наблюдалась у 7
больных. Начавшись с асимметричных парезов мышц ног,
развивались распространенные фибрилляции, судороги мышц
голени и бедер. Мышечная слабость была особенно заметна
56
при ходьбе и выполнении глобальных нагрузок, например
ходьба на носках или на пятках, подъемы тяжестей. Все боль-
ные продолжали работать, а некоторые выполняли достаточно
разнообразную и тяжелую работу. Так, больная Т. (наблюде-
ние 7) работала в колхозе, обслуживала семью, кормила грудью
ребенка. Больная Ш. (наблюдение 9) продолжала занятия с
детьми по классу физкультуры. Все больные обращались к
врачам. Диагноз АБС в 2 наблюдениях (больные И., Ж.) не
был поставлен. Предполагались опухоль конского хвоста, по-
яснично-крестцовый радикулит.
Таким образом, в локальном периоде вследствие гнездного
заболевания основной популяции мотонейронов в отдельных
сегментах спинного моза и ядрах каудальной группы черепных
нервов начинает развиваться неврологический дефицит. В 2
наблюдениях (больные Т., Г.) произошло выключение функ-
ции диафрагмы, и уже в этом раннем локальном периоде АБС
потребовалась срочная ДР. Продолжительность локального пе-
риода колебалась от 2 до 26 мес. В течение этого срока двое
больных адаптировались к аппаратам ИВЛ и постоянно ис-
пользовали три аппарата: в ночное время респиратор ДП-8 или
аппарат Энгстрема-150. В дневное — портативные респирато-
ры, изготовленные для индивидуального пользования и уста-
новленные на письменном столе для работы. Третий — порта-
тивный типа АМБУ применялся во время туалета, при ходьбе.
Прогрессирование процесса было медленнным.
При шейно-грудной и поясничной локализации больные
еще передвигались, некоторые из них сохранили обычные фи-
зические нагрузки, хотя все уже имели выраженный двигатель-
ный дефицит.
В третьем периоде начальной генерализации парезы, наблю-
давшиеся в локальном периоде, углублялись до параличей. При
поясничной локализации процесса параличи были восходящи-
ми. При первичной локализации в верхнешейных сегментах
происходило, напротив, нисходящее развитие параличей. Ка-
залось бы, при первоначальном заболевании мотонейронов в
III—V шейных сегментах следовало ожидать гибели наиболее
близко расположенных мотонейронов ядер ствола, но погиба-
ют лежащие ниже мотонейроны спинною мозга. Почти во всех
наблюдениях оказалось, что, пока не произойдет гибель всех
мотонейронов спинного мозга, процесс не перебросится на
ядра ствола.
Наиболее характерным симптомом были распространенные
мышечные фасцикуляции, которые вызывали, по выражению
одного больного, неприятные ощущения типа "жующихся
мышц" (больной Е.). Фасцикуляции отмечались даже в глубоко
парализованных мышцах. Фасцикуляции имеют большую диа-
57
гностическую значимость. Они постоянны, поэтому отсутствие
их вызывает сомнение в диагнозе АБС. В отличие от доброка-
чественных фасцикуляций, наблюдающихся иногда у здоровых
лиц, чаще в одном и том же месте, при АБС они наступают
повсюду и по мере прогрессирования охватывают все произ-
вольные мышцы. Причины фасцикуляций недостаточно выяс-
нены, хотя гипотезы об их происхождении многочисленны.
Фасцикуляций не имеют двигательного эффекта, возникают
как в клинически не пораженных, так и в атрофичных мышеч-
ных группах. У больного П. в условиях тотального поражения
всего двигательного нейрона и развития синдрома деэфферен-
тации фасцикуляций ощущались в парализованных мимичес-
ких мышцах и были невидимы врачам. На ЭМГ наблюдалась
аритмичная, в основном низкочастотная активность двигатель-
ных единиц. Фасцикуляций возникали с интервалом в 3 с,
усиливались при нагрузках, особенно в начале их выполнения
[Pongratz D. et al., 1984]. Основываясь на теории прогресси-
рующей потери дендритов нейронов, G.Karpati и соавт. (1988)
объясняют фасцикуляций и фибрилляции перевозбудимостью
моторных нейронов, возможно, обусловленных накоплением
глютаматных нейротрансмиттеров [Rothstein J. et al., 1992]. В
ранних стадиях АБС, когда имеется легкое или умеренное
истощение дендритов, единственным проявлением расторма-
живания мотонейронов являются судороги и фасцикуляций.
Получила распространение теория периферического проис-
хождения фасцикуляций. При АБС возбуждение возникает в
претерминалях и терминалях двигательного аксона. Импульсы,
генерализованные в этих местах, антидромно проводятся к
нервным разветвлениям и отсюда ортодромно достигают мы-
шечных волокон. Подтверждением периферического проис-
хождения фасцикуляций является устранение их непаралити-
ческими синтетическими производными кураре, в частности
павулоном, и усиление неостигмином, тормозящим выброс
холинэстеразы [Pongratz D. et al., 1984]. В периоде начальной
генерализации ДН наступила у 8 из 12 больных, двое (больные
Г. и Т.) использовали постоянно ИВЛ, которая была начата в
локальном периоде. Они могли ходить, заниматься научной
работой, консультировать аспирантов и проводить за письмен-
ным столом многие часы. Для них были возможны выезды на
дачу и прогулки.
У больного 3. к парезам рук присоединился спазм приво-
дящих мышц гортани с приступами асфиксии. Острый приступ
асфиксии явился показанием к трахеостомии. После операции
приступы асфиксии не повторялись. ЖЕЛ составила 60—70 %
ДЖЕЛ. Больной мог дышать без аппарата ИВЛ еще 3 мес. Этот
58
факт подтверждает возможное участие ВМН в реализации
спазмов (корково-ядерные связи).
При поясничной локализации абсолютное большинство на-
блюдаемых нами больных (4 из 7) уже в начале генерализации
процесса нуждались в периодической ИВЛ. Причины возник-
новения ДН оказались различными.
В наблюдении 10 (больной А.) параличи дыхательных мышц
еще не развились, но больной страдал бронхоэктатической
болезнью с частыми обострениями, поэтому ДН развилась
раньше, чем это наступало при поясничной локализации про-
цесса. Уже на 9-м месяце болезни развилась ателектатическая
пневмония с большим скоплением мокроты. Откашливание
было ослаблено. Произведена трахеостомия. После санации
трахеобронхиального дерева больного отключали от аппарата.
Периодически ИВЛ проводилась больной К. (наблюдение 12)
в связи с расстройством откашливания из-за слабости мышц
живота. К концу периода начальной генерализации двое боль-
ных были прикованы к постели и страдали приступами удушья.
В обоих случаях наступало облегчение при. использовании на-
тельных респираторов. У больной Ж. наряду с распространен-
ными парезами и параличом мышц левой ноги развились па-
ралитическая деформащш языка и нарушение оральной фазы
глотания. ДН еще не было.
Таким образом, в этом: периоде больные могли себя обслу-
живать во время еды, туалета, кроме больного Б., страдавшего
бульбарной формой АБС. Двое больных (Г. и Т.) сохраняли
двигательную активность: передвигались с посторонней помо-
щью, элементарно себя обслуживали, занимались научной ра-
ботой. У больного П. (наблюдение 4) в течение 4 лет продол-
жалась генерализация процесса: прогрессировали парезы
мышц обеих рук, бедер, появился степпаж, нарастали гипотро-
фии. Однако больной, проживавший в Омске, мог выезжать на
курорт, а также на консультацию в Институт неврологии. Боль-
ная Тр., имевшая парезы мышц ног и легкую слабость в ругах,
опираясь на палку, могла пройти несколько километров в сель-
скую амбулаторию. Особое место занимает больной Б., 59 лет, у
которого в конце 3-го месяца от начала дизартрии развился ГФЛП.
К этому времени больной уже находился в критическом состоянии
и нуждался в ДР. На протяжении 2 мес происходила начальная
генерализация процесса: наступили параличи мышц обеих рук,
половины диафрагмы. В отличие от других больных у него
особенно резко были выражены признаки поражения ВМН.
Итак, в начальном периоде генерализации процесса проис-
ходит развитие парезов и параличей, охватывающих все
мышцы туловища и конечностей, но в разной степени и с
59
мозаичным распределением парезов различных мышечных
групп.
Из 12 больных 8 страдали ДН, 4 больным была необходима
непрерывная эндотрахеальная ИВЛ, двое (больные 3., А.) ис-
пользовали ИВЛ периодически. Двум больным (Ш., Е.) ИВЛ
производилась периодически с помощью нательных респира-
торов. Мозаичность в распределении парезов позволяла сохра-
нять активное передвижение, самообслуживание и выполнение
профессиональных навыков.
Период развернутой генерализации процесса характеризует-
ся прогрессирующей степенью двигательного дефицита. Всем
больным была необходима ИВЛ, которая в 11 наблюдениях
производилась эндотрахеально. Одному больному (И.) была
применена ИВЛ с помощью нательного респиратора-кирасы.
При глубоких парезах дыхательных мышц и резко ослабленном
кашлевом рефлексе из-за парезов мышц живота нательные
респираторы не создают адекватной ИВЛ. Больной умер спустя
48 дней от начала ИВЛ при общей продолжительности болезни
12 мес от присоединившейся ателектатической пневмонии.
Наиболее тяжелое течение развернутой генерализации было
при бульбарной форме АБС (больной Б.). ИВЛ продолжалась
10 мес, из них 8 мес — в развернутом периоде. Наряду с ГФЛП
отмечались паралич диафрагмы, вялые параличи мышц рук и
спастическая параплегия. В конце 16-го месяца от начала бо-
лезни развились трахеоэзофагеальная фистула и гнойный ме-
диастинит, что послужило причиной смерти. Двое больных
(наблюдения 2, 3), как уже указывалось, с начала локального
периода использовали ИВЛ и находились дома. По личному
опыту, лечение таких больных целесообразнее проводить в
домашних условиях.
У всех 12 больных отмечен ГФЛП различной степени.
У больных Т., Тр. была дисфагия, но они могли глотать само-
стоятельно. У двух (больные Т., III.) наблюдались выраженные
признаки ГФЛП, процедура кормления малыми порциями спе-
циально приготовленных, по желанию больных, кашиц затя-
гивалась до 2 ч. Иногда наблюдалась аспирация, была необхо-
дима частая санация трахеи, особенно при ослабленном меха-
низме кашлевого рефлекса. По психологическим соображе-
ниям сами больные отдаляли сроки неизбежного питания через
назогастральный зонд. Больной Ж. питание производилось
через гастростому, так как паралитически деформированный
язык полностью закрывал полость ротоглотки и введение на-
зогастрального зонда было невозможно. Остальным 6 больным
энтеральное питание производилось через назогастральный
зонд от 7 мес (больной А.) до 172 мес (больной П.). Нужно
принимать во внимание, что длительное расположение зонда
60
в верхних отделах пищевода, по соседству с псевдомембраноз-
ной частью трахеи, создает условия для травматических по-
вреждений слизистой пищевода и формирования язв и фистул.
В 2 наблюдениях (больные Б., Е.) развились трахеоэзофагеаль-
ный свищ и гнойный медиастинит (больной Б.). Периодичес-
кое удаление зонда, попеременная смена его положения в
разных половинах носа, распускание герметизирующей манже-
ты имеют профилактическое значение в условиях длительных
сроков кормления через назогастральный зонд, но не всегда
предупреждают осложнения.
Больному П. кормление через назогастральный зонд прово-
дилось 172 мес, по его желанию зонд удаляли после каждого
кормления. Консистенция питательных кашиц была различ-
ной, поэтому использовались зонды различного диаметра. Ос-
ложнений не было.
В течение последних 15 лет [Gauderer М. et al., 1980; Hill
М. et al., 1993] при хронических расстройствах глотания при
неврологических заболеваниях и, в частности, болезнях мотор-
ного нейрона [Park R. et al., 1992] для кормления производится
подкожная эндоскопическая гастростомия (ПЭГ). Этот метод
легче переносится больными, позволяет проводить разнообраз-
ное и длительное питание не только в стационаре, но и в
домашних условиях.
Последовательное восходящее развитие нарушения мотор-
ных функций ядер V и VII пар черепных нервов наблюдалось
у 8 из 12 больных. При первоначальной поясничной локали-
зации параличи развивались к концу развернутого периода в
сроки от ЗО мес (больные Е., А., Ш.) до 35—60 мес-(больные
К., Ж.) от начала болезни.
При шейно-грудной локализации процесса у больного Г.
парез жевательных и мимических мышц наступил на 72-м
месяце от начала болезни. У больного П. парезы мимических
мышц стали развиваться с 80-го месяца от начала болезни и
закончились параличами к 152-му месяцу. Движения жеватель-
ных мышц угасали еще более медленно. В течение 96 мес
пребывания на ИВЛ больной П. мог сигнализировать персо-
налу, сжимая зубами звуковое устройство. Прекращение этой
функции произошло в стадии тотального паралича.
При бульбарной форме (больной Б.) парез жевательных и
мимических мышц развился к концу 1-го года болезни.
Функция глазодвигательных нервов была сохранена у 9
больных. В наблюдениях Е. и Б. отмечалось небольшое огра-
ничение движений глаз в стороны. Больной П. не мог быстро,
по команде, сомкнуть веки, небольшое оіраничение движений
не препятствовало контакту с ним при составлении слов путем
слежения глазами по азбуке или мигания век.
61
В конечном периоде продленной жизни при АБС происхо-
дит развитие синдрома деэфферентации или тотального пара-
лича, отличающегося от синдрома locked in, описанного впе-
рвые F.Plum и соавт. (1966) при обширных инфарктах основа-
ния моста мозга. При синдроме locked in развиваются
избирательная надъядерная спастическая тетраплегия, супра-
бульбарный паралич мышц, иннервируемых каудальной груп-
пой черепных нервов, сохраняется собственное дыхание, осу-
ществляемое через трахеостому, которая необходима вследст-
вие супрабульбарного паралича. Сознание, движение глаз,
обычно в вертикальном направлении, сохраняются.
Больные могут находиться в этом состоянии длительное
время. Используя азбуку морзе, они могут движениями глаз
выражать свои мысли с достаточной полнотой.
При АБС, напротив, синдром деэфферентации обусловлен
тотальным вялым параличом, прекращением собственного ды-
хания, выключениями функции двигательных ядер ствола.
Единственной сохраняющейся функцией являются движения
глазных яблок и возможность общения с больными по азбуке
миганием век и движениями глаз в разных направлениях. В
этом только и состоит сходство тотального паралича при АБС
с синдромом locked in, описание которого приводит F.Plum.
Интеллектуальные функции сохранялись. Больные охотно
вступали в контакт, интересовались жизнью отделения, регу-
лярно (а иногда и постоянно) смотрели телевизор, общались с
близкими родственниками. Сон существенно не нарушался.
При полиграфической регистрации сердечного ритма во
время ночного сна у больного П. (ИВЛ 172 мес) не обнаружены
изменения сердечного ритма. Выявлены его стабильность при
переходе от одной стадии сна к другой, нерезкое сужение
диапазона вариабельности на протяжении всей ночи, т.е. от-
сутствовал циркадный ритм пульса. Отсутствие варьирования
кардиоинтервалов, вероятно, непосредственно связано с
многолетней адинамией [Кобрин В. и др., 1978].
Пролежни при АБС, как правило, отсутствуют. Наиболее
уязвимыми местами для пролежней является кожа в области
крестца, интенсивно подвергающаяся давлению и локальной
ишемии. Кожа в этой области теряет эластичность, становится
задубленной. При растяжении медленно возвращается в исход-
ное состояние. При электронной микроскопии было обнару-
жено, что коллагеновые фибриллы становятся плотно упако-
ванными и по мере продолжительности болезни отделяются
аморфным материалом [Ono S. et al., 1988]. Возможно, изме-
нение кожи при АБС уникально и может служить в качестве
дифференциального диагностического признака БМН. При
АБС-Гуам также отмечено отсутствие пролежней. В периоде
62
тотального паралича выявляется крайняя степень атрофии всей
произвольной мускулатуры и остеопороза. Формируются гене-
рализованная тугоподвижность суставов и фиксащія их по типу
разгибательных контрактур. Срок жизни в состоянии деэфферен-
тации имел значительные колебания. По нашим данным, про-
должительность его в двух наблюдениях (больные Е. и А.) соста-
вила от 2 до 4 мес, в наблюдении П. — 96 мес, в наблюдении
К. — 24 мес. Относительно короткий период пребывания осталь-
ных больных в состоянии деэфферентации и редкость перехода
в него объясняются отягощенностью больных соматическими
заболеваниями и осложнениями в процессе продолжения
жизни. Более длительный срок состояния деэфферентации на-
блюдался у заболевших в молодом возрасте (18—27 лет).
Причиной смерти больных АБС, проживших в условиях
продленной жизни различные сроки (см. табл. 1), была брон-
холегочная патология. У больных 3. и И. развились ателектазы,
у больных Т. и Ж. — абсцесс легких, больной А. страдал брон-
хоэктатической болезнью. В двух наблюдениях летальный
исход объяснялся развитием трахеоэзофагеального свища, ос-
ложнившегося гнойным медиастинитом (больной Б.) и трахео-
васкулярной фистулой (больная Тр.) с фатальным кровотече-
нием. Остальные 4 больных умерли от разных причин: отклю-
чение от аппарата ИВЛ (больные Г., Ш.), сепсис (больной Е.),
спонтанная гипотермия (больной П.). Средняя продолжитель-
ность АБС до развития ДН составила около 23 мес при коле-
баниях от 6 до 100 мес. Средний срок жизни при использова-
нии ИВЛ равен 44 мес с колебаниями от 1,5 до 172 мес. Общая
продолжительность болезни в среднем составила 71 мес при
колебаниях от 12 до 272 мес.
Достигнутые сроки продления жизни больным АБС не яв-
ляются предельньїми. Наименьшая продолжительность жизни
при ИВЛ наблюдалась при бульбарной форме. При первона-
чальной спинальной локализации продолжительность ИВЛ
была наиболее длительной. Особый интерес представляет дли-
тельный срок жизни на ИВЛ при первоначальной локализации
в ядрах диафрагмы, хотя ИВЛ была применена больным в
возрасте от 55 лет до 71 года. ИВЛ применялась много месяцев
(от 38 до 87 мес). Факт этот указывает на вовлечение в процесс
нижележащих мотонейронов и большую устойчивость двига-
тельных ядер ствола.
Заключение
В условиях продленной жизни клинические проявления
АБС отличаются от естественного течения этой болезни пара-
личами дыхательных мышц и полной зависимостью жизни
63
больных от аппаратов ИВЛ. Слежение за вовлечением в пато-
логический процесс двигательных нейронов показало, что
четко наметились определенные периоды болезни, различаю-
щиеся по признаку своеобразия прогрессирующей гибели мо-
тонейронов. Прежде всего в процессе тесной кооперации с
больными АБС ясно определился факт существования пред-
вестников болезни еще до возникновения первого двигатель-
ного дефицита.
Период предвестников проявляется неспецифическими
симптомами в виде судорог и спазмов мышц, одышкой, повы-
шенной, часто локальной утомляемостью мышц, потерей
массы тела, тянущих болей в ногах. Этот симптомокомплекс
отражает скрытое начало болезни мотонейронов; отсутствие
двигательного дефицита объясняется сохранностью основной
популяции МН. Для возникновения четких парезов необходи-
ма гибель примерно половины МН. Период предвестников
продолжался от 1 до 16 мес. Разброс сроков объясняется,
вероятно, недооценкой признаков болезни самими больными.
Локальный период сопровождается развитием парезов.
Именно в эти сроки формируются традиционные формы АБС:
бульбарная, шейная, шейно-грудная, поясничная. В локальном
периоде уже возникает опасность для жизни. Если первона-
чально погибают мотонейроны диафрагмы, каудальные ядра
черепных нервов, то без применения ДР больные погибают в
сроки от 5 до 8 мес от первых признаков неврологического
дефицита. Своевременное применение ИВЛ не только сохра-
няет жизнь больных, но и позволяет им самостоятельно пере-
двигаться и работать по специальности. Естественно, это ка-
сается в первую очередь больных с параличами диафрагмы и
сохранностью остальных двигательных функций. При другой
локализации первоначального поражения МН, особенно пояс-
ничной, сохраняется самообслуживание, но снижается выпол-
нение силовых физических нагрузок. Продолжительность ло-
кального периода — от 2 до 26 мес.
Начало генерализации процесса знаменует распространен-
ную гибель мотонейронов: наряду с углублением парезов до
параличей происходит формирование парезов в других областях,
чаще близко расположенных к уже парализованным. Двигатель-
ный дефицит мозаичен: в регионах, отдаленных от первона-
чального очага, движения могут сохраняться. ДН в этом пе-
риоде появляется постоянно: 8 больным из 12 было необходи-
мо периодическое применение ИВЛ при условии дифференци-
рованного использования аппаратов ИВЛ. Продолжительность
начального периода генерализации составляет от 2 до 38 мес.
Период развернутой генерализации характеризуется распро-
страненным охватом всех двигательных нейронов, включая мо-
64
тонейроны ядер черепных нервов. Все больные нуждаются в
постоянной эндотрахеальной ИВЛ, у всех наблюдается ГФЛП
разной степени выраженности. Продолжительность разверну-
той локализации составляет 4—60 мес. Значительный разброс
сроков объясняется внезапной смертью некоторых больных от
осложнений (фатальное кровотечение из трахеоваскулярной
фистулы, медиастинит, ателектазы легких, технические дефек-
ты аппаратов ИВЛ).
Вовлечение ВМН наблюдается постоянно, но в разной сте-
пени выраженности. При первоначальной поясничной локали-
зации проявления симптомокомплекса ВМН минимальны. В
условиях преобладания вялого восходящего паралича вследст-
вие поражения НМН, особенно поясничных мотонейронов,
соучастие ВМН не выявляется. При бульбарной локализации
поражение ВМН четко выступает и прогрессирует вместе с
вовлечением в процесс мотонейронов ядер каудальной группы
черепных нервов.,
Конечный период в условиях продленной жизни обознача-
ется синдромом деэфферентации, или тотального паралича.
Тотальная вялая тетраплегия, прекратившееся собственное ды-
хание, арефлексия, атрофия всей двигательной мускулатуры,
прекращение функции мотонейронов ядер черепных нервов
при сохраняющихся движениях глаз и интеллектуальной дея-
тельности являются основным клиническим симптомоком-
плексом заключительного периода АБС. Максимальная про-
должительность жизни при синдроме деэфферентации достиг-
ла 96 мес.
Глава 3
Клиническая физиология дыхательной
недостаточности при амиотрофическом
боковом склерозе и методы искусственной
вентиляции легких
Анализ ДН неврогенного генеза основывается на изучении
степени повреждения верхнего и нижнего мотонейронов, обес-
печивающих регуляцию и исполнение дыхательного акта.
ВМН регулирует центральные (командные) функции про-
извольных дыхательных движений. От соматомоторных облас-
тей головного мозга импульсы передаются по корково-спин-
номозговым путям к мотонейронам спинного мозга и корко-
во-ядерным — к ядрам черепных нервов. Оценка функции
дыхательных движений производится в бодрствующем состоя-
нии, при ясном сознании, понимании задания, путем выпол-
нения различных по сложности легочных тестов.
К центральной регуляции дыхания относится и метаболи-
ческая система, заложенная в хеморецепторах нейронов дыха-
тельного центра в продолговатом мозге. Система является не-
произвольной, функционирует в автоматическом режиме,
имеет свой внутренний ритм, управляет газообменом непре-
рывно и, главное, регулирует дыхание во сне.
НМН представляет собой исполнение дыхательного акта.
Импульсы идут от мотонейронов передних рогов спинного
мозга, каудальных ядер черепных нервов и по периферическим
нервным стволам и их разветвлениям в мышцах. НМН иннер-
вирует дыхательные мышцы и поддерживает дыхательные пути
свободными для движения воздуха путем согласованных сокра-
щений мышц глотки, гортани, языка, а также механизма каш-
левого рефлекса.
Развитие ДН при АБС зависит от степени вовлечения в
процесс и последующей гибели ВМН и НМН. Поражение
верхнего нейрона в слабой степени влияет на развитие ДН.
Прежде всего при АБС полностью сохраняется метаболическая
функция хеморецепторов респираторных нейронов дыхатель-
ного центра и нисходящего респираторного тракта. Как извест-
но, признаками нарушения метаболической регуляции являет-
ся прекращение дыхания во сне (синдром Ундины). В этих
случаях вдыхание повышенных концентраций С02 субъектив-
но не ощущается и не вызывает прироста легочной вентиля-
ции. Больные при АБС, напротив, испытывают малейшую
нехватку воздуха, не могут уснуть при первых признаках ДН.
66
ЖЕЛ, л
1-Х! XII I II III IV V VI VII VIII IX X XI XII I II III IV V VI
1961г. 1962 г. 1963 г 13Л/Іумер
Рис. 7. Наблюдение 5, больной 3. Развитие дыхательной недостаточ-
ности. Объяснение в тексте.
Сохраняется чувствительность хеморецепторов респираторных
нейронов дыхательного центра к С02.
Поражение корково-спинномозговых путей имеет ограни-
ченное влияние на процессы формирования ДН. При иссле-
довании легочных функций больные АБС управляют произ-
вольными дыхательными движениями и выполняют различные
по сложности функциональные легочные тесты. Ритм и коор-
динация дыхательных движений бывают правильными.
Если преобладают спастические симптомы, то может за-
трудняться воспроизведение сложных произвольных проб, на-
пример РОвьщ, задержка дыхания на вдохе и выдохе, выпол-
нение по заданию кашля.
Поражение корково-ядерных путей имеет при АБС более
ощутимое значение. В таких случаях легочные объемы и ем-
кости снижаются умеренно, но при наличии спастического
симптомокомплекса могут наступать приступы своеобразного
удушья, обусловленного гипертонусом мышц глотки, гортани
и внезапным прекращением потока воздуха при спазме голо-
совых мышц (синдром экстраторакальной обструкции).
У больного 3. (рис. 7) отмечались рецидивирующие присту-
пы удушья, сопровождающиеся тахипноэ до 35 в 1 мин, стри-
дором, цианозом, страхом смерти. Приступы рецидивировали,
и в один из них по витальным показаниям была произведена
67
трахеостомия, после которой приступы исчезли, ЖЕЛ состави-
ла 50 % ДЖЕЛ. В течение 2 мес собственное дыхание было
адекватным. В дальнейшем, по мере прогрессирования паре-
зов ДМ, появилась необходимость в ИВЛ, сначала периоди-
чески, а затем круглосуточно. В эти же сроки развилась
афагия, возникла необходимость питания через назога-
стральный зонд. ИВЛ проводилась 15 мес после наложения
трахеостомы.
Параметры легочных функций были прослежены в разные
периоды АБС при различной степени поражения НМН и
ВМН, примерно в одинаковые сроки от начала болезни.
В группе больных без клинических признаков ДН с пре-
имущественным поражением НМН (табл. 2) наблюдалась
общая тенденция к гипервентиляции. При спирометрии было
снижение ЖЕЛ, ОЕЛ, Р0ВЫД, повышение ООЛ и в меньшей
степени ФОБ. В механике дыхания отмечались выраженное
снижение ОФВ1, объемных скоростей на вдохе и выдохе, по-
вышение сопротивления дыхательных путей.
В группе больных, имеющих сочетанное поражение мото-
нейронов, но с преобладающим поражением ВМН, наблюда-
лись сходные параметры внешнего дыхания. В меньшей сте-
пени снижен РОввд и слабее выражено увеличение ООЛ. Зна-
чительный разброс параметров легочных функций в обеих
группах мог быть объяснен разными сроками болезни. В более
поздние сроки от начала болезни патология внешнего дыха-
ния становилась все более ощутимой. В газовом составе
крови отмечались сходные показатели, хотя степень гипок-
семии была более заметна в группе с преобладающим пора-
жением НМН.
Замеры параметров внешнего дыхания, в особенности ле-
гочных объемов и емкостей, проводили R.Fallat и соавт. (1979)
у 218 больных АБС со смешанной локализацией. ЖЕЛ и ОЕЛ
снижались умеренно. Характерно увеличение ООЛ. Значение
локализации процесса в нервной системе для реализации сни-
жения легочных объемов наблюдали E.Orvoln-Erya и соавт.
(1979). Среди 86 больных АБС снижение наблюдалось у 2/з
больных с бульбарными формами, у остальных показатели
были нормальными. При преимущественном поражении мото-
нейронов, обеспечивающих иннервацию верхних и нижних
конечностей, легочные объемы снижались у 50 % больных.
Таким образом, замеры легочных объемов, особенно ЖЕЛ,
хотя и являются информативными, при медленном прогресси-
ровании процесса не обеспечивают точного определения функ-
ций диафрагмы и, следовательно, могут быть малоинформа-
тивны до появления ДН.
Наиболее ранними и чувствительными маркерами функци-
68
Таблица 2
Показатели легочных функций и газового состава крови у больных АБС без клинических признаков ДН
Показатели
Норма*
число
боль-
ных
Генерализованные формы
преобладание поражения
мотонейронов спинного
мозга и ядер черепных
нервов (НМН)
число
боль-
ных
сочетанное поражение
мотонейронов спинного
мозга с преобладанием
корково-спинномозговых
и корково-ядерных
путей (ВМН)
Легочная вентиляция
ЧД в 1 мин
мод/дмод, %
Спирометрия
ЖЕЛ/ДЖЕЛ,%
РОвьщ., Л
ОФВ1/ДОФВ1, %
мвл/дмвл, %
ОЕЛ/ДОЕЛ, %
ООЛ/ДООЛ, %
ООЛ/ОЕЛ, %
ФОЕ/ДФОЕ, %
ФОЕ/ОЕЛ, %
10-20
80-120
>85
1,0-1,4
>75
>75
80-120
90-125
25-44
90—125
44-56
10
12-29
115,6-260,9
21,8-97,3
0,17-1,12
25,9-120,8
19,7-167,7
59,4-118,8
102,0-248,3
36,1-71,8
81,2-179,8
57,9-81,2
17-27
135,8—241,1
35,7-
0,3-
37,5-
31,3-
84,2-
75,0-
26,6-
88,1-
47,1-
-97,0
-2,0
101,4
-121,9
-98,9
181,6
-60,9
-143,0
-74,0
Показатели
Норма*
число
боль-
ных
Т
аблица 2 (продолжение)
Генерализованные формы
преобладание поражения
мотонейронов спинного
мозга и ядер черепных
нервов (НМН)
число
боль-
ных
сочетанное поражение
мотонейронов спинного
мозга с преобладанием
корково-спинномозговых
и корково-ядерных
путей (ВМН)
Механика дыхания
Ивд., кПа л/с
Rbb№, кПа л/с
ПОС, %
МОС 75, %
МОС 50, %
МОС 25, %
Газовый состав крови и КОС
рН log"1
РкСОг, мм рт. ст.
БЕ, ммоль/л
Рк02, мм рт. ст.
НЬОг, %
<0,25
<0,25
>75
>70
>60
>55
7,35-7,45
34-45
-з,о-+з,о
>75
>95
10
Срок болезни, мес
0,132-0,451
0,101-2,808
20,5-150,5
21,8-117,9
24,8-136,4
24,6-202,1
7,361-7,46
28,2-47,4
-5,7—М,7
58,8-88,6
90,0-96,8
9,5-36
0,113-0,44
0,116-1,77
28,0-112,6
23,1-116,2
14,2-157,0
22,1-201,8
7,38-7,437
28,7-41,4
-5,0-+1,6
63,8-84,8
92,7-96,4
7-42
* Нормальные значения по R-Knudson (1976), J.H.Comroe (1961).
онального состояния диафрагмы считается измерение макси-
мального инспираторного [Pasenal J. et al., 1990] и трансдиа-
фрагмального давления [Newson-Devis S., 1979]. Замеры этих
параметров позволяют определить раннее появление парезов
диафрагмы при снижении ЖЕЛ до 53—79 % от нормы.
Существенный контраст представляли больные с развитием
ДН (табл. 3). Параметры легочных функций у больных с пре-
обладающим поражением НМН измерялись при естественном
варианте течения АБС, т.е. без применения ИВЛ. У всех на-
блюдались выраженная гипервентиляция, снижение ЖЕЛ до
катастрофических значений (14—31 % ДЖЕЛ). Наблюдались
экстремальное снижение в параметрах РОвьщ, ОФВ1, МВЛ,
ОЕЛ и резкое повышение ООЛ. Характерны весьма низкие
объемы —потоки при форсированном вдохе и выдохе (рис. 8).
В газовом составе крови отмечались различные степени газо-
вого ацидоза. ДН, развиваясь при АБС постепенно, сопровож-
дается стойкой гиперкапнией и умеренной гипоксемией, кото-
рые иногда продолжаются свыше месяца. Возможно резкое
повышение гиперкапнии и гипоксемии, что бывает достаточно
часто вследствие внезапного развития ателектазов, особенно
при парезах мьппц диафрагмы, живота и нарушении механизма
кашлевого рефлекса.
Из представленного описания клинических проявлений и
замеров легочных функций в разных фазах болезни ясно, что
при АБС наблюдается рестриктивно-обструктивная форма ДН,
наиболее выраженная при поражении НМН. ДН всегда закан-
чивается смертью. Применение ИВЛ продлевало жизнь боль-
ных на срок от 10 до 172 мес.
Проблема длительного замещения отсутствующего дыхания
имеет многовековую историю. Гениальная идея Клода Бернара
об искусственном поддержании дыхания была осуществлена
им свыше 100 лет тому назад. Паралич дыхательных мышц
вызывался у животных в эксперименте путем введения кураре,
после чего производилась трахеостомия и газообмен восстанав-
ливался путем вдувания воздуха в дыхательные пути с помо-
щью кузнечных мехов. После восстановления газообмена и
прекращения действия кураре животное оставалось здоровым.
Спустя почти 100 лет этот эксперимент пережил свое второе
рождение во время эпидемий острого полиомиелита. Пример-
но у 30 % заболевших наблюдались параличи ДМ и бульбарные
расстройства. Летальность достигала 80—95 %. Применение
ИВЛ, поддержание дыхательных путей свободными для движе-
ния в них воздуха сразу снизило летальность до 18 % [Lassen
Н.С., 1955]. Применение ИВЛ в России позволило снизить
летальность с 93 до 23 % [Попова Л.М., 1965]. После окончания
эпидемий острого полиомиелита больные с резидуальными
71
параличами дыхательных мьппц, используя постоянно ИВЛ,
хорошо адаптировались к аппаратам и прожили многие годы
и даже десятилетия [Попова Л.М., 1971; Christensen M.S. et al.,
1975]. Накопленный опыт по длительной ИВЛ при полиомие-
лите был использован при многих заболеваниях нервной сис-
темы, протекающих с параличами дыхательных мьппц, в том
числе при АБС.
Таблица 3
Показатели легочных функций и газового состава
крови у больных АБС с ДН (п=4)
Показатели
Легочная вентиляция
ЧД, в 1 мин
мод/дмод, %
Спирометрия
ЖЕЛ/ДЖЕЛ, %
РО
ГЧУБЫД., Л
ОФВ1/ДОФВ1, %
мвл/дмвл, %
ОЕЛ/ДОЕЛ, %
ООЛ/ДООЛ, %
ООЛ/ОЕЛ, %
ФОЕ/ДФОЕ, %
ФОЕ/ОЕЛ, %
Механика дыхания
ІЦд., кПа л/с
Rbi^, кПа л/с
ПОС, %
МОС 75, %
МОС 50, %
МОС 25, %
Газовый состав крови
и КОС
рН, log"1
РкС02, мм рт. ст.
БЕ, ммоль/л
Рк02 мм рт. ст.
НЬ02', %
Срок болезни, мес
1
Норма
10-20
80-120
>85
1,0-1,4
>75
>75
80-120
90-125
25-44
90-125
44-56
<0,25
<0,25
>75
>70
>60
>55
7,35-7,45
34-45
-3,0-+3,0
>75
>95
Генерализованные
формы с преобладани-
ем поражения мотоней-
ронов спинного мозга
и ядер черепных нервов
(НМН)
19-36
143,7-272
14,9-31
0,04-1,0
23,9-48,8
23,6-70,1
65,3-98,0
184,5-230,5
65,2-79,1
92,8-140,7
76,4-79,8
0,07-0,139
0,103-0,18
31-40,7
33,2-44,2
38,2-55,4
44,4-87,7
7,386-7,078
60,2-115
-4,0-+10,9
74,6-43,0
94,7-57,0
21-36
72
10L.
выдох, л/с
ч_/
Рис. 8. Кривые поток — объем.
1 — нормальная форма кривой; 2 — рестриктивные изменения; 3 — вариа-
бельная экстраторакальная обструкция.
Прогрессирующее развитие парезов и формирование ДН
происходят при полной сохранности интеллекта. Больные
обычно хорошо осведомлены о возможном использовании ап-
паратов ИВЛ при постоянно выраженной ДН в специализиро-
ванных реанимационных отделениях либо в домашней обста-
новке.
Программа ДР при АБС имеет ряд особенностей, поскольку
она формируется в соответствии с хроническим прогрессиру-
ющим процессом и зависит от сроков и степени гибели НМН.
Основное значение имеет выполнение трех условий.
Во-первых, аппаратная ИВЛ устанавливает адекватную ле-
гочную вентиляцию, которая вначале поддерживает угасающее
собственное дыхание и после прекращения дыхания полностью
его замещает.
73
Во-вторых, создаются условия для свободного движения
воздуха в дыхательных путях. Наиболее радикально это дости-
гается трахеостомиеи с использованием трахеостомических
трубок с герметизирующими манжетами, изолирующими ды-
хательные пути от пищеварительного тракта, чем предупреж-
даются аспирация и утечка воздуха во время ИВЛ. Всегда
необходима санация трахеобронхиального дерева путем отса-
сывания мокроты, усиления механизма кашлевого рефлекса.
В-третьих, при ГФЛП необходимо кормление через назога-
стральный зонд, в редких случаях через гастростому. Послед-
няя при АБС заменена теперь либо цервикальной эзофагосто-
мией [Norris F.N., 1992], либо подкожной эндоскопической
гастростомией (ПЭГ) и является предпочтительной для прове-
дения долговременного кормления при АБС [НШ М.А. et al.,
1993; Ganders M.N. et al., 1980] и других болезнях мотоней-
рона.
Наши первые клинические наблюдения во время продления
жизни были сделаны еще в 1956 г. у больных АБС с первона-
чальной локализацией в пояснично-крестцовых отделах спин-
ного мозга. Начавшись с парезов стоп, двигательные рас-
стройства прогрессировали. В сроки от 8 до 18 мес у больных
уже была угрожающая жизни ДН. Эти наблюдения частично
рассмотрены нами совместно с Н.В.Коноваловым в работах,
посвященных подострому полиомиелиту.
За истекшие десятилетия после нашего первого опыта про-
дления жизни больным АБС в литературе не сообщалось Ъ
подобного рода наблюдениях. Лишь в последние годы появи-
лись публикации [Hajashi et al., 1989; Goulon M. et al., 1989],
а также сообщения в популярных журналах, издаваемых спон-
сорами и объединениями больных АБС. Искусственное под-
держание жизни больных не превышает 5—6 лет. Наибольший
срок продленной жизни в наших наблюдениях достигал почти
14 лет [Попова Л.М. и др., 1987].
В зависимости от первоначальной локализации процесса и
появления функционального дефицита ДМ проводилась диф-
ференцированная ДР. Прежде всего последовательно или одно-
временно использовались различные аппараты ИВЛ (табл. 4).
Решающее значение при выборе аппаратов и применении
всего комплекса ДР имеют свободная проходимость дыха-
тельных путей для воздуха и отсутствие бронхолегочной па-
тологии.
Нательные респираторы использовались в периоде прогрес-
сирующих восходящих парезов ДМ, что обычно наблюдается
при первоначальной поясничной локализации. При возникно-
вении ГФЛП, легочной патологии были необходимы респира-
торы для эндотрахеальной ИВЛ.
74
Таблица 4
Виды применявшихся аппаратов ИВЛ и способы питания в условиях продленной жизни
N° на-
блю-
дения
Больные/
Возраст (лет)
при поступ-
лении в реа-
нимационное
отделение
Первоначаль-
ная локали-
зация
Способ ИВЛ
Вид аппарата ИВЛ
Продолжи-
тельность
ИВЛ, мес
в раз-
лич-
ных
аппа-
ратах
об-
щий
срок
Способ питания
Срок
пита-
ния,
мес
1
2
3
4
5
6
7
Б/59
Г/55
Т/71
П/27
3/56
И/42
Тр/27
Бульбарная
Шейная
То же
Шейно-
грудная
То же
Поясничная
То же
Эндотрахеальный
»
»
»
»
Нательный
Нательный,
эндотрахеальный
Гульбера; 6
Энгстрема 4
Энгстрема, ДП-8, 24
АМБУ 63
То же 38
ДП-8
ДП-8, 4
Гульбера, 4
РО-1 7
Кираса
Железные легкие,
Энгстрема
10
10 Назогастральный
Оральный
87
38 То же
172 172 Назогастральный 172
15 То же
48 48 Оральный
дней дней
3 4 То же
1
13
ON
Таблица 4 (продолжение)
Mb на-
блю-
дения
Больные/
Возраст (лет)
при поступ-
лении в реа-
нимационное
отделение
Первоначаль-
ная локали-
зация
Способ ИВЛ
Вид аппарата ИВЛ
Продолжи-
тельность
ИВЛ, мес
в раз-
лич-
ных
аппа-
ратах
об-
щий
срок
Способ питания
Срок
пита-
ния,
мес
8
9
10
11
12
Е/39
Ш/47
А/56
Ж/44
К/32
Поясничная
То же
» »
» »
» »
Нательный
Эндотрахеальный
Нательный
Эндотрахеальный
То же
» »
» »
Качающаяся
кровать,
железные легкие,
Энгстрема
Железные легкие,
Гульбера
Энгстрема,
Гульбера
То же
РО-5
4
19
2
16
26
35
108
23 Назогастральный 22
18 Оральный
26 Назогастральный 7
35 Гастростома 35
108 Назогастральный 86
Нательные аппараты
Качающаяся кровать воспроизводит старый метод ИВЛ рас-
качиванием на доске: при подъеме ножного конца кровати
органы брюшной полости давят на диафрату, вследствие чего
происходит выдох. И наоборот, при опускании ножного конца
диафрагма освобождается от давления и наступает вдох.
Больных укладывают на спину, коленные суставы припод-
нимают на 10—12 см, а голову на 5—7 см. Большой подъем
головы не рекомендуется, так как при качании может ограни-
чиваться подвижность диафрагмы. В области поясницы ис-
пользуют мягкие крепления, уменьшающие скольжение туло-
вища во время качания. Качающаяся кровать применялась с
1932 г. при дифтерийном параличе диафрагмы, в фазе отвыка-
ния от ИВЛ при остром полиомиелите.
Кирасовый аппарат состоит из выпуклой оболочки или пан-
циря (кираса), края которого охвачены надувным резиновым
поясом. Панцирь надевают на переднюю поверхность грудной
клетки и живота, затем плотно укрепляют ремнями и метал-
лическими рычагами. Панцирь соединен с мехом, приводимым
в движение электромотором. Благодаря движениям меха в пан-
цире попеременно создается отрицательное и положительное
давление. В фазе отрицательного давления внутри кирасы на-
ступает вдох, а в фазе положительного — выдох.
Железные легкие — боксовый респиратор, предложен Дрин-
кером в 1929 г. Для проведения ИВЛ туловище больного по-
мещают в камеру (бокс). Шею окружают резиновым воротником,
обеспечивающим герметизацию камеры от окружающей среды.
Давление внутри камеры создают с помощью мехов или подвиж-
ного дна, приводимых в действие электромотором. Давление
внутри камеры колеблется в пределах от —30 до +20 см вод. ст.
Во время отрицательного давления наступает вдох, положи-
тельного — выдох. Отношение вдоха к выдоху составляет 1:3.
Железные легкие широко использовались в качестве основ-
ного прибора ИВЛ при парезах и параличах ДМ во время
эпидемий острого полиомиелита, особенно в США. Известны
редкие случаи длительной жизни в железных легких, достигав-
шие 18 лет [Smith S. et al., 1952] у больных с резидуальными
параличами ДМ и свободной проходимостью дыхательных
путей для воздуха. Клиническая физиология дыхания в желез-
ных легких характеризует один из видов ИВЛ под положитель-
ным давлением: во время вдоха вокруг тела создается отрица-
тельное давление ниже атмосферного и воздух всасывается в
дыхательные пути под положительным давлением из атмосфе-
ры. Вьщох обеспечивается положительным давлением внутри
бокса. При нарушении герметизации во время туалета над
77
головой больного укрепляют колпак, воздух в который вдува-
ется под положительным давлением тем же механизмом.
Использование железных легких возможно только при сво-
бодных дыхательных путях, отсутствии бульварных нарушений,
бронхолегочной патологии и так называемых "сухих формах".
Как только происходят нарушение глотания, скопление слизи
в верхних дыхательных путях ("мокрые формы"), наступает
аспирация дыхательных путей и обычно начинается бронхоле-
гочная патология. Поэтому дальнейшее применение железных
легких могло приносить только вред. В этом случае была не-
обходима эндотрахеальная ИВЛ.
Аппараты для эндотрахеальной ИВЛ
Аппарат Гульбера получил широкое распространение и вы-
пускался фирмой Кифа (Швеция). Использовалась модель эн-
дотрахеальной ИВЛ. Вдуваемый воздух увлажняется и подогре-
вается.
Отечественный аппарат ДП-8 разработан в 1964 г. [По-
пова Л.М. и соавт., 1967]. Осуществляется ИВЛ по системе
активный вдох — пассивный выдох. Переключение вдоха на
выдох производится по частоте дыхания. ИВЛ может осущест-
вляться воздухом либо смесью его с кислородом. Вдуваемый
воздух обогревается, увлажняется и регулируется по желанию
больного. Аппарат широко использовался при АБС, весьма
надежен в эксплуатации, которая достигла 15 лет без сущест-
венного ремонта.
Аппарат Энгстрема разработан во время эпидемий острого
полиомиелита в Швеции в 1953 г. В России модели 150 и 300
эксплуатировались с 1956 г. до 80-х годов. Объем вдуваемого
воздуха и частота дыхания регулируются раздельно. ИВЛ осу-
ществляется эндотрахеально и зависит от функционального
состояния дыхательных путей. Повышение сопротивления их,
снижение податливости легких видоизменяют работу механики
аппарата, чем достигается адекватное распределение воздуш-
ного потока в легких.
Ручной дыхательный аппарат (РДА) состоит из резинового
или пластикового мешка и клапанов, отделяющих фазу вдоха
от фазы выдоха. Впервые РДА был выпущен в 1958 г. фирмой
АМБУ (Дания) и называется мешком АМБУ. Ритмическое
сдавливание мешка руками направляет воздушный поток в
дыхательные пути больного.
РДА применялся во время туалета, ходьбы и при аварийных
ситуациях (отключение электротока) и т.д.
РО-1 и РО-5— отечественные аппараты ИВЛ, регулирую-
щиеся по объему. Основным узлом аппаратов являются меха,
78
расположенные под колоколом. Нагнетание воздуха под коло-
кол и отсасывание его производятся воздуходувкой. Аппараты
приводятся в действие электродвигателем. В настоящее время
не выпускаются.
В условиях первоначальной гибели мотонейронов в шейных
сегментах ДН развивалась на 8-м месяце от начала болезни.
Клинические проявления были однотипными. Больные Г. и Т.
вследствие паралича диафрагмы страдали постоянной одыш-
кой, могли спать только сидя, избегали минимальных физи-
ческих нагрузок, большую часть времени проводили в кресле,
хотя движения в мышцах туловища, рук и ног были сохранены.
Ранний диагноз ДН в обоих случаях не был установлен, и после
кратковременного пребывания в неврологическом стационаре
они были выписаны домой, где примерно в течение 1—1,5 мес
на фоне одышки развивались гиперкапния (РкС02 = 60 мм рт.
ст.), гипоксемия (РкО2<50 мм рт. ст.). В реанимационное от-
деление больные поступили из дома. Больной Г. находился в
сопорозном состоянии с явлениями ДН и сердечной недоста-
точности. Дыхание больного Т. осуществлялось с помощью
вспомогательных мышц с частотой 40 в 1 мин, МОД 20 л/мин.
В этих случаях была начата эндотрахеальная ИВЛ, продол-
жавшаяся затем от 38 до 87 мес. Нарастание параличей было
растянуто на многие месяцы и годы. Постоянное пребывание
больных в стационаре не оправдано из психологических сооб-
ражений: интересы больных искусственно ограничиваются.
Они сосредоточены на болезненных переживаниях, своих и
окружающих больных, становятся раздражительными, по-
скольку не могут получить достаточно внимания и доброты.
Поэтому при малейших благоприятных материальных условиях
важно стремиться, как это делается в ряде стран, переводить
больных в домашние условия при постоянном использовании
аппарата. Пациенты интеллектуального труда могут продол-
жать свою работу.
ИВЛ проводили респираторами ДП-8, настольным порта-
тивным и ручным респиратором типа АМБУ. ДП-8 устанав-
ливали у постели больного для подключения во время сна. На
рис. 9 представлен портативный респиратор на письменном столе.
Ручной мешок АМБУ обеспечивал ИВЛ во время передвижения,
туалета, ванны и т.д. Необходимым условием являлось обуче-
ние родственников и друзей больных, а также медицинских
сестер методам ИВЛ и санации трахеобронхиального дерева.
Обучение начиналось еще во время пребывания больных в
стационаре. В домашних условиях осуществлялось системати-
ческое врачебное наблюдение, не реже 1 раза в 2—3 нед про-
водился профилактический технический осмотр аппаратуры.
По мере прогрессирования ДН ИВЛ стала необходима в
79
Рис. 9. Наблюдение 2, больной Г. Паралич диафрагмы. ИВЛ посто-
янно. Сохраняется работоспособность.
обоих наблюдениях непрерывно. При отключении более чем
на 3—5 мин использовался РДА. Оба больных были профес-
сорами физики и на протяжении всех лет пребывания на ИВЛ
не оставляли научной деятельности, постоянно общаясь с уче-
ными, аспирантами, друзьями.
При первоначальной шейно-грудной локализации процесса
ДН наступила особенно поздно. У больного П. (наблюдение 4)
после развития параличей мышц левой руки произошло рас-
пространение их на все мышцы тела и сформировался ГФЛП.
Спустя 100 мес от начала параличей ДН протекала с типичной
клиникой гиповентиляционного синдрома. Проводилась не-
прерывная ИВЛ, и одновременно начато кормление через на-
зогастральный зонд. Вследствие обильного назофарингеально-
то секрета требовалась сначала перемежающаяся, а затем по-
стоянная герметизация трахеи, предупреждающая затекание
слизи и слюны в трахею. Периодическое распускание манжеты
было возможно по 2 ч в сутки, а затем до 30 мин несколько
раз в дневное время. Санация трахеобронхиального дерева
была необходима каждый час в дневное время и каждые 4 ч
ночью. Периодически отмечался гнойный трахеобронхит. На
рентгенограммах грудной клетки однотипно выявлялись уси-
ление и деформация легочного рисунка по тяжисто-ячеистому
типу. Корни структурны, с петрифицированными железками.
Слева в нижнем легочном поле очаг Гона. Периодически в
80
различных участках легких отмечалась гиповентиляция. Непре-
рывная вентиляция и питание через назогастральныи зонд
продолжались 172 мес. После смерти больного исследование
легких и бронхов выявило умеренный хронический бронхит,
нарушение лимфообращения, склероз стенок бронхов, нерав-
номерную гипертрофию гладких мышц бронхиол и мелких
бронхов, мозаичное чередование ателектазов разной давности
и эмфиземы, умеренно выраженный склероз аэрогемического
барьера. Формирование небольшого количества сосудов гло-
мусного типа объяснялось шунтированием кровотока в очагах
старых ателектазов. Очаговое нарушение сопротивления кро-
вотоку не сопровождалось системной гипертензией малого
круга [Попова Л.М. и др., 1984].
При первоначальной гибели мотонейронов спинного мозга
в пояснично-крестцовом отделе ДН наступала после восходя-
щих параличей, охвативших мышцы туловища и конечностей.
Больные были уже прикованы к постели. У всех больных,
имевших такую локализацию, дыхательные пути были свобод-
ны для движения в них воздуха, и поэтому применялись на-
тельные аппараты. Вместе с тем нательные респираторы не-
пригодны для ИВЛ при наличии бронхолегочной патологии.
У больного И., 42 лет (наблюдение 6), ДН появилась на
11-м месяце от начала слабости в ногах в связи с плевропнев-
монией. Было тахипноэ до 40 в 1 мин с участием вспомога-
тельных мышц при неподвижной диафрагме. ИВЛ проводилась
респиратором кираса, но синхронизации с аппаратом не было,
возникали приступы удушья. Отмечалось скопление мокроты
в дыхательных путях. Из-за слабости мышц живота и невоз-
можности произвести глубокий вдох механизм кашлевого реф-
лекса был резко ослаблен. Наши возможности в 1956 г. по
использованию длительной ИВЛ с аппаратами для эндотрахе-
ального дыхания были ограничены. При рентгеноскопии вы-
явились паралич диафрагмы и ателектаз правого легкого. ИВЛ
проводилась только 48 дней. Смерть наступила в конце 12-го
месяца от начала болезни.
У больных Е., Ш., А. (наблюдения 8, 9, 10) ДН развилась
в сроки 9—12 мес от начала параличей и объяснялась присо-
единением бронхолегочной патологии (ателектазы). Эндотра-
хеальная ИВЛ всегда была эффективной.
Больной А. (наблюдение 10), 57 лет, до заболевания АБС
много курил и страдал бронхоэктатической болезнью. Появи-
лись одышка, цианоз, тахикардия, ЧД 40—60 в 1 мин. Дыхание
•осуществлялось вспомогательными дыхательными мышцами.
Левый купол диафрагмы подвижен на 0,5 см, правый купол и
межреберные мышцы неподвижны. Справа ателектатическая
пневмония, в нижней доле бронхоэктазы. Произведена трахе-
81
остомия, и начата непрерывная ИВЛ аппаратом Энгстрема.
В течение 2 нед проводилась санация трахеобронхиального
дерева. Кашлевой толчок был ослаблен. ЖЕЛ достигла 20 %
ДЖЕЛ. Периодически отключался от респиратора на срок от
5 до 1 ч 30 мин в сутки. Собственное дыхание исчезло спустя
З мес от начала ИВЛ. К этому сроку появились признаки
дисфагии, начато кормление через назогастральный зонд.
Общая продолжительность ИВЛ достигла 26 мес, а продолжи-
тельность болезни 35 мес.
У больного Е. (наблюдение 8), 39 лет, ДН началась спустя
11 мес от начала болезни. Появилась одышка, не мог спать
лежа, постоянно испытывал мучительное удушье, даже в поло-
жении сидя. ИВЛ сначала проводилась на качающейся кровати
круглые сутки. При наклоне кровати на 25° ДО составлял
500—600 мл при частоте качания 18 циклов в 1 мин, МОД
8—10 л в минуту. Адаптация происходила в течение 20—30 мин.
Периодически было возможно отключение на срок от 8 до 3 ч
в сутки для кормления, туалета. Спустя 4 мес перестал синхро-
низироваться с качанием, во сне возникала одышка, ЧД до
35—40 в 1 мин. Возникла необходимость использования же-
лезных легких. Дыхательный комфорт был достигнут сразу, но
днем больной по желанию перемещался на качающуюся кро-
вать. Синхронизация легко нарушалась, поскольку при каждой
смене аппаратов тахипноэ достигало 40—35 в 1 мин и осущест-
влялось только вспомогательными дыхательными мышцами.
По мере прогрессирования парезов и появления первых при-
знаков ГФЛП была произведена трахеостомия, ИВЛ до конца
жизни проводилась аппаратом Энгстрема. Общая продолжи-
тельность ИВЛ различными респираторами достигла 23 мес.
Развитие ДН у больной Ш., 47 лет (наблюдение 9), началось
спустя 12 мес после появления слабости в ногах. Первые 2 мес
ИВЛ проводилась в качающейся кровати, а в ночное время —
в боксовом респираторе. Ателектаз легкого и острая гипоксе-
мия явились показаниями для трахеостомии с последующей
ИВЛ с аппаратом Энгстрема и респиратором Гульбера. Про-
должительность ИВЛ составила 18 мес. Умерла внезапно из-за
остановки респиратора.
Больная Тр., 27 лет (наблюдение 7), спустя 18 мес от начала
парезов мышц ног начала страдать одышкой. ИВЛ проводилась
в железных легких. Отключение от аппарата переносила 5—10
мин, и только при положительном давлении воздуха под кол-
паком. Далее в течение 4 мес ИВЛ проводилась аппаратом
Энгстрема. Умерла внезапно от кровотечения из трахеоваску-
лярного свища.
У больной Ж., 44 лет (наблюдение 11), признаки ДН по-
явились спустя 27 мес от начала пареза левой ноги. Парезы
82
прогрессировали относительно медленно. Особенностью их те-
чения было своеобразное и медленное развитие ГФЛП. При-
мерно к 44-му месяцу болезни нарушилась оральная фаза гло-
тания вследствие паралитической деформации языка, который
был атрофичен и переместился к мягкому небу и задней стенке
глотки, полностью перекрывая вход в носо- и ротоглотку.
Назогастральный зонд ввести было невозможно. Произведена
гастростомия. ИВЛ и питание через гастростому проводились
35 мес. Общая продолжительность болезни достигла 79 мес.
У больной К., 32 лет (наблюдение 12), периоды болезни до
развития ДН продолжались 40 мес. Эндотрахеальная ИВЛ про-
водилась респиратором РО-5 в течение 108 мес.
Представленный опыт многомесячной и многолетней ИВЛ
при АБС был первым в нашей стране и накапливался около
30 лет. Особенностью применяемых нами методов ИВЛ при
АБС является использование почти всех видов аппаратов (см.
табл. 4). Этот факт может быть объяснен спецификой развития
параличей, прежде всего при поясничных формах АБС.
При современном развитии медицинской техники может
сложиться мнение, что нательные респираторы утратили свое
значение при ИВЛ. Наш опыт, а также опыт многих зарубеж-
ных авторов свидетельствует об обратном. Железные легкие,
например, в определенном периоде заболевания мотонейрона
продолжают широко использоваться [Cunan F. et al., 1981;
Smith P. et al., 1987]. Нательные респираторы при АБС приме-
няют до сих пор. Используется комбинированная ИВЛ, напри-
мер, кирасовым респиратором в сочетании с перемежающим-
ся давлением через загубник. Сроки применения достигают
3—32 мес. Получила распространение многомесячная ИВЛ под
положительным давлением с помощью мундштуков, загубни-
ков. При отсутствии собственного дыхания и длительной ИВЛ
единственным контролем адекватности ИВЛ является газовый
состав крови и КОС.
Длительная ИВЛ при АБС у больных, находящихся в пол-
ном сознании и при отсутствии дыхания, немыслима без по-
стоянного ощущения дыхательного комфорта, который дости-
гается только при условии умеренно выраженной гипервенти-
ляции. Последствиями ее являются гипокапния и дыхательный
алкалоз, который компенсируется за счет снижения бикарбо-
натов и возникновения метаболического ацидоза при умерен-
ном повышении органических кислот.
При гипокапнии у всех больных появляются "новое состо-
яние КОС55 [Christensen M. et al., 1975], выражающееся в по-
вышении рН эритроцитов, увеличении сродства гемоглобина
к С02, и смещение кривой диссоциации оксигемоглобина
(КДО) влево — щелочной эффект Бора. В то же время в ще-
83
лочной среде возрастает синтез 2,3 ДФГ, способствующий
уменьшению сродства гемоглобина к С02, наступает нормали-
зация или смещение КДО вправо как компенсаторная реакция,
предупреждающая гипоксию и облегчающая отдачу С02 тка-
ням. Сочетание длительной гипокапнии и паралитической аки-
незии, сопровождающейся деминерализацией костного скеле-
та, вызывает появление щелочной мочи вследствие сброса би-
карбоната натрия, кальция, фосфатурии.
Таким образом, создается комплекс условий для возникнове-
ния почечнокаменной болезни и гнойного пиелоцистита. Среди
больных АБС, использующих ИВЛ свыше 2 лет, пиурия и обра-
зования фосфатных конкрементов наблюдались у двух больных.
Продолжение жизни при АБС методом ИВЛ относится к
категории этических проблем. Некоторые авторы [Хондкариан
О.А. и др., 1978] считают, что применение ИВЛ при АБС не
имеет практического значения, другие [Sivak E. et al., 1982],
напротив, рекомендуют длительную ИВЛ проводить в домаш-
них условиях. В США, Японии, Франции использование дли-
тельной ИВЛ при АБС достаточно распространено, что облег-
чается разнообразием портативных дыхательных приборов раз-
личных конструкций, иногда вмонтированных в кресло для
передвижения больных.
В настоящее время важно определить подходы и рекомен-
дации по методам лечения больных с ДН при АБС. К основ-
ным положениям этой проблемы следует отнести мониторинг
легочных функций путем замера наиболее информативных по-
казателей, рентгенологическое определение подвижности диа-
фрагмы. Необходима инструкция о путях предупреждения ас-
пирации, о раннем использовании катетеров и простейших
отсасывателей. Кормление нужно проводить только в положе-
нии сидя, когда глотание улучшается путем сгибания шейного
отдела позвоночника. Если нарушение глотания прогрессирует
и введение назогастрального зонда затруднено либо не соот-
ветствует желаниям больных, то рекомендуется операция под-
кожной эзофагогастростомии (ПЭГ). После наполнения же-
лудка по способу ПЭГ противопоказано лежание на спине.
При начинающихся парезах диафрагмы рекомендуются низкие
дозы теофиллина, улучшающие ее сокращение-[Auber М. et al.,
1981; Hopkins L. et al., 1996]. Все большее распространение при
ДН получают респираторные вспомогательные приспособле-
ния, особенно простейшие аппараты ИВЛ, поддерживающие
дыхание посредством перемежающегося давления в дыхатель-
ных путях через маску, загубник с использованием носовых
зажимов. Трахеостомия ц длительное применение эндотрахе-
альной ИВЛ является правом выбора больного и его семьи.
Стоимость жизнеобеспечения больных АБС, страдающих
84
ДН, высокая. В США экономические затраты на одного боль-
ного АБС с ДН в домашних условиях и обеспечение полным
набором необходимого медицинского оборудования с привле-
чением медицинских сестер на 16 ч в сутки достигают десятка
тысяч долларов в месяц при условии, что аппараты ИВЛ не
покупаются, а берутся напрокат. Эти финансовые затраты
[Klein L. et al., 1996] касаются тех больных, которым был уже
поставлен диагноз АБС с развитием ДН и все виды обследо-
вания уже проведены. Для длительного проведения ИВЛ не-
обходимо согласие больного и его семьи. Затем персоналом
реанимационного отделения проводится предварительное обу-
чение родственников и друзей методам ведения больных с ДН
и распространенными параличами в домаїлних условиях.
Заключение
Дыхательная недостаточность при амиотрофическом боко-
вом склерозе наступает вследствие параличей и парезов дыха-
тельных, глоссофаринголарингеальных мышц и относится к
обструктивно-рестриктивному типу нарушений легочной вен-
тиляции.
Сроки развития ДН зависят от места первоначальной лока-
лизации процесса. При начальной локализации прогрессирую-
щей гибели мотонейронов ядер каудальной группы черепных
нервов (бульбарная локализация), мотонейронов ядер диафрагмы
(шейная локализация) ДН начинается на 5— 8-м месяце от начала
развития параличей. В случаях начального, прогрессирующего
восходящего поражения мотонейронов поряснично-крестцовых
сегментов ДН наступает в сроки от 11 до 44 мес от начала
параличей мышц ног. Развитие ДН ранее указанных сроков
объясняется присоединяющейся бронхолегочной патологией.
Исследование функции внешнего дыхалия позволяет уста-
новить диагноз в ранние сроки. Наиболее информативными
являются мониторинг ЖЕЛ и скоростные показатели. Снижение
ЖЕЛ ниже 30 % ДЖЕЛ, уравнивание ее с дьдхательным объемом,
учащение дыхания свыше 30—35 в 1 мин являются прогности-
чески неблагоприятными признаками. Присоединение газово-
го ацидоза с различными степенями компенсации свидетель-
ствует об угрожающей жизни ДН. Внезапное появление неком-
пенсированного газового ацидоза характерно для бронхоле-
гочной патологии (ателектазы, закупорка дыхательных путей).
В проблеме прогрессирующей ДН при АБС невозможно
игнорировать этические, социальные проблемы и финансовые
возможности. Информированное согласие больных, семьи,
спонсоров на проведение длительной ИВЛ в домашних усло-
виях необходимо получить до критического развития болезни.
85
Глава 4
Патоморфоз амиотрофического бокового
склероза, обусловленный продлением жизни
больных методом дыхательной реанимации
Морфологические изменения нервной системы, наблюдаю-
щиеся при АБС, протекающем в условиях "естественного"
течения болезни, подробно описаны в работах отечественных
и зарубежных авторов.
Согласно полученным данным, наиболее выраженным и
постоянным признаком АБС, протекающим в "естественных"
условиях, т.е. без продления жизни методом дыхательной реа-
нимации, являются патологические процессы, развертываю-
щиеся в области локализации верхнего и нижнего мотонейро-
нов. Традиционно к верхнему мотонейрону относят нейроны
прецентральной, т.е. двигательной области коры мозга, к ниж-
нему мотонейрону — нейроны двигательных ядер черепных
нервов и нейроны передних рогов спинного мозга. Патологи-
ческий процесс, развертывающийся при АБС в этих системах,
приводит к неуклонной гибели верхнего и нижнего мотоней-
ронов, а также волокон белого вещества проводящих путей,
берущих начало от нервных клеток области верхнего мотоней-
рона и волокон двигательных корешков черепных и передних
корешков спинномозговых нервов, образуемых аксонами нерв-
ных клеток, соответствующих нижнему мотонейрону.
Наиболее постоянным морфологическим изменением при
АБС является гибель больших мотонейронов с замещением их
астроцитарной глией. Гибель нейронов обнаруживается в III и
V слоях коры двигательной зоны головного мозга, особенно
заметная в V слое, представленном пирамидальными невроци-
тами и гигантскими пирамидальными невроцитами (клетками
Беца) в передней центральной извилине.
Деструкция волокон корково-спинномозгового пути про-
слеживается в белом веществе полушария, внутренней капсуле,
ножке мозга, основании моста мозга, пирамиде продолговатого
мозга, боковом и переднем канатиках спинного мозга. Потеря
мотонейронов, обнаруживаемая в виде выпадений разной сте-
пени выраженности, сопровождается образованием на их месте
глиальных узелков и нейрофагией.
Гибнут нейроны переднего рога спинного мозга, а также
нейроны двигательных ядер черепных нервов (подъязычного,
блуждающего, языкоглоточного, лицевого и тройничного с ак-
86
еонами). На разных участках корково-спинномозгового пути
деструкция волокон выражена неравномерно, в некоторых слу-
чаях обнаруживается лишь в отдельных регионах мозга.
Деструкция миелина и аксонов сопровождается удалением
продуктов распада, поглощаемых макрофагами, т.е. зернисты-
ми шарами (липофагами).
Все эти процессы развиваются в перечисленных структурах
головного и спинного мозга, как правило, симметрично, уро-
вень их максимальной выраженности определяет ту или иную
форму АБС — бульбарная, спинальная и др.
В представленных нами материалах описаны случаи АБС с
длительным продолжением заболевания в условиях ИВЛ, за-
меняющей угасающее собственное дыхание больных. Смерть
была отсрочена на довольно значительный период времени. В
течение всего этого периода (разного у всех больных) АБС
продолжал прогрессировать, что в условиях ИВЛ, перенесшей
больных за порог смерти от ДН, наложило определенный от-
печаток на распространенность и характер морфологических
изменений нервной системы и скелетных мышц. Это различие
в морфологических изменениях, наблюдающихся при АБС,
протекающем в условиях ИВЛ и в "обычных" условиях, трак-
туется нами как патоморфоз АБС в условиях продления жизни
методом ЦВЛ.
Часть результатов этих клинических наблюдений была
опубликована Н.В.Коноваловым и соавт. (1962), Л.М.Поповой
и соавт. (1987). В основу настоящих материалов положены
результаты клинических наблюдений и морфологических иссле-
дований 10 больных АБС, жизнь которых была продлена методом
ИВЛ на сроки от Iі/2 до 172 мес при общей продолжительности
заболевания от 12 до 272 мес. Смерть этих больных была
обусловлена различными причинами (см. табл. 1).
Морфологические изменения структур ЦНС, обеспечиваю-
щих двигательные функции, имели в указанных наблюдениях
ряд особенностей, зависящих от продолжительности ИВЛ и
общего срока болезни, а также начальной локализации пато-
логического процесса, нарушающего функции двигательной
системы.
Первую группу составили больные Б., И., Т. и 3. с общей
продолжительностью АБС от 12 до 29 мес при ИВЛ от 1У2 до
15 мес.
В случае Б. была первоначальная бульбарная локализация,
начавшаяся нарушением функции языка и глотания. Общая
продолжительность заболевания составила 16 мес, и ИВЛ про-
водилась в течение 10 мес (см. табл. 1). Причиной смерти был
гнойный медиастинит, развившийся вследствие трахеоэзофа-
рингеального свища.
87
Морфологическое исследование выявило отсутствие нейро-
нов в ядрах подъязычного нерва с обеих сторон от средней
линии, на их месте возникли глиальные узелки и диффузный
глиоз. Полное отсутствие нейронов и выраженный глиоз об-
наружены и в двойном ядре. В двигательных ядрах тройничных
нервов и в ядрах лицевых нервов также выявлены выпадения
нейронов. Оставшиеся нервные клетки имели шаровидную или
грушевидную форму, некоторые были в виде клеток-теней,
другие содержали в цитоплазме большое количество липофус-
цина. На месте погибших нейронов выявлены глиальные узел-
ки. Ядра глазодвигательных нервов были без изменений. В крас-
ных ядрах и черном веществе среднего мозга изменений также
не обнаружено. Основная масса нейронов передних рогов шей-
ного отдела спинного мозга погибла. В грудном, поясничном
и крестцовом отделах нейроны передних рогов уменьшены, их
отростки окрашиваются слабо либо не видны (рис. 10). Неко-
торые еще сохраняют следы аксонального бугорка, но уже
происходит деформация мотонейрона, виден распад хроматина
на базофильные глыбки, и характерно окружение таких ней-
ронов глиальными клетками (рис. 11). В некоторых из них
определяется липофусцин, заполняющий цитоплазму. Ядра
нейронов уменьшены, имеют вытянутую форму, расположены
эксцентрично (рис. 12), причем эта эктопия иногда настолько
выражена, что ядро кажется вытолкнутым из цитоплазмы. Яд-
рышки сохранны в большинстве нейронов. Цитоплазма во
многих нейронах вакуолизирована. Форма их грушевидная, что,
по-видимому, обусловлено утратой каркасных свойств цитоске-
лета. На месте погибших нейронов видны глиальные узелки,
вокруг некоторых контурирующих нейронов имеются глиаль-
ные клетки, отчетливо определяется нейронофагия (рис. 13).
Оксифильные включения (рис. 14) обнаружены в цитоплазме
многих мотонейронов, чаще включения спарены, множествен-
ны. Цитоплазма вакуолизирована, деформирована. Ядрышко,
кариоплазма с явлениями гиперхроматоза, ядерная мембрана
неправильной формы. Ядрышко сохранено. В передних цент-
ральных извилинах обратило на себя внимание значительное
количество липофусцина в цитоплазме нервных клеток всех
слоев коры. Гигантопирамидальные невроциты (клетки Беца)
не имели отростков, также содержали большое количество
липофусцина, их ядра были смещены к периферии цитоплаз-
мы, последняя имела гомогенную структуру либо окрашива-
лась, была вакуолизирована. В корково-спинномозговых путях
наблюдался распад миелина, прослеживавшийся на всех уров-
нях. В субкортикальном белом веществе передних центральных
извилин видны деструкция волокон, гнездные скопления зер-
нистых шаров (липофагов). Миелин в этих скоплениях не
88
РисЛО. Мотонейроны переднего рога Ш поясничного сегмента
спинного мозга. Потеря формы нейронов, хроматолиз, вакуоли-
зация цитоплазмы, нейронофагия (стрелка). Окраска тионином.
Ув. 400.
РисЛІ. Деталь предыдущего рисунка. Распад хроматина в мо-
тонейроне, базофильные глыбки окружены светлым полем. Ок-
ругление контуров цитоплазмы, сохранились только два отрост-
ка. Окружение мотонейрона глиальными клетками. Окраска
тионином. Ув. 600.
Рис. 12. Деформация мотонейрона переднего рога спинного
мозга. Вакуолизация цитоплазмы и кариоплазмы. Эктопия ядра
и потеря его формы. Окраска тионином по Нисслю. Ув. 900.
Рис. 13. Мотонейроны Ш поясничного сегмента переднего рога
спинного мозга. Грушевидная деформация нейрона, потеря от-
ростков, гомогенность цитоплазмы. Нейрофагия распадающего-
ся нейрона. Окраска тионином по Нисслю. Ув. 900.
Рис. 14. Мотонейрон с эктопированным и деформированным ядром,
грушевидной формы клетки с оксифильными цитоплазматическими
включениями (стрелка), имеющими парное расположение и окружен-
ными светлым полем. Окраска по Унна. Ув. 900.
выявлялся. Непосредственно вблизи участков деструкции мие-
лина наблюдалось увеличенное количестю астроцитов. Распад
миелина с очаговыми и диффузными скоплениями зернистых
шаров, содержащих продукты распада волокон корково-спинно-
мозгового пути, прослеживался во внутренней капсуле в области
локализации корково-ядерных и корково-спинномозговых воло-
кон (колено), в основании ножки мозга, в основании моста, в
пирамидах продолговатого мозга (рис. 15) и в области пере-
креста пирамид (рис. 16). Наиболее выраженный распад мие-
лина волокон корково-спинномозгового пути был выявлен в
спинном мозге. Полному распаду подвергся миелин волокон
латерального и, в меньшей степени, переднего корково-спин-
номозговых путей на всем протяжении спинного мозга. В облас-
ти волокон латерального корково-спинномозгового пути зернис-
тые шары располагались компактно и их скопления были четко
отграничены от остальных отделов бокового канатика (рис. 17).
По периферии распавшегося бокового корково-спинального
пути была спонгиозная структура без глиозной реакции.
91
Рис.15. Распад миелина корково-спинномозговых путей в области
пирамид продолговатого мозга. Окраска по Шпильмейеру. Мик-
ропланар 65.
Больной И. страдал АБС 12 мес, ИВЛ проводилась в тече-
ние \ХІ2 мес. Первый симптом — слабость мышц левой ноги.
В течение всех 12 мес парезы прогрессировали вплоть до раз-
вития параличей мышц ног и глубоких парезов остальных
мышц, включая диафрагму. Максимально выраженные изме-
нения были обнаружены в грудных и поясничных сегментах
спинного мозга. Почти все нейроны передних рогов в этих
сегментах отсутствовали, на их месте сформировались глиаль-
ные узелки, отмечался диффузный астроглиоз передних рогов.
Единичные оставшиеся нервные клетки имели округлую, гру-
шевидную форму, их цитоплазма была сетчатого вида за счет
вакуолизации, содержала значительное количество липофусци-
на. Ядра были уменьшены, гиперхромны, смещены к перифе-
рии цитоплазмы (рис. 18). Отдельные нейроны имели вид
клеток-теней. В шейных сегментах основная масса нейронов
была изменена: ядра гиперхромны, деформированы, эктопи-
рованы к периферии цитоплазмы, ядрышки увеличены. Со-
хранилась основная популяция мотонейронов' всех двигатель-
92
Рис.16. Распад корково-спинномозговых путей в области пере-
креста пирамид продолговатого мозга. Окраска шарлахом. Мик-
ропланар 65.
Рис.17. Распад волокон боковых канатиков спинного мозга в
области локализации корково-спинномозговых путей. Ок-
раска по Шпильмейеру. Микропланар 65.
Рис. 18. Мотонейрон переднего рога V шейного сегмента спинного
мозга. Контуры цитоплазмы грушевидной формы. Цитоплазма вакуоли-
зирована и заполнена липофусцином, ядро эктопировано и деформи-
ровано, ядрышко увеличено. Окраска тионином по Нисслю. Ув. 1400.
ных ядер ствола. В ядрах подъязычного, двоякого нервов она
составляла от 10 до 15 клеток на 1 срез. В цитоплазме нейронов
наблюдались хроматолиз, скопление липофусцина. Начальный
отдел аксона был утолщен, ядра смещены к периферии цито-
плазмы. Несколько уменьшенных нервных клеток имели гру-
шевидную и овальную форму, их цитоплазма окрашивалась
бледно.
Измененные таким образом нейроны распределялись моза-
ично в указанных ядрах. Значительный контраст представляли
ядра лицевого нерва. Основная популяция мотонейронов также
сохранялась. В отдельных срезах их насчитывалось до 30—40
клеток. В них обнаруживались четкие мозаичные изменения.
Большее число мотонейронов сохраняло форму, иногда аксон
и дендриты, но уже в цитоплазме появлялись скопления ли-
пофусцина. Наряду с этим обнаруживались в срезе 1—2 поги-
бающих нейрона с типичной картиной деформации, вакуоли-
зации, периферическим смещением ядра.
В ядрах мозгового ствола и в черном веществе обнаружи-
94
вались глиальные узелки, нейронофагая, периваскулярные ин-
фильтраты. В передних и боковых канатиках спинного мозга во
всех отделах деструкция миелина занимала область локализации
волокон корково-спинномозговых путей при полной сохран-
ности, как и в предыдущих наблюдениях, задних канатиков.
Первым проявлением заболевания у больной Тр., 27 лет,
был парез мышц правой ноги. Общая продолжительность за-
болевания 26 мес, ИВЛ 4 мес. В передних рогах поясничных
и грудных сегментов почти полная гибель нейронов. Единич-
ные сохранившиеся нервные клетки резко уменьшены в объе-
ме, с бледной вакуолизированной цитоплазмой, деформирова-
ны (округлены), без отростков. Ядра смещены к периферии
цитоплазмы, некоторые неправильной формы, ядерная мем-
брана гиперхромна, ядрышко сохранено. Некоторые нейроны
с признаками нейронофагии. Диффузная пролиферация астро-
цитов на территории передних рогов. В шейных и верхних
грудных сегментах значительное количество мотонейронов со-
хранно, но все они изменены: в одних глыбки хроматина
различимы, аксоны набухшие, в других большое количество
липофусцина в цитоплазме, смещающего ядра к периферии ее,
многие нейроны в виде клеток-тканей. Сходные изменения
обнаружены в нейронах ядер подъязычного, блуждающего, ли-
цевого нервов и мотонейронах тройничного нерва. Кроме того,
в них выявлена и отчетливая пролиферация астроцитов. Ней-
роны ядер Кларка сохранны. В передней центральной извили-
не определяются клетки Беца (рис. 19), однако они имеют
изменения: форма их округла, отростки набухшие, укорочены,
в цитоплазме хроматолиз, рисунок ее сетчатый, напоминает
мелкую вакуолизацию, ядро смещено к краям цитоплазмы,
деформировано, ядрышко сохранно (рис. 20). Ядра глазодви-
гательных нервов сохранны. Распад миелина выявлялся в бо-
ковых и передних канатиках спинного мозга в области корко-
во-спинномозговых путей, в них определялось большое коли-
чество зернистых шаров ("шарлаховая" стадия распада
миелина). В пирамидах продолговатого мозга и волокнах кор-
ково-спинномозговых путей основания моста мозга отмечалось
побледнение миелина, а при окраске шарлахом в этих областях
выявлялись гнездные скопления зернистых шаров. Кроме
того, определялась очаговая и диффузная пролиферация аст-
роцитов.
У больного 3. заболевание началось с проксимальных отде-
лов рук. Общая продолжительность болезни 29 мес, ИВЛ 15
мес. Передние рога шейных и верхних грудных сегментов
имели ладьевидную форму. В передних и боковых канатиках
определялись полный распад миелина и скопления зернистых
шаров в области локализации корково-спинномозговых путей.
95
Рис. 19. Передняя центральная извилина. Диффузное выпадение
нейронов, цролиферация глиоцитов. Видны гигангопирамидальные
нейроны (клетки Беца). Окраска тионином по Нисслю. Ув. 40.
Рис. 20. Хроматолиз цитоплазмы, эктопия ядра гигантопирами-
дального нейрона (клетки Беца). Окраска тионином по Нисслю.
Ув. 1000.
Особенно большие скопления зернистых шаров были выявле-
ны в периваскулярных пространствах. В грудных и поясничных
сегментах распад миелина был более выражен в боковых ка-
натиках (рис. 21). Распад миелина до "шарлаховой" стадии
прослеживался также в области перекреста пирамид (рис. 22)
в продолговатом мозге, в среднем мозге (рис. 23) и во внут-
ренней капсуле в области локализации корково-спинномозго-
вых и корково-ядерных (рис. 24) волокон. В передних рогах
всех отделов спинного мозга обнаруживалось по 5—6 нейронов
на 1 сегмент, причем они были безотростчаты, уменьшены в
объеме и имели овальную, грушевидную форму (рис. 25), их
ядра были смещены в периферические участки цитоплазмы,
ядрышко сохранно. В поясничных сегментах обнаруживалось
не более 10—11 нейронов на один сегмент. Тигроид в них не
определялся, цитоплазма заполнена липофусцином. Выявля-
лась также пролиферация астроцитов, особенно резко выра-
женная в периферических отделах передних рогов. На месте
погибших нейронов были видны глиальные узелки, состоящие
из астроцитов с увеличенными отростками. Ядра Кларка со-
хранны, среди нейронов видны единичные глиальные узелки.
Задние канатики, как и в предыдущих наблюдениях, сохра-
нили свою нормальную структуру во всех отделах спинного
мозга, что резко контрастирует с боковыми и передними ка-
натиками.
В ядрах подъязычных нервов и в двояких ядрах выяг^лись
полное выпадение нейронов и резко выраженная пролифера-
ция астроцитарной глии, что четко выделяет эти ядра из ок-
ружающих структур продолговатого мозга. В ядрах лицевых
нервов и в двигательных ядрах тройничных нервов сохранилось
большинство нейронов, местами в них определялись глиаль-
ные узелки. Оставшиеся нейроны этих ядер имели округлую
форму, содержали в цитоплазме большое количество липофус-
цина. Цитоплазма была вакуолизирована, ядро находилось на
ее периферии, ядрышки были сохранны. Ядра глазодвигатель-
ных нервов были сохранны. В передних центральных извили-
нах выявлены гиперхромные гигантопирамидальные нейроны
(клетки Беца) с укороченными отростка?ш. В белом веществе,
прилежащем к коре этих извилин, местами выявлялось поблед-
нение миелина.
Вторую группу наблюдений составили 3 случая с относи-
тельно одинаковой продолжительностью АБС — 35, 37 и 39
мес, сходными начальными симптомами — парезами мышц
ног. Продолжительность ИВЛ у этих больных составила 18, 23
и 26 мес. Морфологические изменения головного и спинного
мозга во вс^х 3 случаях были практически одинаковы. Спинной
мозг был истончен до У4 нормы за счет резкого уменьшения
97
Рис. 21. Распад волокон боковых и передних канатиков. Уровень
II грудного сегмента спинного мозга. Окраска шарлахом. Микро-
планар 65.
Рис. 22. Распад волокон в области передних канатиков (стрел-
ки) и в корково-спинномозговом перекресте. Окраска по Шпиль-
мейеру. Микропланар 60.
Рис. 23. Распад волокон корково-сішнномозгового пути и кор-
ково-ядерных трактов (стрелки) в области ножки мозга на уровне
красного ядра. Окраска по Шпильмейеру. Ув. 60.
Рис. 24. Распад волокон внутренней капсулы в области корково-
спинномозгового пути и корково-ядерных трактов (стрелка). Ок-
раска по Шпильмейеру. Ув. 40.
Рис. 25. Нейроны переднего рога V поясничного сегмента спинного
мозга. Деформация (башюновидная) двух из них, потеря отростков,
эктопия ядра в одном из них. Выраженная пролиферация глиоцитов.
Окраска тионином по Нисслю. Ув. 400.
объема передних рогов спинного мозга, боковых и передних
канатиков. С ними резко контрастировали сохранные объемы
задних рогов и задних канатиков. При микроскопии обнару-
жилось, что нейроны в передних рогах почти полностью от-
сутствовали, лишь в некоторых сегментах были видны единич-
ные нейроны. Они уменьшены в объеме, деформированы, ядра
смещены к периферии. В оставшихся нейронах гиперхроматоз,
хроматолиз, деформация тел нейронов была грушевидной, тра-
пециевидной и шаровидной формы. Цитоплазма одних нейро-
нов была комковатого вида, чаще сетчатая. В других сегментах
нейроны были также уменьшены в объеме, имели форму оваль-
ных пузырьков. Ядра смещены к периферии цитоплазмы, не-
редко выбухали из нее. Ядрышко в некоторых нейронах выяв-
лялось четко, в других вместо ядрышек в ядерной плазме
появились мелкие образования и гиперхроматоз ядерной мем-
браны. Нейрон приобретал трапециевидную форму, цитоплаз-
ма состояла из масс липофусцина. Включения были оксифиль-
ными, крупными, имеющими иногда двухконтурную оболочку,
окруженными светлым ободком. По соседству с ними распо-
лагались комковатые массы. Некоторые нейроны имели набух-
100
ший вид, сетчатую цитоплазму с нечеткими контурами и круп-
ные базофильные включения, окруженные плотной оболочкой.
Контуры другах нейронов, напротив, четко ограничены, цито-
плазма и отростки набухшие, имеют сетчатую вакуолизирован-
ную структуру и множественные включения. Встречались безъ-
ядерные нейроны трапециевидной формы, гомогенно окра-
шенные. В их цитоплазме наблюдались гиалиноподобные
включения, окруженные светлым ободком (рис. 26). В ткани
передних рогов выраженная диффузная пролиферация глии,
встречались мелкие узелки, состоящие из 3—4 клеток макро-
фагеального типа, а также плазматические астроциты, а по
соседству с передним рогом — периваскулярная лимфоцитар-
ная инфильтрация.
Важно заметить, что в более поздние сроки жизни больных
(35—39 мес) Е., А. и Ш. включения резко отличаются: произо-
шло увеличение их размеров, появление внутренней структуры.
Пролиферация астроцитарной глии была резко усилена,
местами сформировались густые скопления ее. Особое значе-
ние имеет поражение ядер черепных нервов ствола, не встре-
чавшееся в предыдущих случаях.
В ядрах подъязычных нервов, дорсальных ядрах блуждаю-
щих нервов и двояких ядрах обнаружились значительные вы-
падения нейронов. В ядрах лицевых нервов и в двигательных
ядрах тройничных нервов основная популяция нейронов со-
хранялась, но они имели несвойственную им форму — округ-
лую, овальную, треугольную, вытянутую. Объем цитоплазмы
был уменьшен, отростки отсутствовали, цитоплазма была ва-
куолизированной или гомогенной и бледноокрашенной. Во
многих клетках хроматин представлял собой комковатые
массы, ядро смещено к краю цитоплазмы, но ядрышко сохран-
но (рис. 27). Одновременно с этими изменениями выявлялась
четкая мозаичность в степени поражения мотонейронов.
Кроме описанных погибающих нейронов бесструктурных кле-
ток-теней с периферическим смещенным ядром, встречаются
почти сохранные либо с начальными признаками изменений
нейроны. Ядра этих нейронов занимают центральное положе-
ние в цитоплазме, в которой, однако, уже заметен хроматолиз,
отростки выявляются нечетко или уже отсутствуют. Во всех
указанных ядрах отмечались резко выраженная пролиферация
астроцитов, глиальные узелки, нейронофагия. Аналогичные
изменения были в ядрах V пары, где сохранилась минимальная
популяция погибающих нейронов, но при этом отмечалась
сходная мозарчностъ в степени поражения: наблюдались ок-
ругления, грушевидная деформация, диффузная окрашивае-
мость, но ядро занимало центральное положение и имело
сохранную структуру. На фоне диффузной пролиферации глии
101
Рис. 26. Мотонейрон V поясничного сегмента спинного мозга.
Деформация цитоплазмы, гомогенная структура, гиалиноподоб-
ное включение в цитоплазме, окруженное светлым полем. Ок-
раска гематоксилином и эозином. Ув. 400.
Рис. 27. Ядро лицевого нерва. Один нейрон без изменений
(стрелка). Остальные с гиперхроматозом цитоплазмы, эктопией
ядер. Цитолиз и выпадение нейронов. Пролиферация гаиоцитов.
Окраска тионином по Нисслю. Ув. 700.
Рис. 28. Нейроны блокового нерва. В центре нейронофагия, осталь-
ные нейроны с центральным хроматолизом. Окраска тионином по
Нисслю. Ув. 600.
местами происходило ее сгущение. В ядрах глазодвигательных
нервов нейроны были сохранны. В их цитоплазме содержалось
большое количество липофусцина. В ядре блокового нерва
найдено локальное скопление астроцитов, напоминающее
формирующийся глиальный узелок (рис. 28). Во всех сегментах
спинного мозга, вплоть до крестцовых, наблюдался распад
миелина передних и боковых канатиков со скоплениями боль-
шого количества зернистых шаров, особенно выраженный в
областях локализации волокон переднего и бокового корково-
спинномозговых путей (рис. 29). Распаду подверглись также
все миелинизированные волокна, проходящие в передних
рогах, окружающие их и латеральное промежуточное (серое)
вещество, что свидетельствует о полном перерыве путей, иду-
щих к переднему рогу. В корково-спинномозговых путях, на
уровне перекреста пирамид, продолговатого мозга и моста
мозга (рис. 30) выявлен распад миелина и зернистые шары,
расположенные отдельными группами и рассеянные диффузно
в пределах структур, относящихся к корково-спинномозговому
пути (рис. 31). Такой же распад корково-спинномозговых и
корково-ядерных волокон обнаружился и в основании ножки
мозга (рис. 32), а также в области перехода корково-спинно-
103
Рис. 29. Распад волокон передних и боковых канатиков, умень-
шение объема передних рогов. Полная сохранность задних кана-
тиков и задних рогов I грудного сегмента. Множество зернистых
шаров в боковых и передних канатиках. Окраска шарлахом. Мик-
роішанар 100.
Рис. 30. Деструкция волокон корково-спинномозговых путей в ос-
новании моста мозга. Окраска по Шпильмейеру. Микроішанар 100.
Рис. 31. Мозаичное расположение зернистых шаров (стрелки)
среди волокон корково-спинномозгового пути в основании
моста мозга. Окраска шарлахом. Микропланар 100.
Рис. 32. Тотальный распад волокон корково-спинномозгового
пути в месте его расположения в ножке мозга. Скопления зернис-
тых шаров. Окраска шарлахом. Ув. 100.
мозгового пути от внутренней капсулы к ножке мозга и в
самой внутренней капсуле. Выпадения нейронов в среднем
мозге выявлялись только в области черного вещества. На их
месте были видны или макрофаги, содержащие меланин рас-
павшихся нейронов, или свободно лежащие зерна меланина.
Во всех отделах черного вещества были видны пролиферация
астроцитов и глиальные узелки. Ядра глазодвигательных
нервов, красные ядра, нижние холмики крыши среднего
мозга были без изменений. В корково-спинномозговых путях
на продольных срезах спинного мозга всюду выявлялся
распад миелиновых оболочек (рис. 33). При импрегнации
серебром отмечался распад аксонов (рис. 34). В этих участках
спинного мозга имелось большое количество зернистых
шаров, диффузно рассеянных, а также расположенных пери-
васкулярно.
Третья группа, состоящая из трех наблюдений (Ж., Г., П.),
отличалась от предыдущих необычайно длительными сроками
жизни при ИВЛ. В случаях Ж. и Г. ИВЛ проводилась в течение
35 и 87 мес при общей продолжительности заболевания 79 и
99 мес. Случай П. является уникальным: общая продолжитель-
ность заболевания составила 272 мес, ИВЛ — 172 мес. В силу
исключительности это наблюдение будет рассмотрено отдельно
(см. ниже). В первых 2 случаях, которые имеют сходные черты,
лептоменинкс спинного мозга утолщен и инфильтрирован в
глубине передней щели небольшим количеством лимфоцитов.
Передние и боковые канатики уменьшены в объеме. Стенки
сосудов и капилляров утолщены за счет увеличения в них
коллагеновых волокон, местами в периваскулярных простран-
ствах вен видны скопления зернистых шаров. Контуры перед-
них рогов изменены за счет почти полного выпадения нейро-
нов во всех отделах спинного мозга. Лишь в отдельных сег-
ментах были обнаружены единичные* нейроны. Они были
округлой, грушевидной формы, без отростков, с вакуолизиро-
ванной цитоплазмой. Их ядра были смещены к периферичес-
ким участкам цитоплазмы. Выявлялась диффузная пролифера-
ция астроцитов, на месте погибших нейронов были видны
глиальные узелки.
Ядра Кларка изменены неодинаково с каждой стороны от
средней линии. С одной стороны в них сохранилось до 14—15
нейронов в сегменте, с другой стороны — не более 3—4. Форма
большинства нейронов этих ядер изменена, отростки отсутст-
вуют, цитоплазма вакуолизирована, ядро смещено к периферии
цитоплазмы. Нейроны боковых рогов сохранны. В передних
рогах на месте выпавших нейронов видно множество глиаль-
ных узелков. Обратили на себя внимание изменения сосудов
микроциркуляторного русла передних рогов, а именно их пере-
106
Рис. 33. Распад волокон корково-спинномозгового пуги в V по-
ясничном сегменте спинного мозга. Окраска по Шпильмейеру.
Ув. 600.
Рис. 34. Распад аксонов волокон корково-спинномозгового пуги.
Импрегнация по Билыновскому. Ув. 800.
стройка на редуцированный кровоток вследствие утраты ос-
новной массы их структурно-функциональных элементов —
нейронов. Эти изменения микрососудов выражались в капил-
лярофиброзе и образовании микрососудистых конволютов
(рис. 35). В передних рогах выявлялся также распад миелини-
зированных волокон, прослеживавшийся вплоть до границы с
задним рогом.
Распад волокон наблюдался также и в боковых и передних
корково-спинномозговых путях, причем в случае Г. распад
волокон этих канатиков завершился, о чем можно судить по
их резко уменьшенному объему и структуре, представленной
глиальным рубцом, не содержащим миелина. В случае Ж. в
боковом корково-спинномозговом пути еще остались зернис-
тые шары, локализующиеся в основном периваскулярно (рис.
36), т.е. процесс удаления распавшихся волокон еще не был
завершен к моменту смерти больной. Задние канатики в этих
случаях, как и в вышеописанных, были полностью сохранны.
В передних корешках также были признаки распада нерв-
ных волокон при сохранности соединительнотканных: были
выявлены скопления зернистых шаров, отсутствие миелина в
нервных волокнах. Местами были видны очаговые и диффуз-
ные скопления лимфоцитов. С передними корешками резко
контрастировали своей сохранностью задние корешки.
В ядрах подъязычных нервов и двояких ядрах остались лишь
единичные нейроны, ядра их были эктопированы, отростки
отсутствовали. На остальной территории этих ядер были видны
глиальные узелки, оставшиеся на месте нейронофагии, и диф-
фузная пролиферация астроцитов. В ядрах лицевых нервов и
двигательных ядрах тройничных нервов обнаружено до 8—10
нейронов в срезе, в значительной степени измененных так же,
как и в предыдущих ядрах. Отмечалась также выраженная
пролиферация глиоцитов и нейронофагия отдельных клеток.
В случае Ж. еще оставались нейроны с комковатыми массами
хроматина в цитоплазме и слабо контурированными отростка-
ми. В ядрах глазодвигательных нервов основная масса нейро-
нов была сохранна.
В передних центральных извилинах гигантопирамидальные
нейроны (клетки Беца) имели правильную ориентацию, их
отростки были набухшими, некоторые настолько, что приоб-
рели лентовидную форму, другие контурировались нечетко.
Ядра этих нейронов были сохранны, их структура без сущест-
венных изменений. Отдельные клетки приобрели округлую
форму. Отмечалась пролиферация глиоцитов. В подлежащем
белом веществе были видны вздутия волокон, пролиферация
олигодендроглиоцитов, местами были обнаружены скопления
лимфоцитов в периваскулярных пространствах крупных вен.
108
Рис. 35. Передний рог II шейного сегмента спинного мозга. Видны
оставшиеся единичные нейроны, диффузная пролиферация глиоци-
тов, сформированный конволют (стрелка). Окраска тионином по Нис-
слю. Ув. 100.
Рис. 36, VIII грудной сегмент спинного мозга. Периваскулярное скоп-
ление (стрелка) зернистых шаров в боковом канатике. Уменьшение
объема боковых и передних канатиков. Окраска шарлахом. Микро-
планар 60.
Распад волокон корково-спинномозговых путей четко просле-
живался на уровнях внутренней капсулы, ножки мозга, моста,
продолговатого мозга и особенно четко на уровне перекреста
пирамид и далее в спинном мозге (рис. 37). Распад волокон
прослеживался и по ходу корково-ядерных путей.
Наиболее выраженные и распространенные изменения го-
ловного и спинного мозга, а также мышц были обнаружены у
больного П., умершего спустя 272 мес от начала заболевания.
ИВЛ продлила жизнь на 172 мес. Последние 96 мес он находился
в состоянии тотального паралича (синдром деэфферентации).
На аутопсии выявлена резко выраженная атрофия всех ске-
летных мышц, диафрагмы и языка. Глазодвигательные мышцы
не были изменены. Спинной мозг истончен за счет уменьше-
ния объема передних и боковых канатиков, где большинство
волокон не выявлялось (рис. 38) и лишь редкие волокна имели
остатки миелиновой оболочки и аксон. Макрофаги, содержащие
липиды, локализовались только периваскулярно. В передних и
боковых канатиках были найдены также гипертрофированные
астроциты (заместительный глиоз). Все это свидетельствует о
завершенности процесса дезинтеграции миелина и аксонов боль-
шинства волокон и процессов удаления продуктов распада.
В передних рогах спинного мозга исчезли почти все нейро-
ны, и на их месте располагались гипертрофированные астро-
циты. В грудном и шейном отделах спинного мозга найдены
единичные уменьшенные нейроны, некоторые из них с при-
знаками центрального хроматолиза. На месте многих нейронов
глиоз местами приобрел изоморфный характер. Явлений ней-
рофагии не найдено. Перечисленные изменения можно рас-
сматривать как признаки давнего и длительно протекающего
процесса гибели нейронов и нервных волокон, что подтверж-
далось и характером изменения сосудов спинного мозга. Стен-
ки интрамедуллярных сосудов и капилляров боковых канати-
ков и передних рогов были с явлениями фиброза, их просветы
сужены и облитерированы, сосуды сближены (следствие "минус-
ткани") (рис. 39). Одна из ветвей передней спинальной артерии
на уровне III шейного сегмента имела строение замыкающей
артерии со свойственными таким артериям продольно распо-
ложенными мышечными волокнами кнутри от циркулярных
(рис. 40).
Дезинтеграция миелина и аксонов с завершенным процес-
сом удаления продуктов распада волокон обнаружена также в
области корково-спинномозгового пути на всех уровнях моз-
гового ствола и во внутренней капсуле симметрично с обеих
сторон от средней линии. В белом веществе, в зоне проекции
передних центральных извилин, сохранились лишь немного-
численные волокна. Гигантопирамидальные нейроны (рис. 41)
110
Рис. 37. Распад волокон и резкое уменьшение объема боковых и пе-
редних канатиков при полной сохранности задних канатиков VII шей-
ного сегмента спинного мозга. Контуры передних рогов прослежива-
ются. Окраска по Шпильмейеру. Микропланар 60.
Рис. 38. Распад волокон боковых и передних канатиков, резкое умень-
шение их объема. Задние канатики сохранены. Передние рога не вид-
ны. Окраска по Шпильмейеру. Микропланар 60.
Рис. 39. Резко выраженное утолщение микрососудов за счет их фиброза
в боковом канатике VII шейного сегмента спинного мозга. Окраска
пикрофуксином по Ван?Гизону. Ув. 100.
Рис. 40. Замыкающая артерия в глубине продольной срединной щели
III шейного сегмента спинного мозга. Окраска пикрофуксином по Ван-
Гизону. Ув. 100.
Рис. 41. Кора передней центральной извилины. Виден гигантский
пирамидальный нейрон (клетка Беца) с центральным хроматолизом
и эктопией ядра при значительном уменьшении объема клетки. Гли-
альные узелки на месте погибших нейронов этого слоя коры. Окраска
тионином по Нисслю. Ув. 400.
уменьшены, их цитоплазма и ядра гиперхромны, расположены
эксцентрически, в клетках обнаружены признаки центрального
хроматолиза с эктопией и некоторым увеличением ядра.
Массивное выпадение нейронов выявлено в двигательных
ядрах мозгового ствола. На месте ядер подъязычных нервов
остались лишь единичные резко уменьшенные нейроны, их
цитоплазма гиперхромна, содержала большое количество ли-
пофусцина, ядра не определялись. На месте исчезнувших ней-
ронов отмечались пролиферация и гипертрофия астроцитов с
крупными светлыми ядрами. Подобным же образом изменены
двоякие ядра и ядра лицевых нервов. В двигательных ядрах
тройничных нервов остались лишь единичные нейроны с ги-
перхромной цитоплазмой и уменьшенным ядром. В ретикуляр-
ной формации продолговатого мозга отмечено исчезновение
большинства нейронов, и на их месте возникло большое ко-
личество гипертрофированных астроцитов; оставшиеся нейро-
ны уменьшены, с центральным хроматолизом. В остальных
отделах продолговатого мозга, моста, среднего мозга, мозжечка
выявлены выпадение многих нейронов и сморщивание остав-
113
Рис. 42. Слой клеток Пуркинье коры мозжечка. Набухание и цент-
ральный хроматолиз в одних клетках Пуркинье, гиперхроматоз и
атрофия других. В молекулярном слое коры пролиферация астроцигов
на месте дендритов клеток Пуркинье. Окраска тионином по Нисслю.
Ув. 100.
шихся. Во многих нейронах обнаружен гиперхроматоз цито-
плазмы в сочетании с гиперхроматозом и уменьшением ядра,
центральный хроматолиз, увеличение и эктопия ядра. Такие
же изменения найдены в ретикулярной формации моста и
среднего мозга, ядрах моста, нижних оливах, клетках Пуркинье
(рис. 42) и ядрах мозжечка. В области дорсальных ядер блуж-
дающих нервов, синего пятна и черного вещества среднего
мозга большинство нейронов отсутствовало, на их месте нахо-
дились глыбки пигмента и гипертрофированные астроциты.
В латеральной части моста среди нейронов мелкоклеточного
ядра ретикулярной формации на уровне расположения ядер
отводящих нервов и в пробковидном ядре мозжечка обнару-
жены гранулемы диаметром 300 и 500 мкм, состоящие из
гипертрофированных астроцигов, глиальных макрофагов (мик-
роглиоцитов) и лимфоцитов (рис. 43).
Из двигательных ядер мозгового ствола наиболее сохранны-
ми остались ядра отводящих, блоковых и глазодвигательных
нервов (рис. 44). В них выпали лишь единичные нейроны,
остальные приобрели округлую форму, в некоторых преобладал
114
Рис. 43. Гранулема в мелкоклеточном ядре ретикулярной формации
моста мозга. Окраска тионином по Нисслю. Ув. 400.
Рис. 44. Ядро глазодвигательного нерва. Основная масса нейронов
сохранна, в них наблюдается перинуклеарный хроматолиз. Видна про-
лиферация астроцитов. Окраска тионином по Нисслю. Ув. 200.
Рис. 45. Двигательное ядро тройничного нерва. Выпадение большин-
ства нейронов, оставшиеся с гиперхроматозом цитоплазмы деформи-
рованы, в отдельных различается уменьшенное ядро. Диффузная про-
лиферация астроцитов. Окраска тионином по Нисслю. Ув. 100.
перинуклеарный хроматолиз. Единичные нейроны были смор-
щены или имели признаки цитолиза, в пределах этих ядер
отмечалась пролиферация астроцитов. Одна из мелких артерий
на поверхности верхнего двухолмия имела характерные при-
знаки замыкающей артерии, подобной той, которая находилась
на поверхности спинного мозга.
Описанное наблюдение дало новые факты, относящиеся
как к клиническим особенностям заболевания, протекающего
в условиях продления жизни методом дыхательной реанима-
ции, так и к морфологической картине его, ставшей реальнос-
тью в результате многолетнего прогрессирования патологичес-
кого процесса. Так, установлена определенная сохранность
глазодвигательных мышц, хотя и с признаками начальной ат-
рофии при светооптической микроскопии. Особенности харак-
тера и локализации морфологических изменений волокон бе-
лого вещества и ганглиозно-клеточных образований головного
и спинного мозга позволили сделать вывод о завершенности
процесса деструкции волокон корково-спинномозгового пути,
полной гибели практически всех нейронов ядер подъязычного
и лицевого нервов, двояких ядер, двигательных ядер тройнич-
ного нерва (рис. 45). Гигантопирамидальные нейроны и часть
нейронов других слоев моторной зоны коры, а также нейроны
116
Рис. 46. Изменения спинного мозга в 9 случаях АБС с различной
продолжительностью жизни в месяцах. Нарастающий распад воло-
кон боковых и передних канатиков с резким уменьшением их объема
с полной сохранностью задних канатиков. При продолжительности
болезни 16 мес (1 случай) распаду подверглись только срединные
отделы боковых канатиков в области расположения волокон боково-
го корково-спинномозгового пути. Окраска по Шпильмейеру. Мик-
ропланар 60.
других образований (см. выше) имели признаки "дегенерации"
и, по-видимому, также находились на пути к гибели. На дав-
ность и распространенность патологического процесса, кото-
рый привел к уменьшению массы головного и спинного мозга,
указывали и изменения сосудов: склероз, фиброз и запустева-
ние "метаболического" звена сосудистой системы, т.е. микро-
сосудов, и гемодинамическая перестройка "доставляющего"
звена — относительно крупных артерий поверхности спинного
мозга и мозгового ствола — в виде образования замыкающих
артерий с их внутрисосудистыми сфинктерами, а также пере-
стройка сосудов скелетных мышц с образованием артериоло-
венулярных анастомозов вследствие отсутствия капиллярной
сети, запустевшей вместе с атрофией мышечных волокон. При-
знаками еще продолжающихся патологических процессов яв-
ляются, помимо "дегенерирующих" нейронов, пролиферация
астроцитов и гранулемы, которые, впрочем, могут быть отне-
сены к проявлению и интеркуррентного заболевания.
Процесс в переднебоковых канатиках спинного мозга ока-
зался неоднозначным. Как видно из рис. 46, при продолжи-
117
тельности АБС, равной 16 мес (случай Б.), и первоначальной
бульбарной локализации патологического процесса выявилась
почти изолированная гибель бокового корково-спинномозго-
врго пути. В других случаях наблюдалось сходное поражение
переднебоковых канатиков, но с разной интенсивностью, что
было обусловлено различными сроками болезни. В конце 1-го
года было отмечено побледнение переднебоковых канатиков,
но сгущение распада миелина и очаговое скопление липофагов
были найдены в переднем и боковых трактах. В остальных
наблюдениях сохранялось такое же распределение, но степень
распада миелина и массивность скопления липофагов оказа-
лись наиболее выраженными в сроки от 35 до 39 мес от начала
болезни. При АБС, продолжающемся от 79 до 99 мес, отмеча-
лись заканчивающийся процесс распада миелина в переднебо-
ковых канатиках и начало атрофических процессов.
Особое место занимает случай П. с продолжительностью
АБС, равной 272 мес. Наступили тотальная гибель всего дви-
гательного нейрона и полная завершенность процесса гибели
переднебоковых канатиков спинного мозга с резко выражен-
ной акцентуацией передних и боковых корково-спинномозго-
вых путей. Во всех описанных случаях наблюдалась полная
сохранность задних канатиков.
Электронно-микроскопическое исследование произведено
в участках фронтальной коры (случай П.). В сохранившихся
нейронах отмечены лишь незначительные изменения: расши-
рение цистерн гранулярной эндоплазматической сети (ГЭС) и
вакуолизация митохондрий и миелиновых тел. В нейронах ГЭС
видны хорошо развитые тельца Ниссля. Пластинчатый ком-
плекс и везикулярные структуры не изменены. На телах ней-
ронов видны типичные синапсы. Отсутствие дегенеративно
измененных ультраструктур характерно для перикариона ней-
ронов и нервных волокон, нейропилия и синапсов (рис. 47).
В цитоплазме одного из нейронов обнаружено четко выяв-
ленное включение в виде упорядоченной ячеистой структуры,
связанной с гранулярной эндоплазматической сетью. Включе-
Рис. 48. Участок цитоплазмы астроцита (Ас) с изменениями ГЭС:
цистерны ГЭС фрагментированы, рибосомы распределены нерав-
номерно по мембранам цистерн, многие из них не имеют рибо-
сом. В других участках большое скопление рибосом, распределенных
неравномерно и асимметрично по мембранам цистерн. Матрикс ми-
тохондрий (М) уплотнен. Включение (ВК) образовано чередующими-
ся рядами материала высокой и низкой электронной плотности. Ув.
30 000. Ув. детали ВК 90 000.
118
Рис. 47. Участок цитоплазмы нейрона лобной коры с незначитель-
ными изменениями ультраструктур. Включение (ВК) связано с ГЭС. Ув.
35 000. Деталь ВК представляет ячеистую (сотовидную) структуру,
составленную из 17 шестифанников, фани образованы рибосомами.
Ув. 230 000.
I
Рис. 49. Полное отсутствие мышечных клеток в диафрагмальной мышце. На их месте — фибробласты и кол-
лагеновые волокна. Ув. 20 000.
Рис. 50. Общий вид мышечного волокна верхней прямой мышцы
глаза с сохранными органеллами и упорядоченными филаментами:
Z — полоски, М — митохондрии, Я — ядро. Ув. 30 000.
ние имеет гексогональную форму и построено из 17 кольце-
видных единиц, каждая из которых составлена из отдельных
электронно-плотных субъединиц, сходных с рибосомами. Диа-
метр отдельной ячейки равен 50 нм. Включение, составленное
из регулярно чередующихся рядов электронно-плотного мате-
риала с периодом, равным 25—30 нм, обнаруживалось также в
цитоплазме астроцитов. Изменения ультраструктур в астроци-
тарной глии по сравнению с нейронами выражены более резко.
Рибосомы не распределены равномерно по поверхности цистерн
ГЭС, образуя скопления разной величины и формы (рис. 48).
Субъединицы скоплений рибосом обладают повышенной элек-
тронной плотностью. Неравномерное распределение рибосом
по мембранам приводит к тому, что часть цистерн несет на
себе гроздевидные их скопления, часть их лишена. Скопления
рибосом образуют полисомы, в которых электронно-плотные
структуры образуют ряды. В митохондриях наблюдаются уп-
лотнение матрикса, нарушение правильного чередования
крист, вакуолизация и нарушение целости наружной мембра-
ны. В цитоплазме астроцитов содержится много липофусцина
и лизосом. Специальный интерес представляет электронно-
микроскопическое исследование глазодвигательных мышц. В ли-
тературе постоянно обсуждается вопрос об избирательной со-
хранности или незначительных нарушениях глазодвигательных
функций при АБС. Как известно, вся поперечнополосатая мус-
кулатура, иннервируемая мотонейронами передних рогов
спинного мозга, оказывается резко измененной либо вовсе не
содержит мышечных волокон. Электронно-микроскопическое
121
Рис. 51. Верхняя прямая мышца глаза. Реакция на АХЭ марки-
рует нервно-мышечные пластинки нескольких типов. МБ —
единичная терминаль типа моторной бляшки, ГО — множест-
венные окончания гроздевидного типа. Ув. 400.
Рис. 52. Ультраструктурное устройство моторной бляшки. ТА — тер-
минальное расширение аксона, заполненное синаптическими везикула-
ми (СВ); прилежащий к аксонной терминали участок мембраны мышеч-
ной клетки образует складки. Пространство между мембраной термина-
ли и сарколемой образует синаптическую щель (СЩ). Ув. 60 000.
исследование диафрагмы (рис. 49) больного П., прожившего в
условиях продленной жизни почти 14 лет, выявило полное
отсутствие мышечных волокон в диафрагме, которые замеще-
ны фибробластами и коллагеновыми волокнами. Резко отли-
чается сохранность мышечных волокон верхней прямой
мышцы глаза. В них видны интактные митохондрии, ядро,
мышечные филаменты и Z-полоски (рис. 50). Особо следует
отметить сохранность нервного аппарата, а также интенсив-
ность эфферентной иннервации. Реакция на ацетилхолинэсте-
разу (АХЭ) выявила характерный для нормальных глазодвига-
тельных мышц набор терминалей: единичные моторные бляш-
ки и множественные гроздевидные нервные окончания (рис. 51).
Аксонная терминаль контактирует со складчатой мембраной
миоцита и заполнена синаптическими везикулами (рис. 52).
В эндомизии обнаруживалось большое количество нервных
волокон с интактными аксонами. Представленные электрон-
но-микроскопическое и гистохимическое исследования дока-
зывают сохранность нервных терминалей и мышечных воло-
кон, т.е. всей двигательной единицы и свидетельствуют об
уникальной устойчивости глазодвигательных мышц в позднем
периоде развития тотального паралича при амиотрофическом
боковом склерозе.
123
Заключение
Морфологическое исследование центральной нервной сис-
темы при АБС в условиях продленной жизни на срок от 1,5 до
172 мес и общей продолжительности болезни от 12 до 272 мес
выявило прогрессирующую деструкцию двигательного нейрона
вплоть до тотальной гибели всей популяции мотонейронов и
дезинтеграции связанных с ними миелиновых волокон. Кли-
нически этот процесс выразился синдромом деэфферентации,
или тотальным вялым параличом.
Основная патология сводится к длительно нарастающим
изменениям мотонейронов, заканчивающихся их гибелью.
В двигательных структурах, еще сохраняющих популяцию ней-
ронов, прослеживаются разные формы деструкции их: хрома-
толиз, потеря аксонов и дендритов, выраженная деформация
контуров мотонейров, разные степени липидной дистрофии и
вакуольной дегенерации. Структура ядра мотонейрона сохра-
няется, но оно уменьшено в размерах, вытянуто и эктопиро-
вано. В цитоплазме происходит формирование разнообразных
включений (эозинофильных, базофильных, гиалиноподобных).
Процесс дегенерации мотонейронов заканчивается формиро-
ванием бесструктурных клеточных тел. Прослеживается их
нейронофагия. В местах тотальной гибели мотонейронов на-
блюдается выраженный изоморфный глиоз.
Процесс дезинтеграции и распада волокон белого вещества
акцентуирован в корково-спинномозговых путях и достигает
начала шарлаховой стадии к концу 1-го года болезни.
При первоначальной бульбарной локализации и гибели всей
популяции мотонейронов ядер нижней группы черепных нер-
вов к 16-му месяцу болезни наблюдались скопления липофагов
на месте волокон корково-спинномозгового (бокового) пути
при незначительной деструкции волокон остальных путей
спинного мозга. При первоначальной спинальной локализации
процесса распаду подвергаются обе части корково-спинномоз-
гового пути. Скопление липофагов обнаруживается к концу
1-го года болезни и достигает наибольшей степени к 4 годам.
В дальнейшем наблюдаются глиоз, фиброз сосудов, уменьше-
ние объема и атрофия переднебоковых отделов спинного
мозга. Задние канатики сохраняются в течение всего срока
продленной жизни при АБС.
Наблюдается полное завершение патологического процесса
во всех звеньях двигательного нейрона, кроме ядер глазодви-
гательных нервов, в которых отмечается сохранность нейронов.
Электронно-микроскопическое исследование мышц глазодви-
гательного нерва показало сохранность структуры нервно-мы-
шечного волокна и нервно-мышечных пластинок. Специаль-
124
ное значение имеют ультраструктурные изменения цитоплазмы
астроцитов и в меньшей степени сохранившихся нейронов
фронтальной коры. В гранулярном цитоплазматическом рети-
кулуме обнаружены вирусоподобные включения типа пикор-
навирусов. В случае уникального срока проведения ИВЛ при
светооптическом исследовании наряду с гибелью всего двига-
тельного нейрона, атрофией переднебоковых канатиков обна-
руживаются распространенные изменения нейронов ствола,
мозжечка и его ядер, черного вещества, синего пятна, коры
головного мозга, включая клетки Беца. Эти изменения могли
быть обусловлены утратой связей многих структур с разрушен-
ным общим конечным путем.
Прослеживание патологического процесса в двигательной
системе по срокам заболевания позволяет допустить возмож-
ность одновременного развития патологических изменений
мотонейронов и корково-спинномозгового пути. Вместе с тем
в конце первого года при первоначальной спинальной (пояс-
ничной) локализации и тотальной гибели всей популяции мо-
тонейронов в этом регионе гибель волокон корково-спинно-
мозгового пути выражена умеренно и скопления липофагов
носят очаговый характер.
Глава 5
Клинико-морфологическое сопоставление
Свыше столетия научные разработки патогенеза АБС про-
водились при классических формах болезни в условиях есте-
ственного его течения. Главной причиной смерти была ДН,
наступавшая вследствие параличей дыхательной мускулатуры
и бульбарных расстройств. Как показал наш опыт, длительное
применение аппаратов ИВЛ избавляло больных АБС от мучи-
тельных симптомов ДН, наступающих в последний период
болезни, и продлевало жизнь на различные, иногда длительные
сроки. В этих условиях приобретают особую значимость кли-
ническая эволюция и морфологическая структура процесса,
формирующиеся за пределами естественных сроков болезни.
Предметом обсуждения является продолжительность суще-
ствования патологически измененных ("заболевших") мото-
нейронов при АБС. Прежде всего необходимо установить,
какой отрезок времени происходит до появления первых кли-
нических признаков (парезов), указывающих на состоявшееся
"заболевание" мотонейронов. В неврологической практике,
как правило, отсчет начала болезни ведется от появления па-
резов, когда необходимое количество мотонейронов погибло и
болезнь уже состоялась. Совершенно очевидно, что этому пе-
риоду с явными признаками локального процесса предшеству-
ет период скрытого течения болезни, когда количество забо-
левших мотонейронов еще невелико для того, чтобы реализо-
вать отчетливый двигательный дефицит.
Постановка этой проблемы оправдана, поскольку экспери-
ментальными исследованиями еще 50 лет назад установлено,
что потеря около 50 % всей популяции мотонейронов вызывает
клинически определяемые парезы [Bodian D., 1948]. Многолет-
ний контакт с больными АБС в различные периоды болезни в
условиях продленной жизни с очевидностью подтвердил нали-
чие периода предвестников болезни, существующего до появ-
ления клинически значимого неврологического дефицита. В это
время больные практически здоровы и трудоспособны, но их
уже начинает тревожить комплекс "неспецифических" симп-
томов, укладывающихся в рамки легкого дефицита функции
двигательного нейрона: одышка, необычная общая и локальная
утомляемость при физических, часто профессиональных на-
126
грузках, судороги и подергивания мышц, потеря массы тела в
короткие сроки.
Продолжительность периода предвестников колеблется от
2 мес до 1 года. Такое различие во времени становится понят-
ным, если принять во внимание значимость для жизни перво-
начального поражения мотонейронов. Если "заболевание" на-
чалось с мотонейронов ядер диафрагмы или ядер каудальной
группы черепных нервов, то сроки предвестников с самого
начала совпадают с локальным периодом (больной Б.). Парезы
диафрагмы как первый симптом АБС обычно не диагностиру-
ются (больные Г., Т.). Такие больные поступают в реанимаци-
онное отделение с выраженными признаками ДН, когда уже
необходима ИВЛ.
В остальных наблюдениях предвестники АБС всегда были,
но фиксация сроков их появления зависела от внимательности
больных, а также интенсивности симптомов. Отсюда можно
допустить, что до периода предвестников существует еще скры-
тый период патологических изменений мотонейронов, когда
их минимальная потеря не отражается на двигательных функ-
циях. Следовательно, необходимо отодвинуть начало заболева-
ния мотонейронов за пределы периода предвестников, возмож-
но, на срок до 1—2 лет. В это время жалобы больных на
какой-либо двигательный дискомфорт вовсе отсутствуют, а
гибель мотонейронов только начинается.
Прогрессирующая гибель мотонейронов прослежена нами в
течение всей продленной жизни на ИВЛ, вплоть до тотального
паралича. В наблюдении 4 (больной П.) ДН развилась спустя
примерно 96 мес от начала предвестников. Срок жизни при
ИВЛ достиг 172 мес. Из них в течение первых 5 лет ИВЛ
происходило прогрессирование параличей до стадии тотально-
го паралича. В этой последней стадии больной П. находился
на ИВЛ 96 мес. Таким образом, общая продолжительность
болезни составила более 22 лет.
В наблюдении 12 (больной К.) общая продолжительность
болезни достигла 13 лет. Если исключить двухлетний период
пребывания в состоянии тотального паралича, то срок "заболе-
вания" мотонейронов до полной их гибели составит 11—12 лет,
включая период предвестников. Таким образом; "заболевание"
мотонейронов при АБС продолжается непрерывно и длитель-
но, что достоверно прослеживается в условиях продленной
жизни.
В ряде наших наблюдений продолжительность ИВЛ была
более короткой, поскольку больные рано умерли от тяжелых
соматических заболеваний, а иногда неожиданные причины
обрывали жизнь больных (профузные кровотечения, техничес-
127
кие неполадки аппаратов ИВЛ, обширная бронхолегочная па-
тология и др.).
Сведения о продленной жизни с помощью ИВЛ при АБС
в литературе встречаются весьма редко. Уточнение сроков "бо-
лезни" мотонейронов вообще не проводилось. По материалам
H.Hayashi и соавт. (1987), срок болезни от развернутых пара-
личей до трахеостомии достигал 1 года. Общая продолжитель-
ность АБС от начала параличей достигла 9 лет, из них в течение
5 лет был синдром тотального паралича. Срок измеренного
начала гибели мотонейронов в этом случае не уточнялся. Один
из больных АБС, 50-летний профессор математики, описывая
свое заболевание и длительный срок применения ИВЛ, считал,
что его болезнь продолжалась в течение всей взрослой жизни
[Smith R., 1992].
Процесс вовлечения двигательных нейронов после сформи-
ровавшегося локального дефицита протекает с различной ин-
тенсивностью. Для периода предвестников наиболее характер-
ны судороги мышц, локальная утомляемость, потеря массы
тела. Это происходит именно в тех регионах, в которых затем
разовьются в локальном периоде парезы и параличи. Первона-
чальный гнездный характер гибели мотонейронов определяет
деление АБС на бульбарную, шейную, шейно-грудную и пояс-
ничную формы. Локальный период может продолжаться от 2
до 36 мес. Возможно, медленная гибель мотонейронов (от 18
до 36 мес) в локальном периоде объясняется молодым возрас-
том заболевших (больной П., 18 лет, и больной К., 27 лет).
Более длительное течение АБС у молодых отмечали также
САХондкариаЦ (1987), F.Norris (1992). В остальных наблюде-
ниях локальный период в среднем не превышал 5 мес.
При первоначальной спинальной локализации патологичес-
кого процесса происходит тотальное поражение мотонейронов.
Далее наступает период первоначальной генерализации с наи-
большим вовлечением соседних мотонейронов по типу сегмен-
тарного распространения. Не прослеживается перебрасывания
на отдельные мышечные группы, минуя соседние. Напротив,
распространение происходит с одной части тела на соседнюю,
с одной ноги на другую, "как расплывается масляная капля на
бумаге" (по образному выражению Н.В.Коновалова). Казалось
бы, при первоначальной локализации в шейных и шейно-груд-
ных сегментах следовало ожидать гибели наиболее близко рас-
положенных мотонейронов, в частности каудальных ядер ство-
ла, но погибают мотонейроны, лежащие ниже, в сегментах
спинного мозга. Наиболее примечательно и документально
подтверждено, что в условиях длительно проводившейся ИВЛ
после тотальной гибели мотонейронов, иннервирующих диа-
128
фрагму, парезы и параличи охватывали остальную мускулатуру,
но функция ядер черепных нервов долго сохранялась.
В наблюдении 2 (больной Г.) только после сформировав-
шейся вялой тетраплегии появились признаки ГФЛП, а также
фасцикуляции и слабость мимических мышц, усталость жева-
тельных мышц. Больной Г. страдал выраженной дисфагией, но
самостоятельно проглатывал пишу на 87-м месяце пребывания
на ИВЛ. Морфологически отмечались тотальная гибель мото-
нейронов спинного мозга и признаки гибели мотонейронов
двигательных ядер черепных нервов.
В наблюдении 4 (больной П.) вначале появились парезы
мышц рук, затем постепенно, примерно в течение 100 мес,
параличи охватили все мышцы тела. Самыми последними во-
влеклись мотонейроны ядер черепных нервов, и тогда наступил
тотальный паралич, продолжавшийся около 96 мес. Клиничес-
кая картина тотального паралича полностью соответствовала
морфологическим изменением, характерным для гибели всего
двигательного нейрона.
Фактический материал, освещающий пути распространения
параличей, свидетельствует об устойчивости •мотонейронов
ядер черепных нервов, которые поражаются последними, даже
при первичной локализации процесса в высоких шейных сег-
ментах (Сш—Су). Этот феномен отмечен также при первона-
чальной локализации процесса в поясничных сегментах, но
здесь наблюдается восходящий тип параличей. Сегментарный
путь распространения гибели мотонейронов прослеживался
нами во всех наблюдениях.
Морфологическое исследование ядер ствола в случае И.
(12 мес болезни) выявило в ядре VII пары на 30—40 нормаль-
ных мотонейронов 1—2 погибающих. Надо заметить, что в
этом наблюдении была первоначальная спинальная (пояснич-
ная) локализация и, следовательно, гибель мотонейронов на-
чалась в этом регионе и имела четкое сегментарное распро-
странение. К 12-му месяцу болезни наступили почти тотальная
гибель мотонейронов в спинном мозге и выраженная проли-
ферация глии. Клинически определялись паралич мышц ног и
глубокие парезы остальных мышц. Функция черепных нервов
при этом была полностью сохранена. Морфологически просле-
женная гибель единичных мотонейронов ядер лицевого нерва
указывает на дегенерацию отдельных мотонейронов в местах,
отдаленных от первоначальной локализации, и протекает дли-
тельно без неврологического дефицита.
В периоде развернутой генерализации гибель мотонейронов
становится распространенной. Для всех наблюдений характер-
ны фасцикуляции, охватывающие еще функционально дейст-
вующие мышцы. Разлитые фасцикуляции воспринимаются
129
больными как мучительно "жующиеся" мышцы. Причина
этого феномена точно не установлена, но наряду с другими
теориями можно предполагать дизрегуляцию ВМН и несоот-
ветствующий выброс возбуждающего нейротрансмиттера-глю-
тамата [Rothstein J., 1996].
Тесно связано с проблемой гибели мотонейронов сопостав-
ление морфогенеза с клиническими проявлениями. При пер-
воначальной спинальной локализации (срок болезни до 12 мес)
в поясничных сегментах наблюдалась тотальная, в грудных и
шейных сегментах — субтотальная гибель мотонейронов. Кли-
нически наблюдались параличи мышц ног и парез мышц ту-
ловища и рук. Основная популяция мотонейронов в ядрах
черепных нервов сохранялась, и функция их, как уже указы-
валось, была нормальной.
При применении ИВЛ в течение 18—26 мес при общей
продолжительности болезни 33—39 мес (спинальная локализа-
ция) клинически сформировалась вялая тетраплегия, но функ-
ция мышц, иннервируемых ядрами черепных нервов, сохраня-
лась. Морфологическое исследование спинного мозга показало
почти тотальную гибель мотонейронов и пролиферацию астро-
цитарной глии. В ядрах черепных нервов, в частности VII
пары, были признаки поражения мотонейронов, представлен-
ных мозаично. Распад миелина во всех случаях был особенно
акцентуирован в боковых и передних канатиках, и наиболее
отчетливая шарлаховая стадия обнаруживалась на 29—39-й ме-
сяцы продленной жизни. Таким образом, именно в эти сроки
была четко развернута генерализация текущей гибели всего
двигательного нейрона. Снова подтверждалась различная сте-
пень поражения мотонейронов спинного мозга, где все они
погибли, и одновременно с этим прослеживалась меньшая
степень гибели мотонейронов ядер черепных нервов.
Морфологические изменения в поздние сроки продленной
жизни (79—99 мес) выявили выраженную пролиферацию аст-
роцитарной глии и уменьшение объема областей, в которых
располагались погибшие мотонейроны передних рогов спин-
ного мозга. Во всех случаях была тетраплегия. В двигательных
ядрах черепных нервов основная популяция их погибла. Кли-
нически лишь в наблюдении 2 (больной Г.) отмечались уга-
сающая функция IX—XII пар и парезы VII и V пар.
Крайняя степень патологии была найдена в случае П., когда
ИВЛ продлевала жизнь в течение 172 мес при общей продол-
жительности болезни до 272 мес. Клинически наблюдался то-
тальный паралич (синдром деэфферентации). В передних рогах
на месте отсутствующих мотонейронов сформировался выра-
женный глиоз, стенки микрососудов подверглись фиброзу,
просветы многих из них не определялись, т.е. имелись выра-
130
женные признаки редукции кровотока в связи с утратой мото-
нейронов. Особенно заметны были полная деструкция волокон
боковых и передних корково-спинномозговых путей и глиоз
этих областей с выраженными признаками спонгиоза. Во всех
наблюдениях задние канатики оказывались сохранными,
имели нормальную структуру, что ярко контрастировало с ка-
жущимися большими размерами и отличной сохранностью ми-
елина по сравнению с атрофичными переднебоковыми кана-
тиками спинного мозга.
Подлежат отдельному рассмотрению морфологические из-
менения АБС с первоначальной бульбарной локализацией и
началом процесса, с ГФЛП и последующим развитием вялых
параличей диафрагмы и спастическими параличами ног.
Общая продолжительность болезни 16 мес, при ИВЛ — 10 мес.
Мотонейроны ядер каудальной группы были замещены астро-
цитарной глией. В передних рогах на всем протяжении спин-
ного мозга наблюдалась яркая и развернутая картина гибели
мотонейронов. На первый план выступила патология цито-
плазмы с потерей формы мотонейронов, по-видимому, из-за
утраты аксона и дендритов. Деформированные мотонейроны
содержали обилие базофильных и характерных мелких окси-
фильных включений. Массы липофусциновых гранул, диффуз-
но заполняли цитоплазму нейрона. Оксифильные включения
в них отграничивались светлым полем. Конечным феноменом
были вакуолизация цитоплазмы и распад ее с формированием
узелков нейронофагии. В центре этих узелков всегда были
видны некротизированные остатки мотонейрона.
Представляет интерес и, возможно, имеет патогенетическое
значение крайняя степень распада миелина волокон проводя-
щих путей, ограничивающаяся боковым трактом (наблюдение 1).
Так, на месте корково-спинномозгового пути в спинном мозге,
стволе определялась колонна скопившихся, тесно расположен-
ных: липофагов, отделенная от соседних трактов пористой,
спонгиозной тканью. Миелиновые оболочки остальных трак-
тов боковых канатиков сохранились. Такой же изолированный
и тотальный распад волокон проводящих путей был найден на
остальных уровнях ствола, внутренней сумке и белом веществе
фронтальных отделов коры мозга.
Клинически, как уже указывалось, в этом наблюдении
ГФЛП сочетался с атрофическим параличом мышц руки и
диафрагмы. Спастический паралич ног был выражен в резкой
степени и по своей интенсивности превосходил атрофический
парез мышц ног. Это было единственное наблюдение раннего
и тяжелого распада ВМН.
Первичное или вторичное заболевание НМН или ВНМ
131
имеет непосредственное отношение к разрешению многих па-
тогенетических проблем.
В настоящее время наибольшее распространение получили
две гипотезы. В соответствии с первой [Chou S., 1993], АБС
является первичной "болезнью" НМН с распространением бо-
лезненного процесса транссинаптически к ВМН. Исходя из
упомянутых представлений, первичное "заболевание" НМН
происходит путем проникновения патогенетического начала
(вирусных, токсических, иммунопатических) из нейромышеч-
ных соединений ретроградным транспортом. Затем болезнен-
ный процесс моносинаптически распространяется к ВМН. Ги-
потеза первичного поражения НМН основана на современных
представлениях о функции систем нейроаксонального транс-
порта. Наиболее значительные патологические изменения на-
блюдаются в начальной части аксона (аксональном бугорке).
Появляются набухание, потеря упаковок гладкого плазмати-
ческого ретикулума, повышенное скопление митохондрий и
лизосом. Скопление этих мембранно-связанных цитоплазма-
тических органелл указывает на нарушения в быстром аксо-
нальном транспорте [Sasaki M. et al., 1996]. Присутствие телец
Леви, гиалиновых включений, липофусциновых гранул, мно-
жества мембранных структур может являться отражением дис-
функции аксонального транспорта [Sasaki М. et al., 1996]. Ци-
топлазматическим включениям придается существенное значе-
ние, они формируют не только интрааксональную, но и
интрадендритическую блокаду [Chou S. et al., 1993].
Теория A.Eisen и соавт. (1993), напротив, основывается на
первичном поражении ВМН и на представлениях генетической
детерминированности болезни ВМН, при котором прямым
контактом вторично вовлекается нижний мотонейрон [Hudson
A. et al., 1998]. Предполагается, что специальный тип дисфунк-
ции ВМН ведет к гибели НМН [Swash M., 1992].
В этой теории заложены высказывания Шарко о том, что
амиотрофии распространяются от заболевания "латеральных
столбов", "протопатических" к серому веществу спинальных,
бульбарных отделов ("дейтеропатических"). В гипотезе A.Eisen
критически оценивается и считается неспецифическим для
АБС медленный аксональный транспорт, поскольку набухание
аксона встречается при интоксикации иминодипропионилнит-
рилом (IDPN), отравлении алюминием, врожденной спиналь-
ной атрофии собак и др. Включения в цитоплазме нейронов,
которым придается значение признака АБС [Okamoto К. et al.,
1980; Chou S. et al., 1993], встречаются не только при АБС, но
и при паркинсонизме, болезни Альцгеймера. Эти включения
являются дегенеративными проявлениями, но не более чем
"могильные камни на умерших клетках" [Eisen A., 1993]. Мень-
132
шая гибель кортикальных мотонейронов при АБС объясняется
тем, что ВМН связан с большим числом НМН. Исходя из
этого, гибель нескольких ВМН приводит к гибели многих
НМН. Однако проверочные исследования R.Pamphlett и соавт.
(1993) выявили плохую корреляцию между кортико-моторным
нейроном и плотностью спинальных мотонейронов у больных
БМН. Поэтому гипотеза о том, что ВМН является местом
первичного повреждения, не поддерживается. Более вероятно,
что утрата ВМН и НМН происходит с различной скоростью
и, возможно, независимо один от другого.
В условиях продленной жизни имеется много клинических
наблюдений, достоверно указывающих на первоначальное за-
болевание НМН. Так, у больных Г. и Т. первым симптомом
АБС являлся периферический паралич диафрагмы. Срочное
применение ИВЛ не только спасло этим людям жизнь, но и
позволило длительно самостоятельно, а затем с посторонней
помощью передвигаться, сохранять профессиональный уро-
вень научной работы. Признаки поражения ВМН не появля-
лись, между тем в течение столь длительного срока могли бы
наблюдаться спастические парезы и параличи мышц, сохраня-
ющих свою функцию.
Квалифицированное неврологическое обследование боль-
ного Е. не выявило явных признаков раннего вовлечения
ВМН. Напротив, его коллеги в первую очередь обратили вни-
мание на угасание ахиллова рефлекса. Вероятно, поэтому с
давних пор вследствие раннего поражения -НМН из-за отсут-
ствия спастических параличей при АБС выделялись полинев-
ритические формы. Подострый полиомиелит или мотоневрак-
сит с цитоплазматическими включениями был отделен от АБС
[Коновалов Н.В. и др., 1962]. Эти формы должны быть отне-
сены к АБС, так как морфологически они идентичны. Гисто-
патология их раскрывает массивный распад переднебоковых
канатиков, преимущественно корково-спинномозговых путей.
Как было показано, к концу 1-го года болезни (наблюдение
6, больной И.) при первоначальной поясничной локализации
процесса определялся не тотальный, а мозаичный разброс ли-
пофагов в боковых корково-спинномозговых путях. Миелино-
вые оболочки остальных трактов окрашивались менее интен-
сивно и не содержали липофагов. Сходный характер мозаич-
ного распада миелиновых оболочек был найден в корково-
спинномозговых путях оральных отделов моста мозга в наблю-
дении 10 (случай А.) при сроке болезни 35 мес и первоначаль-
ной спинальной локализации. Эти наблюдения могут под-
тверждать возможность транссинаптической восходящей [Ко-
новалов Н.В., 1964] либо моносинаптической дегенерации
133
[Chou S., 1992]. Возможны и другие суждения о первоначаль-
ном либо одновременном вовлечении ВМН.
В единственном нашем наблюдении (случай Б.) при общей
продолжительности болезни 16 мес наряду с тотальной гибелью
мотонейронов ядер каудальной группы черепных нервов обна-
ружилась тотальная и почти изолированная гибель всего боко-
вого ВМН. На его месте расположена ограниченная колонна
липофагов. В передних рогах на всех уровнях спинного мозга
все мотонейроны погибли.
Массивность процесса ВМН и НМН допускает одновре-
менность поражения структур при спорадическом АБС. Такую
возможность предполагал еще Л.О.Даркшевич.
Одной из проблем АБС в условиях продленной жизни на
многие месяцы является развитие тотального паралича или
синдрома деэфферентации. При этом всегда полностью сохра-
няются интеллект, высшая нервная деятельность, а также обще-
ние и связь с внешним миром путем почти не пострадавшей
функции глазодвигательных мышц. Полностью сохраняется
функция чувствительных систем. Синдром^тотального паралича
наблюдался только при первоначальной спинальной локализа-
ции независимо от того, какой его отдел пострадал первым.
Закономерно предполагать, что гибель всех мотонейронов
может означать прекращение АБС как болезни двигательного
нейрона. Решение этого вопроса не может быть без оценки
морфологических изменений в остальных отделах нервной сис-
темы. H.Hajashi и соавт. (1987) допускают, что прогрессирова-
ние процесса продолжается так же, как при АБС, охватывая
многие структуры ЦНС.
Морфологические исследования, проведенные нами (на-
блюдение 4, больной П. с наибольшей продолжительностью
синдрома тотального паралича), установили очаговое выпаде-
ние нейронов нижней оливы, мозжечка, ядер зрительного
бугра, черной субстанции, собственных ядер моста, ретикуляр-
ной формации, ядер Кларка, различных отделов коры. В со-
храняющихся нейронах происходят разнообразные изменения
в форме гиперхроматоза, пикноза ядер, хроматолиза, клеток-
теней. Пролиферация глии, как правило, не выражена, хотя в
отдельных участках встречаются глиозные узелки.
Все эти изменения могут быть расценены как атрофическое
состояние нейронов, возникшее после массивного, уже закон-
чившегося специфического разрушения (гибели) всего двига-
тельного нейрона при АБС.
Уничтожение связей огромного количества структур ЦНС
с общим конечным двигательньщ путем, филогенетически за-
программированным на самую тесную и постоянно действую-
щую связь, способствовало развитию атрофических процессов
134
во многих вышележащих структурах, лишенных своей главной
деятельности в жизни человека — движений. Узловыми про-
блемами при АБС являются анализ представлений о механизме
гибели — смерти мотонейронов и изучение возможного разли-
чия между процессами смерти их при семейном и спорадичес-
ком АБС [Bredesen D. et al., 1996].
В связи с прорывом знаний по проблеме семейного АБС
[Rosen D. et al., 1996] центральное место начинают занимать
исследования патогенеза процесса, происходящего в мотоней-
ронах, и возможности реализации различных форм его гибели.
Выдвинуты понятия апоптоза, некроза, подразумевающие раз-
ный механизм гибели клеток.
Этот процесс при АБС только изучается, но уже имеются
данные, свидетельствующие о различиях в его патогенезе.
Апоптоз, или запрограммированная смерть клетки, является
такой формой смерти, когда клетка активно вступает в процесс
аутодеструкции. Этот процесс, по-видимому, распространен в
природе. Смерть нейронов наблюдается у червей, а также при
нейродегенеративных болезнях, например при болезни Пар-
кинсона. Апоптоз есть активный ответ клетки, в какой-то
степени специфичный, на повреждение ее в связи с окисли-
тельным стрессом, а также гипотермией, снижением глюкозы,
увеличением Са2+ и др. Апоптоз не сопровождается воспали-
тельной реакцией.
Смерть клеток по типу апоптоза при семейном АБС воз-
можна, хотя еще не доказана [Bredesen D. et al., 1996], но,
вероятно, происходит в результате нарушения окислительных
процессов под влиянием мутантного гена Си—Zn супероксид
дисмутазы (Си—Zn СОД). Смерть по типу некроза наступает
при сильном воздействии на нее и сопровождается воспали-
тельной реакцией.
Патология мотонейронов во всех представленных наблюде-
ниях заканчивалась неизбежной смертью, некрозом их. Воспа-
лительная реакция всегда сопровождала процесс некроза гли-
озной реакцией, формированием узелков, в составе которых
были наряду с микроглией и макрофаги. Некротический рас-
пад завершался нейронофагией, в узелках которой обнаружи-
вались остатки некротических структур нейрона. Глобальная
гибель (некроз) мотонейронов до клинической стадии деэффе-
рентации и морфологически ясного завершения процесса (раз-
растание астроцитарной глии, признаки фиброза сосудов)
может наблюдаться только при сильнейших длительных и по-
стоянных воздействиях на них, что отмечается при споради-
ческом АБС.
Одной из спорных проблем в патогенезе АБС принято счи-
тать существование устойчивости ряда мотонейронов. Установ-
135
лено, что при АБС не поражаются ядра Онуф, расположенные
в мотонейронах II крестцового сегмента спинного мозга, иннер-
вирующие поперечнополосатые мышцы уретры и ректального
сфинктера. При АБС эти функции не нарушаются. Морфологи-
ческая сохранность их прослежена в раде наблюдений [Mannen
Т. et al., 1977]. В наших наблюдениях с продленной жизнью
более 2 лет (случаи Е. и А.) отмечалось неполное опорожнение
мочевого пузыря, а затем и полное расстройство сфинктеров.
Устойчивую функцию при АБС сохраняют мотонейроны
ядер глазодвигательных нервов. В наших наблюдениях эти
расстройства были редкими и умеренными. В 3 наблюдениях
из 12 движение глаз по просьбе задерживалось во времени и
напоминало спазмоидную фиксацию взора. Преходящее двое-
ние, слабость конвергенции, ограничение движений отмечены
при различной первоначальной локализации патологического
процесса. Все эти нарушения не ограничивали общение с боль-
ным. Путем фиксации взора на крупных буквах азбуки, мига-
ния век составлялись фразы, хотя и в замедленном темпе.
На очень редкое поражение мотонейронов глазодвигатель-
ных мышц при естественном течении болезни указывали также
зарубежные авторы [Lawer Т. et al., 1953]. Наружная офталь-
моплегия и гибель мотонейронов III—VI пар черепных нервов
установлена в одном наблюдении при бульбарной форме АБС
[Harvey D. et al., 1979]. Электроокулография показала прогрес-
сирующее и разнонаправленное снижение скорости движений
глаз у 4 из 10 больных АБС, что объяснялось супрануклеарны-
ми расстройствами [Leveille A. et al., 1982].
Своеобразные изменения функции глазодвигательных
мышц у больных с тотальными параличами, находившихся на
ИВЛ, отмечали H.Hajashi и соавт. (1989). Произвольные дви-
жения ограничивались, непроизвольные — сохранялись. Поис-
ки большой мишени также сохранялись во всех случаях, хотя
начало движений и скорость слежения взором были замедлены.
Спазмоидная фиксация взора различной степени была у всех
больных. Иногда один глаз был отведен, другой находился по
средней линии, отмечался транзиторный нистагм отведенного
глаза. Авторы связывают нарушение функции глазодвигатель-
ных мышц с супрабульбарными расстройствами. Морфологи-
ческое исследование мотонейронов глазодвигательных мышц
показало умеренные изменения [Hajashi H. et al., 1987]. Устой-
чивость самих мотонейронов объясняется особенностями
функционирования филогенетических старых структур, каки-
ми являются ядра глазодвигательных нервов. Мы установили
сохранность мотонейронов глазодвигательных ядер при тоталь-
ном параличе или синдроме деэфферентации в условиях почти
14-летней продленной жизни (больной П.).
136
Уникальное электронно-микроскопическое исследование
верхней прямой и нижней косой мышц III пары [Попова Л.М.
и др., 1982] в этом случае выявило сохранение структуры
двигательных единиц мышечных волокон (миофибрилл, мито-
хондрий, Z-полосок), а также миелинизированных волокон в
эндомизии. Реакция на ацетилхолинэстеразу показала отсутст-
вие изменений в нервно-мышечных и терминальных оконча-
ниях. Исключительный контраст сохранившимся глазодвига-
тельным мышцам представляла ультраструктура диафрагмы, в
которой мышечные клетки замещены фибробластами и колла-
геновыми волокнами.
Морфологическая и функциональная сохранность мотоней-
ронов глазодвигательных ядер и их мышечных структур в слу-
чае многолетней продленной жизни при АБС имеет большое
патогенетическое значение. Возможно, одним из факторов изби-
рательной устойчивости мотонейронов III пары является сохран-
ность особенного мышечного трофического фактора, постоянно
доставляемого к мотонейронам глазодвигательных мышц рет-
роградным транспортом [Chou S., 1992]. Не исключается и
филогенетически запрограммированная устойчивость системы
глазодвигательных мотонейронов [Hajashi H. et al., 1987].
Ультраструктурные исследования отдельных нейронов
фронтальной коры показали незначительные изменения грану-
лярной эндоплазматической сети, более выраженное в астро-
цитарной глии. Наиболее примечательным в этих структурах
было формирование четко упорядоченных ячеистых, сотовид-
ных структур [Попова Л.М. и др., 1982]. По форме они сходны
с кристаллоподобными включениями полиовируса при экспе-
риментальном полиомиелите обезьян. Однако дискуссии о
проблеме полиомиелита и АБС ведутся с давних пор, но не
получили окончательного решения.
В литературе неоднократно обсуждался вопрос о вирусном
происхождении оксифильных включений, найденных при све-
товой микроскопии [Бунина Т.Л., 1977] в мотонейронах перед-
них рогов спинного мозга в случае семейного АБС. Ультра-
структурные исследования K.Okamoto и соавт. (1980) не под-
твердили это предположение. Включения состояли из аморф-
ного материала, нейрофиламентов и клеточных органелл, а
также скоплений белкового материала, возможно, связанного
с пластинчатым комплексом.
Успехи в изучении семейного АБС, достигнутые в послед-
ние годы, вследствие открытия в семейных случаях АБС мута-
ций гена СОД 1, кодированного Си—Zn СОД 1, будут иметь
определенное значение в объяснении механизмов появления
включений, а также гибели мотонейронов.
Список литературы
Бунина Т.Л. Патогенез бокового амиотрофического склероза// Авто-
реф. дис. ... д-ра мед. наук. — Москва, 1977. — 36 с.
Зильбер А.А,, Байдакова З.Л., Гардашьян А.М., Коновалов КВ., Бунина
Т.Л., Барабадзе ЕМ. О возможной вирусной этиологии бокового
амиотрофического склероза//Вопр. вирусол. — 1962. — № 5. — С.
520-528.
Касаткина Л.Ф. Динамика изменений двигательных единиц мышц у
больных с остаточными явлениями перенесенного полиомиели-
та//Журн. невропат, и психиатр. — 1991. — Т. 91, вып. 9. — С. 9—
13.
Кобрин В.Н., Попова Л.М., Ротенберг В. С. Сердечный ритм у людей
во время сна в условиях многолетнего искусственного дыхания и
гипо- и адинамии//Физиология человека. — 1978. — № 4. — С.
748-750.
Коновалов КВ. Подострый передний полиомиелит. — М.: Медицина,
1964. - С. 13-96.
Попова Л.М. Опыт длительной искусственной вентиляции легких в
домашних условиях у больных с параличами дыхательных
мышц//Сов. мед. - 1971. - XXXIV, вып. 1. - С. 99-105.
Попова Л.М., Сахарова А.В. Вирусоподобные включения в клетках
центральной нервной системы при боковом амиотрофическом
склерозе//Арх. пат. — 1982. — Т. XLIV, вып. 10. — С. 28—33.
Попова Л.М., Алферова В.П., Ходас М.Я., Мосолова Л.А., Грищенко
М.К, Леонова С.Ф. Кислотно-щелочное равновесие и кислород-
транспортная функция крови у больных с параличом дыхательных
мышц при многолетней непрерывной искусственной вентиляции
легких//Анест. и реаниматол. — 1982. — № 5. — С. 27—32.
Попова Л.М., Есипова И. К. Патология легких в условиях 14-летней
ИВЛ при амиотрофическом боковом склерозе//Анест. и реанима-
тол. - 1984. - № 1. - С. 31-37.
Попова Л.М., Моргунов В.А. К патогенезу и этиологии бокового ами-
отрофического склероза (клинико-морфологическое исследова-
ние//Журн. невропатол. и психиатр. — 1987. — Т. 87, вып. 12. — С.
1761-1766.
Попова Л.М., Попова Е.К Клиника бокового амиотрофического скле-
роза в условиях продленной жизни//Журн. невропатол. и психи-
атр. - 1991. - Т. 91, вып. 9. - С. 28-33.
Хондкариан О.А, Бунина Т.Л., Завалишин И.А. Боковой амиотрофичес-
кий склероз. — М.: Медицина, 1978. — С. 14—18.
Agid Y. Aging disease and nerve cell death//J.Neural Transmission (Gen.
Sect.), Springer Verlag — Wien — New York, 1995.—Vol. 102—1—
LIIL
Anderson F.A., Miller RG. ALS care: A resource for measuring and improv-
ing ALS outcomes//Neurology. — 1996. — Vol. 47, Suppl. 2. — P.
113-116.
138
Armon С, Daube J.R, Windebank AJ., Kurland L. How frequently does
classic amyotrophic lateral sclerosis develop in survivors of poliomyeli-
tis?//Neurology. - 1990. -Vol. 40, N 1. - P. 172-174.
Bartfeld K, Dham C, Donnenfeld К et al. Immunological profile of
amyotrophic lateral sclerosis patients and their cell-mediated immune
response to viral and CNS antigens//Clin. exp. Immunol. — 1982. —
Vol. 48. - P. 137-147.
Bensimon G, Lacomblez L., Meininger V. ALS Rilusole Study Group. A.
Controlled Trial of Riluzolein Amyotrophic Lateral Sclerosis//The New
Engl. J. Med. - 1994. - Vol. 330, N 9. - P. 585-636.
Binet S., Meininger V. Modification of microtubule proteins in ALS nerve
precede detectable histologic and ultrastructural changes//Neurology. —
1988. -Vol. 38. - P. 1596-1600.
Bodian D. The virus, the nerve cell and paralysis. A study of experimental
poliomyelitis in the spinal cord//BuU. Johns Hopk. Hosp. — 1948. —
Vol. 83. - P. 1-109.
Bozek C, Eisen A. Acquired motor neuron disease of the young//Neurolo-
gy. _ 1985. - Vol. 25, Suppl. 1. - P. 249.
Bradley W, Krasna F.A. New Hypothesis of the Etiology of ALS//Arch.
Neurol. - 1982. - Vol. 39. - P. 677.
Bredesen D.E., Wiedau-Pazos M., Goto J.J. et al. Cell death mechanisms in
ALS//Neurology. - 1996. - Vol. 47, Suppl. 2. - P. 36-39.
Breuer AC, Lynn M.D., Atkinson M.B. et al. Fast axonal transport in
amyotrophic lateral sclerosis: an intra-axonal organelle traffic analy-
se/Neurology. - 1987. -Vol. 37, N 5. - P. 738-748.
Brody J.A. et al. Soviet search for viruses that cause chronic neurologic
disease in the USSR//Science. - 1965. -Vol. 147. - P. 114.
Brooks B. Natural history of ALS. Symptoms, strength, pulmonary function
and disability//Neurology. — 1996. —Vol. 47, Suppl. 2. - P. 71—82.
Brooks B.R, Swash M., Bradley W., Festoff B. Criteria for diagnosis of
amyotrophic lateral sclerosis//World Neurol. — 1990. — Vol. 5, N 1. -
P. 12.
Brooke M.H. Diagnostic criteria in clinical trials//Neurology. — 1996. —
Vol. 47, Suppl. 2. - P. 67-70.
Brown W.F. Functional compensation of human motor units in health and
disease//J. Neurol. Sci. - 1973. - Vol. 20. - P. 199-202.
Carruto RM, Yanihara R, Gajdusek C. Disappearance of high-incidence
amyotrophic lateral sclerosis and Parkinsonism-dementia on
Guam//Lancet. - 1988. -Vol. 2, N 1079. - P. 11.
Choi D. W. Glutamate neurotoxicity and diseases of nervous system//Neu-
rology. - 1988. - Vol. 1. - P. 623-634.
Chou S.M. Pathology-Light Microscopy of Amyotrophic Lateral Sclerosis:
Handbook of Amyotrophic Lateral Sclerosisph// Edit. R.A. Smith. —
New York - Basel - Hong Kong, 1992. - P. 133-181.
Chou S.M., Norris F.H. Amyotrophic lateral Sclerosis: lowel motor neuron
disease spreading to upper motor neuron//Muscle & Nerve. — 1993. —
Vol. 16. - P. 864-869.
Cleveland D.W., Bruijn I., Wong P.С et al. Mechanisms of selective motor
neuron death in transgenic mouse model of motor neuron disease//Neu-
rology. - 1996. - Vol. 47. - P. 54-62.
Christensen M.S., Christensen H.S., Hansen KL. Artificial hyperventilation
139
during twenty one years in three cases of complete respiratory paraly-
sis//Acta med. Scand. - 1975. - Vol. 198. - P. 409-413.
Cork L.C.y Griffin J.W., Lorenz M.D. et al. Hereditary canine spinal
muscular atrophy//J. Neuropath, exp. Neurol. — 1979. — Vol. 28. — P.
209-221.
Cremer N.E., Oshiro L.S., Norris EH. et al. Culture of tissues from patients
with amyotrophic lateral sclerosis//Arch. Neurol. — 1973. — Vol. 29. —
P. 331-333.
Dalakas M.C. Post-poliomyelitis motor neuron disease: what did we learn
in reference to amyotrophic lateral sclerosis? In: Hudson A.J., ed.
Amyotrophic lateral sclerosis. Concept in pathogenesis and etiology. —
Toronto: Universitet Toronto Press, 1990. — P. 326—357.
Donnenfeld H, Kascsak R.J., Bartfeld H. Deposits of IgG in C3 in the spinal
cord and motor cortex of ALS patients//J. Immunol. — 1984. — Vol.
6. - P. 51-57.
Durrleman S., Alperovitch A Increasing trend of ALS in France and else-
where: Are the chlanges real?//Neurology. — 1989. — Vol. 39. — P.
768-773.
Eisen AA, Hudson AJ. Amyotrophic Lateral Sclerosis: Concept in Patho-
genesis and Etiology//Canad. J. Neurosci. Sci. — 1987. — Vol. 14. — P.
649-652.
Eisen A.A. Comment on the Lower Motor Neuron Hypothesis// Muscle &
Nerve. - 1993. - Vol. 16. - P. 870-871.
Elliott J.L., Snider W.D. Motor neuron growth factor//Neurology. — 1996. —
Vol. 47, Suppl. 2. - P. 47-53.
Fallet R.J., Jewitt B. Spirometry in amyotrophic lateral sclero-
sis//Arch.Neurol. - 1979. -Vol. 36. - P. 74-80.
Fromm G.B., Wisdom P.J., Block AJ. ALS presenting with respiratory
failure//Chest. - 1977. -Vol. 71, N 5-6. - P. 612-614.
Gardner M.B. Retrovirus spongioform polioencephaiomyelopathy//Rev.In-
fect.Dis. - 1985. - Vol. 7. - P. 99-110.
Gauderer M. W.L., Ponsky J.L., Izant RJ. Gastrostomy without laparotomy:
a percutaneous endoscopic technique//J. pediat. Surg. — 1980. —Vol.
15. - P. 872-875.
Goulon M., Goulon-Goeau I. Amyotrophic Lateral Sclerosis and Respiratory
Assistance//Rev. neurol. (Paris). — 1989. — Vol. 145, N 4. — P. 293—
298.
Gurney M.E, Beton AC, Cashman N. et al. Inhibition of termal axonal
sprouting by serum from patients with amyotrophic lateral sclero-
sis//New. Engl. J. Med. - 1984. -Vol. 311. - P. 933-939. .
Gutman L., Matsumoto H. Advances in ALS//Neurology. — 1996. —Vol.
47, Suppl. 2. - P. 17-18.
Halstead L.S., Wiechers D.O., Ross CD. Late effect of poliomyelitis. Part
II. Results of a survey of 201 poliosurvivors//South Med. J. — 1985. —
Vol. 78.-P. 1281-1287.
Harvey D.G., Torack R.M., Rosenbaum HE. Amyotrophic Lateral Sclerosis
with Ophthalmoplegia (A Clinicopathologic Study)//Arch. Neurol. —
1979. - Vol. 36, N 10. - P. 615-618.
Hajashi H, Kato S., Kawada N., Tsubaki T. Amyotrophic lateral sclerosis
oculomotor function in patients in respirator//Neurology. — 1987. —
Vol. 37, N 8. - P. 1431-1432.
Hajashi H, Kato S. Total manifestation of amyotrophic lateral sclerosis.
140
ALS in the totally locked-in state//J. Neurol. Sci. — 1989. — Vol. 93. —
P. 19-35.
Hill R, Martin J., Hakim A. Acute respiratory failure in motor neuron
disease//Arch. Neurol. - 1983. - Vol. 40. - P. 30-32.
Hill M.A., Rowlings J., Murray RE. et al. Audit of outcome of long-term
enteral nutrition by percutaneous endoscopic gastrostomy//Lancet. —
1993. - Vol. 341, April 3, N 8849. - P. 869-872.
Hirano A., Inone K. Early pathological changes of amyotrophic lateral
sclerosis. Electron microscopic study of chromatolysis, spheroids and
Bunina bodies//Neurol. Med. - 1980. -Vol. 13. - P. 148-160.
Hirano A. Neuropathology of ALS: An overview//Neurology. — 1996. —
Vol. 47, Suppl. 2. - P. 63-66.
Hopkins L.C., Tatarien G.T., Pianta T.F. Management of ALS: Respiratory
care//Neurology. - 1996. -Vol. 47, Suppl. 2. - P. 123-125.
Howard R.S., Wiles CM., Loh L. Respiratory complications and their
management in motor neuron disease//Brain. — 1989. — Vol. 112. — P.
1155-1170.
Jounger D.S., Rowland L.P., Latov N. et al. Motor Neuron Disease and
Amyotrophic Lateral Sclerosis//Neurology. — 1990. — Vol. 40. — P.
595-599.
Karpati G.y Carpenter S., Durham HA. Hypothesis for the Pathogenesis of
Amyotrophic Lateral Sclerosis//Rev. neurol. (Paris). — 1988. — Vol.
144, N 11.-P. 672-675.
Klein L.M., Fonshew D.A. The economic impact of ALS//Neurology. —
1996. - Vol. 47, Suppl. 2. - P. 126-129.
Koh J.K., Gwang B.J., Lobner D., Choi D. Potentiated necrosis of cultured
cortical neurons by neurotrophins//Science. — 1995. — Vol. 268. — P.
573-575.
Kojima H, Furuta Y.y Fujita M.y Fujioka Y. et al. Onufs motoneuron is
resistant to poliovirus//J. Neurol. Sci. — 1989. — Vol. 93. — P. 85—92.
Kott E., Livini E, Zanur R, KuritzJcy A. Amyotrophic lateral sclerosis,
cell-mediated immunity to poliovirus and basis myelin in patient with
high frequency of HLA-BW35//Neurology. - 1976. - Vol. 26, Suppl.
1. - P. 376.
Kreitzler S.M., Saunders N.A., Tyler HR, Ingram J.R Respiratory muscle
function in amyotrophic lateral scierosis//Amer. Rev. Resp. Dis. —
1978. -Vol. 117, N 3. - P. 437-447.
Kurtzke J.F. Epidemiology of amyotrophic lateral sclerosis//Human Motor
Neuron Disease. — New York: Raven Press, 1982. — P. 281—300.
Lawyer Т., Netsky M.G. Amyotrophic Lateral Sclerosis (A Clinicoanatomic
Study of Fifty-Three Cases//AMA. Arch. Neurol. Psychiat. — 1953. —
Vol. 69, N 3. - P. 171-192.
Leveille A., Kiernan J., Goodwin J., AntelJ. Eye Movements in Amyotrophic
Lateral Sclerosis//Arch. Neurol. - 1982. - Vol. 39, N 11. - P. 684-
686.
Mc Comas A.J., Upton ARM., Sica REP. Motoneurone disease and
ageing//Lancet. - 1973. -Vol. 2. - P. 1477-1480.
Mc Holm G.B., Mc Aguibar M.J., Norris F.H Lipofuscin in amyotrophic
lateral sclerosis//Arch. Neurol. — 1984. —Vol. 4Ґ. — P. 1187—1188.
Martyn C.N. Poliovirus and motor neuron disease//J.Neurol. — 1990. —
Vol. 237. - P. 336-338.
Meyrignac C.y PoirierJ.y DegosJ.D. Amyotrophic lateral sclerosis. Presenting
141
with respiratory Insufficiency as the Primary Complaint (Clinico-patho-
logical Study of a Case)//Europ. Neurol. — 1985. — Vol. 24. — P.
115-120.
Mendelsohn C, Johnson В., Lionetti K.A. et al. Transformation of a human
poliovirus receptor gene into mouse cells//Proc. nat. Acad. Sci. USA.
- 1986. -Vol. 83. - P. 7845-7849.
Messer A. Animal Models of Amyotrophic Lateral Sclerosis//Handbook of
Amyotrophic Lateral Sclerosis. — New York, Basel. Hong Kong, 1992.
- P. 433-451.
Miller R.G., Bouchard J.P., Duquette P. et al. Clinical trials of rilusozole in
patients with ALS//Neurology. — 1986. — Vol. 47, Suppl. 2. — P. 86—
92.
Mitchell J.D., Gibson H.N., Gatrell A. Amyotrophic Lateral Sclerosis in
Lancashire and South Cumbria, England 1976—1986. A Geographical
Study//Arch. Neurol. - 1990. - Vol. 47. - P. 875-880.
Mitsumoto H., Bradley W.G. Murine motor disease (the wobbler
mouse)//Brain. - 1982. -Vol. 105: - P. 811-834.
Mitsumoto H, Ikeda K., Klinkoxz B. et al. Arrest of motor neuron disease
in wobbler mice cotreated with CNTFand BDNF//Science. — 1994. —
Vol. 265.-P. 1107-1109.
Mitsumoto K, Olney R.K. Drug combination treatment in patients with
ALS. Current status and future direction//Neurology. — 1996. — Vol.
47, Suppl. 2,-P. 103-107.
Mulder D. W., Howard F.M. Patient resistance and prognosis in amyotrophic
lateral sclerosis//Mayo Clin. Proc. — 1976. —Vol. 51. — P. 537—541.
Newson-Davis S. The diaphragm and neuromuscular disease//Amer. Rev.
resp. Dis. - 1979. - Vol: 119, N 2. - P. 115..
Norris F.H., Smith R.A., Denys E.H. Motor neurone disease toward better
care//Brit. Med. J. - 1985. - Vol. 291. - P. 259-262.
Norris F.H. Amyotrophic Lateral Sclerosis: The Clinical Disorder//Hand-
book of Amyotrophic Lateral Sclerosis. — New York — Basel — Hong
Kong, 1992. - P. 3-39.
Okamoto K. Bunina bodies in amyotrophic lateral sclerosis//Neuropathol-
ogy. - 1993. -Vol. 13. - P. 193-199.
Ono S., Toyokura Y, Mannen Т., Ichibasi Y. Increase dermal collagen
density in amyotrophic lateral sclerosis//J. neurol. Sci. — 1988. — Vol.
83. - P. 81-92.
Ono S., Mannen Т., Toyokura Y Differential diagnosis between amyotrophic
lateral sclerosis and spinal muscular atrophy by skin involvement//J.
neurol. Sci. - 1989. - Vol. 91. - P. 301-310.
Orvaln-Friya K, Rozier A., Dore M.F. et al. Functional evaluation of
respiratory disorders in ALS//J. neurol. Sci. — 1990. — Vol. 98. — P.
341.
Pamphlett R. Motor neuron disease: a primary disorder of corticomo-
toneurons?//Muscle & Nerve. - 1995. - Vol. 18. - P. 314-318.
Park R.H.R., Allison M.C., Lang J. et al. Randomised comparison of
percutaneous endoscopic gastrostomy and naso-gastric tube feeding in
patients with persisting neurological dysphagia//Brit. med. J. — 1992. —
Vol. 304. - P. 1406-1409.
Pascual J., Gea J., Aran X. et al. Early markers of pulmonary dysfunction
in ALS//J. neurol. Sci. - 1990. - Vol. 98. - P. 341.
Perl D.P., Gajdusek D.C., Garruto R.M. et al. Intraneuronal alluminium
142
accumulation in amyotrophic lateral sclerosis and parkinsonism demen-
tia of Guam//Science. - 1982. - Vol. 217. - P. 1053-1055.
Perry J.L., Krieger C, Hansen S., Eisen A. Amyotrophic Lateral Sclerosis:
Amino Acid Levels in Plasma and Cerebrospinal Fluid//Ann. Neurol.
- 1990. - Vol. 28. - P. 12-17.
Plaitakis A Glutamate Dysfunction and Selective Motor Neuron Degene-
ration in Amyotrophic Lateral Sclerosis//Ann. neurol. — 1990. — Vol.
28. - P. 3-8.
Pongratz D.y Hurg D. Myatrophische (amyotrophische) lateral sclerose.
Differential diagnose neurologischer BCrankheitsbilden. — Stuttgart —
New York: Georg Thieme Veriag, 1984. — S. 7—73.
Roos R.P., Viola M. V., Wollmann R et al. Amyotrophic Lateral Sclerosis
with Antecedent Poliomyelitis//Arch. Neurol. — 1980. — Vol. 37. — P.
312-313.
Rosen D.R, Siddique Т., Patterson D. et al. Mutations in Cu/Zn superoxide
dismutase gene are associated with familial amyotrophic lateral sclera-
sis//Nature. - 1993. -Vol. 362. - P. 59-62.
Rothstein J.D., Martin L.S., Kunel RW. Decreased glutamate transport by
the brain and spinal cord in amyotrophic lateral sclerosis//New Engl.
J. Med. - 1992. -Vol. 326. - P. 1464-1468.
Rothstein J.D. Exciototoxicity hypothesis//Neurology. — 1996. —Vol. 47,
Suppl. 2. - P. 19-26.
Rowland L.P. Riluzole for the Treatment of Amyotrophic Lateral Sclerosis —
too soon to tell//New EnglJ.Med. — 1994. — Vol. 330, N 9. — P.
636-637.
Rowland L.P. Amyotrophic Lateral Sclerosis (Theories and Thera-
pies)//Ann. Neurol. - 1994. -Vol. 35. - P. 151-163.
Salazar-Grueso E.F., Roos RP. Viruses and Amyotrophic Lateral Sclera-
sis//Handbook of Amyotrophic Lateral Sclerosis. — New York — Basel —
Hong Kong, 1992. - P. 453-477.
Sasaki S., Iwata M. Impairment of fast axonal transport in proximal axons
of anterior horn neurons in amyotrophic lateral sclerosis//Neurology. —
1996. - Vol. 47, N 2. - P. 537-539.
Schiffman P.L., Belsh J.M. Effect of inspiratory resistance and theophylline
on respiratory muscle strength in patients with amyotrophic lateral
sclerosis//Am. Rev. resp. Dis. - 1989. -Vol. 139. - P. 1418-1423.
Siddique Т., Nijhawan D., Hentaty A. Molecular genetic basis of familial
ALS//Neurology. - 1996. - Vol. 47, Suppl. 2. - P. 27-35.
Siddique Т., Figlewicz D.A., Pericak-Vance M.A et al. Linkage of a gene
causing familial amyotrophic lateral sclerosis to chromosome 21 and
evidence of genetic-locus heterogenety//New Engl. J. Med. — 1991. —
Vol. 324. - P. 1381-1384.
Sherman M.S., Paz H.L. Review of respiratory care of the patient with
amyotrophic lateral sclerosis//Respiration. — 1994. — Vol. 61. — P. 61.
Shy M.E., Rowland L.P., Smith T. et al. Motor neuron disease and plasma
ceU dyscrasia//Neurology. — 1986. —Vol. 36. — P. 1429—1436.
Sivak E.D., Gipson W.T., Hanson M.R Long-term management of respira-
tory failure in amyotrophic lateral sclerosis//Ann. Neurol. — 1982. —
Vol. 12. - P. 18-23.
Smith R.G., Sikbos L., Alexianu M.E. et al. Autoimmunity and ALS//Neu-
rology. - 1996. - Vol. 47, Suppl. 2. - P. 40-45.
Spencer P.C., Roy D.N., Ludoph A. et al. Lathyrus evidence for role of the
143
neuroexcitatory amino acid BOAA//Lancet. — 1986. — Vol. 2. — P.
1066-1067.
Tandan R, Bradley W.G. Amyotrophic lateral sclerosis. Clinical features,
pathology and ethical issue in management//Ann. Neurol. — 1985. —
Vol. 18. - P. 271-280.
Weiner L.P.y Stohlman S.A., Davis RL. Attempts to demonstrate virus in
amyotrophic lateral sclerosis//Neurology. — 1980. — Vol. 30. — P.
1319-1322.
Weiss J.H., Koh J.Y, Choi D.W. Neurotoxicity of BMAA and BOAA on
cultural cortical neurons//Brain Res. — 1980. — Vol. 497. — P. 64—71.
Williams D.B., Windebank A. J. Motor Neuron Disease (Amyotrophic Late-
ral Sclerosis)//Mayo Clin. Proc. - 1991. -Vol. 68. - P. 54-82.
Yase Y The pathogenesis of amyotrophic lateral sclerosis//Lancet. — 1972. —
Vol. 2. - P. 292-296.
Yanagihara RT. Heavy metals and essential mineral in motor neuron
disease//Adv. Neurol. - 1982. - Vol. 36. - P. 233-247.
Монография
Любовь Михайловна Попова
Амиотрофический боковой склероз
в условиях продленной жизни
Зав. редакцией Т.П. Осокина
Научный редактор М.В. Потехина
Художественный редактор Т.С. Тихомирова
Технический редактор Н.М. Гаранкина
Корректор Л.П. Колокольцева
ЛР № 010215 от 29.04 97. Сдано в набор 15.05.98. Подписано к печати 11.06 98. Формат
бумаги 60x90/16. Бумага мелованная. Гарнитура Тайме. Печать офсетная. Усл.печ.л. 9,0.
Усл.кр.-отт. 9,0. Уч.-издл 9,14. Тираж 1000 экз Заказ N° 1529.
Ордена Трудового Красного Знамени издательство "Медицина". 101000, Москва, Петро-
веригский пер., 6/8.
Оригинал-макет изготовлен в АО "ИНПОЛ". 125130, Москва, Старопетровский пр., 11.
Отпечатано с оригинал-макета в типографии ОАО "Внешторгиздат" 127576, Москва,
ул. Илимская, 7
ISBN 5-225-04440-9
9М785225И044404