Author: Свердлов Е.Д.
Tags: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез генетика
ISBN: 5-02-002753-7
Year: 2003
Text
Problems and Prospects
ot Molecular
Genetics
Volume 1
Edited by academician
Ye.D. Sverdlov
MOSCOW
NAUKA
2003
niDtabi и перспективы
молекулярной
генетики
Том 1
Ответственный редактор
академик Е.Д. Свердлов
в
МОСКВА
НАУКА-
2003
УДК 575
ББК 28.04
П78
Ответственный редактор
академик Е.Д. СВЕРДЛОВ
Рецензенты:
доктор биологических наук Б.О. ГЛОТОВ,
член-корреспондент РАН С.Н. КОЧЕТКОВ
На 4-й сторонке переплета Cliff - с разрешения Pant Thiessen
Проблемы и перспективы молекулярной генетики. Том 1 / Отв. ред.
Е.Д. Свердлов. — М.: Наука, 2003. — 372 с.: ил. — ISBN 5-02-002753-7 (в пер.)
Сборник статей охватывает широкий круг проблем современной молекулярной генетики, от
структурных аспектов носителей генетической информации до генома человека, эмбриональных
стволовых клеток и биоинформатики. Сборник отражает научные достижения Института моле-
кулярной генетики РАН за последние годы.
Для научных работников - специалистов в области молекулярной биологии и генетики, для
студентов и преподавателей биологических факультетов высших учебных заведений.
ТП 2002-(1)-266
Problems and Prospects of Molecular Genetics. Vol. 1 / Ed. by E.D. Sverdlov. -
Moscow, Nauka, 2003. 372 p.: ill. — ISBN 5-02-002753-7 (cloth)
The collection of reviews covers a wide circle of problems of modem genetics, from the structural
aspects of genetic information earners to the human genome, embryonic stem cells and bioinformatics
The collection reflects the research achievements of the Instutute of Molecular Genetics of the Russian
Academy of Sciences in the last years.
The publication is designed for researchers of molecular biology and genetics, and also for students and
lectures of biological departments of higher educational establishments.
ISBN 5-02-002753-7
© Российская академия наук, 2003
© Издательство “Наука” (художе-
ственное оформление), 2003
ВВЕДЕНИЕ
Молекулярная генетика призвана расшифровывать структуры геномов,
генов, механизмы их воспроизводства и реализации информации, закодиро-
ванной в этих структурах. Эта область науки исследует также механизмы из-
менчивости генома, лежащие в основе эволюции и биологического разнооб-
разия. С практической точки зрения, молекулярная генетика лежит в осно-
ве современной биотехнологии, диагностики и лечения болезней, интенси-
фикации сельского хозяйства и охраны окружающей среды.
С развитием технологий молекулярных исследований, начавшимся в на-
чале 70-х годов прошлого века, с введением быстрых методов секвенирова-
ния и генно-инженерных способов клонирования фрагментов ДНК, темпы
развития молекулярной генетики приняли стремительный характер и приве-
ли к возникновению в конце 80-х годов программы “Геном человека”. Этот
глобальный проект предполагает к 2005 г. завершить определение полной
последовательности всех 3 млрд нуклеотидных звеньев, составляющих геном
человека. Введение его в действие означало, что техническое развитие моле-
кулярных исследований в области наук о жизни достигло качественно ново-
го уровня, позволяющего решать принципиально новые задачи. Комплекс
исследований молекулярных основ жизнедеятельности, в который входит
и молекулярная генетика, изменил свое лицо идеологически и технически.
Идеологически произошел сдвиг:
от исследований отдельных генов к исследования целых геномов, от ге-
нетики скрещивания к парасексуальной генетике (термин, определяющий
исследования, основанные на введении генетического материала в клетку
или в целый организм неполовым путем и на создании условий для его по-
следующей передачи по наследству);
от классической прямой генетики, двигавшейся к идентификации генов
от признаков, кодируемых этими генами, к “обратной” генетике, которая
сначала идентифицирует фрагмент генома, а уже затем занимается выясне-
нием, какой признак определяет этот фрагмент;
от работы с изолированными генами или продуктами их экспрессии к изу-
чению их эффектов на уровне целого организма, в котором роль этих продук-
тов осмысливается в контексте комплекса их природных взаимосвязей.
Технически стал возможным переход:
к направленному воздействию на генетический аппарат клетки или це-
лого организма, приводящему к его наследственному изменению;
к исследованиям структур отдельных молекул путем их избирательной
амплификации;
к методам эволюции в пробирке: направленному систематическому из-
менению свойств взаимодействующих молекул, позволяющему достигать их
максимального взаимодействия;
5
от традиционных белковых ферментов к искусственным ферментам по-
линуклеотидной природы;
к тотальной автоматизации и роботизации экспериментальной работы и
к максимальному переносу груза анализа экспериментальных результатов
на компьютер;
к созданию интегральных информационных баз данных, позволяющих
быстро сопоставлять структуры новых продуктов с уже существующими и
на основании гомологий делать предварительные выводы об их возможной
функциональной роли.
Началась эпоха интегральных исследований геномов, которые образо-
вали специфический раздел молекулярной генетики - геномику. Геномика
сегодня занимается анализом структуры и функций геномов как инте-
грального функционального массива генов, их регуляторных элементов и
других последовательностей, необходимых для функционирования генома.
В круг ее интересов входит также анализ появившихся и закрепившихся в
геноме паразитических эгоистических элементов, значимость которых для
существования и эволюции геномов еще предстоит узнать. Начавшись с ис-
следований генома человека, геномика значительно расширила диапазон
своих интересов и включила в них множество модельных организмов - ба-
ктерии и дрожжи, нематоду, дрозофилу и мышь, геномы которых исследу-
ются и сравниваются между собой для расшифровки структурных основ их
функциональной организации. Возникло единое пространство геномной
информации, которое стремительно наращивает свой информационный
потенциал. Сравнительный анализ структур геномов различных организ-
мов составляет отправную точку для функциональной геномики, которая
призвана определять функциональную значимость вновь определяемых по-
следовательностей. Концепция “в гомологии структур зашифрована анало-
гия функций” оказывается весьма плодотворной и помогает устанавливать
функции генов человека на основании известных функций генов модель-
ных организмов. Таким образом, современная молекулярная генетика опе-
рирует в едином геномно-информационном поле, где информация о функ-
циях генов в различных организмах интегрируется и распространяется на
другие организмы.
Анализ функций генов не ограничивается только пассивным сравнением
их структур. Функциональный смысл идентифицированной последователь-
ности с характерными особенностями, присущими гену, может анализиро-
ваться и путем ее модификации in vitro, введения модифицированного вари-
анта в клетки или в животных и исследования эффекта вариации последова-
тельности на свойства клеток или животных. Современная молекулярная
генетика использует для этих целей широкий диапазон методов генетики со-
матических клеток и трансгеноза, включая создание так называемых нока-
утированных животных, у которых направленно удаляется исследуемая по-
следовательность или блокируется ее функция. Наконец, продукт, кодируе-
мый данной последовательностью, может быть получен методами генетиче-
ской инженерии, и его свойства могут исследоваться стандартными биохи-
мическими приемами и изменяться методами белковой инженерии. Функцио-
нальная геномика развивается чрезвычайно быстро, но, поскольку функ-
циональный анализ всегда требует больших временных затрат при меньшей
определенности и однозначности результатов, можно предсказать, что
6
функциональный анализ геномов займет очень значительное время после
установления структуры геномов человека и модельных организмов.
Важнейшую роль в структурных исследованиях генома играет изучение
его полиморфизма. Этот раздел молекулярной генетики является основой
для понимания принципов молекулярной эволюции, механизмов возникно-
вения патологических мутаций, для оценки факторов риска при воздействии
потенциальных токсических агентов окружающей среды на человеческий
организм, наконец, для понимания основ различной индивидуальной воспри-
имчивости лекарств. Эти исследования получили новый импульс с открыти-
ем полиморфных мини- и микросателлитов, которые позволили осущест-
вить тонкое генетическое картирование генома и в конечном счете создать
интегрированные карты генома, объединяющие физические и генетические
карты генома человека в единую систему. Это в свою очередь привело к
развитию методов позиционного клонирования, которые позволяют быстро
клонировать гены, начав с исследования их сегрегации в семьях.
Современная геномика была бы невозможной без развития систем кло-
нирования крупных фрагментов генома в специальных векторах, способных
реплицироваться в клетках вместе со встроенными в них фрагментами.
К таким векторам относятся, в частности, искусственные дрожжевые хро-
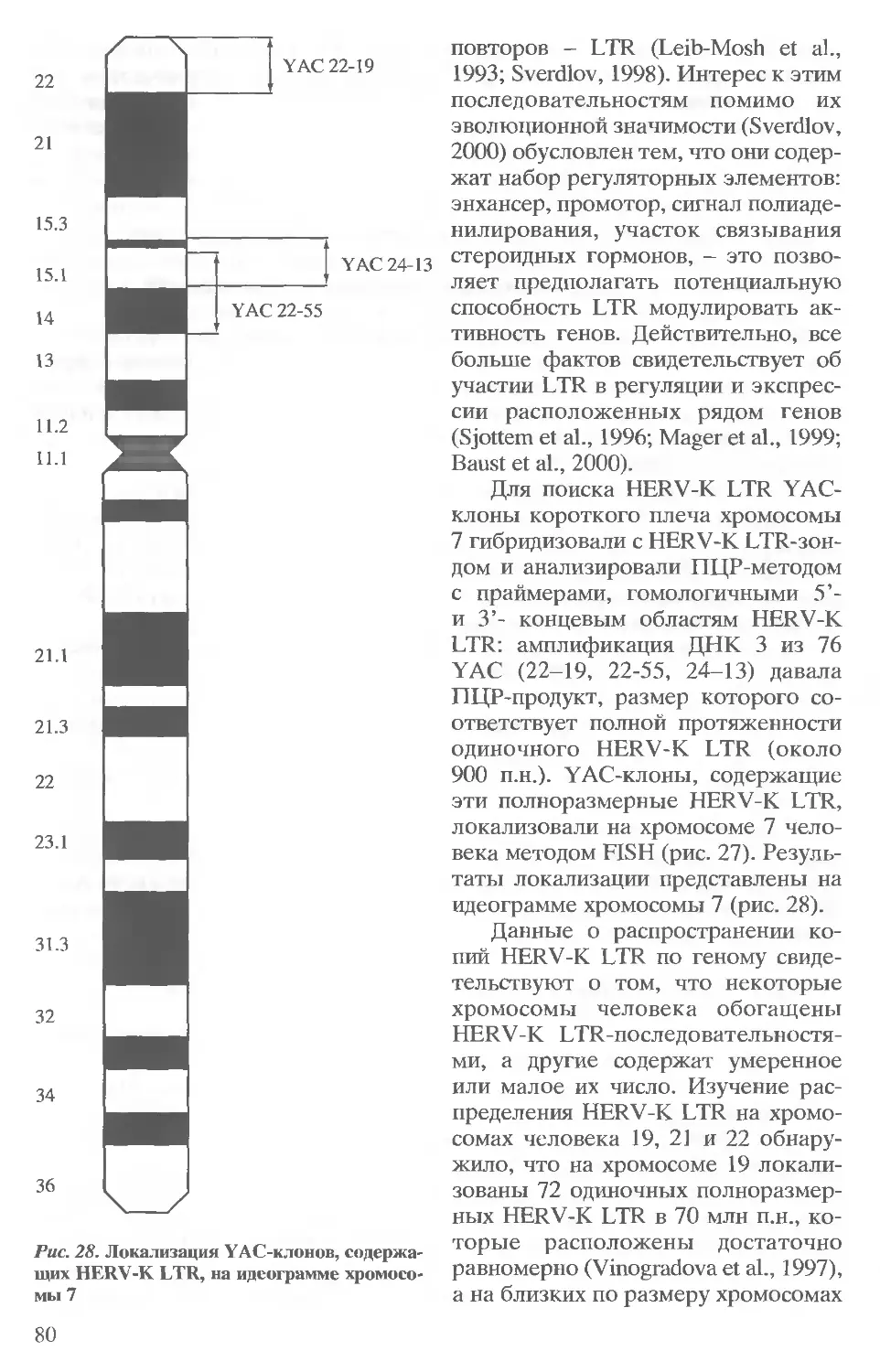
мосомы (YAC), появление которых стало возможным благодаря развитию
молекулярной генетики дрожжей. В результате их появления геном удалось
разбить на фрагменты длиной примерно 106 пар оснований, которые в со-
ставе YAC находятся в библиотеках генов. Каждый фрагмент в этой библио-
теке картирован, т.е. приписан к определенному участку хромосом. Это со-
здает предпосылки для быстрого выделения нужного фрагмента генома для
работы in vitro как для структурного, так и для функционального анализа.
Наличие библиотек фрагментов лежит в основе определения первичной
структуры всего генома.
Хотя интегральные исследования генома играют все возрастающую
роль, это не означает потери актуальности исследований конкретных генов
и механизмов их экспрессии. Накапливается информация о генах, играющих
центральную роль в регуляции клеточной жизнедеятельности, таких как ге-
ны контроля клеточного цикла или гены, кодирующие компоненты переда-
чи сигнала от клеточной поверхности аппарату транскрипции в клеточном
ядре. О генах, контролирующих развитие эмбрионов. О генах, ответствен-
ных за работу защитных систем организма, генах иммунной системы. Рас-
ширяется представление о генах, повреждение которых приводит к возник-
новению раковых опухолей, онкогенах, генах-супрессорах и генах клеточ-
ной смерти, апоптоза. Наконец, все более детальным становится знание
строения аппаратов транскрипции бактериальных и эукариотических кле-
ток и надмолекулярных уровней регуляции экспрессии, включая эффект по-
ложения, инсуляцию и т.д.
Это введение было бы неполным без упоминания о той чрезвычайно
важной роли, которую играют компьютерные методы хранения и анализа
информации, быстро возрастающей по мере развития молекулярной генети-
ки и геномики. Созданные и расширяющиеся базы данных позволяют осу-
ществлять быстрый сравнительный анализ вновь появляющихся данных и
существенно облегчают функциональные выводы на основе сравнительно-
го структурного анализа.
7
Стремительное накопление фундаментальной информации имеет не-
медленные и глубокие практические последствия для биотехнологии, меди-
цины и сельского хозяйства и множества других жизненно важных проблем,
из которых, возможно, важнейшей является экология.
В области биотехнологии молекулярная генетика создает фундамен-
тальные основы для создания продуцентов различного рода веществ по
двум направлениям. Во-первых, в ходе идентификации новых генов чело-
века и других организмов выявляются все новые биорегуляторы и их ре-
цепторы, которые можно использовать в качестве лекарственных препа-
ратов для ветеринарии и медицины. Во-вторых, совершенствуются систе-
мы экспрессии различного рода генов в разнообразных клетках и организ-
мах, что в свою очередь создает две перспективы: создание клеток (бакте-
риальных и эукариотических) и организмов (растений и животных), проду-
цирующих различного рода вещества, которые далее могут использовать-
ся как лекарства, пищевые добавки, ферменты в заводских процессах или
компоненты диагностикумов или вакцин, а также для создания организмов
с улучшенными свойствами, например, трансгенных растений, устойчивых
к засухам или имеющих повышенную переносимость к засоленным поч-
вам, или животных, устойчивых к инфекциям. Наиболее впечатляющим
достижением в области создания новых продуцентов можно назвать созда-
ние живых ферментеров — животных, секретирующих лекарственные пре-
параты в молоко. Развитие технологий создания трансгенных животных
делает процедуру создания такого ферментера достаточно рутинной.
Эти технологии базируются на достижениях генетики соматических кле-
ток и в последнее время намечается тенденция использования для этих це-
лей систем клонирования животных. Можно сказать, что развитие молеку-
лярной генетики перевело биотехнологию на уровень целых организмов,
заложило предпосылки экологически чистых технологических процессов
и интенсивных сельскохозяйственных технологий. Это особенно важно
ввиду намечающихся демографических и экологических кризисов перена-
селенной планеты.
Возможно, наиболее ярко практический потенциал молекулярной гене-
тики проявляется в биомедицинских исследованиях. Здесь развитие молеку-
лярно-генетических подходов также многопланово:
идентификация генов, ответственных за возникновение заболеваний, на-
следственных и приобретенных;
анализ генетических систем, ответственных за метаболизм лекарствен-
ных препаратов в организме (фармакокинетику), их полиморфизма и корре-
ляции этого полиморфизма с различной устойчивостью индивидуумов и по-
пуляций к действию лекарственных препаратов;
анализ генетических систем, кодирующих мишени воздействия лекарст-
венных препаратов в организме (фармакодинамику), их полиморфизма и ро-
ли этого полиморфизма в различной восприимчивости к лекарствам;
развитие систем лечения, основанных на введении в организм новой ге-
нетической информации, призванной исправлять наследственные или при-
обретенные генетические дефекты или подавлять генетические изменения,
связанные с проникновением инфекционных агентов (генная терапия);
развитие группо-специфических средств лечения, основанных на наце-
ленном применении лекарственных препаратов в генетически охарактери-
8
зованных группах, проявляющих к ним восприимчивость и не подвержен-
ных побочным эффектам;
развитие интенсивных методов диагностики, основанных на выявле-
нии генетических дефектов на уровне целого генома и продуктов его экс-
прессии;
переход в диагностике к скринингу популяций и от диагноза болезней
к выявлению предрасположенности к болезни.
Говоря об идентификация генов, ответственных за возникновение забо-
леваний, следует отметить большой прогресс в идентификации генов, вовле-
ченных в их этиологию в случае монотонных наследственных болезней, на-
следование которых подчиняется менделевским законам. Здесь весьма ус-
пешной оказалась стратегия позиционного клонирования. С ее помощью
удалось идентифицировать множество генов, включая гены, ответственные
за муковисцидоз, рак молочной железы, другие виды наследственной пред-
расположенности к опухолям, мышечной дистрофии Дюшенна и миотони-
ческой дистрофии, ген, ответственный за преждевременное старение (син-
дром Вернера), гены, ответственные за нейрофиброматоз 1-го и 2-го типов,
и другие.
Этот процесс будет продолжаться, но главной проблемой генетики чело-
века в ближайшем будущем будет систематическая идентификация генов,
ответственных за предрасположенность к сложным болезням, не подчиняю-
щимся простым менделевским законам наследования: атеросклерозу, гипер-
тонии, психиатрическим заболеваниям, болезни Альцгеймера, диабетам I
и II, астме, ревматоидному артриту и, вероятно, значительным компонентам
обычного старения. Эти болезни, хотя и менее фатальны, чем монотонные,
гораздо более распространены и наносят существенно больший экономиче-
ский ущерб обществу. Пути, которыми развивается медицинская геномика в
этом направлении, определены, но в кратком введении останавливаться на
этой проблеме нет возможности. Понятно, что идентификация генов болез-
ней позволяет осуществить точный диагноз и выработать наиболее рацио-
нальные пути лечения, включая генно-терапевтические воздействия.
Прогресс в анализе генетического полиморфизма в отношении воспри-
имчивости к лекарствам приводит к возникновению нового направления ге-
номики - фармакогеномики, объединяющей генетический полиморфизм
фармакокинетических и фармакодинамических процессов. Сегодня медици-
на опирается на статистические данные, касающихся всей человеческой по-
пуляции. Эти данные используются для лечения пациентов без учета их ин-
дивидуальных особенностей. Задачей фармакогеномики в ближайшем буду-
щем является систематическая идентификация вариаций в последовательно-
стях множества генов, вовлеченных в реакцию организма на условия окру-
жающей среды, в том числе на действие лекарственных препаратов. К та-
ким генам относятся:
гены, контролирующие метаболизм ксенобиотиков;
гены репарации нуклеиновых кислот:
гены контроля клеточного цикла;
гены контроля программируемой клеточной смерти;
гены контроля передачи сигнала от поверхности клетки в ядро.
После такого рода скрининга можно будет стратифицировать популя-
ции на группы по принципу генетической восприимчивости и, следователь-
9
но, выработать стратегии наиболее эффективного и персонализированного
лечения. Особо следует отметить генетические межэтнические различия в
восприимчивости к лекарствам, которые существуют и ставят перед меди-
циной каждой страны задачу анализа восприимчивости к лекарствам в свя-
зи с особенностями гаплотипов в популяциях, живущих в этой стране. Неко-
торые специалисты называют эту область фармакогеномики фармакоан-
тропологией.
Развитие фармакодинамики, по-видимому, расширит возможности пер-
сонолизации медицины. В настоящее время стандартная фармакология ис-
пользует около 500 мишеней воздействия лекарственных препаратов. Это
компоненты молекулярной системы обеспечения жизнедеятельности, либо
инфекционные агенты. Биохимически это - рецепторы, ферменты, факто-
ры, гормоны, ионные каналы, ядерные рецепторы, ДНК и другие. Ожидает-
ся открытие 3-10 тыс. новых мишеней воздействия лекарственных препа-
ратов.
Можно предположить, что характерной особенностью медицины следу-
ющего века станет ее превентивный и персонолизированный характер.
В результате медицинские методы из стандартизированных и усредненных
превратятся в групповые и индивидуальные.
Так выглядит весьма краткий набросок того, что представляет собой мо-
лекулярная генетика сегодня и с чем она вошла в третье тысячелетие.
академик Е.Д. Свердлов
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА ЖИВОТНЫХ
Нижеследующие четыре обзора отражают результаты научно-исследо-
вательских работ Отдела молекулярной генетики клетки ИМГ РАН за
последние годы:
Гетерохроматин (В.А. Гвоздев).
Механизмы и следствия взаимодействий ретротранспозонов с геномом
хозяина (Е.Г. Пасюкова).
Кластер семенник-специфичных генов у дрозофилы (Ю.Я. Шевелев).
Функциональная организация генома дрозофилы: генетические элемен-
ты в протяженном районе эухроматина (В.Е. Алаторцев).
ВВЕДЕНИЕ
В Отделе исследуется структурно-функциональная организация генома
эукариот на примере модельного объекта - плодовой мушки Drosophila
melanogaster. Огромная роль этого объекта в расшифровке механизмов
функционирования более сложных геномов, включая геном человека, хоро-
шо известна. Работы на дрозофиле заложили основу для развития работ на
позвоночных, включая человека, по следующим основным направлениям
молекулярной генетики: молекулярный анализ генетики развития организ-
ма; исследование рецепции сигналов окружающей среды; роль структуры
хроматина в клеточной дифференцировке. Успехи в исследовании геномов
позвоночных, основанные на работах, выполненных на дрозофиле, стали
стимулом для организации проекта секвенирования генома D. melanogaster,
который в значительной степени был завершен в 2000 г. Доступный банк
данных нуклеотидных последовательностей предоставил богатейший мате-
риал для выяснения функций генов, которые до сих пор не были идентифи-
цированы, а также для анализа этой информации с помощью компьютер-
ных программ. Однако гены, кодирующие белки, составляют только малую
часть сложных геномов многоклеточных эукариот. Одной из наиболее важ-
ных задач является выявление в не кодирующих белки последовательностях
ДНК тех контролирующих элементов, которые определяют правильную
экспрессию генов во времени и в отдельных тканях развивающегося орга-
низма.
В Отделе продолжаются исследования проблем, поставленных в свое
время классической генетикой, но далеко еще не решенных. Некоторые из
них (явление компенсации дозы гена и эффекта положения гена) были вы-
браны для экспериментального анализа достаточно давно (Гвоздев, 1968;
Исследования “эффекта положения генов” и “компенсации дозы гена” полу-
11
чили в настоящее время, благодаря использованию технологии рекомбинат-
ных ДНК, широчайшее развитие во многих лабораториях мира. Первые
публикации собственных работ, касающихся этих проблем и выполненных
в лаборатории биохимической генетики животных Радиобиологического
отдела Института атомной энергии, появились в 70-х годах (Гвоздев,
1970; Faizullin, Gvozdev, 1973; Gvozdev et al., 1974). Исследования компенса-
ции дозы гена связаны с самыми общими вопросами регуляции генной ак-
тивности, в первую очередь генов половых хромосом, число которых разли-
чается у разных полов. Несмотря на различие числа генов половых хромо-
сом, общий уровень их экспрессии одинаков у самцов и самок. Экспрессия
генов в единственной Х-хромосоме самца дрозофилы “сверхактивирована”,
ее уровень такой же, как двух Х-хромосом самок. Уровень экспрессии генов
половых хромосом устанавливается в раннем развитии организма и наследу-
ется в ряду клеточных поколений. Новые работы, касающиеся проблемы
“компенсации дозы гена”, выполнены в секторе генных взаимодействий
(В.Е. Алаторцев). Эффект положения генов состоит в изменении характера
экспрессии гена, вызванном перемещением его в другое окружение. При
эффекте положения может наблюдаться нестабильная, обратимая инакти-
вация генов. Эта модель исследования экспрессии гена имитирует процессы
клеточной дифференцировки, а потому издавна привлекает внимание иссле-
дователей. Неактивное состояние вызвано не изменением нуклеотидной по-
следовательности гена, а обусловлено наследуемым в ряду клеточных поко-
лений “неактивным” состоянием гена, определяемым комплексом белков,
связывающихся с ним. Инактивация гена нестабильна, может происходить
реактивация гена в процессе развития организма. Такой обратимый тип на-
следования экспрессии гена называют эпигенетическим (Holliday. 1994;
Henikoff, Matzke, 1997). К исследованию молекулярных механизмов эпигене-
за на самых разных объектах (дрожжи, нематода, дрозофила, позвоночные)
сейчас привлечено большое внимание, поскольку эпигеномное наследова-
ние имеет место в клетках и тканях нормально развивающегося организма в
процессах дифференцировки и морфогенеза. Результаты подобных работ,
выполненных на дрозофиле, были успешно использованы при исследовании
клеточной дифференцировки и ракового перерождения у млекопитающих
(Jones et al., 2000). На фоне интенсивно ведущихся на разных объектах иссле-
дований эффектов положения генов работы отдела представляются ориги-
нальными и вносят свой вклад в развитие представлений о механизмах
этого явления. Обратимый и наследуемый в ряду поколений соматических
клеток характер экспрессии генов имеет место как при эффекте положения,
так и в явлении дозовой компенсации. В обоих случаях речь идет об
эпигеномном характере наследования инактивированного или, напротив,
“сверхактивного” состояния гена.
В самом начале 70-х, еще до революции, вызванной внедрением техно-
логии рекомбинантных ДНК, нами были начаты работы с целью исследова-
ния “тонкой структуры гена” путем “насыщения” ограниченного участка
Х-хромосомы летальными мутациями (Gvozdev et al., 1975). Полученные ре-
зультаты показали многократную “избыточность” содержания ДНК в рас-
чете на жизненно важный ген. Сейчас существование экзон-интронной струк-
туры генов эукариот, в которых подавляющая часть ДНК может быть
представлена некодирующими интронами, в значительной степени объясня-
12
ет этот результат, в то время казавшийся парадоксальным. Генетический
анализ выбранного ограниченного участка Х-хромосомы послужил стиму-
лом для исследования молекулярной организации этого района с использо-
ванием методов клонирования (В.Е. Алаторцев). Актуальность постановки
этой работы определялась также тем, что планировались исследования
эффектов положения генов, локализованных в данном районе Х-хромосо-
мы. Анализ молекулярной организации выбранного участка Х-хромосомы
продолжается и сейчас, уточняются и корректируются результаты, полу-
ченные в рамках геномного проекта (В.Е. Алаторцев, сектор генных взаи-
модействий).
В середине 70-х годов удалось впервые выявить подвижные элементы
дрозофилы (ретротранспозоны). Эти работы были проведены Лаборатори-
ей биохимической генетики животных совместно с лабораторией Г.П. Геор-
гиева (Институт молекулярной биологии РАН). Оказалось, что клонирован-
ные в лаборатории Г.П. Георгиева фрагменты ДНК располагаются в раз-
ных местах в хромосомах разных индивидуумов (Ananiev et al., 1978; Георги-
ев, Гвоздев, 1980), в то время как обычные гены локализованы в строго оп-
ределенных и одинаковых у всех особей данного вида участках хромосом.
Это наблюдение позволяло заключить, что в руках исследователей оказались
клонированные подвижные гены эукариот, ранее обнаруженные у бакте-
рий. Работы по подвижным элементам в 1983 г. были отмечены Государст-
венной премией СССР. Исследования подвижных элементов продолжаются
в лабораториях геномной изменчивости (Е.Г. Пасюкова) и биохимической
генетики животных (В.А. Гвоздев).
В 1967 г. была получена культура клеток дрозофилы (Гвоздев, Какпа-
ков, 1968; Какпаков и др., 1969), которая была использована в ряде работ
Отдела, в том числе и при выделении подвижных генов. Культуры клеток
дрозофилы в 1967 г. были получены и французскими учеными, одновремен-
ный и независимый вклад отечественных и французских авторов в этом на-
правлении исследований признан (Echalier, 1997). В последнее время пересе-
ваемая культура клеток была использована в исследовании явления
РНК-интерференции (Aravin et al., 2001).
В Отделе также были проведены исследования структуры и регуляции
активности отдельных генов. Это гены, кодирующие кальций-связывающий
белок аннексии (Benevolenskaya et al., 1995), изоформы моторного белка ци-
стоскелета - динеина (Nurminsky et al., 1998), ген цитоскелетного белка вин-
кулина и, наконец, ген регуляторной субъединицы протеинкиназы СК2
(Калмыкова и др., 1997; Kalmykova et al., 1998;). Исследования регуляции ак-
тивности ряда генов, которые специфично экспрессируются в семенниках,
сейчас проводятся в лаборатории анализа регуляции активности генов
(Ю.Я. Шевелев).
СЛОВАРЬ ТЕРМИНОВ И СПИСОК СОКРАЩЕНИЙ
Хроматин - комплекс ДНК с белками в составе хромосомы.
Эухроматин - слабо конденсированные участки хроматина, содержащие активно рабо-
тающие гены.
Гетерохроматин - сильно конденсированные, плотно упакованные участки хроматина,
в основном содержащие неактивные гены.
Нуклеосома - частица, представляющая собой единицу упаковки ДНК в хроматине.
13
Хромомер - небольшой участок конденсированного хроматина.
Микросателлиты — присутствующие в эухроматине короткие тандемно повторяющиеся
последовательности ДНК.
Центромера — район хромосомы, к которому прикрепляется нить, обеспечивающая рас-
хождение хромосом при делении клетки.
Политенные хромосомы — гигантские хромосомы слюнных желез дрозофилы, состоя-
щие из 1024 образовавшихся в результате последовательного удвоения неразошед-
шихся хромосом.
м-РНК - матричная, информационная РНК, кодирующая белки.
к-ДНК - ДНК, комплементарная РНК.
Экзои - кодирующая последовательность гена, входящая в первичный транскрипт.
Интрон - некодирующая последовательность ДНК внутри гена.
Промотор - район ДНК, с которого инициируется транскрипция.
Энхансер - усилитель транскрипции; может действовать, находясь на значительном рас-
стоянии от промотора (до сотен тысяч пар нуклеотидов) и независимо от ориента-
ции относительно промотора.
Инсулятор - ограничивает влияние энхансера на промотор.
Трансген - ген или фрагмент ДНК, искусственно введенный в геном организма в соста-
ве генно-инженерной конструкции.
Ген-репортер - ген, активность которого легко определяется в генно-инженерных кон-
струкциях, введенных в клетку или геном.
Косупрессия — подавление экспрессии трансгенов и соответствующего гена в геноме при
увеличении числа копий трансгенов.
РНК-интерференция - способность двухцепочечных молекул РНК вызывать подавле-
ние экспрессии генов, гомологичных по нуклеотидной последовательности.
Ретротранспозон - подвижный элемент генома, использующий синтез ДНК на РНК-ма-
трице для образования своих копий, перемещающихся в новый район генома.
Транспозиция — перемещение ретротранспозона в новый район генома.
Инсерция - встройка ретротранспозона в геном.
Согласованная эволюция - поддержание структурного сходства копий повторяющихся
элементов с гомологичными нуклеотидными последовательностями.
Герминальные стволовые клетки - клетки полового пути, в которых программа диф-
ференцировки еще не запущена; после каждого деления такой клетки одна из
дочерних клеток остается стволовой, а другая начинает дифференцироваться в
гаметы.
Дифференцировка — специализация клеток в процессе развития организма.
Генеративная ткань - ткань, состоящая из клеток, превращающихся в гаметы; семенни-
ки (у самцов) или яичники (у самок) состоят в основном из генеративной ткани.
Эффект положения гена — изменение экспрессии гена в результате изменения его поло-
жения в геноме.
Эпигенетическая изменчивость - наследуемое, но обратимое функциональное состоя-
ние гена, не сопровождающееся изменением его нуклеотидной последовательности.
Дозовая компенсация - выравнивание уровня экспрессии генов половой хромосомы у
самцов с одной хромосомой и у самок с двумя хромосомами.
Приспособленность - параметр, характеризующий способность особи выжить и оста-
вить жизнеспособное потомство.
Популяция - совокупность особей данного вида, проживающих на общей территории и
скрещивающихся между собой.
Количественный признак - признак, который можно измерить или охарактеризовать
определенной величиной.
т.п.н. — тысяча пар нуклеотидов.
м.п.н. - миллион пар нуклеотидов.
14
ГЕТЕРОХРОМАТИН
(структура, молекулярная эволюция
и регуляторные взаимодействия)
В.А. Гвоздев
Лаборатория биохимической генетики животных
Отдела молекулярной генетики клетки
Особое внимание уделяется исследованию гетерохроматина, состав-
ляющего существенную часть эукариотического генома. Проводится
анализ молекулярной организации и эволюции повторяющихся элементов
гетерохроматина. Исследуются закономерности инактивации эухрома-
тиновых генов прилежащим гетерохроматином (цис-взаимодействия),
а также взаимодействия гетерохроматиновых участков разных хромо-
сом (транс-взаимодействия). В последнем случае обнаружено, что транс-
взаимодействия, вызывающие подавление экспрессии повторов гетеро-
хроматина, основаны на механизме РНК-интерференции (см. далее).
Исследуется экспрессия подвижных элементов и роль РНК-интерферен-
ции в этом процессе.
В геноме многоклеточных эукариот выделяют два компонента: эухро-
матин и гетерохроматин. Гетерохроматин включает значительную, иногда
более половины по весу, часть ДНК. У дрозофилы гетерохроматин состав-
ляет более 30% ДНК. На рис. 1, А показаны эухроматиновые и гетерохро-
матиновые участки хромосом, наблюдаемые в делящихся клетках. Гетеро-
хроматин сконцентрирован в основном около центромеры. Основная масса
генов локализована в эухроматине, материал которого доступен для визу-
ального анализа благодаря наличию у дрозофилы политенных хромосом,
присутствующих в ядрах не делящихся клеток слюнных желез (рис. 1, Б). По-
литенные хромосомы представляют собой жгуты, составленные из парал-
лельно расположенных молекул ДНК, образующихся в процессе последова-
тельных актов редупликации ДНК. Существование таких гигантских поли-
тенных хромосом открывает новые возможности исследования геномов и
определения в хромосомах локализации трансгенов, а также подвижных
элементов (см. ниже) с помощью гибридизации in situ.
Гетерохроматин обогащен подвижными элементами и представлен глав-
ным образом некодирующими повторяющимися последовательностями
ДНК. Остается неразгаданным, почему в геноме эукариот сохраняется мас-
са гетерохроматина, представленная, на первый взгляд, в основном “генети-
чески инертным” материалом. Однако и в гетерохроматине, несмотря на не-
большую концентрацию генов в расчете на количество ДНК, обнаружива-
ются отдельные жизненно важные гены. Один из них участвует в регуляции
клеточных делений. Таким образом, гетерохроматин представлен неодно-
родными нуклеотидными последовательностями, включающими не только
разные типы повторов, но и уникальные последовательности. Однако из-
вестна нуклеотидная последовательность лишь небольших участков гетеро-
хроматина. При завершении проекта секвенирования генома районы гете-
рохроматина по техническим причинам остались белыми пятнами, соседст-
вующими с эухроматином, представленным известной нуклеотидной после-
15
довательностью. В районах гетерохроматина ДНК более плотно упакована,
гетерохроматин характеризуется либо более компактным расположением
нуклеосом, либо представлен специальными “ненуклеосомными” структу-
рами. Биологическая роль гетерохроматина остается в значительной степе-
ни не выявленной, и решение этого вопроса является одной из фундамен-
тальных задач молекулярной генетики высших эукариот. Гетерохроматино-
вые районы, по-видимому, определяют самые разные функции: поведение
хромосом в митозе и мейозе, пространственную организацию хромосом в
неделящемся ядре (Gasser, 2001) и, наконец, активность рядом расположен-
ных генов (Weiler, Wakimoto, 1995).
Особый интерес к гетерохроматину не ослабевает в связи с исследовани-
ями явления эффекта положения гена, который представляет собой много-
обещающую модельную систему для понимания молекулярных механизмов
эпигенеза. Классическим объектом исследования эффектов положения ге-
нов, несмотря на обнаружение этого явления и у млекопитающих, остается
дрозофила (Lyko, Раго, 1999).
Функция сконцентрированных в гетерохроматине разных типов повто-
ров не выяснена или вскрыта далеко не до конца. К ним относятся так назы-
ваемые сателлитные ДНК, содержащие повторы от нескольких нуклео-
тидных пар до сотен нуклеотидных пар, а также разные типы потенциально
подвижных элементов. В гетерохроматин помещены также жизненно важ-
ные для каждой клетки тандемно повторяющиеся гены, кодирующие рибо-
сомные РНК. Вряд ли можно дать исчерпывающий ответ на вопрос, почему
рибосомные гены и подвижные (или когда-то бывшие подвижными) эле-
менты сконцентрированы в гетерохроматине. Характер распределения
сгруппированных подвижных элементов по гетерохроматиновым районам
хромосом дрозофилы одинаков в разных линиях и, следовательно, скорее
всего “рисунок” их распределения поддерживается отбором (Pimpinelli et al.,
1995). Образование таких кластеров подвижных элементов в гетерохрома-
тине отражает процессы эволюции генома.
Исследование возникновения кластеров гетерохроматиновых повторов
и экспрессии отдельных повторов в составе кластера представляется важ-
ным для выявления особенностей функционирования генов и в эухромати-
не. Актуальность таких исследований подчеркивается наблюдениями за
трансгенами, искусственно вводимыми в геном. Недавно было показано, что
трансгены, представленные рядом тандемно повторяющихся генов, могут
быть неактивными (Garrick et al., 1998). Однако после удаления большой ча-
сти генов из кластера остающиеся гены реактивируются. Это наблюдение
указывает на роль повторяющихся последовательностей ДНК в функциони-
ровании генов и способности локально амплифицировнных участков ДНК
приводить к инактивации генетического материала. Кроме того, оказалось,
что искусственное введение в геном добавочного числа генов (например,
в биотехнологических целях), рассеянных по геному, может приводить не
к увеличению общего количества кодируемого ими белка, а, напротив, к их
общей инактивации (явление косупрессии) (Henikoff, Matzke, 1997). Поэтому
вопросы о механизмах регуляции активности транскрибируемых гетерохро-
матиновых повторов могут иметь непосредственное отношение к проблеме
взаимной инактивации повторов, присутствующих в эухроматиновых рай-
онах генома. Проблема исследования возникновения и регуляции активно-
16
сти самих гетерохроматиновых повторов и прилегающих к ним генов соста-
вляет один из важных разделов исследований молекулярной эволюции гено-
мов и механизмов эпигеномной изменчивости.
Изучаются следующие нерешенные вопросы, касающиеся эволюции и
функции гетерохроматина.
1. Возникновение гетерохроматиновых повторов и их эволюция, в том
числе проблемы “согласованной эволюции” единиц тандемных повторов;
представление о “согласованной эволюции” возникло на основании анализа
кластеров повторов у близких видов, когда выяснилось, что различие в нук-
леотидной последовательности повторов данного типа для каждого отдель-
ного вида невелико, тогда как межвидовые различия оказываются значи-
тельными (Liao, 1999).
2. Взаимодействие гомологичных гетерохроматиновых элементов в ге-
номе и молекулярная природа инактивации повторяющихся генов.
3. Характер и закономерности инактивации генов, обусловленные их со-
седством с гетерохроматином, приводящие к известному явлению - эффек-
ту положения генов, который проявляется как нестабильная, обратимая
инактивация генов.
4. Пространственное расположение хромосом в ядре, обусловленное вза-
имодействием сегментов гетерохроматина, и активность генов.
ВОЗНИКНОВЕНИЕ БЛОКОВ ГЕТЕРОХРОМАТИНА
В ГЕНОМЕ ЭУКАРИОТ
Структурные исследования гетерохроматина необходимы, с одной сто-
роны, для понимания закономерностей возникновения гетерохроматиновых
блоков, а с другой, как необходимый материал для дальнейших функцио-
нальных исследований этого компонента генома. Секвенированные геномы
нематоды (Caenorhahdites elegans) и дрозофилы (Drosophila melanogaster)
схожи по размерам и общему числу генов. Однако у нематоды отсутствует
развитый гетерохроматиновый компонент и не обособлены прицентромер-
ные районы. Напротив, у дрозофилы прицентромерный гетерохроматин со-
ставляет значительную часть хромосомы (до 50% в Х-хромосоме). Причины
этих различий структур генома дрозофилы и нематоды остаются загадкой.
Вопрос о первых этапах становления гетерохроматина у дрозофилы, как и
всех высших эукариот, также покрыт тайной неизвестности.
В наших исследованиях рассмотрена эволюция отдельных блоков гете-
рохроматина X- и Y-хромосомы, представленных повторами двух типов:
1) повторяющиеся друг за другом гомологичные гены (тандемные по-
вторы). Особенности эволюции этих повторов различаются в X- и Y-хромо-
сомах. Интерес к этим повторам обусловлен их необычным взаимодействи-
ем, определяющим важную биологическую функцию - плодовитость сам-
цов. Сверхэкспрессия повторов Х-хромосомы в отсутствие Y-повторов, при-
водит к стерильности самцов, а Y-повторы, подавляя экспрессию повторов
Х-хромосомы, обеспечивают плодовитость особей. Таким образом, взаимо-
действие гетерохроматиновых повторов, молекулярный механизм которого
представляет большой интерес, может играть существенную роль в судьбе
популяции;
2) перемежающиеся друг с другом разные типы повторов.
17
ТАНДЕМНЫЕ ПОВТОРЫ ГЕТЕРОХРОМАТИНА
Тандемные повторы, собранные в кластеры (рис. 2), обнаруживаются в
геномах эукариот. Тандемными повторами представлены жизненно важные
для каждой клетки гены, например, гены рибосомных РНК и гены гисто-
нов - компонентов нуклеосом, являющихся структурными единицами хрома-
тина. Вопрос о том, как возникли эти повторы и каким образом поддержива-
ется внутренняя идентичность единиц повторов (“согласованная эволюция”),
остается нерешенным. Тандемный кластер генов, кодирующий белки эука-
риотической клетки, известен только в случае генов гистонов. Второй при-
мер - это обнаруженный кластер генов Stellate (далее Ste) в гетерохроматине
Х-хромосомы дрозофилы (рис. 2). Выявленные тандемно организованные
гены кодируют белок, чрезвычайно близкий по аминокислотной последова-
тельности к регуляторной субъединице одной из протеинкиназ (протеинки-
назы СК2), участвующей в регуляции клеточного деления и модулирующей
активность многих белков - факторов транскрипции. Это первый случай об-
наружения в гетерохроматине повторов, кодирующих белки. Функция белка
Stellate остается неизвестной, однако изменчивость единиц кластера ограни-
чена и находится под сильным давлением отбора, что указывает на наличие
определенной функции (Tulin et al., 1997). Кластер генов Ste можно рассмат-
ривать как модель для исследования особенностей молекулярной эволюции
эукариотических кластеров генов, кодирующих белки.
В эухроматине был обнаружен ген, сходный по своей структуре и нук-
леотидной последовательности с повтором Ste. Этот ген, как и повторы Ste,
экспрессируется тканеспецифично - в семенниках, но конкретная функция
этого гена остается невыясненной. Мы рассматриваем этот эухроматино-
вый ген как предшественник транскрибируемых в семенниках тандемных
повторов Ste Х-хромосомы и родственных им повторов в Y-хромосоме
(Kalmykova et al., 1997). Очевидно, в процессе эволюции генома произошла
амплификация эухроматинового гена и закрепление образовавшихся тандем-
ных кластеров в гетерохроматине. Биологический смысл возникновения в
геноме дрозофилы гомологичных тандемных кластеров в X- и Y-хромосо-
мах остается загадочным.
Были рассмотрены особенности эволюции кластера Ste-повторов и род-
ственного ему кластера тандемных повторов в Y-хромосоме (Kogan et al.,
2000). Кодирующие последовательности Ste-повторов, как правило, не по-
вреждены, а различия между ними обусловлены в основном отдельными ну-
клеотидными заменами в третьем положении кодона, не приводящими к из-
менению аминокислотной последовательности белка. Такой характер нук-
леотидных замен указывает на сдерживающее действие отбора в ответ на
спонтанные изменения последовательностей. В то же время было отмечено,
что Ste-повторы, прилегающие с обеих сторон к ретротранспозону, внедрив-
шемуся в межгенный район кластера (см. о ретротранспозонах в статье
Е.Г. Пасюковой), накапливают различия в нуклеотидных последовательно-
стях по сравнению с повторами, непосредственно соседствующими друг с
другом. Этот результат показывает, что внедрение ретротранспозона мо-
жет нарушить согласованную эволюцию генов в составе тандемного повто-
ра и ускорить накопление различий в дуплицированных генах (см. рис. 2).
Нуклеотидные замены, если они несинонимичные, могут, в конце концов,
1 Q
Ретротранспозон
Согласованная
эволюция
нарушена
Рис. 2. Кластер повторов Stellate (показаны стрелками) в гетерохроматине
Треугольник обозначает внедрение ретротранспозона. Помечены повторы с отличающейся друг от дру-
га нуклеотидной последовательностью
привести к возникновению новых функций генов под действием отбора.
Оказалось, что согласованная эволюция повторов Y-хромосомы заметно
нарушена по сравнению со Ле-повторами. Значительно более сильные раз-
личия в нуклеотидных последовательностях Y-повторов (их дивергенция)
могут приводить к функциональным изменениям аминокислотной последо-
вательности предполагаемых полипептидов, кодируемых Y-повторами.
В Y-повторах обнаружены также нуклеотидные замены в некодирующих
белок районах, не меняющие характера сплайсинга (созревания) транскрип-
тов Y-повторов и соответственно предсказываемой аминокислотной пос-
ледовательности полипептидов, кодируемых такими транскриптами. Обна-
руженная изменчивость тандемных Y-повторов внутри кластера, сопровож-
дающаяся изменением характера созревания транскриптов, демонстрирует
интересный случай молекулярной эволюции отдельных повторов, собран-
ных в составе тандемного кластера (Kalmykova et al., 1998).
Нарушения кодирующей функции Y-повторов можно рассматривать и
как свидетельство прекращения их прежней функции, состоящей в кодиро-
вании белков. Вероятно, на смену кодирующей функции приходит другая
функция, связанная с их способностью подавлять экспрессию 5/е-повторов
Х-хромосомы. Действительно, сравнение нуклеотидных замещений в 57е-по-
вторах и в Y-повторах показывает, что на определенных этапах их эволю-
ции в Y-хромосоме отбор поддерживал их кодирующие функции, а затем
“давление отбора” ослаблялось, кодирующая способность терялась и, по-ви-
димому, возникала функция, связанная с репрессией гомологичных Х-повто-
ров (Kogan et al., 2000).
Молекулярный механизм репрессии Х-повторов Y-повторами будет рас-
смотрен далее.
СТРУКТУРА РАЙОНОВ ГЕТЕРОХРОМАТИНА,
ЗАПОЛНЕННЫХ РАЗНЫМИ ТИПАМИ ПОВТОРОВ,
ОБРАЗОВАННЫХ ПОДВИЖНЫМИ ЭЛЕМЕНТАМИ
Подобные структуры, по-видимому, представляют собой “островки”, по-
груженные в “море” коротких, многократно тандемно повторенных после-
довательностей, так называемых сателлитных ДНК (Le et al., 1995). Иссле-
19
дование структур протяженных гетерохроматиновых повторов показало,
что они представляют собой мозаику из повторов разной природы, образо-
вавшуюся в результате последовательных событий внедрения подвижных
элементов в другие предсуществовавшие повторы. В результате основная
масса ДНК островков представлена материалом подвижных элементов.
Хотя “море” сателлитных последовательностей располагается в районе цен-
тромеры, наличие сателлитной ДНК, как оказалось, необязательно для
формирования этой структуры, необходимой для расхождения хромосом в
процессе деления клетки (Sun et al., 1997). Недавно было обнаружено, что
отдельные фракции сателлитной ДНК (обладающие определенным кон-
формационным состоянием, определяемым нуклеотидной последовательно-
стью), могут быть сайтами активного связывания регуляторных белков дро-
зофилы (Henikoff, Vermaak, 2000). В таком случае сателлиты рассматрива-
ются как важный элемент, регулирующий концентрацию регуляторных
белков, связывающихся со множеством эухроматиновых генов. Роль “ост-
ровков” в функционировании сателлитных ДНК остается неясной.
Мы рассматривали структуру повтора размером около 60 тыс. н. пар
(рис. 3). Число копий повторов (60 тыс. н. пар) приближается к десяти в рас-
чете на гаплоидный геном. Функция такого повтора неясна. Однако эти по-
вторы расположены в районах, соответствующих участкам гетерохромати-
на Х-хромосомы (Nurminsky et al., 1994), ответственным за ряд жизненно
важных функций: регуляцию числа рибосомных генов, а также процессов
раннего развития дрозофилы. Схематически структура повтора, составлен-
ного в основном из подвижных элементов (ретротранспозонов) разных ти-
пов, перемещающихся с помощью принципиально разных механизмов, по-
казана на рис. 3. Ретротранспозоны (треугольники) внедрились либо в меж-
генные некодирующие районы Ste-повторов, либо друг в друга. Наши на-
блюдения показывают, что число этих повторов поддерживается отбором и,
возможно, они могут играть определенную функциональную роль
(Nurminsky et al., 1994). Не исключено, что такие повторы могут быть ча-
стью загадочного локуса АВО в гетерохроматине X хромосомы, нехватка
которого нарушает самые ранние стадии развития дрозофилы (Gatti,
Pimpinelli, 1992).
РЕПРЕССИЯ Ste-ПОВТОРОВ Х-ХРОМОСОМЫ
ГОМОЛОГИЧНЫМИ Y-ПОВТОРАМИ ОСУЩЕСТВЛЯЕТСЯ
С ПОМОЩЬЮ МЕХАНИЗМА РНК-ИНТЕРФЕРЕНЦИИ
Рассмотрение природы подавления экспрессии Ste-повторов гомологич-
ными Y-повторами половых хромосом представляет биологический интерес
прежде всего потому, что эти взаимодействия обеспечивают важную биоло-
гическую характеристику - плодовитость самцов дрозофилы, а молекуляр-
ный механизм взаимодействия повторов описывается в рамках явления
РНК-интерференции, к которому сейчас привлечено большое внимание
(Sijen, Kooter, 2000). РНК-интерференцией называют способность двухните-
вых молекул РНК подавлять экспрессию гомологичных по нуклеотидной
последовательности генов. Способность двухнитевой РНК специфически
подавлять активность того или иного гена сейчас с успехом используется в
20
геномике, поскольку завершение секвенирования ряда геномов требует вы-
яснения функции гена с известной нуклеотидной последовательностью
(Fraser et al., 2000). Это можно осуществить, поскольку инъекция двухните-
вой РНК с последовательностью, идентичной данному гену, приводит к воз-
никновению фенотипа, характерного для мутаций по этому гену. Механизм
подавления экспрессии гена, осуществляемый на уровне деградации инфор-
мационной РНК, представлен на рис. 4. Двухнитевая РНК под действием
комплекса ферментов распадается на короткие двухцепочечные нуклеотид-
ные фрагменты, одна из цепей которых “узнает” гомологичные им по нук-
леотидной последовательности мРНК. Затем осуществляется деградация
РНК, причем середина короткого фрагмента РНК указывает сайты расще-
пления мРНК. РНК-интерференция описана в случаях искусственного введе-
ния (инъекций) двухнитевой РНК или в результате конструирования гено-
мов с увеличенным числом того или иного гена. В последнем случае, в ос-
новном в опытах с трансгенными растениями, наблюдалось подавление сум-
марной экспрессии генов, несмотря на увеличение их числа. Это явление по-
лучило название косупрессии (Henikoff, Matzke, 1997). Механизм косупрес-
сии можно объяснить образованием двухнитевой РНК в результате транс-
крипции обеих нитей разных трансгенов, которые внедрились в разные уча-
стки генома и транскрибируются с промоторов, оказавшихся по соседству
с трансгеном. В результате в одном случае будет осуществляться копирова-
ние смысловой кодирующей нити РНК, а в другом - образование антисмы-
словой некодирующей РНК.
Удаление из Y-хромосомы Y-повторов приводит к сверхэкспрессии
Ste-повторов в Х-хромосоме, что сопровождается резким снижением плодо-
витости самцов (Livak, 1984, 1990). Особенности структуры Y-повторов по
сравнению с повторами Ste показаны на рис. 4. Y-повторы, в отличие от
Ste-повторов, содержат подвижные элементы (транспозон), локализованные
в межгенных промежутках кластера (Balakireva et al., 1992). Ste- и Y-повторы
транскрибируются с образованием “смысловых” транскриптов, которые в
случае Ste-повторов кодируют белок, способный активировать каталитиче-
скую субъединицу протеинкиназы (Bozzetti et al., 1995). Однако Y-повторы
продуцируют и комплементарные “антисмысловые” некодирующие транс-
крипты, образование которых начинается, по-видимому, в районе внедрений
подвижного элемента (см. рис. 4). В результате создается условие для обра-
зования двухнитевой РНК, которая в свою очередь является предшественни-
ком коротких фрагментов РНК, непосредственно атакующих Ste-мРНК. Та-
ким образом, можно предполагать следующие этапы эволюции Y-повторов:
сначала они выступали как кодирующие белок гены, а затем, после внедре-
ния транспозона, стали терять эту способность, приобретая другое свойство -
способность к образованию “антисмысловой” РНК, старт транскрипции ко-
торой находится внутри транспозона (Aravin et al., 2001, Коган, Гвоздев 2002).
Спасение самцов от стерильности достигается функционированием механиз-
ма РНК-интерференции и направлено на преодоление избытка транскриптов
повторяющихся Ste-генов. Здесь просматриваются определенные аналогии
с явлением косупрессии у растений, когда гомологичные гены, введенные из-
вне, подавляют экспрессию собственных клеточных генов. В то же время
в нашем случае имеет место естественный процесс подавления экспрессии
генов с помощью механизма РНК-интерференции.
21
Вопрос о том, в какой степени РНК-интерференция с участием двухни-
тевой РНК может быть использована организмом для регуляции экспрессии
обычных эухроматиновых генов, остается открытым. В то же время, оче-
видно, что двухнитевая РНК регулирует количество образующихся смысло-
вых транскриптов Y-повторов: оказалось, что количество смысловых транс-
криптов не уменьшается при резком уменьшении числа Y-повторов. Это
можно объяснить снижением количества двухнитевой РНК Y-повторов,
предназначенной для уничтожения не только Sfr -PHK, но и смысловой РНК
Y-повторов. Иными словами, налицо саморегуляция смысловой транскрип-
ции Y-повторов, вызванная снижением концентрации двухнитевой РНК.
Известны разные механизмы саморегуляции экспрессии генов, но наши
наблюдения позволяет считать, что саморегуляция может быть основана и
на образовании двухнитевой РНК, соответствующей определенному участ-
ку гена.
Функционирование консервативного механизма РНК-интерференции
обнаружено у простейших, нематоды, дрозофилы, растений, и, наконец, у
позвоночных (Sharp, 2001). Считается, что РНК-интерференция может быть
направлена на уничтожение или нейтрализацию таких агентов, как вирусы
или подвижные элементы. Имеются прежде всего в виду вирусы, размно-
жение которых связано со стадией образования двухнитевой РНК и, следо-
вательно, с появлением субстрата для образования коротких РНК, уничто-
жающих транслируемые вирусные мРНК. Двухнитевая РНК, гомологичная
подвижным элементам, например, ретротранспозонам, как и в случае транс-
генов (см. рис. 4), может быть образована в результате транскрипции обеих
цепей ДНК этого элемента (Ilyin et al., 1980). Может ли механизм РНК-ин-
терференции. отвечающий за репрессию генов Ste, участвовать в подавле-
нии экспрессии подвижных элементов? Нарушение образования коротких
РНК из двунитевых транскриптов Y-повторов в результате мутаций в генах
РНК-интерференции, контролирующих нарезание двунитевой РНК, может
сказаться и на экспрессии ретротранспозонов. Действительно, в присутствии
мутации homeless, снимающей подавление экспрессии Sre-повторов Y-повто-
рами, существенно увеличивалось количество транскриптов ретротранспо-
зонов в клетках семенников и яичников дрозофилы (Aravin et al., 2001). Ме-
ханизм действия гена homeless остается невыясненным. Известно лишь, что
ген кодирует предполагаемую РНК-хеликазу, которая может участвовать
на разных стадиях процесса РНК-интерференции, обеспечивая доступность
двухнитевых РНК для взаимодействующих с ними белков. Следовательно,
система РНК-интерференции, кодируемая генами хозяина, непосредственно
контролирует уровень транскрипции и, вероятно, перемещения ретротранс-
позонов в геноме дрозофилы (о корреляциях между уровнем их транскрип-
ции и перемещениями см. в работах лаборатории Е.Г. Пасюковой).
ЭФФЕКТЫ ПОЛОЖЕНИЯ ГЕНОВ
Способность гетерохроматина вызывать инактивацию близлежащих эу-
хроматиновых генов, нестабильно наследуемую в клеточных поколениях
(эффекты положения мозаичного типа), известна давно. Накоплен обшир-
ный материал, описывающий хромосомные белки и их комплексы, вовле-
ченные в инактивацию генов при эффекте положения (Eissenberg, Elgin,
22
2000). Эти комплексы вызывают компактизацию нуклеосомной структуры
хроматина, но отдельные детали этого процесса пока выяснены только при
исследовании инактивации генов у дрожжей (Sherman, Pillus, 1997). Доста-
точно много известно о белках, образующих репрессорные комплексы хро-
матина. В то же время, вопрос о том, какова роль и вклад собственно гете-
рохроматиновых последовательностей ДНК в процесс инактивации, остает-
ся открытым. Оставалось невыясненным, зависит ли степень инактивации
от массы прилегающего к эухроматину гетерохроматинового блока. Вопрос
о преимущественной роли определенных гетерохроматиновых последова-
тельностей также оставался неисследованным.
Были использованы два подхода к исследованию этих вопросов:
1) оценивали степень инактивации в серии родственных эу-гетерохрома-
тиновых перестроек, в результате которых гены перемещались к гетерохро-
матину. Эти перестройки различались размером гетерохроматинового бло-
ка, вызывающего инактивацию прилежащих эухроматиновых генов (рис. 5).
2) эффекты положения моделировали с помощью искусственных транс-
генных конструкций, включающих £щ//а£е-повторы гетерохроматина и
близлежащий ген-репортер, инактивация которого указывала на эффект
положения.
Первый подход состоял в исследовании классического эффекта положе-
ния, сопровождающегося инактивацией ряда генов, приближенных к гете-
рохроматину и определяющих, например, цвет глаз или форму крыльев
(Tolchkov et al., 1997; Лавров и др., 1998; Tolchkov et al., 2000). В результате
хромосомной перестройки эухроматиновый ген, кодирующий винкулин, ра-
зорвался, и его фрагмент объединился с блоком сателлитной ДНК гетеро-
хроматина (белок, связывающий нити цитоскелета с мембраной клетки)
(рис. 5). Инактивация распространяется на большое расстояние, достигая ге-
на, отстоящего от границы с гетерохроматином на 700 тыс. нуклеотидных
пар (см. рис. 6). Оказалось, что способность к инактивации распределена не-
равномерно по длине блока гетерохроматина Х-хромосомы, включающего
около 13 106 н. пар. Оценка снижения степени инактивации по мере умень-
шения размеров гетерохроматинового блока показала, что наибольший
вклад в расчете на единицу массы блока вносит район центромеры. Выясни-
лось также, что для индукции инактивации необходимо сохранение внутрен-
ней структуры гетерохроматина: эффект положения пропадал в результате
внутренней инверсии в гетерохроматиновом блоке, хотя общее количество
прилегающего гетерохроматина не изменялось. Таким образом, получен-
ные данные показали, что инактивация генов протяженными районами ге-
терохроматина зависит как от общей массы прилегающего гетерохромати-
на, так и от природы отдельных его участков и их взаимного расположения.
Эффекты положения могут определяться не только близлежащим сег-
ментом гетерохроматина, но и дальнодействующими взаимодействиями ме-
жду блоками гетерохроматина с образованием в ядре специализированного
пространства (“компартмента”) гетерохроматина, обогащенного репрессор-
ными белками (Demburg et al., 1996; Csink, Her.ikoff, 1996). Полученные нами
результаты соответствуют предложенной модели. Оказалось, что способ-
ность небольшого гетерохроматинового сегмента вызывать инактивацию
эухроматина сильно зависит от расстояния этого сегмента до основного ге-
терохроматинового блока Х-хромосомы. Резкое уменьшение расстояния
23
вызывает инактивацию, что можно объяснить увеличением вероятности ас-
социации сегмента с основным блоком Х-хромосом. Подобное объяснение
находится в соответствии с экспериментально подкрепленными представле-
ниями о том, что хромосомы в неделящемся ядре располагаются не случай-
но в своих “компартментах”, а броуновское движение способствует ограни-
ченному перемещению хромосом в отведенном для них пространстве, обес-
печивая ассоциацию определенных участков хромосом друг с другом
(Marshall et al., 1997).
Второй подход к исследования эффектов положения был нами применен
с целью выявления способности клонированных и секвенированных повто-
ров вызывать инактивацию генов эухроматина. В результате удалось пока-
зать, что зависимость инактивации от изменения гетерохроматиновых бел-
ков, определяющих компактизацию хроматина, может определяться типом
прилегающих повторов. Были созданы конструкции, в которых фрагменты
(8-10 тыс. н. пар) гетерохроматина Х-хромосомы (шесть повторов Ste) или
Y-хромосомы (три Y-повтора) присоединяли к репортерному гену white,
инактивация которого при эффектах положения приводит к нестабильной
мозаичной окраске глаз. Получили трансгенных особей дрозофилы, несу-
щих эти конструкции, и наблюдали мозаичную инактивацию гена white
(рис. 6). Это, насколько нам известно, первый случай обнаружения эффекта
положения, вызванного клонированным “натуральным” гетерохроматином
(Tulin et al., 1998; Гвоздев и др., 1999; Gvozdev et al., 2000). Инактивация ге-
нов при эффектах положения у дрозофилы происходит в результате образо-
вания в районах инактивированных генов эухроматина комплексов разных
репрессорных белков (гетеромультимеров). Недостаток одного из таких
белков, обусловленный мутацией в соответствующем гене, вызывает нару-
шение образования репрессорных комплексов. Подобные, сходные по стру-
ктуре и функции, белки позднее были обнаружены и у человека, причем му-
тации по соответствующим генам приводили к нарушениям регуляции ак-
тивности генов и опухолевому росту (Jones et al., 2000). Мутации в генах, от-
ветственных за образование репрессорных белков или модификацию ре-
прессорных комплексов, приводят в случае классического эффекта положе-
ния к полной или частичной реактивации генов, вызывая так называемую
супрессию эффектов положения генов. Известен набор супрессорных мута-
ций, ослабляющих степень инактивации при эффекте положения. Было ис-
следовано более 10 разных супрессорных мутаций, меняющих образование
или структуру известных мультимерных комплексов, но ни в одном случае
не было обнаружено их влияния на инактивацию гена white, вызванную при-
легающими клонированными Ste- или Y-повторами гетерохроматина. Мы
предполагаем, что в образовании гетерохроматина в данном случае участву-
ют белки, отличные от тех, которые формируют структуру основных бло-
ков гетерохроматина и определяют инактивацию генов при “классическом”
эффекте положения. Поиск генов и белков-модификаторов эффектов по-
ложения, вызываемых повторами Ste, представляется перспективным, по-
скольку успех в подобном исследовании позволит выявить новый тип ре-
прессии активности генов на хромосомном уровне. Этот тип репрессии мо-
жет определяться белками, отличными от тех, которые уже были выявлены
при исследовании других описанных случаев компактизации гетерохромати-
на и инактивации генов при эффектах положения (Jones et al., 2000).
24
ЛИТЕРАТУРА
Аравин А.А., Вагин В.В., Розовский Я.М., Гвоздев В.А. Подавление экспрессии генов
введением гомологичной двуцепочечной РНК в культуру клеток Drosophila
melanogaster // Генетика. 2001. Т. 37. С. 779-783.
Аравин А .А., Кленов М.С., Вагин В.В. и др. Роль двухцепочечной РНК в подавлении экс-
прессии генов эукариот // Молекуляр. биология. 2002. Т. 366. С. 240-251.
Аравин А.А., Наумова Н.М., Тулин А.В. и др. Исследование взаимодействия паралогич-
ных тандемных повторов Stellate и Suppressor of Stellate в геноме Drosophila
melanogaster // Генетика. 2000. Т. 36. С. 559-561.
Гвоздев В.А. Регуляция действия генов у Drosophila melanogaster: (Перспективы биохи-
мических исследований) //Усп. соврем, биологии. 1968. Т. 65. С. 398-423.
Гвоздев В А. Связь между дозой гена и синтезом макромолекул у животных // Изв. АН
СССР. 1970. № 4. С. 499-507.
Гвоздев В.А. Какпаков В.Т. Культура эмбриональных клеток Drosophila melanogaster
in vitro Ц Генетика. 1968. Т. 2. С. 129-141.
Гвоздев В.А., Алаторцев В.В., Аравин А.А. и др. Гетерохроматин: молекулярная эволю-
ция и эффекты положения генов у Drosophila melanogaster // Молекуляр. биология.
1999. Т. 33. С. 14-25.
Георгиев Г.П., Гвоздев В.А. Мобильные диспергированные гены эукариот // Вест. АН
СССР. 1980. № 8. С. 19-27.
Какпаков В.Т., Гвоздев В.А., Платова Т.П., Полукарова Л.Г. Линии эмбриональных
клеток Drosophila melanogaster, пересеваемые in vitro // Генетика. 1969. Т. 5.
С. 67-75.
Калмыкова А.И., Добрица А.А., Гвоздев В.А. Экспрессия гена У-хромосомы Drosophila
melanogaster, кодирующего изоформу регуляторной бета-субъединицы казеинкина-
зы 2 Ц Молекуляр. биология. 1997. Т. 31. С. 463-468.
Коган ГЛ., Гвоздев В.А. Молекулярная эволюция тандемных повторов гетерохромати-
на в связи с их функцией в геноме Drosophila melanogaster // Генетика. 2002. Т. 38.
С. 710-718.
Лавров С.А., Толчков Е.В., Крамерова И.А., Гвоздев В.А. Нарушение политенизации
ДНК эухроматиного района Х-хромосомы D. melanogaster, вызванное эу-гетерохро-
матиновой перестройкой // Молекуляр. Биология. 1998. Т. 32. С. 992-997.
Ananiev E.V., Gvozdev V.A., Ilyin Y.V. et al. Reiterated genes with varying location in intercalary
heterochromatin regions of Drosophila melanogaster polyfene chromosomes Ц Chromosoma.
1978. Vol. 70. P. 1-17.
Aravin. A.A., Naumova N.M., Tulin A.A. et al. Double stranded RNA-mediated silencing of
genomic tandem repeats and transposable elements in Drosophila melanogaster germline //
Curr. Biol. 2001. Vol. 11. P. 1017-1027.
Balakireva M.D., Shevelyov Y.Y., Nurminsky D.I. et al. Structural organization and diversification
of Y-linked sequences comprising Su(Ste) genes in Drosophila melanogaster // Nucl. Acids
Res. 1992. Vol. 120. P. 3731-3736.
Benevolenskaya E.V., Kogan G.L., Tulin A.V. et al. Segmented gene conversion as a mechanism
of correction of 18S rRNA pseudogene located outside of rDNA clusyer in D. melanogaster I I
J. Mol. Evol. 1997. Vol. 44. P. 646-651.
Benevolenskaya E.V., Nurminsky D.I., Gvozdev V.A. Structure of the Drosophila melanogaster
Annexin X gene // DNA Cell. Biol. 1995. Vol. 14. P. 349-357.
Bozzetti M.P., Massari S., Finelli P. et al. The Ste locus, a component of the parasitic cry-Ste sys-
tem of Drosophila melanogaster, encodes a protein that forms crystals in primary spermato-
cytes and mimics properties of the beta subunit of casein kinase 2 // Proc. Nat. Acad. Sci
USA. 1995. Vol. 92. P. 6067-6071.
Csink A.K., Henikoff S. Genetic modification of heterochromatic association and nuclear organi-
zation in Drosophila // Nature. 1996. Vol. 381. P. 529-531.
Dernhurg A.F., Sedat J.W. Hawley R.S. Direct evidence of a role for heterochromatin in meiotic
chromosome segregation // Cell. 1996. Vol. 86. P. 135—146.
Echaier G. Drosophila in cell culture. San Diego; N.Y.: Acad. Press, 1997. 702 p.
25
Eissenberg J.C., Elgin S.C.R. The HP1 protein family, getting a grip on chromatin // Curr. Opin.
Genet, and Develop. 2000. Vol. 10. P. 204—210.
Faizullin L.Z., Gvozdev VA. Dosage compensation of sex-linked genes in Drosophila
melanogaster. The activities of glucose-6-phosphate dehydrogenase and 6-phosphogluconate
dehydrogenase in flies with normal and disturbed genetic balance // Mol. Gen. Genet. 1973.
Vol. 126. P. 233-235.
Eraser A.G., Kamath R.S., Zipperlen P. et al. Functional genomic analysis of C. elegans chromo-
some I by systematic RNA interference // Nature. 2000. Vol. 408. P. 325-330.
Garrick D., Fiering S., Martin D.I., Whitelaw E. Repeat-induced gene silencing in mammals //
Nat. Genet. 1998. Vol. 18. P. 56-59.
Gatti M.„ Pimpinelli S. Functional elements in Drosophila melanogaster heterochromatin // Annu.
Rev. Genet. 1992. Vol. 26. P. 239-275.
Gvozdev VA., Gerasimova T.I., Bizstein V.Y. Inactivation of 6-phosphogluconate dehydrogenase
structural gene of Drosophila melanogaster caused by translocation to heterochromatin //
Mol. Gen. Genet. 1974. Vol. 130. P. 251-260.
Gvozdev V.A., GostimskySA., Gerasimova T.L et al. Fine genetic structure of the 2D3-2F5 region
of the X-chromosome of Drosophila melanogaster // Ibid. 1975. Vol. 141. P. 269-275.
Gvozdev VA., Kogan G.L., Tulin AA. et al. Paralogous Stellate and Su(Ste) repeats: evolution and
ability to silence a reporter gene // Genetica. 2000. Vol. 109. P. 131-140.
Henikoff S., Matzke M.A. Exploring and explaining epigenetic effects // Trends in Genet. 1997.
Vol. 13. P. 293-295.
Henikoff S., Vermaak D. Bugs on drugs go GAGAA // Cell. 2000. Vol. 103. P. 695—698.
Holliday R. Epigenetics: an overview // Develop. Genet. 1994. Vol. 15. P. 453^157.
Ilyin Y.V., Chmeliauskaite V.G., Georgiev G.P. Double-stranded sequences in RNA of Drosophila
melanogaster'. relation to mobile dispersed genes // Nucl. Acids. Res. 1980. Vol. 8.
P. 3439-3457.
Jones D.O., Cowell EG., Singh P.B. Mammalian chromodomain proteins: their role in genome
organisation and expression // BioEssays. 2000. Vol. 22. P. 124—137.
Kalmykova A.I., Dobritsa A A., Gvozdev VA. Su(Ste) repeat in the Y-chromosome and betaCK2tes
gene encode predicted isoforms of regulatory beta-subunit of protein kinase CK2 in
Drosophila melanogaster 11FEBS Lett. 1997. Vol. 416. P. 164—166.
Kalmykova A.I., Dobritsa A A., Gvozdev VA. Su(Ste) diverged tandem repeats in a Y-chromosome
of Drosophila melanogaster are transcribed and variously processed // Genetics. 1998.
Vol. 148. P. 243-249.
Kalmykova A., Maisonhaute C., Gvozdev V. Retrotransposon 1731 in Drosophila melanogaster
changes retrovirus-like expression strategy in host genome // Genetics. 1999. Vol. 107.
P. 73-77.
Kalmykova A.I., Shevelyov Y.Y., Dobritsa A.A., Gvozdev VA. Acquisition and amplification of a
testis-expressed autosomal gene, SSL, by the Drosophila Y-chromosome // Proc. Natl. Acad.
Sci. USA. 1997. Vol. 94. P. 6297-6302.
Kogan G.L., Epstein V.N., Aravin A.A., Gvozdev V.A. Molecular evolution of two paralogous
tandemly repeated heterochromatic gene clusters linked to the X- and Y-chromosomes of
Drosophila melanogaster!7 Mol. Biol. Evol. 2000. Vol. 17. P. 697-702.
Le М.-H., Duricka D., Karpen G. Islands of complex DNA are widespread in Drosophila centric
heterochromatin//Genetics. 1995. Vol. 141. P. 283—303.
Liao D. Concerted evolution: Molecular mechanism and biological implications // Amer. J. Hum.
Genet. 1999. Vol. 64. P. 24-30.
Livak KJ. Organization and mapping of a sequence on the Drosophila melanogaster X- and
Y-chromosomes that is transcribed during spermatogenesis // Genetics. 1984. Vol. 107.
P. 611-634.
Livak K.J. Detailed structure of the Drosophila melanogaster stellate genes and their transcripts //
Ibid. 1990. Vol. 124. P. 303-316.
Lyko F.R., Paro R. Chromosomal elements conferring epigenetic inheritance // BioEssays. 1999.
Vol. 21. P. 824-832.
Marshall W.F., Fung J.C., SedatJ.W. Deconstructing the nucleus: global architecture from local
interactions // Curr. Opin. Genet. Dev. 1997. Vol. 7. P. 259-263.
Nurminsky D.I., Nurminskaya M.V.. Benevolenskaya E.V. et al. Cytoplasmic dynein intermediate-
chain isoforms with different targeting properties created by tissue-specific alternative splic-
ing Ц Mol. Cell. Biol. 1998. Vol. 18. P. 6816-6825.
Nurminsky D.I., Shevelyov Y.Y., Nuzhdin S.Y., Gvozdev V.A. Structure, molecular evolution and
maintenance of copy number of extended repeated structures in the X-heterochromatin of
Drosophila melanogaster // Chromosoma. 1994. Vol. 103. P. 277—285.
Pimpinelli S., Berloco M., Fanti L. et al. Transposable elements are stable structural components
of Drosophila melanogaster heterochromatin // Proc. Nat. Acad. Sci. USA. 1995. Vol. 92.
P. 3804-3808.
Sharp P. RNA interference-2001 // Genes Develop. 2001. Vol. 15. P. 485—490.
Sherman J.M.. Pillus L. An uncertain silence // Trends in Genet. 1997. Vol. 13. P. 308-313.
Sijen T., Kooter J.M. Post-transcriptional gene-silencing: RNAs on the attack or on the defense? //
BioEssays. 2000. Vol. 22. P. 520-531.
Sun X., "Wahlstrom J., Karpen G. Molecular structure of a functional Drosophila centromere //
Cell. 1997. Vol. 91. P. 1007-1019.
Tolchkov E.V., Kramerova 1.А., Lavrov S.A. et al. Position-effect variegation in Drosophila
melanogaster X-chromosome inversion with a breakpoint in a satellite block and its suppres-
sion in a secondary rearrangement // Chromosoma. 1997. Vol. 106. P. 520-525.
Tolchkov E.V., Rasheva V.I., Bonaccorsi S. et al. The size and internal structure of a heterochro-
matic block determine its ability to induce position effect variegation in Drosophila
melanogaster // Genetics. 2000. Vol. 154. 1611-1626.
Tulin A.V., Kogan G.L., Filipp D. et al. Heterochromatic Stellate gene cluster in Drosophila
melanogaster: structure and molecular evolution // Genetics. 1997. Vol. 146. P. 253-262.
Tulin A.V., Naumova N.M., Aravin A.A., Gvozdev V.A. Repeated, protein-encoding heterochro-
matic genes cause inactivation of a juxtaposed euchromatic gene I I FEBS Letters. 1998.
Vol. 425. P. 513-516.
Weiler K.S., Wakimoto B.T. Heterochromatin and gene expression in Drosophila // Annu. Rev.
Genet. 1995. Vol. 29. P. 577-605.
МЕХАНИЗМЫ И СЛЕДСТВИЯ ВЗАИМОДЕЙСТВИЙ
РЕТРОТРАНСПОЗОНОВ С ГЕНОМОМ ХОЗЯИНА
Е. Г. Пасюкова
Лаборатория геномной изменчивости
Отдела молекулярной генетики клетки
Исследование ретротранспозонов было начато в Отделе в конце 70-х
годов. В работах последних лет развивалось новое направление исследова-
ния ретротранспозонов — анализ популяционных и молекулярно-генети-
ческих механизмов коадаптации и коэволюции ретротранспозонов и гено-
ма многоклеточных эукариот. Впервые в прямых экспериментах было
продемонстрировано и количественно оценено влияние ретротранспозо-
нов на приспособленность в расчете на копию. Была открыта положи-
тельная зависимость интенсивности перемещений ретротранспозонов
от числа их копий в геноме, и таким образом показано отсутствие у них
саморегуляции. Удалось доказать, что поведение ретротранспозонов в
значительной мере определяется как их собственными свойствами, так и
физиологическими и генетическими свойствами организма хозяина. В ча-
стности, была выявлена половая специфичность транспозиций ряда рет-
ротранспозонов и впервые описана зависимость частоты транспозиций
от возраста хозяина. Для выявления геномных факторов, контролирую-
щих экспрессию подвижных элементов, впервые были успешно применены
методические подходы, характерные для количественной генетики.
27
РЕТРОТРАНСПОЗОНЫ ДРОЗОФИЛЫ
Необычные элементы генома, способные перемещаться по хромосомам,
были открыты генетиками у дрозофилы (Demerec, 1928) и кукурузы
(McClintock, 1950) уже давно. С годами стало понятно, что такие мобильные
элементы (МЭ) являются принадлежностью генома практически всех выс-
ших организмов, причем на их долю приходятся десятки процентов геном-
ной ДНК. В соответствии с молекулярной структурой и механизмом транс-
позиций мобильные элементы высших организмов разделены на несколько
групп (Berg, Howe, 1989): ретротранспозоны, включая ретропозоны, или
LINE-элементы; SINE-элементы; транспозоны; FB-элементы. Исследова-
ния, проводимые в Отделе молекулярной генетики клетки, посвящены
анализу популяционных и молекулярно-генетических механизмов коадапта-
ции и коэволюции ретротранспозонов (copia, мдг-1, мдг-3, Doc и некоторых
других) и генома плодовой мушки Drosophila melanogaster.
История исследования ретротранспозонов дрозофилы насчитывает
20 лет, начиная с тех пор, когда разбросанные по геному, активно транскри-
бирующиеся последовательности ДНК дрозофилы были одновременно опи-
саны учеными России и США (Finnegan et al., 1978; Ильин и др., 1978; Ananiev
et al., 1978). Впоследствии оказалось, что ретротранспозоны являются при-
надлежностью генома практически всех организмов, причем на их долю мо-
жет приходиться до 50% геномной ДНК.
Ретротранспозоны были открыты как последовательности ДНК с неиз-
вестной функцией, которую предстояло найти, исходя из их структуры и
других свойств. В последнее время структурно-функциональный анализ пол-
ных последовательностей геномов различных организмов, таких разнооб-
разных, как бактерии, дрожжи, нематода, дрозофила, мышь, человек, рас-
сматривается как одно из наиболее перспективных направлений генетики,
молекулярной и клеточной биологии. Предполагается, что полное описание
генома является базовым этапом на пути к пониманию его функционирова-
ния в контексте целого организма. Исследование ретротранспозонов пред-
ставляет собой пример изучения генетических элементов в направлении от
молекулярной структуры к функции, показывающий, что путь этот даже
в таком простом случае весьма сложен.
Взаимоотношения ретротранспозона и генома, в котором он присутству-
ет, могут быть рассмотрены в терминах более широкой проблемы сосуще-
ствования и совместной эволюции эндопаразита (эндосимбионта) и хозяина.
Упомянем вкратце некоторые факты, делающие такое предположение пра-
вомочным. Ретротранспозоны представляют собой в значительной степени
обособленную часть генома, поскольку, благодаря особенностям своего
строения они не только способны к размножению внутри генома, но и сами
кодируют ряд необходимых для этого ферментов. По структуре ретротранс-
позоны очень близки к провирусам ретровирусов млекопитающих (рис. 7) -
одной из наиболее интересных и важных групп вирусов, к числу которых от-
носятся онковирусы и вирусы иммунодефицита. Последовательности ДНК
ретротранспозонов и ретровирусов включают гены, кодирующие сходные
белки, которые обеспечивают их размножение и перемещение в геноме.
Как и у ретровирусов, последовательность ретротранспозонов ограничена
по концам длинными, до нескольких сотен нуклеотидов, и одинаковыми по
28
последовательности участками ДНК - ДКП (длинные концевые повторы).
Эти повторы содержат регуляторные последовательности, обеспечиваю-
щие экспрессию генов ретротранспозонов. Не только молекулярное строе-
ние, но и предполагаемый механизм транспозиций ретротранспозонов и
ретровирусов аналогичен и включает транскрипцию, экспрессию белков,
упаковку полноразмерного транскрипта в комплексе с белками в вирусопо-
добную частицу, синтез ДНК-копии на матрице РНК, интеграцию в геном.
Было высказано предположение о том, что ретротранспозоны предста-
вляют собой “эгоистичную” ДНК (Doolittle, Sapienza, 1980; Orgel, Crick,
1980), т.е. функционально незначимые для организма последовательности,
сохраняющиеся в нем только благодаря способности к внутригеномной экс-
пансии, обусловленной особенностями их структуры. Позже удалось полу-
чить данные, свидетельствующие о том, что ретротранспозоны принимают
участие в столь важных клеточных процессах, как поддержание целостно-
сти концов хромосом у дрозофилы (Beissmann et al., 1993) и залечивание раз-
рывов ДНК у дрожжей (Teng, Gabriel, 1996; Moore, Harber, 1996). В послед-
ние годы для многих организмов получены также данные об участии ретро-
транспозонов в регуляции активности генов хозяина (Britten, 1997). Однако
эти функции можно рассматривать и как побочные, вторичные, приобре-
тенные в процессе существования отдельных ретротранспозонов в геноме
некоторых организмов.
Существенная доля информации об особенностях поведения ретротранс-
позонов была получена в исследованиях на дрозофиле. Это объясняется не
только удобством плодовой мушки как модельного лабораторного объекта
в целом, но и тем, что общее число ретротранспозонов у дрозофилы отно-
сительно мало, около 103 копий на геном, разделенных на 40-50 семейств на
основании сходства нуклеотидных последовательностей, которое внутри ка-
ждого семейства очень велико (Berg, Howe, 1989). Для сравнения, у растений
и человека, например, суммарное число копий на геном намного больше и
может достигать 105, а внутри каждого семейства последовательности могут
быть гетерогенны, что затрудняет их идентификацию. Такие особенности
ретротранспозонов дрозофилы, а также наличие у нее политенных хромо-
сом, на которых местоположение копии ретротранспозона может быть оп-
ределено с помощью гибридизации in situ с меченой ДНК этого ретротранс-
позона (рис. 8), позволяют изучать перемещения и наследование индивиду-
альных копий. Это обусловливает преимущества использования дрозофилы
как модельного объекта для изучения ретротранспозонов. Кроме того,
обычным затруднением для экспериментального исследования транспози-
ций является их низкая спонтанная частота. У дрозофилы же известны слу-
чаи, когда частота транспозиций какого-либо ретротранспозона существен-
но превышает обычную, причем в некоторых случаях эта высокая частота
может сохраняться в течение нескольких лет или воспроизводиться в опре-
деленных экспериментальных условиях (Ким, Беляева, 1986; Георгиев и др.,
1988; Пасюкова, Нуждин, 1992). Для прямого измерения частоты транспози-
ций ретротранспозонов в Отделе был разработан и успешно использован
оригинальный генетический метод. Все вышеперечисленное делает дрозо-
филу наиболее удобным объектом для эффективного исследования динами-
ки числа копий ретротранспозонов в геноме, факторов, контролирующих
транспозиции ретротранспозонов, их фенотипических эффектов и других
29
аспектов взаимодействия ретротранспозон-хозяин. Исследования на дрозо-
филе являются источником идей и методических подходов для изучения ре-
тротранспозонов других организмов.
В Отделе проводится комплексное исследование ретротранспозонов
дрозофилы с точки зрения взаимоотношения эндосимбионт-хозяин. Такой
подход представляется плодотворным, поскольку дает возможность сфор-
мулировать конкретные вопросы, требующие экспериментального разре-
шения, на основании комплексного общебиологического подхода к пробле-
ме. Можно выделить три основных аспекта взаимодействия ретротранспо-
зон-хозяин (рис. 9). Прежде всего ретротранспозоны, внедряясь в различ-
ные локусы и меняя функции генов, генерируют генетическую изменчи-
вость и фенотипическую вариабельность хозяина. Вновь возникающие фе-
нотипы экспонируются естественному отбору, и, таким образом, отбор мо-
жет играть важную роль в регулировании взаимодействия ретротранспо-
зон-хозяин. Кроме того, взаимодействие ретротранспозон-хозяин осущест-
вляется на генетическом уровне. С одной стороны, активность ретротранс-
позонов зависит от их собственных нуклеотидных последовательностей, ко-
торые не только кодируют ключевые белки их жизненного цикла, но
также, благодаря присутствию различных регуляторных сайтов, обес-
печивают взаимодействие с геномом хозяина. С другой стороны, в геноме
хозяина присутствуют гены, управляющие активностью ретротранс-
позонов.
РЕТРОТРАНСПОЗОНЫ КАК ИСТОЧНИК
ГЕНЕТИЧЕСКОЙ ИЗМЕНЧИВОСТИ
Генетическая изменчивость - основополагающее свойство живого, и од-
ним из главных ее источников являются мутации. У дрозофилы около поло-
вины мутаций с видимым эффектом вызваны встройками (инсерциями) ре-
тротранспозонов в соответствующие гены. Отметим, что такие инсерцион-
ные мутации описаны не только у дрозофилы, но и у многих других организ-
мов, в том числе и у человека.
И в природных популяциях, и в лабораторных линиях дрозофилы нор-
мальная частота транспозиций ретротранспозонов оценивается как
10 4—10 s транспозиций на одну копию на поколение. Многие линии дрозо-
филы, характеризующиеся повышенной частотой транспозиций какого-ли-
бо ретротранспозона, впервые были описаны как “нестабильные” линии с
повышенной частотой видимых мутаций, причем в большинстве случаев
лишь в определенных генах (Georgiev et al., 1990; Kim et al., 1990). Это наво-
дит на мысль о преимущественной встройке ретротранспозонов в опреде-
ленные гены, в результате таких встроек часто мутирующие. В нашем Отде-
ле было проведено подробное исследование специфичности встройки рет-
ротранспозонов в различные участки генома. Действительно, на цитологи-
ческом уровне нами были описаны “горячие точки” встраивания ретро-
транспозонов мдг-1 и мдг-3 (Pasyukova et al., 1986; Беляева и др., 1994).
Противоположные результаты дал, однако, проведенный нами анализ
спектра транспозиций ретротранспозона copia, места встройки которого
оказались случайными (Nuzhdin et aL, 1996; Pasyukova et al., 1998). Следует
30
учесть, что транспозиции разных ретротранспозонов были исследованы
в разных линиях. Таким образом, особенности спектра транспозиций и спе-
цифичность встройки зависят и от ретротранспозона, и, возможно, от линии
хозяина.
Каков бы ни был спектр транспозиций ретротранспозонов с точки зре-
ния механизмов сосуществования ретротранспозон-хозяин, интерес пред-
ставляют те мутации, вызванные встройками ретротранспозонов, которые
влияют на приспособленность хозяина. Приспособленность характеризует
способность особи выжить и оставить жизнеспособное потомство и являет-
ся ключевым признаком, позволяющим оценить эволюционную судьбу по-
пуляции. Согласно современным представлениям, равновесное существова-
ние ретротранспозонов в геноме определяется балансом между скоростью
их внутригеномного размножения, с одной стороны, и силой отбора против
их вредных фенотипических эффектов, с другой. Само существование рав-
новесной ситуации подтверждается данными о том, что среднее число копий
какого-либо семейства ретротранспозонов сходно в разных линиях и попу-
ляциях.
Есть несколько экспериментальных подходов, позволяющих проверить,
как влияют на приспособленность инсерционные мутации. Первый основан
на экспериментальном тестировании предсказаний, полученных в результа-
те теоретических расчетов и моделирования популяционной динамики рет-
ротранспозонов. Отметим сразу, что все подобные теории и модели основа-
ны на многочисленных допущениях о характере и частотах транспозиций,
уровне рекомбинации, численности популяций и т.п. Далеко не все допуще-
ния оказываются близкими к реальности, если такие реальные параметры
удается установить опытным путем. Например, одно из допущений заклю-
чается в том, что частоты транспозиций ретротранспозонов одинаковы у
самцов и самок. Однако проведенные нами на обширном материале иссле-
дования показали, что частота транспозиций ретротранспозонов характери-
зуется половой специфичностью. Например, ретротранспозон Doc переме-
щается только у самок (Pasyukova et aL, 1998), а ретротранспозон copia —
только у самцов (Pasyukova, Nuzhdin, 1993, Pasyukova et al., 1997). Несмотря
на то, что многие допущения, используемые в моделях популяционной дина-
мики ретротранспозонов, оказываются не совсем точными, проверке теоре-
тических предсказаний были посвящены многие экспериментальные рабо-
ты, в том числе и в нашем Отделе. С этой целью было исследовано распре
деление различных семейств ретротранспозонов по хромосомам мух из при-
родных популяций (Пасюкова, Гвоздев, 1986; Biemont et al., 1994). Результа-
ты не позволили сделать какого-либо общего вывода. Встройки таких рет-
ротранспозонов, как copia и мдг-1, в большинстве популяций приводили к
снижению приспособленности, в то время как инсерции мдг-3 оказались
нейтральными, а инсерции ряда других ретроэлементов вели себя по-разно-
му в разных популяциях.
Существуют и более прямые методы оценки влияния инсерционных му-
таций на приспособленность. Одним из таких методов является поиск корре-
ляций между накоплением новых инсерций ретротранспозонов и увеличени-
ем числа их копий в геноме, с одной стороны, и изменением приспособлен-
ности, с другой. Принципиальную возможность оценить корреляцию между
числом копий ретротранспозонов в геноме и приспособленностью дает срав-
31
Относительная разница в числе копий ретротранспозонов
Рис. 10. Изменение приспособленности линий с нарастанием числа копий ретротранспозонов
в геноме
По оси абсцисс отложено число копий ретротранспозонов, на которое каждая из исследованных субли-
ний одной из лабораторных линий дрозофилы отличается от числа копий ретротраспозонов, характер-
ных для самой малокопийной сублинии. По оси ординат отложены значения индекса внутривидовой кон-
куренции, служащего для количественного измерения приспособленности
нение многих сублиний одной линии дрозофилы, достаточно сильно разли-
чающихся по числу копий ретротранспозонов в геноме при однородности ге-
нетического фона. Если эффект каждой новой копии невелик, но вреден, то
чем больше в геноме копий ретротранспозонов, тем ниже должна быть при-
способленность линии. Результаты проведенных в Отделе исследований
свидетельствуют о том, что накопление ретротранспозонов в геноме может
приводить к снижению приспособленности (Nuzhdin et al., 1997; Пасюкова и
др., 1999; Морозова, Пасюкова, 2000). Действие ретротранспозонов на при-
способленность становится ощутимым при накоплении большого числа до-
полнительных встроек, около 200 копий на геном. Изменение приспособ-
ленности при этом составляет около 20% (рис. 10). Следовательно, каждая
копия ретротранспозона снижает приспособленность примерно на 0,1%. По-
лученные нами результаты впервые прямо показали, что приспособлен-
ность хозяина находится в тесной связи с присутствием в его геноме ретро-
транспозонов.
Учитывая слабый вклад в приспособленность каждой копии ретротранс-
позона, увидеть сильные эффекты отдельных копий можно только в каких-
либо исключительных случаях. Подробно исследованные нами транспози-
32
ции в одной из лабораторных линий дрозофилы коррелировали с резким
увеличением ее приспособленности более чем на порядок (Pasyukova et al.,
1986). Детальный анализ данных показал, что увеличение приспособленно-
сти на самом деле коррелирует только с появлением одного из исследован-
ных ретротранспозонов, мдг-1, в определенных районах генома. Вопрос о
причинах столь жесткой корреляции уровня приспособленности с локализа-
цией мдг-1 в этих районах остается пока без ответа. В целом транспозиции
в этой линии, характеризующейся крайне низкой исходной приспособленно-
стью, можно рассматривать как реализацию некоего sos-механизма: в ре-
зультате инсерционного мутагенеза происходит резкое увеличение изменчи-
вости, способной послужить основой для дальнейшего положительного от-
бора. Возможно, мдг-1, в силу каких-то своих особенностей, часто попадает
именно в те локусы, которые являются главными генами, контролирующи-
ми такой сложный количественный признак, как приспособленность, и вы-
зывает в них мутации, повышающие адаптивные свойства линии.
САМОРЕГУЛЯЦИЯ РЕТРОТРАНСПОЗОНОВ
Равновесное существование ретротранспозонов в геноме определяется
не только силой отбора против их вредных эффектов, но и скоростью их
внутригеномного размножения. Иными словами, для сохранения стабильно-
го числа копий ретротранспозонов в популяции либо приспособленность,
либо частота транспозиций должны резко падать с увеличением числа ко-
пий. Обратную связь между числом копий ретротранспозонов в геноме и ча-
стотой его транспозиций называют саморегуляцией.
Саморегуляция числа копий ретротранспозонов предполагает негатив-
ную корреляцию между числом копий в геноме и частотой транспозиций,
однако экспериментально полученная нами при исследовании этого вопроса
зависимость оказалась противоположной (рис. 11). Полученные данные яви-
лись первым экспериментальным доказательством того, что саморегуля-
цию числа копий вряд ли можно считать характерной для ретротранспозо-
нов (Nuzhdin et al., 1996; Pasyukova et al., 1998). Мы предполагаем, что повы-
шение частоты транспозиций в исследованных нами случаях является след-
ствием постепенного накопления копий ретротранспозонов в результате
редких транспозиций, происходящих с частотой, равной спонтанной. Дости-
жение порогового уровня числа копий приводит далее к самоускоряющему-
ся процессу увеличения частоты транспозиций и накопления ретротранспо-
зонов в геноме. Ясно, однако, что обычно такого накопления не происходит.
Об этом свидетельствует тот факт, что число копий данного семейства рет-
ротранспозонов сходно в разных линиях и популяциях. Возможно, отбор
поддерживает число копий, начиная с того момента, когда их избыток начи-
нает снижать приспособленность, т.е. когда, согласно нашим данным, до-
полнительное число копий превышает 200. Вторая возможность заключает-
ся в том, что мутации в генах хозяина, запрещающие транспозиции, возни-
кают, получают селективное преимущество благодаря своему сдерживаю-
щему эффекту и распространяются в популяции, останавливая экспансию
ретротранспозонов.
Тем не менее ретротранспозоны способны регулировать процесс собст-
венных транспозиций. Это обусловлено тем, что они содержат как нуклео-
2. Проблемы и перспективы...
33
Рис. 11. Соотношение между числом копий и частотой транспозиций copia в линиях 2Ь и
Harwich
тидные последовательности, кодирующие белки, необходимые для процесса
транспозиций, так и регуляторные последовательности-мишени, способные
воспринимать регуляторные сигналы со стороны генома хозяина. Известно,
что в природных популяциях наблюдается определенная, хотя и не очень
большая вариация в структуре элементов, принадлежащих к одному семей-
ству (Csink, McDonald, 1995). Представляет интерес вопрос о том, как зави-
сит экспрессия (транскрипция, транспозиции) от вариаций в структуре рет-
ротранспозона.
В качестве одного из объяснений резкого увеличения частоты транспо-
зиций, наблюдаемого в некоторых линиях дрозофилы, была предложена ги-
потеза “сумасшедшей” копии. Она подразумевает, что активизация ретро-
транспозона может быть следствием мутации в последовательности самого
элемента. Действительно, удалось выявить два структурных варианта рет-
ротранспозона gypsy, различающихся по транспозиционной активности
(Lyubomirskaya et al., 1990). Однако предпринятый нами анализ последова-
тельности активно перемещающейся копии ретротранспозона copia в ли-
нии, характеризующейся очень высокой частотой его транспозиций, пока-
зал ее идентичность последовательности канонических копий (Филатов и
др., 1998). В регуляторном районе активно перемещающегося ретропозона
34
Doc нами были найдены отличия от канонической копии, однако оказалось,
что этот ранее не описанный структурный вариант ретропозона встречает-
ся во многих линиях, независимо от транспозиционной активности Doc в них
(Пасюкова и др., 1999). Таким образом, структурно перестроенные, “сума-
сшедшие” копии ретротранспозонов могут возникать, но не всегда именно
это служит причиной активизации ретротранспозонов.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ
ЧАСТОТЫ ТРАНСПОЗИЦИЙ
A priori очевидно, что ряд локусов генома играет роль в экспрессии ре-
тротранспозонов, ведь ретротранспозоны используют для реализации сво-
его жизненного цикла белки клетки. Практически все известные гены, за-
трагивающие экспрессию ретротранспозонов, были описаны как модифика-
торы транскрипции или, реже, трансляции. Влияние этих генов на транспо-
зиции ретротранспозонов, т.е. в конечном счете на их жизненный цикл как
самостоятельных, эндосимбиотических элементов генома, было показано,
таким образом, только косвенно, как влияние на один из промежуточных
этапов процесса транспозиций, каковым является транскрипция. Исключе-
ние составляет ген flamenco, который был выявлен методами классической
генетики как ген, контролирующий частоту транспозиций ретротранспозо-
на gypsy (Prudhomme et al., 1995).
Такая ситуация, когда известные гены, контролирующие поведение рет-
ротранспозонов - это в подавляющем большинстве модификаторы транс-
крипции или трансляции, является следствием двух обстоятельств. Первое -
трудность экспериментального исследования транспозиций из-за их низкой
спонтанной частоты и(или) невоспроизводимости в условиях эксперимента.
Второе - тот факт, что частота транспозиций, по существу, представляет со-
бой количественный, мерный признак, и картирование соответствующих ге-
нов требует применения методов количественной генетики. В связи со ска-
занным очевидны две задачи. С одной стороны, необходим более детальный
анализ сопряженности транскрипции с процессом транспозиций, в котором
транскрипция является одной из промежуточных стадий. С другой стороны,
необходимо прямое картирование локусов, контролирующих частоту транс-
позиций, с использованием специальных методов, предназначенных для кар-
тирования генов количественных признаков.
Сопряженность процессов транскрипции и транспозиции была впервые
исследована нами in vivo на нескольких моделях. Сравнение нескольких род-
ственных линий дрозофилы показало, что стократное различие в частоте
транспозиций ретротранспозона copia сопряжено с различиями в количест-
ве транскрипта. Однако различие в количестве транскрипта могло быть
объяснено разницей в числе копий copia в геномах сравниваемых линий дро-
зофилы, а кроме того, линии могли отличаться друг от друга мутациями, ко-
торые контролируют процесс транспозиций и не влияют на количество
транскрипта, или наоборот. Для того чтобы снять эти возражения, мы ис-
следовали взаимосвязь между частотой транспозиций и количеством транс-
крипта на абсолютно идентичном генетическом фоне. Мы сравнили часто-
ту транспозиций и количество транскрипта у самцов и самок одной и той же
2*
35
линии, разница в частоте транспозиций между которыми достигает как ми-
нимум 50 раз, а также у самцов разного возраста с максимальной разницей
по частоте транспозиций в три раза. Достоверная связь между частотой
транспозиций и количеством транскрипта была подтверждена и в том, и в
другом случае (Pasyukova et al., 1997; Филатов, Пасюкова, 1998; Filatov et al.,
1998). Заметим, что зависимость частоты транспозиций от возраста, пока-
зывающая, что поведение ретротранспозона определяется физиологически-
ми особенностями хозяина, была обнаружена нами впервые. Наконец, с по-
мощью эмбриональной трансформации было показано, что различия в ко-
личестве транскрипта между самцами и самками связаны с более интенсив-
ной транскрипцией copia в семенниках (Филатов и др., 1998). Таким образом,
тесная связь транскрипции с процессом транспозиций была доказана на при-
мере ретротранспозона copia. Наличие такой связи показывает, что количе-
ство транскрипта может быть хорошим диагностическим признаком при
анализе генетического контроля транспозиций ретротранспозонов, если в
силу особенностей эксперимента прямое измерение частоты транспозиций
невозможно. Однако, как будет видно из дальнейшего, правило это далеко
не абсолютно, и, исследуя транспозиции, лучше всего использовать в каче-
стве характеристики именно их частоту.
Первая попытка картирования локусов, контролирующих количество
транскрипта и частоту транспозиций, с применением методов количествен-
ной генетики была предпринята нами для линии, характеризующейся высо-
кой частотой транспозиций ретротранспозона copia. С этой целью был ис-
пользован метод рекомбининтных инбредных (РИ) линий, позволяющий
получить линии дрозофилы, содержащие случайный набор геномных фраг-
ментов двух исходных линий, выбранных для эксперимента. Одна из исход-
ных линий в нашем эксперименте характеризовалась высокой частотой
транспозиций ретротранспозона copia, в то время как другая — обычной
низкой частотой его транспозиций. Для выявления достоверных корреля-
ций между частотой транспозиций ретротранспозона copia в данной РИ ли-
нии и присутствием в ее геноме определенного фрагмента генома исходной
линии, в которой частота транспозиций этого ретротранспозона была по-
вышена, была применена компьютерная программа QTL Cartographer. Бы-
ли выявлены два геномных фрагмента, от которых зависит увеличенное
количество транскрипта copia в линии 2Ь, а также три взаимодействующих
геномных фрагмента, которые контролируют повышенную частоту транс-
позиций copia (Nuzhdin et al., 1998). Подчеркнем, что один из локусов, влия-
ющих на количество транскрипта, не совпадает с локусами, контролирую-
щими частоту транспозиций, и наоборот, два локуса, влияющие на частоту
транспозиций, не влияют на количество транскрипта. Какова природа этих
локусов, соответствуют ли они каким-либо известным генам или представ-
ляют собой новые и ранее неописанные, пока остается совершенно не-
ясным.
Генетический контроль транспозиций представляется, таким образом,
довольно сложным. Не один, а несколько генов, контролирующих разные
процессы, отвечают за высокую частоту транспозиций даже в одной линии.
Кроме того, из имеющихся данных о генах хозяина, контролирующих рет-
ротранспозоны copia и gypsy, ясно, что эти гены или по крайней мере их часть
индивидуальны для каждого ретротранспозона. Возникает вопрос, имеют
36
ли описанные в лабораторных линиях локусы отношение к тем генам, кото-
рые регулируют частоту транспозиций МЭ в природных популяциях. Эта
область исследования требует расширения и новых результатов для того,
чтобы возможны были надежные обобщения.
ЗАКЛЮЧЕНИЕ
Можно выделить два уровня в системе взаимодействия и коэволюции ре-
тротранспозон-хозяин. Первый уровень, исследованию которого посвящена
проводимая в Отделе работа, первичен и схож у разных ретротранспозонов.
Он обусловлен самим присутствием ретротранспозона в геноме и выражает-
ся в том, что многие гены хозяина, его белки и клеточная машина в целом
участвуют в реализации жизненного цикла ретротранспозона. Возможность
эффективного взаимодействия генов хозяина с ретротранспозоном обусло-
влена наличием в его структуре рецепторных последовательностей - мише-
ней, способных воспринимать различные регуляторные сигналы, в том чис-
ле сигналы, дискриминирующие базовые физиологические свойства хозяи-
на, например, его пол и возраст. Проведенные исследования пока не дают
оснований считать, что в геноме есть некие локусы, специализированные на
контроле ретротранспозонов, но и исключить возможность того, что в про-
цессе коэволюции некоторые гены специализировались в этом направле-
нии, нельзя. Предполагается, что линии с высокой частотой транспозиций
какого-либо ретротранспозона содержат пермиссивные аллели генов, конт-
ролирующих транспозиционный процесс, в то время как линии с низкой ча-
стотой транспозиций содержат соответствующие рестриктивные аллели.
Генетический контроль транспозиций представляется довольно сложным.
Не один, а несколько генов, контролирующих разные процессы, могут отве-
чать за высокую частоту транспозиций даже в одной линии. Остается от-
крытым вопрос о том, встречаются ли в разных линиях, характеризующих-
ся высокой частотой транспозиций данного ретротранспозона, пермиссив-
ные аллели разных генов, или всякий раз речь идет о пермиссивных мутаци-
ях одного гена, может быть, немногих. Кроме того, гены хозяина, по край-
ней мере их часть, индивидуальны для каждого ретротранспозона. Возника-
ет также вопрос, имеют ли описанные в лабораторных линиях локусы отно-
шение к тем генам, которые регулируют частоту транспозиций ретротранс-
позонов в природных популяциях. Все эти вопросы остаются открытыми
для дальнейшего изучения.
Стартовой точкой внутригеномной экспансии для многих ретротранспо-
зонов может быть самоускоряющийся рост числа копий, который далее мо-
жет быть остановлен в результате возникновения и закрепления структур-
ных изменений в самом ретротранспозоне или возникновения и закрепления
в популяции геномной мутации, ограничивающей размножение ретротранс-
позона и спасающей геном хозяина от переполнения копиями ретротранспо-
зона. Исследование таких изменений и мутаций представляет собой одну из
задач дальнейших исследований.
Важно, что результатом взаимодействия генов хозяина с ретротранспо-
зоном является транспозиционный процесс, ведущий к внутригеномному
размножению ретротранспозона, т.е. к его встройке в новые локусы. По-
37
следствием такого размножения для хозяина является появление новых му-
таций. Спектр транспозиций широк и захватывает все эукариотические рай-
оны генома. В целом встройки ретротранспозонов вредны, хотя эффект ка-
ждой весьма мал. Когда ретротранспозонов накапливается много, отбор вы-
чищает их из генома, но некоторые встройки, нейтральные или полезные,
сохраняются в геноме. Обусловленный транспозициями ретротранспозонов
мутагенез представляет собой мощный и потому очень важный источник ге-
нетической изменчивости, являющейся основой эволюционного развития.
Вспышки транспозиций в популяциях, генетическая изменчивость которых
в силу каких-то причин оказалась сильно редуцированной, можно рассмат-
ривать как реализацию sos-механизма, сальтационно повышающего внутри-
популяционную изменчивость. Периодическая активизация подвижности
ретротранспозонов может служить и одним из механизмов видообразования
(Евгеньев и др., 1998). В сущности, уже первый уровень взаимодействия де-
лает ретротранспозоны вполне необходимой частью генома. В дальнейшем
было бы интересно и важно исследовать роль ретротранспозонов в эволю-
ции на примере конкретных природных популяций дрозофилы.
За пределами исследований, проводимых в Отделе, остался второй уро-
вень взаимодействия ретротранспозон-хозяин, который возникает скорее
всего уже в процессе совместного существования и потому может быть бо-
лее изощренным и различаться для разных ретротранспозонов. Одним из
возможных путей коэволюции ретротранспозона и хозяина может быть тот
или иной вариант глубокого эндосимбиоза, когда какой-либо ретротранспо-
зон приобретает некую специальную функцию (Beissmann et al., 1993; Teng,
Gabriel, 1996; Moore, Harber, 1996; Britten, 1997). Регуляторные элементы ре-
тротранспозонов также могут не только обеспечивать регуляцию прилежа-
щих к ним генов хозяина, но и эволюционировать в новые гены хозяина или
их элементы в результате “молекулярного одомашнивания” (Чуриков, 1996;
Miller et al., 1997).
ЛИТЕРАТУРА
Беляева Е.С., Пасюкова Е.Г., Гвоздев В.А. Адаптивные транспозиции ретротранспозо-
нов в геноме Drosophila melanogaster. сопровождающиеся увеличением приспособ-
ленности особей Ц Генетика, 1994. Т. 30. С. 725—730.
Георгиев П.Г., Симонова О.Б., Герасимова Т.П. Новый тип нестабильности генома у
Drosophila melanogaster // Генетика, 1988, 24, 867—877.
Евгеньев М.Б., Зеленцова Е.С.. Шостак Н.П. и др. Мобильные элементы и видообразо-
вание //Молекулярная биология, 1998. Т. 32. С. 184—192.
Ильин Ю.В., Чуриков Н.А., Любомирская Н.В., Георгиев Г.П. Разбросанные гены
Drosophila melanogaster с варьирующей локализацией // Генетика, 1979. Т. 15.
С. 775-784.
Ким А.И., Беляева Е.С. Транспозиции мдг4 на фоне неизменной локализации других мо-
бильных элементов в мутаторной линии Drosophila melanogaster, характеризующей-
ся генетической нестабильностью // ДАН СССР. 1986. Т. 289. С. 1248—1252.
Морозова Т.В., Пасюкова Е.Г. Изменчивость локализации ретротранспозона copia и его
влияние на приспособленность в инбредных линиях Drosophila melanogaster, харак-
теризующихся различной частотой транспозиций // Генетика, 2000. Т. 36. С. 451—458.
Пасюкова Е.Г.. Гвоздев В.А. Особенности распределения мобильных генетических эле-
ментов в хромосомах особей из природных популяций Drosophila melanogaster //Там
же. 1986. Т. 22. С. 2813-2819.
38
Пасюкова Е.Г., Нуждин С.В. Мобилизация ретротранспозона copia в геноме Drosophila
melanogaster // Там же. 1992. С. 27. С. 5—18.
Пасюкова Е.Г., Нуждин С.В., Филатов ДА., Гвоздев В.А. Ретротранспозон — геном хо-
зяина: механизмы и эффекты взаимодействия // Молекуляр. биология. 1999. Т. 33.
С. 26-37.
Филатов Д.А., Нуждин С.В., Пасюкова Е.Г. Преимущественная транскрипция ретро-
транспозона copia в семенниках Drosophila melanogaster II Там же. 1998. Т. 32.
С. 976-980.
Филатов Д.А., Пасюкова Е.Г. Корреляция между числом сайтов, количеством транс-
крипта и частотой транспозиций ретротранспозона copia у Drosophila melanogaster //
Генетика. 1998. Т. 34. С. 442—445.
Чуриков Н.А. Роль ретроэлементов в эволюции: Анализ суффикс-элемента из генома
дрозофилы //Цитология и генетика. 1996. Т. 30. С. 14—22.
Ananiev E.V., Gvozdev V'.A, Ilyin Y.V. et al. Reiterated genes with varying location in intercalary
heterochromatin regions of Drosophila melanogaster polytene chromosomes // Chromosoma.
1978. Vol. 70. P. 1-11.
Beissmann H., Kasravi B., Jakes K. et al. The genomic organization of HeT-A retrotransposon in
Drosophila melanogaster I I Ibid. 1993. Vol. 102. P. 297—305.
Berg D.E., Howe M. Mobile DNA. Wash. (D.C.): Amer. Soc. for Microbiology, 1989.
Biemont C., Lemeunier F., Garcia Guerreiro M. P. et al. Population dynamics of copia, mdgl,
mdg3, mdg4 and P transposable elements in natural populations of Drosophila melanogaster //
Genet Res. 1994. Vol. 63. P. 197-212.
Britten R.J. Mobile elements inserted in the distant past have taken on important functions //
Gene. 1997. Vol. 205. P. 177-182.
Csink A.K., McDonald J.F. Analysis of copia sequence variation within and between Drosophila
species // Mol. Biol. Evol. 1995. Vol. 12. P. 83—93.
Demerec M. The behavior of mutable genes // Verh. Intern. Kngl. Vererbwiss. 1928. Bd. 1.
S. 183-193.
Doolittle И'. F., Sapienza C. Selfish genes, the phenotype paradigm, and genome evolution //
Nature. 1980. Vol. 284. P. 601-604.
Filatov D.A.. Morozova T.V.. Pasyukova E.G. Age-dependent copia transposition rate is positive-
ly associated with copia transcript abundance in a Drosophila melanogaster inbred line // Mol
and Gen. Genet. 1998. Vol. 258. P. 646-654.
Finnegan D.J., Rubin G.M., Young M.W., Hogness D.S. Repeated gene families in Drosop-
hila melanogaster // Cold Spring Harbor Symp. Quant. Biol. 1978. Vol. 42. P. 1053-
1067.
Georgiev P.G., Kiselev S.L., Simonova O.B., Gerasimova Т.1. A novel transposition system in
Drosophila melanogaster depending on the Stalker mobile genetic element // EMBO J. 1990.
Vol. 9. P. 2034-2037.
Kim A., Belyaeva E.S., Aslanian M.M. Autonomous transposition of gypsy mobile elements and
genetic instability in Drosophila melanogaster Ц Mol. and Gen. Genet. 1990. Vol. 224.
P. 303-308.
Lyubomirskaya N.V., Arkhipova I.R., Win Y.V., Kim А.1. Molecular analysis of the gypsy (mdg4)
retrotransposon in two Drosophila melanogaster strains differing by genetic instability //
.Ibid. 1990. Vol. 223. P. 305-309.
McClintock B. The origin and bahavior of mutable loci in maize // Proc. Nat. Acad. Sci. USA.
1950. Vol. 36. P. 344-355.
Miller WJ., McDonald J.F., Pinsker W. Molecular domestication of mobile elements // Genetica.
1997. Vol. 100. P. 261-270.
Moore J.K., Harber J.E. Capture of retrotransposon DNA at the sites of chromosomal double-
strand breaks I I Nature. 1996. Vol. 383. P. 644—646.
Nuzhdin S.V., Pasyukova E.G., Mackay T.F.C. Positive association between copia transposition
rate and copy number in Drosophila melanogaster // Proc. Roy. Soc. London B. 1996.
Vol. 263. P. 823-831.
Nuzhdin S.V., Pasyukova E.G., Mackay T.F.C. Accumulation of transposable elements in labora-
tory lines of Drosophila melanogaster // Genetica. 1997. Vol. 100. P. 167—175.
39
Nuzhdin S.V., Pasyukova E.G., Morozova E.A., Flavell A J. Quantitative genetic analysis of copia
retrotransposon activity in inbred Drosophila melanogaster lines // Genetics. 1998. Vol. 150.
P. 755-766.
Orgel L.E., Crick F.H. Selfish DNA: the ultimate parasite. Nature. 1980. Vol. 284. P. 604-607.
Pasyukova E.G., Belyaeva E.S., Kogan G.L. et al. Concerted transpositions of mobile genetic ele-
ments coupled with fitness changes in Drosophila melanogaster // Mol. Biol. Evol. 1986.
Vol. 3. P. 299-312.
Pasyukova E.G., Nuzhdin S.V. Doc and copia instability in an isogenic Drosophila melanogaster
stock // Mol Gen Genet. 1993. Vol. 240. P. 302—306.
Pasyukova E.G., Nuzhdin S.V., Filatov D.A. The relationship between the rate of transposition and
transposable element copy number for copia and Doc retrotransposons of Drosophila
melanogaster 11 Genet Res. 1998. 71. Vol. 72. P. 1-11.
Pasyukova E.G., Nuzhdin S.V., Li W., Flavell AJ. Germ line transposition of the copia retrotrans-
poson in Drosophila melanogaster is restricted to males by tissue-specific control of copia
RNA level Ц Mol. and Gen. Genet. 1997. Vol. 255. P. 115-124.
Prud' homme N., Gans M., Masson M. et al. Flamenco, a gene controlling the gypsy retrovirus of
Drosophila melanogaster Ц Genetics. 1995. Vol. 139. P. 697—711.
Teng S., Gabriel A. Retrotransposon reverse-transcriptase-mediated repair of chromosomal breaks I I
Nature. 1996. Vol. 383. P. 641—644.
КЛАСТЕР СЕМЕННИК-СПЕЦИФИЧНЫХ ГЕНОВ
У ДРОЗОФИЛЫ
Ю.Я. Шевелев
Лаборатория анализа регуляции генов
Отдела молекулярной генетики клетки
Сперматогенез, т.е. процесс образования спермы из герминальных
стволовых клеток, протекает в семенниках у млекопитающих и у дрозо-
филы сходным образом. Важным этапом этого процесса является акти-
вация транскрипции массы семенник-специфичных генов перед двумя де-
лениями мейоза, механизмы которой остаются непонятными. В ходе на-
ших исследований у дрозофилы был обнаружен район хромосомы, содер-
жащий пять генов, экспрессирующихся только в семенниках. При этом
гены, составляющие этот район, оказались неродственными между собой,
что является новым типом кластерной организации генов. Предполага-
ется, что в описываемом районе генома находятся функционирующие в
генеративной ткани самцов далънодействующие регуляторы транс-
крипции — активатор транскрипции (энхансер) и элементы, препятству-
ющие распространению влияния активатора на соседние гены (инсуля-
торы). На этой модельной системе мы исследуем механизмы транскрип-
ционной активации семенник-специфичных генов. С этой целью изуча-
ются премоторные области генов, входящих в кластер, далънодейству-
ющие транскрипционные регуляторы (энхансеры и инсуляторы), веро-
ятно, присутствующие в кластере, а также состояние хроматина в кла-
стере.
Один из генов, входящих в кластер, кодирует семенник-специфичную
субъединицу казеинкиназы 2. Казеинкиназа 2 (casein kinase 2, СК2) — проте-
инкиназа, фосфорилирующая по остаткам серина и/или треонина более
полутора сотен белков в эукариотической клетке. Основная функция
СК2 в настоящее время не известна. У большинства изученных организ-
уй
мое СК2 состоит из двух каталитических а- и/или а'-субъединиц и двух
регуляторных ^-субъединиц. Мы обнаружили, что у дрозофилы, помимо
представленной во всех тканях ^-субъединицы, имеются еще две тканес-
пецифичные ([З/сл и субъединицы СК2, регулирующие активность и суб-
страт-специфичность фосфорилирования в ходе сперматогенеза. Регуля-
торные субъединицы СК2, выполняющие тканеспецифичные функции,
обнаружены впервые.
ВВЕДЕНИЕ
Сперматогенез, т.е. процесс образования спермы из герминальных ство-
ловых клеток, протекает в семенниках у млекопитающих и у дрозофилы
сходным образом. На рис. 12 схематично показаны стадии этого процесса у
дрозофилы (см. обзор: Fuller, 1998). На первом этапе стволовая клетка де-
лится, воспроизводя себя и давая начало сперматогониальной клетке (или
гониобласту). Сперматогониальные клетки проходят несколько митотиче-
ских делений и вступают в стадию первичных сперматоцитов. На этом эта-
пе идет активная подготовка к мейозам. Происходит 25-кратное увеличение
клеток в объеме, сопровождаемое активной транскрипцией множества ге-
нов. Часть синтезированных мРНК транслируется на этой же стадии, в то
время как другая, большая, часть служит матрицами для синтеза белков на
более поздних стадиях сперматогенеза (после мейотических делений), на ко-
торых транскрипция практически не идет. Происходит так называемая “от-
ложенная трансляция” этих мРНК. После того как сперматоциты созрели,
т.е. накопили все необходимое для последующих превращений, в них осуще-
ствляются два последовательных мейотических деления, после завершения
которых клетки вступают в стадию ранних сперматид.
На этом этапе множество митохондрий сливаются в две гигантские ми-
тохондрии, видимые под микроскопом в виде темного образования рядом с
ядром. Затем происходит ряд морфологических изменений, сопровождаю-
щих дифференцировку сперматид в зрелую сперму. В первую очередь, это
образование хвостика спермия, сформированного преимущественно из бел-
ка Р2-тубулина. Для придания подвижности спермиям хвостики совершают
колебательные движения, для которых необходима энергия. Запасение
энергии осуществляется в слитых в единую структуру митохондриях, кото-
рые в ходе дифференцировки сперматид распределяются вдоль всей длины
их хвостиков. В это же время происходит компактизация хроматина в ядре,
расположенном в головной части сперматид. Наконец, на последнем этапе
созревания сперматид происходит их “индивидуализация”. До этого пучки из
64 сперматид были покрыты общей оболочкой, внутри которой находилась
единая цитоплазма, в результате чего каждая гаплоидная сперматида полу-
чала одинаковый, и независимый от ее хромосом, набор факторов для сво-
ей дифференцировки. На этапе “индивидуализации” у каждой сперматиды
образуется своя собственная цитоплазматическая мембрана, а ненужная ци-
топлазма выдавливается в мешок, образующийся из остатков общей обо-
лочки. Созревание спермы завершается.
Транскрипционная активация множества генов в первичных спермато-
цитах необходима для синтеза практически всего материала, формирующе-
го зрелую сперму. Поэтому один из ключевых вопросов, необходимых для
41
Деление стволовых
клеток дает
гониобласт,
а он, делясь,
дает две
сперматогонии
S- стволовые
клетки
G - гониобласты
3 митоти-
ческих
деления
сперматогонии
Вхождение
в стадию
роста и
экспрессии
генов
- сперматогонии
16 первичных
Два деления
мейоза
сперматоцитов
Активная
транскрипция
множества
генов
Стадия дифферен-
цировки сперматид
Ранние
сперматиды
Индивидуа-
лизация
Рис. 12. Схема сперматогенеза у дрозофилы
Полностью
удлиненные
сперматиды
Зрелые
сперматиды
понимания процесса сперматогенеза, состоит в следующем: каким образом
на этапе первичных сперматоцитов осуществляется транскрипция массы
молчащих до этого генов? К сожалению, здесь в наших знаниях имеется еще
множество пробелов. У дрозофилы известен ряд генов, таких, например,
как always early (aly), и cannonball (сап), мутации которых блокируют транс-
42
крипцию большинства известных семенник-специфичных генов. Ген aly
(White-Cooper et al., 2000) кодирует белок, предположительно участвующий
в изменении структуры хроматина. Возможно, что белок Aly необходим
для перевода хроматина сперматоцит-специфичных генов в декомпактизо-
ванное, транскрипционно-активное состояние, которое является необходи-
мой предпосылкой для последующей активной экспрессии этих генов. Одна-
ко декомпактизованное состояние хроматина является необходимым, но не
достаточным условием массированной транскрипции генов на стадии пер-
вичных сперматоцитов. Здесь требуются белковые факторы, способные не-
посредственно взаимодействовать с регуляторными элементами конкрет-
ных генов, чтобы инициировать их транскрипцию. Действительно, охарак-
теризованный недавно белковый продукт гена (сап) оказался семенник-спе-
цифичным транскрипционным фактором (Hiller et al., 2001). Если он в самом
деле участвует в распознавании премоторных областей генов, экспрессиру-
ющихся в ходе сперматогенеза, то эти области должны иметь сходные нук-
леотидные последовательности. Проведенные исследования показали, что
рядом со стартом транскрипции нескольких таких генов находится короткая
(около 14 н.п.) последовательность, необходимая для транскрипции этих ге-
нов в семенниках (Michiels et al., 1989). Однако все еще не ясно, насколько
такая последовательность универсальна и какие белковые факторы с ней
связываются.
В ходе наших исследований у дрозофилы был обнаружен кластер генов,
экспрессирующихся в ходе сперматогенеза. На этой модельной системе мы
исследуем механизмы транскрипционной регуляции семенник-специфичных
генов. Изучаются как премоторные области генов, входящих в кластер, с це-
лью выявления в них участков, необходимых для транскрипции в семенни-
ках, так и дальнодействующие транскрипционные регуляторы (энхансеры и
инсуляторы), вероятно, присутствующие в кластере. Предполагается также
исследование состояния хроматина в кластере на разных стадиях спермато-
генеза. Мы надеемся, что раскрытие системы активации транскрипции в
первичных сперматоцитах у самцов дрозофилы позволит в дальнейшем лег-
че понять механизм транскрипционной регуляции, действующий в ходе об-
разования спермы у млекопитающих и человека.
КЛАСТЕРНАЯ ОРГАНИЗАЦИЯ СЕМЕННИК-СПЕЦИФИЧНЫХ ГЕНОВ
У ДРОЗОФИЛЫ
ПРИМЕРЫ КЛАСТЕРОВ
В настоящее время у различных организмов известно множество приме-
ров скоплений на хромосомах, родственных по последовательности и сход-
ных по функциям генов. Обычно такие кластеры сформированы последо-
вательно повторенными множество раз копиями (гены рРНК, 5S РНК, гис-
тонов и др.), либо представлены менее регулярно организованными, содер-
жащими меньшее число копий и менее сходными по последовательности
генами (кластеры ос- и Р-глобиновых генов у позвоночных, АроЕ кластер
человека и др.) (рис. 13; см. обзор: Bonifer, 2000). Как правило, гены, входя-
щие в кластер, экспрессируются в определенной ткани, либо на определен-
ной стадии развития. В этих случаях предполагается, а иногда и показано су-
43
ществование в кластере общих регуляторных элементов (locus control
regions - LCRs), в число которых входят энхансеры, активирующие транс-
крипцию в определенный момент развития или в определенной ткани, и ин-
суляторы, защищающие гены кластера от влияния внешних по отношению
к генам кластера энхансеров. Однако известны примеры кластеров генов,
имеющих общие регуляторные элементы (LCR), но экспрессирующихся при
этом в разных тканях, органах или на разных стадиях развития. Так, ген, ко-
дирующий гормон роста человека, экспрессируется в гипофизе, в то время
как родственные ему гены, входящие в единый с ним кластер и имеющие об-
щие с ним регуляторные элементы, экспрессируются в плаценте (Su et al.,
2000).
Известно лишь несколько примеров кластерной организации генов, экс-
прессирующихся в ходе сперматогенеза. Так, у дрозофилы описан кластер
из четырех Mst84D-renoB, экспрессирующихся в семенниках и кодирующих
белки, существенные для подвижности спермы (Kuhn et al., 1991). У мыши
известен кластер из трех сперматоцит-специфичных генов (PRM1, PRM2,
TNP2), кодирующих протамины (Kramer et al., 1998). В обоих случаях класте-
ры сформированы родственными генами и, вероятно, образовались в ре-
зультате нескольких актов локальных дупликаций исходного предкового ге-
на с последующим накоплением различий между копиями.
У ДРОЗОФИЛЫ ОБНАРУЖЕН КЛАСТЕР
ИЗ ПЯТИ НЕРОДСТВЕННЫХ ГЕНОВ, АКТИВИРОВАННЫХ
НА ОПРЕДЕЛЕННОЙ СТАДИИ СПЕРМАТОГЕНЕЗА
В ходе наших исследований (Калмыкова и Шевелев, неопубликованные
данные) у дрозофилы был обнаружен участок хромосомы, состоящий из пя-
ти генов, экспрессирующихся только в ходе сперматогенеза. По признаку
экспрессии в определенной ткани эти гены можно объединить в семенник-
специфичный кластер. При этом гены, входящие в кластер, оказались не-
родственны между собой, что является первым примером такого рода орга-
низации. Работа была начата, когда выяснилось, что изучаемый нами ген
CK2$tes, кодирующий семенник-специфичную регуляторную субъединицу
казеинкиназы 2 (подробнее про казеинкиназу 2 см. следующий раздел), рас-
положен на хромосоме 2 дрозофилы вблизи гена Pros28.1B, кодирующего
одну из семенник-специфичных субъединиц ответственного за расщепление
отработавших в клетке белковых молекул протеасомного комплекса (Yuan
et al., 1996). Проведенный нами анализ показал, что в непосредственной бли-
зости от этих генов находятся три новых гена с неизвестными функциями,
которые также экспрессируются исключительно в семенниках самцов.
Структура исследуемого кластера приведена на рис. 14.
К кластеру с обеих сторон примыкают гены, экспрессирующиеся во всех
тканях взрослых мух, обозначая, таким образом, вероятные границы семен-
ник-специфичного домена. Можно предположить, что элементы, располо-
женные на границах этого домена, проявляют свойства инсуляторов, т.е.
способны защищать гены кластера от влияния активаторов транскрипции,
расположенных вне его и работающих в других тканях и органах, либо, на-
оборот, ограждать внешние гены от гипотетического активатора, находя-
44
щегося внутри кластера. Нахождение в одном коротком хромосомном фраг-
менте пяти неродственных друг другу генов, экспрессирующихся в семенни-
ках, предполагает существование внутри кластера общего для всех генов
тканеспецифичного энхансера, активирующего их транскрипцию на опреде-
ленной стадии сперматогенеза.
В пользу существования энхансера и инсуляторов в кластере свидетель-
ствуют также результаты компьютерного предсказания участков связыва-
ния с ядерным матриксом в исследуемом районе (рис. 14, красные овалы).
Считается, что это места прикрепления ДНК к белковому слою, выстилаю-
щему ядерную мембрану, которые создают определенную пространствен-
ную структуру хромосом в ядре, тем самым регулируя активность располо-
женных на хромосомах генов. Известно, что такие места часто совпадают по
локализации с участками, выполняющими функции энхансеров и инсулято-
ров (см. обзор: Boulikas, 1995). В нашем случае такие предсказанные места
находятся на границах кластера (вероятные инсуляторы) и внутри него
(вероятный энхансер) (см. рис. 14).
Как уже упоминалось, пять генов, входящих в кластер, неродственны ме-
жду собой. Тем не менее они экспрессируются в генеративной ткани самцов
дрозофилы на определенной стадии сперматогенеза, что предполагает су-
ществование общих для всех генов регуляторных элементов (энхансера и
инсуляторов). Можно думать, что исходно в данном районе существовали
один-два гена, промоторы которых активировались семенник-специфичным
энхансером, а влияние на эти гены окружающих последовательностей, либо
влияние энхансера на соседние гены, ограничивалось расположенными вок-
руг инсуляторами. В ходе эволюции генома (рис. 15) в результате случайных
транспозиций дуплицированных копий клеточных генов в участок хромосо-
мы, в котором находился семенник-специфичный энхансер, новые реплики
приобрели способность к экспрессии в семенниках. Возможно, именно так
возник описываемый кластер семенник-специфичных генов.
Эта гипотетическая схема подтверждается существованием в геноме
дрозофилы по меньшей мере двух экспрессирующихся во всех тканях генов,
от которых произошли тканеспецифичные гены кластера. Так, ген CK2f}tes
возник около 50 млн лет назад в результате дупликации гена, кодирующего
представленную во всех клетках [3-субъединицу СК2, и внедрения реплики в
район хромосомы, где теперь находится описываемый кластер. При этом,
ген-реплика, в отличие от исходного гена, приобрел способность транскри-
бироваться только в семенниках (Kalmykova et al., 1997а). Другой семенник-
специфичный ген кластера, Pros28.1B, также образовался вследствие вне-
дрения в район будущего кластера реплики гена Pros28.1, в различных типах
клеток кодирующего субъединицу протеасомы (Yuan et al., 1996). Таким об-
разом, представляется, что образование тканеспецифичных кластеров по
описываемому выше механизму (внедрение реплик генов в какие-либо тка-
неспецифичные домены) должно происходить достаточно часто в ходе эво-
люции геномов.
Как было сказано выше, помимо трех новых генов с неизвестной функ-
цией, в кластер входит ген, кодирующий одну из семенник-специфичных
субъединиц протеасомы - белкового комплекса, ответственного за расщеп-
ление ненужных клетке, отработавших свое белковых молекул. Известно,
что такие белки “помечаются” пришиваемыми к ним молекулами убиквити-
лч
на, что и является для протеасомы сигналом для их расщепления. Однако в
недавней работе (Salghetti et al., 2001) было обнаружено, что многие транс-
крипционные факторы также месятся молекулами убиквитина, и это явля-
ется необходимым условием для осуществления этими факторами активной
транскрипции. Кроме того, появились данные, показывающие необходи-
мость присутствия самой протеасомы для проведения транскрипции РНК-
полимеразой (Ferdons et al., 2001). Эти результаты свидетельствуют об уча-
стии протеасом не только в процессе белковой деградации, но и в процессе
регуляции транскрипции. В этой связи роль семенник-специфичной субъ-
единицы протеасомы Pros28.1B еще предстоит выяснить. Помимо вышепере-
численных генов в описываемый кластер входит также ген CK2$tes, кодиру-
ющий регуляторную субъединицу казеинкиназы 2, функционирующую в
сперматогенезе дрозофилы. В следующем разделе мы подробно остановим-
ся на свойствах казеинкиназы и ее семенник-специфичной регуляторной
субъединицы.
КАЗЕИНКИНАЗА 2 И ЕЕ РОЛЬ
В СПЕРМАТОГЕНЕЗЕ ДРОЗОФИЛЫ
ОБЩИЕ СВЕДЕНИЯ О КАЗЕИНКИНАЗЕ 2
Около трети всех белков в эукариотической клетке фосфорилированы,
т.е. содержат фосфатные группы, связанные с аминокислотными остатками
тирозина, серина либо треонина. Такие модификации изменяют свойства
белков, и, таким образом, выполняют определенные регуляторные функ-
ции. Так, например, широко известна роль фосфорилирования в регуляции
клеточного цикла, дифференцировке и передаче сигнала. Фосфорилируют
белки сотни различных протеинкиназ, причем некоторые из них строго спе-
цифичны в отношении какого-либо одного белка, в то время как другие могут
модифицировать несколько белков. Казеинкиназа 2 (casein kinase 2 - СК2) -
одна из первых обнаруженных протеинкиназ, была названа так из-за своей
способности фосфорилировать белок молока казеин. Позже выяснилось,
что казеин является далеко не единственным и не главным физиологиче-
ским субстратом СК2. Среди белков, фосфорилируемых СК2, оказались
РНК-полимеразы, ДНК-топоизомеразы, факторы трансляции и транскрип-
ции (среди последних - ряд онкобелков), белки, участвующие в передаче
сигнала, белки цитоскелета, хроматина и пр. Так, в недавней работе
(Yamaguchi et al., 1998) было показано, что СК2 фосфорилирует ДНК-связы-
вающий белковый домен у многих транскрипционных факторов и это при-
водит к изменению их способности связываться с ДНК и, таким образом,
стимулировать транскрипцию. В целом казеинкиназа 2 фосфорилирует по
остаткам серина, либо треонина более полутора сотен клеточных белков
(Allende J., Allende С., 1995), что делает ее достаточно уникальной, если не
единственной в своем роде. Она представляет собой крайне интересный
объект для исследований, поскольку вовлечена в такие различные процес-
сы, как раковое перерождение клетки, передача сигнала, контроль транс-
крипции, апоптоз (запрограммированная смерть клетки), регуляция клеточ-
ного цикла и другие.
46
СК2 большинства организмов представляет собой тетрамер, состоящий
из двух каталитических а- и/или а'-субъединиц и двух [3-субъединиц, играю-
щих регуляторную роль. У дрожжей 5. cerevisiae имеется также другая регу-
ляторная [3'-субъединица (Padmanabla, Glover, 1987), а у растений (A. thaliana)
в геноме находятся три гена, кодирующие разные [3-субъединицы СК2
(Sugano et al., 1998).
Данные биохимических экспериментов свидетельствуют, что регулятор-
ные субъединицы СК2 увеличивают стабильность, активность и специфич-
ность действия каталитических субъединиц (Allende J., Allende С., 1995). В то
же время каталитическая субъединица СК2 обладает заметной фосфорили-
рующей активностью сама по себе, что поднимает вопрос о возможности су-
ществования клетки вообще без регуляторных субъединиц СК2. Известно,
что инактивация обоих генов каталитических ос- и ос'-субъединиц у 5. cere-
visiae летальна, хотя “выключение” гена лишь ot-субъединицы не влияет на
жизнеспособность дрожжей, но делает их чувствительными к изменениям
температуры. Мутации, одновременно инактивирующие гены обеих [3-субъ-
единиц СК2, не приводят к каким-либо заметным фенотипическим проявле-
ниям у дрожжей при росте на нормальной среде; в то же время дрожжи ста-
новятся более чувствительными к концентрации в среде солей Na+ и Li+.
У 5. pombe, где имеется по одному гену для ос- и [3-субъединиц, мутации по
гену ос-субъединицы летальны. Делеция гена [3-субъединицы у 5. pombe при-
водит к замедлению скорости роста и повышенной чуствительности к холо-
ду (Glover, 1998).
Резюмируя данные по мутациям генов регуляторных и каталитических
субъединиц у дрожжей, можно сказать, что полная инактивация каталити-
ческой активности СК2 является летальной для клетки, в то время как час-
тичное снижение этой активности, связанное с “выведением из строя” регу-
ляторных субъединиц, приводит лишь к некоторым изменениям фенотипа.
У ДРОЗОФИЛЫ, В ОТЛИЧИЕ ОТ ДРУГИХ ОРГАНИЗМОВ,
В ГЕНОМЕ ИМЕЮТСЯ ДВЕ СПЕЦИФИЧНЫХ ДЛЯ СПЕРМАТОГЕНЕЗА
РЕГУЛЯТОРНЫХ СУБЪЕДИНИЦЫ КАЗЕИНКИНАЗЫ 2
Недавно было показано (Guerra et al., 1999), что максимальная фосфори-
лирующая активность казеинкиназы 2 у млекопитающих наблюдается в се-
менниках. В этой связи особенно интересны данные работы Хью с соавто-
рами (Xu et al., 1999). Оказалось, что ген ос'-субъединицы СК2 у мышей наи-
более активно экспрессируется на поздних стадиях сперматогенеза. У осо-
бей с искусственно инактивированным геном не было выявлено каких-либо
аномалий развития, за исключением нарушений сперматогенеза. У самцов
наблюдаются олигоспермия (недостаточное число сперматозоидов в спер-
ме) и глобозооспермия (сперматозоиды имеют неправильную форму), что
приводит к стерильности. Вероятно, одна из двух каталитических субъеди-
ниц СК2 у млекопитающих (ot'-субъединица) является специфичной и необ-
ходимой для сперматогенеза, обеспечивая максимальную фосфорилирую-
щую активность в семенниках.
В согласии с этими результатами находятся другие данные, показываю-
щие что количество регуляторной [3-субъединицы СК2 у млекопитающих в
47
50 млн
25 млн
---------СК2Р
---------CK20tes
---------Su(Ste)
6млн rSteay
---- и,3 млн
L Ste гетеро
Рис. 16. Эволюционное древо генов, родственных регуляторной субъединице казеинкина-
зе 2, у D. melanogaster
семенниках также максимально по сравнению с другими тканями (Guerra et
al., 1999). Мы задались вопросом, какие субъединицы СК2 функционируют
в процессе сперматогенеза у дрозофилы. В геноме D. melanogaster нами был
обнаружен ген CK2fites (от testis - семенник), родственный гену [3-субъедини-
цы СК2 и предположительно кодирующий регуляторную субъединицу казе-
инкиназы 2, специфичную для процесса сперматогенеза (Kalmykova et al.,
1997а; Kalmykova et al., 1997b). Эволюционный анализ показал, что около
50 млн лет назад предшественник гена СК2 fifes возник у дрозофилы в ре-
зультате вставки в геном копии гена основной [3-субъединицы СК2, причем
образование копии происходило с участием процесса обратной транскрип-
ции (рис. 16). Позднее, в результате размножения реплики гена CK2fites, по-
павшей в половые хромосомы дрозофилы, в Х-хромосоме возникли класте-
ры семенник-специфичных генов с неизвестной функцией Stellate, а в Y-xpo-
мосоме - кластер их супрессоров Su(Ste) (подробнее о генах Stellate и Su(Ste)
см. обзор В.А. Гвоздева, наст, сборник).
Нам удалось показать, что ген С К2 files действительно кодирует семен-
ник-специфичную субъединицу СК2 у дрозофилы (Kalmykova et al., 2002).
Белок P/es связывается с каталитической субъединицей СК2 in vitro и in vivo,
и взаимодействие субъединиц приводит к стимуляции фосфорилирующей
активности СК2. Таким образом, Pres - это первая известная тканеспецифичная
регуляторная субъединица СК2. В недавней работе (Bidwai et al., 1999) показа-
но существование у дрозофилы еще одного гена, кодирующего белок, родст-
венный Р-субъединице СК2. Проведенные нами эксперименты продемонстри-
ровали, что эта третья Р-субъединица, так же как и CK2fites, экспрессируется
только в семенниках самцов дрозофилы. Таким образом, в действительности у
дрозофилы имеется одна экспрессирующаяся во всех тканях (Saxena et al., 1987)
и две семенник-специфичных регуляторных субъединицы СК2.
Данные на млекопитающих и на дрозофиле свидетельствуют, что наи-
большая концентрация молекул регуляторной субъединицы СК2 требуется
именно в ходе сперматогенеза (дрозофила даже использует для этого два
новых гена, один из которых - С К2 files). Для чего же необходимо такое
большое количество и разнообразие Р-субъединиц СК2 в семенниках? К со-
жалению, ответ на этот вопрос пока неизвестен. Как было сказано выше,
мутации по гену регуляторной субъединицы СК2 получены лишь у дрож-
жей. Мы попытались искусственно снизить количество Pres-субъединицы в
семенниках самцов дрозофилы (Kalmykova et aL, 2002). Для этого были по-
лучены мухи, экспрессирующие в семенниках “антисмысловую” РНК
CK2fites. У трансгенных самцов количество Pres-субъединицы СК2 оказа-
48
лось сниженным в семенниках в 3-5 раз. Однако, как выяснилось, такое сни-
жение не привело к стерильности самцов. Вероятно, для ответа на вопрос о
необходимости регуляторных субъединиц казеинкиназы 2 для нормального
прохождения сперматогенеза требуется полностью инактивировать CK2$tes-
ген, а еще лучше - оба гена семенник-специфичных субъединиц СК2.
ЗАКЛЮЧЕНИЕ
Из данных статистических исследований известно, что примерно каждая
шестая пара, находящаяся в репродуктивном возрасте, страдает бесплодием.
Среди причин мужского бесплодия можно отметить мутации по генам, уча-
ствующим в сперматогенезе, хромосомные абберации, органические нару-
шения семенного тракта, гормональные нарушения, нарушения эрекции.
Если пара хочет иметь ребенка, то многие из этих проблем могут быть
обойдены с помощью современных методов медицины, в частности с помо-
щью метода внутрицитоплазматического введения спермы в зрелую яйце-
клетку (ICSI - intracytoplasmic sperm injection). Оказывается, что достаточно
одного сперматозоида для проведения искусственного оплодотворения яй-
цеклетки, с последующей имплантацией развивающегося эмбриона в матку
матери и рождения здорового ребенка. Поэтому, даже в случае азооспер-
мии, т.е. практически полного отутствия спермы, у мужчины сохраняется
шанс стать отцом. Однако во многих случаях мутации, блокирующие спер-
матогенез на ранних стадиях, приводят к тому, что в семенной жидкости от-
сутствуют даже единичные зрелые сперматозоиды. Учитывая такие ситуа-
ции, в лабораториях всего мира ведутся попытки доращивания in vitro спер-
матоцитов, взятых у страдающих азооспермией мужчин, до стадии зрелых
сперматид с последующим оплодотворением ими яйцеклеток будущих мате-
рей. К сожалению, такие попытки часто заканчиваются неудачами. Вероят-
но, в некоторых случаях, например когда мутация затрагивает структурный
белок аксонемы, такие попытки принципиально неосуществимы. Потенци-
ально здесь могли бы помочь генотерапевтические подходы, при которых в
геном мужской генеративной стволовой клетки in vitro вводился бы ген, кор-
ректирующий дефект созревания спермы. Затем трансформированная ство-
ловая клетка переносилась бы в семенники страдающего данным типом бес-
плодия мужчины и дифференцировавшись, приводила бы к появлению у не-
го нормальной спермы. Следует отметить, что описываемый подход не яв-
ляется научно-фантастическим. Так, расширение наших знаний о генах, уча-
ствующих в сперматогенезе, приводит ко все большим возможностям гено-
диагностики нарушений плодовитости у мужчин. Трансформация стволовых
клеток нужным геном также не является непреодолимой проблемой. Да и
перенос герминальных стволовых клеток в семенники в настоящее время
технически возможен (Schlatt et al., 1999). Тем не менее описываемая схема
является чисто гипотетической, поскольку сегодня на подобного рода гено-
терапевтические эксперименты наложен запрет по этическим соображени-
ям. Как известно, в большинстве стран законодательно запрещены целена-
правленные изменения генома человека, передающиеся по наследству. Оче-
видно, пока такое ограничение существует, человеческое сообщество будет
избавлено от ряда этических и юридических проблем, но при этом люди бу-
49
дут недополучать потенциально возможную медицинскую помощь. В лю-
бом случае, расширение наших знаний о генах и белках, функционирующих
в ходе сперматогенеза, является безусловно необходимым. Как уже упоми-
налось, процесс образования спермы протекает у дрозофилы и млекопита-
ющих сходным образом, поэтому исследования, проводимые в этой области
на дрозофиле, могут существенно расширить наши представления и о меха-
низмах регуляции сперматогенеза у млекопитающих и человека.
ЛИТЕРАТУРА
Allende J.E., Allende С.С. Protein kinase СК2: an enzyme with multiple substrates and a puzzling
regulation//FASEB J. 1995. Vol. 9. P. 313-323.
Bidwai A.P. et al. A gene located at 56F1-2 in Drosophila melanogaster encodes a novel meta-
zoan p-like subunit of casein kinase II // Mol. Cell. Biol. Res. Common. 1999. Vol. 1.
P. 21-28.
Bonifer C. Developmental regulation of eukaryotic gene loci // TIG. 2000. Vol. 16. P. 310-315.
Boulikas T. Chromatin domains and prediction of MAR sequences // Intern. Rev. Cytol., 1995.
Vol. 162A. P. 29-388.
Ferdous A. et al. The 19S regulatory particle of the proteasome is required for efficient transcrip-
tion elongation by RNA polymerase II // Mol. Cell 2001. Vol. 7. P. 981—991.
Fuller M. Genetic control of cell proliferation and differetiation in Drosophila spermatogenesis //
Sem. Cell Develop. Biol. 1998. Vol. 9. P. 433-444.
Glover C.V.C. On the physiological role of casein kinase II in Saccharomyces cerevisiae // Progr.
Nucl. Acid Res. Mol. Biol. 1998. Vol. 59. P. 95-133.
Guerra B. et al. Protein kinase CK2: evidence for a protein kinase CK2p subunit fraction, devoid
of the catalytic CK2oc subunit, in mouse brain and testicles // FEBS Lett. 1999. Vol. 462.
P. 353-357.
Hiller MA. et al., Developmental regulation of transcription by a tissue-specific TAF homolog //
Genes Develop. 2001. Vol. 15. P. 1021-1030.
Kalmykova A.I. et al. Acquisition and amplification of a testis expressed autosomal gene, SSL, by
the Drosophila Y chromosome // Proc. Nat. Acad. Sci. USA. 1997a. Vol. 94. P. 6297-6302.
Kalmykova A J. et al. The Su(Ste) repeat in the Y chromosome and pCK2tes gene encode predict-
ed isoforms of regulatory p-subunit of protein kinase CK2 in Drosophila melanogaster //
FEBS Lett. 1997b. Vol. 416. P. 164-166.
Kalmykova А.1. et al. CK2ptes gene encodes a testis-specific isoform of the regulatory subunit of
casein kinase 2 in Drosophila melanogaster // Europ. J. Biochem. 2002. Vol. 269.
P. 1418-1427.
Kramer J. et al. Differentiation: the selective potentiation of chromatin domains //Development.
1998. Vol. 125. P. 4749^1755.
Kuhn R. et al. A cluster of four selectively expressed genes in the male germ line of Drosophila
melanogaster I/ Meeh. Develop. 1991. Vol. 35. P. 143-151.
Michiels F. et al. A 14 bp promoter element directs the testis specificity of the Drosophila P2 tubu-
lin gene // EMBO J. 1989. Vol. 8. P. 1559-1565.
Padmanabla R., Glover C.V.C. Casein kinase II of yeast contains two distinct a. polypeptides and
an unusually large p subunit //J. Biol. Chem.. 1987. Vol. 262. P. 1829-1835.
Salghetti S.E. et al. Regulation of transcriptional activation domain function by ubiquitin //
Science. 2001. Vol. 293. P. 1651-1653.
Saxena A. et al. Isolation and sequencing of cDNA clones encoding a and P subunits of
Drosophila melanogaster casein kinase II // Mol. and Cell. Biol. 1987. Vol. 7. P. 3409-3417.
Schlatt S. et al. Germ cell transfer into rat, bovine, monkey and human testes // Human Reprod.
1999. Vol. 14. P. 144-150.
Su Y. et al. The human growth hormone gene cluster locus control region supports position-inde-
pendent pituitary- and placenta-specific expression in the transgenic mouse // J. Biol. Chem.
2000. Vol. 275. P. 7902-7909.
sn
Sugano S. et al. Protein kinase CK2 interacts with and phosphorylates the Arabidopsis circadian
clock-associated I protein//Proc. Nat. Acad. Sci. USA. 1998. Vol. 95. P. 11020-11025.
White-Cooper H. et al. Transcription of meiotic cell cycle and terminal differetiation genes
depends on a conserved chromatin associated protein, whose nuclear localisation is regulat-
ed // Development. 2000. Vol. 127. P. 5463—5473.
Xu X. et al. Globozoospermia in mice lacking the casein kinase II a' catalytic subunit // Nat. Genet.
1999. Vol. 1. P. 118-121.
'Yamaguchi Y. et al. Casein kinase II interacts with the bZIP domains of several transcription fac-
tors // Nucl. Acids Res., 1998. Vol. 26. P. 3854-3861.
Yuan X. et al. Duplicated proteasome subunit genes in Drosophila melanogaster encoding testes-
specific isoforms // Genetics. 1996. Vol. 144. P. 147-157.
ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
ГЕНОМА ДРОЗОФИЛЫ:
ГЕНЕТИЧЕСКИЕ ЭЛЕМЕНТЫ
В ПРОТЯЖЕННОМ РАЙОНЕ ЭУХРОМАТИНА
В.Е. Алаторцев
Сектор генных взаимодействий
Отдела молекулярной генетики клетки
Сиквенирование и компьютерный анализ генома Drosophila
melanogaster позволили получить ряд важных результатов, касающихся
структурной организации генома, и перейти к более детальному анализу
особенностей его структурно-функциональной организации. Мы исследу-
ем район Х-хромосомы длиной 200 т.п.н.. Охарактеризован ряд новых ге-
нов и составлена детальная карта транскрипции данного района. Значи-
тельную часть всех генов составляют дуплицированные гены. Как прави-
ло, гены расположены очень компактно, с минимальными межгенными
расстояниями. Организация экспрессии многих соседних генов характери-
зуется образованием тандемных и перекрывающихся транскриптов. По-
видимому, эухроматическая часть генома дрозофилы сильно неоднородна
по плотности генов и содержит протяженные районы с максимально
компактным расположением генов, подобные исследуемому нами району.
Обсуждается роль обнаруженных в исследуемом районе кластеров повто-
ров динуклеотидов GT и повторов сателлитной ДНК в регуляциии ак-
тивности генов района и компактизации хроматина.
Структура генома Drosophila melanogaster была определена в 2000 г.
(Adams et al., 2000). Для предсказания генов в геномном сиквенсе дрозофилы
были использованы компьютерные программы, а также данные по гомоло-
гии с сиквенироваными кДНК дрозофилы и известными доменами белков
(Adams et al., 2000). Было выявлено 13 600 генов дрозофилы. Примерно 3000
генов - имеют гомологиии с генами, найденными также у нематоды С. ele-
gans и дрожжей 5. cerevisiae. Значительное число предсказанных генов ока-
залось совершенно новыми, с неизвестными функциями. Возможно, кодиру-
емые такими генами белки участвуют в каких-то специфических для дрозо-
филы процессах. Однако, учитывая ошибки при компьютерном предсказа-
нии генов в геномной ДНК дрозофилы, необходимо выполнить большой
объем экспериментальной работы по проверке существования in vivo пред-
51
сказанных генов дрозофилы. Кроме того, остаются не охарактеризованны-
ми разнообразные регуляторные и структурные элементы генома, обеспе-
чивающие надежную работу генов и генома как целого.
Наш подход заключается в выявлении закономерностей и особенностей
функционирования генома на основе подробного исследования структурно-
функциональной организации небольшой, но репрезентативной части гено-
ма. Для такого исследования был выбран район 2DF Х-хромосомы (по цито-
логической карте политенных хромосом дрозофилы) длиной 200 т.п.н.. Дан-
ный район - один из наиболее подробно изученных генетическими метода-
ми участков генома (ссылки см/. Alatortsev, 1997а), а большинство генов рай-
она были детально охарактеризованы структурно и функционально молеку-
лярными методами. Район содержит несколько десятков генов и около деся-
ти структурных элементов хромосомы - хромомеров. Как часть Х-хромосо-
мы район подвергается дозовой компенсации - двукратному увеличению
активности генов Х-хромосомы у самцов, несущих одну Х-хромосому, по
сравнению с самками, имеющими две Х-хромосомы. Для изучаемого района
получены хромосомные перестройки, в которых гены района перенесены к
прицентромерному гетерохроматину, что позволяет изучать взаимодейст-
вия между эу- и гетерохроматином в геноме дрозофилы.
КОМПАКТНАЯ ОРГАНИЗАЦИЯ ТРАНСКРИПЦИИ
Сколько всего транскриптов (генов) присутствует в исследуемом протя-
женном районе генома? Есть ли какие-либо взаимодействия при транскрип-
ции соседних генов? Для ответов на эти и другие вопросы, связанные с орга-
низацией синтеза РНК в данном районе, предварительно были клонированы
в космидах фрагменты ДНК района 2DF и построена рестриктная карта
района (Алаторцев, 1987, 1988). В дальнейшем были охарактеризованы 10
генов данного района (Фролов, Алаторцев, 1993а, б; Frolov, Alatortsev, 1994;
Frolov, Zverlov, Alatortsev, 1994; Alatortsev et al., 1997; Алаторцев и др., 1998;
Алаторцев и др., 2000). Еще 12 генов района были исследованы в разное
время в других лабораториях, подробную информацию о генах района мож-
но найти в базе данных FlyBase. Полный геномный сиквенс данного района,
полученный Европейским консорциумом из 10 лабораторий (Benos et al.,
2000) и компанией Целера Геномике (Adams еу al., 2000), позволил предска-
зать еще ряд генов в данном районе. Однако предсказаны были только уча-
стки, кодирующие белки, сведения о полных транскриптах отсутствовали.
Кроме того, эти предсказания нуждались в экспериментальном подтвержде-
нии, так как сравнение двух аннотаций геномного сиквенса показало, что
для 40% предсказанных кодирующих последовательностей ДНК наблюда-
ются определенные различия, причем в 9% случаев предсказания не соот-
ветствовали друг другу (Benos et al., 2000).
Использование геномного сиквенса помогло нам построить подробную
транскриптную карту для изучаемого района. Для поиска новых РНК, соот-
ветствующих как предсказанным генам, так и, возможно, синтезируемых в
протяженных участках между известными ранее генами района, было скон-
струировано несколько десятков уникальных праймеров. Новые кДНК об-
наруживали с помощью полимеразной цепной реакции с использованием
суммарной кДНК дрозофилы, полученной с олиго-дТ-затравки, и синтези-
52
1. Тандемная транскрипция
Cyp4d2 Сур4е4 рп
cm 30В8.3 10330 30В8.6 2567
2. Ген в интроне
Mctl
11715
103В4.2
9145
3. Перекрывание 3-концов транскриптов
рп
Or2F
Nmd3
crn
4. Перекрывание 5-концов генов
К10 25Е8.3
kz 2567
Рис. 18. Примеры компактной организации экспрессии соседних генов в районе 2DF Х-хро-
мосомы дрозофилы
Стрелки показывают относительное расположение и направление транскрипции отдельных генов
рованных геном-специфических праймеров. Продукты амплификации,
представляющие собой новые кДНК из района 2EF, были клонированы и
сиквенированы. В результате в районе были картированы в общей сложно-
сти 40 транскриптов или генов (рис. 17). Были уточнены не только структу-
ры транскриптов, но и само существование некоторых предсказанных ге-
нов. Так, транскрипты предсказанного in silica на участке ДНК 180-182
т.п.н. гена EG:25E8.6 не были обнаружены, однако точно в месте располо-
жения данного предполагаемого гена несколькими независимыми экспери-
ментальными методами нами был обнаружен совершенно другой, новый ген
дрозофилы, названный Vml. Транскрипция гена Vml идет в сторону, проти-
воположную предсказанной, и он кодирует новый белок, имеющий сходст-
во с белками вителлиновой мембраны ооцита дрозофилы.
В среднем на один ген в исследуемом нами районе приходится 5 т.п.н..
Размеры транскрибируемых областей варьируют от 0,3 до 20 т.п.н.. Как пра-
вило, гены расположены вплотную, с минимальными межгенными расстоя-
ниями. Транскрипты могут располагаться тандемно, с перекрыванием
З'-концов или с перекрыванием 5'-концов (рис. 18). Более того, в районе
53
есть два гена, EG:103B4.2 и 11715, полностью расположенные в интронах
других генов. Обнаружение перекрывающихся районов транскрипции под-
нимает вопрос о функциональной взаиморегуляции обнаруженных генов.
Картирование транскриптов для протяженного района генома дрозофи-
лы, содержащего 40 генов, осуществлено впервые. Интересно, что плот-
ность транскриптов в исследованном ранее более коротком фрагменте ДНК
Х-хромосомы, содержащем 12 генов, такая же (Malezka et al., 1998). С другой
стороны, при исследовании структуры протяженного района комплекса ге-
нов Bithorax, регулирующих становление плана (сегментов) тела насекомо-
го, было показано, что значительную часть комплекса составляют межген-
ные участки ДНК (Levis et al., 1995), выполняющие до конца не выясненные
функции. Однако в геноме дрозофилы известно всего несколько районов,
организованных подобно комплексу генов Bithorax, и, скорее всего, боль-
шинство генов эухроматической части генома дрозофилы находится в рай-
онах с компактной организацией транскрипции, похожих на район 2DF
Х-хромосомы.
Хромомер - локально компактизованный участок хромосомы. В гигант-
ских политенных хромосомах дрозофилы индивидуальные хромомеры об-
разуют видимые в световой микроскоп поперечные хромосомные полосы
или диски. Существует ли взаимосвязь между расположением генов и стру-
ктурных элементов хромосомы - хромомеров? Согласно цитологической
карте политенных хромосом дрозофилы (Bridges, 1935), район 2DF содер-
жит десять дисков (хромомеров), и, следовательно, в одном диске содержит-
ся в среднем четыре гена. С помощью гибридизации клонированных фраг-
ментов ДНК in situ с политенными хромосомами нам удалось грубо карти-
ровать расположение ряда хромомеров на физической карте района (Ала-
торцев, 1987). Сопоставление границ генов и хромомеров указывает на от-
сутствие корреляции в их расположении. Вероятно, видимая хромомерная
организация нужна в основном для компактной упаковки генома в хромосо-
мы, а не для регуляции генной активности. Однако вопрос о точном карти-
ровании хромомеров на последовательности ДНК района остается откры-
тым. Одним из подходов к выявлению отдельных доменов хроматина может
быть анализ распределения особых структур в ДНК, которые могли бы оп-
ределять возможные границы хромомеров.
ДУПЛИКАЦИИ ГЕНОВ И ЭВОЛЮЦИЯ ГЕНОМА
В геномах многоклеточных эукариот присутствует значительное коли-
чество дуплицированных генов. Дупликации генов с их последующей дивер-
генцией исключительно важны для эволюции и функционирования геномов,
например, в качестве материала для появления генов с новой функцией
(Ohno, 1970). В районе 2Е Х-хромосомы дрозофилы выявлен новый ген
msta, активно экспрессирующийся в головах взрослых мух (Алаторцев и др.,
2000). Он содержит два экзона и кодирует полипептид с доменом, присутст-
вующим в ряде белков - модуляторов структуры хроматина и активности ге-
нов. Рядом с данным геном обнаружен ген msts, представляющий собой ди-
вергировавшую и не имеющую второго экзона копию гена msta. В настоя-
щее время ген msts, вероятно, является псевдогеном, однако нельзя исклю-
54
чить и того, что ген msts - это локус с новой, пока неясной функцией, воз-
никший в ходе эволюции копии гена msta. Средний уровень дивергенции ме-
жду генами msta и msts около 50%. Учитывая скорость замен нуклеотидов,
можно предположить, что локальная дупликация генов произошла около
20 млн лет назад, т.е. во время образования подрода D. melanogaster (Lachaise
et al., 1988). Какое-то время после образования дупликации работали оба ге-
на, так как дивергенция в кодирующей области меньше, чем дивергенция
в интроне. Учитывая скорости замен нуклеотидов в кодирующих и некоди-
рующих областях, можно предположить, что ген msts перестал функциони-
ровать еще до расхождения видов D. simulans и D. melanogaster, произошед-
шего около 2,5 млн лет назад (Lachaise et al., 1988).
Другой случай дупликации генов района - впервые описанный у дрозофи-
лы кластер из четырех генов цитохромов Р450 (Frolov, Alatortsev, 1994). Ци-
тохромы Р450 участвуют в процессах инактивации различных токсичных мо-
лекул. Интересно, что белок, кодируемый одним из генов кластера, судя по
его структуре, имеет отличную от остальных субстратную специфичность и
принадлежит к особому подсемейству цитохромов Р450. По-видимому, в дан-
ном случае произошли дублирование и последующее усовершенствование
функции гена. Два других дуплицированных гена в данном районе, гены poly-
homeotic, ph-d и ph-p, активны, и каждый способен компенсировать работу
другого (Boivin et aL, 1999). Таким образом, на исследуемом участке ДНК
имеются три локальных дупликации, в которых копии генов расположены
рядом (см. рис. 17), и восемь генов из имеющихся в этом районе 40 генов, т.е.
20% всех генов района, являются локально дуплицированными генами. При
исследовании другого протяженного участка генома дрозофилы, района гена
Adh, также было обнаружено, что не менее 17% всех генов являются дупли-
цированными генами (Ashbumer et al., 1999). Можно заключить, что локаль-
ные дупликации генов у дрозофилы - довольно частое событие.
Наряду с дупликациями целых генов в геноме дрозофилы присутствуют
и дупликации отдельных частей генов, кодирующих определенные белко-
вые домены. Можно предположить, что дупликации частей гена, представ-
ленные в других генах, могут повышать надежность выполнения функции,
определяемой данным геном. Интересным примером такого типа является
обнаруженный нами уникальный ген винкулина дрозофилы (Alatortsev et al.,
1997). В случае эу-гетерохроматической перестройки ген винкулина разры-
вается, однако особи, несущие такую хромосому, вполне жизнеспособны.
Следовательно, этот ген не является жизненно важным для дрозофилы, не-
смотря на то, что он кодирует эволюционно консервативный белок цитоске-
лета. Возможно, функции винкулина компенсируются другими белками,
имеющими отдельные белковые домены винкулина, в частности, белком
а-катенином (Alatortsev, 1997b).
ПОВТОРЫ ДНК Х-ХРОМОСОМЫ
И ДОЗОВАЯ КОМПЕНСАЦИЯ
Выравнивание количества мРНК и количества образующегося белка,
кодируемого генами Х-хромосомы у самцов, имеющих одну Х-хромосому,
и самок с двумя Х-хромосомами регулируется с помощью механизма дозо-
вой компенсации. У дрозофилы этот механизм поддерживается различными
55
Рис. 19. Повторы GT в области начала транскрипции гена вннкулина (Алаторцев и др., 1998)
Стрелка на геномной ДНК обозначает начало и направление транскрипции, треугольники - места рас-
положения повторов GT
генетическими элементами, структура которых неизвестна и которые рас-
положены как в премоторной и кодирующей областях (Qian, Pirrotta, 1995),
так и вне генов (Roseman et al., 1995). Интересно, что молекулярные меха-
низмы дозовой компенсации у человека и дрозофилы во многом сходны -
это распространение эффекта (инактивации Х-хромосомы у человека или
же дополнительной декомпактизации Х-хромосомы у дрозофилы) вдоль
хромосомы на большие расстояния с участием специальных некодирую-
щих РНК.
Микросателлитными ДНК или микросателлитами называют присутст-
вующие в эухроматине короткие тандемно повторяющиеся (от нескольких
раз до нескольких десятков раз) последовательности ДНК. Их роль в функ-
ционировании генома пока неясна. Ранее было показано, что Х-хромосома
дрозофилы в целом обогащена повторами GT (Pardue et aL, 1987), однако ха-
рактер их расположения относительно индивидуальных генов не был иссле-
дован. Мы обнаружили блоки тандемно повторенных динуклеотидов GT
сразу перед предполагаемым стартом транскрипции и в первом интроне ге-
на винкулина (Алаторцев и др., 1998) (рис. 19). На участке длиной 850 п.н. в
районе старта транскрипции присутствуют пять повторов GT длиной не
меньше 8 нуклеотидов. Такая концентрация повторов GT в начале гена не
является случайной. Повторы GT отсутствуют в основной части гена винку-
лина. Интересно, что все три других кластера повторов GT, выявляемые в
данном районе, также расположены в областях стартов транскрипции (гены
wapl, ph-d и ph-p). Известно, что ДНК, содержащая повторы GT, способна
образовывать Z-форму. Известно также, что с динуклеотидом GT способен
связываться архитектурный белок HMG-D (High Mobility Group protein of
Drosophila) (Churchill et al., 1995), который может изгибать ДНК в сайтах
связывания и вызывать плавление ДНК в близлежащих районах. В присут-
ствии этого белка хромосомы менее компактны (Ner et al., 1994). Такое из-
менение структуры ДНК в 5'-конце гена могло бы облегчать инициацию
транскрипции гена. Возможно, повторы GT вовлечены в процесс дозовой
компенсации, приводящий к дополнительной декомпактизации Х-хромосо-
мы у самцов дрозофилы.
Другими кандидатами на роль генетических элементов, участвующих в
явлении дозовой компенсации генов района 2DF, могут быть обнаруженные
между генами msta и msts тандемные повторы ДНК (Алаторцев и др., 1998)
56
(см. рис. 17), представляющие собой дивергировавшие, гомологичные на
58%, копии повторов сателлитной ДНК дрозофилы с плотностью 1,688 г/см3
(сатДНК 1,688), присутствующей только в Х-хромосоме. СатДНК 1,688 ло-
кализуется в прицентромерном гетерохроматине Х-хромосомы, образуя
протяженные массивы тандемных повторов (Hilliker, Appels, 1982). СатДНК
1,688 представляет собой главным образом повторы с длиной мономерной
единицы 359 пар нуклеотидов (Carlson, Brutlag, 1977). Наши данные свиде-
тельствуют, что основным видом нарушений в тандемной структуре
сатДНК 1.688 могут быть инсерции ретротранспозона Doc (Слободкин,
Алаторцев, 1992). Показано, что инсерции происходят в один и тот же сайт
последовательности ДНК мономера сатДНК 1,688. Обнаружен белок, спо-
собный связывать первые 117 нуклеотидов мономерной единицы сатДНК
1.688, оставляя свободным участок от 118 до 359 нуклеотидов (Hsieh, Brutlag,
1979), точно посередине которого находится место инсерции Doc - 237-238
нуклеотиды. Это обстоятельство может говорить о том, что Doc выбирает
для встраивания в мономере сатДНК 1,688 свободную от белка область.
Число копий повторов сатДНК 1,688 в районе 2Е различно в разных ли-
ниях дрозофилы. С помощью гибридизации in situ мы показали, что данные
повторы есть в районах ЗА, 6Е и 7А Х-хромосомы. Анализ геномного сик-
венса подтвердил, что кластеры из нескольких дивергировавших копий тан-
демных повторов сатДНК 1,688 действительно присутствуют в этих рай-
онах. Ранее были описаны еще несколько семейств последовательностей
ДНК, гомологичных сатДНК 1,688 и располагающихся в других местах эу-
хроматина Х-хромосомы (Waring, Pollac, 1987; DiBartolomeis et al., 1992). Они
присутствуют в эухроматине Х-хромосомы в виде кластеров из 2-4 копий,
гомологичных между собой на 85-98%. Все эти последовательности на
60-80% гомологичны последовательности мономера сатДНК 1.688. По все-
му эухроматину Х-хромосомы рассредоточено около 300 копий повторов
сатДНК 1,688, что составляет несколько процентов от количества сатДНК
1,688 в геноме. Можно предположить, что рассеянные по эухроматину
Х-хромосомы повторы сатДНК 1,688 представляют собой цис-действующие
элементы процесса дозовой компенсации, с которыми связаны дальнодейст-
вующие регуляторные функции, распространяющиеся на протяженный до-
мен Х-хромосомы. Известно, что сателлитная ДНК 1,688 содержит сайт свя-
зывания ДНК-топоизомеразы II (Kas, Laemmli, 1992). Расположенные в эу-
хроматине Х-хромосомы повторы сатДНК 1,688 могли бы связывать комп-
лексы ДНК-топоизомеразы II с другими ДНК-расплетающими белками и
участвовать в изменении компактизации хроматина в определенном районе.
ИНАКТИВАЦИЯ ГЕНОВ
ПРИ ПРИБЛИЖЕНИИ К ГЕТЕРОХРОМАТИНУ
У многоклеточных эукариот существуют специальные механизмы регу-
ляции активности больших групп генов: на определенных стадиях развития
в дифференцированных клетках могут быть полностью выключенными
большие группы генов, периодическое выключение большинства генов про-
исходит и в клеточном цикле - на стадии митоза, могут быть постоянно вы-
ключены гены одной из хромосом генома. Интересной моделью для изуче-
57
ния процессов инактивации генов в протяженных районах хромосом являет-
ся мозаичный эффект положения (МЭП). Так называется явление инакти-
вации генов, перенесенных к гетерохроматину, в части соматических клеток
(Henikoff, 1992). Важным свойством МЭП является распространение инакти-
вации генов от границы с гетерохроматином на значительные расстояния.
Молекулярные механизмы, лежащие в основе распространения инактива-
ции вдоль хромосомы, в настоящее время неясны. Сильный МЭП для генов
района 2DF был обнаружен в случае перицентрической инверсии Х-хромо-
сомы In(lLR)pn2a (Алаторцев и др., 1982; Толчков и др., 1984). Мозаичная
инактивация генов в этой перестройке распространяется далеко за пределы
исследуемого нами района. В хромосоме In(lLR)pn2a фрагмент ДНК, содер-
жащий гены от ели’ до Vine, перенесен к гетерохроматину Х-хромосомы
(рис. 20), а соединение эу- и гетерохроматина произошло по гену винкулина
и повторам сателлитной ДНК (AAGAG)n (Alatortsev et al., 1997; Tolchkov et
al., 1997). Были проведены количественные измерения уровней активности
для расположенных на разных расстояниях от границы с гетерохроматином
в инверсии генов Pgd (Алаторцев и др., 1982) и рп (Фролов, Алаторцев,
1993). Оказалось, что оба гена в инверсии инактивированы в среднем на
50%.
Данный результат указывает на то, что в пределах определенного рай-
она хромосомы степень инактивации разных генов может быть одинаковой.
Что же может представлять собой такой “домен инактивации”? Это могла
бы быть содержащая несколько генов петля хроматина, выходящая из осто-
ва хромосомы (Hart, Laemmli, 1998) в норме и остающаяся в компактном со-
стоянии в части клеток в случае МЭП. Дальнейший анализ распространения
МЭП на данной молекулярно-генетической модели поможет охарактеризо-
вать возможные дальнодействующие регуляторные элементы в изучаемом
районе генома дрозофилы.
ЗАКЛЮЧЕНИЕ
Корень термина “геном” отсылает нас только к генам, и геном какого-
либо организма обычно рассматривается как полная последовательность
нуклеотидов его ДНК, в которой записана информация обо всех генах. Дей-
ствительно, геномы бактерий и дрожжей состоят преимущественно из коди-
рующих гены областей. Однако у многоклеточных эукариот гены составля-
ют только малую часть генома. Мы еще далеки от детального знания о не-
генных элементах генома, определяющих функции гетерохроматина, тело-
меры, центромеры, участвующих в процессах компактизации хромосомы,
транскрипции, репликации, митоза, мейоза, репарации. В настоящее время
наиболее важными задачами являются поиск и характеристика элементов
генома, определяющих правильную временную и пространственную экс-
прессию генов, детальная идентификация энхансеров, сайленсеров, инсуля-
торов и других регуляторных элементов, а также анализ нуклеосомного
и/или хроматинового кода, выявление мест связывания различных белко-
вых факторов с ДНК и хроматином. В дальнейшем мы узнаем больше о та-
ких элементах генома, как, например, гены, кодирующие РНК, которые не
кодируют белков, участки начала репликации ДНК и генетические элемен-
58
ты, контролирующие структуру хромосом. Однако уже сейчас ясно, что в ге-
номной ДНК многоклеточных эукариот и, в частности, дрозофилы в
очень плотном виде записан исключительно большой объем информации.
Читать ее можно научиться на основе экспериментального выявления и де-
тального анализа перечисленных выше элементов генома для типичных
районов генома, таких, например, как район 2DF Х-хромосомы дрозофилы.
Работа поддержана грантами РФФИ 00-04-48905 и 03-04-48656.
ЛИТЕРАТУРА
Алаторцев В.Е. Молекудярно-генетический анализ эффекта положения мозаичного
типа у Drosophila melanogaster. Дис. ... канд. биол. наук, М., 1987, 120 с.
Алаторцев В.Е. Инверсия Х-хромосомы Drosophila melanogaster, сопровождающаяся
эффектом положения мозаичного типа: анализ с помощью клонированных фраг-
ментов ДНК Ц Генетика. 1988. Т. 24. С. 23-33.
Алаторцев В.Е., Коваленко ТА., Калмыкова А.И. Локальная дупликация генов с инсер-
цией сложного микросателлита // Молекуляр. биология. 2000. Т. 34. С. 300-303.
Алаторцев В.Е., Крамерова И.А., Коржева ELB. Простые и сложные микросателлит-
ные ДНК в районе гена винкулина дрозофилы //Там же. 1998. Т. 32. С. 981-986.
Алаторцев В.Е., Толчков Е.В., Слободянюк С.Я., Гвоздев К.А. Клеточный мозаицизм и
исчезновение антигена при эффекте положения гена Pgd у Drosophila melanogaster И
Генетика. 1982. Т. 18. С. 13—23.
Слободкин И.В., Алаторцев В.Е. Инсерции мобильного элемента Doc в сателлитную
ДНК дрозофилы Ц Там же. 1992. Т. 28. С. 169-173.
Толчков Е.В., Балакирева М.Д., Алаторцев В.Е. Инактивация района Х-хромосомы
Drosophila melanogaster с известной тонкой генетической структурой в результате
эффекта положения // Там же. 1984. Т. 20. С. 1846-1856.
Фролов М.В., Алаторцев В.Е. Район локуса prune у Drosophila melanogaster является
транскрипционно насыщенным //Там же. 1993а. Т. 29. С. 1460-1467.
Фролов М.В., Алаторцев В.Е. Транскрипция гена prune при эффекте положения моза-
ичного типа у Drosophila melanogaster // Там же. 19936. Т. 29.С. 1573-1577.
Adams M.D., Celniker S.E., Holt R.A. et al. The genome sequence of Drosophila melanogaster //
Science. 2000. Vol. 287. P. 2185-2195.
Alatortsev V.E. Genetic loci in the Pgd-KIO region of the Drosophila X chromosome // Dros.
Inform. Serv. 1997a. Vol. 80. P. 34.
Alatortsev V.E. An indication on overlapping functions of the Vinculin and a-catenin loci in
Drosophila melanogaster I I Ibid. 1997b. Vol. 80. P. 37-38.
Alatortsev V.E., Kramerova I.A., Frolov M.V. et al. Vinculin gene is non-essential in Drosophila
melanogaster 11 FEBS Lett. 1997. Vol. 413 P. 197-201.
Ashburner M., Misra S., Roote J. et al. An exploration of the sequence of a 2.9-Mb region of the
genome of Drosophila melanogaster: the Adh region // Genetics. 1999. Vol. 153. P. 179-219.
Benos P.V., Gatt M.K., Ashburner M. et al. From sequence to chromosome: the tip of the X chro-
mosome of D. melanogaster /I Science. 2000. Vol. 287. P. 2220-2222.
Boivin A., Fauvarque M.O., Dura J.M. One-to-one correspondence between the two genetic units
and the tandemly duplicated transcriptional units of the polyhomeotic locus of Drosophila //
Mol. and Gen. Genet. 1999. Vol. 261. P. 196-200.
Bridges C.B. Salivary chromosome maps with a key to the banding of the chromosomes of
Drosophila melanogaster // J. Hered. 1935. Vol. 26. P. 60-64.
Carlson M., Brutlag D. Cloning and characterization of a complex satellite DNA from Drosophila
melanogaster H Cell. 1977. Vol. 11. P. 371—381.
Churchill M.E., Jones D.N., Glaser T. et al. HMG-D is an architecture-specific protein that pref-
erentially binds to DNA containing the dinucleotide TG // EMBO J. 1995. Vol. 14.
P. 1264-1275.
59
Di Bartolomeis S.M., Tartof K.D., Jackson F.R. A superfamily of Drosophila satellite related (SR)
DNA repeats restricted to the X chromosome euchromatin // Nucl. Acids Res. 1992. Vol. 20.
P. 1113-1116.
Frolov M.V., Alatortsev V.E. Cluster of cytochrome P450 genes on the X chromosome of Dro-
sophila melanogaster // DNA and Cell Biol. 1994. Vol. 13. P. 663—668.
Frolov M.V., Zverlov V.V., Alatortsev V.E. The mRNA product of the Drosophila gene prune is
spliced and encodes a protein containing a putative transmembrane domain // Mol. Gen.
Genet. 1994. Vol. 242. P. 478^183.
Hart C.M., Laemmli U.K. Facilitation of chromatin dynamics by SARs // Curr. Opin. Genet, and
Develop. 1998. Vol. 8. P. 519-525.
HenikoffS. Position effect and related phenomena // Ibid. 1992. Vol. 2. P. 907-912.
Hilliker A J., Appels R. Pleiotropic effects associated with the deletion of heterochromatin sur-
rounding rDNA on the X chromosome of Drosophila // Chromosoma. 1982. Vol. 86.
P. 469^190.
Hsieh T., Brutlag D.L. A protein that preferentially binds Drosophila satellite DNA // Proc. Nat.
Acad. Sci. USA. 1979. Vol. 76. P. 726-730.
Kas E., Laemmli U.K. In vivo topoisomerase II cleavage of the Drosophila histone and satellite III
repeats: DNA sequence and structural characteristics // EMBO J. 1992. Vol. 11. P. 705-716.
Lachaise D., Cariou M.-L., David J.R. et al. Historical biogeography of the Drosophila melano-
gaster species subgroup // Evol. Biol. 1988. Vol. 22. P. 159-225.
Lewis E.B., Knafels J.D., Mathog D.R., Celniker S.E. Sequence analysis of the cis-regulatory
regions of the bithorax complex of Drosophila // Proc. Nat. Acad. Sci. USA. 1995. Vol. 92.
P. 8403-8407.
Maleszka R., de Couet H.G., Miklos G.G. Data transferability from model organisms to human
beings: insights from the functional genomics of the flightless region of Drosophila // Ibid.
1998. Vol. 95. P. 3731-3736.
Ner S.S., Travers A.A. HMG-D, the Drosophila melanogaster homologue of HMG 1 protein, is
associated with early embryonic chromatin in the absence of histone Hl // EMBO J. 1994.
Vol. 13. P. 1817-1822.
Ohno S. Evolution by gene duplication. Berlin etc.: Springer, 1970.
Pardue M.L., Lowenhaupt K.. Rich A., Nordheim A. (dC-dA)n. (dG-dT)n sequences have evolu-
tionarily conserved chromosomal locations in Drosophila with implications for roles in chro-
mosome structure and function //EMBO J. 1987. Vol. 6. P. 1781-1789.
Qian S., Pirrotta V. Dosage compensation of the Drosophila white gene requires both the X chro-
mosome environment and multiple intragenic elements // Genetics. 1995. Vol. 139.
P. 733-744.
Roseman R.R., Swan J.M., Geyer P.K. A Drosophila insulator protein facilitates dosage compen-
sation of the X chromosome min-white gene located at autosomal insertion sites // Deve-
lopment. 1995. Vol. 121. P. 3573-3582.
Tolchkov E.V., Kramerova LA., Lavrov S.A. et al. Position effect variegation in Drosophila
melanogaster X chromosome inversion with a breakpoint in satellite block and its suppres-
sion in a secondary rearrangement // Chromosoma. 1997. Vol. 106. P. 520-525.
Waring G.L., Pollac J.C. Cloning and characterization of a dispersed, multicopy, X chromosome
sequence in Drosophila melanogaster // Proc. Nat. Acad. Sci. USA. 1987. Vol. 84.
P. 2843-2847.
НАСЛЕДСТВЕННЫЕ СТРУКТУРЫ ДРОЖЖЕЙ И ГЕНЫ,
ОПРЕДЕЛЯЮЩИЕ ИХ МИТОТИЧЕСКУЮ СТАБИЛЬНОСТЬ
И.П. Арман, А.Б. Девин
Лаборатория молекулярной генетики дрожжей
Отдела молекулярной генетики клетки
Рассмотрены литературные и собственные данные, относящиеся к
конструированию и анализу рекомбинантных наследственных структур,
способных поддерживаться в клетках дрожжей Saccharomyces cerevisiae.
в том числе структур, содержащих последовательности ДНК высших эу-
кариот (YAC). Представлены также результаты, характеризующие кон-
троль генетической стабильности у дрожжей и участие в этом контро-
ле генов SRM, которые опосредуют координированное поддержание ядер-
ных и митохондриальных генетических структур.
СПИСОК СОКРАЩЕНИЙ
рДНК — гены рибосомных РНК.
ACS - консенсус ARS последовательности (11 п.н.).
Alu — один из типов некодирующих последовательностей, часто повторяющихся
в геноме человека.
ARS — последовательность ДНК хромосомы, обеспечивающая автономную реп-
ликацию плазмид в дрожжах.
CEN - центромерная нуклеотидная последовательность.
DUE - элемент ДНК спирали, раскручиваемый пререпликативным комплексом
FISH - флуоресцентная ДНК-гибридизация in situ.
ORC — репликативный комплекс.
ORI - область начала репликации.
PCR - полимеразная цепная реакция.
PFGE — гель-электрофорез в пульсирующем поле.
STS - маркерный сайт с известной нуклеотидной последовательностью ДНК.
TEL — теломера конец эукариотической хромосомы.
Yip - рекомбинантный вектор с геном дрожжей в качестве маркера.
YRp - рекомбинантный вектор с ARS и геном дрожжей.
YRCp - рекомбинантный вектор с ARS, центромерой CEN и геном дрожжей, коль-
цевая минихромосома.
YAC — искусственная хромосома дрожжей.
СЛОВАРЬ ТЕРМИНОВ
Аллель - вариант гена, может отличаться нуклеотидной последовательностью.
Амплификация - увеличение числа копий генов, плазмид, фрагментов ДНК.
Аск - орган полового спороношения грибов-аскомицетов, в которые образуются аскос-
поры.
Библиотека или клонотека - полный набор генов данного организма в составе рекомби-
нантных ДНК.
Вакцина - препарат, содержащий антигенные детерминанты инфекционного агента,
способный вызывать образование иммунитета к данной инфекции.
Вектор — молекула ДНК, в состав которой включают чужеродную ДНК для введения ге-
нетической информации в клетку.
61
Гаплоидная клетка — клетка с одинарным набором хромосом. Вегетативная гаплоидная
клетка
Ген - фрагмент ДНК или РНК, кодирующий структуру полипептида или РНК.
Ген-репортер - ген, продукт которого используется в генно-инженерных конструкциях
для маркирования целевого продукта.
Геном - совокупность генетической информации данного организма.
Генотип - наследуемые свойства организма.
К-полимераза - фермент матричного синтеза ДНК.
Зигота — диплоидная клетка, полученная при слиянии гамет.
Интрон - некодирующий участок гена, который транскрибируется, но удаляется при
сплайсинге.
кДНК - однонитевая ДНК, синтезированная по РНК-матрице обратной транскриптазой.
Контиг - перекрывающиеся по последовательности ДНК клоны, происходящие из од-
ной протяженной области генома.
Лигаза - фермент, образующий фосфодиэфирную связь между двумя полинуклеотида-
ми.
Локус — участок ДНК хромосомы с определенной генетической детерминантой.
Маркерный ген — ген в составе рекомбинантной ДНК, кодирующий селективный при-
знак
Мейоз - деление клеточного ядра, предшествующее образованию половых клеток.
Митоз - основной способ деления эукариотических клеток, обеспечивает строго равно-
мерное распределение дочерних хромосом в дочерние клетки.
Обратная транскриптаза - фермент, осуществляющий синтез ДНК по РНК-матрице.
Плазмида - автономно реплицирующаяся в клетке кольцевая или линейная молекула
ДНК.
Промотор - регуляторный участок гена, куда присоединяется РНК-полимераза для на-
чала транскрипции.
Рекомбинация гомологичная - обмен генетическим материалом между двумя гомоло-
гичными последовательностями ДНК.
Репликация - процесс удвоения молекул ДНК.
Репликатор - область ДНК, ответственная за инициацию репликации.
Сплайсинг - процесс формирования зрелой мРНК путем удаления интронов у РНК.
Транскрипция - синтез РНК на ДНК-матрице
Трансформация - перенос генетической информации посредством изолированной ДНК.
Центромера - область хромосомы, физически необходимая для распределения гомоло-
гичных хромосом в дочерние клетки.
Экзон - часть гена, которая сохраняется после удаления интронов в результате сплай-
синга.
Энхансер - регуляторный участок ДНК, усиливающий репликацию или транскрипцию.
Эукариоты - организмы, клетки которых содержат ядра.
ВВЕДЕНИЕ
Знание структуры материальных носителей наследственности и меха-
низмов, обеспечивающих их точное воспроизведение и надежную передачу
при размножении эукариотических клеток, необходимо для понимания клю-
чевых аспектов существования и эволюции живых систем. Исследования
данных механизмов важны также с практической точки зрения, в частности
для медицины и при оптимизации свойств линий клеток для биотехнологи-
ческих целей
Высокая точность передачи хромосом в митозе и мейозе необходима для
нормального развития организма и для наследования различных признаков.
Нарушения правильности передачи хромосом дочерним клеткам приводят.
62
в частности, к таким катастрофическим последствиям как анеуплоидии, т.е.
к отклонениям от нормального числа хромосом. У человека анеуплодия воз-
никает в 7% зигот и обнаруживается в 45% случаев спонтанных абортов.
(Jacobs, Hassold, 1995). Многие хорошо известные врожденные аномалии
(например, синдромы Дауна, Клайнфельтера, Шерешевского-Тернера) так-
же вызваны анеуплодией. Почти всегда в процессе развития опухолей так-
же возникают дефекты хромосом: документированы свыше 84 000 кариоти-
пических аномалий, ассоциированных с неопластическими изменениями у
человека (Mitelman, 1994). Несмотря на очевидную значимость анеуплоидии,
мы только еще начинаем понимать причины аберрантной трансмиссии хро-
мосом; для углубления понимания этих причин необходимы дальнейшие ис-
следования.
В качестве объекта для экспериментального изучения механизмов гене-
тической стабильности рядом существенных достоинств обладают дрожжи
сахаромицеты. Несколько видов дрожжей, образующие род Saccharomyces,
одомашнены, как считается, более 8 тыс. лет назад, используются в хлебо-
печении, виноделии, пивоварении и пр. и служат по этой причине объекта-
ми непрекращающейся селекционной работы. Среди них наиболее изучен
генетически вид Saccharomyces cerevisiae (рис. 21), предоставляющий иссле-
дователю широкие возможности применения классических генетических
подходов в сочетании с постоянно развивающимися и совершенствующи-
мися методиками молекулярной генетики. Начало генетике S. cerevisiae бы-
ло положено в середине 30-х годов прошлого века. С тех пор эта область ис-
следований интенсивно развивается; в настоящее время над проблемами ге-
нетики дрожжей активно работают тысячи исследователей во многих стра-
нах мира. Популярность дрожжей как объекта генетических исследований
во многом обусловлена реальной возможностью изучать фундаментальные
проблемы генетики эукариотических клеток с помощью высокоэффектив-
ных методов генетики микроорганизмов. Преимуществами S. cerevisiae как
объекта генетических исследований являются: а) одноядерность клеток, по-
зволяющая сравнительно легко получать генетически маркированные ли-
нии клеток; б) простота жизненного цикла (рис. 22) и неприхотливость в от-
ношении питательных сред; в) особенности полового процесса, позволив-
шие легко и быстро осуществлять классический генетический (тетрадный)
анализ (уже к началу 80-х годов были картированы сотни генов S. cerevisi-
ae), а также исследовать закономерности генетической рекомбинации на
стадии четырех хроматид; г) характерные уникальные особенности органи-
зации и функционирования митохондриального генома; д) способность кле-
ток приобретать извне разнообразные рекомбинантные генетические стру-
ктуры, поддерживать их в относительно неизменном виде в автономном со-
стоянии (эта способность делает Saccharomyces едва ли не единственным
счастливым исключением среди многих родов дрожжей) и обеспечивать
экспрессию содержащейся в них генетической информации.
Инструментом, без которого практически невозможно обойтись при по-
иске и изучении цис- и транс-активных факторов, участвующих в воспроиз-
ведении и распределении компонентов наследственного аппарата клеток,
служит анализ митотической стабильности (надежности митотической пе-
редачи) различных наследственных структур и ее вариаций, обусловленных
генетически. Изучению митотической стабильности наследственных струк-
63
тур дрожжей положили начало на рубеже 40-х и 50-х годов прошлого века
работы Эфрусси и его сотрудников по генетике цитоплазматического фак-
тора rho, идентифицированного благодаря характерной для него низкой ми-
тотической стабильности и оказавшегося при дальнейшем изучении тожде-
ственным геному митохондрий. За истекшие полвека накоплен огромный
экспериментальный материал, относящийся к высокой изменчивости, харак-
терной для митохондриального генома дрожжей (см., например, обзор:
Contamine, Picard, 2000), и к генетическим механизмам, обеспечивающим вы-
сокую митотическую стабильность дрожжевых хромосом.
В последней трети XX в. дрожжи-сахаромицеты оказались самым пер-
спективным объектом исследований организации и функции эукариотиче-
ского генома и его наследственных структур методами молекулярной био-
логии и генетики (Botstein, Fink, 1988). Геном дрожжей (16 хромосом, 12 млн
п.о., 6000 генов) явился первым эукариотическим геномом, последователь-
ность которого была полностью определена (Goffeau et al., 1996). Дрожжи
Saccharomyces cerevisiae были первым организмом, у которого технология
рекомбинантных ДНК дала возможность изолировать и изучить структуру
основных элементов эукариотической хромосомы: область начала реплика-
ции ДНК (оп), центромеру (CEN), которая обеспечивает равное распределе-
ние хромосом при делении клетки, и концы хромосом - теломеры (TEL),
функция которых - сохранение целостности хромосом и завершение репли-
кации (Данилевская, Арман, 1989; Захаров, 1989). Благодаря этому появи-
лась возможность включать структурные элементы хромосомы поодиночке
или в разных сочетаниях в генно-инженерные конструкции. Был создан на-
бор эффективных челночных векторов дрожжей для исследования фунда-
ментальных проблем и решения задач биотехнологии. Самым замечатель-
ным достижением молекулярной генетики стало создание искусственной
хромосомы дрожжей (YAC) (Burke et al., 1987). Развитие техники клонирова-
ния в YAC в качестве вектора явилось важнейшим этапом для изучения
сложных геномов, построения физических карт хромосом и идентификации
генов.
Структура YAC и схема клонирования представлены на рис. 23. Первые
YAC-векторы содержат в кольцевой структуре все необходимые элементы
хромосом: область начала репликации (ARS), центромеру (CEN), селектив-
ные маркеры по обе стороны от центромеры (TRP1 и URA3) и две теломер-
ные последовательности (TEL). Уникальные сайты для клонирования гете-
рологичной ДНК расположены в гене SUP4, разрыв последовательности
которого приводит к изменению фенотипа дрожжей. Эти фенотипичес-
кие изменения свидетельствуют о наличии вставки гетерологичной ДНК
в YAC.
Клонирование ДНК в YAC стало доминирующим подходом для констру-
ирования библиотек геномов эукариот. В рамках международной програм-
мы “Геном человека” зарубежными исследователями в начале 90-х годов
было создано несколько библиотек тотальной ДНК генома (Anand et al.,
1990; Albertsen et al., 1990; Bellanne-Chantelot et aL, 1992) и хромосом-специ-
фичные клонотеки ДНК человека (Sleister et al., 1992; Green et al., 1994; Qin
et al., 1993; McCormick et al., 1989).
К числу основных преимуществ YAC в качестве вектора относятся:
большая емкость (размеры YAC могут достигать размеров природных хро-
64
EcoRI
Геномная ДНК
CEN
ARS
TRP1
Amp
on
SUP 4-0
pYAC4
TEL
HIS3
URA3
TEL
Bamll
BamH
Частичная рестрикция EcoRI
с фракционированием
фрагментов ДНК
Рестрикция Ecorl/BamHI с
дефосфорилированием
фрагментов
EcoRI EcoRI
TEL
EcoRI
|mi ii I !
TEL TRPl : ARS : CEN
вставка
URA3 TEL
YAC (0,1-2 млн n.H.)
Puc. 23. Схема конструирования YAC in vitro
3. Проблемы и перспективы...
мосом дрожжей), позволяющая клонировать целиком протяженные гены
высших эукариот; возможность манипулировать структурой YAC на основе
использования рекомбинационной системы дрожжей (сайт-специфической
мутагенез, делетирование, изменение ориентации вставки относительно ве-
ктора и т.п..); способность обеспечить клонирование ряда важных последо-
вательностей, не поддающихся клонированию в прокариотических векто-
рах, и др.
Разработаны методы получения трансгенных животных, использующие,
в частности, введение YAC в эмбриональные стволовые клетки (Peterson et
al., 1997). Основной недостаток YAC - относительно часто встречающаяся
неаутентичность вставок и природных последовательностей генома - “химе-
ризм”. Эти расхождения возникают как вследствие манипуляций in vitro при
конструировании YAC, так и в результате воздействия на YAC рекомбина-
ционной системы хозяйских дрожжевых клеток. К настоящему времени раз-
работаны методы, позволяющие в значительной степени преодолевать ука-
занный недостаток. Более подробно применение YAC, их преимущества и
недостатки рассмотрены в основном тексте обзора.
В наших исследованиях, результаты которых рассматриваются в насто-
ящем обзоре, можно выделить следующие два направления.
1. Создание и структурно-функциональный анализ искусственных хро-
мосом дрожжей (YAC) - рекомбинантных наследственных структур, способ-
ных поддерживаться в дрожжевых клетках и содержащих генетический ма-
териал высших эукариот. Успешность создания таких структур зависит от
знания механизмов генетической стабильности дрожжевых клеток.
2. Изучение генов, опосредующих координированное поддержание ядер-
ных и митохондриальных наследственных структур дрожжевой клетки. Это
направление как раз и имеет своей целью прежде всего выяснение механиз-
мов генетической стабильности S. cerevisiae.
1. НАСЛЕДСТВЕННЫЕ СТРУКТУРЫ ДРОЖЖЕЙ,
КОНСТРУИРОВАНИЕ И АНАЛИЗ ИСКУССТВЕННЫХ ХРОМОСОМ
ДРОЖЖЕЙ (YAC), СОДЕРЖАЩИХ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК
ВЫСШИХ ЭУКАРИОТ
1.1. ОСНОВНЫЕ СТРУКТУРНЫЕ ЭЛЕМЕНТЫ ХРОМОСОМЫ
1.1.1. ОБЛАСТИ НАЧАЛА РЕПЛИКАЦИИ (or/)
И ПОСЛЕДОВАТЕЛЬНОСТИ ARS ДРОЖЖЕЙ
Хромосома эукариот содержит множество дискретных участков - обла-
сти начала репликации (ori), где в поздней М и G1 фазе клеточного цикла со-
бирается пререпликативный комплекс и формируется двунаправленная ре-
пликационная вилка, которая активируется в S-фазе. Нуклеотидные после-
довательности ori репликации у дрожжей S. cerevisiae идентичны репликато-
рам - автономно реплицирующимся последовательностям (ARS), которые
определяются по их способности к автономной репликации в составе экст-
рахромосомных плазмид (рис. 24).
Размер ARS у дрожжей колеблется от 100 до 150 нуклеотидов. Цент-
ральный элемент (домен А) содержит консенсус из 11 нуклеотидов (ACS -
66
autonomous consensus sequence), ассоциированный с двумя или тремя корот-
кими мотивами (Bl, В2, ВЗ), которые могут различаться последовательно-
стями, но консервативны функционально. Это усилители репликации -
энхансеры, которые не обладают собственной активностью, но необходи-
мы для функции ACS. 3'-область ARS содержит элемент DUE (double
unwinding element), богата AT и обладает низкой термодинамической ста-
бильностью.
Последовательность ACS служит сайтом посадки комплекса ORC (origin
recognition complex), состоящего из шести белков. За посадкой ORC следует
формирование преинициирующего комплекса, в котором участвуют белок
Cdc6 и шесть белков Mem. Протеинкиназа Cdc7/Dbf4 активирует преиници-
ирующий комплекс, после чего инициируется репликация ДНК, и комплекс
белков Mem следует за вилкой репликации, а комплекс ORC остается свя-
занным с оп-элементом (Тоуп et al.,1995).
Сравнение нескольких репликаторов показало, что их структура высоко
консервативна в области связывания с белками комплекса ORC, но варьиру-
ет в 3' направлении от сайта узнавания ORC и в областях, прилегающих к
ACS (Newlon, Theis, 1993; Gilbert, 1998).
Некоторые из клонированных ARS уникальны (например ARS1,
ARS14), другие повторены в геноме 3—15 раз (например ARS120, ARS131).
Около 100 копий ARS последовательности находится в составе кластера рРНК
генов на хромосоме XII дрожжей. Полирепликонная структура хромосом
предполагает наличие в клетке механизма, запрещающего повторную ини-
циацию репликации хромосом в пределах одного S периода. В составе экст-
рахромосомных плазмид активность ARS-элементов также находится под
строгим контролем: если два идентичных ARS-элемента расположены ря-
дом, то только один из них активен. Фактором активации является иниции-
рующий комплекс белков ORC, который взаимодействует с сайтом связыва-
ния, а выбор ARS зависит, по-видимому, от контекста фланкирующих пос-
ледовательностей (Diffley, 1996; Newlon, 1997).
1.1.2. ЦЕНТРОМЕРА
Центромера является элементом хромосомы, присоединение нитей ве-
ретена к которому обеспечивает движение гомологичных хромосом к про-
тивоположным полюсам клетки в митозе и мейозе (Allshire, 1997). У боль-
шинства организмов хромосома имеет одну центромеру (рис. 24). Впервые
центромеры эукариотических хромосом были изолированы у дрожжей,
что позволило изучить их структуру и функцию (Clarke, Carbon, 1980). CEN
элемент обусловливает стабильное наследование в митозе и мейозе хромо-
сом и рекомбинантных плазмид. Копии бесцентромерных ARS-плазмид не-
стабильны в гаплоидной клетке дрожжей, поскольку нерегулярно сегреги-
руют в митозе (Murrey, Szostak, 1983а). Включение CEN ДНК в конструк-
цию репликативной ARS-плазмиды резко увеличивает ее стабильность и
снижает число копий до 1-2 (Clarke, Carbon, 1985). Центромера определяет
число копий плазмидной ДНК, по всей вероятности, за счет контроля не
только сегрегации, но и числа раундов репликации (Tschumper, Carbon,
1983).
з*
67
Контроль стабильности и копийности оказался важнейшим свойством
центромеры дрожжей, на котором основан общий принцип клонирования
дрожжевых центромер по признаку стабилизации ARS плазмид.
Анализ нуклеотидной последовательности клонированных центромер
дрожжей выявил сходный тип их организации. “Кор” центромеры, размером
220 т.п.н., резистентен к нуклеазам и состоит из трех элементов. Элемент
CDEI (8 п.н.) гомологичен во всех центромерах, a CDEII - (центральная
часть) не консервативен, но обладает общими с другими CEN признаками:
АТ богатые (более 90%) сайты равной длины (78-86 п.н.), где А и Т череду-
ются с периодичностью 6-7 оснований. Элемент CDEIII (26 п.н.) представля-
ет консервативный сегмент с двухсторонней симметрией. Мутационный ана-
лиз выявил первичную структуру, необходимую для функции центромеры.
(Clarke, Carbon, 1985; Fitzgerald-Hayes, 1987).
Выделены белки, которые связываются с CEN и образуют комплекс -
примитивный кинетохор, т.е. место прикрепления нитей веретена. Присое-
динение к CEN тубулинов микротрубочек происходит за счет взаимодейст-
вия с центромерными белками. Важную роль в организации уникальной
структуры центромеры играют гистоновые белки. Репрессия гистонов Н2В
или Н4 делает клетки неспособными к сегрегации хромосом, повышает чув-
ствительность “кора” к нуклеазам, меняет сайты атаки нуклеаз в ДНК,
фланкирующей CEN. Это свидетельствует о том, что гистоновые белки во-
влечены в сборку хроматиновой структуры центромеры, отличающейся от
нуклеосомной организации. Показана связь репликации ДНК с функцией
центромеры и возможность ее транскрипционной инактивации (Hegeman,
Fleig, 1993; Clarke, 1998).
Центромеры разных хромосом дрожжей функционально взаимозаменя-
емы, несмотря на определенные различия их первичной структуры. Сниже-
ние активности центромеры в результате сайт-специфического мутагенеза
или делетирования одинаково проявляются в нарушении митоза и мейоза
ARS плазмид, искусственных (YAC) и природных хромосом (Clarke, 1998).
Митотическая стабильность рекомбинантных структур с центромерой (типа
YRCp и YAC) на два порядка ниже стабильности природных хромосом.
1.1.3. ТЕЛОМЕРА ДРОЖЖЕЙ
Теломера - конец линейной хромосомы эукариот — является третьим
структурно-функциональным элементом, который обеспечивает стабиль-
ность поддержания хромосом и их способность к трансмиссии в виде цело-
стных единиц генетической информации (рис. 24). Теломера выполняет
ряд важнейших функций, главные из которых - стабилизация хромосом за
счет предотвращения слияния их концов и деградации ядерными нуклеаза-
ми, завершение репликации концов и фиксация их положения в ядре, а так-
же регуляция экспрессии генов, локализованных вблизи теломер (De
Lange, 1998; Cooper, 2000). Показана связь между теломерой, ДНК-полиме-
разами, белками репарации ДНК и компонентами центросом. Это свиде-
тельствует о многозначности функции теломеры в поддержании хромосом
и в регуляции движения хромосом в митозе и мейозе (De Lange, 1998;
Cooper, 2000).
68
Наиболее детально организация суб- и теломерных последовательно-
стей изучена у дрожжей. Концы хромосом дрожжей состоят из блоков
C\_3A, тандемно повторенных 20-60 раз. Большая часть блока теломерных
повторов имеет структуру двунитевой ДНК и лишь его небольшая часть об-
разует выступающий однонитевой 3'-конец. У дрожжей к теломерной пос-
ледовательности повторов С13А примыкают субтеломерные последова-
тельности: 3-4 тандемных повтора Y-элемента длиной 6,7 т.п.о. и Х-после-
довательность, сильно варьирующая по длине от 0,3 до 3 т.п.н. Y- и Х-обла-
сти содержат ARS последовательность (Zakian, 1995). Теломеры разных хро-
мосом идентичны по структуре, но различаются по длине. Число копий те-
ломерных повторов различно в разных штаммах дрожжей и может менять-
ся во время жизненного цикла клетки (Szostak, Blackbum, 1982; Blackbum,
1984).
Тандемные повторы теломеры синтезируются при участии теломераз -
рибонуклеопротеиновых ферментов (Greider, Blackburn, 1985). Теломе-
раза является РНК-зависимой ДНК-полимеразой, т.е. обратной транскрип-
тазой. Уникальная особенность этого фермента состоит в том, что РНК в
его составе служит матрицей для синтеза теломерной ДНК. У дрожжей раз-
мер РНК-компонента теломеразы может доходить до 1 т.п.н., однако мат-
ричный участок РНК, который комплементарен теломерному повтору,
представлен единственной копией, длина которой не превышает размера
двух повторов. В зависимости от теломеразной активности длина теломеры
может увеличиваться, а при ингибировании или репрессии фермента - уко-
рачиваться (Bryan, Cech, 1999; Price, 1999). Установлена и широко обсужда-
ется связь между активностью теломеразы, канцерогенезом, старением кле-
ток и организма (Богданов, 1998; Reddel 1998).
Известны белки, которые взаимодействуют с одно- и двухцепочечной
ДНК теломеры. Дефекты в экспрессии этих белков тоже могут приводить к
удлинению или укорачиванию теломеры, к потере одноцепочечных повто-
ров, слиянию концов хромосом и апоптозу (De Lange, 1998; Smorgorzewska et
al., 2000). Один из таких белков - белок дрожжей RAP1, сайт связывания ко-
торого - основа формирования репрессивного хроматина, а длина теломеры
обусловлена счетным механизмом, который запускает RAP1 (Morse, 2000).
1.1.4. АВТОНОМНЫЕ ВЕКТОРЫ В БИОТЕХНОЛОГИИ
Биотехнологический синтез цитокинов, ростового гормона, инсулина,
эпидермального фактора роста, бета-эндорфина человека и многих других
биологически активных соединений осуществляется в настоящее время во
многих странах, благодаря созданию автономно реплицирующихся экстра-
хромосомных векторов дрожжей.
Дрожжи - прекрасные продуценты для биотехнологии: не патогенны и
не продуцируют токсины, растут на дешевых субстратах, генетически ста-
бильны, способны, в отличие от прокариот, гликозилировать синтезируе-
мые гетерологичные белки, активные in vivo. Для клонирования и экспрес-
сии гетерологичной ДНК используют YRp и YEp - челночные векторы, ав-
тономно реплицирующиеся в клетках дрожжей и бактерий (Арман и др.,
1984). Эти векторы создаются на основе простейших конструкций -Yip , ко-
69
Таблица 1.1. Основные свойства векторов дрожжей (Рыбчин, 1999)
Характеристика Yip YEp YRp YCp YLp YAC
Автономная репликация Нет Да Да Да Да Да
Число копий на клетку 1 25-200 1-20 1-2 10-50 1-2
Репликатор Нет ori 2 мкм ДНК ARS ARS ARS ARS
Другие элементы Нет STB 2 мкм ДНК* Нет CEN TEL CEN, TEL
Частота трансфор- 10 5 10^-10 2 I0 3 10 3 мации на 1 мкг ДНК * STB - центромероподобный сайт двухмикронной плазмиды. 10-3 lo^-io3
торые, помимо бактериальной основы, содержат только маркерный ген
дрожжей и трансформируют дрожжи, интегрируясь в хромосомы. Автоном-
но реплицирующиеся последовательности (ARS) хромосом дрожжей и дру-
гих организмов, включенные в состав векторов Yip, обеспечивают автоном-
ное экстрахромосомное поддержание плазмид. Такие плазмиды называются
репликативными (YRp); уровень их митотической стабильности является
мерой активности ARS (Легчилина и др., 2001). YRp-плазмиды трансформи-
руют дрожжи с высокой частотой, число копий сильно варьирует (5-50 на
клетку), уровень митотической стабильности колеблется в широком диапа-
зоне (Арман, Легчилина, 1982). Классификация и свойства векторов приве-
дены в табл. 1.1. и на рис. 24.
Гетерологичная экспрессия в дрожжах, включающая синтез и в неко-
торых случаях секрецию чужеродных белков, была важнейшей пробле-
мой биотехнологии 80-х годов. Существенным вкладом в решение пробле-
мы явились анализ и подбор факторов оптимизации системы “вектор-
клетка”.
В наших работах по оптимизации стабильности репликативных экспрес-
сионных плазмид для задач биотехнологии обнаружено, в частности, что ге-
терологичная ДНК со структурными свойствами ARS способна функциони-
ровать в дрожжах как усилитель — энхансер репликации. Анализ последо-
вательности ДНК вируса гепатита В (HBV aywl) выявил два фрагмента,
у которых обнаружены признаки В домена ARS дрожжей S. cerevisiae (см.
раздел 1.2.1.): повышенное содержание АТ пар, А2_5 треки по шагу спирали
ДНК, присутствие несовершенных ACS гомологов (9 из 11) и наличие ста-
тичного изгиба ДНК (Легчилина и др., 1990). Включение в конструкцию
YRp-плазмид данной области ДНК вируса значительно увеличивает их ми-
тотическую стабильность в трансформантах дрожжей (Ефименко и др.,
1991; Legchilina et al., 1991).
Повышение митотической стабильности за счет энхансера репликации
вируса HBV происходит не только у репликативных плазмид, с ARS хромо-
сом, но и у плазмид с ori 2 мкм ДНК (Арман и др., 1985; Легчилина и др.,
1990; Ефименко и др., 1991).
70
Нами было установлено, что эффективность экспрессии в дрожжах и со-
ответственно выход желаемого продукта можно увеличить многократно за
счет ряда факторов: 1) повышения стабильности вектора при включении в
его состав гетерологичного энхансера репликации; 2) минимизации размера
вектора для повышения числа его копий; 3) модификации “кассеты экспрес-
сии” (индуцибельный промотор, специфичный терминатор, два АТГ кодона
начала транскрипции), 4) создания штамма реципиента с ускоренным рос-
том культуры путем гибридизации неродственных гаплоидных штаммов
(Арман и др., 1985; Чеперегин и др., 1990). Использование этих факторов
оптимизации позволило создать первые отечественные штаммы дрожжей -
высокоэффективные продуценты белка гена поверхностного антигена ви-
руса гепатита В (HbsAg) для получения вакцины (Грановский и др., 1986;
Чеперегин и др., 1990). В совместной работе с Институтом вирусологии
им. Д.И. Ивановского разработаны условия ферментации штаммов - проду-
центов и технология очистки белка, что подтверждено пятью авторскими
свидетельствами и патентом (Арман и др., 1989). Вакцина прошла контроль
в ГИСК им. Тарасевича, клинические испытания и была передана в произ-
водство.
В тот же период был осуществлен синтез в дрожжах обратной транс-
криптазы ретротранспозона дрозофилы (Резник и др. 1988, 1990) и белка се-
мейства eRFl человека (Frolova et al., 1994).
1.2. ИСКУССТВЕННАЯ ХРОМОСОМА ДРОЖЖЕЙ
1.2.1. ИСКУССТВЕННАЯ ХРОМОСОМА ДРОЖЖЕЙ
КАК ВЕКТОР КЛОНИРОВАНИЯ
На рубеже 80-х годов стала очевидной возможность использовать искус-
ственную хромосому дрожжей в качестве емкого вектора для клонирования
ДНК геномов высших организмов, включая человека (Burke et al., 1987).
Размер фрагментов ДНК, которые можно включать в YAC, сопоставим с
размером природных хромосом дрожжей - в среднем 1,2 млн п.н., что в не-
сколько раз больше размера клонов ДНК в бактериальных, фаговых и кос-
мидных векторах (рис. 23). Большой размер клонируемых фрагментов поз-
воляет уменьшить количество клонов, необходимых для перекрытия экви-
валента генома. С помощью YАС в качестве вектора стало возможным пре-
одолеть трудности клонирования, которые связаны с особенностями струк-
турной организации хромосом высших эукариот: присутствием в геноме
множества повторяющихся элементов и метилированных участков, нерав-
номерностью распределения генов по хромосомам и пр. (Schlessinger,1990).
Как уже отмечено выше, эффективная рекомбинационная система
дрожжей позволяет вносить изменения в структуру клонированного фраг-
мента ДНК. При скрещивании дрожжей можно за счет митотической и мей-
отической рекомбинации создать YAC, который содержит полностью жела-
емый фрагмент генома (Den Dunnen et al., 1992; Popov et al., 1996). Последу-
ющее введение такого YAC в клетки млекопитающих методом герминаль-
ного переноса или с помощью других технологий позволяет провести функ-
циональный анализ интересующей области генома (Pachnis et al. 1990;
Peterson, 1997).
71
1.2.2. ПРОГРАММА ТЕНОМ ЧЕЛОВЕКА’
1.2.2.1. Роль искусственных хромосом дрожжей
в изучении генома человека
Прочтение генетического кода генома человека стало центральной про-
блемой молекулярной биологии и генетики в конце 80-х годов. Националь-
ные программы “Геном человека” были приняты во всех странах с-развитой
наукой, в том числе и в бывшем Советском Союзе. В итоге за 10 лет интен-
сивной работы мирового сообщества на рубеже третьего тысячелетия вчер-
не расшифрована нуклеотидная последовательность генома человека, соз-
даны физические карты каждой из 23 хромосом, идентифицированы гены,
ответственные за многие наследственные заболевания. Полностью завер-
шено секвенирование более десятка геномов микроорганизмов, растений,
низших и высших эукариот. Возникли новые науки - геномика и протеоми-
ка. Успехи в этих областях во многом обусловлены возможностью клониро-
вать ДНК в искусственных хромосомах дрожжей (YAC).
Лаборатория молекулярной генетики дрожжей ИМГ РАН - единственный
отечественный научный коллектив, который освоил и применяет прецизи-
онную и трудоемкую технику конструирования YAC-клонотек с последую-
щим скринингом YAC-клонов, их анализом и характеристикой, а также оп-
ределение генетического контроля поддержания YAC в клетках дрожжей.
В рамках всесоюзной, а позднее всероссийской программы “Геном чело-
века” нами были получены и охарактеризованы в 90-91-х годах YAC-клоно-
теки ДНК дрозофилы и лимфоцитов человека для поиска протяженных не-
сателлитных повторяющихся последовательностей рДНК генов.
Частичная библиотека генома D. melanogaster содержала YAC-клоны,
размер которых от 90 до 500 т. и. н. определен при сравнении их с молекуляр-
ной массой природных хромосом, фракционируемых методом электрофоре-
за в пульсирующем поле, с последующей визуализацией окраской броми-
стым этидием и ДНК-ДНК-гибридизацией. В соавторстве с сотрудниками ла-
боратории чл.-корр. РАН В.А. Гвоздева YAC-клоны были генетически кар-
тированы методом гибридизации in situ с политенными хромосомами слюн-
ных желез личинок дрозофилы. Помимо клонов, локализующихся только
в единственном сайте эухроматина, получены клоны с повторяющимися по-
следовательностями из районов прицентромерного бета-гетерохроматина
(Коган и др., 1991; Filipp et al., 1991). Анализ первичной структуры одного из
YAC-клонов с гетерохроматичной ДНК Х-хромосомы дрозофилы выявил
две последовательности, которые представили интерес для дальнейших ис-
следований. Одна из них - тандем вовлеченных в процесс сперматогенеза ге-
нов Stellate, структура и функции которых в то время были мало изучены,
а другая - последовательность псевдогена 18S рРНК вне известного ранее
кластера 18S рДНК. Вопреки общепринятому мнению о том, что копии по-
второв, кодирующих 18S рРНК, идентичны, были получены результаты о су-
ществовании в геноме вариантов 18S рДНК генов и о возможности рекомби-
нации между ними. Этот факт свидетельствует о внутригеномной диверген-
ции и эволюции последовательностей рДНК. Таким образом, результаты мо-
лекулярного анализа гетерохроматических районов, которые включают ут-
ратившие свои функции элементы - псевдогены, могут прояснить отдельные
этапы эволюции генома (Беневоленская и др., 1994).
72
Клонирование ДНК лимфоцитов человека было предпринято тоже для
поиска повторяющихся последовательностей рДНК. К началу работы, про-
веденной в 1992-1993 гг. совместно с лабораторией академика А.А. Баева
(ИМБ РАН), было известно, что кластер генов 5S рРНК человека локализо-
ван в хромосоме 1 и представлен двумя типами коротких повторов 2,2 и
2,6 т.п.н., их олигомерами из двух-четырех копий, а также протяженными
участками (около 100 т.п.н.) с последовательностью рДНК (Little, Braaten,
1989). Для более детального изучения организации и полиморфизма класте-
ра генов 5S рРНК нами был проведен скрининг 903 YAC-трансформантов, в
результате которого были отобраны 12 клонов, давших положительный сиг-
нал с зондом 5S рРНК. Субклонирование и рестриктный анализ ДНК восьми
из этих клонов показали, что они содержат кластер повторов с размером по-
вторяющегося элемента 6 т.п.н., в котором имеются три равных субэлемен-
та, содержащих последовательность псевдогена 5S рРНК (400 п.н.). Проме-
жутки между субэлементами различаются по наличию сайтов рестрикции.
Эти данные подтвердили предположение о гетерогенности организации кла-
стеров повторяющихся генов рДНК у человека. Полиморфизм может быть
фактором, модулирующим экспрессию генов в составе кластера (Тимофеева,
Захарьев, 1994).
1.2.2.2. Проект “Хромосома 19”
Проект “Хромосома 19” в рамках программы “Геном человека” предпо-
лагал осуществить картирование, секвенирование и изучение роли функци-
онально-значимых некодирующих последовательностей. В дополнение к ко-
смидной и кДНК-вой клонотекам хромосомы 19 была создана частичная
клонотека протяженных фрагментов ДНК в искусственных хромосомах
дрожжей.
В качестве источника ДНК хромосомы 19 были использованы две линии
гибридных соматических клеток (грызун-человек) GL12-42 (ИБХ РАН) и
UU5HL-58 (LLNL, США), содержащие в качестве человеческого компонен-
та только хромосому-19.
Скрининг клонотеки (более двух тысяч трансформантов) с помощью ин-
тегративной селекции и методом гибридизации колоний in situ с зондами по-
вторяющихся элементов ДНК человека показал, что YAC-клоны с ДНК че-
ловека составляют около 1%.
Клоны с фрагментами ДНК хромосомы 19 человека, использованные в
нашей работе, были переданы для физического картирования и депонирова-
ния в банк данных в Национальную лабораторию Ливермора (США), с ко-
торой сотрудничал российский коллектив проекта “Хромосома 19”.
1 2.3. ГЕНЕТИЧЕСКАЯ СТАБИЛЬНОСТЬ
ИСКУССТВЕННОЙ ХРОМОСОМЫ
1.2.3.1. Проблема химер
Коллекция нескольких тысяч YAC-клонов, содержащих фрагменты
ДНК дрозофилы, лимфоцитов и хромосомы 19 человека, предоставила за-
мечательную возможность использовать YAC в качестве модельной систе-
73
мы для исследования структурной и митотической стабильности искусствен-
ной хромосомы.
При анализе библиотек тотальной ДНК генома и хромосом-специфич-
ных клонотек ДНК человека, созданных в начале 90-х годов, обнаружено от
20 до 50% химерных клонов, которые вносят артефакты в исследования ну-
клеотидной последовательности генома и при сопоставлении физических и
генетических карт хромосом (Green et al., 1991; Wada et al., 1994).
Механические разломы, одно- и двунитевые разрывы ДНК, а также ли-
гирование плеч вектора более чем с одним фрагментом ДНК рестриктов из
разных областей хромосомы могут приводить к образованию химерных
YAC, которыми трансформируют сферопласты дрожжей. Для снижения ве-
роятности таких событий in vitro процедуры с клонированной ДНК проводи-
ли в легкоплавкой агарозе, иммобилизуя молекулы ДНК. Доля химер умень-
шается и при снижении концентрации клонируемой ДНК человека в лигиру-
ющей смеси. Сходный эффект “разведения” имеет место при создании YAC-
клонотеки из клеток соматических гибридов, где доля ДНК человека соста-
вляет около 1%. В таких YAC-клонотеках доля химер не превышает 10%.
В последние годы была предложена новая технология получения клонов
в составе YAC - метод трансформационно-ассоциированной рекомбинации
(Larionov et al., 1996а). Метод исключает лигирование YAC in vitro и снижает
тем самым вероятность образования химер. Детально метод описан ниже
(см. раздел 3.4.1. и рис. 25).
In vivo нестабильность структуры YAC возникает в процессе митотиче-
ского деления дрожжей при рекомбинации повторов в ДНК YAC или гомо-
логичных сайтов клонированной и природной ДНК дрожжей. Частота всех
типов перестроек в ДНК YAC снижается в 5-8 раз при использовании в ка-
честве реципиентов дрожжей с мутациями в генах, контролирующих репа-
рацию/рекомбинацию (Kouprina et al., 1999).
1.2.3.2. Генетические эффекты поддержания YAC
в клетках дрожжей
Нами исследована возможность изменений в геноме клетки-реципиента,
содержащей YAC в дополнение к набору собственных природных хромосом.
Трансформанты дрожжей, в генотипе которых имеется мутация гена
ADE2, образуют колонии, накапливающие красный пигмент. В наших опы-
тах, помимо красных, с большой частотой, возникали колонии трансфор-
мантов, лишенные пигментации, но содержащие YAC со вставкой ДНК.
Анализ полового потомства пяти непигментированных YAC-трансформан-
тов с ДНК дрозофилы показал, что у каждого из этих трансформантов ут-
рата пигментации обусловлена ядерной рецессивной мутацией гена ADE5.
Аналогичные результаты получены при генетическом анализе десяти YAC-
клонов со вставками ДНК лимфоцитов человека. Мутантные сайты в локу-
се ADE5 оказались изоаллельными. В массовых рассевах клеток штамма ре-
ципиента АВ 1380 не удалось обнаружить спонтанно возникших абе5-мута-
ций. Следовательно, изоаллельность мутаций ade5 в случайных выборках
трансформантов, несущих YAC со вставкой ДНК дрозофилы и лимфоцитов
человека, является следствием специфической индукции и селекции этих му-
таций в процессе трансформаций.
74
Этот факт согласуется с нашими данными о достоверном увеличении ча-
стоты спонтанных реверсий к прототрофности по аденину у некоторых из
случайно отобранных YAC-трансформантов. Очевидно, присутствие YAC
в клетке дрожжей способно существенно повышать вероятность возникно-
вения и селекции специфичных мутаций (Арман и др., 1993).
1.2.3.3. Структурные перестройки YAC
Успех применения YAC для любых молекулярно-генетических задач за-
висит от его структурной и митотической стабильности. Множество повто-
ряющихся элементов в ДНК высших эукариот индуцирует процессы гомо-
логичной рекомбинации в ДНК YAC, приводя к внутри- и межмолекуляр-
ным перестройкам клонированного фрагмента.
Перестройки структуры клонированного фрагмента ДНК YAC: деле-
нии, инсерции, обмены - были количественно оценены нами в опытах с
“маркированными” YAC. Методом ретрансформации в клонированную
ДНК более двухсот YAC была встроена кассета Alu-HIS3-Alu. Анализ мар-
кированных фенотипом Н18+-ретрансформантов показал, что в процессе ре-
трансформации и последующих митозов клетки происходит ряд генетиче-
ских эффектов.
1. Интеграция кассеты Alu-HIS3-Alu происходит не только за счет го-
мологии Alu повторов в ДНК человека, но и вследствие гомологии гена
HIS3 дрожжей в составе кассеты. Методом гибридизации ДНК Alu зонда с
ДНК хромосом каждого из 60 случайно отобранных His+ ретрансфор-
мантов обнаружено, что у 6 из них HIS3 маркер локализуется не в YAC-по-
следовательности. Два акта интеграции произошли в хромосому 15,
где расположен HIS3 ген, остальные четыре в хромосомы 2, 4, 11, и
14 дрожжей.
2. Выборка из 121 маркированного YAC была использована для опреде-
ления частоты делеций в YAC-последовательности при репликации и под-
держании его в дрожжах. Контролем служили рYAC-векторы, не содержа-
щие ДНК человека. Анализ не менее 50 субклонов каждого ретрансформан-
та (всего 6561) после 20-30 генераций выявил, что 239 субклонов, несущих
YAC (4,5%), утратили HIS3 маркер. В контроле эта величина равна 0,06%.
Таким образом, частота делеций кассеты Alu-HIS3-Alu в YAC с ДНК челове-
ка повышается на два порядка.
3. Нам удалось также количественно оценить частоту обменов между
ДНК YAC и природных хромосом дрожжей: 5% ретрансформантов, утра-
тивших YAC во время инкубации, сохраняют Н18+-фенотип. Генетический
анализ показал, что последовательность HIS3 обнаруживается как в районе
локуса этого гена, так и в локусах других хромосом. Частота рекомбинаци-
онных событий составляет IO2.
При определении размеров YAC всей клонотеки было обнаружено, что
часть первичных трансформантов содержит не один, а несколько YAC
(2-4), отличающихся по молекулярной массе. Этот факт отмечен в публи-
кациях и других авторов, которые считали его следствием проникновения в
клетку при трансформации нескольких рекомбинантных структур одновре-
менно. Однако выявлена и другая причина: несколько YAC в одной клетке
могут явиться результатом структурной перестройки одного и того же
7S
YAC-клона. Была прослежена судьба YAC в 6 линиях независимых транс-
формантов. Генетический анализ диплоидных гибридов этих линий после
пятикратного последовательного скрещивания показал, что ни один из двух
или более YAC не утрачивается при прохождении клеткой митоза и мейо-
за. Все три генетических маркера YAC обнаруживают косегрегацию и мен-
делевское наследование, т.е. проявляют свойства одиночной автономно-ре-
плицирующейся структуры. Тот же вывод следует из результатов рестрикт-
ного анализа и опытов по ДНК-ДНК-гибридизации в клетках постмейоти-
ческих сегрегантов. Очевидно, в изученных линиях имеет место структур-
ная нестабильность клонированного в YAC фрагмента ДНК, при которой
только определенные перестройки жизнеспособны и поддерживаются
клеткой. Эти результаты количественно подтверждают данные других
авторов об актах рекомбинации, как источнике химерных YAC (Larionov et
al., 1994).
Таким образом, сочетание методов молекулярной биологии и классиче-
ской генетики при анализе YAC-клонотек, содержащих ДНК из разных ис-
точников, дало возможность количественно оценить вероятность наруше-
ния аутентичности клонированной ДНК (Арман и др., 1999).
1.2.3.4. Митотическая стабильность YAC
Стабильность поддержания YAC, как и природных хромосом, зависит
от эффективности их репликации и точной сегрегации в дочернюю клетку
в процессе митоза. Эта величина у YAC составляет 10-2, несмотря на при-
сутствие всех трех компонентов хромосомы: ARS, CEN, TEL, обеспечиваю-
щих контроль репликации и сегрегации. Величина митотической стабиль-
ности YAC имеет тенденцию возрастать с увеличением размера вставки
(Арман и др., 1993). Наблюдаемые отклонения от этого правила обусловле-
ны, по-видимому, специфичностью нуклеотидной последовательности
вставки. Определение митотической стабильности коллекции YAC-клонов
с ДНК человека выявило и другие факторы, влияющие на частоту утра-
ты YAC.
1. Скорость утраты YAC в митозе зависит от типа клонирующего век-
тора. Наиболее стабильными оказались YAC на основе векторов pJS
97-98. По-видимому, этот факт можно объяснить тем, что каждый из двух
pJS векторов, образующих плечи YAC, имеет в составе ARS Н4. Как из-
вестно, увеличение числа ARS повышает стабильность рекомбинантных
структур.
2. Уровень митотической стабильности YAC существенно выше в дипло-
идной клетке по сравнению с гаплоидной. Возможно, диплоидность, свойст-
венная дрожжам S. cerevisiae в природе, представляет более стабильную си-
стему поддержания генетических структур.
3. Генотип клетки-реципиента также может определять уровень митоти-
ческой стабильности YAC. Например, фактором ее повышения могут явить-
ся мутации генов SRM, которые вызывают у дрожжей координированные
изменения стабильности природных и рекомбинантных генетических струк-
тур. Нами обнаружен стабилизирующий эффект мутаций srml и srm8: ско-
рость утраты YAC снижается на порядок по сравнению с этой величиной
в клетках дикого типа (Смирнова и др., 1995).
76
1.2.4. СОЗДАНИЕ YAC-КЛОНОТЕКИ ХРОМОСОМЫ 7
ЧЕЛОВЕКА
В рамках проекта “Хромосома 19” в лаборатории, руководимой акаде-
миком Е.Д. Свердловым (ИБХ РАН), детально изучены последовательно-
сти длинных концевых повторов эндогенных ретровирусов человека семей-
ства К (LTR HERV-K) хромосом 19,21 и 22 человека, для которых определе-
ны первичная структура этих элементов и фланкирующей их геномной
ДНК, локализация на физической карте, систематика, эволюционный воз-
раст и предполагаемые регуляторные функции (Vinogradova et al., 1997; Khil
et al., 1997; Артамонова и др., 2000). Анализ распределения копий LTR по
всему геному свидетельствует о том, что некоторые хромосомы, в том чис-
ле 19-я, обогащены LTR, а другие содержат умеренное или малое число их
копий. Для определения функциональной активности, специфичности рас-
пределения и времени интеграции в геном LTR HERV-K необходим сравни-
тельный анализ этих последовательностей в разных хромосомах. В связи с
этим в качестве еще одного объекта исследования авторских коллективов в
РФ и ФРГ (Филиппе Университет Марбурга) в 1997 г. была выбрана хромо-
сома 7 (Grzeschik et al., 1994).
1.2.4.1. Клонирование в YAC методом
трансформационно-ассоциированной рекомбинации (TAR)
Для конструирования клонотеки нам была передана проф. К.-Х. Гржеши-
ком (ФРГ) линия гибридных соматических клеток RuRag 14-4-7-44, где хромо-
сома 7 представлена малым плечом со своей теломерой и другой теломерой,
близко сцепленной с центромерой, а геном мыши - гетероплоидным набо-
ром хромосом, близким к 4п. Менее 10% клеток линии RuRag 14-4-7-44 пос-
ле размножения культуры имеют малое плечо 7 хромосомы. Исходя из раз-
меров генома мыши и 7р хромосомы следовало ожидать, что не более 1 из
2000 полученных YAC-трансформантов будут содержать ДНК человека при
рутинном методе клонирования.
С целью сохранения аутентичности ДНК человека в YAC и повышения
эффективности проводимой работы нами был применен альтернативный
подход клонирования - метод трансформационно-ассоциированной реком-
бинации (TAR) (Ketner et al. 1994; Larionov et al., 1996a). Искусственная хро-
мосома дрожжей с клонированным фрагментом гетерологичной ДНК
“конструируется” in vivo за счет сопутствующих процессу котрансформа-
ции актов гомологичной рекомбинации между повторяющимися элемента-
ми ДНК человека (например Alu) и теми же повторами, включенными в со-
став вектора. В результате селективное клонирование ДНК человека про-
исходит внутриклеточно на стадии возникновения трансформантов
(рис. 25). Преимуществами метода являются практически полное отсутст-
вие химерных фрагментов клонированной ДНК человека и многократное
обогащение клонами ДНК человека при создании библиотеки из ДНК кле-
ток монохромосомных соматических гибридов грызун/человек (Larionov et
al., 1996b).
В опытах по клонированию TAR-методом использованы векторы, кото-
рые образуют в процессе трансформации линейные и кольцевые YAC.
77
Характерной особенностью TAR-векторов является отсутствие ARS-по-
следовательности, обеспечивающей репликацию YAC в дрожжах. Известно,
что в геноме человека ARS-подобные последовательности расположены до-
статочно часто, в среднем 1 на 30-40 т.п.н. (Stinchcomb et al., 1980). Следова-
тельно, протяженные фрагменты ДНК человека, клонированные в YAC,
могут с большой вероятностью содержать ARS-структуры, способные реп-
лицироваться в дрожжах. Использование векторов, лишенных дрожжевого
ARS, обеспечивает дополнительный механизм селекции.
1.2.4.2. Отбор и анализ YAC клонов с ДНК человека
Методом TAR-клонирования было получено 1806 первичных трансфор-
мантов. Многоступенчатый скрининг, включающий генетическую селек-
цию, гибридизацию колоний in situ с меченой тотальной ДНК человека и
inter-Alu-PCR, показал, что 76 из них содержат вставку ДНК человека
(рис. 26). Поскольку тотальная ДНК клеток соматического гибрида содер-
жит 0.05% ДНК человека, а выход клонов 7р среди TAR трансформантов со-
ставил 4,2%, что на два порядка выше, очевидно, что избранный метод
TAR-клонирования оказался примерно в 100 раз эффективнее традицион-
ного.
Размер клонированных фрагментов составил от 100 до 900 т.п.н. Анализ
inter-Alu PCR продуктов показал отсутствие перекрытий вставок, что свиде-
тельствует о случайном распределении клонов по хромосоме. Исходя из раз-
меров и количества YAC-клонов, библиотека содержит суммарно около
12 млн п.н., что составляет 20% короткого плеча хромосомы 7.
1.2.4.3. Поиск терминальной последовательности 7р
Субтеломерные области хромосом человека содержат ARS-последова-
тельности (Flint et al., 1997), этот факт мог бы повысить вероятность клони-
рования концов хромосом TAR-вектором, не содержащим ARS дрожжей.
Изучение концов хромосом является необходимым этапом в определе-
нии границ физической и генетической карт хромосом любых геномов. Кло-
нирование концов хромосом представляло определенные сложности и пер-
вые фаговые и космидные библиотеки практически не содержали теломер-
ных последовательностей. Применение метода “полу-YAC’' для клонирова-
ния концов хромосом (Riethman et al., 1989) весьма трудоемко. В этой рабо-
те лишь один YAC из 600 “полу-YAC” клонов был строго локализован в об-
ласти теломеры 7ц. В более поздней работе для отбора 40 YAC клонов,
представляющих 31 конец хромосом, пришлось анализировать 12 000 пер-
вичных трансформантов (Vocero-Akbani et al., 1996).
Поиск терминальной последовательности короткого плеча хромосомы 7
человека в ДНК YAC-клонов проведен нами методом ПЦР с парой прай-
меров (D1 и D2), которые образуют ПЦР-продукт размером 246 п.н. при ам-
плификации ДНК соматического гибрида с коротким плечом хромосомы 7,
и не образуют продукта с ДНК дрожжей, мыши и соматического гибрида,
содержащего 7q (Brown et al., 1990).
Четыре YAC-клона, позитивных в реакции с D1-D2, локализованы в
7р21, 7р15.1-7р15.3, 7р15.1-7р15.2, 7р15.1-7р15.2 областях хромосомы 7 ме-
78
тодом флуоресцентной in situ гибридизации (FISH) с метафазными хромосо-
мами человека продуктов Alu-PCR ДНК YAC-клонов. Следовательно, эти
клоны не являются фрагментами теломеры 7р, а лишь содержат гомологич-
ные последовательности, которые выполняют функцию теломерных кон-
цов в YAC. Этот тип YAC составлял основной генетический шум, на фоне
которого велся поиск клонированных терминальных последовательностей
человека во всех работах с векторами, имеющими только одну теломеру.
Механизм образования структуры, функционирующей на конце искусст-
венной хромосомы дрожжей, мало изучен. Известно, что такие последова-
тельности часто встречаются в геноме эукариот и локализуются, в частно-
сти, у человека в разных, нетерминальных сегментах хромосом (Brown et al.,
1990; Monfouilloux et al., 1998). Такие концы обладают структурной неста-
бильностью: в процессе репликации и размножения клонированный фраг-
мент может существенно укорачиваться. После нескольких пассажей наря-
ду с линиями клеток, несущих первичный YAC, нами обнаружены линии с
YAC меньшего размера. Подобные факты отмечены и в других работах
(Larionov et al., 1996а).
Для более направленного поиска теломерных и субтеломерных клонов
мы использовали 5 пар STS праймеров в качестве тестов на последователь-
ности, расположенные на разном расстоянии от теломеры хромосомы 7р (до
300 т.п.н). ПЦР продукты были обнаружены с тремя последовательно рас-
положенными праймерами в ДНК YAC 24-17. Следовательно, этот YAC со-
держит терминальный фрагмент короткого плеча 7 хромосомы.
Локализация клона YAC 24-17 на терминальном участке 7р хромосомы
подтверждена методом FISH. ДНК данного клона гибридизуется также с не-
сколькими, преимущественно терминальными, районами других хромосом:
7cen: Ipter; lq41; 5qter; 16qter; 16pter. Множественная гибридизация подтвер-
ждает данные о том, что терминальные области разных хромосом обладают
сходной структурой и богаты консервативными повторами (Monfouilloux et
al., 1998).
Итак, в клонотеке хромосомы 7р, размером 12 млн.п.н, удалось клони-
ровать терминальную последовательность этой хромосомы. Успех клониро-
вания концевой области с ARS-последовательностью обусловлен, возмож-
но, применением TAR векторов, не содержащих области начала репликации
(Глазкова и др., 2000).
1.2.4.4. Поиск последовательности LTR семейства HERV-K
Среди частичной YAC-клонотеки хромосомы человека 7р проведен по-
иск и локализация последовательностей длинных концевых повторов (LTR)
эндогенных ретровирусов семейства HERV-K (HML-2), а также анализ их
возможной функциональной значимости. Известно, что в геноме человека
до 4,5% ДНК составляют последовательности эндогенных ретровирусов
(Lander et al., 2001). Имеются данные об участии HERV в регуляции генов, в
процессах клеточной дифференцировки, иммунного ответа, злокачествен-
ного перерождения и патологии некоторых аутоиммунных заболеваний
(Kazazian 1998; Larsson, Andersson, 1998). Одно из наиболее многочисленных
семейств - HERV-K (HML-2) - представлено в геноме не только ретровирус-
подобными элементами, но и большим количеством одиночных концевых
7Q
Рис. 28. Локализация YAC-клонов, содержа-
щих HERV-K LTR, на идеограмме хромосо-
мы 7
повторов - LTR (Leib-Mosh et al.,
1993; Sverdlov, 1998). Интерес к этим
последовательностям помимо их
эволюционной значимости (Sverdlov,
2000) обусловлен тем, что они содер-
жат набор регуляторных элементов:
энхансер, промотор, сигнал полиаде-
нилирования, участок связывания
стероидных гормонов, - это позво-
ляет предполагать потенциальную
способность LTR модулировать ак-
тивность генов. Действительно, все
больше фактов свидетельствует об
участии LTR в регуляции и экспрес-
сии расположенных рядом генов
(Sjottem et al., 1996; Mager et al., 1999;
Baust et al., 2000).
Для поиска HERV-K LTR YAC-
клоны короткого плеча хромосомы
7 гибридизовали с HERV-K LTR-зон-
дом и анализировали ПЦР-методом
с праймерами, гомологичными 5’-
и 3’- концевым областям HERV-K
LTR: амплификация ДНК 3 из 76
YAC (22-19, 22-55, 24-13) давала
ПЦР-продукт, размер которого со-
ответствует полной протяженности
одиночного HERV-K LTR (около
900 п.н.). YAC-клоны, содержащие
эти полноразмерные HERV-K LTR,
локализовали на хромосоме 7 чело-
века методом FISH (рис. 27). Резуль-
таты локализации представлены на
идеограмме хромосомы 7 (рис. 28).
Данные о распространении ко-
пий HERV-K LTR по геному свиде-
тельствуют о том, что некоторые
хромосомы человека обогащены
HERV-K LTR-последовательностя-
ми, а другие содержат умеренное
или малое их число. Изучение рас-
пределения HERV-K LTR на хромо-
сомах человека 19, 21 и 22 обнару-
жило, что на хромосоме 19 локали-
зованы 72 одиночных полноразмер-
ных HERV-K LTR в 70 млн п.н„ ко-
торые расположены достаточно
равномерно (Vinogradova et aL, 1997),
а на близких по размеру хромосомах
80
21 и 22 только 15 и 13 соответственно. Нами локализованы три полнораз-
мерных HERV-K LTR в клонотеке, содержащей 12 млн п.н. короткого
плеча хромосомы 7, что согласуется с представлением о неравномерности
распределения LTR в разных хромосомах генома (Глазкова и др., 2000).
При этом распределение имеет тенденцию следовать за плотностью генов
(Артамонова и др., 2000; Kurdyukov et al., 2001).
Эти факты свидетельствуют в пользу предположения о преимуществен-
ной интеграции эндогенных ретровирусов в транскрипционно активные об-
ласти генома (Scherdin et al., 1990). Транскрипция в клетках нормальной тка-
ни (см. ниже, раздел 1.2.4.7.) всех трех LTR-содержащих фрагментов из кло-
нотеки короткого плеча хромосомы 7 также согласуется с таким представ-
лением.
1.2.4.5. Нуклеотидная последовательность HERV-K LTR
Последовательности HERV-K LTR и фланкирующих их участков ДНК
в составе клонов YAC22-19, YAC22-55, YAC24-13 были определены мето-
дом ПЦР-супрессии. На основании анализа характерных замен и делеций в
последовательностях LTR проведена их классификация и определен эволю-
ционный возраст. Последовательность HERV-K LTR из клона YAC22-19 де-
понирована в базу данных GenBank (AF205860) (Nadezhdin et al., 2001). Пуб-
ликация данных чернового прочтения последовательности генома чело-
века в 2001 г. позволила сравнить последовательности исследуемых нами
HERV-K LTR с базой данных (GenBank) и тем самым подтвердить или уточ-
нить их локализацию, а также установить генетический контекст данных
последовательностей. Рассмотрены гены, расположенные на расстоянии до
100 т.п.н. от HERV-K LTR-последовательности. Протяженность 100 т.п.н.
представляет собой средний размер упорядоченных петель хроматина, кото-
рые, как предполагают ряд авторов, являются независимо регулируемыми
функциональными элементами хромосомы. Присутствие HERV-K LTR в
этой области может, по-видимому, оказывать влияние на экспрессию генов.
Для HERV-K LTR-последовательность клона YAC22-19 на хромосоме 7
человека имеются две идентичные последовательности - АС079804 (97%)
и АС079882 (98%) (GenBank), которые расположены в 7р22 области хромо-
сомы на расстоянии ~1 млн п.н. друг от друга в насыщенных генами участ-
ках. Эти данные совпадают с нашими результатами по FISH-картированию.
Копии HERV-K LTR из клона YAC22-19 присутствуют также на длинном и
коротком плечах хромосомы 3, на 8-й и 11-й хромосомах. Гомология имеет-
ся не только в области самого HERV-K LTR элемента, но и в области уни-
кальных фланкирующих HERV-K LTR-последовательностей.
Гомологичная генетическому контексту HERV-K LTR-элемента с флан-
кирующими последовательностями ДНК клона YAC 22-19 область хромосо-
мы 3 человека (3р13) включает кластеры OR-генов/псевдогенов - рецепто-
ров обоняния (olfactory receptor genes). Показано, что хромосомы 11, 4, 8,
а также область 7р22 хромосомы 7 входят в группу хромосом, среди кото-
рых полиморфно распределены кластеры OR генов/псевдогенов. Это позво-
ляет предполагать совместное распространение по геному данного HERV-K
LTR-элемента и OR-генов в соответствии с гипотезой о межхромосомных
дупликациях и транслокациях больших геномных фрагментов (Trask et al.,
81
1998; Nadezhdin et al, 2001). Фрагмент с последовательностью HERV-K LTR
клона YAC22-55, имеет 99%-ную идентичность с областью АС069279
(GenBank) 7р12.3 хромосомы 7 человека, расположенной на расстоянии
~49 млн п.н. от теломеры короткого плеча этой хромосомы. YAC22-55 был
локализован методом FISH в области 7р14-7р15.1. Некоторое расхождение
данных можно объяснить более низким разрешением FISH-метода в прокси-
мальных областях хромосомы. 60 т.п.н. дистальнее рассматриваемого фраг-
мента с последовательностью HERV-K LTR расположен ген человека
HUS1 - гомолог гена husl дрожжей Schitosaccharomyces pombe. Предполага-
ется, что продукты генов HUS1 и RAD1 являются компонентами белкового
комплекса, который активируется в ответ на повреждение ДНК (Volkmer,
Karnitz, 1999). Последовательность HERV-K LTR клона YAC24-13 идентич-
на последовательности АС005091, которая расположена на расстоянии
~27,8 млн п.н. от теломеры короткого плеча хромосомы 7, что полностью
согласуются с локализацией HERV-K LTR в 7р15.2 области методом FISH.
В соответствии с данными GenBank фрагмент ДНК, содержащий HERV-K
LTR, находится в первом интроне гена ТАХ1ВР1 в ориентации, противопо-
ложной направлению транскрипции. Белок, кодируемый этим геном, явля-
ется транскрипционным активатором промотора вируса Т-клеточной лейке-
мии (HTL V), а также стимулирует экспрессию некоторых клеточных генов
(Gachon et al., 1998). Имеются данные об участии белка ТАХ1ВР1 в апопто-
зе. Влияние HE.RV-K LTR-элемента на регуляцию данного гена может про-
исходить, в том числе и на уровне образования антисмысловой РНК.
1.2.4.6. Транскрипционная активность фрагментов ДНК,
содержащих HERV-K LTR, в клетках нормальной
и опухолевой паренхимы (семиномы) яичка человека
Одним из показателей функциональной значимости последовательности
является ее транскрипционная активность. В литературе имеются данные о
транскрипции последовательностей HERV и их длинных концевых повторов
в тератокарциномах и некоторых других клетках зародышевого пути, в от-
личие от нормальных соматических тканей.
Нами была изучена транскрипция трех фрагментов, содержащих HERV-K
LTR из YAC-клонов короткого плеча хромосомы 7 человека в клетках тка-
ни нормальной паренхимы яичка и опухолевых клетках этой же ткани -
семиномы.
Знание уникальных последовательностей, фланкирующих HERV-K
LTR, дало возможность применить метод RT-PCR для анализа транскрипци-
онной активности исследуемых фрагментов. Для каждого фрагмента, со-
держащего HERV-K LTR, были использованы три пары праймеров: одна -
для амплификации последовательностей всего HERV-K LTR содержащего
фрагмента, и две пары для амплификации только фланкирующих HERV-K
LTR 3’- и 5’-областей. Материалом исследования (любезно предоставлен
Т. Виноградовой) служили три пробы “первых цепей” ДНК, полученных
путем обратной транскрипции с тРНК, выделеных из нормальных кле-
ток паренхимы яичка и из клеток семиномы одного и того же пациента
(образцы 30N и 30S), а также из клеток семиномы другого пациента (обра-
зец 6S).
82
1 2 3 4 5 М
12345М М 1 2 345М
22-19 For +134 Rev
915 For+ 22-19 Rev
22-19 For+ 22-19 Rev
Puc. 29. Транскрипционная активность фрагмента, содержащего HERV-K LTR клона
YAC 22-19 (RT-PCR-анализ)
Электрофореграммы продуктов RT-PCR -фрагмента, содержащего HERV-K LTR, и последовательно-
стей, фланкирующих собственно LTR-элемент. Дорожки: 1 — семинома 6S; 2 — семинома 30S; 3 — нормаль-
ная ткань 30N; 4 - отрицательный контроль; 5 - ДНК человека; 6 - М-маркер мол. веса pUC mix.
RT-PCR-продукт (рис. справа) для нормальных клеток паренхимы — 1437 п.н. (дорожка 3) помимо транс-
криптов одинакового размера для семином 6S (дорожка 1) и 30S (дорожка 2) имеет дополнительный
транскрипт меньшего размера (дорожка 3)
Транскрипты, которые содержат HERV-K LTR и прилегающие участки,
были обнаружены во всех трех образцах: в клетках нормальной паренхимы
яичка 30N, семиномы 30S и 6S. Однако в клетках нормальной ткани в отли-
чие от клеток семиномы присутствует дополнительный транскрипт меньше-
го размера (рис. 29). Появление такого транскрипта можно отнести, по-ви-
димому, за счет сплайсинга, который может быть нарушен в опухолевых
клетках.
При определении транскрипции фрагментов, содержащих HERV-K LTR
двух других клонов YAC22-55 и YAC24-13, были получены сходные резуль-
таты. Транскрипты присутствуют в клетках нормальной паренхимы яичка
(30N), но не обнаружены в клетках семиномы того же больного (30S). По-
видимому, в случае семиномы 30S развитие опухоли привело к изменению
транскрипционной активности данных фрагментов. В клетках другой семи-
номы 6S обе последовательности транскрибируются, так же как и в клетках
нормальной паренхимы яичка. По-видимому, отсутствие экспрессии иссле-
дованных LTR-элементов не является общим и обязательным свойством се-
мином.
Изменение характера транскрипции может зависеть либо от стадии раз-
вития опухоли, либо явиться следствием хромосомных перестроек, которые
часто сопровождают злокачественное перерождение клеток.
Таким образом, показана разница в экспрессии трех фрагментов, содер-
жащих HERV-K LTR короткого плеча хромосомы 7 в нормальных и опухо-
левых клетках зародышевого пути. Вопрос, является ли отсутствие транс-
крипции в клетках семиномы причиной или следствием развития опухоли,
требует дальнейших исследований. Полученные данные свидетельствуют о
том, что в трех исследованных фрагментах хромосомы 7 инициация и терми-
нация транскрипции имеет место за пределами последовательности HERV-K
LTR-элемента. Следовательно, изученные последовательности одиночных
HERV-K LTR не функционируют в качестве промотора или сигнала поли-
аденилирования. В то же время не исключено, что данные HERV-K LTR по-
83
следовательности могут служить промотором для образования антисмысло-
вой РНК (например, в случае HERV-K LTR клона YAC24-13, см. выше),
играть роль энхансера или служить участком связывания стероидных гормо-
нов. Значимость LTR в регуляции генов представляет большой интерес и
требует дальнейших исследований.
1.2.4.7. Промоторная активность в клетках дрожжей
последовательности HERV-K LTR клона YAC22-19
Известны факты премоторной активности полноразмерных одиночных
LTR в отношении интактных генов, а также репортерных генов в составе ре-
комбинантных ДНК в некотороых тканеспецифичных линиях клеток чело-
века (Sjottem et al.,1996; Domansky et al.,2000; Schon et al.,2001).
Консервативность в эволюции последовательностей одиночных LTR
предполагает и консервативность функций. Нами впервые показана актив-
ность LTR в клетках низших эукариот дрожжей - сахаромицетов. Для этого
были сконструированы репликативные плазмиды, в состав которых введена
последовательность HERV-K LTR клона YAC22-19 в прямой и обратной
ориентации по отношению к репортерному гену лихеназы-LicB Clostridium
thermocellum (Piruzian et al.,2001). Этими плазмидами (LTRnp-LicB и LTRo6p-
LicB) трансформировали клетки дрожжей штамма YPH 857.
Эффективность работы промотора HERV-K LTR в клетках трансфор-
мантов определяли качественно и количественно по активности экспресси-
руемой лихеназы. Для качественного теста колонии трех независимых и
трех контрольных трансформантов инкубировали 3-12 ч на среде, содержа-
щей лихенан. Ареол свечения вокруг образовавшихся колоний указывает на
экспрессию гена лихеназы, находящегося под контролем HERV-K LTR-про-
мотора (рис. 30).
Для количественного измерения активности лихеназы готовили клеточ-
ный лизат из 5 независимых трансформантов для каждой из двух ориента-
ций HERV-K LTR-промотора. В лизате измеряли активность лихеназы
и нормировали ее на общее количество белка в клетке (табл. 1.2.).
Очевидно, что последовательность HERV-K LTR-клона YAC22-19 спо-
собна инициировать транскрипцию репортерного гена лихеназы в клетке
дрожжей в качестве единственного промотора. Следовательно, промотор
HERV-K LTR не является специфичным для клеток человека, а может функ-
ционировать и в низших одноклеточных эукариотах. HERV-K LTR иниции-
рует транскрипцию в дрожжах, находясь в прямой и обратной ориентации
относительно гена репортера, т.е. обладает двунаправленной премоторной
активностью. Свойство двунаправленности было отмечено при изучении
промотора HERV-K LTR в клеточной линии тератокарциномы человека.
Эту способность HERV-K LTR сохраняет и в дрожжевых клетках. Сравне-
ние активности HERV-K LTR промотора и наиболее сильных промоторов
генов дрожжей Gal и TDH в опытах с репортерным геном показало, что ак-
тивность промотора HERV-K LTR составляет -6,8% активности индуцибель-
ного Gal промотора и -0,26% активности конститутивного промотора гена
TDH (см. табл. 1.2.). Относительно слабая промоторная активность HERV-K
LTR имела место и в клетках человека. Усиление премоторной активности
HERV-K LTR в линии клеток человека может происходить за счет энхансер-
84
Таблица 1.2. Количественное определение активности лихеназы в клонах с плазмидами
HERV-K LTRnpHM-LicB, HERV-K LTR обратн-LicB, Gal-LicB, TDH-LicB
Промотор, используемый в конструкции Активность лихеназы, U/mg Относительная активность по сравнению с Gal промтором
HERV-K LTR прям-LicB 0,86±0,06 6,5%
HERV-K LTR обратн-LicB 0,90±0,09 6,8%
Gal-LicB 13,15±0,7 100%
TDH LicB 350±39 -
ных последовательностей, с которыми связываются белковые факторы
транскрипции (Domansky et al, 2000). В отношении дрожжей пока
не известно, имеются ли белки, способные взаимодействовать с последова-
тельностью LTR в роли промотора.
ЗАКЛЮЧЕНИЕ
Дрожжи - популярная экспериментальная модель для изучения биоло-
гии эукариот на клеточном и молекулярном уровне. Успешное использова-
ние этой модели основывается на применимости методов классической гене-
тики и молекулярной биологии для изучения наследственных структур и их
функций. С помощью технологии рекомбинантных ДНК созданы векторы
для клонирования и экспрессии чужеродных генов и высокоэффективные
рекомбинантные штаммы дрожжей - продуценты гетерологичных бел-
ков, - широко применяемые в прикладной биотехнологии. Использование
искусственной хромосомы дрожжей в качестве вектора клонирования про-
тяженных фрагментов ДНК генома человека существенно ускорило выпол-
нение проекта “Геном человека”. Последующие этапы исследований в обла-
сти геномики и протеомики также включают ряд методов, разработанных в
опытах с дрожжами. Например, поиск и сравнение функций гомологичных
генов; экспрессия в дрожжах генов высших организмов для анализа функ-
ции их продуктов; определение взаимодействия белков с помощью дрожже-
вой двугибридной системы у разных или у одного и того же организма; вы-
яснение механизмов эпигенетической наследственности, в частности, зага-
дочных процессов “прионизации” белков.
2. МИТОТИЧЕСКАЯ ТРАНСМИССИЯ
НАСЛЕДСТВЕННЫХ СТРУКТУР ДРОЖЖЕЙ И ГЕНЫ SRM
2.1. ПРЕДВАРИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
Более полувека назад высокая изменчивость митохондриального генома
дрожжей привлекла к себе интерес исследователей, породивший впоследст-
вии несколько тысяч научных публикаций. Вместе с тем систематическое
изучение генетического контроля гйсг-мутабильности, необходимое для по-
85
нимания причин, механизмов и биологического значения этой высокой из-
менчивости, долгое время не предпринималось. Не затрагивался также воп-
рос о наличии или отсутствии связи между rho -мутабильностью и митоти-
ческой стабильностью ядерных наследственных структур клетки. Мы пред-
приняли попытку идентифицировать ядерные гены, необходимые для высо-
кой гЛо -мутабильности. Когда попытка дала положительный результат,
встал вопрос о роли упомянутых генов в жизнедеятельности дрожжевых
клеток.
Данные, относящиеся к этому вопросу и рассматриваемые в настоящем
и следующем разделах, получены в исследованиях, проведенных совместно
с Объединенным институтом ядерных исследований (Дубна) и Санкт-Петер-
бургским Институтом ядерной физики имени Б.П. Константинова РАН.
2.2. ПОЛУЧЕНИЕ И СВОЙСТВА МУТАЦИЙ SRM
2.2.1. ИЗОЛЯЦИЯ МУТАНТОВ SRM
Клетки изогенных гаплоидных линий дрожжей Saccharomyces cerevisiae
71а и 71а на полноценной среде образуют колонии, имеющие характерную
“звездчатую” форму (признак Sta+), в колониях доля клеток rho- составляет
50% и более. Генетический анализ показал, что “звездчатость” у линий 71а
и 71а обусловлена одновременным присутствием не менее 5 генов, каждый
из которых вызывает лишь относительно слабое повышение спонтанной
гйо -мутабильности (Devin, Koltovaya, 1987). Полигенность признака Sta+ по-
зволила использовать 71аи71ав качестве исходных линий для отбора му-
таций, специфически блокирующих или ослабляющих гйсг-мутагенез (при-
знак Sta~). Первоначально, используя в качестве мутагена азотистую кисло-
ту и проведя несколько последовательных бэккроссов, изолировали 4 клона
Sta, дающих каждый в половом потомстве от скрещивания с 71а или 71 а мо-
нотонное расщепление 2Sta+ : 2Sta~ (Devin, Koltovaya, 1981). Соответствую-
щие ядерные мутации независимого происхождения, обусловливающие
фенотип Sta , обозначили srml, srm2, srm3 и srm4 {srm — spontaneous rho~ mu-
tation).
Как показало непосредственное определение темпов спонтанных мута-
ций rho-, выделенные нами мутации srm не блокируют спонтанный г/го -му-
тагенез, а лишь более или менее ощутимо ослабляют его. У мутантов srm
темп спонтанных мутаций rho- остается гораздо более высоким, чем темпы
других спонтанных генетических изменений, таких как генные мутации или
потери и нерасхождение хромосом. В попарных сочетаниях мутации
srml-srm4 не усиливают действия друг друга (Девин, Колтовая, 1986).
В дальнейшем было установлено (Devin et al., 1987; Смирнова и др.,
1994а), что: 1) на спонтанную /7го -мутабильность дрожжевых клеток могут
оказывать заметное влияние нарушения хромосомного баланса; 2) мутация
srml не только изменяет спонтанную гйо~-мутабильность, но, в отличие от
трех других мутаций srm, способна вызывать значительные изменения мито-
тической стабильности хромосом у анеуплоидных клеток. Эти данные ука-
зывали на возможную общность механизмов, опосредующих (более вероят-
но - регулирующих) поддержание ядерных и митохондриальных наследст-
венных структур в дрожжевых клетках.
86
Такие механизмы вероятнее всего должны контролироваться множест-
венными генами. Следовательно, можно пытаться изолировать новые му-
танты srm, которые не будут аллельны мутанту srml, но будут сходны с ним
по фенотипическому проявлению. Попытки такого рода были предприняты
нами дважды. Первая из них привела к выделению мутации smi5 (Devin et al.,
1990).
В результате второй попытки (Девин и др., 1994) выделен еще ряд му-
тантов srm, в частности, srm8, srml2, srml5 и srml7, в половом потомстве ко-
торых моногенно наследовалась характерная для этих мутантов сниженная
спонтанная /•Ло -мутабильность. Ниже описываются особенности фенотипи-
ческого проявления некоторых мутаций srm.
2.2.2. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
И ОСОБЕННОСТИ ДЕЛЕНИЯ КЛЕТОК У SR/W-МУТАНТОВ
Клетки srml не обнаруживают выраженных морфологических отклоне-
ний от нормы. Гаплоидные клетки srm5 и диплоиды srm5/srm5 крупнее нор-
мальных клеток и имеют вытянутую форму. При споруляции клеток
srm5lsrm5 часто образуются линейные аски. Большинство клеток в культу-
рах линий srm8 имеет отчетливо вытянутую форму. При микроскопирова-
нии хгт?2-мутантных культур в большом количестве обнаруживаются:
а) клетки, форма которых заметно отклоняется от круглой, б) бледные
остатки лизировавшихся клеток. Мутации srml5 и srml7 не вызывают
значительных морфологических изменений клеток, по сравнению с
клетками SRM.
Мутации srm5, srm8, srml2 и srml5, существенно снижают скорость деле-
ния клеток, тогда как влияние мутаций srml и srm!7 на скорость деления от-
носительно невелико (табл. 2.1).
Клетки srm5 способны размножаться как при 18 °C, так и при 37 °C и
прекращают размножаться только вблизи границы физиологических темпе-
ратур - при 41,5 °C (клетки SRM+ при этой температуре еще размножаются).
В старых культурах линий srml2, несущих одновременно ос/гге-супресси-
бельную мутацию ade2-101, накапливается большое количество А<7е+-ревер-
тантов. Параллельно с восстановлением прототрофности по аденину у ре-
вертантов исчезают морфологические изменения, характерные для исход-
ных мутантов srml2, и восстанавливается практически нормальная скорость
деления клеток. По-видимому, мутация srml2 ос/гге-супрессибельна. Появ-
ление фенотипически нормальных клеток наблюдалось в мти/2-мутантных
культурах и в ходе проверки их способности расти при повышенной темпе-
ратуре (Девин и др., 1994). Возможно, этот эффект также вызывается су-
прессией мутации srm!2.
Клетки с мутацией srm8, напротив, размножаются при 37 °C существен-
но медленнее, чем при 30 °C, их морфологические аномалии при повышен-
ной температуре выражены сильнее. Таким образом, мутация srm8 обнару-
живает сходство с температурочувствительными мутациями. Однако ген
SRM8 может быть инактивирован (disrupted) без утраты жизнеспособности
клетками (Колтовая и др., 2001). Мутации srm8 и srml2 практически полно-
стью блокируют споруляцию у гомозиготных мутантных диплоидов (Девин
и др., 1994).
87
Таблица 2.1. Влияние мутаций srm на скорость размножения диплоидных дрожжевых
клеток (Колтовая и др., 1998b; 2001)
Генотип клеток Количество проверен- ных клонов Число генераций, прой- денных культурами Время генерации, мин
SRM+/SRM+ 3 3-5 77,0±1,9
srmllsrml 3 3-5 82,3±10,4
srm5/srm5 3 3-5 94,8±3,6
srm8lsrm8 3 2 200,7±9,0
srml2/srml2 4 3-6 126,4±3,2
srml5/srml5 3 7-9 113,0±12,0
srm!7/srml7 2 4 78,7±3,3
Известно, что для круглых гаплоидных клеток типично аксиальное поч-
кование, т.е. образование новых почек парой, состоящей из материнской и
дочерней клетки, вблизи места соединения последних, тогда как более вытя-
нутым диплоидным клеткам свойственно биполярное почкование (Freifelder,
1960). В этой связи представлял интерес характер почкования клеток srm8 и
srm!2, форма которых заметно отличается от круглой. Наблюдая за началь-
ным этапом образования колоний (на стадии четырех клеток), мы обнару-
жили, что для клеток SRM+ и srm5 характерно образование почек рядом
с местом соединения материнской и дочерней клеток. У мутантов srml2
и srm8 довольно часто (20%) наблюдается возникновение почки с противо-
положной стороны от места соединения материнской и дочерней клеток.
По-видимому, генам SRM8 и SRM12 принадлежит существенная роль в меха-
низме, определяющем аксиальный характер почкования нормальных гапло-
идных клеток.
2.2.3. КАРТИРОВАНИЕ МУТАЦИЙ SRM5 И SRM8
Среди продуктов мейоза у триплоида srm5lsrm5/+ идентифицировали
клон XI, по-видимому, являющийся дисомиком srm5{+. Клетки XI имели нор-
мальную круглую форму, однако в постмейотическом потомстве гибрида XI
и нормальной линии 71 ос появлялись srm5-мутантные длинные клетки. Ана-
лиз скрещиваний XI с четырьмя линиями, у которых по совокупности мар-
кированы 15 хромосом, позволил установить у линии XI дисомию по хромо-
соме II, а мутация srm5 оказалась сцепленной с маркером lys2 в правом пле-
че этой хромосомы. Дальнейший генетический анализ (табл. 2.2) подтвер-
дил, что srm5 действительно располагается на хромосоме II, в ее правом пле-
че, примерно на 10 сМ ближе к центромере, чем маркер tyrl (Devin et al.,
1990).
Анализ скрещиваний мутантов srm8 с дисомиками по хромосомам II, III,
IV, VII, VIII, X, XIV показал, что мутация srm8 локализуется в хромосоме X.
Далее анализировали скрещивания мутантов srm8 с близкородственными им
штаммами-анализаторами, несущими генетические маркеры хромосомы X
arg3 и ига2. Результаты тетрадного анализа, приведенные в табл. 2.2, пока-
зывают, что мутация srm8 находится на расстоянии около 10 сМ от локуса
arg3 по направлению к центромере. В этом же районе хромосомы X карти-
88
Таблица 2.2. Генетическое картирование мутаций srm5 и srm8 (Devin et al., 1990; Арман
и др., 1999)
Пара маркеров Проанализировано тетрад Соотношение типов тетрад Р : N : Т Генетическое расстояние, сМ
Iys2—srm5 133 61:0:74 27,4
tyrl-srm5 133 107:0:26 10,3
lys2-tyrl 133 41:0:94 34,8
ura2-srm8 124 33:6:85 48,8
arg3-srm8 209 163:0:46 10.6
ura2-arg3 93 28:0:65 35,0
рован ген SCP160 (Wintersberger et al., 1995). Однако плазмида с клонирован-
ным геном SCP160, предоставленная проф. Винтерсбергер, не комплементи-
ровала мутацию srm8. Очевидно, гены SCP160 и SRM8 не аллельны (Арман
и др., 1999).
2.2.4. ИДЕНТИФИКАЦИЯ ГЕНА SRM5
Генетическое картирование показало, что мутация srm5 локализуется в
непосредственной близости от локуса CDC28 и, возможно, даже внутри не-
го. Результаты тестов на аллелизм (Devin et al., 1990) и на функциональную
комплементацию мутации srm5 геном CDC28, клонированным в составе
кольцевой плазмиды (Koltovaya et al., 1998), подтвердили, что srm5 является
мутантным аллелем CDC28. В дальнейшем мутация srm5 будет обозначать-
ся cdc28-srm. Секвенирование показало, что мутация cdc28-srm должна вы-
зывать в аминокислотной последовательности белка Cdc28p замену G20S
(Н.А. Колтовая, личное сообщение).
2.2.5. КЛОНИРОВАНИЕ И ИДЕНТИФИКАЦИЯ
НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА SRM8
(Колтовая и др., 1998а; 2001)
Для клонирования гена SRM8 воспользовались чувствительностью кле-
ток srm8 к повышенной температуре. Штамм C3L (MATa srm8 1еи2) транс-
формировали ДНК геномной библиотеки дрожжей 2J351; среди трансфор-
мированных клонов, утративших температурочувствительность, характер-
ную для C3L, идентифицировали варианты с морфологически нормальными
круглыми клетками (клетки C3L, как и клетки других линий srm8, сильно
вытянуты). Один из идентифицированных таким образом клонов, обозна-
ченный C3L-2J-1, был подвергнут дальнейшему анализу.
Из культуры клеток C3L-2J-1 выделили плазмиду размером около
9 т.п.н., обозначенную 2J-1. Соответственно за вычетом длины ДНК векто-
ра YEp351, клонированный фрагмент ДНК должен иметь размер около
3,5 т.п.н.
Плазмидой 2J-1 ретрансформировали клетки штамма C3L (srm8). Мито-
тическая стабильность плазмиды 2J-1 оказалась относительно высокой
89
Таблица 2.3. Митотическая стабильность плазмид с оп-последовательностью 2|лш ДНК
(Колтовая и др., 2001)
Штамм-реципиент Плазмида
YEpl3 2J-1
Количест- во изучен- ных кло- нов Просмот- рено коло- ний Доля коло- ний, содер- жащих плазмиду, % Количест- во изучен- ных кло- нов Просмот- рено коло- ний Доля коло- ний, содер- жащих плазмиду, %
71L(WW+) 5 796 57,5+8,3 4 648 10,7±3,2
C3L 4 970 23,0+5,3 2 405 69,1± 10,5
C3L (ретрансфор- манты) — — — 3 728 71,7±10,5
(около 80%) как у первичного трансформанта C3L-2J-1, так и у ретрансфор-
мантов (табл. 2.3). Мы не располагали вектором YEp351, исходным для 2J-1,
однако имевшийся в нашем распоряжении вектор YEpl3, структурно сход-
ный с YEp351, характеризуется относительно высокой митотической ста-
бильностью в клетках 71L (SRM+) и существенно менее стабилен в клетках
C3L (srm8) (табл. 2.3).
Таким образом, мутация srm8 сопровождается снижением митотической
стабильности плазмиды YEpl3 {ori 2pm ДНК). По всей вероятности, ген
SRM8 участвует в поддержании плазмид, содержащих в своем составе огг-по-
следовательность из 2цш-плазмиды, в том числе и плазмиды YEp351, исход-
ной для 2J-1. Соответственно мутация srm8 должна вызывать снижение ми-
тотической стабильности таких плазмид. Относительно высокая митотиче-
ская стабильность плазмиды 2J-1 в клетках srm8 по всей вероятности обу-
словлена присутствием в ней вставки размером около 3,5 т.п.н., которая
предположительно комплементирует мутацию srm8. Иными словами, рас-
смотренные данные указывают на возможность наличия в составе 2J-1 кло-
нированной последовательности гена SRM8.
В подтверждение высказанного предположения трансформанты C3LD
{srm8!srm8), получившие плазмиду 2J-1, а) менее чувствительны к у-облуче-
нию (см. раздел 3), чем трансформанты того же реципиента, несущие плаз-
миду YEpl3 (сходную с исходным вектором для 2J-1) и б) способны спорули-
ровать, в отличие от реципиентных клеток или трансформантов с YEpl3
(данные не приведены).
Таким образом, присутствие в xrmS-мутантных клетках плазмиды 2J-1
сопровождается устранением морфологических изменений клеток, а также
восстановлением у гомозиготных диплоидов нормальной радиорезистентно-
сти и способности спорулировать. Кроме того, фрагмент ДНК, клонирован-
ный в 2J-1, по-видимому, обеспечивает относительно высокую (сравнитель-
но с YEpl3) митотическую стабильность этой плазмиды в s/mS-мутантных
клетках, количественно соответствующую митотической стабильности
YEpl3 в клетках 71L {SRM+). Перечисленные свойства 2J-1 позволяют кон-
статировать функциональную комплементацию мутации srm8 фрагмен-
том ДНК, клонированным в этой плазмиде. Митотическая стабильность
90
YJL076w
5' ________EXZZZZZZ2SXZZXZZZZXXXZZZXZZZ3_____________5'
3' Ш-------------------------------^НМ--------------- 3’
YJL077c YJL075c
Клонированный фрагмент ДНК
Рис. 31. Схема участка Х-хромосомы S. cerevisiae (вверху), содержащего открытые рамки
считывания YJL077c (392 п.н.) и YJL076W (3566 п.н.), которые частично присутствуют в
клонированном фрагменте ДНК (внизу)
плазмиды 2J-1 у трансформантов 71L (SRM+) неожиданно оказалась низкой
(см. табл. 2.3). Природа этого эффекта нуждается в специальном исследова-
нии. Возможно, он вызван присутствием в клетках множественных копий
последовательности SRM8.
Установлены нуклеотидные последовательности длиной 760 п.н. с обоих
концов клонированного фрагмента. Анализ нуклеотидной последователь-
ности с использованием баз данных SGD (BLAST) выявил присутствие в кло-
нированной последовательности фрагментов двух дивергентно транскриби-
руемых рамок считывания, локализованных на хромосоме X (как и следова-
ло ожидать на основании результатов генетического картирования) и отсто-
ящих друг от друга на расстояние менее 200 п.н. (рис. 31). Одна из этих ра-
мок, YJL076w, имеет длину 3566 н., другая, YJL077C, - 392 и. Клонированная
нами последовательность ДНК содержит фрагмент YJL076w, кодирующий
80% последовательности соответствующего белка, начиная с N-конца,
и 38% последовательности YJL077c (вся последовательность YJL077c в 9 раз
короче последовательности YJL076w).
С помощью ПЦР описанный выше клонированный фрагмент рамки
YJL076w достроен до ее полноразмерной величины согласно данным банка
нуклеотидных последовательностей S. cerevisiae. Затем полученную конст-
рукцию использовали для инактивации (disruption) соответствующего хро-
мосомного гена. Нулевой мутант по рамке YJL076w фенотипически не от-
личался от мутантов srm8 и оказался аллелен этим мутантам: скрещиваясь с
ними, он давал диплоиды, характеризовавшиеся, как и диплоиды srm8/srm8,
существенно сниженной скоростью деления, специфическими морфологи-
ческими изменениями клеток, утратой способности спорулировать. Таким
образом, гену SRM8 соответствует открытая рамка считывания YJL076w.
Как следует из публикаций последних лет, гену SRM8 идентичен ген
CEIUNET1, который опосредует прохождение клеточного цикла, являясь
негативным регулятором выхода из митоза (Visintin et al., 1999; Shou et al.,
1999). Клетки с инактивированным геном NETl жизнеспособны, но имеют
аномально вытянутую форму, часто образуют цепочки и размножаются
медленно как на сбраживаемом, так и на несбраживаемом субстрате подоб-
но описанным нами клеткам srm8. Помимо изменений регуляции клеточно-
го цикла, у клеток netl обнаружены митохондриальные аномалии. Так, у му-
танта с инактивированным геном NET1 обнаруживается снижение митохон-
дриального мембранного потенциала (Entian et al., 1999).
91
2.2.6. ИДЕНТИФИКАЦИЯ ГЕНА SRM12
(Колтовая и др., 1998а)
Ген SRM12 был клонирован в составе фрагмента ДНК длиной 11,6 т.п.н.
из геномного банка дрожжей, сконструированного на основе вектора р366.
Рестрикционное картирование и частичное секвенирование клонированного
фрагмента ДНК позволили определить его положение на хромосоме XVI
S. cerevisiae. Данный фрагмент содержит несколько рамок считывания. Суб-
клонирование показало, что ген SRM12, по всей вероятности, идентичен ге-
ну SUP110IHFI1IADA1 (Horiuchi et al., 1997), кодирующему транскрипцион-
ный коактиватор и первоначально изученному в лаборатории проф.
Т.Д. Фокса (Корнеллский университет, США) (Brown, 1994).
Профессор Фокс любезно предоставил нам плазмиду pNGB52, несущую
клонированный ген SUP ПО, и штамм дрожжей NGB121 с инактивирован-
ным геном SUP110 (SUP 110::LEU2).При скрещивании этого штамма с
srml2-мутантом образовывались медленно размножающиеся и не способ-
ные спорулировать диплоиды, фенотипически неотличимые от гомозигот
srml2/srml2. Плазмида pNGB52 комплементировала мутацию srml2. Пере-
численные данные свидетельствуют об идентичности SRM12 гену
SUP110IHF11IADA1.
2.3. ГЕНЫ SRM И ПОДДЕРЖАНИЕ НАСЛЕДСТВЕННЫХ СТРУКТУР
В ДРОЖЖЕВЫХ КЛЕТКАХ
2.3.1. МУТАЦИИ SRM
И ПОДДЕРЖАНИЕ МИТОХОНДРИАЛЬНОГО ГЕНОМА
2.3.1.1. Спонтанная гйсг-мутабильность мутантов srm
Частоты спонтанных мутантов rho- в культурах клеток различных гено-
типов (Devin, Koltovaya, 1981; Devin et al., 1990; Девин и др., 1994) приведены
в табл. 2.4, из которой видно, что изученные мутации srm снижают спонтан-
ную rhcr- мутабильность дрожжевых клеток в десятки раз.
2.3.1.2. Индукция мутаций rho- бромистым этидием
у клеток различных генотипов
От скрещиваний каждого из мутантов srml, cdc28-srm, srm8, srml2, srml5
и srml7 с родительскими линиями 71a или 71a отобрали по 2 полных тетра-
ды. Для каждого моноспорового клона из этих тетрад определили чувстви-
тельность к мутагенному действию БЭ. Клоны srml, cdc28-srm и srm8, по
сравнению с клонами SRM+, оказались существенно менее чувствительными
к мутагенному действию БЭ (Девин, Колтовая, 1986; Devin et al., 1990; Кол-
товая и др., 2001). Существенного влияния мутаций srml2, srm!5, srml7 на
г/ггг-мутабильность клеток под действием БЭ не обнаружено (данные не
приведены). Мутанты, резистентные к митохондриальному мутагену броми-
стому этидию (БЭ) (Slonimski et al., 1968), описаны у дрожжей Kluyveromyces
lactis (Brunner et al.,1973) и у .S', cerevisiae (Bech-Hansen, Rank, 1972; 1973;
Gouhier, Mounolou, 1973). У К. lactis мутант по гену РМА1, кодирующему
92
Таблица 2.4. Влияние мутаций srm на частоту спонтанных мутантов rho в культурах
дрожжевых клеток
А. Диплоидные культуры
Генотип штаммов Число повторностей Число просмотренных колоний Частота мутантов rho , %
SRM+/SRM+ 3 2024 52,0±3,0
srml 1 srml 3 4083 1,1+0,3
cdc28-srmlcdc28-srm 4 4163 3,1±О,7
Б. Гаплоидные культуры
Генотип клонов Количество клонов Суммарное число про- смотренных колоний Частота мутантов rho , %
srm8 4 7373 3,4+1,1
SRM+ 4 14 782 74,6+6,5
srml 2 4 1879 1,8+0,8
SRM+ 4 4167 82,9+5,6
srml5 3 8892 2,7+0,9
SRM+ 3 11 017 48,2+4,0
srml 7 4 5969 23,7+18,4
SRM+ 4 И 678 71,5+10,7
Н+-АТРазу плазматической мембраны, проявлял резистентность к БЭ и де-
фектность по транспорту ионов К+ (Miranda et al., 1995). Вообще, для значи-
тельной доли (10-20%) БЭ-резистентных мутантов у К. lactis имеет место де-
фектность по транспорту БЭ и одновременно по транспорту одновалентных
катионов, особенно ионов КL Транспорт в клетку молекул БЭ и катиона К+
зависит от мембранного потенциала и, по-видимому, осуществляется с уча-
стием одних и тех же носителей (Brunner et al., 1982; Pena, Ramirez, 1975;
1991). Поскольку у мутантов netl (=srm8) S. cerevisiae обнаруживаются изме-
нения митохондриального мембранного потенциала (Entian et al., 1999), мож-
но предположить, что обнаруженная нами резистентность мутанта srm8 к
БЭ связана с пониженной проницаемостью клеток и/или митохондрий для
красителя.
2.3.2. ВЛИЯНИЕ МУТАЦИЙ SRM
НА МИТОТИЧЕСКУЮ СТАБИЛЬНОСТЬ ХРОМОСОМ
Предпринятая оценка влияния мутаций srm на митотическую стабиль-
ность избыточных хромосом у дисомиков выявила примерно стократное по-
вышение темпа спонтанной потери хромосомы IV у клеток srml при отсут-
ствии существенного влияния srml на митотическую стабильность дисоми-
ков по хромосоме VII (Devin et al, 1987; Devin et al., 1990), примерно двадца-
тикратное и примерно стократное повышение темпа спонтанной потери со-
ответственно хромосомы IV и хромосомы VII у клеток cdc28-srm (Просвиро-
ва, Девин, 1988; Devin et al., 1990), примерно тридцатикратное повышение
93
Таблица 2.5. Митотическая стабильность VII хромосомы у диплоидов разных генотипов
Генотип штаммов Количество проверенных клонов Частота спонтанных потерь хромосом
srml/srml 4 (1,4+0,5) х 10~7
srml!SRM* 4 (1,4+0,4) х 10~7
cdc28-srm/cdc28-srm 4 (0,9±0,3) х 10 7
cdc28-srmlSRM* 4 (4,4+1,3) х I0 7
srni8/srm8 3 (4,2+2,1) х 10~5
srm8/SRM+ 2 (1,5+0,6) х 1(Г7
srmI2/srml2 4 (6.2+3,9) х I0 7
srrnl2!SRM+ 1 0,9 х 1 (Г7
srml5!srml5 1 1,6 х 10~7
srml7!srml7 1 2,9 х 10~7
темпа спонтанной потери хромосомы XIV у клеток srml2 по сравнению с ди-
сомиками SRM+ (Девин и др., 1994). Значительно более слабое, но все-таки
статистически значимое повышение величины упомянутого темпа вызыва-
ла также мутация srml5. Оценку влияния мутаций srm8 и srml 7 на поддержа-
ние избыточных хромосом провести не удалось из-за очень медленного раз-
множения соответствующих мутантных дисомиков. Мутации srm2, srm3 и
srm4 не оказывали заметного влияния на поддержание хромосом.
Предпринята попытка оценить влияние мутаций srm на точность мито-
тической трансмиссии хромосом у эуплоидных клеток. Для этой цели ис-
пользовали специальную генетическую систему (Parry, Zimmermann, 1976).
Используя специально сконструированные .что-мутантныс и немутантные
цис-гетерозиготы по маркерам хромосомы VII ade6/ + cyh2/ + leul/+, следи-
ли за утратой гомолога, несущего нормальные аллели указанных генов. Как
видно из табл. 2.5, у линий srm8lsrm8, по сравнению с линиями SRM+, часто-
та спонтанной утраты хромосомы VII повышена примерно на два порядка,
а у линий srml2lsrml2 эта частота повьлиспа в несколько раз. Приведенные
данные подтверждают участие генов SRM8 и SRM12 в поддержании хромо-
сом клетками дрожжей. Мутации srml, cdc28-srm, srml5 и srm!7 не вызыва-
ют заметного увеличения частоты спонтанной утраты хромосомы VII эуп-
лоидными клетками (табл. 2.5).
2.3.3. ГЕНЫ SRM И ПОДДЕРЖАНИЕ РЕКОМБИНАНТНЫХ
НАСЛЕДСТВЕННЫХ СТРУКТУР КЛЕТКАМИ ДРОЖЖЕЙ
2.3.3.1. Влияние мутаций srm на митотическую стабильность
рекомбинантных плазмид
Мутация srml примерно вдвое снижает темп спонтанной потери дрож-
жевыми клетками кольцевых минихромосом, содержащих элемент ARS1 и
последовательности CEN, тогда как мутация cdc28-srm повышает этот темп
тоже примерно вдвое (Devin et al., 1990). Качественно сходное влияние ока-
зывали упомянутые 2 мутации на поддержание клетками бесцентромерной
94
кольцевой плазмиды pTl (ARS1 TRP1) (Смирнова и др., 1995). По-видимому,
влияние мутаций srml и cdc28-srm на поддержание кольцевых минихромо-
сом может быть опосредовано не через цис-активные центромерные после-
довательности.
Мутации srml и cdc28-srm не оказывали влияния на митотическую ста-
бильность плазмид YEpl3 и pYF91, несущих ori 2pm ДНК. Очевидно, меха-
низм, обеспечивающий относительно высокую митотическую стабильность
плазмид с on 2pm ДНК и зависимый от функций, кодируемых этой эндоген-
ной плазмидой (Broach, 1982), не зависит сколько-нибудь значительно от ге-
нов SRM1 и CDC28.
Наконец, мутации srml и cdc28-srm вызывали заметное повышение ис-
ходно весьма низкой митотической стабильности бесцентромерных плазмид
с различными хромосомными элементами ARS. По-видимому, соответству-
ющие два гена принимают участие в механизмах, определяющих эффектив-
ность репликации кольцевых рекомбинантных плазмид и/или асимметриче-
скую передачу бесцентромерных плазмид при делении клеток (Murray,
Szostak, 1983а).
Было также изучено влияние других мутаций srm на митотическую ста-
бильность кольцевой минихромосомы YCp50 (CEN4 ARS1) и бесцентромер-
ной кольцевой плазмиды YRp 12 (ARS1). Указанными плазмидами транс-
формировали клетки специально сконструированных близкородственных
ято-мутантных и немутантных урацилзависимых (игаЗ) гаплоидных штам-
мов-реципиентов (Колтовая и др., 2001).
Как видно из табл. 2.6А, для каждой из четырех групп .отл-мутантных
трансформантов, имеющих нормальный митохондриальный геном (rho*), по
сравнению с группой трансформантов SRM* rho*, митотическая стабиль-
ность кольцевой минихромосомы YCp50 оказывается сниженной. Снижение
митотической стабильности бесцентромерной плазмиды YRp 12 обнару-
живается у мутантов srml2, srml5, srml 7. Очевидно, гены SRM8, SRM 12,
SRM15 и SRM17, подобно генам SRM1 и CDC28, участвуют в поддержании
дрожжевыми клетками кольцевых рекомбинантных плазмид, содержащих
хромосомный элемент ARS.
2.3.3.2. Повреждения митохондриального генома клеток srm
способны модифицировать митотическую стабильность плазмид
Имеются немногочисленные литературные данные, показывающие, что
поддержание рекомбинантных плазмид в дрожжевой клетке зависит от
функционирования ее митохондриального генома. Митотическая стабиль-
ность плазмиды Rcp-CEN3 (ARS рДНК, CEN3) оказалась заметно выше у
мутантов rho~, полученных после обработки бромистым этидием, чем у ды-
хательно-компетентных клеток исходного штамма (Ларионов и др. 1983).
В другой работе (Irie et al., 1991) обнаружено еще более сильное стаби-
лизирующее влияние rho°- и rho -мутаций на поддержание в клетках S. cere-
visiae плазмиды, выделенной из клеток Zygosaccharomyces rouxii и содержа-
щей две ARS-последовательности. Эта стабилизация плазмид не связана не-
посредственно с нарушением дыхания, поскольку она не наблюдается у
ядерных рег-мутан^ов, которые имеют дыхательно-недостаточный фено-
тип, но сохраняют интактный митохондриальный геном. Продемонстриро-
95
Таблица 2.6. Митотическая стабильность плазмид YCp50 (А) и YRpll (В) у гаплоидных
штаммов различных генотипов при размножении клеток в иеселективиых (А) и
селективных (Б) условиях
Генотип клонов Количество изученных клонов Просмотрено колоний Доля колоний, сохранив- ших плазмиду, %
SRM+ rho+ 5 1641 41,6+11,6
rho 7 2965 42,3+3,8
rho° 13 4407 38,9+5,4
srm8 rho+ 4 1240 23,1 ±5,4
rho~ 5 1673 41,3+10,2
srml2 rho* 8 3153 18,0+3,1
rho~ 8 396 13,1+3,0
srml5 rho+ 6 1850 18,1+5,1
rho~ 5 1010 20,6+7,0
srml 7 rho* 8 194ч 28,7+2,0
Генотип клонов Количество изученных клонов Просмотрено колоний Доля колоний, сохранив- ших плазмиду, %
SRM+ rho+ 8 3383 34,3+2,6
rho 5 2667 38,9+2,4
rho° 7 1728 38,2+1,7
srm8 rho+ 6 1956 34,1+5,5
rho~ 7 2106 48,7+4,0
srml 2 rho+ 7 3390 6,4+1,7
srml5 rho+ 7 2024 10,1+1,3
rho~ 7 1503 5,8+1,4
srml7 rho+ 8 1938 16,8+0,9
вана невозможность совместного поддержания в клетках S. cerevisiae
мтДНК и плазмиды-киллера из Kluyveromyces lactis (Gunge, Yamane. 1984).
Сходная ситуация может иметь место и для плазмиды из Z. rouxii. С другой
стороны, мутации дыхательной недостаточности могут усиливать экспрес-
сию ядерных генов (Puglisi, Algeri, 1971; Parikh et al., 1987; Kaisho, 1989), в том
числе, возможно, и генов, участвующих в поддержании этой плазмиды.
Спонтанно возникшие цитоплазматические мутации petite в большинст-
ве своем являются мутациями rho~, т.е. необратимыми дегенеративными пе-
рестройками митохондриального генома. В группах мта-мутантых транс-
формантов, упомянутых в предыдущем параграфе, отбирали для анализа
спонтанно возникшие мутанты petite, сохранившие плазмиды. Как видно
из табл. 2.6, А и Б, у клеток SRM+ дефекты генома митохондрий не сказыва-
ются на поддержании изученных плазмид YCp50 и YRpl2. Вместе с тем
выявлены по меньшей мере два случая модификации поддержания плазмид
у мутантов rhcr, а именно возникновение гЛ/г-мутаций сопровождалось
повышением митотической стабильности обеих плазмид в клетках srm8
и снижением митотической стабильности YRpl2 в клетках srml5 (у 2 = 21,2;
Р < 0,001).
96
Таким образом, в поддержании дрожжевыми клетками рекомбинантных
генетических структур, по-видимому, играют роль ядерно-митохондриаль-
ные генетические взаимодействия с участием хотя бы некоторых ге-
нов SRM.
3. ГЕНЫ SRM, CHECKPOINT-КОНТРОЛЬ
И РАДИОЧУВСТВИТЕЛЬНОСТЬ ДРОЖЖЕЙ
3.1. ПРЕДВАРИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
Известно, что генетически обусловленные нарушения поддержания на-
следственных структур, прежде всего хромосом, часто сопровождаются по-
вышением чувствительности клеток к ДНК-тропным повреждающим аген-
там. С другой стороны, у нормальных эукариотических клеток, в частности,
клеток дрожжей, аномалии, возникающие на протяжении цикла клеточного
деления, например повреждения наследственных структур, способны вызы-
вать остановку клеточного цикла. Этот ответ клеток на возникающие внут-
риклеточные нарушения опосредован множественными генами; предполо-
жительно продукты некоторых таких генов сканируют хромосомную ДНК
и в случае обнаружения повреждений обеспечивают задержку клеточного
деления. Задержка, как полагают, дает клеткам дополнительное время для
репарации поврежденной ДНК. В отсутствие задержки в митоз будут всту-
пать клетки с генетическими повреждениями, потомство которых скорее
всего окажется дефективным или нежизнеспособным. Механизм обратной
связи, обеспечивающий остановку клеточного цикла при нарушении его
нормального прохождения и именуемый checkpoint-контролем, обнаружен у
Saccharomyces cerevisiae более 15 лет назад (Weinert, Hartwell, 1988). (Одному
из авторов открытия, Л. Хартуэллу, в 2001 г. присуждена Нобелевская
премия). Последствиями нарушений checkpoint-регуляции клеточного деле-
ния в ответ на повреждения ДНК во многих случаях являются снижение точ-
ности митотической передачи компонентов наследственного аппарата и по-
вышение чувствительности клеток к летальным эффектам ДНК-тропных
агентов (Weinert, Hartwell, 1990). Значительный интерес исследователей к
рассматриваемому регуляторному механизму связан, в частности, с широко
распространившимся представлением о тесной связи между нарушениями
checkpoint-контроля и малигнизацией клеток (Morgan, Kastan, 1997). К насто-
ящему времени идентифицированы некоторые гены дрожжей, играющие
ключевую роль в checkpoint-контроле.
Согласно современным представлениям о механизме checkpoint-контро-
ля, запускаемого в действие при наличии повреждений в ДНК, гены RAD9,
RAD17 и RAD24 действуют на первых этапах узнавания повреждений. Бел-
ковый комплекс RFC-Rad24, по-видимому, играет роль в загрузке (loading)
комплекса Radl7-Mec3-Ddcl или репарационных ферментов на поврежде-
ния ДНК (Longhese et al., 1998). Протеинкиназа Rad53 участвует в киназном
каскаде передачи сигнала, а активность другой киназы, Cdc28 [серин-трео-
ниновой протеинкиназы p34cdc2/28, играющей центральную роль в регуляции
клеточного цикла (Mendenhall, Hodge, 1998)], существенна на завершающих
4. Проблемы и перспективы...
97
этапах механизма обратной связи, который задерживает смену фаз клеточ-
ного цикла. Протеинкиназа Rad53 обеспечивает ингибирование киназы
Cdc5, необходимой для деградации циклинов - регуляторных субъединиц
киназы Cdc28 (Sanchez et al., 1999). Поддерживая таким образом высокую
активность протеинкиназы, Cdc28, Rad53 препятствует, например, выходу
клеток из митоза и завершению цикла деления, (оба события происходят
при инактивации киназы Clb2/Cdc28). Эту задержку событий клеточного ци-
кла, возникающую в ответ на повреждения ДНК, снимают мутации как в ге-
не RAD53, так и в гене CDC28, а также мутации в генах RAD9 и RAD24, на-
рушающие распознавание повреждений ДНК.
Мутации перечисленных 4 генов, вовлеченных в один общий механизм
checkpoint-контроля/определения радиочувствительности клеток, при их фе-
нотипическом проявлении должны, очевидно, маскировать присутствие
друг друга (эпистаз). Мутации, полностью инактивирующие гены RAD53 и
CDC28, легальны. Поэтому следует ожидать, что мутации rad9A и rad24A,
полностью блокирующие функции соответствующих генов, будут эписта-
тичны по отношению к нелегальным (leaky) мутациям rad53 и cdc28 (а пос-
ледние, соответственно, гипостатичны по отношению к rad9A и rad24A).
Взаимодействие мутаций rad53 и cdc28, которые у жизнеспособных клеток
блокируют функции соответствующих генов не полностью, не обязательно
должно носить характер эпистаза, возможен аддитивный или даже синерги-
ческий эффект. Вместе с тем радиочувствительность двойных мутантов
rad53 cdc28 не должна, вероятно, быть выше радиочувствительности клеток
с эпистатичной мутацией rad9A или rad24A. Как будет видно из материала,
приводимого в следующем параграфе, такие предположения, основанные на
современных моделях checkpoint-контроля (Lowndes, Murguia, 2000), в опыте
подтверждаются лишь отчасти. Мутации rad9A и rad24A действительно эпи-
статичны по отношению к каждой из мутаций cdc28 и rad53. Однако радио-
чувствительность двойных мутантов rad53 cdc28 оказывается выше радио-
чувствительности мутантов rad9A или rad24A. Этот результат указывает
(по-видимому, впервые) на существование иного, зависящего от генов
CDC28 и RAD53, но 7?АП9-независимого механизма определения радиочув-
ствительности клеток.
3.2. ГЕНЫ SRM И РАДИОЧУВСТВИТЕЛЬНОСТЬ
ДРОЖЖЕВЫХ КЛЕТОК
Данные, позволившие предположить участие гена CDC28 в checkpoint-
контроле, были опубликованы сравнительно недавно (Li, Cai, 1997;
Koltovaya et al., 1998). Однако еще более 10 лет назад мы впервые обнаружи-
ли, что мутация cdc28-srm, вызывает повышение чувствительности клеток к
ионизирующей радиации (Колтовая, Девин, 1990). У дрожжей известны два
основных пути репарации повреждений ДНК, вызванных ионизирующей ра-
диацией: /МП52-зависимый и /?АП6-зависимый путь (Game, 2000). Анализ
попарных взаимодействий мутаций cdc28-srm, rad52 и rad6 показал, что обе
мутации rad не являются эпистатичными по отношению к cdc28-srm, т.е. ген
CDC28, по-видимому, не принадлежит непосредственно ни к одному из упо-
мянутых двух основных путей репарации. Вместе с тем эпистатичной по от-
98
Доза, Гр
Рис. 32. Типичные кривые выживания для диплоидных штаммов с различными генотипами
ношению к cdc28-srm является мутация rad9, т.е. обе эти мутации затрагива-
ют, а соответствующие гены вовлечены в один и тот же механизм, модули-
рующий радиочувствительность клеток (Koltovaya et al., 1998). RAD9, как
уже упоминалось, принадлежит к checkpoint-генам, контролирующим регу-
ляцию клеточного цикла в его определенных точках по механизму обратной
связи (Weinert, Hartwell, 1990). Таким образом, данные о влиянии мутации
cdc28-srm на радиочувствительность дрожжевых клеток согласуются с пред-
ставлением об участии гена CDC28 в checkpoint-контроле.
Мы попытались также оценить влияние других мутаций srm на чувстви-
тельность дрожжевых клеток к летальному действию у-излучения. С этой
целью использовали упомянутые ранее диплоидные штаммы, цис-гетерози-
готные по маркерам VII хромосомы. Типичные кривые выживания для дип-
лоидных штаммов с генотипами соответственно SRM+/srm8, srm8lsrm8,
srml2lsrml2, srml5lsrml5, srml7lsrm!7, приведенные на рис. 32 (Колтовая и
др., 2001), показывают, что гомозиготы по рецессивным мутациям srm8,
srml2 и srm!7 более чувствительны к летальному действию у-излучения, чем
гетерозиготный штамм, проявляющий нормальную радиочувствительность.
Мутации srml (Колтовая и др., 1998b) и srml5 не обнаруживают заметного
влияния на радиочувствительность клеток.
4*
99
Не исключено, что другие мутантные аллели генов SRM1 и SRM15 спо-
собны изменять также и радиочувствительность, однако более вероятным
представляется предположение об иерархичности генетического контроля
поддержания наследственных структур в дрожжевой клетке. В соответствии
с этим предположением гены SRM5, SRM8 и SRM12 находятся на более вы-
соких ступенях иерархической лестницы, чем гены SRM1, и SRM15. Соответ-
ственно, у мутаций первых трех генов по сравнению с остальными мутация-
ми srm плейотропное действие выражено шире.
Отметим, что мутация rad9 оказалась эпистатичной не только по отно-
шению к мутации cdc28-srm, но и к мутации srm8 (данные не приведены).
У .отиЛ’-мутантных клеток пострадиационная задержка деления существенно
уменьшена по сравнению с клетками SRM+ (Н.А. Колтовая, личное сообще-
ние). Можно предполагать, что ген SRM8, наряду с CDC28, вовлечен в гене-
тические механизмы checkpoint-контроля.
Изучение генетической системы checkpoint-регуляции часто основыва-
ется на совокупном анализе эффектов, относящиеся как к остановке кле-
точного цикла, так и к чувствительности клеток к повреждающим агентам.
Для формирования адекватных представлений о функциях checkpoint-генов
представляются, однако, целесообразными также раздельное рассмотрение
и систематическое сопоставление сведений о характере генных взаимодей-
ствий, полученных при использовании каждого из указанных критериев.
Имея это в виду, мы анализировали влияние парных сочетаний мутаций в ге-
нах, опосредующих различные этапы checkpoint-контроля, на чувствитель-
ность дрожжевых клеток к у-излучению.
Проведя скрещивания исходных линий, несущих мутации checkpoint-ге-
нов, с изогенными друг другу линиями 71а или 71а и ряд последовательных
бэккроссов потомства этих скрещиваний с родителями 71а и 71а, мы скон-
струировали близкородственные диплоидные штаммы, несущие в гомози-
готном состоянии мутации генов RAD9, RAD24, RAD53 и CDC28 поодиночке
и в парных сочетаниях. Чувствительность к у-излучению определяли для
групп линий с одинаковыми генотипами (по 3 линии в каждой группе). Кри-
вые выживания изученных линий после у-облучения, приведенные на
рис. 33-35, соответствуют усредненным данным для соответствующих групп
линий с одинаковыми генотипами.
Ранее анализ радиочувствительности одиночных и двойных мутантов
показал, что мутация rad9A эпистатична по отношению к мутации cdc28-srnr,
на этом основании нами было высказано предположение об участии гена
CDC28 в checkpoint-контроле и о повышении радиочувствительности клеток
cdc28-srm как следствии мутационного нарушения checkpoint-контроля
(Koltovaya et al., 1998). В подтверждение этого предположения эпистатичной
по отношению к cdc28-srm оказалась и мутация rad24A\ радиочувствитель-
ность двойных мутантов cdc28-srm rad24A совпадает с радиочувствительно-
стью наиболее чувствительного из одиночных мутантов - rad24A (рис. 33).
У двойных мутантов rad9A rad53 радиочувствительность также не выше,
чем у каждого из соответствующих одиночных мутантов (рис. 34). Этот ре-
зультат согласуется с некоторыми молекулярно-биологическими данными
(de la Torre-Ruiz et al., 1998; Navas et al., 1996; Sun et al., 1998). Показано, что
в ответ на повреждения ДНК (но не ингибирование репликации) белок
Rad9p фосфорилируется и взаимодействует с С-концевым доменом белка
100
Рис. 33. Кривые выживания после у-о б лучения диплом дов, гомо- и гетерозиготных по мута-
циям cdd28-srm и rad24\
Кривые соответствуют результатам усреднения экспериментальных значений радиочувствительности
клеток, полученных в каждом случае для 3 штаммов одинакового генотипа: показаны среднеквадратич-
ные ошибки. Для сравнения дана кривая, ожидаемая при аддитивности влияния двух мутаций на радио-
чувствительность клеток
Rad53p. Это взаимодействие необходимо для фосфорилирования белка
Rad53p, индуцированного повреждениями ДНК, остановки в G2/M и транс-
крипционного ответа. Вместе с тем приведенные данные о взаимодействии
белков Rad9p и Rad53p не позволяют с уверенностью делать универсальные
прогнозы относительно взаимодействия мутаций rad9 и rad53: например,
эффекты rad9& и rad53 в отношении чувствительности клеток к MMS адди-
тивны (Paulovich et al., 1997).
Неожиданный результат получен при анализе взаимодействия между
мутациями cdc28-srm и rad53. Совместное влияние этих мутаций на радио-
чувствительность клеток характеризуется аддитивностью эффектов отдель-
ных мутаций (рис. 35). При этом, во-первых, можно с определенностью ут-
верждать, что ни одна из рассматриваемых двух мутаций не является эписта-
тичной по отношению к другой, и, во-вторых, сочетание мутаций cdc28-srm
rad53 определяет заметно более высокую радиочувствительность клеток по
сравнению с одиночной мутацией rad9A, которая эпистатична по отноше-
нию к каждой из мутаций cdc28-srm и rad53.
101
Рис. 35. Кривые выживания после у-облучения диплоидов, гомо- и гетерозиготных по мута-
циям cdc28-srm и rad53
Кривые соответствуют результатам усреднения экспериментальных значений радиочувствительности
клеток, полученных в каждом случае для 3 штаммов одинакового генотипа; показаны среднеквадратич-
ные ошибки. Для сравнения дана кривая, ожидаемая при аддитивности влияния двух мутаций на радио-
чувствительность клеток
Возможно, 7М£)9-независимый механизм оказывает влияние на радио-
чувствительность клеток и обеспечивается протеинкиназами Cdc28 и Rad53,
фосфорилирующими общий субстрат, в результате чего достигается адди-
тивность эффектов мутаций cdc28-srm и rad53.
Несомненно, участие checkpoint-генов в определении чувствительности
клеток к повреждающим агентам выходит за рамки роли этих генов в check-
point-регуляции. В пользу такого заключения свидетельствует, например,
невозможность полностью снять повышение чувствительности к поврежда-
ющим агентам у мутантов S. cerevisiae rad9 (Weinert, Hartwell, 1988;
Aboussekhra et al., 1996), rad53 (Allen et al., 1994) и mecl (Bashkirov et al., 2000)
за счет специально вызванной дополнительной задержки клеточного цикла.
Отметим также, что у мутантных клеток chkl затронута способность оста-
навливать клеточный цикл на границе G2/M в ответ на индуцированные по-
вреждения ДНК, но не изменена чувствительность к летальным эффектам
102
этих повреждений (Sanchez et al., 1999). Мутант по гену геликазы SGS1,
у которого затронут S/M-checkpoint, не обнаруживает повышенной чувстви-
тельности к у- и УФ-излучению (Frei, Gasser, 2000)]. В ряде случаев повыше-
ние радиочувствительности у мутантов S. cerevisiae по checkpoint-генам не
удается полностью объяснить нарушениями собственно checkpoint-контро-
ля. Возможно, соответствующие мутации также препятствуют активации
репарационной системы и/или оптимальной доставке ее компонентов к сай-
ту повреждения ДНК (Longhese et al., 1998). Роль checkpoint-генов в механиз-
мах, определяющих чувствительность клеток к ДНК-тропным агентам, в
частности, в механизмах репарации ДНК, представляется заслуживающей
дальнейшего анализа.
ЗАКЛЮЧЕНИЕ
Таким образом, первоначальная попытка идентифицировать гены дрож-
жей, отвечающие за высокую спонтанную /7?<?--мутабил ьность, привела нас
к получению мутаций в ядерных генах, которые, по всей вероятности, зани-
мают узловые позиции в системе координированной регуляции генетиче-
ской стабильности, смены фаз клеточного цикла и радиочувствительности.
Современные достижения геномики существенно облегчили идентифика-
цию этих генов. Представляются целесообразными как дальнейший деталь-
ный анализ уже обнаруженной регуляторной роли генов SRM, так и выявле-
ние и исследование функций этих генов применительно к таким, например,
существенным аспектам генетической регуляции, как метаболическая ин-
дукция/репрессия и сайленсинг.
ЛИТЕРАТУРА
Арман И.П., Глазкова Д.В., Девин А.Б. и др. Генетика дрожжей в ИМГ РАН, некоторые
итоги и перспективы // Молекуляр. биология. 1999. Т. 33. С. 48-54.
Арман И.П., Грановский Н.Н., Легчилина С.11., Жданов В.М. Высокая генетическая ста-
бильность плазмиды, содержащей геном вируса гепатита В, в трансформантах
Saccharomyces cerevisiae // Докл. АН СССР, 1985. Т. 285, № 2. С. 465—469.
Арман И.П., Легчилина С.П. Уровень митотической стабильности и его модификация у
трансформантов дрожжей Saccharomyces cerevisiae // Там же. 1982. Т. 267.
С. 749-752.
Арман И.П., Легчилина С.П., Грановский П.Н. Штамм дрожжей Saccharomyces cerevisi-
ae — продуцент белка гена поверхностного антигена (HBsAg) вируса гепатита В и
способ его получения. Авторское свидетельство 1524484. 1989.
Арман И.П., Легчилина С.П.. Семенова В.Д. и др. Репликация гибридных плазмид, содер-
жащих полный геном вируса SV40, в трансформантах дрожжей Saccharomyces cere-
visiae Ц Молекуляр. генетика, микробиология и вирусология. 1984. Т. 8. С. 17-23.
Арман И.П., Филипп Д., Девин А.Б. и др. Генетические эффекты при клонировании ге-
терологичной ДНК в искусственных хромосомах дрожжей // Докл. РАН. 1993.
Т. 329, № 5. С. 652-654.
Артамонова И.И., Городенцева Т.Н., Лебедев Ю.Б., Свердлов Е.Д. Неслучайное распре-
деление эндогенных ретровирусных регуляторных элементов HERV-K LTR на 22-й
хромосоме человека // Там же. 2000. Т. 372. С. 401^103.
Беневоленская Е.В., Коган ГЛ., Балакирева М.Д. и др. Изменчивость генов рДНК, об-
наруживаемая в результате анализа нуклеотидной последовательности псевдогена
у Drosophila melanogaster // Генетика. 1994. Т. 30. С. 318-325.
103
Богданов А.А. Теломеры и теломеразы // Сорос, образов, жури., 1998. Т. 12. С. 16-24.
Глазкова Д.В., Ефименко И.Г., Легчилина С.П. и др. TAR-клонирование короткого пле-
ча хромосомы 7 человека в дрожжах и поиск терминальных последовательностей //
Генетика. 2000. Т. 36. С. 622-629.
Грановский Н.Н., Жданов В.М., Арман И.П. и др. Экспрессия гена поверхностного анти-
гена вируса гепатита В в клетках дрожжей // Молекуляр. генетика, микробиология
и вирусология. 1986. Т. 8 С 12-17.
Данилевская О.Н., Арман И.П Молекулярная организация структурных элементов хро-
мосом // Организация генома. М.: Наука, 1989. С. 89-109.
Девин А.Б., Колтовая Н.А. Генетический анализ митохондриальной /7го-мутабильности
у дрожжей сахаромицетов. III. Сравнительный анализ влияния различных ядерных
мутаций srm и дисомии по хромосоме IV на ,7го-мутагенез // Генетика. 1986. Т. 22.
С. 2768-2774.
Девин А.Б., Колтовая Н.А., Гаврилов Б.В., Арман И.П. Получение и характеристика
новых ядерных генных мутаций srm, вызывающих координированные изменения
поддержания ядерных и митохондриальных генетических структур у дрожжей саха-
ромицетов Ц Там же. 1994. Т. 30. С. 1194-1201.
ЕфименкоИ.Г, ЛегчилинаС.П., Арман И.П. Энхансер репликации вирусного происхож-
дения повышает митотическую стабильность трансформантов дрожжей // Там же.
1991. Т. 27. С. 1705-1713.
Журавлева Г.А., МироноваЛ.Н., Инге-Вечтомов С.Ю. Геном дрожжей и первые шаги в
постгеномную эру // Молекуляр. биология. 2000. Т. 34, № 4. С. 560-571.
Захаров И.А. Хромосомы дрожжей сахаромицетов // Организация генома. М.: Наука.
1989. С. 74-88.
Коган ГЛ., Филипп Д., Арман И.П. и др. Клонирование участков генома Drosophila
melanogaster в искусственных хромосомах дрожжей Saccharomyces cerevisiae // Гене-
тика. 1991. Т. 27, № 7. С. 1317-1323.
Колтовая Н.А., Девин А.Б. Координация митотической стабильности генетических
структур и радиочувствительность дрожжей сахаромицетов // Докл. АН СССР.
1990. Т. 315. С. 986-990.
Колтовая Н.А.. Карташева Н.Н., Кадышевская Е.Ю. и др. SRM8 и SRM12 - два гена
/?А09-зависимого пути, контролирующего радиочувствительность Saccharomyces
cerevisiae Ц Докл. РАН. 1998а. Т. 360. С. 420-422.
Колтовая Н.А., Карвига Т.Д., Любимова К.А. и др. Радиочувствительность дрожжей са-
харомицетов и гены SRM: эффекты мутаций srml и srm5 И Генетика. 1998b. Т. 34.
С. 610-624.
Колтовая Н.А. Майорова Е.С., Рзянина А.В. и др. Новые мутации генов SRM
Saccharomyces cerevisiae и некоторые особенности их фенотипического проявле-
ния //Там же. 2001. Т. 37. С. 1213-1224.
Ларионов ВЛ., Куприна Н.Ю., Трауготт М.Н. Исследование внехромосомной ДНК у
дрожжей-сахаромицетов//Молекуляр. биология. 1983. Т. 17. С. 983-991.
Легчилина С.П., Ефименко И.Г., Арман И.П. и др. ARS-активность фрагмента ДНК
Bombyx rnori в трансформантах дрожжей Saccharomyces cerevisiae // Генетика. 2001.
Т. 37. С. 1497-1506.
Легчилина С.П., Ефименко И.Г., Шляхтенко Л.С., Арман И.П. Области ДНК вируса ге-
патита В. гомологичные усилителю репликации дрожжей // ДАН СССР 1990.
Т. 314. С. 1243-1246.
Просвирова Т.Ю., Девин А.Б. Генетический анализ митохондриальной /7го_-мутабильно-
сти у дрожжей сахаромицетов. Сообщение V. Выделение и картирование ядерной
мутации srm5. снижающей одновременно г/го--мутабильность и митотическую ста-
бильность хромосом // Генетика. 1988. Т. 24. С. 1586-1592.
Резник НЛ., Арман И.П., Ефименко И.Г. и др. Фенотипическое проявление активности
обратной транскриптазы в дрожжевых клетках // Молекуляр. генетика, микробио-
логия и вирусология. 1990. Т. 8. С. 5-8.
Резник НЛ., Чеперегин С.Э., Горелова Т.В. и др. Экспрессия ретранспозона дрозофилы
в дрожжах Ц Там же. 1988. Т. 7. С. 20-24.
104
Рыбчин В.Н. Основы генетической инженерии. СПб., 1999.
Смирнова М.Е., Арман И.П., Девин А.Б. Анализ поддержания избыточных генетиче-
ских структур у дрожжей Saccharomyces cerevisiae: Дисомия и спонтанная митохонд-
риальная гЛо_-мутабильность // Генетика. 1994а. Т. 30. С. 1184-1193.
Смирнова М. Е., Арман И.П., Девин А.Б. и др. Анализ поддержания избыточных гене-
тических структур у дрожжей Saccharomyces cerevisiae: Эффекты мутаций cdc 28-srm
и srml Ц Там же. 1995. Т. 31. С. 464-470.
Смирнова М.Е., Арман И.П., Ефименко И.Г. и др. Об одной закономерности совместно-
го поддержания ядерных и митохондриальных генетических структур в дрожжевых
клетках // Докл. РАН. 1994b. Т. 337. С. 283-286.
Тимофеева М.Я., Захарьев В.М. Исследования по картированию хромосом //Итоги нау-
ки и техники. Геном человека. М., 1994. Т. 2. С. 22-37.
Чеперегин С.Э., Арман И.П., Грановский Н.Н. Оптимизация экспрессии гена поверхно-
стного антигена вируса гепатита В в дрожжах // Молекуляр. генетика, микробиоло-
гия и вирусология. 1990. Т. 5. С. 17-19.
Aboussekhra A., Vialard J.E., Morrison D.E. et al. A novel role for the budding yeast RAD9
checkpoint gene in DNA damage-dependent transcription // EMBO J. 1996. Vol. 15.
P. 3912-3922.
Albertsen H.M., Abderrahim H., Cann H.C. et al. Construction and characterization of a yeast arti-
ficial chromosome library containing seven haploid genome equivalents // Proc. Nat. Acad.
Sci. USA 1990. Vol. 87. P. 5109-5113.
Allen J.B., Zhou Z., Siede W. et al. The SAD1/RAD53 protein kinase controls multiple checkpoints
and DNA damage-induced transcription in yeast // Genes Develop. 1994. Vol. 8.
P. 2401-2415.
Allshire R.C. Centromeres, checkpoints and chromatid cohesion // Curr. Opin. Genet. Develop.
1997. Vol. 7. P. 264-273.
Anand R., Riley J.H., Butler R. et al. A 3.5 genome equivalent multiaccess YAC library:
Construction, characterization, screening and storage // Nucl. Acids Res. 1990. Vol. 18.
P. 1951-1955.
Arman 1.Р., Legchilina S.P., Yefimenko I.G., Devin A.B. Genetic effect of heterologous DNA
cloned in yeast artificial chromosomes // Yeast. 1992. Vol. 8. P. 696.
Bashkirov V.I., King J.S., Bashkirova E.V. et al. DNA repair protein Rad55 is a terminal substrate
of the DNA damage checkpoints // Mol. and Cell. BioL 2000. Vol. 20. P. 4393^4404.
Baust C., Seifarth W., Germaier H. et al. HERV-K-T47D-related long terminal repeats mediate
polyadenylation of cellular transcripts // Genomics. 2000. Vol. 66. P. 98—103.
Bech-Hansen NT., Rank G.H. Ethidium bromide resistance and petite induction in Saccharomyces
cerevisiae // Canad. J. Genet, and Cytol. 1972. Vol. 14. P. 681-689.
Bech-Hansen NT., Rank G.H. Cytoplasmically inherited ethidium bromide resistance in suppres-
sive petites of Saccharomyces cerevisiae // Ibid. 1973. Vol. 15. P. 381—387.
Bellanne-Chantelot, C., Lacroix, B., Ougen P. et al. Mapping the whole human genome by fin-
gerprinting yeast artificial chromosomes // Cell. 1992. Vol. 70. P. 1059—1068.
Blackburn E.H. Telomeres: do the ends justify the means? // Cell. 1984. Vol. 37. P. 7.
Botstein D., Fink G.R. Yeast: An experimental organism for modem biology // Science. 1988.
Vol. 240. P. 1439-1443.
Broach J.R. The yeast plasmid 2 mu circle // Cell. 1982. Vol. 28. P. 203-204.
Brown N.G. Ph.D. Thesis. Ithaka: Cornell. Univ., 1994.
Brown W.R.A., MacKinnon P.J., Villasante A. et al. Structure and polymorphism of human telom-
ere-associated DNA // Cell. 1990. Vol. 63. P. 119-132.
Brunner A., Carrasco N., Pena A. Correlation between resistance to ethidium bromide and
changes in monovalent cation uptake in yeast // Arch. Biochem. and Biophys. 1982. Vol. 217.
P. 30-36.
Brunner A., Mas J., Celis E., Mattoon J.R. Cytoplasmic and nuclear inheritance of resistance to
alkylguanidines and ethidium bromide in a petite-negative yeast // Biochem. and Biophys.
Res. Commun. 1973. Vol. 53. P. 638-644.
Bryan T.M., Cech T.R. Telomerase and the maintanance of chromosome ends // Curr. Opin. Cell
Biol. 1999. Vol. 11. P. 318-324.
105
Burke D.T., Carle G.F., Olson M.V. Cloning of large segments of exogenous DNA into yeast by
means of artificial chromosome vectors // Science. 1987. Vol. 236. P. 806-812.
Clarke L. Centromeres: proteins, protein complexes and repeated domains at centromeres of sim-
ple eukariotes // Curr. Opin. Genet, and Develop. 1998. Vol. 8. P. 212-218.
Clarke L., Carbon J. Isolation of yeast centromere and construction of functional small circular
chromosome//Nature. 1980. Vol. 287. P. 504-509.
Clarke L., Carbon J. Structure and function of yeast centromeres // Annu. Rev. Genet. 1985.
Vol. 19. P. 29-56.
Contamine V., Picard M. Maintenance and integrity of the mitochondrial genome: A plethora of
nuclear genes in the budding yeast Ц Microbiol and Mol. Biol. Rev. 2000. Vol. 64. P. 281-315.
Cooper J.P. Telomere transitions in yeast: the end of the chromosome as we know it // Curr. Opin.
Genet, and Develop. 2000. Vol. 10. P. 169-177.
De Lange T. Telomeres and senescence: ending the debate // Science. 1998. Vol. 279. P. 334-335.
Den Dunnen J.T., Grootscholten P.M., Dauwerse J.D. et al. Reconstruction of the 2.4 MB human
DMD-gene by homologous YAC recombination Ц Hum. Mol. Genet. 1992. Vol. 1. P. 19—28.
Devin A.B., Koltovaya N.A. Nuclear mutants of yeast with reduced apontaneous mutability of the
mitochondrial genome //Mutat. Res. 1981. Vol. 91. P. 451-455.
Devin A.B., Koltovaya N.A. Genetic modification of the spontaneous rho -mutability in
Saccharomyces cerevisiae // Curr. Genet. 1987. Vol. 11. P. 411—413.
Devin A.B., Koltovaya N.A., Cheryomukhina NJ. The disomy for chromosome IV and the sponta-
neous ///«--mutability in Saccharomyces cerevisiae // Ibid. 1987. Vol. 11. P. 407^110.
Devin A.B., Prosvirova T.Yu., Peshekhonov V.T. et al. The start gene CDC28 and the genetic sta-
bility of yeast // Yeast. 1990. Vol. 6. P. 231-243.
Diffley J.F.X. Once and only once upon a time: specifying and regulating origins of DNA replica-
tion in eukaryotic cells // Genes Develop. 1996. Vol. 10. P. 2819-2830.
Domansky A.N., Kopantzev E.P., Snezhkov E.V. et al. Solitary HERV-K LTRs possess bi-direc-
tional promotor activity and contain a negative regulatory element in the U5 region // FEBS
Lett. 2000. Vol. 472. P. 191-195.
Eckardt-Schupp F., Siede W., Game J.C. The RAD24 (= Rsl) gene product of Saccharomyces
cerevisiae participates in two different pathways of DNA repair // Genetics. 1987. Vol. 115.
P. 83-90.
Entian K.D., Schuster T., Hegemann J.H. et al. Functional analysis of 150 deletion mutants in
Saccharomyces cerevisiae by a systematic approach // Mol. and Gen. Genet. 1999. Vol. 262.
P. 683-702.
Filipp D., Kogan G.L., Belyaeva E.S. et al. Cloning of large segments of Drosophila melanogaster
genome using yeast artificial chromosomes // Dros. Inform. Serv. 1991. Vol. 70. P. 170-178.
Fitzgerald-Hayes M. Yeast centromeres // Yeast. 1987. Vol. 3. P. 187-200.
Flint J., Thomas K., Micklem G. The relationship between chromosome structure and funct'on at
a human telomeric region // Nature Genet. 1997. Vol. 15. P. 252-257.
Frei Ch., Gasser S.M. The yeast Sgslp helicase acts upstream of Rad53p in the DNA replication
checkpoint and colocalizes with Rad53p in S-phase-specific foci // Genes Develop. 2000.
Vol. 14. P. 81-96.
Freifelder D. Bud formation in Saccharomyces cerevisiae // J. Bacteriol. 1960. Vol. 80.
P. 567-568.
Frolova L.. Le GoffX.. Rasmussen H. et al. Identification and assignment of a highly conserved
eukaryotic protein family (e RF1) with the properties of polypeptide chain release factor //
Nature. 1994. Vol. 372. P. 701-703.
Gachon F., Peleraux A., Thebaidt S. et al. CREB-2, a cellular CRE-dependent transcription repres-
sor, functions in association with tax as an activator of the human T-cell leukaemia virus type
1 promoter//J. Virol. 1998. Vol. 72. P. 8332-8337.
Game J.C. The Saccharomyces repair genes at the end of the century I I Mutat. Res. 2000. Vol. 451.
P. 277-293.
Gilbert D Replication origins in yeast versus metazoa: separation of the haves and the have nots Ц
Curr. Opin. Genet, and Develop. 1998. Vol. 8. P. 194-199.
Goffeau A., Barrel B.G., Bussey H. et al. Life with 6000 genes // Science. 1996. Vol. 274.
P. 546-567.
106
Gouhier M., Mounolou J.C. Yeast mutants resistant to ethidium bromide I I Mol. and Gen. Genet.
1973. Vol. 122. P. 149-154
Green E.D., Idol J.R., Mohr-Tidwell R.M. et al. Integration of physical, genetic and cytogenetic
maps of human chromosome 7: Isolation and analysis of yeast artificial chromosome clones
for 117 mapped genetic markers //Hum. Mol. Genet. 1994. Vol. 3. P. 489-501.
Green E.D., Riethman H.C., DutchikJ.E., Olson M.V. Detection and characterization of chimeric
yeast artificial chromosome clones // Genomics. 1991. Vol. 11. P. 658-669.
Greider C.W.. Blackburn E.H. Identification of a specific telomere terminal transferase activity in
Tetrahymena extracts // Cell. 1985. Vol. 43. P. 405^443.
Grzeschik К-H., Tsui L-С., Green E.D. Report of the first international workshop on human chro-
mosome 7 mapping 1993 // Cytogenet. and Cell Genet. 1994. Vol. 65. P. 52-73.
Gunge N., Yamane C. Incompatibility of linear DNA killer plasmids pGKLl and pGKL2 from
Kluyveromyces lactis with mitochondrial DNA from Saccharomyces cerevisiae // J.
Bacterio!. 1984. Vol. 159. P. 533-539.
Hartwell L., Smith D. Altered fidelity of mitotic chromosome transmission in cell cycle mutants
of S', cerevisiae // Genetics. 1985. Vol. 110. P. 381-395.
Hegeman J.F., Fleig U.N. The centromere of budding yeast // BioEssays. 1993. Vol. 15.
P. 451-460.
Horiuchi J., Silverman N., Pina B. et al. ADA1, a novel component of the ADA/GCN5 complex,
has broader effects than GCN5, ADA2, or AD A3 // Mol. and Cell. Biol. 1997. Vol. 17.
P. 3220-3228.
Irie K., Araki H., Oshima Y. Mutations in a Saccharomyces cerevisiae host showing increased
holding stability of the heterologous plasmid pSRl // Mol. and Gen. Genet. 1991. Vol. 225.
P. 257-265.
Jacobs P.A., Hassold TJ. The origin of numerical chromosome abnormalities // Adv. Genet. 1995.
Vol. 33. P. 101-133.
Jakohovits A, Moore A.L., Green L.L. et al. Germ-line transmission and expression of a human-
derived yeast artificial chromosome //Nature. 1993. Vol. 362. P. 255-258.
Kaisho Y., Yoshimura K., Naka ha ma K. Increase in gene expression by respiratory-deficient muta-
tion // Yeast. 1989. Vol. 5. P. 91-98.
Kazazian H.H., Jr. Mobile elements and disease // Curr. Opin. Genet. Develop. 1998. Vol. 8.
P. 343-350.
Ketner G„ Spencer F., Tugendreich S. et al. Efficient manipulation of the human adenovirus
genome as an infectious yeast artificial chromosome clone // Proc. Nat. Acad. Sci. USA.
1994. Vol. 91. P. 6186-6190.
Khil P.P., Kostina M.B., Azhikina T.L. et al. Structural features of four long terminal repeats of
human endogenous retroviruses and their integration sites // Russ. J. Bioorg. Chem. 1997.
Vol. 23. P. 406-411.
Koltovaya N.A., Arman I.P., Devin A.B. Mutations of the CDC28 gene and the radiation sensitiv-
ity of Saccharomyces cerevisiae // Yeast. 1998. Vol. 14. P. 133-146.
Kouprina N., Nikolaishvili N., Graves J. et al. Integrity of human YACs during propagation in
recombination-deficient yeast strains // Genomics. 1999. Vol. 56. P. 262-273.
Kurdyukov S.G., Lebedev Yu.B., Artamonova LV. et al. Human endogenous retroviral sequences
on human chromosome 21: Map locations and evolutionary history // Gene. 2001. Vol. 273.
P. 51-61.
Lander E., Linton L. et al. Initial sequencing and analysis of the human genome // Nature. 2001.
Vol. 409 (6822). P. 860-921.
Larionov V., Kouprina N., Graves J., Resnick M.A. Specific cloning of human DNA as yeast arti-
ficial chromosomes by transformation-associated recombination // Proc. Nat. Acad. Sci.
USA, 1996a. Vol. 93. P. 491-496.
Larionov V., Kouprina N., Graves J., Resnick M.A. Highly selective isolation of human DNA from
rodent-human hybrid cells as circular yeast artificial chromosomes by transformation-associ-
ated recombination cloning // Ibid. 1996b. Vol. 93. P. 13925—13930.
Larionov V., Kouprina N., Nikolaishvili N„ Resnick M. Recombination during transformation as a
source of chimeric mammalian artificial chromosomes in yeast (YACs) // Nucl. Acids Res.
1994. Vol. 22. P. 4154-4161.
107
Larsson E., Andersson G. Beneficial role of human endogenous retroviruses: Facts and hypothe-
ses I I Scand. J. Immunol. 1998. Vol. 48. P. 329-338.
Lavrentieva L, Khil P., Vinogradova T. et al. Subfamilies and nearest-neighbour dendrogram for
the LTRs of human endogenous retroviruses HERV-K mapped on human chromosome 19:
physical neighbourhood does not correlate with identity level // Hum. Genet., 1998. Vol. 102.
P. 107-116.
Legchilina S.P., Efimenko LG., Shlychtenko L.S., Arman LP. Hepatitis В virus DNA fragments are
homologous to the yeast Ars replication enchancer // Biomed. Sci. 1991. Vol. 2. P. 298—301.
Leib-Mosch C., Haltmeier M., Werner T. et al. Genomic distribution and transcription of solitary
HERV-K LTRs // Genomics. 1993. Vol. 18. P. 261-269.
Li X., Cai M. Inactivation of the cyclin-dependent kinase Cdc28 abrogates cell cycle arrest induced
by DNA damage and disassembly of mitotic spindles in Saccharomyces cerevisiae I I Mol. and
Cell. Biol. 1997. Vol. 17. P. 2723-2734.
Little R.D., Braaten D.C. Genomic organization of human 5 S rDNA and sequence of one tandem
repeat // Genomics. 1989. Vol. 4. P. 376-383.
Longhese M.P, Foiani M., Muzi-Falconi M. et al. DNA damage checkpoint in budding yeast //
EMBO J. 1998. Vol. 17. P. 5525-5528.
Lowndes N.F., Murguia J.R. Sensing and responding to DNA damage // Curr. Opin. Genet.
Develop. 2000. Vol. 10. P. 17-25.
Mager D.L., Hunter D.G., Schertzer M. et al. Endogenous retroviruses provide the primary
polyadenylation signal for two new human genes (HHLA2 and HHLA3) // Genomics. 1999.
Vol. 59. P. 255 -263.
McCormick M.K., Shero J.H., Cheung M.C. et al. Construction of human chromosome 21-specific
yeast artificial chromosomes // Proc. Nat. Acad. Sci. USA. 1989. Vol. 86. P. 9991-9995.
Mendenhall M.D., Hodge A.E. Regulation of Cdc28 cyclin-dependent protein kinase activity dur-
ing the cell cycle of the yeast Saccharomyces cerevisiae // Microbiol, and Mol. Biol. Rev.
1998. Vol. 62. P. 1191-1243.
Miranda M., Ramirez J., Pena A., Coria R. Molecular cloning of the plasma membrane
H+-ATPase from Kluyveromyces lactis: a single nucleotide substitution in the gene confers
ethidium bromide resistance and deficiency in K+ uptake // J. Bacteriol. 1995. Vol. 177.
P. 2360-2367.
Mitelman F. Catalog of chromosome Aberrations in Cancer. 5th ed. N.Y.: Wiley, 1994.
Monfouilloux S., Avet-Loiseau H., Amarger V. et al. Recent human-specific spreading of a sub-
telomeric domain // Genomics. 1998. Vol. 51. P. 165—176.
Morse RJL. RAP, RAP, open up! New wrinkles for RAP1 in yeast // Trends Genet. 2000. Vol. 16.
P. 51-53.
Morgan S.E., Kastan M.B. p53 and ATM: cell cycle, cell death, and Cancer // Adv. Cancer Res.
1997. Vol. 71. P. 1-25.
Mouchiroud D., D’Onofrio G., Aissani B. et al. The distribution of genes in the human genome //
Gene. 1991. Vol. 100. P. 181-187.
Murray A.W., Schultes N.P., Szostak J.V. Chromosome length controls mitotic chromosome seg-
regation in yeast I I Cell. 1986. Vol. 45. P. 529-536.
Murray A., Szostak J. Pedigree analysis of plasmid segregation in yeast // Cell. 1983a. Vol. 34.
P. 961-970.
Murray A.W., Szostak J.W. Construction of artificial chromosomes in yeast // Nature. 1983b.
Vol. 305. P. 189.
Nadezhdin E.V., Lebedev Yu.B., Glazkova D.V. et al. Identification of patalogous HERV-K LTRs
on human chromosomes 3, 4, 7 and 11 in regions containing clusters of olfactory receptor
genes // Mol. Genet. Genomics. 2001. Vol. 265. P. 820-825.
Navas T.A., Sanchez Y., Elledge SJ. RAD9 and DNA polymerase epsilon form parallel sensory
branches for transducing the DNA damage checkpoint signal in Saccharomyces cerevisiae //
Genes Develop. 1996. Vol. 10. P. 2632-2643.
Newlon C.S. Putting it all together: building a prereplicative complex // Cell.1997. Vol. 91.
P. 717-720.
Newlon C.S., Theis J.F. The structure and function of yeast ARS elements // Curr. Opin. Genet.
Develop. 1993. Vol. 3, N 5. P. 752-758.
108
Nugent С.I., Lundblad V. The telomerase reverse transcriptase: components and regulation //
Genes Develop. 1998. Vol. 12. P. 1073-1085.
Pachnis V., Pevny L., Rothstein R., Costantini F. Transfer of a yeast artificial chromosome carry-
ing human DNA from Saccharomyces cerevisiae into mammalian cells // Proc. Nat. Acad.
Sci. USA. 1990. Vol. 87. P. 5109-5113.
Parikh V.S., Morgan M.M., Scott R. et al. The mitochondrial genotype can influence nuclear gene
expression in yeast // Science. 1987. Vol. 235. P. 576-580.
Parry J.M., Zimmermann F.K. The detection of monosomic colonies produced by mitotic chro-
mosome non-disjunction in the yeast Saccharomyces cerevisiae // Mutat. Res. 1976. Vol. 36.
P. 49-66.
Paulovich A.G., Margulies R.U., Garvik B.M., Hartwell L.H. RAD9, RAD17, and RAD24 are
required for S phase regulation in Saccharomyces cerevisiae in response to DNA damage //
Genetics. 1997. Vol. 145. P. 45-62.
Pena A., Ramirez G. Interaction of ethidium bromide with the transport system for monovalent
cations in yeast// J. Membr. Biol. 1975. Vol. 22. P. 369-384.
Pena A., Ramirez J. An energy-dependent efflux system for potassium ions in yeast // Biochim. et
biophys. acta. 1991. Vol. 1068. P. 237-244.
Peterson K.R., Clegg C.H., Li Q., Stamatoyannopoulos G. Production of transgenic mice with
yeast artificial chromosomes //Trends Genet. 1997. Vol. 13, N 2. P. 61-66.
Piruzian E.S., Goldenkova I.V., Musiychuk K.A. et al. A reporter system for prokaryotic and
eukaryotic cells based on the thermostable lichenase from Clostridium thermocellum // Mol.
Genet. Genom. 2002. Vol. 266. P. 778-786.
Popov A.V., Butzler C., Frippiat J.-P. et al. Assembly and extension of yeast artificial chromo-
somes to build up a large locus // Gene. 1996. Vol. 177. P. 195-201.
Price C.M. Telomeres and telomerase: broad effects on cell growth // Curr. Opin. Genet. Develop.
1999. Vol. 9. P. 218-224.
Puglisi P., Algeri A. Role of the mitochondrion in the regulation of protein synthesis in the eucary-
ote Saccharomyces cerevisiae //Mol. and Gen. Genet. 1971. Vol. 110. P. 110-117.
Qin S., Zhang J., Isaacs C.M. et al. A chromosome 11 YAC library // Genomics. 1993. Vol. 16.
P. 580-585.
Reddel R.R. A reassessment of the telomere hypothesis of senescence // BioEssays. 1998. Vol. 20.
P. 977-984.
Riethman H.C., Moyzis R.K., Meyne J. et al. Cloning human telomer DNA fragments into
Saccharomyces cerevisiae using a yeast-artificial-chromosome vector // Proc. Nat. Acad. Sci.
USA. 1989. Vol. 86. P. 6240-6244.
Sanchez Y., Bachant J., Wang H. et al. Control of the DNA damage checkpoint by chkl and rad53
protein kinases through distinct mechanisms // Science. 1999. Vol. 286. P. 1166-1171.
Scherdin U., Rhodes K., Breindl M. Transcriptionally active genome regions are preferred targets
for retrovirus integration // J. Virol. 1990. Vol. 64. P. 907-912.
Schlessinger D. Yeast artificial chromosomes: tools for mapping and analysis of complex
genome // Trends Genet. 1990. Vol. 6, N 8. P. 248—258.
Schon U., Seifarth W., Baust C. et al. Cell type-specific expression and promoter activity of human
endogenous retroviral long terminal repeats // Virology. 2001. Vol. 279, N 1. P. 280-291.
Shou W., Seol J.H., Shevchenko A. et al. Exit from mitosis is triggered by Tern 1-dependent release
of the protein phosphatase Cdcl4 from nucleolar RENT complex // Cell. 1999. Vol. 97.
P. 233-244.
Sjottem E., Anderssen S., Johansen T. The promoter activity of long terminal repeats of the HERV-
H family of human retrovirus-like elements is critically dependent on Spl family proteins
interacting with a GC/GT box located immediatelu 3’ to the TATA box // J. Virol. 1996.
Vol. 70. P. 188-198.
Sleister H.M., Mills K.A., Blackwell S.E. et al. Construction of a human chromosome 4 YAC pool
and analysis of artificial chromosome stability // Nucl. Acids Res. 1992. Vol. 20.
P. 3419-3425.
Slonimski P.P., Perrodin G., Croft J.H. Ethidium bromide induced mutation of yeast mitochon-
dria: complete transformation of cells into respiratory deficient non-chromosomal “petites” //
Biochem. and Biophys. Res. Commun. 1968. Vol. 30. P. 232-239.
109
Smorgorzewska A., Van Steensel B., Bianchi A. et al. Control of human telomere length by TRF1
and TRF2 // Mol. and Cell Biol. 2000. Vol. 20. P. 1659-1668.
Stinchcomb D.T., Thomas M., Kelly I. et al. Eucaryotic DNA segments capable of autonomous
replication in yeast // Proc. Nat. Acad. Sci. USA. 1980. Vol. 77. P. 4559-4563.
Sun Z., Hsiao J., Fay D.S, Stern D.F. Rad53 FHA domain associated with phosphorylated RAD9
in the DNA damage checkpoint // Science. 1998. Vol. 281. P. 272-274.
Sverdlov E.D. Perpetually mobile footprints of ancient infections in human genome // FEBS Lett.
1998. Vol. 428. P. 1-6.
Sverdlov E.D. Retroviruses and primate evolution //BioEssays. 2000. Vol. 22. P. 161-171.
Szostak J.W., Blacburn E.H. Cloning yeast telomeres on linear plasmid vectors // Cell. 1982.
Vol. 29. P. 245.
Torre-Ruiz M.A. de la, Green C.M., Lowndes N.F. RAD9 and RAD24 define two additive, inter-
acting branches of the DNA damage checkpoint pathway in budding yeast normally required
for Rad53 modification and activation // EMBO J. 1998. Vol. 17. P. 2687-2698.
Toyn J.H., Toon W.M., Morgan B.A., Johnston L.H. The activation of DNA replication in yeast //
Trends Biochem. Sci. 1995. Vol. 20. P. 70-73.
Trask В J., Friedman C., Martin-Gallardo A. et al. Members of the olfactory receptor gene fami-
ly are contained in large blocks of DNA duplicated polymorphically near the ends of human
chromosomes // Hum. Mol. Genet. 1998. Vol. 7. P. 13—26.
Tschumper G., Carbon J. Copy number control by a yeast centromere Ц Gene. 1983. Vol. 23.
P. 221-232.
Vinogradova T., Volik S., Lebedev Yu. et al. Positioning of 72 potentially full size LTRs of human
endogenous retroviruses HERV-K on the human chromosome 19 map: Occurrences of the
LTRs in human gene sites // Gene. 1997. Vol. 199. P. 255-264.
Visintin R., Hwang E.S., Amon A. Cfil prevents premature exit from mitosis by anchoring Cdcl4
phosphatase in the nucleolus //Nature. 1999. Vol. 398. P. 818—823.
Vocero-Akbani A.. Helms C., Wang J-C. et al. Mapping human telomere regions with YAC and
Pl clones: chromosome-specific markers for 27 telomeres including 149 STSs and 24 poly-
morphisms for 14 proterminal regions // Genomics. 1996. Vol. 36. P. 492-506.
Volkmer E., Karnitz L.M. Human homologs of Schizosaccharo-myces pombe Radi, Husl, and
Rad9 form a DNA damage-responsive protein complex // J. Biol. Chem. 1999. Vol. 274.
P. 567-570.
Wada M., Abe К., Okumura K. et al. Chimeric YACs where generated at unreduced rates in con-
ditions that suppress coligation // Nucl. Acids Res. 1994. Vol. 22. P. 1561-1564.
Walmsley R.W. Yeast telomeres: the end of chromosome story // Yeast. 1987. Vol. 3. P. 139—144.
Weinert T.A., Hartwell L.H. The RAD9 gene controls the cell cycle response to DNA damage in
Saccharomyces cerevisiae // Science. 1988. Vol. 241. P. 317—322.
Weinert T.A., Hartwell L.H. Characterization of RAD9 of Saccharomyces cerevisiae and evidence
that its function acts posttranslationally in cell cycle arrest after DNA damage // Mol. Cell.
Biol. 1990. Vol. 10. P. 6554-6564.
Wintersberger IL, Kuhne C.. Karwan A. Scpl60p, a new yeast protein associated with the nuclear
membrane and the endoplasmic reticulum, is necessary for maintenance of exact ploidy //
Yeast. 1995. Vol. 11. P. 929-944.
Zakian V.A. Telomeres: beginning to understand the end // Science. 1995. Vol. 270. P. 1601-1607.
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ИССЛЕДОВАНИЯ
РНК-ПОЛИМЕРАЗЫ
В. Г. Никифоров
Лаборатория молекулярной генетики микроорганизмов
Исследования РИК-полимеразы, начатые Р.Б. Хесиным, ведутся в ос-
нованной им лаборатории почти сорок лет (с 1989 г. в сотрудничестве
с лабораторией А. Гольдфарба). Используются генетические методы
в сочетании с методами специфических химических сшивок нуклеиновых
кислот с белком. В статье дается оценка основных результатов этих ис-
следований в сопоставлении с появившимися недавно рентгеноструктур-
ными данными высокого разрешения.
СЛОВАРЬ ТЕРМИНОВ
Транскрипция - считывание информации с ДНК-матрицы ферментом РНК-полимера-
зой.
Инициация - начальный этап транскрипции, образование первой связи в цепи РНК.
Промотор - участок ДНК перед началом гена, к которому присоединяется РНК-поли-
мераза на стадии инициации.
Элонгация - наращивание цепи РНК.
Терминация - завершение транскрипции в конце гена.
Мутация - наследуемое изменение структуры гена, приводящее или не приводящее к из-
менению свойств организма.
Летальная мутация - мутация, приводящая к гибели организма.
Условно-летальная мутация - мутация, вызывающая гибель организма лишь при опре-
деленных условиях (например, при повышенной или пониженной температуре).
Направленный мутагенез — экспериментальное внесение изменения в последователь-
ность нуклеотидов в заранее заданный участок ДНК, т.е. получение мутации в оп-
ределенной точке гена.
Первичная структура - последовательность звеньев в цепи биополимера (нуклеотидов в
ДНК или РНК, или аминокислот в цепи белка).
Конформационная подвижность - изменение пространственной формы молекулы, воз-
никающее при изменении относительной ориентации отдельных ее частей.
Домен - участок полипептидной цепи белка, выполняющий какую-либо его функцию.
ВВЕДЕНИЕ
Исследования РНК-полимеразы были начаты в нашем Институте в
1960 г. Р.Б. Хесиным, исходившим из того, что изучение механизмов функ-
ционирования РНК-полимеразы должно дать ключ к пониманию механиз-
мов регуляции активности генов. Сейчас известно, что такая регуляция осу-
ществляется на всех стадиях транскрипции - инициации, элонгации и терми-
нации синтеза РНК. Несмотря на громадные различия в деталях, структур-
ные основы механизмов транскрипции всех живых организмов от бактерий
до человека едины. Поэтому исследования относительно просто устроенных
бактериальных РНК-полимераз способствуют пониманию механизмов тран-
скрипции не только бактерий, но и эукариот. Долгие годы из-за недоступно-
сти методов прямого рентгеноструктурного анализа для исследования
РНК-полимеразы использовались различные косвенные методы. Они дали
111
возможность описать последовательные стадии транскрипции и выяснить
важные принципы организации транскрипционных комплексов на каждой
из этих стадий. Было выяснено, что важную роль в транскрипции и ее регу-
ляции играет конформационная подвижность компонентов реакции. Лучше
всего была изучена конформационная подвижность нуклеиновых кислот в
этих комплексах (Korzheva et al., 1998). Менее подробно и главное менее
конкретно была изучена конформационная подвижность самой РНК-поли-
меразы (Gross et al., 1998). И лишь недавно ситуация резко изменилась.
В 1999 г. рентгеноструктурными методами высокого разрешения была уста-
новлена пространственная структура РНК-полимеразы термофильной бак-
терии Thermus aquaticus (Zhang et al., 1999), а в 2001 г. РНК-полимеразы II
дрожжей (Cramer et al., 2001; Gnatt et al., 2001). Эти работы открыли совер-
шенно новые возможности для структурно-функциональных исследований
транскрипции путем проецирования результатов косвенных методов на уже
установленные пространственные структуры высокого разрешения. Приме-
ром такого подхода является наша работа (Korzheva et al., 2000), в которой
была построена первая реалистичная молекулярная модель транскрипцион-
ного комплекса путем проецирования на кристаллическую структуру мини-
мальной РНК-полимеразы Т. aquaticus результатов картирования химиче-
ских сшивок РНК-полимеразы Е. coli с искусственными конструкциями,
имитирующими ДНК-матрицу и РНК-продукт. Мы надеемся, что использо-
вание такого подхода позволит зарегистрировать состояния транскрипцион-
ных комплексов, которые трудно или невозможно закристаллизовать, и зна-
чительно продвинуться в выяснении молекулярных деталей динамики ак-
тивного центра РНК-полимеразы и механизмов передачи регуляторных сиг-
налов от белков-регуляторов к этому центру. В данном обзоре кратко изло-
жены основные результаты и перспективы исследований РНК-полимеразы
Е. coli в Лаборатории молекулярной генетики микроорганизмов. Более под-
робно механизм функционирования РНК-полимеразы и история ее исследо-
ваний описаны в обзоре (Никифоров, 2002).
СУБЪЕДИНИЧНАЯ СТРУКТУРА РНК-ПОЛИМЕРАЗ
РНК-полимеразы эубактерий состоят из 6 субъединиц. Р-, Р’-, со- и две
идентичные ос-субъединицы образуют кор, или минимальный фермент, об-
ладающий каталитической активностью, но не способный узнавать начала
генов и обеспечивать их специфическую транскрипцию (Zhang et al., 1999).
Такой способностью обладает полный фермент (холофермент), содержа-
щий всего одну дополнительную субъединицу <у (Gross et al., 1998, Wosten et
al., 1998). Из изученных бактерий только микоплазмы обходятся единствен-
ной о-субъединицей. Остальные бактерии содержат несколько разных
о-субъединиц, одна из которых является главной. Есть бактерии с тремя
разными субъединицами, у Е. coli их 7, у В. subtilis - 18; рекордсменом на дан-
ный момент является Streptomyces coelicolor, содержащая более сорока раз-
ных о-субъединиц (http:llwww.sanger.ac.uk/ProjectslS_coelicolorl). Присоеди-
нение разных о-субъединиц придает РНК-полимеразе способность исполь-
зовать разные группы промоторов, что широко используется для регуляции
транскрипции. Кроме того, регуляция работы бактериальных промоторов -
112
у Е. coli их не менее пятисот - осуществляется с помощью белков-репрессо-
ров и белков-активаторов. В регуляции индивидуального промотора обыч-
но участвует небольшое число (один-два) белков-регуляторов. Всего у Е. coli
их насчитывают 240-260 (Ishihama, 2000) у Pseudomonas aeruginosa (5570 ге-
нов) было обнаружено 408 потенциальных регуляторов транскрипции
(Stover et al., 2000). Один белок-регулятор может участвовать в регуляции
нескольких разных промоторов.
Процесс транскрипции у эукариот протекает с участием гораздо боль-
шего числа белков, чем в случае бактерий. Транскрипцию хромосомной
ДНК у эукариот обеспечивают три эволюционно родственные транскрип-
тазы: РНК-полимеразы I, II и III, состоящие из 14, 12 и 17 полипептидов со-
ответственно. 5 субъединиц являются общими для всех трех форм, две - для
РНК-полимераз I и III (Bell, Jackson, 2000). Две самые большие субъедини-
цы проявляют сходство по аминокислотной последовательности с соответ-
ствующими субъединицами (Р и Р') бактериальных РНК-полимераз.
Подобно минимальным РНК-полимеразам эубактерий, вышеописанные
РНК-полимеразы не способны самостоятельно начинать транскрипцию с
промоторов. Для базальной (не регулируемой промотор-специфичными
белками-регуляторами) транскрипции требуется набор белковых факторов
GTF (general transcription factors). Для РНК-полимеразы II (молекулярная
масса 513 KDa) насчитывают не менее 25 GTF с общей массой 1500 Kda
(Lee, Young, 2000). Для регулируемой инициации транскрипции РНК-поли-
меразой II с индивидуальных промоторов кроме специфических белков ак-
тиваторов и GTF необходим медиатор, содержащий двадцать субъединиц
(Dotson et al., 2000; Myers, Kornberg, 2000). Общая масса медиатора состав-
ляет 1000 KDa.
ТРАНСКРИПЦИОННЫЙ ЦИКЛ
РНК-полимеразы осуществляют последовательное наращивание цепи
РНК, используя в качестве субстратов рибонуклеозидтрифосфаты (NTP) и
одну из двух нитей ДНК в качестве матрицы. Синтез РНК начинается с при-
соединения молекул РНК-полимеразы к специальным участкам ДНК - про-
моторам, определяющим специфические места инициации транскрипции
(DeHaseth et al., 1998). Присоединение РНК-полимеразы Е. coli, содержащей
о70, к промотору завершается расплетанием 10-15 пар оснований двойной
спирали ДНК с образованием так называемого открытого промоторного
комплекса, способного к инициации синтеза РНК.
При добавлении NTP к открытому промоторному комплексу РНК-поли-
мераза синтезирует и тут же высвобождает набор коротких РНК длиной от
2 до 8 нуклеотидов, не теряя прочных контактов с ДНК-матрицей. Переход
от этой стадии абортивного синтеза к стадии элонгации сопровождается су-
щественными структурными перестройками комплекса, в результате кото-
рых прочность комплекса значительно возрастает (Mooney et al., 1998).
Транскрипционный комплекс на стадии элонгации отличается поразитель-
ной стабильностью, позволяющей РНК-полимеразе, не покидая матрицы,
синтезировать молекулы РНК длиной до 104 н. в случае бактерий и до
10б н. - в случае эукариот (Landick, 2001).
113
Катализ образования фосфодиэфирной связи между 3'-концом расту-
щей цепи РНК, занимающим так называемый (О-центр РНК-полимеразы,
и 5'-концом альфа-фосфата входящего NTP, занимающего (i + 1)-центр, осу-
ществляется ионом магния, располагающимся на РНК-полимеразе около
(i)- и (i + 1)-центров (Zaychikov et al., 1996). После присоединения очередно-
го нуклеотида, сопровождающегося освобождением пирофосфата, его
3'-конец некоторое время остается в претранслокационном состоянии, зани-
мая (i + 1)-центр.
В определенных положениях матрицы РНК-полимераза может перехо-
дить в арестованное состояние, в котором она, сохраняя прочную связь с ма-
трицей и РНК-продуктом, теряет способность удлинять цепь РНК. Выход из
этого состояния возможен только через эндонуклеотическое расщепление
цепи РНК (Surratt et al., 1991) на расстоянии нескольких (иногда более деся-
ти) нуклеотидов от ее 3'-конца. Скорость этой реакции, осуществляемой са-
мой РНК-полимеразой (Orlova et al., 1995), значительно стимулируется спе-
циальными факторами элонгации: GreA и GreB у бактерий (Borukhov et al.,
1992, 1993) и TFSII у эукариот (Reines et al., 1989). После отщепления фраг-
мента РНК РНК-полимераза выходит из арестованного состояния, приобре-
тая способность присоединять нуклеотиды к новообразованному 3'-концу
РНК. Мы обнаружили, что переход в арестованное состояние происходит в
результате возвратного движения РНК-полимеразы (backtracking), при ко-
тором несколько 3'-концевых нуклеотидов вытесняются из гибрида с мат-
ричной нитью ДНК (Komissarova, Kashlev, 1997; Nudler et al., 1997). В резуль-
тате активный центр РНК-полимеразы теряет связь с 3'-концом РНК, но
приобретает способность расщеплять фосфодиэфирную связь, против кото-
рой он оказался.
В определенных положениях матрицы происходят замедления (паузы) в
движении РНК-полимеразы, особенно заметные при низких концентрациях
субстратов. Длительность пауз у бактерий модулируется регуляторными
белками NusA и NusG. Паузы сопровождаются возвратными движениями
РНК-полимеразы, которые, в отличие от возвратных движений при аресте,
имеют меньшую амплитуду и носят обратимый характер. При обратимых
возвратных движениях, так же как и при аресте, возможно расщепление
РНК с последующим наращиванием новообразованного 3'-конца. Предпо-
лагается, что эти процессы не только регулируют скорость элонгации, но и
позволяют осуществлять коррекцию РНК в случае включения некомпле-
ментарного нуклеотида.
Для терминации транскрипции необходима дестабилизация элонгацион-
ного комплекса. В случае бактерий это происходит в результате взаимодей-
ствия РНК-полимеразы со специальными последовательностями РНК, зако-
дированными в ДНК-терминаторами (Uptain et al., 1997; von Hippel, 1998;
Nudler, 1999). Для узнавания некоторых терминаторов бактериальной РНК-
полимеразе не требуется никаких белковых факторов. Важную роль в таких
терминаторах играют шпильки РНК.
114
ОПРЕДЕЛЕНИЕ СТРУКТУРЫ
МИНИМАЛЬНОЙ РНК-ПОЛИМЕРАЗЫ THERMUS AQUATICUS
МЕТОДАМИ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
Кристаллы минимальной РНК-полимеразы Т. aquaticus давали рентге-
новские рефлексы, соответствующие умеренному разрешению 3,7 ангстре-
ма. При таком разрешении нельзя увидеть положение боковых цепей без
привлечения дополнительной информации. Подробное описание процедур,
позволивших значительно улучшить модель и добиться разрешения индиви-
дуальных аминокислотных остатков, можно найти в статьях (Zhang et al.,
1999; Darst, 2001). Важную роль сыграли наши данные, позволившие опре-
делить положения иона магния, удерживаемого небольшим эволюционно
консервативным (т.е. практически одинаковым у всех исследованных живых
организмов) участком 0'-субъединицы (Zaychikov et al., 1996).
При описании структуры молекулы РНК-полимеразы (см. рис. 36) ис-
пользуется пестрая смесь терминов, заимствованных из анатомии и техники.
Чаще всего встречается сравнение с клешнями краба. Одна из клешней (или
челюстей), которая на исходном рисунке была помещена наверху и названа
крышей, образована в основном 0-субъединицей, а другая - 0'-субъедини-
цей. Между клешнями располагается канал, средняя ширина которого со-
ставляет 27 ангстрем. Наличие канала, в котором может поместиться двуни-
тевая ДНК, было обнаружено ранее при изучении структур РНК-полимера-
зы низкого разрешения (12-25 ангстрем). Совершенно неожиданно оказа-
лось, что в этом канале имеется мостик, образованный центральной частью
эволюционно консервативного района Р0'-субъединицы, имеющий спираль-
ную структуру. Этот так называемый 0'-Р-мостик пересекает канал пример-
но посередине, связывая верхнюю клешню с нижней. К 0'-Р-мостику приле-
гает петля, образованная консервативным районом С0'-субъединицы. Вме-
сте они образуют стенку, которая разделяет канал на главный и малый ка-
налы. Малый канал имеет диаметр около 12 ангстрем и следовательно
слишком узок для того, чтобы пропускать двунитевую ДНК. Каталитиче-
ский ион магния располагается при входе в малый канал.
Из других бросающихся в глаза структурных элементов главного кана-
ла следует отметить потенциально подвижную заслонку (flap), закрываю-
щую главный канал на одном из его концов, и петлю, поддерживаемую спи-
раль-спираль-подобной структурой, которая по терминологии Дарста напо-
минает руль самолета (rudder) и которую я предлагаю называть по-русски
шипом.
Рассмотрение структуры показывает, что эволюционно консервативные
участки 0- и 0'-субъединиц пространственно сближены, образуя сердцевину
минимальной РНК-полимеразы в виде сферы диаметром 80 ангстрем с цен-
тром в районе каталитического магния. Этот результат согласуется с наши-
ми данными по расщеплению РНК-полимеразы свободными радикалами,
испускаемыми ионами железа, введенными в РНК-полимеразу вместо ката-
литического иона магния (Mustaev et al., 1997).
115
КРАТКАЯ ИСТОРИЯ ИССЛЕДОВАНИЙ РНК-ПОЛИМЕРАЗЫ
В ЛАБОРАТОРИИ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
МИКРООРГАНИЗМОВ В ДОРЕНТГЕНОВСКУЮ ЭРУ
Начало исследованиям РНК-полимеразы в нашем Институте положила
работа Хесина и сотрудников, продемонстрировавшая, что РНК полимераза
Е. coli способна считывать с очищенной ДНК фага Т2 не все имеющиеся в
ней гены, а только те, которые функционируют в живой клетке на ранних
стадиях инфекции (Хесин и др., 1962). Эта классическая работа продолжает
цитироваться и обсуждаться и в настоящее время (Kolesky et al., 1999).
Крупным прорывом было получение первых мутаций, изменяющих ге-
ны РНК-полимеразы Е. coli, а следовательно, и свойства самого белка. Это
были мутации устойчивости к антибиотикам рифампицину и стрептолидиги-
ну (Ovchinnikov et al., 1983; Лисицын и др., 1985 ) и первая условнолетальная
мутация tsX (Khesin et al., 1969). Молекулярная природа дефекта, вызывае-
мого мутацией tsX, была вскрыта много позже (Nedea et al., 1999).
После того как в лабораториях Овчинникова и Свердлова была опреде-
лена полная первичная структура генов РНК-полимеразы Е. coli
(Ovchinnikov et al., 1977, 1981, 1982), в совместной работе лабораториий Хе-
сина и Свердлова были расшифрованы первые мутации устойчивости к ан-
тибиотику рифампицину. На Западе эти работы были продолжены в конце
десятилетия (Jin, Gross 1988). Время от времени возвращаемся к ним и мы.
В последние годы, когда устойчивость к рифампицину возбудителя туберку-
леза стала грозной международной проблемой, эти работы продолжают ци-
тироваться (Ramaswamy, Musser, 1998).
Новый этап исследований начался после того как в лаборатории Гольд-
фарба в Нью-Йорке была разработана система сверхпродукции всех субъе-
диниц РНК-полимеразы Е. coli и сборки из них активного фермента
(Zalenskaya et al., 1990), а в ЛМГМ была разработана система генетического
анализа сверхпродуцируемой 0-субъединицы и подготовлена программа на-
правленного мутагенеза (Кашлев и др., 1989). В результате объединения
усилий двух лабораторий появилась работа, в которой впервые была скон-
струирована летальная мутация, направленно изменяющая РНК-полимера-
зу (Kashlev et al., 1990).
В ходе дальнейших исследований генетическими и биохимическими ме-
тодами в наших лабораториях была изучена доменная организация 0- и
Р'-субъединиц РНК-полимеразы Е. coli (Borukhov et al., 1991; Severinov et al.,
1992, 1995a, 1996). С помощью сочетания генетических и химических мето-
дов в составе доменов локализованы участки, имеющие отношение к связы-
ванию субстратов (Mustaev et al., 1991; Lee et al., 1991; Sagitov et al., 1993;
Zakharova et al., 1998; Polyakov et al., 1999), подробно изучены участки связы-
вания антибиотиков рифампицина и стрептолидигина (Лисицин и др., 1985;
Огрызько и др., 1988; Mustaev et al., 1991,1994; Lee et al., 1991; Severinov et al.,
1993, 1994a, 1995), обнаружены участки, имеющие отношение к взаимодей-
ствию РНК-полимеразы с ДНК (Martin, 1992; Nudler et al., 1996) и фактора-
ми Ale фага Т4 (Severinov et al., 1994) и gp2 фага T7 (Nechaev, Severinov, 1999).
Локализованы участки РНК-полимеразы, окружающие ион магния, участ-
вующий в катализе (Zaichikov et al., 1996; Mustaev et al., 1997). В результате
этих исследований мы пришли к заключению, что эволюционно консерва-
116
тивные участки РНК-полимеразы формируют каталитический центр, а эво-
люционно вариабельные участки отвечают за взаимодействие с регулятор-
ными белками. Это заключение полностью подтвердилось при анализе
рентгеновских структур.
Особое внимание в наших исследованиях последнего десятилетия уделя-
лось стадии элонгации РНК. Долгое время считалось, что эта стадия не
представляет особого интереса с точки зрения регуляции генной активности
и является относительно простым монотонным процессом, в котором при-
соединение очередного нуклеотидного звена к цепи РНК ничем не отлича-
ется от присоединения всех предыдущих и последующих звеньев. Интерес к
стадии элонгации резко возрос после обнаружения неравномерности движе-
ния РНК-полимеразы и открытия белковых факторов, модулирующих ско-
рость этого движения. Важным событием стала работа М. Чемберлена с со-
авторами (Surratt et al., 1991) которые обнаружили, что в процессе элонгации
РНК-полимераза может осуществлять реакцию расщепления РНК-продук-
та. Нами были открыты элонгационные факторы GreA и GreB, стимулиру-
ющие этот процесс (Borukhov et al., 1992, 1993). Изучена доменная организа-
ция этих факторов (Koulich, 1998). Были разработаны методы исследования
структуры транскрипционного комплекса, иммобилизованного на твердом
носителе (Kashlev et al., 1993). С их помощью показано, что на определенных
участках матрицы РНК-полимераза переходит в нестабильное состояние,
для которого характерны нарушение нормальных контактов с ДНК, резко
повышенная чувствительность к фактору GreB и склонность к переходу в
неактивное, так называемое арестованное состояние (Nudler et al., 1995;
Komissarova, Kashlev, 1997). Получены данные, свидетельствующие о том,
что переход в такое нестабильное состояние играет ключевую роль на ста-
дии терминации транскрипции. Установлено, что переход в нестабильное
состояние обусловлен сдвигом РНК-полимеразы назад (backtracking), а не ее
сжатием, как одно время представлялось в рамках модели червеобразного
движения РНК-полимеразы (Komissarova, Kashlev, 1997; Nudler et al., 1997).
Незадолго до выяснения пространственной структуры РНК-полимеразы
нами была предложена модель транскрипционного комплекса на стадии
элонгации, которая подвела основные итоги нашей многолетней работы по
исследованию химических сшивок и мутантных РНК-полимераз и послужи-
ла отправной точкой для построения молекулярных моделей, основанных на
данных ретгеноструктурного анализа. Центральным элементом этой (как и
всех предшествующих) модели является гибрид между матричной нитью
ДНК и растущей нитью РНК-продукта (Yager et al., 1991). Многие годы шли
споры относительно длины (от 2 до 12 н.п.) этого гибрида и о его роли в оп-
ределении стабильности элонгационного комплекса. Наши данные проде-
монстрировали, что эта длина составляет около 8 н.п. (Korzheva, 1998). Мо-
дель включает следующие элементы нуклеинового каркаса: передний и зад-
ний (относительно хода транскрипции) ДНК-дуплексы длиной примерно
10 н.п. каждый, РНК-ДНК-гибрид (гетеродуплекс) длиной 8-9 н.п., неспа-
ренную нематричную нить ДНК длиной около 12 н. и неспаренную нить
РНК позади гетеродуплекса. Предполагается, что все узлы описанного вы-
ше нуклеинового каркаса фиксируются специфическими контактами с
РНК-полимеразой. Замки, фиксирующие узлы этого каркаса, должны обес-
печивать не только его высокую прочность, но и способность РНК-полиме-
117
разы легко скользить относительно нуклеиновых кислот, обеспечивая рас-
плетание и заплетание гетеро- и гомодуплексов. Поверхностным описанием
этих устройств может служить аналогия с застежкой “молнией”.
ПРОСТРАНСТВЕННАЯ МОДЕЛЬ
ЭЛОНГАЦИОННОГО КОМПЛЕКСА
Рентгеноструктурные работы открыли недоступные ранее возможности
исследования структуры и функций РНК-полимераз, в частности для анали-
за структур низкого разрешения, видимых под электронным микроскопом
(Finn et al., 2000), а также для интерпретации данных по контактам РНК-по-
лимеразы с ДНК-матрицей и РНК-продуктом, полученных методом химиче-
ских сшивок. Рассмотрение структуры показало, что все наши ранее опуб-
ликованные предсказания относительно общего характера организации ак-
тивного центра и прилегающих к нему участков оказались правильными.
Более того, на основании этих данных сразу же удалось расположить моле-
кулу ДНК-матрицы на белке и определить направление транскрипции - от
иона магния в сторону кармана, где были локализованы мутации устойчиво-
сти к рифампицину (Zhang et al., 1999). Дополнительные эксперименты по
химическим сшивкам позволили нам в содружестве с лабораторией С. Дар-
ста построить пространственную модель комплекса РНК-полимеразы с ну-
клеиновыми кислотами в процессе удлинения (элонгации) цепи РНК
(Korzheva et al., 2000; Korzheva, Mustaev, 2001). При построении модели мы
придерживались весьма жесткого ограничения, согласно которому
ДНК-ДНК- и РНК-ДНК дуплексы имели жесткую структуру, известную
для нуклеиновых кислот вне комплексов с белками, а изменений в структу-
ре РНК-полимеразы не допускалось. Поэтому модель не претендует на де-
тальное описание взаимодействий индивидуальных звеньев нуклеиновых
кислот и аминокислотных остатков РНК-полимеразы.
Предложенная нами модель дает представление о том, где должны рас-
полагаться постулированные нами ранее замки, и ясно показывает, что для
их закрывания необходимо сближение верхней и нижней челюстей РНК-по-
лимеразы. В формировании переднего замка может участвовать стенка,
а в формировании заднего замка - шип, как это показано на рисунке. Для за-
слонки напрашивается важная роль во взаимодействии РНК-полимеразы со
шпильками РНК в процессе терминации и при паузах. В настоящее время
мы занимаемся проверкой этих предсказаний.
Весной 2001 г. появились пространственные модели РНК-полимеразы II
дрожжей высокого разрешения, построенные на основании рентгенострукт-
руктурного анализа кристаллов свободной РНК-полимеразы (Cramer et aL,
2001) и РНК-полимеразы в элонгационном комплексе с ДНК и РНК-продук-
том (Gnatt et al., 2001). Как и ожидалось, не только общая организация, но и
большинство деталей структуры в районе активного центра и района, обес-
печивающего удержание РНК-ДНК гибрида, у дрожжевой и бактериальных
РНК полимераз очень похожи. Существенные отличия наблюдаются на пе-
реферии, где располагаются малые субъединицы дрожжевой полимеразы,
в частности в тех районах, которые обеспечивают удержание переднего и
заднего ДНК-дуплекса. Анализ структур подтвердил наше предположение
118
о том, что в процессе формирования транскрипционного комплекса происхо-
дит сближение челюстей фермента, и позволил идентифицировать шарнир-
ные участки, ответственные за этот структурный переход. Эти данные пока-
зали, что замыкание РНК-полимеразы вокруг ДНК происходит совсем по-
другому, чем в случае репликации ДНК (Jeruzalmi et aL, 2001).
ПЕРСПЕКТИВЫ
Наша долгосрочная цель при изучении элонгации заключается в выясне-
нии динамики активного центра в этом процессе и расшифровке структур-
ных механизмов передачи регуляторных сигналов от белковых факторов к
активному центру. При выборе конкретных задач на ближайшее время мы
уделили особое внимание тем деталям активного центра, в которых на фоне
значительного структурного сходства бактериальной и дрожжевой РНК-по-
лимераз, удалось обнаружить характерные отличия. В настоящее время мы
пытаемся выяснить возможную функциональную роль этих различий.
В число наших ближайших задач входит также изучение центра(ов) вза-
имодействия РНК-полимеразы с каталитическими ионами магния. Извест-
но, что в односубъединичных ДНК- и РНК-полимеразах синтез фосфо-
диэфирной связи осуществляется при прямом участии двух близкорасположен-
ных ионов магния, удерживаемых в каталитическом центре отрицательно
заряженными аминокислотными остатками (Joyce, Steitz, 1995). В ДНК-по-
лимеразе I Е. coli - это D705, D882 и Е883, в РНК-полимеразе Т7 - это D537
и D812. Участие этих остатков в хелатировании двух близко расположенных
ионов магния показано ретгеноструктурным анализом. Функциональная
важность этих остатков продемонстрирована с помощью мутаций. Предпо-
лагается, что ионы двухвалентных металлов играют аналогичную роль и в
многосубъединичных РНК-полимеразах, однако вопрос этот изучен явно
недостаточно. В наших работах с помощью расщепления белка железом,
вытеснившим ион(ы) магния из состава РНК-полимеразы Е. coli, был выяв-
лен центр удержания магния и марганца с константой диссоциации порядка
10 цМ. В этих же работах было продемонстрировано, что основную роль в
формировании этого центра играет эволюционно-консервативный мотив
NADFDGD бета-штрих субъединицы. Именно в этом центре был обнаружен
ион металла в кристаллической структуре минимальной РНК-полимеразы
Т. aquaticus. Второго иона магния у этой РНК-полимеразы не было обнару-
жено. Изучая свойства мутантных РНК-полимераз Е. coli, нам удалось полу-
чить данные в пользу участия в катализе двух ионов магния и построить про-
странственную модель их расположения в активном центре. В рамках пред-
ложенной модели удалось значительно продвинуться в понимании механиз-
ма действия белков GreA и GreB.
Планируем мы также исследования структуры центра узнавания и от-
крывания промоторов и механизмов превращения промоторного транс-
крипционного комплекса в элонгационный. Для этого предполагается ис-
пользовать, в частности, развиваемый в нашей лаборатории метод формаль-
дегидных сшивок. Результаты этих исследований скоро получат солидную
структурную базу, так как в ближайшее время ожидается публикация стру-
ктуры холофермента Т. aquaticus (С. Дарст, частное сообщение).
119
ЛИТЕРАТУРА
Кашлев М.В., Басс И.А., Лебедев А.Н. и др. Делеционно-инсерционное картирование
области, не существенной для функционирования бета-субъединицы РНК-полиме-
разы Escherichia coli // Генетика. 1989. Т. 25. С. 396-405.
Лисицын Н.А., Свердлов Е.Д., Моисеева Е.П., Никифоров В.Г. Локализация мутации,
приводящей к устойчивости РНК-полимеразы Е. coli к антибиотику стрептолидиги-
ну, в гене гроВ, кодирующем р-субъединицу фермента // Биоорган, химия. 1985.
Т. 11. С. 132-133.
Никифоров В.Г. Структурно-функциональные исследования РНК-полимеразы // Моле-
куляр. биология. 2002. Т. 36. С. 197-207.
Хесин Р.Б., Шемякин Н.Ф., Горленко Ж.М. и др. РНК-полимераза в клетках Escherichia
coli В, зараженных фагом Т2 Ц Биохимия. 1962. Т. 27. С. 1092-1105.
Bartlett M.S., Thomm М., Geiduschek Е.Р. The orientation of DNA in an archaeal transcription
initiation complex // Nat. Struct. Biol. 2000. Vol. 7. P. 782-785.
Beal R.B., Pillai R.P., Chuknyisky P.P. et al. Structural studies on the active site of Escherichia
coli RNA polymerase. 2. Geometrical relationship of the interacting substrates //
Biochemistry. 1990. Vol. 29. P. 5994-6002.
Bell S.D., Jackson S.P. Charting a course through RNA polymerase // Nat. Struct. Biol. 2000.
Vol. 7. P. 703-705.
Borukhov S., Polyakov A., Nikiforov V., Goldfarb A. GreA protein: a transcription elongation fac-
tor from Escherichia coli // Proc. Natl. Acad. Sci. USA. 1992. Vol. 89. P. 8899-8902.
Borukhov S., Sagitov V., Goldfarb A. Transcript cleavage factors from E. coli Ц Cell. 1993.
Vol. 72. P. 459-466.
Borukhov S., Severinov K., Kashlev M. et al. Mapping of trypsin cleavage and antibody-binding
sites and delineation of a dispensable domain in the beta subunit of Escherichia coli RNA
polymerase Ц J. Biol. Chem. 1991. Vol. 266. P. 23921—23926.
Brodolin K., Mustaev A., Severinov K., Nikiforov V. Identification of RNA polymerase beta' sub-
unit segment contacting the melted region of the lacUV5 promoter Ц Ibid. 2000. Vol. 275.
P. 3661-3666.
Cramer P., Bushnell D.A., Fu J. et al. Architecture of RNA polymerase П and implications for the
transcription mechanism // Science. 2000. Vol. 288. P. 640-649.
Cramer P., Bushnell D.A., Kornberg R.D. Structural basis of transcription: RNA polymerase II at
2.8 angstrom resolution // Ibid. 2001. Vol. 292 № 5523. P. 1863-1876.
Darst S.A. Bacterial RNA polymerase // Curr. Opin. Struct. Biol. 2001. Vol. 11. P. 155—162.
Ebright R.H. RNA polymerase: Structural similarities between bacterial RNA polymerase and
eukaryotic RNA polymerase II // J. Mol. Biol. 2000. Vol. 304. P. 687-698.
Finn R.D., Orlova E.V., Gowen B. et al. Escherichia coli RNA polymerase core and holoenzyme
structures // EMBO J. 2000. Vol. 19. P. 6833-6844.
Gnatt A.L., Cramer P., Fu J. et al. Structural basis of transcription: an RNA polymerase II elon-
gation complex at 3.3 A resolution // Science. 2001. Vol. 292. P. 1876-1882.
Gross C.A., Chan C., Dombroski A. et al. The functional and regulatory roles of sigma factors in
transcription // Cold Spring Harbor Symp. Quant. Biol. 1998. Vol. 63. P. 141-155.
Hippel P.H. von. An integrated model of the transcription complex in elongation, termination, and
editing Ц Science. 1998. Vol. 281. P. 660-665.
Jeruzalmi D, Yurieva O, Zhao Y. et al. Mechanism of processivity clamp opening by the delta sub-
unit wrench of the clamp loader complex of E. coli DNA polymerase III // Cell. 2001.
Vol. 106. P. 417-428.
Jin DJ., Gross C.A. Mapping and sequencing of mutations in the Escherichia coli rpoB gene that
lead to rifampicin resistance // J. Mol. Biol. 1988. Vol. 202. P. 45-58.
Joyce C.M., Steitz T.A. Polymerase structures and function: Variation on a theme? // J. Bacteriol.
1995. Vol. 177. P. 6321-6329.
Kashlev M., Lee J., Zalenskaya K. et al. Blocking of the initiation-to-elongation transition by a
transdominant RNA polymerase mutation // Science. 1990. Vol. 248. P. 1006-1009.
Kashlev M., Martin E., Polyakov A. et al. Histidine-tagged RNA polymerase: dissection of the
transcription cycle using immobilized enzyme // Gene. 1993. Vol. 130. P. 9-14.
120
Khesin R.B., Shemyakin M.F., Gorlenko Zh.M. et al. Studies on the RNA polymerase in
Escherichia coli KI 2 using mutation affecting its activity // J. Mol. Biol. 1969. Vol. 42.
P. 401-411.
Kolesky S., Ouhammouch M., Brody E.N., Geiduschek E.P. Sigma competition: the con-
test between bacteriophage T4 middle and late transcription // Ibid. 1999. Vol. 291.
P. 267-281.
Komissarova N., Kashlev M. RNA polymerase switches between inactivated and activated states
by translocating back and forth along the DNA and the RNA // J. Biol. Chem. 1997. Vol. 272.
P. 15329-15338.
Korzheva N., Mustaev A. A transcription elongation complex: Structure and function // Curr. Opin.
Microbiol. 2001. Vol. 4. P. 119-125.
Korzheva N., Mustaev A., Kozlov M. et al. A structural model of transcription elongation //
Science. 2000. Vol. 289. P. 619-625.
Korzheva N., Mustaev A., Nudler E. et al. Mechanistic model of the elongation complex of
Escherichia coli RNA polymerase // Cold Spring Harbor Symp. Quant. Biol. 1998. Vol. 63.
P. 337-345.
Koulich D., Nikiforov V., Borukhov S. Distinct functions of N and C-terminal domains
of GreA, an Escherichia coli transcript cleavage factor // J. Mol. Biol. 1998. Vol. 276.
P. 379-389.
Kulbachinskiy A., Mustaev A., Goldfarb A., Nikiforov V. Interaction with free beta' subunit
unmasks DNA-binding domain of RNA polymerase sigma subunit // FEBS Lett. 1999.
Vol. 454. P. 71-74.
Lee J., Kashlev M., Borukhov S., Goldfarb A. A beta subunit mutation disrupting the catalytic
function of Escherichia coli RNA polymerase Ц Proc. Nat. Acad. Sci. USA. 1991. Vol. 88.
P. 6018-6022.
Lisitsyn N. A., Sverdlov E D., Moiseyeva E.P. et al. Mutation to rifampicin resistance at the begin-
ning of the RNA polymerase P subunit gene in Escherichia coli // Mol. and Gen. Genet. 1984.
Vol. 196. P. 173-174.
Malhotra A., Severinova E., Darst S.A. Crystal structure of a sigma 70 subunit fragment from
E. coli RNA polymerase // Cell. 1996. Vol. 87. P. 127-136.
Martin E., Sagitov V.. Burova E. et al. Genetic dissection of the transcription cycle. A mutant RNA
polymerase that cannot hold onto a promoter // J. Biol. Chem. 1992. Vol. 267.
P. 20175-20180.
Mustaev A., Kashlev M., Lee J.Y. et al. Mapping of the priming substrate contacts in the active cen-
ter of Escherichia coli RNA polymerase // Ibid. 1991. Vol. 266. P. 23927-23931.
Mustaev A., Kozlov M., Markovtsov V. et al. Modular organization of the catalytic center of RNA
polymerase // Proc. Nat. Acad. Sci. USA. 1997. Vol. 94. P. 6641-6645.
Naryshkin N., Revyakin A., Kim Y. et al. Structural organization of the RNA polymerase-promoter
open complex // Cell. 2000. Vol. 101. P. 601-611.
Nechaev S., Chlenov M., Severinov K. Dissection of two hallmarks of the open promoter complex
by mutation in an RNA polymerase core subunit // J. Biol. Chem. 2000. Vol. 275.
P. 25516-25522.
Nechaev S., Severinov K. Inhibition of Escherichia coli RNA polymerase by bacteriophage T7
gene 2 protein // J. Mol. Biol. 1999. Vol. 289. P. 815-826.
Nedea E.C., Markov D., Naryshkina T., Severinov K. Localization of Escherichia coli rpoC muta-
tions that affect RNA polymerase assembly and activity at high temperature // J. Bacterio!.
1999. Vol. 181. P. 2663-2665.
Nedler E. Transcription elongation: structural basis and mechanisms Ц J. Mol. Biol. 1999.
Vol. 288. P. 1-12.
Nudler E., Kashlev M., Nikiforov V.. Goldfarb A. Coupling between transcription termination and
RNA polymerase inchworming // Cell. 1995. Vol. 81. P. 351-357.
Nudler E., Mustaev A., Lukhtanov E., Goldfarb A. The RNA-DNA hybrid maintains the register
of transcription by preventing backtracking of RNA polymerase // Cell. 1997. Vol. 89.
P. 33-41.
Orlova M., Newlands J., Das A. et al. Intrinsic transcript cleavage activity of RNA polymerase //
Proc. Nat. Acad. Sci. USA. 1995. Vol. 92. P. 4596^600.
121
Ovchinnikov Y.A., Lipkm V.M., Modyanov N.N. et al. Primary structure of alpha-subunit of
DNA-dependent RNA polymerase from Escherichia coli // FEBS Lett. 1977. Vol. 76.
P. 108-111.
Ovchinnikov Y.A., Monastyrskaya G.S., Gubanov V.V. et al. The primary structure of Escherichia
coli RNA polymerase. Nucleotide sequence of the rpoB gene and amino-acid sequence of the
beta-subunit//Europ J. Biochem. 1981. Vol. 116. P. 621—629.
Ovchinnikov Y.A., Monastyrskaya G.S., Gubanov V.V. et al. The primary structure of E. coli RNA
polymerase. Nucleotide sequence of the rpoC gene and amino acid sequence of the beta'-sub-
unit // Nucl. Acids Res. 1982. Vol. 10. P. 4035^1044.
Ovchinnikov YA., Monastyrskaya G.S., Guriev S.O. et al. RNA polymerase rifampicin resistance
mutations in Escherichia coli: sequence changes and dominance // Mol. and Gen. Genet.
1983. Vol. 190. P. 344-348.
Poglitsch C.L., Meredith G.D., GnattA.L. et al. Electron crystal structure of an RNA polymerase II
transcription elongation complex // Cell. 1999. Vol. 98. P. 791-798.
Polyakov A., Nikiforov V., Goldfarb A. Disruption of substrate binding site in E. coli RNA poly-
merase by lethal alanine substitutions in carboxy terminal domain of the beta subunit // FEBS
Lett., 1999.Vol. 444. P. 189-194.
Polyakov A., Severinova E., Darst S.A. Three-dimensional structure of E. coli core RNA poly-
merase: promoter binding and elongation conformations of the enzyme // Cell. 1995. Vol. 83.
P. 365-373.
Ramaswamy S., Musser J.M. Molecular genetic basis of antimicrobial agent resis-
tance in Mycobacterium tuberculosis: 1998 update // Tuber Lung Diseas. 1998. Vol. 79.
P. 3-29.
Reines D., Chamberlin M.J., Kane CM. Transcription elongation factor SII (TFIIS) enables RNA
polymerase II to elongate through a block to transcription in a human gene in vitro // J. Biol.
Chem. 1989. Vol. 264. P. 10799-10809.
Rudakova E.A., Ivanovskaya M.G., Kozlov M.V. et al. Probing contacts of phosphate groups of
oligonucleotides from the non-template strand of lac UV5 promoter with E. coli RNA poly-
merase using regioselective cross-linking // Biochemistry (Moscow). 2000. Vol. 65.
P. 640-650.
Sagitov V., Nikiforov V., Goldfarb A. Dominant lethal mutations near the 5' substrate binding site
affect RNA polymerase propagation // J. Biol. Chem. 1993. Vol. 268. P. 2195-2202.
Severinov K, Kashlev M., Severinova E. et al. A non-essential domain of Escherichia coli RNA
polymerase required for the action of the termination factor Ale I I Ibid. 1994. Vol. 269.
P. 14254-14259.
Severinov K, Markov D., Severinova E. et al. Streptolydigin-resistant mutants in an evolutionari-
ly conserved region of the beta' subunit of Escherichia coli RNA polymerase // Ibid. 1995.
Vol. 270. P. 23926-2329.
Severinov K, Mustaev A., Kashlev M. et al. Dissection of the beta subunit in the Escherichia coli
RNA polymerase into domains by proteolytic cleavage // Ibid. 1992. Vol. 267.
P. 12813-12819.
Severinov K., Mustaev A., Severinova E. et al. Assembly of functional Escherichia coli RNA poly-
merase containing beta subunit fragments // Proc. Nat. Acad. Sci. USA. 1995a. Vol. 92.
P. 4591^1595.
Severinov K., Soushko M., Goldfarb A., Nikiforov V. Rifampicin region revisited. New rifampicin-
resistant and streptolydigin-resistant mutants in the beta subunit of Escherichia coli RNA
polymerase // J. Biol. Chem. 1993. Vol. 268. P. 14820-14825.
Severinov K., Soushko M., Goldfarb A., Nikiforov V. RifR mutations in the beginning of the
Escherichia coli rpoB gene // Mol. and Gen. Genet. 1994a. Vol. 244. P. 120-126.
Surratt C.K., Milan S.C., Chamberlin MJ. Spontaneous cleavage of RNA in ternary complexes of
Escherichia coli RNA polymerase and its significance for the mechanism of transcription //
Proc. Nat. Acad. Sci. USA. 1991. Vol. 88. P. 7983-7987.
Uptain S.M., Капе C.M., Chamberlin MJ. Basic mechanisms of transcript elongation and its reg-
ulation//Annu. Rev. Biochem. 1997. Vol. 66. P. 117-172.
122
Yager T.D., Von Hippe P.H. A thermodynamic analysis of RNA transcript elongation and termi-
nation in Escherichia coli // Biochemistry. 1991. Vol. 30. P. 1097-1118.
Zakharova N., Bass I., Arsenieva E. et al. Mutations in and monoclonal antibody binding to evo-
lutionary hypervariable region of Escherichia coli RNA polymerase beta' subunit inhibit
transcript cleavage and transcript elongation // J. Biol. Chem. 1998. Vol. 273. P. 24912-
24920.
Zalenskaya K., Lee J., Gujuluva C.N. et al. Recombinant RNA polymerase: inducible overexpres-
sion, purification and assembly of Escherichia coli rpo gene products // Gene. 1990. Vol. 89.
P. 7-12.
Zaychikov E., Martin E„ Denissova L. et al. Mapping of catalytic residues in the RNA polymerase
active center//Science. 1996. Vol. 273. P. 107-109.
Zhang G., Campbell E.A., Minakhin L. et al. Crystal structure of Thernius aquaticus core RNA
polymerase at 3.3 A resolution // Cell. 1999. Vol. 98. P. 811-824.
ГОРИЗОНТАЛЬНЫЙ ПЕРЕНОС ГЕНОВ
В ПРИРОДНЫХ ПОПУЛЯЦИЯХ БАКТЕРИЙ.
ГЕНЫ И ТРАНСПОЗОНЫ УСТОЙЧИВОСТИ
К СОЕДИНЕНИЯМ РТУТИ
С.З. Миндлин, И.А. Басс, Е.С. Богданова,
Ж.М. Горленко, Э.С. Каляева, М.А. Петрова,
Г.Я. Холодий, В.Г. Никифоров
Лаборатория молекулярной генетики микроорганизмов
В обзоре рассмотрены собственные и литературные данные по гори-
зонтальному переносу детерминант устойчивости к соединениям ртути
в природных популяциях бактерий. Показано, что практически одинако-
вые по нуклеотидной последовательности опероны и транспозоны ус-
тойчивости к соединениям ртути распространены среди бактерий раз-
личных систематических групп, обитающих в географически удаленных
регионах земного шара. Обнаружены рекомбинантные тег-опероны и
транспозоны. Представленные данные свидетельствуют о распростра-
ненности горизонтального переноса детерминант устойчивости к рту-
ти в природе и рекомбинационных взаимодействиях между ними. Исследо-
ваны механизмы горизонтального переноса генов у природных штаммов
грамотрицательных и грамположителъных бактерий. Выделены и иссле-
дованы ранее неизвестные транспозоны.
СЛОВАРЬ ТЕРМИНОВ
Авторадиография - метод выявления распределения пятен радиоактивности на
фильтре путем наложения на него в темноте специальной фотопленки.
Геном — совокупность генов клетки.
Гибридизация по Саузерну - метод обнаружения специфических нуклеотидных пос-
ледовательностей ДНК путем переноса электрофоретически разделенных фраг-
ментов ДНК из агарозного геля на нитроцеллюлозный фильтр и гибридизации
последнего с мечеными ДНК-зондами. Образование гибридов обнаруживают ме-
тодом авторадиографии.
Гомологичная рекомбинация - процесс рекомбинации, осуществляемый между мо-
лекулами ДНК с высоким уровнем гомологии (сходства).
Горизонтальный перенос генов (ГПГ) - передача генов между одновременно существу-
ющими организмами, а не от родителей - потомству (вертикальная передача генов).
Грамотрицательные и грамположительные бактерии - две большие (содержат бо-
лее 180 и 80 родов, соответственно) эволюционно далекие группы бактерий.
Эти группы отличаются структурой клеточной стенки и идентифицируются по
их способности связывать красители: первые не способны окрашиваться по ме-
тоду Грама, а вторые - окрашиваются.
Дивергенция - появление различий в структуре генов в процессе эволюции.
Днк-зонд - фрагмент ДНК, помеченный радиоактивным изотопом и используемый
для идентификации родственных молекул ДНК или их участков.
Инвертированные терминальные повторы — близкие или идентичные короткие по-
следовательности ДНК, находящиеся на концах /S-элементов (транспозонов) в
противоположной ориентации.
IS-элементы (инсерционные, или вставочные, последовательности) - мобильные гене-
тические элементы длиной 700-1800 пар нуклеотидов, содержащие на концах по-
вторы длиной 10-40 пар нуклеотидов. В их составе могут быть один-два гена, необ-
ходимые для транспозиции. /S'-элементы рассматриваются как простейшие транс-
позоны.
124
Коинтеграт - структура, образующаяся при слиянии двух репликонов (двух плазмид
или плазмиды и хромосомы). Коинтеграты, возникающие в процессе транспози-
ции, содержат на границах репликонов две копии транспозона, ориентирован-
ных в одном направлении.
Мобильный генетический (подвижный) элемент — нуклеотидная последовательность
(участок ДНК), способная изменять положение в геноме. К мобильным элементам
бактерий относят умеренные фаги, плазмиды, IS элементы и транспозоны.
Оперон - участок хромосомы или плазмиды, содержащий несколько структурных
генов, транскрибируемых с образованием одной молекулы мРНК. Оперон, как пра-
вило, включает также элементы, контролирующие его активность (оператор и ре-
гулятор).
Плазмиды - внехромосомные генетические элементы, способные к длительному ав-
тономному существованию и репликации в клетке. Чаще всего это кольцевые
двунитевые молекулы ДНК длиной до 200 тыс. пар нуклеотидов. Могут содер-
жать, помимо необходимых для существования плазмиды, дополнительные ге-
ны, например, гены устойчивости к солям тяжелых металлов или устойчивости
к антибиотикам. Бактерия может содержать одну или несколько разных плаз-
мид, копийность которых также может быть различной.
Популяция - совокупность особей одного вида, обладающих общим генофондом
(что определяется наличием свободного скрещивания) и занимающих опреде-
ленную территорию.
Прокариоты - организмы, клетки которых не содержат ограниченного мембраной
ядра. Аналогом ядра у этих организмов является нуклеоид (примитивная хромо-
сома). К прокариотам относят бактерий.
Резольваза - фермент, участвующий в транспозиции. Осуществляет разделение ко-
интеграта на исходные репликоны посредством сайт-специфической рекомби-
нации между rc.v-сайтами двух транспозонов, находящихся в коинтеграте в виде
прямых повторов. Ген резольвазы входит в состав транспозона.
Рекомбинация - создание новой комбинации генов в результате обмена участками
разных молекул ДНК. При этом возможен взаимный обмен участками молекул
ДНК или односторонний перенос участка ДНК.
Рекомбинантная плазмида - гибридная плазмида, возникающая в результате реком-
бинации между двумя плазмидами или сконструированная in vitro с использова-
нием методов генной инженерии.
Репликация ДНК - самовоспроизведение молекул ДНК, приводящее к образова-
нию их точных копий.
Репликон — единица генома, способная к автономной репликации ДНК. Содержит
одну точку инициации репликации. У бактерий отдельными репликонами явля-
ются хромосома и плазмиды.
res-область (включает в себя несколько сайтов) - специфический участок ДНК в транс-
позоне, с которым связывается фермент резольваза, осуществляющая в про-
цессе транспозиции разделение (“разрешение”) коинтегратов на два отдельных
репликона.
Сайт-специфическая рекомбинация - процесс рекомбинации, осуществляемый ме-
жду молекулами ДНК, имеющими низкий уровень гомологии (сходства) или во-
обще негомологичными. Пример сайт-специфической рекомбинации - разделе-
ние (разрешение) коинтегратов в процессе транспозиции.
Секвенирование ДНК - определение последовательности нуклеотидов в ДНК.
Транспозаза - фермент, участвующий в интеграции транспозона в новый сайт. Ген
транспозазы входит в состав транспозона.
Транспозиция — процесс дупликации транспозона; при этом одна копия сохраняется
в исходном сайте, а другая копия обнаруживается в новом сайте. Транспозиция
включает в себя репликацию нуклеотидной последовательности транспозона и
разрыв последовательности ДНК-мишени, приводящий к образованию сайта, в
который и внедряется транспозон. В процессе транспозиции обычно участвуют
ферменты транспозаза и резольваза.
Транспозоны - последовательности ДНК, способные реплицироваться и внедрять
одну из копий в новое место генома. Относятся к мобильным генетическим эле-
125
ментам. Отличаются от /S'-элементов наличием структурных генов, определяю-
щих функции, не связанные непосредственно с самим процессом перемещения
транспозона по геному, например, гены устойчивости к соединениям ртути или
гены устойчивости к антибиотикам.
Трансформация — перенос генетической информации в бактериальные клетки при
помощи изолированной ДНК.
Хромосома бактерий - молекула ДНК, являющаяся носителем генетической ин-
формации (генов), способная к воспроизведению точных копий в процессе реп-
ликации при участии ферментов.
Эукариоты — организмы (животные, растения, грибы, водоросли, кроме синезеле-
ных, и простейшие), клетки которых содержат сформированное ядро.
СПИСОК СОКРАЩЕНИЙ
ГПГ - горизонтальный перенос генов.
Hg-r - устойчивость к соединениям ртути.
IR — инвертированные повторы.
тег — wcr-оперон, определяет устойчивость к соединениям ртути.
R (Rl, R2) - варианты гена merR, регулируют индукцию оперона ионами Hg2+.
Т,Р,С — гены тег Т, тег Р, тег С, участвуют в транспорте ионов Hg2+ внутрь
клетки.
D - ген тег D, участвует в дополнительной регуляции оперона.
F - ген тег F, функция неизвестна.
В (Bl, В2 , ВЗ) - варианты гена тег В, кодируют различные органомеркуриатлиазы.
ORF - открытая рамка считывания.
ПЦР - полимеразная цепная реакция.
REP-PCR - анализ структуры межгенных повторяющихся палиндромных
последовательностей методом ПЦР.
res — res-область.
sig Y - сигма-фактор.
Tn - транспозон.
1. ГОРИЗОНТАЛЬНЫЙ ПЕРЕНОС ГЕНОВ-
ФУНДАМЕНТАЛЬНАЯ И МЕДИЦИНСКАЯ ПРОБЛЕМА
В настоящее время горизонтальный перенос генов (ГПГ) между различ-
ными видами организмов рассматривается в качестве одного из основных
механизмов адаптивной эволюции [The Horizontal Gene Pool, 2000].
Представление о ГПГ оформилось около 30 лет назад в связи с широким
использованием в лечебных целях антибиотиков и других антибактериаль-
ных препаратов. К этому времени накопилось много фактов появления в
клинике устойчивых к антибиотикам штаммов бактерий и их быстрого рас-
пространения от одних больных к другим, причем этот процесс был описан
одновременно исследователями разных стран и континентов. Выяснилось,
что устойчивые к лекарственным препаратам штаммы бактерий приобрели
способность защищаться от их губительного действия с помощью различ-
ных механизмов. Один из распространенных способов защиты состоит в
инактивации антибиотика посредством специфического фермента, образуе-
мого устойчивыми клетками. Очень часто гены, кодирующие эти фермен-
ты, расположены не на хромосоме, а на внехромосомных элементах - плаз-
мидах. На рис. 37 показано, как осуществляется инактивация ампициллина и
его производных ферментом, кодируемым плазмидным геном. Плазмиды с
126
высокой эффективностью могут перемещаться из одних бактериальных
клеток в другие и придавать им новые свойства. Во многих случаях перенос
происходил между бактериями, относящимися к различным видам, родам и
даже семействам (рис. 38). Так, было обнаружено, что наследственные при-
знаки могут передаваться не только от предков к потомкам (по вертикали),
но и между неродственными организмами, т.е. “по горизонтали”.
В последующие годы подробно исследовали способы горизонтального
переноса генов, открыли и всесторонне изучили различные мобильные эле-
менты, в том числе плазмиды и транспозоны, осуществляющие этот про-
цесс. В настоящее время плазмиды и транспозоны широко используются для
переноса генов в лабораторных условиях.
Природные штаммы бактерий, обитающие в почве и воде, отличаются
от клинических и лабораторных штаммов по своему видовому составу. Кро-
ме того, условия жизни природных бактерий существенно отличаются от ус-
ловий, в которых находятся клинические и лабораторные бактерии. Значи-
тельные колебания температуры и влажности, дефицит питания, частые
стрессы, вызываемые изменением погоды, приводят к тому, что скорость
размножения природных бактерий часто не превышает нескольких делений
в год (в организме человека и в лабораторных условиях бактерии могут де-
литься каждые 20-30 мин.). Поэтому ГПГ у бактерий в природных услови-
ях, несомненно, может иметь свои характерные особенности.
Изучение переноса генов у природных бактерий представляет значи-
тельно большие трудности по сравнению с его исследованиями у клиниче-
ских микроорганизмов, и полученные сведения до сих пор во многом явля-
ются противоречивыми (Mazodier, Davis, 1991; Bell, Friedman, 1994; Duncan et
al., 1994; Roberts, Cohan, 1995; Zavadski et al., 1996; Wemergreen et al., 1997;
Souza, Eguiarte, 1997). Остаются неизвестными масштабы этого явления, его
конкретные механизмы, а также его закономерности и биологические пос-
ледствия.
Исследование ГПГ в природе важно не только для понимания фундамен-
тальных основ эволюционного процесса, но и в прикладном аспекте - для
оценки экологического риска интродукции генно-инженерных микроорга-
низмов и растений в окружающую среду [Stephenson, Wames, 1996; Velkov,
1996].
В Лаборатории молекулярной генетики микроорганизмов (ЛМГМ) ис-
следования ГПГ у бактерий, обитающих в природе, были начаты в 1983 г.
Они были задуманы и инициированы Р.Б. Хесиным в развитие его предста-
влений о роли мобильных генетических элементов в микро- и макроэволю-
ции живых организмов, изложенных в его монографии “Непостоянство ге-
нома” (Хесин, 1984). В качестве модельной системы для этих исследований
были избраны детерминанты устойчивости к ртути. Этот выбор был обу-
словлен тем, что бактерии, устойчивые к ртути (Hg-r), встречаются повсеме-
стно, и их легко изолировать на селективных средах. Кроме того, уже были
расшифрованы механизмы устойчивости к соединениям ртути и показано,
что детоксификация различных соединений ртути осуществляется группой
генов, объединенных в тег-оперон. Как схематически показано на рис. 39,
токсичные ионы двухвалентной ртути, Hg2+, попадая в клетку, восстанавли-
ваются до менее токсичной металлической ртути, Hg°, и выделяются в окру-
жающую среду (обзоры: Silver, Phung, 1996; Hobman, Brown, 1997).
127
Hg-г-бактерии могут жить при концентрации HgCl2 до 100 мг/л, при этом
в местах их обитания происходит снижение уровня ртутного загрязнения
(Mahler et al., 1986).
Главная задача исследований, развернутых в ЛМГМ, состояла в изуче-
нии вопроса о существовании и распространенности горизонтального пере-
носа в природе на модели детерминант устойчивости к ртути. Основные уси-
лия были сконцентрированы на сравнительном анализе молекулярно-гене-
тической структуры тег-оперонов и обеспечивающих их перенос мобиль-
ных элементов (плазмид и транспозонов), а также на определении характе-
ра их распределения в природных популяциях бактерий.
После смерти Р.Б. Хесина в 1985 г. эту работу возглавил В.Г. Никифоров.
В результате исследований, проведенных в ЛМГМ, была собрана уни-
кальная коллекция устойчивых к ртути штаммов бактерий и при ее комп-
лексном изучении выявлены многочисленные случаи горизонтального пе-
реноса оперонов и транспозонов устойчивости к ртути, изолированы и под-
робно исследованы ранее неизвестные транспозоны, содержащие тег-опе-
роны, а также изучены механизмы и закономерности их распространения
в природе.
2. ОПЕРОНЫ И ТРАНСПОЗОНЫ УСТОЙЧИВОСТИ К РТУТИ,
ИХ ВЫДЕЛЕНИЕ И ГЕНЕТИЧЕСКАЯ ОРГАНИЗАЦИЯ
2.1. СОЗДАНИЕ КОЛЛЕКЦИИ ШТАММОВ Нд-г-БАКТЕРИЙ
Hg-r бактерии обнаружили еще в XIX в. при выяснении причины сниже-
ния эффективности лечения сифилиса ртутными препаратами. В 1968-
1969 гг. были впервые выделены природные Hg-r-бактерии из почвы, и на-
чато изучение механизмов устойчивости (цит. по: Hobman, Brown, 1997).
К настоящему времени наиболее изучен механизм, определяемый mer-one-
ронами.
В большинстве исследований зарубежных ученых Hg-r штаммы бакте-
рий, использованные в работах по изучению структуры mer-оперонов, выде-
ляли из ограниченных регионов, загрязненных соединениями ртути, и сосед-
них с ними незагрязненных водоемов и участков земли (Kelly, Reanney, 1984;
Mahler et al., 1986; Nakamura et al., 1986; Summers, 1986; Barkay, 1987; Jobling
et al., 1988a; Belliveau et al., 1991; Nakamura, Silver, 1994; Osborn et al., 1997).
В отличие от них мы применили глобальный подход и создали коллекцию,
состоящую из небольших выборок Hg-r-бактерий, изолированных из отда-
ленных географических регионов, причем отбирали только штаммы, высо-
коустойчивые к соединениям ртути. Подобные коллекции в литературе не
описаны. Трудности создания такой коллекции описаны Треворсом с соавт.
(Belliveau et al., 1991).
Наша коллекция содержит Hg-r штаммы, выделенные из ртутных место-
рождений, находящихся в горах Западного Тянь-Шаня в Киргизии (Хайдар-
кан), в восточном предгорье Карпат (Боркут и Большой Шаян), на Северном
Кавказе (Сахалинский и Дальнее), в Никитовке на Украине, а также
Hg-r-штаммы, выделенные из неразрабатывающихся ртутных месторожде-
ний на Камчатке и острове Кунашир (Курильские острова). В некоторых
128
случаях проводили отлов грызунов и земноводных, обитающих внутри или
вблизи шахт, и отбирали пробы из кишечника этих животных. Позднее кол-
лекция была дополнена штаммами, собранными вне ртутных месторожде-
ний в нескольких местах Центральной России, Северной Америки и Новой
Зеландии (Хесин, 1985; Миндлин и др., 1986; Богданова и др., 1988, 1998;
Kholodii et al., 1993a,b, 1997, 2000; Yurieva et al., 1997; Bogdanova et al., 1998;
Mindlin et al., 2001).
Для идентификации бактерий использовали морфологические и биохи-
мические методы. В ряде случаев определяли нуклеотидную последователь-
ность гена 16S г РНК. Для выявления отличий между некоторыми штамма-
ми сравнивали структуры их повторяющихся межгенных палиндромных по-
следовательностей (метод REP-PCR).
Грамотрицательные Hg-r-бактерии нашей коллекции относятся преиму-
щественно к трем систематическим группам у-подкласса: Acinetobacter (око-
ло 50 штаммов), Pseudomonadaceae (около 100 штаммов), Enterobacteriaceae
(около 50 штаммов).
Грамположительные Hg-r-бактерии являются представителями обеих
эволюционных ветвей этих бактерий - групп с высоким (Arthrobacter, Myco-
bacterium, Micrococcus, Rhodococcus, Citreobacterium) и низким (Bacillus,
Exiguobacterium) содержанием Г + Ц в ДНК. Они были выделены из грунта
Закарпатья, Подмосковья, Средней Азии, Камчатки и Курильских островов
(всего около 60 штаммов).
2.2. ВЫДЕЛЕНИЕ ОПЕРОНОВ
И ТРАНСПОЗОНОВ РТУТНОЙ УСТОЙЧИВОСТИ
Как упоминалось выше, устойчивость бактерий к соединениям ртути мо-
жет обеспечиваться не только присутствием w/ег-оперонов, но и другими ме-
ханизмами, например способностью синтезировать сероводород, как у бак-
терий в коллекции Треворса (Belliveau et al., 1991). Поэтому на первом эта-
пе работы в результате анализа почти 150 штаммов грамотрицальных и
грамположительных бактерий мы отобрали Hg-r штаммы, несущие тег-опе-
роны. О присутствии у бактерий тег-оперонов судили по активности коди-
руемых ими ферментов ртуть-редуктаз.
В дальнейшем поиск оперонов и транспозонов устойчивости к ртути
проводили двумя способами:
1) методом гибридизации по Саузерну: колонии бактерий или ДНК, вы-
деленную из Hg-r-штаммов, гибридизовали с фрагментами тег-оперонов
или транспозонов в качестве специфических зондов. Затем тег-опероны
вместе с прилегающими к ним участками ДНК клонировали или ПЦР-амп-
лифицировали и определяли их нуклеотидные последовательности.
2) путем выделения активных транспозонов с помощью плазмид широ-
кого круга хозяев, переноса возникших гибридных плазмид в клетки
Escherichia coli и последующего их перемещения на векторные плазмиды.
Этот метод позволяет не только находить ранее неизвестные транспозоны,
но и исследовать распространение как самих транспозонов, так и их состав-
ных элементов. Тем не менее этот метод практически не использовался в
работах зарубежных лабораторий.
5. Проблемы и перспективы...
129
2.3. ГЕНЕТИЧЕСКАЯ ОРГАНИЗАЦИЯ тег-ОПЕРОНОВ
И РТУТНЫХ ТРАНСПОЗОНОВ
В настоящее время молекулярно-генетическая структура тег-оперонов
и функции генов, входящих в их состав, в основном выяснены. Показано, что
они кодируют регуляторные белки, белки транспорта иона ртути внутрь
клетки, фермент ртуть-редуктазу, восстанавливающую ионы ртути в метал-
лическую ртуть, и фермент органомеркуриат-лиазу, гидролизующую орга-
нические соединения ртути (обзоры: Summers, 1986; Silver, Phung, 1996;
Hobman, Brown, 1997). Среди генов, входящих в состав mer-оперона, разли-
чают гены, строго необходимые для его функционирования (тег R,T,P и А)
(рис. 40), и гены дополнительные (тег С, F, В, D, G, Е и иг(2). Первые обяза-
тельно присутствуют во всех оперонах; вторые встречаются в них в различ-
ных сочетаниях (Osborn et al., 1993,1995, 1996,1997; Reniero et al., 1998; Silver,
Phung, 1996; Hobman, Brown, 1997; Liebert et al., 1997; Bogdanova et al., 1998;
Gupta et al.. 1999; Huang Ch.-Ch. et al., 1999b; Kiyono et al., 1999; Mindlin et aL,
2001).
Бактерии, содержащие mer-оперон без гена тегВ (опероны узкого спек-
тра), устойчивы только к неорганическим соединениям ртути. Ген тегВ
обеспечивает устойчивость бактерий и к органомеркуриатам (опероны ши-
рокого спектра) (Kiyono et al., 1995, 1997; обзоры: Silver, Phung, 1996; Hobman,
Brown, 1997).
Некоторые штаммы могут содержать два или три отличающихся по сво-
ей структуре mer-оперона (Griffin et al., 1987; Inoue et al., 1991, Kiyono et al.,
1995).
Транспозоны, несущие mer-опероны, широко распространены среди
клинических штаммов бактерий. Первые из описанных транспозонов этой
группы, Тп507 (рис. 40) и Тп27 были исследованы особенно подробно и пол-
ностью секвенированы. Предполагают, что они произошли от более просто
организованных ртутных транспозонов, возникших первоначально у бакте-
рий окружающей среды (Liebert et al., 1999).
3. ГОРИЗОНТАЛЬНЫЙ ПЕРЕНОС ГЕНОВ
МЕЖДУ РАЗЛИЧНЫМИ БАКТЕРИЯМИ
3.1. МЕТОДЫ ТЕСТИРОВАНИЯ ГПГ
По мере развития и совершенствования методов молекулярной биоло-
гии происходило и повышение уровня достоверности при определении фа-
ктов ГПГ. На первых этапах, помимо анализа фенотипических признаков,
использовали метод сравнительного изучения полиморфизма ферментов;
в настоящее время основным методом является секвенирование (полное
или частичное) геномов различных организмов и их сравнительный
анализ.
В наших исследованиях мы использовали два способа доказательства
фактов ГПГ:
1) когда, при относительно недавнем переносе (в масштабах эволюции),
у неродственных бактерий удается обнаружить очень сходные нуклеотид-
ные последовательности (менее 0,5% нуклеотидных замен): блоки генов, от-
130
дельные гены или их участки, а также полноразмерные плазмиды и транс-
позоны или их фрагменты;
2) когда в геноме бактерии обнаруживают мозаичные участки ДНК,
причем сохраняется граница между последовательностями разного происхо-
ждения, а в идеальных случаях удается идентифицировать исходные донор-
ные последовательности.
Важно, что анализ только недавних случаев ГПГ может позволить выяс-
нить механизмы этого процесса: анализировать механизмы давно произо-
шедшего ГПГ затруднительно из-за постоянных изменений генома, вызыва-
емых перестройками и мутационным процессом.
Исходя из этого, мы проводили широкомасштабный поиск сходных по
нуклеотидной последовательности mer-оперонов и Hg-r транспозонов у
разных бактерий нашей коллекции. В этих исследованиях нами было
выявлено разнообразие mer-оперонов, удалось обнаружить новые, ранее
не описанные структурные варианты этих генов, найти рекомбинант-
ные (мозаичные) опероны и получить указания на то, что ранее тег-опе-
роны были распространены гораздо шире, чем это наблюдается
теперь, т.е. в процессе эволюции бактерий происходила их постепенная
утрата.
Обнаруженные факты ГПГ позволили нам исследовать возможные ме-
ханизмы этого явления. Мы выяснили внутриклеточную локализацию тег-
оперонов, чтобы выявить роль плазмид в их перемещении, и анализировали
нуклеотидные последовательности, окружающие опероны, чтобы выяс-
нить, связаны ли они с транспозонами.
Для выявления случаев ГПГ мы использовали также другой, ориги-
нальный подход - анализировали структуру функционально активных, т.е.
способных к перемещению, Hg-r-транспозонов. В ходе этой работы были
выделены и исследованы более 30 Hg-r-транспозонов и выявлены мозаич-
ные транспозоны и принципиально новые структурные варианты транспо-
зонов.
Детальный анализ мозаичных тег-оперонов и обнаруженных нами моза-
ичных Hg-r-транспозонов позволил выявить механизмы рекомбинации,
происходящие при образовании этих структур, и, следовательно, участвую-
щие в горизонтальном переносе.
3.2. ГОРИЗОНТАЛЬНЫЙ ПЕРЕНОС тег-ОПЕРОНОВ
МЕЖДУ НЕРОДСТВЕННЫМИ БАКТЕРИЯМИ
На первом этапе исследований мы применили метод иммунологическо-
го сравнения ртуть-редуктаз различных Hg-r-штаммов бактерий. С этой це-
лью получили антитела к пяти различным ртуть-редуктазам грамположи-
тельных и грамотрицательных бактерий (Bogdanova, Mindlin, 1988, 1991).
(В литературе описаны антитела только к двум, причем эволюционно близ-
ким ферментам (Silver, Kinscherf, 1982)).
При сравнении ртуть-редуктаз из 60 штаммов грамотрицательных и
60 штаммов грамположительных бактерий, выделенных в Киргизии, Закар-
патье, на Северном Кавказе и Камчатке, было выявлено не менее 4 типов
иммунологически не родственных ртуть-редуктаз и около 20 подтипов.
5*
131
Электрофорез белков с последующим иммуноблоттингом показал разнооб-
разие молекулярных масс ртуть-редуктаз, а опыты по ограниченному про-
теолизу этих ферментов позволили получить более детальные сведения об
их структуре и обнаружить новые структурные варианты. Эта работа впер-
вые показала: 1) большую степень разнообразия ртуть-редуктаз, а, следова-
тельно, и тег-оперонов; 2) отсутствие горизонтального переноса этих генов
между грамотрицательными и грамположительными бактериями и даже ме-
жду двумя эволюционными ветвями грамположительных бактерий; 3) дала
указания на существование горизонтального переноса mer-оперонов среди
неродственных бактерий из географически удаленных районов (Богданова и
др., 1988; Bogdanova, Mindlin, 1988, 1989, 1991). Эти результаты были особен-
но важны для последующей работы с грамположительными бактериями,
для изучения mer-оперонов которых долгое время отсутствовали нуклеотид-
ные зонды.
Как отмечалось ранее, строгие доказательства факта ГПГ можно по-
лучить только определением нуклеотидных последовательностей предпо-
лагаемых перемещенных участков ДНК. В начале нашей работы из лите-
ратуры были известны нуклеотидные последовательности только двух
тег-оперонов, Тп501 иТп21 (Brown et al., 1983, 1986; Misraetal., 1984; 1985;
Barrineau et al., 1983). К настоящему времени нами полностью секвениро-
ваны около 20 mer-оперонов (в других лабораториях — около 10) из раз-
личных грамотрицательных бактерий, а также проведен сравнительный
анализ их структуры (Kholodii et al., 1993а, 1995, 1997, 2000; Yurieva et al.,
1997; Mindlin et al., 2001; Каляева и др., 2001 и цит. по: Liebert et al., 1997,
2000).
Результаты исследований, проведенных как в нашей, так и зарубежных
лабораториях, показали высокий уровень дивергенции генов тег-оперонов
и выявили не менее 10 их различных типов (Yurieva et al., 1997; Liebert et al.,
1997, 2000; Mindlin et al., 2001; Каляева и др., 2001). В то же время анализ
относительно небольшого количества штаммов ( около 200) позволил об-
наружить горизонтальный перенос трех типов mer-оперонов: Тп5053,
Тп5041 и pKLH2. Например, почти идентичные mer-опероны рКЬН2-типа
были найдены в бактериях различных систематических групп, изо-
лированных в отдаленных географических регионах: Enterobacter cloacae
в Закарпатье (Украина), Е. coli в Чикаго (США), Enterobacter agglomerans
в Киргизии, и у Acinetobacter sp. в Саратове, в р. Волге (Yurieva et al.,
1997).
После предварительного анализа тег-оперонов 25 штаммов грамполо-
жительных бактерий, относящихся к ветви с низким Г + Ц-составом, в ос-
новном бацилл, нами были полностью секвенированы 5 разных вариантов
mer-оперонов (в других лабораториях были секвенированы 3 других вариан-
та) (Bogdanova et al., 1998, 2001 и не опубл.; Laddaga et al., 1987; Wang et al.,
1989; Sedlmeier, Altenbuchner, 1992). Практически идентичные mer-опероны с
узким спектром действия мы обнаружили в штаммах разных видов бацилл
(В. cereus и В. sphaericus), изолированных на Камчатке и в Средней Азии со-
ответственно. У Exiguobacterium sp. из рудника в Закарпатье мы обнаружи-
ли тег-оперон широкого спектра действия, практически идентичный оперо-
ну В. cereus RC607 из Бостонского залива в США (Bogdanova et al., 1998;
Wang et al., 1989), и позднее описанным оперонам В. megaterium МВ1 и ана-
132
эробной Clostridium butiricum Mersaru из залива Минамата в Японии (Huang
et aL, 1999а,b; Narita et al., 1999).
Таким образом, при анализе относительно небольшого количества
штаммов бактерий мы обнаружили факты горизонтального переноса 5 раз-
ных вариантов mer-оперонов. Основные выводы, которые позволяют сде-
лать эти результаты: 1) распространенность горизонтального переноса тег-
оперонов среди различных систематических групп природных бактерий и
2) всемирное распространение близких вариантов этих генов (Yurieva et al.,
1997;. Bogdanova et al., 1998; Mindlin et al., 2001).
Далее, мы обнаружили, что разные типы mer-оперонов распространены
неравномерно: одни встречаются повсеместно и с высокой частотой, дру-
гие - значительно реже и, в некоторых случаях, имеют, по-видимому, ло-
кальное распространение (Yurieva et al., 1997; Minakhina et al., 1999; Mindlin
et aL, 2001). Данные нашей лаборатории и групп Ричи и Саммерс свидетель-
ствуют о том, что в природе наиболее часто встречается лишь ограниченное
число типов mer-оперонов. (Yurieva et al., 1997; Osborn et aL, 1997; Liebert
et aL, 1997, 2000; Bogdanova et aL, 1998, 2001; Никифоров и др., 1999).
Закономерности горизонтального переноса mer-оперонов у грамотрица-
тельных и грамположительных бактерий, по-видимому, сходны (Bogdanova
et al., 1998).
Наконец, совокупные данные нашей и других лабораторий продемонст-
рировали присутствие почти одних и тех же mer-оперонов не только у бак-
терий окружающей среды, но и в штаммах неродственных бактерий, обита-
ющих в кишечнике животных (приматов) и человека (Yurieva et aL, 1997;
Osborn et aL, 1997; Liebert et aL, 2000; Mindlin et aL, 2001).
При исследовании грамположительных бактерий, относящихся к родам
Micrococcus, Brevibacterium и Rhodococcus, мы впервые обнаружили у бакте-
рий широкое распространение дефектных шег-оперонов, не способных
обеспечить устойчивость бактерий к соединениям ртути (например, до 70%
штаммов некоторых видов микрококков содержат такие опероны). На осно-
вании этих данных мы предположили, что предки современных бактерий со-
держали, по-видимому, необходимые им полноценные, функционирующие
mer-опероны, а в процессе эволюции происходила их постепенная утрата
(Bogdanova et aL, 1992). Действительно, в настоящее время при сиквенсе ге-
номов различных бактерий часто обнаруживают один из генов тег-оперона,
merR, расположенный внутри различных последовательностей, например,
у Haemophilus influenza, Е. coli и Bacillus subtilis (Christie et aL, 1994;
Fleischmann et. aL, 1995; Parro et al., 1997).
3.3. НОВЫЕ ТРАНСПОЗОНЫ, СОДЕРЖАЩИЕ ДЕТЕРМИНАНТЫ
УСТОЙЧИВОСТИ К РТУТИ
Благодаря использованию оригинальных методов и подходов, упомяну-
тых выше, нам удалось при анализе сравнительно небольшого материала
найти ранее неизвестные ртутные транспозоны, кардинально отличающие-
ся от транспозонов клинических бактерий по структурно-функциональной
организации. Мы подробно описали четыре новых транспозона, обнаружен-
ных нами в штаммах грамотрицательных бактерий, Тп5053, Тп5041, Ег\5044
133
и Тп5070 и провели их сравнительный анализ с “классическими” транспозо-
нами Тп507 и Тп27 (рис. 41).
Транспозиционный модуль Тп5053 содержит четыре гена, негомологич-
ные генам транспозиции Тп27 и родственных ему транспозонов, и нестан-
дартно организованную гел-область (Kholodii et aL, 1993а, 1995; Холодий,
1995). Тп5053 обладает необычно высокой специфичностью при выборе
сайта встраивания: он интегрирует преимущественно в res-сайты плазмид и
транспозонов (Minakhina et al., 1999). В настоящее время Тп5053 вместе с не-
которыми другими транспозонами и ретровирусами объединяют в самосто-
ятельное семейство мобильных элементов (Radstrom et al., 1994; Kholodii
et al., 1995).
Второй из найденных транспозонов, Тп5041, по последовательности ге-
на транспозазы (tnpA) оказался близкородственным транспозону Тп4657, не-
сущему гены деградации толуола. Тп5041 способен перемещаться в ограни-
ченном круге бактерий-хозяев. Транспозоны Тп5041 и Тп4б57 выделили
в отдельную группу внутри семейства ТпЗ (Kholodii et aL, 1997; Холодий
и др., 2000).
Транспозон Тп5044, обнаруженный на Камчатке (Kholodii et aL, 2000),
отличается от других транспозонов как по структуре транспозиционного мо-
дуля, так и по строению тег-оперона. Последний, в дополнение к стандарт-
ному набору генов (merR, Т, Р, С, A, D), содержит ген sigY, кодирующий бе-
лок, родственный сигма-субъединице РНК-полимеразы. Тп5044 вместе с
родственными транспозонами также выделили в отдельную группу внутри
семейства ТпЗ (Kholodii et aL, 2000; Mindlin et aL, 2001).
Обособленное положение занимает также транспозон Тп5070 (см.
рис. 41). По структуре транспозиционного модуля он отличается от “клас-
сических” ртутных транспозонов (гены tnpR и tnpA транскрибируются
в противоположных направлениях; res-сайт расположен между ними).
Нестандартно организован и mer-оперон Тп5070, который содержит толь-
ко четыре гена (merR, Т, Р, А), и все они транскрибируются в одном и том
же направлении (у других транспозонов ген merR транскрибируется в про-
тивоположном направлении, чем остальные гены оперона) (Mindlin et aL,
2001).
Транспозоны с генами устойчивости к ртути у грамположительных бак-
терий до последнего времени не были известны. Впервые в нашей лабора-
тории (Bogdanova et al„ 1998) были получены данные о том, что тег-оперо-
ны грамположительных бактерий сцеплены с генами транспозиции. Даль-
нейшие исследования, проведенные в нашей лаборатории и в Японии, пол-
ностью подтвердили вывод о том, что по крайней мере некоторые mer-one-
роны грамположительных бактерий находятся в составе транспозонов,
сходных с транспозонами ТпЗ-типа (Huang et aL, 1999а,b; Bogdanova et aL,
2001). К настоящему времени у грамположительных бактерий описаны че-
тыре Hg-r-транспозона, три из которых были впервые обнаружены и иссле-
дованы в нашей лаборатории: Тп5Ш5 (из Exigoubacterium sp.TC38-2b),
Тп5084 (из В. cereus RC607), и Tn50S5 (из В. megaterium МК64-1). Мы обнару-
жили, что Тп5Ш5 способен перемещаться в клетках грамотрицательных
Е. coli (Bogdanova et al., 2001).
134
3.4. ГОРИЗОНТАЛЬНЫЙ ПЕРЕНОС
РТУТНЫХ ТРАНСПОЗОНОВ
В ряде исследований показано, что транспозоны, близкородственные
транспозонам клинических бактерий Тп501 и Тп27, повсеместно встречают-
ся среди бактерий, обитающих в природе. Однако нет доказательств распро-
странения идентичных или почти идентичных транспозонов среди бактерий
различных систематических групп (Dahlberg et al., 1995; Pearson et al., 1996;
Osborn et aL, 1997). Такие данные удалось получить в нашей лаборатории в
ходе исследований структуры транспозонов, выделенных из Hg-r-штаммов
почвенных и водных бактерий (Yurieva et aL, 1997; Minakhina et al., 1999;
Bogdanova et al., 2001; Mindlin et aL, 2001).
Два практически идентичных транспозона, Тп5036 и Tn5036vl были вы-
делены из штаммов Enterobacter cloacae (Закарпатье, грунт) и Aeromonas sp.
(Нью-Йорк, вода), соответственно. Эти транспозоны оказались высокого-
мологичными транспозону клинических бактерий, Тп3926 (Osbourn et aL,
1995).
В различных регионах США были обнаружены также два почвенных
штамма псевдомонад, содержащие транспозоны, практически не отличаю-
щиеся от классического транспозона клинических бактерий Тп501 (Mindlin
et aL, 2001).
Несколько случаев горизонтального переноса были выявлены и у транс-
позонов, относящихся к другим типам и семействам мобильных элементов.
Наиболее интересны данные о всемирном распространении вариантов
транспозона Тп5053 среди бактерий различных систематических групп. Эти
транспозоны были обнаружены в Подмосковье, Саратове, Закарпатье и
Киргизии, в США (Нью-Йорк и Бетесда), и в Великобритании у разных ви-
дов Pseudomonas, Enterobacter sp., Xanthomonas sp. и Alcaligenes sp. Результа-
ты частичного секвенирования нескольких из этих транспозонов показали,
что они отличаются от описанного нами “классического” транспозона
Тп5053 менее чем на 0,5%, что свидетельствует о сравнительно недавнем го-
ризонтальном переносе предшественника или варианта этого транспозона
(Hobman et aL, 1994; Mindlin et aL, 2001).
Горизонтальный перенос транспозонов устойчивости к ртути недавно
удалось обнаружить и среди грамположительных бактерий. Так, TnMERIl,
обнаруженный в штамме В. megaterium МВ1 (залив Минамата в Японии), от-
личается от Tn50S5 из Exigoubacterium sp. ТС38-2Ь (Закарпатье) только на-
личием интрона, в остальном они практически идентичны (Huang et aL,
1999а,b; Bogdanova et aL, 2001).
Полученные данные полностью подтвердили выводы о закономерно-
стях ГПГ, сделанные на основании изучения mer-оперонов: широкую
распространенность горизонтального переноса ртутных детерминант
среди бактерий разных видов и родов и преобладание практически одних и
тех же, “наиболее успешных” типов этих генов в разных частях земного
шара.
135
3.5. УЧАСТИЕ ПЛАЗМИД В ПЕРЕНОСЕ ДЕТЕРМИНАНТ
УСТОЙЧИВОСТИ К РТУТИ
По литературным данным, но в основном из работ нашей лаборатории
следует, что mer-опероны часто находятся на плазмидах (Khesin, Karasyova,
1984; Миндлин и др., 1986; Jobling et al., 1988а,b; Grinsted et aL, 1990; Bogda-
nova, Mindlin, 1991; Yurieva et al., 1997; Bogdanova et al., 1998, 2001).
Многие из них способны обеспечить горизонтальный перенос, генов ус-
тойчивости к ртути между различными штаммами и видами природных бак-
терий. Так, конъюгативные плазмиды, обладающие широким кругом хозя-
ев, были обнаружены в штаммах Pseudomonas, Alcaligenes, Citrobacter,
Enterobacter, Acinetobacter, Ralstonia и др. Они принадлежат к различным
группам несовместимости (обзор Summers, 1986; Jobling et al., 1988a,b; Hobman
et al., 1994; Yurieva et al., 1997; Smit et al., 1998; Newby et aL, 2000; Droge
et aL, 2000).
Сложная система распространения Hg-r-детерминант среди широкого
круга бактерий была обнаружена нами у некоторых штаммов Acinetobacter,
содержащих Hg-r-плазмиды двух типов: крупные и мелкие. Крупные плаз-
миды посредством конъюгации могли распространяться только среди штам-
мов различных видов ацинетобактеров; мелкие плазмиды не обладали
конъюгативными свойствами, но с помощью крупных плазмид могли прони-
кать в различные виды бактерий, в том числе далекие в систематическом от-
ношении (Lomovskaya et aL, 1986).
Идентичные mer-опероны рКЕН2-типа были обнаружены в составе
крупных конъюгативных плазмид pKLH272 и pKLH247 у штамма
Enterobacter (Киргизия) и штамма Acinetobacter (р. Волга) соответственно.
Четыре близких варианта тег-оперона pKLHl-типа были найдены в составе
одной и той же неконъюгативной, но мобилизуемой плазмиды у разных ви-
дов Acinetobacter в разных ртутных рудниках Азии и Европы (Миндлин и др.,
1986).
Наконец, мы экспериментально показали перенос ДНК неконъюгатив
пых плазмид при совместном выращивании систематически далеких бакте-
рий Acinetobacter calcoaceticus, Escherichia coli и Pseudomonas aeruginosa
(Миндлин и др., 1990).
До последнего времени считали, что Hg-r-детерминанты многих грам-
положительных бактерий, в частности бацилл, в большинстве случаев
находятся не на плазмидах, а в хромосоме (Mahler et aL, 1986; Wang et aL,
1987, 1989; Nakamura, Silver, 1994; Hart et aL, 1998; Huang Ch.-Ch. et aL,
1999a).
Недавно полученные нами данные о плазмидной локализации детерми-
нант устойчивости к ртути у нескольких штаммов бацилл, в том числе ши-
роко используемого в качестве тестерного американского штамма Bacillus
cereus RC607, заставляют пересмотреть это положение (Bogdanova et aL,
1998, 2001).
136
4. РОЛЬ РЕКОМБИНАЦИИ
В ГОРИЗОНТАЛЬНОМ ПЕРЕНОСЕ
4.1. МОЗАИЧНАЯ (РЕКОМБИНАНТНАЯ) СТРУКТУРА
mer-ОПЕРОНОВ И РАСПРОСТРАНЕНИЕ МОЗАИЧНЫХ
mer-ОПЕРОНОВ В ПРИРОДНЫХ ПОПУЛЯЦИЯХ
В тех случаях, когда удается идентифицировать родительские формы, с
достоверностью можно говорить, что возникновение как отдельных моза-
ичных генов, так и целых оперонов или транспозонов произошло в резуль-
тате рекомбинации между различными элементами, объединившимися в од-
ной клетке в результате горизонтального переноса (например, Maynard
Smith, 1992; The Horizontal Gene Pool, 2000).
Мозаичные опероны устойчивости к ртути, содержащие участки различ-
ного происхождения, впервые были обнаружены в исследованиях нашей ла-
боратории при сравнительном анализе структуры Hg-r-детерминант круп-
ных и мелких плазмид ацинетобактеров (Ломовская, Никифоров, 1988).
Оказалось, что нуклеотидные последовательности Hg-r-детерминант мел-
ких плазмид могут быть представлены в виде продукта рекомбинации меж-
ду соответствующими последовательностями крупной плазмиды и тег-опе-
рона, входящего в состав транспозона Тп507. Поскольку Тп501 был исходно
обнаружен в штамме Р. aeruginosa, присутствие идентичных ему последова-
тельностей в плазмидах ацинетобактеров позволяет сделать вывод о межви-
довом переносе этого транспозона.
Дальнейшие исследования показали, что мозаичные (рекомбинантные)
опероны часто встречаются в нашей коллекции грамотрицательных бакте-
рий. Например, в бактериях различных систематических групп (Enterobacter
cloacae, Enterobacter agglomerans, E. coli и Acinetobacter sp.), изолированных в
географически отдаленных районах (г. Саратов, Закарпатье, Киргизия,
США), мы нашли практически одни и те же mer-опероны, близкородствен-
ные mer-onepony pKLH2 и содержащие вставки других типов последователь-
ностей. Одну из них удалось идентифицировать как последовательность
Тп50/-типа (Yurieva et al., 1997) (рис. 42).
Мозаичные mer-опероны мы обнаружили также у разных видов
Pseudomonas в составе транспозонов, близкородственных Тп5047. В случае
штамма ТС97 mer-оперон содержал, кроме фрагмента mer-оперона Тп5047,
участки генов плазмиды pKLH2 и плазмиды pDU1358 из клинического
штамма Serratia marcescens (Yurieva et al., 1997).
Мозаичный ген ртуть-редуктазы был обнаружен нами в составе тег-
оперона грамположительной В. megaterium МК64-1 (Bogdanova et aL, 2001).
Позднее мозаичные mer-опероны были обнаружены и детально исследо-
ваны в лабораториях Ричи и Саммерс (Osborn et al., 1997; Liebert et al., 1997,
2000).
Таким образом, совокупные данные ЛМГМ и зарубежных лабораторий
с очевидностью свидетельствуют о широком распространении мозаичных
тег-оперонов у бактерий различных систематических групп.
137
4.2. МОЗАИЧНЫЕ (РЕКОМБИНАНТНЫЕ) ТРАНСПОЗОНЫ
Анализ молекулярно-генетической структуры транспозонов показыва-
ет, что многие из них являются рекомбинантами и возникли в результате
взаимодействия между родственными или неродственными мобильными
элементами. Впервые рекомбинантная структура была установлена у
транспозона Тп501. Предполагают, что при его образовании имело место
внедрение одного родственного транспозона в другой с последующим де-
легированием генов транспозиции первого транспозона (Grinsted, Brown,
1984).
Литературные данные о существовании рекомбинантных транспозонов
в природе очень немногочисленны и в основном носят косвенный характер
(Holt et al, 1996; Pearson et al, 1996). Благодаря использованному нами ориги-
нальному подходу к изучению Hg-r-транспозонов, нам удалось показать, что
рекомбинантные транспозоны встречаются в бактериях окружающей среды
с высокой частотой. Так, из 29 транспозонов, исследованных в одной из на-
ших последних работ, 12 имели очевидные признаки рекомбинантного про-
исхождения, например, Тп5036, Тп5041, Тп5053 и Tn5059 (Kholodii et al.,
1993b, 1995, 1997; Yurieva et al., 1997; Mindlin et al., 2001).
Для некоторых рекомбинантных транспозонов удалось четко выявить
обе исходные родительские формы. Так, было показано, что транспозон
Тп5046 является мозаичным и состоит из фрагментов ДНК, близкородствен-
ных соответствующим фрагментам транспозонов Тп5044 и Тп504/ (рис. 43).
Три из четырех известных Hg-r-транспозонов бацилл, Tn50<S4, Tn50S5 и
TvtMERH также можно считать рекомбинантными. Структура рекомбинант-
ных транспозонов Тп5084 и Tn50S5, изученных в нашей лаборатории
(Bogdanova et aL, 2001), схематически представлена на рис. 44. Видно, что оба
этих транспозона имеют общего родителя - Тп5Ш5. Тп5084 представляет со-
бой в основном Тп5Ш5, ген резольвазы и res-область которого заменены на
аналогичный фрагмент неизвестного транспозона. Другой - Tn50<S3, возник,
по-видимому, в результате сайт-специфической рекомбинации в области
res-сайта между Тп5Ш5 и значительно отличающимся от последнего транс-
позоном, близким транспозону из В. firmus и содержащим гены устойчиво-
сти к кадмию. Гены транспозиции последнего всего на 60% гомологичны ге-
нам транспозициии Tn50<S'5 (Bogdanova et aL, 2001).
Для образования рекомбинантных mer-оперонов и транспозонов необхо-
димо одновременное присутствие внутри бактерии двух или более этих эле-
ментов. Действительно, по нашим и литературным данным, в клетке часто
обнаруживаются разные mer-опероны и транспозоны в составе одной или
нескольких плазмид (Миндлин и др., 1986; Lomovskaya et а!.. 1986; Kiyono
et al., 1995; Yurieva et aL, 1997; Liebert et aL, 1997; Mindlin et aL, 2001).
А в штамме E. coli CH-210 мы обнаружили два транспозона, Тп5057 и
Тп5059, относящиеся к различным семействам мобильных элементов; пер-
вый находится в хромосоме, второй - на плазмиде (Yurieva et aL, 1997;
Mindlin et aL, 2001).
Все полученные данные о мозаичных mer-оперонах и транспозонах яви-
лись подтверждением вывода о распространенности горизонтального пере-
носа Hg-r-детерминант в окружающей среде и позволили выяснить механиз-
мы рекомбинации, участвующие в горизонтальном переносе этих генов.
138
4.3. МЕХАНИЗМЫ РЕКОМБИНАЦИИ, УЧАСТВУЮЩИЕ
В ГОРИЗОНТАЛЬНОМ ПЕРЕНОСЕ ГЕНОВ
Подробное исследование структуры рекомбинантных mer-оперонов и
Hg-r-транспозонов позволяет в ряде случаев хотя бы частично расшифро-
вать историю их возникновения. Ряд данных указывает на участие системы
гомологичной рекомбинации при возникновении мозаичных генов, напри-
мер, в случаях mer-оперонов и транспозонов, содержащих последовательно-
сти pKLHl- и рКГН2-типов, тег-оперона транспозона Тп56Ш, а также генов
транспозиции Тп5084 (Ломовская, Никифоров, 1988; Yurieva et al., 1997;
Bogdanova et aL, 2001).
Присутствие в составе транспозона последовательности, гомологичной
концевому повтору другого транспозона, свидетельствует о том, что при его
возникновении произошло внедрение одного транспозона в другой, неродст-
венный ему, путем транспозиции. Таково, по-видимому, происхождение
транспозона Тп5053 и, возможно, Тп5041 (рис. 45) (Kholodii et aL, 1993b, 1995,
1997; Mindlin et aL, 2001).
Мозаичная структура гел-области транспозонов Тп5036, Тп5059 и Тп56Ш
указывает на то, что при их возникновении происходила с«йт-специфиче-
ская рекомбинация между двумя гау-сайтами, по-видимому, гел-сайтами двух
разных транспозонов (Yurieva et aL, 1997; Bogdanova et aL, 2001). Транспозо-
ны с гибридными res-сайтами встречались в нашей коллекции с высокой ча-
стотой (Yurieva et al.,1997; Mindlin et al., 2001).
Во многих случаях при возникновении рекомбинантных транспозонов,
несомненно, имели место несколько последовательных актов рекомбина-
ции, механизм которых не всегда понятен, например, при формировании
Тп5053 и Tn50S3 (Kholodii et aL, 1993b; Bogdanova et aL, 2001).
Данные, недавно полученные в нашей лаборатории, указывают на то,
что в процессах горизонтального переноса генов могут участвовать также
и системы резолюции. В плазмидах ацинетобактеров, поблизости от де-
фектных Hg-r-транспозонов, Г.Я. Холодий обнаружил новую систему резо-
люции CinH/RS2 и исследовал особенности ее функционирования. Оказа-
лось, что, резольваза CinH в отличие от других резольваз, характеризуется
низкой избирательностью при выборе гел-сайтов и в связи с этим обладает
способностью не только разрешать коинтеграты, но и объединять в них
разнообразные плазмидные репликоны. Последующее разъединение обра-
зовавшихся коинтегратов (рис. 46) может приводить к перераспределению
генетического материала исходных плазмид и как следствие к возникнове-
нию новых плазмид, в том числе с широким кругом хозяев. Таким образом
может происходить перемещение дефектных Hg-r-транспозонов и других
генетических структур среди систематически отдаленных бактерий
(Kholodii, 2001).
ЗАКЛЮЧЕНИЕ
К настоящему времени стала известна последовательность хромосом бо-
лее 50 видов бактерий и ряда плазмид. В результате одним из самых сущест-
венных выводов, вытекающих из сравнительного анализа целых геномов,
явилась оценка роли горизонтального переноса генов (ГПГ) в эволюции ми-
139
кроорганизмов - оказалось, что эта роль гораздо более значима, чем дума-
ли раньше (обзоры: Ochman et al., 2000; Nesbo et al., 2001; Ochman, 2001;
Koonin et al., 2001). Геномика показала эволюционное разнообразие генов-
’’пришельцев”, их предполагаемую долю в геноме и их локализацию. Напри-
мер, в геноме хламидий, патогенов человека и животных, предполагают
присутствие около 30 эукариотических генов, часть из которых была пере-
несена, по-видимому, из растений. Возможно, на ранней стадии эволюции
хламидии были патогенами одноклеточных растительных организмов и
лишь потом стали патогенами животных (Wolf et al.,1999). В результате се-
квенирования генома бактерии Thermotoga maritima обнаружили, что чет-
верть ее генов, возможно, была перенесена из представителей другого цар-
ства живых организмов - из архебактерий. Эти “островки” и “архипелаги”
чужих геномов размером от 4 до 20 тыс. пар нуклеотидов находятся в 15 уча-
стках генома термотоги (Nelson et al., 1999).
Геномика показала также большую роль, которую играли мобильные
элементы в эволюции бактерий. Например, в хромосомах Bacillus halodurans
и цианобактерии Synechocystis обнаруживаются около 100 генов транспозаз
и их фрагментов (Takami et al., 2000; Kaneko et al., 1996). У Sinorhizobium
meliloti эти гены составляют около 2% генома (Capela et al., 2001). /5-подоб-
ные элементы обнаружены и в хромосоме высокорадиорезистентных
Deinococcus radiodurans (White et al., 1999). Наконец, в хромосоме Bacillus
subtilis были выявлены, по крайней мере, 10 профагов или их фрагментов
(Kunst et al., 1997), что указывает на участие трансдуцирующих фагов в эво-
люции этой бактерии.
В то же время ограниченный круг секвенированных геномов (он вклю-
чает в себя в основном геномы патогенов человека и животных и бактерий,
связанных с культивируемыми человеком растениями) не позволяет оце-
нить роль ГПГ в популяционной динамике и эволюции бактерий окружаю-
щей среды, остаются не ясны масштабы, распространенность и движущие
силы этого процесса. Современная геномика не позволяет сделать заключе-
ний и о конкретных механизмах ГПГ, которые оказываются “скрытыми”
последующими перестройками генома и мутационным процессом. Даже вы-
воды геномики об источниках “генов-пришельцев” далеко не всегда кажут-
ся обоснованными, например, часто не учитывается возможность существо-
вания общего предка или возможность конвергентной эволюции белков
(Fraser et al., 2000). Ряд исследователей даже полагают, что в работах, цити-
рованных выше, роль ГПГ в эволюции живых организмов явно завышена
(Glansdorf, 2000; Kurland, 2000).
В будущем непрерывно продолжающееся увеличение количества секве-
нированных геномов, по-видимому, расширит современное представление
о роли ГПГ в эволюции бактерий и даст новые примеры возможных ГПГ.
Однако для выявления распространенности ГПГ в популяциях бактерий, его
конкретных механизмов у разных видов бактерий, особенно бактерий окру-
жающей среды, и движущих сил этого процесса необходимо сравнение гено-
мов различных бактерий из разных популяций, в том числе близких систе-
матически, и обитающих в отличающихся экологических условиях и в гео-
графически удаленных регионах. Коллекция бактерий, устойчивых к соеди-
нениям ртути, созданная в нашей лаборатории, удовлетворяет всем этим
требованиям и подготовлена к такой работе.
140
Интересно отметить, что в Японии недавно начаты и проводятся широ-
ким фронтом работы по изучению ГПГ на примере mer-оперонов из бакте-
рий залива Минамата.
Наш подход заключается в поиске и анализе только бесспорных фактов
относительно недавнего (в масштабах эволюции) ГПГ - когда у разных
штаммов, видов, родов организмов удается обнаружить достаточно протя-
женные (длиной в сотни и более пар нуклеотидов) идентичные или почти
идентичные нуклеотидные последовательности генов (менее 0,5% отличий),
которые сами по себе достаточно дивергентны, т.е. в большинстве случаев
значительно отличаются у разных организмов. Поэтому решение постав-
ленных вопросов требует принципиального увеличения масштабов секвени-
рования геномов (на порядки!). По-видимому, упрощение и удешевление ме-
тодов автоматического секвенирования позволит проводить секвенирова-
ние большого количества и значительно более протяженных фрагментов
хромосомных и плазмидных геномов природных бактерий, чем это было
возможно до недавнего времени.
Дальнейшее изучение проблемы ГПГ у бактерий окружающей среды
должно быть направлено на выяснение прежде всего 1) вклада ГПГ в дина-
мику генотипов популяций, 2) оценку скорости изменения генотипов, 3) ме-
ханизмов этого явления. Полученные результаты, возможно, позволят про-
гнозировать влияние интродуцируемых человеком генно-инженерных эука-
риотических и прокариотических организмов на природные бактерии окру-
жающей среды.
ЛИТЕРАТУРА
Богданова Е.С., Миндлин С.З., Каляева Э.С., Никифоров В.Г. Изучение горизонтально-
го переноса генов устойчивости к ртути в природных популяциях бактерий с помо-
щью антител к ртуть-редуктазам // Молекуляр. генетика, микробиология и вирусо-
логия, 1988. Т. 12. С. 16-23.
Каляева Э.С., Холодий Г.Я., Басс Н.А. и др. Тп5637-Тп2/-подобный ртутный транспо-
зон, обнаруженный у Thiobacillus ferrooxidans // Генетика. 2001. Т. 37. С. 1160-1164.
Ломовская ОЛ., Никифоров В.Г. Нуклеотидные последовательности детерминант ус-
тойчивости к ртути бактерий, обитающих в ртутных месторождениях: обнаружение
семейств рекомбинантных ртутных транспозонов в плазмидах бактерий рода
Acinetobacter // Там же. 1988. Т. 24. С. 1539-1549.
Миндлин С.З., Горленко Ж.М., Басс И.А., Хачикян Н.А. Спонтанная трансформация в
смешанных культурах различных видов Acinetobacter и при совместном росте
Acinetobacter calcoaceticus с Escherichia coli и Pseudomonas aeruginosa // Там же. 1990.
Т. 26. С. 1729-1739.
Миндлин С.З., Горленко Ж.М., Ломовская ОЛ. и др. Плазмиды, определяющие устой-
чивость к HgCl2 Acinetobacter. распространенность в различных ртутных месторож-
дениях // Там же. 1986. Т. 22. С. 2684-2692.
Никифоров В.Г., Басс И.А., Богданова Е.С. и др. Распространение транспозонов устой-
чивости к ртути в природных популяциях бактерий // Молекуляр. биология. 1999.
Т. 33. С. 55-62.
Хесин Р.Б. Непостоянство генома. М.: Наука, 1984. 472 с.
Хесин Р.Б. R-факторы резистентности к ртути у бактерий, выделенных в районе ртут-
но-сурьмяного месторождения // Молекуляр. биология. 1985. Т. 19. С. 505—515.
Холодий ЕЯ. Инверсионная активность системы резолюции транспозонов Тп5053 и
Тп402, обладающих нестандартно организованной res-областью // Генетика. 1995.
Т. 31. С. 1698-1703.
141
Холодий Г.Я., Миндлин С.З., Горленко Ж.М. и др. Молекулярно-генетический анализ
системы транспозиции Тп5041 //Там же. 2000. Т. 36. С. 1459-1469.
Barkay Т. Adaptation of aquatic microbial communities to Hg2+ stress // Appl. Environ. Microbiol.
1987. Vol. 53. P. 2725-2732.
Barrineau P., Gilbert P., Jackson WJ. et al. The DNA sequence of the mercury resistance oper-
on of the IncFII plasmid NR1 // J. Mol. Appl. Genet. 1984. Vol. 2. P. 601-619.
Bell J.A., Friedman S.B. Genetic structure and diversity within local populations of Bacillus
nrycoides //Evolution. 1994. Vol. 48. P. 1698—1714.
Belliveau B.H., Starodub M.E., Trevors J.T. Occurrence of antibiotic and metal resistance and
plasmids in Bacillus strains isolated from marine sediment // Canad. J. Microbiol. 1991.
Vol. 37. P. 513-520.
Bogdanova E.S., Bass LA., Minakhin L.S. et al. Horizontal spread of mer operons among Gram-
positive bacteria in natural envinronment // Microbiology. 1998. Vol. 144. P. 609-620.
Bogdanova E.S., Minakhin L.S., Bass LA. et al. Class П broad-spectrum mercury resistance trans-
posons in Gram-positive bacteria from natural environments I I Res. Microbiol. 2001.
Vol. 152. P. 503-514.
Bogdanova E.S., Mindlin S.Z. Two structural types of mercury reductases and possible ways of
their evolution I I FEBS Lett. 1989. Vol. 247. P. 333-336.
Bogdanova E.S., Mindlin S.Z. Occurence of two structural types of mercury reductases among
Gram-positive bacteria//FEMS Microbiol. Lett. 1991. Vol. 78. P. 277-280.
Bogdanova E.S., Mindlin S.Z. Mercuric reductase in environmental Gram-positive bacteria sensi-
tive to mercury // Ibid. 1992. Vol. 97. P. 95-100.
Bogdanova E.S., Mindlin S.Z., Kalyaeva S.Z., Nikiforov V.G. The diversity of mercury reductases
among mercury-resistant bacteria // FEBS Lett. 1988. Vol. 234. P. 280-282.
Brown N.L., Ford S.J., Pridmore R.D., Fritzinger D.C. Nucleotide sequence of a gene from the
Pseudomonas transposon Tn50/ encoding mercuric reductase // J. Biochem. 1983. Vol. 22.
P. 4089-4095.
Brown N.L., Misra T.K., Winnie J.N. et al. The nucleotide sequence of the mercuric resistance
operons of plasmid R100 and transposon Tn507: further evidence for mer genes which
enchance the activity of the mercuric ion detoxification system // Mol. and Gen. Genet. 1986.
Vol. 202. P. 143-151.
Capela D., Barloy-Hubler F., Gouzy J. et al. Analysis of the chromosome sequence of the legume
symbiont Sinorhizobium meliloti strain 1021 // Proc. Nat. Acad. Sci. USA. 2001. Vol. 98.
P. 9877-9882.
Christie G.E., White T.J., Goodwin T.S. A wzerR homologue at 74 minutes on the Escherichia coli
genome//Gene. 1994. Vol. 146. P. 131-132.
Craig N.L. Transposition in Escherichia coli and Salmonella typhimurium // Cell, and Mol. Biol.
1996. Vol. 11.
Dahlberg C., Hermansson M. Abundance of Tn.?, Tn2/, and Tn50/-transposase (tnpA) sequences
in bacterial community DNA from marine environments // Appl. Environ. Microbiol. 1995.
Vol. 61 P. 3051-3056.
Droge M. Puhler A., Selbitscha W. Phenotypic and molecular characterization of conjugative
antibiotic resistance plasmids isolated from bacterial communities of activated sludge Ц Mol.
and Gen. Genet. 2000. Vol. 263. P. 471^482.
Duncan K.E., Ferguson N., Kimura K. et al. Fine-scale genetic and phenotypic structure in natu-
ral populations of Bacillus subtilis and Bacillus licheniformis'. implications for bacterial evo-
lution and speciation //Evolution. 1994. Vol. 48. P. 2002-2025.
Fleischman R.D., Adams M.D., White O. et al. Whole-genome random sequencing and assembly
of Haemophilus influenzae Rd // Science. 1995. Vol. 269. P. 496-512.
Fraser C.M., Eisen J.A., Salzberg S.L. Microbial genome sequencing // Nature. 2000. Vol. 406.
P. 799-803.
GlansdorffN. About the last common ancestor, the universal life-tree and lateral gene transfer: a
reappraisal // Mol. Microbiol. 2000. Vol. 38. P. 177-185.
Griffin H.G., Foster TJ., Silver S., Misra T.K. Cloning and DNA sequence of the mercuric- and
organomercurial-resistance determinants of plasmid pDU1358 H Proc. Nat. Acad. Sci. USA.
1987. Vol. 84. P. 3112-3116.
142
GrinstedJ., Brown N.L. A Tn27 terminal sequence within Tn5O7: complementation of tnpA gene
function and transposon evolution // Mol. and Gen. Genet. 1984. Vol. 197. P. 497-502.
Grinsted J., De La Cruz F., Schmitt R. The Tn27 subgroup of bacterial transposable elements //
Plasmid. 1990. Vol. 24. P. 163-189.
Gupta A., Phung L.T., Chakrabarty L., Silver S. Mercury resistance in Bacillus cereus RC607:
transcriptional organization and two new open reading frames //J. Bacteriol. 1999. Vol. 181.
P. 7080-7086.
Hart M.C., Elliott G.N., Osborn A.M. et al. Diversity amongst Bacillus merA genes amplified from
mercury resistant isolates and directly from mercury polluted soil // FEMS Microbiol. Ecol.
1988. Vol. 27. P. 73-84.
Hobman J., Kholodii G., Nikiforov V. et al. The sequence of the nter operon of pMER327/419 and
transposon ends of pMER327/419, 330 and 05 // Gene. 1994. Vol. 146. P. 73-78.
Hobman J.L., Brown N.L. Bacterial mercury resistance genes // Metal ions in biological systems.
N.Y: Dekker, 1997. P. 527-567.
Holt R.J., Strike P., Bruce K.D. Phylogenetic anlysis of tnpR genes in mercury resistant soil bac-
teria: the relationship between DNA sequencing and RFLP typing approaches // FEMS
Microbiol. Lett. 1996. Vol. 144. P. 95-102.
Huang Ch.-Ch., Narita M., Yamagata T. et al. Structure analysis of a class II transposon encoding
the mercury resistance of the Gram-positive bacterium Bacillus megaterium MB1, a strain
isolated from Minamata Bay, Japan I I Gene. 1999a. Vol. 234. P. 361-369.
Huang Ch.-Ch., Narita M., Yamagata T., Endo G. Identification of three merB genes and charac-
terization of a broad-spectrum mercury resistance module encoded by a class II transposon of
Bacillus megaterium strain MB1 // Gene. 1999b. Vol. 239. P. 361—366.
Inoue C., Sugawara K., Kusano T. The w/e/ R regulatory gene in Thiobacillus ferrooxidans is
spaced apart from the nter structural genes // Mol. Microbiol. 1991. Vol. 5. P. 2707-2718.
[stock С.А., Duncan K.E., Ferguson N., Zhou X. Sexuality in a natural population of bacteria —
Bacillus suhtilis challenges the clonal paradigm // Mol. Ecol. 1992. Vol. 1. P. 95-103.
Jobling M.G., Peters S.E., Ritchie D.A. Plasmid-bome mercury resistance in aquatic bacteria //
FEMS Microbiol. Lett. 1988a. Vol. 49. P. 31-37.
Jobling M.G., Peters S.E., Ritchie D.A. Restriction pattern and polypeptide homology among
plasmid-bome mercury resistance determinants // Plasmid. 1988b. Vol. 20. P. 106-112.
Kaneko T., Sato S., Kotani H. et al. Sequence analysis of the genome of the unicellular cyano-
bacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire ge-
nome and assignment of potential protein-coding regions // DNA Res. 1996. Vol. 30.
P. 109-136.
Kelly W.J., Reanney D.S. Mercury resistance among soil bacteria; ecology and transferability of
genes encoding resistance // Soil Biol, and Biochem. 1984. Vol. 16. P. 1-8.
Khesin R.B., Karasyova E.V. Mercury-resistant plasmids in bacteria from a mercury and antimo-
ny deposit area // Mol. and Gen. Genet. 1984. Vol. 197. P. 280-285.
Kholodii G. The shuffling function of resolvases Ц Gene. 2001. Vol. 269. P. 121-130.
Kholodii G.Ya., Gorlenko Zh.M., Lomovskaya O.L. et al. Molecular characterization of an aberrant
mercury resistance transposable element from an environmental Acinetobacter strain //
Plasmid. 1993a. Vol. 30. P. 303-308.
Kholodii G.Ya., Mindlin S.Z., Bass LA. et al. Four genes, two ends, and a res region are involved
in transposition of Tn5053: a paradigm for a novel family of transposons carrying either a mer
operon or an integron // Mol. Microbiol. 1995. Vol. 17. P. 1189-1200.
Kholodii G.Ya., Yurieva O.V., Gorlenko Zh.M. et al. Tn5041: a chimeric mercury resistance trans-
poson closely related to a toluene degradative transposon Tn465l // Microbiology. 1997.
Vol. 143. P. 2549-2556.
Kholodii G.Ya., Yurieva O.V., Lomovskaya O.L. et al. Tn5053, a mercury resistance transposon
with integral's ends // J. Mol. Biol. 1993b. Vol. 230. P. 1103-1107.
Kholodii G., Yurieva O., Mindlin S. et al. Tn5044, a novel Tn3 family transposon coding for tem-
perature-sensitive mercury resistance Ц Res. Microbiol. 2000 Vol. 151. P. 291-302.
Kiyono M., Ontura T., Fujimori H., Pan-Hou H. Organomercurial resistance determinants in
Pseudomonas K-62 are present on two plasmids // Arch. Microbiol. 1995. Vol. 163.
P. 242-247.
143
Kiyono M., Omura T., Inuzuka M. et al. Nucleotide sequence and expression of the organomercu-
rial-resistance determinants from a Pseudomonas K-62 plasmid, pMR26 // Gene. 1997.
Vol. 189. P. 151-157.
Kiyono M., Pan-Hou HJ. The merG gene product is involved in phenylmercury resistance in
Pseudomonas strain K-62 //J. Bacterio!. 1999. Vol. 181. P. 726-730.
Koonin E.V., Makarova K.S., Aravind L. Horizontal gene transfer in prokaryotes: quantification
and classification // Annu. Rev. Microbiol. 2001. Vol. 55. P. 709-742.
Kunst F., Ogasawara N., Moszer I. et al. The complete genome sequence of the Gram-positive
bacterium Bacillus subtilis // Nature. 1997. Vol. 390. P. 249-256.
Kurland C.G. Something for everyone. Horizontal gene transfer in evolution // EMBO. Rep. 2000.
Vol. 1. P. 92-95.
Laddaga R.A.. Chu L., Misra T.K., Silver S. Nucleotide sequence and expression of the mercurial-
resistance operon from Staphylococcus aureus plasmid pI258 // Proc. Nat. Acad. Sci. USA.
1987. Vol. 84. P. 5106-5110.
Liebert C.A., Hall R.M., Summers A.O. Transposon Tn27, flagship of the floating genome //
Microbiol, and Mol. Biol. Rev. 1999. Vol. 63. P. 507-522.
Liebert C.A., Watson A.L., Summers A.O. The quality of nterC, a module of the mer mosaic //
J. Mol. Evol. 2000. Vol. 51. P. 607-622.
Liebert С.А., Wireman J., Smith T., Summers A.T. Phylogeny of mercury resistance (mer) operons
of Gram-negative bacteria isolated from the fecal flora of primates // Appl. Environ.
Microbiol. 1997. Vol. 63. P. 1066-1076.
Lomovskaya O.L., Mindlin S.Z., Gorlenko Zh.M., Khesin R.B. A nonconjugative mobilizable broad
host range plasmid of Acinetobacter sp., that determines HgCl2 resistance // Mol. and Gen.
Genet. 1986. Vol. 202. P. 286-290.
Lorenz M.G., Wackernagel W. Bacterial gene transfer by natural genetic transformation in the
environment // Microbiol. Rev. 1994. Vol. 58. P. 563-602.
Mahler L, Levinson H.S.. Wang Y., Halvorson H.O. Cadmium- and mercury-resistant Bacillus
strains from a salt marsh and from Boston Harbor// Appl. Environ. Microbiol. 1986. Vol. 52.
P. 1293-1298.
MazodierP., Davies J. Gene transfer between distantly related bacteria// Annu. Rev. Genet. 1991.
Vol. 25. P. 147-171.
Maynard Smith J., Dowson C.G., Spratt B.G. Localized sex in bacteria // Nature. 1991. Vol. 349.
P. 29-31.
Minakhina S., Kholodii G., Mindlin S. et al. Tn5053 family transposons are res site hunters sens-
ing plasmidal res sites occupied by cognate resolvases I I Mol. Microbiol. 1999. Vol. 33.
P. 1059-1068.
Mindlin S., Kholodii G., Gorlenko Zh. et al. Mercury resistance transposons of Gram-nega-
tive environmental bacteria and their classification // Res. Microbiol. 2001. Vol. 152.
P. 811-822.
Misra T.K., Brown N.L., Fritzinger D.C. et al. Mercuric ion-resistance operons of plasmid R100
and transposon Tn507: the beginning of the operon including the regulatory region and the
first two structural genes //Proc. Nat. Acad. Sci. USA. 1984. Vol. 81. P. 5975-5979.
Misra T.K., Brown N.L., Haherstroh L. et al. Mercuric reductase structural genes from plasmid
R100 and transposon Tn507: functional domains of the enzyme // Gene. 1985. Vol. 34
P. 253-262.
Nakamura K, Fujisaki T., Tamashiro H. Characteristics of Hg-resistant bacteria isolated from
Minamata Bay sediment I I Environ. Res. 1986. Vol. 40. P. 58-67.
Nakamura K., Silver S. Molecular analysis of mercuty-resistant Bacillus isolates from sediment of
Minamata Bay, Japan // Appl. Environ. Microbiol. 1994. Vol. 60. P. 4596-4599.
Narita M., Koizumi T., Huang C., Endo G. Broad-spectrum mercury resistance and its genetic
characterization of anaerobic mercury-resistant bacterium, Clostridium butyricum Mersaru,
isolated from sediment of Minamata Bay, Japan // DDBJ/EMBL/GenBank submission. 1999.
Ac: AB024961.
Nelson, Clayton R.A., Gill S.R. et al., Evidence for lateral gene transfer between Archae and
teria from genome sequence of Thermotoga maritima // Nature. 1999. Vol. 399.
P. 323-329.
144
Nesbo C.L., Boucher Y., Doolittle W.F. Defining the core of nontransferable prokaryotic genes: the
euryarchaeal core I I J. Mol. Evol. 2001. Vol. 53. P. 340-350.
Newby D.T., Josephson K.L., Pepper I.L. Detection and characterization of plasmid pJP4 transfer
to indigenous soil bacteria // Appl. Environ. Microbiol. 2000. Vol. 66. P. 290-296.
Ochrnan H. Lateral and oblique gene transfer // Curr. Opin. Genet, and Develop. 2001. Vol. 11.
P. 616-619.
Ochrnan H., Lawrence J.G., Groisman E.A. Lateral gene transfer and the nature of bacterial inno-
vation I I Nature. 2000. Vol. 405. P. 299-304.
Osborn A.M., Bruce K.D., Ritchie D.A., Strike P. The mercury resistance operon of the incJ plas-
mid pMERPH exhibits structural and regulatory divergence from other Gram-negative mer
operons H Microbiology. 1996. Vol. 142. P. 337-345.
Osborn A.M., Bruce K.D., Strike P., Ritchie D.A. Polymerase chain reaction-restriction fragments
length polymorphism analysis shows divergence among mer determinants from Gram-nega-
tive soil bacteria indistinguishable by DNA-DNA hybridization // Appl. Environ. Microbiol.
1993. Vol. 59. P. 4024-4030.
Osborn A.M., Bruce K.D.. Strike P., Ritchie D.A. Sequence conservation between regulatory mer-
cury resistance genes in bacteria from mercury polluted and pristine environments // Syst.
Appl. Microbiol. 1995. Vol. 18. P. 1-6.
Osborn A.M., Bruce KD., Strike P., Ritchie D.A. Distribution, diversity and evolution of the
bacterial mercury resistance (mer) operon // FEMS Microbiol. Rev. 1997. Vol. 19.
P. 239-262.
Osbourn S.E.V., Turner A.K. Grinsted J. Nucleotide sequence within Tn3926 confirms this as
Tn27-like transposable element and provides evidence for the origin of the mer operon car-
ried by plasmid pKLH2 // Plasmid. 1995. Vol. 33. P. 25-29.
Parro V., San Roman M., Galindo I. et al. A 23911 bp region of the Bacillus subtilis genome com-
prising genes located upstream and downstream of the lev operon // Microbiology. 1997.
Vol. 143. P. 1321-1326.
Pearson A.J., Bruce K.D., Osborn A.M. et al. Distribution of class II transposase and resolvase
genes in soil bacteria and their association with mer genes // Appl. Environ. Microbiol. 1996.
Vol. 62. P. 2961-2965.
Radstrom P., Skod O., Swedberg G. et al. Transposon Tn5090 of plasmid R751, which carries an
integron, is related to Tn7, Mu, and the retroelements // J. Bacteriol. 1994. Vol. 176.
P. 3257-3268.
Reniero D., Mozzon E., Galli E., Barbieri P. Two aberrant mercury resistance transposons in the
Pseudomonas stutzery plasmid pPB // Gene. 1998. Vol. 208. P. 37^4-2.
Roberts M.S., Cohan F.M. Recombination and migration rates in natural populations of Bacillus
subtilis and Bacillus mojavensis // Evolution. 1995. Vol. 49. P. 1081-1094.
Sedlnteier R., Altenbuchner J. Cloning and DNA sequence analysis of the mercury resis-
tance genes of Streptomyces lividans // Mol. and Gen. Genet. 1992. Vol. 236. P. 76-85.
Silver S., KinscherfT.G. Genetic and biochemical basis for microbial transformations and detoxi-
fication of mercury and mercurial compounds // Biodegradation and detoxification of envi-
ronmental pollutants. Boca Raton (Fla.): CRC press. 1982. P. 85-103.
Silver S., Phung L.T. Bacterial heavy metal resistance: new surprises // Annu. Rev. Microbiol.
1996. Vol. 50. P. 753-789.
Smit E., Wolters A., Van Elsas J.D. Self-transmissible mercury resistance plasmids with gene-
mobilizing capacity in soil bacterial populations: influence of wheat roots and mercury addi-
tion // Appl. Environ. Microbiol. 1998. Vol. 64. P. 1210-1219.
Souza V., Eguiarte L.E. Bacteria gone native vs. bacteria gone awry?: Plasmidic transfer and bac-
teria evolution // Proc. Nat. Acad. Sci. USA. 1997. Vol. 94. P. 5501-5503.
Stephenson J.R., Warnes AJ. Release of genetically modified microorganisms into environment //
Chem. Technol. and Biotechnol. 1996. Vol. 65. P. 5-14.
Summers A.O. Organization, expression, and evolution of genes for mercury resistance // Annu.
Rev. Microbiol. 1986. Vol. 40. P. 607-634.
Takami H., Nakasone K., Takaki Y. et al. Complete genome sequence of the alkaliphilic bacteri-
um Bacillus halodurans and genome sequence comparison with Bacillus subtilis // Nucl.
Acids Res. 2000. Vol. 28. P. 4317^4331.
145
The horizontal gene pool // Ed. C.M. Thomas. Harwood: Acad, publ., 2000. 419 p.
Velkov V.V. Environmental genetic engineering: Hope or hazard? Ц Curr. Sci. 1996. Vol. 70.
P. 823-832.
Wang Y., Mahler I., Levinson H.S., Halvorson H.O. Cloning and expression in Escherichia coli of
chromosomal mercury resistance genes from a Bacillus sp. // J. Bacteriol. 1987. Vol. 169.
P. 4848-4851.
Wang Y., Moore M., Levinson H.S. et al. Nucleotide sequence of a chromosomal mercury resist-
ance determinant from a Bacillus sp. with broad-spectrum mercury resistance Ц Ibid. 1989.
Vol. 171. P. 83-92.
Wernegreen J J., Harding E.E., Riley M.A. Rhizobium gone native: unexpected plasmid stability
of indigenous Rhizobium leguminosarum Ц Proc. Nat. Acad. Sci. USA. 1997. Vol. 94.
P. 5483-5488.
White O., Eisen J.A., Heidelberg J.F. et al. Genome sequence of the radioresistant bacterium
Deinococcus radiodurans R1 // Science. 1999. Vol. 286. P. 1571-1577.
Wolf Y.I., Aravind L., Koonin E.V. Rickettsiae and Chlamydiae: evidence of horizontal gene trans-
fer and gene exchange // Trends Genet. 1999. Vol. 15. P. 173-175.
Yurieva O., Kholodii G., Minakhin L. et al. Intercontinental spread of promiscuous mercury resist-
ance operons in environmental bacteria // Mol. Microbiol. 1997. Vol. 24. P. 321-329.
Zawadski P., Riley M., Cohan F.M. Homology among nearly all plasmids infecting three Bacillus
species//J. Bacteriol. 1996. Vol. 178. P. 191-198.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ПАТОГЕННОГО
ДЕЙСТВИЯ ВИРУСОВ ИММУНОДЕФИЦИТА
НА КЛЕТКИ
В.З. Тарантул
Лаборатория молекулярной генетики ретровирусов и СПИДа
Отдела вирусной и клеточной молекулярной генетики
В обзоре рассматриваются собственные и литературные данные
по воздействию вирусов иммунодефицита человека (HIV) и обезьян (SFV), а
также подуктов их отдельных генов на метаболизм, морфологию, проли-
ферацию и злокачественную трансформацию разных типов клеток
в системах in vivo и in vitro. Описаны многочисленные биологические эффе-
кты, оказываемые на клетки регуляторными генами этих вирусов (tat и
nef), и их взаимосвязь с развитием различных патологий у человека и
обезьяны, наблюдаемых при HIV/SIV-инфекции. При этом особое внимание
уделено молекулярным механизмам вирус-ассоциированного лимфомо-
генеза. В заключительной части приводятся данные по широкому
поиску в геноме человека структурных элементов, имеющих сходство
с регуляторными генами HIV типа 1.
СПИСОК СОКРАЩЕНИЙ
HIV - вирус иммунодефицита человека.
SIV - вирус иммунодефицита обезьяны.
HTLV - Т-лимфотропный вирус человека.
HBV - вирус гепатита В.
HCV - вирус гепатита С.
EBV - вирус Эпштейна-Барр.
HSV - вирус простого герпеса.
HERV - эндогенные ретровирусы человека.
LTR - длинные концевые повторы.
NHL - неходжкинские лимфомы.
LB - лимфома Бёркитта.
HD — болезнь Ходжкина.
DLBCL - диффузная крупноклеточная В-клеточная лимфома.
ALCL - анапластическая крупноклеточная лимфома.
LPL - лимфоплазмоцитоидная лимфома.
MCL - лимфома покровных клеток.
DLLC - диффузная лимфома с крупноклеточным компонентом.
CLL - хроническая лимфоцитарная лимфома.
IDL - лимфома с промежуточной дифференцировкой.
FL - фолликулярная лимфома.
MALT - лимфома, ассоциированная с лимфоидными тканями слизистой оболочки.
CCL - центроцитарная лимфома.
CL - центробластная лимфома.
IL - иммунобластная лимфома.
СПИД — синдром приобретенного иммунодефицита.
ПЦР — полимеразная цепная реакция.
EST - экспрессирующиеся последовательности-мишени.
OR F — открытая рамка считывания.
ОФ - окислительное фосфорилирование.
147
ВВЕДЕНИЕ
Более двадцати лет назад (в 1981 г.) в Центре по контролю за болезнями
в Атланте (штат Джорджия, США) были получены сведения о заболевании
молодых мужчин-гомосексуалистов необычной формой пневмонии, вызыва-
емой условно-патогенными простейшими - Pneumocystis carinii. Хотя клини-
ческая картина указывала на известный уже к тому времени синдром имму-
нодефицита, причина и пути заболевания оставались неясными. Медики сра-
зу же поняли, что они столкнулись с каким-то новым заболеванием, в основе
патогенеза которого лежит подавление иммунитета. Это заболевание в
1982 г. получило название Acquired Immunodeficincy Syndrome (AIDS), в рус-
ском переводе - синдром приобретенного иммунодефицита (СПИД). Различ-
ные факты давали весомые основания для предположения, что СПИД имеет
инфекционную природу, причем его возбудитель должен специфически раз-
рушать Т-лимфоциты, отвечающие за клеточный иммунитет. В 1983 г. две
группы исследователей под руководством профессора Р. Г алло и профессора
Л. Монтанье выделили возбудитель СПИДа, которым оказался новый ретро-
вирус. С 1986 г. по решению подкомитета Международного комитета по та-
ксономии вирусов он получил название вируса иммунодефицита человека
(Human Immunodefficiency Virus, HIV, в русской транскрипции ВИЧ). В насто-
ящее время ясно, что существуют по крайней мере три родственных типа
возбудителя иммунодефицита человека: HIV-1, HIV-2 и HTLV-4. Из них наи-
более распространен HIV-1, более известный в литературе просто как HIV.
Впоследствии у обезьян также был обнаружен вирус иммунодефицита,
получивший название Simian Immunodeficiency Virus (SIV). Этот вирус по
своей структуре напоминал вирус человека HIV-2.
Таким образом, было установлено, что различные типы HIV и SIV явля-
ются этиологическими агентами синдрома приобретенного иммунодефици-
та (СПИДа) у человека и обезьян, соответственно.
СПИД был назван чумой XX века. Только в 2000 г. от СПИДа в мире
умерли три миллиона человек (за все время - 21,8 млн). В настоящее время
35 млн человек на земле инфицированы HIV. В России на 1 ноября 2001 г.
число официально зарегистрированных инфицированных составило около
150 000 человек, а оценочные цифры реально инфицированных достигли
600-700 тыс. По прогнозу, в 2005 г. в России число инфицированных HIV до-
стигнет 1 млн.
Главным клиническим показателем СПИДа является резкое уменьше-
ние Т-лимфоцитов, относящихся к классу CD4+, в крови инфицированных
организмов. Иммунный дефицит, возникающий в результате инфицирова-
ния HIV/SIV, сопровождается, как правило, развитием ряда сопутствующих
патологий: нейропатией, энтеропатией, нефропатией, миопатией, наруше-
нием гематопоэза, опухолеобразованием. На рис. 47 приведены различ-
ные типы злокачественных заболеваний, наиболее часто возникающих у
HIV-инфицированных пациентов. Их частота у HIV-носителей возрастает
в десятки и тысячи раз.
Однако до сих пор детальные молекулярные механизмы возникновения
этих и других патологий остаются неизвестными.
Сразу же после обнаружения HIV и SIV были начаты исследования
функциональных свойств вирусных генов и кодируемых ими продуктов,
148
Системные неходжкинские
лимфомы
(в 200 раз)
Рак шейки матки
(в 10 раз)
Саркома Калоши
(в 75 000 раз)
Первичные лимфомы
центральной нервной системы
(в 4000 раз)
Рис. 47. HIV-ассоциированные неоплазии
В скобках указано, во сколько раз чаще развиваются соответствующие злокачественные заболевания у
HIV-инфицированных пациентов по сравнению с популяцией неинфицированных людей
а также молекулярных механизмов взаимодействия между этими вирусами
и клетками. Особое внимание было уделено влиянию вирусов иммунодефи-
цита и отдельных их генов на клеточный метаболизм и зависимость репли-
кации вирусов от молекулярных систем клеток-хозяев (см. обзор: Свердлов,
Тарантул, 1992).
Исследование функции отдельных вирусных генов можно назвать эта-
пом функциональной анатомией генома вируса. На этом этапе широко ис-
пользовались и используются различные клеточные модели (системы in
vitro), а также трансгенные животные и искусственно инфицированные ре-
комбинантными SIV обезьяны (системы in vivo). Большое внимание в этих
исследованиях было обращено на изучение роли как структурных, так и ре-
гуляторных генов HIV/SIV. Последние участвуют не только в регуляции
экспрессии и репликации вирусного генома, но оказывают также сущест-
венное влияние на метаболизм хозяйских клеток.
Следующим должен стать этап синтеза, т.е. исследования функций цело-
го вирусного генома в координированном взаимодействии отдельных его ге-
нов между собой и с геномом клетки-хозяина.
Лаборатория молекулярной генетики ретровирусов и СПИДа (ЛМГРС)
присоединилась к этим исследованиям сразу после своего создания в 1990 г.
Главная задача, решаемая в ЛМГРС, заключалась в изучении молекулярных
механизмов взаимодействия вируса и продуктов его отдельных регулятор-
ных генов с клетками, а также в исследовании их роли в различных патоло-
гиях, наблюдаемых при СПИДе. Основные усилия были направлены на изу-
чение молекулярных механизмов лимфомогенеза, ассоциированного с
HIV/SIV. Параллельно осуществлялся поиск в геноме человека элементов,
которые сходны по своей структуре с регуляторными генами HIV-1.
149
HIV И БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ПРОДУКТОВ
ЕГО РЕГУЛЯТОРНЫХ ГЕНОВ
Сейчас вирусы иммунодефицита относят к особому типу ретровирусов,
лентивирусам, похожим на аналогичные вирусы животных. Все лентиви-
русы поражают в основном клетки иммунной системы. Лентивирусы от-
личаются от других ретровирусов значительно большей сложностью ге-
номов. Они содержат многочисленные гены, которые обусловливают
многоэтапную регуляцию жизнедеятельности вируса внутри клетки и, ве-
роятно, вносят существенный вклад в патогенез, вызываемый этими виру-
сами.
Вирусная частица (вирион) HIV имеет сферическую форму диамет-
ром 100-150 нм (рис. 48). В общих чертах его строение подобно другим пред-
ставителям подсемейства лентивирусов. Наружная оболочка HIV состоит из
бимолекулярного слоя липидов, который имеет происхождение из клеточ-
ной мембраны клетки хозяина. В эту мембрану встроены рецепторные об-
разования, по виду напоминающие грибы. “Шляпка” гриба состоит из четы-
рех молекул гликопротеида gpl20, который обладает сродством к молеку-
лам CD4, расположенным на поверхности Т-лимфоцитов. “Ножка” гриба
формируется из четырех молекул гликопротеида gp41, которые встроены
в мембрану. Так как мембрана имеет клеточное происхождение, то на ее по-
верхности и внутри нее сохраняется множество клеточных белков. Под на-
ружной оболочкой располагается сердцевина вируса (кор), которая имеет
форму усеченного конуса и образована белком р24. Промежуток между на-
ружной вирусной мембраной и сердцевиной вируса заполнен матриксным
белком р17. Внутри сердцевины располагаются две молекулы вирус-
ной РНК, связанные с низкомолекулярными белками (р9 и р7) основного
характера.
В результате обратной транскрипции вирусной РНК образуется ее ДНК-
копия, которая встраивается в геном клеток хозяина, формируя так называ-
емый провирус. Изучение структуры генетического аппарата HIV выявило
его сложную организацию и значительные различия между изолятами.
ДНК провируса имеет размер 9283 п.н. и окружена длинными концевыми
повторами (LTR) длиной 638 п.н. В LTR расположены различные регулятор-
ные элементы. Каждая молекула РНК и соответственно провируса содер-
жит 9 генов: три из них являются структурными (gag, env и pol), три - регу-
ляторными (tat, rev и nef), и три, называемыми дополнительными (ури, vpr
и vif) (рис. 49). Все эти гены содержат информацию, необходимую для обра-
зования белков, которые управляют способностью вируса инфицировать
клетку, реплицироваться и вызывать заболевание.
На начальном этапе наших исследований основной интерес был обра-
щен на два регуляторных гена HIV- tat и nef. Эти гены по существовавшим
на то время данным имели разнонаправленное влияние на экспрессию и ре-
пликацию HIV в клетках. Ген tat рассматривался как трансактиватор транс-
крипции HIV, а ген nef как негативный фактор экспрессии вирусных генов и
репликации вируса. При этом весьма мало было известно относительно вли-
яния этих генов на клеточные гены. Однако уже первые исследования по
влиянию продуктов регуляторных генов на клеточный метаболизм показа-
ли, что существует тесная взаимосвязь между этими процессами. Постепен-
но
но накапливались данные, указывающие на плейотропные эффекты генов
tat и nef на клетки и на их участие в развитии некоторых патологий, сопут-
ствующих СПИДу.
Продукт гена tat представляет собой секретируемый фактор, который
является трансактиватором транскрипции как вирусных, так и отдельных
клеточных генов, влияет на рост и пролиферацию клеток, их миграцию,
апоптоз и ангиогенез (Rautonen et al., 1994; Zauli et al., 1995; Macho et al., 1999;
Taraboletti et al., 1999; Salzman, Burmester, 2000). Впоследствии выяснилось,
что наряду с этим ген tat иногда оказывает и ингибирующее воздействие на
экспрессию ряда клеточных генов (Zauli et al., 2000). Была показана нейроток-
сичность белка Tat, что позволило понять молекулярные механизмы некото-
рых нейропатологий, сопровождающих СПИД (Maggirwar et al., 1999). Важ-
ным было обнаружение у гена tat онкогенного потенциала, который, по-ви-
димому, ассоциирован с развитием лимфом и саркомы Капоши у ВИЧ-ин-
фицированных пациентов (Vogel et al., 1988; Zauli et al., 1995; Шугурова и др.,
1997; Kundu et aL, 1999; Taraboletti et al., 1999). В дальнейшем было определе-
но, что многие из эффектов гена tat на клетки осуществляются в результа-
те взаимодействия белка Tat с определенным набором клеточных белков
(Romano et aL, 1999; Taraboletti et aL, 1999). Одним из результатов взаимодей-
ствия Tat с клеточными факторами транскрипции является усиление экс-
прессии гена репарирующего фермента ДНК бета-полимеразы (Srivastava
etaL, 2001).
В отношении гена nef существуют данные, свидетельствующие об его
участии как в негативной, так и в позитивной регуляции экспрессии генов
HIV/SIV и репликации вируса (Kestler et al„ 1991; Jamieson et aL, 1994), а так-
же в негативной и позитивной регуляции экспрессии отдельных клеточных
генов (De et aL, 1998; Tangsinmankong et aL, 2000). При этом было показано,
что влияние гена nef на экспрессию клеточных генов является клеточно-спе-
цифичным (Tangsinmankong et aL, 2000). Кроме того, был обнаружен эффект
гена nef на эндоцитоз некоторых клеточных белков, локализованных на
мембране (Schwariz et aL, 1996), косвенно показано его регулирующее влия-
ние при образовании синцитиев у Т-лимфоцитов и макрофагов (Meylan et aL,
1998) и др. На астроцитах человека был выявлен модулирующий эффект ге-
на nef на TNF-alpha, что проявлялось в задержке апоптоза и, возможно, свя-
зано с нейродегенеративными заболеваниями, ассоциированными с HIV (Ro-
bichaud, Poulin, 2000). В настоящее время ясно, что продукт гена nef, так же
как и гена tat, взаимодействует в клетках с большим числом белков, участ-
вующих в передаче клеточных сигналов и транспорте белковых продуктов
(Benichou et aL, 1994; Collette et aL, 1996).
Таким образом, имеющиеся данные указывают на полифункциональ-
ный характер действия генов nef и tat HIV-1 на клетки. Однако в полной ме-
ре молекулярные механизмы взаимодействия этих генов с метаболизмом
клеток и их роль в развитии различных патологий у HIV-инфицированных
пациентов остается неизвестной. Существует также множество вопросов
связанных с ткане- и видоспецифическими эффектами продуктов этих двух
регуляторных вирусных генов.
Для изучения функции и биологических эффектов отдельных регуля-
торных генов HIV/SIV на клетки широко использовались и используются
два основных подхода: трансфекция этими генами различных культивируе-
151
мых in vitro клеток и создание трансгенных животных. Свои эксперименты
по функциональной анатомии генома HIV мы также проводили с примене-
нием этих подходов.
ИССЛЕДОВАНИЕ ФУНКЦИИ РЕГУЛЯТОРНЫХ ГЕНОВ HIV
НА МОДЕЛИ КУЛЬТУР КЛЕТОК
В большинстве работ для изучения функции отдельных регуляторных
генов HIV на культивируемых клетках в качестве основного подхода ис-
пользовали различные линии клеток человека, в которых преимущественно
происходит размножение вируса (многочисленные линии Т-клеток, монону-
клеарные клетки периферической крови, макрофаги и их производные, ми-
кроглия). Главным образом на этих типах клеток были показаны основные
эффекты продуктов регуляторных генов на экспрессию клеточных генов,
апоптоз, пролиферацию и трансформацию клеток. Вместе с тем известно,
что вирус экспрессирует свои белки и при транфекции его в другие типы
клеток (например, HeLa). Кроме того, продукты некоторых вирусных генов
(в частности белок Tat) способны выходить из инфицированных HIV клеток
и оказывать воздействие на другие типы клеток, дистанцированные от ин-
фицированных вирусом.
Однако вопрос о клеточно-специфическом действии вирусных генов был
исследован существенно меньше. Лишь в последнее время появились неко-
торые данные, свидетельствующие о том, что эффекты продуктов регуля-
торных генов HIV могут зависеть от типа клеток, на которые они действу-
ют (Verhasselt et al., 1999). Также было обращено мало внимания на видоспе-
цифическое действие генов HIV, хотя имеются отдельные наблюдения, сви-
детельствующие о наличии такой специфичности (Chang et al., 2000). В лите-
ратуре существуют данные о том, что даже в клетках дрожжей отдельные
регуляторные гены HIV могут проявлять свои эффекты. В частности, опи-
саны перестройки цитоскелета дрожжевых клеток под действием гена nef
(Plemenitas et al., 1999), влияние регуляторного гена vpr на митохондриаль-
ную дисфункцию дрожжей (Macreadie et al., 1997). Последнее, например, по-
зволило описать один из возможных механизмов, который обеспечивает ос-
тановку роста HIV-инфицированных клеток на стадии G2/M, наблюдаемую
под действием единичного гена vpr на клетки человека.
Нами была проведена серия работ по трансфекции разных типов клеток
крысы рекомбинантными плазмидами, содержащими регуляторные гены
ВИЧ tat и nef (Шугурова и др., 1997, 2000; Shugurova et al., 2002). Была поста-
влена задача изучить как клеточно-специфические, так и возможные видо-
специфические эффекты (по сравнению с аналогичными клетками человека)
указанных регуляторных вирусных генов. Известно, что в клетках грызунов
имеются многочисленные препятствия для размножения HIV (Beniasz,
Cullen, 2000), однако это обстоятельство, на наш взгляд, должно было толь-
ко способствовать изучению более тонких механизмов генерализированно-
го взаимодействия продуктов вирусных генов с клеточным метаболизмом.
В работе были использованы три линии клеток крысы: линия феохро-
моцитомы PC 12, псевдонормальные клетки линии Rat-2 и первичные фиб-
робласты. Кроме того, эксперименты проводились на эмбриональных ство-
152
ловых клетках мыши (об этом подробнее см. в статье Гривенникова И.А.
и др., наст, сборник).
На первом этапе все линии клеток котрансфецировали геном tat HIV-1,
находящемся под контролем индуцируемого цинком металлотионеинового
промотора мыши, и плазмидой, содержащей ген пео. Для анализа ростовых
характеристик (пролиферации и способности образовывать фокусы) и мор-
фологии трансфецированных клеток использовали получаемые в результа-
те трансфекции поликлональные культуры клеток, резистентных к анти-
биотику G-418. Как клетки Rat-2, так и клетки PC 12, трансфецированные ге-
ном tat, характеризовались существенно более высокой пролиферативной
активностью по сравнению с контрольными клетками. В обоих случаях этот
эффект усиливался при добавлении в среду индуктора - ZnSO4 (рис. 50). Эти
результаты соответствуют данным, полученным ранее на хондроцитах че-
ловека и клетках PC 12, которые указывали на активирующее действие гена
tat HIV-1 на пролиферацию этих клеток (Lotz et al., 1994; Zauli et al., 1995).
В экспериментах, проведенных на клетках PC 12, было выявлено влияние
белка Tat на передачу сигналов в этих клетках, в частности, за счет усиления
фосфорилирования фактора pl25FAK и его ассоциации с фосфоинозитид-3-
киназой (Milani et al., 1998). Возможно, этим влиянием отчасти и обусловле-
но наблюдаемое в наших и других экспериментах усиление пролиферации
PC 12 клеток под действием гена tat. Следует отметить, что наряду с этим в
литературе имеются данные об ингибирующем действии белка Tat на проли-
ферацию лимфоцитов (Patki, Lederman, 1996). В частности, в первичных ней-
ронах человека белок Tat вызывал апоптоз через вовлечение в данный про-
цесс окислительного стресса (New et al., 1998).
Таким образом, имеющиеся в настоящее время факты подчеркивают
полифункциональность продукта гена tat и позволяют заключить, что эф-
фекты этого гена могут существенно различаться в разных типах клеток.
Наши эксперименты с tot-трансфецированными Rat-2 клетками показа-
ли, что такие генетически модифицированные клетки способны образовы-
вать мультислойные колонии (рис. 51). Однако морфология другого вида
клеток - культуры клеток PC 12 - оставалась неизменной под действие гена
tat. Не было обнаружено также влияния фактора роста нервов на нейро-
нальную дифференцировку клеток PC 12, трансфецированных геном tat.
Трансфекция геном tat эмбриональных фибробластов мыши показала,
что этот ген индуцирует у них формирование фокусов трансформации
(табл. 1). Кроме того, когранфекция генами tat и c-Ha-ras\ увеличивала эф-
фективность образования фокусов. Это увеличение было статистически
значимым как и при котранфекции этих клеток двумя хорошо известными
онкогенами c-Ha-ras\ и с-тус. Число мультислойных колоний заметно воз-
растало и после котранфекции клеток генами tat и с-тус. Полученные ре-
зультаты подтверждают данные о наличии у гена tat онкогенного потенциа-
ла и свидетельствуют о наличии кооперации между продуктом гена tat
HIV-1 и классическими клеточными онкогенами c-Ha-ras\ и с-тус.
На основании этих данных был сделан вывод, о том что по крайней ме-
ре некоторые эффекты гена tat на клетки являются клеточноспецифически-
ми, на отдельные типы клеток он оказывает онкогенное действие.
На следующем этапе мы проводили котрансфекцию этих же трех линий
клеток крысы плазмидами, содержащими ген nef ВИЧ-1, находящийся под
153
Рис. 51. Морфология нормальных (А) и tot-трансфенированных (Б) клеток Rat-2. Увеличе-
ние х320
контролем промотра цитомегаловируса. В качестве отрицательного конт-
роля использовали плазмиду с геном nef, содержащую мутацию, приводя-
щую к сдвигу рамки трансляции. В результате было показано, что под дей-
ствием гена nef происходит уменьшение скорости пролиферации клеток Rat-2
(рис. 52) и PC 12, что противоположно эффекту, оказываемому геном tat.
Полученные нами результаты коррелируют с данными, свидетельствующи-
154
Таблица 1. Формирование фокусов трансформации в эмбриональных фибробластах
крысы при трансфекции разными рекомбинантными плазмидами
Трансфецированная ДНК Число фокусов на 1,5 x 105 клеток Эффективность трансформа- ции (xlO5)
0 0
pMTta/ 6,5±l,0 0,43
pMTfaZ + pEJ6.6 13,2+2,1 0,88
pMTfaZ + pSVc-mjc-1 9,0+1.9 0,60
pMTta/ + pNef 9,3±1,7 0,62
pNef 0 0
pSVc-wyc-1 0 0
pEJ6.6 0 0
pEJ6.6 + pSVc-mjC'l 15.1±1,5 1,00
* Средние значения из 3 независимых экспериментов.
ми о том, что продукт гена nef способен уменьшать пролиферативный ответ
на действие тромбоцитарного фактора роста (Graziani et al., 1996), снижает
пролиферативную активность лимфоцитов за счет уменьшения количества
рецепторов интерлейкина-2 на клеточной поверхности (Greenwey et al.,
1995). Наряду с эти имеются данные, указывающие на способность экзоген-
ного белка Nef стимулировать пролиферацию нормальных мононуклеарных
клеток периферической крови человека (Quaranta et aL, 1999).
Морфология эмбриональных фибробластов и клеток Rat-2 не менялась
под действием гена nef. Однако трансфекция этим геном клеток РС12 при-
водила к образованию многоядерных синцитиев (рис. 53). Параллельно с
этим уменьшался уровень пролиферации клеток. Таким образом, нами по-
лучено прямое указание на участие гена nef в механизме образования много-
ядерных синцитиальных клеток, возникновение которых наблюдается при
инфицировании некоторыми изолятами HIV-1 Т-лимфоцитов и макрофагов
человека. Вместе с тем подобный эффект не выявлен нами в пе/-трансфе-
цированных клетках Rat-2. Все это свидетельствует о том, что синцитийоб-
разующее действие гена nef по-видимому, зависит от типа клеток, подверга-
ющихся воздействию его продукта. В настоящее время в отношении регули-
рующего влияния гена nef на синцитийобразование имеются немногочислен-
ные и противоречивые данные (Otake et aL, 1994; Meylan et aL, 1998). В част-
ности, существуют указания на заметные отличия между генами nef разных
изолятов HIV-1 в осуществлении контроля формирования синцития в CD4+
Т-лимфоцитах (Meylan et aL, 1998).
Эмбриональные фибробласты крысы, трансфецированные геном nef,
не образовывали фокусов трансформации. Вместе с тем был получен не-
ожиданный эффект: при котрансфекции этих клеток генами tat и nef эффе-
ктивность образования фокусов увеличивалась по сравнению с клетками,
трансфецированными только геном tat (табл. 1). Кооперативный эффект ге-
нов tat и nef на неопластическую трансформацию клеток обнаружен нами
впервые. В этом свете интересно, что недавно был описан кооперативный
эффект между генами nefti hek (Briggs et aL, 2000). Это может означать, что
ген nef способен усиливать онкогенную активность некоторых клеточных
генов, имеющих онкогенный потенциал. Кроме того, недавно было также
155
Рис. 53. Образование синцитий-подобных структур в ие/-трансфицированной поликлональ-
ной культуре клеток РС12
показано, что в астроцитах человека, стабильно трансфецированных геном
nef, он сам по себе обладает онкогенным потенциалом (Kohleisen et aL, 1999).
На основании всех этих данных можно заключить, что онкогенный потен-
циал гена nef проявляется клеточноспецифично и/или видоспецифично.
В этой связи интересно, что видоспецифичные эффекты характерны и для
таких генов HIV-1, как vpr и vpx HIV-1 (Chang et al., 2000).
Таким образом, полученные нами результаты в экспериментах in vitro,
указывают на плейотропное, но в целом противоположное действие регуля-
торных генов nef и tat на непермиссивные для HIV-1 клетки грызунов разно-
го происхождения. При этом некоторые эффекты этих генов специфичны
для определенных типов клеток.
ТРАНСГЕННЫЕ МЫШИ КАК МОДЕЛЬ ИССЛЕДОВАНИЯ
ФУНКЦИИ РЕГУЛЯТОРНЫХ ГЕНОВ HIV
Для изучения молекулярных основ различных патологий, вызываемых
продуктами отдельных клеточных и вирусных генов, более адекватной мо-
делью по сравнению с культивируемыми клетками являются трансгенные
животные (Тарантул, Мудрик, 1991; см. также статью Андреевой и Таранту-
ла, наст, сборник).
С целью выяснения реальных функций вирусных генов в клетках,
т.е. для изучения функциональной анатомии генома вируса, в ряде лабора-
торий были сконструированы трансгенные мыши, содержавшие единичные
156
структурные и регуляторные гены HIV под контролем различных промото-
ров. Для изучения возможных биологических эффектов генов tat и nef
HIV-1 нами также была использована данная модель. С помощью микро-
инъекций в зиготы мышей были получены и охарактеризованы три незави-
симых трансгенные линии животных, содержащих ген tat HIV-1 под конт-
ролем металлотионеинового промотора, который индуцируется цинком
(Шугурова и др., 1997). Для морфологического анализа мышей в возрасте
1,2-1,5 года забивали после их предварительного содержания в течение
2 недель на воде с ZnSO4. В результате у одного трансгенного самца (^-по-
коление), который был стерильным, обнаружены аденокарцинома подже-
лудочной железы и множественные морфологические изменения внутрен-
них органов (метастазы в печени, желудке, легких, увеличенные размеры
тимуса, редуцированная селезенка). У 2 самцов из 6 потомков (Ргпоколе-
ние) другой линии обнаружены аномалии, которые проявлялись в обоих
случаях в возникновении аденокарциномы слезных желез. Ни у одного из
восьми контрольных животных такого же возраста, содержавшихся на ди-
ете с цинком, никаких патологий обнаружено не было. Эти результаты сви-
детельствуют об онкогенном потенциале in vivo регуляторного гена tat,
который проявляется главным образом в развитии аденокарциномы под-
желудочной железы.
В ряде работ других авторов также установлено, что у трансгенных мы-
шей с генами tat ВИЧ-1 (Vogel et al., 1988; Corallini et al., 1993; Campioni et al.,
1995) и его аналогом геном tax HTLV-I и HTLV-II (Pavlakis et al., 1990), нахо-
дящимися под контролем вирусных регуляторных элементов, возникают
опухоли разного происхождения, изредка и аденокарциномы (Campioni et al.,
1995). Недавно было показано (Kundu et aL, 1999), что при использовании ак-
тинового промотора, обеспечивающего эффективную экспрессию трансге-
на в лимфоидных тканях, ген tat вызывал образование у трансгенных мы-
шей В-клеточных лимфом. Таким образом, очевидно, что ген tat обладает
онкогенным потенциалом не только in vitro, но и in vivo. В последнем случае
тип индуцируемых геном tat опухолей зависит от места его экспрессии у
трансгенных животных.
Нами также были получены трансгенные мыши, содержащие ген nef
HIV-1 под контролем промотора цитомегаловируса, обспечивающего экс-
прессию трансгена в широком спектре клеток и тканей (Мудрик и др., 1992).
Их анализ показал наличие сущестьенных различий в соотношении различ-
ных типов клеток как в костном мозге, так и в периферической крови по
сравнению с контрольными животными (табл. 2).
Наиболее значительным в обеих популяциях клеток у трансгенных мы-
шей было увеличение относительного содержания лимфоцитов. Кроме то-
го, наблюдалось достоверное уменьшение в костном мозге незрелых ней-
трофилов и базофилов. В опубликованных позднее работах других авторов
у трансгенных мышей с геном nef также наблюдали ряд патологий, включая
значительные изменения в пролиферации лимфоцитов (в частности, умень-
шение Т лимфоцитов) (Scowronski et al., 1993) и цитопатичности, подобной
той, которую вызывает целый вирус (Dickie, 2000).
Таким образом, использование трансгенных животных как моделей
in vivo не только подтвердило результаты исследований на клеточных моде-
лях (in vitro), но и существенно расширило наше понимание молекулярных
157
Таблица 2. Соотношение различных типов клеток в костном мозге и периферической
крови у трансгенных с геном nef и контрольных животных
Клетки Содержание клеток, % Р
Контрольные мыши Трансгенные мыши
Костный мозг
Эритроциты 2,4+0,57 3,00+0,60 —
Нормобласты 1,8+0,61 2,25+0,55 —
Ретикулоциты 2 5+0 78 2,20+1,30 —
Нейтрофилы:
незрелые 25,3+2,90 14,80+1,40 <0,05
ядерные 45,7+2,10 42,80+2,60 —
Моноциты 1.1+0.18 0,85+0,25 —
Базофилы 0,9+0,17 0,57+0 15 <0,05
Лимфоциты 18,2+1,2 30,70+0,20 < 0,001
Кровь
Эритроциты 99,16+0,18 99,150+0,35 —
Нейтрофилы 0,075+0,012 0,125+0,025 —
Ретикулоциты 0,625+0,17 0,500+0,20 —
Моноциты 0.075+0.025 0,001+0,0005 <0,05
Лимфоциты 0,0625+0,015 0,250+0,05 <0,001
механизмов HIV-индуцируемого патогенеза, показало, что ряд известных
патологий может вызываться продуктами отдельных регуляторных вирус-
ных генов, а не действием вируса как целого патогена.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ
HIV/SIV-АССОЦИИРОВАННОГО лимфомогенеза
Вирусно-генетическая теория возникновения опухолей была предложе-
на еще в 40-х годах советским ученым Л.И. Зильбером. За прошедшие годы
стало понятным, что, хотя причины рака далеко не всегда связаны с вируса-
ми, однако в ряде случаев вирусы действительно могут вызывать злокачест-
венные образования. В этом принимают участие различные ДНК- и РНК-
содержащие вирусы. Хорошо известно, например, что Т-лимфотропный ви-
рус человека (HTLV) индуцирует Т-клеточный лейкоз у взрослых, существу-
ет тесная ассоциация вирусов папилломы человека (HPV) и карциномы шей-
ки матки и рака гортани, вирусы гепатита В (HBV) и С (HCV) способствуют
развитию карциномы печени, вирус гепатита С ассоциирован кроме того с
неходжкинскими лимфомами (NHL), вирус Эпштейна-Барр (EBV) способен
вызывать лимфому Бёркитта (LB), рак носоглотки и желудка, а герпесвирус
(HSV) тесно ассоциирован с саркомой Капоши (KSHV). Показано также, что
вирус иммунодефицита человека (HIV) и вирус иммунодефицита обезьян
(SIV) способствуют развитию таких злокачественных перерождений, как
В-клеточные лимфомы и саркома Капоши. Так, в США от 8 до 27% всех
лимфом возникает как последствие инфицирования HIV. По данным Все-
мирной организации здоровья Европейского региона (21 страна), лимфомы
развивались у 3% пациентов, инфицированных HIV. Согласно другим дан-
158
ным, лимфомы характерны для 3,5-12% HIV-носителей (Cote et al., 1997).
У обезьян в норме лимфомы не встречаются, но до 40% искусственно инфи-
цированных SIV животных оказываются поражеными этим заболеванием.
За последние два десятилетия произошел значительный прогресс в изу-
чении механизмов вирусного онкогенеза. К ключевым моментам можно от-
нести открытие мутационного эффекта, оказываемого вирусами и их онко-
генами на геном млекопитающих, сделанное Н.И. Шапиро и его коллегами
(Gorbunova et al., 1982: Baron et al.. 1992), выявление инсерционного мутаге-
неза, вызываемого внедрением вирусов в геном (Varmus, 1982; Green, Wyke,
1988), обнаружение влияния, оказываемого продуктами различных вирус-
ных генов на экспрессию клеточных генов (Steulund, Botchan, 1990; Husain
et al., 1996) и многое др.
За миллионы лет сосуществования вирусов и их хозяев (человека) виру-
сы выработали различные стратегии, с помощью которых они избегают им-
мунного контроля и осуществляют свое трансформирующее действие на
клетки. Так, многие вирусы ингибируют образование в клетках цитокинов и
хемокинов, они часто влияют на апоптоз клеток и этим пролонгируют или
сокращают их выживание (Herbein et al., 1998; Liu et al., 1998; Derfuss et al.,
1998; Alcami, Kosinowski, 2000). В частности, показано, что HIV индуцирует
апоптоз в CD+T-лимфоцитах (Herbein et al., 1998), вирус MDV оказывает ан-
тиапоптотическое действие на Т-лимфоциты (Liu et al., 1998), препятствует
апоптозу и вирус HVS (Derluss et al., 1998). С другой стороны, HVS в резуль-
тате конвергентной эволюции приобрел белок, имеющий сходство с анти-
апоптотическими клеточными белками семейства Bcl-2 (Herbein et al., 1998).
Вирус HBV использует для предотвращения апоптоза свой продукт НЬх, ко-
торый воздействует в клетке на сигнальную систему МАРК (Liu et aL, 1998).
Становится все более очевидным, что влияние вирусов на экспрессию кле-
точных генов и на клеточный метаболизм (в частности на апоптоз клеток)
тесно взаимосвязано с вирус-ассоциированным канцерогенезом.
Как при вирусном, так и при невирусном онкогенезе генетические по-
вреждения, обнаруживаемые в раковых клетках, можно разделить на два ос-
новных вида: доминантные, которые связаны в основном с протоонкогена-
ми, и рецессивные, затрагивающие главным образом различные антионко-
гены (называемые также рецессивными онкогенами). Как правило, доми-
нантные мутации обусловлены “приобретением функции” (gain of function),
а негативные - потерей функции (loss of function) (Haber, Fearon, 1998). Одна-
ко в настоящее время такая классификация во многом представляется ус-
ловной, поскольку порой трудно разделить так называемые классические
онкогены и антионкогены и другие клеточные гены, участвующие в процес-
се злокачественного перерождения клеток. В последние годы обнаружено
множество различных мутаций в генах, ассоциируемых с злокачественным
перерождением клеток, выявлены многочисленные хромосомные аббера-
ции, происходящие при канцерогенезе и приводящие к появлению новых
“слитых” генов, к активации или инактивации имеющихся. В литературе
описано свыше 27 000 неоплазий с определенными хромосомными аберра-
циями (Mitelman et al., 1997).
Новый важный момент в изучении молекулярных механизмов канцеро-
генеза заключается в понимании того, что этот патологический процесс яв-
ляется многоэтапным, каскадным процессом, вовлекающим множество раз-
159
Таблица. 3. Вирусные гены, индуцирующие онкогенез у трансгенных мышей (из: Таран-
тул и др., 1999а, с добавлениями)
Вирус и трансген/промотор
Злокачественное перерождение
SV40 T-ag/ингибин
SV40 T-ag/эластаза
SV40 T-ag/антитромбин
FLV envlenv
JVC T-ag/T-ag
EBV EBNA-1/иммуноглобулин
HVS Tip/металлотионеин
HBV НЬх/металлотионеин
HCV core/HBV
Н8У16Е7/кератин 14
Ру V T-ag/C3
HTLV-I pX/H-2Kd
HTLV-I to/иммуноглобулин
HIV-1 raf/LTR
v-Ha-zas/эмбриональный глобин
у-На-гал/кальцитонин
Опухоль гонад
Опухоль панкреатической железы
Гепатоцеллюларная карцинома
Эритролейкемия
Опухоль нейронального креста
В-клеточная лимфома
Т-клеточная лимфома
Гепатоцеллюларная карцинома
Гепатоцеллюларная карцинома
Эпителиальная карцинома
Инвазийная карцинома
Карцинома молочной железы
Лимфома
Саркома Капоши
Эпидермальная папиллома
Тироидная карцинома
Сокращения. SV40 - вирус обезьяны 40, HIV — вирус иммунодефицита человека, PyV - вирус
палиомы, FLV — вирус лейкемии кошки, EBV — вирус Эпштейна—Барр, НВ V—вирус гепатита В, HSV —
простой вирус герпеса, HVS - герпесвирус saimiri, HTLV - Т-лимфотропный вирус человека, T-ag -
Т-антиген.
личных генов (Hunter, 1997). При этом, однако, не всегда понятно, что слу-
жит основным сигналом, запускающим данный каскад, зачастую остается
неясной цепь последующих изменений и сопровождающих их событий.
Большой трудностью является определение того, что является причиной, а
что следствием злокачественной трансформации клетки.
Для выяснения молекулярных механизмов онкогенеза в последние годы
стали широко использовать такие новые подходы, как трансгеноз в сочета-
нии с таргетингом, вычитающую гибридизацию, дифференциальный дисп-
лей, сравнительную геномную гибридизацию, гибридизацию с микрочипами
и др. Новые подходы существенно расширили наши представления о меха-
низмах злокачественного перерождения клетки, хотя и не позволили окон-
чательно решить данную проблему. Была получена обширная новая инфор-
мация о генах, экспрессия которых в раковых клетках сильно увеличивает-
ся или уменьшается (Copie-Bergman et al., 1999; Alizadeh et al., 2000; Wellmann
et al., 2000). Анализ таких генов позволил обнаружить новые онкогены и ан-
тионкогены, показать участие известных и неизвестных ранее генов в кан-
церогенезе. При этом выяснилось, что при злокачественной трансформации
резко изменяется экспрессия не только ядерных, но и митохондриальных
генов.
При изучении механизмов опухолеобразования под действием вирусов с
успехом используют в качестве модели трансгенные организмы. В табл. 3
приведены данные, полученные при изучении роли в онкогенезе разных ви-
русных генов с помощью трансгеноза. В результате этих исследований бы-
ли выявлены различные гены ДНК- и РНК-содержащих вирусов, не все из
которых являются типичными онкогенами, но которые способствуют раз-
витию у трансгенных животных большого спектра неоплазий. Принципи-
160
ально важно, что вид злокачественного перерождения, индуцируемого еди-
ничным вирусным геном, чаще всего коррелирует с тем, который вызывает
инфицирование организма соответствующим целым вирусом. Такая корре-
ляция позволяет понять тонкие механизмы канцерогенного действия виру-
сов, указывая на природу продукта, обусловливающего процессы опухоле-
образования.
Среди множества злокачественных заболеваний, связанных с вирусами,
нами было обращено внимание на HIV-ассоциированный лимфомогенез.
Согласно последним данным, неходжкинские лимфомы присутствуют у
4-12% HIV-носителей (Carbone, Gaidano, 2001). У пациентов, инфицирован-
ных HIV, возникают преимущественно В-клеточные лимфомы, которые от-
носятся к трем основным морфологическим субтипам: центробластной (CL)
иммунобластной (IL) и лимфоме Бёркитта (LB).
В частности, как уже указывалось выше, важным аргументом в пользу
ассоциации HIV с развитием такого типа рака, как лимфома, послужили экс-
перименты на трансгенных мышах. В лимфоме Бёркитта часто наблюдает-
ся хромосомная транслокация, приводящая к дерегуляции протоонкогена
с-тус в результате его соединения с энхансером одного их генов иммуногло-
булинов. Моделирование этой патологии на трансгенных мышах было нача-
то еще в 1991 г. Недавно было показано, что реконструированный трансген,
содержащий мутантный ген с-тус и все элементы энхансера гена легкой це-
пи иммуноглобулина, вызывает у трансгенных мышей патологию, очень
сходную с лимфомой Бёркитта у людей (Kovalchuk et al., 2000).
Исследование лимфомогенеза имеет длинную историю и в настоящее
время обнаружено множество клеточных генов, которые участвуют в тех
или иных процессах, ведущих к злокачественному перерождению лимфоид-
ной ткани. В табл. 4 приведен список отдельных известных к настоящему
времени генов, изменения в структуре и/или экспрессии которых взаимосвя-
заны с образование лимфом.
Лимфомогенез, как и другие формы канцерогенеза, является многоэтап-
ным процессом. Одним из убедительных подтверждений этому являются
эксперименты на двойных трансгенных мышах. Эти исследования показали
наличие синергизма между большим числом генов. Некоторые из известных
данных по кооперативному действию различных генов на процесс лимфомо-
генеза, полученные с использованием модели трансгенных животных, пред-
ставлены в этом сборнике в статье Андреевой Л.Е. и Тарантула В.З.
Одним из вирусных генов-кандидатов, который может быть ответствен
за HIV-ассоциированный лимфомогенез, является ген tat. Выше уже были
приведены результаты, полученные на трансгенных животных, которые
подтверждают участие гена tat в лимфомогенезе. Одним из возможных ме-
ханизмов действия гена tat является Tat-опосредованная индукция гена бета-
полимеразы, изменяющей стабильность ДНК в HIV-ассоциированных лим-
фомах (Srivastava et al., 2001). В HIV-ассоциированных лимфомах обнаружи-
ли множество клеточных генов, потенциально ответственных за их разви-
тие. Одним из таких генов является ген TCL1, детектированный с помощью
вычитающей гибридизации (Teitell et al., 1999).
С целью получения более полной картины молекулярного механизма
HIV-индуцированного лимфомогенеза нами была проведена серия экспери-
ментов с использованием метода вычитающей гибридизации, позволяюще-
6. Проблемы и перспективы...
161
Таблица 4. Гены, ассоциированные с лимфомогенезом у человека
Ген Модификация Тип лимфомы Ген Модификация Тип лимфомы
API2, MLT Транслокация MALT ras Мутации B-NHL
bcl-1 (cyclin D1) Транслокация MCL, CCL rel Амплификация DLLC
bcl-2 Транслокация FL, DLCL cdc25A Активация B-NHL
bcl-3 Транслокация CLL p!5INK4b Инактивация DLLC
bcl-6 Транслокация DLCL p!6INKA?i Инактивация MCL. DLLC
bcl-7A Транслокация BL p21Wafl Инактивация MCL
bcl-8 Транслокация DLBCL lyt-10 Транслокация B-NHL
bcl-10 Транслокация MALTL survivin Активация B-NHL
BTG-1 Транслокация B-CLL hoxc5 Активация ALCL
с-тус Транслокация BL, FL, DLCL pax-5 Транслокация LPL
mdm-2 Активация DLCL ALK Транслокация DLBCL, ALCL
р53 Мутации BL, B-NHL IL-7 Активация HD
р73 Гиперметили- BL IL-12 Активация HD
рование
Rb Инактивация CLL, IDL
Сокращения. HD - болезнь Ходжкина, DLBCL - диффузная крупноклеточная лимфома, ALCL -
анапластическая крупноклеточная лимфома, LPL — лимфоплазмоцитоидная лимфома, В-NHL —
В-клеточная неходжкинская лимфома, MCL - лимфома покровных клеток, DLLC - диффузная
лимфома с крупноклеточным компонентом, CLL - хроническая лимфоцитарная лимфома, IDL -
лимфома с промежуточной дифференцировкой, BL — лимфома Бёркитта, FL — фолликулярная
лимфома, MALT - лимфома, ассоциированная с лимфоидными тканями слизистой оболочки, CCL -
центроцитарная лимфома.
го идентифицировать гены, экспрессия которых усиливается или подавляет-
ся в лимфомах у HIV-инфицированных пациентов (Николаев и др., 1999;
Tarantul et al., 2001; Ненашева и др., 2001). Общая схема метода, использо-
ванного в этих работах, представлена на рис. 54.
На первом этапе с помощью вычитающей гибридизации были исследо-
ваны популяции мРНК двух В-клеточных неходжкинских лимфом пациен-
тов, инфицированных HIV-1: центробластная (CL) и иммунобластная (IL)
(по классификации KIEL). По классификации REAL обе эти лимфомы отно-
сятся к диффузным В-клеточным крупноклеточным лимфомам (DLBCL).
Для изучения спектра генов, которые усиливают свою экспрессию в этих
лимфомах, были проведены вычитающие гибридизации с использованием
кДНК, синтезированных на мРНК лимфомных клеток и нормальных лим-
фоцитов человека. В качестве трейсера при вычитающей гибридизации слу-
жили лимфомные кДНК, а в качестве драйвера кДНК нормальных лимфо-
цитов крови человека. После получения вычтенных библиотек кДНК осу-
ществляли их двухэтапный скрининг. Примерно 10% клонов кДНК, полу-
ченных после вычитания, по данным двойного дифференциального скри-
нинга, представляли собой лимфомоспецифические кДНК. После отбора
специфических для лимфом клонов эти кДНК частично секвенировали и их
последовательности сравнивали с существующими базами данных нуклео-
тидных последовательностей (табл. 5). В результате проведенного анализа
было выявлено три типа клонов: (1) не имеющие гомологии с нуклеотидны-
ми последовательностями, представленными в существующих базах данных;
(2) имеюшие гомологию с клонированным ранее кДНК неизвестной приро-
162
Таблица 5. Дифференциально экспрессирующиеся гены в CL и IL человека
Клон Регистра- ционный № Секвени- рованный фраг- мент (п.н.) Родствен- ный ген или кДНК Регистрационный № Сходство
п.н. %
Центробластная лимфома (CL)
hll-1 Y16696 139 Неизвестен - Нет Нет hll-2 Y16715 161 EST АЮ50976 104 95 hl 1-5 Y16713 255 Неизвестен - Нет Нет hll-6 Y16702 194 X2(3)IgL Х51755 71 84 hll-8 Y16712 183 Неизвестен - Нет Нет hll-9 Y16700 203 XlIgL/.vez Х51755/М93651 48/154 96/97 hll-10 Y16708 272 EST AI377400 229 95 hll-11 Y16697 108 Неизвестен - Нет Нет hll-12 Y16714 110 IFN-ind U22970 136 97 hll-14 Y16709 152 set M93651 152 97 hll-15 Y16706 143 Неизвестен — Нет Нет hll-35 Y16711 109 Неизвестен Нет Нет hll-45 Y16703 108 Неизвестен - Нет Нет hll-61 Y16704 245 ND-I V00662 117 95 hll-76 Y16699 131 ND-IV V00662 151 94 hll-79 Y16707 129 ND-IV V00662 128 99 hll-86 Y16705 278 IFN-ind U22970 145 97 hll-98 Y16698 203 Xllg/.veZ X51755/M93651 48/154 96/97 hll-101 Y17174 250 16SrRNA V00662 247 99
Иммунобластная лимфома (IL)
Ы2-201 Y17170 422 16SrRNA V00662 349 99 Ы2-222 Y17172 230 ND-IV V00662 175 98 Ы2-229 Y17171 364 AS-6 V00662 328 99 Ы2-253 Y17173 329 ND-IV V00662 194 99 Ы2-254 Y17174 243 16S rRNA V00662 242 98 Ы2-264 Y17176 259 ND-IV V00662 246 98 Ы2-274 Y17175 196 COX-II V00662 180 97 Ы2-378 Y17177 95 CYTb V00662 78 92 Ы2-383 Y17178 298 ND-IV V00662 296 98 Ы2-494 Y17179 264 AS 6 V00662 264 95 Ы2-498 Y17180 265 ND-IV N00662 208 98 Ы2-500 Y17170 227 16S rRNA V00662 225 99 Ы2-501 Y17170 302 16S rRNA V00662 299 99 Ы2 502 Y17170 205 16S rRNA V00662 203 99 1112-503 Y17170 274 16S rRNA V00662 271 99 1112-504 Y17170 255 16S rRNA V00662 252 99 Сокращения. AS - АТФ-синтаза, COX - цитохром-с-оксидаза, CYT - цитохром, ND - НАДН-де- гидрогеназа, INF-ind - ген, индуцируемый интерфероном, Xllg - легкая цепь иммуноглобулина.
ды (EST) и (3) имеющие гомологию с описанными ранее генами. При срав-
нении лимфомоспецифических генов CL и IL выяснилось, что среди них есть
как общие, так и специфические для отдельных лимфом.
Далее, с целью более полного анализа спектра высокоэкспрессирую-
щихся генов в этих двух лимфомах человека и для доказательства того, что
обнаруженные нами различия в спектре высокоэкспрессирующихся генов
6*
163
Таблица 6. Гены, характеризующиеся повышенным уровнем экспрессии в CL
по сравнению с IL человека (Tarantul et al., 2001; Ненашева и др., 2001) *
Клон Секвенированный фрагмент (п.н.) Родственный ген или кДНК Регистрационный номер Сходство, %
hss1-204 137 ND-I V00662 83
hss1-206 107 Неизвестен — Нет
hss 1-209 188 Неизвестен — Нет
hssl-219 144 set M93651 96
hss 1-221 198 ND-IV V00662 100
hss 1-225 105 UgL X51755 100
hss1-250 143 set M93651 97
hss 1-254 161 ND-IV V00662 98
hss1-255 171 set M93651 97
hss1-257 165 set M93651 98
hss 1-301 133 IFN-ind U22970 100
hssl-316 177 IL4R X52425 94
hss 1-328 128 TAP2 U07844 95
hssl-342 105 a-myb X66087 100
Сокращения. IL4R — рецептор интерлейкина 4, TAP2 — ABC транспортер 2.
являются реальными, а не результатами ограниченных возможностей ис-
пользованного метода, была проведена дополнительная вычитающая гиб-
ридизация с использованием РНК CL как трейсера и РНК IL как драйвера.
Результаты, представленные в табл. 6, свидетельствуют о том, что обнаружен-
ные нами на первом этапе различия в спектре высокоэкспрессирующихся
генов между двумя типами лимфом действительно имеют место. Кроме это-
го, был выявлен ряд новых высокоэкспрессирующихся в CL генов. Интерес-
но, что полученные нами данные по сравнительному анализу CL и IL хоро-
шо совпали с результатами масштабного анализа, проведенного одновре-
менно с нами с использованием новой техники на базе микрочипов (Alizadeh
et al., 2000). Обнаруженный нами повышенный уровень транскрипции генов
в CL по сравнению с IL, таких как онкогены set и a-myb, IL-4R, ТАР2, был
выявлен для ряда DLBCL в результате анализа, проведенного с использова-
нием микрочипов. Все лимфомы, в которых было обнаружено повышение
экспрессии описанных нами генов, относились к большому подтипу DLBCL,
содержащих клетки, схожие с В-лимфоцитами центра размножения. Эти
данные являются еще одним подтверждением специфичности выявленного
нами спектра генов, высокоэкспрессирующихся в CL.
В CL человека в первую очередь обратил на себя внимание высокий
уровень экспрессии “слитого” гена иммуноглобулин-set (получено несколь-
ко идентичных клонов кДНК, содержащих в пределах одной молекулы по-
следовательности легкой цепи иммуноглобулина и гена set). Ранее в лите-
ратуре не было указаний на участие онкогена set в лимфомогенезе. Секве-
нирование кДНК, а также детальный ПЦР-анализ (рис. 55) и блот-гибриди-
зация подтвердили, что активация этого онкогена в CL связана скорее все-
го с хромосомной транслокацией между 9 и 22 хромосомами, в результате
которой образуется слитый ген Ig-set (Николаев и др., 1999; Tarantul et al.,
2001b).
164
12 3 4 5
12 3 4 5 6
Рис. 55. ПЦР-анализы, выявляющие наличие слитого транскрипта (А) и гена (Б) lg-set в CL
А - ПЦР-анализ, выявляющий слитую IgLIset кДНК. ПЦР проводилась с суммарной кДНК, синтезиро-
ванной на мРНК контрольных В-лимфоцитов (дорожка 1), IL (дорожка 2), CL (дорожка 3) и кДНК кло-
на hll 98 как положительный контроль (дорожка 4). Дорожка 5 — маркер молекулярных весов (pBR322,
рестрицированная эндонуклеазой А1иГ). Б - ПЦР-анализ, выявляющий слитую последовательность
IgLIset в геномной ДНК. Реакция проводилась с геномными ДНК из нормальных В-лимфоцитов челове-
ка (дорожка 1), клеток нормальной селезенки человека (дорожка 2), CL (дорожка 3) и IL (дорожка 4).
В качестве положительного контроля служила кДНК клона hll-98 (дорожка 5). Дорожка 6 - маркер мо-
леулярных весов (pBR322, рестрицированная эндонуклеазой А1иГ)
Вместе с тем в результате проведенного исследования на лимфомах че-
ловека выяснилось, что к HIV-ассоциированному лимфомогенезу могут
иметь отношение такие общие для двух лимфом высокоэкспрессирующиеся
гены, как гены отдельных субъединиц белков, участвующих в процессе
окислительного фосфорилирования (ОФ).
В случае лимфомогенеза у HIV-илфицированных людей пока можно гово-
рить лишь об ассоциации между вирусной инфекцией и злокачественным пере-
рождением. Однако наличие причинно-следственной связи между образова-
нием лимфом у обезьян и инфицированием их SIV, по-видимому, является уста-
новленным фактом, так как от 15 до 40% искусственно инфицированных SIV
животных содержат лимфомы (Feichtinger et al., 1990, 1992; Hannig et al., 1998).
Следует отметить, что одновременно в более 90% лимфом у обезьян присутст-
вуют вирусы, подобные человеческому EBV (Blaschke et al., 2001).
С помощью того же варианта метода вычитающей гибридизации, кото-
рый был использован выше для лимфом HIV-инфицированных пациентов,
а также с помощью Норзен-блот гибридизации и дифференциального скри-
нинга были проанализированы три лимфомы SIV-инфицированных обезьян
(Масаса mulatto). Две из них относились к типу DLBCL, а одна к лимфомам,
подобным лимфоме Бёркитта (BLL). Результаты этих анализов приведены
в табл. 7. Как и в случае HIV-1-ассоциированного лимфомогенеза у челове-
ка, в SIV-индуцированной лимфоме обезьяны происходило усиление транс-
крипции ряда генов, кодирующих белки окислительного фосфорилирова-
ния. Кроме этого, спектры высокоэкспрессирующихся генов в лимфомах
165
Таблица 7. Дифференциально экспрессирующиеся кДНК в лимфомах обезьян, вы-
явленные с помощью вычитающей гибридизации (ВГ), дифференциального скрининга
(ДС) и норзен-блот гибридизации (НБ)
Гены DLBCL (#1725) DLBCL (#1794) BLL(#1774)
ВГ ДС HE ВГ ДС HE HE
SAA + + —
AGP + + +
RPS3 + + + +
RPL8 + +
RPL41 + +
INF-ind + + +
Mtsl + + +
[}2MG + +
KIAAO129 + + + + + +
SET — + + -
TEF-1 +
ND-I + + + + + + +
ND-IV — + + + + +
COX-II — + + + +
СУТЬ — + +
16S rRNA — + + +
ND-II - - - - -
Обозначения. SAA — сывороточный амилоид A,RPS — рибосомный белок, TEF-1 — фактор элон
гации трансляции 1, mts - метастазин, Q2MG - бета2микроглобулин. + - повышенная транскрипция,
— отсутствие изменения в уровне транскрипции.
человека и обезьян перекрываются и по некоторыми другими генам: онко-
ген set, интерферон-индуцируемый ген и неизвестный ранее ген, условно
обозначенный как KIAA0129 (увеличение экспрессии этого гена в HIV-ассо-
циированных лимфомах человека обнаружили с помощью Норзен-гибриди-
зации). Интересно, что в имеющейся литературе ни один из этих генов ра-
нее не был ассоциирован с развитием лимфом.
Сравнение спектров генов, высокотранскрибирующихся в лимфомах че-
ловека и обезьян по сравнению с нормальными В-клетками и лимфоузлами,
свидетельствует об их существенном перекрывании. Это указывает на опре-
деленное сходство механизмов лимфомогенеза у человека и макак, инфици-
рованных вирусами иммунодефицита. Следовательно, Масаса mulatto, искус-
ственно инфицированная SIV, может служить адекватной моделью при изу-
чении процессов лимфомогенеза, ассоциированного у людей с HIV, что весь-
ма важно для экспериментальных исследований.
Вместе с тем проведенный анализ экспрессии генов в SIV-ассоциирован-
ных лимфомах обезьян показал повышенную экспрессию таких, которые не
были обнаружены при использовании вычитающей гибридизации на лим-
фомах человека. Например, среди высокоэкспрессирующихся генов в лим-
фомах обезьян имеется ген сывороточного амилоида А, который служит из-
вестным индикатором воспаления и повреждения тканей, но его повышен-
ную экспрессию никто до сих пор не связывал с лимфомогенезом. В то же
время с помощью вычитающей гибридизации ранее была показана повы-
166
шенная экспрессия данного гена в
опухоли почки, наблюдали повы-
шенную экспрессию гена амилоида
А при остром лейкозе.
Обращает на себя внимание и
повышенная экспрессия в лимфо-
мах обезьян ряда генов рибосом-
ных белков (RPS3, RPL8 и RPL41).
Ранее повышенную экспрессию
этих генов обнаруживали в ряде
злокачественных клеток, что зача-
стую связывали с увеличением син-
теза рибосом. Однако в последние
годы было установлено, что эти
полипептиды не только входят в
состав рибосом, но и влияют на
Таблица 8. Изменения уровней экспрес-
сии генов окислительного фосфорили-
рования у трансгенных мышей, содер-
жащих ген tat HIV-1
Ген Трансгенные мыши
№312 №313 №502
НАДН-де- + + N гидрогеназа 4 Цитохром-с- + + + оксидаза 2 Цитохром b + + + АТФ-синтаза 6 N N + Обозначения. + — повышенная экспрессия по сравнению с нормой, N - отсутствие измене- ний (норма).
различные процессы в клетке, в ча-
стности, на репарацию ДНК в ядре,
а также на апоптоз. Следовательно, при рассмотрении результатов вычита-
ющих гибридизаций следует иметь в виду, что некоторые рибосомные бел-
ки могут выполнять не только те функции, которые им стандартно припи-
сывают, но и иные внерибосомные функции. В общем виде мы еще коснем-
ся этого вопроса ниже.
Вирус-индуцируемый лимфомогенез может быть обусловлен действием
на клетку не просто вируса как целого, а отдельных вирусных белков. В ча-
стности, выше уже говорилось о том, что продукт регуляторного гена tat ви-
руса HIV-1 обладает онкогенным потенциалом. Для выяснения природы
клеточных генов, на которые может действовать в клетке продукт гена tat
HIV-1, нами была проведена вычитающая гибридизация с использованием
РНК печени трансгенных мышей, содержащих ген tat HIV-1 под контролем
металлотионеинового промотора (Тарантул и др., 1999). В результате нам
удалось показать, что основным геном, характеризующимся повышенной
экспрессией в печени таких мышей, является ген цитохрома Ь. В печени
3 различных трансгенных животных имела место также повышенная экспрес-
сия и некоторых других генов окислительного фосфорилирования (табл. 8).
Полученные данные указывают на то. что наличие в клетках продукта всего
лишь одного вирусного гена может приводить к тем же изменениям в экспрес-
сии генов морфологически нормальных клеток печени, как и те, которые име-
ли место в опухолях, индуцированных целым вирусом HIV-1.
МИТОХОНДРИАЛЬНЫЕ ГЕНЫ И КАНЦЕРОГЕНЕЗ
В настоящее время становится очевидным, что злокачественная транс-
формация клеток определяется интегральным процессом, в который вовле-
чено множество различных генов (Свердлов, 2001). При правильном потоке
многочисленных сигналов, приходящих к клеткам, они нормально растут и
дифференцируются. При нарушении интеграции этих сигналов и происхо-
дит перерождение клеток. Раковое перерождение является многоэтапным
167
процессом. Определенные изменения в работе генетического аппарата вы-
ступают в качестве триггеров. Поскольку метаболизм клетки является ин-
тегральным процессом, нарушение даже в одном из звеньев приводит к цеп-
ной реакции, отражающейся в изменении экспрессии сотен других генов.
При этом нарушается баланс между продуктами онкогенов и антионкоге-
нов, между различными факторами, участвующими в апоптозе, которые в
норме во многом определяют процессы нормальной жизнедеятельности
клеток. Метаболизм в раковых клетках направляется в сторону их неуправ-
ляемого размножения. Перепрограммирование, происходящее в раковых
клетках, затрагивает множество метаболических путей. Поэтому, когда ин-
тегрально исследуется картина экспрессирующихся генов в опухолях, суще-
ствует главная проблема - это вычленение причины и следствия.
Один из важных метаболических путей, меняющих свои свойства в зло-
качественных клетках, связан с такими органеллами, как митохондрии,
обеспечивающими энергетику клеток. Транскрипция, трансляция, реплика-
ция и репарация митохондриального генома зависят от ядерного генома, но
пока не до конца ясно, как эти два генома интегрированы друг с другом.
Изучение механизмов межгеномного взаимодействия может стать полез-
ным для понимания интегральной картины процессов злокачественного пе-
рерождения клеток.
К митохондриям в настоящий момент приковано внимание многих групп
исследователей. Это связано с осознанием того влияния, которое оказыва-
ют митохондрии на метаболизм клетки, в том числе на злокачественную
трансформацию и апоптоз. Как выяснилось, в осуществлении этих процес-
сов значимую роль играет регуляция экспрессии митохондриальных генов
(Capuano et al., 1997; Heddy et aL, 1999; Penta et al., 2001). В разных типах ра-
ковых клеток среди усиленно экспрессирующихся генов “домашнего хозяй-
ства” встречаются гены белков ОФ. Это свидетельствует о том, что повы-
шенная экспрессия ряда генов окислительного фосфорилирования может
быть общим свойством предраковых и раковых клеток. Имеющиеся данные
можно рассматривать как указание на заметные изменения в энергетиче-
ском метаболизме раковой клетки. В принципе данное заключение можно
было бы высказать, исходя из общих соображений, а также на основании не-
которых известных данных по исследованию ферментативной активности в
раковых клетках. Однако последние указывали на энергетическую зависи-
мость злокачественных клеток скорее от гликолиза, чем от окислительного
фосфорилирования.
Выше были приведены данные, свидетельствующие о том, что в разных
типах лимфом человека и обезьян усиливает свою экспрессию ограниченный
спектр митохондриальных генов, кодирующих белки ОФ. Хотя набор этих
генов слегка различается в разных типах опухолевых клеток, следует отме-
тить, что во всех проанализированных нами лимфомах имела место повы-
шенная экспрессия гена субъединицы 2 цитохром-с-оксидазы и субъединиц 1
и 2 NADH-дегидрогеназ. В то же время анализ экспрессии гена NADH-дегид-
рогеназы 2, проведенный в качестве контроля, не позволил обнаружить из-
менение уровня его транскрипции в опухолевых клетках (см. табл. 7).
Повышенную экспрессию ряда генов, кодирующих белки окислительно-
го фосфорилирования (цитохрома Ь, субъединицы 2 цитохром-с-оксидазы,
субъединиц 1 и 4 NADH-дегидрогеназы) и митохондриальную 16S рРНК,
168
обнаруживали ранее в разных типах раковых тканей и трансформирован-
ных клеточных линиях (Sharp et al., 1992; Wang et al., 1996; Heddy et al., 1996;
Penta et al., 2001). Данные, полученные в этих работах, в целом коррелируют
с нашими результатами в том отношении, что при этом в опухолевых клет-
ках усиливают свою экспрессию не все, а лишь ограниченный набор мито-
хондриальных генов.
Важно отметить, что увеличение экспрессии в злокачественных клетках
отдельных митохондриальных генов белков ОФ не связано с изменением от-
носительного содержания в клетках митохондриальной и ядерной ДНК.
Изучение биогенеза митохондрий в опухолевых клетках с увеличенным чис-
лом транскриптов некоторых генов ОФ показало, что копийность митохон-
дриальной ДНК в них не увеличивается по сравнению с нетрансформиро-
ванными клетками. Напротив, оказалось, что в опухолевых клетках сниже-
но количество митохондрий при парадоксальном увеличении содержания
митохондриальных транскриптов (Mullauer et al., 1991; Luciakova, Kuzela,
1992; Heddy, 1996, 1999). Обнаруженное нами увеличение экспрессии огра-
ниченного набора митохондриальных генов при лимфомогенезе также не
может быть просто объяснено эффектом увеличения числа митохондрий в
злокачественной клетке, так как происходило изменение экспрессии не всех
генов митохондриального генома.
Остается нерешенным вопрос, заключающийся в том, что в этих процес-
сах является первичным, а что вторичным. Согласно нашим данным, в част-
ности полученным на трансгенных мышах с геном tat HIV-1, усиление
окислительного фосфорилирования может по крайней мере в некоторых
случаях предшествовать злокачественному перерождению клеток и, вероят-
но, быть причиной последнего. В этом отношении интересны результаты,
полученные недавно Cavalli с соавт. (1997), которые показали, что при исто-
щении раковых клеток митохондриальной ДНК они ревертируют к дикому
типу. Ответ на вопрос о том, является ли усиление экспрессии ряда митохон-
дриальных генов белков ОФ одной из причин лимфомогенеза, или его след-
ствием, могло отчасти дать определение уровней экспрессии митохондриаль-
ных генов белков ОФ в первичных иммортализованных клетках человека -
модельной системе ранних этапов онкогенеза. С этой целью был проведен
дифференциальный скрининг клонотек кДНК нормальных и иммортализо-
ванных SV40 фибробластов человека с использованием в качестве зондов
кДНК некоторых митохондриальных генов ОФ, уровень экспрессии кото-
рых в клетках лимфом выше, чем в В-лимфоцитах и лимфоузлах. Оказалось,
что в иммортализованных клетках также повышен уровень экспрессии
СОХ-П, ND-IV и сохранен неизменным уровень экспрессии гена ND-II (Нико-
лаев и др., 2001). Эти данные позволяют считать, что изменение (повышение)
экспрессии отдельных генов митохондриального генома может быть одним
из ранних проявлений онкогенеза и, в частности, лимфомогенеза.
Таким образом, как наши результаты, так и данные других авторов
(Penta et al., 2001) позволяют предположить наличие причинно-следственной
связи между увеличением экспрессии определенного набора митохондри-
альных генов, кодирующих белки окислительного фосфорилирования, и
злокачественной трансформацией.
К настоящему времени уже возникло несколько гипотез, связывающих
неопластическую трансформацию с митохондриями. В частности, недавно
169
выдвинуто предположение, что злокачественное перерождение клеток мо-
жет быть обусловлено избытком в них АТФ (Ray S., Ray М., 1997). Можно
также предположить, что повышение транскрипционной активности опре-
деленного набора митохондриальных генов, кодирующих белки ОФ, спо-
собствует поддержанию нужной скорости дыхания в злокачественной клет-
ке. Механизм, лежащий в основе такого процесса, может быть связан с
увеличением содержания субъединиц, лимитирующих сборку белков ОФ.
Эта коррекция работы дыхательной цепи митохондрий злокачественной
клетки позволяет поддерживать трансмембранный потенциал на уровне,
обеспечивающем целостность митохондриальной оболочки, что важно для
компартментализации компонентов межмембранного пространства. Пос-
леднее обстоятельство, как недавно стало ясно, является определяющим для
судьбы клетки. Снижение трансмембранного потенциала приводит в конеч-
ном итоге к образованию мегаканалов в мембране митохондрий и вовлека-
ет внутримитохондриальные продукты, в частности, факторы, индуцирую-
щие апоптоз (AIF, цитохром с), в каскад событий, приводящих к гибели
клетки (Huser et al., 1998). Обеспечение нужной скорости дыхания является
средством, с помощью которого в опухолевой клетке устанавливается уро-
вень трансмембранного потенциала, достаточный для стабилизации мито-
хондрий и компартментализации компонентов межмембранного простран-
ства. Возможность апоптоза при осуществлении этих процессов остается не-
реализованной. Таким образом, повышение уровня экспрессии отдельных
митохондриальных генов может служит одним из средств, с помощью кото-
рых злокачественная клетка контролирует свой статус, блокируя апоптоз.
Вместе с тем в поддержании злокачественного статуса клетки могут
играть ключевую роль некоторые субъединицы белков ОФ при условии их
избытка в клетке. В этой связи внимание привлекают субъединицы 1 и 2 ци-
тохром-с-оксидазы, поскольку активация транскрипции генов этих субъеди-
ниц часто связана со злокачественным перерождением клетки (см. выше).
Важно отметить, что повышение транскрипционной активности гена COX-II
в опухолях не зависит от изменений в энергетическом балансе злокачествен-
ной клетки, но связано с изменением экспрессии некоторых генов, регули-
рующих клеточный рост и пролиферацию (Patel et al., 1997; Kato, 1999).
Недавно нами было высказано предположение о возможном механизме
участия цитохром-с-оксидазы в подавлении апоптоза в лимфомных клетках
(Тарантул и др., 1999; Tarantul, Hunsmann, 2001). Так как апоптоз иницииру-
ется выходом цитохрома с в цитоплазму, можно думать, что любой меха-
низм, препятствующий выходу цитохрома с из митохондрий, должен задер-
живать наступление апоптоза и тем самым способствовать началу каскада
событий, ведущих к иммортализации клеток. В цепи переноса электронов
цитохром-с-оксидаза окисляет цитохром с. Повышенный уровень экспрес-
сии гена цитохром-с-оксидазы (который, как указывалось выше, имеет мес-
то во многих злокачественных клетках) может приводить к ингибированию
транспорта свободного цитохрома с из митохондрий в цитоплазму в резуль-
тате уменьшения концентрации свободного цитохрома с в митохондриях за
счет формирования стабильного электростатического комплекса с цито-
хром-с-оксидазой, прикрепленной к внутренней митохондриальной мембра-
не. По-видимому, цитохром-с-оксидаза действует подобно онкобелку Вс1-2,
блокирующему выход цитохрома с в цитоплазму через мегаканалы мито-
17(1
Таблица 9. Полифуикционалыюсть отдельных субъединиц мультимерных белков и
комплексов
Полипептиды Функции/свойства
Субъединица 2 цитохром-с- оксидазы Участие в ОФ, специфическое взаимодействие с цикли- ном G1, вовлеченность в сигнальный путь Raf-1, изби- рательное усиление экспрессии в лимфомах
Рибосомный белок RPS3a Участие в трансляции мРНК и в апоптозе, трансформи- рующая активность, экспрессия в лимфомных клетках
Кислый рибосомный белок РО Апурин/апиримидин-эндонуклеазная активность, участие в репарации ДНК, трансформирующий эффект, избирательное усиление экспрессии в лимфомах
Субъединица Rpp20 РНКазы Р РНКазная и АТФазная активность
хондрий, но использует иной механизм. Прекращение или уменьшение
транспорта цитохрома с в цитоплазму клетки снижает вероятность насту-
пления апоптоза. В результате задержки апоптоза повышается вероятность
накопления мутаций в геноме, и как следствие этого увеличивается вероят-
ность злокачественного перерождения клеток.
Для понимания взаимосвязи процессов онкогенеза и регуляции экспрес-
сии митохондриального генома важны данные, полученные при изучении
механизмов действия разнообразных противоопухолевых средств. Показа-
но, в частности, что широко используемый противоопухолевый антибиотик
адриамицин специфически ингибирует субъединицу 2 цитохром-с-оксидазы
(Papadopoulou et aL, 1999), тогда как цитостатик ангиостатин специфически
ингибирует ос/р субъединицы ATP-синтазы (Moser et al„ 1999). Применение
мофаротена для химиотерапии опухолей молочной железы приводило к по-
давлению транскрипции гена ND-I (Uchida et al„ 1994). Обнаружено, что воз-
никновение устойчивости к цисплатину коррелирует с изменением уровня
экспрессии гена COX-II в клетках-мишенях (Higuchi, 1999). Все эти данные
позволили предположить, что ингибирование активности и некоторых дру-
гих субъединиц белков ОФ может иметь противоопухолевый эффект
(Tarantul, Hunsmann, 2001). Поскольку митДНК не находится под строгим
контролем клеточного цикла, она потенциально является уникальной
мишенью для терапии рака.
Из наших исследований, а также из тех результатов, которые постепен-
но накапливаются в литературе (табл. 9), следует еще один принципиальный
вывод, который может быть сделан в настоящее время и который важно
иметь в виду при оценке полученных нами результатов: отдельные субъеди-
ницы мультимерных белков могут выполнять самостоятельную и независи-
мую от мультимерного белка функцию.
Ярким примером полифункциональности макромолекул и генов в клет-
ках может служить ситуация с геном, кодирующим митохондриальную
16S рРНК. Как показал проведенный нами анализ, этот ген кроме
16S рРНК, которая является структурной основой митохондриальных рибо-
сом, способен кодировать короткий функционально активный пептид.
Такой вывод был сделан в результате сравнения последовательностей ядер-
ной и митохондриальной ДНК с кДНК хьюманина, обнаруженной Хашимо-
то с соавт. (Hashimoto et aL, 2001). Эти авторы показали, что хьюманин об-
171
ладает способностью предотвращать клеточную гибель, вызываемую му-
тантными генами пресенилина, однако о природе соответствующего гена
ничего не было сказано. Наш анализ позволил прийти к выводу о том, что
ген хьюманина расположен внутри гена 16S рРНК митохондрий (Maximov et
al., 2002). Как указывалось выше, нами в клетках лимфом обнаружено зна-
чительное усиление экспрессии гена, который имеет гомологию с митохон-
дриальным геном 16S РНК. Но продукт этого гена полиаденилирован и его
3-конец не совпадает с 3'-концом гена 16S рРНК. Повышенный уровень по-
лиаденилированных РНК, гомологичных 16S рРНК, имеет место и в ряде
других типов злокачественных клеток. Все это позволило нам заключить,
что во всех этих случаях происходит усиленная экспрессия гена хьюманина,
входящего в состав гена 13S рРНК, а не повышенное образование самой
16S рРНК. Таким образом, на одном гене возможно образование различных
продуктов с совершенно разными функциями (рибосомная РНК и белок).
В заключение следует отметить, что предложенный нами механизм ин-
гибирования апоптоза, характеризующий один из множества возможных
этапов в цепи событий взаимодействия вирусов с клеткой, находится в рус-
ле современных взглядов на влияние ряда опухолеродных вирусов на апоп-
тоз клетки посредством воздействия на митохондрии и экспрессию митохон-
дриальных генов - процесса, следствием которого может быть злокачест-
венная трансформация клетки.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ГЕНОМА ЧЕЛОВЕКА,
ИМЕЮЩИХ ЧАСТИЧНУЮ ГОМОЛОГИЮ
С РЕГУЛЯТОРНЫМИ ГЕНАМИ HIV-1
Геном человека содержит большое число последовательностей эндоген-
ных ретровирусов (human endogenous retroviruses, HERVs) (Leib-Mosch et al.,
1990). Для их выявления и клонирования использованы разные подходы и
прежде всего гибридизация в мягких условиях с ранее выделенными генами
экзогенных и эндогенных ретровирусов грызунов и птиц. После обнаруже-
ния первых экзогенных ретровирусов человека, Т-лимфотропных вирусов
человека (HTLV) и вирусов иммунодефицита человека (HIV), имеющих ме-
жду собой существенную гомологию, первоначально считали, что в геноме
человека отсутствуют нуклеотидные последовательности, гомологичные
геному этих вирусов. Позднее немногочисленные работы, посвященные по-
иску в геноме человека последовательностей, имеющих сходство с HIV, по-
зволили обнаружить несколько элементов, частично гомологичных струк-
турному гену env этого вируса. Имеются отдельные сообщения о наличие
небольшого сходства между регуляторными белками Nef, Tat и Rev HIV-1 и
некоторыми белками человека (Horwitz et al., 1992; см. также ссылки в рабо-
те Хайдаровой и др., 1997а). Все эти данные позволяли думать о наличии в
геномах млекопитающих последовательностей, которые в какой-то степени
родственны регуляторным генам лентивирусов человека. Однако вопрос о
возможной гомологии между геномом HIV и геномом человека, а также
других млекопитающих не был детально изучен. В частности, не проводили
систематических исследований по поиску в геноме человека и обезьян пос-
ледовательностей, родственных регуляторным генам, которые имеются у
172
HIV и отсутствуют у большинства других ретровирусов. Между тем этот во-
прос представляется важным. Наши знания о наличии структурного и функ-
ционального сходства вирусных регуляторных генов и генов млекопитаю-
щих принципиальны для более полного понимания путей возникновения и
эволюции вирусов данного типа, и, кроме того, могут быть полезными для
выяснения функции этих вирусных генов и гомологичных им участков гено-
ма млекопитающих, указывая на возможные пути их дальнейшего исследо-
вания. В частности, в связи с наличием онкогенного потенциала у гена tat
(см. выше) можно было предположить, что подобно многим другим вирус-
ным онкогенам, он имеет клеточное происхождение.
Нами был проведен цикл исследований по поиску в геноме человека
(преимущественно в хромосоме 19) и обезьян последовательностей, имею-
щих частичную гомологию с регуляторными генами nefvt tat/rev и со струк-
турным геном env HIV-1 (Хайдарова и др., 1997а-в).
Наличие в геномах человека и шимпанзе последовательностей, имею-
щих частичное сходство с различными генами HIV-1, первоначально тести-
ровали с помощью блот-гибридизации в мягких условиях, позволяющих вы-
являть последовательности, сходство которых с генами ВИЧ составляет от
60% и выше. В очень мягких условиях гибридизации геномных ДНК челове-
ка и шимпанзе с перекрывающимися генами tat/rev наблюдали в основном
диффузное распределение сигнала. При более жестких условиях отмывки
фильтров диффузный гибридизационный сигнал уменьшался и были обна-
ружены дискретные положительные сигналы как с ДНК человека, так и с
ДНК шимпанзе. Наличие дискретных гибридизующихся фрагментов не ис-
ключает существование и других последовательностей, имеющих сходство
с генами tat/rev, которые представлены менее часто встречающимися фраг-
ментами других размеров. Об этом свидетельствуют полуколичественные
данные гибридизации в точках, согласно которым общее число tat/rev-no-
добных элементов в геноме человека составляет около 103. Сходное значе-
ние было получено и при скрининге тотальной библиотеки генов человека
(102-103). Эти оценки совпадают с теми, которые можно рассчитать на осно-
вании данных гибридизации с фильтрами высокой плотности, на которых
нанесен ранжированный банк генов хромосомы 19. Около десятка рекомби-
нантных космид гибридизовалось в мягких условиях с зондом tatlrev. Учиты-
вая, что хромосома 19 содержит примерно 1/50 часть генома, можно рассчи-
тать, что общее количество щ//гег-подобных элементов в геноме человека
составляет около 5 х 102.
Из клонотеки генов хромосомы 19 клонировали рекомбинантные фаги,
содержащие последовательности, сходные с генами tat/rev. Анализ этих по-
следовательностей показал, что в отдельных из них содержится по несколько
фрагментов, имеющих гомологию с зондом. Это свидетельствует о соседст-
вовании в геноме человека некоторых tof/rev-подобных элементов.
Секвенирование одного из гибридизующихся фрагментов хромосомы
19 человека показало (рис. 56), что в нем в районе от 240 до 340 п.н. содер-
жится несколько участков размером от 13 до 27 п.н., имеющих от 71 до 78%
гомологии с зондом, которые расположены в клонированной последова-
тельности и гене tat/rev колинеарно. При сравнении последовательности
этого фрагмента с базами данных нуклеотидных последовательностей обна-
ружено заметное сходство (score >100) одной и той же области фрагмента
173
Xhal
PstI
Bglll Sal! Alni SspI Sspl EcoRl BamHl Bglll
(___i___!___f_________i,____________i______i_________i
1 cctagggggaaccacaccaccacgtacagtcattagggtcgatgagccctccgactccgt 60
61 cctcttagtaacttggatcctccaccttcaacgtcaatcagttctagtgtggtaacgtga 120
121 qqtccaaccaqttttctcqttctqaqqaqttttttttttttttttttttttcacatactt 180
181 tggatatatatgaacatacaattaaaacataaaacgattaaatgactcacatgaattatc 240
241 aaatctqtctaaaattacat qacaaataccaaaaaatatatqt qttaacatactaqatqt 300
301 txqccqtt qaaaaat gaaaaaaataaaqct atcaaaaaaac aaaqaaact qattaaqaaq 360
361 acqqtqtatqaaqqtcacqatqtaattttatcttcqtqaccqqtccqaqacaccqaqtqt 420
421 cccctagg 428
Puc. 56. HIV-1 tal/rev-подобный элемент хромосомы 19 человека
A — рестриктазная карта клонированного фрагмента хромосомы 19 (линией снизу указан секвенирован-
ный фрагмент, гибридизирующийся с геном tat, который назван ЛМ428). Б - последовательность нуклео-
тидов фрагмента Д/и428 (участки гомологии с зондом подчеркнуты). В - участки последовательности
Д/и428, имеющие сходство с геном tat (заштриховано несколько участков размером от 13 до 27 п.н., име-
ющих от 71 до 78% сходства с зондом, которые расположены в клонированной последовательности ге-
нома человека и генах tatlrev HIV-1 колинеарно)
Alu428 (примерно со 150 по 300 п.н.) с множеством различных участков ге-
нома. Степень гомологии составляла от 50 до 65%.
В геноме человека с помошью гибридизации в мягких условиях обнару-
жено также множество нуклеотидных последовательностей, имеющих час-
тичную гомологию с другим регуляторным геном HIV-1 - nef. При гибриди-
зации геномных ДНК с зондом, содержащим ген nef, часть длинного конце-
вого повтора (LTR) HIV-1 и часть гена env, были выявлены последователь-
ности, имеющие частичную гомологию с HIV-1, которые диспергированы в
геномах как у человека, так и у мыши. Сходную картину наблюдали и при
гибридизации с ДНК шимпанзе. По мере ужесточения условий гибридиза-
ции и отмывки фильтров наблюдали постепенное уменьшение сигнала на
автографах, что свидетельствовало о наличие у разных классов млекопита-
ющих гетерогенного семейства геномных последовательностей, имеющих
частичную гомологию с использованным зондом.
Для более детальной характеристики этих элементов из клонотеки ге-
нов хромосомы 19 человека были выделены и охарактеризованы рекомби-
174
нантные фаги, имеющие частичную гомологию с геном nef. По данным
скрининга и результатам гибридизации в точках общее число элементов ге-
нома человека, имеющих частичную гомологию с геном nef составляет
Юз-104.
Блот-гибридизация клонированных рекомбинантных фаговых ДНК, со-
держащих фрагменты геномной ДНК человека, с геном nef показала, что в
мягких условиях, как правило, несколько рестрикционных фрагментов каж-
дой фаговой ДНК дают положительный сигнал. Это указывает на то, что в
геноме человека отдельные ле/-подобные элементы, как и ^/-подобные эле-
менты, сближены между собой. Некоторые независимо клонированные по-
следовательности генома имели сходную картину рестрикции, рестриктная
картина других несколько отличается.
Компьютерный анализ двух из клонированных «(/-подобных нуклеотид-
ных последовательностей (размером 399 п.н. (RP399) и 258 п.н. (В258)), про-
веденный с помощью программы DNA-SUN, показал, что в обоих фрагмен-
тах имеются небольшие области гомологии с геном «е/HIV-l (рис. 57,А, Б).
Следует отметить, что частичную гомологию с обеими клонированными по-
следовательностями имеет один и тот же участок гена nef (с 8832 по
8851 п.н.), расположенный сразу за инициирующим AUG-кодоном и непере-
крывающийся с LTR. Фрагмент В258 кроме короткой области подобия с ге-
ном nef имел гомологию с А/и-повторами человека. Но наибольший интерес
представляет собой последовательность фрагмента RP399, в котором рядом
с короткими участками, гомологичными гену nef присутствовал довольно
протяженный участок (75 п.н.), имеющий 67% гомологии с геном env. Важ-
но отметить, что ген env соседствует в геноме HIV-1 с геном nef. Следова-
тельно, клонированный нами фрагмент имеет сходство не только с геном
nef а с елг/ле/-областью генома HIV-1.
Анализ базы данных EMBL позволил обнаружить значительную гомо-
логию фрагмента RP399 (66-75%) еще с четырьмя секвенированными ранее
последовательностями: с клонами EHS-1 и EHS-2, выделенными при скри-
нинге библиотеки генов человека с помощью гена env HIV-1 (Horwitz et al.,
1992), и разными участками двух РНК-co держащих вирусов (вируса гепати-
та С и ротавируса человека). Кроме того, в RP399 имеется открытая рамка
считывания (ORF), способная кодировать полипептид размером не менее 72
аминокислотных остатков. Таким образом, принципиальным моментом яв-
ляется обнаружение в геноме человека елг/ле/-подобной последовательно-
сти HIV. Маловероятно, что такое совпадение случайно.
При гибридизации в жестких условиях елг/не/-подобной последователь-
ности человека с фильтрами высокой плотности, на которых были нанесе-
ны рекомбинантные космиды с фрагментами ДНК хромосомы 19 человека,
ранжированными ранее на хромосоме 19, было выявлено шестнадцать раз-
личных космид и удалось локализовать их на хромосоме 19 (рис. 58). Круж-
ками на рисунке отмечены те космиды, которые наряду с последовательно-
стями, имеющими сходство с RP399, содержали ранее локализованные в ла-
боратории Е.Д. Свердлова LTR эндогенных провирусов (Lebedev et aL, 1995).
Маловероятно, что такая высокая корреляция является случайной.
Таким образом, в случае последовательности RP399 можно с определен-
ной долей уверенности говорить о том, что мы имеем дело с неким семейст-
вом повторяющихся элементов генома человека, имеющих родство по нук-
175
Sa P PvR P E XS XSP Bg Bg Sa
t___________I H t t H IH_______I t I
I === II =—
Б
1 ccccacagct agaggtgagt aaaggcaata gctaaactac acacacggca cacacacaca
61 cacacacaca cacacacacg tctccacctc tcatccccac actcctacct cccacatctc
121 tggaagtgtc agcaaactcc cagcaactaa atgtaaaaat atagattagt ttcctctgct
I------► ORF (>216 а. к.) ------------------------------
181 caaagtagac aggcgacctc tagtggacaa aaagggatga ttgacagcac actatttctt
241 tgctgatttt gtggagtccg ctgaaattct aatagcagag gccacagatg tcgcctgaaa
301 tgagaacttt ctttcagtat ataaacctta aaccctgcac catgcctctt ctcatcaacg
361 ttctcacaca tgcacacaca cacacacaca cccaacagt
В
1 ccccccacac tggtctcaaa ctcctaggct caagcatcct cccacttcca cctcccaaag
61 tgctgggatt acaggcatga gcacaacatg cagcccaaag aaatcttgat aatatttata
5++++++++++++++++++++++++++
121 taggctggct atataaattt atatatatat gtatatgtgt gtgtgtatat atatgtgtgt
181 gggtgtgtgt gtgtgtgtat atatatatac atatatatat atttgagaag ttggcgaaag
241 gtcaaaaata tttaaggg 258
Puc. 57. HIV-1 nef-подобные элементы хромосомы 19 человека
A — рестриктазная карта клонированного фрагмента хромосомы 19 человека. Двойной штриховой лини-
ей под рестриктазной картой обозначены две гибридизуюгциеся с геном nef области (I - последователь-
ности размером 399 п.н. (RP 399), II - последовательность размером 258 п.н. (В 258). Б -
последовательность RP 399. В - последовательность В 258. Сплошной линией в Б и В подчеркнуты обла-
сти гомологии с геном nef. Штриховой линией в Б подчеркнута область гомологии с геном env HIV-1.
Стрелкой указано начало открытой рамки считывания. Крестиками в В обозначена область гомологии
с Д/и-повтором. Рестриктазы: Е - EcoRI, Sa - Sacl, Р - Pstl, X - Xbal, Bg - Bg/Il, Pv - PvhII, Rs - Rsal
D13.3 d13.2 D13.1 d!2 al2 Q13.1 013.2 013.3 013.4
Puc. 58. Локализация env!nef -подобных последовательностей на хромосоме 19 человека
Стрелками указано расположение на хромосоме космид, содержащих еш/ие/ подобные последователь-
ности, цифры сверху - номера космид. Кружками отмечены космиды, которые содержали картирован-
ные ранее (Lebedev et al., 1995) LTR-подобные последовательности эндогенных провирусов
176
леотидной последовательности с геномом HIV-1. Эту уверенность придает
тот факт, что во фрагменте, клонированном с помощью гена nef, одновре-
менно содержится последовательность, имеющая значительное сходство с
геном env, который соседствует с геном nef в геноме HIV-1. Кроме того, су-
ществует высокая корреляция между распределением елг/ле/-подобных эле-
ментов и LTR HERV. Случайное соседствование в геноме человека двух та-
ких элементов представляется маловероятным.
Число космид, гибридизуюгцихся с ле/-содержащим зондом в мягких ус-
ловиях, примерно в 40 раз больше. Если считать, что env/nef- и nef-подобные
элементы равномерно распределены не только в хромосоме 19, но и в дру-
гих хромосомах человека, то их общее число в геноме человека можно оце-
нить величиной порядка 103 и 2 х 104 соответственно.
В настоящее время опубликовано небольшое число работ, посвященных
анализу распределения ретровирус-подобных элементов на хромосомах.
Так, Лейб-Мёш с соавт. (Leib-Mosch et al., 1990) показали присутствие 25 000
LTR HERV почти на всех хромосомах человека. Лебедев с соавт. (Lebedev et
al., 1995) наблюдали довольно равномерное распределение LTR HERV вдоль
хромосомы 19. В совокупности с нашими данными в настоящий момент
можно считать, что разные типы ретровирус-подобных элементов широко
диспергированы в геноме человека.
Характеристика участков генома человека, гомологичных регулятор-
ным генам HIV-1, возможно позволит прояснить вопрос о происхождении
этих генов. Однако представленные здесь результаты пока не позволяют
сделать однозначное заключение. Вместе с тем обнаружение нами частич-
ного сходства между регуляторными вирусными генами nef и tat/rev HIV-1 -
с одной стороны, и ДНК человека и других млекопитающих - с другой по-
зволяют предположить, что подобно таким типичным онкогенам, как src,
ras и другие, отдельные регуляторные гены (или элементы) HIV могли
быть “приобретены” из эукариотического генома в процессе эволюции
вируса.
ЗАКЛЮЧЕНИЕ
На рубеже XX и XXI веков бурный прогресс в развитии структурной и
функциональной геномики кардинально изменил ситуацию в молекулярной
генетике. В результате этого прогресса появились принципиально новые
подходы и методы исследования молекулярных механизмов, работающих
в живых клетках и, в частности, механизмов взаимодействия вирусных и
клеточных генов. Так, революционизирующее влияние оказало использова-
ние в экспериментах микрочиповой технологии. Она сейчас идет на смену
ранее использованным методам вычитающей гибридизации. С помощью
микрочипов в небольшой серии экспериментов удается изучать и сопостав-
лять характер экспрессии одновременно десятков тысяч разных генов. Важ-
ное значение для изучения функции генов приобрели такие подходы, как на-
правленный мутагенез генов in vivo (таргетинг генов), использования явле-
ния РНК-интерференции и др. Все эти новые подходы позволяют теперь
однозначно устанавливать причинно-следственные связи между генотипом
и фенотипом. В частности, с помощью таргетинга и трансгеноза возможно
177
выяснить, какие из выявленных нами лимфомоспецифических генов имеют
прямое отношение к вирус-ассоциированному лимфомогенезу, каковы их
функции в норме и при патологиях.
На базе новых данных о функциях вирусных генов и механизмов взаимо-
действия вирусов с клетками происходит переосмысливание некоторых об-
щепринятых принципов работы и регуляции экспрессии генов у эукариот,
а также их эволюции. Здесь существенную роль должна сыграть сравни-
тельная геномика.
Не вызывает сомнения, что, благодаря прогрессу в области геномики,
в ближайшие годы будут раскрыты основные молекулярные пути взаимо-
действия отдельных продуктов вирусных генов и вирусов в целом с генами
и белками клеток-хозяев, роль вирусов в канцерогенезе. Огромный массив
данных может быть понят и осмыслен только в результате развития биоин-
форматики как составной части геномики. В конечном результате вся эта
огромная информация послужит ключем к пониманию тонких механизмов
различных патологий и созданию принципиально новых высокоэффектив-
ных и высокоспецифичных средств лечения заболеваний человека, в том
числе и вызываемых вирусными инфекциями.
Автор выражает большую благодарность всем своим коллегам, кото-
рые активно помогали ему при написании этой обзорной статьи: А.И. Нико-
лаеву, И.А. Гривенникову, И.В. Бобрышевой, Е.С. Мануйловой, Н.В. Хай-
даровой, В.В. Ненашевой, А.В. Мартыненко, В.В. Максимову и др. В статью
включены экспериментальные данные, полученные коллективами сотруд-
ников двух лабораторий Отдела вирусной и клеточной молекулярной гене-
тики: Лаборатории молекулярной генетики ретровирусов и СПИДа и Лабо-
ратории молекулярной генетики соматических клеток.
ЛИТЕРАТУРА
Мудрик Н.Н., Андреева Л.Е., Дубовая В.И. и др. Эффект гена nef ВИЧ-1 на соотноше-
ние клеток в костном мозге и периферической крови у трансгенных животных //
Докл. РАН. 1992. Т. 325. С. 606-608.
Ненашева В.В., Максимов В.В., Николаев А.И., Тарантул В.З. Сравнительный анализ
уровней транскрипции генов в двух типах ВИЧ-ассоциированных лимфом // Моле-
куляр. генетика, вирусология, микробиология. 2001. № 4. С. 27-31.
Николаев А.И., Мартыненко А.В., Калмырзаев Б.Б. и др. Усиление транскрипции ми-
тохондриальных генов в В-клеточных неходжкинских лимфомах человека и обезь-
яны //Молекуляр. биология. 2001. Т. 3. С. 108-114.
Николаев А.И., Хенниг X., Мухоян И.А. и др. Анализ лимфомоспецифических транс-
криптов в В-клеточных неходжкинских лимфомах людей, инфицированных виру-
сом иммунодефицита типа 1 //Там же. 1999. Т. 33. С. 252-260.
Свердлов Е.Д. Некоторые принципы организации сигнальных систем клетки: геном —
инструктор или исполнитель? //Вести. РАМН. 2001. Т. 10. С. 8-18.
Свердлов Е.Д., Тарантул В.З. Структурно-функциональная анатомия и вариабельность
генома вирусов иммунодефицита приматов // Итоги науки и техники. Иммунология.
М.: ВИНИТИ. 1992. С. 3-82.
Тарантул В.З., Мудрик Н.Н. Изучение молекулярных основ патологии на модели
трансгенных животных // Биополимеры и клетка. 1991. Т. 7. С. 5—12.
Тарантул В 3., Николаев А.И., Калмырзаев Б.Б. и др. Молекулярные механизмы вирус-
индуцированного онкогенеза // Молекуляр. биология. 1999. Т. 33. С. 86—93.
178
Хайдарова Н.В., Алексеевская О.Д., Тарантул В.З. Обнаружение и характеристика по-
следовательностей хромосомы 19 человека, имеющих частичное сходство с регуля-
торными генами tat/rev вируса иммунодефицита человека типа 1 // Там же. 1997а.
Т. 31. С. 819-824.
Хайдарова Н.В., Несмеянова Х.П., Тарантул В.З. Клонирование и характеристика уча-
стков генома человека частично гомологичных вирусу иммунодефицита человека
типа 1 // Докл. РАН. 19976. Т. 354. С. 265—267.
Хайдарова Н.В., Несмеянова Х.Н., Тарантул В.З. Последовательности хромосомы
19 человека, имеющие гомологию с геномом вируса иммунодефицита человека ти-
па 1 // Молекуляр биология. 1997в. Т. 31. С. 38—44.
Шугурова И.М., Андреева Л.Е., Дубовая В.И. и др. Влияние генов nefu tat вируса имму-
нодефицита человека типа 1 на клетки грызунов in vivo и in vitro // Генетика. 1997.
Т. 33. С. 1202-1208.
Шугурова И.М., Бобрышева И.В., Гривенников И.А., Тарантул В.З. Эффекты генов nef
и tat вируса иммунодефицита человека типа 1 на клетки феохромоцитомы крысы
РС12 Ц Генетика. 2000. Т. 36. С. 1140-1146.
Alcami A., Kozinowski U.H. Viral mechanisms of immune evasion // Immunol. Today. 2000.
Vol. 21. P. 447^455.
Alizadeh A.A., Eisen M.B., Davis R.E. et al. Distinct types of diffuse large В-cell lymphoma iden-
tified by gene expression profiling // Nature. 2000. Vol. 403. P. 503—511.
Baron H.M., Bobrysheva I.V., Varshaver N.B. The activated human c-Ha-ras-1 oncogene as a
mutagen // Cancer Genet, and Cytogenet. 1992. Vol. 62. P. 15-20.
Beniasz P.D., Cullen B.R. Multiple blocks to human immunodeficiency virus type 1 replication in
rodent cells // J. Virol. 2000. Vol. 74. P. 9868-9877.
Benichou S., Bomsel M., Durand H. et al. Physical interaction of the HIV-1 Nef protein with beta-
COP? A component of non-clathrin-coated vesicles essential for membrane traffic // J. Biol.
Chem. 1994. Vol. 269. P. 30073-30076.
Bishop J.M. Molecular themes in oncogenesis // Cell. 1991. Vol. 64. P. 235-248.
Blaschke S., Hannig H., Buske C. et al. Expression of the simian epstein-barr virus-encoded latent
membrane protein-1 in malignant lymphomas of SIV-infected Rhesus macaques // J. Med.
Virol. 2001. Vol. 65. P. 114-120.
Briggs S.D., Lerner E.C., Smithgall T.E. Affinity of src family kinase SH3 domains for HIV nef
in vitro does not predict kinase activation by nef in vivo // Biochemistry. 2000. Vol. 39.
P. 489-495.
Campioni D.. Corralini A., Zaula G. et al. HIV type 1 extracellular Tat protein stimulates growth
and protects cells of BK virus/tat transgenic mice from apoptosis // AIDS Res. Hum. Retrovir.
1995. Vol. 11. P. 1039-1048.
Capuano F., Guerrieri F., Papa SJ. Oxidative phosphorylation enzymes in normal and neoplas-
tic cell growth // Bioenerg. Biomembr. 1997. Vol. 29. P. 379-384.
Carbone A., Gaidano G. Acquired immunodeficiency syndrome-related cancer. A study model for
the mechanisms contributing to the genesis of cancer // Eur. J. Cancer. 2001. Vol. 37.
P. 1184-1187.’
Cavalli L.R., Varella-Garcia M., Liang B.C. Diminished tumorigenic phenotype after depletion of
mitochondrial DNA // Cell Growth Differ. 1997. Vol. 8. P. 1189-1198.
Chang L.-J., Chen С.-H., Urlacher V., Lee T.-F. Differential apoptosis effect of primate lentiviral
Vpr and Vpx in mammalian cells // J. Biomed. Sci. 2000. Vol. 7. P. 322-333.
Collette Y., Dutartre H., Benziane A. et al. Physical and functional interaction of Nef with Lck-
HIV-1 Nef induced T-cell signalling defects // J. Biol. Chem. 1996. Vol. 271. P. 6333-6341.
Copie-Bergman C., Gaulard P., Maouche-Chretien L. et al. The MAL gene is expressed in pri-
mary mediastinal large В-cell lymphoma // Blood. 1999. Vol. 15. P. 3567-3575.
Corallini A., Altavilla G., Pozzi L. et al. Systemic expression of HIV-1 tat gene in transgenic mice
induced endothelial proliferation and tumors of different histo types // Cancer Res. 1993.
Vol. 53. P. 5569-557.,.
Cote T.R., Biggar R.J., Rosenberg P.S. et al. Non-Hodgkin’s lymphoma among people with AIDS:
incidence, presentation and public health burden (AIDS) Cancer Study Group // Intern.
J. Cancer. 1997. Vol. 73. P. 645-650.
179
De S.K., Venkateshan C.N., Seth P. et al. Adenovirus-mediated human immunodeficiency virus-1
Nef expression im human monocytes/macrophages and effect of Nef on downmodulation of
Fc receptor and expression of monokines // Blood. 1998. Vol. 91. P. 2108-2117.
Derfuss T., Fickenscher H„ Kraft M.S. et al. Antiapoptotic activity of the herpesvirus saimiri-
encoded Bcl-2 homolog: stabilization of mitochondria and inhibition of caspase-3-like acti-
vity // J. Virol. 1998. Vol. 72. P. 5897-5904.
Dickie P. HIV type 1 nef perturbs eye lens development in transgenic mice I I AIDS Res. Hum.
Retrovir. 1996. Vol. 12. P. 177-189
Dickie P. Nef modulation of HIV type 1 gene expression and cytopathicity in tissues of HIV trans-
genic mice. AIDS Res. Hum. Retroviruses. 2000. Vol. 20. P. 777—790.
Feichtinger H., Kaaya E., Putkonen P. et al. Malignant lymphoma associated with human AIDS
and with SIV-induced immunodeficiency in macaques // Ibid. 1992. Vol. 8. P. 339-348.
Feichtinger H, Putkonen P., Paravicini C. et al. Malignant lymphomas in cynomolgus monkeys
infected with simian immunodeficiency virus // Amer. J. Pathol. 1990. Vol. 137.
P. 1311-1315.
Garcia J.V., Miller A.D. Serine phosphorylation-independent downregulation of cell-surface CD4
by nef// Nature. 1991. Vol. 350. P. 508-511.
Gorbunova L.V., Varshaver N.B., Shapiro N.I. The role of the transforming A gene of SV40 in the
mutagenic activity of the virus // Mol. and Gen. Genet. 1982. Vol. 187. P. 473^476.
Graziani A.. Galiini F., Medico E. et al. The HIV-1 Nef protein interferes with phosphatidylinosol
3-kinase activation 1 //J. Biol. Chem. 1996. Vol. 271. P. 6590-6593.
Green A.R., Wyke J.A. Integrated proviruses as probes for chromosomal position effects in mam-
malian cells and their hybrids // Cancer Surv., 1988. Vol. 7. P. 335-351.
Greenwey A., Azad A., McPhee D. Human immunodeficiency virus type 1 Nef protein inhibits
activation pathways in peripheral blood mononuclear cells and T-cell lines // Virology. 1995.
P. 69. P. 1842-1850.
Haber DA., Fearon E.R. The promise of cancer genetics // Lancet. 1998. Vol. 351. P. SII1-SII8.
Hannig H., Buske C., Matz Rensing K. et al. Elevated serum level of soluble CD23 precedes deve-
lopment of B-non-Hodgkin’s lymphoma in SIV-infected Rhesus monkeys // Intern. J. Cancer.
1998. Vol. 77. P. 734-740.
Hashimoto Y., Niikura T., Tajima H. et al. A rescue factor abolishing neuronal cell death by a wide
spectrum of familial Alzheimer’s disease genes and Abeta // Proc. Nat. Acad. Sci. USA. 2001.
Vol. 98. P. 6336-6341.
Heddy A., Faure-Vigny H., Wallace D.C., Stepien G. Coordinate expression of nuclear and mito-
chondrial genes involved in energy production in carcinoma and oncocytoma // Biochim. et
biophys. acta. 1996. Vol. 1316. P. 203-209.
Heddy A., Stepien G., Benke P.J., Wallace D.C. Coordinate induction of energy gene expression
in tissues of mitochondrial disease patients //J. Biol. Chem. 1999. Vol. 274. P. 22968-22976.
Herbein G., van Lint C., Lovett J.L., Vordin EJ. Distinct mechanisms trigger apoptosis in human
immunodeficiency virus type 1-infected and in uninfected bystander T lymphocytes // J.
Virol. 1998. Vol. 72. P. 660-670.
Higuchi E. Up-regulation of human chorionic gonadotropin alpha subunit gene and human mito-
chondrial cytochrome c oxidase subunit II gene in cis-Diamminedichloro-platinum(II)-resist-
ant human head and neck squamous carcinoma cells // Hokkaido igakku zasshi. 1999.
Vol. 74. P. 231-238.
Horwitz M.S., Boyce-Jacino M.T., Faras A J. Novel human endogenous sequences related to
human immunodeficiency virus type 1 // J. Virol. 1992. Vol. 66. P. 2170-2179.
Hunter T. Oncoprotein networks // Cell. 1997. Vol. 88. P. 333-346.
Husain S.R., Leland P., Aggarwal B.B., Puri R.K. Transcriptional up-regulation of interleukin 4
receptors by human immunodeficiency virus type 1 tat gene // AIDS Res. Hum. Retrovir.
1996. Vol. 12. P. 1349-1359.
HuserJ., Rechenmacher C.E., Blatter L.A. Imaging the permeability pore transition in single mito-
chondria // Biophys. J. 1998. Vol. 74. P. 2129-2137.
Jamieson B.D., Aldrovandi G.M., Planelles V. et al. Requirement of human immunodeficiency
virus type 1 nef for in vivo replication and pathogenicity // J. Virol. 1994. Vol. 68.
P. 3478-3485.
180
Kato M.V. The mechanisms of death of an erythroleukemic cell line by p53: involvement of the
microtubule and mitochondria // Leukemia and Lymphoma. 1999. Vol. 33. P. 181-186.
Kestler H.W. IIL, Ringler D.J., Mori K. et al. Importance of the nef gene for maintenance of high
virus loads and for development of AIDS // Cell. 1991. Vol. 65. P. 651-662.
KohleisenB., Shumay E., Sutter G. et al. Stable expression of HIV-1 Nef induces changes ingrowth
properties and activation state of human astrocytes // AIDS. 1999. Vol. 13. P. 2331-2341.
Kovalchuk A.L., Qi C.F., Torrey TA. et al. Burkitt lymphoma in the mouse // J. Exp. Med. 2000.
Vol. 192. P. 1183-1190.
Kundu R.K., Sangiorgi F., Wu L.Y. et al. Expression of the human immunodeficiency virus-tnt
gene in lymphoid tissues of transgenic mice is associated with В-cell lymphoma // Blood.
1999. Vol. 94. P. 275-282.
Lebedev Y.B., Volik S.V.. Obradovic D. et al. Physical mapping of sequences homologous to an
endogenous retrovirus LTR on human chromosome 19 // Mol. and Gen. Genet. 1995.
Vol. 247. P. 742-748.
Leib-Mosch C., Brack-Werner R., Werner B. et al. Endogenous retroviral elements in human
DNA // Cancer Res. 1990. Vol. 50. P. 5636s-5642s.
LiuJ.-L., Ye Y., Lee L.F., Kung H.-J. Transforming potential of the herpesvirus oncoprotein MEQ:
morphological transformation, serum-independent growth, and inhibition of apoptosis // J.
Virol. 1998. Vol. 72. P. 388-395.
Lotz M., Clark-Lewis L, Ganu V. HIV-1 transactivator protein Tat induces proliferation and TGF
beta expression in human articular chondrocytes // J. Cell Biol. 1994. Vol. 124. P. 365—371.
Luciakova K., Kuzela S. Increased steady-state levels of several mitochondrial and nuclear gene
transcripts in rat hepatoma with a low content of mitochondria // Europ. J. Biochem. 1992.
Vol. 205. P. 1187-1193.
Macho A., Calzado M.A., Jimenez-Reina L. et al. Susceptibility of HIV-l-TAT transfected cells to
undergo apoptosis. Biochemical mechanisms // Oncogene. 1999. Vol. 18. P. 7543-7551.
Macreadie LG., Thorburn D.R., Kirby D.M et al. HIV-1 protein Vpr causes gross mitochondrial
dysfunction in the yeast Saccharomyces cereviciae // FEBS Lett. 1997. Vol. 410. P. 145-149.
Maggirwar S.B., Tong N., Ramirez S. et al. HIV-1 Tat-mediated activation of glycogen synthase
kinase-3beta contributes to Tat-mediated neurotoxicity // J. Neurochem. 1999. Vol. 73.
P. 578-586.
Matthews G.V., Bower M., Mandalia S. et al. Changes in acquired immunodeficiency syndrome-
related lymphoma since the introduction of highly active antiretroviral therapy // Blood. 2000.
Vol. 96. P. 2730-2734.
Maximov V.V., . Martynenko A.V., Hunsmann G., Tarantul VZ. Mitochondrial 16S rRNA gene
encodes a functional peptide with drug potential for Alzheimer’s disease and cancer therapy //
Med. Hyphoteses. 2002. Vol. 59. P. 670-673.
Meylan P.R., Baumgartner M., Ciuffi A. et al. The nef gene controls syncytium formation in pri-
mary human lymphocytes and macrophages infected by HIV type 1 // AIDS Res. Hum.
Retrovir. 1998. Vol. 14. P. 1531-1542.
Milani D., Mazzoni M., Zauli G. et al. HIV-1 Tat induces tyrosine phosphorytion of pl25FAK and
its association with phosphoinositide 3-kinase in PC12 cells // AIDS. 1998. Vol. 12.
P. 1275-1284.
Mitelman F., Mertens F., Johansson B. A breakpoint map of recurrent chromosomal rearrange-
ments in human neoplasia // Nature Genet. 1997. Vol. 15. P. 417-474.
Moser T.L., Stack M.S., Asplin I. et al. Angiostatin binds ATP synthase on the surface of human
endothelial cells //Proc. Nat. Acad. Sci. USA. 1999. Vol. 96. P. 2811—2816.
Mullauer L., Suzuki H., Fujita H. et al. Identification of genes that exhibit increased expression
after flat reversion of NIH/3T3 cells transformed by human activated Ha-ras oncogene //
Cancer Lett. 1991. Vol. 59. P. 37^-3.
New D.R., Maggirwar S.B., Epstein L.G. et al. HIV-1 Tat induces neuronal death via tumor necro-
sis factor-alpha and activation of non-N-methyl-D-aspartate receptors by a NF-kappaB-inde-
pendent mechanism //J. Biol. Chem. 1998. Vol. 273. P. 17852-17858.
Otake K., Fujii Y., Nakaya T. et al. The carboxyl-terminal region of HIV-1 Nef protein is a cell
surface domain that can interact with CD4+ T cells // J. Immunol. 1994. Vol. 153.
P. 5826-5837.
181
Papadopoulou L.C., Theophilidis G., Thomopoulos G.N., Tsiftsoglou A.S. Structural and func-
tional impairment of mitochondria in adriamycin-induced cardiomyopathy in mice: suppres-
sion of cytochrome C oxidase If gene expression // Biochem. Pharmacol. 1999. Vol. 57.
P. 481-Л89.
Patel S., Wang F.H., Whiteside T.L., Kasid U. Constitutive modulation of Raf-1 protein kinase is
associated with differential gene expression of several known and unknown genes // Mol.
Med. 1997. Vol. 3. P. 674-685.
Patki A.H., Lederman M.M. HIV-1 Tat protein and its inhibitor Ro 24—7429 inhibit lymphocyte
proliferation and induce apoptosis in peripheral blood mononuclear cells from healthy
donors // Cell Immunol. 1996. Vol. 169. P. 40-46.
Pavlakis G.N., Felhor B.K., Rosenberg M.P. et al. Oncogenic potential of tax transcriptional acti-
vator proteins of HTLV-I and HTLV-II in transgenic mice // AIDS Res. Hum. Retrovir. 1990.
Vol. 6. P. 86-87.
Penta J.S., Johnson F.M., Wachsman J.T., Copeland W.C. Mitochondrial DNA in human malig-
nancy // Mutat. Res. 2001. Vol. 488. P. 119-133.
Plemenitas A., Lu X., Geyer M. et al. Activation of Ste20 by Nef from human immunodeficiency
virus induces cytoskeletal rearrangement and downstream effector functions in Saccharo-
myces cereviciae // Virology. 1999. Vol. 258. P. 271—281.
Quaranta M.G., Camponeschi B., Straface E. et al. Induction of interleukin-15 production by HIV-1
Nef protein: a role in the proliferation of uninfected cells // Exp. Cell Res. 1999. Vol. 250.
P. 112-121.
Rautonen J., Rautonen N., Martin N.L., Wara D.W. HIV type 1 Tat protein induced immunoglo-
bulin and interleukin 6 synthesis by uninfected peripheral blood mononuclear cells // AIDS
Res. Hum. Retrovir. 1994. Vol. 10. P. 781-785.
Ray S., Ray M. Does excessive adenosine 5'-triphosphate formation in cells lead to malignancy?
A hypothesis on cancer Ц Med. Hypotheses. 1997. Vol. 48. P. 473-476.
Robichaud G.A., Poulin L. HIV type 1 nef gene inhibits tumor necrosis factor alpha induced apop-
tosis and promotes cell proliferation through the action of МАРК and JNK in human glial
cells // AIDS Res. Hum. Retrovir. 2000. Vol. 16. P. 1959-1965.
Romano G., Kasten M., De Falco G. et al. Regulatory functions of Cdk9 and of cyclin T1 in HIV
tat transactivation pathway gene expression // J. Cell Biochem. 1999. Vol. 75. P. 357—368.
Salzman S.A., Burmester J.K. HIV-1 tat induced apoptosis of T-cells is not mediated by TGF-
beta// Med Oncol. 2000. Vol. 17. P. 211-217.
Schwariz 0., Marechai V., Le Gall S. et al. Endocytosis of major histocompatibility complex class
I molecules is induced by the HIV-1 Nef protein // Nature Med. 1996. Vol. 2. P. 338-342.
Scowronski L, Parks D.. Mariani R. Altered T cell activation and development in transgenic mice
expressing the HIV-1 nef gene // EMBO J. 1993. Vol. 12. P. 703-713.
Sharp M.G., Adams S.M., Walker R.A. et al. Differential expression of the mitochondrial gene
cytochrome oxidase II in benign and malignant breast tissue // J. Pathol. 1992. Vol. 168.
P. 163-168.
Shi B., Ranina J., Lorenzo A. et al. Neuronal apoptosis induced by HIV-1 Tat protein and TNF-
alpha: potentiation of neurotoxicity mediated by oxidative stress and implications for HIV-1
dementia // J. Neurovirol. 1998. Vol. 4. P. 281-290.
Shugurova L, Bobrisheva L, Surkova I. et al. The expression of HIV-1 tat and nef genes induces
cell-specific changes in growth properties and morphology of different types of rat cells //
Cell Proliferation. 2002. Vol. 65. P. 237—245.
Srivastava D.K.. Tendler C.L., Milani D. et al. The HIV-1 transactivator protein Tat is a potent
inducer of the human DNA repair enzyme beta-poly.nerase // AIDS. 2001. Vol. 15.
p. 433-440.
Steulund A., Botchan M.R. The E2 transactivator can act as a repressor by interfering with a cel-
lular transcription factor // Gene and Develop. 1990. Vol. 4. P. 123—126.
Tangsinmankong N., Day N.K., Good R.A., Haraguchi S. Monocytes are target cells for IL-10
induction by HIV-1 nef protein Ц Cytokine. 2000. Vol. 12. P. 1506-1511.
Taraboletti G., Benelli R., Borsotti P. et al. Thrombospondin-1 inhibits Kaposi’s sarcoma (KS)
cell and HIV-1 Tat-induced angiogenesis and is poorly expressed in KS lesions Ц J. Pathol.
1999. Vol. 188. P. 76-81.
182
Tarantul V.Z., Hunsmann G. Mitochondrial polypeptides of the oxidative phosphorylation path-
way as potential new targets for anti-cancer therapy // Med. Hypotheses. 2001. Vol. 56.
P. 386-387.
Tarantul V.Z., Nikolaev A.I., Hannig H. et al. Detection of abundantly transcribed genes and gene
translocation in human immunodeficiency virus associated non-Hodgkin’s lymphoma //
Neoplasia. 2001b. Vol. 3. P. 132-142.
Tarantul V.Z., Nikolaev A.I., Martinenko A.V. et al. Differential gene expression in В cell non-
Hodgkin’s lymphoma of SIV-infected monkey // AIDS Res. Hum. Retrovir. 2000. Vol. 16.
P. 173-179.
Teitell M., Damore M.A., Sulur G.G. et al. TCL1 oncogene expression in AIDS-related lym-
phomas and lymphoid tissues //Proc. Natl. Acad. Sci. USA. 1999. Vol. 96. P. 9809-9814.
Uchida T., Inagaki N.. Furuichi Y., Eliason J.F. Down-regulation of mitochondrial gene expres-
sion by the anti-tumor arotinoid mofarotene (Ro 40-8757) // Int. J. Cancer. 1994. Vol. 58.
P. 891-897.
Varmus H.E. Form and function of retroviral proviruses // Science. 1982. Vol. 216. P. 812-820.
Verhasselt B., Naessens E., Verhofstede C. et al. Human immunodeficiency virus ne/gene expres-
sion affects generation and function of human T cells, but not dendric cells // Blood. 1999.
Vol. 94. P. 2809-2818.
Vogel J., Hindrichs S.H., Reynolds R.K. et al. The HIV tat gene induces dermal lesions resembling
Kaposi’s sarcoma in transgenic mice // Nature. 1988. Vol. 335. P. 606-611.
Wang F. L., Wang Y., Wong W.K. et al. Two differentially expressed genes in normal human
prostate tissue and in carcinoma // Cancer Res. 1996. Vol. 56. P. 3634—3637.
Wellmann A., Thiehlemont C., Pittaluga S. et al. Detection of differentially expressed genes in
lymphomas using cDNA arrays: identification of clusterin as a new diagnostic marker for
anaplastic large-cell lymphomas // Blood. 2000. Vol. 96. P. 398^104.
Zamzami N., Susin S.A., Marchetti P. et al. Mitochondrial control of nuclear apoptosis // J. Exp.
Med. 1996. Vol. 183. P. 1533-1544.
Zauli G., La Placa M., Vignoli M. et al. An autocrine loop of HIV type-1 Tat protein responsible
for the improved survival/proliferation capacity of permanently Tat-transfected cells and
required for optimal HIV-1 LTR transactivating activity // J. Acquir. Immune Defic. Syndr.
Hum. Retrovir. 1995. Vol. 10. P. 306-316.
Zauli G., Secchiero P., Rodella L. et al. HIV-1 Tat-mediated inhibition of the tyrosine hydroxy-
lase gene expression in dopaminergie neuronal cells // J. Biol. Chem. 2000. Vol. 275.
P. 4159-4165.
ТРАНСГЕННЫЕ ЖИВОТНЫЕ:
ФУНДАМЕНТАЛЬНЫЕ И ПРИКЛАДНЫЕ АСПЕКТЫ
Л.Е. Андреева, В.З. Тарантул
Отдел вирусной и клеточной молекулярной генетики
Создание технологии получения трансгенных животных, широко
применяемой в молекулярной генетике в последние два десятилетия, яви-
лось одним из впечатляющих достижений молекулярной генетики и эмб-
риологии конца XX в. Ее возможности широко использовались и продол-
жают использоваться для решения как фундаментальных научно-иссле-
довательских проблем молекулярной биологии и генетики, так и некото-
рых прикладных целей в медицине, в сельском хозяйстве, для получения
продуктов питания. Трансгеноз стал одним из важных инструментов
в новом бурно развивающемся направлении молекулярной генетики -
функциональной геномике. Данный обзор посвящен истории развития
трансгеноза в нашем Институте и за рубежом, его достижениям в совре-
менной науке и практике, а также перспективам использования и совер-
шенствования этой эффективной технологии в XXI в.
СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ
АРР - белок-предшественник амилоида.
БА - болезнь Альцгеймера.
ГГР - ген гормона роста.
Г-КСФ - гранулоцит-колоний-стимулирующий фактор.
СПИД — синдром приобретенного иммунодефицита.
ЭГК - эмбриональные герменативные клетки.
ЭСК — эмбриональные стволовые клетки.
ЭПО - эритропоэтин.
CMV - цитомегаловирус человека.
GFP - зеленый флуоресцентный белок.
HIV - вирус иммунодефицита человека.
HSV - вирус простого герпеса.
ICSI - внутрицитоплазматическая инъекция сперматозоидов.
LIF - фактор ингибирования лейкемии.
LTR — длинный концевой повтор.
MMTV - вирус опухоли молочной железы.
МТ — металлотионеин.
MoMLTV - мышиный вирус лейкемии Молони.
MuLV - вирус лейкоза мышей.
NGF — фактор роста нервов,
ori - место начала репликации.
PSEN - пресенилин.
RSV - вирус саркомы Рауса.
SEAP - секреторная щелочная плацентарная фосфатаза.
SV40 - обезьяний вирус 40.
ВВЕДЕНИЕ
Прогресс любой науки определяется не только появлением принципи-
ально новых идей, но и в значительной мере возникновением и разработкой
новых высокоэффективных технологий и методов. Яркой иллюстрацией
184
этому могут служить те революционизирующие успехи, которые были дос-
тигнуты в молекулярной биологии и генетике в результате возникновения
такой методологии, такого комплекса новых методов и приемов, как генная
инженерия, которая позволила манипулировать с отдельными генами лю-
бых организмов в системах in vitro. На базе генной инженерии вскоре возникла
еще одна новая технология - трансгеноз - искусственный перенос экзо-
генной ДНК (генов) через клетки зародыша в целые организмы животных.
Это дало возможность перенести методологию генной инженерии из систем
in vitro в системы in vivo.
Сам термин “трансгеноз” возник еще в начале 70-х годов, значительно
ранее того момента, когда он стал использоваться в современном значении
этого слова. Первоначально им обозначали перенос генов в клетки, расту-
щие в культуре, т.е. in vitro. В настоящее время этот термин используют пре-
имущественно применительно к переносу генов в целые организмы (систе-
ма in vivo), а сами такие генетически измененные организмы называют
трансгенными.
Основа этой новой методологии была заложена еще в экспериментах по
генетической трансформации клеточных культур (см. статью Гривенникова
и др., наст, сборник). Если в начальных экспериментах по переносу генов ис-
пользовали простую инкубацию клеток в среде с экзогенной ДНК, то с поя-
влением селективных сред, позволяющих выявлять и размножать трансфор-
мированные клетки in vitro, стали усложняться и методы переноса ДНК в со-
матические клетки животных (в виде рекомбинат ных вирусов, клониро-
ванных генов в составе кольцевых и линейных векторов, упакованных в ли-
посомы, и др.). Эффективность трансформации клеток повышали разными
способами: переносом ДНК в клетки, обработанными вирусом Сендай, по-
лиэтиленгликолем, диметилсульфоксидом, инкубацией ДНК в поликатионе
диэтиламиноэтилдекстрана, с помощью соосаждения кальций-фосфатным
комплексом, электропорацией, путем обстрела клеток частицами вольфра-
ма, золота, титана с сорбированными на них молекулами ДНК, заключени-
ем донорской ДНК, метафазных хромосом или интерфазных ядер в липосо-
мы, введением ДНК в реконструированные оболочки вирусов и, наконец,
микроиньекциями раствора ДНК с помощью прокола клеток и их ядер мик-
роиглой (Серов, 1985; Houdebine, 1997).
Основой для манипуляций с оплодотворенными и неоплодотворенными
яйцеклетками млекопитающих послужило развитие техники получения до-
имлантационных зародышей, культивирования их в синтетических средах in
vitro, последующего переноса приемной матери и рождения организма.
В это же время появились методические приемы разделения зародыша на
части или, напротив, слияния нескольких зародышей для получения так на-
зываемых химер (Мак-Ларен, 1979). В экспериментах Лина с помощью ми-
крохирургической техники было показано, что инъекция растворов опреде-
ленных объемов в цитоплазму или отсасывание части цитоплазмы из опло-
дотворенной яйцеклетки (зиготы) мыши не сказывается на нормальном раз-
витии зародышей и не препятствует рождению здорового потомства (Lin.
1967). В середине 70-х годов были опубликованы первые работы по инъек-
ции ДНК вирусов в полость бластоцисты мышей (Jaenisch, 1974, 1976), в ко-
торых была доказана способность чужеродной вирусной ДНК интегриро-
вать с геномом хозяина и затем передаваться по наследству. И, наконец,
185
в 1980 г. с помощью микроинъекций “голой” ДНК в мужской пронуклеус зи-
готы мыши были получены первые животные, содержавшие в своем гено-
ме искусственно введенную экзогенную ДНК (Gordon et al., 1980; Gordon,
Ruddle, 1981). Такие животные в дальнейшем и были названы трансгенны-
ми, а сам процесс их получения - трансгенозом. Первоначальный вариант
трансгеноза, использованный Гордоном, сейчас называют классическим
(рис. 59).
В 1979 г. в Институте молекулярной генетики АН СССР и на кафедре
эмбриологии МГУ были начаты совместные эксперименты по переносу чу-
жеродной генетической информации в геном млекопитающих путем прямой
микроинъекции ДНК в пронуклеусы зигот мыши. Первые результаты по
интеграции чужеродной ДНК (ДНК аденовируса SA7 обезьян) с геномом
мыши были получены нами в 1981 г. независимо от появившихся в это вре-
мя зарубежных работ (см. обзор: Газарян, 1985). Уже к концу 1982 г. в Ин-
ституте молекулярной генетики было получено пять поколений трансген-
ных мышей, в геноме которых содержались полные копии или фрагменты
ДНК высокоонкогенного обезьяньего аденовируса SA7 (Эшкинд и др., 1982;
Газарян и др., 1983).
Техника и процедура трансгеноза, использованные в наших работах,
изображены на рис. 60 и 61.
Первоначально для трансгеноза использовали главным образом ДНК раз-
личных вирусов и отдельные вирусные гены, так как клонирование эукарио-
тических генов в то время только начиналось. Было показано, что в целом эк-
зогенная ДНК при ее микроинъецировании в зиготы мышей способна ин-
тегрировать с геномом хозяина, экспрессироваться в клетках и стабильно
передаваться потомству. Наряду с этим уже в первых работах наблюдались
случаи изменения структуры как самих трансгенов, так и фланкирующих их
последовательностей ДНК хозяина (образование конкатенатов, перестройки,
делеции и др.) (Серов, 1985; Tarantul et al., 1986; Palmiter, 1998).
На начальном этапе работ по трансгенозу многие авторы в качестве эк-
зогенной ДНК использовали ген тимидинкиназы (th) вируса простого герпе-
са (HSV). При этом высокие уровни экспрессии гена rCHSV наблюдали
в различных органах и тканях трансгенных мышей в случае, когда ген на-
ходился под контролем сильного промотора металлотионеинового гена 1
(МТ-1) мыши (Brinster et aL, 1981). В работах отечественных авторов актив-
ность вирусной тимидинкиназы была выявлена и в тех случаях, когда ген
rt-HSV не имел чужого промотора (Дыбан, Городецкий, 1983). В серии на-
ших работ по введению гена rCHSV в зиготы мышей было показано, что
присутствие в плазмиде длинных концевых повторов (LTR) ретровирусов -
LTR провируса саркомы Рауса (RSV) или LTR эндогенного ксенотропного
провируса лейкоза мышей (MuLV) - способствовало переносу и экспрессии
чужеродной ДНК (Газарян и др., 1984).
С развитием техники молекулярного клонирования генов число публи-
каций по получению и исследованию трансгенных мышей стремительно
росло, постепенно расширялся спектр проблем и задач, решаемых с помо-
щью трансгеноза. Одной из самых впечатляющих работ на ранних этапах
развития трансгеноза были эксперименты Пальмитера с соавт. (Palmiter et
aL, 1982) по микроинъекции в зиготы мышей гена гормона роста (ГГР) кры-
сы, находяхцегося под контролем промотора гена МТ-1 мыши. Перенос та-
186
Сбор оплодотворенных
яйцеклеток
Инъекция ДНК в один из
Имплантация инъецированной
в приемную мать
Псевдобеременная самка
Потомство (около 10% содержит трансген)
Тестирование наличия
трансгена
Скрещивание трансгенных мышей
и получение гомози! отных трансгенных животных
Рис. 59. Классическая схема трансгеноза
Рис. 62. Трансгенная мышь с геном гормона роста быка (слева) н контрольная мышь (справа)
кого искусственного конструкта привел к ускоренному росту мышей в онто-
генезе и значительному увеличению веса трансформированных животных,
развившихся из прооперированных зигот. Аналогичные результаты были
получены и в нашей работе, когда в качестве чужеродной ДНК использова-
ли клонированный нами ГГР быка, находящийся под контролем LTR вируса
опухоли молочной железы мыши (MMTV) (Генинг и др., 1987). Вес транс-
генных самцов был примерно на 50% больше, чем у контрольных мышей,
и эти фенотипические особенности передавались потомству (Газарян и др.,
1988) (рис. 62).
Вскоре анализу стадио- и тканеспецифической экспрессии были под-
вергнуты сотни структурных генов, генов различных вирусов, онкогенов,
антионкогенов и др. (Palmiter, Brinster, 1986; Тарантул, Мудрик, 1991).
К середине 80-х годов были начаты эксперименты по созданию транс-
генных сельскохозяйственных (с/х) животных. К этому времени были подо-
браны оптимальные условия для визуализации пронуклеусов зигот с/х жи-
вотных, поскольку большинство зигот имеет значительное количество пиг-
ментных и жировых гранул, затрудняющих процесс микроинъекции (Wall et
al., 1985) (рис. 63) (Андреева и др., 1990).
В первой из опубликованных работ по получению трансгенных кроли-
ков, свиней и овец авторы использовали в качестве трансгена ГГР человека,
однако столь драматического ускорения темпов роста животных, как это
было получено на мышах, не наблюдалось (Hammer et al., 1985). Вместе с
тем у трансгенных свиней были замечены увеличение эффективности по-
требления пищи и заметное снижение жира. Следует подчеркнуть также,
что у трансгенных свиней с повышенным содержанием в крови гормона ро-
ста человека отмечались отклонения в состоянии здоровья.
188
В это же время совместно с коллегами из Восточной Германии (Дум-
мерсдорф, Росток) нами были проведены эксперименты по микроинъекции
ГГР быка под контролем промотора MMTV в зиготы крупного рогатого
скота с использованием промежуточных реципиентов. Эти эксперименты
явились одной из первых попыток работы по изменению генотипа крупных
с/х животных. В результате у одного из родившихся животных было доказа-
но наличие чужеродной ДНК. Однако трансген был перестроен и содержал
в своем составе только LTR MMTV и последовательности плазмидного век-
тора (Roschlau et al., 1989а, b).
Попытки переноса ГГР быка, овец, человека, гена рилизинг-фактора
гормона роста человека (выход гормона роста в кровь находился под конт-
ролем эндогенных регуляторов) в дальнейшем были продолжены на зиготах
овец (Ward et al., 1990), свиней (Андреева и др., 1990), кроликов (Газарян и
др., 1988) и рыбах (Chen, Power, 1990) как в нашей стране, так и за рубежом.
Трансгеноз открыл новые пути направленного изменения продуктивно-
сти разных видов с/х животных (повышение темпов роста, изменение коли-
чества и качества молока, шерсти, увеличение плодовитости), получения
животных-биореакторов ценных биологически активных препаратов (таких
как фактор свертываемости крови, сс-антитрипсин, гемоглобин и антитела в
молоке, крови или моче), создание новых форм и пород животных, приспо-
собленных к биомедицинским исследованиям, которые могут быть источни-
ками органов для ксенотрансплантации, пород, устойчивых к различным за-
болеваниям (Wall et al., 1997; Chan, 1999; Muller, Brem, 1998; Cozzi et al., 2000).
В частности, с успехом для направленной экспрессии фармакологических
белков используются гены, кодирующие основные белки молока - казеины.
В России, например, были получены трансгенные мыши, экспрессирующие
в молоко ценный медицинский препарат - у-интерферон человека (600 мкг
у-интерферона на 1 мл молока) (Lagutin et al., 1999).
В одном из наших экспериментов гены хлорамфениколацетилтрансфе-
разы Е. coli и гормона роста быка были подставлены под контроль 5'-обла-
сти гена х-казеина. Однако анализ экспрессии трансгена у полученных нами
трансгенных мышей показал, что выбранная последовательность 5'-облас-
ти гена х-казеина не обеспечивала активной экспрессии в эпителиальных
клетках молочной железы (Попов и др., 1995).
Одним из генов, имеющих фармакологическую ценность, является ген,
кодирующий гранулоцит-колоний-стимулирующий фактор (Г-КСФ) чело-
века. В настоящее время с нашим участием ведутся исследования по анали-
зу экспрессии гена Г-КСФ, находящегося под контролем промотора и
3'-фланкирующей области гена сс^-казеина быка (Дворянчиков и др., 2000)
в молоке полученных нами трансгенных мышей (работа проводится совме-
стно с исследователями государственного университета г. Рио-де-Жанейро,
Бразилия). Методом иммуноферментного анализа у трансгенных самок в
лактирующей молочной железе обнаружен рекомбинантный белок на уров-
не 0,1-0,3 мкг в мл. Были проведены тесты на биологическую активность
белка в молоке трансгенных мышей с помощью Г-КСФ -зависимой миелоид-
ной линии клеток мышей, первичной культуры костного мозга мышей и че-
ловека в агаре. Оба теста выявили стимулирующую активность молока в
разведении, соответствующей концентрации 1-2 пкг/мл рекомбинантного
белка (Dvoryanchikov et al., 2003). Предполагается, что данная генетическая
189
конструкция и ее модификации могут быть использованы для получения
трансгенных коз, в молоке которых будет экспрессироваться лекарствен-
ный белок.
Вместе с тем с самого начала работ по трансгенозу были выявлены не-
которые сложности, связанные с этой технологией. В первую очередь проце-
дура получения трансгенных животных пока еще остается малоэффектив-
ной. Трансгенные животные часто менее жизнеспособны, чем природные
особи. Имеются проблемы и со стабильностью экспрессии трансгена. Все
это, а также ряд других причин, включая настороженное отношение обще-
ственности к данной проблеме, и обусловили ту ситуацию, что до сих пор
трансгенные животные (в отличие от трансгенных растений) находят пока
лишь ограниченное применение в практике.
НОВЫЕ МЕТОДЫ ПЕРЕНОСА ГЕНОВ
Кроме традиционного (классического) способа введения чужеродной
ДНК с помощью микроинъекций в пронуклеус зиготы (о чем шла речь вы-
ше), в последние 10 лет получили развитие новые системы и способы пере-
носа генов в геном животных (рис. 64). Их развитие связано в основном с це-
лью возможного повышения эффективности трансгеноза, что особенно
важно для дорогостоящих экспериментов в области биотехнологии с/х жи-
вотных. Показано, например, что эффективность получения с помощью ми-
кроинъекций трансгенных коров, по меньшей мере, в 40 раз ниже, чем у мы-
шей (Wall et al., 1997).
Одним из таких альтернативных подходов является использование спер-
матозоидов в качестве векторов для привнесения чужеродной ДНК в яйце-
клетку при ее искусственном оплодотворении (Lavitrano et al., 1989; Maione et
al., 1998). Известно, что сперматозоиды ряда видов животных в отсутствие
семенной жидкости при определенных условиях способны захватывать чу-
жеродную ДНК. Легкость и простота использования этого метода привели
к многочисленным попыткам трансформировать таким образом геном мы-
шей, свиней, крупного рогатого скота, овец, рыб, морского ежа, насекомых,
птиц, шпорцевой лягушки, моллюсков (Кузнецов и др., 1999; Chan, 1999).
Однако среди различных видов животных наблюдаются значительные вари-
ации в эффективности вхождения экзогенной ДНК в ядро сперматозоида,
что приводит пока к нестабильным результатам. Успешная трансформация
сперматозоидов зависит, по-видимому, от эффективности связывания ДНК
с поверхностью сперматозоида и ее последующей интернализацией в ядро
спермия. Интеграция ДНК в ядро может происходить значительно позже
процесса оплодотворения, что приводит к высокой степени мозаицизма и
невозможности передачи трансгена следующему поколению. Тем не менее
есть несколько сообщений об успешной передаче чужеродной ДНК потом-
ству после оплодотворения яйцеклеток сперматозоидами, обработанными
ДНК (мыши, свиньи, рыбы, коровы) (Chan, 1999). В частности, нами впер-
вые успешно продемонстрирована экспрессия гена Р-галактозидазы (lacZ)
Е. coli под промотором цитомегаловируса человека (CMV) в 3- и 5-суточных
предличинках вьюна, развившихся из икринок, оплодотворенных спермато-
зоидами, которые предварительно инкубировались в растворе плазмидной
190
Техника переноса
Носители ДНК
Рис. 64. Схема основных методов переноса чужеродной ДНК в геном животных
ДНК, содержащей этот ген (Андреева и др., 2003) (рис. 65). Не исключено,
что совершенствование методов введения ДНК в геном животных через
сперматозоиды, понимание механизмов связывания, интернализации и инте-
грации ДНК с ядром сперматозоидов увеличат шансы успешного примене-
ния этого метода для получения трансгенных животных. Необходимо отме-
тить, однако, что существует опасность непреднамеренного введения экзо-
генного генетического материала, который может случайно находиться в
окружающей среде, при использовании метода внутрицитоплазматической
инъекции сперматозоидов (ICSI) в клиниках по искусственному оплодотво-
рению человека (Chan et al., 2000). Показано также, что отмывка спермато-
зоидов человека после инкубации в растворе с ДНК вируса папилломы че-
ловека не приводила к полному удалению экзогенной ДНК из клеток. Часть
ДНК прочно связывалось со сперматозоидами и интернализовалась вместе
с ними (Brossfield et al., 1999).
Еще одним подходом, дающим надежду на увеличение эффективности
переноса генов, является использование в качестве векторов ретровирусов.
Основное преимущество этих векторов заключается в том, что они способ-
ны эффективно инфицировать большое число различных клеточных типов.
Общий вид вирусного вектора, используемого для трансгеноза, изображен
на рис. 66. Ретровирусные векторы обеспечивают интеграцию единичной
копии трансгена в эмбрионы на разных стадиях развития. Первые экспери-
менты, продемонстрировавшие внедрение и наследование у мышей экзоген-
но введенного мышиного вируса лейкемии Молони (MoMLTV), были прове-
дены еще в середине 70-х годов прошлого века Енишем с сотрудниками
191
(Jaenisch et al., 1974; Jaenisch, 1976). Эти исследователи показали, что прямая
инфекция до- и постимплантационных эмбрионов мыши, кокультивирова-
ние их с клетками-продуцентами вируса или инъекция их в полость бласто-
цисты приводит к интеграции вектора и его наследованию. Однако из-за
биологической опасности работы с ретровирусами техника введения ДНК
путем прямой микроинъекции в пронуклеусы оставалась преимуществен-
ной. Развитие методов, обеспечивающих репликацию дефектных ретрови-
русных векторов, дало новый толчок к использованию этих векторов для со-
здания трансгенных животных. И если первоначально внимание исследова-
телей концентрировалось на таких традиционных объектах, как мыши и
птицы (Sanes et al., 1986; Mitrani et al., 1987), то, начиная c 1993 года, стали по-
являться работы, выполненные и на других видах животных. Так, была про-
демонстрирована успешная инфекция освобожденных от блестящей обо-
лочки предимплантационных эмбрионов коров репликативным дефектным
ретровирусным вектором на основе MoMLTV, у которого собственная обо-
лочка была замещена на оболочку вируса лейкемии гиббона (Kim et al.,
1993). Позже клетки, продуцирующие этот вектор, были помещены под
блестящую оболочку эмбрионов коров в перивителлиновое пространство
для их постоянного инфицирования, однако, это привело к множественным
инсерциям трансгена и леталям (Haskell, Bowen, 1995).
Известно, что успешная интеграция вирусного генома с хозяйским гено-
мом происходит только в митотически активных клетках (исключение со-
ставляют лентивирусы). Предположительно разрыв ядерной оболочки яв-
ляется критическим моментом для транслокации преинтеграционного ком-
плекса ретровируса в ядро клетки (Roe et al., 1993). Основываясь на этих
публикациях, Чан с соавт. (Chan et al., 1998) предложили новый метод введе-
ния ретровирусного вектора в геном крупного рогатого скота, который за-
ключался в следующем. Ооциты, находящиеся на стадии метафазы II второ-
го деления мейоза и не имеющие ядерной оболочки на этой стадии вплоть
до образования пронуклеусов после оплодотворения, инфицировали ретро-
вирусным вектором, сконструированным на основе MoMLTV, упакованного
в оболочку, в состав которой входил гликопротеин псевдотипа вируса вези-
кулярного стоматита G. В результате оплодотворения инфицированных
ооцитов и их культивирования in vitro часть из них развилось до стадии бла-
стоцисты. После переноса бластоцист реципиентам 4 эмбриона развились
до рождения. И хотя количество животных, полученных таким путем, было
ограниченным, все они (100%) оказались трансгенными и экспрессировали
трансген.
Уже появилось сообщение о рождении первой трансгенной обезьяны,
полученной аналогичным путем. Высокий титр вышеупомянутого вектора,
содержащий в своем составе ген, кодирующий зеленый флуоресцентный бе-
лок (GFP) под промотором гена ос-1-фактора элонгации человека, был инъ-
ецирован под блестящую оболочку ооцитов обезьян (Масаса mulatto). Опло-
дотворение проводили методом ICSI. Эмбрионы на стадии дробления пере-
саживали суррогатным самкам. 3 эмбриона развивались до рождения, один
из новорожденных оказался трансгенным и экспрессировал трансген в клет-
ках ногтей и волос (Chan et al., 2001).
Недавно предложен простой и эффективный метод получения трансген-
ных мышей, крыс и других животных путем инфицирования оплодотворен-
192
ных яйцеклеток с помощью рекомбинантного лентивирусного вектора.
10-100 пкл раствора данного вектора, содержащего ген GFP, вводили непо-
средственно под блестящую оболочку зигот мышей. 80% полученных таким
образом потомков оказались трансгенными, почти у всех потомков была
обнаружена экспрессия трансгена (Lois et al., 2002).
В результате прогресса в развитии трансгеноза появились возможности
для крупномасштабных изменений генома, включая манипуляции с фраг-
ментами или целыми хромосомами (Smith et al., 1995; Ramirez-Solis et al.,
1995). Последняя технология получила название хромосомная инженерия.
Ей способствовала разработка подходов к созданию искусственных хромо-
сом млекопитающих, обязательными элементами которых являются цент-
ромера, теломеры и ori репликации. Искусственные хромосомы предостав-
ляют уникальную возможность для изучения взаимосвязи между хромосом-
ными структурами и их функциями. Использование хромосомного трансге-
ноза позволяет осуществлять перенос очень больших генов и целых класте-
ров генов со всеми окружающими их природными генетическими элемента-
ми (Brown et al., 2000). При этом также полностью исключается негативное
влияние эффекта положения на трансген. Использование нового подхода на
базе эмбриональных стволовых клеток (ЭСК) (подробнее об этих клетках
см. далее), получившего название опосредованного микроклетками транс-
порта хромосом, позволило получать химерных мышей с целыми хромосо-
мами человека или их фрагментами (трансхромосомные мыши). В частно-
сти, были получены мыши, содержащие фрагменты хромосом человека с
локусами легких и тяжелых цепей иммуноглобулинов, которые оказались
способными синтезировать специфические человеческие антитела (Tomi-
zuka et al., 2000).
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ТРАНСГЕНОЗА
ФОРМЫ ИНТЕГРАЦИИ ТРАНСГЕНА С ГЕНОМОМ
Первоначально казалось маловероятным, что при инъекции в зиготы
может сохраняться ее целостность и осуществляться перенос генов. Однако
в дальнейшем выяснилось, что это вполне возможно и процедура теперь вы-
глядит вполне рутинно. Хотя обычно лишь небольшую часть проопериро-
ванных зигот удается превращать в трансгенные организмы, оказалось воз-
можным генетически модифицировать практически все использованные в
эксперименте виды животных. При микроинъекции в пронуклеусы экзоген-
ной ДНК встройка трансгена происходит, как правило, в единичный участок
генома в виде тандемов (до 50 и более копий, расположенных чаще всего
в ориентации голова-хвост) (Brinster et al., 1985). Единичные фрагменты ге-
нов удается встраивать в геном при использовании в качестве вектора рет-
ровирусов. Изредка происходит встраивание единичных копий и при приме-
нении других подходов. В частности, в наших экспериментах на трансгенных
мышах и кроликах в ряде случаев наблюдали встройки в геном единичных
генов (Tarantul et al., 1986; Газарян и др., 1989). Однако детальные механиз-
мы внедрения экзогенной ДНК в геном клеток хозяина по-прежнему оста-
ются неизвестными.
7. Проблемы и перспективы...
193
Наряду с интеграцией трансгена с геномом в некоторых довольно ред-
ких случаях трансген оказывается способным к экстрахромосомной репли-
кации. В частности, мы наблюдали подобное при работе с трансгенным ту-
товым шелкопрядом (см. статью Николаева, наст, сборник).
МЕСТА ИНТЕГРАЦИИ
Существует общее мнение, что при трансгенозе чужеродная ДНК мо-
жет встраиваться в произвольные участки генома. Между тем постепенно
накапливаются данные, свидетельствующие о том, что существуют неко-
торые “предпочтительные” зоны, с которыми интегрирует экзогенная
ДНК. Таковыми, по-видимому, являются транскрибирующиеся участки ге-
нома, “горячие” точки рекомбинации, области начала репликации и др.
Нами, а также рядом других авторов, было установлено, что места инте-
грации чужеродной ДНК с геномом мыши часто содержат повторяющие-
ся последовательности. В специальной серии экспериментов нами были
охарактеризованы последовательности генома, прилежащие к трансгенам,
у семи различных линий трансгенных мышей и одной линии трансгенного
кролика (Тарантул и др., 1989). Непосредственно рядом с трансгенами у
этих животных во всех 8 случаях были обнаружены умеренные и (или) ча-
стые (обращенные) повторяющиеся последовательности генома мыши.
Оценка вероятности такого события, сделанная на основании данных о
структуре генома мыши, указывает на склонность интеграции трансгенов
с повторяющимися элементами ДНК. При этом высокомолекулярные
фрагменты ДНК, содержащие трансген, у разных трансгенных животных
отличались по GC-содержанию. В литературе также имеются многочис-
ленные данные, указывающие на соседствование трансгенов и повторов.
Несмотря на то, что в геноме мышей содержится довольно много повторя-
ющихся элементов, имеющиеся данные (как наши, так и данные литерату-
ры) позволяют сделать предположение об участии (прямом или косвен-
ном) повторяющихся элементов генома в интеграции с чужеродной ДНК.
Возможно, это связано с повышенной склонностью этих участков генома
к рекомбинациям. В частности, детальный анализ структуры участка гено-
ма трансгенной мыши, в который произошло внедрение трансгена, пока-
зал, что в одной из фланкирующих трансген последовательностей на рас-
стоянии 60 п.н. от точки интеграции присутствуют перекрывающиеся ме-
жду собой короткие прямые и обращенные повторы. В этой же фланкиру-
ющей последовательности на расстоянии 0,3-1 т.п.н. от трансгена имелась
протяженная (-3,5 т.п.н.) последовательность, повторяющаяся в геноме
мыши 100-300 раз и характеризующаяся высокой консервативностью (го-
мологи этого повтора выявлены в геномах других видов млекопитающих,
птиц, рыб и насекомых) (Тарантул и др., 19866; Tarantul et al., 1986). Это не-
известное ранее семейство диспергированных повторов было названо на-
ми Т1. Предполагается, что обнаруженные короткие обращенные повто-
ры, способные формировать шпильки с петлями, и повтор Т1 являются
структурами, участвовавшими в процессе негомологичной встройки чуже-
родной ДНК в данный участок генома трансгенной мыши (Макарова и др.,
1988).
194
ПЕРЕСТРОЙКИ ГЕНОМА
И ТРАНСГЕНОВ ПРИ ТРАНСГЕНОЗЕ
Уже в первых работах по переносу генов и получению трансгенных жи-
вотных было замечено, что экзогенная ДНК, перенесенная с помощью ми-
кроинъекции в пронуклеус зиготы, при интеграции с геномом клеток-хозя-
ев может претерпевать значительные изменения по сравнению с исходной
молекулой, структура трансгена может быть существенно изменена за счет
различного рода мутаций: инверсий, делеций, точечных мутаций. Такие яв-
ления наблюдали Гордон с соавт. уже в самой первой работе по трансгенозу
(Gordon et al., 1980).
В наших экспериментах по получению трансгенных мышей с вирусными
геномами (RSV, аденовирус) также наблюдались различного рода аномалии,
происходящие с трансгенами (Газарян и др., 1985; Tarantul et al., 1986). Мно-
гочисленные эксперименты, в которых мы вводили интактный RSV в зиго-
ты мышей, не привели к созданию трансгенных животных. Интеграцию
провирусных последовательностей с геномом мыши, сопровождающуюся
перестройками внедренных последовательностей, наблюдали лишь при вве-
дении в зиготы мышей плазмиды, содержащей часть кольцевой формы
ДНК RSV (около 2/3 длины), которая включала в себя два LTR, гены src и
gag и части генов pol и env. При этом интеграция плазмиды не происходила
по LTR, что согласовывалась с некоторыми данными литературы. Для это-
го, видимо, необходимо присутствие дополнительных факторов, таких, на-
пример, как вирусные ферменты. Интересно, что последовательность про-
вирусной ДНК RSV, претерпевшая перестройки при интеграции с геномом
мыши, транскрибировалась (Газарян и др., 1985).
При работе с трансгенными мышами, содержащими ДНК аденовируса
SA7, нами был выявлен неожиданный феномен. Анализ различных органов
двух разных линий мышей Fo-F3 поколений показал, что трансген специфи-
чески элиминировался из сердца и скелетной мускулатуры (Gazaryan et al.,
1984; Тарантул и др., 1986а). Интересно, что в повторной, независимой серии
экспериментов по инъекции ДНК аденовируса SA7 в зиготы мышей факт
отсутствия трансгена в сердце и мышцах первых двух поколений мышей
полностью подтвердился. Это свидетельствовало о том, что скорее всего
наблюдаемые изменения были обусловлены не столько положением транс-
гена в геноме, сколько самой его природой. Было показано также преиму-
щественное встраивание в хозяйский геном последовательностей левого
конца генома аденовируса, где расположен онкоген (Кузнецова и др., 1989).
Специфические однотипные перестройки в структуре трансгена наблю-
дали у трансгенных мышей с геном, кодирующим белок оболочки вируса ге-
патита В под контролем раннего промотора вируса SV40. Вместе с тем в пе-
чени одной из трансгенных мышей были выявлены транскрипты гена, что
указывало на то, что по крайней мере в некоторых трансгенных мышах
ранний промотор вируса SV40 функционировал в высокодифференцирован-
ных клетках (гепатоцитах) (Андреева и др., 1987).
Удобным для изучения структуры трансгена и фланкирующих последо-
вательностей стал метод “спасения плазмиды”. С помощью этого метода на-
ми была клонирована встроенная в геном одной из линий трансгенных мы-
шей рекомбинантная плазмида с геном А-FISV под контролем LTR провиру-
7*
195
ca RSV. Оказалось, что в “спасенной” плазмиде отсутствовали все вирусные
последовательности и сохранились только участки плазмиды pBR322, ответ-
ственные за репликацию плазмиды и устойчивость клеток Е. coli к ампицил-
лину (Тарантул и др., 19866; Tarantul et al., 1986).
ВЛИЯНИЕ МИКРОМАНИПУЛЯЦИЙ
С РАННИМИ ЗАРОДЫШАМИ НА ИХ РАЗВИТИЕ
Многие репродуктивные биотехнологии, применяемые в животноводст-
ве и медицине, используют различные манипуляции с половыми клетками и
эмбрионами ранних стадий развития. Достаточно перечислить такие из них,
как трансплантация зародышей приемным реципиентам, искусственное по-
лучение близнецов путем рассечения зиготы, клонирование, получение хи-
мер, трансгеноз, замораживание и длительное хранение спермы или яйце-
клеток и экстракорпоральное оплодотворение у человека. Отдаленные по-
следствия таких манипуляций недостаточно изучены.
Имеются многочисленные сведения, указывающие на высокую смерт-
ность эмбрионов в экспериментах с трансгенозом, появление разнообраз-
ных фенотипических эффектов не только у трансгенных животных, но и у
нетрансгенных однопометных сибсов и т.д. В связи с этим нами были изу-
чены онкологические последствия внедрения в геном чужеродных генов и
неспецифического повреждающего действия манипуляций при получении
трансгенных мышей (Серова и др., 1991). В качестве трансгена использова-
ли фрагменты ДНК аденовируса SA7 обезьян. Анализ более трех сотен мы-
шей, родившихся из гибридных зигот (Balb/c х DD)F,, микроинъецирован-
ных чужеродной ДНК или контрольным буфером независимо от того, яв-
лялись они трансгенными или нет, показал, что статистически достовер-
но повышалась частота возникновения опухолей; при этом нозологическая
характеристика опухолей подопытных мышей была значительно разнооб-
разнее, чем в контроле. Так, помимо существенного возрастания частоты
опухолей, характерных для этих гибридов (аденокарцинома молочной же-
лезы и легкого), выявлены опухоли печени, желудочно-кишечного тракта,
системы гематопоэза, кожи, органов мочеполовой системы и мягких
тканей.
В последующей серии экспериментов, направленных на изучение неспе-
цифического повреждающего действия микроманипуляционной техники на
потомство, зиготы линейных и гибридных мышей (C57BL и (BALB/c х DD)F1)
подвергали следующим манипуляциям: 1) инкубации в культуральной среде,
2) проколу стеклянной микроиглой мужского пронуклеуса, 3) инъекции бу-
ферного раствора и 4) инъекции ДНК (гена р53 мыши с промотором гена
инсулина человека) в мужской пронуклеус. Обнаружено, что все эти мани-
пуляции вызывали внутриутробную гибель эмбрионов, появление значи-
тельного количество мертворожденных и нежизнеспособных потомков с
многочисленными аномалиями развития. Статистический анализ показал,
что наиболее травматичным этапом микроманипуляционной техники являл-
ся прокол пронуклеуса зигот, поскольку последствия этого повреждения
были выше, чем при инкубации зигот, и сопоставимы с результатами микро-
инъекции буфера и ДНК (Андреева, Серова, 1992; Серова и др., 1998).
196
Полученные нами результаты согласуются с некоторыми данными зару-
бежных исследователей, работающих в области экстракорпорального опло-
дотворения человека с помощью метода ICSI (Ludwig, Ditrich, 2000). Осто-
рожно следует относиться и к таким манипуляциям с человеческими эмбри-
онами, как пересадка ядер в целях клонирования клеточных культур в тера-
певтических целях, так как исследования в этой области только начинают-
ся, а их последствия могут оказаться непредсказуемыми.
ИЗУЧЕНИЕ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ
И ИХ ФУНКЦИИ
Трансгенные животные получили широкое распространение в экспери-
ментах по изучению молекулярных механизмов регуляции экспрессии раз-
личных генов и определению их биологической функции.
В продолжение цикла работ по биологическому эффекту ГГР и гена ри-
лизинг-фактора гормона роста, проведенным на мышах (см. выше), нами
были получены трансгенные кролики с геном рилизинг-фактора гормона
роста человека под МТ-промотором. При интенсивной экспрессии этого
трансгена в печени достоверно происходило увеличение веса тела у живот-
ных на 10% (Газарян и др., 1989). Исследование уровней ряда гормонов по-
казало, что в крови трансгенного кролика были в несколько раз повышены
уровни инсулина, тироксина, трийодтиронина. Отмечен низкий уровень со-
матостатина и снижены в 2-4 раза уровни лютеинизирующего гормона, про-
гестерона и тестостерона (Коваль и др., 1991).
С этой же генетической конструкцией нами были получены также не-
сколько линий трансгенных свиней. Однако явных признаков ускоренных
темпов роста животных замечено не было, за исключением случая увеличе-
ния в 1,5 раза размеров почек и печени у двух трансгенных мертворожденных
потомков, где была доказана экспрессия трансгена (Андреева и др., 1990).
Гормон эритропоэтин (ЭПО) является важным фактором дифференци-
ровки эритроидных клеток. Трансгенные животные могут быть удобной мо-
делью для исследования биологического эффекта ЭПО в организме, меха-
низма действия этого гормона и регуляции экспрессии соответствующего
гена. Нами были получены трансгенные мыши, содержащие ген ЭПО чело-
века под контролем LTR RSV (Мудрик и др., 1991). Как показали проведен-
ные исследования, длительное действие трансгена не оказывало эффекта на
гематокрит и содержание гемоглобина в эритроцитах и ретикулоцитах пе-
риферической крови (рис. 67). Вместе с тем при исследовании костного моз-
га трансгенных мышей были выявлены значительные изменения в составе
эритрона. В среднем количество клеток эритроидного ряда увеличивалось
более чем в 3 раза по сравнению с таковыми у контрольных животных, при-
чем наибольшее статистически достоверное увеличение происходило в ко-
личестве нормобластов и ретикулоцитов, т.е. неделящихся клеток. Полу-
ченные данные позволили сделать вывод о том, что костный мозг является
достаточно закрытой системой. Существенное увеличение концентрации
ЭПО, происходившее за счет экспрессии трансгена, которое приводило к
сильному изменению важных параметров этой системы, не отражалось на
состоянии периферической крови трансгенных животных.
197
Большинство трансгенных животных, созданных к настоящему времени,
получено путем прямой микроинъекции генов в пронуклеусы зигот, но эф-
фективность переноса генов остается довольно низкой (менее 1 %). Поэтому
одной из основных задач в области трансгенной технологии животных явля-
ется создание такой системы направленного изменения генома, которая бы
значительно снизила затраты на их получение. В последние 10 лет в этой об-
ласти наметился заметный прогресс. Появилось целое поколение генов-ре-
портеров, с помощью которых, с одной стороны, можно заранее отобрать
трансгенных эмбрионов перед тем как переносить их суррогатной матери
для их дальнейшего развития, а с другой стороны, наблюдать локализацию
экспрессии генов на разных этапах онтогенеза, в различных тканях и орга-
нах, минуя стадию определения наличия трансгена.
К таким репортерным генам относятся гены lacZ Е. coli, секреторной
щелочной плацентарной фосфатазы (SEAP), люциферазы светлячка, зеле-
ного флуоресцентного протеина и др. Дополнительно к этим методам для
отбора трансгенных эмбрионов ранних стадий развития используют поли-
меразную цепную реакцию и флуоресцентную гибридизацию in situ (FISH)
(Chan, 1999). Так, в наших работах ген lacZЕ. coli под контролем или LTR ви-
руса саркомы Рауса (RSV-lacZ) или промотора CMV (CMV-/acZ) был исполь-
зован для исследования динамики экспрессии трансгенов в ходе эмбриональ-
ного развития вьюнов и мышей. Было показано, что экспрессия трансгена с
RSV-промотором, которую наблюдали у 3-5-суточных личинок вьюна, не
зависела от стадии развития икринки, на которой вводился экзоген (ранний
бластодиск, поздний бластодиск, 2-бластомерный зародыш) и области вве-
дения генетического материала (цитоплазма бластодиска или желток яйце-
клетки). Вместе с тем при инъекции гена в желток наблюдали меньшее ко-
личество точек экспрессии, а их распределение в 75% случаев ограничива-
лось поверхностью желточного мешка. Наличие экзогенной ДНК в одной
из серий опытов доказано у 100% 5-6-недельных личинок, инъецированных
в цитоплазму бластодиска, и 67% личинок, инъецированных в желток (Анд-
реева и др., 1993; Андреева, Дворянчиков, 1995). Сравнение уровней экс-
прессии RSV-lacZ и CMV-lacZ генов в трансгенных эмбрионах и личинках
вьюна показало, что впервые она выявляется на поверхности бластодермы
10-11-часовых зародышей, инъецированных геном CMV-lacZ, и 13-14-часо-
вых зародышей, инъецированных геном RSV-toZ. Максимальные уровни
экспрессии RSV-ZacZ гена наблюдали у 1-5-суточных эмбрионов, а гена
CMV-lacZ - с первых суток эмбрионального развития (рис. 68) и до 2-месяч-
ного возраста (рис. 69). На любой из исследованных стадий эффективность
экспрессии трансгена была значительно большей у особей, инъецирован-
ных CMV-/<7cZ-геном по сравнению с геном RSN-lacZ. Она не зависела от то-
го, вводился ли трансген на стадии зиготы или 2-клеточного зародыша, не-
сколько снижалась у особей, инъецированных на стадии 8 клеток и морул, и
только единичные особи, инъецированные на стадии бластулы, экспресси-
ровали трансген. По мере развития эмбрионов с геном CMV-/acZ спектр экс-
прессирующих тканей сужался, и у 6-8-недельных личинок экспрессию на-
блюдали только в мышцах плавников и туловищной мускулатуре. В отдель-
ных сериях экспериментов экспрессию и наличие трансгена наблюдали у
100% особей, что было подтверждено PCR-анализом и блот-гибридизацией
по Саузерну (Андреева и др., 1996).
198
Экспрессия гена RSV-lacZ обнаружена у 13-дневного плода мыши в тка-
нях экто- и мезодермального происхождения, а экспрессия гена CMV-lacZ -
у 14-дневного плода в тканях всех трех зародышевых листков (Андреева
и др., 1996) (рис. 70).
С целью выявления трансгена на доимплантационных стадиях развития
млекопитающих в качестве репортерного гена нами был предложен ген
SEAP. Этот ген интересен тем, что продукт его экспрессии может быть об-
наружен в окружающей среде. Вектор, включающий кодирующую область
этого гена под контролем промотора актина крысы или промотора CMV и
3'-области ГГР быка, инъецировали в пронуклеусы зигот коров и мышей.
После культивирования в течение трех суток среду исследовали на наличие
SEAP. Положительные группы отбирали и продолжали культивировать.
Уровень секреции трансгена в среде превышал контрольный фон в 12-55
раз (Городецкий, Андреева, 1995; Chan et al„ 1995).
Однако используемые методы детектирования экспрессии имеют свои
недостатки. Большинство проблем связано с невозможностью отличить ис-
тинно интегрированный трансген от неинтегрированной экзогенной ДНК,
экспрессирующейся экстрахромосомно. Также критичными для репортер-
ных генов являются продолжительность экспрессии и ее интенсивность.
Не во всех случаях на ранних стадиях дробления зародыша возможно немед-
ленное обнаружение экспрессии трансгена (исключением является работа,
когда для селективного отбора трансгенных предимплантационных эмбрио-
нов мыши использовали ген GFP под промотором ос-1-фактора элонгации
человека) (Takada et aL, 1997).
В настоящее время с помощью трансгеноза изучено большое число ре-
гуляторных элементов, которые обеспечивают экспрессию генов в разных
органах, в определенных типах клеток и/или на определенных стадиях раз-
вития. В частности, нами была показана стадио- и тканеспецифическая экс-
прессия эмбрионального е-глобинового гена цыпленка, который был инъе-
цирован в зиготы мышей. Гибридизационный анализ тотальной РНК, изо-
лированной из 12-дневного трансгенного плода мыши, показал присутствие
молекул, комплементарных перенесенному е-глобиновому гену цыпленка,
при этом количество молекул мРНК составило примерно половину от коли-
чества молекул р-глобиновой РНК мыши. В эмбрионе не было обнаружено
транскрипционной активности р-глобиновой РНК взрослой мыши. Транс-
крипты е-глобинового гена цыпленка отсутствовали в РНК, выделенной из
печени новорожденной мыши (Tarantul et al., 1987).
ИССЛЕДОВАНИЯ РЕГУЛЯЦИИ
И ФУНКЦИИ ВИРУСНЫХ ГЕНОВ
На модели трансгенных животных были получены многочисленные дан-
ные, касающиеся регуляции экспрессии клеточных и вирусных генов in vivo
и их функции в целых организмах. Для понимания сложных процессов взаи-
модействия вирусов и клеток принципиально важным является выяснение
функций отдельных вирусных генов, т.е. создание функциональной анато-
мии геномов вирусов. Вирусные гены, в отличие от клеточных, часто не
имеют сходных генов в геноме и их эффект проявляется в “чистом” виде.
199
Таблица 1. Вирусные гены, индуцирующие онкогенез у трансгенных мышей (см.
Тарантул и др., 1999)
Трансген/промотор Опухоли
SV40 T-ag/ингибин SV40 T-ag/эластаза SV40 T-ag/антитромбин FLV env JVC T-ag EBV EBNA-1/иммуноглобулин HBV Hbx/MT HCV core/HBV HSV16 Е7/кератин 14 PyV T-ag/C3 HTLV-I pX/H-2Kd HTLV-I гах/иммуноглобулин HIV-1 tof/LTR v-Ha-ra.s/эмбриопальпый глобин v-Ha-ra.s/кальцитонип Опухоль гонад Опухоль панкреатической железы Гепатоцеллюларная карцинома Эритролейкемия Опухоль нейронального креста Лимфома Гепатоцеллюлярная карцинома Гепатоцеллюлярная карцинома Эпителиальная карцинома Инвазивная карцинома Карцинома молочной железы Лимфома Саркома Капоши Эпидермальная папиллома Тироидная карцинома
Трансгенные животные являются более адекватной моделью по сравнению
с культивируемыми клетками для изучения молекулярных основ различных
патологий, вызываемых продуктами отдельных вирусных генов (Тарантул,
Мудрик, 1991).
В первых экспериментах на трансгенных мышах наше внимание было
обращено на исследование регуляторных элементов, содержащихся в LTR
RSV и LTR MuLV . Анализ РНК показал, что в ряде органов трансгенных
мышей ген /A-HSV активно транскрибировался под контролем обоих типов
LTR. При этом было выявлено аномальное развитие мышей с геном /А-HSV,
содержащим в качестве промотора LTR MuLV, что коррелировало с нали-
чием транскрипционной активности этой плазмиды (Газарян и др., 1984).
В последующем было показано, что LTR этих двух провирусов не имеет
сильно выраженной видо- и тканеспецифичности, а их промоторные свойст-
ва примерно одинаковы (Косиков и др., 1986).
Для выяснения реальных функций вирусных генов в клетках в ряде ла-
бораторий были сконструированы трансгенные мыши, содержавшие еди-
ничные структурные и регуляторные гены вируса иммунодефицита (HIV)
под контролем различных промоторов. В табл. 1 приведены данные по
изучению с помощью трансгеноза роли в онкогенезе разных вирусных ге-
нов. В результате этих исследований были выявлены различные гены
ДНК- и РНК-содержащих вирусов, не все из которых являются типичны-
ми онкогенами, но все способствуют развитию у трансгенных животных
большого спектра неоплазий. Принципиально важно, что часто тип злока-
чественного перерождения, индуцируемого введением единично-
го вирусного гена, часто коррелирует с тем типом рака, который вызыва-
ется инфицированием организма соответствующим вирусом. Такая корре-
ляция позволяет понять механизм канцерогенного действия вирусов, ука-
зывая на природу продукта, обусловливающего процессы опухолеобразо-
вания.
200
Использование трансгенных животных многое дало для изучения функ-
ции отдельных регуляторных генов HIV. Так, у трансгенных мышей с геном
tat HIV-1 под контролем МТ-1 промотора мы наблюдали аномалии, которые
проявлялись у разных линий трансгенных животных в возникновении адено-
карциномы поджелудочной железы (Шугурова и др., 1997). Эти результаты
свидетельствуют об онкогенном потенциале регуляторного гена tat, кото-
рый под контролем МТ-1 промотора проявляется главным образом в разви-
тии аденокарциномы поджелудочной железы. Ранее у трансгенных мышей
с генами tat HIV-1, находящимися под контролем вирусных регуляторных
элементов, также наблюдали образование опухолей разного происхожде-
ния, изредка и аденокарциномы (Vogel et al., 1988; Campioni et al., 1995).
Нами также были получены трансгенные мыши, содержащие ген nef
HIV-1 под контролем промотора CMV, обеспечивающего экспрессию транс-
гена в широком спектре клеток и тканей (Мудрик и др., 1992). Их анализ по-
казал наличие существенных различий в составе клеток, как в костном
мозге, так и в периферической крови по сравнению с контрольными живот-
ными (подробнее см. статью Тарантула В.З., наст, сборник). В опубликован-
ных позднее работах других авторов у трансгенных мышей с геном nef так-
же наблюдали ряд патологий, включая значительные изменения в пролифе-
рации лимфоцитов (Scowronski et al., 1993), развитие катаракты, папиллома-
тозных нарушений кожи и цитопатичности, наблюдаемой у HIV-инфециро-
ванных организмов (Dickie, 2000).
Таким образом, использование трансгенных животных как модели
in vivo не только подтвердило результаты исследований на клеточных моде-
лях (in vitro), но и существенно расширило наше понимание молекулярных
механизмов HIV-индуцируемого патогенеза, показало, что ряд известных
патологий может вызываться продуктами отдельных вирусных генов, а не
действием вируса как целого патогена.
МОДЕЛИРОВАНИЕ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА
Очень важным направлением использования трансгенных животных яв-
ляется создание моделей различных патологий человека. Это, с одной сто-
роны, позволяет подтвердить роль тех или иных генов в определенном забо-
левании, а, с другой, создать модель, на которой можно более детально ис-
следовать молекулярные механизмы нарушений и осуществлять целенапра-
вленный подбор лекарственных средств (см. обзор: Тарантул, Мудрик,
1991). Использование для этих целей мышей важно с той точки зрения, что
у них примерно такой же размер генома и такое же число генов, как у чело-
века. В настоящее время с помощью трансгеноза осуществлено моделирова-
ние множества различных заболеваний человека, таких, например, как рак
груди, рак простаты, нейрофиброма, эритролейкемия, диабет и др.
РАК
На модели трансгенных животных проведены многочисленные исследо-
вания по выяснению роли различных онкогенов в злокачественных переро-
ждениях клеток млекопитающих. Благодаря этим экспериментам установ-
лено, в частности, что отдельные онкогены, перенесенные в мышей и крыс,
201
могут определять появление у трансгенных особей опухолей в тех тканях,
где они экспрессируются. Так, ген с-тус под контролем регуляторных эле-
ментов гена иммуноглобулина (гены иммуноглобулинов экспрессируются
тканеспецифично в В-клетках) вызывал у трансгенных мышей лимфомы
В- и пре-В-клеток, а этот же онкоген под контролем LTR вируса MMTV обу-
словливал возникновение аденокарциномы в молочной железе самок, т.е.
в том органе, где экспрессируются гены вируса MMTV. Вместе с тем анализ
трансгенных мышей с генами ранней области аденовируса 12 показал, что,
несмотря на транскрибируемость трансгенов во многих типах тканей, опухо-
ли возникают только в желудке. Следовательно, канцерогенное действие
ранних аденовирусных генов органоспецифично и требует присутствия ка-
ких-то дополнительных продуктов или отсутствия специфических ингибито-
ров. Почти во всех случаях исследования трансгенных животных с онкоге-
нами наблюдали общую закономерность, которая заключается в развитии у
этих животных пролиферативной гиперплазии и появления гистологически
тестируемых солидных опухолей. Кроме того, обнаружено, что для воз-
никновения нарушений в пролиферации клеток под действием онкобелков
необходим довольно протяженный период времени. На трансгенных живот-
ных установлено также, что для формирования опухолей в ряде случаев тре-
буются дополнительные генетические изменения. Так, специфические цито-
генетические аномалии в хромосомах 8 (трисомия или дупликация) и/или 14
(моносомия или транслокация) были выявлены при исследовании кариоти-
па клеток в ходе развития фибросаркомы у трансгенных мышей с генами
бычьего вируса папилломы.
С использованием трансгенных мышей продемонстрировано онкоген-
ное свойство мутантного гена р53. В кооперации с онкогеном ras мутантный
ген р53 вызывал злокачественное перерождение клеток. У 20% трансген-
ных животных возникали аденокарциномы легких, остеосаркомы и лимфо-
мы. Полученные данные позволили прийти к заключению о том, что нор-
мальный ген р53 является не онкогеном, а антионкогеном, продукт которо-
го инактивируется при наличии мутантного белка Р53.
Уже давно в качестве диагностического маркера лейкемии человека ис-
пользовали так называемую филадельфийскую хромосому, которая возни-
кает в результате хромосомной транслокации t(9; 22)(q34; qll). При этом
происходит соединение онкогена аЫ с 5 '-концевым экзоном гена Ьсг. В ре-
зультате экспрессируется новый химерный белок bcrtabl с молекулярной
массой 190 000. Чтобы установить наличие или отсутствие взаимосвязи ме-
жду возникновением нового гена и острой лейкемией у человека, химерный
ген человека hcrlabl вводили в зиготы мышей и получали трансгенных жи-
вотных. У последних быстро развивалось заболевание, сходное с таковым
человека, и они погибали вскоре после рождения. Таким образом, на моде-
ли трансгенных животных была впервые установлена причинная связь меж-
ду возникновением филадельфийской хромосомы и острой лейкемией чело-
века (см. обзор: Тарантул, Мудрик, 1991).
С помощью трансгеноза большие успехи были получены при изучении и
моделировании лимфомогенеза. Моделирование различных типов злокаче-
ственных лимфом с использованием трансгенных мышей было начато еще
в 1985 г., когда Адамс с соавт. осуществили первые эксперименты по полу-
чению животных с геном с-тус, находящимся под контролем различных
202
Таблица 2. Синергизм генов при возникновении лимфом, выявляемый с помощью
скрещивания у двойных трансгенных животных
Трансген Синергичный ген Тип лимфомы
с-тус v-ahl пре-В -клеточная
с-тус pim-1 пре-В -клеточная
с-тус N-ras про- и пре-В-клеточная
с-тус hcl-2 В-клеточная
N-myc hcl-2 В- и Т-клеточные
tal-1 casein kinase Ila Т-клеточная лейкемия/лимфома
pim-2 c-myc Т-клеточная/пре-В-клеточная
pim-I E2a-Phx-I Т-клеточная
с-тус hmi-1, pim-1 пре-В-клеточная
с-тус Notch-1 Т-клеточная
с-тус p53 В-клеточная
с-тус til-1 Т-клеточная
pim-1 c-myc, N-myc Т-клеточная
pim-1 ,L-myc gfi-Upal-l Т-клеточная
с-тус, pim-1 hmi-1 В- и Т-клеточные
с-тус, pim-1 gfi-Hpal-1 Т клеточная
промоторов (Adams, Cory, 1991). У трансгенных мышей с геном с-тус и эн-
хансерами генов иммуноглобулинов через несколько недель после рожде-
ния образовывались мультицентрические лимфосаркомы. Наблюдаемая
картина соответствовала тем патологиям, которые наблюдаются у челове-
ка с транслоцированным геном с-тус. Трансгеноз может быть использован
и для изучения участия в лимфомогенезе тех генов, которые были выявле-
ны нами как высокоэкспрессирующиеся в лимфомах человека и обезьян
(Tarantul et al., 2000, 2001). Лимфомогенез, как и другие формы онкогенеза,
является многоэтапным процессом. Одним из убедительных подтверждений
этому явились эксперименты на так называемых двойных трансгенных
мышах, получаемых в результате скрещивания разных трансгенных живот-
ных. Эти эксперименты показали наличие синергизма между большим чис-
лом различных генов (табл. 2). В совокупности многочисленные и разнооб-
разные результаты, полученные на модели трансгенных мышей (т.е. в сис-
теме in vivo), послужили веским подтверждением данных, которыми распо-
лагали исследователи относительно роли отдельных генов и их кооперации
в таком сложном онкологическом процессе, как лимфомогенез у человека.
БОЛЕЗНЬ АЛЬЦГЕЙМЕРА
Другим примером моделирования патологий человека может служить
болезнь Альцгеймера (БА), которая является наиболее распространенной
причиной прогрессирующей деменции в пожилом возрасте. Была показана
важная роль в этом мутаций в трех генах: АРР, пресенилинах 1 и 2 (PSEN 1
и 2). Первые попытки смоделировать БА у млекопитающих заключались
в получении трансгенных мышей, экспрессирующих ген АРР, несущий мута-
ции, приводящие к развитию заболевания у человека (Games et al., 1995).
203
Такие мыши развивались нормально, но с возрастом накапливали множест-
венные отложения нерастворимого амилоида, а также в ряде случаев демон-
стрировали отклонения в поведении. Трансгенные мыши, несущие мутант-
ный ген АРР, были недавно использованы для разработки нового подхода к
терапии БА - Р-амилоидной иммунизации (Morgan et al., 2000; Janus et al.,
2000).
Важная роль пресенилинов в процессинге АРР была также продемонст-
рирована на моделях “knock-in”, когда эндогенный PSEN I мыши был заме-
нен на человеческий, несущий мутацию (Nakano et al., 1999), и “knock-out”, с
полной потерей гена PSEN 1 (De Strooper et al., 1998). В первом случае у жи-
вотных в возрасте 16-20 недель наблюдали накопление Ар~42(43), зависи-
мое от дозы гена, у нокаутированных же по PSEN 1 мышах почти полностью
ингибировался процессинг АРР.
В нашей работе, в экспериментах по созданию трансгенных мышей, не-
сущих мутантную форму PSEN 1 C410Y под контролем промотора CMV
(универсального промотора, определяющего интенсивную экспрессию
трансгена), мы отмечали высокий уровень эмбриональной гибели, по всей
видимости связанный с токсичным действием гена в условиях гиперэкспрес-
сии. Недавно было показано также, что гиперэкспрессия PSEN может вызы-
вать апоптоз в моделях трансфецированных клеточных культур и трансген-
ных дрозофил (Weihl et al.,1999; Araki et al., 2000; Ye, Fortini, 1999).
Кроме того, недавно была получена трансгенная линия мышей, экспрес-
сирующих антитела к фактору роста нервов (NGF), у которых вдвое был
снижен уровень NGF в мозге. При анализе фенотипа животных обнаружи-
лись возрастные патологии, включающие накопление, как нерастворимого
амилоида, так и гиперфосфорилированного тау, нейрональную гибель и на-
рушения поведения. На сегодняшний день это пока наиболее адекватная мо-
дель БА, демонстрирующая важную роль сигнального каскада NGF в про-
цессе нейродегенерации (Capsoni et al., 2000).
СПИД
На трансгенных мышах были проведены многочисленные работы по
изучению функций отдельных генов HIV и получению модели такого забо-
левания человека, как синдром приобретенного иммунодефицита (СПИД).
Выше мы уже останавливались на результатах наших исследований функ-
ции двух регуляторных генов HIV с использованием трансгенных животных.
Наличие у мышей единичных вирусных генов воспроизводит некоторые па-
тологии, присущие СПИДу, но не позволяет создать модель этого заболева-
ния. С самого начала было очевидно, что для решения данной задачи необ-
ходимо получать трансгенные организмы, содержащие целый или почти це-
лый геном вируса. Вместе с тем, даже когда были получены такие трансген-
ные мыши, они не стали адекватной моделью СПИДа (Dickie et al., 1991).
Хорошая модель появилась лишь десять лет спустя, когда в качестве объе-
кта для переноса генома HIV были использованы крысы (Reid et al., 2001).
Неудача в случае использования трансгенных мышей объяснилась тем, что
у мышей, в отличие от крыс, циклин Т, являющийся кофактором, не взаи-
модействует функционально с вирусным белком Tat. Такие ограничения не-
204
обходимо учитывать при создании и других моделей болезней человека. Это
важно также для использования трансгенных животных в фармакологиче-
ских и токсикологических исследованиях. С этой целью осуществляют про-
цесс “хьюманизации” организмов, т.е. создают с помощью трансгеноза жи-
вотных со специфическими рецепторами или антигенами человека, которые
в норме у них отсутствуют. В частности, в настоящее время получены транс-
генные модели с человеческими генами рецептора интерлейкина 6, антиге-
на CD4, рецептором иммуноглобулина Е и др. (Kirkland, Muller, 2000).
МИТОХОНДРИАЛЬНЫЕ ПАТОЛОГИИ
Недавно появились сообщения о переносе целой экзогенной митохонд-
риальной ДНК (мтДНК) в эмбрионы мышей. Цитопласты (энуклеирован-
ные клетки), несущие в мтДНК мутацию, связанную с энергетическим мета-
болизмом, сливали с ЭСК с инактивированными митохондриями. Затем эти
ЭСК использовали для получения химер (см. Эмбриональные стволовые
клетки и таргетинг генов). В результате химерные мыши и их потомки име-
ли ряд аномалий, сходных с клиническими проявлениями болезни человека,
обусловленной аналогичной мутацией в мтДНК (Hirano, 2001).
ЭКСТРАХРОМОСОМНЫЕ ТРАНСГЕНЫ
Изредка обнаруживалось, что переносимая экзогенная ДНК не интегри-
рует с геномом клеток хозяина, а персистирует и передается по наследству в
экстрахромосомной форме. Внехромосомно локализованные трансгены
обычно получают с использованием плазмид, которые содержат функцио-
нальные элементы ДНК-содержащих вирусов, обеспечивающие автоном-
ную репликацию трансгена в реципиентных клетках.
Цикл исследований по изучению экстрахромосомных трансгенов был
проведен в нашей лаборатории на модели трансгенного тутового шелкопря-
да (подробнее эти данные рассмотрены в настоящем сборнике в обзоре Ни-
колаева А.И.). Рекомбинантные плазмиды, не обладающие в принципе спо-
собностью к автономной репликации, инъецировали в грены тутового шел-
копряда. Из ДНК трансгенных насекомых с помощью метода “спасения
плазмиды” был клонирован стабильный экстрахромосомный трансген, на-
званный рг8а и состоящий из фрагментов бактериальной плазмиды pBR322
(она присутствовала в инъецированной рекомбинантной плазмиде) и кле-
точной ДНК тутового шелкопряда (Николаев и др., 1992; 1993; Nikolaev et
al., 1993). Эта плазмида образовалась in vivo в результате негомологичной
рекомбинации в Е0-поколении трансгенных насекомых и передавалась по
наследству, по крайней мере, до поколения F4.
Плазмиду рг8а после ее “спасения” из трансгенных насекомых инъеци-
ровали в зиготы мышей с целью изучения ее поведения в организме млеко-
питающих (Николаев и др., 1998). У трансгенных животных нуклеотидные
последовательности, гомологичные последовательности плазмиды рг8а,
также обнаруживались преимущественно во внехромосомной форме. Как и
в клетках тутового шелкопряда, структура трансгена у трансгенных мышей
изменялась в процессе его переноса и при передаче по наследству. Последо-
205
вательно возникающие делеции в экзогенной ДНК имели сходный характер
у разных особей, что указывает на существование каких-то общих механиз-
мов рекомбинации, участвующих в “адаптации” трансгена к хозяйской сис-
теме репликации. Частичное секвенирование нуклеотидной последователь-
ности данной плазмиды показало, что она содержит области гомологии с от-
дельными повторяющимися элементами генома человека. Сравнение этой
последовательности с известными ранее элементами вирусных и клеточных
ДНК, обеспечивающими начало репликации (оп), указывает на существен-
ное сходство с некоторыми из них. Область гомологии с огг-элементами пе-
рекрывается с участком рг8а, сходным с ретранспозоном L1 человека.
ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ
И ТАРГЕТИНГ ГЕНОВ
Все вышеперечисленные системы получения трансгенных животных
имеют тот недостаток, что вводимая этими способами ДНК интегрируется с
реципиентным геномом случайным образом, зачастую в виде множества ко-
пий, часто наблюдаются перестройки трансгена, мутации в геноме хозяина
вплоть до летальных (Jaenisch et al., 1983). Вследствие этого нередко экс-
прессия одного и того же трансгена может варьировать в широких пределах
у трангенных животных до полного ее отсутствия. Однако в последнее деся-
тилетие техника введения чужеродной ДНК в геном животных усовершен-
ствовалась так, что стало возможным осуществлять направленное введение
ДНК в любую желаемую часть генома или конкретного локуса (Тарантул,
1996).
Основой новой технологии послужило создание эмбриональных стволо-
вых клеток. В 1981 г. одновременно в двух лабораториях были получены
первые культуры клеток, выделенных из внутренней клеточной массы бла-
стоцист мыши (Evans, Kaufman, 1981; Martin, 1981). Все ЭСК имеют нормаль-
ный диплоидный кариотип, обладают активностями щелочной фосфатазы и
теломеразы, экспрессируют ряд других маркеров, характерных для недиф-
ференцированных клеток. Это состояние поддерживается в определенных
условиях культивирования, в частности, при наличии в культуре фидерного
слоя эмбриональных фибробластов и/или фактора ингибирования лейкемии
LIF. При удалении последних ЭСК начинают дифференцироваться в много-
клеточные агрегаты, состоящие из дифференцированных и недифференци-
рованных клеток, называемые эмбриоидными телами (см. статью Гривен-
никова и др., наст, сборник). Несколько позднее были получены культуры
эмбриональных герменативных клеток (ЭГК), выделенные из первичных
половых клеток мыши (Donovan, 1994). Затем были выделены линии кле-
ток, подобные ЭСК из эмбрионов кролика, хомячка, норки, свиньи, коровы,
овцы, обезьян (Prelie et al., 1999) и, наконец, в последние годы такие линии
выделены из бластоцист и первичных половых клеток человека (Reubinoff
et al., 2000).
ЭСК и ЭГК сохраняют высокие плюрипотентные свойства при длитель-
ном культивировании in vitro и, будучи вновь введенными в эмбрион, способ-
ны формировать химер, участвуя в развитии тканей всех трех зародышевых
листков, включая образование гамет (Papaioannou, Johnston, 1993; Hogan et
206
aL, 1994). Однако способность ЭСК к формированию химер и наследованию
этих клеток у их потомков твердо установлена пока только для ЭСК мы-
шей. Так, неоднократные попытки исследователей Института цитологии и
генетики СОН РАН (при нашем участии) получить химерных норок после
инъекции клеток, подобных ЭСК, в полость бластоцисты оказались безре-
зультатными (Sukoyan et al., 1992).
Недавно с нашим участием была предпринята попытка получения ЭСК
козы (Матвеева и др., 2000). Трансгенные козы являются наиболее подхо-
дящими кандидатами в продуценты терапевтических рекомбинантных
протеинов, и ЭСК, технология получения которых у с/х животных все еще
находится в стадии разработки, могли бы служить идеальной системой для
этих целей. Работа проводилась на базе государственного университета
Рио-де-Жанейро (Бразилия). С целью получения ЭСК нами были исполь-
зованы бластоцисты коз местной породы (штат Сеара, Бразилия). Бласто-
цисты помещали в соответствующие условия культивирования. В резуль-
тате было выделено несколько клеточных линий: в одной из них преобла-
дали эндодермально-подобные клетки с отрицательной активностью ще-
лочной фосфатазы, тогда как другие представляли смесь клеток, подоб-
ных ЭСК с положительной и отрицательной активностью щелочной фос-
фатазы и способностью к спонтанному образованию эмбриоидных тел.
В настоящее время проводится оценка плюрипотентности этих клеток
(рис. 71-73).
Уникальная способность ЭСК сохранять длительное время in vitro свои
плюрипотентные свойства открыла широкие возможности для различных
манипуляций с их генами. Были разработаны пути и методы направленного
введения чужеродной ДНК в ЭСК путем гомологичной рекомбинации с эк-
зогенной ДНК (Тарантул, 1996; Muller, 1999). При трансформации ЭСК in
vitro в результате такой рекомбинации происходит инсерция эндогенной
ДНК в ‘Тен-мишень’’. Затем, после отбора ЭСК с модифицированным гено-
мом, их инъецируют в полость бластоцисты другой линии мышей (рис. 74)
или агрегируют с зародышами более ранних стадий развития, после чего их
пересаживают в матку приемной матери. Среди потомков отбирают химер-
ных животных (рис. 75, Андреева, Языков, 1981), в результате скрещивания
которых получают гомозиготных мышей. Генотип гомозигот представлен
исключительно модифицированными ЭСК. Общая схема осуществления на-
правленного изменения генов у животных приведена на рис. 76.
Данная технология позволяет получать направленные изменения в лю-
бом желаемом гене (технология “gene targeting” или “knock out”). Совокуп-
ность перечисленных выше методов можно определить как генетическую
модификацию генома на уровне индивидуальных генов. Они позволили при-
менять, по крайней мере, к мышам такие два основных генетических подхо-
да как “от фенотипа к гену” и “от гена к фенотипу”. Это имело революцио-
низирующее воздействие как в фундаментальных научных, так и во всевоз-
можных прикладных исследованиях.
В первую очередь технология таргетинга внесла существенный вклад в
генетику мыши и анализ различных аспектов функции генов in vivo. В ре-
зультате использования таргетинга генов были созданы многочисленные
трансгенные мыши с различными целенаправленными изменениями генов,
начиная от точечных мутаций и кончая хромосомными перестройками. При
207
Рис. 75. Химерные мыши, полученные путем агрегации эмбрионов двух разных линий мышей
внешней простоте подхода он несет множество трудностей. Одна из них свя-
зана с дизайном вектора для гомологичной рекомбинации. В частности, на-
ми было показано, что только один из четырех сконструированных векто-
ров на базе гена PDGF-A (тромбоцитарный фактор роста) позволял успеш-
но осуществлять нокаут этого гена (Макарова и др., 1997).
Важнейшим моментом в технологии направленного изменения генов
явилось создание ткане- и стадиоспецифического индуцибельного генного
таргетинга с использованием cre-loxP и других подобных систем. Сге
(cyclyzation recombination) является белком фага Р1 с молекулярным весом
38 КД, обладающим рекомбиназной активностью. Эта циклирующая реком-
биназа катализирует процесс рекомбинации между сайтами loxP (locus of
X-over of Pl), которые могут быть расположены в любой ориентации друг к
другу. Один из методов получения направленных хромосомных перестроек
in vivo, основан на комбинации двух технологий: 1) получение ЭСК, в кото-
рые с помощью гомологичной рекомбинации введены foxP-сайты в желае-
мые локусы внутри одной хромосомы или в разные негомологичные хромо-
сомы. Такие ЭСК используют для получения химерных животных, а затем
и их потомков, несущих эти /охР-сайты; 2) получение трансгенных мышей,
в геном которых введена генетическая конструкция, содержащая Сге под
контролем конститутивного или тканеспецифического промотора. С помо-
щью скрещивания получают двойных трансгенных мышей, у которых про-
исходит рекомбинация между этими /охР-сайтами, благодаря активности ре-
комбиназы Сге. Таким образом удается получать животных с направленны-
ми хромосомными перестройками. Этот подход во многих случаях способст-
вовал преодолению такого отрицательного момента, как появление у нока-
утированных мышей деталей на ранних стадиях развития, и позволил изу-
208
Химера
Потомство,
произошедшее из клеток
хозяйского эмбриона
произошедшее из
таргетированных ЭСК
Рис. 76. Схема получения трансгенных мышей путем направленного изменения (таргетинга)
генов в ЭСК
чать функции генов в отдельных типах клеток и тканей на разных стадиях
развития организмов (Muller, 1999; Серов, Матвеева, 2001).
В результате внедрения в практику этих технологий в настоящее время
получены принципиально новые данные о функции более тысячи различ-
ных генов (DeChiara, 2001).
209
Таким образом, генный нокаут, как и перенос новых генов, митохондрий
и целых хромосом, позволяет не только определять функцию гена, но и мо-
делировать некоторые патологии человека. В настоящий момент этот при-
ем становится одним из ключевых в молекулярной генетике. Его чрезвы-
чайная важность на данном этапе исследований определяется массовым
переходом от исследований по структурной генетике к функциональной ге-
нетике.
ТРАНСГЕНОЗ И КЛОНИРОВАНИЕ ЖИВОТНЫХ
Новая страница в области модификации геномов животных была откры-
та после сенсационных успехов по клонированию животных (Wilmut et aL,
1997). Сама техника клонирования основана на переносе ядер соматических
клеток донора в цитоплазму энуклеированного ооцита реципиента (рис. 77).
В данном случае речь идет уже о генетических манипуляциях на уровне це-
лого генома. В настоящее время после пересадки ядер соматических клеток
(фибробластов, фолликулярных клеток, клеток Сертоли, клеток гранулезы
и др.) в энуклеированные ооциты получены клонированные овцы (Wilmut et
aL, 1997), коровы (Kubota et aL, 2000), мыши (Wakayama et aL, 1998), козы
(Baguisi et aL, 1999), свиньи (Polejaeva et aL, 2000), кошки (Shin et al., 2002).
Вне всякого сомнения, эта техника в комбинации с методами трансгеноза
открывает самые широкие возможности для генетической модификации
геномов животных. К настоящему времени нокаутированию подвергнуто
огромное количество генов мышей, исследованы функции нескольких
тысяч генов. Развитие техники клонирования значительно сокращает путь
получения животных с целенаправленными изменениями функций генов.
Однако стабильные линии ЭСК (см. выше) получены только у некоторых
линий мышей.
Альтернативным подходом к решению этой проблемы явились исследо-
вания по трансформации чужеродными генами клеток фибробластов пло-
дов с последующей пересадкой их ядер в энуклеированные ооциты овец и
коров (Schnieke et al.,1997; Cibelli et aL, 1998), что привело к рождению транс-
генных потомков. А в 2000 г. появилось первое сообщение (McCreath et aL,
2000) о целенаправленном введении в клеточную культуру фибробластов
плода овцы вектора, созданного на основе а 1 (1)-проколлагенового гена ов-
цы, содержащего в своем составе ген а 1-антитрипсина человека под промо-
тором Р-лактоглобулина. Были отобраны клоны фибробластов, прошедшие
гомологичную рекомбинацию и экспрессирующие а 1-антитрипсин челове-
ка. Ядра этих фибробластов пересадили в энуклеированные ооциты овец,
а эмбрионы, развившиеся из них до стадии морулы или бластоцисты, были
перенесены суррогатным матерям для их дальнейшего развития. Из 16 про-
анализированных плодов и новорожденных 15 содержали в своем геноме
таргетированную аллель. 14 потомков развилось до рождения, и трое из них
достигли годовалого возраста. У одной из самок был обнаружен в молоке
а 1-антитрипсин в количестве 650 мкг/мл.
Аналогичным путем были получены трансгенные свиньи, в которых
был нокаутирован один аллель локуса а-1,3-галактозилтрансферазы, от-
ветственной за острую реакцию отторжения органов при ксенотрансплан-
210
тации. Трансгенные особи были получены с использованием техники кло-
нирования, когда в качестве доноров ядер были использованы нокаутиро-
ванные по данной аллели клетки фибробластов плода свиньи (Lai et al.,
2002).
ЗАКЛЮЧЕНИЕ
Таким образом, за последние два десятилетия научные достижения в эм-
бриологии, молекулярной биологии, генетике и структурной геномике, поя-
вление новых методов и подходов в трансгенной технологии модификации
генома животных создали основу для решения большого числа общебиоло-
гических, биомедицинских и биотехнологических задач. Если генная инже-
нерия послужила основой для развития структурной геномики, то трансге-
ноз стал основной технологией, способствующей прогрессу в функциональ-
ной геномике. Без всякого сомнения, в ближайшие годы широкое примене-
ние и дальнейшее развитие получат такие направления, как классический
трансгеноз, направленный таргетинг генов в определенных типах клеток
и/или на определенных стадиях развития организмов. В частности, в перспе-
ктиве эти подходы могут быть использованы для выяснения роли генов, вы-
сокоэкспрессирующихся в лимфомных клетках, как в процессе лимфомоге-
неза, так и в норме (см. статью Тарантула В.З., наст, сборник).
Широкое распространение получили в последние годы так называемые
двойные трансгенные животные. Первоначально таких животных получали
путем скрещивания друг с другом трансгенных животных с разными транс-
генами. В дальнейшем стали использовать и другие стратегии, такие как ко-
инъекции разных генов, инъекции бицистронных рекомбинантных ДНК
(Jankowsky et al., 2001). Использование двойных трансгенных животных су-
щественно расширило возможности трансгеноза, особенно при использова-
нии трансгенов, экспрессия которых контролируется тетрациклином или эк-
дизоном. Перспективным является и создание двойных трансхромосомных
животных, в частности для получения полноценных человеческих антител
(Tomizuka et al., 2000).
Технология получения трансгенных животных с заданными хозяйст-
венно ценными признаками будет в дальнейшем одним из перспективных
направлений современной биотехнологии. Она позволит создавать разно-
образные организмы, обладающие свойствами, не имеющими аналогов
в природе. Трансгенные животные помогут решению ряда проблем, с ко-
торыми человечество сталкивается на всем протяжении своей истории.
Это, прежде всего проблема создания лекарственных препаратов и их по-
лучения в достаточном количестве, а также потенциально продовольст-
венная проблема.
Еще одним существенным моментом на рубеже двух столетий стала ус-
пешная отработка подходов к клонированию разных видов животных орга-
низмов. Сочетание клонирования с трансгенозом может стать очень эффе-
ктивным путем как для дальнейшего развития функциональной геномики,
так и для решения различных прикладных задач. В перспективе эти подхо-
ды, наряду с генной терапией, могут быть весьма полезными для клеточной
и органной терапии человека.
211
ЛИТЕРАТУРА
Андреева Л.Е., Газарян К.Г., Капицкая М.З., Томилин Н.В. Генетическая трансформа-
ция соматических клеток. XV. Получение трансгенных мышей, содержащих ген
белка оболочки вируса гепатита В человека // Цитология. 1987. Т. 29. С. 1190-1295.
АндрееваЛ.Е., Григоренко А.П., Гордеева О.Ф., Дворянчиков Г.А. Экспрессия CMV-lacZ
и RSV-tacZ-генов в трансгенных эмбрионах рыб и мышей // Генетика. 1996. Т. 32,
№ 12. С. 1661-1668.
Андреева Л.Е., Дворянчиков ГА. Анализ экспрессии KSV-TacZ-гена в трансгенных эмб-
рионах вьюна при различных вариантах инъекций Ц Там же. 1995. Т. 31, № 6.
С. 759-766.
АндрееваЛ.Е., Жаданов А.Б., Кузнецов Ю.М. Экспрессия гена р-галактозидазы в трансген-
ных эмбрионах вьюна Missgurnus fossilis L. // Там же. 1993 Г 29, № 5. С. 740-747.
АндрееваЛ.Е., Серова И.А. Влияние микроманипуляционной техники, применяемой для
трансгенеза, на развитие мышей // Онтогенез. 1992. Т. 23, № 6. С. 637-643.
Андреева Л.Е.. Слепцова Л.А., Григоренко А.П. и др. Сперматозоиды вьюна переносят
чужеродную ДНК, экспрессия которой обнаруживается на стадиях раннего разви-
тия // Генетика. 2003. Т. 39, Кв 6. С. 758-761.
Андреева Л.Е., Хайдарова Н.В., Солодухина Л.И. и др. Эксперименты по микроинъек-
ции гена рилизинг-фактора гормона роста человека в зиготы и эмбрионы свиней //
Докл. ВАСХНИЛ. 1990. Кв 7. С. 46-51.
Андреева Л.Е., Языков А.А. Получение агрегационных химер мышей Ц VI Всесоюз. со-
вещ. эмбриологов. М.: Наука, 1981. С. 7.
Газарян К.Г. Микроинъекции генов в зиготы и эмбрионы // Успехи соврем, генетики.
1985. Т. 13. С. 75-88.
Газарян К.Г., АндрееваЛ.Е., Кузнецова Е.Д. и др. Получение трансгенного кролика, не-
сущего транскрибирующийся ген релизинг-фактора гормона роста человека //
Докл. АН СССР. 1989. Т. 305. С. 726-728.
Газарян К.Г., Андреева Л.Е., Серова И.А. и др. Получение трансгенных кроликов и мы-
шей, содержащих ген гормона роста быка // Молекуляр. генетика, микробиология,
вирусология. 1988. Кв 10. С. 23—26.
Газарян К.Г, Генинг Л.В., Незнанов Н.С. и др. Микроинъекции в зиготы мышей реком-
бинантных ДНК, содержащих ген тимидинкиназы вируса герпеса и последователь-
ности ДНК ретровирусов // Там же. 1984. Кв 10. С. 22-28.
Газарян К.Г., Гольцов В.А.. Набирочкин С.Д. и др. Введение последовательностей ДНК
вируса саркомы Рауса в геномы дрозофилы и мыши путем микроинъекций в яйце-
клетки Ц Молекуляр. биология. 1985. Т. 19. С. 760-766.
Газарян К.Г., Кузнецова Е.Д., Эшкинд Л.Г. и др. Микроинъекции ДНК высокоонкоген-
ного аденовируса обезьян в зиготы мышей: интеграция и передача по наследству //
Молекуляр. генетика, микробиология, вирусология. 1983. Кв 9. С. 22-28.
Генинг Л.В., Бегетова Т.В., Газарян Т.Г. и др. Умеренное повторение в геноме последо-
вательностей ДНК, окружающих ген гормона роста быка // Там же. 1987. Кв 7.
С. 16-18.
Городецкий С.И., АндрееваЛ.Е. Факторы тканеспецифичности экспрессии генов каппа-
и бета-казеинов быка // V Всерос. планово-отчет. конф, по направлению “Генная и
клеточная инженерия”. М., 1995. С. 112.
Дворянчиков ГА., Иванова Л.Б., Светченко В.Г. Получение генно-инженерной конст-
рукции, включающей ген гранулоцит колоний-стимулирующего фактора человека
и фланкирующие районы гена aS 1-казеина быка // Сб. тр. ВНИИФБиП. 2000. Т. 39.
С. 3-10.
Дыбан А.П., Городецкий С.И. Генетическая трансформация млекопитающих // V Всесоюз.
симпоз. “Молекулярные механизмы генетических процессов”. М.: Наука, 1983.
С. 22-25.
Коваль Т.Ю., Хамидов Д.Х., АндрееваЛ.Е., Газарян К.Г. Влияние экспрессии гена рили-
зинг-фактора гормона роста человека на уровень гормонов у трансгенного кролика //
Пробл. эндокринологии. 1991. Т. 6. С. 51-54.
212
Косиков А.И., Тарантул В.З., Макарова И.В. и др. Микроинъекции ДНК высокоонко-
генного аденовируса обезьян в зиготы мышей: интеграция и передача по наследст-
ву//Молекуляр. генетика, микробиология, вирусология. 1986. № 10. С. 21-26.
Кузнецов А.В., Григоренко А.П., Кузнецова И.В. и др. Перенос плазмидной ДНК в ооци-
ты с помощью электропарированной спермы вьюна Missgurnus fossilis L. // Генети-
ка. 1999. Т. 35, № 2. С. 110-115.
Кузнецова Е.Д., Андреева Л.Е., Серова И.А. и др. Новые данные о характере структур-
ных изменений ДНК аденовируса обезьян SA7. микроинъецированной в зиготы мы-
шей Ц Молекуляр. генетика, микробиология, вирусология. 1989. № 4. С. 6-10.
Макарова И.В., Незнанов Н.С., Цимбалюк Е.С. и др. Таргетинг гена A-цепи тромбоци-
тарного фактора роста (PDGF-A) и получение химерной мыши с нокаутированным
геном Ц Молекуляр. генетика, микробиология, вирусология. 1997. № 4. С. 23-25.
Макарова И В., Тарантул В.З., Газарян К.Г. Структурные особенности сайта интегра-
ции чужеродной ДНК в геноме трансгенной мыши // Молекуляр. биология. 1988.
Т. 22. С. 1553-1561.
Мак-Ларен 3. Химеры млекопитающих. М.: Мир, 1979. 176 с.
Матвеева Н.М., Серова И.А., Андреева Л.Е. и др. Выделение и характеристика ЭС-по-
добных клеток из эмбрионов козы: (Предварительные результаты) // Материалы II
Междунар. науч. конф. “Биотехнология в растениеводстве, животноводстве и вете-
ринарии”. М., 2000. С. 43^44.
Мудрик Н.Н., Андреева Л.Е., Дубовая В.И. и др. Эффект гена nef ВИЧ-1 на соотноше-
ние клеток в костном мозге и периферической крови у трансгенных мышей // Докл.
РАН. 1992. Т. 325, № 3. С. 606-608.
Мудрик Н.Н., Эшкинд Л.Г., Манакова Т.Е. и др. Биологический эффект эритропоэтина
человека у трансгенных мышей // Молекуляр. генетика, микробиология, вирусоло-
гия. 1991. № 10. С. 25-28.
Николаев А.И.. Калмырзаев Б.Б., АндрееваЛ.Е. и др. Характеристика последовательно-
сти ДНК, автономно-реплицирующейся у трансгенных насекомых и мышей // Моле-
куляр. биология. 1998. Т. 32. С. 427-434.
Николаев А.И., Кафиани-Эристави К.А., Тарантул В.З. Получение челночной авто-
номно-реплицирующейся плазмиды в результате негомологичной рекомбинации in
vivo Ц Там же. 1993. Т. 27, № 4. С. 856-859.
Николаев А.И., Чкония Т.Т., Эристави-Кафиани К.А., Тарантул В.З. Анализ “спасен-
ной” плазмиды из трансгенного тутового шелкопряда // Биополимеры и клетка.
1992. Т. 8, № 3. С. 29-32.
Попов Л.С., Коробко И.В., Андреева Л.Е. и др. О функциональной значимости 5'-обла-
сти гена казеина быка Ц Докл. РАН. 1995. Т. 340, № 1. С. 111-113.
Серов О Л. Перенос генов в соматические и половые клетки. Новосибирск: Наука, 1985.
120 с.
Серов ОЛ., Матвеева Н.М. Генетическая модификация генома животных на уровне
хромосом Ц Успехи соврем, биологии. 2001. Т. 121, № 4. С. 387-397.
Серова И.А., Андреева Л.Е., Кузнецов Ю.М. и др. Изменение онкологических характе-
ристик мышей при трансгенезе, не обусловленное наличием трансгена // Эксперим.
онкология. 1991. Т. 13. С. 33-35.
Серова И. А., АндрееваЛ.Е., Семенова Л. А. Повреждающее действие микроманипуляци-
онной техники, применяемой для трансгенеза, на развитие мышей // Рабочее совещ.
“Криоконсервация генетических ресурсов”, Пущино, 1998: Сб. докл. Пущино, 1998.
С. 110-113.
Тарантул В.З. Таргетинг генов как современная методология изучения их функции //
Молекуляр. генетика, микробиология, вирусология. 1996. № 2. С. 3-13.
Тарантул В.З., Кузнецова Е.Д.. Газарян К.Г. ДНК аденовируса обезьян и ее экспрессия
в органах потомства трансгенных мышей // Молекуляр. биология. 1989. Т. 23.
С. 1036-1040.
Тарантул В 3., Кучерявый В.В., Макарова И.В. и др. Клонирование фрагмента ДНК
трансгенной мыши, содержащего интегрированную рекомбинантную плазмиду //
Молекуляр. биология. 1986а. Т. 20. С. 278-287.
213
Тарантул В.З., Макарова И.В., Андреева Л.Е. и др. ДНК аденовируса обезьян и ее экс-
прессия в органах потомства трансгенных мышей // Молекуляр. генетика, микро-
биология, вирусология. 19866. № 1. С. 22-26.
Тарантул В.З., Мудрик Н.Н. Изучение молекулярных основ патологии на модели
трансгенных животных // Биополимеры и клетка. 1991. Т. 7. С. 5-12.
Тарантул В.З., Николаев А.И., Калмырзаев Б.Б. и др. Молекулярные механизмы вирус-
индуцированного онкогенеза // Молекуляр. биология. 1999. Т. 33. С. 86-93.
Шугурова И.М., Андреева Л.Е., Дубовая В.И. и др. Влияние генов nef и tat вируса имму-
нудефицита человека типа 1 на клетки грызунов in vivo и in vitro // Генетика. 1997.
Т. 33. С. 1202-1208.
Эшкинд Л.Г., Кузнецова Е.Д., Попов Л.С. и др. Микроинъекции обезьяньего высокоон-
когенного вируса SA7 в оплодотворенные яйцеклетки мыши // Всерос. конф. “Ре-
комбинантные ДНК”, Пущино, 22-23 декабря, 1982. Пущино, 1982. С. 97.
Adams J.M., Cory S. Transgenic models of tumor development I I Science. 1991. Vol. 251, N 5035.
P. 1161-1167.
Araki W., Yuasa K., Takeda S. et al. Overexpression of presenilin-2 enhances apoptotic death of
cultured cortical neurons // Ann. N.Y. Acad. Sci. 2000. Vol. 920. P. 241-244.
Baguisi A., Behbood E., Mehcan D.T. et al. Production of goats by somatic cell nuclear transfer //
Nature Biotechnol. 1999. Vol. 17. P. 456-461.
Brinster R.L., Chen H.Y., Trumbauer M.E. et al. Somatic expression of herpes thymidine kinase in
mice following injection of a fusion gene into eggs // Cell. 1981. Vol. 27. P. 223-231.
Brinster R.L., Chen H.Y., Trumbauer M.E. et al. Factors affecting the efficiency of introducing for-
eign DNA into mice by microinjecting eggs // Proc. Nat. Acad. Sci. USA. 1985. Vol. 82.
P. 4438^1442.
Brossfield J.E., Chan PJ., Patton W.C., King A. Tenacity of exogenous human papillomavirus
DNA in sperm washing Ц J. Assist. Reprod. Genet. 1999. Vol. 16, N 6. P. 325-328.
Brown W.R., Mee P.J., Hong Shen M. Artificial chromosomes: ideal vectors? //Trends Biotechnol.
2000. Vol. 18, N 5. P. 218-223.
Campioni D., Corallini A., Zauli G. et al. HIV type 1 extracellular Tat protein stimulates growth
and protects cells of BK virus/tat transgenic mice from apoptosis // AIDS Res. Hum. Retrovir.
1995. Vol. 11, N 9. P. 1039-1048.
Capsoni S., Ugolini G., Comparini A. et al. Alzheimer-like neurodegeneration in aged antine-
rve growth factor transgenic mice // Proc. Nat. Acad. Sci. USA. 2000. Vol. 97. P. 6826-
6831.
Chan A.IV'.S. Transgenic animals: current and alternative strategies // Cloning. 1999. Vol. 1, N 1.
P. 25—46.
Chan A.W.S., Andreeva L.E., Gorodetsky S.I., Bremel R.D. Non-invasive screening of transgenic
embryo by using secreted placental alcaline phosphatase as a co-injected reporter // Biol.
Reprod. 1995. Vol. 52, suppl. 1. P. 137.
Chan A.M'.S, Chong K.Y., Martinovich C. et al. Transgenic monkeys produced by retroviral gene
transfer into mature oocytes // Science. 2001. Vol. 291. P. 309-312.
Chan A.IV.S., Homan EJ.. Ballou L.U. et al. Transgenic cattle produced by reverse-transcribed
gene transfer in oocytes Ц Proc. Natl. Acad. Sci. USA. 1998. Vol. 95. P. 14028-14033.
Chan A.W., Luetjens C.M., Dominko T. et al. TransgenICSI reviewed: Foreign DNA transmission
by intracytoplasmic sperm injection in rhesus monkey // Mol. Reprod. Develop. 2000.
Vol. 56, suppl. 2. S. 325-328.
Chen T.T., Powers DA. Transgenic fish // Trends Biotechnol. 1990. Vol. 8, N 8. P. 209—215.
Cibelli J.B., Stice S.L., Golueke PJ. et al. Cloned transgenic calves produced from nonquiescent
fetal fibroblasts // Science. 1998. Vol. 280. P. 1256-1258.
Cozzi E, Soin B, Holmes B, White D. Genetic engineering of the donor as an approach to clinical
xenotransplantation // Transplant Proc. 2000. Vol. 32, N 8. P. 2701-2703.
DeChiara T.M. Gene targeting in ES cells Ц Meth. Mol. Biol. 2001. Vol. 158. P. 19—45.
De Strooper B., Saftig P., Craessaerts K. et al. Deficiency of presenilin-1 inhibits the normal
cleavage of amyloid precursor protein // Nature. 1998. Vol. 391. P. 387-390.
Dickie P. Nef modulation of HIV type 1 gene expression and cytopathicity in tissues of HIV trans-
genic mice // AIDS Res. Hum. Retrovir. 2000. Vol. 16. P. 777-790.
214
Dickie P., Felser J., Eckhaus M. et aL HIV-associated nephropathy in transgenic mice expressing
HIV-1 genes // Virology. 1991. Vol. 185, N 1. P. 109-119.
Donovan P. Growth factor regulation of mouse primordial germ cell development // Curr. Top.
Develop. Biol. 1994. Vol. 229. P. 189-225.
Dvoryanchikov GA., Andreeva L.E., Serova LA. et al. Preliminary data on biological activity of
human G-SCF in milk of transgenic mice // Brazil. J. Mol. Biol, and Genet. 2003.
Evans M.G., Kaufman M.H. Establishment in culture of pluripotent cells from mouse embryos //
Nature. 1981. Vol. 292. P. 154-156.
Games D., Adams D., Alessandrini R. et al. Alzheimer-type neuropathology in transgenic mice
overexpressing V717F beta-amyloid precursor protein // Nature. 1995. Vol. 373. P. 523-527.
Gazaryan K.G., Kuznetsova E.D., Eshkind L.G. et al. Microinjection of simian adenovirus SA7
(C-8) DNA into the mouse zygotes: differential distribution of viral DNA in organs // Cell
Differ. 1984. Vol. 4. P. 267-276.
Gordon J.W., Ruddle F.H. Integration and stable germ line transmission of genes injected into
mouse pronuclei//Science. 1981. Vol. 214. P. 1244-1246.
Gordon J.W., Scangos J.A., Plotkin DJ. et al. Genetic transformation of mouse embryos by
microinjection of purified DNA // Proc. Nat. Acad. Sci. USA. 1980. Vol. 77. P. 7380-7384.
Hammer R.E., Pursel V.G., Rexroad C.E.J. et al. Production of transgenic rabbits, sheep and pigs
by microinjection // Nature. 1985. Vol. 315. P. 680-683.
Haskell R.E., Bowen R.A. Efficient production of transgenic cattle by retroviral infection of early
embryos // Mol. Reprod. Develop. 1995. Vol. 40. P. 386-390.
Hirano M. Transmitochondrial mice: proof of principle and promises // Proc. Nat. Acad. Sci. USA.
2001. Vol. 98. P. 401^103.
Hogan B., Beddington R., Constantini F., Lacy E. Manipulating the mouse embryo. N.Y.L: Cold
Spring Harbor Lab. press, 1994. 497 p.
Houdebtne L.M. Transgenic animals: generation and use. Amsterdam: Harwood Acad, publ.,
1997. 576 p.
Jaenisch R. Infection of mouse blastocysts with SV 40 DNA: Normal development of infected
embryos and persistance SV 40-specific DNA sequences in the adult animals // Cold Spring
Harbor Sump. Quant. Biol. 1974. Vol. 39. P. 375- 380.
Jaenisch R. Germ line integration and Mendelian transmission of the exogenous Moloney
leukemia virus //Proc. Nat. Acad. Sci. USA. 1976. Vol. 73. P. 1260-1264.
Jaenisch R., Harbers K., Schnieke A. et al. Germline integration of Moloney murine leukemia
virus at the Movl3 locus leads to recessive lethal mutation and early embryonic death // Cell.
1983. Vol. 32. P. 209-216.
Jankowsky J.L., Slant H.H., Ratovitski T. et al. Co-expression of multiple transgenes in mouse
CNS: a comparison of strategies Ц Biomol. Eng. 2001. Vol. 17. P. 157-165.
Janus C., Pearson J., McLaurin J. et aL A beta peptide immunization reduces behavioural impair-
ment and plaques in a model of Alzheimer’s disease // Nature. 2000. Vol. 408. P. 979-982.
Kim T., Leibfried-Rutledge M.L., First N.L. Gene transfer in bovine blastocysts using replication-
defective retroviral vectors packaged with Gibbon ape leukemia virus envelopes // Mol.
Reprod. Develop. 1993. Vol. 35. P. 105-113.
Kirkland DJ., Muller L. Interpretation of the biological relevance of genotoxicity test results: the
importance of thresholds // Mutat Res. 2000. Vol. 464. P. 137-147.
Kubota C., Yamakuchi H., Todoroki J. et al. Six cloned calves produced from adult fibroblast cells
after long-term culture//Proc. Nat. Acad. Sci. USA. 2000. Vol. 97. P. 990-995.
Lagutin O.V., Dobrovolsky V.N., Vinogradova T.V. et al. Efficient human IFN-gamma expression
in the mammary gland of transgenic mice // J. Interferon Cytokine Res. 1999. Vol. 19.
P. 137-144.
Lai L., Kolber-Simonds D., Park K.W. et al. Production of alpha-1,3-galactosyltransferase knock-
out pigs by nuclear transfer cloning // Science. 2002. Vol. 295. P. 1089-1092.
Lavitrano M., Camaioni A., Fazio V.M. et al. Sperm cells as vectors for introducing foreign DNA
into eggs: genetic transformation of mice // Cell. 1989. Vol. 57. P. 717-723.
Lin T.P. Micropipetting cytoplasm from the mouse eggs //Nature. 1967. Vol. 216. P. 162-163.
Lois C., Hong E.J., Pease S. et al. Germline transmission and tissue-specific expression of trans-
genes delivered by lentiviral vectors // Science. 2002. Vol. 295. P.'868-872.
215
Ludwig M., Ditrich К. Genetics in assisted reproduction - basic aspects and clinical perspectives //
Mannual on assisted reproduction. N.Y.: Springer, 2000. P. 461—472.
Maione B., Lavitrano M., Spadafora C., Kiessling A.A. Sperm-mediated gene transfer in mice //
Mol. Reprod. Develop. 1998. Vol. 50, N 4. P. 406-409.
Martin G.R. Isolation of a pluripotent cell line from mouse embryos cultured in medium condi-
tioned to teratocarcinoma stem cells // Proc. Nat. Acad. Sci. USA. 1981. Vol. 78.
P. 7634-7638.
McCreath KJ., Howcroft J., Campbell K.H.S. et al. Production of gene-targeted sheep by nuclear
transfer from cultured somatic cells // Nature. 2000. Vol. 405. P. 1066-1069.
Mitrani E., Coffin J., Boedtker H., Doty P. Rous sarcoma virus is integrated but not expressed
in chicken early embryonic cells // Proc. Nat. Acad. Sci. USA. 1987. Vol. 84. P. 2781-
2784.
Morgan D., Diamond D.M., Gottschall P.E. et al. A beta peptide vaccination prevents memory
loss in an animal model of Alzheimer’s disease // Nature. 2000. Vol. 408. P. 82-85.
Muller M., Brem G. Transgenic approaches to the increase of disease resistance in farm animals //
Rev. Sci. Technol. 1998. Vol. 17, N 1. P 365-378.
Muller U. Ten years of gene targeting: targeted mouse mutants, from vector design to phenotype
analysis // Meeh. Develop. 1999. Vol. 82. P. 3-21.
Nakano Y., Kondoh G., Kudo T. et al. Accumulation of murine amyloidbeta42 in a gene-dosage-
dependent manner in PS 1 ‘knock-in’mice//Europ. J. Neurosci. 1999. Vol. 11. P. 2577-2581.
Nickolaev A.I., Thkonia T.T., Eristavi Kafiani C.A., Tarantul V.Z. Preferential extrachromosomal
localization of exogenous DNA in the transgenic silkworm Bombyx mori L. // Mol. and Gen.
Genet. 1993. Vol. 236. P. 326-330.
Palmiter R.D. Transgenic mice - the early days // Intern. J. Develop. Biol. 1998. Vol. 42, N 7:
Special number. P. 847-854.
Palmiter R.D., Brinster R..L. Germline transformation of mice // Ann. Rev. Genet. 1986. Vol. 20.
P. 465—499.
Palmiter R.D., Brinster R.L., Hammer R.E. et al. Dramatic growth of mice that develop from eggs
microinjected with metallothioneingrowth hormone fusion genes // Nature. 1982. Vol. 300.
P. 611-615.
Papaioannou V, Johnston R. Gene targeting: A practical approach. Oxford: Oxford Univ, press,
1993. 107 p.
Polejaeva L.A, Chen S.H., Vaught T.D. et al. Cloned pigs produced by nuclear transfer from adult
somatic cells // Nature. 2000. Vol. 407, N 6800. P. 86-90.
Prelle K, Vassiliev I.M., Vassilieva S.G. et al. Establishment of pluripotent cell lines from verte-
brate species - present status and future prospects // Cell Tissue Organs. 1999. Vol. 165.
P. 220-236.
Ramirez-Solis R., Liu P., Bradley A. Chromosome engineering in mice // Nature. 1995. Vol. 378,
N 6558. P. 720-724.
Reid W., Sadowska M., Denaro F. et al. An HIV-1 transgenic rat that develops HIV-related pathol-
ogy and immunologic dysfunction //Proc. Nat. Acad. Sci. USA. 2001. Vol. 98. P. 9271-9276.
Reubinoff B.E., Pera M.F., Fong C.Y. et al. Embryonic stem cell lines from human blastocysts:
somatic differentiation in vitro // Nature Biotechnol. 2000. Vol. 18. P. 399—404.
Roe T.Y., Reynolds T.C., Yu G., Brown P.O. Integration of murine leukemia virus DNA depends
on mitosis // EMBO J. 1993. Vol. 12. P. 2099-2108.
Roschlau K., Andreeva LE., Zackel B. et al. Experimente zur Erzengung transgener Rinderdurch
Mikroinjection von rekombinanten bovinen Wachstrum Shormongenen in Zygoten I I Archiv.
Tierz. 19896. Bd. 3. P. 295-303.
Roschlau K., Rommel P., Andreeva L. et al. Gene transfer experiments in cattle // J. Reprod. Fertil.
Suppl. 1989a. Vol. 38. P. 153-160.
Sanes J.R., Rubenstein J.L.R., Nicolas J.F. Use of a recombinant retrovirus to study post-implan-
tation cell lineage in mouse embryos // EMBO J. 1986. Vol. 5. P. 3133-3142.
Schnieke A.E., Kind A J., Ritchie W.A. et al. Human factor IX transgenic sheep produced by trans-
fer of nuclei from transfected fetal fibroblasts // Science. 1997. Vol. 278. P. 2130-2133.
Scowronski L, Parks D., Mariani R. Altered T cell activation and development in transgenic mice
expressing the HIV-1 nef gene // EMBO J. 1993. Vol. 12. P. 703-713.
216
Shin T., Kraemer D., Pryor J. et al. A cat cloned by nuclear transplantation // Nature. 2002.
Vol. 415. P. 859.
Smith AJ., De Sousa M.A., Kwahi-Addo В et al. A site-directed chromosomal translocation
induced in embryonic stem cells by Cre-loxP recombination // Nat. Genet. 1995. Vol. 9, N 4.
P. 376-385.
Solter D. Mammalian cloning: advances and limitations I I Nat. Rev. Genet. 2000. Vol. 1, N 3.
P. 199-207.
Sukoyan M.A., Golubitsa A.N., Zhelezova A.I. et al. Isolation and cultivation of blastocyst-derived
stem cell lines from American mink (Mustela vison) // Mol. Reprod. Develop. 1992. Vol. 33,
N4. P. 418—431.
Takada T., lida K., Awaji T. et al. Selective production of transgenic mice using green fluorescent
protein as a marker//Nature Biotechnol. 1997. Vol. 15. P. 458—461.
Tarantul V.Z., Kucheriavy V.V., Makarova EV. et al. Rearrangements of microinjected recombi-
nant DNA in the genome of transgenic mice // Mol. and Gen. Genet. 1986. Vol. 203.
F 305-311.
Tarantul V.Z.. Makarova l.V., Andreeva L.E., Gazaryan K.G. A study of globin gene expression
in transgenic mice: analysis of the problem // Folia haemotol. 1987. Vol. 114, N 4.
P. 504-507.
Tarantul V., Nikolaev A., Hannig H. et al. Rearrangements of microinjected recombinant DNA in
the genome of transgenic mice I I Neoplasia. 2001. Vol. 3, N 2 P. 132-142.
Tarantul V.Z., Nikolaev A.I., Martmenko A.V. et al. Rearrangements of microinjected recombinant
DNA in the genome of transgenic mice // AIDS Res. Hum. Retrovir. 2000. Vol. 16, N 2.
P. 173-179.
Tomizuka K., Shinohara T., Yoshida H. et al. Double trans-chromosomic mice: maintenance of
two individual human chromosome fragments containing Ig heavy and kappa loci and expres-
sion of fully human antibodies // Proc. Nat. Acad. Sci. USA. 2000. Vol. 97. P. ITL-lTl.
Vogel J.. Hindrichs S.H.. Reynolds R.K. et al. The HIV tat gene induces dermal lesions resembling
Kaposi’s sarcoma in transgenic mice // Nature. 1988. Vol. 335. P. 606-611.
Wakayama T., Репу A.C., Zuccotti M. et al. Full-term development of mice from enucleated
oocytes injected with cumulus cell nuclei // Nature. 1998. Vol. 394. P. 369-377.
Wall R.J., Kerr D.E., Bondioli K.R. Transgenic dairy cattle: genetic engineering on a large scale //
J. Dairy Sci. 1997. Vol. 80. P. 2213-2224.
Wall R.J., Pursel V.G., Hammer R.E., Brinster R.L. Development of porcine ova that were cen-
trifuged to permit visualization of pronuclei and nuclei // Biol. Reprod. 1985. Vol. 32.
P. 645-651.
Ward K.A., Nancarrow C.D., Byrne C.R. et al. The potential of transgenic animals for improved
agricultural productivity // Rev. Sci. Technol. 1990. Vol. 9. P. 847-864.
Weihl C.C., Ghadge G.D., Kennedy S.G. et al. Mutant presenilin-1 induces apoptosis and down-
regulates Akt/PKB // J. Neurosci. 1999. Vol. 19. P. 5360-5369.
Wilmut 1., Schnieke A.E., McWhir J. et al. Viable offspring derived from fetal and adult mam-
malian cells Ц Nature. 1997. Vol. 385. P. 810-813.
Ye Y., Fortini M.E. Apoptotic activities of wild-type and Alzheimer’s disease-related mutant pre-
senilins in Drosophila melanogaster // J. Cell Biol. 1999. Vol. 146. P. 1351-1364.
АВТОНОМНЫЕ ТРАНСГЕНЫ
И ПЕРСПЕКТИВЫ ГЕННОЙ ТЕРАПИИ
А.И. Николаев
Отдел вирусной и клеточной молекулярной генетики
Рассматривается феномен автономного (экстрахромосомного) под-
держания экзогенной ДНК в эукариотической клетке, находящийся в не-
разрывной связи с функционированием механизма автономной репликации.
Подробно анализируются литературные и собственные данные по
судьбе различных автономных гибридных плазмид после их переноса в
культуру клеток и клетки полового пути высших эукариот. Большое
внимание уделено вопросу взаимосвязи дизайна рекомбинантных плазмид
со способностью к автономному поддержанию в клетке.
Обсуждаются возможность и варианты проектирования и использо-
вания автономных конструкций для нужд перспективной генной терапии.
Сформулированы некоторые новые требования, обеспечивающие безопас-
ность генно-терапевтических средств.
СПИСОК СОКРАЩЕНИЙ
ARS - автономно реплицирующаяся последовательность.
ACS - консенсусная ARS-последовательность.
ori - ориджин репликации ДНК.
EBV - вирус Эпштейн-Барр.
SV40 - вирус обезьяны 40.
BPV — вирус бычьей полиомы.
DUE - элемент ori, где происходит локальное расплетение ДНК.
ММТ - металлотионеиновый промотор мыши.
ТК - тимидин киназа.
спасение плазмиды - клонирование фракции кольцевой экзогенной ДНК (трансгена),
содержащей селективный маркер, с помощью трансформации клеток Е. colt суммар-
ной ДНК, выделенной из трансгенного организма, с последующим получением бак-
териальных колоний, содержащих этот трансген, на селективной среде.
ЭКСТРАХРОМОСОМНОЕ ПОДДЕРЖАНИЕ ТРАНСГЕНОВ
КАК ЗАКОНОМЕРНЫЙ ВАРИАНТ ТРАНСГЕНОЗА
Трансгеноз как метод переноса экзогенного генетического материала
в клетки полового пути реципиента известен на протяжении более 20 лет,
за которые был получен широкий круг трансгенных объектов (см. статью Ан-
дреевой и Тарантула, наст, сборник). К началу 80-х годов стало ясно, что экзо-
генная ДНК. перенесенная в клетки полового пути многих организмов, как
правило, случайным образом встраивается в хромосомы клетки-мишени
(Palmiter, Brinster, 1986) (рис. 78, А). Интегрированный в хромосому трансген
наследуется по закону Менделя (Jaenisch, 1988). Считается установленным, что
на уровень экспрессии интегрированного трансгена влияют такие факторы,
как нуклеотидные последовательности хозяйского генома, окружающие
трансген, структура хроматина в месте его интеграции, а также тандемная
организация трансгена в том случае, если его интеграция произошла в виде
218
мультикопийного повтора. Влияние этих факторов обусловливает вариацию
уровня экспрессии трансгена в различных трансгенных животных (Bishop,
1997).
Альтернативой традиционному подходу является получение трансген-
ных особей, в которых трансген присутствует в экстрахромосомной форме
и, тем самым, в меньшей степени подвергается многофакторному влиянию
генома хозяина (рис. 78, Б).
Последний подход первоначально представлялся умозрительным (чему
способствовал большой поток материала по интегрированным трансгенам),
до тех пор пока в середине 80-х годов не был продемонстрирован феномен
экстрахромосомного поддержания трансгена в трансгенных мышах (Kies-
sling et aL, 1986). Появление этих и других данных позволило предположить,
что для экстрахромосомного поддержания трансгена достаточным условием
является наличие в нем автономно-реплицирующейся последовательности
(ARS) подобной той, которая в те же годы была обнаружена в эндогенных
плазмидах дрожжей S. cereviciae (Umec et al., 1989). Для подтверждения этой
гипотезы в качестве средства автономной репликации трансгена был ис-
пользован механизм репликации ДНК-содержащих вирусов, достаточно хо-
рошо изученный к тому времени. С этой целью в одном из модельных опы-
тов в пронуклеус мышей была введена плазмида, несущая фрагмент генома
вируса полиомы, содержащий участок инициации репликации (ori) вируса,
а также последовательности трех Т-антигенов этого вируса, кодирующие
факторы необходимые для инициации репликации (Rassoulzadegan et al.,
1986). Было обнаружено, что трансгены в полученных животных Fo- и Fr
поколений, как и ожидалось, локализованы экстрахромосомно и наследова-
лись, как это также ожидалось, с нарушением законов Менделя. Оказалось,
что экстрахромосомные трансгены большинства трансгенных животных от-
личаются от исходной плазмиды тем, что вирусные последовательности
подверглись перестройкам и в ряде случаев вообще не выявлялись в составе
трансгенов. Вместо них в составе трансгенов появились последовательности
центромерной ДНК мыши, которые, как предположили авторы, вносили
определяющий вклад в поддержание экстрахромосомного статуса трансге-
нов в трансгенных мышах (Rassoulzadegan et al., 1986).
В другом эксперименте в качестве ARS-элемента гибридной конструк-
ции была использована последовательность из состава сложного хромосом-
ного ori, локализованного в локусе гена с-тус (рис. 79, А). Было обнаруже-
но, что данная конструкция, после ее переноса в ядро клеток полового пути
мышей (рис. 79, Б), поддерживалась в клетках хвоста мышей в течение не-
скольких поколений в качестве стабильного экстрахромосомного генетиче-
ского элемента, передаваемого из поколения в поколение с нарушением
менделевских законов наследования (рис. 79, В) (Sodo et al., 1990). Важный
момент данной работы заключался в том, что впервые была продемонстри-
рована ARS-активность фрагмента ori высших эукариот.
Таким образом, к началу 90-х годов возможность экстрахромосомного
поддержания трансгена была неоднократно экспериментально подтвержде-
на, а также был сформулирован принцип создания экстрахромосомных кон-
струкций, заключающийся во внесении ARS-элемента в известный клониру-
ющий вектор. В последующие годы исследования автономной репликации и
транскрипции экстрахромосомных трансгенов сконцентрировались глав-
ным образом на модели трансфецированных (трансформированных) клеток
219
A ARS фрагмент гена с-тус
Б
В
Микроинъекция ртиус(Н-Р)
в ядро клеток полового пути
Jtr
F0
1234 5 6789 10
ООО оооо□□□
F1
I 2 3 4 5 67 8 9 ЮП 1213
14 15 16 17 18 19
Рис. 79. Структура и неменделевское наследование автономного трансгена ртиус(Н-Р) в се-
мействах трансгенных мышей (Sudo et al., 1990)
А - схема переносимой конструкции ртус(Н-Р); темный участок конструкции: ARS-фрагмент из локуса
гена с-тус; неокрашенный участок конструкции: бактериальная последовательность плазмиды pUC19.
Б - этап переноса ртус (Н-Р) в ядро клеток полового пути мышей с помощью микроинъекции в зиготу.
В - неменделевское (100%) наследование конструкции ртус(Н-Р) по материнской линии: 1 и 2 - основа-
тели, трансгенные no ртус(Н-Р).
Мыши мужского пола (затемненные квадраты — трансгенные мыши, открытые квадраты — мыши без
трансгена); мыши женского пола (затемненные кружки - трансгенные мыши, открытые кружки - мы-
ши без трансгена); К - контрольные мыши
1
2
млекопитающих. При этом анализ ARS-активности рекомбинантных конст-
рукций, осуществляемый путем наблюдения за экстрахромосомными транс-
генами в трансфецированных клетках, превратился в один из методических
подходов к изучению строения как ori, так и ARS-элементов высших эука-
риот (Depamphilis, 1993).
220
ИЗУЧЕНИЕ УЧАСТКОВ ИНИЦИАЦИИ РЕПЛИКАЦИИ - ОСНОВА
ДЛЯ КОНСТРУИРОВАНИЯ АВТОНОМНЫХ ТРАНСГЕНОВ
В настоящее время установлено, что инициация репликации ДНК хро-
мосом, а также экстрахромосомной ДНК (эписом) происходит, как правило,
в определенных участках ДНК, называемых соответственно ori- и ARS-эле-
ментами репликации. Уже пионерные исследования структуры ori высших
эукариот показали, что они устроены гораздо сложнее, чем ori прокариот,
вирусов и дрожжей S. cerevisiae (Benbow et al., 1992). Инициация репликации
в области ori/ARS является многостадийным процессом, включающим коор-
динированное взаимодействие десятков ядерных факторов со специфиче-
скими сайтами в области ori, а также за его пределами (Coverly, Laskey,
1994).
К настоящему моменту изучено несколько ori высших млекопитаю-
щих, к числу которых относятся ori, локализованные в локусе DHFR
(DijkweL Hamlin, 1992, 1995; Vassilev et al., 1990), в области генов с-тус
(рис. 80, a) (Leffak, James, 1989; McWhinney, Leffak, 1990), гена Р-глобина
(Kitsberg et aL, 1993; Aladjem et al., 1995) и гена альдолазы В (Zhao et aL, 1994).
Важно, что для последних трех ori однозначно показано, что относительно
короткие хромосомные фрагменты этих элементов способны поддерживать
автономную репликацию содержащих их рекомбинантных плазмид в кле-
точной культуре, т.е. функционировать так же, как ARS-элементы
(рис. 80, А, Б). В целом однозначного соответствия между ARS-активностью
и хромосомной репликацией у высших эукариот не имеется, так как фраг-
менты ori высших эукариот не всегда обладают ARS-активностью даже в
одних и тех же типах клеток. Только в дрожжах S. cerevisiae было обнару-
жено, что ori и ARS этого организма во многом эквивалентны (Umec et aL,
1989). Принимая во внимание сходство принципов структурной организации
ori дрожжей и многоклеточных организмов, дрожжи можно рассматривать
как одну из возможных хозяйских систем для предварительной характери-
стики ARS-активности и отработки принципов конструирования автоном-
ных векторов.
Очевидно, характеристика новых ARS-элементов и изучение их структу-
ры (в том числе в сопоставлении со структурой хорошо охарактеризованных
ARS-элементов) может способствовать изучению различных аспектов регу-
ляции репликации ДНК, а также дать информацию по принципам дизайна
автономных конструктов.
В настоящее время известно лишь несколько подробно охарактеризо-
ванных ARS высших эукариот (De Pamphilis, 1999). К числу таких элементов
относится клонированный нами ARS, находящийся в составе стабильного
трансгена шелкопряда рг8а. Этот элемент является первым клонированным
ARS шелкопряда, способным, к тому же, к функционированию в других хо-
зяйских системах (Николаев и др., 1993, 1998). Функционирование ARS в не-
скольких гетерологичных системах является редким событием, имеются
лишь отдельные сообщения, фиксирующие примеры такого рода (Ariga et
aL, 1987; Hayashi et aL, 1997). Очевидно, данные такого рода являются значи-
мыми для выяснения влияния особенностей экспрессии генома в разных ти-
пах клеток на регуляцию автономной репликации. Сравнительное исследо-
вание ARS-активности в нескольких хозяйских системах, в том числе в
221
дрожжах S. cereviciae, может быть эффективным методом струк-
турно-функционального анализа ARS-элементов и составлять одно из
направлений функциональной геномики, в том числе функциональной ге-
номики человека. Эти работы могли бы служить основой, необходимой
для создания перспективных автономных конструкций в интересах генной
терапии.
ВИРУСНЫЕ ЭКСТРАХРОМОСОМНЫЕ КОНСТРУКЦИИ
Современные конструкции экстрахромосомных векторов основаны на
использовании компактных вирусных ori (сотни пар нуклеотидов), которые
нуждаются в вирусных транс-действующих факторах, активирующих эти
элементы. За последние 10-15 лет сконструированы экстрахромосомные
автономно реплицирующиеся векторы, использующие элементы реплика-
ции ДНК-содержащих вирусов: вируса Эпштейна-Барр (EBV), вируса обезь-
яны 40 (SV40), вируса бычьей полиомы (BPV), других паповавирусов.
Среди этого многообразия векторов наиболее изученными и удачно ис-
пользуемыми являются векторы, сконструированные на основе элементов
вируса Эпштейна—Барр. Преимущество этих векторов заключается в их вы-
сокой митотической стабильности, а также в низкой частоте перестроек по-
следовательностей вектора. Эти векторы способны к автономной реплика-
ции в клетках приматов, а также в клетках грызунов (Krysan, Calos, 1993;
Tomiyasu et al., 1998).
Механизм репликации векторов, основанных на элементах вируса Эп-
штейна-Барр хорошо изучен. Их функциональным компонентом является
ori Р - участок инициации репликации EBV, который взаимодействует с ви-
русным транс-действующим белком EBNA-1 (ядерным антигеном 1 вируса
EBV) (рис. 81). Ori Р включает в себя два компонента: FR (family of repeats),
который при связывании с EBNA-1 обеспечивает удержание вектора в ядре,
и DS (dyad symmetry element), который является собственно участком иници-
ации автономной репликации (Gahn, Schildkraut, 1989) (рис. 81). Ori Р обеспе-
чивает синхронную репликацию экстрахромосомного вектора с хромосом-
ной ДНК клеток-мишеней в течение ранней S-фазы клеточного цикла
(Adams, 1987).
В создании векторов на основе элементов EBV можно выделить две
стратегии: (а) конструирование рекомбинантных плазмид, включающих как
ori Р, так и ген EBNA.-1-, (б) конструирование плазмид, которые включают
только ori Р или один из его двух элементов (DS или FR). В последнем слу-
чае выявление характеристик экстрахромосомного поддержания конструк-
ций проводится в клетках конститутивно продуцирующих белок EBNA-1.
Последняя стратегия была использована для создания стабильной экст-
рахромосомной мультикопийной конструкции on PYAC, имеющей размер
не менее 600 т. п. н. (Simpson et al., 1996). В этой разработке ori P-область бы-
ла включена в YAC-плазмиду путем гомологичной рекомбинации в дрож-
жах S. cerevisiae. Полученная конструкция была перенесена в культуру кле-
ток человека, в которых экспрессировался белок EBNA-1. Было показано,
что конструкции ori PYAC была способна сохраняться экстрахромосомно в
течении 180 генераций в отсутствие селекции в связанном с хромосомами со-
222
стоянии, что говорит о высокой митотической стабильности конструкций.
В работе обращено внимание на то что ori P/EBNA-1 взаимодействие явля-
ется достаточным условием для стабилизации трансгенов и, по-видимому,
именно оно обусловливает низкий уровень их перестроек. Авторы считают,
что рекомбинантные плазмиды, подобные описанным в этой работе, могут
быть использованы для исследования генной экспрессии, функций генов
(путем комплементации мутантных фенотипов), а также для решения задач
генной терапии (Simpson et al., 1996).
Возможность стабильного поддержания рекомбинантных конструкций
на основе элементов EBV, несущих репортерный ген Р-галактозидазы, бы-
ла продемонстрирована для клеток грызунов (Tomiyasu et al., 1998). Был по-
казан высокий уровень экспрессии гена Р-галактозидазы во всех клеточных
линиях; при этом его экспрессия была продемонстрирована также и in vivo,
при непосредственной инъекции плазмид в сердце крысы. Особенностью
этой работы является использование непермессивных для EBV клеток-ми-
шеней, в которых трансгены были не способны к автономной репликации.
Несмотря на это, трансгены обладали большей митотической стабильно-
стью, чем контрольные конструкции, за счет чего обеспечивался повышен-
ный уровень репортерного продукта. Косвенно эти данные указывают на
функционирование FR-элемента ori Р и в клетках грызунов.
Имеются примеры использования векторов, сконструированных на ос-
нове элементов вируса EBV, для моделирования решения некоторых генно-
терапевтических подходов. Так, например, была показана вероятная эффе-
ктивность таких векторов в целях локальной генной терапии EBV-ассоции-
рованных неоплазм (Hirai et al., 1997). В этой работе были сконструированы
экстрахромосомные векторы, содержащие ori Р и экспрессионную кассету
ТК гена вируса герпеса. Эти конструкции были перенесены в культуру лим-
фомных клеток, в которой далее был обнаружен высокий уровень экспрес-
сии ТК гена. В конечном итоге было продемонстрировано ингибирующее
действие продукта ТК гена на рост культуры лимфомных клеток.
Недавно были предложены две новые стратегии генной терапии лим-
фомных заболеваний, ассоциированных с EBV, которые основаны на пере-
носе гена-убийцы (цитозин диаминазы (CD)) в В-клеточные лимфомы с
помощью векторов, основанных на элементах EBV (Кеппу et al., 1998).
Эти стратегии основаны на индукции процессов, приводящих в конечном
итоге к апоптозу, за счет экспрессии гена CD в клетках лимфом в присутст-
вии 5'-флюороцитозина.
Первая стратегия заключается в использовании стандартного вектора
(ori Р-CD), содержащего ген CD, и ori Р, который способен к автономной ре-
пликации только в клетках лимфом и не обладает способностью к передаче
от клетки к клетке. Вторая - вектора ori Lyt-CD, содержащего литический
ori EBV, последовательности, отвечающие за упаковку вируса, а также ген
BZF1 EBV, который включает экспрессию ряда белков вируса, необходимых
для функционирования ori Lyt. Последняя конструкция реплицируется с oi I
Lyt-CD домена в EBV-позитивных В-клетках лимфом, упаковывается в псев-
довирион и, благодаря этому, может инфицировать другие клетки, содержа-
щие соответствующий рецептор.
Было продемонстрировано, что каждая из этих стратегий генной тера-
пии вызывает гибель EBV-позитивных В-клеток in vitro (в присутствии
223
5'-флюороцитозина). Авторами данных стратегий обсуждаются преимуще-
ства той или иной схемы для терапии различных типов лимфом (Кеппу et al.,
1998).
Довольно широкое применение для моделирования генной терапии по-
лучили также векторные системы, сконструированные на основе элементов
вируса SV40, которые во многих отношениях функционируют подобно век-
торным системам, основанным на элементах EBV. Они также включают ви-
русный цис-действующий элемент (ori репликации) и транс-действующий
фактор - большой Т антиген вируса SV40 (T-ag SV40). Взаимодействие T-ag
с ori SV40 хорошо изучено и является эталонным объектом исследования
ДНК-белок взаимодействий (Boroviec et al., 1990). Исследование судьбы про-
стой конструкции, созданной на основе этих элементов с добавлением гена
селективного маркера, показало возможность обеспечения чрезвычайно
высокой копийности автономного трансгена, часто превышающей уровень
1000 копий плазмидной ДНК на клетку. В cos-7 клетках такой трансген ста-
бильно поддерживался в течении двух месяцев, причем автономная реплика-
ция трансгена происходила синхронно с репликацией хромосомной ДНК
(Chittenden et al., 1991). Высокая копийность конструкций на основе ori SV4O,
которая недостижима для других векторов, делает их возможными прототи-
пами для отдельных задач генной терапии.
Однако известной особенностью этих конструкций является то, что
T-ag SV40 способен связываться с белками-супрессорами злокачественной
трансформации и тем самым вызывать и/или модулировать ряд процессов
злокачественной трансформации клетки (Jiang et al., 1993). Замечательным
развитием конструкции векторов этого типа, дающим начало новому напра-
влению в создании вирусных конструкций, является модификация гена боль-
шого T-ag, приводящая к значительному снижению его трансформирующе-
го потенциала. Оказалось, что для этой модификации необходимо сделать
несколько нуклеотидных замен в гене, приводящих к одной-двум аминокис-
лотным заменам в его продукте (рис. 82).
Знаменательным шагом на этом пути стала разработка M.J. Cooper с со-
трудниками модифицированного безопасного вектора, основанного на ис-
пользовании элементов вируса SV40 (Cooper et al., 1997). Эта векторная сис-
тема использует мутантный по 107 и 402 аминокислотам T-ag, который не
взаимодействует с продуктами антионкогенов р53, р107, RB ( рис. 82, А и Б).
Сконструированная в этой работе векторная система включает вектор-
помощник, содержащий ori и модифицированный T-ag, находящийся под
контролем CMV-промотора. Вторая конструкция - репортерный вектор -
включает репортерный ген и ori SV40. Котрансфекция этих плазмид приво-
дит к поддержанию высокой копийности автономных конструкций в не-
скольких культурах раковых клеток человека и в лимфоидных клетках Рад-
жи (рис. 82, В). При этом уровень репортерной экспрессии, обеспечиваемый
этой системой, более чем на порядок превышает уровень, достижимый с по-
мощью нереплицирующихся простых плазмидных конструкций (рис. 82, Г)
(Cooper et al., 1997).
Другой подход к проблеме "безопасности” вирусных конструкций был
развит в работе по созданию автономной конструкции, способной функцио-
нировать вообще без большого T-ag (Piechazek et al., 1999). Для этого в век-
тор, содержащий ori SV40, был вставлен S/MAR-элемент (scaffold matrix
224
attached region) гена Р-интерферона человека. Результаты, полученные с по-
мощью гибридизации и спасения плазмиды, показали, что такие экстрахро-
мосомные векторы высокостабильно поддерживаются в СНО клетках при
низком уровне их копийности. Автономная репликация данных конструк-
тов, по-видимому, осуществляется за счет взаимодействия эндогенного он-
кобелка Мус (который способен заменить T-ag в качестве транс-действую-
щего фактора репликации) с ori, а их стабильное поддержание обеспечива-
ется благодаря S/MAR-последовательностям, связывающим их с хозяйскими
хромосомами. Можно думать, что низкокопийный и митотически стабиль-
ный вектор такого типа может быть использован в некоторых стратегиях
генной терапии, направленных на долговременную и одновременно на низ-
коуровненную дозировку генно-терапевтического средства.
Помимо этих двух охарактеризованных выше уникальных векторных
систем существуют и иные возможности для обеспечения экстрахромосом-
ного поддержания рекомбинантных ДНК за счет элементов генома некото-
рых других ДНК-содержащих вирусов. Из возможных вариантов (ВК-виру-
сы, папиломавирусы, полиомавирусы и др.) необходимо отметить удачное
использование модифицированных элементов генома вируса полиомы для
создания стабильной автономной конструкции, способной к длительному су-
ществованию без интеграции в геном в культуре эмбриональных стволовых
клетках мыши, а также в культурах различных клеток мыши при наличии
селективного давления. Введение в эту конструкцию репортерного гена по-
казало высокий уровень его экспрессии во всех исследованных типах клеток
(Gassman et al., 1995; Camenisch et al., 1996).
Очевидно, вирусные конструкции обладают уникальными свойствами в
плане моделирования некоторых вариантов генной терапии. Однако клас-
сические вирусные векторы не могут быть прямо использованы для перспе-
ктивных задач генной терапии (кроме, быть может, некоторых случаев те-
рапии лимфо-пролиферативных заболеваний) ввиду потенциального транс-
формирующего действия собственных транс-действующих факторов, при-
водящего к нарушению основных требований по безопасности лечения.
Безусловно перспективным направлением в данной области является разра-
ботка новых и тестирование имеющихся векторных систем, транс-действу-
ющие факторы которых в значительной степени утрачивают трансформи-
рующую способность (онкогенный потенциал). Однако даже и в этом случае
в настоящий момент трудно адекватно оценить их воздействие на живой
организм.
НЕВИРУСНЫЕ ЭКСТРАХРОМОСОМНЫЕ КОНСТРУКЦИИ
В настоящий момент в свете новых требований к безопасности генно-
терапевтических средств для перспективной генной терапии стала актуаль-
ной разработка невирусных автономно-реплицирующихся конструкций.
Безопасность конструкций этого рода связана не только со стабильным
поддержанием их автономного статуса в клетках-мишенях, но и с отсутст-
вием побочного действия (онкопотенциала) факторов, регулирующих ori
этих систем. Для конструирования перспективных векторов необходим по-
иск новых и использование известных компактных эукариотических ori-
8. Проблемы и перспективы...
225
элементов, регулируемых эндогенными факторами клеток-мишеней выс-
ших эукариот.
На данный момент еще не создано каких-либо генно-терапевтических
конструкций с эукариотическими ori, однако ведуться интенсивные исследо-
вания ARS-активности отдельных фрагментов некоторых ori в культурах
клеток млекопитающих. Целью этих работ является определение модуль-
ной структуры ori. В тех случаях, когда участок инициации репликации име-
ет компактный размер (2-4 т.п.н.), данные о его структуре могут быть ис-
пользованы для поиска дизайна автономных конструкций.
В геноме высших млекопитающих картирована серия ori, потенциально
способных к функционированию в качестве ARS-элементов (De Pamphilis,
1999). В эту серию входят несколько хорошо изученных ori двунаправлен-
ной репликации (OBR) гена дегидрофолатредуктазы (DHFR) и гена c-myqi
К первым ori относиться «п'Р и oriy, локализованные в обширной зоне ини-
циации репликации (более 30 т.п.н.), расположенной вблизи 3' конца гена
DHFR (Dijkwel, Hamlin, 1992, 1995).
Плазмиды, сконструированные на основе фрагментов огг’Р, несущие се-
лективный маркер, были способны автономно реплицироваться в культуре
клеток человека при селективном давлении (Zannis-Hadjopoulos et al„ 1994).
Плазмида, содержащая примыкающий к orifl фрагмент ДНК, размером
4.8 т.п.н., также способна к автономной репликации и, по-видимому, содер-
жит самостоятельный ori (orifi'~) (Kobayashi et al., 1998). Продемонстрирова-
но, что примыкающие к оп’Р участки ДНК могут оказывать решающее вли-
яние на ARS-активность содержащих их конструктов (Caddie, Calos,
1992).
В настоящий момент наиболее перспективными для генно-терапевтиче-
ских целей представляются работы по изучению участка 5'-фланкирующей
последовательности ДНК протоонкогена с-тус, продукт которого стимули-
рует репликацию, взаимодействуя с собственным ori (Ariga et al., 1989;
Leffak, James, 1990). Результаты работ группы Леффака показали, что ини-
циация репликации ДНК в области гена с-тус в клетках HeLa происходит
главным образом во фрагменте ДНК размером 2,4 т.п.н., расположенном
непосредственно перед промотором гена (рис. 80, A) (Malot, Leffak, 1999).
Для характеристики ARS-активности этого (Ьрагмента гена с-тус
(Hindlll-Xhol фрагмент, размером 2,4 т.п.н), была сконструирована плазми-
да pNeo. Мус-2.4, содержащая также селективный маркер и бактериальную
последовательность плазмиды pML2 (рис. 80, Б) (McWhinney, Leffak, 1990).
Перенос этой конструкции в клетки HeLa с последующим картированием
новообразованной ДНК показал, что pNeo. Мус-2.4 обладает способностью
к автономной репликации, инициируемой в двух сайтах HindIII-XhoI-фраг-
мента этой плазмиды, содержащего ДНК с-тус (рис. 80, А, В) (Trivedi et al.,
1998).
Поддержание автономного статуса этого трансгена в клетках HeLa при
селективном давлении продолжалось в течение более чем 300 генераций
(примерно 1 год) с увеличением количества первоначально перенесенной в
клетку плазмидной ДНК в 1000 раз. Важно отметить, что в ходе столь про-
должительных периодов персистирования не было обнаружено интеграции
этой конструкции в хромосому (McWhiney, Leffak, 1990). Копийность данно-
го экстрахромосомного трансгена в клетках HeLa составляла 30-100 копий
226
на клетку. Было показано, что данный конструкт обладает значительной
митотической стабильностью: за одну клеточную генерацию в отсутствие
селекции терялось не более 5% плазмиды pNeo.Myc-2,4, что на порядок ни-
же, чем уровень потери нереплицирующихся плазмид (McWhiney, Leffak,
1990) (рис. 80В).
В настоящее время составлена структурно-функциональная карта раз-
личных генетических элементов фрагмента 2,4 т.п.н. (Trivedi et al., 1998) и
проводится ее дальнейшая детализация. В составе этого фрагмента обнару-
жены три ACS, семь участков гиперчувствительности к ДНКазе, элемент
DUE, а также минимизированный ARS, поддерживающий автономную реп-
ликацию содержащих его плазмид in vivo и in vitro. Локализация минимизи-
рованного ARS на фрагменте 2,4 т.п.н. подтверждена данными двумерного
электрофореза и электронной микроскопии (Trivedi et al., там же).
Таким образом, данные по тестированию ARS-активности фрагментов
ori с-тус, показывают его потенциальную применимость к созданию перспе-
ктивных персистирующих экспрессирующих векторов. Важным моментом
для использования этого ori является прогнозируемость его функциональ-
ной активности в различных типах клеток (Tao et al., 1997), а также возмож-
ность сопряжения процессов автономной репликации и транскрипции
в гибридных конструкциях, содержащих этот элемент (McWhiney, Leffak,
1990).
ПОЛУЧЕНИЕ И ХАРАКТЕРИСТИКА
СТАБИЛЬНОГО АВТОНОМНОГО
ТРАНСГЕНА ТУТОВОГО ШЕЛКОПРЯДА рг8а
ОБРАЗОВАНИЕ ЭКСТРАХРОМОСОМНЫХ ФОРМ ТРАНСГЕНА
ПРИ ПЕРЕНОСЕ ЭКЗОГЕННОЙ ДНК В РАННИЕ ЭМБРИОНЫ
ШЕЛКОПРЯДА В. MORI
На модели трансгенного тутового шелкопряда нами проводилось изуче-
ние судьбы экзогенной ДНК после ее переноса в клетки полового пути на-
секомых. На первоначальном этапе работы определялось влияние условий
микроинъекций ДНК на выход жизнеспособных особей и влияние введен-
ной ДНК на развитие оперированных особей. После решения технических и
методических вопросов, связанных с отработкой технологии микроинъек-
ций ДНК в ранние эмбрионы (грену) и получения трансгенных особей (Ни-
колаев, Кафиани, 1988, Николаев и др. 1989а), основное внимание было со-
средоточено на характеристике процесса переноса и передачи по наследст-
ву экзогенной плазмидной ДНК.
Нами были проведены серии микроинъекций в грену различных реком-
бинантных ДНК с последующим анализом их судьбы методом блот-гибри-
дизации. На первом этапе осуществлялась совместная микроинъекция кон-
струкций, что позволило быстро получить исходную информацию. С этой
целью в ранние эмбрионы шелкопряда была перенесена комбинация из двух
плазмид представляющая систему транспозиции, основанную на функции
P-элемента дрозофилы и комбинация плазмид рр25.1 (кодирующей Р-эле-
мент дрозофилы) и pPrdlLTRl.5 (несущей копии LTR вируса RSV). В обо-
их случаях были получены однотипные результаты.
8*
227
Основной результат, полученный в этих и других опытах, заключался в
том, что плазмидная экзогенная ДНК после ее переноса в ранние эмбрионы,
поддерживалась во фракции экстрахромосомной ДНК вне зависимости от
ее генетической структуры.
В качестве методического подхода к определению физического статуса
трансгенов нами использовался электрофорез суммарной ДНК трансгенных
шелкопрядов без рестрикции. В случае комбинации плазмид рр25.1 и
pPrCHLTR1.5 автономный статус гомологичных трансгенов был определен
по присутствию дискретных полос гибридизации в области молекулярных
весов меньших, чем у тотальной хромосомной ДНК (рис. 83, дорожки 1 и 2).
Автономные трансгены представляли собой низкокопийные плазмиды (по-
рядка 1-3 копии на геном), которые передавались по наследству (Николаев
и др. 1989а, б). Исследование структуры экзогенной ДНК блот-гибридизаци-
ей с рестрикцией показало, что после введения в грену экзогенная ДНК пре-
терпевала структурные перестройки как в соматических клетках эмбриона-
реципиента, так и в клетках полового пути. Об этом свидетельствовало из-
менение картины гибридизационных сигналов как с нерестрицированной
(рис. 83, дорожки 1, 2), так и с рестрицированной тотальной ДНК бабочек
Fo- и Fj-поколений (рис. 83, дорожки 3-7). При этом было обнаружено, что
экстрахромосомные трансгены у сибсов А и Б (дорожки 4—5, 6-7) одной
и той же родительской пары отличаются и друг от друга и от родительско-
го (дорожка 3).
Блот-гибридизационный анализ перестроек ДНК трансгенов также по-
казал, что одни и те же гибридизационные сигналы детектируются с помо-
щью зондов, полученных из разных переносимых конструкций. Эти наблю-
дения, взятые вместе, свидетельствуют о рекомбинации между экстрахро-
мосомными трансгенами и указывают на высокий уровень активности ре-
комбинационной системы ранних эмбрионов шелкопряда. Можно предполо-
жить, что такая активность локализована в области полярной плазмы ран-
них эмбрионов (стадия синцициальной бластодермы) шелкопряда, в кото-
рую производились микроинъекции ДНК.
Принимая во внимание накопленный экспериментальный материал, мы
заключили, что обнаружение экстрахромосомных экзогенных ДНК в ба-
бочках Fo представляло собой закономерный исход всех экспериментов по
трансгенезу на тутовом шелкопряде и происходило с вероятностью ~5%,
равной вероятности получения трансгенного шелкопряда в результате еди-
ничной микроинъекции. Но и эта сравнительно небольшая вероятность
получения трансгенных особей представляется значительной, если принять
во внимание отсутствие во вводимых рекомбинантных конструктах
ori / ARS-элементов. Наличие в бабочках Fo экстрахромосомной экзогенной
ДНК, прошедшей (по минимальной оценке) 104-кратную репликацию, пред-
полагает, что введенные молекулы ДНК приобрели подобные элементы за
счет внутренних перестроек или за счет рекомбинации с молекулами фрак-
ции эндогенной экстрахромосомной ДНК шелкопряда (рис. 83 и 84). В обо-
их случаях экзогенные рекомбинантные ДНК должны были бы претерпеть
структурные перестройки, что и показал блот-гибридизационный анализ.
Одним из важных его результатов явилось обнаружение гомологичной ге-
ному шелкопряда “дополнительной” ДНК в составе автономных трансгенов
уже в особях-основателях трансгенных линий (рис. 84).
228
Без
рестрикции
Рестриктаза
PstI
1 2 3 4 5 6 7
8 т.п.н.
4 т.п.н.
1.2 т.п.н.
Рис. 83. Обнаружение нестабильных экстрахромосомных трансгенов тутового шелкопряда,
образовавшихся после переноса рекомбинантное экзогенной ДНК в ранние эмбрионы с по-
мощью блот-гибридизационного анализа (Николаев и др., 1989)
Дорожки: 1 - суммарная ДНК основателя семейств сибсов А и Б; 2 - суммарная ДНК одного из сибсов А;
3 — суммарная ДНК основателя, гидролизованная t'sfl; 4—5 — суммарная ДНК сибсов семейства А, гидро-
лизованная Р.«1; 6-7 - суммарная ДНК сибсов семейства Б, гидролизованная PstI
Можно предполагать, что тутовый шелкопряд В. mori обладает уникаль-
ной рекомбинационной системой, которая в ряде случаев может быть ис-
пользована для модификации переносимой ДНК с целью придания ей спо-
собности к экстрахромосомному поддержанию в клетках этого организма.
СТАБИЛИЗАЦИЯ СТРУКТУРЫ ТРАНСГЕНОВ
в р2-поколении трансгенного тутового шелкопряда
Для дальнейшей характеристики поддержания экстрахромосомных
трансгенов у тутового шелкопряда было предпринято систематическое изу-
чение судьбы рекомбинантной плазмиды pPrCHLTR1.5 после ее переноса в
ранние зародыши этого насекомого. В ходе этого исследования, как и в пре-
дыдущих случаях, было установлено, что гомологичные введенной плазми-
де последовательности передавались потомству в экстрахромосомной фор-
ме со структурными перестройками. Анализ серии блот-гибридизаций поз-
229
волил составить схему перестроек pPrCHLTR1.5, имевших место от момен-
та переноса этой конструкции в ранние эмбрионы шелкопряда и далее до
поколения F2 трансгенных насекомых. Эта схема приведена на рис. 84. (Ни-
колаев и др., 1991, 1993а; Nikolaev et al., 19936). Из Р2-поколения трансген-
ных насекомых методом спасения плазмиды нами был клонирован автоном-
ный трансген рг8а (Чкония и др., 1991). Эта плазмида (рг8а) образовалась в
клетках тутового шелкопряда в результате негомологичной рекомбинации
in vivo между переносимой плазмидой pPrCHLTR1.5 (Gazaryan et al., 1987) и
ДНК хозяина в Р0-Р2-поколениях трансгенных насекомых (рис. 84, А). Было
показано, что “спасенная” плазмида рг8а содержит бактериальную последо-
вательность pBR322 (BamHI-EcoRI фрагмент размером 3.6 т.п.н.) и фраг-
мент последовательности ДНК шелкопряда размером 4 т.п.н., соединенный
с бактериальной последовательностью (рис. 84, Б). Эта последовательность
содержит ARS шелкопряда, обеспечивающий экстрахромосомное (автоном-
ное) поддержание трансгена в клетках тутового шелкопряда. Важно, что все
небактериальные последовательности pPrCHLTR1.5, в том числе и LTR, от-
сутствуют в рг8а (Чкония и др., 1991; Николаев и др. 1992).
Для проверки стабильности структуры рг8а были получены трансгенные
насекомые Р3-поколения, а также был осуществлен перенос собственно рг8а
в ранние эмбрионы тутового шелкопряда.
Блот-гибридизационный анализ показал, что трансгены особей Р3-поко-
ления и вновь полученных основателей неотличимы от рг8а (Николаев и др.,
1993а). Кроме того, нами было проведено “спасение плазмиды” из препара-
тов тотальной ДНК бабочек F3 и Fo поколений (вновь полученные основате-
ли). Детальный рестрикционный анализ “спасенных” плазмидных ДНК так-
же показал, что трансгены во всех исследованных случаях имеют автоном-
ный статус и идентичны рг8а (Николаев и др. 1992, 1993а).
Таким образом, в отличие от передачи трансгенов по наследству в F0-F2
поколениях (в процессе которых имели место перестройки структуры
трансгенов), в F2 и дальнейших поколениях трансгенных насекомых про-
изошла стабилизация структуры автономного трансгена в форме плазмиды
рг8а. Самостоятельный перенос этой плазмиды в ранние эмбрионы тутово-
го шелкопряда был более не связан с изменениями структуры трансгена, что
позволяет сделать заключение о том, что рг8а является стабильным авто-
номным трансгеном тутового шелкопряда, содержащим ARS-элемент шел-
копряда.
АВТОНОМНЫЙ СТАТУС И НЕСЛУЧАЙНЫЕ ПЕРЕСТРОЙКИ рг8а
И ЕЕ ДЕРИВАТОВ В ТРАНСГЕННЫХ МЫШАХ
Для выяснения степени универсальности функции ARS рг8а был осуще-
ствлен перенос этой плазмиды в зиготу мыши. Микроинъекции плазмидной
ДНК были сделаны либо в цитоплазму зиготы, либо в мужской пронуклеус.
Трансгенные мыши были получены только во втором варианте микроинъ-
екций, что свидетельствует о локализации процесса автономной репликации
рг8а в ядре клеток раннего эмбриона мыши.
Изучение схемы наследования трансгена показало, что имела место не-
менделевская, близкая к 100% передача трансгена между поколениями Fo и
230
Трансгенные мыши Р2-поколения
1 2 3 4 5 6
олигомерные
трансгены
23 т.п.н.
мономерные
трансгсны
1.8 т.п.н.
ТТИ 1 ' .п Н
СТАБИЛИЗАЦИЯ
ГРАНСТЕНОВ
Рис. 85. Обнаружение и характеристика экстрахромосомных трансгенов мышей Р2-поколе-
ния, потомков основателя № 1, полученного после переноса в пронуклеус мыши плазмиды
рг8а с помощью блот-гибридизационного анализа (Nikolaev et al., 2003)
№ 1 -6 - трансгенные мыши Fj-поколения, содержащие экстрахромосомные трансгены, имеющие размер
3 т.п.н. (см. также рис. 86, Б) 3 т.п.н. - положение линеаризованного трансгена
F,, а также между F, и F2. Это наблюдение свидетельствовало в пользу авто-
номного статуса трансгена. Однозначный вывод об автономном статусе
трансгенов не мог быть нами сделан (на этом этапе) ввиду недостаточного
для адекватной статистики количества трансгенных животных.
Для определения физического статуса трансгена в клетках мышей F2-no-
коления был проведен блот-гибридизационный анализ тотальной ДНК без
ее рестрикции (см выше). Как и в случае трансгенных тутовых шелкопря-
дов, гибридизационные сигналы в низкомолекулярной (по сравнению с хро-
мосомной ДНК) области были обнаружены у шести трансгенных мышей F2
поколения (рис. 85). Идентичность гибридизационных картин во всех иссле-
дованных случаях указывает на очень близкое структурное сходство транс-
генов этих мышей и свидетельствует о стабилизации структуры трансгенов
в Р2-поколении трансгенных животных. Множественность гибридизацион-
ных сигналов отражает существование в мышах Р2-поколения нескольких
физических форм трансгена. Из этих форм одна имеет подвижность, кото-
рая совпадает с подвижностью линейной формы трансгена (3 т. п. н., см. ни-
231
же), тогда как остальные могут представлять собой либо суперспирализо-
ванные формы (1,8 т. п. н.), либо относительно высокомолекулярные олиго-
мерные формы (рис. 85).
Для более подробного изучения структуры автономных трансгенов у
мышей нескольких поколений был проведен классический блот-гибридиза-
ционный анализ, из которого следовало, что, начиная с момента переноса и
далее при передаче по наследству вплоть до Е2-поколения, в исходной плаз-
миде (рг8а) происходили последовательные делеции (Николаев и др. 1998),
схема которых представлена на рис. 86,А. В результате таких делеций в
трансгенах мышей Е2-поколения была потеряна бактериальная и частично
шелкопрядная последовательности рг8а. Важно, что картина делеций была
одна и та же в потомстве основателей. При этом все исследованные транс-
гены Р2-животных содержали 80%-часть ARS рг8а, приблизительно совпада-
ющую с EcoRI-PvuII фрагментом этого элемента размером 3 т. п. н и были
лишены бактериальной последовательности вектора (рис. 86,Б) (Николаев
и др. 1998).
Таким образом, при исследовании судьбы рг8а в трансгенных мышах на-
ми были получены данные, свидетельствующие в пользу неслучайного хара-
ктера перестроек автономного трансгена.
АКТИВНОСТЬ ARS ргва В КЛЕТКАХ ДРОЖЖЕЙ
Одной из наиболее известных хозяйских систем по изучению автоном-
ной репликации являются дрожжи S. cereviciae. Действительно, на этой мо-
дельной системе выполнено большинство работ по анализу процесса иници-
ации репликации ДНК и по определению состава предрепликационного
комплекса (см. обзоры: De Pamphilis, 1999; Spredling, 1999). К настоящему
времени также хорошо изучена структура дрожжевых оп и ARS-элементов
(Koshland, 1985), которые во многом эквивалентны. Известно, что ACS-эле-
менты дрожжей S. cereviciae являются обязательным компонентом ori выс-
ших эукариот (Benbow et al., 1992). Принимая во внимание эти данные, мы
решили определить ARS-активность полных и делеционных вариантов ARS
рг8а для определения его модульной структуры и для выявления его потен-
циально минимизированных вариантов.
Для того чтобы определить, способен ли ARS стабильного трансгена
рг8а поддерживать в дрожжах S. cerevisiae автономную репликацию, были
сконструированы плазмиды р(27-8)- и р(27-8)+, содержащие почти полную
последовательность ARS рг8а, (3,95 т. п. н EcoRI-BamHI-фрагмент), клони-
рованную в интегративном дрожжевом векторе (pVL27) в обоих возможных
ориентациях.
ARS-активность конструкций, содержащих этот фрагмент рг8а, опреде-
лялась по частоте трансформации (измерялась в расчете на 1 мл трансфор-
мированных клеток и на 1 мкг вносимой ДНК). Эти данные приведены в
таблице (Легчилина и др. 2001), из которых следует, что эффективность
трансформации дрожжевых клеток гибридными плазмидами р(27-8)
и р(27-8)+ составляет ~104 на мкг плазмидной ДНК. Эта величина соответст-
вует уровню эффективности трансформации с использованием контроль-
ной плазмиды репликативного типа pYAC4 и является характерной для
232
Эффективность трансформации штамма S. cerevisiae YPH857 гибридными плазмидами,
содержащими фрагменты трансгена рг8а
Плазмиды Эффективность трансформации на 1мл компетентных клеток Эффективность трансфор- мации на 1 pg вносимой ДНК
РУас4 1,2 X 105 0,8 х 104
р(27-8)+ 1,1 X 105 0,7 х 104
р(27-8)“ 1,2 X 105 0,8 х 104
p(27-8)h-2.4 1,5 х 105 1,0 х 104
p(27-8)h-0.9 Не определена <1
p(27-8)h-0.6 Не определена <1
pVL27 Не определена <10“2
плазмид, содержащих “сильный” дрожжевой ARS. Эффективность транс-
формации клеток дрожжей плазмидой pVL27, интегрирующей в геном, бы-
ла в 10б раз меньше, чем соответствующие величины для гибридных плаз-
мид. При этом ориентация встроенного фрагмента рг8а в этих плазмидах не
отразилась на эффективности трансформации. Таким образом, высокая ча-
стота появления трансформантов является фактом, отражающим автоном-
ную репликацию р(27-8) и р(27-8)+ и связанное с этим их экстрахромосом-
ное поддержание в трансформированных дрожжевых клетках.
частично
перестроенные
трансгены
стабильные
трансгены
1 2 3 4 5 6
7 8 9 10 11 12
0,5 т.п.н.--------
Рис. 87. Электрофореграмма траисгеиов, “спасенных” из дрожжевых трансформантов и гид-
ролизованных рестриктазой PvuII (Легчилина и др., 2001)
1 - вектор р(27-8)+; 2-5 - плазмиды, “спасенные” из клеток культуры дрожжей, трансформированных
вектором р(27-8)+, Во всех трансгенах присутствует “дополнительный” фрагмент ДНК, имеющий раз-
мер 0,5 т‘.п,н. 7 — вектор р(27—8)~ 8—12 — плазмиды, “спасенные” из клеток культуры дрожжей, трансфор-
мированных вектором р(27-8)_; 6 - ДНК фага К, гидролизовгнная PstI
233
Челночная структура гибридных плазмид позволила провести спасение
гомологичных трансгенов, с последующим рестрикционным анализом их
структуры (рис. 87). Этот анализ показал, что молекулярный вес плазмид и
их структура остались без изменений в случае с вектором р(27-8). Плазмиды
с противоположной ориентацией вставки - р(27-8)+ были подвержены одно-
типным структурным перестройкам. Действительно, из электрофореграм-
мы видно, что во всех вариантах “спасенных” трансгенов, имеющих данную
ориентацию экзогенной ДНК, появлялся дополнительный низкомолекуляр-
ный фрагмент (0,5 т. п. н.). Наличие однотипной перестройки структуры
вносимой ДНК, так же как и в случае вышеприведенных наблюдений за
судьбой дериватов рг8а в трансгенных мышах, свидетельствует о направлен-
ном характере перестройки конструкции р(27-8)+ (рис. 87) (Легчилина и др.
2001).
Таким образом, полученные данные показывают, что полноразмерный
фрагмент ДНК стабильного трансгена рг8а размером 3,95 т. и. н., встроен-
ный в дрожжевую плазмиду интегративного типа pVL27, способен функци-
онировать в дрожжевых клетках как ARS и поддерживать тем самым авто-
номный статус этой конструкции.
ТЕСТИРОВАНИЕ ARS-АКТИВНОСТИ ДЕЛЕЦИОННЫХ
ВАРИАНТОВ ргваВ ТРАНСФОРМИРОВАННЫХ ДРОЖЖАХ
Для того чтобы выяснить, какой субфрагмент интактного фрагмента
размером 3,95 т. п. н. стабильного трансгена рг8а является ответственным за
ARS-активность в трансформированных дрожжах, нами были сконструиро-
ваны гибридные плазмиды: p(27-8)h-2,4, p(27-8)h-0,6, p(27-8)h-0,95, содер-
жащие PvuII-PvuII и RcoRI-PvuII субфрагменты ARS-последовательности
рг8а размерами 2,4, 0,9 и 0,6 т. п. н. соответственно, которые были клониро-
ваны в дрожжевом интегративном векторе pVL27. Этими гибридными кон-
структами была проведена трансформация дрожжей S. cerevisiae и результа-
ты ее эффективности представлены в таблице (Легчилина и др. 2001).
Как видно из этой таблицы, вариант трансформации с использованием
плазмиды p(27-8)h-2,4 (содержащей только центральную часть ARS рг8а)
на 25% более эффективен по сравнению с конструктами, несущими полно-
размерный шелкопрядный фрагмент рг8а. Наоборот, трансформация дрож-
жевых клеток гибридными плазмидами, в состав которых входили
EcoRI-PvuII фланкирующие последовательности ARS рг8а (варианты
p(27-8)h-0,6 и p(27-8)h-0,9), была стабильно неэффективной - дрожжевые
трансформанты не возникали, что говорит об отсутствии в изолированных
фланкирующих фрагментах собственной ARS-активности. Из полученных
данных можно сделать вывод о том, что только центральная часть
(2,4 т. п. н.) шелкопрядного фрагмента рг8а проявляет собственную ARS-ак-
тивность в трансформированных дрожжевых клетках. Из этого следует, что
DUE (элемент, в котором происходит локальное расплетение ДНК) должен
находиться в центральном фрагменте рг8а.
Особенностью поддержания гибридных конструкций в трансформиро-
ванных дрожжах являлась низкая митотическая стабильность соответству-
ющих автономных трансгенов, составляющая величину ~1%. При этом об-
наруживается, что гибридная конструкция, содержащий центральный PvuII-
234
фрагмент ARS рг8а, обладает в 6 раз большей митотической стабильностью,
чем конструкты, содержащие полноразмерный ARS. Это позволяет заклю-
чить, что субфрагменты, фланкирующие центральный фрагмент, не обла-
дающие собственной ARS-активностью, также не активны и в отношении
регуляции автономной репликации и точности сегрегации трансгенов в
клетках трансформированных дрожжей. В конечном итоге это означает,
что ARS рг8а не является функциональным эквивалентом дрожжевых
ARS-элементов, а, по-видимому, имеет лишь минимально необходимые
структурные гомологии, требующиеся для автономной репликации в клет-
ках дрожжей.
ОСОБЕННОСТИ СТРУКТУРЫ ARS ргва
В настоящий момент мы выяснили первичную структуру концевых
фрагментов ARS рг8а, составляющих в сумме половину массы этого элемен-
та. Оказалось, что генетические контексты последовательностей, фланки-
рующих центральный 2,4 т. п. н. фрагмент, различаются. Важной особенно-
стью фрагмента 0,95 т. и. н. является предсказание участка изогнутой ДНК,
размером 70 п. н. (рис. 88,Б). Изогнутые фрагменты ДНК не были обнару-
жены с помощью использованных программ в противоположном фланкиру-
ющем фрагменте.
Ранее изогнутая ДНК выявлена в составе ARS1 дрожжей (Snyder et al.,
1986), в составе автономного трансгена мышей ртус(Н-Р) (рис. 88,A) (Sudo
et al., 1990), а также в 2,4 т.п.н. ARS-фрагменте ori с-тус (McWhinney et al.,
1995). Предполагается, что участок изогнутой ДНК является одним из обя-
зательных модулей ог/'/АРЗ-элементов (Benbow et al., 1992).
Фрагмент 0,95 т. п. н. имеет участки сходства с несколькими последова-
тельностями генома человека: 5'-фланктрующей последовательностью
псевдогена а-интерферона, повторами MER27 и LINE1 (рис. 89). На проти-
воположном фрагменте (0,6 т. п. н.) нам не удалось выявить какие-либо про-
тяженные повторяющиеся элементы. Фрагмент 0,95 т. п. н. имеет две обла-
сти гомологии с ACS-элементом дрожжей (9 совпадений из 11), а также де-
вять октамерных мотивов, из которых один является сайтом связывания фа-
ктора транскрипции Octi (Николаев и др., 1998). Области гомологии с кон-
сенсусной ARS-последовательностью, а также сайт фактора Octi отсутству-
ют в противоположном фланкирующем фрагменте, хотя и в этом фрагмен-
те имеются три октамерных мотива. Известно, что ACS являются неотъем-
лемым компонентом эукариотических участков инициации репликации
(Palzkill, Newlon, 1988; McArthur et al., 1991; Benbow et al., 1992). Участие в ре-
гуляции репликации транскрипционного фактора Octi является установлен-
ным фактом и продемонстрировано в случаях многих вирусов и позвоноч-
ных (Neil et al., 1988; Melvin, De Pamphilis, 1993; Луняк, Тимченко, 1994). Из-
вестно также, что октамерные мотивы являются компонентами промотор-
но-энхансерных элементов генома высших эукариот и могут принимать уча-
стие в регуляции репликации (Iguchi-Ariga et al., 1993). Исходя из этих на-
блюдений, мы предполагаем, что 0,95 т. п. н. фрагмент действительно может
иметь значение для регуляции инициации репликации в области полнораз-
мерного ARS рг8а.
235
На этом фрагменте и только на нем локализованы участки сходства с
минимальными ori 5’-области гена с-тус человека и вируса BPV1, а также с
фрагментом ДНК DARK 146, обнаруживаемом в пререпликационном комп-
лексе, включающем ДНК-полимеразу а (Николаев и др. 1998). Интересным
наблюдением является обнаружение 70%-ного сходства двух участков этого
фрагмента с энхансером репликации REE1 (Obuse et al., 1996).
Очевидно, что ни одно из перечисленных черт сходства, рассматривае-
мое отдельно, не является значимым для какой-либо функции этого фраг-
мента. Однако совместная компактная локализация участка предположи-
тельно изогнутой ДНК, участков указанных гомологий и сходства говорит в
пользу специфичной первичной структуры фрагмента 0,9 т. п. н., котовая
может быть важной для функционирования этого фрагмента в качестве од-
ного из модулей ARS рг8а.
Отмеченные генетические и физические отличия фланкирующих ARS
рг8а фрагментов могут быть важны для понимания особенностей поддержа-
ния трансгенов в мышах. Действительно, в последнем случае для автономной
репликации трансгенов в F2 поколении трансгенных мышей (где имеет место
стабилизация их структуры) требуется EcoRI-PvuII-фрагмент рг8а размером
3 т. и. н, включающий фрагмент 0,95 т. п. н, тогда как фрагмент 0,6 т. п. н.,
находящийся с противоположной стороны ARS рг8а, подвергается элимина-
ции при передаче по наследству мышам Fj-поколения (Николаев и др. 1998).
ЗАКОНОМЕРНОСТИ В СУДЬБЕ НАСЛЕДУЕМЫХ
АВТОНОМНЫХ ТРАНСГЕНОВ
Автономные трансгены, созданные и охарактеризованные к настояще-
му времени, были неоднократно использованы для изучения инициации ав-
тономной репликации в эукариотической клетке (Nielsen et al., 2000; Trivedy
et al., 1998; Waltz et al., 1996; Piirsoo et al., 1996). Автономные конструкты яв-
ляются полезными инструментами также для исследования мутационных
процессов (Zemik-Kobak et al., 1995; Inga et al., 1995) и определения взаимо-
связи между интегрированными и экстрахромосомными формами вирусных
геномов в эукариотической клетке (Mazur et al., 1995; Ten Hagen et al., 1995;
и др.). Большинство работ данных направлений базировалось на механизмах
вирусной автономной репликации, тогда как изучение toT/ARS-элементов
высших эукариот было реализовано только для случая ori с-тус. Очевидно,
что изоляция новых ARS высших эукариот и изучение структуры и функции
этих элементов (в том числе в сравнительном аспекте) может способство-
вать прогрессу в понимании как общих закономерностей репликации ДНК,
так и принципов конструирования стабильных автономных векторов для
различных специализированных исследований.
Стабильный автономный трансген рг8а был клонирован в ходе изучения
трансгеноза у тутового шелкопряда В. той. Данный трансген возник в ре-
зультате негомологичной рекомбинации переносимой ДНК с клеточной
ДНК (по-видимому, с ее экстрахромосомной фракцией) шелкопряда (Нико-
лаев и др., 1991; Чкония и др., 1991). Эта рекомбинация привела к транспо-
зиции фрагмента ДНК шелкопряда в трансген, сопровождаемой перестрой-
ками его структуры (Nikolaev et al., 1993). Именно эти события дали транс-
236
гену ARS, обеспечивающий его автономный статус в клетках тутового шел-
копряда (рис. 83). Ранее похожий ход событий, описывающий судьбу пере-
носимого рекомбинантного конструкта, был показан на модели трансгенной
мыши (Rassoulzadegan et al., 1986; Leopold et al., 1987). В работах этой груп-
пы авторов был также подробно охарактеризован процесс перестройки
трансгена при его наследовании, показавший транспозицию хромосомных
последовательностей ДНК мыши в состав автономных трансгенов, сопрово-
ждающуюся как элиминацией оригинальных фрагментов вектора, так и ин-
серцией фрагментов клеточной ДНК в состав трансгенов. В ходе этого про-
цесса не были обнаружены стабильные формы автономных трансгенов мы-
ши. Напротив, в нашем случае плазмида рг8а является стабильным автоном-
ным трансгеном шелкопряда, поскольку ее собственный перенос в эмбрио-
ны тутового шелкопряда уже более не приводил к каким-либо изменениям
структуры трансгена (Николаев и др., 1993). Таким образом, в нашем случае
серия перестроек экзогенной ДНК привела к образованию стабильного,
“адаптированного” к данной хозяйской системе (тутовый шелкопряд) транс-
гена (Николаев и др., 1993).
В ходе детального изучения судьбы рг8а после ее переноса в пронуклеус
мышей (Николаев и др., 1998) нами было показано, что в трансгенных мы-
шах последовательности ДНК, гомологичные рг8а, имеют автономный ста-
тус, что проявлялось прежде всего в неменделевском характере наследова-
ния трансгена. Высокая частота передачи автономного трансгена ршус(Н-Р)
по наследству была ранее описана также на модели трансгенной мыши, для
которой была определена 100%-ная передача трансгена по наследству по
материнской линии (рис. 79) (Sudo et al., 1990). В нашем исследовании было
обнаружено, что при переносе, а также при передаче по наследству, в транс-
генах происходили последовательные делеции ДНК рг8а. Такой процесс
продолжался вплоть до F2 поколения трансгенных животных, в котором бы-
ла обнаружена стабилизация структуры трансгена (рис. 85, 86). Ранее эли-
минация более чем половины массы переносимой ДНК, сопровождаемая
формированием миниплазмиды, была обнаружена в ходе изучения поддер-
жания в клетках HeLa автономного трансгена pNeo.Myc-2.4, содержащего
ARS-фрагмент ori гена с-тус. Миниплазмида стабильно поддерживалась в
клетках HeLa наряду с исходным конструктом, а также с высокомолекуляр-
ными олигомерными формами (McWhinney, Leffak, 1990). Следует отметить,
что олигомерные формы дериватов рг8а были обнаружены нами совместно
с мономерными формами трансгенов в ходе исследования судьбы рг8а в
трансгенных мышах (см. рис. 85).
Сопоставление результатов работ, проведенных на трансформирован-
ных дрожжах и трансгенных мышах, позволяет предположить, что цент-
ральный фрагмент размером 2,4 т. п. н. является одним из модулей ARS рг8а,
обеспечивающим автономный статус трансгена в дрожжах и, вероятно, вно-
сящий вклад в автономное поддержание дериватов рг8а в трансгенных мы-
шах, хотя для последней хозяйской системы мы еще не можем оценить роль
0,95 т. п. н. фрагмента. Для дальнейшей характеристики межмодульных вза-
имодействий в ARS рг8а нами проводится эксперимент по определению ста-
туса модельного конструкта, несущего 2, 4 т. п. н. фрагмент в трансгенных
мышах. Мы полагаем, что фрагмент 2,4 т. п. н. может представлять собой
минимизированный ARS рг8а, который способен поддерживать автономный
237
статус трансгенов не только в трансформированных дрожжах, но и в других
гетерологических системах. Миними визированные ARS-элементы (разме-
ром менее 1 т. п. н.) были ранее изолированы из состава ori гена с-тус чело-
века ( McWhinney, Leffak, 1990; Waltz et al., 1996).
Совокупность наших данных позволяет заключить, что ARS рг8а имеет
размер приблизительно 3 т.п.н. и включает центральный и, возможно, один
из фланкирующих фрагментов оригинальной шелкопрядной последова-
тельности рг8а, составляя, таким образом, 80% ее массы. Для сравнения
можно отметить, что ori гена альдолазы В имеет размер 1-2 т. п. н. (Zhao et
al., 1997), orz'P локуса DHFR имеет размер около 4 т. п. н. (Dijkwel, Hamlin,
1992; Caddie, Calos, 1992), ori/ARS-элемент гена с-тус — 2,4 т. п. н. (Leffak,
James, 1989; McWhinney, Leffak, 1990).
Важной особенностью процесса перестроек переносимых конструктов в
использованных нами трансгенных объектах является их неслучайный хара-
ктер. Последовательности RSV (включая LTR) подверглись полной элими-
нации в трансгенных шелкопрядах (Николаев и др. 1991, 1992, 1993; Чкония
и др., 1991). В трансгенных мышах, с использованием механизма последова-
тельных делеций, были полностью элиминированы бактериальные последо-
вательности и фрагмент шелкопрядной последовательности рг8а (рис. 85). В
ходе последнего процесса перестройки трансгенов были однотипны в раз-
личных сибсах одного и того же поколения, в чем заключалось отличие от
наблюдений, полученных на трансгенных шелкопрядах. Это может озна-
чать наличие различий в рекомбинационных системах клеток полового пу-
ти насекомых и млекопитающих. При этом важно отметить, что стабилиза-
ция автономных трансгенов шелкопряда и мыши произошла одновремен-
но - в Р2-поколении трансгенных особей (см. рис. 83-85).
Неслучайный характер перестроек автономных трансгенов также оче-
виден на модели трансгенов, поддерживаемых в трансформированных клет-
ках дрожжей. Действительно, изменения в структуре переносимого констру-
кта (появление “дополнительной” ДНК) было обнаружено только в случае
(+) ориентации ДНК рг8а в векторе р(27-8) (рис. 86) Спасение плазмид, про-
веденное для соответствующих трансгенов, выявило идентичность пере-
строек векторной ДНК для всех исследованных случаев. Можно предпола-
гать, что неслучайный характер перестроек, наблюдаемых на различных
трансгенных моделях, отражает общие принципы специфического взаимо-
действия между экзогенной экстрахромосомной ДНК и хозяйским геномом.
В пользу этого предположения свидетельствуют также и данные по ста-
бильному поддержанию делетированного варианта известного трансгена
pNeo.Myc-2.4 (миниплазмиды) во множестве клеточных линий HeLa
(McWhinney, Leffak, 1990).
Согласно нашей гипотезе, функционирование хозяйской рекомбинаци-
онной системы в некоторых организмах (шелкопряд, мышь и других) может
быть направлено на перестройку разнообразных форм перенесенной ДНК в
пользу формирования трансгенов, способных к автономной репликации.
Мы считаем, что в таких хозяйских системах экзогенная ДНК претерпевает
серию неслучайных перестроек, приводящих в конечном итоге к “адапта-
ции” трансгена к стабильному экстрахромосомному поддержанию. По-види-
мому, “адаптация” связана с негомологичной рекомбинацией, происходящей
между автономными трансгенами и хозяйским геномом.
238
Мы также считаем, что использование процесса “адаптации” экзогенной
ДНК in vivo как одного из этапов конструирования автономных векторов,
может дать принципиально новые возможности по созданию стабильных
конструкций, способных к длительному персистированию и экспрессии це-
левых последовательностей как в трансгенных организмах, так и в специа-
лизированных клетках высших эукариот.
СОПРЯЖЕНИЕ ПРОЦЕССОВ РЕПЛИКАЦИИ И ТРАНСКРИПЦИИ-
НОВЫЙ ПРИНЦИП КОНСТРУИРОВАНИЯ АВТОНОМНЫХ ВЕКТОРОВ
Одним из результатов тестирования ARS-активности дериватов рг8а в
трансформированных дрожжах является установление совместимости про-
цессов автономной репликации и транскрипции гена селективного маркера
автономных трансгенов, сконструированных на базе этой плазмиды. Ранее
такие же данные были получены для невирусного автономного трансгена
клеток человека pNeo.Myc-2.4. В обоих случаях рассматриваемые конструк-
ции представляют собой класс стабильных автономных трансгенов, кото-
рые являются прототипами перспективных конструкций для широкого
спектра задач генной терапии.
Важно, что сопряжение процессов автономной репликации и транскрип-
ции не следует автоматически из самого наличия некоторого набора регуля-
торных элементов, а подразумевает существование “разрешенных” и “за-
прещенных” комбинаций этих элементов. Неучет взаимовлияния реплика-
ции и транскрипции может приводить к подавлению того или иного процес-
са (Waldenstrom et al., 1992) или обоих одновременно (Chen et al., 2000).
Уже давно признается очевидным, что репликация ДНК и транскрипция
во многом сходны. Действительно, оба эти процесса требуют узнавания спе-
цифических последовательностей (участков инициации репликации или
промоторов транскрипции) и включают в себя стадию сборки мультибелко-
вых комплексов, способных к локальному расплетанию ДНК и инициации
(с последующей элонгацией) процессов матрица-зависимого синтеза поли-
нуклеотидных цепей.
Первые намеки на взаимозависимость репликации и транскрипции поя-
вились в 80-е годы, когда стали накапливаться сведения о том что реплика-
ция ДНК может быть связана с такой формой репрессии транскрипции, как
сайленсинг. Данные, полученные в первой половине 90-х годов на модели
дрожжей, непосредственно показывали, что комплекс белковых молекул,
узнающий ориджины репликации дрожжей и специфически связывающий-
ся с ними (ORC-комплекс), играет ключевую роль как в репликации ДНК,
так и в сайленсинге. Детальный молекулярно-генетический анализ сайленсе-
ров дрожжей (таких как Е- и 1-элементы локусов HML и HMR ) позволил вы-
явить их тонкую структуру. В частности было показано, что HMR-Е сайлен-
сер состоит из трех генетических элементов: А, Е и В (Brand et al., 1987), вно-
сящих различный вклад в подавление транскрипции. Было обнаружено, что
A-элемент сайленсера содержит ACS-последовательность, с которой спосо-
бен связываться ORC. Е- и В-элементы сайленсеров несут сайты связывания
транскрипционных факторов RAP1 и ABF-1 (Bell et al., 1993). Анализ
свойств синтетических сайленсеров, моделирующих Е- и 1-элементы, пока-
239
зал, что для проявления их свойств достаточно этих трех сайтов связывания.
Свойства сайленсера таковы, что элементы, играющие независимую роль
в активации как процессов репликации так и транскрипции, функционируя
в новом контексте совместно, каким-то, пока не ясным образом, подавляют
транскрипцию. При этом сайленсеры дрожжей проявляют собственную
ARS-активность (см. обзоры: Laurenson, Rine, 1992; Kelly et al., 1994).
Одним из достижений последнего десятилетия в области понимания ме-
ханизмов репликации и транскрипции было открытие важной роли некото-
рых транскрипционных факторов в регуляции репликации. Наиболее убе-
дительные данные о характере участия транскрипционных факторов в ре-
пликации были получены при детальном изучении жизненного цикла ряда
вирусов в эукариотических клетках и при функционально-делецион-
ном анализе ori и фланкирующих их последовательностей в дрожжах
S. cerevisiae.
Так, например, изучение репликации аденовируса - первого вируса, для
которого была создана модельная система репликации in vitro - показало, что
такие транскрипционные факторы, как NF I и NF III (Oct-1), независимо друг
от друга стимулируют вирусную репликацию (в 60 и 6 раз, соответственно).
Их одновременное присутствие в тест-системе in vitro приводит к 200-кратно-
му росту скорости репликации (Coenjaerts et al., 1994; Mui et al., 1992).
В дрожжах S. cerevisiae структура области ori напоминает таковую у ви-
русов животных и состоит из основной области (где находится консенсусная
ARS-последовательность) и прилегающих к ней участков ДНК (В-области).
Известно, что хорошо изученный ВЗ-элемент ARS1 содержит сайт связыва-
ния с транскрипционным фактором Abfl. Связывание этого фактора со
своим сайтом увеличивает репликационную активность ARS1 (Marahrens,
Stillman, 1992). При этом ВЗ-элемент в ARS1 может быть заменен на сайт
связывания с транскрипционным фактором GAL4 без существенной потери
функциональной активности этого ori (Murakami, Ito, 1999). Новейшие дан-
ные по исследованию модулирующего действия этих транскрипционных фа-
кторов на ARS1 активность показали, что конечный эффект от действия
этих факторов на репликационную активность зависит от генетических кон-
текстов достаточно обширных прилегающих областей (Kohzaki et al., 1999).
У высших эукариот взаимосвязь регуляции транскрипции и репликации
сложнее и ее анализ находится в настоящее время на стадии становления.
Такое положение сложилось из-за того, что сами ori значительно больше по
размеру и более сложно устроены (см. обзор: De Pamphilis, 1993). Важной
особенностью ori высших эукариот, также усложняющей их анализ, являет-
ся то, что большинство известных ori локализованы в регуляторных рай-
онах генов (De Pamphilis, 1999). Присутствие сайтов связывания с различны-
ми транскрипционными факторами является неотъемлемой характеристи-
кой этих районов. Однако функциональная значимость присутствия этих
сайтов в оп'-содержащих районах генома в настоящее время мало изучена.
На данном этапе большое значение приобретают модельные исследования,
в ходе которых функционирование различных генетических элементов и их
комбинаций исследуется на автономных (эписомных) рекомбинантных кон-
струкциях (см. обзор: Murakami, Ito, 1999).
Новыми являются данные о том, что репликация ДНК может сильно ме-
нять функциональное значение генетических контекстов (см. обзор:
240
Murakami, Ito, 1999). Так, например, было показано, что репликация ДНК
способна подавить негативную функцию сайленсеров, репрессирующих
транскрипцию нескольких групп генов (Yamaguchi, Matsukage, 1990). Этот
эффект достаточно сложен. Действительно, было обнаружено, что в том
случае, когда транскрипция управляется с проксимального промотера (ли-
шенного энхансера транскрипции), положительный эффект процесса реп-
ликации на транскрипцию не обнаруживается; для его проявления в каждом
конкретном случае требуется наличие синергических отношений между
on/ARS-элементом и энхансером транскрипции (Wilson, Patient, 1993).
Суммируя вышеприведенные данные и наблюдения, которые в настоя-
щее время носят разрозненный характер, можно признать сложный харак-
тер взаиморегуляции репликации и транскрипции. Очевидным является тот
факт, что стимулирующее действие некоторых транскрипционных факто-
ров может увеличивать частоту инициации репликации в определенных уча-
стках хромосом. Элементы, усиливающие репликацию, - энхансеры репли-
кации, такие как октамерные мотивы и другие элементы - могут, по-види-
мому, играть важную роль в регуляции репликации генома и клеточного ци-
кла у высших эукариот.
Несомненно, эти элементы также могут быть с успехом использованы
для конструирования нового поколения невирусных автономно-реплициру-
ющихся плазмид.
По нашим представлениям, одним из возможных подходов к решению
этого вопроса может быть частичная имитация генетических контекстов
тех участков генома, которые управляют как репликацией, так и транскрип-
цией. Действительно, именно в таких участках локализовано около полови-
ны всех картированных ori генома высших эукариот (De Pamphilis, 1999).
Исходя из этих данных, можно предполагать, что возможным вариантом ди-
зайна автономного экспрессирующего вектора является клонирование
orz'/ARS-элемента непосредственно перед или близко к промотору целевого
гена (например перед CMV-промотором широко распространенных плазмид
pCI-neo (“Promega”) и pcDNA3, pcDNA4 (“Invitrogen”). Такой принцип дизай-
на рекомбинантной конструкции является естественной имитацией природ-
ных генетических контекстов.
Помимо этого принципиального шага потребуется также доводка конст-
рукции вектора, необходимая для обеспечения заданного соотношения меж-
ду уровнями копийности самого вектора, а также РНК-продукта. Решение
вопроса о соотношении копийностей может быть существенным моментом
в выборе схемы генно-терапевтического курса. Очевидно, сопряжения реп-
ликации и транскрипции будет являться важным моментом для создания
перспективных невирусных автономных векторов.
О НОВЫХ МЕТОДИЧЕСКИХ возможностях
ГЕННОЙ ТЕРАПИИ В XXI в.
Задачей генной терапии является достижение в клетках-мишенях физио-
логически активных уровней терапевтического продукта. Кроме того, в
большинстве случаев требуется пролонгированное поддержание этого уров-
ня для достижения терапевтического эффекта. При этом особым требова-
241
нием, предъявляемым к генно-терапевтическому средству, является его без-
опасность для генетического аппарата клетки. Этим требованиям медицины
в полной мере удовлетворяют только автономные (экстрахромосомные) век-
торы, функционирующие на основе невирусных элементов, пролонгиро-
вание экспрессирующие терапевтические продукты (за счет поддержания
собственной копийности в клетках-мишенях). Векторы этого типа должны
открыть новый этап в развитии генной терапии и преодолеть недостатки
предыдущего поколения векторов, основанных на использовании рекомби-
нантных вирусов и простых (нерепликативных) плазмидных конструкций
(Calos, 1996).
Для создания векторов нового типа требуются компактные невирусные
ARS-последовательности с изученной модульной структурой и понимание
взаимосвязи процессов автономной репликации и транскрипции в экстра-
хромосомных трансгенах.
За счет использования компактных невирусных ARS-элементов
(составляющих не десятки, а несколько тысяч п. и.) представляется воз-
можным создание безопасных челночных векторных конструкций, кото-
рые можно получать в препаративных количествах в Е. coli и которые спо-
собны нести достаточно протяженные целевые последовательности ДНК,
кодирующие генно-терапевтический продукт или несколько таких
продуктов.
Мы считаем, что использование ARS экстрахромосомных ДНК, изна-
чально приспособленных к поддержанию автономного статуса этих ДНК в
клетках высших эукариот, является наиболее эффективным и естествен-
ным путем создания перспективных автономных конструкций. В настоящий
момент мы рассматриваем образованную in vivo плазмиду рг8а, содержащую
ARS шелкопряда, наряду с плазмидой pNeo.Myc-2.4 (сконструированную в
группе М. Леффака), как прототипы перспективных безопасных векторов,
предназначенных для использования в целях моделирования генно-терапев-
тического курса лечения.
Очевидно, для различных вариантов генной терапии необходимы как
ARS-элементы, способные функционировать во многих типах клеток, так и
ARS-элементы, чья функциональная активность связана с единственным ти-
пом клеток. Эта ситуация со специфичностью элементов репликации, по на-
шему мнению, близка известной ткане-специфичной и стадия-специфичной
активности большинства эукариотических элементов транскрипции. Можно
думать, что в будущем для каждого конкретного варианта генной терапии
будет выбрана уникальная комбинация элементов репликации и транскрип-
ции, обеспечивающая требуемый терапевтический эффект при минимизи-
рованном побочном действии.
ЛИТЕРАТУРА
Легчилина С.П., Ефименко И.П., Арман И.П., Тарантул В.З., Николаев А.И. Автоном-
ная репликация фрагмента трансгена Bombyx mori в клетках S. cereviciae // Генети-
ка, 2001. Т. 37. С. 1497-1506.
Луняк В.В., Тимченко Н.А. Фрагмент ДНК DARC146 из комплексной формы ДНК-по-
лимеразы содержит несколько участков связывания ядерных белков // Молекуляр.
биология. 1994. Т. 28. С. 822-831.
242
Николаев А.И., Калмырзаев Б.Б., Андреева Л.Е. и др. Характеристика последовательно-
сти ДНК, автономно реплицирующейся у трансгенных насекомых и мышей // Моле-
куляр. биология. 1998. Т. 32. С. 427-433.
Николаев А.И., Кафиани К.А. Способ микроинъекций ДНК в яйца насекомых. Автор-
ское свидетельство № 1 336 570.
Николаев А.И., Кафиани-Эриапави КА., Тарантул В.З. Получение челночной авто-
номно реплицирующейся плазмиды в результате негомологичной рекомбинации in
vivo. // Молекуляр. биология. 1993а. Т. 4. С. 856-860.
Николаев А.И., Чкония Т.Т., Кафиани-Эриапави К.А. В нехромосомная локализа-
ция и передача по наследству рекомбинантной плазмиды, микроинъекцированной
в грену тутового шелкопряда //Там же. 1991. Т. 25. С. 1136- 1146.
Николаев А.И., Чкония Т.Т., Кафиани-Эриапави К.А.. Тарантул В.З. Анализ “спасен-
ной” плазмиды из трансгенного тутового шелкопряда // Биополимеры и клетка.
1992. Т. 6. С. 29-32.
Николаев А.И., Чкония Т.Т., Семенова Н.А. и др. Микроинъекция рекомбинантной
ДНК в ранние эмбрионы тутового шелкопряда Bombyx mori // Молекуляр. биология.
1989. Т. 23. С. 1177-1187.
Чкония Т.Т., Николаев А.И., Кафиани-Эриапави КА. Рестрикционный анализ автоном-
но-реплицирующихся молекул, содержащих экзогенную ДНК в линии трансгенного
шелкопряда//Молекуляр. биология. 1991. Т. 25. С. 1427-1436.
Adams A. Replication of latent Epstein-Barr virus genomes in Raji cells. // J. Virol. 1987. Vol. 61.
P. 1743-1746.
Aladjem M.I., Groudine M., Brody L.L. et al. Participation of the human beta-globin locus control
region in initiation of DNA replication // Science, 1995. Vol. 270. P. 815-819.
Ariga H., Imamura Y„ Iguchi-Ariga S.M.M. DNA replication origin and transcriptional enchancer
in c-myc gene share the c-myc protein binding sequences // EMBO J. 1989. Vol. 8.
P. 4273^1279.
Ariga H., Tsuchihashi Z., Naruto M., Yamada M. Cloned mouse DNA fragment can replicate in
a simian virus 40 T antigen-dependent system in vivo and in vitro. Mol. and Cell. Biol., 1985.
Vol. 5. P. 563-568.
Avedisov S.N., Surkov S.A., IT in Yu.V. Unusually prolonged stability of plasmids containing frag-
ments of retrotransposon MDG4 after transfection of Drosophila hydei cell culture // Dokl.
Akad. Nauk (Russia) 1995. Vol. 341. P. 273-276.
Bell S.P., Kobayashi R, Stillman B. Yeast origin recognition complex functions in transcription
silencing and DNA replication // Science. 1993. Vol. 262. C. 1844-1849.
Bell S.P., Mitchell J., Leber J. et al. The multidomain structure of Orclp reveals similarity to
regulators of DNA replication and transcriptional silencing // Cell. 1995. Vol. 83.
C. 563-568.
Benbow R.M., Zhao J., Larson D.D. On the nature of origins of DNA replication in eukaryotes Ц
BioEssayas. 1992. Vol. 14. P. 661-670.
Berberich S., Trivedi A., Daniel D.C. et al. In vitro replication of plasmids containing human
c-myc DNA // J. Mol. Biol. 1995. Vol. 245. P. 92-109.
Bishop J.O. Chromosomal insertion of foreign DNA. In Transgenic Animals / Ed. L.M. Houdebine.
Amsterdam: Harwood Acad, publ., 1997. P. 507.
Boroviec J.A., Dean F.B., Bullock P.F., Hurwitz J. Binding and unwinding — how T-antigen
engages the SV40 origin of DNA replication // Cell. 1990. Vol. 60. P. 181-184.
Brand A.H., Micklem G., biasmyth K. A yeast silencer contains sequences that can promote
autonomous plasmid replication and transcription activation // Cell. 1987. Vol. 51.
P. 709-719.
Brewer В J., Lockshon D., Fangman W.L. The arrest of replication forks in the rDNA of yeast
occurs independently of transcription // Cell. 1992. Vol. 71. P. 267-276.
Burke D.T., Carle G.F., Olson M.V. Cloning of large DNA segments of exogenous DNA into yeast
by means of artificial chromosome vectors. Science. 1987. Vol. 236. P. 809-816.
Caddie M.S., Calos M.P. Analysis of the autonomous replication behavior in human cells of the
dihydrofolate reductase putative chromosomal origin of replication // NucL Acids. Res., 1992.
Vol. 20. P. 5971-5978.
243
Calos M.P. The potential of extrachromosomal replicating vectors for gene therapy // Trends
Genet. 1996. Vol. 12. P. 463^66.
Camenisch G., Gruber M., Donogo G. et al. A polyoma-based episomal vector efficiently expresses
exogenous genes in mouse embryonic stem cells // Nucl. Acids. Res. 1996. Vol. 24.
P. 3707-3713.
Chen P.H., Tseng W.B., Chu Y.I., Hsu M.T. Interference of the simian virus 40 origin of replica-
tion by the cytomegalovirus immediate early gene enhancer: evidance for competition of
active regulatory chromatin conformation in a single domain // Mol. and Cell. Biol. 2000.
Vol. 20. P. 4062-4074.
Chittenden T., Frey A., Levine AJ. Regulated replication of an episomal simian virus 40 origin
plasmid in cos-7 cells // J. Virol. 1991. Vol. 65. P. 5944—5951.
Coenjaerts F.E., van Oosterhout J.A., Van der Vliet P.C. The Oct-1 POU domain stimulates ade-
novirus DNA replication by a direct interaction between the viral precursor terminal protein-
DNA polymerase complex and the POU domain // EMBO J. 1994. Vol. 13. C. 5401-5409.
Cooper MJ., Lippa M., Payne J.M. et al. Safety-modified episomal vectors for human gene ther-
apy // Proc. Nat. Acad. Sci. USA. 1997. Vol. 94. P. 6450-6455.
Coverley D., Laskey R.A. Regulation of eukariotic DNA replication // Annu. Rev. Biochem. 1994.
Vol. 63. C. 745-776.
De Pamphilis M.L. Eukaryotic DNA replication: Anatomy of an origin // Ibid. 1993. Vol. 62.
P. 29-63.
De Pamphilis M.L. Initiation of DNA replication in eukaryotic chromosomes Ц J. Cell. Biochem.
Suppl. 1998. N 30/31. P. 8-17.
De Pamphilis M.L. Replication origins in metazoan chromosomes: fact or fiction // BioEssays.
1999. Vol. 21. P. 5-16.
Dijkwel P.A., Hamlin J.L. Initiation of DNA replication in dihydrofolate reductase locus is con-
fined to the early S period in CHO cells synchronized with the plant amino acid momosine //
Mol. and Cell. Biol. 1992. Vol. 12. P. 3715-3722.
Dijkwel P.A., Hamlin J.L. Origins of replication and the nuclear matrix: the DHFR domain as a
paradigm//Intern. Rev. Cytol., 1995. Vol. 162. P. 455^84.
Dobbs D.L., Shaiu W.L., Benrow R.M. Modular sequence elements associated with origin regions
in eukaryotic chromosomal DNA // Nucl. Acids. Res. 1994. Vol. 22. P. 2479-2489.
Foss M., McNally FJ., Laurenson P., Rine J. Origin recognition complex (ORC) in transcrip-
tional silencing and DNA replication in 5. cerevisiae // Science. 1993. Vol. 262. P. 1838-1844.
Gahn T.A., Schidkraut C.L. The Epstein-Barr virus origin of plasmid replication, oriP, contains
both the initiation and termination sites of DNA replication // Cell. 1989. Vol. 58. P. 527—535.
Gassman M., Donoho G., Berg P. Maintenace of an extrachromosomal plasmid vector in mouse
embryonic stem cells //Proc. Nat. Acad. Sci. USA. 1995. Vol. 92. P. 1292-1296.
Gazaryan K.G., Nabirochkin S.D., Shibanova E.N. et al. Unstable visible mutation induced in
Drosophila melanogaster by injection of oncogenic virus DNA into the polar plasm of early
embryos // Mol. and Gen. Genet. 1987. Vol. 207. N 28. P. 130-141.
Gilbert D.M. Replication origins in yeast versus metazoa: separation of the haves and the have nots
// Curr. Opin. Genet, and Develop. 1999. Vol. 8. P. 194-199.
Hayashi C., Fujino F., Ogata M. et al. Determination of the functional domain of a mouse
autonomous replicating sequence // Biol. Pharm. Bull. 1997. Vol. 20. P. 690-693.
Hirai H., Satoh E., Osawa M. et al. Use of EBV-based vector/HVJ-liposome complex vector for
targeted gene therapy of EBV-associated neoplasms // Biochem. Biophys. Res. Commun.
1997. Vol. 241. P. 112-118.
Hirochika H., Otsuki H. Extrachromosomal circular forms of the tobacco retrotransposon Ttol I I
Gene. 1995. Vol. 165. P. 229-232.
Iguchi-Ariga S.M., Ogawa N., Ariga H. Identification of the initiation region of DNA replication
in the murine immunoglobulin heavy chain gene and possible function of the octamer motif
as a putative DNA replication origin in mammalian cells // Biocim. et Biophys. acta. 1993.
N20. P. 73-81.
Inga A., lannone R., Campomenosi P. et al. Mutational fingerprint induced by the antineoplastic
drug chloroetylcyclohexyl-nitrosourea in mammalian cells // Cancer Res. 1995. Vol. 55.
P. 4658^4663.
244
Ishimi Y., Matsumoto K. Model system for DNA replication of a plasmid DNA containing the
autonomously replicating sequence from Saccharomyces cerevisiae // Proc. Nat. Acad. Sci.
USA. 1993. Vol. 90. P. 5399-5403.
Jaenisch R. Transgenic animals // Science. 1988. Vol. 240. P. 1468-1474.
Jiang D., Srinivasan A., Lozano G., Robbins P.D. SV40 T antigen abrogates p53-mediated tran-
scriptional activity //Oncogene. 1993. Vol. 8. P. 2805-2812.
Kelly T.J., Jallepally P.V., Clyne R.K. Silence of the ORCs // Curr. Biol. 1994. Vol. 4. P. 238-241.
Kenney S., Ge J.Q.. Westphal E.M., Olsen J. Gene therapy strategies for treating Epstein-Barr
virus-associated lymphomas: comparison of two different Epstein-Barr virus-based vectors //
Hum. Gene. Ther. 1998. Vol. 9. P. 1131-1141.
Kiessling U , Becker K, Strauss M. et al. Rescue of a tk-plasmid from transgenic mice reveals its
episomal transmission // Mol. and Gen. Genet. 1986. Vol. 204. P. 328-333.
Kitsberg D., Selig S., Keshet L, Cedar H. Replication structure of the human beta-globin gene
domain // Nature. 1993. Vol. 366. P. 588-590.
Kobayashi T., Rein T., De Pamphilis M.L. Identification of primary initiation sites for DNA repli-
cation in the hamster dihydrofolate reductase gene initiation zone // Mol. and Cell. Biol. 1998.
Vol. 18 P. 3266-3277.
Kohzaki H., Ito Y., Murakami Y. Context-dependent modulation of replication activity of 5. cere-
viciae autonomous replicating sequence by transcription factors // Ibid. 1999. Vol. 19.
P. 7428-7435.
Koshland D., Kent J.C., Hartwell I.H. Genetic analysis of the mitotic transmission of minichro-
mosomes // Cell. 1985. Vol. 40. P. 393^103.
Krysan PJ., Calos M.P. Epstein-Barr virus-based vectors that replicate in rodent cells // Gene.
1993. Vol. 136. P. 137-143.
Laurenson P., Rine J. Silencers, silencing, and heriditable transcriptional states // Microbiol. Rev.
1992. Vol. 56. P. 543-560.
Leffak M„ James C.D. Opposite replication polarity of the germ line c-myc gene in HeLa cells
compared with that of two Berkitt Lymphoma cell lines // Mol. and Cell. Biol. 1989. Vol. 9.
P. 586-593.
Leopold P., Vailly J., Cuzen F., Rassoulzadegan M. Germ-line maintenance of plasmids in trans-
genic mice // Cell. 1987. Vol. 51. P. 885-886.
Malott M., Leffak M. Activity of the c-myc replicator at an ectopic chromosomal location // Mol.
and Cell. Biol. 1999. Vol. 19. P. 5685-5695.
Marachrens Y., Stillman B. A yeast chromosomal origin of DNA replication defined by multiple
functional elements // Science. 1992. Vol. 255. P. 817-823.
Mazur S., Feunteun J., De la Roche-Saint-Andre C. Episomal amplification or chromosomal inte-
gration of the viral genome: alternative pathways in hamster polyomavirus-induced
lymophomas // J Virol. 1995. Vol. 69. P. 3059-3066.
McArthur J.G., Beitel L.K., Chamberlain J.W., Stunners C.P. Elements which stimulate gene
amplification in mammalian cells: role of recombinogenic sequences/structures and tran-
scriptional activation // Nucl. Acids Res. 1991. Vol. 19. P. 2477-2484.
McWhinney C., Leffak M. Autonomous replication of a DNA fragment containing the chromoso-
mal replication origin of the human c-myc gene // Ibid. 1990. Vol. 18. P. 1233-1242.
McWhinney C., Waltz S.E., Leffak M. Cis-acting effects of sequences within 2.4-kb upstream of
the human c-myc gene on autonomous plasmid replication in HeLa cells // DNA Cell. Biol.
1995. Vol. 14. P. 565-579.
Melvin L., DePamphilis M.L. Eukariotic DNA replication: anatomy of an origin // Annu. Rev.
Biochem. 1993. Vol. 62. P. 29-63.
Mevel-Nino M., Lutfalla G., Bertolotti R. A polyoma-derived plasmid vector maintained episoma-
lly in both E.coli and mouse hepatoma cells // Exp. Cell. Res. 1986. Vol. 166. P. 63-76.
Micklem G., Rowley A., Harwood J. et al. Yeast origin recognition complex is involved in DNA
replication and transcriptional silencing // Nature. 1993. Vol. 366. P. 87-89.
Mui Y.M., van der Vliet P.C. Nuclear factor I enhances adenovirus DNA replication by increasing
the stability of a preinitiation complex // EMBO J. 1992. Vol. 11. P. 751-760.
Murakami Y., Ito Y. Transcription factors in DNA replication. Front Biosci., 1999. Vol. 4.
P. 824-833.
245
Nielsen T.O., Cossons N.H.. Zannis-Hadjopoulos M., Price G.B. Circular YAC vectors containing
short mammalian origin sequences are maintained under selection as HeLa episomes //
J. Cell. Biochem. 2000. Vol. 76. P. 674-685.
Nikolaev Л.I., Tchkonia T.T., Kafiani-Eristavi C.A., Tarantul V.Z. Preferential extrachromosomal
localization of exogenous DNA in transgenic silkworm Bombyx mori L. // Mol. and Gen.
Genet. 1993. Vol. 236. P. 326-330.
O’Neil Е.А., Fletcher C., Burrow C.R. et al. Transcriptional factor OTF1 is functionally identical
to the DNA replication factor NFIII // Science. 1988. Vol. 241. P. 1210-1213.
Palmiter R.DBrinster R.L. Germ-line transformation of mice//Annu. Rev. Genet. 1986. Vol. 20.
P. 465^499.
Palzkill T.G., Newlon C.S. A yeast replication origin consists of multiple copies of a small con-
served sequence // Cell. 1988. Vol. 53. P. 441^450.
Piechaczek C., Fetzer C., Baiker A. et al. A vector based on SV40 origin of replication and chro-
mosomal S/MARs replicates episomally in CHO cells. Nucleic Acids Res., 1999. Vol. 27.
P. 426-428.
Piirsoo M., Ustav E., Mandel T. et al. Cis and transrequirements for stable episomal maintenance
of the BPV-1 replicator//EMBO J. 1996. Vol. 15. P. 1-11.
Rassoulzadegan V., Leopold M., Vailly J., Cuzin F. Germ-line transmission of autonomous genet-
ic elements in a transgenic mouse strain // Cell. 1986. Vol. 46. P. 513-519.
Simpson K., McGuigan A., Huxley C. Stable episomal maintenance of yeast artificial chromo-
somes in human cells // Mol. and Cell. Biol. 1996. Vol. 16. P. 5117-5126.
Snyder M., Buchman A.R., Davis R.W. Bent DNA at a yeast autonomously replicating sequence I I
Nature. 1986. Vol. 324. P. 87-89.
Spradling A.C. ORC binding, gene amplification, and the nature of metazoan replication origins //
Genes and Develop. 1999. Vol. 13. P. 2619-2623.
Stinchcomb D.T., Struhl K., Davis R.W. Isolation and characterization of yeast chromosomal repli-
cator//Nature. 1979. Vol. 282. P. 39-42.
Stinchcomb D.T., Thomas M., Kelly J. et al. Eukaryotic DNA segments capable of autonomous
replication in yeast//Proc. Nat. Acad. Sci. USA. 1980. Vol. 77. P. 4559-4563.
Sudo K., Ogata M., Sato Y. et al. Cloned origin of DNA replication in c-mys gene can function and
be transmitted in transgenic mice in an episomal state // Nucl. Acids. Res. 1990. Vol. 18.
P. 5425-5432.
Tao L., Nielsen T., Friedlander P. et al. Differential DNA replication origins activities in hu-
man normal skin fibroblast and HeLa cell lines // J. Mol. Biol. 1997. Vol. 273. P. 509-
518.
Ten Hagen K.G., Ravnan J.B., Cohen S.N. Disparate replication properties of integrated and
extrachromosomal forms of bovin papilloma virus in ID13 cells // Ibid. 1995. Vol. 254.
P. 119-129.
Tomiyasu K., Satoh E., Oda Y. et al. Gene transfer in vitro and in vivo with Epstein-Barr virus-
based episomal vector results in markedly high transient expression in rodent cells //
Biochem. and Biophis. Res. Commun. 1998. Vol. 253. P. 733—738.
Trivedi A., Waltz S.E.. Kamath S., Leffak M. Multiple initiations in the c-myc replication origin
independent of chromosomal location // DN A Cell. Biol. 1998. Vol. 17. P. 885-896.
Umec R.M., Linskens M.H., Kowalski D., Huberman J A. New begining in studies of eukaryotive
DNA replication origins // Biochim. et biophys. acta. 1989. Vol. 1007. P. 1-14.
Vassiliev L.T., Burhans W.C., De Pamphilis M.L. Mapping an origin of DNA replication at a sin-
gle copy locus in exponentially proliferating mammalian cells // Mol. and Cell. Biol. 1990.
Vol. 10. P. 4685^4689.
Waldenstrom M., Schenstrom K., Sollerhrant K., Hansson L. Replication of bovine papilloma
virus vectors in murine cells // Gene. 1992. Vol. 120. P. 175-181.
Waltz S.E., Trivedy A A., Leffak M. DNA replication initiates non-randomly at ultiple sites near c-
myc gene in HeLa cells // Nucl. Acids Res. 1996. Vol. 24. P. 1887-1894.
Wilson A.C., Patient R.K. DNA replication facilitates the action of transcriptional enhancers in
transient expression assays // Ibid. 1993. Vol. 21. P. 42296-42304.
Yamaguchi M., Matsukage A. DNA replication can overcome the silencer function on transcrip-
tion // New Biol. 1990. Vol. 2. P. 343-350.
246
Zannis-Hadjopoulos M„ Nielsen T.O., Todd A., Price G.B. Autonomous replication in vivo and in
vitro of clones spanning of the DHFR origin of bidirectional replication (orip) // Gene. 1994.
Vol. 151. P. 273-277.
Zernik-Kobak M., Szumiel I., Levine AS., Dixon K. Analysis of mutagenesis in UV-sensitive
mouse lymphoma L5178Y-R cells with a polyomavirus-based shuttle vector // Mutat. Res.
1995. Vol. 344. P. 31-39.
Zhao Tsutsumi R., Yamaki M. et al. Initiation zone of DNA replication at the aldolase В locus
encompasses transcription promoter region // Nucl. Acids Res. 1994. Vol. 22. P. 5385-5390.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ДИФФЕРЕНЦИРОВКИ,
ЗЛОКАЧЕСТВЕННОЙ ТРАНСФОРМАЦИИ И ГИБЕЛИ
СОМАТИЧЕСКИХ КЛЕТОК МЛЕКОПИТАЮЩИХ IN VITRO
И.А. Гривенников, И.В. Бобрышева, Н.Б. Варшавер,
А.П. Григоренко, Л.С. Иноземцева, Е.С. Мануйлова
Лаборатория молекулярной генетики соматических клеток
Отдела вирусной и клеточной молекулярной генетики
Рассматриваются вопросы, связанные с различными аспектами ис-
пользования культивируемых соматических клеток млекопитающих при
исследованиях молекулярно-генетических механизмов дифференцировки,
злокачественной трансформации и гибели клеток in vitro. Приведены ре-
зультаты экспериментов в области спонтанного и индуцированного му-
тагенеза, особенно индуцированного онкогенными ДНК-содержащими ви-
русами и активированными клеточными онкогенами. Показано, что по-
добно вирусным онкогенам, активированные клеточные онкогены (с-На
rasl и с-тус) повышают в клетке частоту генных мутаций и хромосом-
ных аберраций. Рассмотрены возможные пути перерождения нормальной
клетки в злокачественную, описано получение иммортализованных фиб
робластов человека, дана их характеристика. Исследовано влияние мута-
ций в гене пресенилина 1 человека, ответственных за развитие ранней ау-
тосомно-доминантной семейной формы болезни Альцгеймера, на процес-
сы пролиферации, дифференцировки и апоптоза в стабильно трансфици-
рованных клеточных линиях.
СЛОВАРЬ ТЕРМИНОВ И СОКРАЩЕНИЙ
ГФРТ - гипоксантинфосфорибозилтрансфераза.
ТК - тимидинкиназа.
HAT — селективная среда, содержащая гипоксантин, аминоптерин, тимидин,
ts -температурочувствительность.
Rb — ретинобластома ( опухоль сетчатки глаза).
ПЦР - полимеразная цепная реакция.
БА — Болезнь Альцгеймера.
hPS-1, hPS-2 — ген пресенилина-1 или пресенилина-2 человека.
АРР - ген предшественника Р-амилоида.
PC 12 - линия клеток феохромоцитомы крысы.
Апоптоз - генетически программированная гибель клеток.
Трансфекция - введение чужеродной ДНК в клетку.
АПФ или АСЕ - ангиотензин-превращающий фермент.
Парасексуальный процесс - аналог полового процесса.
Гетерокарион — клетка, содержащая два или более ядра разных генотипов.
Комплементация - метод генетического анализа, позволяющего определить принад-
лежность двух мутаций со сходным фенотипом к одному или разным генам.
Гаметопоколение - одна генерация половых клеток от начала развития организма до
возможности оставить им потомство.
Энуклеация - удаление из клетки ядра.
Малигнизация - злокачественное перерождение клетки.
Амплификация генов - увеличение числа генов.
Псевдонормальная линия клеток - линия обладающая не всеми, но лишь некоторыми
признаками злокачественного фенотипа.
248
Ауксотрофы - организмы, утратившие способность к самостоятельному синтезу како-
го-либо метаболита.
Прототрофы — организмы дикого типа, не требующие для своего развития включения
в питательную среду аминокислот, витаминов или других факторов роста и синтези-
рующие их из неорганических или органических соединений.
Хромосомные перестройки (аберрации) - тип мутаций изменяющих структуру хромо-
сом. Могут затрагивать одну хромосому (потеря или удвоение какого-либо участка),
или негомологичные хромосомы путем обмена участками (транслокации).
8-АГ — 8-азагуанин.
6-МГ — 6-меркаптопурин.
6-ТГ — 6-тиогуанин.
Деления - потеря участка хромосомы.
ВВЕДЕНИЕ
Соматические клетки - это клетки всех органов и тканей организма за
исключением половых клеток. Усовершенствование методов культивирова-
ния соматических клеток вне организма определило возможность новых пу-
тей изучения генетики высших организмов, применяя наряду с методами
классической генетики методы молекулярной биологии. Это послужило
предпосылкой для возникновения нового раздела генетики - сначала гене-
тики соматических клеток, а затем, с развитием методов генной инженерии,
и молекулярной генетики соматических клеток. Специфические особенно-
сти соматических клеток позволяют успешно эксплантировать из организма
различные типы клеток и поддерживать их в культуре в течение длительно-
го времени в специально разработанных питательных средах, включающих
наборы аминокислот, витаминов, сахаров, а также сыворотки крови, содер-
жащей различные ростовые факторы. Наибольшее развитие получила мо-
лекулярная генетика соматических клеток млекопитающих, что, безуслов-
но, связано с появившейся возможностью постановки прямых эксперимен-
тов с клетками человека. В настоящее время разработаны специальные ме-
тоды культивирования различных клеток человека (фибробластов, глиаль-
ных и эндотелиальных клеток, клеток крови и др.) при сохранении нормаль-
ного кариотипа и других признаков нормальных клеток в течение длитель-
ных сроков культивирования. Такие диплоидные штаммы используются для
различных экспериментов, в частности, при приготовлении противовирус-
ных вакцин.
Популяции соматических клеток в культуре насчитывают десятки и сот-
ни миллионов клеток, что сравнимо по масштабам с культурами микроорга-
низмов. Кроме того, время генерации соматических клеток in vitro на много
порядков короче гаметопоколения в организме in vivo. Так, время генерации
клеток человека в культуре равно примерно 24—48 ч, в то время как продол-
жительность одного гаметопоколения человека составляет в среднем
25 лет. Все эти особенности культивируемых соматических клеток создают
условия для многократного ускорения и увеличения масштабов эксперимен-
тов. Основные исследования, которые проводятся в настоящее время на со-
матических клетках млекопитающих, суммированы на рис. 90.
Следует отметить относительную условность такого деления и явное пе-
рекрывание подходов и вопросов, решаемых в рамках исследований по пред-
ставленным направлениям.
249
| ГИБЕЛЬ КЛЕТОК |
ЗЛОКАЧЕСТВЕННОЕ
ПЕРЕРОЖДЕНИЕ
Рис. 90. Основные направления исследований, проводимых на соматических клетках млеко-
питающих
Основными методами, позволяющими проводить широкий круг экспе-
риментов на этих клетках, являются методы получения клонов, происходя-
щих из одной клетки, и методы создания селективных условий, позволяю-
щих выявлять и изолировать мутантные формы, частота спонтанного воз-
никновения которых равна примерно 10~7 в популяции клеток дикого типа.
Это относится также к генно-инженерным модифицированным клеткам,
которые получаются с относительно низким выходом, но могут быть селе-
ктированы с помощью стандартных приемов селекции соматических кле-
ток. Особо следует отметить методы направленного изменения функций тех
или иных генов с помощью гомологичной рекомбинации (таргетинг генов).
ИСТОРИЧЕСКИЙ АСПЕКТ
Специализированные лаборатории генетики соматических клеток были
созданы в мире в конце 50-х годов, и почти одновременно, в 1963 г. в Радио-
биологическом отделе Института атомной энергии им. И.В. Курчатова
(ИАЭ) была организована Лаборатория генетики соматических клеток мле-
копитающих (с 1992 г. Лаборатория молекулярной генетики соматических
клеток в составе Отдела вирусной и клеточной молекулярной генетики), ко-
торую возглавил известный генетик профессор Н.И. Шапиро.
Генетика соматических клеток позволила перевести исследования спон-
танного мутагенеза с хромосомного на генный уровень в прямом экспери-
менте. Такие эксперименты чрезвычайно важны, учитывая роль генных му-
таций как основы новых адаптивных признаков в эволюции вида, а также их
значение в селекционной работе. Было установлено, что частота генных му-
таций одинакова в соматических и герминальных клетках в расчете на кле-
250
точную генерацию, но значительно выше в расчете на единицу времени. Та-
кое явление вполне объяснимо, если учесть, что многие мутации являются
вредными. Следовательно, мутация в герминальной клетке будет снижать
жизнеспособность организма и, как следствие, приносить вред популяции в
целом, в то время как мутация в соматической клетке будет вредна лишь для
отдельных клеток (Шапиро, Варшавер, 1976).
Для дальнейшего успешного развития генетики соматических клеток не-
обходимо было создать коллекцию мутантов. Поскольку спонтанный темп
мутирования в соматических клетках достаточно низок, важно было разра-
ботать методы индукций мутаций и тем самым ускорить мутационный про-
цесс. Для мутантов соматических клеток характерны изменения определен-
ных ферментов, контролирующих такие признаки, как пищевые потребно-
сти, резистентность к различным токсическим химическим веществам, тем-
пературочувствительность и другие подобные признаки. Идентификация и
выделение таких мутантов возможны лишь путем создания селективных ус-
ловий, при которых основная масса клеточной популяции погибает, а выжи-
вают только мутантные формы. На первом этапе при попытке индукции му-
таций в соматических клетках возник ряд методических трудностей, кото-
рые, однако, были успешно преодолены, и в 1968 г. индукция генных мута-
ций в соматических клетках была одновременно и независимо достигнута
в трех лабораториях (Шапиро и др., 1968; Chu, Mailing, 1968; Као, Puck, 1968).
Мутанты, резистентные к различным токсическим веществам, выделяются
с использованием селективной среды, содержащей определенное вещество в
концентрации, летальной для исходной популяции. Наибольшее распростра-
нение получили мутанты, резистентные к аналогам пуриновых оснований.
Биохимический анализ показал, что этот тип резистентности определяется
изменением или полным отсутствием фермента гипоксантинфосфорибозил-
трансферазы (ГФРТ). Такая мутация присутствует у больных с синдромом
Lesh-Nyhan. Ген, кодирующий ГФРТ, локализован в Х-хромосоме. Разрабо-
тана специальная селективная среда, содержащая гипоксантин, аминопте-
рин и тимидин (HAT), позволяющая улавливать обратные мутации к норме
(Szybalska, Szybalski, 1962; Littlefield, 1964).
Мутантные клетки грызунов и человека резистентные к аналогам пури-
новых оснований были получены и используются во многих лабораториях
мира (Шей, 1985; Shapiro, Varshaver, 1975). В Лаборатории генетики сомати-
ческих клеток ИАЭ были выделены мутанты клеток человека и китайско-
го хомячка резистентные к 8-АГ, 6-МП и 6-ТГ (Маршак, Варшавер, 1970;
Волкова и др., 1981). Были получены также мутанты, резистентные к ана-
логам пиримидинов с мутацией тимидинкиназы (ТК) (Patterson, Camright,
1977), к оубаину (Чеснокова, Мануйлова, 1991) и ряду других веществ (Шей.
1985). Создание селективных условий для выделения ауксотрофных мутан-
тов значительно сложнее, чем для выделения резистентных форм. В генети-
ке соматических клеток наиболее распространен метод, в основе которого
лежит создание условий для гибели размножающихся клеток дикого типа и
выживания мутантов. Для этого используют явление повышения чувстви-
тельности клеток, включивших в ДНК вместо тимина его галоидозамещен-
ные аналоги, к различным видам излучений. В Лаборатории генетики сома-
тических клеток ИАЭ в среду, минимальную по определенному веществу,
добавляли 5-бромдезоксиуридин (БДУ). Размножающиеся прототрофные
251
клетки дикого типа включали БДУ при синтезе ДНК, что приводило к их ги-
бели при последующем облучении длинноволновым УФ. Ауксотрофы, со-
хранявшие в течение 2-3 сут. культивирования жизнеспособность, но не раз-
множавшиеся при этом, а следовательно, не включавшие БДУ, выживали
после облучения. Наибольшее число ауксотрофных мутантов было получе-
но в линии клеток китайского хомячка СНО (Puck, Као, 1982). В Лаборато-
рии генетики соматических клеток ИАЭ были получены линии клеток ки-
тайского хомячка, ауксотрофные по глутамину (Varshaver et al., 1977), а так-
же температурочувствительные мутанты (Варшавер и др., 1972). Были так-
же выделены два клона клеток китайского хомячка, чувствительные как к
летальному, так и к мутагенному действию УФ-излучения. Было установле-
но, что радиочувствительность определяется нарушением пострепликатив-
ной репарации (Мануйлова, Шапиро, 1973; Пинто и др., 1980).
ГЕНЕТИЧЕСКИЙ АНАЛИЗ В СОМАТИЧЕСКИХ
КЛЕТКАХ МЛЕКОПИТАЮЩИХ И СФЕРЫ ЕГО ПРИМЕНЕНИЯ
Для соматических клеток уже в 60-х гг., т.е. в самом начальном периоде
развития генетики соматических клеток, для проведения генетического ана-
лиза, был предложен своеобразный метод парасексуального процесса
(Barski et al., 1960, 1961). Оказалось, что при совместном культивировании,
клетки разных линий способны сливаться, образуя двуядерные и многоядер-
ные гетерокарионы. В конечном счете возникают две одноядерные дочер-
ние клетки, содержащие хромосомы, полученные от исходных родитель-
ских клеток, которые во многих случаях могут дать начало длительно раз-
множающимся гибридным клеточным линиям. Такие гибриды могут содер-
жать полный набор хромосом одной из исходных клеток и одну или несколь-
ко хромосом из другой. Такие гибридные клетки служат мощным орудием
исследования функций индивидуальных хромосом. Методы гибридизации
получили широкое распространение и стали совершенствоваться во всех ла-
бораториях, изучающих генетику соматических клеток. В Советском Сою-
зе гибридизация соматических клеток впервые была осуществлена в Лабо-
ратории соматических клеток ИАЭ (Волкова, Какпакова, 1972).
Возможность передачи генетической информации от клетки к клетке
открыла новые пути к исследованию многих важнейших фундаментальных
и прикладных проблем генетики, таких как взаимодействие ядра и цитоплаз-
мы, межгенной и межаллельной комплементации, картирование генов, ге-
нетических механизмов канцерогенеза, регуляции действия генов и диффе-
ренцировки и многих других проблем. Если в первых работах по гибридиза-
ции, гибридные клетки возникали спонтанно и были идентифицированы по
наличию хромосомных наборов двух родительских линий, которые отлича-
лись по своему кариотипу, то в дальнейшем стали использовать мутантные
линии клеток и селективные среды, позволяющие не только идентифициро-
вать, но и изолировать гибридные клетки. Впервые такой способ был при-
менен Литтлфилдом (Littlefield, 1964) при гибридизации двух линий мыши-
ных клеток, одна из которых была дефектна по ГФРТ, а другая - по ТК.
На среде НАТ могли выжить только клетки, с нормальной активностью
ГФРТ и ТК, т.е. гибриды, в которые эти ферменты были привнесены одной
252
и другой родительскими линиями. Поскольку спонтанное слияние клеток яв-
ление достаточно редкое, были предложены методы, ускоряющие этот про-
цесс. На первом этапе в качестве сливающего агента использовали вирус
Сендай, способный образовывать многоядерные клетки (Harris, Watkins,
1965; Harris et al., 1969; Klein et al., 1971), а позднее полиэтиленгликоль (ПЭГ)
(Pontecorvo, 1975; Шей, 1985). Характерной особенностью клеток млекопи-
тающих in vitro является их высокая совместимость. Гетерокарионы и даже
гибридные линии могут образовываться в результате слияния клеток, при-
надлежащих не только разным видам, но даже более отдаленным система-
тическим единицам. Так, получены гибриды между куриными эритроцита-
ми и клетками печени крысы, т.е. между клетками, принадлежащими к раз-
ным классам животных (Trisler, Coon, 1973).
ВЗАИМОДЕЙСТВИЕ ЯДРА И ЦИТОПЛАЗМЫ
Большой интерес представляют работы Харриса (1973), в которых изу-
чались ядерно-цитоплазматические отношения. С помощью включения
3Н-уридина и 3Н-тимидина исследовали синтез нуклеиновых кислот при раз-
ных сочетаниях клеток, синтезирующих РНК, но не синтезирующих ДНК
(макрофаги кролика, лимфоциты крыс) и клетками, не синтезирующими ни
РНК, ни ДНК (эритроциты кур), а также с клетками линии HeLa, синтезиру-
ющими обе нуклеиновые кислоты. Как было показано, в гетерокарионах,
в которых одна из родительских клеток не синтезирует РНК или ДНК, в то
время как вторая их синтезирует, в ядре инертной клетки синтез соответст-
вующей нуклеиновой кислоты восстанавливается. Даже в гетерокарионах
между клетками HeLa и высокодифференцированными эритроцитами кури-
цы в ядре эритроцита наблюдается синтез ДНК и РНК. Инертная клетка ни-
когда не подавляет синтеза у активного партнера. Эти данные представляют
исключительный интерес, так как демонстрируют возможность обратимо-
сти дифференцировки клеток с высоким ее уровнем, что в последнее время
было подтверждено при получении клонов животных с использованием
дифференцированных клеток взрослого организма.
АНАЛИЗ КОМПЛЕМЕНТАЦИИ
Возможность гибридизации соматических клеток позволяет исследовать
межгенную и внутригенную (межаллельную) комплементацию. Выживание
гибридов на селективной среде при попарной гибридизации мутантов с оди-
наковым фенотипом, будет свидетельствовать о наличии комплементации.
Очевидно, в таком случае одинаковый фенотип контролируется разными
генами, ответственными за разные звенья биосинтеза, определяющего дан-
ный фенотип. Отсутствие комплементации будет наблюдаться в том случае,
если изучаемый фенотип зависит от действия одного и того же гена. Впер-
вые комплементационный анализ был проведен на мутантах, ауксотрофных
по глицину, а позднее на ауксотрофах по пуринам в клетках китайского хо-
мячка СНО-К1, у которых было выявлено 9 групп комплементации (Puck,
Као, 1982). Межаллельная комплементация по гену ГФРГ была детально
изучена в Лаборатории генетики соматических клеток Института молеку-
253
лярной генетики РАН и установлено 9 групп комплементации (Волкова и
др., 1981). Была исследована комплементация между 59 мутантами по ГФРТ,
полученными на селективных средах с 8-АГ, 6-МП и 6-ТГ. Среди них были
спонтанные мутанты и мутанты, индуцированные различными мутагенами.
Было выявлено 9 комплементирующих пар мутантов, причем комплемента-
ция наблюдалась только между мутантами, выделенными в присутствии раз-
ных пуриновых аналогов. По-видимому, изученные мутанты представляют
собой серию множественных аллелей.
ГЕНЕТИКА СОМАТИЧЕСКИХ КЛЕТОК
И КАРТИРОВАНИЕ ГЕНОВ
О значении картирования генов человека говорит создание международ-
ной программы “ Геном человека”, которая ставила своей задачей картиро-
вать все гены человека и секвенировать всю ДНК генома. Методы генети-
ки соматических клеток открыли совершенно новые перспективы картиро-
вания генов. Эти методы позволили не только точно локализовать ген в оп-
ределенной хромосоме и даже в определенном ее участке, но значительно
ускорили процедуру картирования. Особое значение это имеет для картиро-
вания генов человека, которому уделяется наибольшее внимание, особенно
для картирования генов, определяющих различные наследственные болез-
ни. Ранее для локализации генов человека использовали анализ родослов-
ных. При таком методе удавалось картировать только гены, локализован-
ные в Х-хромосоме, или в аутосомах в тех случаях, когда экспрессия гена
была всегда связана с наличием определенных специфических хромосомных
аберраций. Поэтому до разработки методов генетики соматических клеток
у человека были картированы преимущественно гены, локализованные в
Х-хромосоме, в частности впервые Вильсоном был картирован на этой хро-
мосоме ген дальтонизма (Wilson, 1911)
Основной принцип картирования с помощью гибридизации соматиче-
ских клеток основан на двух особенностях клеточных гибридов: 1) возмож-
ность отдаленной гибридизации и 2) потеря хромосом одной из родитель-
ских форм в ходе культивирования межвидовых гибридов на селективной
среде. С этой целью преимущественно используется гибридизация клеток
человека и грызунов. Впервые такая элиминация хромосом человека была
показана у гибридов между диплоидными клетками человека (ГФРТ+ТК+) и
анеуплоидной мышиной линией В82 (ГФРТ+ТК-) на среде HAT. В ходе
культивирования происходила постепенная потеря всех хромосом человека
за исключением одной, которая всегда сохранялась у гибрида. Все мышиные
хромосомы сохранялись вне зависимости от длительности культивирования.
Поскольку на среде HAT в этом случае способны выживать только клетки
с генотипом ГФРТ+ТК+, а ген ТК был привнесен только клетками человека,
то, очевидно, ген ТК локализован в той хромосоме, которая всегда сохра-
нялась у гибрида (Weiss, Green, 1967). Помимо среды HAT для картирования
генов при получении гибридов используют также другие селективные сре-
ды. Так, на среде, минимальной по глицину, культивировали гибридные
клетки, полученные при слиянии клеток китайского хомячка, ауксотроф-
ных по глицину с нормальными диплоидными клетками человека. В ходе
254
культивирования терялись все хромосомы человека за исключением хро-
мосомы, содержащей ген прототрофности по глицину (Као et al., 1969). Это
была хромосома 12. Однако в ходе культивирования может сохраняться не
одна, а несколько хромосом человека. В таких случаях получают панель
гибридов. При их культивировании в селективных условиях в разных гиб-
ридах будут элиминироваться разные хромосомы, но всегда остается хро-
мосома, несущая соответствующий нормальный ген, обеспечивающий
выживание гибрида в селективной среде. Разработаны также методы, по-
зволяющие ускорить процесс картирования, поскольку элиминация хромо-
сом одного из родительских видов (в данном случае человека), требует до-
статочно длительного времени. С целью такого ускорения получают так
называемые микроклетки, которые исходно содержат неполный набор
хромосом. Клетки человека обрабатывают колцемидом, или колхицином,
которые нарушают митоз и правильное расхождение хромосом. В резуль-
тате образуются микроядра с разным числом хромосом, а иногда даже с
одной хромосомой. Микроклетки человека сливают с целыми клетками
грызуна (Шей, 1985).
Помимо картирования генов в определенной хромосоме, разработаны
также методики регионального картирования в определенном участке изу-
чаемой хромосомы. Для этого используют различные методы. Наиболее
точный уровень картирования был достигнут при использовании клониро-
ванных генов и рекомбинантных ДНК в сочетании с методами генетики
соматических клеток. Можно без преувеличения сказать, что применение
методов молекулярной биологии революционизировали методы картиро-
вания. Применяется гибридизация клонированного гена с метафазными
хромосомами гибрида или с хромосомами клеток родительской формы
(гибридизация ш situ). Важно отметить, что эти методы позволяют карти-
ровать гены, не экспрессирующиеся в гибридных клетках, что характерно
для многих тканеспецифичных генов. Гибридизация in situ меченых клони-
рованных генов с метафазными хромосомами позволяет с высокой досто-
верностью идентифицировать участок локализации гена (цит. по: Варша-
вер, 2000). Впервые с помощью этого метода были картированы гены а- и
Р-глобулинов у гибридов между клетками человека и мыши (Puck, Као,
1982).
ГЕНЕТИКА СОМАТИЧЕСКИХ КЛЕТОК
И ПРОБЛЕМА РАКА
Генетические механизмы превращения нормальной клетки в злокачест-
венную не могли не вызвать самого пристального внимания ученых, работа-
ющих в области генетики соматических клеток, поскольку именно сомати-
ческие клетки организма являются мишенью малигнизации. Уже в самых
первых работах при слиянии клеток, характеризующихся разной степенью
злокачественности, или злокачественных и нормальных клеток, исследова-
ли проявление признаков трансформированного фенотипа. (Barski, 1960:
1961). Первоначальные выводы о доминировании признаков злокачествен-
ности были вскоре опровергнуты и было установлено, что у гибридов доми-
нирует нормальный фенотип (Harris et al., 1969).
255
Были проведены опыты по переносу признаков трансформированного
фенотипа из злокачественных клеток в нормальные с помощью ДНК.
В 1971 г. впервые было показано, что ДНК из клеток, трансформированных
вирусом саркомы Рауса, индуцировала признаки злокачественности в эмбри-
ональных фибробластах курицы (Hill, Hillova, 1971). Таким образом, было
установлено, что признаки злокачественности закодированы в ДНК. Это
положение получило дальнейшее подтверждение в конце 70-х и в 80-х гг.
Важнейшим из них было открытие клеточных онкогенов, определяющих
появление признаков злокачественности. Впервые это было показано на
примере переноса в псевдонормальные клетки мыши NIH ЗТЗ ДНК, выде-
ленной из карциномы мочевого пузыря человека. Клетки NIH ЗТЗ характе-
ризуются типичной для малигнизированных клеток способностью к неогра-
ниченному росту в культуре, но не обладают другими признаками трансфор-
мированного фенотипа, такими, как например, многослойный рост. После
трансфекции в культуре появлялись многослойные колонии, и ДНК, выде-
ленная из таких колоний, передавала этот признак при повторных циклах
трансфекции. Ген, ответственный за трансформирующий эффект, был
идентифицирован и оказался гомологичным вирусному онкогену ras. Его
назвали клеточным онкогеном c-Ha-rasl (Shih et al., 1979, 1981). Определение
последовательностей показало, что онкоген ras выделенный из различных
опухолей (так называемый “активированный” онкоген), отличается от сво-
его нормального аллеля (протоонкогена) точечными мутациями в кодирую-
щей области. Таким образом, появление трансформирующей активности
определялось в данном случае, изменением структуры продукта гена ras
(Barbacid, 1987; Fasano et al., 1984). В настоящее время показано, что транс-
формирующая активность онкогена может зависеть не только от изменения
структуры его продукта, но и от изменения регуляции его экспрессии, т.е. от
количества продукта гена. Наиболее типичным примером такой активации
является протоонкоген с-тус, у которого повышение уровня транскрипции
связано с хромосомными перестройками, приводящими к переносу гена в
участки активно транскрибирующихся генов иммуноглобулинов. Специфи-
ческие хромосомные аберрации известны в настоящее время для целого ря-
да опухолей (Погосянц, 1982). Повышение экспрессии может также быть
обусловлено амплификацией генов. Примерами могут служить онкоген
с-abl, а также с-тус (Rabbits Т., Rabbits Р., 1989).
Все эти данные подтверждают мутационную теорию рака, зависимость
злокачественной трансформации от тех или иных изменений протоонкоге-
нов, превращающих их в онкогены. Подтверждением этой теории является,
с другой стороны, тот факт, что практически все физические и химические
канцерогены являются мутагенами. Мутагенами оказались и ДНК-содержа-
щие онкогенные вирусы. Как было показано в Лаборатории генетики сома-
тических клеток в содружестве с Институтом молекулярной биологии и ге-
нетики АН Украины, онкогенные ДНК-содержащие вирусы SV40 и бычий
аденовирус BAV3 индуцируют генные мутации и хромосомные аберрации в
клетках человека и китайского хомячка in vitro. Мутагенным эффектом об-
ладали вирусные онкогены (Shapiro et al., 1984). В 1987 г. Государственный
комитет СССР по делам изобретений и открытий зарегистрировал откры-
тие за N 315 “Явление индукции онкогенными вирусами генных мутаций в
клетках млекопитающих”, выполненное сотрудниками Лаборатории гене-
256
тики соматических клеток Н.И. Шапиро, М.И. Маршак и Н.Б. Варшавер.
Позднее эти данные были подтверждены в ряде зарубежных лабораторий
для всех групп онкогенных ДНК-содержащих вирусов (Shapiro et aL, 1984).
Вирусы индуцировали мутации в разных генах, т.е. их действие не было ло-
кусспецифичным. В связи с этим можно было предположить, что подобно
другим канцерогенам, онкогенные вирусы способны индуцировать мута-
ции в протоонкогенах и, следовательно, малигнизация, индуцированная он-
когенными вирусами, может определяться не только их собственной
трансформирующей активностью, но и теми мутациями, которые они ин-
дуцируют в клеточных генах. Для решения этого вопроса необходимо бы-
ло исключить трансформирующий эффект вируса, отделить его от его му-
тагенного действия. Такая задача представлялась возможной, если воздей-
ствовать вирусом на злокачественные, т.е. уже трансформированные
клетки и попытаться получить реверсии к норме. Такие реверсии, если та-
ковые будут индуцированы, могут возникнуть лишь в результате мутаген-
ного действия вируса на гены, ответственные за малигнизацию. В Лабора-
тории генетики соматических клеток Института молекулярной генетики
РАН, такие эксперименты были проведены, и под влиянием вируса SV40 в
клетках китайского хомячка были индуцированы реверсии по одному
из признаков трансформированного фенотипа - контактному торможе-
нию, в результате чего возникли однослойные колонии, в то время как в
исходной трансформированной линии колонии были многослойными.
Эти данные подтвердили предположение о том, что в злокачественное пе-
рерождение клеток, вызванное онкогенным вирусом, вносит свой вклад не
только трансформирующая активность вирусного онкогена, но и его мута-
генный эффект. На рис. 91 представлена многослойная колония исходной
злокачественной линии клеток китайского хомячка и однослойные
колонии - ревертанты (Rayevskaya et al., 1989), что характерно для нор-
мальных клеток. В контроле однослойные колонии не возникали, т.е.
“фон” был нулевым.
Это предположение определило направление дальнейших исследований,
которые были посвящены изучению мутагенного эффекта активированных
клеточных онкогенов c-Ha-rasl и с-тус.
Наряду с открытием онкогенов не менее важным было открытие ге-
нов - супрессоров злокачественности, показавшее, что размножение клеток
определяется сложным взаимодействием генов, стимулирующих и подавля-
ющих пролиферацию. Как отмечалось выше, при гибридизации нормаль-
ных и злокачественных клеток доминировал нормальный фенотип, что сви-
детельствовало о наличии в нормальных клетках генов, подавляющих зло-
качественность (Harris et aL, 1971). У гибридов между нормальными клетка-
ми человека и злокачественными клетками грызунов происходила элимина-
ция хромосом человека и одновременно появление клонов, проявляющих
признаки трансформированного фенотипа (Bregula et aL, 1971; Klein et aL,
1971), т.е. потеря хромосом нормальной родительской формы устраняла су-
прессию злокачественности, что свидетельствовало о наличии в нормальной
клетке генов-супрессоров. Для ускорения процесса идентификации хромо-
сом, ответственных за супрессию, использовали микроклетки, содержащие
одну или несколько хромосом нормальных родительских клеток. Было по-
казано, что введение нормальных хромосом человека 1, 4, 6 и 11 приводит к
9. Проблемы и перспективы...
257
Рис. 91. Многослойная колония исходной злокачественной линии клеток китайского хомяч-
ка (А) и однослойные колонии ревептантов, характерные для нормального фенотипа
(Б) х 160
появлению признаков нормального фенотипа в злокачественных клетках
(Kugoh et al., 1990; Sugovara et al., 1990; Trent et al., 1990), что подтвердило до-
минантность нормальных аллелей генов-супрессоров. Позднее была выяв-
лена супрессорная активность хромосом 3, 5, 9, 13 и 22.
Наряду с генетикой соматических клеток, большую роль в открытии и
анализе механизма супрессии внесла генетика человека при изучении на-
следственной предрасположенности к раку, особенно таких раков детей, как
ретинобластома (Rb) (Knudson, 1971) и опухоль Вилмса (нефробластома)
(Haber et al., 1990). В настоящее время известно большое число генов-супрес-
соров, многие из которых картированы и клонированы. Наиболее детально
изучены гены Rb и р53. При анализе и характеристике этих генов, помимо
методов молекулярной биологии, были также использованы методы генети-
ки соматических клеток. Наиболее убедительные доказательства супресси-
рующего действия генов Rb и р53 были получены в экспериментах по транс-
фекции их нормальных аллелей в опухолевые клетки. В результате транс-
фекции происходила частичная нормализация этих клеток (Huang et al.,
1988; Michalovitz et al., 1990). Важным результатом этих исследований яви-
лось обнаружение того факта, что для развития ретинобластомы (как и в
случае других супрессоров, за исключением р53, который был назван Вейн-
бергом “нарушителем правил”) необходима инактивация или потеря обоих
аллелей гена, т.е. потеря супрессии определяется гомозиготностью по двум
рецессивным мутациям. Вместе с тем на уровне организма наследственная
предрасположенность к раку наследуется как доминантный признак и опре-
деляется существованием передаваемой по наследству мутации в одном из
аллелей, которая повышает вероятность того, что у носителя такой мутации
возникнет рак вследствие инактивации второго аллеля. Открытие генов, су-
прессирующих злокачественный рост, вносит существенный вклад в реше-
ние многих проблем фундаментальной науки и медицины, в частности
открываются перспективы использования генов-супрессоров в генной тера-
пии рака.
ИММОРТАЛИЗАЦИЯ КЛЕТОК МЛЕКОПИТАЮЩИХ
Понятие “иммортализация”, т.е. “бессмертие” по отношению к культу-
рам клеток означает способность этих клеток к неограниченному делению
и росту in vitro. Вопрос о продолжительности жизни клеток in vitro и in vivo
интересовал науку с точки зрения понимания процессов, вызывающих
биологическое старение организма. Краткая история применения культур
клеток для исследования старения берет начало от идей Вейсмана и работ
Карреля (Хейфлик, 1997). В 1881 г. великий немецкий биолог Август Вейс-
ман предположил, что соматические клетки высших животных должны
иметь ограниченный потенциал деления (Weismann, 1891). В начале XX в.
Алексис Каррель — известный специалист по культуре клеток, хирург, ла-
уреат Нобелевской премии - описал эксперимент, поставленный, чтобы
показать возможность последовательного и неограниченно долгого раз-
множения в культуре фибробластов, полученных из сердца цыпленка.
Рост культуры экспериментаторами был прекращен произвольно через
34 года. Открытие Карреля о бессмертии культивируемых клеток цыплен-
9*
259
ка долгие годы позволяло считать, что клетки имеют потенциальную спо-
собность нормально размножаться и функционировать in vitro в течение
периода, превышающего продолжительность жизни вида (максимальная
зарегистрированная продолжительность жизни домашних кур - 12 лет).
Таким образом, либо важен тип клеток, либо старение обусловлено про-
цессами, происходящими во внеклеточном матриксе, или на более высоких
уровнях организма, т.е. при взаимодействии клеток при их объединении
в ткани и органы. Интерпретация Каррелем полученных им данных нашла
подтверждение в работах еще ряда лабораторий, где обнаружили, что по-
пуляции клеток, взятых от других видов, в том числе и человека, также
имели поразительную способность к, казалось бы, неограниченному деле-
нию. Иммортализованные популяции клеток и сейчас возникают случайно
в культурах нормальных клеток вследствие неизвестного процесса. Одна-
ко в настоящее время иммортализацию клеток можно вызвать искусст-
венными методами, хотя и с достаточно низкой эффективностью. Смерть
клеток в культуре наблюдалась с тех пор, как в 1907 г. Р. Харрисон создал
первую общепризнанную культуру клеток (Harrison, 1907). Однако укрепи-
лось мнение, базирующееся на работах Карреля, что все клетки в культу-
ре являются изначально иммортализованными, а гибель происходит из-за
того, что не известны точные условия роста культуры. В дальнейшем по-
ложение о врожденном бессмертии клеток в культуре стало догмой среди
специалистов по культуре клеток.
В 1961 г. работы Леонарда Хейфлика и его коллег совершили револю-
ционный переворот в представлении о бессмертии клеток. Хейфлик показал
ограниченность репликативной способности нормальных фибробластов че-
ловека (Hayflick, Moorhead, 1961; Hayflick, 1965). Впервые были исключены
артефакты или незнание адекватных условий культуры как возможные при-
чины смерти нормальных клеток in vitro. Авторы объяснили этот феномен
как следствие старения на клеточном уровне. Было показано, что нормаль-
ные эмбриональные фибробласты человека, растущие в наиболее благо-
приятных условиях, погибают после ~50 удвоений популяции. Исследования
были выполнены на фибробластах потому, что эти клетки имеют наиболь-
шую продолжительность жизни in vitro. Отмечено, что и другие, более диф-
ференцированные нормальные клетки в культуре имеют конечную способ-
ность к размножению, и даже клетки, вовсе не способные к делению (напри-
мер, нейроны, мышечные клетки), тоже имеют ограниченную способность
функционировать in vitro. Продолжая проводить исследования в данной об-
ласти, Хейфлик выдвинул представление о существовании биологической
связи между свойствами нормальных клеток in vitro и нормальными клетка-
ми in vivo, которые отличают их от биологических свойств аномальных или
злокачественных клеток in vivo', все нормальные клетки (как in vitro, так и in
vivo) смертны, а видоизмененные злокачественные клетки бессмертны (как
in vitro, так и in vivo). Это первая попытка классифицировать клеточные по-
пуляции на две категории по основному критерию-смертности или бессмер-
тию. Этим взаимоотношением определяется современный интерес к меха-
низмам иммортализации нормальных клеток. Достижение состояния бес-
смертия нормальными клетками рассматривается многими исследователями
как фундаментальная основа исследований процессов старения и злокачест-
венной трансформации.
260
Таблица 1. Три основных категории культур клеток животных и человека (Хейфлик,
1997)
Первичные культуры клеток Штаммы диплоидных клеток Штаммы клеток, способных к неограниченному делению в культуре
Получены из интактных тканей и не подвергнуты культивированию Имеют ограниченную способность удваиваться; не вызывают опухолей при введении эксперименталь- ным животным; имеют кариологическую картину тканей, из которых они происходят; диплоиды; зависимы от прикрепления к субстрату Иммортализованные линии; могут вызывать опухоли пос- ле инъекции эксперимен- тальным животным; обычно не имеют кариологи- ческой картины ткани, из ко- торой они происходят; анеуплоиды; обычно не зависят от при- крепления к субстрату
В работах Хейфлика (Hayflick, Moorhead, 1961; Hayflick, 1965) сформули-
рованы некоторые свойства, присущие нормальным диплоидным клеткам:
клетки, выделенные из эмбрионов человека, совершают ~50 удвоений
популяции;
у диплоидных клеток человека число удвоений популяций обратно про-
порционально возрасту донора;
штаммы клеток, выделенных из нормальных тканей, имеют диплоид-
ный кариотип;
нормальные штаммы клеток, в отличие от иммортализованных линий,
не способны к репликации в суспензионной культуре. Это свойство получи-
ло название зависимости от прикрепления к субстрату (anchorage depen-
dence);
штаммы диплоидных клеток человека не вызывают опухолей при их
инокуляции лабораторным животным;
штаммы диплоидных клеток человека можно хранить замороженными,
причем клетки “помнят” на каком уровне удвоения их заложили на хране-
ние, даже при длительном времени хранения.
Эти характеристики позволили исследователям (Хейфлик, 1997) разде-
лить все культуры клеток человека и животных на три категории (табл. 1).
Нормальные клетки человеческого организма редко претерпевают (или
никогда не претерпевают) спонтанную иммортализацию in vitro в отличие
от клеток грызунов. Биологический смысл этого факта, по-видимому, за-
ключается в том, что у человека, как у более долго живущего, чем грызуны,
организма значительно сильнее действуют механизмы, препятствующие
клеточной трансформации. Поэтому получение иммортализованных клеток
человека в отличие от клеток грызунов представляет определенные трудно-
сти (Curatolo et al., 1984; Kraemer et al., 1986; McCormick, Maher, 1988) и миро-
вая коллекция иммортализованных диплоидных клеток человека значи-
тельно беднее, чем клеток грызунов. Речь здесь не идет о клеточных лини-
ях, происходящих из опухолевых клеток. Иммортализация фибробластов
человека под влиянием различных агентов происходит с более низкой час-
тототой (10 7), что сопоставимо со спонтанными мутациями генов в клетке
(Sager, 1984; Fry et al., 1988; McCormick, Maher, 1988).
261
Природа злокачественого перерождения клетки (малигнизация) состав-
ляет предмет изучения клеточной и молекулярной биологии постольку, по-
скольку на этом уровне исследования находится ответ на вопрос о причинах
сбоя регуляции развития, в результате которого клетка получает импульс
к неконтролируемому делению. Иммортализованные диплоидные клетки
человека могут служить моделью, в частности, для идентификации генов,
ответственных за иммортализацию, т.е. за первый этап процесса малигни-
зации.
Наиболее часто в качестве индуктора иммортализации клеток человека
используют вирус SV40 (обезъяний вирус 40), а также его мутанты и конст-
рукции, несущие различные последовательности вируса (Neufeld et al., 1987;
Shay, Wrigh, 1989; Bartek et al., 1991; Rinehart et al., 1993). Особый интерес
представляют условно иммортализованные линии клеток человека, получа-
емые под действием температурочувствительных (ts) мутантов SV40, несу-
щих мутации в ранней области (ген А), кодирующей трансформирующий бе-
лок Т - антиген (Wynford-Thomas et al., 1990).
Задача наших исследований состояла в получении под действием tsA -
мутанта вируса SV40 и плазмиды pSV3neo, имеющей в своем составе ген А,
иммортализованных клеток человека и последующей их характеристики с
целью выяснения роли вируса в поддержании иммортализованного феноти-
па (см. раздел “Основная часть”).
ИЗУЧЕНИЕ ЭКСПРЕССИИ ГЕНОВ И ПОДХОДЫ К СОЗДАНИЮ
КЛЕТОЧНЫХ МОДЕЛЕЙ НЕКОТОРЫХ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА
НА ПРИМЕРЕ ГЕНА ПРЕСЕНИЛИНА-1
Болезнь Альцгеймера (БА) - наиболее часто встречающееся нейродеге-
неративное заболевание людей в среднем и пожилом возрасте. Ранняя се-
мейная форма, составляющая около 10% всех случаев БА, характеризуется
началом заболевания в возрасте до 65 лет, быстрым прогрессированием и
связана с аутосомно-доминантным наследованием мутаций в трех генах:
предшественнике 0-амилоида (арр), пресенилине-1 (hpsl; Sherrington et al.,
1995) и пресенилине-2 (hps2; Rogaev et al., 1995) (структура гена пресенилина-1
представлена на рис. 92).
Следует отметить, что за развитие ранней семейной формы БА более
чем в 60% случаев, отвечают мутации в гене hpsl. Основным гистопатоло-
гическим признаком БА является накопление сенильных бляшек и внутри-
клеточных нейрофибриллярных клубков, которое сопровождается массо-
вой гибелью нейронов в ряде структур головного мозга. Каким образом му-
тации, в частности в генах hpsl и hps2, влияют на развитие перечисленных
признаков, до конца не известно. По ряду выдвигаемых гипотез оно сводит-
ся к следующему:
изменению процессинга, а также стабильности комплексов ряда белков
(самих пресенилинов, предшественника 0-амилоида, некоторых белков сис-
тем передачи информации в клетке и др.);
изменению транскрипционной активности ряда генов;
нарушению клеточного гомеостаза: дестабилизации кальциевого обме-
на, оксидативному стрессу, дисфункции митохондрий и др.
262
На сегодняшний день наиболее популярной моделью изучения патогене-
за БА in vitro являются клеточные линии, трансфицированные различными
(нормальными и мутантными) формами генов БА. Так, в ряде работ
(Yamatsuji et al., 1996; Nishimura et al., 1998) экспрессия гена, кодирующего
АРР, как с мутациями, приводящими к развитию БА, так и без них, вызыва-
ла апоптоз в трансфицированных клеточных линиях. Повышенная чувстви-
тельность к различным апоптотическим стимулам (депривации по трофиче-
ским факторам, оксидативному стрессу, действию Р-амилоида) показана в
культурах с гиперэкспрессией ряда мутантных форм генов hpsl и hps2 (Guo
et al., 1996, 1997, 1998; Deng et al., 1996; Wolozin et al., 1996, Чернявская и др.,
1998). Следует отметить, что получение клеточных систем с негативным
воздействием мутантных форм гена hpsl представляется актуальным в све-
те использования их как модельных при поиске и тестировании лекарствен-
ных препаратов (потенциальных агентов для терапии БА), способных уве-
личивать жизнеспособность клеток.
Настоящая работа по изучению влияния ранее не исследованных мута-
ций в гене hpsl на фундаментальные клеточные процессы, была проведена
на модельных трансфицированных культурах, которые были созданы на ос-
нове линии клеток феохромоцитомы крысы РС12. Основные результаты,
полученные в ходе выполнения этой работы представлены в соответствую-
щем подразделе раздела “Основная часть”.
ОСНОВНАЯ ЧАСТЬ
МУТАГЕННОЕ ДЕЙСТВИЕ АКТИВИРОВАННЫХ
КЛЕТОЧНЫХ ОНКОГЕНОВ
Основной целью исследований явилось изучение мутагенного эффекта
активированных клеточных онкогенов c-Ha-rasl, выделенного из клеток EJ
карциномы мочевого пузыря человека и с-тус, выделенного из плазмоцито-
мы мыши МОРС 315.
Работу проводили на клетках клона спонтанно трансформированной ли-
нии фибробластов китайского хомячка. Были использованы плазмиды
pEJ6.6, содержащая онкоген c-Ha-rasl, и pSVc-myc-1 (Shih, Weinberg, 1982;
Land, 1983). Модельной системой служил ген hprt, кодирующий фермент ги-
поксантин- фосфорибозилтрансферазу (ГФРТ), мутации которого опреде-
ляют резистентность к аналогам пуриновых оснований 6-тиогуанину (6-ТГ)
и 6-меркаптопурину (6-МП).
А. Мутагенная активность плазмид pEJ6.6 и pSVc-myc-1. Прежде чем
исследовать мутагенный потенциал плазмид, необходимо было убедиться,
что их ДНК обладает биологической активностью, т.е. что встроенные в
плазмиды онкогены способны индуцировать злокачественную трансформа-
цию. С этой целью проводили трансфекцию псевдонормальных крысиных
клеток Rat2 плазмидой pEJ 6.6 и плазмидой pSVc-myc-1. Было показано, что
после трансфекции в клетках Rat2 возникают многослойные фокусы мор-
фологической трансформации с частотой 1СН, в то время как контрольные
плазмиды pBR322 и pSV2-neo, на основе которых были сконструированы со-
ответственно плазмиды pEJ6.6 и pSVc-myc-1, не вызывали образования фо-
кусов (рис. 93).
263
При исследовании мутагенного действия плазмиды pEJ6.6 после транс-
фекции наблюдалось заметное увеличение частоты мутантов ГФРТ , рези-
стентных к аналогам пуриновых оснований, в среднем в 2,6 раза по сравне-
нию с контролем (pBR 322). Анализ всей совокупности данных по критерию
Вилкоксона (6 опытов) позволяет сделать вывод о достоверности наблюда-
емой индукции генных мутаций (Р < 0,05) (Барон и др., 1992). Аналогичные
результаты были получены и при изучении индукции хромосомных аберра-
ций. Плазмида pEJ6.6 повышала частоту хромосомных аберраций и частоту
разрывов на клетку по сравнению с контролем (Барон и др., 1992). Мутаген-
ным эффектом обладала и плазмида, несущая онкоген с-тус (pSVc-myc-1),
которая в такой же степени, как плазмида pEJ6.6, повышала частоту генных
мутаций (7 опытов, Р < 0,05) и хромосомных аберраций (Бобрышева и др.,
1993).
Б. Роль активированного клеточного онкогена c-Ha-rasl в мутагенном
эффекте плазмиды pEJ6.6. Результаты опытов с плазмидой pEJ6.6 не позво-
ляли, однако, исключить возможность определенного вклада в наблюдае-
мый мутагенный эффект не только действия онкогена, но и каких-то других
последовательностей в составе плазмиды pEJ6.6. С целью выяснения этого
вопроса, была сконструирована плазмида pEJdl, в которой онкоген инакти-
вировали за счет делеции (~0,3 т.п.н.), включающей первый интрон и затра-
гивающей границы первого и второго экзонов. В отличие от плазмиды с ак-
тивным онкогеном плазмида pEJdl не вызывала появления многослойных
фокусов трансформации. Следовательно, делеция инактивировала онкоген,
и плазмида pEJdl могла быть использована в качестве контроля для оценки
роли онкогена c-Ha-rasl в мутагенном эффекте плазмиды pEJ6.6.
Полученные данные показали (6 опытов), что частота мутантов ГФРТ,
возникших после трансфекции плазмиды pEJ6.6 с активным онкогеном, в
1,6 раза достоверна (Р < 0,05) превышала их частоту в контроле (pEJdl)
(Baron et al., 1992).
В. Характеристика мутантов, индуцированных онкогеном c-Ha-rasl, и
природа мутагенного действия онкогена. В дальнейшем представлялось
необходимым выделить индуцированные онкогеном резистентные мутанты
ГФРТ- и проверить степень стабильности признака резистентности, что в ге-
нетике соматических клеток рассматривается как тест, подтверждающий
его мутационную природу. При изоляции клонов, резистентных к 6-МП и
6-ТГ, важно было применить методику, которая с высокой долей вероятно-
сти позволяла бы утверждать, что резистентные клоны были индуцированы
онкогеном, а не являются спонтанными мутантами, присутствующими в по-
пуляции. С этой целью была использована специальная методика (флуктуа-
ционный тест), которая позволяла исключить возможность появления рези-
стентных колоний в контроле, т.е. фон спонтанных мутантов в контроле
был нулевым.
Была проверена степень стабильности признака резистентности при
длительном культивировании в неселективных условиях, т.е. в отсутствие
давления отбора по селективному признаку. Последующий перевод в селек-
тивные условия показал, что все клоны сохраняли резистентность и были
способны к росту как в массовом, так и в разреженном посеве, что подтвер-
дило их мутационную природу. Тем не менее степень резистентности клонов
значительно варьировала, что указывало на возможность сохранения у не-
264
которых клонов (с низкой степенью резистентности), определенного уровня
активности фермента ГФРТ. Об этом свидетельствует также способность
таких клонов расти на “контрселективной” среде HAT, содержащей гипок-
сантин, аминоптерин и тимидин (Littlefield, 1964). Как известно, для роста на
такой среде необходимо в большей или меньшей степени сохранение актив-
ности ГФРТ. Подобного рода “аномальные” мутанты, растущие и на селек-
тивной, и на “контрселективной” средах, были неоднократно описаны в ли-
тературе (Shapiro et al., 1985; Gillin et al., 1972; Fenwick et al., 1977). Тем не ме-
нее эффективность посева (на среде с 6-ТГ) клеток, характеризующихся да-
же самой низкой степенью резистентности, превышала эффективность по-
сева клеток исходной популяции на несколько порядков (17 и 0,001% соот-
ветственно) (Бобрышева, Варшавер, 1995). Таким образом, среди индуциро-
ванных c-Ha-rasl резистентных клонов присутствовали leaky мутанты, кото-
рые, как известно, нередко проявляют температурочувствительность (ts)
(Fenwick et al., 1977). Среди 6 индуцированных резистентных мутантов, ис-
пытанных при рестриктивной температуре 39 °C, 4 оказались температуро-
чувствительными, в то время как среди 20 клонов независимого происхож-
дения, выделенных из родительской популяции, не было обнаружено ни од-
ного As-мутанта. Анализ As-мутантов показал, что среди них можно выделить
два класса мутантов по температурочувствительности.
Рост мутантов первого типа снижался при повышении температуры
только на селективной среде, на неселективной среде различий в росте не
наблюдалось. Следовательно, температурочувствительность данных му-
тантов определялась мутацией в гене hprt. Рост мутантов второго типа за-
висел только от температуры, и эффективность посева клеток снижалась в
одинаковой степени как на среде с HAT, так и на неселективной среде, т.е.
температурочувствительность данных мутантов не зависела от уровня ак-
тивности ГФРТ и, следовательно, определялась мутацией в каком-то дру-
гом гене. Таким образом, рост мутантов первого типа зависел не только от
температуры, но и от состава среды, в то время как рост мутантов второго
класса зависел только от температуры. Эта гипотеза была проверена еще
одним методом. Если As-мутация возникла в гене ГФРТ, то его активность
снижается при 39 °C и соответственно возрастают его резистентность и эф-
фективность посева на среде 6-ТГ. Как показывают данные, представлен-
ные на рис. 94, такая закономерность наблюдается для клона первого типа
2-V-1, в то время как эффективность посева клеток клона второго типа
2-VII-2 на среде с 6-ТГ не отличается при двух температурах. Это подтвер-
ждает предположение о том, что в данном случае As-мутация возникла не в
гене hprt.
На основании приведенных данных можно сделать заключение, что му-
тагенный эффект онкогена c-Ha-rasl не является локус-специфичным. Ана-
логичные данные были получены для онкогена c-fos (Van der Berg et al.,
1991). Таким образом, возникновение As-мутаций не только в гене, кодирую-
щем ГФРТ, но и в ряде других генов свидетельствует, что изучение мутаген-
ного действия активированных клеточных онкогенов на уровне одного ло-
куса не отражает общей величины индукции мутаций на геном в целом.
Изученные ГФРТ-клоны были исследованы с помощью блот гибриди-
зации на присутствие в их геноме экзогенных ras-последовательностей че-
ловека. Анализ радиоавтографов показал возможность применяемой мето-
265
40
2-V-l
2-VII-2
Рис. 94. Выживаемость (эффективность посева) мутантных клонов на среде, содержащей
6ТГ при 33 и 39 °C
дики обнаружить уникальную последовательность в составе геномной ДНК
и не выявил наличия последовательностей плазмиды pEJ6.6 ни у одного из
10 мутантов, индуцированных c-Ha-rasl (Бобрышева, Варшавер, 1995). Эти
данные позволяют сделать вывод, что 6-ТГ резистентность индуцированных
клонов не связана со стабильной инсерцией плазмиды pEJ6.6, несущей акти-
вированный онкоген человека c-Ha-rasl в геномную ДНК, а, следовательно,
и с постоянной экспрессией данного онкогена. Так как не обнаружено ста-
бильной интеграции онкогена, то вероятнее всего он оказывает свое мута-
генное действие на ранних сроках после введения плазмидной ДНК в клет-
ки, как это было показано для онкогенных ДНК-содержащих вирусов
(Shapiro et al., 1984). Очевидно, в данном случае механизм мутагенного дей-
ствия онкогена можно отнести к типу “hit-and-run”. Этот механизм получил
подтверждение в работах по индукции мутаций и злокачественной транс-
формации, вызываемой некоторыми вирусами (Marengo et al., 1981; Galloway
et al., 1983; Bouchard et al., 1988). Результаты проведенных экспериментов по-
зволяют сделать следующие выводы.
1. Показана статистически достоверная индукция генных мутаций и хро-
мосомных аберраций в клетках китайского хомячка под влиянием плазмид,
несущих активированные клеточные онкогены c-Ha-rasl и с-тус.
2. Продемонстрировано, что основной вклад в мутагенную активность
плазмиды pEJ6.6 вносит активированный клеточный онкоген c-Ha-rasl.
3. Мутагенный эффект c-Ha-rasl онкогена не является локус-специфич-
ным.
4. Механизм действия онкогена не является инсерционным и, по-видимо-
му, принадлежит к типу “hit-and-run”.
266
Несмотря на то, что величина индукции под влиянием онкогена, учиты-
ваемая по одному гену, является относительно низкой, суммарное увеличе-
ние уровня индуцированного мутагенеза на геном клетки может быть значи-
тельным. В таком случае мутация в каком-либо протоонкогене, превраща-
ющая его в онкоген, будет повышать частоту мутаций на геном и тем самым
способствовать увеличению генетической нестабильности трансформиро-
ванных клеток.
ИММОРТАЛИЗАЦИЯ ФИБРОБЛАСТОВ ЧЕЛОВЕКА
А. Получение иммортализованных фибробластов. В экспериментах по
получению иммортализованных линий, наряду с фибробластами, использо-
вались и другие типы клеток человека: эпителиальные эмбриональные
клетки кишечника, миобласты скелетных мышц, клетки щитовидной желе-
зы, кератиноциты, клетки эндометрия, клетки глии. Также широк спектр
индуцирующих иммортализацию агентов - от онковирусов, химических кан-
церогенов до гамма-облучения. Данные по получению некоторых имморта-
лизованных линий клеток и их характеристики приведены в табл. 2.
Общепринятая схема получения иммортализованных линий клеток че-
ловека включает три основных этапа:
Культивирование первичных диплоидных клеток человека на специаль-
ных средах, обеспечивающих оптимальные условия роста;
Обработка клеток индуцирующим иммортализацию агентом;
Отбор полученных клонов-трансфектантов, с их последующей характе-
ристикой.
Наши работы мы проводили в сотрудничестве с коллегами из Медико-
генетического научного центра (МГНЦ) В.Г. Черниковым и Г.Б. Раевской,
откуда были получены первичные диплоидные фибробласты человека.
Подробные схемы экспериментов по получению иммортализованных линий
клеток под действием tsA мутанта SV40 и плазмиды pSV3neo описаны в
статьях (Иноземцева и др., 1997; 2001). Здесь же следует отметить некото-
рые важные моменты этих работ.
Для получения линий иммортализованных фибробластов человека были
выбраны два варианта воздействия онкогенного вируса SV40 на нормаль-
ные клетки: tsA мутантом вируса и вектором pSV3neo, содержащим последо-
вательность ДНК, кодирующую ранние белки вируса SV40, в том числе
большой Т-антиген, а также бактериальный ген пео в качестве селективно-
го маркера.
Чем был обусловлен наш выбор вируса SV40, как индуктора иммортали-
зации? Во-первых тем, что он был всесторонне изучен и генетически и ви-
русологически. Во-вторых, к началу наших опытов (конец 80-х - начало 90-х
годов) среди многочисленных работ нашей Лаборатории по изучению му-
тагенеза, индуцированного различными мутагенами, проводились работы,
посвященные изучению генетического контроля процессов репарации и му-
тагенеза, индуцированного онкогенными вирусами, в частности, вирусом
SV40 (Marshak et al., 1975; Varshaver et aL, 1980; Gorbunova et al., 1982; Shapiro
et al., 1984; Rayevskaya et al., 1989). Хорошо известно, что каждый вид виру-
сов имеет свой круг хозяев, в клетках которых они могут размножаться.
267
Таблица 2. Характеристики некоторых иммортализованных линий
клеток млекопитающих
Клетки Трансфор- мирующий агент Время жизни у Ускорение роста Эффективность посева, %
1 2 3 4 5
Эмбриональные эпителиаль- SV40 33 пассажа Ни 4,5
ные клетки кишечника Миобласты скелетных мышц SV40 4—8 мес. + Ни
Клетки щитовидной железы tsSV40 >200 УП + 9,8
Кератиноциты AD12-SV40 >1года Ни Ни
Клетки эндометрия MNNG >2 лет + 10,0
Клетки глии SV40 ori 80 УП Ни Ни
Фибробласты у-лучи Неогр. + 16.0
Фибробласты 4NQO 2 года Ни Ни
Фибробласты, пигментная ксе- MNNG SV40 ori 2 года + 40,0
родерма Астроциты спинного мозга Adl6 18 мес. + Ни
эмбриона человека Фибробласты взрослого чело- pSV3neo >60 пасса- + 4,3
века Фибробласты эмбриона чело- tsSV40 жей >2 лет + 28,1
века * Модальное число хромосом в двух линиях из трех = 46. Примечание. Ни - не исследовалось, УП - удвоение популяции: плюс - да, минус - нет.
Те виды инфицированных вирусом клеток животных, где он размножается,
так называемые пермиссивные, в конечном счете гибнут. В клетках, при-
надлежащих другим видам млекопитающих, где вирус размножаться не спо-
собен, его геном встраивается в геном клетки хозяина и, как правило, транс-
формирует ее. Клетки человека - непермиссивная для вируса SV40 система.
Как уже говорилось, было показано, что ген А (онкоген SV40), определяет
не только возможность встройки генома вируса в геном клетки хозяина, но
и обусловливает трансформацию нормальной клетки в злокачественную.
Температурочувствительный мутант этого гена может обусловить транс-
формацию только в условиях пермиссивной температуры (33 °C) и не спосо-
бен осуществить ее при непермиссивной (40 °C). В этом случае мы имеем де-
ло как бы не с изменением вируса в целом, а с изменением только его онко-
гена. Поэтому, проводя эксперименты в непермиссивных для вируса услови-
ях, можно выяснить роль онкогена в возникновении и становлении иммор-
тализованного фенотипа клеток. Схема эксперимента с использованием
плазмиды pSV3neo современнее, но требует предварительной отработки ус-
ловий трансфекции вектора в клетки методом электропарации. Входящий в
состав плазмиды ген пео облегчает отбор трансфектантов на селективной
268
Снижение за- висимости рос- та клеток от сыворотки Рост в агаре Контактное торможение Прививае- мость Кариотип Авторы
6 7 8 9 10 11
Ни + Ни - Анеупл. Berry et al., 1988
+ + - - Ни Miranda et al., 1983
+ — Ни — Анеупл* Wynford-Thomas et al., 1990
Ни — Ни — Анеупл. Rhim et al., 1985
Ни + — — Ни Dorman et al., 1983
4- — — Ни Ни Major et al., 1985
— + — — Анеупл. Namba et al., 1986
Ни + — — Анеупл. Kakunaga et al., 1978
+ + Ни Ни Ни Daga-Grosjean et al., 1987
+ — — Ни Ни Балабанов и др., 1990
+ — Ни — Гетероплоид Иноземцева и др., 2001
+ Ни Ни Анеупл. Иноземцева и др., 1997, 2001
среде, содержащей антибиотик генетицин (G 418). О приобретении клетка-
ми признака бессмертия можно судить либо по их способности к длительно-
му культивированию, либо по способности к клонированию и субклонирова-
нию. Иммортализованные клетки, полученные в результате воздействия tsA
мутанта SV40, способны к длительному культивированию и ведутся нами в
культуре более 2 лет. А клетки, полученные в результате трансфекции плаз-
мидой pSV3neo, пассируются в культуре более 60 пассажей и способны к суб-
клонированию, что позволяет их считать условно иммортализованными.
В результате проведенной серии экспериментов каждому коллективу
удалось получить по одной иммортализованной линии фибробластов чело-
века. Показано, что индуцированная частота иммортализации равна 1 х 10~7,
что сопоставимо с данными, известными в литературе (Mayne et al., 1986;
McCormick et al., 1988; Shay et al., 1989; Wright, Shay, 1992). Райнехарт
(Rinehart et al., 1993) отмечает, что разные типы клеток могут иммортализо-
ваться с различной частотой от 1 х К)-6 для эндометриальных стромальных
клеток до 3 х 1О7 для фибробластов.
Одной из особенностей процесса иммортализации клеток человека явля-
ется наличие или отсутствие состояния кризиса. Впервые состояние кризиса
269
было описано в 1965 г. в результате исследования эффектов вируса SV40 на
фибробласты человека (Girardi et al., 1965). Многие авторы (Wright et al.,
1989; Bischoff et al., 1990; Rinehart et al., 1993; Дункан, 1997; Спитковский,
1997) указывают на то, что иммортализация клеток человека под действием
SV40 чаще всего протекает в две стадии. Первая стадия - временное удлине-
ние жизни: после введения в клетки последовательности ДНК, кодирующей
ранние белки вируса SV40, такие как большой Т-антиген и другие онкобел-
ки, нормальные клетки человека претерпевают “морфологическую транс-
формацию” и продолжительность их жизни по сравнению с исходными
клетками увеличивается в среднем на 40 удвоений популяции. Затем эти
клетки обычно приходят к состоянию кризиса, т.е. к прекращению деления
и гибели части клеток популяции. Вторая стадия - достижение неограничен-
ного пролиферативного потенциала: некоторые клетки, преодолев состоя-
ние кризиса, могут возобновить пролиферацию и стать иммортализованны-
ми. Иммортализация, вызванная вирусом папилломы человека, также осу-
ществляется через эти две стадии (De Silva et al., 1994). Наличие кризиса,
возможно, говорит о том, что для иммортализации клеток действия только
вируса SV40 недостаточно. В пользу этого предположения свидетельствуют
и данные, по иммортализации клеток человека химическими и физическими
канцерогенами, когда требовалась многократная обработка клеток агентом
для успешного выделения бессмертных линий (Dorman et al., 1983; Namba et
al., 1988). Предполагается, что состояние кризиса, при котором не происхо-
дит общего роста популяции, это следствие действия доминантного супрес-
сора, инактивация которого ведет к иммортализации (Shay, Wright, 1989;
Sandhu, et al., 1994). Это событие может быть как спонтанным, так и индуци-
рованным присутствующим в клетке вирусом. В большинстве случаев при
получении иммортализованных линий клеток человека кризис наблюдается
(Neufeld et al., 1987; Wright et al„ 1989; Bartek et al., 1991), но имеются данные,
показывающие возникновение перевиваемых линий человека и без кризиса
(Miranda et al., 1983; Wynford-Thomas et al., 1990). Наши исследования показа-
ли, что полученные линии иммортализованных клеток, по-видимому, не
претерпели кризиса. Однако факт получения большого количества фокусов
трансформации на начальной стадии в этом эксперименте и дальнейшая по-
степенная гибель этих клеток, увеличивших продолжительность своей про-
лиферативной жизни на 20-60 удвоений популяции сверх предела, отпущен-
ного нормальным клеткам человека, подтверждают представление о том,
что наличие кризиса является характерной чертой иммортализации клеток
под действием SV40.
Иммортализация клеток, как правило, сопровождается возникновением
ряда признаков злокачественной трансформации. Клетки полученных им-
мортализованных линий были подвергнуты анализу по некоторым из них, а
именно: повышению эффективности посева на субстрате, увеличению ско-
рости роста клеток, появлению признака независимого роста клеток от со-
держания сывопотки в культуральной среде и их способность расти в полу-
жидком агаре.
Б. Характеристика диплоидных фибробластов и клеток иммортали-
зованных линий. Морфология клеток обеих полученных иммортализован-
ных линий (рис. 95 Б, В, Г) отличается от морфологии нормальных фиброб-
ластов (рис. 95 А) и характеризуется наличием округлых, гексагональных и
270
Рис. 95. Диплоидные фибробласты человека
А — эмбриональные диплоидные фибробласты, Х160; Б — иммортализованные клетки, полученные при
трансфекции плазмидой pSV3neo, содержащей последовательность, кодирующую Т-антиген, х400. фазо-
вый контраст;
271
Рис. 95 (В, Г)
В - иммортализованные клетки, полученные под действием fs-мутанта SV40, культивировавшиеся при пер-
миссивной (33 °C) для вируса температуре. Х160: Г — иммортализованные клетки, полученные под действием
Av-мутанта SV40, культивировавшиеся при непермиссивной (39 °C) для вируса температуре, х400
272
Рис. 96. Зависимость скорости роста клеток от содержания сыворотки в среде. Скорость ро-
ста диплоидных (1, 2) и иммортализованных (3-6) клеток при 5% (А) и 10% (Б) эмбриональ-
ной сыворотки в среде
Линии 3,4, 5 соответствуют иммортализованным клеткам, полученным под действием /s-мутанта SV40,
культивировавшимся при разных температурах; линия 6 - иммортализованным клеткам, полученным
при трансфекции плазмидой pSV3neo. Для линий 1, 3 температура культивирования 39 °C, для линий 2, 5,
6-37 °C; для линии 4 - 33 °C
треугольных клеток с пониженной адгезивностью, рост которых малоупо-
рядочен. При переносе иммортализованных клеток, полученных под дейст-
вием As-мутанта SV40, в непермиссивную для вируса температуру не наблю-
далось реверсии к норме морфологии клеток (рис. 95, В, Г). Иммортализован-
ные клетки изменили скорость роста, успешно размножаясь при пересеве
в соотношении 1:4, 1:6, в то время как диплоидные фибробласты лишь в со-
отношении 1:2.
Клетки полученных иммортализованных линий были испытаны нами на
наличие признаков злокачественной трансформации (см. табл. 2). Помимо
способности культивироваться неопределенно долго in vitro, эти клетки мо-
гут быть клонированы при низкой клеточной плотности, обладают сниже-
нием зависимости скорости роста от количества сыворотки в культуральной
среде, но не растут в полужидком агаре и не способны образовывать опухо-
ли при инокуляции лабораторным животным. Известно, что злокачествен-
ная трансформация - многоэтапный процесс, следовательно, появление при-
знаков трансформированного фенотипа может происходить независимо и
разновременно. Рост в агаре характерен для клеток, находящихся на более
поздней стадии малигнизации, и больше других признаков коррелирует с
прививаемостью (Bols et al., 1991). Нормальные фибробласты человека
очень требовательны к составу ростовой среды, в особенности к такому фа-
ктору, как сыворотка. Клетки иммортализованных линий при пониженном
(5%) содержании сыворотки в среде сохраняли скорость роста, характерную
для исходных диплоидных фибробластов, растущих в среде с 15% сыворот-
ки (рис. 96).
Для выяснения роли вирусного онкобелка (Т-антигена) в иммортализа-
ции клеток, во-первых, определяли наличие генома вируса в полученных ли-
ниях методом полимеразной цепной реакции (ПЦР) (Rinehart et al., 1993) и,
273
во-вторых, экспрессию Т-антигена при помощи стандартной реакции непря-
мой иммунофлуоресценции (Marschak et al., 1975). Результаты ПЦР-анализа
при исследовании клеток, трансформированных to-мутантом SV40, свиде-
тельствуют о присутствии последовательностей ДНК вируса на ранних пас-
сажах и об их отсутствии на более поздних пассажах. Иммортализованные
клетки, полученные при трансфекции плазмидой, содержащей последова-
тельность, кодирующую Т-антиген, показали присутствие его последова-
тельностей в геноме клеток на всех исследованных пассажах. Аналогичные
результаты получены при изучении иммортализованных клеток на наличие
экспрессии онкобелка. Причем для клеток, полученных в случае инфекции
toSV40, это верно как для пермиссивной так и непермиссивной температур.
Одной из важных характеристик иммортализованных линий является
кариотип клеток. Нормальные фибробласты человека имеют диплоидный
кариотип (2п = 46). Для всех трансформированных клеток характерно уве-
личение частоты аномалий числа хромосом, т.е. анеуплоидия, а также коли-
чество хромосомных аберраций. Показано (Counter et al., 1992), что до кри-
зиса значительно увеличивается количество хромосомных аберраций, но по-
сле негр их число стабилизируется и даже уменьшается. Кариотип имморта-
лизованных клеток обеих линий характеризуется ярко выраженной анеуп-
лоидией. Следует отметить, что модальный класс, представленный клетка-
ми с 46 хромосомами, составлял 26% для непермиссивной температуры и
40% для пермиссивной, а также при этой температуре не наблюдаются хро-
мосомные перестройки. Для клеток, трансфицированных плазмидой, содер-
жащей последовательность ДНК вируса SV40, модальный класс выделить
трудно, околодиплоидное число хромосом встречается в 5% изученных ме-
тафаз, околотриплоидное - в 60%, причем в основном эти клетки имеют пе-
рестроенный кариотип (дицентрики, хромосомные фрагменты, хроматид-
ные разрывы, дупликации). В 30% исследуемых клеток содержатся полицен-
трические хромосомы, образующиеся в результате слипания теломерных
участков хромосом. Расстояние между центромерами в наблюдаемых ассо-
циациях хромосом значительно больше, чем суммы длин плеч хромосом,
участвующих в ассоциации. На основании этих наблюдений можно предпо-
ложить, что в теломерах происходит амплификация генетического матери-
ала. Таким образом, анализ полученных данных позволяет говорить вероят-
нее всего о разных механизмах иммортализации клеток человека. Данные,
относящиеся к анализу иммортализованной линии, полученной с помощью
инфекции клеток toSV40, говорят в пользу того, что вирус SV40 имеет непо-
средственное отношение к возникновению иммортализованного фенотипа
на первых этапах, когда, по-видимому, реализуется его мутагенный эффект.
Т.е. возможно, SV40 определяет иммортализацию за счет индукции активи-
рующих мутаций в клеточных протоонкогенах или инактивации генов-
супрессоров (Варшавер, 1996), действуя по типу “hit and run” (Galloway,
McDougall, 1983; Bouchard et al., 1988). Весь приведенный материал, касаю-
щийся иммортализованной линии, выделенной после трансфекции плазми-
дой, не позволяет определенно говорить о механизме возникновения иммор-
тализованного фенотипа в этих клетках. Возможно, в этом случае для им-
мортализации необходимо присутствие вирусного онкобелка. Для решения
этого вопроса необходимо проведение более длительного исследования этих
клеток.
274
ГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ, СВЯЗАННЫЕ С ИММОРТАЛИЗАЦИЕЙ
Исследование механизмов иммортализации клеток человека представ-
ляется весьма существенным для понимания как процессов старения, так и
злокачественной трансформации. Однако молекулярные механизмы им-
мортализации до сих пор остаются неясными. Со времени появления сооб-
щения Хейфлика об ограниченности способности нормальных клеток к
размножению многие исследователи стремятся найти и понять механизм
предполагаемого счетчика, определяющего этот лимит, и того способа,
которым иммортализованные клетки обходят это ограничение. В 1971 г.
А.М. Словников, исходя из теоретических предпосылок, предположил, что
клетка может стареть в связи с потерей повторяющихся последовательно-
стей ДНК на концах хромосом из-за их концевой недорепликации (Словни-
ков, 1971; Olovnikov, 1973а, Olovnikov, 1996b). Существование самого про-
цесса недорепликации независимо предположил также Д. Уотсон в 1972 г.
Через два десятилетия после того, как Словников предложил теорию мар-
гинотомии, Харли и-сотрудники обнаружили, что потеря теломерной ДНК в
результате деления клеток может быть фактором их старения (Harley et al.,
1990, Harley, 1991, Harley et al., 1992). Теломерная гипотеза (рис. 97) предпо-
лагает, что потеря теломер играет роль митотических часов, которые от-
считывают число клеточных делений. По достижении критической длины
теломерной ДНК запускаются процессы остановки клеточного цикла.
После трансфекции клеток Т-антигеном SV40 клетки избегают старе-
ния и продолжают терять теломерную ДНК до тех пор, пока не наступит со-
стояние кризиса. Преодоление кризиса связано со стабилизацией теломер и
экспрессией теломеразы (Counter et al., 1992) - рибонуклеопротеидной об-
ратной транскриптазы, способной удлинять теломеры in vivo (Morin, 1989).
Показано, что теломераза активирована в большинстве исследованных им-
мортализованных линий клеток и в первичных опухолях, но не в нормаль-
ных клетках (Kim et al., 1994). Поэтому экспрессию теломеразы считают не-
обходимым фактором иммортализации клеток. Однако недавнее обнаруже-
ние посткризисных клеток и линий опухолевых клеток, не экспрессирую-
щих теломеразу, но поддерживающих длину теломер через альтернативный
механизм (Bryan et al., 1995; Rogan et al., 1995), показало, что выживание кле-
ток возможно и без теломеразы.
Нашлись и другие генетические изменения, сопровождающие блокиров-
ку программы старения или кризиса (Спитковский, 1997). Некоторые из
этих изменений могут быть необходимы для дерепрессии одного или не-
скольких механизмов поддержания теломер, а некоторые могут быть след-
ствием изменений теломер, тогда как другие не связаны с необходимостью
поддержания теломер. Показано (Cristofalo et al., 1992; Meyyappan et aL,
1996), что экспрессия многих генов изменяется после начала старения кле-
ток и при иммортализации. В настоящее время неизвестно, какие из этих из-
менений первичны, а какие вторичны. Дункан (1997) приводит примеры не-
которых генов, изменивших характер экспрессии после иммортализации:
прохибитин - известный супрессор роста; О6-метилгуанин ДНК-метил-
трансфераза - фермент репарации ДНК; стауроспорин - ингибитор проте-
инкиназ; морталин - кодирует белок, подавляющий пролиферацию клеток;
некоторые гены, кодирующие белки цитоскелета. В свете полученных ре-
275
СТАРЕНИЕ КРИЗИС
КЛЕТОЧНОЕ ДЕЛЕНИЕ
Рис. 97. Теломерная гипотеза клеточного старения и иммортализации (Greider C.W. Current
Biology. 1998. Vol. 8. P. 178-181)
зультатов и исходя из выше изложенных предпосылок было интересно вы-
явить гены, которые в процессе 8У40-индуцированной иммортализации под-
верглись перестройкам, либо изменили уровень своей экспрессии. Проводя
сравнительный анализ уровня экспрессии митохондриальных генов окисли-
тельного фосфорилирования в иммортализованных клетках и в разных ти-
пах лимфом (Николаев и др., 2001), было обнаружено, что в иммортализо-
ванных клетках наблюдается усиление экспрессии двух митохондриальных
генов, участвующих в окислительном фосфорилировании - гена цитохром-
с-оксидазы 2 и гена НАДН-дегидрогеназы 4, а также впервые показано уси-
ление экспрессии онкогена set в этих клетках (Николаев и др., 1999).
ПОЛУЧЕНИЕ И АНАЛИЗ МОДЕЛЬНЫХ КЛЕТОЧНЫХ КУЛЬТУР,
ЭКСПРЕССИРУЮЩИХ РАЗЛИЧНЫЕ ФОРМЫ
ГЕНА ПРЕСЕНИЛИНА-1 ЧЕЛОВЕКА
Настоящая работа по изучению влияния ранее не исследованных мута-
ций в гене hpsl на фундаментальные клеточные процессы, была проведена
на модельных трансфицированных культурах, которые были созданы на ос-
нове линии клеток феохромоцитомы крысы PC 12. Данные клетки являют-
ся удобной и широко используемой моделью для изучения процессов нейро-
нальной дифференцировки и клеточной гибели, поскольку под действием
фактора роста нервов (NGF), добавляемого в культуральную среду, они при-
обретают нейроноподобный фенотип.
Трансфекция клеток PC 12 методом электропорации была проведена ве-
ктором pcDNA3 (несущим селективный ген резистентности к неомицину
пеог, позволяющий отбирать стабильные трансфектанты на среде с анти-
биотиком G418) и плазмидами, сконструированными на его основе. Данные
276
250 п.н.
A pcPSlwt
I----------
Рис. 98. Плазмиды, использованные для трансфекции клеток РС12, были сконструированы
на основе вектора pcDNA3 и содержали вставки кДНК различных аллелей hPSl под контро-
лем промотора цитомегаловируса CMV
А - psPSlwt (hPSl дикого типа); Б - pcPS!M146V; В - pcPS!C410Y. Мутации кДНК обозначены стрелками
плазмиды содержат вставки кДНК различных аллелей гена hPSl под конт-
ролем промотора цитомегаловируса человека (CMV): 1) pcPSlwt (hPSl ди-
кого типа), 2) pcPSlM146V (с мутацией в 6-м экзоне, приводящей к замене
Met на Va] в 146 положении) и 3) pcPSlC410Y (с мутацией в 12-м экзоне, при-
водящей к замене Cys на Туг в 410 положении). Структура соответствующих
векторов для трансфекции представлена на рис. 98.
Точечные мутации в гене hPSl, приводящие к единичным заменам ами-
нокислот M146V (Alzheimer’s Disease Collaborative Group, 1995) и C410Y
(Sherrington et al., 1995), характеризуются аутосомно-доминантным наследо-
ванием и приводят к развитию наиболее агрессивной ранней семейной фор-
мы БА.
В результате трансфекции и последующей селекции на устойчивость к
антибиотику G418 были получены 4 поликлональные культуры, а именно:
К-poly (трансфекция вектором pcDNA3), wt-poly (pcPSlwt), M146V-poly
vpcPSlM146V) и C410Y-poly (pcPSlC410Y).
Было показано, что данные поликлональные культуры при культивиро-
вании на различных средах не демонстрируют статистически достоверных
различий в скорости роста. Рост клеток определяли по изменению их числа,
вычисляемого по показателям оптической плотности при добавлении МТТ
277
(3-(4,5-диметилтиазолил-2)-2,5-дифенил тетразолиум бромид) - витального
реагента, имеющего тропность к митохондриям живых клеток.
Совсем иная картина наблюдалась для индивидуальных клонов незави-
симого происхождения, полученных в тех же вариантах трансфекции, что и
поликлональные культуры. На среде, обедненной факторами роста и тро-
фическими факторами ( содержание сыворотки снижено до 1%), и на среде
с NGF, вызывающей нейрональную дифференцировку, клетки клонов,
трансформированные мутантным hPSl -C410Y, обладали более низкой про-
лиферативной активностью. Мы предполагали, что наблюдаемые различия
в пролиферации поликлональных и моноклональных культур могут объяс-
няться гетерогенностью клеточной популяции и низким уровнем экспрессии
hPSl в поликлональных культурах. По расчетам, сделанным на основе PCR-
анализа и Nothem-гибридизации 10-20-ти клонов каждого варианта транс-
фекции, экспрессия mRNA hPSl отсутствовала у 40% клеток в поликлональ-
ных культурах.
Эти предположения подтвердились при анализе экспрессии экзогенного
hPSl методом иммуноблота. Для проведения Western-анализа трансфициро-
ванных культур в лаборатории были получены поликлональные антитела к
N-терминальному участку белка hPS]. Белковый продукт гена hPSl длиной
467 аминокислот локализован как на наружной, так и на внутренних мемб-
ранах клетки и имеет в своем составе 8 гидрофобных трансмембранных до-
менов, гидрофильные С-конец, N-конец и петлю, ориентированные в одну
сторону - в цитоплазму. Известно, что полноразмерный белок hPSl 43-45
kD в норме подвергается эндопротеолизу в районе гидрофильной петли и
присутствует в клетке в виде двух основных фракций: N-концевого фраг-
мента 27-28 kD и С -концевого фрагмента 16-17 kD (Рогаев, 1999).
Western-анализ показал, что в трансфицированных различными форма-
ми гена hPSl культурах, в отличие от контрольной (К-poly), наблюдается
сильный сигнал в районе 43-45 kD, соответствующий непроцессированному
белку экзогенного PS1 человека. Кроме того, во всех культурах присутству-
ет 30 kD форма эндогенного пресенилина крысы (степень гомологии пресе-
нилинов крысы и человека около 96%).
Нейронально дифференцированные под действием NGF (100 ng/ml, в те-
чение 6 дней) клетки трансфицированных культур на ранних пассажах были
подвергнуты воздействию апоптотических стимулов, таких как депривация
(культивирование в течение 24 ч на среде без сыворотки и NGF) и окисли-
тельный стресс (культивирование в течение того же времени на бессыворо-
точной среде с добавлением 100 цМ перекиси водорода). В качестве контро-
ля использовали клетки, культивируемые на бессывороточной среде с
добавлением NGF. Апоптотическими считали клетки, ядра которых при ок-
рашивании флуоресцентным красителем имели выраженную степень кон-
денсации или фрагментации (рис. 99).
Количество клеток в контрольных вариантах практически не отлича-
лось во всех культурах и на гистограмме (рис. 100) приведено к 100%.
Видно, что во всех исследованных культурах в контрольных условиях
степень апоптоза была незначительной. Депривация же вызывала сущест-
венную гибель клеток. Этот эффект был еще более выражен при окисли-
тельном стрессе. Наиболее выраженная гибель клеток в обоих случаях на-
блюдалась в культуре C410Y-poly, в которой за 24 ч исчезало более 70%
278
Рис. 99. Конденсация и фрагментация ядер клеток РС12 под действием апоптотических сти-
мулов
А - контрольные клетки (стандартная среда + NGF); Б - культивирование клеток в течение 24 ч на сре-
де без сыворотки и NFG; В - культивирование в течение 24 ч на бессывороточной среде с добавлением
100 цМ перекиси водорода (+ NGF + Н2О2); 1 - фазовый контраст; 2 - окрашивание ядер по Хехсту. х400
клеток, причем все оставшиеся клетки имели апоптотические ядра. Из пред-
ставленных данных можно заключить, что культура C410Y-poly является
наиболее чувствительной к апоптотическим стимулам. Предполагается, что
указанная мутация hPSl, ассоциированная с ранней аутосомнодоминантной
формой БА, может вызывать сходные изменения в нейронах, увеличивая их
чувствительность к апоптотическим стимулам (Чернявская и др., 1998).
279
Рис. JOO. Влияние депривации и окислительного стресса на количество нормальных и апоп-
тотических клеток в стабильно трансфицированных и контрольных культурах
Рис. 101. Влияние экспрессии нормального и мутантного hPSI на скорость пролиферации
клеток стабильно трансфицированных клонов
а — число клеток дифференцированных культур на 6-й день культивирования на среде с NGF (100 нг/мл)
и пониженным содержанием сыворотки (1%); б - Western-анализ экспрессии hPSI в трансфицированных
клеточных культурах с использованием антител к N-концевому участку белка
В дальнейшем было проведено изучение экспрессии экзогенного hPSl
в моноклональных культурах. Многие клоны сохраняют высокий уровень
экспрессии hPSl-C410Y до 20-го пассажа. Изучая клоны со стабильной, но
различной степенью экспрессии hPSI, была показана зависимость уровня
пролиферации клеток на среде, содержащей NGF, от количества белкового
продукта hPSI. На гистограмме (рис. 101) показано, что гиперэкспрессия не-
процессированной формы 43 kD hPSI дикого типа (клон dN-F4) угнетает
рост клеток по сравнению с контрольной культурой (К-ро1у).
Мутантный hPSl-C410Y (клон M1-D5) даже с меньшей экспрессией, чем
у дикого типа, оказывает еще более негативное воздействие на пролифера-
цию клеток. Возрастание уровня экспрессии мутантного hPSI (клон М1-Е5)
приводит к дальнейшему уменьшению пролиферации.
Таким образом, продемонстрированная корреляция скорости роста кле-
ток и уровня экспрессии экзогенного hPSI, позволяет нам говорить о том, что
мы имеем клеточную систему с негативным воздействием мутантного hPSl-
C410Y, которую можно использовать как модельную для поиска и тестирова-
ния лекарственных препаратов, способных увеличивать жизнеспособность
клеток, экспрессирующих hPSI, т.е. потенциальных агентов для терапии БА.
В настоящее время полученные клеточные линии используются для те-
стирования потенциального терапевтического действия ингибиторов антео-
тензин-превращающего фермента (АПФ или АСЕ), а именно каптоприла и
эналаприла. Выбор данных препаратов обусловлен существующей гипоте-
зой о тесной связи между сосудистыми и нейродегенеративными заболева-
ниями. Так, показаны: связь атеросклероза и болезни Альцгеймера, повы-
шенный риск БА у пациентов с гипертонией, уменьшение риска деменции у
пожилых людей, проходивших курс лечения гипотензивными препаратами
(ACE-ингибиторами). На основании перечисленных данных делается пред-
положение о том, что особенности сосудистой системы человека (как гене-
тические, так и обусловленные влиянием окружающей среды) могут корре-
лировать с предрасположенностью к деменции альцгеймеровского типа
(Amouyel et al., 2000). Генами-кандидатами такой связи являются гены, коди-
рующие белки ренин-ангиотензиновой системы, важнейшего компонента в
регуляции сосудистого гомеостаза. В ряде работ показана ассоциация поли-
морфизма в гене ангеотензин-I превращающего фермента, центрального
белка ренин-ангеотензиновой системы, с БА (Щербатых и др., 1999; Fairer et
al., 2000). Предполагается, что генотип, определяющий пониженную актив-
ность ангиотензин превращающего фермента, может являться фактором,
протектирующим развитие некоторых форм сенильной деменции Альцгей-
меровского типа. Поэтому ингибиторы данного фермента могут быть по-
тенциальными терапевтическими препаратами при БА.
Мы изучали действие каптоприла и эналаприла на скорость пролифера-
ции трансформированных hPSI клеток. Под действием ингибиторов во всех
вариантах трансфицированных культур пролиферация падает, что хорошо
коррелирует с данными литературы. Известно, что каптоприл является ин-
гибитором пролиферации клеток в ряде культур эпителиального и мезодер-
мального происхождения (фибробласты, карциномы молочной железы, ме-
зенхимы) (Chisi et al., 2000; Nguyen et al., 1994; Small et al., 1999). Для капто-
прила и эналаприла показано также их влияние на снижение скорости роста
клеток нейробластомы человека SH-SY5Y (Chen et al., 1991).
281
С другой стороны, для некоторых клеточных линий (клеток гематопоэ-
тического ряда, эпителиальных клеток легких и кардиомиоцитов) показано,
что под действием ACE-ингибиторов снижалась апоптотическая гибель кле-
ток (Wang et al., 2000; Uhal et al., 1908; Li et al., 1997). Поэтому в настоящее
время нами изучается действие ACE-ингибиторов на апоптоз в трансфици-
рованных культурах с экспрессией hPSl (как мутантных форм, так и формы
дикого типа).
Суммируя полученные на данный момент результаты, можно сказать,
что исследованные нами трансфицированные клеточные культуры с нега-
тивным воздействием мутантных форм hPSl могут представлять интерес
как для дальнейшего изучения функций данного гена, так и в качестве мо-
дельных систем для поиска и тестирования лекарственных препаратов при
терапии БА.
ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ
Как показывают приведенные данные, развитие молекулярной генетики
соматических клеток в последние годы сопровождается тенденцией исполь-
зования комплексного подхода при решении важнейших проблем фундамен-
тальной и прикладной науки. Это наглядно можно продемонстрировать на
примере работ, посвященных анализу функций генов путем их целенаправ-
ленного изменения (нокаутирования) (Тарантул, 1996; Свердлов, 1996).
На первом этапе эксперименты проводятся на клеточном уровне методами
генетики соматических клеток и молекулярной биологии с последующим
переходом к исследованиям эмбрионального развития и функционирования
организма в целом. Для этого необходим комплексный анализ с использова-
нием методов эмбриологии, гистологии, цитогенетики и других биологиче-
ских дисциплин. Недавние достижения в исследованиях “опухолевых” генов
и генов-супрессоров злокачественного перерождения клеток, механизмов
контроля клеточного деления и “теломерной” биологии дают лишь общее,
далеко не полное представление о механизмах клеточного старения и гибе-
ли, иммортализации и злокачественной трансформации. Выяснение вклада
каждого из имеющихся представлений и причинно-следственных связей ме-
жду ними продолжает оставаться актуальной проблемой.
Трансфицированные клеточные культуры представляют собой удобную
и чрезвычайно ценную модель как для изучения функций отдельных генов в
клетке, так и в качестве систем моделирующих различные заболевания че-
ловека in vitro. Кроме того, такие клеточные культуры позволяют прово-
дить широкий предварительный скрининг химических соединений и отби-
рать среди них потенциальные лекарственные препараты.
ЛИТЕРАТУРА
Балабанов Ю.В., Завизион Б.А., Трахт И.Н. Получение иммортализованных
астроцитов спинного мозга эмбриона человека // ДАН СССР. 1990. Т. 315.
С. 1238-1241.
Барон Е.М., Бобрышева И.В., Варшавер Н.Б. Плазмида pEJ6.6, несущая активирован-
ный онкоген c-Ha-ras-1, повышает частоту мутаций в клетках китайского хомячка //
Генетика. 1992. Т. 28. С. 35^10.
282
Бобрышева И.В., Барон Е.М., Варшавер Н.Б. Плазмида pSVc-myc-1 индуцирует генные
мутации и хромосомные аберрации в культивируемых клетках китайского хомяч-
ка // Цитология и генетика. 1993. Т. 27. С. 51-56.
Бобрышева И.В., Варшавер Н.Б. Характеристика мутантов, индуцированных онкогеном
c-Ha-ras-1, и природа мутагенного действия онкогена // Генетика. 1995. Т. 31.
С. 1598-1604.
Варшавер Н.Б. Гены-супрессоры злокачественности // Молекуляр. генетика, микробио-
логия и вирусология. 1996. Т. 1. С. 3-10.
Варшавер Н.Б. История генетики соматических клеток млекопитающих: становление,
развитие и современное состояние // Успехи соврем, биологии. 2000. Т. 120. С. 115—
128.
Варшавер Н.Б., Черников В.Г.. Маршак М.И., Шапиро Н.И. Температурочувствитель-
ные мутанты в популяциях клеток китайского хомячка // Генетика. 1972. Т. 8.
С. 54-60.
Волкова Л.В., Какпакова Е.С. Получение и характеристика гибридов соматических кле-
ток мыши и китайского хомячка // Там же. 1972. Т. 8. С. 120-127.
Волкова Л.В., Лусс Е.В., Моисеенко Е.В. и др. Исследование клеток китайского хомяч-
ка мутантных по локусу гипоксантин гуанинфосфорибозилтрансферазы // Там же.
1981. Т. 17. С. 297-307.
Дункан ЭЛ., Реддел Р.Р. Генетические изменения, связанные с иммортализацией // Би-
охимия. 1997. Т. 62. С. 1477-1490.
Иноземцева Л.С., Мануйлова Е.С., Маршак М.И. и др. Получение и характеристика им-
мортализованных фибробластов человека // Молекулярная генетика, микробиоло-
гия и вирусология. 1997. Т. 4. С. 27-33.
Иноземцева Л.С., Черников В.Г., Мануйлова Е.С. и др. Иммортализация фибробластов
человека под действием ts-A-мутанта SV40 и плазмиды pSV3neo // Цитология. 2001.
Т. 43. С. 944-953.
Мануйлова Е.С., Шапиро Н.И. Изучение генетического контроля чувствительности кле-
ток млекопитающих к летальному и мутагенному действию ультрафиолетовых лу-
чей // Генетика. 1973. Т. 9. С. 82—89.
Маршак М.И., Варшавер Н.Б. Спонтанный темп возникновения мутаций резистентно-
сти к 8-азагуанину в диплоидных и анеуплоидных клетках человека in vitro // Там же.
1970. Т. 6. С. 130-138.
Николаев А.И., Мартыненко А.В., Калмырзаев Б.Б. и др. Усиление транскрипции от-
дельных митохондриальных генов в В-клеточных неходжкинских лимфомах чело-
века и обезьяны // Молекуляр. биология. 2001. Т. 35. С. 120-127.
Николаев А.И., Хенниг X., Мухоян И.А. и др. Анализ лимфомоспецифических транс-
криптов в В-клеточных лимфомах людей ВМЧ-1 // Там же. 1999. Т. 33. С. 252-260.
Оловников А.М. Принцип маргинотомии в матричном синтезе полинуклеотидов // Докл.
АН СССР. 1971. Т. 201. С. 1496-1499.
Пинто Р.И., Манукян КЛ., Виханская ФЛ и др. Пострепликативная репарация ДНК в
УФ-чувствительных клонах клеток китайского хомячка // Цитология. 1980. Т. 22.
С. 1085-1094.
Погосянц Е.Г. Новое в цитогенетике рака // Генетика. 1981. Т. 17. С. 2087-2099.
Рогаев Е.И. Генетические основы болезней Альцгеймера // Там же. 1999. Т. 35.
С. 1558-1571.
Спитковский Д.М. Теломерные последовательности ДНК и концепция о клетках онто-
генетического резерва // Биохимия. 1997. Т. 62. С. 1503—1509.
Харрис Г. Ядро и цитоплазма. М.: Мир, 1973. С. 22—50.
Хейфлик Л. Смерть и бессмертие на клеточном уровне // Биохимия. 1997. Т. 62.
С. 1380-1393.
Чернявская Л., Григоренко А., Бобрышева И. и др. Трансфекция мутантным геном пре-
сенилина-1 человека увеличивает чувствительность клеток РС12 к апоптозу // Ней-
рохимия. 1998. Т. 15. С. 308-311.
Чеснокова Л.Г., Мануйлова Е.С. Изучение взаимосвязи между чувствительностью к уба-
ину и злокачественностью в клетках мыши//ДАН СССР. 1991. Т 317. С. 1238-1241.
283
Шапиро Н.И., Варшавер Н.Б. О темпе спонтанного мутационного процесса в соматиче-
ских клетках млекопитающих и о некоторых вопросах с ним связанных // Генетика.
1976. Т. 12. С. 132-149.
Шапиро Н.И., Петрова О.Н., Хализев А.Е. Индукция генных мутаций в клетках млеко-
питающих. М., 1968. (Препр. / Ин-т атом, энергии им. И.В. Курчатова; № 1782).
ШейД. Методы генетики соматических клеток. М.: Мир, 1985.
Щербатых Т., Кирьянов С., Коровайцева Г., Рогаев Е. Ген ангиотензин-превращающе-
го фермента как возможный фактор риска или протектирующий фактор при болез-
ни Альцгеймера // Журн. неврологии и психиатрии им. С.С. Корсакова. 1999. Т. 99.
С. 51-52.
Alzheimer’s Disease Collaborative Group. The structure of the presenilin 1 (SI82) gene and iden-
tification of six novel mutations in early onset AD families // Nat. Genet. 1995. Vol. 11.
C. 219-222.
Amouyel P., Richard F., Berr C. et al. The renin angiotensin system and Alzheimer’s disease //
Ann. N.Y. Acad. Sci. 2000. Vol. 903. P. 437-441.
BarbacidM. Ras genes//Ann. Rev. Biochem. 1987. Vol. 56. P. 779-815.
Baron H.M., Bobrysheva I.V., Varshaver NB. The activated human c-Ha-ras-1 oncogene as a
mutagen // Cancer Genet. Cytogenet. 1992. Vol. 62. P. 15-20.
Barski G., Sorieul S., Cornefert F.C. Production dans des cultures in vitro de deux souches cellu-
laires en association de cellules de caractere “hybride” // C.r. Acad. sci. 1960. Vol. 251.
P. 1825-1827.
Barski G., Sorieul S., Cornefert F. “Hybrid” type cells in combined cultures of two different mam-
malian cell strains // J. Nat. Cancer Inst. 1961. Vol. 26. P. 1269-1292.
Bariek J., Bartkova J., Kyprianou N. et al. Efficient immortalization of luminal epithelial cells
from human mammary gland by introduction of simian virus 40 large tumor antigen with a
recombinant retrovirus // Proc. Nat. Acad. Sci. USA. 1991. Vol. 88. P. 3520-3524.
Berry R.D., Powell S.C., Paraskeva C. In vitro culture of human foetal colonic epithelial cells and
their transformation with origin minus SV40 DNA // Brit. J. Cancer. 1988. Vol. 57.
P. 287-289.
Bischoff F.Z., Yim S.O., Pathak S. et. al. Spontaneous abnormalities in normal fibroblasts from
patients with Li-Fraumeni cancer syndrome: aneuploidy and immortalization I I Cancer Res.,
1990. Vol. 50. P. 7979-7984.
Bockstahler L.E. Lytle C.D., Lubinieski A.S. et al. Mutagenic virus replication in human tumor
cells // Cancer Letters. 1982. Vol. 17. P. 141-145.
Bols B.L.M.C., Naaktgeboren J.M., Simons J.W.I.M. Immortalization of Syrian hamster embryo
cells is in itself a multistep event // Cancer Res., 1991. Vol. 51. P. 1177—1184.
Bouchard L., Mathelu F., Bastin M. Polyoma large-T can activate middle T expression by a hit-
and-run mechanism I I Oncogene. 1988. Vol. 2. P. 379-386.
Bregula U., Klein G., Harris HJ. The analysis of malignancy by cell fusion. II. Hybrids between
Ehrlich cells and normal diploid cells // J. Cell. Sci. 1971. Vol. 8. P. 673—680.
Bryan T.M., Englezou A., Gupta J. et al. Telomere elongation in immortal human cells without
detectable telomerase activity // EMBO J. 1995. Vol. 14. P. 4240^1248.
Campbell K., Mewhir J., Ritchie B., Wilmut I. Production of live lambs following nuclear transfer
of cultured embryonic disc cells //Theriogenology. 1995. Vol. 4. P. 181.
Chen L., Re R.N., Prakash O., Mondal D. Angiotensin-converting enzyme inhibition reduces
neuroblastoma cell growth rate // Proc. Soc. Exp. Biol, and Med. 1991. Vol. 196. P. 280-
283.
Chisi J.E., Briscoe C.V., Ezan E. et al. Captopril inhibits in vitro and in vivo the proliferation of
primitive haematopoietic cells induced into cell cycle by cytotoxic drug administration or
irradiation but has no effect on myeloid leukaemia cell proliferation // Brit. J. Haematol.,
2000. Vol. 109. P. 563-570.
Chu E.H.Y., Mailing H.V. Mammalian cell genetics. II. Chemical induction of specific locus muta-
tions in Chinese hamster cells in vitro // Proc. Nat. Acad. Sci. USA. 1968. Vol. 61.
P. 1306-1312.
Conover J.C.N.I., IpPoueymirou W.T., Bates B. et al. Ciliary neutrophic factor maintains the
pluripotentiality of embryonic stem cells // Development. 1993. Vol. 119. P. 559-565.
284
Counter C.M., Avilion AA., Le Feuvre C.E. et al. Telomere shortening associated with chromosome
instability is arrested in immortal cells which express telomerase activity // EMBO J.
1992. Vol. 11. P. 1921-1929.
Cristofalo VJ., Pignolo RJ., Cianciarulo F.L. et al. Changes in gene expression during senes-
cence in culture // Exp. Gerontol. 1992. Vol. 27. P. 429—432.
Curatolo L., Erba E., Morasca L. Culture conditions induce the appearance of immortalized C3H
mouse cell lines // In Vitro. 1984. Vol. 20. P. 597-601.
Davies K.E., Pearson P.L., Harper P.S. et al. Linkage analysis of two cloned sequences flanking
the Duchenne muscular distrophy locus on the short arm of the human X- chromosome //
Nucl. Acids Res. 1983. Vol. 11. P. 2303-2312.
Daya-Grosjean L., James M.R., Drougard C., Sarasin A. An immortalized xeroderma pigmento-
sum, group C., cell line which replicates SV40 shuttle vectors // Mutat. Res. 1987. Vol. 183.
P. 185-196.
De Silva R., Whitaker NJ., Rogan E.M., Reddel R.R. HPV-16 E6 and E7 genes, like SV40 early
region genes, are insufficient for immortalization of human mesothelial and bronchial epithe-
lial cells // Exp. Cell Res. 1994. Vol. 213. P. 418^127.
Deng G., Pike CJ.,Cotman C.W. Alzheimer-associated presenilin-2 confers increased sensitivity
to apoptosis in PC12 cells // FEBS Lett. 1996. Vol. 397. P. 50-54.
Dorman B.H., Siegfried J.M., Kaufman D.G. Alterations in human endometrial stromal cells pro-
duced by N’-methyl-N’-nitro-N-nitrosoguanidine // Cancer Res. 1983. Vol. 43.
P. 3348-3357.
Farrer L.A., Sherbatich T., Keryanov S.A. et al. Association between angiotensin-converting
enzyme and Alzheimer disease // Arch. Neurol. 2000. Vol. 57. P. 210-214.
Fasano O., Aldrich T., Tamanoi F. et al. Analysis of the transforming potential of the human
Ha-ras gene by random mutagenesis // Proc. Nat. Acad. Sci. USA. 1984. Vol. 81. P. 4008-
4012.
Fenwick R.G., Sawyer T.H., Kruh G.D. et al. Forward and reverse mutations affecting the kinetics
and apparent molecular weight of mammalian HGPRT // Cell. 1977. Vol. 12. P. 283-291.
Fry D.G., Hurlin P., Maher V.M., McCormick J J. Transformation of diploid human fibroblasts by
transfection with V-SIS. PDGF2/C-SIS or T24H-ras genes // Mutat. Res. 1988. Vol. 199.
P. 341-351.
Galloway D.A., McDougall J.K. The oncogenic potential of herpes simplex viruses: evidence for
a “hit-and-run” mechanism // Nature. 1983. Vol. 302. P. 21—24.
Gillin F.D., Roufa DJ., Beauder A.L., Caskey C.T. 8-Azaguanine resistance in mammalian
cells. I. Hypoxanthine-guanine phosphoribosyltransferase // Genetics. 1972. Vol. 72.
P. 239-252.
Girardi A J , Jensen F.C., Kaprowski H. SV40-induced transormation of human diploid cells: cri-
sis and recovery // J. Cell. Comp. Physiol. 1965. Vol. 65. P. 69-84.
Gorbunova L.V., Varshaver N.B., Shapiro NJ. The role of the transforming A gene of SV40 in the
mutagenic activity of the virus // Mol. Gen. Genet. 1982. Vol. 187. P. 473—476.
Greider C.W. Telomeres and senescence: the history, the experiment, the future // Curr. Biol.
1998. Vol. 8. P. 178-181.
Guo Q., Furukawa K., Sopher B.L. et al. Alzheimer’s PS-1 mutation perturbs calcium homeosta-
sis and sensitizes PC 12 cells to death induced by amyloid beta-peptide // Neuroreport. 1996.
Vol. 20, N 8. P. 379-383.
Guo Q., Robinson N., Mattson M.P. Secreted beta-amyloid precursor protein counteracts the
proapoptotic action of mutant presenilin-1 by activation of NF-kappaB and stabilization of
calcium homeostasis // J. Biol. Chem. 1998. Vol. 273. P. 12341-12351.
Guo Q., Sopher B.L., Furukawa K. et al. Alzheimer’s presenilin mutation sensitizes neural cells to
apoptosis induced by trophic factor withdrawal and amyloid beta-peptide: Involvement of cal-
cium and oxyradicals // J. Neurosci. 1997. Vol. 17. P. 4212—4222.
Gusella G.F., Varsanyi-Breiner A.. Kao F.-T. et al. Precise location of human-[3-globin gene
complex on chromosome 11 // Proc. Nat. Acad. Sci. USA. 1979. Vol. 76. P. 5239-
5243.
Gusella G.F., Wexler N.S., Conneally P.M. et al. A polymorphic DNA marker genetically linked
to Huntington’s disease // Nature. 1983. Vol. 306. P. 234-238.
285
Haber D., Buckler A.J., Glaser T. et al. An internal deletion within an 1 Ipl3 zink finger gene con-
tributes to the development of Wilm’s tumor // Cell. 1990. Vol. 61. P. 1257-1269.
Harley C.B. Telomere loss: mitotic clock or genetic time bomb? // Mutat Res. 1991. Vol. 256.
P. 271-282.
Harley C.B., Futcher A.B., Greider C.IV. Telomeres shorten during ageing of human fibroblasts //
Nature. 1990. Vol. 345. P. 458^160.
Harley C.B., Vaziri H., Counter C.M., Allsopp R.C. The telomere hypothesis of cellular aging //
Exp. Gerontol. 1992. Vol. 27. P. 375-382.
Harris H., Miller О J., Klein G. et al. Suppression of malignance by cell fusion // Nature. 1969.
Vol. 223. P. 363-368.
Harris H., Watkins J.F. Hybrid cells derived from mouse and man: artificial heterokaryons of
mammalian cells from different species // Ibid. 1965. Vol. 205. P. 640-646
Harris H., Wiener F., Klein G. The analysis of malignancy by cell fusion. 3. Hybrids between
diploid fibroblasts and other tumour cells // Cell Sci. 1971. Vol. 8. P. 681-692.
Harrison R.G. Observations on the living developing nerve fiber // Proc. Soc. Exp. Biol, and Med.
1907. Vol. 4. P. 140-143.
Hayflick L. The limited in vitro lifetime of human diploid strains // Exp. Cell Res. 1965. Vol. 37.
P. 614-636.
Hayflick L., Moorhead P.S. The serial cultivation of human diploid strains // Ibid. 1961. Vol. 25.
P. 585-621.
Hill M., Hillova J. Integration of mouse DNA into chicken cell genome in vitro // Inform, and Mol.
Biol. Systems. 1971. P. 113-123.
Hill R.P. Tumor progression: Potential role of unstable genomic changes // Cancer Metastasis Rev.
1990. Vol. 9. P. 137-147.
Huang H.J., Yee J.-K., Shew J-Y., et al. Suppresion of the neoplastic phenotype by replacement of
the Rb gene in human cancer cells // Science. 1988. Vol. 242. P. 1563-1566.
Kakunaga T. Neoplastic transformation of human diploid fibroblast cells by chemical carcino-
gens // Proc. Nat. Acad. Sci. USA. 1978. Vol. 75. P. 1334-1338.
Kao F.-T., Chasin L., Puck T.T. Genetics of somatic mammalian cells. X. Complementation analy-
sis of glycine-requiring mutants // Ibid. 1969. Vol. 64. P. 1284-1291.
Kao F.-T., Puck T.T. Genetics of somatic mammalian cells. VII. Induction and isolation of nutri-
tional mutants in Chinese hamster cells // Ibid. 1968. Vol. 60. P. 1275-1281.
Kemler R., Morello D. Jacob F. // Cell lineage, stem cells an cell determination / Ed. N. Le
Douarin. Amsterdam: North-Holland, 1979. P. 101-113.
Kendal W.S., Frost P. Genetic instability and tumor progression // Pathol, and Immunopathol. Res.
1986. Vol. 5. P. 455^167.
Kim N.W., Piatyszek MA., Prowse K.R. et al. Specific association of human telomerase activity
with immortal cells and cancer // Science. 1994. Vol. 266. P. 2011-2015.
Klein G., Bregula U., Weiner F., Harris H.J. The analysis of malignancy by cell fusion. I. Hybrids
between tumour cells and L cell derivatives // J. Cell Sci, 1971. Vol. 8. P. 659-672.
Knudson A.G. Mutation and cancer. Statistical study of retinoblastoma // Proc. Nat. Acad. Sci.
USA. 1971. Vol. 68. P. 820-823.
Kosaka M., Nishina Y., Takeda M. et al. Reversible effects of sodium butyrate on the differentia-
tion of F9 embryonal carcinoma cells // Exp. Cell Res. 1991. Vol. 192. P. 46-51.
Kraemer P.M., Ray F.A., Brothman A.R. et al. Spontaneous immortalization rate of cultured
Chinese hamster cells //J. Nat. Cancer Inst. 1986. Vol. 76. P. 703-709.
Kugoh H.M., Hashiba H., Shimizu M., Oshimura M. Suggestive evidence for functionally distinct
tumor-suppresor genes on chromosome 1 and 11 for a human fibrosarcoma cell line
HT1080//Oncogene. 1990. Vol. 5. P. 1637-1644.
Land H., Parada L.F., Weinberg R.A. Tumorigenic conversion of primary embryo fibroblasts
requires at least two cooperating oncogenes // Nature. 1983. Vol. 304. P. 596-602.
Law M.L., Davidson J.N., Kao F.-T. Isolation of a human repetitive sequences and its application
to regional chromosome mapping // Proc. Nat. Acad. Sci. USA. 1982. Vol. 79. P. 7390-7394.
Li X., Greenwald I. Additional evidence for an eight-transmembrane-domain topology for
Caenorhabditis elegans and human presenilins // Ibid. 1998. Vol. 95. P. 7109-7114.
Li Z., Bing O.H., Long X. et al. Increased cardiomyocyte apoptosis during the transition to heart
286
failure in the spontaneously hypertensive rat // Amer. J. Physiol. 1997. Vol. 272.
H2313-H2319.
Littlefield J.W. Selection of hybrids from matings of fibroblasts in vitro and their presumed recom-
binants // Science. 1964. Vol. 145. P. 709-710.
Major E.O., Miller A.E., Mourrain P. et al. Establishment of a line of human fetal glial cells that
supports JC virus multiplication // Proc. Nat. Acad. Sci. USA. 1985. Vol. 82. P 1257—1261.
Marengo C., Mbikay M., Weber J. Adenovirus-induced mutations at the hypoxanthine phosphori-
bosyltransferase locus of Chinese hamster cells // J. Virol. 1981. Vol. 38. P. 184-190.
Marshak M.L, Varshaver N.B., Shapiro N.I. Induction of gene mutations and chromosomal aber-
rations by simian virus 40 in cultured mammalian cells // Mutat. Res. 1975. Vol. 30.
P. 383-396.
Mayne L.V., Priestley A.. James M.R.. Burke J.F. Efficient immortalization and morphological
transformation of human fibroblasts by transfection with SV40 DNA linked to a dominant
marker // Exp. Cell Res. 1986. Vol. 162. P. 530-538.
McCormick J.J., Maher V.M. Towards an understanding of the malignant transformation of
diploid human fibroblasts // Mutat. Res. 1988. Vol. 199. P. 273—291.
Mercola D. // Gene regulation: biology of antisense RNA and DNA. N.Y.. 1992. P. 329-353.
Meyyappan M., Atadja P.W., Riabowol K.T. Regulation of gene expression and transcription fac-
tor binding activity during cellular aging // Brol. Signals. 1996. Vol. 5. P. 130-138.
Michalovitz D., Halevy O., Oren M. Conditional inhibition of transformation and cell proliferation
by a temperature-sensitive mutant of p53 // Cell. 1990. Vol. 62. P. 671—680.
Miranda A.F., Babiss L.E., Fisher P.B. Transformation of human skeletal muscle cells by simian
virus 401 I Proc. Nat. Acad. Sci. USA. 1983. Vol. 80. P. 6581-6585.
Morin G.B. The human telomere terminal transferase enzyme is a ribonucleoprotein that synthe-
sizes TTAGGG repeats // Cell. 1989. Vol. 59. P. 521-529.
Namba M., Nishitani K., Fukushima F. et al. Multistep process of neoplastic transformation of nor-
mal human fibroblasts by 60Co gamma rays and Harvey sarcoma viruses // Intern. J. Cancer.
1986. Vol. 37. P. 419-423.
Namba M., Nishitani K., Fukushmia F. et al. Multistep neoplastic transformation of normal human
fibroblasts by Co 60 gamma rays and Ha-ras oncogenes // Mutat. Res. 1988. Vol. 199.
P. 415^123.
Nishimura I., Uetsuki T., Dani S.U. et al. Degeneration in vivo of rat hippocampal neurons by
wild-type Alzheimer amyloid precursor protein overexpressed by adenovirus-mediated gene
transfer//J. Neurosci. 1998. Vol. 18. P. 2387-2398.
Neufeld D.S., Ripley S., Henderson A., Ozer ILL. Immortalization of human fibroblasts trans-
formed by origin-defective simian virus 40 // Mol. Cell. Biol. 1987. Vol. 7. P. 2794-2802.
Nguyen L., Ward W.F., Ts’ao C.H., Molteni A. Captopril inhibits proliferation of human lung
fibroblasts in culture: a potential antifibrotic mechanism // Proc. Soc. Exp. Biol, and Med.,
1994. Vol. 205. P. 80-84.
Olovnikov A.M. A theory of marginotomy. The incomplete copying of template margin in enzymic
synthesis of polynucleotides and biological significance of the phenomenon // J. Theor. Biol.
1973. Vol. 41. P. 181-190.
Olovnikov A.M. Telomeres, telomerase, and aging: origin of the theory // Exp. Gerontol. 1996.
Vol. 31. P. 443^148.
Paolella G., Santamaria R., Buono P., Salvatore F. Mapping of a restriction fragment length poly-
morphism within the human aldolase В gene // Human Genet. 1987. Vol. 77. P. 115-117.
Patterson D., Carnright D.V. Biochemical genetic analysis of pyrimidine biosynthesis in mam-
malian cells. 1. Isolation of a mutant defective in the early steps of de novo pyrimidine syn-
thesis // Somatic Cell Genet. 1977. Vol. 3. P. 483—495.
Pontecorvo G. Production of mammalian somatic cell hybrids by means of polyethylene glycol
treatment//Ibid. 1975. Vol. 1. P. 397—400.
Риск T.T., Kao F.-T. Somatic cell genetics and its application to medecine // Ann. Rev. Genet.
1982. Vol. 16. P. 225-271.
Rabbits Т.Н., Rabbits P.H. Molecular pathology of chromosomal abnormalities and cancer genes
in human tumors // OncogenesEd. D.M. Glover, B.D. Hames. N.Y.: Oxford Univ, press,
1989. P. 23-67.
287
Rayevskaya G.B., Varshaver N.B., Shapiro N.I. Reversion to normal phenotype induced by SV40
in a spontaneously transformed malignant Chinese hamster cells // Cancer Genet. Cytogenet.
1989. Vol. 37. P. 39-47.
Reddel R.R., Yeager T.R. Constructing immortalized human cell lines // Curr. Opin. Biotechnol.
1999. Vol. 10. P. 455^169.
Rhim J.S., Jay G., Arnstein P. et al. Neoplastic transformation of human epidermal keratinocytes
by AD12-SV40 and Kirsten sarcoma viruses // Science. 1985. Vol. 227. P. 1250-1252.
Rinehart C.A.. Laundon C.H.. Mayben J.P. et al. Conditional immortalization of human endome-
trial stromal cells with a temperature-sensitive simian virus 40 // Carcinogenesis, 1993.
Vol. 14. P. 993-999.
Rogaev E.I., Sherrington R., Rogaeva E.A. Familial Alzheimer’s disease in kindreds with missense
mutations in a gene on chromosome 1 related to the Alzheimer’s disease type 3 gene //
Nature. 1995. Vol. 376. P. 775-778.
Rogan E.M., Bryan T.M., Никки В. et al. Alterations on p53 and pl6INK4 expression and telom-
ere length during spontaneous immortalization of Li—Fraumeni syndrome fibroblasts // Mol.
and Cell Biol. 1995. Vol. 15. P. 4745^1753.
Sager R. Resistance of human cells to oncogenic transformation // Cancer Cells. 1984. Vol. 2.
P. 487^193.
Sandhu A.K., Hubbard K„ Kaur G.P. et al. Senescence of immortal human fibroblasts by the intro-
duction of normal human chromosome 6 // Proc. Nat. Acad. Sci. USA. 1994. Vol. 91.
P. 5498-5502.
Shapiro NJ. Luss E.V., Volkova L.V., Moiseenko H.V. Complementation analysis of locus for
hypoxanthine-guanine phosphoribosyltransferase in Chinese hamster cells // Somatic. Cell
and Mol. Genet. 1985. Vol. 11. P. 135-147.
Shapiro NJ., Marshak MJ., Varshaver N.B. Mutagenic effects of DNA-containing oncogenic
viruses and malignant transformation of mammalian cells // Cancer Genet, and Cytogenet.
1984. Vol. 13. P. 167-179.
Shapiro NJ., Varshaver N.B. Mutagenesis in cultured mammalian cells // Meth. Cell Biol. 1975.
Vol. 10. P. 209-234.
Shay J.W., Wright W.E. Quantitation of the frequency of immortalization of normal diploid fibrob-
lasts by SV40 large T-antigen // Exp. Cell Res. 1989. Vol. 184. P. 109-118.
Sherrington R., Rogaev E.I., Liang Y. Cloning of a gene bearing missense mutations in early-onset
familial Alzheimer’s disease // Nature. 1995. Vol. 375. P. 754-760.
Shih C., Padhy L.C., Murray M., Weinberg R.A. Transforming genes of carcinomas and neurob-
lastomas introduced into mouse fibroblasts // Ibid. 1981. Vol. 290. P. 261—263.
Shih C., Shilo B., Goldfarb M.P. et al. Passage of phenotypes of chemically transformed cells via
transfection of DNA and chromatin // Proc. Nat. Acad. Sci. USA. 1979. Vol. 76.
P. 5714-5718.
Shih C., Weinberg R.A. Isolation of a transforming sequense from a human bladder carcinoma cell
line//Cell. 1982. Vol. 29. P. 161-169.
Small W., Molteni A., Kim Y.T. et al. Mechanism of captopril toxicity to a human mammary duc-
tal carcinoma cell line in the presence of copper // Breast Cancer Res. Treat. 1999. Vol. 55.
P. 223-229.
Sugovara O. Oshimura M., Koi M. et al. Induction of cellular senescence in immortalized cells by
human chromosome 1 // Science. 1990. Vol. 247. P. 707-710.
Szybalski E.H., Szybalski W. Genetics of human cell lines IV. DNA-mediated heritable transfor-
mation of a biochemical trait // Proc. Nat. Acad. Sci. USA. 1962. Vol. 48. P. 2026-2034.
Trent J.M., Stanbridge, E.J., McBride H.L. et al. Tumorigenicity in human melanoma cell
lines controlled by introduction of human chromosome 6 // Science. 1990. Vol. 247.
P. 568-571.
Trisler G.D., Coon H.G. Somatic cell hybrids between two vertebrate classes // J. Cell. Biol. 1973.
Vol. 59. P. 347.
Uhal B.D., Gidea C., Bargout R. et al. Captopril inhibits apoptosis in human lung epithelial cells:
a potential antifibrotic mechanism // Amer. J. Physiol. 1998. Vol. 275. P. L1013—1017.
Van der Berg S., Kaina B., RamsdorfHJ. et al. Involvement of fos in spontaneous and ultraviolet
light-induced genetic changes // Mol. Carcinogenesis. 1991. Vol. 4. P. 460^166.
288
Varshaver N.B., Marshak M.I., Gorbunova L.V. et al. The synergistic effects of SV40 and BudR
on induction of gene mutations and chromosomal aberrations in Chinese hamcter cells //
Mutat. Res. 1980. Vol. 70. P. 351-364.
Varshaver N.B., Marshak M.I., Luss E.V. et al. Spontaneous, chemical and viral mutagenesis in
temperature-sensitive glutamine-requiring Chinese hamster cells // Ibid. 1977. Vol. 43.
P. 263-278.
Wang R., Ibarra-Sunga O., Verlinski L. et al. Abrogation of bleomycin-induced epithelial apopto-
sis and lung fibrosis by captopril or by a caspase inhibitor // Amer. J. Physiol., 2000. Vol. 279.
P. L143-L151.
Weismann A. Essays upon heredity and kindred biological problems. 2nd ed. Oxford: Clarendon
press, 1891.
IVeA.v M.C., Green H. Human-mouse hybrid cell lines containing partial complements of human
chromosomes and functioning human genes // Proc. Nat. Acad. Sci. USA. 1967. Vol. 58.
P. 1104-1111.
Wilson E.B. // Arch. Mikrosk. Anat. und Entwicklungsmech. 1911. Bd. 11. P. 249-271.
Witkovski J.A. The molecular genetics of Duchenne muscular distrophy: the beginning and the
end // Trends Genet. 1988. Vol. 4. P. 27-30.
Wolozin B., Iwasaki K., Vito P. et al. Participation of presenilin 2 in apoptosis: enhanced basal
activity conferred by an Alzheimer mutation // Science. 1996. Vol. 274. P. 1710-1713.
Wright W.E., Pereira-Smith O.M., Shay J.W. Reversible cellular senescence: implications for
immortalization of normal human diploid fibroblasts // Mol. and Cell. Biol., 1989. Vol. 9.
P. 3088-3092.
Wynford-Thomas D., Bond J.A., Wyllie F.S. et al. Conditional immortalization of human thyroid
epithelial cells: a tool for analysis of oncogene action // Ibid. 1990. Vol. 10. P. 5365-5377.
Yamatsuji T„ Okamoto T., Takeda S. et al. Expression of V642 APP mutant causes cellular apop-
tosis in Alzheimer trait-linked phenotype // EMBO J. 1996. Vol. 15. P. 498-509.
10 Проблемы и перспективы...
ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ
В ИЗУЧЕНИИ ФУНКЦИИ ГЕНОВ В ПРОЦЕССАХ
ДИФФЕРЕНЦИРОВКИ И РАЗВИТИЯ
И.А. Гривенников, Е.С. Мануйлова
Лаборатория молекулярной генетики соматических клеток
Отдела вирусной и клеточной молекулярной генетики
На модели эмбриональных стволовых клеток мыши осуществлено
“нокаутирование" гена, кодирующего А-цепъ фактора роста тромбоци-
тов (PDGF-A). Показана спонтанная дифференцировка эмбриональных
стволовых клеток в кардиомиоциты. Изучено влияние генов nef и tat ви-
руса иммунодефицита человека на пролиферацию и дифференцировку
этих клеток в культуре. Обсуждаются проблемы направленной диффе-
ренцировки эмбриональных стволовых клеток и перспективы их исполь-
зования для клеточной терапии при различных заболеваниях человека.
СЛОВАРЬ ТЕРМИНОВ И СОКРАЩЕНИЙ
ЭС — эмбриональные стволовые [клетки].
Плюрипотентность — способность ЭС клеток к дифференцировке в условиях in vivo и in
vitro.
Фидерный слой — питающий слой для ЭС клеток, представленный эмбриональными
фибробластами.
LIF — фактор, ингибирующий лейкемию.
Трансфекция - введение или перенос генетического материала в клетку.
МТТ - 3-(4,5-диметилтиазолил-2)-2,5-дифенил тетразолиум бромид.
“Нокаутирование” генов — инактивация генов с помощью гомологичной рекомбинации.
Таргетинг генов - изменение функции гена с помощью гомологичной рекомбинации.
Химера - организм, полученный путем механического объединения клеток разных эм-
брионов и состоящий из двух или более генетически различных клеточных популя-
ций.
А'н//-аллели - инактивация двух аллелей какого-либо гена в результате гомологичной
рекомбинации.
Генеративная химера - химера у которой ЭС клетки участвуют в формировании клеток
зародышевого пути.
Тератокарцинома - опухоль, возникающая при пролиферации плюрипотентных стволо-
вых клеток, либо эмбриональных карциномных клеток, при пассировании опухоли
in vitro.
РТ-ПЦР — полимеразная цепная реакция, совмещенная с обратной транскрипцией.
ВВЕДЕНИЕ
Сообщение о получении культуры ЭС клеток мыши было сделано одно-
временно в двух работах в 1981 г. (Evans, Kaufman, 1981; Martin, 1981). В на-
стоящее время ЭС клетки подразделяют на три типа.
1. Клетки, изолированные из внутренней клеточной массы бластоцисты
млекопитающих, именно эти клетки принято называть эмбриональными
стволовыми клетками.
2. Клетки эмбриональных карцином.
3. Первичные половые клетки зародыша.
290
На рис. 102 представлена общепринятая в настоящее время схема полу-
чения ЭС клеток и их использование для получения химерных животных.
В последние годы ЭС клетки используются в различных направлениях ис-
следований. На рис. 103 приведены некоторые из таких направлений.
Кроме экспериментов по получению химерных животных и направлен-
ному изменению генов с целью изучения их функций в процессе развития и
на уровне взрослого организма, ЭС клетки используются в экспериментах
по клонированию животных и изучению начальных стадий эмбрионального
развития in vitro. Большой интерес в последние годы вызывает направление
(см. рис. 103), связанное с изучением путей направленной дифференцировки
ЭС и стволовых клеток млекопитающих и, что особенно важно человека, в
определенные типы клеток in vitro. Способность управлять этими процесса-
ми позволит в перспективе использовать такие клетки в заместительной те-
рапии различных тяжелых заболеваний человека, таких как нейродегенера-
тивные, онкологические и др.
ЭС клетки обладают высокой пролиферативной активностью и способ-
ностью в течение длительного времени в культуре поддерживаться в не-
дифференцированном состоянии. Для сохранения недифференцированного
фенотипа ЭС клеток в культуре требуется наличие фидерного слоя, кото-
рый может быть представлен первичными эмбриональными фибробласта-
ми или перевиваемыми фибробластами мыши линии STO (Evans, Kaufman,
1981).
На рис. 104 показан рост ЭС клеток на фидерном слое эмбриональных
фибробластов мыши. Другой метод предупреждения дифференцировки ЭС
клеток включает добавление в культуральную среду в отсутствие фидера
LIF (фактор, ингибирующий лейкемию), который представляет собой гемо-
поэтический регулятор, индуцирующий дифференцировку клеток миелоид-
ной лейкемии линии Ml. Успешно используются и ряд других цитокинов для
сохранения недифференцированного состояния ЭС клеток: интерлейкин-6
(Nichols et al., 1994), онкостатин (Rose, Bruce, 1994), цилиарный нейротрофи-
ческий фактор (CNTF) (Conover et al., 1993). В качестве методических прие-
мов предупреждения дифференцировки ЭС клеток используются: добавле-
ние в среду LIF в присутствии фидерного слоя (Nichols et al., 1990), фидерные
клетки, трансформированные рекомбинантным вектором и экспрессирую-
щие LIF (McMahon, Bradley, 1990), и применение рекомбинантного LIF
в отсутствие фидерного слоя (Pease et al., 1990).
Все описанные линии ЭС клеток мыши сходны по своим морфологиче-
ским характеристикам. Клетки имеют крупное ядро, содержащее преиму-
щественно эухроматин и несколько ядрышек. Для них свойственно высо-
кое ядерно-цитоплазматическое отношение: цитоплазма представлена
узким ободком, окружающим ядро. Клеточный цикл 18—20 ч, Сц-фаза
очень короткая (Rohwedell et al., 1994). Кариотипический анализ 35 линий
ЭС клеток показал, что 25 из них имеют кариотип ХУ, а остальные ХО и
XX (Robertson, Bradley, 1986). Авторы полагают, что ЭС клетки предпоч-
тительней образуются из клеток с мужским кариотипом, поскольку вторая
Х-хромосома может явиться дестабилизатором плюрипотентности. В ос-
новном все ЭС клетки имеют нормальный кариотип 2п = 40, изменения в
кариотипе могут приводить к потере плюрипотентности (Миталипов и др.,
1994).
ю*
291
химерное
потомство
трансплантация
ложнобеременной
самке
Germ-line
трансмиссия
Рис. 102. Схема получения ЭС клеток и их использование при изучении процессов направлен-
ной дифференцировки в системах in vitro и in vivo, а также при создании трансгенных
животных
Особенностью ЭС клеток является высокая активность эндогенной ще-
лочной фосфатазы. Методом количественного анализа было установлено,
что активность эндогенной щелочной фосфатазы стволовых клеток терато-
карцином, внутренней клеточной массы бластоцисты, эпибласта 5-6-днев-
ного эмбриона, первичных половых клеток в 10 раз превышает таковую у
дифференцированных соматических клеток (Wobus et al., 1984; Дыбан,
1988). Для ЭС клеток характерен также высокий уровень теломеразной ак-
тивности, который коррелирует со степенью недифференцированности ЭС
клеток (Thomson et al., 1998; Yeager, Reddel, 1999). Сохранение недифферен-
292
Рис. 103. Основные направления исследований, в которых в настоящее время используются
эмбриональные стволовые клетки млекопитающих
цированного фенотипа ЭС клеток в культуре может быть подтверждено
использованием антител к специфическим поверхностным антигенам ЭС,
таких как ЕСМА-7, SSEA-1 (Kemler et aL, 1979).
При определенных условиях культивирования (в суспензионном состоя-
нии) ЭС клетки формируют эмбриоидные тела, которые представляют со-
бой зачатки эндодермы, эктодермы и мезодермы, напоминая постимпланта-
ционное эмбриональное развитие. Если эмбриоидные тела прикрепляются к
субстрату, то клетки, формирующие внутренние слои таких тел, способны в
дальнейшем дифференцироваться в широкий спектор тканей, такие как мы-
шечная, нервная, эпителиальная и др. Способность ЭС клеток к дифферен-
цировке in vitro используется как модель для исследования процессов кле-
точной дифференцировки в разные типы тканей.
После инъекции ЭС клеток в бластоцисты они способны участвовать в
образовании всех тканей, включая и линии зародышевых клеток химерного
организма. Способность ЭС клеток дифференцироваться in vivo оценивает-
ся по частоте химер и степени колонизации тканей химерного потомства,
а также по частоте генеративных химер. Это свойство клеток в сочетании
с методом гомологичной рекомбинации, которая позволяет направленно
изменять геном ЭС клеток, дает возможность создавать трансгенных жи-
вотных с заданным (измененным) генотипом (см. рис. 102).
В 1982 г. впервые было показано, что соматические клетки млекопита-
ющих обладают ферментативным механизмом, способным осуществлять
гомологичную рекомбинацию между хромосомной и экзогенной ДНК, вве-
денной в соматические клетки (Folger et al., 1982). Частота гомологичной ре-
комбинации достаточно низкая и в зависимости от локуса может быть от
10-3 до 10 7. Существует две возможности для гомологичной рекомбинации
между экзогенной (вектор) и геномной (мишень) последовательностями
ДНК: замещение и внедрение. В случае замещения происходит двойной
кроссинговер между гомологичными последовательностями вектора и гено-
293
ма, в случае внедрения происходит простой кроссинговер. Замещение при-
водит к инактивации гена, т.е. к его “нокауту”.
В первых экспериментах на ЭС клетках для таргетинга был избран ген
hprt. Ген hprt локализован на Х-хромосоме, поэтому мужские ЭС клетки ге-
мизиготны по hprt и достаточно инактивации только одной копии гена для
получения селективного фенотипа. Hprt мутанты могут расти в среде, содер-
жащей аналог пурина, 6-тиогуанин, тогда как клетки, имеющие нормальный
фермент, на этой среде не растут (Thomas, Capecchi, 1987). Этими авторами
впервые был сконструирован вектор, в котором бактериальный ген пео (нео-
мицинфосфотрансферазы), обеспечивающий устойчивость к антибиотику
G418, вставлен в восьмой экзон клонированного фрагмента гена hprt. Двой-
ная резистентность клеток (G418. 6TG) свидетельствует о гомологичной
рекомбинации, приводящей к разрушению гена. Было показано, что одна
гомологичная рекомбинация происходит на 1000 случайных интеграций.
В данной работе сам таргетируемый ген являлся селективным маркером.
Для таргетирования неселективных генов был разработан метод позитивно-
негативной селекции (Mansour et al., 1988). Вектор для таргетинга содержит
позитивный селективный маркер (нее) и негативный маркер - ген тимидин-
киназы (tk) вируса герпеса HSV, которые расположены в разных местах ве-
ктора и каждый имеет свой промотор. Гомологичная рекомбинация с тарге-
тированным геном приводит к встраиванию гена пео и элиминации гена tk,
а негомологичная рекомбинация к встраиванию в хромосому обоих марке-
ров. Селекция гомологичных рекомбинатов проводится на среде, содержа-
щей G418 и противовирусный препарат ганцикловир. Ганцикловир способен
фосфорилироваться герпесной тимидинкиназой (в отличие от клеточной) и
при последующем встраивании в ДНК при репликации приводит к гибели
клеток, экспрессирующих эту тимидинкиназу. Ген tk присутствует в клетках
при случайном встраивании вектора и отсутствует в клетках, претерпевших
гомологичную рекомбинацию. Таким образом последние селектируются,
будучи пео- и ганцикловир-резистентными, тогда как клетки, включившие
вектор путем случайной интеграции, будут нео-резистентны, но ганцикло-
вир чувствительны. Другим геном, обеспечивающим отрицательную селек-
цию, является фрагмент гена дифтерийного токсина, кодирующего его
A-цепь (ДТ-А). Продукт этого гена токсичен для эукариотических клеток за
счет ингибирования синтеза белка. Если ген ДТ-А встраивается в геном вме-
сте с вектором и экспрессируется, то происходит гибель клетки (Yagi et aL,
1990).
Существует еще ряд подходов для выявления клонов ЭС клеток. Более
подробную информацию об этих подходах можно найти в соответствующем
обзоре (Тарантул, 1996). Одним из важных факторов, влияющих на частоту
гомологичной рекомбинации, является степень гомологии между хромосом-
ной и экзогенной ДНК (Те Riele et al., 1992.). В основном все линии ЭС кле-
ток, которые используются для таргетинга, выделены из линии мышей
129Sv. В связи с этим в работах по гомологичной рекомбинации вектора
конструируют на базе генов, клонированных из банка генов этих линий
мышей.
Использование ЭС клеток в сочетании с методом гомологичной реком-
бинации открыло новые возможности для направленного мутагенеза. В ос-
новном, в большинстве работ получены мыши, у которых в результате му-
294
тации произошло выключение изучаемых генов. Анализ мышей, гомозигот-
ных по ««//-аллелям, выявил несколько типов фенотипического проявления
индуцированных мутаций:
1. Летальный эффект в эмбриогенезе или сразу после рождения.
2. Нарушение развития, функций, морфологии различных органов и ги-
бель до наступления половой зрелости.
3. Нормальное развитие, жизнеспособность, плодовитость, отсутствие
отклонений от нормы.
Например, в случае эмбриональных леталей происходит инактивация
таких генов, как: nfl, Rb, N-myc, GAP, c-jun, c-myb. Гибель после рождения
наблюдается при выключении следующих генов; c-abl, BDNF, trk, N-myc,
TGF-3. Инактивация генов: CNTF, Dlx-2, FNAR-l, Ki-ras, c-mos, АТ-2 приво-
дит к нарушению развития, функций и морфологии разных органов. Нор-
мальное развитие без изменения жизнеспособности, плодовитости наблюда-
ли при инактивации таких генов, как: ароЕ, N-ras, MyoD, pim-1, c-fos. Очевид-
но, в этих случаях функции определенных генов могут выполняться други-
ми родственными генами.
Стратегия генного таргетинга позволяет изучать функции отдельных
генов как в развитии, так и во взрослом состоянии и моделировать на жи-
вотных (мышах) наследственные аномалии, встречающиеся у человека,
с целью исследования их патогенеза и фенотипического проявления.
В настоящее время методы выделения ЭС клеток разработаны для раз-
ных видов животных: свиньи, овцы, коровы, норки, кролика и хомячка.
В 1998 г. появилось два сообщения о выделении ЭС клеток человека из бла-
стоцист (Thomson et al., 1998) и из первичных половых клеток зародыша
(Shamblott et al., 1998). Несмотря на широкое распространение линий ЭС
клеток и их интенсивное использование в экспериментах, остается еще дос-
таточно много вопросов по вопросам их культивирования и дифференци-
ровки. В настоящей работе (см. раздел “Основная часть”) представлены
результаты экспериментов по морфологической характеристике началь-
ных стадий эмбрионального развития, влиянию продуктов некоторых ге-
нов на пролиферацию и дифференцировку этих клеток в культуре, а также
данные по таргетингу гена, кодирующего фактор роста фибробластов
(PDGF-A).
ОСНОВНАЯ ЧАСТЬ
А. Характеристика эмбриональных стволовых клеток мыши. Отсут-
ствие экспериментальных подтверждений бессмертности ЭС клеток и слож-
ность их культивирования послужили основанием для проведения исследо-
ваний по выявлению и поддержанию плюрипотентных свойств, отличаю-
щих эмбриональные клетки от соматических клеток культуры тканей. В на-
стоящей работе были использованы две линии ЭС клеток мыши D3 и R1,
обе линии выделены из бластоцист линии мышей 129/Sv (Doetschman et al.,
1985, Nagy et al., 1993). Одним из основных критериев плюрипотентности ЭС
клеток принято считать форму колоний (Doetschman et al., 1985). Однако
этот показатель во многом носит условный характер. По форме колоний
иногда трудно отличить истинно эмбриональные клетки от клеток, спонтан-
295
Рис. 105. Ультраструктура ЭС клетки. Х5800
Видно крупное ядро клетки, а также эндоплазматический ретикулум (а) и митохондрии (б)
но трансформированных в эмбриональную карциному. При фидерном спо-
собе культивирование формируются монослойные колонии округлой или
удлиненной формы, с четко выраженными краями по периферии. Диффе-
ренцировка ЭС клеток приводит к морфологической гетерогенности и поя-
влению колоний с неровными краями и тенденцией к вертикальному росту.
Исследования ультраструктуры ЭС клеток показали, что клетки имеют от-
носительно крупное ядро, содержащее преимущественно эухроматин, одно
или два ядрышка, в которых доминируют гранулярные компоненты. В отли-
чие от общепринятых представлений о том, что ЭС клетки лишены боль-
шинства органелл (Doetschman et al., 1985; Robertson. Bradley, 1986), в их ци-
топлазме были обнаружены многочисленные свободные рибосомы, шеро-
ховатый эндоплазматический ретикулум представлен единичными цистер-
нами, что свидетельствует о низком уровне синтетической активности, ком-
плекс Гольджи, около которого располагались 1-2 центриоли, митохондрии
и многочисленные лизосомы (рис. 105).
296
Аналогичная ультраструктура была выявлена в ранних мышиных заро-
дышах на стадии бластоцисты. Клетки внутренней клеточной массы и ЭС
клетки прошедшие, в культуре несколько пассажей, на ультраструктурном
уровне имели большое сходство, что свидетельствует об общности их про-
исхождения.
Были обнаружены небольшие межлинейные различия в пролифератив-
ной активности и способности к дифференцировке, что, возможно, опреде-
лялось генетической принадлежностью и возрастом ЭС клеток, т.е. количе-
ством пассажей.
В популяции ЭС клеток преобладали клетки среднего размера
(10-12 мкм). Они обладали адгезивными и пролиферативными свойствами,
при контакте с фидером давали нормальные по внешнему виду монослой-
ные колонии, а также были способны к дифференцировке в эмбриоидные
тела. Более мелкие (до 10 мкм) и более крупные (свыше 15 мкм), оставались
не прикрепленными к субстрату и через некоторое время погибали или фор-
мировали колонии дифференцированных клеток. При этом морфологиче-
ская дифференцировка сопровождалась увеличением продолжительности
стадии метафазы, а также частоты анеуплоидных и полиплоидных клеток и
их гибели по механизму апоптоза.
Цитохимическое окрашивание ЭС клеток на выявление активности эн-
догенной щелочной фосфатазы позволяет объективно оценить степень диф-
ференцированности этих клеток (Лойд и др., 1982). Окрашиваются колонии,
сформированные недифференцированными эмбриональными клетками.
Клетки фидера не дают положительной реакции на выявление активности
щелочной фосфатазы (рис. 106).
Разные линии мышиных ЭС клеток гетерогенны по морфологии, требо-
вательны к составу питательных сред, сыворотки и качеству фидера. Во-
прос о том, какие из ЭС клеток являются плюрипотентными, т.е. способны-
ми нормально развиваться в составе целого зародыша, является важнейшим
при решении задач биологии развития и эмбриотехнологии (Межевикина и
др., 1998, 2001).
Б. Трансформация ЭС клеток геном lif. Показано, что для поддержания
ЭС клеток в плюрипотентном состоянии необходимо их культивирование
на фидерном слое или в присутствии некоторых цитокинов, в частности LIF.
В связи с этим были начаты исследования по изучению роли цитокина LIF в
регуляции и поддержании плюрипотентных свойств ЭС клеток мыши in
vitro. Эти исследования необходимы для выявления роли цитокина в процес-
сах регуляции межклеточных взаимодействий и генетической стабильности.
Для проведения трансформации геном lif использовали плазмиду
pcDNA3, несущую кодирующую последовательность гена lif мыши, и ген пео
(ген неомицинфосфотрансферазы), обеспечивающий устойчивость к
антибиотику G418 (производное неомицина). Трансформацию клеток R1
проводили с помощью метода электропорации. Трансформированные ге-
ном lif клоны были способны развиваться в культуре, при переносе их на
подложку из желатины, с последующей селекцией на выживаемость в среде
с высоким содержанием G418. Массовая гибель после трансформации на-
блюдалась на 3-й сутки культивирования. У трансформированных клеток
R1 обнаруживается низкий уровень пролиферативной активности. В селек-
тивной среде с G418 клетки формируют небольшие плоские колонии без
297
признаков морфологической дифференцировки в течение 10 дней. При ок-
рашивании на выявление активности эндогенной щелочной фосфатазы
G418 резистентные клоны дают положительную реакцию. По морфологии
колоний можно говорить о том, что сама процедура трансформации, по-ви-
димому, не сопряжена с потерей плюрипотентности ЭС клеток.
Для детектирования уровня экспрессии гена lif устойчивые к G418 кло-
ны клеток линии R1 были проанализированы методом РТ-ПЦР, с использо-
ванием соответствующих праймеров (5GGGCCTCCTCAGCAATGTGC3 и
5GCCCAGCCCAGAGTGCAGTG3). Было показано, что экспрессия гена lif
обнаруживается в клонах с видимыми признаками морфологической диф-
ференцировки. Возможно, что высокий уровень эндогенного LIF в трансфи-
цированных клетках тормозит их пролиферативную активность и способст-
вует переходу в дифференцированное состояние (Федченко и др., 2001).
Необходимость применения фидерного слоя при культивировании ЭС
клеток связано с продукцией LIF клетками первичных эмбриональных фиб-
робластов, которые обеспечивают достаточный уровень концентрации это-
го фактора в непосредственной близости от ЭС клеток. Попытка стабили-
зировать плюрипотентные свойства ЭС клеток мыши линии R1 путем
трансформации их геном lif подтверждает его участие в процессах раннего
развития и дифференцировки.
В. Дифференцировка ЭС клеток in vitro. Одним из основных признаков
ЭС клеток in vitro является их способость дифференцироваться с образова-
нием эмбриоидых тел различной сложности, которые представляют собой
зачатки всех трех зародышевых листков. Дифференцировка ЭС клеток мо-
жет происходить как спонтанным путем, так и под действием некоторых хи-
мических реагентов и ростовых факторов. Известно, что активин А и транс-
формирующий фактор роста бетта (TGF-1) индуцирует дифференцировку
клеток мезодермального происхождения соматических мышечных и кардио-
миоцитов. Другая группа факторов - ретиноевая кислота, фактор роста
фибробластов (FGF) и эпидермальный фактор роста (EGF) - направляет диф-
ференцировку мезодермальных и эктодермальных клеток. Наконец, фак-
тор роста нервов (NGF) и фактор роста гепатоцитов (HGF) участвуют в раз-
витии всех трех эмбриональных листков, их воздействие приводит к появле-
нию клеток печени и поджелудочной железы, мышечных, хрящевых, крове-
творных и нейрональных клеток (Rohwedel et al., 1994; Bain et al., 1995;
Shuldiner et al., 2000). Интересно отметить, что при разных концентрациях
ретиноевой кислоты можно добиться преимущественной дифференциров-
ки, либо в нейрональном, либо в миогенном направлении. Исследования ге-
нетического контроля миогенной и эпителиальной дифференцировки ЭС
клеток показало, что последовательность экспрессии тканеспецифических
генов такая же, как и в процессе нормального развития (Rohwedel et al., 1994;
Bagutti et al., 1996).
Существует ряд фактов, указывающих, что некоторые клеточные про-
то- и онкогены принимают определенное участие в пролиферации и диффе-
ренцировке клеток. Действие ТФА (12-0-тетрадеканоилфорбол-13-ацетат),
стимулирующего дифференцировку клеток нейробластомы человека, одно-
временно повышает активность c-src (Bjelfman et al., 1990). Микроинъекция
мутантного онкогена c-Ha-ras в клетки феохромоцитомы крысы PC-12 вы-
зывает их дифференцировку и появление нейроноподобных клеток (Ваг-
298
Sagi, Feramicko, 1985). Однако в этих работах использовались злокачествен-
ные клетки, поэтому представляет интерес исследовать возможность инду-
цировать дифференцировку нормальных плюрипотентных стволовых кле-
ток путем воздействия на них клеточных прото- и онкогенов.
Одной из задач наших исследований явилось проведение сравнительного
анализа действия регуляторных генов вируса иммунодефицита человека ти-
па 1 tat и nef на пролиферацию и дифференцировку ЭС клеток мыши in vitro.
Продукты генов tat и nef имеют противоположное влияние на клеточные ге-
ны. Ген tat, обладая онкогенным потенциалом, активирует транскрипцию
некоторых клеточных генов и повышает пролиферацию клеток. Ген nef, по-
давляет экспрессию отдельных клеточных генов, и снижает рост клеток,
вместе с тем кооперирует с геном tat при образовании фокусов трансформа-
ции (Шугурова и др, 1997, 2000). Более подробно функции этих генов рас-
смотрены в обзоре В.З. Тарантула в этой книге. Для проведения этих иссле-
дований была отработана методика получения эмбриоидных тел в линии R1.
При культивировании клеток RI в суспензии на 2-3-и сутки они образовыва-
ли плотные шарообразные агрегаты, называемые простыми эмбриоидными
телами. При дальнейшем культивировании эмбриоидные тела увеличивают-
ся в своих размерах и усложняются в строении (рис. 107,а). При переносе эм-
бриоидных тел на подложку с желатиной, они прикрепляются к субстрату,
происходит миграция клеток из эмбриоидного тела по поверхности и их
дифференцировка в различные клеточные типы (рис. 107,6). В результате
проведенных экспериментов показано, что эффективность образования эм-
бриоидных тел клетками линии R1 зависит от количества клеток, высевае-
мых на поверхность чашки без фидерного слоя, способных образовывать
эмбриоидные тела и времени культивирования эмбриоидных тел до начала
дифференцировки.
Известно, что бутират натрия вызывает ряд эффектов на клетках мле-
копитающих в культуре, включая снижение репликации ДНК, которая при-
водит к остановке деления клеток, изменению морфологии клеток, измене-
нию уровня экспрессии некоторых генных продуктов. Показано, что бути-
рат натрия индуцирует дифференцировку клеток тератокарциномы (Kasaka
et al., 1991). Нами были проведены эксперименты по спонтанной дифферен-
цировке, а также под влиянием бутирата (1 мМ) в клетках R1. Обнаружено
появление кластеров сокращающихся клеток, предположительно кардио-
миоцитов, на 2-3-и сутки, после прикрепления к подложке эмбриоидных
тел. Время развития сокращающихся клеток in vitro колеблется от 2 до
10 сут. Частота пульсации этих клеток также менялась в зависимости от вре-
мени после посева эмбриоидных тел. В первые сутки частота не превышала
60 сокращений в минуту, затем она снижалась (Гордеева и др., 2001; Ману-
йлова и др., 2001). Очевидно, способность ЭС клеток к дифференцировке
in vitro является уникальной моделью для исследования процессов клеточ-
ной дифференцировки в разных типах тканей. Особенно важно, что эта кле-
точная система обладает способностью к направленной дифференцировке
при воздействии эндогенных и экзогенных факторов. В связи с этим мы про-
водили исследование по изучению влияния регуляторных генов вируса им-
мунодефицита человека типа 1 tat и nef на пролиферацию, морфологию и
дифференцировку ЭС клеток мыши. Для проведения трансфекции ЭС клеток
линии R1 использовали следующие рекомбинантные плазмиды; pTat, содержа-
299
Рис. 108. Схема плазмиды pTat. 3,1 кб Sall/PstI-фрагмент изолята НХВ-2 HIV-1, в котором
делетировав ген nef, содержит 1-й транслируемый экзон гена tat, интрон и 2-й транслируе-
мый экзон гена tat. Ген находится под управлением промотора цитомегаловируса в векторе
pcDNA3. Плазмида несет также ген устойчивости к неомицину (А); схема плазмиды pNef
(любезно предоставлена S. Hammes). Плазмида содержит ген nef изолята HXD-3 HIV-1
(0,692 кб HindIII-TaqI-фрагмент) под цитомегаловирусным промотором в векторе
pBC12/CMv (Б)
щую ген tat под промотором цитомегаловируса и ген пео, устойчивость к
неомицину, pNef, несущую ген nef под контролем промотора цитомегаловиру-
са. Структура соответствующих плазмид представлена на рис. 108.
Для выявления трансфектантов ЭС клеток в варианте с геном nef прово-
дили котрансформацию с плазмидой pSV2neo. Параллельно клетки R1
трансфицировали плазмидой pSV2neo и использовали как контрольные.
В результате проведения трансфекции и селекции эмбриональных стволо-
вых (ЭС) клеток мыши получены 3 линии клеток; /геоА-(вектором pSV2neo)
контроль, /«/-(вектором pTatneo), «/’/-(вектором pNef, pSV2neo). Изменения в
морфологии наблюдали только для клеток линии nef. Как видно из рис. 109,
при изучении пролиферативной активности клеток всех трех выделенных
линий обнаружено, что пролиферация клеток линии tat была выше, а поли-
ферация клеток линии nef снижалась примерно в 1,5 раза по сравнению с
контрольными клетками линии пеок (Шугурова и др., 2001).
Для изучения возможного влиния генов tat и /ге/на дифференцировку ЭС
клеток проводили эксперименты, где определяли следующие показатели
для трех линий клеток: 1) время, необходимое для формирования эмбриоид-
ного тела; 2) количество сформированных эмбриоидных тел; 3) размер эм-
бриоидного тела; 4) появление клеток с различной тканеспецифичностью.
В результате проведенных экспериментов было показано, что время необ-
ходимое для образования эмбриоидных тел, одинаково для клеток линии
пеок, tat, nef. Клетки линии пеок и nef формируют примерно одинаковое ко-
личество эмбриоидных тел - от 3 до 6 - на 3-и сутки после посева, тогда как
клетки линии tat формируют в основном только одно эмбриоидное тело.
Значительных различий в размерах эмбриоидных тел для этих линий не об-
наружено. На 5-й день после прикрепления эмбриоидных тел клеток линии
300
пеок к подложке появились участки сокращающихся клеток-кардиомиоци-
тов, что было подтверждено результатами иммуноцитохимического анали-
за. Количество эмбриоидных тел с сокращающимися кардиомиоцитами уве-
личивалось в клетках линии пеок в течение 5 дней. В клетках линии nef кар-
диомиоциты появились только на 10-й день после прикрепления эмбриоид-
ных тел к подложке, их количество заметно не увеличивалось в период про-
ведения эксперимента (10 дней). В эмбриоидных телах, сформированных
клетками линии tat не было обнаружено появление кардиомиоцитов в тече-
ние 10 дней наблюдения. Результаты представленных экспериментов позво-
ляют сказать, что под влиянием гена tat наблюдается тенденция повышения
пролиферативной активности ЭС клеток мыши и ее подавление под влияни-
ем гена nef, что согласуется с данными, полученными на клетках крысы двух
линий: псевдонормальных клетках Rat-2 и клетках феохромоцитомы PC-12
(Шугурова и др. 1997, 2000). Полученные данные также позволяют предпо-
ложить, что регуляторные гены ВИЧ-1 tat и nef могут оказывать влияние
как на ранние стадии дифференцировки ЭС клеток (на уровне эмбриоидных
тел), так и на процесс дифференцировки этих клеток в кардиомиоциты.
Разработка методов направленной тканеспецифической дифференци-
ровки, помимо теоретического значения для изучения молекулярных меха-
низмов клеточной дифференцировки, имеет и прикладное значение, такие
клетки в перспективе могут быть использованы в клеточной терапии и
трансплантации у человека.
Для изучения путей дифференцировки ЭС клеток в разные типы клеток
in vivo используются подходы по пересадке таких клеток в различные органы
взрослых животных (мозг, печень, селезенка и т.д.) с последующей регист-
рацией судьбы этих клеток. Для объективного обнаружения пересаженных
клеток необходимо иметь “маркированные” линии ЭС клеток. Нами были
получены линии ЭСК, трансфицированные геном “зеленого белка”. Такие
клетки легко детектируются на срезах органов и тканей с помощью флуо-
ресцентной микроскопии. На рис. ПО показаны ЭС клетки линии R1, транс-
фицированные плазмидой, содержащей ген “зеленого белка”.
Проведенные нами совместно с Институтом биологии гена РАН и Ин-
ститутом биологии развития РАН по пересадке “зеленых клеток” в различ-
ные отделы мозга крысы, показали, что такие клетки могут сохранять жиз-
неспособность в чужеродном организме не менее одной недели.
Г. Гомологичная рекомбинация в ЭС клетках мыши. В нашем отделе
была проведена работа по нокаутированию гена PDGF-A в ЭС клетках мы-
ши и получению на основе этих клеток химерной мыши (Макарова и др.,
1997).
PDGF-A- белок, фактор роста тромбоцитов. Существует три типа диме-
ров PDGF: АА, АВ и ВВ, состоящих из двух полипептидных цепей - PDGF-A
и PDGF-В, которые кодируются двумя различными генами. Эти гены явля-
ются гомологичными и кодируют длинную и короткую формы PDGF, полу-
чающиеся путем альтернативного сплайсинга. В свою очередь существует
3 вида рецепторов для PDGF, кк и кк, также состоящих из полипептидов -
PDGFR и PDGFR, кодируемых разными генами. Митогенная активность
PDGF реализуется при его взаимодействии с рецептором, при этом PDGFR-a
может связываться как с А-, так и с В-цепью PDGF, a PDGFR - только с
В-цепью (Bowen-Pope et al., 1991). Основным местом синтеза PDGF являют-
301
5 6 7
1 т.п.н.
Рис. 111. Схема строения гена PDGF-A, вектора, использованного для таргетинга (Б), и му-
тантного гена PDGF-A со встроенной в его 3-й экзон PGK-иео-кассетой (В). Г - Handlll-фраг-
мент гена PDGF-A дикого типа, Д - Hindlll-фрагмент гена. DT-A - кассета с геном субъеди-
ницы А дифтерийного токсина. PGK-пео-кассета с геном неомицинфосфотрансферазы под
промотором гена фосфоглицерокиназы
Зонд отмечен линией под А. Заштрихованными и нумерованными прямоугольниками изображены экзо-
ны гена PDGF-A, а линиями между ними - интроны. Стрелками указаны направления транскрипции ге-
нов. Сайты рестрикции: Н - Hindlll, А' - Kpnl, В - BamHI, Z - EcoRl, Mr - Ncol
ся тромбоциты, хотя в незначительных количествах они синтезируются
в эндотелии, моноцитах и макрофагах, гладкой мускулатуре, фибробластах,
цитотрофобластах плаценты, нейронах и в глии. В большинстве клеточных
типов экспрессия PDGF происходит при функциональной или митогенной
активации, хотя в мегакариоцитах и нейронах она, по-видимому, конститу-
тивна. По некоторым данным, помимо митогенной активности, PDGF при-
нимает участие в процессах дифференцировки, хемотаксиса, в регуляции
синтеза компонентов межклеточного матрикса (Bowen-Pope el al., 1991;
Grotendorst et al., 1992; Heldin, 1992). Обнаружена экспрессия PDGF и рецеп-
торов к этим ростовым факторам как на самых ранних, доимплантацион-
ных, стадиях эмбрионального развития, так и при дифференцировке мезен-
химы и нервной ткани (Adamson, 1993) PDGF продуцируют также многие
опухоли, такие, например, как глиобластомы, нейробластомы, меланомы и
остеосаркомы.
Вектор замещения для таргетинга конструировали на основе гена PDGF-A,
проклонированного из библиотеки генов линии мышей 129Sv (рис. 111).
На рис. 111 представлены этапы конструирования и окончательная стру-
ктура соответствующего вектора. Этот вектор включал в себя фрагмент,
содержащий экзоны 3 и 4. В экзон 3 был вставлен ген пео, обеспечивающий
устойчивость к антибиотику неомицину (G418). В качестве промотора гена
пео использовали промотор гена фосфоглицерокиназы (PGK-пео-кассета).
Для проведения негативной селекции против случайного встраивания в ге-
302
ном использовали кассету с геном субъединицы А дифтерийного токсина
(ДТ-А). В работе использовали линию ЭС клеток w9.5, выделенную из ли-
нии мышей 129SvJ. Для получения химерных мышей ЭС клетки инъециро-
вали в полость 3,5-дневных бластоцист мышей линии C57BI/6. Далее бласто-
цисты переносили в рог матки мышей линии BALB/c в сроки псевдоберемен-
ности 2,5-3,5 дня. Трансфекцию ЭС клеток проводили методом электропро-
боя. После электропорации ЭС клеток и последующей селекции было полу-
чено около 400 G418 устойчивых клонов ЭС клеток мыши, из которых 130
были заморожены и использованы для выделения ДНК. Среди первых
5 клонов, проанализированных с помощью блот-гибридизации, был обнару-
жен один клон с таргетированным геном PDGF-A (клон 1).
Следующим этапом работы было получение химерных мышей путем
инъекции клеток клона 1. В бластоцисты мыши. В результате пересадки
13 бластоцист родилась одна химерная самка со смешанной пигментирован-
ной шерстью черного цвета и цвета агути, что свидетельствует о способно-
сти таргетированных ЭС клеток принимать участие в развитии волосяных
фолликулов в эмбриогенезе. Подробнее проблема получения трансгенных и
химерных животных изложена в статье Л.Е. Андреевой и В.З. Тарантула в
настоящей книге.
У гомозиготных мышей с нокаутированным геном PDGF-A наблюда-
лись патологии во многих тканях мезенхимного происхождения (Boston et
al., 1996). При развитии легких эта мутация приводила к эмфиземе и невоз-
можности формирования альвеол. Как и ожидалось, гомозиготные по му-
тантному гену мыши погибали либо на эмбриональных стадиях, либо сразу
после рождения. Эта работа уже дала первую важную информацию о роли
PDGF-A. Однако поскольку имеются данные о различном фенотипическом
проявлении гомозиготных “нокаутированных” генов в различных линиях
мышей (Sibilia, Wagner, 1995), одним из возможных вариантом продолжения
этой работы является получение линии мышей, гомозиготной по “нокаути-
рованному” гену PDGF-A с целью более детального анализа функций этого
гена.
ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ
В последнее время все большее внимание исследователей направлено на
возможность клонирования млекопитающих путем переноса ядер в энукле-
ированные ооциты. Преимущество этого метода заключается в том, что все
клетки в потомстве, включая зародышевые, представлены генотипом ЭС
клеток. ЭС клетки сельскохозяйственных животных могут служить источ-
ником тотипотентных ядер, которые могут быть использованы в качестве
доноров для пересадки ядер с целью получения генетически идентичных
трансгенных животных причем практически в неограниченном количестве
(Bondioli et al., 1990, Stice, Robl, 1989, Campbell et al, 1995). Широкие перспе-
ктивы открываются в плане возможного использования эмбриональных
стволовых и стволовых клеток для клеточной терапии различных тяжелых
заболеваний человека, таких как, например, диабет, онкологические и ней-
родегенеративные заболевания. Необходимым для достижения этой цели
условием является получение in vitro как можно более “гомогенных” (по ти-
303
пу клеток) клеточных культур. В связи с этим чрезвычайно важным являет-
ся поиск факторов как белковой так и небелковой природы, способных ре-
гулировать процессы дифференцировки этих клеток в определенном напра-
влении. Таким образом, комплексные исследования соматических клеток
млекопитающих и человека, включая эмбриональные стволовые клетки,
открывают широкие возможности как для продолжения исследований фун-
даментальных молекулярно-генетических процессов, лежащих в основе
жизнедеятельности этих клеток, так и для практической медицины XXI в.
ЛИТЕРАТУРА
Гордеева О.Ф., Мануйлова Е.С., Гуляев Д.В., Гривенников И.А. Дифференцировка эмб-
риональных стволовых клеток в культуре. Морфологические аспекты. Цитология.
2001. Т. 43, №9. С. 851.
Дыбан А.П. И Раннее развитие млекопитающих. Л.: Наука, 1988. С. 34-49.
Лойда 3., Госсрау Р., Шиблер Т. // Гистохимия ферментов: Лабораторные методы. М.:
Мир, 1982. С. 64—67.
Макарова И.В., Незнанов Н.С., Цымбалюк Е.С. и др. Таргетинг гена A-цепи тромбоци-
тарного фактора роста (PDGF) и получение химерной мыши с “нокаутированным”
геном // Молекуляр. генетика микробиология и вирусология. 1997. Т. 4. С. 23-25.
Мануйлова Е.С., Гордеева О Ф Гривенников И.А., Озернюк Н.Д. Эмбриональные ство-
ловые клетки; спонтанная и направленная дифференцировка // Изв. РАН. 2001. Т. 6.
С. 704-710.
Межевикина Л.М., Мануйлова Е.С.. Попов В.И., Савченкова И.П. Физико-химические
аспекты роста и дифференцировки эмбриональных стволовых клеток в условиях
культуры. Консервация генетических ресурсов. Пущино, 1998. С. 182-186.
Межевикина Л.М., Смирнов С.В. Смолихина Т.П. и др. Плюрипотентность и генетиче-
ское разнообразие эмбриональных стволовых клеток линии D3 в зависимости от ус-
ловий культивирования // Цитология. 2001. № 4. С. 363.
Миталипов Ш.М., Миталипова М.М., Иванов В.И. Влияние длительности культивиро-
вания на плюрипотентность эмбриональных стволовых клеток in vitro и in vivo // Он-
тогенез. 1994. Т. 25. С. 19-27.
Тарантул В.З. Таргетинг генов как современный подход к изучению их функции //
Молекуляр. генетика микробиология и вирусология. 1996. № 2. С. 2-13.
Федченко В.И., Межевикина Л.М.. Гурьев С.О., Мануйлова Е.С. Поддержание устой-
чивой плюрипотентности эмбриональных стволовых клеток мыши in vitro в ре-
зультате трансформации этих клеток геном lif Ц Цитология. 2001. Т. 43. № 4.
С. 407.
Шугурова И.М., Андреева Л.Е., Дубовая В.И. и др. Влияние генов tat и nef вируса имму-
нодефицита человека типа 1 на клетки грызунов in vivo и in vitro Ц Генетика. 1997.
Т. 33. С. 1202-1208.
Шугурова И.М., Бобрышева И.В., Гривенников И.А., Тарантул В.З. Эффекты генов nef
и tat вируса иммунодефицита человека типа 1 на клетки феохромоцитомы крысы
РС12 // Там же. 2000. Т. 36. С. 1140-1146.
Шугурова И.М., Мануйлова Е.С., Гривенников И.А.,Тарантул В.З. Влияние генов tat и
nef вируса иммунодефицита человека типа 1 на эмбриональные стволовые клетки
мыши в культуре // Цитология. 2001. Т. 43. С. 415—416.
Adamson ED. Growth factors and their receptors in development // Develop. Genet. 1993. Vol. 14.
P. 159-164.
Bagutti C., Wobus A.M.. Fassler R., Watt F.M. Differentiation of embryonal stem cells into ker-
atinocytes: Comparison of wild-type and integrin-deficient cells // Develop. Biol. 1996.
Vol. 179. P. 184-196.
Bain G., Kitchens D.,Yao M. et al. Embryonic stem cells express neuronal properties in vitro //
Ibid. 1995. Vol. 168. P. 342-357.
304
Bar-Sagi D., Feramisco J.R. Microinjection of the ras oncogene protein into PC12 cells induces
morphological differentiation //Cell. 1985. Vol. 42. P. 841-848.
Bjelfman C., Meyeeson G., Cartwrigt C. et al. Early activation of endogenous pp 60 src kinaze
activity during neuronal differentiation of a cultured human neuroblastoma cells // Mol. and
Cell. Biol., 1990. Vol. 10. P. 361-370.
Bondioli K.R., Westhusin M.E., Looney C.R. Production of identical bovine offspring by nuclear
transfer//Theriogenology. 1990. Vol. 33. P. 165-173.
Bostrom H., Willetts К.. Pekny M. et al. PDGF-A signaling is a critical event in lung alveolar
myofibroblast development and alveogenesis // Cell. 1996. Vol. 85. P. 863-873.
Bowen-Pope D.F., Van Koppen A., Schatteman G. Is PDGF really important testing the hypothess //
Trends Genet. 1991. Vol. 7. P. 413-418.
Campbell K., Me Whir J.. Ritchie B., Wilmut I. Production of live lambs following nuclear trans-
fer of cultured embryonic disc cells // Theriogenology. 1995. Vol. 42. P. 181.
Conover J.C.N.I., IpPoueymirou WT., Bates B. et al. Ciliary neutrophic factor maintains the
pluripotentiality of embryonic stem cells // Development. 1993. Vol. 119. P. 559-565.
Doetschman T.C.. Eistetter H., Katz M. et al. The in vitro development of blastocyst-derived
embryonic stem cell lines: formation of visceral yolk sac, blood islands and myocardium //
J. Embryol. and Exp. MorphoL 1985. Vol. 87. P. 27-45.
Evans M. J.. Kaufman M.H. Establishment in culture of pluripotential cells from mouse embryos //
Nature. 1981. Vol. 292. P. 154-156.
Folger K.R., Wong E.A., Wahl G., Capecchi M.R. Patterns of integration of DNA microinjected
into cultured mammalian cells: evidence for homologous recombination between injected
plasmid DNA molecules // Mol. and Cell. Biol. 1982. Vol. 2. P. 1372-1387.
Grotendorst G.R., Chang T, Seppa H.E. et al. Platelet-derived growth factor is a chemoattractant
for vascular smooth muscle cells // J. Cell. Physiol. 1982. Vol. 113. P. 261-266.
Heldin C.H. Structural and functional studies on platelet-derived growth factor // EMBO J. 1992.
Vol. 11. P. 4251-4259.
Kemler R., Morello D., Jacob F. // In Cell lineage, stem cells an cell determination / Ed. N. le
Douarin. Amsterdam: North-Holland, 1979. P. 101-113.
Kosaka M., Nishina Y., Takeda M. et al. Reversible effects of sodium butyrate on the differentia-
tion of F9 embryonal carcinoma cells // Exp. Cell Res. 1991. Vol. 192. P. 46-51.
Mansour S.L., Thomas K.R., Capecchi M.R. Distruption of the proto-oncogene int-2 in mouse
embryo-derived stem cell: A general strategy for targeting mutations to non-selectable genes
// Nature. 1988. Vol. 336. P. 348-353.
Martin G.R. Isolation of a pluripotent cell cultured in medium conditioned by teratocarcinoma
stem cells 11 Proc. Nat. Acad. Sci. USA. 1981. Vol. 78. P. 7634-7638.
McMahon A.P., Bradley A. The Wnt-1 (int-1) proto-oncogene is required for development of a
larch region or the mouse brain // Cell. 1990. Vol. 62. P. 1073-1085.
Nagy A., Rossant J., Nag) R. et al. Derivation of completely cell culture-derived mice from early-
passage embryonic stem cells // Proc. Nat. Acad. Sci. USA. 1993. Vol. 90. P. 8424—8428.
Nichols J., Chambers I., Smith A. Derivation of germ line competent embryonic stem cells with
combination of interleukin-6 and solube interleukin-6 receptor // Exp. Cell. Res. 1994.
Vol. 215. P. 237-239.
Nichols J., Evans E.P., Smith A.G. Establishment of germlinecompetent embryonic stem (ES)
cells using differentiation-inhibiting activity (LIF) // Development. 1990. Vol. 110.
P. 1341-1348.
Pease S., Braghetta P., Gearing D. et al. Isolation of embryonic stem (ES) cells in media
suplemented with recombinant leukemia inhibiting factor (LIF) // Develop. Biol. 1990.
Vol. 141. P. 344-352.
Reddel R.R., Yeager T.R. Constructing immortalized human cell lines // Curr. Opin.
Biotechnology. 1999. Vol. 10. P. 455—469.
Robertson E.J., Bradley A. // Experimental approaches to mammalian embryonic development.
Cambridge: Cambridge Univ, press. 1986. P. 475-508.
Rohwedel J., Sehlmeyer U.,Jin S. et al. Primordial germ cell-derived mouse embryonic germ (EG)
cells in vitro resemble undifferentiated stem cells with respect to differentiation capacity and
cell cycle distribution // Cell Biol. Intern. 1996. Vol. 20. P. 579-587.
405
Rose T.M.. Bruce G Oncostatin M is a member of a cytokine family that includes leukaemia
inhibitory factor granulocyte colony stimulating factor and interleukin-6 // Proc. NatL Acad.
Sci. USA. 1994. Vol. 88. P. 8641-8645.
Si huldiner M., Yanuka O., Itskovitz-Eldor J. et al. Effects of eight growth factors on the differen-
tiation of cells derived human embryonic stem cells //Ibid. 2000. Vol. 97. P. 11307-11312.
Shamblott M.J., Axelman J., Wang S. et al. Derivation of pluripotent stem cells from cultured
human primordial germ cells // Ibid. 1998. Vol. 95. P. 13726-13731.
Sibilia M., Wagner E.F. Strain-dependent epithelial defects in mice lacking the EGF receptor //
Science. 1995. Vol. 269. P. 234-238.
Smith A.G., Heath J.K., Donaldson D.D. et al. Inhibition of pluripotential embryonic stem cell dif-
ferentiation by purified polypeptides // Nature. 1988 Vol. 336. P. 688-690.
Stice S.L., Robl J.M. Current successes in cloning mammalian embryos // Age. 1989. Vol. 12.
P. 83-88.
Те Riele H., Maandag E.R., Berns A. Highly efficient gene targeting in embryonic stem cell
through homologous recombination with isogenic DNA constructs // Proc. Nat. Acad. Sci.
USA. 1992. Vol. 89. P. 5128-5132.
Thomas K.R., Capecchi M.R. Site-directed mutagenesis by gene targeting in mouse embryo-
derived stem cells // Cell. 1987. Vol. 51. P. 503-512.
Thomson J .A., Itskovitz-Eldor JShapiro S.S. et al. Embryonic stem cell lines derived from human
blastocysts // Science. 1998. Vol. 282. P. 1145-1147.
Williams R.L., Hilton D.J., Pease S. Myeloid leukemia inhibitory factor maintains the develop-
mental potential of embryonic stem cells // Nature. 1988. Vol. 336. P. 684—687.
Wohus A.M., Holzhausen H., Jakel PSchoneich J. Characterization of pluripotent stem cell line
derived from mouse embryo // Exp. Cell. Res. 1984. Vol. 152. P. 212—219.
Yagi T., Ikawa I., Yoshida R. et al. Homologous recombination at c-fyn locus of mouse embryon-
ic stem cells with use of diphtheria toxin А-fragment gene in negative selection // Proc. Nat.
Acad. Sci. USA. 1990. Vol. 87. P. 9918-9922.
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА ЧЕЛОВЕКА:
МЕДИКО-ГЕНЕТИЧЕСКИЕ
И ПОПУЛЯЦИОННЫЕ ИССЛЕДОВАНИЯ
С.А. Лимборская, П.А. Сломинский
Отдел молекулярных основ генетики человека
В статье представлены результаты работ последних лет по меди-
цинской и этнической геномике, ведущихся в Отделе молекулярных основ
генетики человека ИМГ РАН. На примере изучения торзионной дистонии
показаны особенности молекулярно-генетических подходов при анализе
типичных моногенных болезней. Новый тип мутаций, называемый дина-
мическими мутациями, рассмотрен на примере исследования миотониче-
ской дистрофии. Боковой амиотрофический склероз изучается с позиций
его особых генетических свойств, позволяющих отнести его к переходной
группе от моногенных к мулътифакториалъным заболеваниям. Предста-
влены также исследования, которые являются первым этапом генетиче-
ского анализа наиболее распространенных заболеваний человека, таких
как ишемическая болезнь сердца, сахарный диабет, инсульт и др.
В области этнической геномики проведено изучение большого числа
популяций Восточно-Европейского региона по ряду полиморфных марке-
ров ДНК. Получены подробные популяционные характеристики кон-
кретных маркеров. Методами компьютерной геногеографии показаны
особенности и основные тенденции изменчивости в генофонде изучаемого
региона, что позволяет получить новые сведения о сложном характере
взаимодействия и взаимовлияния этносов, проживающих на данной тер-
ритории.
СЛОВАРЬ ТЕРМИНОВ
Ассоциативная связь — сочетательная связь, между геном и признаком, наблюдаемая в
популяциях.
Антиципация - тенденция признака к более раннему и сильнее выраженному проявле-
нию в следующих друг за другом поколениях.
Геномный полиморфизм — нейтральные вариации в строении генома у разных особей
одного вида.
Доминантный тип наследования - характеризуется прямой передачей признака от роди-
теля к потомкам- это предполагает, что признак проявляется у гетерозигот по гену,
его определяющему.
Маркеры ДНК — полиморфные участки ДНК, для которых известна точная хромосом-
ная локализация. Используются для картирования генов, индивидуальной иденти
фикации и популяционной характеристики.
Миссенс-мутация - замена нуклеотида в кодирующей части гена, ведущая к замене ами-
нокислотного остатка в соответствующем белке.
Наследственные болезни — заболевания, обусловленные генными или хромосомными
мутациями.
Моногенные болезни - наследственные болезни, обусловленные дефектом одного гена.
Мультифакториальные болезни - заболевания, имеющие в своей основе как генетиче-
скую, так и средовую компоненты; генетическая компонента представляет собой
сочетание аллелей нескольких локусов, определяющих наследственную предраспо-
ложенность к заболеванию при разных условиях внешней среды.
Спорадические случаи - заболевания, которые обусловлены либо вновь возникшими до-
минантными мутациями, либо ненаследственными вариантами заболевания.
307
Оксидантный стресс — повышенное содержание в тканях и клетках организма свободно-
радикальных соединений.
Сахарный диабет - заболевание, связанное с нарушением углеводного обмена с повыше-
нием концентрации сахара в крови. Различают С.Д. I типа - зависимый от инсулина
и С.Д. II типа — независимый от инсулина.
SSCP-анализ - метод выявления мутаций в геномной ДНК, который основан на анализе
электрофоретической подвижности амплифицированных и денатурированных
ДНК, различающихся вследствие нуклеотидных замен по пространственной органи-
зации.
Типирование ДНК - определение в ДНК особи конкретных вариантов полиморфных
маркеров ДНК.
Пенетрантность — частота фенотипического проявления признака, определяемая по чис-
лу особей, у которых он проявляется относительно всех особей, несущих ген, опре-
деляющий данный признак. Полная пенетрантность — фенотипический признак про-
является у всех особей, несущих ген, определяющий признак.
Рецессивный тип наследования — характеризуется отсутствием прямой передачи призна-
ка от родителя к потомкам: это предполагает,что признак проявляется только у го-
мозигот по гену, его определяющему; гетерозиготы не отличаются от нормальных
особей.
Эксайтотоксичность - гиперстимуляция чувствительных нервных клеток под воздейст-
вием высоких концентраций аминокислотных трансмиттеров (передатчиков), дейст-
вующих как раздражители.
Экспансия триплетных повторов (динамические мутации) — значительное увеличение
числа тринуклеотидных повторов, локализованных в кодирующих или регулятор-
ных участках гена, приводящих к нарушению его функции и тем самым - к возник-
новению соответствующей наследственной болезни.
Эффект “горлышка бутылки” - эффект возникновения генетической изменчивости в
популяции, прошедшей стадию резкого сокращения численности.
ВВЕДЕНИЕ
Последние годы на рубеже двух столетий ознаменованы стремительным
прогрессом в области молекулярной генетики человека. Это связано преж-
де всего с работами по расшифровке генома человека, проведенными в
рамках международных и национальных программ “Геном человека”. Ре-
зультатом этих работ стало не только получение громадной по объему ин-
формации о строении ДНК человека, но и разработка новых эффективных
технологий типирования ДНК, создание и хранение информационных баз
данных, способов обработки больших массивов результатов и т.д. На осно-
ве развития этих исследований возникло новое научное направление, полу-
чившее название геномики, которое революционизировало современную
биологию, позволило выявить многие черты организации генома, провести
сравнение геномов различных организмов, обнаружить новые гены и гене-
тические элементы, расшифровать мутации при значительном числе на-
следственных болезней, в том числе и такие типы мутаций, которые не бы-
ли известны ранее. Разработка столь многочисленных проблем привела к
существенному расширению областей интереса молекулярно-генетической
науки, а также к распространению ее подходов и методов как на смежные,
так и достаточно отдаленные научные направления. Это в первую очередь -
медицинская генетика, фармакология, сравнительная биология, криминали-
стика, судебная медицина, биотехнология, а также - антропология, археоло-
гия, история. В соответствии с этим в рамках геномики стали развиваться
308
специализированные разделы, такие как функциональная геномика, сравни-
тельная геномика, медицинская геномика, компьютерная геномика и, нако-
нец, этническая геномика (этногеномика).
Представленные материалы посвящены рассмотрению работ Отдела в
области медицинской геномики и этногеномики в приложении к изучению
генофонда народонаселения Восточно-Европейского региона, до недавнего
времени с молекулярно-генетических позиций остававшегося наименее изу-
ченным среди всех регионов мира.
Медицинская геномика занимается определением генных дефектов при
наследственных и других болезнях, изучением экспрессии мутантных генов
и разработкой новых методов диагностики, лечения и профилактики. В сво-
ей работе основное внимание мы уделяем изучению молекулярных основ
наследственных неврологических заболеваний. Большой интерес, который
проявляется к этой группе болезней, связан с тем, что именно при их иссле-
довании удается выявить новые гены, функционирующие в нервных клет-
ках. Это позволяет значительно расширить генетическую базу, закладыва-
ющую основы изучения молекулярных принципов функционирования нерв-
ной системы. Следует также отметить, что именно при изучении неврологи-
ческих заболеваний за последние годы был обнаружен новый, неизвестный
ранее тип мутаций (динамические мутации), связанных с экспансией три-
плетных и некоторых других повторов.
В рамках изучения неврологических болезней сейчас получили развитие
исследования по выработке подходов к анализу так называемых сложных
заболеваний, имеющих мультифакториальную природу, т.е. зависящих как
от генетических факторов, так и от факторов внешней среды. Некоторые
неврологические заболевания, такие как боковой амиотрофический скле-
роз, имеют необычные генетические характеристики, которые позволяют
считать их переходной группой от моногенных к мультифакториальным бо-
лезням. Их изучение может явиться ключом к пониманию генетических ос-
нов таких наиболее распространенных болезней, как инсульт, диабет, ише-
мическая болезнь сердца, пути исследования которых сейчас активно разра-
батываются мировой наукой. В своей работе мы также ищем подходы к ана-
лизу генетической предрасположенности к данным заболеваниям. В наших
исследованиях показано, что в случае заболеваний с сосудистой патологией
большую роль играют гены, относящиеся к так называемой ренин-ангио-
тензиновой системе. У больных из популяций нашей страны выявлена ассо-
циативная связь полиморфизма некоторых из этих генов с развитием и тя-
жестью проявления клинических признаков при ишемической болезни серд-
ца и осложнениях сахарного диабета типа II. Развитие исследований в этом
направлении является новым этапом в молекулярной генетике человека, ко-
торый позволит разработать методы диагностики, лечения и профилактики
для группы наиболее распространенных болезней.
Другое направление наших исследований - этногеномика, основной за-
дачей которой являемся изучение особенностей геномного полиморфизма и
геномного разнообразия на разных уровнях популяционной системы наро-
донаселения - отдельных популяций, этносов, этно-территориальных общ-
ностей.
Огромное множество полиморфных маркеров, выявленное при рас-
шифровке генома человека, является мощным инструментом для анализа
309
генофонда, его основных характеристик, динамики, истории и географии.
Молекулярно-генетические маркеры отличаются от всех прежних марке-
ров, применяемых в популяционно-генетических исследованиях, в первую
очередь — по степени полиморфизма, связанной со значительной мультиал-
лельностью. Хотя классическая генетика и использовала целый ряд высо-
кополиморфных белковых локусов (HLA, GM и др.), однако они являлись
скорее исключением, чем правилом. Есть и другие принципиальные осо-
бенности ДНК маркеров (см. словарь терминов). Это открывает возмож-
ность определения популяционных характеристик конкретных полиморф-
ных маркеров, их сравнения с классическими популяционными маркерами
(представляющими собой, главным образом, полиморфные белки плазмы
крови) и выявления их новых дополнительных свойств. Весьма эффектив-
ным для всестороннего анализа геномных маркеров является геногеогра-
фический подход, позволяющий с наибольшей убедительностью опреде-
лить внутри- и межпопуляционные параметры изменчивости маркеров, вы
явить основные тенденции их пространственной динамики. Это поможет
в дальнейшем получить существенно новую информацию о генофонде ис-
следуемого региона и заложить основы нового подхода к изучению основ-
ных тенденций микроэволюции и становления генофонда современного
человека.
В перспективе можно ожидать, что оба направления - медицинская и эт-
ническая геномика - будут более тесно взаимосвязаны, так как предполага-
ется разработка новых подходов к решению сложной проблемы выявления
генетических основ мультифакториальных заболеваний, к которым отно-
сится большая часть наиболее распространенных болезней. Уже сейчас ста-
ло ясно, что эта работа потребует комбинированного использования мето-
дов и подходов, применяемых в обоих направлениях геномики. Предполага-
ется анализ чрезвычайно большого количества полиморфных маркеров
ДНК в значительных по численности группах больных и популяционных
выборок здоровых лиц. Здесь будут важны данные о частотных характери-
стиках конкретных полиморфных маркеров в различных популяциях. Это
позволит найти ассоциации между болезнью и нейтральными вариантами
полиморфизма ДНК, расположенными вблизи генов, определяющих риск
заболевания.
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА
МОНОГЕННЫХ НЕВРОЛОГИЧЕСКИХ БОЛЕЗНЕЙ
За последние годы в области медицинской геномики самые большие
успехи были достигнуты при изучении моногенных болезней. На сегод-
няшний день известно более 3000 моногенных болезней, среди них такие,
как фенилкетонурия, гемоглобинопатии, мышечные дистрофии и др. Для
большого числа этих заболеваний осуществлены картирование генов на
хромосомах, их клонирование и анализ структуры (множество генов ока
зались новыми, неописанными ранее) и, наконец, установление мутаций,
определяющих заболевание, а также анализ особенностей распределеня
мутаций в различных популяциях. Многие гены, ответственные за наслед-
ственные болезни, были клонированы с использованием предварительно-
310
го знания их функциональных характеристик. Например, было известно,
что фенилкетонурия связана с дефектами фенилаланингидроксилазы, сер-
повидноклеточная анемия - с дефектом структуры гемоглобина, точнее -
Р-глобиновой цепи. На основании знания о том, какой белок вовлечен в па -
тологию, можно было осуществлять клонирование гена через использова-
ние соответствующих мРНК и кДНК. Однако для подавляющего числа на-
следственных болезней такой информации нет. В этом случае для выделе-
ния гена, обусловливающего заболевание, используют так называемое по-
зиционное клонирование. Этот подход включает в себя несколько этапов,
первый из них — выявление хромосомной локализации предполагаемого
гена, т.е. определение позиции, которую он занимает в геноме (в конкрет-
ном участке конкретной хромосомы). Это достигается исследованием
больших родословных, где имеется заболевание, путем сопоставления на-
следования самой болезни с наследованием большого числа полиморфных
маркеров с известной локализацией в геноме. Большим подспорьем в та-
кой работе являются так называемые гены-кандидаты, т.е. те, которые
предположительно могут являться причинами болезни. В этом случае,
зная локализацию генов-кандидатов, можно резко уменьшить число изуча-
емых маркеров, взяв в исследование только те, которые расположены
вблизи генов-кандидатов.
После анализа родословных выявляют маркеры, наиболее тесно связан-
ные с геном болезни, и по их локализации определяют ориентировочно ло-
кализацию искомого гена. На втором этапе - собственно клонирования - ис-
пользуют библиотеки геномной ДНК, откуда выделяют клоны, содержащие
маркеры, наиболее близко расположенные к гену болезни и, последователь-
но, все более сужая область локализации, удается выйти на искомый ген. Да-
лее исследуется структура гена, выявляются в нем мутации, и определяется
все разнообразие мутаций, встречающихся у больных при изучаемом забо-
левании.
Наш коллектив активно участвовал в этих исследованиях как в облас-
ти картирования и тонкой хромосомной локализации генов [(торзионная
дистония (Ozelius at al, 1997), прогрессирующая мышечная дистрофия
(Illarioshkin et al., 1996)], так и в определении мутаций и их спектров, харак-
терных для популяций нашей страны (хорея Гентингтона (Иванова-Смо-
ленская и др., 1998) болезнь Вильсона-Коновалова (Карабанов и др., 2001),
миодистрофия Эрба-Ротта (Pogoda et al., 2001), спиномозжечковая атаксия
(Иллариошкин и др., 1997), торзионная дистония (Klein et al., 1998;
Illarioshkin et al., 1998; Slominsky et al., 1999, Markova et al., 1999; Маркова и
др., 2000), миотоническая дистрофия (Сломинский и др., 2000; Хидиятова и
др., 2000).
Из этого довольно значительного списка мы рассмотрим в качестве при-
мера торзионную дистонию и миотоническую дистрофию, которые опреде-
ляются принципиально различными типами мутаций и могут дать представ-
ление о принципах и подходах, применяемых в данной области. Эти исследо-
вания были проведены в тесном взаимодействии с сотрудниками Отдела
нейрогенетики Института неврологии РАМН (зав. Отделом - профессор,
И.А. Иванова-Смоленская).
311
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ АНАЛИЗ
ТОРЗИОННОЙ ДИСТОНИИ
Торзионная дистония (ТД) - это группа нейродегенеративных заболева-
ний, которые характеризуются рядом клинических проявлений и в том чис-
ле - своеобразными вращательными судорогами, что нашло отражение в
названии заболевания (torsion - вращение). Частота встречаемости торзион-
ной дистонии составляет 1 : 160 000 (Zeman, 1976). Заболевание наследуется
по аутосомно-доминантному типу со сниженной пенетрантностью (около
30%) (Zilber et al., 1984; Rich et al., 1990). Первые симптомы болезни обычно
появляются в возрасте от 5 до 20 лет. Заболевание начинается с вовлечения
какой-либо группы мышц рук, ног, шеи или туловища. Чаще всего на пер-
вом этапе болезни больные жалуются на затруднения при ходьбе. Сначала
эти симптомы непостоянны, но при прогрессировании заболевания вовлека-
ются новые группы мышц. Тяжесть течения заболевания коррелирует с воз-
растом начала: у больных с более поздним началом (после 25-30 лет) встре-
чаются преимущественно локальные формы ТД (т.е. с вовлечением неболь-
шого числа мышц). У пациентов с ранним началом болезнь быстро прогрес-
сирует, с развитием тяжелых генерализованных форм, с захватом множест-
венных групп мышц. В начале 70-х годов Е.Д. Марковой было предложено
разделять ТД на две формы - ригидную и гиперкинетическую (Маркова,
1975). При ригидной форме наблюдаются постоянное повышение мышечно-
го тонуса и формирование так называемых патологических поз, на поздней
стадии болезни наблюдается развитие сильного ограничения подвижности в
суставах. Тем не менее при этой форме отмечается более мягкое прогресси-
рование болезни. Вторая, гиперкинетическая, форма характеризуется появ-
лением генерализованных спастических состояний (спазм отдельных мышц
или групп мышц), которые резко усиливаются при ходьбе и в конце концов
приводят больного к инвалидности. Биохимические исследования показали,
что развитие ригидных форм связано со снижением активности дофаминэр-
гической и серотонинэргической систем с одновременной активацией холин-
эргической системы, в то время как при гиперкинетических формах наблю-
даются обратные изменения (Бархатова, 1988; Jeon, 1997). Было также об-
наружено, что обе формы заболевания различаются по реакции на лечение
препаратами, содержащими дофамин. Ригидная форма к такому лечению
чувствительна, тогда как гиперкинетическая - нет. На основании этих дан-
ных в 1988 г. Nygaard предложил новое название для ригидной дистонии -
дофа-зависимая дистония (dopa-responsive dystonia = DRD) (Nygaard et al.,
1988, 1995).
Ген, определяющий развитие дофа-зависимой дистонии (ДЗД), был кар-
тирован на 14 хромосоме в области 14qll-q24.3 (Ichinoe et al., 1994, 1995).
Этот ген кодирует белок ГТФ-циклогидролазу I (ГЦГ-1). ГЦГ-1 - это фер-
мент, регулирующий превращение ГТФ в дигидронеоптерин-трифосфат, ко
торый является субстратом для образования тетрагидробиоптерина (ВН4) -
кофактора тирозин-, фенилаланин- и триптофангидроксилаз, регулирую-
щих синтез катехоламинов и серотонина. ГЦГ-1 является скорость-лимити-
рующим ферментом в процессе биосинтеза ВН4 из ГТФ (рис. 112) (Kang,
1998; Thony, Blau, 1997). Ген состоит из 6 экзонов и в результате альтерна-
тивного сплайсинга дает начало четырем различным видам мРНК, отлича-
312
ГТФ
ГТФ-циклогидролаза
дигидронеоптерин-трифосфат
6-пирувоил-тетрагидроптерин-
синтетаза
б-пирувоил-тетрагидроптерин
сепиаптерин-редуктаза
тирозин
тетрагидробиоптерин (ВН4)
тирозин-гидроксилаза
дофа-
декарбоксилаза
дегидроптерин-
редуктаза
дофамин
леводофа
каиноид-
дигидробиоптерин
Рис. 112. Биохимический путь синтеза биоптерина и его связь с синтезом дофамина
ющимся по структуре 3' концевой области. Только один из этих видов мРНК
транслируется с образованием функционально активного фермента (ГЦГ-1)
размером 250 аминокислот (27 кД). Варианты ГСГ-2, GCH-3 и ГЦГ-4 отли-
чаются от активной формы ГТФГЦГ-структурой С-концевой области
(Togari et al.. 1992).
Первыми мутациями, обнаруженными в гене ГЦГ-I, были три толковые
мутации, приводящие к замене аминокислот, и одна делеция со сдвигом рам-
ки считывания и обрывом трансляции (Tanaka, 1995). В настоящее время в
различных популяциях описано большое число независимых мутаций в гене
ГЦГ-I, обусловливающих развитие ДЗД (Ichinoe et al., 1994, 1995; Tanaka,
1995; Bandmann, 1996; Beyer, 1997; Steinberger, 1998). Описанные мутации не
кластерированы вокруг активного центра фермента ГЦГ-I, а равномерно
распределены по всем шести экзонам. Большинство найденных мутаций яв-
ляются уникальными, т.е. типичными для каждой конкретной семьи или
спорадического случая заболевания, и до сих пор не удалось обнаружить
преимущественного расположения мутаций в конкретном экзоне. Предпо-
313
Таблица 1. Идентифицированные мутации
гена ГЦГ-1 в семьях больных дофа-тависи-
мой дистонией из России
Экзон Нуклеотидные замены Аминокислотные замены в белке ГЦГ-1
1 АТС -> AAG MetlO2Lys
2 ТСТ -> TGG Cysl41Trp
3 ACG —>AAG Tre94Lys
6 CGA ->TGA Arg216Stop
4 AGT —>АСТ Serl76Thr
лагается, что ген ГЦГ-1 не явля-
ется единственным, с которым
связано развитие это формы за-
болевания. Но для обоснования
этого требуется проведение бо-
лее обширных исследований мо-
лекулярно-генетических причин
возникновения ДЗД.
Данные проведенного нами
анализа восьми семей с дофа-за-
висимой дистонией из России под-
тверждает это предположение.
Поиск мутаций в гене ГЦГ-1 с ис-
пользованием SSCP-анализа и при наличии сдвига полосы с последующим
секвенированием соответствующего экзона у больного позволил идентифи-
цировать различные мутации в кодирующей области этого гена в 5 семьях;
в каждой семье была обнаружена своя мутация (табл. 1). Только одна из
этих мутаций - нонсенс-мутация в экзоне 6 - была описана ранее в одной из
семей с дофа-зависимой торзионной дистонией из Англии. Все остальные
мутации выявлены впервые, что подтверждает очень высокую генетиче-
скую гетерогенность этой формы торзионной дистонии.
Обнаруженные нами изменения кодирующей последовательности рас-
положены в высококонсервативной области гена ГЦГ-1 и их патогенетиче-
ское значение подтверждается косегрегацией в обследованных семьях мута-
ции в гене ГЦГ-! и фенотипа ДЗД. Найденные мутации, так же как и в дру-
гих случаях, не кластерированы вокруг или внутри активного центра фер-
мента, кодируемого экзонами 2 и 3 гена ГЦГ-1, что вызывает дополнитель-
ные вопросы о механизме влияния подобных изменений на уровень активно-
сти ГЦГ-1 и соответственно на развитие фенотипа ДЗД.
Интересно отметить, что выявление новых мутаций в исследуемых семь-
ях позволило расширить спектр известных клинических проявлений. Выяс-
нилось, что в пределах одной семьи носители мутации могут резко разли-
чаться по фенотипу заболевания и он может варьировать от классического
фенотипа ДЗД до изолированного тремора рук или атипичной стопы. Это
позволяет пересмотреть имеющиеся представления об уровне пенетрантно-
сти мутаций в гене ГЦГ-1. Если принимать во внимание только классиче-
скую форму заболевания, то пенетрантность действительно не превышает
30%. Но с учетом атипичных вариантов при достоверно установленных му-
тациях в гене ГЦГ-1 пенетрантность заболевания оказывается выше 80%.
Аналогичные дачные были недавно получены при анализе семей с ДЗД из
Германии, где с учетом стертых форм (form fruste) заболевания пенетрант-
ность ДЗД также оценена в 80-100%.
Что касается другой формы торзионной дистонии - гиперкинетиче-
ской - то наиболее тяжелый вариант этого заболевания связан с геном
DYTI. Еще в 1997 г. американские авторы (Ozelius et al., 1997) локализовали
ген DYT1 на длинном плече хромосомы 9 в области q32-q34. Дальнейшие ис-
следования, в том числе проведенные совместно с нами, позволили осущест-
вить тонкое картирование, а затем клонирование и секвенирование гена
DYT1. В результате было показано, что этот ген кодирует белок, названный
314
торзином А. Этот белок относится к семейству АТФ-связывающих белков
и родствен белку С1р нематоды, играющему роль в процессах пострансля-
ционной модификации и протеолиза ядерных белков.
Данная форма дистонии встречается во многих популяциях, но особенно
часто - у евреев-ашкеназов. Проведенный ранее (Ozelius et al., 1997) анализ
полиморфных маркеров, расположенных вблизи гена DYTI, показал, что в
этой популяции явно выражен эффект родоначальника. Согласно проведен-
ным расчетам, мутация в данной популяции появилась 20—30 поколений на-
зад в Восточной Европе, предположительно в Литве или Белоруссии. Затем
роль эффекта родоначальника мутации DYT1 у евреев-ашкеназов была уси-
лена за счет эффекта “горлышка бутылки” (резкого снижения численности
популяции), что привело при дальнейшем росте популяции к резкому увели-
чению частоты встречаемости данного гена. Последующий анализ структу-
ры гена торзина А у евреев-ашкеназов подтвердил роль эффекта основате-
ля в распространении этой формы заболевания - у всех проанализирован-
ных больных в этой этнической группе обнаружена одна и та же мутация,
делеция тринуклеотида GAG в последовательности GAGGAG. которая воз-
никла в результате ошибки репликации.
Эта же мутация является основной причиной гиперкинетической дофа-
независимой торзионной дистонии и в славянских популяциях. Нами был
проведен анализ частоты встречаемости делеции триплета GAG в 20 семьях
с гиперкинетической торзионной дистонией из различных этнических групп,
проживающих в России, результаты которого представлены в табл. 2. В ней
приведены данные о числе семей с делецией тринуклеотида GAG и без этой
делеции. Делеция обнаружена во всех шести проанализированных семьях
евреев-ашкеназов; в семьях славянского происхождения (русские и украин-
цы) частота делеции GAG также велика и составляет 50% (7 из 14 семей)
В этой группе болезнь могут вызывать и другие, пока неидентифицирован-
ные мутации в гене торзина А. Такое распределение частоты делеций три-
нуклеотида GAG у евреев-ашкеназов и славян подтверждает как возмож-
ность славянского происхождения этой мутации в относительно отдаленный
исторический период, так и возможность ее интродукции в еврейскую попу-
ляцию с последующим быстрым распространением.
Таким образом, проведенное молекулярно-генетическое исследование
торзионной дистонии показало, что выявленные ранее на клиническом
уровне две формы заболевания являются по сути двумя разными генетиче-
скими болезнями, связанными с дефектами двух разных генов. В одном слу-
чае (при дофа-зависимой дистонии) болезнь определяется дефектами гена
ГТФ циклогидролазы-I, причем оказалось, что данный тип патологии хара-
ктеризуется чрезвычайно высокой молекулярно-генетической гетерогенно-
стью - практически каждая изученная семья или спорадический случай за-
болевания характеризуется “своей” мутацией (как правило - миссенс-мута-
цией) и мутации очень редко повторяются у неродственных больных. Не
удалось также обнаружить какую-либо закономерность в расположении му-
таций по длине гена и соответственно кодируемого им белка.
Другой тип торзионной дистонии (дофа-независимая) связан с дефекта-
ми другого гена, который, как выяснилось в данных исследованиях, кодиру-
ет неизвестный ранее белок, названный торзином. В отличие от предыдуще-
го типа заболевания, здесь болезнь в большинстве случаев определяется од-
315
Таблица 2. Деления тринукллеотида GAG в гене торзина А у больных с дофа-неза-
виеимой торзионной дистонией из Росссии
Этническая группа Всего семей Семьи с делецией GAG Семьи без делеции GAG
Евреи-ашкеназы 6 6 0
Славяне, в том числе 14 7 7
украинцы 2 1 1
русские 12 6 6
ной мутацией - в некоторых популяциях она определяет все 100% случаев
болезни (у евреев-ашкеназов), в других - около 50% (русские, украинцы).
Для практических целей наличие при заболевании такой мажорной (наи-
более часто встречающейся) мутации имеет большое значение, так как по-
зволяет с большой эффективностью и с меньшими затратами осуществлять
его молекулярную диагностику. В противоположном случае диагностика ка-
ждого нового больного требует, по сути, отдельного научного исследова-
ния - вплоть до секвенирования конкретных участков гена - что на сегод-
няшний день не может быть выполнено в клинических лабораториях.
МИОТОНИЧЕСКАЯ ДИСТРОФИЯ
КАК ПРИМЕР ДИНАМИЧЕСКОЙ МУТАЦИИ
Исследования последнего десятилетия обнаружили, что в некоторых ге-
нах, связанных с развитием наследственных неврологических болезней, име-
ются участки, представляющие собой тандемно организованные триплетные
повторы. В норме число тандемных повторов варьирует в определенных для
каждого гена пределах, однако у каждого человека имеется два варианта та-
ких повторов, полученных им от каждого из родителей. В некоторых случа-
ях по пока еще не ясным причинам происходит резкое увеличение числа по-
второв в том или ином гене, выходящее далеко за пределы его нормальной
вариабельности. Это явление получило название экспансии триплетных по-
второв или динамической мутации и с ним связано развитие того или иного
неврологического заболевания. Впервые этот феномен был обнаружен в
1991 г. при синдроме ломкости Х-хромосомы. В табл. 3 приведены примеры
болезней, связанных с экспансией триплетных повторов. Видно, что последо-
вательность триплетов, участвующих в описываемом явлении, может разли-
чаться - но большая их часть представлена повторами типа CXG, где X - лю-
бой из четырех нуклеотидов. Было показано, что с увеличением размера
блока триплетных повторов тяжесть заболевания обычно возрастает.
Важной особенностью болезней, связанных с экспансией триплетных
повторов, является феномен, называемый антиципацией. Ранее, еще до рас-
шифровки молекулярных основ этой группы болезней, клиницисты замети-
ли, что в семьях в каждом последующем поколении болезнь протекает все
тяжелее. Это явление получило название антиципации. Теперь стали ясны
молекулярные механизмы этого феномена - оказалось, что часто при пере-
даче динамических мутаций по наследству происходит еще большее увели-
чение длины триплетного повтора и это обусловливает утяжеление карти-
ны заболевания.
316
Таблица 3. Характеристика наследственных заболеваний человека, развитие которых
связано с динамическими мутациями
Заболевание Хромосом- ная локали- зация Повторяю- щийся трип- лет Число пов- торов в нор- ме Число пов- торов у больных Автор
Синдром ломкой Х-хромосомы Xq27.3 CCG 6-60 >50 Gusella, 1996
Миотоническая дистрофия 19ql3.2- 19ql3.3 CTG 3-37 >50 Richards, 1997
Спиноцеребел- лярная атаксия (SCA1) 6р22-р23 CAG 6-39 41-81 Nelson, 1993
Хорея Гентинг- тона 4р16.3 CAG 6-37 37-121 Nelson, 1993
Дентаторубро- палидарная атро- фия 12р12 AGC 7-34 54-75 Koide et al., 1994
Спинобульбар- ная мышечная атрофия Xqll-12 AGC 13-30 39-60 Nelson, 1993
Синдром Мача- до-Джозефа (SCA3) 14q32.1 CAG 13-36 68-79 Silveira et al., 1998
Атаксия Фрид- рейха 9ql3-q21.1 GAA 10-21 200-900 Bidichandani et al., 1998
Окологлоточная мышечная ди- строфия 14ql 1 GCG ДО 6 8-13 Brais et al., 1998
Для всех этих синдромов характерно также явление соматического мо-
заицизма, когда в различных тканях одного индивидуума обнаруживаются
различающиеся по длине варианты аллеля с экспансией.
Молекулярные механизмы, с помощью которых происходит экспансия
триплетных повторов, пока не известны. В настоящее время предложено не-
сколько молекулярных моделей экспансии. Все их объединяет представле-
ние о том, что основной причиной этого феномена является проскальзыва-
ние ДНК полимеразы во время репликации или репарации ДНК. Действи-
тельно, последовательности повторов (CTG)n(CAG)n, (CGG)n(CCG)n и
(GAA)n(TTC)n являются гибкими и могут формировать различные структу-
ры (шпильки, внутримолекулярные триплексы и квадриплексы), что может
стать причиной такого проскальзывания (Gellibolian et al., 1997). К числу та-
ких структур в первую очередь относятся двухцепочечные шпильки на лю-
бой из нитей ДНК, которые образуются после расплетания ДНК при репли-
кации или репарации. Возможно образование и более экзотичных струк-
тур - типа триплексов и квадруплексов, когда свободная нить ДНК образу-
ет комплекс с двухцепочечной ДНК или разные нити из двух расплетенных
участков ДНК образуют взаимные дуплексы с формированием четырехце-
почечной структуры. Так, недавно показано, что атаксия Фридрейха связа-
317
на с увеличением размера блока поли-GAA области в интроне. Оказалось,
что последовательность (GAA)n обладает способностью формировать свое-
образную триплексную структуру (Albanese et al., 1998; Gacy et al., 1998;
Djian, 1998; Pearson et al., 1998).
С другой стороны, на стабильность повторов могут оказывать влияние
специфичные ДНК-белковые взаимодействия между повторами и белками,
принимающими участие в процессе репликации - такие белки могут, напри-
мер, регулировать образование шпилечных структур с участием повторов
или повышать стабильность ДНК-дуплексов в области повтора. Нами было
показано в частности, что в клеточных экстрактах из клеток печени присут-
ствуют два белка, взаимодействующих с одноцепочечными олигонуклеоти-
дами типов (CAG)9 и (CTG)9 - причем оба этих белка с большим аффините-
том связываются с повтором (CTG)9 (Сломинский и др.. 1997).
Специфически связывающиеся с (СТС)0-повтором белки выявлены на-
ми также в клеточных экстрактах мозга крысы и ядерных экстрактах из
клеток мозга. Это свидетельствует о том, что связывающиеся с повтором
(CTG)9 белки присутствуют как в пострепликативных клетках нервной сис-
темы, так и в относительно активно делящихся клетках печени. Выявление
таких белков в ядерных экстрактах из клеток мозга говорит о их преимуще-
ственно ядерной локализации - хотя окончательный вывод можно сделать
только после выделения этих белков в частично очищенном виде и получе-
ния к ним антител.
Возможно, что связывающийся с (СТС)9-повтором белок играет роль в
предотвращении образования шпилечных структур в области с триплетными
повторами по аналогии с описанным ранее белком SSBP (белком, связываю-
щимся с любыми одноцепочечными ДНК ) и тем самым подавляет процесс
экспансии. По современным моделям при образовании экспансии в ходе про-
скальзывания при репликации с участием повторов происходит образование
вторичных структур в области репликационной вилки. При этом выявлен-
ный нами белок отличается от белка SSBP, так как связывание с этим бел-
ком (СТС)9-повтора не блокируется одноцепочечными ДНК произвольной
структуры. С другой стороны, присутствие этого белка в неделящихся клет-
ках мозга может косвенно указывать на то, что данный белок может in vivo
образовывать комплексы не только с ДНК, но и с РНК ( например, с (CTG)n-
повтором в 3' нетранслируемой области мРНК миотонин-протеин-киназы) и
тем самым регулировать экспрессию этих генов на уровне транскрипта.
Одним из наиболее ярких примеров динамической мутации является мио-
тоническая дистрофия Россолимо-Куршмана-Штейнерта-Баттена (МД).
МД - аутосомно-доминантное системное заболевание, для которого харак-
терны мышечная слабость, миотония, катаракты, кардиомиопатия, атрофия
гонад и умственная недостаточность при наиболее тяжелых клинических
формах (Наследственные болезни нервной системы, 1998). Частота встреча-
емости данного заболевания составляет 2,2-5,5/100000 в Западной Европе
(Harper, 1989) и 5,5/100000 в Японии (Davies et al., 1992); реже заболевание
проявляется в Юго-Восточной Азии и редко или вообще отсутствует в Юж-
ной и Центральной Африке (описан единственный случай в нигерийской се-
мье (Ashizawa, Epstein, 1991).
Развитие миотонической дистрофии обусловлено увеличением числа
тринуклеотидных CTG повторов в 3' нетранслируемой области гена миото-
318
нин-протеин-киназы (DMPK). Этот ген расположен на хромосоме 19 в обла-
сти ql3.2-ql3.3. У здоровых лип, число тринуклеотидных повторов поли-
морфно и колеблется от 5 до 37 CTG. У больных число повторов превыша-
ет 50 и может достигать двух тысяч и более. Вероятно, ген DMPK является
не единственным геном, на функционирование которого влияет увеличение
области повторов. Экспансия области повторов может вызывать нарушение
работы соседних с ним генов, одним из которых может быть ген белка го-
меодомена, связанного с миотонической дистрофией (DMHAP). Изменение
экспрессии этого гена кажется вполне вероятным, так как гены, кодирую-
щие транскрипционные факторы, обнаружены во всех органах и тканях, за-
трагиваемых при миотонической дистрофии. Кроме того, область CTG-по-
втора совпадает с промотором гена DMHAP, а энхансер для этого гена рас-
положен более дистально, по отношению к области CTG-повтора внутри
большой CpG-области (Klesert et al., 1997). Возможно, увеличение размера
области повторов приводит к конденсации хроматина в области энхансера,
и это препятствует доступу транскрипционных факторов к энхансеру. Про-
грессивное увеличение длины CTG-области приводит к более выраженному
нарушению транскрипции гена DMHAP, тем самым снижая уровень этого
гомеодомен-содержащего белка (Djian, 1998).
С другой стороны, Timchenko и др. была выдвинута оригинальная гипо-
теза, согласно которой причиной развития миотонической дистрофии явля-
ется связывание с областью повторов в белке, специфически распознающем
CUG триплетные повторы в РНК. В результате такого связывания развива-
ется дефицит этого белка (названного ими CUG-BP) в клетке, что нарушает
нормальный процессинг самых разных РНК. Эта гипотеза подтверждается
тем, что гомолог белка CUG-BP у лягушки Xenopus laevis играет важную
роль в процессах регуляции аденилирования и дезаденилирования мРНК.
Для изучения особенности экспансии триплетных повторов при миото-
нической дистрофии нами были проанализированы образцы ДНК больных
миотонической дистрофией и членов их семей, обследованных в Отделении
нейрогенетики Института неврологии РАМН и на Кафедре нервных болез-
ней Уфимского государственного медицинского университета.
Всего было проанализировано 126 человек из семей с миотонической
дистрофией. 69 из них имели клинические проявления, характерные для раз-
ных форм заболевания. У 60 больных удалось обнаружить наличие увели-
ченной зоны CTG-повторов в гене МПК (87% всех исследованных больных).
При этом для определения наличия и размера экспансии был использован
разработанный нами метод, основанный на амплификации области повтора
в гене миотонин-протеин-киназы, на электрофоретическом разделении про-
дуктов амплификации и проведении гибридизации полученных фрагментов
с олигонуклеотидным зондом (CTG)9 по методу Саузерна. В отличие от
обычно используемого метода гибридизации, по Саузерну, с геномной рест-
риктированной ДНК разработанная нами методика позволяет сократить
время выполнения анализа. Кроме этого, резко снижается количество ДНК,
необходимое для проведения анализа, что позволяет использовать микроко-
личества ткани больных.
Большую часть исследованных больных составляли индивидуумы, име-
ющие классическую взрослую форму МД (52 человека). У 2 больных обна-
ружена ранняя детская форма, в 7 случаях встречалась классическая юве-
319
нильная форма, 4 человека имели минимальные проявления МД, у одного из
обследованных имеется врожденная МД. Не было выявлено каких либо за-
кономерностей, позволяющих сделать выводы о связи триплетных повторов
определенной длины с конкретной формой МД. Это может быть обусловле-
но недостаточно большим объемом выборок по отдельным формам, а так-
же большими размерами зоны гибридизации продуктов ПЦР.
На рис. 113,А и Б представлены фрагменты родословных двух семей, в
которых имеются больные миотонической дистрофией. В этих семьях
встречаются пациенты с различными формами заболевания (от полного от-
сутствия клинических симптомов до классической ювенильной формы МД).
На примере родословной на рис. 113, А можно наблюдать увеличение длины
DM-повтора при передаче в ряду поколений. У отца пробанда и его брата
мутантный аллель содержит 160 CTG повторов, в то время как ген МПК
пробанда включает 160-1000 CTG-повторов. На рис. 113, Б приведен фраг-
мент родословной семьи, в которой наблюдается переход от классической
взрослой формы МД к классической ювенильной форме. При этом можно
видеть снижение возраста начала болезни (от 19-50 до 14 лет). У одного из
членов этой родословной выявлена экспансия в гене МПК, но не обнаруже-
но клинических проявлений заболевания (обозначены серой штриховкой).
Возможно, данное явление обусловлено тем, что оба эти пациента на мо-
мент проведения исследования не достигли возраста проявления первых
симптомов МД (20-25 лет). Наличие экспансии в данном случае позволяет
предполагать возможность начала болезни спустя некоторое время, по-
скольку в данной семье имеется четкая аутосомно-доминантная схема насле-
дования и не наблюдается проскоков поколений.
В 3 случаях при наличии клинически выраженной МД не было выявле-
но экспансии при гибридизации продуктов ПЦР с олигонуклеотидным зон-
дом. Все эти больные являются спорадическими и, при проведении исследо-
вания ДНК из образцов крови, полученных от этих пациентов, с использо-
ванием денатурирующего электрофореза было выявлено наличие двух ал-
лелей нормальной длины. Иногда отсутствие удлиненного аллеля при нали-
чии клинических симптомов, характерных для МД, может быть связано с
поражением другого локуса DM-2, картированного на 3-й хромосоме, и при-
водящего к развитию сходного заболевания, названного позднее прокси-
мальная миотоническая миопатия (ПММ) (Ranum et al., 1998; Nestor et aL,
1998). При этом наблюдаемые клинические симптомы сходны с таковыми
при миотонической дистрофии, но при детальном изучении пораженных
групп мышц, а также некоторых патологических симптомов удается обнару-
жить некоторые различия между двумя этими заболеваниями. Кроме того,
нельзя исключать возможности различного толкования клинических симп-
томов (в настоящее время известно достаточно большое количество вари-
антов различных наследственных миодистрофий со сходной симптома-
тикой).
Полученные нами данные позволяют использовать данный метод для
проведения дифференциальной диагностики при наличии клинических симп-
томов, характерных для МД, допускающих спорную трактовку диагноза.
В сочетании с быстрыми методами выделения ДНК данная методика дела-
ет возможным определение наличия/отсутствия экспансии в достаточно ко-
роткие сроки (1-2 дня), что может ускорить процесс постановки диагноза,
320
A
1
Рис. 113. Фрагменты родословных двух семей с клиническими диагнозом миотоническая дис-
трофия
Стрелками указан пробанд. Около каждого члена семьи указана форма МД, генотип и возраст начала за-
болевания. ND-анализ не проводился. Черные фигуры - клинически выраженная миотоническая дистро-
фия. Серые фигуры — экспансия триплетного повтора без клинических проявлений
проведение диагностики на доклинической стадии развития болезни, а так-
же позволит использовать данный метод для пренатальной диагностики
в семьях, отягощенных МД.
Итак, исследование миотонической дистрофии показывает наличие
в ней всех черт, характерных для болезней, связанных с динамическими му-
тациями. Здесь обнаружены и соответствие тяжести заболевания увеличе-
нию числа триплетных повторов, и явление антиципации, обусловленное
тем же увеличением длины повтора при передаче гена в ряду поколений,
'/,11. Проблемы и перспективы...
321
и тканевый мозаицизм, связанный с изменением числа повторов в клетках
разных тканей. Имеются и некоторые молекулярно-генетические особен-
ности, отличающие это заболевание от других заболеваний с динамически-
ми мутациями. Основная из них - это нахождение триплетного повтора в
некодирующей области гена. Таким образом, здесь динамическая мутация
не влияет на структуру белка и не находится под жестким влиянием отбора,
ограничивающим длину экспансии, как в других случаях. По этой причине
величина экспансии при данном заболевании достигает огромных раз-
меров.
В настоящее время активно ведутся исследования по выявлению меха-
низмов экспансии триплетных повторов, и наши данные по обнаружению
белков, взаимодействующих с конкретными вариантами триплетных повто-
ров, вносят определенный вклад в решение этой проблемы.
БОКОВОЙ АМИОТРОФИЧЕСКИЙ СКЛЕРОЗ: ОТ МОНОГЕННОЙ
ПАТОЛОГИИ К МУЛЬТИФАКТОРИАЛЬНЫМ ЗАБОЛЕВАНИЯМ
Рассмотренные выше болезни являются типичными монотонными забо-
леваниями, каждое из которых определяется дефектами одного конкретно-
го гена. В тех случаях, когда в основе заболевания имеются нарушения двух
различных генов (как при торзионной дистонии), то, как правило, и с клини-
ческих позиций внутри заболевания хорошо различимы две группы боль-
ных, в каждой из которых развитие болезни определяется дефектами одно-
го гена.
Боковой амиотрофический склероз (БАС), к рассмотрению которого
мы сейчас приступаем, имеет сложный характер наследования, и даже те
случаи, которые определяются мутациями одного и того же гена, ведут себя
с генетических позиций необычным образом. Как будет видно далее, это за-
болевание может стать ключом к решению сложной проблемы генетиче-
ского анализа мультифакториальных заболеваний, в число которых входят
такие широко распространенные болезни, как ишемическая болезнь сердца,
инфаркт миокарда, инсульт, сахарный диабет и др.
Итак, БАС - хроническое прогрессирующее, клинически и генетически
неоднородное, фатальное заболевание, которое характеризуется признака-
ми поражения центральных и периферических мотонейронов. БАС привле-
кает внимание исследователей уже более 100 лет, с момента открытия его
F. Aran в 1847 г. и клинического описания J. Charcot и A. Joffray в 1869 г.
БАС относится к группе заболеваний, в клинике которых на первый
план выступает синдром поражения мотонейронов (МН). До настоящего
времени не сформированы единые представления об этиопатогенезе БАС,
хотя заболевание является достаточно распространенным (средний уровень
заболеваемости составляет 1-5 случаев на 100 000 человек в год без учета
эндемичных территорий) (Завалишин, Бархатова, 1999). Имеется значи-
тельное число гипотез и фактов, все многообразие которых может быть
сведено к двум большим концепциям:
1) инфекционно-токсической, связанной с влиянием внешних факторов
(вирусы, токсины, тяжелые металлы, дисбаланс макроэлементов окружаю-
щей среды);
322
2) эндогенно-биотрофической, предполагающей генетически обуслов-
ленный дефект метаболизма мотонейронов, приводящий к функциональной
несостоятельности и преждевременному старению двигательной системы.
При этом обе концепции сходятся в том, что непосредственная причина
гибели нейронов головного мозга при БАС связана с феноменом оксидант-
ного стресса, который часто реализуется через эксайтотоксичность
(Hayashi, Yandell, 1993; Spencer et al., 1992).
Последнее явление связано с токсическим воздействием на определен-
ные типы клеток нормальных клеточных метаболитов в условиях повыше-
ния их концентрации или изменения локализации метаболита. При БАС
эксайтотоксичность связывают в основном с действием глутамата и аспар-
тата - основных возбуждающих аминокислот нейронов пирамидного тракта
и интернейронов. У больных БАС повышено содержание этих аминокислот
в синаптической щели в нейронах двигательной коры и мотонейронах пе-
редних рогов спинного мозга, что сопровождается усилением перекисного
окисления липидов с последующим развитием оксидантного стресса (Appel,
1981).
Причиной этого стресса может быть не только эксайтотоксическая ак-
тивация, но и ряд других факторов, в частности, повышение уровня свобод-
ных ионов кальция в нейронах, нарушение процессов окислительного фос-
форилирования в митохондриях, снижение активности антиоксидантной си-
стемы.
Важная роль системы контроля за оксидантным стрессом в патогенезе
БАС была подтверждена при анализе семейных форм БАС. Несмотря на то
что обычно БАС является спорадическим заболеванием, примерно в 10%
случаев БАС представлен семейными случаями. Первые детальные описа-
ния семейных форм БАС были сделаны в 1959 г., когда были выявлены се-
мьи с множественными случаями БАС: в одной из семей заболевание выяв-
лялось в 4 поколениях у 11 человек (Engel et al., 1959). Более поздние наблю-
дения за семейными случаями БАС позволили сделать вывод о преобладаю-
щем аутосомно-доминантном характере наследования заболевания
(Haberlandt, 1961; Husquinet et al., 1980), хотя были выявлены семьи с рецес-
сивным и Х-сцепленным наследованием (Wilkins et al., 1977).
Исходя из аутосомно-доминантного типа наследования БАС, Т. Siddique
и др. (1989) провели анализ сцепления БАС с панелью высокополиморфных
ДНК маркеров, диспергированных по всему геному, в 150 семьях с семейной
формой БАС. При этом было выявлено сцепление с маркерами длинного
плеча хромосомы 21, и в частности, с локусом D21S13. Дальнейшее развитие
этих работ уточнило локализацию гена БАС в области хромосомы 21q22.1-
q22.2. (Siddique et al., 1989). Однако в этой же работе была показана высокая
генетическая гетерогенность семейной формы БАС: по оценкам авторов, с
расположенным на хромосоме 21 геном могло быть связано не более 50%
случаев семейной формы БАС.
В этой области хромосомы 21 был ранее картирован ген медь-цинк-за-
висимой супероксидисмутазы (СОД1). Согласно взглядам на этиопатогенез
БАС, свободнорадикальные процессы могут играть роль в развитии заболе-
вания, и с учетом этого в 1993 г. Розен и др. (Rosen et al., 1993) провели ана-
лиз сцепления между геном СОД1 и семейным БАС. При этом было обна-
ружено крайне тесное сцепление между БАС и СОД1 геном. Это позволило
7,11*
323
авторам сделать вывод о вовлеченности гена СОД1 в патогенез БАС и пе-
рейти к прямому поиску мутаций в этом гене у больных БАС. Ими было
описано первых одиннадцать мутаций в гене СОД1 и была показана косег-
регация этих мутаций с БАС в ряде исследованных семей.
Розен и др. выдвинули две гипотезы о возможных механизмах, связыва-
ющих семейный БАС и мутации в гене СОД1. Согласно первой гипотезе,
мутации ведут к снижению активности фермента и накоплению в клетке то-
ксичных свободнорадикальных соединений. По второй гипотезе мутации,
напротив, активируют СОД1 и тем самым вызывают повышение уровня пе-
рекисных соединений и образование токсичных ОН-радикалов. Последняя
гипотеза нашла свое подтверждение в работах Gurney и др. (Gurney et al.,
1994). Ими были получены трансгенные мыши, содержащие в геноме ген
СОД1 человека, и показано, что усиленная экспрессия гена СОД1 у таких
мышей приводит к специфичным поражениям мотонейронов, особенно в
области аксонов. При этом активно экспрессирующаяся мутантная форма
СОД1 может обладать доминантно-негативным эффектом в отношении
фермента дикого типа, что может объяснить доминантное наследование
миссенс-мутаций в гене СОД1 — основного типа мутаций при семейном БАС
с мутациями в гене СОД1. Точку зрения на активацию СОД1 при вызываю-
щих БАС мутациях подтверждают данные Pardo и др. по анализу распреде-
ления фермента в разных типах нейронов у здоровых лиц и у больных БАС.
При этом у больных было обнаружено селективное накопление СОД1 в мо-
тонейронах, но не в нейронах других типов (Pardo et al„ 1995).
Однако свое экспериментальное подтверждение нашла и гипотеза о сни-
жении активности СОД1 в результате мутаций в одноименном гене как при-
чине БАС. В опытах по ингибированию активности фермента антисмысло-
выми олигонуклеотидами к мРНК СОД1 было показано, что хроническая
недостаточность СОД1 приводит к гибели в результате апоптоза нейронов
спинного мозга и в том числе мотонейронов (Rothstein et al., 1994).
Таким образом, нельзя считать окончательно решенным вопрос о том, к
какому эффекту приводят вызывающие БАС мутации в гене СОД1 - акти-
вации или инактивации фермента. Один из возможных путей ответа на этот
вопрос связан с дальнейшим изучением вызывающих БАС мутаций в гене
СОД1 и возможной дальнейшей биохимической характеристикой этих мута-
ций. Неясно также, насколько велика роль генетических факторов - в част-
ности мутаций в гене СОД1 - в патогенезе спорадической формы БАС.
Для изучения молекулярных причин заболевания в нашей стране нами
были начаты совместные исследования с кафедрой неврологии Московско-
го медицинского университета (зав. кафедрой - профессор В.И Скворцова).
Был проведен поиск мутаций в кодирующей области гена СОД1 у больных
со спорадической формой БАС из России. Всего было проанализировано
42 больных, у которых в двух случаях при помощи SSCP и прямого секвени-
рования экзонов с измененной подвижностью была выявлена миссенс-мута-
ция D90A (Асп90Ала). При этом один больной оказался гомозиготным но-
сителем мутации D90A, тогда как второй был гетерозиготен по данной му-
тации.
Мутация ранее уже была описана при БАС и она достаточно часто
встречается у европейцев. Анализ больных с данной мутацией обнаружил ее
необычные свойства, главное из которых состоит в том, что характер насле-
324
дования БАС при этой мутации различен в разных популяциях. В южных и
центральных областях Европы при мутации D90A БАС наследуется как ау-
тосомно-доминантное заболевание и все больные оказываются гетерозиго-
тами. В Северной Европе (Швеция, Финляндия) выявлен другой тип насле-
дования БАС при той же мутации, а именно - аутосомно-рецессивный. Здесь
больными оказываются только гомозиготы по мутации D90A, а у гетерози-
гот болезнь не развивалась, и ее носители оказывались практически здоро-
выми. Интересно, что данный типа БАС, связанный с гомозиготностью по
мутации D90A, имеет более мягкое клиническое течение, чем у гетерозигот
по мутации D90A в других популяциях. Только в двух странах - в России и
Франции - выявлены оба типа наследования БАС при мутации D90A.
Таким образом, эта мутация ведет себя в разных случаях то как рецес-
сивная, то как доминантная мутация - причем не ясно, чем определяется та-
кой разный тип наследования БАС у больных с одной и той же аминокис-
лотной заменой. Было выдвинуто предположение, что это связано с други-
ми особенностями гена БАС - например, со структурной организацией про-
мотора и соответственно с разным уровнем экспрессии мутантной СОД1.
Это подтверждается данными Al-Chalabi и др. (Al-Chalabi et al., 1998) о том,
что эта мутация в доминантном и рецессивном состоянии ассоциирована с
разными полиморфными гаплотипами гена СОД1. В связи с этим значитель-
ный интерес представляет анализ ассоциированных с этой мутацией гапло-
типов гена СОД1 у выявленных нами больных.
В обоих случаях выявлены признаки поражения периферических и цен-
тральных мотонейронов на уровне поясничного и шейного утолщений с вос-
ходящим типом распространения. Однако у первого больного, несмотря на
гомозиготность по мутации в 90 кодоне, заболевание медленно прогрессиру-
ет в течение 18 лет при сравнительно раннем возрасте начала развития
БАС (49 лет). У гетерозиготного по данной мутации больного заболевание
началось позднее - в возрасте 55 лет - но характеризуется очень быстрым
прогрессированием. Таким образом, развитие заболевания определяется не
только характером мутации в гене СОД1: возможно действие различных ге-
нетических и эпигенетических факторов, влияющих на возраст начала забо-
левания и на скорость его прогрессирования.
Было интересно также провести анализ частоты встречаемости мутации
D90A в различных популяциях России - так как появление рецессивной
формы мутации D90A может отражать варяжский компонент в современ-
ном генетическом пуле населения России. К настоящему моменту проанали-
зировано пять популяций - якутская (75 человек), популяция калмыков
(75 человек), русские из Архангельской, Новгородской и Курской областей
в количестве 49, 50, 75 человек соответственно. В результате проведенных
исследований мутация D90A обнаружена в гетерозиготном состоянии толь-
ко у одного человека из Новгородской области. С учетом имеющихся исто-
рических данных можно предположить возможность проникновения данной
мутации в русский генофонд за счет потока генов со стороны Скандинавско-
го полуострова. При этом мутация D90A является в русской популяции ред-
кой - исходя из численности выборок, можно считать, что частота данной
мутации в исследованных популяциях не превышает 1%. Для более точной
оценки требуются увеличение размера выборок и получение нового матери-
ала для исследований - особенно из различных регионов северной и северо-
325
западной России, основных областей варяжского и шведского влияния по ис-
торическим данным.
Кроме гена СОД1 в развитии БАС может быть задействован и ряд дру-
гих генов. Например, при БАС имеют место аномальные скопления нейро-
филаментов в проксимальных аксонах и клеточных телах мотонейронов.
В исследованиях на трансгенных мышах с толковыми мутациями в гене ней-
рофиламента, приводящими к повышенной экспрессии белка, и на мышах,
трансгенных по мутантному гену СОД1, было выявлено развитие патологии
мотонейронов с аккумуляцией в нейронах нейрофиламентов (Julien, Cote,
1995; Gurney et al., 1994; Trocoso et al., 1992; Xu et al., 1993). Эти данные поз-
волили предположить, что нейрофиламенты могут играть либо прямую
роль в развитии нейродегенеративных патологий, либо аккумулироваться
вторично в результате различных механизмов смерти клетки. Таким обра-
зом, гены нейрофиламентов, по-видимому, являются генами-кандидатами
для поиска в них мутаций, связанных с развитием БАС.
Существует три субъединицы нейрофиламентов, разделенных по моле-
кулярной массе: легкая (НФЛ), средняя (НФС) и тяжелая (НФТ). Особый
интерес представляет тяжелая цепь НФТ, которая содержит в хвостовом до-
мене повторяющийся мотив Х-лизин-серин-пролин-У-лизин (XKSPYK), где
X - единственная аминокислота, а Y - блок из одной-трех аминокислот.
Этот домен НФТ отвечает за взаимодействие с микротрубочками, ассоции-
рованными с ними белками и аксональными белками-транспортерами.
В связи с этим нарушение структуры хвостового домена НФТ может изме-
нять структуру всего комплекса цитоскелета аксонов и тем самым влиять на
функционирование как аксона, так и нейрона в целом. Это подтверждается
выявлением патологически значимых мутаций в гене НФТ — хотя эти мута-
ции и являются очень редкими (Al-Chalabi et al., 1999; Lees et al., 1998)
В норме у человека обнаружены два аллельных варианта НФТ-цепи
с 44 и 43 повторами XKSPYK, которые обозначаются соответственно как
длинный (L) и короткий (S) аллели. В связи с этим было выдвинуто предпо-
ложение о том, что этот нормальный полиморфизм может влиять на риск
развития БДН. Для проверки этой гипотезы был проведен анализ встреча-
емости L- и S-аллелей у больных БАС из России. Результаты представлены
в табл. 4. Как видно из таблицы, аллели L и S встречаются в обеих выбор-
ках. Частота этих аллелей в контрольной выборке и у больных практически
не различается. Но в то же время обнаружена существенная разница между
представленностью генотипов SS в контрольной выборке и у больных
БАС - генотипы SS преобладают у больных и могут рассматриваться как
фактор риска развития БАС. Обнаруженные отличия между двумя выбор-
ками являются статистически достоверными (%2= 6,95 и Р < 0,05). Таким об
разом, полученные нами данные противоречат данным, полученным при
сравнении частоты S и L у больных БАС и здоровых лиц из Скандинавии и
Великобритании. В этих популяциях не было выявлено какой-либо стати-
стически достоверной ассоциации между L- или S-аллелем и развитием забо-
левания (Al-Chalabi, 1999).
Таким образом, в популяции России развитие БАС обусловлено как ми-
нимум двумя генетическими системами - геном СОД1 и геном тяжелых це-
пей нейрофиламентов. Но, очевидно, роль генома в развитии БДН не огра-
ничена этими генами, и дальнейший анализ позволит выявить еще ряд свя-
326
Таблица 4. Частота встречаемости генотипов LL, LS и SS у больных БАС
и в контрольной популяции
Генотип Больные БАС Контроль
Количество Частота, % Количество Частота, %
LL 12 33 14 31
LS 16 45 28 62
SS 8 22 3 7
L-аллель 40 55 56 62
S-аллель 32 44 34 38
занных с поражением мотонейронов генов. При этом имеет место сочетание
чисто моногенных случаев (например, БАС в результате мутаций в гене
СОДГ) с клинически неотличимыми случаями БАС в результате взаимодей-
ствия генетических факторов (например, генотип SS по гену тяжелых цепей
нейрофиламентов) с факторами внешней среды.
РАЗРАБОТКА ПОДХОДОВ
К МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОМУ АНАЛИЗУ
ФАКТОРОВ РИСКА
РАЗВИТИЯ МУЛЬТИФАКТОРИАЛЬНЫХ ЗАБОЛЕВАНИЙ
Как уже говорилось выше, на данном этапе достигнуты большие успехи
в понимании молекулярных механизмов многих наследственных заболева-
ний человека, особенно имеющих простой менделевский характер наследо-
вания. Знание этих механизмов является основой для изучения сложных
признаков, в том числе полигенных и мультифакториальных заболеваний,
к которым относятся атеросклероз, гипертония, диабет, полиметаболиче-
ский синдром, рак и др. Для этих заболеваний характерна высокая слож-
ность взаимодействия между генотипом и фенотипом. Это связано с тем, что
данному классу фенотипических признаков присущи сложный характер на-
следования, большое количество генов, непосредственно вовлеченных в па-
тогенез, и выраженное влияние на ход патологического процесса эпигенети-
ческих факторов и условий окружающей среды. Необходимо отметить, что
генетическую структуру можно рассматривать либо как фактор, увеличива-
ющий риск развития болезни, либо как фактор, снижающий восприимчи-
вость к заболеванию. В связи с этим возникает очень много проблем при
изучении механизмов развития болезней, и в каждом случае перед исследо-
вателем стоит сложная задача подбора адекватных методов исследования
конкретного заболевания (Ghosh, Collins, 1996; Summers, 1996). Одним из ва-
риантов подхода может быть выделение группы генов с потенциально наи-
большим вкладом в клиническую картину заболевания на основании уже
имеющихся представлений о его патогенезе. Нами ведутся работы по анали-
зу молекулярно-генетических факторов риска развития сердечно-сосуди-
стых заболеваний и сахарного диабета типа II. Для этих заболеваний такими
интересными, с точки зрения их клинической картины, генами в первую
очередь являются гены белков, регулирующих кровяное давление и сосуди-
327
стый гомеостаз, гены белков углеводного обмена и обмена инсулина, гены
липидного обмена.
Одним из наиболее интересных, с точки зрения развития сердечно-сосу-
дистых заболеваний, является изучение роли генов ренин-ангиотензиновой
системы.
Ренин-ангиотензиновая система (РАС) филогенетически является ста-
рейшей системой регуляции кровяного давления, жидкостного и электроли-
тического гомеостазов. При активации данной системы в организме проис-
ходят следующие процессы. Определенные клетки клубочкового аппарата
почек секретируют гликопротеид-ренин, который высвобождается из этих
клеток в ответ на снижение концентрации Na+ в плазме или понижение дав-
ления крови в просвете приносящей артриолы. Там он действует на ангио-
тензиноген - гликопротеин, синтезируемый в печени и циркулирующий в
плазме крови.
Ренин расщепляет в молекуле ангиотензина связь между двумя остатка-
ми лейцина, освобождая декапептид ангиотензин-1. Затем ангиотензин-пре-
вращаюший фермент (АПФ) отщепляет еще два аминокислотных остатка,
превращая его в активный ангиотензин-П. Пептиды группы ангиотензина
участвуют в регуляции не только уровня артериального давления и сопря-
женных процессов почечной фильтрации и водно-солевого обмена, но так-
же и в репродуктивной функции, многих процессах генерализованного ха-
рактера (стресс, алкогольная мотивация, агрессивное поведение). Ангио-
тензин участвует в синтезе или выбросе в кровь ряда других физиологиче-
ски активных соединений - гормонов, низкомолекулярных медиаторов (ка-
техоламины, серотонин), чем в значительной мере объясняется широкий
спектр физиологических функций этих субстанций. Исследования послед-
него времени уделяют внимание молекулярным аспектам рецепторов ангио-
тензина II. Физиологические эффекты ангиотензина II (АНГ-П) осуществ-
ляются при участии рецепторов ATI и АТ2. Их тканевая локализация
(в регионах мозга и периферических тканях) определяют особенности фи-
зиологических реакций А-П и его функциональное взаимодействие с други-
ми пептидами. Распределение ATI и АТ2 типов рецепторов АНГ-П в отде-
лах мозга человека оказывается отличным от такового для других млеко-
питающих.
Ангиотензин-превращающий фермент (АПФ) - один из важнейших
компонентов ренин-ангиотензиновой системы, осуществляющий конвер-
сию ангиотензина-I в ангиотензин-П, который в свою очередь является од-
ним из сосудосуживающих соединений. Кроме того, АПФ осуществляет
инактивацию брадикинина до неактивных метаболитов. Брадикинин же яв-
ляется одним из стимуляторов выделения эндотелием NO - основного эндо-
телиального фактора снижения тонуса сосудистой стенки. Таким образом,
АПФ является одним из ключевых звеньев поддержания равновесия между
факторами, вызывающими сужение или увеличение просвета сосудов, и,
следовательно, регуляции сосудистого тонуса. Хотя АПФ изучается преи-
мущественно как один из составных элементов регуляции кровянного дав-
ления, он также имеет множество других физиологических функций
(рис. 114).
У здоровых людей уровень АПФ в плазме может иметь значительные
межиндивидуальные различия, однако, с другой стороны, изменения данно-
328
Рис. 114. Ренин-ангнотензиновая система и ее основные физиологические эффекты
го показателя у одного индивидуума незначительны. Камбьен с соавт.
(Cambien et al., 1988) изучали уровень АПФ в 87 здоровых семьях. Средний
уровень был 34,1, 30,7 и 43,1 у отцов, матерей и детей соответственно. Не
было обнаружено корреляции с возрастом, ростом, весом или уровнем кро-
вяного давления у родителей, но у детей была обнаружена отрицательная
корреляция с возрастом. После того как был клонирован ген АПФ, было
высказано предположение, что индивидуальные различия уровня АПФ по
крайней мере частично определяются инсерционно-делеционным полимор-
физмом Alu повтора в 16 интроне гена АПФ. Cambien et al. (1985) описали се-
мью, в которой аномальное повышение уровня АПФ в плазме крови пере-
давалось как аутосомно-доминантный признак. Значение этого показателя
были намного выше, чем описанные в 87 здоровых семьях (Cambien et al.,
1988).
Анализ уровня АПФ в плазме крови у лиц с разными генотипами по этой
инсерции Alu-повтора показал, что гомозиготы по D-аллелю обладают мак-
симальной активностью АПФ (Tiret et al., 1992; Jeffeiy et al., 1999). Механизм
действия данного полиморфизма на уровень синтеза АПФ не ясен. Инсерция
Alu-последовательности не влияет на уровень синтеза мРНК АПФ. Возмож-
12. Проблемы и перспективы...
329
но, она влияет на стабильность мРНК АПФ или ее трансляционную актив-
ность (Hunley et al., 1996). С другой стороны, этот полиморфизм может быть
маркером для другой тесно сцепленной последовательности, которая снижа-
ет экспрессию этого гена (Tiret et al., 1994).
Эти данные достаточны для того, чтобы определить эффект этого поли-
морфизма на уровень АПФ в эндотелиальной ткани - экспрессия гена АПФ
выше у лиц, имеющих генотип DD, и лишь недавно был показан доминант-
ный эффект аллеля D в экспрессии этого гена в почках (Miruiri et al., 1997).
Исходя из предполагаемой центральной роли АПФ в регуляции сосудис-
того тонуса и общего состояния системы циркуляции крови и роли генети-
ческих факторов в определении уровня АПФ в плазме, были начаты иссле-
дования роли полиморфизма гена АПФ в различных патологических про-
цессах - гипертонии, гипертрофии миокарда, диабетической нефропатии,
инфаркте миокарда, ишемической болезни сердца и т.д.
Другим важным элементом РАС является ген ангиотензиногена. Имеют-
ся данные, что уровень ангиотензиногена в плазме ассоциирован с уровнем
кровяного давления и у больных наблюдали повышение кровяного давления
при инъекции ангиотензиногена ((Walker et al., 1979; Menard et al., 1991). При
использовании моделей с трансгенными животными также было выявлено
влияние различных генотипов и повышенного уровня экспрессии гена ангио-
тензиногена на кровяное давление (Kimura et al., 1992; Yang et al., 1994).
В процессе изучения гена ангиотензиногена обнаружено более 15 точ-
ковых мутаций, большая часть которых приводит к аминокислотным заме-
нам (Hixson, Powers, 1995; Kamitani et al., 1995). Было проведено большое
количество работ по анализу связи между этими мутациями и сердечно-со-
судистыми заболеваниями. Наиболее широко исследовались варианты, свя-
занные с аминокислотными заменами М235Т ( Мет235—>Тре) и Т174М
(Тре174—>Мет). Для Т174М полиморфизма установлено наличие ассоциа-
ции между 174М аллелем и уровнем систолического кровяного давления
у франко-канадцев (Hegele et al., 1996), однако в других популяциях показа-
но отсутствие такой ассоциации с гипертонией (Kamitani et al., 1995; Rutledge
et al., 1994), а также с инфарктом миокарда (Jeunemaitre et al., 1992) и диабе-
тической нейропатией (Tarnow et al., 1996). При анализе M235T поли-
морфизма гена ангиотензиногена была показана строгая корреляция меж-
ду 235Т аллелем и разнообразными формами гипертонии, преимуществен-
но, в европейских популяциях и у японцев (Iwai et al., 1995; Kamitani et al.,
1995).
В последнем нетранслируемом 3' экзоне гена ангиотензиногена обнару-
жен динуклеотидный повтор (СА)П, который может также быть использо-
ван в качестве генетического маркера при изучении роли гена ангиотензи-
ногена в патогенезе ИБС и родственных ИБС заболеваний. Этот микроса-
теллит был охарактеризован во французской популяции и выявлено 13 ал-
лельных вариантов повтора (гетерозиготность 75%) (Kotelevtsev et al., 1991).
Было обнаружено строгое неравновесное сцепление между аллельным ва-
риантом с 16 повторами и аллелем М235 (Kamitani et al 1995). Таким обра-
зом, в этой популяции полиморфизм (СА)п-повтора можно рассматривать
как дополнительный к М235Т-полиморфизму генетический фактор, анализ
которого позволит лучше понять роль полиморфизма М235Т в развитии па-
тологических процессов.
330
Таблица 5. Сравнительный анализ частоты генотипов и аллельных вариантов
инсерционно-делеционного полиморфизма гена АПФ
Аллели Генотипы
I D II ID DD
Контроль 27,38 72,62 7,14 40,48 52,38 Больные 46,07 53,93 22,47 48,31 29,22 ИНСД Примечание. Курсивом выделены значения, имеющие статистически значимые отличия от контрольной группы.
Нами был проведен анализ ассоциации с развитием некоторых мульти-
факториальных заболеваний в популяции России трех из выше описанных
полиморфных сайтов - инсерционно-делеционного полиморфизма гена
АПФ, точковой замены М235Т и микросателлитного полиморфизма гена
ангиотензиногена.
Были проанализированы группы здоровых индивидуумов и больных
полиметаболическим синдромом (ПМС), инсулин-независимым сахарным
диабетом (ИНСД) и ишемической болезнью сердца из различных регионов
России.
Для изучения влияний гена АПФ на уровень кровяного давления иссле-
довалась выборка из якутской популяции. Были выделены 3 подгруппы, в
соответствии с определенным генотипом по гену АПФ и для каждой под-
группы были вычислены средние значения систолического, диастолическо-
го и пульсового давления. Не обнаружено достоверно значимых различий
между средним значением давления для групп с различными генотипами при
анализе полиморфизмов генов АПФ и ангиотензиногена. Отличия также не
были обнаружены и при проведении анализа уровня кровяного давления в
разделенных по половому признаку группах. Таким образом, данный поли-
морфизм не оказывает влияния на уровень кровяного давления в изучаемых
группах (табл. 5).
На следующем этапе было оценено влияние данного полиморфизма на
риск возникновения ИНСД в различных популяциях. Была проанализирована
группа больных ИНСД в количестве 89 человек, клинически охарактеризо-
ванная в Чебоксарском государственном медицинском институте. Степень по-
ражения сосудов оценивалась в баллах, где 0 соответствует отсутствию пора-
жения, а 4 - максимальной выраженности атеросклероза сосудов. При срав-
нении случайной выборки из Чувашии и больных ИНСД наблюдается сниже-
ние частоты DD-генотипа (%2 = 6,66, Р = 0,01) и увеличение частоты /-аллеля
(%2 = 7,82, Р = 0.005), что может косвенно свидетельствовать о протекционной
роли D-аллеля при возникновении ИНСД. Ранее в популяции китайцев Тайва-
ня не было выявлено ассоциации между риском развития ИНСД и I/D поли-
морфизмом гена АПФ (Chuang et al., 1997), а в популяции Швеции были полу-
чены противоположные данные - аллель D в этой популяции ассоциирован с
повышенным риском развития ИНСД (но только у лиц с гипертонией).
Таким образом, выявлено популяционно-специфичное влияние поли-
морфизма гена АПФ на риск развития ИНСД. В изучаемой нами популяции
12*
331
Таблица 6. Средний балл оценки ангиопатий для различных генотипов
Поражение сосу- дов нижних ко- нечностей Диабетическая ретинопатия Диабетическая нефропатия Суммарная оцен- ка
II 1,94 1,89 3,11 Р94
ID 2,10 1,93 3,08 7,11
DD 2,31 2,00 3,38 7,69
Значение t-крите- рия Сгьюдента 4,03 0,98 1,46 2,49
при сравнении групп II и DD
Примечание. Курсивом выделены величины, имеющие статистически значимые отличия от
контрольной группы
аллель D является протективным фактором, хотя механизм этого влияния
не ясен. Возможно, что оно обусловлено отличиями в гемодинамике у лиц с
разными генотипами по гену АПФ.
Для анализа возможной взаимосвязи инсерционно-делеционного поли-
морфизма АПФ с сосудистыми осложнениями (ангиопатиями) при диабете
на следующем этапе был проведен более детальный анализ этого поли-
морфизма в группе больных ИНСД с учетом выраженности у них сосуди-
стых осложнений, таких ретинопатия, нефропатия и поражение сосудов
нижних конечностей. Для этого группа больных ИНСД была разделена
на три подгруппы в зависимости от определенных генотипов (табл. 6).
Наблюдаются значимые различия в оценке тяжести ангиопатий в целом
(t = 4,82, Р = 0,13). Эти отличия обусловлены главным образом разной сте-
пенью поражения сосудов нижних конечностей (t = 12,8, Р = 0,05) — тяжесть
поражения сосудов почек или сетчатки у лиц с разными генотипами по ге-
ну АПФ не отличается. Таким образом, наблюдается избирательное пора-
жение сосудов, и наибольшее влияние DD-генотип оказывает на состояние
сосудов и/или гемодинамику нижних конечностей. Отсутствие ассоциаций
между DD-генотипом, ретинопатией и нефропатией при ИНСД была про-
демонстрирована рядом авторов (Nagi et al., 1995; Doi et al., 1996, Grzeszczak
et al., 1998; Gutierrez et aL, 1997) и подтверждается в нашей работе. В то же
время нам не удалось найти данных, относящихся к поражению сосудов
нижних конечностей, хотя это является достаточно частой патологией при
ИНСД. Таким образом, DD-генотип является независимо ассоциирован-
ным с данным осложнением при ИНСД и может потенциально использо-
ваться как маркер для выявления предрасположенности к нему у лиц с
ИНСД.
Суммируя сказанное выше, ген АПФ ведет себя двояким образом. С од-
ной стороны, делеционный аллель гена АПФ понижает риск возникновения
ИНСД. С другой стороны, при уже сформировавшемся ИНСД, данный ал-
лель ассоциирован с более тяжелым клиническим течением ИНСД с боль-
шей выраженностью сосудистых осложнений.
В литературе наблюдается расхождение мнений по поводу значимости
инсерционно-делеционного полиморфизма гена АПФ в развитии ИБС,
ИНСД и их сосудистых осложнений. Большинство авторов склоняются к
332
Таблица 7. Распределение частот и генотипов в различных возрастных группах
Аллели Генотипы
I D 11 ID DD
Дети 0,52 0,48 0,36 0.32 0,32 Молодые люди 0,44 0,56 0,24 0,40 0,36 Средний возраст 0,38 0,62 0,13 0,50 0,37 Пожилые люди 0,32 0.68 0.14 0,36 0,50 Примечание. Курсивом выделены величины, имеющие статистически значимые отличия от группы детей.
мнению, что имеется связь между DD-генотипом гена АПФ и этими заболе-
ваниями, но другие исследователи данной связи не обнаруживают. Возмож-
но, в данном случае имеют значение этно-демографические характеристики
изучаемых популяций и в обследованных нами выборках именно I-аллель и
И-генотип оказываются факторами риска.
По крайней мере, частично эти отличия могут быть объяснены возраст-
ной динамикой полиморфизма гена АПФ и изменением частоты I- и D-алле-
лей с возрастом. Для того чтобы определить влияние среднего возраста в
группе на распределения частот аллелей и генотипов, было проведено сле-
дующее исследование. В четырех возрастных группах (менее 10 лет,
30-40 лет, 50-60 лет, более 80 лет) были установлены средние частоты ал-
лелей и генотипов. Полученные результаты приведены в табл. 7. При уве-
личении среднего возраста групп наблюдается тенденция увеличения часто-
ты D-аллеля и DD-генотипа и снижения частоты П-генотипа. При этом дос-
товерно значимые отличия получены при сравнении аллельного спектра
двух крайних возрастных групп (%2 = 4,8) и П-генотипа при сравнении груп-
пы детей и 2 группы (%2 = 5,6).
Основываясь на полученных результатах, можно по-новому взглянуть
на результаты, полученные M.L. Hibberd (Hibberd et al., 1997). Им было по-
казано, что частота П-генотипа достоверно снижается у лиц с инсулин-зави-
симым сахарным диабетом с увеличением продолжительности заболевания.
Возможно, что это снижение отражает именно возрастную динамику П-ге-
нотипа и не связано с сахарным диабетом - в детском возрасте изменение
частоты П-генотипа происходит наиболее быстро. В работе М. Pfohl (Pfohl
et al., 1998) была получена ассоциация между возникновением микроальбу-
минурии и нефропатии и DD-генотипом, и он обосновывает это также про-
должительностью заболевания - частота DD-генотипа выше у лиц с боль-
шей продолжительностью заболевания.
Исходя из этого, при подборе групп для ассоциативных исследований,
необходимо принимать во внимание не только этнический состав групп, но
также учитывать их возрастную структуру.
В гене ангиотензиногена были проанализированы 2 полиморфных сай-
та - аминокислотная замена М235Т в кодирующей области и (СА)-полимор-
физм в 3' нетранслируемом экзоне.
Анализ М235Т полиморфизма не выявил различий в распределении ча-
стот аллелей и генотипов при сравнении контрольной группы и групп боль-
333
пых ИБС и ИНСД и, по-видимому, данный полиморфизм не оказывает вли-
яния на риск развития ИНСД и ПМС в московской популяции.
В случае полиморфизма, связанного с числом СА-повторов, наиболее
часто у больных встречались аллели с 16 и 14 СА-повторами. В контроль-
ной группе более частыми были аллели с 16-19 повторами. Распределение
аллельного спектра приведено на рис. 115. Наблюдаемый сдвиг спектра ал-
лельных вариантов гена ангиотензиногена в сторону уменьшения числа по-
второв у больных всех групп (полиметаболический синдром, ишемическая
болезнь сердца, сахарный диабет типа 2) указывает на то, что изучаемый по-
лиморфизм данного гена может играть определенную роль в развитии всех
этих заболеваний.
Для оценки значимости такой тенденции аллели были объединены в 2
группы - S-группа, содержащая аллели с числом повторов до 16 включи-
тельно, и L-группа, с числом повторов более 16 - и было проведено сопос-
тавление частоты генотипов по S/L-аллелям у больных разных групп и в
случайной выборке. При этом было обнаружено, что происходит статисти-
чески значимое перераспределение генотипов в сторону увеличения гомози-
гот по коротким аллелям во всех группах больных. Возможно, что микроса-
теллит может быть вовлечен в патогенез ИБС и ПМС, так как он располо-
жен в последнем нетранслируемом 3' экзоне гена ангиотензиногена. Можно
предположить, что уменьшение количества повторов на 3' конце транскри-
бируемой РНК может приводить к изменению ее стабильности, а значит и к
изменению уровня ангиотензиногена в плазме крови.
Таким образом, ренин-ангитензиновая система, как следует из ассоциа-
тивных исследований, играет важную роль в процессах развития сердечно-
сосудистой патологии. Однако полученные данные необходимо подтвердить
с использованием других генетических подходов - таких как сибсовые мето-
ды анализа мультифакториальной патологии.
ЭТНОГЕНОМИКА И ПОЛИМОРФИЗМ ДНК
В РАЗЛИЧНЫХ ПОПУЛЯЦИЯХ РОССИИ
Другим направлением наших исследований, которое тесно связано с пре-
дыдущим, является изучение геномного разнообразия в популяциях, населя-
ющих Россию. Вопросы эволюции популяций человека, их происхождения,
родства и исторического развития всегда были в центре внимания науки о
человеке.
Подлинный переворот в такого рода исследованиях произошел в связи с
появлением нового инструмента в виде огромного числа полиморфных мар-
керов ДНК разного типа и значимости. Это - однонуклеотидные замены,
инсерционно-делеционный полиморфизм, полиморфные мини- и микроса-
теллиты. Однако на современном этапе необходима подробная характери-
стика как отдельных маркеров, так и их групп для того чтобы в дальнейшем
осознанно их использовать для конкретных целей, для получения ответов на
вопросы, связанные с различными временными и пространственными пара-
метрами. Далее мы рассмотрим в качестве примеров конкретные поли-
морфные локусы, относящиеся к различным типам, а также продемонстри
руем возможности, которые открываются при их суммарном использовании
для анализа генофонда и закономерности его изменчивости.
334
ИНСЕРЦИОННО-ДЕЛЕЦИОННЫЙ ПОЛИМОРФИЗМ
ГЕНА РЕЦЕПТОРА ХЕМОКИНОВ CCR5
Инсерционно-делеционный полиморфизм в гене рецептора хемокинов
CCR5 может служить примером диаллельного полиморфизма ДНК. Извест-
но, что рецептор хемокинов CCR5 является также корецептором для макро-
фаготропных штаммов вируса иммунодефицита человека ВИЧ-1, т.е. ис-
пользуется данным типом вируса для проникновения в клетки. Ген рецепто-
ра CCR5 (обозначаемый CMKBR5), локализован в регионе р.21.3 хромосо-
мы 3. В 1996 г. в гене обнаружена делеция 32 пар нуклеотидов в том сегмен-
те, который кодирует вторую экстрацелюлярную петлю рецептора CCR5.
Данная делеция, по-видимому, препятствует взаимодействию рецептора с
вирусом и тем самым определяет устойчивость к инфекции вирусом ВИЧ-1.
При этом люди, гомозиготные по этой делеции, не могут заболеть
СПИД, связанным с ВИЧ-1-инфекцией, даже если они входят в группы вы-
сокого риска. Мутантный аллель обнаружен с частотой от 2 до 15% (в сред-
нем 9%) в европейских популяциях и у белых американцев, тогда как в по-
пуляциях коренного населения Африки и Японии он выявлен не был (Dean
et al., 1996; Martinson et al., 1997). У обследованных аборигенов Азиатского
континента делеция наблюдалась значительно реже, чем в Европе, - ее ча-
стота в отдельных популяциях не превышала 5%, а в большинстве популя-
ций она отсутствовала (Martinson et al., 1997). Таким образом, было обнару-
жено важное свойство этого полиморфизма - расово-диагностическое, так
как встречаемость аллельных вариантов маркера существенно различается
в популяциях разных рас.
В изученных популяциях стран СНГ частота аллеля CCR5A32 колеба-
лась в широких пределах: от 3-8,5% в пяти азиатских популяциях (тувинцы,
уйгуры, азербайджанцы, казахи, узбеки) до 12-14% в популяциях татар,
русских и белорусов (Асеев и др., 1997; Сломинский и др., 1997). На рис. 116
представлено распределение частоты этой делеции в географическом про-
странстве. В популяциях Волго-Уральского региона частота гетерозигот
варьировала в широких пределах: от 4,35% у северо-восточных башкир до
26,88% у татар.
Гомозиготный генотип по мутантному аллелю был обнаружен только у
одного индивидуума из удмуртской популяции. В Волго-Уральском регионе
наименьшие частоты аллеля CCR5A32 были обнаружены в северо-восточ-
ной и юго-восточной этногеографических группах башкир (2,17% и 2,50%,
соответственно). В популяции башкир в целом она также была низкой -
3,66%. Максимальная частота аллеля наблюдалась в популяции татар
(13,44%), относящейся, как и башкирская популяция, к тюркской ветви ал-
тайской языковой семьи. В среднем в Волго-Уральском регионе частота де-
леции составила 7,02% (Галеева и др., 1998). На рис. 116 видно, что очаги с
максимальной частотой расположены в северной и восточной частях Евро-
пы. Появление на севере Европы очагов со значительным накоплением му-
тантных генов неожиданно - ведь европейское население с вирусом СПИД
ранее не сталкивалось. Можно предположить, что иные инфекционные
агенты также используют рецептор CCR5 для проникновения в клетки.
В этом случае отбор мог привести к накоплению данной мутации в очагах
распространения инфекции. В любом случае наличие или отсутствие деле-
335
Таблица 8. Коэффициенты корреляции частот аллеля CCR5A32 с климато-геогра-
фическими параметрами
Номер параметра Климатические параметры Коэффициен- ты ранговой корреляции (в соответствии со Спирманом) Коэффициен- ты частной корреляции Без темпера- турных пара- метров (номер параметра)
Температурные параметры
1 Годовой радиационный баланс, ккал/см2/год -0,59 -0,62 2, 3,4
2 Среднеянварская температура, °C -0,36 +0,50 1,3,4
3 Среднеиюльская температура, °C -0,53 -0,22 1,2,4
4 Общее количество инсоляции, ккал/см2/год -0,52 -0,06 1,2,3
Географические координаты
5 Долгота -0,43 —
6 Широта Общие параметры 0,59 —
7 Высота над уровнем моря, м -0,27
8 Ежегодное количество осадков, мм/год -0,03
ции является одним из типов полиморфизма, который эффективно может
использоваться в популяционном анализе народонаселения.
Приведенное картографическое моделирование распространения дан-
ной мутации (рис. 116) осуществлено на основании собственных и литера-
турных данных по 77 популяциям из различных регионов Старого Света.
Кроме того, для каждой исследованной популяции были определены харак-
теристики восьми климато-географических параметров, а именно: широта,
долгота, общее годовое количество солнечной радиации, годовой радиаци-
онный баланс, годовой уровень осадков, средняя январская температура,
средняя июльская температура и высота над уровнем моря. Для каждого па-
раметра были построены соответствующие карты, а затем построены кор-
реляционные карты, отражающие пространственную изменчивость связи
между распределением CCR5A32 и каждым из климато-географических па-
раметров. На этой основе были рассчитаны ранговые корреляции, по Спир-
мену, приведенные в табл. 8. Видно, что имеется сильная положительная
корреляция CCR5A32 с широтой (р =0,59), сильная отрицательная корреля-
ция с годовым радиационным балансом (р = - 0,59), с общим количеством
инсоляции (р = - 0,52) и со средней июльской температурой (р = - 0,53),
меньшая отрицательная корреляция наблюдается с долготой (р = - 0,43).
Были также рассчитаны коэффициенты частных корреляций. Первые
четыре фактора (названные температурными) тесно связаны между собой,
поэтому необходимо выявить, какой из них сохраняет наибольшее значение
при исключении влияния трех остальных. Оказалось, что лишь один пара-
метр - радиационный баланс - сохраняет высокий уровень связи с частотой
336
Рис. 116. Географическое распределение аллеля CCR5A 32 в популяциях Старого Света (Лимборская и др., 2002)
CCR5A32 (г = -0,62). Интересно, что при переходе от парных к частным
корреляциям уровень связи частоты аллеля со среднеиюльской темпера-
турой и инсоляцией резко падает, со среднеянварской температурой - воз-
растает.
Таким образом, расчет ранговых и частных корреляций выявил, что
наибольший уровень связи делеции CCR5A32 обнаруживается с радиацион-
ным балансом. Отсюда можно предположить, что особенности географиче-
ского распределения аллеля CCR5A32 могут быть связаны - скорее всего не
прямо, а опосредованно - с влиянием климато-географических факторов.
Как видно из рис. 116, распределение аллеля CCR5A32 в Северной Евро-
пе характеризуется максимальной частотой в районе Балтийского моря с по-
степенным уменьшением во всех направлениях. Можно предположить, что
это явление обусловлено рядом причин. Во-первых, зона максимальной кон-
центрации аллеля совпадает с ареалом северной европейской малой расы.
Рассматриваемая мутация могла возникнуть в этой группе популяций, закре-
питься в них, благодаря возможным селективным преимуществам аллеля,
и уже затем постепенно распространиться в соседние регионы. Во-вторых,
учитывая функцию гена CCR5A32, можно предположить, что делеционный
аллель может действительно обусловливать устойчивость людей к каким-то
инфекциям, отличным от СПИД. И, в-третьих, полученные результаты по
корреляциям с климато-географическими параметрами показывают, что в
комплексе факторов генетической микроэволюции (мутации, дрейф генов,
миграции, устойчивость к инфекциям, адаптация к окружающей среде) роль
климатических факторов может быть весьма существенной.
МИКРОСАТЕЛЛИТНЫЙ ЛОКУС DM
В отличие от диаллельных, мультиаллельные маркеры характеризуют-
ся особым типом строения, представленным тандемно-организованными по-
вторяющимися последовательностями, в основном - мини- и микросател-
литами.
Эти участки генома относятся к так называемым гипервариабельным.
Они содержат короткие последовательности ДНК (олигонуклеотидные зве-
нья), многократно повторенные один за другим. Для минисателлитов харак-
терны более длинные элементарные звенья от 10 и более нуклеотидов.
Например, в известном минисателлитном локусе D1S80 длина элементарно-
го звена составляет 16 нуклеотидных пар (Kasai et al., 1990), в интроне мио-
глобинового гена имеется минисателлит с элементарным звеном в 33 нукле-
отидные пары, повторенный несколько раз (Jeffreys et al., 1985).
Длина элементарного звена у микросателлитов меньше 10 нуклеотид-
ных пар (н.п). В основном исследователи имеют дело с микросателлитами,
имеющими размер звена от 2 до 4-5 н.п. Эти последовательности ранее на-
зывали простыми повторами, их число в геноме чрезвычайно велико. Наи-
более представленными являются СА-повторы, за последнее время в гено-
ме человека выявлено несколько тысяч этих локусов, большая часть кото-
рых является вариабельной.
Вариабельность мини- и микросателлитов достигается тем, что у разных
людей в одном и том же локусе одной и той же хромосомы число тандемных
338
повторов может различаться. Например, число тандемных повторов в локу-
се АроВ у разных людей может варьировать от 21 до 55, давая в общей
сложности 10-14 аллельных варианта в тех или иных популяциях (Renges et
al., 1992). Имеются локусы с еще более выраженной мультиаллельностью,
так, D1S80 содержит более 25 аллельных вариантов, a D14S1 - более 80
(Wyman et al., 1985).
Таким образом, полиморфизм мультиаллельных локусов довольно вы-
сок, отсюда следует, что и их информативность также должна быть весьма
значительной.
Ранее показано, что основным механизмом, ведущим к образованию но-
вых аллельных вариантов мини- и микросателлитов, является неравный крос-
синговер, хотя рассматривались также и другие механизмы, в частности -
репликативного проскальзывания. Однако в последнее время появились
данные, указывающие на то, что рекомбинационные события не являются
основной причиной образования новых аллелей мини- и микросателлитов.
Многочисленными исследованиями было показано, что скорость мута-
ций в микросателлитных районах, находящихся на аутосомах, составляет ве-
личину 2 х 10 3 (Sajantila et al., 1999). Приблизительно такая же величина
(2,8 х 10 3) была определена и для микросателлитных локусов, находящихся
в нерекомбинирующем районе Y-хромосомы (Kayser et al., 2000). Равенство
величин скорости мутаций для микросателлитов аутосом и У-хромосомы
косвенно указывает на то, что рекомбинации не являются причинами мута-
ций этих последовательностей, т.е. образования новых аллельных вариан-
тов, отличающихся по длине - по количеству элементарных звеньев. В то
же время само строение микросателлитов позволяет предполагать склон-
ность таких участков к неравному кроссинговеру. Но коль скоро неравный
кроссинговер на них не происходит, можно считать, что здесь имеются ме-
ханизмы, его запрещающие.
Детальный анализ мутационных событий в микросателлитных локусах
показал, что чаще всего происходит добавление или выпадение участка,
равного одному элементарному звену (одношаговое изменение). При этом
увеличение длины микросателлита происходит примерно в 2,5 раза чаще,
чем уменьшение. Отсюда следует, что со временем должна наблюдаться
тенденция образования все более длинных аллельных вариантов в локусе.
Таким образом, более короткие аллели могут рассматриваться как более
древние по сравнению с длинными. Действительно, если сравнивать прима-
тов и человека, то аллельные варианты тех же локусов оказываются у при-
матов более короткими. Однако необходимо отметить, что тенденция удли-
нения аллелей наблюдается не для всех локусов - некоторые имеют мута-
ции, как удлиняющие, так и укорачивающие аллельные варианты. Также
отмечено, что скорость мутаций увеличивается у более длинных микроса-
теллитов, а также у тех, которые имеют сложное строение, т.е. содержат
в своем составе более одного типа повторяющегося звена.
Таким образом, можно подчеркнуть следующие свойства микросател-
литных локусов.
1. Происходящие в них мутационные изменения связаны, по-видимому,
с механизмом проскальзывания при репликации.
2. Мутационные события происходят чаще всего одношагово - путем до-
бавления или потери одного элементарного звена.
339
Таблица 9. Распределение частот аллелей локуса DM в различных популяциях
Этнос Популяция Числен- ность Номер аллеля (число тандемных повторов)
5 6 7 8 9 10 11 12
Русские Курск (Курский р-он) 81 47,5 0,6 4 15,4
Курск (Октябрьский р-он) 70 40 I I 1 12 13
Курск (Понырёвский р-он) 73 38,3 0,6 14,4 12.3
Архангельск (Ошевенск) 78 41,7 1,3 11,5 9
Архангельск (Холмогоры) 49 31,8 1 18,4 12,2
Новгород (Волот) 114 32 0,4 21,5 12
Новгород (Парфино) 88 37 13,7 13,7
Москва 50 50 5 15
Кострома 53 42 1 14 8
Рязань 47 40 1 15 11
Белорусы ! Хойники М 43,9 0,9 1 9 11
Несвиж 41 42 21 12
Гродно 66 33 10,5 14
Бобруйск 95 35 0,5 1 14 9
Пинск 71 48 1,4 7 14,1
Украинцы Алчевск 56 28 1,8 1,8 13 19
Львов 68 36 I 16 21
Киев 71 38 1 15 13
Молдованс Кишинев 50 44 1 1 12 II
Башкиры Белорецкий р-н 60 32,5 1,7 12,5 9,2
Архангельский р-н 50 27 1 6 15
Абзелиловский р-н 66 28 12 16
Стрел ибашевский р-н 48 28 16 22
Илишевский р-н 59 28 I 2 12 14
Коми Сыктыквар 69 31 1 14 11
1 т Татары Елабуга 45 33 11,5 13
Удмурты 1 1 Воткинск 46 28 13 19
Ижевск 52 45 6 11
М. Пурга 64 38 10 18
| Мордва с. Алова 74 31 1 10 16,5
с. Подгорная 68 22 I 21 9,5
[ Мари с. Каркатово 100 34 0,5 3,5 16 18
Чуваши Чебоксары 49 40 1 8 14
Адыги Шасуги 289 37 0,2 0,7 0,2 0,2 15,6 10,4
Майкоп 59 35 1,7 3,4 12 19
Хаиты с. Русскинское 70 25,7 1,4 21, 13 21,4
Калмыки г. Элиста 100 14,5 0,5 10 28,5
| Коряки Камчатский п-ов 81 23 2,5 2,3 9 25 25
| Якуты с. Тюнгюлю 85 7 0,6 14,7
I СЕРН Среднеевропейская выборка, сформированная Центром по изучению полиморфизма че- ловека (Париж, Франция) 42 1 1 12 13
340
Номер аллеля (число тандемных повторов)
13 14 15 16 17 18 19 20 21 22 23 24 25
14,8 7,4 4,3 0,6 0,6 1,2 0,6 1,2 12,
14 6 1 1 2 3 1 I
19 7 0,6 0,6 2 0,6 3,4 0,6
22,4 8,3 1,3 0,6 1,3 1,3 1,3
21,4 8,2 2 I 2 I 1
17,5 10,1 0,4 0,4 0,4 1,3 2 0,4 0,4 0,4
17 10 0,6 1,7 0,6 1,1 1,7 0,6
11 12 3 1 I 1 1
17 6 2 2 1 2 1 2 1
24 5 1 3
16 9 0,9 2 1,6 2 0,9 0,9
13 8 1 I 1 1
21 10,5 1,5 2 3 1,5 1 1 1
24 11 3 1,5 1 0,5
14,1 6,3 2,8 0,7 1,4 2,8 0,7
22,3 6 0,9 0,9 0,9 1,8 0,9 0,9
13 6 1,3 1 1,3 1,3
16 6 1 1 3 1 1 1 1 1 I
14 9 2 5 1
14,2 15,8 0,8 0,8 0,8 5,8 4,2 1,7
16 21 4 2 2 5
24 7 2 3 6 1 1
17 6 1 I 4 1 1 I
20 13 2 1 1 3 1 I
23 7 1 1 1 4 4 2
19 9,5 1 1 3,5 3,5 1 I
18 14 1 2 2
13 20 2
10 14 3,5 3,5 1 1 1
16,5 12 5 2 1 1 1 1
18 9 4 1,5 1,5
17,5 4,5 1 1,5 0,5 1,5
28 4 2
13,7 5,7 1,7 1 0,5 0,3 0,9 4,7 3,3 0,9 1,2 0.5
14 9,3 0,8 0,8 0,8 0,8
16,4 5,7 0,7 2,1 2,1 3,6 0,7
30 2,5 0,5 1,5 2 2,5 1 2,5 2,5
7 2,5 2,5 0,6
39 31 4,1 1 I
13 8 1 3 1 1 2 2
341
Таблица 9 (окончание)
Этнос Популяция Числен- ность Номер аллеля (число тандемных повторов)
26 27 28 29 30 31 32 33
Русские Курск (Курский р-он) 81 0,6
Курск (Октябрьский р-он) 70 2 1
Курск (Понырёвский р-он) 73 0,6
Архангельск (Ошевенск) 78
Архангельск (Холмогоры) 49
Новгород (Болот) 114 0,4 0,4
Новгород (Парфино) 88 1,1 0,6 0,6
Москва 50
Кострома 53 1
Рязань 47
Белорусы Хойники 64 0,9
Несвиж 41
Гродно 66
Бобруйск 95 0,5
Пинск 71 0,7
Украинцы Алчевск 56 0,9 0,9
Львов 68 1 1,3
Киев 71
Молдоване Кишинев 50
Башкиры Белорецкий р-н 60
Архангельский р-н 50 1
Абзелиловский р-н 66
Стрелибашевский р-н 48 1 1
Илишевский р-н 59 1
Коми Сыктыквар 69
Татары Елабуга 45 1 1 1
Удмурты Воткинск 46 2 1
Ижевск 52 2
М. Пурга 64
Мордва с. Алова 74 1 1
с. Подгорная 68 1,5
Мари с. Каркатово 100 1,5
Чуваши Чебоксары 49 2 1
Адыги Шасуги 289 1,4 0,2 0,2
Майкоп 59 0,8 0,8 0,8
Ханты с. Русскинское 70 3 0,7 0,7 0,7
Калмыки г. Элиста 100 0,5 0.5 0,5
Коряки Камчатский п-ов 81 0,6
Якуты с. 1 юнгюлю 85 1 0,6
СЕРН Среднеевропейская выборка, сформированная Центром по изучению полиморфизма че- ловека (Париж, Франция)
342
3. Во многих локусах мутации имеют большую тенденцию увеличивать
длину тандемного повтора, реже уменьшать.
Что касается минисателлитных локусов, то для ряда из них, а именно
тех, которые наиболее активно используются в популяционных и идентифи-
кационных исследованиях (АроВ, D1S80, D17S30 и др.), были обнаружены
сходные закономерности в мутационных событиях, как и в случае микро-
сателлитов. Среднее значение скорости мутаций составляло 0,5р 10~3 (с до-
верительным интервалом 0,1-0,9 х 10~3), что практически совпадает с та-
ковым для тетрануклеотидных микросателлитов - 0,6 х 10~3 (интервал
0,2-1,0 х 10~3) (Sajantila et al., 1999). У минисателлитов также наиболее часто
возникают мутации с изменением длины участка на небольшое число повто-
ряющихся единиц (от 1 до 7), независимо от того, каков размер повторяю-
щейся единицы в локусе. Анализ мутационных событий в минисателлитных
локусах показывает, что основным механизмом также является проскаль-
зывание цепи во время репликации, и только в редких случаях (теоретиче-
ски) можно допустить неравный кроссинговер. Рассмотрим популяционно-
генетические свойства мультиаллельных микросателлитных локусов на
примере триплетного повтора в гене миотонинпротеинкиназы (хромосо-
ма 19). Этот повтор находится в некодирующей области гена и известен тем,
что его значительная экспансия (удлинение) является причиной наследст-
венной неврологической болезни, называемой миотонической дистрофией
(Tishkoff et al., 1998). В норме число триплетных повторов данного локуса
варьирует от 5 до 30 и несколько более. При миотонической дистрофии, как
было рассмотрено ранее, число повторов достигает сотен и тысяч, образуя
гигантские по размеру микросателлитные участки на хромосоме. По наз-
ванию этой болезни данный триплетный локус часто обозначают как ло-
кус DM.
Однако, несмотря на такую тесную связь с наследственной патологией,
микросателлитный локус в норме ведет себя как нейтральный маркер и
имеет характеристики, делающие его пригодным для популяционных иссле-
дований. В различных популяциях количество аллельных вариантов дости-
гает 20. На рис. 117 представлено в качестве примера распределение алле-
лей данного локуса для трех популяций.
Видно, что у русских наиболее часто встречается пятичленный повтор
(так называемый мажорный аллель), его частота встречаемости в популяци-
ях славян достигает 40, а иногда 50% (табл. 9). Значимыми аллелями являет-
ся группа аллелей с числом повторов от 11 до 14, причем соотношения час-
тот внутри этой группы варьируют в различных популяциях. В отдельных
случаях частота 13-членного повтора достигает более высоких значений
(> 20%). Интересно, что между пятичленным повтором и 11-членным име-
ется значительное “разрежение” частот - в этой области (с 6-го по 10-член-
ный повтор) встречаемость аллелей крайне низкая, в некоторых популяци-
ях они вообще отсутствуют. Связано ли это явление с его какими-то стери-
ческими особенностями данного участка ДНК, или же с влиянием на функ-
ционирование гена - остается не ясным. Однако видно, что эта область на-
ходится под неким влиянием сильного отрицательного давления. Следую-
щее “разрежение” начинается с 15-членного повтора и доходит до 19-член-
ного. В области аллелей 20-22 можно уловить третью волну (очень слабую
по значимости) и затем размытую область более длинных аллельных вари-
343
антов, достигающих в отдельных случаях величин, превышающих 30 пов-
торов.
Например, у башкир, как и у многих других уральских народов, встреча-
емость пятичленного повтора уменьшается - у этих народов вторыми по
значимости аллелями являются 12, 13 иногда 14 повторов. Для сравнения на
рис. 117 приведены результаты по распределению аллельных частот у яку-
тов, относящихся к монголоидам. Видно, что спектр частот здесь существен-
но отличается, обнаруживая тем самым расово-диагностические свойства
данного локуса.
Распределение частот аллелей локуса DM в различных популяция.
В табл. 9 приведены частотные характеристики триплетного повтора
локуса DM в разных популяциях Восточно-Европейского региона, а также
для сравнения - в нескольких североазиатских монголоидных группах. Для
наиболее часто встречающихся (мажорных) аллелей построены геногеогра-
фические карты в пределах изучаемого региона. На приведенных далее в
качестве примера картах даны результаты только по тем территориям, где
имеется надежная интерполяции с вероятностью правильного картографи-
ческого прогноза Р > 0,90 (при уровне строгости 0,4).
На рис. 118 представлено распределение в географическом пространст-
ве Восточной Европы аллельного варианта 5, пятичленного тринуклеотид-
ного повтора. Этот аллель, как уже говорилось выше, в европеоидных по-
пуляциях встречается с частотой более 40%, являясь не просто мажорным, а
супермажорным аллелем. Это его свойство в значительной степени опреде-
ляет ряд популяционных характеристик локуса в целом, как можно увидеть
далее. Видно, что максимальная встречаемость аллеля 5 наблюдается в цен-
тральной части Русской равнины и в Молдавии, минимальная - в северо-
прикаспийских районах и на юге Урала.
Карта распределения аллеля 12 (рис. 119) имеет выраженный максимум
в северо-прикаспийском регионе - в этническом ареале калмыков, истори-
чески недавно переселившихся в Восточную Европу. Такой результат не ка-
жется неожиданным, так как именно аллель 12 является одним из выражен-
ных по значимости в монголоидных популяциях (см. табл. 7), а доля монго-
лоидного компонента у калмыков довольно существенна.
Географическое распределение аллеля 13 - еще одного значимого алле-
ля в монголоидных популяциях - имеет свои особенности (рис. 120). Один из
максимумов, так же как и в предыдущем случае, располагается в области
расселения калмыков. Второй максимум меньше по площади, но оказывает
большее влияние на все северные области. Его можно соотнести с террито-
рией проживания мари, которые по данным антропологии имеют наиболее
выраженные монголоидные черты по сравнению со всеми другими финно-
угорскими народами Восточной Европы.
Сравнительный анализ географического распределения значимых алле-
лей рассматриваемого локуса позволяет заметить необычную закономер-
ность: чем больше размер аллеля, тем восточнее располагается максимум
его встречаемости.
На рис. 121 представлена синтетическая карта гетерозиготности по всем
аллелям локуса DM. Если сравнить эту карту с картой распределения алле-
ля 5, то можно заметить, что эти карты являются зеркальным отображени-
ем друг друга в отношении минимальных и максимальных величин: там, где
344
1:20000000
200 О 200 400 600 800 1000 км
fa fa I
Рис. 118. Распространенность аллеля 5 локуса DM в Восточной Европе (Лимборская
и др., 2002)
13. Проблемы и перспективы...
345
1:20000000
Рис. 119. Распространенность аллеля 12 локуса DM в Восточной Европе (Лимборская
и др., 2002)
200 400 600 800 1000 км
346
в.д. 10° 20° 30° • 40° 50° 60° 70°
30°40° 50°
1:20000000
200 0
200 400 600 800 1000 км
Рис. 120. Распространенность аллеля 13 локуса DM в Восточной Европе (Лимборская
и др., 2002)
13*
347
200
к
Рис. 121. Карта гетерозиготности локуса DM в Восточной Европе (Лимборская и др., 2002)
1:20000000
348
на одной карте максимум - на другой минимум, и наоборот. Понятно, что
аллель, столь часто встречающийся на данной территории, обусловливает
наличие здесь заметного числа гомозигот и тем самым снижает общий уро-
вень гетерозиготности. Отсюда можно заключить, что в данном случае ге-
терозиготность локуса в значительной степени определяется показателями
супермажорного аллеля и система локуса DM по этому параметру выглядит
как диаллельная, состоящая из аллеля 5 и объединения всех других аллелей
(не-аллель 5). Теоретически такое положение возможно в любых высоко-
полиморфных локусах, где имеется супермажорный аллель, встречающийся
в популяциях с высокой частотой (~ 40-50%).
Продолжая сравнение карты гетерозиготности и распределения алле-
ля 5, можно отметить, что высокое “зеркальное” соответствие обеих карт
особенно велико, вплоть до деталей, в западной части изучаемого региона,
где частота аллеля 5 достигает наибольших значений. В восточной части ре-
гиона это соответствие, хотя в целом и сохранятся, но имеет различия в де-
талях, которые связаны с тем, что в восточном регионе в общую гетерози-
готность локуса заметный вклад вносят аллели 12 и 13, достаточно часто
встречающиеся на данной территории.
Приведенные геногеографические карты для каждого аллельного вари-
анта гена DM содержат довольно существенную конкретную информацию.
В принципе таких карт по данному локусу можно представить значительно
больше, учитывая, что в популяциях изучаемого региона выявлено 27 алле-
лей. Важно из этого огромного массива информации получить сведения об
основных обобщающих свойствах и тенденциях генетической изменчивости
локуса DM в целом. Наиболее подходящими статистическими подходами,
позволяющими обрабатывать большие массивы данных и выявлять обоб-
щающую информацию, являются методы многомерного статистического
анализа, которые дают возможность провести “сжатие” объемов статисти-
ческой информации без потерь в ее информативности. Одним из таких ме-
тодов является метод главных компонент, при котором сжатие информации
происходит за счет перехода от исходного набора признаков к небольшому
числу вспомогательных переменных, по которым можно достаточно точно
определить свойства всего анализируемого массива данных.
С генетических позиций, метод главных компонент позволяет перейти
от совокупности огромного числа первичных данных (например, частотных
аллельных характеристик) к новым обобщенным показателям, описываю-
щим общие закономерности изменчивости.
Первая главная компонента включает в себя основные, наиболее общие
закономерности в изменчивости изучаемых генов. Вторая главная ком-
понента, третья и т.д. являются следующими по рангу и значимости вели-
чинами.
Распределение в географическом пространстве первой главной компо-
ненты всех аллелей изучаемого локуса DM представлено на рис. 122.
Эта карта содержит обобщающую информацию по совокупности более
20 карт распределения аллелей. На карте первой главной компоненты вид-
но два экстремума - один в центре Восточно-Европейской равнины, второй
имеет более сложную форму и состоит из трех областей: области Северно-
го Прикаспия и Северного Кавказа и двух областей Южного Урала с тенден-
цией ухода на восток. Таким образом видно, что основная закономерность в
349
1:20000000
200 0 200 400 600 800 1000 км
fa d i»ll I
Puc. 122. Карта первой главной компоненты изменчивости локуса DM в Восточной Европе
(Лимборская и др., 2002)
350
изменчивости локуса DM - это изменение с юго-востока и востока к центру
региона. Промежуточная зона (серый цвет), где первая главная компонента
меняет знак на противоположный, является областью уравновешивания
двух противоположных тенденций. Интересно, что в данном случае зона
уравновешивания имеет причудливую форму, практически окружая со всех
сторон область экстремума, расположенного в центре равнины. Нельзя не
отметить, что в районе Кавказа имеются два экстремума 1-й главной компо-
ненты, причем переход между ними значительно более резкий, чем в основ-
ной части Восточной Европы. Однако самая южная часть представленной
карты расположена в зоне, где надежность картографического прогноза
только Р = 0,90, а не 0,95, как в основной части. Учитывая также, что здесь
пока нет опорных точек, преждевременно делать какие-либо заключения
для этой области. Тем не менее в работе Балановской и соавт. (1999) пока-
зано, что первая главная компонента классических маркеров в Кавказском
регионе ведет себя сходным образом. На рис. 123, а представлено распреде-
ление второй главной компоненты локуса DM в географическом простран-
стве Восточной Европы. Представлена только территория, где надежность
результатов не менее 90% при уровне строг ости а = 0,4. Расположение экс-
тремумов здесь подчеркивает особую роль популяций Кавказа в определе-
нии генетической изменчивости локуса DM на изучаемом пространстве.
Еще одним весьма интересным вопросом является взаимозависимость
конкретных аллелей внутри локуса DM. По характеру распределения частот
аллелей можно видеть особенности локуса: наличие супермажорного алле-
ля, почти полное отсутствие некоторых аллельных вариантов и т.д. Имеют-
ся предположения о том, что генерирование “длинных” аллелей с числом
повторов > 20 может происходить либо непосредственно из пятичленного
повтора (Imbert et al., 1933; Neville et al.,1994), либо из аллелей средней дли-
ны ( с числом повторов от 11 до 14 ) ( Tishkoff et al., 1998). В связи с этим бы-
ли посчитаны корреляции между соответствующими аллелями. Данные
приведены в табл. 10 и 11. Из табл. 10 видно, что аллель 5 имеет высокую
отрицательную корреляцию с аллелями 12 (р = - 0,58), 13 (р = -0,55) и осо-
бенно с “длинными” аллелями (р = - 0,71), имеющими число повторов >20.
Остальные аллели не имеют друг с другом выраженных корреляций, что
особенно видно из табл. 11, где приведены частные корреляции и устранено
влияние аллеля 5.
Имеется только заметная отрицательная корреляция между аллелем 11
и аллелем 12 (г = - 0,42) а также между аллелем 11 и длинными аллелями
(г = -0,46). Эти результаты можно трактовать таким образом, что аллель 5
на изучаемой территории может являться непосредственным предшествен-
ником аллелей 12 и 13, а также “длинных” вариантов. По-видимому, алле-
ли 12, 13, 14 не являются таковыми для “длинных” аллелей и оказываются
достаточно стабильными, тогда как аллель Ис некоторой вероятностью
может мутировать, превращаясь как в “длинные” аллели, так и в аллель 12.
Последний вариант вполне ожидаем, так как наиболее частой мутацией ми-
кросателлитов является добавление одного повторяющегося звена. Удиви-
тельно, что для этого локуса мутации такого типа в некоторых случаях не-
возможны, так увеличение длины аллеля 5 на 1-5 шагов происходит редко,
как можно судить по частоте встречаемости соответствующих аллелей. Ал-
лели с числом повторов менее 5 для этого локуса вообще практически не
351
в.д. 10° 20° 30° 40° 50° 60° 70°
200
1:20000000
200 400 600 800 1000 км
Рис. 123. Карта генетических расстояний от средних частот популяций уральской языковой
семьи (Лимборская и др., 2002)
352
Таблица 10. Коэффициенты ранговой корреляции между аллелями DM локуса
Dm_5 Dm_ll Dm_12 Dm. 13 Dm_14 Dm_>20
Dm 5 .029 -.580 -.550 -.101 -.714
Dm 11 -.382 .060 -.173 -.338
Dm 12 .097 .063 .379
Dm 13 -.180 .335
Dm_14 .028
Dm_>20
Таблица 11. Коэффициенты частной корреляции между аллелями DM локуса
(устранено влияние аллеля Dm_5)
Dm.ll Dm_12 Dm_13 Dm 14 Dm_>20
Dm 11 -.417 -.013 -.166 -.457
Dm 12 -.069 -.147 -.174
Dm 13 -.347 -.084
Dm J4 .072
Dm_>20
встречаются. Пока еще не ясны механизмы, с помощью которых возникают
аллели, группирующиеся по длине в виде двух волн (с числом повторов
11-14 и 20-22), не говоря уже о более длинных. Внутри этих “волн” (мод)
можно представить переход аллелей друг в друга за счет одношаговых мута-
ций. Однако поддержание этих мод на значимом уровне происходит под дей-
ствием неизвестных причин, возможно селективного характера. Является
ли наблюдаемые особенности локуса DM характерными вообще для локу-
сов, склонных к значительным экспансиям, остается пока не ясным. В даль-
нейшем после подробного изучения аллельных вариантов других локусов
такого рода, например DRPLA, SCA-1 и т.д., можно будет получить более
определенный ответ на этот вопрос.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЕ ИЗУЧЕНИЕ
ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ ГЕНОФОНДА
ВОСТОЧНО-ЕВРОПЕЙСКОГО РЕГИОНА
Обобщенный анализ совокупности данных по ряду полиморфных локу-
сов позволяет получить принципиально новую информацию о структуре
изучаемого генофонда и основных закономерностях его пространственной
изменчивости. Сопоставление результатов такого обобщенного анализа с
результатами, полученными теми же методами, но по другим системам при-
знаков (в первую очередь - по данным о классических генных маркерах), по-
зволяет выявить те общие генетические закономерности, которые объек-
тивно присутствуют в генофонде народов Восточной Европы. Такое сопос-
тавление может выявить и те особенности маркеров ДНК, которые можно
расценить как их преимущества или же недостатки в сравнении с другими ге-
нетическими системами.
353
Обобщенный анализ генофонда Восточной Европы по данным молеку-
лярной генетики проведен по данным о четырех локусах ДНК полиморфиз-
ма (Лимборская и др., 2002). Три из них относятся к гипервариабельным
тандемным повторам. Это рассмотренный выше локус DM, а также микро-
сателлит CAct685 и минисателлит в гене АроВ. Четвертый локус - CCR5 -
относится к инсерционно-делеционному типу ДНК полиморфизма.
Все использованные нами маркерные локусы характеризуются выра-
женными расово-диагностическими свойствами, особенно в отношении ев-
ропеоидных и монголоидных групп. Другими словами, распределение ал-
лельных вариантов каждого маркера существенно различается у народов,
относящихся к разным расам - европеоидной или монголоидной.
В табл. 12 приведены этно-лингвистические характеристики изученных
популяций, которые относятся к различным этносам, входящим в состав че-
тырех основных лингвистических семей Евразии.
Совокупность частот аллелей перечисленных локусов анализировали с
помощью компьютерной геногеографической технологии, описанной в ра-
ботах Е.В. Балановской и соавт. (1994 а, б, 1995, 1997). Рассмотрим сначала
анализ генетических расстояний от различных реперных популяций до каж-
дой точки карты Восточной Европы. Существо метода состоит в том, что на
карту наносятся не собственные значения частот аллелей, а величины их от-
клонений от какой-то заданной величины. Обычно такой величиной для
сравнения служит среднее значение аллельных частот реперной популя-
ции - в качестве такой точки отсчета выступает либо реальная популяция,
или же усредненные характеристики частот для какой-либо этно-террито
риальной общности. Этот метод позволяет оценить в терминах генетиче-
ских расстояний “близость” или “отдаленность” всех остальных популяций
региона от той, которая взята в качестве точки отсчета.
В данной работе мы провели оценку генетических расстояний от четы-
рех различных точек отсчета (Лимборская и др., 2002).
Одна из таких реперных точек - это средние частоты, рассчитанные по
всем популяциям, относящимся к уральской языковой семье (коми, мари,
мордва, удмурты). Эти народы относятся к финно-угорской ветви языков и
являются потомками древнего населения Восточно-Европейской равнины.
По данным других наук о человеке, установлено, что финно-угорские наро-
ды представляют основной субстрат, легший в основу и сформировавший
физический облик большинства народов Восточной Европы. По генетиче-
ским расстояниям от этих народов мы хотели оценить, каково их влияние на
генофонд отдельных популяций и региона в целом. Полученные результаты
представлены на карте (рис. 123). Светло-серым цветом обозначены мини-
мальные генетические расстояния (наибольшая близость к финно-уграм),
черным - максимальные. Хорошо видно, что наиболее генетически близки-
ми к средним частотам уральской языковой группы являются (кроме, разу-
меется, самих этих народов) популяции междуречья Волги и Дона, северных
областей, а также территории, простирающиеся между ними. Наиболее от-
даленными генетически оказались популяции западных областей Русской
равнины, Кавказа и Южного Урала.
Видно, что генетическое влияние на восточно-европейский генофонд на-
родов уральской языковой группы, значительно выходит за границы их со-
временного ареала.
354
Таблица 12. Этно-лингвистическая принадлежность изученных популяций
Языковые семьи Языковые группы Народы (число изученных популяций)
Алтайская Тюркская Ьашкиры (4)
Ногайцы (1)
Татары (3)
Чуваши (1)
Индо-европейская Романская Молдаване (1)
Славянская Белорусы (4)
Русские (3)
Северокавказская Нахско-дагестанская Народы Дагестана (3)
Уральская Финно-угорская Коми (1)
Мари (2)
Мордва (2)
Удмурты (3)
На рис. 124 приведена карта генетических расстояний, рассчитанных
от средних частот аллелей, характеризующих популяции, принадлежащие к
другой обширной лингвистической семье - алтайской. В наших материалах
по ДНК маркерам эта семья представлена народами, относящимися к ее
тюркской ветви - татарами, башкирами, ногайцами. На этой карте мы ви-
дим иные закономерности, чем для финно-угров. Самыми близкими к тюрк-
скому генофонду оказались популяции Южного Урала, Зауралья, Северно-
го Прикаспия и вновь междуречья Волги и Дона. Генетически удалены по-
пуляции западных территорий региона, Кавказ и Северный Урал. Основной
вектор карты совпадает с направлением продвижения кочевых племен,
с древними взаимодействиями коренного населения лесной полосы и степ-
ными кочевниками.
На рис. 125 приведены генетические расстояния от средних значений по-
пуляций индо-европейской языковой семьи. При расчете средних характери-
стик были использованы частоты аллелей в популяциях русских, белорусов
и молдаван. Карта демонстрирует, что наиболее генетически близкими к
ним (т.е. наиболее полно воспроизводящими их генофонд) являются популя-
ции центральной, западной, северо-западной и юго-западной частей Восточ-
но-Европейской равнины. Наиболее отдаленными оказались популяции
Северного и Южного Урала, а также Кавказа.
Следующий вопрос, который может представлять интерес, это выявле-
ние популяций, в наибольшей степени приближающихся к средним по Вос-
точной Европе частотам генов.
Эти средние по Восточной Европе частоты были получены следующим
образом. Для каждого аллеля были определены частоты его встречаемости
в каждой популяции, затем они были использованы для вычисления средних
значений частоты аллеля каждого народа. На основании этих средних час-
тот были определены средние частоты для каждой лингвистической семьи.
355
Рис. 124. Карта генетических расстояний от средних частот популяций алтайской языковой
семьи (Лимборская и др., 2002)
Рис. 125. Карта генетических расстояний от средних частот популяций индо-европейской
языковой семьи (Лимборская и др., 2002)
И наконец, эти частоты были взяты для определения общих средних частот
по всему Восточно-Европейскому региону.
Далее по каждому локусу были рассчитаны генетические расстояния от
этих средних частот до каждой популяции региона (узла сетки карты), а за-
тем расстояния усреднены по всем локусам. Карта этих усредненных по че-
тырем локусам расстояний представлена на рис. 126. Видно, что ближе все-
го к средним частотам оказались популяции, находящиеся в южной части
Восточно-Европейской равнины, точнее, в междуречье Волги и Дона. Сле-
дующие по степени близости к территории простираются широкой полосой
от Онежского озера до Каспия и предгорий Кавказа. Наиболее отдаленны-
ми генетически являются популяции Южного Урала и севера европейской
части России и западной части Восточно-Европейской равнины.
Таким образом, близкие к средним территории расположены в зоне тес-
ного соседства народов всех трех языковых семей. Это может свидетельст-
вовать, что средние значения частот ДНК маркеров по данному региону
сформированы под влиянием популяций трех языковых семей (уральской,
индо-европейской и алтайской).
Следующий этап состоял в использовании метода главных компонент
для анализа изучаемых популяций. Этот метод, как уже говорилось выше,
позволяет перейти от совокупности исходных признаков к новым обобщен-
ным признакам, описывающим общие закономерности изменчивости.
Какие же общие причины могут лежать в основе закономерностей, вы-
являемых методом главных компонент? Мутационная история и естествен-
ный отбор обычно сильно различаются от гена к гену, но два других эволю-
ционных фактора, миграция и дрейф генов, влияют сходным образом на все
гены. Именно эти явления в значительной степени определяют обобщаю-
щие генетические характеристики популяций, которые в первую очередь и
тестируют с помощью главных компонент.
Первая главная компонента включает в себя основные, а главное - наи-
более общие закономерности изменчивости изученных генов в простран-
стве региона. Вторая главная компонента, третья и так далее являются сле-
дующими по рангу и значимости величинами. Карты главных компонент от-
ражают изменчивость совокупности отдельных признаков - генов, поэтому
они воспроизводят наиболее общие тенденции в географии генов и даже ге-
нофонда в целом.
На рис. 127 приведено распределение первой главной компоненты в гео-
графическом пространстве. Здесь хорошо видно наличие двух экстремумов,
один - на северо-востоке, другой - на юго-западе Восточно-Европейской
равнины (Лимборская, 2002). Интересно, что точно такие же экстремумы
обнаружены на карте первой главной компоненты классических маркеров
(в основном белков плазмы крови). Эти данные получены на основе боль-
шого массива популяций и по большому набору маркеров - по 100 аллелям
34 локусов, но по своей сути они совпали с данными по 4 локусам. Рассчи-
танный коэффициент корреляции этих двух карт оказался высоким и дости-
гал величины 0,834.
Распределение первой главной компоненты свидетельствует в обоих
случаях о давнем и длительном взаимодействии европеоидов и северных
монголоидов народов на территории Восточно-Европейской равнины. Инте-
ресно, что эта картина совпадает с картой классических маркеров, приве-
3SR
Рис. 126. Карта генетических расстояний от средних частот всего Восточно-Европейского
региона (Лимборская и др., 2002)
359
Рис. 127. Карта первой главной компоненты изменчивости вариабельных локусов ДНК в
Восточной Европе (Лимборская и др., 2002)
1:20000000
200 0 200 400 600 800 1000 км
had Ы ' ' ' I
Рис. 128. Карта второй главной компоненты изменчивости вариабельных локусов ДНК в
Восточной Европе (Лимборская и др., 2002)
200 0
1:20000000
200 400 600 800 1000 км
Рис. 129. Карта третьей главкой компоненты изменчивости вариабельных локусов ДНК в
Восточной Европе (Лимборская н др., 2002)
362
денная Cavalli-Sforza (1998), но по географии 2-й главной компоненты всей
Европы. По мнению автора, это может отражать распространение ураль-
ских племен, происходившее несколько тысячелетий назад из области Се-
верного Урала.
Распределение второй главной компоненты в Восточной Европе
(рис. 128) также имеет два экстремума, однако их положение другое - один
располагается на западе, второй - на юго-востоке. Здесь также наблюдает-
ся высокая корреляция с картой второй компоненты классических марке-
ров - коэффициент равен 0,572. Данные по второй главной компоненте в
обоих случаях указывают на существование в древние времена длительного
взаимодействия европеоидных народов с южными монголоидами.
Интересно, что эти данные совпадают с данными, приведенными Cavalli-
Sforza (1998), но по распространению 3-й главной компоненты по всей
Европе. Для этой карты автор предлагает также историческую аналогию:
именно из прикаспийских районов в бронзовом веке (около 5 тыс. лет назад)
происходило расселение кочевых пастушеских племен.
И, наконец, на рис. 129 приведено распределение 3-й главной компонен-
ты в географическом пространстве Восточной Европы. Здесь видно 4 экс-
тремума. Карта отражает сложное взаимодействие народов, происходившее
в последнее тысячелетие на данной территории. Центр равнины оказался
как бы зоной уравновешивания градиентов влияния различных этнических
компонентов.
Приведенные результаты анализа сложного в расовом отношении реги-
она Восточной Европы, показавшие на меньшем по объему фактическом
материале сходство оценок межпопуляционного разнообразия и карт глав-
ных компонент с классическими маркерами, указывают на высокую разре-
шающую способность ДНК маркеров при анализе генофонда.
ЗАКЛЮЧЕНИЕ
Приведенные результаты представляют собой начальный этап широко-
масштабных исследований по медицинской и этнической геномике народо-
населения нашей страны. Несомненно, в дальнейшем информация о гено-
фонде э^ого региона будет пополняться как за счет все большего расшире-
ния массива изученных популяций и народов, так и благодаря увеличению
спектра анализируемых ДНК маркеров - особенно маркеров, важных с ме-
дицинской точки зрения.
Можно ожидать еще больших успехов в изучении природы наследствен-
ных болезней, в результате чего будут получены ответы на вопросы о при-
чинах их клинического полиморфизма и генетической гетерогенности. Эти
исследования позволят поставить на качественно новый уровень службу ме-
дико-генетического консультирования, так как на их основе будут разрабо-
таны новые эффективные методы диагностики, лечения и профилактики.
Из тех первых исследований по этнической геномике, часть из которых
изложена здесь, складывается представление о том, что маркеры ДНК обла-
дают свойствами, позволяющими получать с их помощью большую инфор-
мацию о генофонде по сравнению с маркерами прежних типов. Немалые на-
дежды в этой связи возлагаются на их использование для выяснения времен-
363
ных параметров исторического развития этнических и региональных гено-
фондов. Предпосылкой этому является все более уточняющиеся сведения
о скорости мутационного процесса, происходящего в различных областях
генома, включая гипервариабельные участки, являющиеся маркерами ДНК.
В перспективе можно ожидать большое вовлечение подходов этногено-
мики в исследования, связанные с экологической генетикой. В представлен-
ной статье приведены результаты сопоставления геногеографического рас-
пределения одного из генов с факторами внешней среды. Эта работа может
рассматриваться как первый этап геномно-экологических исследований
региона, где в выявлении различных закономерностей ведущую роль будет
играть геногеографический подход.
Другой перспективой такого рода исследований можно считать их дальней-
шее развитие в направлении медицинской геномики, особенно в области изуче-
ния наследственной патологии и генетических факторов предрасположенности
к таким распространенным болезням, как болезни сердца, диабет, гипертония,
зависящим также от факторов внешней среды. Оценка спектров мутаций и по-
пуляционная характеристика маркеров, сцепленных с генами предрасположен-
ности, в сочетании с анализом параметров внешней среды позволит выявить
новые важные закономерности, влияющие на здоровье человека.
Таким образом, полученные результаты дают основание считать, что
дальнейшее развитие геномных исследований расширит наши представле-
ния о генофонде человека, внесет весомый вклад в наше понимание вопро-
сов исторического развития и эволюции человека, а также в столь важные
практические проблемы, связанные с диагностикой, лечением и профилак-
тикой широкого круга заболеваний.
ЛИТЕРАТУРА
Асеев М.В., ШауиА.,Дин М., Баранов В.С. Популяционные особенности частот мутации
гена хемокинового рецептора CKR-5, определяющего чувствительность к вирусу
СПИДа // Генетика. 1997. Т. 33, № 11. С. 1597-1599.
Балановская Е.В., Нурбаев С.Д. Компьютерная технология геногеографического изуче-
ния генофонда. III. Вычленение трендовых поверхностей // Генетика. 1995. Т. 31,
№ 4. С. 536-559.
Балановская Е.В., Нурбаев С Д Компьютерная технология геногеографического изуче-
ния генофонда. IV. Популяции в пространстве главных компонент. //Там же. 1997.
Т. 33, № 12. С. 1693-1710.
Балановская Е.В., Нурбаев С.Д., Рычков Ю.Г. Компьютерная технология геногеографи-
ческого изучения генофонда. I. Статистическая информация карт. //Там же. 1994а.
Т. 30, № 7. С. 951-965.
Балановская Е.В., Нурбаев С.Д., Рычков Ю.Г. Компьютерная технология геногеографи-
ческого изучения генофонда. II. Статистическая трансформация карт // Там же.
19946. Т. 30, № 11. С. 1538-1555.
Балановская Е.В., Нурбаев С.Д., Балановский О.А. и др. Геногеографический анализ
подразделенной популяции: генофонд адыгов в системе кавказских генофондов //
Генетика. 1999. Т. 35, № 6. С. 818-830.
Бархатова В.П. Нейротрансмиттеры и экстрапирамидная патология. М.: Медицина,
1988. 176 с.
Галеева А.Р., Хуснутдинова Э.К., Сломинский Н.А., Лимборская С.А. Распространен-
ность делеции 32 п.н. в гене рецептора хемокинов CCR5 в популяциях Волго-Ураль-
ского региона // Генетика. 1998. Т. 34, № 8. С. 1160-1162.
Завалишин И.А., Бархатова М.Н. Боковой амиотрофический склероз // Неврология и
психиатрия. М., 1999. Вып. 4. С. 21-26
Иванова-Смоленская И.А., Овчинников И.В., Иллариошкин С.Н. и др. Молекулярно-ге-
нетический анализ в диагностике спорадических случаев болезни Гентингтона //
Ж. неврол. и психиатрии им. С.С. Корсакова. 1998. Т. 98, № 3. С. 19-22.
Иллариошкин С.Н., Иванова-Смоленская И.А., Лимборская С А. и др. Досимптоматиче-
ская ДНК диагностика спиномозжечковой атаксии типа I // Генетика. 1997. Т. 33,
№ 5. С. 693-698.
Карабанов А.А., Овчинников И.В., Иллариошкин С.Н. и др. Анализ мутации в гене
АТР7В и опыт прямой диагностики при гепато-лентикулярной дегенерации // Ж.
неврол. и психиатрии им. С.С. Корсакова. 2001. Т. 101, № 4. С. 44М-7.
Лимборская С.А. Молекулярная генетика человека: Медико-генетические и популяци-
олнные исследования // Молекуляр. биология. 1999. Т. 33, № 1. С. 63-73.
Лимборская С.А., Хуснутдинова Э.К., Балановская Е.В. Этногеномика и геногеогра-
фия народов Восточной Европы. М.: Наука, 2002.
Маркова Е.Д. Клинические аспекты и течение торзионной дистонии // Клиническая ме-
дицина. 1975. Т. 53, № 9. С. 89-92.
Маркова Е.Д. Клиника, патогенез и лечение торзионной дистонии // Журн. неврапатоло-
гии и психиатрии. 1989, № 8. С. 32-35.
Маркова Е.Д., Сломинский П.А., Шадрина М.И. и др. Молекулярно-генетический ана-
лиз торсионной дистонии в России // Генетика. 2000. Т. 36, № 7. С. 952-958
Микулич А.И..Лимборская С.А., Сломинский П.А. и др. Использование полиморфных
маркеров ДНК в решении задач этнической антроплогии и генетики человека //
Докл. Нац. академии наук Беларуси. 1999. Т. 43, № 2. С. 168-172.
Милосердова О.В., Перова Н.В., Балаболкин М.И. и др. Анализ полиморфных ва-
риантов генов ренин-ангиотензиновой системы при полиметаболическом синдроме
и инсулин-независимом сахарном диабете // Генетика. 2001. Т. 37, № 10. С. 1396-
1401.
Милосердова О.В., Сломинский И.А., Лимборская С.А. Зависимые от возраста измене-
ния частот аллелей и генотипов инсерционно-делеционного полиморфизма гена ан-
гиотензин-преврагцающего фермента // Там же. 2001. Т. 37, № 11. С. 1525-1527.
Милосердова О.В., Сломинский П.А., Мауянов И.В. и др. Ассоциация между инсерцион-
но-делеционным полиморфизмом гена ангиотензин-превращаюгцего фермента и
развитием ангиопатий у больных инсулин-независимым сахарным диабетом из Рес-
публики Чувашия // Там же. 2001. Т. 37, № 1. С. 112-116.
Милосердова О.В., Сломинский П.А., ТарскаяЛ.А. и др. Изучение полиморфизма генов
ангиотензиногена и ангиотензин-превращающего фермента у якутов. Отсутствие
ассоцииации с уровнем кровяного давления // Там же. 2001. Т. 37, № 5. С. 712-715.
Наследственные болезни нервной системы: Руководство для врачей / Под ред.
Ю.Е. Вельтищева, П.А. Темина. М.: Медицина, 1998. 496 с.
Погода Т.В., Никонова А.Л., Колосова Т.В. и др. Аллельные варианты генов аполипо-
протеинов В и С2 у больных ишемической болезнью сердца и здоровых лиц из мос-
ковской популяции // Генетика. 1995. Т. 31, № 7. С. 1001-1009.
Попова С.Н., Микулич А Н., Сломинский П.А. и др. Полиморфизм повтора (CTG)n в ге-
не миотонин-протеин-киназы (DM) в популяциях Белоруссии: Анализ внутриэтни-
ческой гетерогенности // Там же. 1999. Т. 33, № 4. С. 787—790.
Попова С.Н., Сломинский П.А., Бебякова НА., Лимборская С.А. Полиморфизм три-
плетных повторов в генах МРК, DRPLA и SCA1 в популяциях Архангельской облас-
ти Ц Пробл. экологии. 2000. № 6. С. 69-73.
Скворцова В.И.,Лимборская С.А., Сломинский ПА. и др. Спорадический боковой амио-
трофический склероз, ассоцированный с Асп90Ала мутацией в медь-цинк-зависи-
мой супероксиддисмутазы в России // Журн. неврологии и психиатрии им. Корсакова.
2001. № 1. С. 44М7.
Сломинский П.А., Шадрина М.И., Лимборская С.А. Выделение белка, специфически
связывающегося с триплетным повтором типа (CTG)n // Молекуляр. биология. 1997.
Т. 31, № 1. С. 45-48.
Сломинский П.А Молекулярно-генетический анализ наследственных неврологических
заболеваний // Молекуляр. биология. 1999. Т. 336, № 1. С. 74-79.
Сломинский П.А., Попова С.Н., Фатхлисламова Р.И. и др. Анализ экспансии триплет-
ного повтора типа (CTG)n у больных миотонической дистрофией из Башкирии //
Генетика. 2000. Т. 36, № 6. С. 844-848.
Сломинский П.А., Попова С.П., Шадрина М.И. и др. Нормальный полиморфизм повто-
ра (CTG)n в гене миотонин-протеин-киназы (DM) на хромосоме 19ql3,3 в популяци-
ях Восточной Европы // Там же. 2000. Т. 36. С. 980-985.
Фатхлисламова Р.И., Хидиятова И.М., Хуснутдинова Э.К. и др. Анализ полиморфиз-
ма CTG-повторов в гене миотонической дистрофии в популяциях Волго-Уральско-
го региона // Там же. 1999. Т. 7. С. 990-993.
Хидиятова ИА., Фатхлисламова Р.И., Магжанов Р.В. и др. Изучение экспансии и час-
тоты мутирования CTG-повторов гена миотонической дистрофии // Там же. 2000.
Т. 36. С. 1410-1413.
Шадрина М.И., Сломинский П.А., Милосердова О.В. и др. Анализ полиморфизма гена
ангиотензин-превращающего фермента у больных ишемической болезнью сердца в
московской популяции Ц Там же. 2001.Т. 37, № 4. С. 1—5.
Albanese V., Holbert S., Saada C. CAG/CTG and CGG/GCC repeats in human brain reference
cDNAs: outcome in searching for new dynamic mutations // Genomics. 1998. Vol. 47.
P. 414-418.
Al-Chalabi A. Recessive amyotrophic lateral sclerosis families with the D90A SOD1 mutation
share a common founder: evidence for a linked protective factor // Hum. Mol. Genet. 1998.
Vol. 7. P. 2045-2050.
Al-Chalabi A., Andersen P.M., Nilsson P. Deletions of the heavy neurofilament subunit tail in
amyotrophic lateral sclerosis//Ibid. 1999. P. 157-164.
Appel S.H. A unifying hypothesis for the cause of amyotrophic lateral sclerosis, parkinsonism and
Alzheimer disease // Ann. Neurol. 1981. Vol. 10. P. 499-505.
Ashizawa T., Epstein H.F. Ethnic distribution of myotonic dystrophy gene // Lancet. 1991.
Vol. 338. P. 642-643.
Bandmann O. The GTP-cyclohydrolase I gene in atypical parkinsonian patients: A clinico-genetic
study // J. Neurol. Sci. 1996. Vol. 141. P. 27-32.
Belyaeva O.V., Balanovsky O.P., Ashworth L.K. et al. Fine mapping of a polymorphic CA repeat
marker on human chromosome 19 and its use in population studies // Gene 1999. Vol. 230.
N 4. P. 259-266.
Beyer K. A novel point mutation in the GTP-cyclohydrolase I gene in Spanish family with hered-
itary progressive and dopa responsive dystonia // J. Neurol. Neurosurg. Psichiatry, 1997.
Vol. 62. P. 420-421.
Bidichandani S.J.. Ashizawa T.. Patel P.I. The GAA triplet-repeat expansion in Friedreich ataxia
interferes with transcription and may be associated with an unusual DNA structure // Amer.
J. Hum. Genet. 1998. Vol. 62. P. 111-121.
Brais B., Boushard J.-P., Xie Y.-G. Short GCG expansions in the PABP2 gene cause oculophar-
ingeal muscular dystrophy // Nature Genet. 1998. Vol. 18. P. 164-167.
Cambien F., Alhenc-Gelas F., Herheth B. et al. Familial resemblance of plasma angiotensin-
converting enzyme level, the Nancy study // Amer. J. Hum. Genet. 1988. Vol. 43.
P. 774-780.
Cambien F., Poirier O., LecerfL. et al. Deletion polymorphism in the gene for angiotensin-con-
verting enzyme is a potent risk factor for myocardial infarction // Nature. 1992. Vol. 359.
P. 641-644.
Cavalli-Sforza L.L. The DNA revolution in population genetics // TIG 1998. Vol. 14. N 2.
P. 60-65.
Cavalli-Sforza L.L., Piazza A. Human genomic diversity in Europe: A summary of recent research
and prospects for the future // Europ. J. Hum. Genet. 1993. Vol. 1. P. 3-18.
Chuang L.M.. Chiu K.C.. Chiang F.T. et al. Insertion/deletion polymorphism of the angiotensin
I-converting enzyme gene in patients with hypertension, non-insulin-dependent diabetes
mellitus, and coronary heart disease in Taiwan // Metabolism. 1997. Vol. 46, N 10.
P. 1211-1214.
366
Davies J. D., Yamagata H., Shelbourne P. Comparison of the myotonic dystrophy associated
CTG repeat in European and Japanese populations // J. Med. Genet. 1992. Vol. 29.
P. 766-769.
Dean M., Carrington M., Winkler C. et al. Genetic restriction of HIV-1 infection and progression
to AIDS by a deletion allele of the CKR5 structural gene // Science. 1996. Vol. 273.
P. 1856-1862.
Djian P. Evolution of simple repeats in DNA and their relation to human disease // Cell. 1998.
Vol. 94. P. 155-160.
Doi Y., Yoshizumi H., Yoshinari M. et al. Association between a polymorphism in the angiotensin-
converting enzyme gene and microvascular complications in Japanese patients with NIDDM //
Diabetologia. 1996. Vol. 39, N 1. P. 97-102.
Engel W.K.. Kurland L.T., Klatzo I. An inherited disease similar to amyotrophic lateral sclerosis
with a pattern of posterior column involvement: an intermediate form? // Brain. 1959. Vol. 82.
P. 203-220.
Gacy A.M. et. al. Influence of hairpins on template reannealing at trinucleotide repeat duplexes:
A model for slipped DNA // Biochemistry. 1998. Vol. 37. P. 9426-9434.
Gellibolian R., Bacolla A., Wells R.D. Triplet repeat instability and DNA topology: an expansion
model based on statistical mechanics // J. Biol. Chem. 1997. Vol. 227. P. 16793-16797.
Ghosh S., Collins F.S. The geneticist’s approach to complex disease // Annu. Rev. Med., 1996.
Vol. 47. P. 333-353.
Grzeszczak W., Zychma MJ., Lacka B., Zukowska-Szczechowska E. Angiotensin 1-converting
enzyme gene polymorphisms, relationship to nephropathy in patients with non-insulin-
dependent diabetes mellitus // J. Amer. Soc. Nephrol. 1998. Vol. 9. P. 1664-1669.
Gurney M.E., Pu H., Chiu A.Y. et al. Motor neuron degeneration in mice that express a human Cu,
Zn superoxide dismutase mutation // Science. 1994. Vol. 264. P. 1172—1175.
Gutierrez C., Vendrell J., Pastor R. et al. Angiotensin I-converting enzyme and angiotensinogen
gene polymorphisms in non-insulin-dependent diabetes mellitus. Lack of relationship with
diabetic nephropathy and retinopathy in a Caucasian Mediterranean population //
Metabolism. 1997. Vol. 46. P. 976-980.
Gusella J.F., MacDonald M.E. Trinucleotide instability: a repeating theme in human inherited dis-
orders // Annu. Rev Med. 1996. Vol. 47. P. 201-209.
Elaberlandt W.F. Aspects genetiques de la sclerose laterale amyotrophique // World Neurol. 1961.
Vol. 2. P. 356-365.
Harper P.S. Myotonic dystrophy. 2nd ed. L.; Philadelphia: Saunders, 1989.
Hayashi K., Yandell D.W. How sensitive is PCR-SSCP? Ц Hum. Mutat. 1993. Vol. 2. P. 338-346.
Hegele R.A., Brunt H., Connelly Ph.W. Genetic and biochemical factors associated with variation
in blood pressure in genetic isolate // Hypertension. 1996. Vol. 27. P. 308-312.
HibberdM.L., Millward B.A., Demaine A.G. The angiotensin I-converting enzyme (ACE) locus is
strongly associated with age and duration of diabetes in patients with type I diabetes //
J. Diabetes Complications. 1997, Vol. 11. N 1. P. 2—8.
Hixson J.E., Powers P.K. Detection and characterization of new mutations in the human
angiotensinogen gen <AGT) // Hum. Genetics. 1995. Vol. 96. P. 110-112.
Hunley T.E., Julian B.A., Phillips J.A. III. Angiotensin converting enzyme gene polymorphism:
Potential silencer motif and impact on progression in IgA nephropathy Ц Kidney Int. 1996.
Vol. 49. P. 571-577.
Husquinet H., Franck G. Hereditary amyotrophic lateral sclerosis transmitted for five generations
// Clin. Genet. 1980. Vol. 18. P. 109-115.
Ichinoe H., Blau N., Matalom R., Nagatsu T. Genomic organization of mouse and human GTP
cyclohydrolase I genes and mutations found in human gene // Pteridines, 1995. Vol. 6.
P. 104-107.
Ichinose H., Ohye T., Takahashi E. Hereditary progressive dystonia with marked diurnal fluctua-
tion caused by mutations in the GTP cyclohydrolase I gene // Nat. Genet. 1994. Vol. 8.
P. 236-241.
Ularioshkin S.N., Ivanova-Smolenskaya I.A., Tanaka H. et al. Clinical and molecular analysis of a
large family with three distinct phenotypes of progressive muscular dystrophy // Brain. 1996.
Vol. 119. P. 1895-1909.
367
Illarioshkin S.N., Markova E.D., Slominsky PA. et al. The GTP cyclohydrolase I gene in
Russian families with dopa-responsive dystonia // Arch. Neurol. 1998. Vol. 55, N 6. P.
789-792.
Imbert G., Kretz C., Johnson K., Mandel J.L. Origin of the expansion mutation in myotonic dys-
trophy // Nat. Genet. 1993. Vol. 4. P. 72-76.
Iwai N., Shimoike H., Ohmichi N., Kinoshita M. Angiotensinogen gene and blood pressure in the
Japanese population // Hypertension. 1995. Vol. 25. P. 688-693.
Jeffreys A J.. Wilson V., Thein S.L. Hypervariable minisatellite regions in human DNA // Nature.
1985. Vol. 314. P. 67-73.
Jeffery S., Malik A.K.S., Crosby A. et al. A dominant relationship between the ACE D allele
and serum ACE levels in a Ghanaian population // J. Med. Genet. 1999.Vol. 36.
P. 869-870.
Jeffreys A J., Tamer M., Debenham P. The efficiency of multilocus DNA fingerprint probes for
individualization and establishment of family relationships determined from extensive case-
work // Amer. J. Hum. Genet. 1991. Vol. 48, N 5. P. 824-840.
Jeon B.S. Dopa-responsive dystonia: A syndrome of selective negrostriatal dopaminergic deficien-
cy // J. Korean Med. Sci. 1997. Vol. 12. P. 269-279.
Jeunemaitre X., Lifton R.P., Hunt S.C. et al. Absence of linkage between the angiotensin
converting enzyme locus and human essential hypertension // Nat. Genet. 1992. Vol. 1.
P. 72-75.
Julien J.P., Cote F. Mice overexpressing the human neurofilament heavy gene as a model of ALS //
Neurobiol. Aging. 1995. Vol. 16. P. 487^-90.
Kamitani A.., Rakugy H., Higaki J. et al. Enhanced predictability of myocardial infraction in
Japanese by combined genotype analysis // Hypertension. 1995. Vol. 25. P. 950-953.
Kang U.J. The effect of CTP cyclohydrolase 1 on tyrosine hydroxilasc expression: implications in
DOPA-responsive dystonia // Adv. Neurol. 1998. Vol. 78. P. 319-324.
Kasai K„ Nakamura Y.. White R. Amplification of a variable number of tandem repeal locus
(pMCT118) by PCR and its application to forensic science // J. Forensic Sci. 1990. Vol. 35,
N5. P. 1196-1200.
Kayser M., Roewer L., Hedman M. et al. Characteristics and frequency of germline mutations at
microsatellite loci from the human Y chromosome, as revealed by direct observation in
father/son pairs // Amer. J. Hum. Genet. 2000. Vol. 66, N 5. P. 1580-1588.
Kimura S., Mullins J J., Bunnemmann B. High blood pressure in transgenic mice carrying the rat
angiotensinogen gene // EMBO J 1992. Vol. 11. P. 821-827.
Klein C„ Brin MF., de Leon D. et al. De novo mutations (GAG deletion) in the DYT1 gene in two
non-Jewish patients with early-onset dystonia // Hum. Mol. Genet. 1998. Vol. 7, N 7.
P. 1133-1136.
Klesert T.R., Otten. A.D., Bird T.D. Trinucleotide repeat expansion at the myotonic dystrophy
locus reduces expression of DMHAP//Nat. Genet. 1997. Vol. 16. P. 402—406.
Koide R., Ikeuchi I., Onodera O. Unstable expansion of CAG repeat in hereditary dentatorubral-
pallidoluysian atrophy (DRPLA) // Ibid. 1994. Vol. 6. P. 9-13.
Kotelevtsev Yu.V.. Clauser E., Corvol P.. Souhrier F. Dinucleotide repeat polymorphism in human
angiotensinogen gene // Nucl. Acids Res. 1991. Vol. 19. P. 6978.
Lees J.F., Shneidman P.S., Skuntz S.F. The structure and organization of the human heavy neuro-
filament subunit (NF-H) and the gene encoding it // EMBO J. 1998. N 7. P. 1947-1955.
Markova E.D., Slominsky P.A.. Illarioshkin S.N. et al.A novel mutation in the GTP cyclohydrolase
I gene associated with a broad range of clinical presentations in a family with autosomal dom-
inant dopa-responsive dystonia // Europ. J. Neurol. 1999. Vol. 6, N 5. P. 605-608.
Martinson J.J., Chapman N.H., Rees D.C. et al. Global distribution of the CCR5 gene 32 -basepair
deletion // Nat. Genet. 1997. Vol. 16. P. 100-103.
Menard J., El Amrani A.-L, Savoie F., Bouhnik J. Angiotensinogen: an attractive and
underrated participant in hypertension and inflammation // Hypertension. 1991. Vol. 18.
P. 705-706.
Miruiri S., Hemmi H., Kumanomidou H. Decreased renal ACE mRNA levels in healthy subjects
with II ACE genotype and diabetic nephropathy // J. Am. Soc. Nephrol. 1997.Vol. 5.
P. 115A.
368
Nagi D.K., Mansfield M.W., Stickland M.H., Grant PJ. Angiotensin converting enzyme (ACE)
insertion/deletion (I/D) polymorphism, and diabetic retinopathy in subjects with IDDM and
NIDDM // Diabet. Med. 1995. Vol. 12. P. 997-1001.
Nei M. The theory of genetic distance and evolution of human races // Jap. J. Hum. Genet. 1978.
Vol. 23. P. 341-369.
Nelson D.L. Six human genetic disorders involving mutant trinucleotide repeats // Genome Anal.
1993. Vol. 7. P.1-24.
Nestor P., Dennet X.. Day B. Proximal myotonic myopathy: A report of a kindred // J. Clin.
Neurosci. 1990. Vol. 5. P. 218-220.
Neville C.E., Mahadevan M.S., BarceloJ.M., Korneluk R.G. High resolution genetic analysis sug-
gests one ancestral predisposing haplotype for the origin of the myotonic dystrophy mutation
// Human Molec. Genet. 1994. Vol. 3. N 1. P. 45-51.
Nygaard T.G., Marsden C.D., Duvoisin R.C. Dopa-responsive dystonia // Adv. Neurol. 1988.
Vol. 50. P. 377-384.
Nygaard T.G. Dopa-responsive dystonia // Curr. Opin. Neurol. 1995. Vol. 8. P. 310-313.
Ozelius L., Kramer P.L., Moskowitz C.B. Human gene for torsion dystonia located on chromosome
9q32-q34 // Neuron. 1989. Vol. 2. P. 1427-1434.
Ozelius LJ., Hewett J. W., Kramer P. et al. Fine localization of the torsion dystonia gene (DYT1)
on human chromosome 9q34: YAC map and linkage disequilibrium // Genome Res. 1997a.
Vol. 7, N 5. P. 483-494.
Ozelius LJ., Hewett J .W., Page C.E. et al. The early-onset torsion dystonia gene (DYT1) encodes
an ATP-binding protein // Nat. Genet. 1997b. Vol. 17. P. 40-48.
Pearson C.E., Eischler E.E., Lorenzetti D. Interraptions in the triplet repeats of SCA1 and FRAXA
reduce the propensity and complexity of slipped strand DNA (S-DNA) formation //
Biochemistry. 1998. Vol. 37. P. 2701-2708.
Pearson C.E., Sinden RR. Trinucleotide repeat DNA structures: dynamic mutations from dynam-
ic DNA // Curr. Opin. Struct. Biol. 1998 Vol. 8. P. 321-330.
Pearson C.E., Wang Y.H., Griffith J.D., Sinden R.R. Structural analysis of slipped-strand DNA
(S-DNA) formed in (CTG)n. (CAG)n repeats from the myotonic dystrophy locus // Nucl.
Acids Res. 1998. Vol. 26. P. 816-823.
Pfohl M., Frost D., Koch M. et al. Lack of association between the insertion/deletion polymor-
phism of the angiotensin-converting-enzyme gene and diabetic nephropathy in IDDM
patients // Horm. Metab. Res. 1998. Vol. 30. N 5. P. 276-280.
Pogoda T.V., Krakhmaleva N.A., Lipatova N.I. et al. High incidence of 550delA mutation in
LGMD 2 patients from Russia // Human Mutation. 2000. Vol. 15, N 3. P. 295-301.
Popova S. N., Slominsky PA., Pocheshnova E.A. et al. Polymorphism of trinudeotide repeats in
loci DM, DRPLA and SCA1 in East European populations Trinudeotide repeat polymor-
phism in East Europe // Europ. J. Hum. Genet. 2001. Vol. 9. P. 829-835.
Ranum L.P.W., Rasmusen P.F., Benzow KA. Genetic mapping of a second myotonic dystrophy
locus // Nat. Genet. 1998. Vol. 19. P. 196-198.
Renges H.H., Peacock R., Dunning A.M. et al. Genetic relationship between the З'-VNTR and
diallelic apolipoprotein В gene polymorphisms: haplotype analysis in individuals of
European and south Asian origin // Ann. Human Genet. 1992. Vol. 56. P. 11-33.
Rich N. et al. Electromyography of rapid forearm flexion and extension and aging // Intern. J.
Aging, and Hum. Develop. 1990. Vol. 31. P. 11-29.
Richards R.I. Simple repeat DNA is not replicated simply // Nat. Genet. 1994. Vol. 6. P. 114-116.
Richards R.L, Sutherland G.R. Dynamic mutation: possible mechanisms and significance in
human disease // Trends Biochem Sci. 1997. Vol. 22. P. 432^136.
Rosen D.R., Siddique T., Patterson D. Mutations in Cu/Zn superoxide dismutase gene are associ-
ated with familial amyotrophic lateral sclerosis // Nature. 1993. Vol. 362. P. 59-62.
Rothstein J.D., Bristol LA., Hosier B. et al. Chronic inhibition of superoxide dismutase pro-
duces apoptotic death of spinal neurons //Proc. Nat. Acad. Sci. USA. 1994. Vol. 91. P. 4155—
4159.
Rutledge D.R., Browe C.S., Kuhilis P.S., Ross E.A. Analysis of two variants of the angiotensino-
gen gene in essential hypertensive African-Americans // Amer. J. Hypertens. 1994. Vol. 7.
P. 651-654.
369
Sajantila A., Lukka M., Syvanen A.-C. Experimentally observed germline mutations at human
micro- and mini-satellite loci // Europ. J. Hum. Genet. 1999. Vol. 7, N 2. P. 263-266
Sajantila A., Salem А-H., Savolainen P. et al. Paternal and maternal DNA lineages reveal a bot-
tleneck in the founding of the Finnish population // Proc. Nat. Acad. Sci. USA. 1996. Vol. 93,
N21. P. 12035-12039 .
Semino O., Passarino G., Oefrier PJ. et al. The genetic legacy of Paleolithic Homo sapiens sapi-
ens in extant europeans: A Y chromosome perspective // Science. 2000. Vol. 290, N 5494.
P. 1155-1159.
Siddique T., Nijhawan D., Hentati A. Molecular genetic basis of familial ALS // Neurology. 1996.
Vol. 47. P. 27-34.
Siddique T., Pericak-Vance M.A., Brooks B.R. et al. Genetic linkage analysis in familial amy-
otrophic lateral sclerosis // Abstr. Cytogenet. and Cell Genet. 1989. Vol. 51. P. 1080.
Silveira I., Countinho P., Maciel P. Analysis of SCA1, DRPLA, MJD, SCA2 and SCA6
CAG repeats in 48 Portuguese ataxia families // Amer. J. Med. Genet. 1998. Vol. 81.
P. 134-138.
Skvortsova V.E, Lumhorska S.A., Slominsky Р.А. et al. Sporadic ALS associated with the D90A
Cu, Zn superoxide dismutase mutation in Russia // Europ. J. Neurol. 2001. Vol. 8.
P. 167-172.
Slominsky P.A., Markova E.D., Shadrina M.J. et al. A common 3-bp deletion in the DYT1 gene in
Russian families with early-onset torsion dystonia // Hum. Mutat. 1999. Vol. 14, N 3.
P. 269-272.
Slominsky P.A., Shadrina M.E, Kondratyeva E.A. et al. Cu, Zn-superoxide dismutase gene in spo-
radic amyotrophic lateral sclerosis patients from Russia: Asp90Ala(D90A) mutation and
novel rare polymorphism IVS3+35 A > C // Ibid. 2000. Vol. 16, N 3. P. 227-228.
Spenser P.S., Kishy G., Smith R. // Handbook of ALS. N.Y.: Acad, press, 1992. P. 575-587.
Spitsyn V.A., Khorte M.V., Pogoda T.V. et al. Apolipoprotein В З’-VNTR polymorphism in the
Udmurt population // Hum. Hered. 2000. Vol. 50, N 4. P. 224-226.
Steinberger D. High penetrance and pronounsed variation in expressivity of GCH-1 mutations in
five families with DOPA-responsive dystonia // Ann. Neurol. 1998. Vol. 43. P. 634-639.
Summers K.M. Relationship between genotype and phenotype in monogenic diseases, revelance to
polygenic diseases // Hum. Mutation. 1996. Vol. 7. P. 283-293.
Tanaka H. The gene for hereditary progressive dystonia with marked fluctuation maps to chro-
mosome 14q // Ann. Neurol. 1995. Vol. 37. P. 405^108.
Tarnow L., Cambien F., Rossing P. et al. Angiotensinogen gene polymorphisms in IDDM patients
with diabetic nephropathy // Diabetes. 1996. Vol. 45. P. 367-369.
Thony B., Blau N. Mutations in the GTP cyclohydrolase I and 6-pyruvoyl-tetrahydropterin syn-
thase genes // Hum. Mutat. 1997. Vol. 10. P. 11-20.
Tiret L., Bonnardeaux A., Poirier O. et al. Synergistic effects of angiotensin-converting enzyme
and angiotensin-П type 1 receptor gene polymorphisms on risk of myocardial infarction //
Lancet. 1994. Vol. 344. P. 910-991.
Tiret L., Rigat B., Visvikis S. et al. Evidence from combined segregation and linkage analysis that
a variant of the angiotensin-I-converting enzyme (ACE) gene controls plasma ACE level //
Amer. J. Hum. Genet. 1992. Vol. 51. P. 197-205.
Tishkoff S.A., Goldman A., Calafell F. et al. A global haplotype analysis of the myotonic dystro-
phy locus: implications for the evolution of moder humans and for the origin of myctonic dys-
trophy mutations // Amer. J. Hum. Genet. 1998. Vol. 62. P. 1389-1402.
Togari A., Ichinose H., Matsumoto S. et al. Multiple mRNA forms of human GTP cyclohydrolase
I // Biochem. and Biophys. Res. Commun. 1992. Vol. 187, N 1. P. 359-365.
Trocoso J.C., Gilbert M.R.. Muma N.A., Smith R. // Handbook of ALS. N.Y.: Acad, press, 1992.
P. 543-554.
Walker W.G., Whelton P.K., Saito H., Hermann J. Relation between blood pressure and renin,
renin substrate, angiotensin II, aldesterone and urinary sodium and potassium in 574 ambula-
tory subjects // Hypertension. 1979.Vol. 1. P. 287-291.
Wilkins L.E., Winter R.M., Myer E.C., Nance W.E. Dominantly inherited amyotrophic lateral
sclerosis (motor neuron disease) // Med. Coll. Va. Quart. 1977. Vol. 13, N 4.
P. 182-186.
370
Wyman A., Wolfe L., Botstein D. Propagation of some human DNA sequences in bacteriophage
lambda vectors requires mutant Eslierichia coli hosts // Proc. Nat. Acad. Sci. USA. 1985.
Vol. 82, N 9. P. 2880-2884.
Xu Z., Cork L.C., Griffin J.W., Cleveland D.W. Increased expressions of neurofilament subunit
NF-L produces morphological alterations that resemble the pathology of human motor neu-
ron disease // Cell. 1993. Vol. 73. P. 23-33.
Yang Y., Merrill D.C., Thompson M.W. et al. Functional expression of human angiontensinogen
gene in transgenic mice // J. Biol. Chem. 1994. Vol. 269. P. 32497-32502.
Zeman W. Dystonia: an overview // Adv. Neurol. 1976. Vol. 14. P. 91—103.
Zilher N. Inheritance of idiopathic torsion dystonia among Jews I I J. Med. Genet. 1984. Vol. 21.
P. 13-20.
К ст. В.А. Гвоздева
Рис. 1. Четыре нары хромосом дрозофилы обозначены разными цветами. Гетерохроматино-
вые районы обозначены зеленым цветом
А - в делящихся клетках значительная часть хромосомы представлена гетерохроматином; Б — гигант-
ские ноли генные хромосомы в ядрах слюнных желез; гомоло! ичпые хромосомы кон ькл провалы; зна-
чительная часть гетерохроматина удаляется при развитии и дифференцировке клеток слюнных желез
Рис. 3. Структура протяженного гетерохроматинового повтора (60 т. н. п.)
Треугольники, выделенные бледно-розовым, красным и оранжевым цветами, обозначают внедрение
представителей разных семейств рстротранспозонов со сходным механизмом перемещений (ретротранс-
позоны с длинными концевыми повторами). Зеленым и синим цветами обозначена локализация других
ретротранспозонов, не содержащих длинных концевых повторов. Черные прямоугольники показывают
расположение поврежденных повторов Stellate, желтым цветом обозначен фрагмент кластера генов ри-
босомной РНК
РНК-интерференция Косупрессия Подавление экспрессии генов
Stellate
Рис. 4. Механизм РНК-интерференции
Транскрипция обеих цепей Y-повторов обеспечивает образование двухнитевой РНК. Компоненты бел-
ковых комплексов, участвующих в “интерференции” и деградации мРНК, обозначены разноцветными
шариками. Старты транскрипции показаны сломанными стрелками
ген
винкулина
(разорван)
Сателлит
Распространение инактивации
600 т.н.п.
Г етерохроматин
нет инактивации
Рис. 5. Инактивация генов эухроматина Х-хромосомы в случае эу-гетерохроматиновых пере-
строек
Разнокачественные блоки гетерохроматина изображены разными цветами. Ц-центромера. Эухромати-
новый ген, кодирующий винкулин (см. статью В.Е. Алаторцева), разорван в результате эу-гстсрохрома-
тиновой перестройки. Длина горизонтальных стрелок отражает степень инактивации генов. При умень-
шении размеров блока гетерохроматина наблюдается постепенное снижение степени инактивации, пока-
занное вертикальной стрелкой. Инверсия фрагмента гетерохроматинового блока полностью снимает
инактивацию (нижняя строка)
Рис. 6. Нестабильная инактивация гена-репортера w, вызванная прилегающими повторами
Stellate
Участки ткани с резко ослабленной окраской свидетельствуют об инактивации гена. Обнаруживаемая
мозаичная окраска иллюстрирует нестабильность инактивации гена и,+. Рядом изображен глаз мухи с
нормальной равномерной окраской в отсутствие эффекта положения гена
К ст. Е.Г. Пасюковой
U3 RU5
U3 R U5
U3 RU5
U3 RU5
ДКП
Рис. 7. Строение ретровирусов (А) и ретротранспозонов (Б)
U5. К U3 - регуляторные районы длинных концевых повторов (ДКП), стрелка - старт транскрипции,
красная полоса - сайт связывания транспортной РНК, зеленая полоса - полипуриновый тракт, gag, pal,
ellv - гены
Рис. 8. Взаимодействие ретротранспозон - хозяин
Р-ретротранспозон; 1 - встройка ретротранспозона в геном влияет на признаки хозяина, на которые мо-
жет действовать естественный отбор; 2 - ретротранспозон сам регулирует свои жизненный цикл: 3 - ю
ны хозяина регулируют жизненный цикл ретротранспозона
Рис. 9. Локализация ретротранспозона copia на политенных хромосомах дрозофилы
Места локализации указаны стрелками и видны как черные диски на фоне фиолетовой окраски хромосом
К ст. Ю.Я. Шевелева
Чувствительность к ДНКазе I
Рис. 13. Примеры кластерной организации генов млекопитающих
Родственные гены имеют одинаковый цвет, овалы - энхансеры, квадраты или прямоугольни
торы, синие полосы - инсуляторы. В некоторых случаях над кластером указана кривая чув<
сти хроматина к ДНКазе I
Yu
CG13581
Crtp
Инсулятор?
Энхансер? и Инсулятор?
II *
CG13590
CK2$tes Pros28.1B
anon60Da
Рис. 14. Структурная организация кластера семенник-специфичных генов
Гены, входящие в кластер, закрашены зеленым цветом, гены вне кластера нс закрашены. Красные ова-
лы - предсказанные компьютерной программой места связывания ДНК с ядерным матриксом. Указаны
возможные области расположения энхансера и инсуляторов
10Е 14В
СК2$ Pros28.1
Рис. 15. Эволюционная схема возникновения кластера
60D Энхансер |
14В
Pros28.1
□□
CG13581
CK2$tes Pros28.1B
К ст. В.Е. Алаторцева
87В13
Дупликации генов
Повторы сатДНК 1.688
152АЗ.7 Сур4е4 CG17777
tw _ Pf>d 1527V33Cyppd2 рп!7Е2.1 dMetl рех К10 Or2F 25Е83 Vml
ph-d ph-p bcn92waplCyp4dlCyp4d8dNmd3103B4.2mstamstsVbic kz crn 10330 256725E8210146 11715
Igrl CG14053 30B8.330B8.6 25E8.1 25E8.4
I-----1----1-----1----1-----1-----1--—I-----1-----1-----1-----1----1-----1-----1----I-----1----1-----1-----1----1
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 т.п.н
Транскрипты
Рис. 17. Элементы генома в районе 2DF Х-хромосомы дрозофилы
Участки синтеза РНК, определенные в результате исследований отдельных генов района и анализа кло-
нов кДНК, обозначены прямоугольниками. Оранжевым цветом показаны транскрипты, синтезируемые
в направлении слева направо, желтым - по комплементарной цепи. Описания соответствующих генов да-
ны в базе данных FlyBasc (http://flybase.bio.indiana.edu:82/).
Показаны локальные дупликации генов и расположение повторов сатДНК 1.688
Распространение инактивации генов на ~1 м.п.н.
50% -50%
Г етрохроматин
।-------1-------1-------1------1-------1-------1-------1-------1-------1-------1-------1------1
0 10 20 30 40 50 60 70 80 90 100 110 Ш т.п.н
Рис. 20. Инактивация генов района 2DF при приближении к гетерохроматину
Показана область эу-гетерохроматической границы в перестройке Х-хромосомы In(lLR)pn2a. Гены, для
которых были проведены количественные измерения активности, отмечены красным цветом
К ст. И.П. Арман, А.Б. Девина
Рис. 21. Клетки Saccharomyces cerevisiae
Вверху: дрожжевые клетки, активно размножающиеся почкованием; внизу: отдельная пара материнског
(более крупная) и дочерней клеток; на поверхности материнской клетки заметны “шрамы” от предыду-
щих почкований
Аск со спорами
Рис. 22. Жизненный цикл дрожжей Saccharomyces cerevisiae
Гаплоидная клетка содержит набор из п различных хромосом, у диплоидов каждая хромосома гаплоидно! о набора
представлена двумя гомологами (2л). Индивидуальные гаплоидные клетки обладают типом спаривания, или полом;
полов у них два - а и а. Зиготы образуются при слиянии клеток противоположного пола
ПРИРОДНАЯ ХРОМОСОМА ДРОЖЖЕЙ
TEL Ml CEN М2 ARS TEL
YAC
Рис. 24. Рекомбинантные векторы и искусственная хромосома дрожжей
А - природная хромосома и ее основные элементы: TEL - теломера, Ml и М2 - гены-маркеры, ARS - ав-
тономно реплицирующаяся последовательности, CEN - центромера; Б - Yip - кольцевой вектор бакте-
рии, содержащий ген-маркер дрожжей - Ml; В - YRp - в состав Yip включена ARS-последовательность;
Г - YCp - в состав YRp включена CEN-последовательность; Д - YLp - линейный вектор: YRp фланкиро-
ван TEL последовательностями; Е — YAC - в состав YLp включена CEN-последовательность, гены Ml и
М2 расположены по обе стороны CEN и маркируют правое и левое плечи искусственной хромосомы (см.
табл. 1.1)
ДНК
Трансформация сферопластов
Рис. 25. Схема TAR-клонирования: конструирование YAC in vivo
ДНК человека вводят в клетки дрожжей одновременно с двумя линеаризованными векторами, в составе
которых гены дрожжей (Ml и М2) и CEN, а на флангах каждого вектора - TEL- и Alu-последовательно-
сти. YAC образуется за счет процессов гомологичной рекомбинации между Alu-послсдоватслыюстями
(черные блоки) ДНК человека и векторов (Larionov et aL, 1996а)
Рис. 26. Этапы отбора колоний трансформантов с YAC, содержащими ДНК человека, при
TAR-клонировании (Larionov et al., 1996а)
1 - колонии первичных трансформантов; 2 - генетическая селекция; 3 - изоляция YAC методом PFGE;
4 - окраска бромистым этидием и гибридизация с зондом Д1IK человека
LicB
LTRnp-LicB
Рис. 30. Качественное определение активности лихеназы в клетках дрожжей, содержащих
контрольную плазмиду HERV-K LicB и плазмиды HERV-K LTR-LicB
Колонии трех контрольных (плазмида LicB) и трех независимых трансформантов, содержащих плазми-
ду LTR-LicB, инкубировали в течение 3-10 ч на среде с лихенаном. В зависимости от времени инкубации
усиливается ореол свечения вокруг растущих колоний. Контрольные колонии ореола нс образуют
Рис. 27. Гибридизация продуктов Alu PCR ДНК YAC, содержащих HERV-K LTR, с метафаз-
ными хромосомами человека (метод FISH)
Стрелки указывают на сигнал гибридизации
Доза, Гр
Рис. 34. Кривые выживания после 7-облучения диплоидов, гомо-гетерозиготных по мутаци-
ям rad9A и rad53
Кривые соответствуют результатам усреднения экспериментальных значений радиочувствительности
клеток, полученных в каждом случае для 3 штаммов одинакового генотипа; показаны среднеквадратич-
ные ошибки. Для сравнения дана кривая, ожидаемая при аддитивности влияния двух мутаций на радио-
чувствительность клеток
К ст. В.Г. Никифорова
Рис. 36. Модель активного центра (А) и трехмерная структура минимальной РНК-полимера-
зы Thermus aquaticus (Б)
К ст. С.З. Миндлина и др.
гидролиз
р-лактамного
кольца
О „
II ZS\ /СН3
I III Хсн3
nh2 о=с-------N СН—соон
но н
Рис, 37. Инактивация антибиотика ампициллина ферментом р-лактамазой
Ген Ыа на плазмиде - ген, кодирующий р-лактамазу. Красным обозначено интактное
цо ампициллина, синим - гидролизованное кольцо неактивной формы
плазмиды
Рис, 38. Перемещение плазмид из одной бактерии в другую
Розовым кольцом обозначена конъюгативная плазмида
Hg2+ Hg°
Рис. 39. Механизм устойчивости бактерий к неорганическим соединениям ртути (по: Osborn
et aL, 1997)
Описание дано в тексте
Рис. 40. Генетическая организация транспозона Tn501 (Grinsted et al., 1990)
Условные обозначения: неправильные прямоугольники соответствуют генам, заостренные концы ука-
зывают направление транскрипции. Гены mer-оперона закрашены красным: R - ген merR, регулирует ин-
дукцию оперона ионами Hg2+; Т, Р - гены тегТ, тегР, участвуют в транспорте ионов Hg2+ внутрь клетки;
ген тег А, кодирует фермент ртуть-редуктазу, который восстанавливает токсичные ионы Hg2+ до метал-
лической ртути; D - ген merD, участвует в дополнительной регуляции оперона; 1 (orfl), 2 (prf2) - гены с
неизвестной функцией. Гены, необходимые для транспозиции, закрашены зеленым: ген tnpP кодирует
резольвазу и ген tnp/\ — транспозаз'7; res — / ^-область; треугольники на концах транспозона - инвертиро-
ванные повторы
Tn501
•о
Тп5041
Тп5044
Тп5053
Тп5070
и
1 kb
I------1
Рис. 41. Транспозоны устойчивости к ртути различных типов (Kholodii et al., 1995,1997,2000)
Обозначения mer-генов как на рис. 40. Дополнительные гены тег-оперона: С, ген тегС, участвует в
транспорте ионов Hg2+ внутрь клетки; F, ген тегВ, функция неизвестна; гены orfX и W//-858 - гены с не-
известной функцией; sigY - сигмаподобный фактор, входящий в состав шег-оперона Тп5044. Обозначе-
ния генов, необходимых для транспозиции, Тп501, Тп5041, Тп5044 и Тп5070 как на рис. 40. Гены tniA, tniB,
tniO контролируют транспозицию, tniB - резолюцию Tn5053; tnpC, 408 (m/408), 237 (prf23T), orf[, orfQ,
orfP, oX, R — гены с неизвестной функцией, входящие в состав транспозонов
pKLH2
pKLH272
pKLH247
1 kb
Рис. 42. Мозаичный игег-оперон “рКЬН2”-типа
Вверху представлена генетическая организация шег-оперона плазмиды pKLH2 (Kholodii et aL, 1993a).
Внизу - схематически изображена структура мозаичного шег-оперона плазмиды pKLH272 Enterobacter
aqglomerans КН72 и плазмиды pKLH247 Acinetobacter sp. LS47 (Yurieva et al., 1997). Обозначения генов,
как на рис. 40 и 41; вертикальными стрелками отмечено место инвертированного повтора (IR) и res-сай-
та (res). Участки прямоугольников, соответствующие последовательностям pKLH2, заштрихованы, а и
Р - ранее неизвестные последовательности; у - последовательность, гомологичная Тп501
Tn5041
merA
orfY tnpC
Tn5046
Тп5085
Тп5084
Тп5083
Tn5044
Рис. 43. Генетическая организация рекомбинантного транспозона Tn5046 (Mindlin et al., 2001)
Обозначения, как на рис. 41. Участки Тп5046, гомологичные Тп5041, выделены оранжевым; участки
Тп5046, гомологичные Тп5044, - синим
комплекс генов
Рис. 44. Схематическое изображение мозаичной структуры \w5084 и Tn50&3 (Bogdanova et
al., 1998, 2001)
R1 и R2 обозначают гены mctRI и merR2, кодирующие разные белки-регуляторы. ORFs обозначает гены
ог/2, orf3 и ог/4, функции которых не вполне ясны (Wang et aL, 1989; Gupta et al., 1999; ilobman. Brown,
1997; Huang et aL, 1999b).
Bl, B2, ВЗ обозначают гены /??е/В1, /??с/В£ и ше/ВЗ, кодирующие различные органомеркурпат-лпазы:
tnpR, tnpK и tnpA.' обозначают гены, кодирующие резольвазу, транспозазу и фрагмент транспозазы. IRr,
IRt и res обозначают терминальные повторы и предполагаемый гел-сайт 1. Участки, закрашенные синим
и черным на схемах Тп5084 и Тп5083, отличаются от соответствующих участков Тп5085 на 6-10 и 40% со-
ответственно. Участки гена тег А. на схеме Тп5083, закрашенные желтым, отличаются от соответствую-
щих участков Тп5085 на 5-8%
рекомбинация
тег
res}/2
Рис. 45. Гипотетические схемы происхождения рекомбинантных транспозонов (Kholodii et
al., 1993b; Mindlin et al., 2001)
A - возникновение рекомбинантного транспозона в результате транспозиции одного мобильного элемента в
другой, неродственный ему элемент, и последующей внутренней делеции; Б - возникновение рекомбинант-
ного транспозозна в результате специфической рекомбинации по /^-сайтам между родственными транспо-
зонами. тег обозначает тле/'-оперон; tnp\ и tnp2 (tni) - транспозиционные модули взаимодействующих транс-
позонов; res 1 и res2 - соответствующие res-сайты. Концевые повторы обозначены треугольниками
К ст. В.З. Тарантула
Рис. 49. Структура генома вируса иммунодефицита человека типа 1 (HIV-1)
Рис. 46. Предполагаемый механизм перераспределения плазмидных генов с помощью новой
системы резолюции CinH/RS2 (Kholodii, 2001)
1 - слияние плазмидных репликонов с образованием коинтеграта (рекомбинация между /ел-саитами X и
X'); 2 - разрешение коинтеграта с образованием рекомбинантных плазмид (рекомбинация между /тл-сай-
тами Y и Y')
Рис. 50. Динамика роста трансформированных генов tat HIV-1 поликлональных культур кле-
ток PC 12 и Rat-2 в стандартных условиях культивирования
Фиолетовые линии и значки - контрольные культуры клеток, трансфицированные плазмидой с геном
пест, зеленые линии и значки - культуры клеток, трансфицированные геном tat HIV-1, красные линии и
значки - культуры клеток, трансфицированные геном tat HIV-1 и культивируемые в присутствии индук-
тора металлотионеинового промотора (ионов цинка)
Рис. 52. Динамика роста трансформированной геном nef HIV-1 поликлональной культуры
клеток Rat-2 в стандартных условиях культивирования
мРНК лимфомы
(трейсер)
мРНК нормальных клеток
(драйвер)
Обратная транскрипция
с праймером Т1
Поли(А)
Поли(А)
Обратная транскрипция
с праймером Т2
кДНК
Праймер Т1
кДНК
Праймер Т2
Пришивка олиго(dА)
Олиго(йА)
ПЦР с праймером Т2
ПЦР с праймером Т1
Один цикл ПЦР с
праймерами L1 и L2
Праймер L1
Праймер L2
Биотинилирование
Заполнение концов
Лигирование с вектором
Рис. 54. Схема метода вычитающей гибридизации, использованная для выявления лим<|
специфических генов в HIV/SIV-ассоциированных лимфомах
К ст. Л.Е. Андреевой, В.З. Тарантула
Рис. 60. Микроскоп с оптикой интерференционного контраста и микроманипулятор, исполь-
зуемые для микроинъекций экзогенной ДНК в яйцеклетки млекопитающих: общий план
(А), камера с яйцеклетками (Б)
Рис. 61. Микроинъекция экзогенной ДНК в зиготы мыши: зиготы мыши (А), зигота мыши
перед микроинъекцией раствора с экзогенной ДНК (Б)
Рис. 63. Зиготы свиньи до центрифугирования (А), микроинъекция экзогенной ДНК в зиго
ту свиньи после центрифугирования (Б)
Рис. 65. Экспрессия репортерного гена CMV-lacZ в 3-суточных предличипках вьюна после
оплодотворения икринок сперматозоидами, которые предварительно инкубировались в рас-
творе с плазмидой, содержащей этот ген
SD SA
Puc. 66. Общая схема строения ретровирусного вектора, используемого для трансгеноза
LTR - длинные концевые повторы ретровируса, SA - акцепторный сайт сплайсинга, SD - донорный сайт
сплайсинга, - участок, отвечающий за упаковку вируса
Рис. 67. Гистологический анализ костного мозга контрольных и трансгенных мышей Fj-no-
коления с геном ЭПО (бордовые столбики - контрольные мыши, синие - трансгенные)
ПЭ - проэритробласты; БЭ — базофильные эритробласты; ПХЭ - полихроматофильные эритробласты;
НБ-нормобласты; РЦ-ретикулоциты; МК - миелоидные клетки; ЭК - эритроидные клетки; ЛЦ-лим-
фоциты
Рис. 68. Трансгенные эмбрионы вьюна с геном CMV-lacZ через 19 ч после оплодотворения
Рис. 69. Клоны клеток, экспрессирующих ген CMV-lacZ в мышцах 4-суточной личинки вьюна
70. Локализация экспрессии гена CMV-lacZ в 14-суточном эмбрионе мыши
Рис. 71. Поздняя бластоциста козы на 4-е сутки культивирования в среде для ЭСК
Рис. 72. Окраска на щелочную фосфатазу островков клеток козы, подобных эмбриональным
стволовым клеткам
•. 73. Эмбриоидное тело, образованное клетками козы, подобными эмбриональным ство-
клеткам
Рис, 74. Инъекция ЭСК в полость бластоцисты мыши: бластоциста перед инъекцией бласто-
циста с ЭСК внутри бластоцеля (Б)
Б а неоплодотворенная яйцеклетка
зигота перед энуклеацией
проноклеусы
в перенос ядра
перенос ядра
б энуклеация
б энуклеация
микропипетка
блестящая
оболочка
пронуклеусы
в кариопласте
Рис. 77. Схема получения клонированных животных с помощью пересадки ядер
А - реципиент ядра - оплодотворенная яйцеклетка (зигота) на стадии пронуклеусов, а - мыкропипетка
для удаления ядра находится напротив одного из пронуклсусов: б - оба пронуклеуса, окруженные не-
большим количеством цитоплазмы и плазматической мембраной, втянуты в энуклеационную микропп-
петку. в - кариопласт или целая клетка с донорским ядром помещается под блестящую оболочку и сли-
вается с цитопластом путем электрослияния или. например, с помощью инактивированного вируса Сен-
дай Б - реципиент ядра - овулировавший нсоплодотвореннып ооцит, а - ооцит на стадии метафазы вто-
рого мейоч ичсского деления с метафазной пластинкой и веретеном деления на анимальном полюсе: б -
плазматическая мембрана и небольшое количество цитоплазмы, содержащие веретено деления и мета-
фазные хромосомы втягиваются в энуклеационную микропипетку; в - кариопласт или целая клетка с до-
норским ядром помещается под блестящую оболочку и сливается с цитопластом путем электрослияния
или инактивированного вируса Сендай, либо “голое” донорское ядро инъецируется непосредственно в
цитоплазму (Seller, 2000)
К ст. А.И. Николаева
Рис. 78. Альтернативные судьбы молекул экзогенной ДНК после ее переноса в клетки-ми-
шени
А - интеграция с хромосомой клетки-мишени; Б - автономное существование в виде экстрахромосомной
кольцевой ДНК
Копииность
100
50
Время после
трансфекции, (дни)
Рис. 80. Локализация хромосомного ori в локусе гена с-тус и конструкция автономного век-
тора, содержащего ARS-фрагмент этого ori (McWhinney, Leffak, 1990)
А - экзонно-интронная схема гена с-тус с прилегающей 5-областью, содержащей ARS-элсмснт и про-
моторы этого гена. Е - EcoRI, Н - Hindlll. X - Xhol. Красным цветом выделен ARS-элемент размером
2,4 т. п.н. Б - структура рекомбинантной автономной плазмиды pNeo.Мус - 2.4, содержащей ARS-эле-
мент, размером 2,4 т. п.н.. ген пео под контролем ММТ-промо гора и сигнала полиадснилирования SV40.
В - пролонгированное поддержание автономно-реплицирующейся конструкции pNeo.Myc - 2.4 в культу-
ре клеток человека HeLa по сравнению с простой плазмидной конструкцией
Ori P
Белок
EBNA-1
Трансформирующее
действие на клетки-
мишени
Терапевтическое
де не тг.ие на клетки-
МИ1ПСН11
Puc. 81. Структура разработанных автономных векторов, основанных на использовании
ori Р вируса EBV, активируемого вирусным белком EBNA-1 (Krysan et aL, 1989)
Family of repeats - модуль ori, взаимодействующий с ядерным матриксом. Dyad - модуль ori, необходимый
для инициации репликации. EBNA-1 - ген EBV, кодирующий транс-действующий фактор, активирующий
ori. обладающий онкопотенциалом. Гетерологичная кДНК - последовательность вектора, кодирующая
белок, обладающий терапевтическим действием в клетках-мишенях, выбранных для генной терапии
г
Время, дни
Рис. 82. Подход к созданию и характеристики экстрахромосомпого поддержания безопасно-
го автономного вирусного вектора, основанного на модифицированном трансдействующем
вирусном факторе (Cooper et al., 1997)
А - схема полипептидной цепи T-ag с генетическими детерминантами, определяющими его взаимодейст-
вие с белками-супрессорами злокачественной трансформации р53, РВ, а также с ori SV40. Б - модифика-
ция T-ag с помощью замены двух аминокислотных остатков (107 и 402), приводящая к снижению онко-
потенциала за счет потери взаимодействия модифицированного белка с р53 и РВ. В - поддержание ре-
комбинантных автономно-реплицирующихся конструкций, основанных на функции ori SV40 и содержа-
щих гены дикого и модифицированного T-ag (транс-действующего фактора ori) в культуре клеток Рад-
жи. Г - уровень репортсрного продукта гена LacZ, клонированного в модифицированной автономно-ре-
плицирующейся конструкции, регулируемой модифицированным T-ag, по сравнению с вариантом про-
стой плазмидной конструкции
1 Т. II. н.
Рис. 84. Формирование стабильного экстрахромосомного трансгена рг8а тутового шелкопря-
да в результате серии перестроек трансгенов (Николаев и др., 1991, 1993а, б)
А - схема формирования стабильного экстрахромосомного трансгсна в результате серии перестроек
трансгенов при переносе экзогенной ДНК н при передаче по наследству.
Красная линия - ARS-содсржащая область трансгенов и эндогенной экстрахромосомнои ДНК. Желтая
линия - фра! мент клеточной ДНК шелкопряда Б()-ноколсния (желтая линия). Зеленая линия - фрагмент
клеточной ДНК шелкопряда Р^поколения (зеленая линия). Черная линия - фрагмент плазмиды pBR322
(черная линия).
Б - физическая карта рг8а с указанием рестрикционных сайтов. Красная линия - ARS-элсмснт рг8а. Чер-
ная линия - фрагмент последовательности pBR322
A
Рис. 86. Схема перестроек стабильного трансгена шелкопряда после его переноса и переда-
чи по наследству в трансгенных мышах (Николаев и др., 1998)
А - схема последовательных делеций рг8а после переноса ее в зиготу мыши. Del 1 - обнаружена после пе-
реноса рг8а в пронуклеус мышей. Del2 - обнаружена после передачи трансгена по наследству от основа-
телей к мышам Fj-поколения. Del3 - обнаружена после передачи трансгена по наследству от мыши Fr
поколения к мышам Р2-поколения. Красная линия - ARS мыши. Лиловая линия - фрагмент ARS рг8а, де-
легированный на стадии dell, и не требующийся для поддержания автономного статуса трансгенов в мы-
шах. Б - стабильный трансген, обнаруживаемый в мышах Р2-поколения, являющийся образованной in
vivo производной рг8а. Выявление этого трансгена в составе суммарной ДНК трансгенных мышей F2-no-
коления представлено выше (рис. 85). Размеры плазмид и делеций даны в т. п.н.
Sequence
Рис. 88. Обнаружение в автономных трансгенах участков изогнутой ДНК (Nikolaev et al.,
неопубликовано)
А - стабильный экстрахромосомный трансгсн мышей pmyc(H-P) (Sudo et al., 1990), в ARS-элементе ко-
торого ранее было экспериментально показано присутствие участка изогнутой ДНК (Trivedi et al., 1998).
Ь - стабильный трансгсн шелкопряда рг8а (представлена гистограмма части EcoRI-RvuII фрагмента
трансгена). Детектирование участков изогнутой ДНК проведено с помощью программы Bent-lt, разме-
щенной на сайте: www2,icgcb.trieste.it/dna/bend_it.html, согласно которой участок предположительно изо-
гнутой ДНК должен характеризоваться уменьшенным ГЦ-содержанисм и увеличенным свыше 5° углом
поворота двойной спирали в расчете на один виток. Зеленая линия - изогнутая ДНК
Д 1 ctgtttttctcaccacatttttttcattattgtttccttcctcttttaccccagagcctt
61 tttagaaacttttttctgattgattctcccattatattttaatcacatatacactgtgta
121 t r*t я 111 яеяГ at er-t яГ gt яГ яГ <~t гГ.яГ. t rt ata rat, t.aa att aaa aa gtata3 30t t
181 aatqttttattattqcaaaqaatqataaaacaattaaaaattaaattaaaaqqctattga
241 cattttactt aactt gat aactat att ctt agagcaacttttttgaaaat agatttttgt
301 gggtacataagaggcgtctgtgtttatggaataagtgaaatatttttatataggcagaca
361 attcataataatcacagcagggtgaatggagtatccaatgcttcaaacatttatcatttc
421 t ctctgctacatacatcccatttat act attttagttattttataatatataataaatta
481 tcattaacagtagtcatcctattgagctatcgaatactaaat cat att cattttttctaa
841 ctatattttttgtgcccgttagccatctccattttcccccatatgatccagcaatcccac
601 t actgggtatttatccaaaggaaatgaaatcagtatgtcaacaaaatatttacactccca
661 tgtttattgcagcactattcacaatagctaagattt ggaagcaacttaggtgtctaacag
721 atgaatggataaagaaaatatggcacttatacacaatggagtactacttagccataaaaa
781 agaatgagagatcctgtcatttgcaagaacatggatggagetggaggacattatgtteat
8 41 t ggacaacatt aaaccca11gatetgcacatacctaaccacactt gaatetet aggасаa
901 attccacttg gtcat gat gaatgattgttttaatgt gtt ctt
Б
AKS "
OCT 1 сайт
REE- подобный элемент
Изогнутая
ДНК
5’flank ocINF (94%) А / Т MER 27 (77%) LINE 1 (69%)
---------------------------------------------------------------►
О 100 200 300 400 500 600 700 800 900 п.н.
Рис. 89. Генетическая и физическая карта EcoRI-Pvull фрагмента ARS рг8а
А - последовательность нуклеотидов этого фрагмента, на которой выделены: синяя линия - участок изо-
гнутой ДНК, красная линия — ACS-элементы. Б - карта фрагмента с указанием генетических детерми-
нант: MER — повторяющаяся последовательность со ‘средней ' частотой встречаемости в геноме челове-
ка; LINE - повторяющаяся транспозонподобная последовательность генома человека; АТ - участок
ДНК, обогащенный А и Т нуклеотидами; INF (интерферон) — ген человека; Octi — сайт связывания фак-
тора транскрипции/репликации Octi; REE - энхансер репликации
К ст. И.А. Гривенникова и др.
BPS 1
Рис. 92. Схема топологии белка пресенилина-1 человека (Li, Greenwald, 1998)
Трансмембранные домены обозначены римскими цифрами. Серые прямоугольники - дополнительные
гидрофобные домены. Красные горизонтальные стрелки показывают локализацию мутаций M146V и
CHOY, использованных в работе. Вертикальный треугольник обозначает место протеолитическою рас-
щепления белка
К ст. И.А. Гривенникова и др.
Рис. 93. Трансфекция псевдонормальных клеток крысы Rat-2
А - монослой клеток в контрольных вариантах трансфекции плазмидами pBR322, pSV2-neo и pEJdl.
Б - многослойные фокусы морфологической трансформации при трансфекции плазмидой pEJ6.6
К ст. И.А. Гривенникова, Е.С. Мануйловой
Рис. 104. Колонии ЭС клеток мыши на фидерном слое эмбриональных фибробластов, х 40
а - колония клеток линии R1, б - клетки фидерного слоя
Рис, 106, Выявление активности щелочной фосфатазы в культуре ЭС клеток мыши, X 20
а - окрашены колонии, сформированные ЭС клетками; б - неокрашенные клетки фидерного слоя эмбриональных фибробластов. Окраска с
помощью нафтола AS-BI-фосфата и ВВ-красного
Рис. 107. Эмбриоидные тела, образовавшиеся из ЭС клеток на 3-4-е сутки после прикрепле-
ния их к желатиновой дорожке, х 5
а - эмбриоидное тело; б - миграция клеток из эмбриоидного тела
4
Рис. 109. Влияние регуляторных генов nef и tat вируса иммунодефицита человека на проли-
ферацию ЭС клеток мыши in vitro
По оси абсцисс дни культивирования, по оси ординат количество клеток. Зеленые столбики - контроль-
ные клетки. Синие столбики - клетки трансфицированные геном tat. Малиновые столбики - клетки
трансфицированные геном nef
Рис. ПО. Флуоресцентная микрофотография эмбриональных стволовых клеток в культуре,
трансфицированных плазмидой с геном “зеленого белка”. X 100
К ст. С.А. Лимборской, П.А. Сломинского
0,4
0,35
0,3
0,25
0,2
0,15
0,1
0,05
0
Больные ПМС
Случайная выборка
Больные диабетом (II)
Больные ИБС
Больные ПМС
Больные ИБС
Z Больные диабетом (II)
Случайная выборка
Рис. 115. Распределение аллельных вариантов (СА) микросателлитного повтора в 3' нетранс-
лируемом экзоне гена ангиотензиногена в московской популяции в случайной выборке и у
больных различными заболеваниями
Число повторов
СОДЕРЖАНИЕ
Е.Д. Свердлов. Введение ............................................ 5
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА ЖИВОТНЫХ
Введение........................................................... 11
В.А. Гвоздев. Гетерохроматин (структура, молекулярная эволюция и регуля-
торные взаимодействия)........................................ 15
Е.Г. Пасюкова. Механизмы и следствия взаимодействий ретротранспозонов
с геномом хозяина ............................................ 27
Ю.Я. Шевелев. Кластер семенник-специфичных генов у дрозофилы....... 40
В.Е. Алаторцев. Функциональная организация генома дрозофилы: генетиче-
ские элементы в протяженном районе эухроматина ............... 51
* * *
И.П. Арман, А.Б. Девин. Наследственные структуры дрожжей и гены, опреде-
ляющие их митотическую стабильность........................... 61
В .Г. Никифоров. Структурно-функциональные исследования РНК-полиме-
разы ............................................................. 111
С.З. Миндлин, И.А. Басс, Е.С. Богданова, Ж.М. Горленко, Э.С. Каляева,
М.А. Петрова, ЕЯ. Холодий, В.Г. Никифоров. Горизонтальный перенос
генов в природных популяциях бактерий. Гены и транспозоны устойчи-
вости к соединениям ртути ........................................ 124
В .З. Тарантул. Молекулярные механизмы патогенного действия вирусов
иммунодефицита на клетки.......................................... 147
Л.Е. Андреева. В.З. Тарантул. Трансгенные животные: фундаментальные
и прикладные аспекты ........................................ 184
А.И. Николаев. Автономные трансгены и перспективы генной терапии . 218
И.А. Гривенников, И.В. Бобрышева, Н.Б. Варшавер, А.П. Григоренко,
Л.С. Иноземцева, Е.С. Мануйлова. Молекулярные механизмы диффе-
ренцировки, злокачественной трансформации и гибели соматических
клеток млекопитающих in vitro .................................... 248
И.А. Гривенников, Е.С. Мануйлова. Эмбриональные стволовые клетки в изу-
чении функции генов в процессах дифференцировки и развития ....... 290
С.А. Лимборская, П.А. Сломинский. Молекулярная генетика человека: меди-
ко-генетические и популяционные исследования...................... 307
Научное издание
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
Том 1
Утверждено к печати
Ученым советом Института
молекулярной генетики
Российской академии наук
Зав. редакцией Н.А. Степанова
Редактор А.М. Гидалевич
Художник Ю.И. Духовская
Художественный редактор В.Ю. Яковлев
Технический редактор Т.В. Жмелъкова
Корректоры ТА. Печко, ЕЛ. Сысоева, Т.1
Подписано к печати 09.07.2003. Формат 70X100 1/16
Гарнитура Таймс. Печать офсетная
Усл.печ.л. 30,6 + 4,23 вкл. Усл.кр.-отт. 33,2. Уч.-изд.л. 3
Тираж 480 экз. Тип. зак. 4428
Издательство “Наука”
117997 Москва, Профсоюзная ул., 90
E-mail: secret@naukaran.ru
Internet: www.naukaran.ru
Санкт-Петербургская типография “Наука”
199034 Санкт-Петербург, 9-я линия, 12
с Т В О • I