Text
А. А. ЯРОСЛАВЦЕВ
СБОРНИК
ЗАДАЧ
И УПРАЖНЕНИЙ
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Издание четвертое, исправленное
Допущено Министерством высшего н среднего специального образования СССР в качестве учебного пособия для учащихся химнко-технологических техникумов
Мшт 1/0 „ХИМПРОМ*
HJ4I0-T0XBiч8сваг. '
БИБЛИОТЕКА
Москва «Высшая школа» 1979
ББК 24.4 Я76
УДК 543(076)
Рецензент:
канд. хим. наук Г. Ф. Семиколенов (кафедра аналитической химии МГПИ им. В. И. Ленина)
Я
Ярославцев А. А.
Я76 Сборник задач и упражнений по аналитической химии: Учеб, пособие для учащихся техникумов. — 4-е изд., испр. — М.: Высш, школа, 1979.— 224 с., ил.
В пер.: 55 к.
Книга представляет собой сборник систематически подобранных задач и упражнений (около 1500) по основным разде-
лам курса аналитической химии. Каждому разделу предшествуют небольшое теоретическое введение и решение типовых
задач. Третье издание вышло в 1973 г.
20506—184
----------- 232—79 1804000000
001(01)—79
543
ББК 24.4
АНАТОЛИЙ АНАТОЛЬЕВИЧ ЯРОСЛАВЦЕВ
СБОРНИК ЗАДАЧ И УПРАЖНЕНИЙ ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Редактор В. Н. Боранеикова. Художественный редактор Т. М. Скворцова. Переплет художника Ю. Д. Федичкина. Технический редактор Н. В. Яшукова. Корректор М. А. Минкова
ИБ № 1490
Изд. № ХИМ—596. Сдано в набор 08.08.78.
Подп. в печать 05.02.79. Формат 84Х108,/з2- Бум. тип. № 2.
Гарнитура литературная. Печать высокая. Объем 11,76 усл. печ. л.
12,15 уч.-изд. л. Тираж 40 000 экз. Зак. № 1007. Цена 55 коп. Издательство «Высшая школа», Москаа, К-51, Неглннная ул., д. 29/14
Московская типография № 8 Союзполнграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли, Хохловский пер., 7
© Издательство «Высшая школа», 1979
i ОГЛАВЛЕНИЕ Предисловие................................................ 4
Введение.................................................. 5
l Глава I. Общая теоретическая часть курса аналитической хи-। м’ии...................................................14
£ А. Способы выражения концентрации растворов..........14
I Б. Химическое равновесие.............................32
( В. Ионное равновесие.................................41
I Г. Равновесие в насыщенных растворах...................51
[ Д. Комплексные соединения............................62
t
! Глава II. Гравиметрия (весовой анализ)...................67
: А. Весы и взвешивание.................................67
; Б. Расчет навески.....................................72
В. Расчет растворителя и осаждающего реактива.........76
Г. Вычисление потерь при промывании осадка.............81
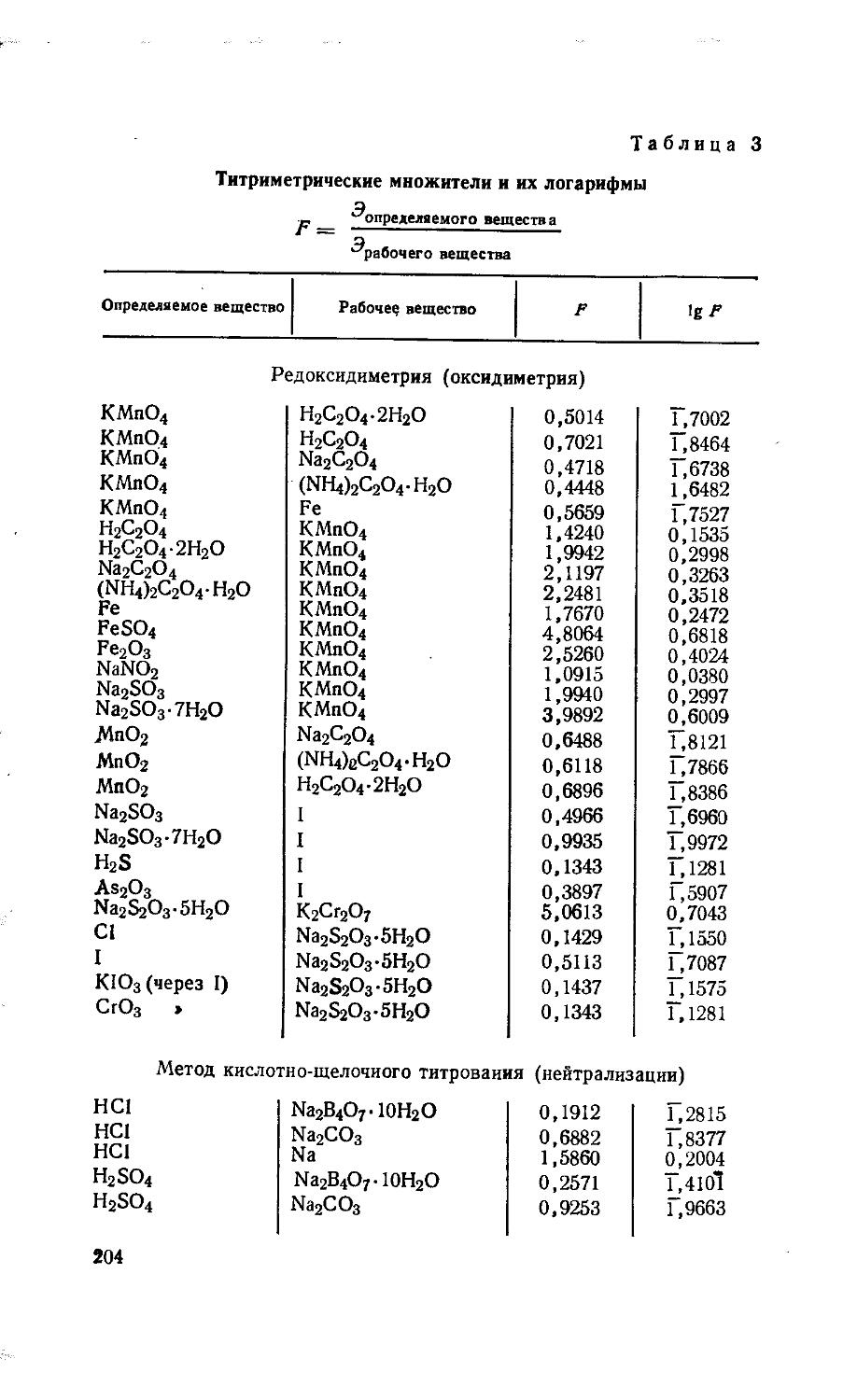
Д. Вычисление факторов (аналитических множителей) . . 83
Е. Вычисление результата гравиметрических (весовых) анализов...............................................85
Ж- Расчеты, связанные с исключением или введением какой-либо составной части ............................. 95
3. Вывод формулы анализируемого вещества...............98
И. Косвенный анализ...................................102
Глава III. Теоретические основы титриметрического (объемного) анализа......................................... 105
А. Расчеты в титриметрическом анализе...............105
Б. Измерение объемов ................................108
В. Способы выражения концентрации рабочего раствора 112
Глава IV. Редоксидиметрия (оксидиметрия).................120
А. Теоретические основы метода окисления — восстановления ...............................................120
Б. Перманганатометрия................................128
В. Иодометрия.......................................144
Глава V. Метод кислотно-щелочного титрования (нейтрализации) ..................................................153
А. Теоретические основы метода........................153
Б. Приготовление и установка титров рабочих растворов . 161
В. Вычисление результатов анализов....................165
Глава VI. Метод осаждения и комплексообразования .... 176
А. Предварительные расчеты и расчеты по установке титров рабочих растворов ............................. 176
Б. Расчеты результатов анализа по данным прямого и обратного титрования..................................180
В. Расчеты результатов комплексонометрических определений ..............................................184
Ответы..................................................187
Приложение........................................ ’ ; 196
3
Предисловие
«Сборник задач и упражнений по аналитической химии» составлен в соответствии с основным принципом педагогики: «от простого — к сложному». Условия задач содержат реальные примеры вычислений, встречающиеся в повседневной работе химиков-аналитиков заводских лабораторий химической, металлургической и других отраслей промышленности. Ответы к задачам вычислены при помощи счетных машин и в соответствии с «правилом запасной цифры». Читатели, пользуясь для вычислений четырехзначными таблицами логарифмов и применяя не достаточно рациональный порядок решения задач, могут получить ответы, несколько отличающиеся от приведенных, но не более чем на пять единиц в четвертом знаке.
При пользовании «Сборником» следует иметь в виду, что номера задач совпадают полностью только в 3-м и 4-м изданиях. Большинство задач «Сборника» во 2-м и 3-м изданиях также имеют одинаковую нумерацию. В книгах 3-го издания добавлены задачи № 63—66 в разделе «В» IV главы и в VI главе введен раздел «В» — «Расчеты результатов комплексонометрических определений», отсутствующий в предыдущих изданиях.
Чтобы предоставить преподавателю широкую возможность выбора материала как для домашних заданий, так и для контрольных работ, все задачи «Сборника» представлены в нескольких вариантах, причем строго выдержана «парность» задач: все задачи с четными номерами аналогичны предыдущим — с нечетными.
Автор выражает глубокую благодарность преподавателю Ярославского химико-механического техникума В. С. Калининой, оказавшей большую помощь в подборе задач для некоторых разделов и в вычислительной работе.
Автор г. Ярославль
Введение
Математический расчет для химика-аналитика — заключительная и решающая стадия работы. Какую бы высокую квалификацию ни имел аналитик и насколько бы точно он ни работал, математическая ошибка, допущенная в вычислениях, сделает бессмысленной всю выполненную, может быть, очень длительную работу. Поэтому техник-аналитик должен помнить, что ошибка в расчете равносильна ошибке в анализе.
Рациональное выполнение вычислений. Для рационального выполнения расчетов нужно хорошо усвоить некоторые математические понятия, определения и правила. *
Число есть выражение количества. Числа бывают точными и приближенными. Точное число является результатом подсчета небольшого числа предметов или результатом вычисления, в котором применялись только точные числа. В расчетах такие числа встречаются сравнительно редко. Примерами их могут служить числа выполненных определений, взятых навесок, мелких единиц, на которые условно разделена крупная единица (1000 мл в 1 л, 60 мин в 1 ч и пр.); атомная и эквивалентная масса изотона углерода 12С в углеродной шкале атомных масс. Приближенное число выражает данную величину не точно, но с некоторой определенной степенью точности, например, результат измерения массы или объема. Результат вычисления, в котором участвуют только приближенные числа или приближенные наряду с точными, есть число тоже приближенное. Верной записью приближенного числа является только такая, которая указывает на его точность.
* Более полные сведения можно найти в книге: В. М. Брадис. Средства и способы элементарных вычислений. Изд-во Акад. пед. наук РСФСР, 1951.
5
Точность числа определяется числом десятичных знаков или числом значащих цифр. Десятичными знаками числа называются все цифры, стоящие вправо от запятой, отделяющей его целую часть. Например, в числе 25,304 три десятичных знака, 10,00008—пять, 734,00 — два.
Значащими цифрами приближенного числа называются все его цифры, кроме нулей, стоящих слева, и тех нулей справа, которые поставлены вместо цифр неизвестных или отброшенных при округлении. Все нули, стоящие в середине числа, являются значащими цифрами. Например, в числе 230,908 шесть значащих цифр, в 0,00014— две, в 167,0000 — три. В последнем случае, если известно, что это число точное, оно будет содержать семь значащих цифр. Таким образом, значащими являются только те нули, которые стоят в точном целом числе или в точной части приближенного числа.
В записи приближенного числа различают цифры достоверные и недостоверные. В записи результата отсчета по шкале правильного измерительного прибора цифры, соответствующие делениям шкалы, считаются достоверными; цифры, соответствующие отсчету между делениями низшего порядка шкалы «на глаз»,— недостоверными. При округлении точного числа оно становится приближенным, и последняя его значащая цифра является недостоверной. Так, если точное число 249 округлить до 250, то полученное число будет приближенным, цифра 2 будет достоверной, а цифра 5 — уже недостоверной. В результатах вычислений достоверны только те цифры, которые получены вследствие арифметических действий над достоверными цифрами. Все остальные цифры недостоверны. Верен такой результат вычисления, в котором все цифры достоверны, кроме одной последней. Верна такая запись отсчета по шкале измерительного прибора, которая содержит только одну недостоверную цифру, соответствующую отсчету «на глаз». Точность результата вычисления не может быть выше точности наименее точного числа, участвующего в вычислении. Наименее точным числом считают то, которое содержит наименьшее количество или значащих цифр — в случае умножения и деления, или десятичных знаков — в случае сложения и вычитания.
Производить арифметические действия имеет смысл только над числами одинаковой точности. Прежде чем приступать к вычислениям, необходимо все числа округ
6
лить по правилу «запасной цифры»: найти наименее точное число, а все остальные числа округлить так, чтобы в них осталось на одную значащую («запасную») цифру больше, чем в наименее точном числе. Округляя, следует придерживаться обычного правила: если первая из отбрасываемых цифр 5 или больше, последнюю оставляемую цифру увеличивают на единицу. В противном случае оставляемые цифры не изменяют. При сложении и вычитании смешанных десятичных дробей наименее точным считают число, в котором меньше всего десятичных знаков. Вычисляют результат только до получения одной запасной цифры, которую затем отбрасывают, округляя последнюю оставшуюся цифру. Окончательный результат должен иметь столько значащих цифр (при умножении и делении) или десятичных знаков (в сложении и вычитании десятичных дробей), сколько их имеет наименее точное число, участвующее в вычислении.
В тех случаях, когда данные для выполнения расчета известны с большой степенью точности, но результат требуется получить очень приближенный, все данные округляют так, чтобы в них осталось на одну значащую цифру (на один десятичный знак) больше, чем их требуется получить в результате. Нельзя вычислять с большей точностью, чем это требуется условиями задачи.
Если приближенное вычисление выполняется с большой степенью точности, то перед результатом ставится знак = (равно); в случае малой точности результата вместо знака равенства ставится знак « (приблизительно равно). Вычисления, выполненные без учета приведенных правил, будут неверными.
Техника вычислений. Вычисления можно выполнять пятью способами: 1) устным; 2) устно-письменным; 3) письменным; 4) с помощью таблиц, графиков, номограмм, логарифмической линейки; 5) с помощью счетных машин. Вычисления малой степени точности следует выполнять устно, устно-письменно или при помощи логарифмической линейки. Умножение и деление многозначных чисел с высокой степенью точности выполняют при помощи таблиц логарифмов или счетных машин. Обычный письменный способ вычисления можно употреблять только: 1) для сложения и вычитания многозначных чисел; 2) для умножения и деления многозначных чисел на числа, состоящие из одной цифры или содержащие одну значащую цифру, отличную от единицы. Пользуясь счет-
7
ними машинами, необходимо округлять все результаты (как конечные, так и промежуточные) в соответствии с изложенными правилами. Нельзя умножать и делить многозначные числа письменным способом и, тем более, сохраняя несколько недостоверных цифр.
Решая аналитическую задачу, ни в коем случае не следует находить числовые значения всех промежуточных расчетов. Вполне достаточно для каждого отдельного действия составить вычислительную формулу, подставить в нее нужные числа, а результат обозначить какой-нибудь буквой, которой и оперировать как числовой величиной в последующих действиях. Дойдя таким образом до последнего действия, следует составить общую вычислительную формулу, произвести сокращения, прологарифмировать и найти окончательный результат. Вычисляя, надо аккуратно вести все записи, располагая их в определенном порядке; цифры писать четко. При сложении и вычитании многозначных чисел особенно важно подписывать их одно под другим так, чтобы цифры каждого разряда располагались по одной вертикальной линии. Для этой цели лучше всего вести вычисления в тетради, разлинованной в клетку.
На листе тетради со стороны бокового обреза отчерчивают вертикальной линией поле в */з ширины страницы. На широкой части страницы записывают условие задачи, вспомогательные данные, взятые из таблиц, и все действия с соответствующими вопросами. Все вычисления следует аккуратно располагать и выполнять только на поле. Такое расположение записей уменьшает возможность ошибок, удобно для быстрой проверки решения и позволяет обходиться без черновиков. Как располагать записи и вычисления, показывают примеры.
В условии первой задачи все данные имеют очень малую точность, ограничивающуюся только одной значащей цифрой, и все необходимые для решения вспомогательные данные необходимо округлить по правилу «запасной цифры», т. е. до двух значащих цифр. Что касается результата, то в нем следует оставить только одну значащую цифру, так как точность результата не может быть больше точности наименее точного числа, участвующего в вычислении. Другими словами, в условиях первой задачи можем только сказать, что требуется около 10 мл раствора H2SO4, поэтому перед полученным результатом и поставлен знак (приблизительно равно), а не знак ра-8
Широкая часть страницы
Поле
Задача . . . (№) Сколько миллилитров 50%-ного раствора H2SO4 потребуется для нейтрализации раствора 9 г едкого кали?
Вспомогательные данные:
Табличные Округленные
Мол. масса H2SO4 98,08 98
» » КОН . . 56,11 56
Плотность 50%-ного раствора H2SO4 . . . 1,395 1,4
Уравнение реакции
2КОН + H2SO4=K2SO4+2Н2О
Решение. 1. Сколько граммов безводной H2SO4 потребуется для нейтрализации 9 г КОН?
2КОН—H2SO4 2-56-98
9 — х
9-98
882=5 880
2. Сколько граммов 50%-ного раствора потребуется для той же цели?
50- 100 „ а-ЮО
а-У =
3. Какой объем займут Ь г 50%-ного раствора H2SO4?
1000 мл — 1400 г ЮОО^ =
z » —ь * 1400 ~
9-98-100 882 880
с =------------- =------а; —
2-56-50-1.4 78,4 78
X56 х1,4 ,224 +56
78,4
880 78 ZZLZT
100
~ 78
22 (ост.)
Задача . . . (№). Рассчитать с наибольшей возможной точностью, сколько миллилитров 50%-ного раствора H2SO4 потребуется для нейтрализации 9,00 г х. ч. КОН.
Вспомогательные данные:
Мол. масса H2SO4 98,08
» » КОН 56,11
Плотность 50%-ного раствора H2SO4 .... 1,395.
9
Продолжение
Широкая часть страницы
Поле
Уравнение реакции:
2КОН + H2SO4 = K2SO4 + 2Н2О
Решение. 1. Сколько граммов безводной H2SO4 требуется для нейтрализации 9,000 г КОН?
2КОН - H2SO4 2-56,11 — 98,08
9,00 -х
9,000-98,08 -----------=а г.
2-56,11
2. Сколько граммов 50%-кого раствора H2SO4 потребуется для той же цели?
50,00 — 100 а-100
a-у У=^ = ЬГ'
3. Какой объем займут b г 50,00 %-ного раствора H2SO4?
1000 мл— 1395 г z » — b »
1000-ь ь
г ~ 1395 ~ 1,395 = С Мл:
9,000-98,08-100
С = 2-56,11-50,00-1,395 = 11 ’27 мл‘
1g 56,11 = 1,7491 +
1g 1,395 = 0,1446
1,8937
Ig 9,000 = 0,9542 +
lg 98,08 = 1,9916
2,9458 ~1,8937
lg x = 1,0521 x = 11,27
венства. Данный пример показывает, как упрощается решение, если применять рациональные методы вычислений. Еще быстрее можно решать подобные задачи с помощью логарифмической линейки или счетной машины. Правда, логарифмическая линейка ограничивает точность результата только двумя-тремя значащими цифрами. Выполняя вычисления, следует помнить, что ошибки в них легко допустить при простом переписывании чисел, чего, по возможности, следует избегать. Так, в приведенном примере после проведения сокращения дроби сначала находят сумму логарифмов чисел знаменателя, затем числителя и, не переписывая ее второй раз, прямо под ней подписывают первую сумму и производят вычитание.
10
Задачи
1, Какими числами — точными или приближенными — можно выразить: а) массу тела; б) число пробирок в штативе; в) число пробирок во всех лабораториях завода; г) число секунд в одном часе; д) число л; е) выражение числа л; ж) объем раствора, измеренный цилиндром; з) объем раствора, измеренный бюреткой?
2. Из приведенных величин выбрать приближенные: а) результат анализа; б) среднее значение нескольких параллельно выполненных анализов одного и того же образца; в) постоянная Авогадро; г) данные таблицы плотностей растворов кислот различных концентраций; д) логарифм точного числа; е) логарифм приближенного числа; ж) валентность элемента; з) данные таблиц атомных и молекулярных масс.
3. Какие числа — точные и какие — приближенные: а) навеска образца 0,5674 г; б) отвешено 5 г хлорида натрия; в) 1 л содержит 1000 мл; г) длина стержня 50 мм?
4. Из приведенных чисел выбрать приближенные и точные: а) атомная масса изотопа углерода 12С 12; б) атомная масса водорода 1,008; в) навеска 12,0056 г; г) выполнено 3 анализа.
5. Как следует записать результат взвешивания 8 г вещества при помощи технических, технохимических и аналитических весов?
6. В три колбы налито по 10 мл раствора: в одну — цилиндром на 1 л, в другую — цилиндром на 25 мл, в третью — бюреткой на 50 мл. Записать объем, налитый в каждую колбу.
7. Число 25,9352 округлить с точностью до пяти, четырех, трех и двух значащих цифр.
8. Масса воды, вмещаемой литровой мерной колбой при 20° С, равна 0,99717 кг. Округлить это число до четырех, трех и двух значащих цифр.
9. Сколько значащих цифр и десятичных знаков в числах: а) 20,0008; б) 0,0025; в) 987,500?
10. Сколько значащих цифр и десятичных знаков в приближенных числах: а) 900; б) 0,2005; в) 5,4000; г) 1,008?
11. Из двух навесок по 5 г каждая приготовлено по 150 мл раствора соли. Для приготовления одного раствора навеска взята на технических весах с чувствительно
11
стью 0,1 г, а для приготовления другого — на аналитических весах. Сколько граммов соли содержится в 50 мл каждого раствора?
12. Кусок проволоки длиной 25,0 см измерен с точностью до 0,1 см. Найти длину 7з части его.
13. Округлить точное число 2090 до сотен. Определить количество значащих цифр в этом числе до и после округления.
14. Масса бюкса с навеской равна 25,0950 г. Какое это число — точное или приближенное? Сколько в нем значащих цифр до и после округления до сотых долей грамма?
15. Для анализа было взято 2,2457 г реактива. Так как этого количества реактива оказалось мало, прибавлено еще 0,5248 и 0,2442 г. Наконец, по ходу работы пришлось добавить еще одну навеску того же реактива, масса которой, взвешенная на технохимических весах, оказалась 0,1 г, масса же ее, взвешенная на аналитических весах, не была записана. Сколько граммов реактива было взято. для анализа?
16. Найти сумму приближенных чисел: 27,9458; 0,4; 2452,35 и 0,0004.
17. При делении приближенного числа 2,5 на точное число 17 получен результат 0,1470588. Какие цифры в этом результате недостоверные? Как надо записать результат?
18. Аналитик, выполнив три параллельных определения зольности образца угля, получил данные: 12,0; 12,2 и 12,3% золы и записал среднее значение: 12,167%. Верна ли такая запись? Как следует записать средний результат?
19. Округлить числа и выполнить расчет по формуле 0,9821-24,36-55,86-500
25,00-1000-0,9
(числа 500 и 1000 — точные).
20. Произвести вычисления с предварительным округлением:
258-0,001-18-0,45
300,28-0,0091 ~
(число 0,001 —точное).
21. Произвести вычисление, сохранив в результате необходимое число цифр:
0,4941-20,23
18,81
12
i 22. Произвести вычисления с наибольшей возможной точностью:
0,0016865-1000
31,607
(1000 — число точное).
23. Какой способ вычисления следует применить для решения задач 19 и 21?
24. Какой способ вычисления следует применить для решения задач 20 и 22?
25. Рассчитать с точностью до двух значащих цифр, какую часть грамм-молекулы составляет 1 г сульфата алюминия?
26. Рассчитать с наибольшей возможной точностью число молекул сульфата меди, содержащееся в 5 г его кристаллогидрата CuSO4-5H2O, если принять постоянную Авогадро, равной 6-Ю23.
27. Рассчитать процентное содержание алюминия в кристаллогидрате KA1(SO4)2- 12Н2О алюмокалиевых квасцов: а) с точность до одной значащей цифры; б) с наибольшей возможной точностью.
28. Рассчитать: а) с точностью до двух значащих цифр и б) с наибольшей рациональной точностью, процентное содержание воды в кристаллогидрате сульфата меди.
Глава!
ОБЩАЯ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ КУРСА АНАЛИТИЧЕСКОЙ ХИМИИ
А. СПОСОБЫ ВЫРАЖЕНИЯ
КОНЦЕНТРАЦИИ РАСТВОРОВ
Концентрация раствора есть число, показывающее, сколько растворенного вещества содержится в весовой или объемной единице раствора. Концентрацию насыщенных растворов принято выражать в граммах безводного вещества на 100 г растворителя. Эта величина при данной температуре является постоянной и называется растворимостью. Существует несколько способов выражения концентрации растворов.
Процентная концентрация. Процентная концентрация раствора есть число, которое показывает, сколько граммов чистого растворенного вещества содержится в 100 г раствора.
Пример 1. Сколько граммов хлорида натрия следует взять для приготовления 80 г 5 %-него раствора?
Решение. Составим н решим пропорцию:
в 100 г раствора содержится 5 г NaCl 80-5
. 80 » » . х. NaCl Х=100'= Г‘
Разность 80—4 = 76 г есть масса растворителя, необходимая для приготовления 80 г 5%-ного раствора из 4 г соли.
Если известны весовые количества растворяемого вещества (а) н растворителя (Ь), то процентную концентрацию раствора (с%) можно определить из пропорции:
а +6 — 100 а-100
х=—— =с%.
а — х а-\-Ь
Молярная концентрация. Молярностью раствора называется число, показывающее, сколько грамм-молекул растворенного вещества содержится в 1 л раствора. Для определения молярности раствора сначала определяют, сколько граммов растворенного вещества содержится в 1 л раствора, а затем найденную величину делят на молекулярную массу растворенного вещества.
14
Пример 2. Сколько граммов CnSOr БНгО потребовалось бы для приготовления 2 л 4 М раствора?
! Решение. Молекулярная масса CuSOvSHsO равна 249,69 (см.
(табл. 1 приложении)', округлим ее до 250. Составим и решим две /пропорции:
/а) для 1 л 1 М раствора требуется 250 г соли 2,- 250
. 2 , 1 М , . х . . Х ~ 1 ~
б) для 2 л 1 М раствора требуется а г соли
. 2 » 4 М . . у . .
а-4
2-250-4
1-1
= 2000
г.
Пример 3. Определить молярность раствора, содержащего 5,0 г безводного сульфата натрия в 150 мл раствора.
Решение. Сколько граммов соли (а) содержит 1 л раствора?
а — 5,0-1000/150.
Определяем молярность раствора, деля найденную величину на молекулярную массу сульфата натрия:
а 5,0-1000
М = — = ---------- = 0,24.
142 150-142
Нормальная концентрация. Нормальностью раствора называется число, показывающее, сколько грамм-эквивалентов растворенного вещества содержится в 1 л раствора. Задачи на определение нормальности раствора решают так же, как и предыдущую, но вместо молекулярной массы растворенного вещества берут его грамм-эквивалент. Выражая концентрацию раствора в г-экв/л, необходимо правильно вычислять эквивалент, так как он может быть различным у одного и того же вещества в зависимости от реакции, в которую оно вступает. Так, чтобы найти эквивалент азотной кислоты в реакции его со щелочью, нужно молекулярную массу разделить на единицу: Э = М/1 (так как реакция сводится только к взаимодействию одного однозарядного иона водорода с ионом гидроксила) . Если же азотная кислота действует как окислитель, восстанавливаясь До NO, то азот в ней меняет степень окисления от +5 до +2 за счет присоединения трех электронов. В этом случае эквивалент азотной кислоты будет равен ’/з молекулярной массы:
Э = Л4/3.
Если азотная кислота в какой-то реакции восстанавливается до аммиака (в котором азот проявляет степень
15
окисления —3, то эквивалент HNO3 будет равен молекулярной массе, деленной на 8, так как (+5) — (—3)=8.
Обычно эквивалент H2SO4 принимают равным половине ее молекулярной массы, т. е. 49,04, так как серная кислота двухосновная. Но это справедливо только для химических реакций, в которых оба ее однозарядных иона водорода вступают во взаимодействие, например в реакции полной нейтрализации:
H2SO4 + 2КОН = K2SO4 -]- 2Н2О
В реакции
H2SO4 + КОН = KHSO4 + Н2О у серной кислоты замещается только один ион водорода, и 5h2so( будет равен молекулярной массе кислоты, т. е. 98,08. И если для второй реакции приготовим, например, 10 н. раствор, содержащий 980,8 г кислоты в 1 л раствора, то этот же самый раствор в случае применения его для первой реакции будет являться уже 20 н. Таким образом, нельзя говорить об эквиваленте вещества и нормальности раствора вообще, а можно говорить об этом только применительно к конкретной химической реакции.
Переход от одной системы выражения концентрации раствора к другим. Перейти от процентной концентрации к молярной или нормальной (и обратно) можно только в том случае, если известна плотность раствора, так как процентная концентрация указывает на содержание вещества в определенном весовом количестве раствора (в 100 вес. ч.), а молярная и нормальная — в определенном объеме (в 1 л). Следовательно, для решения задач подобного рода необходимо пересчитывать массу раствора на объем и объем на массу, что выполняется делением массы (или умножением объема) на плотность данного раствора.
Пример 4. Определить молярность 62%-ного раствора серной кислоты.
Решение. Определить молярность раствора — это значит узнать, сколько молей безводной H2SO4 содержится в 1 л его раствора. Плотность 62%-ного раствора равна 1,520 г/см3 (см. приложение, табл. 9). Следовательно, 1 л раствора серной кислоты весит 1520 г. Отсюда
100 — 62 1520-62
х =-------= а г.
1520 — х 100
Вычислим молярность:
„ о. 1520-62 „
.И =--------------------_ 9>6
мол. масса 190-98
16
Для перехода от молярности (или нормальности) к процентной концентрации необходимо иметь таблицы плотностей растворов различных молярностей (или нормальностей). Выполняя подобные расчеты приближенно, плотность очень разбавленных растворов (порядка 1%) можно считать равной единице, что даст ошибку порядка 1 %
Смешение и разбавление растворов. Если раствор разбавить водой, то его концентрация изменится обратно пропорционально изменению объема. Если от разбавления объем раствора увеличится в два раза, то его концентрация в два раза уменьшится. То же самое происходит при смешении нескольких растворов; при этом уменьшаются концентрации всех смешиваемых растворов. *
Пример 5. Смешаны 5 мл 1 М раствора вещества А, 3 мл 2 М раствора вещества В н 2 мл 4 М раствора вещества D. Найти концентрацию каждого вещества в растворе после смешения.
Решение. Общий объем раствора после смешения
5 + 2 + 3 = 10 мл.
Следовательно, концентрация нового раствора в отношении каждого из веществ, растворенных в первоначальных растворах, соответственно уменьшится. Если объем раствора вещества А до смешения был 5 мл, а после смешения то же самое количество этого вещества стало находиться уже в 10 мл, концентрация А после смешения уменьшится в два раза:
1-5
[А] =—-- = 0,5М.
Сч 10
_ ® Аналогично изменяются концентрации двух других растворов:
2-3 4-2
[В] = —=0,6М; [D] = —= 0,8М.
При смешении двух растворов одного и того же вещества, но разных концентраций, получается раствор новой концентрации. Если смешать а%-ный раствор с 6%-ным, то получится с%-ный раствор, причем если а>Ь, то а>с>Ь. Новая концентрация ближе к концентрации того раствора, которого при смешении было взято большее количество. Эту закономерность можно назвать законом смешения и формулировать так: количества смешиваемых растворов обратно пропорциональны абсолютным разностям между их концентрациями и кон
* Но абсолютные количества веществ (в г, г-экв, моль) до и после смешивания или разбавления растворов остаются без изменения.
17 i
центрацией получившегося раствора. Закон смешения можно выразить математической формулой:
/”а с-Ь гпв а— с
где /ид и /Ив — количества растворов А и В, взятые для смешения; а, Ь, с — соответственно концентрации растворов А, В и раствора, полученного в результате смешения. Надо помнить, что если концентрации выражены в процентах, то количества смешиваемых растворов нужно брать в единицах массы; если же в моль/л или г-экв/л, то количества смешиваемых растворов можно выражать только в литрах.
Чтобы вычислить соотношения, в каких следует взять два раствора известных концентраций для получения раствора заданной концентрации, пользуются так называемым правилом креста. Пользуясь этим правилом, две прямые линии располагают «косым» крестом. В центре креста пишут ту концентрацию, которую требуется получить. У концов линий слева — концентрации исходных растворов: большую — сверху, меньшую — снизу. У концов линий креста справа — искомые количества растворов, которые получаются вычитанием по направлению линий из большей величины меньшей.
Пример 6. В каком отношении следует смешать 90%-ный раствор H2SO4 с 10%-ным, чтобы получить 40%-ный раствор?
Решение. По правилу креста находим
90. х30
юХзо
40 - 10 = 30
90 - 40 = 50
Таким образом, следует взять 30 вес. ч. 90%-ного раствора и прибавить к ним 50 вес. ч. 10%-ного.
В общем виде схема решения задач по правилу креста имеет вид
/(<:-*) =/иА b/ \(а-с) = тв
Если в задаче требуется узнать, какие количества растворов данной концентрации следует взять, чтобы получить заданное количество раствора новой концентрации, то сначала определяют (как в предыдущем примере) отношение тА : отв, а потом делят заданное количество пропорционально этому отношению.
18
Пример 7. Какие весовые количества 90%- и 10%-ного растворов серной кислоты нужно взять, чтобы приготовить 1600 г 40%-ного раствора?
Решение. Сначала, так же как в примере 6, находим, что отношение гпа' «в =30 : 50. Затем делим 1600 на две части пропорционально этому отношению:
1600-30
тК ~ 30 + 50
= 600
г;
1600-50 тв ~ 30 + 50
= 1000 г.
т. е. нужно взять 600 г 90%-ного и 1000 г 10%-ного раствора.
Пример 8. Сколько граммов 90%-ной серной кислоты нужно добавить к 500 г 10%-ной кислоты, чтобы получить 70%-ный раствор?
Решение. Пользуясь правилом креста, находим:
70 - 10 = 60
90 — 70 = 20
90. .60
,о>™<2о
Таким образом, на 20 г 10%-ного раствора надо взять 60 г 90%-кого раствора. Но по условию имеем 10%-ного раствора не 20, а 500 г. Поэтому составляем и решаем пропорцию:
20 — 60 500-60
х =——— = 1500 г.
500 — х 20
Если в задачах подобного рода концентрации даны в процентах, а количества растворов — в объемах, то последние необходимо перевести в весовые единицы, помножив объемы растворов на их плотности, взятые из таблиц.
Пример 9. Какие весовые количества 25%- и 95%-ного раствора серной кислоты нужно смешать, чтобы получить 1 л 50%-ного раствора?
Решение. Находим соотношение весовых частей, в которых нужно смешать растворы:
25
45
I 50 - 25 = 25
I 95 — 50 = 45
Но взяв 25 и 45 г исходных растворов, получим только 70 г 50%-ного раствора, тогда как по условию нужно получить 1 л его, весящий 1395 г (пл. 1,395). Чтобы узнать, сколько граммов исходных растворов следует взять для получения этого количества 50%-ного раствора, нужно 1395 разделить на две части в отношении 25 : 45. Для этого составим две для 95%-ного раствора — из 25 г получим 70 . х , . 1395
пропорции:
1395-25
-------= 498 г;
70
для 25%-ного раствора — из 45 г получим 70 г . У . . 1395 .
1395-45 „„„
У = —77— — 897
а 70
г.
19
Если количества исходных растворов требуется выразить в миллилитрах, то найденные весовые количества нужно разделить на плотности этих растворов:
498 897
-----= 271,5 мл; --------— 761,5 мл.
1,834 1,178
Практически подобные вычисления выполняют приближенно.
Задачи на разбавление растворов чистым растворителем можно также решать на основании закона смешения, применяя правило креста. В этих случаях чистый растворитель считают за второй раствор с концентрацией 0.
Пример 10. Сколько воды нужно прибавить к 100 г 25%-иого раствора аммиака, чтобы получить 5%-ный раствор?
Решение. Пользуясь правилом креста, определяем соотношение количеств исходного раствора и воды:
2^\5/5 m25°/<,NH, 5
о/ \20 т воды 20
Далее, как в примере 8, определяем количество воды, необходимое для приготовления раствора:
При решении задач, в которых концентрации растворов выражены в моль/л или г-экв/л, исходят также из закона смешения, но количества растворов выражают в литрах или его долях.
Пример 11. Сколько миллилитров 0,5 М и 0,1 М растворов следует взять для приготовления 1000 мл 0,2 М раствора?
Решение.
v0>5 1 1000-1 „
_ 250 мл.
0,5. .0,1 )о,2< »0,1 3 и 4
од/ Х),3 1000-3
»0,1 — =750 4 МЛ.
Пример 12. Сколько граммов 25%-ного раствора КОН нужно прибавить к 400 мл воды, чтобы получить 15%-ный раствор?
Решение. По правилу креста найдем, что 25%-ный раствор и воду нужно смешать в соотношении
25. .15 15 з
у15< —— или —.
О/ \ц) Ю 2
Составим и решим пропорцию:
на 2 г воды требуется 3 г 25%-ного раствора 400-3 , 400 , , х » 25%-ного . 2
20
Пример 13. Сколько миллилитров воды следует прибавить к 1000 мл 1,120 и. раствора серной кислоты, чтобы получить точно 1 н. раствор?
Решение. Пользуясь правилом креста, составим и решим пропорцию:
1,120. /1 1 — 0,120 1000-0,120
>1( х =-------------= 120 мл.
0z ч),120 1000 — х 1
Тот же результат можно получить простым рассуждением. В 1 л раствора содержится 1,120 г-экв вещества. Если бы это количество содержалось в 1120 мл, то раствор оказался бы точно 1 и. (так как тогда в 1 л его содержался бы 1 г-экв), что и требуется по условию. Следовательно, к 1 л данного раствора, чтобы он стал точно 1 н„ надо прибавить недостающие 120 мл воды.
Пример 14. Сколько миллилитров воды и соляной кислоты (пл. 1,19) необходимо для приготовления 12,0 л 2 и. раствора?
Решение. Сначала определим нормальность раствора НС1, предварительно узнав по табл, приложения, что он содержит 38% НС1, и зная, что 1 л его весит 1190 г:
в 100 г раствора — 38 г НС1 38-1190
х =--------= а г.
. 1190 . » — х . НС1 100
Следовательно, нормальность 38%-ного раствора НС1 равна
а 38-1190
36,47 ~100-36,47
где 36,47 — молекулярная масса НС1.
Далее по правилу креста определим, в каких объемных соотношениях следует взять воду и 12,4 н. раствор НО, чтобы получить раствор заданной концентрации:
12’4\2/2
О/ Ч10,4
vhci______2______1_
v,. п 10,4 5,2'
Но взяв 1 л раствора НС1 и 5,2 л тогда как по условию нужно и решим пропорции: л раствора НС1 пл.
» » НС1 »
из 5,2 л воды
.У. .
12,0 х= = 1,9 6,2
раствора, Составим
из 1
воды, получим только 6,2 л приготовить 12,0 л 2 и. НС1.
1,19 получится 6,2 л 2,0 н. НС1 1,19 , 12,0 . 2,0 н. НС1
получится 6,2 л 2,0 н.
, 12,0 , 2,0 и.
5,2-12,0 ,
л и У = —= Ю,1 л.
Пользуясь правилом креста при решении задач на смешение растворов, концентрации которых выражены в моль/л или г-экв/л (или при смешении таких растворов с водой), необходимо учитывать, что практически точные результаты могут получаться только в случае незначи-
21
тельной разницы в плотностях исходных и получающихся растворов. Так, в вычислениях, связанных со смешением ~37 н. H2SO4 (пл. 1,836) с большим количеством воды, ошибка может достигать почти 5%.
Задачи
Процентная концентрация
1. Сколько граммов хлорида натрия потребуется для приготовления 400 г 15%-ного раствора?
2. Сколько граммов хлорида аммония потребуется, чтобы приготовить 1,6 кг 10%-ного раствора?
3. Чему равна процентная концентрация раствора, полученного растворением 7,5 г нитрата натрия в 42,5 г воды?
4. В 100 г воды растворено 15 г хлорида натрия. Чему равна процентная концентрация раствора?
5. В 100 мл спирта (пл. 0,80) растворено 8,5 г иода. Чему равна процентная концентрация раствора?
6. Растворимость иода в 95%-ном спирте 14,8 г на 100 г спирта. Чему равна процентная концентрация насыщенного раствора?
7. Сколько граммов воды потребуется для растворения 12 г хлорида натрия, чтобы получить 5%-ный раствор?
8. Сколько миллилитров спирта (пл. 0,80) потребуется для приготовления из 5,0 г 10%-ного раствора иода?
9. Сколько граммов поваренной соли, имеющей 15% влажности, требуется для приготовления 1000 г 20%-ного раствора?
10. Сколько граммов 60%-ного раствора едкого кали и воды потребуется, чтобы приготовить 500 г 10%-ного раствора?
11. Сколько граммов технического едкого натра, содержащего 97,00% NaOH, потребуется для приготовления 1500 г 10,00%-ного раствора NaOH?
12. Сколько граммов технического едкого натра, содержащего 75% NagO, потребуется для приготовления 600 г 15%-ного раствора NaOH?
13. Сколько граммов кристаллогидрата сульфата меди потребуется для приготовления 50 г 8%-ного раствора?
14. В 300 г раствора содержится 10% безводной соды. Сколько граммов десятиводного кристаллогидрата кар-22
боната натрия потребовалось для приготовления этого раствора?
15. Требуется приготовить 250 г 3,0%-ного раствора буры. Сколько граммов десятиводного тетрабората натрия и воды необходимо для этого?
16. Сколько граммов воды потребуется для приготовления 10%-ного раствора из 35 г двухводного кристаллогидрата хлорида бария?
17. Сколько граммов безводной серной кислоты содержится в 20,00 мл 50,00%-ного раствора?
18. Сколько граммов НС1, HNO3 и H2SO4 соответственно содержится в 1 мл концентрированных кислот: соляной (пл. 1,19), азотной (пл. 1,40) и серной (пл. 1,836)?.
19. В одном объеме воды при 20° С растворяется 0,878 объема (приведенного к нормальным условиям — н. у.) СОг. Найти процентную концентрацию насыщенного при 20° С раствора этого газа в воде.
20. В одном объеме воды при 20° С растворяется 702 объема аммиака (н. у.). Чему равна процентная концентрация насыщенного при 20° С раствора его в воде?
21. В одном объеме воды при 20° С растворяется 2,58 объема сероводорода (н. у.). Чему равна процентная концентрация насыщенного при 20° С раствора его в воде?
22. В 100 г воды при 20° С растворяется 11,3 г SO2. Чему равна процентная концентрация раствора?
23. В 60 г воды растворено 10 г хлорида калия. Найти процентную концентрацию раствора.
24. В 30 г воды растворено 3 г иодида калия. Чему равна процентная концентрация раствора?
25. В 90 г воды растворено 10,0 г ВаС12-2Н2О. Вычислить процентное содержание ВаС12 в растворе.
26. В 50 г воды растворено 5,0 г нитрата натрия. Найти процентную концентрацию раствора.
27. В 60 г воды растворено 20 мл 40%-ной фосфорной кислоты (пл. 1,254). Чему равна процентная концентрация раствора?
28. К 1000 г 80 %-ной уксусной кислоты прибавлено 3 л воды. Найти процентную концентрацию раствора.
Молярная и нормальная концентрации
29. Чему равен эквивалент серной кислоты в реакциях: а) полной нейтрализации; б) неполной нейтрализа-
23
ции; в) восстановления до свободной серы, до сероводорода?
30. Чему равен эквивалент азотной кислоты в реакциях: а) нейтрализации; б) восстановления до NO2, до NO, до аммиака?
31. Вычислить эквивалент сероводорода в реакциях: а) нейтрализации; б) окисления до свободной серы, до SO2, до серной кислоты.
32. Вычислить эквивалент SO2 в реакциях: а) с двумя молекулами едкой щелочи; б) окисления до серной кислоты; в) восстановления до свободной серы.
33. Чему равен грамм-эквивалент перманганата калия в реакциях: а) обмена; б) восстановления до манганата, до МпО2, до иона Мп2+?
34. Чему равен эквивалент хромата калия в реакциях: а) обмена; б) восстановления до Сг3+?
35. Чему равен грамм-эквивалент железоаммониевых квасцов NH4Fe(SO4)2-12Н2О в реакциях: а) на ион аммония; б) на ион железа; в) на сульфат-ион?
36. Чему равен грамм-эквивалент хлорного железа (III) в реакциях: а) обмена; б) восстановления до F2+?
37. Чему равен грамм-эквивалент дихромата калия в реакциях; а) обмена; б) восстановления до Сг3+?
38. Чему равен грамм-эквивалент кристаллогидрата сульфата железа (II) FeSO4-7H2O в реакциях: а) обмена; б) окисления до Fe3+?
39. Чему равен эквивалент соли Мора r(NH4)2Fe(SO4)2-6H2O в реакциях: а) на ион NH^; б) на ион Fe2+; в) окисления железа до Fe3+?
40. На сколько надо разделить молекулярную массу каждого из следующих веществ, чтобы вычислить эквивалент в реакциях взаимодействия с серной кислотой: Na2O, Ре20з, Ва(ОН)2, Саз(РО4)2, имея в виду получение во всех случаях нормальных солей?
41. Чему равен эквивалент кристаллогидрата щавелевой кислоты Н2С2О4-2Н2О в реакциях: а) обмена; б) окисления перманганатом калия до СО2?
42. Чему равен грамм-эквивалент хлорида олова (II) в реакциях: а) обмена; б) окисления?
43. В 250,0 мл раствора серной кислоты содержится 1,226 г моногидрата. Определить молярную и нормальную (для полной нейтрализации) концентрации раствора.
44. В 600,0 мл раствора содержится 11,76 г ортофос-форной кислоты: Определить: а) молярность; б) нормаль-24
ность для полной и неполной (диссоциация по I и II ступеням) нейтрализации раствора.
45. В 1 мл раствора содержится 20 мг CuSO4. Найти молярность и нормальность раствора (для обменных реакций) .
46. Навеска безводного карбоната натрия 10,600 г растворена в мерной колбе на 500 мл; вода долита до метки. Чему равны молярность и нормальность (для полной и неполной нейтрализации) раствора?
47. Чему равны молярная и нормальная концентрации кислот (имеющих одинаковую пл. 1,14): а) серной; б) соляной; в) азотной?
48. Определить нормальную (для полной нейтрализации) концентрацию следующих кислот: а) серной (пл. 1,836); б) азотной (пл. 1,400); в) соляной (пл. 1,189).
49. Определить нормальность (для реакции нейтрализации) раствора, имеющего плотность 0,910 и содержащего 24 масс. % NH3.
50. Определить молярную и нормальную (для полной и неполной нейтрализации) концентрации раствора, содержащего 18% Н3РО4 (пл. 1,100).
51. Сколько граммов серной кислоты содержится в 1 мл 0,1000 н. раствора?
Примечание. В дальнейшем, если при обозначении нормальности отсутствует ссылка на конкретный тип реакции, то следует считать, что имеется в виду реакция обмена, или полная нейтрализация, или та реакция, которая для данного вещества является специфичной (например, для КМпО4 — реакция окисления какого-либо вещества в кислой среде с восстановлением Мп7+ до Мп2+).
52. Сколько граммов хлористого водорода содержится в 200 мл 0,005 н. НС1?
53. Сколько граммов кристаллогидрата сульфата меди выкристаллизуется из 5 мл 0,200 н. раствора?
54. Сколько граммов кристаллогидрата карбоната натрия выкристаллизуется из одной капли 0,100 н. раствора (объем капли 0,05 мл)?
55. Сколько миллиграммов ионов Na+ содержится в 10,00 мл 0,2000 и. раствора NaCl?
56. Сколько миллиграммов ионов СН содержится в 1,00 мл 0,500 н. НС1?
57. Вычислить процентную концентрацию 15 и. NH4OH (пл. 0,898).
58. Какова процентная концентрация 6 н. НС1 (пл. 1,098)?
25
59. Определить процентную концентрацию 6 н. растворов следующих кислот: а) серной (пл. 1,18); б) азотной (пл. 1,19); в) уксусной (пл. 1,043).
60. Определить процентную концентрацию и молярность 1,9 н. Н3РО4 (пл. 1,031).
61. Сколько граммов едкого натра (х. ч.) потребуется для приготовления 500 мл 0,10 н. раствора?
62. Сколько граммов безводной соды (х. ч.) потребуется для приготовления 500 мл 0,100 н. раствора?
63. Сколько граммов буры (х. ч.) потребуется для приготовления 250 мл 0,050 н. раствора?
64. Сколько граммов ледяной уксусной кислоты потребуется для приготовления 2 л 2 н. раствора?
65. Сколько литров хлористого водорода (н. у.) надо растворить, чтобы получить 10,00 л 0,100 н. раствора?
66. Сколько миллилитров СОг (н. у.) надо растворить, чтобы получить 500 мл 0,0500 н. Н2СО3?
67. Определить молярную и нормальную концентрации насыщенного при 20° С раствора сероводорода в воде, взяв необходимые данные из справочных таблиц и считая плотность раствора ~1.
68. Определить молярную и нормальную концентрации сернистой кислоты, полученной насыщением воды при 20° С SO2, взяв необходимые данные из справочных таблиц и считая плотность раствора ~1.
69. Сколько граммов 36 %-ной соляной кислоты потребуется для приготовления 5 л 0,2 н. раствора?
70. Сколько граммов серной кислоты (пл. 1,611) потребуется для приготовления 8,00 л 0,300 н. раствора?
71. Сколько граммов азотной кислоты (пл. 1,40) потребуется для приготовления 3000 мл 2,000 н. раствора?
72. Сколько граммов 80%-ного раствора СН3СООН потребуется для приготовления 1500 мл 0,0500 н. раствора?
73. Сколько миллилитров азотной кислоты (пл. 1,31) потребуется для приготовления 3 л 0,5 н. раствора?
74. Сколько миллилитров соляной кислоты (пл. 1,198) потребуется для приготовления 5 л 0,3 н. раствора?
75. Сколько миллилитров 96%-ного раствора H2SO4 потребуется для приготовления 6 л 2 н. раствора?
76. Сколько миллилитров 24%-ного раствора аммиака потребуется для приготовления 2 л 0,5 н. раствора?
77. Сколько миллилитров 2н. HNO3 можно приготовить из 10 мл концентрированной кислоты (пл. 1,430)?
26
78. Сколько миллилитров 0,1 и. Н3РО4 можно приготовить из 1 мл ее раствора, имеющего пл. 1,140?
79. Сколько литров 2 и. NH4OH можно приготовить из 1 л 24%-ного раствора аммиака?
80. Сколько литров 2 н. раствора можно приготовить из 100 мл 96%-ного раствора H2SO4?
81. Сколько миллилитров 0,1 н. H2SO4 можно приготовить из 1 мл олеума, содержащего 85,30% общего SO3 и имеющего пл. 1,897?.
82. Сколько миллилитров 0,5 н. H2SO4 можно приготовить из 10,00 мл олеума, содержащего 30% свободного SO3 и имеющего плотность 1,931?
83. Сколько граммов алюмокалиевых квасцов KA1(SO4)2- 12Н2О потребуется для приготовления 3 л 0,5 н. раствора, если он будет применяться для открытия в нем ионов: а) К+; б) А13+; в) SO4~ ?
84. Сколько граммов соли Мора потребуется для приготовления 2 л 0,5 н. раствора, если он предназначен для открытия в нем ионов: a) NH^; б) Fe2+; в) SO4~ ?
85. Сколько граммов КМпО4 потребуется для приготовления 5 л 0,1 н. раствора, если он предназначается для реакций: а) обмена; б) восстановления до МпО2; в) восстановления до Мп2+?
86. Сколько граммов дихромата калия потребуется для приготовления 2,5 л 0,2 н. раствора, если он предназначается для реакций: а) взаимодействия с AgNO3; б) восстановления до Сг3+?
87. В 1 л раствора содержится 24,11 г железоаммонийных квасцов. Чему равна его нормальность, если он предназначается для: а) открытия в нем ионов NH^ , Fe3+ и SO4- ; б) восстановления до Fe2+?
88. В 200 мл раствора содержится 25,21 г азотной кислоты. Чему равна его нормальность, если он предназначается для реакций: а) обмена; б) восстановления до NO; в) восстановления до NH3?
Примечание. Во всех задачах растворимость веществ дана в граммах на 100 г растворителя (воды) при 20° С.
89. Определить растворимость сульфата кальция в моль/л, если растворимость его 0,200.
90. Определить растворимость сульфата бария в моль/л, если растворимость его 2,3-10~4.
91. Определить молярную концентрацию насыщенно
27
го раствора хлорида серебра, если растворимость его 1,5-10-4.
92. Определить молярную концентрацию насыщенного раствора гидроксида магния, если растворимость его 0,9-10-3.
93. Определить молярные концентрации насыщенных водных растворов хлорида свинца, карбоната бария, сульфата стронция, бромида серебра, воспользовавшись справочными таблицами.
94. Определить молярные концентрации насыщенных водных растворов роданида, карбоната и иодида серебра.
Смешение и разбавление растворов
95. Смешаны равные объемы 0,5 н. раствора хлорида калия и 0,2 н. раствора нитрата натрия. Определить концентрацию каждого вещества после смешения.
96. Смешаны равные объемы 1 н. раствора сульфата цинка, 0,5 н. раствора хлорида магния и 0,3 н. раствора нитрата калия. Определить концентрацию каждого вещества в получившемся растворе.
97. Смешаны 50 мл 0,5 М раствора хлорида бария с 10 мл 0,5 М раствора нитрата магния. Определить концентрацию каждого вещества в получившемся растворе.
98. Смешаны 20 мл 0,3 М раствора бромида натрия с 5 мл 0,8 М раствора хлорида натрия. Определить концентрацию каждого вещества в получившемся растворе.
99. Смешаны равные объемы насыщенного раствора сульфата кальция (0,2 г/100 г НгО) и 0,1 М раствора нитрата стронция. Определить концентрацию (в г-ион/л) ионов стронция и сульфат-ионов в момент смешения.
100. Смешаны 10 мл насыщенного раствора хлорида свинца и 20 мл гипсовой воды. Определить концентрации (в г-ион/л) ионов свинца и сульфат-ионов в момент смешения.
101. В каких весовых отношениях надо смешать 38%-ную соляную кислоту с 10 %-ной, чтобы получить 15%-ную?
102. В каких весовых отношениях надо смешать 24%-ный раствор аммиака с 5%-ным, чтобы получить 10%-ный раствор?
103. В каких весовых отношениях надо смешать 80%-ный раствор серной кислоты с 20%-ным, чтобы получить 60%-ный раствор?
28
104. В каких весовых отношениях следует смешать 15%-ный раствор уксусной кислоты с 3%-ным, чтобы получить 10%-ный раствор?
105. Сколько граммов 96%- и 20%-ного растворов серной кислоты надо взять, чтобы получить 1000 г 40%-ного раствора?
106. По скольку граммов 5%- и 80%-ного растворов азотной кислоты потребуется для приготовления 2 кг 20%-ного раствора?
107. Сколько граммов 90%- и 25%-ного растворов серной кислоты нужно взять, чтобы получить 1000 г 40%-ного раствора?
108. По скольку килограммов 5%- и 25%-ного растворов аммиака потребуется для приготовления 4 кг 20%-него раствора?
109. Сколько граммов 5%-ного раствора соли надо прибавить к 500 г 40%-ного раствора ее, чтобы получить 20%-ный раствор?
ПО. Как приготовить 20%-ный раствор азотной кислоты, если имеется 100 г 50%-ного раствора кислоты и 10%-ный раствор кислоты?
111. Сколько миллилитров 5%- и 30%-ного растворов едкого кали потребуется для приготовления 600 мл 10%-ного раствора?
112. Сколько миллилитров 10% - и 90%-ного растворов азотной кислоты потребуется для приготовления 1500 мл 16%-ного раствора?
113. В каких весовых отношениях надо смешать 62%-ный раствор серной кислоты и воду, чтобы получить 12%-ный раствор?
114. В каких весовых отношениях надо смешать 50%-ный раствор едкого натра с водой, чтобы получить 30%-ный раствор?
115. Сколько граммов воды и 36%-ного раствора соляной кислоты потребуется для приготовления 1000 г 20%-ного раствора?
116. Сколько килограммов воды и 25%-ного раствора аммиака потребуется для приготовления 5 кг 10%-ного раствора?
117. Сколько граммов воды нужно прибавить к 200 г 20%-ного раствора соляной кислоты, чтобы получить 5%-ный раствор?
118. Сколько граммов 96%-ного раствора серной кис
29
лоты нужно влить в 1,00 л воды, чтобы получить 10%-ный раствор?
119. Сколько литров воды нужно прибавить к 1 кг 10%-ного раствора аммиака, чтобы получить 2,5%-ный раствор?
120. Сколько граммов 50%-ного раствора уксусной кислоты потребуется прибавить к 250 мл воды, чтобы получить 12%-ный раствор?
121. Сколько миллилитров воды нужно прибавить к 100 мл 24%-ного раствора аммиака, чтобы получить 5%-ный раствор?
122. Сколько миллилитров воды нужно прибавить к 1,00 л соляной кислоты (пл. 1,189), чтобы получить 18%-ный раствор?
123. Сколько миллилитров воды и 60%-ного раствора серной кислоты нужно, чтобы приготовить 1,00 л 10%-ного раствора?
124. Как приготовить 10 кг 20%-ного раствора азотной кислоты из 67%-ного раствора?
125. Как приготовить 200 мл 30%-ного раствора серной кислоты из 96%-ного раствора?
126. Сколько миллилитров воды и 24%-ного раствора аммиака потребуется для приготовления 1,00 л 10%-ного раствора?
127. Сколько миллилитров воды и 80%-ного раствора уксусной кислоты потребуется для приготовления 5,00 л 3%-ного раствора?
128. Определить процентное содержание аммиака в растворе, полученном путем разбавления 1,00 л 28%-ного его раствора 9,00 л воды.
129. К Ю мл 20%-ного раствора соляной кислоты прибавлено 40 мл воды. Какова процентная концентрация полученного раствора?
130. Сколько миллилитров 50%- и 20%-ного растворов едкого натра потребуется для приготовления 500 мл 40%-ного раствора?
131. В каком отношении нужно смешать 12 н. НС1 с 2 н. раствором, чтобы получить 4 и. раствор?
132. В каких объемных отношениях нужно смешать
6 н. HNO3 с водой, чтобы получить 2 н. раствор?
133. В каких объемных отношениях надо смешать 1 н. раствор уксусной кислоты с водой, чтобы получить 0,05 н. раствор?
30
134. В каких объемных отношениях надо смешать 0,5 и 0,1 н. растворы едкого натра, чтобы получить 0,2 н. раствор?
135. Сколько миллилитров 6 и 1 н. растворов азотной кислоты надо смешать для получения 500 мл 2 н. раствора?
136. Сколько миллилитров 2 и 0,2 н. растворов едкого кали потребуется для получения 1,8 л 0,6 н. раствора?
137. Сколько миллилитров 0,1 н. раствора азотной кислоты надо прибавить к 200 мл 0,5 н. раствора, чтобы получить 0,2 н. раствор?
138. Сколько миллилитров 6 н. раствора соляной кислоты надо прилить к 250 мл 0,3 н. раствора, чтобы получить 0,5 н. раствор?
139. Сколько миллилитров воды надо прибавить к 1,00 л 0,125 н. раствора едкого натра, чтобы получить 0,1000 н. раствор?
140. Сколько миллилитров воды надо прибавить к 10,0 мл 12 н. раствора соляной кислоты, чтобы получить 0,1 н. раствор?
141. Сколько литров воды и 13 н. NH4OH надо взять, чтобы после разбавления водой получить 3 л 4 н. раствора?
142. Сколько литров воды и 2 н. H2SO4 надо взять, чтобы после разбавления водой получить 5 л 0,05 н. раствора?
143. Сколько миллилитров воды и 12 н. H2SO4 нужно взять, чтобы получить 500 мл 20%-ного раствора?
144. Сколько миллилитров воды надо прибавить к 1500 мл 13 н. NH4OH, чтобы получить 14%-ный раствор?
145. Приготовлен 0,100 н. NaCl в мерной колбе на 250 мл. Из нее взято пипеткой 25,00 мл. Сколько граммов NaCl следует прибавить в колбу, чтобы после заполнения ее водой до метки раствор стал 0,2500 н.?
146. Из мерной колбы на 200 мл, в которой приготовлен 0,2500 н. КС1, взято пипеткой 50,00 мл. Сколько граммов КС1 (х. ч.) нужно добавить в эту колбу, чтобы после заполнения водой до метки раствор стал 0,5000 н.?
147. В мерной колбе на 500 мл приготовлен 0,1822 н. Na2CO3. Из этой колбы взято пипеткой 50,00 мл раствора и добавлено 8,0540 г того же реактива (безводного), после чего колба снова долита до метки водой. Найти нормальность получившегося раствора.
31
148. Из мерной колбы на 250 мл, в которой находится 0,0520 н. Na2B4O7 (Эха2в,о7=М : 2), взято пипеткой 50,00 мл и введено в колбу 2,2784 г Na2B4O7-10Н2О. После растворения навески колба доведена до метки водой. Определить нормальность полученного раствора.
149. Приготовлен 0,1200 н. H2SO4 в мерной колбе на 500 мл. Из нее взято пипеткой 25,00 мл, после чего в колбу введено из весовой бюретки 3,4740 г Н25О4(пл. 1,836) . Какова нормальность раствора, полученного после доливания колбы водой до метки?
150. Из мерной колбы на 250 мл, в которой приготовлен 0,09650 н. H2SO4, взято 25,00 мл. Сколько граммов раствора H2SO4 (пл. 1,611) следует ввести в колбу, чтобы после доливания ее водой до метки получить 0,2000 н. раствор?
Б. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Скорость химической реакции измеряется количеством молей продукта реакции, образующегося в единицу времени. Скорость химической реакции зависит от различных внешних условий, но аналитику чаще всего приходится влиять на скорость, изменяя концентрации реагирующих веществ. Зависимость между скоростью химической реакции и концентрациями реагирующих веществ выражается законом действия масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Этот закон предложен Гульдбер-гом и Вааге. Если в реакции участвуют m молей вещества А и п молей вещества В, то скорость v реакции будет равна
v=k[A]m [Bf,
где [А] и [В] — концентрации веществ А и В, моль/л; k — коэффициент пропорциональности.
Этому закону достаточно точно следуют только реакции, протекающие в гомогенной среде — между газами или веществами в растворах. Для реакций, протекающих в гетерогенной среде, можно приближенно считать, что их скорость пропорциональна только концентрации того вещества, которое находится в растворенном или газообразном состоянии.
32
Пример 1. Написать выражение закона действия масс для следующих реакций:
а) Н2 + Вг2 = 2НВг
б) Na2S2O3 + 2HCI = 2NaCl + SO2 + S + H2O .
в) С -| О2 — СО2
Решение.
a) v = *[H2][Br2]
б) v = *[Na2S2O3HHCI]2
в) v = k [О2]
Если в каком-то частном случае концентрация каждого из участвующих в реакции веществ равна 1 моль/л, то v=k. Отсюда вытекает химический смысл коэффициента пропорциональности в выражении закона действия масс: он равен скорости данной реакции в том случае, если концентрация каждого из реагирующих веществ равна 1 моль/л. Величину k часто называют константой скорости химической реакции.
Закон действия масс позволяет решать вопрос о том, как изменится скорость реакции при изменении концентрации всех или некоторых веществ, участвующих в ней.
Пример 2. Во сколько раз изменится скорость реакции взаимодействия водорода с бромом, если их концентрации увеличить в два раза?
Решение. Напишем уравнение закона действия масс для данного случая:
v = k [Н2] [Вг2]
Пусть концентрации водорода и брома до их увеличения равны: [Н2] =а молей и [Вг2] =Ь молей. Тогда
v = kab.
После увеличении концентраций будем иметь
vi = k2.a2b = 4 kab, т. е. после увеличения каждой концентрация в два раза скорость реакции увеличится в четыре раза.
Пример 3. В реакции
Na2S2O3 + 2НС1 = 2NaCl + S + SO2 + H2O
исходные концентрации реагирующих веществ были (в моль/л): [NajSjOajM и [НС1]=2. Как изменится скорость реакции, если концентрацию тиосульфата натрия оставить прежней, а концентрацию кислоты сделать равной 6 моль/л?
Решение. Согласно закону действия масс, до изменения концентрации HCI
v = k [Na2S2O3] [НСI]2 = k-1 -22 = М,
2 Ярославцев А. А. 33
а после увеличения концентрации
v1 = *1.1-62 = *36.
Скорость реакции увеличится в 9 раз.
Пример 4. Как изменится скорость реакции из предыдущего примера, если одновременно увеличить и концентрацию тиосульфата натрия до 3 моль/л?
Решение.
v2 = й-3-62 = k-108.
Скорость увеличится в 27 раз.
Задачи на определение изменения скорости реакции при изменении концентраций реагирующих веществ можно также решать в общем виде без указания конкретных концентраций.
Пример 5. Как изменится скорость химической реакции
А 4- 2В 2D + Е
если концентрацию вещества А увеличить в 2, а В — в 4 раза?
Решение. Обозначим константу скорости реакции через k, концентрацию вещества А — через х, концентрацию вещества В — через у, скорость реакции до изменения концентраций — через г>1, после изменения — через v2. Тогда
хц = kxy?, «2 = Ю.х (ЬуУ2 = ЮхЛЪу2.
Разделив v2 на получим
«2 *2х-16у2
" ” = 1 — оЛ.
«1 kxy2
Скорость реакции увеличится в 32 раза.
Надо помнить, что при смешении растворов в формулу закона действия масс следует подставлять не те концентрации, которые имели растворы до смешения, а те, которые получились после смешения. На это обращалось внимание в примере 5 раздела А (с. 17).
По мере течения химической реакции концентрации исходных веществ уменьшаются, вследствие чего, согласно закону действия масс, уменьшается скорость реакции. Если бы имелась возможность полностью удалять из сферы реакции ее продукты, то скорость реакции в соответствии с правилом Бертолле стремилась бы стать равной нулю, т. е. реакция дошла бы до конца и все исходные вещества полностью превратились бы в конечные продукты. В действительности этого не происходит: продукты реакции, постепенно накапливаясь в сосуде, начинают взаимодействовать между собой, образуя опять исходные вещества. Таким образом, наряду с прямой ре
34
акцией возникает реакция обратная и создается такое состояние системы, которое называется химическим равновесием. Такой химический процесс называется обратимой химической реакцией, которая в общем виде выражается уравнением
mA + nB pD + ?Е
где А и В — исходные вещества; D и Е — конечные вещества; т, п, р и q — коэффициенты.
Химическое равновесие характеризуется неизменностью концентрации всех веществ, равенством скоростей прямой и обратной реакций и кажущейся внешней неизменностью системы. Из закона действия масс, как его непосредственное следствие, вытекает закон химического равновесия: при установившемся химическом равновесии отношение произведения концентраций конечных веществ к произведению концентраций исходных веществ есть величина постоянная, называемая константой химического равновесия:
[D]* (ЕИ _ к
[Л]"* ГВ|"
Этот закон позволяет определить концентрации продуктов реакции в равновесной системе, если известны К и концентрации исходны к веществ.
Пример 6. После установления равновесия реакции A+B^D+E концентрации веществ равны (в моль/л): [А] =0,25, [В] =0,25, [D]=0,75 и [Е]=0,75. Определить К.
Решение. Подставим концентрации в уравнение закона химического равновесия и произведем расчет:
0.75-0,75
К ~ 0,25-0,25
Пример 7. Константа равновесия реакции A+Bs*D+E равна 9. Определить концентрата продуктов реакции D и Е после установления равновесия, если концентрации исходных веществ были (в моль/л); [А] = 1; |В| = 1.
Решение. Пишем уравнение реакции; сверху над формулами веществ показываем их исходные концентрации, а снизу — концентрации при установившемся равнмеии, обозначив неизвестные концентрации через х:
1 тио
А + В z Г> + Е
(1—X) (1— X) X X
Подставив концентрации в уравнение закона хищ|сеского равновесия, получим
------—------= 9,
и
Преобразуем:
8х2 — 18х + 9=0.
Решая это уравнение, получим два значения концентрации х( и х2:Х| = 1,5, х2=0,75. Имея по 1 моль/л исходных веществ А и В, нельзя получить больше 1 моль/л D или Е. Следовательно, значение Х| не удовлетворяет условию задачи, а действительным ответом будет значение х2.
Пример 8. Для реакции A+Bs^D + E взяты 1 л 2 М раствора вещества А и 1 л 4 М раствора вещества В. Найти концентрации веществ D и Е при достижении равновесия, если К=9.
Решение. Сначала определим концентрации веществ А и В после смешения растворов (см. пример 5, с. 17):
2-1 4-1
[А] = — = 1 моль/л; [В] - — = 2 моль/л.
Напишем уравнение реакции с исходными и конечными концентрациями всех веществ:
1 2 0 0
А + В ~D+E (1-х) (2-х) х х
Подставляем эти концентрации в формулу закона химического равновесия:
(1—х)(2 —х)
Преобразуем:
8x2 _ 27х +18=0.
Решая квадратное уравнение, получим Х|=2,46, х2=0,91. Имея только 1 моль/л одного из исходных веществ, нельзя ни при каких условиях получить больше 1 моль/л ни одного из продуктов реакции. Поэтому х не может быть в данном случае больше единицы. Отсюда удовлетворяющим условию будет только х2.
Сравнивая результаты примеров 7 и 8, можно увидеть, что повышение концентрации даже одного только из исходных веществ ведет к повышению концентрации продуктов реакции. В подобных случаях говорят, что увеличивается выход реакции. Выходом реакции называется отношение количества вещества, полученного в результате реакции в данных условиях, к тому количеству вещества, которое получилось бы, если бы реакция дошла до конца. Обычно выход реакции выражают в процентах. Из последних примеров видно, что увеличение концентрации одного из реагирующих веществ в два раза приводит к увеличению выхода с 75 до 91%.
Пример 9. Концентрации исходных веществ А и В в реакции A+B^D + E равны соответственно 2 и 3 МОДь/л. Определить ВЫХОД вещества Е, если А=9, 36
Решение.
2 3 0 0
А + В ~D+E (2-х) (3—х) х х
Отсюда по закону химического равновесия получим
Х1 ------------= 9; 8x2 _ 45х + 54 = 0. -х)(3-х)
Решив уравнение, получим: Xj = 3,89, х2=1,74. В данном случае значение х не может быть больше 2, поэтому удовлетворяет условию только х2. Выход реакции равен
Задачи
1. Написать математические выражения скорости следующих реакций:
2NO + О2 Г 2NO2 (а)
Fe2O3 + ЗН2 2Fe + ЗН2О (б)
2. Написать математическое выражение скорости следующих реакций:
СО -f- С12 7^ СОС12 (а)
N2 + ЗН2 z 2NH3 (б)
NaCl + H2SO4 ~ NaHSO4 + НС1 (в)
. 3. Концентрации веществ А и В, реагирующих по уравнению
A+B-D+E
равны 1 моль/л каждая. Как изменится скорость прямой реакции, если [А] оставить прежней, а [В] увеличить до 2 моль/л?
4. Как изменится скорость прямой реакции
С2Н5ОН + СН3СООН z СН3СООС2Н5 + н2о
если концентрацию этилового спирта увеличить в три раза, а концентрацию уксусной кислоты уменьшить в два раза?
5. Как изменится скорость прямой реакции A + B=ptD, рели концентрации веществ А и В увеличить в три раза?
fi. Как изменится скорость прямой реакции
ЗСНзОН f НзРОз В (ОСНз)з + 3H?Q
37
если увеличить концентрацию метилового спирта с 0,3 до 0,6 моль/л, а концентрацию борной кислоты — с 0,2 до 1,2 моль/л?
7. Как изменится скорость реакции
2А + В z 2D + Е
если {А] уменьшить, а [В] увеличить в два раза?
8. Как изменится скорость реакции
2A + B^2D + E
если [А] увеличить, а [В] уменьшить в два раза?
9.В реакции
A+B^D+E
после установления равновесия [А] увеличена в два раза, a [D] — в четыре раза. В каком направлении сместится равновесие реакции?
10. В каком направлении сместится равновесие реакции
FeCl3 + 3KSCN Z Fe (SCN)3 + ЗКС1
если концентрацию хлорида железа (III) увеличить с 0,1 до 0,3 моЛь/л, а концентрацию хлорида калия — с 0,4 до 1,2 моль/л?
11. В равновесной газообразной системе А2 + 02 X 2АВ
давление газовой смеси увеличено: а) в два раза: б) в четыре раза. Как это повлияет на равновесие системы?
12. Как сместится равновесие реакции
ЗН2 + N2 г 2NH3
протекающей в закрытом сосуде, если давление в нем увеличить в три раза?
13. Равновесие реакции
С2Н5ОН + СНзСООН ^*сн3соос2н5 + Н2О
при некоторых условиях устанавливается тогда, когда концентрации участвующих в ней веществ становятся равными (в моль/л): [С2Н5ОН]=0,25; [СН3СООН] = 0,25; (СН3СООС2Н5]=0,75; [Н20]=0,75. Определить константу равновесия.
14. Исходные концентрации хлорида натрид и серной кислоты в реакции
38
равны соответственно 1 и 2,5 моль/л. После установления равновесия концентрация хлористого водорода стала 0,75 моль/л. Чему равна константа равновесия?
15. Исходные концентрации веществ А и В в реакции 2А + В Z 2D + Е
соответственно равны 1,5 и 2 моль/л. После установления равновесия [А] оказалась равной 20% от первоначальной концентрации. Определить К.
16. В реакции
2СН3ОН + H2SO4 Z (CH3)2SO4 + 2Н?О концентрация метилового спирта равна 2 моль/л, серной кислоты— 1 моль/л. После установления равновесия концентрация диметилсульфата стала 30% от исходной концентрации метилового спирта. Определить К.
17. Константа равновесия реакции
А + В д: D + Е
равна 4. Прямая или обратная реакция имеет большую константу скорости. Во сколько раз?
18. Константа равновесия реакции
A + BzrD + E
равна 0,8. Как относятся между собой константы скоростей прямой и обратной реакций?
19. Равновесие реакции
СО + С12 Г СОС12
устанавливается при концентрациях (в моль/л): [СО] = = 0,55, [С12] = 0,05, [СОС12] = 0,95. Определить исходные концентрации СО и хлора.
20. Равновесие реакции
A + B^2D
устанавливается при концентрациях (в моль/л): [А]=0,35, [В]=0,15, [D]=l,2. Чему были равны исходные концентрации веществ А и В?
21. Константа равновесия реакции
С2Н5ОН + СНзСООН - С2Н5СООСН3 + Н2О
при некоторых условиях равна 4. Чему равна концентрация уксусной кислоты при установившемся равновесии, если исходную концентрацию этилового спирта взять 2 моль/л, а исходную концентрацию уксусной кислоты — 2,8 моль/л?
39
22. В реакций
A+B^D+E
исходные концентрации веществ А и В соответственно равны 0,5 и 0,3 моль/л. Сколько процентов вещества А останется неиспользованным, если константа равновесия этой реакции равна 1,2?
23. Как будет изменяться концентрация вещества D в реакции
A+B^D+E
если К=4 и если при постоянной концентрации вещества А концентрацию вещества В последовательно брать 1, 2, 3 и т. д. моль/л до тех пор, пока реакция станет практически необратимой? Зависимость между [В] и [D] изобразить графически. Вычислять с точностью до 0,01.
24. Константа равновесия реакции
КС1 + H2SO4 KHSO4 + НС1
при некоторых условиях равна 9. Как будет изменяться выход реакции, если при постоянной величине [КС1]= = 2 моль/л, [H2SO4] последовательно брать 1, 2, 3 моль/л и т. д. до тех пор, пока дальнейшее увеличение [H2SO4] перестанет быть выгодным (1 моль полученного хлористого водорода в 10 раз дороже 1 моль затраченной серной кислоты)?
25. Для реакции
A-f-B^D+E
смешаны 1 л 2 М раствора вещества А с 2 л 4 М раствора вещества В. Как изменится скорость прямой реакции, если раствора вещества В взять 3 л?
26. Константа равновесия реакции
A+B^D+E
равна 4. Определить выход продукта реакции D, если для проведения реакции взять 3 л 4 М раствора вещества А и 7 л 2 М раствора вещества В.
27. При 850° С константа равновесия реакции
СО2 -J- н2 со 4- Н2О
равна единице. При каких концентрациях всех веществ установится равновесие, если исходные [СО2]=0,1 моль/л, [Н2]=0,2 моль/л?
28. Сколько СО (в моль/л) получится в результате реакции, приведенной в предыдущей задаче, если исходные [СО2]= 1 моль/л и [Н2]=3 моль/л?
40
29. Для реакции
А+В-D+E
константа равновесия которой равна 6, взято 2 л 3 М раствора вещества А и 3 л 5 М раствора вещества В. Определить выход вещества D.
30. Смешаны 100 мл 0,5 М раствора вещества А с 400 мл 0,3 М раствора вещества В, реагирующих между собой по уравнению:
А+ВДЙ+Е
Определить выход веществ D и Е, если константа равновесия этой реакции равна 5.
В. ИОННОЕ РАВНОВЕСИЕ
Согласно классической теории электролитической диссоциации, созданной в 80-х годах прошлого столетия Сванте Аррениусом, некоторая часть электролита, растворенного в воде, распадается на электрически заряженные частицы — ионы. Эти частицы в растворе проявляют индивидуальные свойства и в отличие от молекул, из которых они получились, могут принимать участие в реакциях. Поэтому скорость химической реакции, протекающей в растворе, определяется концентрацией не всего растворенного вещества, а только концентрацией образовавшихся из него ионов, которые и составляют как бы активную часть всего вещества. Отсюда вытекает важность представления о степени диссоциации. Степенью электролитической диссоциации а называется отношение концентрации вещества, распавшегося на ионы, к общей его концентрации в растворе. Общую концентрацию вещества в растворе часто называют аналитической концентрацией. Процесс электролитической диссоциации в общем виде записывают как уравнение обратимой химической реакции:
АВ - А+ + В-
где АВ — недиссоциированные молекулы; А+ и В-— ионы.
Рассматривая в этом уравнении недиссоциированные молекулы как исходные вещества реакции, а ионы — как ее продукты и применяя закон химического равновесия,
41
получим математическое выражение закона ионного равновесия
[А+] [В-]
[АВ]
Закон ионного равновесия является частным случаем общего закона химического равновесия и читается так: в растворах слабых электролитов при установившемся ионном равновесии отношение произведений концентраций ионов к концентрации недиссоциированных молекул есть величина постоянная, называемая константой диссоциации. Применяя этот закон, можно решать разнообразные задачи, связанные с процессом диссоциации и взаимодействием веществ в растворах слабых электролитов.
Основные положения современной теории электролитической диссоциации. Между ионами электролитов в растворе действуют силы электростатического взаимодействия: притяжения между разноименно заряженными ионами и отталкивания между одноименно заряженными. Эти силы зависят от природы электролита, концентрации его раствора и диэлектрической проницаемости растворителя. Чем меньше силы электростатического притяжения между ионами данного вещества, тем больше возможность взаимодействия этих ионов с ионами других веществ.
Поведение электролита в растворе определяется, собственно, не степенью его диссоциации а, а более реальной величиной, учитывающей все взаимодействия, влияющие на подвижность ионов: отношением активности вещества к его общей концентрации. Это отношение называют коэффициентом активности, и обозначают буквой f:
активность а
f = —--, откуда а = fC.
общая концентрация С
Коэффициент активности, как и а, имеет различные значения, но не больше 1: f^l.
Величины f и и обычно имеют близкие значения. Поэтому, выполняя расчеты, относящиеся к разведенным растворам слабых электролитов, вполне достаточно в уравнение закона ионного равновесия подставить концентрацию ионов, найденную по величине а. Но чтобы подчеркнуть, что в действительности следует пользоваться активностью а, степень диссоциации называют кажущейся, или эффективной.
42
Остановимся на вычислений константы диссоциации. Для определения /Сдисс необходимо в формулу закона ионного равновесия подставить равновесные концентрации ионов и молекул и произвести расчет. Равновесные концентрации всех веществ могут быть определены практически или вычислены на основании кажущейся степени диссоциации.
Пример 1. Концентрации ионов Н+ и СН3СОО~ в 0,1 М растворе уксусной кислоты равны 0,00136 г-ион/л. Определить Кдисс СНзСООН.
Решение. Составим уравнение диссоциации кислоты и напишем их концентрации — сверху исходные, снизу равновесные:
0,1 о о
СНзСООН Н+ + СНзСОО-
0,09864 0,00136 0,00136
Вычислим концентрацию недиссоциированных молекул, вычитая из общей концентрации раствора концентрацию одного из ионов, так как сколько образовалось грамм-ионов каждого иона, столько же молей кислоты
Подставив
Пример 2.
продиссоциировало:
0,1—0,00136=0,09864 моль/л.
найденные величины в формулу, получим
0,00136-0,00136
Кдисс =---------------= 1,88-10-5.
ди с 0,09864
Определить Кдисс уксусной кислоты, если известно,
что кажущаяся степень диссоциации 0,1 М ее раствора равна 1,36%. Решение. Сначала определим концентрацию ионов в данном растворе, приняв его концентрацию (0,1 М) за 100%:
0,1 - 100% х — 1,36%
0,1-1,36 --------= 0,00136 г-ион/л.
100
Затем, как и в предыдущем примере, находим Кдисс.
Зная константу диссоциации вещества, можно решать задачи обратного характера и находить концентрации ионов, находящихся в растворе.
Пример 3. Определить концентрации ионов Н+ и СНзСОО-в 0,2 М растворе уксусной кислоты, если КДИсс = 1,8-10*~5.
Решение. Как и в предыдущем примере, составляем уравнение диссоциации кислоты и пишем концентрации частиц (в моль/л и в г-иои/л), обозначив неизвестные величины через х:
0,2
СНзСООН Д Н+ + сн3соо-(0,2—лг) х х
На основании закона ионного равновесия будем иметь: х2
——------= 1,8-10-5; х?+ 1,8-10-5х-0,36-10-5 = 0.
(0,2 — х)
43
Решив уравнение, поЛучйм х=1,9-10~з г-ион/л. Так как уксуб-ная кислота очень слабая и поэтому диссоциирована мало, величину (0,2 — х) можно считать приблизительно равной 0,2. Тогда полное квадратное уравнение превращается в неполное и решается проще:
Х2 г________
— = 1,8-10-5; X = У3,6-10-6 = 1,9-10-3 г-ион/л.
На основании закона ионного равновесия, зная кон-станту диссоциации, можно определять и кажущуюся степень диссоциации.
Пример 4. Кдисс уксусной кислоты равна 1,8-10-5. Определит кажущуюся степень диссоциации 0,2 М ее раствора.
Решение. Аналогично предыдущему сначала определим, что концентрация ионов в данном растворе равна 1,9-10-3. Затем определим степень диссоциации:
1,9-10-з-ЮО л а =-------—-------= 0,95%.
0,2
Таким образом, зная константу диссоциации, можно находить степень диссоциации раствора любой концентрации, а также определять, во сколько раз изменится при разбавлении кажущаяся степень диссоциации или концентрация ионов данного вещества.
Пример 5. Как н во сколько раз изменится кажущаяся степень диссоциации 0,2 М раствора уксусной кислоты прн разбавлении его водой в 4 раза?
Решение. Найдем по табл. 4 приложения КДИсс уксусной кислоты: 1,8-10~5. Отсюда определим степень диссоциации 0,2 М раствора, как это было сделано в предыдущем примере. Затем найдем концентрацию раствора после разбавления: 0,2:4=0,05 М. Аналогично предыдущему определим концентрацию нонов в растворе:
----=1,8-10-5; х — 9,5-10-4;
0,05
9,5-10-4-100
------ода------= 1’9%'
Разделив 1,9 на а 0,2 М раствора (0,95%), получим
1,9:0,95 =2 раза.
Если в решении этого и предыдущего примеров записать первые равенства в общем виде, заменив концентрацию х иона выражением Со. (произведением концентра-44
ции раствора на степень его диссоциации, выраженную в частях от целого, а не в процентах), то получим
(Са)2
= А/.сс, или, сократив, Cat = /<тасс,
откуда ___
Эта формула применяется для решения задач, аналогичных приведенным, и является выражением так называемого закона разбавления Оствальда для бинарных (диссоциирующих только на два иона) слабых электролитов, для которых величину (1—а) практически можно считать равной единице. Строгое математическое выражение константы диссоциации слабых бинарных электролитов имеет вид
с&С
При решении подобных задач очень часто приходится иметь дело с очень малыми величинами, которые для упрощения вычислений удобно записывать в экспоненциальной форме, т. е. в виде двух сомножителей, одним из которых является 10 в какой-либо отрицательной степени. Делая вычисления, величины, выраженные таким образом, не следует переводить в обычные десятичные дроби с громадным числом нулей. Это только затрудняет расчет и часто ведет к ошибкам. (Такие превращения приходится выполнять только при выполнении действий сложения и вычитания.) Например, уравнение примера 5 нужно решать так:
х2 = 0,05-1,8-10-5 = 5-10-2.1,8-10-5 = 9.10-7;
х = /9-10-7 = /90-10-8 = 9,5-10-4.
Дальнейшие вычисления:
9,5-10-4.100 9,5
Х~ 5.Ю-»
При таком способе вычислений все действия выполняются в уме и записываются только промежуточные результаты. Извлекать корни удобно с помощью логарифмической линейки или таблиц.
В аналитической химии очень часто приходится рассчитывать изменение концентрации ионов в растворе при
45
введении в него электролита, содержащего одноименный ион. Задачи этого типа решают также на основании закона ионного равновесия. В уравнение этого закона подставляют концентрации, получившиеся после введения в раствор второго электролита, имеющего с первым одноименный ион. Искомые концентрации обозначают через х. Если расчеты выполняют приближенно, то обычно исходные концентрации тех ионов, концентрации которых после введения второго электролита сильно увеличиваются, не учитывают.
Пример 6. Определить концентрацию ионов водорода в 0,1 н. СНзСООН, в 1 л которой содержится 8,2 г безводного ацетата натрия.
Решение. Напишем уравнения диссоциации уксусной кислоты и ацетата натрия:
СН3СООН Н+ + сн3соо-
CH3COONa Z Na+ + СН3СОО~
У этих электролитов ион СН3СОО- одноименный. Сначала определим концентрацию ацетата натрия:
8,2:82 = 0,1 моль/л, где 82 — молекулярная масса CH3COONa.
Составим уравнение закона ионного равновесия для уксусной кислоты:
[Н+] [СНзСОО-] [СНзСООН] Лдисс‘
Выясним числовые значения всех имеющихся в формуле величин: [Н+]—искомая величина, которую обозначим через х; [СН3СОО_] равна сумме концентраций этого иона в растворах уксусной кислоты и ацетата натрия. Первую концентрацию можно не учитывать, потому что она по сравнению со второй очень мала, так как уксусная кислота слабая и диссоциирована очень мало, а 0,1 н. раствор ацетата, как всякий раствор малой концентрации большинства солей, диссоциирован очень хорошо. Поэтому [СН3СОО-] можно принять равной его концентрации в 0,1 н. CH3COONa. Рассчитаем эту концентрацию, помножив концентрацию CH3COONa на степень диссоциации, взятую из табл. 5 приложения (для 0,1 и. растворов солей типа А+В-). Следовательно,
[СН3СОО-] = 0,1 0,86 = 0,086 моль/л,
где 0,86 — кажущаяся степень диссоциации солей типа А+ В-, выраженная не в процентах, а в частях от целого; [СН3СООН] = =0,1 моль/л, по условию, а КДисс = 1,8-10-5 (см. табл. 4 приложения).
Таким образом, после подстановки всех величин в формулу будем иметь:
х-0,086
——------= 1,8-10—5; х = 2,1 • 10—5 моль/л.
46
При менее точных расчетах можно не учитывать кажущуюся степень диссоциации введенного электролита, принимая ее за единицу. Тогда решение примера еще более упрощается:
х-0,1
——— = 1,8-10—5, откуда х — 1,8-10—5.
Ответ получается несколько отличающимся от предыдущего, ио достаточной для большинства случаев точности.
Пример 7. Во сколько раз изменится кажущаяся степень диссоциации 0,1 М раствора уксусной кислоты, если в 1 л ее растворить 8,2 г безводного ацетата натрия (изменения объема от введения соли не учитывать)?
Решение. Сначала найдем степень диссоциации 0,1 М СН3СООН так, как это показано в примере 4, илн взяв ее из таблиц. Определим [СН3СОО~] в растворе после прибавления CH3COONa, как это было сделано в примере 6. Определим а 0,1 М раствора кислоты, содержащего 0,1 моль/л ацетата натрия:
Разделив а 0,1 М раствора уксусной кислоты (~1,4%) на найденную величину, получим
1,4:0,021 =67 раз (уменьшение).
Задачи
Примечание. Если для решения задач требуются данные о величинах a, Kwee растворимости, которые отсутствуют в условии задачи, следует пользоваться таблицами в приложении или справочной литературой. Степень диссоциации веществ в растворах малой концентрации, если в условии задачи нет определенных данных, считать равной 100%.
1. Сколько грамм-ионов Н+ и С1_ получится в результате полной диссоциации 1 моля соляной кислоты?
2. Сколько грамм-ионов Na+ и С1_ получится в результате полной диссоциации 2 молей хлорида натрия?
3. Сколько грамм-ионов Н+ и SO4 получится в результате полной диссоциации 1 моля серной кислоты?
4. Сколько грамм-ионов Ва2+ и ОН- получится в результате полной диссоциации 1 моля гидроксида бария?
5. Сколько грамм-ионов А13+ и SO Г получится в результате полной диссоциации 0,01 моля сульфата алюминия?
6. Сколько грамм-ионов Na+ и РО1~ получится в результате полной диссоциации 0,5 моля фосфата натрия?
7. Сколько молей хлорида бария получится при соединении 0,5 г-иона Ва2+ с 1 г-ионом СН?
47
8. Сколько молей хлорида свинца получится при соединении 0,02 г-иона РЬ2+ с 0,04 г-ионом С1_?
9. Сколько молей фосфорной кислоты получится при соединении 0,3 г-иона Н+ с 0,1 г-ионом POl-?
10. Сколько молей фосфата кальция образуется при соединении 0,6 г-иона Са2+ с 0,4 г-ионом РО*-?
11- Эффективная концентрация ионов Н+ в 1 н. НС1 0,78 г-ион/л. Определить кажущуюся степень диссоциации НС1.
12. Определить кажущуюся степень диссоциации сульфата меди в 0,1 М растворе, если эффективная концентрация сульфат-иона в нем 0,04 г-ион/л.
13. Концентрация Н+-иона в растворе, содержащем 3,65 г НС1 в 1 л, равна 0,00009 г-ион/мл. Чему равна кажущаяся степень диссоциации НС1?
14. Определить кажущуюся степень диссоциации гидроксида аммония в 1,028 М растворе, если эффективная концентрация ионов ОН- в нем 0,004112 г-ион/л.
15. Чему равна эффективная концентрация ионов Н+ в 3%-ном растворе уксусной кислоты, если а=0,6%?
16. Чему равна эффективная концентрация иона СНзСОО- в 0,001 М СНзСООН, если а=12,4%?
17. Сколько граммов иона Н+ содержится в 100 мл 0,1 М растворов соляной и уксусной кислот?
18. Сколько граммов ионов Н+, С1~ и недиссоцииро-ванных молекул НС1 содержится в 500 мл 1 М раствора?
19. Сколько граммов иона Na+ содержится в 500 мл 2 М NaOH, если а = 60%?
20. Имеются одинаковые объемы 0,1 М растворов уксусной и синильной кислот. Где больше ионов Н+? Во сколько раз?
21. Сколько граммов и грамм-ионов Ва2+ содержится в 250 мл насыщенного раствора сульфата бария?
22. Определить концентрацию (в г-ион/л и г/л) иона Са2+ в насыщенных при 20° С растворах: а) гидроксида кальция; б) сульфата кальция; в) карбоната кальция?
23. Написать уравнение диссоциации муравьиной кислоты. Составить для нее выражение закона ионного равновесия, обозначив концентрации частиц формулами, заключенными в квадратные скобки.
24. Выполнить задание, аналогичное условию задачи 23, для диссоциации сероводородной кислоты (I и II ступени).
48
25. То же, для гидроксидов аммония, магния и алюминия.
26. То же, для карбоната магния, хлорида свинца и сульфата алюминия.
27. Определить константу диссоциации уксусной кислоты, если кажущаяся степень диссоциации ее в 0,2 М растворе 0,95%.
28. Кажущаяся степень диссоциации 0,001 М НСООН 36,8%. Чему равна КДИСс кислоты?
29. Определить Лдисс азотистой кислоты, если в ее 0,1 М растворе а = 6,6%.
30. По величине а раствора синильной кислоты определить ее Кдисс
31. Определить КДИСс Н2СО3 по I ступени в 0,1 М растворе (а = 0,2%).
32. Хлорноватистая кислота в 0,2 М растворе имеет а = 0,053%. Чему равна Лдисс?
33. Подчиняется ли уксусная кислота закону ионного равновесия, если известно, что а ее растворов различной молярности имеет значения:
М 1 0,5 0,1
а, % 0,4 0,6 1,36
34. Кажущаяся степень диссоциации растворов соляной кислоты различной молярности равна:
М 1 0,5 0,1 0,01
а, % 78 86 92 99,7
Подчиняется ли соляная кислота закону ионного равновесия?
35. Вычислить Кдасс гидроксида аммония по кажущейся степени диссоциации:
М 1 0,5 0,1
а, % 0,43 0,60 1,34
36. Можно ли говорить о константе диссоциации NaOH (и почему?), если известно, что кажущаяся степень диссоциации его растворов имеет следующие значения:
М 1,0 0,5 0,1 0,01
а (в частях от целого) 0,73 0.795 0.92 0,966
37. Определить эффективную концентрацию ионов Н+ В 0,6 М СН3СООН, приняв КДИсс = 1,8-10~5.
49
38. Определить эффективную концентрацию ионов Н+ и NO 2 в 0,2 М HNO2, взяв в таблице Кдисс (см. табл. 4 приложения).
39. Как изменится концентрация ионов ОН- в 0,2 М NH4OH, если его разбавить водой в 5 раз?
40. Во сколько раз изменится концентрация ионов Н+ в 1 М НСООН при разбавлении водой в 4 раза?
41. Сколько граммов ионов Н+ и НСОО- содержится в 250 мл 0,5 М НСООН?
42. Сколько граммов ионов ОН* содержится в 100 мл 0,05 М NH4OH?
43. Вычислить кажущуюся степень диссоциации 0,1 М НСООН.
44. Как изменится кажущаяся степень диссоциации 0,1 М раствора синильной кислоты при разбавлении водой в 10 раз?
45. Кдисс НСЮ равна 4-10~8. Найти кажущуюся степень диссоциации растворов кислоты следующих концентраций: 1 М, 0,5 М, 0,1 М, 0,05 М.
46. Рассчитать степень диссоциации 0,1 М раствора сероводорода по I и II ступеням исходя из Кдисс-
47. Как будет меняться кажущаяся степень диссоциации 0,1 М NH4OH при разбавлении водой до концентраций (в моль/л): 0,05; 0,02; 0,01; 0,008; 0,001?
48. Построить кривую зависимости кажущейся степени диссоциации 0,1 М СН3СООН от разбавления в интервале концентраций от 0,1 М до 0,001 М.
49. Определить концентрацию ионов Н+ в 0,1 М НСООН, содержащем 3,4 г формиата натрия в 1 л.
50. Чему равна концентрация ионов Н+ в 1 М СН3СООН, содержащем в 100 мл 0,41 г безводного ацетата натрия?
51. К 100 мл 0,2 М СНзСООН прибавлено 100 мл раствора ацетата натрия, содержащего 1,64 г безводной соли. Определить концентрацию ионов Н+ в полученном растворе.
52. В мерную колбу на 500 мл введено 4,10 г безводного ацетата натрия и 63,6 мл раствора уксусной кислоты (пл. 1,040). Какую концентрацию ионов Н+ имеет раствор, полученный разведением содержимого колбы водой до метки?
53. Определить кажущуюся степень диссоциации 0,2 М НСООН, в 250 мл которого содержится 1,7 г формиата натрия.
50
54. 2,05 г безводного ацетата натрия растворено в мерной колбе на 250 мл в 0,5 М СНзСООН. Колба долита до метки тем же раствором. Какова кажущаяся степень диссоциации полученного раствора?
55. Во сколько раз изменится кажущаяся степень диссоциации 0,05 М СНзСООН, если к 100 мл его прибавить 0,082 г безводного ацетата натрия?
56. Во сколько раз изменится кажущаяся степень диссоциации муравьиной кислоты, если к 400 мл 0,5 М раствора прибавить 100 мл раствора формиата натрия, содержащего 3,4 г соли?
57. Определить кажущуюся степень диссоциации растворов, один из которых содержит в 1 л 3,4 г аммиака и 2,68 г хлорида аммония, а второй—6,8 г аммиака и 2,68 г хлорида аммония.
58. Найти кажущуюся степень диссоциации азотистой кислоты в 0,05 М растворе, содержащем 6,9 г нитрита натрия в 1 л, если кажущаяся степень диссоциации его в этом растворе равна 88%.
59. Какую концентрацию ацетата натрия нужно создать в 0,1 М СНзСООН, чтобы понизить кажущуюся степень диссоциации ее до 0,05%?
60. Сколько граммов ацетата натрия следует растворить в 100 мл 0,1 М СНзСООН, чтобы кажущуюся степень диссоциации ее сделать равной 0,05%.
Г. РАВНОВЕСИЕ В НАСЫЩЕННЫХ РАСТВОРАХ
Равновесие в насыщенном растворе вещества над его осадком подчиняется закону, который называется правилом произведения растворимости: в насыщенном растворе малорастворимого электролита при установившемся равновесии произведение концентраций ионов есть величина постоянная, называемая константой произведения растворимости, или произведением растворимости:
ПРЛ в = [А+Г [В-]’, m п
где ПРдтвч —константа произведения растворимости вещества AmBn; [А+] и [В-] — концентрации ионов в насыщенном растворе; пг и п — количества атомов или атомных групп в молекуле данного вещества.
Этому закону подчиняются строго только малорастворимые вещества. Степень диссоциации насыщенных раст
51
воров, имеющих очень малую концентрацию, обычно считают равной 100%.
Чтобы вычислить ПР данного вещества, нужно перемножить концентрации ионов в насыщенном растворе, возведенные в соответственную степень. Концентрации ионов, которые должны быть выражены в г-ион/л, определяют из величины растворимости данного вещества. Растворимость вещества есть наибольшее количество граммов его, которое может раствориться при данной температуре в 100 г растворителя.
Для перехода от растворимости к молярной концентрации необходимо сначала узнать, сколько граммов данного вещества содержится в 1 л насыщенного раствора. Для этого, допуская незначительную неточность, умножают растворимость на 10. Чтобы определить молярность насыщенного раствора, следует найденную величину разделить на молекулярную массу растворенного вещества.
Пример 1. Определить концентрации иоиов Ag+ и Вг~ в насыщенном растворе AgBr исходя нз его растворимости.
Решение. Растворимость AgBr при 20° С равна 1-Ю"5 г в 100 г воды. Определим молярность насыщенного раствора:
1-10—5.Ю _
М = —— = 5,3-10—7 моль/л.
188
Так как AgBr диссоциирует на один ион Ag+ и один ион Вг~, концентрация каждого иона равна 5,3-10-7 г-ион/л.
Пример 2. Определить ПРддвг.
Решение. Аналогично предыдущему найдем: концентрация Ag+ и Вг~ в насыщенном растворе AgBr равна 5,3-10-’ г-иои/л каждого. Напишем уравнение диссоциации:
AgBr Ag+ + Вг~
Из уравнения следует:
nPAgBr = IAg+] [Вг-J = (5,3-10-7)2 = 2,8-10-13.
Пример 3. Определить nPAgjCiOii если растворимость Ag2C2O4 равна 3,27-10-3.
Решение. Определим молярность насыщенного раствора Ag2C2O4:
„ 3,27-10-3.10
MAg2c2o< =---------------= 1,076-10-4 моль/л.
Из уравнения диссоциации оксалата серебра
Ag2C2O4 2Ag+ + С2О)"
52
видно, что концентрация иона С2О42- в насыщенном растворе равна его молярности, а концентрация Ag+ — в два раза больше, т. е. 1,076-10-4-2 = 2,15-10~4 г-ион/л. Отсюда
ПРлг,Сао. = t Ag+]2 [С2О2-] = (2,15-10- 4)2 i ,676 -10-4 = 5 • 10-12.
Пример 4. Определить концентрацию ионов Ag+ и С2О4г“ в насыщенном растворе оксалата серебра исходя из nPAg2C2O4.
Решение. Обозначим молярность насыщенного раствора оксалата серебра через х. Тогда аналогично предыдущему концентрация иона С2О42 будет также равна х г-ион/л, а концентрация иона Ag+ 2х. Подставив эти обозначения в выражение ПР, имеем
ПрАгЛо4 = (2^ = 4х3.
Взяв nPAgaCs0< из табл. 6 приложения, получим окончательную расчетную формулу: 4х3=5-Г0-12. Решив, найдем х=1,077Х Х10-4 М. Этой же величине, выраженной в г-ион/л, равна концентрация С2О42~, а концентрация Ag+ — в два раза больше, т. е. 2,15-10~4 г-ион/л.
Пример 5. Определить растворимость оксалата серебра исходя из nPAgiCio4.
Решение. Как и в примере 4, сначала определим молярность насыщенного раствора серебра, а затем умножим найденное значение на молярную массу оксалата серебра. Так как растворимость рассчитывают не на литр, а на 100 г воды, разделим массу на 10:
1,077-10-4-304
10
= 3,27-10-3 г/100.
Возможность выпадения осадка при смешивании растворов определяют по ПР. Сначала определяют создающиеся после смешения растворов концентрации осаждающихся ионов. Затем найденные концентрации перемножают. Полученное произведение сравнивают с произведением растворимости вещества, выпадающего в осадок. Если произведение концентраций ионов окажется много больше ПР, то осадок выпадает. При небольшом превышении ПР (менее чем в 100 раз) раствор становится пересыщенным, но осадок длительное время не выпадает.
Пример 6. Выпадает ли осадок при смешении 10 мл 0,02 н. СаС12 с '5 мл 0,1 и. КгСгО4?
Решение. Из уравнения реакции
СаС12 + К2СгО4 СаСгО4 4 2КС1
видно, что для решения задачи нужно знать концентрации иоиов Са2+ и СгО42-. Переведем нормальные концентрации в молярные:
0,02 н. СаС12 = 0,01 М; 0,1 н. К2СгО4 = 0,05 М.
53
Определим концентрации ионов после смешения растворов:
0,01-10
ГСа2+] =------ =6,7-10_з г-ион, л,
1 . J (10 + 5)
9 0,05-5
[СгО* ] = —~ = 1,67-10-2 г-ион/л.
(1U -Г D)
Отсюда ,
[Са2+][СгО“~] = 6,7-10-з.1,7-10-2 ; -; 11,4-10- 5= 1,14-10—4.
Находим в табл. 6 приложения ПРСаСг0 = 2,3 -10~2. Так как 1,14-10“4<2,3-10-2, то осадок выпасть не может, ибо полученный после смешения раствор будет ненасыщенным. Чтобы удобнее сравнивать числа, имеющие отрицательные показатели степеней, преобразовываем эти числа так, чтобы показатели степеней стали одинаковыми. В данном случае 2,3-10-2 = 230-10-4. Сразу становится видно, что 230-10“4> 1,14-10-4.
В тех случаях, когда смешивают резко различные объемы растворов, можно допустить, что концентрация раствора, взятого в большом объеме, практически не изменится от добавления к нему малого объема другого раствора. Например, если смешать 100 мл одного раствора с 1 мл другого, то концентрация первого раствора практически не изменится, тогда как концентрация второго раствора уменьшится приблизительно в 100 раз.
Если в условии задачи концентрации смешиваемых растворов не указываются, а говорится, что они (или один из них) являются насыщенными, то концентрации этих растворов находят по ПР в таблице (см. пример 4).
Задачи, связанные с введением реактива в смесь ионов, дающих с этим реактивом осадки, решают также по закону ПР. Из этого закона вытекает: два иона, находящиеся в растворе, при введении общего осаждающего реактива будут выпадать в осадок одновременно только при условии, что их концентрации относятся между собой как величины ПР образующихся осадков.
Пример 7. При каком соотношении концентраций ионов Sr2+ и Ва2+ их сульфаты при введении иона SO42~ будут выпадать одновременно?
Решение. Из табл. 6 приложения найдем величины ПР сульфатов и определим
[Sr2+] 3,6-10-4 3,6
[Ва2+]~ l-10-io ~ ю-з
54
Следовательно, сульфаты стронция и бария будут выпадать из раствора одновременно при условии, что [Sr2+] > [Ва2+] в 3600 раз. г Sr2+]
Если •—ГГ" > 3600, то из раствора первым начнет выпадать [Ba2+j
сульфат стронция до тех пор, пока отношение концентраций ионов стронция и ,бария не станет равным 3600, после чего начнут одновременно выпадать оба осадка. Если же [ga2+] < т0 пеР"
вым начнет выпадать в осадок сульфат бария, и это будет продол-[Sr2+]
жаться опять до тех пор, пока отношение т—не достигнет [Ва2+]
той же величины, при которой оба осадка станут выпадать одновременно.
Пример 8. Раствор содержит ионы бария и стронция, концентрации которых равны (в г-ион/л): [Ва2+] =0,0003 и [Sr2+] — 1. Какой осадок будет выпадать из раствора первым при постепенном прибавлении раствора К2СЮ4?
Решение. Воспользовавшись табл. 6 приложения, найдем
nPsrCrO4
PPBaCrO4
3,6-10-5
— 2,3-10-ю
160 000.
Отношение концентраций ионов в данном растворе равно 1/(3-104) =3300. Это значит: отношение концентраций ионов много меньше, чем отношение ПР осадков. В осадок первым станет выпадать хромат бария.
Не менее важен вопрос о том, как будет протекать процесс осаждения в зависимости от условий, например, в зависимости от среды раствора. И этот вопрос решается на основании ПР. Часто приходится сталкиваться с расчетами, связанными с осаждением катионов сероводородом. Обычно встречаются задачи следующих типов: а) определение концентрации катиона, оставшегося не-осажденным при данной концентрации иона водорода; б) определение возможности осаждения одного катиона в присутствии другого; в) определение концентрации ионов водорода в растворе, из которого необходимо практически полно осадить данный катион. Решая подобные задачи в случае двухзарядных катионов, пользуются формулой
Е 11PMeS _ K1K2[H2S] [Ме2+] - [Н+]2 ’
где ПРмез — произведение растворимости сульфида двух-зарядного катиона; К\ и Л2— константы первой и второй ступеней диссоциации сероводорода; [H2S] — концентрация сероводорода в насыщенном растворе, моль/л;
55
[Ме2+] — концентрация осаждаемого двухзарядного катиона при установившемся в растворе равновесии, г-ион/л; [Н+] — концентрация ионов водорода в растворе, из которого ведется осаждение, г-ион/л.
Так как К\, Кг, [H2S] в насыщенном растворе величины постоянные, их произведение можно вычислить заранее и подставить в числитель отношения. Тогда формула примет более простой вид:
nPMeS __ 1,08-10-23 [Ме2+] “ [Н+]2
из которого вытекает:
[Ме2+] =
ПРме5[Н+Р
1,08-10-23
(О
И
, / [Ме2+]. 1,08-10-23
[Н+]=1/ 1----------------
(2)
n^MeS
Воспользовавшись формулой (1), можно определить концентрацию катиона, оставшегося неосажденным из его раствора при данной концентрации в нем иона водорода. По формуле (2) можно определить концентрацию иона водорода, обеспечивающую практическую полноту осаждения данного иона металла.
На основании правила ПР можно также решать очень важные для аналитика вопросы о возможности превращения одного осадка в другой и о необходимых для этой цели концентрациях реактивов.
Пример 9. При какой наименьшей концентрации NaCl можно превратить осадок AgBr в осадок AgCl?
Решение. Образование осадка AgCl по уравнению
AgBr + NaCl AgCl + NaBr
будет происходить, если [Ag+] [СН] >ПРАйС1. Так как раствор над осадком AgBr насыщен, то в нем
[Ag+1 =/ПР^; = 5,7-10-7.
ПРа8щ= 1,7-10-10 (из табл. 6 приложения). Подставив эти данные в формулу значения ПР, найдем
1,7-10-ю
[СН] = 5'~7-10-7' = 3'10-4 г‘ион/л•
Такое же значение будет иметь [NaCl] в г-моль/л. Если [NaCl] окажется ниже найденной величины, то даже частичное превращение бромида серебра в хлорид невозможно. Чтобы быстрее сместить
56
равновесие превращения AgBr в AgCl, найденную концентрацию необходимо увеличить в 10—100 раз и удалять из раствора накапливающиеся ионы брома.
Задачи *.
1. Написать математическое выражение ПР хлорида серебра, сульфата кальция, сульфида меди.
2. Написать математическое выражение ПР бромида серебра, сульфата бария, сульфида никеля, карбоната кальция.
3. Написать математическое выражение ПР хлорида свинца, хромата серебра, иодида ртути, фосфата кальция.
4. Написать математическое выражение ПР сульфата серебра, фосфата алюминия, сульфида мышьяка.
5. Чему равна молярная концентрация насыщенного раствора BaSO3, если его растворимость 0,02?
6. Чему равна молярная концентрация насыщенного раствора PbSO4, растворимость которого при данных условиях 4,1 10-3.
•7. Найти молярную концентрацию насыщенного раствора ВаСгО4, если его растворимость 3,4-10~4.
8. Чему равна молярность насыщенного раствора SrSO4, растворимость которого 1,14-10-2?
9. Чему равна концентрация (в г-ион/л) ионов Ag+ и С1_ в насыщенном при 20° С растворе AgCl, растворимость которого 1,5-10-4?
10. Определить концентрацию (в г-ион/л) ионов Са2+ и SO4~ в насыщенном растворе CaSO4, если его растворимость 0,2.
11. Чему равна концентрация (в г-ион/л) ионов Са2+ и СгО4~ в насыщенном растворе СаСгО4, если считать его растворимость 2,34 и не учитывать некоторую неполноту диссоциации?
12. Осадок карбоната кальция взбалтывали продолжительное время с водой. Найти концентрацию (в г-ион/л) ионов Са2+ и СОз~ в получившемся растворе, если растворимость СаСОз при данной температуре 1,3-10-3.
13. Растворимость BaSO4 2,3-104. Определить ПР.
* Растворимость во всех задачах выражена в граммах на 100 г растворителя.
57
14. Определить ПРсасо3, если его растворимость 1,3-10-3.
15. Найти ПРм8со3. Растворимость 2,67 • 10"2.
16. Определить nPAga, если его растворимость при 25° С 1,86-10-4.
17. Определить ПРрьс12, если его растворимость при некоторых условиях 0,445.
18. Определить ПРА8гсго(, если его растворимость 2,6-10-3.
19. Чему равно ПРгщони, если известно, что при некоторых условиях его растворимость 2,2- КН?.
20. Чему равно ПРрьвг2, если его растворимость 0,427?
21. Определить FIPas2s3, если его растворимость 2-КН.
22. Определить nPAg2co3, если его растворимость при 25°С 3,5-10-3.
23. Определить степень насыщенности раствора * CaSO4, в котором концентрация Са2+ равна 0,008 г-ион/л.
24. Концентрация иона Mg2+ в растворе MgCO3 равна 3-10~3 г-ион/л. Определить степень насыщенности раствора.
25. Раствор PbSO4 содержит 1,5-10-4 г-ион/л SO4~ Определить степень насыщенности раствора.
26. Раствор SrCrO4 содержит 6-10—3 г-ион/л CrOl--Будет ли увеличиваться его концентрация при встряхивании с осадком хромата стронция?
27. Какова степень насыщенности раствора Ag2CrO4, содержащего 1 -10—4 г-ион/л СгО4~ ?
28. Раствор Ag2Cr2O7 содержит 7,4-10-3 г-ион/л Ag+. Какова степень насыщенности раствора?
29. Концентрация Ag+ в растворе Ag3AsO4 равна 2,5-10—5 г-ион/л. Определить степень насыщенности раствора.
30. Какова степень насыщенности раствора Ag3PO4, в котором концентрация РО4“ равна 1,6-10-5 г-ион/л?
31. Определить концентрацию ионов (в г-ион/л). в насыщенном растворе ВаСО3 по ПР.
32. Определить концентрацию ионов (в г-ион/л) в насыщенном растворе CaSO4.
33. Определить концентрацию ионов (в г-ион/л) в насыщенном растворе BaSO4 по ПР.
* Степень насыщенности раствора указывает на то, является ли данный раствор ненасыщенным, насыщенным илн пересыщенным (см. задачи 23—44).
58
34. Сколько грамм-ионов Ag+ содержится в 1 л насыщенного раствора веществ: AgCl, AgBr, Agl?
35. Определить концентрацию ионов (в г-ион/л) в насыщенном растворе РЬС12.
36. Сколько грамм-ионов Ag+ и СгО4~ содержится в 1 л насыщенного раствора Ag2CrO4?
37. Определить растворимость карбоната цинка по ПР.
38. Определить растворимость оксалата магния по ПР.
39. Определить растворимость РЬС12 по ПР.
40. Определить растворимость CaF2 по ПР.
41. В каком насыщенном растворе — AgCl или РЬС12— содержится больше хлора (в г-ион/л)? Во сколько раз?
42. Имеются два насыщенных раствора: сульфата и фосфата свинца. В каком из них концентрация ионов свинца (в г-ион/л) больше? Во сколько раз?.
43. Исходя из ПР, определить, какое вещество имеет большую растворимость — Сг(ОН)3 или Zn(OH)2. Во сколько раз?
44. Сколько граммов иона S2” содержится в 100 МЛ Насыщенных растворов CuS и As2S3?
45. К Ю мл 0,01 М СаС12 прибавлено 10 мл 0,01 М H2S£)4. Выпал ли осадок?
46. Смешаны одинаковые объемы 0,02 н. растворов SrCl2 и КгСгО4. Выпал ли осадок?
47. К Ю мл 0,01 н. ВаС12 прибавлено 5 мл 0,1 н. Na2SO4. Выпал ли осадок?
48. Выпадет ли осадок, если к 100 мл 0,001 н. РЬС12 прибавить 1 мл 0,001 М. H2SO4?
49. Выпадет ли осадок, если к 100 мл 0,01 М СаС12 прибавить одну каплю H2SO4 (пл. 1,080)?
50. К 100 мл 0,05 н. AgNO3 прибавлено 5 капель раствора НС1 (пл. 1,018). Выпадет ли осадок?
51. Выпадет ли осадок, если к 3 объемам 0,01 н. Ca(NO3)2 прибавить 2 объема 0 1 н. (М14)2СО3?
52. К 10 объемам 0,1 н. ZnSO4 прибавлен 1 объем сероводородной воды. Выпал ли осадок?
53. К 50 мл 0,2 М CuSO4 прибавлено 5 мл сероводородной воды. Выпадет ли осадок?
54. Выпадет ли осадок, если к 15 мл 0,02 н. SrCl2 прибавить 5 МЛ ГИПСОВОЙ воды?
55. Смешаны одинаковые объемы насыщенного раст-рора РЬС)2 и гипсовой роды, Выпадет ли орйДбК?
................................................ И
56. Из раствора нитрата свинца свинец осажден сульфатом натрия и осадок отфильтрован. Выпадет ли осадок карбоната свинца, если к 10 объемам фильтрата прибавить 1 объем 0,2 н. раствора карбоната аммония?
57. Чему равно отношение концентраций ионов бария и стронция в растворе, если при введении в него ионов SO<~ оба сульфата стали осаждаться одновременно?
58. При каком соотношении концентраций SO*- и СгОГ прибавление к раствору РЬ2+ вызовет одновременное выпадение в осадок обоих ионов?
59. Раствор содержит ионы хлора и брома, концентрация которых 0,01 г-ион/л. Какой осадок выпадет из раствора от прибавления одной капли разведенного раствора соли серебра?
60. Какой осадок начнет выпадать первым, если к раствору, содержащему в одинаковой концентрации ионы РЬ2+ и Ва2+, прибавить незначительное количество ионов СгОГ?
61. Во сколько раз концентрация одного из ионов Са2+ или Sr2+ должна быть больше, чтобы при введении в него иона СО?- образовались одновременно оба карбоната?
62. Раствор содержит ионы СгО4~ и СгСН-. Концентрация какого иона должна быть больше и во сколько раз, чтобы осаждение оксалата и хромата свинца началось одновременно?
63. Концентрация иона В г- в растворе в 10 000 раз больше концентрации иона I-. Какой ион будет осаждаться первым при введении в раствор иона Ag+?
64. Раствор содержит ионов Ва2+ в 100 раз меньше, чем ионов Sr2+. Какой осадок будет выпадать первым при введении в раствор ионов СгО??
65. Концентрация ионов Ва2+ равна 0,1 г-ион/л. При какой концентрации ионов РЬ2+ хроматы обоих ионов выпадут из раствора одновременно?
66. Концентрация иона SO? в растворе равна 0,01 г-ион/л. При какой концентрации иона СгО4- осадки сульфата и хромата выпадут одновременно, если ввести в раствор ион Ва2+?
67. В 100 мл раствора содержится по 1 г CaCh и Sr(NOs)2. Какой осадок выпадет из раствора от прибавления к нему незначительного кодичеетва карбоната нар рия?
60
68. К 50 мл раствора, содержащего 0,05 г Са(ЬЮз)г и 0,5 мг хлорида бария, прибавлена одна капля концентрированной серной кислоты. Выпадут ли осадки и если выпадут, то в какой последовательности?
69. При какой наименьшей концентрации сульфата натрия возможно превращение хромата свинца в его сульфат?
70. Осадок оксалата кальция требуется перевести в карбонат. При какой наименьшей концентрации соды возможно это превращение?
71. При какой концентрации хлорида натрия возможно превращение роданида серебра в хлорид?
72. Требуется хромат стронция превратить в сульфат. Какой реактив и при какой наименьшей концентрации потребуется для этой цели?
73. Сульфат стронция требуется перевести в карбонат. При помощи какого реактива и при какой наименьшей концентрации можно выполнить это превращение?
74. На смесь сульфатов кальция, стронция и бария действуют раствором соды высокой концентрации. Что произойдет с осадком? Почему?
75. Сколько иона РЬ2+ (в г-ион/л) останется неосаж-денным при пропускании сероводорода через раствор, содержащий 0,3 г-ион/л иона Н+? *
76. Определить концентрацию иона Cd2+ в растворе после осаждения сероводородом, если концентрация иона Н+ 0,4 г-ион/л.
77. Раствор с концентрацией иона Н+ 0,3 г-ион/л содержит ионы Fe2+ и Си2+. Что осадится после насыщения раствора сероводородом?
78. Раствор с концентрацией иона Н+ 0,05 г-ион/л содержит ионы Cd2+ и Ni2+. Что осадится из раствора сероводородом?
79. Можно ли осадить сероводородом ион Fe2+ из раствора, в котором концентрация иона Н+ 0,2 г-ион/л?
80. Можно ли практически полно осадить сероводородом ион Cd2+ из раствора, в котором концентрация нона Н+ 0,5 г-ион/л?
* Решая эту и последующие задачи, надо исходить из того, что осаждение иона считается полным, если его концентрация в растворе меньше 10~4 г-ион/л. Осаждение невозможно, если концентрация иеосаждеииого иона больше 1 г-ион/л. Осаждение возможно при любой концентрации иона Н+, если eg вычисленная величина окажется больше г-цои/л,
ь-
61
81. Раствор, в котором концентрация иона Н+ 0,5 г-ион/л, содержит ионы РЬ2+ и Cd2+. Кон гентрация какого иона и во сколько раз будет больше после осаждения сероводородом, если считать, что концентрация иона Н+ в процессе осаждения остается постоянной’
82. Раствор содержит ионы Sn2+ и РЬ2+. Какого иона останется неосажденным больше и во сколько раз, если концентрация иона Н+ во время осаждения сероводородом 0,2 г-ион/л?
83. При какой наибольшей концентрации иона 11+ можно практически полно осадить из раствора ион Zn2+ сероводородом?
84. Какова должна быть наибольшая кони, птрация иона Н+ в растворе, из которого требуется практически полно осадить ион Cd2+?
85. При каком значении [Н+] в растворе будет осаждаться ион Fe2+ сероводородом (и возможно ли это)?
86. При какой наибольшей концентрации иона Н+ можно практически полно осадить ион Sn2+?
87. Какую концентрацию иона Н+ необходимо создать в растворе, чтобы из него можно было полностью осадить ион Zn2+, не затронув иона Ni2+?
88. В 0,5 н. растворе уксусной кислоты содержатся ионы Мп2+, РЬ2+ и Си2+. Какие из них перейдут в осадок при насыщении раствора сероводородом?
89. В 1 н. растворе уксусной кислоты находятся ионы Fe2+, Zn2+ и Cd2+. Каков будет состав осадка, полученного осаждением сероводородом?
90. 2,0 мл раствора серной кислоты (пл. 1,80) разведены до 100 мл раствором, содержащим ионы Fe2+, Cd2+ и Cu2+. Какие ионы перейдут в осадок при осаждении сероводородом?
Д. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Сложные ионы, образовавшиеся в результате соединения нескольких ионов или ионов и незаряженных частиц, называются комплексными. Например, при соединении иона Fe3+ с ионами CN- получается новый ион [Fe(CN)6]3-, отличающийся по свойствам от тех исходных ионов, из которых он образовался. Комплексные соединения играют очень важную роль благодаря их специфику №
ским свойствам. * Составляя уравнение реакций, в результате которых образуются комплексные соединения, необходимо учитывать правило определения заряда комплексного иона: заряд комплексного иона равен алгебраической сумме зарядов ионов, из которых он образовался.
Пример 1. Определить заряд комплексного иона [Fe(CN)e]x, в котором железо проявляет степень окисления (+3).
Решение. Заряд иона железа +3, а заряд 6 ионов одноосновной синильной кислоты —6. Алгебраическая сумма зарядов будет —3:
( + 3) + ( - 6) = - 3.
Это и есть заряд комплексного иона.
Пример 2. Какую степень окисления имеет кобальт в комплексном ионе [Co(N02)6]3-?
Решение. Обозначим степень окисления кобальта через х. Ион NO2~ имеет заряд —1. Следовательно,
х + ( — 6) = — 3, откуда х = + 3.
Пример 3. Какую степень окисления имеет ртуть в комплексе [Hg(NH3)4]2+?
Решение. Так как частицы NH3 нейтральны и их заряд равен нулю, заряд иона ртути равен заряду всего комплекса, т. е. +2.
Образование комплексных ионов можно рассматривать как обратимую химическую реакцию. В растворе комплексного соединения наряду с комплексными ионами имеется некоторое число ионов, из которых образовался комплекс. Поэтому комплексные ионы в растворе можно рассматривать как слабый электролит и применять к ним законы действия масс и ионного равновесия. Например, уравнение реакции, выражающее процесс диссоциации комплексного иона [Fe(CN)e]3~ можно записать как уравнение обратимой реакции
[Fe (CN)6]3~ Fe3+ + 6CN~
и применить к нему закон ионного равновесия
[Fe3+][CN-]6
_ — Л дцсс •
[Fe(CN)6] 3~
Константу диссоциации комплекса обычно называют константой нестойкости. Эта величина показывает, насколько неустойчив данный комплекс. Чем меньше константа нестойкости комплекса, тем меньше распадается комплекс на исходные ионы, т. е. тем он устойчивее.
* Комплексные соединения, образованные катионами с органическими веществами, носят название комплексонов.
63
Большая константа нестойкости, наоборот, указывает на неустойчивость комплекса, на высокую концентрацию исходных ионов в растворе. С этой точки зрения двойные соли можно рассматривать как комплексные соединения, константы нестойкости которых велики по сравнению с обычными комплексными соединениями.
Чтобы определить концентрацию исходного иона в растворе комплексного соединения, нужно составить уравнение закона ионного равновесия для данного комплекса, обозначить неизвестные величины через х, подставить значение константы нестойкости (из табл. 7 приложения), составить вычислительную формулу и найти искомую величину. Решая задачи этого раздела, вполне достаточно получить приближенный результат, извлекая корень с точностью до двух значащих цифр. Извлечение корней 2-й и 3-й степеней можно выполнять, применяя таблицы, а более высоких — логарифмически, исходя из того, что 1g "Га = Перед извлечением корня следует г П
преобразовать подкоренное выражение так, чтобы оно представляло собой произведение целого числа (или смешанной десятичной дроби) на 10 в степени, кратной показателю корня.
Пример 4. Определить концентрацию ионов Hg2+ и С1_ в 0,1 М MHgCh].
Решение. Так как концентрация раствора невысокая, а все соли диссоциированы хорошо, считаем, что общая концентрация нона [HgCU]2- также равна 0,1 г-ион/л. Пишем уравнение диссоциации комплексного иона:
[HgCl4]2- - Hg2+ + 4CI—
Применяем формулу закона ионного равновесия:
[Hg2+][C1~]4
[HgCl4p-
= 6-10-17.
(Значение взято из таблицы.)
Обозначим [Hg2+] через х. Тогда [Cl~] =4х, [HgCl4]2~ примем равной общей концентрации раствора (0,1 г-ион/л), так как константа нестойкости этого комплекса очень мала. Подставляем все значения в формулу
х (4х)4 0,1
= 6-10—17, откуда 256x5 = 6.10—18 н
5 / 6 5л------------ 5--------------
1/ ——10-18 = | 0,0234-10-18 = у 2,34-10-20 ~ у 256
~ 1,2-10-4 г-иоп/л.
64
Концентрация иона С1~ будет в 4 раза больше:
1,2-10-4-4 = 4,8-10“4 г-ион/л.
Задачи
1. Написать уравнения реакции образования и диссоциации: а) алюмоаммониевых квасцов; б) гексациано--(III)феррат калия (красной кровяной соли).
2. Написать уравнения реакции образования и диссоциации: а) соли Мора; б) гексациано-(II)феррат калия (желтой кровяной соли).
3. Написать уравнения реакции образования и диссоциации: а) железоаммониевых квасцов; б) сульфата аммиаката меди.
4. Написать уравнения реакции образования и диссоциации: а) хлороплатината калия; б) роданидного комплекса кобальта.
5. Написать структурные формулы: a) [Pt(NH3)6]C14;
б) K2[Co(CNS)4].
6. Написать структурные формулы: а) гексациано-(II)феррат калия (желтой кровяной соли) ; б) гексациано-(III) феррат калия (красной кровяной соли).
7. Написать структурную формулу соединения, состав которого выражен формулой PtCl4- (NH3)6.
8. Написать эмпирические и структурные формулы всех возможных соединений, которые могут получиться из [Pt(NH3)6]C14 путем замены частиц аммиака во внутренней координационной сфере ионами хлора внешней сферы.
9. Чему равны координационные числа комплексооб-разователей в следующих соединениях: а) гексациано-(II)феррат калия (желтая кровяная соль); б) гексациано-(III) феррат калия (красная кровяная соль); в) сульфат аммиаката кадмия?
10. Чему равны координационные числа комплексооб-разователей в следующих соединениях: а) хлороплатинат калия; б) хлорид аммиаката серебра; в) сульфат комплексного аммиаката меди?
И. Какой заряд имеют комплексные ионы: [Fe2+(CN)6]X, (Fe3+ (CN) 6р, (Pt4+(NH3)6]X;
[Pt^(NH3)2Cl4p?
12. Какой заряд имеют комплексные ионы: [Ag(NH3)2]x; [AgCl2]x; [AgS2O3]x?
3 Ярославцев А. А. 65
13. Какой заряд имеют комплексообразователи в соединениях: a) HsfPtCle]; б) [Ni(NH3)6](OH)2; в) H^Hgh]?
14. Какой заряд имеют1 комплексообразователи в соединениях: а) Кз[Со(ЫО2)б]; б) [Ni(NH3)4](OH)2; в) [Ag(NH3)2]Cl?
15. Написать математическое выражение константы нестойкости комплексов: a) [Fe(CN)e]4-; б) [Hg(NH3)4]2+; в) [AgCl2]~.
16. Написать математическое выражение константы нестойкости комплексов: a) [Cd(NH3)4]2+; б) [Fe (CN) б]3-; в) [HgBn]2-.
17. Где (при одинаковых концентрации и объеме) больше ионов Ag+: в растворе K[AgCl2] или в растворе Na[Ag(CN)2]? Во сколько раз?
18. Имеются два 0,1 н. раствора: [Ag(NH3)2]Cl и K[Ag(S2O3)]. Где ионов Ag+ больше?
19. Два одинаковых объема раствора хлорида кадмия одной и той же концентрации обработаны: один избытком аммиака, другой избытком цианида калия. В каком растворе концентрация ионов Cd2+ больше?
20. В каком растворе содержится больше ионов железа при равных условиях: гексациано-(II)феррате калия (желтой) или гексациано-(III)феррате калия (красной кровяной соли)?
21. Определить концентрацию иона Ag+ и NH3 в 0,1 М [Ag(NH3)2]OH.
22. Определить концентрацию ионов Ag+ и С1~ в 1 н. K[AgCl2].
23. Две одинаковые порции 0,1 М раствора сульфата меди обработаны: один избытком KCN, другой избытком аммиака. В каком растворе больше ионов меди?
24. Во сколько раз изменится концентрация иона кобальта в 1 М аммиачном растворе при окислении на воздухе?
25. К Ю мл 0,1 н. раствора сульфата меди прибавлено 5 мл раствора аммиака, в результате чего медь полностью перешла в комплекс. Что произойдет при пропускании сероводорода через раствор?
26. Будет ли выпадать осадок при пропускании сероводорода через 0,1 н. K2[Cd(CN)4]?
Глава II
ГРАВИМЕТРИЯ (ВЕСОВОЙ АНАЛИЗ)
А. ВЕСЫ И ВЗВЕШИВАНИЕ
Основным измерением, на котором основан количественный анализ, является измерение массы. Массу точно измеряют при помощи аналитических .рычажных весов. Точное взвешивание начинают с определения нулевой точки весов. ^/=/7 ^=2,5
Нулевой точкой называют точ- / lj=16,5 1
ку на шкале, от которой стрелка /I_________j___
при ненагруженных весах откло- 111'/| 111111111111 п 11 няется вправо и влево на одинако- I
вое число делений. Ее находят из ---------—--------
трех последовательных отсчетов по шкале стрелки коромысла при его свободном колебании, когда весы не нагружены. За нулевое принимают крайнее правое деление шкалы. Счет ведут справа налево (см. рисунок), если гири при взвешивании помещены на правую чашку весов. Вычисление нулевой точки Lq ведут по формуле Гаусса:
. It + 2/2 + /з Д0= - .
Пример 1. Определить нулевую точку весов по данным, приведенным на рисунке.
Решение.
17 + 2-2,5+16,5 ---1—— = 9,6.
4
Точку равновесия определяют так же, но при колебании коромысла нагруженных весов. Совпадение точки равновесия с нулевой точкой указывает на то, что весы (периодические) находятся в состоянии равновесия.
Взвешивание при помощи гирь позволяет определить массу взвешиваемого тела с точностью до сотых долей грамма. Тысячные и десятичные доли прайма определяют при помощи рейтера и рейтерной шкалы. Чтобы найти 3‘ 67
массу взвешиваемого тела, соответствующую данному положению рейтера, определяют его момент силы, который равен произведению массы рейтера (0,01 т) на расстояние от начала плеча коромысла (нулевое деление) до места посадки рейтера. Расстояние выражают в долях длины плеча, принятого за единицу.
Пример 2. Какой массе взвешиваемого тела соответствует положение рейтера на втором промежуточном делении между 8-м и 9-м нумерованными делениями рейтерной шкалы?
Решение.
0,01-0,84 = 0,0084 г.
Расстояние между нумеров а иными делениями рейтерной шкалы разделены у одних весов на 5, а у других — на 10 мелких делений, каждое из которых составляет в первом случае 0,02, а во втором — 0,01 длины плеча коромысла. Каждое мелкое деление соответствует: у рей-терных шкал первого типа 0,02-0,01 = 0,0002 г, а у рейтер-ных шкал :второго типа 0,01 -0,01 =0,0001 г.
При точном взвешивании большое значение имеет чувствительность весов. Ее выражают числом миллиграммов, вызывающих отклонение стрелки на одно деление рейтерной шкалы.
Пример 3. После того как тело уравновешено гирями и рейтером в его положении на 4-м делении рейтерной шкалы, точка равновесия весов оказалась 8,6, а при перемещении рейтера на 6-е деление— 14. Какова чувствительность весов?
Решение. Перемещение рейтера с 4-го на 6-е деление соответствует увеличению силы на 2 мг, в результате чего точка равновесия перемещается на 14—8,6=5,4 деления. Исходя из определения чувствительности, составляем и решаем пропорцию:
2 мг — 5,4 дел. 2
х — ——
При взвешивании на точных весах большое значение имеет правильность гирь. Погрешность гири не должна искажать результата анализа более чем на 0,01%.
Пример 4. Чему равна предельная допустимая погрешность гири, номинальная масса которой 2 г?
Решение.
2 - 100%
х- 0,01%
68
Задачи
1. При определении нулевой точки весов записаны три последовательных отсчета по шкале стрелки: /1 = 19,5; /2=1,0; /з=19. Чему равна нулевая точка?
2. При свободном колебании коромысла ненагружен-ных весов стрелка занимает последовательно три положения: /1 = 15; /2 = 4,5; /з = 14,5. Чему равна нулевая точка?
3. Вправо или влево следует перемещать балансирные гайки коромысла для его уравновешивания, если при определении нулевой точки весов были получены следующие данные: /1=19,5; /2 = 4,5; /3=18,9?
4. При колебании коромысла ненагруженных весов стрелка его занимает следующие три последовательных крайних положения: /1 = 14,5; /2=0,5; /з=14. В какую сторону следует перемещать балансирные гайки коромысла, чтобы привести систему в равновесие?
5. Определить устойчивость показаний весов по следующим данным: 1-я серия наблюдений —1\ = 17,5; /2 = = 2,5; /з=17; 2-я серия наблюдений — /1 = 13,5; /2 = 7,0; /3= 13. Находится ли расхождение в пределах нормы?
6. Достаточно ли устойчивы показания, весов, если две серии выполненных наблюдений дали результаты: 1-я серия — /1 = 18; /2 = 2,0; /з = 17,5; 2-я серия — /1 = 15; /2=6,5; /3=14,5? Каково расхождение между результатами серий?
7. Чему равен момент силы рейтера нормальной массы, если он помещен на правом плече коромысла на 3-е промежуточное деление между 6-м и 7-м нумерованными делениями?
8. Рейтер нормальной массы помещен на 2-е промежуточное деление между 4-м и 5-м нумерованными делениями левого плеча коромысла. Чему равен момент силы рейтера, если взвешиваемое тело находится на левой чашке весов?
9. Чему равен момент силы рейтера, помещенного на середину двусторонней рейтерной шкалы коромысла?
10. Чему равен момент силы рейтера, помещенного непосредственно на правую чашку весов при положении взвешиваемого тела на левой чашке?
11. Изменится ли равновесие коромысла весов, если рейтер, снятый с 10-го деления правого плеча коромысла, поместить непосредственно на правую чашку весов?
69
12. Рейтер помещен на нулевое деление. Чему равен его момент силы?
13. Истинная масса рейтера равна 0,0095 г. Чему равен его момент силы, если он помещен на 4-е промежуточное деление между 8-м и 9-м нумерованными делениями?
14. Чему равен момент силы рейтера, помещенного на 1-е промежуточное деление между 2-м и 3-м нумерован' ными делениями, если истинная масса рейтера 11 мг?
15. Нулевая точка весов равна 9. При помещении рейтера на 2-е нумерованное деление правого плеча коромысла 11 = 19,5; /2= 11,5; /з=19. Чему равна чувствительность весов?
16. При определении чувствительности весов получены следующие данные: при определении нулевой точки /1 = 18,0; /2=2,5; /3 = 17,5; при помещении рейтера на 5-е деление правого плеча коромысла /1 = 20,0; /2=11,7; /з=19,0. Чему равна чувствительность весов: а) в миллиграммах на одно деление; б) в делениях на 1 мг?
17. Какова масса взвешиваемого тела, если оно уравновешивается гирями 20 и 1 г, помещенными на правую чашку коромысла весов, и рейтером, помещенным на 6-е деление рейтерной шкалы левого плеча коромысла?
18. Для уравновешивания тела, помещенного на левую чашку весов, потребовалось поместить на правую чашку гири 5 г и 500 мг, а рейтер поместить на деление шкалы левого плеча, соответствующее отсчету 3,2. Какова масса взвешиваемого тела?
19. На левой чашке уравновешенных весов находится взвешиваемое тело, на правой — гири 10 г. Рейтер висит на 4-м промежуточном делении между 9-м и 10-м делениями шкалы левого плеча коромысла. Какова масса тела?
20. Какому изменению массы взвешиваемого тела соответствует перемещение рейтера с 10-го деления правого плеча коромысла на 10-е деление'шкалы левого плеча?
21. Нулевая точка весов 9,0. Для уравновешивания часового стекла на правую чашку весов положены гири: 5 и 1 г, 200, 100, 20 мг. Рейтер помещен на 5-е деление правого плеча коромысла, после чего точка равновесия стала 10,6. После перенесения рейтера на 4-е деление того же плеча точка равновесия оказалась 8,4. Определить 70
массу стекла с точностью до десятитысячных долей грамма.
22. Нулевая точка весов 10,2. Гири 7,2800 г находятся на правой чашке. При положении рейтера на 6-м делении правого плеча точка равновесия весов 9,5. При перемещении рейтера на 7-е деление шкалы того же плеча точка равновесия стала 12. Определить массу взвешиваемого тела.
23. Тигель уравновесили на весах; его масса найдена 6,8946 г. При проверке массы рейтера она оказалась 8,5 мг. Какова действительная масса тигля, если рейтер находился на правом плече коромысла, а тигель •— на левой чашке?
24. Масса взвешиваемого тела найдена 12,4968 г; рейтер был на левом плече коромысла. Чему равна масса тела, если истинная масса рейтера 0,0011 г?
25. Методом двойного взвешивания тигля получены два результата: при помещении тигля на левую чашку весов— 12, 4556 г, на правую— 12,4552 г. Чему равна масса тигля?
26. При взвешивании бюкса на левой чашке весов его масса найдена 31,4812 г, а при взвешивании на правой чашке —31,4808 г. Какова истинная масса бюкса?
27. Расстояние между рабочими ребрами грузоприемных призм коромысла аналитических весов равно 175,0000 мм. Масса тела, найденная при взвешивании на левой чашке, равна 28,3642 г, а при взвешивании на правой— 28,3636 г. Какое плечо коромысла длиннее? На сколько?
28. Длина левого плеча коромысла 80,0000 мм. Насколько максимально может быть длиннее правое плечо, чтобы при взвешивании тела массой 5,0000 г абсолютная ошибка на неравноплечность не превышала 0,0002 г?
29. Абсолютная погрешность гирь 20 и 0,1 г равна +0,0002 г. Какова относительная погрешность каждой гири?
30. Какая абсолютная погрешность гири 5 г, если ее относительная погрешность 0,01%?
31. Левое плечо коромысла весов несколько длиннее правого. Каков знак допускаемой погрешности, если пользоваться весами без поправки на неравноплечность?
32. Каков знак погрешности, если пользоваться весами, у которых правое плечо несколько длиннее левого
71
(принимаем обычное положение взвешиваемого тела на левой чашке весов) ?
33. Взвешивая на апериодических весах, на левую чашку поместили бюкс с навеской, на правую — гири 68 г. Отсчет по рейтерным дискам 580, а по шкале вей-тографа +2,8. Какова масса бюкса с навеской?
34. На левой чашке апериодических весов находится тигель, на правой — гири-7 г. Отсчет по рейтерным дискам 090, а по шкале вейтографа +3,2. Определить массу тигля.
35. Взвешивая часовое стекло на апериодических весах, получили данные: масса гирь 10 г, отсчет по рейтерным дискам 800, по вейтографу —0,5. Какова масса часового стекла?
36. При взвешивании железной проволоки на апериодических весах разновесы не потребовались. Отсчет по рейтерным дискам 910, по вейтографу —0,5. Какова масса навески?
Б. РАСЧЕТ НАВЕСКИ
Различают три типа гравиметрических (весовых) определений.
I. Определяемую составную часть количественно выделяют в свободном состоянии из анализируемого вещества и взвешивают.
II. Определяемую составную часть количественно удаляют из анализируемого вещества и взвешивают остаток.
III. Определяемую составную часть количественно превращают в определенное химическое соединение, которое может быть выделено также количественно из анализируемого вещества и взвешено.
Способ расчета навески зависит от типа, к которому относится данное определение. Навеской называют небольшое количество (обычно 0,1—1,0 г) образца анализируемого вещества, которое точно взвешивают и далее количественно подвергают всем аналитическим операциям. Навеска для I и II типов определений должна быть такая, чтобы выделяемая или удаляемая определяемая составная часть весила 0,01—0,1 г.
В III типе определений навеска должна быть такой величины, чтобы из нее образовались следующие коли
72
чества осаждаемой формы в зависимости от характера осадка (в г):
Аморфный, легкий (гидроксиды)................. 0,07—0,1
Кристаллический, легкий (большинство солей) . . 0,1—0,15
Кристаллический, тяжелый (BaSO4 и др.) . . . 0,2—0,4
Кристаллический, очень тяжелый (PbSO4, AgCl и др.)........................................ до 0,5
Задачи
1. Какую навеску торфа нужно взять для анализа на влажность, если ожидаемая влажность около 15%?
2. Рассчитать навеску каменного угля для анализа на содержание летучих веществ, если ожидается, что их в образце около 20%.
3. Какой должна быть навеска каменного угля, анализируемая на содержание золы, если ожидаемая зольность образца около 10%?
4. Рассчитать навеску сплава, содержащего около 56% Au, для определения в нем золота, которое при анализе выделяют в виде чистого металла.
5. Какую навеску медного купороса CuSO4-5H2O следует взять для анализа на содержание кристаллизационной воды?
6. Рассчитать навеску кристаллической соды Na2CO3-• ЮН2О для анализа на содержание кристаллизационной воды.
7. Рассчитать навеску известняка для анализа на содержание СаО методом прокаливания.
8. Какую навеску магнезита следует взять для анализа на содержание СО2 методом прокаливания, если образец состоит из 90% MgCO3, 10% некарбонатных и нелетучих примесей?
9. Рассчитать навеску известняка для анализа на содержание влаги, если предполагаемая влажность образца около 15 % •
10. Рассчитать навеску известняка для анализа на содержание СО2, если образец содержит около 85% СаСО3.
41. Какую навеску мела следует взять для анализа на содержание СаО, если образец содержит около 20% влаги?
73
12. Рассчитать навеску чугуна для анализа на содержание кремния путем растворения навески в соляной кислоте, если кремния в образце около 2%.
13. Рассчитать навеску торфа для анализа на зольность, если золы в образце около 20%.
14. Какую навеску мела следует взять для анализа на содержание нерастворимых примесей, если их в образце около 0,3%?
15. Какую навеску каменного угля, содержащего около 4% серы, следует взять для анализа на содержание серы, если ее определяют в виде BaSO4?
16. Рассчитать навеску сульфида железа, содержащего около 30% S, для определения в нем серы в виде BaSO4.
17. Какую навеску ВаС12-2Н2О следует взять для анализа на содержание бария, если его определяют в виде BaSO4?
18. Какую навеску CuSO4-5H2O следует взять для анализа на содержание меди, если ее определяют в виде СиО после осаждения гидроксида?
19. Смесь равных количеств кристаллогидрата хлорида бария с хлоридом натрия подвергают анализу на содержание бария. Какую навеску смеси следует взять для выполнения анализа, если барий осаждают в виде BaSO4?
20. Какую навеску 30%-ного сульфида железа следует взять для анализа на содержание серы в виде BaSO4?
21. Какую навеску железной проволоки, содержащей около 98% железа, следует взять для определения железа, если его осаждают в виде Fe(OH)3?
22. Какую навеску железной руды, содержащей около 70% железа, следует взять для определения железа, осаждаемого в виде Fe(OH)3?
23. Рассчитать навеску технического железного купороса, содержащего около 90% FeSO4-7H2O, для анализа на содержание FeSO4-7H2O, если осаждаемая форма Fe(OH)3?
24. Какую навеску сидерита надо взять для анализа на содержание железа, если образец содержит около 75% FeCO3, а осаждаемая форма Fe(OH)3?
25. Рассчитать навеску известняка, содержащего около 8% примесей, для анализа на содержание СаСО3 если осаждаемая форма СаС2О4-Н2О.
74
26. Рассчитать навеску кальцита для анализа на содержание кальция, если кальций осаждают в виде СаС2О4-Н2О, а кальцит почти не содержит примесей.
27. Рассчитать навеску мрамора для анализа на содержание в ней кальция в виде СаО.
28. Образец гашеной извести содержит около 15% примесей. Какую навеску извести следует взять для определения в ней Са в виде СаО?
29. Рассчитать навеску сплава, содержащего около 0,5% магния, для анализа на содержание магния, если осаждаемая форма NH4MgPO4-6H2O.
30. Какой должна быть навеска сплава, содержащего около 95% магния, для анализа на содержание магния, если осаждаемая форма NH4MgPO4-6H2O?
31. Какую навеску образца доломита, содержащего около 10% магния, следует взять для анализа на содержание MgO, если магний осаждается в виде NH4MgPO4-•6Н2О?
32. Какую навеску доломита, содержащего около 20% MgO, следует взять для анализа на содержание магния, осаждаемого в виде NH4MgPO4-6H2O?
33. Рассчитать навеску кристаллогидрата сульфата цинка для анализа на содержание цинка, если его осаждают в виде NH4ZnPO4-6H2O.
34. Какую навеску технического семиводного кристаллогидрата сульфата магния, содержащего около 5% примесей, следует взять для определения степени чистоты образца?
35. Рассчитать навеску метафосфата натрия для анализа на содержание фосфора, осаждаемого в виде NH4MgPO4-6H2O.
36. Рассчитать навеску фосфорита, содержащего около 15% Р2С>5, для анализа на содержание фосфора, определяемого в виде пирофосфата магния и осаждаемого в виде NH4MgPO4-6H2O.
37. Какую навеску алюмокалиевых квасцов следует взять для анализа на содержание алюминия, осаждаемого в виде А1(ОН)3?
38. Рассчитать навеску полевого шпата для анализа на содержание А120з, если алюминия в нем около 8%.
39. Рассчитать навеску технической поваренной соли, содержащей около 6% примесей, для анализа на содержание хлора в виде AgCl.
75
40. Какую навеску двухводного кристаллогидрата хлорида бария следует взять для анализа на содержание хлора, определяемого в виде AgCl?
41. Какую навеску сплава, содержащего около 85% серебра, следует взять для анализа на содержание серебра, если его осаждают и определяют в виде хлорида?
42. Какую навеску нитрата серебра следует взять для анализа на содержание серебра, если его осаждают и определяют в виде AgCl?
43. Одинаковые ли навески СаС12-6Н2О следует взять для анализа на содержание кальция в виде СаО и хлора в виде AgCl?
44. Одинаковые ли навески двухводного хлорида бария потребуются для анализа на содержание: а) бария; б) хлора?
45. Какие навески сплава, содержащего около 72% золота, 22% серебра и 6% меди, потребуются для анализа на все компоненты, если серебро определяют в виде AgCl, медь — в виде СиО, а золото выделяется в чистом виде?
46. Рассчитать навеску сидерита для анализа на содержание Fe в виде Fe2O3, если в образце содержится 70% FeCO3.
47. Воспользовавшись справочными данными о составе сплавов и весовых формах, в виде которых определяют их компоненты, рассчитать навески томпака для анализов на содержание всех компонентов сплава.
48. Тс же, что и в задаче 47, для силумина.
49. То же, для сплава Деварда.
50. То же, для латуни.
В. РАСЧЕТ РАСТВОРИТЕЛЯ
И ОСАЖДАЮЩЕГО РЕАКТИВА
Расчет количества растворителя, необходимого для растворения навески, и расчет количества осаждающего реактива относятся к предварительным аналитическим вычислениям, а по точности, с которой они выполняются,— ко второму классу. Иными словами, эти расчеты приближенные, в их результатах окончательно сохраняется не более одной-двух значащих цифр. Теоретической основой этих расчетов является закон эквивалентов: все вещества реагируют друг с другом нацело в количе-76
ствах, пропорциональных их эквивалентам. На основании этого закона можно составить пропорцию:
5р.в — 5р m — х
где Эр.в— эквивалент растворяемого или осаждаемого вещества; <ЭР—эквивалент растворителя или осадителя; ш — масса растворяемого или осаждаемого вещества, содержащегося в навеске; х — масса растворителя или осадителя.
Если применяемый реактив не 100%-ный, а а%-ный, то искомое весовое количество реактива будет (в г)
т' ~ х -100/а.
Чтобы перейти от единиц массы к объемным единицам, найденную величину т' делят на плотность раствора. Так как все подобные расчеты очень приближенны, плотность разведенных растворов можно принимать равной единице. Наконец, чтобы реакция прошла до конца, найденную величину еще увеличивают в несколько раз в соответствии с правилом: если растворитель (или осадитель) — вещество летучее, его берут в два-три раза больше по сравнению с рассчитанным по эквивалентам; нелетучих реактивов берут только в полтора раза больше рассчитанного.
Если концентрация реактива выражена в г-экв/л, то составляют пропорцию:
5р.в — Ю00 мл 1 н. раствора растворителя (или осадителя) mr — х , 1 н. , . ,
Если концентрация реактива не 1 н., а больше или меньше, найденный объем изменяют обратно пропорционально его концентрации. Так, если найдено, что 1 н. раствора требует х мл, то 2 н. раствора потребуется
Задачи
Примечание. Если нет прямого указания на величину избытка реактива, найденные решения могут значительно отличаться от приведенных ответов.
1. Сколько миллилитров 1 н. НС1 со 100%-ным избытком потребуется, чтобы растворить 1 г мела?
77
2. Сколько миллилитров 1 и. HNO3 с 50%-ным избытком надо взять, чтобы растворить навеску кальцита около 2 г?
3. Какой объем 1,5 н. НС1 с 200%-ным избытком потребуется, чтобы растворить навеску железа около 0,2 г?
4. Какой объем 4 н. НС1 со 100%-ным избытком следует взять, чтобы растворить 0,1 г железной проволоки?
5. Какой объем 4 н. H2SO4 (со 100%-ным избытком) потребуется, чтобы растворить 0,1 г карбоната магния, содержащего 90% MgCO3?
6. Какой объем 2 н. NaOH со 100%-ным избытком пойдет на растворение навески технического алюминия около 0,5 г?
7. Какой объем 0,5 н. НС1 следует взять для растворения 1,5 г мела, содержащего около 25% влаги и нерастворимых примесей?
8. Какой объем 0,1 и. H2SO4 следует взять для растворения 1 г магнезита, содержащего 10% нерастворимых примесей?
9. Какой объем раствора, содержащего 200 г H2SO4 в 1 л, следует взять, чтобы растворить около 0,5 г цинка?
10. Какой объем раствора, содержащего 54 г НС1 в 1 л, пойдет на растворение 5 г кальцита?
11. Какой объем 10%-ного раствора H2SO4 пойдет на растворение 0,2 г железа, содержащего 10% нерастворимых примесей?
12. Какой объем 15%-ного раствора НС1 потребуется, чтобы растворить 1,5 г оксида магния?
13. Какой объем раствора H2SO4 (пл. 1,102) потребуется, чтобы растворить 0,3 г магния?
14. Какой объем 10%-ного раствора H2SO4 потребуется, чтобы растворить 0,3 г алюминия?
15. Какой объем НС1 пл. 1,057 (с учетом необходимого избытка) пойдет на растворение 1 г доломита CaCO3-MgCO3?
16. Какой объем раствора аммиака (пл. 0,958) следует взять, чтобы растворить 0,3 г оксида меди?
17. Какой объем раствора НС1 (пл. 1,018) пойдет на растворение 2,5 г гашеной извести, содержащей около 10% нерастворимых примесей?
18. Раствор содержит 50 г НС1 в 1 л. Какой объем его потребуется, чтобы растворить 2 г негашеной извести, содержащей 25% влаги и нерастворимых примесей?
78
19. Сколько миллилитров растврра едкого кали (пл. 1,14) с 200%-ным избытком необходимо, чтобы растворить 0,2 г алюминиевой проволоки?
20. Сколько миллилитров раствора аммиака (пл. 0,994) с 50%-ным избытком пойдет на растворение 0,4 г AgCl, содержащего 30% нерастворимых примесей?
21. Какой объем (с учетом необходимого избытка)
1 н. НС1 потребуется для осаждения Ag+ из раствора, полученного растворением 1 г серебра?
22. Какой объем 2 н. аммиака следует взять, чтобы осадить Fe3+ из раствора, содержащего 0,2 г железа?
23. Какой объем (с учетом необходимого избытка) 2 н. H2SO4 потребуется, чтобы осадить барий из раствора, содержащего 0,6 г ВаС12-2Н2О?
24. Какой объем 1 н. H2SO4 пойдет на осаждение бария из раствора, полученного растворением 0,9 г кристаллогидрата хлорида бария с 40% примесей?
25. Какой объем 4 н. Na2HPC>4 пойдет на осаждение магния из раствора, полученного растворением 0,4 г сплава с 60% M.g?
26. Какой объем 0,2 н. Н2С2О4 пойдет на осаждение кальция, если известно, что для приготовления раствора было взято 0,6 г мрамора?
27. Какой объем 0,5 н. (NH4)2C2O4-H2O нужен, чтобы количественно осадить кальций из раствора, приготовленного из 1 г мела с 25% влаги и нерастворимых примесей?
28. Сколько граммов Na2HPO4-12Н2О следует взять для полного осаждения магния из раствора, полученного растворением 1,5 г образца доломита?
29. Сколько граммов Н2С2О4-2Н2О потребуется для полного осаждения кальция из 50 мл раствора, полученного растворением 1 г образца мрамора в 250 мл растворителя?
30. Сколько граммов (NH4)2HPC>4 потребуется для осаждения магния, если на приготовление раствора было взято 0,8 г образца доломита?
31. Какой объем 2 н. ВаС12 потребуется для осаждения иона 5ОГ из 2 г продажной концентрированной серной кислоты?
32. Какой объем 0,5 н. раствора хлорида бария потребуется для осаждения бария в виде BaSO4 из раствора, полученного соответствующей обработкой 1,5 г каменного угля, если он содержит около 2% серы?
79
33. Какой объем 10%-ного раствора аммиака следует взять для осаждения 0,15 г железа?
34. Какой объем 5%-ного раствора аммиака следует взять для осаждения железа, если на приготовление раствора взято 0,3 г красного железняка, содержащего около 10% пустой породы?
35. Какой объем 10%-ного раствора аммиака потребуется для осаждения железа, если на приготовление раствора взято 0,4 г магнитного железняка?
36. Какой объем 7%-ного раствора Na2HPO4- 12Н2О потребуется для осаждения магния из раствора 0,4 г MgSO4-7H2O (плотность принять 1)?
37. Какой объем раствора аммиака (пл. 0,960) следует взять для осаждения железа из раствора 0,5 г соли Мора, если содержащийся в ней ион Fe2+ предварительно окислен в ион Fe3+?
38. Сколько миллилитров раствора аммиака (пл. 0,980) потребуется для количественного осаждения железа, если на приготовление раствора взято 0,2 г шпатового железняка, содержащего 30% железа?
39. Сколько миллилитров раствора НС1 (пл. 1,028) необходимо для осаждения серебра, если на приготовление раствора взято 1,5 г сплава, содержащего 10% серебра?
40. Растворено 2 г тяжелого шпата, содержащего 20% примесей. Объем раствора доведен до 250 мл. Сколько миллилитров раствора H2SO4 (пл. 1,032) потребуется для осаждения бария из 50 мл приготовленного раствора?
41. В мерной колбе на 250 мл приготовлен и доведен до метки раствор из 2 г асбеста, содержащего около 1 % алюминия и железа вместе. Сколько миллилитров 0,1 н. раствора аммиака следует взять для осаждения полуторных оксидов из 25 мл раствора, взятых из этой колбы?
42. Навеска 2 г сплава, содержащего около 70% серебра, растворена и раствор доведен до 500 мл. Сколько миллилитров раствора НС1 (пл. 1,018) необходимо для осаждения серебра из 25 мл приготовленного раствора?
43. Рассчитать навеску железной проволоки и количество реактивов для анализа на содержание железа. Концентрации реактивов взять по своему усмотрению.
44. Выполнить то же, что и в предыдущей задаче, для определения СаО в негашеной извести, содержащей 15% влаги.
80
45. То же, для определения бария в смеси солей, содержащей около 40% бария.
46. То же, для определения серебра в сплаве, содержащем около 60% серебра.
47. То же, для определения кальция в меле, содержащем около 10% влаги и 15% нерастворимых примесей.
48. То же, для определения магния в доломите, содержащем незначительное количество примесей.
49. То же, для определения алюминия (в виде AI2O3) в алюминиевой бронзе.
50. То же, для определения алюминия в дюрале.
Г. ВЫЧИСЛЕНИЕ ПОТЕРЬ ПРИ ПРОМЫВАНИИ ОСАДКА
Чтобы вычислить потери осадка при его промывании, сначала узнают по таблице величину ПР осаждаемого вещества, а по ПР — концентрацию ионов в промывной жидкости, которая после соприкосновения с осадком превращается в насыщенный раствор. Далее находят количество граммов осаждаемого вещества в 1 л насыщенного раствора, а затем в объеме промывной жидкости, израсходованной на все промывание. Так как потери при промывании осадка чистой водой бывают очень значительны, их понижают, вводя в промывные воды тот ион, который, входя в состав осадка, не входит в состав определяемой части. Так, при определении бария в виде BaSO4 к промывной воде добавляют немного серной кислоты.
Пример. Осадок BaSO4 0,2 г промыт 150 мл жидкости, приготовленной из 1 л воды и 0,5 мл 4 н. раствора серной кислоты. Сколько процентов осадка перешло в раствор?
Решение. Определяем концентрацию H2SO4 в промывной жидкости. Для H2SO4 4 н.=2М. От введения 0,5 мл этого раствора в 1 л воды его концентрация уменьшится в
1000 г „ , 2-0,5
— = 2000 раз, или [H2SO4] = [SOM = —= 0,001 =
U,O *- J J.UUU
= 10~3 моль/л.
На основании правила произведения растворимости определяем концентрацию иона Ва2+ и равную ей концентрацию BaSO4 в насыщенном растворе. Так как ПРВа501 = [Ва2+] [SO42-] ~ 1 • 10_,°,
81
составляем и решаем уравнение, обозначив [Ва2+] через х, а вместо [SO42-] подставив ее найденное значение:
х [SO|-] = 1-10—'0 или х103= Ы0—Ю; х— 10—7 г-ион/л.
Столько же молей BaSO4 содержится в 1 л.
Наконец, определяем количеству BaSO4, содержащееся в 150 мл насыщенного раствора, выражая ответ в процентах к массе промываемого осадка:
1-10—7-233-150-100
1000.0,2
2-10-3 = 0,002%.
Задачи
1. Осадок BaSO4 промыт 250 мл дистиллированной воды. Сколько граммов осадка перешло в раствор?
2. Осадок СаСгО^НгО промыт 500 мл дистиллированной воды. На сколько граммов уменьшилась масса осадка?
3. Сколько граммов осадка ВаСгО4 перейдет в раствор, если его промыть 300 мл дистиллированной воды?
4. Сколько граммов осадка CaSO4 перейдет в раствор, если его промыть 100 мл дистиллированной воды?
5. Осадок Mg (ОН) 2 промыт 500 мл дистиллированной воды. Сколько граммов иона Mg2+ перешло в раствор?
6. Осадок NH4MgPO4 промыт 350 мл дистиллированной воды. Сколько граммов магния перешло в раствор?
7. Осадок BaSO4 0,1 г промыт 250 мл чистой воды. Сколько процентов осадка перешло в раствор?
8. При промывании 0,15 г осадка ВаСОз израсходовано 200 мл дистиллированной воды. Определить потери (%) на растворимость.
9. Сколько процентов осадка перешло в раствор, если 0,1 г СаС2О4.Н2О промыто 150 мл дистиллированной воды?
10. Какова потеря (%) осадка 2 г CaSO4 при промывании его 100 мл дистиллированной воды?
11. Сколько процентов осадка NH4MgPO4-6H2O от 0,05 г будет потеряно, если промыть его 200 мл дистиллированной воды?
12. Сколько процентов от 0,01 г осадка ВаСгО4 перейдет в раствор, если промыть его- 100 мл Дистиллированной воды?
13. Сколько процентов составят потери от осадка СаСгС^-НоО, весившего 0,5 г, если промыть его 200 мл дистиллированной воды?
82
14. Содержание серы в образце каменного угля найдено 2 /о- Какая относительная ошибка допущена, если осадок BaSO4, полученный из 1,5 г образца, промыли 150 мл дистиллированной воды?
15. Сколько граммов BaSO4 перейдет в раствор, если промыть его 500 мл 0,01 М раствора серной кислоты?
16. Сколько граммов BaSO4 растворится в 250 мл промывной жидкости, приготовленной из 500 мл воды и 2 мл 0,1 н. раствора серной кислоты?
17. Сколько граммов СаС2О4-Н2О перейдет в раствор, если его промыть 100 мл жидкости, приготовленной из 750 мл воды, в которой растворено 2,13 г (NH4)2C2O4-H2O?
18. Сколько граммов осадка SrCO3 перейдет в раствор, если промыть его 250 мл жидкости, приготовленной из 500 мл воды и 5,3 г безводной соды?
19. Сколько процентов осадка растворилось, если 0,2 г осадка сульфата бария промыто 150 мл жидкости, приготовленной из 1 л воды и 1 мл 2 н. H2SO4?
20. Сколько процентов осадка перешло в раствор, если 1,5 г осадка NH4MgPO4-6H2O промыто 250 мл жидкости, приготовленной из 500 мл воды и 1 мл 10%-ного раствора аммиака?
21. Во сколько раз растворимость BaSO4 в дистиллированной воде больше, чем в промывной жидкости, приготовленной из 200 мл воды и одной капли концентрированной серной кислоты (объем капли —около 0,04 мл)?
22. Сколько миллилитров 1 М. H2SO4 нужно прибавить к 1 л воды, чтобы при промывании 0,1 г осадка BaSO4 250 мл полученной жидкости потери на растворимость не превышали 0,01 %?
Д. ВЫЧИСЛЕНИЕ ФАКТОРОВ
(АНАЛИТИЧЕСКИХ МНОЖИТЕЛЕЙ)
Аналитическим множителем, или фактором, называют отношение эквивалента определяемой составной части к эквиваленту ее весовой формы. Вычисляя аналитический фактор, обычно берут отношение масс соответственных количеств молекул (или атомов) определяемой составной части и ее весовой формы. Например, вычисляя фактор для определения Ва в виде BaSO4, делят атомную массу бария на молекулярную массу BaSO4. Получают
83
F ва =/4ва/А1Вазо1 • Но при вычислении фактора для оп-
BaSO4
ределения содержания алюминия по весовой форме А12О3 следует удвоенную атомную массу алюминия делить на молекулярную массу А12О3, т. е. F ai =2Аа1/Л1а1,о3-
А120э
Факторы и их логарифмы приводят в справочных таблицах (см. табл. 2 приложения). Пользование таблицами упрощает вычисления результатов анализа, экономит время и уменьшает возможность возникновения арифметических ошибок (см. с. 86).
Задачи
1. Вычислить аналитические множители для определения содержания Ва, ВаО, Ва(ОН)2, ВаС12-2Н2О по BaSO4. Найти их логарифмы.
2. Вычислить аналитические множители для определения S, H2SO4, Na2SO4> SO3 по BaSO4. Найти их логарифмы.
3. Вычислить аналитические множители для определения Fe, FeO, FeCO3, (NH4)2Fe(SO4)2, FeCl3 no Fe2O3. Найти их логарифмы.
4. Вычислить аналитические множители для определения Са, СаСО3, СаС12, СО2 по СаО. Найти их логарифмы.
5. Вычислить аналитические множители для определения Р, Р2Об, Са3(РО4)2, Mg по Mg2P20y. Найти их логарифмы.
6. Вычислить аналитические множители для определения Al, A12(SO4)3, KA1(SO4)2-12Н2О, А1С13 в виде А12О3. Найти их логарифмы.
7. Вычислить аналитические множители для определения Pb, PbO, РЬС12, Pb3O4 по PbSO4. Найти их логарифмы.
8. Вычислить аналитические множители для определения F в виде: a) CaF2, б) SiF4. Найти их логарифмы.
9. Вычислить аналитические множители для определения Си и CuFeS2 в виде: а) СиО, б) Cu2S.
10. Вычислить аналитические множители для определения водорода в виде Н2О и углерода в виде С2Н2.
11. Вычислить аналитический множитель для определения фтористого водорода, если по ходу анализа полу-84 ‘
чают осадок в виде CaF2, который далее растворяют, осаждают ионом SO4~ и взвешивают в виде CaSO4.
12. Для определения калия можно его превратить в хлороплатинат КгР4С16 и взвесить выделенную из него свободную платину. Каков будет аналитический множитель?
13. Для определения содержания карбида кальция в техническом продукте его можно разложить водой, выделившийся ацетилен осадить количественно серебром в виде ацетиленистого серебра, последнее превратить в AgCl, которое и взвесить. Чему будет равен аналитический множитель?
14. Для определения мышьяка его можно осадить сероводородом в виде AS2S3, окислить в нем серу до иона SO4-, осадить этот ион солью бария и взвесить в виде BaSO4. Чему равен аналитический множитель?
Е. ВЫЧИСЛЕНИЕ РЕЗУЛЬТАТА
ГРАВИМЕТРИЧЕСКИХ (ВЕСОВЫХ) АНАЛИЗОВ
Вычисление результатов гравиметрических анализов относится к самому простому типу расчетов, встречающихся в аналитической химии. Если данный анализ относится к первому или второму типу гравиметрических определений (см. с. 72), то вычисление его результата сводится к определению процентного содержания по отношению ко всей навеске. Если же анализ относится к третьему типу весовых определений, то сначала определяют массу определяемой составной части в навеске, исходя из пропорции
^о.ч Эв.ф
7ИО.Ч — тос
где Эо.ч — эквивалент определяемой составной части; Эв.ф — эквивалент весовой формы; т0.ч — масса определяемой составной части; тос — масса осадка.
Обычно отношение эквивалентов заменяют отношением масс соответственного числа молекул определяемой составной части и весовой формы. Найдя массу определяемой составной части, вычисляют, сколько процентов она составляет от массы всей навески. Таким образом, вычисление результатов всех весовых анализов, относящихся к Ш типу, сводится к формуле
^о.ч^ос^бО ttZqpIOO
Х0/ ~ “ — F .
/0 с^.ф навеска навеска
85
Следовательно, чтобы найти результат анализа III типа, нужно фактор (взятый из табл. 2 приложения) умножить на массу осадка, увеличенную в 100 раз, и разделить на массу навески.
Все вычисления этого раздела выполняют только с помощью таблиц логарифмов или вычислительных машин.
Задачи
1. Для определения содержания меди в сплаве взята навеска его 0,2152 г. Из нее методом электролиза получен осадок чистой меди 0,0898 г. Вычислить процентное содержание меди в сплаве.
2. Для анализа доломита взята навеска 1,0842 г. После растворения в кислоте нерастворившийся осадок отделен от фильтра, промыт, прокален и взвешен. Масса его оказалась 0,0356 г. Вычислить процентное содержание нерастворимых веществ в образце.
3. Определяя содержание золота в сплаве, навеска его 0,1000 г растворена в азотной кислоте. Нерастворившее-ся золото отделено, промыто и прокалено. Масса его оказалась 0,0724 г. Вычислить процентное содержание золота в сплаве.
4. Навеска каменного угля 2,6248 г после высушивания до постоянной массы стала весить 2,5420 г. Вычислить процентное содержание влаги в образце.
5. Навеска просушенного каменного угля 2,0500 г после прокаливания была 1,2348 г. Вычислить процентное содержание летучих веществ в образце.
6. Навеска сухого известняка 1,5120 г после прокаливания до постоянной массы была 0,8470 г. Вычислить процентное содержание СаО и СО2 в образце.
7. Для анализа образца торфа взята навеска 1,6340 г. Прокалив ее до постоянной массы, получено 0,4102 г золы. Какова зольность образца?
8. Вычислить процентное содержание безводной соды в частично выветрившемся образце кристаллогидрата, если из навески 2,1080 г образовалось 1,2640 г безводного остатка.
9. Навеска кокса вместе с бюксом весила 12,6100 г; пустой бюкс— 10,5650 г. После высушивания до постоянной массы бюкс с навеской весил 12,3750 г. Вычислить
86
процентное содержание абсолютно сухого вещества в образце.
10. При определении содержания кристаллизационной воды в образце хлорида бария получены данные: масса бюкса 25,6874 г; масса бюкса с навеской 27,2594 г; то же после высушивания 27,0269 г. Вычислить процентное содержание кристаллизационной воды в образце.
11. При определении гигроскопической воды в образце хлорида натрия получены следующие данные: масса тигля 7,2393 г; масса тигля с навеской 7,8809 г; то же после высушивания 7,8616 г. Вычислить процентное содержание гигроскопической воды в образце.
12. При определении летучих веществ в каменном угле получены следующие данные: масса тигля 5,3280 г; масса тигля с навеской 6,5110 г; масса тигля с навеской после удаления летучих 6,2745 г. Вычислить процентное содержание летучих веществ в образце.
13. Анализ образца строительной глины показал следующие результаты: масса тигля 20,3650 г; масса тигля с навеской 21,3870 г; масса тигля с навеской после просушивания до постоянной массы при 105°С 21,3671 г; масса тигля с навеской после прокаливания 21,3368 г. Вычислить: а) процентное содержание гигроскопической влаги в образце; б) потери при прокаливании (%).
14. Навеска 0,5062 г магнезита высушена при 15° С до постоянной массы 0,5043 г. Высушенный образец прокален, после чего масса стала 0,2512 г. Вычислить процентное содержание: а) гигроскопической влаги; б) СО2.
15. Растворена навеска минерала 0,5260 г. Нераство-рившийся осадок промыт, помещен в тигель и прокален. Масса осадка с тиглем оказалась 6,7280 г. Осадок в тигле обработан H2F2 и снова прокален. В результате весь SiO2 удалился в виде SiF4. Масса тигля с осадком после удаления SiF4 стала 6,3140 г. Вычислить процентное содержание SiO2 в образце.
16. Определяя кремний в образце чугуна методом, описанным в предыдущей задаче, получены следующие данные: масса навески чугуна 2,1630 г; масса тигля с прокаленным остатком после растворения навески 5,3396 г; масса тигля с остатком после удаления SiO2 5,2930 г. Вычислить процентное содержание кремния в образце.
17. Проба известняка помещена во взвешенный прибор (кальциметр), заряженный азотной кислотой. Масса
87
кальциметра без известняка 78,4564 г; масса его с известняком 79,5076 г. Масса прибора после окончания реакции и количественного удаления СО2 79,0882 г. Вычислить процентное содержание СО2 в образце.
18. Определяя СО2 в образце мрамора с помощью кальциметра (см. задачу 17), получены следующие данные: масса заряженного кальциметра до введения навески 65,3462 г; масса его с навеской 66,2614 г; масса кальциметра после удаления СО2 65,9000 г. Вычислить процентное содержание СО2 в образце.
19. Определить содержание бария в 0,4765 г BaSO4
20. Определить содержание серы в 0,2854 г BaSO4.
21. Определить содержание серебра в 0,3652 г AgCl.
22. Определить содержание хлора в 0,3652 г AgCl.
23. Из навески глета получено 1,2730 г осадка РЬСгО4. Сколько граммов свинца в навеске?
24. Из навески магнезита получено 0,2164 г осадка Mg2P2O7. Сколько граммов магния в навеске?
25. Навеска цинковой соли дала осадок Zn2P2O7 0,2587 г. Какому количеству: a) Zn; б) ZnO и в) ZnSO4-•7Н2О соответствует осадок?
26. Из навески соли железа (II) образовалось 0,1652 г прокаленного оксида железа (III). Сколько граммов: a) Fe; б) FeSO4; в) FeSO4-7H2O содержалось в навеске?
27. Из навески фосфорита получен осадок Mg2P2O7 0,1829 г. Какому количеству: а) Р; б) Р2О5 и в) Са3(РО4)2 соответствует осадок?
28. Из навески калийной соли получен осадок KzPtCU 0,1120 г. Какому количеству: а) К; б) КгО и в) Кг8О4 соответствует осадок?
29. Сколько граммов AgCl получится из 1,0000 г хлорида калия (х. ч)?
30. Сколько граммов Mg2P2O7 получится из 1,3204 г MgCO3 (х. ч)?
31. Для анализа образца хлорида бария взята навеска 0,6878 г. Из нее получен прокаленный осадок BaSO4 0,6556 г. Вычислить процентное содержание бария в образце.
32. Взята навеска 1,0150 г каменного угля. После обработки ее получен прокаленный осадок BaSO4 0,2895 г. Вычислить процентное содержание сены в образце.
33. Взята навеска 0,3212 г серной кислоты. После осаждения и прокаливания получен осадок BaSO4 0,2642 г. Какова процентная концентрация образца?
88
34. Из навески пирита 0,2794 г после обработки получено 0,4524 г прокаленного осадка BaSO4. Вычислить процентное содержание серы в образце.
35. Из навески 0,1000 г сплава получено 0,1196 г осадка AgCl. Вычислить процентное содержание серебра в сплаве.
36. Растворена навеска 0,5012 г технической соли Мора. Раствор осажден избытком аммиака. Промытый осадок гидроксида железа (III) прокален до постоянной массы и взвешен. Масса Fe2O3 оказалась 0,0968 г. Вычислить процентное содержание (NH4)2Fe(SO4)2-6H2O.B образце.
37. Из навески мрамора 1,8710 г получены осадки: 0,0827 г МёгРгО?, 0,0342 г Fe2O3 и 1,9650 г CaSO4. Вычислить процентное содержание в образце: a) Mg; б) Са; в) Fe.
38. Из навески алюминиевого сплава получен осадок А12О3 0,0984 г. Вычислить процентное содержание А1 в сплаве, если навеска была 0,4524 г.
39. При анализе латуни из ее навески 0,6500 г получено 0,5200 г осадка ZnNH4PO4 и 0,0030 г осадка PbSO4. Вычислить процентное содержание цинка, свинца и меди в образце, если других составных частей в нем нет.
40. При анализе известняка из навески 0,5210 г после обработки получили осадки: 0,2218 г СаО и 0,0146 г Mg2P2O7. Вычислить процентное содержание СаСО3 и MgCO3 в образце.
41. Из навески магнезита 2,4110 г получено 2,1710 г прокаленного осадка Mg2P2O7. Определить процентное содержание магния в образце: a) Mg; б) MgO; в) MgCO3.
42. Из навески суперфосфата 1,4010 г получено 0,1932 г прокаленного осадка СаО. Какому процентному содержанию: а) Са и б) Са3(РО4)2 соответствует этот осадок?
43. Вычислить процентное содержание A12(SO4)3 в образце технического сульфата алюминия, если из навески 0,5278 г получено 0,1552 осадка А12О3.
44. Для анализа кристаллических технических алюмо-аммониевых квасцов взята навеска 0,8563 г. Из нее получено 0,0914 г осадка А12О3. Вычислить процентное содержание химически чистого кристаллогидрата в образце.
45. Из навески криолита 0,5872 г образовалось 0,1060 г осадка А12О3. Вычислить процентное содержание Na3AlF6 в образце.
89
46. Навеска 0,4000 г алюмокалиевых квасцов растворена в воде. Осаждена солью бария. Выпавший осадок промыт, прокален, взвешен. Масса его оказалась 0,3880 г. Вычислить процентное содержание KA1(SO4)2-12Н2О в образце.
47. Анализу подвергается красный железняк. После растворения, осаждения железа аммиаком и прокаливания осадка образовалось 0,5390 г Ее20з. Каково процентное содержание Fe и ЕегОз в образце, если навеска 0,6582 г?
48. Из FeCO3 после растворения, окисления, осаждения и прокаливания получено 1,0000 г ЕегО3. Вычислить процентное содержание Fe и FeO в образце, если навеска была 1,5200 г.
49. Для анализа магнитного железняка взята навеска 0,6012 г. Железняк превращен в осадок ЕегО3 массой 0,4520 г. Вычислить процентное содержание Fe3O4 и Fe в образце.
50. Из навески железа, масса которой равна аналитическому фактору для пересчета Fe2O3 на Fe, выраженному в граммах, получено 1,0000 г ЕегОз. Был ли образец химически чистым или содержал примеси?
51. Определяя барий в образце ВаС12-2Н2О, получены следующие данные: масса часового стекла с навеской 12,3762 г; масса стекла после ссыпания навески 11,6720 г; масса прокаленного тигля 9,2738 г; масса того же тигля с прокаленным осадком BaSO4 9,9464 г. Вычислить процентное содержание бария в образце.
52. При анализе образца технического хлорида бария получены следующие данные: масса бюкса с навеской 24,9418 г; масса бюкса без навески 24,2982 г; масса пустого тигля 6,2638 г; масса тигля с прокаленным BaSO4 6,7376 г. Вычислить процентное содержание ВаС12-2Н2О в образце.
53. При анализе известняка получены следующие данные: масса часового стекла с навеской 9,3310 г; масса стекла без навески 8,6436 г; масса пустого тигля 5,8140 г; масса тигля с прокаленным осадком СаО 6,1192 г. Вычислить процентное содержание СаСО3 в образце.
54. При анализе мрамора получены следующие данные: масса часового стекла с навеской 15,2858 г; масса стекла без навески 14,4714 г; масса пустого тигля 5,9428 г; масса тигля с осадком после осаждения кальция оксалатом аммония и прокаленным до постоянной массы 90
6,3326 г. Вычислить процентное содержание примесей, не содержащих кальция, в образце.
55. Анализируя доломит, получены следующие данные: масса часового стекла с навеской 5,6102 г; масса стекла без навески 5,2132 г; масса тигля с осадком после осаждения магния гидрофосфатом аммония, прокаленным до постоянной массы, 6,2846 г; масса пустого тигля 6,1224 г. Вычислить процентное содержание MgO в образце.
56. При анализе карбонатной породы получены следующие данные: масса часового стекла с навеской 12,8116 г; масса стекла без навески 12,4236 г; раствор, полученный растворением навески, после отделения нерастворимого остатка и полуторных оксидов обработан оксалатом аммония; масса получившегося прокаленного осадка вместе с тиглем 7,2444 г; масса пустого тигля 7,1242 г. Вычислить процентное содержание Са в образце.
57. Определяя азот в органическом соединении гравиметрическим методом, азот превращен в NHt, осажден платинохлористоводородной кислотой. Полученный осадок прокален до полного разложения и взвешен. Вычислить процентное содержание азота в анализируемом соединении, если навеска была 0,1012 г, а масса прокаленного осадка 0,0572 г.
58. Определяя аммиак в образце органического удобрения (см. задачу 57), из 0,1128 г получен осадок 0,0984 г. Вычислить процентное содержание NH3 в образце.
59. Из 0,3006 г технического сульфата кадмия после обработки получено 0,1986 г осадка Cd2P2O7. Вычислить процентное содержание кадмия в образце.
60. Анализируя навеску 17,0200 г камерной серной кислоты на содержание HNO3, после обработки в соответствующих условиях нитроном получено 0,0908 г осадка C2oHi6N4-HN03. Сколько процентов HNO3 в образце?
61. Из навески натриевой соли после растворения и осаждения магний-уранилацетатом получено 0,9980 г безводного осадка NaMg(UO2)3(CH3COO)9. Сколько граммов натрия в образце?
62. Для анализа нейзильбера на содержание никеля взята навеска 1,2014 г. После ее обработки никель осажден диметилглиоксимом. Масса просушенного осадка ни-кельдиметилглиоксима 0,7990 г. Вычислить процентное содержание никеля в сплаве.
91
63. При анализе образца технического NiSO4-7H2O получено 0,2842 г никельдиметилглиоксима. Вычислить процентное содержание основного продукта в образце, если навеска 0,2988 г.
64. Из навески костяной муки после обработки полу чено 0,4980 г осадка (NH4)3PO4-12МоО3. Вычислить процентное содержание фосфорного ангидрида в образце, если навеска 0,1562 г.
65. Для анализа образца манганина на содержание ни келя взята навеска 5,1128 г. После обработки и осаждения диметилглиоксимом осадок отделен, промыт и прокален. Осадок весил 0,1998 г. Вычислить процентное содержание никеля в образце.
66. После обработки навески образца двойного суперфосфата 0,5238 г и осаждения магнезиальной смесью осадок промыт и прокален. Его масса 0,3840 г. Вычислить процентное содержание: а) фосфора; б) фосфорного ангидрида в образце.
67. Для анализа взята навеска образца доломита 0,9980 г и растворена. Из фильтрата выделен алюминий, который осажден в виде оксихинолята. Масса промытого и высушенного осадка 0,1000 г. Сколько процентов А1 в образце?
68. Из навески доломита 0,3996 г после обработки получены осадки: 0,1234 г СаО и 0,1836 г Mg2P2O7. Сколько процентов: а) СаСО3 и б) MgCO3 в образце?
69. Навеска известняка 1,2300 г растворена в кислоте. Раствор отфильтрован и обработан гидроксидом аммония. Масса прокаленного осадка полуторных оксидов 0,0584 г. Из этого осадка выделен алюминий в виде А12О3, масса которого после прокаливания оказалась 0,0232 г. Сколько процентов: a) Fe и б) А1 — в образце?
70. Из навески кальцита 0,4180 г получено 0,2342 г прокаленного осадка СаО. Был ли кальцит чистым карбонатом кальция или содержал примеси?
71. Из навески карбоната кальция 1,7847 г получено 0,5603 г прокаленного осадка СаО. Вычислить процентное содержание СаСО3 в образце.
72. Какова должна быть навеска образца для определения в нем карбоната кальция, чтобы процентное содержание СаСО3 равнялось массе прокаленного осадка СаО, умноженной на 100?
73. Какой должна быть навеска образца для анализа на содержание магния, чтобы при умножении массы про-92
каленного Mg2PzOz на 100 получилось процентное содержание магния в образце?
74. Какой должна быть навеска для определения фосфора, чтобы его процентное содержание в образце равнялось массе прокаленного осадка Mg2P3O7, умноженной, на 100?
75. В органическом соединении определяют содержание водорода по массе воды, полученной при сжигании вещества. Какова должна быть навеска, чтобы процент ное содержание водорода было равно массе полученной воды, умноженной на 10?
76. Какой должна быть навеска фосфорита, чтобы при умножении массы образовавшегося в ходе анализа соединения Р2О3-24МоО3 на 10 получилось процентное содержание фосфора в образце?
77. Каково содержание определяемой составной части в образце, если масса полученной в ходе анализа весовой формы равна 1 г или его десятичной доле?
78. Сколько просушенного осадка хлорида серебра получится из навески серебряного сплава 0,1000 г, если в нем 90,00% Ag?
79. Сколько прокаленного осадка BaSO4 получится в результате обработки навески 1,5000 г каменного угля, если в образце 5,00% серы?
80. Из навески известняка, содержащего 43,32% СаО, получено 1,3000 г прокаленного осадка CaSO4. Определить навеску образца.
81. После обработки навески алюмокалиевых квасцов, содержащих 97,61% КА1(5О4)г- 12НгО, получено 0,2584 г BaSO4. Какова была навеска для анализа?
82. Какова навеска апатита, содержащего 14,74% фосфора, если после обработки ее получено 0,9926 г (NH4)3PO4-12MoO3?
83. Из 0,1150 г смеси (х. ч), но содержащих некоторое количество гигроскопической воды, хлоридов калия и натрия, получено 0,2645 г AgCl и 0,0326 г КгР1С16. Вычислить процентное содержание NaCl в образце.
84. Для анализа на содержание Кг8О4 (примесь) в образце кристаллического сульфата цинка взята навеска 1,2500 г. Из навески получены осадки: 0,8128 г BaSO4, 0,5298 г Zn2P2O7. Сколько процентов Кг8О4 в образце?
85. Из навески препарата ВаС12-2Н2О (х. ч) получено 0,1820 г осадка BaSO4. Сколько’весит осадок AgCl, полученный из той же навески?
93
86. Из навески препарата СаСО3 (х. ч) после прокаливания до постоянной массы получен осадок 0,1124 г. Сколько граммов СО2 при этом выделилось?
87. Из навески СаС12-6Н2О получено 0,2020 г СаО. Сколько граммов осадка AgCl получится из той же навески?
88. Образец технического сульфата алюминия не имеет примесей, содержащих ионы А!^ и SO47 Сколько должен весить прокаленный осадок А12О3, если из навески получено 0,4264 г BaSO4?
89. Из навески кристаллогидрата сульфата железа получены осадки Fe2O3 — 0,1132 г и BaSO4— 0,3309 г. Могут ли в примесях к основному продукту образца находиться сульфаты других металлов или железные соли других кислот?
90. Приготовлена смесь хлоридов калия и натрия эквимолекулярного состава. Проведен анализ, в результате которого из двух одинаковых навесок получено 0,2880 г K2PtCl6 и 0,3396 г AgCl. Правильно ли составлена смесь? Если неправильно, то какого компонента в ней больше?
91. Из навески препарата кристаллического сульфата магния получены 0,2748 г BaSO4 и 0,1280 г Mg2P2O?. Чем загрязнен препарат — немагниевыми сульфатами или солями магния, не являющимися сульфатами, если в образце нет других ионов, дающих указанные весовые формы?
92. Образец СаСО3 может содержать в качестве примеси или кальциевые соли, не являющиеся карбонатами, или карбонаты, не содержащие кальция. Которая из этих двух возможных примесей есть в образце, если из навески получили 0,1846 г СаО и 0,1658 г СО2?
93. Препарат сульфата натрия перекристаллизован и оставлен на некоторое время открытым. Из навески этого препарата 0,7872 г получено 0,5108 г прокаленного осадка BaSO4. Вычислить процентное содержание воды в препарате. Выветрился ли он частично во время стояния или, наоборот, поглотил влагу?
94. Взята навеска 0,2584 г смеси х. ч. препаратов хлоридов калия и натрия. После обработки получено 0,5408 г осадка КгРЮ^. Сколько процентов NaCl в смеси?
95. Анализирована смесь х. ч. препаратов СаСО3, MgCO3 и NaCl. Из 0,9334 г смеси получены осадки: 0,1602 г СаО и 0,6459 г Mg2P2O7. Вычислить процентное содержание NaCl в смеси.
94
96. Из навески (х. ч.) кристаллической буры 1,2190 г получено 0,4451 г В2О3. Вычислить процентное содержание кристаллизационной воды в препарате.
97. Из навески минерала 0,8864 г получено 0,1038 г осадка полуторных оксидов. После растворения определено, что в осадке было 28,50% AI2O3. Вычислить процентное содержание: а) А1 и б) Fe в образце.
98. Препарат нитрата магния загрязнен хлоридом й бромидом натрия. Навеска препарата 1,1260 г растворена и обработана раствором нитрата серебра. В полученном осадке 0,0980 г при дальнейшем анализе обнаружено 65,80% AgCl. Сколько процентов NaBr в образце?
99. Из навески цинковой руды 0,5232 г после обработки получено 0,7850 г осадка пирофосфата цинка. Так как предположено присутствие кадмия в осадке, он растворен, удален обнаруженный кадмий, а цинк превращен в сульфид и взвешен. Масса его оказалась 0,4954 г. Вычислить процентное содержание кадмия в пересчете CdS в образце.
100. Из навески свинцовой руды 0,4864 г получили 0,4732 г осадка сульфидов. После вторичного растворения осадка и осаждения полученного раствора соляной кислотой получено 0,0124 г осадка AgCl (так как в руде присутствовало небольшое количество серебра). Вычислить процентное содержание свинца в образце, если в нем не обнаружено других металлов, осаждаемых сероводородом в кислой среде.
Ж. РАСЧЕТЫ, СВЯЗАННЫЕ С ИСКЛЮЧЕНИЕМ
ИЛИ ВВЕДЕНИЕМ КАКОЙ-ЛИБО СОСТАВНОЙ ЧАСТИ
Если определить содержание какой-нибудь составной части во влажном образце (а), а затем высушить его и снова произвести определение, то новый результат (с) будет во столько раз больше первого, во сколько 100 больше разности (100—6), где b — влажность образца, %1 Это можно выразить формулой
_ д-100 с~ (100-6)*
Пример 1. Содержание золы во влажном образце торфа 21%. Какова зольность образца после высушивания, если влажность его 30%?
95
Решение.
21-ЮО с = ----------= 30%.
(100-30)
Содержание золы во влажном образце будет, наоборот, меньше содержания ее в сухом образце:
с (100-й) а =-----------.
100
Пример 2. Содержание золы в сухом образце торфа 20%. Какова зольность образца до высушивания, если влаги в нем содержится 30% ?
Решение.
а = 20(1£0 30) = 14%-
Делая полный анализ вещества, все определения ведут обычно из воздушно-сухого образца. Его влажность определяют в отдельной пробе и результаты пересчитывают на абсолютно сухое вещество. Сумма всех результатов полного анализа вещества (аналитический баланс) должна равняться 100%. Это существенный признак правильности анализа.
Задачи
1. Содержание СаО в меле с влажностью 8,00% равно 50,50%. Вычислить процентное содержание СаО в абсолютно сухой пробе образца.
2. Проба руды с влажностью 7,12% содержит 20,54% железа. Сколько железа в абсолютно сухой пробе?
3. Проба каменного угля содержит 8,95% золы и 6,25% влаги. Вычислить процентное содержание золы в абсолютно сухой пробе образца.
4. Воздушно-сухая проба известняка содержит 39,07% кальция. Навеска этой же пробы 0,9234 г после прокаливания стала весить 0,5263 г. Определить процентное содержание кальция в прокаленном продукте.
5. Образец извести имеет состав (в %): СаО — 85,84; MgO —10,45; (А12Оз+Ее2О3) —0,97; SiO2 —0,79; (H2O-f--f-CO2) — 1,98. Каков состав образца в пересчете на абсолютно сухое прокаленное вещество?
6. Образец глины имеет состав (в %); SiO2—44,90; А120з —39,32; Н2О — 9,48; Fe2O3 —0,65; СаО —0,55; MgO — 0,38; ТЮ2 — 0,82; прочие — 3,90. Пересчитать состав образца на абсолютно сухое вещество.
96
7. При анализе доломита получены данные (в %): СО2— 46,66; MgO— 22,07; СаО — 30,59; полуторные оксиды— 0,56; нерастворимый остаток — 0,37; влага — 0,19. Каков состав прокаленного остатка?
8. Анализ карбонатной породы дал результат (в %): СО2 — 46,80; MgO — 21,24; СаО — 30,77; полуторные оксиды— 0,22; нерастворимый остаток — 0,46; влага — 0,13. Пересчитать результат анализа на абсолютно сухое вещество.
9. Навеска хлорида бария 1,0070 г после высушивания до постоянной массы стала весить 0,8586 г. Из навески первоначального образца 0,7042 г получен прокаленный осадок BaSO4 0,6727 г. Из навески первоначального образца 0,2468 г получен осадок AgCl 0,2896 г. Вычислить процентный состав исходного вещества и пересчитать его на безводное вещество.
10. Из навески образца железоаммониевых квасцов 0,9644 г получены осадки: 0,9337 г BaSO4 и 0,1597 г Fe2O3. Определить процентное содержание ионов Fe3+ и SO4~B образце и пересчитать его на безводное вещество исходя из того, что в молекуле квасцов содержится 12 молекул кристаллизационной воды.
11. Навеска образца пирита 1,7890 г после высушивания при 105° С стала весить 1,7180 г. Из навески 0,3980 г первоначального образца получен прокаленный осадок BaSO4 1,0780 г. Определить процентное содержание серы в исходном образце и пересчитать его на абсолютно сухое вещество.
12. Навеска образца технического медного купороса 0,5964 г после удаления всей воды стала весить 0,3748 г. Из навески первоначального образца 2,1100 г получено 0,6350 г СиО. Определить процентное содержание меди в образце и пересчитать его на безводное вещество.
13. Анализ абсолютно сухого образца извести дал следующие результаты (в %): СаО — 76,14; MgO—18,52; SiO2 — 4,00 и СО2—1,37. Навеска образца 1,0380 г, взятая до удаления влаги, после высушивания при 105° С стала весить 0,9178 г. Определить процентный состав исходного продукта.
14. Анализ просушенного до постоянной массы образца доломита дал результат (в %): СО2 — 40,49; СаО — 56,60; полуторные оксиды — 2,17; SiO2 — 0,74. Навеска исходного продукта 0,9844 г после прокаливания до по-
4 Ярославцев А. А. 97
стоянной массы стала весить 0,5181 г. Определить процентный состав исходного продукта.
15. Навеска образца каменного угля 1,9982 г после удаления влаги и летучих стала весить 1,2612 г. Зольность получившегося кокса 11,32%. Какова зольность исходного образца?
16. Образец каменного угля содержит 8,12% влаги и 24,05% летучих горючих веществ. Из навески кокса, полученного при пробном коксовании образца 1,3875 г, получили 0,2080 г золы. Вычислить процентное содержание золы в исходном образце угля.
17. Не полностью прокаленный образец извести содержал (в %): СаО — 76,14; MgO—10,40; SiO2 — 4,00; полуторных оксидов — 1,37; (СО2+Н2О)—8,12. Каков состав этого же образца, из которого влага удалена полностью, а содержание СО2 уменьшено до 0,5%?
18. Безводный сульфат оксида железа (III) содержит 39,93% Fe2O3 и 60,07% SO3. Каков процентный состав девятиводного кристаллогидрата?
19. Образец каменного угля с 4% влаги имеет зольность 8%. Какова зольность того же образца после увеличения влажности до 12%?
20. Цена торфа, содержащего 10% влаги, 2 руб. 40 коп. за 1 т. Какова цена того же торфа, увеличившего влажность до 20%, если считать, что цена пропорциональна содержанию сухой массы?
3. ВЫВОД ФОРМУЛЫ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА
Цель анализа определенных химических соединений — установить их химические формулы. В одних случаях требуется только установить число атомов каждого элемента в молекуле исследуемого вещества. Например, устанавливают, что в молекулу вещества входят три атома Са, два атома Р и восемь атомов О, т. е. его формула Са3(РО4)2. В других случаях полезно представить формулу вещества как соединение оксидов, например A12O3-3SO3. Наконец, состав вещества часто выражают в виде соединения нескольких молекул более простого состава, например для двойных солей и кристаллогидратов.
Подобные задачи решают в два приема. Сначала находят отношение числа частиц (атомов, ионов, более 98
простых молекул), входящих в состав молекулы анализируемого соединения, пользуясь формулой
а Ь с
— : — : —— = х: у: г, АВС У
где Л, В, С — атомные (или молекулярные) массы частиц, входящих в состав молекулы; а, Ь, с — их процентное содержание в анализируемом веществе; х, у, z — число частиц в молекуле простейшего состава.
Затем отношение найденных дробных чисел заменяют отношением ближайших целых чисел.
Пример 1. Анализом установлено, что в состав вещества входит 59,19% Bi, 13,62 S и 27,19% О. Какова простейшая формула анализируемого вещества?
Решение.
59,19 13,62 27,19
: —— = 0,2832:0,4248 :1,6994 = х: у : г.
209 32,064 16
Приняв наименьшее число за единицу и разделив на него два других члена отношения, найдем
х : у: г = 1:1,5:6.
Так как число частиц в молекуле не может быть выражено дробным числом, удваиваем величину всех членов отношения и получаем
х : у : z = 2:3 :12,
т. е. в состав молекулы анализируемого вещества входят 2 атома Bi, 3 атома S и 12 атомов О. Формула вещества Bi2(SO4)3.
Во многих природных химических соединениях часто встречается явление изоморфного замещения. Оно заключается в том, что в соединении один химический элемент частично замещен другим, сходным с ним по валентности и другим свойствам. Например, в известняках неопределенная часть кальция замещается магнием, и поэтому известняки, взятые в различных местностях, имеют различный состав. Чтобы указать на явление изоморофного замещения, состав известняка выражают формулой (Са, Mg) СО3. В подобных случаях формула соединения не может быть найдена непосредственно, так как здесь отношение х: у : z не будет равно отношению целых чисел, что и является признаком изоморфного замещения. В этих случаях, чтобы получить для всех членов отношения целые числа, необходимо суммировать те члены, которые относятся к изоморфно заменяемым элементам.
4*
99
Пример 2. Анализом установлен следующий состав минерала (в %): Са — 9,20; Mg — 22,0; С— 13,7; О — 55,1. Найти простейшую химическую формулу минерала.
Решение.
9,2 22,0 13,7 55,1
40,08 : 24,31 : 12,01 '' 16
1,14
= 0,230,91:1,14:3,44 =1:1:3.
Формула соединения (Са, Mg)COs.
Задачи
Пр имечание. Решая задачи этого раздела, вычислять надо с наибольшей возможной точностью.
1. Какую химическую формулу имеет вещество, состоящее из 71,47% Са и 28,53% О?
2. Вещество содержит 63,52% Fe и 36,48% S. Какова его химическая формула?
3. В состав вещества входит 42,88% С и 57,12% О. Найти его химическую формулу.
4. Какова химическая формула вещества, если оно содержит 75,26%' Ag и 24,74% С1?
5. Какую химическую формулу имеет вещество, состоящее из 84,98% Hg и 15,02% С1?
6. Химическое вещество имеет молекулярную массу 135,04 и состоит из 47,49% S, 52,51% С1. Какова его химическая формула?
7. Какую химическую формулу имеет вещество, состоящее из 62,53% Са и 37,47% С?
8. Анализ образца пирита показал, что он состоит из 53,45% S и 46,55% Fe. Какой химической формуле соответствует состав этого минерала?
9. Какую химическую формулу имеет фторид, если он состоит из 51,33% Са и 48,67% F?
10. Пиролюзит содержит 63,19% Мп и 36,81% О. Какой химической формуле соответствует его состав?
11. Минерал состоит из 56,03% СаО и 43,97% СОг. Какова его химическая формула?
12. В состав вещества входит 36,23% MgO и 63,77% Р2О5. Какой химической формулой выражается его состав?
13. Корунд состоит из 52,92% А1 и 47,08% О. Найти его химическую формулу.
14. Минерал стибнит состоит из 71,68% Sb и 28,32% S. Найти его химическую формулу.
100
15. Кристаллогидрат сульфата меди состоит из 63,92% CuSO4 и 36,08% Н2О. Какой химической формуле соответствует состав кристаллогидрата?
16. Кристаллогидрат сульфата цинка состоит из 56,14% ZnSO4 и 43,86%Н2О. Найти формулу кристаллогидрата.
17. Мирабилит содержит 44,09% Na2SO4 и 55,91% Н2О. Какую формулу имеет этот минерал?
18. Карналлит состоит из 26,83% КО; 34,24% MgCl2 и 38,91 % Н2О. Какой химической формуле соответствует состав этого минерала?
19. Криолит содержит 32,85% Na; 12,85% AI и 54,30% F. Какую химическую формулу он имеет?
20. Какой химической формулой можно выразить состав пестрой медной руды (борнит), если она состоит из 63,31% Си; 11,13% Fe и 25,56% S?
21. Фторапатит состоит из 39,74% Са; 18,43% Р; 3,77% F и 38,07% О. Какую химическую формулу он имеет?
22. Определить химическую формулу минерала, содержащего 24,95% Fe; 46,46% Сг и 28,59% О.
23. В состав минерала волластонита в основном входят: 34,50% Са; 24,18% Si; 41,32% О. Какую химическую формулу имеет волластонит?
24. Родонит (орлец) в основном имеет следующий состав: 41,93% Мп; 21,43% Si; 36,63% О. Определить его химическую формулу.
25. Один из пирротинов состоит из 60,38% Fe и 39,62% S. Какова его формула?
26. Одним из цеолитов является натролит, состоящий из 12,09% Na; 14,19% Al; 22,16% Si; 42,08% О и 9,48% легко выделяемой воды. Какова формула этого минерала?
27. Фосфорит содержит 39,13% Са; 1,95% F; 3,28% С1; 55,63% РО4-. Какой химической формулой может быть выражен его состав?
28. Определить химическую формулу вольфрамита, если известно, что он состоит из 6,71 % Fe; 11,53% Мп; 60,66% W и 21,10% О.
29. Найти химическую формулу минерала, состоящего из 20,65% А12О3; 7,03% Fe2O3; 27,65% СаО и 44,55% SiO2.
30. Минерал имеет состав 46,36% МпО; 6,91% СаО; 46,83% SiO2. Какова химическая формула минерала?
101
И. КОСВЕННЫЙ АНАЛИЗ
Все рассмотренные случаи аналитических расчетов сводятся к обработке полученных данных путем составления и решения одного математического уравнения, содержащего одно неизвестное. Но иногда нет возможности получить все данные, необходимые для решения. Тогда можно прибегнуть к более сложному приему вычисления и попытаться воспользоваться такими данными, на основании которых можно составить систему уравнений с несколькими (обычно двумя) неизвестными. Такой путь анализа называется косвенным. Разберем несколько простейших примеров.
Пример 1. Установлено, что содержание СО2 в смеси чистых MgCO3 и ВаСО3 равно 43,97%. Вычислить процентное содержание каждого компонента в смеси.
Решение. Пусть данная смесь содержит а % MgCOs и 6% ВаСОз. Отсюда вытекает первое уравиеиие системы:
а + Ь = 100. (1)
Далее найдем содержание СО2 в чистых компонентах смеси:
в MgCO3
=52,19%;
MgCO3
в ВаСО3
СОо-ЮО
—у——=22,30%
ВаСО3
(формулами веществ обозначены их молекулярные массы).
Теперь можно определить процентное содержание СО2 в каждом компоненте данной смеси:
BMgCO3
л-52,19 100 А’
в ВаСО3
Ь- 22,30
100
Общее содержание СО2 в смеси по условию равно 43,97%. Следовательно, а -52,19 6-22,30
100 + 100
0,5219а + 0,22306 = 43,97%. (2)
Таким образом, получена система из двух уравнений с двумя неизвестными. Решив, найдем: а=72,50% и 6 = 27,50%.
102
43,97%,
Пример 2. После обработки навески 0,1809 г смеси NaCl и NaBr раствором AgNO3 получено 0,3715 г осадка. Вычислить процентное содержание NaCl и NaBr в смеси.
Решение. Обозначим количества NaCl и NaBr в смеси соответственно через х и у. Тогда
х + у = 0,1809. (1)
При осаждении каждая молекула NaCl образует одну молекулу AgCl, а молекула NaBr — молекулу AgBr, следовательно, из х г NaCl образуется:
х AgCl х-143,32
---------=------------= 2,4524л г AgC .
NaCl 58,44 s
Из у г NaBr образуется:
у AgBr у -187,78 NaBr = 102,90
= 1,8249у г AgBr.
На основании этих данных составляем второе уравнение:
2,4524х + 1,82491/ = 0,3715.
(2)
Решив систему уравнений, найдем:
х = 0,0660 г и у = 0,1149 г.
Наконец, определим процентное содержание компонентов:
0,0660-100 0,1149-100
= 63,52% NaBr.
Результаты косвенных методов анализа гораздо менее достоверны, чем результаты прямых аналитических методов. К косвенным методам анализа следует прибегать только в случае невозможности применения прямых методов.
Особенно снижают достоверность результатов косвенного метода анализа даже малейшие погрешности в определении масс (навески, осадка), загрязнение осадков, малая разница в атомных массах главных определяемых элементов, неправильности, допускаемые в округлении результатов.
Задачи
1. Анализируемое вещество принято за SrCOs, что точно подтверждалось полученным результатом анализа на содержание СО2. Однако качественный анализ показал полное отсутствие иона Sr2+ в веществе и наличие ионов Са2+ и Ва2+. Каков действительный состав вещества?
2. Содержание в образце брома точно равно содержанию брома в NaBr. Каков действительный состав образ
103
ца, если он содержит катионы только аммония и калия? 3. Из 0,2120 г смеси КС1 и KI получено 0,1994 г K2SO4.
Сколько граммов К.С1 и KI в образце?
4. Навеска смеси NaCl и NaBr 0,1798 г образует с AgNO3 осадок 0,3802 г. Сколько граммов каждого компонента содержит навеска?
5. Из 0,2905 г смеси NaCl и КС1 получено 0,3502 г смеси сульфатов натрия и калия. Вычислить процентное содержание NaCl и КС1 в смеси.
6. Количественным осаждением с помощью AgNO3 из 0,3988 г смеси NaCl и NaBr получен осадок 0,7822 г. Определить состав смеси.
7. Взята навеска 0,8210 г смеси СаСО3 и MgCO3. После прокаливания ее получено 0,4306 г смеси оксидов. Определить процентный состав смеси.
8. Из навески доломита 0,1840 г после обработки получено 0,0915 г оксидов кальция и магния. Вычислить процентное содержание СаО и MgO в образце.
9. Взята навеска сильвинита 1,4260 г, из которой выделен сухой остаток КС! и NaCl 1,1410 г. Остаток превращен в сульфаты. Масса сульфатов 1,3547 г. Вычислить процентное содержание KCI и NaCl в образце.
10. Из 1,3345 г силиката количественно выделен калий и натрий в виде раствора хлоридов, объем которого 200,0 мл. Из 50,00 мл раствора осаждено 0,2052 г AgCl. Вычислить процентное содержание К2О и №гО в образце, если масса выделенных из ’Д навески хлоридов калия и натрия 0,0879 г.
Глава 111
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ТИТРИМЕТРИЧЕСКОГО (ОБЪЕМНОГО) АНАЛИЗА
А. РАСЧЕТЫ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
Расчеты в титриметрическом анализе, как и в гравиметрическом, основаны на законе эквивалентов — с той лишь разницей, что здесь в расчеты вводятся концентрации и объемы реагирующих растворов. Концентрации в титриметрическом методе выражают только числом грамм-эквивалентов в литре (нормальность), а объемы— в литрах или миллилитрах. В тех случаях, когда требуется определить количество вещества, содержащееся в анализируемом растворе, исходят из того, что в 1000 мл 1 и. рабочего раствора содержится 1 г-экв определяемого вещества. Когда нужно определить только концентрацию определяемого раствора, исходят из основного положения титриметрического анализа: объемы двух растворов, нацело реагирующих между собой, обратно пропорциональны, нормальностям этих растворов'.
vyv2 = N2/Nu
где и N\—объем и нормальность одного раствора; V2 и N2 — то же, другого раствора.
Задачи
1. Для анализа на содержание H2SO4 в растворе взята навеска 0,5080 г. После обработки получен осадок BaSCh 1,1670 г, на что потребовалось 50 мл 0,2 н. ВаОг. Вычислить процентное содержание H2SO4 в образце. Расчет выполнить, исходя: а) из массы полученного осадка; б) из объема израсходованного раствора хлорида бария.
2. Для определения содержания хлора в техническом хлориде калия взята навеска 0,7142 г. На осаждение ионов С1_ в виде AgCl израсходовано 10 мл 1 н. AgNOs и образовалось 1,4334 г AgCl. Вычислить процентное со
105
держание хлора в образце. Расчет произвести, исходя: а) из массы осадка AgCl; б) из объема израсходованного раствора AgNOs и его концентрации.
3. На нейтрализацию раствора КОН израсходовано 25 мл 0,1 н. НС1. Сколько граммов КОН содержалось в растворе?
4. К раствору H2SO4 прибавлено 20,50 мл 0,2 н. КОН, после чего среда стала нейтральной. Сколько граммов H2SO4 было в растворе?
5. Сколько граммов NaOH содержится в растворе, если на его нейтрализацию израсходовано 22,50 мл 0,5 н. НС1?
6. Сколько граммов H2SO4 содержится в растворе, на нейтрализацию которого израсходовано 15,50 мл 0,3 н. КОН?
7. Сколько миллилитров 0,1 н. НС1 потребуется для нейтрализации раствора, содержащего 1,00 г NaOH?
8. Сколько миллилитров 2 н. NaOH потребуется для нейтрализации раствора, в котором содержится 4,9 г H2SO4?
9. К раствору, содержащему 0,5 г КОН, прибавлено 10 мл 1 н. H2SO4. Щелочь или кислота осталась в избытке. В каком количестве?
10. К раствору, содержащему 1,00 г H2SO4, прибавлено 10 мл 2 н. NaOH. Какую среду имеет полученный раствор? -Что и в каком количестве находится в избытке?
11. На нейтрализацию раствора, содержащего 1,0 г каустической соды, израсходовано 20 мл 1 н. НС1. Вычислить процентное содержание NaOH в образце.
12. На нейтрализацию навески 1,00 г технической серной кислоты расходуется 10 мл 2 н. NaOH. Вычислить процентное содержание H2SO4 в образце.
13. К 25 мл соляной кислоты неизвестной концентрации прибавлено 25 мл 0,1 н. NaOH, отчего среда стала нейтральной. Какова нормальность соляной кислоты?
14. Слиты вместе одинаковые объемы раствора КОН неизвестной концентрации и 0,2 н. НС1. Какова нормальность раствора КОН, если после смешения среда стала нейтральной?
15. 50 мл раствора H2SO4 неизвестной концентрации реагируют нацело с 45,65 мл 0,1 н. NaOH. Какова нормальность раствора H2SO4?
106
16. На нейтрализацию 25 мл раствора КОН израсходовано 20,50 мл 0,2 н. НС1. Чему равна нормальность раствора КОН?
17. 25 мл одного раствора реагируют нацело с 20 мл второго раствора. Чему равно отношение нормальности первого раствора к нормальности второго?
18. С 20,00 мл раствора NaCl вступают нацело в реакцию 15,00 мл раствора AgNO3. В каком отношении находятся между собой нормальности раствора AgNO3 и NaCl?
19. На нейтрализацию 25 мл раствора щелочи потребовалось 28,50 мл раствора кислоты. У какого раствора нормальность больше? Во сколько раз?
20. На нейтрализацию 24,75 мл раствора НС1 израсходовано 25,00 мл раствора КОН. Концентрация какого раствора больше? Во сколько раз?
21. Какой объем 0,2 н. НС1 потребуется для нейтрализации 40 мл 0,1 н. NaOH?
22. Какой объем 0,1 н. AgNO3 потребуется для полного осаждения иона С1~ из 25 мл 0,15 н. NaCl?
23. На нейтрализацию 25,00 мл 0,1125 н. раствора H2SO4 израсходовано 28,50 мл раствора КОН неизвестной нормальности. Какова его нормальность?
24. На нейтрализацию 25,00 мл раствора NaOH израсходовано 22,60 мл 0,0965 н. НС1. Определить нормальность раствора NaOH.
25. 20,00 мл раствора КС1 неизвестной концентрации реагируют нацело с 22,45 мл 0,20 н. AgNO3. Определить нормальность раствора КС1.
26. 18,25 мл 0,10 н. КМПО4 реагируют нацело с 15,00 мл раствора FeSO4. Какова нормальность последнего?
27. Сколько миллилитров раствора, содержащего 3,646 г НС1 в 1 л, потребуется для нейтрализации 25 мл раствора, содержащего 4,00 г NaOH в 1 л?
28. Сколько миллилитров раствора AgNO3, содержащего 17 г AgNO3 в 1 л, потребуется для полного осаждения иона С1- из 20 мл раствора соляной кислоты, содержащего 73 г НС1 в 1 л?
29. К 10,00 мл 25%-кого раствора КОН прибавлено 10,00 мл 25%-ного раствора H2SO4. Какую среду имеет полученный раствор?
30. Слиты одинаковые объемы 20%-ных растворов КОН и НС1. Какова среда полученного раствора?
107
Б. ИЗМЕРЕНИЕ ОБЪЕМОВ
За единицу вместимости в метрической системе единиц принимают объем, занимаемый массой одного килограмма воды при температуре ее наибольшей плотности (+3,98°^+4° С) и атмосферном давлении 760 мм рт. ст. В объемном анализе эта единица вместимости называется истинным литром. Другими словами, истинным литром называется объем, занимаемый одним килограммом чистой воды, отвешенной в пустоте при температуре наибольшей плотности.
Объемы растворов в титриметрическом анализе измеряют при помощи измерительных сосудов: мерной колбы, пипетки и бюретки. Точное нанесение на эти сосуды меток, соответствующих определенным объемам (вместимостям), называется калиброванием, а проверка правильности нанесения уже готовых меток — проверкой измерительных сосудов. Калибрование и проверку измерительных сосудов выполняют методом взвешивания вмещаемой ими (мерные колбы) или вытекающей из них (пипетки и бюретки) чистой воды. Во время этих операций взвешивать воду приходится не при +4° С и не в пустоте, а при атмосферном давлении и в сосудах, расширяющихся от нагревания. Поэтому при калибровании и проверке емкости измерительных сосудов вводят три поправки: 1) на температурное расширение воды; 2) на температурное расширение сосуда; 3) на взвешивание в воздухе.
Чтобы не было ошибок во время работы с измерительным сосудом при различных температурах, его калибруют так, чтобы емкость сосуда равнялась обозначенной (номинальной) не при той температуре, при которой производилась калибровка, а при одной общей для всех лабораторий температуре — при 20° С. Следовательно, калибруя измерительные сосуды на одну и ту же вместимость, но при различных температурах, отвешивают различные количества воды.
При калибровании и проверке измерительных сосудов взвешиванием все необходимые данные берут из табл. 10 приложения.
В таблице указано, сколько воды следует отвесить латунными гирями в стеклянном сосуде при различных температурах, чтобы ее объем при 20° С равнялся точно одному истинному литру. Одна тысячная этой величины 108 •
носит название кажущейся, или калибровочной, объемной массы воды.
Так как прн калибровании и проверке измерительных сосудов приходится взвешивать сравнительно большие массы воды( до 1—2 кг), взвешивание ее выполняют на технохимических весах, но обязательно способами, исключающими ошибку на неравноплечность.
Задачи
1. Сколько граммов дистиллированной воды следует отвесить при 20° С латунными разновесами, чтобы ее объем был равен точно одному истинному литру?
2. Сколько граммов дистиллированной воды следует отвесить при 15° С латунными разновесами, чтобы она, приняв температуру 20° С, занимала объем одного истинного литра?
3. Больше или меньше истинного литра занимает объем 1 кг воды, отвешенной в обычных условиях?
4. Для калибрования двух мерных колб отвешено точно по 1 кг воды, причем для первой колбы это выполнено с помощью латунных разновесов, а для второй — платиновых. Какая колба имеет меньшую поправку?
5. Сколько граммов воды следует отвесить при 18,2° С, чтобы объем, занимаемый ею при 20° С, был равен 250 мл?
6. Калибруют мерную колбу на 500 мл. Сколько граммов воды потребуется отвесить для этой цели при 24,6° С?
7. Какую массу гирь надо положить на чашку весов с калибруемой на 500 мл колбой вместо стоявшей при ее тарировании гири 500 г, если работу выполняют при 22,6° С?
8. То же, при 250 мл и 15,8° С?
9. То же, при 200 мл и 24,4° С?
10. То же, при 150 мл и 16,0° С?
11. То же, при 100 мл и 23,6° С?
12. То же, при 50 мл и 20,0° С?
13. При проверке емкости мерной колбы получены следующие данные: обозначенный объем колбы-------;;
масса воды, налитой до метки, 997,20 г; температура
109
17,0° С. Каковы истинный объем (Уист) и поправка (А У) колбы?
14. Обозначенная емкость мерной колбы —20^~ ’
масса воды, налитой до метки, 498,80 г; -температура 21,6°. Определить истинный объем (Уист) колбы и поправку (А У).
15. При проверке емкости мерной колбы получены следующие данные: температура опыта (Л) 15,2° С; обозначенный объем (Уобозн) Ю00 мл; температура, при которой колба имеет точно обозначенный объем (/г), 20°С; масса гири, с которой тарируется пустая колба (tn), 1000 г; сумма мелких гирь (Ат), которые пришлось положить для уравновешивания весов после снятия гири в 1000 г и наливания колбы водой до метки, 2,87 г. Чему равны истинный объем колбы (УИст) и поправка (АУ), если АУ= Уист Уобозн?
16. По примеру предыдущей задачи определить УИСт и АУ колбы, если: УОбозн=500 мл; т=500 г; Ат=1,42 г; /1 = 17,8° и /2 = 20° С.
17. То же, если УОбозн=250 мл; т=250 г; Ат = 0,72 г; Л = 18,2°С и t2= 20° С.
18. То же, если УОбозн=200 мл; т = 200 г; Ат = 0,54 г; Л = 26,4° С и /2 = 20° С.
19. То же, если УОбоэн=150 мл; т=150 г; Ат = 0,40 г; Л = 22,6°С и /2=20°С.
20. То же, если Уобозн=100 мл; т=100 г; Ат=0,29 г; /1 = 15,0° С и /2 = 20°С.
21. Проверяя объем пипетки трехкратным заполнением— до метки водой при 25,4° С и взвешиванием выпущенной воды, получены следующие три результата: 19,962; 19,958 и 19,966 г. Чему равны УИст и АУ пипетки?
22. При проверке объема пипетки получены следующие данные: масса пустого бюкса 24,648 г; масса бюкса с водой, выпущенной из проверяемой пипетки, 49,574; 49,584 и 49,588 г. Температура опыта 19,2° С. Найти истинный объем пипетки и поправку.
23. При калибровании пипетки на 20 мл на ней поставлены две временные метки на расстоянии 50 мм друг от друга. Температура опыта 22,2° С. Масса воды, вылитой из пипетки, заполненной до нижней метки, 19,460 г, ПО
а при заполнении до верхней метки — 20,520 г. На каком расстоянии от нижней метки следует поставить постоянную метку?
24. На каком расстоянии от нижней временной метки следует поставить постоянную метку на трубке пипетки, если при ее калибровании получены следующие данные: расстояние между метками 100 мм; t опыта 18,8° С; масса воды, выпущенной из пипетки от нижней метки, 49,5300 г, от верхней — 50,3200 г?
25. При калибровании пипетки получены следующие данные: расстояние между метками 50 мм; масса пустого бюкса 38,4652 г; масса бюкса с водой, выпущенной из пипетки от нижней временной метки: 1) 57,9552 г, 2) 57,9562 г и 3) 57,9542 г; масса бюкса с водой, выпущенной от верхней метки (в тот же бюкс): 1) 59,0072 г; 2) 59,0052 г и 3) 59,0032 г; температура опыта 21,2° С. Определить место нанесения постоянной метки.
26. При калибровании пипетки получены следующие данные: расстояние между временными метками 100 мм; масса пустого бюкса 53,4200 г; масса бюкса с водой, выпущенной из пипетки от нижней метки: 1) 102,2028 г; 2) 102,1900 г и 3) 102,2050 г; то же, от верхней метки: 1) 104,1992 г; 2) 104,2003 г и 3) 104,1972 г; температура опыта 19,8° С. На каком расстоянии от нижней временной метки следует поставить постоянную метку? Какой объем ей соответствует?
27. При калибровании пипетки получены следующие данные: температура опыта 16,8° С; расстояние между временными метками 50 мм; масса воды, выпущенной из пипетки от верхней метки, 24,7330 г, а от нижней — 23,9450 г. Где следует поставить постоянную метку? Какому объему она соответствует?
28. Для калибрования пипетки на ней поставлены две временные метки на расстоянии 100 мм друг от друга. Масса воды, выпущенной из пипетки от нижней метки при 24,8° С, равна 97,6250 г, а выпущенной из верхней метки — 99,4320 г. Где следует поставить постоянную метку? Какому объему она соответствует?
29. Масса бюкса с водой, выпущенной из бюретки от нулевого деления до 30-го, при 26,2° С равна 72,210 г. Масса пустого бюкса 42,344 г. Каковы истинный объем и поправка, соответствующая этой точке бюретки?
30. Построить кривую поправок бюретки на основании данных, сведенных в следующую таблицу:
111
И -сбозн» мл Масса воды т, г 1, °C Калибровочная масса воды т1 И„сг /
5 4,986 24,8
10 9,984 24,8
15 14,972 24,8
20 19,964 24,8
25 24,930 24,8
30 29,868 24,8
35 34,845 22,8
40 39,830 22,8
45 44,780 22,8
50 49,730 22,8
В. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
РАБОЧЕГО РАСТВОРА
Рабочий раствор — раствор вещества, вступающего в реакцию с определяемым веществом, имеющий точно известную концентрацию.
Рабочее вещество — вещество, из которого приготовлен рабочий раствор.
Титр по рабочему веществу (Т^.в), или просто титр,— количество граммов рабочего вещества, содержащегося в 1 мл рабочего раствора.
Титр по определяемому веществу (Тр.в/о.в) — количество граммов определяемого вещества, эквивалентное количеству рабочего вещества, содержащегося в 1 мл рабочего раствора, т. е. оттитровываемое одним миллилитром его.
Нормальность — количество грамм-эквивалентов рабочего вещества, содержащееся в 1 л (или миллиграмм-эквивалентов в 1 мл) данного рабочего раствора.
Поправочный коэффициент (/<), или поправка,— число, показывающее, во сколько раз нормальность данного рабочего раствора больше одной из следующих точных концентраций: 0,1; 0,2; 0,5; 0,01; 0,02; 0,05; ... н., или какую часть от них она составляет.
Задачи
1. Навеска NaCl (х. ч.) 5,9120 г растворена в мерной колбе на 1 л. Раствор доведен до метки. Чему равен титр полученного раствора по рабочему веществу?
112
2. Из навески КС1 (х. ч.) 3,8260 г приготовлено 500 мл раствора. Каков его титр: а) по КС1; б) по С1?
3. Навеска железа (х. ч.) 2,8120 г растворена в соляной кислоте. Раствор доведен до объема 500 мл. Определить титр раствора: а) по Fe; б) по FeCl2.
4. Навеска Иа2СОз (х. ч.) 1,3540 г растворена в мерной колбе на 250 мл; раствор доведен до метки. Чему равен титр раствора: а) по Иа2СОз и б) по Na2O?
5. На склянке написано: «КОН; Т = 0,005742». Сколько граммов КОН содержится: а) в 10; б) в 25; в) р 100 мл раствора?
6. Сколько граммов NaOH содержится: а) в 10; б) в 250; в) в 1000 мл раствора, титр которого по NaOH 0,004120?
7. Сколько граммов иода содержится в 15,50 мл раствора, если титр его равен 0,01263?
8. Сколько H2SO4 содержится: а) в 28,60 мл; б) в 12,54 мл раствора, титр которого 0,005146?
9. На титрование израсходовано 26,75 мл раствора соляной кислоты, титр которой 0,003782. Сколько граммов НС1 израсходовано на взаимодействие с определяемым веществом?
10. На титрование израсходовано 18,54 мл раствора NaOH, титр которого 0,003980. Сколько граммов NaOH вступило в реакцию с определяемым веществом?
11. Титр раствора NaOH 0,04000. Чему равен его титр по НС1?
12. Титр раствора НС1 0,03647. Чему равен его титр по КОН?
13. Титр раствора AgNOa 0,01702. Определить его титр по NaCl.
14. Титр раствора КС1 0,003756. Определить его титр по Ag.
15. Раствор содержит 2,8640 г КОН в 1 л. Чему равен его титр по H2SO4?
16. Навеску 0,2968 г х. ч. NaCl растворили в мерной колбе на 250 мл. Каков титр раствора по Ag?
17. 7\аон = 0,00400. Найти 7\аон/нсь
18. Тнс1=0,003647. Найти Тна/кон-
19. Ткон=0,005842. Найти Tkoh/h2so4-
20. Tn2so4=0,004674. Найти Tn2so,/Na2o-
21. 7\аон = 0,04102. Найти 7\аОн/зо3-
22. 7”hci=0,03840. Найти Гна/к2о.
23. TAgNo3 = 0,01730. Найти TAgNo3/Na-
113
24. 7’AgNO3 = 0,01882. Найти TAgNo/a-
25. На титрование соляной кислоты израсходовано 10,00 мл рабочего раствора NaOH с 7\аон/нс1=0,003874. Сколько граммов НС1 содержит раствор?
26. На титрование раствора NaOH израсходовано 20,00 мл рабочего раствора НС1 с 7’на/каон = 0,00800. Сколько граммов NaOH содержит раствор?
27. На титрование раствора H2SO4 израсходовано 28,35 мл раствора КОН с 7’koh/h2so<=0,04890. Сколько граммов H2SO4 содержит раствор?
28. На титрование раствора NaCl израсходовано 19,95 мл раствора AgNO3 с 7’AgNOi/ci== 0,03640. Сколько граммов С1 содержит раствор?
29. На титрование раствора H2SO4 расходуется 10,00 мл раствора КОН с 7’koh/ci=0,03565. Сколько граммов H2SO4 содержит раствор?
30. На титрование раствора NaOH расходуется 20,00 мл раствора НС1 с Гна/кон = 0,02820. Сколько граммов NaOH содержит раствор?
31. 7’h2so4/koh = 0,005820. Найти Т’щзо,-
32. 7\таон/нс1 = 0,003952. Найти 7’каон-
33. Составить в общем виде формулу для перехода от Тр.в К 7'р.в/о.в-
34. Составить в общем виде формулу для перехода от
35. 7кон = 0,05611. Найти нормальность КОН.
36. Тнс1 = 0,003647. Найти нормальность НС1.
37. Гиас^ 0,005902. Найти нормальность NaCl.
38. TillS0. = 0,004990. Найти нормальность H2SO4.
39. 7’каон = 0,003882. Найти нормальность NaOH.
40. 7’AgNO3=0,01598. Найти нормальность.
41. ТкаС1=0,005420. Найти нормальность.
42. 7x0/01=0,003674. Найти нормальность.
43. Гк2сг2о7=0,004650. Найти нормальность раствора: а) для реакции обмена; б) для реакции окисления—восстановления, в которой дихромат калия превращается в СгС13.
44. 7кмпо4=0,002980. Найти нормальность раствора для реакций, в которых перманганат превращается: а) в МпО2 и б) в MnSO4.
45. 7’koh/hci=0,003465. Найти нормальность.
46. 7’на/цаон = 0,003984. Найти нормальность.
47. 7’h2so1/k2o = 0,004615. Найти нормальность.
48. 7’NaOH/so3 = 0,004152. Найти нормальность.
114
49. Составить формулу для перехода от Трл к нормальности (N).
50. Составить формулу для перехода от N рабочего раствора к Т$л.
51. Составить формулу для перехода от Тр.в/о.в к N.
52. Составить формулу для перехода от N к Тр.в/о.в.
53. На титрование 20,00 мл раствора НС1 расходуется 19,50 мл 0,9640 н. КОН. Найти нормальность НС1.
54. На титрование 25,00 мл раствора КОН расходуется 28,40 мл 0,1265 н. H2SO4. Найти нормальность раствора кон.
55. На титрование 20,00 мл раствора NaCl требуется 18,25 мл 0,1140 н. AgNO3. Найти нормальность раствора NaCl.
56. На титрование 25,00 мл раствора NaOH потребовалось 22,60 мл 0,9890 н. НС1. Найти нормальность NaOH.
57. На титрование 20,00 мл раствора H2SO4 расходуется 21,55 мл раствора NaOH с 7\дон = 0,008110. Найти нормальность H2SO4.
58. 24,85 мл раствора КОН с Ткон = 0,02806 оттитро-вывают 25,00 мл раствора НО. Найти нормальность НС1.
59. На титрование 25,00 мл раствора КОН расходуется 23,25 мл НС1 с Thci=0,007352. Найти нормальность раствора КОН.
60. На титрование 20,00 мл раствора щелочи израсходовано 19,10 мл раствора H2SO4 с Гна804 = 0,01000. Какова нормальность щелочи? Можно ли узнать ее титр?
61. На титрование раствора КС1 расходуется 30,20 мл раствора AgNO3 (ТАётг =0,1245). Сколько граммов КС1 в растворе? Можно ли узнать его нормальность?
62. На титрование раствора H2SO4 израсходовано 25,40 мл 0,2140 и NaOH. Сколько граммов H2SO4 в растворе?
63. 25,00 мл раствора НС1 неизвестной концентрации требуют для титрования 23,30 мл раствора NaOH с Гмаоп/щзо, =0,04980. Определить нормальность раствора НС1.
64. На титрование 25,00 мл раствора НС1 с 7'nci/NaOn = 0,01122 расходуется 25,82 мл раствора NaOH. Определить нормальность раствора NaOH.
65. На титрование 20,00 мл раствора КОН с Tkoh/hci=0,07255 расходуется 18,40 мл раствора H2SO4. Определить его нормальность.
115
66. На титрование 25,00 мл раствора КС1 с 7ка/ле = = 0,01000 расходуется 23,20 мл раствора AgNO3 неизвестной концентрации. Какова нормальность раствора AgNO3?
67. На титрование 25,00 мл раствора NaOH с 7’NaOH/H,so4 =0,004904 расходуется 25,00 мл раствора НС1. Какова нормальность этого раствора?
68. На титрование 20,00 мл раствора НС1 с 7’нс1/каон = 0,003954 расходуется 20,00 мл раствора КОН неизвестной концентрации. Какова нормальность этого раствора?
69. 7'кмпп< /fp = 0.002830. Какова нормальность раствора в реакциях, в которых перманганат превращается в MnSO4, и в тех реакциях, в которых он превращается в МпОг?
70. Тк^г.о,/Fe=0,01126. Определить нормальность раствора, если он предназначен для реакций, в которых дихромат превращается в СгС13.
71. Нормальность раствора КОН 0,1124. Определить Ккон-
72. Нормальность раствора НС1 0,0954. Определить Кист
73. Нормальность раствора КОН 0,04860. Определить Л’кон-
74. Нормальность раствора NaCl 0,01980. Определить KNaCl-
75. Определить Лиа, если Тиа=0,001842.
76. Определить KHaso4, если Th2so4 =0,009860.
77. Определить Кмаон, если 7\аон = 0,02120.
78. Определить Л’кон, если 7’кон = 0,01122.
79. Определить Кна, если 7hci/koh = 0,005412.
80. Определить Кмаон, если Ткаон/нс^ 0,01890.
81. Определить Kabno,, если TAgNO,/ci=0,007024.
82. Определить Kh.,so„ если 7’H2so4/Na!o = 0,003904.
83. Кмаон= 1,1430 к 0,1 н. Определить Тиаоп-
84. Кнс1= 1,0840 к 0,2 н. Определить Тнсь
85. Ккон = 0,9246 к 0,05 н. Определить 7кон.
86. Kh2so,=0,8542 к 0,01 н. Определить Тщэо..
87. KNaoH= 1,2040 к 0,5 н. Определить Тнаон/на.
88. Кна=0,8642 к 0,02 н. Определить Тна/кон-
89. Ккон= 1,0580 к 0,5 н. Чему равна нормальность КОН?
90. ККс1 = 0,9544 к 0,2 и. Чему равна нормальность КС1?
116
В титриметрическом анализе часто приходится сливать вместе несколько рабочих растворов различных концентраций, а потом суммировать и вычитать введенные количества веществ, узнавая, сколько и какого вещества осталось в избытке. Вести эти вычисления обычным порядком, подсчитывая порознь количества вещества, содержавшиеся в каждом из введенных растворов, очень громоздко и долго. Гораздо быстрее эти вычисления можно выполнять очень простым методом приведения всех, участвующих в вычислении концентраций, к одной общей нормальности, равной единице.
Пример 1. Смешано 25 мл 0,22 н. раствора кислоты с 24 мл 0,25 н. раствора щелочи. Какую среду имеет полученный раствор?
Решение. Приведем оба раствора к 1 н. концентрации, воспользовавшись основным положением титриметрического анализа:
25_____1 24_____1_
х ~ 0,22 И в = 0,25 ’
х — 25 0,22 = 5,5 мл 1 н. раствора кислоты, $ = 24-0,25 = 6,0 мл 1н. раствора щелочи.
Так как щелочи было взято больше, чем кислоты на 6,0—5,5 = = 0,5 мл (в пересчете на объем 1 н. раствора), среда после смешения будет щелочной.
Производя подобные расчеты, очень важно уяснить смысл произведения объема раствора на его нормальность. Оно показывает, в каком объеме точно 1 н. раствора содержится ровно столько же вещества, что и в заданном объеме раствора указанной нормальности. Но в 1 л 1 н. раствора содержится 1 г-экв, а в 1 мл — в 1000 раз меньше, т. е. 1 мг-экв вещества. Отсюда вытекает, что произведение объема (в мл) раствора на его нормальность показывает, сколько в нем содержится миллиграмм-эквивалентов вещества.
Пример 2. К 50,00 мл 0,09840 и. H2SO4 прилито 25,15 мл 0,2050 н. NaOH. Какое вещество и в каком количестве в избытке?
Решение. Сначала, как и в первом примере, приведем объемы обоих растворов к 1 н. концентрации:
50,00-0,09840 =4,920 мл (мг-экв) H2SO4.
25,15-0,2050 = 5,156 мл (мг-экв) NaOH.
Следовательно, в избытке едкий иатр 5,156—4,920=0,236 мг-экв (или мл 1 и. раствора). Чтобы выразить избыток едкого натра в граммах, надо найденную величину умножить на миллиграмм-экви
117
валент NaOH или, что то же, иа содержание NaOH в 1 мл его 1 н. раствора:
40,00
0,236-—— = 0,00944 г.
1000
Пример 3. 2,00 мл 0,100 н. НС1 прибавлено к 20,00 мл 0,0800 н. КОН. Определить нормальность получившегося раствора КОН.
Решение. Приведем объемы обоих растворов к 1 и.:
20,00-0,0800= 1,600 мл 1 н. КОН (мг-экв)
2,00-0,100 =0,200 мл 1 н. НС1 (мг-экв)
1,400 мл 1 н. КОН (мг-экн)
Разность между большим и меньшим объемом покажет, что в растворе оказалось в избытке столько КОН, сколько его содержится в 1,4 мл точно 1 н. раствора. Но в действительности это количество КОН заключается не в 1,4 мл, а в суммарном объеме слитых растворов: 2,00+20,00=22,00 мл. Следовательно, этот раствор относительно КОН будет не 1 н., а
1-1,40/22,00 = 0,064 н.
К тому же результату приведет и несколько иное рассуждение: в 22,00 мл содержится 1,400 мг-экв КОН » 1 , х . КОН
Вычисление показывает, что х=0,064 мг-экв в 1 мл, или столько грамм-эквивалентов в 1 л. Иными словами, раствор КОН 0,064 н.
91. К 50,00 мл 0,2000 н. КОН прилито 25,00 мл 0,3000 н. НС1. Какую среду имеет полученный раствор?
92. Смешаны 10 мл 0,050 н. раствора щелочи с 5,0 мл 0,10 н. раствора кислоты. Определить среду полученного раствора.
93. К 25,00 мл 0,0987 н. НС1 прилито 24,50 мл 0,1020 н. NaOH. Какое вещество в избытке?
94. 50,00 мл 0,0520 н. НС1 обработаны 40,00 мл раствора КОН (К= 1,354 к 0,05 н.). Какое вещество в полученном растворе в избытке?
95. В один сосуд последовательно влиты: 10,00 мл 0,1120 н. НС1, 5,20 мл 0,2000 н. КОН, 2,30 мл 0,0500 н. H2SO4 и 5,10 мл раствора NaOH, у которого К= 1,080 к 0,05 н. Какую среду имеет полученный раствор?
96. Для нейтрализации 25,00 мл 0,1050 н. КОН прибавлено 15,00 мл НО (К= 1,100 к 0,1 н.) и 20,00 мл H2SO4 К=0,9950 к 0,05 н.). Какую среду имеет полученный раствор?
97. К 50,00 мл 0,1150 н. HCI прибавлено 25,00 мл 0,0952 н. КОН. Сколько граммов хлористого водорода не оттитровано?
118
98. К 100,0 мл раствора едкого кали (К= 1,095 к 0,1 н.) прибавили 100,0 мл соляной кислоты (К=0,9920 к 0,05 н.). Сколько граммов и какого вещества осталось не нейтрализованным?
99. Определить нормальность КОН в растворе, полученном смешиванием 2,00 мл 0,8970 н. НС1 и 25,0 мл раствора КОН (К— 1,085 к 0,1 н.).
100. Определить концентрацию H2SO4 в растворе, полученном смешиванием 20,00 мл H2SO4 (К=0,9140 к 0,2 н.) с 4,00 мл NaOH (К= 1,1800 к 0,05 н.).
101. Слиты 25,00 мл H2SO4 (К= 1,002 к 0,05 н.) и 5,23 мл раствора КОН (К=0,9350 к 0,03 н.). Определить титр кислоты в полученном растворе.
102. К 25,00 мл раствора КОН (К= 1,200 к 0,1 н.) прибавлено 2,50 мл 1,00 и. НС1. Какое вещество находится в полученном растворе в избытке? Каков его титр?
Глава IV
РЕДОКСИДИМЕТРИЯ(ОКСИДИМЕТРИЯ)
А. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДА ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
Редоксидиметрией (оксидиметрией) называют метод титриметрического (объемного) анализа, основанный на применении окислительно-восстановительных реакций. В окислительно-восстановительных реакциях атомы или ионы одного вещества — восстановителя — отдают электроны атомам (или ионам) другого вещества — окислителя. Поэтому в таких реакциях меняется степень окисления элементов некоторых участвующих в ней веществ. Атомы-окислители в таких окислительно-восстановительных реакциях приобретают электроны, понижая свою степень окисления, т. е. восстанавливаются; атомы-восстановители, наоборот, отдают электроны окислителям, повышая свою степень окисления, т. е. окисляются.
Чтобы составить уравнение окислительно-восстановительной реакции, необходимо подобрать такие коэффициенты, чтобы число отданных восстановителем электронов равнялось числу электронов, принятых окислителем. Для этого необходимо знать: 1) химические формулы окислителя и восстановителя; 2) химические формулы продуктов окисления и восстановления.
Пример 1. Составить уравнение реакции окисления — восстановления между FeSO4 и КМпО4, если известно, что FeSO4 переходит в Fe2(SO4)3, а КМпО4 — в MnSO4.
Решение.
1. Напишем окислитель и восстановитель, поставим между ними знак плюс и правее, через некоторый промежуток, напишем продукты окисления и восстановления:
FeSO4 + КМпО4 Fe2 (SO4)3 + MnSO4 -F ...
2. Во всех веществах найдем химические элементы, изменяющие степень окисления, и напишем иад ними их степень окисления:
+ 2 +7 +3 +2
FeSO4 + КМпО4 Fe2 (SO4)3 + MnSO4 + ...
3. Под каждым отмеченным элементом подписываем число электронов, отдаваемое или приобретаемое им в результате реакции. Это 120
число находим, вычитая из большей степени окисления данного элемента меньшую. Для марганца (+7) —( + 2) =5 и для железа (+3)-( + 2) = 1:
+ 2 +7 +3 4-2
FeSO4 + КМпО4 + .. .->-Fe, (SO4)3 -f- MnSO4 4- ...
1 5
2 10
Так как в правой части уравнения число атомов Fe должно быть четным (Рег), найденное отношение 1 :5 заменяем отношением 2 : 10.
4. Найденные числа, выражающие количества отдаваемых и приобретаемых атомами окислителя и восстановителя электронов, подставим в качестве коэффициентов к формулам молекул окислителя и восстановителя («крест-накрест»):
10FeSO4 4- 2КМпО4 + .. ,-+Fe2 (SO4)3 + Мп$О4 + ...
5. Найденные коэффициенты для окислителя и восстановителя пишем перед соответствующими продуктами в правой части уравнения:
10FeSO4 + 2КМпО4 -+- .. ,->5Fe2 (SO4)3 4- 2MnSO4 + ...
6. Так как в правой части уравнения нет ионов калия, имеющихся в левой, то в правой части пишем K2SO4. Так как после этого в правой части уравнения будут находиться 18 ионов SO42~, а в левой их только 10, слева вводим 8 молекул H2SO4:
10FeSO4 + 2КМпО4 + 8H2SO4-^ 5Fe2 (SO4)3 + 2KMnO4 + K2SO4
7. Наконец, подсчитываем в обеих частях уравнения число атомов водорода и кислорода. Так как в левой части больше на 16 атомов Н и на 8 атомов О, вводим в правую часть 8 молекул воды, проверяем число остальных атомов и ставим знак равенства между обеими частями уравнения реакции
10FeSO4 + 2КМпО4 + 8H2SO4 = 5Fe2 (SO4).{ f 2MnSO4 +
+ K2SO4 4- 8H2O
Чтобы узнать, в каком направлении будет протекать данная окислительно-восстановительная реакция, следует, воспользовавшись таблицами (см. табл. 8 приложения), сравнить нормальные потенциалы (Е°) систем, участвующих в данной реакции. Система с большим нормальным потенциалом будет окислителем, с меньшим — восстановителем.
Пример 2. В каком направлении должна протекать приведенная выше реакция?
Решение. В данной реакции участвуют 2 системы: Мп,+/Мп2+ и Fe2+/Fe3+. По табл. 8 приложения находим
£МП7+/Мп2+ = + 1’52В " С2+/РеЗ+ = + °-77Р-
Следовательно, в данной реакции перманганат будет являться окислителем и окислит Fe2+ в Fe3+. Но Fe3+ не может окислить MnSO4 в КМпО4, т. е. данная реакция практически может протекать только слева направо.
121
Электродвижущая сила реакции. Разность между величинами нормальных потенциалов систем, участвующих в реакции, называется электродвижущей силой (э. д. с.) реакции. Чем больше э. д. с., тем энергичнее протекает реакция. Поэтому, чтобы выяснить, который из одновременно присутствующих в растворе восстановителей будет окисляться первым, нужно найти э. д. с. обеих возможных реакций. В первую очередь будет протекать реакция с большей э. д. с.
Пример 3. Раствор содержит ионы С1_ и SO32-. Какой из них будет окисляться перманганатом первым, если их концентрации примерно одинаковы?
Решение. По таблице находим
о п
ES02-/so2- = + 0,20В; ЕС1_д,10 = + 1,36В;
Емпо-/Мп2+ = + 1 -52В.
Э. д. с. окисления перманганатом ионов SO32- 1,52—0,20=1,32 В, а окисления ионов С1_ 1,52—1,36 = 0,16 В. Следовательно, первым будет окисляться ион SO32".
Эти вычисления позволяют сделать также выводы о том, что ион С1~ своим присутствием не может мешать количественному определению ионов SO32- вследствие большей разницы в э. д. с. их реакций окисления перманганатом калия.
Задачи
Составить уравнения окислительно-восстановительных реакций:
1. Zn + НС1 -+ ZnCl2 + Н2
2. Al + H2SO4 -+ Al2 (SO4)3 + Н2
3. Zn + КОН+ K2ZnO2 + Н2
4. Al +К0Н-К3А10з + Н2
5. С + О2 —> СО2
6. Fe + S-4-FeS
7. Al + S + A12S3
8. С + HNO3 -4- СО2 + NO + ...
9. Си + H2SO4->- CuSO4 + SO2 + ...
10. Си + HNO3 -► Си (NO3)2 + NO + ...
11. Hg + HNO3 -> Hg (NO3)2 + NO 4-
12. Zn -]- HNO3 —> Zn (NO3)2 NH4NO3 4- ...
13. Sn + HNO3 + .. .4- H2SnO3 + NO
122
14. S + HNO3 -> H2SO4 + NO
15. P + HNO3 H3PO4 + NO
16. H2S 4~ O2 —> H2O 4- so2
17. H2S + HNO3-> H2SO4 + NO + ...
18. H2S 4- HNO3-> S 4- NO 4- ...
19. CrCl3 4" Br2 4" • • K2CrO4 4~ KBr 4_ • •
20. Cr2 (SO4)3 4" Br2 4" • • Na2CrO4 4" NaBr 4" • • •
21. FeCI2 4- Br2 4- ..> Fe (OH)3 4~ KBr + • • •
22. Fe 4- HNO3 4- .. FeCl3 4- NO 4- •. •
23. Fe2O3 4- C Fe 4- CO
24. CuO 4- C -> Cu 4- CO
25. NaCl 4- MnO2 4- • Cl2 + MnSO4 4- ...
26. KBr 4“ MnO2 4- ... —> Br2 4- M11SO4 4- . •.
27. NaBr 4- H2SO4-> Br2 4- SO2 4- •
28. KI 4- H2SO4 —> I2 4- SO2 4- • • •
29. HgCl2 4- SnCl2->- Hg2Cl2 4- SnCl4
30. HgCl2 4- SnCl2 Hg 4- SnCl4
31. BaSO4 4-C-> BaS 4-CO
32. FeC13 4- H2S -> FeCl2 4S4 •
33. K2Cr2O7 4- H2S 4- • • .-> Cr2 (SO4)3 4- S 4- • •.
34. KI 4- K2Cr2O7 4- .. I2 4- Cr2 (SO4)3 4- •
35. KBr 4- K2Cr2O7 4* • • —> Br2 4- Cr2 (SO4)3 4- • • •
36. HBr 4- K2Cr2O7 4- .. -> Br2 4- CrCl3 4- . • •
37. HBr 4* K2Cr2O7 4* • • • Br2 -4 Cr2 (SO4)3 4~ •..
38. SO2 4- K2Cr2O7 4- ... —>- Cr2 (SO4)3 4- • • •
39. FeCl3 4- SnCl2 -> FeCl2 4- SnCl4
40. FeO 4- CO Fe 4- CO2
41. SnSO4 4-12 +•••-»- Sn (SO4)2 4- HI
42. H2S 4-SO2S 4- H2O
43. I2 4- • • • -> KIO3 4- KI 4- •
44. Br2 4- ... -> NaBrO3 4- NaBr 4~ • • •
45. Hg2S-> HgS 4-Hg
46. NH2Hg2CI->NH2HgCl 4-Hg
47. K2MnO4 4- • • KMnO4 4- MnO2 4- • •
48. MnO2 4- KNO3 4- • •. K2MnO4 4- KNO2 4- ...
49. NaCl 4* KMnO4 4~ ... —> Cl2 4“ MnSO4 4~ • • •
50. HC1 4- KMnO4 4- ... Cl2 4- MnSO4 4- ...
123
51. КВг + KMnO4 Br2 + MnSO4 + ...
52. KMnO4 + K2SO3 +...-> MnSO4 4- K2SO4 4- ...
53. KMnO4 + K2SO3 4- • •. MnO2 4“ K2SO4 4- ...
54. MnSO4 + KMnO4 4- ... ->- MnO2 4- ...
55. Mn (0H)2 + PbO2 HMnO4 4- Pb (NO3)2 4- ...
56. Mn (ОН)з 4- PbO2 + HMnO4 4- Pb (NO3)2 4- .
57. PbCl4 4- • • • -> PbCI2 4- HC1
58. Bi (OH)3 4- K2SnO2-> Bi 4- K2SnO3 4- .. •
59. BiCl3 4- K2SnO2 4- ... -> Bi 4- K2SnO3 4- ...
60. As2S3 4- HNO3 4- • • • H3AsO4 4- H2SO4 4* NO
61. As2S5 4- HNO3 4- • • • H3AsO4 4- H2SO4 4- NO
62. Na3AsO3 4- KMnO4 4- . •. —Na3AsO4 4- Mn (NO3)2
63. H3AsO4 4- KI 4- H3AsO3 4- 12 4- KOH
Примечание к задачам 64—73. Окисление пероксидами можно рассматривать как окисление свободным кислородом, получившимся в результате их разложения, например
Н2О2 = Н2О 4- О
64. Fe (ОН)2 4- Н2О2 -> Fe (ОН)3
65. FeCl2 4- Н2О2 4- . •. -> Fe(ОН)3 4- • .
66. МпС12 4- Na2O2 4- • • • -► Н2МпО3 4- • • •
67. Мп (ОН)з 4- Na2O2 -> Н2МпО3 4- .. •
68. СгС13 4- Н2О2 4- . •. К2СгО4 + • • •
69. СгС13 4- Na2O2 4- • • - —* Na2CrO4 4- •«•
70. Cr2 (SO4)3 4- Н2О2 4- • • • К2СгО4 4-'.. •
71. CuS 4" Н2О2 4- • •. CuCl2 4- S 4- • • •
72. NiS 4- Н2О2 4- • • • -> NiC 12 4- S 4 • • .
73. К2Сг2О7 4- Н2О2 4- • • • -* С1О5 4- • • •
Примечания к задачам 74—80. При составлении уравнений окислительно-восстановительных реакций, в которых окислителями являются вещества, имеющие в своих молекулах ковалентные связи (например, (NH4)2S2O8 и другие персульфаты), можно определить количество электронов, принимаемое ими, допуская промежуточное разложение этих соединений, так же как и в случае окисления пероксидами. Например, можно считать, что персульфаты предварительно разлагаются с выделением свободного кислорода (т. е. имеющего валентность нуль), который и производит окисление, отнимая два электрона на каждый атом от восстановителя:
(NH4)2 S2O8 4- Н2О = (NH4)2 SO4 4- H2SO4 4- О
S2O|~ 4- 2й- = 2SO4~
124
Иными словами, молекула персульфата как окислителя требует присоединения двух электронов. Следовательно, при составлении соответствующих окислительно-восстановительных уравнений реакций под формулой персульфата надо поставить 2. Например,
+2 0 +7 -2
MnSC>4 + (NHj)2 S2O8 HMnC>4 + (NH4)2 SO4 + ...
5 2
Отсюда вытекает:
2MnSO4 + 5 (NH4)2 S2O8 2HMnO4 4- 5 (NH4)2 SO4 4- ...
2MnSO4 -J- 5 (NH4)2 S2O8 4- 8H2O —* 2HM11O4 -j- 5 (NH4)2 SO4 4-
+ 7H2SO4
В формуле пирита FeS2 (или FeS-S) можно условно считать один атом серы, имеющий степень окисления —2, а другой 0. Составим, например, уравнение реакции обжига пирита:
+ 2 —2 0 0 +3 —2 +4
Fe S • S 4-0 —> Fe2O3 4- SO2
1 6 4
и 2
-4-2 -4~3
Fe, переходя в Fe, теряет 1е~
—2 +4
S , » S бе—
О +4
S , , S 4е“
вся молекула FeS2 » 11е~
О —2
О, переходя в О, приобретает 2е—.
Следовательно, все уравнение реакции будет иметь окончательный вид:
2FeS2 4- ИО = Fe2O3 4- 4SO2
4FeS2 4- 1102 = 2Fe2O3 4- 8SO2
В карбидах, фосфидах металлов (например, в СГ3С2, Fe3P) все связи ковалентные и у всех атомов при подсчете электронного баланса можно условно показать степень окисления нуль. Сделав это допущение, можно очень легко подобрать коэффициенты даже в таких сложных на первый взгляд уравнениях, как уравнение реакции растворения фосфида железа в азотной кислоте (см. задачу 77, с. 126).
Подбирать коэффициенты в уравнениях окислительно-восстановительных реакций можно также так называемым электроиио-иониым методом, не требующим знания степени окисления элементов, образующих молекулы окислителя и восстановителя. Необходимо только сбалансировать числа электронов отданных и принятых всеми ионами в целом. Это позволяет при составлении уравнений окислительно-восстановительных реакций не делать допущения предварительного разложения молекул с выделением свободного кислорода или наличия в них свободных атомов со степенью окисления, равной нулю, чего в действительности не происходит.
125
Пользуясь этим способом, приведенное уравнение окисления Мпг+ персульфатом составляют в такой последовательности:
Мп2+ + S2Of_-> МпО^ + SO^~ (схема реакции в ионной форме) (1)
Мп2+ + 4Н2О — 5е~ = МпО^- + 8Н+ (окисление иона Мп2+) (2)
( + 2)-(-5)=+7 ( —1) + (+8) = + 7
4 Н2О прибавляем, так как в ионе МпО<_ имеются 4 атома кислорода, а отнять 5е~ необходимо для уравнивания сумм зарядов слева и справа. (Подсчитывать сумму зарядов надо сначала в правой части ионного уравнения.)
Далее в таком же порядке записываем процесс восстановления иона S2O82-:
S2O| -f- 2е— = 2SO4 (3)
( —2) + ( —2)=—4 2-( — 2) = — 4.
Уравниваем количества отданных (5е~) н принятых (2е~) электронов, умножая все члены уравнения (2) на 2, а уравнения (3) на 5 и складываем их
2Мп2+ + 8Н2О — 10е— - 2MnO^ + 16Н+
5S2O|~ + 10е- 108О^~
2Мп2+ + 5S2O|~ + 8Н2О = 2МпО^ + lOSO^ + 16Н+ (4)
Переписываем ионное уравнение реакции (4) в молекулярной форме, дописывая ионы, не участвовавшие в процессе окисления — восстановления:
2MnSO4 + 5 (NHj)2 S2O8 + 8Н2О = 2HMnO4 + 5 (NH^ SO4 + + 7H2SO4
74. Сг2 (SO4)3 + Na2S2O8 +...—> Н2СгО4 + H2SO4 + Na2SO4
75. Мп (NO3)2 -f- Na2S2O8 -f- H2O —> HMnO4 -f- Na2SO4 -bH2SO4-f-..
76. FeS2 + O2 —>• Fe2O3 4- SO2
77. Fe3P + HNO3 -> Fe (NO3)3 + H3PO4 + NO + ...
78. Fe3P + HNO3 -> Fe (NO3)3 + H3PO3 + NO +...
79. Fe3P + HC1 FeCl2 + PH3 + H2
80. Cr3C2 + H2SO4 —> Cr2 (SO4)3 -f- C -f- H2
81. Исходя из нормальных потенциалов окислительно-восстановительных систем, выясните: что будет происходить, если к раствору, содержащему смесь солей Fe(II) и Fe(III), прибавить раствор иода с иодидом калия? Будет ли иод окислять Fe(II) в Fe(III)? Будет ли Fe(III) окислять ион 1~ в свободный иод?
82. В каком направлении будет протекать реакция, идущая по схеме
SnCl4 + FeCl2 Z SnCl2 -f- FeCl3
126
83. Можно ли окислить ион Сг3+ бромной водой в щелочной среде до иона СгО4~?
84. Можно ли окислить ион Сг3+ бромной водой в кислой среде?
85. Можно ли хроматом калия в щелочной среде окислить Sn(II) в Sn(IV)?
86. Будет ли из раствора NaCl под действием бромной воды выделяться свободный хлор?
87. Можно ли окислить ион С1_ до свободного хлора серной кислотой?
88. Будет ли концентрированная серная кислота окислять Fe(II) в Fe(III)?
89. Будет ли перманганат калия окислять Fe(II) в кислой среде?
90. Будет ли перманганат калия окислять Fe(II) в щелочной среде, восстановливаясь в манганат?
91. Чему равна э. д. с. реакции окисления сероводорода пероксидом водорода?
92. Найти э. д. с. реакции взаимодействия между перманганатом калия и хлоридом натрия.
93. Какова э. д. с. реакции взаимодействия между йодатом натрия и сероводородом?
94. Определить э. д. с. реакции восстановления хлорида железа (III) хлоридом олова (II).
95. К раствору, имеющему кислую среду и содержащему ионы С1_, Вг~ и I- постепенно приливают раствор перманганата калия. Подсчитав э. д. с. реакций, выяснить, что будет происходить в растворе.
96. В растворе находятся сульфит и оксалат натрия. Найдя э. д. с. реакций, выяснить, в какой последовательности будут окисляться эти ионы при постепенном прибавлении к ним хлорной воды.
97. Можно ли количественно определить оксалаты перманганатометрическим методом, применяя для создания кислой среды соляную кислоту?
98. Можно ли количественно определить Sn(II) иодо-метрическим методом при одновременном присутствии в анализируемом растворе ионов S2-?
99. Что будет окисляться хлорной водой первым в растворе, содержащем оксалат аммония и FeCh?
100. Каким окислителем будет окисляться лучше фосфористая кислота в фосфорную — пероксидом водорода или хлорной водой?
127
Б. ПЕРМАНГАНАТОМЕТРИЯ
Анализы, выполняемые методом прямого титрования. Задачи этого раздела решаются на основании общих положений титриметрического анализа, подробно рассматриваемых в учебниках количественного анализа, и особых пояснений не требуют. Задачи на предварительные расчеты, какими являются расчеты навески исследуемого вещества, навески веществ для приготовления растворов и пр., надо решать с большим приближением — с точностью до одной-двух значащих цифр. Остальные расчеты выполняют с наибольшей возможной точностью.
Задачи
Расчет навесок
1- Чему равен грамм-эквивалент КМпО4: а) в кислой среде; б) в нейтральной; в) в щелочной?
2. На сколько надо разделить молекулярные массы следующих веществ, чтобы вычислить их эквиваленты в реакциях с КМпО4 в кислой среде: а) FeSO4-7H2O; б) Na2C2O4; в) Nal?
3. Рассчитать эквивалент ионов и веществ в реакциях с КМпО4 в кислой среде: a) Fe2+; б) Н2С2О4-2Н2О; в) KI.
4. Чему равен эквивалент следующих веществ в реакциях окисления КМпО4 в кислой среде: a) FeSO4-7H2O; б) Na2SO3; в) NaNO2?
5. Сколько граммов КМпО4 потребуется для приготовления 750 мл ~0,05 н. раствора?
6. Сколько граммов КМпО4 следует взять для приготовления 1,5 л -—0,2 н. раствора?
7. Сколько граммов КМпО4 потребуется для приготовления 1250 мл раствора, титр которого по перманганату калия 0,001617?
8. Сколько граммов КМпО4 следует взять для приготовления 1 л раствора, у которого К= 1,125 к 0,05 н.?
9. Сколько граммов КМпО4 нужно взять для приготовления 5 л раствора, у которого Ткмпо^ге = 0,005585?
10. Сколько граммов КМпО4 следует взять для приготовления 800 МЛ раствора, у которого T'KMnO./Na.C.O^ = 0,003350?
128
11. Сколько граммов Н2С2О4 • 2Н2О (х. ч.) следует взять для приготовления 500 мл — 0,2 н. раствора?
12. Сколько граммов Na2C2O4 (х. ч.) следует взять для приготовления 200 мл раствора, необходимого для установки --—0,1 н. КМпО4?
13. Рассчитать навеску (NH4)2C2O4-H2O (х. ч.) необходимую для приготовления 200 мл раствора, предназначенного для установки — 0,05 н. КМпО4.
14. Рассчитать навеску оксалата натрия для приготовления 250 мл раствора, предназначенного для установки титра —0,01 н. КМпО4.
15. Для установки титра раствора КМпО4 можно взять железную проволоку и растворить ее в серной кислоте без доступа воздуха. Какую навеску проволоки следует взять, если объем мерной колбы, в которой будет разбавлен полученный раствор, 200 мл, а концентрация устанавливаемого раствора КМпО4 —0,1 н.?
16. Какой должна быть навеска железной проволоки, необходимая для установки титра раствора КМпО4, если Ккмпо4= 1,2 к 0,05 н. и объем колбы 150 мл?
17. Сколько граммов безводной Н2С2О4 (х. ч.) следует взять для установки титра —0,1 н. КМпО4 методом отдельных навесок, чтобы на титрование полученного раствора расходовалось около 25 мл устанавливаемого раствора?
18. Сколько граммов Na2C2O4 (х. ч.) следует взять для установки титра —0,05 н. КМпО4 методом отдельных навесок?
19. Сколько граммов (NH4)2C2O4-H2O (х. ч.) нужно взять для приготовления раствора, на титрование которого будет расходоваться около 25 мл устанавливаемого -0,1 н. КМпО4?
20. Железная проволока растворена в кислоте. На титрование полученного раствора израсходовано около 30 мл —0,1 н. КМпО4. Какова навеска проволоки?
21. Взято 0,32 г Н2С2О4-2Н2О (х. ч.) для установки — 0,1 н. КМпО4 методом отдельных навесок. Можно ли использовать эту навеску, если объем бюретки для титрования 50 мл?
22. Навеска 0,34 г (NH4)2C2O4-H2O растворена в произвольном объеме воды, подкислена и оттитрована 0,2 н. КМпО4 из бюретки на 25 мл. Хватило ли объема бюретки на титрование?
5 Ярославцев А. А.
129
Расчеты по установке титра рабочего раствора
Все точные расчеты титриметрического анализа могут быть выполнены различными способами. Но необходимо уметь выбрать из них в каждом конкретном случае самый короткий и простой. Это умение можно приобрести только настойчивым упражнением в решении аналитических задач различными способами и сопоставлением полученных результатов с затраченным временем. В результате таких сравнений можно увидеть, что если выполнять решение одной задачи различными способами, но не вычислять результатов промежуточных действий, а сводить их в одну конечную вычислительную формулу, то после всех сокращений в ней, независимо от хода pat-суждений, будут оставаться одни и те же величины.
Во всех случаях титриметрических вычислений в целях их упрощения полезно пользоваться одним общим правилом: если анализ проводился с применением мерной колбы и пипетки, то концентрацию рабочего раствора удобнее выражать в виде нормальности N или поправки К и, вычисляя, исходить из основной пропорции:
Vj: V2 = W2 : или V2N2 =
Если же анализ выполнялся методом отдельных навесок (без мерной колбы и пипетки), то концентрацию рабочего раствора удобнее выражать в виде титра по определяемому веществу. Тогда количество определяемого вещества пг, заключающееся в титруемом растворе, равно произведению титра рабочего раствора по определяемому веществу на его объем, израсходованный на титрование: т = Т-р.-а1о.ъ V. Работая методом отдельных навесок, концентрацию рабочего раствора можно выражать и в виде титра по рабочему веществу и далее исходить из пропорции:
Эр.в Эо_в
VTp.B — rn
где Эр.в — эквивалент рабочего вещества; Э0.в — эквивалент определяемого вещества; Тр.в — титр рабочего раствора по рабочему веществу; Тр.11/0.в — титр рабочего раствора по определяемому веществу; V — объем рабочего раствора, пошедший на титрование; m — количество определяемого вещества, заключающееся в титруемом объеме анализируемого раствора.
130
Чтобы найденное количество определяемого вещества выразить в процентах, его умножают на 100 и делят на навеску.
23. Навеска 3,5740 г оксалата аммония (х. ч.) растворена в мерной колбе на 500 мл. Раствор доведен до метки. Определить концентрацию раствора, выразив се в виде: a) 7'(nh4)2c.o1h2o; б) 7'(nhj).cjo1h2o/kmiio4; в) N; г) поправки (/().
24. Из 0,7586 г Н2С2О4-2Н2О (х. ч.) приготовлен раствор в мерной колбе на 250 мл. Найти концентрацию раствора, выразив ее в виде: а) Тн2с2о4-2Н2о'. б) 7н2со4-2Н2о/кмпо4; в) Л7; г) поправки (К).
25. Из 0,8842 г кристаллогидрата оксалата аммония (х. ч.) приготовлено в мерной колбе 250 мл раствора. Рассчитать концентрацию раствора, выразив ее в виде: a) 7’(Nh4)2c2o4h2o; б) ^Н4)2с2о4н2о/кмпо4; в) N; г) поправки (К).
26. Из 0,6784 г Na2C2O4 (х. ч.) приготовлено в мерной колбе 200 мл раствора. Найти концентрацию раствора, выразив ее в виде: а) Т\а,с2о,; б) Tnu.c.o,/kmiiO,; в) N; г) поправки (К).
27. Для установки титра раствора КМпО4 приготовлен раствор из 1,5020 г Н2С2О4-2Н2О в мерной колбе на 250 мл. На титрование 25,00 мл этого раствора расходуется в среднем 23,68 мл устанавливаемого раствора КМпО4. Определить: а) Т’кмпо,; б) Т’кмпо./ищо,: в) АГ; г) Лкмпо4.
28. Навеска 1,2500 г оксалата натрия (х. ч.) растворена в мерной колбе на 250 мл. На титрование 25,00 мл полученного раствора расходуется 21,20 мл устанавливаемого раствора перманганата калия. Определить: а) Л^кмпо4; б) Лкмпо,; в) Т’кмпо,-
29. Из 3,500 г кристаллогидрата оксалата аммония (х. ч.) в мерной колбе па 500 мл приготовлен исходный раствор для установки титра рабочего раствора КМпО4. На титрование 25,00 мл исходного раствора израсходовано 24,90 мл раствора КМпО4. Определить: а) Л/кмпо.; б) ЛкМпОД В) Т’кмпо.; Г) Т’кМпО./Ге-
30. Навеска 1,2540 г Н2С2О4-2Н2О (х. ч) растворена в мерной колбе на 200 мл. На титрование 20,00 мл этого раствора расходуется 22,40 мл раствора КМпО4. Найти: а) Л^КМпО,; б) КкМпО,; В) Т'кЗТпО./ТеЗО..
31. Навеска 0,7120 г кристаллического оксалата аммония (х. ч.) растворена в мерной колбе на 200 мл. На
5*
131
титрование 25,00 мл этого раствора расходуется 18,90 мл раствора КМпО4. Определить: а) Ткмпо/ б) ГКмпо4/ге.
32. Для установки титра раствора КМпО4 навеска 0,8530 г безводной Н2С2О4 растворена в мерной колбе на 200 мл. На 20,00 мл этого раствора при титровании расходуется 21,20 мл устанавливаемого раствора. Определить: а) Л^кмпо4; б) Ккмпо/, в) Гкмпо4-
33. Навеска 0,06895 г безводной Н2С2О4 растворена в произвольном объеме воды и целиком оттитрована устанавливаемым раствором КМПО4, которого израсходовано 30,82 мл. Определить: а) 7кмпо4; б) Л^кмпО,; в) КкМпО,-
34. На титрование раствора, полученного растворением 0,1522 г Н2С2О4-2Н2О в произвольном объеме воды, расходуется 24,68 мл устанавливаемого раствора КМпО4. Определить: а) ГКмпО4; б) Л^кмпо,; в) Ккмпо4.
35. Для установки титра раствора КМ11О4 взято 0,1152 г электролитического железа, растворено в серной кислоте, восстановлено и оттитровано устанавливаемым раствором КМ11О4, которого израсходовано 40,35 мл. Определить: а) 7кмпО4; б) Л^кмпо4; в) КкмпО,.
36. Для установки титра раствора КМпО4 взято 20,00 мл исходного раствора (NH4)2C2O4-H2O, у которого 7=0,07112. Раствор разбавлен в мерной колбе до объема 250 мл. На титрование 25,00 мл этого раствора расходуется 19,85 мл раствора КМ11О4. Определить Лкмпо,-
37. В результате установки титра раствора КМ11О4, выполненной методом отдельных навесок по соли (NH4)2C2O4-H2O (х. ч.), получены следующие данные:
Навеска Масса навески т, г Объем К, мл т т . -V’% (к наименьшему значению) гКМпО4 “ ——F V
1 0,1910 26,80
2 0,1743 23,40
3 0,1593 21,85
4 0,1834 25,20
5 0,2104 28,80
Найти среднее значение Гкмпо4, отбросив значительно отклоняющиеся результаты.
132
38. В результате установки титра раствора КМпО4 по Н2С2О4-2Н2О методом отдельных навесок получены следующие данные:
Навеска Масса навески т, г О&ьем К, мл т V — , % (к V наименьшему значению) гКМпО4 = = -^-F V
1 0,1076 33,90
2 0,1001 31,26
3 0,0836 27,15
4 0,0760 24,95
5 0,0682 22,06
Найти среднее значение Т’кмощ, откинув значительно отклоняющиеся результаты.
39. Рассчитать титриметрический фактор для вычисления результата установки титра раствора КМпО4 по (NH4)2C2O4-H2O.
40. Рассчитать титриметрический фактор для вычисления результата установки титра раствора КМпО4 по Na2C2O4.
41. Навеска Na2C2O4 1,2640 г растворена в мерной колбе на 200 мл. Сколько миллилитров раствора КМпО4 (К=0,9864 к 0,1 н.) израсходуется на титрование 20,00 мл полученного раствора оксалата натрия?
42. Навеска Na2C2O4 1,6260 г растворена в мерной колбе на 250 мл. Какой объем 0,09768 н. КМпО4 израсходуется на титрование 25,00 мл раствора оксалата натрия?
43. Навеска Н2С2О4-2Н2О 0,7564 г растворена в мерной колбе на 250 мл. Сколько миллилитров раствора КМпО4 (7кмпо4=0,001616) израсходуется на титрование 25,00 мл раствора щавелевой кислоты?
44. Навеска Н2С2О4-2Н2О 1,6540 г растворена в мерной колбе на 200 мл. Сколько миллилитров раствора КМпО4 (Т’кмпО4/Ре = 0,005616) израсходуется на титрование 20,00 мл раствора щавелевой кислоты?
45. Сколько миллилитров 0,1054 н. КМпО4 израсходуется на титрование 0,1600 г (NH4)2C2O4-H2O, растворенных в 25,00 мл воды? Изменится ли расход раствора КМпО4 для титирования навески, если растворить ее в другом объеме воды?
133
46. Сколько миллилитров раствора КМ11О4, у которого /(=1,2140 к 0,2 и., потребуется для титрования раствора, полученного растворением 0,1324 г Na2C2O4 в произвольном объеме воды?
47. Сколько миллилитров 0,1112 н. КМпО4 потребуется для титрования 0,1612 г Na2C2O4, растворенных в произвольном объеме воды?
48. Сколько миллилитров раствора КМ11О4 (Т'кмпо4= = 0,001562) израсходуется на титрование раствора, полученного растворением 0,7580 г Н2С2О4-2Н2О в произвольном объеме воды?
Расчет навески анализируемого вещества
49. Рассчитать навеску технического кристаллического железного купороса для определения в нем содержания FeSO4 перманганатометрическим методом, если концентрация рабочего раствора КМпО4~0,1 н., а объем мерной колбы для растворения навески 250 мл.
50. Какую навеску технического оксалата натрия следует взять для анализа на содержание Na2C2O4, если концентрация рабочего раствора КМпО4 —0,05 н., а объем мерной колбы 250 мл?
51. Какую навеску технической кристаллической щавелевой кислоты следует взять для анализа на содержание основного продукта Н2С2О4-2Н2О, если для титрования применяется — 0,1 н. КМпО4, а объем мерной колбы для растворения навески 500 мл?
52. Рассчитать навеску технического одновсдного оксалата аммония для анализа на содержание основного продукта, если для титрования будет применен рабочий раствор КМпО4, у которого К= 1,042 к 0,1 и., а объем мерной колбы для растворения навески 500 мл?
53. Какую навеску сплава следует взять для определения содержания железа перманганатометрическим методом, если навеска после растворения и восстановления будет разведена в мерной колбе на 250 мл; концентрация раствора КМпО4 0,1 н„ а содержание Fe в сплаве -20 %?
54. Образец технического сульфита натрия содержит — 45% Na2SO3. Какую навеску следует растворить в мерной колбе емкостью 200 мл для анализа на содержание основного продукта с помощью —0,05 н. КМпО4?
134
55. Рассчитать навеску технической щавелевой кислоты, содержащей ~70% Н2С2О4, для анализа на содержание основного продукта с помощью ~0,2 н. КМпО4 методом отдельных навесок, если применять бюретку на 50 мл? I
Примечание. Обычно, работая методом отдельных навесок, рассчитывают навеску так, чтобы на ее титрование расходовалось раствора перманганата калия около половины объема бюретки.
56. Какую навеску шлака, содержащего ~5% Fe, следует взять для определения FeO перманганатометрически методом отдельных навесок, если раствор КМпО4 ~0,1 н., а объем бюретки 25 мл?
57. Какую навеску технического железного купороса, содержащего ~15% FeSO4, нужно взять для определения в образце FeSO4 методом отдельных навесок, если применять 0,05 н. КМпО4 и пользоваться бюреткой на 50 мл?
58. Рассчитать навеску железной руды, необходимую для анализа на содержание Fe перманганатометриче-оки методом отдельных навесок, если раствор КМпО4 ~0,2 н., объем бюретки 50 мл, а ожидаемое содержание Fe в образце ~40%.
Расчет анализов по данным прямого титрования
59. Навеска щавелевой кислоты растворена в мерной колбе на 250 мл. На титрование 25,00 мл полученного раствора расходуется 24,30 мл раствора КМпО4 (К= = 1,0142 к 0,05 н.). Сколько граммов Н2С2О4-2Н2О в навеске?
60. Раствор оксалата аммония разведен водой в мерной колбе на 200 мл. На титрование 20,00 мл этого раствора расходуется 19,85 мл раствора КМпО4 (К=0,8960 к 0,10 н.). Сколько граммов (NH4)2C2O4-H2O в растворе?
61. В мерной колбе на 200 мл приготовлен раствор щавелевой кислоты. На 20,00 мл этого раствора расходуется при титровании 18,25 мл раствора КМпО4 (Т’кмпо4= =0,001616). Сколько граммов безводной Н2СгО4 содержалось в растворе?
62. Навеска оксалата натрия растворена в мерной колбе на 500 мл. На титрование 20 мл полученного рас-
135
ТйОра расходуется 21,40 мл раствора КМпО4 (Ткмпо,— = 0,005751). Сколько граммов Na2C2O4 в навеске образца?
63. На титрование раствора (NH4)2C2O4-H2O расходуется 25,80 мл раствора КМпО4 (7KMno4/Fe=0,005585). Сколько граммов (NH4)2C2O4-H2O в титруемом объеме?
64. На 20 мл раствора, полученного растворением навески сплава, расходуется при титровании для определения железа 41,50 мл раствора КМпО4 (7кмпо4/ге= = 0,002980). Сколько граммов Fe было в навеске сплава? Изменится ли результат, если ту же навеску растворить в другом объеме? Почему?
65. На титрование раствора оксалата аммония расходуется 28,15 мл раствора КМпО4 (7=0,003218). Сколько граммов (NH4)2C2O4-H2O в образце?
66. На титрование раствора FeSO4 израсходовано 21,60 мл раствора КМпО4 ( 7=0,002852). Сколько граммов FeSO4 в растворе?
67. Навеска железной руды после растворения и восстановления оттитрована раствором КМпО4; 7кмпо4= = 0,001842; израсходованный объем 42,35 мл. Сколько граммов Ре20з в навеске?
68. Навеска железной проволоки растворена без доступа воздуха в серной кислоте и оттитрована раствором КМпО4, которого на это потребовалось 35,40 мл (7Кмпо4= 0,003082). Сколько граммов Fe в навеске?
69. Сколько граммов железа в растворе, если на его титрование расходуется 26,65 мл раствора КМпО4 (7кмпо4/ге=0,003040) ?
70. Сколько граммов Н2С2О4-2Н2О в растворе, если на его титрование расходуется 26,75 мл раствора КМпО4 (7кМпО4/Ре = 0,01122)?
71. Сколько граммов Fe2O3 в навеске руды, если на титрование полученного из нее раствора расходуется после восстановления 32,88 мл раствора КМпО4 (7KMnO4/FeSO4 = 0,01519)?
72. На титрование раствора оксалата натрия расходуется 21,30 мл раствора КМпО4 (/(=0,9820 к 0,2 н.). Сколько граммов Na2C2O4 было в растворе?
73. Навеска оксалата аммония 1,9710 г растворена в мерной колбе на 500 мл. На титрование 25,00 мл этого раствора расходуется 28,25 мл раствора КМпО4. Вычислить процентное содержание (NH4)2C2O4-H2O в образце, если Ккмпо4=0,9530 к 0,05 н.
136
74. Навеска железной проволоки 1,0130 г растворена без доступа воздуха в соляной кислоте. Раствор разведен до метки в мерной колбе на 250 мл. Вычислить процентное содержание Fe в образце, если /СкмпО4= 1,0050 к 0,1 н., титруемый объем анализируемого раствора 25,00 мл, расход раствора КМпО4 17,81 мл?
75. Вычислить процентное содержание Н2С2О4-2Н2О в образце, если навеску 3,3900 г растворили в мерной колбе емкостью 500 мл и на титрование 25,00 мл этого раствора расходуется 23,52 мл 0,1124 и. КМпО4.
76. Навеска образца технического железного купороса 7,1500 г растворена в мерной колбе на 250 мл. На титрование 25,00 мл полученного раствора расходуется 24,48 мл 0,0986 н. КМпО4. Вычислить процентное содержание FeSO4-7H2O вюбразце.
77. Навеска образца железной руды 1,7950 г растворена, восстановлена, раствор разведен в мерной колбе до объема 250 мл. На титрование 20,00 мл этого раствора расходуется 18,65 мл раствора КМпО4 (Т— = 0,001842). Вычислить процентное содержание Fe в образце.
78. Навеска образца технического железного купороса 15,9900 г растворена в мерной колбе на 500 мл. На титрование 25,00 мл раствора расходуется 27,80 мл КМпО4 (7 = 0,003218). Вычислить процентное содержание FeSO4-7H2O в образце.
79. Навеска образца технического сульфита натрия 2,6770 г растворена в мерной колбе на 200 мл. На титрование 20,00 мл полученного раствора расходуется 19,20 мл раствора КМпО4. Вычислить процентное содержание в образце: a) Na2SO3 и б) N2SO3-7H2O, если Т кмпо4/ре=0,005585?
80. При анализе хлорида железа на содержание FeCl2-4H2O получены следующие данные: навеска 0.2658 г; ТкмпО4/гео = 0,003620; расход раствора КМпО4 23,48 мл. Вычислить процентное содержание FeCl2-4H2O в образце.
81. Навеска пергидроля 5,0000 г разбавлена водой в мерной колбе на 500 мл. На титрование 25,00 мл этого раствора расходуется 37,43 мл раствора КМпО4. Вычислить процентное содержание Н2О2 в образце, если Ккмпо4= 1,1240 к 0,1 н.?
82. 1,1500 г раствора пероксида водорода разбавлено водой в мерной колбе на 250 мл. На титрование 25,00 мл
137
этого раствора расходуется 30,25 мл раствора КМпО4, у которого ТКмпо4/о=0,0004642. Вычислить процентное содержание окисляющего кислорода в образце.
83. Для анализа технического нитрита натрия 1,3730 г его растворено в мерной колбе на 1000 мл. Этим раствором титруют 20,00 мл раствора КМпО4, у которого /< = = 0,9870 к 0,05 н., на что анализируемого раствора требуется 26,90 мл. Вычислить процентное содержание NaNO2 в образце.
84. Навеска нитрита натрия 0,9457 г растворена в мерной колбе на 200 мл. На титрование 20,00 мл раствора КМпО4, у которого Т’Кмпо4/Ре2Оз=0,007985, расходуется 16,85 мл раствора нитрита. Вычислить процентное содержание NaNO2 в образце.
85. Навеска образца технического железного купороса 0,7220 г растворена в воде и целиком оттитрована перманганатом калия, у которого 7= 0,003161. Расход его 23,20 мл. Вычислить процентное содержание FeSO4-7H2O в образце.
86. Навеска образца фортепианной проволоки 0,0689 г растворена без доступа воздуха в серной кислоте и оттитрована перманганатом калия, у которого 7=0,001565. Расход его на титрование 24,55 мл. Вычислить процентное содержание Fe в проволоке.
87. Навеска 0,3745 г образца щавелевой кислоты растворена и оттитрована перманганатом, которого израсходовано на это 38,42 мл (7кмпО4/ре=0,007982). Вычислить процентное содержание Н2С2О4-2Н2О в образце.
88. Для анализа образца оксалата аммония на содержание основного продукта взята навеска 0,1485 г. Навеска растворена и целиком оттитрована перманганатом, которого израсходовано 28,90 мл (7KMno4/(NH4)2c2o4H2o=0,004308). Сколько процентов (NH4)2C2O4-H2O содержал образец?
89. Навеска 0,1709 г железной руды растворена и восстановлена. Полученный раствор оттитрован 0,0505 и. КМпО4, которого израсходовано 38,42 мл. Вычислить процентное содержание Fe2O3 в образце.
90. Раствор 0,2343 г сульфита натрия оттитрован 34,50 мл раствора КМпО4 (Я= 0,9832 к 0,05 н.). Вычислить процентное содержание безводного Na2SO3 в образце.
Анализы, выполняемые методом обратного титрования. Особенность анализов, выполняемых методом об-138
ратного титрования, заключается в том, что в них применяются два рабочих раствора, хорошо взаимодействующих между собой, например окислителя и восстановителя, кислоты и щелочи. Если этим методом требуется определить окислитель, то его навеску обрабатывают точно измеренным количеством х. ч. восстановителя с таким расчетом, чтобы часть его прореагировала с определяемым окислителем, а часть осталась в избытке. Величину этого избытка узнают, оттитровывая его рабочим раствором другого рабочего вещества — окислителя. Вычитая из всего количества взятого восстановителя то его количество, которое было оттитровано вторым рабочим раствором, находят разность. Этой разности эквивалентно количество определяемого окислителя. Например, при анализе пиролюзита его навеску обрабатывают определенным (но обязательно взятым с избытком) количеством оксалата. После того как весь содержащийся в навеске диоксид марганца прореагирует с ним, оставшийся избыток оксалата оттитровывают раствором перманганата калия.
Второе рабочее вещество в этом методе всегда берут в виде рабочего раствора, а первое может быть или взвешено сухим, или тоже взято в виде рабочего раствора, объем которого точно измеряется. В первом случае расчет в общем виде ведется следующим образом.
Пусть х и Эх — количество и эквивалент определяемого окислителя; тх и Эр.в— количество и эквивалент рабочего вещества-восстановителя; — количество оттитрованного избытка восстановителя. Тогда (mi—m2) равно количеству первого рабочего вещества, эквивалентное определяемому окислителю. Поэтому
Эх — Зр.в Эх (пц — m2)
х =--------------г.
х — (mi — т2) Эр.в
Если требуется, то вычисляют процентное содержание определяемой составной части.
Пример 1. Для определения МпО2 в образце пиролюзита 0,2962 г его поместили в раствор, приготовленный из 0,3985 г Н2С2О4-2Н2О (х. ч.) и содержащий H2SO4. Затем раствор оттитровали перманганатом калия (К= 1,1050 к 0,01 н.), которого на это потребовалось 18,25 мл. Вычислить процентное содержание МпО2 в образце.
Решение. Сначала узнаем, сколько Н2С2О4-2Н2О оттитровано перманганатом калия, т. е. сколько этого вещества осталось в избытке после реакции с МпО2. Так как 18,25 мл КМпО4 (К= 1,1050 к 0,01 н.) могут прореагировать с таким же объемом раствора ща-
139
велевой кислоты одинаковой нормальности, то количество оттитрованной Н2С2О4-2Н2О будет равно
1,1050-0,01-63,03-18,25
от2 =-----------7777-------- = 0,01271 Г.
1000
Далее узнаем, сколько Н2С2О4-2Н2О прореагировало с МпО2: т — т2 = 0,3985 — 0,01271 = 0,3858 г.
Отсюда найдем, с каким количеством МпО2 вступило в реакцию это количество щавелевой кислоты:
5HsC10t-2H,0 — 5МпОа
63,03 — 43,47 _ 0,3858-43,47
0,3858 - х Х ~ 63,03 Г'
Следовательно, процентное содержание МпО2 в образце равно
0,3858-43,47-100
63,03-0,2962
= 89,83%.
Во втором случае количества обоих рабочих веществ выражаются объемами израсходованных рабочих растворов, и тогда расчет результата анализа выполняют методом приведения их к одной нормальности, как это описыва юсь на с. 117.
Пример 2. Навеска пиролюзита 0,2462 г обработана в кислой среде 50,00 мл раствора оксалата (К= 1,2460 к 0,1 н.). По окончании реакции на титрование избытка оксалата израсходовано 42,48 мл рабочего раствора перманганата калия (/<=0,9260 к 0,05 н.). Определить содержание МпО2 в образце.
Решение. Приведем объемы обоих растворов к 1 н. концентрации и вычитанием их определим, сколько оксалата потребовалось на взаимодействие с МпО2:
50,00-1,2460-0,1 = 6,230 мл 1 н. оксалата (или 6,230 мг-экв)
42,48-0,9260-0,05 = 1,967 мл 1 н. оксалата (или 1,967 мг-экв)
4,263 мл 1 н. оксалата (или 4,263 мг-экв)
Следовательно, с МпО2 прореагировало столько оксалата, сколько его содержится в 4,263 мл 1 н. раствора, или, что то же, 4,263 мг-экв оксалата, которые прореагировали с таким же числом миллиграмм-эквивалентов МпО2. Поэтому для вычисления содержания МпО2 в навеске нужно найденную разность умножить на миллиграмм-эквивалент МпО2:
43,47
4,263-------= аг.
1000
Отсюда переходим к процентному содержанию: а-100 4,263-43,47-100
---------= —----------’------= 75,27» навеска 1000-0,2462
140
I
Количество восстановителя, необходимого для обработки определяемого окислителя, рассчитывают в три стадии:
1) определяют количество восстановителя на реакцию с окислителем, содержащимся в навеске;
2) определяют избыточное количество восстановителя, на оттитровывание которого расходуется около половины объема бюретки рабочего раствора перманганата;
3) суммируют обе найденные величины.
Пример 3. Сколько граммов (NH4)2C2O4-H2O нужно взять для обработки 0,5 г технической МпО2, содержащей ~75% основного продукта, если пользоваться мерной колбой на 200 мл, пипеткой на 50 мл и применять ~ 0,1 н. КМпО4?
Решение. Определим, сколько МпО2 в навеске:
0,5-75 „ , ------=: 0,4 Г. 100
Далее узнаем, сколько оксалата прореагирует с 0,4 г МпО4: 5МпО, — 50х 43,5 — 71 г 0,4 — х »
0,4-71 ’ 0,65 г.
44
Найдем также массу оксалата, чтобы концентрация его в мерной колбе на 200 мл была 0,1 н.:
71-0,1-200 ------------— 1,4 г.
1000
Следовательно, всего для обработки навески буется
образца потре-
потребуется для его на содержа-навесок при по-
0,4 + 1,4 = 1,8 г оксалата.
Пример 4. Сколько граммов оксалата аммония обработки 0,1 г 75%-ного пиролюзита, если анализ ние МпО2 будет выполняться методом отдельных мощи 0,1 н. КМпО4 с применением бюретки на 50 мл?
Решение. Аналогично предыдущему примеру узнаем приблизительное содержание МпО2 в навеске:
0.1-75
------= 0,075 г.
100
С этим количеством МпО2 прореагирует 0,075-71 ------------------------= 0,12 г оксалата.
44
Так как на титрование избытка оксалата здесь должно израсходоваться ~25 мл (половина бюретки) 0,1 н. КМпО4, этот избыток должен быть
71-0,1.25
= 0,18 г.
1000
Всего оксалата потребуется 0,12+0,18=0,3 г.
141
91. Для анализа на определение МпО2 взято 0,4 г образца пиролюзита. Сколько граммов (NH4)2C2O4-H2O необходимо для растворения навески, если будут применены мерная колба на 250 мл, пипетка на 25 мл и 0,1 и. рабочий раствор 1\МпО4 для обратного титрования избытка оксалата? Содержание МпО2 в образце ~75%.
92. Решить задачу 91, взяв навеску не 0,4 г, а 0,2 г при тех же данных.
93. Сколько граммов кристаллического оксалата аммония следует взять для растворения и обработки 0,3 г пиролюзита, содержащего -~60%MnO2, при определении содержания МпО2, если анализ вести методом пипетиро-вания и применять мерную колбу на 200 мл, пипетку на 20 мл и 0,05 н. КМпО4?
94. Для определения диоксида марганца взято 0,5 г пиролюзита, содержащего -~80% МпО2. Сколько граммов кристаллической щавелевой кислоты следует взять для обработки навески при растворении, пользуясь мерной колбой на 500 мл, пипеткой на 25 мл и 0,2 и. КМпО4?
95. Каким объемом 0,5 н. щавелевой кислоты следует обработать 0,2 г пиролюзита при анализе его образца на содержание МпО2, если применять мерную колбу на 200 мл, пипетку на 20 мл и рабочий раствор КМпО4 с 7=0,00316? Образец содержит ~75% МпО2.
96. Решить задачу 95, взяв раствор Н2С2О4-2Н2О с титром 0,0063 и 0,05 н КМпО4 при тех же данных.
97. Какой навеской кристаллического оксалата аммония (х. ч.) следует обработать 0,1 г технического МпО2 при растворении для определения содержания основного продукта методом отдельных навесок, если применять бюретку на 50 мл и ~0,1 н. КМпО4 и если МпО2 в образце -~90%?
98. Взято 0,2 г пиролюзита, содержащего ~80% МпО2. Каким количеством кристаллического оксалата аммония (х. ч.) надо обработать эту навеску при растворении, чтобы при титровании избытка (NH4)2C2O4 израсходовалось около 25 мл рабочего раствора перманганата калия (К=0,900 к 0,05 н.)?
99. При растворении 0,15 г образца пиролюзита, содержащего ~7О°/о МпО2, израсходовано 50 мл 0,1 н. Н2С2О4. Хватит ли объема бюретки на 50 мл для титрования избытка щавелевой кислоты раствором КМпО4, если Ткмпо, = 0,0031?
142
100. При растворении 0,1 г МпО2 израсходовано 0,2 г кристаллического оксалата аммония. Какой цвет будет иметь раствор после прибавления первых капель рабочего раствора перманганата?
101. Навеска образца пиролюзита 0,3812 г. обработана 0,4220 г Н2С2О4-2Н2О. На титрование непрореагировавшего избытка щавелевой кислоты израсходовано 15,05 мл раствора КМпО4 (К = 0,9850 к 0,1 н.). Вычислить процентное содержание МпО2 в образце.
102. При анализе образца пиролюзита на содержание МпО2 получены следующие данные: навеска пиролюзита 0,4012 г; навеска Na2C2O4 0,4488 г; расход раствора КМпО4 30,20 мл; Ккмпо4= 1,0120 к 0,05 н. Вычислить процентное содержание МпО2 в образце.
103. Навеска образца пиролюзита 0,4036 обработана 50,00 мл раствора щавелевой кислоты (К=0,9750 к 0,1 и.). Избыток непрореагировавшей кислоты потребовал на обратное титрование 15,90 мл раствора КМпО4 (К= = 1,125 к 0,1 н.) Вычислить процентное содержание МпО2 в образце.
104. Навеска образца хлората калия 0,1510 г растворена и обработана 100,00 мл 0,09852 н. Na2C2O4. На титрование избытка оксалата натрия израсходовано 48,60 мл раствора КМпО4 (К= 1,0640 к 0,05 н.). Вычислить процентное содержание КСЮ3 в образце.
105. Навеска хлората калия 2,1510 г растворена в мерной колбе на 250 мл. 25,00 мл полученного раствора обработано 45,00 мл раствора соли Мора (/С—1,3200 к 0,1 н.). На титрование избытка соли Мора израсходовано 17,50 мл раствора КМпО4 (/<=1,2000 к 0,1 н.). Вычислить процентное содержание КС1О3 в образце.
106. Для анализа на содержание МпО2 0,3264 г образца пиролюзита обработано раствором H2SO4 и 3,0527 г Н2С2О4-2Н2О. По окончании реакции весь раствор количественно перенесен в мерную колбу на 250 мл и доведен водой до метки. На титрование 25,00 мл полученного раствора расходуется в среднем 19,20 мл раствора КМпО4 (/<=1,122 к 0,2 и.). Вычислить процентное содержание МпО2 в образце.
107. Навеска мрамора 0,7324 г растворена и затем обработана 1,4960 г (NH4)2C2O4-H2O. Раствор нейтрализован в колбе на 200 мл. Колба заполнена водой до метки. На титрование 25,00 мл отфильтрованного от осадка раствора расходуется в среднем 19,90 мл раствора
143
KMnO4(K=0,8564 к 0,05 н.). Вычислить процентное содержание СаО в образце.
108. Анализируют образец кальцита на содержание СаСО3. Навеска кальцита 0,5890 г; навеска Na2C2O4 1,3470 г; объем мерной колбы 250 мл; титруемый объем 25,00 мл; расход раствора КМпО4 на одно титрование 17,20 мл; Дкмпо4=0,9710 к 0,05 н. Вычислить процентное содержание СаСО3 в образце.
109. Навеска образца известняка 0,8010 г растворена и обработана оксалатом аммония. Осадок СаС2О4 промыт и растворен в H2SO4. Полученный раствор разбавлен водой в мерной колбе на 250 мл до метки. На титрование 25,00 мл этого раствора в среднем расходуется 10,38 мл 0,1230 н. КМпО4. Вычислить процентное содержание СаСОз в образце.
110. Навеска образца известняка 0,1627 г растворена, затем обработана избытком оксалата аммония. Осадок отфильтрован, промыт и обработан H2SO4. Весь полученный раствор титруется раствором КМпО4, которого на это расходуется 31,42 мл (7=0,00293). Определить процентное содержание СаО в известняке.
В. ИОДОМЕТРИЯ
Аналитические расчеты результатов анализов, выполняемых любыми титриметрическими методами, одинаковы и отличаются только величинами грамм-эквивалентов применяемых веществ. Поэтому в иодометрии все расчеты аналогичны расчетам перманганатометрических определений.
Задачи
Расчет навесок для приготовления рабочих растворов и их установки.
1. Сколько граммов иода (х. ч.) потребуется для приготовления 250 мл ~0,05 н. раствора?
2. Сколько граммов иода (х. ч.) следует взять для приготовления 500 мл ~0,1 н. раствора?
3. Сколько граммов кристаллического тиосульфата натрия потребуется для приготовления 1,5 л ~0,1 н. раствора?
4. Какую навеску кристаллического тиосульфата нат
144
рия нужно взять для приготовления 800 мл ~0,05 н. раствора?
5. Сколько граммов дихромата калия (х. ч.) потребуется для приготовления 500 мл раствора, необходимого для установки титра ~0,1 н. Na2S2O3?
6. Сколько граммов дихромата калия (х. ч.) потребуется для приготовления 200 мл ~0,1 н. раствора?
7. Рассчитать навеску К.2СГ2О7 (х. ч.), необходимого для установки титра ~0,05 н. Na2S2O3 методом отдельных навесок, если на титрование полученного из нее раствора должно расходоваться около 25 мл раствора Na2S2O3.
8. Сколько граммов К2СГ2О7 (х. ч.) следует взять для установки титра ~0,05 н. Na2S2O3 методом отдельных навесок, пользуясь бюреткой на 50 мл?
9. Для установки титра ~0,1 н. Na2S2O3 взято 0,1238 г К2СГ2О7 (х. ч.). Можно ли использовать эту навеску, если объем бюретки для титрования 25 мл?
10. Для установки титра ~0,1 н. Na2S2O3 методом отдельных навесок взято 0,1190 г К2СГ2О7 (х. ч.). Достаточен ли для титрования объем бюретки 50 мл?
11. К 20,00 раствора иода (К= 1,0860 к 0,1 н.) прилито 45,00 мл раствора тиосульфата натрия (/(=0,9862 к 0,05 н.), после чего добавлен 1 мл раствора крахмала. Синим или бесцветным будет раствор?
12. К раствору, полученному растворением 0,1432 г К2СГ2О7 (х. ч.) прибавлена кислота, иодид калия, крахмал и 25,00 мл тиосульфата натрия (/(=1,1010 к 0,1 н.). Обесцветится раствор или нет?
Расчеты по установке титра раствора тиосульфата
13. Навеска возогнанного иода 0,6300 г растворена в мерной колбе на 500 мл. Найти титр раствора.
14. Навеска иода (х. ч.) 1,2620 г растворена в мерной колбе на 250 мл. Найти титр раствора.
15. Навеска иода (х. ч.) 2,9840 г растворена в мерной колбе на 500 мл. Найти нормальность раствора.
16. Навеска иода (х. ч.) 6,3250 г растворена в мерной колбе на 1000 мл. Найти нормальность и титр раствора иода по Na2S2O3-5H2O. 1
17. При установке титра раствора тиосульфата натрия взято 1,1780 г К2СГ2О7 (х. ч.) и растворено в мерной
145
колбе на 250 мл. На титрование 25,00 мл раствора (после соответствующей обработки) израсходовано 23,38 мл раствора тиосульфата натрия. Чему равны нормальность и К тиосульфата натрия?
18. Для установки титра раствора тиосульфата натрия взято 0,2486 г К2СГ2О7 (х. ч.) и растворено в мерной колбе на 500 мл. На титрование 25,00 мл этого раствора после прибавления НС1 и KI расходуется в среднем 25,05 мл раствора тиосульфата натрия. Найти нормальность и титр раствора тиосульфата натрия.
19. Навеска К2СГ2О7 (х. ч.) 0,1180 г в кислой среде обработана иодидом калия и оттитрована раствором тиосульфата натрия, которого израсходовано 23,80 мл. Чему равен титр раствора тиосульфата натрия?
20. На титрование иода, выделенного из раствора ио-дида навеской 0,1154 г дихромата калия, расходуется 23,74 мл раствора тиосульфата натрия. Найти: a) 7’Na2S203-SH20; б) 7Na2S2O3-5H2O/I-
21. Взято 20,00 мл раствора КМпО4 (/<=1,056 к 0,1 н.). После прибавления KI и НС1 этот раствор оттитрован раствором тиосульфата натрия, которого израсходовано 18,50 мл. Найти: а) Т\ б) N; в) К раствора тиосульфата натрия.
22. На титрование иода, выделенного из иодида калия 12,50 мл раствора КМпО4 (7=0,001544), израсходовано 17,05 мл раствора Na2S2O3. Чему равны: а) Т; б) N; в) К раствора тиосульфата натрия?
Расчет навески анализируемого вещества
23. Какую навеску образца белильной извести, содержащей ~25% активного хлора, следует взять для анализа на его содержание, если навеску растворить в мерной колбе на 500 мл, а рабочий раствор тиосульфата натрия ~0,2 н.?
24. Какую навеску натриевого хромпика следует взять для анализа на содержание КагСггО?, если в образце ~15% влаги и ~5% нерастворимых примесей? Объем мерной колбы для растворения навески 250 мл, рабочий раствор тиосульфата 0,1 и.
25. Какой может быть наибольшая навеска белильной извести, необходимая для анализа на содержание активного хлора методом отдельных навесок, если ожидаемое
146
содержание активного хлора в образце —20%, концентрация раствора тиосульфата натрия — 0,1 и., расход раствора тиосульфата натрия не должен превышать 40 мл?
26. Какую навеску иода, содержащего — 20% примесей, не обладающих окислительными свойствами, следует взять для анализа, чтобы на титрование полученного из этой навески раствора расходовалось не больше 25 мл 0,05 н. Na2S20s?.
27. Сколько миллилитров раствора пероксида водорода, приготовленного разбавлением 25 мл 3%-го раствора до 250 мл, следует взять, чтобы на титрование полученного раствора после обработки KI и IIC1 расходовалось около 25 мл — 0,15 н. Na2S2O3?
28. Сколько миллилитров хлорной воды, содержащей — 2% хлора, следует взять, чтобы на титрование ее после соответствующей обработки расходовалось —30 мл раствора тиосульфата натрия (7\^Ao<5iro = 0,02500) ?
Расчет результата анализа
по данным прямого титрования
29. Для анализа тиосульфата натрия на содержание основного продукта взята навеска 15,9800 г и растворена в мерной колбе на 500 мл. На титрование 25,00 мл полученного раствора расходуется 30,60 мл рабочего рас-тврра иода (К=0,9780 к0,1 н.). Вычислить процентное содержание Na2S2O3-5H2O в образце.
30. Навеска сульфида натрия 0,9432 г растворена в мерной колбе на 200 мл. На титрование 20,00 мл этого раствора расходуется 15,42 мл рабочего раствора иода (/(=1,2040 к 0,1 н.). Вычислить процентное содержание Na2S в образце.
31. Навеска сульфита натрия 7,3460 г растворена в мерной колбе на 1000 мл. Полученным раствором оттитровано 20,00 мл раствора иода (М = 0,05140). На это израсходовано 23,15 мл анализируемого раствора. Вычислить процентное содержание Na2SO3 в образце.
32. Навеска тиосульфата натрия 1,4460 г растворена в мерной колбе на 500 мл. Полученным раствором оттитровано 20,00 мл раствора иода (К= 1,0250 к 0,01 н.). На это титруемого раствора израсходовано 18,95 мл. Вычислить процентное содержание Na2S2O3-5H2O в образце.
147
33. Навеска хлорного железа 4,8900 г растворена в мерной колбе на 250 мл. 25,00 мл этого раствора обработано в кислой среде иодидом калия и оттитровано раствором тиосульфата натрия (К=0,9230 к 0,1 н.). Израсходовано его 32,10 мл. Вычислить процентное содержание FeiCl3 в образце.
34. Для анализа иода, содержащего нерастворимые примеси, взято его 1,6220 г и растворено в мерной колбе на 250 мл. На титрование 25,00 мл полученного раствора расходуется 19,95 мл раствора тиосульфата натрия (/£=1,0500 к 0,05 и.). Вычислить процентное содержание иода в образце.
35. Навеска белильной извести 3,3580 г разведена до метки в мерной колбе на 250 мл. На титрование 25,00 мл полученной суспензии после прибавления к раствору НС1 и KI расходуется 17,74 мл раствора тиосульфата натрия (/£=0,9882 к 0,1 н.). Вычислить процентное содержание активного хлора в образце.
36. Навеска белильной извести 3,3590 г разведена в мерной колбе на 250 мл. 25,00 мл полученной суспензии после обработки требуют для титрования 18,29 мл раствора тиосульфата натрия (7=0,02453). Вычислить процентное содержание активного хлора в образце.
37. Навеска сульфита натрия 0,3595 г растворена в произвольном объеме воды. Полученный раствор оттитрован рабочим раствором иода (7=0,01142), на что его расходуется 28,65 мл. Вычислить процентное содержание Na2S03-7H20 в образце.
38. Навеска сульфида натрия 0,0902 г растворена. Полученный раствор оттитрован раствором иода, которого на это расходуется 18,20 мл. Вычислить процентное содержание ЫагЗ в образце, если титр раствора иода 0,01320.
39. Навеска белильной извести 0,2608 г после обработки KI и НС1 титруется раствором тиосульфата натрия (/£=1,0020 к 0,1 н.), на что его расходуется 25,95 мл. Вычислить процентное содержание активного хлора в образце.
40. Для анализа взято 0,1254 г хромпика и растворено. Выделенный им из иодида калия иод оттитрован 24,85 мл раствора тиосульфата натрия (/£=0,9978 к 0,1 н.). Вычислить процентное содержание СгО3 в образце.
148
41. На титрование иода, выделенного из раствора 0,2110 г технического гипохлорита, израсходовано 19,50 мл раствора тиосульфата натрия (TNa2s2o3/i= = 0,01273). Вычислить процентное содержание хлора в образце.
42. На титрование 25,00 мл раствора йодата калия, прибавленных к раствору KI и НС1, расходуется 26,55 мл раствора тиосульфата натрия (7'Na2s2o3/K2cr2o7 = 0,004875). Чему равен Ткю3?
43. На титрование иода, выделенного из кислого раствора иодида калия навеской 0,3000 г йодата калия, расходуется 48,00 мл раствора ЬТагЗгОз. Определить: а) Т Naas2o,/i ; б) нормальность раствора тиосульфата натрия.
44. Навеска иодида калия 4,3780 г растворена в мерной колбе на 200 мл. На титрование 20,00 мл этого раствора после обработки окислителем расходуется 23,16 мл раствора тиосульфата (7ыа2й2о!/к2&2о7=0,005248). Вычислить процентное содержание KI в образце.
45. Навеска хромового ангидрида 0,0921 г растворена, обработана KI и НСЛ и оттитрована 23,75 мл раствора тиосульфата натрия (TNa2s2o,/i =0,01354). Вычислить процентное содержание СгО3 в образце.
46. На титрование 0,3319 г гипохлорита после растворения и соответствующей обработки израсходовано 30,19 мл раствора тиосульфата натрия (Т Na2s2o,-5H2o = = 0,02512). Вычислить процентное содержание хлора в образце.
Расчет результатов анализа по данным обратного титрования
47. Навеска сульфида натрия 3,9050 г растворена в мерной колбе на 500 мл. К 20,00 мл этого раствора прилито 40,00 мл раствора иода (/(=0,9342 к 0,2 н.). На титрование избытка иода израсходовано 41,25 мл раствора тиосульфата натрия (/<=0,9520 к 0,1 н.). Вычислить процентное содержание Na2S образце.
48. Анализу подвергается безводный и частично окислившийся сульфит натрия. Навеска образца 2,2590 г; объем мерной колбы 200 мл; титруемый объем раствора сульфита натрия 20,00 мл; объем прибавленного раствора иода 40,00 мл; объем раствора тиосульфата натрия, пошедший на обратное титрование иода, 23,16 мл; Дт—
149
= 1,1990 к 0,1 н.; /<Na2s2o3=0,8822 к 0,1 н. Вычислить процентное содержание Na2SO3 в образце.
49. К 10,00 мл сероводородной воды прибавлено 50,00 мл раствора иода, на избыток которого потребовалось для титрования 32,79 мл раствора тиосульфата натрия. Вычислить процентное содержание H2S в воде, если; Ki= 1,1120 к 0,1 н., a /(Na2s2o3 = 0,9730 к 0,1 н.
50. Навеска сульфита натрия 0,3878 г растворена и обработана 50,00 мл раствора иода, избыток которого потребовал для обратного титрования 25,40 мл раствора тиосульфата натрия. Тг = 0,01245; 7’Na2s!o3.5H2o = 0,02502. Вычислить процентное содержание Na2SO3 в образце.
Различные определения редоксидиметрическими методами
51. Чтобы определить содержание серы в сталях, ее путем различных операций превращают в H2S. Сероводород окисляют раствором иода, избыток которого от-титровывают раствором тиосульфата натрия. Вычислить процентное содержание серы в образце стали на основании следующих данных: навеска 3,0350 г; объем раствора иода 10,80 мл; объем раствора тиосульфата натрия 5,65 мл; нормальность раствора иода 0,03523; Л Na2s2o3 = 1,0140 к 0,05 н.
52. При определении содержания серы в образце стали получены следующие данные: навеска 3,1640 г; объем раствора иода 5,00 мл; объем раствора тиосульфата натрия 3,34 мл; Ki= 1,1740 к 0,03 н.; нормальность раствора тиосульфата натрия 0,0507. Вычислить процентное содержание серы в образце.
53. При определении серы в образце стали (см. задачу 51) взята навеска 10,0000 г. Объем раствора иода 15,00 мл; объем раствора тиосульфата натрия 8,50 мл; 1 мл раствора иода эквивалентен 0,98 мл раствора тиосульфата натрия; 7i/s = 0,0003079. Вычислить процентное содержание серы в образце.
54. При определении содержания серы в чугуне получены следующие данные: навеска образца 5,1620 г; объем раствора иода 15,40 мл; объем раствора тиосульфата натрия 12,60 мл; 1 мл раствора иода эквивалентен 1,02 мл раствора тиосульфата натрия; 7’i/s = 0,0006452. Вычислить процентное содержание серы в образце.
150
55. Анализируют сталь на содержание марганца. Для этого растворено 0,3510 г образца. Марганец окислен до марганцовой кислоты. На титрование НМпО4 израсходовано 8,43 мл раствора ИазАзОз (/(= 1,004 к 0,03 н.). Вычислить процентное содержание марганца в образце.
56. При определении содержания марганца в стали получены следующие данные: навеска образца 0,3668 г; объем раствора арсенита натрия, пошедшего на титрование образовавшейся марганцовой кислоты, 5,70 мл; нормальность раствора арсенита натрия 0,0315 н. Вычислить процентное содержание марганца в образце.
57. Для анализа стали на содержание хрома растворено 1,1584 г его образца. Хром окислен до хромовой кислоты, для восстановления которой взято 16,00 мл раствора соли Мора. На титрование избытка соли Мора израсходовано 2,70 мл раствора КМпО4, 1,28 мл которого эквивалентны 1,00 мл раствора соли Мора. Вычислить процентное содержание хрома в образце, если Тсоли Мора/Сг= 0,0008638.
58. Для анализа на содержание хрома 1,017 г образца растворено и окислено. На восстановление получившейся хромовой кислоты взято 40,00 мл раствора соли Мора. На титрование избытка восстановителя израсходовано 5,02 мл раствора перманганата калия, нормальность которого 0,02394. 10 мл раствора соли Мора эквивалентны 9,63 мл раствора КМпО4. Вычислить процентное содержание хрома в образце.
59. Для определения содержания олова в сплавах его превращают в SnSO4, которое титруют рабочим раствором иода без доступа воздуха. Вычислить процентное содержание олова в бронзе, если навеска образца 0,9122 г; расход раствора иода на титрование 15,73 мл; нормальность раствора иода 0,03523.
60. Определяют содержание олова в латуни (см. задачу 59). Навеска образца 1,0690 г; объем раствора иода 2,90 мл; нормальность его 0,03666. Вычислить процентное содержание олова в образце.
61. Для анализа образца фенола бромид-броматным методом 1,1100 г его растворено в мерной колбе на 500 мл. 10,00 мл этого раствора обработано 50,00 мл бромид-броматпой смеси (/<=0,9870 к 0,1 н.). На титрование иода, выделенного избытком бромид-броматной смеси из прибавленного к титруемому раствору KL израсходовано 35,20 мл раствора тиосульфата (/(=1,0249
151
к 0,1 н.). Вычислить процентное содержание фенола в препарате.
62. Анализируют степень чистоты фенола. Навеска образца 0,5022 г; объем мерной колбы, в которой растворили навеску, 250 мл; титруемый объем 10,00 мл; объем бромид-броматной смеси 50,00 мл; ее К=0,9867 к 0,1 н.; объем раствора тиосульфата натрия 36,10 мл; нормальность 0,1018. Вычислить процентное содержание примесей в образце.
Примечание. Определение фенола (и других легко броми-рующихся органических веществ) бромид-броматным методом основано на выделении из бромид-броматной смеси в кислой среде свободного брома, который количественно вступает в две химические реакции:
С5Н5ОН + ЗВг2 = СеН2Вг3ОН + ЗНВг
Вг2 + 2KI = Ь + 2КВг
Оттитровав тиосульфатом натрия иод, выделенный бромом, не вступившим в реакцию с определяемым фенолом, вычисляют, сколько фенола содержалось в анализируемом образце. Расчет ведут так же, как и при других определениях, выполняемых способом обратного титрования.
63. Для приготовления рабочего раствора дихромата калия, предназначенного для хроматометрических определений, взята навеска его 10,000 г К2СГ2О7 (х. ч.) и из нее приготовлен раствор в колбе на 2,00 л. Определить: а) нормальность раствора; б) титр его по Fe2O3; в) титр по Sb.
64. Навеска К2СГ2О7 (х. ч.) 1,2850 г растворена в мерной колбе на 500 мл. Сколько миллилитров этого раствора пойдет на титрование 20,00 мл 0,0500 н. раствора соли Мора?
65. Для определения содержания Fe2O3 в образце известняка взята навеска его 1,2290 г. Выделенное из навески железо переведено в раствор, восстановлено и объем доведен до метки в мерной колбе на 250 мл. На титрование 25,00 мл этого раствора расходуется 5,26 мл раствора дихромата калия, титр которого по Fe 0,0003025. Вычислить процентное содержание Fe2O3 в образце.
66. Из 0,5442 г образца припоя выделено олово, восстановлено и оттитровано рабочим раствором дихромата калия (К=0,9835 к 0,2 н.), которого на это потребовалось 28,35 мл. Вычислить процентное содержание олова в образце.
Глава V
МЕТОД КИСЛОТНО-ЩЕЛОЧНОГО ТИТРОВАНИЯ (НЕЙТРАЛИЗАЦИИ)
А. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДА
Теоретические основы метода кислотно-щелочного титрования представляют собой главным образом вычисления и определения концентраций ионов водорода в растворах различных веществ — кислот, оснований, солей — и в их смесях, образующихся в анализируемых растворах в процессе титрования. Для удобства расчетов и графических построений в этом методе принято грамм-ионные или молярные концентрации всех ионов и веществ выражать в двух формах: экспоненциальной и логарифмической. Выразить число в экспоненциальной форме — это значит представить его в виде двух сомножителей, одним из которых является 10п (где п может быть и положительным и отрицательным).
Пример 1. Выразить в экспоненциальной форме числа: 25 000; 1000; 0,001; 0,00035.
Решение. 25 000 = 2,5-104; 1000= 1-Ю3; 0,001 = 1 • 10~3;
0,00035=3,5-10-4, или 35-10~5.
Как видно из примера, показатель степени при 10 равен числу знаков, на которое была перенесена запятая, отделяющая целую часть числа. При перенесении запятой влево показатель степени положителен, а при перенесении вправо — отрицателен. Этим способом можно выражать не только концентрации растворов, но и любые другие величины.
В большинстве расчетов, относящихся к методу кислотно-щелочного титрования, концентрации (а также и другие величины) удобно выражать логарифмически — в виде отрицательных логарифмов этих величин. Обозначив отрицательный логарифм знаком «р», можно написать для любого числа а
р а = — 1g а.
Пример 2. Определить «р» числа 0,00001.
Решение. 0,00001 = 10-5; lgl0-5 =—5; — 1g 10~5 = 5; р = 5.
153
«р» любого числа, выраженного в виде десятичной дроби, равно числу десятичных знаков этой дроби минус логарифм числа, составленного ее значащими цифрами.
Пример 3. Определить «р» числа 0,00035.
Решение. Число десятичных знаков дроби: 5; 1g 35=1,54; р = = 5—1,54 = 3,46.
Для нахождения числа по известному значению «р» выполняют действия в обратном порядке.
Пример 4. Найти число, если р=3,46.
Решение. Из определения величины «р» следует, что если ра=3,46, то a = 10~3’48. Но так как число, выраженное таким образом, неудобно для вычислений, его следует выразить в виде обычной десятичной дроби путем следующих преобразований:
а = Ю-3,46 = 10(— 4)+°>54 = ю~4.10°’54 = 0,0001-3,5 = 0,00035.
Если какое-то число равно 100-54, то это значит, что десятичный логарифм его равен 0,54. По таблице антилогарифмов найдем, что логарифму 0,54 соответствует число 3,5.
Так как подобные вычисления не требуют точности, превышающей две значащие цифры, при их выполнении удобно пользоваться таблицей двузначных логарифмов (см. табл. 13 приложения).
В теоретических основах метода кислотно-щелочного титрования приходится встречаться с вычислениями «р» следующих величин: концентрации ионов водорода (pH), концентрации ионов гидроксила (рОН), концентрации КИСЛОТ, основании И солеи (рб?кисл! рб?осн! рСсоли); константы диссоциации кислот, оснований и индикаторов (рКкисл! Р-Косн! Р-^инд)- Все эти вычисления выполняют так, как было показано в приведенных примерах. Вычисляя pH и рОН, необходимо помнить, что [Н+]=СКИсл и [ОН-] = СОсн только в случае разбавленных растворов сильных кислот и сильных оснований. В случае же других растворов вычисляют значения pH и рОН пользуясь соответствующими формулами из количественного анализа.
Задачи *
1. Какую реакцию среды имеют растворы солей: хлорид калия, бромид натрия, нитрат цинка, сульфат меди?
* Примеры решения задач этого раздела см. в учебнике: А. П. Крешков, А. А. Ярославцев. Курс аналитической химии. М.—Л., Химия, 1975, ч. II, гл. IV.
154
2. Какую реакцию среды имеют растворы солей: хлорид алюминия, нитрат бария, сульфат натрия?
3. Какую реакцию среды имеют растворы солей: карбонат калия, сульфид натрия, сульфат железа (III)?
4. Какую реакцию среды имеют растворы солей: нитрат серебра, трехзамещенный фосфат натрия, хлорид аммония?
5. Уксусная кислота оттитрована раствором едкого кали до нейтральной среды. Правильный ли получится результат? Если нет, то какой знак будет иметь ошибка?
6. Раствор едкого кали оттитрован уксусной кислотой до нейтральной среды. Правильный ли получится результат? Если нет, то какой знак будет иметь ошибка?
7. Соляная кислота оттитрована гидроксидом аммония до нейтральной среды. Правильный ли получится результат? Если нет, то какой знак будет иметь ошибка?
8. Гидроксид аммония оттитрован соляной кислотой до нейтральной среды. Правильный ли получится результат? Если нет, то какой знак будет иметь ошибка?
9. Серная кислота оттитрована раствором едкого натра до слабокислой среды. Правильно ли определена точка эквивалентности? Если нет, то перетитрован или не-дотитрован раствор?
10. Раствор едкого барита оттитрован соляной кислотой до слабокислой среды. Правильно ли определена точка эквивалентности?
11. Выразить в экспоненциальной форме концентрацию ионов водорода в растворе соляной кислоты следующих нормальностей (считая а=1ОО°/о): 1; 0,1; 0,001; 0,000001.
12. Выразить в экспоненциальной форме концентрацию ионов гидроксила в растворах едкого натра следующих молярностей (считая а=100%): 0,01; 0,0001; 0, 00001.
13. Выразить в экспоненциальной форме концентрацию ионов водорода в соляной кислоте следующих молярностей (считая а=100%); 0,2; 0,0002; 0,05; 0,0005.
14. Выразить в экспоненциальной форме концентрацию ионов гидроксила в растворах едкого кали следующих молярностей (считая а=1ОО°/о): 0,03; 0,00003; 0,0035; 0,00052. '
15. Определить концентрацию иона водорода в 0,1 н. и 1 М растворах HNO3, учитывая степень диссоциации
155
растворов и выразив концентрации в экспоненциальной форме.
16. Вычислить концентрацию иона гидроксила в 0,1 н. и 1 н. растворах КОН, учитывая их степень диссоциации и выражая концентрации в экспоненциальной форме.
17. Найти концентрацию иона гидроксила в 0,001 М и 0,0001 М растворах НО, считая а=100%.
18. Определить концентрацию иона водорода в 0,01 М и 0,00001 М растворах едкого натра, считая а=100%.
19. В растворе [Н+] = 0,001 г-ион/л. Чему равен pH?
20. В растворе [Н+]=0,00001 г-ион/л. Определить pH.
21. В растворе [Н+]=0,002 г-ион/л. Определить pH.
22. В растворе [Н+] = 0,0005 г-ион/л. Определить pH.
23. В растворе [ОН-]=0,3 г-ион/л. Определить рОН и pH.
24. В растворе (ОН_]=0,004 г-ион/л. Определить рОН и pH.
25. Определить pH и рОН 0,006 М НС1 (считая а=100%).
26. Определить pH и рОН 0,025 М НС1 (считая а = = 100%).
27. Определить pH и рОН 0,1 М НС1, учитывая а.
28. Определить pH и рОН 1 М НС1, учитывая а.
29. Определить рОН и pH 0,1 М NaOH, учитывая а.
30. Определить рОН и pH 1 М КОН, учитывая а.
31. 0,1 н. НС1 разбавлен водой в 10 раз. Полученный раствор снова разбавлен водой в 10 раз и т. д.— всего семь раз. Как изменяется pH раствора после каждого разбавления? Чему равен pH раствора после 6-го и 7-го разбавлений?
32. Каковы приблизительно возможные пределы шкалы pH?
33. К 20 мл 0,1 н. НС1 прилито 30 мл 0,1 н. NaOH. Чему равен pH полученного раствора?
34. К 55 мл 0,2 н. КОН прибавлено 45 мл 0,2 н. НС1. Чему равен pH полученного раствора?
35. Смешаны 20 мл 0,1 н. NaOH и 10 мл 0,15 н. НС1. Вычислить pH полученного раствора.
36. К 500 мл 0,05 н. КОН прибавлено 500 мл 0,04 н. HNO3. Чему равен pH полученного раствора?
37. К 0,2 н. НС1 прибавлен равный объем 0,15 н. NaOH. Определить pH и рОН получившегося раствора.
38. К 1 л 0,001 н. HNO3 прибавлено 1 мл 1 н. КОН. Чему равны pH и рОН в полученном растворе?
156
39. К 20 мл 0,04 н. HCI прибавлено 45 мл 0,02 н. КОН. Найти pH и рОН полученного раствора.
40. К 15 мл 0,025 н. НС1 прибавлено 10 мл 0,050 н. NaOH. Найти pH и рОН полученного раствора.
41. Константа диссоциации СН3СООН 1,86-10-5. Определить рК.
42. Константа диссоциации NH4OH 1,79-10-5. Определить рК.
43. Концентрация CH3COONa 0,02 М. Определить рС.
44. Концентрация NH4C1 0,005 М. Определить рС.
45. Определить [Н+] раствора, если pH 2,6.
46. Определить [Н+] раствора, если pH 5,2.
47. Определить [Н+] раствора, если pH 8.
48. Определит^ [Н+] раствора, если pH 9,4.
49. Определить [Н+] раствора, если рОН 12,2.
50. Определить [Н+] раствора, если рОН 13,5.
51. Определить [ОН-] раствора, если pH 11,8.
52. Определить [ОН-] раствора, если pH 10,3.
53. Определить pH 0,1 н. СН3СООН.
54. Определить рОН 0,1 н. NH4OH.
55. Определить pH и [Н+] 0,05 н. СН3СООН.
56. Определить pH и [Н+] 0,002 н. НСООН.
57. Определить pH и [Н+] 0,025 н. HNO2.
58. Определить pH и [Н+] 0,04 н. HCN.
59. Определить pH и рОН 0,03 н. NH4OH.
60. Определить pH и рОН 0,5 н. NH4OH.
61. Определить pH 0,05 н. NH4C1.
62. Определить pH 0,02 н. NH4NO3.
63. Определить рОН 0,2 н. NH4Br.
64. Определить pH 0,005 н. NH4C1.
65. Определить pH раствора в точке эквивалентности при титровании 0,2 н. NH4OH соляной кислотой такой же концентрации.
66. Определить pH раствора в точке эквивалентности при титровании 0,1 н. NH4OH 0,1 н. соляной кислотой.
67. При каком pH следует закончить титрование 0,05 н. NH4OH 0,05 н. раствором H2SO4?
68. При каком pH следует закончить титрование 0,2 н. NH4OH 0,01 н. раствором H2SO4?
69. Определить pH 0,01 н. СН3СООК-
70. Определить pH 0,25 н. CH3COONa.
71. Определить pH 0,03 н. HCOONa.
72. Определить pH 0,04 н. KCN.
157
73. Определить pH раствора в точке эквивалентности при титровании 0,2 н. СН3СООН 0,2 н. раствором NaOH.
74. Определить pH раствора в точке эквивалентности при титровании 0,1 н. НСООН 0,1 н. раствором КОН.
75. При каком pH следует закончить титрование 0,1 и. СНзСООН 0,2 н. раствором NaOH?
76. При каком pH следует закончить титрование 0,1 н. СНзСООН 0,025 н. раствором КОН?
77. В 250 мл 0,5 н. NH4OH содержится 1,34 г безводного NH4CI. Чему равен pH раствора?
78. В 100 мл 0,2 н. NH4OH содержится 1,07 г безводного NH4CI. Чему равен pH раствора?
79. К Ю мл 0,05 н. NH4OH прибавлено 5 мл 0,05 н. НО. Определить pH смеси.
80. К 20 мл 0,2 н. NH4OH прибавлено 15 мл 0,2 н. НС1. Определить pH смеси.
81. К 10 мл 0,1 н. NH4OH прибавлено 10 мл 0,06 и. H2SO4. Определить pH смеси.
82. К 25 мл 0,3 н. NH4OH прибавлено 20 мл 0,2 и. HNO3. Определить pH раствора.
83. В 200 мл 0,1 н. СНзСООН содержится 1,64 г безводного ацетата натрия. Чему равен pH раствора?
84. В 500 мл 0,05 н. НСООН содержится 1,7 безводного формиата натрия. Чему равен pH раствора?
85. К 50 мл 0,1 и. СНзСООН прибавлено 50 мл 0,1 н. ацетата натрия. Чему равен pH смеси?
86. К 100 мл 0,2 и. НСООН прибавлено 50 мл 0,5 н. формиата натрия. Чему равен pH смеси?
87. К Ю мл 0,2 н. СНзСООН прибавлено 5 мл 0,2 н. NaOH. Чему равен pH смеси?
88. К 25 мл 0,05 н. СНзСООН прибавлено 20 мл 0,05 и. КОН. Чему равен pH смеси?
89. К 15 мл 0,1 н. НСООН прибавлено 15 мл 0,05 н. NaOH. Чему равен pH смеси?
90. К 20 мл 0,15 н. СНзСООН прибавлено 15 мл 0,12 н. NaOH. Чему равен pH смеси?
91. К Ю мл 1 н. NH4OH прибавлена 1 капля H2SO4, имеющей пл. 1,84. Определить pH смеси.
92. К 20 мл 0,1 н. NH4OH прибавлено 2 капли НС1, пл. которой 1,198. Определить pH смеси.
93. Титруют 20,00 мл 0,2 и. НС1 0,2 н. раствором NaOH. Определить pH раствора в титровальной колбе, когда в нее прилиты следующие объемы щелочи: а) 10; б) 18; в) 20 мл.
158
94. Титруют 20,00 мл 0,2 н. NaOH 0,2 н. соляной кислотой. Определить pH раствора в титровальной колбе, когда в нее влиты следующие объемы кислоты: а) 10; б) 18; в) 20 мл.
95. Титруют 25,00 мл 0,05 н. НС1 0,05 н. раствором NaOH. Рассчитать точки кривой титрования, соответствующие прибавлению: 5, 12,5; 20,00; 22,50; 24,75; 24,98; 25; 25,02 мл щелочи.
96. Титруют 25,00 мл 0,05 н. КОН 0,05 н. серной кислотой. Рассчитать точки кривой титрования, соответствующие прибавлению: 5; 12,5; 20; 22,50; 24,75; 24,98; 25,00; 25,02 мл кислоты. Построить по ним кривую титрования.
97. Титруют 20,00 мл 0,2 н. СН3СООН раствором КОН той же концентрации. Определить pH раствора в титровальной колбе, когда в нее прибавлены следующие объемы щелочи: а) 5; б) 10; в) 15; г) 20 мл.
98. Титруют 25 мл 0,04 н. НСООН раствором NaOH той же концентрации. Определить pH раствора в титровальной колбе, когда в нее прибавлены следующие объемы щелочи: а) 2,5; б) 12,5; в') 19; г) 25 мл.
99. Титруют 25 мл 0,2 н. СН3СООН раствором NaOH той же концентрации. Рассчитать точки кривой титрования, соответствующие прибавлению 5; 10; 15; 20; 24; 24,5; 24,90; 24,95 и 25 мл щелочи.
100. Построить кривую титрования 20 мл 0,2 н. НСООН раствором КОН той же концентрации, рассчитав ее точки, соответствующие прибавлению: 2; 6; 10; 18; 19,8; 19,98; 20 и 20,02 мл щелочи.
101. Титруют 20 мл 0,4 н. NH4OH раствором H2SO1 той же концентрации. Рассчитать точки кривой титрования, соответствующие прибавлению 2; 6; 10; 18; 20 мл кислоты.
102. Построить кривую титрования 25 мл 0,2 н. NH4OH раствором соляной кислоты той же концентрации, рассчитав ее точки, соответствующие прибавлению следующих объемов кислоты: 2,5; 5; 10; 20; 22,5; 24,75; 24,98; 25 и 25,02 мл.
103. Вычислить pKind нейтрального красного.
104. Вычислить pKind метилового красного.
105. Определить границы интервала перехода тро-пеолина 00.
106. Определить границы интервала перехода нитрамина.
159
107, В какой цвет окрасят чистую воду фенолфталеин? Метиловый оранжевый? Лакмус?
108. В какой цвет окрасят чистую воду тропеолин 00? Нейтральный красный? Нитрамин?
109. Какую окраску будет иметь фенолфталеин в 0,1 н. растворах NH4NO3; NasSC^; CH3COONa?
ПО. Какова окраска лакмуса, фенолфталеина и метилового оранжевого в 0,2 н. HCOONa?
111. Раствор не окрашивается фенолфталеином, но окрашивается лакмусом в красный цвет. Какие значения pH может иметь раствор?
112. Раствор окрашивается лакмусом в красный цвет, а метиловым оранжевым — в желтый. Какие значения pH может иметь раствор?
113. Слиты вместе одинаковые объемы 0,2 н. растворов NH4OH и HNO3. Какую окраску в полученном растворе будут иметь метиловый оранжевый? Лакмус? Фенолфталеин?
114. К 20 мл 0,1 н. СНзСООН прибавлено 10 мл 0,2 н. NaOH. Какую окраску будут иметь в полученном растворе метиловый красный? Лакмус? Фенолфталеин?
115. Слито вместе по 25. мл 0,2 н. растворов КОН и H2SO4. В какой цвет окрасят полученный раствор: а) метиловый красный; б) лакмус; в) фенолфталеин?
116. Слиты вместе одинаковые объемы 0,1 н. растворов NH4OH и СНзСООН. В какой цвет окрасит полученный раствор: а) метиловый оранжевый; б) лакмус; в) фенолфталеин?
117. Какие индикаторы будут иметь переходные окраски в точках эквивалентности при титровании 0,1 н. раствором КОН: а) 0,1 н. HNO3; б) 0,1 н. СН3СООН?
118. Какие индикаторы будут иметь переходные окраски в точке эквивалентности при титровании 0,2 н. раствором НС1: а) 0,2 н. Ba(OH)a и б) 0,2 н. NH4OH?
119. Титруют 0,2 н. СНзСООН 0,2 н. раствором КОН в присутствии метилового оранжевого. Правильно ли выбран индикатор? Если неправильно, то какая допущена ошибка?
120. Титруют 0,05 н. НС1 раствором КОН той же концентрации в присутствии фенолфталеина. Правильно ли выбран индикатор? Если неправильно, то какая допущена ошибка?
121. Титруют 0,1 н. НСООН раствором NaOH той же концентрации в присутствии метилового красного. Пра-160
вильно ли выбран индикатор? Если неправильно, то к какой ошибке титрования это привело?
122. Титруют 0,2 и. NH4OH серной кислотой той же концентрации в присутствии фенолфталеина. Правильно ли выбран индикатор? Если нет, то какая допущена ошибка?
Б. ПРИГОТОВЛЕНИЕ И УСТАНОВКА ТИТРОВ РАБОЧИХ РАСТВОРОВ
Задачи
1. Сколько граммов КОН требуется взять для приготовления 1,5 л ~0,02 н. раствора?
2. Сколько граммов NaOH необходимо для приготовления 0,5 л ~0,2 н. раствора?
3. Сколько миллилитров раствора КОН пл. 1,291 требуется для приготовления 5 л ~0,15 н. раствора?
4. Сколько миллилитров раствора NaOH пл. 1,53 следует взять для приготовления 12 л ~ 0,1 н. раствора?
5. Сколько миллилитров раствора НС1 пл. 1,15 требуется для приготовления 1,5 л 0,2 н. раствора?
6. Сколько миллилитров серной кислоты пл. 1,74 требуется для приготовления 2,5 л 0,05 н. раствора?
7. Сколько граммов Na2B4O7-ЮН2О пойдет на приготовление 500 мл раствора, необходимого для установки ~0,1н. НС1.
8. Сколько граммов безводной соды следует взять на мерную колбу емкостью 200 мл, чтобы приготовить раствор, необходимый для установки титра ~0,05 н. H2SO4?
9. Какую навеску янтарной кислоты следует взять для установки титра -~0,4 н. NaOH методом отдельных навесок, чтобы на титрование приготовленных из них растворов расходовалось не более 25 мл устанавливаемого раствора?
10. Сколько граммов кристаллической щавелевой кислоты следует взять для установки титра ~0,5 н. КОН методом отдельных навесок, чтобы на титрование полученного раствора расходовалось около 25 мл устанавливаемого раствора?
11. Для установки титра раствора НС1 навеска безводной соды (х. ч.) 5,2060 г растворена в мерной колбе на 500 мл. На титрование 25 мл раствора расходуется 26,18 мл устанавливаемого раствора. Определить: а) нормальность НС1; б) Кнсг, в) ТнсИ г) Гца/NaOH.
6 Ярославцев А. А. 161
12. Для установки титра раствора H2SO4 навеска Na2B4O7- 10Н2О (х. ч.) 2,4000 г растворена в мерной колбе на 200 мл. На титрование 20 мл раствора H2SO4 расходуется 33,85 мл приготовленного раствора буры. Вычислить: а) нормальность H2SO4; 6)Kh2so4; в) 7h2so4; г) jTlI2SO4/Na2O-
13. Для установки титра H2SO4 1,6750 г навеска Na2C2O4 прокалена в платиновом тигле до постоянной массы, количественно переведена в мерную колбу на 250 мл, растворена. Объем раствора доведен водой до метки. На титрование 25,00 мл полученного раствора расходуется 22,46 мл кислоты. Определить: а) нормальность H2SO4; б) Ah2so4; в) 7h2so4.
14. Для установки титра раствора НС1 взято 20,00 мл раствора NaOH (7’=0,03982). Раствор разбавлен водой в мерной колбе на 200 мл до метки. На титрование 20,00 мл полученного раствора расходуется 18,95 мл раствора НС1. Определить: а) нормальность НС1; б) Anci; в) Гнсь
15. Для установки титра раствора КОН 5,9840 г Н2С2О4-2Н2О растворена в мерной колбе на 1000 мл. На титрование 25,00 мл полученного раствора расходуется 26,32 мл раствора КОН. Определить: а) нормальность раствора КОН; б) Ккон; в) Гкон/нсь
16. Для установки титра раствора NaOH 0,4826 г янтарной кислоты растворена в мерной колбе на 200 мл. На титрование 20,00 мл полученного раствора расходуется 21,05 мл раствора NaOH. Определить: а) нормальность NaOH; б) Кмаон; в) Т^аов/н^о,.
17. На титрование раствора, содержащего 0,2584 г безводной соды, расходуется 21,35 мл раствора H2SO4. Определить: a) 7h2so4; б) 7B2so4/NaOB; b)Kh2so4.
18. На титрование раствора, полученного из 0,5120 г Na2B4O7-ЮН2О (х. ч.), расходуется 26,32 мл раствора НС1. Определить: а) Тиа; б) Гна/к2о; в) нормальность НС1.
19. Для установки титра соляной кислоты 0,1724 г Na2C2O4 прокалено до постоянной массы (Na2C2O4 = = Na2CO3+CO) и растворено в произвольном объеме воды. На титрование полученного раствора расходуется 27,65 мл раствора НС1. Вычислить Тва/NaOB.
20. Для установки титра H2SO4 взято 20,00 мл раствора NaOH (7’=0,001920) и оттитровано устанавливаемым 162
раствором, которого на это израсходовано 22,40 мл. Вычислить 7h2so4.
21. Для установки титра раствора КОН 0,1495 г янтарной кислоты растворено в произвольном объеме воды и оттитровано устанавливаемым раствором. На это его израсходовано 25,15 мл. Определить Ккон-
22. Навеска Н2С2О4-2Н2О 0,07920 г растворена и оттитрована раствором NaOH, которого израсходовано 24,12 мл. Определить Кхаон-
23. На титрование 20,00 мл раствора НС1 расходуется 18,68 мл 0,1 н. раствора «фиксанала» NaOH. Определить: а) /Сна; б) 7нс1/ка2о.
24. Для установки титра раствора H2SO4 взято 20,00 мл 0,1 н. «фиксанала» буры. На титрование израсходовано 19,20 мл устанавливаемого раствора. Определить: а) нормальность H2SO4; б) 7h2so4.
25. При установке титра раствора КОН на титрование 25,00 мл израсходовано 24,22 мл 0,1 н. раствора «фиксанала» H2SO4. Определить: )а /Скон; б) Tkoh/so,-
26. Для установки титра раствора ЙаОНвзято 15,00 мл раствора 0,1 н. «фиксанала» НС1. На титрование израсходовано 18,05 мл устанавливаемого раствора. Определить: а) нормальность NaOH; б) Т^аои-
27. Содержимое ампулы «фиксанал» 0,1 н. H2SO4 перенесено в мерную колбу на 500 мл и разбавлено водой до метки. На титрование 20,00 мл полученного раствора расходуется 18,82 мл раствора NaOH. Определить: а) Кхаон; б) Тыаон/на.
28. Содержимое ампулы «фиксанал» 0,1 н. NaOH перенесено в мерную колбу на 200 мл и разбавлено до метки водой. На титрование 25,00 мл раствора HNO3 израсходовано 25,68 мл раствора «фиксанала». Определить: а) нормальность HNO3; б) ТньгОз/хаон-
29. Вычислить навеску образца каустической соды для анализа на содержание Na2O, если ее растворить в мерной колбе на 200 мл и титровать ~0,1 н. НС1.
30. Какую навеску образца кальцинированной соды надо взять для анализа на содержание основного продукта, если объем мерной колбы, в которой будут растворять навеску, 200 мл, а концентрация рабочего раствора H2SO4 ~0,1 н.?
31. Какую навеску купоросного масла пл. 1,75 следует взять для анализа на содержание SO3, пользуясь мерной колбой на 1000 мл и ~0,05 н. NaOH?
в*
163
32. Сколько миллилитров купоросного масла пл. 1,75 следует взять для анализа на содержание моногидрата, пользуясь мерной колбой на 500 мл, чтобы на 25 мл приготовленного раствора расходовалось около 25 мл ~ 0,1 и. КОН?
33. Сколько миллилитров технической соляной кислоты пл. 1,149 следует взять для определения в ней НС1, чтобы на титрование 20 мл раствора, приготовленного растворением рассчитанной навески в мерной колбе на 250 мл, расходовалось 20 мл 0,2 н. NaOH?
34. Сколько граммов азотной кислоты пл. 1,40 следует взять для анализа на содержание HNO3, пользуясь мерной колбой на 1000 мл и ~0,04 н. КОН?
35. Сколько граммов дымящей серной кислоты, содержащей ~90% SO3, следует взять для анализа на содержание SO3, пользуясь мерной колбой на 500 мл и ~0,5 н. КОН?
36. Какую навеску олеума, содержащего ~2О°/о свободного SO3, следует взять для анализа на содержание SO3 (общего), чтобы на титрование 25 мл раствора, приготовленного растворением навески в мерной колбе на 200 мл, расходовалось около 25 мл~ 1 н. щелочи?
37. Какую навеску каустической соды следует взять для анализа на содержание NaOH, чтобы на титрование полученного из нее раствора в присутствии метилового оранжевого расходовалось около 30 мл 0,5 н. НС1?
38. Сколько граммов кальцинированной соды следует взять для анализа на содержание основного продукта, чтобы на титрование раствора навески в произвольном объеме воды расходовалось в присутствии метилового оранжевого около 30 мл 0,2 н. раствора кислоты?
39. Сколько граммов раствора КОН пл. 1,41 следует взять для анализа на содержание в нем КОН, чтобы на титрование полученного из взятой навески раствора расходовалось около 25 мл ~0,3 и. кислоты?
40. Сколько надо отвесить раствора аммиака пл. 0,91, чтобы на его титрование расходовалось около 35 мл 1 и. H2SO4?
41. Сколько граммов HNO3 следует взять для анализа на содержание основного продукта, если образец содержит ~70% HNO3, чтобы на титрование полученного из навески раствора расходовалось около 25 мл 1 н. раствора щелочи?
42. Сколько граммов олеума, содержащего
164
свободного серного ангидрида, следует взять для анализа на определение SO3, чтобы на титрование полученного из взятой навески раствора расходовалось не менее 30 мл 1 н. раствора щелочи?
В. ВЫЧИСЛЕНИЕ РЕЗУЛЬТАТОВ АНАЛИЗОВ
Задачи
1. На титрование 20,00 мл раствора NaOH расходуется 22,40 мл НС1 (К=0,9325 к 0,1 н.). Сколько граммов NaOH в 1000 мл раствора?
2. В мерной колбе на 1000 мл растворено неизвестное количество H2SO4. На титрование 25,00 мл раствора расходуется 30,45 мл 0,1025 н. NaOH. Сколько граммов H2SO4 было введено в колбу?
3. Навеска каустика 2,1060 г растворена в мерной колбе на 500 мл. Полученным раствором титруют 25,00 мл раствора НС1 (70=0,9850 к 0,1 н.), на что расходуется 24,50 мл раствора анализируемой щелочи. Вычислить процентное содержание Na2O в образце.
4. Навеска купоросного масла 11,6500 г растворена в мерной колбе на 1000 мл. Полученным раствором титруют 25,00 мл раствора КОН (7(=1,1240 к 0,2 н.), на что расходуется 26,80 мл анализируемого раствора. Вычислить процентное содержание SO3 в образце.
5. Навеска калийной щелочи 7,6240 г растворена в мерной колбе на 500 мл. На титрование 25,00 мл полученного раствора расходуется 32,20 мл НС1 (7’nci/Na2o = =0,006442). Вычислить процентное содержание КОН в образце.
6. В мерную колбу на 1000 мл введено из бюретки 29,50 мл H2SO4 пл. 1,553. На титрование 25,00 мл 0,5378 н. NaOH расходуется 22,20 мл полученного раствора кислоты. Вычислить процентное содержание SO3 в образце.
7. Навеска кальцинированной соды 0,1324 г растворена в произвольном объеме воды и оттитрована в присутствии метилового оранжевого соляной кислотой (К= = 0,9850 к 0,1 и.), на что расходуется 24,45 мл НС1. Вычислить процентное содержание Na2CO3 в образце.
8. На нейтрализацию раствора, полученного растворением 0,1822 г купоросного масла, расходуется 30,30 мл раствора NaOH (Ткаои/н^о,=0,005020). Вычислить процентное содержание SO3 в образце.
9. На титрование раствора, полученного растворением
165
3,1580 г едкого кали, расходуется 27,45 мл раствора НС1 (7нс1/ыаон=0,07862). Вычислить процентное содержание КОН в образце.
10. Для выполнения анализа растворено 2,3200 г каустической соды. Полученный раствор оттитрован 1,9640 и. HCI. На это расходуется'28,80 мл НС1. Вычислить процентное содержание Na2O в образце.
11. В титровальную колбу с дистиллированной водой введено микробюреткой 0,500 мл анализируемого купоросного масла пл. 1,498. На титрование полученного раствора расходуется 41,94 мл раствора КОН (Ткон= =0,01266). Вычислить процентное содержание H2SO4 в образце.
12. На титрование раствора, полученного разбавлением 1,0000 мл H2SO4 пл. 1,716, расходуется 49,00 мл раствора NaOH (К= 1,1280 к 0,5 н.). Вычислить процентное содержание SO3 в образце.
13. В мерной колбе на 1000 мл разбавлено до метки 50,00 мл азотной кислоты пл. 1,40. На титрование 20,00 мл раствора КОН (7koh/h2so4=0,04904) расходуется 26,88 мл приготовленного раствора кислоты. Определить содержание HNO3 в исходном растворе.
14. В мерную колбу на 500 мл помещено 25,00 мл НС1 пл. 1,19. Объем доведен водой до метки. На титрование 20,00 мл раствора полученного раствора расходуется 25,13 мл раствора едкого натра (7=0,01976). Какова нормальность исходного раствора кислоты и процентное содержание НС1.
15. Для анализа на содержание SO3 олеум помещают во взвешенную стеклянную тонкостенную ампулу, которую после этого запаивают и взвешивают. Затем ампулу с олеумом бросают в толстостенную банку с дистиллированной водой и там разбивают. Содержимое банки оттит-ровывают раствором КОН. Определить процентное содержание общего, связанного и свободного серного ангидрида в олеуме, если масса пустой ампулы 0,3580 г; масса ампулы с олеумом 1,9790 г; концентрация рабочего раствора щелочи 0,9980 н. и объем его, пошедший на титрование, 35,53 мл.
16. Анализируют олеум на содержание SO3 (см. задачу 15). Навеска олеума 2,1010 г; концентрация рабочего раствора NaOH 1,1000 н.; объем раствора NaOH, израсходованного на титрование раствора, который получен растворением навески, 40,67 мл. Вычислить процентное 166
содержание общего, связанного и свободного SO3 в образце.
17. Навеска кристаллической соды 7,2860 г растворена в мерной колбе на 250 мл. На титрование 25,00 мл полученного раствора в присутствии метилового оранжевого расходуется 22,75 мл H2SO4 (7=0,01020). Вычислить процентное содержание Na2CO3 ,в образце.
18. В мерной колбе на 200 мл приготовлен раствор из 2,7350 г карбоната натрия. На титрование 20,00 мл полученного раствора в присутствии метилового оранжевого расходуется 18,65 мл НС1 (Т=0,003854). Вычислить процентное содержание воды в образце, если известно, что в нем нет посторонних примесей в заметных количествах. На сколько процентов больше или меньше воды в образце по сравнению с точным десятиводным кристаллогидратом?
19. Навеска свежеперекристаллизованной щавелевой кислоты (х. ч.) 2,6910 г растворена в мерной колбе на 500 мл. На титрование 25,00 мл 0,09768 н. NaOH расходуется 28,60 мл приготовленного раствора. Доказать, что кристаллогидрат щавелевой кислоты кристаллизуется с двумя молекулами воды.
20. Навеска свежеперекристаллизованого тетрабората натрия (х. ч.) 1,6690 г растворена в мерной колбе на 200 мл. На титрование 20,00 мл полученного раствора расходуется 17,50 мл раствора H2SO4 ( 7h2so4/koh = =0,002806). Доказать, что кристаллогидрат тетрабората натрия кристаллизуется с 10 молекулами воды.
21. Смешаны одинаковые объемы растворов КОН и H2SO4, имеющие: а) одинаковую нормальность; б) одинаковые титры; в) одинаковые поправки к одинаковым нормальностям. Какую среду имеет каждый раствор?
22. Растворы NaOH и НС1 имеют титры, выраженные одним и тем же числом (7'каон = 7'нс1). В каком отношении должны находиться их объемы, нейтрализующие друг друга?
23. К 25,00 мл раствора КОН неизвестной концентрации прибавлено 50,00 мл раствора H2SO4 (К=0,9500 к 0,1 н.). На титрование избытка кислоты израсходовано 28,90 мл раствора NaOH (К=0,8570 к 0,1 н.). Какова нормальность раствора КОН?
24. К 20,00 мл раствора НС1 неизвестной концентрации прилито 25,00 мл раствора КОН (К=0,8000 к 0,1 н.). После этого раствор стал сильнощелочным. Для обратного
167
титрования избытка щелочи пришлось израсходовать 1,55 мл раствора H2SO4 (/(=1,200 к 0,1 н.). Определить Киа-
25. 25 мл HNO3 титруют 0,09562 н. КОН. Около точки эквивалентности кран бюретки «заело» и его удалось закрыть только тогда, когда объем вылитой щелочи был 24,85 мл, а раствор стал уже щелочным. На титрование введенного избытка щелочи израсходовано 0,58 мл раствора H2SO4 (/<=1,2450 к 0,05 н.). Определить нормальность HNO3.
26. К 50,00 мл раствора НС1 (К=0,9500 к 0,2 н.) прибавлено 25,00 мл раствора NaOH неизвестной концентрации. При этом среда раствора осталась кислой. На дотит-ровывание оставшейся кислоты затрачено 2,50 мл раствора КОН (К = 1,2780 к 0,1 н.). Определить Лъгаон-
27. Навеска кальцита 1,5780 г растворена в 50,00 мл соляной кислоты (Г=0,04000). По окончании растворения и удаления СО2 раствор переведен в мерную колбу на 500 мл и доведен до метки. На титрование 50,00 мл полученного раствора расходуется 23,45 мл раствора NaOH (7=0,004000). Вычислить процентное содержание СаСО3 в образце.
28. В мерную колбу на 200 мл введено 3,6060 г Ва(ОН)2 и 50 мл раствора НС1 (К=1Д200 к 0,5 н.). Содержимое колбы доведено до метки. На титрование 20,00 мл раствора КОН (7=0,0030) расходуется 41,20 мл приготовленного в колбе раствора. Вычислить процентное содержание Ва(ОН)2 в образце.
29. При определении содержания основного продукта в хлориде аммония по Кьельдалю аммиак, выделенный из 0,5570 г навески, отогнан в 100 мл 0,1968 н. H2SO4. По окончании отгонки раствор переведен в мерную колбу на 500 мл и доведен водой до метки. На титрование 25,00 мл этого раствора расходуется 24,50 мл раствора щелочи (/<=1,050 к 0,02 н.). Вычислить процентное содержание NH4CI в образце.
30. При определении аммиака в хлориде аммония получены следующие данные: навеска 0,7124 г; концентрация кислоты, взятой для поглощения выделенного аммиака, 0,5120 н.; объем ее 50,00 мл; объем мерной колбы, в которой разведен раствор после поглощения NH3, 250 мл; титруемый объем этого раствора 25,00 мл; Ккон = = 0,9740 к 0,05 н.; расход его на титрование 25,75 мл. Вычислить процентное содержание NH3 в образце.
168
31. В результате анализа сульфата аммония на содержание азота получены следующие данные: навеска 1,8910 г; объем раствора НС1, взятый для поглощения NH3, 200,00 мл; Тнс1=0,008020; объем колбы, в которой разбавлен раствор после поглощения NH3, 1000 мл; титруемый объем 20,00 мл; расход раствора NaOH, которым ведется титрование, 21,22 мл; Ткаон = 0,0008000. Вычислить процентное содержание азота в образце.
32. Для определения азота в муке навеска 7,0200 г пшеничной муки обработана по Кьельдалю. Аммиак, получившийся из содержащегося в ней азота, поглощен 100,00 мл раствора H2SO4 (7h2so/koh = 0,02260). После поглощения NH3 раствор разведен в мерной колбе на 200 мл водой. 20,00 мл полученного раствора титруют 0,1020 н. КОН, которого расходуется 19,61 мл. Вычислить процентное содержание азота в муке.
33. Для определения содержания оксида цинка 2,000 г цинковых белил растворено в 100,00 мл H2SO4 (К= = 0,9820 к 0,5 н.). На титрование избытка кислоты расходуется 29,90 мл раствора щелочи (К— 1,280 к 0,1 н.). Вычислить процентное содержание ZnO в образце.
34. В 50,00 мл раствора НС1 (К= 1,250 к 0,1 н.) введен аммиак, полученный из 0,3967 г аммонийной соли. На титрование избытка НС1 потребовалось 15,20 мл раствора NaOH (/(=0,980 к 0,1 н.). Вычислить процентное содержание азота в соли.
35. Из 0,2229 г аммонийной соли отогнан аммиак в 100,00 мл раствора НС1 (/(=0,9658 к 0,1 н.). На титрование избытка кислоты израсходовано 51,19 мл раствора NaOH (/(=1,0720 к 0,1 н.). Вычислить процентное содержание NH3 в соли.
36. Азот, содержащийся в 0,8965 г удобрения, превращен в аммиак. NH3 отогнан в 100 мл раствора H2SO4 (/’=0,009185). На титрование избытка кислоты израсходовано 30,25 мл раствора NaOH (К= 1,200 к 0,2 н.). Вычислить процентное содержание азота в образце.
37. Навеска кальцита 0,8679 г растворена в 25,00 мл 0,7873 н. НС1, избыток которой потребовал на титрование 2,70 мл 0,8818 н. NaOH. Вычислить процентное содержание СаСО3 и СО2 в образце.
38. Навеска мрамора 0,5668 г растворена в 30,00 мл НС1 (Т=0,02871). На титрование избытка НС1 израсходовано 14,10 мл 0,8818 н. NaOH. Вычислить процентное содержание некарбонатных примесей в образце.
169
39. При анализе синтетической аммиачной воды получены следующие данные: масса пустой ампулы 0,4252 г; масса ампулы с образцом 1,6222 г; объем раствора H2SO4, взятый для поглощения NH3, 40,00 мл; концентрация его 1,004 н.; объем раствора NaOH, которым оттитрован избыток кислоты, 20,30 мл; концентрация его 0,9650 н. Вычислить процентное содержание NH3 в аммиачной воде.
40. Для анализа взято в ампуле 0,9654 г азотной кислоты. Ампулу разбивают в воде, в которую предварительно вводят 50,00 мл 0,8919 н. NaOH. На титрование избытка щелочи потребовалось 35,20 мл раствора НС1 (Т= = 0,03550). Вычислить процентное содержание HNO3 и N2O5 в образце.
41. Для анализа едкого натра, частично превратившегося под влиянием СО2 воздуха в соду, взято 0,9184 г образца и растворено в мерной колбе на 250 мл. На титрование 25,00 мл раствора в присутствии фенолфталеина расходуется 20,70 мл, а в присутствии метилового оранжевого— 21,48 мл 0,1042 н. НС1. Вычислить процентное содержание a) NaOH и б) ИагСОз в образце.
42. Навеска образца едкого натра 0,2298 г, частично превратившегося в соду, растворена в произвольном объеме воды и оттитрована соляной кислотой (К—0,897 к 0,2 н.). На это в присутствии фенолфталеина израсходовано 29,65 мл раствора НС1. В титруемый раствор добавлен метиловый оранжевый. Не доливая бюретки, раствор дотитрован до изменения его окраски, чему соответствует второй отсчет по бюретке 30,90 мл. Вычислить процентное содержание NaOH и ИагСОз в образце.
43. Навеска соды 0,1354 г, содержащей примесь дикарбоната натрия, растворена в воде и оттитрована 0,1028 н. НС1 до обесцвечивания прибавленного фенолфталеина. Этому соответствует первый отсчет по бюретке 10,25 мл. После дотитровывания раствора (без доливания бюретки) в присутствии метилового оранжевого сделан второй отсчет по бюретке 23,24 мл. Вычислить процентное содержание Na2CO3 и NaHCO3 в образце.
44. Навеска соды 1,0140 г, содержащей примесь дикарбоната натрия, растворена в мерной колбе на 200 мл. 20,00 мл раствора оттитровано с фенолфталеином. На это израсходовано 8,72 мл H2SO4 (7=0,004920). При дотит-ровывании того же раствора с метиловым оранжевым (без доливания бюретки) объем кислоты достиг 18,10 мл.
170
Вычислить процентное содержание ИагСОз и ИаНСОз в образце.
45. Навеска вещества 0,3106 г, содержащего ионы Na+ и СО в-, растворена в воде. Раствор имеет щелочную реакцию. На титрование раствора в присутствии фенолфталеина расходуется 26,20 мл, а в присутствии метилового оранжевого — 29,30 мл раствора H2SO4 (Т=0,0120). Вычислить процентное содержание веществ, содержащихся в навеске.
46. На титрование навески вещества 0,3667 г. содержащего ионы К+ и СОз~, обладающего щелочными свойствами, после растворения в воде было израсходовано фенолфталеина 21,15 мл, а в присутствии метилового оранжевого — 22,50 мл НС1 (/(=1,1150 к 0,2 н.). Вычислить процентное содержание главных составных частей в веществе.
47. На титрование щелочного раствора в присутствии фенолфталеина расходуется 7,52 мл, а в присутствии метилового оранжевого—18,25 мл раствора НС1 (/(= = 0,9560 к 0,2 н.). Какие компоненты и в каком количестве содержатся в растворе, если в нем, кроме ионов К+, других катионов не содержится и нет анионов, кроме СО1~?
48. Навеска вещества 0,2800 г, содержащего ионы К+ и СОз~ и обладающего щелочными свойствами, растворена в воде. На титрование полученного раствора в присутствии фенолфталеина расходуется 5,14 мл, а в присутствии метилового оранжевого — 21,45 мл раствора НС1 (/(=1,5210 к 0,1 н.). Вычислить процентное содержание главных компонентов в веществе.
49. Для анализа образца карбонатного вещества, не содержащего никаких катионов, кроме Na+, взято 0,5164 и растворено в произвольном объеме воды. При титровании раствора в присутствии фенолфталеина последний сразу обесцвечивается, а на титрование с метиловым оранжевым затрачивается 29,30 мл раствора НС1 (/(= 1,020 к 0,2 н.). Что представляет собой вещество? Вычислить процентное содержание основного продукта в нем.
50. Навеска неизвестного вещества 0,3810 г, содержащего только ионы калия и остатка угольной кислоты, растворена в воде. Полученный слабощелочной раствор титруется раствором НС1 (/( = 0,003780). При титровании
171
в присутствии фенолфталеина раствор обесцвечивается от прибавления первых капель кислоты, а на титрование в присутствии метилового оранжевого расходуется 32,40 мл. Что является основным продуктом в исследуемом веществе? Сколько процентов?
51. На титрование раствора 0,7092 г натриевого щелочного вещества в присутствии фенолфталеина расходуется 12,95 мл, а в присутствии метилового оранжевого— 26,02 мл 0,5100 н. H2SO4. Что является основным продуктом в исследуемом веществе? Сколько процентов?
52. Навеска щелочного калиевого вещества 0,2590 г, растворена в воде и оттитрована серной кислотой (Г= = 0,005142). На титрование в присутствии фенолфталеина затрачивается 14,86 мл, а в присутствии метилового оранжевого— 29,70 мл кислоты. Что является основным продуктом в анализируемом веществе? Сколько процентов?
53. Смесь серной и фосфорной кислот 5,00 мл помещена в мерную колбу на 250 мл. Колба заполняется водой до метки. На титрование 25,00 мл полученного раствора в присутствии метилового оранжевого расходуется 30,) 5 мл 0,08264 н. NaOH. При этом титровании нейтрализуется вся серная кислота, а фосфорная — до однозамещенной соли:
H2SO4 + 2NaOH = Na2SO4 + 2Н2О
Н3РО4 + NaOH = NaH2PO4 + Н2О
После дотитровывания раствора и прибавления фенолфталеина (без доливания бюретки) расход раствора NaOH достигает 44,90 мл. При дотитровывании однозамещенная соль превращается в двузамещенную:
NaH2PO4 + NaOH = Na2HPO4 + Н2О
Сколько граммов каждой из кислот в 1 л анализируемой смеси?
54. При анализе на содержание H2SO4 и Н3РО4 в их смеси получены следующие данные: объем смеси 10,00 мл; объем мерной колбы, в которой разведен образец, 500 мл; титруемый объем 20,00 мл; 7^аон = 0,003986; расход раствора NaOH в присутствии метилового оранжевого 18,45 мл; расход его в присутствии фенолфталеина 29,80 мл (сущность определения см. в задаче 53). Сколько граммов H2SO4 и Н3РО4 в 1 л смеси?
55. При получении фосфорной кислоты из фосфорита требуется избыток H2SO4, так как при недостатке ее об-172
разуется Са(Н2РО4)2. Контроль над процессом осуществляется определением в производственной жидкости H2SO4, Н3РО4 и Са(Н2РО4)2. При анализе образца этой жидкости получены следующие результаты: объем образца 5,00 мл; объем мерной колбы, в которой разбавлен образец, 200 мл; титруемый объем 20,00 мл; концентрация рабочего раствора КОН 0,1000 н.; расход его при титровании с метиловым оранжевым 10,00 мл, а с фенолфталеином— 21,40 мл. Какие компоненты находятся в смеси: H2SO4 с Н3РО4 или Н3РО4 с Са(Н2РО4)2? Сколько граммов каждого компонента в 1 л анализируемого раствора, если при определении мегут протекать реакции, аналогичные приведенным в задаче 53?
56. Анализируют ту же жидкость, что указана в задаче 55. Объем образца 5,00 мл; объем мерной колбы для разбавления образца 250 мл; титруемый объем 25,00 мл; Лкон=0,9789 к 0,1 н., расход его при титровании с метиловым оранжевым 21,40 мл, а при титровании с фенолфталеином— 34,60 мл. Какие компоненты содержатся в смеси: Н3РО4 с H2SO4 или Н3РО4 с Са(Н2РО4)2? Сколько граммов каждого компонента в 1 л анализируемого раствора?
57. Карбонатная жесткость воды определяется на основании следующих химических реакций:
Са (НСО3)2 + 2НС1 = СаС12 + 2СО2 + 2Н2О
Mg (НСО3)2 + 2НС1 = MgCl2 + 2СО2 + 2Н2О
При определении карбонатной жесткости взято 100,00 мл воды, на титрование которых израсходовано 2,44 мл 0,1103 н. НС1. Выразить жесткость образца: а) в мг-экв/л и б) в немецких градусах (1°=1 мг СаО в 100 мл воды).
58. На титрование 200,00 мл воды израсходовано 2,60 мл раствора НС1 (Т = 0,004023). Определить карбонатную жесткость воды, выразив ее: а) в мг-экв/л и б) в немецких градусах жесткости (см. задачу 57).
59. Для анализа воды на карбонатную жесткость взято 200,00 мл, которые требуют для титрования 3,84 мл НС1 (7'== 0,004102). Определить жесткость образца, выразив ее: а) в мг-экв/л и б) во французских градусах (1°= 1 мг СаСОз В 100 мл).
60. Анализируют воду на жесткость. Объем воды 100,00 мл; Ана=0,9968 к 0,1 н.; объем раствора НС1 на
173
титрование 1,20 мл. Определить карбонатную жесткость образца, выразив ее: а) в мг-экв/л и б) в английских градусах жесткости (Г=1 мг СаСОз в 70 мл).
61. Определяют общую жесткость промышленной воды. 100,00 мл ее после переведения карбонатной жесткости в некарбонатную обработано 25,00 мл щелочной смеси (Ыа2СОз + МаОН), общая нормальность которой 0,0965. В результате ионы Са2+ и Mg2+ перешли в осадок в виде СаСОз и Mg(OH)2. Раствор вместе с осадком количественно переведен в мерную колбу на 200 мл и доведен водой до метки. На титрование избытка щелочной смеси в 100 мл отфильтрованного раствора расходуется 5,85 мл 0,1020 н. НС1. Определить общую жесткость воды, выразив ее: а) в мг-экв/л и б) в немецких градусах жесткости (см. задачу 57).
62. Анализируют воду на жесткость. Объем воды 100 мл; объем раствора НО, израсходованный на титрование карбонатной жесткости и переведение ее в некарбонатную, 1,08 мл; объем щелочной смеси, взятый для осаждения ионов Са2+ и Mg2+, 25,00 мл; объем мерной колбы, в которую переведен раствор с осадком, 250 мл; объем фильтрата, взятый для титрования избытка щелочной смеси, 100,00 мл; объем раствора НС1, израсходованный на титрование избытка, 5,13 мл; Кна= 1,103 к 0,1 н.; Ащел.смеси=0,7625 к 0,1 н. Определить: а) карбонатную жесткость; б) общую жесткость и в) некарбонатную жесткость, выразив их в немецких градусах (см. задачу 57).
63. В 200 мл воды содержится 4,28 мг ионов Са2+ и 2,13 мг ионов Mg2+. Определить общую жесткость воды, выразив ее в: а) мг-экв/л; б) немецких; в) французских и г) английских градусах (см. задачи 57—60).
64. Вода насыщена карбонатом магния. Определить жесткость, выразив ее в: а) мг-экв/л; б) немецких, в) французских и г) английских градусах жесткости.
65. В производстве соды аммиачным способом, анализируя производственную жидкость, определяют свободный аммиак [в NH4OH и (NH4)2CO3], связанный (в солях других кислот) и общий. Свободный аммиак определяют прямым титрованием кислотой, в результате чего он превращается в связанный. Общий аммиак определяют из солей аммония формальдегидным методом:
4NH4C1 + 6НСНО = (CH2)6N4 + 4НС1 + 6Н2О
174
Выделившуюся в результате реакции кислоту, количество которой эквивалентно прореагировавшему аммиаку, титруют раствором щелочи. При определении NH3 указанным методом получены следующие данные: объем образца 10,00 мл; объем кислоты на титрование 12,15 мл; концентрация раствора кислоты 0,9659 и.; объем раствора щелочи на титрование кислоты, выделившейся в результате реакции, 45,60 мл; концентрация раствора щелочи 0,9890 н. Определить количество граммов аммиака, содержащегося в 1 л образца: а) свободного; б) общего и в) связанного.
66. Для определения аммиака в производственной жидкости взято 15,00 мл образца. На его титрование израсходовано 14,80 мл раствора НС1 (7=0,03672). На титрование кислоты, выделившейся из оттитрованного раствора после обработки его формальдегидом, израсходовано 48,50 мл раствора щелочи, концентрация которой 1,012 н. Определить массу связанного аммиака в 1 л анализируемой жидкости.
Глава VI
МЕТОД ОСАЖДЕНИЯ
И КОМПЛЕКСООБРАЗОВАНИЯ
А. ПРЕДВАРИТЕЛЬНЫЕ РАСЧЕТЫ И РАСЧЕТЫ ПО УСТАНОВКЕ ТИТРОВ РАБОЧИХ РАСТВОРОВ
Задачи
1. Сколько граммов нитрата серебра требуется для приготовления 250 мл ~0,05 н. раствора?
2. Сколько граммов нитрата серебра требуется для приготовления 1,5 л 0,1 н. раствора?
3. Сколько граммов серебра (х. ч.) следует взять для приготовления 200 мл раствора, необходимого для установки титра — 0,1 н. NH4SCN?
4. Сколько граммов серебра, содержащего 3,98% примесей, следует взять для приготовления 250 мл точно 0,025 н. раствора?
5. Какую навеску КС1 (х. ч.) следует взять, чтобы приготовить раствор, необходимый для установки титра ~0,1 н. AgNO3, пользуясь мерной колбой на 500 мл?
6. Рассчитать навеску NaCl (х. ч.) на 250 мл ~0,05н. раствора, необходимого для установки титра раствора нитрата серебра.
7. Рассчитать навеску NaCl (х. ч.), необходимую для установки титра ——0,1 н. AgNO3 методом отдельных навесок, пользуясь бюреткой на 50 мл.
8. Какую навеску NaCl (х. ч.) следует взять для установки титра ~0,05 н. AgNO3, чтобы на титрование полученного из нее раствора уходило не больше 25 мл?
9. Сколько граммов роданида аммония потребуется для приготовления 0,5 л —0,1 и. раствора?
10. Сколько граммов роданида аммония потребуется для приготовления 750 мл ~ 0,05 н. раствора?
11. Навеска КС1 (х. ч.) 1,4960 г растворена в мерной колбе на 200 мл. Сколько миллилитров 0,100 н. AgNO3 израсходуется на титрование 20,00 мл раствора КС1?
12. Из 0,8142 г NaCl (х. ч.) приготовлено 250 мл раствора. Сколько миллилитров 0,0500 н. AgNO3 израсходуется на титрование 25 мл раствора NaCl?
176
13. Сколько миллилитров 0,05 н. AgNO3 пойдет на титрование 20,00 мл раствора, полученного растворением 0,1052 г NaCl (х. ч.) в воде?
14. Взято 0,3782 г КС1 (х. ч.). Можно или нельзя использовать эту навеску для установления титра 0,1 н. AgNO3 методом отдельных навесок, пользуясь бюреткой на 50 мл?
15. Сколько миллилитров раствора AgNO3 (Т= — 0,01760) израсходуется на титрование 25,00 мл раствора, полученного растворением 1,1820 г NaCl (х. ч.) в мерной колбе на 250 мл?
16. Сколько миллилитров раствора AgNO3 (7A„N0/A„ = 0,005040) пойдет на титрование 20,00 мл раствора, полученного растворением 0,1000 г КС1 (х. ч.) в мерной колбе на 250 мл?
17. Сколько миллилитров раствора AgNO3 (7’AgNO3/Ag = 0,005000) израсходуется на титрование
25,00 мл раствора NaCl (Т = 0,005000)? Оба титра выражаются одним и тем же числом.
18. К раствору, полученному растворением 0,2130 г КС1, прибавлен хромат калия и 30,00 мл раствора AgNO3 (А= 1,060 к 0,1 н.). Какой цвет имеет содержимое колбы?
19. Имеются растворы КС1 и NaCl с одинаковыми титрами. На титрование какого из них (при равных объемах) расходуется больше одного и того же раствора AgNO3? Во сколько раз?
20. Растворы КС1 и AgNO3 имеют одинаковые титры. В каком соотношении находятся их объемы в точке эквивалентности?
21. Рассчитать навеску поваренной соли, содержащей ~80% NaCl, необходимую для анализа на содержание хлора, если объем мерной колбы 500 мл, а раствор AgNO3 0,05 н.
22. Какую навеску хлорида аммония, содержащего ~50% хлора, следует взять для анализа на содержание хлора, пользуясь ~0,1 н. AgNO3 и мерной колбой на 250 мл?
23. Какую навеску нитрата натрия, содержащего ~1,5% хлора, следует взять для анализа на содержание хлора (условия см. в задаче 21)?
24. Рассчитать навеску хлорида бария, содержащего '"'30% хлора, для анализа на содержание хлора (условия указаны в задаче 22).
177
25. Рассчитать навеску карналлита, содержащего ~40% хлора, необходимую для анализа на содержание хлора, методом отдельных навесок, пользуясь 0,1 н. AgNO3 и бюреткой на 50 мл.
26. Сколько граммов нашатыря, содержащего ~60% хлора, следует взять чтобы на титрование расходовалось 25 мл 0,05 н. AgNO3?
27. Сколько граммов поваренной соли, содержащей 15%влаги, следует взять, чтобы на титрование полученного из нее раствора расходовалось около половины бюретки (емкость 25 мл) раствора AgNO3 (7=0,01425)?
28. Какую навеску карналлита, содержащего ~10% свободной влаги, следует взять для анализа на содержание хлора методом отдельных навесок, имея 0,2 н. AgNO3 и бюретку на 25 мл?
29. Из навески NaCl (х. ч.) приготовлен раствор в колбе на 500 мл. К 25 мл раствора прилито 50 мл 0,1 н. AgNO3. На титрование избытка AgNO3 израсходовано 25 мл. 0,1 н. NH4SCN. Какая взята была навеска?
30. Из навески NH4C1 (х. ч.) приготовлен раствор в мерной колбе на 200 мл и к 20 мл полученного раствора прилито 40 мл 0,05 н. AgNO3. На титрование избытка AgNO3 израсходовано 12,50 мл 0,1 н. NH4SCN. Какова была навеска?
31. Навеска КО (х. ч.) 0,9330 растворена в колбе на 250 мл. Сколько миллилитров 0,1 н. AgNO3 следует взять для осаждения хлора из 25,00 мл полученного раствора, чтобы на титрование избытка AgNO3 затрачивалось 25,00 мл 0,05 н. NH4SCN?
32. Навеска NaCl (х. ч.) 3,00 г растворена в мерной колбе на 500 мл. Каким объемом 0,100 н. AgNO3 следует обработать 20,00 мл полученного раствора, чтобы на титрование избытка серебра расходовалось 25,0 мл 0,0500 н. NH4SCN.
33. Навеска хлорида аммония (х. ч.), но содержащего 15% свободной влаги, растворена в воде. К раствору прилито 50,00 мл раствора AgNO3 (7=0,0338). На титрование избытка AgNO3 израсходовано 25,00 мл 0,05 н. NH4SCN. Рассчитать навеску.
34. Рассчитать навеску карналлита для анализа на содержание хлора, чтобы после растворения ее и осаждения 20,00 мл 0,1 н. AgNO3 потребовалось на титро-178
вание избытка серебра 25,00 мл раствора NH4SCN (Г=0,003808)?
35. Сколько граммов сплава, содержащего 84% серебра, требуется растворить в азотной кислоте, чтобы после разбавления полученного раствора водой в мерной колбе емкостью 200 мл на титрование 25,00 мл этого раствора расходовалось столько же миллилитров 0,1 н. NH4SCN?
36. Сколько граммов чистого серебра следует растворить в азотной кислоте и разбавить в мерной колбе емкостью 100 мл, чтобы на титрование 20,00 мл полученного раствора расходовалось столько же миллилитров раствора NH4SCN (Т= 0,00400)?
37. Сколько граммов сплава, содержащего 90% Ag, следует растворить, чтобы на титрование полученного раствора расходовалось не менее 25 и не более 50 мл 0,1 н. NH4SCN?
38. В каких пределах нужно взять навеску Ag (х. ч.), чтобы после растворения ее в азотной кислоте и разведения водой на титрование полученного раствора расходовалось не менее 12 и не более 25 мл раствора роданида аммония (7’=0,0080)?
39. Какой титр должен иметь раствор NH4SCN, чтобы 25,00 мл его оттитровывали такой же объем раствора, полученного растворением 2,6970 г Ag (х. ч.) в азотной кислоте и разведением в колбе на 250 мл?
40. Какую нормальность должен иметь раствор роданида аммония, чтобы 20,00 мл его оттитровывали раствор, полученный растворением 0,2100 г сплава, содержащего 84% Ag?
41. Навеска NaCl (х. ч.) 2,9010 г растворена в мерной колбе на 1000 мл. На 25,00 мл этого раствора расходуется 25,80 мл устанавливаемого раствора AgNO3. Определить: а) нормальность раствора AgNO3; б) KAgNO3 и в) титр раствора AgNO3.
42. Навеска КС1 (х. ч.) 3,8460 г растворена в колбе на 500 мл. На титрование 20,00 мл этого раствора расходуется 18,40 мл устанавливаемого раствора серебра. Определить: а) нормальность раствора AgNO3; б) KAgNO3 И В) 7’AgNO3/Ag.
43. На титрование раствора, приготовленного растворением 0,1020 г NaCl, расходуется 38,40 мл устанавливаемого раствора AgNOj. Определить: а) нормальность раствора AgNO3; б) KAgNO3 и в) TAgNO/ci.
179
44. Навеска КО (х. ч.) 0,1560 г растворена и оттитрована раствором AgNO3, которого расходуется 41,20 мл. Определить: а) нормальность раствора AgNO3; б) KAgNO3 и в) Т’л^ХО./Вг-
45. На титрование 25,00 мл раствора хлорида натрия (TNaci/a=0,001890) расходуется 24,30 мл раствора AgNO3. Определить: а) нормальность раствора AgNO3; б) KAgNOj и в) 7AgNO/NH4SCN.
46. На титрование раствора, полученного растворением 0,1204 г NaCl, расходуется 21,12 мл раствора AgNO3. Определить: a) Takno/i; б) нормальность раствора AgNO3 И в) KAgNO3.
47. Навеска NaCl (х. ч.) 0,1740 г после растворения оттитрована 30,22 мл раствора AgNO3. На титрование 20,00 мл раствора AgNO3 требуется 19,85 мл раствора NH4SCN. Определить: а) нормальность раствора NH4SCN; б) T’NH.SCN/Ag-
48. На титрование навески 0,1220 г КС1 после ее растворения расходуется 35,40 мл раствора AgNO3, 25,00 мл которого требуют для титрования 26,60 мл раствора NH4SCN. Определить 7nh,scn.
49. Навеска NaCl (х. ч.) 0,1810 г растворена и оттитрована 30,65 мл раствора AgNO3. На титрование 25,00 мл последнего расходуется 24,20 мл раствора NH4SCN. Определить титр и нормальность раствора роданида аммония.
50. На титрование раствора, полученного растворением 0,3142 г КС1 (х. ч.), расходуется 38,75 мл раствора AgNO3, 20,00 мл которого эквивалентны 18,80 мл раствора роданида аммония. Определить нормальность и титр последнего.
Б. РАСЧЕТЫ РЕЗУЛЬТАТОВ АНАЛИЗА ПО ДАННЫМ ПРЯМОГО И ОБРАТНОГО ТИТРОВАНИЯ
Задачи
1. Для анализа на содержание хлора 1,4265 г хлорида растворено в колбе на 250 мл. На титрование 20,00 мл раствора расходуется 19,95 мл 0,1055 н. AgNO3. Вычислить процентное содержание хлора в образце.
2. Навеска смеси хлорида и нитрата натрия 0,8180 г растворена в мерной колбе на 200 мл. На титрование 20,00 мл этого раствора расходуется 18,35 мл раствора 180
AgNO3 (TAgNO3/Kci=0,003442). Вычислить процентное содержание NaCl в образце.
3. Навеска NaCl 2,4080 г растворена в мерной колбе на 500 мл. На титрование 25,00 мл полученного раствора расходуется 20,35 мл раствора AgNO3 (7<=0,9860 к 0,1 н.). Вычислить процентное содержание хлора в образце.
4. Навеска ВаС12-2Н2О 6,7000 г растворена в мерной колбе на 1000 мл. На титрование 25,00 мл этого раствора расходуется 28,95 мл раствора AgNO3 (TAgNo3/Ag = = 0,005120). Вычислить процентное содержание хлора в образце.
5. Для анализа образца рассола 10,0 мл его разбавлено в колбе на 500 мл. На титрование 25,00 мл полученного раствора расходуется 24,42 мл раствора AgNO3 (А = 0,9245 к 0,1 н.). Сколько граммов NaCl в 1 л образца?
6. Сколько граммов НС1 в 1 л раствора НС1, если 25,00 мл соляной кислоты нейтрализовано и разбавлено водой в мерной колбе на 250 мл. На титрование 20,00 мл полученного раствора расходуется 24,37 мл 0,9850 н. AgNO3.
7. Навеска серебряного сплава 1,7450 г растворена в азотной кислоте. Раствор разбавлен водой в колбе на 200 мл. На титрование 10,00 мл полученного раствора расходуется 11,75 мл раствора роданида аммония (А= = 0,9344 к 0,05 н.). Вычислить процентное содержание серебра в сплаве.
8. Из 1,5150 г соли серебра приготовлено 250 мл раствора. На титрование 15,00 мл полученного раствора расходуется 11,25 мл раствора роданида аммония (7’nh1scn = = 0,003568). Вычислить процентное содержание AgNO3 в образце.
9. На титрование раствора, приготовленного растворением 0,0973 г хлорида в произвольном объеме воды, расходуется 28,60 мл раствора AgNO3 (А=0,9120 к 0,05 н.). Вычислить процентное содержание хлора в образце.
1. 0. Для определения содержания основного продукта в бромиде калия 0,3038 г его растворено в воде. Полученный раствор оттитрован 23,80 мл раствора AgNO3 (7’AgNO3/ci=0,003546). Вычислить процентное содержание КВг в образце.
11. На титрование раствора, полученного растворением 0,2122 г серебряного сплава, расходуется 32,40 мл
181
раствора роданида аммония (К— 1,0200 к 0,05 н.). Вычислить процентное содержание Ag в сплаве.
12. При определении содержания серебра в сплаве 0,1900 г его растворено и оттитровано 0,0500 н. NH4SCN, которого на это потребовалось 21,12 мл. Вычислить процентное содержание серебра в сплаве.
13. Для анализа цинковой руды на содержание цинка навеска 3,1540 г растворена и разбавлена в мерной колбе на 250 мл. На титрование 20,00 мл полученного раствора после обработки расходуется 4,90 мл раствора гексацианоферрата (II) калия (T'kj[Fe(CN)e]/zno = 0,01285.) Вычислить процентное содержание Zn в образце.
14. Для анализа на содержание цинка взято 0,2775 г цинковой соли. На ее титрование после обработки расходуется 6,48 мл раствора гексацианоферрата (II) калия (7,K4/Fe(CN)6=0,03876). Вычислить процентное содержание Zn в пересчете на ZnO в образце.
15. Навеска хлорида 1,4790 г растворена в колбе на 250 мл. 25,00 мл полученного раствора обработаны 50,00мл раствора AgNO3 (К=0,9580 к 0,1 н.). На титрование избытка серебра расходуется 25,50 мл раствора роданида аммония (К= 1,1200 к 0,1 н.). Вычислить процентное содержание хлора в хлориде. Какой катион в молекуле хлорида?
16. Для анализа хлорида калия на степень чистоты 3,0360 г его растворено в мерной колбе емкостью 500 мл. К 25,00 мл полученного раствора прибавлено 50,00 мл 0,0847 н. AgNO3. На титрование избытка AgNO3 расходуется 20,68 мл раствора NH4SCN (TNH4scN/Ag=0,01165). Вычислить процентное содержание хлорида калия в образце.
17. На титрование раствора, полученного растворением 0,1160 г поваренной соли и обработкой его 40,00 мл 0,09540 н. AgNO3, расходуется 19,35 мл раствора роданида аммония (К= 1,0500 к 0,1 н.). Вычислить процентное содержание NaCl в образце.
18. Навеска смеси хлористых солей 0,1730 г растворена и обработана 50,00 мл раствора AgNO3 (7=0,01721). На титрование избытка серебра расходуется 56,40 мл раствора роданида аммония (К=0,8532 к 0,05 н.). Вычислить процентное содержание хлора в смеси.
19. Для определения примеси серной кислоты в веществе 3,9770 г его растворено в мерной колбе на 250 мл. 25,00 мл этого раствора осаждено 25,00 мл раствора хло-182
рида бария. На титрование избытка ВаС12 израсходовано 32,25 мл раствора К2Сг2О7 (7=0,01252). Вычислить процентное содержание H2SO4 в образце, если известно, что 20,00 мл раствора ВаС12 эквивалентны 26,63 мл раствора дихромата калия.
20. Навеска сульфосоединения 4,1650 г растворена в воде и объем раствора доведен в мерной колбе до 250 мл. Взятые отсюда 20,00 мл обработаны 20,00 мл раствора ВаС12. Избыток ионов Ва2+ оттитрован 24,20 мл 0,02677 н. (как окислителя) КгСггО?. Отдельным титрованием установлено, что 1,00 мл раствора ВаС12 эквивалентен 1,27 мл раствора дихромата калия. Вычислить процентное содержание свободной серной кислоты в образце.
21. Для определения степени чистоты бромида натрия 0,2058 г его растворено в воде. Раствор обработан 40,00 мл раствора AgNO3, концентрация которого 0,0998 н. На обратное титрование избытка серебра израсходовано 21,20 мл раствора роданида аммония. Вычис; лить процентное содержание примесей в образце, если известно, что 1,00 мл раствора AgNO3 эквивалентен 1,06 мл раствора NH4SCN.
22. Для анализа соды на содержание NaCl навеска 2,1010 г растворена, подкислена азотной кислотой и обработана 5,00 мл раствора AgNO3 (К= 1,0220 к 0,1 н.). На титрование избытка AgNO3 израсходовано 2,40 мл раствора роданида аммония (7 = 0,007598). Вычислить процентное содержание NaCl в образце.
23. При анализе производственной жидкости из карбонизационной колонны содового производства на содержание иона С1~ взята проба 10,00 мл и разбавлена водой в колбе на 500 мл. Для анализа взято 10,00 мл полученного раствора, подкислено HNO3 и обработано 20,00 мл 0,09854 н. AgNO3. На титрование избытка AgNO3 израсходовано 15,20 мл раствора роданида аммония (7NH4scN/AgNO3=0,01699). Сколько граммов иона С1~ в 1 л образца?
24. В производстве соды применяется почти насыщенный раствор поваренной соли, который анализируется на содержание иона С1~. Для анализа 5,00 мл соляного рассола разбавлено водой в мерной колбе на 200 мл. Из этого раствора взято 20,00 мл, подкислено HNO3 и обработано 30,00 мл раствора AgNO3 (7=0,01679). На титрование избытка серебра израсходовано 9,86 мл раствора роданида аммония. Отдельным титрованием установлено,
183
что 1,00 мл роданида аммония эквивалентен 0,94 мл раствора AgNO3. Определить содержание (в г/л): а) иона СК и б) NaCl в образце.
25. Навеска каменной соли 3,2680 г растворена в колбе на 250 мл. 10,00 мл полученного раствора обработано 20,00 мл раствора AgNO3 (/<=1,0040 к 0,1 н.). На обратное титрование избытка серебра израсходовано 2,12 мл 0,09950 н. NH4SCN. Вычислить процентное содержание: а) иона С1_ и б) NaCl в образце.
26. Для анализа на содержание ZnO взято 0,1624 г цинковых белил. Раствор, полученный растворением навески, после обработки оттитрован с явным избытком 22,40 мл раствора феррицианида калия. На обратное титрование избытка феррицианида калия израсходовано 2,82 мл раствора ZnSO4. Вычислить процентное содержание ZnO в образце, если 7K4[Fe(CN),]/zn=0,006517, а 1,00 мл раствора гексацианоферрата (II) калия эквивалентен 1,08 мл раствора ZnSO4.
В. РАСЧЕТЫ РЕЗУЛЬТАТОВ
КОМПЛЕКСОНОМЕТРИЧЕСКИХ ОПРЕДЕЛЕНИЙ
Для титрометрических определений можно с успехом применять некоторые органические соединения, образующие с рядом ионов прочные комплексные соединения. Такие вещества получили название комплексонов, а метод, основанный на применении приготовленных из них рабочих растворов, называют комплексометрическим, или комплексонометрическим. Этот метод прочно вошел .в аналитическую практику заводских химических лабораторий. Комплексонами называется группа а-аминокис-лот, в молекулах которых атом азота связан с метилкарбоксильными группами. Для титриметрических определений широко применяется двунатриевая соль этилен-диаминтетрауксусной кислоты, известная в литературе под различными названиями: трилон Б, ЭДТА, хела-тон III, комплексон III, титриплекс III, версен и др. Наиболее употребительны первое и второе названия. Молекула этого соединения имеет строение
НООСН2С\ /CH2COONa
NaOOCH2C/N 2 2 \СН2СООН 2
Ионы многих металлов образуют с трилоном Б прочные внутрикомплексные соединения:
184
--ООСН2С\ /СН2 - Н2С\ /СН2СООМа
NaOOCH2C/N'^ у \CH2COO=i
\Ме2+/I
Грамм-эквивалент трилона Б равен половине его молекулярной массы. Применяемая обычно концентрация — 0,1 или 0,05 и. Титриметрический метод, основанный на применении этого вещества в качестве рабочего раствора, часто называют трилонометрическим.
В качестве индикатора в трилонометрии употребляют различные вещества в зависимости от определяемого иона. При определении кальция (а также Ni, Со, Си) хорошие результаты дает мурексид CnIIsOeNg-Н2О— аммонийная соль пурпуровой кислоты. При определении магния применяют эриохром черный Т (хромоген специальный ET00). Применяются и другие индикаторы.
Рабочий раствор трилона Б обычно предварительно устанавливают по приготовленному раствору соли определяемого катиона, строго выдерживая идентичность всех условий, в которых будет происходит определение (концентрация растворов, количество вводимого индикатора, pH раствора). Расчеты результатов тригонометрических определений ничем не отличаются от применяемых во всех титриметрических методах и описанных ранее.
Задачи
1. Сколько граммов трилона Б потребуется для приготовления 250 мл 0,05 н. раствора?
2. Рассчитать навеску для приготовления 2,5 л ~0,1 н. рабочего раствора трилона Б.
3. Сколько граммов трилона Б пойдет на приготовление 250 мл рабочего раствора, предназначенного для определения кальция в растворе, содержащем его ~ 1 г/л?
4. Сколько граммов трилона Б нужно взять для приготовления 200 мл раствора, которым определяют магний в минерале, содержащем его около 15%. Учесть, что 1 г образца растворен и раствор после отделения мешающих компонентов разбавлен водой в мерной колбе на 500 мл.
5. Чтобы установить рабочий раствор трилона Б, 1,3250 г высушенного СаСОз (х. ч.) растворено в мерной колбе на 250 мл. На титрование 25,00 мл этого раствора (после соответствующей обработки и разбавления) из
185
расходовало 26,47 мл устанавливаемого раствора. Определить его нормальность и титр по Са.
6. На титрование 20,00 мл раствора, приготовленного из 1,5250 г безводного MgSO4 (х. ч.) в мерной колбе на 500 мл, расходуется 19,55 мл устанавливаемого раствора трилона Б. Определить его нормальность и титр по Mg.
7. Для определения общей жесткости воды готовят 0,05 н. раствор трилона Б, устанавливаемый по стандартному раствору, в котором [Са]: [Mg] = 3 : 1. Этот раствор готовят следующим образом. Навески химически чистых СаСО3 и MgSO4 (безводного) растворяют порознь в мерных колбах на 500 мл. Затем в колбу на 250 мл вводят 75 мл первого раствора (содержащего Са2+), 25 мл второго и доливают дважды перегнанную дистиллированную воду до метки. Рассчитать навески СаСО3 и MgSO4, которые следует взять для этой цели.
8. Определить нормальность стандартного раствора, полученного растворением в мерных колбах на 500 мл 3,0000 г MgSO4 (безводного) и 2,5000 г СаСО3, если затем 25 мл первого раствора смешать в мерной колбе на 200 мл с 75 мл второго и долить водой до метки.
9. Растворено 2,0250 г доломита. Раствор после отделения нерастворимого остатка и полуторных оксидов помещен в мерную колбу на 500 мл и разбавлен водой до метки. На титрование 25,00 мл этого раствора после разбавления водой и соответствующей обработки — нейтрализации, введения индикатора и буферного раствора — расходуется 20,20 мл 0,1025 и. раствора трилона Б. Из той же колбы взято 100,0 мл раствора и в нем количественно осажден Са2+, а фильтрат (после соответствующей обработки) оттитрован тем же рабочим раствором трилона Б. Его на это израсходовано 38,50 мл. Вычислить процентное содержание СаО и MgO в образце.
10. Для трилонометрического определения кальция и магния 2,0850 г минерала после выполнения необходимых операций для отделения мешающих определению составных частей растворено и разбавлено водой до метки в мерной колбе на 250 мл. Из этого раствора в титровальные колбы взяты две аликвотные части — 25,00 и 100,0 мл. На титрование первой (в надлежащих условиях) израсходовано 11,20 мл 0,05240 н. рабочего раствора трилона Б, а на титрование второй (после количественного отделения Са2+) израсходовано 21,65 мл. Вычислить процентное содержание Са и Mg в образце.
Ответы
Введение
1. б, г, д точные, остальные приближенные. 2. Точное число — валентность. 3. Точное число (в), остальные приближенные. 4. Точные числа а и г; бив приближенные. 5. 8 г; 8,00 г; 8,0000 г. 6. 10 мл; 10,0 мл; 10,00 мл. 7. 25,935; 25,94; 25,9; 26. 8. 0,9972 кг; 0,997 кг; 1,0 кг. 9. а) 6 значащих цифр и 4 десятичных знака; б) 2 значащие цифры и 4 десятичных знака; в) 4 или 6 значащих цифр (в зависимости от точности числа) и 3 десятичных знака. 10. а) одна значащая цифра, десятичных знаков нет; б) 4 значащие цифры и 4 десятичных знака; в) 2 значащие цифры и 4 десятичных знака; г) 4 значащие цифры и 3 десятичных знака. 11. 1,7 г; 1,6667 г. 12. 8,3 см. 15. 3,1 г. 16. 2480,7. 17. 0,15. 18. 12,2%.
„ 0,98-24-56-500 „ 258-0,001.18-0,45
19. —--------------30. 20. --------’-------’— 0,77.
25-1000-0,9 300-0,0091
21. 0,5314. 22. 0,053358. 23. а) Логарифмическая линейка; б) четырехзначные таблицы логарифмов. 24. а) Логарифмическая линейка; б) пятизначные таблицы логарифмов. 25. 0,0029 моль безводной соли. 26. 1-Ю22. 27. а) ~6%; б) 5,687%. 28. а) 36%; б) 36,077%.
Глава I
А. Способы выражения концентрации растворов
1. 60 г. 2. 160 г. 3. 15%. 4. 13%. 5. 9,6%. 6. 12,9%. 7. 228 г. 8. 56 мл. 9. 235 г. 10. 83 г; 417 г. И. 154,6 г. 12. 93 г. 13. 6,3 г. 14. 80,9 г. 15. 14 г; 236 г. 16. 263 г. 17. 13,95 г. 18. 0,45 г; 0,94 г; 1,76 г. 19. 0,17%. 20. 34,8%. 21. 0,39%. 22. 10,2%. 23. ~14%. 24. 9,1%. 25. 8,5%. 26. 9,1%. 27. 11,8%. 28. 20%. 29. а) 49,04; б) 98,08; в) 49,04; 16,34; 12,26; 30. а) 63,01; б) 63,01; 21,01; 7,88. 31. а) 17,05; б) 17,05; 5,68; 4,26. 32. а) 32,03; б) 32,03; в) 16,02. 33. а) 158,04 г; б) 158,04 г; 52,68 г; 31,61 г. 34. а) 97,11; б) 64,74. 35. а) 482,19 г; б) 160,73 г; в) 120,55 г. 36. а) 54,07 г; б) 162,21 г. 37. а) 147,10 г; б) 49,03 г. 38. а) 139,01 г; б) 278,02 г. 39. а) 196,07; б) 196,07; в) 392,14. 40. 1/2 М; 1/6 М; 1/2 М; 1/6 М. 41. 63,03; 63,03. 42. а) 94,80 г; б) 94,80 г. 43. 0,0500 М; 0,100 н. 44. а) 0,2000 М; б) 0,6000 н.; 0,4000 и.; 0,2000 н. 45. 0,125 М; 0,250 н. 46. 0,200 М; 0,400 н. 47. а) 2,33 М; 4,65 н.; б) 8,75 М и н.; в) 4,34 Мин. 48. а) 35,94 н.; б) 14,88 н.; в) 12,39 н. 49. 12,82 н. 50. а) 2,02 М;
187
б) 6,06 н.; 4,04 н.; 2,02 н. 51. 0,004904 г. 52. 0,0365 г. 53. 0,125 г. 54. 0,00072 г. 55. 46 мг. 56. 17,7 мг. 57. 28,4%. 58. 19,9%. 59. а) 25%;
б) 31,8%; в) 34,5%. 60. 6,02%; 0,63 М. 61. 2,0 г. 62. 2,65 г. 63. 2,38 г.
64. 240 г. 65. 22,4 л. 66. 280 мл. 67. 0,1 М; —0,2 н. 68. 1,6 М; 3,2 н.
69. 101 г. 70. 168 г. 71. 564,4 г. 72. 5,63 г. 73. 144 мл. 74. 114 мл.
75. 334 мл. 76. 78 мл. 77. 84 мл. 78. 84 мл. 79. 6,4 л. 80. 1,8 л. 81. 404 мл. 82. 840,7 мл. 83. а) 711 г; б) 237 г; в) 178 г. 84. а) 196 г; б) 196 г; в) 98 г. 85. а) 79 г; б) 26 г; в) 16 г. 86. а) 73,6 г; б) 24,5 г. 87. а) 0,05 н.; 0,15 н.; 0,2 н.; б) 0,05 н. 88. а) 2 н.; б) 6 н.; в) 16 н. 89. 0,0147 моль/л. 90. 9,9-10-° моль/л. 91. 1,05-IO-5 М. 92. 1,5-10“4М. 93. 3,6-10-2 М; 1,1-10-‘ М; 6,2-10“4 М; 5-10"7 М. 94. 1-10-° М; 1,2-10-4 М; 1-Ю-8 М; 95. 0,25 н.; 0,1 и. 96. 0,33 н.; 0,17 н.; 0,10 н. 97. 0,42 М; 0,083 М. 98. 0,24 М; 0,16 М. 99. 7,3-10~3 г-нон/л; 5-10~2 г-нон/л. 100. 0,012 г-ион/л; 0,0098 г-ион/л. 101. 5:23 или 1 : 4,6. 102. 5 : 14 или 1 : 2,8. 103. 2 : 1. 104. 7 : 5. 105. 263 г, 96% и 737 г, 20%. 106. 400 г и 1600 г. 107. 231 г и 769 г. 108. 1 кг и 3 кг. 109. 667 г. 110. Прибавить 300 г 10%-ной кислоты. 111. 501 и 102 мл. 112. 1435 мл и 83 мл. 113. 12:50. 114. 3:2. 115. 444 и 556 г. 116. 3 кг Н2О и 2 кг NH3. 117. 600 г. 118. 116 г. 119. 3 л. 120. 78,9 г. 121. 346 мл. 122. 1321 мл. 123. 888 мл Н2О и 119 мл 60 %-ной кислоты. 124. Смешать 3 кг кислоты и 7 л воды. 125. Растворить 76,2 г кислоты в 167,6 г Н2О. 126. 559 мл Н2О и 439 мл NH3. 127. 4,82 л воды и 176 мл кислоты. 128. 2,54%. 129. 4,31%. 130. 313 мл 50%-ного и 196 мл 20%-ного раствора. 131. 1 : 4. 132. 1 : 2. 133. 1 : 19. 134. 1 : 3. 135. 100 мл 6 н. и 400 мл 1 н. раствора. 136. 400 мл 2 н. и 1400 мл 0,2 н. раствора. 137. 600 мл. 138. 9,09 мл. 139. 250 мл. 140. 1190 мл. 141. 0,92 л NH3 и 2,08 л воды. 142. 0,125 л кислоты и 4,875 л воды. 143. 306 мл воды и 194 мл кислоты. 144. 1016 мл. 145. 2,338 г. 146. 4,659 г. 147. 0,4679 н. 148. 0,08939 н. 149. 0,2514 н. 150. 1,982 г.
Б. Химическое равновесие
3. Увеличится в 2 раза. 4. Увеличится в 1,5 раза. 5. Увеличится в 9 раз. 6. Увеличится в 48 раз. 7. Уменьшится в 2 раза. 8. Увеличится в 2 раза. 9. В обратном. 10. В обратном. 11. Не повлияет. 12. Сместится вправо. 13. К=9. 14. К=1,3. 15. К=6,9. 16. К=3,37. 17. К'>К" в 4 раза. 18. К">К' в 1,25 раза. 19. [СО] = 1,5 моль/л; [С12] = 1,0 моль/л. 20. [А] =0,95 моль/л; [В] =0,75 моль/л. 21. 1,3 М. 22. 60%. 24. [НС1] =0,91; 1,50; 1,74; 1,83 моль/л; далее невыгодно. 25. Уменьшится в 1,2 раза. 26. 70%. 27. [СО] = [Н2О] =0,067 моль/л; [СО2] = 0,03 моль/л; [Н2]=0,13 моль/л. 28. 0,75 моль/л. 29. 92%. 30. 88%.
В. Ионное равновесие
1. 1 г-ион Н+ н 1 г-ион С1-. 2. 2 г-иона Na+ и 2 г-иона С1_.
3. 2 г-иона Н+ и 1 г-ион SO^-. 4. 1 г-ион Ва2+ и 2 г-иона ОН-. 5. 0,02 г-нона А13+ и 0,03 г-иона SO4~.6. 1,5 г-иона Na+ и 0,5 г-иона РО|—. 7. 0,5 моля ВаС12. 8. 0,02 моля РЬС12. 9. 0,1 моля Н3РО4. 10. 0,2 моля Са3(РО4)2. 11. 0,78 или 78%. 12. 0,4 или 40%. 13. 0,9 или 90%. 14. 0,004 или 0,4%. 15. ~0,003 г-нон/л. 16. 1,24-10~4 г-ион/л. 17. 9-Ю-3; 1,3-Ю-4 г. 18. 0,39 г; 13,85 г; 4,02 г. 19. 13,8 г. 20. В СНзСООН; в ~200 раз. 21. 3,43-10~4 г; 2,5-10-° г-ион. 22. а) 0,023 г-ион/л; 0,92 г/л; б) 0,014 г-ион/л, 0,56 г/л; в) 1,3-Ю-4 г-ион/л и 5,2-10-3 г/л. 27. 1,8-10-5. 28. 2,1-10~4. 29. 4,7-Ю'4. 30. 5-10-*°.
188
31. 4-Ю-7. 32. 5,6-10-8. 33. Подчиняется. 34. Не подчиняется. 35. 1,8-Ю-5. 38. Непостоянна. 37. 3,3-10—3 г-ион/л. 38. 9,5-10—3 г-ион/л. 39. Уменьшается в 2,2 раза. 40. Уменьшается в ~2 раза. 41. 2 4-Ю-3 г' 0,1 г. 42. 1,6-10-3 г. 43. 4,2%. 44. Увеличится в 3,2 раза. 45. 0,02%; 2,8-10-2%; 6,3-10-2%. 46.0,1%; 10-5%. 47. 1,9%; 3%; 4,2%; 4,7%; 13%. 49. 3,54-10-4 г-ион/л. 50. 3,7-10-4 г-ион/л. 51. 1.86-10-5 г-ион/л. 52. 1,3-Ю-4 г-ион/л. 53. 0,18%. 54. 0,0186%. 55. В ~ 10 раз. 56. Уменьшится в ~11 раз. 57. 0,04%. 58. 0,51%. 59. 0,037 М. 60. 0,3 г.
Г. Равновесие в насыщенных растворах
5. 0,0092 моль/л. 6. 1,4-10-4 моль/л. 7. 1,3-Ю-5 моль/л. 8. 6,2Х Х10"4 моль/л. 9. 1,1-Ю-5 г-ион/л. 10. 1,5-10-2 г-ион/л. 11. 0,15 г-ион/л. 12. 1,3-10-4 г-ион/л. 13. 0,98-10~10. 14. 1,7-10-8. 15. 1,01 -10-5. 16. 1,69-Ю-10. 17. 1,64-Ю-5. 18. 1,9-10-’2. 19. 4,3-10-17. 20. 6,24-10-®. 21. 4-Ю-29. 22. 8,2-10-12. 23. Насыщенный. 24. Ненасыщенный. 25. Пересыщенный. 26. Не будет. 27. Пересыщенный. 28. Насыщенный. 29. Пересыщенный. 30. Ненасыщенный. 31. 7-10—5 г-ион/л. 32. 7,9-10-3 г-ион/л. 33. 1 • 10-5 г-ион/л. 34. Agl— 9,2-10-9 г-ион/л; AgBr — 5,8-Ю-7 г-ион/л; AgCl—1,3-Ю-5 г-ион/л. 35. [РЬ2+]=1,6-10-2; [С1-]=3,2-10-2. 36. (СгО^- ]=7,9-Ю-5;
[Ag+] = l,6-10-4. 37. 1,3-Ю-4 г/100. 38. 0,10 г/100 г Н2О. 39. 0,45 г. 40. 1,7-Ю-3 г. 41. В РЬС12 в ~2500 раз. 42. В PbSO4 в ~790 раз. 43. Zn(OH)2; в 160 раз. 44. В CuS 5,8-10-’9; в As2S3 7,9-10-6 г. 45. Не выпадет. 46. Не выпадет. 47. Выпадет. 48. Не выпадет. 49. Не выпадет. 50. Выпадет. 51. Выпадет. 52. Выпадет. 53. Выпадет. 54. Выпадет. 55. Выпадет. 56. Выпадет. 57. [Sr2+] : [Ва2+] =3600 ; 1. 58. 106 : 1. 59. AgBr. 60. РЬСгО4. 61. [Са2+] в 18 раз. 62. [С2Ов 1900 раз. 63. Вг-. 64. ВаСгО4. 65. 8-10-6 г-ион/л. 66. 2,3-10-2 г-мон/л. 67. SrCO3. 68. BaSO4 и CaSO4. 69. 0,13 моль/л. 70. 2,9-10-4 моль/л. 71. 1,59-10-4 моль/л. 72. Любой растворимый сульфат; >О,6Х ХЮ-4 моль/л. 73. Любой растворимый карбонат; 1,6-10—6 моль/л. 75. 5,7-10-7 г-ион/л. 76. 1,8-10-6 г-ион/л. 77. CuS. 78. CdS. 79. Нельзя. 80. Можно. 81. [Cd2+]>B 1,8 раза. 82. [Sn2+] >в 15 раз. 83. 0,12 г-ион/л. 84. 0,95 г-ион/л. 85. Практически невозможно. 86. 0,33 г-ион/л. 87. 0,01—0,12 г-ион/л. 88. РЬ2+ и Си2+. 89. ZnS и CdS. 90. Cd2+ и Cu2+.
Д. Комплексные соединения
17. В растворе K[AgCl2] больше в 1,3-Ю5 раз. 18. В аммиакате. 19. В аммиакате. 20. В желтой. 21. [Ag+] = 1,2-10-3 г-ион/л; [NH3] = = 2,4-10-3 моль/л. 22. [Ag+] =8,3-10-3 г-ион/л; [С1-] = 1,7Х
Х10-2 г-ион/л. 23. В аммиакате. 24. Уменьшится в 2-104 раз. 25. Выпадет осадок. 26. Выпадет.
Глава II
А. Весы и взвешивание
1. 10,1. 2. 9,6. 3. Влево. 4. Вправо. 5. Да. 6. Нет. 7. +0,0066. 8. —0,0044. 13. 0,0084. 14. 0,0024. 15. 0,3 мг. 16. а) 0,91 мг; б) 1,1 деления. 17. 20,9940 г. 18. 5,4968 г. 19. 9,9902 г. 21. 6,3243 г. 22. 7,2863 г. 23. 6,8939 г. 24. 12,4965 г. 25. 12,4554 г. 26. 31,4810 г. 27. Правое; на 0,002 мм. 28. На 0,0032 мм. 29. 0,001%; 0,2%. 30. 0,0005 г. 33. 68,5828 г. 34. 7,0932 г. 35. 10,7995 г. 36. 0,9095 г.
189
Б. Расчет навески
1. — 0,7 г. 2. — 0,5 г. 3. — 1 г. 4. — 0,2 г. 5. — 0,3 г. 6. ~0,2 г. 7. — 0,2 г. 8. —0,2 г. 9. ~0,7 г. 10. ~0,3 г. 11. — 0,2 г. 12. — 2,5 г. 13. — 0,5 г. 14. — 3 г. (при норме осадка 0,01 г). 15. — 1 г. 16. -0,2 г. 17. — 0,4 г. 18. — 0,3 г. 19. — 0,8 г. 20. -0,5 г. 21. — 0,07 г. 22. — 0,1 г. 23. — 0,3 г. 24. —0,2 г. 25. -0,1 г. 26. —0,1 г. 27. —0,1 г. 28. —0,1 г. 29. —3 г. 30. -0,02 г. 31. —0,2 г. 32. —0,2 г. 33. —0.3 г. 34. —0,2 г. 35. -0,1 г. 36. —0,4 г. 37. —0,6 г.
38. —0,4 г. 39. —0,2 г. 40. —0,4 г. 41. -0,4 г. 42. —0,6 г.
45. —0,1 г Au; — 1,7 г Ag; —1,3 г Си. 46. —0,2 г.
В. Расчет растворителя и осаждающего реактива
1. —40 мл. 2. —60 мл. 3. —15 мл. 4. —2 мл. 5. —1 мл. 6. —60 мл. 7. —90 мл **. 8. —300 мл *. 9. —8 мл **. 10. — 130 мл **. 11. —6 мл**. 12. —30 мл**. 13. —15 мл**. 14. —20 мл*. 15. —15 мл**. 16. —8 мл***. 17. —100 мл**. 18. —80 мл**. 19. —20 мл. 20. —10 мл. 21. —20 мл**. 22. —20 мм***. 23. — 4 мл *. 24. — 10 мл **. 25. —8 мл *. 26. — 120 мл **. 27. —60 мл. 28. —5 г*. 29. —0,5 г**. 30. —0,9 г*. 31. —30 мл. 32. —6 мл*. 33. —4 мл***. 34. —10 мл***. 35. —8 мл***. 36. —9 мл*. 37. —2 мл***. 38. —4 мл***. 39. —2 мл **. 40. —6 мл*. 41. — 4 мл ***. 42. — 1 мл **.
Г. Вычисление потерь при промывании осадка
1. 5,8-10-4 г. 2. 4,5-10~3 г. 3. 1,1 Ю"3 г. 4. 0,11 г. 5. 1,4-10~3 г. 6. 5.3-10-4 г. 7. 0,6%. 8. 1,8%. 9. 1,4%. 10. 5,4%. 11. 6,2%. 12. 3,8%. 13. 3,6%. 14. 0,16%. 15. 1,2- 10-е г. 16. 2,9-10~5 г. 17. 2,8-10-« г. 18. 3,5-10-’ г. 19. 2-10-3%. 20. 0,02%. 21. В 400 раз. 22. 0,6 мл.
Е. Вычисление результатов гравиметрических (весовых) анализов
1. 41,73%. 2. 3,28%. 3. 72,40%. 4. 3,16%. 5. 39,77%. 6. 43,98% СО2; 56,04% СаО. 7. 25,10%. 8. 59,96%. 9. 88,51%. 10. 14,80%. 11. 3,01%. 12. 19,99%. 13. а) 1,95%; б) 3,02%. 14. а) 0,38%; б) 50,19%. 15. 78,71%. 16. 1,01%. 17. 39,90%. 18. 39,49%. 19. 0,2804 г. 20. 0,03921 г. 21. 0,2749 г. 22. 0,09034 г. 23. 0,8161 г. 24. 0,04729 г. 25. а) 0,1110 г; б) 0,1382 г; в) 0,4883 г. 26. а) 0,1156 г; б) 0,3143 г; в) 0,5752 г. 27. а) 0,0509 г; б) 0,1166 г; в) 0,2549 г. 28. а) 0,01802 г; б) 0,02170 г; в) 0,04015 г. 29. 1,9224 г. 30. 1,7426 г. 31. 56,09%. 32. 3,92%. 33. 34,56%. 34. 22,24%. 35. 90,01%. 36. 94,85%. 37. а) 0,97%; б) 30,92%; в) 1,28%. 38. 11,51%. 39. а) 29,32%; б) 0,32%; в) 70,36%. 40. а) 75,98%; б) 2,13%. 41. а) 19,67%; б) 32,62%; в) 68,22%. 42. а) 9,86%; б) 25,43%. 43. 98,68%. 44. 94,92%. 45. 74,34%. 46. 98,57%. 47. а) 57,27%; б) 81,89"%. 48. а) 46,01%; б) 59,19%. 49. а) 72,67%;
* При избытке растворителя 50%.
** При избытке растворителя 100%.
*** При избытке растворителя 200%.
190
б) 52 58%. 50. Является х. ч. 51. 56,21%. 52. 77,05%. 53. 79,24%. 54. 14 58%. 55. 14,80%. 56. 22,14%. 57. 8,12%. 58. 15,22%. 59. 37,25%. 60. 0 09%. 61. 0,0164 г. 62. 13,51%. 63. 92,47%. 64. 12,06%. 65. 3,07%. 66. а) 20,40%; б) 46,75%. 67. 0,59%. 68. а) 55,11%; б) 34,81%. 69. а) 2,00%; б) 0,998%. 70. Является х. ч. 71. 56,03%. 72. 1,7847 г. 73. 0 2185 г. 74. 0,2783 г. 75. 1,119 г. 76. 0,1723 г. 78. 0,1196 г. 79. 0,5460 г. 80. 1,2361 г. 81. 0,2690 г. 82. 0,1112 г. 83. 86,98%. 84. 0,07%. 85. 0,2235 г. 86. 0,08821 г. 87. 1,0326 г. 88. 0,06208 г. 89. Не могут. 90. Правильно. 91. Немагниевыми сульфатами. 92. Некальциевые карбонаты. 93. 60,51%. Влаги избыток. 94. 35,81%. 95. 16,94%. 96. 47,24%. 97. а) 1,77%; б) 5,86%. 98. 1,63%. 99. 1,45%. 100. 82,34%.
Ж. Расчеты, связанные с исключением или введением какой-либо составной части
1. 54,89%. 2. 22,11%. 3. 9,55%. 4. 68,55%. 5. 87,57% СаО; 10,66% MgO; 0,99% (Al2O3+Fe2O3); 0,81% SiO2. 6. 49,60% SiO2. 7. 41,36% MgO. 8. 46,86% CO2. 9. 65,94% Ba; 34,05% Cl. 10. 39,85% SO^-; 72,23% SO^-; 11,58% Fe3+; 20,99% Fe3+. 11. 37,22%; 38,76%. 12. a) 24,04%; 6) 38,26%. 13. 11,58% H2O; 67,34% CaO; 16,38% MgO; 3,54% SiO2; 1,21% CO2. 14. 52,71% CaO; 37,71% CO2; 2,02% полуторных оксидов; 0,69% SiO2. 15. 7,15%. 16. 10,17%. 17. 82,45% CaO; 11,26% MgO; 4,33% SiO2; 1,48% полуторных оксидов. 18. 28,41% Fe2O3; 42,74% SO3. 19. 7,33%. 20. 2 руб. 13 коп.
И. Косвенный анализ
1. 65% ВаСО3; 35% СаСО3. 2. 72,83% NH4Br; 27,17% KBr. 3. 0,1368 г КС1; 0,07518 г KI. 4. 0,0830 г NaCl; 0,09673 г NaBr. 5. 79,04% NaCl; 20,96% КС1; 6. 21,74% NaCl; 78,26% NaBr. 7. 43,57% MgCO3; 56,43% СаСОз. 8. 13% CaO; 37% MgO. 9. 32% NaCl; 48% KC1. 10. 11% Na2O; 3,7% KsO.
Глава III
А. Расчеты в титриметрическом анализе
1. 96,53%. 2. 49,65%. 3. 0,1401 г. 4. 0,2011г. 5. 0,4500 г. 6. 0,2280 г. 7. 250 мл. 8. 50 мл. 9. 0,0534 г избыток кислоты. 10. 0,01962 г. избыток H2SO4. И. 80,0%. 12. 98,08%. 13. 0,1 н. 14. 0,2 н. 15. 0,09130 и. 16. 0,1640 и. 17. 4:5. 18. 4 ; 3. 19. 1,14 раза. 20. 1,01 раза. 21. 20 мл. 22. 37,50 мл. 23. 0,09868 и. 24. 0,08724 н. 25. 0,2245 н. 26. 0,1217 и. 27. 25 мл. 28. 400 мл. 29. Кислая. 30. Кислая.
Б. Измерение объемов
1. 997,17 г. 2. 997,94 г. 3. Больше 1 л. 4. Первая. 5. 249,37 г. 6. 498,12 г. 7. 1,67 г. 8. 0,54 г. 9. 0,75 г. 10. 0,33 г. 11. 0,36 г 12. 0,142 г. 13. 999,53 мл; —0,47 мл. 14. 500,37 мл; +0,37 мл. 15. 999,21 мл; —0,79 мл. 16. 499,80 мл; —0,20 мл. 17. 249,91 мл; —0,09 мл. 18. 200.30 мл; +0,30 мл. 19. 150,10 мл; +0,10 мл. 20. 99,92 мл; —0,08 мл. 21. 20,04 мл; +0,04 мл. 22. 25,00 мл. 23. 22,4 мм. 24. 42,93 мм выше нижней метки. 25. На 21,4 мм выше
191
нижней метки. 26. На 54,1 мм выше нижней метки; объем 50 мл. 27. На 13,3 мм выше верхней метки; объем 25 мл. 28. На 10,3 мм выше верхней метки; объем 100 мл. 29. 29,99 мл; —0,01 мл.
В. Способы выражения концентрации рабочего раствора
1. 0,005912. 2. а) 0,007652; б) 0,003639. 3. а) 0,005624; б) 0,01276. 4. а) 0,005416; б) 0,003167. 5. а) 0,05742 г; б) 0,1436 г; в) 0,5742 г. 6. а) 0,04120 г; б) 1,030 г; в) 4,120 г. 7. 0,1958 г. 8. а) 0,1472 г; б) 0,06453 г. 9. 0,1012 г. 10. 0,07379 г. 11. 0,03647. 12. 0,05611. 13. 0,005856. 14. 0,005435. 15. 0,002503. 16. 0,002191. 17. 0,003647. 18. 0,005611. 19. 0,005106. 20. 0,002954. 21. 0,04106. 22. 0,04960. 23. 0,002341. 24. 0,003928. 25. 0,03874 г. 26. 0,1600 г. 27. 1,386 г. 28. 0,7262 г. 29. 0,4794 г. 30. 0,4020 г. 31. 0,005087. 32. 0,004335. 35. 1,000 н. 36. 0,1000 н. 37. 0,1010 н. 38. 0,1018 н. 39. 0,09705 и. 40. 0,09406 н. 41. 0,09273 н. 42. 0,1036 н. 43. а) 0,03161 н.; б) 0,09483 н. 44. а) 0,05657 н.; б) 0,09428 н. 45. 0,09502 н. 46. 0,09960 н. 47. 0,09798 н. 48. 0,1037 н. 53. 0,9399 н. 54. 0,1437 н. 55. 0,1040 н. 56. 0,8941 н. 57. 0,2185 н. 58. 0,4971 н. 59. 0,1875 н. 60. 0,1947 н.; нельзя. 61. 1,650 г; нельзя. 62. 0,2666 г. 63. 0,9464 н. 64. 0,2716 н. 65. 2,162 н. 66. 0,09989 н. 67. 0,1000 н. 68. 0,09885 н. 69. 0,05067 н.; 0,03040 н. 70. 0,2016 н. 71. 1,124 к 0,1 н. 72. 0,954 к 0,1 н. 73. 0,972 к 0,05 н. 74. 0,9900 к 0,02 н. 75. 1,010 к 0,5 н. 76. 1,006 к 0,2 н. 77. 1,060 к 0,5 н. 78. 0,9998 к 0,2 н. 79. 0,9645 к 0,1 н. 80. 1,037 к 0,5 н. 81. 0,9905 к 0,2 н. 82. 1,260 к 0,1 н. 83. 0,004572. 84. 0,007907. 85. 0,002594. 86. 0,0004189. 87. 0,02196. 88. 0,0009698. 89. 0,5290 н. 90. 0,1909 н. 91. Щелочную. 92. Нейтральная. 93. NaOH. 94. КОН. 95. Щелочную. 96. Кислую. 97. 0,1229 г. 98. 0,3361 г КОН. 99. 0,03404 н. 100. 0,1425 н. 101. 0,001794. 102. 0,001020.
Глава IV
Б. Перманганатометрия
5. - 1,2 г. 6. —9,5 г. 7. 2,021 г. 8. — 1,8 г. 9. — 16 г. 10. 1,264 г. 11. —6,3 г. 12. —1,34 г. 13. —0,71 г. 14. —0,17 г. 15. —1,1 г. 16. —0,50 г. 17. —0,11 г. 18. —0,08 г. 19. 0,18 г. 20. —0,17 г. 21. Нельзя. 22. Хватит. 23. а) 0,007148; б) 0,003180; в) 0,1006 н.; г) 1,006 к 0,1 н. 24. а) 0,003034; б) 0,001522; в) 0,04813 н.; г) 0,9628 к 0,05 н. 25. а) 0,003537; б) 0,001573; в) 0,04978 н.; г) 0,9956 к 0,05 н. 26. а) 0,003392; б) 0,001600; в) 0,05063 н.; г) 1,0126 к 0,05 н. 27. а) 0,003180; б) 0,004530; в) 0,1006 н.; г) 1,006 к 0,1 н. 28. а) 0,08800 н.; б) 0,8800 к 0,1 н.; в) 0,002782. 29. а) 0,09891 н.; б) 0,9891 к 0,1 н.; в) 0,003126; г) 0,005524. 30. а) 0,08881 н.; б) 0,8881 к 0,1 н.; в) 0,01349. 31. а) 0,002095; б) 0,003701. 32. а) 0,08938 и.; б) 0,8938 к 0,1 н.; в) 0,002825. 33. а) 0,001571; б) 0,04969 н.; в) 0,9939 к 0,05 н. 34. а) 0,003092; б) 0,09784 н.; в) 0,9784 к 0,1 н. 35. а) 0,001616; б) 0,05107 н.; в) 1,022 к 0,05 н. 36. 1,008 к 0,1 н. 41. 19,13 мл. 42. 24,84 мл. 43. 23,47 мл. 44. 26,09 мл.
45. 21,36 мл; не повлияет. 46. 8,14 мл. 47. 21,64 мл. 48. 24,33 мл.
49. —7,0 г. 50. —0,84 г. 51. —3,2 г. 52. —3,7 г. 53. —7,0 г. 54. —1,4 г. 55. —0,32 г. 56. —1,4 г. 57. —0,46 г. 58. —0,70 г.
59. 0,7767 г. 60. 1,264 г. 61. 0,4200 г. 62. 6,522 г. 63. 0,1833 г.
64. 0,1237 г; нет. 65. 0,2037 г. 66. 0,2961 г. 67. 0,1971 г. 68. 0,1928 г.
192
69 0 08102 г. 70. 0,3388 г. 71. 0,2625 г. 72. 0,2803 г. 73. 97,06%.
74. 98,68%. 75. 98,32%. 76. 93,86%. 77. 42,27%. 78. 98,42%.
79. а) 45,20%; б) 90,43%. 80. 88,49%. 81. 28,63%. 82. 12,21%.
83. 92,20%. 84. 86,63%. 85. 89,34%. 86. 98,51%. 87. 92,42%. 88.
83,84%. 89. 90,65%. 90. 45,62%. 91. — 2 г. 92. — 2 г. 93. ~1 г. 94. ~7 г 95. — 50 мл. 96. — 140 мл. 97. — 0,3 г. 98. — 0,3 г. 99. Хватит 100. Бесцветный. 101. 59,45%. 102. 56,00%. 103. 33,24%. 104. 98,31%. 105. 36,47%. 106. 71,20%. 107. 54,50%. 108. 99,88%. 109. 79,77%. ПО. 50,19%.
В. Иодометрия
'• 1. — 1,6 г. 2. —6,4 г. 3. —37 г. 4. —10 г. 5. —2,5 г. 6.-1 г. 7. —0,06 г. 8. —0,06 г. 9. Нельзя. 10. Можно. 11. Бесцветный. 12. Не обесцветится. 13. 0,001260 г. 14. 0,005048 г. 15. 0,04703 н. 16. 0,04984 н.; 0,01237. 17. 0,1028 н.; 1,028 к 0,1 н. 18. 0,01012 н.; 0,002512. 19. 0,02509. 20. а) 0,02460; б) 0,01258. 21. а) 0,02833; б) 0,1142 н.; в) 1,142 к 0,1 н. 22. а) 0,008888; б) 0,03581 н.; в) 0,7163 к 0,05 н. 23. —14 г. 24. —1,4 г. 25. -0,7 г. 26. -0,2 г. 27. -20 мл. 28. -5 мл. 29. 92,96%. 30.76,82%. 31. 38,10%. 32. 92,84%. 33. 98,29%. 34. 81,95%. 35. 18,51%. 36. 19,08%. 37. 90,42%. 38. 81,90%. 39. 35,35%. 40. 65,92%. 41. 32,87%. 42. 0,003766. 43. а) 0,02224; б) 0,1752 н. 44. 93,98%. 45. 91,73%. 46. 32,64%. 47. 88,60%. 48. 76,81%. 49. 0,404%. 50. 38,09%. 51. 0,050%. 52. 0,0035%. 53. 0,02%. 54. 0,038%. 55. 0,80%. 56. 0,53%. 57. 1,04%. 58. 1,37%. 59. 3,61%. 60. 0,59%. 61. 94,00%. 62. 1,66%. 63. а) 0,1020 н.; б) 0,008143; в) 0,006208. 64. 19,08 мл. 65. 1,85%. 66. 60,81%.
Глава V
А. Теоретические основы метода
11. 1.10е; 1-10-’; 1-10-3; 1-Ю-6. 15. 9,2-10"2 г-ион/л; 8.2Х ХЮ"1 г-ион/л. 17. 1 10-“; J Ю"10 г-ион/л. 19. 3. 21. 2,7. 23. 0,52; 13,48. 25. 2,22; 11,78. 26. 1,6; 12,4. 27. 1,04; 12,96. 28. 0,11; 13,89. 29. 1,08; 12,92. 30. 0,11; 13,89. 33. 12,3. 34. 12,3. 35. 12,23. 36. 11,7. 37. 1,6; 12,4. 39. 11,18; 2,82. 40. 11,7; 2,3. 41. 4,73. 45. 0,0025 г-ион/л. 49. 0,016 г-ион/л. 51. 6,3-10-3 г-ион/л. 53. 2,9. 54. 2,9. 55. 3,02; 0,001. 56. 3,2; 0,00059. 57. 2,47; 0,0034. 58. 5,27; 5,4-Ю"6. 59. 10,86; 3,14. 60. 11,5; 2,5. 61. 5,27. 62. 5,5. 63. 9. 64. 5,8. 65. 5,1. 66. 5,3. 67. 5,4. 68. 5,2. 69. 8,4. 70. 9,1. 71. 8,1. 72. 10,9. 73. 8,9. 74. 8,2. 75. 8,8. 76. 8,5. 77. 9,95. 78. 9,25. 79. 9,25. 80. 8,77. 81. 9,07. 82. 9,19. 83. 4,73. 84. 3,75. 85. 4,73. 86. 3,87. 87. 4,73. 88. 5,32. 89. 3,75. 90. 4,90. 91. 9,9. 92. 8,98. 93. а) 1,17; б) 1,96; в) 7. 94. а) 12,8; б) 12; в) 7. 97. а) 4,25; б) 4,73; в) 5,20; г) 8,87. 98. а) 2,79; б) 3,75; в) 4,24; г) 8,0. 101. 10,21; 9,63; 9,25; 8,29; 4,97.
Б. Приготовление и установка титров рабочих растворов
1. —1,7 г. 2. —4 г. 3. —109 мл. 4. —63 мл. 5. —32 мл.
6. —4,4 мл. 7. —10 г. 8. —0,53 г. 9. —0,59 г. 10. 0,79 г. 11. а) 0,1876 н.; б) 0,9380 к 0,2 н.; в) 0,006841; г) 0,007504. 12.
а) 0,1065 н.; б) 1,065 к 0,1 н.; в) 0,005223; г) 0,003300. 13.
7 Ярославцев А. А.
193
a) 0,1113 и.; б) 1,113 к 0,1 н.; в) 0,005458. 14. а) 0,1051 н.; б) 1,051 к 0,1 и.; в) 0,003833. 15. а) 0,09017 и.; б) 0,9017 к 0,1 н.; в) 0,003288. 16. а) 0,03884 и.; б) 0,7767 к 0,05 и.; в) 0,001905. 17. а) 0,01120; б) 0,009135; в) 1,142 к 0,2 и. 18. а) 0,003720; б) 0,004804; в) 0,1020 н. 19. 0,003722. 20. 0,002102. 21. 1,007 к 0,1 и. 22. 1,042 к 0,05 и. 23. а) 0,9340 к 0,1 и.; б) 0,002895. 24. а) 0,1042 и.; б) 0,005108. 25.
а) 0,9688 к 0,1 и.; б) 0,003879. 26. а) 0,08310 и.; б) 0,003324. 27.
а) 1,063 к 0,2 и.; б) 0,007753. 28. а) 0,5136 и.; б) 0,02054. 29. ~0,8. 30. — 1,1 г. 31. — 3 г. 32. — 1,7 мл. 33. —5,3 мл. 34. —3,8 г.
35. — 11 г. 36. —9,4 г. 37. —0,6 г. 38. —0,32 г. 39. — 1 г. 40. —2,5 г.
41. —2,3 г. 42. —1,4 г.
В. Вычисление результатов анализов
1. 4,178 г. 2. 6,122 г. 3. 73,95%. 4. 72,06%. 5. 98,52%. 6. 52,92%. 7. 96,40%. 8. 68,15%. 9. 95,86%. 10. 75,56%. 11. 60,00%. 12. 64,48%. 13. 66,99%. 14. 12,41 н.; 38,04%. 15. 87,58%; 55,20%; 32,38%. 16. 85,25%; 65,56%; 19,69%. 17. 34,42%. 18. 38,20%; меньше на 1,16%. 23. 0,09092 н. 24. 0,9070 к 0,1 н. 25. 0,09360 н. 26. 0,7344 к 0,5 н. 27. 99,59%. 28. 54,20%. 29. 90,19%. 30. 31,22%. 31. 16,87%. 32. 4,047%. 33. 92,10%. 34. 16,81%. 35. 31,86%. 36. 17,92%. 37. 99,77%; 43,87%. 38. 1,23%. 39. 29,27%. 40. 67,41%; 63,12%. 41. 90,40%; 9,38%. 42. 88,69%; 10,34%. 43. 82,49%; 17,48%. 44. а) 91,45: б) 5,49%. 45. 72,80% NaOH; 25,89% Na2CO3. 46. 67,56%; 11,35%. 47. 0,1987 г; 0,06145 г. 48. 38,59%; 60,75%. 49. 97,24%. 50. 88,26%. 51. 99,17%. 52. 83,12%. 53. 124,82 г/л H2SO4; 238,91 г/л Н3РО4. 54. 86,74 г/л; 277,1 г/л. 55. 196,0 г/л; 32,77 г/л. 56. 253,26 г/л; 78,73 г/л. 57. а) 2,69 мг-экв/л; б) 7,55°. 58. а) 1,43 мг-экв/л; б) 4,02°. 59.
а) 2,16 мг-экв/л; б) 10,81°. 60. а) 1,20 мг-экв/л; б) 4,19°. 61.
а) 12,20 мг-экв/л; б) 34,21°. 62. а) 3,34°; б) 13,78°; в) 10,44°. 63. а) 1,94 мг-экв/л; б) 5,45°; в) 9,73°; г) 6,80°. 64. а) 6,30 мг-экв/л;
б) 17,6°; в) 31,5°; г) 22,1°. 65. а) 19,99 г/л; б) 76,80 г/л; в) 56,81 г/л.
66. а) 16,92 г/л; б) 55,72 г/л; в) 38,80 г/л>
Глава VI
А. Предварительные расчеты н расчеты по установке титров рабочих растворов
1. —2,1 г. 2. —26 г. 3. —2,16 г. 4. 0,7022 г. 5. -3,7 г. 6. —0,73г. 7. -0,15 г. 8. —0,073 г. 9. —3,8 г. 10. —2,9 г. 11. 20,06 мл.
12. 27,85 мл. 13. 36,00 мл. 14. Нельзя. 15. 19,52 мл. 16. 2,30 мл.
17. 46,14 мл. 21. -1,8 г. 22. —1,8 г. 23. —60 г. 24. -3 г. 25.
— 0,22 г. 26. —0,074 г. 27. —0,07 г. 28. —0,3 г. 29. —3 г. 30. —0,4 г.
31. 25,01 мл. 32. 33,04 мл. 33. 0,5474 г. 34. 0,0695 г. 35. 2,569 г. 36. 0,5667 г. 37. От 0,3 г до 0,6 г. 38. От 0,136 г до 0,283 г. 39. 0,007615. 40. 0,08176 и. 41. а) 0,04810 н.; б) 0,9619 к 0,05 и.; в) 0,008171. 42. а) 0,112 н.; б) 1,121 к 0,1 и.; в) 0,01210. 43.
а) 0,04545 и.; б) 0,9090 к 0,05 н.; в) 0,001612. 44. а) 0,05078 и.;
б) 1,016 к 0,05 и.; в) 0,004058. 45. а) 0,05484 и.; б) 1,097 к 0,05 и.;
в) 0,004176. 46. а) 0,01238; б) 0,09754 и.; в) 0,9754 к 0,1 и. 47.
а) 0,09926 и.; б) 0,01071. 48. 0,003308. 49. а) 0,007948; б) 0,1044 и. 50. а) 0,1157 и.; б) 0,008810.
194
Б. Расчеты результатов анализов по данным прямого и обратного титрования
1. 65,39%. 2. 60,53%. 3. 59,09%. 4. 29,08%. 5. 263,9 г. 6. 437,7 г. 7. 67,88%. 8. 98,51%. 9. 47,53%. 10. 93,24%. 11. 84,01%. 12. 59,96%. 13. 20,04%. 14. 29,99%. 15. 46,38%. 16. 98,32%. 17. 89,89%. 18. 54,50%. 19. 2,18%. 20. 0,31%. 21. 0,2%. 22. 0,7553%. 23. 79,90 г/л. 24. а) 145,3 г/л; б) 239,5 г/л. 25. а) 48,74%; б) 80,35%. 26. 98,85%.
В. Расчеты результатов комплексонометрических определений
1. ~2,3 г. 2. ~46,5 г. 3. Точная навеска около 2 г. 4. Точная навеска около 0,9 г. 5. 0,1000 н.; 0,002005. 6. 0,05184 н. 7. Точные навески: СаСОз ~ 2,5 г; MgSO4 ~ 3,0 г. 8. .Vca + A^Mg = 0,04988 н. 9. 30,02% СаО; 19,64% MgO. 10. 2,92% Са; 1,65% Mg.
Приложение
Таблица двузначных логарифмов (для приближенных вычислений)
Мантиссы логарифмов постоянно встречающихся чисел:
2 ЗОЮ
25 3 979
5 6 990
7’
Приложение
Таблица 1
Атомные, молекулярные и эквивалентные массы некоторых веществ и их логарифмы
Соединение Молекулярная масса M ig м
Ag 107,87 0329
AgBr 187,78 2737
AgSCN AgCl Ag2CrO4 Ag2CO3 Agl 165,96 143,32 331,73 275,75 234,77 2201 1562 5208 4405 3707
AgNO3 169,88 2303
Ag2O 231,74 3651
Ag2S 247,80 3941
A! 26,98 4311
i/3Al 8,99 9538
2A1 53,96 7321
A1(C9H6ON)3 (оксихинолинат) A12O3 459,44 101,96 6622 0086
>/6Al2O3 16,99 2303
A1(OH)3 78,00 8921
A12(SO4)3 342,15 5343
Al2(S04)3-18H2O As 666,42 74,92 8240 8746
197,84 2963
246,04 3910
1/4As2O3 49,46 6942
As2O5 229,84 3613
Ba 137,34 1379
i/2Ba 68,67 8368
BaBr2 297,16 4731
BaCO3 197,35 2954
BaCl2 208,25 3186
BaCl2-2H2O 244,28 3879
BaCrO4 253,33 4037
Ba(OH)2 171,36 2340
BaSO4 233,40 3681
196
Продолжение табл. 1
Соединение Молекулярная масса tg M
BaSO3 217,40 3373
В2О3 69,62 8429
Вг 79,909 9026
С 12,011 0793
СО 28,01 4473
СО2 44,01 6436
>/2 С©2 22,01 3426
Са 40,08 6000
1/2 Са 20,04 3018
СаСОз 100,09 0004
1/2 СаСО3 50,05 6694
СаСзО4 128,10 1075
СаС2О4-Н2О 146,12 1647
CaF2 78,08 8925
СаС12 110,99 0453
СаС12-6НгО 219,08 3406
Са3(РО4)2 310,18 4916
Са(Н2РО4)2 234,04 3693
СаО 56,08 7488
1/2 СаО 28,04 4478
Са(ОН)2 74,10 8698
1/2 Са(ОН)2 37,05 5688
Ca(NO3)2 164,09 2151
Са(Н2РО4)2 Н2О CaSO4 252,06 136,14 4016 1341
CaSO4-2H2O 172,17 2360
Cd2P2O7 398,74 6007
Cl 35,453 5497
2 Cl C6H5OH 70,906 94,11 8507 9736
Cr2O3 151,99 1818
V2 Cr2O3 76,01 8809
CrO3 100,00 0000
i/3 CrO3 33,33 5230
Cr(OH)3 103,02 0129
CuSCN Cu2O CuO 1/2 CuO CuSO4 CuSO4-5H2O Fe 2Fe 63,546 121,62 8031 0849
. 143,08 1556
79,54 39,77 159,60 249,68 9006 5997 2031 3974
55,85 7470
FeCO3 FeCl2 FeCl3 FeO Fe2O3 111,70 115,86 126,75 0479 0641 1030
162,21 2101
71,85 159,69 8564 2034
197
Продолжение табл. 1
Соединение Молекулярная масса M !g M
Fe (ОН), 106,87 0290
1/2Ре2О3 79,85 9023
Fe3O4 231,54 3647
2Fe (ОН)3 213,74 3299
FeS 87,91 9441
FeSO4 151,91 1815
FeSO4-7H,O 278,02 4442
Fe2 (504)3 399,88 6020
H 1,00797 0034
H<> 2,016 3045
ho- 17,01 2307
H2O 18,015 2558
i/2H>O 9,008 9542
2H>6 36,030 5567
3H,O 54,045 7328
H2O2 H3BO,S 34,01 61,83 5318 7913
НСООН 46,03 6631
СНзСООН 60,05 7785
CH,COO 59,04 7712
H2C2O, 90,04 9544
1/9Н2С >о4 45 02 6534
Н,С-,О4-‘2Н>О 126,07 1007
1/2Н>С2О4-2Н2О 63,04 7996
1/2Н>С4Н4О4 (янтарная кислота) 59,05 7712
С6НзСООН (бензойная кислота) 122,13 0868
НС 36,46 5618
2НС1 72,92 8629
HNO, 63,01 7994
н3ро4 98,00 9912
H2S 34,08 5326
H2SO4 98,08 .. 9916
1/2H2SO4 49,04 6906
Hg 200,59 3023
Hg2CU 472,09 6740
HgCl2 271,50 4338
HgO 216,59 3356
I 126,90 1035
к 39,10 5922
KAI (SO4)2 • 12H2O 474,39 6762
KBr 119,01 0755
КВгОз 167,00 2227
i/sKBiOa 27,83 4446
KHCO3 100,11 0005
K2CO3 138,21 1405
i/2K2CO3 69,11 8396
KC1 74,56 8726
KC1O3 122,55 0885
198
Продолжение табл. 1
Соединение Молекулярная масса Л1 lg м
V6KC1O3 20,43 3102
К2СгО4 194,20 2882
К2Сг2О7 294,19 4686
1/6К2Сг2О7 49,03 6905
К3 [Fe (CN)6] 329,23 5175
К4 [Fe (CN)6] 368,33 5662
KI 166,01 2201
KIO3 214,00 3304
’/бКЮ3 35,67 5523
KMnO4 158,04 1987
i/5KMnO4 31,61 4998
1/3КМпО4 52,68 7216
к2о 94,20 9741
i/2K2O 47,10 6731
K2PtCl6 486,01 6867
кон 56,11 7491
K2SO4 174,27 2412
Mg 24,31 3858
MgCO3 84,32 9259
Mg (MH4) PO4-6H2O 245,43 3899
MgO 40,31 6054
Mg (OH)2 58,33 7659
MgC>04 112,33 0505
MgCi2-KCi-6H2o 277,86 4438
Mg2P2O7 222,56 3476
MgSO4 120,37 0806
MgSO4-7H2O 246,48 3918
MnCO3 114,95 0607
MnO2 86,94 9392
>/2MnO-> 43,47 6382
N 14,007 1464
NH3 17,03 2311
2NH3 34,06 5323
18,04 2562
(NH4)2A12 (SO4)4-24H2O 906,66 9574
(NH4)3PO412MoO3 1877 2/Зэ
NH4Br 97,95 9910
NH4SCN 76,12 8815
(NH4)2C2O4-H2O 142,11 1526
i/2 (NH4)2C2O4-H2O 71,06 8517
nh4ci 53,49 7282
NH4Fe (SO4)2-12H2O 482,19 6832
(NH4)?Fe(SO4)2-6H2O 392.14 5935
nh4h2po4 115,03 0607
(NH4)2HPO4 132,06 1209
nh4i 144,94 1611
nh4no3 80,00 9031
199
Продолжение табл. 1
Соединение Молекулярная масса M lg M
NH4OH 35,046 5447
(NH4)2PtCl6 443,88 6473
(NH4)2SO4 132,14 1212
N2O5 108,01 0335
Na 22,99 3615
Na2B4O7 201,22 3038
Na2B4O7- 10H2O 381,37 5814
1/2^28407- 10H2o 190,69 2804
NaBr 102,90 0123
Na2CO3 105,99 0253
NaHCOO 68,02 8326
i/2Na2CO3 53,00 7243
Na2CO3-10H2O 286,14 4567
1/2Na2CO3- 10H2O 143,07 1556
Na2C2O4 134,00 1271
i/2Na2C2O4 67,00 8261
Na3AlF6 209,94 3222
NaCH3COO 82,03 9140
Na2Cr2O7 261,97 4183
i/6Na2Cr2O7 43,66 6401
NaMg (UO2)3-(CH3COO)9 1388,94 1427
NaCl 58,44 7667
Na2CrO4 161,98 2095
NaHCO3 84,01 9244
Na2HPO4- 12H2O 358,14 5541
NaPO3 101,96 0085
Nal 149,89 1759
NaNO2 69,00 8389
NaNO3 85,00 9294
Na2O 61,98 7923
1/2^а2О 30,99 4913
Na2O2 77,98 8919
NaOH 40,00 6021
Na2S 78,04 8923
i/2Na2S 39,02 5913
Na2S2O3 158,11 1990
Na2S2O3.5H2O 248,18 3948
Na2SO3 126,04 1004
1/2Na2SO3 63,02 7994
Na2SO3-7H2O 252,15 4017
i/2Na2SO3-7H2O 126,08 1007
Na2SO4 142,04 1523
Na2SO4-10H2O 322,19 5082
Ni 58,71 7687
NiO 74,71 8734
Ni (C4N2O2H7)2 288,94 4609
NiSO4-7H2O 280,88 4485
200
Продолжение табл. 1
(Соединение Молекулярная масса M IgAf
о 15,9994 20412
он- 17,01 2307
р 30,97 4910
Р2О5 141,98 1523
Р205-24Мо03 3596,50 5559
РЬ 207,19 3164
РЬВг2 368,01 5647
РЬ (СН3СОО)2-ЗН2О 379,33 5790
РЬСОз 267,20 4268
РЬС12 278,10 4442
РЬСгО4 323,18 5095
РЫ2 461,00 6637
РЬО 223,19 3487
рь3о4 685,57 8361
РЬО2 239,19 3788
PbS 239,25 3790
PbSO4 303,25 4818
Pt 195,09 2880
s 32,064 5059
SO2 64,06 8066
so3 80,06 9034
SO^- 96,06 9826
Sb 121,75 0856
БЬзОз 291,50 4647
Si 28,09 4486
SiF4 104,08 0173
SiO2 60,09 7788
Sn 118,69 0745
SnCl2 189,60 2779
SnCl2-2H2O 225,63 3536
SnO 134,69 1294
SnO2 150,69 1781
Sr 87,62 9426
SrCO3 147,63 1692
Sr (OH)2-8H2O 265,76 4245
Sr (NO3)2 211,63 3255
SrSO4 183,68 2641
Zn 65,37 8154
Z11CO3 125,38 0982
Zncl2 136,28 1345
ZnNH4PO4 178,40 2515
ZnO Zn (OH)2 81,37 99,39 9105 9973
Zn2P20y 304,68 4840
ZnSO4-7H2O 287,54 4587
ZnS 97,43 9857
201
Таблица 2
Аналитические множители (факторы) гравиметрического анализа и их логарифмы
Определяют Весовая форма F ig F
Ag AgCl 0,7526 Г.8766
AgNO3 AgCl 1,1852 0,0738
Ag2O AgCl 0,8084 1,9076
Al ai2o3 0,5292 1,7237
Al2 (5О4)з ai2o3 3,3558 0,5258
Ba BaSO4 0,5885 “,7697
BaCO3 BaSO4 0,8455 Г.9271
BaCl> BaSO4 0,8923 1,9505
ВаС12-2Н2О BaSO4 1,0466 0,0198
С co. 0,2729 £,4360
со2 CaCO3 0,4397 1,6432
СО2 CaO 0,7848 1_,8947
Са CaCO3 0,4005 1,6025
Са CaO 0,7147 “,8541
СаСО3 СаСОз CO2 CaO 2,2743 1,7847 0,3569 0,2516
СаСОз CaSO4 0,7351 “,8664
СаС12 CaO 1,9793 0,2965
СаО co2 1,2743 0,1052
СаО CaC O3 0,5603 Г.7484
Са3 (РО4)2 CaO Г.8444 0,2659
CaSO4 CaO 2,4276 0,3852
Cl AgCl 0,2474 “,3933
Си CuO 0,7989 “9025
Си CuS 0,6648 “8227
СиО Си 1,2517 0,0975
CUSO4 CuO 2,0061 0,3024
CuSO4-5H2O Си 3,9297 0,5942
CuSO4-5H2O CuO 3,1391 0,4968
Fe Fe2O3 0,6994 Г.8448
Feo Fe2O3 0,8998 1,9542
Fe2O3 Fe 1,4297 0,1553
FeS2 Fe>O3 1,5025 0,1768
FeSO4-7H2O Fe 4,9782 0,6971
202
Продолжение табл. 2
Определяют Весовая форма F lg F
Fe3O4 Fe2O3 0,9666 E9853
НС1 AgCl 0,2544 1,4055
H2SO4 BaSO4 0,4202 Г.6235
К K2PtCl6 0,1609 1,2065
КС1 K2PtCl6 0,3068 К 4868
Mg MgO 0,6032 Г, 7804
Mg Mg2p2o7 0,2185 173395
MgCO3 Mg2P2O7 0,7576 Г, 8794
MgO Mg2P2O7 0,3623 Г, 5591
Ni NiO 0,7858 Г, 8953
0 H2O 0,8881 Г, 9485
p Mg2P2O7 0,2783 Г, 4446
РгО5 Mg2P2O7 0,6377 Г, 8046
Pb PbCrO4 0,6411 Г, 8069
Pb PbSO4 0,6833 Г, 8346
S BaSO4 0,1374 Г, 1380
SO3 BaSO4 0,3430 Г, 5353
Si SiO2 0,4672 1,6695
Zn ZnNH4PO4 0,3665 Г,5641
Zn Zn2P2O7 0,4291 Г, 6326
ZI1CO3 ZnO 1,5407 0,1877
ZnO Zn 1,2447 0,0951
ZnO Zn2P2O7 0,5341 Г, 7277
ZnS ZnO 1,1975 0,0783
203
Таблица 3
Титриметрические множители и их логарифмы
Э р___ определяемого вещества
п ^рабочего вещества
Определяемое вещество Рабочее вещество F lg F
Редоксидиметрия (оксидиметрия)
КМпО4 H2C2O4-2H2O 0,5014 1,7002
КМпО4 H2C2O4 0,7021 1,8464
КМпб4 Na2C2O4 0,4718 1,6738
КМпО4 (NH4)2C2O4.H2O 0,4448 1,6482
КМпО4 Fe 0,5659 1,7527
Н2С2О4 KMnO4 1,4240 0,1535
Н2С2О4-2Н2О KMnO4 1,9942 0,2998
Na2C2O4 KMtiO4 2,1197 0,3263
(NH4)2C2O4-H2O KMnO4 2,2481 0,3518
Fe KMnO4 1,7670 0,2472
FeSO4 KMnO4 4,8064 0,6818
Fe2O3 KMnO4 2,5260 0,4024
NaNO2 KMnO4 1,0915 0,0380
Na2SO3 KMnO4 1,9940 0,2997
Na2SO3-7H2O KMnO4 3,9892 0,6009
MnO2 Na2C2O4 0,6488 1,8121
MnO2 (NH4)aC2O4-H2O 0,6118 1,7866
MnO2 H2C2O4 - 2H2O 0,6896 1,8386
Na2SO3 I 0,4966 1,6960
Na2SO3-7H2O I 0,9935 1,9972
H2S I 0,1343 1,1281
As2O3 I 0,3897 1,5907
Na^Os-SHjjO K2Cr2O7 5,0613 0,7043
Cl Na2S2O3-5H2O 0,1429 1,1550
I Na2S2O3-5H2O 0,5113 1,7087
KIO3 (через I) Na2S2O3-5H2O 0,1437 1_, 1575
CrO3 » Na2S2O3-5H2O 0,1343 1,1281
Метод кислотно-щелочного титрования (нейтрализации)
HC1 Na2B4O7-10H2O 0,1912 1,2815
HC1 Na2CO3 0,6882 1,8377
HC1 Na 1,5860 0,2004
H2SO4 Na2B4O7-10H2O 0,2571 T,410l
H2SO4 Na2CO3 0,9253 1,9663
204
Продолжение табл. 3
Определяемое вещество Рабочее вещество F lg F
H2SO4 Na 2,1325 0,3289
кон Н2С2О4.2Н2О 0,8902 1,9495
NaOH Н2С2О4-2Н2О 0,6346 1,8025
SO3 * KOH 0,7135 1,8534
so3 * NaOH 1,0008 0,0003
КОН HC1 1,5387 0,1872
кон H2SO4 1,1442 0,0585
к2о HC1 1,2916 0,1111
к2о H2SO4 0,9604 1,9825
NaOH HC1 1,0969 0,0402
NaOH H2SO4 0,8156 1,9115
Na2O HC1 0,8499 1,9294
Na2O H2SO4 0,6320 1,8007
Таблица 4
Константы диссоциации некоторых слабых электролитов
Электролит Константы диссоциации Величина константы диссоциации (при 25° С)
Вода [н+][он-] [Н2О] 1,8-10-16
Минеральные кислоты
[Н+] [ПОП
Азотистая к = — 4,5-10-4
[HNO2]
[Н+] [Н2воп
Борная к, = — 6-10-ю
[H3BO3J
[Н+] [Hson
Сернистая Л1 — ... 1,2-10-2
[H2SO3]
[Н+] [SQ2-]
7^9 — 1,0-10-7
[hsoh
205
Продолжение табл. 4.
Электролит Константы диссоциации Величина константы диссоциации (при 25° С)
Сероводородная [Н+] [HS-] 1 [H2S] 1,08-10-7
[Н+] [S2-] Кг~ [HS-J ib> 1,0-10-15
Синильная [H+HCN-] Л [HCN] 7,2-10-ю
Угольная [Н+] [НСО-] 4,3-10-7
[Н2СО3]
[Н+] [СО2-] 5,6-10-п
[НСО-]
Фосфорная [Н+] [Н2РО^-] 1,1-10-2
1 ~ [Н3РО4]
[Н+] [НРО2-] /<2 = [Н2РО2-] 2,0-10-7
[Н+ПРОЗ-] 0,9-10-12
Ki ~ [HPQ2-]
Органические кислоты
Винная [Н+] [HC4H4OjT] 1,04-Ю-з
Л1 ~ [Н2С4Н4О6] [Н+] [С4Н4о2-] Д'
4,55-10-5
[НС4Н4О^]
Муравьиная ,, _ [Н+] [НСОО-] [НСООН] 1,77-10-4
Уксусная ,, [Н+] [СНзСОО-] [СНзСООН] 1,86-10-5
206
Продолжение табл. 4
Электролит Константы диссоциации Величина константы диссоциации (ври 25° С)
Щавелевая [Н+] [НС2О4-] ~ [Н2С2О4] [Н+] [С2О4-] д- 2 [НС2О~] 5,9-10-2 6,4-10-5
Основания
[NH+][OH-] 1,79-10-5
Аммиак IS — - - — [NH4OH]
Степень диссоциации кислот, оснований и солей в водных растворах
Таблица 5
Электролит Формула Степень диссоциации, %
в 1 н. растворе в 0,1 н. растворе
Кислоты
Азотная HNO3 82 92
Соляная НС1 78 91
Бромистоводородная НВт — 90
Иодистовод ородная Н1 — 90
Серная H2SO4 51 58
Щавелевая Н2С2О4 — 31
Фосфорная Н3РО4 — 26
Сернистая H2SO3 — 20
Фтористоводородная HF — 15
Винная Н2С4Н4О6 — 13
Уксусная СНзСООН 0,4 1,3
Угольная Н2СОз — 0,17
Сероводородная H2S — 0,07
Борная НзВОз — 0,01
Синильная HCN — 0,007
207
Продолжение табл. 5
Электролит Формула Степень диссоциации, %
в 1 и. растворе в 0,1 н. растворе
Основания
Едкое кали кон 77 89
Едкий натр NaOH 73 84
Гидроокись аммония Соли NH4OH 0,4 1.3
Тип Ме+А~, например КС1 — 86
Тип Mef А2- и Ме2+А^~, напри- — 73
мер KjSO^, ВаС12 Тип Ме^А3- или Ме3+А~, на- — 65
пример К3РО4, AICI3 Тип Ме2+А2-, например CuSO4 — 40
Примечания: 1. В случае сильных электролитов приведенные цифры представляют собой «кажущиеся степени диссоциации», определенные по электрической проводимости растворов.
2. Цифры для двух- и миогоосновных кислот относятся к первой ступени диссоциации их.
3. Степени диссоциации различных солей одного и того же .типа в одно-яормальных растворах различаются между собой довольно сильно. Поэтому в таблице они не приведены. Укажем здесь соответствующие данные для некоторых солей: KCl — 75%, NaCl —67%, KNO3 — 64%, CHsCOONa — 63%, K2SO4 — 53%, NasSO4 —45% и т. п.
Таблица 6
Произведения растворимости некоторых электролитов (при 25° С)
Электролит ПР Электролит ПР
CuCl 1,4-10-6 Ag2C2O4 5,0-10-12
CuBr 4,1-10-8 Ag2CrO4 2,0-10-12
Си! 1,1-10-12 Ag2Cr2U? 2,0-10-7
Cu2S 2,6-10-49 Ag2SO4 6,0-10-6
CuS 3,2-10-38 Ag3PO4 1,8-10-16
CuCOs 2,36-10-W Ag3AsO4 1,0-10-19
СиС2О4 2,9-10-8 AgSCN 1,2-10-12
AgOH 2,0-10-8 Mg(OH)2 5,5-10-12
AgCl 1,7-10-10 MgCO3 1,0-10-5
AgBr 3,3-10-13 MgC2O4 8,6-10-5
Ag! 8,5-10-1? MgNH4PO4 2,5-10-13
Ag2S 5,9-10-52 Ca(OH)2 2,2-10-2
Ag2CO3 8,15-10-12 CaCO3 1,7-10-8
208
Продолжение табл. 6
Электролит ПР Электролит ПР
CaSO4 6,26-10-5 А1(ОН)3 1,1-10-15
CaF2 4-10-П SnS 1,0-10-27
СаС2О4 3,8-10-9 РЬС12 1,7-10-5
СаСгО4 2,3-10-2 PbBr2 6,3-10-6
Са3(РО4)2 1,2-10-14 Pbl2 8,7-10-9
Zn(OH)2 4,5-10-17 PbS 6,8-10-29
ZnS 7,4-10-27 РЬСОз 7,24-10-14
ZnCO3 9,98-10-H PbSO4 1,8-10-8
Sr(OH)2 6,7-10-2 Pbc2d4 3,4-10-U
SrCO3 9,42-10-Ю PbCrO4 1,8-10-14
SrSO4 3,6-10-7 Pb3(PO4)2 1,5-10-32
SrC2O4 5,6-10-8 AS2S3 4,1-10-29
SrCrO4 3,6-10-5 2,9-10-59
CdS 1,2-10-28 Mn(OH)2 4,0-10-14
CdCO3 1,82-10-14 MnS 1,1-10-15
Ba(OH)2 2,2-10-1 MnCO3 5,05-10-10
BaCO3 4,93-10-9 Fe(OH)2 1,65-10-15
BaSO4 9,9-10-n FeS 3,8-10—20
BaC2O4 1,7-10-7 FeCO3 2,11-10-u
BaCrO4 2,3-10-ю Fe(OH)3 4,0-10-38
Ваз(РО4)г 1,5-10-28 Co(OH)2 1,6-10-18
Hg2Cl2 2,0-10-18 CoS 3,1-10-23
Hg2Br2 1,3-10-21 CoCO3 1,45-10-13
Hg2I2 1,2-10-28 Ni(OH)2 8,7-10-19
Hg2CO3 9,0-10-17 NiS 1,4-10-24
HgS 4,0-10-53 NiCO3 1,35-10-7
Таблица 7
Константы нестойкости некоторых комплексных ионов
Диссоциация комплекса Константа нестойкости
[AgCl2]-^:Ag+ + 2Cl- 2,3-10-6
[Ag(NH3)2]+^Ag+ +2NH3 7,2-10-8
[AgS2O3]-^Ag++S2O32- 1,0-10-13
[Ag(CN)2]-^Ag+ + 2CN- 1-10-21
[CuCI4]2- Сц2+ + 4C1- 2,4-10-6
[Cu(NH3)4]2+^Cu2+ +4NH3 2,1-10-13
[Cu(CN)4]2— Сц2+ + 4CN- 5-10-28
(Zn(NH3)4]2+ ^>Zn2+ + 4NH3 3,5-10-Ю
[Zn(CN)4]2-;£Zn2+ + 4CN- 2-10-17
209
Продолжение табл. 7
Диссоциация комплекса Константа нестойкости
[Cd(NH3)4]2+ Cd2+ + 4NH3 [Cd(CN)4]2-^tCd2+ +4CN-[HgCI4]2- Hg2+ + 4C1- [HgBr4]2— Hg2+ + 4Bt~ [Hgl4]2- Hg2+ + 41-[Hg(CN)4]2-^t Hg2+ + 4CN-[Fe(CN)j]4— Fe2+ 6CN~ [Fe(CN) ]3-^> Fe3+ + 6CN~ [Co(NH3)6]2+ Co2+ + 6NH3 [Co(NH3)6]3+ Co3+ + 6XH3 [Ni(NH3)6]2+ ^>Ni2+ + 6NH3 1-10-7 1,4-10-17 6-10-17 2,2-10-22 5-10—31 4-10-42 1 • 10-37 1-10-м 7,8-10-6 6,2-10—66 1,8-10-9
Таблица 8
Нормальные потенциалы некоторых окислительно-восстановительных систем
Восстановленная форма Окисленная форма Нормальный потенциал, В Восстановленная форма Окисленная форма Нормаль-] иый потенциал, В
Li Li + —3,02 S sof- +0,45
Са Са2+ -2,87 I- 1/9 ь +0,53
Zn Zn2+ —0,76
Н2С2О4 СО-2 -0,49 МпО4- мпО7 +0,54
Fe Fe2+ -0,44 Н2О2 О2+2Н+ +0,662
СгЗ+ CrO?— —0,12* Fe2+ Fe3+ +0,771
2Вг- ВГ7 + 1,065
^2 2Н+ 0
H2S S +0,141 I- ЮГ + 1,085
Sn2+ S++ +0,15 Сг3+ Сг2Оу- + 1,36
S-Дз S4O2- +0,17 С1- V2 С12 + 1,36
so*- SO*- +0,20 Мп2 + МпО7 + 1,52
Си Cu +0,34 2F- F2 +2,85
* В щелочной среде.
210
Таблица 9
Плотность и процентный состав растворов кислот и щелочей Плотность растворов КОН и NaOH
Масс., % Плотность Масс., % Плотность
кон NaOH кон NaOH
1 1,008 1,010 27 1,259 —
2 1,018 1,021 28 1,270 1,306
3 1,027 1,032 29 1,280 —
4 1,036 1,043 30 1,291 1,328
5 1,045 1,054 31 1,301 —
6 1,051 1,065 32 1,312 1,349
7 1,064 1,076 33 1,322 —
8 1,073 1,087 34 1,333 1,370
9 1,082 1,098 35 1,344 —
10 1,092 1,109 36 1,355 1,390
11 1,101 — 37 1,366 —
12 1,111 1,131 38 1,377 1,410
13 1,120 — 39 1,388 —
14 1,130 1,153 40 1,399 1,430
15 1,140 — 41 1,410 —
16 1,149 1,175 42 1,421 1,449
17 1,159 — 43 1,433 —
18 1,169 1,197 44 1,444 1,469
19 1,179 —. 45 1,456 —-
20 1,188 1,219 46 1,467 1,487
21 1,198 - 47 1,479 -
22 1,208 1,241 48 1,491 1,507
23 1,218 — 49 1,503 —
24 . 1,229 1,263 50 1,514 1,525
25 1,239 — 51 1,526 —
26 1,249 - 1,285 52 1,538 —
Плотность растворов сильных
кислот
Масс., % Плотность Масс., % Плотность
HCI H.SO. HNO, НС1 H2SO4 HNO,
1 1,003 1,005 1,004 10 1,047 1,066 1,054
2 1,008 1,012 1,009 и — 1,073 1,060
3 — 1,018 1,015 12 1,057 1,080 1,066
4 1,018 1,025 1,020 13 — 1,087 1,072
5 — 1,032 1,026 14 1,068 1,095 1,078
б 1,028 1,038 1,031 15 — 1,102 1,084
7 — 1,045 1,037 16 1,078 1,109 1,090
8 1,038 1,052 1,043 17 — 1,117 1,096
9 — 1,059 1,049 18 1,088 1,124 1,103
211
Продолжение табл. 9
Масс., % Плотность Масс., % Плотность
НС1 H,SO4 HNO, НС1 H.SO, HNO,
19 1,132 1,109 60 1,498 1,367
20 1,098 1,139 1,115 61 1,509 1,372
21 1,147 1,121 62 1,520 1,377
22 1,108 1,155 1,128 63 1,531 1,382
23 1,163 1,134 64 1,542 1,387
24 1,119 1,170 1,140 65 1,553 1,391
25 1,178 1,147 66 1,565 1,396
26 1,129 1,186 1,153 67 1,576 1,400
27 1,194 1,160 68 1,587 1,405
28 1,139 1,202 1,167 69 1,599 1,409
29 1,210 1,173 70 1,611 1,413
30 1,149 1,219 1,180 71 1,622 1,418
31 1,227 1,187 72 1,634 1,422
32 1,159 1,235 1,193 73 1,646 1,426
33 1,243 1,200 74 1,657 1,430
34 1,169 1,252 1,207 75 1,669 1,434
35 1,260 1,214 76 1,681 1,438
36 1,179 1,268 1,221 77 1,693 1,441
37 1,277 1,227 78 1,704 1,445
38 1,189 1,286 1,234 79 1,716 1,449
39 1,294 1,240 80 1,727 1,452
40 1,198 1,303 1,246 81 1,738 1,456
41 1,312 1,253 82 1,749 1,459
42 1,321 1,259 83 1,759 1,462
43 1,329 1,266 84 1,769 1,466
44 1,338 1,272 85 1,779 1,469
45 1,348 1,278 86 1,787 1,472
46 1,357 1,285 87 1,795 1,475
47 1,366 1,291 яя 1,802 1,477
48 1,376 1,298 яс 1,809 1,480
49 1,385 1,304 QO 1,814 1,483
50 1,395 1,310 Q1 1,819 1,485
51 1,405 1,316 Q9 1,824 1,487
52 1,415 1,322 1,828 1,489
53 1,425 1,328 ад 1,831 1,491
54 1,435 1,334 ск 1,834 1,493
55 1,445 1,339 ан 1,836 1 495
56 1,456 1,345 Q7 1,836 1,497
57 1,466 1,351 ая 1,836 1,501
58 1,477 1,356 аа 1,834 1,506
59 1,488 1,361 100 1,831 1,513
212
Продолжение табл. 9
Плотность растворов уксусной кислоты
Масс., % Плотность Масс., % Плотность' Масс., % Плотность
0 0,998 34 1,043 68 1,068
1 1,000 35 1,044 69 1,068
2 1,001 36 1,045 70 1,069
3 1,002 37 1,046 71 1,069
4 1,004 38 1,047 72 1,069
5 1,006 39 1,048 73 1,069
6 1,007 40 1,049 74 1,069
7 1,008 41 1,050 75 1,070
8 1,010 42 1,051 76 1,070
9 1,011 43 1,052 77 1,070
10 1,013 44 1,053 78 1,070
И 1,014 45 1,053 79 1,070
12 1,015 46 1,054 80 1,070
13 1,017 47 1,055 81 1,070
14 1,018 48 1,056 82 1,070
15 1,020 49 1,057 83 1,070
16 1,021 50 1,058 84 1,069
17 1,022 51 1,058 85 1,069
18 1,024 52 1,059 86 1,069
19 1,025 53 1,060 87 1,068
20 1,026 54 1,060 88 1,068
21 1,028 55 1,061 89 1,067
22 1,029 56 1,062 90 1,066
23 1,030 57 1,062 91 1,065
24 1,031 58 1,063 92 1,064
25 1,033 59 1,064 93 1,063
26 1,034 60 1,064 94 1,062
27 1,035 61 1,065 95 1,061
28 1,036 62 1,065 96 1,059
29 1,037. 63 1,066 97 1,057
30 1,038 64 1,066 98 1,055
31 1,040 65 1,067 99 1,052
32 1,041 66 1,067 100 1,050
33 1,042 67 1,068
Плотность раствора аммиака
Масс., % Плотность Масс., % Плотность
1 0,994 16 0,936
2 0,990 18 0,930
4 0,981 20 0,923
6 0,973 22 0,916
8 0,965 24 0,910
10 0,958 26 0,904
12 0,950 28 0,898
14 0,943 30 0,892
213
214
Таблица 10
Калибровочная объемная масса воды
Стеклянный сосуд вместимостью точно 1 л при 20° С содержит при соответствующей температуре тга граммов воды, взвешенной в воздухе латунным разновесом
t /ПдО 1000 t /Идо 1000 t /Идо 1000 t /Идо 1000
0 0,99831 16,0 0,99781 20,8 0,99702 25,4 0,99604
1 0,99840 16,2 0,99778 21,0 0,99699 25,6 0,99600
2 0,99846 16,4 0,99776 21,2 0,99695 25,8 0,99595
3 0,99851 16,6 0,99773 21,4 0,99691 26,0 0,99590
4 0,99854 16,8 0,99770 21,6 0,99687 26,2 0,99585
-5 0,99856 17,0 0,99767 21,8 0,99683 26,4 0,99580
6 0,99856 17,2 0,99764 22,0 0,99679 26,6 0,99575
7 0,99855 17,4 0,99761 22,2 0,99675 26,8 0,99570
8 0,99852 17,6 0,99758 22,4 0,99671 27,0 0,99565
9 0,99848 17,8 0,99755 22,6 0,99666 27,2 0,99560
10 0,99842 18,0 0,99751 22,8 0,99662 27,4 0,99555
11 0,99835 18,2 0,99748 23,0 0,99658 27,6 0,99550
12 0,99827 18,4 0,99745 23,2 0,99654 27,8 0,99545
13 0,99817 18,6 0,99742 23,4 0,99649 28,0 0,99540
14 0,99806 18,8 0,99738 23,6 0,99645 28,2 0,99535
14,2 0,99804 19,0 0,99735 23,8 0,99641 28,4 0,99529
14,4 0,99802 19,2 0,99731 24,0 0,99636 28,6 0,99524
14,6 0,99799 19,4 0,99728 24,2 0,99632 28,8 0,99519
14,8 0,99797 19,6 0,99724 24,4 0,99627 29,0 0,99514
15,0 0,99794 19,8 0,99721 24,6 0,99623 29,2 0,99508
15,2 0,99792 20,0 0,99717 24,8 0,99618 29,4 0,99503
15,4 0,99789 20,2 0,99714 25,0 0,99614 29,6 0,99497
15,6 0,99787 20,4 0,99710 25,2 0,99609 29,8 0,99492
15,8 0,99784 20,6 0,99706
215
! Числа i 0 1 2 3 4 5
10 0000 0043 0086 0128 0170 0212
и 0414 0453 0492 0531 0569 0607
12 0792 0828 0864 0899 0934 0969
13 1139 1173 1206 1239 1271 1303
14 1461 1492 1523 1553 1584 1614
15 1761 1790 1818 1847 1875 1903
16 2041 2068 2095 2122 2148 2175
17 2304 2330 2355 2380 2405 2430
18 2553 2577 2601 2625 2648 2672
19 2788 2810 2833 2856 2878 2900
20 ЗОЮ 3032 3054 3075 3096 3118
21 3222 3243 3263 3284 3304 3324
22 3424 3444 3464 3483 3502 3522
23 3617 3636 3655 3674 3692 3711
24 3802 3820 3838 3856 3874 3892
Таблица 11
Логарифмы
6 7 8 9 Пропорциональные части
1 2 3 4 5 6 7 8 9
0253 0294 0334 0374 4 8 12 17 21 25 29 33 37
0645 0682 0719 0755 4 8 11 15 19 23 26 30 34
1004 1038, 1072 1106 3 7 10 14 17 21 24 28 31
1335 1367 1399 1430 3 6 10 13 16 19 23 26 29
1644 1673 1703 1732 3 6 9 12 15 18 21 24 27
1931 1959 1987 2014 3 6 8 11 14 17 20 22 25
2201 2227 2253 2279 3 5 8 11 13 16 18 21 24
2455 2480 2504 2529 2 5 7 10 12 15 17 20 22
2695 2718 2742 2765 2 5 7 9 12 14 16 19 21
2923 2945 2967 2989 2 4 7 9 И 13 16 18 20
3139 3160 3181 3201 2 4 6 8 11 13 15 17 19
3345 3365 3385 3404 2 4 6 8 10 12 14 16 18
3541 3560 3579 3598 2 4 6 8 10 12 14 15 17
3729 3747 3766 3784 2 4 6 7 9 И 13 15 17
3909 3927 3945 3962 2 4 5 7 9 11 12 14 16
Продолжение табл. 11
216
Числа 0 1 2 3 4 5 6 7 8 9 Пропорциональные части
1 2 3 4 5 6 7 8 9
25 3979 3997 4014 4031 4048 4065 4082 4099 4116 4133 2 3 5 7 9 10 12 14 15
26 4150 4166 4183 4200 4216 4232 4249 4265 4281 4298 2 3 5 7 8 10 И 13 15
27 4314 4330 4346 4362 4378 4393 4409 4425 4440 4456 2 3 5 6 8 9 И 13 14
28 4472 4487 4502 4518 4533 4548 4564 4579 4594 4609 2 3 5 6 8 9 11 12 14
29 4624 4639 4654 4669 4683 4698 4713 4728 4742 4757 1 3 4 6 7 9 10 12 13
30 4771 4786 4800 4814 4829 4843 4857 4871 4886 4900 1 3 4 6 7 9 10 11 13
31 4914 4928 4942 4955 4969 4983 4997 5011 5024 5038 1 3 4 6 7 8 10 11 12
32 5051 5065 5079 5092 5105 5119 5132 5145 5159 5172 1 3 4 5 7 8 9 11 12
33 5185 5198 5211 5224 5237 5250 5263 5276 5289 5302 1 3 4 5 6 8 9 10 12
34 5315 5328 5340 5353 5366 5378 5391 5403 5416 5428 1 3 4 5 6 8 9 10 11
35 5441 5453 5465 5478 5490 5502 5514 5527 5539 5551 1 2 4 5 6 7 9 10 11
36 5563 5575 5587 5599 5611 5623 5635 5647 5658 5670 1 2 4 5 6 7 8 10 11
37 5682 5694 5705 5717 5729 5740 5752 5763 5775 5786 I 2 3 5 6 7 8 9 10
38 5798 5809 5821 5832 5843 5855 5866 5877 5888 5899 1 2 3 5 6 7 8 9 10
39 5911 5922 5933 5944 5955 5966 5977 5988 5999 6010 1 2 3 4 5 7 8 9 10
40 6021 6031 6042 6053 6064 6075 6085 6096 6107 6117 1 2 3 4 5 6 8 9 10
41 6128 6138 6149 6160 6170 6180 6191 6201 6212 6222 1 2 3 4 5 6 7 8 9
42 6232 6243 6253 6263 6274 6284 6294 6304 6314 6325 1 2 3 4 5 6 7 8 9
43 6335 6345 6355 6365 6375 6385 6395 6405 6415 6425 1 2 3 4 5 6 7 8 9
44 6435 6444 6454 6464 6474 6484 6493 6503 6513 6522 1 2 3 4 5 6 7 8 9
Продолжение табл. 11
Пропорциональные части
СО 0 1 2 3 4 5 6 7 8 9 1 2 3 4 5 6 7 8 9
X
45 6532 6542 6551 6561 6571 6580 6590 6599 6609 6618 1 2 3 4 5 6 7 8 9
46 6628 6637 6646 6656 6665 6675 6684 6693 6702 6712 1 2 3 4 5 6 7 7 8
47 6721 6730 6739 6749 6758 6767 6776 6785 6794 6803 1 2 3 4 5 5 6 7 8
48 6812 6821 6830 6839 6848 6857 6866 6875 6884 6893 1 2 3 4 4 5 6 7 8
49 6902 6911 6920 6928 6937 6946 6955 6964 6972 6981 1 2 3 4 4 5 6 7 8
50 6990 6998 7007 7016 7024 7033 7042 7050 7059 7067 1 2 3 3 4 5 6 7 8
51 7076 7084 7093 7101 7110 7118 7126 7135 7143 7152 1 2 3 3 4 5 6 7 8
52 7160 7168 7177 7185 7193 7202 7210 7218 7226 7235 1 2 2 3 4 5 6 7 7
53 7243 7251 7259 7267 7275 7284 7292 7300 7308 7316 1 2 2 3 4 5 6 б 7
54 7324 7332 7340 7348 7356 7364 7372 7380 7388 7396 1 2 2 3 4 5 6 б 7
55 7404 7412 7419 7427 7435 7443 7451 7459 7466 7474 1 2 2 3 4 5 5 6 7
56 7482 7490 7497 7505 7513 7520 7528 7536 7543 7551 1 2 2 3 4 5 5 О 7
57 7559 7566 7574 7582 7589 7597 7604 7612 7619 7627 1 2 2 3 4 5 5 6 7
58 7634 7642 7649 7657 7664 7672 7679 7686 7694 7701 1 1 2 3 4 4 5 б 7
59 7709 7716 7723 7731 7738 7745 7752 7760 7767 7774 1 1 2 3 4 4 5 б 7
60 7782 7789 7796 7803 7810 7818 7825 7832 7839 7846 1 1 2 3 4 4 5 6 6
61 7853 7860 7868 7875 7882 7889 7896 7903 7910 7917 1 1 2 3 4 4 5 О О
62 7924 7931 7938 7945 7952 7959 7966 7973 7980 7987 1 1 2 3 3 4 5 О О
63 7993 8000 8007 8014 8021 8028 8035 8041 8048 8055 1 1 2 3 3 4 5 5 О
64 8062 8069 8075 8082 8089 8096 8102 8109 8116 8122 1 1 2 3 3 4 5 5 О
to
Нппдплм'.риир табл //
Пропорциональные части —
0 1 2 3 4 5 6 7 8 9
5- 1 2 3 4 5 6 7 81 9
65 8129 8136 8142 8149 8156 8162 8169 8176 8182 8189 1 1 1 1 1 1 2 з Q A r ft
66 8195 8202 8209 8215 8222 8228 8235 8241 8248 8254 2 2 з з A cr D e 0 ft
67 8261 8267 8274 8280 8287 8293 8299 8306 8312 8319 1 Q Q A 5 A 0 0
68 8325 8331 8338 8344 8351 8357 8363 8370 8376 8382 1 2 3 3 A 5 0 ft
69 8388 8395 8401 8407 8414 8420 8426 8432 8439 8445 1 1 2 2 3 4 4 0 5 0 6
70 8451 8457 8463 8470 8476 8482 8488 8494 8500 8506 1 1 1 1 1 2 9 3 A A e
71 72 73 8513 8573 8633 8519 8579 8639 8525 8585 8645 8531 8591 8651 8537 8697 8657 8543 8603 8663 8549 8609 8669 8555 8615 8675 8561 8621 8681 8567 8627 8686 1 1 1 2 2 2 2 2 2 3 3 3 4 4 4 4 4 4 0 5 5 e 0 5 5
74 8692 8698 8704 87Ю 8716 8722 8727 8733 8739 8745 1 1 2 2 3 4 4 0 5 Э 5
75 8751 8756 8762 8768 8774 8779 8785 8791 8797 8802 1 1 2 2 3 3 4 s 5
76 8808 8814 8825 8831 8837 8842 8848 8854 8859 1 1 2 2 3 3 4
77 8865 8871 8876 8882 8887 8893 8899 8904 8910 8915 1 1 2 2 3 3 4 A
78 8921 8927 8932 8938 8943 8949 8954 8960 8965 8971 1 1 2 2 3 3 4 A 0 5 5
79 8976 8982 8987 8993 8998 9004 9009 9015 9020 9025 1 1 2 2 3 3 4 4
80 9031 9036 9042 9047 9053 9058 9063 9069 9074 9079 1 1 2 2 3 3 4 A e
sl 9085 9090 9096 9101 9106 9112 9117 9122 9128 9133 1 1 2 2 3 3 4 A
82 9138 9143 9149 9154 9159 9165 9170 9175 9480 9186 1 1 1 2 2 3 3 4 A D e
83 9191 9196 9201 9206 9212 9217 9222 9227 9232 9238 1 2 2 3 3 4 4 к
84 9243 9248 9253 9258 9263 9269 9274 9279 9284 9289 1 1 2 2 3 3 4 4 5
219
Числа 0 1 2 3 4 5 6 7
85 9294 9299 9304 9309 9315 9320 9325 9330
86 9345 9350 9355 9360 9365 9370 9375 9380
87 9395 9400 9405 9410 9415 9420 9425 9430
88 9445 9450 9455 9460 9465 9469 9474 9479
89 9494 9499 9504 9509 9513 9518 9523 9528
90 9542 9547 9552 9557 9562 9566 9571 9576
91 9590 9595 9600 9605 9609 9614 9619 9624
92 9638 9643 9647 9652 9657 9661 9666 9671
93 9685 9689 9694 9699 9703 9708 9713 9717
94 9731 9736 9741 9745 9750 9754. 9759 9763
95 9777 9782 9786 9791 9795 9800 9805 9809
96 9823 9827 9832 9836 9841 9845 9850 9854
97 9868 9872 9877 9881 9886 9890 9894 9899
98 9912 9917 9921 9926 9930 9934 9939 9943
99 9956 9961 9965 9969 9974 9978 9983 9987
Продолжение табл. 11
8 9 Пропорциональные часки
1 2 3 4 5 6 7 8 9
9335 9340 1 1 2 2 3 3 4 4 5
9385 9390 1 1 2 2 3 3 4 4 5
9435 9440 0 1 1 2 2 3 3 4 4
9484 9489 0 1 1 2 2 3 3 4 4
9533 9538 0 1 1 2 2 3 3 4 4
9581 9586 0 1 1 2 2 3 3 4 4
9628 9633 0 1 1 2 2 3 3 4 4
9675 9680 0 1 1 2 2 3 3 4 4
9722 9727 0 1 1 2 2 3 3 4 4
9768 9773 0 1 1 2 2 3 3 4 4
9814 9818 0 1 1 2 2 3 3 4 4
9859 9863 0 1 1 2 2 3 3 4 4
9903 9908 0 1 1 2 2 3 3 4 4
9948 9952 0 1 1 2 2 3 3 4 4
9991 9996 0 1 1 2 2 3 3 3 4
Логарифмы 0 1 2 3 4 5
,00 1000 1002 1005 1007 1009 1012
,01 1023 1026 1028 1030 1033 1035
.02 1047 1050 1052 1054 1057 1059
,03 1072 1074 1076 1079 1081 1084
,04 1096 1099 1102 1104 1107 1109
,05 1122 1125 1127 ИЗО 1132 1135
,06 1148 1151 1153 1156 1159 1161
.07 1175 1178 1180 1183 1186 1189
,08 1202 1205 1208 1211 1213 1216
.09 1230 1233 1236 1239 1242 1245
,ю 1259 1262 1265 1268 1271 1274
.11 1288 1291 1294 1297 1300 1303
,12 1318 1321 1324 1327 1330 1334
.13 1349 1352 1355 1358 1361 1365
,14 1380 1384 1387 1390 1393 1396
,15 1413 1416 1419 1422 1426 1429
,16 1445 1449 1452 1455 1459 1462
,17 1479 1483 1486 1489 1493 1496
,18 1514 1517 1521 1524 1528 1531
,19 1549 1552 1556 1560 1563 1567
Таблица 12
Антилогарифмы
6 7 8 9 Пропорциональные части
1 2 3 4 5 6 7 8 9
1014 1016 1019 1021 0 0 1 1 1 1 2 2 2
1038 1040 1042 1045 0 0 1 1 1 1 2 2 2
1062 1064 1067 1069 0 0 1 1 1 1 2 2 2
1086 1089 1091 1094 0 0 1 1 1 1 2 2 2
1112 1114 1117 1119 0 1 1 1 1 2 2 2 2
1138 1140 1143 1146 0 1 1 1 1 2 2 2 2
1164 1167 1169 1172 0 1 1 1 1 2 2 2 2
1191 1194 1197 1199 0 1 1 1 1 2 2 2 2
1219 1222 1225 1227 0 1 1 1 1 2 2 2 3
1247 1250 1253 1256 0 1 1 1 1 2 2 2 3
1276 1279 1282 1285 0 1 1 1 1 2 2 2 3
1306 1309 1312 1315 0 1 1 1 2 2 2 2 3
1337 1340 1343 1346 0 1 1 1 2 2 2 2 3
1368 1371 1374 1377 0 1 1 1 2 2 2 3 3
1400 1403 1406 1409 0 1 1 1 2 2 2 3 3
1432 1435 1439 1442 0 1 1 1 2 2 2 3 3
1466 1469 1472 1476 0 1 1 1 2 2 2 3 3
1500 1503 1507 1510 0 1 1 1 2 2 2 3 3
1535 1538 1542 1545 0 1 1 1 2 2 2 3 3
1570 1574 1578 1581 0 1 1 1 2 2 3 3 3
Продолжение табл. 12
. Логарифмы 0 1 2 3 4 5 6 7 8 9 Пропорциональные части
1 2 3 4 5 6 7 8 9
,20 1585 1589 1592 1596 1600 1603 1607 1611 1614 1618 0 1 1 1 2 2 3 3 3
,21 1622 1626 1629 1633 1637 1641 1644 1648 1652 1656 0 1 1 2 2 2 3 3 3
,22 1660 1563 1667 1671 1675 1679 1683 1687 1690 1694 0 1 1 2 2 2 3 3 3
,23 1698 1702 1706 1710 1714 1718 1722 1726 1730 1734 0 1 1 2 2 2 3 3 4
,24 1738 1742 1746 1750 1754 1758 1762 1766 1770 1774 0 1 1 2 2 2 3 3 4
,25 1778 1782 1786 1791 1795 1799 1803 1807 1811 1816 0 1 1 2 2 2 3 3 4
,26 1820 1824 1828 1832 1837 1841 1845 1849 1854 1858 0 1 1 2 2 3 3 3 4
,27 1862 1866 1871 1875 1879 1884 1888 1892 1897 1901 0 1 1 2 2 3 3 3 4
,28 1905 1910 1914 1919 1923 1928 1932 1936 1941 1945 0 1 1 2 2 3 3 4 4
,29 1950 1954 1959 1963 1968 1972 1977 1982 1986 1991 0 1 1 2 2 3 3 4 4
,30 1995 2000 2004 2009 2014 2018 2023 2028 2032 2037 0 1 1 2 2 3 3 4 4
,31 2042 2046 2051 2056 2061 2065 2070 2075 2080 2084 0 1 1 2 2 3 3 4 4
,32 2089 2094 2099 2104 2109 2113 2118 2123 2128 2133 0 1 1 2 2 3 3 4 4
,33 2138 2143 2148 2153 2158 2163 2168 2173 2178 2183 0 1 1 2 2 3 3 4 4
,34 2188 2193 2198 2203 2208 2213 2218 2223 2228 2234 1 1 2 2 3 3 4 4 5
,35 2239 2244 2249 2254 2259 2265 2270 2275 2280 2286 1 1 2 2 3 3 4 4 5
,36 2291 2296 2301 2307 2312 2317 2323 2328 2333 2339 1 1 2 2 3 3 4 4 5
,37 2344 2350 2355 2360 2366 2371 2377 2382 2388 2393 1 1 2 2 3 3 4 4 5
,38 2399 2404 2410 2415 2421 2427 2432 2438 2443 2449 1 1 2 2 3 3 4 4 5
ю »39 го 2455 2460 2465 2472 2477 2483 2489 2495 2500 2506 1 1 2 2 3 3 4 5 5
№
Логариф-
Продолжение табл. /2
Пропорциональные части
а 0 1 2 3 4 ь 6 7 8 9 1 2 3 4 5 S 7 8 9
,40 2512 2518 2523 2529 2535 2541 2547 2553 2559 2564 1 1
,41 2570 2576 2582 2588 2594 2600 2606 2612 2618 2624 1 1
,42 2630 2636 2642 2649 2655 2661 2667 2673 2679 2685 1 1
,43 2692 2698 2704 27)0 2716 2723 2729 2735 2742 2748 1 1
,44 2754 2761 2767 2773 2780 2786 2793 2799 2805 2812 1 1
,45 2818 2825 2831 2838 2844 2851 2858 2864 2871 2877 1 1
,46 2884 2891 2897 2904 2911 2917 2924 2931 2938 2944 1 1
,47 2951 2958 2965 2972 2979 2985 2992 2999 3006 3013 1 1
,48 3020 3027 3034 3041 3048 3055 3062 3069 3076 3083 1 1
,49 3090 3097 ' 3105 3112 3119 3126 3133 3141 3148 3155 1 1
,50 3162 3170 3177 3184 3192 3199 3206 3214 3221 3228 1 1
,51 3236 3243 3251 3258 3266 3273 3281 3289 3296 3304 1 2
,52 3311 3319 3327 3334 3342 3350 3357 3365 3373 3381 1 2
,53 3388 3396 3404 3412 3420 3428 3436 3443 3451 3459 1 2
,54 3467 3475 3483 3491 3499 3508 3516 3524 3532 3540 1 2
,55 3548 3556 3565 3573 3581 3589 3597 3606 3614 3622 ' 1 2
,56 3631 3639 3648 3656 3664 3673 3681 3690 3698 3707 I 2
,57 3715 3724 3733 3741 3750 3758 3767 3776 3784 3793 1 2
,58 3802 3811 3819 3828 3837 3846 3855 3864 3873 3882 1 2
,59 3890 3899 3908 3917 3926 3936 3945 3954 3963 3972 1 2
Продолжение табл. 12
to
Логарифмы 0 1 2 3 4 5 G 7 8 9 Пропорциональные части
1 2 3 4 5 6 7 8 9
,60 3981 3990 3999 4009 4018 4027 4036 4046 4055 4064- 1 2 3 4 5 6 6 7 8
,61 4074 4083 4093 4102 4111 4121 4130 4140 4150 4159 1 2 3 4 5 6 7 8 9
,62 4169 4178 4188 4198 4207 4217 4227 4236 4246 4256 1 2 3 4 5 6 7 8 9
,63 4266 4276 4285 4295 4305 4315 4325 4335 4345 4355 1 2 3 4 5 6 7 8 9
,64 4365 4375 4385 4395 4406 4416 4426 4436 4446 4457 1 2 3 4 5 6 7 8 9
,65 4467 4477 4487 4498 4508 4519 4529 4539 4550 4560 1 2 3 4 5 6 7 8 9
,66 4571 4581 4592 4603 4613 4624 4634 4645 4656 4667 1 2 3 4 5 6 7 9 10
,67 4677 4688 4699 4710 4721 4732 4742 4753 4764 4775 1 2 3 4 5 7 8 9 10
,68 4786 4797 4808 4819 4831 4842 4853 4864 4875 4887 1 2 3 4 6 7 8 9 10
,69 4898 4909 4920 4932 4943 4955 4966 4977 4989 5000 1 2 3 5 6 7 8 9 10
,70 5012 5023 5035 5047 5058 5070 5082 5093 5105 5117 1 2 4 5 6 7 8 9 11
71 5129 5140 5152 5164 5176 5188 5200 5212 5224 5236 1 2 4 5 6 7 8 10 11
,72 5248 5260 5272 5284 5297 5309 5321 5333 5346 5358 1 2 4 5 6 7 9 10 11
,73 5370 5383 5395 5408 5420 5433 5445 5458 5470 5483 1 3 4 5 6 8 9 10 1 1
,74 5495 5508 5521 5534 5546 5559 5572 5585 5598 5610 1 3 4 5 6 8 9 10 12
,75 5623 5636 5649 5662 5675 5689 5702 5715 5728 5741 1 3 4 5 7 9 9 10 12
,76 5754 5768 5781 5794 5808 5821 5834 5848 5861 5875 1 3 4 5 7 8 9 11 12
77 5888 5902 5916 5929 5943 5957 5970 5984 5998 6012 1 3 4 5 7 8 10 11 Г2
78 6026 6039 6053 6067 6081 6095 6109 6124 6138 6152 1 3 4 6 7 8 10 11 13
,79 6166 6180 6194 6209 6223 6237 6252 6266 6281 6295 1 3 4 6 7 9 10 11 13
Продолжение табл. 12
224
Логарифмы 0 1 2 3 4 5 6 7 8 9 Пропорциональные части
1 2 3 4 5 6 7 8 9
,80 6310 6324 6339 6353 6368 6383 6397 6412 6427 6442 1 3 4 6 7 9 10 12 13
,81 6457 6471 6486 6501 6516 6531 6546 6561 6577 6592 2 3 5 6 8 9 и 12 14
,82 6607 6622 6637 6653 6668 6683 6699 6714 6730 6745 2 3 5 6 8 9 и 12 14
,83 6761 6776 6792 6808 6823 6839 6855 6871 6887 6902 2 3 5 6 8 9 11 13 14
,84 6918 6934 6950 6966 6982 6998 7015 7031 7047 7063 2 3 5 6 8 10 и 13 15
,85 7079 7096 7112 7129 7145 7161 7178 7194 7211 7228 2 3 5 7 8 10 12 13 15
,86 7244 7261 7278 7295 7311 7328 7345 7362 7379 7396 2 3 5 7 8 10 12 13 15
,87 7413 7430 7447 7464 7482 7499 7516 7534 7551 7568 2 3 5 7 9 10 12 14 16
,88 7586 7603 7621 7638 7656 7674 7691 7709 7727 7745 2 4 5 7 9 11 12 14 16
,89 7762 7780 7798 7816 7834 7852 7870 7889 7907 7925 2 4 5 7 9 11 13 14 16
,90 7953 7962 7980 7998 8017 8035 8054 8072 8091 8110 2 4 6 7 9 и 13 15 17
,91 8128 8147 8166 8185 8204 8222 8241 8260 8279 8299 2 4 6 8 9 и 13 15 17
,92 8318 8337 8356 8375 8395 8414 8433 8453 8472 8492 2 4 6 8 10 12 14 15 17
,93 8511 8531 8551 8570 8590 8610 8633 8650 8670 8690 2 4 6 8 10 12 14 16 18
,94 8710 8730 8750 8770 8790 8810 8831 8851 8872 8892 2 4 6 8 10 12 14 16 18
,95 8913 8933 8954 8974 8995 9016 9036 9057 9078 9099 2 4 6 8 10 12 15 17 19
,96 9120 9141 9162 9183 9204 9226 9247 9268 9290 9311 2 4 6 8 И 13 15 17 19
,97 9333 9354 9376 9397 9419 9441 9462 9484 9506 9528 2 4 7 9 11 13 15 17 20
,98 9550 9572 9594 9616 9638 9661 9683 9705 9727 9750 2 4 7 9 11 13 16 18 20
,99 9772 9795 9817 9840 9863 9886 9908 9931 9954 9977 2 5 7 9 и 14 16 18 20
fe'. '