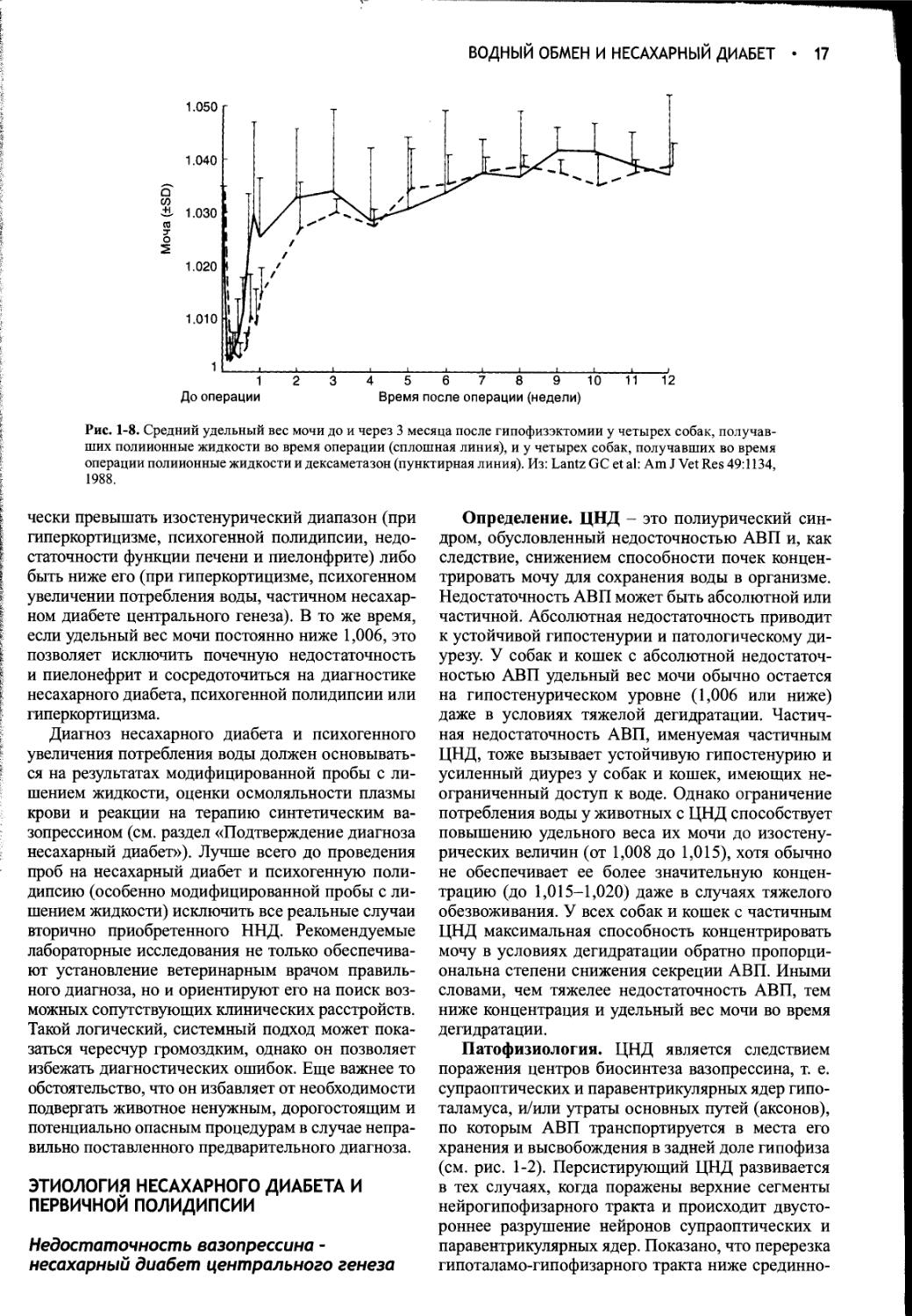
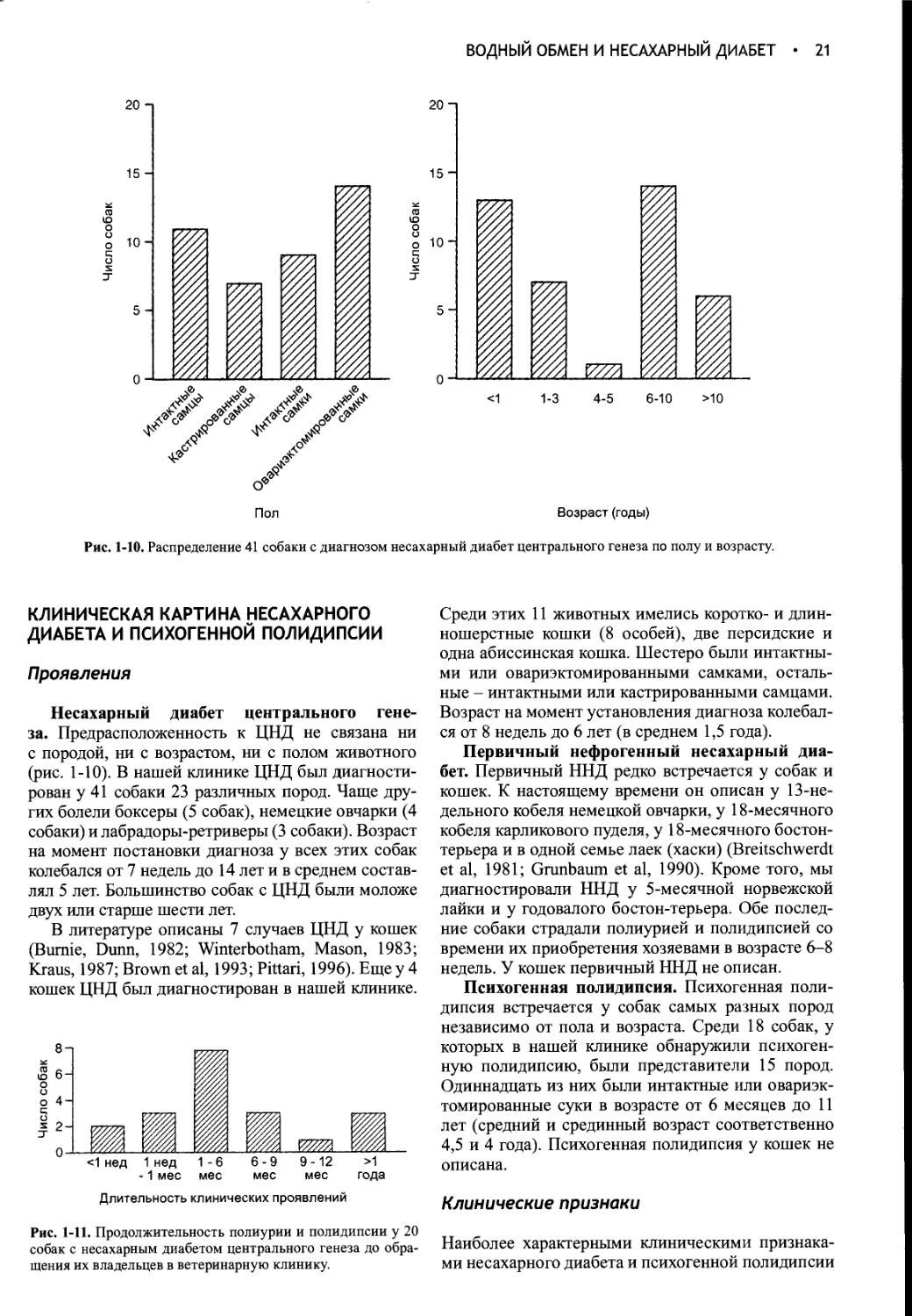
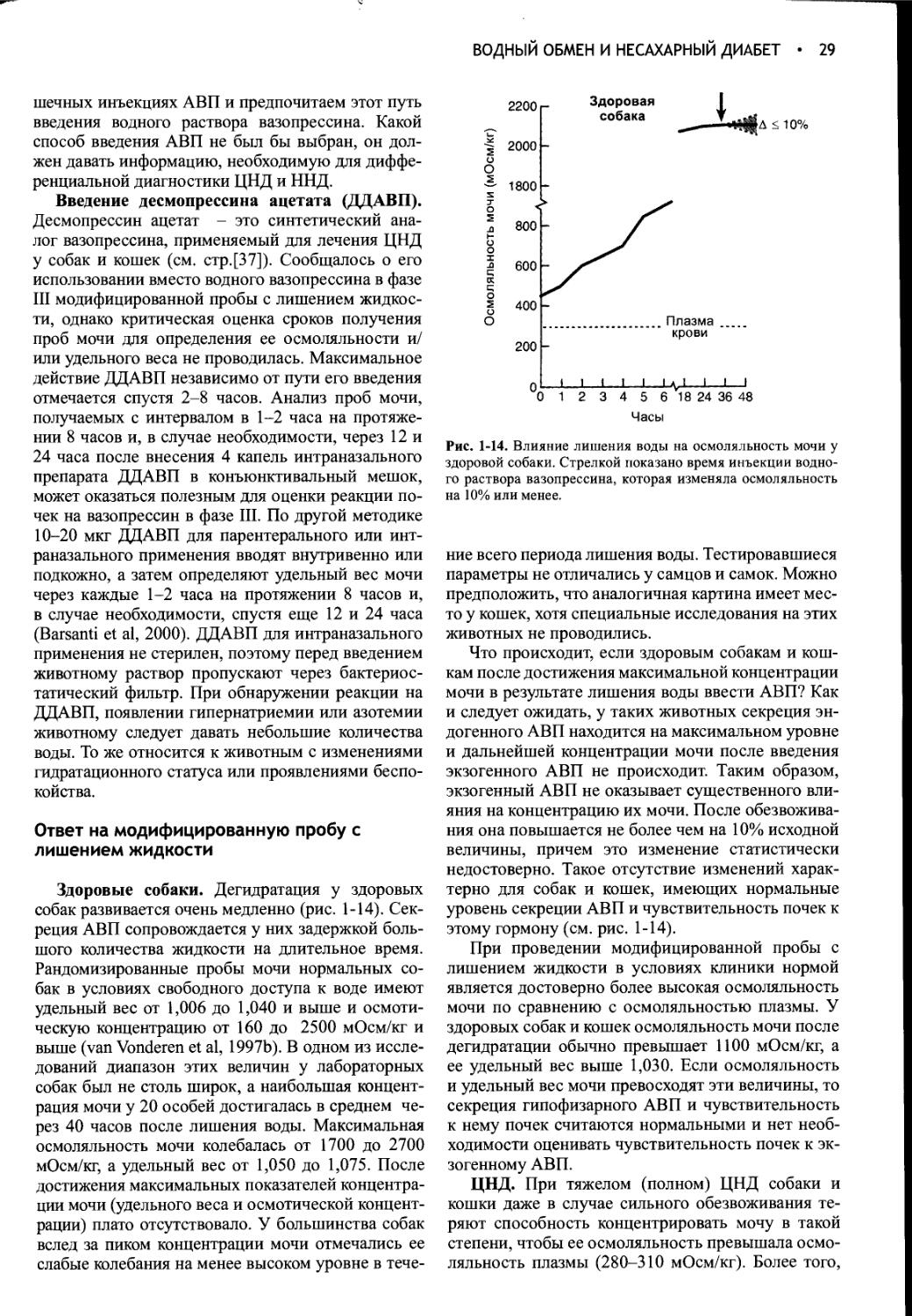
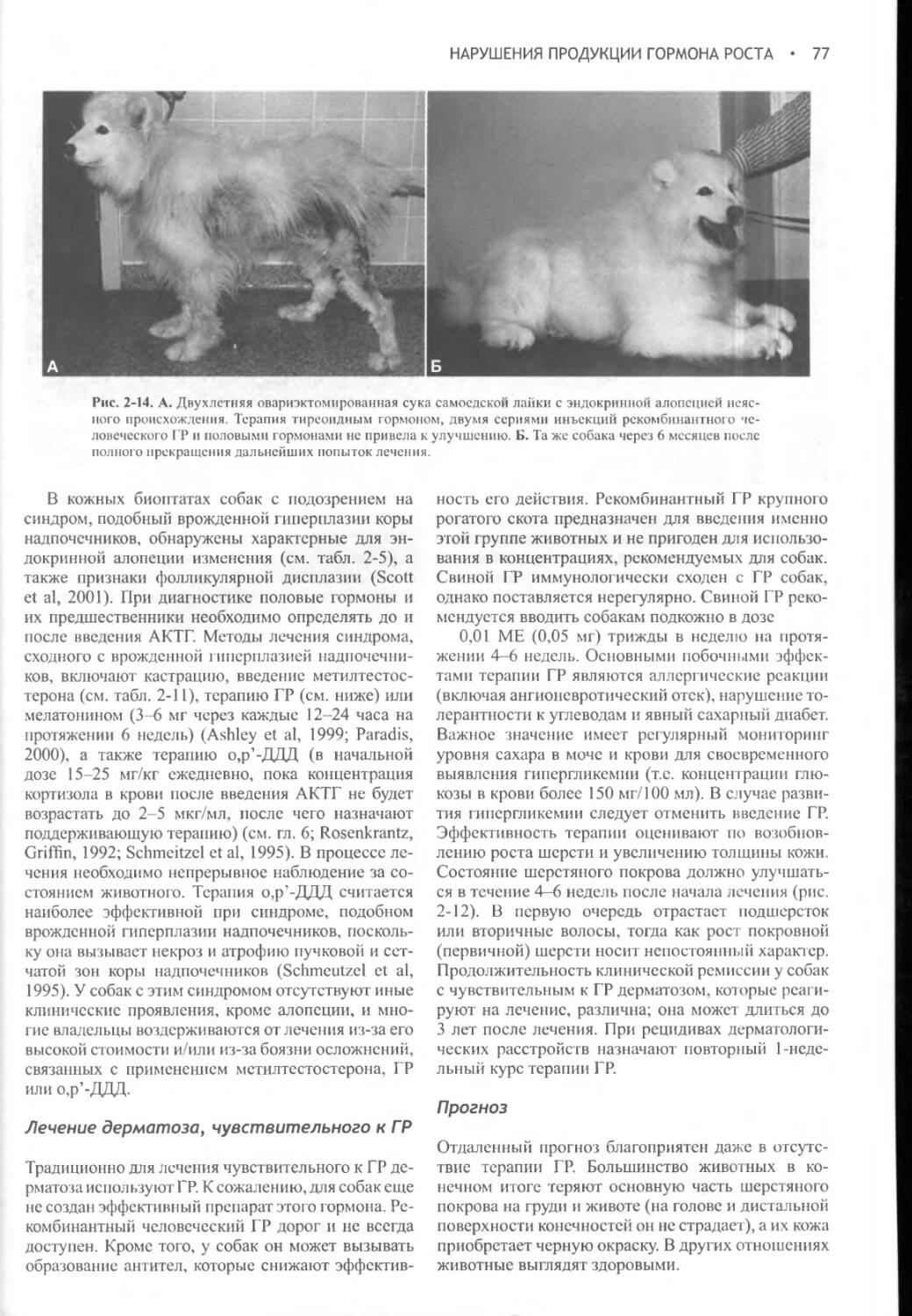
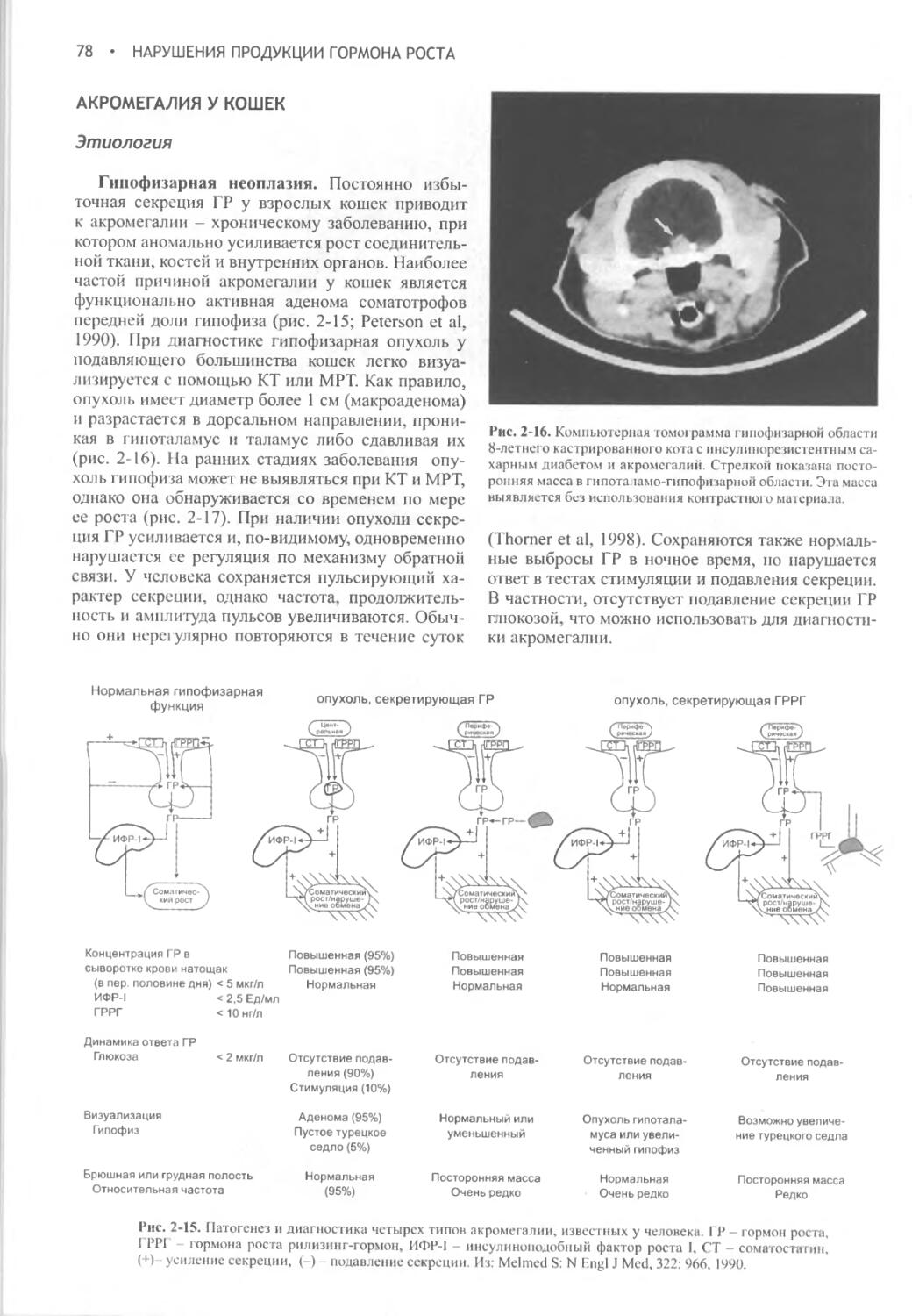
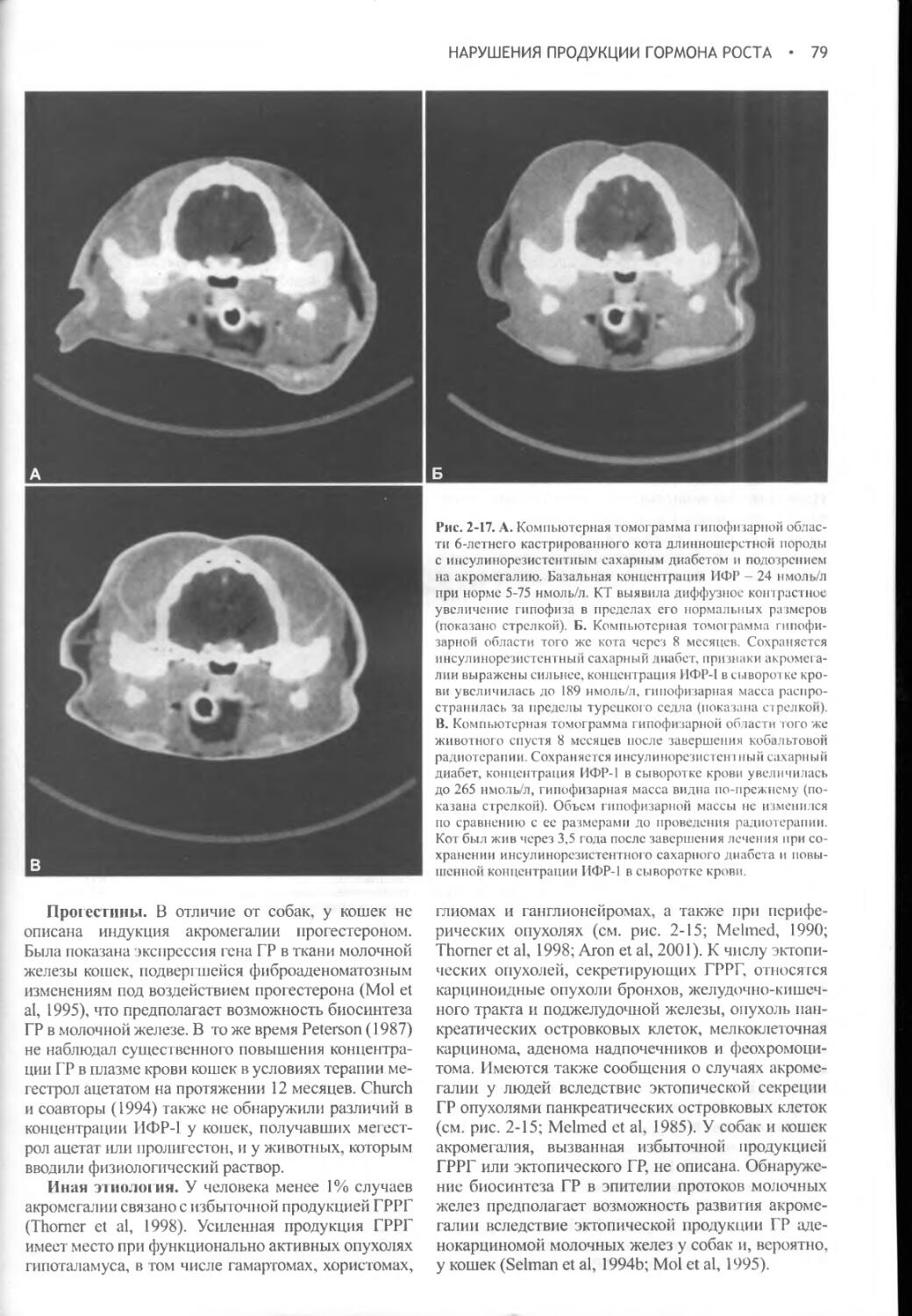
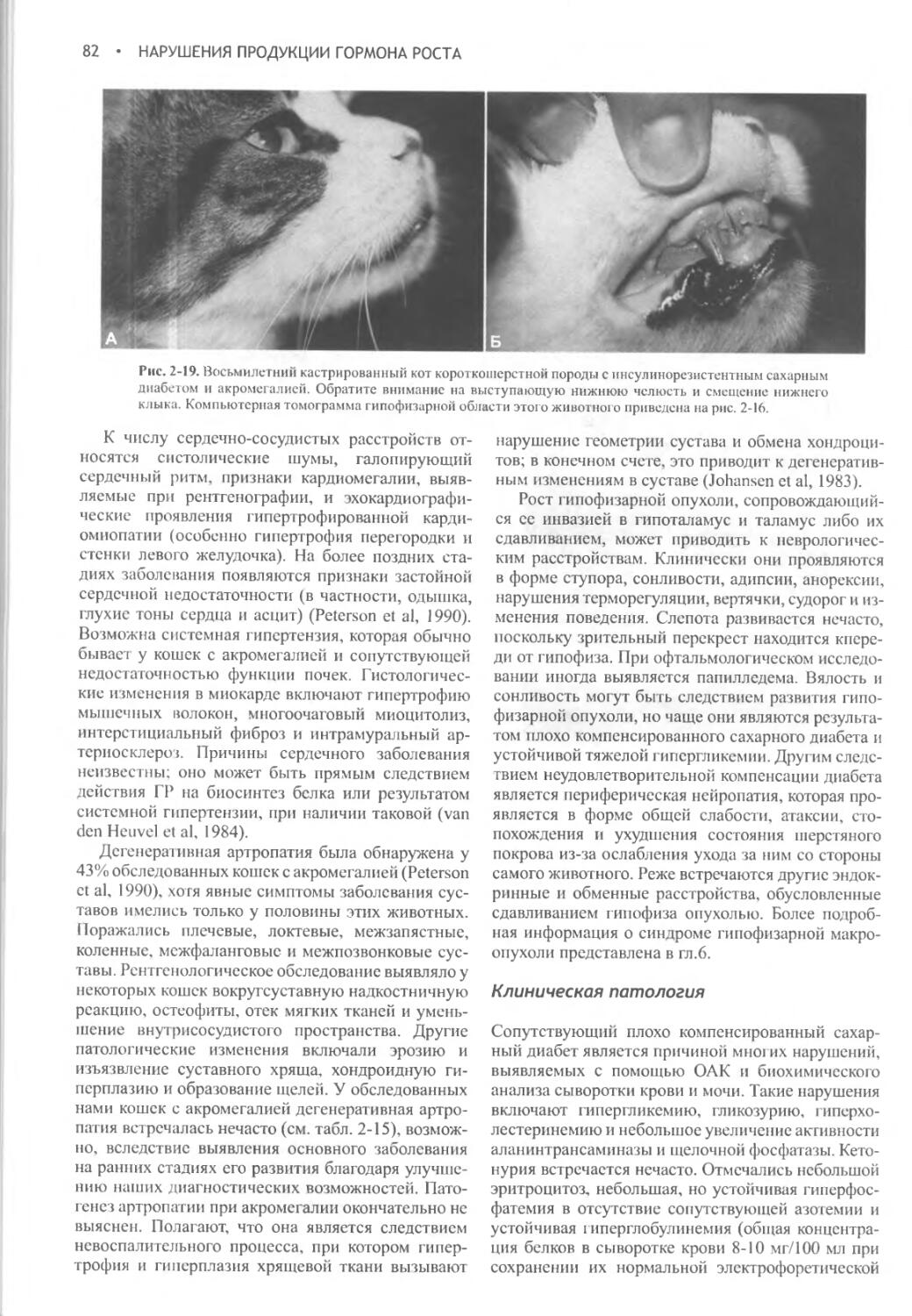
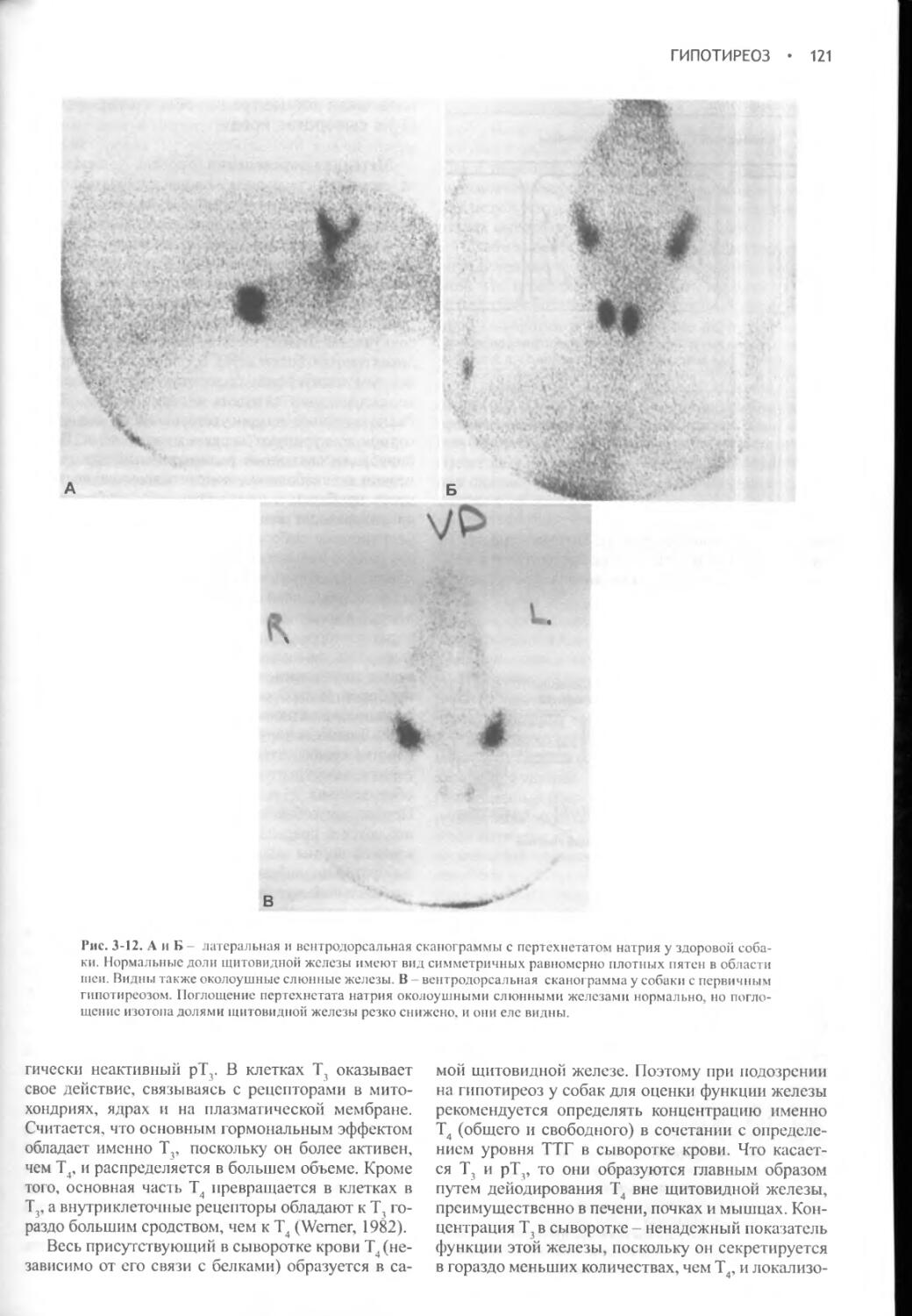
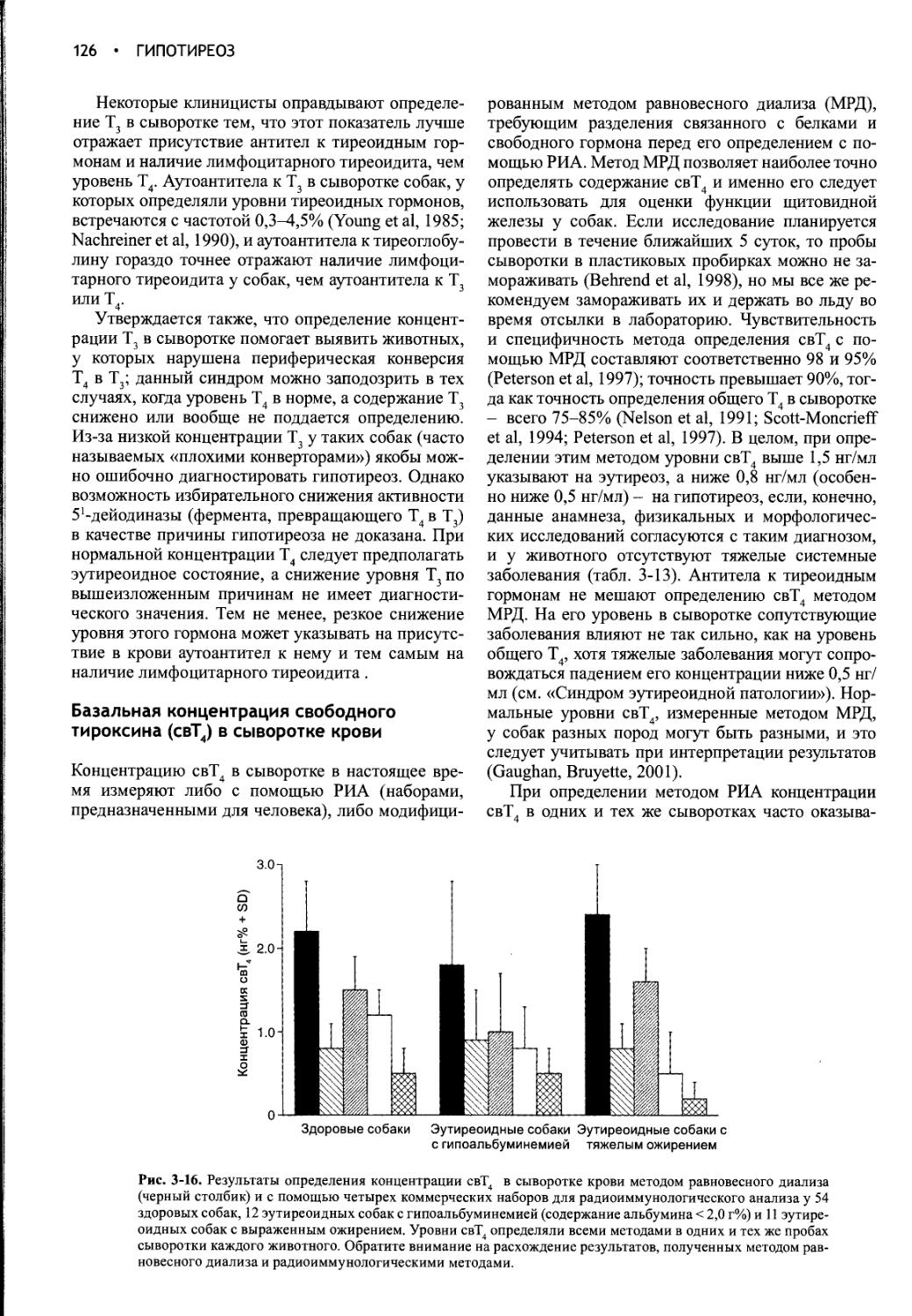
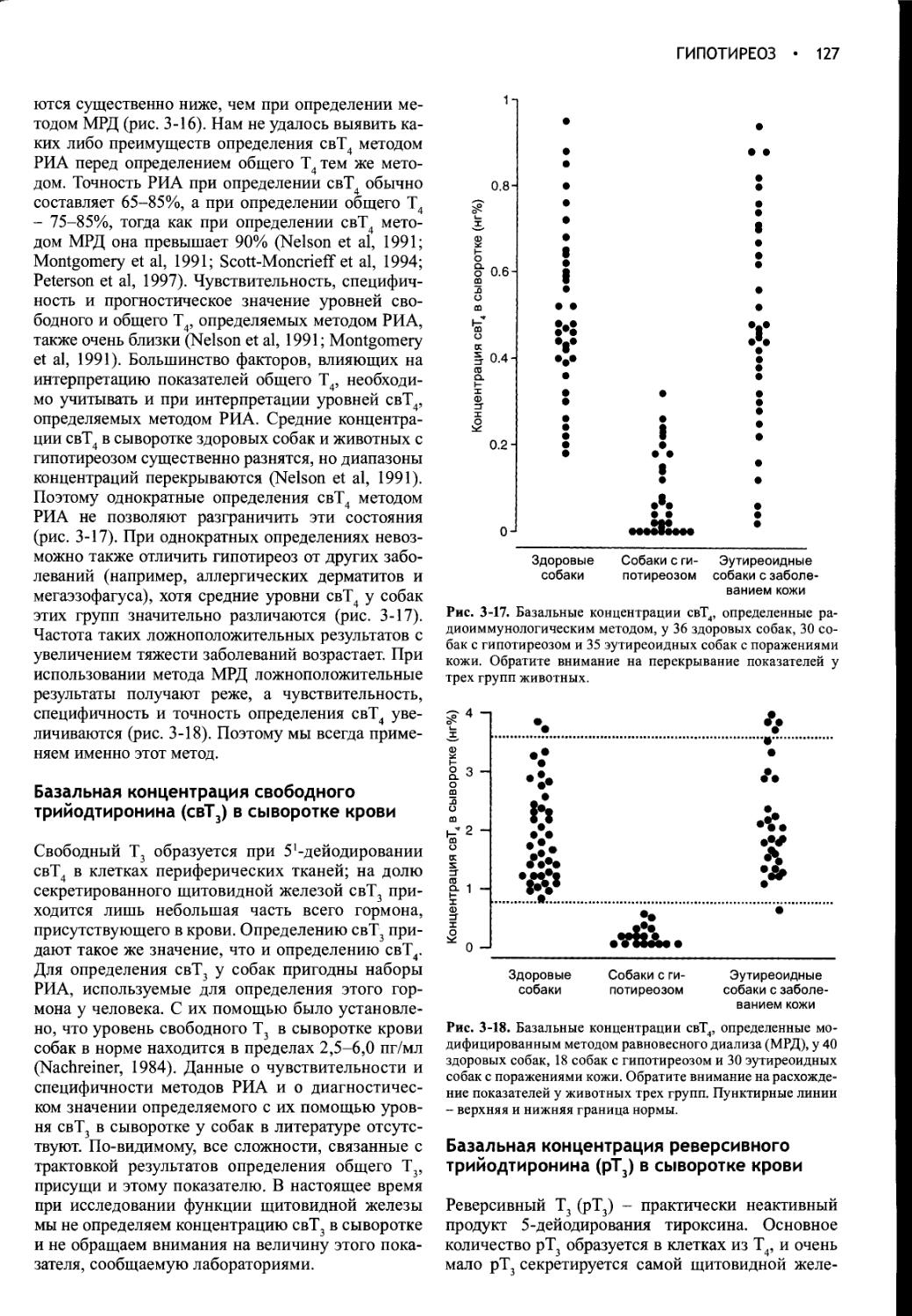
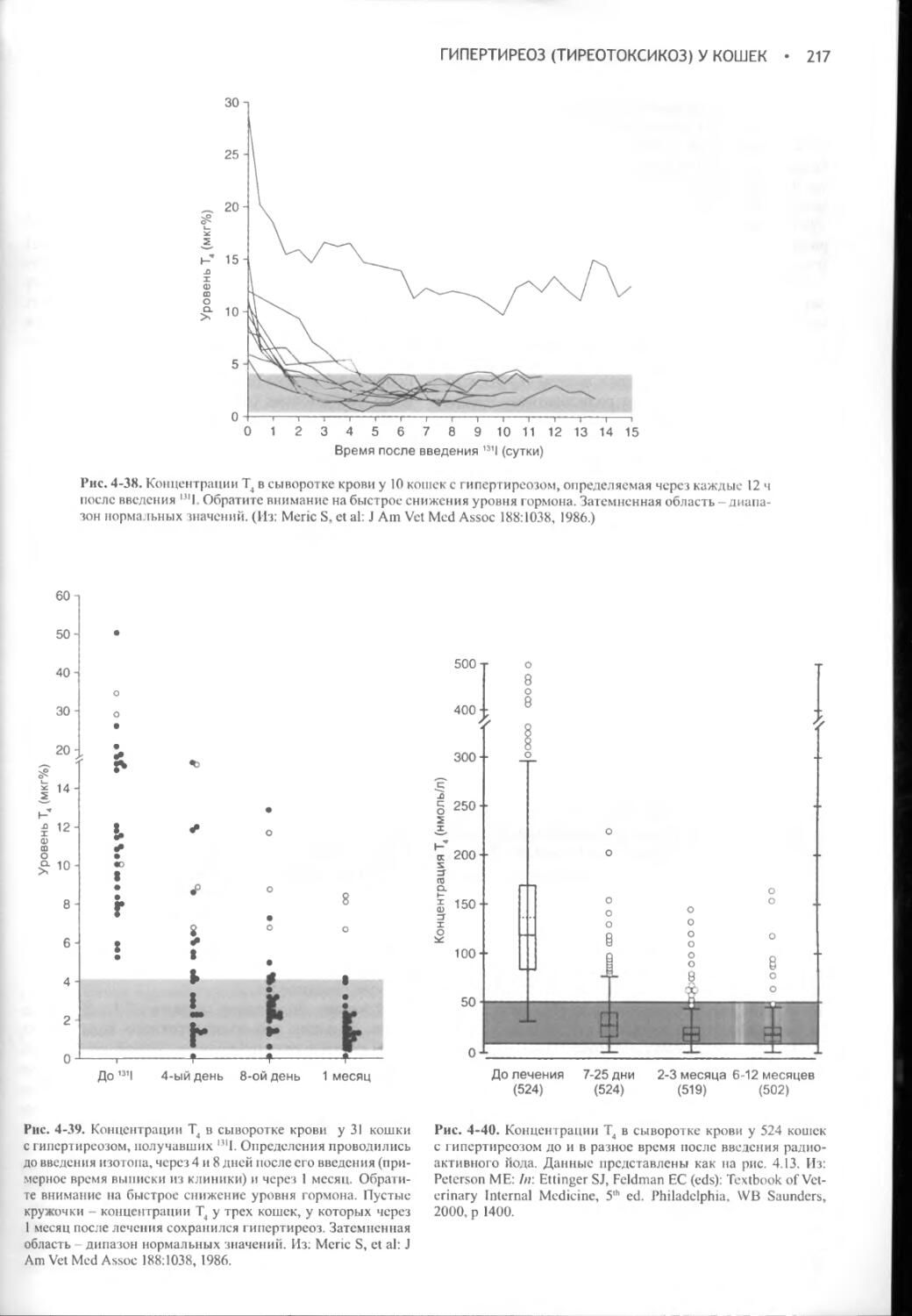
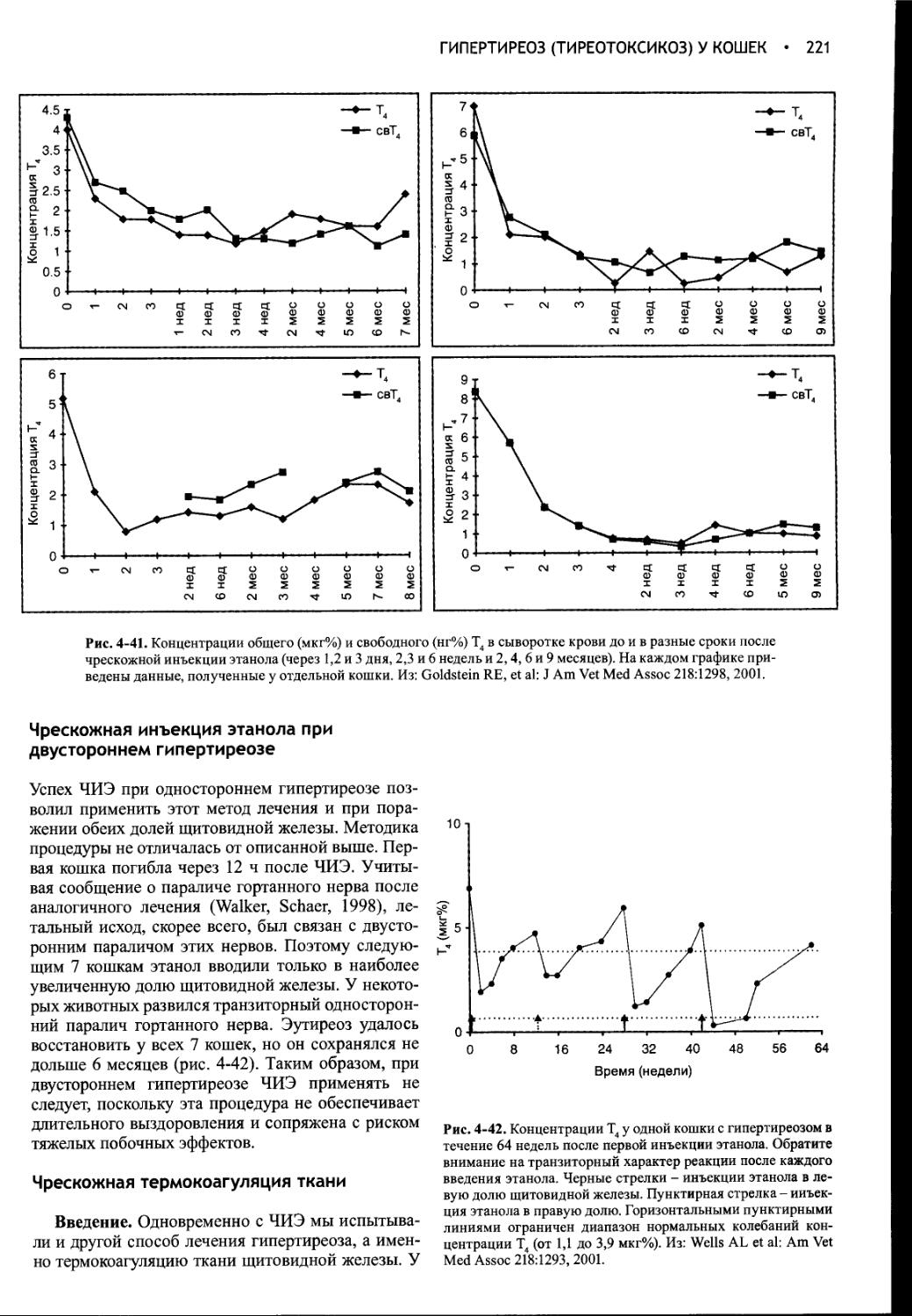
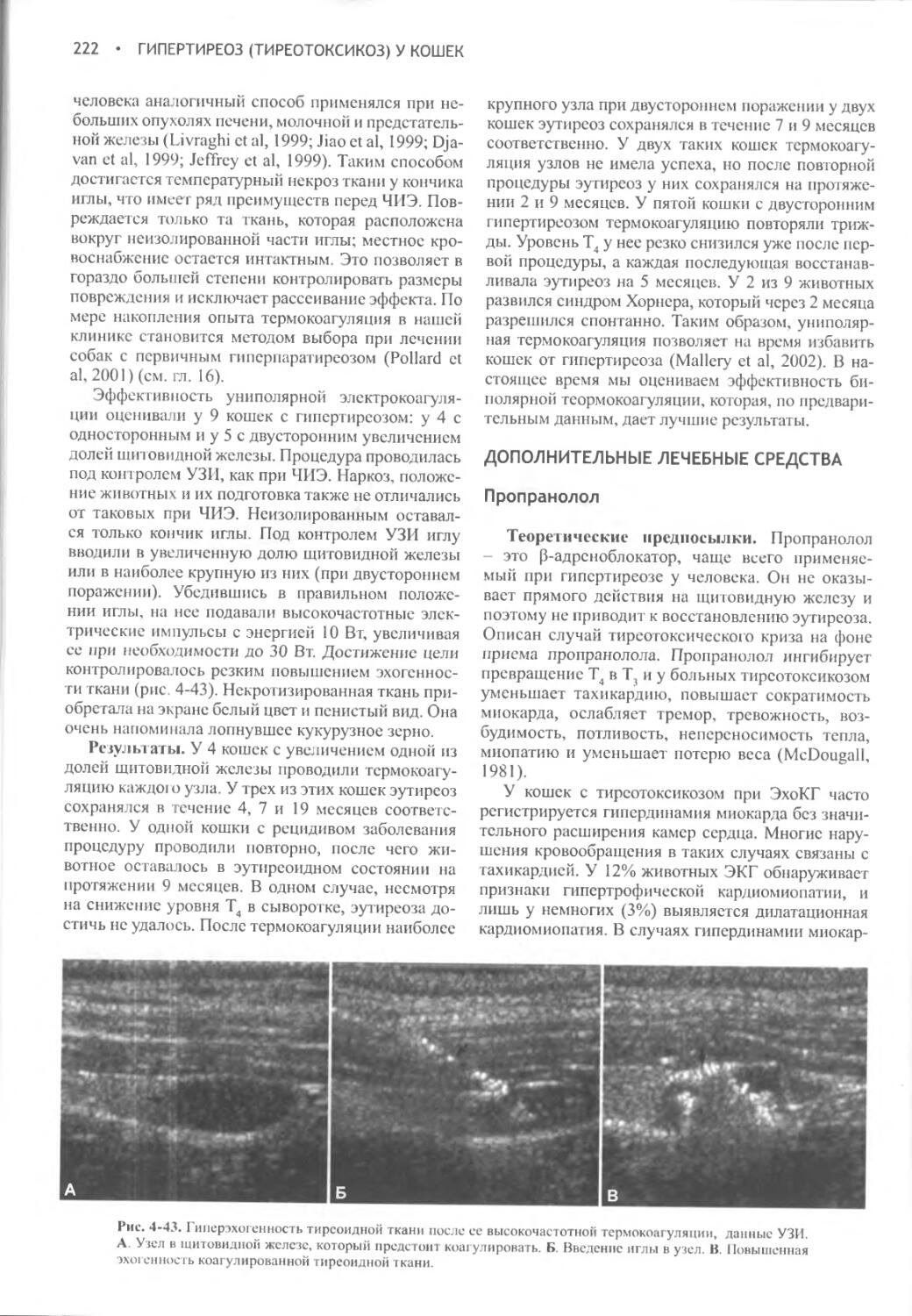
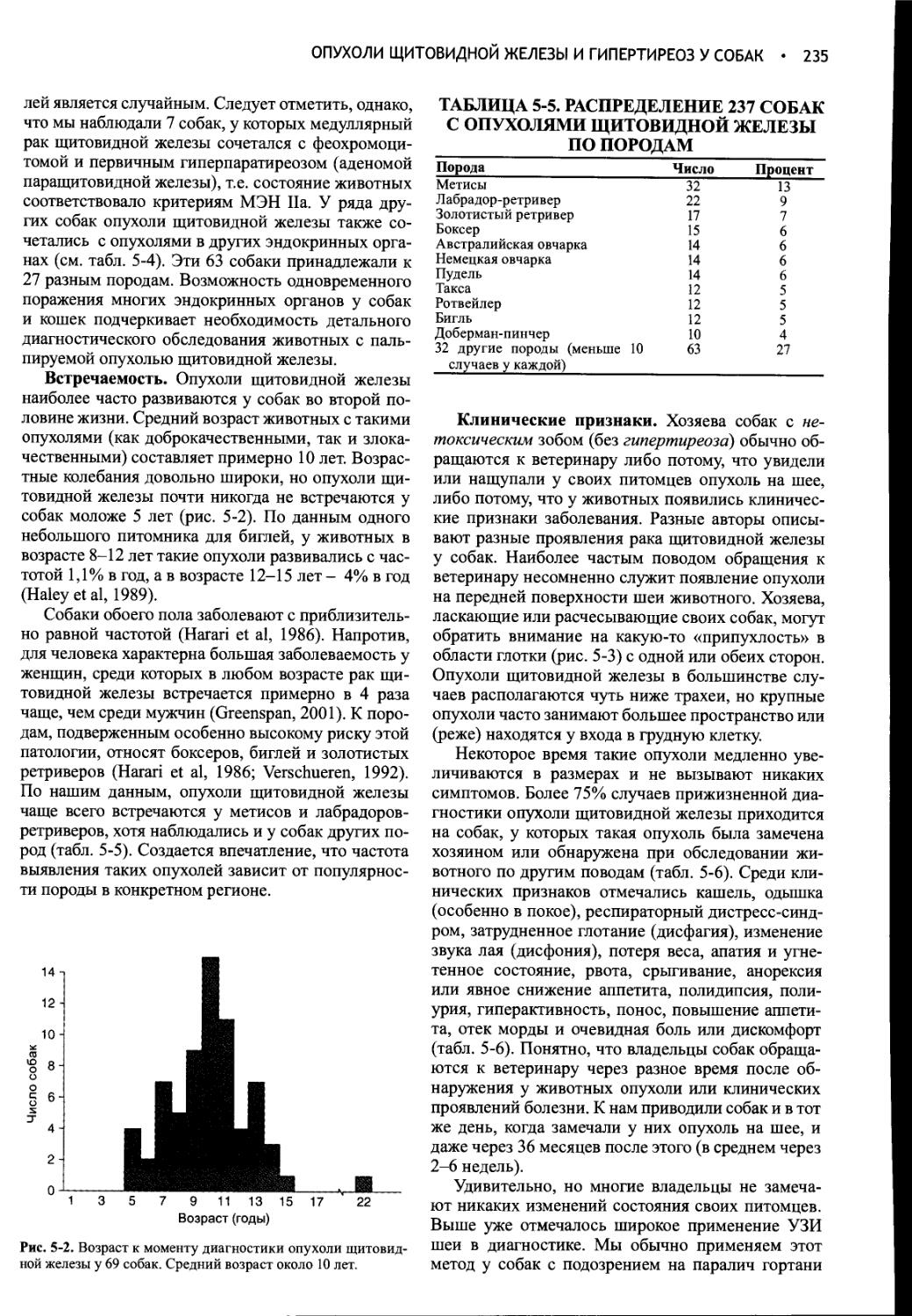
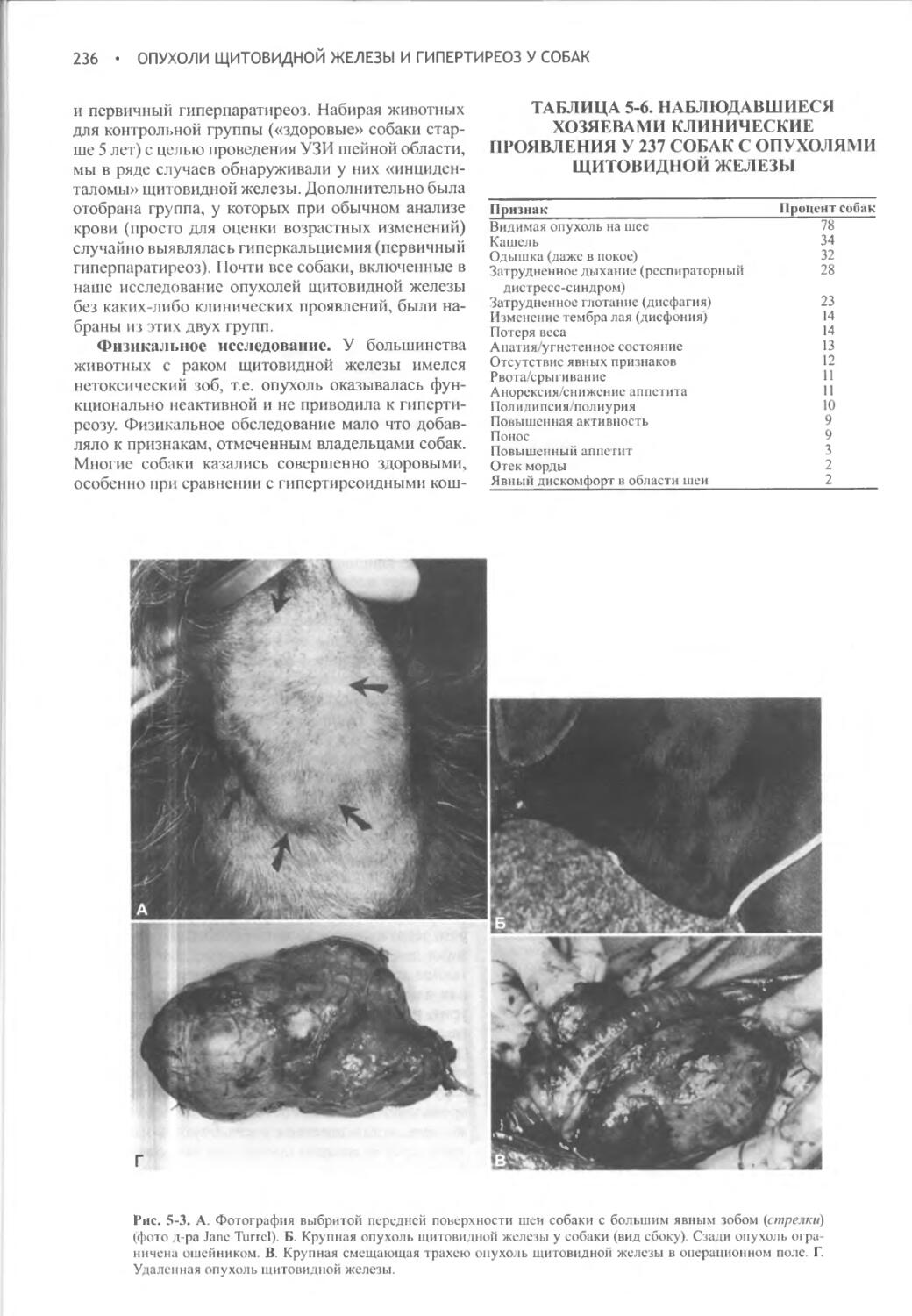
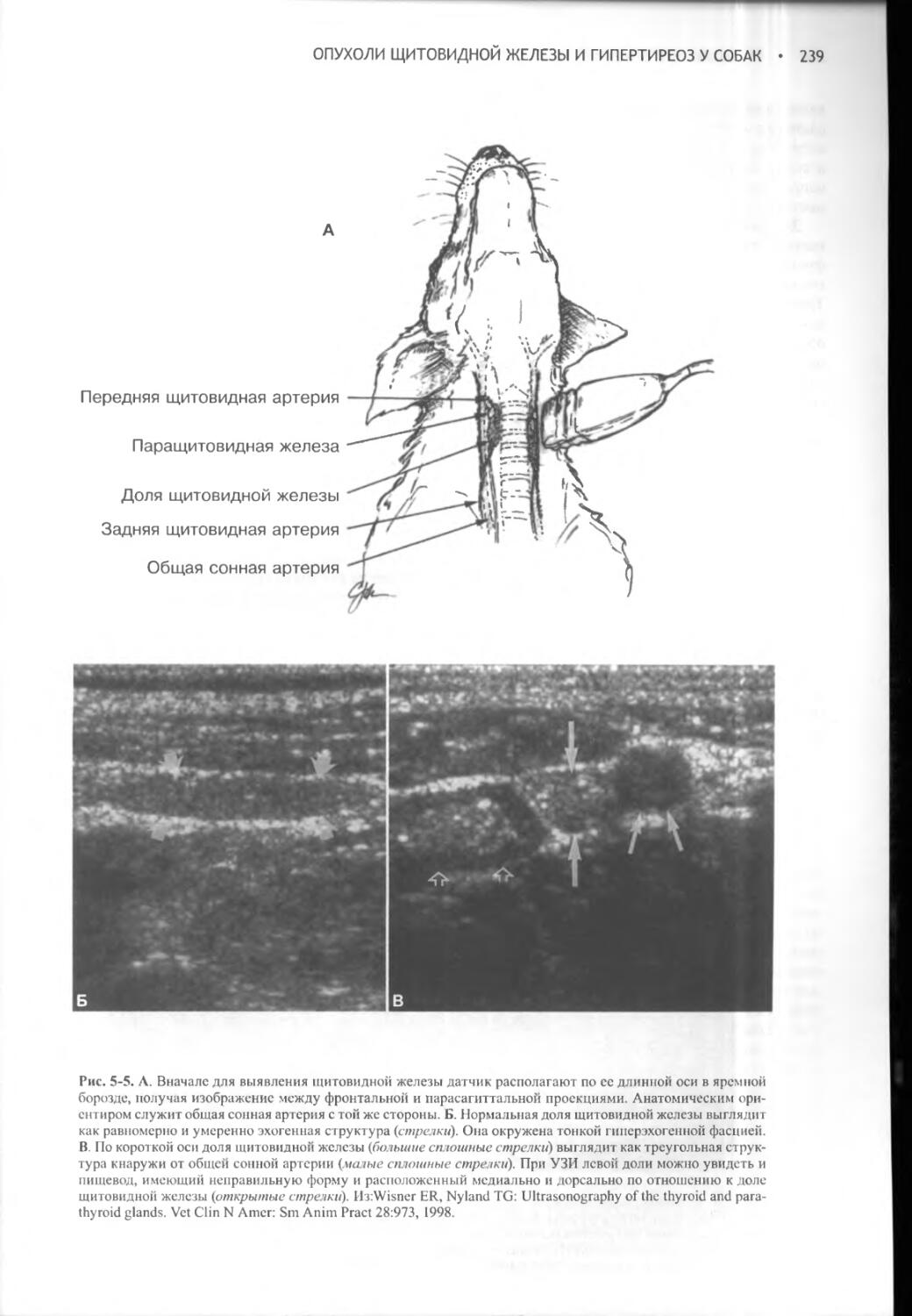
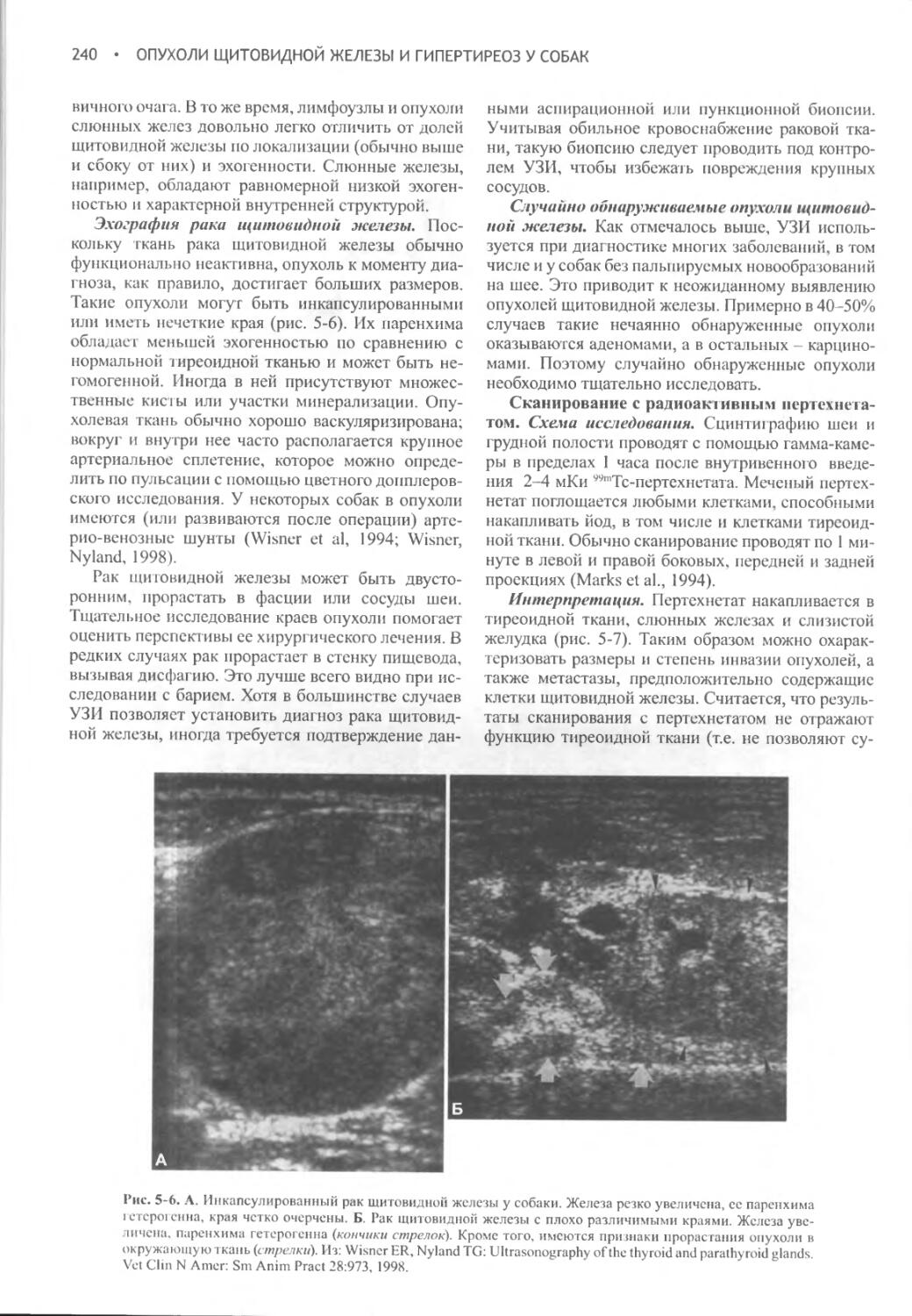
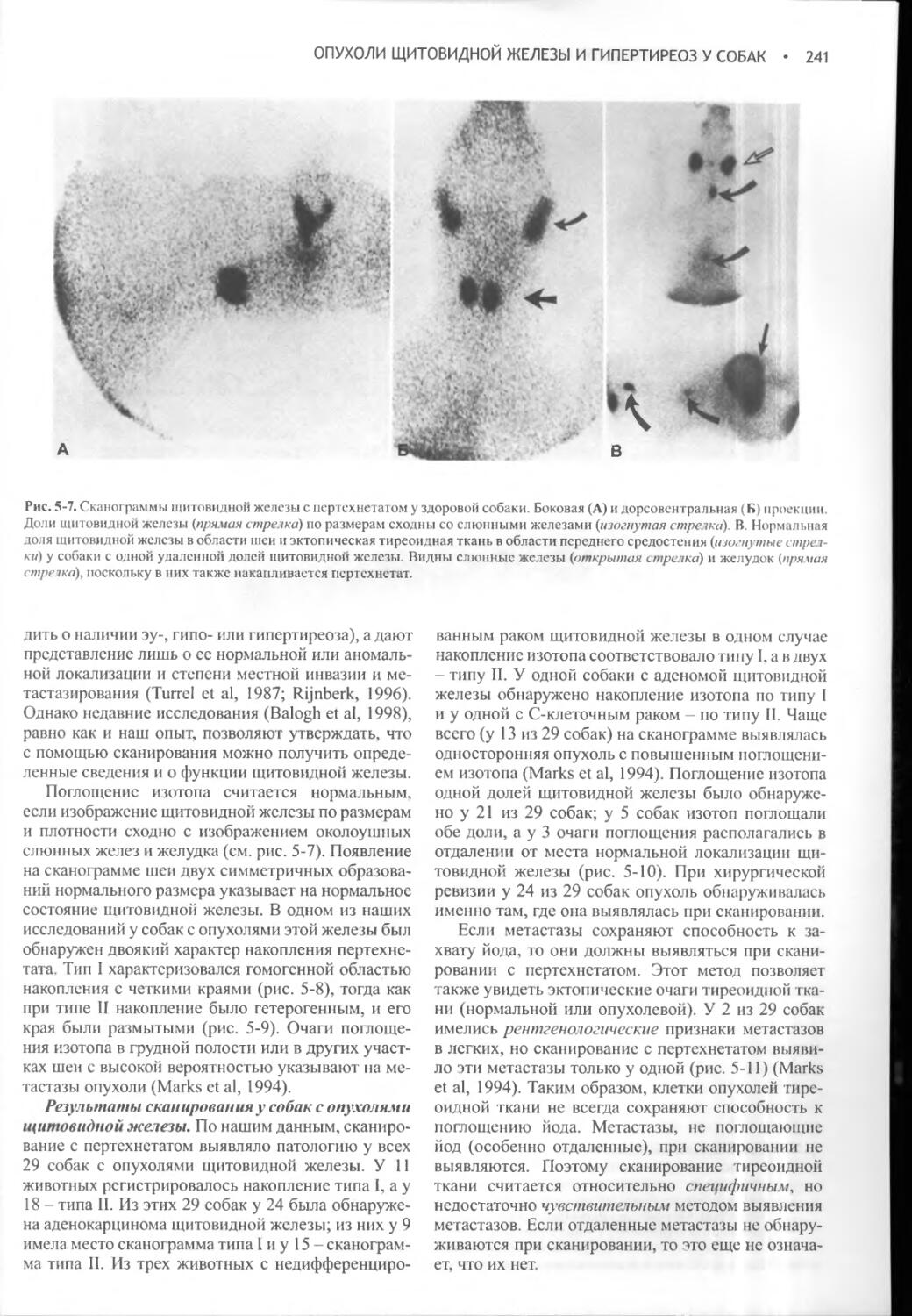
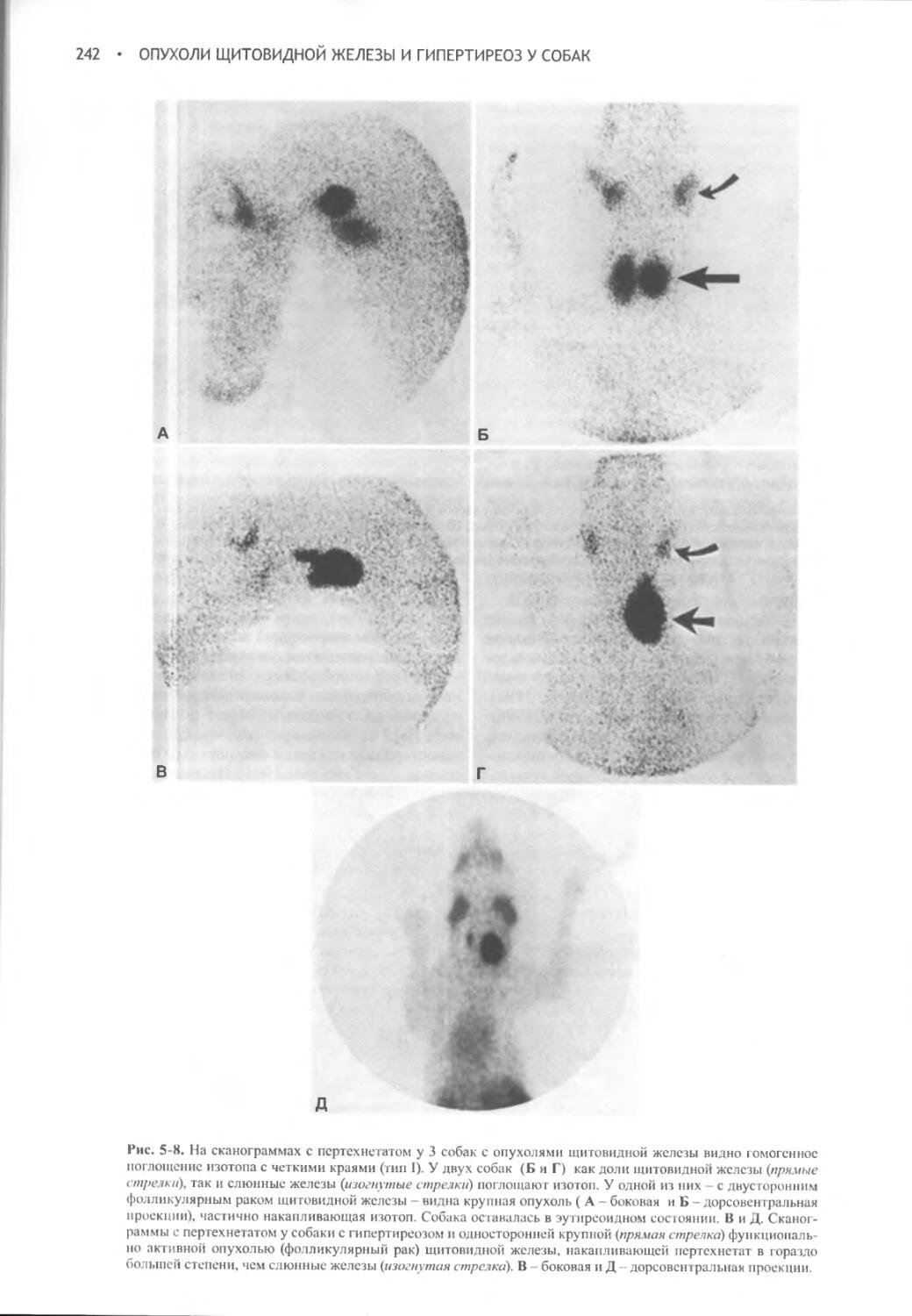
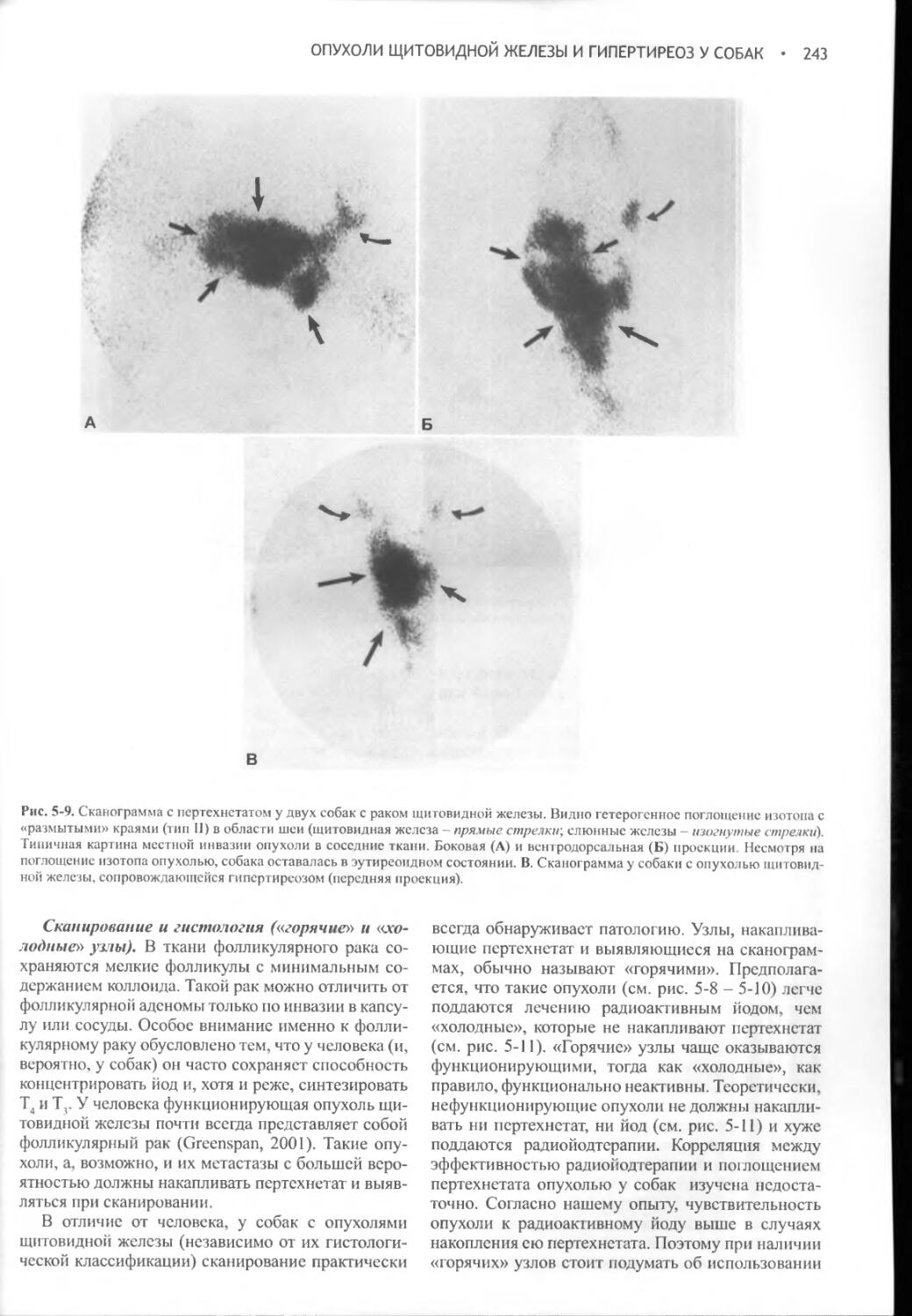
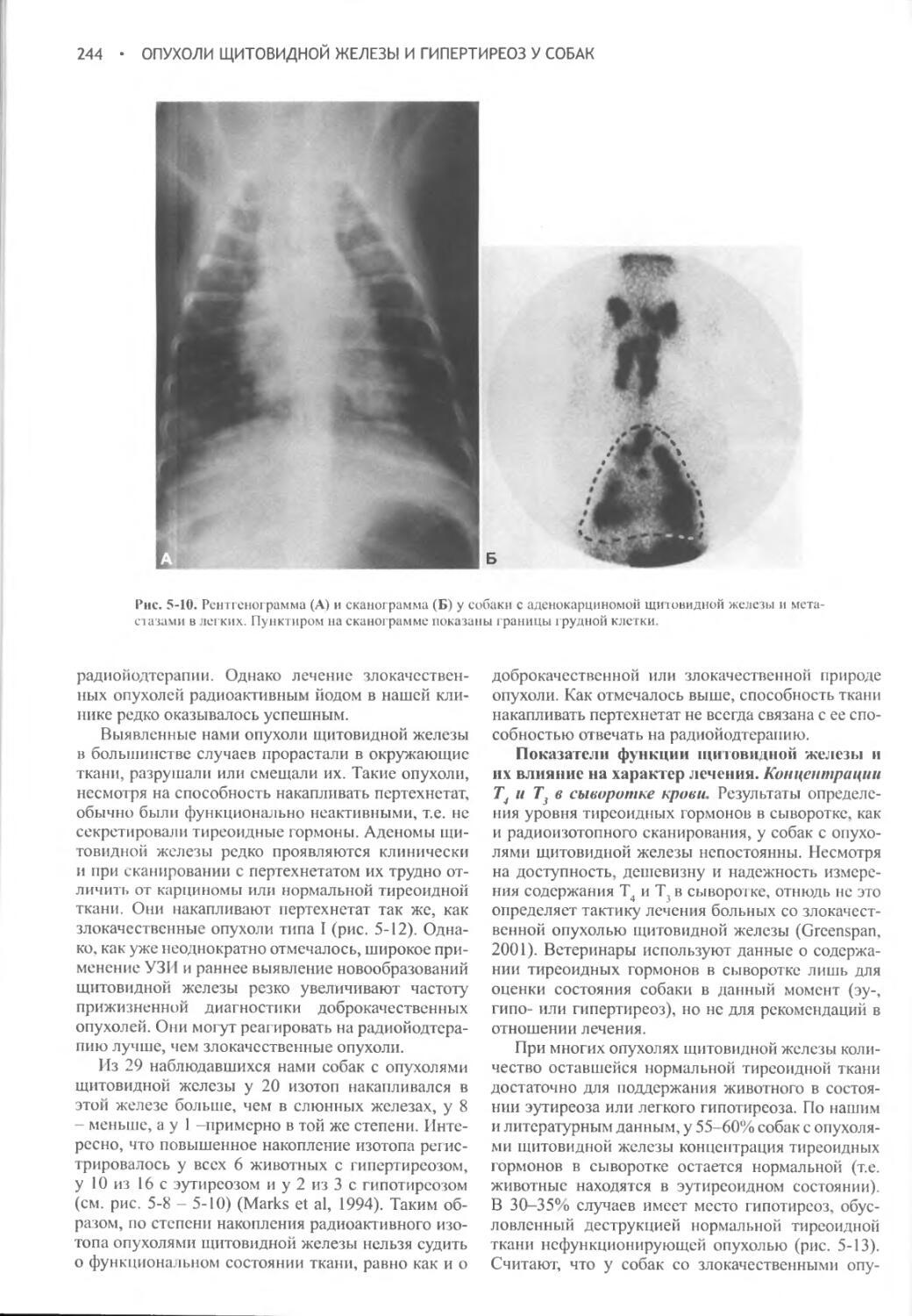
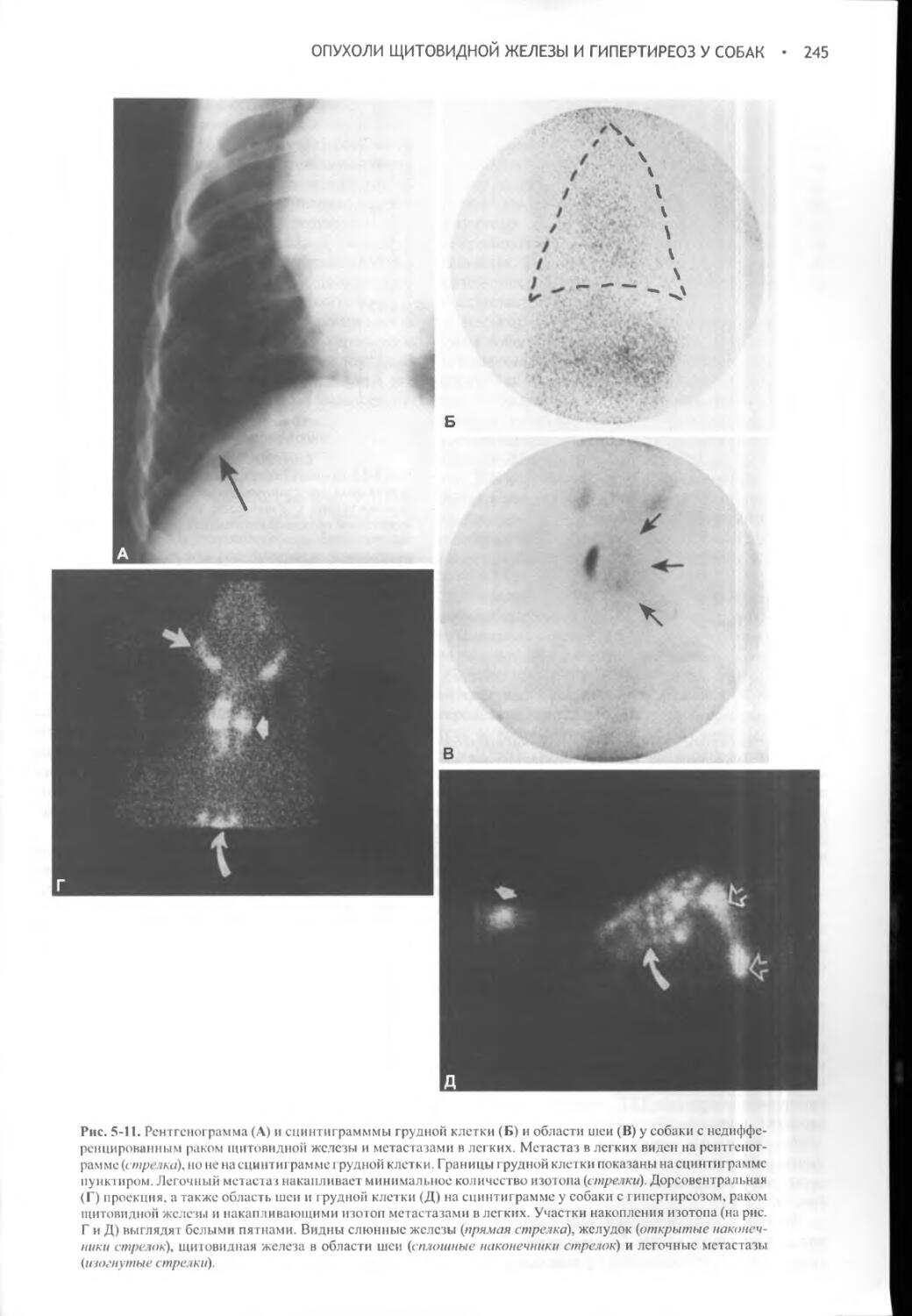
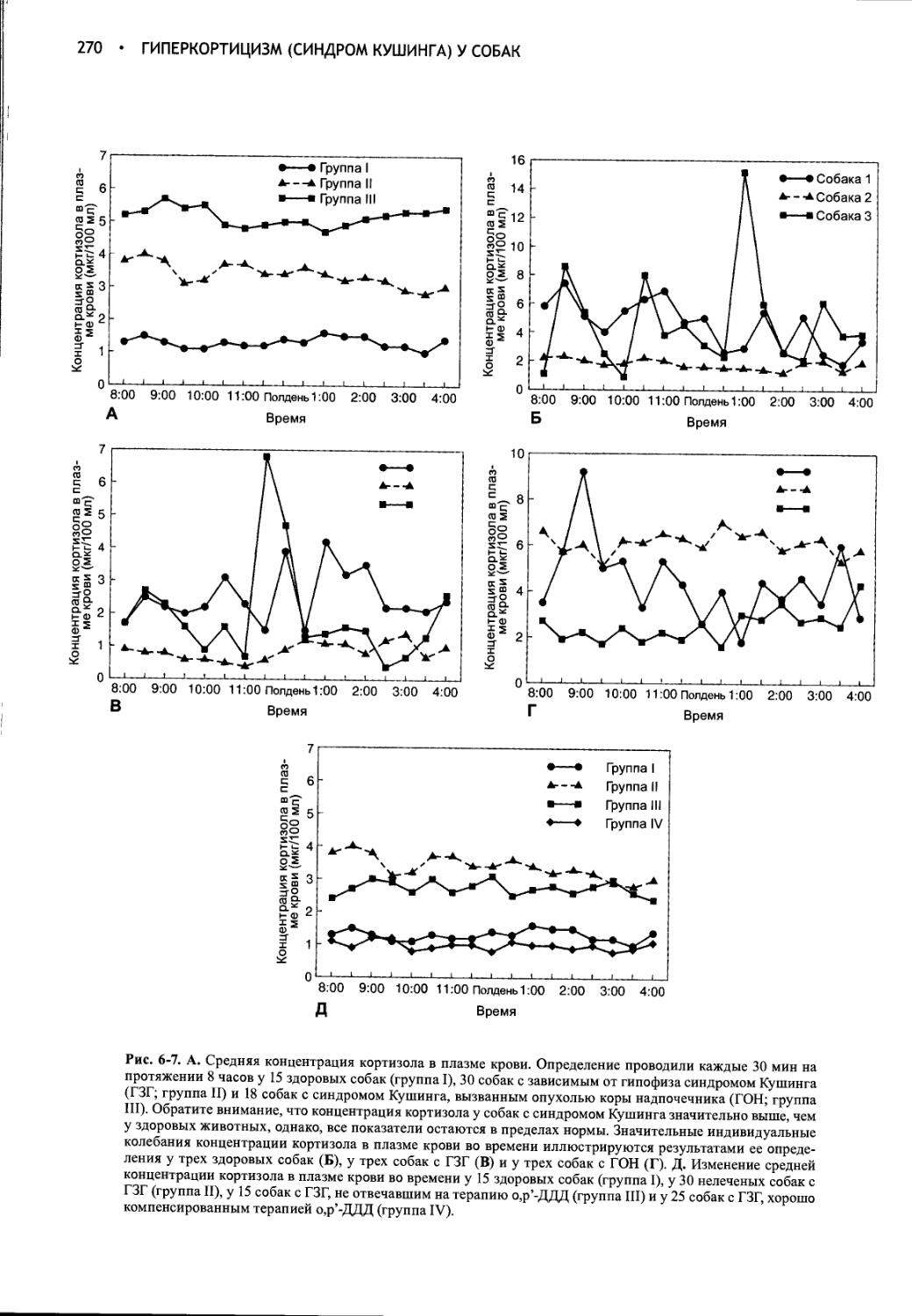
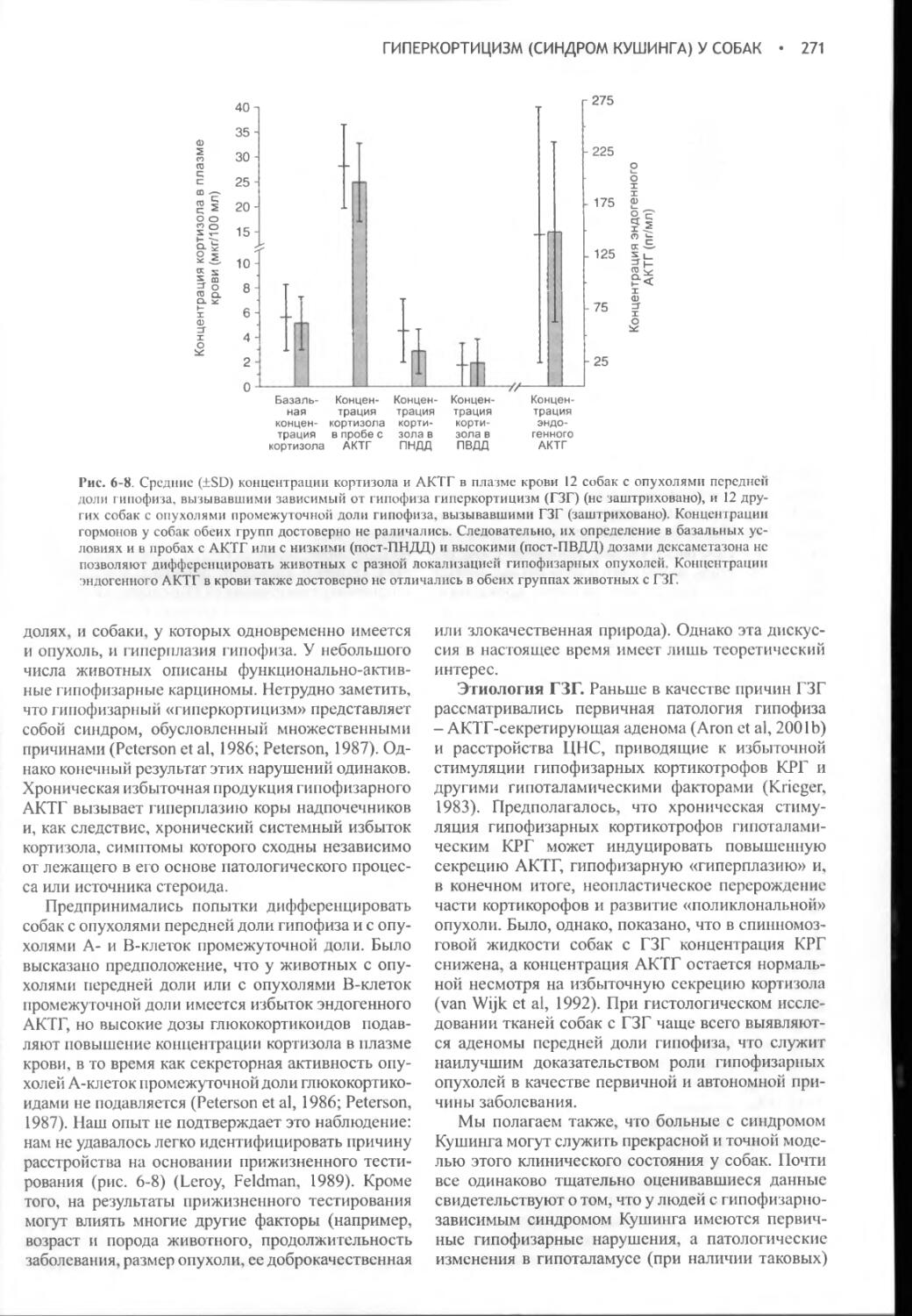
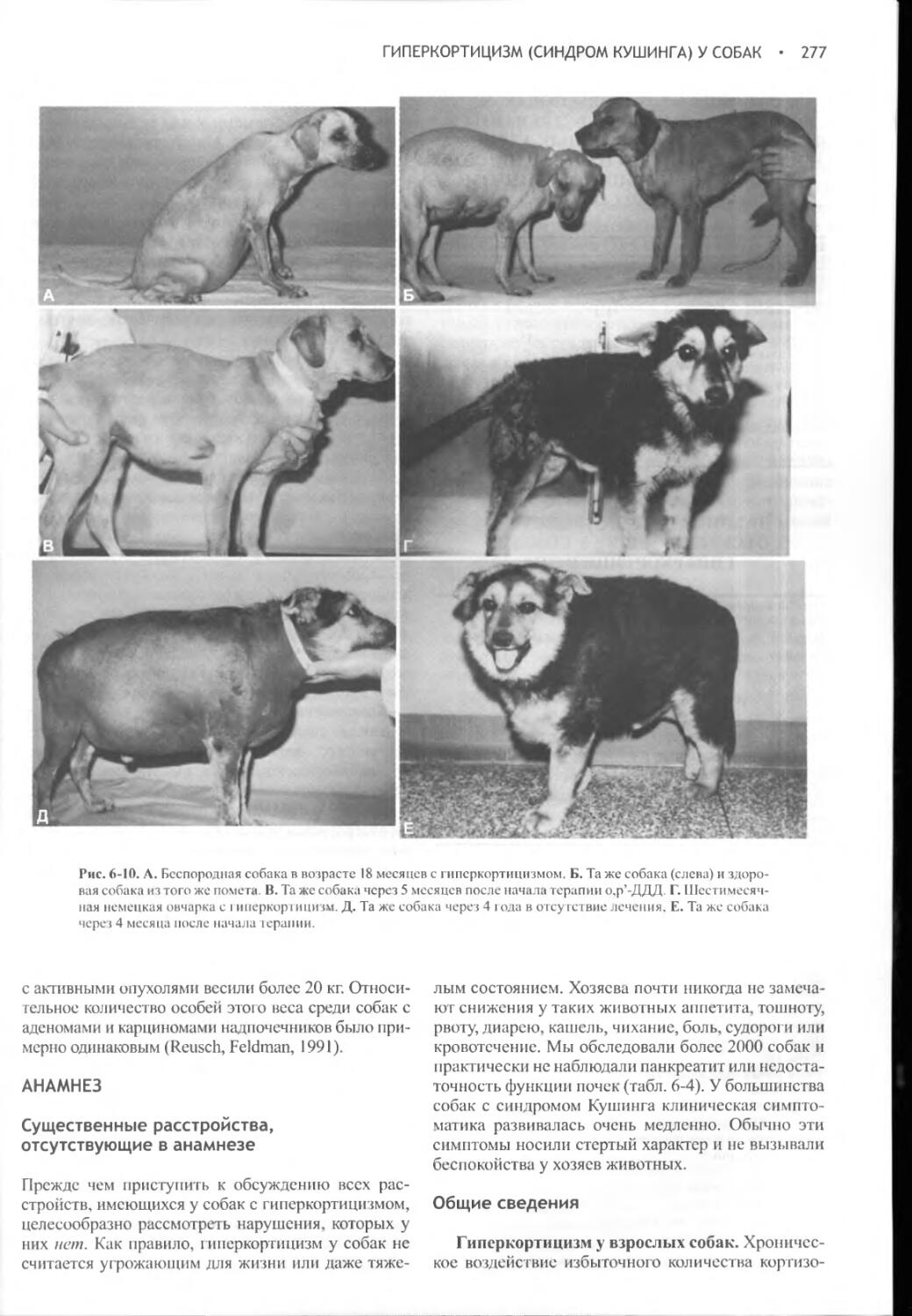
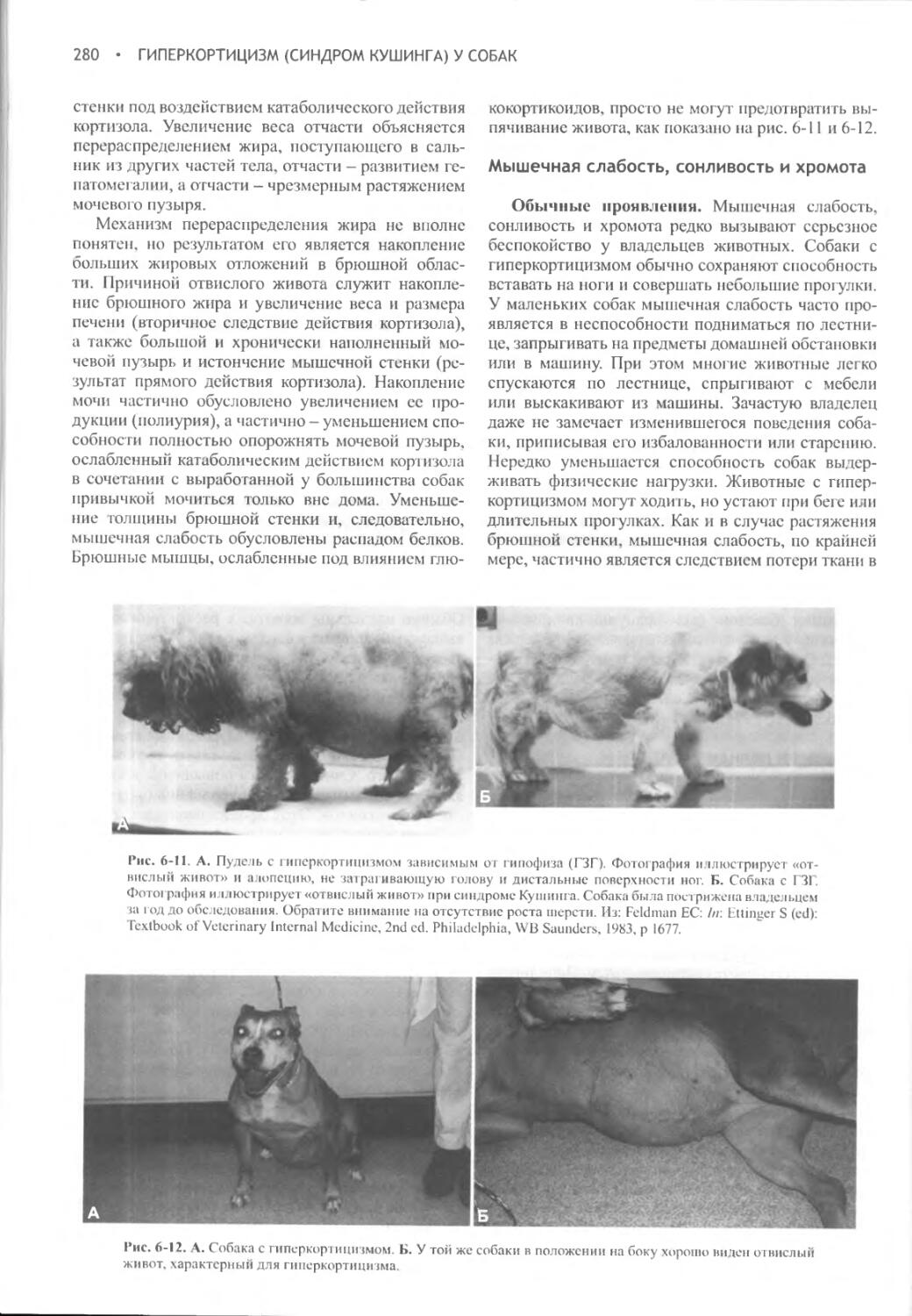
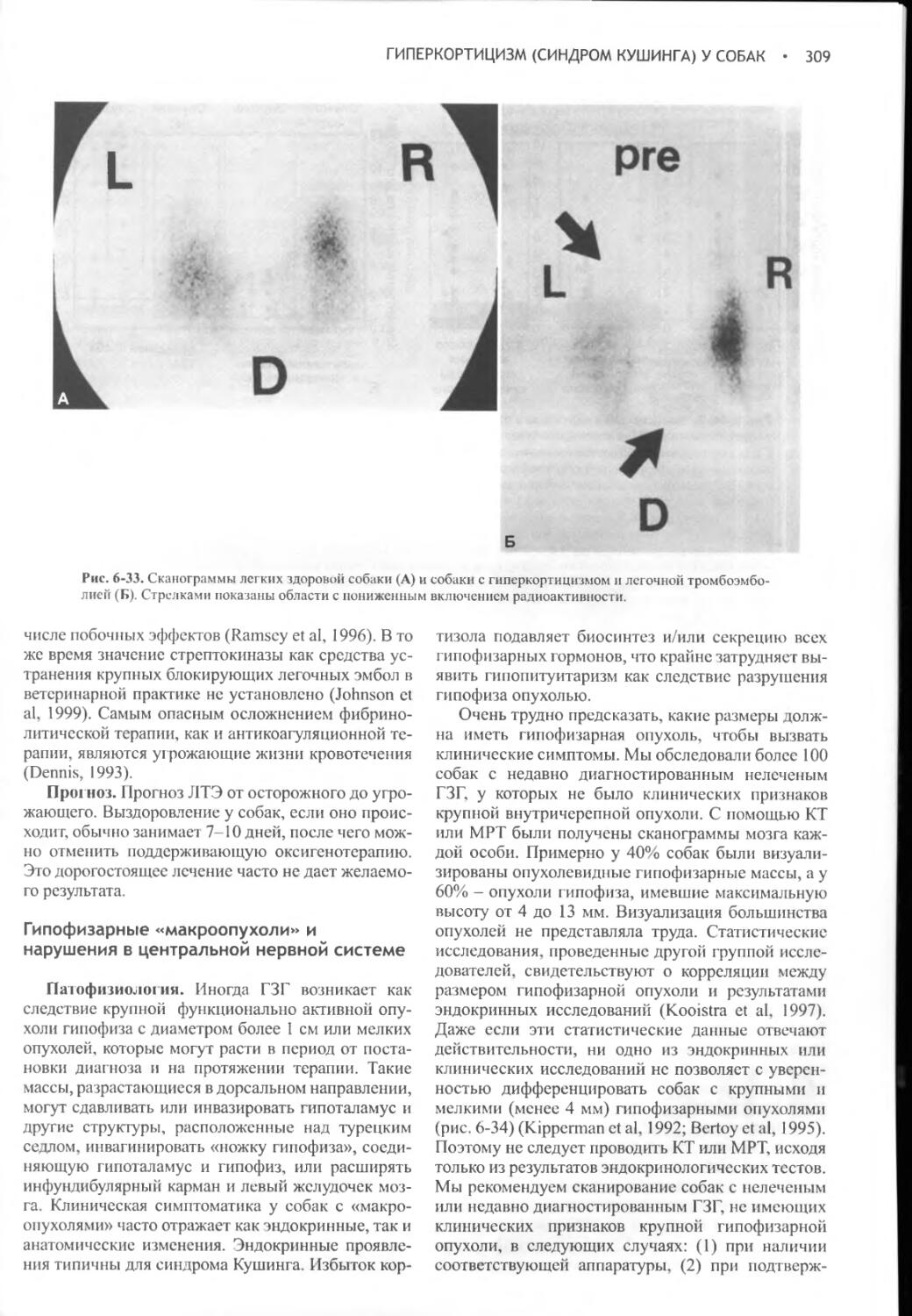
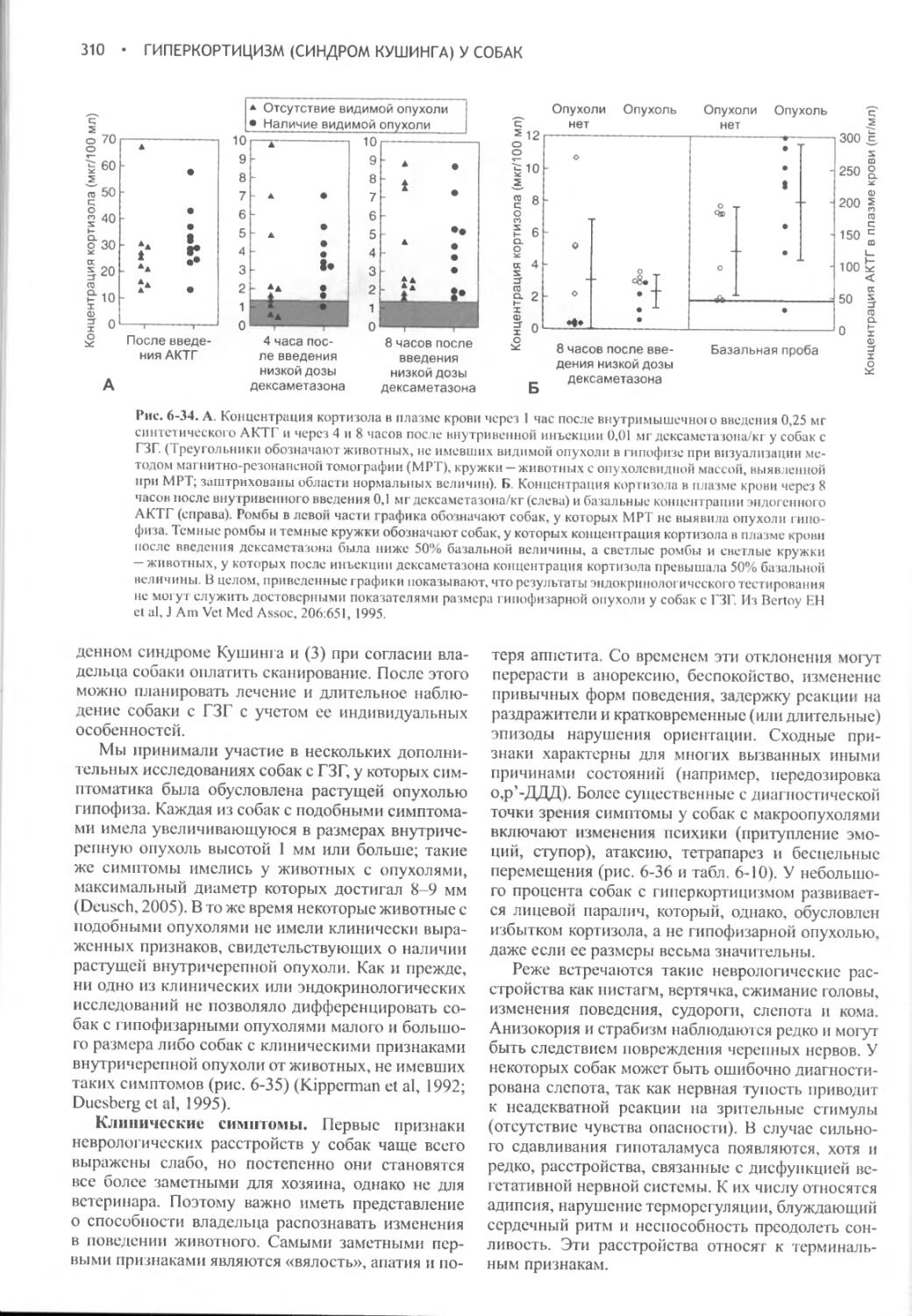
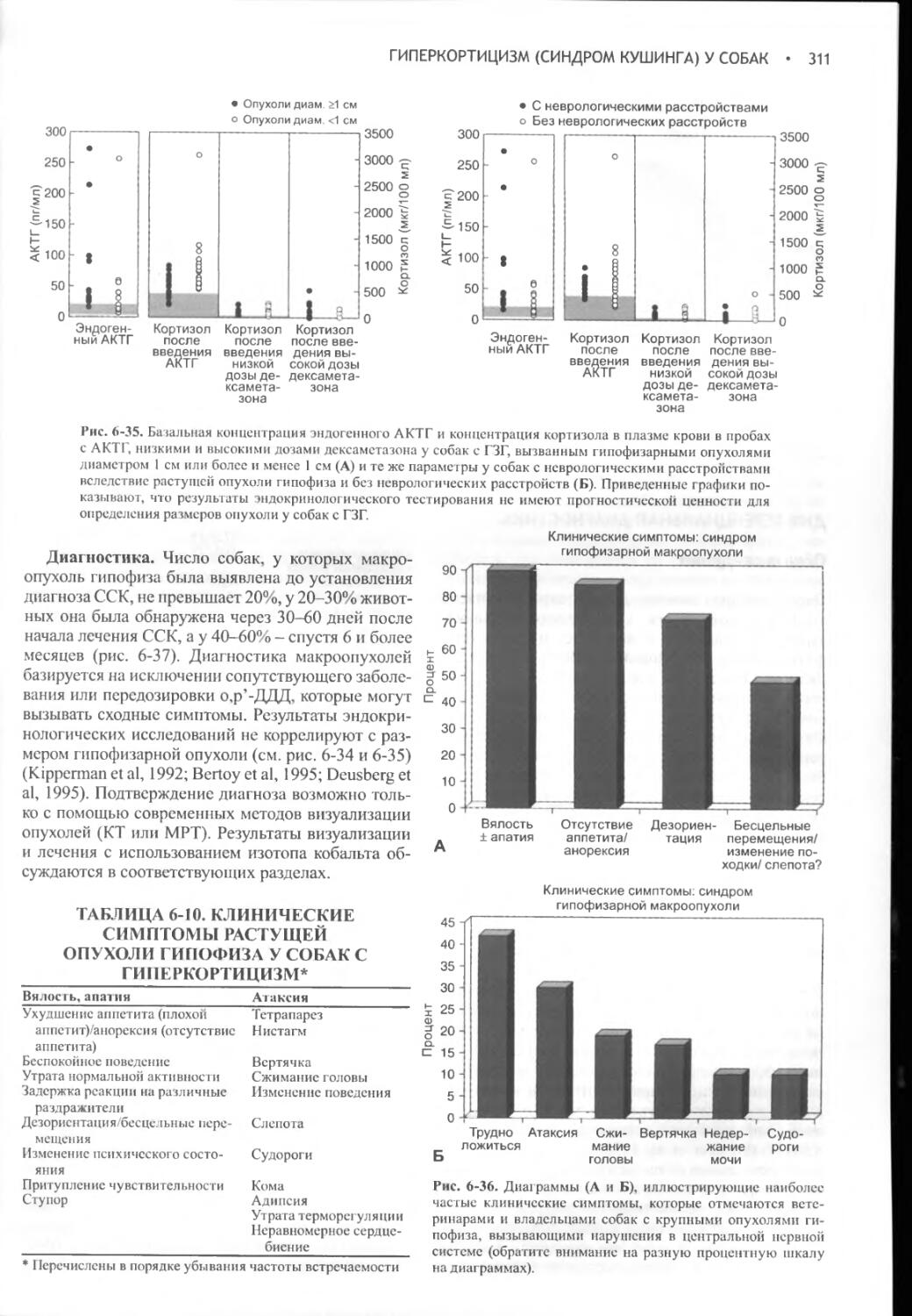
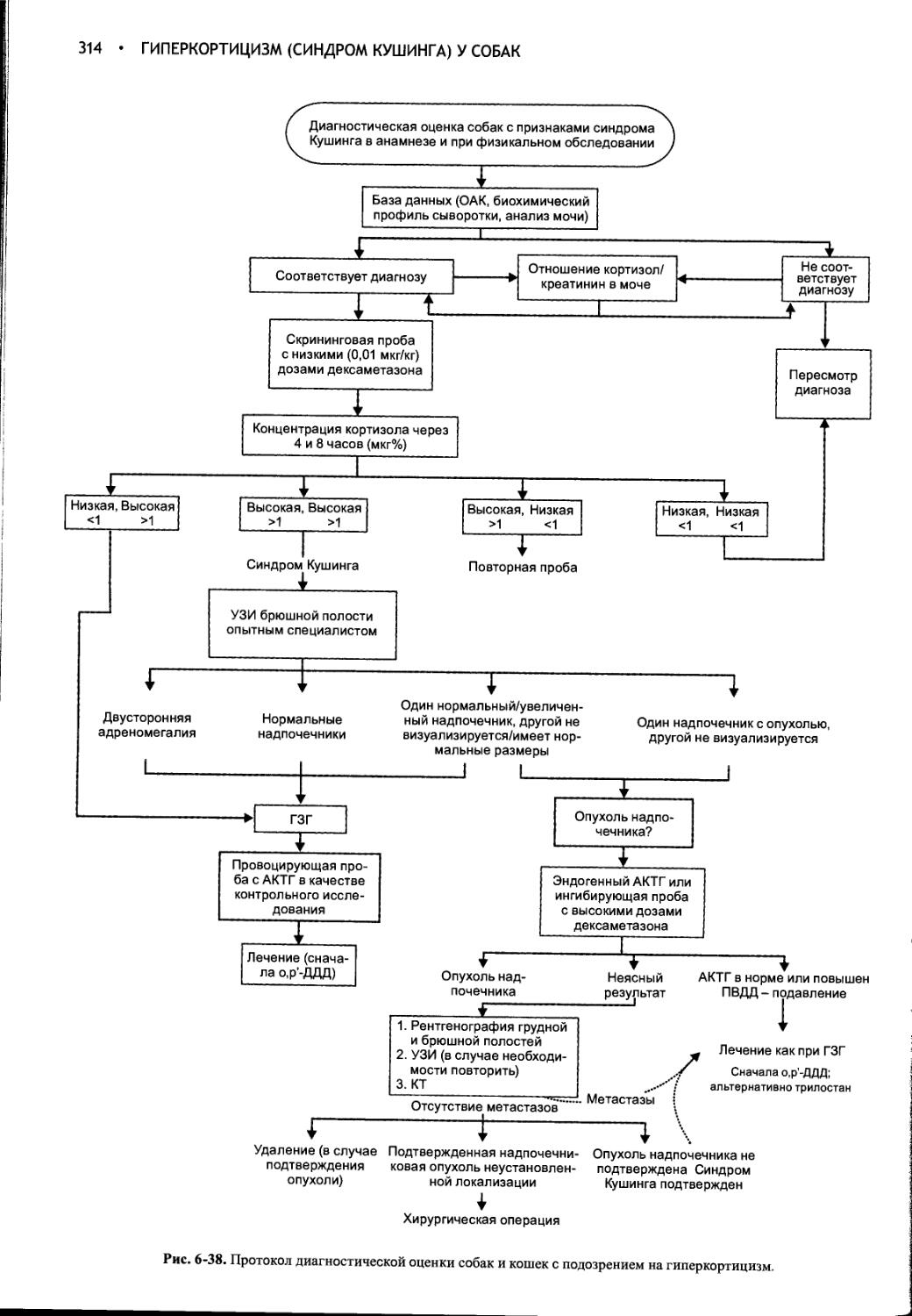
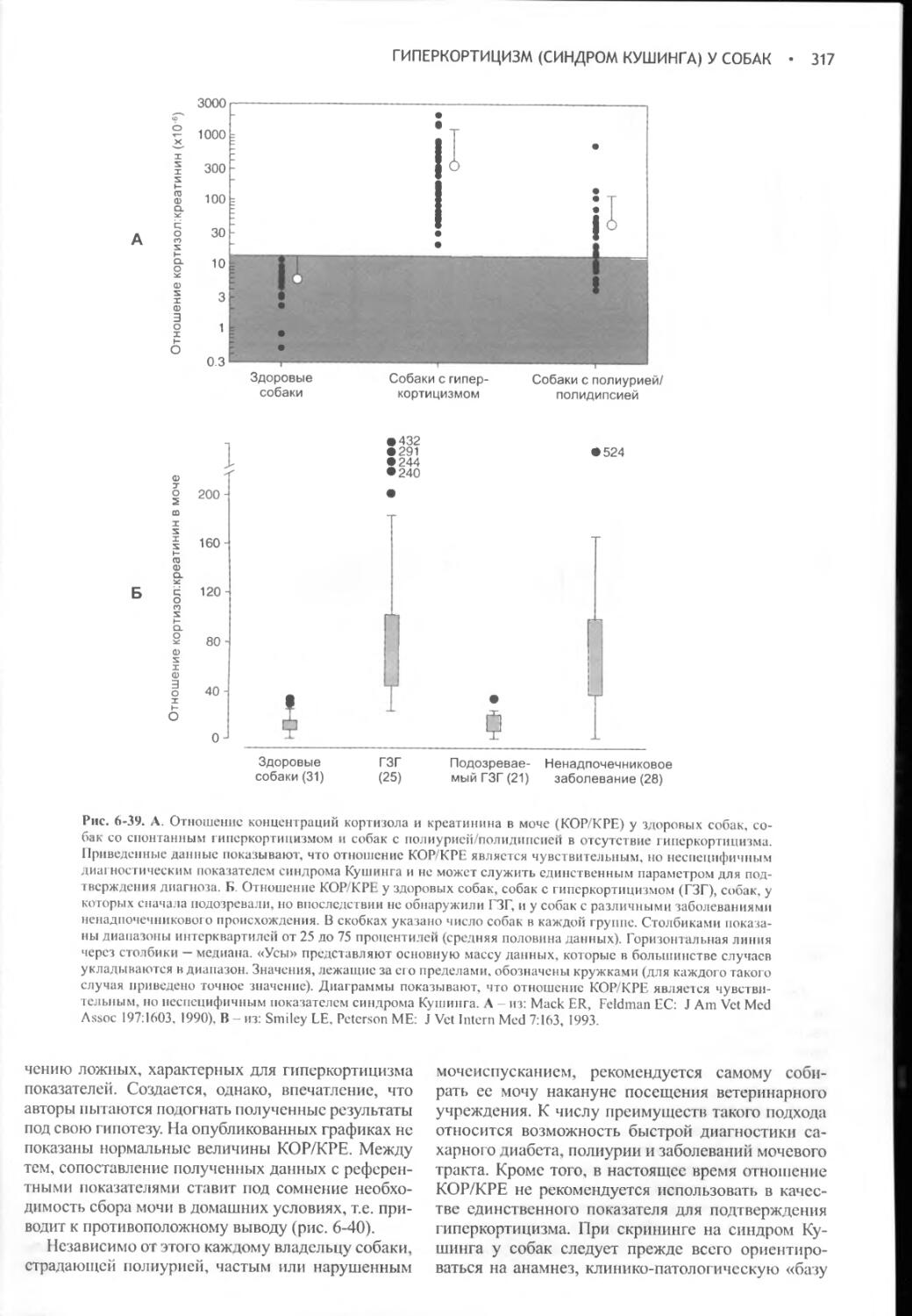
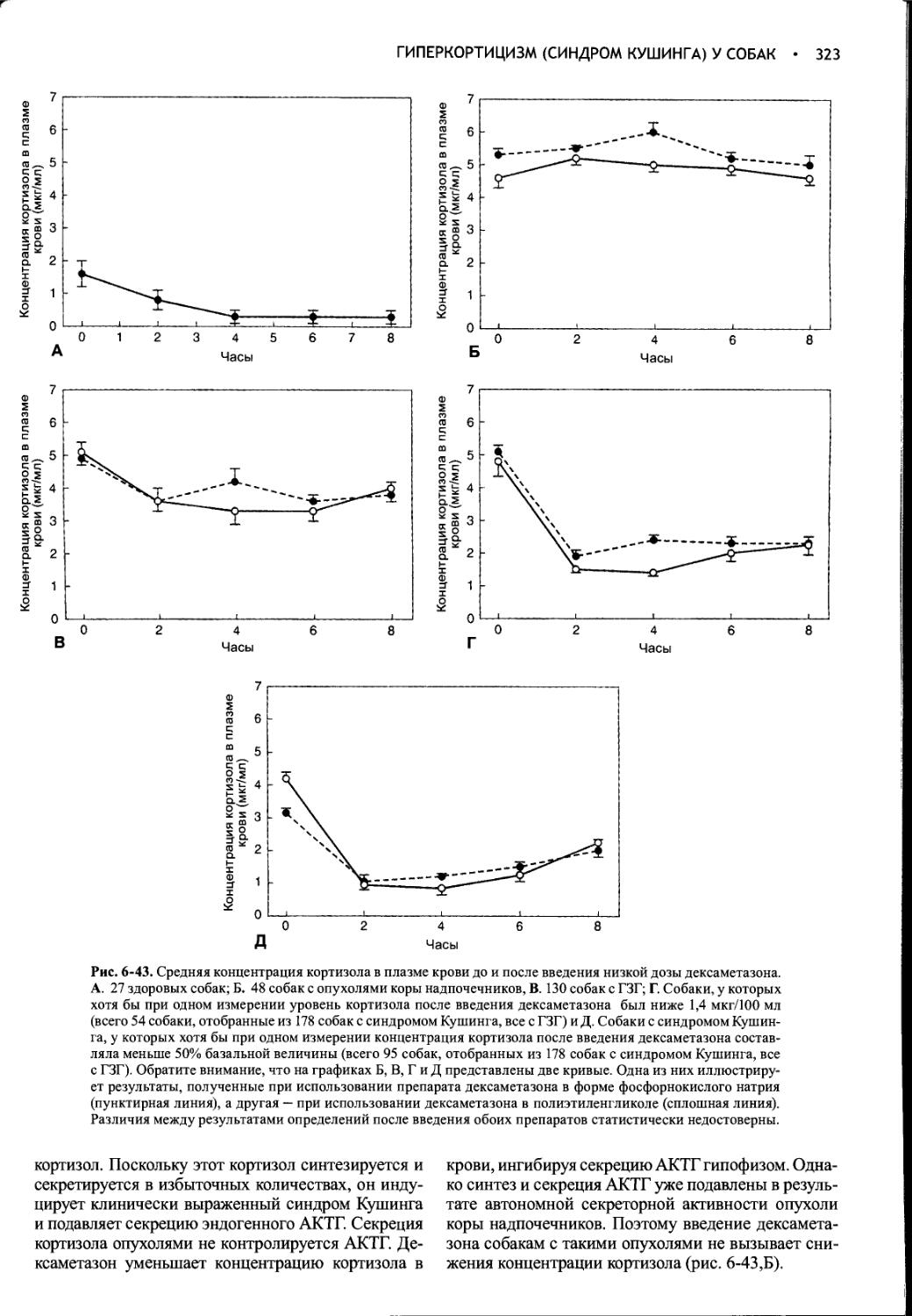
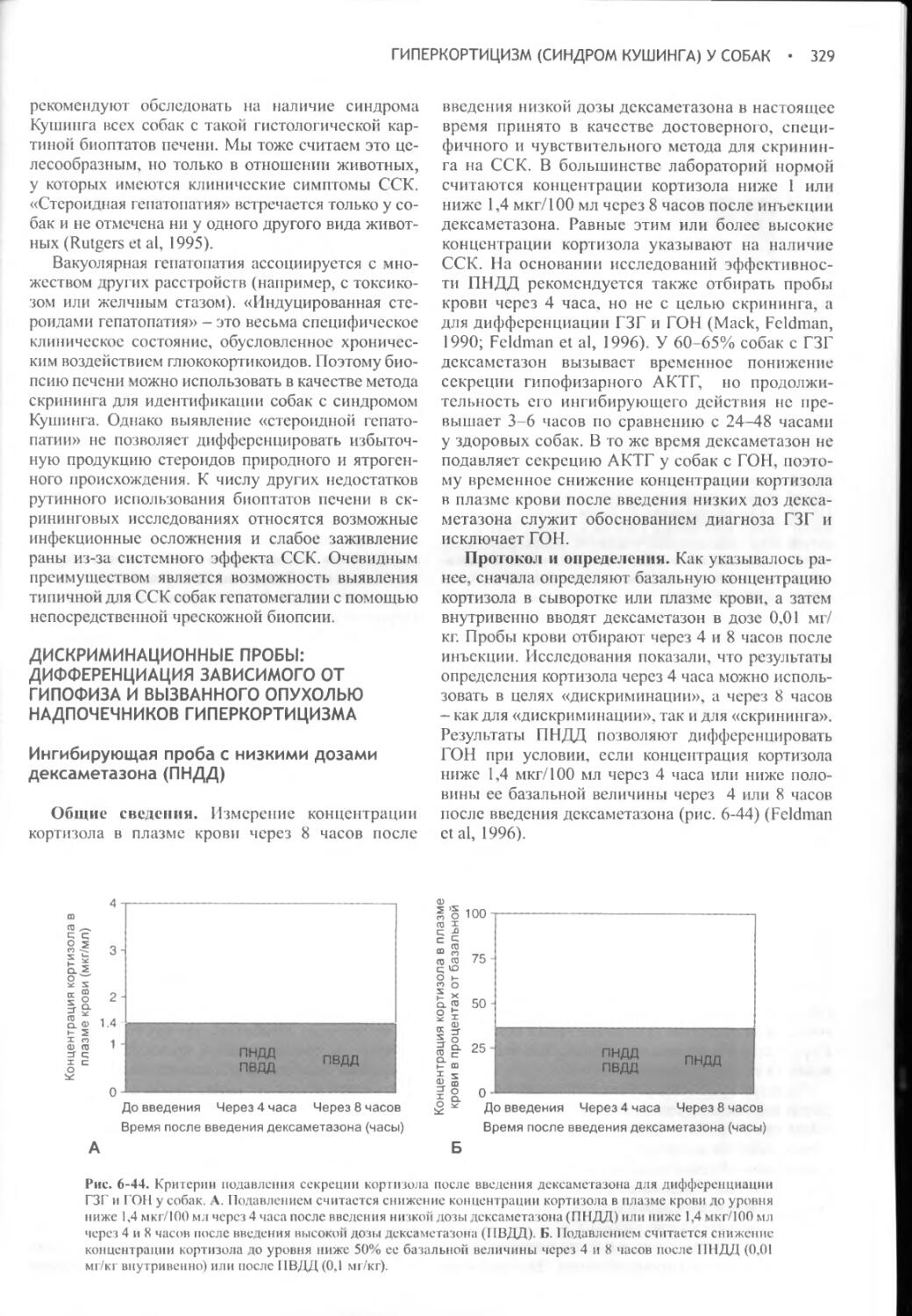
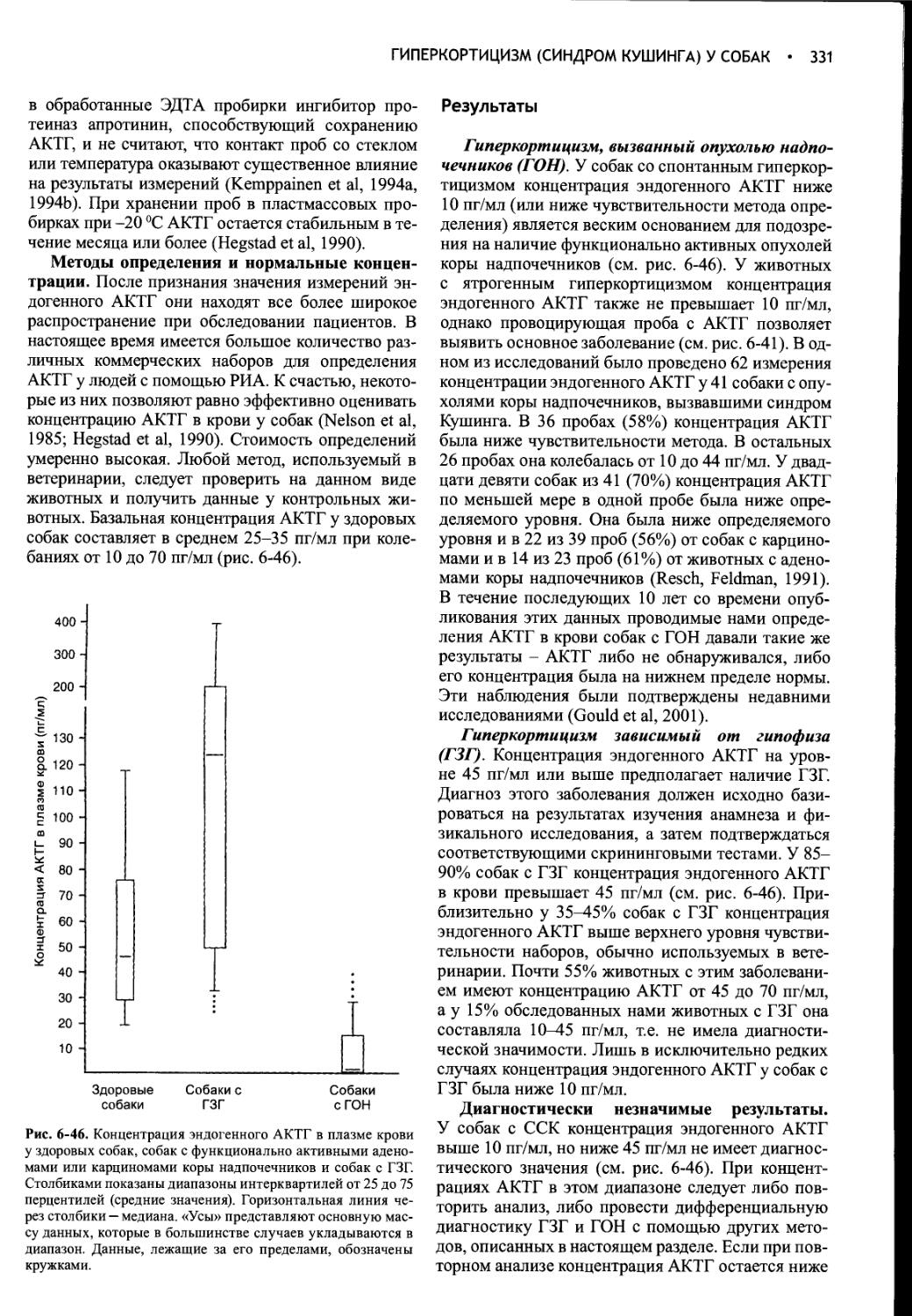
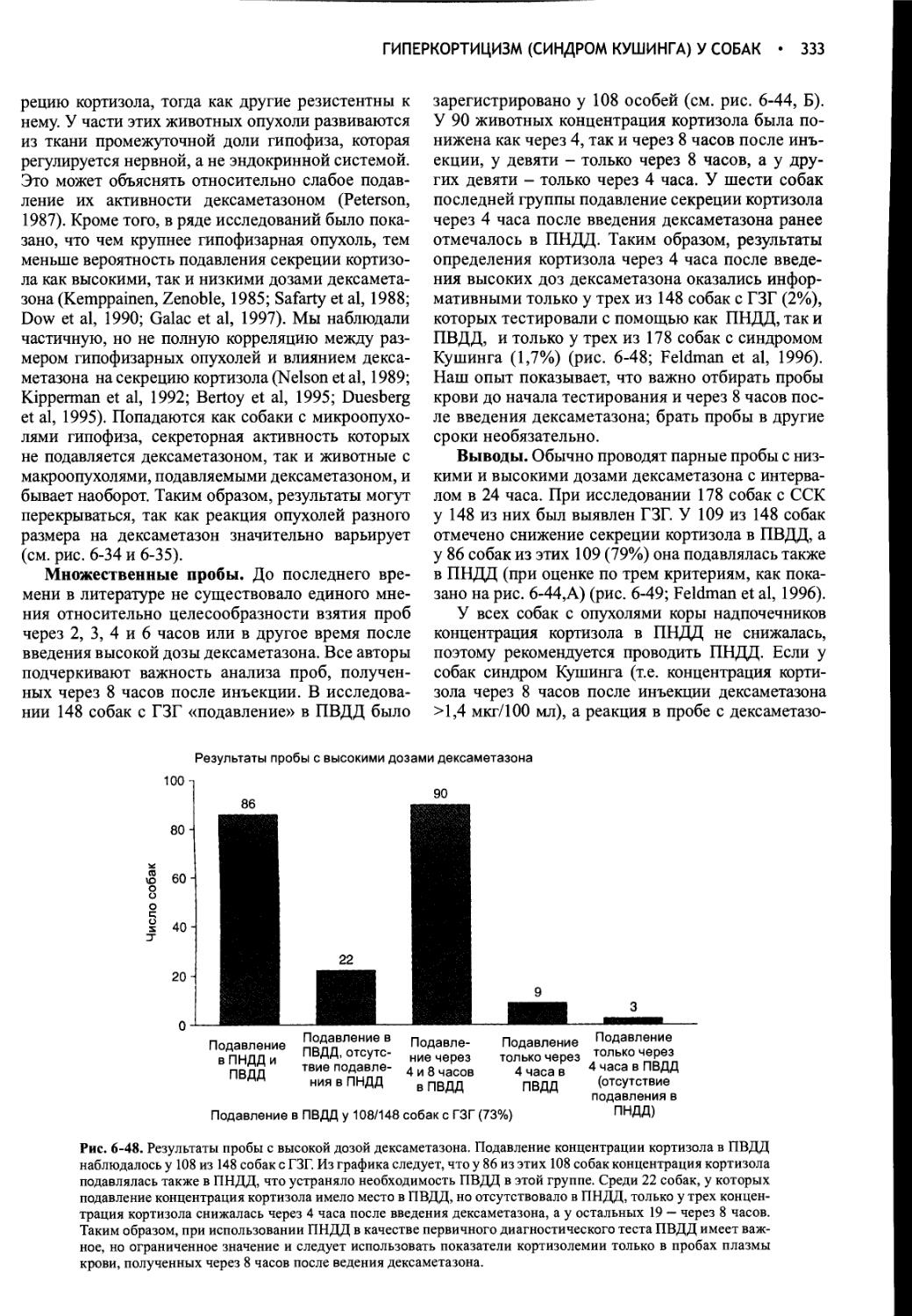
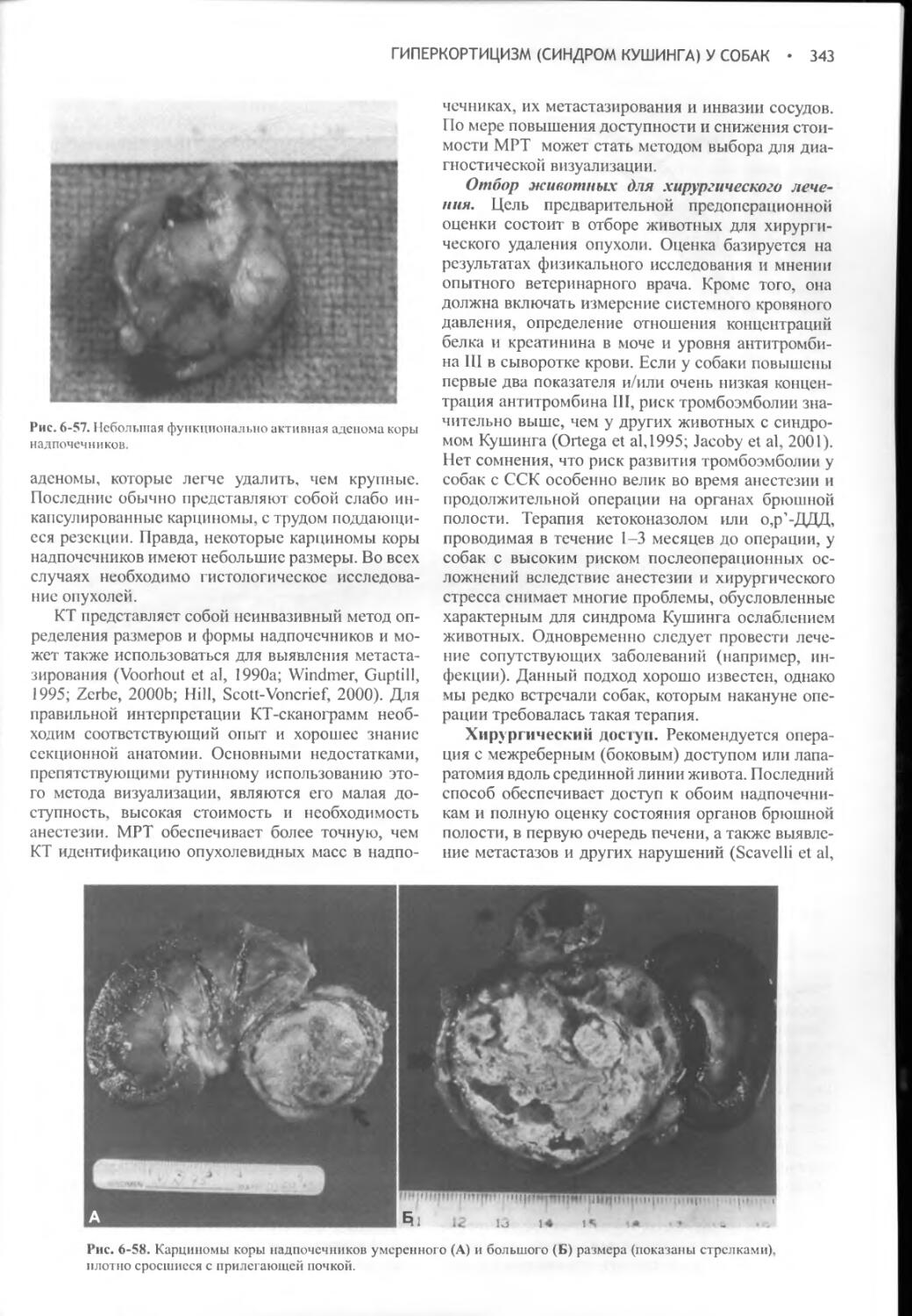
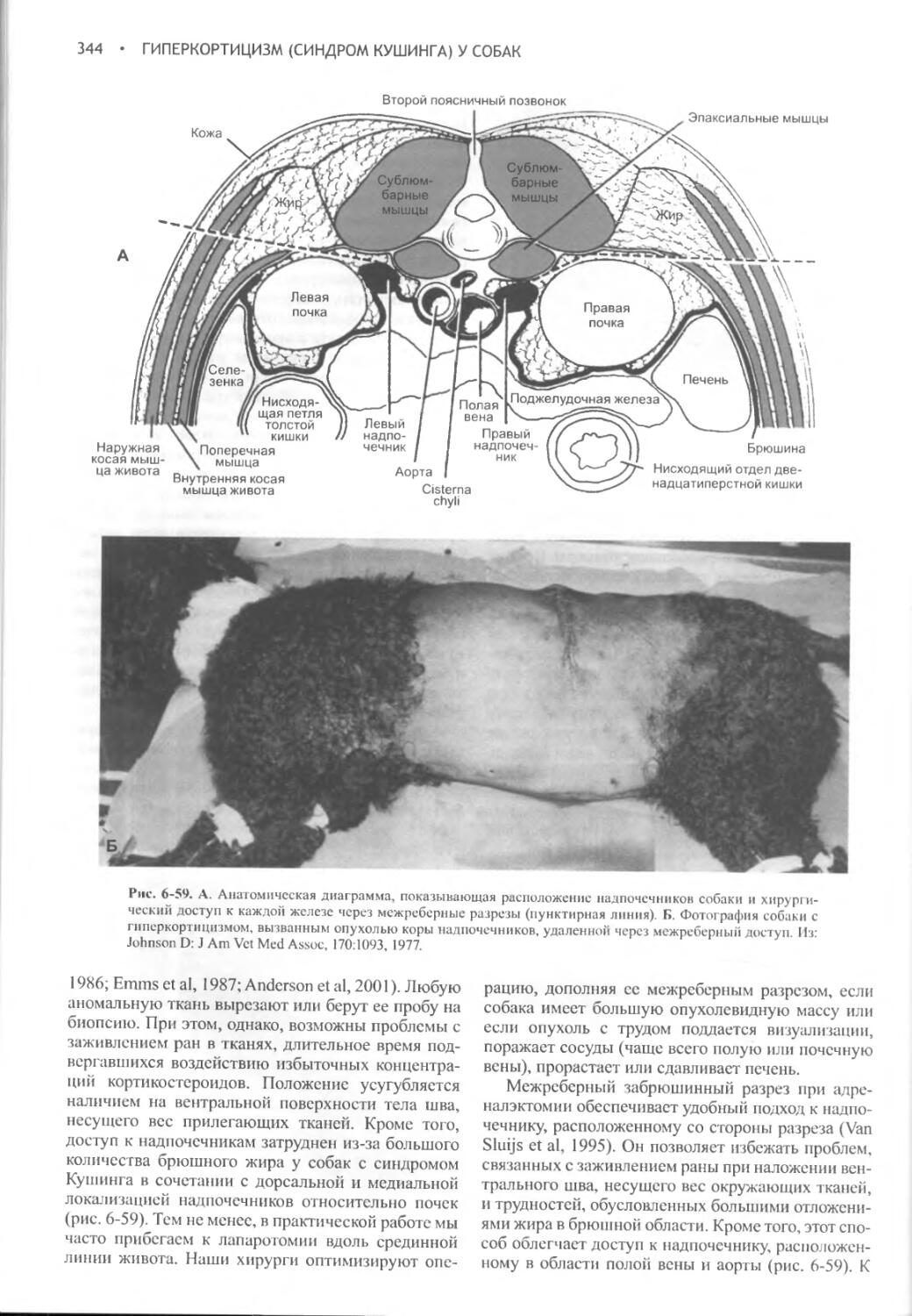
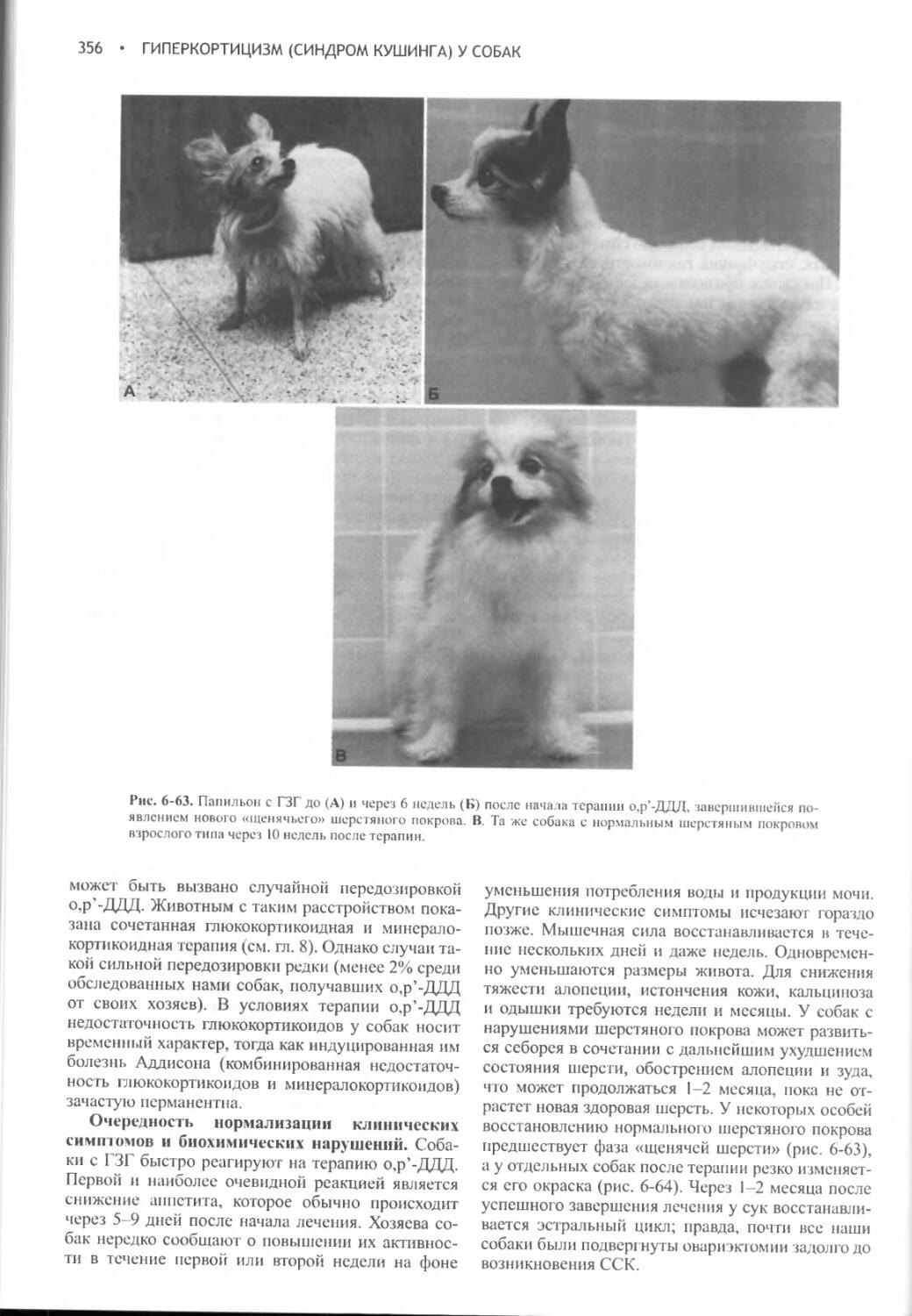
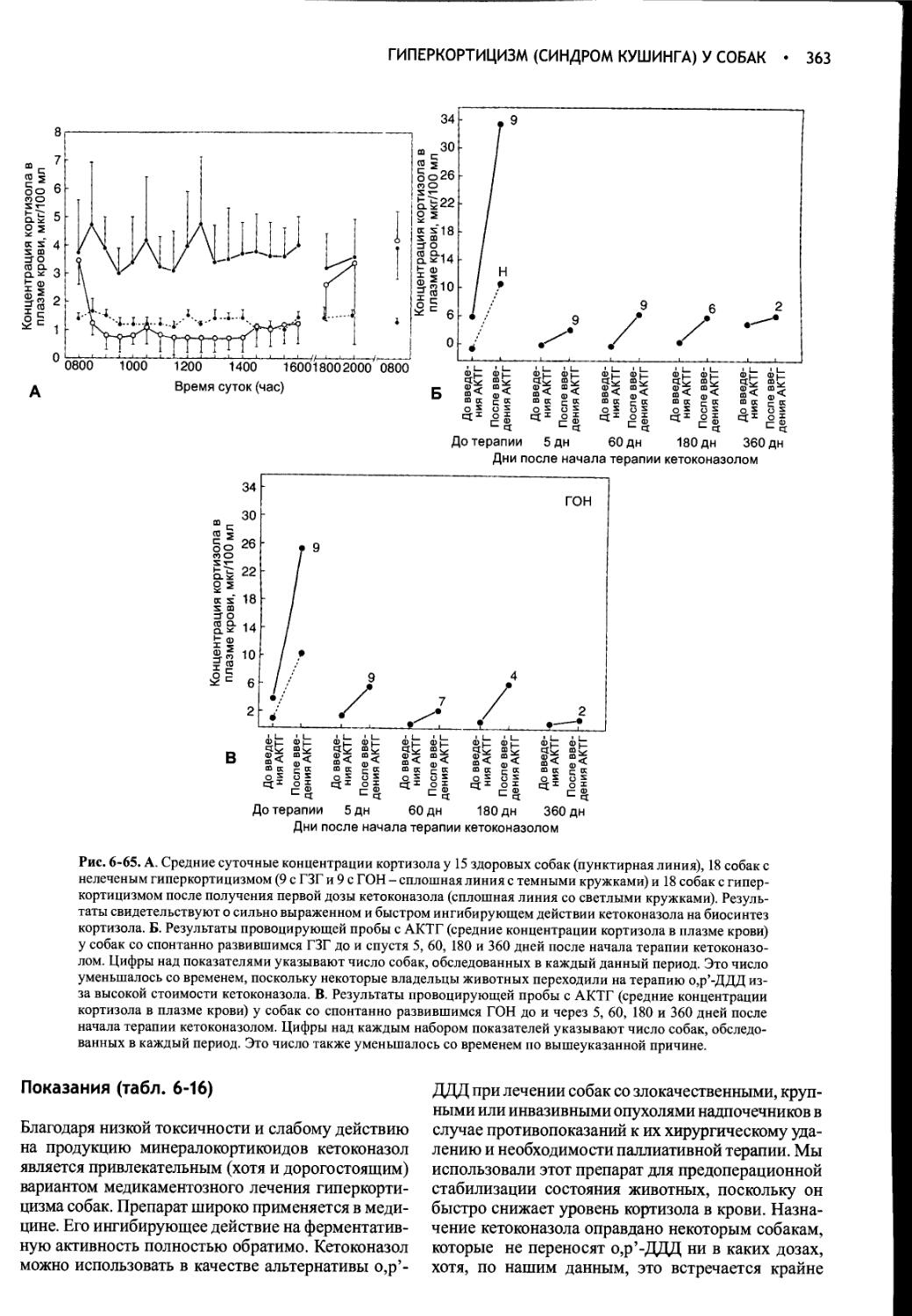
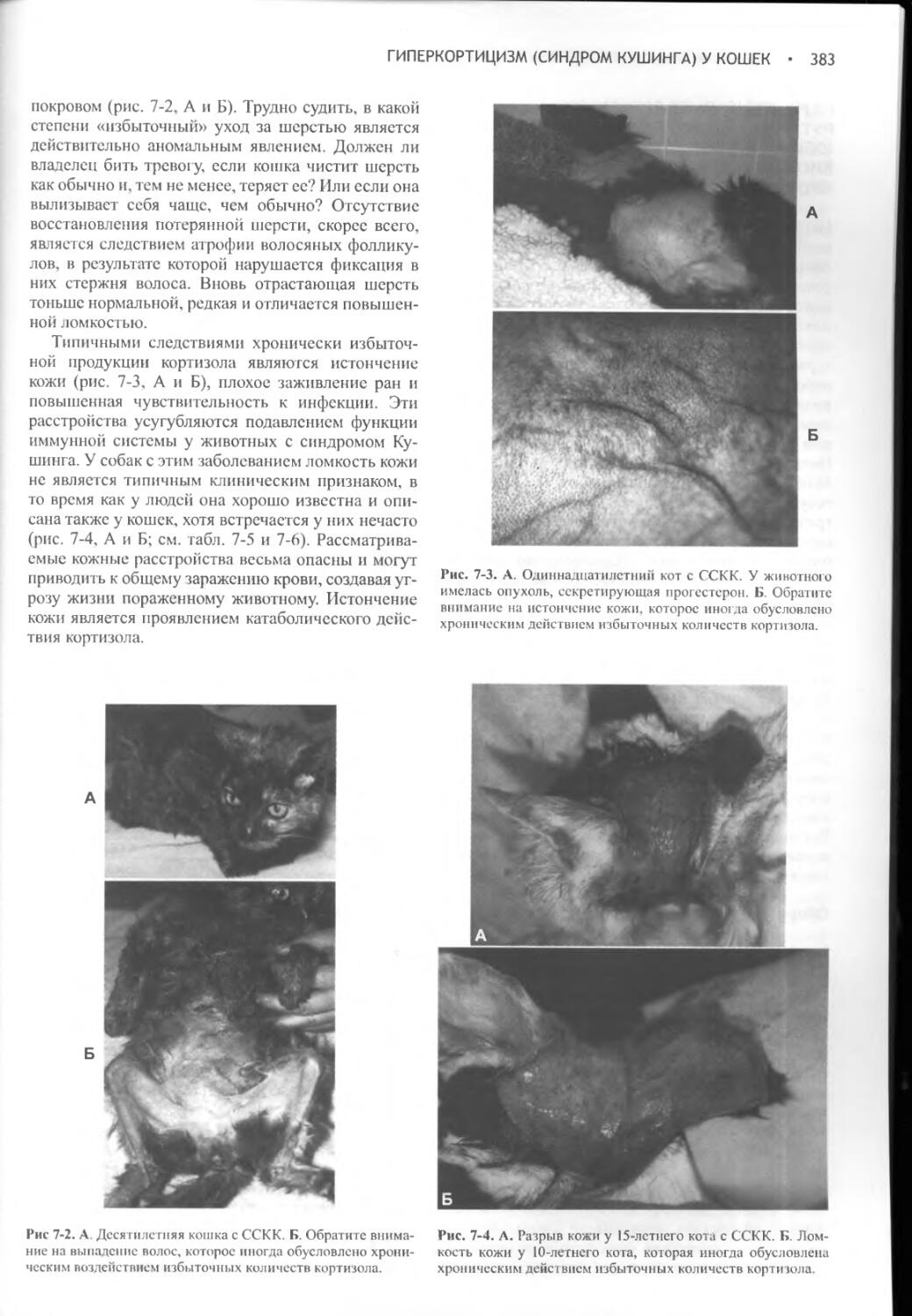
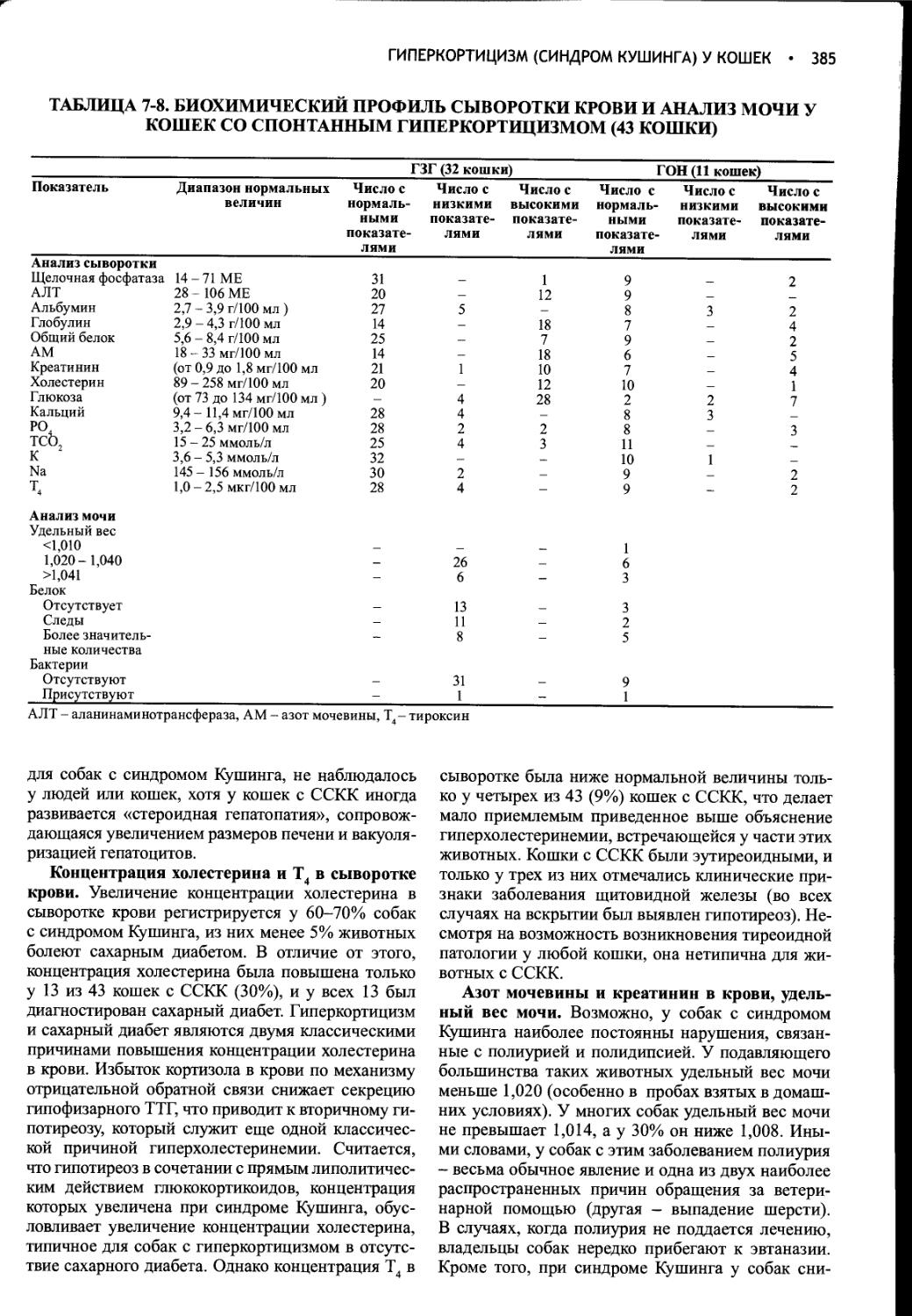
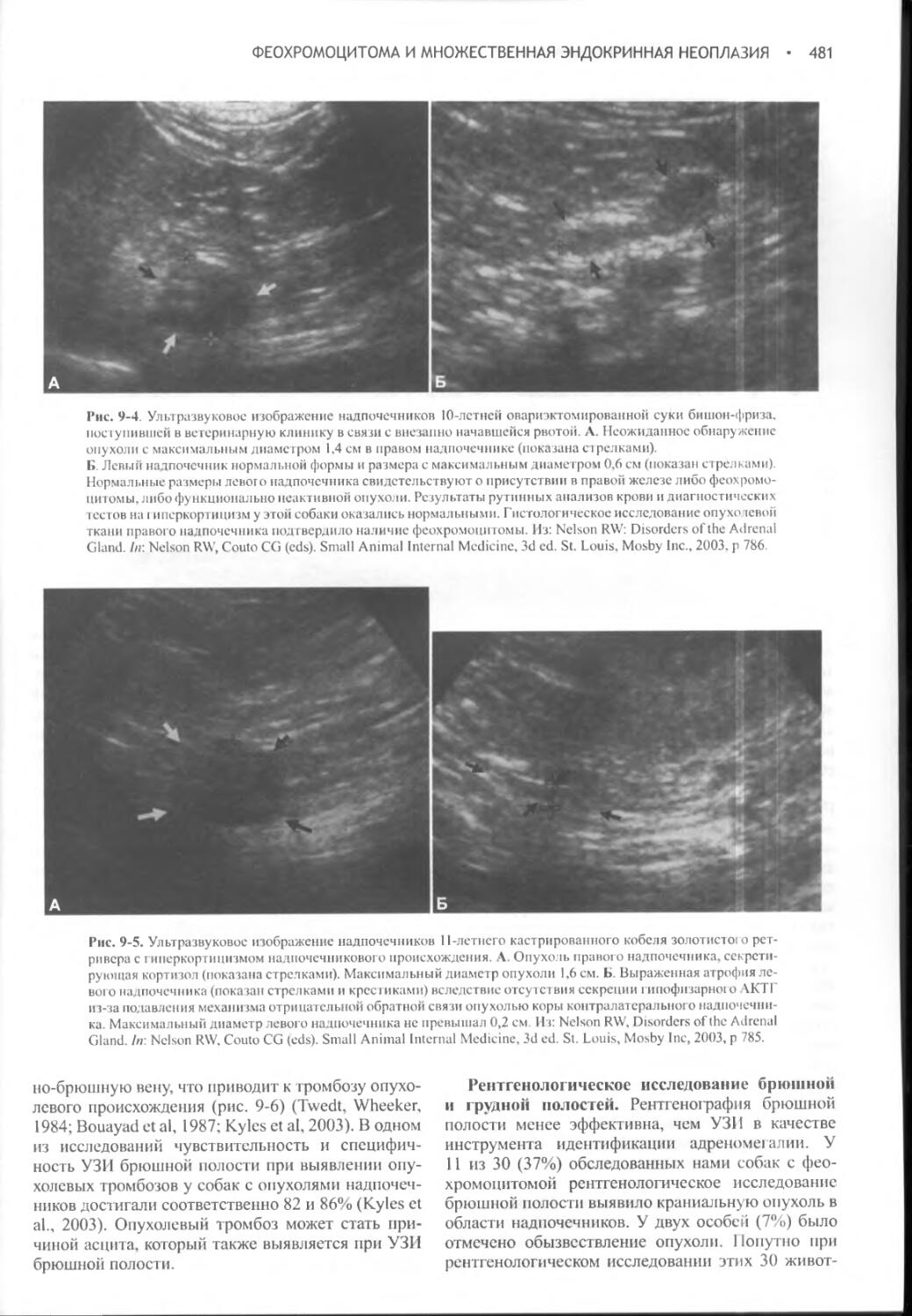
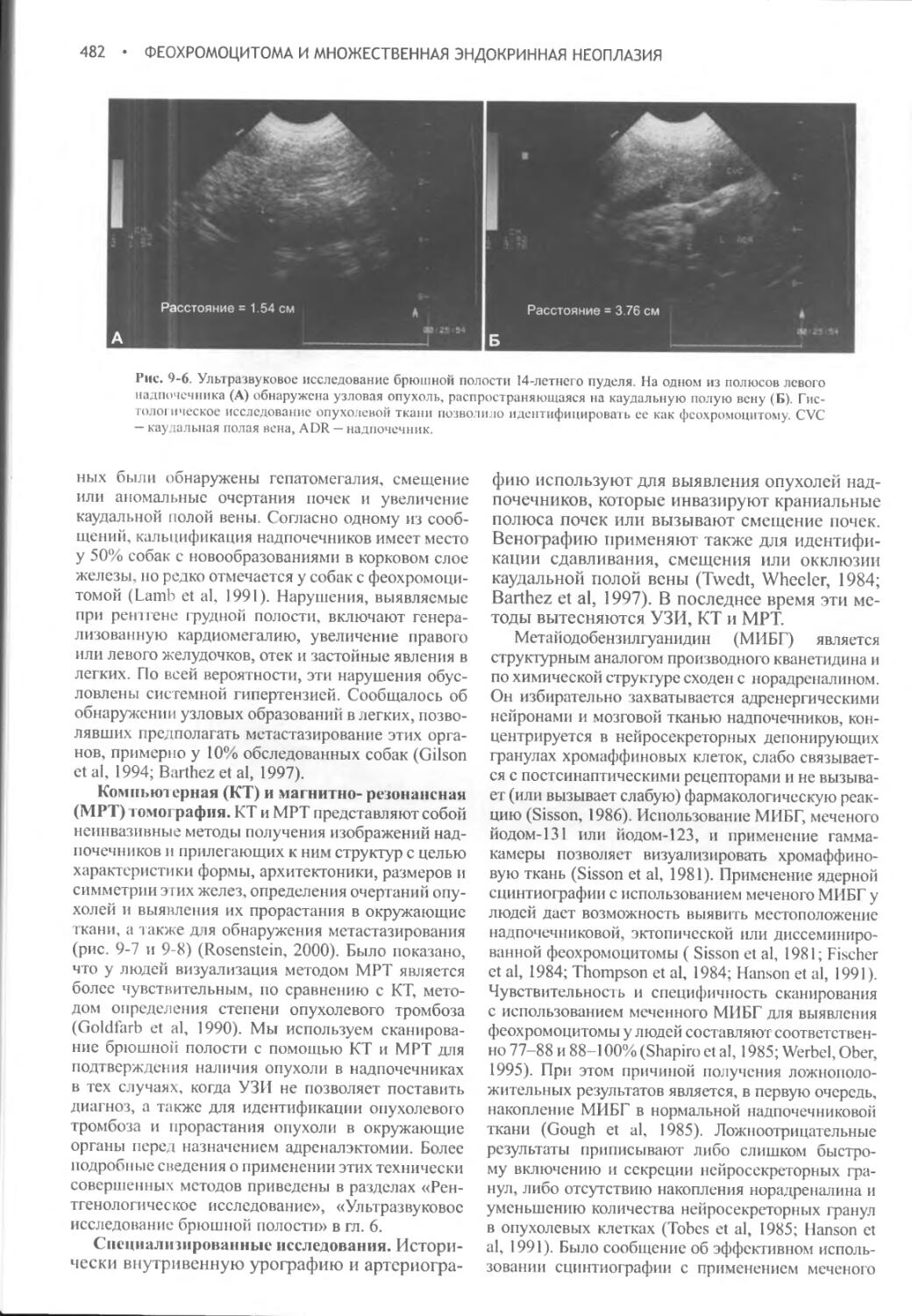
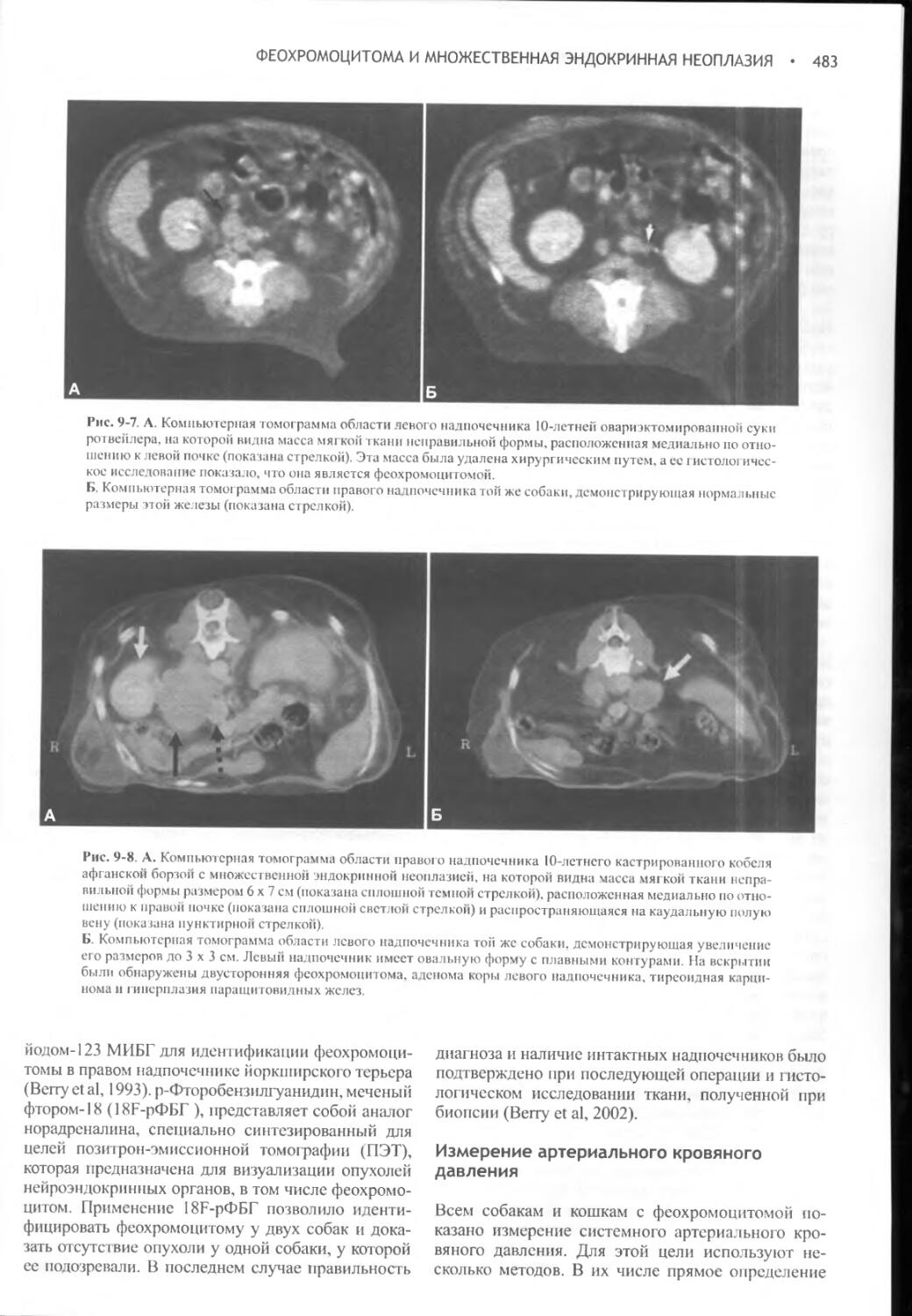
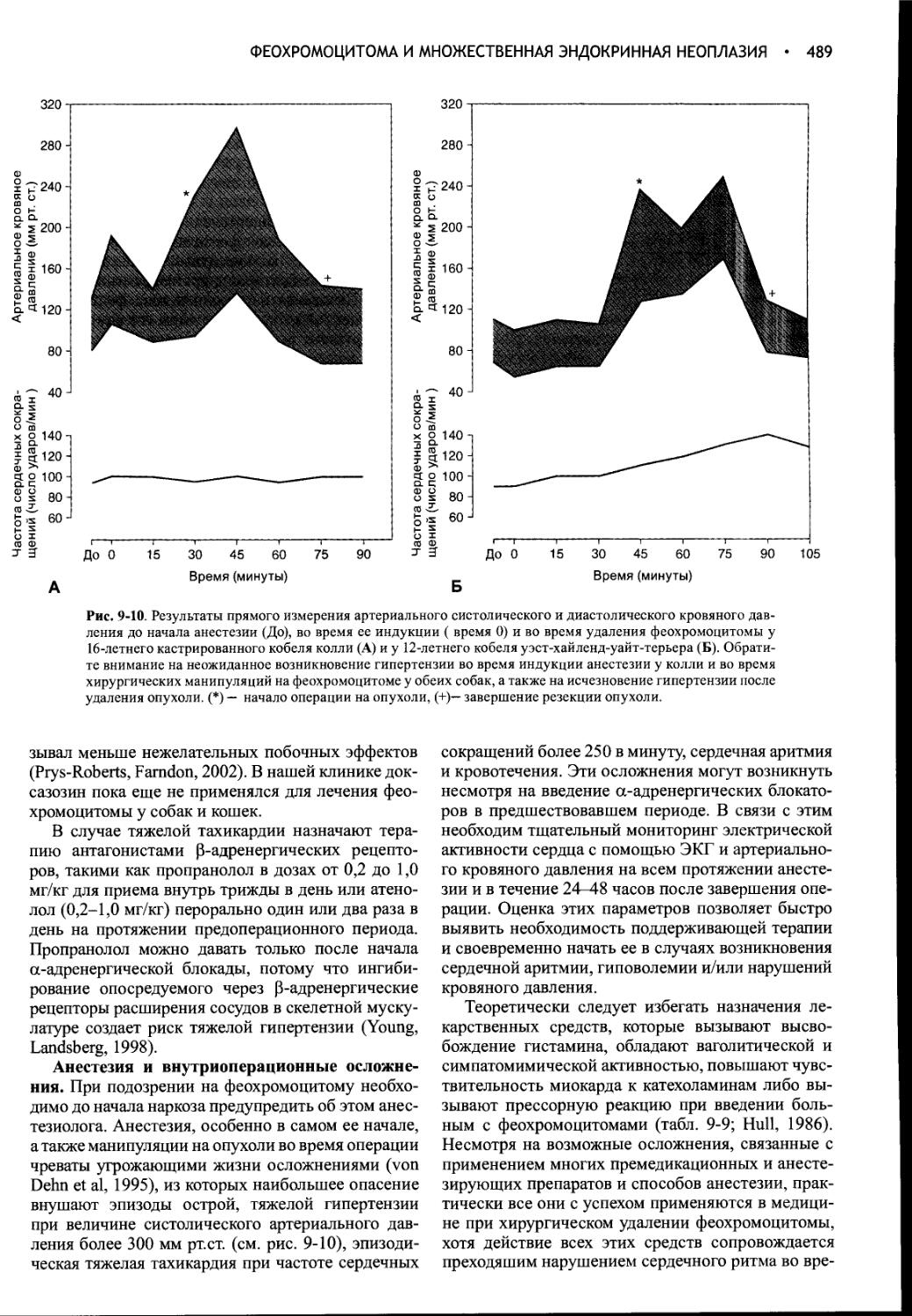
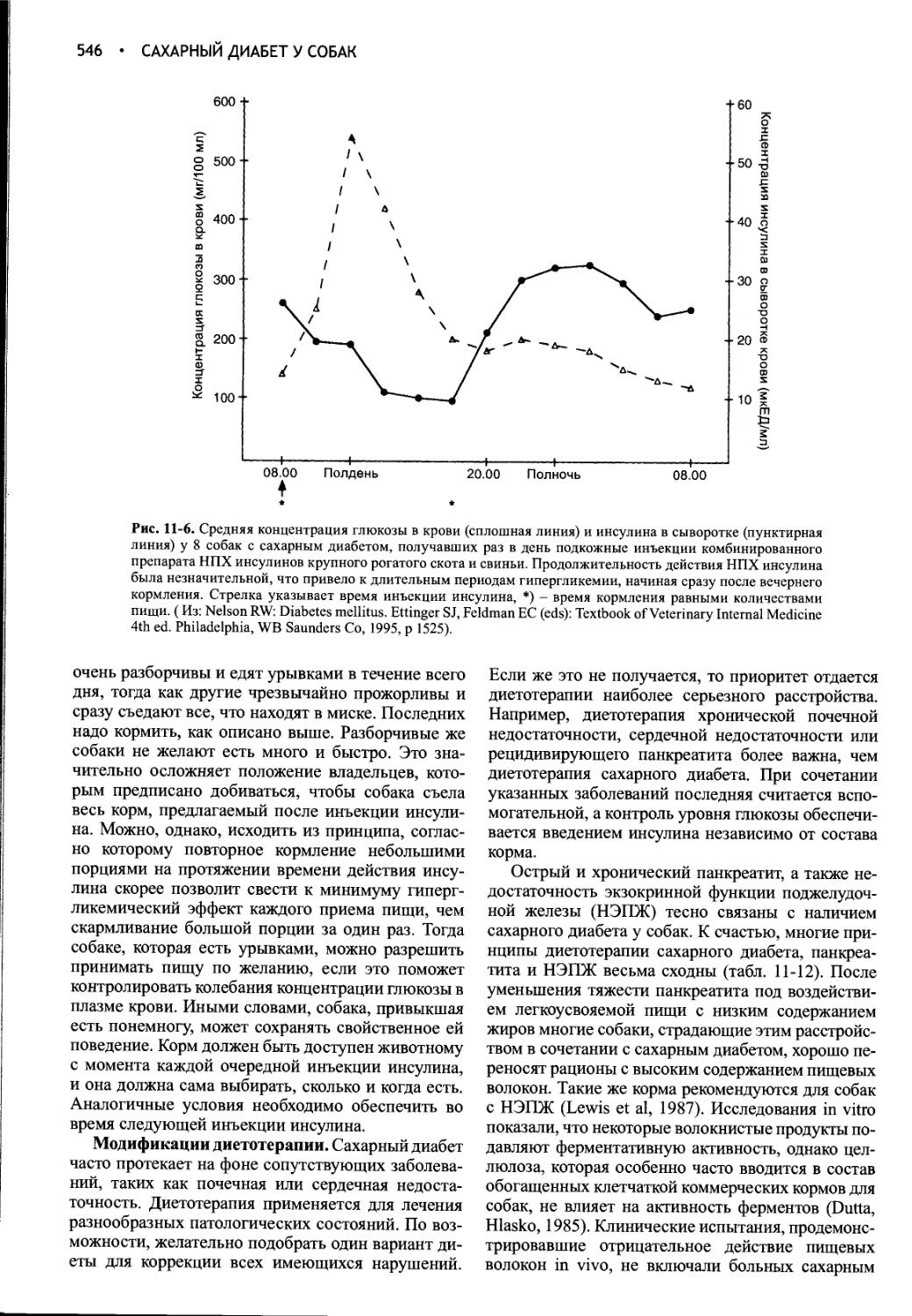
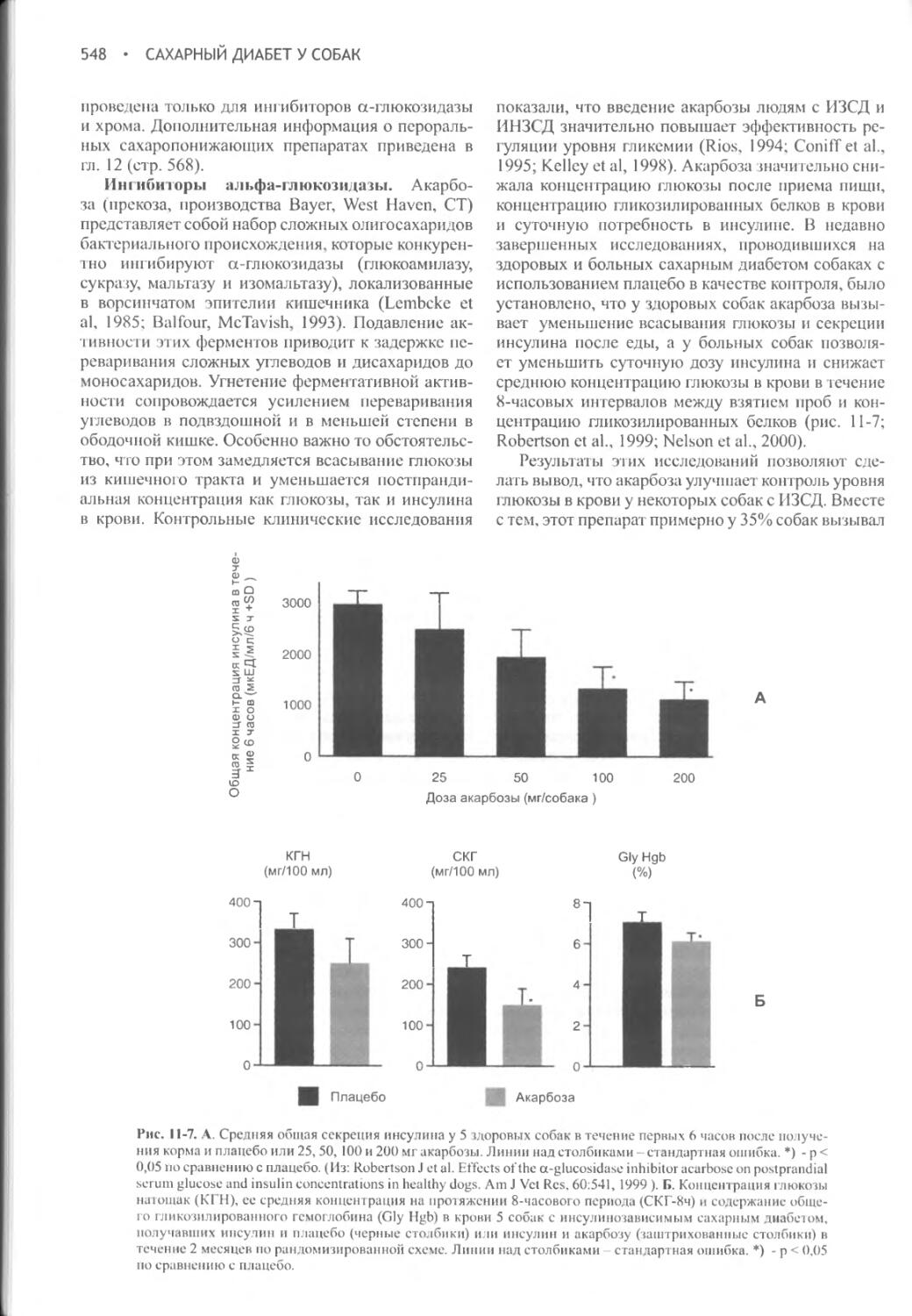
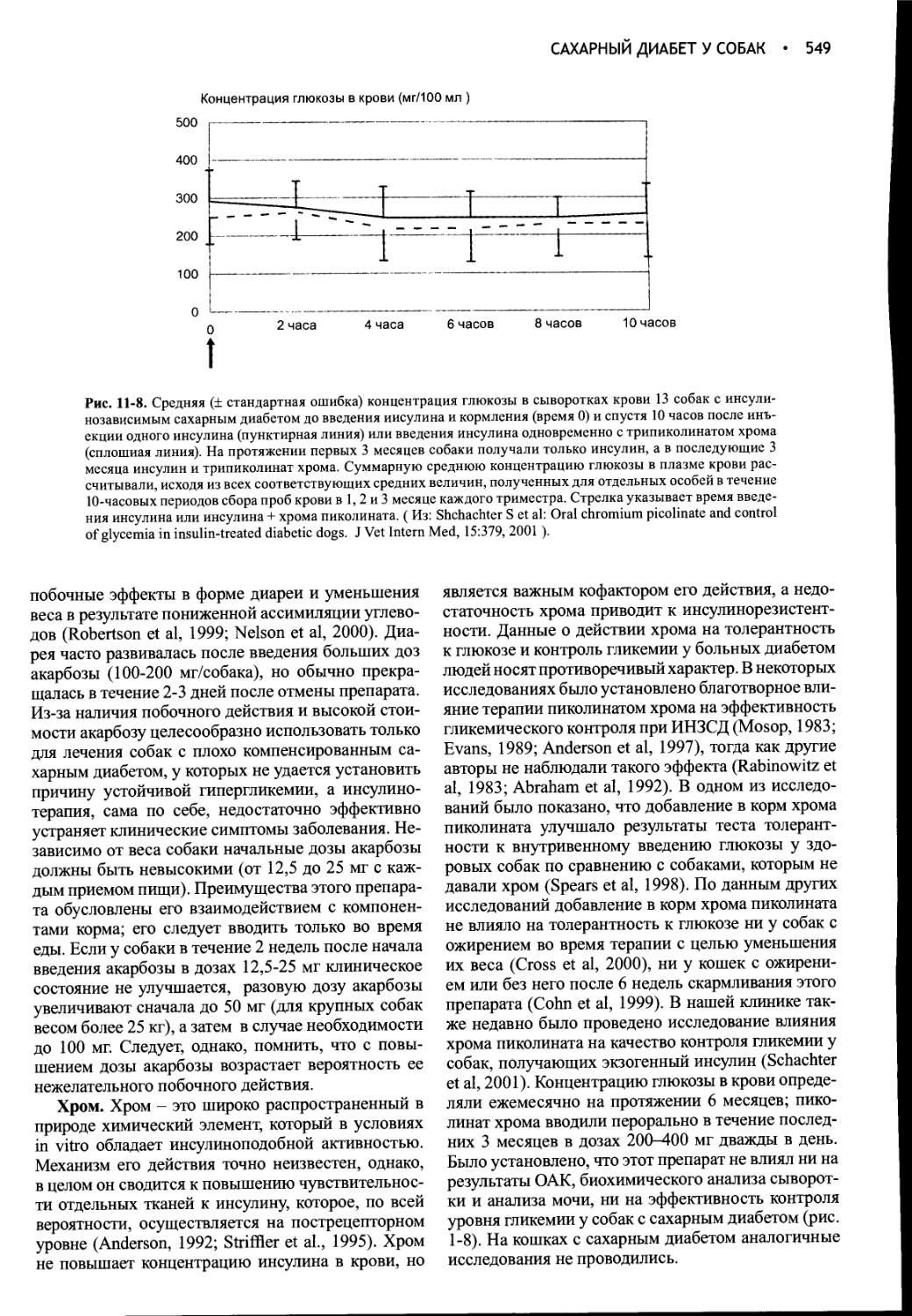
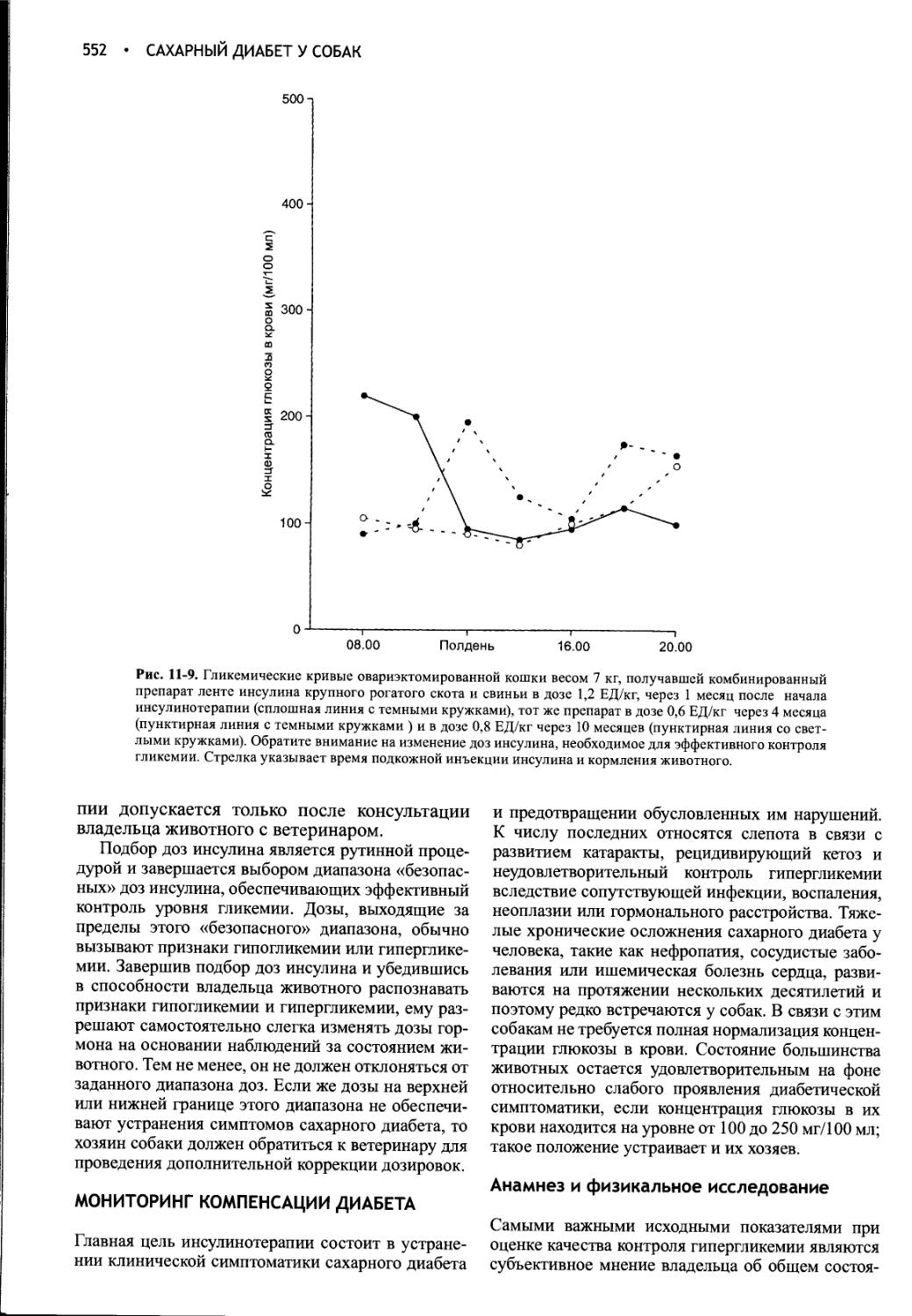
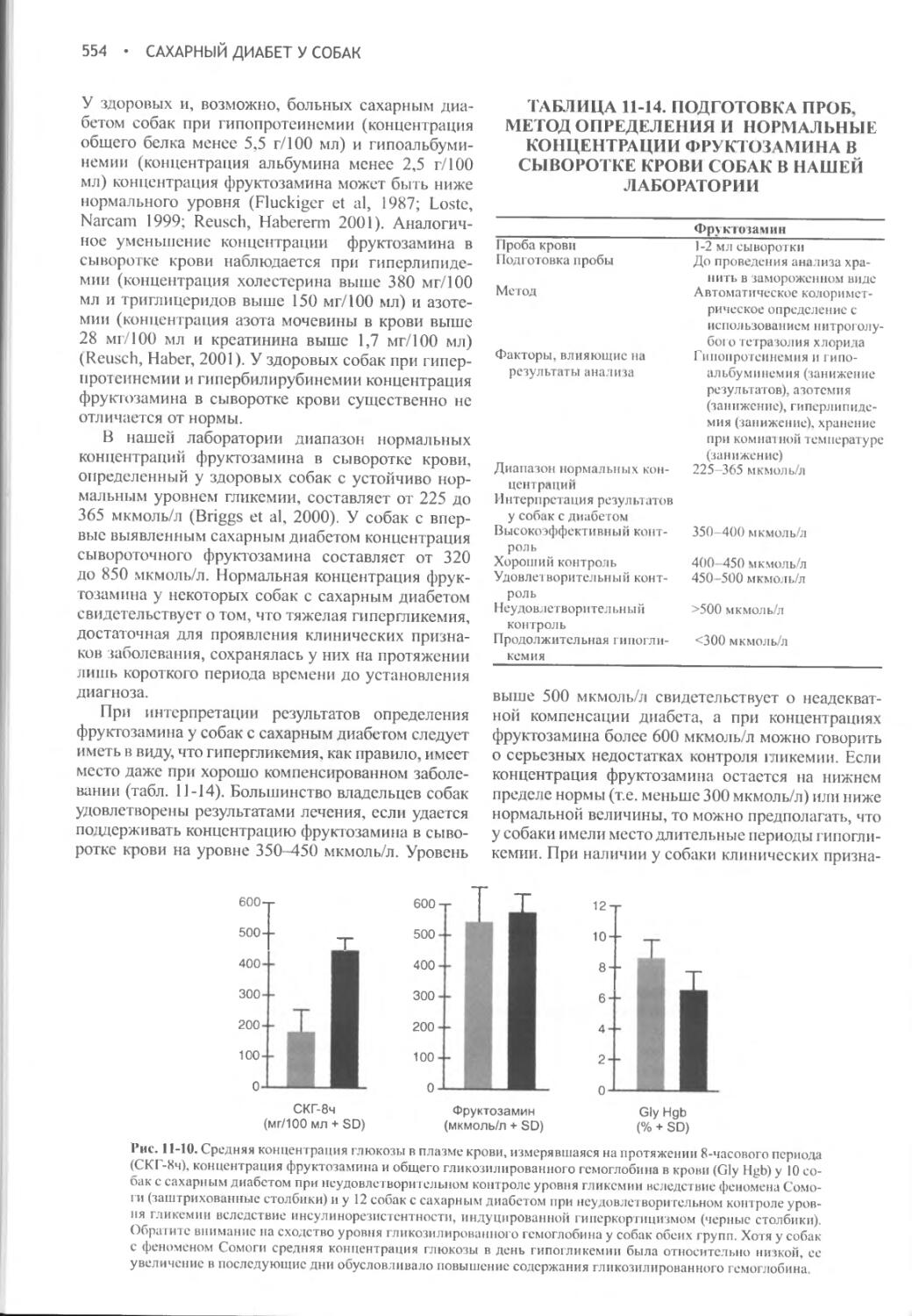
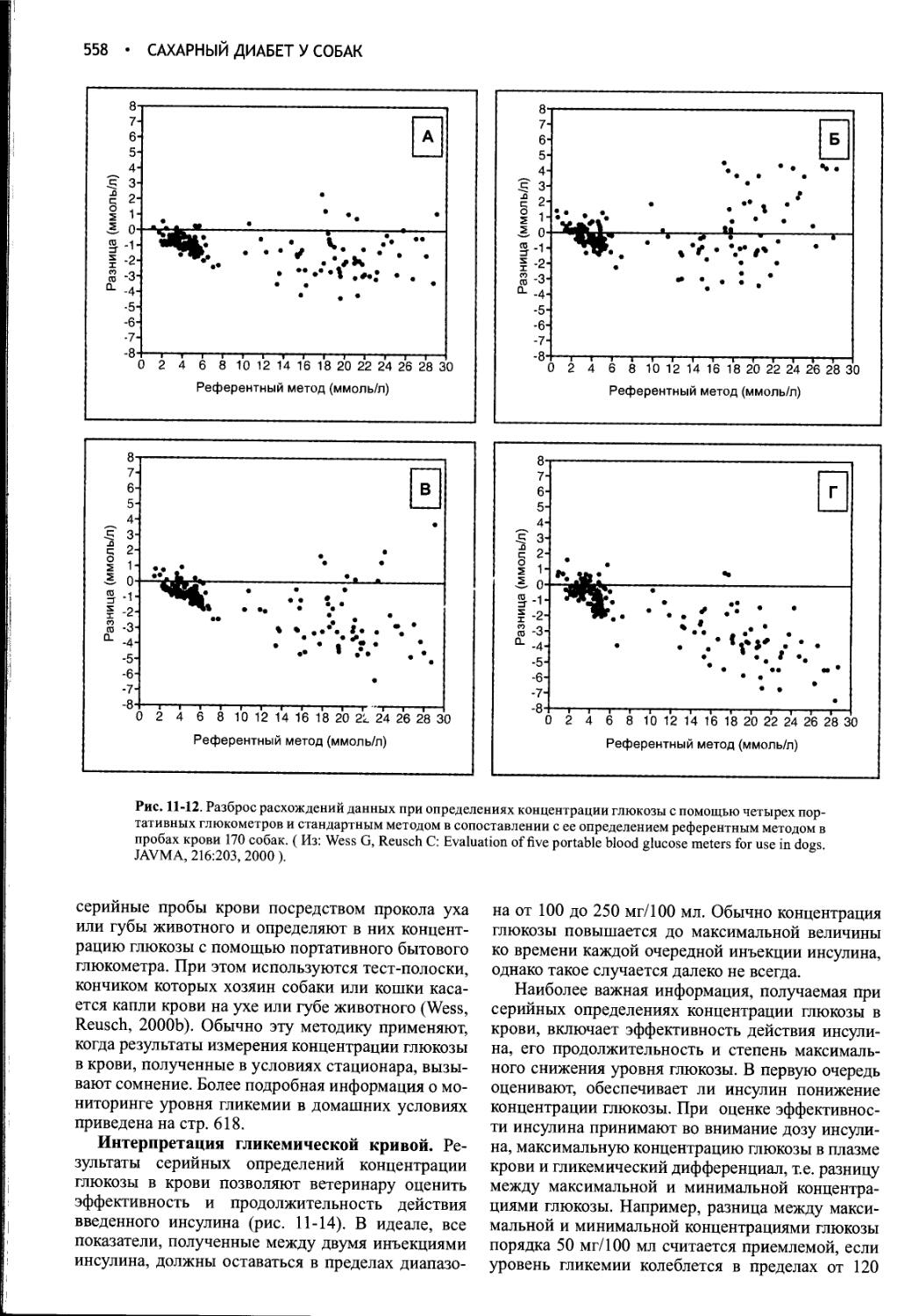
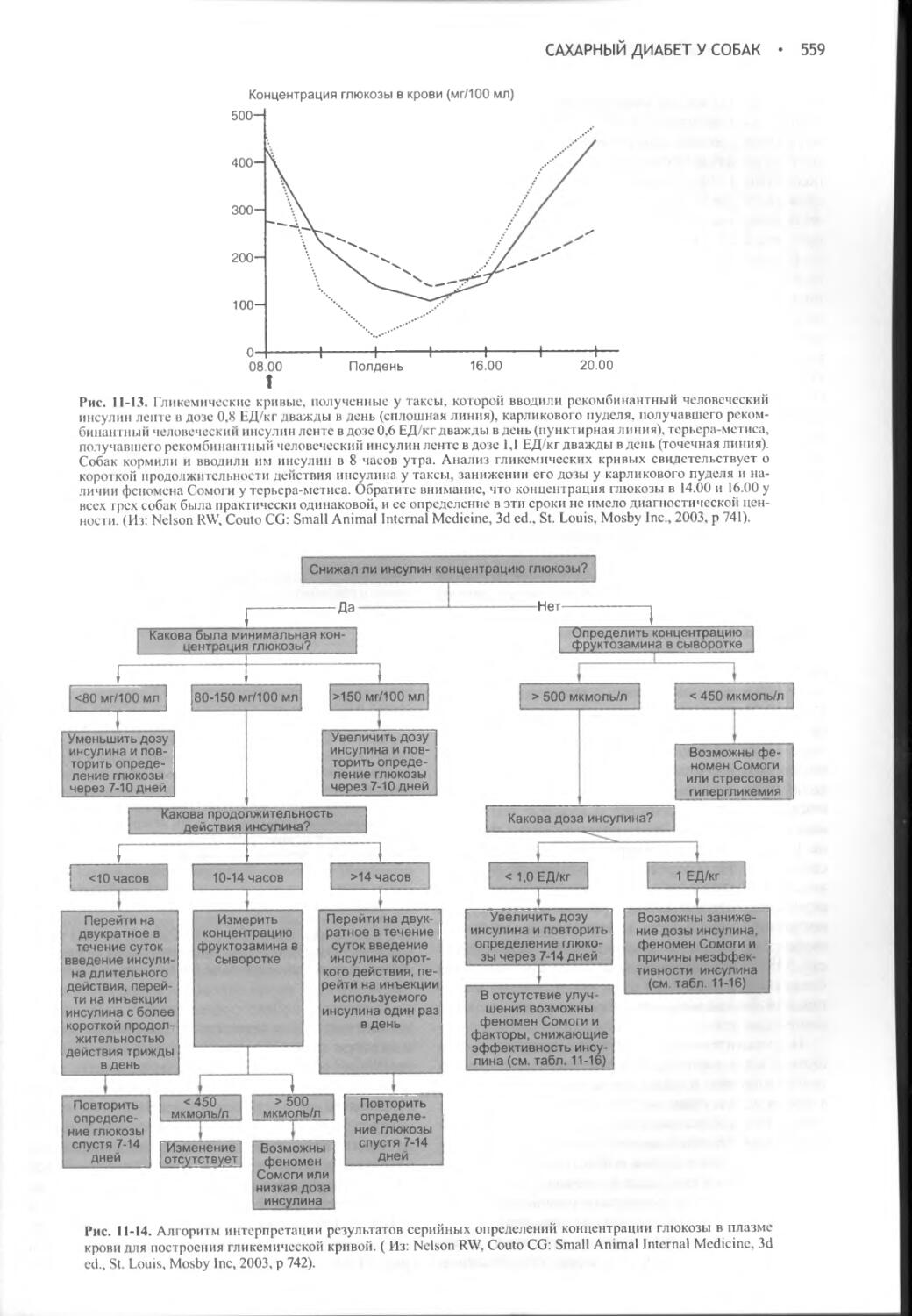
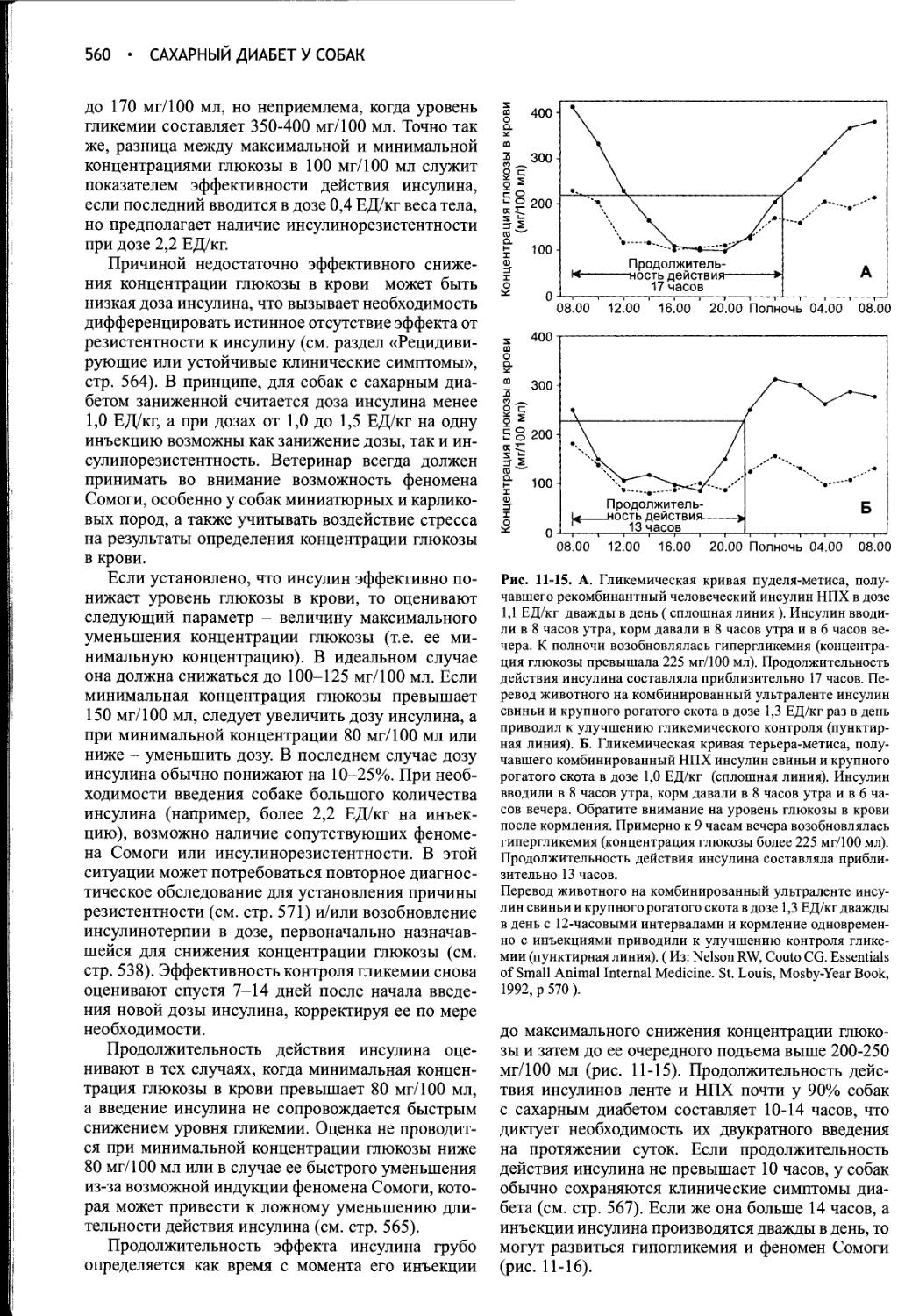
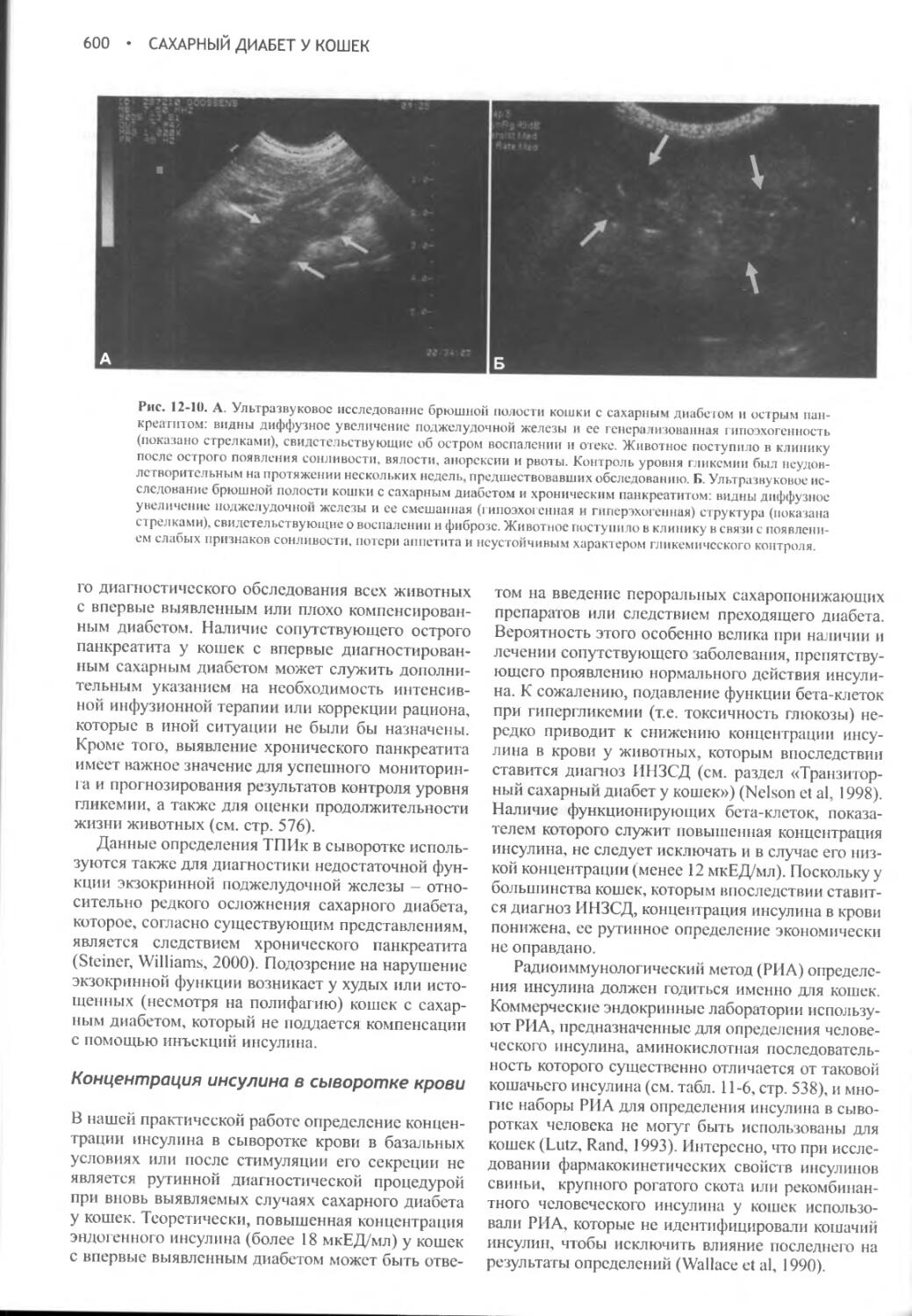
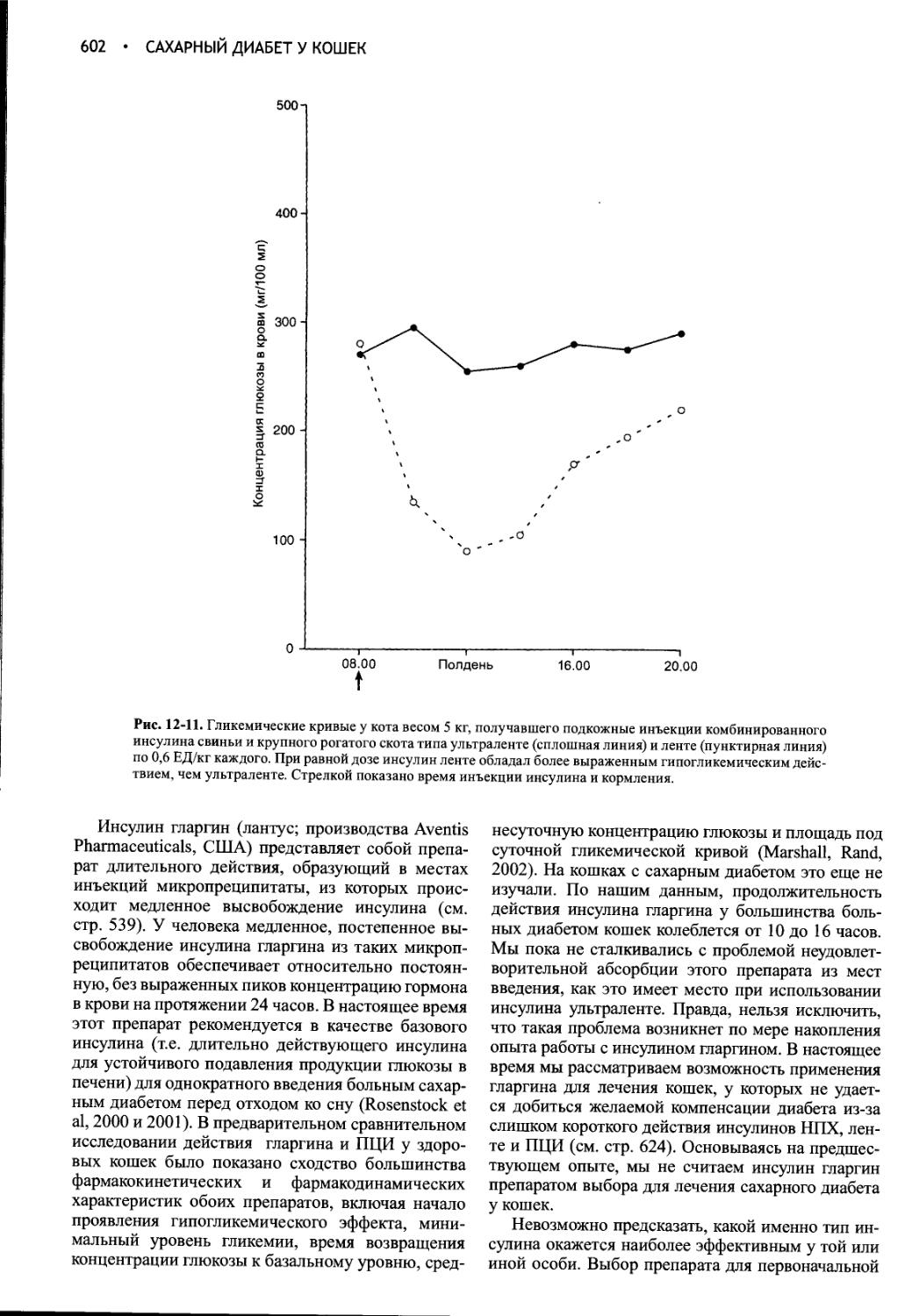
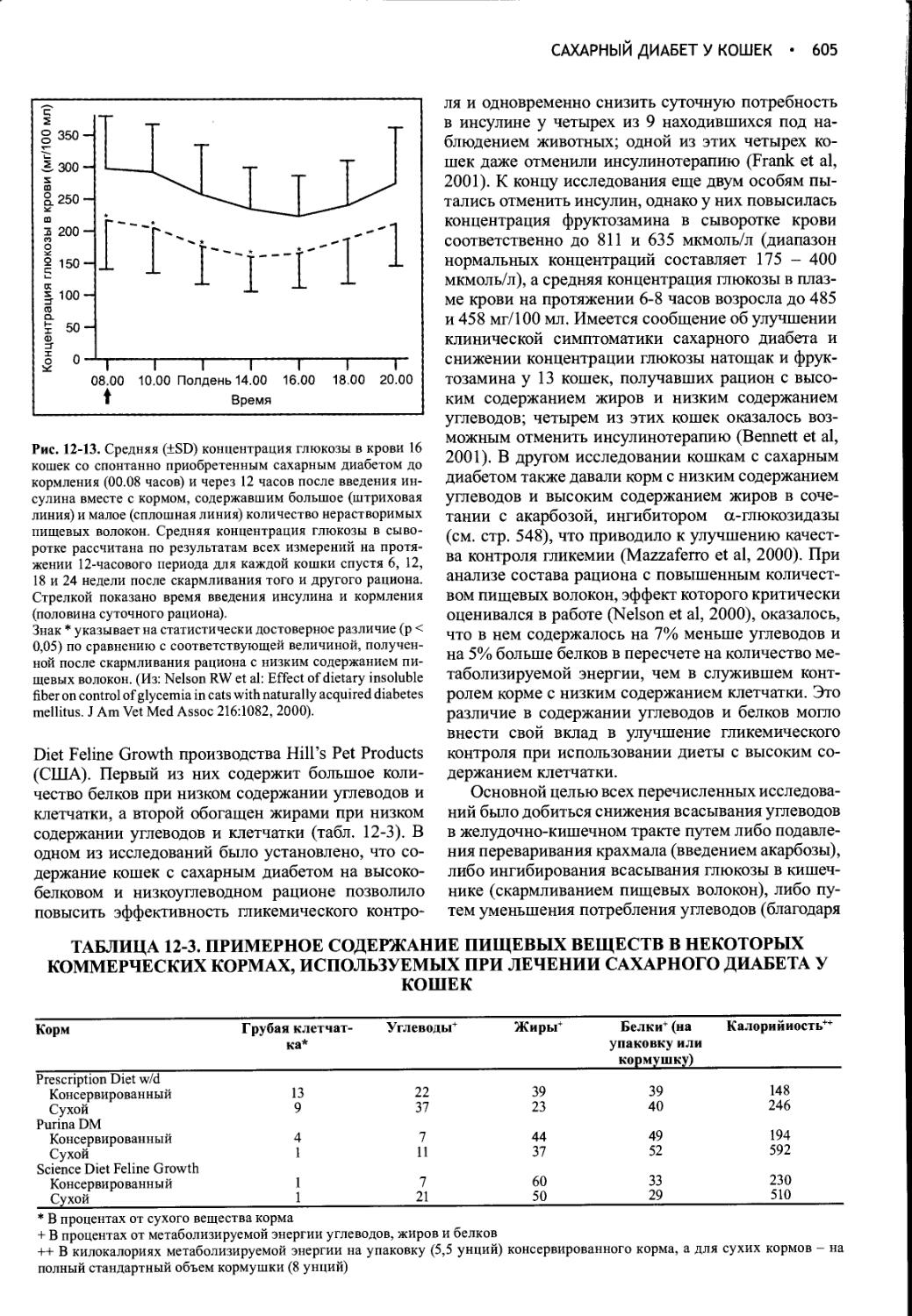
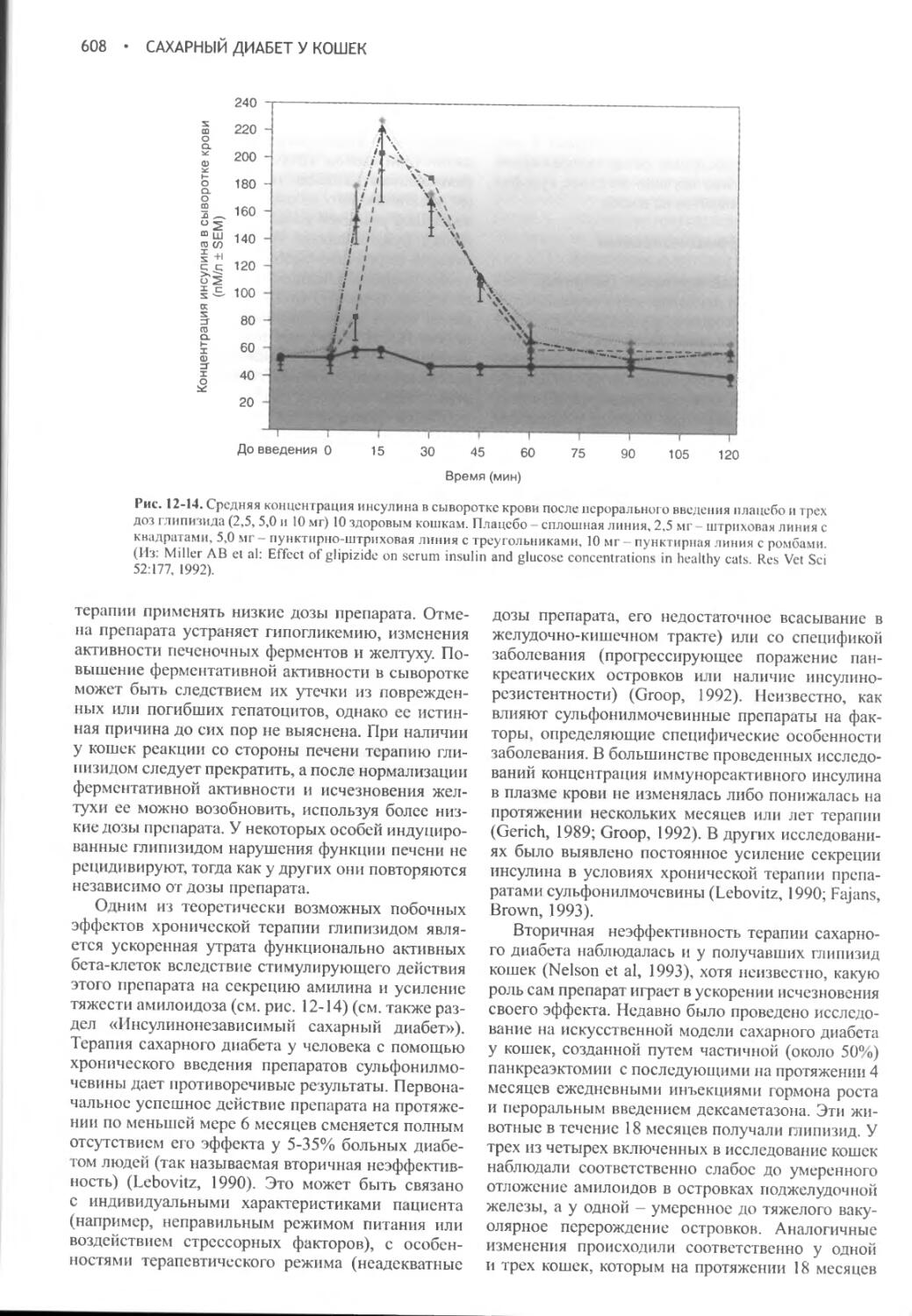
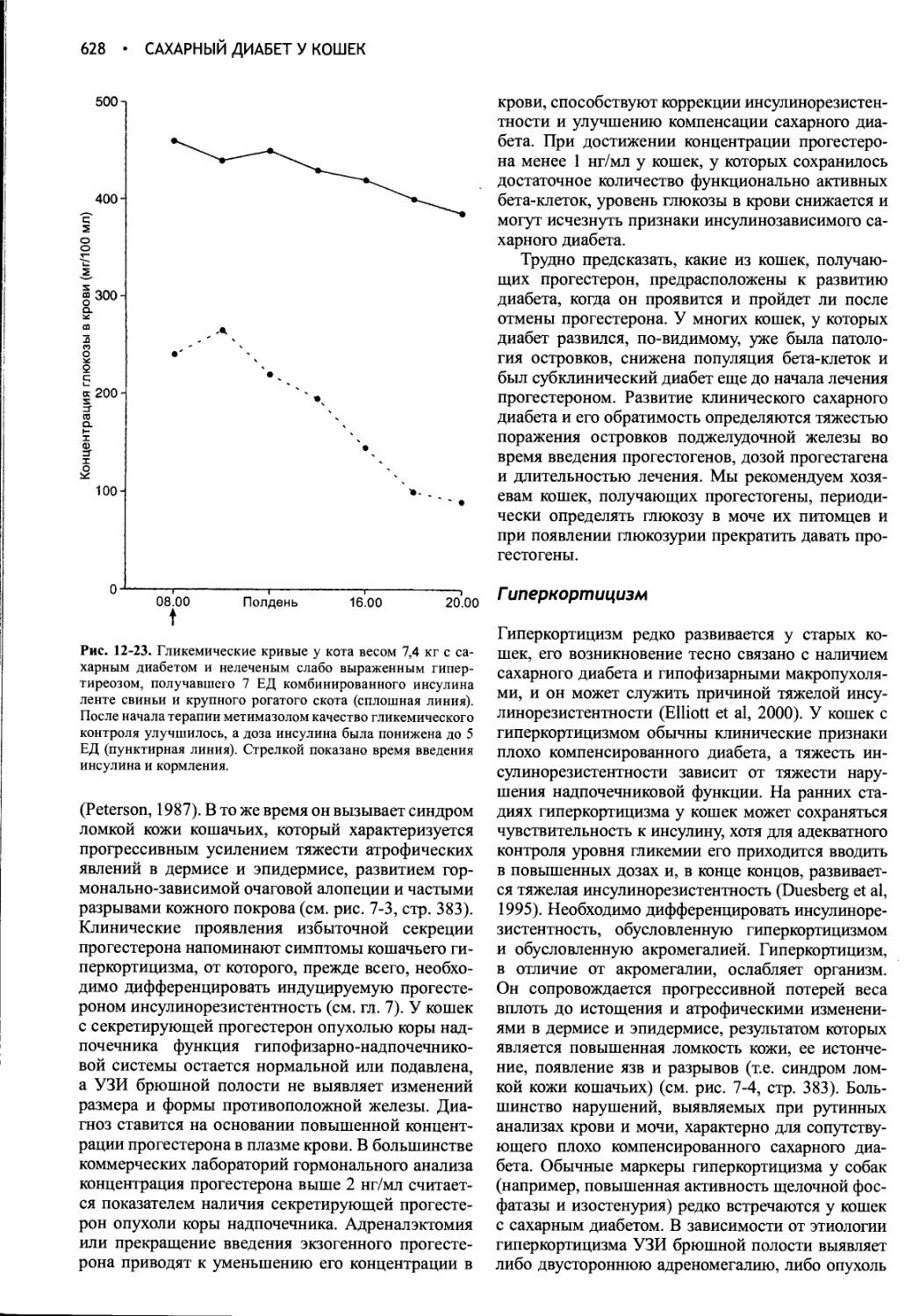
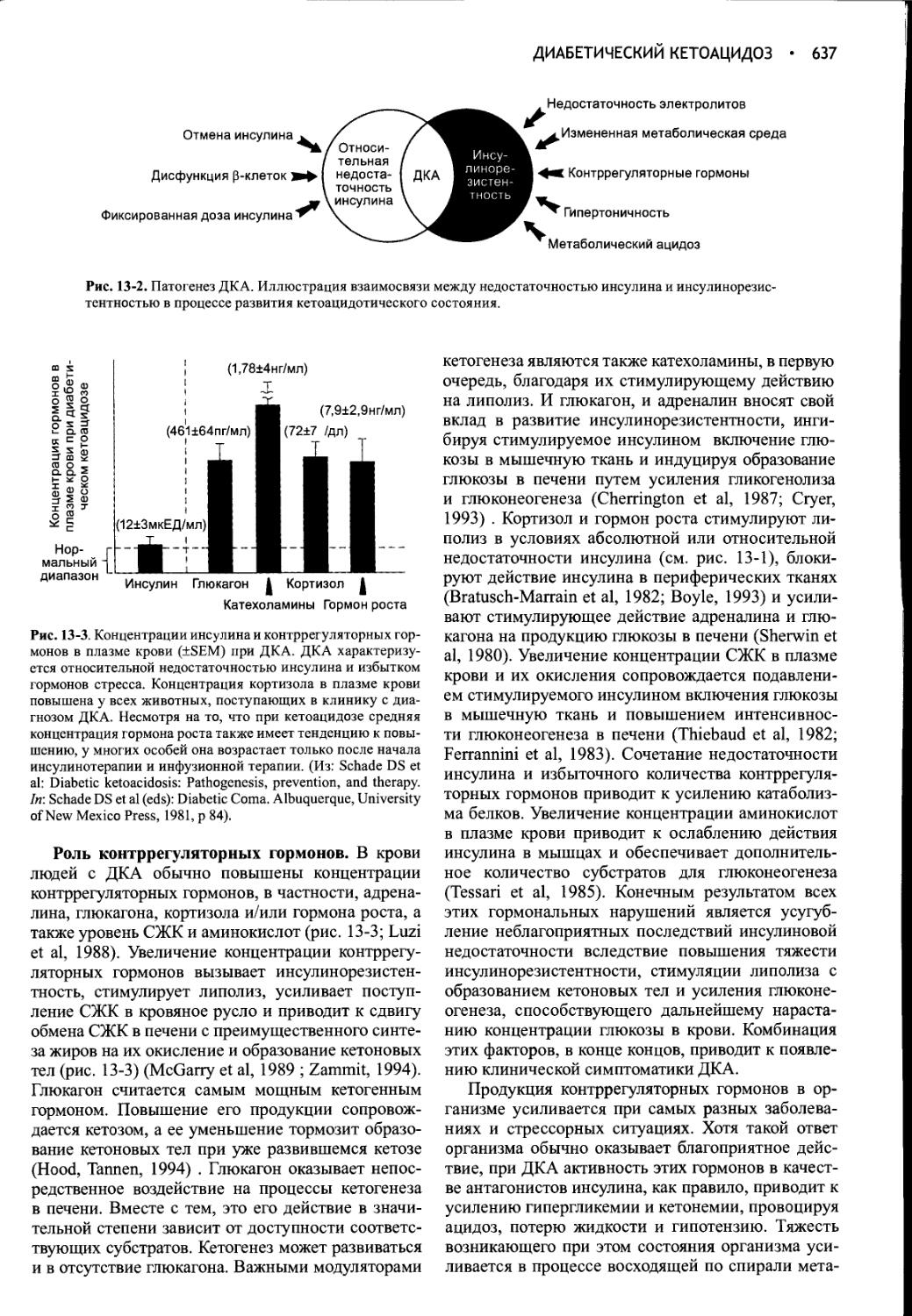
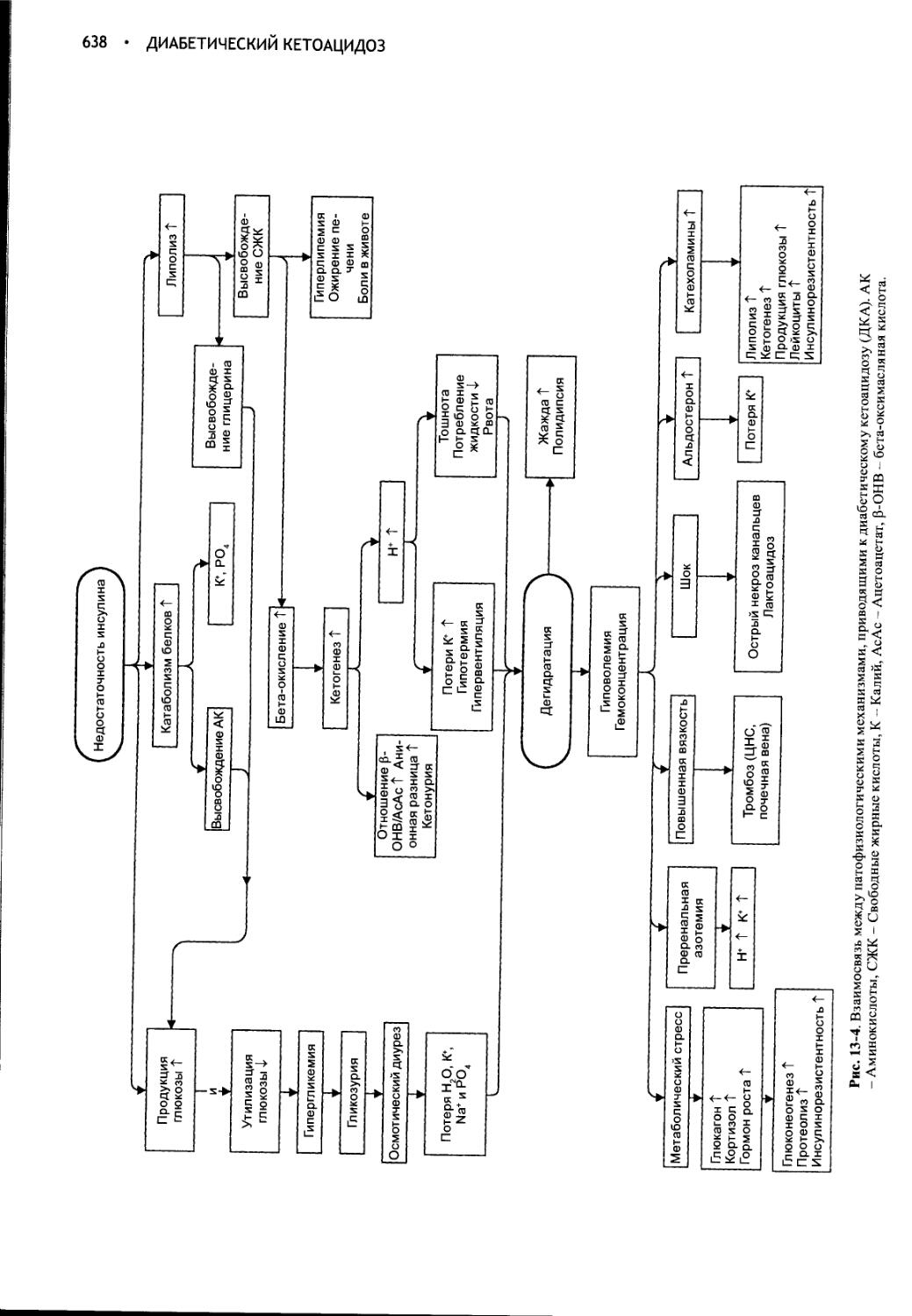
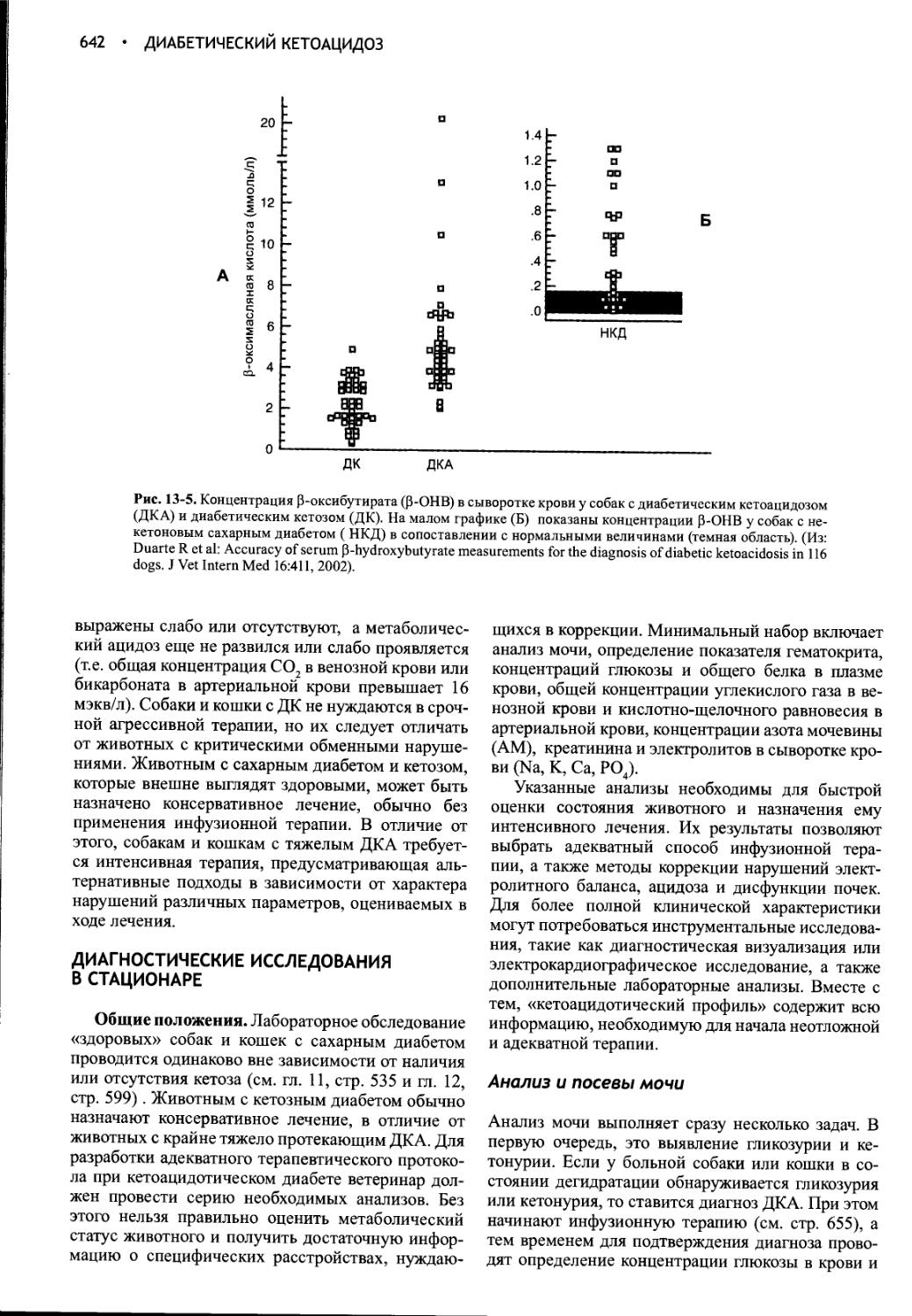
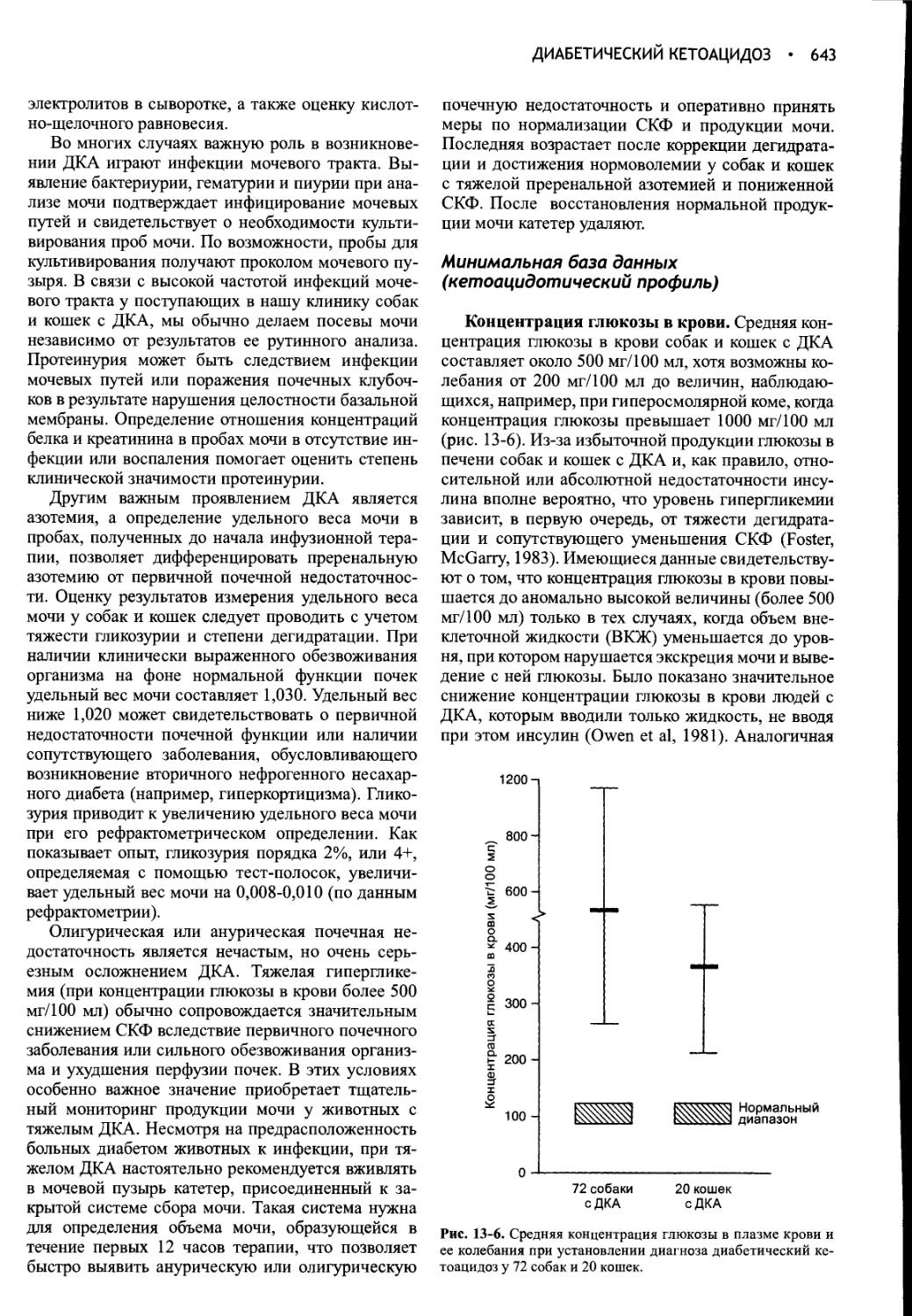
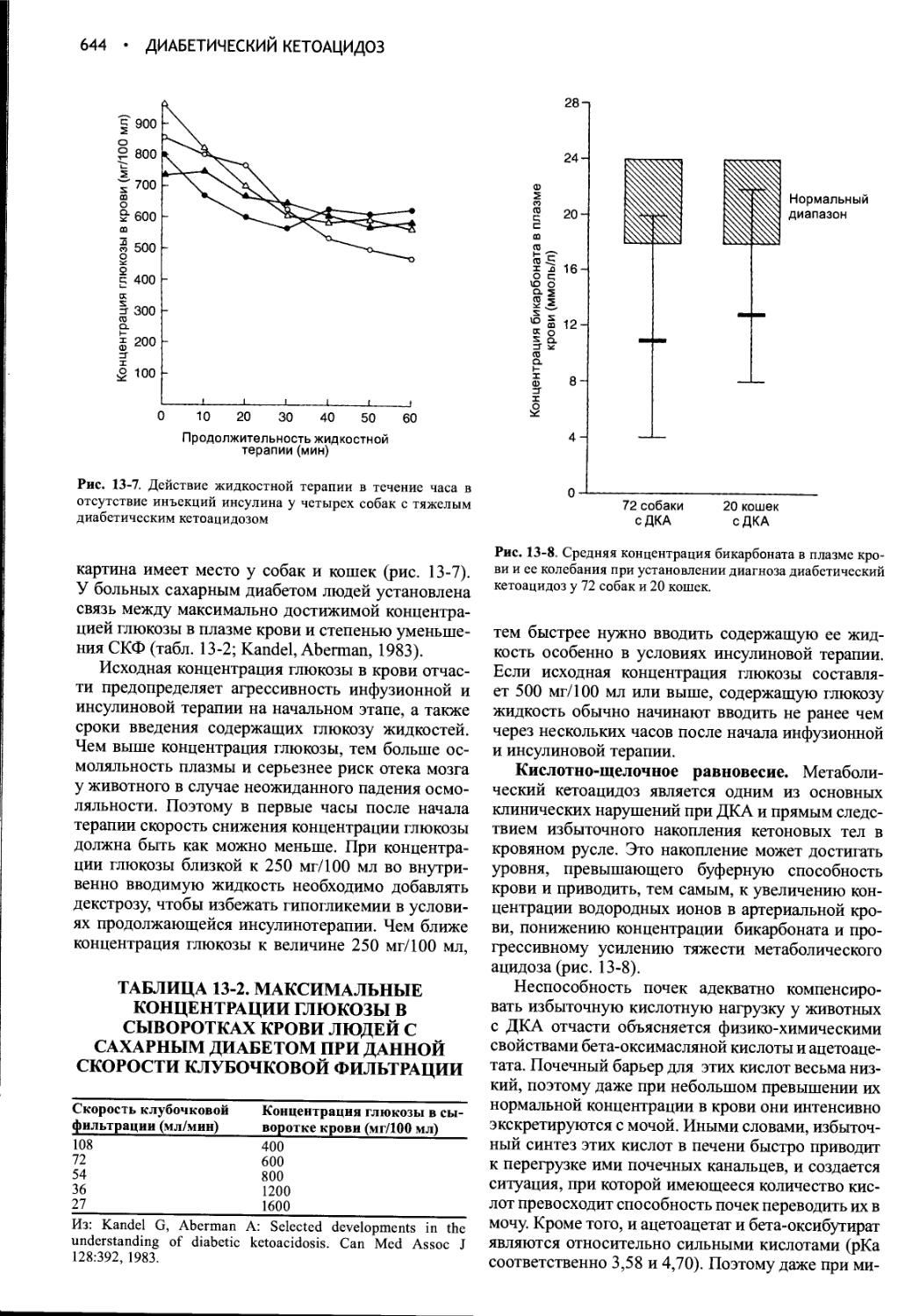
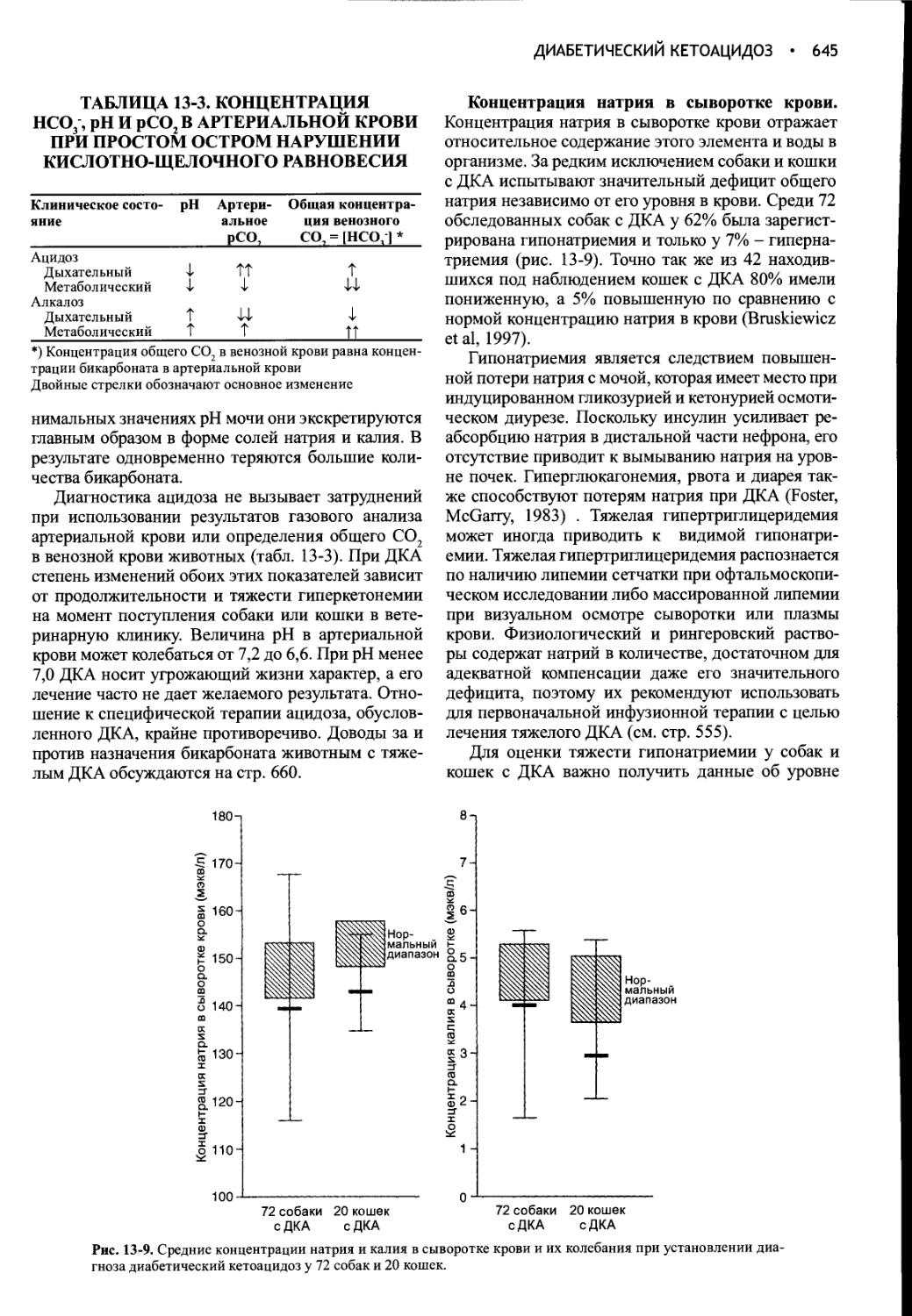
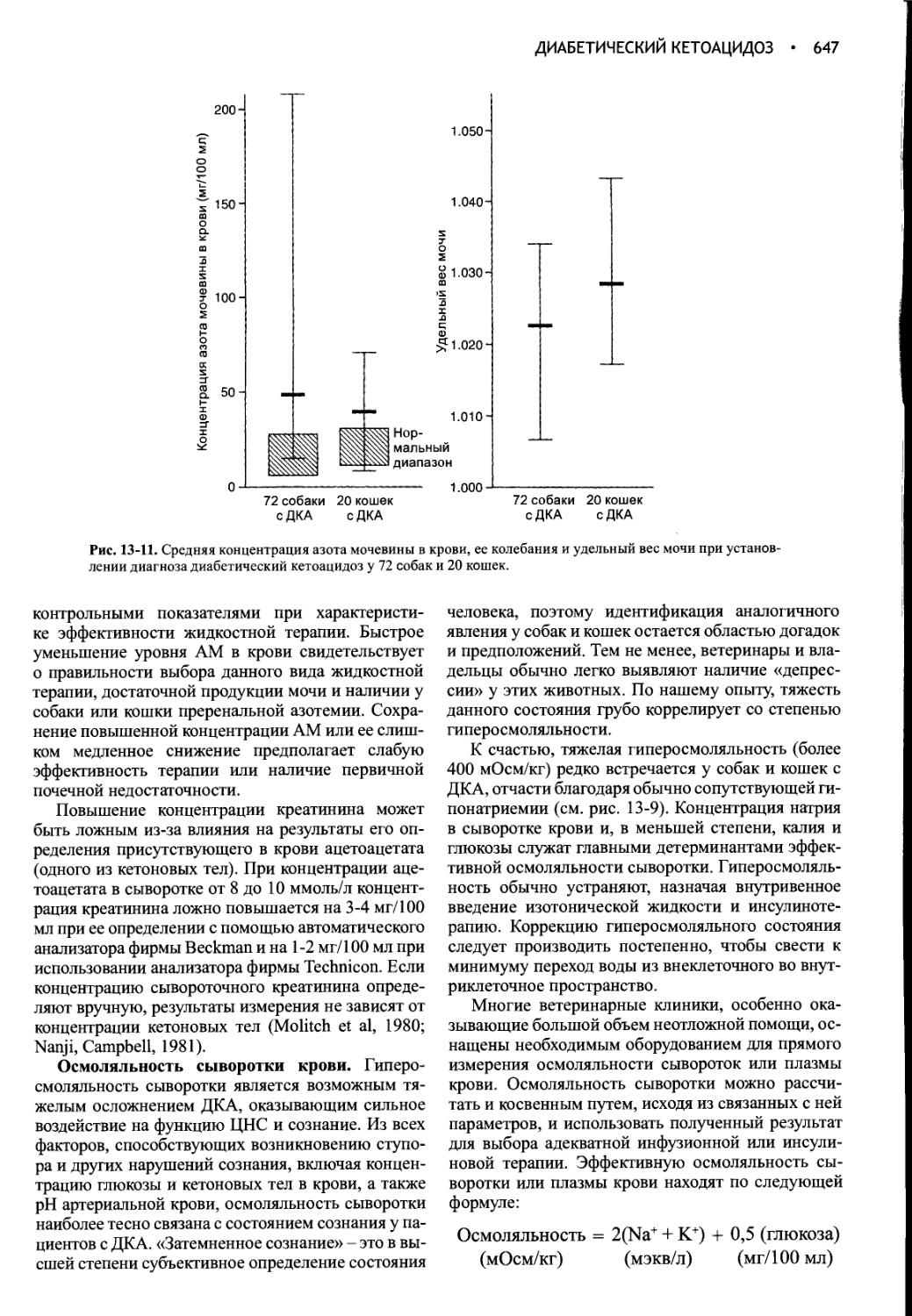
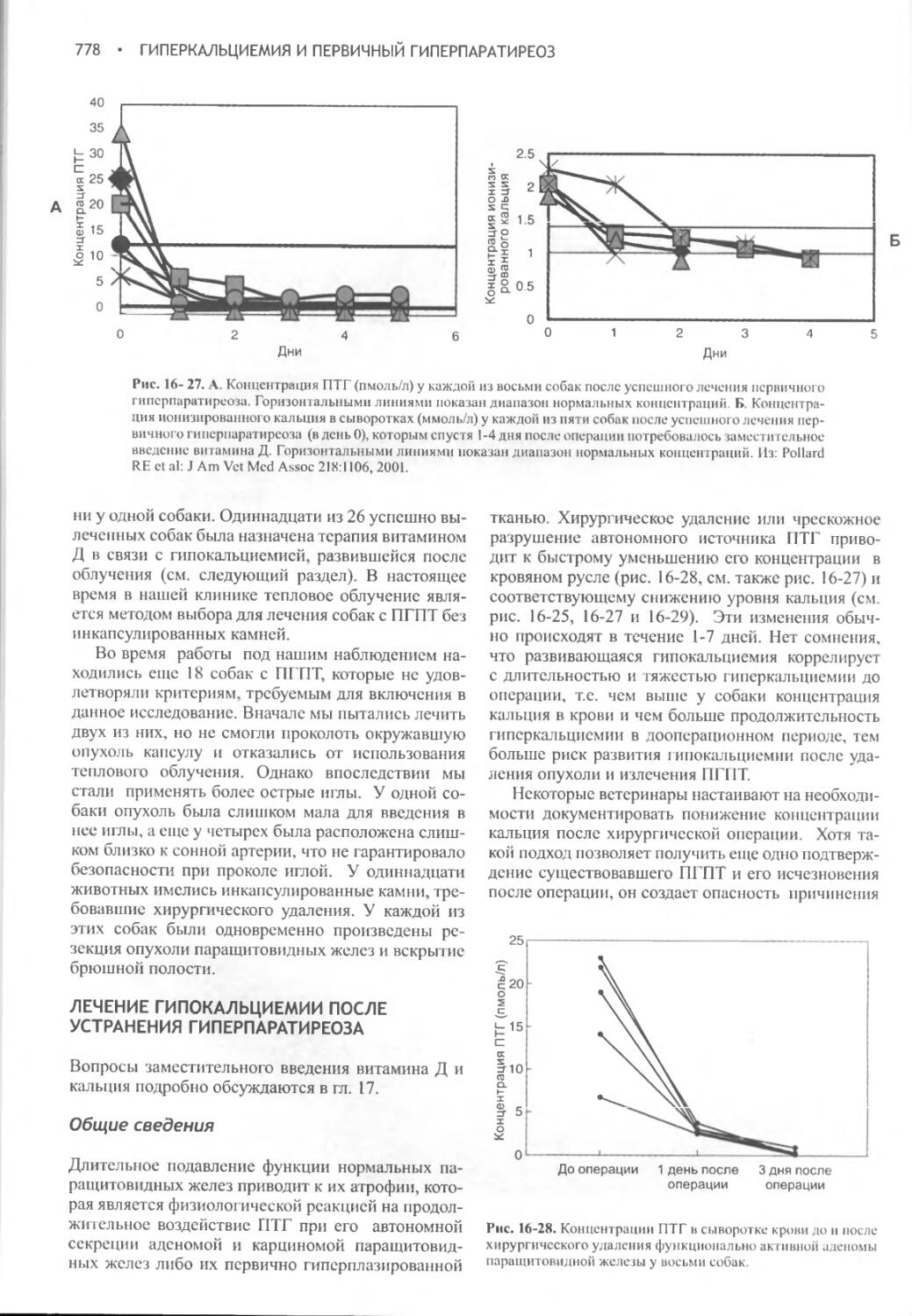
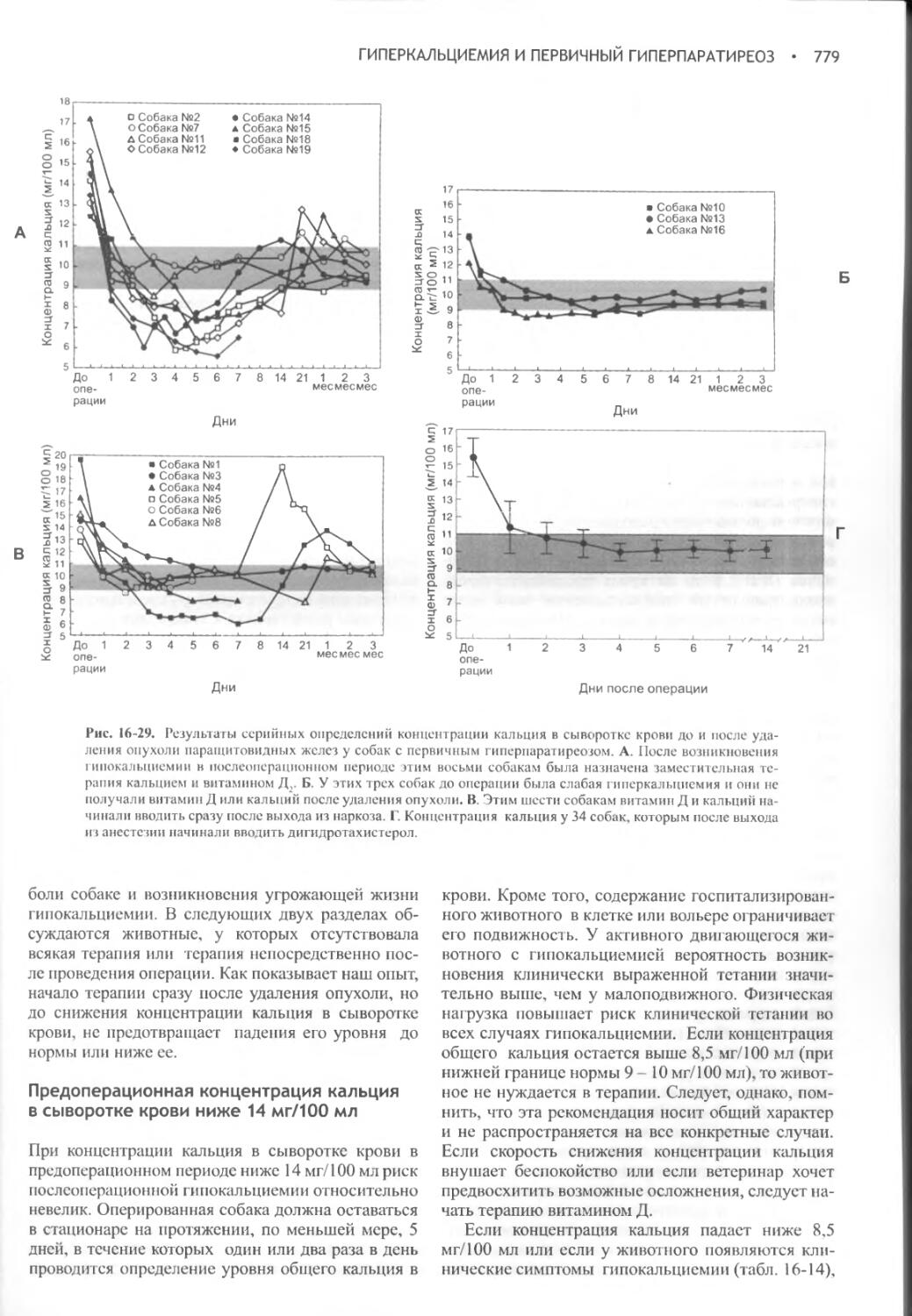
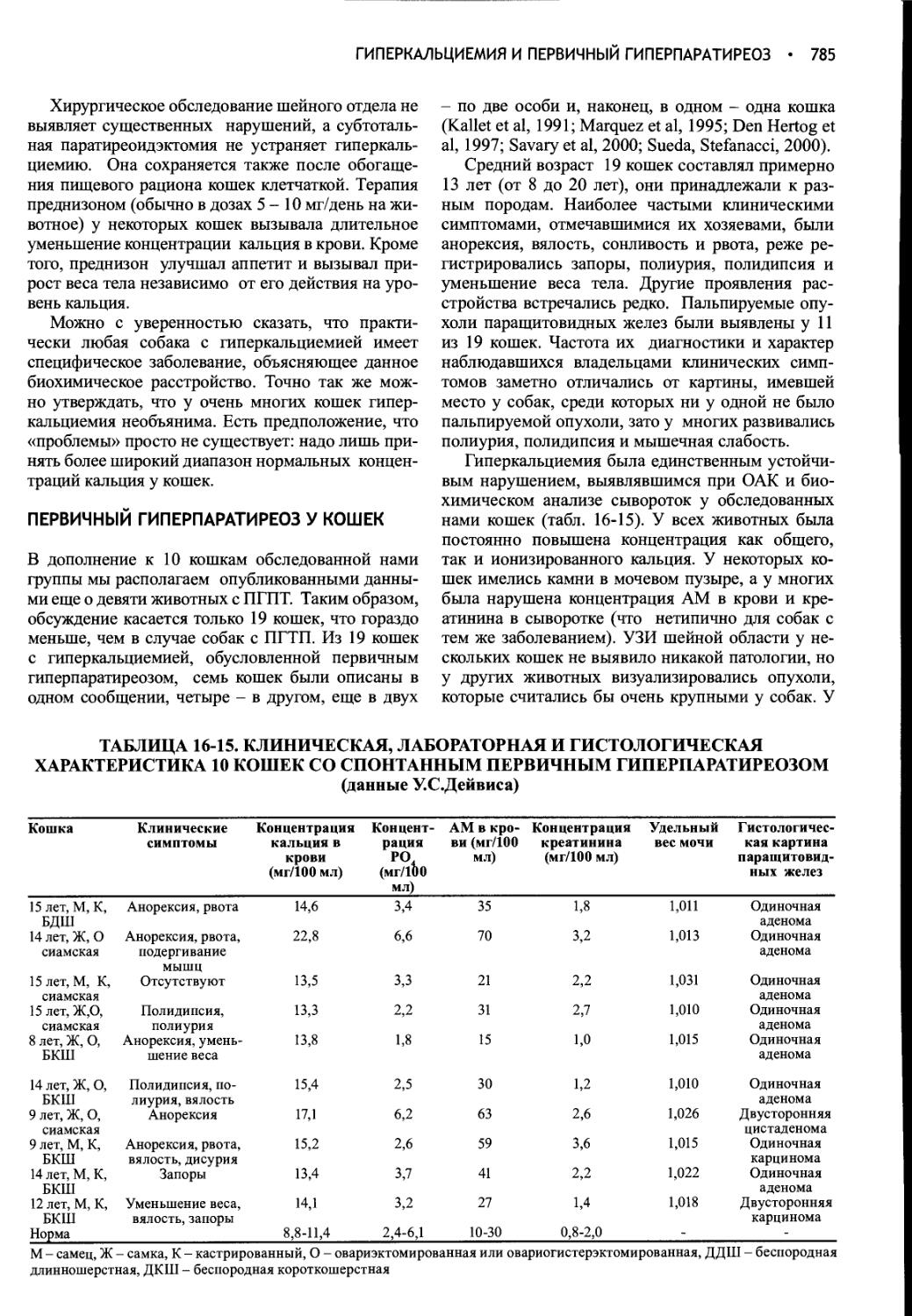
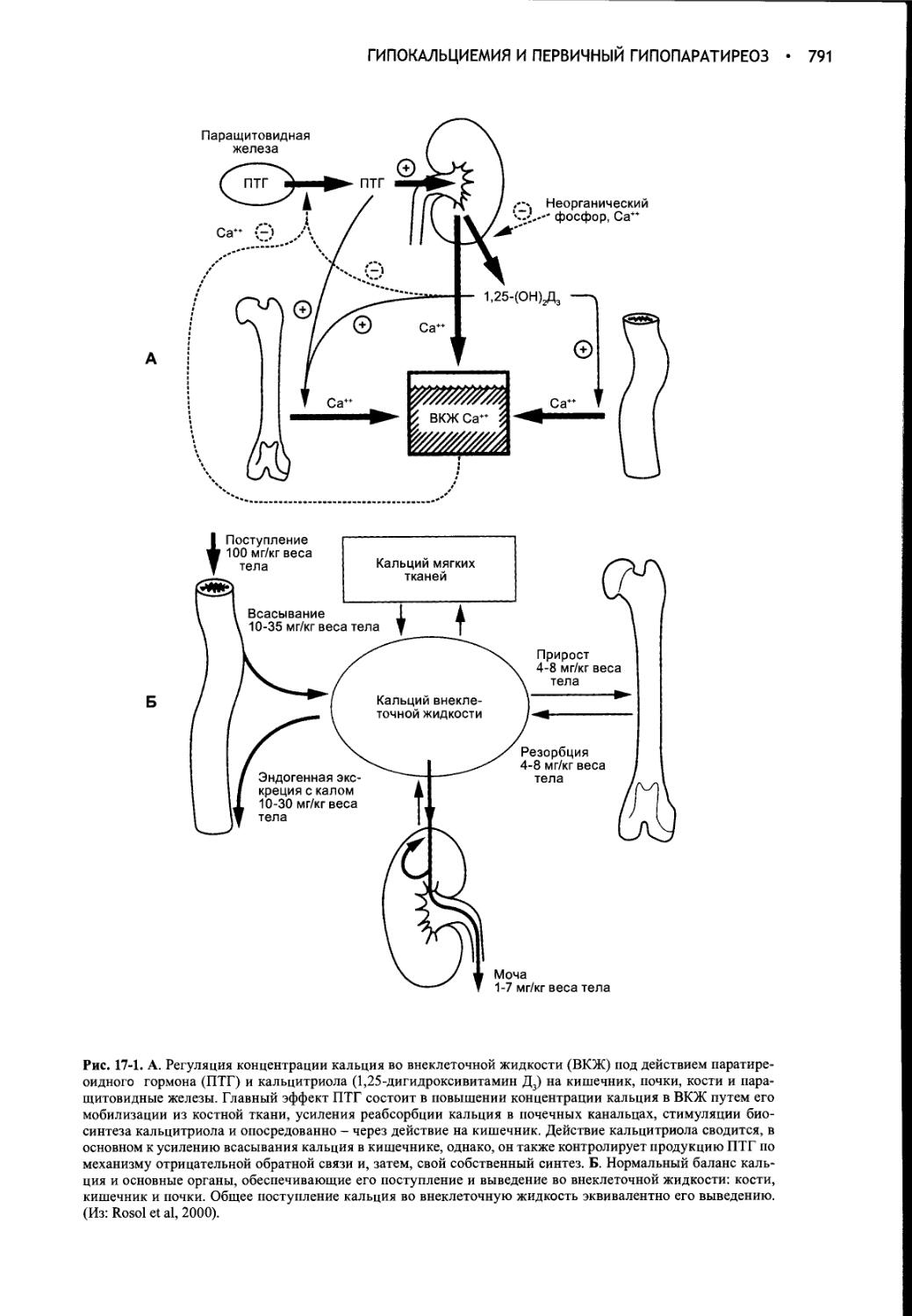
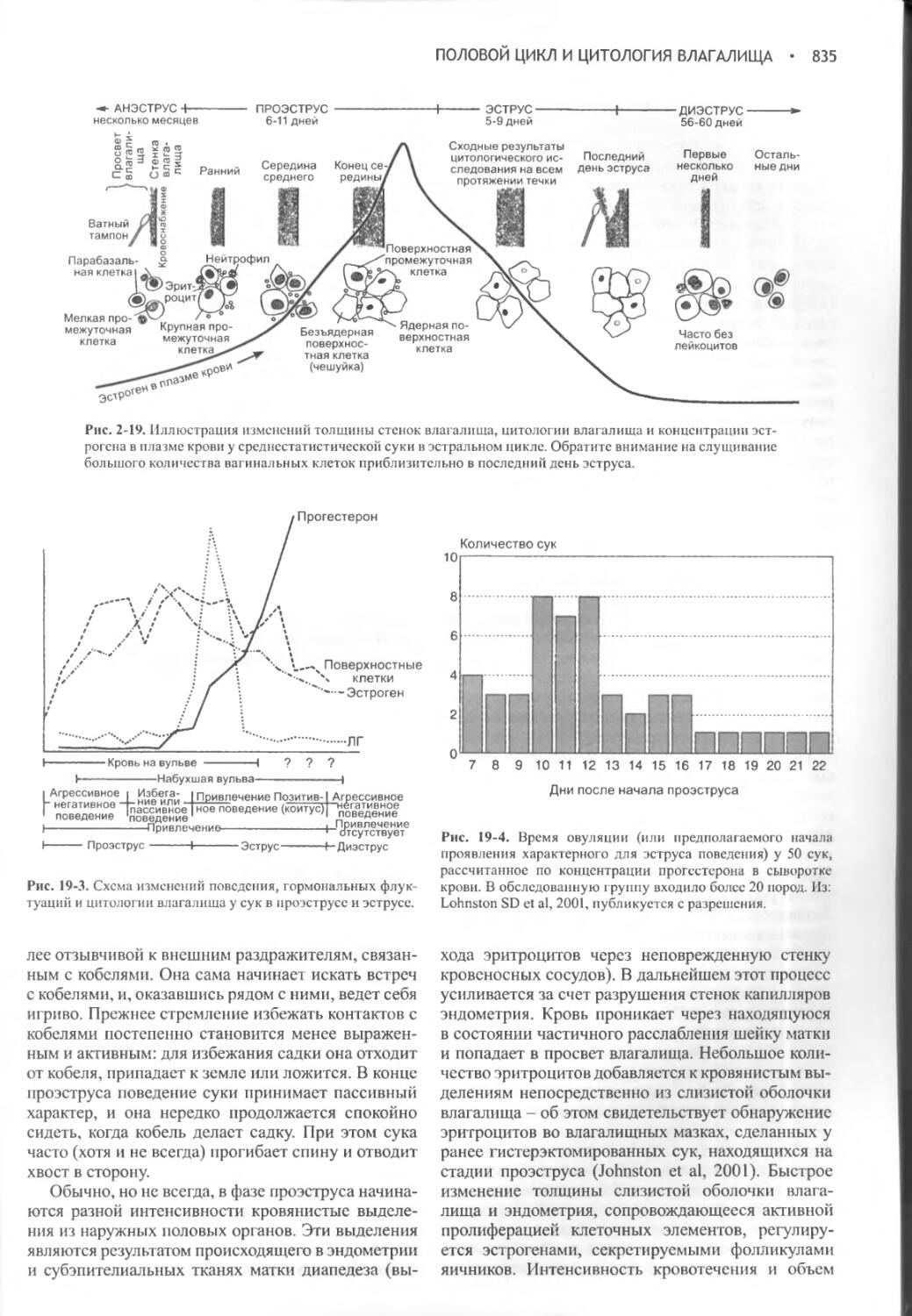
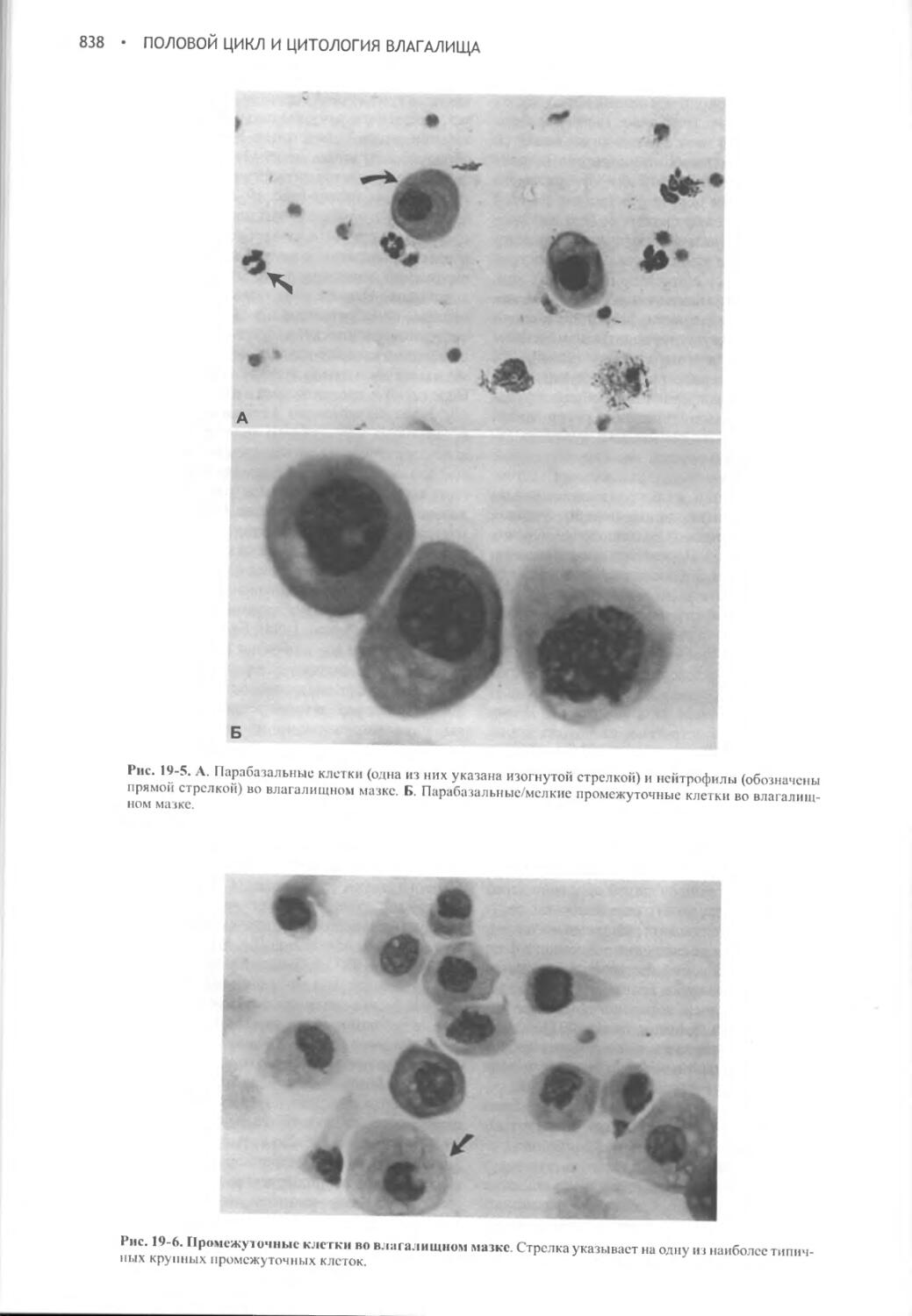
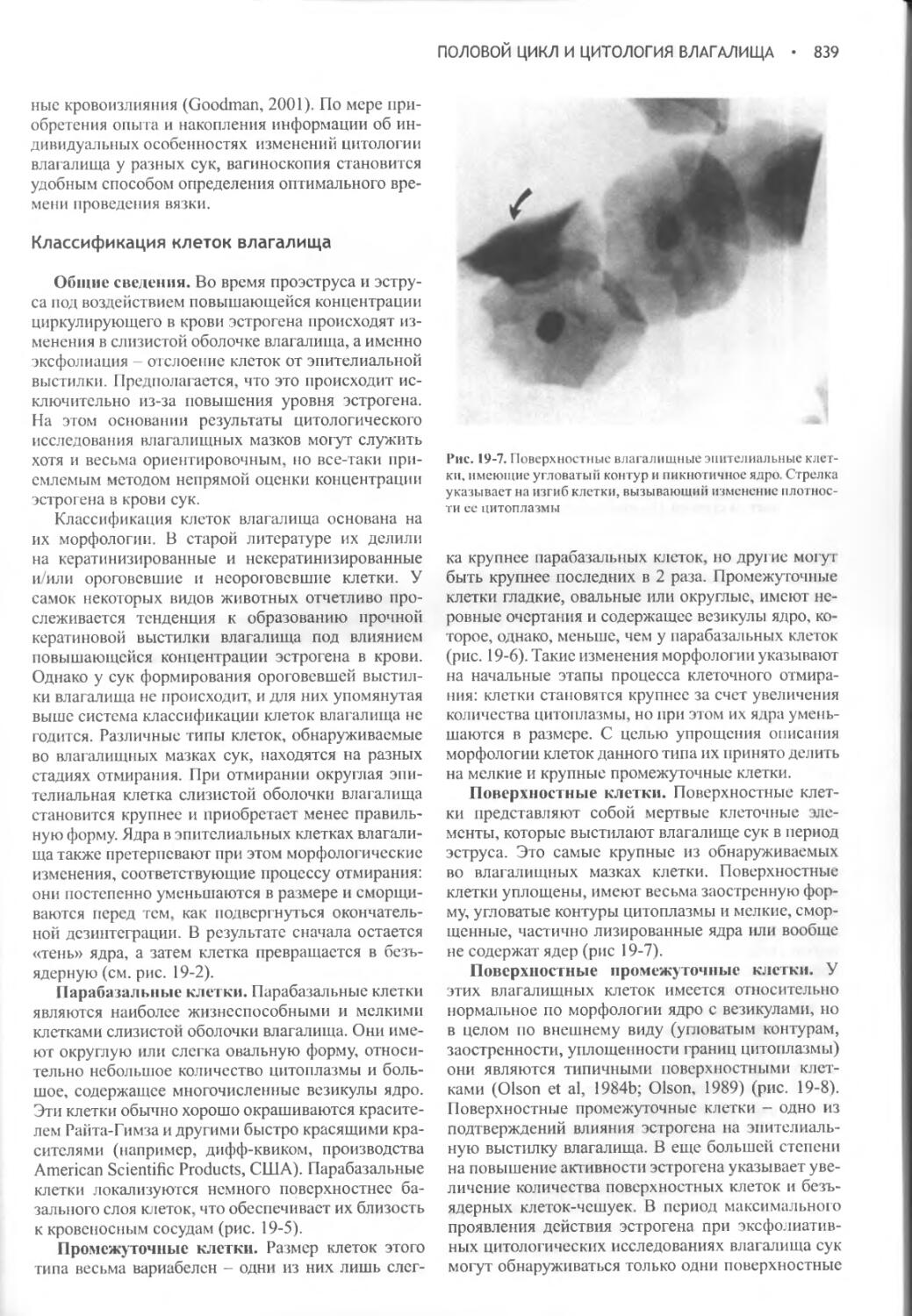
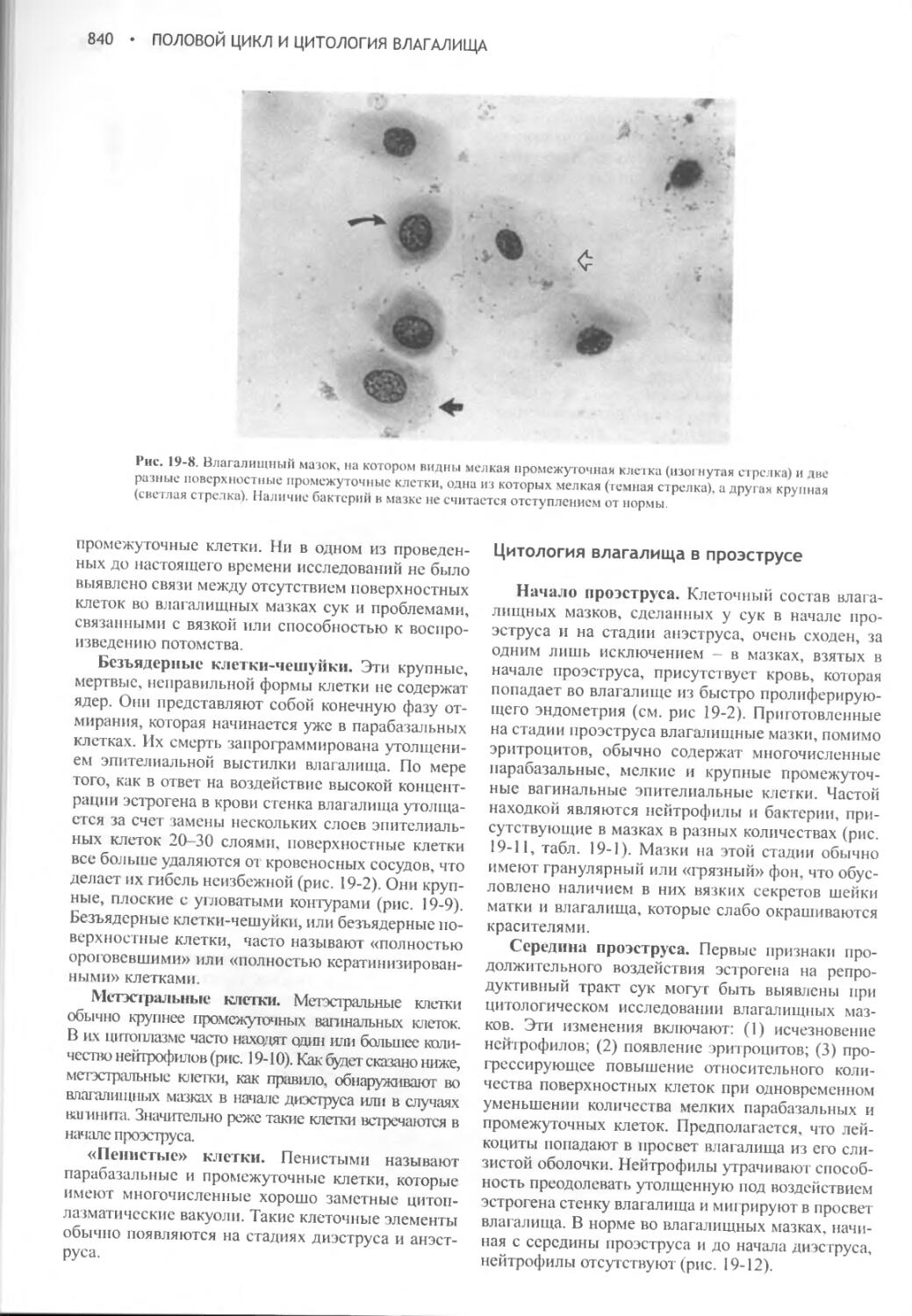
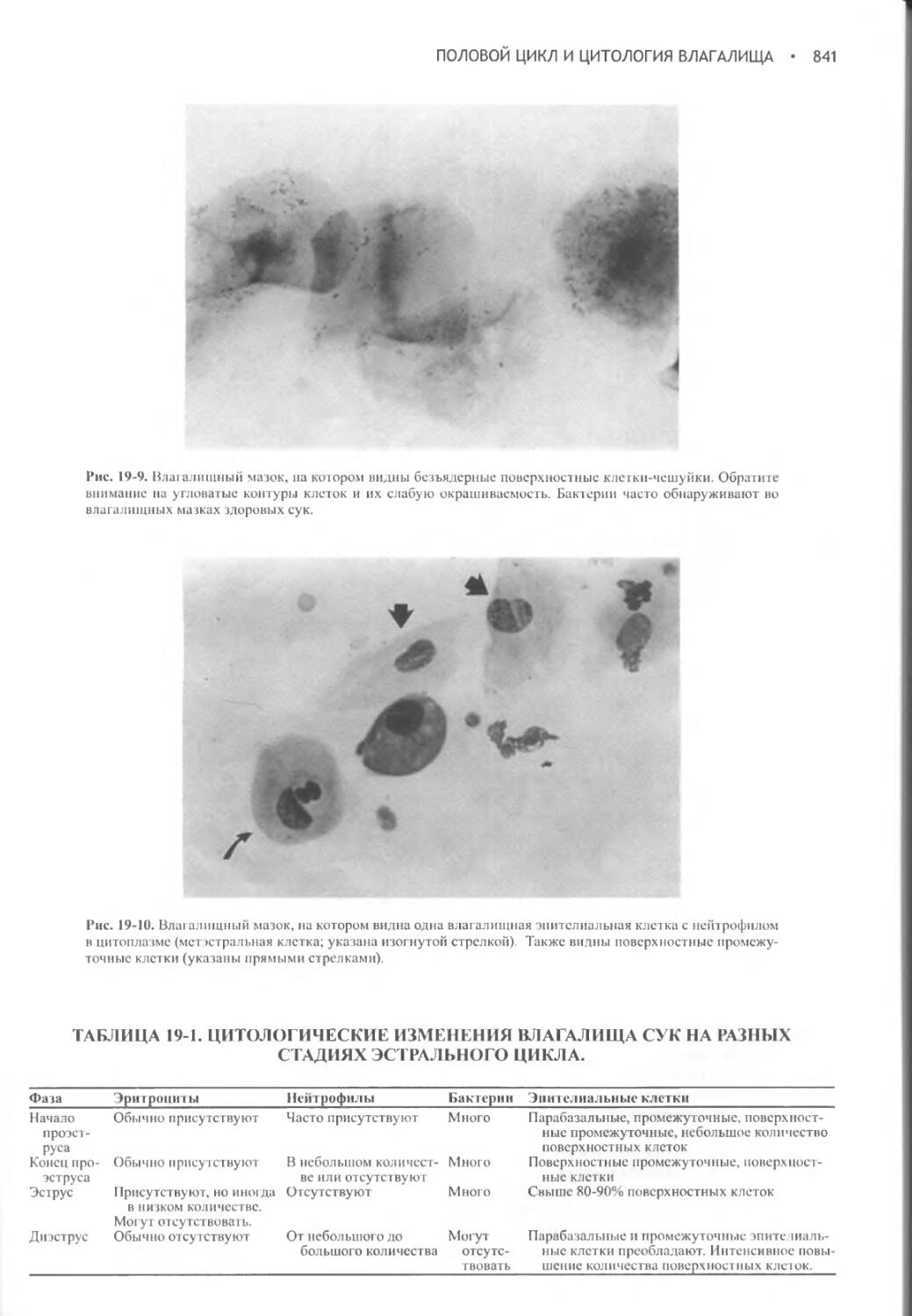
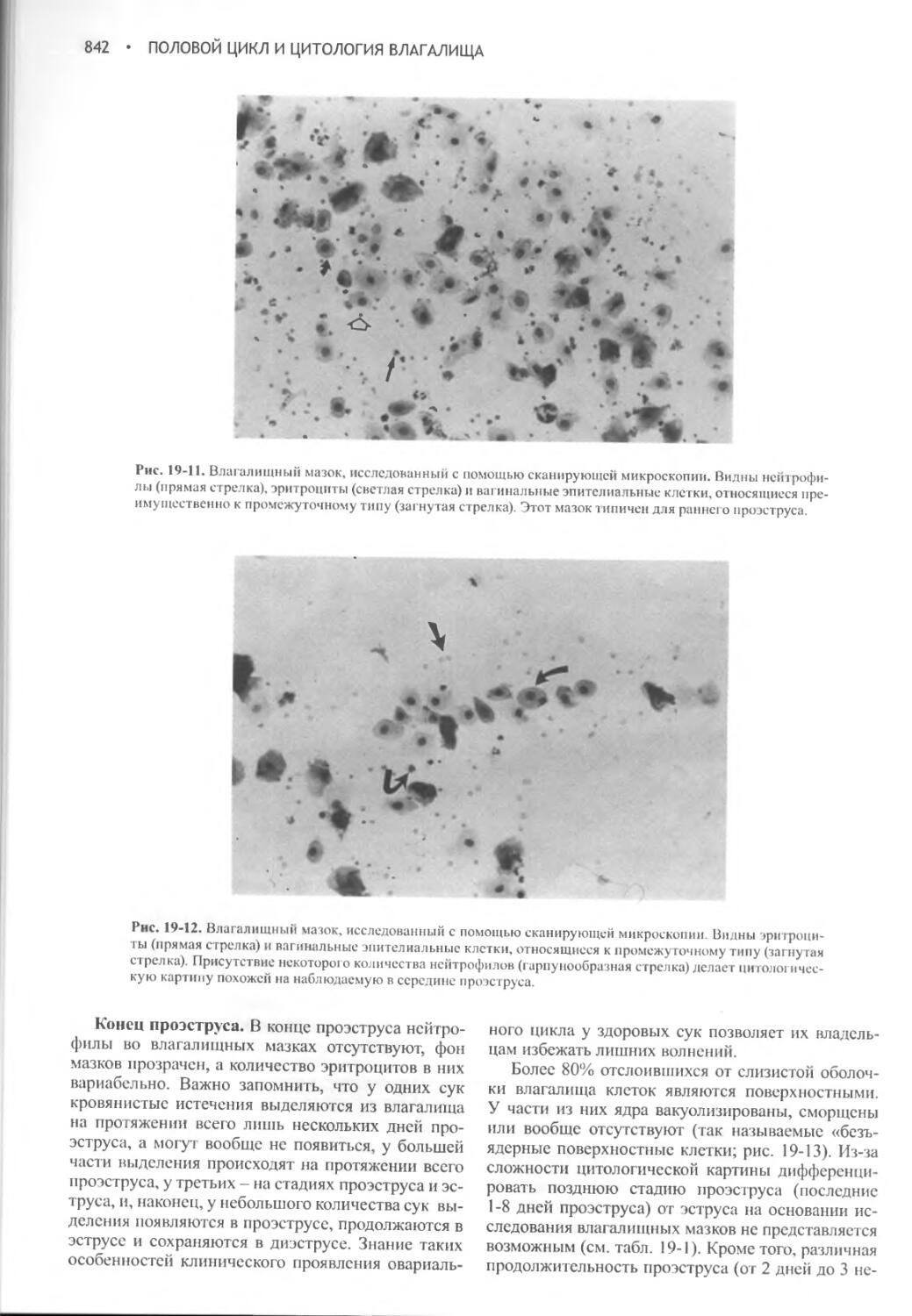
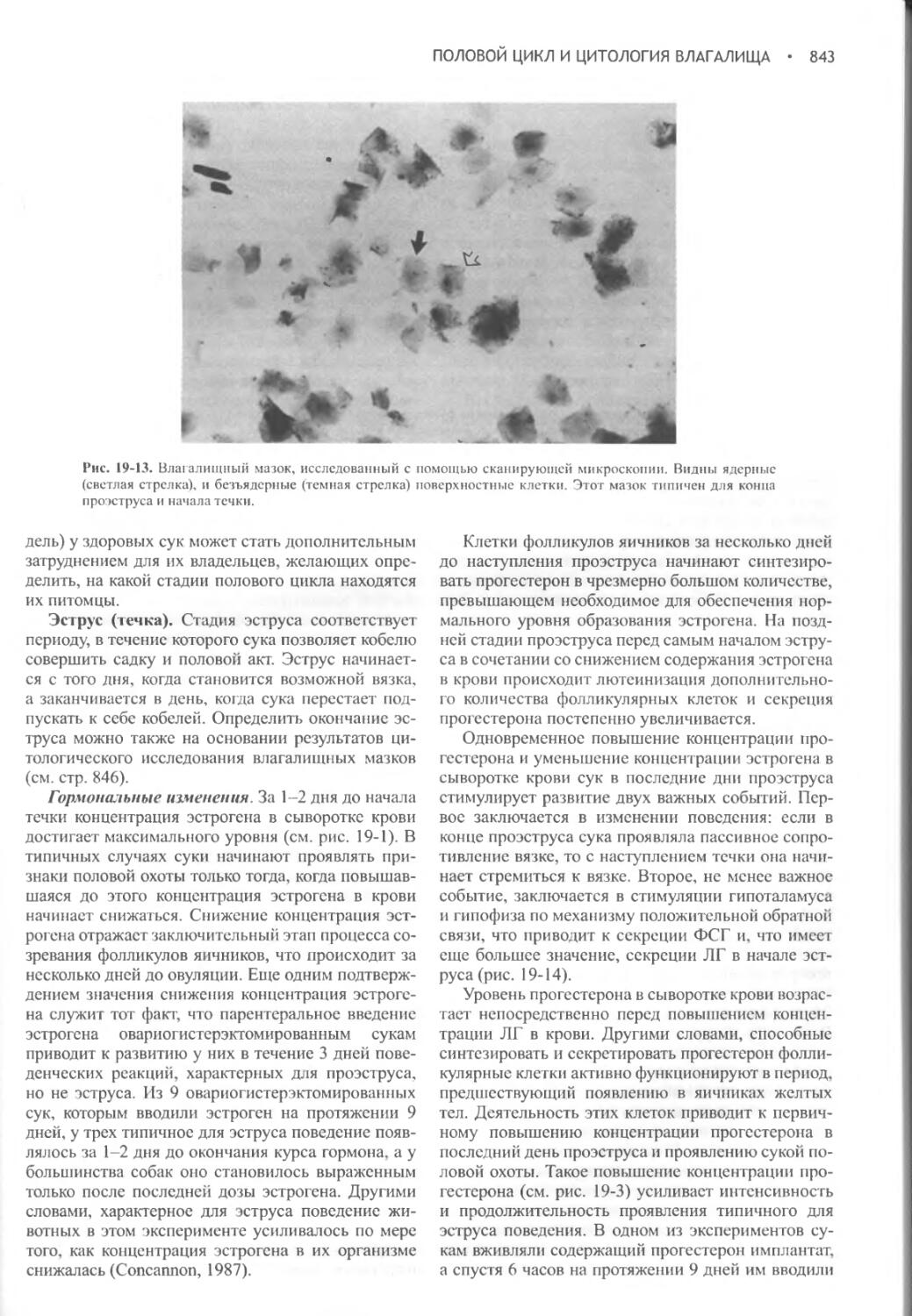
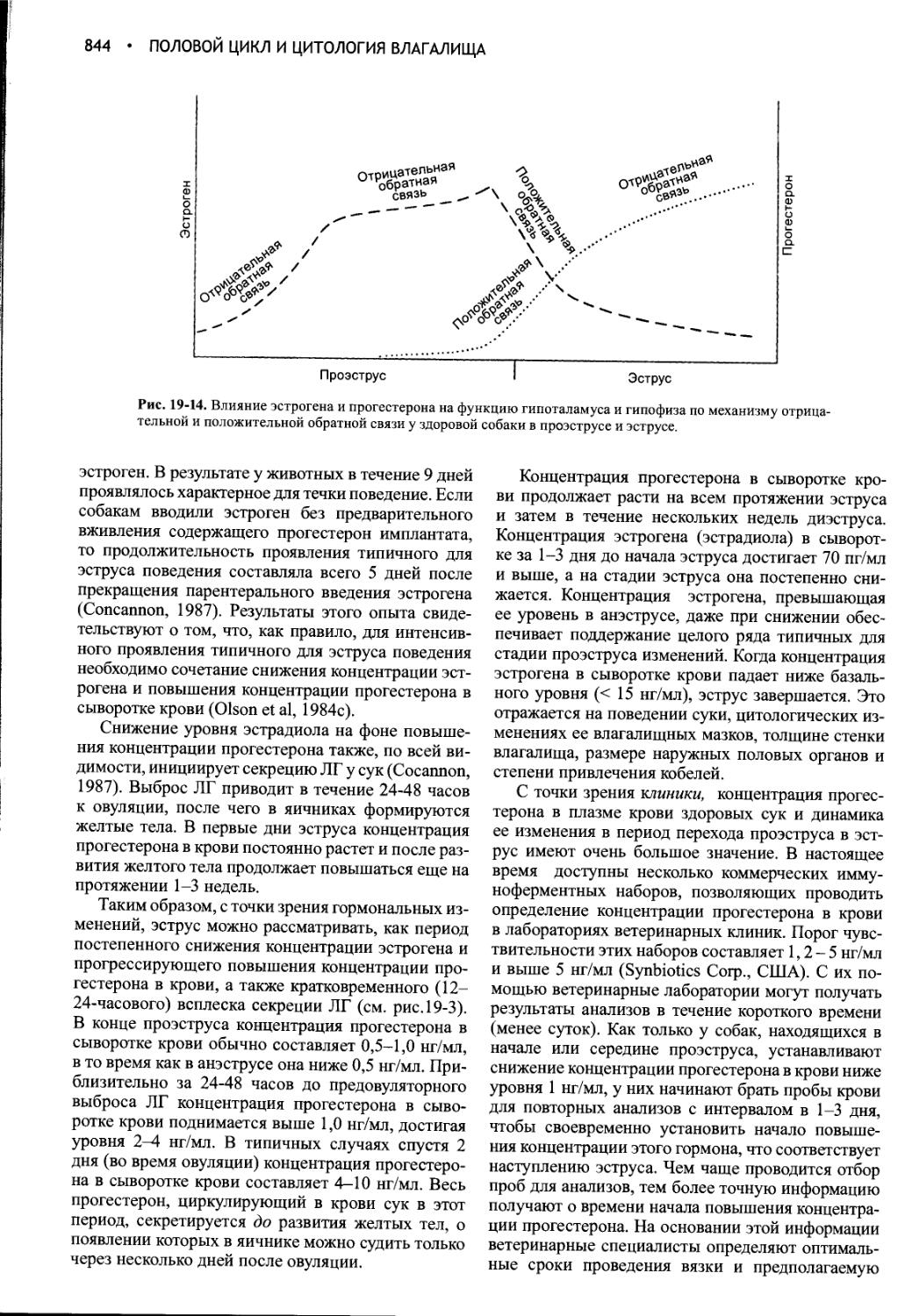
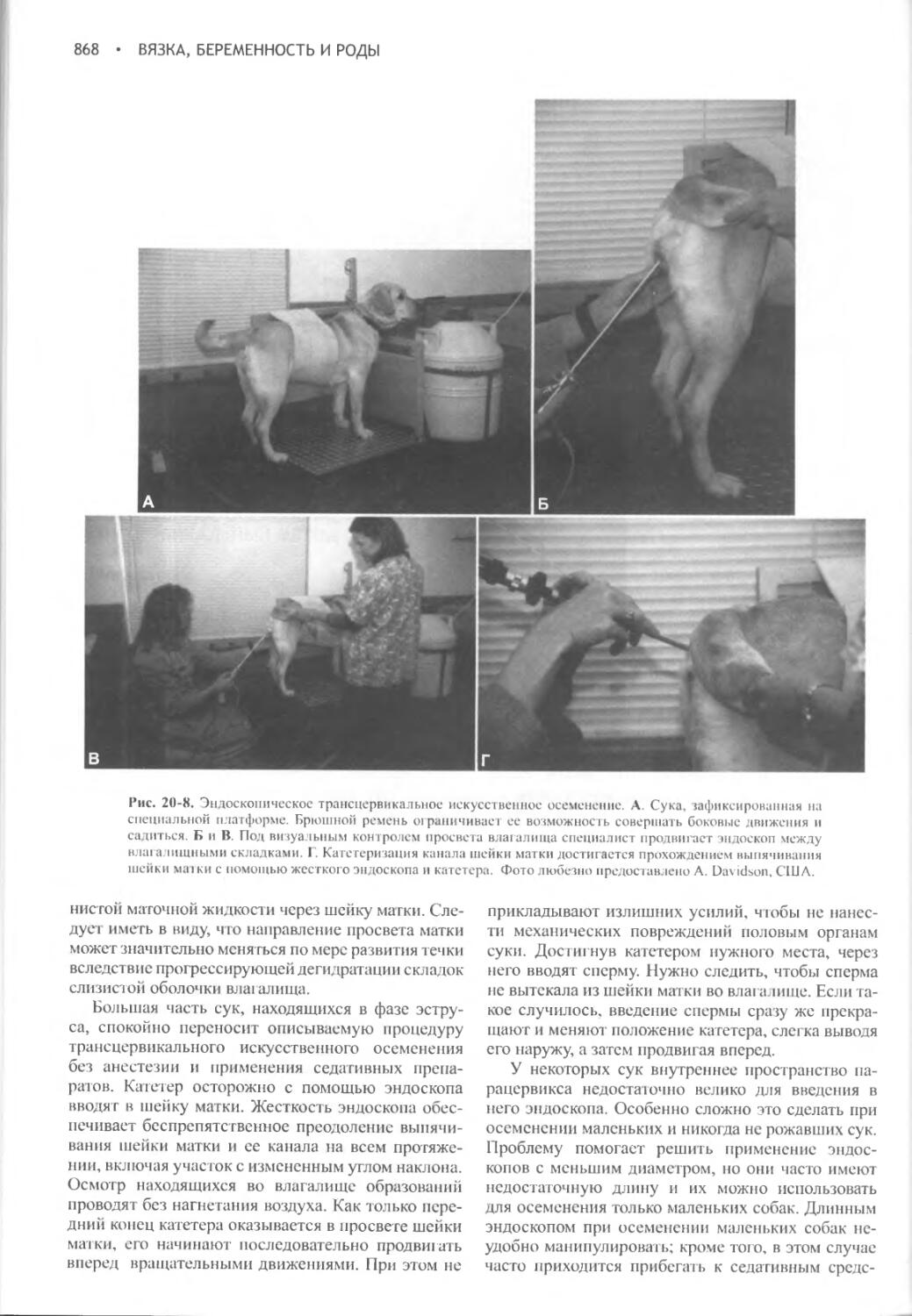
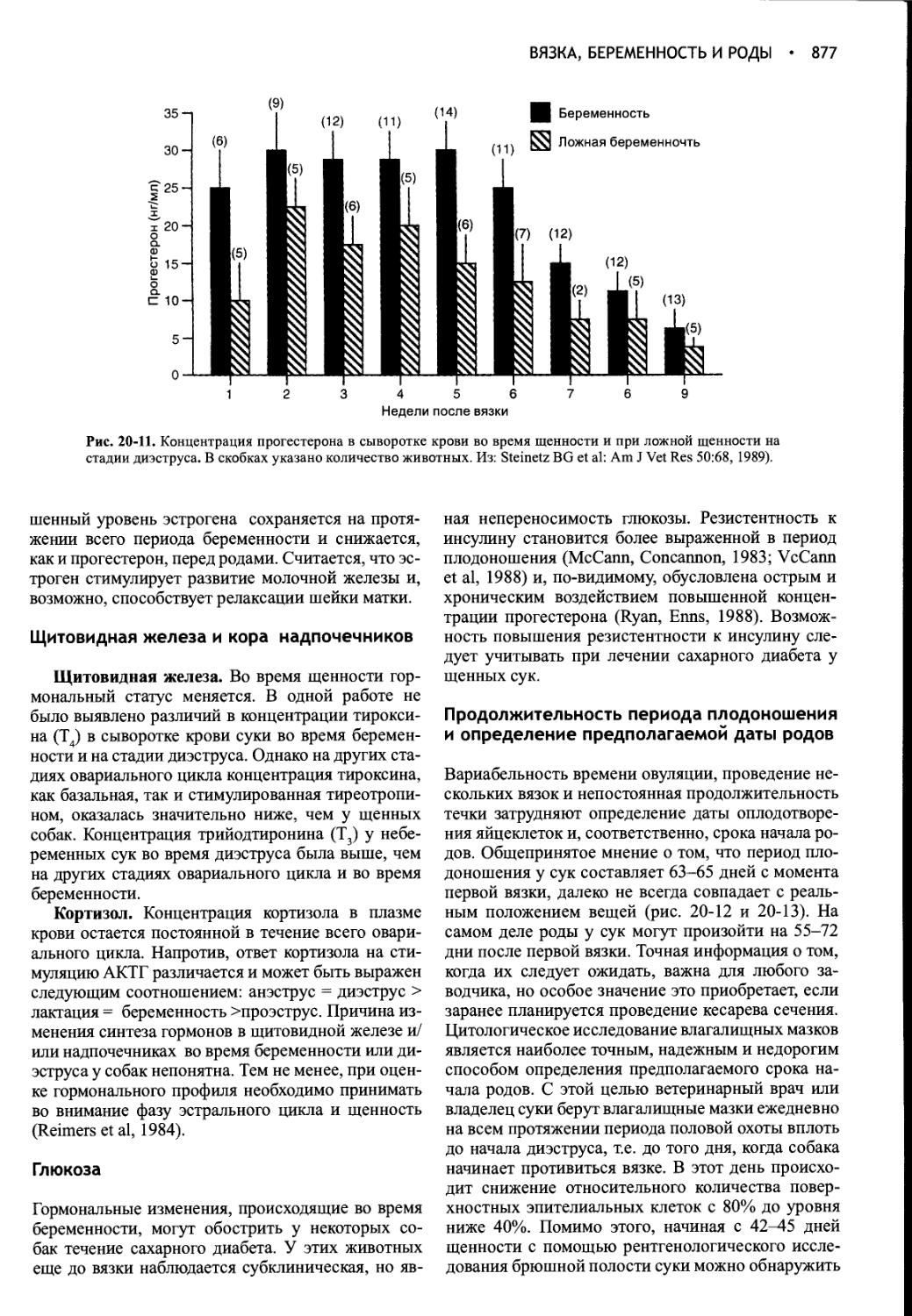
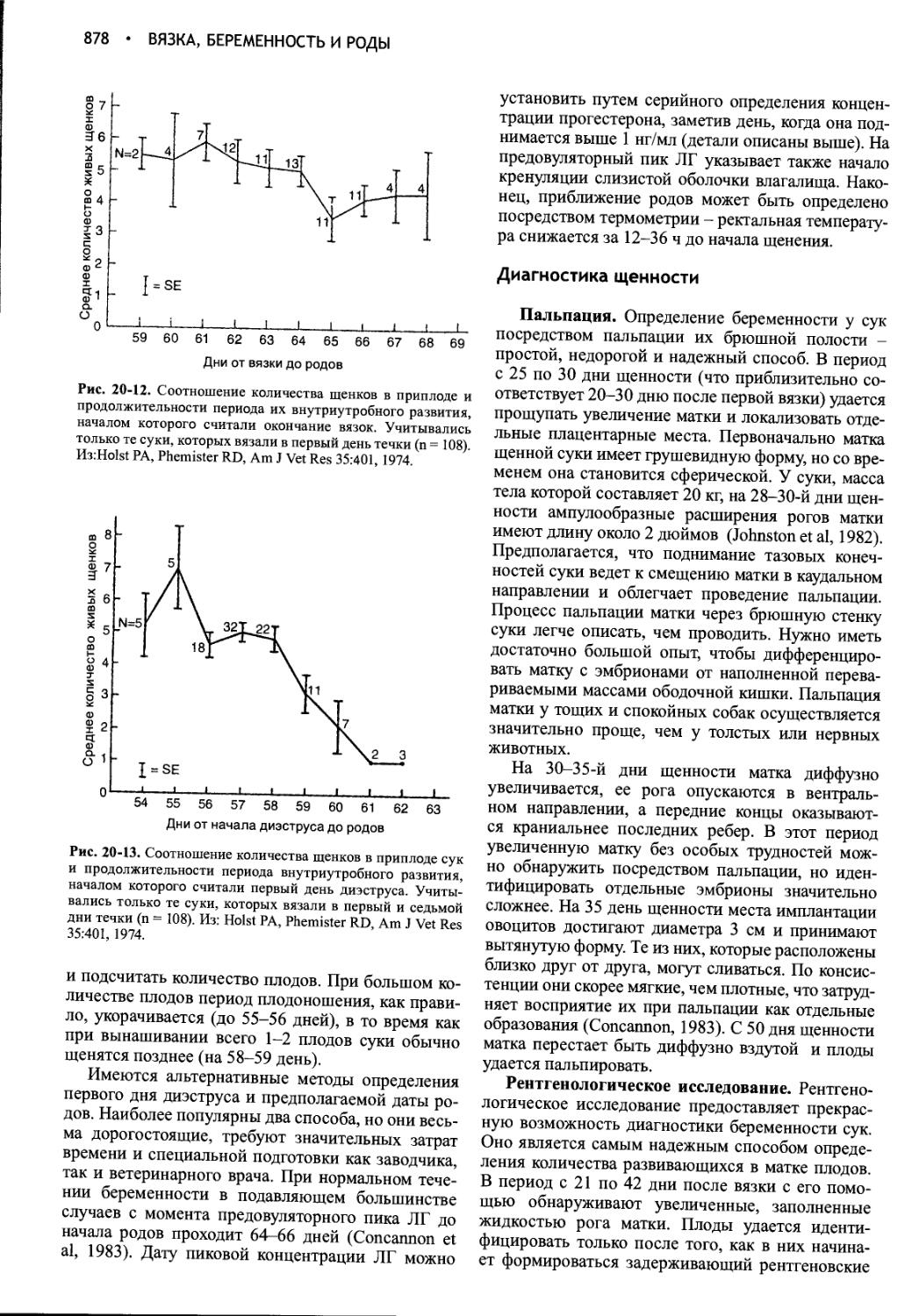
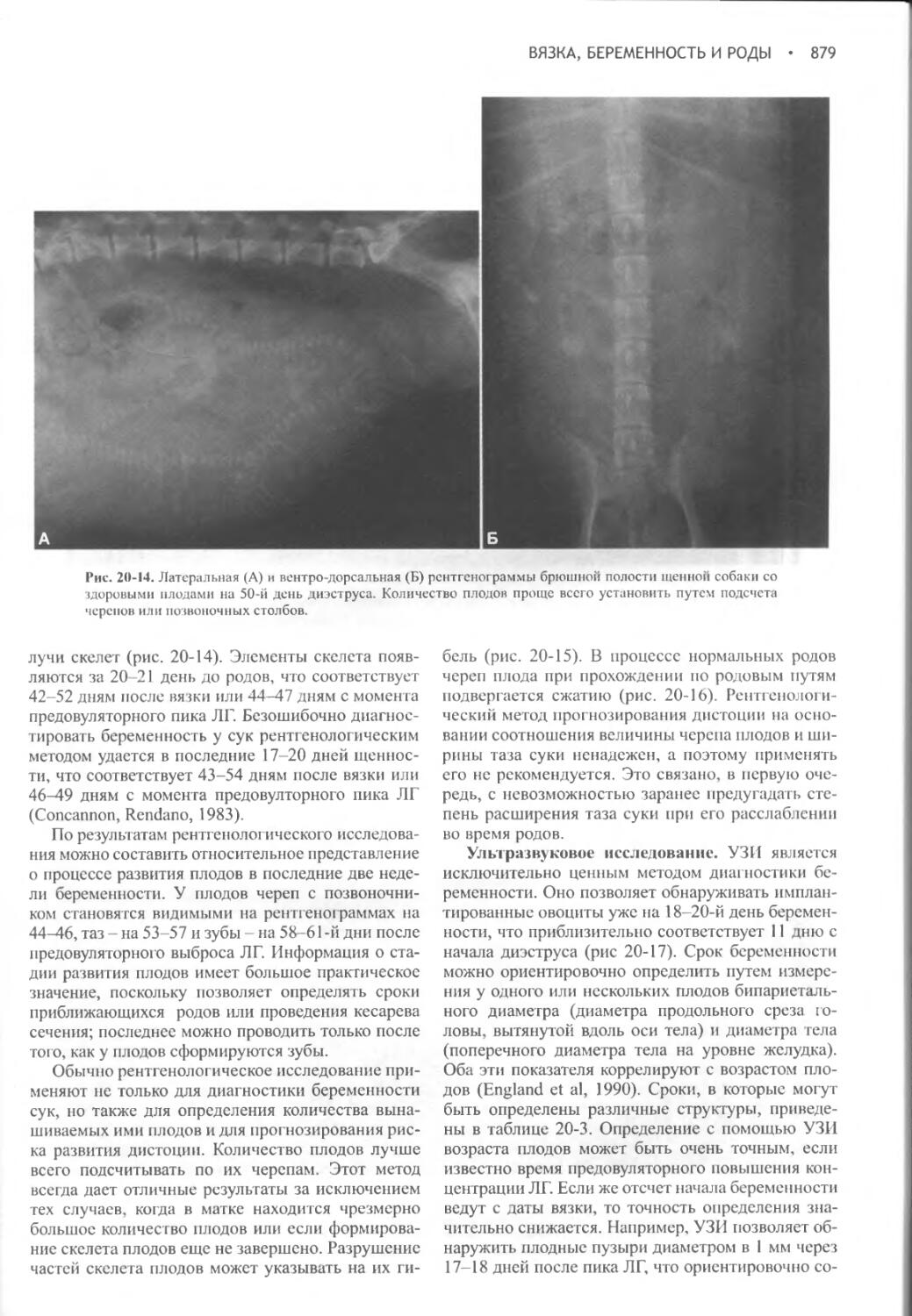
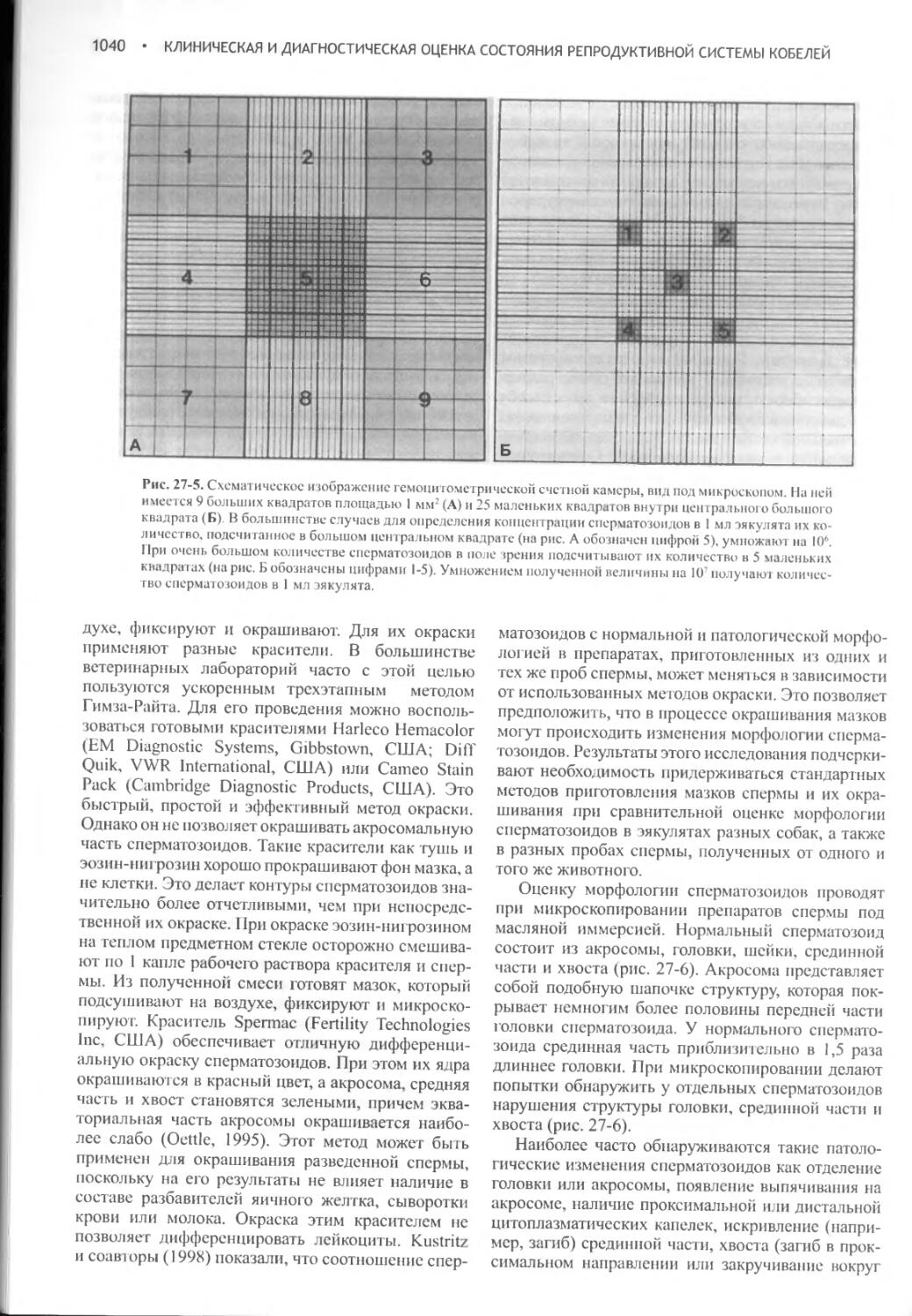
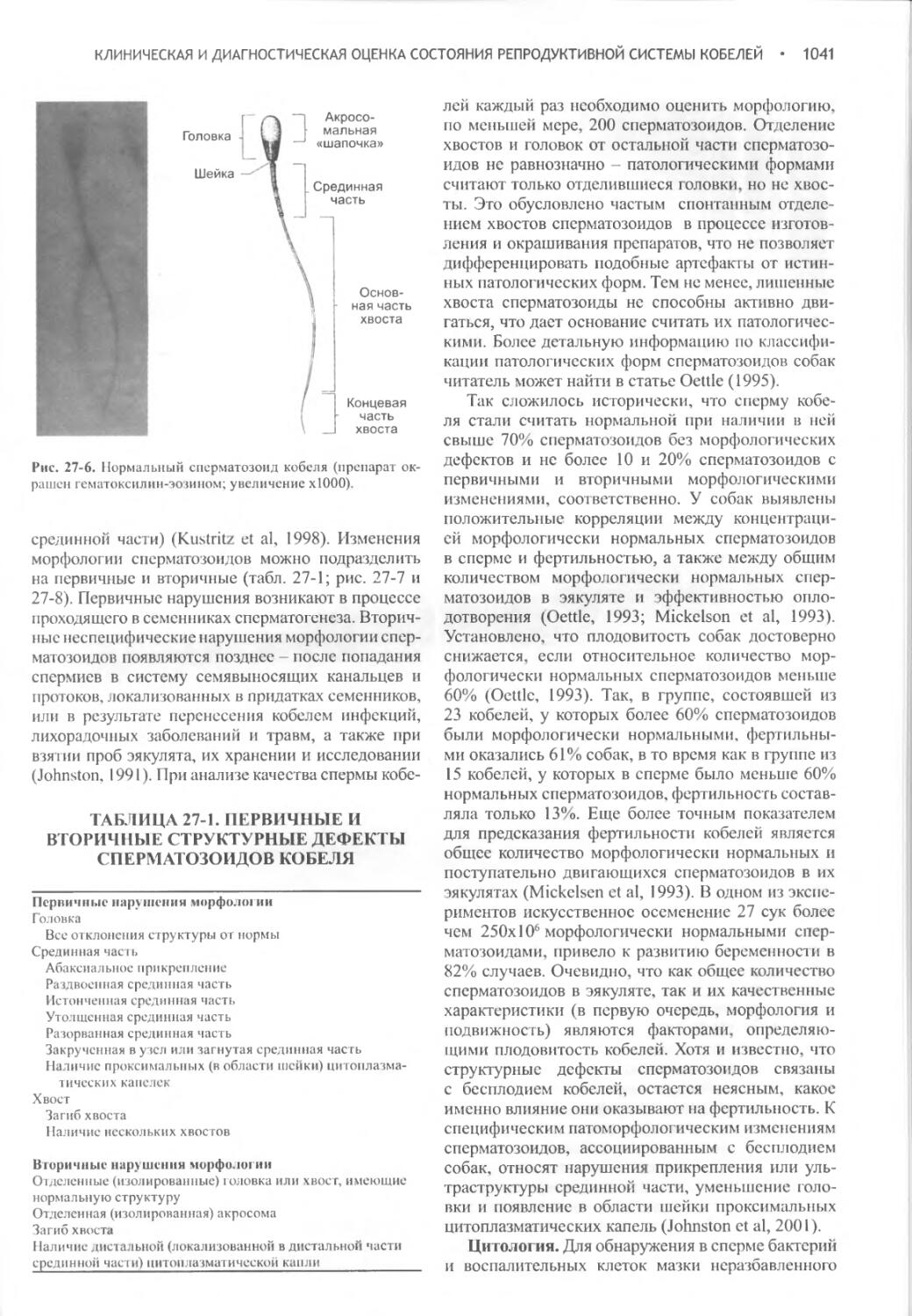
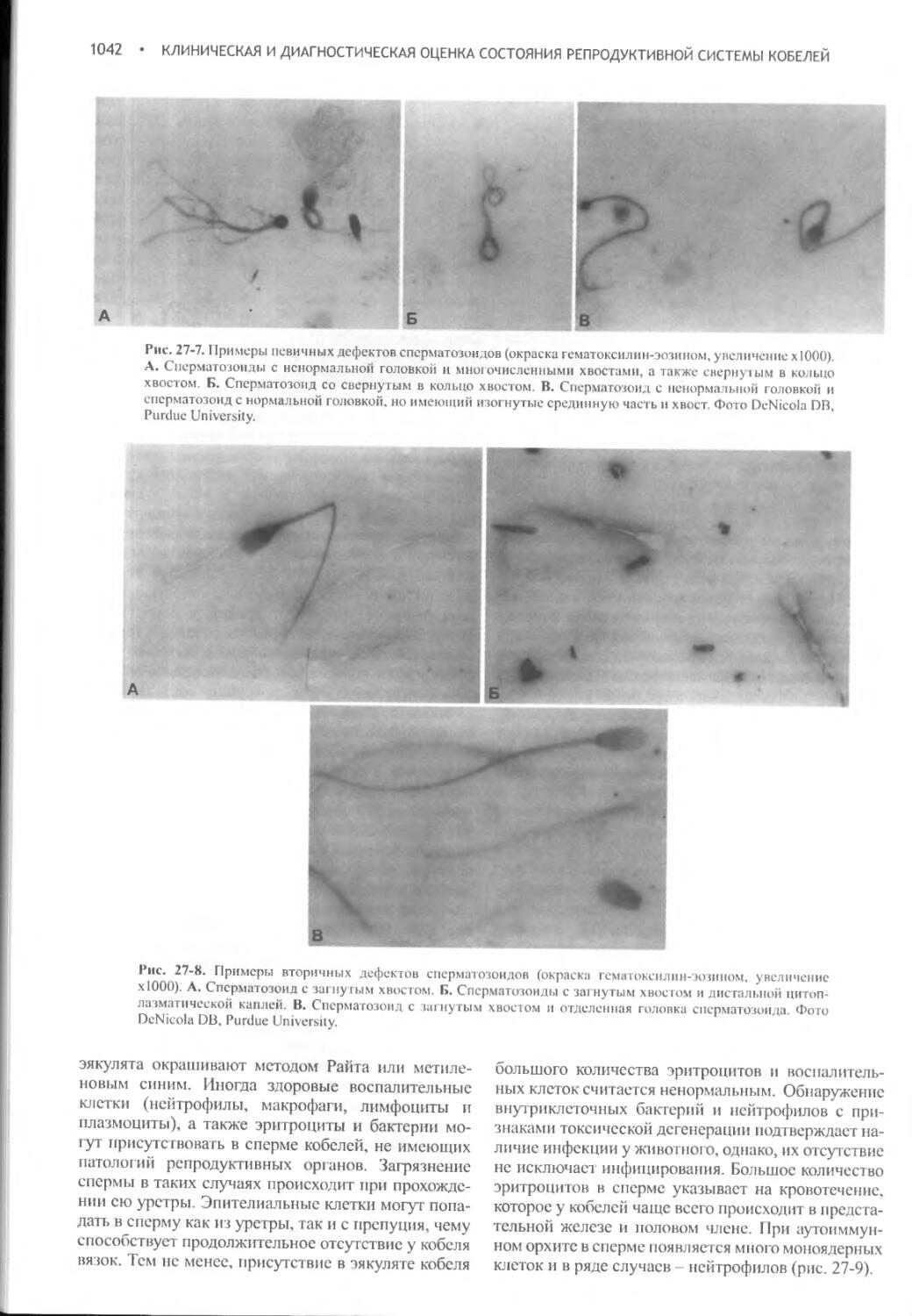
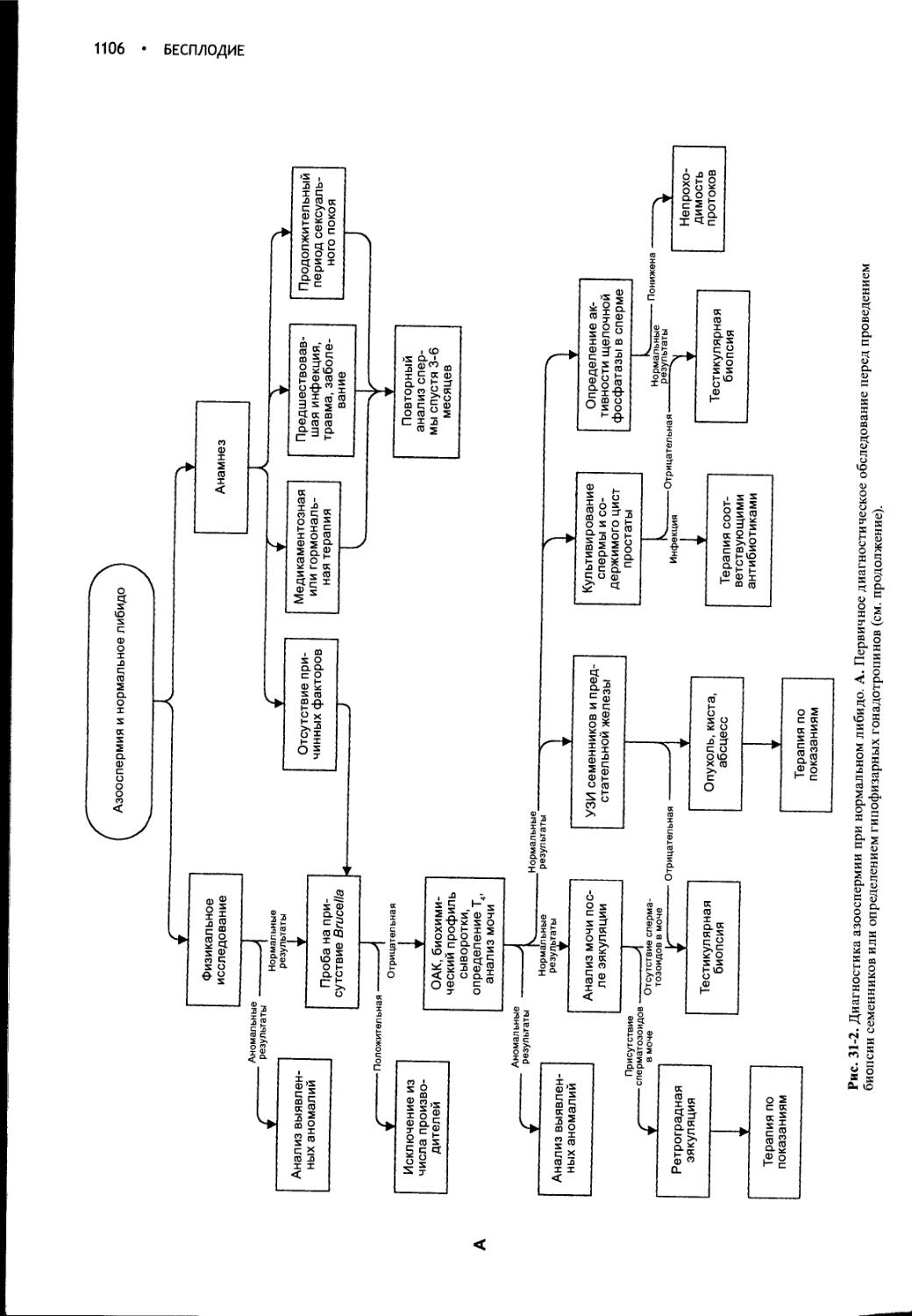
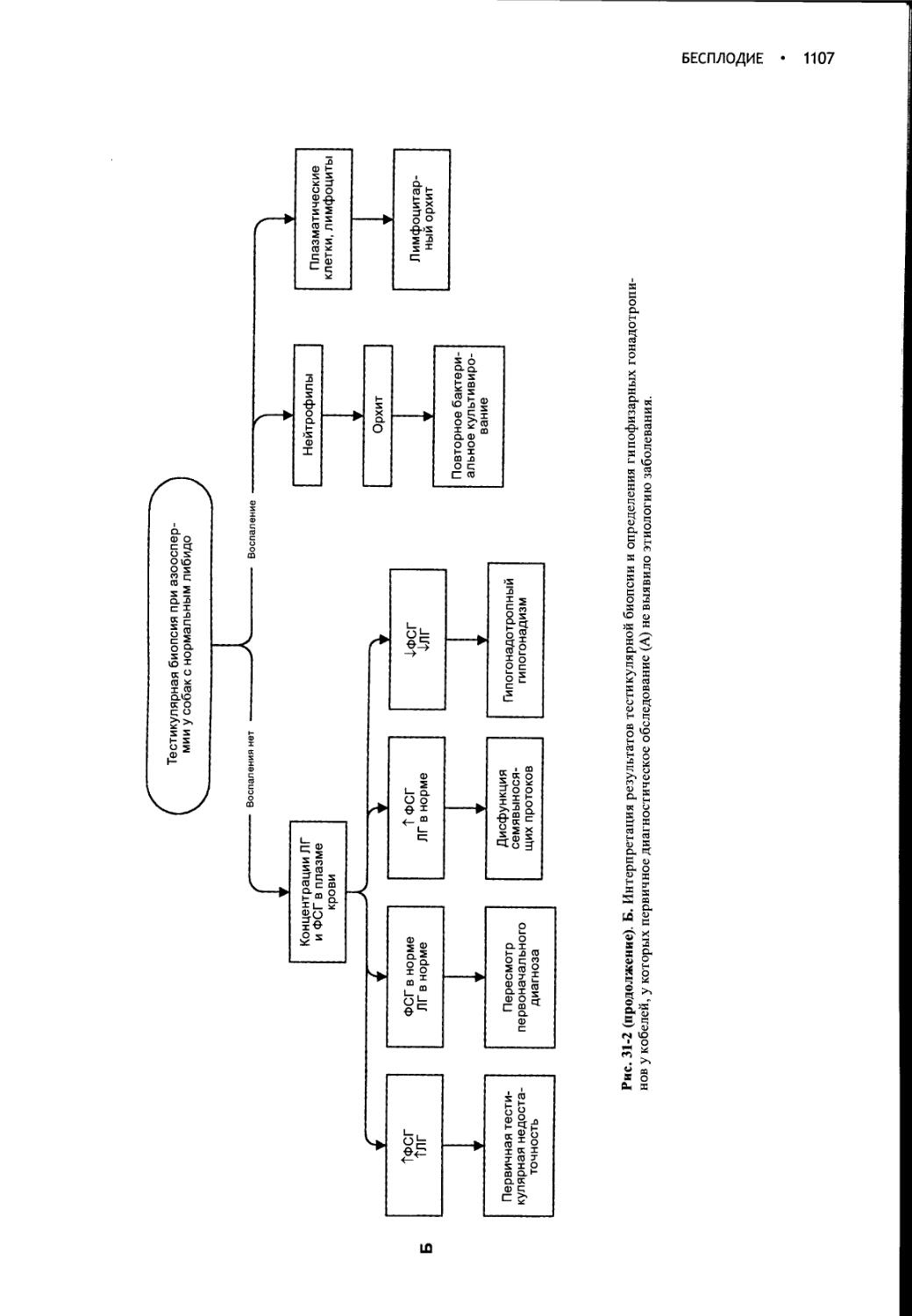
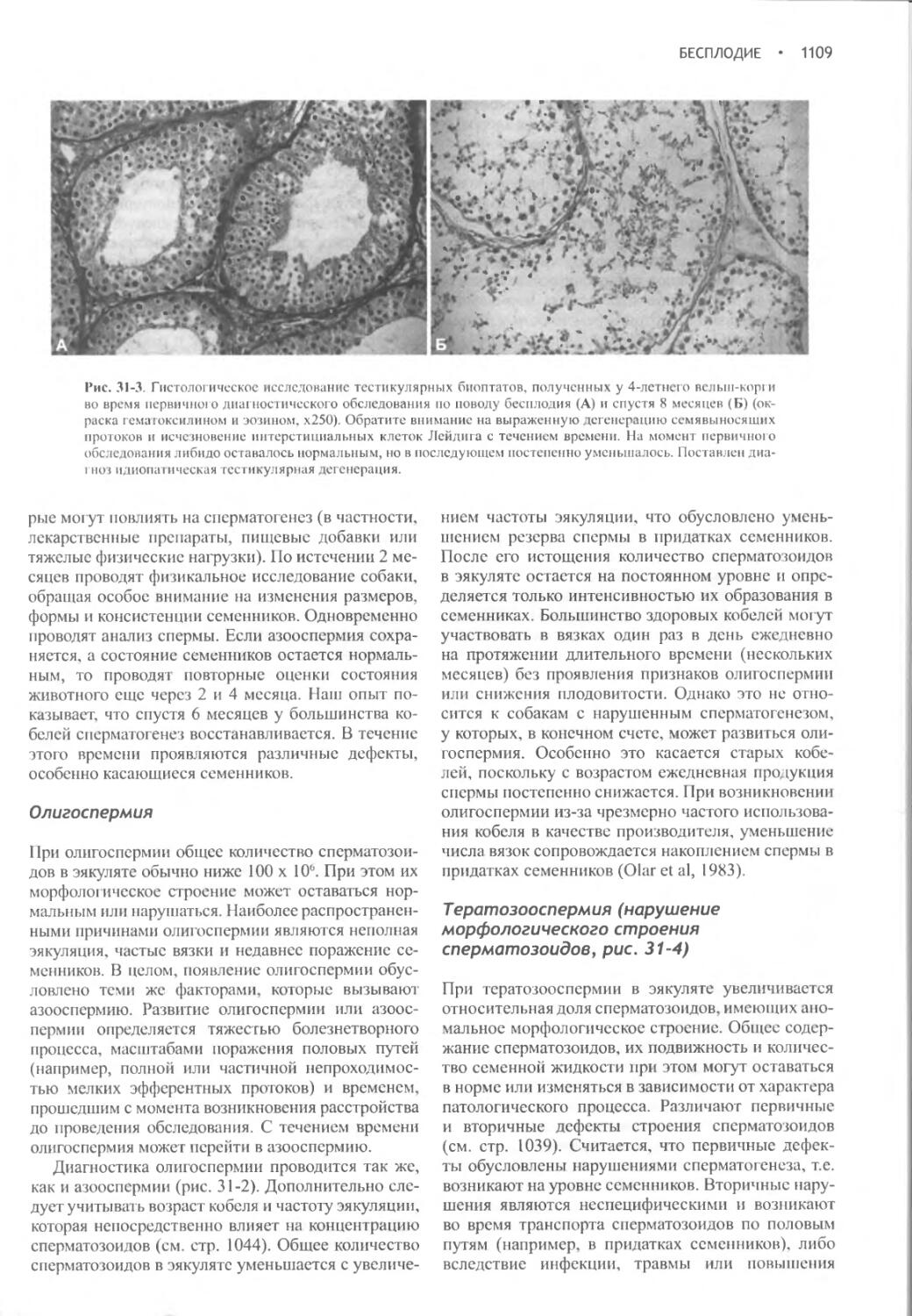
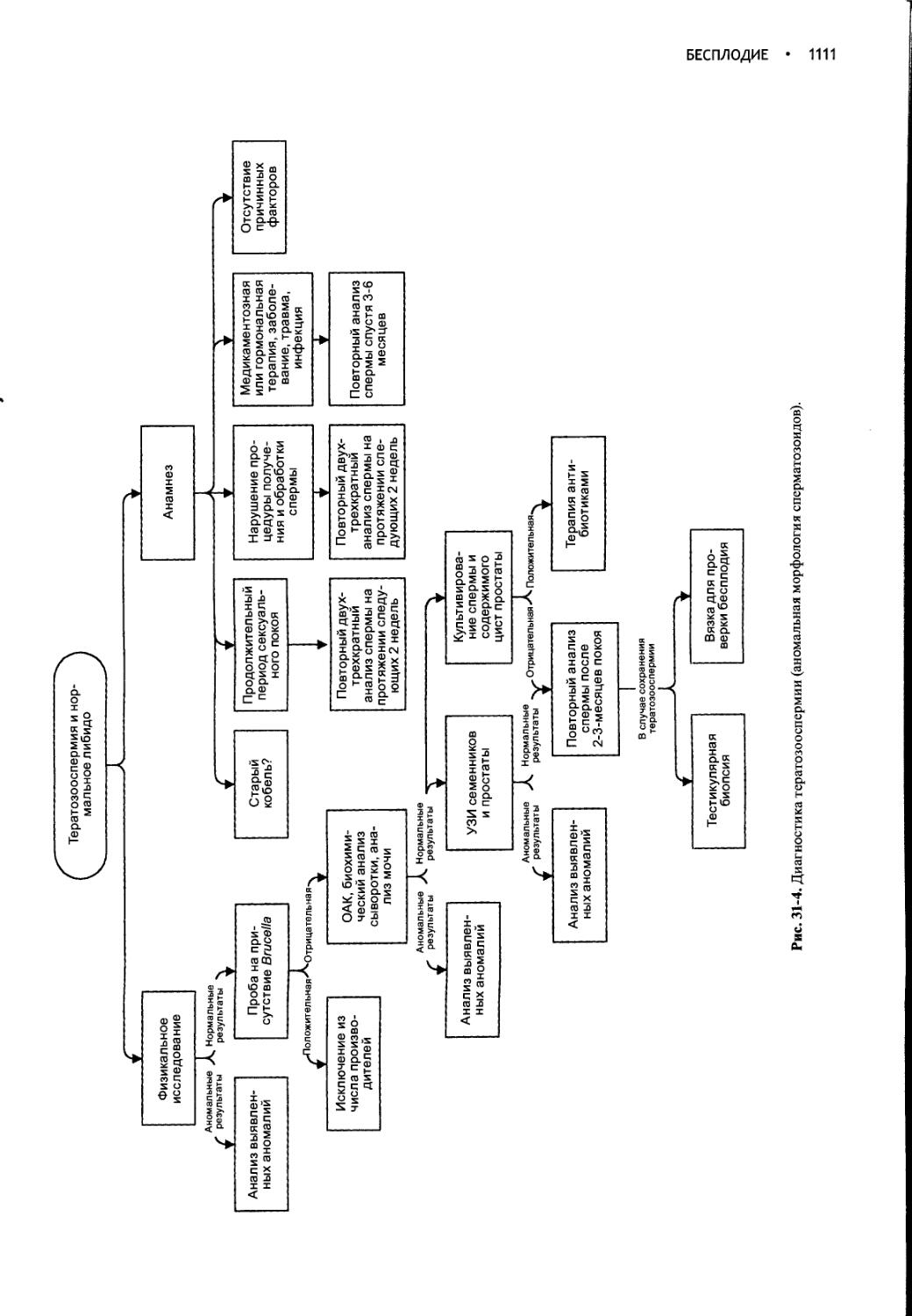
Author: Фелдмен Эдвард Нелсон Ричард
Tags: медицинские науки заболевания кроветворной системы, лимфатической системы и желез внутренней секреции эндокринные заболевания общее животноводство разведение млекопитающих животных и птиц скотоводство домашние животные и их разведение ветеринария биология эндокринология собаки кошки
ISBN: 5-9668-0014-6
Year: 2004
Серия: Ветеринарная медицина
Эдвард Фелдмен
Ричард Нелсон
Эндокринология и репродукция собак и кошек
THIRD EDITION
CANINE and FELINE ENDOCRINOLOGY and REPRODUCTION Medicine for Small Animals
EDWARD C. FELDMAN, DVM
Diplomate, American College of Veterinary Internal Medicine
Professor, Department of Medicine and Epidemiology
School of Veterinary Medicine
University of California
Davis, California
RICHARD W. Nelson, DVM
Diplomate, American College of Veterinary Internal Medicine
Professor, Department of Medicine and Epidemiology
School of Veterinary Medicine
University of California
Davis, California
With 850 illustrations
SAUNDERS
An Imprint of Elsevier
Эдвард Фелдмен, Ричард Нелсон
ЭНДОКРИНОЛОГИЯ И РЕПРОДУКЦИЯ СОБАК И КОШЕК
Перевод с английского с 3-его издания
д-ра мед. наук В. И. Кандрора, канд. хим. наук Ю. М. Кеда, канд. биол. наук Ю. В. Морозова, д-ра мед. наук Л. А. Певницкого, канд. вет. наук Б. Ф. Шуляка
под редакцией
канд. вет. наук А. В. Ткачева-Кузьмина
канд. хим. наук Ю. М. Кеда
при участии канд. биол. наук М. Д. Гроздовой
Москва, «Софион», 2008
УДК 619:616.4:636
ББК 48.7
Ф37
Э. Фелдмен, Р. Нелсон
Ф37 Эндокринология и репродукция собак и кошек
Пер. с англ. - М.: Софион. 2008, 1256 с., 850 ил.
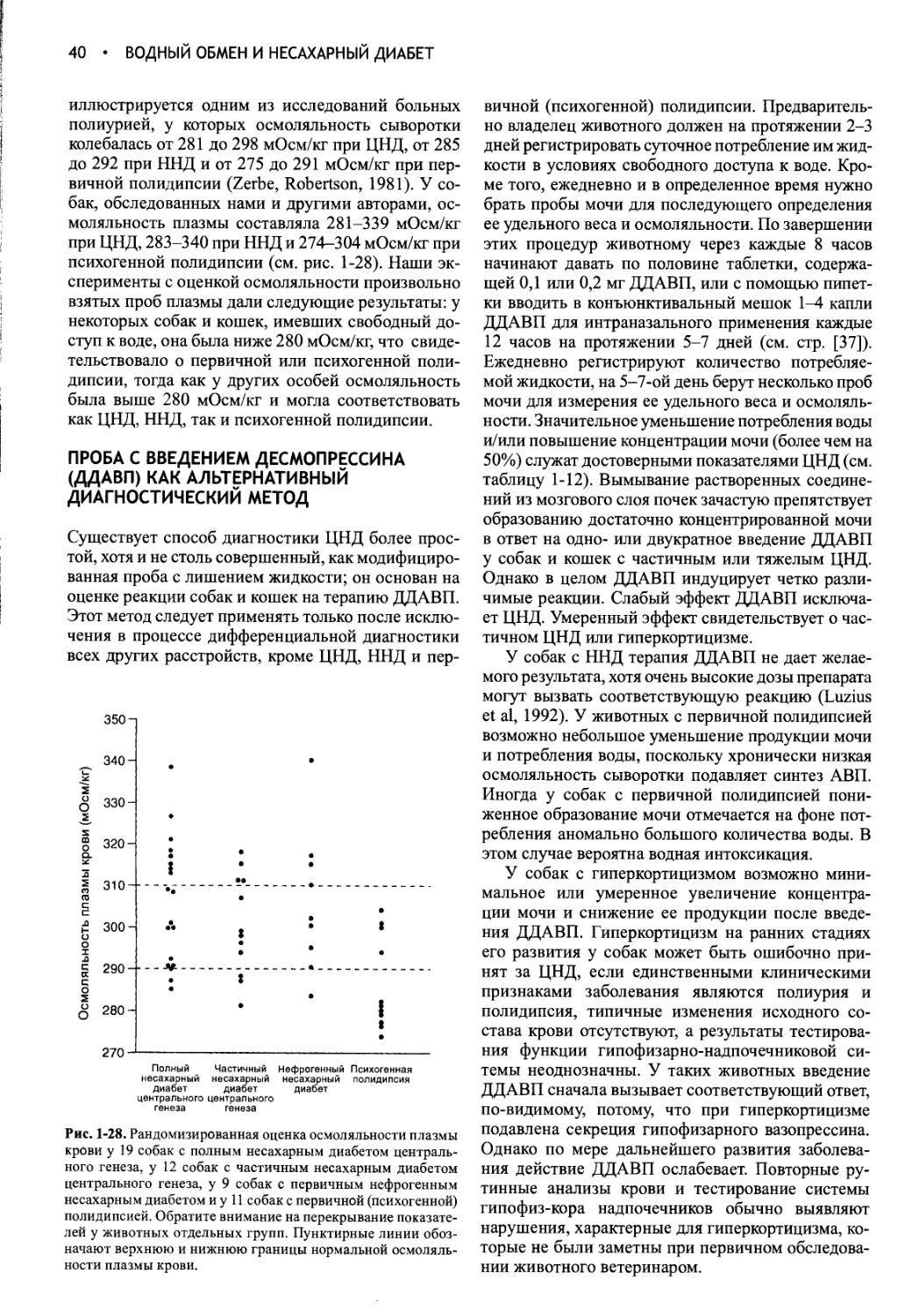
ISBN 5-9668-0014-6
Фундаментальное руководство по физиологии, патофизиологии и патологии эндокринной системы и репродуктивной функции у кошек
Книга открывается описанием функций гипофиза и таких заболеваний, как несахарный диабет и нарушение секреции гормона роста. Следующие главы посвящены обсуждению роли щитовидной железы и клинических состояний, связанных с ее дисфункцией: представлен подробнейший обзор по тиреотоксикозу у кошек; рассматриваются также гипотиреоидные состояния у собак и кошек, опухоли щитовидной железы и гипертиреоз у собак. Раздел «Кора надпочечников» включает описание гиперкортицизма (синдрома Кушинга), гипокортицизма (аддисоновой болезни), феохромоцитомы и множественной эндокринной неоплазии у мелких домашних животных, а также методов глюкокортикоидной терапии; здесь особый интерес представляет обзор быстро накапливающихся в последнее время данных о распространенности и клинических признаков гиперкортицизма у кошек. В разделе, посвященном эндокринной функции поджеледочной железы, дается описание патофизиологии, клинических признаков, диагностики и лечения сахарного диабета у собак, а также - впервые! - обобщены сведения об особенностях развития и протекания сахарного диабета у кошек. В этом же разделе рассматриваются диабетический кетоацидоз и опухоли поджелудочной железы. Далее обсуждаются нарушения функции паратиреоидных желез (первичный гипер- и гипопаратиреоз и, соответственно, гипер- и гипокальциемия) и роль почечных гормонов. Последние три раздела руководства содержат описание нормального репродуктивного цикла, эндокринологии беременности и родов, методов контроля размножения, причин бесплодия и заболеваний репродуктивных органов у сук; подробно рассмотрены патофизиология, диагностика и лечение репродуктивных нарушений у кобелей, а также получение спермы для искусственного осеменения и использование замороженной спермы. Завершает книгу глава по репродукции кошек.
Информативность данного руководства трудно переоценить. Оно послужит незаменимым справочным изданием для любого ветеринарного врача, сталкивающегося с проблемами эндокринной дисфункции у своего пациента.
Предназначено для ветеринарных врачей, студентов и преподавателей ветеринарных факультетов и академий, специалистов-эндокринологов, а также для врачей и студентов любой медицинской специальности.
ББК 48.7
Автор и издатели не несут ответственности за какой-либо вред или ущерб, возникший в результате использования идей, рекомендаций, лекарственных средств, упомянутых в книге.
Данный перевод публикуется по соглашению с Elsevier Inc., Нью-Йорк, США
ISBN 0-7216-9315-6 (англ.)
ISBN 5-9668-0014-6 (русск.)
Copyright © 2004 Elsevier Science, USA. All rights reserved © Перевод на русский язык «Софион», 2008 © Оформление, ООО «Софион», 2008
ПОСВЯЩЕНИЕ
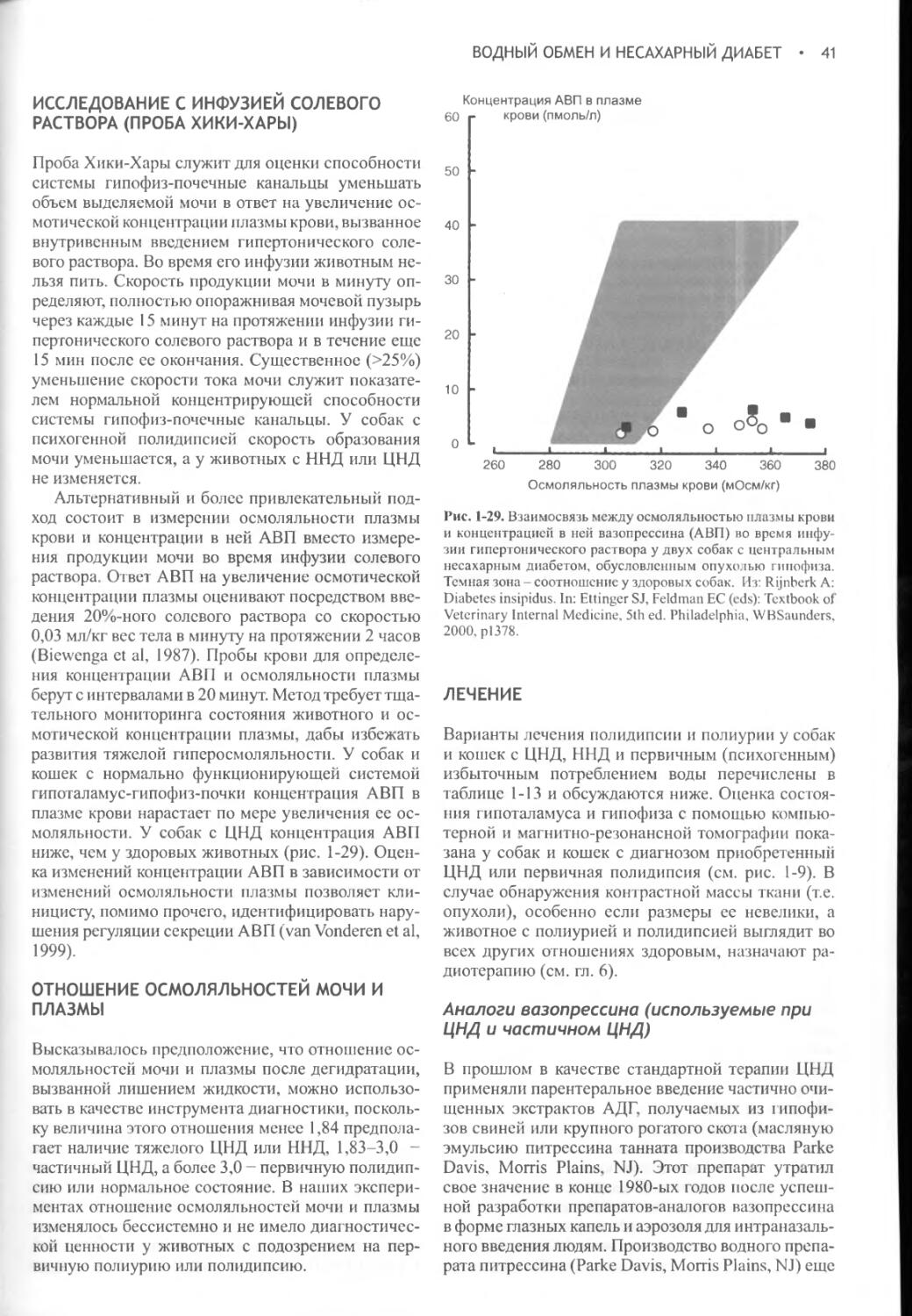
Нашим коллегам и клиентам, которые много лет предоставляли нам животных и поддерживали нас в работе. С особой благодарностью - нашим врачам, помощникам и студентам, участвовавшим в проведении многих клинических исследований и не дававшим нам останавливаться в поисках решений
Э. Фелдмен и Р. Нелсон
Кей, Бет Анне и Кристоферу
Р. Нелсон
С признательностью за понимание того, что жизнь, как сознание бегуна-марафонца, заполнена «испытанием километрами и километрами испытаний».
Тяжелая борьба с километрами и испытаниями не прекращалась все первые годы после выхода предыдущего издания этой книги.
В такой обстановке поддержка и понимание являются истинным благодеянием. Я посвящаю этот труд моим весьма снисходительным дочерям, Ронде и Шайне, равно как и другим членам моей семьи: Берни, Джеку, Джуди, Карен, Ребекке и Митчелу, которые были рядом, когда я больше всего в них нуждался. Я также посвящаю его моим друзьям, помогавшим мне сгладить путь и переносить испытания: Стиву, Пату, Лори, Нанси, Джимми, Мэри, Питеру, Телме Ли, Дику, Кей, Дженнифе-ру, Стефану, Чаку, Терри, Эли, Мэг, Джэми, Марии и тете Анне...
Но прежде всего Шон Марии - с тобою дорога была короче и шла под уклон, а испытания казались не столь тяжкими. Спасибо за то, что вселяла в меня энергию для выполнения поставленной задачи; спасибо за то, что научила меня ценить красоту, искренность и сочувствие, которыми я так дорожу в тебе.
Э. Фелдмен
ПРЕДИСЛОВИЕ
Цель третьего издания нашего руководства по эндокринологии и репродукции собак и кошек та же самая, что и двух предшествовавших, а именно: дать ветеринарам краткий, но исчерпывающий источник данных по патофизиологии, клинике, диагностике и лечению эндокринных, обменных и репродуктивных расстройств у этих животных. Колоссальное увеличение объема информации об этих заболеваниях после выхода последнего издания книги не позволяет нам ограничиться «простым редактированием и небольшой правкой». Нынешнее, третье издание представляет собой полный пересмотр предыдущего. Мы сохранили формат двух первых изданий, но внесли существенные изменения и дополнения; мы рассчитываем, что это сделает книгу более полезной для практикующих ветеринаров.
Взглянув на оглавление, читатель сразу же заметит, что в учебнике отдельно рассматриваются эндокринные и репродуктивные расстройства. В эндокринный раздел введены две очень важные новые главы: «Гиперкор-тицизм у кошек» и «Сахарный диабет у кошек». Мы давно уже поняли, что кошки - это не маленькие собаки. По мере расширения наших знаний о кошках и их заболеваниях становится все более очевидной потребность в специальной информации по патофизиологии, клинике, диагностике и лечению болезней кошачьих.
В третьем издании мы снова пытаемся концентрировать внимание на клинически значимой информации. Фактически, все главы переписаны почти заново, их материалы приведены в соответствие с современными знаниями, составлены новые или пересмотрены старые таблицы, предложены новые или исправленные рисунки и алгоритмы, отражающие непрерывное углубление нашего понимания патологических процессов и подходов к их объяснению. Этот же принцип использован при изложении способов совершенствования диагностики, имеется в виду, прежде всего, удобство их практического применения, снижение затрат и клиническую целесообразность. Наконец, мы продолжаем показывать ветеринарным врачам, как лучше справляться с отдельными эндокринными или репродуктивными расстройствами, чтобы обеспечить долгую и здоровую жизнь кошкам и собакам, принадлежащим нашим клиентам. Рекомендации по лечению разрабатывались с учетом его практичности, стоимости и гуманного отношения к животным. Мы не устаем подчеркивать важность изучения анамнеза, физикального исследования и индивидуальной оценки клинического состояния каждой кошки или собаки.
VII
Мы рассчитываем, что данная книга окажется полезной для студентов, врачей и ординаторов, специализирующихся в области ветеринарии, а также для владельцев животных, специалистов по их разведению и для широкой публики. Работа над книгой ставила перед нами трудную и трудоемкую, но благородную задачу. Мы не думаем, что смогли дать окончательный ответ на все вопросы, но надеемся, что читатель получит полную, современную и полезную, практическую информацию по эндокринным и репродуктивным болезням собак и кошек. Мы не претендуем также на абсолютную объективность. Более того, наш большой клинический опыт предполагает пристрастное отношение, которое, как мы думаем, обеспечивает прочную основу предлагаемых рекомендаций по диагностике и лечению указанных заболеваний.
Книгу такого рода нельзя написать без всесторонней поддержки. Нашим семьям пришлось пережить еще один период ночных бдений, без выходных и свободного времени, чтобы осуществить мечту и создать полезное справочное пособие для людей, которых мы не знаем, но с которыми разделяем общую любовь к животным. Мы хотим искренне поблагодарить издательский и производственный персонал Saunders и Elsevier, а также Джоан Адамс, Аллана Рейнеро и других сотрудников Калифорнийского Университета (Дейвис), которые в той или иной мере старались облегчить нашу задачу и способствовали ее выполнению.
Эдвард Фелдмен
Ричард Нелсон
VIII
СОДЕРЖАНИЕ
Часть I ГИПОФИЗ................................................1
Глава 1 Водный обмен и несахарный диабет.......................2
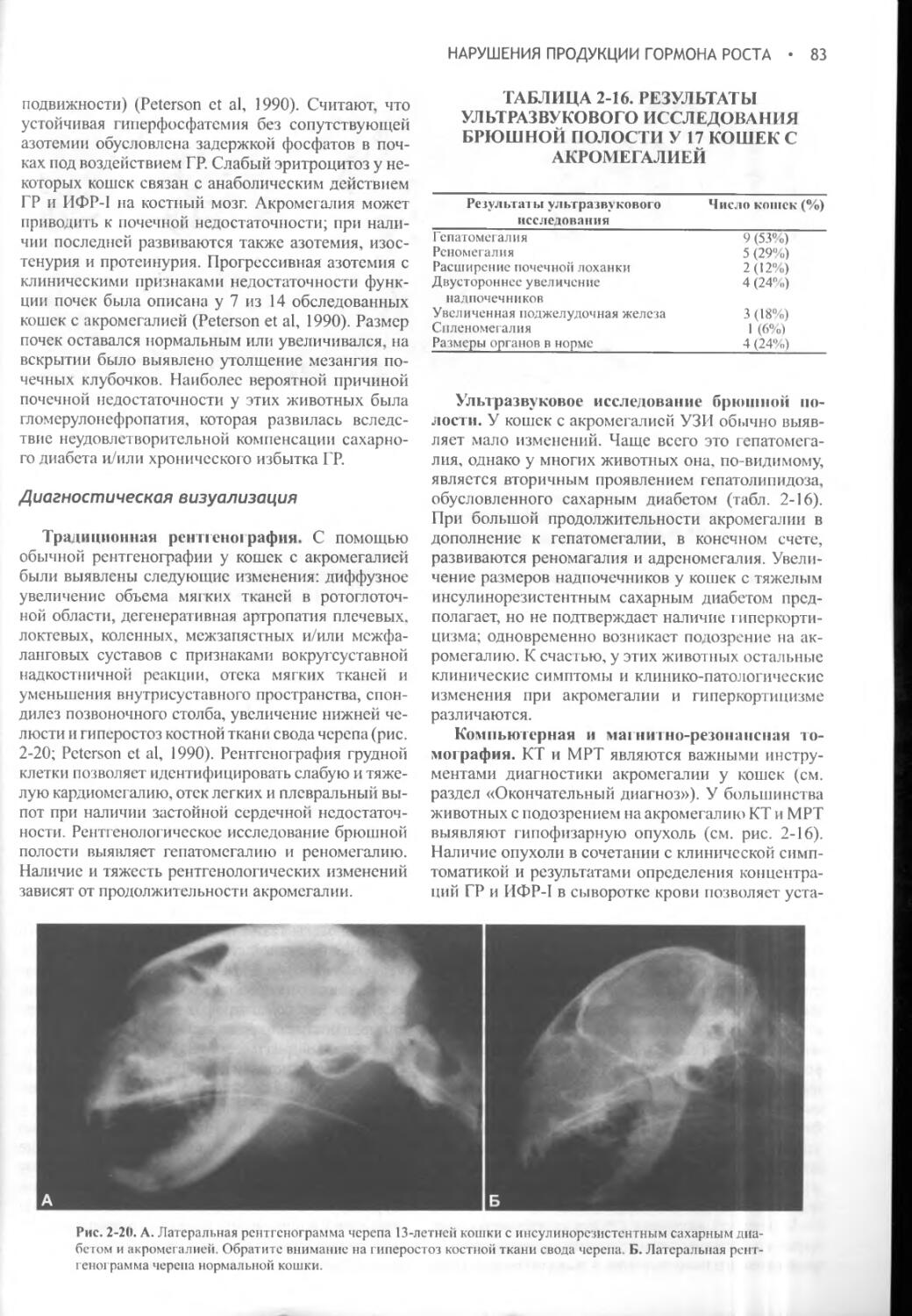
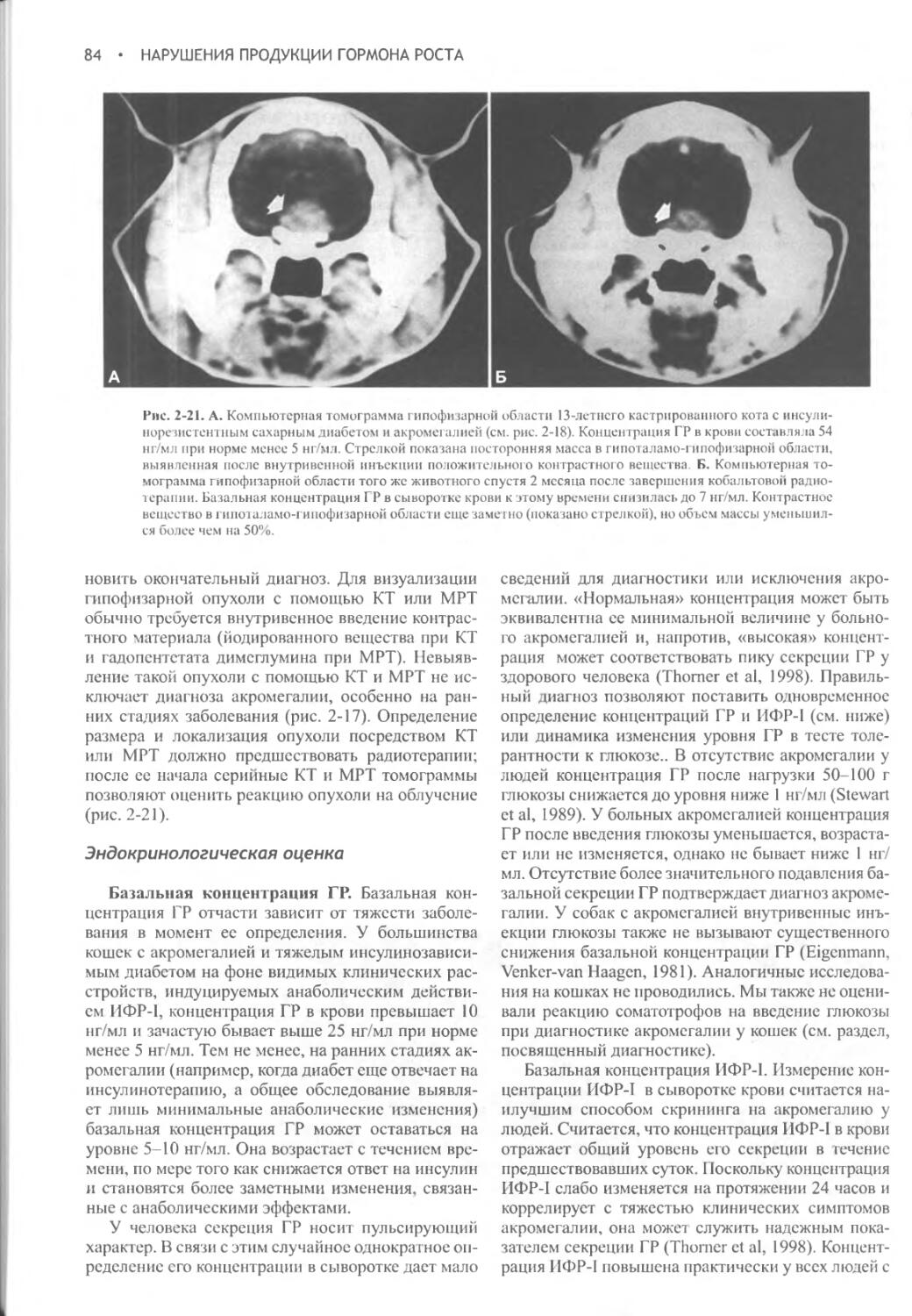
Глава 2 Нарушение продукции гормона роста.....................51
Часть II ЩИТОВИДНАЯ ЖЕЛЕЗА.....................................95
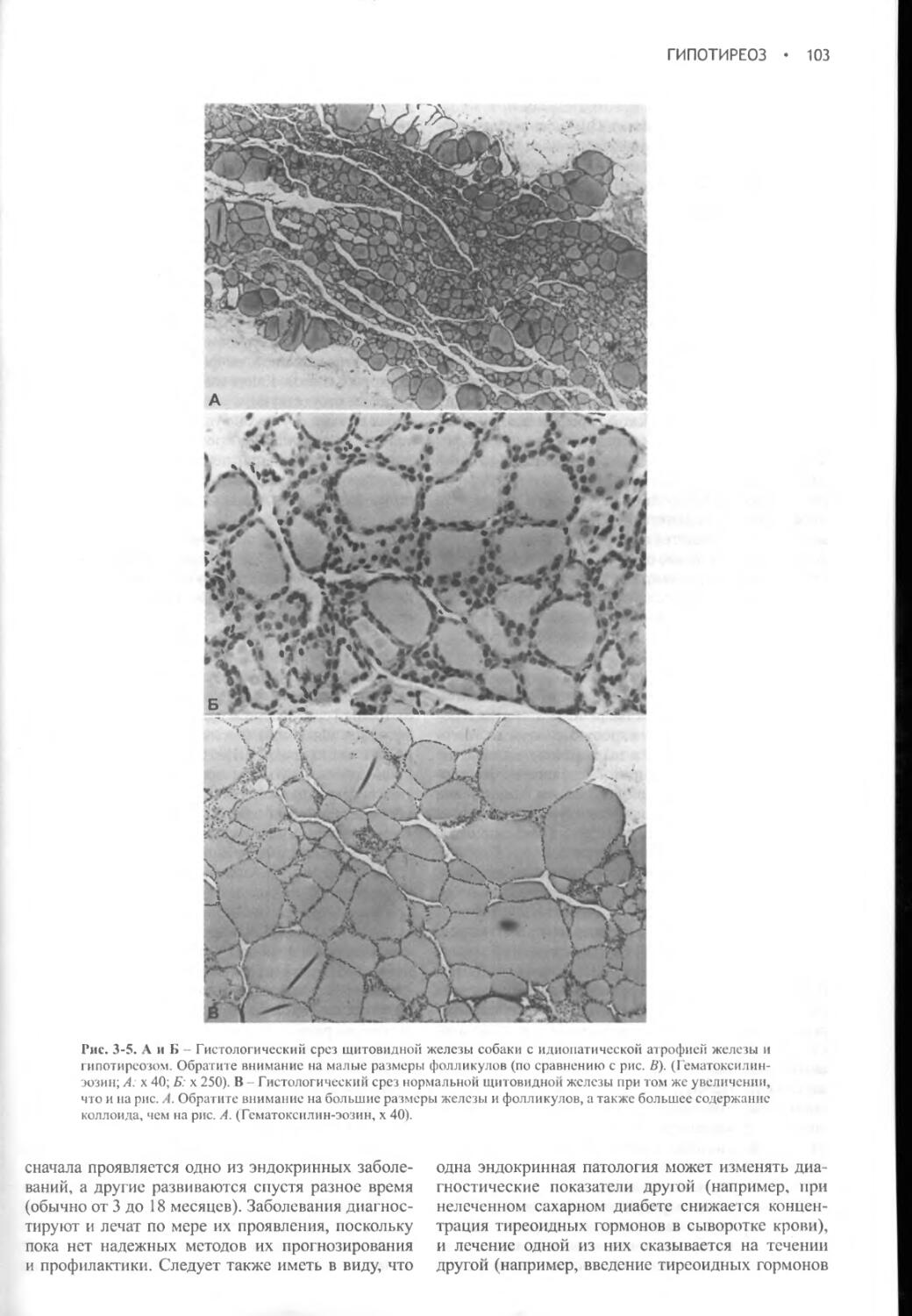
Глава 3 Гипотиреоз............................................96
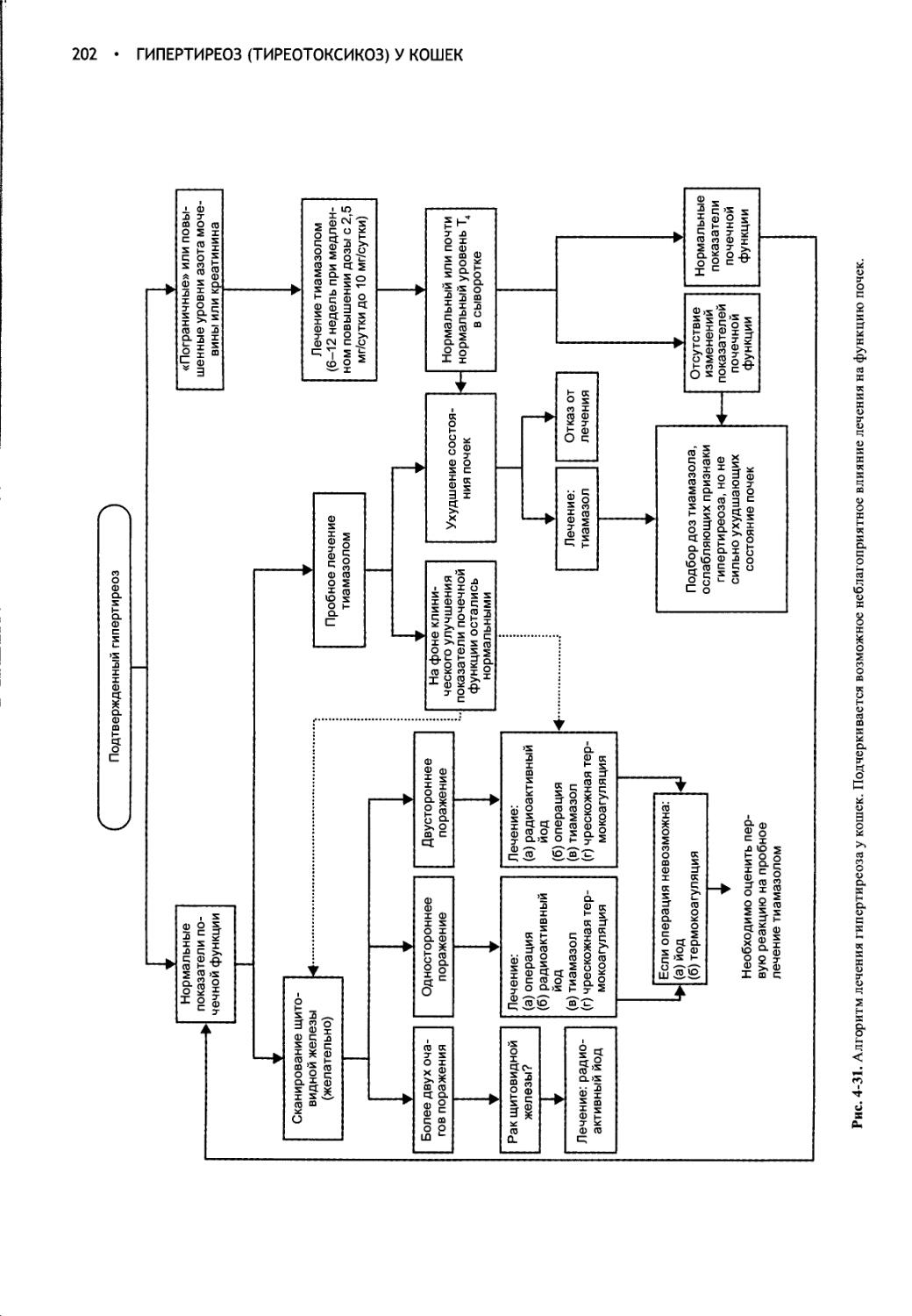
Глава 4 Гипертиреоз (тиреотоксикоз) у кошек..................161
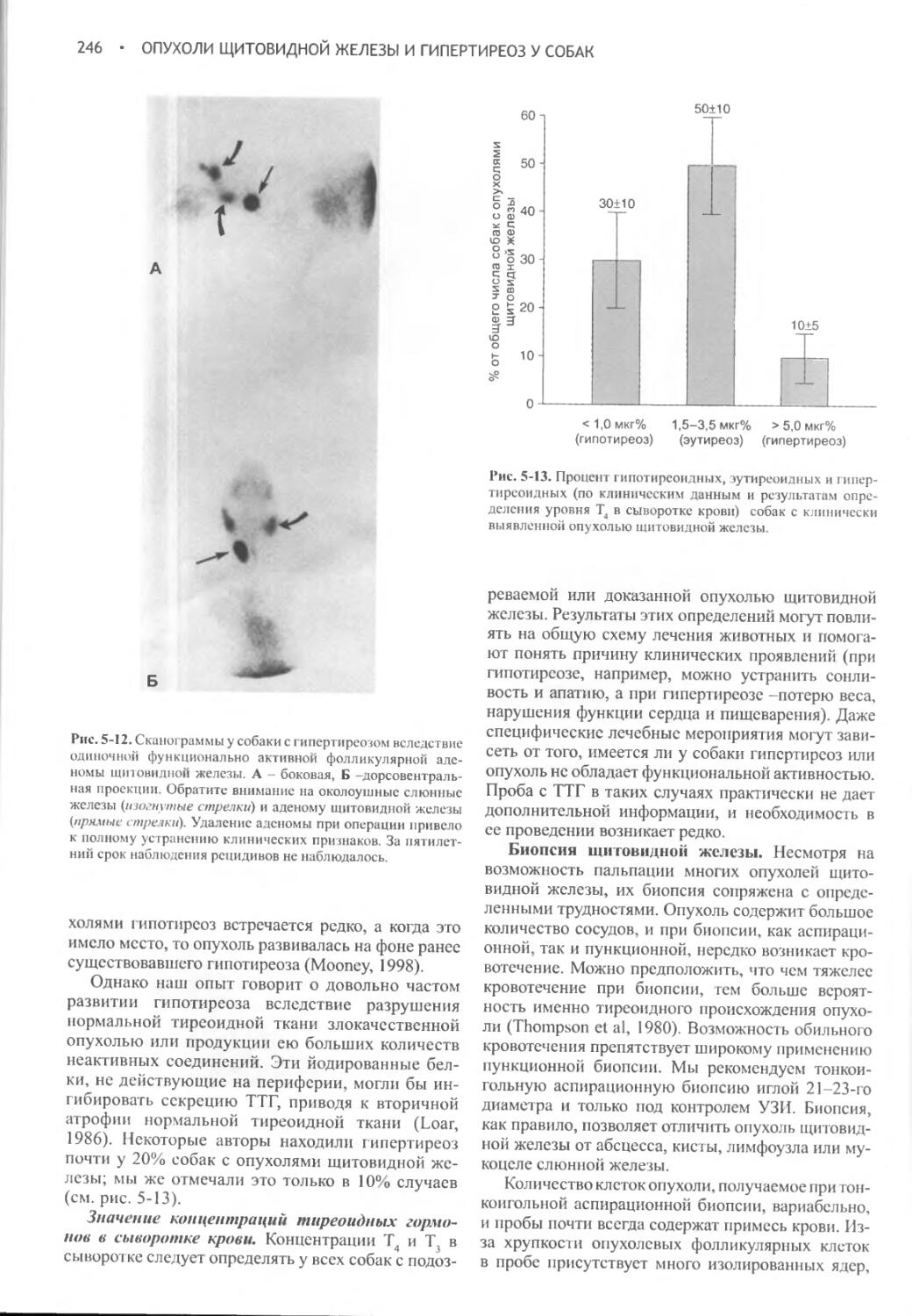
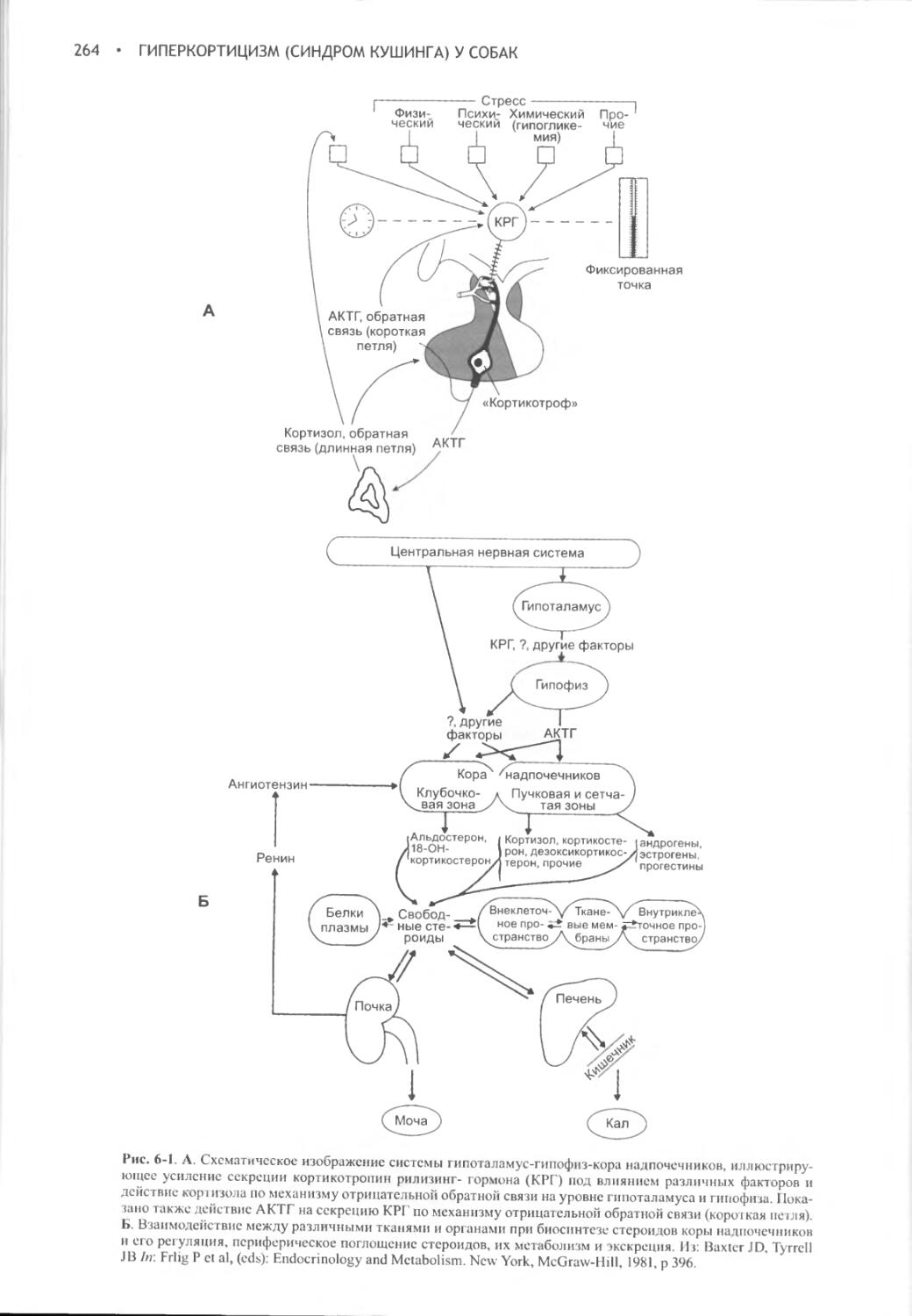
Глава 5 Опухоли щитовидной железы и гипертиреоз у собак......228
Часть III НАДПОЧЕЧНИКИ.........................................261
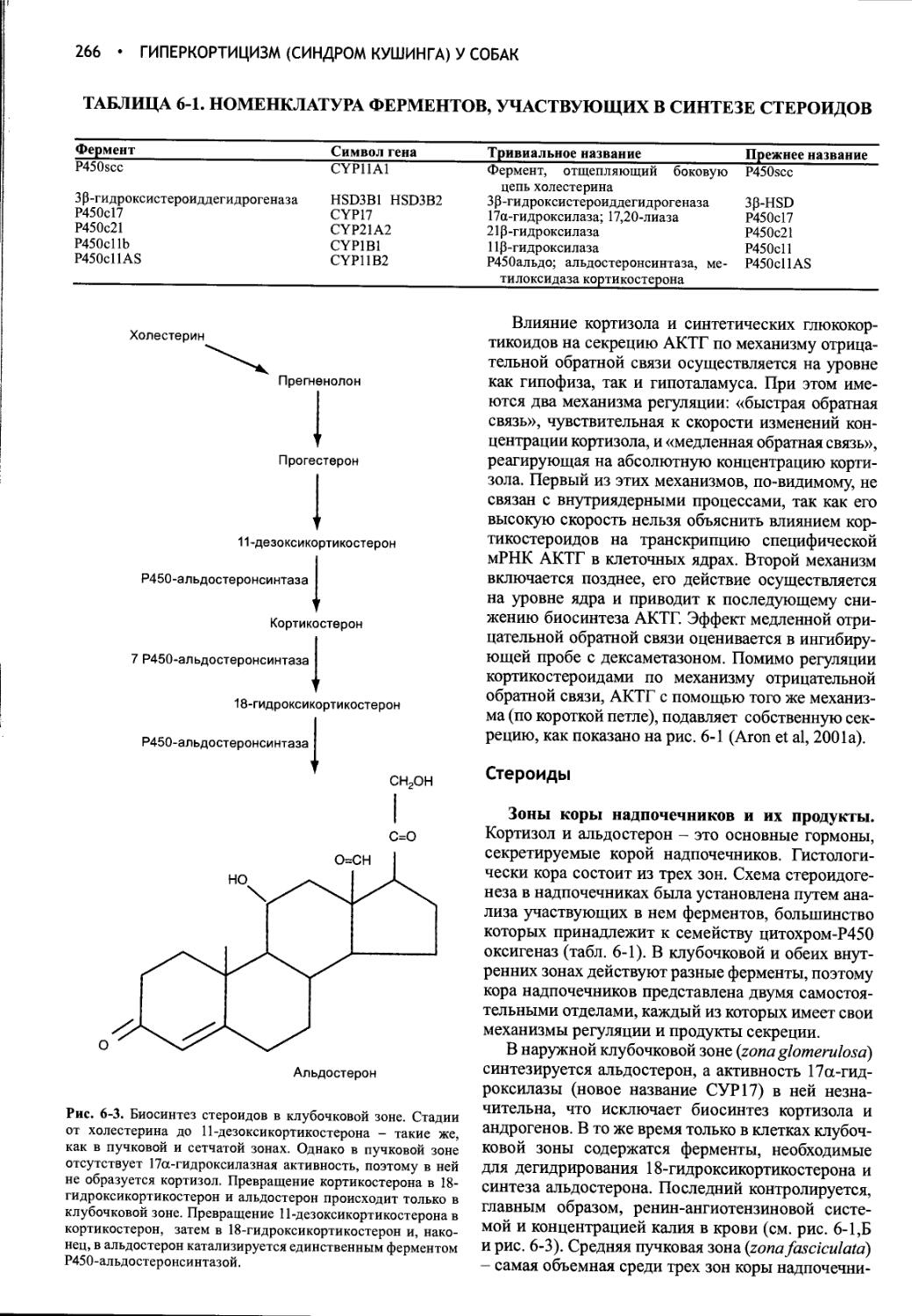
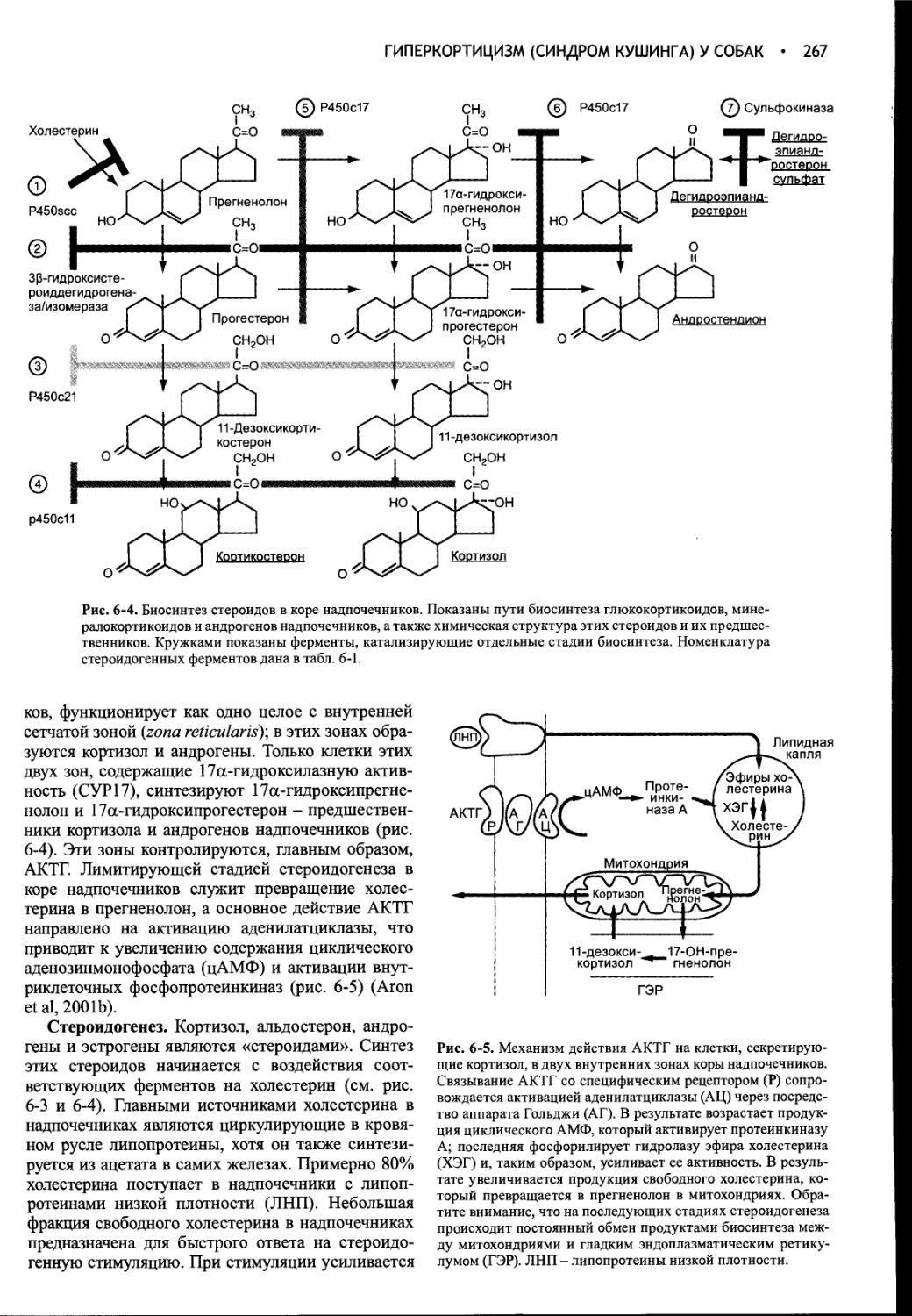
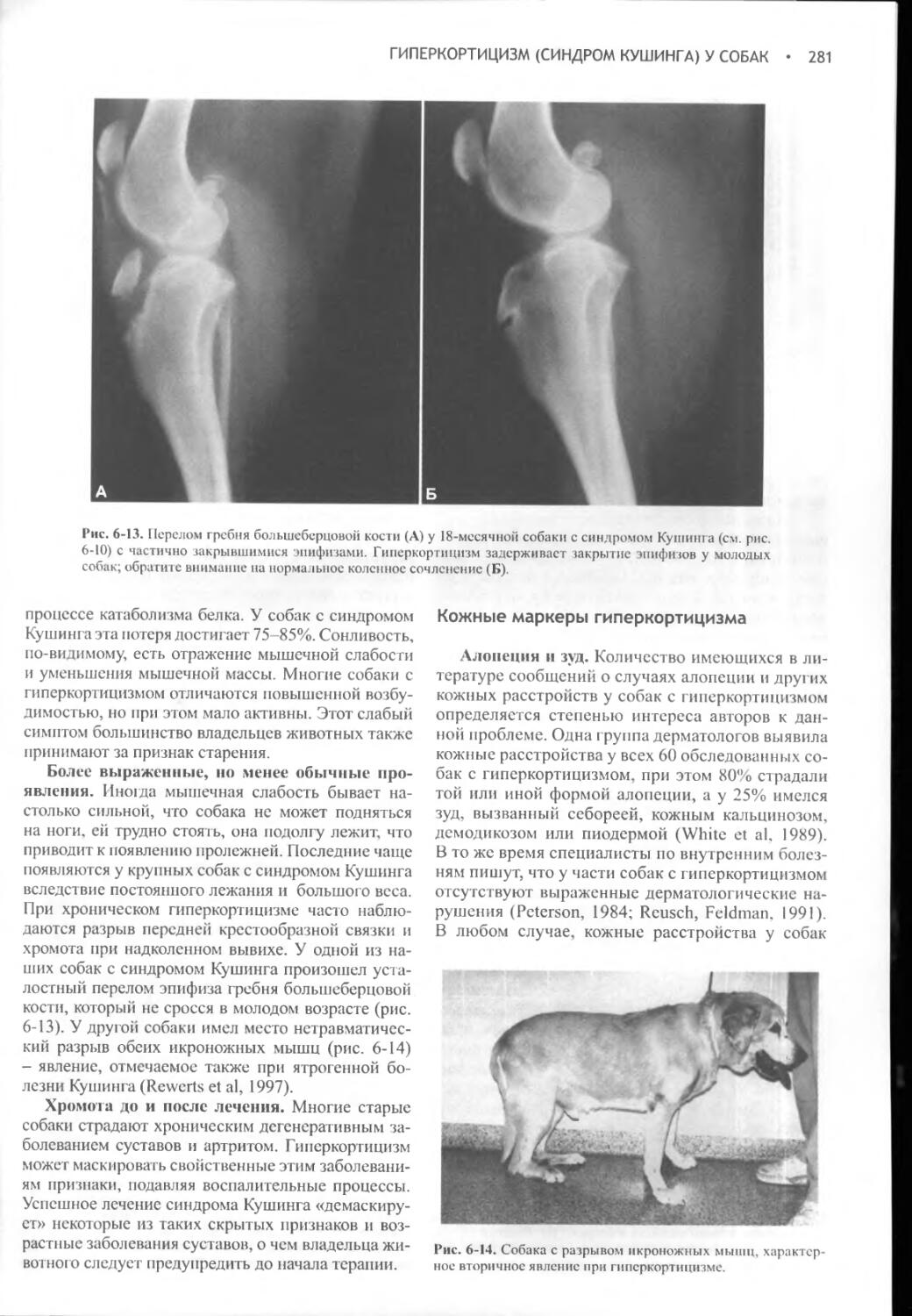
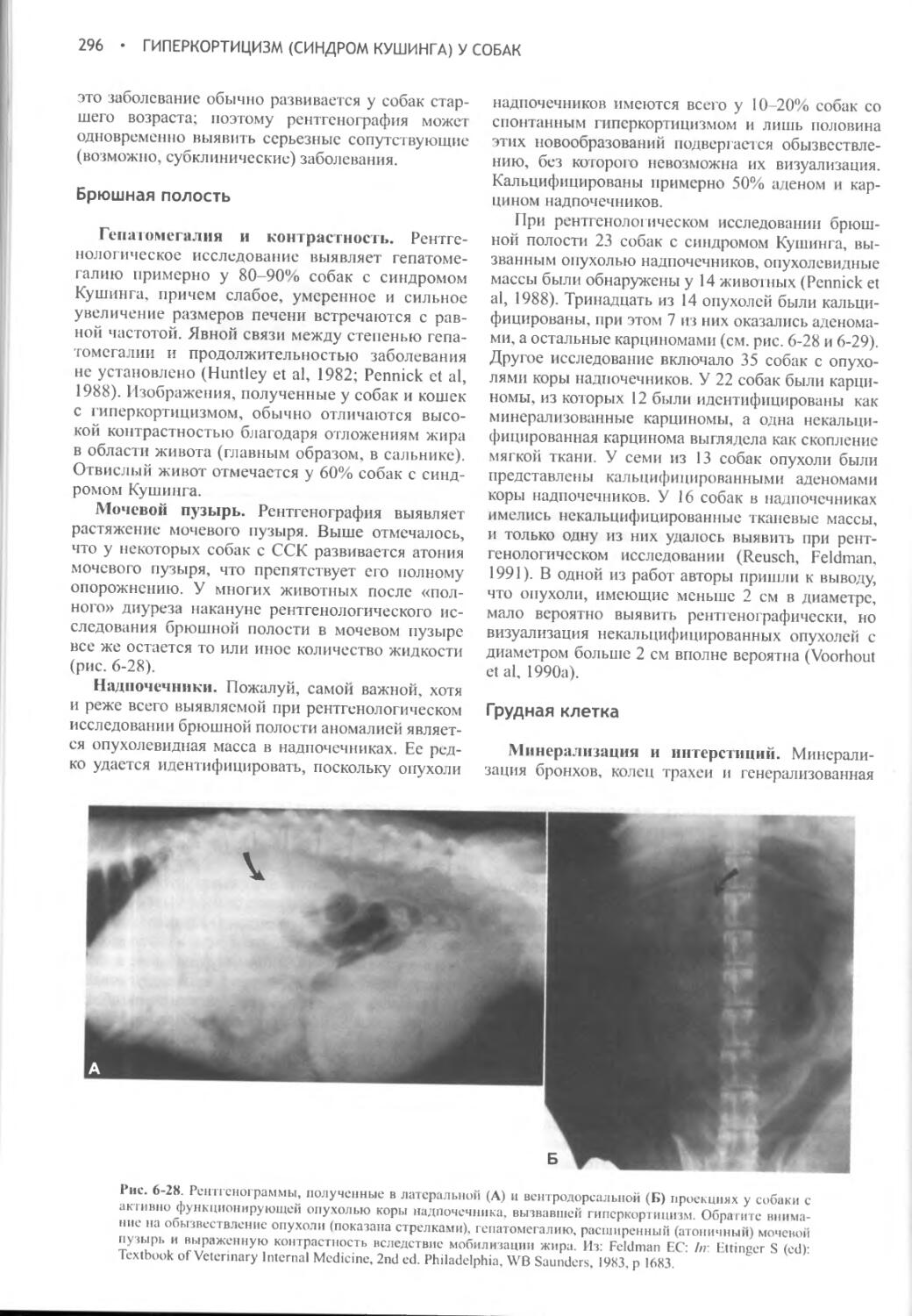
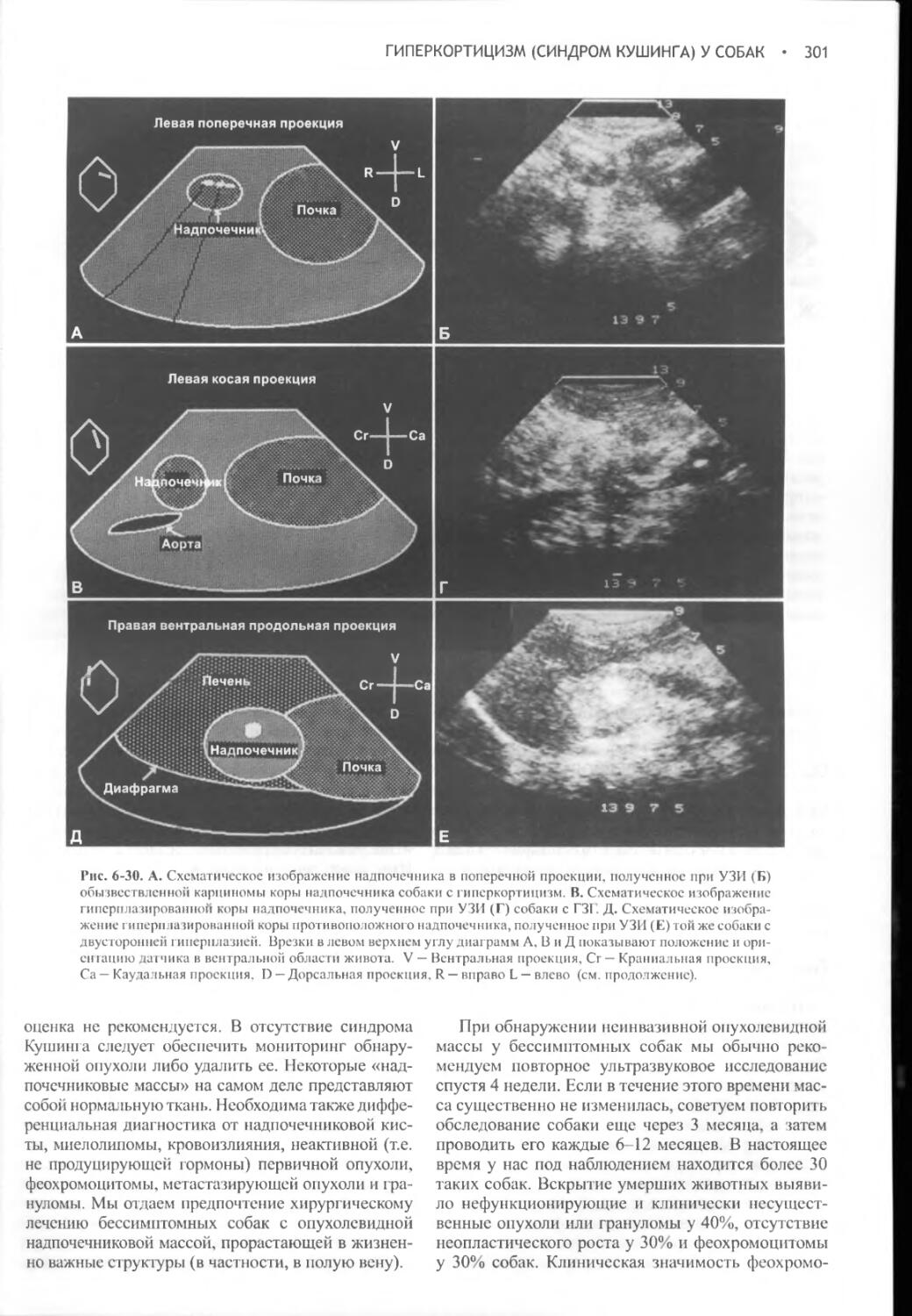
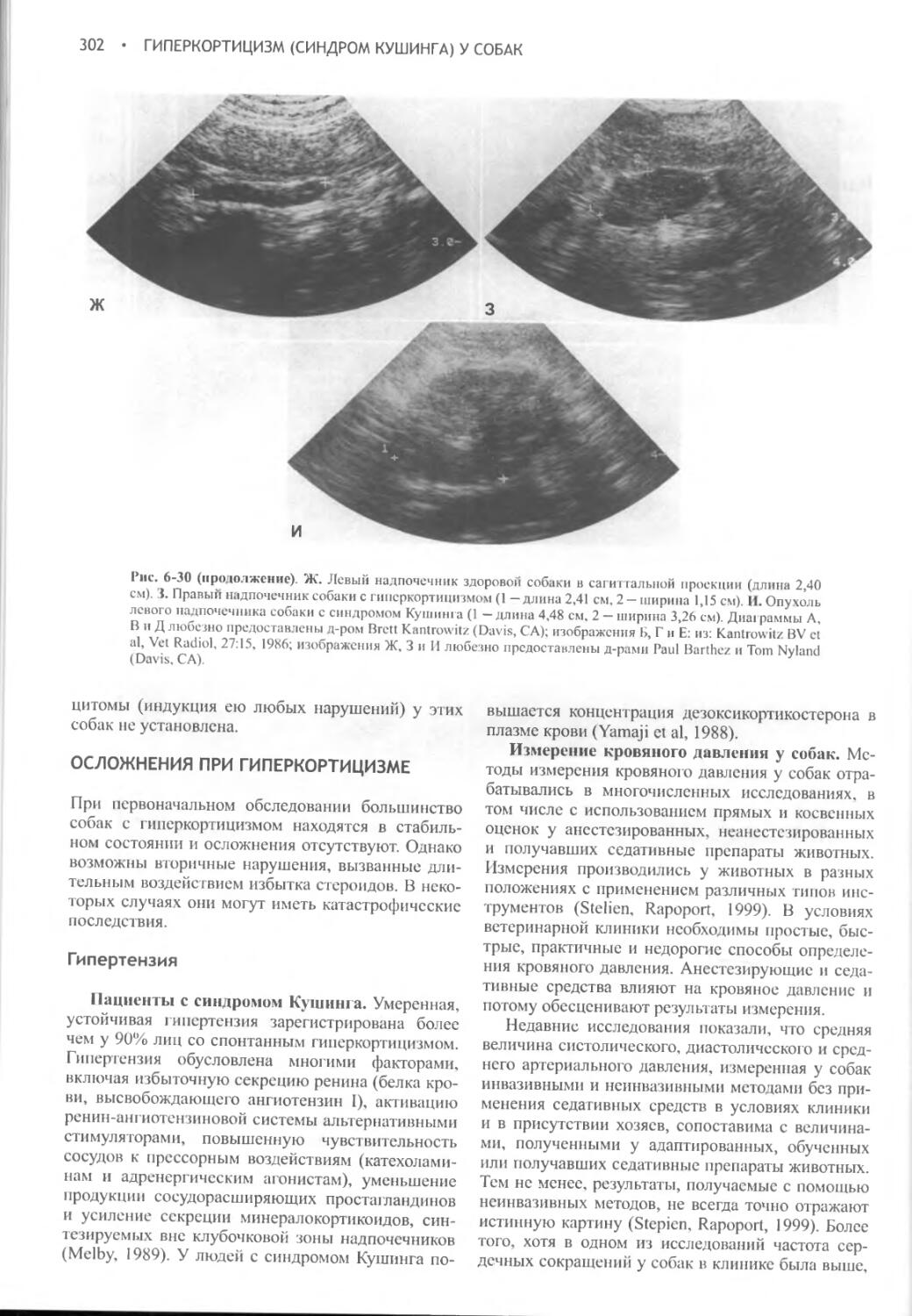
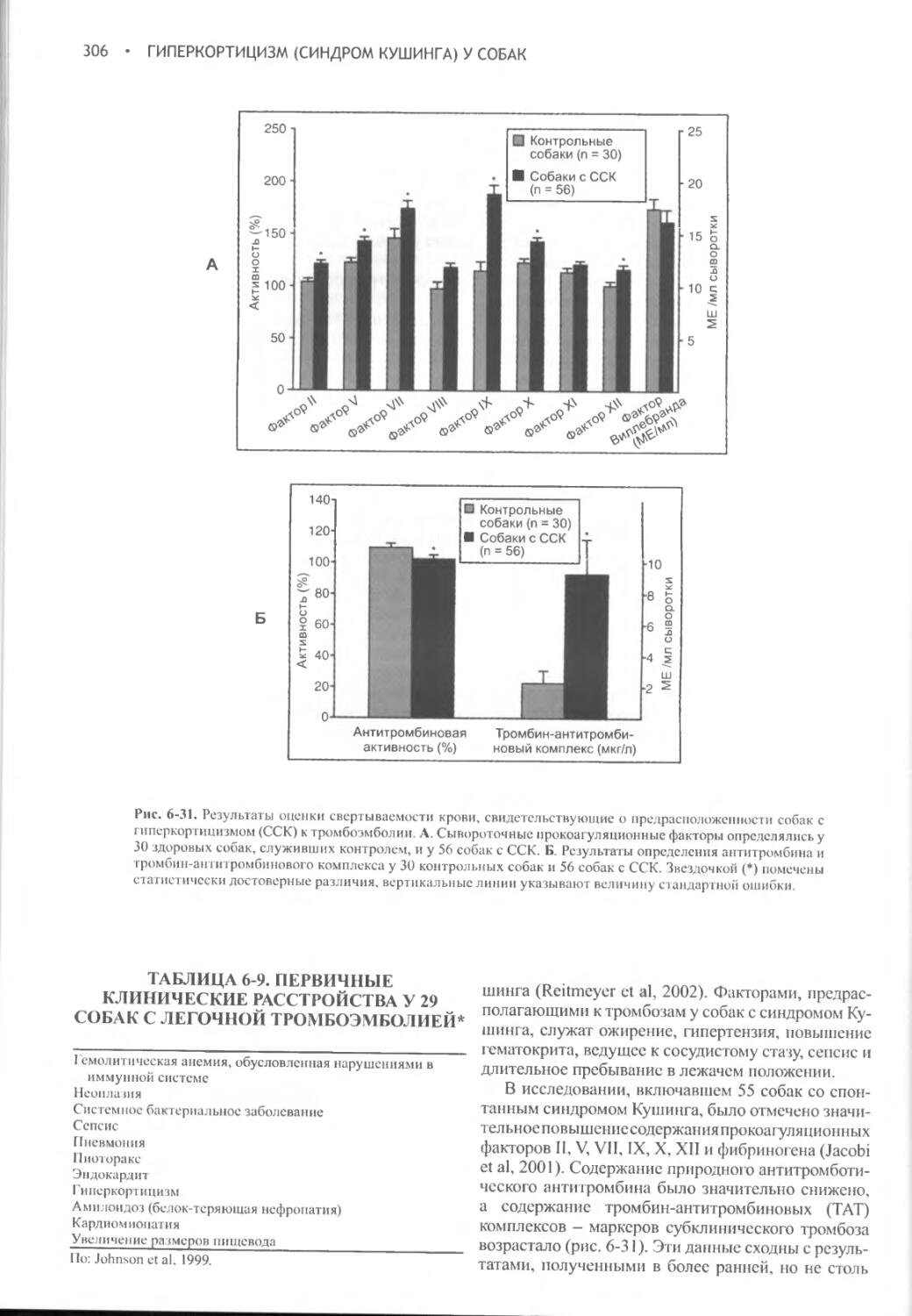
Глава 6 Гиперкортицизм (синдром Кушинга) у собак.............262
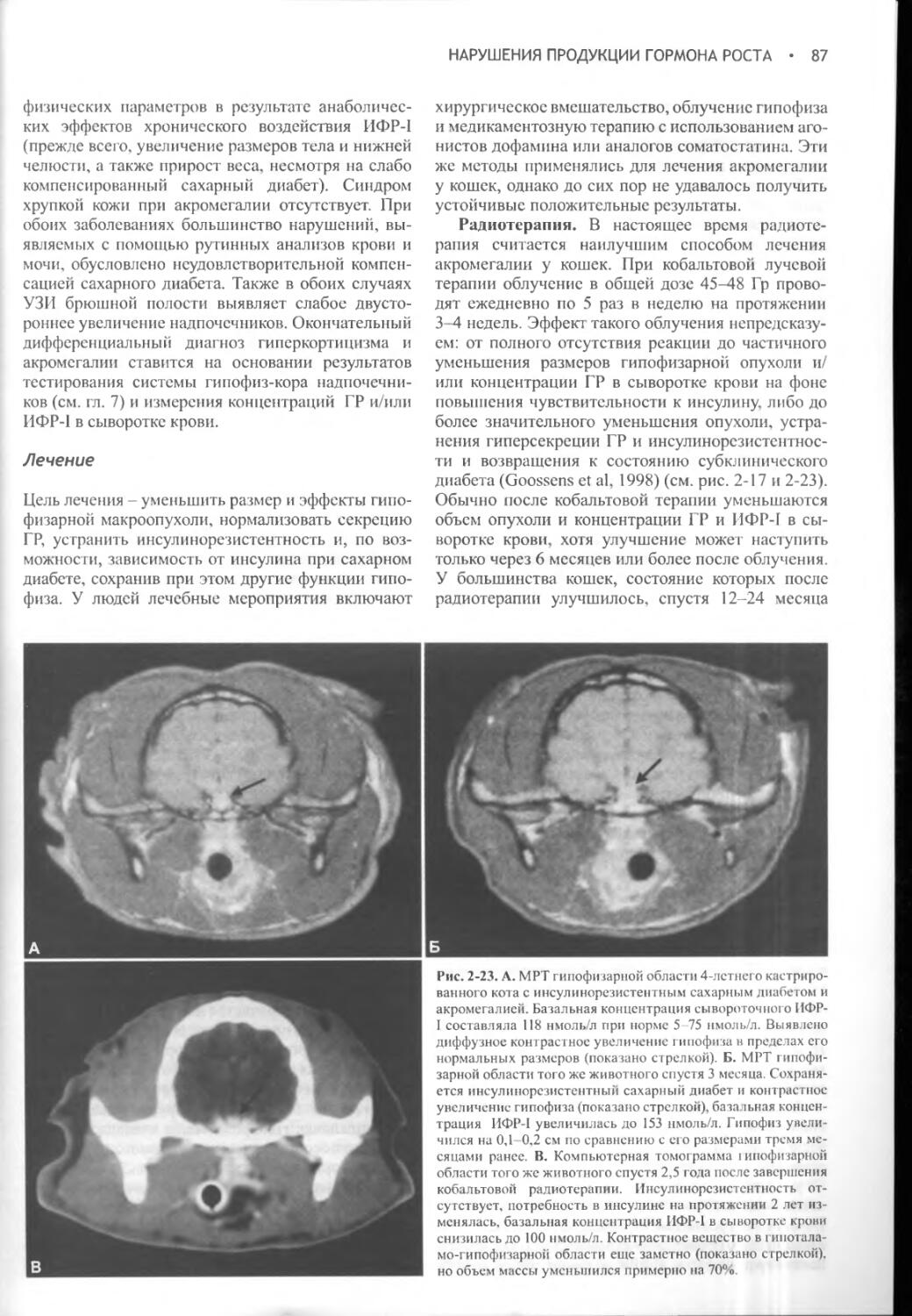
Глава 7 Гиперкортицизм (синдром Кушинга) у кошек.............376
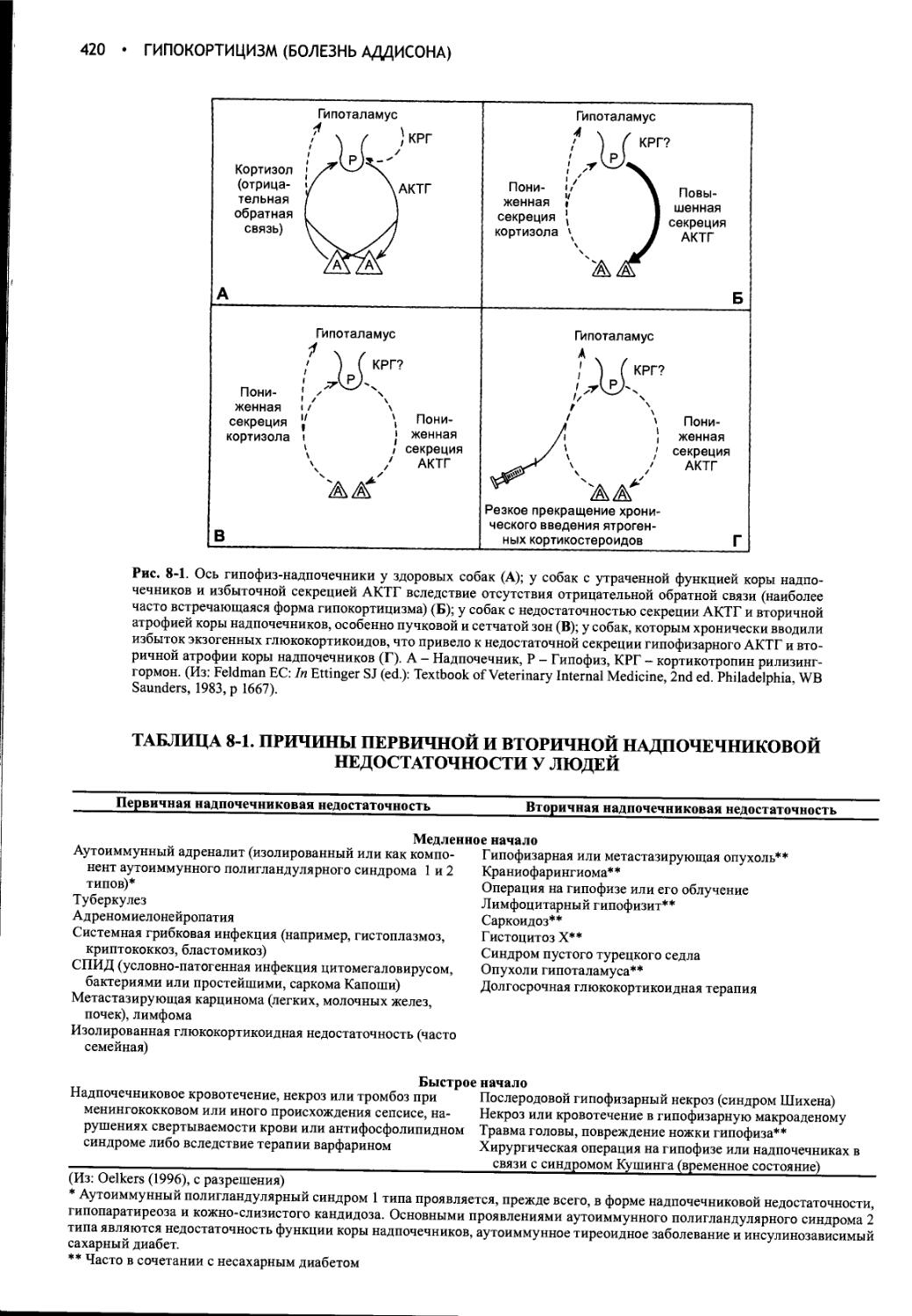
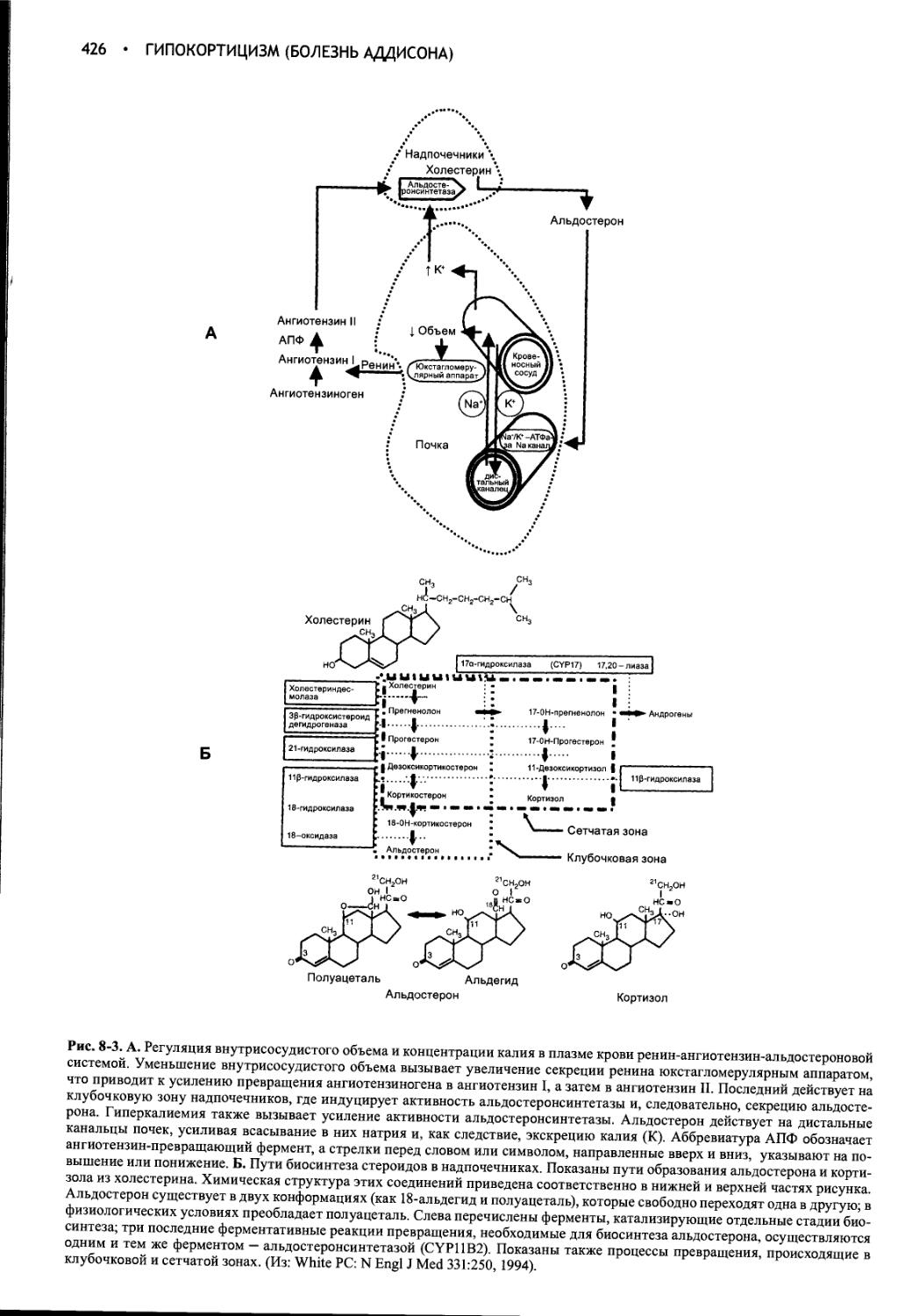
Глава 8 Гипокортицизм (болезнь Аддисона).....................418
Глава 9 Феохромоцитома и множественная эндокринная неоплазия.472
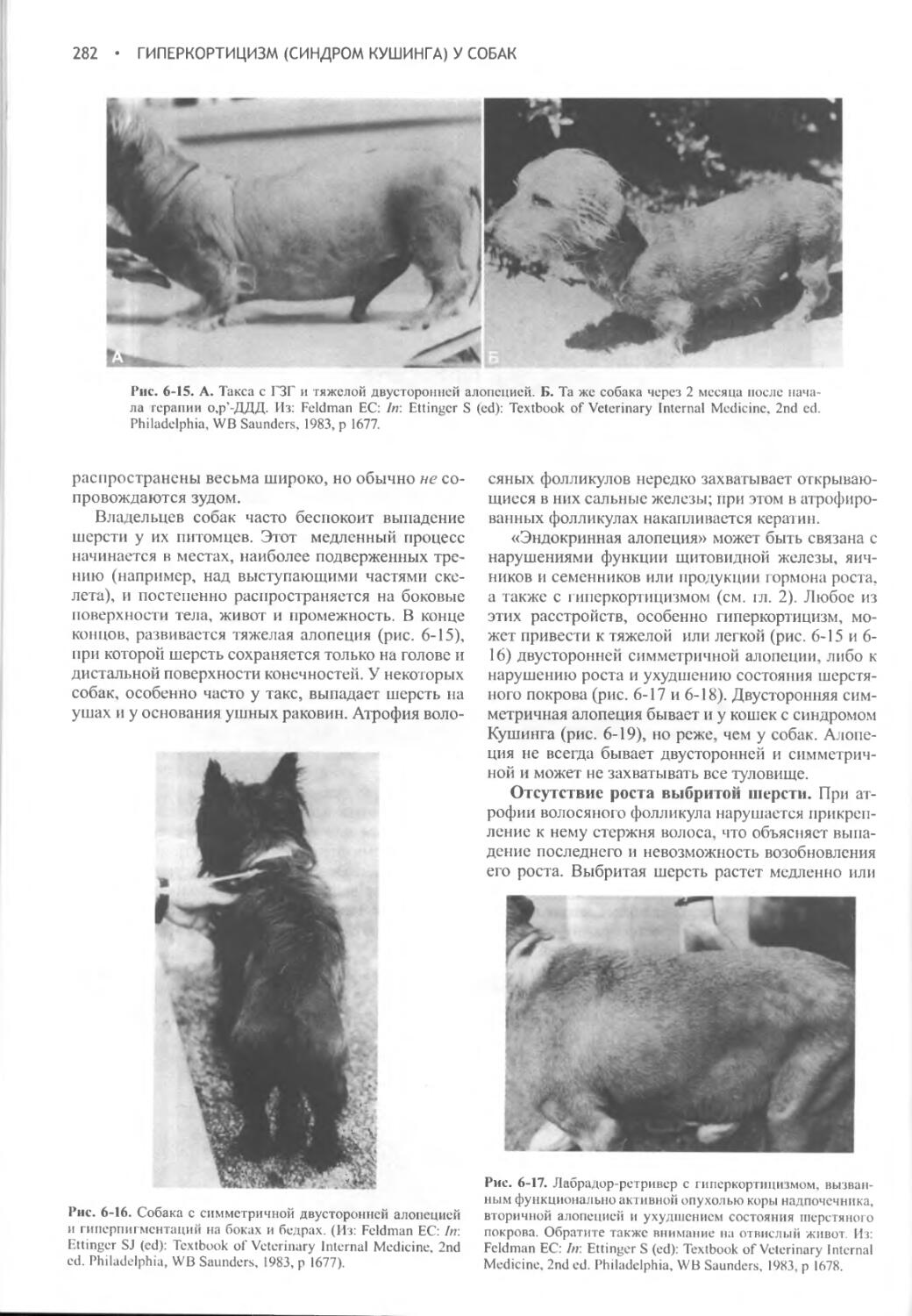
Глава 10 Глюкокортикоидная терапия............................499
IX
Часть IV ЭНДОКРИННАЯ ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА.....................525
Глава 11 Сахарный диабет у собак..............................526
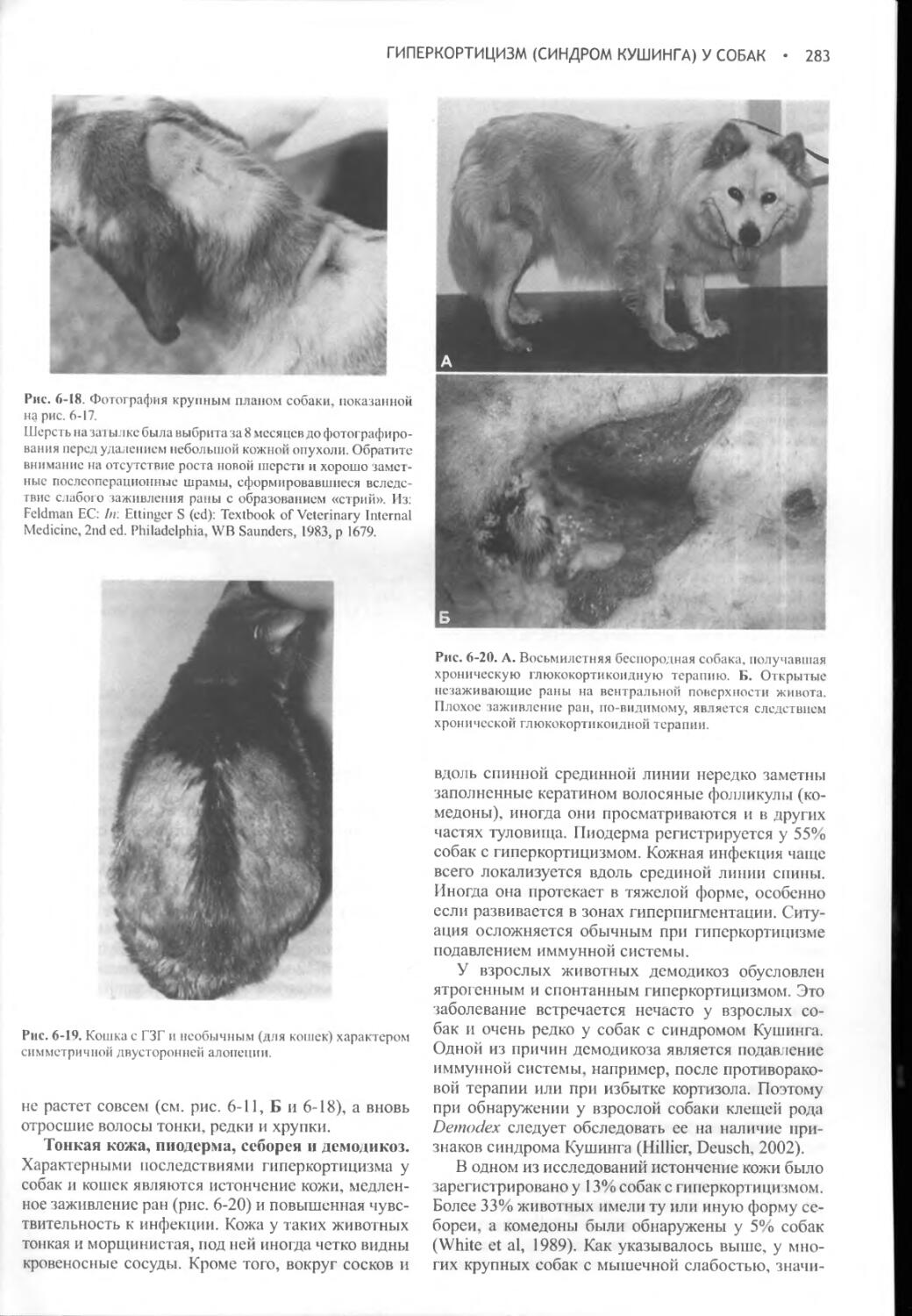
Глава 12 Сахарный диабет у кошек..............................588
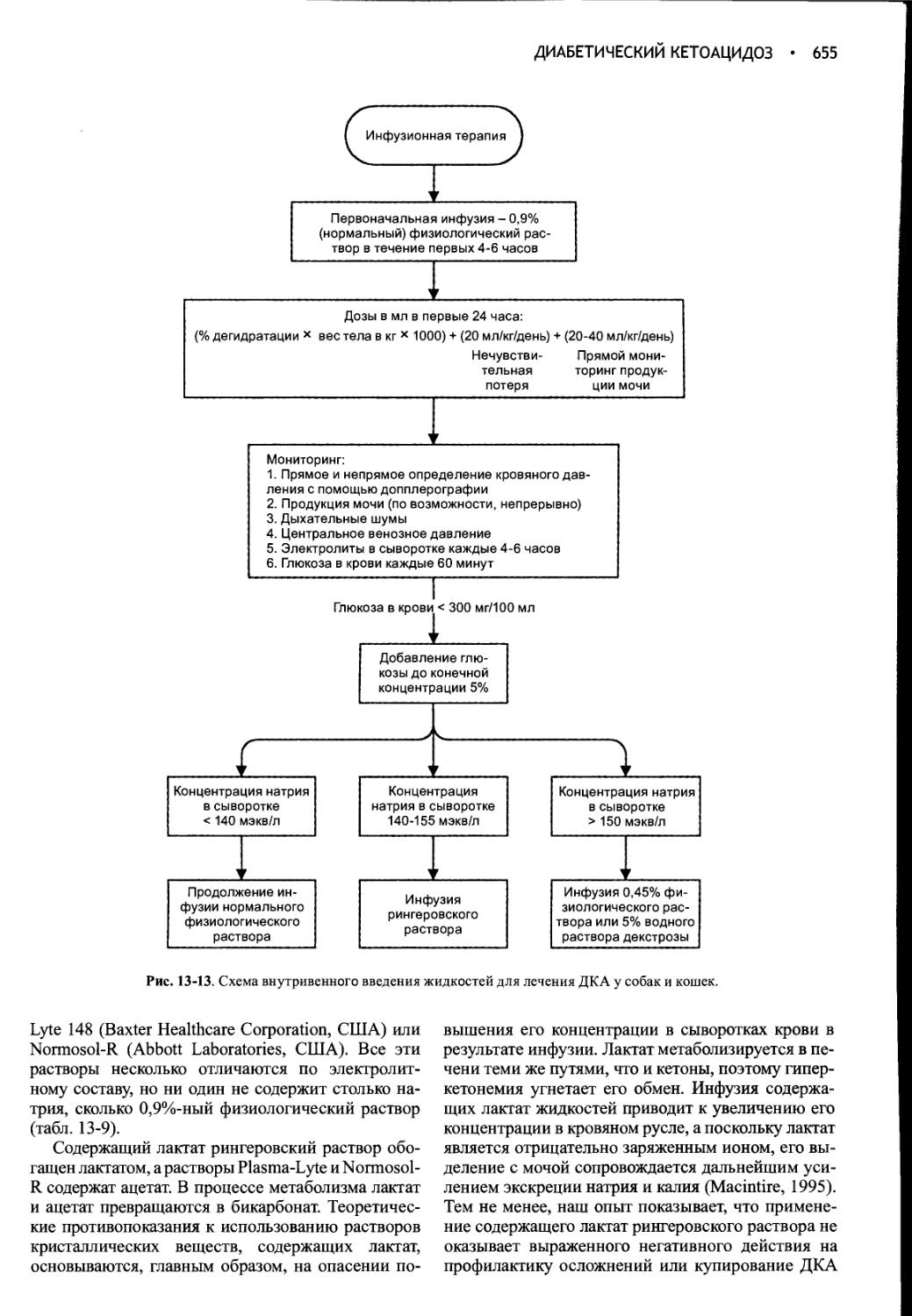
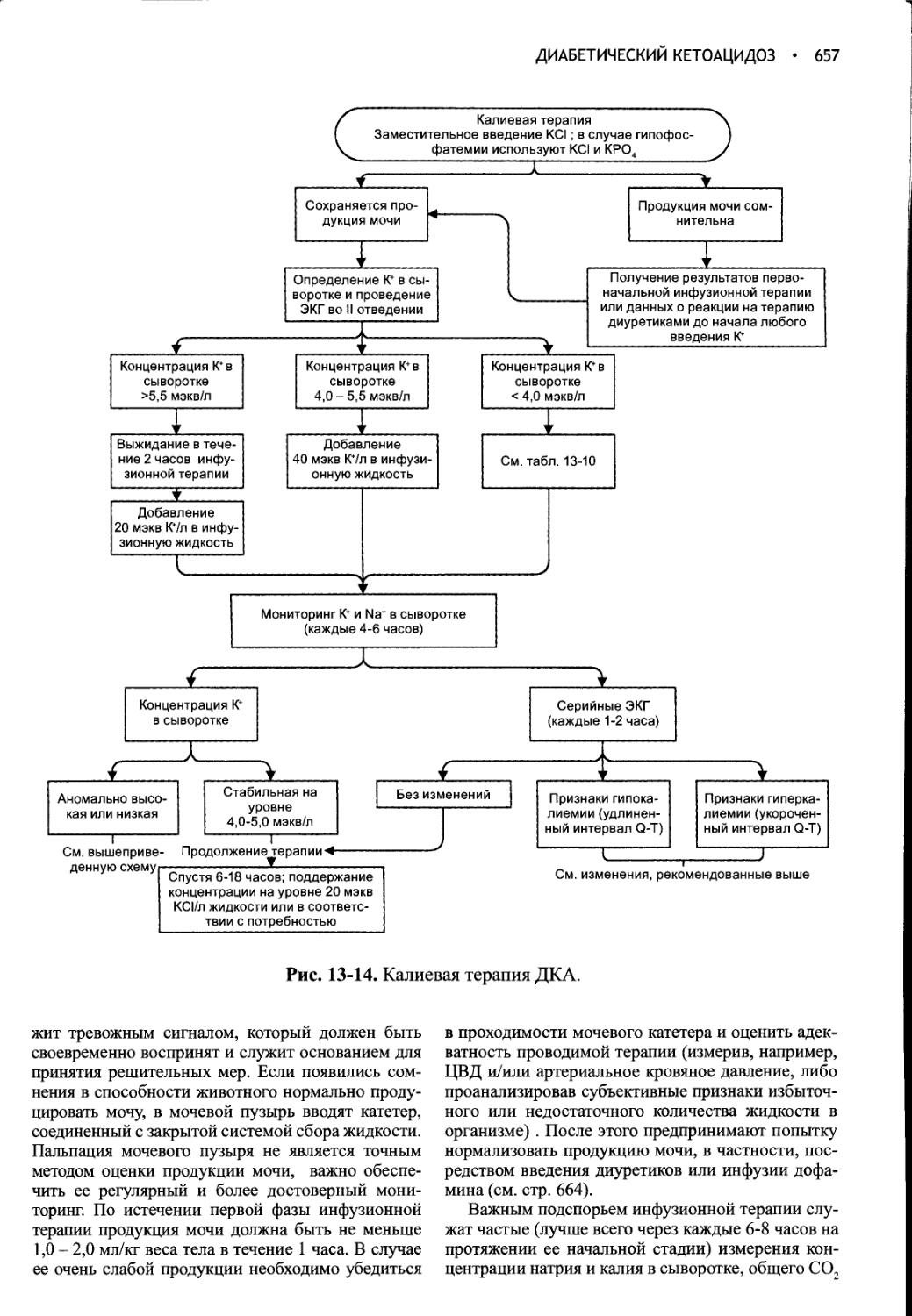
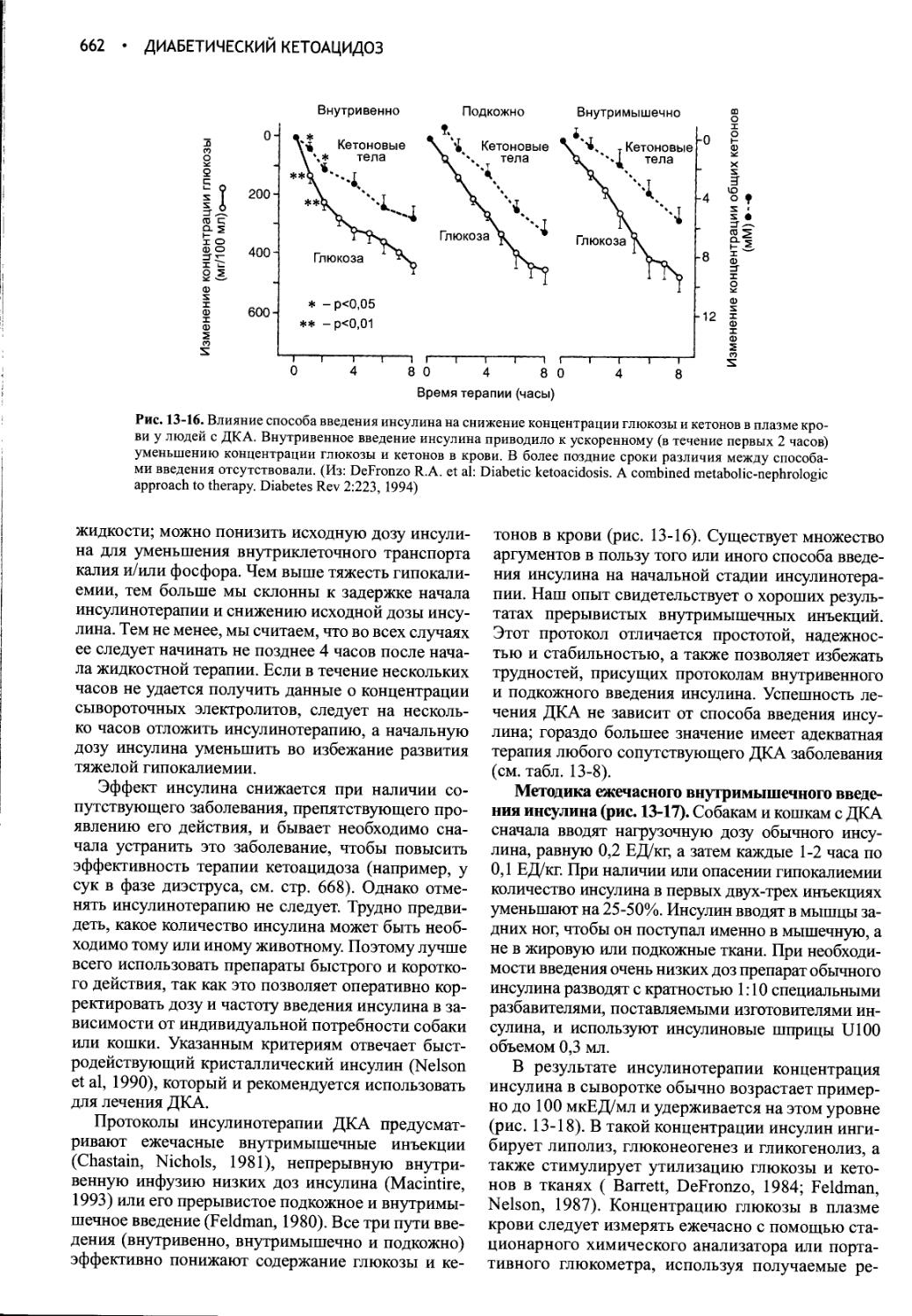
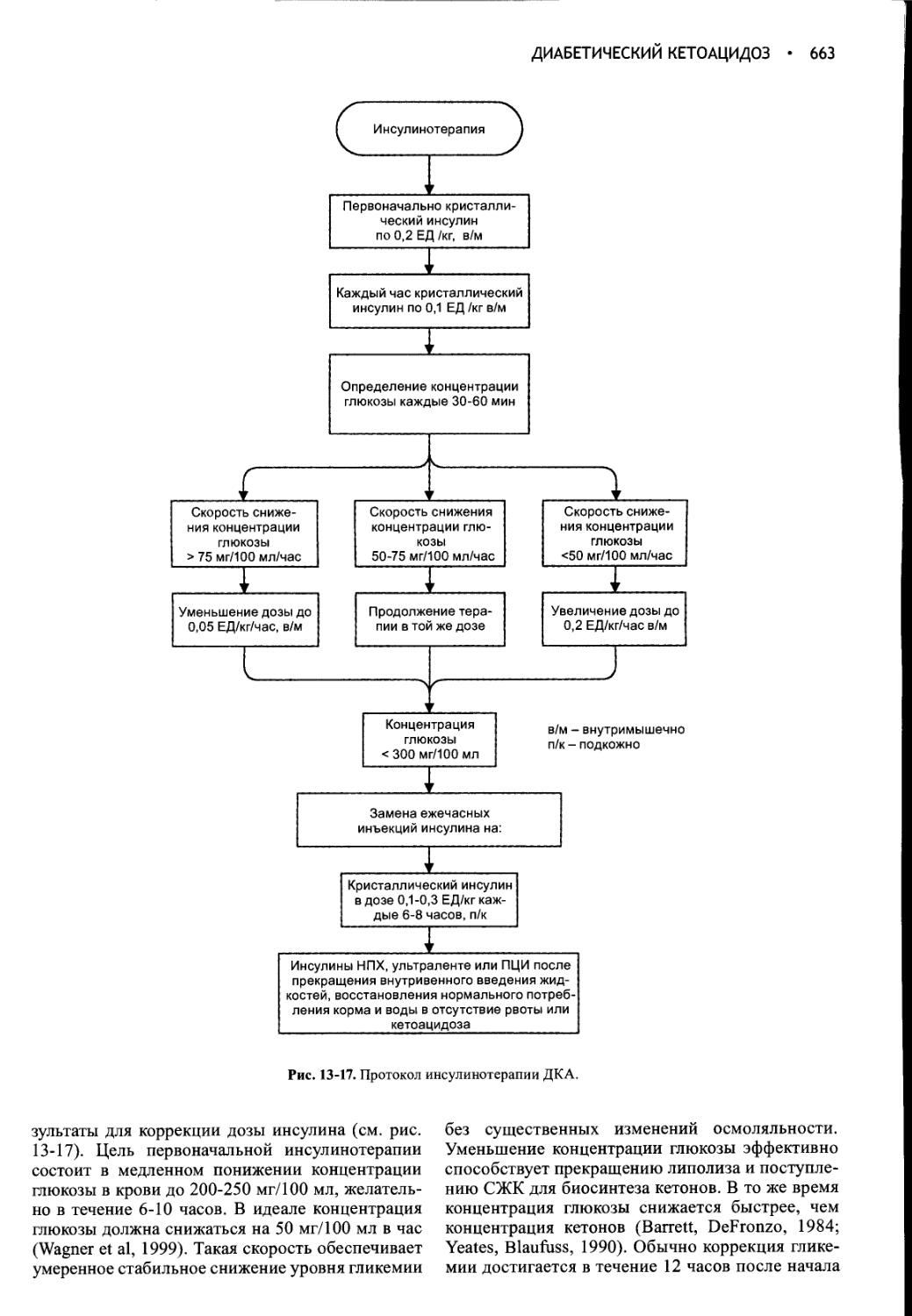
Глава 13 Диабетический кетоацидоз.............................635
Глава 14 Опухоли бета-клеток: инсулинома......................677
Глава 15 Гастринома, глюкагонома и другие АПУДомы.............710
Часть V ПАРАЩИТОВИДНЫЕ ЖЕЛЕЗЫ................................727
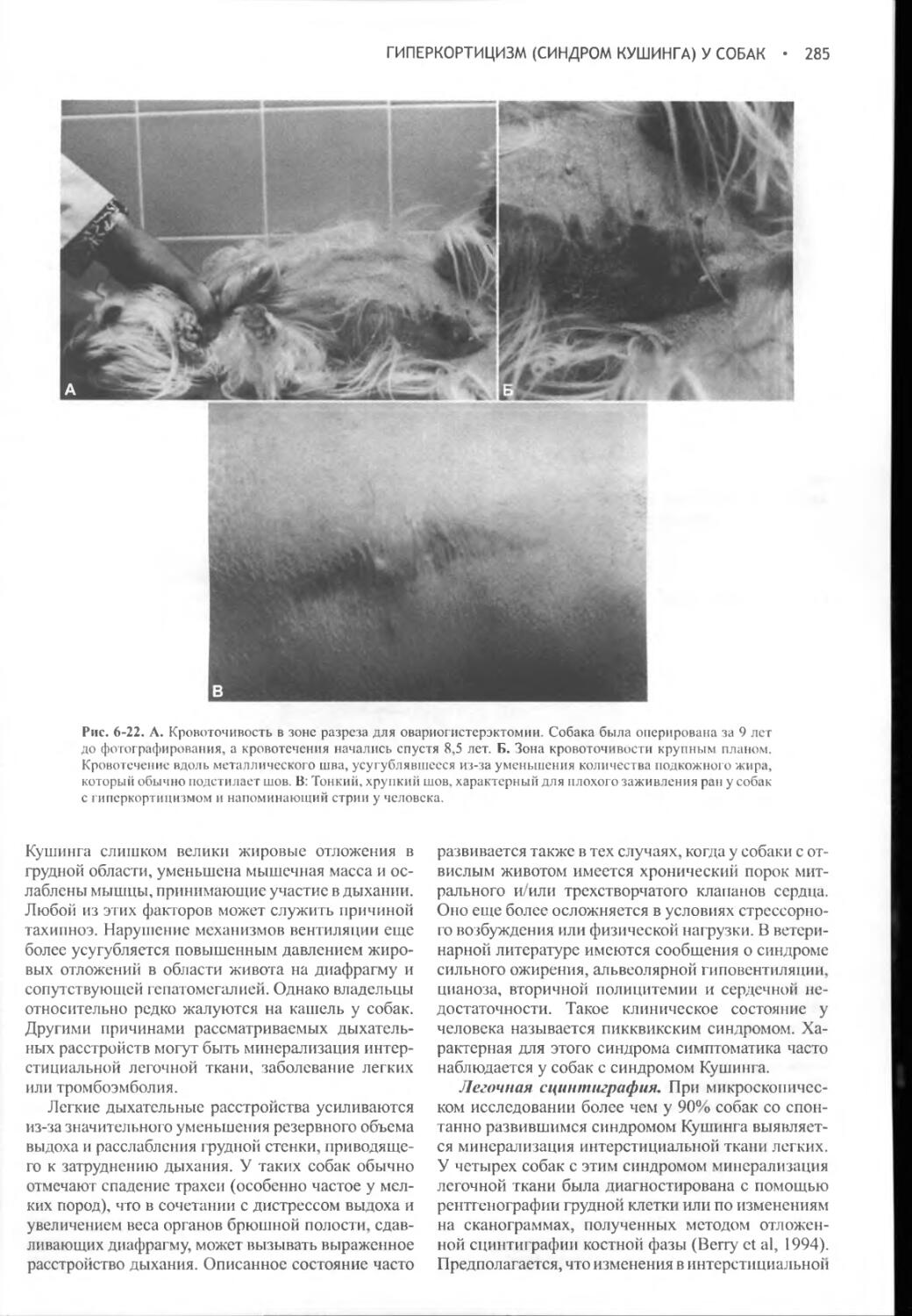
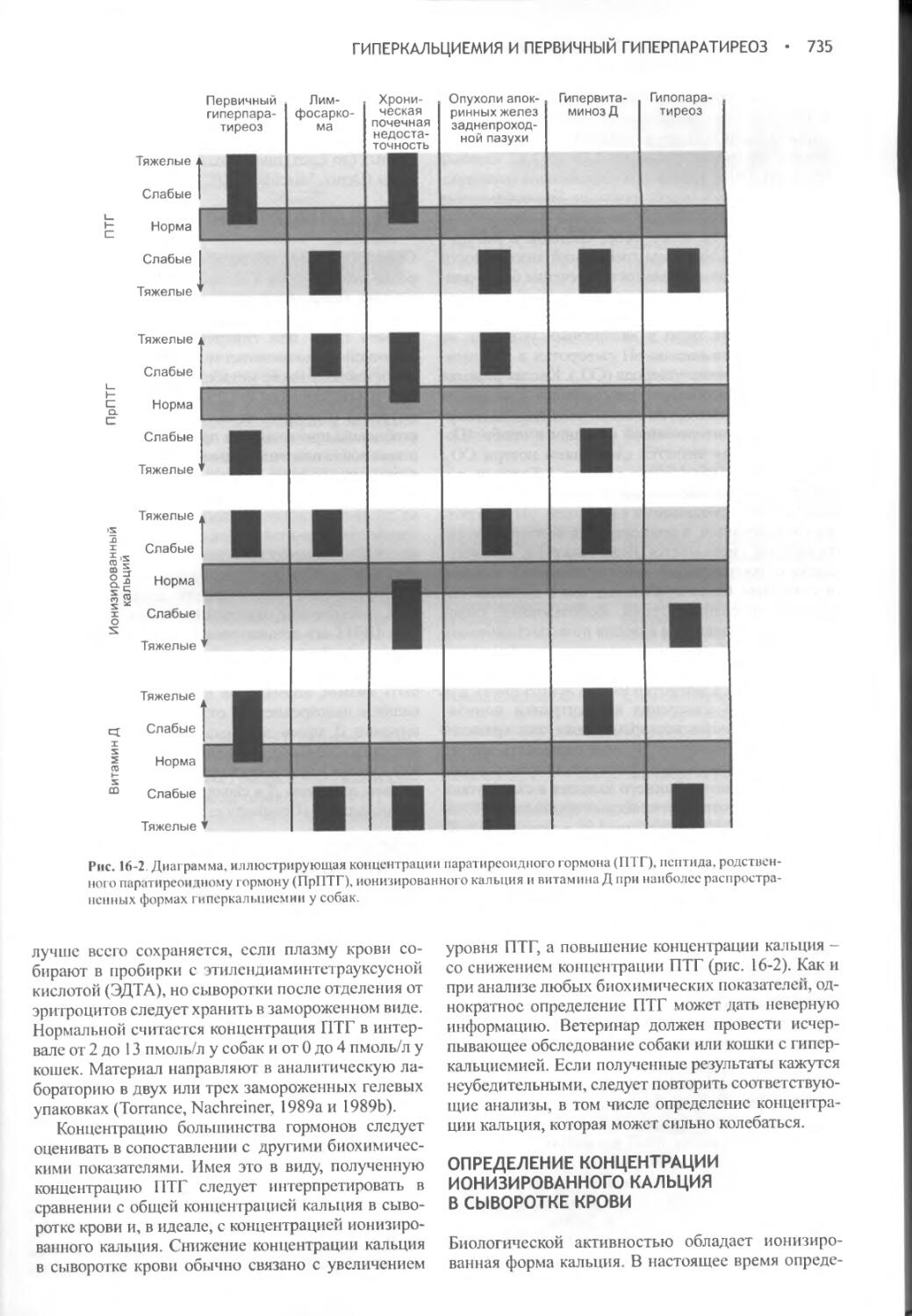
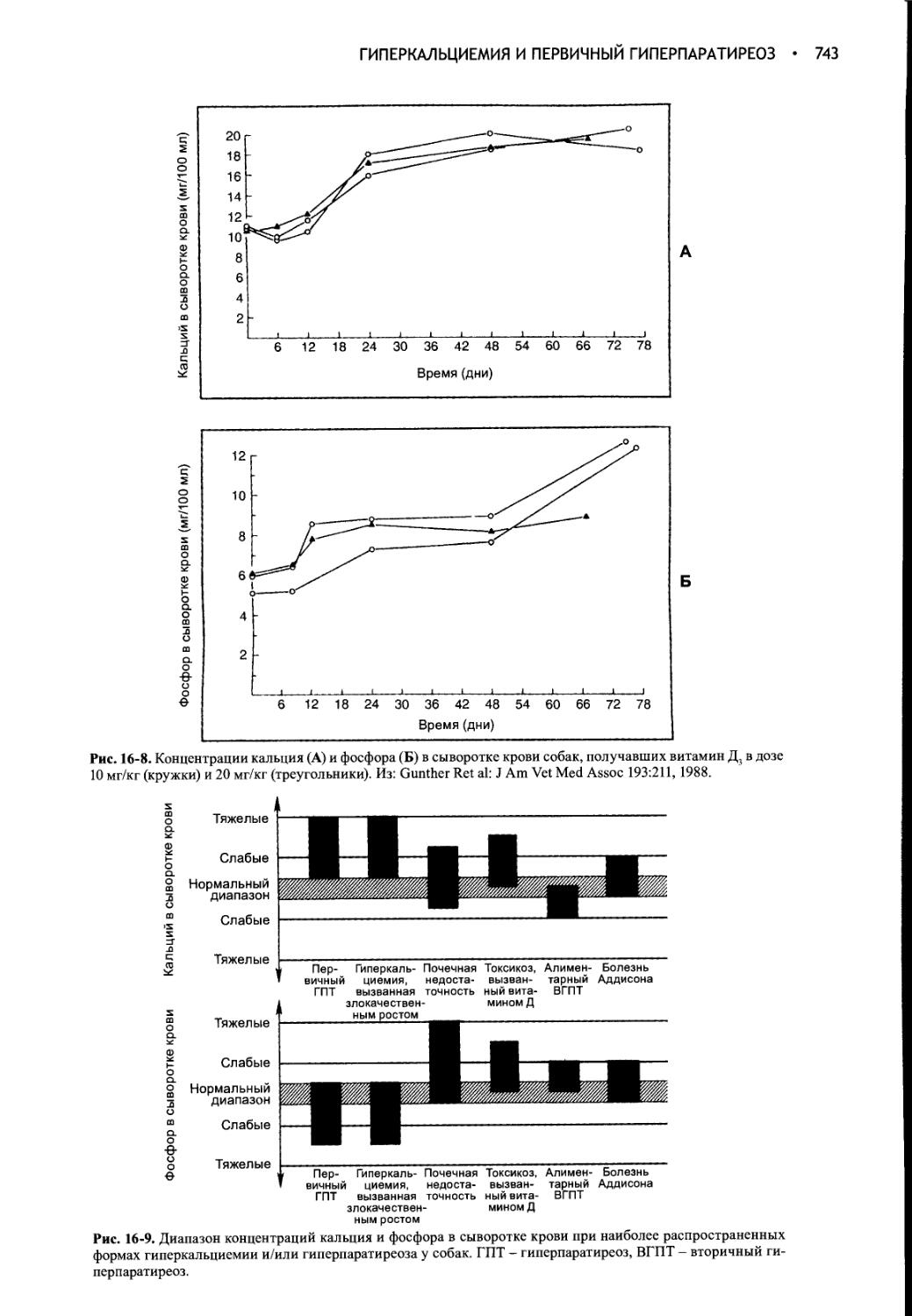
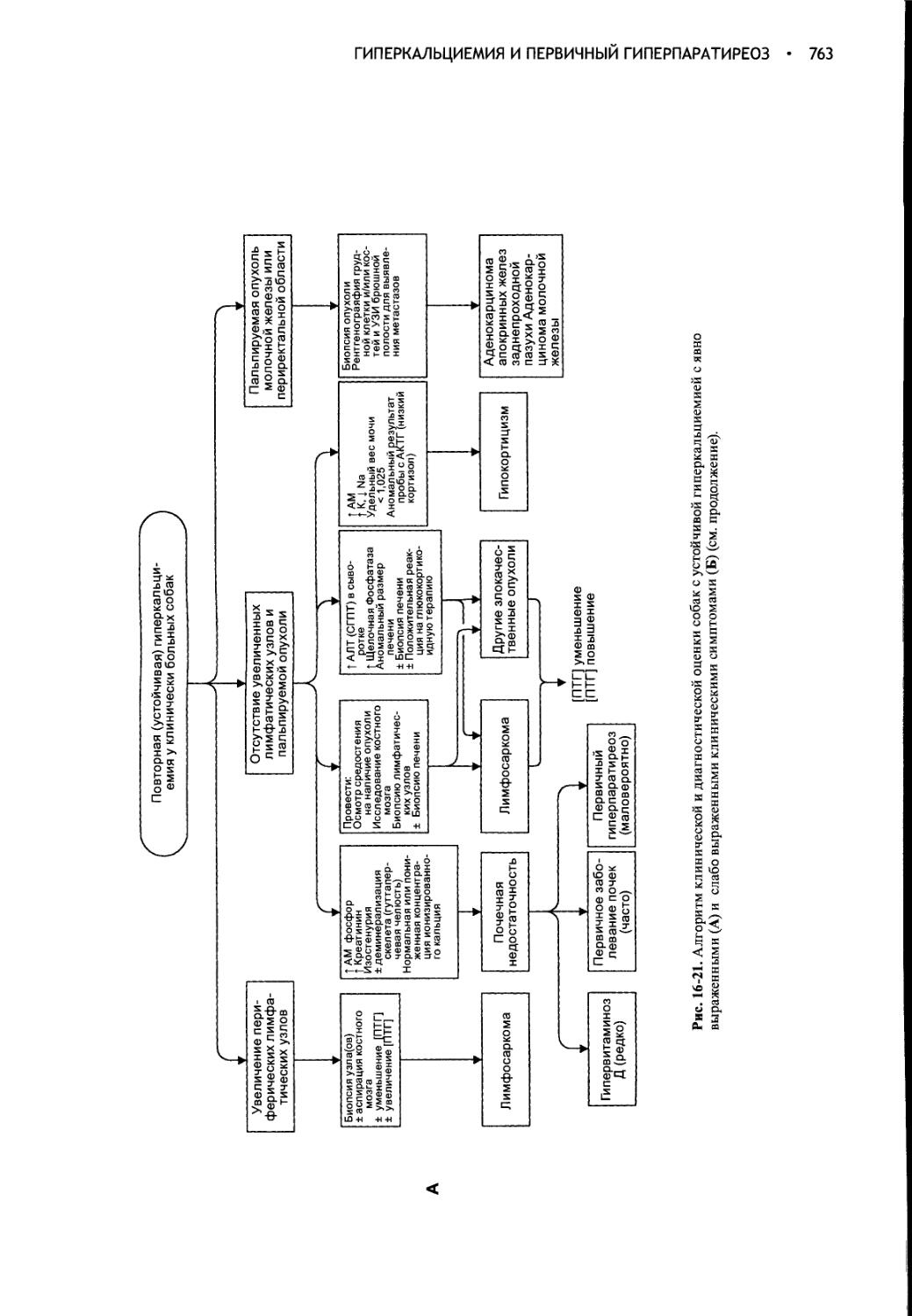
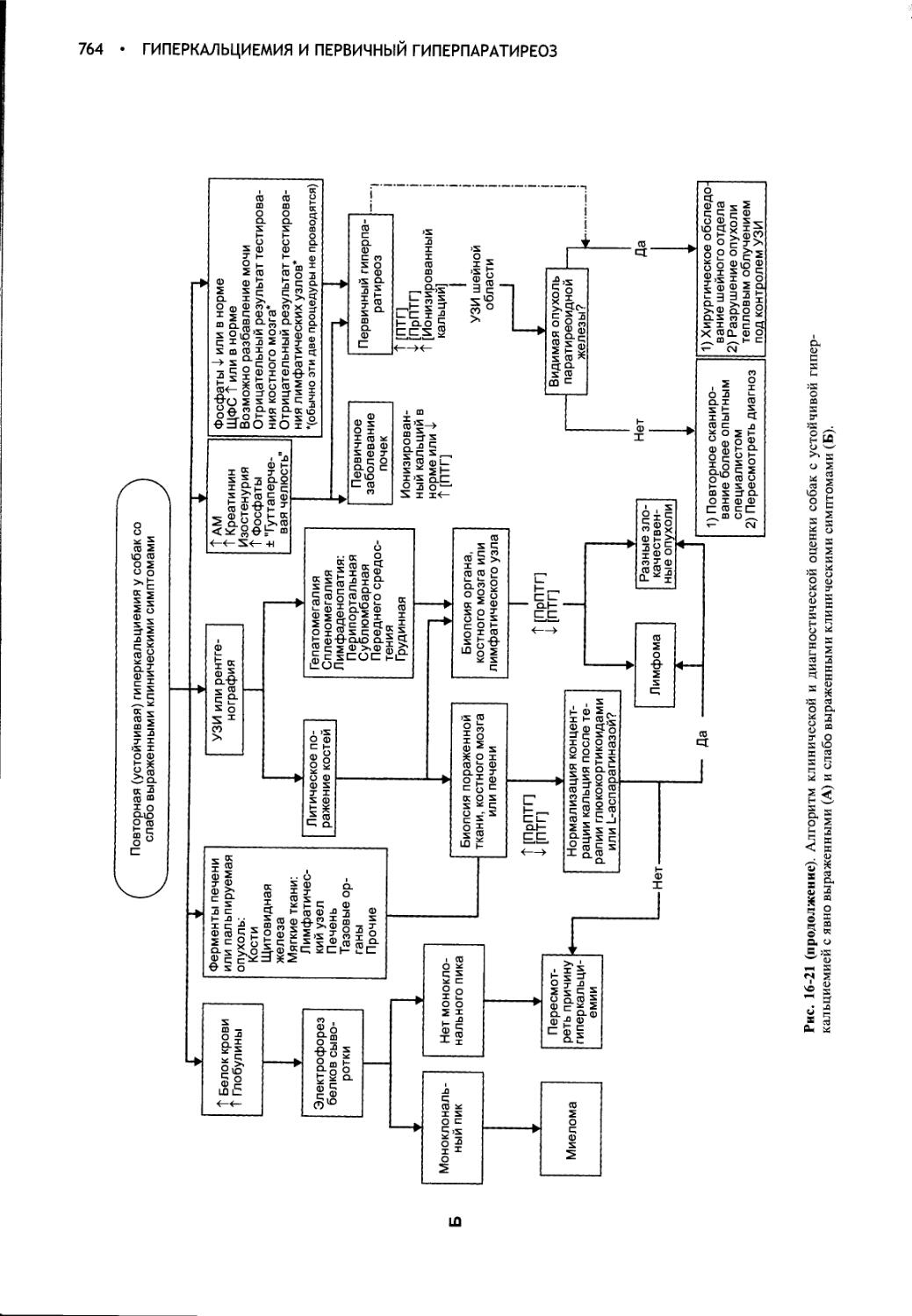
Глава 16 Гиперкальциемия и первичный гиперпаратиреоз..........728
Глава 17 Гипокальциемия и первичный гипопаратиреоз............789
Часть VI
ПОЧЕЧНЫЕ ГОРМОНЫ И
НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ....................821
Глава 18
Почечные гормоны и натриуретический гормон предсердия.822
Часть VII РЕПРОДУКЦИЯ СУК......................................831
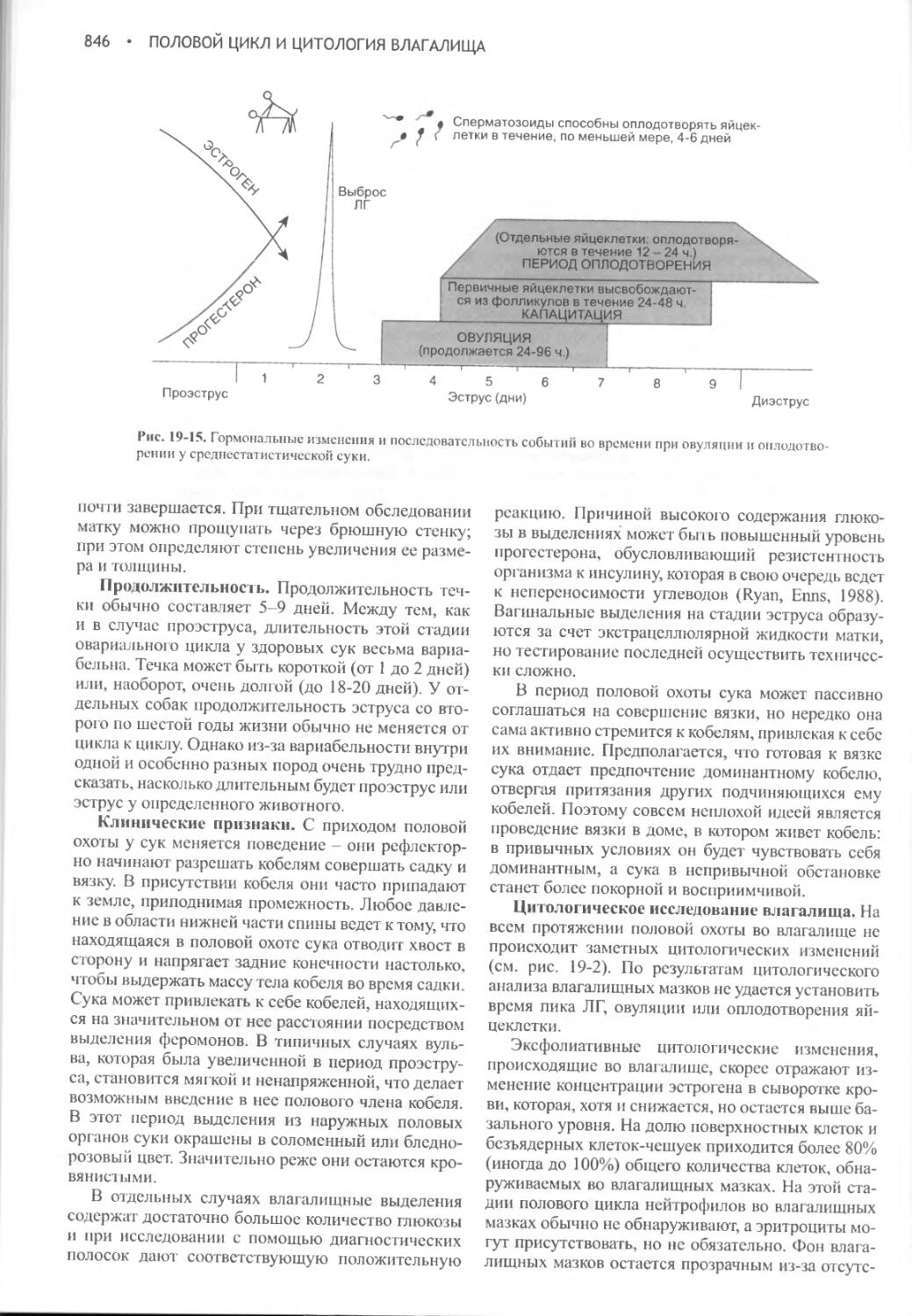
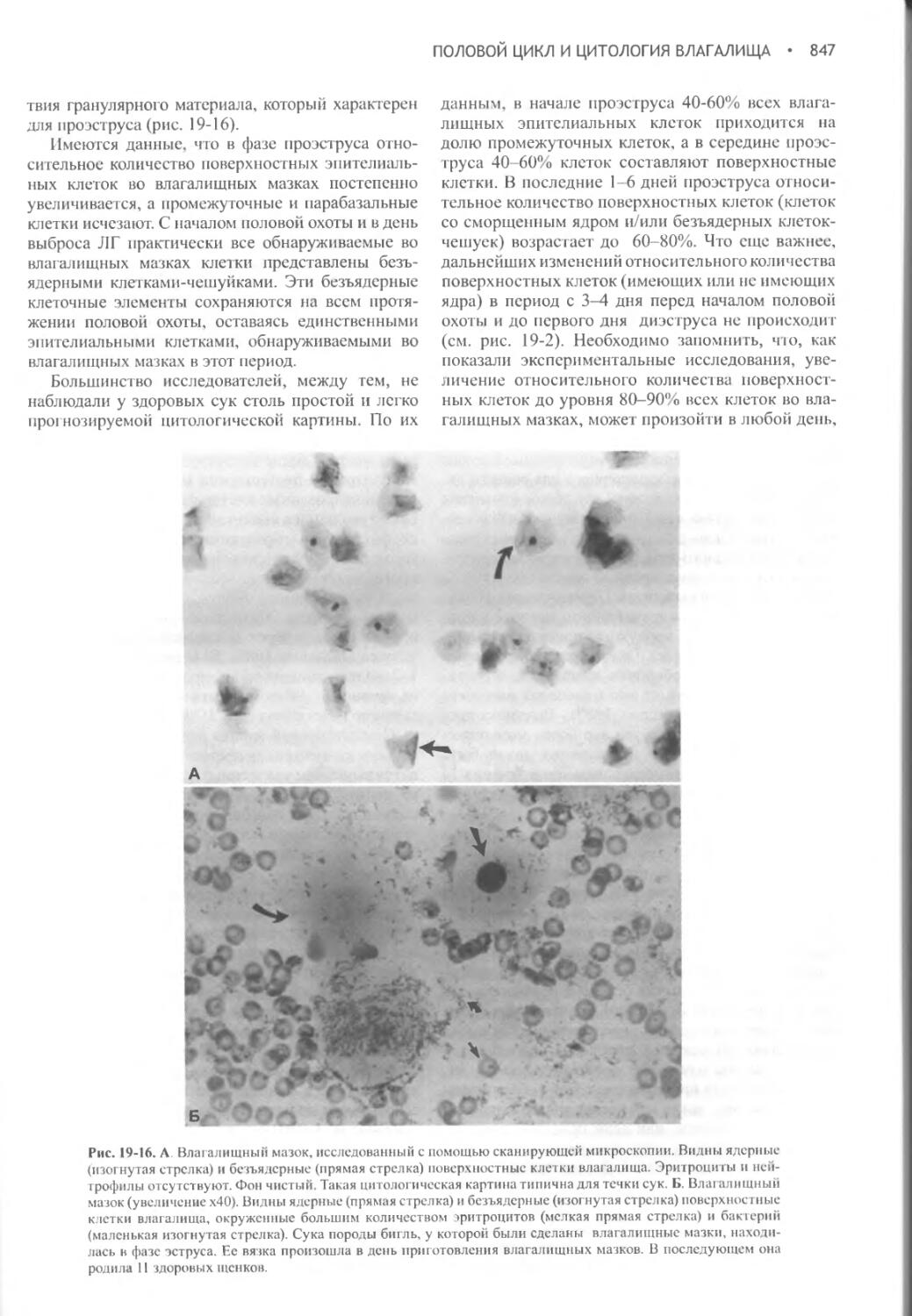
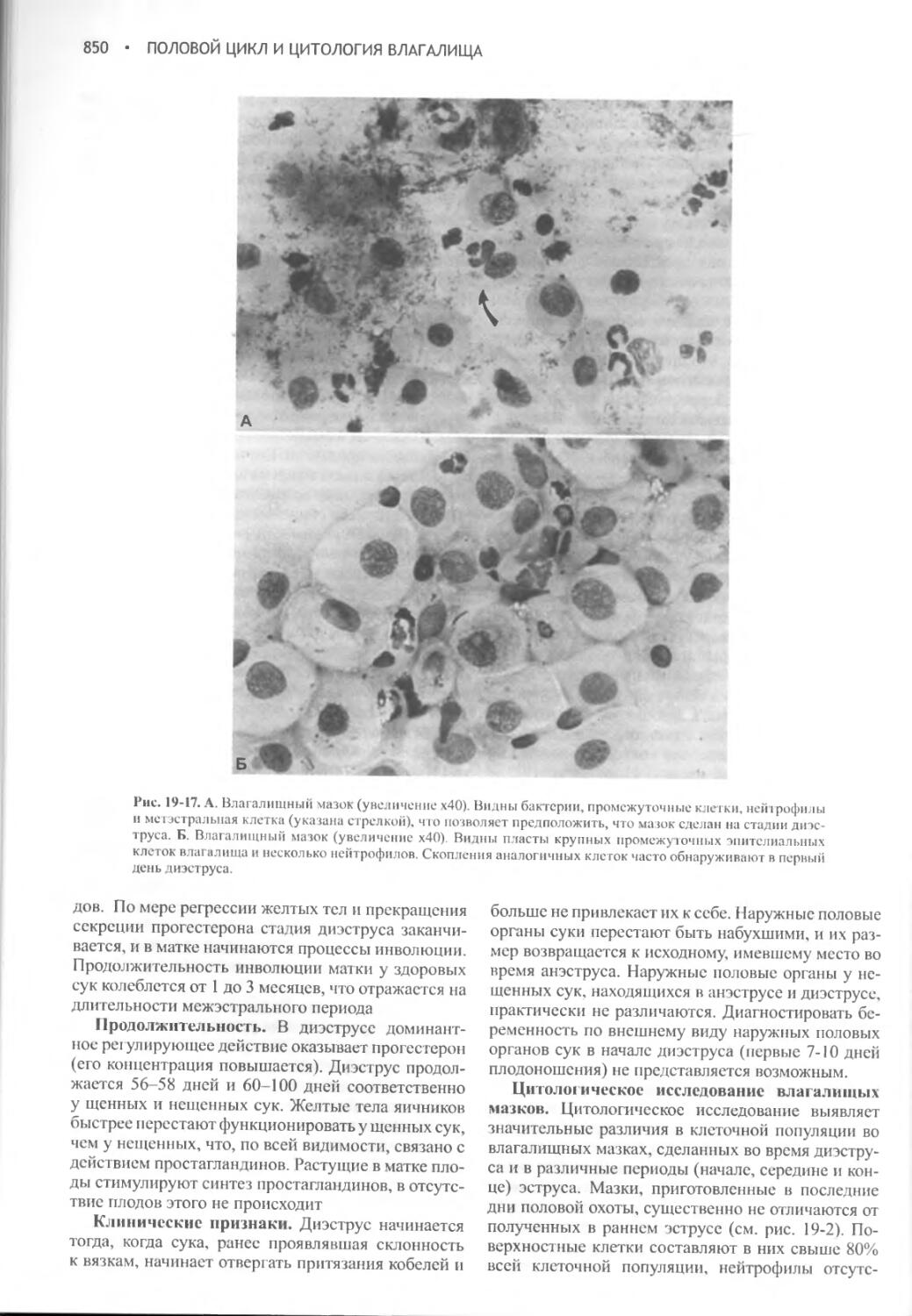
Глава 19 Половой цикл и цитология влагалища...................832
Глава 20 Вязка беременность и роды............................859
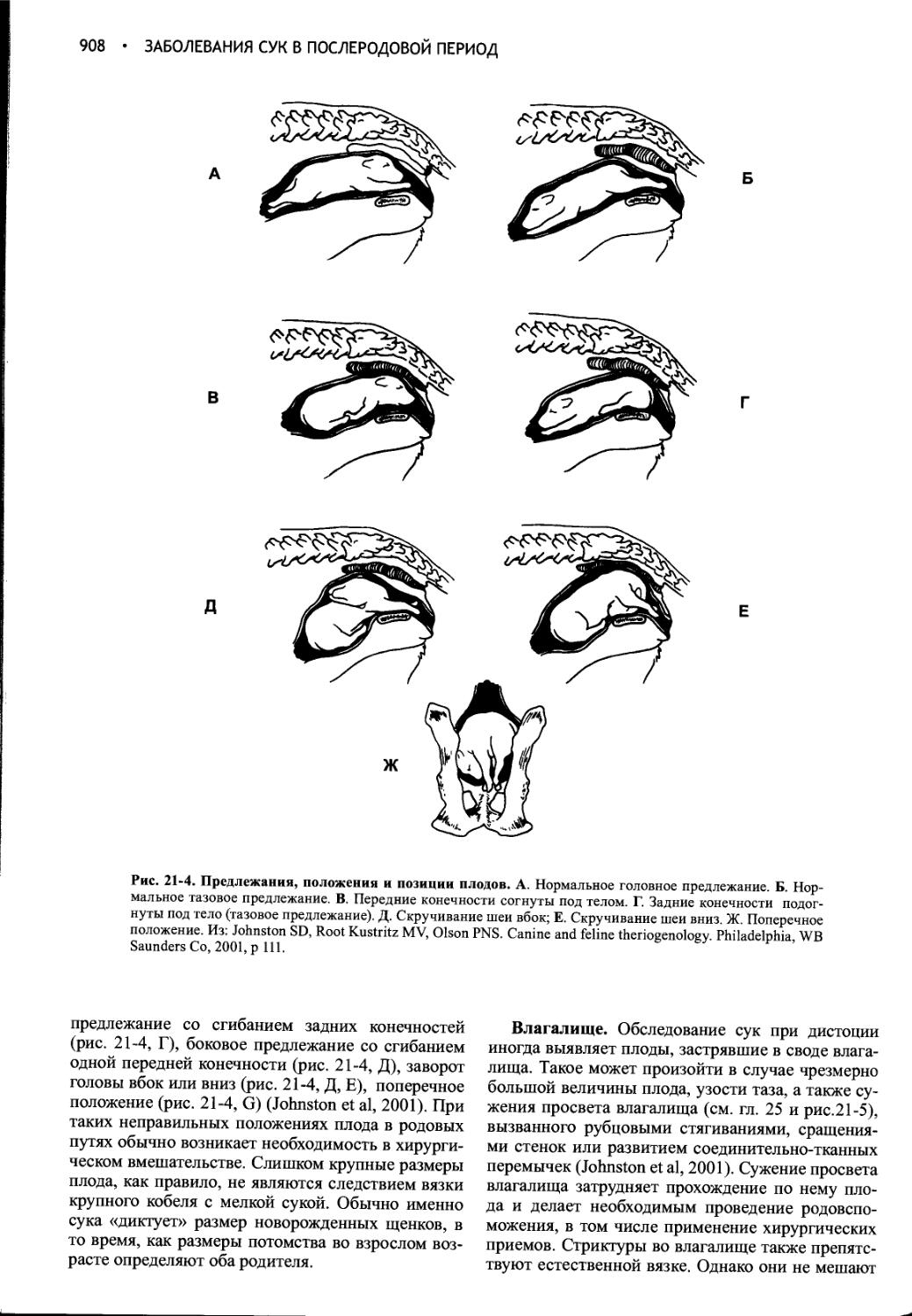
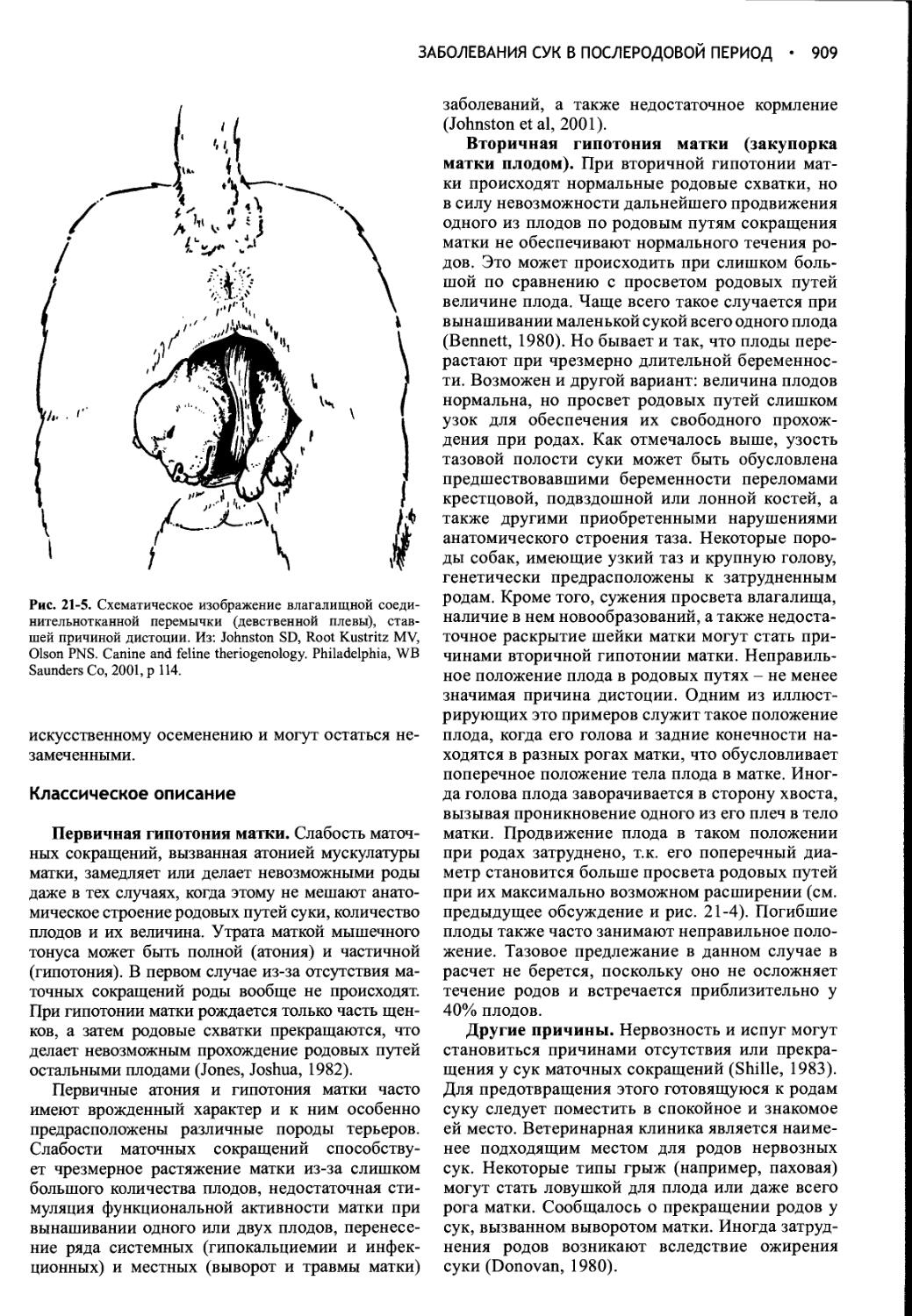
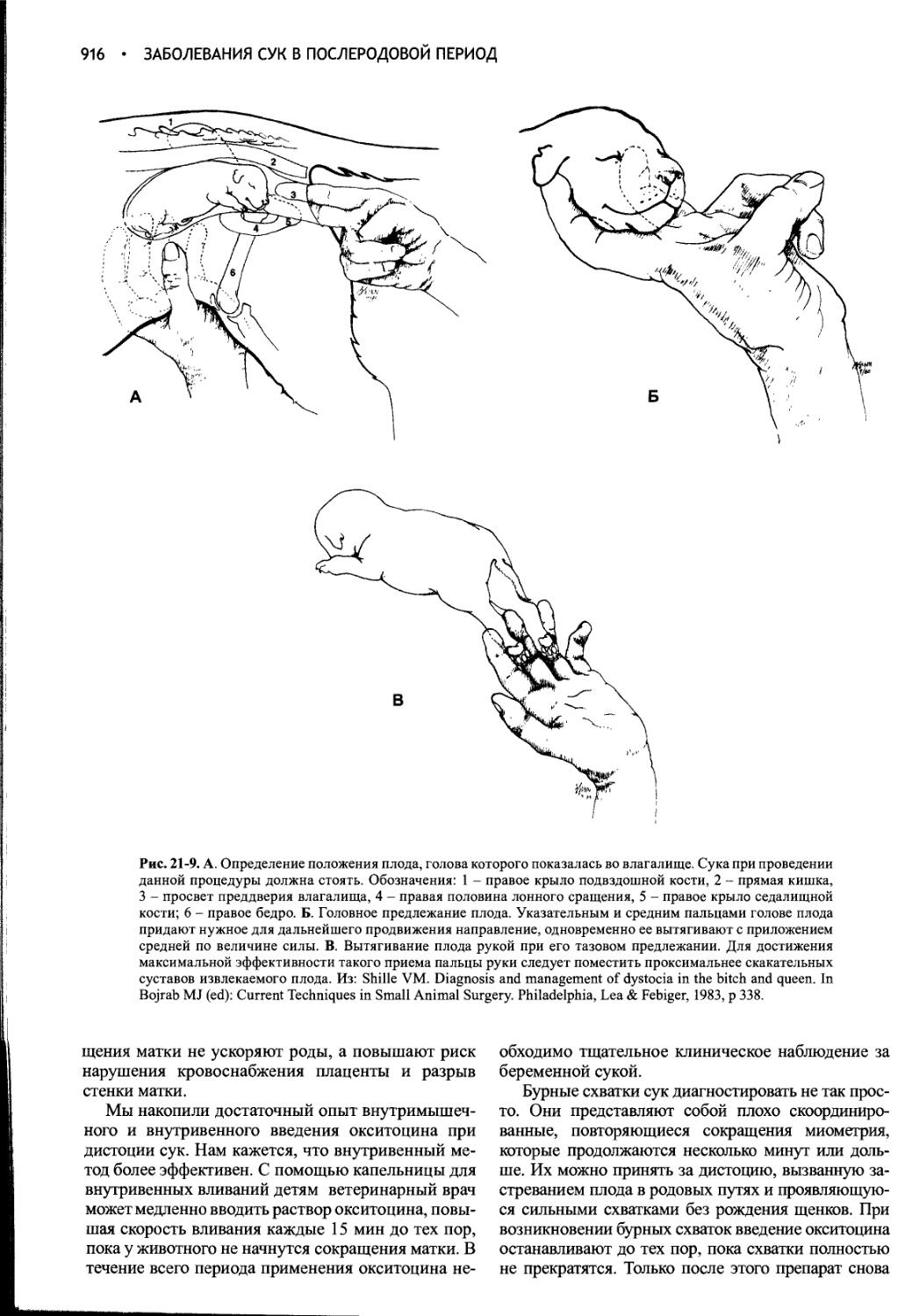
Глава 21 Заболевания сук в послеродовой период................897
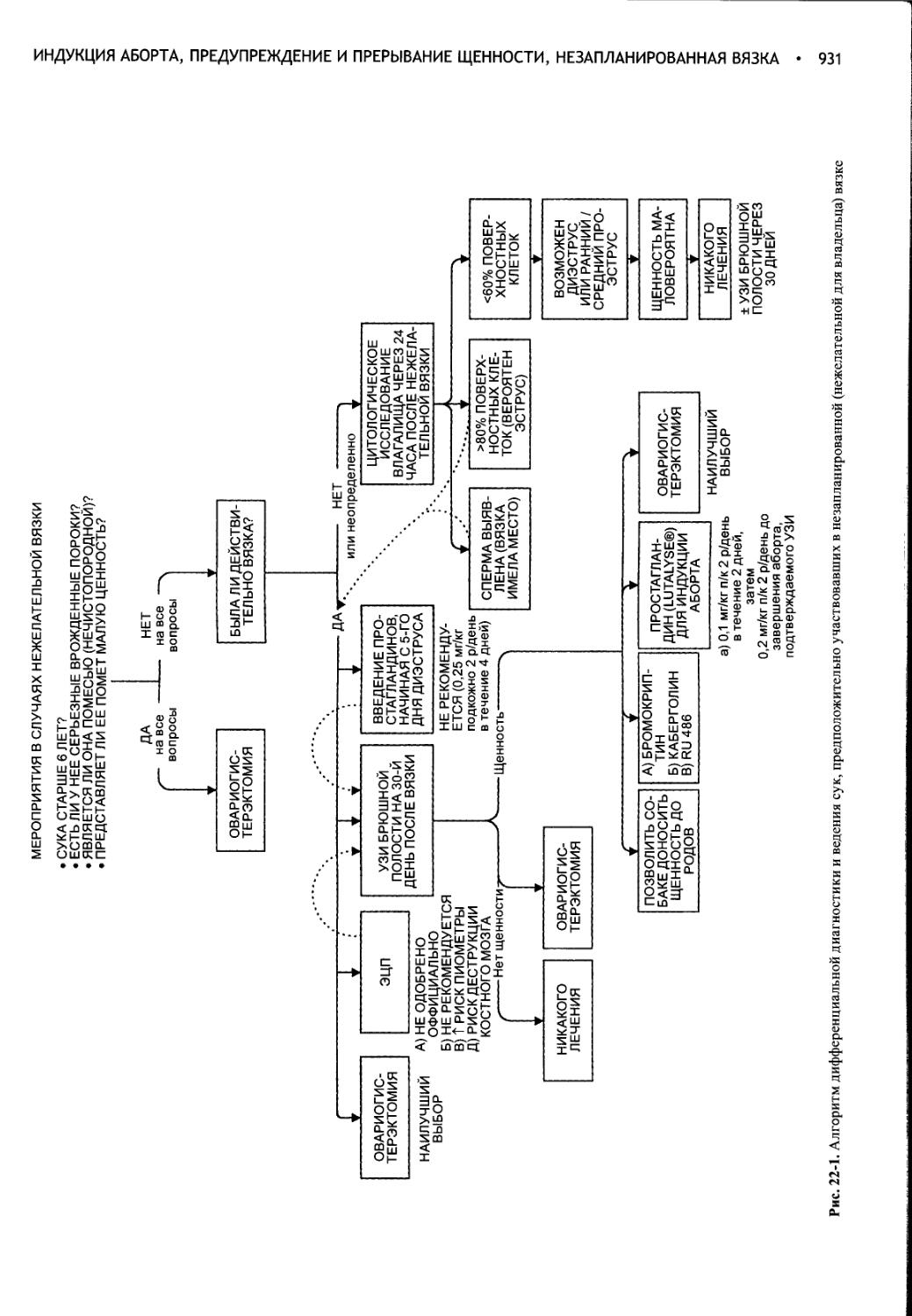
Глава 22 Индукция аборта, предупреждение и прерывание щенности, незапланированная вязка..............................930
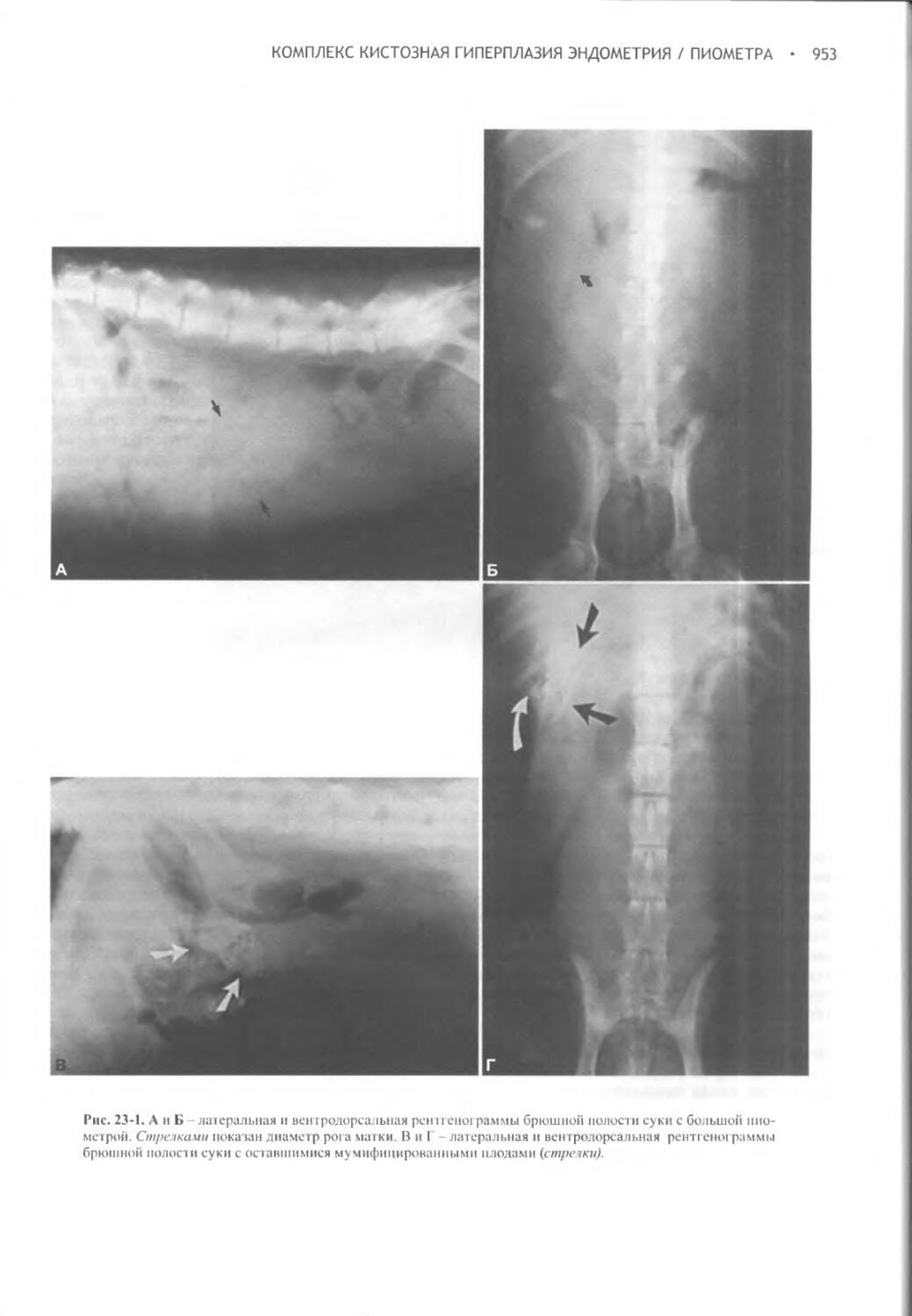
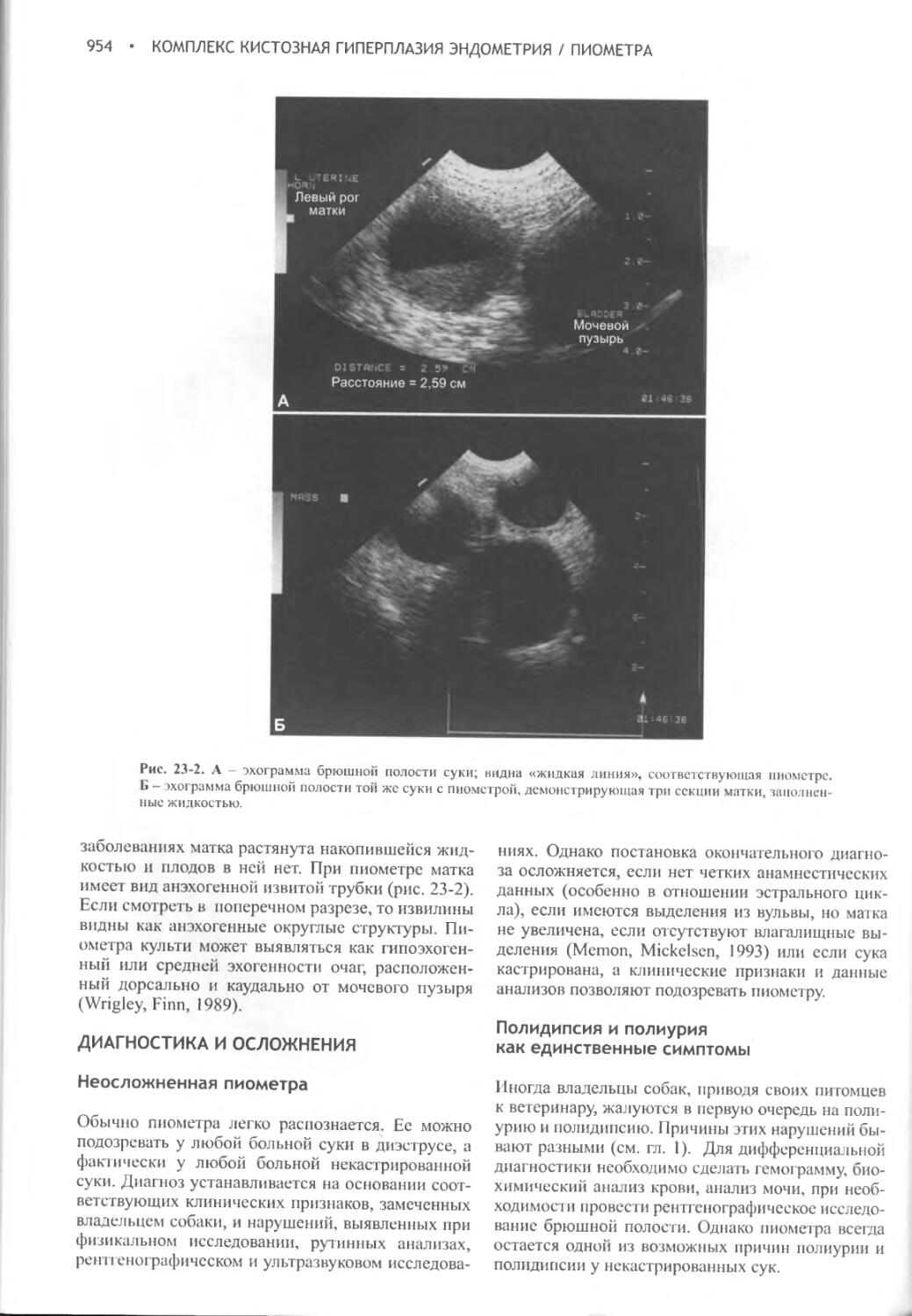
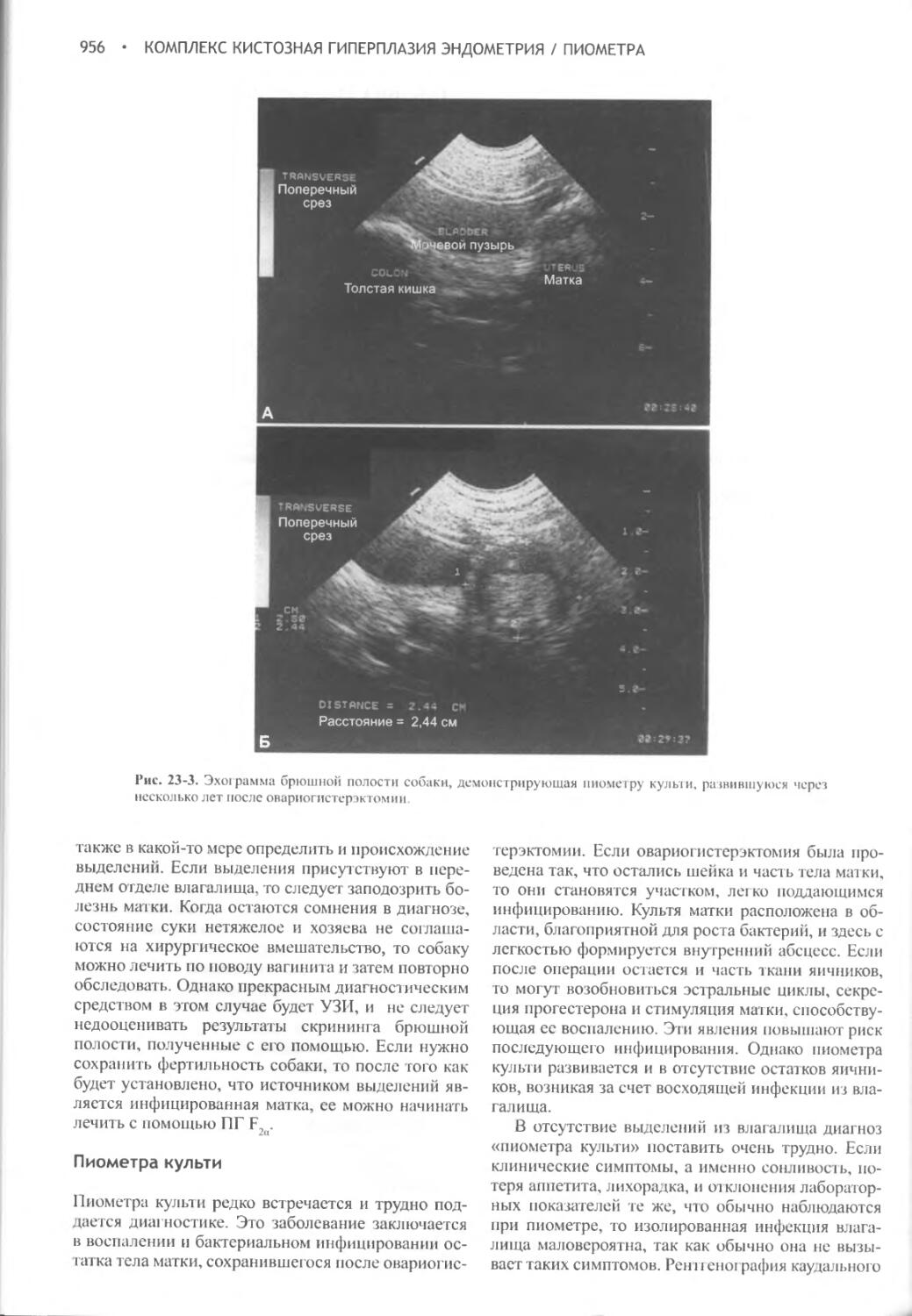
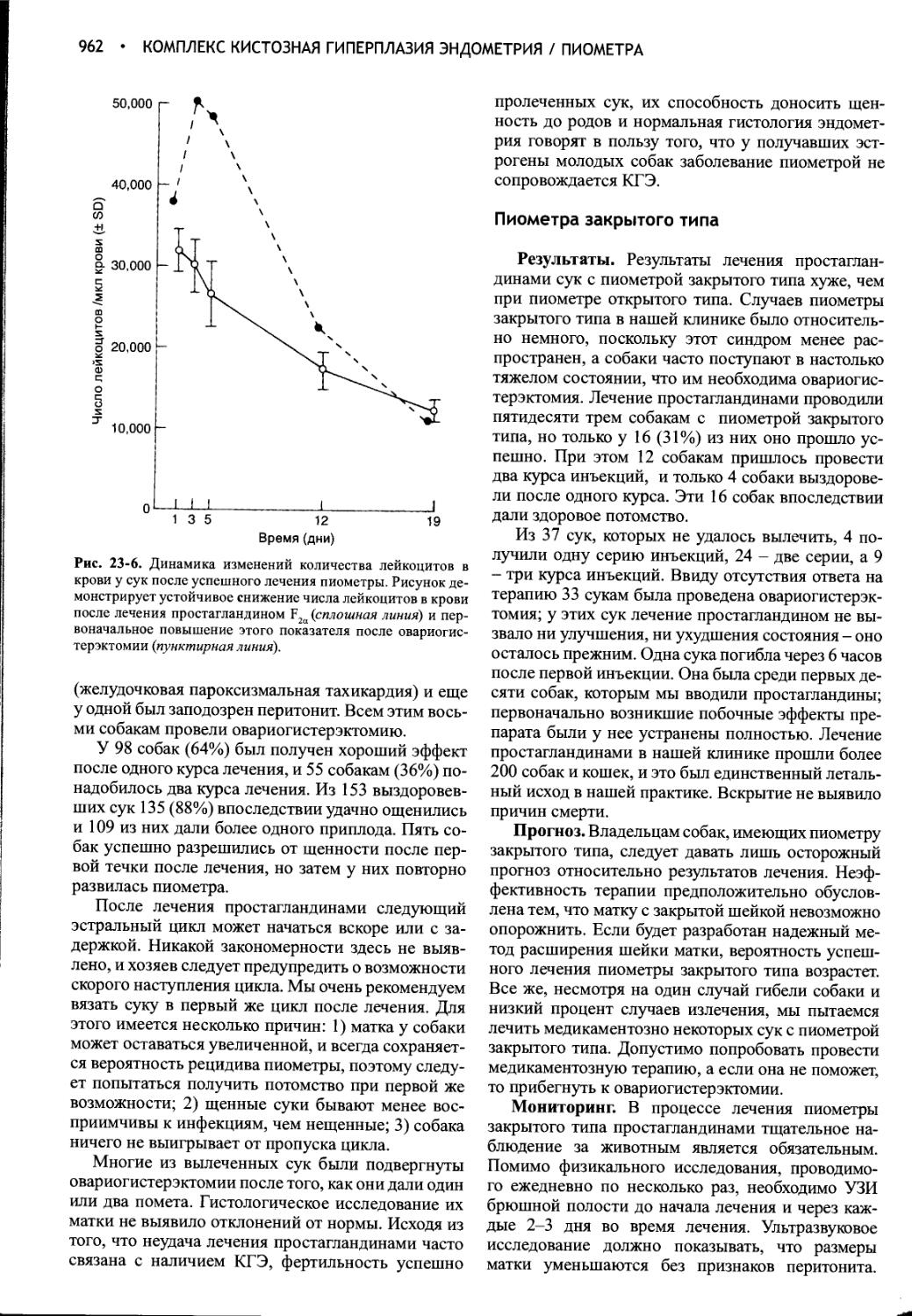
Глава 23 Комплекс кистозная гиперплазия эндометрия / пиометра.948
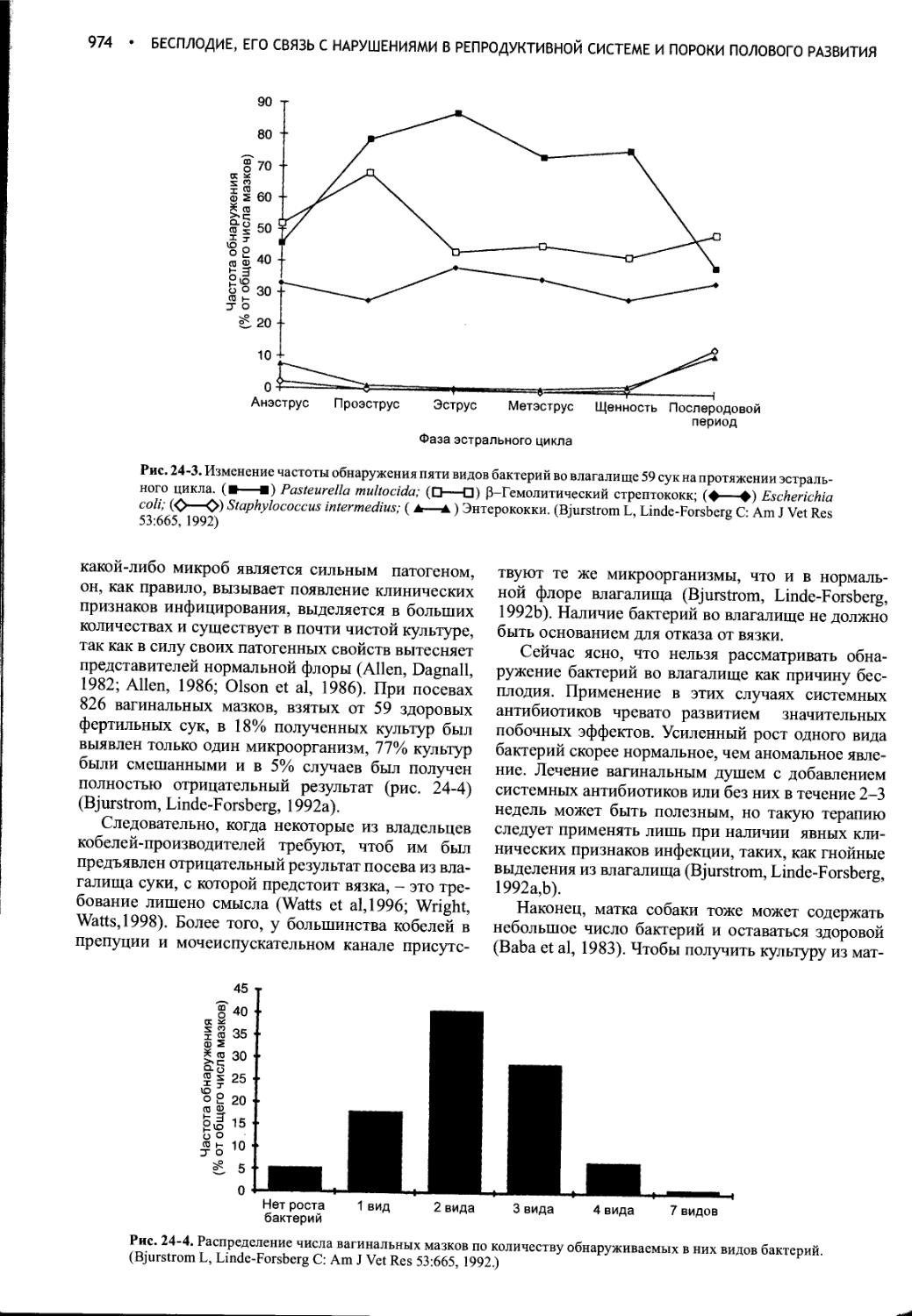
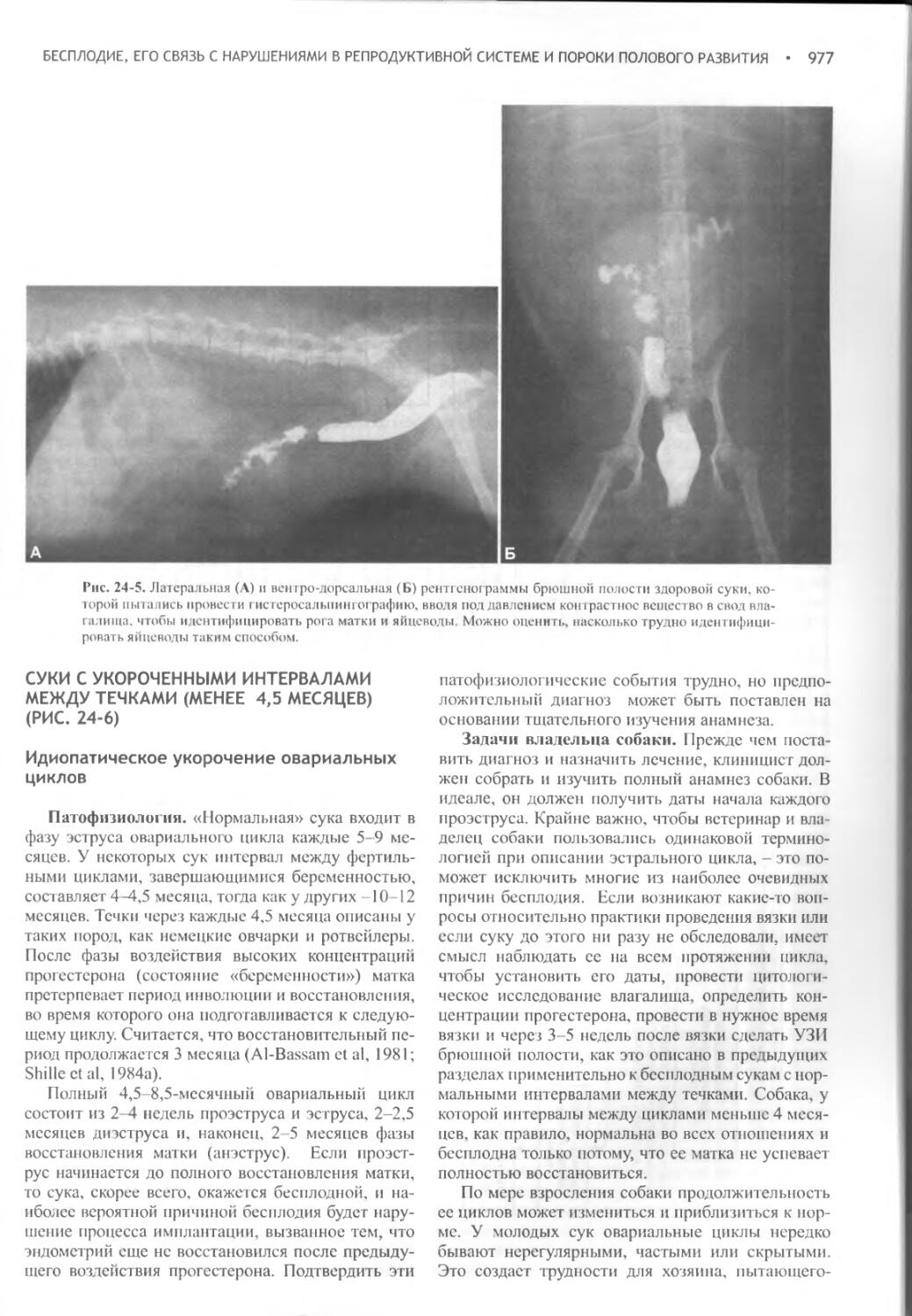
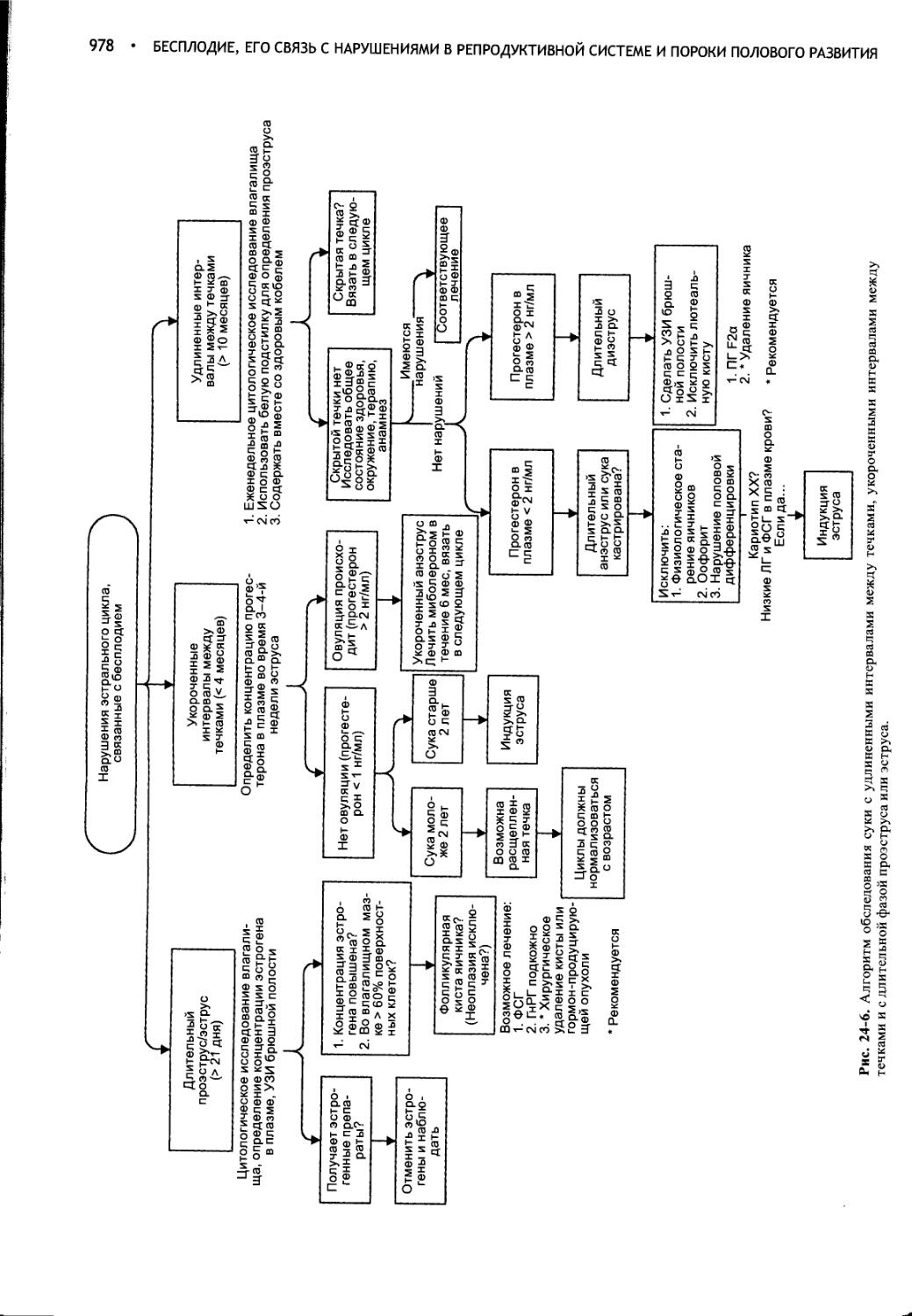
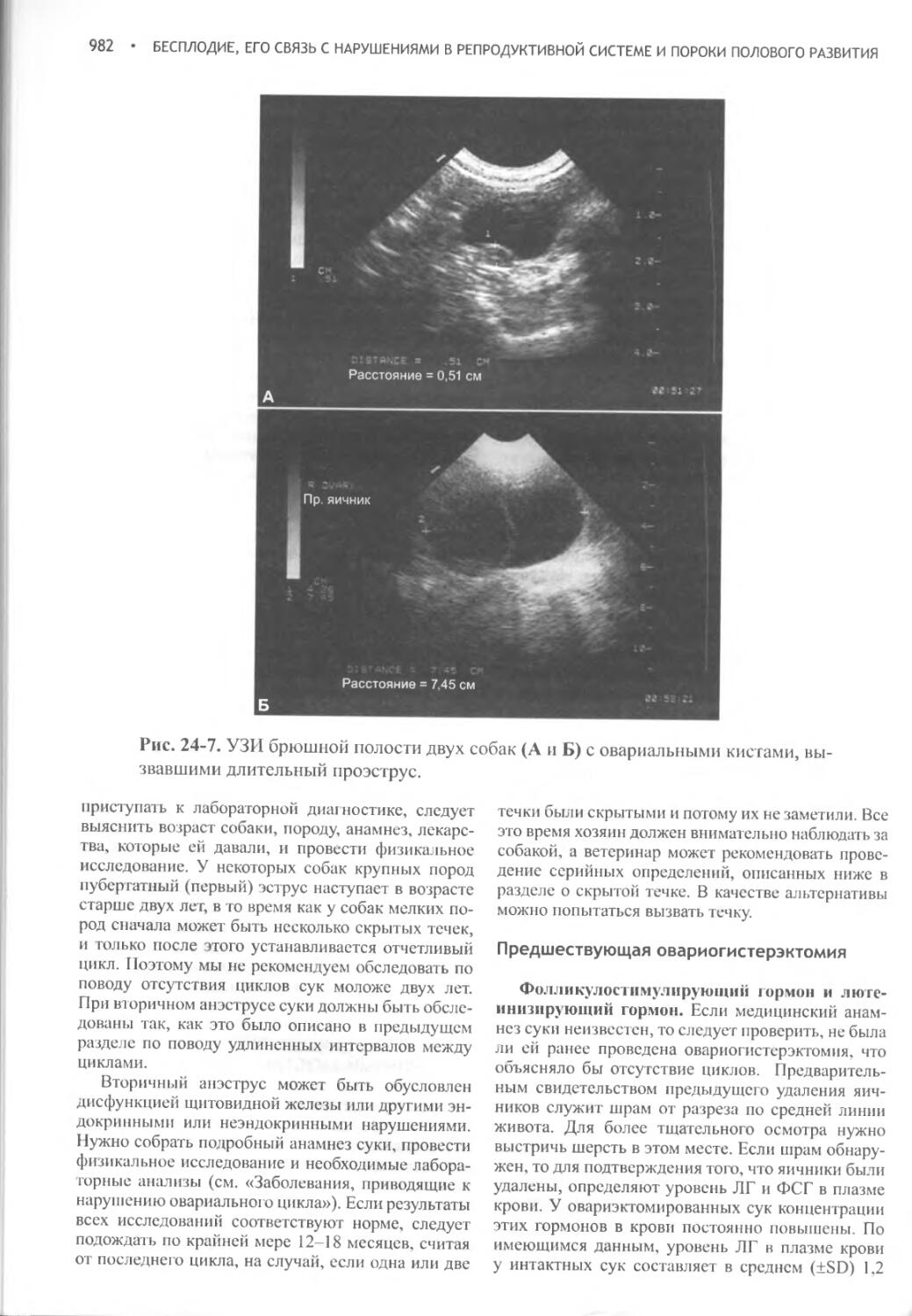
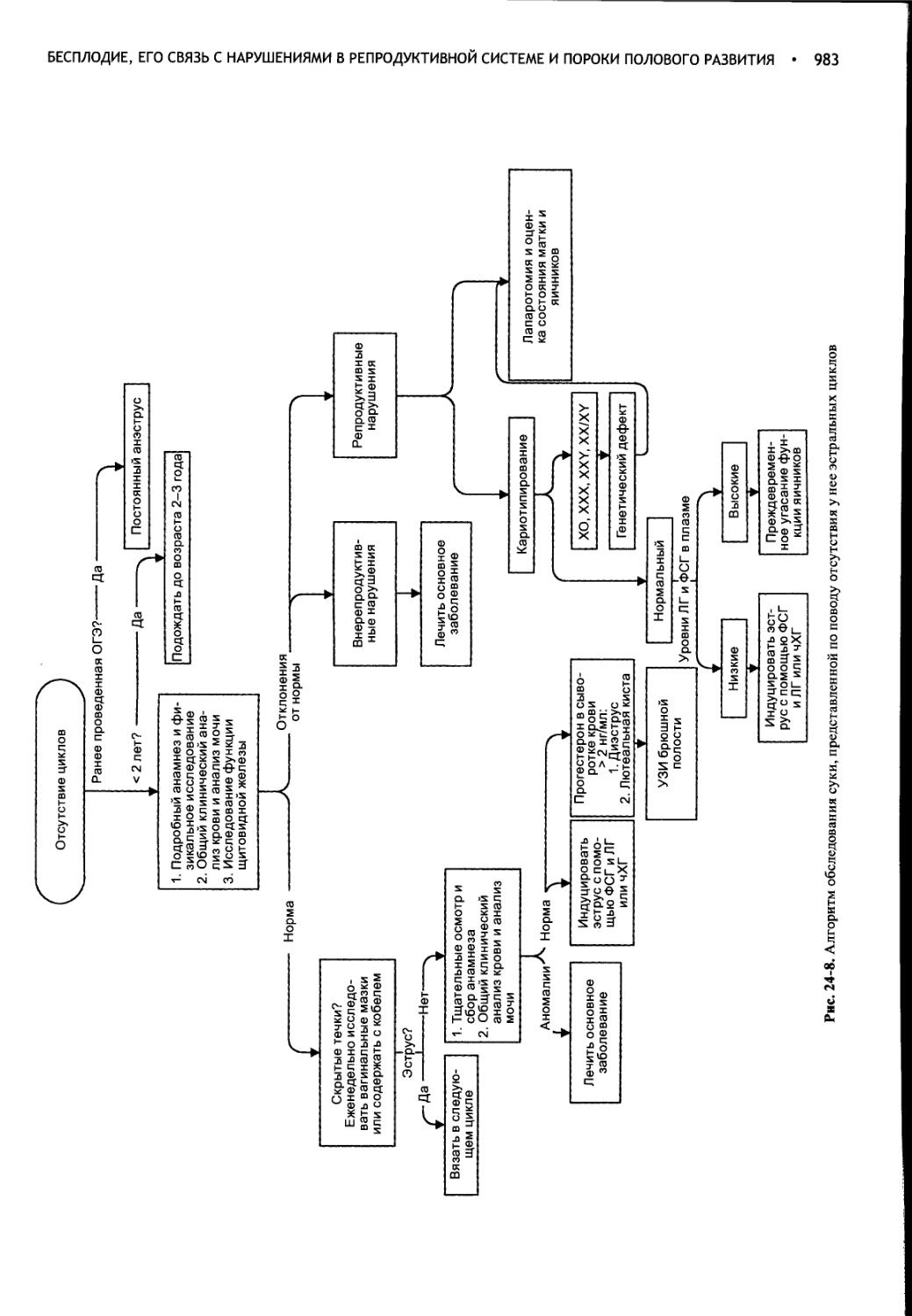
Глава 24 Бесплодие, его связь с нарушениями в репродуктивной системе и пороки полового развития...........................965
X
Глава 25
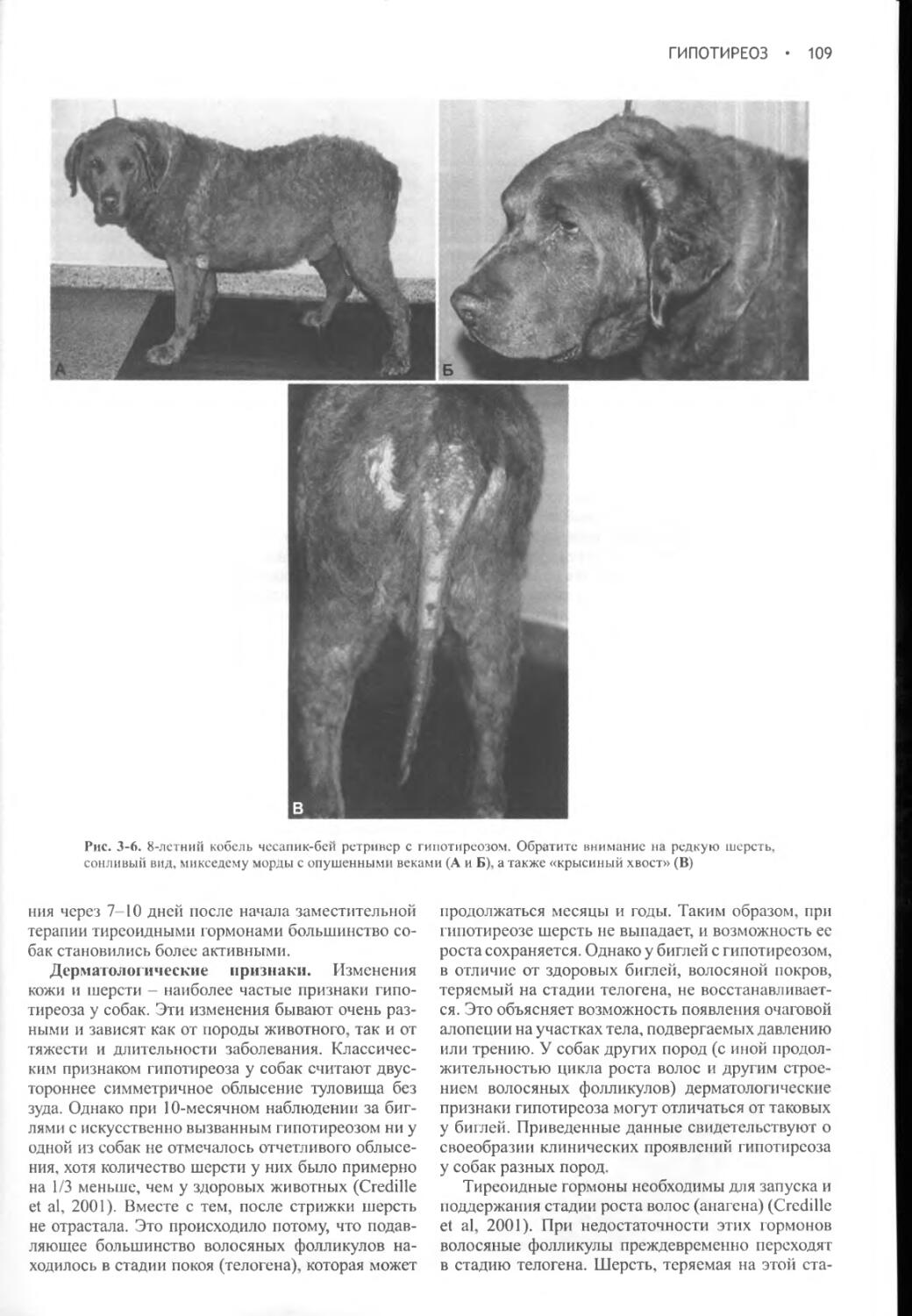
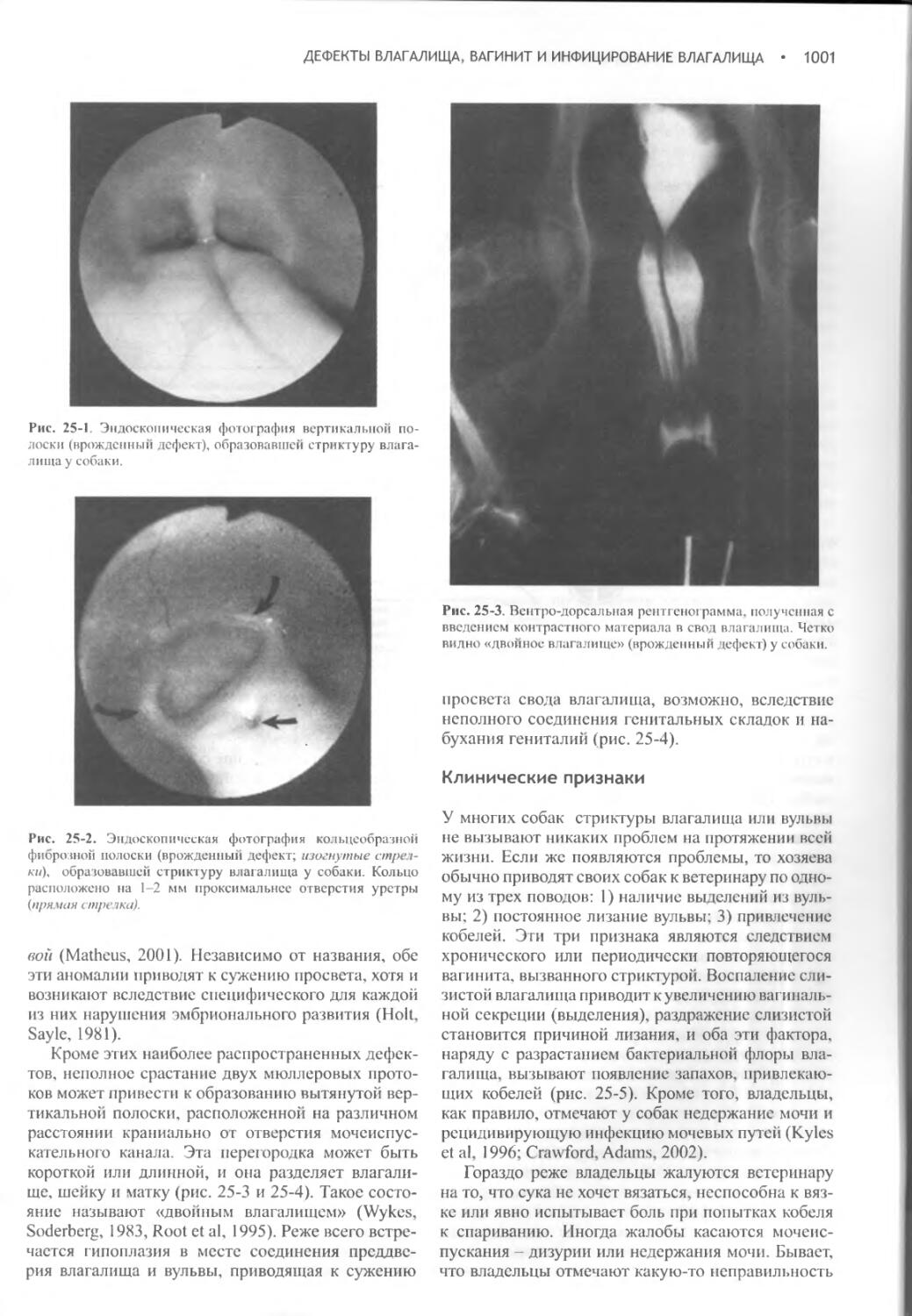
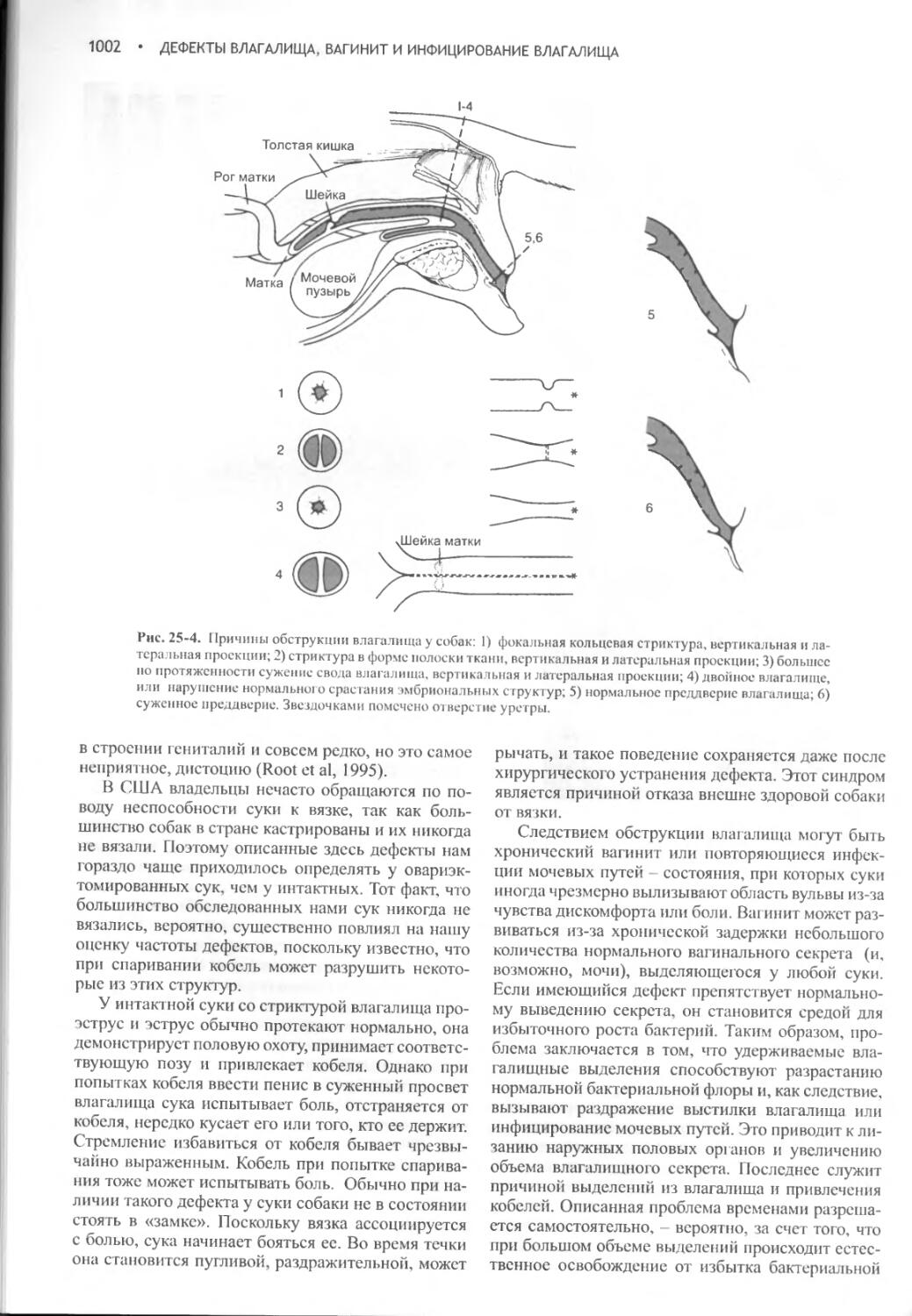
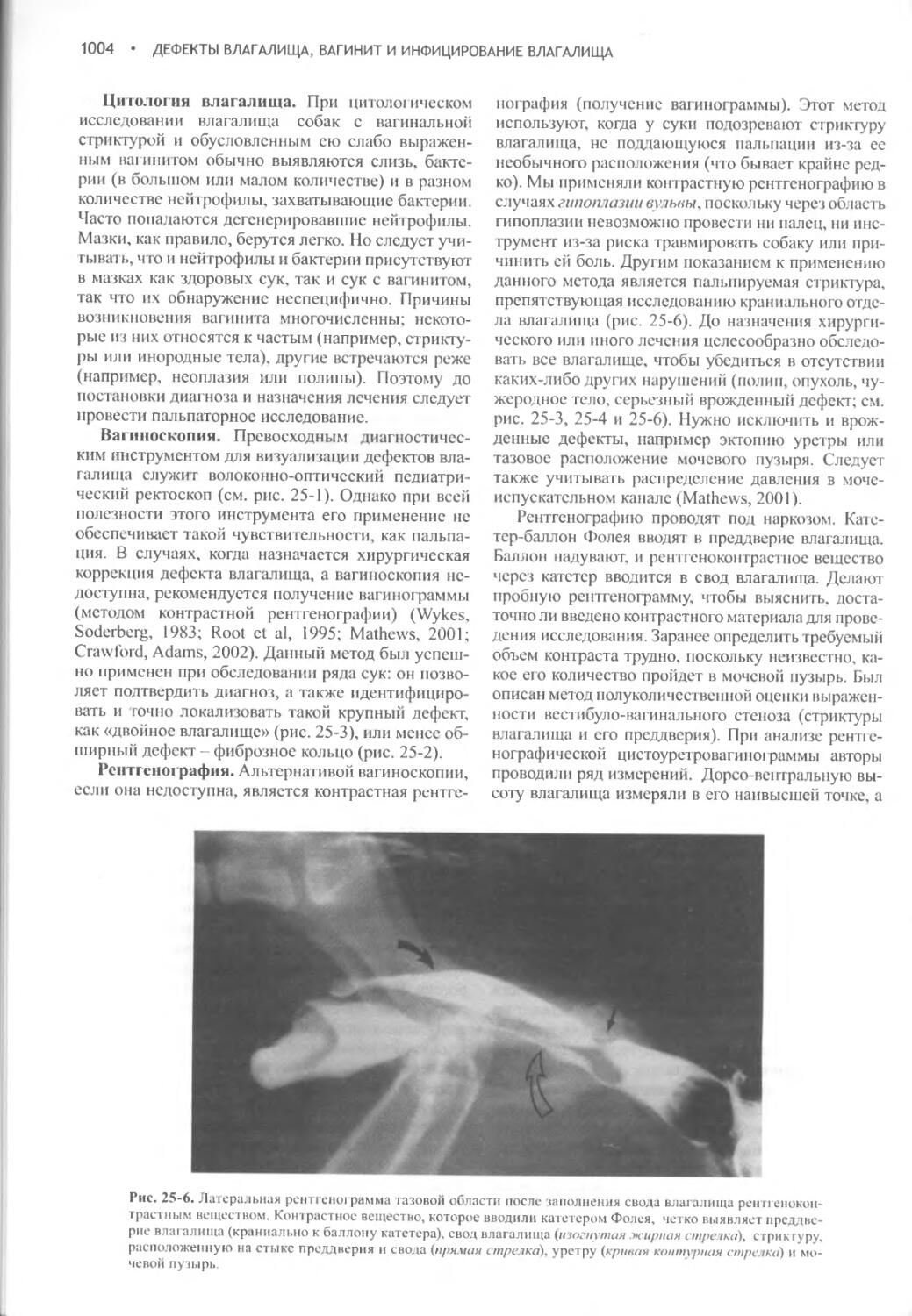
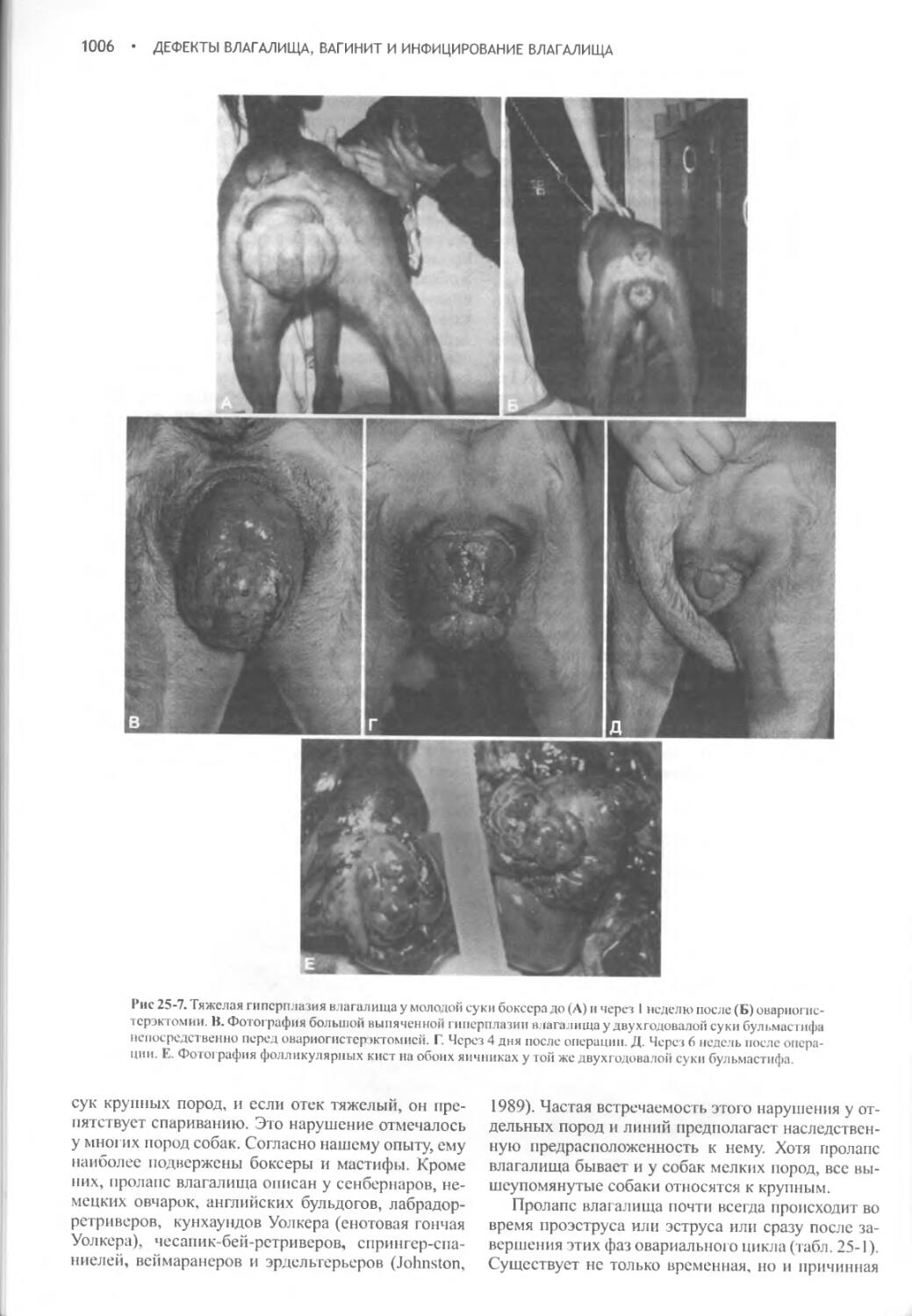
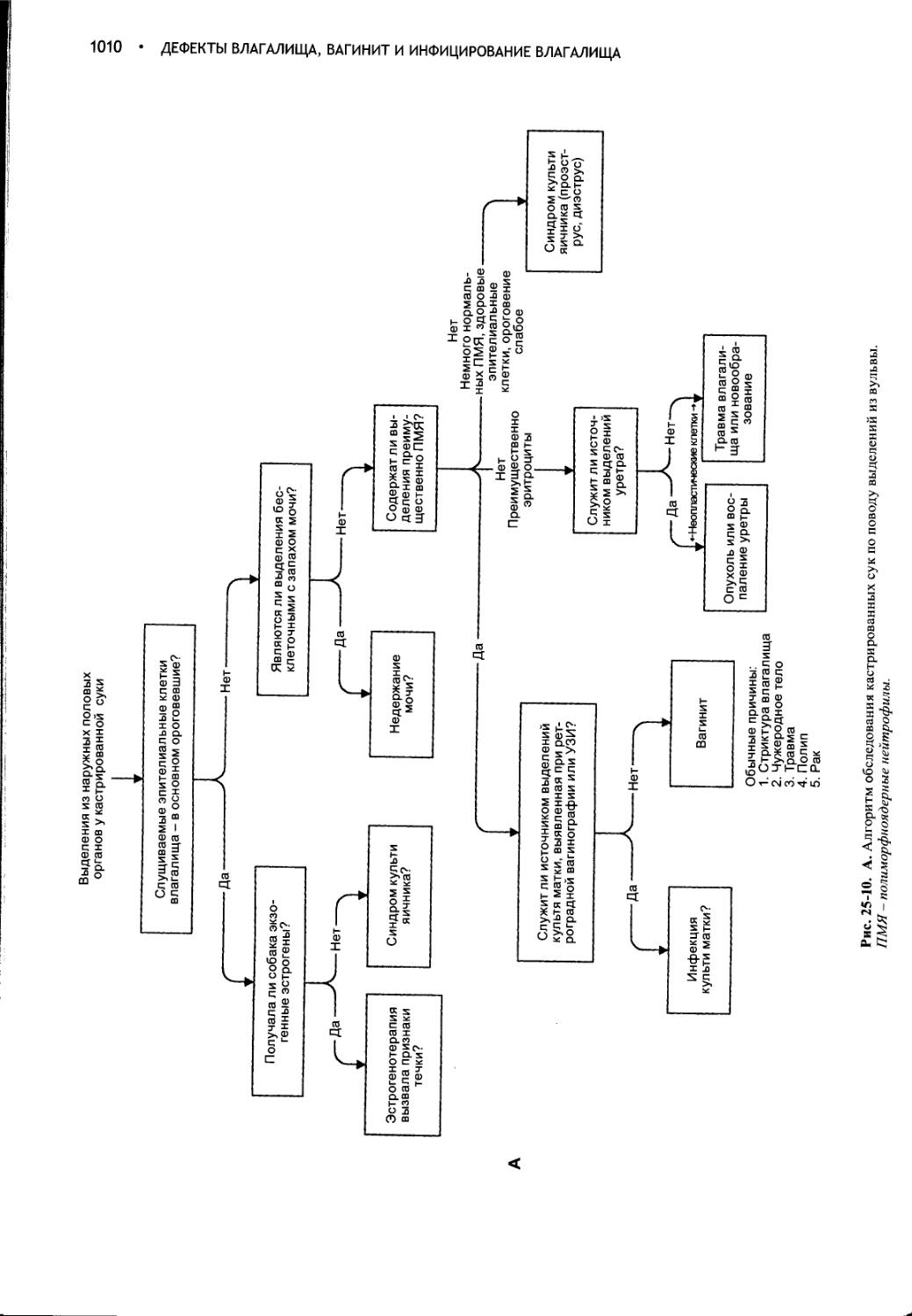
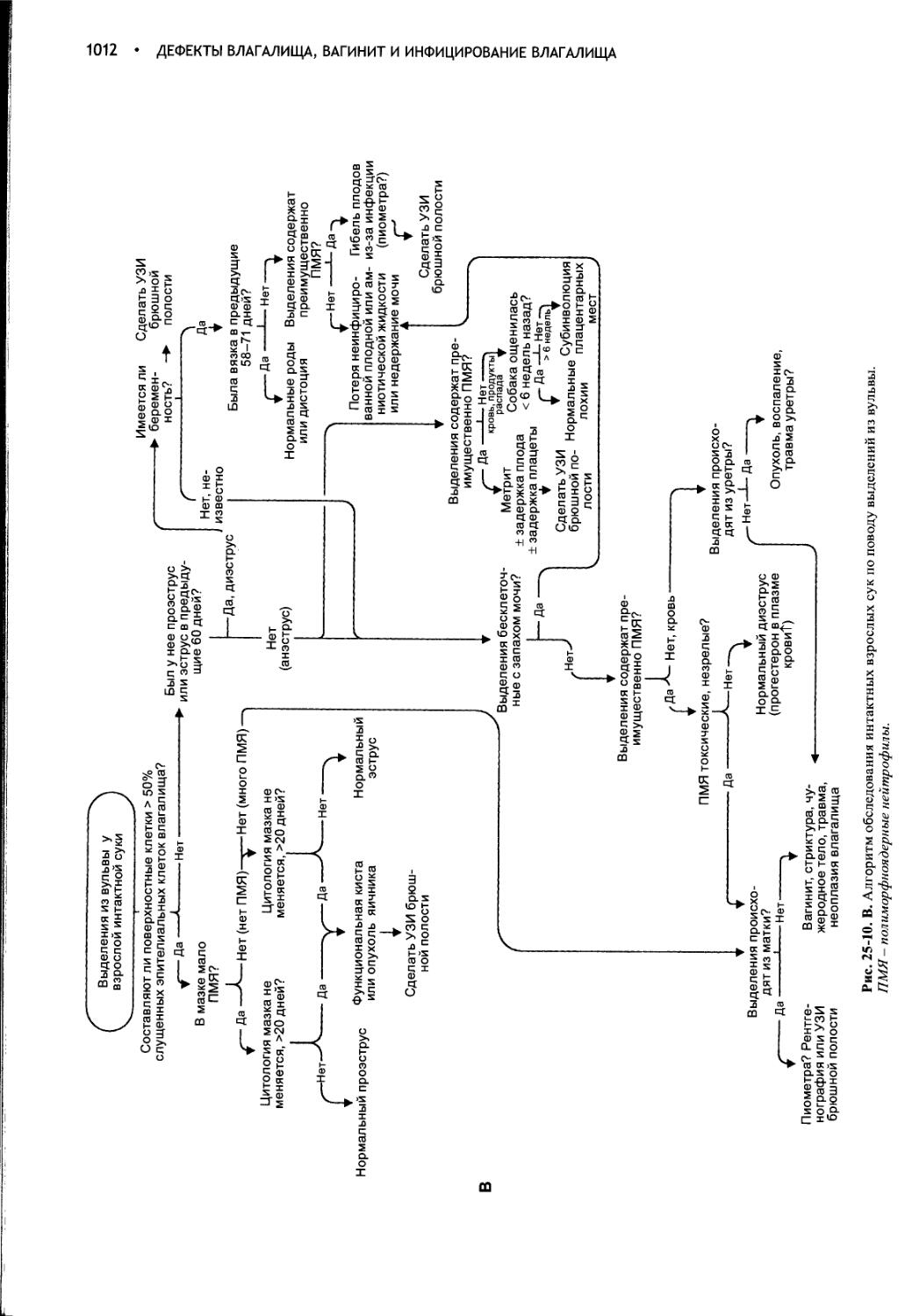
Дефекты влагалища, вагинит и инфицирование влагалища.1000
Глава 26
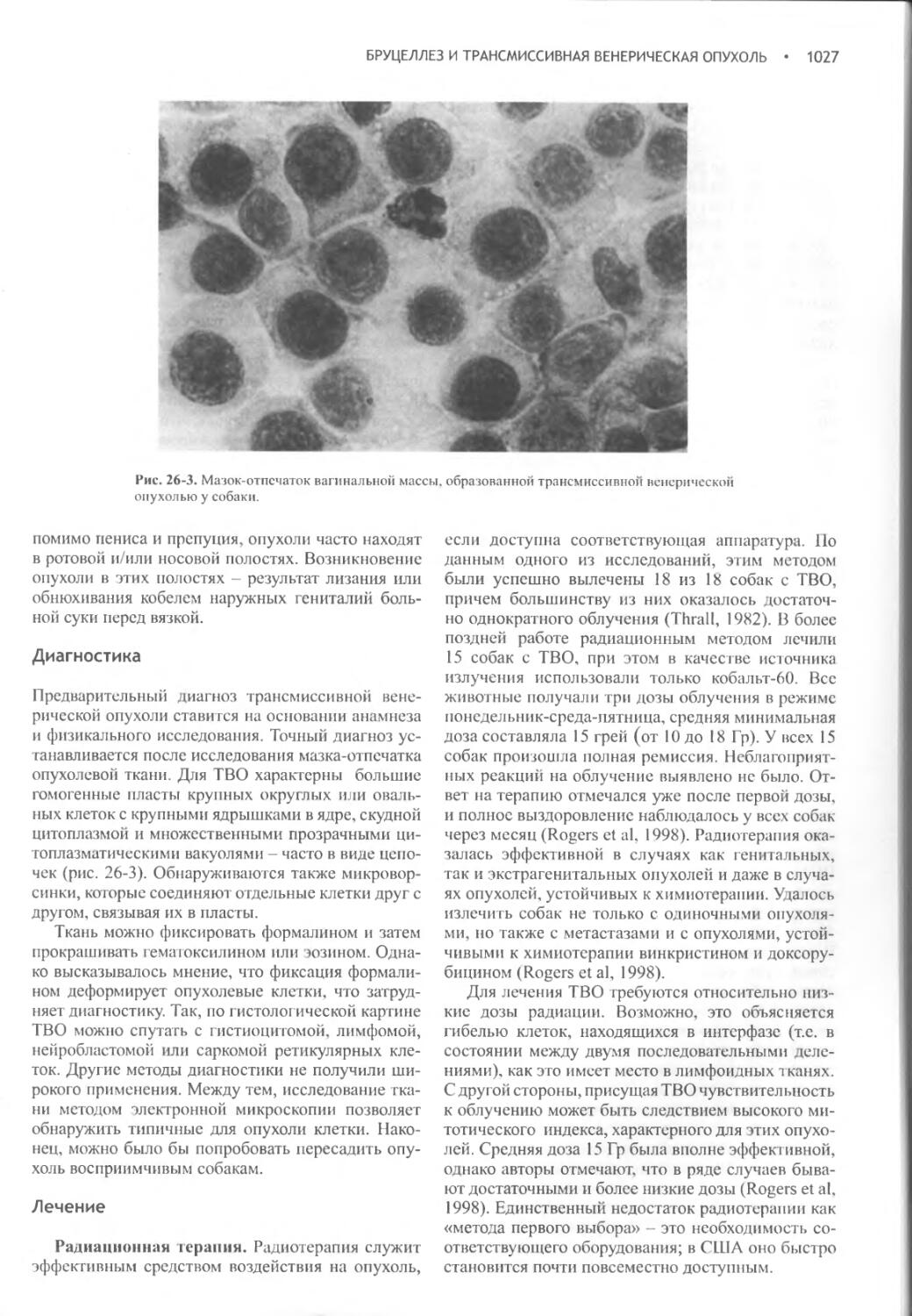
Бруцеллез и трансмиссивная венерическая опухоль......1019
Часть VIII РЕПРОДУКЦИЯ КОБЕЛЕЙ.................................1031
Глава 27
Клиническая и диагностическая оценка состояния репродуктивной системы кобелей.....................................1032
Глава 28
Заболевания полового члена и препуция...............1059
Глава 29
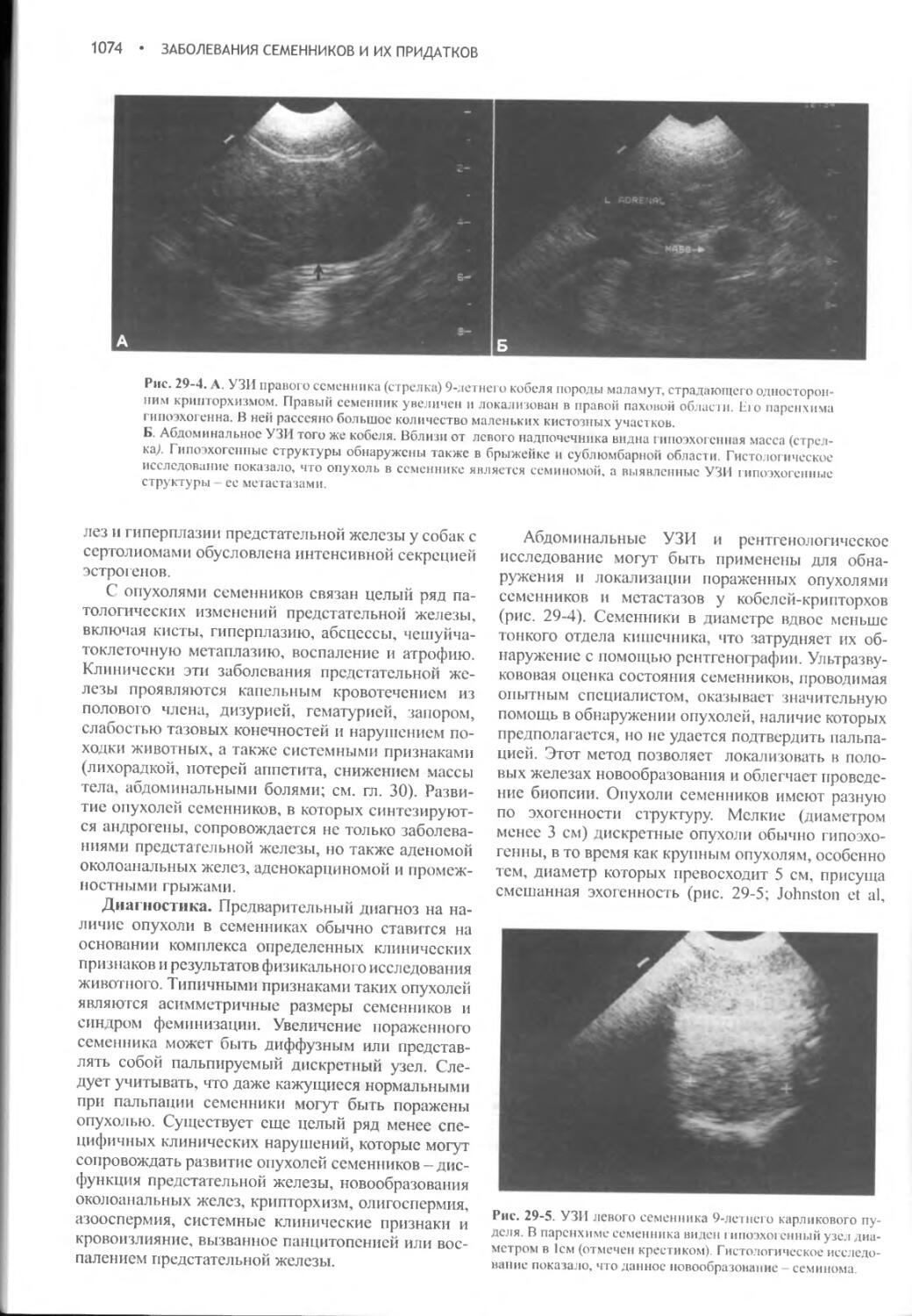
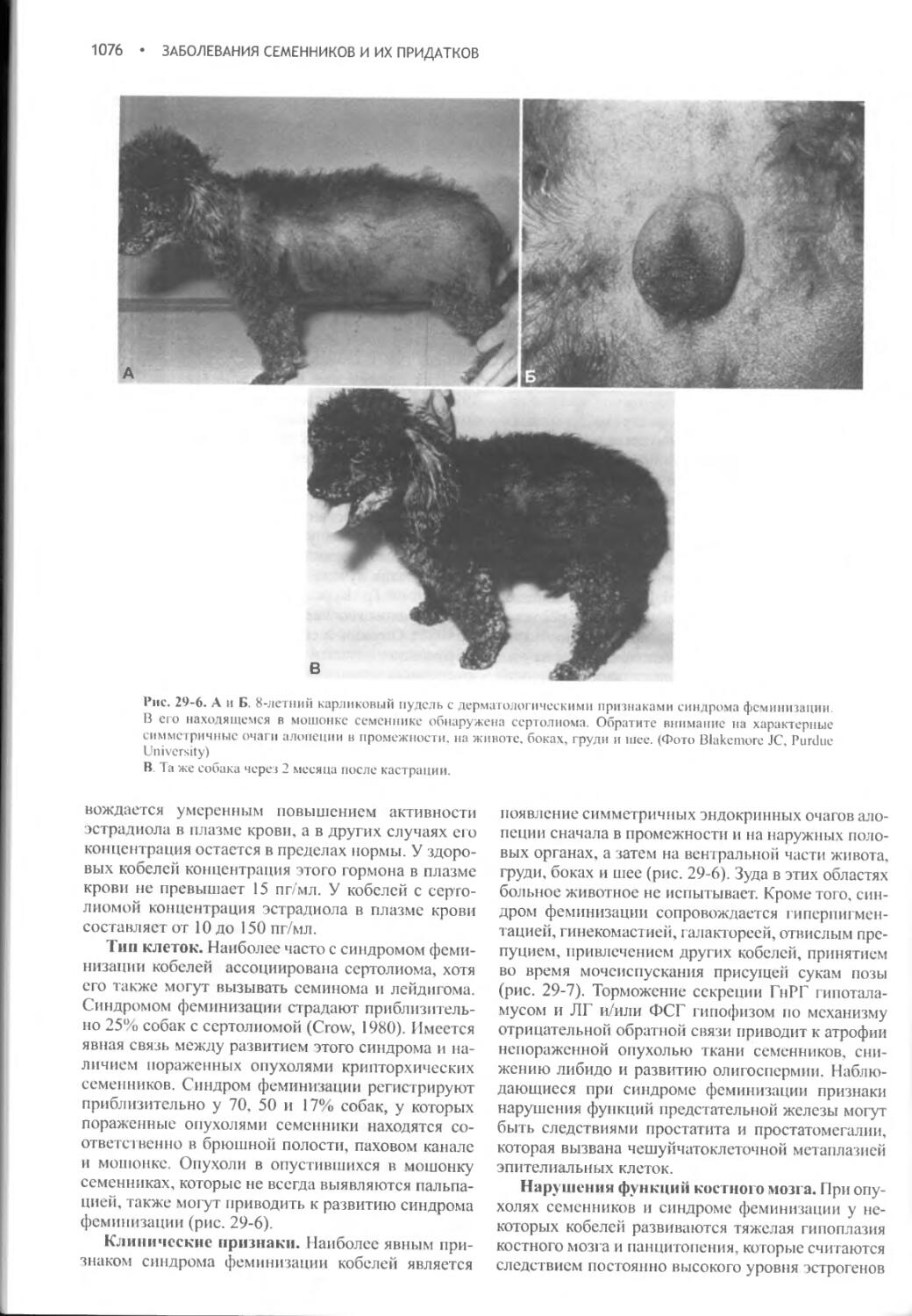
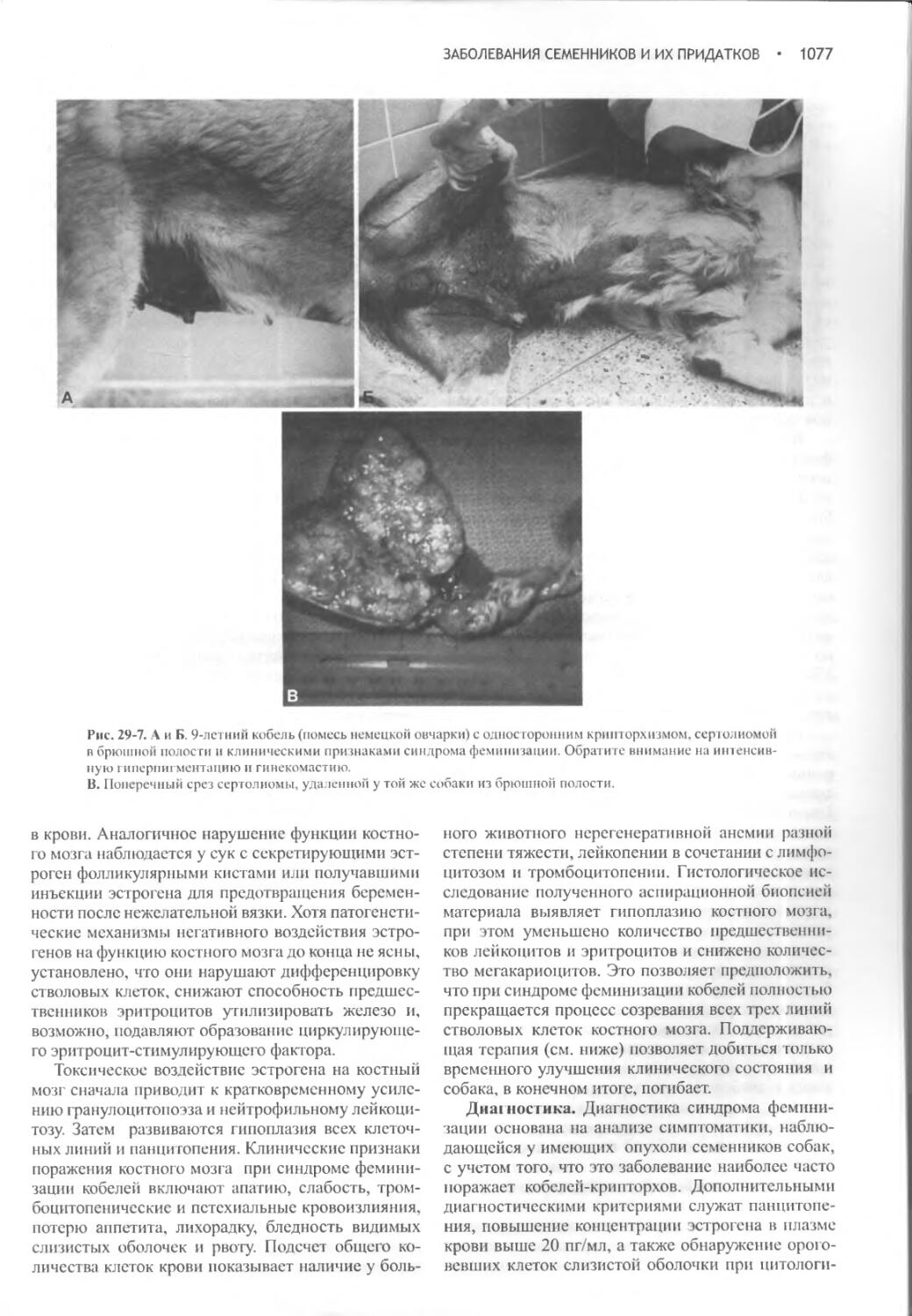
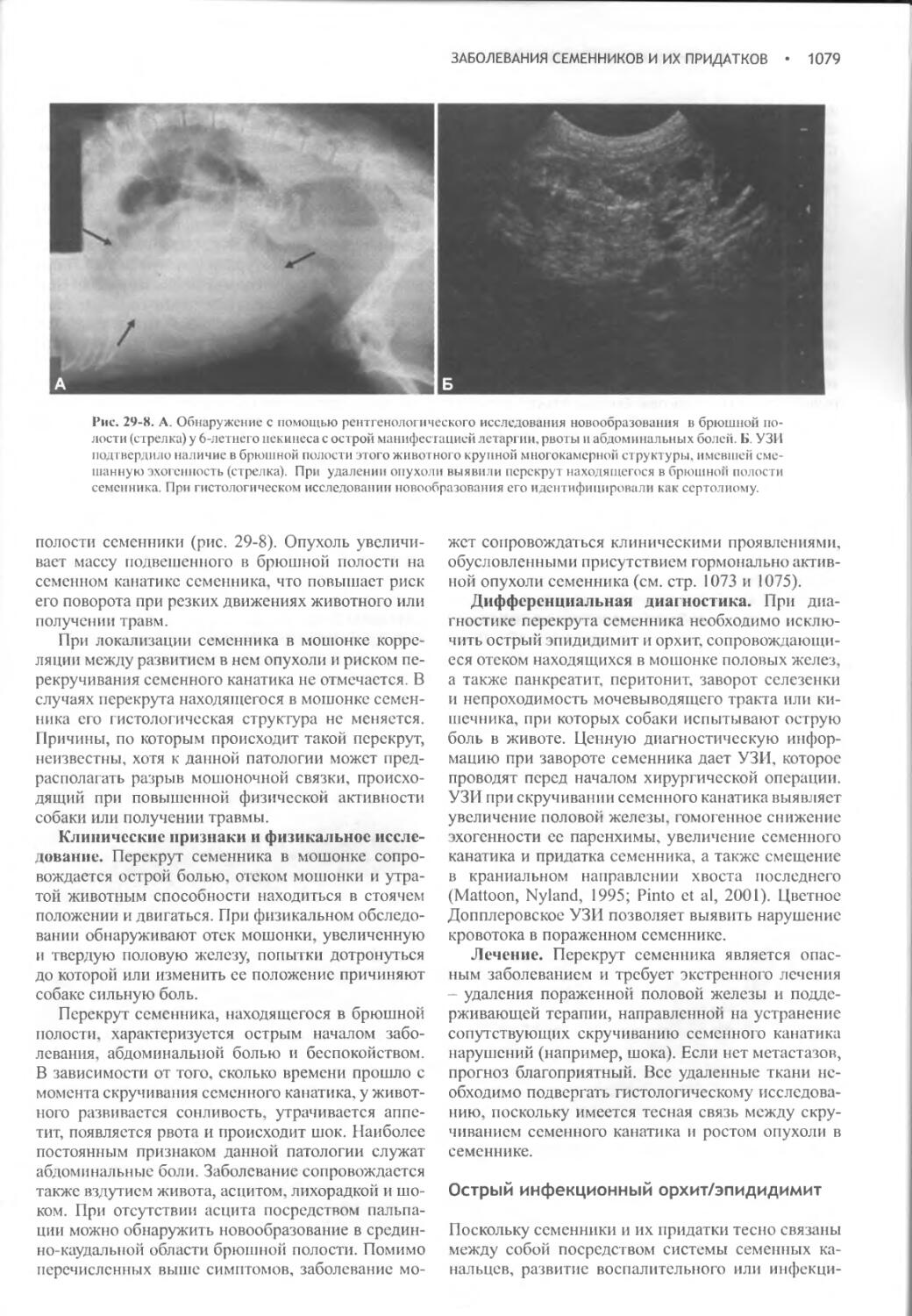
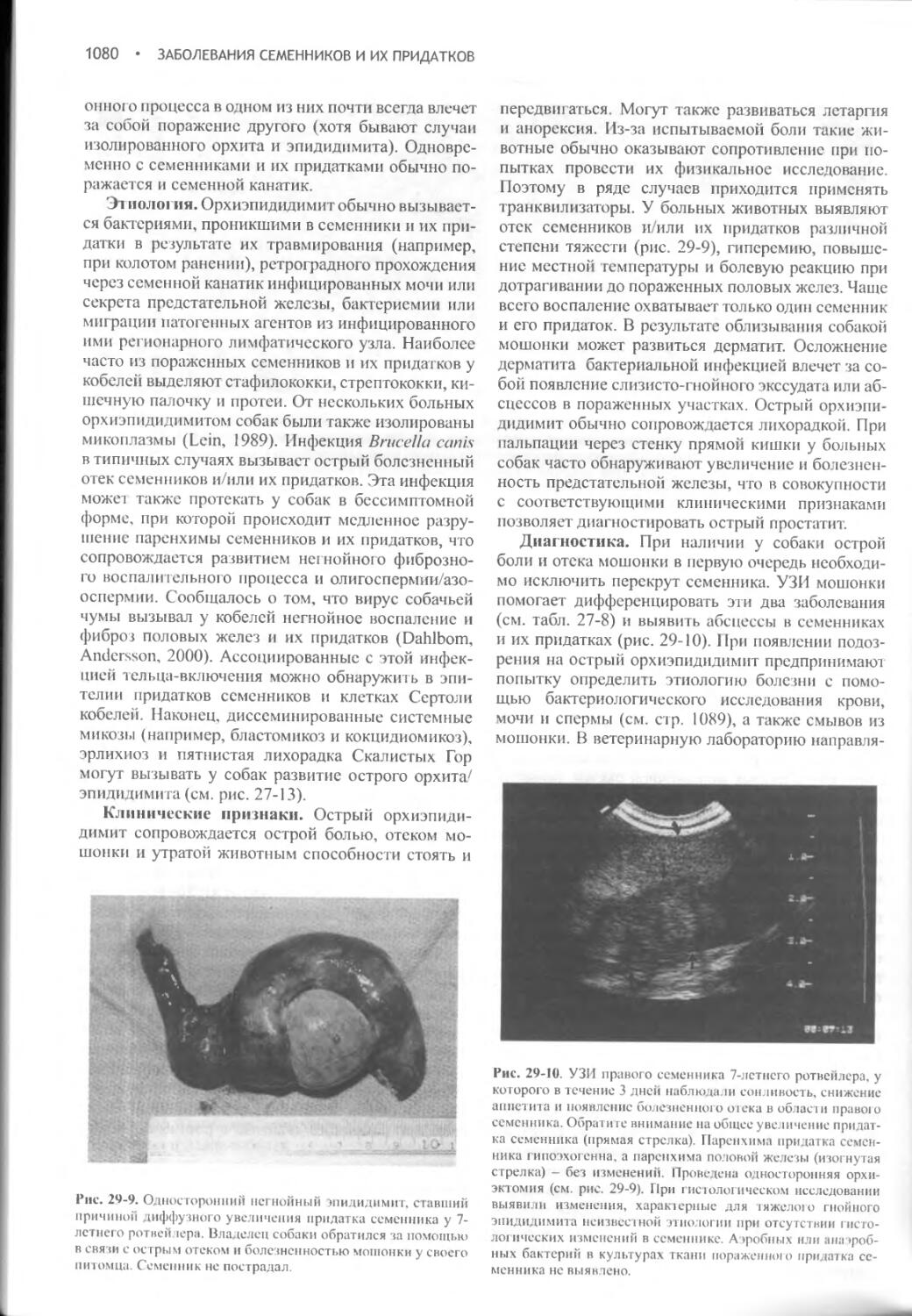
Заболевания семенников и их придатков...............1068
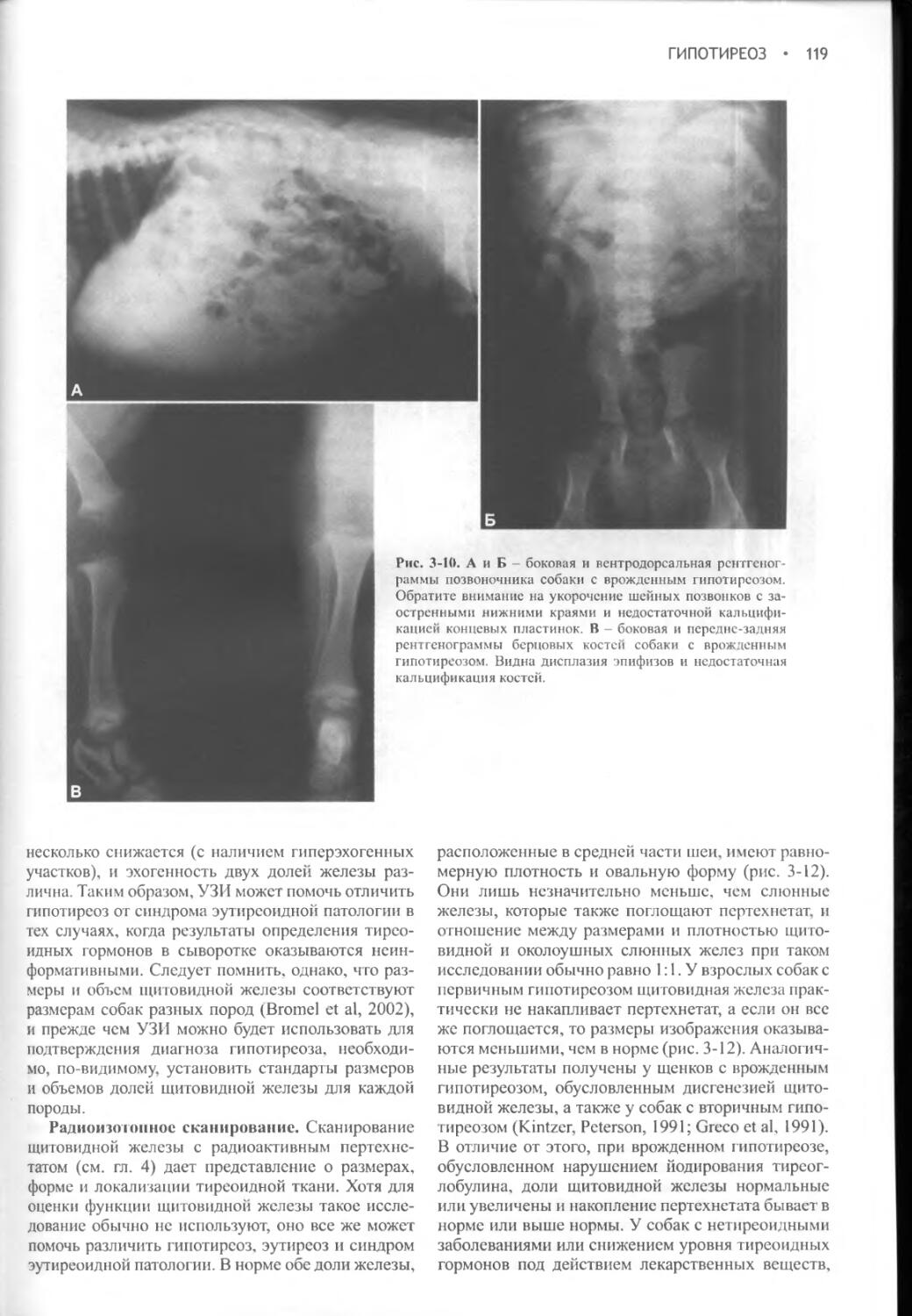
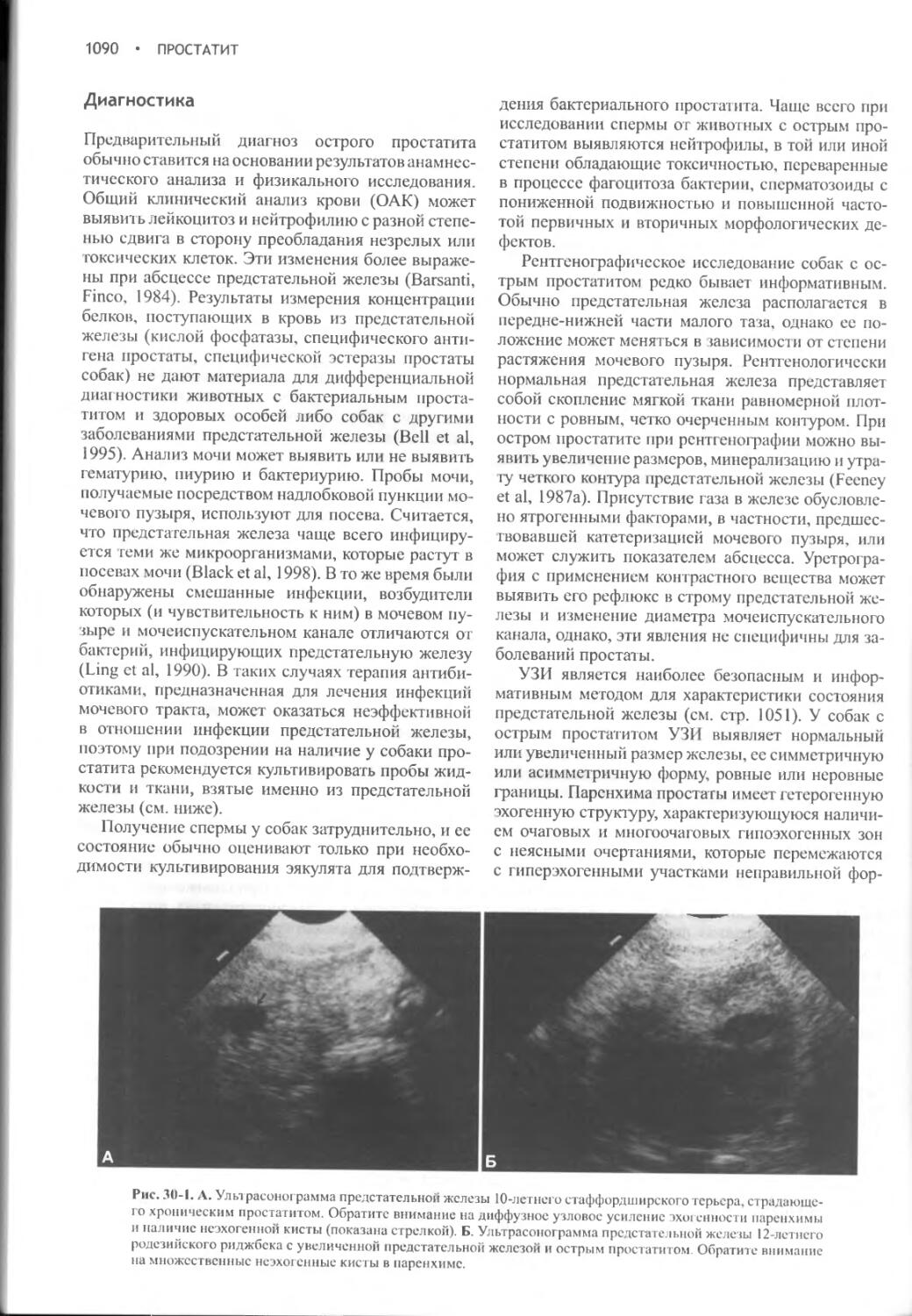
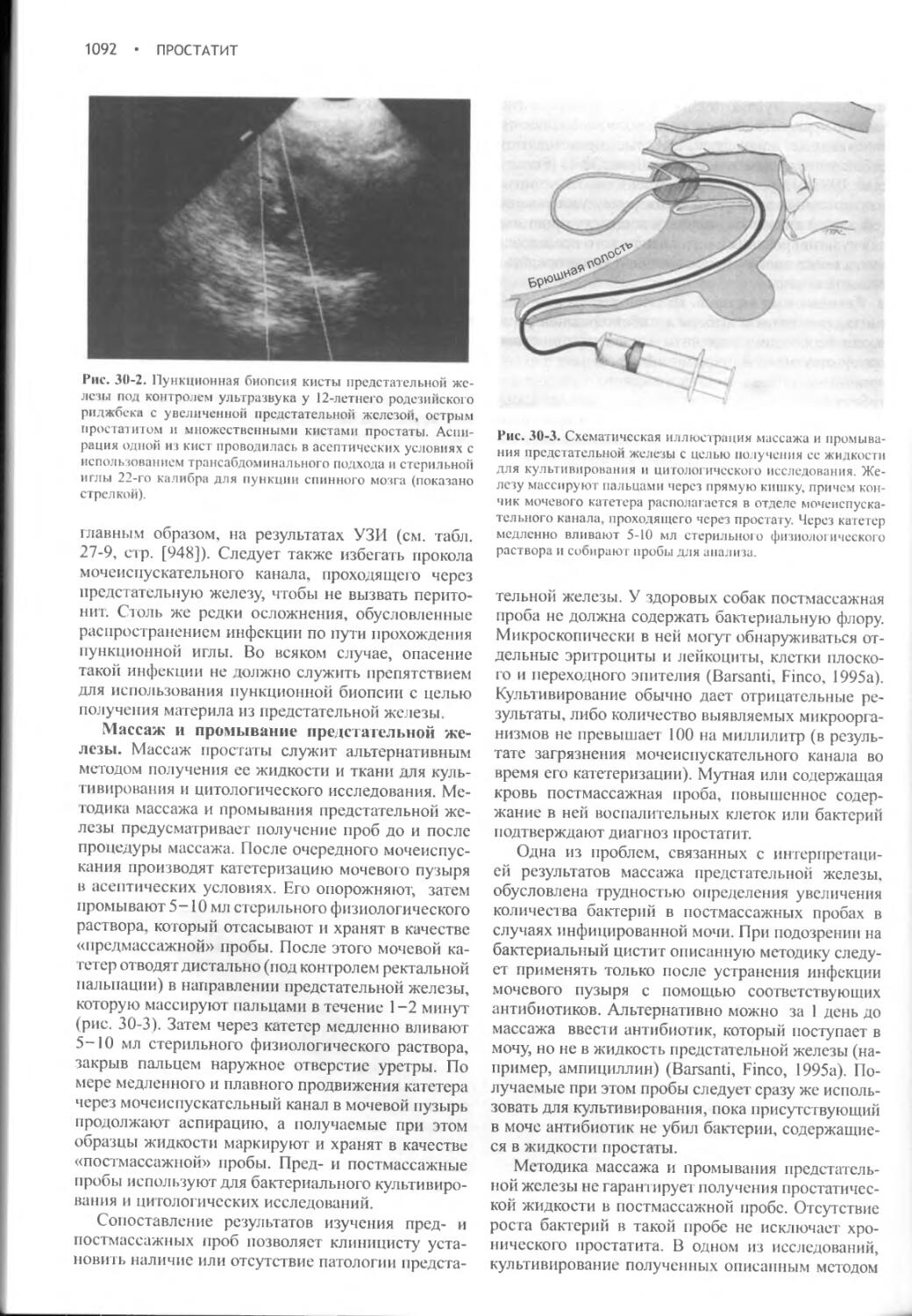
Глава 30 Простатит...........................................1088
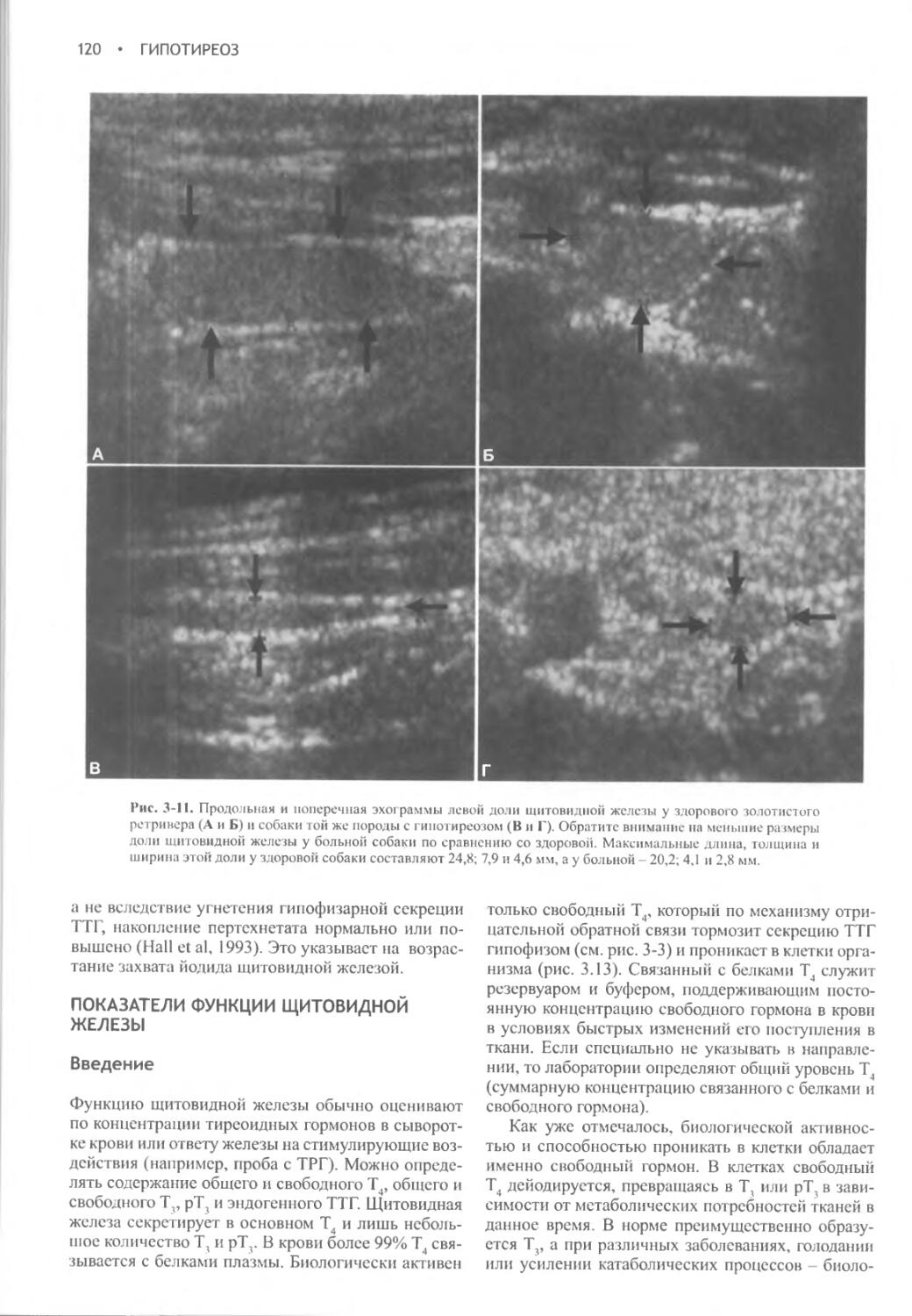
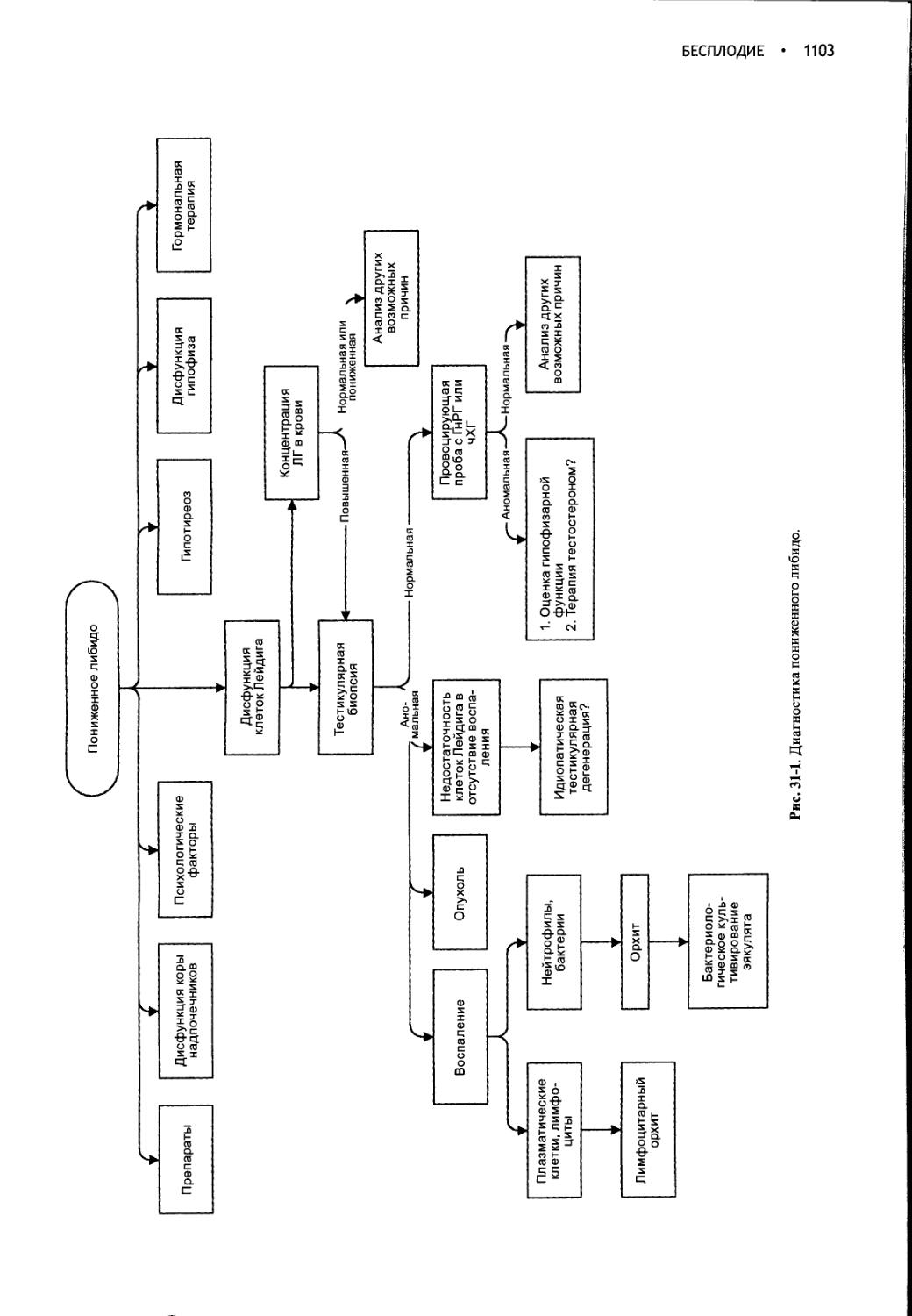
Глава 31
Бесплодие............................................1099
Глава 32
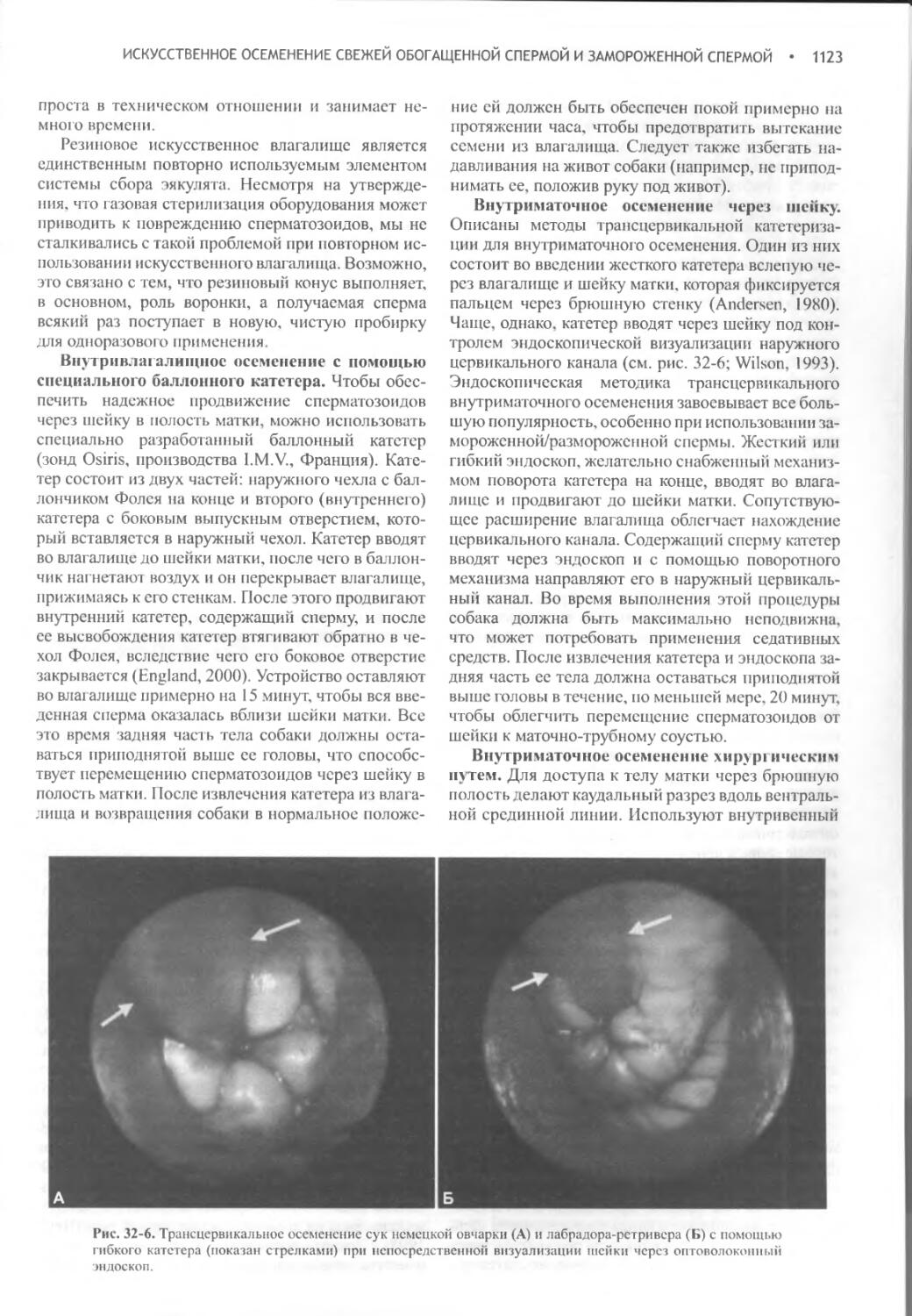
Искусственное осеменение свежей обогащенной спермой и замороженной спермой..............................1119
Часть IX
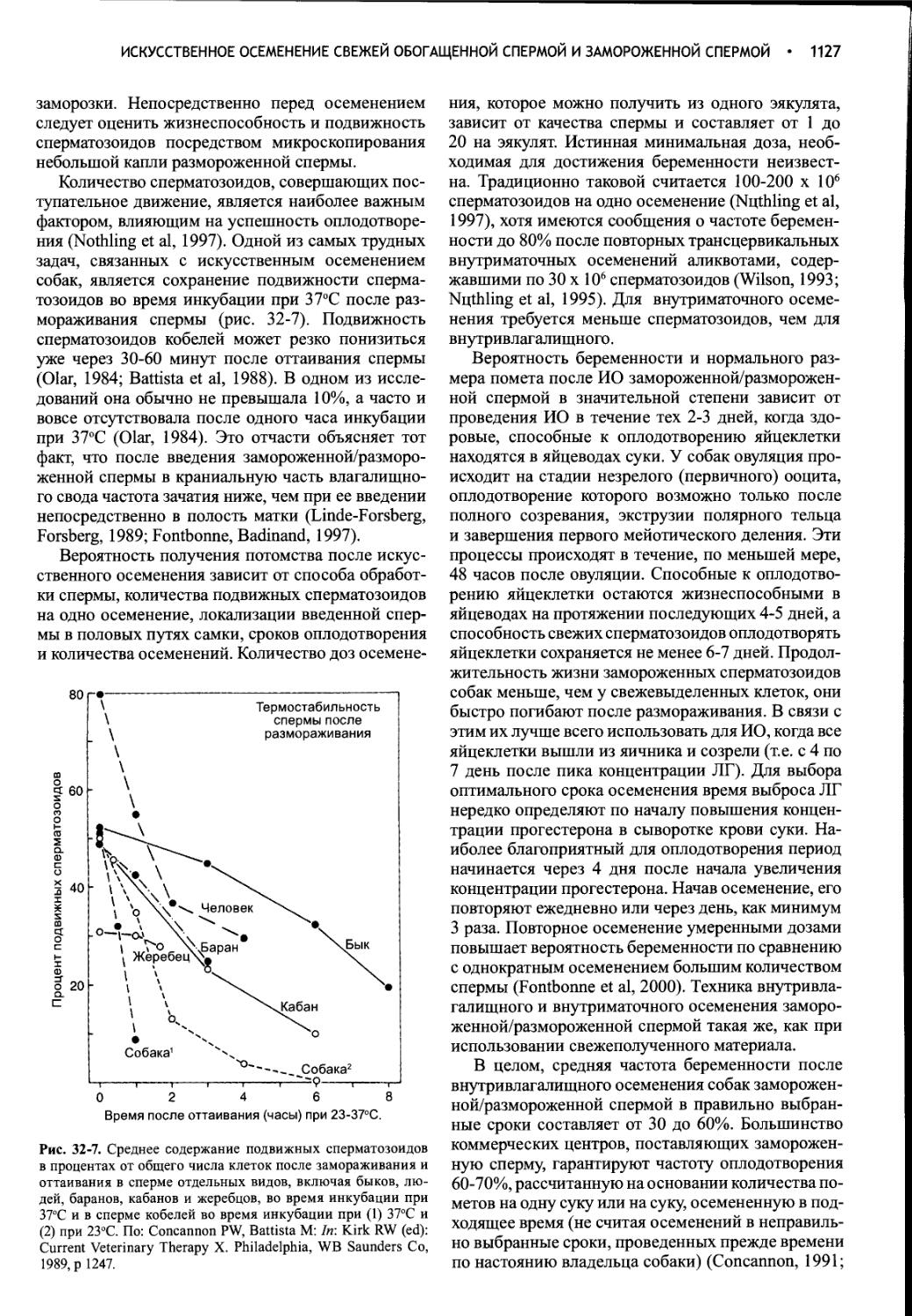
РЕПРОДУКЦИЯ КОШЕК...................................1129
Глава 33
Репродукция кошек...................................1130
Предметный указатель................................1165
XI
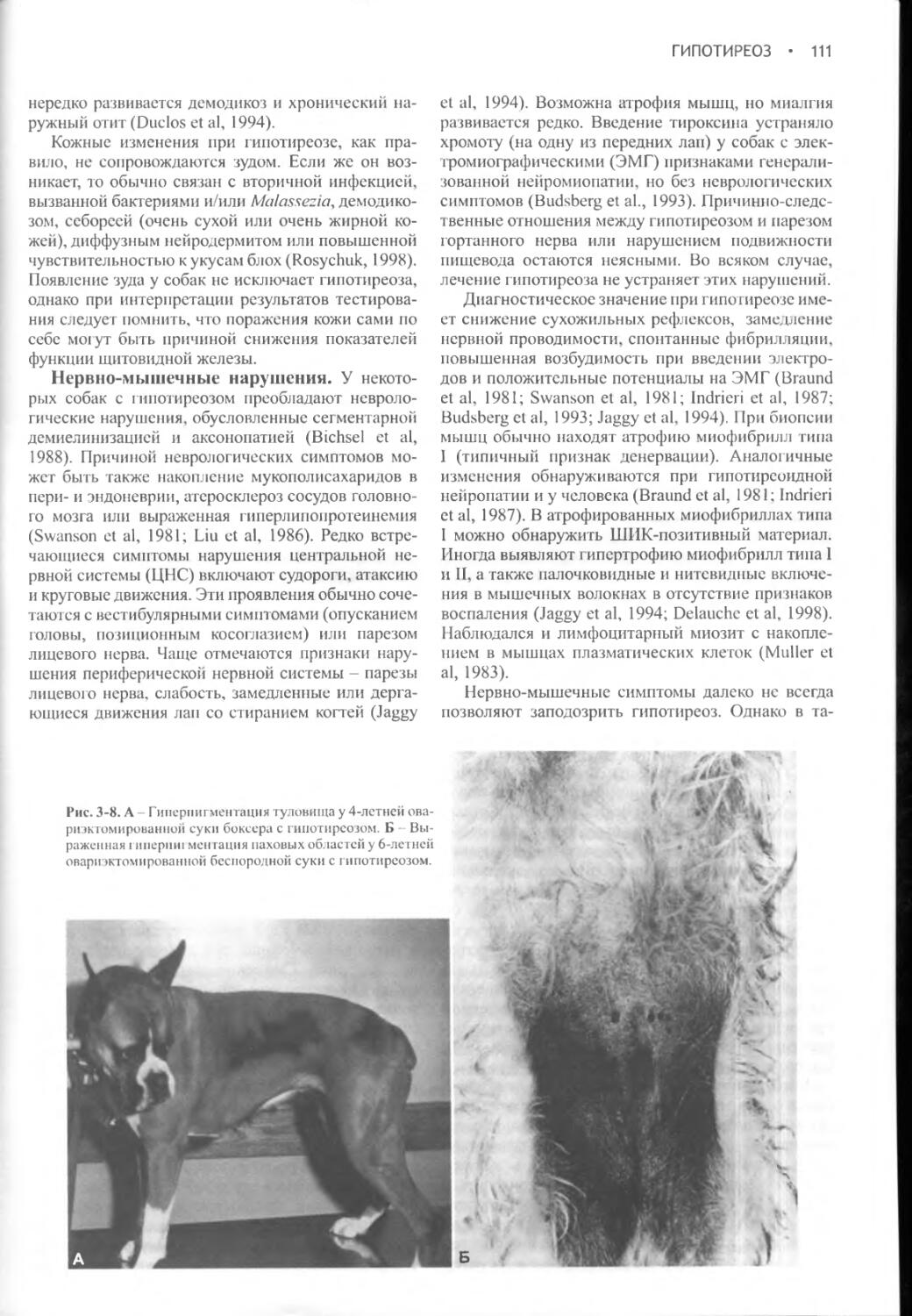
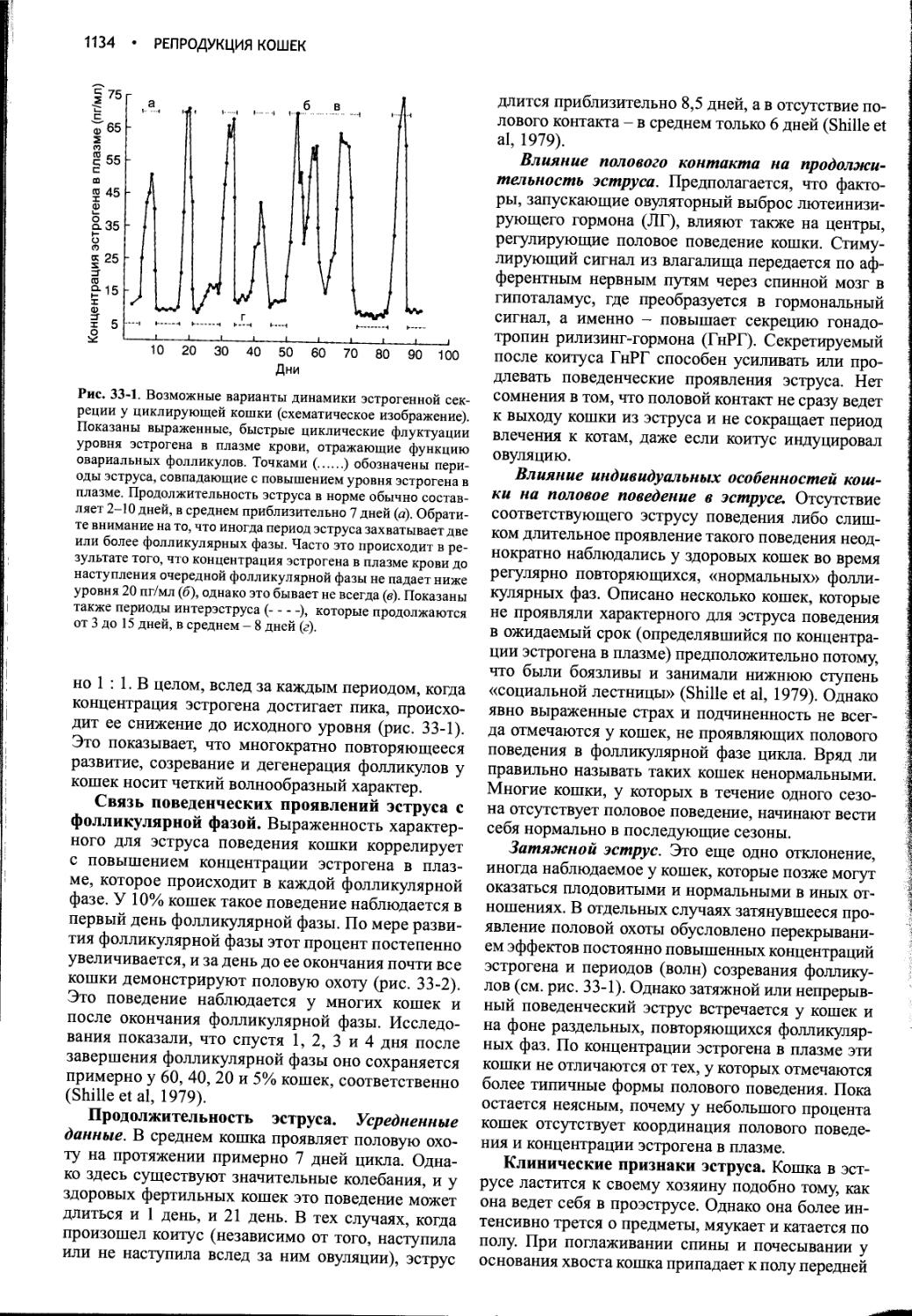
Часть I
ГИПОФИЗ
Глава 1
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ
ДИАБЕТ
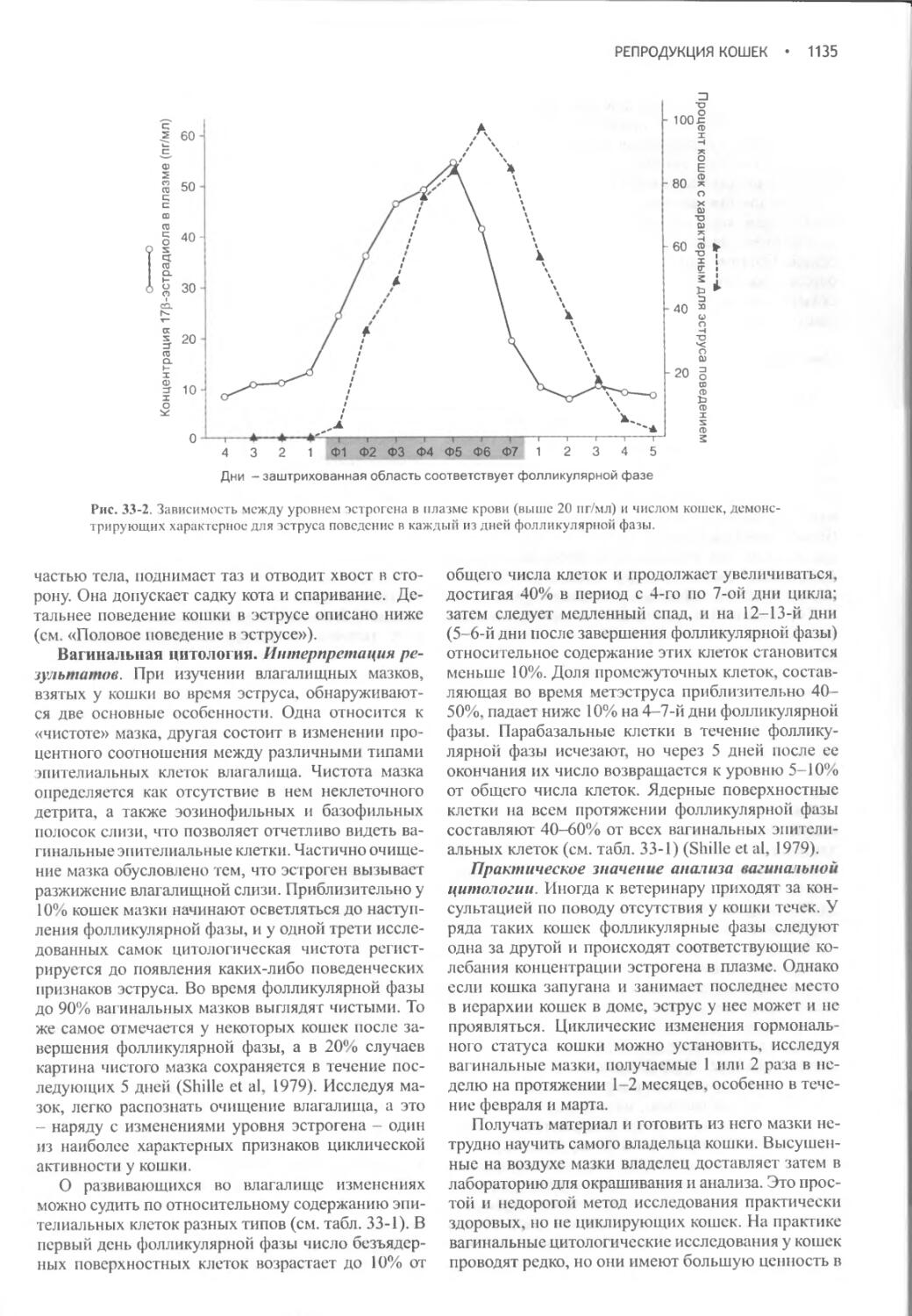
ФИЗИОЛОГИЯ ВОДНОГО ОБМЕНА.....2
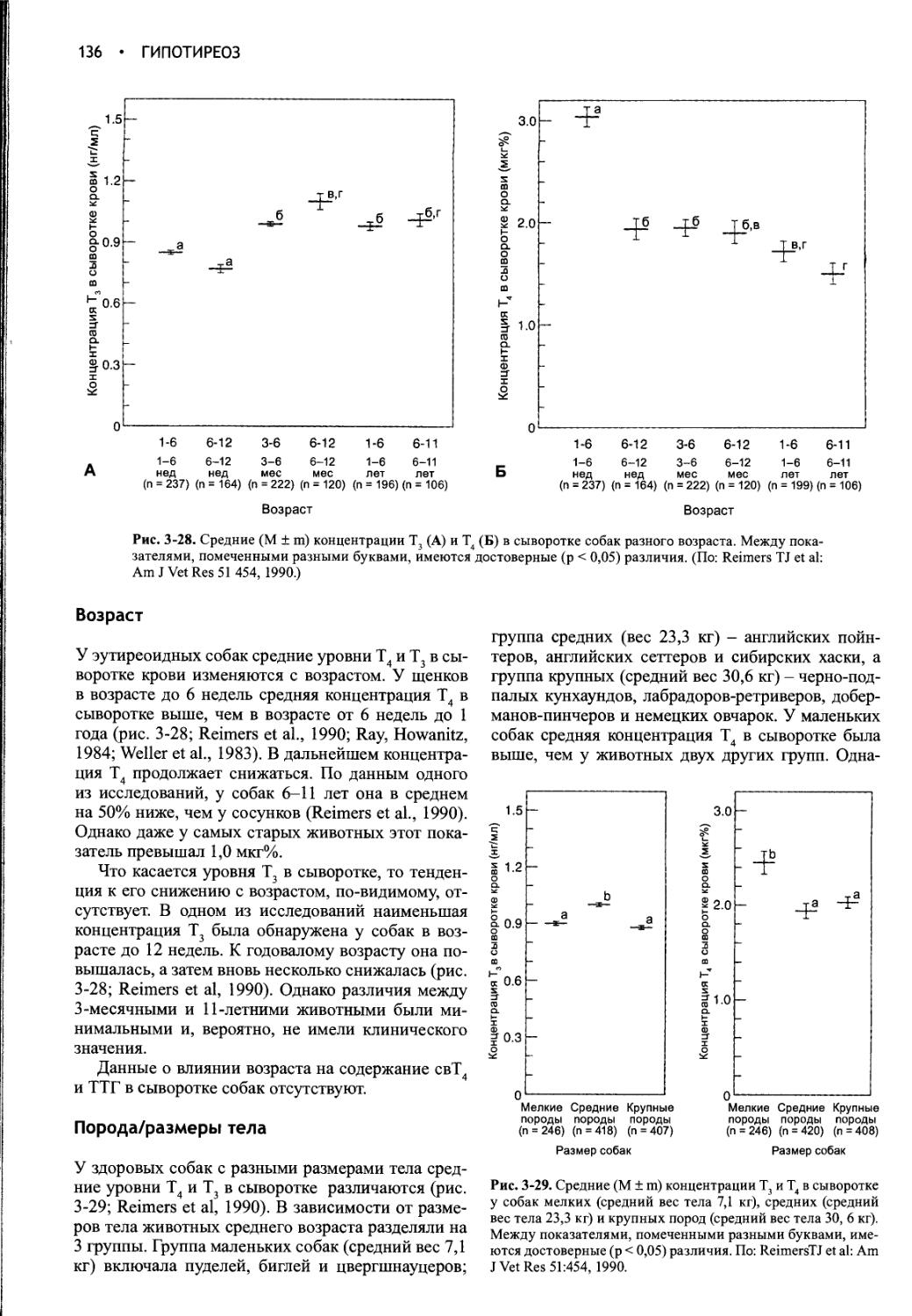
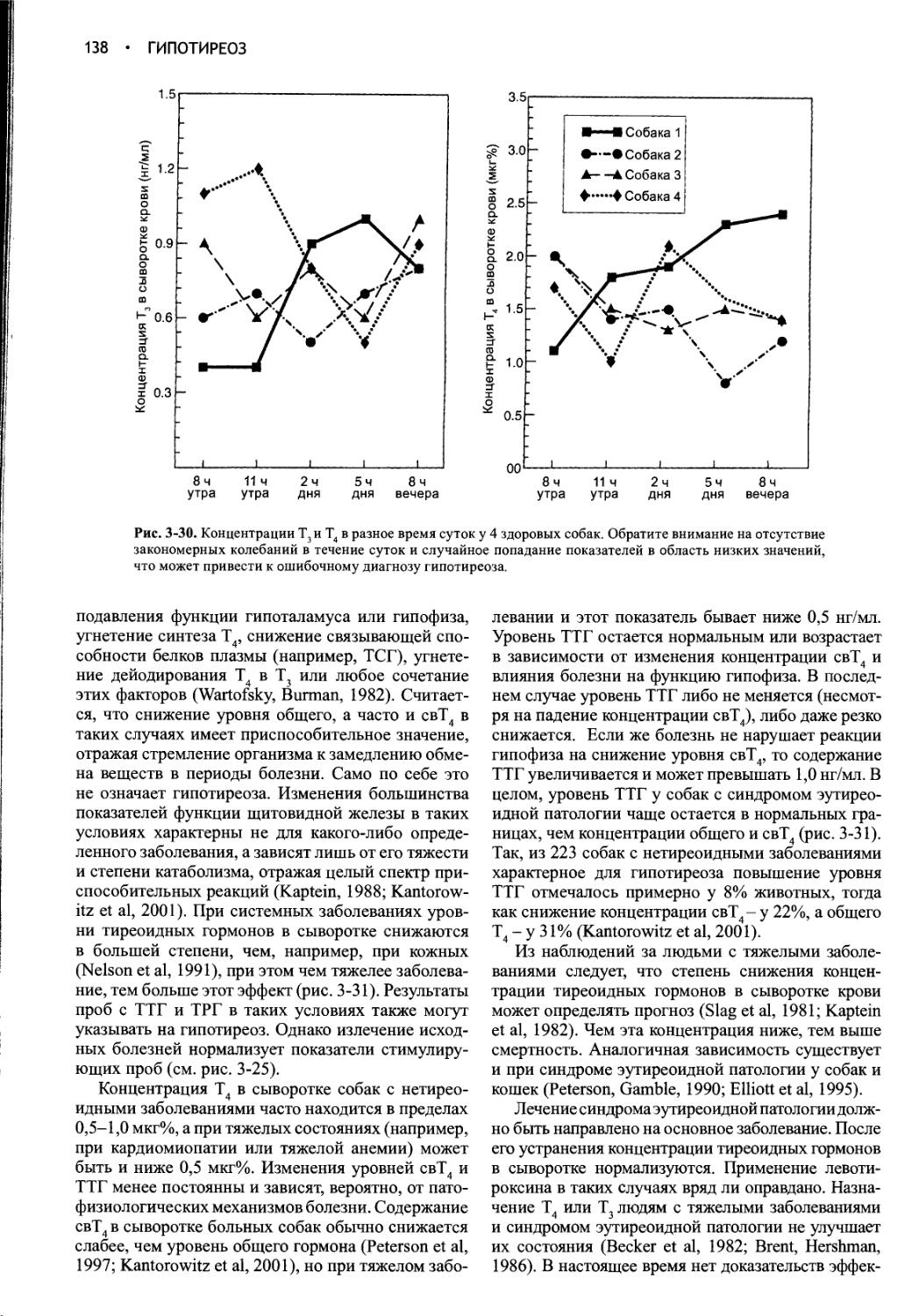
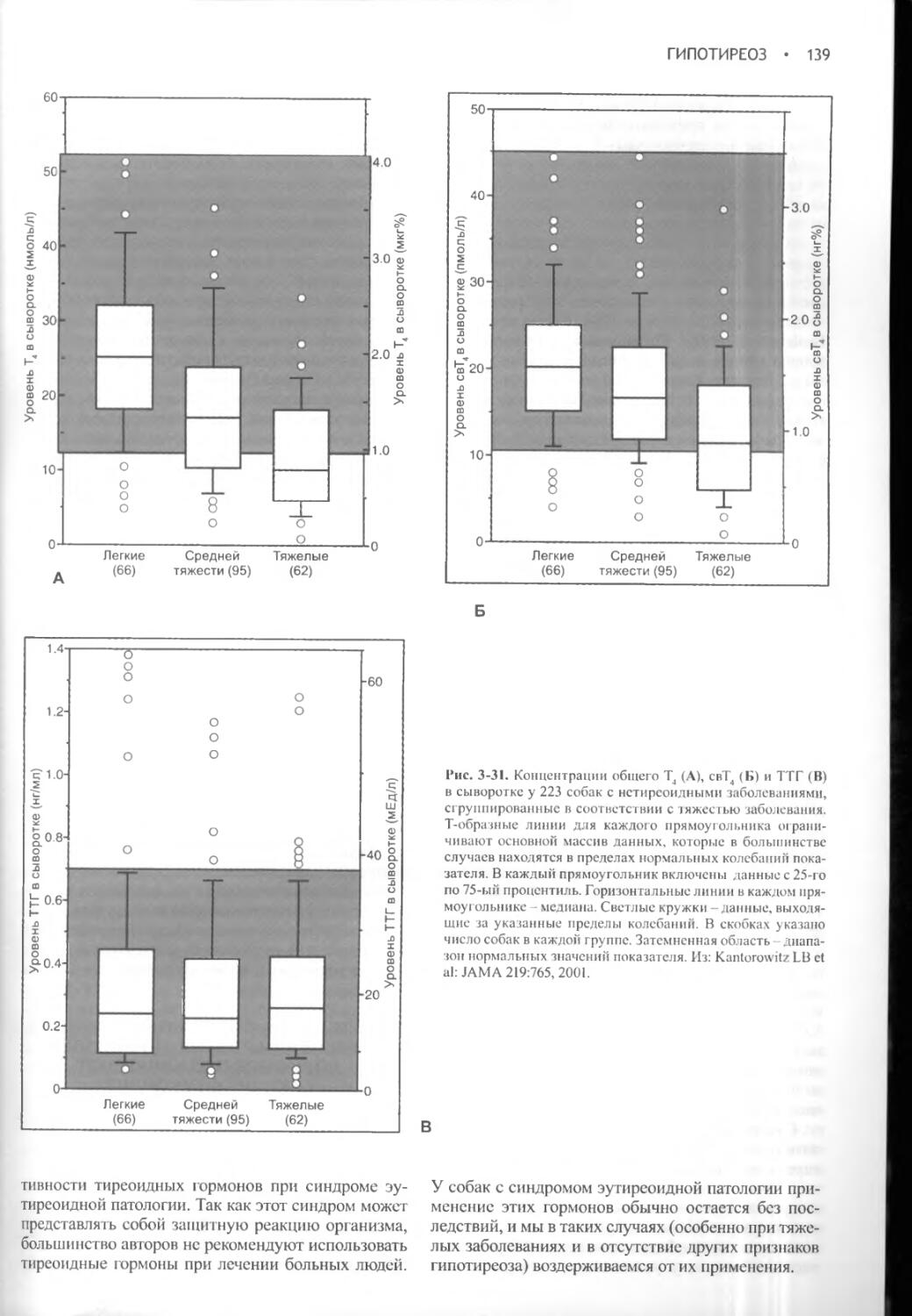
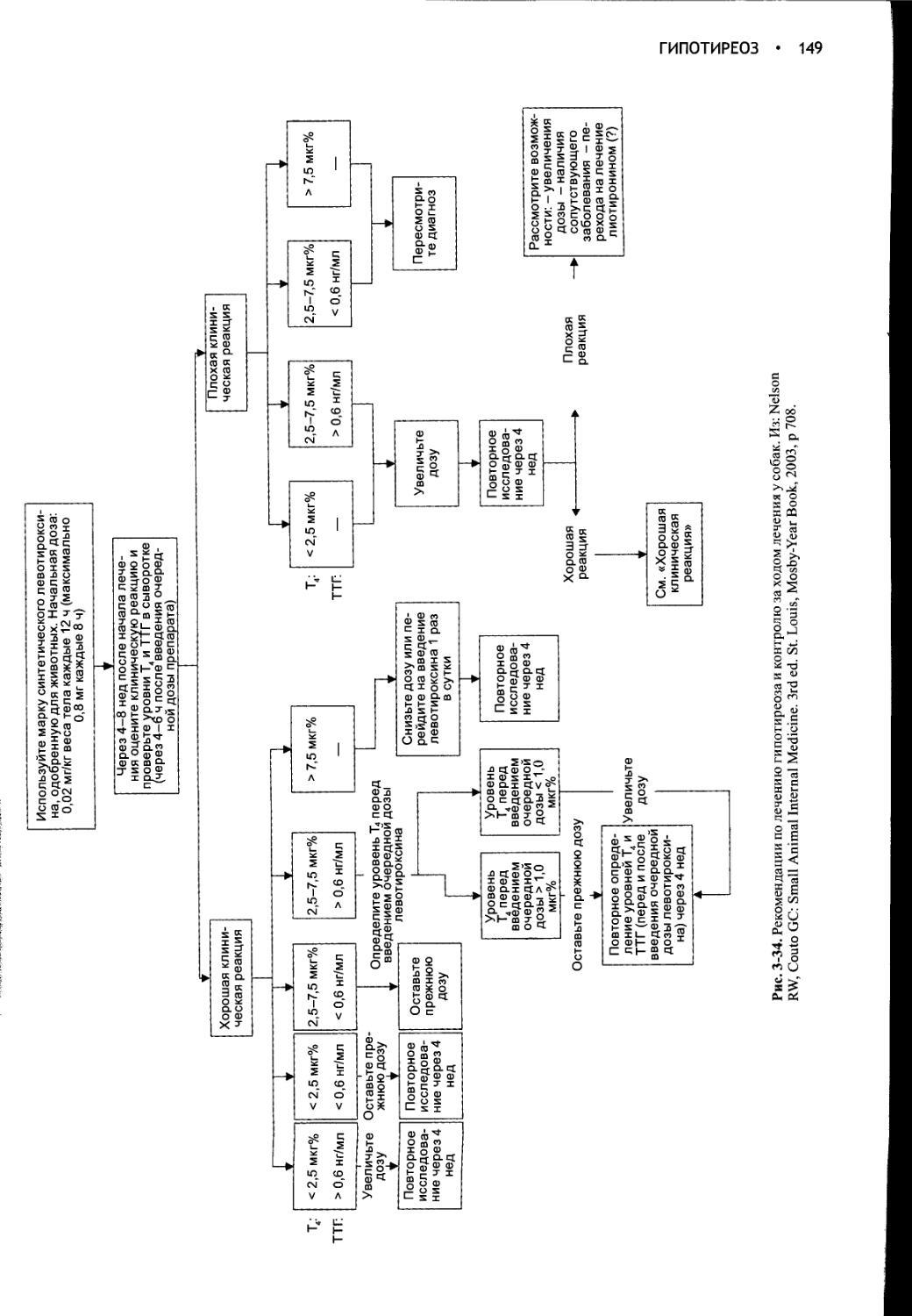
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
ПОЛИДИПСИИ И ПОЛИУРИИ.......10
МЕТОДЫ ДИАГНОСТИКИ ПОЛИУРИИ и
ПОЛИДИПСИИ .................14
ЭТИОЛОГИЯ НЕСАХАРНОГО ДИАБЕТА И
ПЕРВИЧНОЙ ПОЛИДИПСИИ .......17
КЛИНИЧЕСКАЯ КАРТИНА НЕСАХАРНОГО
ДИАБЕТА И ПСИХОГЕННОЙ ПОЛИДИПСИИ ................21
ПОДТВЕРЖДЕНИЕ ДИАГНОЗА НЕСАХАРНЫЙ ДИАБЕТ...........24
МОДИФИЦИРОВАННАЯ ПРОБА С
ЛИШЕНИЕМ ЖИДКОСТИ..........24
Принцип метода...............24
Противопоказания к проведению пробы........................24
Терминология, используемая в исследованиях водного баланса .24
Протокол (табл. 1-9)...........25
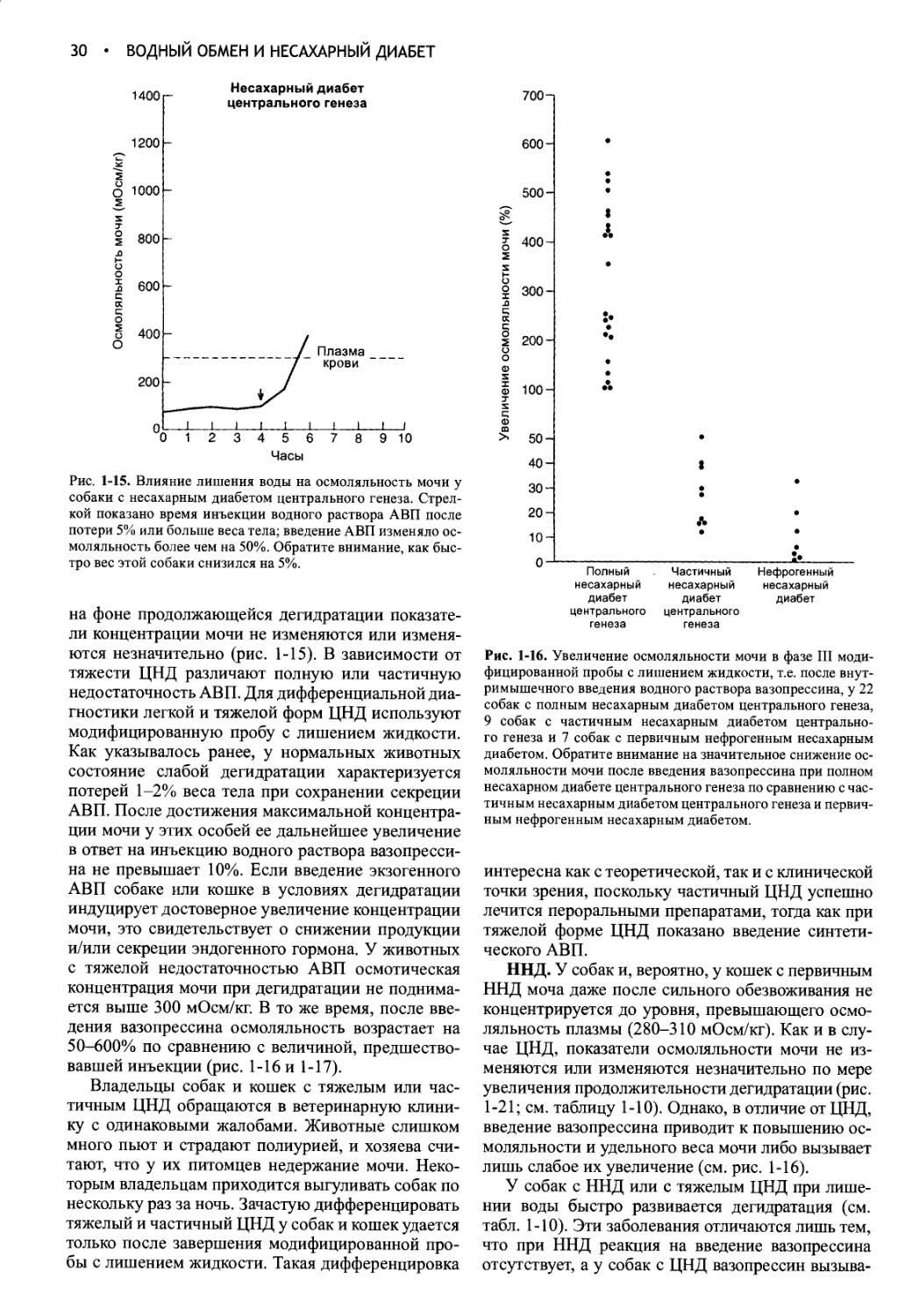
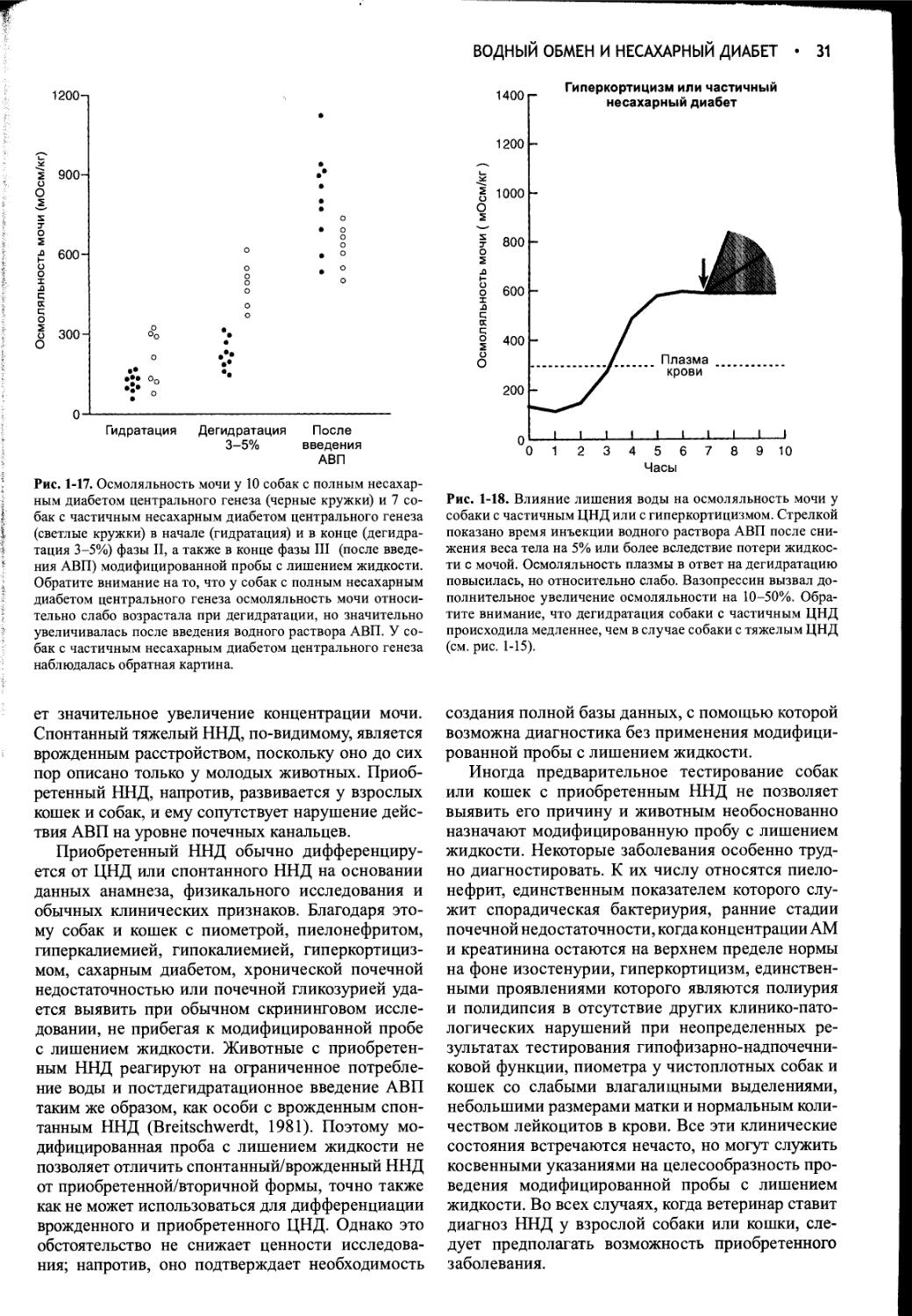
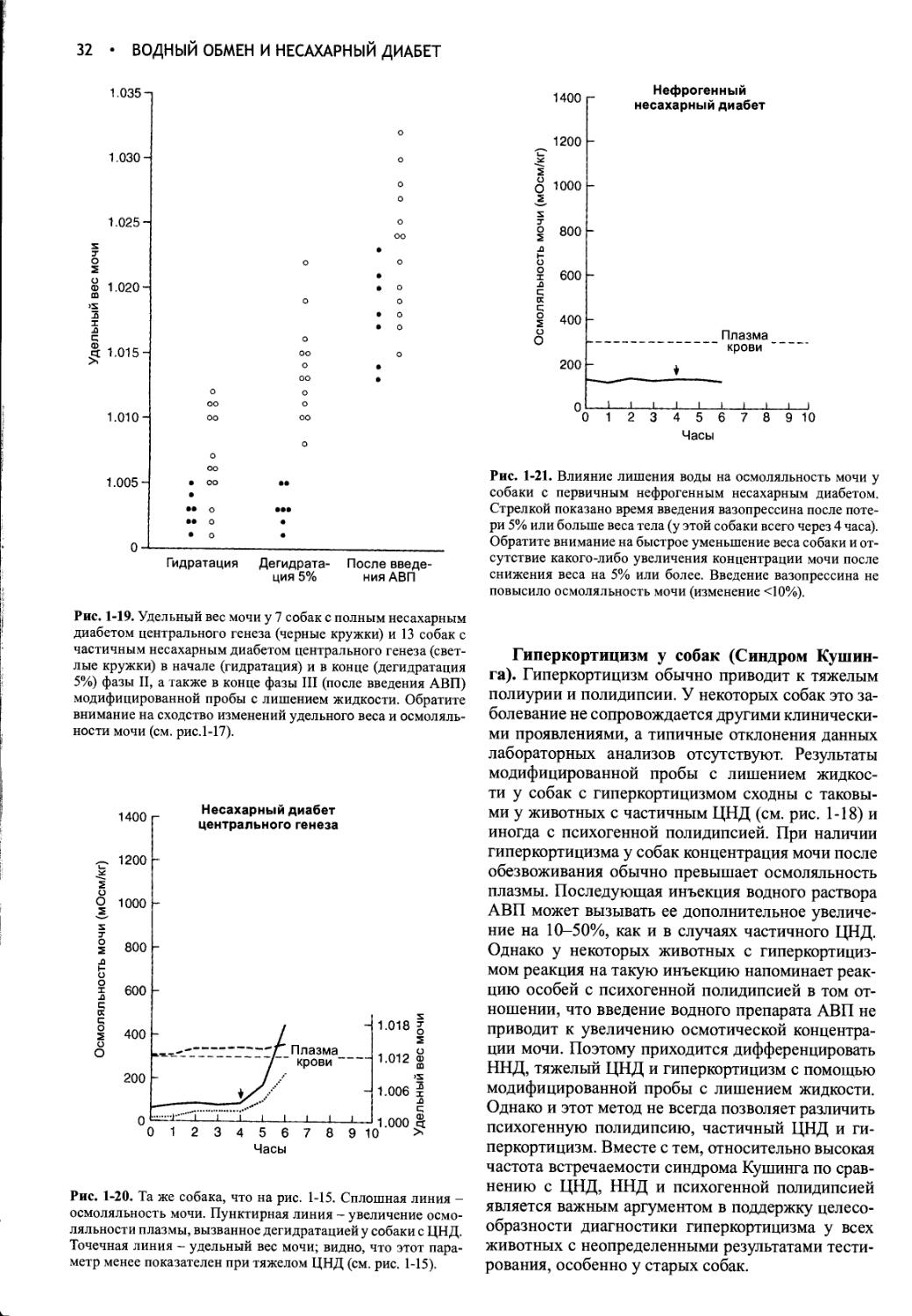
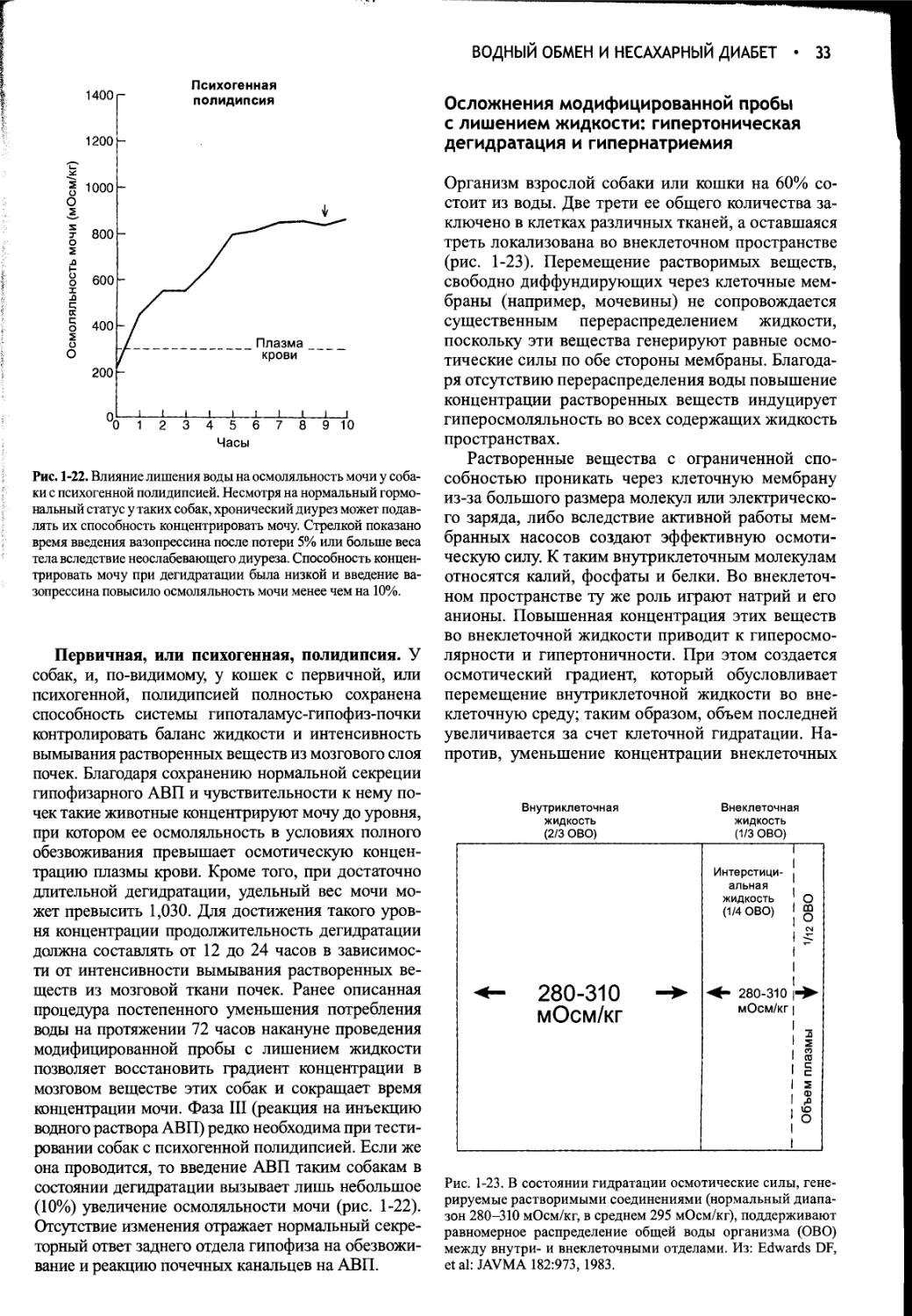
Ответ на модифицированную пробу с лишением жидкости..............29
Осложнения модифицированной пробы с лишением жидкости: гипертоническая дегидратация и гипернатриемия..33
Ошибки (неточности) диагностики при использовании модифицированной пробы с лишением жидкости......36
Определение вазопрессина в плазме крови..........................37
Мероприятия при поступлении в клинику собак или кошек в состоянии дегидратации...................38
РАНДОМИЗИРОВАННАЯ ОЦЕНКА
ОСМОЛЯЛЬНОСТИ ПЛАЗМЫ КРОВИ КАК
ИНСТРУМЕНТ ДИАГНОСТИКИ......39
ПРОБА С ВВЕДЕНИЕМ ДЕСМОПРЕССИНА (ДДАВП) КАК АЛЬТЕРНАТИВНЫЙ ДИАГНОСТИЧЕСКИЙ МЕТОД.......40
ИССЛЕДОВАНИЕ С ИНФУЗИЕИ СОЛЕВОГО
РАСТВОРА (ПРОБА ХИКИ-ХАРЫ) .41
ОТНОШЕНИЕ ОСМОЛЯЛЬНОСТЕЙ МОЧИ И
ПЛАЗМЫ......................41
ЛЕЧЕНИЕ.....................41
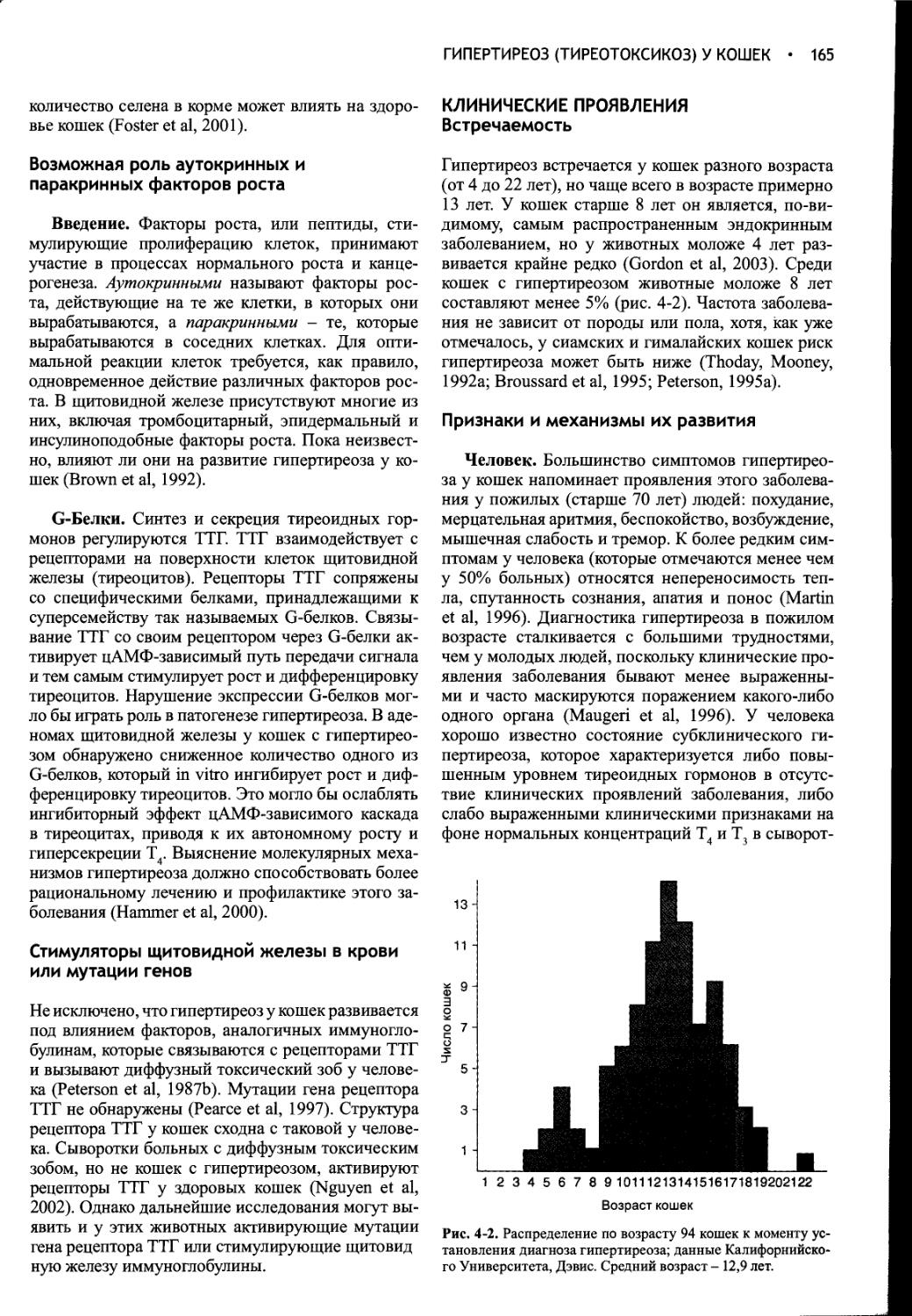
ПРОГНОЗ.......................46
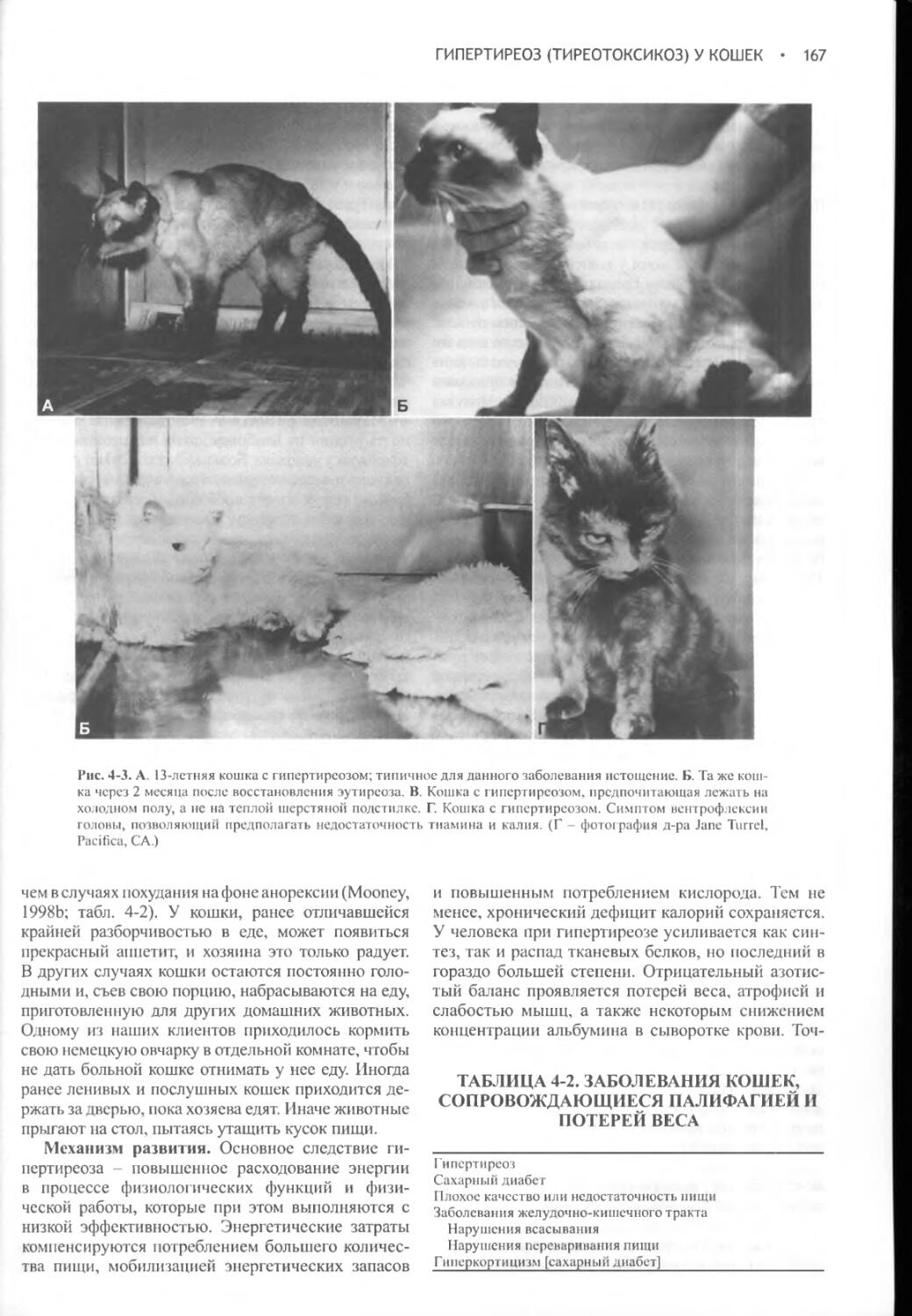
СИНДРОМ НАРУШЕННОЙ СЕКРЕЦИИ
ВАЗОПРЕССИНА: ИЗБЫТОК ВАЗОПРЕССИНА ...............47
ГИПОДИПСИЧЕСКАЯ ГИПЕРНАТРИЕМИЯ
(ЭССЕНЦИАЛЬНАЯ ГИПЕРНАТРИЕМИЯ) ............48
Список сокращений
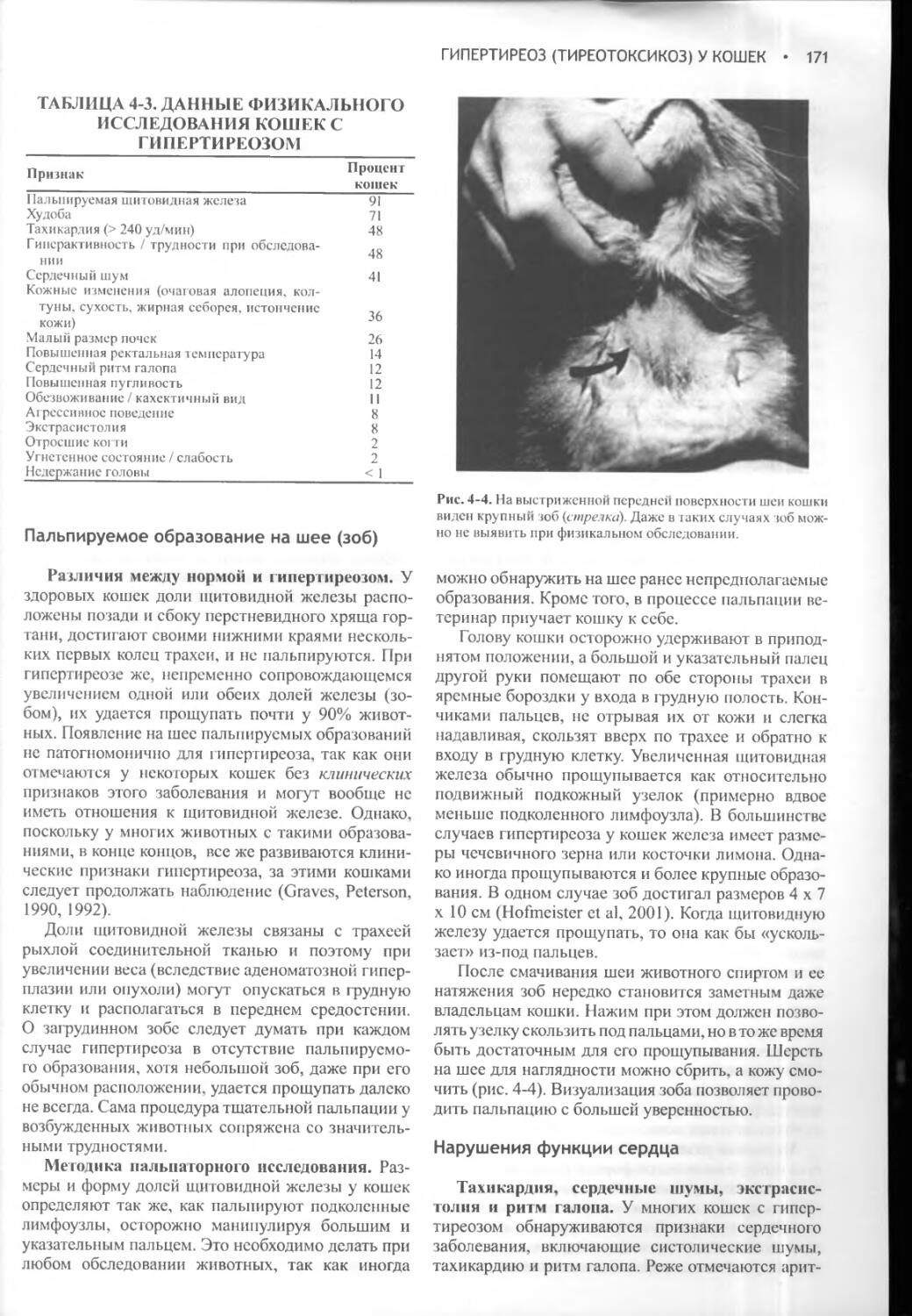
АВП, АДГ - аргинин-вазопрессин, аитидиуретический гормон
AM — азот мочевины
цАМФ - циклический адеиозинмонофосфат
АТФ - аденозннтрифосфат
ВКЖ - внеклеточная жидкость ДДАВП- 1-дезамино(8-Ц-аргинин)-вазопрессин, десмопрессин
ННД - нефрогенный иесахарный диабет
НПП - натрийуретический пептид предсердия
ОАК - общий клинический анализ крови СМЖ - спинномозговая жидкость СНСАВП - синдром нарушения секреции АВП
ЦНД - центральный несахариый диабет ЦНС - центральная нервная система
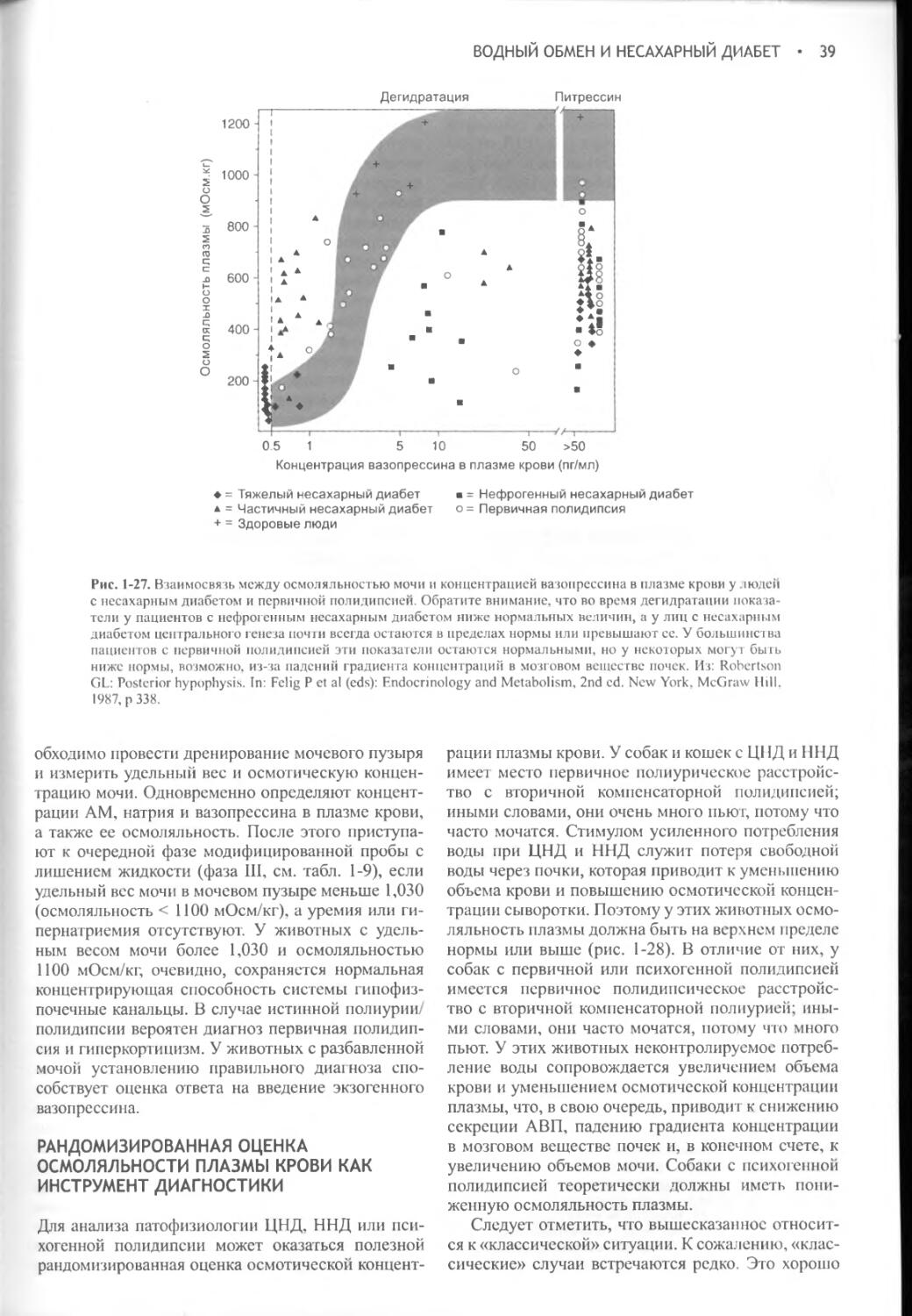
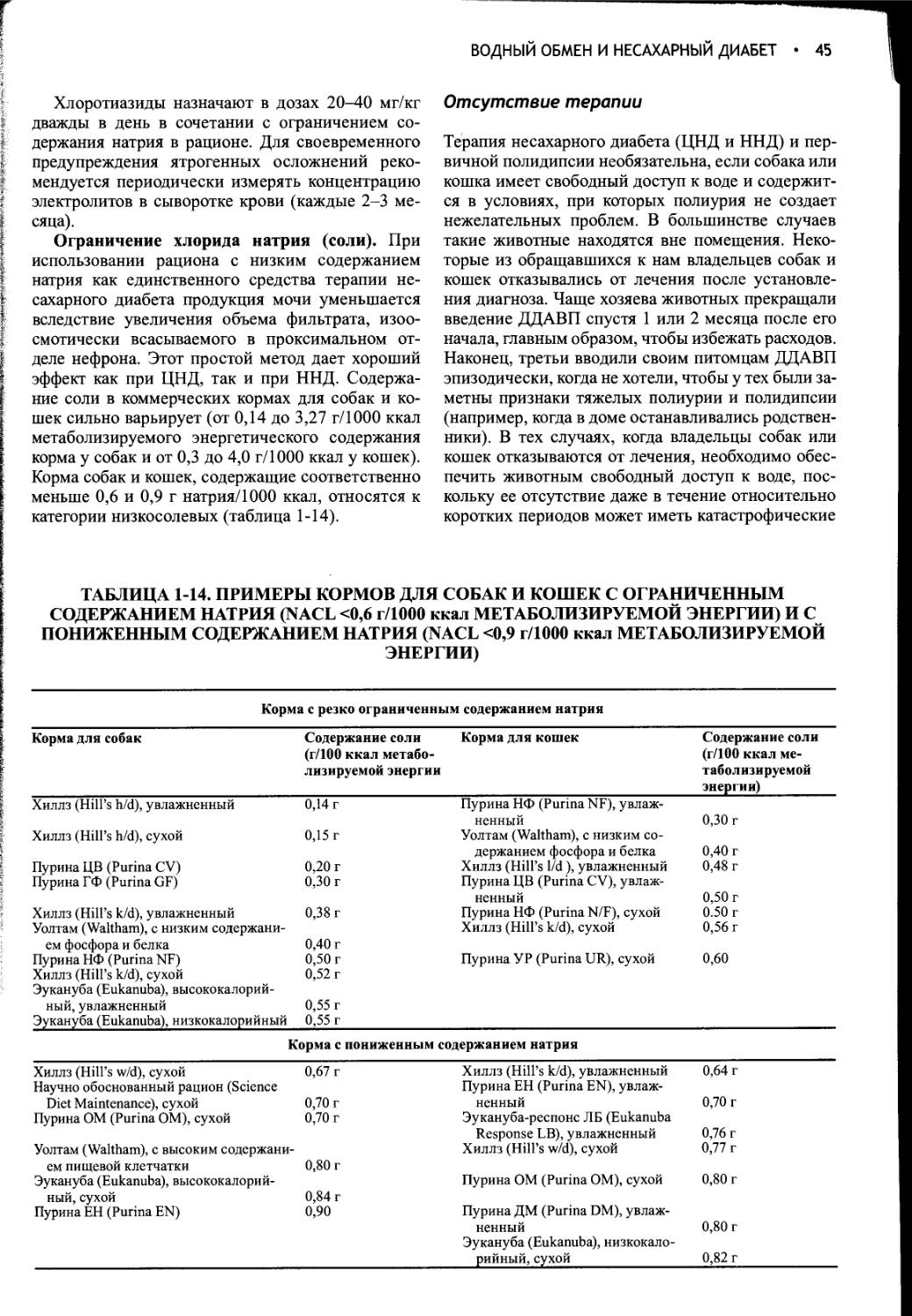
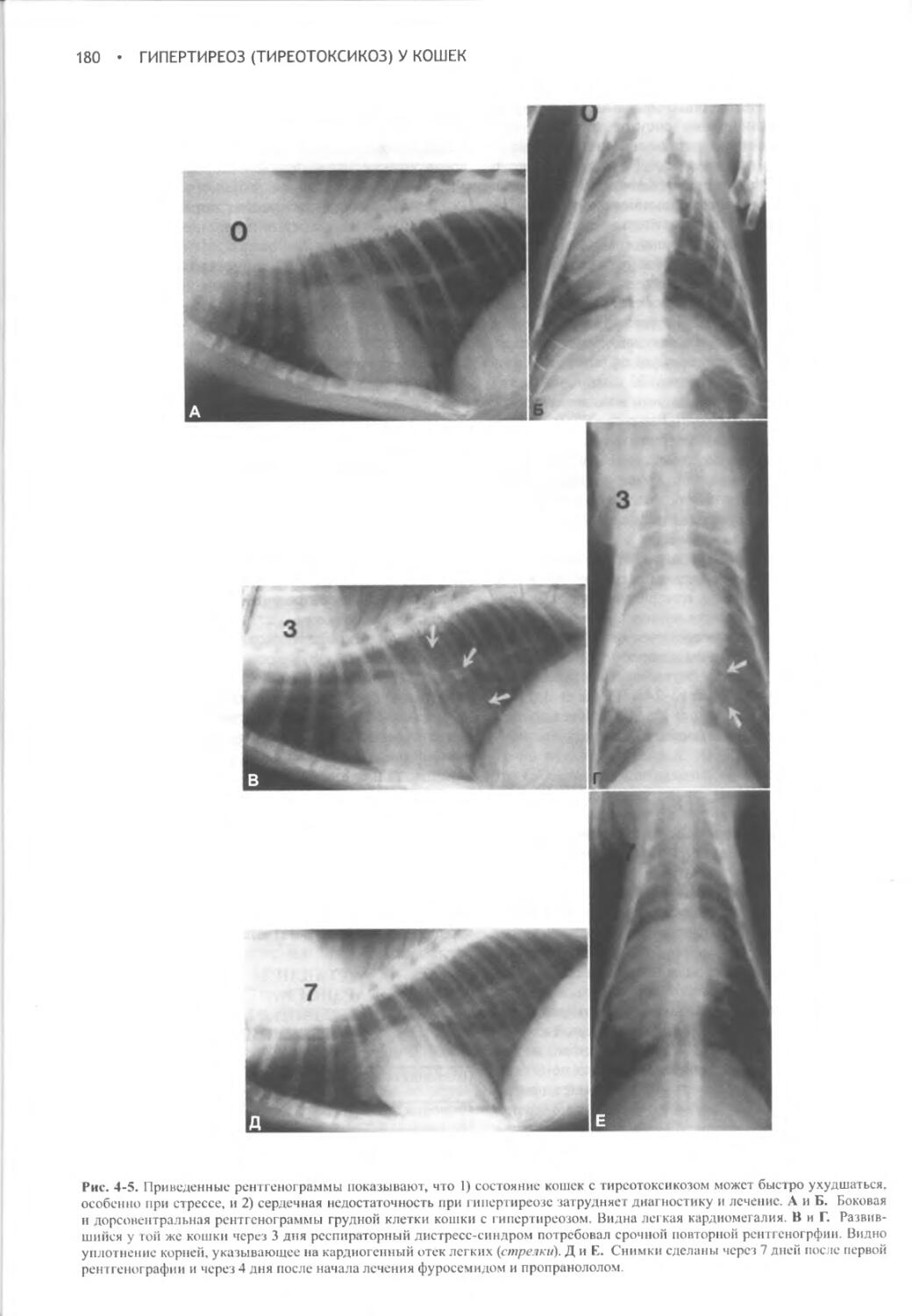
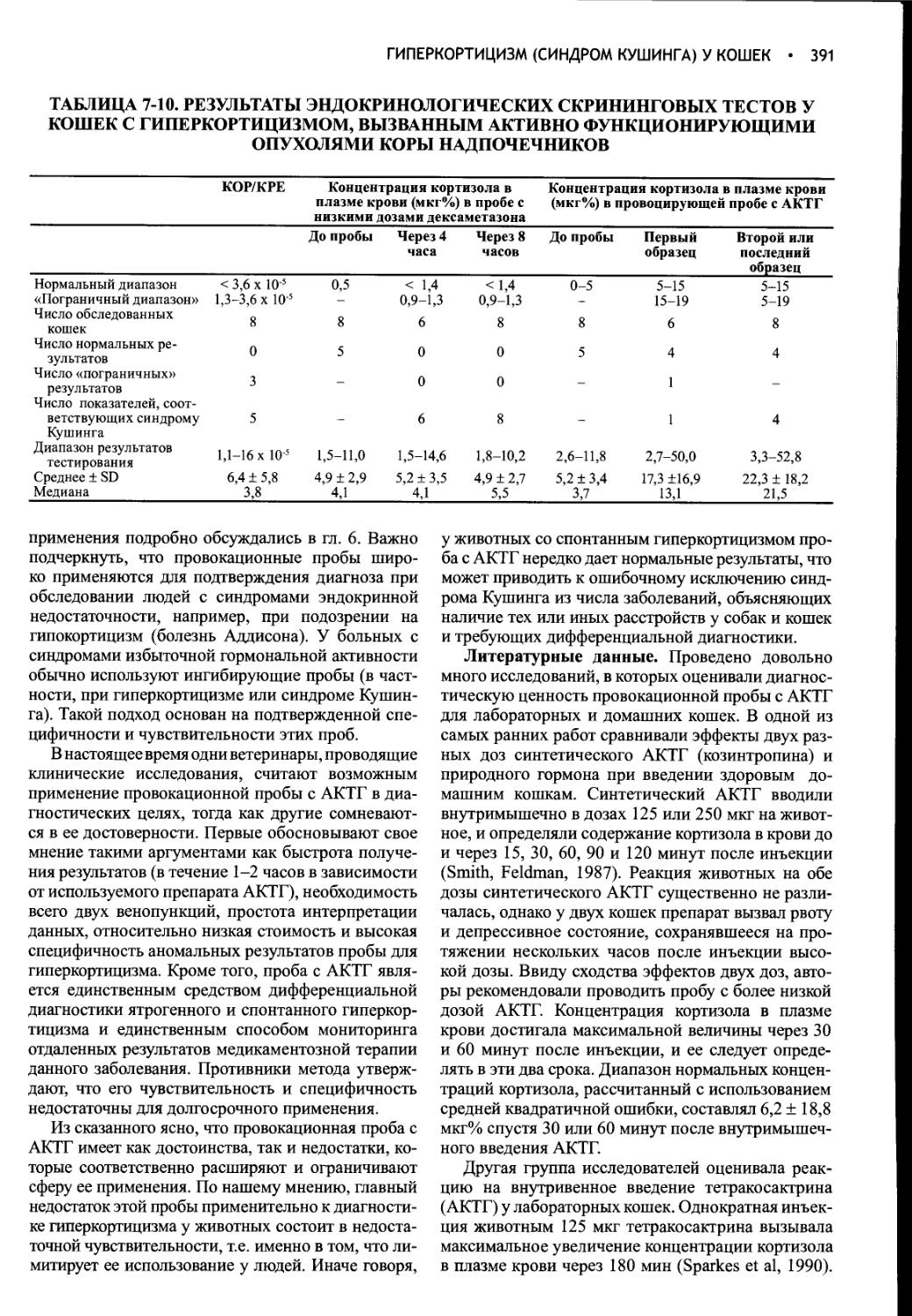
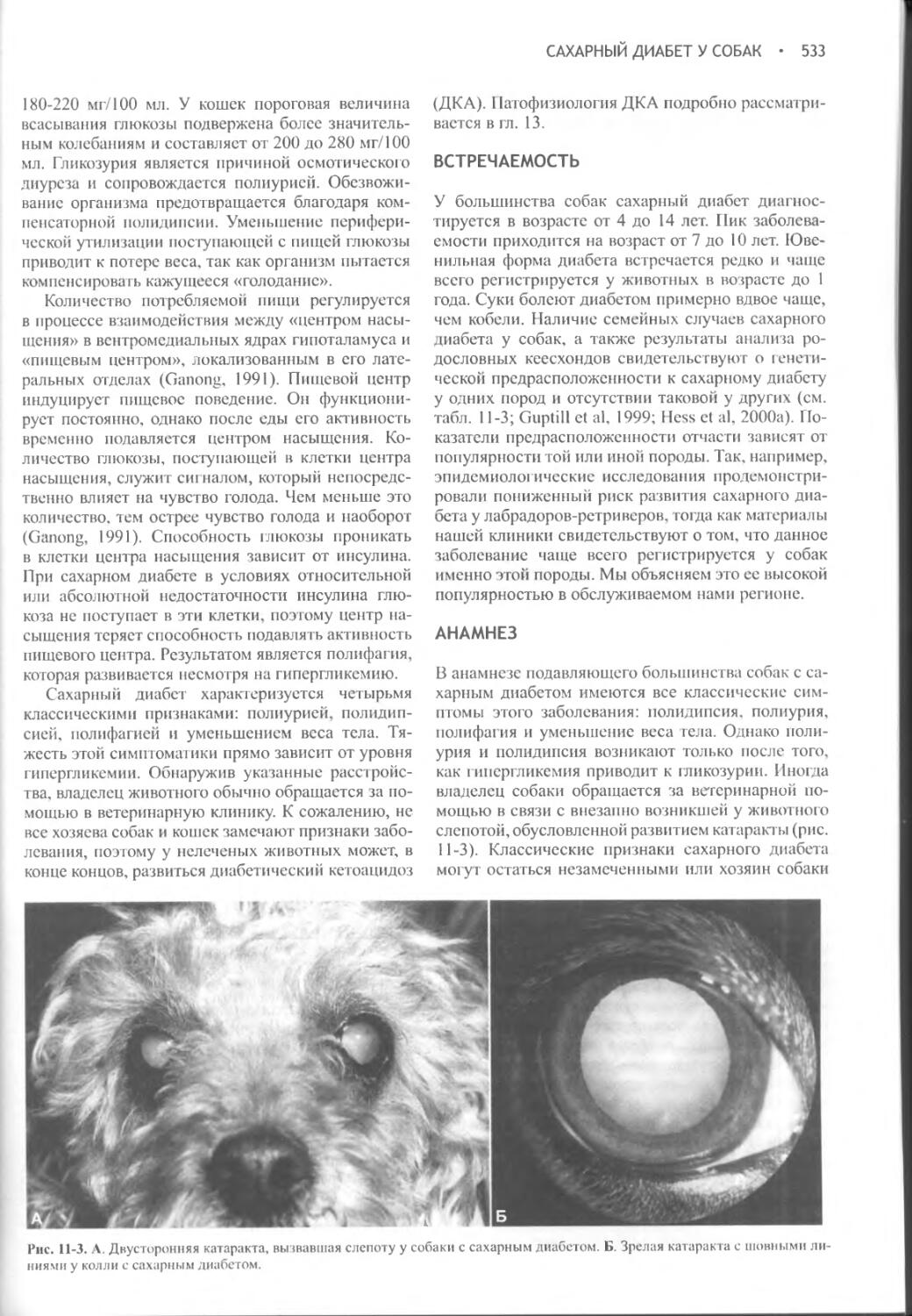
Потребление воды и образование мочи контролируются в процессе сложного взаимодействия между осмоляльностью плазмы крови, объемом жидкости в сосудистой системе, питьевым центром, почками, гипофизом и гипоталамусом. Функциональное расстройство на любом из этих уровней приводит к клиническим проявлениям полиурии и полидипсии. Вазопрессин (аитидиуретический гормон, АДГ) играет ключевую роль в регуляции всасывания воды почками, образования и концентрации мочи, а также водного баланса. При наличии вазопрессина в условиях дегидратации средняя осмотическая концентрация мочи собак и кошек составляет 2300 мОсм/кг или выше. В отсутствие вазопрессина или его действия на почки концентрация мочи может понижаться до 20 мОсм/кг.
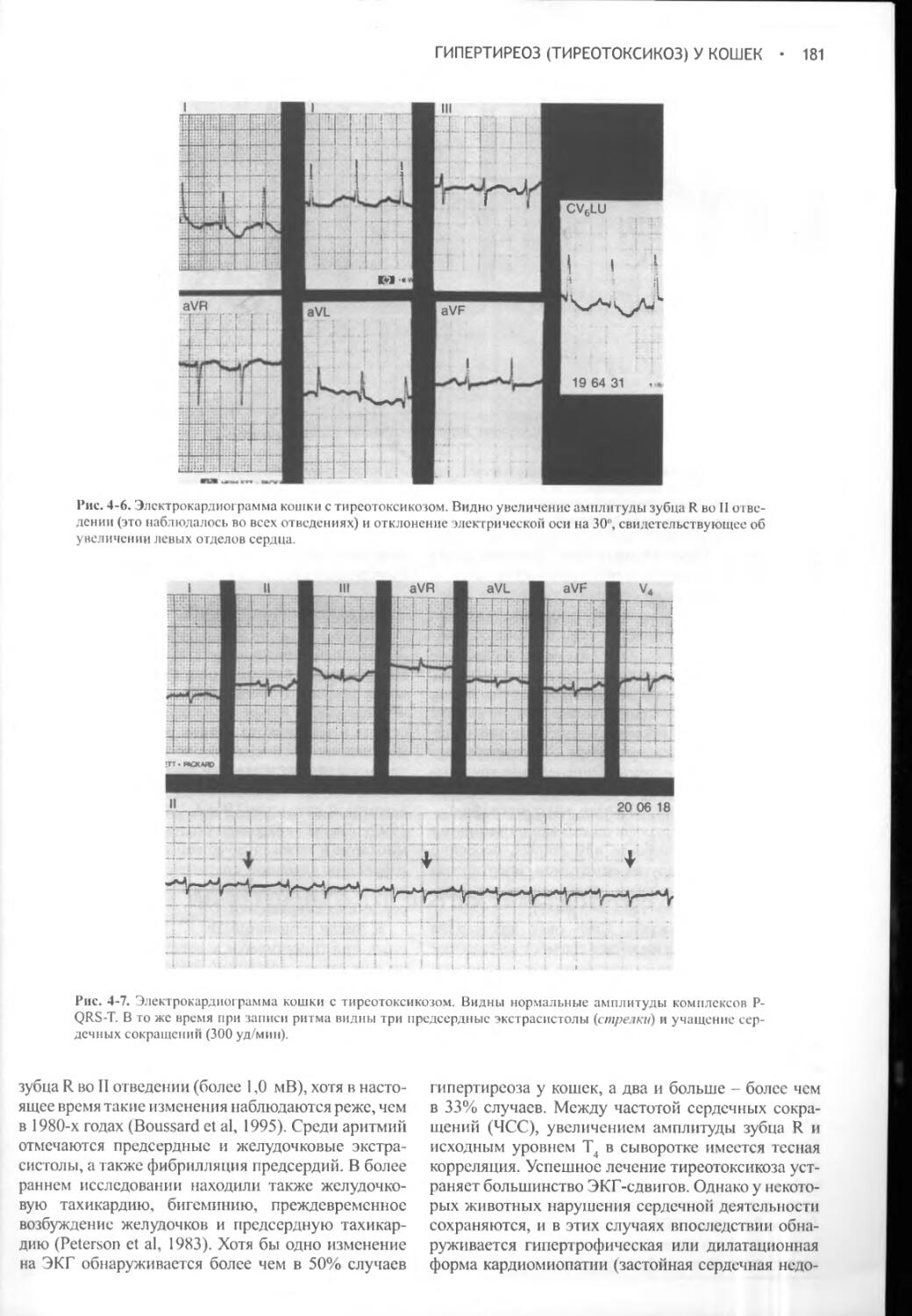
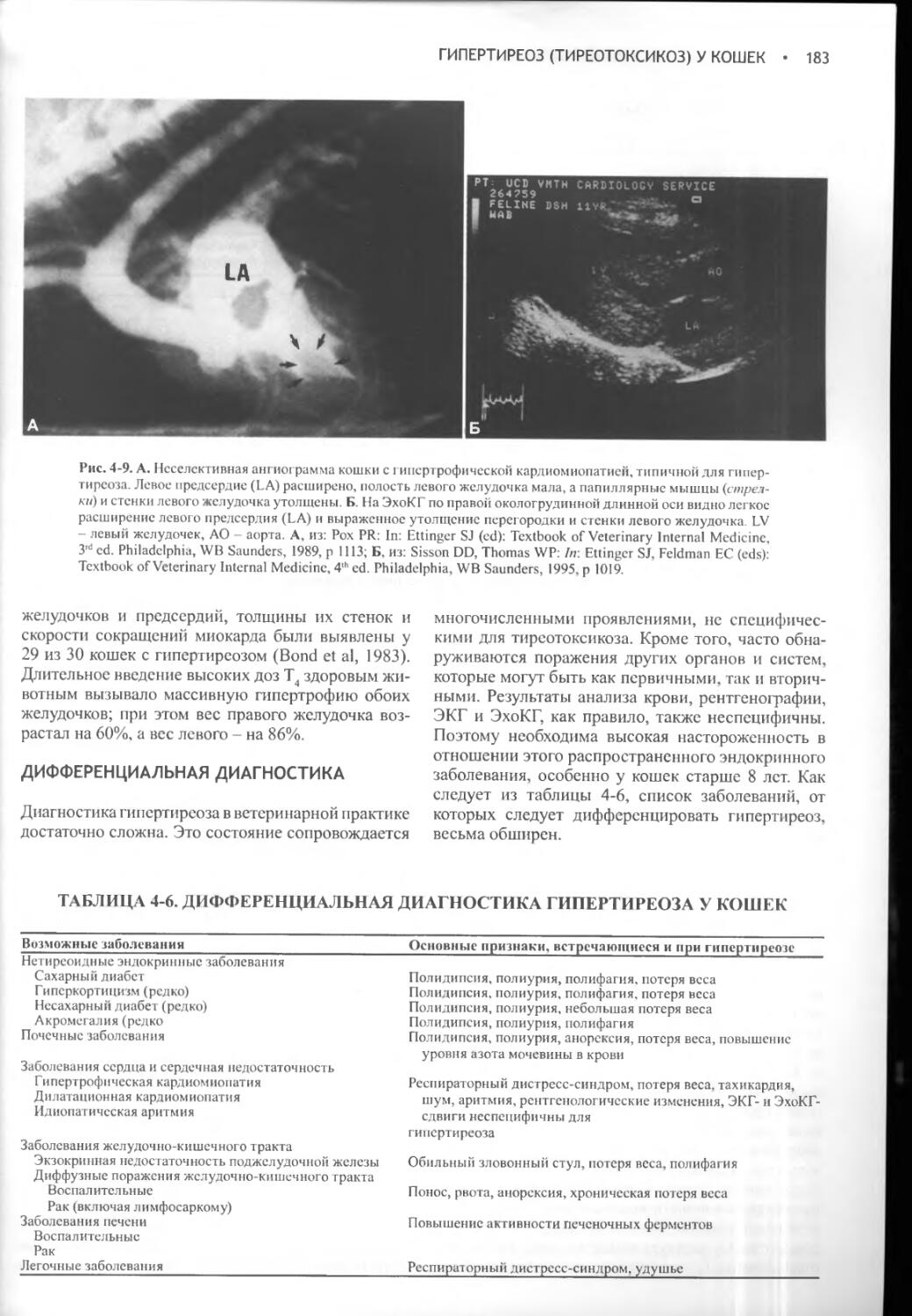
Несахарный диабет развивается при недостаточной секреции вазопрессина или его неспособности нормально взаимодействовать с рецепторами, локализованными в клетках дистальных и извитых почечных канальцев. При любом из этих расстройств нарушается способность удерживать воду и концентрировать мочу, что, в свою очередь, приводит к ее разведению и вызывает компенсаторную полидипсию. Полиурия и полидипсия явно выражены как
при сахарном, так и несахарном диабете, поэтому оба заболевания исторически определяются термином «диабет». Однако, в отличие от сахарного диабета, при котором моча имеет сладковатый вкус из-за присутствия сахара при несахарном диабете она безвкусна, так как полиурия не связана с индуцируемым глюкозой осмотическим диурезом.
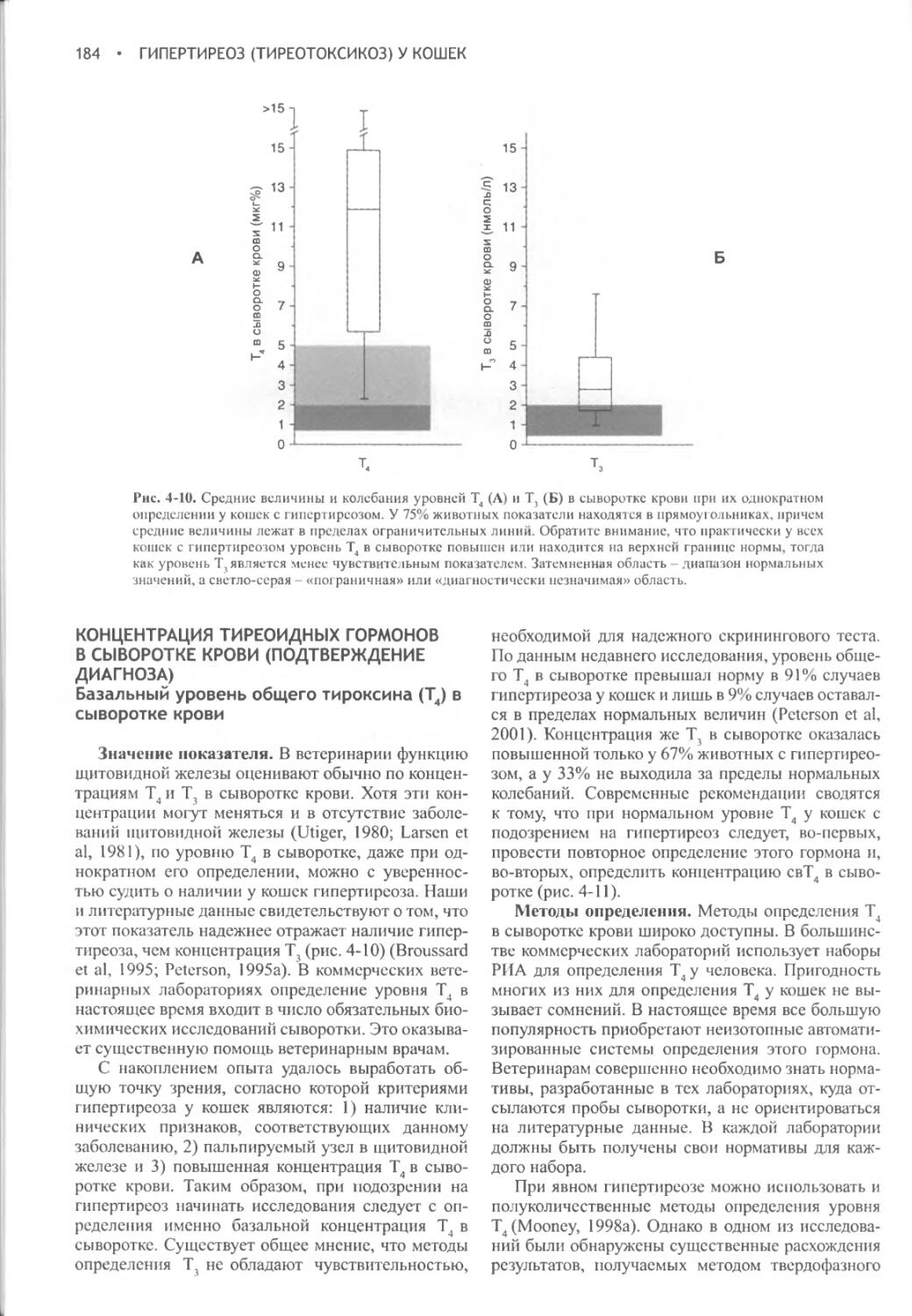
ФИЗИОЛОГИЯ ВОДНОГО ОБМЕНА
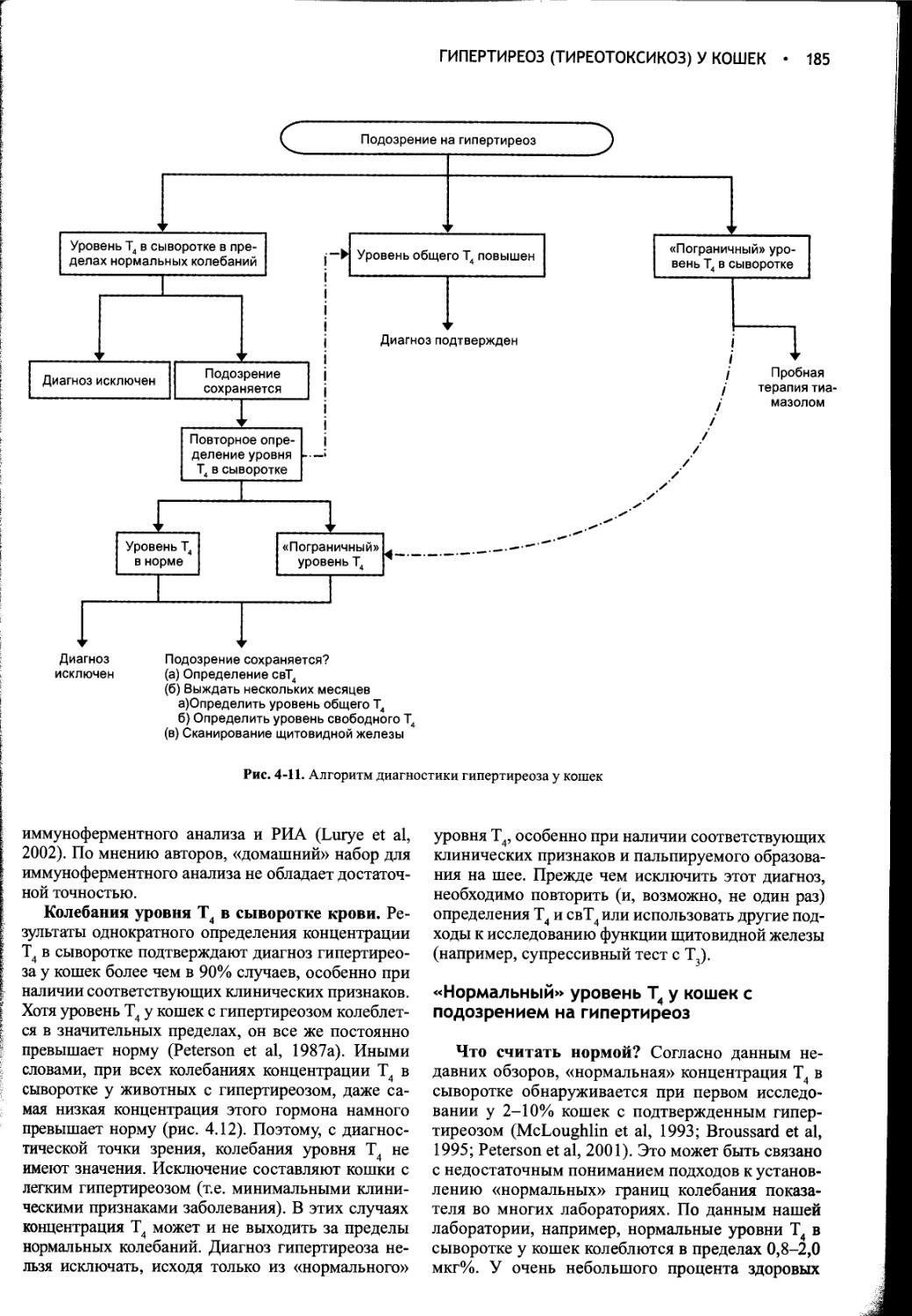
Общая характеристика. Изменения осмоляльности плазмы крови и ее главной детерминанты - концентрации ионов натрия обычно происходят в очень узком диапазоне. Такое постоянство обусловлено, главным образом, поддержанием равновесия между общим содержанием воды в организме и концентрацией натрия в сыворотке крови. Водный баланс регулируется интегрированной системой, обеспечивающей точный контроль потребления воды и ее выведения; этот контроль осуществляется соответственно через питьевой центр и через стимуляцию секреции вазопрессина (рис. 1-1). Основное количество воды выводится из организма собак и кошек с мочой, калом и через дыхательные пути. У человека в условиях свободного потребления воды
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 3
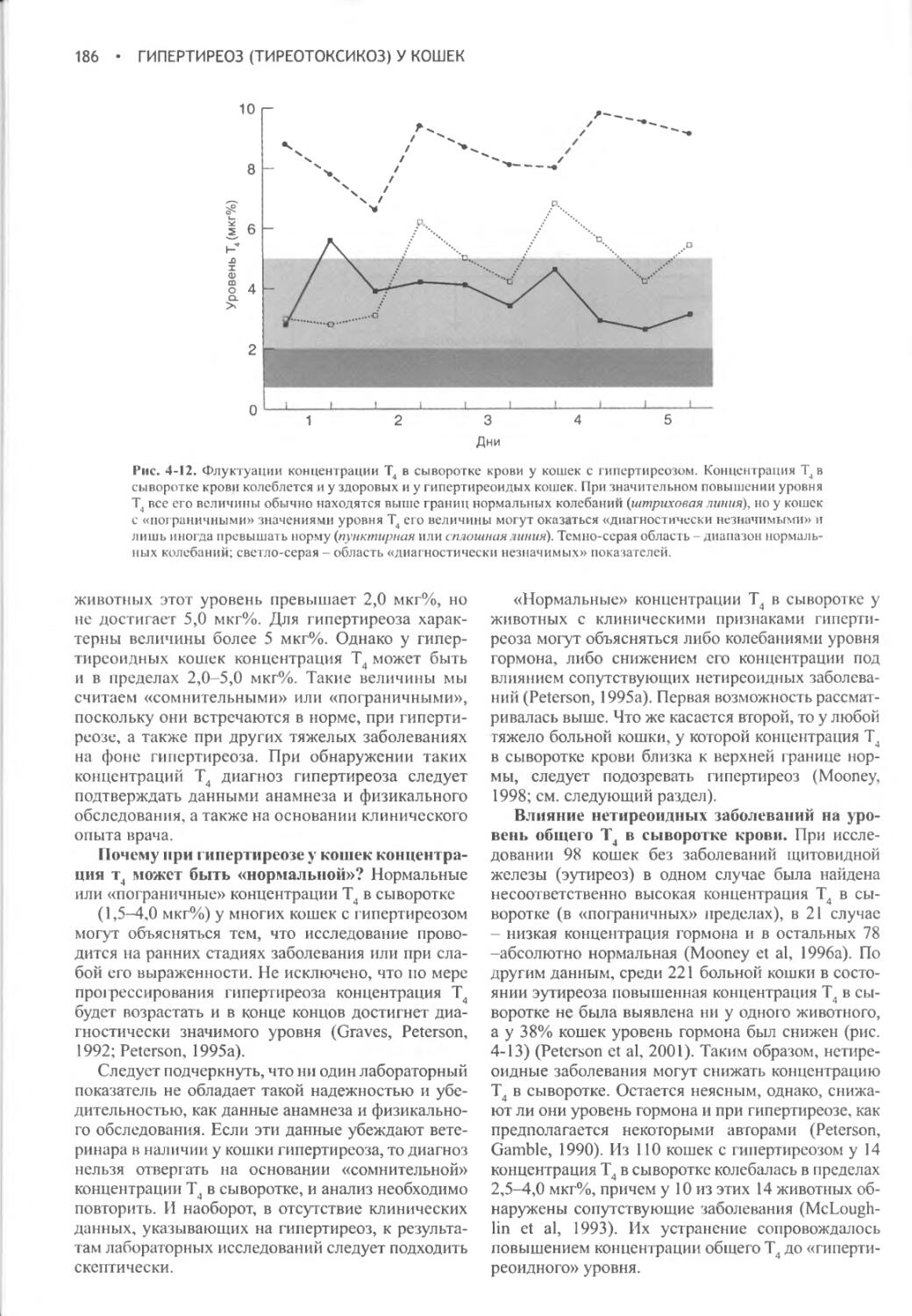
Увеличение
Уменьшение объема
осмоляльности ВКЖ на 2%
циркулирующей крови на 10%
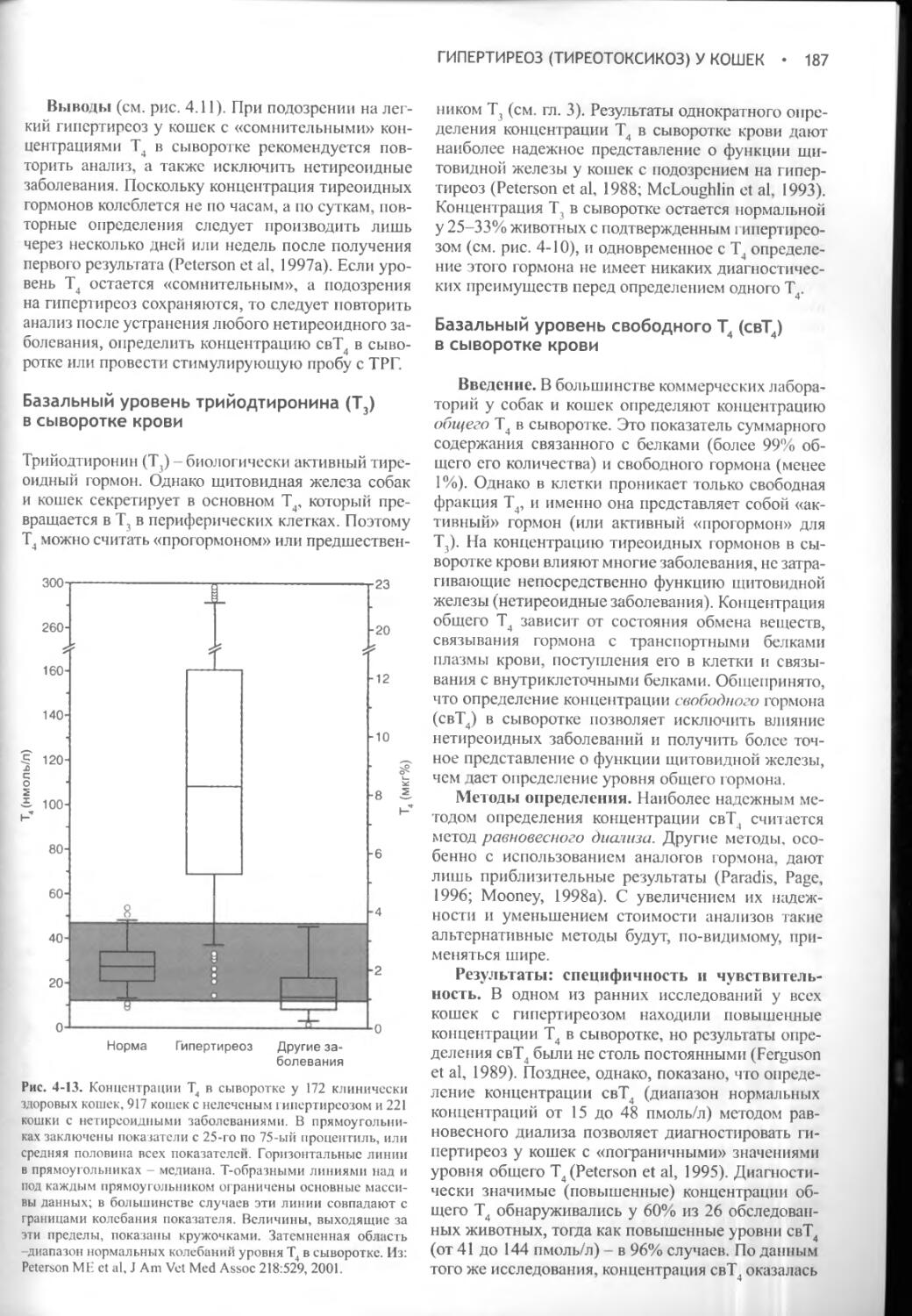
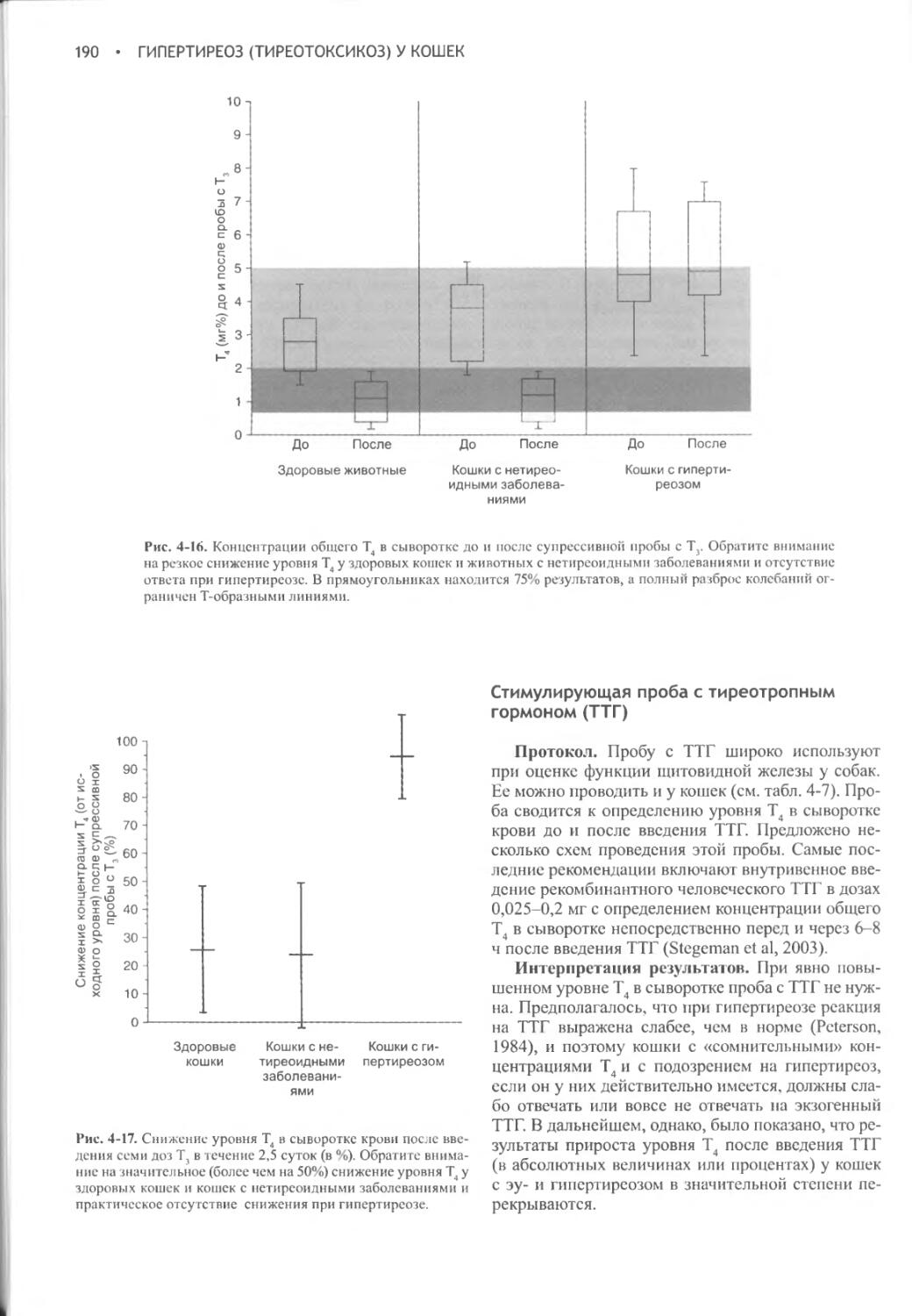
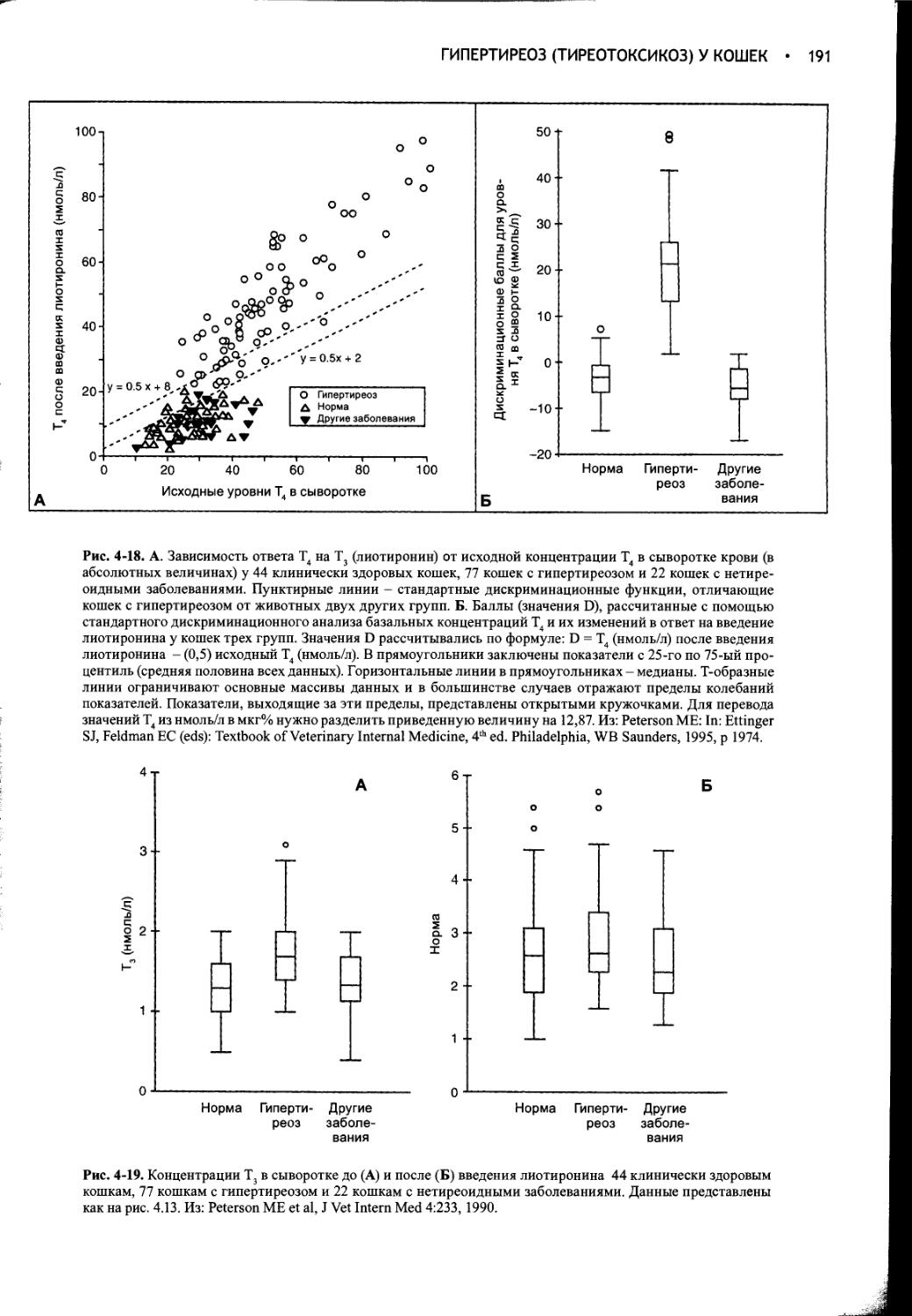
ПНП
Объем циркулирующей крови i|r Осмоляльность ВКЖ
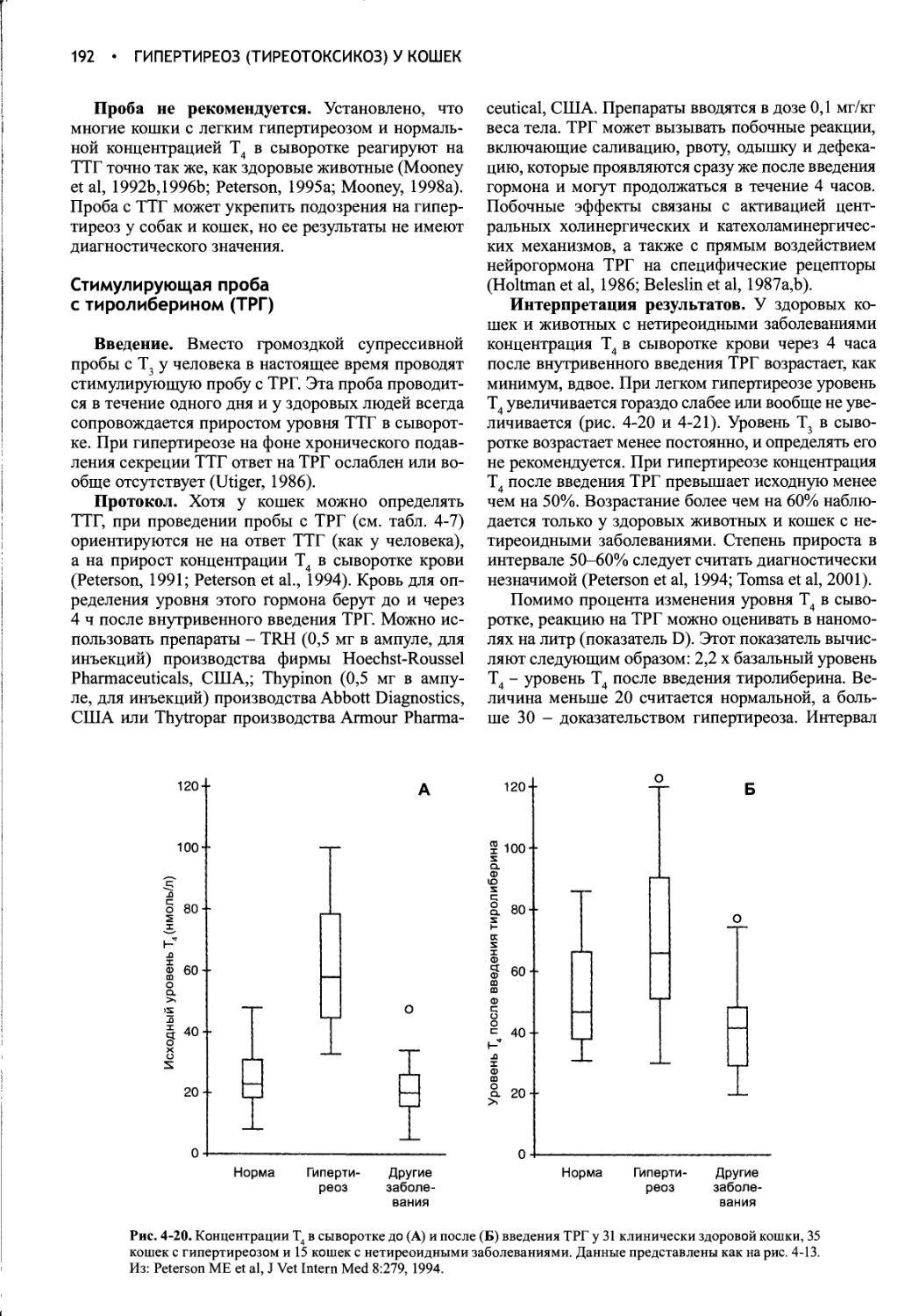
ПНП
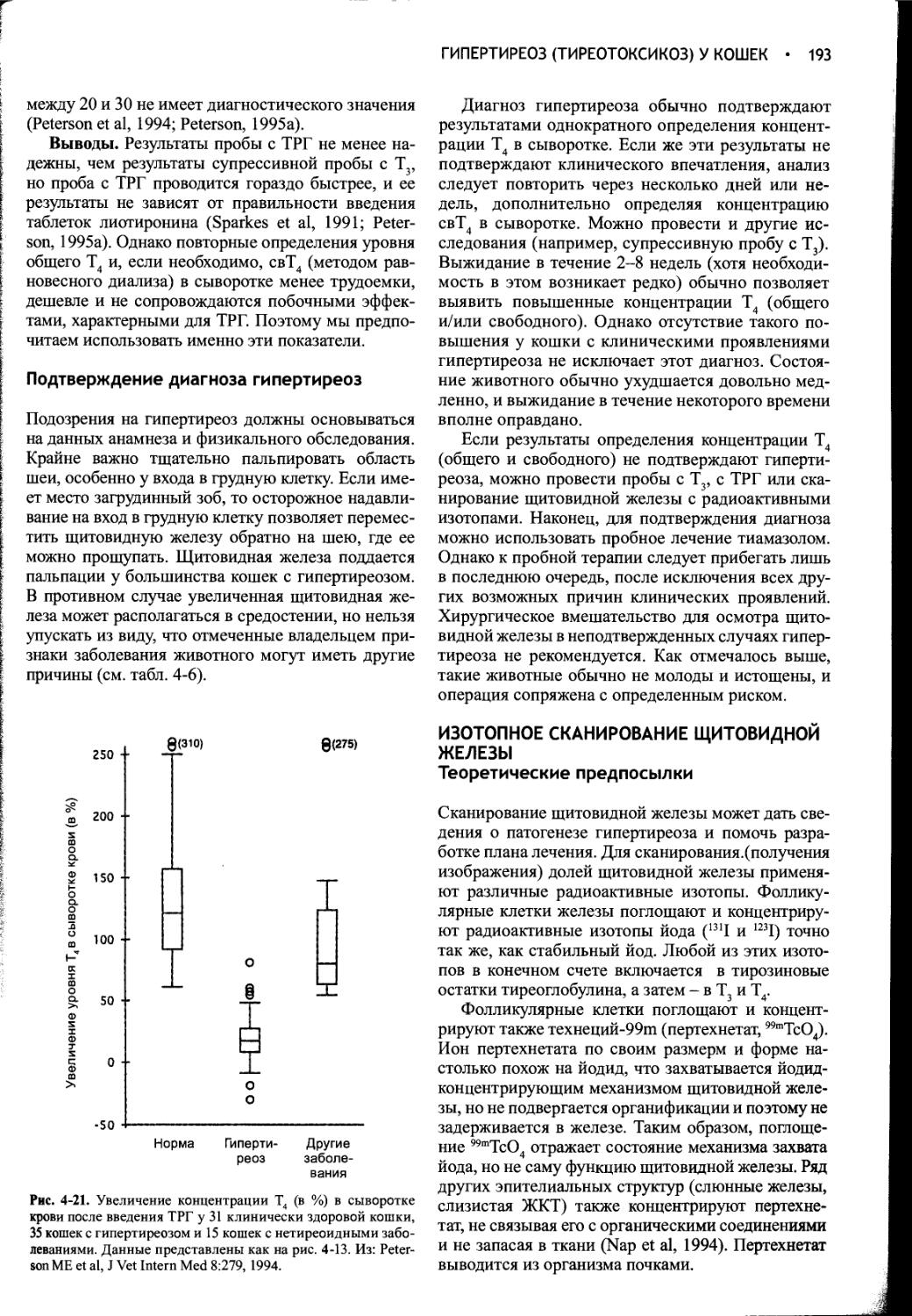
Рис. 1-1. Схема, иллюстрирующая первичные механизмы поддержания водного баланса. Жирные линии указывают осмотически индуцируемые пути, а пунктирные линии - пути, зависимые от объема. ПНП - предсердный натриуретичес-кий пептид, АДГ - антидиуретический гормон, ЦНС - центральная нервная система, ВКЖ - внеклеточная жидкость, ОФР - орофарингеальный рефлекс. Из: Reeves WB, Andreoli ТЕ: The Posterior Pituitary and Water Metabolism. In: Wilson JD, Foster DW (eds.) Williams Textbook of Endocrinology, 8th ed., Philadelphia, W.B.Saunders, 1992, p 311.
ее общее содержание в организме редко изменяется более чем на 1-2% (Aron et al., 2001). Большая часть воды, необходимой для поддержания гомеостаза, поступает при питье и лишь относительно небольшое количество с пищей.
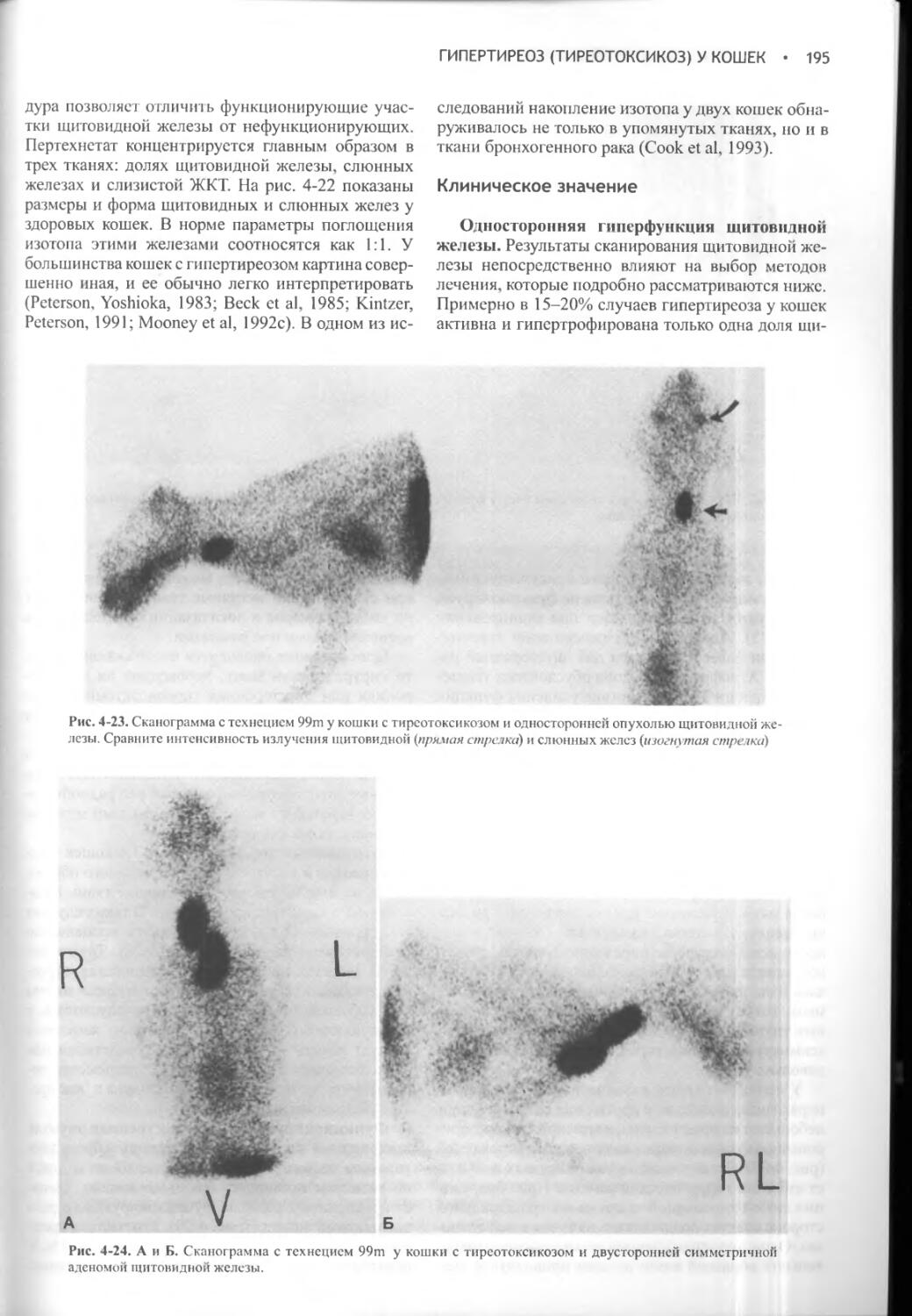
Важную роль в поддержании водного баланса играет способность почек продуцировать концентрированную мочу. Животные получают рацион, обеспечивающий образование осмотически активных продуктов, которые в конечном счете выводятся с мочой; для их экскреции необходима вода. Чем
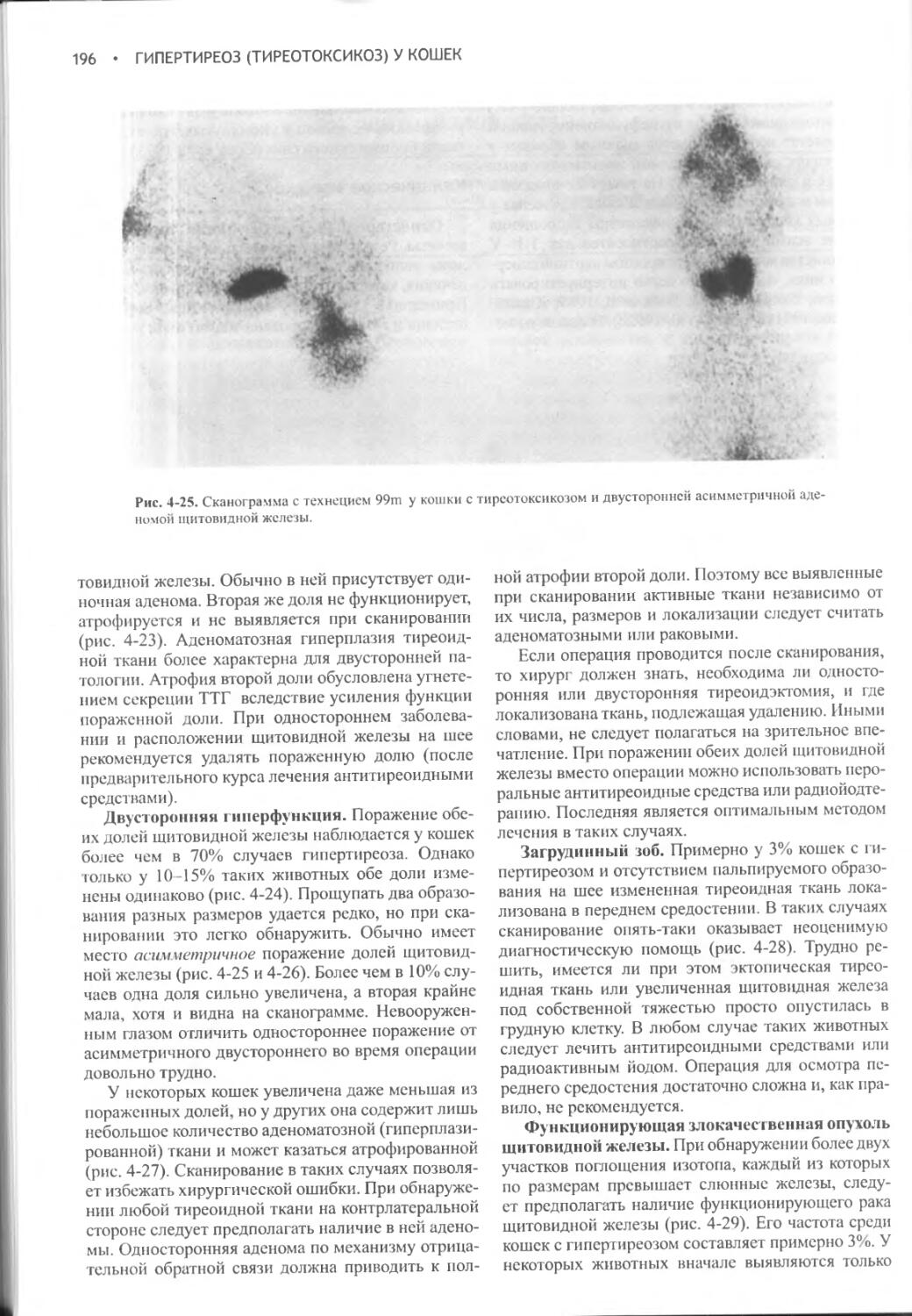
выше концентрация мочи, образующейся в почках, тем меньше воды требуется для выведения указанных продуктов.
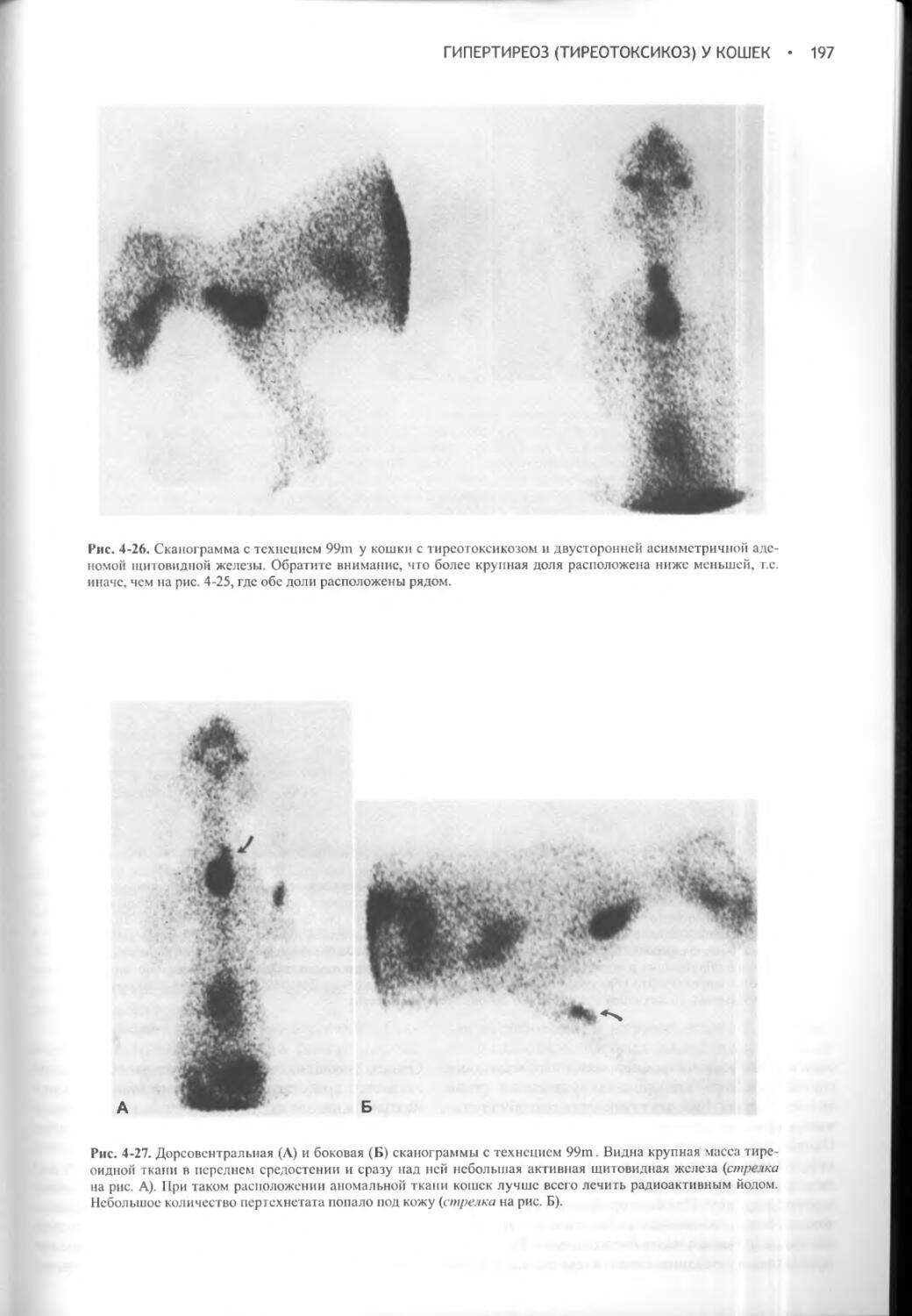
Механизмы концентрации мочи уменьшают, но не могут полностью предотвратить выведение воды. Даже в тех случаях, когда у животных образуется максимально концентрированная моча, неизбежны довольно значительные потери жидкости. Они еще более возрастают в условиях повышенной температуры окружающей среды, когда значительное количество жидкости теряется в процессе рассеяния тепла при учащенном дыхании. Содержание жидкости в организме восстанавливается только благодаря повышенному потреблению воды. Неудивительно поэтому, что механизмы контроля жажды питьевым центром и секреции вазопрессина имеют много общего.
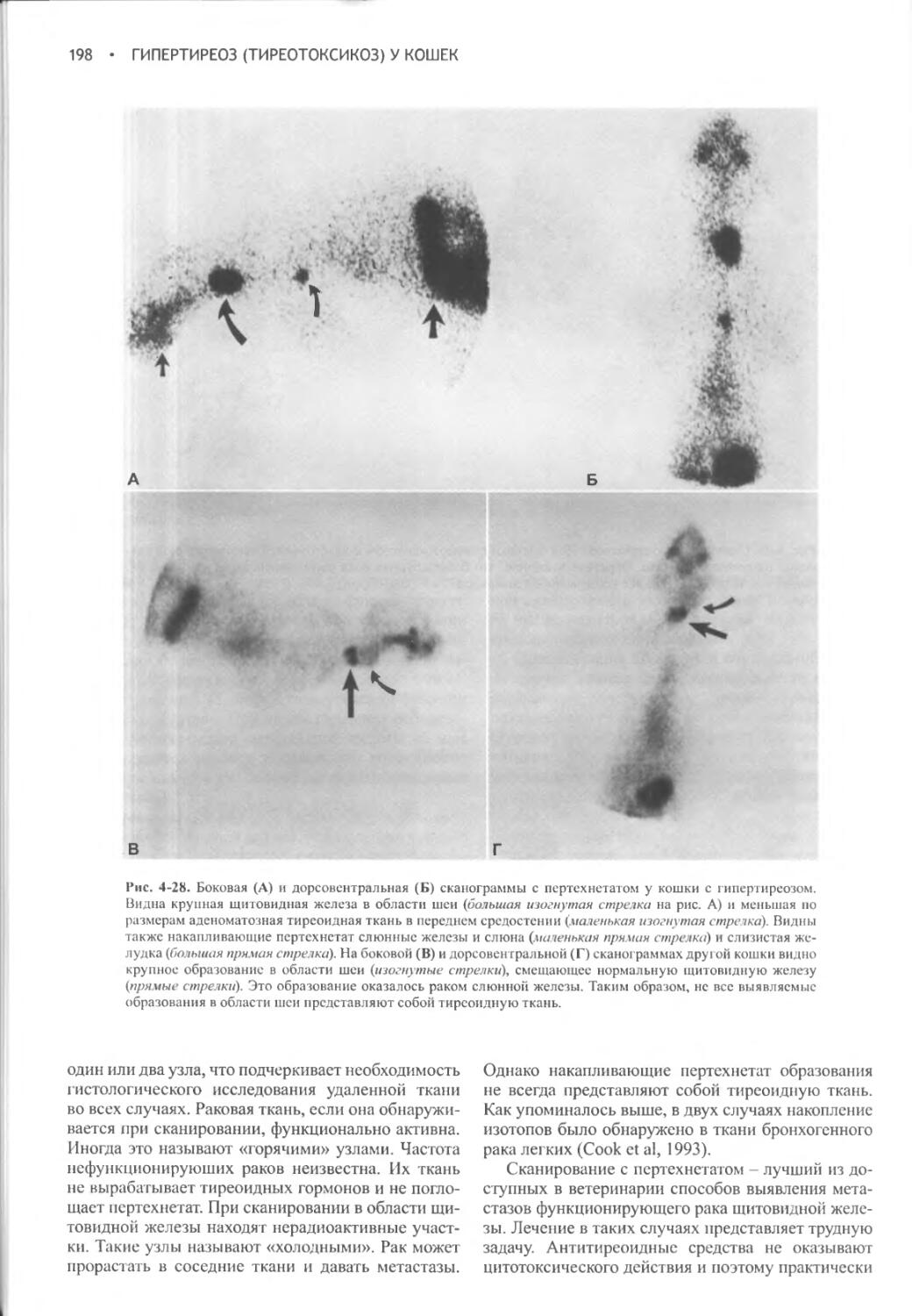
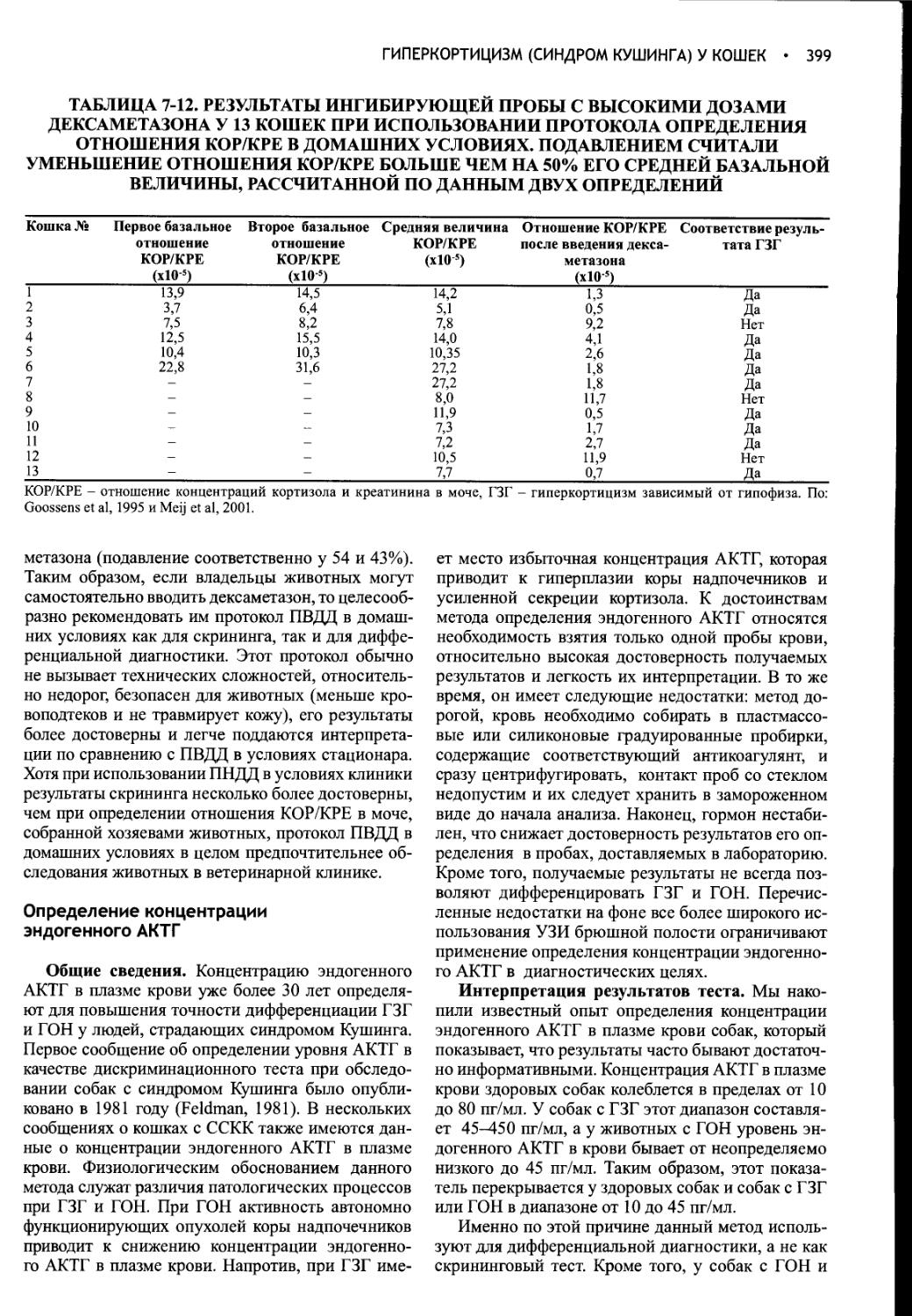
Нейрогипофиз. Нейрогипофиз представляет собой совокупность следующих структур: гипоталамических ядер (супраоптического и паравентри-кулярного), обеспечивающих синтез окситоцина и вазопрессина; аксонов этих нейронов, которые образуют супраоптикогипофизарный тракт, и их нервных окончаний в задней доле гипофиза (рис. 1-2; Reeves et al, 1998). Нейросекреторные клетки паравентри-кулярного и супраоптического ядер выделяют вазопрессин и окситоцин в ответ на соответствующую стимуляцию. Они получают нейрогенные сигналы от разнообразных сенсорных элементов, к числу которых относятся барорецепторы низкого давления, имеющиеся в сердце и артериальных сосудах, и два околожелудочковых органа - субфорникальный орган и васкулезный орган терминальной пластинки. Эти органы лежат за пределами гематоэнцефалического барьера и могут принимать участие в осморецепции и взаимодействии с гормонами крови, в частности с ангиотензином II.
Вазопрессин: биосинтез, транспорт и обмен. Вазопрессин и окситоцин представляют собой нонапептиды, состоящие из шестичленного дисульфид-
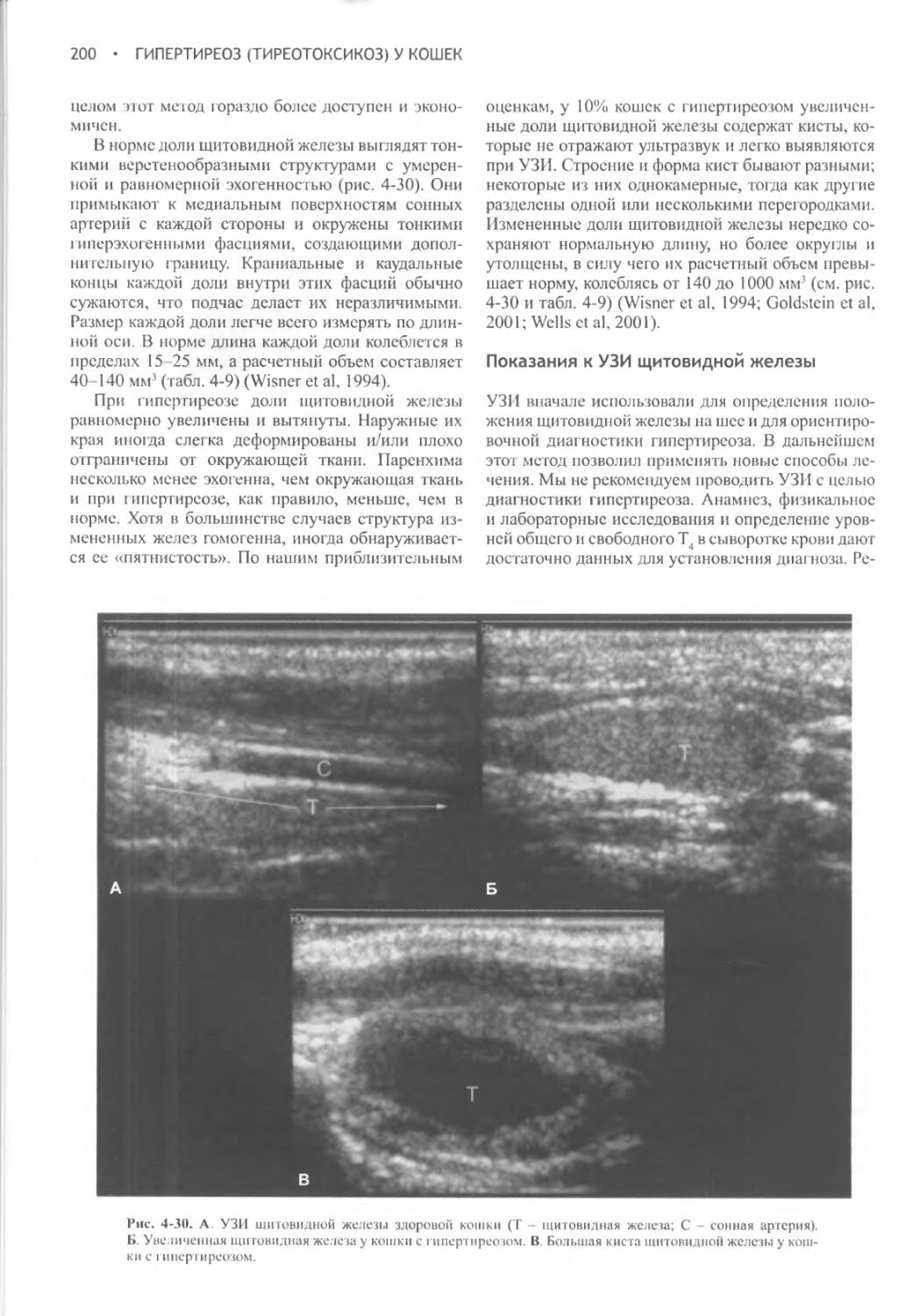
Ножка гипофиза (pars tuberalis)
Сосцевидное тело
Зрительный перекрест
Нервные окончания на синусоидных капиллярах
Гипоталамо-нейрогипо-физарные пути
Супраоптическое X
ядро I
Паравентрикулярное ? Гипоталамус
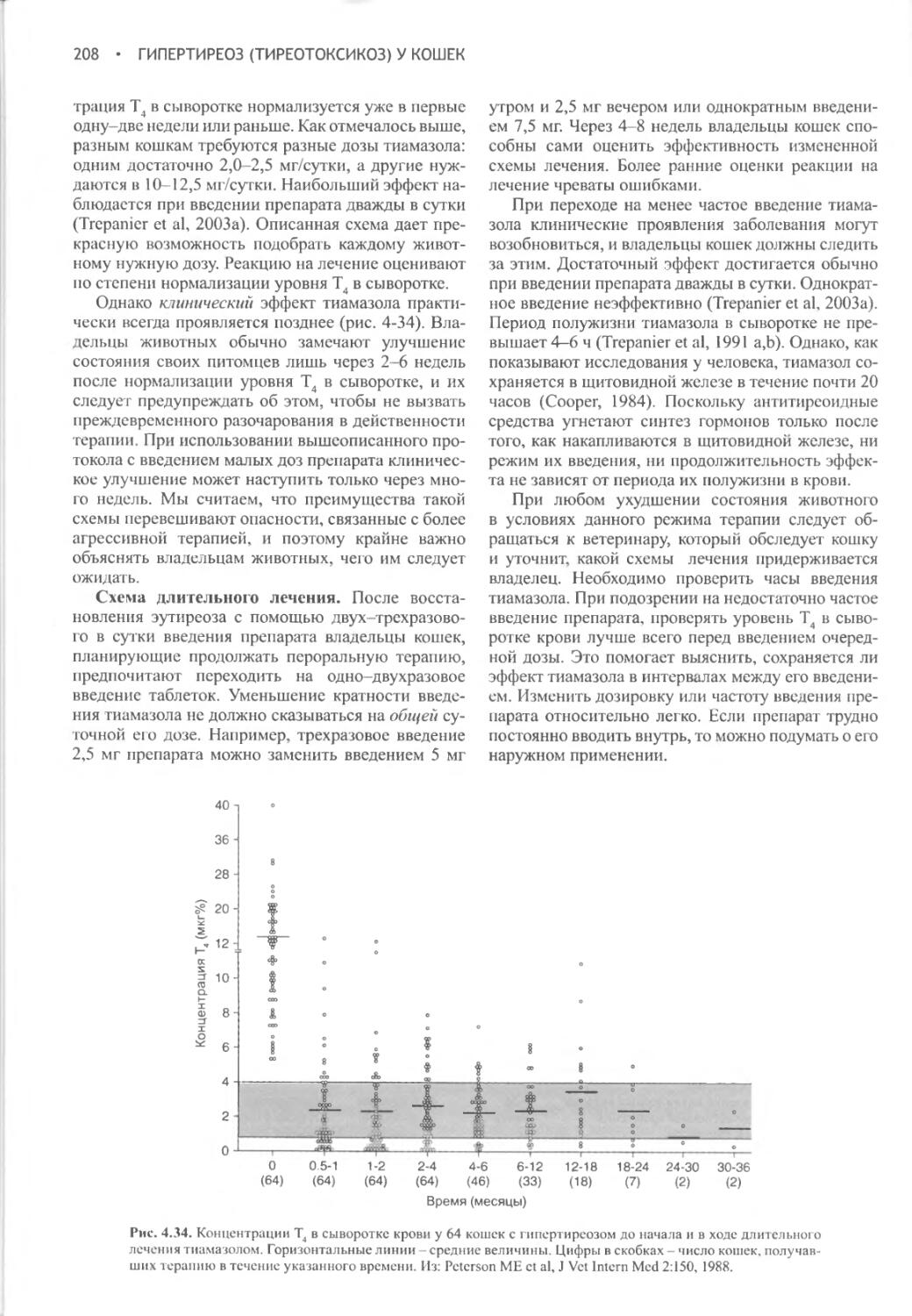
ядро J
Pars intermedia (пере- X дняя доля гипофиза) I Pars distalis (задняя \ Гипофиз доля гипофиза) I Нейрогипофиз J
Рис. 1-2. Схема, иллюстрирующая взаимосвязи между синтезирующими гормоны отделами гипоталамуса и гипофиза
4 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
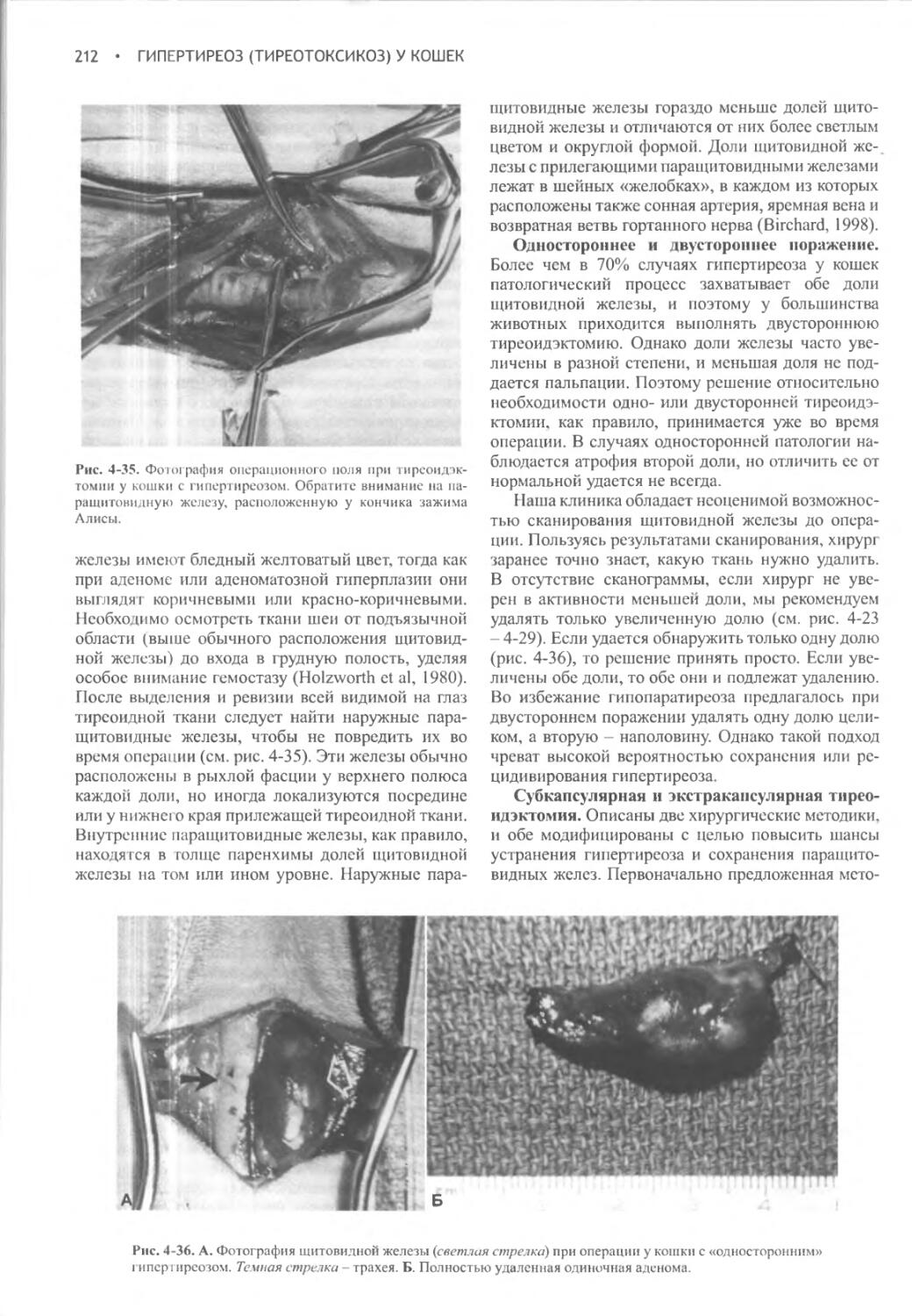
Положение
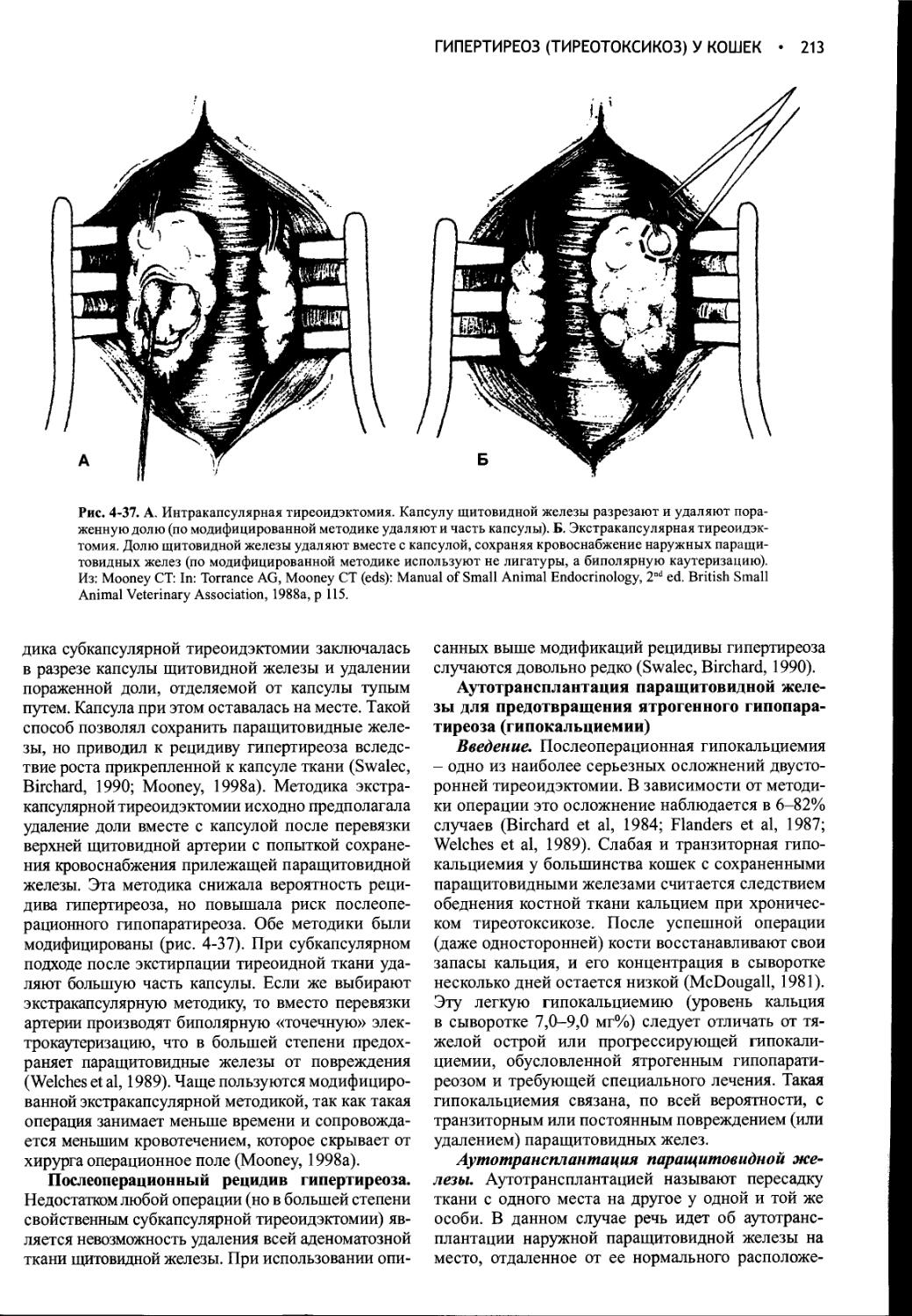
1
3
4
4
5
6
7
8
9
Окситоцин
NH2
Цистеин -
I
Тирозин
I
Изолейцин
I
Глютамин
I
Аспарагин
I
Цистеин —
Пролин
I
Лейцин
I
Глицинамид
Вазопрессин
NH2
Цистеин--------
I
Тирозин
I s
Фенилаланин
Глютамин
I S
Аспарагин
I
Цистеин--------
I
Пролин
I
Аргинин
I
Глицинамид
ДДАВП
Цистеин —
Тирозин
I
Фенилаланин
I
Глютамин
I
Аспарагин
I
Цистеин —
I
Пролин
D-аргинин
Глицинамид
Рис. 1-3. Структура окситоцина, вазопрессина и 1-дезамино (8-В-аргинин)-вазопрессина (ДДАВП)
него кольца и прямой трехчленной цепи с амидиро-ванной концевой карбоксильной группой (рис. 1-3). Аргинин-вазопрессин (АВП) - это антидиуретичес-кий гормон, имеющийся у всех млекопитающих, кроме свиней и других представителей подотряда Suina, которые синтезируют лизин-вазопрессин (Reeves et al, 1998). У большинства млекопитающих вазопрессин отличается от окситоцина только замещением изолейцина на фенилаланин в кольце и лейцина на аргинин в трехчленной цепи. Замена L-аргинина в положении 8 на D-аргинин значительно повышает отношение антидиуретической активности вазопрессина к его прессорной активности. Такая модификация, так же как удаление концевой аминогруппы из цистеинового остатка, приводит к образованию 1 -дезамино(8-О-аргинин)-вазопресси-на (ДДАВП), коммерческого синтетического препарата (см. рис. 1-3). ДДАВП является клинически эффективным аналогом вазопрессина с более высокой и пролонгированной антидиуретической активностью, применение которого не требует инъекций.
Образование вазопрессина и окситоцина сопряжено с синтезом специфических связывающих белков, называемых нейрофизинами. Одна молекула нейрофизина I, который стимулируется эстрогенами, связывает одну молекулу окситоцина, а каждая молекула нейрофизина II, который стимулируется никотином, связывает одну молекулу вазопрессина (Reeves et al., 1998). Комплекс гормона с нейрофи-зином нередко называют нейросекреторным материалом; он транспортируется по аксонам гипота-ламо-гипофизарного нервного тракта и запасается в составе гранул нервных окончаний в задней доле гипофиза (см. рис. 1-2). Вазопрессин высвобождается в кровяное русло при электростимуляции нейросекреторных клеток, содержащих АВП. Секреция осуществляется путем экзоцитоза и приводит к пос
туплению в кровь вазопрессина и нейрофизина II. В плазме крови комплекс вазопрессина и нейрофизина распадается с высвобождением свободного гормона. Практически весь вазопрессин присутствует в плазме в несвязанном виде; благодаря его относительно небольшой молекулярной массе он легко проникает через стенки периферических и клубочковых капилляров. Метаболическая деградация АВП, по-видимому, происходит в результате его связывания со специфическими рецепторами и последующего протеолитического расщепления гормона (Reeves et al, 1998). Другим механизмом выведения циркулирующего в крови вазопрессина служит почечная экскреция; этим путем осуществляется метаболический клиренс примерно четверти всего количества вазопрессина.
Действие вазопрессина. Действие на клетки. Действие АВП опосредуется через тканевые рецепторы, относящиеся к классу V) в гладкой мускулатуре и классу V2 в почечном эпителии (Reeves et al, 1998). Только последние активируют аденилатциклазу. Антидиуретическая активность АВП реализуется в процессе взаимодействия с V2-рецепторами, зависимыми от циклического АМФ, тогда как его сосудосуживающее действие опосредуется через рецепторы V), зависимые от фосфатидилинозитола. Вазопрессин стимулирует рецепторы классов V, и V2, а его аналог десмопрессин (ДДАВП), который обычно используется для лечения несахарного диабета центрального генеза, обладает высоким сродством только к У2-рецепто-рам, проявляя при этом минимальную прессорную (опосредуемую через Vj-рецепторы) активность.
Антидиуретическое действие АВП в основном направлено на повышение проницаемости концевых сегментов нефронов или собирательных трубочек.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 5
Барбитураты
Бета-адренергические средства
Карбамазепин
Холинергические препараты
Хлорпропамид
Клофибрат
Наркотические средства
Никотин
Окись азота
Трициклические антидепрессанты
Винкристин
Демеклоциклин Галотан
Литий
Метоксифлуран
Альфа-адренергические средства Эндотоксин E.coli Глюкокортикоиды Гиперкальциемия Гипокалиемия
Хлорпропамид
б'-АМФ
киназы
Нейрогипофиз
Этанол
Глюкокортикоиды
Фенитоин
Хлорпропамид
ФДЭ
Вазопрессин
АТФ
ПГЕ
Выстилка просвета
Нестероидные противовоспалительные средства
Клетки собирательной трубочки
АК
Н2О
базолатеральная мембрана
АК
ПГЕ
Интерстициальные клетки мозгового вещества почек
Рис. 1-4. Влияние отдельных лекарственных средств и электролитов на секрецию и действие вазопрессина. АК - арахидоновая кислота, АЦ - аденилатциклаза, ПГЕ - простагландин Е, АТФ - аденозинтрифосфат, цАМФ - циклический аденозинмонофосфат, ФДЭ - фосфодиэстераза, 5’-АМФ - 5’-аденозинмонофосфат. Из: DeBartola SP: Disorders of sodium and water: Hypernatremia and hyponatremia. In: DiBartola SP (ed.) Fluid Therapy in Small Animal Practice, 2nd ed., Philadelphia, WB Saunders, 2000, p 52.
Эффекты АВП опосредуются преимущественно через внутриклеточный второй посредник цАМФ (рис. 1-4). АВП связывается с У2-рецепторами в чувствительных к нему эпителиальных клетках и активирует мембранную аденилатциклазу, которая катализирует образование цАМФ из АТФ. Зависимая от цАМФ активация протеинкиназной системы приводит к повышению проницаемости люминальных (обращенных в просвет канальца) оболочек эпителиальных клеток посредством внедрения в их апикальный отдел водных каналов, образуемых аквапорином-2. Трансмембранный транспорт воды осуществляется именно через эти каналы, а не путем ее диффузии через липидный бислой либо в участках межклеточных контактов (рис. 1-5; Каппо et al, 1995; Lee at al, 1997). В сущности, АВП, действуя через цАМФ и протеинкиназу, изменяет движение воды в чувствительном к нему эпителии; этот эффект, в реализации которого участвуют такие внутриклеточные структуры, как микротрубочки, достигается путем внедрения в верхушечный (апикальный) сегмент клеточной оболочки специализированных мембранных комплексов (водных каналов аквапорина-2). Повышение проницаемос
ти этих сегментов для воды приводит к усилению ее осмотического оттока из просвета почечных канальцев в гипертонический интерстиций мозгового вещества, что обеспечивает максимальную концентрацию мочи при антидиурезе (Reeves et al, 1998).
Внутриклеточная концентрация цАМФ, по-ви-димому, является главным фактором, регулирующим действие АВП на клетку, и она возрастает либо в результате повышения биосинтеза цАМФ (благодаря стимуляции аденилатциклазы после взаимодействия АВП с рецепторами), либо из-за снижения его катаболизма. Ферментом катаболизма служит цАМФ-фосфодиэстераза, которая катализирует распад цАМФ до 5’-АМФ. Ряд лекарственных препаратов и гормонов, а также некоторые заболевания изменяют ответ почечных канальцев на АВП за счет своего влияния на взаимодействие этого гормона с рецепторами, либо на активацию аденилатциклазы или расщепление цАМФ.
Моча из дистальных и прямых канальцев через собирательную трубочку поступает в почечную лоханку. По мере прохождения мочи по прямым канальцам, локализованным в мозговом веществе, ее осмотическая концентрация прогрессивно на
6 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
растает и на вершине почечного сосочка у собак достигает 2000-2500 мОсм/кг воды. В присутствии вазопрессина жидкость из собирательной трубочки поступает в эту гиперосмотическую среду и уравновешивается с ней до тех пор, пока осмотическая концентрация мочи не сравняется с осмоляльностью интерстициальной жидкости мозгового вещества. Всосавшаяся вода через прямые артериолы распределяется по системной циркуляции, что позволяет поддерживать гипертоничность медуллярного интерстиция. Вазопрессин усиливает также проницаемость для мочи эпителия сосочковых собирательных протоков. Таким образом, в присутствии вазопрессина образуется намного меньше мочи, чем в его отсутствие.
Клиническое действие. Основное действие АВП состоит в задержке жидкости за счет уменьшения объема мочи (табл. 1-1). Этот антидиурети-ческий эффект достигается путем усиления реабсорбции воды (без растворенных в ней соединений) в дистальных и/или извитых почечных канальцах. В отсутствие АВП выстилка просвета этого отдела нефрона служит надежным барьером, препятствующим диффузии воды и осмотически активных веществ. По этой причине гипотонический фильтрат, образующийся в более проксимальном отделе нефрона, не изменяется при прохождении через дистальный каналец и собирательную трубочку. В результате возникает так называемый водный диурез - состояние, для которого характерно выделение большого объема мочи с низкой осмоляльностью (см. рис. 1-5).
В присутствии АВП и при нормальной активности его почечных рецепторов возрастает гид-роосмотическая проницаемость дистальных и извитых канальцев, вследствие чего происходит обратная диффузия воды по осмотическому градиенту, который обычно существует между внут-риканальцевой жидкостью и изотонической либо гипертонической средой коркового и мозгового вещества почек. Поскольку вода реабсорбируется
ТАБЛИЦА 1-1. ЭФФЕКТЫ ВАЗОПРЕССИНА
Орган-мишень Действие
Почки Собирательные протоки коркового и наружного мозгового слоя Сосочковые собирательные трубочки Толстый восходящий отдел петли Генле Юкстагломерулярные клетки Сердце Артериолы Мозг Печень Аденогипофиз (передняя доля гипофиза) Усиливает проницаемость для воды Усиливает проницаемость для воды и мочевины Подавляет высвобождение ренина Брадикардия Сужение Усиливает пассивное избегание Усиливает гликогенолиз и синтез жирных кислот Усиливает секрецию АКТГ
без растворенных соединений, остающаяся в просвете нефрона моча становится более концентрированной и ее скорость протекания через канальцы уменьшается. Количество воды, реабсорбированной в дистальном нефроне, зависит от уровня АВП в плазме крови и наличия выраженного осмотического градиента в почечном интерстиции. Вазопрессин не вызывает активную (т.е. требующую затрат энергии) реабсорбцию воды, свободной от растворенных соединений. Он лишь «открывает водные каналы» в выстилке просвета, обеспечивая таким образом ток воды в направлении повышенной осмоляльности, т.е. по осмотическому градиенту. У здоровых животных фильтрат, поступающий в дистальные канальцы, имеет низкую осмоляльную концентрацию, а почечный интерстиций - высокую, что благоприятствует реабсорбции воды при открытых порах. Повышение осмоляльности интерстициальной ткани мозгового вещества усиливает способность реабсорбировать воду и концентрировать мочу. Так, пустынные грызуны, имеющие чрезвычайно высокую осмоляльность этой ткани, продуцируют более концентрированную, чем у собак, мочу, и за счет этого прекрасно сохраняют воду. Напротив, утрата гипертоничности мозгового вещества приводит к подавлению антидиуретичес-кой активности вазопрессина (см. рис. 1-5). Снижение медуллярной гипертоничности (или ее отсутствие) может быть следствием разнообразных причин, например хронического водного диуреза или уменьшения скорости кровотока в мозговом веществе. Тем не менее, основное количество жидкости, вытекающей из петли Генле, все еще может изотонически реабсорбироваться в дистальном извитом канальце и проксимальной собирательной трубочке. Поэтому исчезновение градиента концентрации в мозговом веществе почек само по себе редко приводит к выраженной полиурии (Robertson, 1981).
Следует отметить, что 85-95% жидкости, профильтровавшейся через почечный клубочек, реабсорбируется в проксимальном отделе нефрона вместе с осмотически эквивалентным объемом натрия и глюкозы. После этого из остающейся жидкости избирательно реабсорбируется натрий, поэтому в дистальный сегмент нефрона поступает гипотоническая жидкость. Еще 90% оставшейся жидкости может реабсорбироваться под воздействием АВП (Robertson, 1981). Однако при избыточном потреблении соли с пищей или при наличии в клубочковом фильтрате таких плохо реабсорбируемых веществ, как манни-тол, мочевина или глюкоза, всасывание жидкости из проксимальных канальцев уменьшается. В результате объем жидкости в дистальном отделе нефрона может превысить его ограниченную способность реабсорбировать воду. Следствием этого становится снижение осмоляльности и увеличение объема мочи даже в присутствии больших количеств вазопрессина. Такой тип полиурии называют солевым диурезом (салиурией), дабы отличить его от диуреза, обуслов-
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
7
-АВП
+АВП
осмоляльность
(мОсм/кг)
Рис. 1-5. Схема действия вазопрессина на образование мочи в нефроне человека. Осмотическое давление ткани и канальцевой жидкости показано плотностью штриховки. Цифры в полости нефрона показывают типичные скорости тока жидкости в миллиметрах в минуту. Стрелки показывают активную (сплошные) и пассивную (пунктирные) реабсорбцию натрия (Na) или воды (Н20). Обратите внимание, что вазопрессин действует только на дистальный нефрон, где он усиливает гидроосмотическую проницаемость канальцевых мембран. Жидкость, поступающая в этот отдел нефрона, обычно составляет от 10 до 15% общего объема фильтрата и является гипотонической благодаря избирательной реабсорбции натрия в восходящем колене петли Генле. В отсутствие вазопрессина мембраны дистального нефрона остаются относительно слабо проницаемыми и для воды, и для растворенных в ней соединений, а выходящая из петли Генле жидкость экскретируется в совершенно неизмененном виде в качестве мочи. В условиях максимального действия вазопрессина вся содержащаяся в этой жидкости вода, за исключением 5-10%, пассивно реабсорбируется по существующему в норме нисходящему осмотическому градиенту с окружающей тканью. Следует иметь в виду, что у собак концентрация интерстициальной жидкости в мозговом веществе почек может превышать 2500 мОсм/кг. Из: Felig Р, et al (eds): Endocrinology and Metabolism, New York, McGraw Hill Book Co, 1981, p 258.
ленного недостаточностью действия вазопрессина (см. раздел «Осложнения модифицированной пробы с лишением жидкости»). С другой стороны, при таких заболеваниях, как застойная сердечная недостаточность, в проксимальном нефроне реабсорбируется повышенное количество фильтрата, а из-за этого способность экскретировать воду без растворенных соединений значительно понижается даже в отсутствие вазопрессина.
Менее понятна физиологическая значимость других эффектов вазопрессина, перечисленных в табл. 1-1. Предполагается, что его прессорное действие способствует поддержанию кровяного давления в условиях гиповолемии. Кроме того, вазопрессин влияет на работу желудочно-кишечного тракта и центральной нервной системы (ЦНС). Что касается нейрофизинов, то об их биологическом действии известно лишь то, что они образуют комплексы с окситоцином и вазопрессином в нейросекреторных гранулах нейрогипофиза.
Питьевой центр. Потребление воды для поддержания нормальной концентрации жидкостей в организме регулируется чувством жажды, которое, в свою очередь, зависит от тех же факторов, что и секреция АВП. Ощущение жажды определяется осморецепторами, которые находятся в непосредственной близости от гипоталамических клеток, синтезирующих АВП. Механизмы осморегуляции жажды и высвобождения АВП сходны (например, гипертонический раствор NaCl усиливает как жажду, так и секрецию АВП), тогда как гипертонические растворы мочевины или глюкозы не влияют ни на ту, ни на другую функции (Reeves et al, 1998). Несмотря на функциональное сходство механизмов осморегуляции жажды и секреции АВП, электрофизиологические исследования показали, что они опосредуются через разные, хотя и прилежащие друг к другу осморецепторы.
Регуляция жажды и секреции вазопрессина. Изменения осмоляльности плазмы и объема крови
8 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
служат основным механизмом контроля жажды и секреции вазопрессина.
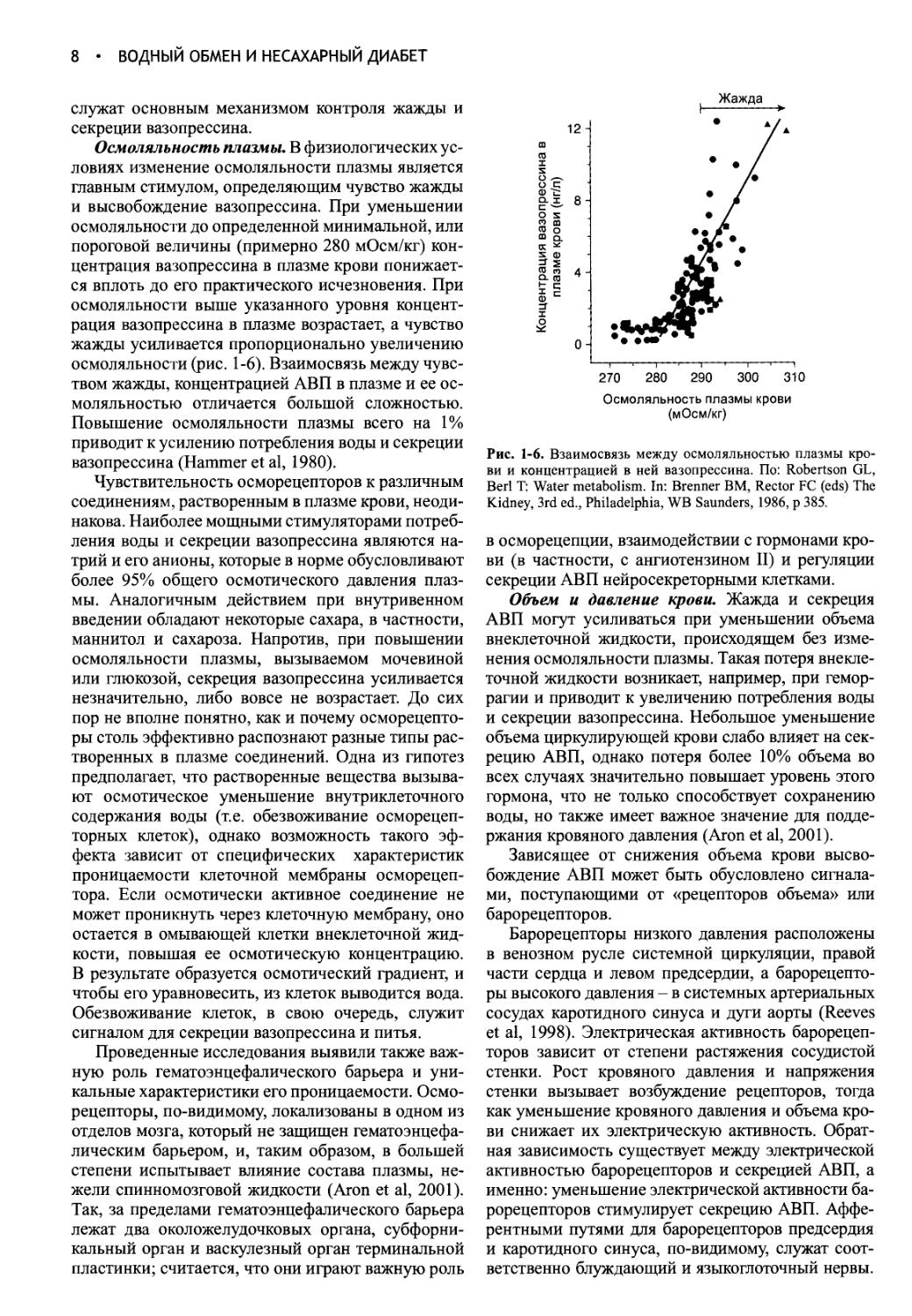
Осмоляльность плазмы. В физиологических условиях изменение осмоляльности плазмы является главным стимулом, определяющим чувство жажды и высвобождение вазопрессина. При уменьшении осмоляльности до определенной минимальной, или пороговой величины (примерно 280 мОсм/кг) концентрация вазопрессина в плазме крови понижается вплоть до его практического исчезновения. При осмоляльности выше указанного уровня концентрация вазопрессина в плазме возрастает, а чувство жажды усиливается пропорционально увеличению осмоляльности (рис. 1-6). Взаимосвязь между чувством жажды, концентрацией АВП в плазме и ее осмоляльностью отличается большой сложностью. Повышение осмоляльности плазмы всего на 1% приводит к усилению потребления воды и секреции вазопрессина (Hammer et al, 1980).
Чувствительность осморецепторов к различным соединениям, растворенным в плазме крови, неодинакова. Наиболее мощными стимуляторами потребления воды и секреции вазопрессина являются натрий и его анионы, которые в норме обусловливают более 95% общего осмотического давления плазмы. Аналогичным действием при внутривенном введении обладают некоторые сахара, в частности, маннитол и сахароза. Напротив, при повышении осмоляльности плазмы, вызываемом мочевиной или глюкозой, секреция вазопрессина усиливается незначительно, либо вовсе не возрастает. До сих пор не вполне понятно, как и почему осморецепторы столь эффективно распознают разные типы растворенных в плазме соединений. Одна из гипотез предполагает, что растворенные вещества вызывают осмотическое уменьшение внутриклеточного содержания воды (т.е. обезвоживание осморецеп-торных клеток), однако возможность такого эффекта зависит от специфических характеристик проницаемости клеточной мембраны осморецептора. Если осмотически активное соединение не может проникнуть через клеточную мембрану, оно остается в омывающей клетки внеклеточной жидкости, повышая ее осмотическую концентрацию. В результате образуется осмотический градиент, и чтобы его уравновесить, из клеток выводится вода. Обезвоживание клеток, в свою очередь, служит сигналом для секреции вазопрессина и питья.
Проведенные исследования выявили также важную роль гематоэнцефалического барьера и уникальные характеристики его проницаемости. Осморецепторы, по-видимому, локализованы в одном из отделов мозга, который не защищен гематоэнцефалическим барьером, и, таким образом, в большей степени испытывает влияние состава плазмы, нежели спинномозговой жидкости (Aron et al, 2001). Так, за пределами гематоэнцефалического барьера лежат два околожелудочковых органа, субфорни-кальный орган и васкулезный орган терминальной пластинки; считается, что они играют важную роль
Осмоляльность плазмы крови (мОсм/кг)
Рис. 1-6. Взаимосвязь между осмоляльностью плазмы крови и концентрацией в ней вазопрессина. По: Robertson GL, Berl Т: Water metabolism. In: Brenner BM, Rector FC (eds) The Kidney, 3rd ed., Philadelphia, WB Saunders, 1986, p 385.
в осморецепции, взаимодействии с гормонами крови (в частности, с ангиотензином II) и регуляции секреции АВП нейросекреторными клетками.
Объем и давление крови. Жажда и секреция АВП могут усиливаться при уменьшении объема внеклеточной жидкости, происходящем без изменения осмоляльности плазмы. Такая потеря внеклеточной жидкости возникает, например, при геморрагии и приводит к увеличению потребления воды и секреции вазопрессина. Небольшое уменьшение объема циркулирующей крови слабо влияет на секрецию АВП, однако потеря более 10% объема во всех случаях значительно повышает уровень этого гормона, что не только способствует сохранению воды, но также имеет важное значение для поддержания кровяного давления (Aron et al, 2001).
Зависящее от снижения объема крови высвобождение АВП может быть обусловлено сигналами, поступающими от «рецепторов объема» или барорецепторов.
Барорецепторы низкого давления расположены в венозном русле системной циркуляции, правой части сердца и левом предсердии, а барорецепторы высокого давления - в системных артериальных сосудах каротидного синуса и дуги аорты (Reeves et al, 1998). Электрическая активность барорецепторов зависит от степени растяжения сосудистой стенки. Рост кровяного давления и напряжения стенки вызывает возбуждение рецепторов, тогда как уменьшение кровяного давления и объема крови снижает их электрическую активность. Обратная зависимость существует между электрической активностью барорецепторов и секрецией АВП, а именно: уменьшение электрической активности барорецепторов стимулирует секрецию АВП. Афферентными путями для барорецепторов предсердия и каротидного синуса, по-видимому, служат соответственно блуждающий и языкоглоточный нервы.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 9
Электроактивация питьевого центра и содержащих АВП нейросекреторных клеток контролируется группой нейронов, которые находятся в переднем гипоталамусе вблизи, но не в составе супраоптического и паравентрикулярного ядер, и отличаются от них.
В регуляции высвобождения АВП также участвует ренин-ангиотензиновая система. У всех изученных видов животных ангиотензин является эффективным дипсогеном (агентом, провоцирующим жажду). Кроме того, ангиотензин может усиливать секрецию АВП, особенно при повышенной осмоляльности плазмы, воздействуя непосредственно на продуцирующие АВП нейроны и стимулируя афферентные проводящие пути из других отделов мозга. Гиповолемия усиливает секрецию ренина, что способствует образованию ангиотензина. Насколько велика роль прямого участия барорецепторов и как она соотносится с ангиотензин-зависимыми механизмами в возбуждении жажды в ответ на внеклеточную дегидратацию, остается пока неясным.
Взаимосвязь осмоляльности плазмы и объема крови. В нормальных условиях повседневная регуляция водного баланса предполагает взаимодействие между осмотическими стимулами и сигналами об изменении объема внеклеточной жидкости. Что касается высвобождения вазопрессина, то уменьшение объема циркулирующей крови повышает чувствительность его секреции к осмотической стимуляции. Иными словами, повышение уровня вазопрессина в плазме крови при данном увеличении осмоляльности будет более выраженным в условиях гиповолемии, чем в условиях нормоволемии.
В условиях дегидратации повышение осмоляльности плазмы приводит к потере внутриклеточной жидкости. При уменьшении общего содержания воды в организме ее внутри- и внеклеточное содержание падает в одинаковой степени. Увеличение осмоляльности и уменьшение объема внеклеточной жидкости синергично стимулируют секрецию вазопрессина. Однако при недостаточном потреблении соли концентрация вазопрессина в плазме остается на постоянном уровне или слегка возрастает несмотря на падение осмоляльности. В этой ситуации гиповолемия, возникающая как результат осмотического перемещения воды из внеклеточного во внутриклеточное пространство, по-видимому, оказывает сенсибилизирующее действие.
Регуляция потребления воды включают также и взаимосвязь между осмоляльностью и объемом внеклеточной жидкости. В периоды обезвоживания усиление чувства жажды примерно на 70% обусловлено повышением осмоляльности плазмы, тогда как остальные 30% объясняются гиповолемией. При недостатке соли ситуация не столь очевидна; по некоторым данным, нормальное или повышенное потребление воды у экспериментальных животных связано с возникающей гиповолемией (Ramsay, 1983).
ТАБЛИЦА 1-2. ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ГОРМОНЫ, ВЛИЯЮЩИЕ НА СЕКРЕЦИЮ ИЛИ ДЕЙСТВИЕ ВАЗОПРЕССИНА
ВЛИЯНИЕ НА СЕКРЕЦИЮ
Стимулируют высвобождение АВП Ингибируют высвобождение АВП
Ацетилхолин а-Адренергические препараты
Анестетики Предсердный натриуретичес-кий пептид
Ангиотензин II Глюкокортикоиды
Апоморфин Галоперидол
р-Адренергические пре- Оксилорфан
параты Барбитураты Фенитоин
Карбамазепин Клофибрат Циклофосфамид Гистамин Прометазин
Инсулин Метоклопрамид Морфин и наркотические
анальгетики
Простагландин Е2 Винкристин
ВЛИЯНИЕ НА ПОЧКИ
Усиливают действие АВП Ингибируют действие АВП
Аспирин а- Адренергические препараты
Карбамазепин Натриуретический пептид предсердия
Хлорпропамид Барбитураты
Нестероидные противовоспалительные средства Демеклоциклин
Тиазиды Глюкокортикоиды Гиперкальциемия Гипокалиемия Метоксифлуран Простагландин Е, Протеинкиназа С Тетрациклины Алкалоиды барвинка
Иные факторы. Секреция АВП в той или иной мере может возрастать под влиянием разнообразных неосмотических и негемодинамических факторов. К их числу относятся тошнота, гипогликемия, ренин-ангиотензиновая система и неспецифические стрес-сорные факторы, включая боль, эмоции и физические нагрузки. Многие лекарственные средства и гормоны тоже могут изменять секрецию вазопрессина. Перечень агентов, стимулирующих или подавляющих секрецию АВП, а также повышающих либо понижающих чувствительность почечных канальцев к АВП, приведен в табл. 1-2 и на рис. 1-4 (Reeves et al, 1998).
Утоление жажды. Обезвоженные животные обладают замечательной способностью компенсировать недостаток жидкости, потребляя соответствующее количество воды. Было показано, что собаки, оставленные без воды на разные периоды времени, выпивают в течение 5 минут ровно столько жидкости, сколько необходимо для устранения ее дефицита. Эта способность развита у всех животных, однако некоторые виды затрачивают больше времени, чтобы выпить требуемое количество воды. Для устранения
10
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
ТАБЛИЦА 1-3. МЕТОДЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПОЛИДИПСИИ И ПОЛИУРИИ
Расстройство
Сахарный диабет
Почечная глико-зурия
Хроническая по-
______Диагностические средства____
Определение глюкозы в крови натощак, анализ мочи
Определение глюкозы в крови натощак, анализ мочи
Определение AM, креатинина, Са:Р,
чечная недоста- анализ мочи
точность
Постобструкционный диурез
Пиометра
Escherichia coli и
септицемия
Г иперкальциемия
Недостаточность функции печени
Г иперкортицизм
Первичный гипе-
Бактериальный пиелонефрит
Гипокалиемия Гипонатриемия Гипокортицизм Гипертиреоз
Анализ анамнестических данных, мониторинг продукции мочи
Анализ анамнестических данных, ОАК, радиография и УЗИ брюшной полости
Посев проб крови
Определение кальция в сыворотке
Определение биохимического профиля крови и желчных кислот, тест толерантности к аммиаку, радиография и УЗИ брюшной полости
Проба с АКТГ, проба с дексаметазоном, определение соотношения кортизола и креатинина в моче
Определение натрия и калия в сыворот-
ральдостеронизм ке крови, измерение кровяного давле-
ния, УЗИ брюшной полости, проба с АКТГ (на альдостерон)
Посев мочи, УЗИ брюшной полости, экскреторная урография
Определение калия в сыворотке крови
Определение натрия в сыворотке крови Na:K, проба с АКТГ
Определение тироксина в сыворотке
крови
Несахарный диабет Модифицированная проба с лишением
жидкости
Психогенная поли- Модифицированная проба с лишением
дипсия Полицитемия Акромегалия
Паранеопласти чес-
жидкости
ОАК
Определение гормона роста и инсулиноподобного фактора роста I, компьютерная томография
кие расстройства
Кишечная лейоми- УЗИ брюшной полости, биопсия осаркома
Ятрогенные рас- Анализ анамнестических данных стройства
Рацион с очень Анализ анамнестических данных низким содержанием белка
жажды у собак и кошек необходимо восстановить до нормальной величины как осмоляльность плазмы, так и объем крови, причем особенно важна коррекция осмоляльности. Если у собак с повышенной осмоляльностью крови и снижением ее объема нормализовали осмоляльность крови в сонных артериях без ее изменения вне ЦНС, то это уменьшало потребление воды животными на 70% (Reeves et al, 1998). С другой стороны, восстановление объема крови у тех же собак без одновременной коррекции гипертоничности плазмы уменьшало потребление воды только на 30%. Какую-то роль при этом могут играть дополнительные механизмы, в том числе растяжение желудка
и, возможно, рецепторы печени. Сходные с указанными воздействия подавляли не только жажду, но и секрецию вазопрессина. У обезвоженных животных после самостоятельной регидратации уровень вазопрессина в плазме крови нормализовался еще до того, как достигалось нормальное разведение жидкостей организма.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПОЛИДИПСИИ И ПОЛИУРИИ
Патологическая жажда (полидипсия) и повышенное выделение мочи (полиурия) - весьма распространенные расстройства у мелких животных, с которыми приходится сталкиваться в ветеринарной практике. Суточное потребление воды собаками и кошками колеблется от 20 до 70 мл/кг (Barsanti et al, 2000). Диагноз полидипсии и полиурии у этих животных ставится соответственно при потреблении воды свыше 100 мл/кг/день и выделении мочи свыше 50 мл/кг/день. Однако встречаются собаки и кошки, у которых патологическая жажда и повышенное выделение мочи имеют место и при нормальных значениях этих показателей. Полидипсия и полиурия обычно развиваются одновременно, а выявление первичного компонента этого комплексного синдрома является одной из главных задач дифференциальной диагностики.
Полидипсия и полиурия вызываются разнообразными метаболическими расстройствами (таблица 1-3). На основании первичных патофизиологических нарушений последние можно классифицировать следующим образом: первичный гипофизарный и нефрогенный несахарный диабет; вторичный нефрогенный несахарный диабет, к причинам которого относятся нарушение нормального взаимодействия АВП с канальцевыми У2-рецепторами почек, снижение внутриклеточной продукции цАМФ или функции канальцевых клеток либо исчезновение градиента концентрации в интерстициальном мозговом веществе; осмотический диурез; нарушение гипоталамо-гипо-физарных механизмов секреции АВП.
Осмотический диурез
Сахарный диабет. Это одна из наиболее частых эндокринопатий у собак и кошек. В условиях относительной или абсолютной недостаточности инсулина утилизация глюкозы снижается и происходит ее накопление в крови. Когда уровень глюкозы возрастает настолько, что почечные канальцы не справляются с ее реабсорбцией, то глюкоза появляется в моче и действует в качестве осмотического диуретика, усиливая потерю воды с мочой. Такая потеря приводит к гиповолемии, которая, в свою очередь, стимулирует потребление воды. Скрининговое исследование с анализом мочи и определением концентрации глюкозы в крови обычно достаточно для диагностики сахарного диабета.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 11
Первичная почечная гликозурия. Эта редкая врожденная патология встречается преимущественно у басенджей и норвежских лаек (элкхаун-дов). В основе ее лежит неспособность нефрона реабсорбировать глюкозу из ультрафильтрата. У некоторых собак и кошек почечная гликозурия является компонентом синдрома, подобного синдрому Фанкони, при котором нарушается обратное всасывание фосфора, калия, мочевой кислоты, аминокислот, натрия и/или бикарбоната из ультрафильтрата. Как и при сахарном диабете, в моче появляется глюкоза, которая действует как осмотический диуретик; в результате развивается полиурия и затем полидипсия.
Хроническая почечная недостаточность. Это синдром, при котором количество функционирующих нефронов прогрессивно уменьшается вследствие нарушения структуры почек, как это имеет место при хроническом интерстициальном нефрите, медуллярном интерстициальном амилоидозе и хроническом пиелонефрите. При этом происходит компенсаторное увеличение скорости клубочковой фильтрации (СКФ) в пересчете на сохранившиеся нефроны, однако одновременно возрастает количество жидкости, поступающей в дистальные почечные канальцы. Усиление тока внутриканаль-цевой жидкости сопровождается уменьшением реабсорбции мочевины, натрия и других соединений. В результате развивается осмотический диурез, осложняемый уменьшением градиента концентрации в мозговом веществе почек. Эти изменения способствуют развитию полиурии. Потеря воды приводит к гиповолемии, которая вызывает компенсаторную полидипсию. В крови животных повышаются концентрации азота мочевины (AM), креатинина и неорганического фосфора, развиваются нерегенеративная анемия и изостенурия (удельный вес мочи 1,008-1,015).
Постобструкционный диурез. Это заболевание может развиться у любого животного, однако чаще всего оно встречается после устранения закупорки мочеиспускательного канала у котов с заболеванием нижних мочевых путей (т.е. урологического синдрома кошачьих). У таких животных концентрация AM обычно сильно повышается в результате закупорки, а после устранения закупорки возникает выраженный осмотический диурез. Постобструкционный диурез является самокупи-рующимся расстройством. Тем не менее, ветеринар должен уметь распознать его и предупредить дегидратацию животного с помощью агрессивной инфузионной терапии. Интенсивность последней постепенно снижают на протяжении нескольких дней по мере уменьшения тяжести уремии и проявлений осмотического диуреза.
Недостаточность вазопрессина (антидиуретического гормона)
Частичное или полное прекращение продукции вазопрессина нейросекреторными клетками, ло
кализованными в супраоптическом и паравентри-кулярном ядрах, называют несахарным диабетом центрального генеза (ЦНД). Этот синдром рассматривается в последующих разделах.
Первичный нефрогенный несахарный диабет
Частичная или полная утрата чувствительности почечных канальцев к действию АВП называется нефрогенным несахарным диабетом (ННД). Причиной первичного ННД служит врожденный дефект клеточных механизмов, обеспечивающих «открытие водных каналов», через которые вода абсорбируется из внутриканальцевого ультрафильтрата. Этот синдром обсуждается в нижеследующих разделах.
Приобретенный (вторичный) нефрогенный несахарный диабет
Различные заболевания могут приводить к нарушению нормального взаимодействия АВП с рецепторами почечных канальцев, угнетать функцию канальцевых клеток и уменьшать объем гипертонического медуллярного интерстиция, обусловливая, таким образом, утрату нормального осмотического градиента. В результате развиваются полиурия и компенсаторная полидипсия, иногда в очень тяжелой форме. Это расстройство напоминает первичный ННД, но считается приобретенным или вторичным, поскольку сохраняются продукция АВП, его рецепторы и пострецепторные механизмы, обеспечивающие всасывание воды.
Пиометра. Бактериальные эндотоксины, особенно продуцируемые Escherichia coli, могут конкурировать с АВП за его связывающие места в стенках почечных канальцев и вызывать потенциально обратимую потерю чувствительности канальцев к АВП. При этом уменьшается способность почек концентрировать мочу и удерживать воду, развиваются полиурия и компенсаторная полидипсия. Пиометра является самым распространенным инфекционным заболеванием, обусловливающим развитие полиурии и полидипсии, хотя имеются данные и о ее связи с абсцессом простаты, пиелонефритом и септицемией (Barsanti et al, 2000). У самок собак и кошек с пиометрой концентрация мочи чрезвычайно низка, что приводит к значительной потере жидкости и компенсаторной полидипсии. Способность концентрировать мочу обычно нормализуется через несколько дней после успешного устранения пиометры. Во всех случаях пиометры с полиурией и полидипсией следует подозревать вторичный ННД.
Гиперкальциемия. Повышенная концентрация кальция в плазме крови может препятствовать связыванию АВП с его рецепторами, повреждать последние в почечных канальцах, инактивировать аденилатциклазу и нарушать действие АВП на уровне почечных канальцев (приобретенный ННД)
12 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
либо угнетать транспорт натрия и хлоридов в мозговое вещество почек. Полидипсия и полиурия являются частыми ранними проявлениями гиперкальциемии, которая легко диагностируется по результатам биохимического анализа крови. После выявления гиперкальциемии проводят тщательное диагностическое обследование для выяснения ее причины (см. гл. 16).
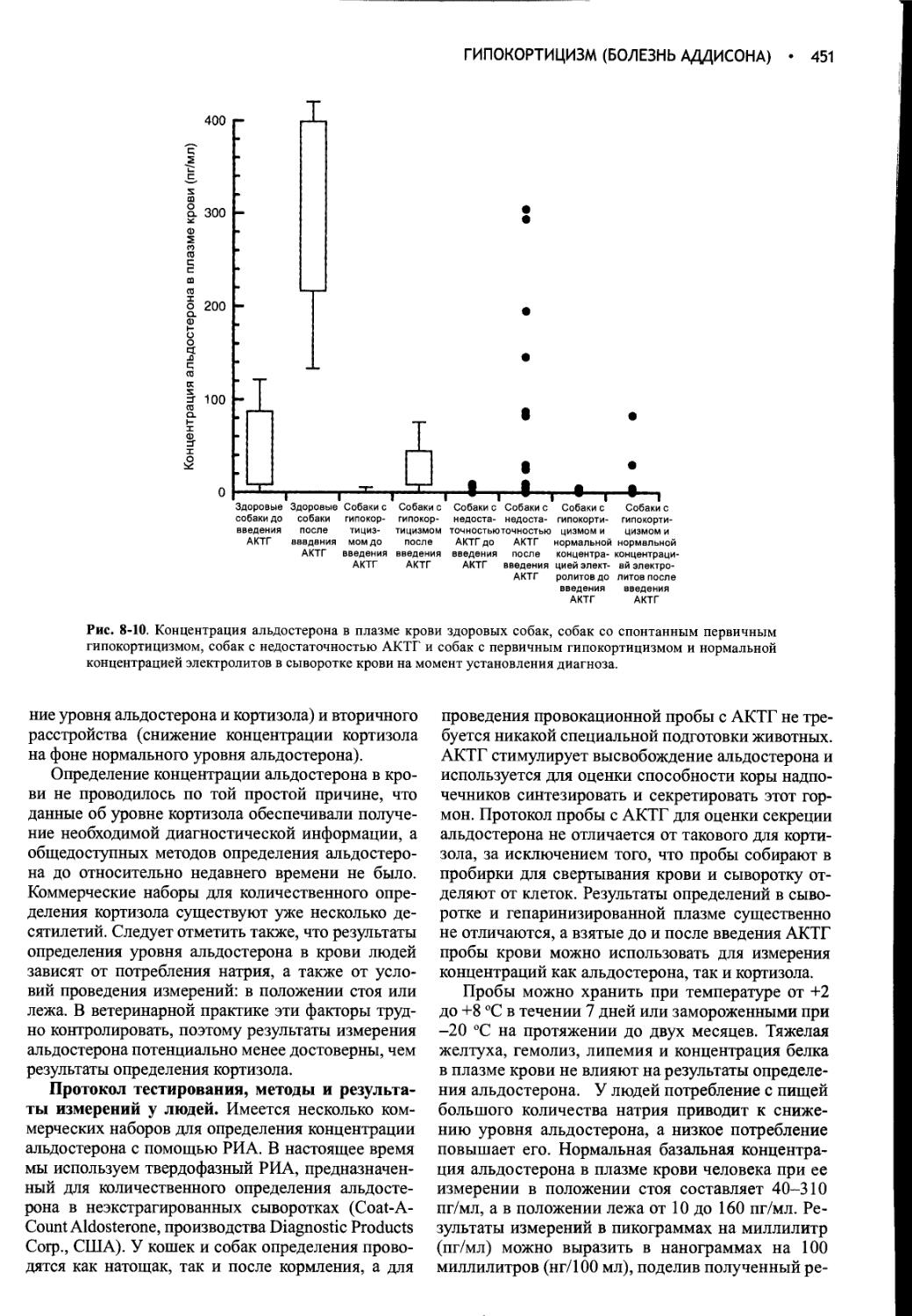
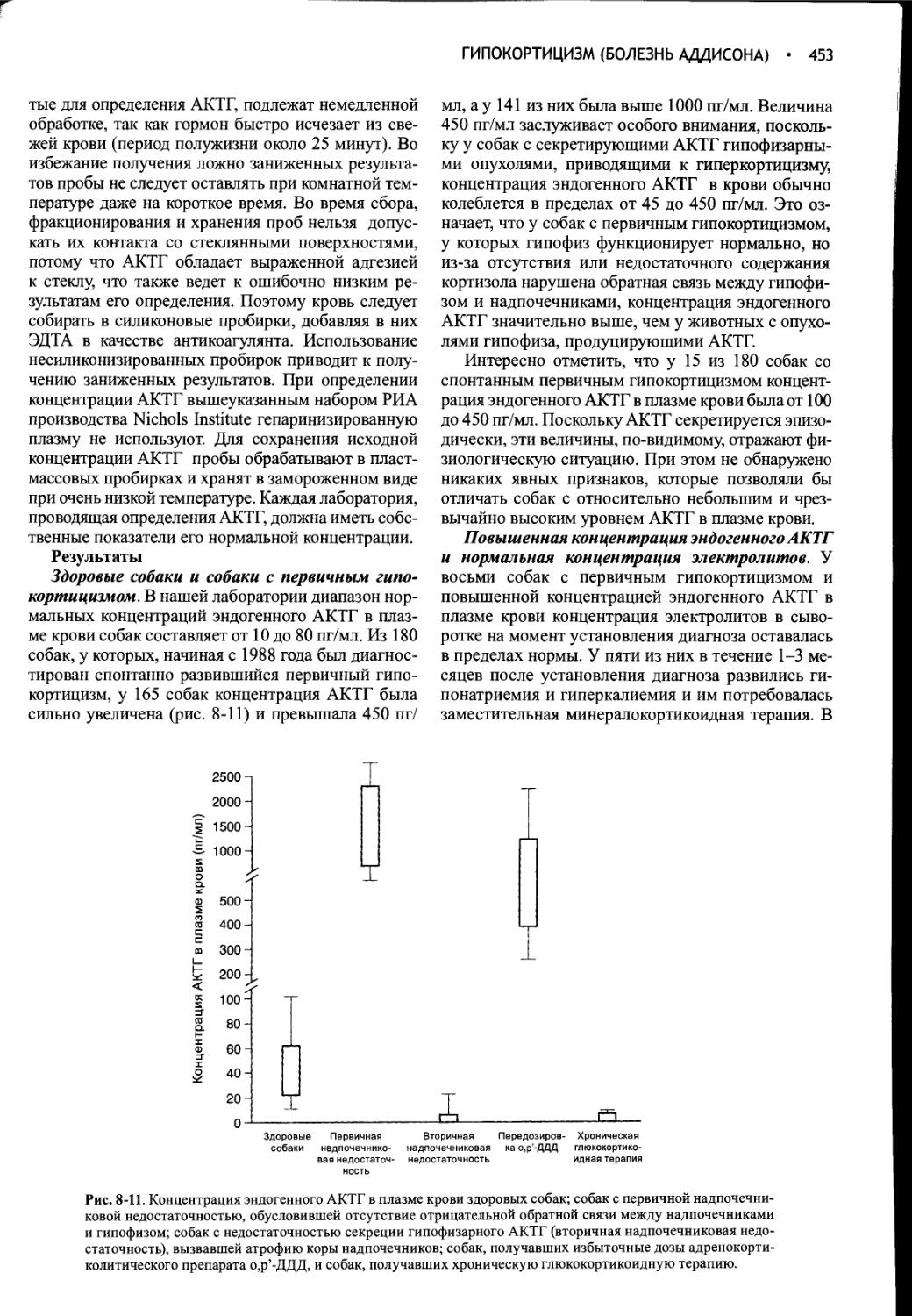
Недостаточность функции печени и порто-системные шунты. Недостаточность функции печени и портосистемные шунты могут быть причинами полиурии и полидипсии. Однако многие метаболические расстройства, вызывающие полиурию и полидипсию (в частности, сахарный диабет, гиперкортицизм или гиперкальциемия), воздействуют на функцию печени, что затрудняет выяснение ее роли в развитии полиурии и полидипсии. Точная причина полиурии не известна, однако ее возникновение может быть связано с утратой медуллярной гипертоничности вследствие уменьшения продукции азота мочевины или изменения скорости кровотока, с увеличением СКФ и объема почек, гипокалиемией, угнетением обмена кортизола или первичной полидипсией (Deppe et al, 1999). Азот мочевины играет ключевую роль в установлении и поддержании градиента концентрации в мозговом веществе почек. В отсутствие азота мочевины почки теряют способность концентрировать мочу, что приводит к полиурии и компенсаторной полидипсии. Подозрение на недостаточность функции печени и портосистемные шунты обычно возникает на основании результатов общего клинического анализа крови (ОАК), биохимического анализа сыворотки, анализа мочи и ультразвукового исследования брюшной полости. Для подтверждения диагноза используют функциональные пробы (например, определение желчных кислот до и после еды, тест на толерантность к аммиаку) и специализированое диагностическое сканирование (позитивную контрастную портографию, сканирование с применением технеция), а также гистологическое исследование биоптатов печеночной ткани.
Гиперкортицизм (Синдром Кушинга). Полиурия и полидипсия являются обычными клиническими признаками гиперкортицизма. Глюкокортикоиды подавляют высвобождение АВП, действуя непосредственно на гипоталамус и/или гипофиз (Papanek, Raff, 1994; Papanek et al, 1997). При этом одновременно повышается осмотический порог и уменьшается чувствительность ответа АВП на возрастающую осмоляльность (Biewenga et al, 1991). Гиперкортицизм вызывает также резистентность почек к АВП, возможно, в результате нарушения его действия на уровне прямых канальцев или непосредственного уменьшения проницаемости почечных канальцев для воды. В отдельных случаях недостаточность АВП может быть следствием прямого сдавливания нейросекреторных клеток разрастающейся опухолью гипофиза. Подозрение
на гиперкортицизм обычно возникает после тщательного изучения анамнеза, физикального исследования, ОАК, биохимического анализа сыворотки крови и мочи. Для подтверждения диагноза проводят гипофизарную и надпочечниковую функциональные пробы (см. гл. 6).
Первичный гиперальдостеронизм. Имеются сообщения о полиурии и полидипсии у собак и кошек с первичным гиперальдостеронизмом. Механизм возникновения полиурии и полидипсии не выяснен, однако у собаки с первичным гиперальдостеронизмом были выявлены индуцированная минералокортикоидами резистентность к действию АВП на почки и нарушение осмотической регуляции секреции АВП (Rijnberk et al, 2001). Такие же расстройства установлены у собак с избыточной продукцией глюкокортикоидов, что предполагает сходство механизмов возникновения полиурии и полидипсии при гиперальдостеронизме и гиперкортицизме. Характерными проявлениями первичного гиперальдостеронизма являются общая слабость, тяжелая гипокалиемия, гипернатриемия, системная гипертензия и адрено-мегалия, выявляемая при ультразвуковом исследовании брюшной полости. Концентрация альдостерона в плазме крови повышена как до, так и после введения АКТГ на фоне пониженной активности ренина в плазме (см. гл. 6).
Пиелонефрит. При инфекции и воспалении почечной лоханки возможно нарушение механизма противотока в мозговом веществе, ведущее к изос-тенурии, полиурии, полидипсии и, в конце концов, к почечной недостаточности. Бактериальные эндотоксины, особенно токсины Escherichia coli, могут конкурировать с АВП за связывающие места в выстилке почечных канальцев и, таким образом, вызывать потенциально обратимую потерю чувствительности канальцев к АВП. У собак и кошек с острым бактериальным пиелонефритом развиваются неспецифические системные признаки, такие как сонливость, анорексия и лихорадочное состояние, а ОАК выявляет нейтрофильный лейкоцитоз. При хроническом пиелонефрите такие системные признаки обычно отсутствуют. Подозрение на пиелонефрит возникает также при рецидивирующей инфекции мочевых путей. Диагноз подтверждается присутствием в моче лейкоцитов, кровяных цилиндров, бактерий и эритроцитов при наличии бактериального роста в посеве мочи, полученной с помощью надлобковой пункции мочевого пузыря. УЗИ брюшной полости и экскреторная урография также выявляют нарушения, свидетельствующие о пиелонефрите (например, расширение почечной лоханки).
Гипокалиемия. Считается, что гипокалиемия понижает чувствительность концевого отдела нефрона к АВП, вероятно, вследствие подавления продукции цАМФ в клетках почечных канальцев. Гипокалиемия влияет также на гипертонический градиент медуллярного интерстиция, изменяя на
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
13
копление растворенных веществ, и, кроме того, нарушает высвобождение АВП из гипофиза. Гипокалиемия не всегда сопровождается полиурией и полидипсией; к ее наиболее частым проявлениям относятся нейромышечная дисфункция скелетной, сердечной и гладкой мускулатуры, в частности, общая слабость и шейная вентрифлексия. Гипокалиемия обычно является следствием других расстройств (таблица 1-4), многие из которых также вызывают полиурию и полидипсию.
Гипокортицизм (Болезнь Аддисона). Недостаточность функции коры надпочечников нарушает способность концентрировать мочу (см. гл. 8). У многих собак с гипокортицизмом удельный вес мочи не превышает 1,030 несмотря на нормальную функцию почек и выраженную гиповолемию. Недостаточность минералокортикоидов приводит к хронической потере натрия, вымыванию растворимых веществ из мозгового вещества надпочечников и утрате гипертонического градиента медуллярного интерстиция. У адреналэктомированных крыс уменьшается стимулирующее действие АВП на аденилатциклазную активность в мозговом веществе почек, главным образом, из-за нарушения сопряжения АВП-рецепторных комплексов с адени-латциклазой. Этот дефект устраняется введением дексаметазона. В ряде случаев гипокортицизм сочетается с гиперкальциемией, которая может играть роль в возникновении полиурии и полидипсии.
Полиурия и полидипсия обычно развиваются на ранних стадиях заболевания и быстро оттесняются на задний план значительно более выраженными и вызывающими серьезное беспокойство явлениями, такими как рвота, диарея, анорексия, общая слабость и депрессия. Полиурию при гипокортицизме трудно дифференцировать от первичной почечной недостаточности без тестирования функции гипофизарно-надпочечниковой системы с помощью специальных проб, например пробы с АКТГ. Подозрение на гипокортицизм обычно возникает при соответствующих результатах определения электролитов в сыворотке, хотя почечная недостаточность также может сопровождаться гиперкалиемией и гипонатриемией.
Гипертиреоз. Полиурия и полидипсия - частые явления у собак и кошек с гипертиреозом. Механизм их возникновения при этом расстройстве точно не известен. Усиление кровотока в мозговом веществе почек может вызывать снижение его гипертоничности и уменьшать всасывание воды из дистальных отделов нефрона. Известную роль в возникновении полиурии и полидипсии при гипертиреозе может играть вторичная психогенная полидипсия, а у некоторых животных и сопутствующая почечная недостаточность. Предварительный диагноз гипертиреоза обычно ставится на основании клинических признаков, обнаружения увеличенной доли или долей щитовидной железы при пальпации (т.е. зоба), определения концентрации тироксина (Т4) в сыворотке крови.
ТАБЛИЦА 1-4. ПРИЧИНЫ ГИПОКАЛИЕМИИ У СОБАК И КОШЕК
Трансклеточные перемещения (из внеклеточной во внутриклеточную жидкость)
Метаболический алкалоз
Диабетический кетоацидоз* *
Гипокалиемический периодический паралич (бирманские кошки)
Усиленная потеря жидкости
Потеря жидкости через желудочно-кишечный тракт* Хроническая почечная недостаточность, особенно у кошек* Пищевая гипокалиемическая нефропатия у кошек Дистальный (1 типа) ацидоз почечных канальцев Проксимальный (2 типа) ацидоз почечных канальцев после лечения бикарбонатом натрия
Постобструкционный диурез
Первичный гиперальдостеронизм
Вторичный гиперальдостеронизм*
Недостаточность функции печени
Врожденный порок сердца
Нефротический синдром
Гипертиреоз
Г ипомагнезиемия
Ятрогенные причины*
Введение бескалиевой жидкости (например, 0,9% NaCl) Парентеральное введение пищевых растворов
Введение инсулина и жидкостей, содержащих глюкозу Терапия бикарбонатом натрия
«Петлевые» диуретики (например, фуросемид) и тиазиды Недостаточное питание
Псевдогипокалиемия
Гиперлипидемия (метод сухих реагентов, пламенная фотометрия)
Гиперпротеинемия (метод сухих реагентов, пламенная фотометрия)
Гипергликемия (метод сухих реагентов)
Азотемия (метод сухих реагентов)
По: DiBartola SP, De Morais НА. Disorders of potasssium: Hypokalemia and hyperkalemia In: DiBartola SP, (ed.): Fluid Therapy in Small Animal Practice, 2-nd ed, Philadelphia, 2000, WB Saunders, p 93.
* Распространенная причина.
Акромегалия. Избыточная секреция гормона роста (ГР) у взрослых собак и кошек приводит к акромегалии (см. гл. 2). При акромегалии нарушается толерантность к углеводам и развивается явный сахарный диабет. Предполагается, что у большинства собак и кошек с акромегалией полиурия является результатом осмотического диуреза, индуцированного гликозурией. Может играть роль и почечная недостаточность, развивающаяся вследствие диабетической или индуцированной ГР гломерулонефропатии (Peterson et al, 1990).
Полицитемия. Полиурия и полидипсия могут сопутствовать полицитемии. У двух собак с вторичной полицитемией был повышен осмотический порог секреции АВП, что приводило к задержке ответа АВП на повышение осмоляльности плазмы крови (van Vbnderen et al, 1997a). По мнению авторов, аномальный ответ АВП вызван увеличением объема и вязкости крови, что приводит к
14 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
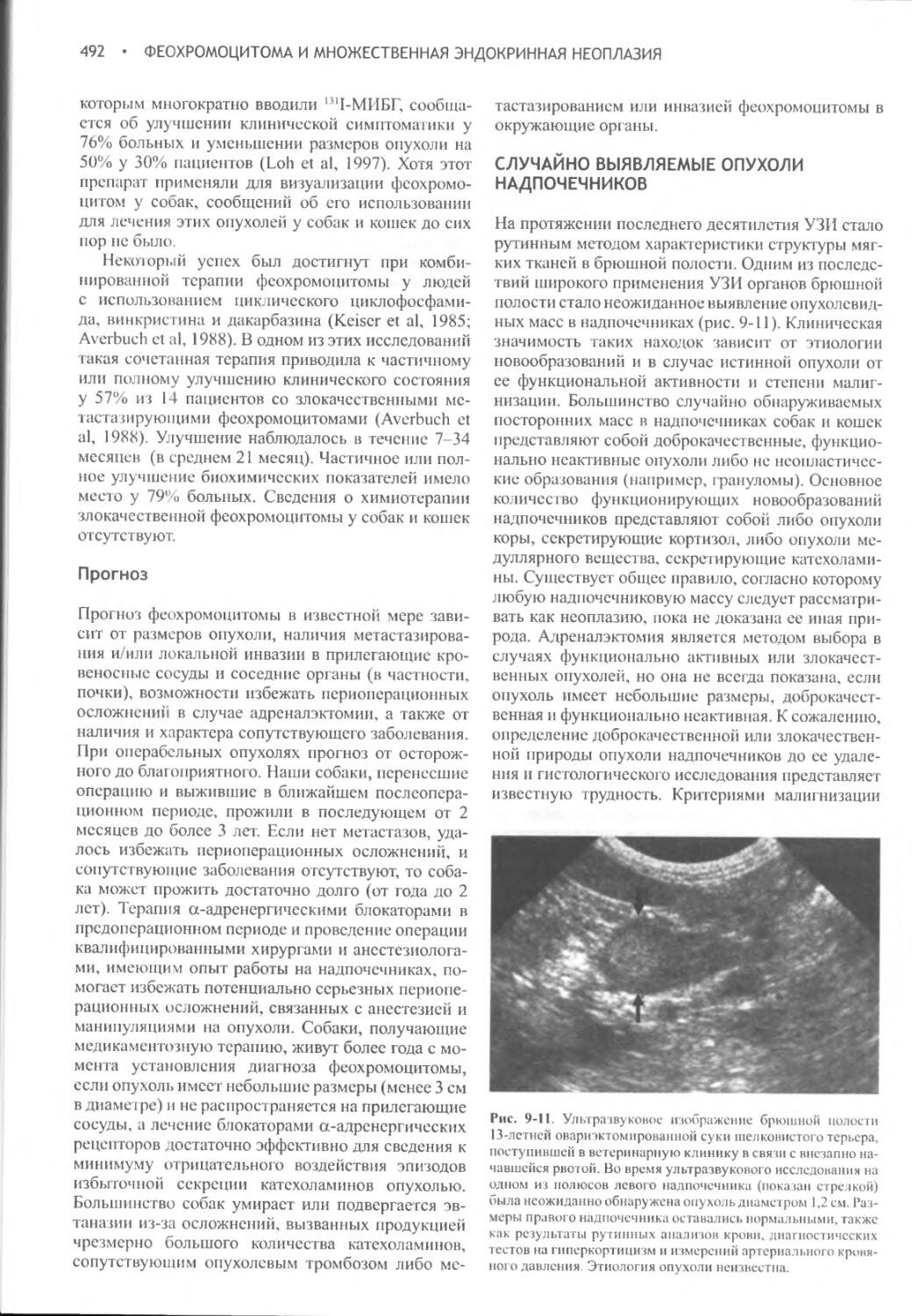
ТАБЛИЦА 1-5. ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ГОРМОНЫ, ВЫЗЫВАЮЩИЕ ПОЛИУРИЮ И ПОЛИДИПСИЮ У СОБАК И
КОШЕК
Противосудорожные средства* Фенобарбитал
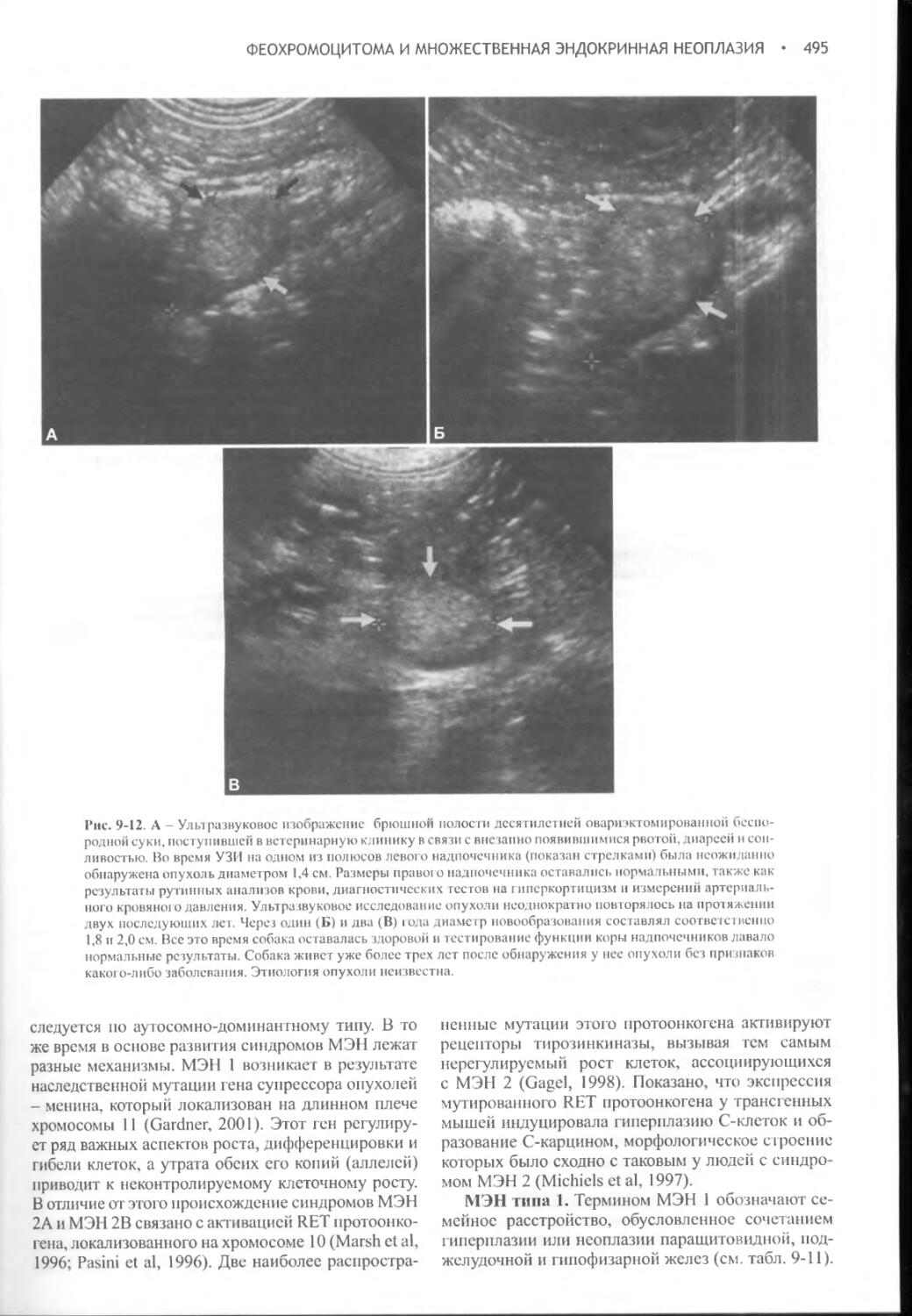
Примидон Дилантин Глюкокортикоиды* Диуретики* Маннитол
Добавки синтетических тиреоидных гормонов Амфотерицин В Литий
Метоксифлюран
Бикарбонат натрия Добавки соли* Витамин Д (токсичность)
* Распространенная причина.
стимуляции секреции натрийуретического пептида предсердия (НПП) и активации барорецепторов в предсердии и каротидном синусе. НПП, в свою очередь, ингибирует секрецию АВП из гипофиза и снижает чувствительность собирательных трубочек к действию АВП (Dillingham, Anderson, 1986; Leeetal, 1987).
Первичная и психогенная полидипсия
Первичной полидипсией называют чрезмерное потребление воды, значительно превышающее необходимость компенсировать избыточную потерю жидкости. У людей первичная полидипсия является следствием нарушения функции питьевого центра и может быть связана с психическим расстройством (Reeves et al, 1998). Первичная дисфункция питьевого центра, приводящая к компульсивному потреблению воды, у собак и кошек не описана, хотя у собак с подозрением на первичную полидипсию отмечали аномальный ответ вазопрессина на инфузию гипертонического солевого раствора (van Vonderen et al, 1999). Компульсивное потребление воды, имеющее психогенную и поведенческую основу, наблюдалось у собак, но неизвестно у кошек. Психогенная полидипсия может быть вызвана сопутствующим заболеванием (например, недостаточностью функции печени или гипертиреозом) либо является усвоенным поведением после изменения условий содержания животного. Возникающая при этом полиурия представляет собой компенсаторное явление, служащее для предотвращения избыточной гидратации. Психогенную полидипсию диагностируют методом исключения других причин полиурии и полидипсии, а также подтверждением способности лишенных воды собак или кошек концентрировать мочу до удельного веса выше 1,030. Более подробно этот синдром рассматривается в последующих разделах.
Ятрогенные (лекарственные) причины полиурии и полидипсии
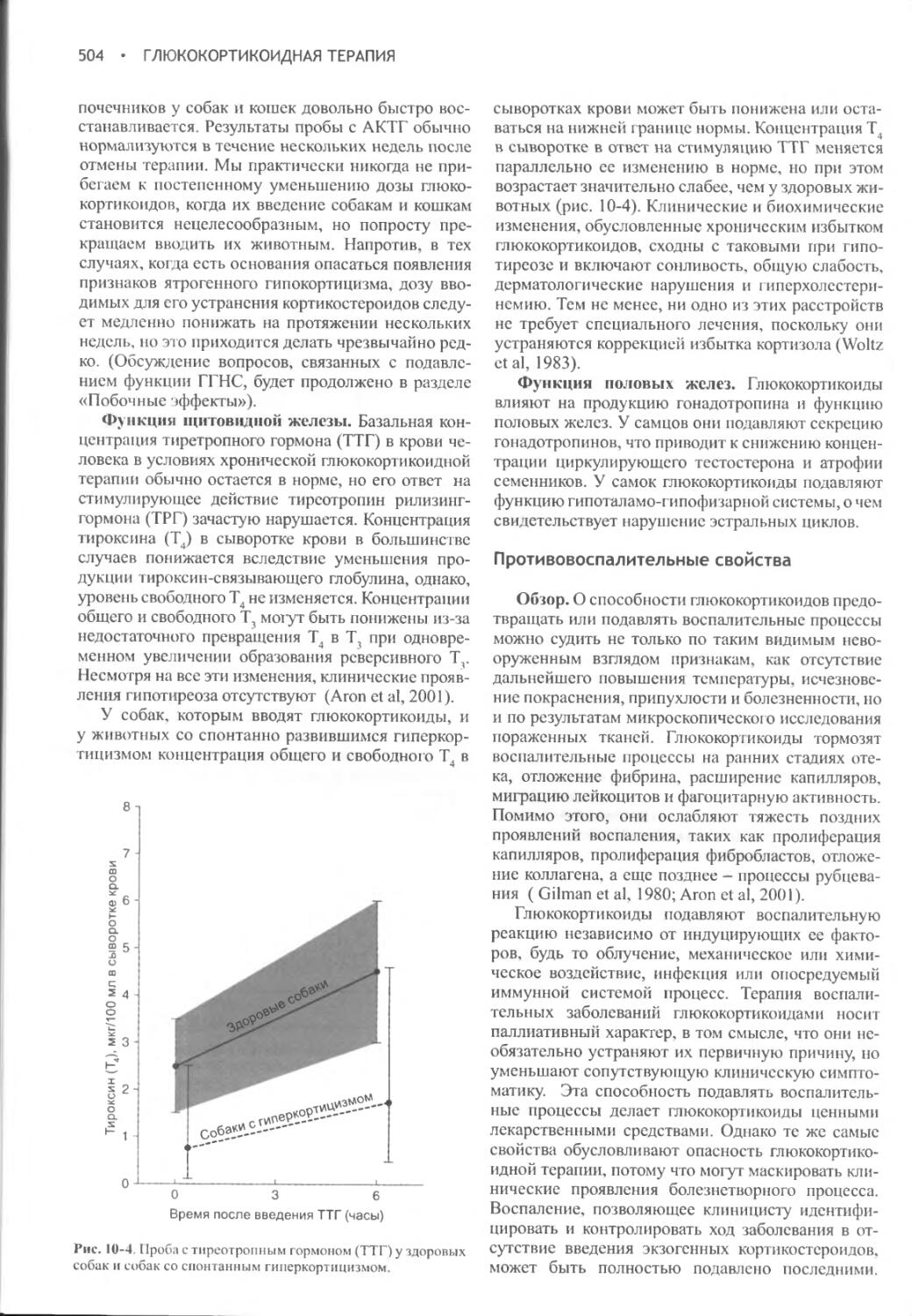
Некоторые лекарственные средства могут вызывать полиурию и полидипсию (табл. 1-5). В ветеринарии мелких животных такими средствами чаще всего оказываются глюкокортикоиды, диуретики, противосудорожные препараты (например, фенобарбитал), синтетический левотироксин и солевые добавки. Диагностика ятрогенных полиурии и полидипсии обычно не вызывает затруднений, и они исчезают после отмены вызвавшего их препарата. Если этого не происходит, следует провести обследование на наличие сопутствующего заболевания либо оценить вероятность вымывания растворимых веществ из мозговой ткани почек.
Вымывание растворенных соединений из мозгового вещества почек
Потеря растворенных соединений, в первую очередь натрия и мочевины, из мозгового вещества почек приводит к исчезновению его гипертоничности и нарушает способность нефронов концентрировать ультрафильтрат. Вымывание растворенных соединений из мозгового вещества почек обычно обусловлно одним из описанных выше расстройств. Оно может быть вызвано хроническим приемом диуретиков или нарушениями циркуляции, в частности, при синдромах повышенной вязкости крови (полицитемия, гиперпротеинемия), непроходимости лимфатических протоков почек (лимфосаркома, лимфангиэктазия) или системном васкулите (септицемия, системная красная волчанка). Возможно, клинически наиболее важным последствием вымывания растворенных соединений из мозгового вещества почек является его влияние на результаты модифицированной пробы с лишением жидкости. Гипертоничность мозгового вещества почек обычно восстанавливается после устранения причины полиурии и полидипсии.
МЕТОДЫ ДИАГНОСТИКИ ПОЛИУРИИ И полидипсии
В зависимости от причины полиурии и полидипсии обследование собак и кошек может требовать больших затрат времени и средств (например, при частичном ЦНД) либо быть быстрым и недорогим (например, при сахарном диабете). Поэтому подозрение на полидипсию и полиурию должно быть достаточно обоснованным как данными анамнеза, так и результатами повторных определений удельного веса мочи и, при необходимости, количественной оценкой потребления воды собакой или кошкой на протяжении нескольких дней в домашних условиях. Среднесуточное потребление воды собаками обычно не превышает 60 мл/кг веса тела при максимальном нормальном значении 100 мл/кг. Такие же показатели установлены для кошек, хотя, как
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 15
ТАБЛИЦА 1-6. РЕЗУЛЬТАТЫ АНАЛИЗА МОЧИ У СОБАК С НЕКОТОРЫМИ ЗАБОЛЕВАНИЯМИ, ВЫЗЫВАЮЩИМИ ПОЛИУРИЮ И ПОЛИДИПСИЮ
УДЕЛЬНЫЙ ВЕС МОЧИ
Расстройство Число собак Среднее Диапазон Протеинурия Лейкоциты (>5 в поле зрения)
Несахарный диабет цент- 20 1,005 1,001-1,012 5% 0%
рального генеза Психогенная полидипсия 18 1,011 1,003-1,023 0% 0%
Г иперкортицизм 20 1,012 1,001-1,027 48% 0%
Почечная недостаточ- 20 1,011 1,008-1,016 90% 25%
ность Пиелонефрит 20 1,019 1,007-1,045 70% 75%
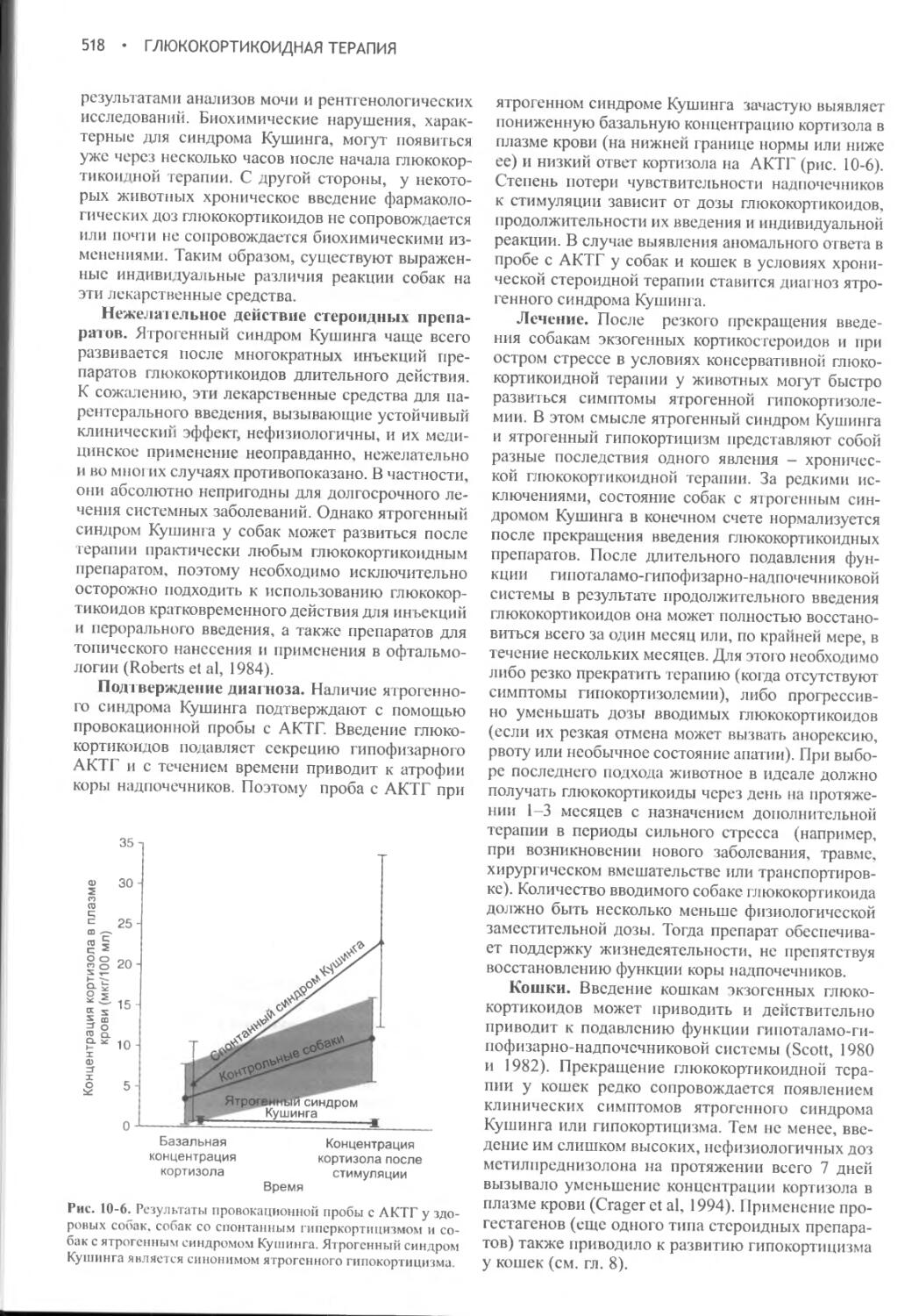
правило, они пьют гораздо меньше. Если владелец знает, сколько воды выпивает его питомец в среднем за сутки, и если количество воды стало превышать предельную норму, то углубленная диагностика причины данного расстройства вполне оправдана. При ранее нормальном среднесуточном потреблении воды патологические полиурия и полидипсия мало вероятны и следует предполагать влияние иных факторов (например, жаркой погоды) либо неправильное толкование понятия полиурии (т.е. наличие дизурии, а не полиурии). Диагностика обоснована и в том случае, когда владелец уверен, что потребление воды и интенсивность мочеиспускания изменились, даже если потребление воды остается в нормальных пределах.
Для выявления полиурии и полидипсии полезно определение удельного веса мочи, которое может дать ключ к постановке диагноза, особенно если проводятся повторные анализы (табл. 1-6). У здоровых собак удельный вес мочи варьирует в весьма широком диапазоне, иногда от 1,006 до 1,040 в течение суток (van Vbnderen et al, 1997b). У здоровых кошек такие сильные колебания удельного веса мочи не зарегистрированы.
Мы рекомендуем владельцам животных собирать несколько проб мочи в разное время суток на протяжении 2-3 дней и хранить их в холодильнике до обращения в ветеринарную клинику для определения удельного веса. Если удельный вес множественных проб мочи значительно меньше 1,030 (особенно если он меньше 1,020), то вероятность полиурии и полидипсии весьма высока и необходимо выяснить причины расстройства. Если же удельный вес разовой или множественных проб превышает 1,030, значит, у животного сохраняются нормальная способность концентрировать мочу и нормальное взаимодействие гипофизарного вазопрессина с клетками почечных канальцев. Тем не менее, полиурия и полидипсия у собак и кошек бывают даже при нормальной концентрации мочи. В этих случаях необходима дифференциальная диагностика для исключения заболеваний, вызывающих осмотический диурез (например, сахарного диабета), психогенной полидипсии и нарушений регуляции секреции АВП (van Vbnderen et al, 1999).
Существует множество возможных причин полидипсии и полиурии у собак и кошек (см. табл. 1-3).
Одна из наиболее редких - несахарный диабет. Поэтому при наличии в анамнезе животного тяжелых полиурии и полидипсии, специфической диагностике несахарного диабета должен предшествовать тщательный анализ иных возможных причин (рис. 1-7). Современная система дифференциальной диагностики позволяет избежать поспешных выводов или необоснованной постановки диагноза и неправильного лечения. Необходимо создать достоверную базу данных. Используя исходную информацию, можно дифференцировать многие частые клинические расстройства, сопровождающиеся полиурией и полидипсией, от более редких, таких как ЦНД, ННД или психогенная полидипсия.
Наш подход к диагностике полиурии и полидипсии у животных (см. рис. 1-7) состоит в первоначальном исключении наиболее часто встречающихся заболеваний. Мы рекомендует сначала проводить ОАК, анализ мочи с ее посевом после взятия пробы методом надлобковой пункции мочевого пузыря для выявления бактериальной инфекции и оценку биохимического профиля крови с определением ферментов печени, AM, кальция, фосфора, натрия, калия, холестерина, глюкозы, общего белка и альбумина. У старых кошек необходимо также определение концентрации тироксина (Т4) в сыворотке крови. В зависимости от анамнеза и результатов физикального исследования может быть показано УЗИ брюшной полости для определения размеров печени, почек, надпочечников или матки, а также исследование на обызвествление надпочечников при подозрении на гиперкортицизм. Внимательная оценка анамнеза, результатов физикального исследования и исходной базы данных обычно позволяет сразу поставить диагноз (например, сахарный диабет или пиометра) либо сосредоточить внимание клинициста на других возможных причинах полидипсии и полиурии (увеличение активности сывороточной щелочной фосфатазы или повышение концентрации холестерина при гиперкортицизме).
Бывает, что у собак и кошек с полиурией и полидипсией ни физикальное исследование, ни анализ первичной базы данных не выявляют видимых нарушений. В этих случаях у животных возможно наличие несахарного диабета, психогенного увеличения потребления воды, нетипичного гиперкор-тицизма, почечной недостаточности в отсутствие
16
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
1-й этап
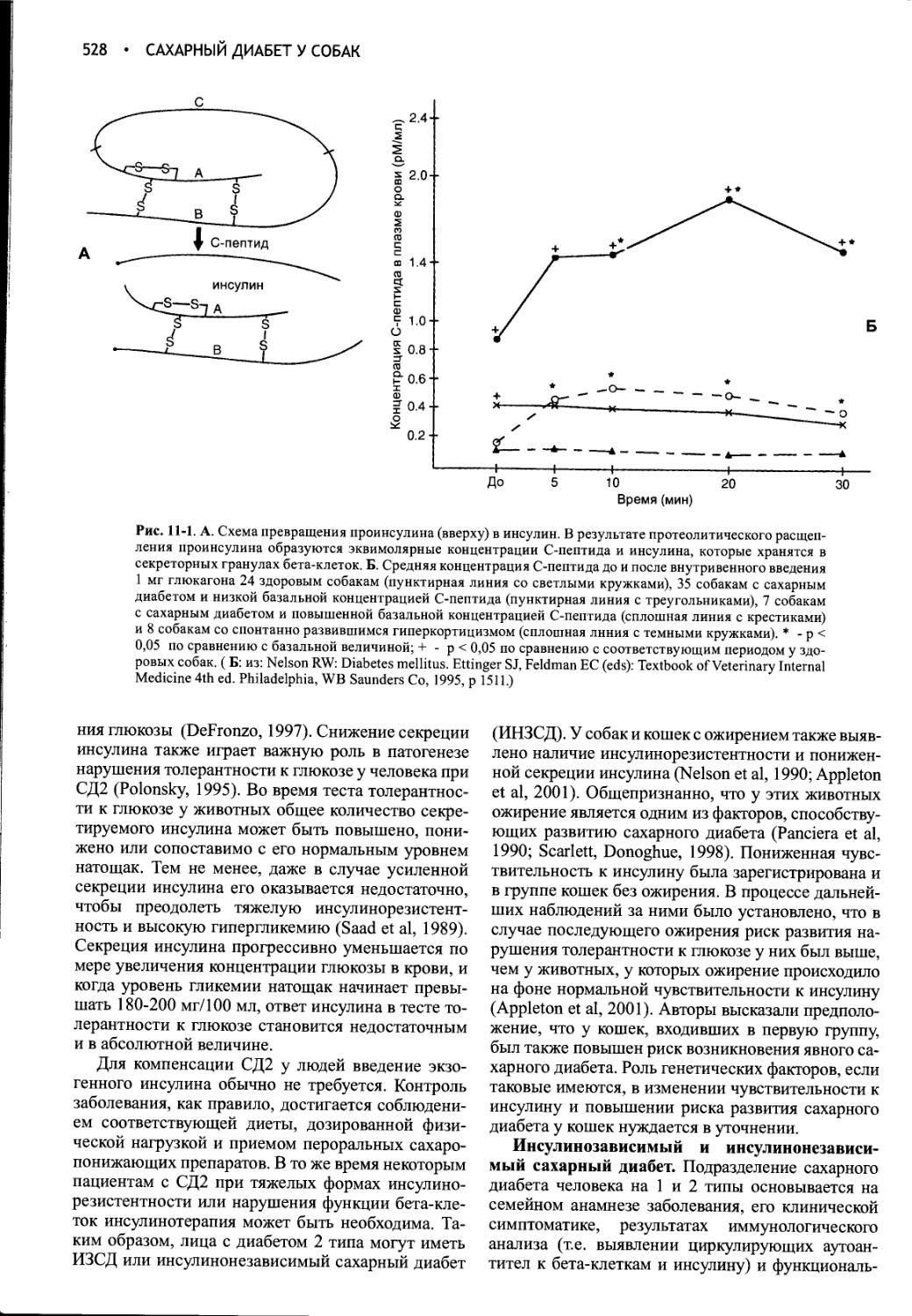
2-й этап
Предварительная оценка
а) Потребление воды >100 мг/кг веса тела
б) Продукция мочи >50 мл/кг веса тела
в) Удельный вес рандомизированных проб мочи <1,012
I
Анамнез и Физикальное исследование
а) Интактная самка: Иск. пиометры
б) Лимфаденопатия: Иск. гиперкальциемии
в) Потеря веса, полифагия, беспокойное состояние, тахикардия:
Иск. гиперкортицизма Иск. сахарного диабета
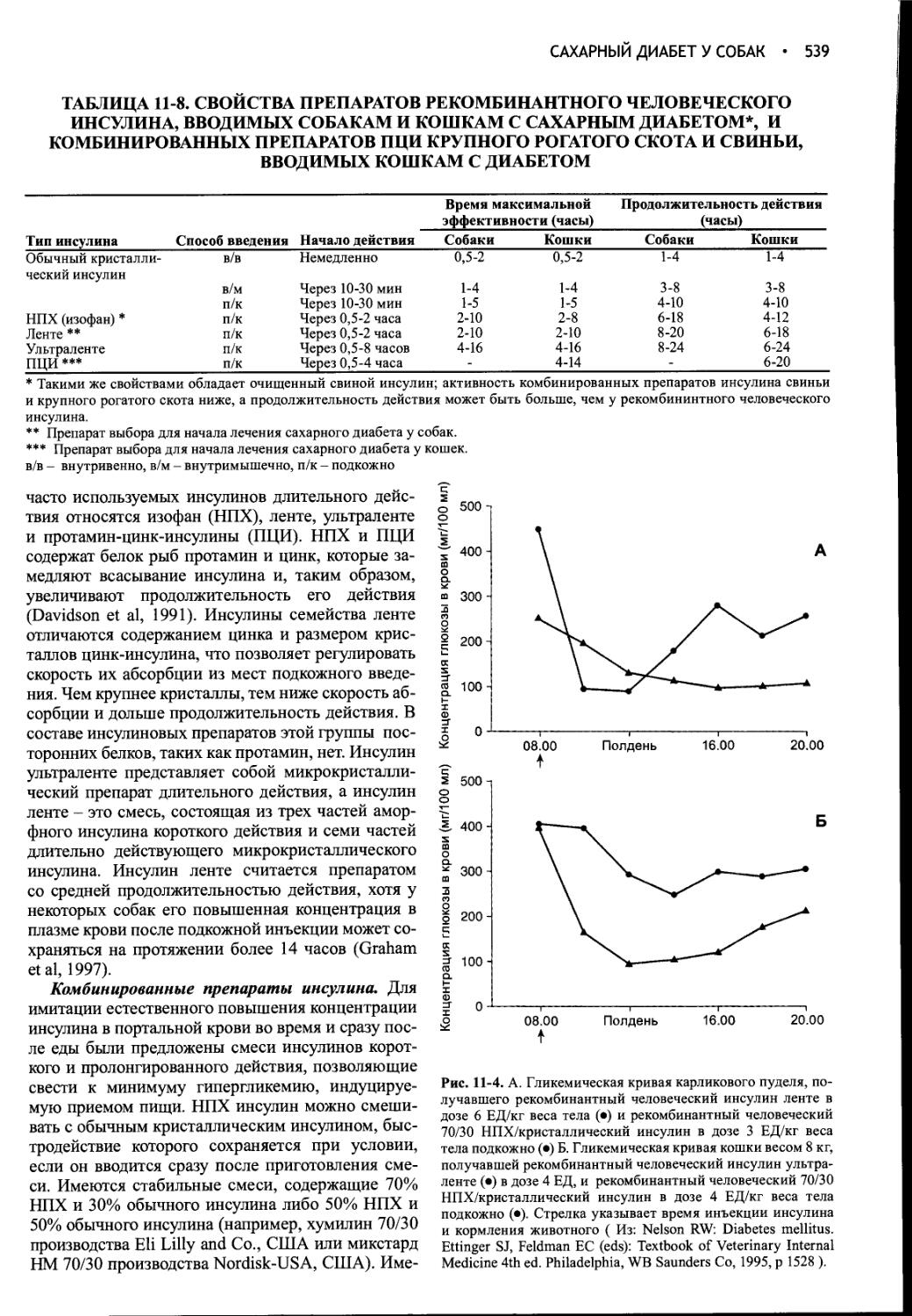
г) Симметричная алопеция, вздутый живот, calcinosis cutis, истончение кожи, мышечная слабость, гепатомегалия и т.д.: Иск. гиперкортицизма
д) Лекарственные средства:
Иск. глюкокортикоидов
Иск. диуретиков
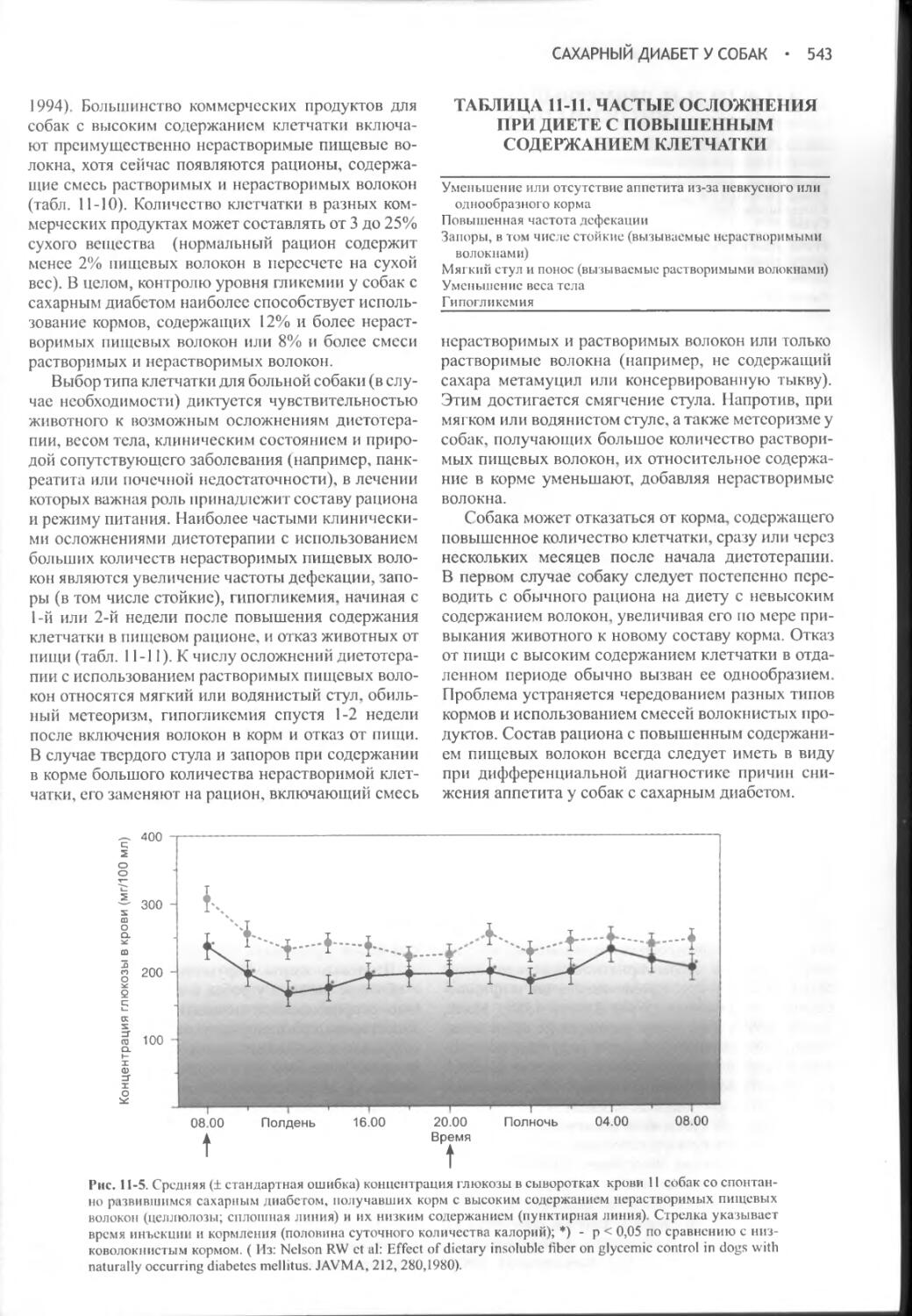
Иск. примидона
Иск. добавок соли
е) Норма
3-й этап
а) Гликозурия
Глюкоза крови
Эугликемия
Иск. первичной почечной гликозурии Глюкозурия
Гипергликемия (>200 мг/100 мл) Иск. сахарного диабета
4-й этап
а) Если УВ <1,006; возможны ЦНД, ННД, ПП, синдром Кушинга
5-й этап
Анализ мочи
б) Пиурия, бактериурия Иск. пиелонефрита Иск гиперкортицизма Иск пиометры
в) Выраженная протеинурия г) Норма
Иск дисфункции почек
Иск пиометры
Определение удельного веса (УВ) мочи б) Если УВ >1,030; полиурия и полидипсия отсутствуют,
Создание базы данных
в) ЕслиУВ 1,007-1,030
а) Гемограмма
Иск. пиелонефрита
Иск. пиометры
б) Биохимический профиль
Иск. почечной недостаточности
Иск. гиперкортицизма
Иск. гиперкальциемии
Иск недостаточности функции печени
в) Электролиты
Иск. гипокортицизма
Иск. гипокалиемии
г) Рентгенография/УЗИ брюшной полости
Иск. пиометры
Иск. гиперкортицизма
Иск. недостаточности функции печени
Иск хронической почечной недостаточности
6-й этап
а) подозрение на синдром Кушинга
1. Проба с АКТГ
2. Проба с дексаметазоном
t
б) Вероятность другого диагноза
в) Норма
7-й этап
Модифицированная проба с лишением жидкости
Иск. гипофизарного несахарного диабета
Иск. нефрогенного несахарного диабета
Иск первичной полидипсии
Рис. 1-7. Схема диагностического обследования собак и кошек с тяжелыми полиурией и полидипсией. Иск - исключение (диагноза), ЦНД - несахарный диабет центрального генеза, ННД - нефрогенный несахарный диабет, ПП - первичная (психогенная) полидипсия
азотемии или слабого нарушения функции печени. До проведения проб на несахарный диабет и психогенную полидипсию необходимо исключить гиперкортицизм и почечную недостаточность. К числу рекомендуемых тестов относятся оценка функции гипофизарно-надпочечниковой системы и печени (в частности, определение уровня желчных кислот до и после еды), проба на белок мочи, креатининовый индекс, контрастная рентгенография и, по показаниям, биопсия почки.
Ключ к диагностике причин полиурии и полидипсии может дать определение удельного веса мочи и содержания в ней белка (таблица 1-6). Например, если удельный вес мочи при повторных определе
ниях постоянно находится в изостенурическом диапазоне (от 1,008 до 1,015), то в качестве первичного дифференциального диагноза можно предположить недостаточность функции почек, особенно при наличии протеинурии и показателях AM и сывороточного креатинина на верхнем пределе нормы или выше (соответственно > 25 мг/100 мл и > 0,8 мг/100 мл). Изостенурия довольно обычна для собак с гиперкортицизмом, психогенно повышенным потреблением жидкости, недостаточностью функции печени, пиелонефритом и частичным несахарным диабетом центрального генеза с сопутствующим ограничением воды. Однако удельный вес мочи при этих расстройствах непостоянен и может периоди-
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 17
Рис. 1-8. Средний удельный вес мочи до и через 3 месяца после гипофизэктомии у четырех собак, получавших полиионные жидкости во время операции (сплошная линия), и у четырех собак, получавших во время операции полиионные жидкости и дексаметазон (пунктирная линия). Из: Lantz GC et al: Am J Vet Res 49:1134, 1988.
чески превышать изостенурический диапазон (при гиперкортицизме, психогенной полидипсии, недостаточности функции печени и пиелонфрите) либо быть ниже его (при гиперкортицизме, психогенном увеличении потребления воды, частичном несахарном диабете центрального генеза). В то же время, если удельный вес мочи постоянно ниже 1,006, это позволяет исключить почечную недостаточность и пиелонефрит и сосредоточиться на диагностике несахарного диабета, психогенной полидипсии или гиперкортицизма.
Диагноз несахарного диабета и психогенного увеличения потребления воды должен основываться на результатах модифицированной пробы с лишением жидкости, оценки осмоляльности плазмы крови и реакции на терапию синтетическим вазопрессином (см. раздел «Подтверждение диагноза несахарный диабет»). Лучше всего до проведения проб на несахарный диабет и психогенную полидипсию (особенно модифицированной пробы с лишением жидкости) исключить все реальные случаи вторично приобретенного ННД. Рекомендуемые лабораторные исследования не только обеспечивают установление ветеринарным врачом правильного диагноза, но и ориентируют его на поиск возможных сопутствующих клинических расстройств. Такой логический, системный подход может показаться чересчур громоздким, однако он позволяет избежать диагностических ошибок. Еще важнее то обстоятельство, что он избавляет от необходимости подвергать животное ненужным, дорогостоящим и потенциально опасным процедурам в случае неправильно поставленного предварительного диагноза.
ЭТИОЛОГИЯ НЕСАХАРНОГО ДИАБЕТА И ПЕРВИЧНОЙ ПОЛИДИПСИИ
Недостаточность вазопрессина -несахарный диабет центрального генеза
Определение. ЦНД - это полиурический синдром, обусловленный недосточностью АВП и, как следствие, снижением способности почек концентрировать мочу для сохранения воды в организме. Недостаточность АВП может быть абсолютной или частичной. Абсолютная недостаточность приводит к устойчивой гипостенурии и патологическому диурезу. У собак и кошек с абсолютной недостаточностью АВП удельный вес мочи обычно остается на гипостенурическом уровне (1,006 или ниже) даже в условиях тяжелой дегидратации. Частичная недостаточность АВП, именуемая частичным ЦНД, тоже вызывает устойчивую гипостенурию и усиленный диурез у собак и кошек, имеющих неограниченный доступ к воде. Однако ограничение потребления воды у животных с ЦНД способствует повышению удельного веса их мочи до изостену-рических величин (от 1,008 до 1,015), хотя обычно не обеспечивает ее более значительную концентрацию (до 1,015-1,020) даже в случаях тяжелого обезвоживания. У всех собак и кошек с частичным ЦНД максимальная способность концентрировать мочу в условиях дегидратации обратно пропорциональна степени снижения секреции АВП. Иными словами, чем тяжелее недостаточность АВП, тем ниже концентрация и удельный вес мочи во время дегидратации.
Патофизиология. ЦНД является следствием поражения центров биосинтеза вазопрессина, т. е. супраоптических и паравентрикулярных ядер гипоталамуса, и/или утраты основных путей (аксонов), по которым АВП транспортируется в места его хранения и высвобождения в задней доле гипофиза (см. рис. 1-2). Персистирующий ЦНД развивается в тех случаях, когда поражены верхние сегменты нейрогипофизарного тракта и происходит двустороннее разрушение нейронов супраоптических и паравентрикулярных ядер. Показано, что перерезка гипоталамо-гипофизарного тракта ниже срединно
18 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
го возвышения гипоталамуса или удаление задней доли гипофиза вызывает лишь преходящие (хотя и тяжелые) ЦНД и полиурию, поскольку из волокон, оканчивающихся в срединном возвышении и ножке гипофиза, продолжает высвобождаться достаточное количество гормона, предотвращающего развитие стабильного несахарного диабета (рис. 1-8; Ramsay, 1983).
Хирургическое повреждение гипоталамуса у кошек вызывало трехфазный ответ, приводящий к развитию несахарного диабета. Сразу после повреждения возникали полиурия и полидипсия, которые обычно сохранялись на протяжении 4-5 дней. Затем наступал 6-дневный период интенсивного антидиуреза, сменявшийся, в свою очередь, стабильным несахарным диабетом. Как полагают, первая фаза была обусловлена острой травмой, которая нарушала способность высвобождать накопленный АВП. Антидиуретическая фаза была связана с дегенерацией ткани, содержащей гормон, и высвобождением в кровяное русло избыточного количества АВП. Это подтверждается отсутствием обычной диуретической реакции на нагрузку водой во второй фазе. Когда у животных одновременно с повреждением гипоталамуса удаляли заднюю долю гипофиза, антидиуретическая фаза отсутствовала. При слабом повреждении гипоталамуса стабильный ЦНД после второй фазы не развивался.
Этиология. ЦНД может возникнуть при любой форме поражения нейрогипофизарной системы. Известные причины ЦНД у собак и кошек перечислены в табл. 1-7. Наиболее часто встречается идиопатический ЦНД, возникающий в любом возрасте независимо от породы и пола животных. Посмер-
ТАБЛИЦА 1-7. ИЗВЕСТНЫЕ ПРИЧИНЫ НЕСАХАРНОГО ДИАБЕТА ЦЕНТРАЛЬНОГО
ГЕНЕЗА У ЛЮДЕЙ, СОБАК И КОШЕК
Люди Собаки и кошки
Приобретенные Приобретенные
Идиопатические Идиопатические
Травматические Травматические
Неоплазия Неоплазия
Краниофарингиома Краниофарингиома
Герминома Хромофобная аденома и аденокарцинома
Менингиома Метастазы
Лимфома Порок развития гипофиза
Аденома Кисты
Метастазы Гранулемы Инфекции Вирусные Бактериальные Сосудистые расстройства Синдром Шихена Аневризмы Аутоиммунные расстройства Воспаление
Семейные (аутосомнодоминантные) Семейные?
твое вскрытие собак и кошек с идиопатическим ЦНД не позволяет установить причину недостаточности АВП.
В качестве возможной причины идиопатического ЦНД у человека рассматривалось аутоиммунное поражение гипоталамуса (Salvi et al, 1988). У некоторых людей с этим заболеванием были найдены в крови антитела к АВП, которые связывались с клеточными мембранами в препаратах гипоталамуса (Scherabum, 1987). Антитела к клеткам, содержащим АВП, обнаруживались еще до возникновения ЦНД, причем их титр снижался до отрицательных значений по мере увеличения продолжительности заболевания (Bhan, O’Brien, 1982; Scherbaum et al, 1986). У этих больных была также выявлена достоверная связь ЦНД с другими эндокринопатиями (в частности, с аутоиммунным тиреоидитом и болезнью Аддисона). Следовательно, по крайней мере, в отдельных случаях, полиэндокринные аутоиммунные процессы могут затрагивать и гипоталамус (см. гл. 3). У собак и кошек подобная связь между ЦНД и другими эндокринопатиями не установлена, и роль иммунных механизмов в возникновении ЦНД не исследована.
Наиболее частыми причинами ЦНД у собак и кошек являются травма головы (случайная или нейрохирургическая), неоплазия и пороки развития гипоталамуса или гипофиза (например, образование кистозных структур). Травма головы приводит к временному или персистирующему ЦНД в зависимости от жизнеспособности клеток супраоптического и паравентрикулярного ядер. Травматический разрыв ножки гипофиза нередко вызывает преходящий ЦНД, чаще всего продолжительностью от 1 до 3 недель (см. рис. 1-8; Lantz et al, 1988; Authement et al, 1989). Длительность несахарного диабета зависит от расстояния от места перерезки ножки гипофиза до гипоталамуса. Перерезка на проксимальных уровнях, близко к срединному возвышению гипоталамуса, увеличивает время восстановления гипоталамических аксонов и секреции АДГ. Подозрение на травматическую этиологию ЦНД возникает, когда тяжелые полиурия и полидипсия развиваются в течение 48 часов после травмы головы, либо когда гипонатриемия, гипостенурия и гипертоническая дегидратация у травмированной собаки или кошки развиваются после внутривенного вливания жидкости, а не после неограниченного доступа к воде.
К числу первичных внутричерепных опухолей, сопровождающихся развитием несахарного диабета у собак и кошек, относятся краниофарингиома, хромофобная аденома гипофиза и гипофизарная хромофобная аденокарцинома (рис. 1-9; Neer, Reavis, 1983; Goossens et al, 1995; Harb et al, 1996). Метастазы опухолей в гипоталамусе и гипофизе также могут приводить к возникновению ЦНД. У человека такие метастазы обычно исходят из опухолей легкого или молочной железы (Reeves et al, 1998). Участие метастазирующих карциномы, лимфомы
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 19
Рис. 1-9. МР1-томограмма гипофизарной области 12-летнсго самца боксера с песахарным диабетом центрального генеза, гипотиреозом и неврологической симптоматикой (в поперечной (А) и сагиттальной (Б) плоскостях) Видно скопление ткани в области гипофиза, гипоталамуса и ростральной части дна свода черепа (показано стрелками)
и злокачественной меланомы молочной железы, а также карциномы поджелудочной железы в возникновении ЦНД подтверждено обнаружением метастазов в гипофизе и гипоталамусе собак с этими заболеваниями (Capen, Martin. 1983; Davenport et al, 1986). Данных о роли метастатической неоплазии в качестве причины ЦНД у кошек не имеется.
У людей известна редкая наследственная форма ЦНД. которая передается как аутосомный доминантный признак и с равной частотой встречается у мужчин и женщин; она передается от отца к сыну и проявляется с разной степенью выраженности у отдельных лиц (Baylis, Robertson, 1981). Считается, что это заболевание является следствием дегенеративного поражения нейросекреторных клеток (Kaplowitz et al. 1982). Несмотря на известные случаи ЦНД у котят и щенков, наследственная форма заболевания у них до сих пор не была документирована. В одном из сообщений было высказано предположение о наследственном ЦНД у двух щенков афганской борзой из одного помета, у которых несахарный диабет был диагностирован в возрасте до 4 месяцев. Мать этих собак «всю жизнь» страдала полиурией и полидипсией (Post et al. 1989). При вскрытии погибших щенков в нейрогипофизе и ги-поталамо-гипофизарном тракте на уровне серого бугра были обнаружены вакуолизированные зоны, свидетельствовавшие о гипомиелинизации или демиелинизации. Мы также диагностировали ЦНД в помете из пяти 8-недельных щенков немецкого короткошерстного пойнтера и у трех из пяти 7-недельных шнауцеров, что может говорить о семейной природе заболевания у этих собак.
Первичный (семейный) нефрогенный несахарный диабет
Определение. ННД - полиурическое расстройство, обусловленное пониженной чувствительностью нефронов к действию АВП. Концентрация АВП в плазме крови у животных при этом может быть нормальной или повышенной. Различают первичный (семейный) и вторичный (приобретенный) ННД. Вторичный, или приобретенный, ННД обычен у собак и кошек. Первичный, или семейный, ННД у этих животных - редкое врожденное заболевание, при котором полидипсия и полиурия обычно развиваются к 8-12-недельному возрасту.
Этиология. У человека известны два типа врожденного или семейного ННД. Сцепленный с X-хромосомой ННД является результатом мутаций в гене AVPR2, кодирующем антидиуретический (V,) рецептор АВП. Это редкое рецессивное, сцепленное с Х-хромосомой заболевание, встречается преимущественно у мужчин (Fujiwara et al. 1995; van Lieburg et al. 1995). Аутосомно-рецессивный ННД является не сцепленной с Х-хромосомой формой ННД, которая возникает вследствие мутаций гена AQP2, кодирующего зависимые от АВ11 водные каналы; эти мутации приводят к нарушениям на пострецепторном (пост-цАМФ) уровне (van Lieburg et al, 1994; Deen et al, 1994). Сцепленный с Х-хромо-сомой ННД встречается чаще, чем аугосомно-ре-цессивная форма. Клинические проявления обоих заболеваний развиваются вскоре после рождения.
В ветеринарной литературе имеется лишь несколько сообщений о врожденном (первичном) ННД у собак (Breitschwerdt et al, 1981; Grunbaum et al, 1990; Grunbaum, Moritz, 1991). У кошек первичный ННД еще не диагностирован. Причина первичного ННД у животных не известна. Электронно-микроскопическое исследование мозгового вещества почек у карликового пуделя с первичным ННД выявило вакуолизацию клеток в петле Генле, кровеносных сосудах и интерстициальной ткани, однако значение этих изменений установить нс удалось. При вскрытии немецкой овчарки с первичным ННД никаких изменений в почках обнаружено не было.
Первичный ННД был выявлен у трех из четырех щенков-самцов эскимосской лайки, которая была носительницей гена ННД (Grunbaum et al, 1990). Во внутренних отделах мозгового вещества почек у щенков с ННД количество рецепторов V. было в норме, однако сродство рецепторов к АВП было в 10 раз меньше, чем у здоровых собак (Luzius et al 1992). Отмечалось также зависимое от дозы снижение стимулирующего действия АВП на активность аденилатциклазы. В то же время активация этого фермента химическими агентами, действующими независимо от АВП, была сопоставима с таковой у здоровых животных. Следовательно, у эскимосских лаек с семейным ННД сохраняется нормальная активность аденилатциклазы. Кроме того, у
20 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
ТАБЛИЦА 1-8. ГИПОТОНИЧЕСКИЕ СИНДРОМЫ У ЧЕЛОВЕКА
Избыточное потребление воды
Пониженное выделение воды
Сниженное поступление растворенных веществ в разбавляющие сегменты нефрона
Голодание
Пивная дипсомания
Избыток АВП
Синдром нарушенной секреции антидиуретического гормона
Секреция АВП, индуцированная лекарственными средствами
Избыток АВП при сниженном поступлении растворенных соединений в дистальные отделы нефрона
Врожденный порок сердца
Цирроз печени
Нефротический синдром
Недостаточность кортизола
Гипотиреоз
Применение диуретиков
Почечная недостаточность
этих щенят сохранялся ответ на антидиуретическое действие высоких доз ДДАВП, что свидетельствовало о наличии у них рецепторов V2 с пониженной способностью к связыванию АВП.
Первичная или психогенная полидипсия
Первичная полидипсия (компульсивное потребление воды) - это синдром, который характеризуется потреблением воды в количествах, превышающих нормальную экскреторную способность почек. Первичная полидипсия у человека - одно из нескольких расстройств, объединяемых под названием гипотонические синдромы (табл. 1-8). Оно включает нарушение водного гомеостаза, при котором скорость экскреции свободной воды недостаточна для поддержания нормальной концентрации натрия в крови или нормальной осмоляльности жидкости в организме (Reeves et al, 1998). Гипонатриемия является наиболее показательным признаком гипотонических синдромов, хотя у людей с первичной полидипсией она обычно выражена довольно слабо; в большинстве случаев концентрация натрия в сыворотке крови составляет около 135 мЭкв/л.
Первичная полидипсия чаще всего встречается у пациентов с психическими расстройствами (Cronin, 1987; Victor et al, 1989) и иногда у лиц с повреждениями, затрагивающими питьевой центр. Причина полидипсии у больных с психическими расстройствами неизвестна, у многих из них, помимо полидипсии, имеются нарушения экскреции воды, связанные с избыточной секрецией АВП (Goldman et al, 1988).
У собак и кошек первичная полидипсия, вызванная поражением гипоталамуса, затрагивающим питьевой центр, не встречается. Компульсивное потребление воды, обусловленное психическим
расстройством, у собак бывает редко, а у кошек отсутствует. Обычно первичная полидипсия развивается у гиперактивных собак, содержащихся в условиях ограниченной подвижности. Некоторые из этих животных перенесли резкую смену условий содержания, что оказало на них мощное стрессор-ное воздействие. У отдельных собак компульсивное потребление воды является усвоенным поведением, направленным на привлечение внимания хозяина. В условиях ограничения питья собаки с психогенно-обусловленной полидипсией могут концентрировать мочу до удельного веса более 1,030, но на это уходит несколько часов, так как одновременно происходит вымывание растворенных веществ из мозгового вещества почек. Удельный вес мочи значительно варьирует во времени, поэтому при многократном анализе могут быть выявлены и концентрированные пробы. Наличие таких проб свидетельствует о продукции АВП в гипоталамусе и его секреции гипофизом, а также о чувствительности почечных канальцев к АВП.
Недавно у четырех собак с подозрением на первичную полидипсию была описана аномальная секреция АВП в ответ на стимуляцию гипертоническим солевым раствором (van Vbnderen et al, 1999). У всех этих животных имелись полиурия и полидипсия на фоне нормальных результатов рутинного лабораторного обследования, за исключением того, что были выявлены гипостенурия и концентрация мочи в пробе с лишением воды. При серийных измерениях осмоляльность мочи у двух собак спонтанно достигала высоких значений (т.е. превышала 1000 мОсм/кг). В модифицированной пробе с лишением воды концентрация АВП в крови всех собак оставалась на относительно низком уровне. У всех животных был нарушен ответ АВП на инфузию гипертонического солевого раствора, причем порог был повышен у трех особей, чувствительность была увеличена у двух собак, и у одной собаки наблюдался чрезмерно высокий ответ. Эти данные свидетельствуют о первичном нарушении регуляции секреции АВП, хотя ее снижение в условиях повышенного осмотического давления могло быть следствием хронического перенасыщения организма водой (Moses, Clayton, 1993). Пониженная секреция АВП в тестах с лишением жидкости и гипертонической стимуляцией была описана у людей с первичной полидипсией (Zerbe, Robertson, 1981); в последующем у них был диагностирован частичный несахарный диабет. Не вполне ясно, имелся ли у собак, описанных в приведенной выше работе (van Vbnderen et al, 1999), вариант или начальная стадия частичного несахарного диабета. Наличие у них первичной полидипсии было установлено на основании способности концентрировать мочу до удельного веса более 1,030, однако выявленные патологические изменения предполагают скорее расстройство секреции АВП, нежели нарушение функции питьевого центра как такового.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 21
Рис. 1-10. Распределение 41 собаки с диагнозом несахарный диабет центрального генеза по полу и возрасту.
КЛИНИЧЕСКАЯ КАРТИНА НЕСАХАРНОГО ДИАБЕТА И ПСИХОГЕННОЙ ПОЛИДИПСИИ
Проявления
Несахарный диабет центрального генеза. Предрасположенность к ЦНД не связана ни с породой, ни с возрастом, ни с полом животного (рис. 1-10). В нашей клинике ЦНД был диагностирован у 41 собаки 23 различных пород. Чаще других болели боксеры (5 собак), немецкие овчарки (4 собаки) и лабрадоры-ретриверы (3 собаки). Возраст на момент постановки диагноза у всех этих собак колебался от 7 недель до 14 лет и в среднем составлял 5 лет. Большинство собак с ЦНД были моложе двух или старше шести лет.
В литературе описаны 7 случаев ЦНД у кошек (Bumie, Dunn, 1982; Winterbotham, Mason, 1983; Kraus, 1987; Brown et al, 1993; Pittari, 1996). Еще у 4 кошек ЦНД был диагностирован в нашей клинике.
-1 мес мес мес мес года
Длительность клинических проявлений
Рис. 1-11. Продолжительность полиурии и полидипсии у 20 собак с несахарным диабетом центрального генеза до обращения их владельцев в ветеринарную клинику.
Среди этих 11 животных имелись коротко- и длинношерстные кошки (8 особей), две персидские и одна абиссинская кошка. Шестеро были интактными или овариэктомированными самками, остальные - интактными или кастрированными самцами. Возраст на момент установления диагноза колебался от 8 недель до 6 лет (в среднем 1,5 года).
Первичный нефрогенный несахарный диабет. Первичный ННД редко встречается у собак и кошек. К настоящему времени он описан у 13-не-дельного кобеля немецкой овчарки, у 18-месячного кобеля карликового пуделя, у 18-месячного бостон-терьера и в одной семье лаек (хаски) (Breitschwerdt et al, 1981; Grunbaum et al, 1990). Кроме того, мы диагностировали ННД у 5-месячной норвежской лайки и у годовалого бостон-терьера. Обе последние собаки страдали полиурией и полидипсией со времени их приобретения хозяевами в возрасте 6-8 недель. У кошек первичный ННД не описан.
Психогенная полидипсия. Психогенная полидипсия встречается у собак самых разных пород независимо от пола и возраста. Среди 18 собак, у которых в нашей клинике обнаружили психогенную полидипсию, были представители 15 пород. Одиннадцать из них были интактные или овариэк-томированные суки в возрасте от 6 месяцев до 11 лет (средний и срединный возраст соответственно 4,5 и 4 года). Психогенная полидипсия у кошек не описана.
Клинические признаки
Наиболее характерными клиническими признаками несахарного диабета и психогенной полидипсии
22 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
являются полиурия и полидипсия. Как показывает пример двух поступивших к нам собак с ЦНД, которые пили воду даже во время мочеиспускания, клиническое течение полиурии и полидипсии может быть достаточно тяжелым. Обычно к моменту обращения за ветеринарной помощью собаки находятся в таком состоянии уже в течение 1-6 месяцев (рис. 1-11). Многие владельцы собак и кошек жалуются на недержание мочи у животных, проявляющееся в виде частого мочеиспускания и неспособности дождаться выгула, а отчасти неспособности, особенно во время сна, удерживать мочу из-за ее слишком большого объема. Хозяева кошек с несахарным диабетом нередко сетуют также на необходимость частой смены подстилки (ежедневно или два раза в день). Неутолимая жажда иногда приводит к тому, что животные пьют любую жидкость, в том числе снег, лед и мочу. Бывают случаи, когда жажда пересиливает нормальный аппетит, т.е. животные охотнее пьют, чем едят, и потому теряют в весе.
Характер других клинических проявлений определяется первичной причиной расстройства. В анамнезе больных собак и кошек с врожденной, идиопатической или травматической формами несахарного диабета, как правило, отсутствуют рвота, диарея и кашель. Такие животные обычно возбуждены, игривы и хорошо переносят нормальную физическую нагрузку. В то же время у собак с приобретенным ЦНД, обусловленным прогрессирующей гипофизарной или гипоталамической опухолью, могут развиться дополнительные нервные расстройства, включая ступор, нарушение ориентации, анорексию, атаксию, судороги и дрожь (Harb et al, 1996). Неврологические симптомы иногда присутствуют уже ко времени установления диагноза ЦНД, но чаще развиваются спустя несколько недель или месяцев. В одном из исследований они проявились у шести из 20 собак с ЦНД в период от 2 недель до 5 месяцев (в среднем 1 месяц) после постановки диагноза (Harb et al, 1996). У всех шести животных компьютерная томография или аутопсия выявили опухоль в области гипоталамуса и гипофиза. Неврологические признаки могут быть следствием гипертонической дегидратации или тяжелой гипернатриемии.
Физикальное исследование
Как и в случае анамнестического анализа, характер нарушений, выявляемых при физикальном исследовании собак и кошек, определяется исходной причиной заболевания. У большинства животных физикальное обследование не приводит к обнаружению серьезных аномалий, если не считать худобы отдельных особей. Нарушения со стороны сердечно-сосудистой, дыхательной, желудочно-кишечной и мочеполовой систем обычно отсутствуют. Животные с идиопатическим или врожденным несахарным диабетом подвижны и активны. При
свободном доступе к воде у них, как правило, сохраняются нормальные гидратация, окраска слизистых оболочек и время исчезновения белого пятна после надавливания на кожу. Неврологические расстройства различаются по своему характеру в зависимости от природы ЦНД - травматической или неопластической деструкции гипоталамуса и/ или гипофиза. У большинства этих животных обследование не выявляет явных неврологических симптомов. У некоторых имеются слабые или тяжелые неврологические проявления в форме ступора, слабости, атаксии, вертячки и проприоцептивных расстройств.
Клиническая патология
Общий клинический анализ крови. Клинический анализ крови у собак и кошек с ЦНД или ННД обычно не выявляет серьезных нарушений. Общее количество лейкоцитов и лейкоцитарная формула у этих животных остаются нормальными, поскольку они мало чувствительны к инфекции. Количество эритроцитов тоже не изменено или несколько увеличено. Полицитемия обнаруживается редко и является результатом слабой, клинически не проявляющейся дегидратации. Несахарный диабет - это первичное полиурическое расстройство с компенсаторной полидипсией. Больные собаки и кошки испытывают хронический, хотя и слабо выраженный недостаток жидкости, компенсируемый усиленным потреблением воды для утоления жажды. Хозяева, уставшие от последствий полиурии и полидипсии у своих питомцев, ограничивают им доступ к воде, что еще больше усиливает дегидратацию. Потеря жидкости приводит к гемоконцентрации со слабым увеличением гематокрита, количества эритроцитов и концентрации общего белка в сыворотке крови. У собак с психогенной полидипсией результаты ОАК редко отклоняются от нормы.
Анализ мочи. Рандомизированный анализ мочи собак и кошек с ЦНД, ННД или психогенной полидипсией обычно дает показатели удельного веса менее 1,006, чаще всего 1,001 и 1,002 (рис. 1-12). Соответствующие величины осмоляльности мочи обычно не превышают 300 мОсм/кг. Удельный вес мочи в изостенурическом диапазоне (от 1,008 до 1,015) не исключает несахарный диабет (рис. 1-12) или психогенную полидипсию (см. таблицу 1-6), особенно если пробы мочи были получены после намеренного или неумышленного лишения животного воды (например, во время длительной поездки на автомашине или ожидания в ветеринарной клинике). Находясь в условиях дегидратации, собаки и кошки с частичным несахарным диабетом способны концентрировать мочу до изостенурического уровня. Остальные показатели мочи у этих животных обычно остаются в пределах нормы.
Животные с сильно разбавленной мочой редко встречаются в ветеринарной практике. Обычно такая моча бывает у животных с пост-обструкцион-
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 23
ным диурезом, гиперкортицизмом, ЦНД, ННД или психогенной полидипсией, а также после внутривенного вливания избыточного количества жидкости или лечения диуретиками. Полиурия и полидипсия могут быть следствием самых разнообразных заболеваний, однако наш опыт показывает, что большинство из них не вызывает тяжелую полиурию с настолько выраженным снижением удельного веса мочи (< 1.006). Мы наблюдали животных с полиурией, обусловленной гиперкальциемией, гипокалиемией, пиометрой, пиелонефритом и другими заболеваниями, однако степень разбавления мочи была не слишком велика, и ее удельный вес оставался в пределах 1,008-1,020. Тем не менее, даже небольшое нарушение способности концентрировать мочу, приводившее к снижению ее удельного веса до 1,008-1,015, зачастую меняло поведение животного столь значительно, что хозяин не мог этого не заметить.
Биохимический анализ крови. У большинства собак и кошек с несахарным диабетом и психогенной полидипсией сохраняется нормальный биохимический профиль сыворотки. Тяжелый и хронический диурез при ЦНД, ННД и психогенной полидипсии сопровождается значительными потерями мочевины через почки и может в последующем приводить к уменьшению содержания AM до 5-10 мг/100 мл. У 40% из 20 собак с ЦНД, поступивших на первичное обследование в нашу клинику, содержание AM было ниже 10 мг/100 мл. Ограничение потребления воды может вызвать тяжелое обезвоживание и пре-ренальную азотемию с гипостенурией. Азотемия (AM >30 мг/100 мл) и гипернатриемия (> 158 мЭкв/ л) были обнаружены у 15% наших собак с ЦНД при первом поступлении в клинику. Эти клинико-пато-логические расстройства устранялись обеспечением собакам доступа к воде и терапией десмопрессином. Дополнительные нарушения, выявлявшиеся при биохимическом анализе сывороток кошек и собак с несахарным диабетом, включали слабое повышение
активности аланинаминотрансферазы и щелочной фосфатазы, а также концентраций креатинина, холестерина и общего белка.
Электролиты в сыворотке крови. У собак и кошек с несахарным диабетом и психогенной полидипсией обычно сохраняется нормальная концентрация электролитов в сыворотке крови. Слабые гипонатриемия (140-144 мЭкв/л) и гипокалиемия (3,8-4,0 мЭкв/л) были зарегистрированы у 20% обследованных нами собак с ЦНД и психогенной полидипсией. Гораздо большее значение имеет обнаружение тяжелых гипернатриемии (концентрация натрия в сыворотке от 159 до 165 мЭкв/л) и гиперкалиемии (5,4—5,9 мЭкв/л) у 15% собак с ЦНД из той же группы (оба эти состояния были, вероятно, обусловлены ограничением потребления воды и дегидратацией). Изредка у собак и кошек с несахарным диабетом, которые не могут пить (например, в результате травмы) или которым ограничивают потребление воды, развиваются гипертоническая дегидратация, тяжелая гипернатриемия и неврологическая симптоматика (Reidarson et al, 1990). Более подробные данные по этому вопросу приведены в разделе «Осложнения модифицированной пробы с лишением жидкости: Гипертоническая дегидратация и гипернатриемия» (стр. 33).
У большинства собак и кошек с интактной системой ренин-ангиотензин-альдостерон сохраняется нормальный гомеостаз электролитов, несмотря на значительную продукцию мочи, обусловленную ЦНД, ННД и психогенной полидипсией. Водный и электролитный баланс поддерживается центрами жажды и голода в гипоталамусе. Лишение доступа к воде уже через нескольких часов может вызвать тяжелое обезвоживание. Поскольку выведение свободной воды с мочой продолжается несмотря на снижение ее потребления, развивается сосудистая и системная гиперосмоляльность. Этому в значительной степени способствует увеличение концентрации натрия в крови. Тяжелая гипернатриемия сопровож
Рис. 1-12. Удельный вес мочи у 30 собак с несахарным диабетом центрального генеза при поступлении в ветеринарную клинику.
24 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
дается выраженными обменными расстройствами и с трудом поддается коррекции терапевтическими средствами. Проведение пробы с лишением жидкости для подтверждения диагноза несахарного диабета чревато осложнениями и требует тщательного наблюдения за состоянием животного во избежание опасного исхода (см. раздел «Осложнения модифицированной пробы с лишением жидкости: гипертоническая дегидратация и гипернатриемия»),
ПОДТВЕРЖДЕНИЕ ДИАГНОЗА НЕСАХАРНЫИ ДИАБЕТ
Для подтверждения наличия ЦНД, первичного ННД и первичной (психогенной) полидипсии используются разнообразные диагностические подходы. Наилучшим инструментом диагностики считается модифицированная проба с лишением жидкости (см. ниже), которая позволяет дифференцировать все три причины полиурии и полидипсии. Однако это дорогостоящий метод, требующий больших затрат труда и времени, особенно при одновременном измерении осмоляльности плазмы и мочи и концентрации АВП в крови. Результаты пробы, в частности при синдромах частичной недостаточности, неоднозначны. При всем том модифицированная проба с лишением жидкости служит прекрасным методом для оценки секреции АВП и реакции почечных канальцев на АВП, а также для диагностики психогенной полидипсии, так как позволяет определить способность животного концентрировать мочу до удельного веса более 1,030 в условиях лишения воды.
Более простой подход, особенно полезный в условиях большой загруженности работой, состоит в анализе осмоляльности рандомизированных (эпизодических) проб плазмы крови с целью диагностики психогенной полидипсии с последующей оценкой реакции животных на контрольное введение десмопрессина (ДДАВП) (см. стр. 39). При использовании этого метода необходимо сначала исключить все другие причины полиурии и полидипсии, кроме ЦНД, первичного ННД и психогенной полидипсии. Хотя рандомизированное измерение осмоляльности плазмы с последующим введением ДДАВП занимает не столь много времени, как модифицированная проба с лишением воды, затраты на проведение обоих тестов сопоставимы, отчасти из-за высокой стоимости ДДАВП. Кроме того, если более простая методика дает недостаточно четкие результаты, необходимо дополнительно проводить модифицированную пробу с лишением воды.
МОДИФИЦИРОВАННАЯ ПРОБА С ЛИШЕНИЕМ ЖИДКОСТИ
Принцип метода
Модифицированная проба с лишением жидкости предназначена для определения секреции эндогенного АВП в условиях дегидратации и ответа почек
на АВП. Правильно поставленная проба позволяет провести дифференциальную диагностику ЦНД, ННД и психогенной полидипсии. Иногда она помогает отличить эти три состояния от гиперкортицизма. Модифицированная проба с лишением жидкости не используется для диагностики других расстройств и не предназначена для оценки функции почек. В случаях, когда ветеринарному врачу удается исключить иные расстройства, кроме ЦНД, ННД и психогенной полидипсии, у собак и кошек с полиурией и полидипсией, данный тест помогает поставить окончательный диагноз. Для правильной интерпретации результатов следует предварительно исключить вторичный ННД, а также все другие причины полиурии и полидипсии. При изложении материала в следующих разделах подразумевается полная завершенность анализа анамнестических данных, результатов физикального обследования и предварительного скрининга в условиях стационара. Изложение сосредоточено на различиях между ЦНД, ННД и психогенной полидипсией. Дополнительно обсуждается гиперкортицизм у собак, поскольку тяжелые полиурия и полидипсия с разбавлением мочи нередки и при этой довольно распространенной эндокринопатии. Нужно отметить, что данные анамнеза, физикальное исследование и предварительное тестирование рутинными методами в условиях стационара обычно обеспечивают дифференциальную диагностику ЦНД, ННД и психогенной полидипсии.
Противопоказания к проведению пробы
Модифицированная проба с лишением воды предназначена для оценки реакции почечных канальцев на АВП и не используется при изучении функции других органов. Особенно противопоказано ее применение при подозреваемом или подтвержденном заболевании почек, при уремии вследствие пре-ренальных или первичных нарушений почечной функции и у животных с подозреваемой или явной дегидратацией.
Терминология, используемая в исследованиях водного баланса
Осмоляльность. Осмоляльность является ключевым показателем во всех случаях исследования полидипсии, полиурии, водного баланса и ограничения потребления воды. Осмоляльную концентрацию вещества в растворе определяют по степени снижения точки замерзания раствора: концентрация идеального растворенного соединения 1 моль/л понижает температуру замерзания на 1,86° С. Число миллиосмолей на литр раствора эквивалентно снижению точки замерзания, деленному на 0,00186. Такой показатель, как осмолярность выражают в осмолях на литр раствора, например плазмы крови. В отличие от этого осмоляльность - это число осмолей на килограмм растворителя. Следовательно,
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 25
осмолярность зависит от объема растворенных веществ в растворе и его температуры, тогда как осмоляльность от этого не зависит. Осмотически активные соединения в организме растворены в воде, плотность которой равна 1. Поэтому осмоляльные концентрации можно выражать в осмолях на килограмм воды. В данной работе рассматриваются осмоляльные (а не осмолярные) концентрации и осмоляльность дается в миллиосмолях на килограмм (мОсм/кг).
В норме осмоляльность плазмы крови находится в пределах 280-310 мОсм/кг.
Следует обратить внимание на относительный вклад отдельных компонентов плазмы в ее общую осмоляльную концентрацию. При среднем значении последней 290 мОсм/кг на долю натрия и сопутствующих анионов, в первую очередь хлорида и бикарбоната, приходится 270 мОсм/кг. Вклад других катионов и анионов значительно меньше. При нормальной концентрации глюкозы ее вклад в общую осмоляльность составляет примерно 5 мОсм/кг, потому что глюкоза не диссоциирует и имеет относительно большую молекулярную массу (180). Молекулярные массы белков плазмы еще больше. Поэтому их вклад в осмоляльность плазмы весьма невелик несмотря на высокое содержание. Осмоляльная концентрация белковых производных (отличных от электролитов) составляет лишь 0,33 таковой AM или примерно 6 мОсм/кг. Поскольку плазма не является идеальным раствором, ее осмоляльную концентрацию вычисляют по следующей формуле:
Осмоляльность _ 2(Na++ К+) 0,05 (глюкоза) 0,33 (AM) (мОсм/кг) — (мЭкв/л) + (мг/100 мл) (мг/100 мл)
Эту и подобные ей формулы можно использовать для характеристики нарушений обмена жидкости и электролитов, а также для оценки вклада индивидуальных компонентов нормальной плазмы в ее осмоляльность.
Осмотическое давление. Осмотическое давление зависит не от типа частиц, а от их количества в растворе. Объясняется это тем, что в растворе активность частиц растворенного вещества уменьшается. Активность вещества - это эффективная концентрация вещества, оцениваемая по его поведению в растворе. После растворения вещества активность его молекул падает. Гомогенный раствор какого-либо одного вещества обладает осмотическим давлением, однако оно проявляется только тогда, когда раствор отделен от более разбавленного раствора мембраной, проницаемой для растворителя, но не для растворенного вещества. В этих условиях молекулы вещества диффундируют из области, где их активность выше, а осмотическое давление ниже (разбавленный раствор), в область пониженной активности и более высокого осмотического давления (т.е. в более концентрированный раствор). Иными словами, если 10% раствор глюко
зы контактирует с водой через мембрану, проницаемую для воды, но не для глюкозы, объем раствора глюкозы возрастает, а концентрация глюкозы в нем уменьшается по мере того, как в него через мембрану поступают все новые молекулы воды.
Напряжение (тоничность) раствора. Все жидкости тела находятся в состоянии осмотического равновесия или близко к нему, за исключением тех случаев, когда равновесие не успело установиться после резкого изменения состава той или иной жидкости. Термин «напряжение раствора» используется для характеристики эффективного осмотического давления раствора относительно плазмы. Растворы, имеющие такое же осмотическое давление, как плазма крови, называются изотоническими. Растворы, имеющие более высокое или низкое осмотическое давление, чем плазма, называются соответственно гипертоническими и гипотоническими. Все изоосмотические плазме растворы являются также изотоническими, если только растворенные вещества не диффундируют в клетки или не метаболизируются. Таким образом, 0,9% солевой раствор является изотоническим, поскольку в нем отсутствует переход осмотически активных частиц в клетки и их метаболизм. В то же время мочевина быстро диффундирует в клетки; поэтому если клетки суспендировать в водном растворе, исходно содержавшем 290 мОсм/л мочевины, то эффективное осмотическое давление раствора будет падать. Точно так же внутривенно вводимый 5% раствор глюкозы сначала изотоничен, однако из-за процессов обмена глюкозы он, в конечном счете, действует как гипотонический раствор.
Удельный вес мочи. Поместить каплю мочи в рефрактометр гораздо проще, чем определять ее осмоляльность. Поэтому в клинике до сих пор судят о концентрации мочи по ее удельному весу. Удельный вес ультрафильтрата плазмы составляет 1,010, тогда как в пробах сильно концентрированной мочи он достигает 1,060. В то же время удельный вес того или иного раствора зависит как от природы, так и от количества содержащихся в нем частиц. Например, при экскреции рентгенографически контрастного материала удельный вес может составлять от 1,040 до 1,050 при относительно низкой осмоляльности. Осмотическая концентрация является более постоянным и точным показателем, чем удельный вес. Тем не менее, определение последнего в большинстве случаев клинически оправдано, технически несложно и недорого. Перед проведением модифицированной пробы с лишением воды клиницист должен проверить показания рефрактометра, используя для калибровки дистиллированную воду с удельным весом 1,000 (Barsanti et al, 2000).
Протокол (табл. 1-9)
Подготовка к проведению пробы (фаза 1). У животных с тяжелыми полиурией и полидипсией нелегко оценить интенсивность вымывания раство-
26
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
ТАБЛИЦА 1-9. ПРОТОКОЛ МОДИФИЦИРОВАННОЙ ПРОБЫ С ЛИШЕНИЕМ ЖИДКОСТИ
Фаза I. Подготовка пробы
А. Определение общего суточного потребления воды в условиях свободного доступа к воде
Б. Постепенное в течение 3-5 дней уменьшение общего суточного потребления воды до 100 мл/кг или до проявлений агрессивного поведения
В. Прекращение кормления за 12 часов до начала пробы
Фаза II. Лишение воды
А. Перед началом теста
1. Отмена корма и воды
2. Полное опорожнение мочевого пузыря
3. Определение точного веса животного
4. Определение осмоляльности и удельного веса мочи
5. Определение осмоляльности сыворотки крови
6. Определение концентрации AM и электролитов в сыворотке крови
7. Оценка уровня гидратации и состояния ЦНС
Б. Процедура тестирования
1. Полное опорожнение мочевого пузыря каждые 60-120 минут
2. Точное взвешивание животного каждые 60 минут
3. Определение осмоляльности и удельного веса мочи в каждом из интервалов
4. Оценка уровня гидратации и состояния ЦНС в каждом из интервалов
5. Повторное определение концентрации AM и электролитов в сыворотке крови
6. Повторное определение осмоляльности сыворотки крови
В. Прекращение фазы II
1. Если удельный вес мочи превышает 1,030
2. Если собака клинически обезвожена или появились признаки недомогания
3. При снижении веса животного на 3-5%
а. Получение сыворотки (плазмы) крови для определения концентрации вазопрессина
б. Опорожнение мочевого пузыря
в. Определение осмоляльности и удельного веса мочи
г. Определение концентрации AM и электролитов в сыворотке крови
д. Определение осмоляльности сыворотки крови
Фаза III. Ответ на экзогенный АВП
А. Введение водного раствора вазопрессина (2-5 Е внутримышечно)
Б. Продолжение отмены корма и воды
В. Мониторинг состояния животного
1. Опорожнение мочевого пузыря каждые 30 мин в течение не более 1-2 часов
2. Определение осмоляльности и удельного веса мочи
3. Определение осмоляльности сыворотки крови
4.Определение концентрации AM и электролитов в сыворотке крови
5. Оценка уровня гидратации и состояния ЦНС
Фаза IV. Завершение тестирования
А. Предложение животному небольших порций воды (10-20 мл/кг) каждые 30 мин на протяжении 2 часов
Б. Мониторинг рвоты, уровня гидратации и состояния ЦНС
В. При нормальном состоянии животного, демонстрируемом в течение 2 часов после окончания пробы, разрешить сво-бодный доступ к воде
ренных веществ из мозгового слоя почек. Теоретически, коррекция скорости вымывания улучшает способность почечных канальцев концентрировать мочу и повышает точность дифференциальной диагностики ЦНД, ННД и первичной полидипсии
пробы Время (часы)
Рис. 1-13. Результаты модифицированной пробы с лишением жидкости у годовалой персидской кошки с врожденным несахарным диабетом центрального генеза. Сплошная линия - результаты обычной пробы с лишением воды. Точечная линия - результаты пробы с постепенным снижением потребления воды в течение 7 дней до начала тестирования. Пунктирная линия - результаты пробы с постепенным уменьшением потребления воды и инъекциями АВП дважды в день на протяжении 7 дней до начала тестирования. Инъекции АВП прекращали за 24 часа до полного прекращения питья. Стрелками показаны сроки потери 5% веса и введения водных растворов АВП.
с помощью модифицированной пробы с лишением жидкости. Тем не менее, у животных с ЦНД ограничение потребления воды само по себе не всегда нормализует вымывание растворенных веществ из мозгового слоя почек, и способность почечных канальцев концентрировать мочу может быть полностью оценена только после коррекции полиурии и полидипсии с помощью терапии вазопрессином в сочетании с ограничением потребления воды (рис. 1-13). Несмотря на это, мы пытались свести к минимуму влияние сильного вымывания на результаты модифицированной пробы с лишением жидкости, постепенно уменьшая потребление воды перед полным прекращением питья. Цель состояла в том, чтобы сначала уменьшить суточное потребление воды примерно до 100 мл/кг веса и только потом провести модифицированную пробу с лишением жидкости. Среднесуточное потребление воды животными определялось их владельцами в условиях свободного доступа к ней. После получения необходимых исходных данных начинали постепенно в течение 3-5 дней снижать количество предлагаемой животному воды, пока оно не достигало 100 мл/кг/24 часа или пока у животного не развивалось агрессивное поведение. Конечную суточную дозу воды разделяли на 6-8 порций, последнюю из которых давали перед сном. Животных не кормили в течение первых 12 часов от начала пробы или на протяжении всего теста.
Начало пробы (фаза ПА). Через катетер опоражнивают мочевой пузырь тестируемого животного, а непосредственно перед началом теста опре-
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 27
ТАБЛИЦА 1-10. УКАЗАНИЯ ПО ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ МОДИФИЦИРОВАННОЙ ПРОБЫ С ЛИШЕНИЕМ ЖИДКОСТИ*
Удельный вес мочи Время достижения 5% дегидратации (часы)
Расстройство Начальная величина 5%-ная дегидратация После введения АВП Среднее Диапазон
ЦНД Полный <1,006 <1.006 <1,010 4 3-7
Частичный <1,006 1,008-1,020 <1,015 8 6-11
Первичный ННД <1,006 <1,006 <1,006 5 3-9
Первичная полидипсия 1,002-1,020 1,030 НП 13 8-20
* По результатам тестирования 20 собак с несахарным диабетом центрального генеза, 5 собак с нефрогенным несахарным диабетом и 18 собак с первичной (психогенной) полидипсией
ЦНД - несахарный диабет центрального генеза
ННД - нефрогенный несахарный диабет
НП - не применяется
деляют точный вес тела. Начиная с 8-9 часов утра, животное полностью лишают воды. Предварительно определяют удельный вес и, по-возможности, осмоляльность мочи. Рекомендуется, хотя это и не строго обязательно, оценивать также осмоляльность плазмы, что помогает при интерпретации результатов пробы. Для своевременного выявления полиурии и полидипсии с самого начала теста периодически измеряют концентрации AM и натрия в сыворотке. Возникновение уремии или гипернатриемии служит критерием для прекращения тестирования.
Пробу с лишением воды всегда начинают с утра, поскольку тестируемое животное должно находиться под постоянным наблюдением. У большинства собак и кошек с ЦНД или ННД дегидратация и потеря 3-5% веса тела (к концу теста) происходят за 3-10 часов (табл. 1-10). Во время лишения воды животных с тяжелым несахарным диабетом нельзя оставлять без присмотра на несколько часов или на ночь, так как это может привести к тяжелым осложнениям и даже гибели (см. раздел. «Осложнения модифицированной пробы с лишением жидкости: гипертоническая дегидратация и гипернатриемия». Регулярное наблюдение и адекватное использование методов позволяют избежать осложнений или тяжелого обезвоживания.
Процедура тестирования (фаза ПБ). Мочевой пузырь необходимо полностью опорожнять каждые 60-120 минут. Накануне проведения пробы в мочевой пузырь собак вживляют катетер Фолея либо проводят катетеризацию повторно, по мере необходимости. У некоторых собак мочеиспускание стимулируют кратковременным выгулом. Выбор метода зависит от размеров животного и простоты процедуры. Кошкам необходимо вживление катетера. Удельный вес мочи определяют в каждой пробе и оставляют аликвоты для определения осмоляльности (если таковое планируется). Важно взвешивать кошку или собаку, по меньшей мере, один раз в час. Фазу II прерывают после потери животным 3-5% веса тела или увеличения удельного веса мочи выше 1,030. Дополнительно проводят клиническое обследование с целью выявления признаков де
гидратации и изменений в поведении или психике животного. Периодически измеряют концентрации AM и натрия в сыворотке крови. Тестирование прекращают в случаях возникновения уремии, гипернатриемии или тяжелого обезвоживания либо при изменениях поведения или психики животного.
Окончание фазы II (фаза ПВ). Секреция АВП и концентрация мочи достигают максимальной величины, когда животное теряет 3-5% веса вследствие лишения жидкости и одновременной ее потери с мочой. Задача состоит в том, чтобы к моменту окончания фазы II потеря веса была близка к 5%. В это время мочевой пузырь должен быть совершенно пустым, а пробы мочи проанализированы для установления удельного веса и осмоляльности. Это позволяет приступить к фазе III пробы с лишением жидкости (см. таблицу 1-9). Для облегчения интерпретации результатов пробы в это же время следует определить концентрацию вазопрессина в плазме крови (см. раздел «Определение вазопрессина в плазме крови»).
Здоровым собакам для потери 3-5% веса обычно нужно более 24 часов лишения доступа к воде. В отличие от них животные с ЦНД или ННД при обезвоживании теряют 3-5% веса за 3-10 часов (см. табл. 1-10). Собакам и кошкам с частичным несахарным диабетом или психогенной полидипсией для такой потери веса требуется 10 часов. Нужно всегда быть готовым к тому, что пробу придется продолжать до позднего вечера. Если это невозможно, а вес животного к концу рабочего дня еще не уменьшился на 3-5% или удельный вес мочи не поднялся выше 1,030, животное следует перевести в ветеринарную клинику, чтобы обеспечить наблюдение в ночное время и не прерывать тест.
С другой стороны, можно прекратить тестирование и напоить животное, причем сначала небольшими порциями, чтобы избежать чрезмерного потребления воды. В этом случае модифицированную пробу с лишением жидкости повторяют спустя несколько дней, внеся в протокол следующие поправки: взвешивание животного проводят в полночь и тогда же начинают ограничивать потребление им воды; остаток ночи собака или кошка проводит в
28 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
клетке (или дома), в идеале с периодической визуальной оценкой ее состояния соответственно дежурным специалистом или владельцем; утром животному в первую очередь опоражнивают мочевой пузырь, определяют удельный вес и осмоляльность мочи, затем взвешивают и продолжают фазу II тестирования, как описано выше. При использовании такого протокола к началу рабочего дня фаза II продолжается уже 6-8 часов. В случае применения данной модификации пробы необходимо предварительно исключить полные ЦНД и ННД; иными словами, следует убедиться, что для снижения веса тела собаки или кошки на 3-5% после полного прекращения питья требуется не менее 10 часов. Ни в коем случае не следует использовать этот вариант модифицированной пробы с лишением жидкости при первичном тестировании собаки или кошки.
Повторное взвешивание животных - простой, доступный, недорогой и надежный способ определения времени окончания фазы II модифицированной пробы. При этом следует стремиться к тому, чтобы в результате лишения воды собака или кошка потеряла более 3% веса (желательно около 5%). Снижение веса на 1-2% вследствие дегидратации может оказаться недостаточным для максимальной стимуляции секреции АВП. При потере около 2% веса получали ложное плато осмоляльности и удельного веса мочи, что приводило к ошибкам при оценке результатов пробы.
Для определения максимальной концентрации мочи и времени ее достижения в условиях лишения жидкости используются и другие критерии. Один из способов состоит в выявлении «плато» или отсутствия повышения осмоляльности мочи после потери животным 3% веса тела. В основе этого критерия лежит тот факт, что после достижения максимальной реакции почек на лишение жидкости, осмоляльность мочи остается относительно постоянной. Плато концентрации мочи определяется как изменение ее осмоляльности менее чем на 5% или на 30 мОсм/кг в течение одночасовых промежутков между тремя последовательными взятиями проб. Мониторинг удельного веса мочи вместо осмоляльности дает менее достоверные результаты, чем мониторинг веса тела, поскольку ложное плато удельного веса зачастую отмечается даже когда животное теряет 3% своего веса. Несмотря на простоту определения удельного веса мочи, этот показатель не может служить достаточно точным критерием для завершения фазы II, если только он не превысил 1,030, что указывает на нормальную секрецию АВП и сохранение реактивности почек.
Упругость кожи и величина гематокрита оказались нестабильными и недостоверными показателями степени дегидратации. Более надежным может быть определение содержания общего белка в плазме крови, однако этот параметр не является столь же информативным и достоверным, как определение веса тела и клинические наблюдения. Важным подспорьем при проведении фазы II моди
фицированной пробы с лишением жидкости является периодическое измерение концентраций AM и натрия в сыворотке крови. Повышение концентрации AM выше 30 мг/100 мл свидетельствует о развитии азотемии и необходимости прекращения фазы II. При мониторинге описанными выше способами азотемия редко развивается у собак и кошек в условиях модифицированной пробы с лишением жидкости. С другой стороны, определение AM несложно и недорого. Поэтому в тех случаях, когда есть опасение, что азотемия может развиться как осложнение при лишении жидкости, следует либо проводить ее мониторинг, либо отложить тестирование. Мощными стимуляторами секреции АВП являются также гипернатриемия и повышенная осмоляльность плазмы крови; при их обнаружении следует прервать фазу II.
Реакция на экзогенный АВП (фаза III). В фазе II оценивают влияние обезвоживания на секрецию эндогенного АВП и его действие на почечные канальцы. В фазе III определяют, какое действие (если оно вообще имеет место) оказывает экзогенный АВП на способность почечных канальцев концентрировать мочу в условиях дегидратации. Эта фаза позволяет дифференцировать пониженную секрецию АВП и пониженную чувствительность к нему почечных канальцев.
После потери 3-5% веса в результате лишения жидкости животным внутримышечно (в/м) вводят водный раствор вазопрессина (Parke Davis, Morris Plains, NJ) в дозе 0,55 Ед/кг веса тела. Максимально допустимая доза для собак и кошек во всех случаях составляет 5 единиц. Затем продолжают тестирование, опоражнивая мочевой пузырь животного через 30, 60 и 120 мин после инъекции. Определяют удельный вес и/или осмоляльность полученных таким образом проб мочи. На этом тестирование заканчивается и на протяжении следующих 2 часов животное получает небольшие порции воды. Постепенно его переводят на нормальный питьевой режим. Однако вначале собаку или кошку следует поить небольшими дозами, дабы избежать чрезмерного потребления жидкости, которое может вызвать рвоту или водную интоксикацию.
Подкожное (П/К) и внутривенное (В/В) введение АВП. Способность концентрировать мочу после подкожного введения водного раствора вазопрессина весьма изменчива, поэтому оно не рекомендуется. Внутривенные инъекции АВП дают более достоверные результаты. Водный препарат АВП, предназначенный для внутривенного введения, разводят рингеровским раствором, содержащим лактат, или 5%-ным раствором декстрозы до концентрации АВП 1 миллиединица/мл. Полученную жидкость вводят в/в в количестве 10 мл на килограмм веса тела (10 мЕд АВП/кг). Инфузию проводят медленно, в течение 60 минут, а пробы мочи собирают непосредственно перед началом инфузии и через 15, 30, 45, 60, 75 и 90 мин после ее начала. Мы не сталкивались с трудностями при внутримы
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 29
шечных инъекциях АВП и предпочитаем этот путь введения водного раствора вазопрессина. Какой способ введения АВП не был бы выбран, он должен давать информацию, необходимую для дифференциальной диагностики ЦНД и ННД.
Введение десмопрессина ацетата (ДДАВП). Десмопрессин ацетат - это синтетический аналог вазопрессина, применяемый для лечения ЦНД у собак и кошек (см. стр.[37]). Сообщалось о его использовании вместо водного вазопрессина в фазе III модифицированной пробы с лишением жидкости, однако критическая оценка сроков получения проб мочи для определения ее осмоляльности и/ или удельного веса не проводилась. Максимальное действие ДДАВП независимо от пути его введения отмечается спустя 2-8 часов. Анализ проб мочи, получаемых с интервалом в 1-2 часа на протяжении 8 часов и, в случае необходимости, через 12 и 24 часа после внесения 4 капель интраназального препарата ДДАВП в конъюнктивальный мешок, может оказаться полезным для оценки реакции почек на вазопрессин в фазе III. По другой методике 10-20 мкг ДДАВП для парентерального или интраназального применения вводят внутривенно или подкожно, а затем определяют удельный вес мочи через каждые 1-2 часа на протяжении 8 часов и, в случае необходимости, спустя еще 12 и 24 часа (Barsanti et al, 2000). ДДАВП для интраназального применения не стерилен, поэтому перед введением животному раствор пропускают через бактериостатический фильтр. При обнаружении реакции на ДДАВП, появлении гипернатриемии или азотемии животному следует давать небольшие количества воды. То же относится к животным с изменениями гидратационного статуса или проявлениями беспокойства.
Ответ на модифицированную пробу с лишением жидкости
Здоровые собаки. Дегидратация у здоровых собак развивается очень медленно (рис. 1-14). Секреция АВП сопровождается у них задержкой большого количества жидкости на длительное время. Рандомизированные пробы мочи нормальных собак в условиях свободного доступа к воде имеют удельный вес от 1,006 до 1,040 и выше и осмотическую концентрацию от 160 до 2500 мОсм/кг и выше (van Vonderen et al, 1997b). В одном из исследований диапазон этих величин у лабораторных собак был не столь широк, а наибольшая концентрация мочи у 20 особей достигалась в среднем через 40 часов после лишения воды. Максимальная осмоляльность мочи колебалась от 1700 до 2700 мОсм/кг, а удельный вес от 1,050 до 1,075. После достижения максимальных показателей концентрации мочи (удельного веса и осмотической концентрации) плато отсутствовало. У большинства собак вслед за пиком концентрации мочи отмечались ее слабые колебания на менее высоком уровне в тече-
Рис. 1-14. Влияние лишения воды на осмоляльность мочи у здоровой собаки. Стрелкой показано время инъекции водного раствора вазопрессина, которая изменяла осмоляльность на 10% или менее.
ние всего периода лишения воды. Тестировавшиеся параметры не отличались у самцов и самок. Можно предположить, что аналогичная картина имеет место у кошек, хотя специальные исследования на этих животных не проводились.
Что происходит, если здоровым собакам и кошкам после достижения максимальной концентрации мочи в результате лишения воды ввести АВП? Как и следует ожидать, у таких животных секреция эндогенного АВП находится на максимальном уровне и дальнейшей концентрации мочи после введения экзогенного АВП не происходит. Таким образом, экзогенный АВП не оказывает существенного влияния на концентрацию их мочи. После обезвоживания она повышается не более чем на 10% исходной величины, причем это изменение статистически недостоверно. Такое отсутствие изменений характерно для собак и кошек, имеющих нормальные уровень секреции АВП и чувствительность почек к этому гормону (см. рис. 1-14).
При проведении модифицированной пробы с лишением жидкости в условиях клиники нормой является достоверно более высокая осмоляльность мочи по сравнению с осмоляльностью плазмы. У здоровых собак и кошек осмоляльность мочи после дегидратации обычно превышает 1100 мОсм/кг, а ее удельный вес выше 1,030. Если осмоляльность и удельный вес мочи превосходят эти величины, то секреция гипофизарного АВП и чувствительность к нему почек считаются нормальными и нет необходимости оценивать чувствительность почек к экзогенному АВП.
ЦНД. При тяжелом (полном) ЦНД собаки и кошки даже в случае сильного обезвоживания теряют способность концентрировать мочу в такой степени, чтобы ее осмоляльность превышала осмоляльность плазмы (280-310 мОсм/кг). Более того,
30 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
Рис. 1-15. Влияние лишения воды на осмоляльность мочи у собаки с несахарным диабетом центрального генеза. Стрелкой показано время инъекции водного раствора АВП после потери 5% или больше веса тела; введение АВП изменяло осмоляльность более чем на 50%. Обратите внимание, как быстро вес этой собаки снизился на 5%.
на фоне продолжающейся дегидратации показатели концентрации мочи не изменяются или изменяются незначительно (рис. 1-15). В зависимости от тяжести ЦНД различают полную или частичную недостаточность АВП. Для дифференциальной диагностики легкой и тяжелой форм ЦНД используют модифицированную пробу с лишением жидкости. Как указывалось ранее, у нормальных животных состояние слабой дегидратации характеризуется потерей 1-2% веса тела при сохранении секреции АВП. После достижения максимальной концентрации мочи у этих особей ее дальнейшее увеличение в ответ на инъекцию водного раствора вазопрессина не превышает 10%. Если введение экзогенного АВП собаке или кошке в условиях дегидратации индуцирует достоверное увеличение концентрации мочи, это свидетельствует о снижении продукции и/или секреции эндогенного гормона. У животных с тяжелой недостаточностью АВП осмотическая концентрация мочи при дегидратации не поднимается выше 300 мОсм/кг. В то же время, после введения вазопрессина осмоляльность возрастает на 50-600% по сравнению с величиной, предшествовавшей инъекции (рис. 1-16 и 1-17).
Владельцы собак и кошек с тяжелым или частичным ЦНД обращаются в ветеринарную клинику с одинаковыми жалобами. Животные слишком много пьют и страдают полиурией, и хозяева считают, что у их питомцев недержание мочи. Некоторым владельцам приходится выгуливать собак по нескольку раз за ночь. Зачастую дифференцировать тяжелый и частичный ЦНД у собак и кошек удается только после завершения модифицированной пробы с лишением жидкости. Такая дифференцировка
700-1
600-
500-
5 400-2
S н
о 300-
с; к
2 200-О
о 0) S ф 100-т
m > 50-
40-
30-
20-
10-
0 J--------------
Полный несахарный диабет центрального генеза
Частичный несахарный диабет центрального генеза
Нефрогенный несахарный диабет
Рис. 1-16. Увеличение осмоляльности мочи в фазе III модифицированной пробы с лишением жидкости, т.е. после внутримышечного введения водного раствора вазопрессина, у 22 собак с полным несахарным диабетом центрального генеза, 9 собак с частичным несахарным диабетом центрального генеза и 7 собак с первичным нефрогенным несахарным диабетом. Обратите внимание на значительное снижение осмоляльности мочи после введения вазопрессина при полном несахарном диабете центрального генеза по сравнению с частичным несахарным диабетом центрального генеза и первичным нефрогенным несахарным диабетом.
интересна как с теоретической, так и с клинической точки зрения, поскольку частичный ЦНД успешно лечится пероральными препаратами, тогда как при тяжелой форме ЦНД показано введение синтетического АВП.
ННД. У собак и, вероятно, у кошек с первичным ННД моча даже после сильного обезвоживания не концентрируется до уровня, превышающего осмоляльность плазмы (280-310 мОсм/кг). Как и в случае ЦНД, показатели осмоляльности мочи не изменяются или изменяются незначительно по мере увеличения продолжительности дегидратации (рис. 1-21; см. таблицу 1-10). Однако, в отличие от ЦНД, введение вазопрессина приводит к повышению осмоляльности и удельного веса мочи либо вызывает лишь слабое их увеличение (см. рис. 1-16).
У собак с ННД или с тяжелым ЦНД при лишении воды быстро развивается дегидратация (см. табл. 1-10). Эти заболевания отличаются лишь тем, что при ННД реакция на введение вазопрессина отсутствует, а у собак с ЦНД вазопрессин вызыва-
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 31
1200-1
2 900-О О g s 7 О 2 £ 600-о о
J5 с а q О о 300-О
Гидратация
Дегидратация После 3-5% введения АВП
Рис. 1-18. Влияние лишения воды на осмоляльность мочи у собаки с частичным ЦНД или с гиперкортицизмом. Стрелкой показано время инъекции водного раствора АВП после снижения веса тела на 5% или более вследствие потери жидкости с мочой. Осмоляльность плазмы в ответ на дегидратацию повысилась, но относительно слабо. Вазопрессин вызвал дополнительное увеличение осмоляльности на 10-50%. Обратите внимание, что дегидратация собаки с частичным ЦНД происходила медленнее, чем в случае собаки с тяжелым ЦНД (см. рис. 1-15).
Рис. 1-17. Осмоляльность мочи у 10 собак с полным несахарным диабетом центрального генеза (черные кружки) и 7 собак с частичным несахарным диабетом центрального генеза (светлые кружки) в начале (гидратация) и в конце (дегидратация 3-5%) фазы II, а также в конце фазы III (после введения АВП) модифицированной пробы с лишением жидкости. Обратите внимание на то, что у собак с полным несахарным диабетом центрального генеза осмоляльность мочи относительно слабо возрастала при дегидратации, но значительно увеличивалась после введения водного раствора АВП. У собак с частичным несахарным диабетом центрального генеза наблюдалась обратная картина.
ет значительное увеличение концентрации мочи. Спонтанный тяжелый ННД, по-видимому, является врожденным расстройством, поскольку оно до сих пор описано только у молодых животных. Приобретенный ННД, напротив, развивается у взрослых кошек и собак, и ему сопутствует нарушение действия АВП на уровне почечных канальцев.
Приобретенный ННД обычно дифференцируется от ЦНД или спонтанного ННД на основании данных анамнеза, физикального исследования и обычных клинических признаков. Благодаря этому собак и кошек с пиометрой, пиелонефритом, гиперкалиемией, гипокалиемией, гиперкортициз-мом, сахарным диабетом, хронической почечной недостаточностью или почечной гликозурией удается выявить при обычном скрининговом исследовании, не прибегая к модифицированной пробе с лишением жидкости. Животные с приобретенным ННД реагируют на ограниченное потребление воды и постдегидратационное введение АВП таким же образом, как особи с врожденным спонтанным ННД (Breitschwerdt, 1981). Поэтому модифицированная проба с лишением жидкости не позволяет отличить спонтанный/врожденный ННД от приобретенной/вторичной формы, точно также как не может использоваться для дифференциации врожденного и приобретенного ЦНД. Однако это обстоятельство не снижает ценности исследования; напротив, оно подтверждает необходимость
создания полной базы данных, с помощью которой возможна диагностика без применения модифицированной пробы с лишением жидкости.
Иногда предварительное тестирование собак или кошек с приобретенным ННД не позволяет выявить его причину и животным необоснованно назначают модифицированную пробу с лишением жидкости. Некоторые заболевания особенно трудно диагностировать. К их числу относятся пиелонефрит, единственным показателем которого служит спорадическая бактериурия, ранние стадии почечной недостаточности, когда концентрации AM и креатинина остаются на верхнем пределе нормы на фоне изостенурии, гиперкортицизм, единственными проявлениями которого являются полиурия и полидипсия в отсутствие других клинико-патологических нарушений при неопределенных результатах тестирования гипофизарно-надпочечниковой функции, пиометра у чистоплотных собак и кошек со слабыми влагалищными выделениями, небольшими размерами матки и нормальным количеством лейкоцитов в крови. Все эти клинические состояния встречаются нечасто, но могут служить косвенными указаниями на целесообразность проведения модифицированной пробы с лишением жидкости. Во всех случаях, когда ветеринар ставит диагноз ННД у взрослой собаки или кошки, следует предполагать возможность приобретенного заболевания.
32
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
Гидратация Дегидрата- После введе-ция 5% ния АВП
Рис. 1-19. Удельный вес мочи у 1 собак с полным несахарным диабетом центрального генеза (черные кружки) и 13 собак с частичным несахарным диабетом центрального генеза (светлые кружки) в начале (гидратация) и в конце (дегидратация 5%) фазы II, а также в конце фазы III (после введения АВП) модифицированной пробы с лишением жидкости. Обратите внимание на сходство изменений удельного веса и осмоляльности мочи (см. рис.1-17).
Нефрогенный несахарный диабет
1200
1000
800
600 -
400
200
Плазма крови
♦
о!_I_।-1_I_I-1_I_I_।—।
01 23456789 10
Часы
Рис. 1-21. Влияние лишения воды на осмоляльность мочи у собаки с первичным нефрогенным несахарным диабетом. Стрелкой показано время введения вазопрессина после потери 5% или больше веса тела (у этой собаки всего через 4 часа). Обратите внимание на быстрое уменьшение веса собаки и отсутствие какого-либо увеличения концентрации мочи после снижения веса на 5% или более. Введение вазопрессина не повысило осмоляльность мочи (изменение <10%).
Рис. 1-20. Та же собака, что на рис. 1-15. Сплошная линия -осмоляльность мочи. Пунктирная линия - увеличение осмоляльности плазмы, вызванное дегидратацией у собаки с ЦНД. Точечная линия - удельный вес мочи; видно, что этот параметр менее показателен при тяжелом ЦНД (см. рис. 1-15).
Гиперкортицизм у собак (Синдром Кушинга). Гиперкортицизм обычно приводит к тяжелым полиурии и полидипсии. У некоторых собак это заболевание не сопровождается другими клиническими проявлениями, а типичные отклонения данных лабораторных анализов отсутствуют. Результаты модифицированной пробы с лишением жидкости у собак с гиперкортицизмом сходны с таковыми у животных с частичным ЦНД (см. рис. 1-18) и иногда с психогенной полидипсией. При наличии гиперкортицизма у собак концентрация мочи после обезвоживания обычно превышает осмоляльность плазмы. Последующая инъекция водного раствора АВП может вызывать ее дополнительное увеличение на 10-50%, как и в случаях частичного ЦНД. Однако у некоторых животных с гиперкортицизмом реакция на такую инъекцию напоминает реакцию особей с психогенной полидипсией в том отношении, что введение водного препарата АВП не приводит к увеличению осмотической концентрации мочи. Поэтому приходится дифференцировать ННД, тяжелый ЦНД и гиперкортицизм с помощью модифицированной пробы с лишением жидкости. Однако и этот метод не всегда позволяет различить психогенную полидипсию, частичный ЦНД и гиперкортицизм. Вместе с тем, относительно высокая частота встречаемости синдрома Кушинга по сравнению с ЦНД, ННД и психогенной полидипсией является важным аргументом в поддержку целесообразности диагностики гиперкортицизма у всех животных с неопределенными результатами тестирования, особенно у старых собак.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 33
Психогенная
Рис. 1-22. Влияние лишения воды на осмоляльность мочи у собаки с психогенной полидипсией. Несмотря на нормальный гормональный статус у таких собак, хронический диурез может подавлять их способность концентрировать мочу. Стрелкой показано время введения вазопрессина после потери 5% или больше веса тела вследствие неослабевающего диуреза. Способность концентрировать мочу при дегидратации была низкой и введение вазопрессина повысило осмоляльность мочи менее чем на 10%.
Первичная, или психогенная, полидипсия. У собак, и, по-видимому, у кошек с первичной, или психогенной, полидипсией полностью сохранена способность системы гипоталамус-гипофиз-почки контролировать баланс жидкости и интенсивность вымывания растворенных веществ из мозгового слоя почек. Благодаря сохранению нормальной секреции гипофизарного АВП и чувствительности к нему почек такие животные концентрируют мочу до уровня, при котором ее осмоляльность в условиях полного обезвоживания превышает осмотическую концентрацию плазмы крови. Кроме того, при достаточно длительной дегидратации, удельный вес мочи может превысить 1,030. Для достижения такого уровня концентрации продолжительность дегидратации должна составлять от 12 до 24 часов в зависимости от интенсивности вымывания растворенных веществ из мозговой ткани почек. Ранее описанная процедура постепенного уменьшения потребления воды на протяжении 72 часов накануне проведения модифицированной пробы с лишением жидкости позволяет восстановить градиент концентрации в мозговом веществе этих собак и сокращает время концентрации мочи. Фаза III (реакция на инъекцию водного раствора АВП) редко необходима при тестировании собак с психогенной полидипсией. Если же она проводится, то введение АВП таким собакам в состоянии дегидратации вызывает лишь небольшое (10%) увеличение осмоляльности мочи (рис. 1-22). Отсутствие изменения отражает нормальный секреторный ответ заднего отдела гипофиза на обезвоживание и реакцию почечных канальцев на АВП.
Осложнения модифицированной пробы с лишением жидкости: гипертоническая дегидратация и гипернатриемия
Организм взрослой собаки или кошки на 60% состоит из воды. Две трети ее общего количества заключено в клетках различных тканей, а оставшаяся треть локализована во внеклеточном пространстве (рис. 1-23). Перемещение растворимых веществ, свободно диффундирующих через клеточные мембраны (например, мочевины) не сопровождается существенным перераспределением жидкости, поскольку эти вещества генерируют равные осмотические силы по обе стороны мембраны. Благодаря отсутствию перераспределения воды повышение концентрации растворенных веществ индуцирует гиперосмоляльность во всех содержащих жидкость пространствах.
Растворенные вещества с ограниченной способностью проникать через клеточную мембрану из-за большого размера молекул или электрического заряда, либо вследствие активной работы мембранных насосов создают эффективную осмотическую силу. К таким внутриклеточным молекулам относятся калий, фосфаты и белки. Во внеклеточном пространстве ту же роль играют натрий и его анионы. Повышенная концентрация этих веществ во внеклеточной жидкости приводит к гиперосмолярности и гипертоничности. При этом создается осмотический градиент, который обусловливает перемещение внутриклеточной жидкости во внеклеточную среду; таким образом, объем последней увеличивается за счет клеточной гидратации. Напротив, уменьшение концентрации внеклеточных
Внутриклеточная Внеклеточная
жидкость жидкость
Рис. 1-23. В состоянии гидратации осмотические силы, генерируемые растворимыми соединениями (нормальный диапазон 280-310 мОсм/кг, в среднем 295 мОсм/кг), поддерживают равномерное распределение общей воды организма (ОВО) между внутри- и внеклеточными отделами. Из: Edwards DF, et al: JAVMA 182:973, 1983.
34
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
растворенных веществ приводит к появлению ги-поосмотической, гипотонической внеклеточной жидкости и, как следствие, вызывает транспорт воды в клетки с последующей гиповолемией и избыточной гидратацией клеток (Edwards et al, 1983).
В ветеринарной практике приходится сталкиваться с тремя разными формами дегидратации (изотонической, гипотонической и гипертонической). Изотоническая дегидратация обусловлена пропорциональной потерей воды и электролитов (растворенных веществ) (рис. 1-24, А). Причинами изотонической дегидратации могут служить длительная рвота или диарея, при которых электролиты выводятся из внеклеточного пространства в окружающую среду. Концентрация натрия в сыворотке в этом случае обычно остается нормальной, а тяжесть клинических проявлений, таких как изменение упругости и эластичности кожи, пропорциональна степени гиповолемии.
При гипотонической дегидратации потеря электролитов превышает потерю воды, как это имеет место при гипокортицизме. В этом случае в мочу и желудочно-кишечный тракт поступает избыточное количество натрия, что обусловливает гипотоничность внеклеточной жидкости, из которой вода выводится как во внешнюю среду, так и во внутриклеточное пространство. Концентрация натрия
в сыворотке крови в этих условиях понижается, нередко развивается преренальная азотемия, а признаки гиповолемии выражены сильнее, чем при изотонической дегидратации (см. рис. 1-24, Б).
Гипертоническая дегидратация является следствием большей потери воды по сравнению с потерей электролитов. Это состояние чаще всего развивается после лишения воды собак и кошек с ЦНД, ННД или первичной полидипсией, а также у собак и кошек с ЦНД травматического происхождения, получающих недостаточное количество жидкости (см. рис. 1-24, В). Объем гипертонической внеклеточной среды сохраняется благодаря дегидратации внутриклеточного пространства. Общий дефицит воды затрагивает все содержащие жидкость отделы, при этом потеря воды пропорциональна ее количеству в отделах в условиях нормы (Edwards et al, 1983). Поэтому клетки, в которых заключено две трети всей воды организма, теряют гораздо больше жидкости, чем внеклеточная среда, а объем плазмы, на который приходится лишь 1/12 всей воды, относительно слабо изменяется в этих условиях. Таким образом, гипертоническая дегидратация сопровождается лишь частью ожидаемых признаков тяжелого дефицита жидкости. Тахикардия, утрата упругости и эластичности кожи, снижение пульсового давления и сосудистого объема отсутствуют до тех
ВнуКЖ
ВКЖ
I
I 295 <280 !-►
(мОсм/к) (мОсм/к)
I
I
I
I
I
Рис. 1-24. А. Изотоническая дегидратация является следствием выведения воды и электролитов из внеклеточной жидкости ( ВКЖ ), изоосмотичной (295 мОсм/кг) по отношению к ОВО. Поскольку осмоляльность и напряженность раствора в отдельных средах не изменяются (295 мОсм/кг), существенного перемещения внутриклеточной жидкости (ВнуКЖ) не происходит. Б. Гипотоническая дегидратация является результатом выведения из ВКЖ воды и электролитов гиперосмотически (>310 мОсм/кг) по отношению к ОВО. ВКЖ становится гипоосмолярной и гипотоничной (< 280 мОсм/кг) по отношению к ВнуКЖ. Транспорт ВКЖ в клетки восстанавливает равновесие между обеими средами при меньшем осмотическом давлении (<295 мОсм/кг) и сводит к минимуму потерю воды внутриклеточной средой. В. Гипертоническая дегидратация возникает вследствие выведения воды и электролитов из ВКЖ гипоосмотической (<280 мОсм/кг) по отношению к ОВО. Если ВКЖ становится гиперосмолярной и гипертоничной (>310 мОсм/кг) и имеет большее осмотическое давление, чем ВнуКЖ, это сводит к минимуму потерю ею воды. Из: Edwards DF, et al: JAVMA 182:973,1983.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
35
пор, пока не разовьется выраженная дегидратация. Гораздо раньше уменьшается вес тела, что лишний раз подчеркивает необходимость его мониторинга при проведении модифицированной пробы с лишением жидкости.
Тяжелые гипернатриемия и гипостенурия являются классическими признаками гипертонической дегидратации у собак и кошек с ЦНД и ННД. Другие причины гипернатриемии обычно не ассоциируются с гипостенурией (таблица 1-11). Основные клинические проявления гипертонической дегидратации обусловлены нарушением функции ЦНС. К числу ранних критических признаков относятся раздражительность, общая слабость и атаксия. По мере усиления тяжести гипернатриемии ступор переходит в кому и судороги. Развитие и тяжесть этих симптомов зависят от скорости нарастания, продолжительности и тяжести гипернатриемии. Поступление натрия в клетки мозга ограничено и происходит недостаточно быстро, чтобы уравновесить его концентрацию с концентрацией в спинномозговой жидкости (СМЖ). Интенсивно развивающаяся тяжелая гипернатриемия сопровождается переходом воды из внутриклеточного во внеклеточное пространство и индуцирует уменьшение объема СМЖ по мере того, как содержащаяся в ней вода переходит в другую гиперосмотическую жидкость. В конечном счете, эти изменения приводят к уменьшению объема мозга и, как следствие, к разрыву венозных сосудов, субдуральным кровоизлияниям и тромбозу вен. Мозг синтезирует осмотически активные соединения (например, полиолы), которые локализуются в его клетках, компенсируя гиперосмолярность внеклеточной жидкости и сводя к минимуму переход воды во внеклеточное пространство. Продукция осмотически активных веществ в мозге начинается через 1 час после индукции устойчивой гиперосмоляльности внеклеточной среды (Pollock, Arieff, 1980).
ТАБЛИЦА 1-11. ПРИЧИНЫ ГИПЕРНАТРИЕМИИ У СОБАК И КОШЕК
Потеря воды, превышающая потерю электролитов Несахарный диабет центрального генеза Нефрогенный несахарный диабет
Потеря жидкости через желудочно-кишечный тракт Осмотический диурез
Почечная недостаточность
Сахарный диабет
Введение маннитола
Тепловой удар Жар Ожоги
Дисфункция гипоталамуса ( первичная адипсия ) Избыток натрия из-за замедленного его выведения Ятрогенные факторы
Повышенное потребление соли
Инфузионная терапия с введением солевого раствора Инфузионная терапия с использованием бикарбоната натрия
Первичный гиперальдостеронизм
Целью лечения гипернатриемической гипертонической дегидратации являются восстановление объема внеклеточной жидкости до нормального уровня и коррекция дефицита воды при скорости инфузии, исключающей развитие серьезных осложнений. Поскольку мозг адаптируется к условиям гипертоничности, повышая внутриклеточное содержание растворенных веществ путем накопления «идиогенных осмолей», слишком быстрая нормализация содержания воды в организме с разбавлением внеклеточной жидкости индуцирует поступление воды в клетки и может привести к отеку мозга (Edwards et al, 1983; Reeves et al, 1998). При медленной нормализации содержания воды клетки мозга теряют накопленные в них растворенные соединения, и осмотическое равновесие устанавливается без набухания клеток.
Прежде всего необходимо восстановить объем внеклеточной жидкости (ВКЖ) до нормальной величины. Выбор жидкости для инфузии определяется наличием или отсутствием сосудистой недостаточности, скоростью развития гипернатриемии и ее тяжестью. При умеренном уменьшении объема (в частности, при тахикардии, обезвоживании слизистых или медленном восстановлении упругости кожи) для коррекции дефицита жидкости следует использовать 0,45% солевой раствор, содержащий соответствующее количество калия. В случае тяжелой дегидратации для увеличения сосудистого объема производят вливание физиологического раствора или плазмы. Противопоказано слишком быстрое заместительное вливание жидкости для устранения ее дефицита, за исключением случаев, когда выражены признаки гиповолемии. Объем любой вводимой жидкости не должен превышать объема, необходимого для коррекции гиповолемии. Ухудшение неврологического статуса или внезапные судороги во время инфузионной терапии обычно свидетельствуют о развитии отека мозга и необходимости введения гипертонического солевого раствора либо терапии маннитолом.
После устранения дефицита ВКЖ и стабилизации внутрисосудистой среды повторно определяют концентрацию натрия в крови и, если сохраняется гипернатриемия, корректируют содержание воды. Для приблизительной оценки дефицита воды в литрах используют следующую формулу:
0,6 х вес тела (кг) х
[1 - (концентрация Na+ в сыворотке (желаемая) / концентрация Na+ в сыворотке (имеющаяся)]
Для коррекции дефицита воды рекомендуется пероральное введение жидкости, и только при невозможности оральной терапии следует прибегать к внутривенному вливанию. У животных с гипернатриемией недостаток воды компенсируют вливанием наполовину разбавленного физиологического раствора (0,45%), содержащего 2,5% декстрозы, или 5% водного раствора декстрозы (D5W). Пос
36 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
ледний раствор можно использовать для восстановления нормального объема воды у животных с острым началом слабой гипернатриемии (продолжительностью менее 24 часов при концентрации натрия ниже 165 мЭкв/л) в отсутствие выраженной сосудистой недостаточности, однако скорость инфузии должна быть меньше скорости обмена глюкозы, чтобы избежать гликозурии и индуцируемого глюкозой осмотического диуреза. При тяжелой гипернатриемии (>170 мЭкв/л), особенно когда она развивалась постепенно на протяжении 24 часов, рекомендуется сначала использовать наполовину разбавленный физиологический раствор (0,45%), содержащий 2,5% декстрозы. Если же в течение 12-24 часов такой инфузионной терапии гипернатриемия не уменьшается, то разбавленный физиологический раствор с декстрозой заменяют раствором D5W. Дефицит воды следует восполнять медленно, вливая примерно 50% жидкости в первые 24 часа, а остальное ее количество в течение следующих 24 или 48 часов. Концентрация натрия в крови должна снижаться постепенно, желательно со скоростью менее 1 мЭкв/л в 1 час. Это позволяет уменьшить до минимума скорость перехода жидкости из внеклеточного во внутриклеточное пространство и, таким образом, в значительной степени предотвратить набухание нервных клеток, отек мозга и повышение внутричерепного давления. Ухудшение состояния ЦНС после начала инфузионной терапии указывает на развитие отека мозга и требует немедленного снижения скорости введения жидкости. Частое определение концентрации сывороточных электролитов наряду с правильным выбором жид
кости для инфузии и скорости инфузии определяет успех коррекции гипернатриемии. Гораздо проще избежать этих осложнений посредством тщательного мониторинга в условиях лишения воды.
Ошибки (неточности) диагностики при использовании модифицированной пробы с лишением жидкости
Модифицированная проба с лишением жидкости является эффективным способом дифференциальной диагностики тяжелых ННД и ЦНД, однако она не всегда позволяет вполне четко отличить частичный ЦНД от первичной полидипсии (рис. 1-25). Трудность распознавания частичного ЦНД и первичной полидипсии объясняется двумя взаимосвязанными изменениями реакции почек на АВП. Первое из них состоит в уменьшении максимальной концентрирующей способности в результате самой хронической полиурии (т.е. вымывания растворенных соединений из мозгового вещества), и оно проявляется как пониженная концентрация мочи при избыточном содержании АВП в плазме крови. Второе изменение заключается в повышенном антидиуретическом ответе на низкую концентрацию АВП в плазме крови животных с ЦНД, т.е. такие животные гиперчувствительны к небольшим количествам эндогенного АВП (Block et al, 1981). Следствием повышенного антидиуретического эффекта является улучшение показателей мочи при частичной недостаточности АВП. Поэтому животные с частичным ЦНД и первичной полидипсией (не достигшие уменьшения веса тела на 3-5%) при лишении жидкости имеют
900 800 700
600 500
400 300
200
100
50 0
Тяжелый несахарный диабет (ошибка = 6%)
Частичный несахарный диабет (ошибка = 59%)
♦ °
------------
Нефрогенный несахарный диабет (ошибка = 0%)
° о\ □ А 8 А „О □ О
» / —~~~
Нормальная функция вазопрессина (ошибка = 35% )
Нормальная функция
(первичная полидипсия)
♦ = Диагноз с помощью пробы с вазопрессином а = Тяжелый НД
= Частичный НД
• = Нефрогенный НД
0 200 400 600 800 1000 1200
Максимальная осмоляльность мочи после обезвоживания
Рис. 1-25. Взаимосвязь между максимальной осмоляльностью мочи после обезвоживания и ее увеличением (в процентах) после введения вазопрессина у людей с центральным и нефрогенным несахарным диабетом (НД) и первичной полидипсией. Обратите внимание на перекрывание показателей у пациентов с частичным несахарным диабетом центрального генеза и у лиц с нормальной функцией вазопрессина (например, при первичной полидипсии) Из: Robertson GL: The Endocrine Society 41st Postgraduate Annual Assembly Syllabus, New Orleans, October, 1989, p 25.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 37
сходную концентрацию мочи, которая не поддается дальнейшему повышению при введении АВП (см. рис. 1-17 и 1-21). Иными словами, ни абсолютный уровень осмоляльности мочи после прекращения доступа к воде, ни относительное (в процентах) увеличение осмоляльности при введении экзогенного АВП не позволяют провести четкое различие между двумя указанными расстройствами (Zerbe, Robertson, 1981).
Модифицированная проба с лишением жидкости иногда приводит к ошибкам в диагностике ННД у людей. Это объясняется тем, что у некоторых пациентов имеется лишь частичная резистентность к антидиуретическому действию вазопрессина и сохраняется способность в той или иной мере концентрировать мочу при очень высоком содержании этого гормона в крови (Robertson, Scheidler, 1981). Поскольку стандартная диагностическая доза водного раствора АВП обычно вызывает выраженную гипервазопрессинемию, пациенты с частичной резистентностью к этому гормону реагируют в данной фазе модифицированной пробы с лишением жидкости так, как если бы у них имелся ЦНД (Zerbe, Robertson, 1981). Частичная резистентность к антидиуретическому действию вазопресина была продемонстрирована также у лаек с врожденным ННД (Luzius et al, 1992). Это свидетельствует о возможности, хотя и нечастой, ошибок при использовании модифицированной пробы с лишением жидкости для диагностики ННД не только у людей, но и у животных.
Многим людям ошибочно ставился диагноз первичной (психогенной) полидипсии. Сначала диагноз базировался на результатах модифицированной пробы с лишением жидкости, как показано на рис. 1-22. Однако тщательные исследования показали, что у некоторых лиц такие результаты обусловлены обменными расстройствами. У этих пациентов нарушен «осмостат», т.е. аномально повышен порог чувствительности осморецепторов, участвующих в стимуляции высвобождения АВП. Поэтому при относительно высокой осмоляльности плазмы, которая должна была бы вызвать секрецию АВП, последний отсутствует на фоне полиурии
и, как ее следствия, полидипсии. Одновременно у этих пациентов может понижаться порог жажды. В этом случае ощущение жажды появляется при осмоляльности плазмы крови 290 мОсм/кг, тогда как в норме оно отсутствует, пока осмоляльность не возрастет до 295 или 300 мОсм/кг. Сходное явление описано у 4 собак с подозрением на первичную полидипсию. Эти особи характеризовались аномальной реакцией АВП на инфузию гипертонического солевого раствора, что свидетельствовало о первичном нарушении регуляции секреции АВП (van Vbnderen et al, 1999).
Случаи неправильной диагностики при использовании модифицированной пробы с лишением жидкости не означают полной непригодности этой методики. Напротив, знание ее недостатков должно помочь ветеринарам более надежно интерпретировать получаемые результаты. Применение этого теста для обследования собак и кошек в нашей клинике подтвердило его диагностическую ценность. Дополнение методики определением концентрации вазопрессина в плазме крови, как описано в следующем разделе, повышает точность окончательного диагноза, что было показано в исследованиях на людях (таблица 1-12; Zerbe, Robertson, 1981).
Определение вазопрессина в плазме крови
Непосредственное определение АВП в плазме крови значительно повышает точность рутинных методов, используемых для диагностики полиурии у людей (Zerbe, Robertson, 1981). Сама по себе модифицированная проба с лишением жидкости достаточно надежна в качестве инструмента диагностики тяжелого ЦНД, и ее результаты не нуждаются в корректировке после дополнительного прямого измерения концентрации АВП у пациентов, утративших способность концентрировать мочу в условиях обезвоживания. Однако при использовании этого метода для дифференциальной диагностики частичного ЦНД от первичной полидипсии и ННД возможны ошибки. Дополнительное определение концентрации АВП в плазме крови повышает точность диагностики.
ТАБЛИЦА 1-12. РЕЗУЛЬТАТЫ ДИАГНОСТИЧЕСКИХ ИССЛЕДОВАНИЙ У СОБАК С ЦНД, ННД, И ПСИХОГЕННОЙ ПОЛИДИПСИЕЙ
Тест ЦНД ННД Психогенная полидипсия
Рандомизированная оценка осмоляльности плазмы Норма или повышение Норма или повышение Норма или понижение
Рандомизированная оценка осмоляльности мочи Понижение Понижение Понижение
Осмоляльность мочи после лишения воды (потеря >5% веса тела) Без изменений Без изменений Повышение
Осмоляльность мочи во время инфузии гипертонического раствора Без изменений Без изменений Повышение
Осмоляльность мочи после введения вазопрессина Концентрация вазопрессина в плазме Повышение Без изменений Без изменений или слабое повышение
после лишения воды (потеря > 5% веса тела) Низкая Нормальная или высокая Нормальная или высокая
38
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
200 290 300 310
Осмоляльность плазмы крови (мОсм/кг)
♦ = Тяжелый несахарный диабет д = Частичный несахарный диабет = Нефрогенный несахарный диабет о = Первичная полидипсия
+ = Здоровые люди
Рис. 1-26. Взаимосвязь между концентрацией АВП в плазме крови и ее осмоляльностью после обезвоживания у людей с несахарным диабетом и первичной полидипсией. Обратите внимание, чю показатели у пациентов с нссахарным диабегом центрального генеза ниже нормальных величин (темная зона), а у лиц нефрогенным несахарным диабетом или первичной полидипсией почти всегда остаются в пределах нормы или превышают ее. Из: Robertson GL: Posterior hypophysis. In: Felig P, et al (eds): Endocrinology and Metabolism, 2nd ed. New York, McGraw Hill, 1987, p 338.
В ветеринарной литературе лишь изредка появляются сообщения о применении модифицированной пробы с лишением жидкости в сочетании с измерением концентрации АВП в плазме крови. Было, в частности, показано, что у двух собак с врожденным ЦНД уменьшение веса тела на 5% в результате лишения воды не сопровождалось повышением концентрации АВП (Poat et al, 1989). Концентрация АВП у этих двух собак составляла соответственно 3,3 и 3,7 пг/мл по сравнению с ее средним значением 31,3 пг/мл у трех лишенных воды здоровых живо гных. Аналогичная недостаточность АВП в условиях дегидратации была выявлена у кошки с ЦНД (концентрация АВП в плазме составляла 1,3 пг/мл по сравнению со средней величиной 84,6 пг/мл у восьми здоровых животных) (Brown et al, 1993). У четырех собак с подозрением на первичную полидипсию концентрация АВП после обезвоживания оставалась на базальном уровне или понижалась (т.е. была ниже 7 пг/мл). Позднее у этих животных было выявлено нарушение регуляции секреции АВП (van Vonderen et al, 1999).
При определении концентрации АВП в крови в условиях модифицированной пробы с лишением
жидкости образцы плазмы получают после потери животными 3-5% веса в результате дефицита воды, но до введения экзогенного АВП (т.е. в конце фазы 2). Можно, хотя и не обязательно, собирать плазму и накануне лишения животного воды. Во многих коммерческих ветеринарных эндокриноло! ичес-ких лабораториях не проводятся анализы на АВП, однако соответствующая методика имеется в ряде медицинских и некоторых ветеринарных учебных заведениях.
Данные определения концентрации АВП в плазме крови у людей интерпретируются с учетом результатов одновременного измерения осмотических концентраций плазмы крови и или мочи. При сопоставлении концентрации АВП и осмоляльности плазмы после дегидратации у лиц с тяжелым или частичным ЦНД соотношение этих показателей оказывается ниже нормальных величин, тогда как у пациентов с ИНД или первичной полидипсией оно почти всегда остается в пределах нормы или превышает ее (рис. 1-26; Robertson, 1988). Если после обезвоживания сопоставляют концентрацию АВП в плазме крови и осмоляльность мочи, то у людей с тяжелым или частичным ЦНД отношение осмоляльности мочи к уровню АВП в плазме крови почти всегда бывает нормальным или повышенным, а у пациентов с ННД неизменно ниже нормальной величины (рис. 1-27). У большинства лиц с первичной полидипсией эти параметры остаются нормальными, но у некоторых понижаются, предположительно вследствие вымывания растворенных соединений из мозгового вещества почек. Данных об аналогичных исследованиях на большой группе собак и кошек с первичной полиурией и полидипсией пока нет. До завершения более обширных исследований мы интерпретируем имеющиеся результаты определения концентрации АВП в плазме крови после дегидратации следующим образом: пациенты с тяжелым или частичным ЦНД должны испытывать недостаток АВП, а у лиц с ННД или первичной полидипсией в условиях обезвоживания концентрация АВП в крови должна оставаться нормальной или увеличиваться на фоне пониженной осмоляльности мочи (см. таблицу 1-12).
Мероприятия при поступлении в клинику собак или кошек в состоянии дегидратации
Иногда у животных с тяжелой полидипсией и полиурией выраженные клинические признаки дегидратации или гипернатриемии появляются еще до проведения модифицированной пробы с лишением жидкости. Наиболее вероятной причиной дегидратации в этих случаях является желание владельцев не допустить мочеиспускания в доме, что побуждает их ограничивать потребление воды собакой или кошкой Если у содержащихся в таких условиях животных появляются симптомы ЦНД, следует немедленно начать инфузионную терапию. Если же явные признаки недомогания отсутствуют, не-
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
39
Дегидратация Питрессин
1200
1000
800
600
400
200
0.5 1 5 10 50 >50
Концентрация вазопрессина в плазме крови (пг/мл)
♦ = Тяжелый несахарный диабет л = Частичный несахарный диабет + = Здоровые люди
= Нефрогенный несахарный диабет о= Первичная полидипсия
Рис. 1-27. Взаимосвязь между осмоляльностью мочи и концентрацией вазопрессина в плазме крови у людей с несахарным диабетом и первичной полидипсией. Обратите внимание, что во время дегидратации показатели у пациентов с нефрогенным нссахарным диабетом ниже нормальных величин, а у лиц с несахарным диабетом центрального генеза почти всегда остаются в пределах нормы или превышают ее. У большинства пациентов с первичной полидипсией эти показатели остаются нормальными, но у некоторых могут быть ниже нормы, возможно, из-за падений градиента концентраций в мозговом веществе почек. Из: Robertson GL: Posterior hypophysis. In: Fclig P et al (eds): Endocrinology and Metabolism, 2nd cd. New York. McGraw Hili. 1987, p 338.
обходимо провести дренирование мочевого пузыря и измерить удельный вес и осмотическую концентрацию мочи. Одновременно определяют концентрации AM, натрия и вазопрессина в плазме крови, а также ее осмоляльность. После этого приступают к очередной фазе модифицированной пробы с лишением жидкости (фаза III, см. табл. 1-9), если удельный вес мочи в мочевом пузыре меньше 1,030 (осмоляльность <1100 мОсм/кг), а уремия или гипернатриемия отсутствуют. У животных с удельным весом мочи более 1,030 и осмоляльностью 1100 мОсм/кг, очевидно, сохраняется нормальная концентрирующая способность системы гипофиз-почечные канальцы. В случае истинной полиурии полидипсии вероятен диагноз первичная полидипсия и гиперкортицизм. У животных с разбавленной мочой установлению правильного диагноза способствует оценка ответа на введение экзогенного вазопрессина.
РАНДОМИЗИРОВАННАЯ ОЦЕНКА ОСМОЛЯЛЬНОСТИ ПЛАЗМЫ КРОВИ КАК ИНСТРУМЕНТ ДИАГНОСТИКИ
Для анализа патофизиологии ЦНД. ННД или психогенной полидипсии может оказаться полезной рандомизированная оценка осмотической концент
рации плазмы крови. У собак и кошек с ЦНД и ННД имеез место первичное полиурическое расстройство с вторичной компенсаторной полидипсией; иными словами, они очень много пью г, потому что часто мочатся. Стимулом усиленного потребления воды при ЦНД и ННД служит потеря свободной воды через почки, которая приводит к уменьшению объема крови и повышению осмотической концентрации сыворотки. Поэтому у этих животных осмоляльность плазмы должна быть на верхнем пределе нормы или выше (рис. 1-28). В отличие от них. у собак с первичной или психогенной полидипсией имеется первичное полидипсическое расстройство с вторичной компенсаторной полиурией; иными словами, они часто мочатся, потому что много пьют. У этих животных неконтролируемое потребление воды сопровождается увеличением объема крови и уменьшением осмотической концентрации плазмы, что, в свою очередь, приводит к снижению секреции АВП, падению градиента концентрации в мозговом веществе почек и, в конечном счете, к увеличению объемов мочи. Собаки с психогенной полидипсией теоретически должны иметь пониженную осмоляльность плазмы.
Следует отметить, что вышесказанное относится к «классической» ситуации. К сожалению, «классические» случаи встречаются редко. Это хорошо
40 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
иллюстрируется одним из исследований больных полиурией, у которых осмоляльность сыворотки колебалась от 281 до 298 мОсм/кг при ЦНД, от 285 до 292 при ННД и от 275 до 291 мОсм/кг при первичной полидипсии (Zerbe, Robertson, 1981). У собак, обследованных нами и другими авторами, осмоляльность плазмы составляла 281-339 мОсм/кг при ЦНД, 283-340 при ННД и 274—304 мОсм/кг при психогенной полидипсии (см. рис. 1-28). Наши эксперименты с оценкой осмоляльности произвольно взятых проб плазмы дали следующие результаты: у некоторых собак и кошек, имевших свободный доступ к воде, она была ниже 280 мОсм/кг, что свидетельствовало о первичной или психогенной полидипсии, тогда как у других особей осмоляльность была выше 280 мОсм/кг и могла соответствовать как ЦНД, ННД, так и психогенной полидипсии.
ПРОБА С ВВЕДЕНИЕМ ДЕСМОПРЕССИНА (ДДАВП) КАК АЛЬТЕРНАТИВНЫЙ ДИАГНОСТИЧЕСКИЙ МЕТОД
Существует способ диагностики ЦНД более простой, хотя и не столь совершенный, как модифицированная проба с лишением жидкости; он основан на оценке реакции собак и кошек на терапию ДД АВП. Этот метод следует применять только после исключения в процессе дифференциальной диагностики всех других расстройств, кроме ЦНД, ННД и пер-
350 -|
340-
330-
320-
310--
300
290
280
270
Полный Частичный Нефрогенный Психогенная
несахарный несахарный несахарный полидипсия
диабет диабет диабет
центрального центрального генеза генеза
Рис. 1-28. Рандомизированная оценка осмоляльности плазмы крови у 19 собак с полным несахарным диабетом центрального генеза, у 12 собак с частичным несахарным диабетом центрального генеза, у 9 собак с первичным нефрогенным несахарным диабетом и у 11 собак с первичной (психогенной) полидипсией. Обратите внимание на перекрывание показателей у животных отдельных групп. Пунктирные линии обозначают верхнюю и нижнюю границы нормальной осмоляльности плазмы крови.
вичной (психогенной) полидипсии. Предварительно владелец животного должен на протяжении 2-3 дней регистрировать суточное потребление им жидкости в условиях свободного доступа к воде. Кроме того, ежедневно и в определенное время нужно брать пробы мочи для последующего определения ее удельного веса и осмоляльности. По завершении этих процедур животному через каждые 8 часов начинают давать по половине таблетки, содержащей 0,1 или 0,2 мг ДДАВП, или с помощью пипетки вводить в конъюнктивальный мешок 1-4 капли ДДАВП для интраназального применения каждые 12 часов на протяжении 5-7 дней (см. стр. [37]). Ежедневно регистрируют количество потребляемой жидкости, на 5-7-ой день берут несколько проб мочи для измерения ее удельного веса и осмоляльности. Значительное уменьшение потребления воды и/или повышение концентрации мочи (более чем на 50%) служат достоверными показателями ЦНД (см. таблицу 1-12). Вымывание растворенных соединений из мозгового слоя почек зачастую препятствует образованию достаточно концентрированной мочи в ответ на одно- или двукратное введение ДДАВП у собак и кошек с частичным или тяжелым ЦНД. Однако в целом ДДАВП индуцирует четко различимые реакции. Слабый эффект ДДАВП исключает ЦНД. Умеренный эффект свидетельствует о частичном ЦНД или гиперкортицизме.
У собак с ННД терапия ДДАВП не дает желаемого результата, хотя очень высокие дозы препарата могут вызвать соответствующую реакцию (Luzius et al, 1992). У животных с первичной полидипсией возможно небольшое уменьшение продукции мочи и потребления воды, поскольку хронически низкая осмоляльность сыворотки подавляет синтез АВП. Иногда у собак с первичной полидипсией пониженное образование мочи отмечается на фоне потребления аномально большого количества воды. В этом случае вероятна водная интоксикация.
У собак с гиперкортицизмом возможно минимальное или умеренное увеличение концентрации мочи и снижение ее продукции после введения ДДАВП. Гиперкортицизм на ранних стадиях его развития у собак может быть ошибочно принят за ЦНД, если единственными клиническими признаками заболевания являются полиурия и полидипсия, типичные изменения исходного состава крови отсутствуют, а результаты тестирования функции гипофизарно-надпочечниковой си-темы неоднозначны. У таких животных введение ДДАВП сначала вызывает соответствующий ответ, по-видимому, потому, что при гиперкортицизме подавлена секреция гипофизарного вазопрессина. Однако по мере дальнейшего развития заболевания действие ДДАВП ослабевает. Повторные рутинные анализы крови и тестирование системы гипофиз-кора надпочечников обычно выявляют нарушения, характерные для гиперкортицизма, которые не были заметны при первичном обследовании животного ветеринаром.
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 41
ИССЛЕДОВАНИЕ С ИНФУЗИЕЙ СОЛЕВОГО РАСТВОРА (ПРОБА ХИКИ-ХАРЫ)
Проба Хики-Хары служит для оценки способности системы гипофиз-почсчные канальцы уменьшать объем выделяемой мочи в ответ на увеличение осмотической концентрации плазмы крови, вызванное внутривенным введением гипертонического солевого раствора. Во время его инфузии животным нельзя пить. Скорость продукции мочи в минуту определяют, полностью опоражнивая мочевой пузырь через каждые 15 минут на протяжении инфузии гипертонического солевого раствора и в течение еще 15 мин после ее окончания. Существенное (>25%) уменьшение скорости тока мочи служит показателем нормальной концентрирующей способности системы гипофиз-почечные канальцы. У собак с психогенной полидипсией скорость образования мочи уменьшается, а у животных с ННД или ЦНД не изменяется.
Альтернативный и более привлекательный подход состоит в измерении осмоляльности плазмы крови и концентрации в ней АВП вместо измерения продукции мочи во время инфузии солевого раствора. Ответ АВП на увеличение осмотической концентрации плазмы оценивают посредством введения 20%-ного солевого раствора со скоростью 0,03 мл/кг вес тела в минуту на протяжении 2 часов (Biewenga et al, 1987). Пробы крови для определения концентрации АВП и осмоляльности плазмы берут с интервалами в 20 минут. Метод требует тщательного мониторинга состояния животного и осмотической концентрации плазмы, дабы избежать развития тяжелой гиперосмоляльности. У собак и кошек с нормально функционирующей системой гипоталамус-гипофиз-почки концентрация АВП в плазме крови нарастает по мере увеличения ее осмоляльности. У собак с ЦНД концентрация АВП ниже, чем у здоровых животных (рис. 1-29). Оценка изменений концентрации АВП в зависимости от изменений осмоляльности плазмы позволяет клиницисту, помимо прочего, идентифицировать нарушения регуляции секреции АВП (van Vbnderen et al, 1999).
ОТНОШЕНИЕ ОСМОЛЯЛЬНОСТЕЙ МОЧИ И ПЛАЗМЫ
Высказывалось предположение, что отношение осмоляльностей мочи и плазмы после дегидратации, вызванной лишением жидкости, можно использовать в качестве инструмента диагностики, поскольку величина этого отношения менее 1,84 предполагает наличие тяжелого ЦНД или ННД, 1,83-3,0 -частичный ЦНД, а более 3,0 - первичную полидипсию или нормальное состояние. В наших экспериментах отношение осмоляльностей мочи и плазмы изменялось бессистемно и не имело диагностической ценности у животных с подозрением на первичную полиурию или полидипсию.
Концентрация АВП в плазме
60 г крови (пмоль/л)
50
Осмоляльность плазмы крови (мОсм/кг)
Рис. 1-29. Взаимосвязь между осмоляльностью плазмы крови и концентрацией в ней вазопрессина (АВП) во время инфузии гипертонического раствора у двух собак с центральным несахарным диабетом, обусловленным опухолью гипофиза. Темная зона - соотношение у здоровых собак. Из: Rijnbcrk А: Diabetes insipidus. In: Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5th ed. Philadelphia, WBSaundcrs, 2000, p!378.
280 300 320 340 360
ЛЕЧЕНИЕ
Варианты лечения полидипсии и полиурии у собак и кошек с ЦНД, ННД и первичным (психогенным) избыточным потреблением воды перечислены в таблице 1-13 и обсуждаются ниже. Оценка состояния гипоталамуса и гипофиза с помошью компьютерной и магнитно-резонансной томографии показана у собак и кошек с диагнозом приобретенный ЦНД или первичная полидипсия (см. рис. 1-9). В случае обнаружения контрастной массы ткани (т.е. опухоли-), особенно если размеры ее невелики, а животное с полиурией и полидипсией выглядит во всех других отношениях здоровым, назначают радиотерапию (см. гл. 6).
Аналоги вазопрессина (используемые при ЦНД и частичном ЦНД)
В прошлом в качестве стандартной терапии ЦНД применяли парентеральное введение частично очищенных экстрактов АДГ, получаемых из гипофизов свиней или крупного рогатого скота (масляную эмульсию питрессина танната производства Parke Davis, Morris Plains. NJ). Этот препарат утратил свое значение в конце 1980-ых годов после успешной разработки препаратов-аналогов вазопрессина в форме глазных капель и аэрозоля для интраназального введения людям. Производство водного препарата питрессина (Parke Davis, Morris Plains, NJ) еще
42 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
ТАБЛИЦА 1-13. МЕТОДЫ ЛЕЧЕНИЯ СОБАК С ПОЛИУРИЕЙ И ПОЛИДИПСИЕЙ ПРИ ЦНД, ННД ИЛИ ПЕРВИЧНОЙ (ПСИХОГЕННОЙ) ПОЛИДИПСИЕЙ
А. Несахарный диабет центрального генеза (тяжелый)
1. ДДАВП (десмопрессина ацетат)
а. Эффективный
б. Дорогой
в. В отсутствие эффекта при приеме внутрь может потребоваться введение в конъюнктивальный мешок
2. ЛВП (липрессин [диапид])
а. Короткая продолжительность действия, менее активен, чем ДДАВП
б. Введение по каплям в нос или в конъюнктивальный мешок
3. В отсутствие терапии необходим свободный доступ к воде
Б. Несахарный диабет центрального генеза (частичный)
1. ДДАВП
2. ЛВП
3. Хлорпропамид
а. Эффективность 30-70%
б. Недорогой
в. Выпускается в форме таблеток
г. Терапевтический эффект через 1-2 недели после начала терапии
д. Может вызывать гипогликемию
4. Клофибрат (не испытывался в ветеринарной практике ) 5. Тиазиды
а. Слабоэффективны
б. Недороги
в. Выпускаются в форме таблеток
г. Применяются в сочетании с рационом с низким содержанием натрия
6. Рацион с низким содержанием натрия
7. В отсутствие терапии необходим свободный доступ к воде
В. Нефрогенный несахарный диабет
1. Тиазиды (см. выше)
2. Рацион с низким содержанием натрия
3. В отсутствие терапии необходим свободный доступ к воде
Г. Первичная (психогенная) полидипсия
1. Периодическое лишение доступа к воде
2. Ограничение потребления воды
3. Модификация поведения
а. Физические нагрузки
б. Приобретение второго питомца
в. Расширение жизненного пространства животного
продолжается, однако он непригоден для длительной терапии ЦНД. Продолжительность его действия не превышает нескольких часов, что требует повторных инъекций. Вместе с тем, он является идеальным средством для проведения модифицированной пробы с лишением жидкости.
ДДАВП (Десмопрессина Ацетат; Aventis Pharmaceuticals, США). Синтетический аналог вазопрессина (ДДАВП, десмопрессин, см. рис. 1-1) разрешен для медицинского применения и продается в формах для парентеральных инъекций (ампулы на 1 и 2 мл, содержащие 15 мкг ДДАВП/мл и ампулы на 1 и 10 мл, содержащие 4 мкг ДДАВП/мл), капель для введения в нос (флаконы на 2,5 и 5,0 мл, содержащие 100 мкг ДДАВП/ мл) и таблеток для перорального введения, содер
жащих по 0,1 и 0,2 мг ДДАВП. Препарат обладает сильным антидиуретическим действием, которое осуществляется через рецепторы V2, и минимальной вазопрессорной активностью, опосредуемой через рецепторы V, (Pliska, 1985). Описан также ряд внепочечных эффектов ДДАВП, в частности, высвобождение двух факторов свертываемости крови (фактора VIIIc и фактора Виллебранда; Richardson, Robinson, 1985), снижение кровяного давления и периферической резистентности и увеличение активности ренина плазмы (Schwartz et al, 1985; Williams et al, 1986).
Терапия ДДАВП имеет ряд преимуществ перед использованием масляной эмульсии питрессина танната. Замещения аминокислот в положениях 1 и 8 молекулы удваивают ее антидиуретическую активность, устраняют прессорное действие и повышают устойчивость к метаболической деградации. Кроме того, ДДАВП обладает более высоким сродством к почечным рецепторам АВП (V2), чем масляная эмульсия питрессина танната (Schwartz-Porsche, 1980). Пониженная скорость метаболического клиренса, всасывание через слизистые оболочки, стабильность в водной среде и отсутствие побочного действия делают ДДАВП отличным средством для лечения ЦНД.
Обмен ДДАВП в организме человека описывается биэкспоненциальной кривой с периодами полужизни в 1-й и 2-й фазах соответственно 7,8 и 75,5 минут. Аналогичные данные были получены в экспериментах на здоровых собаках (Feiring, 1985) и у животных со спонтанным ЦНД. Кроме того, изучение химического состава крови и вскрытие получавших ДДАВП собак (Ferring, 1985), а также опыт лечения собак и кошек с ЦНД (Kraus, 1987; Harb et al, 1996) свидетельствуют о безопасности применения препарата у этих животных. У большинства людей интраназальная инсуффляция ДДАВП дважды в день в дозах от 10 или 25 мкг (0,2 мл 0,01% раствора) полностью устраняет симптомы ЦНД. Для лечения ЦНД у собак и кошек чаще всего используют интраназальную лекарственную форму ДДАВП. Однако ее введение животным интраназально хотя и возможно, но не рекомендуется. Поэтому препарат переносят в стерильную глазную пипетку и по каплям вводят в конъюнктивальный мешок собаки или кошки. Хотя раствор препарата имеет кислый pH, он редко вызывает раздражение глаз. В одной капле ДДАВП содержится от 1,5 до 4,0 мкг активного вещества; его вводят в количестве 1 -4 капель один или два раза в день, что в большинстве случаев достаточно для устранения симптомов ЦНД.
Недавно мы применили таблетки ДДАВП для пероральной терапии ЦНД и получили хорошие результаты. Таблетки содержат по 0,1 или 0,2 мг ДДАВП. Биологическая доступность ДДАВП при пероральном введении составляет примерно 5-15% его интраназальной дозы для человека. Людям сначала назначают половину таблетки, содержащей 0,1 мг ДДАВП, дважды в день, а затем корректиру
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 43
ют дозу для достижения максимального клинического эффекта. Оптимальная терапевтическая доза ДДАВП для человека составляет от 0,1 до 0,8 мг; это количество делится на 2-3 приема в течение суток. Мы вводили ДДАВП собакам в исходной дозе 0,1 мг трижды в день. Если через 1 неделю после начала терапии сохранялся неприемлемо высокий уровень полиурии и полидипсии, дозу постепенно увеличивали до получения желаемого результата. В случае клинического улучшения частоту введения ДДАВП уменьшали до двух раз в день. По нашим данным для эффективного контроля полиурии и полидипсии собакам необходимо вводить по 0,1 или 0,2 мг ДДАВП два или три раза в день. У нас нет опыта лечения кошек препаратами ДДАВП для перорального введения.
Вместо глазных капель или таблеток ДДАВП можно использовать его форму для парентерального (подкожного) введения. Начальная доза ДДАВП для п/к инъекций составляет 0,5-2,0 мкг 1 или 2 раза в день. Учитывая разную стоимость препаратов ДДАВП для парентерального и интраназального применения, последний вводили собакам и кошкам путем подкожных инъекций, хотя он и не предназначен для такой цели; побочные эффекты отсутствовали (Nichols, 2000). Следует, однако, помнить, что интраназальная форма ДДАВП не стерильна, поэтому перед парентеральным введением препарат следует пропустить через бактериостатический фильтр.
Независимо от способа введения максимальное терапевтическое действие ДДАВП проявляется через 2-8 часов и продолжается 8-24 часа. Более высокие дозы усиливают антидиуретический эффект препарата и увеличивают продолжительность его действия. Однако применение таких доз лимитируется стоимостью препарата. ДДАВП можно вводить только на ночь в качестве профилактики ночной полиурии.
В идеале после получения каждой дозы ДДАВП собака или кошка не должна иметь немедленного свободного доступа к воде, особенно если у нее повторно развиваются тяжелые полиурия и полидипсия. В отсутствие такого ограничения животное может выпивать большое количество воды, которая не будет выводиться вследствие ятрогенного ан-тидиуретического действия ДДАВП на почечные канальцы. Физиологически, неспособность экскретировать свободную воду вызывает относительное снижение осмоляльности внеклеточной жидкости и последующую гипергидратацию клеток. Поступление воды в клетки, особенно в мозге, может сопровождаться выраженными расстройствами, включая депрессию, повышенное слюноотделение, рвоту, атаксию, мышечную дрожь, кому и судороги (Schwartz-Porsche, 1980). Тем не менее, многие владельцы игнорируют упомянутое ограничение без ущерба для состояния животных.
Мы получили прекрасные результаты, ежедневно вводя собакам и кошками ДДАВП на протяже
нии более 5 лет. По словам хозяев, животные с ЦНД привыкают к введению глазных капель, а раздражение глаз или конъюнктивы отмечаются редко. Если полиурия и полидипсия возобновляются несмотря на применение ДДАВП, следует проанализировать возможные причины рецидивов, в том числе несоблюдение хозяевами животных предписанного режима лечения, использование инактивированного ДДАВП или препарата с истекшим сроком действия, возникновение сопутствующего заболевания, вызывающего полиурию и полидипсию. Наиболее вероятной причиной рецидива полиурии и полидипсии у собак с ЦНД в условиях терапии ДДАВП может быть гиперкортицизм.
Терапия ДДАВП давала хороший эффект у щенков лаек (хаски) с семейным ННД, обусловленным нарушением связывания АВП с рецепторами V2 (Luzius et al, 1992). Однако для устранения полиурии и полидипсии требовались очень большие дозы ДДАВП (0,33 Ед/кг веса тела внутримышечно три раза в день) и большинство владельцев животных находили такое лечение слишком дорогостоящим. Поэтому с практической точки зрения терапия ННД с использованием ДДАВП представляется неэффективной.
ЛВП (лизин-8-вазопрессин). Диапид (аэрозоль для интраназального применения производства Novartis Pharmaceuticals, США) представляет собой еще один синтетический аналог вазопрессина. Людям его назначают только в качестве дополнения к другим лекарственным средствам, поскольку антидиуретический эффект этого препарата сохраняется на протяжении всего 2-6 часов. Кратковременное действие в сочетании со слабой антидиуретической активностью и высокой стоимостью, очевидно, не оправдывают применение диапида в качестве рутинного средства лечения ЦНД у собак и кошек.
Пероральные средства (применяемые при ЦНД, частичном ЦНД, ННД и первичной полидипсии)
Хлорпропамид. Хлорпропамид (диабинез; Pfizer Inc., New York, NY) представляет собой препарат сульфомочевины для приема внутрь и используется при лечении гипергликемии у человека (см. гл. 12). Совершенно случайно было установлено, что хлорпропамид оказывает терапевтическое действие и на больных с ЦНД и при частичном ЦНД снижает продукцию мочи на 30-70%. Такое снижение сопровождается пропорциональным увеличением осмотической концентрации мочи, коррекцией дегидратации и уменьшением потребности в воде, как это имеет место при лечении небольшими дозами вазопрессина (Robertson, 1981). Кроме того, препарат обладает антидиуретическим действием у здоровых людей и у пациентов с первичной полидипсией. В последнем случае его эффект, по неизвестным причинам, менее выражен, чем при ЦНД.
44 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
Точный механизм усиления хлорпропамидом действия АВП в почках не известен. Хлорпропа-мид может усиливать стимуляцию АВП образования цАМФ в мозговом веществе почек, либо повышая чувствительность аденилатциклазы к АВП, либо подавляя фосфодиэстеразную активность (Reeves et al, 1998). Предполагается также, что одним из механизмов этого потенциирующего эффекта хлорпропамида является ингибирование синтеза простагландина Е2 - антагониста АВП. Наконец, терапия хлорпропамидом может усиливать зависимую от АВП абсорбцию ионов натрия и хлора в толстой восходящей петле Генле в мозговом веществе почек и, таким образом, увеличивать движущую силу всасывания воды в собирательных трубочках (Kusano et al, 1983). Подобно ДДАВП, хлорпропамид не годится для лечения ННД. Другие препараты сульфонилмочевины не обладают выраженным антидиуретическим действием при ЦНД, а у некоторых пациентов даже слегка усиливают мочеотделение.
Эффективность хлорпропамида в качестве средства лечения ЦНД у собак еще дебатируется в соответствующей литературе. Как и у людей, для проявления его действия необходимо сохранение, в той или иной мере, продукции эндогенного АВП. Некоторые ветеринарные врачи сообщают о неудачных или малоэффективных попытках лечения хлорпропамидом, приводивших к уменьшению объема мочи всего на 18% на протяжении 7 дней лечения (Schwartz-Porsche, 1980). По наблюдениям других авторов, объем мочи снижался на 50% после терапии в течение 5 дней. Столь же противоречивые данные были получены при использовании хлорпропамида для лечения ЦНД у кошек (Kraus, 1987).
Неоднозначные результаты лечения хлорпропамидом, по всей вероятности, обусловлены наличием обеих форм ЦНД, частичной и тяжелой, из которых первая отвечает, а вторая не отвечает на этот препарат. Кроме того, для проявления эффекта препарат необходимо вводить на протяжении нескольких последовательных дней. У людей максимальный терапевтический эффект хлорпропамида отмечался спустя 3-10 дней после начала лечения и зависел от дозы. Ежедневный прием препарата в дозах от 250 до 750 мг пациентами с частичным ЦНД уменьшал полиурию на 50-80% (Reeves et al, 1998). Эффективная доза для собак и кошек при лечении частичного ЦНД не установлена, однако некоторые авторы предлагают вводить препарат в количестве 10^40 мг/кг/день (Hardy, 1982). Применение хлорпропамида у собак в дозе 250 мг дважды в день не давало желаемого эффекта (Schwartz-Porsche, 1980); сообщалось также об отсутствии реакции у кошки при введении препарата в дозе около 30 мг/кг/день (Kraus, 1987). В сообщении об эффективности препарата при полиурии и полидипсии у собак доза хлорпропамида не указана, а у одной кошки составила около 10 мг/кг/день.
Главный побочный эффект хлорпропамида - гипогликемия, обусловленная его стимулирующим действием на секрецию инсулина. В случае возникновения гипогликемии необходимо упорядочить режим кормления животного. Мы не располагаем большим опытом применения хлорпропамида, так как получали прекрасные результаты с помощью ДДАВП, а обращавшиеся к нам владельцы животных находили приемлемой стоимость такого лечения и мирились с сопутствующими трудностями. Если клинические испытания хлорпропамида окажутся успешными, он может стать альтернативным средством терапии частичного ЦНД.
Клофибрат. Гиполипидемическое средство клофибрат уменьшает полиурию и полидипсию у людей с частичным ЦНД, но не дает эффекта при полном ЦНД и ННД. По-видимому, клофибрат действует путем прямой стимуляции высвобождения АВП из гипоталамуса. Полагают, что он менее эффективен, чем хлорпропамид. Сведения о его применении у собак и кошек отсутствуют.
Карбамазепин. Противосудорожное средство карбамазепин уменьшает полиурию и полидипсию у людей с частичным ЦНД. Подобно клофибрату карбамазепин не обладает терапевтическом действием при тяжелом ЦНД и ННД. Предполагаемый механизм действия карбамазепина состоит в прямой стимуляции высвобождения АВП из гипоталамуса и повышении чувствительности почек к АВП (Gold et al, 1983). Данные о его применении у собак и кошек не публиковались.
Тиазиды. Диуретики тиазидного ряда могут снижать полиурию и полидипсию у животных с несахарным диабетом (Breitschwerdt et al, 1981). Этот кажущийся парадоксальным эффект имеет место как при ННД, так и при ЦНД, что предполагает отличие механизма действия тиазидов от такового хлорпропамида и клофибрата. Тиазидные диуретики ингибируют реабсорбцию натрия в восходящем колене петли Генле и, таким образом, уменьшают его общую концентрацию в организме; это, в свою очередь, приводит к сокращению объема внеклеточной жидкости и усилению реабсорбции соли и воды в проксимальных почечных канальцах. Как следствие, в дистальных канальцах снижаются концентрация натрия и осмотический эффект, необходимый для поддержания их объема. Конечным результатом этих изменений является уменьшение объема мочи. Иными словами, при несахарном диабете происходит слабое повышение осмоляльности мочи и пропорциональное уменьшение ее объема. В зависимости от потребления натрия у людей с ЦНД или ННД полиурия может уменьшаться на 30-50%. Существенные побочные эффекты отсутствуют, если не считать эпизодической гипокалиемии. Тиазиды понижают способность экскретировать избыток воды в условиях нагрузки ею, а у больных с первичной полидипсией могут усиливать водную интоксикацию (Robertson, 1981).
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
45
Хлоротиазиды назначают в дозах 20-40 мг/кг дважды в день в сочетании с ограничением содержания натрия в рационе. Для своевременного предупреждения ятрогенных осложнений рекомендуется периодически измерять концентрацию электролитов в сыворотке крови (каждые 2-3 месяца).
Ограничение хлорида натрия (соли). При использовании рациона с низким содержанием натрия как единственного средства терапии несахарного диабета продукция мочи уменьшается вследствие увеличения объема фильтрата, изоосмотически всасываемого в проксимальном отделе нефрона. Этот простой метод дает хороший эффект как при ЦНД, так и при ННД. Содержание соли в коммерческих кормах для собак и кошек сильно варьирует (от 0,14 до 3,27 г/1 ООО ккал метаболизируемого энергетического содержания корма у собак и от 0,3 до 4,0 г/1000 ккал у кошек). Корма собак и кошек, содержащие соответственно меньше 0,6 и 0,9 г натрия/1000 ккал, относятся к категории низкосолевых (таблица 1-14).
Отсутствие терапии
Терапия несахарного диабета (ЦНД и ННД) и первичной полидипсии необязательна, если собака или кошка имеет свободный доступ к воде и содержится в условиях, при которых полиурия не создает нежелательных проблем. В большинстве случаев такие животные находятся вне помещения. Некоторые из обращавшихся к нам владельцев собак и кошек отказывались от лечения после установления диагноза. Чаще хозяева животных прекращали введение ДДАВП спустя 1 или 2 месяца после его начала, главным образом, чтобы избежать расходов. Наконец, третьи вводили своим питомцам ДДАВП эпизодически, когда не хотели, чтобы у тех были заметны признаки тяжелых полиурии и полидипсии (например, когда в доме останавливались родственники). В тех случаях, когда владельцы собак или кошек отказываются от лечения, необходимо обеспечить животным свободный доступ к воде, поскольку ее отсутствие даже в течение относительно коротких периодов может иметь катастрофические
ТАБЛИЦА 1-14. ПРИМЕРЫ КОРМОВ ДЛЯ СОБАК И КОШЕК С ОГРАНИЧЕННЫМ СОДЕРЖАНИЕМ НАТРИЯ (NACL <0,6 г/1000 ккал МЕТАБОЛИЗИРУЕМОЙ ЭНЕРГИИ) И С ПОНИЖЕННЫМ СОДЕРЖАНИЕМ НАТРИЯ (NACL <0,9 г/1000 ккал МЕТАБОЛИЗИРУЕМОЙ ЭНЕРГИИ)
Корма с резко ограниченным содержанием натрия
Корма для собак Содержание соли (г/100 ккал метаболизируемой энергии Корма для кошек Содержание соли (г/100 ккал метаболизируемой энергии)
Хиллз (Hill’s h/d), увлажненный 0,14 г Пурина НФ (Purina NF), увлаж-
ненный 0,30 г
Хиллз (Hill’s h/d), сухой 0,15 г Уолтам (Waltham), с низким со-
держанием фосфора и белка 0,40 г
Пурина ЦВ (Purina CV) 0,20 г Хиллз (Hill’s 1/d ), увлажненный 0,48 г
Пурина ГФ (Purina GF) 0,30 г Пурина ЦВ (Purina CV), увлаж-
ненный 0,50 г
Хиллз (Hill’s k/d), увлажненный 0,38 г Пурина НФ (Purina N/F), сухой 0.50 г
Уолтам (Waltham), с низким содержани- Хиллз (Hill’s k/d), сухой 0,56 г
ем фосфора и белка 0,40 г
Пурина НФ (Purina NF) 0,50 г Пурина УР (Purina UR), сухой 0,60
Хиллз (Hill’s k/d), сухой Эукануба (Eukanuba), высококалорий- 0,52 г
ный, увлажненный 0,55 г
Эукануба (Eukanuba), низкокалорийный 0,55 г
Корма с пониженным содержанием натрия
Хиллз (Hill’s w/d), сухой 0,67 г Хиллз (Hill’s k/d), увлажненный 0,64 г
Научно обоснованный рацион (Science Пурина ЕН (Purina EN), увлаж-
Diet Maintenance), сухой 0,70 г ненный 0,70 г
Пурина ОМ (Purina ОМ), сухой 0,70 г Эукануба-респонс ЛБ (Eukanuba
Response LB), увлажненный 0,76 г
Уолтам (Waltham), с высоким содержани- Хиллз (Hill’s w/d), сухой 0,77 г
ем пищевой клетчатки Эукануба (Eukanuba), высококалорий- 0,80 г Пурина ОМ (Purina ОМ), сухой 0,80 г
ный, сухой 0,84 г
Пурина ЕН (Purina EN) 0,90 Пурина ДМ (Purina DM), увлажненный Эукануба (Eukanuba), низкокало- 0,80 г 0,82 г
рийный, сухой
46 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
последствия (см. «Осложнения модифицированной пробы с лишением жидкости: гипертоническая дегидратация и гипернатриемия»).
Модификация поведения (при первичной полидипсии)
Ограничение потребления воды. У собак с психогенной полидипсией постепенное ограничение потребления воды в пределах верхней границы нормы (60-80 мл/кг/24 часа) уменьшает тяжесть полиурии и полидипсии и может привести к их полному устранению. У некоторых животных резкое уменьшение потребления воды вызывает необычное поведение, непрерывный лай, питье мочи и дегидратацию. Поэтому мы рекомендуем владельцам сначала приблизительно определить суточное потребление воды питомцем в условиях свободного доступа к ней. После этого количество воды еженедельно уменьшать на 10%, пока оно не понизится до 60-80 мл/кг/24 часа. Общий суточный объем потребляемой воды следует поделить на несколько порций, последнюю из которых давать перед сном. Кроме того, в течение 3-5 дней можно давать животным соль (1 г/30 кг дважды в день) и/или бикарбонат натрия (0,6 г/30 кг дважды в день), чтобы восстановить градиент концентрации в мозговом веществе почек. Мы получали очень хорошие результаты, постепенно ограничивая потребление воды, и не прибегали к регулярному использованию питьевой соды.
Изменение условий содержания. Большинство собак с психогенной полидипсией реагируют на ограничение потребления воды, как описано в предыдущем абзаце. Если такой реакции нет, можно попытаться использовать менее «научные» подходы, например: (1) ежедневные большие физические нагрузки (бег с хозяином или за велосипедом либо автомобилем); (2) приобретение второго животного; (3) нервно-психическая стимуляция (включение радио на время отсутствия хозяев); (4) помещение собаки в условия, обеспечивающие повышенный контакт с людьми. Если эти меры не приносят желаемого результата, следует подумать о передаче животного в другие руки.
ПРОГНОЗ
Адекватная терапия обычно купирует клиническую симптоматику идиопатического или врожденного ЦНД у собак и кошек и при соответствующем уходе увеличивает продолжительность жизни животных. К сожалению, из-за высокой стоимости ДДАВП, многие владельцы прекращают лечение своих питомцев через несколько месяцев после его начала или прибегают к эвтаназии. В отсутствие терапии такие животные обычно остаются жизнеспособными, если имеют постоянный доступ к воде и содержатся в условиях, при которых тяжелая полиурия не создает серьезных проблем для владельцев. Тем
не менее, всегда сохраняется опасность дегидратации, угрожающей жизни животного, когда оно на несколько часов лишается воды. Более того, даже легкое недомогание, сопровождающееся рвотой или уменьшением потребления воды, может перейти в состояние тяжелой дегидратации. По этой причине к прогнозу заболевания у нелеченных собак и кошек следует подходить с осторожностью.
Длительное наблюдение за 19 собаками с ЦНД, проводившееся в одном из исследований, показало, что 7 из них прожили в среднем 29 месяцев (медиана 30 месяцев) после установления диагноза (Harb et al, 1996). Возраст шести из этих 7 животных на момент постановки диагноза ЦНД составлял 3 года или меньше. Остальные двенадцать собак погибли в среднем в течение 6 месяцев (медиана 2 месяца) после выявления заболевания. Три собаки умерли вне связи с ЦНД или по неизвестной причине, две были умерщвлены вскоре после обнаружения ЦНД, а семь собак погибли или подверглись эвтаназии из-за появления неврологических симптомов. Последние развились через 2 месяца (медиана 1 месяц, диапазон 0,5-5 месяцев) после установления диагноза ЦНД, а смерть наступила спустя 3,3 месяца (медиана 1,5 месяца, диапазон 1-7 месяцев) (Harb et al, 1996). У всех 6 собак, обследованных с помощью компьютерной томографии или на вскрытии, выявлено опухолевидное образование в области гипофиза. Семь собак, у которых развилась неврологическая симптоматика, были старше 6 лет.
Естественно, у собак с таким серьезным расстройством на гипофизарном и гипоталамическом уровнях, как развитие опухоли, прогноз неблагоприятен. В этих случаях можно предпринять либо облучение гипофиза и гипоталамуса (см. гл. 6), либо химиотерапию (например, кармустином), хотя исход такого лечения непредсказуем. Нам пришлось лечить трех собак с ЦНД, обусловленным опухолью гипоталамуса или гипофиза. У двух из них во время радиотерапии появились неврологические симптомы и лечение не оказало видимого влияния на продолжительность их жизни. У третьей собаки признаки полиурии и полидипсии после радиотерапии исчезли, что позволило отменить ДДАВП; неврологических расстройств через 2 месяца после завершения радиотерапии не наблюдалось (см. рис. 1 -9), и собака прожила еще 2 года без клинических проявлений ЦНД. Имеющийся опыт лечения макроопухолей гипофиза показывает, что вероятность успеха радиотерапии повышается при небольших размерах новообразования и начале лечения до появления клинически выраженных неврологических симптомов. При диагностике ЦНД показаны компьютерная томография и визуализация гипоталамо-гипофизарной области методом магнитно-резонансной томографии (МРТ), особенно когда идет речь о приобретенном ЦНД у старых собак и кошек.
Поскольку терапия ННД далеко не всегда бывает успешной, прогноз этого расстройства у собак также сомнителен или неблагоприятен. Риск се
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ • 47
рьезных осложнений при возникновении легкого заболевания у этих животных гораздо выше, чем у других особей. Их хозяева должны знать об опасности возникновения тяжелой дегидратации. Прогноз вторичного ННД зависит от прогноза первичного заболевания, обусловившего развитие ННД.
Прогноз психогенной полидипсии обычно благоприятный. Ограничение потребления воды и модификация отдельных элементов поведения приводят к исчезновению клинической симптоматики у этих животных, хотя не исключают рецидивы.
СИНДРОМ НАРУШЕННОЙ СЕКРЕЦИИ ВАЗОПРЕССИНА: ИЗБЫТОК ВАЗОПРЕССИНА
Первичный избыток АВП отмечается в двух клинических ситуациях:
при синдроме нарушенной секреции АВП (СНСАВП) и как следствие применения лекарственных средств, усиливающих высвобождение или действие АВП (см. таблицу 1-2). Постоянная секреция АВП при СНСАВП происходит в отсутствие осмотической или неосмотической стимуляции (Reeves et al, 1998). У людей СНСАВП отмечается при самых разных заболеваниях, особенно при легочной, краниальной и неопластической патологии (таблица 1-15). Опухоли продуцируют вазопрессин или пептид, обладающий подобной биологической активностью. У собак и кошек СНСАВП встречается редко. Он был описан у одной собаки с гельминтозом сердца, у одной с недифференцированной карциномой и у одной с опухолью в области гипоталамуса; у двух собак был идиопатический СНСАВП (Rijnberk et al, 1988; Houston et al, 1989).
Постоянная секреция АВП или подобных ему соединений способствует задержке воды и развитию гипонатриемии, умеренному увеличению объема жидкости в организме и повышению веса тела (Reeves et al, 1998). Увеличение объема жидкости сопровождается снижением скорости всасывания натрия в проксимальных канальцах, что приводит к натриурезу, который еще более усиливается вследствие повышения секреции натриуретического пептида предсердия. Таким образом, диагностические признаки СНСАВП включают гипонатриемию, увеличение объема жидкости в отсутствие отека, снижение осмоляльности плазмы крови, повышение осмоляльности мочи, непропорциональное снижению осмотической концентрации плазмы, и непрерывную экскрецию натрия с мочой на фоне гипонатриемии. Аналогичную клиническую картину можно получить экспериментально, вводя здоровым животным большие дозы АВП в условиях нормального или повышенного потребления жидкости. Ограничение потребления воды приводит к нормализации осмоляльности плазмы и концентрации натрия в сыворотке крови(Агоп et al, 2001).
У людей с СНСАВП описаны четыре типа секреции АВП, что предполагает четыре разных дефекта осморегуляции при этом синдроме. Чаще всего (в
ТАБЛИЦА 1-15. ЗАБОЛЕВАНИЯ, АССОЦИИРУЮЩИЕСЯ С СНСАВП У ЧЕЛОВЕКА*
Злокачественная неоплазия
Карцинома: бронхогенная, поджелудочной железы, простаты, мочевого пузыря
Лимфома и лейкемия
Тимома и мезотелиома
Заболевания центральной нервной системы
Травма
Инфекция
Опухоли
Порфирия
Легочные заболевания
Туберкулез
Пневмония
Индуцирующие СНСАВП лекарственные средства
Клофибрат
Хлорпропамид
Тиазиды
Винкристин
Циклофосфамид
Другие
Эндокринные заболевания
Надпочечниковая недоста-
точность
Гипотиреоз
Гипофизарная недостаточ-
ность
* Из: Ramsay DJ: Posterior pituitary gland. In: Greenspan FS. Fosham PH (eds): Basic and Clinical Endocrinology. Los Altos, CA, Lange Medical Publications, 1983, p 120.
40% случаев) имеют место значительные колебания концентрации АВП в плазме крови, которые не зависят от осмотической или неосмотической регуляции (Reeves et al, 1998). Такая неустойчивая и нерегулярная секреция АВП может быть обусловлена как злокачественным, так и доброкачественным заболеванием. Около трети лиц с СНСАВП имеют «перестраиваемый осмостат»; у них аномально низка пороговая чувствительность секреции АВП, однако при достаточно выраженной гипонатриемии эти пациенты продуцируют максимально разбавленную мочу. Примерно у 20% людей с СНСАВП имеет место «утечка АВП», т.е. постоянная продукция АВП при осмоляльности сыворотки ниже 278 мОсм/кг и сохранении нормального ответа АВП на осмотические стимулы. Реже всего встречаются пациенты с СНСАВП без каких-либо нарушений уровня АВП; по неизвестным пока причинам у них не происходит максимального разбавления мочи. Выявить корреляцию между характером нарушений секреции АВП и патогенезом СНСАВП не удается. Чувствительность секреции вазопрессина и ее пороговые значения оценивали посредством инфузии гипертонического солевого раствора двум собакам с идиопатическим СНСАВП (Rijnberk et al, 1988). У одной из них был выявлен перестраиваемый осмостат, у другой - секреция вазопрессина по типу утечки.
Клинические признаки СНСАВП являются следствием водной интоксикации, вызванной гипонатриемией и увеличением объема жидкости; они имеют преимущественно неврологическую природу, так как обусловлены отеком мозга. Тяжесть клинических проявлений определяется степенью и продолжительностью гипонатриемии. У людей они обычно появляются, когда концентрация натрия в
48 • ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
сыворотке крови падает ниже 120 мЭкв/л. Самыми ранними из них являются сонливость, отсутствие аппетита и общая слабость, которая по мере нарастания тяжести гипонатриемии приводит к мышечной фасцикуляции, судорогам и коме.
Диагноз СНСАВП ставят методом исключения других причин гипонатриемии (см. таблицу 8-11). Критериями служат наличие гипонатриемии на фоне гипоосмоляльности плазмы, аномально высокая осмоляльность мочи для данной осмотической концентрации плазмы, нормальная функция почек и надпочечников, наличие натриуреза несмотря на гипонатриемию, отсутствие гиповолемии, асцита или отечности, возможность коррекции гипонатриемии посредством ограничения потребления жидкости (Reeves et al, 1998).
Лечение СНСАВП направлено на уменьшение тяжести гипонатриемии и устранение первичного расстройства. Цель коррекции гипонатриемии состоит в нормализации осмоляльности воды в организме и восстановлении клеточного объема посредством увеличения отношения содержания натрия и воды во внеклеточной среде. Повышение осмоляльности внеклеточной жидкости приводит к выходу воды из клеток и, таким образом, уменьшает их объем. Выбор терапии зависит от тяжести гипонатриемии и наличия или отсутствия клинических проявлений расстройства. Для лечения острой, тяжелой гипонатриемии (при концентрации натрия в сыворотке менее 120 мЭкв/л) с неврологической симптоматикой используют инфузию нормального (0,9%) или гипертонического (3-5%) солевого раствора и фуросемид в дозах, обеспечивающих постепенное повышение концентрации натрия в сыворотке крови до 125 мЭкв/л или выше в течение 6-8 часов (Reeves et al, 1998). Диуретик вызывает выведение солей с мочой и уменьшает риск увеличения объема внеклеточной жидкости. Сочетание внутривенной инфузии нормального или гипертонического раствора и индуцируемого фуросемидом выделения мочи, разбавленной по сравнению с плазмой, является эффективным методом повышения концентрации натрия в сыворотке крови у лиц с увеличенным объемом жидкости при СНСАВП.
Быстрое повышение концентрации натрия в сыворотке до уровня выше 125 мЭкв/л потенциально опасно, поэтому его следует избегать. Выведение растворенных веществ из мозга служит одним из компенсаторных механизмов, направленных на сохранение объема мозговых клеток при гипонатриемии. Поэтому увеличение концентрации натрия в сыворотке крови до нормальной величины (выше 140 мЭкв/л) относительно гипертонично для клеток мозга, концентрация растворенных веществ в которых понижена в результате гипонатриемии (Stems et al, 1989; Stems et al, 1993). Следовательно, быстрое увеличение концентрации натрия выше 125 мЭкв/л может вызвать поражение ЦНС (Ayus et al, 1987; Stems et al, 1994). В настоящее время для коррекции тяжелой гипонатриемии у человека ре
комендуется медленно наращивать концентрацию натрия, со скоростью примерно 0,5 мЭкв/л в час, пока она не достигнет 125 мЭкв/л. После того как концентрация натрия превысит этот уровень, дальнейшая коррекция гипонатриемии осуществляется посредством ограничения потребления воды. Его снижение до уровня, при котором потери жидкости с мочой и менее явными путями приводят к отрицательному водному балансу, способствует нормализации объема жидкости в организме, уменьшению экскреции натрия с мочой и увеличению его концентрации в сыворотке.
Альтернативным способом терапии у людей является назначение демеклоциклина и нонапептид-ного антагониста АВП ОРС-31260. Демеклоцик-лин (декломицин; Ledeerle Pharmaceutical, США) является антибиотиком группы тетрациклинов. Он ингибирует действие АВП на почечные канальцы и угнетает способность концентрировать мочу у лиц с СНСАВП (Reeves et al, 1988). Сообщений о применении демеклоциклина при СНСАВП у собак и кошек нет. ОРС-31260 (Otsuka Pharmaceutical Со., Япония) - это избирательный нонапептидный антагонист V2 рецепторов АВП, усиливающий экскрецию свободной воды у крыс и людей при СНСАВП (Fujisawa et al, 1993; Ohnishi et al, 1993). Пероральное введение ОРС-31260 в дозе 3 мг/кг собакам через каждые 12 часов для лечения СНСАВП приводило к значительному увеличению экскреции свободной воды и заметному ослаблению клинических симптомов в отсутствие видимых побочных эффектов на протяжении более чем трехлетнего периода терапии (Fleeman et al, 2000).
ГИПОДИПСИЧЕСКАЯ ГИПЕРНАТРИЕМИЯ (ЭССЕНЦИАЛЬНАЯ ГИПЕРНАТРИЕМИЯ)
Гиподипсическая или эссенциальная гипернатриемия характеризуется хронической гипернатриемией на фоне эуволемии, нормальной функции почек, пониженного чувства жажды и нормальной реакции почек на экзогенный АВП (Reeves et al, 1998). Несмотря на повышение концентрации натрия в сыворотке крови и осмоляльности ВКЖ, имеют место гиподипсия и непропорциональное для данной осмоляльности плазмы разбавление мочи. Первичным расстройством у людей с эссенциальной гипернатриемией, по-видимому, является нечувствительность питьевого центра и осморецепторов к осмотическим стимулам. При этом сохраняется нормальный ответ АВП (оцениваемый либо по осмоляльности мочи, либо по увеличению концентрации АВП в плазме крови) на стимуляцию барорецепторов после уменьшения объема жидкости.
Поскольку имеется связь между пониженной чувствительностью к жажде и уменьшением ответа АВП на осмотическую стимуляцию, вполне вероятно, что эссенциальная гипернатриемия отражает более или мене специфическое угнетение функции гипоталамических осморецепторов. У детей эссен
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
49
циальная гипернатриемия считается врожденным заболеванием, а у взрослых она встречается в связи с гистоцитозом ЦНС, опухолью пинеальной железы, сосудистыми расстройствами, такими как ишемия и геморрагия, а также после травмы головы или хирургического удаления краниофарингиомы. Посмертное вскрытие пяти собак с эссенциальной гипернатриемией выявило дисплазию гипоталамуса у 4,5-месячного далматина (Bagley et al, 1993), гидроцефалию у взрослой беспородной собаки (DiBartola et al, 1994), астроглиоз и дегенерацию нейронов в области гипоталамуса и таламуса у 7-месячного цвергшнауцера (Crawford et al, 1984), тяжелый очаговый менингоэнцефалит гипоталамуса у 7-летнего доберман-пинчера (Mackay, Curtis, 1999) и отсутствие видимых изменений в переднем мозге, третьем желудочке, гипоталамусе и гипофизе у 5-месячного дога (Hawks et al, 1991). Эссенциальная гипернатриемия описана также у 14-месячного цвергшнауцера (Hoskins, Rothschmitt, 1984), причем собака была жива на момент публикации. Известен также случай эссенциальной гипернатриемии у 7-месячной беспородной короткошерстной кошки с гидроцефалией, выявленной с помощью компьютерной томографии (Dow et al, 1987).
Все шесть собак и кошка поступили в ветеринарные учреждения с клинически выраженными признаками гипернатриемии, включая сонливость, отсутствие аппетита, слабость и неврологические расстройства. Во всех случаях физикальное исследование и первичные лабораторные анализы выявляли обезвоживание, гипернатриемию, гиперхлоремию и преренальную азотемию при удельном весе мочи более 1,030. Концентрация натрия в сыворотке крови колебалась от 168 до 215 мЭкв/л, что обусловливало значительное увеличение осмоляльности плазмы. Собаки и кошка оставались в сознании на фоне адипсии или гиподипсии несмотря на тяжелую гипернатриемию и гиперосмоляльность. Это свидетельствовало о правильности диагноза гиподипсической или эссенциальной гипернатриемии. Диагноз у одной из собак подтверждался также отсутствием секреции эндогенного АВП в сочетании с усиливающейся гиперосмоляльностью, индуцированной инфузией гипертонического раствора, и значительным повышением секреции АВП при введении апоморфина в конъюнктивальный мешок (DiBartola et al, 1944).
Лечение направлено на снижение уровня гипернатриемии и, если возможно, устранение основного заболевания. Слишком быстрая коррекция концентрации натрия в крови посредством внутривенной инфузии гипотонической жидкости не рекомендуется, поскольку гипернатриемия обычно развивается на протяжении недели или более, а в нейронах в ответ на повышение осмотической концентрации внеклеточной жидкости продуцируются внутриклеточные осмотически активные соединения. Резкое снижение осмоляльности плазмы может вызвать быстрое поступление воды в нейроны
и, таким образом, привести к обострению неврологических симптомов (см. раздел «Гипертоническая дегидратация»). Людям в таких случаях рекомендуется много пить, однако это не всегда помогает снизить концентрацию натрия в крови. Добавление воды в корм в количествах, превышающих нормальную потребность, и/или ее принудительное пероральное введение дает хорошие результаты у большинства (хотя и не у всех) собак и кошек с эссенциальной гипернатриемией. Терапия хлорпропамидом - сульфонилмочевинным препаратом, усиливающим антидиуретический эффект низких концентраций АВП в крови (см. стр. 33), оказалась эффективным способом нормализации осмотического гомеостаза у людей с эссенциальной гипернатриемией (Reeves et al, 1998). Описана безуспешная попытка устранить гипернатриемию у собаки ежедневным введением хлорпропамида в дозе 33 мг/кг на протяжении 2 недель (Crawford et al., 1984). При наличии неврологических расстройств, вызванных тяжелой гипернатриемией, для ее коррекции может потребоваться интенсивная инфузионная терапия.
ЛИТЕРАТУРА
Aron DC, et al: Hypothalamus and pituitary. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology. New York, McGraw Hill Co, 2001, p 100.
Authement JM, et al: Transient, traumatically induced, central diabetes insipidus in a dog. JAVMA 194:683, 1989.
Ayus JC, et al: Treatment of symptomatic hyponatremia and its relation to brain damage: A prospective study. N Engl J Med 317:1190, 1987.
Bagley RS, et al: Hypernatremia, adipsia, and diabetes insipidus in a dog with hypothalamic dysplasia. JAAHA 29:267, 1993.
Barsanti JA, et al: Diagnostic approach to polyuria and polydipsia. In Bona-gura JD (ed): Current Veterinary Therapy XIII. Philadelphia, WB Saunders Co, 2000, p 831.
Baylis PH, Robertson GL: Vasopressin function in familial cranial diabetes insipidus. Postgrad Med J 57:36, 1981.
Bhan GL, O’Brien TD: Autoimmune endocrinopathy associated with diabetes insipidus. Postgrad Med J 58:165, 1982.
Biewenga WJ, et al: Vasopressin in polyuric syndromes in the dog. Front Horm Res 17:139, 1987.
Biewenga WJ, et al: Osmoregulation of systemic vasopressin release during long-term glucocorticoid excess: A study in dogs with hyperadrenocorti-cism. Acta Endocrinol 124:583, 1991.
Block LH, et al: Changes in tissue sensitivity to vasopressin in hereditary hypothalamic diabetes insipidus. Klin Wochenschr 59:831, 1981.
Breitschwerdt EB: Clinical abnormalities of urine concentration and dilution. Compend Cont Ed 3:413, 1981.
Breitschwerdt EB, et al: Nephrogenic diabetes insipidus in three dogs. JAVMA 179:235, 1981.
Brown BA, et al: Evaluation of the plasma vasopressin, plasma sodium, and urine osmolality response to water restriction in normal cats and a cat with diabetes insipidus [abstract]. J Vet Intern Med 7:113, 1993.
Burnie AG, Dunn JK: A case of central diabetes insipidus in the cat: Diagnosis and treatment. J Small Anim Pract 23:237, 1982.
Capen CC, Martin SL: Diseases of the pituitary gland. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1983, p 1523.
Crawford MA, et al: Hypernatremia and adipsia in a dog. JAVMA 184:818, 1984.
Cronin RE: Psychogenic polydipsia with hyponatremia: Report of eleven cases. Am J Kidney Dis 4:410, 1987.
Davenport DJ, et al: Diabetes insipidus associated with metastatic pancreatic carcinoma in a dog. JAVMA 189:204, 1986.
Deen PMT, et al: Requirement of human renal water channel aquaporin-2 for vasopressin-dependent concentration of urine. Science 264:92, 1994.
Deppe TA, et al: Glomerular filtration rate and renal volume in dogs with congenital portosystemic vascular anomalies before and after surgical ligation. J Vet Int Med 13:465, 1999.
DiBartola SP, et al: Hypodipsic hypernatremia in a dog with defective osmoregulation of antidiuretic hormone. JAVMA 204:922, 1994.
Dillingham MA, Anderson RJ: Inhibition of vasopressin action by atrial natriuretic factor. Science 231:1572, 1986.
50
ВОДНЫЙ ОБМЕН И НЕСАХАРНЫЙ ДИАБЕТ
Dow SW, et al: Hypodipsic hypernatremia and associated myopathy in a hydrocephalic cat with transient hypopituitarism. JAVMA 191:217, 1987.
Edwards DF, et al: Hypernatremic, hypertonic dehydration in the dog with diabetes insipidus and gastric dilatation volvulus. JAVMA 182:973, 1983.
Ferring AB: Product Information, DDAVP, Malmo, Sweden, 1985.
Fleeman LM, et al: Effects of an oral vasopressin receptor antagonist (OPC-31260) in a dog with syndrome of inappropriate secretion of antidiuretic hormone. Aust Vet J 78:825, 2000.
Fujisawa G, et al: Therapeutic efficacy of non-peptide ADH antagonist OPC-31260 in SIADH rats. Kidney Int 46:237, 1993.
Fujiwara TM, et al: Molecular biology of diabetes insipidus. Annu Rev Med 46:331, 1995.
Gold PW, et al: Carbamazepine diminishes the sensitivity of the plasma arginine vasopressin response to osmotic stimulation. J Clin Endocrinol Metab 57:952, 1983.
Goldman MB, et al: Mechanisms of altered water metabolism in psychotic patients with polydipsia and hyponatremia. N Engl J Med 318:397, 1988.
Goossens MMC, et al: Central diabetes insipidus in a dog with a pro-opiomela-nocortin-producing pituitary tumor not causing hyperadreno-corticism. J Vet Int Med 9:361, 1995.
Grunbaum EG, Moritz A: Zur diagnostik des diabetes insipidus renalis beim hund. Tierarztliche Praxis 19:539, 1991.
Grunbaum EG, et al: Genetisch bedingter diabetes insipidus renalis beim hund. 35th Annual Meeting, Deutsche Veterinarmedizinische Gesellschaft DVG, Fachgeruppe Kleintierkrankheiten (ed. DVG), DVG, GieBen FRG, 1990, p 126.
Hammer M, et al: Relationship between plasma osmolality and plasma vasopressin in human subjects. Am J Physiol 238:E313, 1980.
Harb M, et al: Central diabetes insipidus: 20 dogs (1986-1995). J Am Vet Med Assoc 209:1884, 1996.
Hardy RM: Disorders of water metabolism. Vet Clin North Am [Small Anim Pract] 12:353, 1982.
Hawks D, et al: Essential hypernatremia in a young dog. J Small Anim Pract 32:420, 1991.
Hoskins JD, Rothschmitt J: Hypernatremic thirst deficiency in a dog. Vet Med 79:489, 1984.
Houston DM, et al: Syndrome of inappropriate antidiuretic hormone secretion in a dog. Can Vet J 30:423, 1989.
Kanno K, et al: Urinary excretion of aquaporin-2 in patients with diabetes insipidus. N Engl J Med 332:1575, 1995.
Kaplowitz PB, et al: Radioimmunoassay of vasopressin in familial central diabetes insipidus. J Pediatr 100:76, 1982.
Kraus KH: The use of desmopressin in diagnosis and treatment of diabetes insipidus in cats. Compend Cont Educ Small Anim Pract 9:752, 1987.
Kusano E, et al: Chlorpropamide action on renal concentrating mechanism in rats with hypothalamic diabetes insipidus. J Clin Invest 72:1298, 1983.
Lantz GC, et al: Transsphenoidal hypophysectomy in the clinically normal dog. Am J Vet Res 49:1134, 1988.
Lee J, et al: Atrial natriuretic factor inhibits vasopressin secretion in conscious sheep. Proc Soc Exp Biol Med 185:272, 1987.
Lee MD, et al: The aquaporin family of water channel proteins in clinical medicine. Medicine 76:141, 1997.
Luzius H, et al: A low affinity vasopressin V2 receptor in inherited nephrogenic diabetes insipidus. J Receptor Res 12:351, 1992.
Mackay BM, Curtis N: Adipsia and hypernatremia in a dog with focal hypothalamic granulomatous meningoencephalitis. Aust Vet J 77:14, 1999.
Moses AM, Clayton B: Impairment of osmotically stimulated AVP release in patients with primary polydipsia. Am J Physiol 265: R1247, 1993.
Neer TM, Reavis DU: Craniopharyngioma and associated central diabetes insipidus and hypothyroidism in л dog. JAVMA 182:519, 1983.
Nichols R: Clinical use of the vasopressin analogue DDAVP for the diagnosis and treatment of diabetes insipidus. In Bonagura JD (ed): Current Veterinary Therapy XIII. Philadelphia, WB Saunders Co, 2000, p 325.
Ohnishi A, et al: Potent aquaretic agent: A novel nonpeptide selective vasopressin 2 antagonist (OPC-31260) in men. J Clin Invest 92:2653, 1993.
Papanek PE and Raff H: Chronic physiological increases in Cortisol inhibit the vasopressin response to hypertonicity in conscious dogs. Am J Physiol 267: R1342, 1994.
Papanek PE, et al: Corticosterone inhibition of osmotically stimulated vasopressin from hypothalamic-neurohypophysial explants. Am J Physiol 272: R158, 1997.
Peterson ME, et al: Acromegaly in 14 cats. J Vet Intern Med 4:192, 1990.
Pittari JM: Central diabetes insipidus in a cat. Feline Pract 24:18, 1996.
Pliska V: Pharmacology of deamino-d-arginine vasopressin. In Czenichow P, Robinson AG (eds): Frontiers of Hormone Research. Vol 13. Diabetes Insipidus in Man. Basel, Switzerland, S. Karger, 1985, p 278.
Pollock AS, Arieff Al: Abnormalities of cell volume and their functional consequence. Am J Physiol 239:F195, 1980.
Post K, et al: Congenital central diabetes insipidus in two sibling Afghan Hound pups. JAVMA 194:1086, 1989.
Ramsay DJ: Posterior pituitary gland. In Greenspan FS, Forsham PH (eds): Basic and Clinical Endocrinology. Los Altos, CA, Lange Medical Publications, 1983, p 120.
Reeves WB, et al: The posterior pituitary and water metabolism. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 341.
Reidarson TH, et al: Extreme hypernatremia in a dog with central diabetes insipidus: A case report. JAAHA 26:89, 1990.
Richardson DW, Robinson AG: Desmopressin. Ann Intern Med 103:228, 1985.
Rijnberk A, et al: Inappropriate vasopressin secretion in two dogs. Acta Endocrinol 117;59, 1988.
Rijnberk A, et al: Aldosteronoma in a dog with polyuria as the leading symptom. Domest Anim Endocrinol 20:227, 2001.
Robertson GL: Diseases of the posterior pituitary. In Felig P, et al (eds): Endocrinology and Metabolism. New York, McGraw Hill Book Co, 1981, p 251. Robertson GL: Differential diagnosis of polyuria. Ann Rev Med 39:425, 1988.
Robertson GL, Scheidler JA: A newly recognized variant of familial nephrogenic diabetes insipidus distinguished by partial resistance to vasopressin (type 2) [abstract]. Clin Res 29:555A, 1981.
Salvi M, et al: Role of autoantibodies in the pathogenesis and association of endocrine autoimmune disorders. Endocr Rev 9:450, 1988.
Scherbaum WA: Role of autoimmunity in hypothalamic disorders. Bailliere’s Clin Immunol 1:237, 1987.
Scherbaum WA, et al: Autoimmune cranial diabetes insipidus: Its association with other endocrine diseases and with histiocytosis X. Clin Endocrinol 25:411, 1986.
Schwartz J, et al: Hemodynamic effects of neurohypophyseal peptides with antidiuretic activity in dogs. Am J Physiol 249:H1001, 1985.
Schwartz Porsche D: Diabetes insipidus. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders Co, 1980, p 1005.
Sterns RH, et al: Brain dehydration and neurologic deterioration after rapid correction of hyponatremia. Kidney Int 35:69, 1989.
Sterns RH, et al: Organic osmolytes in acute hyponatremia. Am J Physiol 264: F833, 1993.
Sterns RH, et al: Neurologic sequelae after treatment of severe hyponatremia: a multicenter perspective. J Am Soc Nephrol 4:1522, 1994.
van Lieburg AF, et al: Patients with autosomal nephrogenic diabetes insipidus homozygous for mutations in the aquaporin 2 water-channel gene. Am J Hum Genet 55:648, 1994.
van Lieburg AF, et al: Clinical phenotype of nephrogenic diabetes insipidus in females heterozygous for a vasopressin type 2 receptor mutation. Hum Genet 96:70, 1995.
Van Vonderen IK, et al: Polyuria and polydipsia and disturbed vasopressin release in two dogs with secondary polycythemia. J Vet Int Med 11: 300, 1997a.
van Vonderen IK, et al: Intra- and interindividual variation in urine osmolality and urine specific gravity in healthy pet dogs of various ages. J Vet Int Med 11: 30, 1997b.
van Vonderen IK, et al: Disturbed vasopressin release in four dogs with so-called primary polydipsia. J Vet Int Med 13: 419, 1999.
Victor W, et al: Failure of antipsychotic drug dose to explain abnormal diurnal weight gain among 129 chronically psychotic inpatients. Prog Neuropsy-chopharmacol Biol Psychiatry 13:709, 1989.
Williams TDM, et al: Hormonal and cardiovascular responses to DDAVP in man. Clin Endocrinol (Oxf) 24:89, 1986.
Winterbotham J, Mason KV: Congenital diabetes insipidus in a kitten. J Small Anim Pract 24:569, 1983.
Zerbe RL, Robertson GL: A comparison of plasma vasopressin measurements with a standard indirect test in the differential diagnosis of polyuria. N Engl J Med 305:1539, 1981.
БИОСИНТЕЗ ГОРМОНА РОСТА
И ИФР-1 .....................51
ВЛИЯНИЕ ГОРМОНА РОСТА НА ОБМЕН.. 52
РЕГУЛЯЦИЯ СЕКРЕЦИИ ГОРМОНА РОСТА..................53
Глава 2
НАРУШЕНИЯ ПРОДУКЦИИ
ГОРМОНА РОСТА
ВРОЖДЕННАЯ НЕДОСТАТОЧНОСТЬ ГОРМОНА РОСТА: ГИПОФИЗАРНАЯ КАРЛИКОВОСТЬ.................55
ПРИОБРЕТЕННАЯ НЕДОСТАТОЧНОСТЬ ГОРМОНА РОСТА................67
ЧУВСТВИТЕЛЬНЫЙ К ГОРМОНУ РОСТА
ДЕРМАТОЗ ВЗРОСЛЫХ ЖИВОТНЫХ ... 68
АКРОМЕГАЛИЯ У КОШЕК...........78
АКРОМЕГАЛИЯ У СОБАК...........89
Список сокращений
АКТГ - адренокортикотропный гормон ГнРГ - гонадотропин рилизинг-гормон ГР - гормон роста
ГРРГ - гормон роста рилизинг-гормон ГРСБ - гормон роста-связывающий белок ИФР - инсулиноподобиый фактор роста
ИФРСБ - инсулиноподобный фактор роста-связывающий белок
КРГ - кортикотропин рилизинг-гормон
КТ - компьютерная томография
ЛГ - лютеинизирующий гормон
МПА - медроксипрогестерон ацетат
МРТ - магнитно-резонансная томография
ОАК - общий клинический анализ крови ТРГ - тиреотропин рилизинг-гормон ТТГ - тиреотропный гормон, тиреотропин ФСГ - фолликулостимулирующий гормон ЩФ - щелочная фосфатаза
БИОСИНТЕЗ ГОРМОНА РОСТА И ИФР-1
Гормон роста (ГР, соматотропин) представляет собой одноцепочечный полипептид с молекулярной массой около 22000 дальтон (Thomer et al, 1998). Установлена аминокислотная последовательность ГР собак, которая оказалась идентичной последовательности свиного ГР (Mol, Rijnberk, 1997; Secchi et al, 2001). Аминокислотная последовательность ГР гомологична последовательностям пролактина и плацентарного лактогена, что предполагает эволюцию этих гормонов из общего гена-предшественника. ГР синтезируется и секретируется соматотро-фами, локализованными в передней доле гипофиза. ГР образуется путем процессинга более крупного полипептида-предшественника (преГР), который также секретируется гипофизом, но его физиологическое значение неизвестно (Aron et al, 2001). Пульсирующая секреция ГР характеризуется выраженным суточным ритмом с интервалами в 4-6 часов между последовательными выбросами (French et al, 1987; Conzemius et al, 1998). У человека концентрация ГР в плазме крови начинает увеличиваться вскоре после рождения, достигает максимальной величины на исходе подросткового возраста и постепенно снижается у взрослых людей. В отличие от этого, как показано Nap и соавторами (1993), средняя концентрация ГР у щенков датского дога снижается с 13,7±2,2 до 0,7±0,4 мкг/л между 7 и 12 неделями жизни. Характер пульсирующей секреции ГР у здоровых взрослых сук изменяется в зависимости от фазы эстрального цикла. На стадиях с высокой концентрацией прогестерона в крови
базальная секреция ГР повышается, а амплитуда пульсов снижается (Kooistra et al, 2000а). Высота пиков секреции ГР у людей, крупного рогатого скота и домашней птицы уменьшается с возрастом; предполагается, что такое же снижение имеет место и у других животных, в том числе у собак и кошек (Mol, Rijnberk, 1997). В плазме крови человека присутствуют белки, с высоким сродством связывающие ГР (ГРСБ); сообщалось о наличии ГРСБ и у собак (Maxwell et al, 2000). Показано, что ГРСБ играют важную роль в модуляции активности гормона роста (Styne, 2000). Аминокислотная последовательность высокоаффинного ГРСБ идентична последовательности внеклеточного домена рецептора ГР (Thomer et al, 1998). Обмен ГР, связанного с белком, происходит иначе, чем обмен свободного гормона; связанный ГР дольше сохраняется в плазме крови и имеет меньший объем распределения по сравнению с мономерным ГР. Связывание с белком повышает биологическую активность ГР.
В конце 1950-ых годов исследователи обнаружили «фактор сульфирования», который усиливал рост и контролировался ГР, и фракцию сыворотки, обладавшую инсулиноподобной активностью, которая не устранялась антителами к инсулину. В 1970-ых годах эти факторы получили название соответственно соматомединов (поскольку они опосредуют действие соматотропина) и инсулиноподобных факторов роста (ИФР). В последующем было показано, что соматомедин С и инсулиноподобный фактор роста-1 (ИФР-1) представляют собой одну и ту же молекулу. Рост-стимулирующее действие ГР опосредуется, в основном, через ИФР-1, структура
52 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
которого примерно на 50% гомологична структуре проинсулина и инсулина. Рецептор ИФР-I, локализованный на клеточных мембранах, сходен по структуре с рецептором инсулина. Связываясь с рецепторами инсулина, ИФР-I способствует утилизации глюкозы, повышает чувствительность ткани к инсулину и снижает концентрацию глюкозы в крови. ИФР-I синтезируется во многих тканях и, по-видимому, экспортируется в соседние клетки, оказывая на них паракринное действие (Yakar et al, 1999; Styne, 2001). Поэтому концентрация ИФР-I в сыворотке крови сама по себе может не отражать его биологическую активность. Основным местом биосинтеза ИФР-I является печень, из которой в кровь поступает наибольшая часть этого фактора. У человека его концентрация в крови изменяется при поражении печени.
Секреция ИФР-I находится под прямым контролем ГР. Его концентрация в сыворотке незначительна при недостаточности ГР и возрастает при акромегалии. Биологическое действие циркулирующего ИФР-I модулируется несколькими различными связывающими белками (ИФРСБ), из которых ИФРСБ-3 присутствует у собак и кошек в наибольшем количестве (Maxwell et al, 1998; Lewitt et al, 2000). У собак ИФР-I связывается главным образом с ИФРСБ-3 и с лабильной в кислой среде субъединицей (КЛС), образуя трехкомпонентный комплекс, который не проникает через сосудистый эндотелий, увеличивает продолжительность полужизни ИФР-1 в плазме крови и служит хранилищем резервного ИФР-I (Maxwell et al, 2000). В одном из исследований было установлено, что у кошек концентрация КЛС в крови ниже, чем у других животных и соответственно ограничено образование трехкомпонентного комплекса ИФРСБ-3 (Lewitt et al, 2000). Интересно, что при диабете концентрация КЛС у кошек повышается, что может способствовать формированию трехкомпонентных комплексов и увеличению концентрации ИФР-I в сыворотке по сравнению с таковой у здоровых животных. Эти данные свидетельствуют о возможности использования определения концентрации ИФР-I для диагностики акромегалии у кошек.
ИФРСБ-1 является единственным быстрым регулятором биологической доступности ИФР-1 (Lee et al, 1997). Основная функция ИФРСБ-1 состоит в быстром связывании поступающего в кровь ИФР-1. Чем выше концентрация ИФРСБ-1, тем ниже концентрация свободного ИФР-I и наоборот. ГР понижает концентрацию ИФРСБ-1 в плазме крови. Исследования in vitro и in vivo показали, что ИФРСБ-1 ингибирует рост и дифференцировку под воздействием ИФР-I, а также противодействует инсулиноподобной гипогликемической активности ИФР-1 (Ferry et al, 1999). Присутствующий в крови ИФР-1 и его взаимодействие с ИФРСБ-1 являются, по-ви-димому, важными детерминантами гомеостаза глюкозы, обеспечивающими связь между питанием и ростом (Sandhu et al, 2002). Например, прием пищи
стимулирует секрецию грелина, который усиливает высвобождение ГР, а последний снижает уровень ИФРСБ-1 и повышает количество свободного ИФР-I, доступного для связывания с рецепторами инсулина и стимуляции утилизации глюкозы. Инсулин подавляет активность ИФРСБ-1. Показано, что у людей с ожирением и сахарным диабетом 2 типа концентрация ИФРСБ-1 в крови снижена, что предполагает целесообразность определения ИФРСБ-1 в качестве маркера резистентности к инсулину. Наконец, концентрация ИФРСБ-1 повышается при некоторых заболеваниях, что может снижать диагностическую ценность определения концентрации ИРФ-1 в сыворотке крови в качестве показателя избыточной секреции ГР. У человека почечная недостаточность и некоторые солидные опухоли сопровождаются увеличением концентрации ИФРСБ-1 в крови, что приводит к повышению концентрации общего ИФР-I на 30-50%.
ВЛИЯНИЕ ГОРМОНА РОСТА НА ОБМЕН
По данным исследований in vitro на изолированных тканях и in vivo с введением фармакологических доз ГР, гормон обладает анаболическим, липолитическим и диабетогенным действием. Главная функция ГР состоит в стимуляции линейного роста (Conzemius et al, 1998). Рост-стимулирующая активность ГР в основном опосредуется через ИФР-1 (рис. 2-1). Предложена двойная эффекторная модель действия ГР, в соответствии с которой он сначала стимулирует дифференцировку прехондроцитов в ростовой пластинке эпифиза и экспрессию ИФР-1 в гепатоцитах и хондроцитах, а затем ИФР-I действует в качестве митогена, стимулируя клональный рост дифференцированных клеток (Isaksson et al, 1987; Scheven, Hamilton, 1991). Таким путем ИФР-I, локально синтезированный под контролем ГР, способствует проявлению стимулирующего действия гормона, в первую очередь усилению линейного роста.
Различия размеров тела у отдельных пород собак обусловлены разным характером секреции ГР в молодом возрасте, а не различиями концентрации ИФР-I в крови. В одном из исследований показано, что у молодых датских догов период повышенной секреции ГР был гораздо более продолжительным, чем у молодых коротконогих гончих (биглей) (Favier et al, 2001). При этом концентрация ИФР-I в крови собак обеих групп была одинаковой. По мнению авторов, более длительный период секреции ГР у датских догов обусловлен задержкой формирования механизмов ингибирующего действия соматостатина на высвобождение ГР. В отличие от этого, у взрослых собак разных пород концентрация ГР в крови существенно не различалась, несмотря на их разные размеры, тогда как концентрация ИФР-I отличалась весьма значительно и положительно коррелировала с размером тела (Eigenmann, 1987). В целом, у маленьких собак концентрация ИФР-1
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 53
Усиление хондрогенеза и роста скелета
Усиление биосинтеза белков и клеточной
Усиление Гипергликемия, липолиза антиинсулиновое
действие
пролиферации
Рис. 2-1. Анаболическое и катаболическое действие гормона роста. По: Underwood LE, Van Wyk JJ. In: Wilson J, Foster D (eds): Williams Textobook of Endocrinology, 7th ed. Philadelphia, WB Saunders, 1985, p 155.
ниже, чем у собак крупных пород. Так, было показано, что средняя концентрация ИФР-1 у кокер-спаниелей составляет 36±27 нг/мл, у коротконогих гончих 87±33 нг/мл, у кеесхондов 117±34 нг/мл, а у немецких овчарок 280±23 нг/мл (Eigenmann et al, 1984b). При сравнении концентрации ИФР-1 у собак разного размера, относящихся к одной породе (обыкновенный, карликовый или той-пудель) была установлена линейная корреляция между размерами тела и концентрацией ИФР-1 в крови (Eigenmann et al, 1984а). В условиях провокационной пробы все обследованные животные секретировали нормальные количества ГР.
Другим важным анаболическим действием ГР является стимуляция белкового синтеза, которая также опосредуется через ИФР-1 (рис. 2-1). ГР усиливает включение аминокислот в клетки, ускоряет транскрипцию и трансляцию мРНК и активирует ферментативные реакции, необходимые для биосинтеза белка (Daughaday, 1985). Синтез ДНК усиливается в различных типах клеток, включая фибробласты, хондроциты, мышечные, печеночные и кроветворные клетки (Van Wyk et al, 1981). Указанные эффекты ГР приводят к усилению клеточной пролиферации или к дифференцировке клеток в отсутствие сопутствующей пролиферации. Во всех чувствительных к ГР тканях усиливается образование клеточных продуктов, специфичных для данной ткани-мишени.
ГР снижает интенсивность катаболизма белков путем прямой стимуляции липолиза и превращения жирных кислот в ацетил-коэнзим А (ацетил-СоА), который служит источником энергии (см. рис. 2-1; Aron et al, 2001). Кроме того, ГР непосредственно влияет на углеводный обмен. При избытке ГР уменьшается утилизация углеводов и включение глюкозы в клетки. Индуцируемая ГР инсулинорезистентно сть, по-видимому, обусловлена нарушением действия инсулина на пострецепторном уровне (Bratusch-Marrain et al, 1982; Rosenfeld et al, 1982). В результате усиливается
гипергликемия и нарушается толерантность к углеводам. При устойчиво повышенной концентрации ГР в крови развивается сахарный диабет, и животные быстро приобретают резистентность к действию инсулина.
РЕГУЛЯЦИЯ СЕКРЕЦИИ ГОРМОНА РОСТА
У многих домашних животных, ГР высвобождается из гипофиза в пульсирующем режиме вследствие двойной регуляции его секреции, осуществляемой, с одной стороны, гипоталамическим ГР рилизинг-гормоном (ГРРГ; соматокринином), а с другой стороны, соматостатином, ингибирующим высвобождение ГР (рис. 2-2). Согласованное действие обоих факторов обеспечивает строгий контроль секреции ГР, необходимый для поддержания гомеостаза в развивающемся организме со времени внутриутробной жизни до достижения половой зрелости. Взаимодействие положительного и отрицательного стимулов сохраняется и у взрослых особей.
Стресс
Ритмы сна
Гормон роста
Печень
Физическая нагрузка
/ р-адренергические (-)
^Нейромедиаторы-а-адренергические (+) хдофаминэргические (+)
Гипоталамус
ГРРГ | I Соматостатин
(+) || Н (
Гипофизарные соматотрофы
Грелин (+)
Инсулиноподобный фактор роста I
Рис. 2-2. Предполагаемые стимулирующие и ингибирующие воздействия, участвующие в регуляции секреции гормона роста и инсулиноподобного фактора роста I. По: Reichlin S: In: Wilson J, Foster D (eds): Williams Textobook of Endocrinology, 7th ed. Philadelphia, WB Saunders, 1985, p 155.
54 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
ГР Рилизинг-гормон (ГРРГ). ГРРГ стимулирует как синтез, так и секрецию ГР. Он вызывает требуемое повышение концентрации ГР в крови, которая затем быстро снижается до базального уровня (Thomer et al, 1983). Пульсирующее увеличение концентрации ГР отражает прежде всего прерывистое высвобождение ГРРГ из гипоталамуса (Thomer et al, 1998). Непрерывная, в течение нескольких часов инфузия ГРРГ сначала приводит к повышению концентрации ГР в плазме крови, а затем к ее прогрессивному снижению. Следовательно, физиологическое действие ГРРГ проявляется только в условиях его пульсирующей секреции (Reichlin, 1998). Действие ГРРГ направлено почти исключительно на ГР, хотя иногда он вызывает и минимальное увеличение секреции пролактина.
Соматостатин. Соматостатинами называют семейство пептидов, которое включает соматостатин-14 - циклический пептид, состоящий из 14 аминокислотных остатков, и соматостатин-28, имеющий удлиненную N-концевую последовательность и содержащий 28 аминокислотных остатков. Молекула соматостатина-14 идентична 14 С-концевым аминокислотам соматостатина-28. Соматостатин-14 локализован преимущественно в центральной нервной системе (ЦНС), включая гипоталамус, а соматостатин-28 - главным образом в желудочно-кишечном тракте, в том числе в поджелудочной железе (Reichlin, 1998). В качестве регулятора гипофизарной функции соматостатин служит мощным ингибитором секреции ГР. Его секреция усиливается при повышении концентраций ГР и ИФР-1 в крови. Соматостатин определяет сроки и ампли-
ТАБЛИЦА 2-1. БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ СОМАТОСТАТИНА ВНЕ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Подавление секреции гормонов Подавление функций желудочно-кишечного тракта
Гипофиз Секреция желудочной кис-
ТТГ, ГР лоты
Желудочно-кишечный тракт Опорожнение желудка
Гастрин Секреция панкератического
Секретин бикарбоната
Желудочно-кишечные Секреция панкреатических
полипептиды ферментов
Мотилин Кишечное всасывание
Энтероглюкагон Желудочно-кишечный кро-
ВАПК воток
Поджелудочная железа Транспорт воды, стимулируе-
Инсулин мый АВП
Глюкагон Ток желчи
Соматостатин
Мочеполовой тракт
Ренин
По: Reichlin S: In: Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co., 1998, p 191.
ТТГ - тиреотропин, ГР - гормон роста, АВП - аргинин-ва-зопрессин, ВАПК - вазоактивный пептид кишечника.
ТАБЛИЦА 2-2. ФАКТОРЫ, СТИМУЛИРУЮЩИЕ СЕКРЕЦИЮ ГОРМОНА РОСТА У ПРИМАТОВ
Физиологические Гормоны н нейромедиаторы
Эпизодические, спонтанные Индуцируемая инсулином
Физическая нагрузка (не гипогликемия
относится к собакам) Инфузия аминокислот (у
Стресс собак нерегулярно)
Сон Пептидные гормоны
Постпрандиальные: ГРРГ
Г ипераминоацидемия Вазопрессин
Гипогликемия (относитель- альфа-МСГ
ная) АКТГ
Натощак (гипогликемия) Глюкагон
Патологические Низкие концентрации
Акромегалия ИФР-1
Гипотиреоз (у собак, но не у Моноаминэргическая стиму-
приматов) ляция
Некомпенсированный сахар- Альфа-адренергические
ный диабет агонисты
Хроническая почечная недо- Клонидин, адреналин
статочность Бета-адренергические аго-
Цирроз печени нисты
Голодание, недоедание Пропранолол
Белковый дефицит Агонисты дофамина
Эктопическая продукция L-дофа, бромкриптин
ГРРГ Предшественники серото-
Интерлейкины 1,2,6 нина
При акромегалии Мелатонин
ТРГ Агонисты ацетилхолина
ЛГРГ Непептидные гормоны
Глюкоза Эстрогены
Аргинин Диэтилстильбестрол Прогестерон (у собак, но не у приматов) Инфузия калия
По: Reichlin S. In: Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co., 1998, p 210.
туду выбросов ГР, но не влияет на его биосинтез (Thomer et al, 1998). Кроме того, соматостатин подавляет секрецию тиреотропного гормона (ТТГ), а при определенных условиях - также секрецию пролактина и адренокортикотропного гормона (АКТГ). Вне гипофиза соматостатин функционирует как нейромодулятор в центральной и периферической нервной системе и в качестве регуляторного пептида в кишечнике и поджелудочной железе (табл. 2-1; Reichlin, 1998). Соматостатин блокирует высвобождение гормонов из многих видов эндокринных опухолей, таких как инсулиномы, глюкагономы, опухоли, секретирующие вазоактивный кишечный полипептид (VIPomh), карциноидные опухоли и некоторые гастриномы (см. гл. 14 и 15). Длительно действующие аналоги соматостатина используются в терапевтических целях для коррекции избыточной продукции ГР и при наличии активных нейроэндокринных опухолей у людей (Reichlin, 1998).
Стимулы, влияющие на факторы, регулирующие секрецию ГР. Действие ГРРГ и соматостатина на секрецию ГР строго регулируется интегрированной системой нервных, метаболических и гормональных факторов, в том числе самим
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 55
ТАБЛИЦА 2-3. ФАКТОРЫ, ПОДАВЛЯЮЩИЕ СЕКРЕЦИЮ ГОРМОНА РОСТА У ПРИМАТОВ
Физиологические
Гипергликемия после еды (у приматов, но не у собак)
Повышенная концентрация свободных жирных кислот
Антагонисты серотонина Повышенные концентрации
ГР и ИФР-1 Ципрогептадин Патологические Гипотиреоз (у приматов, но не у собак)
Гипертиреоз
Г иперкортицизм Ожирение При акромегалии
L-ДОФА
Апоморфин
Фентоламин
Бромокриптин
Гормоны и нейромедиаторы
Соматостатин
Глюкокортикоиды
Прогестерон (у приматов, но не у собак)
Повышенная концентрация ИФР-1
Мелатонин
Альфа-адренергические агонисты
Фентоламин
Бета-адренергические антагонисты
Изопротеренол
Антагонисты серотонина
Метизергид
Ципрогептадин
Антагонисты дофамина
Фенотиазины
Антагонисты ацетилхолина
Теофиллин
Морфин
По: Reichlin S. In: Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co., 1998, p 210.
ГР (табл. 2-2 и 2-3) (Buonomo, Baile, 1990). Большинство этих стимулов действует на высвобождение ГР, изменяя секрецию ГРРГ или соматостатина из гипоталамуса. Преобладает стимулирующее действие гипоталамуса на секрецию ГР, поскольку нарушение его связи с гипофизом приводит к блокаде как базального, так и индуцированного высвобождения ГР (Reichlin, 1998). Исключение составляет грелин -недавно открытый гормон, который синтезируется преимущественно в желудке и в меньших количествах в гипоталамусе. Грелин выделяется в ответ на прием пищи, а его первичное действие состоит в подавлении опорожнения желудка и создании чувства насыщения во время еды. Кроме того, грелин стимулирует секрецию ГР, что, в свою очередь, приводит к увеличению концентрации ИФР-I, который, действуя через рецепторы инсулина, усиливает утилизацию глюкозы в тканях. Одновременно ростовой гормон понижает концентрацию ИФРСБ-1 и тем самым повышает содержание свободного ИФР-I. Как указывалось ранее, главная роль ИФРСБ-1 состоит в связывании ИФР-I и уменьшении концентрации свободного ИФР-I в крови.
Создается впечатление, что некоторые стимулы по-разному действуют на секрецию ГР у людей и собак. В частности, умеренная физическая нагрузка усиливает секрецию ГР у человека, но, по-видимому, не влияет на нее у собак. Аргинин является мощным стимулятором секреции ГР у человека, но при введении собакам вызывает неоднозначный ответ. Секреция ГР в ответ на индуцированную инсулином гипогликемию также проявляется не у всех животных: одни авторы сообщают о ее выраженном
усилении, тогда как другие отмечают лишь слабое увеличение. Точно так же гипергликемия, развивающаяся при инфузии глюкозы, сопровождается подавлением секреции ГР у людей, но очень слабо влияет на нее у собак. Ввиду столь выраженных видовых различий приходится признать, что полученные на людях данные о воздействии различных факторов на секрецию ГР нельзя автоматически переносить на собак.
Более подробная информация о метаболических эффектах ГР и факторах, регулирующих его секрецию, содержится в первом издании книги «Эндокринология и репродукция собак и кошек».
ВРОЖДЕННАЯ НЕДОСТАТОЧНОСТЬ ГОРМОНА РОСТА: ГИПОФИЗАРНАЯ КАРЛИКОВОСТЬ
Этиология
Гипофизарная карликовость является следствием врожденной недостаточности ГР. Это расстройство встречается как в форме изолированного дефекта, так и в сочетании с недостаточностью других гормонов передней доли гипофиза, в том числе ТТГ, пролактина, АКТГ, фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ)). У собак и, возможно, у кошек карликовость чаще всего обусловлена атрофией передней доли гипофиза вследствие ее сдавливания кистозным разрастанием остаточного краниофарингеального протока (так называемой щели Ратке) и гипоплазией гипофиза в результате первичного нарушения дифференцировки краниофарингеальной эктодермы кармана Ратке в нормальную переднюю долю.
Гипофизарная киста. Гипофизарная карликовость может быть следствием врожденного кистозного расширения или сохранения «внутрисе-дельной» части краниофарингеального протока (кармана Ратке). Внутриседельный сегмент заключен в турецком седле - области черепа, которая образует «чехол» гипофиза. Передняя доля гипофиза (аденогипофиз) формируется в процессе эмбрионального развития из кармана Ратке, который представляет собой выпячивание задней глоточной стенки. Та часть кармана, которая соприкасается с нейрогипофизом, претерпевает дифференцировку в промежуточную долю (pars intermedia) аденогипофиза, а передняя стенка кармана - в его заднюю часть (pars distalis). Ткани эмбрионального кармана пролиферируют в латеральном направлении вокруг инфундибулярного ствола, образуя ножку гипофиза (pars tuberalis). У собак и кошек задняя и промежуточная доли переднего гипофиза разделены остаточной гипофизарной щелью, которая представляет собой рудиментарную полость кармана Ратке. У эмбриона ножка кармана Ратке редуцируется в краниофарингеальный проток, который в последующем исчезает, хотя у собак обычно сохраняются остатки одного или обоих его концов. Особенно часто рудименты внутриседельных частей
56 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Рис. 2-3. Компьютерная томограмма гипофизарной области овариэктомированной низкорослой двухлетней суки датского дога, полученная при диагностике функции гипофиза. В гипофизарной области видна крупная рентгенопрозрачная киста (показана стрелкой).
протока имеются у собак брахицефалических пород. Характер рудиментов и их проявлений бывает разным. Они могут быть одно- и многокамерными или переходить в кисту, эпителиальная выстилка которой нередко выделяет муцин. Обычно кисты имеют микроскопические размеры и не вызывают клинически значимых последствий, однако иногда их объем превышает объем нормального гипофиза (рис. 2-3). Крупные кисты могут вызвать сдавливание и атрофию гипофизарных клеток.
Гипофизарные кисты довольно часто встречаются у собак, но редко приводят к гипофизарной карликовости. Последняя чаще всего диагностируется у немецких овчарок, причем ассоциируется с кистами очень небольшого размера. Это ставит под сомнение гипотезу о кистозном расширении кра-ниофарингеального протока как первопричине атрофии аденогипофиза. Согласно альтернативному предположению, первичным нарушением является отсутствие дифференцировки клеток аденогипофиза в нормальные секретирующие гормон клетки (Kooistra et al, 2000b).
Гипоплазия гипофиза. Формирование передней доли гипофиза сопровождается экспрессией целого ряда гомеодоменных факторов транскрипции, которые необходимы для нормального развития примордиального гипофиза (Treier et al, 1998; Watkins-Chow, Camper, 1998). В результате пролиферации в строго определенной последовательности образуются клетки разных фенотипов, отличающиеся высоко избирательной функцией и специфическим характером дифференцировки (Simmons et al, 1990; Voss, Rosenfeld, 1992). Первым четко разли
чимым типом клеток, которые дифференцируются из стволовых гипофизарных клеток, являются кортикотрофы, секретирующие АКТГ (Sheng et al, 1997). Окончательно сформировавшаяся передняя доля гипофиза содержит пять разных типов эндокринных клеток, которые легко отличить по гормонам, которые они секретируют. Любое нарушение органогенеза гипофиза может привести к изолированной или сочетанной гипофизарной недостаточности.
Гипофизарная карликовость чаще всего встречается как простое, аутосомно-рецессивное наследственное расстройство у немецких овчарок (Kooistra et al, 2000b). Наследственная гипофизарная карликовость может быть результатом изолированной недостаточности ГР или частью сочетанного синдрома недостаточности гормонов передней доли гипофиза. У немецких овчарок карликовость особенно часто сочетается с недостаточностью ТТГ и пролактина на фоне нормальной секреции АКТГ (рис. 2-4; Hamann et al, 1999; Kooistra et al, 2000b). Kooistra с соавторами (2000b) выдвинули гипотезу, согласно которой карликовость немецких овчарок обусловлена мутацией фактора транскрипции, участвующего в онтогенезе, которая препятствует эффективному развитию стволовых клеток гипофиза после дифференцировки кортикотрофов. Мутации генов, кодирующих фактор транскрипции Pit-1 или его предшественник (Ргор-1), у человека и мышей приводят к сочетанной недостаточности гормонов передней доли гипофиза (Bouiller et al, 1996; Fofanova et al, 1998; Wu et al, 1998). К сожалению, мутации факторов Pit-1 и Prop-1 не идентифицированы при гипофизарной карликовости немецких овчарок; это указывает на поражение иного го-меодоменного гена у этих животных (Lantinga-van Leeuwen et al, 2000a, 2000b). По мнению Kooistra и его сотрудников (2000b), первичным дефектом может быть мутация, которая блокирует нормальное развитие стволовых клеток гипофиза. Поскольку сохраняется нормальная секреция АКТГ, комбинированная недостаточность продукции гормонов аденогипофиза у немецких овчарок-карликов скорее всего вызвана мутацией фактора транскрипции, препятствующей развитию стволовых клеток после дифференцировки кортикотрофов. Такой фактор, очевидно, аналогичен факторам транскрипции Pit-1 и Ргор-1, но должен действовать на более ранней стадии формирования гипофиза (Kooistra et al., 2000b).
Кистозные изменения, затрагивающие гипофиз у собак с врожденной недостаточностью 1 Р, являются скорее следствием первичного нарушения дифференцировки передней доли, а не причиной гормональной недостаточности. Недифференцированные клетки аденогипофиза, по-видимому, секретируют в краниофарингеальный проток осмотически активный белковоподобный материал (Eigenmann, 1983). При анализе кистозной жидкости у крыс был выявлен осмотически активный белковоподобный
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
57
АКТГ (нг/л) ТТГ (мкг/л) ГР (мкг/л)
Время (мин)
Рис. 2-4. Результаты комбинированного тестирования функции передней доли гипофиза (средние величины ± SEM) у восьми немецких овчарок с карликовостью (о) и восьми нормальных взрослых коротконогих гончих (•). Вертикальные линии, показывающие SEM у овчарок-карликов, приведены только в тех случаях, когда выходят за пределы размера кружка. Из: Kooistra HS et al: Dom Аппл Endocr, 19: 177, 2000.
58 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
материал, вызывающий приток воды и приводящий к кистозным изменениям, которые сопоставимы с наблюдаемым со временем увеличением размеров кисты (Benjamin, 1981; Kooistra et al, 1998).
Синдромы нечувствительности к ГР. Гипофизарная карликовость может быть следствием нечувствительности к ГР. Первым примером такой нечувствительности к ГР была карликовость Ларона у человека. У людей с этим синдромом повышена концентрация ГР в крови на фоне недостаточности ИФР-I. Данное состояние вызвано инактивирующей мутацией гена, кодирующего рецептор ГР; эта мутация обусловливает дефект рецептора или его полное отсутствие, т.е. соответственно частичную или полную нечувствительность к ГР (Rosenfeld et al, 1994; Goddard et al, 1995). Нечувствительность к ГР может быть также следствием нарушения структуры ГР (мутации в гене ГР) (Takahashi et al, 1996) или передачи его сигнала в клетки (дефект на пострецепторном уровне), первичных дефектов биосинтеза ИФР-I или отсутствия реакции тканей-мишеней на ИФР-I (Lanes et al, 1980; Takahashi et al, 1996; Reiter, Rosenfeld, 1998).
Пока нет убедительных данных о наличии аналогичных подтипов карликовости у собак и кошек. Во всех случаях, когда у собак с гипофизарной карликовостью определяли ГР или ИФР-I, концентрация последнего была низкой, а концентрация ГР - низкой или ниже определяемого уровня. У таких животных отсутствовал ответ ГР в провокационных пробах (Rijnberk et al, 1993). У двух немецких овчарок с низкой активностью ИФР-I гистологическая картина гипофиза была нормальной. Авторы предположили, что причиной карликовости у этих животных является вторичная недостаточность ГР (т.е. нарушение его структуры или чувствительности тканей-мишеней), поскольку считали, что концентрация ГР в крови оставалась в норме. К сожалению, это предположение не было подтверждено прямыми определениями уровня ГР в плазме крови. В другом исследовании были выдвинуты сходные аргументы в пользу вторичной недостаточности ГР как причины карликовости у немецкой овчарки (Muller-Peddinghaus et al, 1980). При этом оценивали не секреторную способность гипофиза, а базальную концентрацию ГР. Однако базальная концентрация ГР у нормальных и карликовых животных может быть одинаковой, что делает этот параметр непригодным для оценки способности гипофиза секретировать ГР (Eigenmann, Eigenmann, 1981а).
Представляет интерес сообщение о двух немецких овчарках с задержкой роста, которые сначала выглядели низкорослыми, но к концу первого года жизни достигли нормальных размеров (Randolph et al, 1990). У обеих собак сохранялась нормальная концентрация ГР и ИФР-I в сыворотке крови, нормальная секреторная активность гипофиза в пробе с ксилазином и нормальная функция надпочечников и щитовидной железы. По мнению авторов, задержка роста была вызвана слабым гипопитуитаризмом
или перемежающейся нейросекреторной дисфункцией. Логично предположить, что существует целый спектр форм гипопитуитаризма от слабого до тяжелого, и его симптоматика зависит от степени нарушения секреции ГР.
Патофизиология
Клинические проявления гипофизарной карликовости обусловлены недостаточностью ГР и, как следствие, уменьшением концентрации ИФР-I в крови (Eigenmann et al, 1984с). У неполовозрелых животных недостаточность ГР приводит к задержке линейного роста и, в конечном итоге, к аномально малым размерам тела. У собак с сочетанной недостаточностью гормонов передней доли гипофиза обычно понижается концентрация не только ГР, но и ТТГ и пролактина. Недостаток ТТГ также играет роль в нарушении роста тела (см. гл. 3). Нормальное физическое развитие зависит от концентрации в крови гормонов щитовидной железы, которые усиливают стимулирующее действие ГР и ИФР-1 на образование хондроцитов. Отсутствие секреции пролактина препятствует формированию молочных желез и послеродовой лактации у собак. У животных с сочетанной недостаточностью гормонов аденогипофиза может быть нарушена секреция гонадотропинов (ЛГ и ФСГ), что приводит к гипогонадизму и бесплодию. Показно, что у немецких овчарок при сочетанной недостаточности гормонов передней доли гипофиза сохраняются нормальные секреция АКТГ и функция кортикотрофов (Kooistra et al, 2000b). У большинства собак с комбинированной недостаточностью гипофизарных гормонов отсутствует вторичная надпочечниковая недостаточность. Кроме того, у гипофизарных карликов не наблюдаются клинические признаки дефицита нейрогипофизарных гормонов (вазопрессина и окситоцина). При повреждении нейрогипофиза вазопрессин продолжает выделяться непосредственно из гипоталамуса, что объясняет отсутствие несахарного диабета. Любая недостаточность окситоцина не имеет клинических проявлений вследствие сопутствующего гипогонадизма.
Встречаемость
Гипофизарная карликовость встречается главным образом у немецких овчарок, хотя описана и у других пород собак, таких как веймаранер, шпиц, той-пинчер и карельская медвежья собака. Это расстройство известно также у кошек. Установлено, что у немецких овчарок и карельских медвежьих собак оно наследуется по аутосомно-рецессивному типу. При исследовании группы карликовых немецких овчарок и их нормальных родственников концентрация ИФР-1 в плазме крови последних была выше, чем у карликов, но ниже, чем у здоровых животных неродственной группы. Следовательно, имеет значение степень поражения на генном уров-
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
59
не (Willeberg et al, 1975). Такую картину следует ожидать, если родственники карликов, не имеющие клинических признаков заболевания, являются гетерозиготами, и у них имеет место экспрессия примерно 50% данного признака в отличие от его полной экспрессии у гомозиготных карликов. К сожалению, в данном исследовании не определяли базальную концентрацию ГР и не оценивали ответ соматотрофов в провокационных пробах.
Предрасположенность к развитию гипофизарной карликовости, по-видимому, не зависит от пола животных. У пораженных особей клинические признаки заболевания (т.е. задержка роста) впервые регистрируются на втором или третьем месяце жизни. Возраст животных, поступающих в ветеринарную клинику в связи с гипофизарнои карликовостью, значительно варьирует. Обычно животные впервые поступают для осмотра в связи с задержкой роста или дерматологическими нарушениями в возрасте до года.
Клинические признаки
Наиболее частыми клиническими проявлениями гипофизарной карликовости служат задержка роста (т.е. низкорослость», эндокринная алопеция и гиперпигментаиия кожи (табл. 2-4). Обычно животные нормально развиваются в первые один-два месяца жизни, а затем их рост замедляется по сравнению с другими особями того же помета. К 3-4 месяцам больные собаки и кошки выглядят «коротышками», а взрослея так и не достигают нормальных размеров (рис. 2-5 и 2-6). Первоначально нормальная скорость развития гипофизарных карликов объясняется тем, что у большинства животных и человека рост в течение определенного периода ранней постнатальной жизни происходит даже в отсутствие I Р.
ТАБЛИЦА 2-4. КЛИНИЧЕСКИЕ ПРИЗНАКИ ГИПОФИЗАРНОЙ КАРЛИКОВОСТИ
Мышсчно-ске.^сшыс
Низкорослость
Топкие кости, ювенильные черты морды
Квадратное, приземистое тело (у взрослых животных)
Деформация костей
Задерж ка закрытия зон роста
Задержка прорезывания зубов
Репрод)ктивные
Атрофия тестикул
Дряблый чехол полового члена
Отсутствие астрального цикла
Другие признаки
Эмоциональная тупость
Визгливый, «щенячий» лай
Признаки вторичного гипо-тироза
Признаки вторичной надпочечниковой недостаточности
Дерматологические
Мягкий, пушистый шерстяной покров
Сохранение подшерстка Отсутствие первичных волос Алопеция
Двусторонняя, симметричная
Па туловище, шее, прок-симатьной поверхности конечностей
Гиперпигментация кожи Тонкая, хрупкая кожа Кожные складки Шелушение
Комедоны
Папулы
Пиодерма
Себорея сухая
По мере взросления у карликов с изолированной недостаточностью ГР обычно сохраняются нормальные очертания и пропорции тела (пропорциональная карликовость). При сочетанной недостаточности гормонов аденогипофиза (особенно в отсутствие ТТГ) животные выглядят приземистыми, их тело приобретает характерную для врожденного гипотиреоза квадратную форму (непропорциональная карликовость) (см. рис. 2-6, а также гл. 3).
Рис. 2-5. А. Полуторогодовалая сука немецкой овчарки с гипофизарнои карликовостью. Размер тела такой же, как у 4-месячного щенка этой породы. Б. ll-месячная сука золотистого ретривера с гипофизарной карликовостью Размер тела такой же, как у 10-недельного щенка этой породы. Обратите внимание, что у обеих собак сохраняются нормальные контуры тела, общий вид напоминает таковой у щенков, сохраняется вторичная шерсть при одновременной утрате первичного шерстяного покрова.
60 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Рис. 2-6. А. Восьмимесячный кот короткошерстной породы с гипофизарной карликовостью. Размер тепа, как у 8-недельного котенка. Обратите внимание, что у животного сохраняются нормальные контуры тела, а общий вид напоминает таковой у котенка. Б. Годовалая длинношерстная кошка с гипофизарной карликовостью. Для иллюстрации се отставания в росте рядом показана нормальная кошка сопоставимого возраста. Обрат ите внимание на характерную квадратную форму головы карлика.
У гипофизарных карликов обычно задерживается закрытие эпифизарных зон роста, а роднички черепа могут оставаться открытыми. Прорезывание зубов также задерживается, но зубочелюстная система в целом развивается нормально.
Наиболее заметным дерматологическим признаком является сохранение лануго, животные-карлики выглядят мя1 кими и пушистыми. Пушковые волосы легко выпадают, что приводит к постепенному развитию симметричной двусторонней алопеции. В первую очередь оголяются участки тела, подвергающиеся повышенному трению: шея (из-за ошейника) и за ще-боковые поверхности бедер (на которых животное сидит). В конце концов, шерсть исчезает на туловище, шее и проксимальных поверхностях конечностей; первичный шерстяной покров сохраняется только на морде и дистальной поверхности ног.
Кожа животных-карликов сначала остается нормальной, но со временем подвергается гиперпигментации (из серой становится бурой или черной), истончается, сморщивается и шелушится. У взрослых особей нередко развиваются комедоны, папулы и вторичная пиодермия. Частыми и длительными осложнениями являются вторичные бактериальные инфекции кожи и дыхательных путей.
Возможно также развитие гипогонадизма, хотя у некоторых карликов сохраняется нормальная репродуктивная функция. У самцов обычно имеют место атрофия семенников, азооспермия и дряблость чехла полового члена. У самок в результате пониженной секреции гипофизарных гонадотропинов нарушается астральный цикл. У большинства собак при карликовости сохраняется визгливый «щенячий» лай (Campbell, 1988). В молодости карлики - живые. активные собаки, но по мере старения становятся все более вялыми, скучными, малоподвижными и теряют аппетит. Эти изменения поведения могут отражать разные эндокринные расстройства, связанные с прогрессивным разрастанием гипофизарной кисты или кист.
Клиническая патология
Общий клинический анализ крови (ОАК), биохимический анализ сыворотки и мочи у собак и кошек с гипофизарной карликовостью вследствие изолированной недостаточности ГР обычно дают нормальные результаты. Возможно небольшое вторичное увеличение параметров, характеризующих функцию почек (содержание азота мочевины и креатинина), вследствие недоразвития клубочков или снижения скорости клубочковой фильтрации (Feld. Hirschberg, 1996). Сообщалось также о появлении гипофосфатемии, гипоальбуминсмии и анемии (Eigenmann, 1983). При карликовости с комплексной недостаточностью гормонов передней доли гипофиза развиваются дополнительные клиникопатологические изменения, прежде всего из-за сопутствующего гипотиреоза (см. гл. 3).
Гистопатологическая картина кожи
Гистопатологические изменения в коже собак с недостаточностью ГР сходны с таковыми при других эндокринопатиях (табл. 2-5). К их числу относятся ортокератотический гиперкератоз, фолликулярный кератоз, расширение или атрофия фолликулов, телогенизация волосяных фолликулов, избыточная трихилемная кератинизация, атрофия сальных желез и эпидермиса, эпидермальный меланоз и истончение дермы разной степени тяжести (Scott et al, 2001). Весьма характерным проявлением недостаточности ГР является уменьшение количества и размера кожных эластиновых волокон. Эти волокна становятся меньше, чем у нормальных животных, число их снижается, и они претерпевают фрагментацию. У собак с сопутствующим вторичным гипотиреозом к этим гистопатологическим изменениям могут добавляться вакуолизация или гипертрофия мышц, поднимающих шерсть.
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 61
ТАБЛИЦА 2-5.
ДЕРМАТОГИСТОПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ПРИ АЛОПЕЦИИ, ВЫЗВАННОЙ ЭНДОКРИНОПАТИЯМИ
Нарушение Специфическое эндокринное расстройство
Неспецифические нарушения, подтверждающие наличие эндокринопатии Ортокератотический гиперкератоз Фолликулярный кератоз Расширение фолликулов Атрофия фолликулов Преобладание телогенных волосяных фолликулов Атрофия сальных желез Атрофия эпидермиса Эпидермальный меланоз Истончение кожи Атрофия коллагена кожи -
Нарушения, свидетельствующие о специфическом эндокринном расстройстве
Уменьшение количества и размера эластиновых волокон в дерме Чрезмерная трихилемная кератинизация (пламенные фолликулы) Вакуолизация или гипертрофия мышц, поднимающих шерсть Повышенное содержание муцина в дерме Утолщение дермиса Комедоны Кальциноз кожи Отсутствие мышц, поднимающих шерсть Недостаточность ГР Дерматоз, чувствительный к ГР и кастрации Гипотиреоз Гипотиреоз Гипотиреоз Г иперкортицизм Г иперкортицизм Г иперкортицизм
Эндокринологическая оценка
Базальная концентрация ГР. В норме базальная концентрация ГР у собак колеблется от 1,5±1,2 до 4,3±1,1 нг/мл (Eigenmann, 1983), а у кошек от 1,2±1,0 до 3,2±0,7 нг/мл (Eigenmann et al, 1984d; Peterson et al, 1990). К сожалению, у собак и кошек с недостаточностью ГР (как врожденной, так и приобретенной) базальная концентрация ГР также может оставаться в этих пределах, что затрудняет выявление пониженной секреции ГР только на основании определения базального уровня гормона. Правда, у двух исследованных собак с врожденной недостаточностью ГР его уровень был ниже определяемого (Rijnberk et al, 1993). В настоящее время считается, что определение базальной концентрации ГР в рандомизированных пробах крови недостаточно для постановки диагноза недостаточности ГР. Для этой цели необходима дополнительная оценка секреторной способности гипофиза в условиях стимуляции соматотрофов.
Тесты со стимуляцией ГР. Предложено несколько провокационных проб для оценки способности гипофиза секретировать ГР. У собак чаще
всего используют пробы с клонидином, ксилазином и ГРРГ, а также комбинированный тест для оценки функции передней доли гипофиза с помощью четырех рилизинг-гормонов: ГРРГ, тиреотропин рилизинг-гормона (ТРГ), гонадотропин рилизинг-гормона (ГнРГ) и кортикторопин рилизинг-гормона (КРГ) (табл. 2-6). О применении этих тестов для характеристики секреции ГР у кошек данных нет.
Для интерпретации результатов перечисленных тестов необходимо иметь представление о факторах, которые влияют на чувствительность соматотрофов к различным воздействиям. Это особенно важно при диагностике частичной недостаточности ГР. У человека чувствительность соматотрофов к отдельным стимуляторам зависит от многих факторов (табл. 2-7) (Lazarus, 1984). У собак влияние этих факторов столь тщательно не изучалось, однако известно, что при гиперкортицизме, гипотиреозе и некоторых нарушениях соотношения половых гормонов концентрация ГР в крови обратимо понижается (Peterson, Altszuler, 1981; Lothrop, 1988; Regnier, Gamier, 1995). С другой стороны, бета-адренергические агонисты усиливают ответ ГР на ГРРГ (Regnier et al, 1992).
ТАБЛИЦА 2-6. ПРОТОКОЛЫ ТЕСТОВ СТИМУЛЯЦИИ СЕКРЕЦИИ ГОРМОНА РОСТА
Тест Описание и результат
Проба с ксилазином*
Протокол 100 мкг/кг, в/в; взятие проб крови до и через 15, 30, 45 и 60 мин после введения ксилазина**
Нормальные результаты Концентрация ГР в плазме >10 нг/мл через 15-30 мин после введения ксилазина
Побочные реакции Седативный эффект (обычен), брадикардия, гипотензия, коллапс, шок, судороги
Проба с клонидином
Протокол 10 мкг/кг, в/в; взятие проб крови до и через 15, 30, 45 и 60 мин после введения клонидина**
Нормальные результаты Концентрация ГР в плазме >10 нг/мл через 15-30 мин после введения клонидина
Побочные реакции Седативный эффект (обычен), брадикардия, гипотензия, коллапс, агрессивное поведение
Проба с ГРРГ
Протокол 1 мкг/кг, в/в; взятие проб крови до и через 15, 30,45 и 60 мин после введения ГРРГ
Нормальные результаты Концентрация ГР в плазме >10 нг/мл через 15-30 мин после введения ГРРГ
Побочные реакции Не зарегистрированы
* В настоящее время используется наиболее широко.
** Сокращенный протокол, при котором пробы крови берут до и через 20 и 30 мин после стимуляции.
ГР - гормон роста, ГРРГ - гормона роста рилизинг-гормон.
62 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
ТАБЛИЦА 2-7. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ОТВЕТ СОМАТОТРОФОВ НА СТИМУЛЯЦИЮ СЕКРЕЦИИ ГОРМОНА РОСТА У ЧЕЛОВЕКА
Пониженная чувствительность Повышенная чувствительность
Старые люди Задержка пубертатного развития Ожирение Гипотиреоз Тиреотоксикоз Г иперкортицизм Стресс Г люкокортикои ды Плохо компенсированный сахарный диабет Недостаточность или нарушение питания Почечная недостаточность Цирроз печени Метастазирующая карцинома Эстрогенотерапия
По: Lazarus L: In: Donald RA (ed): Endocrine Disorders: A Guide to Diagnosis. New York, Marcel Dekker, Inc., 1984, p 273.
Проба с клонидином. Клонидин - это альфа-адренергический агонист, стимулирующий секрецию ГРРГ, который, в свою очередь, стимулирует секрецию ГР. Введение клонидина собакам дозозависимо повышает концентрацию ГР и глюкозы в крови и снижает концентрацию инсулина (Hampshire, Altszuler, 1981). При использовании клонидина увеличение секреции ГР более выражено и результаты лучше воспроизводятся, чем при применении других стимулирующих агентов. В настоящее время для диагностики недостаточности ГР чаще всего используют пробы с клонидином или ГРРГ.
Дозы клонидина, применяемые в провокационных пробах, несколько отличаются в зависимости от протокола, принятого в той или иной лаборатории. Концентрация ГР может возрастать после внутривенного введения всего 3 мкг клонидина/кг веса тела (Hampshire, Altszuler, 1981), хотя использовались и более высокие дозы: 10 мкг/кг (Eigenmann, 1983), 16,5 мкг/кг (Roth et al, 1980) и даже 30 мкг/кг. Следует иметь в виду, что высокие дозы (т.е. 16,5 или 30 мкг/кг) вызывают более выраженную и продолжительную гипергликемию и чаще сопровождаются побочными эффектами в форме вялости, брадикардии, гипотензии, коллапса и агрессивного поведения (Lothrop, 1988; Eigenmann, Eigenmann, 1981а). Эти эффекты продолжаются от 15 до 60 минут. В случае необходимости для устранения брадикардии применяют атропин, а для предотвращения гипотензивного действия клонидина (и ксилазина) - а-адренергические агонисты: фентоламин или йохимбин. Пробы плазмы крови для определения ГР берут перед введением клонидина и через 15, 30, 45, 60 и 120 мин после инъекции. ГР относительно стабилен и долго сохраняется в замороженных пробах, хранящихся при -20 °C.
У здоровой собаки концентрация ГР в крови увеличивается сразу после введения клонидина и достигает максимальной величины через 15-30 мин после инъекции (рис. 2-7) (Hampshire, Altszuler, 1981, Eigenmann, 1983). Индуцированная концентрация ГР превышает 10 нг/мл, а затем быстро снижается
до базальной величины. При карликовости, а также при полной недостаточности ГР, развившейся в зрелом возрасте, ответ на клонидин отсутствует (рис. 2-7) и концентрация ГР после инъекции клонидина не увеличивается. Аномальные результаты пробы с клонидином во всех случаях служат основанием для подозрения на частичную недостаточность ГР (табл. 2-8) (Eigenmann, Peterson, 1984).
Для оценки соматотропной функции полезно определять концентрацию глюкозы в условиях индуцированной клонидином секреции ГР. У здоровых собак концентрация глюкозы в крови также возрастает пропорционально дозам клонидина (Hampshire, Altszuler, 1981). Ее максимальное повышение отмечается примерно через 90 мин после инъекции. Напротив, у гипофизэктомированных собак и у животных с недостаточностью ГР увеличения глюкозы не происходит (Eigenmann, 1981). Механизм индуцируемой гипергликемии точно не известен, хотя предполагается, что она обусловлена антиинсулиновым действием ГР и вызываемым им снижением поглощения глюкозы клетками.
Проба с ксилазином. Ксилазин - это седативный анальгетик, структурно родственный клониди-ну. Введение ксилазина вызывает повышение концентрации ГР в крови здоровых собак (Hampshire, Altszuler, 1981) и является эффективным методом диагностики недостаточности ГР. Пробы крови бе-
Время (мин)
Рис. 2-7. Результаты провокационной пробы с клонидином у нормальных собак и девяти немецких овчарок с гипофизарной карликовостью. Клонидин в дозе 10 мкг/кг вводили внутривенно в момент 0. (Из: Eigenmann JE, et al: Acta Endocrinol, 105: 289, 1984.)
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 63
ТАБЛИЦА 2-8. РЕЗУЛЬТАТЫ ПРОБЫ С КЛОНИДИНОМ У ДЕВЯТИ ВЗРОСЛЫХ СОБАК С НЕДОСТАТОЧНОСТЬЮ ГОРМОНА РОСТА
ГР (нг/мл)
Собака 0 мин 15 мин 30 мин 45 мин 60 мин 90 МИИ
1** * 6,2 6,0 4,3 3,1 3,1
2** ♦ 5,8 2,0 0,5 ♦ ♦
3 * * 2,0 0,5 * *
4 * 0,5 * * * *
5 * * * * * *
6 * * * * * *
7 * * * * * *
8 * 0,8 1,0 0,9 0,9 *
9 * * * * * *
Норма 1,5 29,6 44,4 16,5 10,3 6,0
±SEM ±0,1 ±9,6 ±13,9 ±4,9 ±2,9 ±2,7
Из: Eigenmann JE, Peterson DF: JAAHA, 20: 741, 1984.
* Ниже чувствительности определения (0,39 нг/мл).
** У собак 1 и 2 имелось подозрение на частичную недостаточность ГР, тогда как остальные 7 собак имели полную недостаточность ГР. Клонидин (10 мг/кг) вводили внутривенно в момент 0.
рут до внутривенной инъекции и спустя 15. 30, 45, 60 и 120 мин после нее. Ксилазин вводят в дозах от 100 до 300 мкг/кг. Обычно рекомендуют повышенные дозы, чтобы обеспечить максимальную стимуляцию секреции ГР, однако они могут вызывать такие нежелательные явления, как выраженный седативный эффект, гипотензию, шок и изредка судороги. Низкие дозы (порядка 100 мкг/кг) эффективно стимулируют секрецию ГР, но не повышают концентрацию глюкозы в крови (Hampshire, Altszuler, 1981). Частота побочных эффектов (вялость, брадикардия, гипотензия, коллапс) при низких дозах кси-лазина также уменьшается. Результаты этой пробы интерпретируют так же, как результаты пробы с клонидином. В одном из исследований максимальная концентрация ГР через 15 мин после введения ксилазина составляла в среднем 43,5±40,8 нг/мл (Schmeitzel, Lothrop, 1990).
Проба с гормон роста рилизинг-гормоном. Применение ГРРГ в диагностической пробе у собак с врожденной или приобретенной недостаточностью ГР исследовали Lothrop (1986), Rijnberk et al (1993) и Kooistre et al (2000b). Внутривенная инъекция ГРРГ (Peninsula Lab, США) в дозе 1 мкг/ кг вызывала быстрое увеличение концентрации ГР в плазме крови с максимумом через 10-30 мин после начала пробы (рис. 2-8) (Abribat et al, 1989; Meij et al, 1996). Средняя (±SE) концентрация ГР составляла 14,7±3,7 нг/мл через 10 мин после введения ГРРГ (Meij et al, 1996). У восьми немецких овчарок с гипофизарной карликовостью базальная концентрация ГР была низкой и не повышалась под действием ГРРГ (см. рис. 2-4; Kooistra et al, 2000b). У шести других собак с подозрением на приобретенную в зрелом возрасте недостаточность ГР его концентрация в крови была низкой либо нормальной, но также не увеличивалась под влиянием ГРРГ
(Rijnberk et al, 1993). Побочное действие ГРРГ отсутствовало. В тесте с ГРРГ пробы крови берут перед его инъекцией и через 5, 10, 20, 30, 45 и 60 минут после внутривенного введения 1 мкг ГРРГ/ кг веса тела. Существенными недостатками этого теста являются трудность приобретения ГРРГ и его высокая стоимость.
Комбинированный тест для оценки функции аденогипофиза. Этот тест применяют для характеристики секреторной способности гипофиза собак при подозрении на его дисфункцию или после ги-пофизэктомии по поводу болезни Кушинга (см. гл. 6). Процедура комбинированного теста включает 30-секундное внутривенное введение четырех гипоталамических рилизинг-гормонов в следующей последовательности: КРГ 1 мкг/кг, ГРРГ 1 мкг/кг, ГнРГ 10 мкг/кг и ТРГ 10 мкг/кг (Meij et al, 1996). Пробы крови берут перед началом теста и через 5, 10, 20, 30, 45, 60, 90 и 120 мин после инъекции последнего рилизинг-гормона. В пробах определяют концентрации ГР, АКТГ, ТТГ, ЛГ, ФСГ и пролактина. В одном из исследований при сочетанном введении четырех гипоталамических рилизинг-гормонов они не обладали взаимным ингибирующим или синергическим действием в отношении секреции ГР, АКТГ и ТТГ, однако, индуцированная секреция ЛГ была на 50% слабее, чем после введения одного ГнРГ (Meij et al, 1996). К числу побочных эффектов комбинированных инъекций относятся беспокой-
Время (мин)
Рис. 2-8. Изменения концентрации ГР в плазме крови у восьми кобелей коротконогой гончей после быстрой (30 секунд) внутривенной инъекции (стрелка) четырех гипоталамических рилизинг-гормонов (•) по сравнению со стимуляцией одним ГРРГ в дозе 1 мкг/кг (О). В комбинированном тесте гормоны вводились в следующей последовательности: 1 мкг КРГ/кг, 1 мкг ГРРГ/кг, 10 мкг ГнРГ/кг и 10 мкг ТРГ/кг. Площадь под кривой и прирост (максимальный выброс ГР сразу после инъекции) концентрации ГР в плазме достоверно не отличались при стимуляции его секреции комбинацией рилизинг-гормонов и одним ГРРГ. КРГ - кортикотропин рилизинг- гормон, ГРРГ - гормона роста рилизинг-гормон, ГнРГ - гонадотропин рилизинг- гормон, ТРГ - тиреотропин рилизинг- гормон. Из: Meij BP, et al.: Dorn. Anim. Endocr., 13: 161, 1996.
64 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
ное состояние и тошнота, которые исчезают вскоре после завершения тестирования. Комбинированный тест для оценки функции передней доли гипофиза использовали с целью подтверждения сочетанной недостаточности ГР, ТТГ и пролактина у 10 немецких овчарок с гипофизарной карликовостью (см. рис. 2-4; Hamann et al, 1999; Kooistra et al, 2000b). Очевидными недостатками комбинированной пробы являются сложная процедура тестирования и его высокая стоимость.
Базальная концентрация ИФР-1. У собак с гипофизарной карликовостью концентрация ИФР-1 в крови ниже нормы. В исследовании, включавшем девять немецких овчарок, средняя концентрация ИФР-1 у здоровых взрослых животных составляла 280±23 нг/мл, у здоровых неполовозрелых особей 345±50 нг/мл, а у карликов 11±2 нг/мл (Eigenmann et al, 1984с). В трех других исследованиях на девяти собаках с гипофизарной карликовостью также была показана низкая концентрация ИФР-1 в крови (Rijnberk et al, 1993; Kooistra et al, 1998; Kooistra et al, 2000b). Эти данные подтверждают, что ГР контролирует концентрацию ИФР-1 в плазме крови и что ИФР-1 играет важную роль в регуляции роста (см. рис 2-2). Показана возможность использования коммерческих наборов для радиоиммунологичес-кого определения ИФР-1 у человека при обследовании собак (Randolph et al, 1990) и кошек (Church et al, 1994). При невозможности прямого определения ГР в крови, измерение уровня ИФР-1 в плазме крови радиоиммунологическим методом позволяет подтвердить, что причиной задержки роста у собак и кошек является недостаточность ГР. Однако при интерпретации данных, полученных этим методом, следует учитывать размеры животных, поскольку у собак небольших пород нормальная концентрация ИФР-1 в целом ниже, чем у нормальных крупных собак (Eigenmann et al, 1984b).
Функция щитовидной железы. Оценка функции щитовидной железы имеет первостепенное значение у любого животного с подозрением на недостаточность ГР, поскольку клинические признаки гипотиреоза и недостаточности ГР сходны и необходима дифференциальная диагностика этих заболеваний. Кроме того, недостаточность ТТГ является наиболее частым сопутствующим гормональным расстройством при гипофизарной карликовости вследствие гипоплазии гипофиза и сочетанной гормональной недостаточности. Теоретически, у гипофизарных карликов с сопутствующим гипотиреозом базальная концентрация ТТГ, общего и свободного тироксина в сыворотке крови должна быть низкой вплоть до неопределяемого уровня. К сожалению, даже видимое отсутствие эндогенного ТТГ не может служить доказательством нарушения его секреции, так как чувствительность имеющихся доступных наборов для определения ТТГ слишком мала для измерения его концентрации на нижнем пределе нормы. Кроме того, снижение концентраций общего и свободного тироксина может
быть вызвано не только гипофизарной недостаточностью ТТГ, но и другими факторами, влияющими на функцию щитовидной железы (например, при синдроме эутиреоидной патологии). Наконец, при гипофизарной карликовости с пониженной секрецией ТТГ может сохраняться нормальная концентрация тироксина в крови (Kooistra et al, 1998). Учитывая сказанное, функцию гипофиза и щитовидной железы рекомендуется оценивать в пробе с тиреотропин рилизинг-гормоном (ТРГ) (см. гл. 3). У собак и кошек с изолированной недостаточностью ГР эта проба должна давать нормальные показатели. При врожденном гипотиреозе или гипофизарной карликовости вследствие комбинированной недостаточности гормонов передней доли гипофиза, базальные концентрации ТТГ, общего и свободного тироксина должны быть низкими и лишь минимально увеличиваться или оставаться без изменения после введения ТРГ (см. рис. 2-4). Тестирование функции щитовидной железы более подробно описано в гл. 3.
Функция коры надпочечников. У собак с изолированной недостаточностью ГР или комбинированной недостаточностью гормонов аденогипофиза обычно сохраняется нормальная функция кортикотрофов (см. рис. 2-4). Оценка состояния системы гипофиз-кора надпочечников показана при гипофизарной карликовости с признаками недостаточности продукции кортизола (вялость, потеря аппетита, рвота, уменьшение веса). Для подтверждения вторичного гипокортицизма следует определить базальную концентрации эндогенного АКТГ и ответ надпочечников на стимуляцию экзогенным АКТГ или, что предпочтительнее, провести пробу со стимуляцией секреции АКТГ кортикотропин рилизинг-гормоном. Более подробные данные о вторичном гипокортицизме представлены в гл. 8.
Окончательный и дифференциальный диагноз
По внешнему виду и на основании анамнеза и результатов физикального исследования предполагаемым диагнозом при низкорослости является гипофизарная карликовость. Дополнительное подтверждение диагноза получают, исключая менее вероятные причины (табл. 2-9) после углубленного изучения анамнеза, данных физикального исследования и рутинных лабораторных анализов (в частности, ОАК, биохимического профиля крови, анализа мочи и кала), а также результатов визуализации органов (рис. 2-9). Наиболее трудную задачу при дифференциальной диагностике представляет исключение кретинизма, протоваскулярных анастомозов и микрососудистой дисплазии печени. Окончательный диагноз недостаточности ГР базируется на оценке ответа соматотрофов в провокационных пробах. У большинства гипофизарных карликов стимуляторы секреции ГР не вызывают повышения его концентрации в плазме крови. Любые аномаль-
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 65
ТАБЛИЦА 2-9. ВОЗМОЖНЫЕ ПРИЧИНЫ НИЗКОРОСЛОСТИ У СОБАК И КОШЕК
Эндокринные Неэндокринные
Недостаточность ГР Недостаточное или непра-
Гипотиреоз вильное питание
Г иперкортицизм Желудочно-кишечные рас-
Гипокортицизм стройства
Сахарный диабет Нарушение пищеварения Экзокринная панкреатическая недостаточность Нарушение всасывания Тяжелая глистная инвазия Дисфункция печени Портосистемный сосудистый анастомоз Гликогеновая болезнь Заболевание почек Сердечно-сосудистое заболевание, аномалия Скелетная дисплазия, хондродистрофия Мукополисахаридоз Гидроцефалия
ные результаты тестирования дают основания для подозрения на частичную недостаточность ГР. У собак и кошек с гипофизарной карликовостью базальная концентрация ИФР-1 в плазме крови также понижена, либо он вообще не определяется существующими методами.
Лечение
Терапия гормоном роста. Лечение гипофизарной карликовости основано на введении ГР. К сожалению, для собак еще не создан соответствующий эффективный препарат. Рекомбинантный человеческий ГР дорог и не всегда доступен. Кроме того, он может индуцировать образование антител, которые снижают его эффективность у животных (Van Herpen et al, 1994). Рекомбинантный ГР крупного рогатого скота предназначен именно для этой группы животных и не пригоден для использования в концентрациях, рекомендуемых для собак. Свиной ГР иммунологически сходен с ГР собак, однако поставляется нерегулярно (Ascacio-Martinez et al, 1994). При наличии свиного ГР его рекомендуется вводить собакам подкожно три раза в неделю при исходной дозе 0,01 ME (0,05 мг). Последующую коррекцию дозы и частоты инъекций осуществляют, учитывая клиническую реакцию и концентрацию ИФР-1 в плазме крови (Mandel et al, 1995; Kooistra et al, 1998). Цель терапии - повысить уровень ИФР-1 до величины, нормальной для данной породы собак. При оценке и интерпретации результатов измерений ИФР-1 следует принимать во внимание размеры животных, так как нормальный диапазон его концентраций отличается у разных пород. Основными побочными эффектами терапии ГР являются аллергические реакции (включая ангионевротический отек), нарушение толерантности к углеводам и явный сахарный диабет. Важное значение имеет регулярный мониторинг уровня саха
ра в моче и крови для своевременного выявления гипергликемии (т.е. концентрации глюкозы в крови более 150 мг/100 мл). При возникновении указанных расстройств следует отменить ГР, в противном случае может развиться устойчивый инсулинозависимый сахарный диабет.
Поскольку ГР и тиреоидные гормоны обладают синергическим действием на процессы роста, при низкой концентрации тиреоидных гормонов ГР менее эффективен. В связи с этим при подозрении на сочетанную недостаточность гормонов аденогипофиза и вторичный гипотиреоз у собак или кошек необходима заместительная терапия тиреоидными гормонами, как описано в гл. 3. Ежедневное введение тиреоидных гормонов следует продолжать на протяжении всей жизни животного.
Лечение прогестинами. Продолжительная терапия прогестинами может вызвать у собаки или кошки избыточную секрецию ГР, которая, в свою очередь, приводит к изменениям, характерным для акромегалии, к нарушению толерантности к глюкозе и сахарному диабету (Eigenmann et al, 1983а). Повышенная под воздействием прогестинов секреция ГР не претерпевает пульсирующих колебаний, не изменяется под действием ГРРГ или клонидина и не подавляется соматостатином (Watson et al, 1987; Selman etal, 1991). Индукция прогестинами концентрации ГР не сопровождается повышением уровня ИФР-1 в плазме крови (Selman et al, 1994а). Последующие исследования показали, что источником ГР, продукция которого стимулируется прогестинами, являются очаги гиперплазированного эпителия протоков молочных желез (Selman et al., 1994b). В тканях молочной железы собак экспрессируется ген, кодирующий ГР (Mol et al, 1995). Анализ последовательности нуклеотидов в молекуле этого гена выявил его идентичность гипофизарному гену ГР (Mol et al, 1996). Нет сомнения, что локальный синтез ГР и сопутствующая продукция ИФР-1 имеют значение для циклического развития молочных желез у собак.
Стимулирующее действие прогестинов на секрецию ГР и ИФР-1 предполагает интересную возможность их применения в терапии гипофизарной карликовости у собак. У кобеля и суки немецкой овчарки с этим заболеванием подкожные инъекции медроксипрогестерон ацетата (МПА) в дозах 2,5-5,0 мг/кг веса тела приводили к улучшению клинического состояния собак. МПА сначала вводили с трехнедельными, а потом с шестинедельными интервалами (Kooistra et al, 1998). Дозы и режим введения выбирали, исходя из наблюдавшихся изменений физического облика животных и концентраций ГР и ИФР-1 в крови. У обеих собак МПА вызывал увеличение размеров тела и полное восстановление шерстяного покрова. Одновременно у них развивался зудящий пиодерматоз. Кроме того, побочным эффектом терапии у суки была кистозная эндометриоидная гиперплазия и мукометра, а у кобеля появились признаки акромегалии. Посколь-
Рис. 2-9. Алгоритм диагностики при отсутствии роста у щенков и котят
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 67
ку индуцируемая прогестинами избыточная секреция ГР может стать причиной сахарного диабета, приходилось периодически измерять уровень сахара в крови и моче. Обе собаки оставались живыми и здоровыми через соответственно 3 и 4 года после начала терапии МПА. В другом исследовании подкожное введение полигестона в дозе 10 мг/кг веса тела с трехнедельными интервалами на протяжении 9 недель кобелю и суке немецкой овчарки с гипофизарной карликовостью приводило к повышению уровня ИФР-1 и веса тела, а также улучшало состояние шерстяного покрова (Herrtage, Evans, 1998).
Целесообразность применения прогестинов для терапии гипофизарной карликовости у кошек нуждается в дополнительном исследовании. Установлена экспрессия гена ГР в ткани молочных желез кошки, претерпевшей фиброаденоматозные изменения под воздействием прогестина (Mol et al, 1995). Это свидетельствует о способности молочной железы синтезировать ГР. Однако Peterson (1987) не обнаружил существенных изменений концентрации ГР в плазме крови кошек при терапии мегестрол ацетатом на протяжении 12 месяцев. Аналогично, по данным Church и соавторов (1994), полигестон или мегестрол ацетат не влияли на уровень ИФР-I в крови кошек и после их введения он оставался таким же, как у кошек, которым вводили физиологический раствор.
Реакция на терапию - прогноз
Благотворное действие заместительного введения ГР и тиреоидных гормонов на состояние кожи и шерсти обычно сказывается спустя 6-8 недель. Отрастает главным образом пушковая, или вторичная, шерсть, тогда как рост первичного шерстяного покрова вариабелен и происходит только на отдельных участках тела (Eigenmann et al, 1981). Характер линейного роста животного непредсказуем; отчасти он зависит от возраста и состояния эпифизарных пластинок в начале терапии ГР или прогестинами. Чем моложе животное, тем больше вероятность сохранения открытых зон роста и тем больше ожидаемое увеличение размеров тела. Эффект лечения будет незначительным или отсутствовать, если при первичном обследовании зоны роста закрыты или почти закрыты.
Долгосрочный прогноз гипофизарной карликовости требует осторожности. В целом, ожидаемая продолжительность жизни гипофизарных карликов меньше нормальной. В отсутствие лечения такие животные обычно погибают или подвергаются эвтаназии в молодом возрасте (как правило, моложе 5 лет). Непосредственной причиной смерти чаще всего является инфекция, дегенеративное заболевание или неврологическое расстройство, которые развиваются вследствие хронической недостаточности ГР, ИФР-1 и ТТГ, либо продолжающегося увеличения гипофизарной кисты или кист. Осторожный прогноз при терапии ГР или прогестинами
отчасти зависит от степени нормализации уровня ИФР-1 и отсутствия осложнений, сопутствующих хроническому введению больших доз ГР или прогестинов (например, сахарного диабета, пиометры и акромегалии).
ПРИОБРЕТЕННАЯ НЕДОСТАТОЧНОСТЬ ГОРМОНА РОСТА
Недостаточность ГР развивается у взрослых собак и реже у взрослых кошек в результате деструкции гипофиза при нарушениях воспалительного, травматического, сосудистого или неопластического происхождения, при подавлении функции соматот-рофов на фоне сопутствующего заболевания либо как идиопатическое расстройство (Eigenmann et al, 1983b). Клинические проявления приобретенной недостаточности ГР у собак сводятся к изменениям кожного покрова. Классические признаки включают симметричную эндокринную алопецию и гиперпигментацию. Этот синдром получил название чувствительного к ГР дерматоза взрослых особей. Данных о приобретенной недостаточности ГР у кошек в литературе нет.
В зависимости от этиологии и тяжести деструктивных изменений гипофиза возможно нарушение синтеза и секреции и других тропных гормонов. В конечном счете, может развиться пангипопитуитаризм, или недостаточность всех гипофизарных гормонов. Симптомы недостаточности ГР могут быть мало заметны, но могут и преобладать в общей картине пангипопитуитаризма. При этом хозяин животного легче распознает клинические признаки, обусловленные недостаточностью вазопрессина, АКТГ или ТТГ, чем связанные с недостаточностью ГР. Сопутствующие нарушения продукции пролактина и гонадотропинов клинически не выражены и, если не планируется вязка, могут остаться незамеченными. При определенной этиологии гипопитуитаризма не исключены клинические проявления, связанные с неврологической дисфункцией (см. гл. 6).
У человека секреция ГР уменьшается при самых разнообразных клинических состояниях, в том числе при ожирении, гипо- и гипертиреозе, спонтанном гиперкортицизме или введении экзогенных глюкокортикоидов (Lazarus, 1984). У собак, как и у людей, избыточная продукция эндогенных глюкокортикоидов (синдром Кушинга) является следствием зависимой от гипофиза двусторонней гиперплазии коры надпочечников или надпочечниковой неоплазии. В обоих случаях возможно угнетение секреции ГР, которое, однако, носит обратимый характер при условии успешного лечения основного заболевания (Peterson, Altszuller, 1981). Сопоставимое уменьшение секреции ГР происходит также при длительном лечении глюкокортикоидами или при применении высоких доз глюкокортикоидов. Предполагается, что аналогичное обратимое подавление секреции ГР имеет место у собак с гипотиреозом (Lothrop, 1988). Хотя признаки недостаточности ГР при этих расстройс
68 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
твах явно не проявляются, при интерпретации результатов тестирования секреции ГР следует учитывать возможное подавление функции соматотрофов.
ЧУВСТВИТЕЛЬНЫЙ К ГОРМОНУ РОСТА ДЕРМАТОЗ ВЗРОСЛЫХ животных
Этиология
Чувствительный к ГР дерматоз - слабо изученное кожное заболевание взрослых собак. Оно является отражением исходно легкой (частичной?), но прогрессирующей формы врожденной недостаточности ГР, не настолько тяжелой, чтобы привести к карликовости, но которая со временем вызывает кожные заболевания у молодых взрослых собак. Приобретенная недостаточность ГР возникает у ранее нормально развивавшихся животных по неизвестным пока причинам. У таких собак базальная концентрация ГР в плазме крови понижена и не увеличивается в ответ на стимуляцию, что свидетельствует о нарушении функции соматотрофов.
Отсутствие данных аутопсии собак с чувствительным к ГР дерматозом до сих пор препятствует пониманию этого заболевания. Вскрытие трех собак с дерматозом, чувствительным к гормону роста, выявило умеренную атрофию гипофиза у двух и его нормальное состояние у одной особи (Scott, Walton, 1986; Schmeitzel, 1990). Неизвестно, чем вызвано это заболевание: дисфункцией гипофиза, гипоталамуса или иного органа. Несомненно, что в его возникновении участвуют генетические факторы, так как животные определенных пород имеют выраженную предрасположенность к нему. Имеет значение и пол животного, поскольку чувствительный к ГР дерматоз чаще встречается у кобелей, чем у сук. Ясно одно: это расстройство не является прогрессирующим и не связано с нарушением других эндокринных функций гипофиза. Сохранение нормальной реакции органов-мишеней в провокационных пробах с АКТГ и ТТГ свидетельствует о биосинтезе и функциональной активности этих тропных гормонов. Кроме того, чувствительный к ГР дерматоз имеет у собак благоприятный прогноз, что подтверждается отсутствием описаний посмертного вскрытия после постановки диагноза. Иными словами, у этих животных поражена только гипофизарная секреция ГР.
При обследовании 95 собак с чувствительным к ГР дерматозом у 32 был получен нормальный ответ ГР в провокационном тесте (Lothrop 1988; Lothrop, Schmeitzel, 1990). Двадцать две (69%) из этих 32 собак принадлежали к породам, предрасположенным к данному заболеванию (в частности, чау-чау и кеесхонды). Кроме того, у собак с нарушенным ответом ГР на стимуляцию его секреции уровень ИФР-1 в крови был в норме. Некоторые собаки с нормальным ответом ГР на стимуляцию отвечали на терапию этим гормоном. Следовательно, не у всех животных с синдромом чувствительного к
ГР дерматоза имела место истинная соматотропная недостаточность (особенно у таких пород, как чау-чау, кеесхонд, померанская и самоедская лайки). Эти данные свидетельствуют также о существовании малоизученных эндокринных дерматозов, имитирующих чувствительный к ГР дерматоз, и о возможности сохранения реакции на терапию ГР у собак без недостаточности ГР. Чувствительный к ГР дерматоз может возникать по разным причинам и, помимо ГР, имеются другие способы его лечения (например, кастрация или о,р’-ДДД).
Патофизиология
Теоретически, клинические симптомы дерматоза, чувствительного к ГР, обусловлены недостаточностью функции соматототрофов при сохранении нормальной активности других трофных клеток гипофиза. Когда недостаточность ГР развивается у взрослых животных, признаки замедления роста отсутствуют, и основными клиническими проявлениями являются изменения кожного покрова вследствие атрофии структур дермиса и эпидермиса и нарушения роста шерсти. Симптомы, имитирующие недостаточность ГР, могут быть следствием зависимого от надпочечников нарушения соотношения половых гормонов (Schmeitzel, Lothrop, 1990). У таких собак ответ ГР в провокационных тестах может быть в норме или нарушенным, а у некоторых из них синдром может сопровождаться недостаточностью ГР.
Встречаемость
Чувствительный к ГР дерматоз может развиться у любой собаки, но ряд пород явно предрасположены к нему. К таким породам относятся чау-чау, померанская лайка, карликовый и той-пудели, кеесхонд, американский водяной спаниель и самоедская лайка (Parker, Scott, 1980; Eigenmann, Peterson, 1984; Lothrop, 1988; Bell et al, 1993). Мы наблюдали это осложнение у нескольких тибетских терьеров. Поскольку среди собак с синдромом, подобным врожденной гиперплазии надпочечников, также преобладают чау-чау, кеесхонды, помераны и самоедские лайки, любое нарушение секреции ГР у этих пород может быть либо сопутствующим, либо вторичным расстройством. Как явствует из литературных и наших собственных данных, чувствительный к ГР дерматоз встречается преимущественно у кобелей, что предполагает существование половой предрасположенности к этому расстройству. Признаки заболевания обычно развиваются у молодых животных (в возрасте от 1 года до 4 лет), хотя известны случаи, когда в клинику приводили 11 -летних собак с подозрением на чувствительный к ГР дерматоз.
Клинические признаки
У половозрелых собак недостаточность ГР приводит прежде всего к нарушениям роста шерсти и
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 69
пигментации кожи (рис. 2-10). Клинические признаки обычно проявляются по достижении собаками возраста 1-3 лет. Заболевание характеризуется симметричной двусторонней алопецией туловища, шеи, ушей, хвоста и каудомедиальной поверхности бедер. В первую очередь поражаются места, чаще других подвергающиеся трению, в частности, шея под ошейником. На таких участках сначала постепенно выпадают покровные (первичные) волосы, вследствие чего шерсть становится похожей на шерсть щенка. Со временем пропадают и вторичные волосы (подшерсток). После этого постепенно исчезает первичный (а затем и вторичный) шерстяной покров на туловище. Полная алопеция туловища бывает редко. Конечности страдают в меньшей степени, а шерсть на голове сохраняется практически полностью. На пораженных участках она легко удаляется, а остающийся шерстяной покров обычно сухой и гусклый. Кожа в зонах алопеции под
вергается гиперпигментации. При хроническом заболевании она истончается и утрачивает тонус. Во всех других отношениях такие животные остаются нормальными, их активность и аппетит не изменяются. Владельцы могли бы считать их совершенно здоровыми, если бы не алопеция.
Клиническая патология
У взрослых собак с синдромом чувствительного к ГР дерматоза рутинные клинические исследования, включая ОАК, анализ биохимического профиля крови и мочи, обычно дают нормальные результаты. Это облегчает дифференциальнную диагностику данного расстройства от гипотиреоза и гиперкортицизма (подробное обсуждение аномальных результатов клинико-патологического исследования при гипотиреозе и гиперкортицизмс, приводится соответственно в гл. 3 и 6).
Рис. 2-10. A-В. Двухлетний самец чау-чау с приобретенным чувствительным к ГР дерматозом. Обратите внимание на симметричную алопецию и гиперпигментацию вокруг шеи, а также на оставшимся сухой, тусклый шерстяной покров. Хотя этого не видно на рисунках, алопеция распространилась и на туловище. Тяжесть алопеции в области шеи, возможно, связана с сильным выпадением шерсти, вызванным ошейником. I и Д. Пятилстний самец миниатюрного пуделя с приобретенным чувствительным к ГР дерматозом. Обратите внимание на симметричную алопецию и гиперпигментацию, захватившие голову и в меньшей степени ноги (А-В - фото D. Serra, Wyoming, RI).
70 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Гистопатологическая картина кожи
При гистологическом исследовании кожных био-птатов могут быть выявлены неспецифические, появляющиеся при эндокринных заболеваниях, изменения кожи (см. табл. 2-4), уменьшение количества и размеров ее эластиновых волокон и пламенные фолликулы (Gross et al, 1992; Scott et al, 2001). Пламенные фолликулы - это очень крупные ката-генные фолликулы, в которых кератин сливается в большие шипы, выступающие через наружное корневое влагалище в стекловидную оболочку. Пламенные фолликулы возникают при эндокринных расстройствах и нарушениях развития, особенно при чувствительных к ГР или кастрации дерматозах, постклиппинговой алопеции и фолликулярной дисплазии у сибирских лаек. Отдельные породы отличаются более выраженной по сравнению с другими предрасположенностью к образованию пламенных фолликулов. Они развиваются, в частности, у чау-чау и померанских лаек как результат других атрофических воздействий на волосяные фолликулы (например, при гиперэстрогенизме или гиперкортицизме). У собак с чувствительным к ГР дерматозом толщина эпидермиса и поверхностного фолликулярного эпителия нормальная, но кожа обычно гиперпигментирована. При остановке роста шерсти плотность волосяных фолликулов в коже уменьшается и большинство фолликулов находится в катагенной фазе.
Эндокринологическая оценка
Концентрация гормона роста. Базальная концентрация ГР у здоровых собак и животных с чувствительным к ГР дерматозом одинаковая. Это затрудняет выявление снижения секреции ГР на основании измерения только его базального уровня в крови. Для постановки диагноза рекомендуется оценивать секреторную способность гипофиза в тестах стимуляции сома-тотрофов клонидином, ГРРГ или ксилазином. У здоровой собаки концентрация ГР в плазме крови через 15-30 мин после стимуляции должна быть выше 10 нг/мл (обычно она превышает 30 нг/мл). У собак с чувствительным к ГР дерматозом, концентрация ГР в крови находится на уровне ниже определяемого на протяжении всего тестирования, а у животных с подозрением на частичную недостаточность ГР максимальное увеличение его концентрации не превышает 10 нг/мл (Bell et al, 1993). Секреция гипофизарного ГР подавляется при гипотиреозе, гиперкортицизме и нарушениях соотношений половых гормонов. Прежде чем приступать к интерпретации результатов пробы с ГР, следует исключить эти клинические состояния (Lothrop, 1988; Schmeitzel, Lothrop, 1990; Rijnberk et al, 1993). Для оценки соматотропной функции полезно измерять концентра
цию глюкозы в пробе с клонидином, особенно если недоступно определение самого ГР.
Проба с рилизинг-гормоном гормона роста. Применение этой пробы для выявления дерматоза, чувствительного к ГР, исследовалось Lothrop (1986) и Rijnberk et al (1993). Введение нормальным собакам человеческого ГРРГ в дозе 1 мкг/кг вызывало в течение 5 минут увеличение концентрации ГР в крови до 10—60 нг/мл (Abribat et al, 1989; Meij et al, 1996). У 6 собак с подозрением на приобретенную недостаточность ГР базальная концентрация ГР была понижена или оставалась в нормальных пределах и не изменялась во время провокационных проб с ГРРГ и ксилазином. Применение ГРРГ более подробно описано в разделе, посвященном диагностическим пробам со стимуляцией секреции ГР.
Базальная концентрация ИФР-1. В то время как у собак с гипофизарной карликовостью базальная концентрация ИФР-1 низкая, у некоторых особей чау-чау, померанов и пуделей с чувствительным к ГР дерматозом она оставалась в норме (Lothrop, 1988; Rijnberk et al, 1993). Причина сохранения нормальной концентрации ИФР-1 у этих животных неизвестна, и, возможно, что у них клинические признаки заболевания не связаны с недостаточностью ГР.
Функция щитовидной железы. Оценка функции щитовидной железы у собак рекомендуется во всех случаях подозрения на чувствительный к ГР дерматоз, поскольку гипотиреоз сопровождается обратимым подавлением секреции ГР в плазме крови и должен быть исключен посредством дифференциальной диагностики (Lothrop, 1988). Методы оценки функции щитовидной железы более подробно описана в гл. 3.
Функция коры надпочечников. Оценка функции коры надпочечников у собак показана во всех случаях подозрения на чувствительный к ГР дерматоз, поскольку в отсутствие других клинических признаков заболевания (полиурии, полидипсии, одышки, общей слабости) причиной алопеции может быть гиперкортицизм. Кроме того, гиперкортицизм и экзогенные глюкокортикоиды обратимо подавляют секрецию ГР (Peterson, Altszuler, 1981; Regnier, Gamier, 1995). Рекомендуемая проба с АКТГ позволяет идентифицировать как ятрогенный, так и спонтанный гиперкортицизм. Более подробные сведения о диагностических пробах для выявления гиперкортицизма приведены в гл. 6.
Методы диагностики эндокринной алопеции и установление диагноза чувствительного к ГР дерматоза
Эндокринная алопеция часто встречается у собак и реже у кошек. Обычно это двустороннее симметричное нарушение шерстяного покрова, поражаю
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 71
щее, в зависимости от причины, разные части тела. У животных выпадает шерсть, кожа истончается, теряет упругость и подвергается гиперпигментации. Другие дерматологические нарушения, в частности шелушение кожи, струпья и папулы, отсутствуют. При некоторых формах основного заболевания возможны себорея и пиодермия.
Возможные причины эндокринной алопеции перечислены в табл. 2-10. Они выявляются путем анамнестического анализа и физикального исследования животного, а для подтверждения диагноза используют функциональные пробы. Если данные анамнеза и физикального исследования не позволяют установить этиологию алопеции, необходимо последовательно исключить возможные причины, начиная с наиболее вероятной.
Самыми распространенными причинами эндокринной алопеции у собак являются гипотиреоз или избыток глюкокортикоидов (ятрогенный или идиопатический). Выявление причины алопеции начинают с ОАК, биохимического анализа крови и анализа мочи. Если полученные показатели не позволяют установить диагноз, (например, все по
казатели оказываются в норме), то следует одновременно провести диагностические тесты с целью выявления гипотиреоза (см. гл. 3) или гиперкорти-цизма (см. гл.6), поскольку избыток глюкокортикоидов подавляет базальную концентрацию тиреоидных гормонов в крови. При отсутствии гипотиреоза и гиперкортицизма дальнейшая диагностика усложняется. В таких случаях в качестве возможных причин алопеции остаются чувствительный к ГР дерматоз или нарушение соотношения стероидных гормонов половых желез и надпочечников. К сожалению, эти патологические состояния с трудом поддаются дифференцировке, отчасти из-за сходства клинических и гистологических характеристик кожи и отсутствия соответствующих методов дифференциальной диагностики. Следует учитывать также фолликулярную дисплазию, которая дает сходную клиническую картину.
Чувствительный к ГР дерматоз не выявляется на основании анамнеза и физикального исследования, и его клинические признаки сводятся к эндокринной алопеции и гиперпигментации. Заболевание диагностируется с помощью проб со стимуляцией
ТАБЛИЦА 2-10. РАССТРОЙСТВА, ВЫЗЫВАЮЩИЕ ЭНДОКРИННУЮ АЛОПЕЦИЮ
Расстройство Частые клинико-патологические нарушения Диагностический тест
Гипотиреоз Гиперхолестеринемия, слабая нерегенеративная анемия Определение базального уровня общего и свободного Т4, ТТГ
Г иперкортицизм Стрессовая лейкограмма, повышенная активность ЩФ в сыворотке крови, гиперхолестеринемия, гипостенурия, инфекция мочевых путей Пробы с АКТГ и низкими дозами дексаметазона, определение отношения содержания кортизола и креатинина в моче
Недостаточность ГР - гипофизарная карликовость Отсутствуют Анализ предрасположенности, физикальное исследование, тест стимуляции ГР
Дерматоз, чувствительный к ГР, у взрослых собак Отсутствуют Тест стимуляции ГР, оценка реакции на заместительную терапию ГР
Дерматоз, чувствительный к кастрации Отсутствуют Оценка реакции на кастрацию
Избыток эстрогенов
Функционально-активная опухоль Отсутствуют (иногда подавле- Физикальное и гистопатологическое исследо-
клеток Сертоли у кобелей ние функции костного мозга) вание, определение концентрации эстрогенов и ингибина в плазме крови
Гиперэстрогенизм у интактных самок Отсутствуют (иногда подавление функции костного мозга) УЗИ брюшной полости, определение концентрации эстрогенов в крови, оценка реакции на овариогистерэктомию
Недостаток эстрогенов (?)
Дерматоз, чувствительный к эстроге- Отсутствуют Оценка реакции на эстрогенотерапию
нам, у овариэктомированных сук
Эндокринная алопеция у кошек См. ниже См. ниже
Недостаток андрогенов (?)
Дерматоз, чувствительный к тестос- Отсутствуют Оценка реакции на терапию тестостероном
терону, у кобелей
Эндокринная алопеция у кошек Отсутствуют Оценка реакции на комбинированную терапию эстрогенами, тестостероном и прогестинами
Телогенная дефлюкция (выпадение шерсти) Отсутствуют Анамнестический анализ последней беременности или диэструса
Сахарный диабет Гипергликемия, гликозурия Определение глюкозы в крови и моче
Дерматоз, обусловленный нарушением продукции половых гормонов в Отсутствуют Определение половых гормонов и их предшественников до и после введения АКТГ
надпочечниках
Прогестины Отсутствуют Определение концентрации прогестерона и 17-ОН-прогестерона в крови
Т - Тироксин, ТТГ - тиреотропный гормон, ЩФ - щелочная фосфатаза, АКТГ - адренокортикотропный гормон.
72 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
секреции ГР (см. табл. 2-6) и реакции собак на заместительную терапию ГР. Базальная концентрация ГР у животных с данной формой дерматоза остается такой же, как у здоровых собак. Для стимуляции секреции ГР чаще всего используется клонидин. Через 15-30 мин после его введения здоровым собакам концентрация ГР в крови поднимается выше 10 нг/мл, а у животных с подозрением на чувствительный к ГР дерматоз должна быть ниже 10 нг/мл или, что еще более показательно, ниже порога чувствительности метода определения. Гипотиреоз, гиперкортицизм и, возможно, нарушение соотношения половых гормонов сопровождаются уменьшением секреции гипофизарного ГР и должны быть исключены для правильной интерпретации результатов провокационных проб (Lothrop, 1988; Schmeitzel, Lothrop, 1990; Rijnberk et al, 1993). К сожалению, наборы для определения концентрации ГР у собак крайне ограничены. В связи с этим ставится предполагаемый диагноз, основанный на известной предрасположенности отдельных пород к данному заболеванию, анамнезе и результатах физикального обследования, отсутствии клинико-патологических изменений, обнаружении соответствующих нарушений гистологической картины кожных биоптатов и исключении более распространенных причин эндокринной алопеции. Если все полученные данные подтверждают наличие дерматоза, чувствительного к ГР, для постановки окончательного диагноза используют реакцию животного на заместительную терапию ГР.
Подозрение на нарушение соотношения стероидных гормонов, продуцируемых половыми железами или надпочечниками (см. следующий раздел), возникает в тех случаях, когда в течение 2 месяцев после начала терапии ГР у собаки не наблюдается улучшения клинического состояния (при условии исключения гипотиреоза и гиперкортицизма). С другой стороны, если результаты анамнестического анализа и физикального исследования предполагают нарушение соотношения половых гормонов, заместительной терапии ГР должны предшествовать соответствующие диагностические пробы и, по показаниям, иные способы лечения (кастрация, введение мелатонина).
Расстройства, сходные с чувствительным к ГР дерматозом
Гонадозависимый дисбаланс половых гормонов. Эндокринная алопеция может развиться вследствие избытка или недостатка одного из половых гормонов, особенно эстрогенов или андрогенов, либо в ответ на введение того или иного из этих гормонов (см. табл. 2-10). Клинические признаки при дерматозах, индуцированных половыми гормонами или чувствительных к половым гормонам, весьма похожи. К их числу относятся эндокринная алопеция (сначала в области гениталий, промежности
и вентральной части живота с последующим распространением на передние части тела); сухая, тусклая и легко выпадающая шерсть; отсутствие восстановления шерстяного покрова после клиппинга; разнообразные проявления себореи и гиперпигментации. В зависимости от этиологии могут появляться и другие клинические признаки. Так, например, у кобелей дополнительными признаками избытка эстрогенов служат гинекомастия, отвислый препуций, привлекательность для других кобелей, приседание при мочеиспускании и односторонняя тестикулярная атрофия (контрлатеральная тестикулярной опухоли). У сук дополнительные признаки включают увеличение наружных половых органов, непрерывный проэструс, эструс или анэструс. Кожные изменения при индуцируемом половыми гормонами или чувствительном к ним дерматозе напоминают изменения, характерные для дерматоза, чувствительного к ГР. Это значительно затрудняет диагностику, особенно когда алопеция имеет место у пород с известной предрасположенностью к чувствительному к ГР дерматозу (например, у собак померанской породы).
Диагностика индуцируемого половыми гормонами или чувствительного к ним дерматоза базируется на учете предрасположенности к нему, анализе анамнеза, результатов физикального исследования и гормональных проб, проводимых в целях исключения других причин эндокринной алопеции, а также реакции на терапию. Для выявления неспецифических гор-мон-зависимых изменений и подтверждения диагноза эндокринной алопеции проводят гистологическое исследование кожных биоптатов (см. табл. 2-5). При индуцируемом половыми гормонами или чувствительном к ним дерматозе отсутствуют патогномонические гистологические изменения. Обнаружение повышенной концентрации эстрогенов в плазме крови собак указывает на наличие функционально активной опухоли клеток Сертоли у кобелей и гиперэстрогенизма у сук (если во время обследования они не находятся в фазе проэструса или раннего эструса). УЗИ брюшной полости позволяет выявить яичниковые кисты или неоплазию у сук с гиперэстрогенизмом. Однако, в конечном счете, диагноз при большинстве этих расстройств зависит от реакции животного на терапию (табл. 2-11). Учитывая вероятность тяжелых побочных эффектов терапии, введению того или иного стероидного гормона (например, диэтилстильбэстрола или метил-тестостерона) всегда должно предшествовать исключение наиболее частых причин эндокринной алопеции. Улучшение состояния шерстяного покрова должно наступить в течение 3 месяцев после начала лечения. Если улучшения не произошло, следует пересмотреть диагноз.
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 73
ТАБЛИЦА 2-11. ЛЕЧЕНИЕ ИНДУЦИРОВАННОЙ ПОЛОВЫМИ ГОРМОНАМИ ИЛИ ЧУВСТВИТЕЛЬНОЙ к ним эндокринной алопеции
Нарушение Первичная терапия Возможные побочные эффекты терапии
Неоплазия клеток Сертоли Кастрация Отсутствуют
Дерматоз, чувствительный к кастрации Кастрация Отсутствуют
Избыток эстрогенов у интактных сук Овариогистерэктомия Отсутствуют
Дерматоз, чувствительный к эстрогенам, у овариэктомированных сук Диэтилстильбэстрол, 0,1—1,0 мг перорально 1 раз в стуки на протяжении 3 недель в месяц; при наличии реакции - 0,1-1,0 мг каждые 4-7 дней Апластическая анемия
Эндокринная алопеция у кошек Мегестрол ацетат, 1 мг/кг раз в 2 дня до возобновления роста шерсти, затем по 2,5-5,0 мг каждые 7-14 дней Угнетение функции надпочечников, доброкачественная гипертрофия или неоплазия молочных желез, пиометра (у самок), бесплодие (у самцов), сахарный диабет
Дерматоз, чувствительный к тестосте- Метилтестостерон, 1 мг/кг (макси- Агрессивное поведение, заболевание
рону мум 30 мг) перорально раз в 2 дня до возобновления роста шерсти, затем каждые 4-7 дней. печени
Телогенная дефлюкция (выпадение шерсти) Отсутствует Отсутствуют
Нарушение продукции половых гормонов в надпочечниках Гормон роста, кастрация, мелатонин, митотан Сахарный диабет, гипокортицизм
Зависимое от надпочечников нарушение соотношения половых гормонов. Нарушение соотношения половых гормонов вследствие дисфункции коры надпочечников может быть первичным или обусловленным гиперкортицизмом. При зависимом от гипофиза гиперкортицизме у собак может быть увеличена продукция половых гормонов и их предшественников, однако преобладающие клинические признаки, такие как полиурия и полидипсия, связаны с избыточной продукцией кортизола (Frank et al, 2001). Концентрация половых гормонов может возрастать также при зависимом от надпочечников гиперкортицизме и влиять на дерматологические проявления этого заболевания (алопеция на боковых поверхностях тела, изменение окраски шерстяного покрова). У кошек описаны опухоли коры надпочечников, секретирующие прогестерон (Boord, Criffin, 1999; Rossmeisl et al, 2000). Клинические проявления этих опухолей были такими же, как при гиперкортицизме, возможно, потому что прогестерон действует как агонист глюкокортикоидов. У собак с признаками гиперкортицизма отмечали повышение базальной и индуцируемой введением АКТГ концентрации 17-гидроксипрогестерона при нормальной концентрации кортизола после инъекций АКТГ или дексаметазона (Ristic et al, 2001).
Синдром, подобный врожденной гиперплазии надпочечников, характеризуется клиническими признаками, сходными с таковыми при дерматозе, чувствительном к ГР. Этот синдром описан у собак различных пород, но особенно часто встречается у померанов, чау-чау, кеесхондов и самоедских лаек (Scott et al, 2001). Он может развиться у собак обоего пола, но особенно часто встречается у кобелей. Полагают, что частичная недостаточность кортизола и альдостерона у этих собак обусловлена дефицитом одного из ферментов надпочечников: 110-гидрок-силазы, 21-гидроксилазы или 30-гидроксистероид-
дегидрогеназы (рис. 2-11) (Schmeitzel et al, 1995). Недостаток кортизола и альдостерона, в свою очередь, стимулирует секрецию гипофизарного АКТГ, развитие гиперплазии надпочечников и накопление предшественников стероидных гормонов на стадиях, предшествующих блокированным этапам их биосинтеза. У собак с врожденной гиперплазией надпочечников обычно повышается концентрация прогестерона и его предшественников (в частности, 17-гидроксипрогестерона). Прогестерон обладает антиандрогенной активностью, и алопеция может быть следствием локального недостатка андрогенов (Scott et al, 2001). Терапия метилтестостероном способствует отрастанию шерсти у некоторых собак (Lothrop, Schmeitzel, 1990).
Стероиды-предшественники (например, 17-гидроксипрогестерон) могут вовлекаться в другие обменные процессы, особенно в биосинтез андрогенов, что в конечном итоге приводит к повышению концентрации дегидроэпиандростерона и андростендиона (Frank et al, 2001). В исследовании на группе померанских шпицев с подозрением на недостаточность 21-гидроксилазы средние концентрации 17-гидроксипрогестерона, дегидроэпиандростерона и андростендиона в сыворотке крови были значительно выше, чем у здоровых животных (табл. 2-12 и 2-13) (Schmeitzel, Lothrop, 1990). Интересно, что не все обследованные собаки имели клинические признаки заболевания. Авторы высказали предположение, что у больных животных имела место «поздняя» форма 21-гидроксилазной недостаточности, которая обусловила развитие клинических признаков в начале пубертатного периода. У кажущихся здоровыми шпицев была выявлена скрытая форма этой ферментативной недостаточности, которая сопровождалась сходными гормональными нарушениями, хотя клинические проявления отсутствовали. (Schmeitzel, Lothrop., 1990).
74
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Холестерин
Фермент, отщепляющий боковую цепь холестерина |
Прогестерон
Андростендион
17-оксипрогестерон ________________________L 21-гидроксилаза
Дезоксикортикостерон | 11|3-гидроксилаза |
сн2он
Кортикостерон
Рис. 2-11. Пути биосинтеза стероидов в коре надпочечников. Показаны пути образования глюкокортикоидов, минералокортикоидов и андрогенов надпочечников, а также химическая структура этих стероидов и их биосинтетических предшественников. Названия участвующих в биосинтезе ферментов помещены в рамку. По: Orth DN, Kovacs W: In: Wilson J, Foster D, Kronenberg H, Larsen P (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 523.
Альдостерон
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
75
ТАБЛИЦА 2-12. КОНЦЕНТРАЦИЯ ПОЛОВЫХ ГОРМОНОВ В СЫВОРОТКЕ ДО И ПОСЛЕ СТИМУЛЯЦИИ АДРЕНОКОРТИКОТРОПИНОМ (АКТГ) У ЗДОРОВЫХ СУК (КОНТРОЛЬНАЯ ГРУППА) И У ПОМЕРАНСКИХ ШПИЦЕВ С ЧУВСТВИТЕЛЬНЫМ К ГОРМОНУ РОСТА ДЕРМАТОЗОМ ИЛИ БЕЗ НЕГО
Половые гормоны Введение АКТГ Контроль (п = 9) Померанский шпиц без дерматоза (н = 8) Померанский шпиц с дерматозом (п = 3)
Прогестерон (нг/мл) До 0,4 (±0,5)* 1,8 (±1,2)**’ 0,8 (±0,5)***
После 1,4 (±1,7)* 6,8 (±1,4)**а у 6****
17-гидроксипрогестерон (нг/мл) До 0,4 (±0,4) 1,3 (±1,1)а 1 4 (il 1)*****а
После 1,9 (±1,1) 6,6 (±2,8)“ 18,9 (±8,7)*****6
11-дезоксикортизол (нг/мл) До 0,5 (±0,1) 1,2 (±0,6)а 2,0 (±0,6)*****а
После 5,6 (±2,6) 7,0 (±2,0) 13 5 (±Ц}4)*****
ДГЭАС (нг/мл) До 6,6 (±2,0) 14,8 (±7,8)а 15,8 (±6,1)*****“
После 8,4 (±1,7) 20,4 (±11.3)“ 26,8 (±14,8)*****“
Андростендион (нг/мл) До 5,2 (±6,4) 2,8 (±1,4) 2,5 (±0,7)*****
После 7,1 (±12,8)) 9,2 (±5,1) 15 3 (±5 9)*****
Тестостерон (нг/мл) До 0,1 (±0,0) 0,0 (±0,0)а о,1 (±0,2)
После 0,1 (±0,0) 0,0 (±0,0)а 0,0 (±0,0)*****
170-эстрадиол (пг/мл) До 33,8 (±21,2) 29,6 (±19,8) 8,1 (±10,5)“
После 29,9 (±16,1) 39,6 (±21,7) 5 0 (±7,1)*****
Из: Schmeitzel LP, Lothrop CD, Jr: Hormonal abnormalities in Pomeranians with growth hormone-responsive dermatosis. JAVMA, 197:1337, 1990.
*) n = 8; 1 самка имела высокую концентрацию прогестерона вследствие метэструса; результаты не использовались при статистическом анализе.
** ) п = 5; 3 самки имели высокую концентрацию прогестерона вследствие метэструса; результаты не использовались при статистическом анализе.
** *) п = 2; 1 самка имела высокую концентрацию прогестерона вследствие метэструса; результаты не использовались при статистическом анализе.
** **) n = 1; у 1 самки определения не проводились; 1 самка имела высокую концентрацию прогестерона вследствие метэструса; результаты не использовались при статистическом анализе.
** ***) п = 2; у 1 самки определения не проводились.
(“) Р < 0,05 по сравнению с контрольными собаками
О р < 0,05 по сравнению с контрольными собаками и померанскими шпицами без дерматоза
ДГЭАС - дегидроэпиандростерон-сульфат.
Данные представлены как средние величины (±SD).
ТАБЛИЦА 2-13. КОНЦЕНТРАЦИИ ПОЛОВЫХ ГОРМОНОВ ДО И ПОСЛЕ СТИМУЛЯЦИИ АДРЕНОКОРТИКОТРОПНЫМ ГОРМОНОМ У ЗДОРОВЫХ КОБЕЛЕЙ (КОНТРОЛЬНАЯ ГРУППА) И КОБЕЛЕЙ ПОМЕРАНСКИХ ШПИЦЕВ С ЧУВСТВИТЕЛЬНЫМ К ГОРМОНУ РОСТА ДЕРМАТОЗОМ И БЕЗ НЕГО
Половые гормоны Введение АКТГ Контроль (п = 10) Померанский шпиц без дерматоза (п = 4) Померанский шпиц с дерматозом (п = 4)
Прогестерон (нг/мл) До 0,4 (±0,5)* 1,8 (±1,7)** 0,4 (±0,2)
После 1,1(±1,2)* 4,4(±1,1)* 2,7 (±0,9)*
17-гидроксипрогестерон (нг/мл) До 0,3(±0,4) 1,2 (±0,6)* 0,5 (±0,2)
После 1,4 (±0,9) 3,2 (±1,0)* 2,1 (±1,0)
11-дезоксикортизол (нг/мл) До 0,9 (±1,0) 2,2 (±2,1) 1,0 (±0,3)
После 4,7 (±1,5) 6,8 (±1,5)* 4,3 (±1,8)
ДГЭАС (нг/мл) До 18,5 (±11,5) 53,9 (±34,0)* 33,3 (±17,8)
После 20,8 (±10,9) 70,2 (±24,7)* 34,7 (±15,0)
Андростендион (нг/мл) До 13,3(±10,1) 31,8 (±24,1) 36,6 (±30,0)*
После 12,2 (±6,7) 29,9 (±18,4)* 33,0 (±13,7)*
Тестостерон (нг/мл) До 3,1 (±4,2) 5,6 (±4,6) 2,3 (±3,6)
После 2,6 (±4,1) 2,6 (±2,2) 1,0 (±1,0)
170-эстрадиол (пг/мл) До 18,7 (±14,6) 4,6 (±5,3) 19,1 (±4,7)
После 15,6 (±8,6) 9,4 (±8,3) 17,2 (±7,0)
Из: Chmeitzel LP, Lothrop CD, Jr: Hormonal abnormalities in Pomeranians with growth hormone-responsive dermatosis. JAVMA, 197, 1337, 1990.
*) P < 0,05 по сравнению с контролем.
** ) P < 0,05 по сравнению с померанскими шпицами без дерматоза. Данные представлены как средние величины (±SD).
См. подписи к табл. 2-12.
76 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Рис. 2-12. А. Шестилетняя сука померанской породы с приобретенным дерматозом, чувствительным к ГР. Б. Та же собака через 3 месяца после начала заместительной терапии экзогенным свиным ГР. В. Трехлетняя овариэктомированиая сука тибетского терьера с чувствительным к ГР дерматозом. Г. Та же собака через 3 месяца после начала заместительной терапии экзогенным рекомбинантным человеческим ГР.
Рис. 2-13. А. Двухлетняя овариэктомированиая сука миниатюрного пуделя с подозрением на приобретенный чувствительный к ГР дерматоз. Б. Та же собака после двух серий из 10 инъекции рекомбинант-Hoi о человеческого гормона роста (фото T.Olivery, Raleigh, NC.)
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 77
Рис. 2-14. А. Двухлетняя овариэктомированная сука самоедской лайки с эндокринной алопецией неясного происхождения. Терапия тиреоидным гормоном, двумя сериями инъекций рекомбинантного человеческого ГР и половыми гормонами нс привела к улучшению. Б. Та же собака через 6 месяцев после полною прекращения дальнейших попыток лечения.
В кожных биоптатах собак с подозрением на синдром, подобный врожденной гиперплазии коры надпочечников, обнаружены характерные для эндокринной алопеции изменения (см. табл. 2-5), а также признаки фолликулярной дисплазии (Scott et al, 2001). При диагностике половые гормоны и их предшественники необходимо определять до и после введения АКТГ. Методы лечения синдрома, сходного с врожденной i иперплазией надпочечников, включают кастрацию, введение метил тестостерона (см. табл. 2-11), терапию ГР (см. ниже) или мелатонином (3-6 мг через каждые 12-24 часа на протяжении 6 недель) (Ashley et al, 1999; Paradis, 2000), а также терапию о,р’-ДДД (в начальной дозе 15-25 мг/кг ежедневно, пока концентрация кортизола в крови после введения АКТГ не будет возрастать до 2-5 мкг/мл, после чего назначают поддерживающую терапию) (см. гл. 6; Rosenkrantz, Griffin, 1992; Schmeitzel et al, 1995). В процессе лечения необходимо непрерывное наблюдение за состоянием животного. Терапия о.р'-ДДД считается наиболее эффективной при синдроме, подобном врожденной гиперплазии надпочечников, поскольку она вызывает некроз и атрофию пучковой и сетчатой зон коры надпочечников (Schmeutzel ei al, 1995). У собак с этим синдромом отсутствуют иные клинические проявления, кроме алопеции, и многие владельцы воздерживаются от лечения из-за его высокой стоимости и или из-за боязни осложнений, связанных с применением метилтестостерона ГР или о,р’-ДДД.
Лечение дерматоза, чувствительного к ГР
Традиционно для лечения чувствительного к ГР дерматоза используют ГР. К сожалению, для собак еще не создан эффективный препарат этого гормона. Рекомбинантный человеческий ГР дорог и не всегда доступен. Кроме того, у собак он может вызывать образование антител, которые снижают эффектив
ность его действия. Рекомбинантный ГР крупного рогатого скота предназначен для введения именно этой группе животных и не пригоден для использования в концентрациях, рекомендуемых для собак. Свиной 1 Р иммунологически сходен с ГР собак, однако поставляется нерегулярно. Свиной ГР рекомендуется вводить собакам подкожно в дозе
0,01 ME (0.05 мг) трижды в неделю на протяжении 4-6 недель. Основными побочными эффектами терапии ГР являются аллергические реакции (включая ангионевротический отек), нарушение толерантности к углеводам и явный сахарный диабет. Важное значение имеет регулярный мониторинг уровня сахара в моче и крови для своевременного выявления гипергликемии (т.е. концентрации глюкозы в крови более 150 мг/100 мл). В случае развития гипергликемии следует отменить введение ГР. Эффективность терапии оценивают по возобновлению роста шерсти и увеличению толщины кожи. Состояние шерстяного покрова должно улучшаться в течение 4—6 недель после начала лечения (рис. 2-12). В первую очередь отрастает подшерсток или вторичные волосы, тогда как рост покровной (первичной) шерсти носит непостоянный характер. Продолжительность клиническом ремиссии у собак с чувствительным к ГР дерматозом, которые реагируют на лечение, различна; она может длиться до 3 лет после лечения. При рецидивах дерматологических расстройств назначают повторный 1-недельный курс терапии ГР.
Прогноз
Отдаленный прогноз благоприятен даже в отсутствие терапии ГР. Большинство животных в конечном итоге теряют основную часть шерстяного покрова на груди и животе (на голове и дистальной поверхности конечностей он нс страдает), а их кожа приобретает черную окраску. В других отношениях животные выглядят здоровыми.
78
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
АКРОМЕГАЛИЯ У КОШЕК
Этиология
Гипофизарная неоплазия. Постоянно избыточная секреция ГР у взрослых кошек приводит к акромегалии - хроническому заболеванию, при котором аномально усиливается рост соединительной ткани, костей и внутренних органов. Наиболее частой причиной акромегалии у кошек является функционально активная аденома соматотрофов передней доли гипофиза (рис. 2-15; Peterson et al, 1990). При диагностике гипофизарная опухоль у подавляющею большинства кошек легко визуализируется с помощью КТ или МРТ. Как правило, опухоль имеет диаметр более 1 см (макроаденома) и разрастается в дорсальном направлении, проникая в гипоталамус и таламус либо сдавливая их (рис. 2-16). На ранних стадиях заболевания опухоль гипофиза может не выявляться при КТ и МРТ, однако она обнаруживается со временем по мере ее роста (рис. 2-17). При наличии опухоли секреция I Р усиливается и, по-видимому, одновременно нарушается ее регуляция по механизму обратной связи. У человека сохраняется пульсирующий характер секреции, однако частота, продолжительность и амплитуда пульсов увеличиваются. Обычно они иере1 улярно повторяются в течение суток
Рис. 2-16. Компьютерная tomoi рамма гипофизарной области 8-летнего кастрированного кота с инсулинорезистентным сахарным диабетом и акромегалий. Стрелкой показана посторонняя масса в гипоталамо-гипофизарной области. Эта масса выявляется без использования контрастного материала.
(Thorner et al, 1998). Сохраняются также нормальные выбросы ГР в ночное время, но нарушается ответ в тестах стимуляции и подавления секреции. В частности, отсутствует подавление секреции ГР глюкозой, что можно использовать для диагностики акромегалии.
опухоль, секретирующая ГР
опухоль секретирующая ГРРГ
Нормальная гипофизарная функция
Повышенная Повышенная Нормальная
Повышенная Повышенная Нормальная
Повышенная
Повышенная
Повышенная
Концентрация ГР в Повышенная (95%)
сыворотке крови натощак Повышенная (95%)
(в пер. половине дня) < 5 мкг/л Нормальная
ИФР-1 < 2,5 Ед/мл
ГРРГ <10 нг/л
Динамика ответа ГР
Глюкоза
< 2 мкг/л
Визуализация
Гипофиз
Отсутствие подавления (90%) Стимуляция (10%)
Аденома (95%) Пустое турецкое седло (5%)
Отсутствие подав-
Отсутствие подав-
ления
ления
Отсутствие подавления
Брюшная или грудная полость Нормальная
Относительная частота
(95%)
Нормальный или уменьшенный
Посторонняя масса Очень редко
Опухоль гипоталамуса или увеличенный гипофиз
Нормальная Очень редко
Возможно увеличение турецкого седла
Посторонняя масса Редко
Рис. 2-15. Патогенез и диагностика четырех типов акромегалии, известных у человека. ГР - гормон роста, I РР1 - гормона роста рилизинг-гормон, ИФР-1 - инсулиноподобный фактор роста I, СТ - соматостатин, (+)- усиление секреции, (-) - подавление секреции. Из: Melmed S: N Engl J Med, 322: 966, 1990.
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 79
Рис. 2-17. А. Компьютерная томограмма гипофизарной области 6-лстнего кастрированного кота длинношерстной породы с инсулинорезистеитпым сахарным диабетом и подозрением на акромегалию. Базальная концентрация ИФР - 24 нмоль/л при норме 5-75 нмоль/л. КТ выявила диффузное контрастное увеличение гипофиза в пределах его нормальных размеров (показано стрелкой). Б. Компьютерная томограмма гипофизарной области того же кота через 8 месяцев. Сохраняется инсулинорезистентный сахарный диабет, признаки акромегалии выражены сильнее, концентрация ИФР-1 в сыворо1ке крови увеличилась до 189 нмоль/л, гипофизарная масса распространилась за пределы турецкого седла (показана стрелкой). В. Компьютерная томограмма гипофизарной области гого же животного спустя 8 месяцев после завершения кобальтовой радиотерапии. Сохраняется инсулинорезистентный сахарный диабет, концентрация ИФР-1 в сыворотке крови увеличилась до 265 нмоль л, гипофизарная масса видна по-прежнему (показана стрелкой). Объем гипофизарной массы не изменился по сравнению с ее размерами до проведения радиотерапии. Кот был жив через 3,5 гола после завершения лечения при сохранении инсулинорезистентного сахарного диабета и повышенной концентрации ИФР-1 в сыворотке крови.
Проценты. В отличие от собак, у кошек не описана индукция акромегалии прогестероном. Была показана экспрессия гена ГР в ткани молочной железы кошек, подвергшейся фиброаденоматозным изменениям под воздействием прогестерона (Mol et al, 1995), что предполагает возможность биосинтеза ГР в молочной железе. В то же время Peterson (1987) не наблюдал существенного повышения концентрации ГР в плазме крови кошек в условиях терапии мегестрол ацетатом на протяжении 12 месяцев. Church и соавторы (1994) также не обнаружили различий в концентрации ИФР-1 у кошек, получавших мегестрол ацетат или пролигестон, и у животных, которым вводили физиологический раствор.
Иная этиология. У человека менее 1% случаев акромегалии связано с избыточной продукцией ГРРГ (Thomer et al, 1998). Усиленная продукция ГРРГ имеет место при функционально активных опухолях гипоталамуса, в том числе гамартомах, хористомах,
глиомах и ганглионейромах. а также при периферических опухолях (см. рис. 2-15; Melmed, 1990; Thomer et al, 1998; Aron et al, 2001). К числу эктопических опухолей, секретирующих ГРРГ, относятся карциноидные опухоли бронхов, желудочно-кишечного тракта и поджелудочной железы, опухоль панкреатических островковых клеток, мелкоклеточная карцинома, аденома надпочечников и феохромоцитома. Имеются также сообщения о случаях акромегалии у людей вследствие эктопической секреции ГР опухолями панкреатических островковых клеток (см. рис. 2-15; Melmed et al, 1985). У собак и кошек акромегалия, вызванная избыточной продукцией ГРРГ или эктопического ГР, не описана. Обнаружение биосинтеза ГР в эпителии протоков молочных желез предполагает возможность развития акромегалии вследствие эктопической продукции ГР аденокарциномой молочных желез у собак и, вероятно, у кошек (Selman et al, 1994b; Mol et al, 1995).
80
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Патофизиология
Хроническая гиперсекреция ГР сопровождается как катаболическими, так и анаболическими эффектами. Последние обусловлены повышением концентрации ИФР-I (Middleton et al, 1985; Abrams-Ogg et al, 1993). Рост-стимулирующее действие ИФР-I вызывает пролиферацию костной, хрящевой и мягких тканей, а также увеличение размера отдельных органов. Эти анаболические эффекты лежат в основе классических клинических проявлений акромегалии. Катаболические эффекты ГР являются прямым следствием его антиинсулиновой активности в тканях. При избыточной продукции ГР тормозит утилизацию углеводов и транспорт глюкозы в клетки. Индуцируемая ГР инсулинорезис-тентность, по-видимому, обусловлена нарушением действия инсулина на пострецепторном уровне (Rosenfeld et al, 1982; Bratush-Marrain et al, 1982). В конечном счете развиваются непереносимость углеводов, гипергликемия и, при устойчиво высокой концентрации ГР в крови, сахарный диабет, который быстро становится резистентным к ин-сулинотерапии. Большинство кошек (но не все) с акромегалией, имеют сопутствующий сахарный диабет, и в последующем у них развивается тяжелая инсулинорезистентность. Так, 22 из 23 кошек, у которых в нашей клинике на протяжении последнего десятилетия была диагностирована акромегалия, одновременно имели инсулинорезистентный сахарный диабет.
Встречаем ость
Акромегалия чаще всего встречается у старых беспородных коротко- и длинношерстных котов (Peterson et al, 1990). Именно к таким кошкам относились 22 из 23 кошек, у которых в нашей клинике за последние 10 лет была диагностирована акромегалия; одна кошка была сиамской породы. Двадцать были кастрированными котами, а три - овариэкто-мированнымы самками. Возраст кошек на момент обнаружения акромегалии колебался от 4 до 17 лет (в среднем 10 лет, медиана 9 лет).
Клинические признаки
Результаты физикального исследования и клинические признаки заболевания зависят от катаболической, диабетогенной активности ГР, анаболического действия ИФР-I и роста гипофизарной макроаденомы (табл. 2-14). Наиболее ранние и типичные признаки включают полиурию (ПУ), полидипсию (ПД) и полифагию вследствие сопутствующего сахарного диабета (табл. 2-15). Полифагия, иногда весьма тяжелая, может также развиться независимо от сахарного диабета как непосредственный результат постоянно высокой секреции ГР. Вес тела при этом варьирует, отчасти в зависимости от соотношения анаболических эффектов ИФР-I и катаболических
ТАБЛИЦА 2-14. КЛИНИЧЕСКИЕ ПРИЗНАКИ АКРОМЕГАЛИИ У СОБАК И КОШЕК
Анаболические, индуцируемые ИФР-1
Дыхательные расстройства Инспираторный стридор Преходящая одышка Нехватка воздуха Непереносимость физических нагрузок
Быстрая утомляемость
Дерматологические расстройства Микседема
Лишние кожные складки Гипертрихоз
Нарушение пропорций тела Увеличение размеров тела Увеличение объема мягких тканей ротоглотки и языка
Увеличение
живота
головы стоп внутренних органов
Широкая морда
Выдающиеся челюстные
кости
Prognathia inferior
Увеличение межзубного расстояния
Быстрый пост когтей
Дегенеративная полиартропатия
Катаболические, индуцируемые ГР
Полиурия, полидипсия
Полифагия
Ятрогенные
Прогестины
Узлы в молочных железах
Пиометра
Индуцируемые неоплазией
Сонливость, ступор
Адипсия
Нарушение терморегуляции
Папилледема
Вертячка
Судороги
Диисфункция гипофиза
Гипогонадизм
Гипотиреоз Гипокортицизм
ИФР-1 - инсулиноподобный фактор роста I.
ТАБЛИЦА 2-15. КЛИНИЧЕСКИЕ ПРИЗНАКИ И РЕЗУЛЬТАТЫ ФИЗИКАЛЬНОГО ИССЛЕДОВАНИЯ У 23 КОШЕК С АКРОМЕГАЛИЕЙ
Клинические признаки Число кошек (%)
Плохо компенсированный сахарный 22 (96%)
диабет
Полиурия и полидипсия 19 (83%)*
Полифагия 18 (78%)*
Увеличение веса тела 8 (35%)
Потеря веса 2 (9%)
Сонливость 8 (35%)*
Увеличение размеров тела 3 (13%)*
Перемежающаяся слабость (гипоглике- 2 (9%)
мия)
Стридор и другие дыхательные рас- 1 (4%)
стройства
Изменения поведения 1 (4%)
Результаты физикального Число кошек (%)
исследования
Крупная кошка с большой головой, жи- 19 (83%)
вотом и стопами
Prognathia inferior 8 (35%)
Диабетическая нейропатия 6 (26%)
Гепатомегалия 6 (26%)
Реномегалия 5 (22%)
Неухоженная, свалявшаяся шерсть 5 (22%)
Сердечные шумы 4 (17%)
Стридор 2 (9%)
Эмоциональная тупость, ступор 2 (9%)
Увеличение объема мягких тканей в 1 (5%)
глоточной области
Большой язык 1 (5%)
Увеличенное расстояние между зубами 1(5%)
Дегенеративная артропатия 1(5%)
*) Включая кошек с акромегалией без сопутствующего сахарного диабета
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 81
Рис. 2-18. А и Б. Тринадцатилетнии кастрированный кот с инсулинорезистентным сахарным шаботом и акромс! алией Владельцы заметили постепенное увеличение размеров головы и ног животного. Обратите внимание на широкую морду и слегка выступающую нижнюю челюсть (прогнатия нижней челюсти). В. То же животное в возрасте 6 пет до возникновения сахарного диабета и акромегалии.
последствий инсулинорезистентности и гипергликемии. Большинство кошек с акромегалией сначала худеют, но затем быстро наступает период стабилизации, за которым следует медленный прирост веса по мере преобладания в клинической картине анаболических эффектов ИФР-I (см. табл. 2-15). Увеличение веса происходит несмотря на тяжелую инсулинорезистентность. В большинстве случаев подозрение на акромегалию возникает только после того, как с помощью инсулинотерапии не удается достигнуть эффективного контроля гипергликемии. Дозы инсулина, вводимого кошкам с акромегалией, зачастую превышают 2 ЕД/кг дважды в день, однако не вызывают существенного снижения концентрации глюкозы в крови. У наших 22 кошек с акромегалией и инсулинорезистентным сахарным диабетом средняя доза инсулина на инъекцию составляла 2,2 ЕД/кг (медиана 2,0 ЕД/кг, диапазон 1,1-4,4 ЕД/кг).
Анаболические эффекты избыточной секреции ГР (см. табл. 2-14) могут быть выявлены на основании клинических симптомов и физикального исследования уже в процессе диагностики сахарного диабета. Однако чаще они выявляются по истечении нескольких месяцев, обычно в связи с
неэффективностью контроля гипергликемии с помощью экзогенного инсулина. Из-за бессимптомного начала и медленного развития к шнических проявлений анаболической активности владельцы кошек часто не замечают небольшие изменения во внешнем виде животных до появления более выраженной симптоматики. Наиболее частой аномалией, регистрируемой ветеринарами, являются крупные размеры животного, большие голова и живот (см. табл. 2-15. рис. 2-18). Двадцать три обследованные нами кошки с акромегалией весили от 4,9 до 9,0 кг (в среднем 6,5 кг). Прирост веса тела или неизменный вес у крупных кошек с плохо компенсированным сахарным диабетом являются важным диагностическим признаком акромегалии. Другим таким признаком служит прогнатия нижней челюсти, отмеченная примерно у трети обследованных нами животных (рис. 2-19). Размеры органов, особенно сердца, почек, печени и надпочечников с течением времени увеличиваются. Реномегалия и гепатомегалия выявляются уже при физикальном исследовании. Диффузное утолщение мягких тканей ротоглотки может вызывать непроходимость экстраторакальных дыхательных путей, стридор и другие расстройства дыхания.
82 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Рис. 2-19. Восьмилетний кастрированный кот короткошерстной породы с инсулинорезистентным сахарным диабетом и акромегалией. Обратите внимание на выступающую нижнюю челюсть и смещение нижнего клыка. Компьютерная томограмма гипофизарной области этого животного приведена на рис. 2-16.
К числу сердечно-сосудистых расстройств относятся систолические шумы, галопирующий сердечный ритм, признаки кардиомегалии, выявляемые при рентгенографии, и жокардиографи-ческие проявления гипертрофированной кардиомиопатии (особенно гипертрофия перегородки и стенки левого желудочка). На более поздних стадиях заболевания появляются признаки застойной сердечной недостаточности (в частности, одышка, глухие тоны сердца и асцит) (Peterson et al, 1990). Возможна системная гипертензия, которая обычно бывает у кошек с акромегалией и сопутствующей недостаточностью функции почек. Гистологические изменения в миокарде включают гипертрофию мышечных волокон, многоочаговый миоцитолиз, интерстициальный фиброз и интрамуральный артериосклероз Причины сердечного заболевания неизвестны; оно может быть прямым следствием действия ГР на биосинтез белка или результатом системной гипертензии, при наличии таковой (van den Heuvel et al, 1984).
Дегенеративная артропатия была обнаружена у 43% обследованных кошек с акромегалией (Peterson et al, 1990), хотя явные симптомы заболевания суставов имелись только у половины этих животных. Поражались плечевые, локтевые, мсжзапястные, коленные, межфаланговые и межпозвонковые суставы. Рентгенологическое обследование выявляло у некоторых кошек вокругсуставную надкостничную реакцию, остеофиты, отек мягких тканей и уменьшение внутрисосудистого пространства. Другие патологические изменения включали эрозию и изъязвление суставного хряща, хондроидную гиперплазию и образование щелей. У обследованных нами кошек е акромегалией дегенеративная артропатия встречалась нечасто (см. табл. 2-15), возможно, вследствие выявления основного заболевания на ранних стадиях его развития благодаря улучшению наших диагностических возможностей. Патогенез артропатии при акромегалии окончательно не выяснен. Полагают, что она является следствием нсвоспалительного процесса, при котором гипертрофия и гиперплазия хрящевой ткани вызывают
нарушение геометрии сустава и обмена хондроцитов; в конечном счете, это приводит к дегенеративным изменениям в суставе (Johansen et al, 1983).
Рост гипофизарной опухоли, сопровождающийся се инвазией в гипоталамус и таламус либо их сдавливанием, может приводить к неврологическим расстройствам. Клинически они проявляются в форме ступора, сонливости, адипсии, анорексии, нарушения терморегуляции, вертячки, судорог и изменения поведения. Слепота развивается нечасто, поскольку зрительный перекрест находится кпереди от гипофиза. При офтальмологическом исследовании иногда выявляется папилледема. Вялость и сонливость могут быть следствием развития гипофизарной опухоли, но чаще они являются результатом плохо компенсированного сахарного диабета и устойчивой тяжелой гипергликемии. Другим следствием неудовлетворительной компенсации диабета является периферическая нейропатия, которая проявляется в форме общей слабости, атаксии, стопохождения и ухудшения состояния шерстяного покрова из-за ослабления ухода за ним со стороны самого животного. Реже встречаются другие эндокринные и обменные расстройства, обусловленные сдавливанием гипофиза опухолью. Более подробная информация о син (роме гипофизарнои макроопухоли представлена в гл.6.
Клиническая патология
Сопутствующий плохо компенсированный сахарный диабет является причиной многих нарушений, выявляемых с помощью ОАК и биохимического анализа сыворотки крови и мочи. Такие нарушения включают гипергликемию, гликозурию, гиперхолестеринемию и небольшое увеличение активности аланинтрансаминазы и щелочной фосфатазы. Кето-нурия встречается нечасто. Отмечались небольшой эритроцитоз, небольшая, но устойчивая гиперфосфатемия в отсутствие сопутствующей азотемии и устойчивая гиперглобулинемия (общая концентрация белков в сыворотке крови 8-10 мг/100 мл при сохранении их нормальной электрофоретической
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 83
подвижности) (Peterson et al, 1990). Считают, что устойчивая гиперфосфатемия без сопутствующей азотемии обусловлена задержкой фосфатов в почках под воздействием ГР. Слабый эритроцитоз у некоторых кошек связан с анаболическим действием ГР и ИФР-1 на костный мозг. Акромегалия может приводить к почечной не остаточности; при наличии последней развиваются также азотемия, изос-тенурия и протеинурия. Прогрессивная азотемия с клиническими признаками недостаточности функции почек была описана у 7 из 14 обследованных кошек с акромегалией (Peterson et al, 1990). Размер почек оставался нормальным или увеличивался, на вскрытии было выявлено утолщение мезангия почечных клубочков. Наиболее вероятной причиной почечной недостаточности у этих животных была гломерулонсфропатия, которая развилась вследствие неудовлетворительной компенсации сахарного диабета и/или хронического избытка ГР.
Диагностическая визуализация
Традиционная peirneiioi рафия. С помощью обычной рентгенографии у кошек с акромегалией были выявлены следующие изменения: диффузное увеличение объема мягких тканей в ротоглоточной области, дегенеративная артропатия плечевых, локтевых, коленных, межзапястных и/или межфаланговых суставов с признаками вокругсуставной надкостничной реакции, отека мягких тканей и уменьшения внутрисуставного пространства, спондилез позвоночного столба, увеличение нижней челюсти и гиперостоз костной ткани свода черепа (рис. 2-20; Peterson et al, 1990). Рентгенография грудной клетки позволяет идентифицировать слабую и тяжелую кардиомегалию, отек легких и плевральный выпот при наличии застойной сердечной недостаточности. Рентгенологическое исследование брюшной полости выявляет гепатомегалию и реномегалию. Наличие и тяжесть рентгенологических изменений зависят от продолжительности акромегалии.
ТАБЛИЦА 2-16. РЕЗУЛЬТАТЫ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ БРЮШНОЙ ПОЛОСТИ У 17 КОШЕК С АКРОМЕГАЛИЕЙ
Результаты ультразвукового несло ювания Число кошек (°о)
Гепатомегалия 9 (53%)
Рсномегалия 5 (29° о)
Расширение почечной лоханки 2(12%)
Двустороннее увеличение 4 (24° ь)
надпочечников
Увеличенная поджелудочная железа 3(18%)
Спленомегалия 1 (6%)
Размеры органов в норме 4 (24%)
Ультразвуковое исследование брюшной полости. У кошек с акромегалией УЗИ обычно выявляет мало изменений. Чаще всего это гепатомегалия, однако у многих животных она, по-видимому, является вторичным проявлением гепатолипидоза. обусловленного сахарным диабетом (табл. 2-16). При большой продолжительности акромегалии в дополнение к гепатомегалии, в конечном счете, развиваются реномагалия и адрсномегалия. Увеличение размеров надпочечников у кошек с тяжелым инсулинорезистентным сахарным диабетом предполагает, но не подтверждает наличие гиперкортицизма; одновременно возникает потозрение на акромегалию. К счастью, у этих животных остальные клинические симптомы и клинико-патологические изменения при акромегалии и гиперкортицизме различаются.
Компьютерная и магнитно-резонансная томография. КТ и МРТ являются важными инструментами диагностики акромегалии у кошек (см. раздел «Окончательный диагноз»). У большинства животных с подозрением на акромегалию КТ и МРТ выявляют гипофизарную опухоль (см. рис. 2-16). Наличие опухоли в сочетании с клинической симптоматикой и результатами определения концентрации ГР и ПФР-I в сыворотке крови позволяет уста-
Рис. 2-20. Л. Латеральная рентгенограмма черепа 13-летнсй кошки с инсулинорезистентным сахарным диабетом и акромегалией. Обратите внимание на гиперостоз костной ткани свода черепа. Б. Латеральная рентгенограмма черепа нормальной кошки.
84 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Рис. 2-21. А. Компьютерная томограмма гипофизарной области 13-летнего кастрировиниого кота с инсули-норезистентным сахарным диабетом и акромегалией (см. рис. 2-18). Концентрация ГР в крови составляла 54 нг/мл при норме менее 5 нг/мл. Стрелкой пока зана посторонняя масса в гипоталамо-гипофизарнои области, выявленная после внутривенной инъекции положительного контрастного вещества. Е. Компьютерная томограмм 1 гипофизарной области того же животного спустя 2 месяца после завершения кобальтовой радиотерапии. Базальная концентрация ГР в сыворотке крови к этому времени снизилась до 7 нг/мл. Контрастное вещество в гипоталамо-гипофизарнои области еще заметно (показано стрелкой), но объем массы уменьшился бо iee чем на 50° и.
новить окончательный диагноз. Для визуализации гипофизарной опухоли с помощью КТ или МРТ обычно требуется внутривенное введение контрастного материала (иодированного вещества при КТ и гадопентетата димеглумина при МРТ). Невыяв-ленис такой опухоли с помощью КТ и МРГ не исключает диагноза акромегалии, особенно на ранних стадиях заболевания (рис. 2-17). Определение размера и локализация опухоли посредством КТ или МРТ должно предшествовать радиотерапии; после ее начала сери шые КТ и МРТ томограммы позволяют оценить реакцию опухоли на облучение (рис. 2-2 Г).
Эндокринологическая оценка
Базальная концентрация ГР. Базальная концентрация ГР отчасти зависит от тяжести заболевания в момент ее определения. У большинства кошек с акромегалие: i и тяжелым инсулинозависимым диабетом на фоне видимых клинических расстройств, индуцируемых анаболическим действием ИФР-1, концентрация I Р в крови превышает 10 нг/мл и зачастую бывает выше 25 нг/мл при норме менее 5 нг/мл. Тем не менее, на ранних стадиях акромегалии (например, когда диабет еще отвечает на инсулинотерапию, а общее обследование выявляет лишь минимальные анаболические изменения) базальная концентрация ГР может оставаться на уровне 5-10 нг/мл. Она возрастает с течением времени, по мере того как снижается ответ на инсулин и становятся более заметными изменения, связанные с анаболическими эффектами.
У человека секреция ГР носит пульсирующий характер. В связи с этим случайное однокра! ное определение его концентрации в сыворотке дает мало
сведении для диагностики или исключения акромегалии. «Нормальная» концентрация может быть эквивалентна ее минимальной величине у больного акромегалией и, напротив, «высокая» концентрация может соответствовать пику секреции ГР у здорового человека (1 homer et al, 1998). Правильный диагноз позволяют поставить одновременное определение концентраций ГР и ИФР-1 (см. ниже) или динамика изменения уровня ГР в тесте толерантности к глюкозе.. В отсутствие акромегалии у людей концентрация ГР после нагрузки 50-100 г глюкозы снижается до уровня ниже 1 нг/мл (Stewart et al, 1989). У больных акромегалией концентрация ГР после введения глюкозы уменьшается, возрастает или не изменяется, однако не бывает ниже 1 нг, мл. Отсутствие более значительною подавления базальной секреции ГР подтверждает диагноз акромегалии. У собак с акромегалией внутривенные инъекции глюкозы также не вызывают существенного снижения базальной концентрации ГР (Eigenmann. Venker-van Haagen, 1981). Аналогичные исследования на кошках не проводились. Мы также не оценивали реакцию соматотрофов на введение глюкозы при диагностике акромегалии у кошек (см. раздел, посвященный диагностике).
Базальная концентрация ИФР-1. Измерение концентрации ИФР-I в сыворотке крови считается наилучшим способом скрининга на акромегалию у людей. Считается, что концентрация ИФР-1 в крови отражает общий уровень его секреции в течение предшествовавших суток 11оскольку концентрация 1 [ФР-I слабо изменяется на протяжении 24 часов и коррелирует с тяжестью клинических симптомов акромегалии, она может служить надежным показателем секреции ГР (Thomer et al, 1998). Концентрация ИФР-I повышена практически у всех людей с
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 85
Плохо компенсирован- Плохо компенсиро-ный диабет и акроме- ванный диабет
галия (20 кошек) (26 кошек).
Рис. 2-22. Распределение концентраций сывороточного инсулиноподобного фактора роста I (ИФР-1) у 20 кошек с плохо компенсированным сахарным диабетом, вызванным сопутствующей акромегалией, и у 26 кошек с плохо компенсированным диабетом, вызванным иным расстройством. Вертикальные Т-образные линии представляю! основной набор данных, большинство которых сосредоточено в области, ограниченной прямоугольником. Каждая диаграмма представляет интерквартильный диапазон (от 25-н до 75-и перцентили). Горизонтальная линия внутри каждого прямоугольника - медиана, а темные кружки - показатели, отклоняющиеся от основной массы данных. По: Nelson RW. In: Nelson RW, Couto GC (eds): Small Animal Internal Medicine, 3rd ed. St.Louis Mosby, 2003. p 676.
акромегалис i. Ее увеличение отмечено также у кошек с акромегалией (Middleton et al, 1985; Abrams-Ogg et al, 1993), что свидетельствует о возможности использования определения ИФР-1 в качестве полезного диагностического теста. Следует, однако, отметить что в одном из исследовании значение этого метода для определения избыточной секреции ГР было поставлено под сомнение, поскольку уровень ИФР-1 в сыворотке восьми произвольно отобранных кошек с сахарным диабетом оказался в 4 раза выше, чем у восьми здоровых животных (Lewitt et al, 2000). Ни у одной из кошек с сахарным диабетом не возникло подозрения на акромегалию. В то же время наш опыт свидетельствует о целесообразности определения концентрации ИФР-1 при скрининговых исследованиях избыточной продукции ГР у кошек с инсулинорезистентным диабетом (рис. 2-22).
Существуют коммерческие наборы для определения ИФР-1 в сыворотке крови (например, Diagnostic Endocrinology Laboratory, College of Veterinary Medicine, Michigan State LTniversity, East Lansing, Mich.). При использовании указанного набора нормальная концентрация ИФР-1 в сыворотке крови находится в диапазоне от 5 до 70 нмоль/л. а у большинства кошек с акромегалией она превышает 100 нмоль/л (см. рис. 2-22). Показатели от 70 до 100 нмоль/л не имеют диагностической значимости. Дело в том, что у некоторых кошек с инсулинорезистентным диабетом в отсутствие акромегалии концентрация ИФР-1 находится в пределах этого
диапазона, а у кошек с диабетом и акромегалией на ранних стадиях заболевания она держится на верхнем пределе нормы (см. рис. 2-17). В случае дальнейшего развития акромегалии повторные измерения спустя 3-6 месяцев обычно выявляют увеличение концентрации ИФР-1, которое, как правило, совпадает с возникновением и развитием соматотропиномы. Поскольку коммерческие наборы для определения ГР не всегда доступны, мы при рутинном скрининге на акромегалию у кошек измеряем уровень ИФР-1. Получаемые при этом данные следует интерпретировать с учетом анамнеза, ре зульта-тов физикального исследования, анализов крови и мочи и оценки инсулинорезистентности. Если клиническая картина предполагает наличие акромегалии и концентрация ИФР-1 в сыворотке повышена, то для подтверждения гипофизарной макроопухоли рекомендуется использовать КТ и МРГ.
Функция панкреатических бета-клеток. Существует тесная связь между сахарным диабетом инсулинорезистентностью и акромегалией. Известно также, что лечение акромегалии способствует устранению инсулинозависимого сахарного диабета. Эти факты поднимают интересный вопрос о функции панкреатических бета-клеток у кошек с акромегалией. Базальная концентрация инсулина в сыворотке подвержена колебаниям и частично зависит от длительности и тяжести гипсрсекре-ции ГР, тяжести патологических изменений в панкреатических островках и токсичности глюкозы. Вначале 0-клетки усиливают секрецию инсулина в ответ на индуцируемое ГР нарушение толерантности к углеводам и антагонистическое действие ГР. Гиперинсулинемия является естественной физиологической реакцией направленной на регуляцию концентрации глюкозы в крови. На ранних стадиях развития гиперсекреции ГР высокие концентрации инсулина способны поддерживать концентрацию глюкозы в крови на нормальном или слегка повышенном уровне. При продолжительном воздействии высоких концентраций I Р резистентность к инсулину усиливается, развиваются гипергликемия и. в конце концов, явный сахарный диабет. Кроме того, у кошек гипергликемия подавляет функцию 0-клеток. Это явление получило название «токсичность глюкозы» (см. гл. 12). В конечном итоге описанные процессы приводят к акромегалии, инсулинорезистентному сахарному диабету и гипоин-сулинемии. Теоретически, у кошек на фоне высоких концентрации ГР базальная секреция инсулина может быть низкой, нормальной или повышенной в зависимости от того, на какой стадии заболевания проводится измерение. Однако на практике ко времени установления диагноза акромегалии она остается в пределах нормы, либо понижена до уровня <10 мкЕд/мл. Это предполаг ает гипоинсулинсмию, зачастую на фоне выраженной гипергликемии. В то же время низкая концентрация инсулина в крови у кошек с акромегалией не всегда точно отражает состояние 0-клеток и не во всех случаях является
86 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
надежным прогностическим показателем обратимости сахарного диабета в условиях успешного лечения акромегалии. При тяжелом поражении 0-клеток и значительном уменьшении их популяции инсулинозависимый сахарный диабет может перейти в перманентное состояние. Восстановление функции 0-клеток и исчезновение явного диабета возможно в тех случаях, когда островки поражены в минимальной степени, сохраняются в достаточном количестве, а подавление их активности в результате токсичности глюкозы прекращается благодаря эффективному лечению акромегалии.
Функция щитовидной железы. У людей увеличение размеров органов при акромегалии затрагивает также щитовидную железу и ее пальпируемые узлы (Thomer et al, 1998). Аденоматозная гиперплазия щитовидной железы на фоне нормальной концентрации тиреоидных гормонов в крови была описана у некоторых кошек с акромегалией (Peterson et al, 1990). Аналогичные данные для собак отсутствуют. В тех случаях, когда определяли тиреоидные гормоны, их концентрация в сыворотке крови обычно была в норме (Peterson et al, 1990). Низкий уровень этих гормонов означал бы наличие синдрома эутиреоидной патологии (см. гл. 3). Теоретически вторичный гипотиреоз может развиться на поздних стадиях акромегалии, вызванной неоплазией, после того как нормальная гипофизарная ткань сдавливается разрастающейся макроопухолью или разрушается под воздействием радиотерапии. Однако такие ситуации встречаются редко. Повышенная секреция тиреоидных гормонов предполагает сопутствующий гипертиреоз (см. гл. 4).
Функция коры надпочечников. При тяжелом инсулинорезистентном сахарном диабете у кошек следует прежде всего провести дифференциальную диагностику гиперкортицизма и акромегалии (см. ниже). Кошек с подтвержденным диагнозом акромегалии нередко обследуют с помощью соответствующих тестов для оценки функции коры надпочечников. У животных с акромегалией описана многоузловая гиперплазия коры надпочечников разной тяжести (Peterson et al, 1990). УЗИ брюшной полости выявляет слабое двустороннее увеличение надпочечников (максимальная ширина железы 0,5-1,0 см), которое может свидетельствовать о зависимом от гипофиза гиперкортицизме. Одновременно возрастает отношение концентраций кортизола и креатинина в моче, возможно, из-за влияния неудовлетворительно компенсированного сахарного диабета на базальную концентрацию кортизола. К счастью, у кошек с акромегалией и инсулинорезистентным сахарным диабетом кора надпочечников сохраняет нормальный секреторный ответ на стимуляцию АКТГ и подавление дексаметазоном.
Окончательный диагноз
Кошки с акромегалией обычно поступают на ветеринарное обследование в связи с нарушениями,
обусловленными плохо компенсированным сахарным диабетом. В начале заболевания изменения пропорций тела (см. табл. 2-15) мало заметны и нередко ускользают от внимания владельцев. Они выявляются ветеринаром при физикальном исследовании и в сочетании с определенными сопутствующими признаками служат характерными показателями акромегалии. Если типичных изменений нет, акромегалия менее вероятна. В этом случае диагностика должна быть направлена на исключение более частых причин нарушения контроля гликемии (см. гл. 12). До их исключения, а также в отсутствие прогрессирующего изменения пропорций тела подозрение на акромегалию нельзя считать подтвержденным.
Для постановки диагноза акромегалии необходимо подтвердить повышение базальной секреции ГР. У кошек с этим заболеванием базальная концентрация ГР в сыворотке крови обычно выше 10 нг/мл (при норме менее 5 нг/мл). К сожалению, коммерческие наборы для определения ГР у кошек еще не созданы, а при направлении проб крови для анализа в исследовательские лаборатории результат становится известным спустя месяцы. У большинства кошек акромегалия устанавливается на основании следующих показателей: 1) изменение физических параметров (увеличение размеров тела, большие голова и нижняя челюсть, увеличение размеров внутренних органов) у животных с инсулинорезистентным сахарным диабетом; 2) устойчивое повышение (а не понижение) веса тела у кошек с плохо компенсированным сахарным диабетом; 3) повышенная концентрация ИФР-1 в сыворотке крови инсулинорезистентных кошек с характерными для акромегалии клиническими признаками и (4) наличие гипофизарной опухоли, подтвержденное с помощью КТ или МРТ (см. табл. 2-16). Кроме того, предварительному диагнозу акромегалии должно предшествовать исключение гиперкортицизма.
Акромегалия и гиперкортицизм. Акромегалия и гиперкортицизм иногда развиваются у старых кошек. Оба заболевания тесно связаны с сахарным диабетом, служат причиной тяжелой инсулиноре-зистентности и нередко индуцируют возникновение гипофизарных макропухолей (Elliot et al, 2000). У кошек акромегалия и гиперкортицизм сопровождаются клиническими проявлениями, характерными для плохо компенсированного сахарного диабета. В то же время дополнительные клинические признаки акромегалии и гиперкортицизма существенно отличаются, что создает основу для их дифференциальной диагностики. Гиперкортицизм - это изнуряющее расстройство, которое приводит к прогрессивной потере веса, кахексии, атрофии дермиса и эпидермиса; последняя, в свою очередь, служит причиной истончения кожи, ее повышенной хрупкости, частых разрывов и изъязвления (так называемый синдром хрупкой кожи кошачьих). В отличие от этого, в клинической картине акромегалии преобладают такие признаки, как изменение
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 87
физических параметров в результате анаболических эффектов хронического воздействия ИФР-1 (прежде всего, увеличение размеров тела и нижней челюсти, а также прирост веса несмотря на слабо компенсированный сахарный диабет). Синдром хрупкой кожи при акромегалии отсутствует. При обоих заболеваниях большинство нарушений, выявляемых с помощью рутинных анализов крови и мочи, обусловлено неудовлетворительной компенсацией сахарного диабета. Также в обоих случаях УЗИ брюшной полости выявляет слабое двустороннее увеличение надпочечников. Окончательный дифференциальный диагноз гиперкортицизма и акромегалии ставится на основании результатов тестирования системы гипофиз-кора надпочечников (см. гл. 7) и измерения концентраций I Р и или ИФР-1 в сыворотке крови.
Лечение
Цель лечения - уменьшить размер и эффекты гипофизарной макроопухоли, нормализовать секрецию ГР, устранить инсулинорезистентность и, по возможности, зависимость от инсулина при сахарном диабете, сохранив при этом другие функции гипофиза. У людей лечебные мероприятия включают
хирургическое вмешательство, облучение г ипофиза и медикаментозную терапию с использованием агонистов дофамина или аналогов соматостатина. Эти же методы применялись для лечения акромегалии у кошек, однако до сих пор не удавалось получить устойчивые положительные результаты.
Радиотерапия. В настоящее время радиотерапия считается наилучшим способом лечения акромегалии у кошек. При кобальтовой лучевой терапии облучение в общей дозе 45-48 Гр проводят ежедневно по 5 раз в неделю на протяжении 3-4 недель. Эффек! такого облучения непредсказуем: от полного отсутствия реакции до частичного уменьшения размеров гипофизарной опухоли и/ или концентрации ГР в сыворотке крови на фоне повышения чувствительности к инсулину либо до более значительного уменьшения опухоли, устранения гиперсекреции ГР и инсулинорезистептнос-ти и возвращения к состоянию субклинпческого диабета (Goossens et al. 1998) (см. рис. 2-17 и 2-23). Обычно после кобальтовог терапии уменьшаются объем опухоли и концентрации ГР и ПФР-1 в сыворотке крови, хотя улучшение может наступить только через 6 месяцев или более после облучения. У большинства кошек, состояние которых после радиотерапии улучшилось, спустя 12 -24 месяца
Рис. 2-23. А. МРТ гипофизарной области 4-лстнсго кастрированного кота с инсулинорезистентным сахарным диабетом и акромегалией. Базальная концентрация сывороточного ИФР-[ составляла 118 нмоль л при норме 5-75 нмоль/л. Выявлено диффузное контрастное увеличение гипофиза в пределах его нормальных размеров (показано стрелкой). Б. МРТ гипофизарной области того же животного спустя 3 месяца. Сохраняется инсулинорезистентный сахарный диабет и контрастное увеличение гипофиза (показано стрелкой), база ьная концентрация ИФР-I увеличилась до 153 нмоль/л. Гипофиз увеличился на 0,1- 0,2 см по сравнению с его размерами тремя месяцами ранее. В. Компьютерная томограмма гипофизарной области того же животного спустя 2,5 гола после завершения кобальтовой радиотерапии. Инсулинорезистентность отсутствует, потребность в инсулине на протяжении 2 лет изменялась, базальная концентрация ИФР-1 в сыворотке крови снизилась до 100 нмоль/л. Контрастное вещество в гинотала-мо-гипофизарной области еще заметно (показано стрелкой), но объем массы уменьшился примерно на 70* п.
88 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
после завершения лечения имеют место рецидивы сахарного диабета и/или инсулинорезистентности, хотя КТ и МРТ часто не выявляют увеличения опухолевой массы.
В нашей клинике в течение последнего десятилетия радиотерапия гипофизарных макроопухолей была проведена у 10 кошек с акромегалией. У трех особей в последующие 6 месяцев развилась гипогликемия, и одна из них погибла в результате тяжелых гипогликемических приступов через месяц после завершения облучения. Приступы гипогликемии были вызваны передозировкой инсулина, но не вследствие увеличения его дозы, а в результате значительного повышения чувствительности к нему тканей-мишеней. Инсулинозависимый сахарный диабет отсутствовал у пяти кошек спустя 6-9 месяцев после завершения радиотерапии. У одной из них на протяжении последующих двух лет имелся рецидивирующий транзиторный диабет, у двух рецидивирующий инсулинозависимый диабет через соответственно 1 и 3 года, а еще у двух эугликемия сохранялась более года после возвращения к состоянию инсулинонезависимого сахарного диабета.
К числу недостатков радиотерапии относятся ее ограниченная доступность, высокая стоимость, необходимость длительной госпитализации, частая анестезия и непредсказуемость исхода лечения. Наиболее распространенным осложнением у наших кошек была гипогликемия вследствие устранения инсулинорезистентности. У людей с акромегалией осложнения после радиотерапии включают вторичные гипотиреоз, гиперкортицизм и утрату зрения вследствие поражения зрительного нерва (Thomer et al, 1998). Сходные осложнения возможны и у кошек, хотя в нашей клинике мы не наблюдали их после радиационного лечения акромегалии. Более подробная информация о радиотерапии гипофизарных опухолей приводится в гл. 4.
Медикаментозная терапия. До сих пор не предложена эффективная медикаментозная терапия акромегалии у кошек. У 70% людей с акромегалией положительная динамика заболевания наблюдается при лечении дофаминовым агонистом бромокриптином, который также снижает концентрацию ГР в крови (Thomer et al, 1998). Применение агонистов дофмина для лечения акромегалии у кошек не описано. Использование дофмина в терапии гиперкортицизма у собак дало более чем скромные результаты (Drucker, Peterson, 1981) (см. гл. 6). Частые побочные реакции включали рвоту, анорексию, депрессию и изменение поведения.
Аналог соматостатина - октреотид (Novartis Pharmaceuticals, США) представляет собой циклический пептид, состоящий из 8 аминокислотных остатков. Его введение подавляет высвобождение ГР у здоровых людей и больных акромегалией в течение 8 часов (Plewe et al, 1984; Davies et al, 1986). Лечение октреотидом приводило к ослаблению клинических проявлений акромегалии и снижению концентраций ГР и ИФР-1 в крови почти у 90%
больных. Примерно у 30% уменьшался объем гипофизарной опухоли (Thomer et al, 1998). Реакция на терапию октреотидом положительно коррелирует с плотностью рецепторов соматостатина в ткани аденомы (Reubi, Landlot, 1989). К сожалению, у кошек с акромегалией октреотид не снижал концентрацию ГР в сыворотке крови и не повышал чувствительность к инсулину (Morrison et al, 1989; Peterson et al, 1990). Препарат вводили подкожно в дозах от 10 до 200 мкг два-три раза в день. Отсутствие эффекта у кошек до сих пор не получило объяснения, тем более что структура соматостатина высоко консервативна у разных видов животных. Среди возможных причин предполагаются отсутствие рецепторов соматостатина в секретирующих ГР соматотропных аденомах кошек, аномальное сродство их связывания с аналогами соматостатина, неправильный выбор режима терапии или ее недостаточно большая продолжительность, чтобы вызвать соответствующую реакцию.
Пегвисомант - это генноинженерный аналог человеческого гормона роста, который действует как антагонист рецепторов ГР (Fuh et al, 1992). В 12-не-дельном исследовании с двойным слепым контролем и использованием плацебо в качестве контроля пегвисомант значительно улучшал клинические и биохимические показатели у 112 человек с акромегалией (Trainer et al, 2000). Препарат хорошо переносился, повышение концентрации ГР было незначительным, в дальнейшем не возрастало и не было видимых признаков роста опухоли. Впоследствии было показано, что введение пегвисоманта в течение 1 года снижало концентрацию ИФР-1 в крови до нормы почти у 90% больных с акромегалией (van der Lely et al, 2001). Возможность применения пегвисоманта для лечения акромегалии у кошек требует исследования.
Хирургическое лечение. Транссфеноидальная селективная аденомэктомия, или гипофизэкто-мия, является методом выбора для лечения лиц с акромегалией. Исход операции зависит от размера опухоли и квалификации хирурга. Оперативное вмешательство показано в первую очередь при опухолях диаметром менее 1 см. При большем размере опухоли вероятность успешного исхода операции значительно понижается, особенно если опухоль распространяется на турецкое седло или в пещеристую пазуху (Thomer et al, 1998). Концентрация ГР в крови в послеоперационном периоде нормализуется примерно у 60% больных, причем чем меньше опухоль, тем лучше исход операции (Davis et al, 1993). Микрохирургическая транссфеноидальная гипофизэктомия оказалась эффективным способом лечения зависимого от гипофиза гиперкортицизма у кошек (см. гл. 7) (Meij et al, 2001), однако специальные хирургические методы для устранения акромегалии у этих животных не описаны. Сообщалось об успешном применении транссфеноидальной криотерапии у кошек с акромегалией (Abrams-Ogg et al, 1993). К сожалению,
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 89
в обозримом будущем применение хирургического лечения акромегалии у кошек будет по-прежнему ограничено из-за отсутствия соответствующего опыта и оборудования.
Прогноз
Краткосрочный и долгосрочный прогноз обусловленной опухолью гипофиза акромегалии у кошек должен быть осторожным. Продолжительность жизни колеблется от 4 до 60 месяцев (обычно 1,5-3 года) со времени установления диагноза. В большинстве случаев продуцирующие ГР опухоли гипофиза растут медленно, а неврологические расстройства, связанные с ростом опухоли, проявляются только на поздних стадиях заболевания. Сахарный диабет с трудом поддается контролю даже высокими дозами инсулина (20 ЕД и более на инъекцию при введении дважды в день), однако таких больших доз следует избегать. Тяжесть инсулинорезистентности у кошек с акромегалией претерпевает непредсказуемые изменения. Спустя месяцы после устойчивой инсулинорезистентности и концентрации глюкозы в крови выше 400 мг/100 мл возможен внезапный приступ угрожающей жизни гипогликемии. Две из поступивших к нам кошек с нелеченой акромегалией погибли через несколько месяцев после установления диагноза в результате гипогликемической комы, которая была вызвана неожиданным повышением чувствительности к инсулину, когда животные получали его в больших дозах (18 и 20 ЕД на инъекцию). Во избежание тяжелой гипогликемии содержание инсулина в одной инъекции не должно превышать 12-15 единиц. Большинство кошек с акромегалией, в конце концов, погибают или подвергаются эвтаназии из-за возникновения тяжелой застойной сердечной недостаточности, почечной недостаточности, расстройства дыхания, неврологических нарушений, связанных с разрастанием гипофизарной опухоли, или острой гипогликемической комы.
АКРОМЕГАЛИЯ У СОБАК
Этиологий
Прогестерон. Индуцируемая прогестероном акромегалия - наиболее частый тип этого заболевания у собак. Акромегалия может возникнуть после длительного введения прогестинов, особенно МПА, или в фазе диэструса у интактных взрослых самок (Eigenmann, Rijnberk, 1981; Eigenmann et al, 1983 a). У щенных собак с повышенной продукцией прогестерона акромегалия развивается не часто. Стимулируемая прогестинами секреция ГР не имеет пульсирующего характера, не чувствительна к воздействию ГРРГ или клонидина и не подавляется соматостатином (Watson et al, 1987; Selman et al, 1991). Повышение концентрации ГР под влия
нием прогестинов не сопровождается увеличением концентрации ИФР-1 в плазме крови (Selman et al, 1994а). Последующие исследования выявили очаги гиперплазии в эпителии протоков молочных желез в местах индуцируемой прогестинами продукции ГР (Selman et al, 1994b). Установлена экспрессия гена, кодирующего ГР, в молочных железах собак, нуклеотидная последовательность которого идентична последовательности гипофизарного гена ГР (Mol et al, 1995). Стимулирующее действие экзогенных прогестинов на секрецию ГР, по-видимому, зависит от дозы: чем больше доза, тем выше базальная концентрация ГР (Scott, Concannon, 1983). Акромегалия развивалась после введения МПА в дозах от 10 мг/кг один раз в три недели до таких небольших как 50 мг/кг дважды в год (Eigenmann, Rijnberk, 1981; Eigenmann et al, 1983 a). Введение эстрогенов ова-риэктомированным собакам усиливало стимулирующее действие МПА на продукцию ГР (Eigenmann, Eigenmann, 1981b). Одновременно эстрогены повышали концентрацию рецепторов прогестерона в мозге, гипоталамусе и гипофизе.
Неоплазия гипофиза и гипоталамуса. У собак редко развивается акромегалия, обусловленная соматотропной аденомой гипофиза, секретирующей ГР. В литературе имеется единственное сообщение о 9-летнем кобеле добермана-пинчера с тяжелым инсулинорезистентным сахарным диабетом; физикальное исследование не выявило у него признаков акромегалии. Концентрацию ГР и ИФР-1 у этой собаки не определяли, но при вскрытии была обнаружена аденома гипофиза диаметром 0,5 см, а иммуногистохимическое исследование выявило большое количество иммунореактивного ГР в цитоплазме опухолевых клеток (van Keulen et al, 1996).
У одной молодой собаки избыток ГР в крови был обусловлен гипоталамической астроцитомой (Nelson et al, 1981). Избыточная секреция ГР предполагала нарушение высвобождения соматостатина или повышенную продукцию ГРРГ. Интересно, что хозяева этой собаки обратились за ветеринарной помощью по поводу симптоматики, напоминавшей диэнцефальный синдром у человека (тревожное состояние, полифагия, значительное снижение веса). Потенциально этот синдром может быть следствием воздействия избытка ГР в младенческом возрасте.
Патофизиологий
См. гл. 16.
Встречаемость
Предрасположенность отдельных пород или возрастных групп собак к акромагалии не выявлена. Почти все известные случаи спонтанного заболевания были обнаружены у интактных взрослых сук, что объясняется ролью прогестерона в стимуляции секреции ГР. В сообщении, в котором приводятся
90 • НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
данные обследования 7 собак с акромегалией, их возраст на момент поступления в ветеринарную клинику составлял 8-11 (в среднем 10) лет (Eigenmann, Venker-van Haagen, 1981). В том же исследовании возраст 15 сук с индуцированной прогестином акромегалией был от 4 до 11 лет (в среднем 7,7). Эти собаки получали по 50 мг МПА дважды в год для подавления астрального цикла (продолжительность терапии не указана).
Клинические признаки
У собак с индуцированной прогестинами акромегалией обычно преобладают клинические симптомы, обусловленные анаболическим действием ИФР-1, хотя не исключено развитие гипергликемии и сахарного диабета (см. табл. 2-14). Промежуток времени между началом терапии прогестинами и появлением клинических признаков акромегалии может быть разным и отчасти зависит от дозы и частоты введения прогестина. Повышение концентрации ГР у собак наблюдали через 9 недель после начала терапии МПА в дозе 10 мг/кг один раз в 3 недели (Eigenmann, Rijnberk, 1981).
Наиболее частыми симптомами акромегалии являются стридор и другие расстройства дыхания вследствие увеличения массы мягких тканей ротоглотки, гортани и языка (Rijnberk, 2000). В результате собака быстро утомляется, трудно переносит физические нагрузки и задыхается. Акромегалия может приводить к кардиомиопатии, которая также сопровождается расстройствами дыхания.
Индуцируемая ИФР-1 пролиферация костных и особенно соединительных тканей приводит к увеличению размеров тела, чаще всего живота, головы, конечностей и стоп (Rijnberk, 2000). При этом у собак расширяется морда, резко выражены выступы челюстных костей, выдается вперед нижняя челюсть и увеличивается расстояние между зубами. В случае хронического заболевания развивается дегенеративная артропатия, а при пальпации живота выявляется увеличение органов брюшной полости.
Кожа становится утолщенной на ощупь, на ней появляются лишние складки, особенно в области головы, шеи и дистальной поверхности конечностей (Scott, Concannon, 1983). Эти изменения являются следствием пролиферации соединительной ткани и накопления межклеточного матрикса. Отложение в дерме гиалуронатов приводит к интерстициальному отеку (т.е. к микседеме), из-за которого кожа выглядит вздутой. Возможен также гипертрихоз, утолщение и отвердевание когтей (Scott et al., 2001).
Прогестины могут также вызывать образование узлов в молочных железах и влагалищные выделения вследствие развития пиометры открытого типа (Eigenmann, Venker-van Haagen, 1981). Возможны клинические проявления пиометры закрытого типа (см. гл. 23).
Клиническая патология
См. гл. 17.
Гистопатологическая картина кожи
Гистопатологические изменения кожи у собак с акромегалией включают ортокератотический гиперкератоз, гипергранулез, гиперплазию дермы и эпидермиса разной тяжести (Scott, Concannon, 1983). Особенно заметна и характерна гиперплазия дермы, при которой кожа становится плотной, твердой, ячеистой и зачастую утолщается вследствие повышенного содержание коллагена и увеличения количества фибробластов. Возможна диффузная мукоидная дегенерация (микседема).
При гистопатологических изменениях кожи у собак с акромегалией необходимо провести дифференциальную диагностику, чтобы исключить гипотиреоз. Последний сопровождается дополнительными кожными нарушениями, включая атрофию сальных желез, фолликулярный кератоз и атрофию, преобладание телогенных волосяных фолликулов и гипертрофию/вакуолизацию мышц, поднимающих шерсть.
Диагностическая визуализация
См. гл. 17.
Эндокринологическое исследование
У собак с индуцированной прогестероном акромегалией обычно повышается уровень ГР и ИФР-1 в сыворотке крови. В одном из исследований, включавшем группу собак со спонтанной и индуцированной прогестинами акромегалией, концентрация ГР в крови колебалась от 11 до 1476 нг/мл при норме менее 5 нг/мл (Eigenmann, Venker-van Haagen, 1981). В другом исследовании средняя (±SE) концентрация ИФР-1 у 20 собак с акромегалией и 13 здоровых немецких овчарок составляла соответственно 679±116 и 280±23 нг/мл (Eigenmann et al, 1984b). Показано также, что у собак с акромегалией отсутствует снижение концентрации ГР после внутривенного введения глюкозы, что служит дополнительным подтверждением данного заболевания (Eigenmann, Venker-van Haagen, 1981). Глюкозу (50% раствор) вводят внутривенно из расчета 1 г/кг и определяют концентрацию ГР в крови через 15, 30, 45, 60 и 90 минут после инъекции. У собак с акромегалией концентрация ГР не снижается или снижается незначительно, тогда как у здоровых животных после введения глюкозы она достоверно уменьшается.
Явный сахарный диабет у собак с индуцированной прогестероном акромегалией встречается реже, чем у кошек с секретирующими ГР гипофизарными опухолями. Тем не менее, у таких собак тест на толерантность к глюкозе выявляет нарушение толе
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА • 91
рантности, гиперинсулинемию и аномальный ответ инсулина на нагрузку глюкозой (Eigenmann et al, 1983а). При исходно высоком уровне инсулина нагрузка глюкозой не вызывает его дальнейшего повышения, а при более умеренном базальном уровне инсулина его секреция либо возрастает, либо не изменяется после введения глюкозы. При постоянно высокой концентрации ГР в крови толерантность к глюкозе резко ухудшается. В исследовании, проведенном на 21 собаке с гиперсекрецией ГР, средний (±SE) показатель скорости исчезновения глюкозы (К) составил 0,9±0,1, тогда как у 20 здоровых собак он равнялся 3,9±0,2 (Eigenmann et aL, 1983а). Процедура теста толерантности к глюкозе более подробно описана в гл. 11.
Базальный уровень тиреоидных гормонов у собак с индуцированной прогестероном акромегалией обычно остается в норме, хотя у отдельных особей может быть понижен (Rijnberk et al, 1980; Eigenmann, Venker-van Haagen, 1981). Снижение уровня тиреоидных гормонов является, вероятно, следствием синдрома эутиреоидной патологии (см. гл. 3), а не первичного гипотиреоза как такового. Поскольку экзогенные прогестины обладают глюкокортикоидной активностью, они могут подавлять секрецию АКТГ и тем самым вызывать вторичную надпочечниковую недостаточность. В результате у собак с акромегалией, индуцированной хроническим введением прогестинов, концентрация кортизола в плазме крови может быть низкой (Concannon et al., 1980).
Окончательный диагноз
Предварительный диагноз акромегалии у собак ставится на основании клинических признаков, выявляемых при физикальном исследовании взрослых интактных сук с нормальным эстральным циклом, или по результатам анамнестического анализа у животных, которым хронически вводились прогестины. Наиболее частыми клиническими проявлениями заболевания являются расстройства дыхания вследствие увеличения массы мягких тканей в ротоглоточной области, увеличение размеров тела (в первую очередь, черепа и стоп), увеличение нижней челюсти и межзубного расстояния, утолщение и микседематозные изменения кожи, появление лишних кожных складок. Для окончательного диагноза необходимо установить повышение концентраций ГР и ИФР-1 в крови. К сожалению, коммерческие наборы для определения ГР у собак отсутствуют. Поэтому диагноз обычно базируется на клинической симптоматике в сочетании с идентификацией диэструса у старых сук или с предыдущим хроническим введением прогестинов.
Лечение
Индуцированная прогестероном акромегалия. Лечение сук с индуцированной прогестеро
ном акромегалией состоит либо в отмене экзогенных прогестинов, либо им проводят овариэктомию. В одном из исследований хирургическое удаление яичников и матки у 12 собак с акромегалией приводило к нормализации концентрации ГР в крови, которая составляла 82,9 ±35,9 и 2,8 ±0,7 нг/мл соответственно до и после операции (Eigenmann, Venker-van Haagen, 1981). Клинические симптомы, вызванные анаболическим действием прогестинов (в частности, увеличение массы мягких ротоглоточных тканей), исчезают после коррекции продукции и секреции ГР. Возможность устранения катаболических нарушений, в первую очередь, непереносимости углеводов, зависит от функционального состояния бета-клеток поджелудочной железы. Если ко времени удаления источника прогестерона (показателем которого служит гиперинсулинемия) сохранилось достаточное количество бета-клеток, то коррекция секреции ГР способствует нормализации толерантности к углеводам и концентрации глюкозы в крови. При значительном уменьшении популяции функционально активных бета-клеток следует ожидать развития устойчивого сахарного диабета.
Прогноз
Индуцируемая прогестероном акромегалия имеет благоприятный прогноз. Все клинические симптомы, за исключением гипоинсулинемического сахарного диабета, имеют потенциально обратимый характер и устраняются после отмены экзогенных прогестинов или овариогистерэктомии.
ЛИТЕРАТУРА
Abrams-Ogg ACG, et al: Acromegaly in the cat: Diagnosis with magnetic resonance imaging and treatment by cryohypophysectomy. Can Vet J 34:682, 1993.
Abribat T, et al: Growth hormone response induced by synthetic human growth hormone releasing factor (1-44) in healthy dogs. J Vet Med 36:367, 1989.
Aron DC, et al: Hypothalamus and Pituitary /n Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 100.
Ascacio-Martinez JA, et al: A dog growth hormone: cDNA codes for a mature protein identical to pig growth hormone. Gene 143:277, 1994.
Ashley PF, et al: Effect of oral melatonin administration on sex hormone, prolactin, and thyroid hormone concentrations in adult dogs. J Am Vet Med Assoc 215:1111, 1999.
Bell AG, et al: Growth hormone responsive dermatosis in three dogs. NZ Vet J 41:195, 1993.
Benjamin M: Cysts (large follicles) and colloid in pituitary glands. Gen Comp Endocrinol 45:425, 1981.
Boord M, Griffin C: Progesterone secreting adrenal mass in a cat with clinical signs of hyperadrenocorticism. J Am Vet Med Assoc 214:666, 1999.
Bratusch-Marrain PR, et al: The effect of growth hormone on glucose metabolism and insulin secretion in man. J Clin Endocrinol Metab 55:973, 1982.
Buonomo FC, Baile CA: The neurophysiological regulation of growth hormone secretion. DomAnim Endocr 7:435, 1990.
Campbell K: Growth hormone-related disorders in dogs. Compend Cont Ed Sm Anim Pract 10:477, 1988.
Church DB, et al: Effects of proligestone and megestrol on plasma adrenocorticotrophic hormone, insulin and insulin-like growth factor-l concentrations in cats. Res Vet Sci 56:175, 1994.
Concannon P, et al: Growth hormone, prolactin, and Cortisol in dogs developing mammary nodules and an acromegaly-like appearance during treatment with medroxyprogesterone acetate. Endocrinology 106:1173, 1980.
Conzemius MG, et al: Correlation between longitudinal bone growth, growth hormone, and insulin-like growth factor-l in prepubertal dogs. Am J Vet Res 59:1608, 1998.
92
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
Daughaday WH: The anterior pituitary. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology. Philadelphia, WB Saunders, 1985, p 568.
Da vies RR, et al: Effects of somatostatin analogue SMS 201-995 in normal man. Clin Endocrinol (Oxf) 24:665, 1986.
Davis DH, et al: Results of surgical treatment for growth hormone-secreting pituitary adenomas. J Neurosurg 79:70, 1993.
Drucker WD, Peterson ME: Advances in the diagnosis and management of canine Cushing’s syndrome. Proceedings of the 31st Gaines Veterinary Symposium, Baton Rouge, La, 1981, p 17.
Eigenmann JE: Diagnosis and treatment of dwarfism in a German Shepherd dog. JAAHA 17:798, 1981.
Eigenmann JE: Diagnosis and treatment of pituitary dwarfism in dogs. Proceedings of the Sixth Kai Кад Symposium, Columbus, Ohio, 1983, p 107.
Eigenmann JE: Insulin-like growth factor-l in the dog. Front Horm Res 17:161, 1987.
Eigenmann JE, Eigenmann RY: Radioimmunoassay of canine growth hormone. Acta Endocrinol 98:514, 1981a.
Eigenmann JE, Eigenmann RY: Influence of medroxyprogesterone acetate (Provera) on plasma growth hormone levels and on carbohydrate metabolism. II. Studies in the ovariohysterectomized, oestradiol-primed bitch. Acta Endocrinol 98:603, 1981b.
Eigenmann JE, Patterson DF: Growth hormone deficiency in the mature dog. JAAHA 20:741, 1984.
Eigenmann JE, Rijnberk A: Influence of medroxyprogesterone acetate (Provera) on plasma growth hormone levels and on carbohydrate metabolism. I. Studies in the ovariohysterectomized bitch. Acta Endocrinol 98:599, 1981.
Eigenmann JE, Venker-van Haagen AJ: Progestagen-induced and spontaneous canine acromegaly due to reversible growth hormone overproduction: Clinical picture and pathogenesis. JAAHA 17:813, 1981.
Eigenmann JE, et al: Progesterone-controlled growth hormone overproduction and naturally occurring canine diabetes and acromegaly. Acta Endocrinol 104:167, 1983a.
Eigenmann JE, et al: Panhypopituitarism caused by a suprasellar tumor in a dog. JAAHA 19:377, 1983b.
Eigenmann JE, et al: Body size parallels insulin-like growth factor-l levels but not growth hormone secretory capacity Acta Endocrinol (Copenh) 106:448, 1984a.
Eigenmann JE, et al: Insulin-like growth factor-l in the dog: A study in different dog breeds and in dogs with growth hormone elevation. Acta Endocrinol (Copenh) 105:294, 1984b.
Eigenmann JE, et al: Growth hormone and insulin-like growth factor-l in German Shepherd dwarf dogs. Acta Endocrinol (Copenh) 105:289, 1984c.
Eigenmann JE, et al: Elevated growth hormone levels and diabetes mellitus in a cat with acromegalic features. J Am Anim Hosp Assoc 20:747, 1984d.
Elliott DA, et al: Prevalence of pituitary tumors among diabetic cats with insulin resistance. J Am Vet Med Assoc 216:1765, 2000.
Favier RP, et al: Large body size in the dog is associated with transient GH excess at a young age. J Endocrinol 170:479, 2001.
Feld S, Hirschberg R: Growth hormone, the insulin-like growth factor system, and the kidney. Endocr Rev 17:423, 1996.
Ferry RJ, et al: Insulin-like growth factor binding proteins: new proteins, new function. Horm Res 51:34, 1999.
Fofanova O, et al: Compound heterozygous deletion of the PROP-1 gene in children with combined pituitary hormone deficiency. J Clin Endocrinol Metab 83:2601, 1998.
Frank LA, et al: Steroidogenic response of adrenal tissues after administration of ACTH to dogs with hypercortisolemia. J Am Vet Med Assoc 218:214, 2001.
French MB, et al: Secretory pattern of canine growth hormone. Am J Physiol 252:E268, 1987.
Fuh G, et al: Rational design of potent antagonists to the human growth hormone receptor. Science 256:1677, 1992.
Goddard AD, et al: Mutations of the growth hormone receptor in children with idiopathic short stature. N Engl J Med 333:1093, 1995.
Goossens MMC, et al: Cobalt 60 irradiation of pituitary gland tumors in three cats with acromegaly. J Am Vet Med Assoc 213:374, 1998.
Gross TL, et al: Veterinary Dermatopathology: A Macroscopic and Microscopic Evaluation of Canine and Feline Skin Disease. St Louis, Mosby-Year Book, 1992.
Hamann F, et al: Pituitary function and morphology in two German Shepherd dogs with congenital dwarfism. Vet Rec 144:644, 1999.
Hampshire J, Altszuler N: Clonidine or xylazine as provocative tests for growth hormone secretion in the dog. Am J Vet Res 42:1073, 1981.
Herrtage ME, Evans H: The effect of progestogen administration on insulinlike growth factor concentrations in two pituitary dwarfs. J Vet Int Med 12:212, 1998 (abstract).
Isaksson OGP, et al: Mechanism of the stimulatory effect of growth hormone on longitudinal bone growth. Endocr Rev 8:426, 1987.
Johanson NA, et al: Acromegalic arthropathy of the hip. Clin Orthop 173:130, 1983.
Kooistra HS, et al: Progestin-induced growth hormone (GH) production in the treatment of dogs with congenital GH deficiency. Dorn Anim Endocr 15:93, 1998.
Kooistra HS, et al: Pulsatile secretion pattern of growth hormone during the luteal phase and mid-anoestrus in Beagle bitches. J Repro Fertil 199:217, 2000a.
Kooistra HS, et al: Confirmed pituitary hormone deficiency in German Shepherd dogs with dwarfism. Dorn Anim Endo 19:177, 2000b.
Lanes R, et al: Dwarfism associated with normal serum growth hormone and increased bioassayable, receptorassayable, and immunoassayable somatomedin. J Clin Endocrinol Metab 50:485, 1980.
Lantinga-van Leeuwen IS, et al: Cloning, characterization, and physical mapping of the canine Prop 1 gene: exclusion as a candidate gene for combined pituitary hormone deficiency in German Shepherd dogs. Cytogenet Cell Genet 88:140, 2000a.
Lantinga-van Leeuwen IS, et al: Cloning of the canine gene encoding transcription factor Pit-1 and its exclusion as candidate gene in a canine model of pituitary dwarfism. Mamm Genome 11:31, 2000b.
Lazarus L: Growth hormone. In Donald RA (ed): Endocrine Disorders: A Guide to Diagnosis. New York, Marcel Dekker, 1984, p 273.
Lee PD, et al: Insulin-like growth factor binding protein-1: Recent findings and new directions. Proc Soc Exp Biol Med 216:319, 1997.
Lewitt MS, et al: Regulation of insulin-like growth factor binding protein-3 ternary complex in feline diabetes mellitus. J Endocrinol 166:21, 2000.
Lothrop CD: Growth hormone response to growth hormone-releasing factor in normal and suspected growth hormone-deficient dogs. Proceedings of the Fourth Annual Veterinary Medical Forum, Washington, DC, 1986, p 14.
Lothrop CD: Pathophysiology of growth hormone-responsive dermatosis. Compend Cont Educ Pract Vet 10:1346, 1988.
Lothrop CD, Schmeitzel LP: Growth hormone-responsive alopecia in dogs. Vet Med Rep 2:82, 1990.
Mandel S, et al: Changes in insulin-like growth factor-1 (IGF-1), IGF-bind-ing protein-3, growth hormone (GH)-binding protein, erythrocyte IGF-1 receptors, and growth rate during GH treatment. J Clin Endocrinol Metab 80:190, 1995.
Maxwell A, et al: Nutritional modulation of canine insulin-like growth factors and their binding proteins. J Endocrinol 158:77, 1998.
Maxwell A, et al: Reduced serum insulin-like growth factor (IGF) and IGFbind-ing protein-3 concentrations in two Deerhounds with congenital portosystemic shunts. J Vet Intern Med 14:542, 2000.
Meij BP, et al: Assessment of a combined anterior pituitary function test in Beagle dogs: Rapid sequential intravenous administration of four hypothalamic releasing hormones. Dorn Anim Endocr 13:161, 1996.
Meij BP, et al: Transsphenoidal hypophysectomy for treatment of pituitarydependent hyperadrenocorticism in 7 cats. Vet Surg 30:72, 2001.
Melmed S: Acromegaly. N Engl J Med 322:966, 1990.
Melmed S, et al: Acromegaly due to secretion of growth hormone by.an ectopic pancreatic islet cell tumor. N Engl J Med 312:9, 1985.
Middleton DJ, et al: Growth hormone-producing pituitary adenoma, elevated serum somatomedin C concentration and diabetes mellitus in a cat. Can Vet J 26:169, 1985.
Mol JA, Rijnberk A: Pituitary function. In Kaneko JJ, Harvey JW, Bruss Ml (eds): Clinical Biochemistry of Domestic Animals. San Diego, Academic Press, 1997, p 517.
Mol JA, et al: Growth hormone mRNA in mammary gland tumors of dogs and cats. J Clin Invest 95:2028, 1995.
Mol JA, et al: New insights in the molecular mechanism of progestin-induced proliferation of mammary epithelium: Induction of the local biosynthesis of growth hormone (GH) in the mammary gland of dogs, cats and humans. J Steroid Biochem Molec Biol 57:67, 1996.
Morrison SA, et al: Hypersomatotropism and insulin-resistant diabetes mellitus in a cat. JAVMA 194:91, 1989.
Muller-Peddinghaus R, et al: Hypophysarer zwergwuchs beim deutschen scha-ferhund. Vet Pathol 17:406, 1980.
Nap RC, et al: Age-related plasma concentrations of growth hormone (GH) and insulin-like growth factor (IGF-I) in Great Dane pups fed different dietary levels of protein. Dorn Anim Endocr 10:237, 1993.
Nelson RW, et al: Diencephalic syndrome secondary to intracranial astrocytoma in a dog. JAVMA 179:1004, 1981.
Paradis M: Melatonin therapy for canine alopecia. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p 546.
Parker WM, Scott lAW: Growth hormone-responsive alopecia in the mature dog: A discussion of 13 cases. JAAFIA 16:824, 1980.
Pellegrini-Bouiller I, et al: A new mutation of the gene encoding the transcription factor Pit-1 is responsible for combined pituitary hormone deficiency. J Clin Endocrinol Metab 81:2790, 1996.
Peterson ME: Effects of megestrol acetate on glucose tolerance and growth hormone secretion in the cat. Res Vet Sci 42:354, 1987.
Peterson ME, Altszuler N: Suppression of growth hormone secretion in spontaneous canine hyperadrenocorticism and its reversal after treatment. Am J Vet Res 42M881, 1981.
Peterson ME, et al: Acromegaly in 14 cats. J Vet Intern Med 4:192, 1990.
Plewe G, et al: Long-acting and selective suppression of growth hormone secretion by somatostatin analogue SMS 201-995 in acromegaly. Lancet 2:782, 1984.
Randolph JF, et al: Delayed growth in two German Shepherd dog littermates with normal serum concentrations of growth hormone, thyroxine, and Cortisol. JAVMA 196:77, 1990.
Regnier A, Garnier F: Growth hormone responses to growth hormonereleas-ing hormone and clonidine in dogs with Cushing’s syndrome. Res Vet Sci 58:169, 1995.
НАРУШЕНИЯ ПРОДУКЦИИ ГОРМОНА РОСТА
93
Regnier A, et al: Effect of propranolol on growth hormone response to GH-releasing hormone (GHRH 1 -44) in the dog. Res Vet Sci 52:110, 1992.
Reichlin S: Neuroendocrinology. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 165.
Reiter EO, Rosenfeld RG: Normal and aberrant growth, /n Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 1427.
Reubi JC, Landolt AM: The growth hormone responses to octreotide in acromegaly correlate with adenoma somatostatin receptor status. J Clin Endocrinol Metab 68:844, 1989.
Rijnberk A: Acromegaly. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5th ed. Philadelphia, WB Saunders, 2000, p 1370.
Rijnberk A, et al: Acromegaly associated with transient overproduction of growth hormone in a dog. JAVMA 177:534, 1980.
Rijnberk A, et al: Disturbed release of growth hormone in mature dogs: A comparison with congenital growth hormone deficiency. Vet Rec 133:542, 1993.
Ristic JME, et al: Plasma 17-hydroxyprogesterone concentrations in the diagnosis of canine hyperadrenocorticism. J Vet Int Med 15:298, 2001 (abstract).
Rosenfeld RG, et al: Both human pituitary growth hormone and recombinant DNA-derived human growth hormone cause insulin resistance at a postreceptor site. J Clin Endocrinol Metab 54:1033, 1982.
Rosenfeld RG, et al: Growth hormone (GH) insensitivity due to primary GH receptor deficiency Endocr Rev 15:369, 1994.
Rosenkrantz WS, Griffin C: Lysodren therapy in suspect adrenal sex hormone dermatosis. Proceedings of the Second World Congress of Veterinary Dermatology, Montreal, Canada, May, 1992, p 121.
Rossmeisl JH, et al: Hyperadrenocorticism and hyperprogesteronemia in a cat with an adrenocortical adenocarcinoma. J Am Anim Hosp Assoc 36:512, 2000.
Roth JA, et al: Thymic abnormalities and growth hormone deficiency in dogs. Am J Vet Res 41:1256, 1980.
Sandhu MS, et al: Circulating concentrations of insulin-like growth factor-1 and development of glucose intolerance: a prospective observational study. Uncet 359:1740, 2002.
Scheven BAA, Hamilton NJ: Longitudinal bone growth in vitro: effects of insulin-like growth factor-l and growth hormone. Acta Endocrinol (Copenh) 124:602, 1991.
Schmeitzel LP: Sex hormone-related and growth hormone-related alopecias. Vet Clin North Am 20:1579, 1990.
Schmeitzel LP, Lothrop CD: Hormonal abnormalities in Pomeranians with normal coat and in Pomeranians with growth hormone-responsive dermatosis. JAVMA 197:1333, 1990.
Schmeitzel LP, et al: Congenital adrenal hyperplasia-like syndrome, /n Bo-nagura JD (ed): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders, 1995, p 600.
Scott DW, Concannon PW: Gross and microscopic changes in the skin of dogs with progestagen-induced acromegaly and elevated growth hormone levels. JAAHA 19:523, 1983.
Scott DW, Walton DK: Hyposomatotropism in the mature dog: A discussion of 22 cases. JAAHA 22:467, 1986.
Scott DW, Miller WH, Griffin CE (eds): Muller & Kirk’s Small Animal Dermatology, 6th ed. Philadelphia, WB Saunders, 2001, p 780.
Secchi C, et al: Amino acid modifications in canine, equine, and porcine pituitary growth hormones, identified by peptide-mass mapping. J Chromatography 757:237, 2001.
Selman PJ, et al: Progestins and growth hormone excess’ in the dog. Acta Endocrinol 125[suppl 1]:42, 1991.
Selman PJ, et al: Progestin treatment in the dog: I. Effects on growth hormone, IGF-1, and glucose homeostasis. Eur J Endocrinol 131:413, 1994a.
Selman PJ, et al: Progestin-induced growth hormone excess in the dog originates in the mammary gland. Endocrinology 134:287, 1994b.
Sheng HZ, et al: Multistep control of pituitary organogenesis. Science 278:1809, 1997.
Simmons DM, et al: Pituitary cell phenotypes involve cell-specific Pit-1 mRNA translation and synergistic interactions with other classes of transcription factors. Genes Dev 4:695, 1990.
Stewart PM, et al: Normal growth hormone response to the 75 g oral glucose tolerance test measured by immunoradiometric assay. Ann Clin Biochem 26:205, 1989.
Styne D: Growth. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 601 ed. New York, Lange Medical Books/McGraw-Hill, 2001, pl63.
Takahashi Y, et al: Short stature caused by a mutant growth hormone. N Engl J Med 334:432, 1996.
Thorner MO, et al: Human pancreatic growth hormone-releasing factor selectively stimulates growth hormone secretion in man. Lancet 1:24, 1983.
Thorner MO, et al: The anterior pituitary. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 249.
Trainer PJ, et al: Treatment of acromegaly with the growth hormone receptor antagonist pegvisomant. N Engl J Med 342:1171, 2000.
Treier M, et al: Multistep signaling requirements for pituitary organogenesis in vivo. Genes Dev 12:1691, 1998.
van den Heuvel PACMB, et al: Myocardial involvement in acromegaly. Int J Cardiol 6:550, 1984.
van der Lely AJ, et al: Long-term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 358:1754, 2001.
Van Herpen H, et al: Production of antibodies to biosynthetic human growth hormone in the dog. Vet Rec 134:171, 1994.
van Keulen UM, et al: Diabetes mellitus in a dog with a growth hormone-producing acidophilic adenoma of the adenohypophysis. Vet Pathol 33:451, 1996.
Van Wyk JJ, et al: Role of somatomedin in cellular proliferation. In Ritzen ER (ed): Biology of Normal Human Growth. New York, Raven Press, 1981, p 223.
Voss JW, Rosenfeld MG: Anterior pituitary development: short tales from dwarf mice. Cell 70:527, 1992.
Watkins-Chow DE, Camper SA: How many homeobox genes does it take to make a pituitary gland? Trends in Genetics 14:284, 1998.
Watson ADJ, et al: Effect of somatostatin analogue SMS 201-995 and antiprogestin agent RU486 in canine acromegaly. Front Horm Res 17:193, 1987.
Willeberg P, et al: Pituitary dwarfism in German Shepherd dogs: Studies on somatomedin activity. Nord Vet Med 27:448, 1975.
Wu W, et al: Mutations in Prop-1 cause familial combined pituitary hormone deficiency. Nature Genet 18:147, 1998.
Yakar S, et al: Normal growth and development in the absence of hepatic insulin-like growth factor-l. Proc Natl Acad Sci USA 96:7324, 1999.
Часть II
ЩИТОВИДНАЯ ЖЕЛЕЗА
Глава 3 ГИПОТИРЕОЗ
ФИЗИОЛОГИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ . 96
ГИПОТИРЕОЗ У СОБАК КЛАССИФИКАЦИЯ.................99
ЭТИОЛОГИЯ.....................99
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ПЕРВИЧНОГО
ГИПОТИРЕОЗА У ВЗРОСЛЫХ СОБАК.. 107
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
ВРОЖДЕННОГО ГИПОТИРЕОЗА: КРЕТИНИЗМ..................114
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ВТОРИЧНОГО ГИПОТИРЕОЗА.....115
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ ГИПОТИРЕОЗЕ................115
ГИСТОЛОГИЯ КОЖИ ПРИ ГИПОТИРЕОЗЕ............118
ДАННЫЕ РЕНТГЕНОГРАФИИ, УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ (УЗИ), МАГНИТНО-РЕЗОНАНСНОЙ (МРТ) И КОМПЬЮТЕРНОЙ(КТ) ТОМОГРАФИИ....................118
ПОКАЗАТЕЛИ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ .........120
Базальная концентрация общего тироксина (Т4) в сыворотке крови... 122
Базальная концентрация общего трийодтиронина (Т3) в сыворотке крови..........125
Базальная концентрация свободного тироксина (свТ4) в сыворотке крови 126
Базальная концентрация свободного трийодтиронина (свТ3) в сыворотке крови..........................127
Базальная концентрация реверсивного трийодтиронана (рТ3) в сыворотке крови..........................127
Базальная концентрация тиреотропного гормона (ТТГ) в сыворотке крови ... 128
Поглощение Т3 смолой............130
Стимулирующая проба с ТТГ.......130
Стимулирующая проба с тиролиберином
(тиреотропин-рилизинг гормоном, ТРГ)................131
Показатель «К»..................133
ПОКАЗАТЕЛИ ЛИМФОЦИТАРНОГО ТИРЕОИДИТА.....................133
Аутоантитела к тиреоглобулину...134
Аутоантитела к тиреоидным гормонам 134
ФАКТОРЫ, ИЗМЕНЯЮЩИЕ ПОКАЗАТЕЛИ
ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ..135
Возраст.........................136
Порода/размеры тела.............136
Пол и фазы астрального цикла....137
Суточный ритм...................137
Случайные колебания.............137
Сопутствующие заболевания (синдром эутиреоидной патологии)........137
Температура тела и окружающей среды141 Ожирение......................141
Голодание и кахексия..........141
Физические нагрузки...........141
Лекарственные препараты.......141
Аутоантитела к тиреоидным гормонам 143 БИОПСИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ.....143
ДИАГНОСТИКА...................144
ЛЕЧЕНИЕ.......................145
Начальная терапия натриевой солью
левотироксина (синтетическим Т4).. 145 Реакция на терапию левотироксином .147 Отсутствие эффекта левотироксина... 148 Контроль за ходом лечения......148
Тиреотоксикоз..................150
Пробная терапия натриевой солью
лиотиронина (синтетическим Т3) ....150 Комбинированные препараты Т4/Т3....151 Грубые гормональные препараты
животного происхождения......151
ПРОГНОЗ........................151
ГИПОТИРЕОЗ У КОШЕК ЭТИОЛОГИЯ.....................152
КЛИНИЧЕСКИЕ ПРИЗНАКИ..........153
ПОКАЗАТЕЛИ ФУНКЦИИ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ...........153
ДИАГНОСТИКА...................156
ЛЕЧЕНИЕ И ПРОГНОЗ.............157
Список сокращений
АКТГ - адренокортикотропный гормон ГР - гормон роста
ЖКТ - желудочно-кишечный тракт
ИВЛ - искусственная вентиляция легких
ИФА - иммуноферментный анализ КТ - компьютерная томография ЛВП - липопротеины высокой плотности ЛГ - лютеинизирующий гормон ЛНП - липопротеины низкой плотности
ЛОНП — липопротеины очень низкой плотности
МРД - модифицированный метод равновесного диализа
МРТ - магнитно-ядерная томография ОЦК - объем циркулирующей крови РИА - радиоиммунологический анализ Т3 - трийодтиронин
Т4- тироксин
св Т„- свободный тироксин
ТРГ - тиреотропин рилизинг-гормон
ТТГ - тиреотропный гормон, тиреотропин ТСГ - тиреоидные гормоны-связывающий глобулин
УЗИ - ультразвуковое исследование
ФСГ - фолликулостимулирующий гормон
ЦИС - центральная нервная система
ЭКГ - электрокардиография
ЭМГ - электромиография
ЭхоКГ— эхокардиография
ФИЗИОЛОГИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Синтез тиреоидных гормонов. Основная функциональная единица щитовидной железы - это фолликул. Он представляет собой полый шар, стенки которого образованы одним слоем клеток (тиреоци-тов), окруженных базальной мембраной (рис. 3-1). В покое тиреоциты имеют кубовидную форму, но при активации приобретают цилиндрическую. Полость фолликула заполнена коллоидом (вязким гелем), где запасается вырабатываемый тиреоцитами тиреоглобулин. Тиреоглобулин - это крупный гли
копротеид-димер, содержащий йодтирозины, из которых образуются тиреоидные гормоны.
Синтез тиреоидных гормонов в щитовидной железе невозможен без достаточного поступления в нее йодида. Йодид путем активного транспорта поступает из внеклеточной жидкости в тиреоциты фолликула, где под действием тиреоидной пероксидазы быстро окисляется с образованием промежуточной реактивной формы, которая включается в тирозиновые остатки акцепторных белков, в основном, в тирозиновые остатки тиреоглобулина (Greenspan, 2001). Йодированные остатки тирозина в тиреог-
ГИПОТИРЕОЗ • 97
Рис. 3-1. А и Б - Гистологическим срез щитовидной железы здоровой собаки. Видны фолликулы разных размеров, выстланные фолликулярным эпителием и заполненные аморфным веществом (коллои юм) (Л - гематоксилин-эозин, х 40; Б - та же окраска, х 160).
лобулине (моноиодтирозин, МИГ, и дийодтирозин, ДИТ) объединяются друг с другом, образуя йодти-ронины - тироксин и грийодтиронин (рис. 3-2).
Тиреоглобулин запасается вне клеток (в просвете фолликулов), и секреция тиреоидных гормонов в кровь требует его возвращения в тиреоциты, где
происходит протеолиз этого белка. Поглощение тиреоглобулина клетками осуществляется микроворсинками (псевдоподиями) апикальной повср юности клеток, которые проникают в просвет фолликулов и путем эндоцитоза извлекают из него крупные капли коллоида (Greenspan, 2001). Каждая капля коллоида окружена мембраной, образующейся из апикальной поверхности тиреоцитов. Затем эти капли сливаются с электронно-плотными лизосомами, формируя фаголизосомы. Последние перемещаются к базальной мембране тиреоцитов, и в процессе этой миграции в них происхо ит протеолиз тиреоглобулина. Тироксин (Т ) и в гораздо меньшей степени грмйод-гиронин (Т^) высвобождаются из тиреоглобулина при его протеолизе и выделяются из фаголизосом в кровь, вероятно, путем простой диффузии. Основная часть йодтирозинов (МИТ и ДИТ) подвергается дейодированию, а высвобождающи лея при этом йодид повторно используется для йодирования тиреоглобулина или диффундирует в кровь. В кровь выделяется и небольшое количество тиреоглобулина, причем при повреждении щитови той железы (например, при лимфоцитарном тиреоидите) количество тиреоглобулина в крови возрастает.
Регуляция функции щитовидной железы. Синтез и секреция тиреоидных гормонов регулируются как извне гипофизарным тиреотропным гормоном (ТТГ), гак и изнутри (ауторегуляция). ТТГ - основной регулятор активности щитовидной железы, действие которого приводит к повышению секреции тиреоидных гормонов (рис. 3-3). Секреция ТТГ гипофизом в свою очередь регулируется тиреоидными гормонами по механизму отрицательной обратной связи. Секрецию ТТГ тормозит главным образом Т3 (3,5,31-трийодтиронин), который образуется в гипофизе в результате монодеиодирования Т4 (Greenspan. 2001). Чувствительность
3-монойодтирозин 3,5-дийодтирозин
3,5,31,51-тетрайод-к-тиронин (тироксин, Т4)
3,5,31-трийод-к-тиронин (Т3) З^^б-трийод-к-тиронин (реверсивный Т3)
Рис. 3-2. Структура тиреоидных гормонов и их предшественников
98 • ГИПОТИРЕОЗ
Центральная нервная система
Гипоталамус
ТРГ©
Тиреотропные клетки гипофиза
ТТГ©
Фолликулярные клетки щитовидной железы
т4 рт3 т3
Кровь
Рис. 3-3. Схема гипоталамо-гипофизарно-тиреоидной системы. ТРГ - тиретропин рилизинг-гормон, ТТГ - тиреотропный гормон, Т4 - тироксин, Т3 - ЗДЗ'-трийодтиронин, рТ3 - реверсивный 3,3',5-трийодтиронин; + - стимуляция, - - ингибирование.
гипофиза к действию тиреоидных гормонов по механизму отрицательной обратной связи, в свою очередь, находится под влиянием гипоталамического тиреотропин рилизинг-гормона (ТРГ). Образование и секреция ТРГ гипоталамусом находится под контролем недостаточно изученных нервных импульсов, исходящих из высших центров головного мозга.
Поглощение йодида и синтез тиреоидных гормонов в щитовидной железе могут регулироваться и внутренними (интратиреоидными) механизмами, независимыми от ТТГ. Примерами ауторегуляторных механизмов служат эффект Вольфа-Чайкова (снижение йодирования тиреоглобулина и синтеза тиреоидных гормонов при повышенном поглощении йодида щитовидной железой), изменение чувствительности щитовидной железы к стимулирующему действию ТТГ и возрастание отношения Т3/Т4 в секрете щитовидной железы при дефиците йодида.
Тиреоидные гормоны в плазме крови. Поступая в кровь, тиреоидные гормоны связываются с белками плазмы, главным образом с тироксин-связывающим глобулином (ТСГ), тироксин-связы-вающим преальбумином (транстиретином) и альбумином, а также с некоторыми липопротеинами. В свободном состоянии в крови остается менее 1 % Т4 и Т3. Свободные, или несвязанные, тиреоидные гормоны проникают в клетки, где оказывают свое биологическое действие и затем метаболизируются. Только свободные тиреоидные гормоны регулируют секрецию тиреотропина гипофизом по механизму обратной связи. Связанные гормоны медленно освобождаются из комплекса с белками, компенсируя расход свободных гормонов. Функция щитовидной железы регулируется таким образом, что секреция тиреоидных гормонов возрастает в точном соот
ветствии со скоростью их метаболизма.
Метаболизм тиреоидных гормонов. Основной путь метаболизма Т4 (главного секреторного продукта нормальной щитовидной железы) - последовательное дейодирование его молекулы. Дейодированию может подвергаться как наружное кольцо Т4 (и тогда образуется Т3), так и внутреннее его кольцо (и тогда образуется реверсивный Т3 (рТ3) (рис. 3-2). Поскольку превращение Т4 в Т3 приводит к повышению биологической активности гормона, а превращение в рТ3, наоборот, к ее снижению, то биологическая активность тиреоидных гормонов зависит от активности дейодиназ наружного и внутреннего кольца Т4. На долю Т3, секретируемого щитовидной железой, приходится менее 20% общего количества этого гормона; остальные 80-90% образуются в периферических тканях в результате монодейодирования наружного кольца Т . Наибольшее количество тиреоидных гормонов накапливается в печени, почках и мышцах (Greenspan, 2001). Второй важный путь метаболизма этих гормонов -конъюгация с растворимыми глюкуронидами и сульфатами и последующая экскреция с желчью и мочой.
Действие тиреоидных гормонов. Тиреоидные гормоны действуют на различные процессы обмена веществ, изменяют концентрацию и активность множества ферментов, влияют на обмен субстратов, витаминов и минеральных веществ, скорость секреции и распада практически всех других гормонов и ответ тканей-мишеней на них. Тиреоидные гормоны играют важнейшую роль в развитии плода (особенно его нервной системы и скелета). Они стимулируют продукцию тепла в организме (кало-ригенез), синтез белков и ферментов и все стороны углеводного и липидного обмена, включая их синтез, мобилизацию и распад (Larsen et al, 1998). Кроме того, они оказывают выраженные хронотропное и инотропное действие на сердце, необходимы для стимуляции дыхательного центра в условиях гипоксии и гиперкапнии, усиливают эритропоэз и кругооборот костной ткани, ускоряя как образование, так и резорбцию костей (Greenspan, 2001). Фактически, нет ни одной ткани или органа, на состоянии которых не сказывался бы избыток или недостаток тиреоидных гормонов.
ГИПОТИРЕОЗ • 99
ГИПОТИРЕОЗ У СОБАК
КЛАССИФИКАЦИЯ
Структурные или функциональные нарушения щитовидной железы могут приводить к недостаточной продукции тиреоидных гормонов. Гипотиреоз обычно классифицируют в соответствии с локализацией повреждения в гипоталамо-гипо-физарно-тиреоидной системе (рис. 3-3). Наиболее распространенная форма этой патологии у собак - первичный гипотиреоз, при котором нарушение локализуется в самой щитовидной железе. Как правило, это связано с деструкцией щитовидной железы; случаи врожденного нарушения гормоногенеза в ней встречаются редко. Вторичный гипотиреоз обусловлен недостаточной секрецией ТТГ тиреотропными клетками гипофиза (тиреотрофами), и в этом случае имеет место «вторичное» нарушение синтеза тиреоидных гормонов. Причиной этого состояния, крайне редко наблюдающегося у собак, может быть разрушение гипофиза (например, опухолью) или подавление секреции ТТГ какими-либо лекарственными средствами (например, глюкокортикоидами). Выделяют также третичный гипотиреоз, связанный с недостаточной секрецией ТРГ пептидергическими нейронами супраоптического и паравентрикулярного ядер гипоталамуса. Случаи третичного гипотиреоза у собак не описаны; следует полагать, что эта патология развивается крайне редко.
При вторичном или третичном гипотиреозе дефицит тиреоидных гормонов обусловлен атрофией щитовидной железы, а не патологическими процессами в ней самой. В таких случаях железа сохраняет способность отвечать на введение ТТГ или ТРГ, хотя ответ может быть ослабленным из-за длительного отсутствия стимулирующего воздействия ТТГ. В отличие от этого, у собак с первичным гипотиреозом обнаруживается прогрессирующая патология самой щитовидной железы. Ее чувствительность к вводимым ТТГ и ТРГ резко нарушается, и это издавна используется в диагностике.
ЭТИОЛОГИЯ
Первичный гипотиреоз
Первичный гипотиреоз - это самая частая причина недостаточности щитовидной железы у взрослых собак; на его долю приходится более 95% всех случаев гипотиреоза. Для собак характерны две гистологические формы первичного гипотиреоза: лимфоцитарный тиреоидит и идиопатический тиреоидит (табл. 3-1). Обе эти формы заканчиваются одним и тем же - прогрессирующей деструкцией щитовидной железы и падением уровня тиреоидных гормонов в крови.
ТАБЛИЦА 3-1. ВОЗМОЖНЫЕ ПРИЧИНЫ
___________ГИПОТИРЕОЗА У СОБАК____________________
Первичный гипотиреоз
Лимфоцитарный тиреоидит*
Идиопатическая атрофия щитовидной железы*
Гиперплазия фолликулярных клеток щитовидной железы
(нарушения гормоногенеза?)*
Разрушение щитовидной железы опухолями*
Ятрогенный*
Хирургическое удаление щитовидной железы
Антитиреоидные средства
Радиойодтерапия
Вторичный гипотиреоз
Дефект развития гипофиза*
Кисты гипофиза
Гипоплазия гипофиза
Деструкция гипофиза*
Опухоли
Угнетение активности тиреотропных клеток гипофиза*
Спонтанный гиперкортицизм
Синдром эутиреоидной патологии
Аномальная структура молекулы ТТГ
Нарушение взаимодействия ТТГ с рецепторами на фоллику-
лярных клетках щитовидной железы Ятрогенный*
Лекарственные вещества, особенно глюкокортикоиды
Лучевая терапия
Г ипофизэктомия
Третичный гипотиреоз
Врожденные дефекты развития гипоталамуса
Приобретенные дефекты гипоталамуса
Опухоли
Кровоизлияния
Абсцессы
Гранулемные болезни
Воспалительные процессы
Аномальная структура молекулы ТРГ
Нарушение взаимодействия ТРГ с рецепторами
Врожденный гипотиреоз
Дисгенезия щитовидной железы (аплазия, гипоплазия, эктопия)*
Нарушения гормоногенеза: дефект органификации йода*
Нарушения транспорта тиреоидных гормонов в крови
Потребление зобогенных веществ
Недостаточность йода в диете*_____________________
* Доказанные причины у собак
Лимфоцитарный тиреоидит. Гистологическим признаком лимфоцитарного тиреоидита является диффузная инфильтрация щитовидной железы лимфоцитами, плазматическими клетками и макрофагами, приводящая к разрушению фолликулов с развитием вторичного фиброза (Gosselin et al, 1981а, рис. 3-4). Нейтрофилов обычно мало, и они локализуются в основном в очагах некроза щитовидной железы. Клинические признаки гипотиреоза появляются лишь при разрушении более 75% ткани железы. Наблюдение за собаками, в крови которых присутствуют аутоантитела к тиреоглобулину, показывает, что клинические признаки заболевания, снижение уровня тиреоидных гормонов и повышение концентрации ТТГ в сыворотке кро-
100
ГИПОТИРЕОЗ
Рис. 3-4. А и Б - Гистологический срез щитовидной железы собаки с лимфоцитарным тиреоидитом и гипотиреозом. Обратите внимание на мононуклеарную инфильтрацию, нарушение строения и исчезновение содержащих коллоид фолликулов. (А, хбЗ; Б х250)
ви развиваются постепенно. Этот процесс может затягиваться на 1-3 года (Nachreiner et al, 2002). В развитии лимфоцитарного тиреоидита у собак различают несколько стадий. Начальная субклиническая стадия характеризуется появлением в крови аутоантител к тиреоглобулину и тиреоидным гормонам и минимальными признаками воспаления в щитовидной железе; затем процессы воспаления и деструкции железы нарастают, и все это заканчива
ется повышением концентрации ТТГ и снижением уровня тиреоидных гормонов в сыворотке (Graham et al, 2001а; табл. 3-2). На последних стадиях заболевания число фолликулов уменьшается, паренхима железы атрофируется и замещается жировой соединительной тканью. Среди инфильтратов, состоящих из лимфоцитов и плазматических клеток, сохраняются гнезда парафолликулярных клеток и немного мелких фолликулов, содержащих плохо
ТАБЛИЦА 3-2.ПРЕДПОЛАГАЕМЫЕ СТАДИИ ЛИМФОЦИТАРНОГО ТИРЕОИДИТА У СОБАК
Стадия тиреоидита Клинические признаки шполиреоза Уровень общего и свободного Т4 в сыворотке крови Уровень I ГГ в сыворотке крови Ау тоангителак тиреоглобулину в сыворотке крови
I - Субклинический тиреоидит Нет Нормальный Нормальный Есть
П — Субклинический гипотиреоз Нет Нормальный Повышенный Есть
III - Явный гипотиреоз Присутствуют Сниженный Повышенный Есть
IV - Невоспалительный Атрофический Присутствуют Сниженный Повышенный Нет
гипотиреоз
По: Graham et al. Lymphocytic thyroiditis. Vet Clin North Am 31: 915, 2001.
T4- тироксин; ГТГ - тиреотропный гормон.
ГИПОТИРЕОЗ • 101
окрашивающийся коллоид, окруженный дегенерирующими тиреоцитами (Conaway et al, 1985b). Исследования (определение уровня антител к тиреоглобулину, Т4 и ТТГ) показывают также, что у собак разных пород скорость развития заболевания и сама вероятность его развития могут быть различными, но каждая из перечисленных стадий лимфоцитарного тиреоидита развивается обычно в течение одного-двух лет (Graham et al, 2001а).
Лимфоцитарный тиреоидит является результатом иммунной атаки на щитовидную железу. Роль гуморальных иммунологических механизмов в патогенезе этого заболевания подтверждается, во-первых, повышенной частотой обнаружения в крови аутоантител к тиреоидным антигенам (в том числе к тиреоглобулину и тиреоидным гормонам), во-вторых, утолщением базальных мембран фолликулов, содержащих электронно-плотные включения (комплексы антиген-антитело), и, наконец, индукцией аналогичных изменений при введении в щитовидную железу собак антител к тиреоглобулину (Gosselin et al, 1980, 1981а, 1981b, 1981с; Gaschen et al, 1993). Считается, что взаимодействие антител с антигенами фолликулярных клеток, коллоида или тиреоглобулина активирует каскад реакций комплемента и/или антителозависимую клеточноопосредованную цитотоксичность, что приводит к разрушению тиреоцитов. Антигены, с которыми реагируют антитиреоидные антитела, включают тиреоглобулин (основной антиген коллоида; антитела к нему наиболее характерны для лимфоцитарного тиреоидита), коллоидный антиген СА-2 (другой нейодированный белок), микросомальный, ядерный и мембранный антигены тиреоцитов (Gosselin et al, 1980; Vajner, 1997).
Важную (а возможно, главную) роль в развитии и прогрессировании лимфоцитарного тиреоидита играют клеточные иммунные реакции. Предполагается, что при этом заболевании имеет место нарушение функции супрессорных Т-лимфоцитов, что «позволяет» эффекторным Т-лимфоцитам атаковать фолликулярные клетки, а Т-хелперам - индуцировать дифференцировку плазматических клеток и продукцию ими антитиреоидных антител (Stra-kosch et al, 1982).
Пусковые факторы лимфоцитарного тиреоидита изучены недостаточно. Важнейшую роль, несомненно, играет генетика, поскольку это заболевание особенно часто встречается у собак определенных пород и линий. У выращенных в питомнике гончих (биглей) наблюдалась полигенная наследуемость лимфоцитарного тиреоидита, а в некоторых семействах русских борзых - аутосомно-рецессивный способ его наследования (Conaway et al, 1985а). Антитела к тиреоидным гормонам также чаще обнаруживаются в крови собак определенных пород (табл.3-3; Nachreiner et al, 2002). Факторы внешней среды, повышающие риск этого заболевания у собак, не выяснены. Предполагаемая роль инфекций (Penhale, Young, 1980) остается недоказанной. В
ТАБЛИЦА 3-3. ПОРОДЫ СОБАК С ПОВЫШЕННОЙ ЧАСТОТОЙ ВСТРЕЧАЕМОСТИ АУТОАНТИТЕЛ К ТИРЕОИДНЫМ ГОРМОНАМ
Порода Превышение средней частоты встречаемости аутоантител к тиреоидным гормонам у собак
Пойнтер 3,61
Английский сеттер 3,44
Английский пойнтер 3,31
Скайтерьер 3,04
Немецкий дратхаар 2,72
Староанглийская овчарка 2,65
(бобтейл)
Боксер 2,37
Мальтийская болонка 2,25
Кувас 2,18
Малый вандейский бассет- 2,16
гриффон
Американский стаффордшир- 1,84
ский терьер
Бигль 1,79
Американский питбуль-те- 1,78
рьер
Далматин 1,74
Ризеншнауцер 1,72
Родезийский риджбек 1,72
Золотистый ретривер 1,70
Шетлендская овчарка (шелти) 1,69
Чесапик-бей ретривер 1,56
Сибирская хаски 1,45
Английский спаниель 1,42
Русская борзая 1,39
Австралийская овчарка 1,28
Доберман-пинчер 1,24
Маламут 1,22
Кокер-спаниель 1,17
Метисы 1,05
Из: Nachreiner RF et al, Prevalence of serum thyroid hormone autoantibodies in dogs with clinical signs of hypothyroidism. JAMA 220:466, 2002.
результате инфекционного поражения щитовидной железы тиреоидные антигены могли бы попадать в кровь и «представляться» иммунной системе; не исключается и возможность «молекулярной мимикрии», т.е. сходства вирусных или бактериальных антигенов с собственными тиреоидными антигенами. Провоцирующим фактором лимфоцитарного тиреоидита может быть и вакцинация животных (Smith, 1995; Allbritton, 1996). Как показали недавние исследования на биглях, повторные вакцинации, начиная с 8-недельного возраста, приводят к значительному возрастанию частоты обнаружения и титров антител к бычьему и собачьему тиреоглобулину в крови животных (Scott-Moncrieff et al, 2002). Увеличение титра антител к тиреоглобулину через 2 недели после вакцинации наблюдалось и у взрослых домашних собак. Клиническое значение этих данных и их связь с развитием лимфоцитарного тиреоидита остаются неясными. Неизвестно, как долго сохраняются антитела в крови, хотя их титры у большинства собак ко времени следующей вакцинации снижались до исходного уровня. Лишь у трех собак в этом исследовании развился тиреоидит, который мог быть спонтанным (не связанным с
102
ГИПОТИРЕОЗ
ТАБЛИЦА 3-4. РАССТРОЙСТВА ПРИ АУТОИММУННЫХ ПОЛИГЛАНДУЛЯРНЫХ СИНДРОМАХ ТИПА IИ II
Синдром типа I (% встре-
чаемости)
Надпочечниковая недостаточность (100%)
Гипопаратиреоз (76%)
Кандидоз кожи и слизистых (73%)
Недостаточность половых желез (17%)
Аутоиммунные заболевания щитовидной железы (11%) Инсулинозависимый сахарный диабет (4%)
Прочие заболевания
Алопеция (32%)
Нарушения всасывания
(22%)
Пернициозная анемия (13%)
Хронический активный
гепатит (13%)
Витилиго (8%)
Синдром типа II (% встре-
чаемости)
Надпочечниковая недостаточность (100%)
Аутоиммунные заболевания щитовидной железы (69%) Инсулинозависимый сахарный диабет (52%)
Недостаточность половых желез (4%)
Несахарный диабет (редко) Гипопитуитаризм (редко) Витилиго (5%) Пернициозная анемия (1%) Алопеция (1%)
Миастения
Коллагенозы
Целиакия
Из: Neufeld М et al: Two types of autoimmune Addison’s disease associated with different polyglandular autoimmune (PGA) syndromes. Medicine 60:355, 1981.
ТАБЛИЦА 3-5. КОЛИЧЕСТВО СОБАК, ОБСЛЕДОВАННЫХ В НАШЕЙ КЛИНИКЕ С 1990 ПО 1994 гг, С ИЗОЛИРОВАННОЙ И КОМБИНИРОВАННОЙ НЕДОСТАТОЧНОСТЬЮ РАЗЛИЧНЫХ ЭНДОКРИННЫХ ЖЕЛЕЗ
Эндокринные нарушения Число собак
Инсулинозависимый сахарный диабет 153
Первичный гипотиреоз 124
Первичная надпочечниковая недостаточ- 72
ность
Первичный гипопаратиреоз 13
Сахарный диабет и гипотиреоз 13
Сахарный диабет и гипокортицизм 9
Гипокортицизм и гипотиреоз 3
Сахарный диабет, гипокортицизм и гипоти- 2
реоз Гипопаратиреоз и недостаточность других 0
эндокринных желез
вакцинацией). У остальных до 4,5-летнего возраста не отмечалось каких-либо нарушений функции щитовидной железы. Авторы предполагают, что появление антител обусловлено загрязнением вакцины бычьим тиреоглобулином. Между тиреоглобулинами разных видов существует высокая степень гомологии, и антитела к белку одного из видов животных перекрестно реагируют с тиреоглобулином других видов (Tomer, 1997).
Лимфоцитарный тиреоидит и аутоиммунные полигландулярные синдромы. Поскольку аутоиммунные механизмы играют столь значительную
роль в патогенезе лимфоцитарного тиреоидита, неудивительно, что это заболевание встречается при других аутоиммунных синдромах эндокринной недостаточности. У человека известны два аутоиммунных полигландулярных синдрома: тип I и тип II (табл. 3-4). Последний (синдром Шмидта) является самой частой формой иммунопатологических эндокринных синдромов у человека и включает первичную надпочечниковую недостаточность в сочетании с аутоиммунным поражением щитовидной железы и/или инсулинозависимым сахарным диабетом (Neufeld et al, 1981). В редких случаях сочетание недостаточности ряда эндокринных желез (например, гипотиреоза и сахарного диабета, аддисоновой болезни и гипотиреоза) наблюдалось и у собак (Hargis et al, 1981; Haines, Penhale, 1985; Bowen et al, 1986; Ford et al, 1993; Kooistra et al, 1995; Greco, 2000) (табл. 3-5). По данным ретроспективного исследования 225 собак с недостаточностью коры надпочечников, у 4% из них имелся гипотиреоз, у 0,5% - сопутствующий сахарный диабет и у одной собаки - гипотиреоз, сахарный диабет и гипопаратиреоз (Peterson et al, 1996).
Последовательность и темпы развития нарушений при этих синдромах у собак неизвестны. Доказанная у человека генетическая предрасположенность к аутоиммунным полигландулярным синдромам (Eisenbarth, Jackson, 1992), возможно, играет роль и у собак. Наиболее частый у человека аутоиммунный полигландулярный синдром типа II наследуется как аутосомно-доминантный признак, ассоциированный с антигенами HLA (Verge, 1998). Пораженные эндокринные железы инфильтрированы лимфоцитами и плазматическими клетками, а в крови, как правило, присутствуют органоспецифические аутоантитела. Возникновение деструктивных процессов объясняют действием факторов окружающей среды на фоне сцепленной с HLA генетической предрасположенности. В развитии патологии тканей-мишеней принимают участие как клеточные, так и гуморальные иммунные реакции. Чаще всего обнаруживается функциональный дефект Т-супрессоров. У больных собак находили инфильтрацию эндокринных желез лимфоцитами и плазматическими клетками (например, лимфоцитарный тиреоидит, лимфоцитарный инсулит, лимфоцитарный адреналит) и органоспецифические аутоантитела (например, к тиреоглобулину, к островкам поджелудочной железы, к ткани надпочечников) в крови (Haines, Penhale, 1985; Kooistra et al, 1995), что свидетельствует о сходстве патогенетических механизмов этих синдромов у собак и человека.
Аутоиммунные полигландулярные синдромы следует подозревать при одновременной недостаточности у собак нескольких эндокринных желез. Наблюдалось сочетание недостаточности коры надпочечников с гипотиреозом и (реже) с сахарным диабетом, гипопаратиреозом или первичной недостаточностью половых желез. В таких случаях
ГИПОТИРЕОЗ
103
Рис. 3-5. А и Ь - Гистологический срез щитовидной железы собаки с идиопатической атрофией железы и гипотиреозом. Обратите внимание на малые размеры фолликулов (по сравнению с рис. В). (Гематоксилин-эозин; А. х 40; Б: х 250). В - Гистологический срез нормальной щитовидной железы при том же увеличении, что и на рис. I. Обратите внимание на большие размеры железы и фолликулов, а также большее содержание коллоида, чем на рис. А. (Гематоксилин-эозин, х 40).
сначала проявляется одно из эндокринных заболеваний, а другие развиваются спустя разное время (обычно от 3 до 18 месяцев). Заболевания диагностируют и лечат по мере их проявления, поскольку пока нет надежных методов их прогнозирования и профилактики. Следует также иметь в виду, что
одна эндокринная патология может изменять диагностические показатели другой (например, при нелеченном сахарном диабете снижается концентрация тиреоидных гормонов в сыворотке крови), и лечение одной из них сказывается на течении другой (например, введение тиреоидных гормонов
104 • ГИПОТИРЕОЗ
может резко повышать чувствительность к инсулину при сахарном диабете). Применение иммунодепрессивных средств при сочетанных синдромах не показано, так как они могут утяжелять исходные заболевания. Так, например, большие дозы глюкокортикоидов увеличивают резистентность к инсулину и подавляют функцию щитовидной железы.
Идиопатическая атрофия щитовидной железы. При микроскопическом исследовании железы находят замещение ее паренхимы жировой тканью (рис. 3-5). Воспалительные инфильтраты отсутствуют даже в тех участках, где сохраняются мелкие фолликулы или их остатки (Graham et al, 1981b); отсутствуют и антитиреоидные антитела в крови. Паращитовидные железы и парафолликулярные клетки щитовидной железы обычно остаются интактными.
Причина идиопатической атрофии щитовидной железы неизвестна. Предполагают, что дистрофический процесс начинается с отдельных фолликулярных клеток (Graham et al, 1981b). Затем эти клетки слущиваются в коллоид или межфолликулярное пространство. Фолликулы становятся все меньше и меньше и замещаются жировой тканью. Эта атрофия отличается от наблюдаемой при дефиците ТТГ (т.е. вторичном гипотиреозе). В последнем случае фолликулярный эпителий становится более плоским, но признаки дегенерации клеток отсутствуют.
Атрофией щитовидной железы заканчивается и лимфоцитарный тиреоидит. Морфологические исследования щитовидных желез, проведенные у борзых с лимфоцитарным тиреоидитом в одном из питомников, обнаруживали начальные дистрофические изменения в паренхиме железы, которые быстро переходили в выраженное воспаление с последующим фиброзом. Гистологическая картина последней стадии заболевания напоминала идиопатическую атрофию фолликулов (Conaway et al, 1985b). Однако и на этой стадии все еще были видны остаточные признаки воспаления. Недавно показано, что у собак с идиопатической атрофией щитовидной железы гипотиреоз развивается в более позднем возрасте, чем у животных с лимфоцитарным тиреоидитом. Это подтверждает мнение об идиопатической атрофии как о конечной стадии лимфоцитарного тиреоидита (Graham et al, 2001а). В динамике последнего заболевания наблюдается постепенное снижение титров аутоантител к тиреоглобулину и тиреоидным гормонам, что указывает на исчезновение со временем соответствующих антигенов. Вместе с тем, отсутствие воспалительных инфильтратов в щитовидной железе при идиопатической атрофии, даже на той ее стадии, когда еще обнаруживаются фолликулы, говорит о том, что атрофия железы у собак может иметь разные причины. При идиопатической атрофии (в отличие от лимфоцитарного тиреоидита) в крови отсутствуют какие-либо маркеры заболевания, и поэтому диагноз устанавливают путем исключения. Иными словами, при наличии клинических признаков гипотиреоза идиопатическую атрофию щитовидной
железы диагностируют в случаях отсутствия антитиреоидных аутоантител в крови, характерных для лимфоцитарного тиреоидита. Утверждать существование связи между обоими заболеваниями можно будет лишь после того, как удастся проследить естественную динамику патологического процесса в щитовидной железе у собак с лимфоцитарным тиреоидитом (путем последовательных биопсий железы у одного и того же животного).
Гиперплазия фолликулярных клеток. При гистологическом исследовании щитовидной железы у некоторых собак с гипотиреозом обнаруживаются мелкие фолликулы, содержащие минимальные количества коллоида, на фоне гиперплазии фолликулярных клеток. Какие-либо признаки воспаления в железе отсутствуют, а у немногих обследованных собак в таких случаях не удавалось выявить и антител к тиреоглобулину в крови. Причина этих гистологических изменений неизвестна, хотя они сходны с таковыми при дефиците йода или нарушениях биосинтеза тиреоидных гормонов у молодых собак и кошек (Chastain et al, 1983; Arnold et al, 1984). Дефицит йода в данных случаях можно исключить, поскольку собаки получали сбалансированный корм (коммерческую диету). Возможным объяснением остается нарушение синтеза тиреоидных гормонов. Если допустить нарушение связывания ТТГ с его рецепторами, то возникающий дефицит тиреоидных гормонов должен был бы приводить к усилению секреции ТТГ и вторичной гиперплазии фолликулярных клеток. Интересно, что диета с избыточным содержанием йода может резко нарушать функцию щитовидной железы и вызывать гипотиреоз (Castillo et al, 2001). Избыточное потребление йода угнетает захват и органификацию йодида, а также секрецию тиреоидных гормонов фолликулярными клетками щитовидной железы, приводя к компенсаторному повышению уровня ТТГ в крови (Pisarev, Gartner, 2000).
Разрушение щитовидной железы опухолями. Клинические признаки гипотиреоза появляются при разрушении опухолями более 75% нормальной ткани щитовидной железы. Опухоли могут возникать в самой щитовидной железе или прорастать в нее из соседних тканей. Обширное разрушение щитовидной железы чаще всего наблюдается при раке этого органа или метастазировании в него плоскоклеточного рака.
Опухоли щитовидной железы у собак в большинстве случаев гормонально неактивны и не сопровождаются клиническими признаками гипертиреоза. По нашим данным, у 55-60% собак с опухолями щитовидной железы концентрация тиреоидных гормонов в сыворотке крови оставалась нормальной, у 30-35% - была сниженной (при наличии клинических признаков гипотиреоза), и только примерно у 10% - повышенной и сопровождалась признаками гипертиреоза (см. гл. 5).
«Нефункционирующие» опухоли щитовидной железы на самом деле могут секретировать не
ГИПОТИРЕОЗ • 105
активные (измененные) формы тиреоидных гормонов, которые не вызывают тиреотоксикоза и не определяются стандартными радиоиммунологичес-кими методами. В то же время они могут сохранять способность подавлять секрецию ТТГ, приводя к атрофии сохранившихся участков нормальной тиреоидной ткани. По-видимому, именно так обстояло дело в случае гипотиреоза у собаки с фолликулярным раком одной из долей щитовидной железы (Branam et al, 1982).
Другие причины. Первичный гипотиреоз может быть следствием отравления токсическими веществами или антитиреоидными средствами (например, пропилтиоурацилом или тиамазолом), а также хирургического удаления опухоли щитовидной железы. У собак часто имеется дополнительная тиреоидная ткань (которая может находиться в корне языка и ниже, вплоть до основания сердца). Поэтому тиреоидэктомия редко приводит к постоянному гипотиреозу. Большие дозы радиоактивного йода (1311), применяемые для лечения гипертиреоза, могут разрушать тиреоидную ткань независимо от ее локализации (Meric et al, 1986).
Выводы. Хотя первичный гипотиреоз у собак может иметь различные причины (см. табл. 3-1), в большинстве случаев он обусловлен лимфоцитарным тиреоидитом и идиопатической атрофией щитовидной железы. Обе причины приводят к прогрессирующему снижению функции железы вследствие ее аутоиммунного поражения (лимфоцитарный тиреоидит) или развития в ней дегенеративных процессов (идиопатическая атрофия). В обоих случаях нарушение синтеза и секреции тиреоидных гормонов сопровождается клиническими признаками гипотиреоза.
Вторичный гипотиреоз
В основе вторичного гипотиреоза лежат либо пороки развития тиреотрофов гипофиза (первичная гипоплазия, сопровождающаяся гипофизарной карликовостью), либо нарушения их функции, приводящие к недостаточной продукции ТТГ и «вторичной» недостаточности синтеза и секреции тиреоидных гормонов. В отсутствие ТТГ фолликулярные клетки щитовидной железы постепенно атрофируются. При гистологическом исследовании обнаруживаются растянутые коллоидом фолликулы, выстланные низким кубовидным эпителием. Коллоид однородный, плотный; признаки его эндо-цитоза (например, вакуоли резорбции) выражены слабо. Отсутствуют также лимфоцитарная инфильтрация щитовидной железы и дегенеративные изменения ее эпителиальных клеток.
Возможные причины вторичного гипотиреоза включают врожденные пороки развития гипофиза, разрушение этого органа и подавление его функции. У собак вторичный гипотиреоз, связанный с приобретенными дефектами тиреотропных клеток гипофиза или их деструкцией (например, опухоля
ми гипофиза), встречается редко. Однако подавление тиреотропной функции гипофиза гормонами и другими веществами (например, экзогенными или эндогенными глюкокортикоидами) наблюдается достаточно часто. При вторичном гипотиреозе содержание ТТГ в сыворотке крови снижено или вообще не поддается определению. Современные методы определения ТТГ у собак, к сожалению, не позволяют разграничить нормальные и сниженные его уровни, что затрудняет диагностику вторичного гипотиреоза. Повышенные концентрации ТТГ в сыворотке крови свидетельствуют о первичном гипотиреозе, но неопределяемо низкий уровень ТТГ не может служить подтверждением диагноза вторичного гипотиреоза.
Пороки развития гипофиза. Врожденные аномалии гипофиза наблюдаются у собак многих пород, но чаще всего у немецких овчарок. Нарушением секреции ТТГ сопровождаются кисты кармана Ратке или гипоплазия передней дли гипофиза (Eigenmann, 1981; Hamann et al, 1999; Kooistra et al, 2000a). Врожденные дефекты передней доли гипофиза сопровождаются недостаточностью и других гормонов, особенно гормона роста (ГР), что обычно проявляется карликовостью (см. гл. 2). При нарушении секреции только ТТГ и сохранении секреции ГР развивается кретинизм.
Деструкция гипофиза. В редких случаях вторичный гипотиреоз может быть следствием разрушения тиреотрофов разрастающимися опухолевыми массами. При опухолях гипофиза или соседних участков головного мозга развивается недостаточность не только щитовидной, но и других желез - гипокортицизм (вторичная надпочечниковая недостаточность), несахарный диабет, дисфункция половых желез (например, нерегулярность эс-тральных циклов, потеря либидо, атрофия яичек, азооспермия), а у неполовозрелых животных еще и гипофизарная карликовость. Владельцы собак обычно обращают внимание на признаки наиболее тяжелой эндокринной патологии. К нарушению функции щитовидной железы у собак чаще других приводят опухоли гипофиза, секретирующие избыточные количества адренокортикотропного гормона (АКТГ) и сопровождающиеся гиперкортицизмом. Вторичный гипотиреоз у таких собак обусловлен подавлением тиреотропной функции (т.е. угнетением секреции ТТГ), а не разрушением тиреотрофов опухолью.
Подавление функции тиреотропных клеток гипофиза. Подавление тиреотропной функции гипофиза с развитием вторичного гипотиреоза может быть следствием различных заболеваний, истощения и действия лекарственных веществ или гормонов (см. параграф «Факторы, изменяющие показатели функции щитовидной железы»). Именно это служит самой частой причиной вторичного гипотиреоза у собак. С клинической точки зрения, наибольшее значение имеет, по-видимому, эффект глюкокортикоидов, либо экзогенных, либо эндо
106 • ГИПОТИРЕОЗ
генных (при спонтанном гиперкортицизме). При обследовании 102 собак с гиперфункцией коры надпочечников в 68% случаев было обнаружено снижение базального уровня Т4 и/или Т3 в сыворотке крови (Ferguson, Peterson, 1986). В таких условиях обычно снижается и чувствительность щитовидной железы к экзогенному ТТГ (см. гл. 6). Вторичный гипотиреоз, обусловленный подавлением тиреотропной функции гипофиза (в отличие от других причин), как правило, обратим. Если удается выяснить и устранить причину такого гипотиреоза, то терапия тиреоидными гормонами не нужна.
Другие причины. У человека вторичный гипотиреоз иногда бывает следствием продукции гипофизом аномального ТТГ или нарушения взаимодействия этого гормона с его рецепторами на поверхности фолликулярного эпителия щитовидной железы. У собак такие случаи до сих пор не описаны. Вторичный гипеотиреоз может развиваться после облучения по поводу крупной секретирующей АКТГ аденомы гипофиза, а также в результате гипофизэктомии (Lantz et al, 1988; Meij et al, 1998).
Третичный гипотиреоз
Третичный гипотиреоз развивается в результате недостаточной секреции ТРГ пептидергическими нейронами супраоптического и паравентри-кулярного ядер гипоталамуса. В отсутствие ТРГ снижается секреция ТТГ, что приводит к атрофии фолликулов щитовидной железы. Гистологическая картина железы в таких случаях не отличается от таковой при вторичном гипотиреозе. У человека дефицит ТРГ бывает следствием врожденных пороков развития гипоталамуса, его повреждения опухолями или кровоизлияниями, а также продукции аномального ТРГ или нарушения взаимодействия ТРГ с его рецепторами на поверхности тиреотро-фов гипофиза.(Larsen et al, 1998). В зависимости от причины этой патологии могут наблюдаться неврологические нарушения и недостаточность других гипофизарных гормонов. Теоретически, третичный гипотиреоз можно отличить от вторичного по изменению концентрации ТТГ в сыворотке крови после введения экзогенного ТРГ. У собак третичный гипотиреоз не описан, и следует полагать, что он встречается очень редко.
Врожденные дефекты тиреоидного статуса
Частота врожденного гипотиреоза у собак неизвестна. Среди 2642 собак с гипотиреозом 3,6% были моложе 1 года (Milne, Hayes, 1981). Можно предположить, что у кого-то из них имелись врожденные дефекты щитовидной железы. Не исключено, что врожденный гипотиреоз приводит к ранней гибели щенков, а их смерть списывается на «синдром угасания» (чрезвычайно широкий и неопределенный диагноз). Таким образом, в большинстве случаев
наличие этой патологии у щенков определить невозможно.
У человека врожденные дефекты тиреоидного статуса разделяют на четыре категории: дисгенезия щитовидной железы, нарушения гормоногенеза, нарушения транспорта тиреоидных гормонов в крови и нарушения, обусловленные действием зобогенных веществ. Описаны также мутации гена ТТГ, приводящие к синтезу биологически неактивного гормона, и мутации гена его рецептора, лишающие щитовидную железу способности отвечать на ТТГ (Hayashizaki et al. 1990; Sunthomthepvarakul et al, 1994). Большинство врожденных нарушений тиреоидного статуса у человека обусловлено дисгенезией щитовидной железы - ее аплазией, гипоплазией или эктазией (Larsen et al, 1998), а среди остальных категорий наиболее частая причина врожденного гипотиреоза - дефект органификации йодида. В литературе имеется лишь несколько сообщений о врожденном гипотиреозе у собак. К установленным причинам врожденного первичного гипотиреоза относятся дефицит йода в диете, дефекты органификации йодида и дисгенезия щитовидной железы (Chastain et al, 1983; Greco et al, 1985). У ризеншнауцеров (Greco et al, 1901) и боксеров (Mooney, Anderson, 1993) наблюдался также вторичный гипотиреоз, обусловленный недостаточностью ТТГ. Анализ родословной у больных ризеншнауцеров указывал на аутосомно-рецесиввное наследование этой патологии. Для гипофизарных карликов, помимо дефицита ТТГ, характерна недостаточность и других гормонов передней доли гипофиза: как правило, ГР и пролактина (Hamann et al, 1999; Kooistra et al, 2000a; см. гл. 2). В нарушении роста и развития у этих собак могло играть роль и отсутствие ТТГ.
Появление зоба зависит от причины нарушения тиреоидного статуса. Блокада синтеза тиреоидных гормонов (например, при нарушении органификации йодида в щитовидной железе) в условиях интактной гипоталамо-гипофизарной системы и нормального связывания ТТГ с его рецепторами приводит к развитию зоба под действием повышенного уровня ТТГ. Лечение левотироксином в таких случаях снижает концентрацию ТТГ в сыворотке крови, что подтверждает нормальную функцию тиреотропных клеток гипофиза. Если же дефект кроется в гипоталамо-гипофизарной системе (как в случаях недостаточности ТТГ), то зоб не развивается. Содержание ТТГ в сыворотке крови в таких случаях должно быть сниженным, хотя из-за низкой чувствительности современных методов его определения у собак это показать не удается. При нарушении связывания ТТГ с рецепторами зоб отсутствует, несмотря на повышенную концентрацию ТТГ в крови. Бывает ли у собак нарушено связывание ТТГ с рецепторами, пока не известно.
Низкий уровень Т3 в сыворотке на фоне нормального содержания Т4 у некоторых собак часто объясняют нарушением периферической конверсии Т4 в Т3 вследствие недостаточности б'-монодейодиназы.
ГИПОТИРЕОЗ • 107
Однако доказательства такого дефекта отсутствуют. По-видимому, недостаточность 51-монодейодиназы несовместима с жизнью и должна приводить к рассасыванию плода, аборту или гибели новорожденных (т.е. «синдрому угасания щенков»). Снижение концентрации Т3 в сыворотке крови на фоне нормального уровня Т4 встречается довольно часто у эутиреоидных собак и может быть связано с нормальными колебаниями содержания Т3, сопутствующими заболеваниями и медикаментозной терапией. Иногда при лимфоцитарном тиреоидите у собак Т3 вообще не поддается определению из-за присутствия связывающих его аутоантител, в результате чего при определении этого гормона получаются ложно заниженные результаты.
Дефицит йода
Поскольку имеющийся в продаже корм содержит достаточные количества йода, дефицит этого элемента редко служит причиной гипотиреоза у собак. Потребность в йоде для взрослых биглей составляет 140 мкг/сутки. По данным одного из исследований, снижение уровня Т4и (в меньшей степени) Т3 в сыворотке крови наблюдалось лишь при снижении потребления йода до 20-50 мкг/сут. Однако и в этих случаях клинические признаки гипотиреоза у собак отсутствовали. Концентрация свободного Т4, определяемая методом равновесного диализа, при ограничении потребления йода оставалась нормальной.
Гистологические изменения, выявленные в щитовидной железе собак при дефиците йода, можно разделить на две группы. У одних животных были обнаружены мелкие фолликулы с минимальным содержанием коллоида. Отмечалась гиперплазия фолликулярных клеток, ускоренный захват и быстрое высвобождение радиоактивного йода щитовидной железой. У собак второй группы фолликулы имели большие размеры и содержали большее количество коллоида. Щитовидная железа быстро поглощала радиоактивный йод, но медленно высвобождала его. Тиреотрофы гипофиза были увеличены и содержали очень небольшое количество гранул, что указывало на повышенную активность этих клеток.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ПЕРВИЧНОГО ГИПОТИРЕОЗА У ВЗРОСЛЫХ СОБАК
Факторы риска
Какого-либо одного показателя, который подтверждал бы наличие гипотиреоза у собак, не существует. Поэтому ко всем сообщениям, касающимся частоты и генетики этого заболевания у отдельных пород собак, необходимо относится критически, постоянно задавая себе вопрос: на чем основан данный диагноз. В таблице 3-3 перечислены породы, у которых чаще встречаются аутоантитела к тиреоглобулину и тиреоидным гормонам, что позволяет предполагать
ТАБЛИЦА 3-6. РАСПРЕДЕЛЕНИЕ 130 СОБАК С ПЕРВИЧНЫМ ГИПОТИРЕОЗОМ ПО ПОРОДАМ
Порода Число собак (%)
Золотистый ретривер 24 (18)
Доберман-пинчер 22 (17)
Лабрадор-ретривер 8(6)
Кокер-спаниель 7(5)
Немецкая овчарка 7(5)
Метисы 7(5)
Такса 5(4)
Пудель 4(3)
Ротвейлер 4(3)
Спаниели (спрингер, Кинг-Чальз) 4(3)
Акита 3(2)
Боксер 3(2)
Терьеры (фокс, шотландский, уэст- 3(2)
хайленд-уайт)
Бигль 2(2)
Чесапик-бей ретривер 2(2)
Чау-чау 2(2)
Мальтийская болонка 2(2)
Мастифф 2(2)
Староанглийская овчарка 2(2)
Самоедская лайка 2(2)
Шетладская овчарка 2(2)
13 других пород < 1% каждая
повышенную частоту лимфоцитарного тиреоидита у собак этих пород и может указывать на роль генетического фактора в его развитии (Nachreiner et al, 2002). На мнение ветеринаров о предрасположенности собак отдельных пород к лимфоцитарному тиреоидиту влияет распространенность той или иной породы в данном регионе. Это мнение может не всегда соответствовать действительности. В нашей клинике гипотиреоз чаще всего диагностировался у доберманов, золотистых ретриверов, лабрадоров-ретриверов и кокер-спаниелей (табл. 3-6). Клинические признаки заболевания развивались преимущественно у собак среднего возраста (от 2 до 6 лет). Среди 3206 собак, у которых был диагностирован гипотиреоз, 32% были в возрасте 4-6 лет и 22% - в возрасте 2-3 и 7-9 лет (Milne, Hayes, 1981). У собак разных пород возраст, в котором впервые появляются симптомы гипотиреоза, различается, что связано, вероятно, с причиной и скоростью прогрессирования заболевания. В целом, у пород с повышенным риском гипотиреоза клинические признаки этого заболевания появляются в более раннем возрасте (Milne, Hayes, 1981; Nesbitt et al, 1980; Muller et al, 1983). Различие между полами в этом отношении отсутствует.
Клинические признаки
Тиреоидные гормоны регулируют обмен веществ. При снижении уровня этих гормонов в крови меняется метаболизм практически во всех органах и тканях, что определяет широкое разнообразие клинических признаков гипотиреоза. Эти признаки зависят как от возраста, так и от породы собак (табл. 3-7). Животные разных пород сильно различаются, например, по продолжительности стадий
108
ГИПОТИРЕОЗ
ТАБЛИЦА 3-7. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГИПОТИРЕОЗА У ВЗРОСЛЫХ СОБАК
Снижение основного обмена
Сонливость*
Психическая заторможенность Вялость*
Прибавка в весе*
Зябкость
Кожные проявления
Эндокринная алопеция * (симметричная или ассимет-ричная; на участках тела, подвергающихся трению или давлению; «крысиный хвост»)
Сухая, ломкая шерсть
Г иперпигментация
Сухая или жирная себорея, дерматит
Пиодермия
Наружный отит
Слизистый отек (микседема)
Нарушения половой функции
Хронический анэструс
Слабый или скрытый эструс Увеличение времени астрального кровотечения
Галакторея или гинекомастия Атрофия яичек (?) Отсутствие либидо (?)
Нарушения поведения (?)
* Общие признаки
Нервно-мышечные нарушения
Слабость*
Истончение пальцевых фаланг
Атаксия
Вращение
Вестибулярные расстройства
Парез лицевого нерва
Судороги
Парез гортанного нерва (?) Глазные симптомы Отложение липидов в роговице
Изъязвление роговицы
Увеит
Сердечно-сосудистые нарушения
Брадикардия
Аритмии
Желудочно-кишечные расстройства
Снижение подвижности пищевода (?)
Понос
Запор
Изменения крови
Анемия*
Г иперлипидемия
Коагулопатия
роста шерсти и строению волосяных фолликулов (Credille et al, 2001), и поэтому кожные проявления гипотиреоза у них неодинаковы. У одних пород преобладают кожные нарушения, а у других - нервно-мышечные. Деструкция щитовидной железы - процесс медленный, и от возникновения лимфоцитарного тиреоидита до появления признаков гипотиреоза может пройти больше года. Признаки заболевания зачастую развиваются постепенно и незаметно, что препятствует своевременному установлению диагноза. При сборе анамнеза отдельные признаки (например, нарушение обменных процессов) могут не привлекать внимания просто из-за их медленного развития. Владельцы собак подчас осознают, что их питомцы были больны только после начала заместительной терапии и восстановления исходного состояния животных.
Наиболее постоянные клинические признаки гипотиреоза у взрослых собак связаны со снижением обмена веществ и изменением их психики и активности (табл. 3-8). Кроме того, обычно отмечаются изменения со стороны кожи, нейромышечной и репродуктивной систем. Признаки нарушения функций других органов, как правило, менее выражены и редко служат поводом обращения к ветеринарному врачу.
ТАБЛИЦА 3-8. ЧАСТОТА РАЗЛИЧНЫХ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ СРЕДИ 100 СОБАК С ГИПОТИРЕОЗОМ
Клинический признак Процент собак
Прибавка веса 48
Сонливость, психическая апатия 35
Кожные проявления
Гиперкератоз 33
Симметричная эндокринная алопеция 25
Истончение шерсти 25
Себорея 16
Г иперпигментация 15
Наружный отит 13
«Крысиный хвост» 12
Пиодермия 12
Пятнистая эндокринная алопеция 11
Зуд 9
Слизистый отек морды (микседема) 8
Нервно-мышечные нарушения
Слабость, утомляемость 12
Эпилептические судороги 4
Парез лицевого нерва 4
Недержание головы 3
Дисфагия 3
Парез гортани 3
Нарушения половой функции
Хронический анэструс 4
Бесплодие (у самцов) 1
Зоб 1
Отложение липидов в роговице 1
Носовые кровотечения 1
Отсутствие симптомов, гиперлипидемия 4
Признаки снижения основного обмена. Наш опыт говорит о том, что у большинства взрослых собак с гипотиреозом имеются симптомы, отражающие влияние снижения основного обмена на психическое состояние и активность животных. Эти признаки включают определенную степень психической заторможенности, сонливость, утомляемость или уклонение от физической активности, а также прибавку в весе без увеличения аппетита или потребления пищи. По данным одного из исследований, энергозатраты, определяемые методом непрямой калориметрии, при гипотиреозе примерно на 15% меньше, чем у здоровых собак. Лечение натриевой солью левотироксина нормализует этот показатель (Greco et al, 1998). Собаки с гипотиреозом плохо переносят холод и ищут теплых мест. Однако это вряд ли помогает диагностике, поскольку большинство собак время от времени ищут тепла.
Симптомы нарушения основного обмена, по-видимому, особенно редко привлекают внимание хозяина собаки, так как развиваются медленно и выражены слабо, становясь заметными лишь при длительном гипотиреозе. При визите к ветеринару владельцы собак обычно не упоминают об этих симптомах. Их трудно обнаружить и при физикальном обследовании, особенно если ветеринар видит собаку в первый раз. Среди 108 собак с гипотиреозом сонливость отмечалась только у 11%, а ожирение или непереносимость холода - менее чем у 10% животных (Nesbitt et al, 1980). Однако независимо от анамнеза и результатов физикального обследова-
ГИПОТИРЕОЗ
109
Рис. 3-6. 8-летний кобель чесапик-бей ретривер с гипотиреозом. Обратите внимание на редкую шерсть сонливый вид, микседему морды с опушенными веками (А и Б), а также «крысиный хвост» (В)
ния через 7--10 дней после начала заместительной терапии тиреоидными гормонами большинство собак становились более активными.
Дерматологические признаки. Изменения кожи и шерсти - наиболее частые признаки гипотиреоза у собак. Эти изменения бывают очень разными и зависят как от породы животного, так и от тяжести и длительности заболевания. Классическим признаком гипотиреоза у собак считают двустороннее симметричное облысение туловища без зуда. Однако при 10-месячном наблюдении за биглями с искусственно вызванным гипотиреозом ни у одной из собак не отмечалось отчетливого облысения, хотя количество шерсти у них было примерно на 1/3 меньше, чем у здоровых животных (Credille et al, 2001). Вместе с гем, после стрижки шерсть не отрастала. Это происходило потому, что подавляющее большинство волосяных фолликулов находилось в стадии покоя (телогена), которая может
продолжаться месяцы и годы. Таким образом при гипотиреозе шерсть не выпадает, и возможность ее роста сохраняется. Однако у биглей с гипотиреозом, в отличие от здоровых биглей, волосяной покров, теряемый на стадии телогена, не восстанавливается. Это объясняет возможность появления очаговой алопеции на участках тела, подвергаемых давлению или зрению. У собак других пород (с иной продолжительностью цикла роста волос и другим строением волосяных фолликулов) дерматологические признаки гипотиреоза могут отличаться от таковых у биглеи. Приведенные данные свидетельствуют о своеобразии клинических проявлении гипотиреоза у собак разных пород.
Тиреоидные гормоны необходимы для запуска и поддержания стадии роста волос (анагена) (Credille et al, 2001). При недостаточности этих гормонов волосяные фолликулы преждевременно переходят в стадию телогена. Шерсть, теряемая на этой с га-
110
ГИПОТИРЕОЗ
Рис. 3-7. 5-летний кобель карликовый пудель (А) и 6-летняя овариэктомированная сука карликового пуделя (Б) с эндокринной алопецией и гипотиреозом. Обратите внимание на облысение туловища и гиперпш мен-гацию, не распространяющиеся на голову и лапы, у обеих собак.
дни, не отрастает, что и создает картину облысения. Снижение со щржания в коже жирных кислот и простагландина Е, наряду с атрофией сальных желез, обусловливает гиперкератоз, шелушение и сухую себорею; шерсть также становится сухой и теряет блеск (Campbell, Davis, 1990). На ранних стадиях гипотиреоза шерсть часто теряется неравномерно, и облысение особенно заметно на трущихся участках тела - на задней поверхности бедер, на груди, у основания хвоста и на самом хвосте (так называемый «крысиный хвост») (см. рис. 3-6). С нарастанием тяжести и длительности гипотиреоза облысение становится более симметричным и, наконец, формирует классическую картину. Зуд отсутствует, и облысение обычно не затрагивает голову и дистальные части лап (рис. 3-7). Хотя эндокринная алопеция без зуда - не патогномоничный признак гипотиреоза, но при ее наличии у собаки с замедлением основного обмена в отсутствие полиурии и полидипсии наиболее вероятным диагнозом является именно гипотиреоз.
В зависимости от породы собак шерсть либо легко выщипывается, либо, как у ирландских сеттеров, становится более прочной, приводя к гипертрихозу. У короткошерстных собак (доберманы-пинчеры, боксеры) из-за гипертрихоза образуется очень плотный «ворс», обычно вокруг головы и/или на лапах (Rosychuk, 1998). У одних собак теряется преимущественно подшерсток, а сохраняющиеся остевые волосы придают шерсти грубый вид. У других (например, у северных пород) теряются остевые волосы, и собаки становятся пушистыми. У собак некоторых пород (например, биглей) шерсть истончается, но облысение туловища отсутствует. Как правило, при гипотиреозе шерсть на голове и дистальных частях лап сохраняется, хотя и значительно редеет (на переносице у биглей, ушах у такс или лапах у ньюфаундлендов) (Rosychuk, 1998; Credille et al, 2001).
11оскольку большинство волосяных фолликулов находится в стадии телогена, отрастание шерсти
после стрижки замедлено, и часто именно это служит первым поводом подозревать гипотиреоз. Данный признак характерен также для гиперкортицизма и гиперэстрогенизма (например, при опухолях из клеток Сертоли).
Обычно наблюдается та или иная степень гиперпигментации, особенно на участ ках облысения и трущихся поверхностях тела (подмышечные и паховые области) (рис. 3-8). Иногда отмечают кровоподтеки и плохое заживление ран, что связано с нарушением функции фибробластов и замедлением синтеза белка, в частности коллагена. При тяжелом гипотиреозе в коже накапливаются кислые и нейтральные мукополисахариды и гиалуроновая кислота. Эти соединения связывают воду, вследствие чего кожа утолщается. Такой слизистый отек, называемый микседемой, наблюдается преимущественно на лбу, веках, губах и концах лап. В результате округляются виски, утолщаются кожные складки на морде, верхние веки опускаются, губы отвисают, и все это придает собаке «трагический» вид (рис. 3-6).
Нередко развиваются инфекционные поражения кожи (фолликулит, поверхностная пиодермия, импетиго) с появлением папул, пустул, воспалительных ободков и/или мелких очажков облысения (Rosychuk, 1998). Возбудителем инфекции обычно служит Staphylococcus intermedins, и возникающие поражения могут сопровождаться зудом. Тиреоидные гормоны непосредственно усиливают иммунные реакции лимфоидных клеток (Chen, 1980), а при гипотиреозе снижается общее число лимфоцитов в крови, нарушается функция 7 -клеток и угнетается иммунный ответ. Заместительная терапия тиреоидными гормонами устраняет эти нарушения, но вначале может понадобиться кратковременный курс устойчивых к пенициллиназе антибиотиков и применение бактерицидных шампуней. Во избежание рецидива антибиотики следует продолжать вводить в течение 2 недель после ликвидации инфекции. У собак с гипотиреозом в зрелом возрасте
ГИПОТИРЕОЗ
111
нередко развивается демодикоз и хронический наружный отит (Duclos et al, 1994).
Кожные изменения при гипотиреозе, как правило, не сопровождаются зудом. Если же он возникает, то обычно связан с вторичной инфекцией вызванной бактериями и/или Malassezia, демодико-зом, себореей (очень сухой или очень жирной кожей), диффузным нейродермитом или повышенной чувствительностью к укусам блох (Rosychuk, 1998). Появление зуда у собак не исключает гипотиреоза, однако при интерпретации результатов тестирования следует помнить, что поражения кожи сами по себе могут быть причиной снижения показателей функции щитовидной железы.
Нервно-мышечные нарушения. У некоторых собак с гипотиреозом преобладают неврологические нарушения, обусловленные сегментарной демиелинизацией и аксонопатией (Bichsel et al, 1988). Причиной неврологических симптомов может быть также накопление мукополисахаридов в пери- и эндонсврии, атеросклероз сосудов головного мозга или выраженная гиперлипопротеинемия (Swanson et al, 1981; Liu et al, 1986). Редко встречающиеся симптомы нарушения центральной нервной системы (ЦНС) включают судороги, атаксию и круговые движения. Эти проявления обычно сочетаются с вестибулярными симптомами (опусканием головы, позиционным косоглазием) или парезом лицевого нерва. Чаще отмечаются признаки нарушения периферической нервной системы - парезы лицевого нерва, слабость, замедленные или дергающиеся движения лап со стиранием когтей (Jaggy
et al, 1994). Возможна атрофия мышц, но миалгия развивается редко. Введение тироксина устраняло хромоту (на одну из передних лап) у собак с элек-зромиографическими (ЭМГ) признаками генерализованной нейромиопатии, но без неврологических симптомов (Budsberg et al., 1993). Причинно-следственные отношения между гипотиреозом и парезом гортанного нерва или нарушением подвижности пищевода остаются неясными. Во всяком случае, лечение гипотиреоза не устраняет этих нарушений.
Диагностическое значение при гипотиреозе имеет снижение сухожильных рефлексов, замедление нервной проводимости, спонтанные фибрилляции, повышенная возбудимость при введении электродов и положительные потенциалы на ЭМГ (Braund et al, 1981; Swanson et al, 1981; Indrieri et al, 1987; Budsberg et al, 1993; Jaggy et al 1994). При биопсии мышц обычно находят атрофию миофибрилл типа 1 (типичный признак денервации). Аналогичные изменения обнаруживаются при гипотиреоидной нейропатии и у человека (Braund et al, 1981; Indrieri et al, 1987). В атрофированных миофибриллах типа I можно обнаружить ШИК-позитивный материал. Иногда выявляют гипертрофию миофибрилл типа 1 и II а также палочковидные и нитевидные включения в мышечных волокнах в отсутствие признаков воспаления (Jaggy et al, 1994; Delauchc et al, 1998). Наблюдался и лимфоцитарный миозит с накоплением в мышцах плазматических клеток (Muller et al, 1983).
Нервно-мышечные симптомы далеко нс всегда позволяют заподозрить гипотиреоз. Однако в та-
Рис. 3-8. А - Гиперпигментация ту ювища у 4-летнеи ова-риэктомированнои суки боксера с гипотиреозом. Б - Выраженная гиперит менгация паховых областей у 6-летней овариэктомированной беспородной суки с гипотиреозом
112
ГИПОТИРЕОЗ
ких случаях обычно делают анализ крови, а обнаружение гиперхолестеринемии и гиперлипидемии (например, гипертриглицеридемии), обычных для собак с гипотиреозом, указывают на вероятность такого диагноза.
Нарушения репродуктивной системы. Гипотиреоз издавна считали причиной отсутствия либидо, атрофии яичек и олиго- или азооспермии у кобелей. Однако у самцов биглей с экспериментальным гипотиреозом не было никаких изменений репродуктивных функций (Johnson et al, 1999). На фоне типичных клинических и гистологических признаков гипотиреоза либидо, размеры семенников и общее число сперматозоидов в эякуляте кобелей оставались нормальными. Если эти данные можно распространить на собак других пород, то следует заключить, что гипотиреоз редко сопровождается нарушением репродуктивных функций. Не исключено, однако, что полученные результаты специфичны именно для биглей, что продолжительность гипотиреоза в этом исследовании (2 года) была недостаточной, или что использованная модель экспериментального гипотиреоза не воспроизводит изменений, характерных для лимфоцитарного тиреоидита (наиболее частой причины гипотиреоза у собак данной породы). Возможно также, что лимфоцитарному тиреоидиту сопутствует лимфоцитарный орхит. По нашим данным, гипотиреоз редко приводит к бесплодию кобелей. Тем не менее, в отсутствие других причин бесплодия (особенно в случаях снижения либидо) следует предположить наличие гипотиреоза (см. гл. 31).
Хотя считается, что тиреоидные гормоны необходимы для нормальной секреции ФСГ и ЛГ, связь между гипотиреозом и бесплодием самок в ветеринарии остается недоказанной. У грейхаундов такую связь выявить не удалось (Beale et al, 1992). Согласно нашему клиническому опыту, при гипотиреозе, хотя и в редких случаях, наблюдается увеличение интервалов между течками и нарушение эстрально-го цикла. В ветеринарной литературе можно встретить указания и на слабые или скрытые эстральные циклы при гипотиреозе у собак, удлинение времени кровотечения при течке (что может быть следствием приобретенных нарушений в системе свертывания крови), а также на галакторею и гинекомастию. Последние признаки относят на счет усиленной при гипотиреозе продукции ТРГ, который стимулирует секрецию пролактина (Chastain, Schmidt, 1980; Cortese et al, 1997).
У женщин тиреоидные гормоны играют важную роль в сохранении беременности. Хотя многие женщины с гипотиреозом успешно донашивают плод, нарушение продукции прогестерона (вследствие недостаточной стимуляции плаценты и желтого тела тиреоидными гормонами) может приводить к аборту (Малю et al, 1992). С той же причиной могут быть связаны рассасывание плода, аборты и мертворождения у сук. В таких случаях рекомендуется исследовать состояние щитовидной железы, хотя,
по нашим данным, показатели ее функции у этих животных почти всегда в норме. Гипотиреоз у сук считают также причиной рождения слабых щенков, погибающих вскоре после рождения.
Сердечно-сосудистые нарушения. Клинические признаки нарушения сердечно-сосудистой системы отмечаются редко. При физикальном обследовании можно выявить брадикардию и слабый верхушечный толчок. С гипотиреозом связывали фибрилляцию предсердий у собак (Gerritsen et al, 1996), но, судя по другим данным (Panciera, 2001), это осложнение развивается лишь в редких случаях. При наличии клинических признаков гипотиреоза у собак чаще находят функциональные изменения на электрокардиограмме (ЭКГ) или эхокардиограмме (ЭхоКГ). На ЭКГ выявляются синусовая брадикардия, снижение амплитуды зубцов Р и R, инверсия зубца Т и поперечная блокада сердца первой-второй степени (Panciera, 1994, 2001). На ЭхоКГ обнаруживают увеличение конечного диастолического объема левого желудочка, удлинение периода предизгнания, а также уменьшение толщины задней стенки левого желудочка во время систолы, меньшее ее изменение во время диастолы, снижение толщины межжелудочковой перегородки в систоле и диастоле, уменьшение диаметра аорты, скорости укорочения круговых волокон и фракции выброса (Miller et al, 1984; Panciera, 1994). Многие гемодинамические сдвиги обусловлены, по-видимому, отсутствием тиреоидных гормонов, которые оказывают прямое действие на миокард. В результате при гипотиреозе происходит снижение АТФазной активности миозина сердечной мышцы, активности Са-АТФазы саркоплазматического ретикулума, кальциевых каналов, Na, К-АТФазы и уменьшение числа p-адренорецепторов в миокарде (Bilezikian, Loeb, 1983; Haber, Loeb, 1988; Hawthorn et al, 1988; Dowell et al, 1994). Минутный объем сердца при гипотиреозе может снижаться также вследствие повышения системного сосудистого сопротивления, уменьшения объема циркулирующей крови (ОЦК) и развития атеросклероза (Klein, 1990; Hess et al, 2002). Роль каждого из таких нарушений в патогенезе миокарда при гипотиреозе остается невыясненной. Снижение сократимости сердца у собак с гипотиреозом, как правило, выражено довольно слабо, но может приобретать клиническую значимость во время хирургических операций, требующих длительной анестезии и введения большого количества жидкости. Заместительная терапия тиреоидными гормонами обычно устраняет сердечно-сосудистые нарушения, но далеко не сразу (Panciera, 1994).
Хотя гипотиреоз сопровождается изменениями ЭхоКГ, сам по себе дефицит тиреоидных гормонов редко бывает причиной сердечной недостаточности. Было предположено, что характерные для гипотиреоза гемодинамические сдвиги лишь усугубляют имевшиеся ранее заболевания сердца. У доберманов часто встречается как гипотиреоз,
ГИПОТИРЕОЗ • 113
так и кардиомиопатия, причем между ними усматривали причинно-следственную связь (Calvert et al, 1982). Однако последующие наблюдения этого не подтвердили (Lumsden et al, 1993; Calvert et al, 1998). Исходный уровень тиреоидных гормонов в сыворотке крови при идиопатической дилатационной кардиомиопатии и сердечной недостаточности у собак действительно снижен, но щитовидная железа в большинстве таких случаев сохраняет чувствительность к ТТГ, что указывает на синдром эутиреоидной патологии. Данные о положительных или отрицательных эффектах заместительной терапии тиреоидными гормонами у собак с сердечной недостаточностью и исходно низким уровнем этих гормонов отсутствуют. В миокарде животных с дилатационной кардиомиопатией и хроническим пороком сердца возрастает содержание мРНК и р2-рецепторов тиреоидных гормонов, что, по-видимому, является следствием сердечной недостаточности и нарушения метаболизма тиреоидных гормонов (Shahrara et al, 1999). Эти данные позволяют рассчитывать на улучшение производительности сердца при введении левотироксина собакам с сердечной недостаточностью. У людей с хронической сердечной недостаточностью кратковременный прием левотироксина улучшал производительность сердца и работоспособность. Концентрация мРНК рецепторов тиреоидных гормонов в миокарде при этом снижалась (Morkin et al, 1993; Drvota et al, 1995; Moruzzi et al, 1996). Собакам с сердечной недостаточностью тиреоидные гормоны следует вводить с осторожностью, поскольку они повышают скорость основного обмена и увеличивают потребность тканей в кислороде (Greco et al, 1998). В отсутствие явных признаков гипотиреоза мы воздерживаемся от введения тиреоидных гормонов при сердечной недостаточности.
Глазные признаки. Глазные симптомы отмечаются редко и обусловлены, вероятно, гиперлипоп-ротеинемией. У немецких овчарок с гипотиреозом и гиперлипопротеинемией наблюдались отложения липидов в роговице. С дефицитом тиреоидных гормонов связывают также изъязвления роговицы, увеит, попадание липидов во внутриглазную жидкость, вторичную глаукому, сухой кератоконъюнктивит и синдром Горнера (Kern, Riis, 1980; Gosselin et aL, 1981b; Peruccio, 1982; Kern et al, 1989).
Желудочно-кишечные нарушения. При гипотиреозе у собак иногда отмечаются симптомы нарушения функции желудочно-кишечного тракта (ЖКТ). С изменением электрической активности и сократимости гладких мышц могут быть связаны запоры. Однако бывает и понос, хотя причинно-следственные отношения между гипотиреозом и поносом не выяснены, и у многих таких животных может иметь место не гипотиреоз, а синдром эутиреоидной патологии.
У некоторых собак с гипотиреозом обнаруживается увеличение размеров пищевода (мегаэзофа-гус), которое может быть связано с характерной для
данного заболевания нейро- и миопатией (Jaggy et al, 1994). Однако и в этом случае причинно-следственная связь остается неясной, а в одном из исследований вообще не удалось выявить связи между гипотиреозом и приобретенным мегаэзофагусом у собак (Gaynor et al, 1997). Как и при кардиомиопатии, низкий уровень тиреоидных гормонов при увеличении размеров пищевода может быть следствием синдрома эутиреоидной патологии, а не гипотиреоза. Щитовидная железа у большинства собак с этой патологией отвечает на ТТГ, а мегаэзофагус и его симптомы сохраняются, несмотря на лечение тиреоидными гормонами (Panciera, 1994; Jaggy et al, 1994).
При гипотиреозе у собак наблюдали тяжелую миастению (myasthenia gravis) (Dewey et al, 1995), которая является хорошо известной причиной приобретенного мегаэзофагуса. У человека лимфоцитарный тиреоидит ассоциируется с тяжелой миастенией, и она представляет собой один из компонентов аутоиммунного полигландулярного синдрома типа II (см. табл. 3-4). По-видимому, в основе аутоиммунных реакций против щитовидной железы и рецепторов ацетилхолина лежат одни и те же нарушения функции иммунной системы. Тяжелая миастения наблюдалась лишь у одной из 162 собак с гипотиреозом (Panciera, 2001). Таким образом, связь между этими заболеваниями остается неизвестной.
Нарушения гемостаза. У человека гипотиреоз может сопровождаться различными нарушениями системы свертывания крови, включая снижение уровня факторов VIII и IX, антигена фактора VIII (фактора фон Виллебранда) и адгезии тромбоцитов, а также повышением ломкости капилляров (Hymes et al, 1981; Rogers et al, 1982; Dalton et al, 1987). Эти нарушения относят на счет замедления синтеза белка, и именно они определяют повышенную кровоточивость у некоторых больных. Однако клинически значимые кровотечения при гипотиреозе наблюдаются редко. Снижение содержания антигена фактора VIII находили и у собак с гипотиреозом (Avgeris et al, 1990), но дальнейшие исследования показали, что гипотиреоз не вызывает болезни фон Виллебранда и не сопровождается значительным нарушением гемостаза (Panciera, Johnson, 1994, 1996). В то же время, гипотиреоз способствовал проявлению скрытой болезни фон Виллебранда. По нашим данным, при гипотиреозе у собак кровоточивость наблюдается редко. В отсутствие повышенной кровоточивости исследовать состояние системы свертывания крови или антигена фактора VIII необязательно. С другой стороны, у собак с недавно выявленной болезнью фон Виллебранда целесообразно исследовать состояние щитовидной железы, чтобы исключить гипотиреоз в качестве фактора, провоцирующего это заболевание. Однако трактовка низких уровней тиреоидных гормонов в таких случаях требует осторожности, так как при болезни фон Виллебранда возможно развитие синдрома эутиреоидной патологии.
114 • ГИПОТИРЕОЗ
Влияние терапии тиреоидными гормонами на уровень антигена фактора VIII в крови остается неясным. Одни авторы после начала лечения гипотиреоза левотироксином находили повышение уровня этого антигена (Avgeris et al, 1990), тогда как другие отмечали его снижение как при лечении экспериментального гипотиреоза (Panciera, Johnson, 1996), так и при введении гормона эутиреоидным животным с болезнью фон Виллебранда (Johnstone et al, 1993). Повышение уровней фактора VIII и его антигена под влиянием тиреоидных гормонов могло бы отражать общую стимуляцию синтеза белка. В настоящее время следует, по-видимому, воздерживаться от назначения тироксина эутиреоидным животным с болезнью фон Виллебранда.
Изменение поведения. У человека тиреоидные гормоны оказывают значительное влияние на функции ЦНС. Как гипер-, так и гипотиреоз сопровождаются выраженными изменениями со стороны нервной системы и психики. Типичные проявления гипотиреоза включают замедление всех мозговых функций, ослабление памяти и сонливость. У некоторых больных развиваются психозы. Заместительная терапия левотироксином обычно устраняет эти симптомы (Joffe, 1990; Szabadi, 1991; Monzani et al, 1993). У собак с полигландулярными синдромами, включающими гипотиреоз, также меняется поведение. Одни собаки становятся агрессивными, другие, напротив, покорными и пугливыми; одни пассивны, а другие - раздражительны, капризны и т.д. (Dodds, 1995). Сведения о поведении собак с гипотиреозом чаще всего ограничены описаниями отдельных случаев и лишь иногда содержат данные о нормализации поведения после начала лечения тиреоидными гормонами. Так, после начала лечения у двух собак с гипотиреозом агрессивность снижалась (Dodman et al, 1995). У животных многих видов, включая собак, выявлена обратная зависимость агрессивности от содержания серотонина в ЦНС. У тиреоидэктомированных крыс ускоряется обмен серотонина в мозге и повышается симпатическая активность. Тиреоидные гормоны изменяют чувствительность рецепторов дофамина у крыс и усиливают действие трицикличесих антидепрессантов у людей при некоторых видах депрессии (Crocker, Cameron, 1988; Extein, Gold, 1988; Henley et al, 1991). Эти данные свидетельствуют о способности тиреоидных гормонов влиять на серотониновые и дофаминовые механизмы в ЦНС независимо от функционального состояния щитовидной железы. Тем не менее, целесообразность применения тиреоидных гормонов для снижения агрессивности у собак остается неясной.
Микседематозная кома. Микседематозная кома (редкое осложнение тяжелого гипотиреоза) характеризуется резкой слабостью, гипотермией, брадикардией и заторможенностью, быстро прогрессирующей до ступора, а затем и комы (Chastain et al, 1982; Kelly, Hill, 1984; Henik, Dixon, 2000). Обычно, помимо изменений кожи, владельцы собак
с гипотиреозом отмечают психическую тупость, депрессию, вялость и физическую слабость своих питомцев. При физикальном обследовании обнаруживается резкая слабость, снижение температуры тела, упругий отек кожи, особенно на морде (т.е. микседема), брадикардия, артериальная гипотония и гиповентиляция. Микседема обусловлена накоплением кислых и нейтральных мукополисахаридов и гиалуроновой кислоты. Эти соединения связывают воду, приводя к утолщению кожи. При лабораторном исследовании можно выявить не только гиперлипопротеинемию, гиперхолестеринемию и анемию, но и гипоксемию, гиперкапнию, гипонатриемию и гипогликемию. Концентрация тиреоидных гормонов в сыворотке крови, как правило, резко снижена или вообще не поддается определению; уровень ТТГ колеблется, но обычно повышен.
Смертность при микседематозной коме высока, главным образом, из-за поздней диагностики этого состояния. Крайне важно своевременно обратить внимание на слизистый отек морды и челюстей (см. рис. 3-6). Чем раньше будет поставлен диагноз и начато активное лечение, тем больше вероятность выживания. Поэтому при наличии клинических признаков микседемы лечение нужно начинать, не дожидаясь результатов определения уровня тиреоидных гормонов в крови.
Лечение сводится к введению тиреоидных гормонов и попыткам устранения гипотермии, гиповолемии, электролитных сдвигов и гиповентиляции. Из-за замедления кровотока и резкого снижения Основного обмена трудно предвидеть, как будут всасываться лекарственные вещества при их введении внутрь, подкожно или внутримышечно. Поэтому по возможности тиреоидные гормоны следует вводить внутривенно. Для внутривенного введения существует препарат натриевой соли левотироксина (син-троид). Начальная доза составляет 5 мкг/кг каждые 12 ч (Peterson, Ferguson, 1989). При исходной сердечной недостаточности дозу следует уменьшить на 50-75% (Henik, Dixon, 2000). Левотироксин можно вводить и внутрь каждые 12 ч, чтобы обеспечить равномерное его поступление в кровь. Поддерживающие меры включают внутривенное введение солевых растворов с глюкозой, медленное согревание путем теплых обертываний и при необходимости искусственную вентиляцию легких (ИВЛ). Через 24 ч клиническое состояние животного обычно улучшается. После стабилизации состояния можно переходить на пероральное введение тиреоидных.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ВРОЖДЕННОГО ГИПОТИРЕОЗА: КРЕТИНИЗМ
Тяжелый гипотиреоз у щенков называют кретинизмом. Чем позднее проявляется заболевание, тем его клинические проявления все больше напоминают гипотиреоз у взрослых животных. Нормальное физическое развитие требует нормальной концентрации тиреоидных гормонов в крови. Эти гормо-
ГИПОТИРЕОЗ • 115
ТАБЛИЦА 3-9. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ КРЕТИНИЗМА
Карликовость Нарушения походки
Укороченный плоский череп Позднее прорезывание зубов
Укороченная челюсть Алопеция
Большая голова Сохранение «щенячьей»
Короткие лапы шерсти
Кифоз Сухая шерсть
Психическая заторможен- Утолщение кожи
нось Сонливость
Запор Одышка
Потеря аппетита Зоб
ны совместно с ГР и инсулиноподобным фактором роста-1 (ИФР-I) стимулируют хондрогенез. Основные признаки кретинизма - задержка роста и психического развития (табл. 3-9). Владелец собаки обычно замечает нарушения, когда она достигает 12-недельного возраста. Обращает на себя внимание непропорциональное телосложение, крупная широкая голова, толстый выпадающий из пасти язык, квадратное туловище и короткие лапы (рис. 3-9). В отличие от этого, при гипофизарной карликовости, связанной с дефицитом ГР, щенки сохраняют пропорциональное телосложение (рис. 2-5). Нарушение пропорций тела при врожденном гипотиреозе объясняется задержкой роста эпифизов длинных костей (Saunders, Jezyk, 1991).
Больные щенки выглядят тупыми, сонливыми и не проявляют игривости, свойственной здоровым животным. На теле обычно сохраняется мягкий «детский» пушок, и может развиться полное облысение. Иногда отмечается себорея. Дополнительные признаки могут включать отсутствие аппетита, запоры, задержу прорезывания зубов и зоб. Появление последнего зависит от причины гипотиреоза. При исследовании нервно-мышечной системы выявляется психическая тупость, слабость, снижение рефлексов, разболтанность суставов, спастичность и тремор мышц. Наблюдалось также усиление спинальных рефлексов и диффузная гиперестезия с потерей позы настороженности (Greco et al, 1985).
При дифференциальной диагностике карликовости следует выяснять ее причины (эндокринные и неэндокринные) (см. табл. 2-9 и рис. 2-9).
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ВТОРИЧНОГО ГИПОТИРЕОЗА
Проявления вторичного гипотиреоза у взрослых собак и щенков сходны с таковыми при первичном гипотиреозе. Однако в этом случае на первый план чаще выходят признаки не самого гипотиреоза, а вызвавшего его заболевания. У большинства взрослых собак причиной вторичного гипотиреоза служат опухоли гипофиза, и основные клинические признаки зависят от гормональной активности этих опухолей и степени сдавливания соседних структур головного мозга. В таких случаях обычно преобладают симптомы гипо- или гиперкортицизма, неса
харного диабета или нарушения гипоталамических и таламических функций (сонливость, ступор, анорексия, адипсия, нарушение терморегуляции). Легкие изменения, связанные с гипотиреозом, недостаточностью ГР или нарушением репродуктивной функции, гораздо реже привлекают внимание владельцев собак.
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ ГИПОТИРЕОЗЕ
Изменения лабораторных показателей при гипотиреозе зависят от его тяжести и длительности. Многие из них неспецифичны и наблюдаются при разных других заболеваниях. Однако при наличии соответствующих клинических признаков эти изменения могут подтверждать диагноз.
Общий клинический анализ крови. Классическим признаком считается нормоцитарная нормохромная нерегенеративная анемия. Снижаются общее число эритроцитов, уровень гемоглобина и показатель гематокрита (28-36%). По нашим данным, нерегенеративная анемия выявляется менее чем у 50% собак с гипотиреозом. Причиной анемии может быть снижение концентрации эритропоэтина в плазме крови, обнаруженное у крыс, собак и у человека. Это приводит к недостаточной стимуляции костного мозга. Время жизни эритроцитов при гипотиреозе не меняется. В патогенезе анемии при гипотиреозе может играть роль также снижение реакции эритроидного ростка на эритропоэтин и ослабление прямого влияния тиреоидных гормонов на гемопоэтические полипотентные стволовые клетки (Green, Ng, 1988; Sainteny et al, 1990). Для гипотиреоза характерно снижение потребления кислорода периферическими тканями, снижение уровня эритропоэтина в плазме крови и повышение в эритроцитах концентрации 2,3-дифосфоглицера-та (ускоряющего высвобождение кислорода в периферические ткани). Все это уменьшает потребность в выработке эритроцитов. У человека при гипотиреозе снижаются активность костного мозга, содержание железа и железо-связывающая емкость сыворотки крови, а также общий объем эритроцитов.
При гипотиреозе нарушается и всасывание железа в ЖКТ. Поэтому почти у 15% больных развивается железодефицитная анемия (гипохромная, микроцитарная). Иногда наблюдается и макроцитарная мегалобластная анемия, обусловленная нарушением обмена фолиевой кислоты и витамина В12. Такая же анемия в редких случаях встречается и у собак с гипотиреозом (Muller et al, 1983).
При исследовании морфологии эритроцитов можно обнаружить повышенную концентрацию лептоцитов (мишеневидных клеток). Считается, что они образуются при повышенном содержании холестерина в мембране эритроцитов (прямое следствие характерной для гипотиреоза гиперхолестеринемии). Количество лейкоцитов может быть разным. Сопутствующие инфекции (пиодермия)
116
ГИПОТИРЕОЗ
Рис. 3-9. А и Б - 8-месячные суки ризеншнауцера из одного помета. Слева - здоровая собака; справа - собака с врожденным гипотиреозом (кретинизмом). Обратите внимание на малый рост, непропорциональное строение тела, крупную плоскую голову, квадратное туловище и короткие лапы у больной собаки. В и Г трехлетний самец доберман-пинчер с врожденным гипотиреозом. Обратите внимание на малые размеры тела, «щенячий» вид и сохранение мягкого пушного покрова. Д - та же собака, что на рис. В и Г, рядом с сукой из того же помета.
ГИПОТИРЕОЗ • 117
могут быть причиной лейкоцитоза. Число тромбоцитов либо не меняется, либо возрастает, а их размер может быть снижен (Sulivan et al, 1993).
Биохимические изменения в сыворотке крови. Классический признак - гиперхолестеринемия натощак. По нашим данным, она наблюдается более чем у 75% собак с гипотиреозом. Часто обнаруживается также гиперлипопротеинемия и гипертриглицеридемия натощак. Тиреоидные гормоны стимулируют практически все стороны жирового обмена - синтез, мобилизацию и распад жиров (Larsen et al, 1998). При гипотиреозе замедляются и синтез и распад липидов, но распад замедляется в большей степени. В результате происходит накопление липидов в плазме крови, что повышает риск атеросклероза (Hess et al., 2002).
При электрофорезе плазмы крови 26 собак с гипотиреозом были получены три группы данных: 1) нормальная концентрация липидов с нормальным распределением липопротеинов; 2) гиперхолестеринемия с увеличением полосы альфа2-липопро-теинов и 3) гиперхолестеринемия и гипертриглицеридемия с увеличением полос пре-бета-, бета- и альфа2-липопротеинов (Rogers et al, 1975). Терапия тиреоидными гормонами практически нормализовала уровень липидов в плазме и электрофоретическое распределение липопротеинов. Позднее у 10 собак с гипотиреозом концентрацию липопротеинов в плазме определяли методами ультрацентрифугирования и осаждения (Barrie et al, 1993). Содержание общего холестерина, а также холестерина липопротеинов очень низкой плотности (ЛОНП), низкой (ЛНП) и высокой плотности (ЛВП) оказалось значительно выше, чем в контроле. Изменения в уровне холестерина липопротеинов объясняются снижением активности печеночных рецепторов ЛНП и активностей липопротеиновой и печеночной липаз (Valdermarsson et al, 1983).
Гиперхолестеринемия и гипертриглицеридемия натощак обнаруживаются и при ряде других заболеваний (табл. 3-10) и не патогномоничны для ги-
ТАБЛИЦА 3-10. ПРИЧИНЫ
ГИПЕРЛИПИДЕМИИ У СОБАК И КОШЕК
Гиперлипидемия после еды
Вторичная гиперлипидемия
Гипотиреоз
Г иперкортицизм
Сахарный диабет
Панкреатит
Холестаз
Печеночная недостаточность
Нефротический синдром
Энтеропатия с потерей белка
Первичная гиперлипидемия
Идиопатическая гиперлипопротеинемия (карликовые шна-уцеры)
Идиопатическая гиперхиломикронемия (кошки)
Недостаточность липопротеиновой липазы (кошки)
Идиопатическая гиперхолестеринемия
Лекарственная гиперлипидемия
Глюкокортикоиды
Мегестрол ацетат (кошки)
потиреоза. Однако при наличии соответствующих клинических признаков эти изменения подтверждают диагноз гипотиреоза.
Иногда в сыворотке крови собак с гипотиреозом находят повышение активности лактатдегидрогеназы, аспартат- и аланинтрансаминазы и щелочной фосфатазы. Считается, что это связано с миопатией или липидозом печени. Однако повышение активности перечисленных ферментов наблюдается далеко не всегда и может иметь другие причины.
У некоторых собак с врожденным гипотиреозом обнаруживается легкая гиперкальциемия. Аналогичные изменения при гипотиреозе у детей развиваются вследствие повышения всасывания кальция в кишечнике и снижения его экскреции с мочой.
У людей при гипотиреозе возрастает активность креатинкиназы в плазме. Это наблюдается и у собак, но не всегда (Chastain, Schmidt, 1980; Braund et al, 1981; Muller et al, 1983). У человека активность креатинкиназы находится в обратной зависимости от функции щитовидной железы. Повышение активности этого фермента могло бы отражать характерную для гипотиреоза миопатию. Однако у собак активность креатинкиназы может оставаться нормальной при гипотиреоидной миопатии и возрастать в отсутствие миопатии (Braund et al, 1981). Таким образом, активность креатинкиназы отражает, по-видимому, не только дегенеративные изменения мышечных волокон типа II, но и общие сдвиги катаболизма и анаболизма в мышцах или изменения проницаемости сарколеммы.
Анализ мочи. В моче собак с гипотиреозом какие-либо отклонения от нормы обычно отсутствуют. Однако при лимфоцитарном тиреоидите могут иметь место гломерулонефрит, обусловленный отложением иммунных комплексов, и протеинурия. Полиурия, гипостенурия и инфекции мочевых путей для гипотиреоза нехарактерны.
Уровни нетиреоидных гормонов. Гипотиреоз влияет на секрецию гормонов многих эндокринных желез, особенно гипофиза. У человека, собак и крыс при этом заболевании снижается ответ ГР на стимулирующие воздействия (Froelich, Meserve, 1982; Greco et al, 1985). Лечение одним ГР не устраняет задержку роста у детей с гипотиреозом, тогда как заместительная терапия тиреоидными гормонами нормализует секрецию ГР и быстро восстанавливает скорость роста больных.
Усиленная при гипотиреозе продукция ТРГ может стимулировать секрецию пролактина, приводя к гиперпролактинемии, а у некоторых собак и к галакторее (Chastain, Dchmidt, 1980; Cortese et al, 1997). Тиреоидные гормоны необходимы также для нормальной секреции ЛГ и ФСГ. Гипотиреоз у человека сопровождается снижением секреции этих гормонов, вследствие чего ослабляется либидо, нарушается овуляция и развивается олигоспермия (Larsen et al, 1998). При дефиците тиреоидных гормонов нарушается также обмен андрогенов и эстрогенов.
118 • ГИПОТИРЕОЗ
Наконец, гипотиреоз может быть частью аутоиммунных полигландулярных синдромов. В таких случаях собаки вследствие снижения уровня соответствующих гормонов в крови могут иметь также инсулинозависимый сахарный диабет, гипокортицизм, гипопаратиреоз или недостаточность половых желез.
ГИСТОЛОГИЯ КОЖИ ПРИ ГИПОТИРЕОЗЕ
Диагностическое значение биопсии кожи при гипотиреозе сомнительно. Гистологические изменения в коже не отличаются разнообразием. Поэтому в основе одних и тех же макроскопических изменений могут лежать разные заболевания, в том числе и гипотиреоз. Биопсию кожи у собак часто проводят при подозрении на эндокринную этиологию алопеции, когда обычные диагностические приемы (включая определение уровня тиреоидных гормонов) не позволяют прийти к определенному заключению. Данные, получаемые при этом, в большинстве случаев не имеют диагностического значения. Они свидетельствуют о каких-то эндокринных сдвигах в организме, но не дают возможности точно определить их природу (табл. 3-11; Gross et al, 1992; Scott et al, 2001). Для гипотиреоза особенно характерны вакуолизация и гипертрофия мышц, сокращающих волосяные фолликулы, повышенное содержание муцина и истончение дермы. Обнаружение таких «специфических» изменений служит показанием для дальнейшего исследования функции щитовидной железы. Примерно в 50% биоптатов кожи у собак с гипотиреозом находят ту или иную степень воспаления, связанного с вторичной себореей и/или бактериальной пиодермией (Scott et al, 2001).
ТАБЛИЦА 3-11. ГИСТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ КОЖИ ПРИ ЭНДОКРИННОЙ АЛОПЕЦИИ У СОБАК
Неспецифические нарушения, свидетельствующие об эндокринной патологии
Ортокеротоидный гиперкератоз Фолликулярный кератоз Расширение волосяных фолликулов Атрофия волосяных фолликулов Преобладание фолликулов в стадии телогена Атрофия сальных желез Атрофия эпидермиса Меланоз эпидермиса Истончение кожи
Атрофия кожного коллагена
Нарушения, свидетельствующие о гипотиреозе
Вакуолизация мышц, поднимающих волосы Гипертрофия мышц, поднимающих волосы Повышенное содержание муцина в коже Утолщение дермы
ДАННЫЕ РЕНТГЕНОГРАФИИ, УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ (УЗИ), МАГНИТНО-РЕЗОНАНСНОЙ (МРТ) И КОМПЬЮТЕРНОЙ (КТ) ТОМОГРАФИИ
Рентгенография. Рентгенографию при подозрении на гипотиреоз у собак проводят редко. Рентгенография шейной области не позволяет оценить состояние щитовидной железы. Однако если гипотиреоз обусловлен ее деструкцией опухолью, то рентгенография грудной клетки помогает выявить метастазы.
При врожденном гипотиреозе находят изменения костей. Задержка оссификации эпифизов (рис. 3-10) и их дисгенезия (неравномерность формирования, фрагментация и исчерченность эпифизарных центров) чаще всего обнаруживается в плечевых и бедренных костях и в проксимальных мыщелках большеберцовых костей. Характерно также уплощение костей черепа, укорочение позвонков и общая задержка созревания скелета (Greco et al, 1991; Saunders, Jezyk, 1991; Mooney, Anderson, 1993). Вентральные края позвонков могут быть зазубренными, что указывает на нарушение их продольного роста (рис. 3-10). Диафизы длинных костей укорочены; кости пястья и плюсны недостаточно оссифициро-ваны. Обычно отмечается вальгусное искривление костей. Терапия тиреоидными гормонами ускоряет окостенение эпифизов, но дистрофические изменения суставов могут сохраняться (Saunders, Jezyk, 1991). Владелец собаки должен знать, что это всегда сопровождается артритом. Сходные рентгенологические изменения наблюдались у биглей и карликовых пуделей при множественной эпифизарной дисплазии (Saunders, Jezyk, 1991), а также у собак с гипофизарной карликовостью (см. гл. 2).
Ультразвуковое исследование. УЗИ в режиме реального времени позволяет определить размеры, форму и эхогенность щитовидной железы. Под контролем УЗИ обычно проводят пункционную биопсию щитовидной железы при подозрении на ее опухоль (см. гл. 5). С помощью УЗИ иногда можно также отличить гипотиреоз от синдрома эутиреоидной патологии. Лимфоцитарный тиреоидит и идиопатическая атрофия должны сопровождаться уменьшением размеров и изменением формы и эхогенности долей щитовидной железы. Такие изменения недавно были описаны при гипотиреозе у золотистых ретриверов (Bromel et al, 2001). У здоровых собак доли щитовидной железы имеют веретенообразную форму, а их продольный и поперечный срезы - треугольную или овальную (рис. 3-11). Обе доли обладают равномерной эхогенностью, которая превышает эхогенность окружающих мышц или не отличается от нее. Аналогичная картина наблюдается у золотистых ретриверов с синдромом эутиреоидной патологии, тогда как у собак с гипотиреозом размеры и объем долей щитовидной железы уменьшены. Форма железы остается нормальной. Общая эхогенность щитовидной железы при гипотиреозе
ГИПОТИРЕОЗ • 119
Рис. 3-10. А и Б - боковая и вентродорсальная рентгенограммы позвоночника собаки с врожденным гипотиреозом. Обратите внимание на укорочение шейных позвонков с заостренными нижними краями и недостаточной кальцификацией концевых пластинок. В - боковая и передне-задняя рентгенограммы берцовых костей собаки с врожденным гипотиреозом. Видна дисплазия эпифизов и недостаточная кальцификация костей.
несколько снижается (с наличием гиперэхогенных участков), и эхогенность двух долей железы различна. Таким образом, УЗИ может помочь отличить гипотиреоз от синдрома эутиреоидной патологии в тех случаях, когда результаты определения тиреоидных гормонов в сыворотке оказываются неинформативными. Следует помнить, однако, чго размеры и объем щитовидной железы соответствуют размерам собак разных пород (Bromel et al, 2002), и прежде чем УЗИ можно будет использовать для подтверждения диагноза гипотиреоза, необходимо, по-видимому, установить стандарты размеров и объемов долей щитовидной железы для каждой породы.
Радиоизотопное сканирование. Сканирование щитовидной железы с радиоактивным пертехнетатом (см. гл. 4) дает представление о размерах, форме и локализации тиреоидной ткани. Хотя для оценки функции щитовидной железы такое исследование обычно не используют, оно все же может помочь различить гипотиреоз, эутиреоз и синдром эутиреоидной патологии. В норме обе доли железы,
расположенные в средней части шеи, имеют равномерную плотность и овальную форму (рис. 3-12). Они лишь незначительно меньше, чем слюнные железы, которые также поглощают пертехнетат, и отношение между размерами и плотностью щитовидной и околоушных слюнных желез при таком исследовании обычно равно 1:1. У взрослых собак с первичным гипотиреозом щитовидная железа практически не накапливает пертехнетат, а если он все же поглощается, то размеры изображения оказываются меньшими, чем в норме (рис. 3-12). Аналогичные результаты получены у щенков с врожденным гипотиреозом, обусловленным дисгенезией щитовидной железы, а также у собак с вторичным гипотиреозом (Kintzer, Peterson, 1991; Greco et al, 1991). В отличие от этого, при врожденном гипотиреозе, обусловленном нарушением йодирования тиреоглобулина, доли щитовидной железы нормальные или увеличены и накопление пертехнетата бывает в норме или выше нормы. У собак с нетиреоидными заболеваниями или снижением уровня тиреоидных гормонов под действием лекарственных веществ,
120 • ГИПОТИРЕОЗ
Рис. 3-11. Продольная и поперечная эхограммы левой доли щитовидной железы у здорового золотистого ретривера (А и Б) и собаки той же породы с гипотиреозом (В и Г). Обратите внимание на меньшие размеры доли щитовидной железы у больной собаки по сравнению со здоровой. Максимальные длина, толщина и ширина этой доли у здоровой собаки составляют 24,8; 7,9 и 4,6 мм, а у больной - 20,2; 4,1 и 2,8 мм.
а нс вследствие угнетения гипофизарной секреции ТТГ, накопление пертехнетата нормально или повышено (Hall et al, 1993). Это указывает на возрастание захвата йодида щитовидной железой.
ПОКАЗАТЕЛИ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Введение
Функцию щитовидной железы обычно оценивают по концентрации тиреоидных гормонов в сыворотке крови или ответу железы на стимулирующие воздействия (например, проба с ТРГ). Можно определять содержание общего и свободного Т4, общего и свободного Т , рТ и эндогенного ТТГ'. Щитовидная железа секретирует в основном Т4 и лишь небольшое количество Т, и рТу В крови более 99% Т4 связывается с белками плазмы. Биологически активен
только свободный Т4, который по механизму отрицательной обратной связи тормозит секрецию ТТГ гипофизом (см. рис. 3-3) и проникает в клетки организма (рис. 3.13). Связанный с белками Т4 служит резервуаром и буфером, поддерживающим постоянную концентрацию свободного гормона в крови в условиях быстрых изменении его посгупления в ткани. Если специально не указывать в направлении, то лаборатории определяют общий уровень Т4 (суммарную концентрацию связанного с белками и свободного гормона).
Как уже отмечалось, биологической активностью и способностью проникать в клетки обладает именно свободный гормон. В клетках свободный Т4 дейодируется, превращаясь в Т, или рТ в зависимости от метаболических потребностей тканей в данное время В норме преимущественно образуется Тр а при различных заболеваниях, голодании или усилении катаболических процессов - биоло-
ГИПОТИРЕОЗ
121
В
Рис. 3-12. А и Б - латеральная и вентродорсальная сканограммы с пертехнетатом натрия у здоровой собаки. Нормальные доли щитовидно!! железы имеют вид симметричных равномерно плотных пятен в области шеи. Ви ты также околоушные слюнные железы. В - вентродорсальная сканограмма у собаки с первичным гипотиреозом. Поглощение пертехнетата натрия околоушными слюнными железами нормально но поглощение изотопа долями щитовидной железы резко снижено, и они еле видны.
гически неактивный рТг В клетках Т, оказывает свое действие, связываясь с рецепторами в митохондриях, ядрах и на плазматической мембране. Считается, что основным гормональным эффектом обладает именно Т , поскольку он более активен, чем Г4, и распределяется в большем объеме. Кроме того, основная часть Т. превращается в клетках в Т . а внутриклеточные рецепторы обладают к Т3 гораздо большим сродством, чем к Т4 (Werner, 1982).
Весь присутствующий в сыворотке крови Т (независимо от его связи с белками) образуется в са
мой щитовидной железе. Поэтому при подозрении на гипотиреоз у собак для оценки функции железы рекомендуется определять концентрацию именно Т4 (общего и свободного) в сочетании с определением уровня ТТГ в сыворотке крови. Что касается 1 и рТч, то они образуются главным образом путем дейодирования Т4 вне щитовидной железы, преимущественно в печени, почках и мышцах. Концентрация Т3 в сыворотке - ненадежный показатель функции этой железы, поскольку он секретируется в гораздо меньших количествах, чем Т4, и локализо-
122
ГИПОТИРЕОЗ
Кровеносный сосуд
Свободный Т4 < Л белки плазмы
Рис. 3-13. Схема внутриклеточного превращения свободного Т4 в Т, или рТ3 под действием соответственно 51- и 5-дейоди-назы (5’-D и 5-D). Tv образующийся при монодейодировании свободного Т в клетках, взаимодействует с мембранными, митохон триальными и ядерными рецепторами, обусловливая физиологические эффекты гормона, или с цитоплазматическими связывающими белками (СВР), формируя внутриклеточный резерв Т..
ван в основном внутри клеток. Поэтому уровни Т , свободного 1 и рТг обычно не используются в качестве показателей функции щитовидной железы.
Сыворотка
г
АТ, связывающие ТГ, в сыворотке
Пробирка покрытая АТ
Инкубация и декантирование
Возрастание расчетной концентрации ТГ в сыворотке
Снижение радиоактйв-ности пробирки
1251-ТГ, связанный с АТ
1251-ТГ, связанный с АТ сыворотки
Сцинтилляционный счетчик
Несвязанный ,251-ТГ
Рис. 3-14. Механизм завышения уровня тиреоидных гормонов при их определении одноступенчатым радиоиммуноло-гическим методом с использованием покрытых антителами пробирок в присутствии антител к тиреоидным гормонам. Испытуемую сыворотку и меченый тиреоидный гормон (который придается к набору) помещают в пробирку, на стенках которой адсорбированы антитела к тиреоидному гормону. Содержащийся в сыворотке гормон конкурирует с меченым гормоном за связывание с этими антителами. После инкубации жидкость из пробирки декантируют, измеряют радиоактивность пробирки в сцинтилляционном счетчике и, исходя из его показаний, рассчитывают концентрацию гормона в сыворотке. Чем ниже радиоактивность, тем выше концентрация гормона. Если же испытуемая сыворотка содержит антитела, связывающие гормон, то они конкурируют с антителами, иммоби in шванными на внутренней поверхности пробирки, как *а присутствующий в сыворотке, так и за меченый гормон. 11оскольку они остаются в жидкой фазе, то и декантируются вместе со связавшимся с ними меченым гормоном. Это приводит к снижению радиоактивности пробирки и ложному завышению результатов определения концентрации гормона в сыворотке. TI - тиреоидный гормон, АТ - антитела.
Базальная концентрация общего тироксина (Т4) в сыворотке крови
Методика определения. Уровень Т4 в сыворотке отражает суммарное количество связанного с белками и свободного гормона. В современных лабораториях клинической биохимии концентрацию Т4 в крови определяют либо с помощью радиоим-мунологического анализа (РИА), либо иммунофер-ментными методами. Золотым стандартом считается метод РИА с использованием меченого гормона. Этот метод конкурентного анализа заключается в следующем: известное количество меченного радиоактивным йодом (1251) Т4 смешивают с определенным количеством сыворотки крови в пробирке, содержащей антитела к гормону (рис. 3-14). Радиоактивный и присутствующий в сыворотке гормон конкурируют за связь с антителами. После инкубации связанный радиоактивный гормон отделяют от свободного, подсчитывают радиоактивность пробирки и по стандартной калибровочной кривой находят концентрацию Т4 в сыворотке. В большинстве лабораторий используется однофазная разделительная система: жидкость из пробирки просто декантируют, а саму пробирку помещают в сцинтилляционный счетчик. Между ее радиоактивностью и концентрацией Т4 в сыворотке существует обратная корреляция. Чем выше концентрация Т4 в сыворотке, тем меньше меченого гормона связывается с антителами, и тем меньше радиоактивность пробирки. И наоборот, при низкой концентрации Т4 в сыворотке радиоактивность пробирки увеличивается. Диапазон нормальных концентраций Т4 в сыворотке крови, устанавливаемый в разных лабораториях, зависит от используемых наборов (китов), оборудования и опыта лабораторного работника. Нормы для собак в большинстве лабораторий колеблются в пределах от 1,0 до 3,5 мкг%. Нижняя граница нормы зависит от того, хотят ли в данной лаборатории добиться большей специфичности или большей чувствительности метода определения (см. ниже «Интерпретация результатов»).
Большинство методов РИА, разработанных для человека, пригодно и для собак, так как антитела реагируют с тиреоидными гормонами разных видов. Концентрации Т4 в сыворотке здоровых собак ниже, чем у человека (1,0-3,5 против 4,0-10,0 мкг%). Следовательно, отличить гипотиреоз от эу-тиреоза у собак можно с помощью только такого метода РИА, чувствительность которого позволяет определять уровни Т4 ниже
1,0 мкг0 о. Некоторые наборы для РИА дают точные показания при концентрации Т4 не ниже 2,0-5,0 мкг% и поэтому непригодны для выявления гипотиреоза у собак. Необходимо учитывать чувствительность метода (т.е. наименьшую концентрацию гормона, которую можно надежно определить с его помощью), особенно если определения проводятся в лабораториях гормональною анализа для человека.
ГИПОТИРЕОЗ • 123
Иммуноферментные методы. Для собак адаптирован иммуноферментный метод (ИФА) определения уровня Т4, разработанный для человека (Honey et al, 1999). В данном методе используются рекомбинантные фрагменты Р-галактози-дазы Е. coli, которые сами по себе неактивны, но при спонтанной комбинации образуют активный фермент. Тироксин ковалентно связан с одним из фрагментов, поэтому моноклональные антитела к Т4 препятствуют образованию фермента. Присутствующий в сыворотке гормон конкурирует со связанным с фрагментом Т4 за связь с антителами, «отвлекая» их на себя, и тем самым способствует образованию активного фермента. Поэтому количество образующегося активного фермента прямо пропорционально концентрации Т4 в сыворотке и определяется по степени гидролиза О-нитрофе-нил-р-П-галакгопиранозида. Результаты определения уровней Т4 в сыворотке методами РИА и ИФА (при использовании автоматического анализатора Хитачи-91, фирмы Boehringer Mannheim Corp, США) согласуются друг с другом с коэффициентом корреляции для проб сывороток собак и кошек соответственно 0,88 и 0,97 (Homey et al, 1999). На результаты, получаемые методом ИФА, не влияют гемолиз и повышенный уровень липидов в сыворотке (5-10 г/л). Меньшее влияние, чем на данные, получаемые методом РИА, оказывают и аутоантитела к Т4. Вероятно, это обусловлено тем, что в РИА используются поликлональные антитела, тогда как в ИФА - мышиные моноклональные антитела, обладающие меньшей перекрестной реактивностью. Для точного и надежного определения концентрации Т4 в сыворотке крови собак и кошек методом ИФА в ветеринарных лабораториях широко применяется автоматический фотометр. Определения можно производить одновременно с исследованием других биохимических параметров, что создает неоспоримые преимущества.
Существуют и «быстрые» варианты ИФА для определения уровня Т4 в «домашних» условиях (т.е. в самой клинике). Эти методы экономичны, просты и позволяют получать результаты в день осмотра животного. Однако они недостаточно точны. В одном из исследований были выявлены существенные расхождения в уровнях Т, измеренных «домашним» методом ИФА и методом РИА (Lurye et al, 2002). Результаты, полученные с помощью ИФА, могли быть как завышенными, так и заниженными; ошибочные результаты были получены в 62% случаев (всего исследовали 50 сывороток). У кошек завышенные по отношению к данным РИА результаты обнаружены в 50% случаев (из 50 проб). Однако в другом исследовании была выявлена хорошая корреляция между данными, получаемыми с помощью «домашнего» ИФА и РИА (коэффициент корреляции для кошек составил 0,90, а для собак - 0,91) (Peterson et al, 2003). В целом, точность «домашних» методов ИФА была оценена очень высоко, и получаемые с их помощью данные существенно
отличались от результатов РИА только в 5 из 105 проб сывороток. Но поскольку в разных клиниках получают разные результаты, точность определения с помощью «домашнего» ИФА должна быть документирована, желательно с помощью сравнения результатов, полученных на одних и тех же образцах сыворотки методами РИА и ИФА.
Стабильность Т4 и факторы, мешающие его определению. Т4 - относительно стабильный гормон, что позволяет рассчитывать на точность результатов определения его уровня при направлении проб сыворотки в коммерческие лаборатории. На содержание Т4 не влияет контакт с клетками крови, длительное хранение проб после центрифугирования, гемолиз или повторное замораживание и оттаивание проб (Reimers et al, 1982). Сыворотки можно хранить в пластиковых пробирках в течение 8 суток при комнатной температуре или 5 суток при 37 °C (Behrend et al, 1998). Это справедливо и для образцов плазмы, как гепаринизированных, так и хранящихся в присутствии этилендиаминтетрауксусной кислоты (ЭДТА). Однако при хранении сыворотки или плазмы при 37 °C в стеклянных пробирках концентрация Т4 оказывается значительно выше, чем при хранении сыворотки при -20 °C (Behrend et al, 1998). Таким образом, несмотря на стабильность гормона, пробы сыворотки по возможности следует замораживать в пластиковых пробирках и отсылать в лабораторию в охлажденных пакетах.
На состояние гипофизарно-тиреоидной системы влияют многие физиологические и фармакологические факторы, которые могут изменять уровень Т4 в сыворотке крови, препятствуя разграничению гипо- и эутиреоза (см. «Факторы, изменяющие показатели функции щитовидной железы»). Однако единственный фактор, влияющий на результаты определения концентрации гормона с помощью РИА, - это антитела к Т4 в пробе сыворотки. Антитела к тиреоидным гормонам, присутствующие у собак с лимфоцитарным тиреоидитом, могут как завышать, так и занижать уровень Т4 (Thacker et al, 1992). Влияние этих антител зависит от метода определения Т . Гиперлипопротеинемия не препятствует его определению методом РИА (Lee et al, 1991).
Интерпретация результатов. Определение концентрации Т4 в сыворотке крови можно использовать в качестве первого этапа диагностики гипотиреоза, а также как часть определения всей тиреоидной панели - свободного Т , ТТГ и антитиреоидных антител - для диагностики лимфоцитарного тиреоидита (табл. 3-12). Теоретически, у собак с гипотиреозом концентрации Т4 в сыворотке должны быть ниже, чем у здоровых животных. К сожалению, уровни гормона при гипо- и эутиреозе перекрываются, причем особенно у собак с сопутствующими заболеваниями. По данным одного из исследований, концентрации Т4 в сыворотке 62 здоровых собак колебались от 1,0 до 3,3 мкг%, а у 51 собаки с гипотиреозом - от 0 до 1,5 мкг% (Nelson et al, 1991). Чувствительность и специфичность мето-
124
ГИПОТИРЕОЗ
ТАБЛИЦА 3-12. РЕКОМЕНДАЦИИ ПО ОЦЕНКЕ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У СОБАК
1. Решение о необходимости исследовать функцию щитовидной железы принимают на основании данных анамнеза, физикального обследования и анализа крови (общее число форменных элементов, биохимия) и мочи.
2. Первые однократные ориентировочные исследования включают определение базальной концентрации общего Т4 или свТ4 (методом модифицированного равновесного диализа, МРД) в сыворотке крови.
а. Лечение показано в случае низких концентраций общего или свободного Т4и наличия убедительных клинических признаков гипотиреоза.
б. Лечение не показано в случае нормальных концентраций общего или свободного Т4 и отсутствия убедительных клинических признаков гипотиреоза.
в. В случаях нормальной концентрации Т , но при наличии убедительных клинических признаков гипотиреоза или неопределенности клинических и гормональных данных показаны дополнительные диагностические исследования (определение уровня ТТГ, аутоантител к тиреоглобулину и тиреоидным гормонам).
3. Обычная схема начального диагностического исследования предполагает определение двух показателей: базальной концентрации Т4или свТ4 методом МРД и концентрации ТТГ в сыворотке крови.
а. Лечение показано в случае низкой концентрации общего или свТ4 при наличии убедительных клинических признаков гипотиреоза независимо от уровня ТТГ.
б. Лечение показано в отсутствие убедительных клинических признаков гипотиреоза и нормальных значениях перечисленных показателей.
в. При нормальной концентрации свТ4 и повышенном уровне ТТГ лечение не показано; гормональные исследования повторяют через 8-12 недель.
г. При нормальной концентрации Т, повышенном уровне ТТГ и наличии убедительных клинических признаков гипотиреоза показано определение аутоантител к тиреоглобулину и Т4 в сыворотке крови.
4. Обычные исследования функции щитовидной железы включают определение в сыворотке крови концентрации общего Т4, свТ4 (методом МРД), ТТГ и аутоантител, характерных для лимфоцитарного тиреоидита.
а. Лечение показано при аномальных значениях всех показателей функции щитовидной железы и наличии убедительных клинических признаков гипотиреоза независимо от присутствия аутоантител к тиреоглобулину и тиреоидным гормонам.
б. Лечение не показано в отсутствие убедительных клинических признаков гипотиреоза при нормальных значениях показателей функции щитовидной железы независимо от присутствия аутоантител к тиреоглобулину и тиреоидным гормонам. Присутствие таких аутоантител подтверждает диагноз лимфоцитарного тиреоидита и требует повторных определений показателей функции щитовидной железы каждые 3-6 мес.
в. При расхождении показателей функции щитовидной железы решение о необходимости лечения принимают с учетом клинического состояния животного, уверенности в наличии гипотиреоза и критической оценки каждого показателя. Наиболее точным показателем функции щитовидной железы является концентрация свТ4, определяемая с помощью МРД.
да диагностики гипотиреоза зависят от остаточной функции щитовидной железы в момент взятия пробы, от действия посторонних факторов и от присутствия в крови антител к тиреоидным гормонам.
Перекрывание показателей при эу- и гипотиреозе затрудняет установление нормальных границ уровня Т4 в сыворотке крови. Если в лаборатории за нижнюю границу нормы принимают 1,5 мкг%, то жертвуют чувствительностью ради специфичности. Иными словами, это сводит к минимуму число животных с гипотиреозом, у которых ошибочно диагностируют эутиреоз, но зато увеличивает число эутиреоидных собак, у которых ошибочно диагностируют гипотиреоз. Если же за нижнюю границу нормы принимают меньшую величину (например, 0,8 мкг%), то жертвуют специфичностью ради чувствительности. В этих случаях уменьшается число эутиреоидных собак, которых ошибочно относят к гипотиреоидным, но возрастает число животных с гипотиреозом, у которых ошибочно диагностируют эутиреоз.
Диапазон нормальных концентраций Т4 в сыворотке крови может быть разным для собак разных пород. Обычно за норму принимают среднюю концентрацию Т4 у большого числа животных (независимо от породы) плюс-минус два стандартных отклонения от средней величины. Нормальные уровни Т4 и свободного Т4, измеренные с помощью модифицированного метода равновесного диализа,
у щенков грейхаундов ниже, чем у щенков других пород (Gaughan, Bryuette, 2001). Это свидетельствует о необходимости установления норм для отдельных пород. Пока таких данных нет.
По нашему мнению, при разграничении эу- и гипотиреоза не следует ориентироваться на произвольно установленные нормы; результаты анализа нужно рассматривать в совокупности с данными анамнеза, физикального обследования и другими клинико-морфологическими показателями. Только с учетом всех этих данных можно предположительно диагностировать эу- или гипотиреоз. Клиницисту трудно оценить влияние привходящих факторов (особенно сопутствующих заболеваний) на уровень Т4 в сыворотке. Поскольку такие факторы могут снижать уровень Т4 при эутиреозе до 0,5 мкг% и ниже и поскольку уровень этого гормона в сыворотке у собак с гипотиреозом редко превышает 1,5 мкг%, мы оцениваем концентрацию Т4 в сыворотке крови только как ориентировочный показатель, свидетельствующий лишь о большей или меньшей вероятности заболевания. Чем эта концентрация (в определенных пределах) выше, тем выше вероятность эутиреоза (табл. 3-13). Исключение составляют собаки, у которых в крови присутствуют антитела к тиреоидным гормонам. Наоборот, чем концентрация Т4 ниже, тем вероятнее гипотиреоз, если с таким предположением согласуются данные анамнеза, физикального и других исследований и
ГИПОТИРЕОЗ
125
ТАБЛИЦА 3-13. ТРАКТОВКА РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ Т4, свТ4 В СЫВОРОТКЕ У СОБАК С ПОДОЗРЕНИЕМ НА ГИПОТИРЕОЗ*
Концентрация Т4 (мкг%) Концентрация свТ4 (нг%) Вероятность гипотиреоза
>2 >2 Крайне маловероятен
1,5-2,0 1,5-2,0 Маловероятен
1,0-1,5 0,8-1,5 ?
0,5-1,0 0,5-0,8 Возможен
<0.5 <0.5 Весьма вероятен*
* В отсутствие тяжелых системных заболеваний.
если у животного отсутствуют другие заболевания. В отсутствие клинических данных, позволяющих предполагать гипотиреоз, низкие концентрации Т4 в сыворотке могут указывать на синдром эутиреоидной патологии.
Интерпретация результатов, получаемых на фоне введения тиреоидных гормонов. Иногда возникает необходимость проверить, действительно ли собака, получающая тиреоидные гормоны, страдает гипотиреозом. Экзогенные тиреоидные гормоны, будь-то Т4 или Т3, подавляют гипофизарную секрецию ТТГ и приводят к атрофии тиреотропных клеток гипофиза, а затем и щитовидной железы у здоровых животных (Panciera et al, 1990). Концентрации Т4, свободного Т4 и ТТГ в сыворотке крови в таких случаях могут оказаться ниже чувствительности метода определения. Степень снижения этих показателей зависит от степени атрофии щитовидной железы. У собаки, ранее находившейся в эутиреоидном состоянии, уровни общего и свободного Т4 могут оставаться характерными для гипотиреоза в течение целого месяца после отмены экзогенных тиреоидных гормонов (Panciera et al, 1989). Поэтому концентрации общего и свободного Т4 и ТТГ в сыворотке приобретают диагностическое значение лишь после полного восстановления функции гипофизарно-тиреоидной системы. Временной интервал между отменой экзогенных тиреоидных гормонов и восстановлением функции этой системы зависит от доз гормонов, длительности и частоты их введения, а также от индивидуальных особенностей животного. Как правило, экзогенные тиреоидные гормоны следует отменять не менее чем за 4 недели, а лучше за 6-8 недель до исследования функции щитовидной железы.
Базальная концентрация общего трийодтиронина (Т3) в сыворотке крови
Методика определения. Концентрация Т3 в сыворотке отражает суммарное количество связанного с белками и свободного гормона. Почти во всех лабораториях уровень Т3 в крови определяют методами РИА. Концентрации Т3 у собак практически не отличаются от таковых у человека, и поэтому для их определения можно использовать большинство существующих наборов. Нормальный уровень Т3
в крови (по данным РИА) колеблется в пределах 0,8-1,5 нг/мл, но (по указанным выше причинам) данные разных лабораторий могут различаться.
Стабильность Т3 и факторы, мешающие его определению. Все, что сказано относительно Т4, справедливо и для Т3. При лимфоцитарном тиреоидите у собак антитела к Т3 встречаются чаще, чем антитела к Т4.
Интерпретация результатов. Отличить эути-реоз от гипотиреоза на основании уровня Т3 в сыворотке практически невозможно (рис. 3-15). Концентрации этого гормона у здоровых собак, животных с гипотиреозом и другими заболеваниями не различаются (Nelson et al, 1991; Miller et al, 1992). Уровень T3 в сыворотке не отражает функцию щитовидной железы, поскольку этот гормон образуется в основном путем дейодирования Т4 в периферических тканях, и лишь небольшие его количества секретируются самой железой. Кроме того, как секреция Т3, так и 5'-дейодирование Т4 возрастают уже при минимальной дисфункции щитовидной железы (Utiger, 1980; Lum et al, 1984). Поэтому при гипотиреозе на фоне снижения уровня Т4 концентрация Т3 может оставаться нормальной. У человека периферические ткани обладают способностью регулировать активность 5'-дейодиназы, чтобы по возможности дольше сохранять уровень Т3 в крови (Lum et al, 1984). На содержание Т3 влияют те же факторы, что и на содержание Т4. При оценке функции щитовидной железы у собак мы не определяем концентрацию Т3 в сыворотке крови и не обращаем внимания на этот показатель при получении данных из лаборатории.
Здоровые Собаки с гипо- Эутиреоидные собаки собаки тиреозом с заболеванием кожи
Рис. 3-15. Базальная концентрация Т3 в сыворотке 35 здоровых собак, 35 собак с гипотиреозом и 30 эутиреоидных собак с поражениями кожи. Обратите внимание, что показатели у животных трех групп перекрывают друг друга.
126 • ГИПОТИРЕОЗ
Некоторые клиницисты оправдывают определение Т3 в сыворотке тем, что этот показатель лучше отражает присутствие антител к тиреоидным гормонам и наличие лимфоцитарного тиреоидита, чем уровень Т4. Аутоантитела к Т3 в сыворотке собак, у которых определяли уровни тиреоидных гормонов, встречаются с частотой 0,3-4,5% (Young et al, 1985; Nachreiner et al, 1990), и аутоантитела к тиреоглобулину гораздо точнее отражают наличие лимфоцитарного тиреоидита у собак, чем аутоантитела к Т3 или Т4.
Утверждается также, что определение концентрации Т3 в сыворотке помогает выявить животных, у которых нарушена периферическая конверсия Т4 в Т3; данный синдром можно заподозрить в тех случаях, когда уровень Т4 в норме, а содержание Т3 снижено или вообще не поддается определению. Из-за низкой концентрации Т3 у таких собак (часто называемых «плохими конверторами») якобы можно ошибочно диагностировать гипотиреоз. Однако возможность избирательного снижения активности 5*-дейодиназы (фермента, превращающего Т4в Т3) в качестве причины гипотиреоза не доказана. При нормальной концентрации Т4 следует предполагать эутиреоидное состояние, а снижение уровня Т3 по вышеизложенным причинам не имеет диагностического значения. Тем не менее, резкое снижение уровня этого гормона может указывать на присутствие в крови аутоантител к нему и тем самым на наличие лимфоцитарного тиреоидита.
Базальная концентрация свободного тироксина (свТ4) в сыворотке крови
Концентрацию свТ4 в сыворотке в настоящее время измеряют либо с помощью РИА (наборами, предназначенными для человека), либо модифици
рованным методом равновесного диализа (МРД), требующим разделения связанного с белками и свободного гормона перед его определением с помощью РИА. Метод МРД позволяет наиболее точно определять содержание свТ4 и именно его следует использовать для оценки функции щитовидной железы у собак. Если исследование планируется провести в течение ближайших 5 суток, то пробы сыворотки в пластиковых пробирках можно не замораживать (Behrend et al, 1998), но мы все же рекомендуем замораживать их и держать во льду во время отсылки в лабораторию. Чувствительность и специфичность метода определения свТ4 с помощью МРД составляют соответственно 98 и 95% (Peterson et al, 1997); точность превышает 90%, тогда как точность определения общего Т4 в сыворотке - всего 75-85% (Nelson et al, 1991; Scott-Moncrieff et al, 1994; Peterson et al, 1997). В целом, при определении этим методом уровни свТ4 выше 1,5 нг/мл указывают на эутиреоз, а ниже 0,8 нг/мл (особенно ниже 0,5 нг/мл) - на гипотиреоз, если, конечно, данные анамнеза, физикальных и морфологических исследований согласуются с таким диагнозом, и у животного отсутствуют тяжелые системные заболевания (табл. 3-13). Антитела к тиреоидным гормонам не мешают определению свТ4 методом МРД. На его уровень в сыворотке сопутствующие заболевания влияют не так сильно, как на уровень общего Т , хотя тяжелые заболевания могут сопровождаться падением его концентрации ниже 0,5 нг/ мл (см. «Синдром эутиреоидной патологии»). Нормальные уровни свТ4, измеренные методом МРД, у собак разных пород могут быть разными, и это следует учитывать при интерпретации результатов (Gaughan, Bruyette, 2001).
При определении методом РИА концентрации свТ4 в одних и тех же сыворотках часто оказыва
Рис. 3-16. Результаты определения концентрации свТ4 в сыворотке крови методом равновесного диализа (черный столбик) и с помощью четырех коммерческих наборов для радиоиммунологического анализа у 54 здоровых собак, 12 эутиреоидных собак с гипоальбуминемией (содержание альбумина < 2,0 г%) и 11 эутиреоидных собак с выраженным ожирением. Уровни свТ4 определяли всеми методами в одних и тех же пробах сыворотки каждого животного. Обратите внимание на расхождение результатов, полученных методом равновесного диализа и радиоиммунологическими методами.
ГИПОТИРЕОЗ • 127
ются существенно ниже, чем при определении методом МРД (рис. 3-16). Нам не удалось выявить каких либо преимуществ определения свТ4 методом РИА перед определением общего Т4 тем же методом. Точность РИА при определении свТ4 обычно составляет 65-85%, а при определении общего Т4 - 75-85%, тогда как при определении свТ4 методом МРД она превышает 90% (Nelson et al, 1991; Montgomery et al, 1991; Scott-Moncrieff et al, 1994; Peterson et al, 1997). Чувствительность, специфичность и прогностическое значение уровней свободного и общего Т4, определяемых методом РИА, также очень близки (Nelson et al, 1991; Montgomery et al, 1991). Большинство факторов, влияющих на интерпретацию показателей общего Т4, необходимо учитывать и при интерпретации уровней свТ4, определяемых методом РИА. Средние концентрации свТ4 в сыворотке здоровых собак и животных с гипотиреозом существенно разнятся, но диапазоны концентраций перекрываются (Nelson et al, 1991). Поэтому однократные определения свТ4 методом РИА не позволяют разграничить эти состояния (рис. 3-17). При однократных определениях невозможно также отличить гипотиреоз от других заболеваний (например, аллергических дерматитов и мегаэзофагуса), хотя средние уровни свТ4 у собак этих групп значительно различаются (рис. 3-17). Частота таких ложноположительных результатов с увеличением тяжести заболеваний возрастает. При использовании метода МРД ложноположительные результаты получают реже, а чувствительность, специфичность и точность определения свТ4 увеличиваются (рис. 3-18). Поэтому мы всегда применяем именно этот метод.
Базальная концентрация свободного трийодтиронина (свТ3) в сыворотке крови
Свободный Т3 образуется при 5'-дейодировании свТ4 в клетках периферических тканей; на долю секретированного щитовидной железой свТ3 приходится лишь небольшая часть всего гормона, присутствующего в крови. Определению свТ3 придают такое же значение, что и определению свТ4. Для определения свТ3 у собак пригодны наборы РИА, используемые для определения этого гормона у человека. С их помощью было установлено, что уровень свободного Т3 в сыворотке крови собак в норме находится в пределах 2,5-6,0 пг/мл (Nachreiner, 1984). Данные о чувствительности и специфичности методов РИА и о диагностическом значении определяемого с их помощью уровня свТ3 в сыворотке у собак в литературе отсутствуют. По-видимому, все сложности, связанные с трактовкой результатов определения общего Т3, присущи и этому показателю. В настоящее время при исследовании функции щитовидной железы мы не определяем концентрацию свТ3 в сыворотке и не обращаем внимания на величину этого показателя, сообщаемую лабораториями.
Здоровые Собаки с ги- Эутиреоидные
собаки потиреозом собаки с заболе-
ванием кожи
Рис. 3-17. Базальные концентрации свТ4, определенные ра-диоиммунологическим методом, у 36 здоровых собак, 30 собак с гипотиреозом и 35 эутиреоидных собак с поражениями кожи. Обратите внимание на перекрывание показателей у трех групп животных.
Здоровые Собаки с ги- Эутиреоидные собаки потиреозом собаки с заболеванием кожи
Рис. 3-18. Базальные концентрации свТ4, определенные модифицированным методом равновесного диализа (МРД), у 40 здоровых собак, 18 собак с гипотиреозом и 30 эутиреоидных собак с поражениями кожи. Обратите внимание на расхождение показателей у животных трех групп. Пунктирные линии - верхняя и нижняя граница нормы.
Базальная концентрация реверсивного трийодтиронина (рТ3) в сыворотке крови
Реверсивный Т3 (рТ3) - практически неактивный продукт 5-дейодирования тироксина. Основное количество рТ3 образуется в клетках из Т , и очень мало рТ3 секретируется самой щитовидной желе-
128
ГИПОТИРЕОЗ
зой. Концентрацию рТ3 можно определять методами РИА с использованием антител, не дающих перекрестной реакции с Т4 или Т3. В норме уровни рТ3 в сыворотке составляют примерно j - S от концентраций Т3, т.е. 6-58 нг% (Ferguson, 1984). Клиническое значение этого показателя у собак не установлено. Теоретически, при гипотиреозе у собак концентрация рТ3 (как и уровни общих Т4 и Т3) должна быть снижена, тогда как при гормональных сдвигах, обусловленных другими заболеваниями или лекарственной терапией, базальные уровни Т4 и Т3 могут быть низкими, но концентрация рТ3 - нормальной или повышенной. Однако у человека уровни рТ3 в норме, при гипотиреозе и при синдроме эутиреоидной патологии в значительной степени перекрывают друг друга (Kaplan et al, 1982). Содержание рТ3 в сыворотке определяют лишь в немногих лабораториях.
Базальная концентрация тиреотропного гормона (ТТГ) в сыворотке крови
Рис. 3-19. Средние уровни Т4 (светлые кружки) и ТТГ (темные кружки) в сыворотке у собак после индукции экспериментального гипотиреоза (день 0) и лечения левотироксином (начатого на 42-й день). Вертикальные линии - среднее квадратичное отклонение от средней (SD). Звездочкой помечены величины, достоверно (р < 0,05) отличающиеся от таковых в день 0. (Из: Williams DA et al, JAMA 209:1730, 1996).
Вначале был разработан набор для иммунорадио-метрического определения ТТГ у собак (Count-A-Count Canine TSH IRMA; Diagnostic Products Corp, США). По данным Williams и соавторов (1996), у 6 биглей с экспериментальным гипотиреозом средняя концентрация ТТГ превышала норму в 35 раз, а лечение натриевой солью левотироксина нормализовало этот показатель (рис. 3-19). Введение ТРГ приводило к быстрому и значительному подъему уровня ТТГ в сыворотке крови с максимумом через 10-30 мин (рис. 3-20; Meij et al, 1996). Это свидетельствует о пригодности данного набора для определения концентрации ТТГ у собак. Затем были разработаны хемилюминесцентный иммуномет-рический набор (Immulite Canine TSH; Diagnostic Products Corp, США) и набор для иммунофермен-тного определения ТТГ (Milenia Canine TSH; Diagnostic Products Corp, США). Самым точным из этих методов оказался хемилюминесцентный (Marca et al., 2001), хотя между результатами определения ТТГ в сыворотке собак всеми тремя методами выявлена удовлетворительная корреляция.
Показатели уровня ТТГ в сыворотке крови при гипотиреозе у собак высоко специфичны (90% и выше), если их интерпретировать с учетом базальных концентраций Т4 и свТ4 (Dixon et al, 1996; Ramsey et al, 1997; Peterson et al, 1997; Scott-Mon-crieff et al, 1998). В отрыве от последних данных специфичность результатов определения ТТГ значительно снижается, так как уровни этого гормона у собак с гипотиреозом и с другими заболеваниями перекрывают друг друга (рис. 3-21). Кроме того, в зависимости от метода определения уровень ТТГ у 20^40% собак с гипотиреозом попадает в диапазон нормальных концентраций гормона, и, следовательно, чувствительность теста составляет всего 63-82%. Нормальные уровни ТТГ при гипотиреозе могут быть связаны со случайными их колебаниями
Время (мин)
Рис. 3-20. Ответ ТТГ (М + т) у 8 здоровых биглей после быстрого (30 сек) внутривенного введения (стрелка) комбинации четырех гипоталамических рилизинг-гормонов (темные кружки) и одного ТРГ в дозе 10 мкг/кг (светлые кружки). При введении смеси рилизинг-гормонов их дозы составляли: кортикотропин рилизинг-гормон - 1 мкг/кг, гормон роста рилизинг-гормон - 1 мкг/кг, гонадотропин рилизинг-гормон - 10 мкг/кг, ТРГ - 10 мкг/кг. Из: Meji BP et al: Dom Anim Endocr 13:465, 1996.
(рис. 3-22), вторичным гипотиреозом, какими-либо лекарственными препаратами или заболеваниями (снижающими концентрацию ТТГ), невозможностью с помощью имеющихся методов определить все изоформы ТТГ в крови и снижением секреции ТТГ при длительном гипотиреозе (Ramsey et al, 1997; Peterson et al, 1997; Bruner et al, 1998; Kooistra et al, 2000b). В условиях длительного снижения уровня тиреоидных гормонов могут нарушаться механизмы обратной связи в гипоталамо-гипофизарно-ти-реоидной системе или истощаться секреторные резервы тиреотропных клеток гипофиза (Ransey et al, 1997). Кроме того, нормальный уровень ТТГ в сыворотке у данной собаки может отличаться от
ГИПОТИРЕОЗ
129
О (6.7)
О (5.7)
О (4.6)
О (4.1)
34
с •S
Эутиреоз Норма Гипотиреоз (при наличии других
заболеваний)
Рис. 3-21. Концентрация ТТГ в сыворотке крови у 150 здоровых собак, 54 собак с гипотиреозом и 54 эутиреоидных собак с другими заболеваниями. Т-образные линии для каждого прямоугольника ограничивают основной массив данных, которые в большинстве случаев находятся в пределах колебании показателя В каждый прямоугольник включена половина данных (с 25-го по 75-ый процентиль). Горизонтальные линии в каждом прямоугольнике - медиана. Светлые кружки - данные, выходящие за указанные пределы колебании (в скобках укатны их точные значения). Заполненная точками область — диапазон нормальных значении концентрации 1ТГ в сыворотке крови. (Из: Peterson Mb et al: JAMA 211:1396, 1997.)
средней популяционной нормы, и отдельные определения в таких случаях не позволят обнаружить небольшие, но важные изменения этого показателя. Иначе говоря, для данного конкретного животного уровень ТТГ может быть аномальным, хотя и укладываться в границы нормальных колебании (Iversen et al. 1999). Содержание ГТГ в сыворотке, по-видимому, не зависит от времени отбора проб крови (Bruner et al, 1998).
В большинстве клинических лабораторий за верхнюю границу нормы принимают концентрацию ТТГ 0.6 нг/мл. Чувствительность современных методов определения ТТГ составляет 0,1 нг/мл (Williams et al, 1996), поэтому нижнюю границу нормы установить невозможно. Существующие методы не позволяют также отличить вторичный гипотиреоз от снижения секреции ТТГ, вызванного передозировкой левотироксина или другими лекарственными веществами и заболеваниями.
Уровень ТТГ всегда следует сопоставлять с концентрациями общего или свТ4 в той же пробе сыворотки и никогда не рассматривать его в качестве
Время (ч)
Рис. 3-22. Концентрация ТТГ в сыворотке крови, определяемая с 2-часовыми интервалами с 8 ч утра до 8 ч вечера у 6 собак со спонтанно развившимся гипотиреозом. Пунктирные линии - пределы нормальных концентраций. Приведены кривые для каждой собаки с гипотиреозом. Из: Bruner et al: JAMA 212:1572, 1998.
130
ГИПОТИРЕОЗ
единственного показателя функции щитовидной железы. Низкое содержание общего или свТ4 на фоне повышенного уровня ТТГ у собаки с соответствующими данными анамнеза и физикального обследования подтверждает диагноз первичного гипотиреоза, тогда как нормальные концентрации всех этих гормонов в сыворотке крови позволяют исключить гипотиреоз. Любые другие сочетания показателей интерпретировать трудно. СвТ4 рекомендуется определять наиболее точным методом, а именно МРД. У человека на ранних стадиях первичного гипотиреоза находят нормальные концентрации общего или свТ4 в сыворотке крови при повышенном содержании ТТГ (Larsen et al, 1981). У собак также встречается такое сочетание показателей функции щитовидной железы (см. табл. 3-2), но у какого процента этих животных в дальнейшем разовьется явный гипотиреоз, предсказать невозможно. В силу нормальных концентраций общего и свободного Т4 клинические признаки гипотиреоза в таких случаях отсутствуют. Поэтому через 3-6 месяцев рекомендуется повторно обследовать этих собак, особенно если в их крови присутствуют антитиреоидные антитела. Прогрессирующая деструкция щитовидной железы должна сопровождаться постепенным нарастанием уровня ТТГ, снижением концентраций общего Т4 и свТ4 и появлением, в конце концов, клинических признаков гипотиреоза.
Поглощение Т3 смолой
Результаты этого теста косвенно отражают изменения связывания тиреоидных гормонов белками плазмы крови. У человека поглощение Т3 смолой достаточно хорошо коррелирует с процентом свободного Т4 в сыворотке при его определении методом равновесного диализа (Belshaw, 1983; Ferguson, 1984). Умножив уровень общего Т4 в сыворотке крови на поглощение Т3 смолой, получают показатель, называемый индексом свободного тироксина. У человека определение этого индекса надежно заменяет прямые измерения концентрации свТ4. В сыворотке собак содержится относительно мало глобулина, связывающего тиреоидные гормоны с высоким сродством (ТСГ), и поэтому поглощение Т3 смолой - малочувствительный показатель функции щитовидной железы для собак. Столь же малочувствительным показателем является и индекс свободного тироксина, величина которого зависит от поглощения Т3 смолой.
Стимулирующая проба с ТТГ
С помощью этой пробы оценивают чувствительность щитовидной железы к экзогенному ТТГ. У собак с низким уровнем тиреоидных гормонов она позволяет отличить гипотиреоз от синдрома эутиреоидной патологии. К сожалению, цена препарата ТТГ для инъекций слишком высока, чтобы его мож-
81
7-
6-
5-
4-
3-
2-
1-
0-
До введения ТТГ
После введения ТТГ
Рис. 3-23. Интерпретация результатов стимулирующей пробы с ТТГ у собак. Уровень Т, находящийся в пределах нормы после введения ТТГ, обычно указывает на нормальную функцию щитовидной железы. Исключения составляют случаи с исходно высоким уровнем Т4, не возрастающим после введения ТТГ (линия а), и исходно низким уровнем Т4, возрастающим после введения ТТГ до значений, характерных для нормального ответа (линия в). Ответ Т4, показанный линиями а и б, может отражать влияние антител к Т4 при первичном гипотиреозе, а ответ, показанный линией в, - вторичный гипотиреоз или влияние других заболеваний. Низкие уровни Т4 и до, и после введения ТТГ (линия г), а также уровни Т4 после введения ТТГ, попадающие в область неопределенных значений, могут указывать как на гипотиреоз, так и на другие заболевания. Чем тяжелее заболевание, тем ниже уровни Т4 после введения ТТГ. Редкая косая штриховка - область нормальных значений; крестообразная штриховка - область диагностически неопределенных значений; сплошная косая штриховка - область значений, характерных для гипотиреоза. Из: Nelson RW, Couto GC: Essentials of Small Animal Internal Medicine. St. Louis, Mos-by-Year Book, 1992, p 549. Публикуется с разрешения.
но было использовать у животных. Ниже приводится краткое описание этой пробы. Более подробные сведения изложены во 2-ом издании монографии.
Стимулирующую пробу проводят с бычьим или рекомбинантным человеческим ТТГ. Щитовидная железа собак реагирует на эти препараты, так как биологическая активность ТТГ, в отличие от иммунологической, лишена видовой специфичности (Kaptein et al, 1982). Мы предпочитаем следующую схему: бычий ТТГ вводят собакам внутривенно в дозе 0,1 МЕ/кг (максимум 5 ME), а рекомбинантный человеческий ТТГ - в дозе 50 мкг на животное. Кровь для определения концентрации Т4 берут до и через 6 ч после введения гормона. Уровень свТ4 при этом возрастает параллельно уровню общего Т , и его определение не увеличивает диагностическую ценность исследования (Sauve, Paradis, 2000).
Концентрации Т4 до и после введения ТТГ сравнивают с нормативными показателями, установленными в данной лаборатории. По нашим данным, концентрация Т4 в сыворотке после введения бычьего ТТГ в норме превышает 3 мкг%, тогда как при первичном гипотиреозе она остается ниже нормального исходного уровня (т.е. ниже 1,5 мкг%). Показатели между 1,5 и 3 мкг% неинформативны. Они могут отражать как ранние стадии гипотиреоза, так и подав-
ГИПОТИРЕОЗ • 131
ление функции щитовидной железы сопутствующими заболеваниями или лекарственными средствами (рис. 3-23). Для гипотиреоза характерно постепенное снижение функции щитовидной железы и ее чувствительности к ТТГ. В конце концов, железа перестает отвечать на ТТГ. Однако до этого результаты пробы могут напоминать данные, получаемые при синдроме эутиреоидной патологии. Если исходная концентрация тиреоидных гормонов в сыворотке снижена не вследствие гипотиреоза, а в результате нетиреоидных заболеваний, действия глюкокортикоидов или других лекарственных препаратов (т.е. при синдроме эутиреоидной патологии), то ответ на ТТГ обычно сохраняется, хотя и выражен слабее, чем в норме (рис. 3-24). При тяжелых системных заболеваниях концентрация Т4 после введения ТТГ может оставаться на уровне, характерном для первичного гипотиреоза (т.е. ниже 1,5 мкг%; рис. 3-25). Данных о реакции собак с гипотиреозом и синдромом эутиреоидной патологии на рекомбинантный человеческий ТТГ нет. Однако здоровые собаки отвечают на этот препарат так же, как на бычий ТТГ, поэтому интерпретация результатов пробы с использованием человеческого или бычьего ТТГ может быть одинаковой (Sauve, Paradis, 2000).
Стимулирующая проба с тиролиберином (тиреотропин рилизинг-гормоном, ТРГ)
Показания. Результаты этой пробы отражают не только чувствительность гипофиза к ТРГ, но и чувствительность щитовидной железы к эндогенному ТТГ, выделяющемуся под действием ТРГ.
7 -|
Рис. 3-24. Средние концентрации Т4 в сыворотке до и через 6 ч после внутривенного введения ТТГ в дозе 0,1 МЕ/кг у 34 собак с гипотиреозом (а), 12 собак с гиперкортицизмом (б), 10 эутиреоидных собак с периферической нейропатией (в), 10 эутиреоидных собак с идиопатическим увеличением размеров пищевода (г), 8 эутиреоидных собак с кардиомиопатией (д) и 5 эутиреоидных бесплодных самок (е). Затемненная область - диапазон нормальных значений.
0 J!-------------!--
До После
введения введения
ТТГ ТТГ
3.5-1
Рис. 3-25. Средние результаты стимулирующей пробы с ТТГ у 5 собак при их первом приводе в клинику по поводу тяжелого диабетического кетоацидоза (пунктирные линии) и через 4-6 недель после устранения кетоацидоза и нормализации гликемии с помощью инсулина (сплошные линии). Обратите внимание на подавление функции щитовидной железы сопутствующим заболеванием (диабетический кетоацидоз) и восстановление этой функции после устранения тяжелого состояния. Затемненные области - диапазон нормальных концентраций.
132
ГИПОТИРЕОЗ
При низком исходном уровне тиреоидных гормонов проба с ТРГ позволяет отличить гипотиреоз от синдрома эутиреоидной патологии и (теоретически) первичный гипотиреоз от вторичного гипотиреоза. Некоторые считают эту пробу чувствительнее пробы с ТТГ (Lothrop et al, 1984b; Li et al, 1986). Однако результаты пробы с ТРГ трудно интерпретировать, поскольку концентрация Т4 в сыворотке крови после введения ТРГ возрастает очень слабо. Кроме того, препарат ТРГ для инъекции менее доступней.
Протокол. Предложены различные протоколы проведения пробы с ТРГ (табл. 3-14). При введении ТРГ в дозах, превышающих 0,1 мг/кг, возможны побочные эффекты: усиленное слюно- и мочеотделение, дефекация, рвота, миоз, тахикардия и одышка (Lothrop et al, 1984а; Li et al, 1986). С увеличением дозы ТРГ возрастает продолжительность, но не степень повышения уровня Т4 (Lothrop et al, 1984а). Поэтому следует вводить наименьшую из тех доз ТРГ, которые максимально стимулируют секрецию Т4, не оказывая при этом побочного действия.
В нашей клинике собакам внутривенно вводят 0,2 мг ТРГ (Типинон: Abbot Laboratories, США). Кровь для определения Т4 берут до и через 4 ч после введения ТРГ (Evinger et al, 1985), а для определения ТТГ - до и через 30 мин после введения ТРГ (Scott-Moncrieff, Nelson, 1998). Уровень ТТГ в сыворотке крови после введения ТРГ отражает чувствительность гипофиза к стимуляции, а уровень Т4 - чувствительность щитовидной железы к ТТГ, выделяющемуся под влиянием ТРГ. Определение свТ4 не дает дополнительной информации и поэтому обычно не проводится.
Интерпретация результатов. Интерпретация результатов этой пробы достаточно субъективна,
ТАБЛИЦА 3-14. СХЕМЫ ПРОВЕДЕНИЯ СТИМУЛИРУЮЩЕЙ ПРОБЫ С ТРГ У СОБАК
Доза ТРГ Способ введения Время отбора проб крови (ч) Ссылка
0,2 мг/собака в/в* 0,4 Различные авторы
0,25 мг/собака в/в 0,4 Kemppainen et al, 1983
0,05 мг/кг в/в 0,6 Avgeris et al, 1990
0,1 мг/кг в/в 0,6 Lothrop et al, 1984b
0,3 мг/кг в/в 0,4 Kaufman et al, 1985
0,3-0,5 мг/кг в/в 0,6-8 Li et al, 1986
* в/в - внутривенно
поскольку содержание общего Т4 в сыворотке после введения ТРГ возрастает в значительно меньшей степени, чем после введения ТТГ (Frank, 1996). По данным нашей лаборатории, после введения ТРГ по указанной выше схеме концентрация Т4 в сыворотке эутиреоидных собак должна превышать 2 мкг%. Иными словами, эта концентрация должна быть выше исходного уровня Т4 минимум на 0,5 мкг%. У собак с первичным гипотиреозом концентрация Т4 в сыворотке после введения ТРГ остается ниже нормального исходного уровня (т.е. ниже 1,5 мкг%) и увеличивается менее чем на 0,5 мкг% (рис. 3-26). Если уровень Т4 после введения ТРГ находится между 1,5 и 2,0 мкг%, то результаты пробы не имеют диагностического значения. Такие показатели встречаются как на ранних стадиях гипотиреоза, так и при других заболеваниях у собак или при введении им лекарственных препаратов. Факторы, влияющие на результаты пробы с ТРГ, не отличаются от тех, которые могут изменять результаты пробы с ТТГ.
Группы собак
Группы собак
Рис. 3-26. Концентрации Т4 (А) и ТТГ (Б) до (темные точки) и через 30 мин (для ТТГ) и 4 ч (для Т4) после введения ТРГ (светлые точки) здоровым собакам, собакам с гипотиреозом и эутиреоидным собакам с другими заболеваниями. Горизонтальные линии - верхние границы нормы для Т4 (Д) и ТТГ (Б). Из: Scott-Moncrieff JCR, Nelson RW: JAMA 213: 1435, 1998.
ГИПОТИРЕОЗ • 133
Теоретически, различия в ответе ТТГ на экзогенный ТРГ должны помочь отличить гипотиреоз от синдрома эутиреоидной патологии и первичный гипотиреоз от вторичного гиротиреоза. У здоровых собак уровень ТТГ через 10-30 мин после введения ТРГ значительно возрастает (см. рис. 3-20; Meij et al, 1996). В одном из исследований (Scott-Mon-crieff, Nelson, 1998) средние исходные уровни Т4в сыворотке собак с гипотиреозом были существенно ниже, а ТТГ - выше, чем в норме или у животных с другими заболеваниями. После введения ТРГ средняя концентрация ТТГ у собак с гипотиреозом также оказалась выше, чем у собак двух других групп (рис. 3-26). Однако в процентном отношении реакция ТТГ на ТРГ у собак с гипотироеозом была наименьшей (рис. 3-27). Если за норму принять повышение уровня ТТГ после введения ТРГ более чем на 100%, то чувствительность этой пробы составит 85%, специфичность - 94% и общая точность -90%. Это практически совпадает с характеристикой других показателей функции щитовидной железы. Таким образом, проба с ТРГ не имеет каких-либо диагностических преимуществ по сравнению с определением исходных концентраций Т4, свТ4 и ТТГ в сыворотке крови.
У людей с вторичным гипотиреозом уровень ТТГ находится на нижней границе нормы или ниже и не изменяется под действием экзогенного ТРГ. У собак исходные концентрации ТТГ ниже чувствительности метода их определения, поэтому разграничить нормальные и сниженные уровни этого гормона невозможно. Кроме того, поскольку у большинства собак с первичным гипотиреозом ответ ТТГ на ТРГ снижен, то по приросту этого показателя в процентах невозможно отличить и первичный гипотиреоз от вторичного (Scott-Moncrieff, Nelson, 1998).
Показатель «К»
Показатель «К» - это критерий распознавания, объединяющий исходную концентрацию Т4 в сыворотке с его ответом на ТТГ или исходную концентрацию свТ4 с уровнем холестерина в сыворотке (Larsson, 1988). Предполагалось, что одновременная регистрация нескольких параметров повышает точность оценки функции щитовидной железы. Если учитывается исходная концентрация свТ4 (определяемая набором Amerlex-M free Т4 RIA; Amersham Ltd, Англия) и уровень холестерина, то показатель «К» вычисляется по формуле (см. таблицу перевода единиц в систему СИ на внутренней стороне обложки):
К = 0,7 х уровень свободного Т4 (в пмоль/л) - уровень холестерина (в моль/л).
При значениях «К» больше 1 гипотиреоз исключают, а при значениях «К» меньше -4 этот диагноз вполне вероятен. Промежуточные величины (между -4 и 1) не имеют диагностического значения.
Факторы, влияющие на базальный уровень тиреоидных гормонов в сыворотке крови (например, синдром эутиреоидной патологии), сказываются на
2200-
1200-
-100J-----------------------------------------
Здоровые Нетиреоидные Гипотиреоз заболевания (эутиреоз)
Группы собак
Рис. 3-27. Изменение уровня ТТГ (в %) после введения ТРГ здоровым собакам, собакам с гипотиреозом и животным с другими заболеваниями. Горизонтальная линия - предлагаемая граница между эу- и гипотиреозом. Из: Scott-Moncrieff JCR, Nelson RW: JAMA 213:1435, 1998.
величине «К» так же, как и на других показателях функции щитовидной железы. Кроме того, эта величина зависит и от изменений концентрации холестерина при различных заболеваниях, от методов определения холестерина и особенно от методов определения свТ4. Мы предпочитаем интерпретировать показатели функции щитовидной железы, исходя из данных анамнеза, физикального и клинико-патологического исследования, и не рекомендуем полагаться на величину «К».
ПОКАЗАТЕЛИ ЛИМФОЦИТАРНОГО ТИРЕОИДИТА
Присутствие в крови собак аутоантител к тиреоглобулину и тиреоидным гормонам (Haines et al, 1984; Young et al, 1985) считается показателем лимфоцитарного тиреоидита (Chastain et al, 1989; Beale, Torres, 1991; Chastein et al, 1993). Таким образом, определение этих аутоантител в сыворотке можно использовать для диагностики лимфоцитарного тиреоидита, для объяснения необычных сдвигов в концентрации Т3 и Т , и, вероятно, для оценки генетической предрасположенности к лимфоцитарному тиреоидиту (и гипотиреозу) при массовых обследованиях собак. Аутоантитела образуются преимущественно к тиреоглобулину. Т3 и Т4 являются гаптенами, и сами по себе антигенными свойствами не обладают, но поскольку Т3 и Т4 входят в состав молекулы тиреоглобулина, то к ним также образуются аутоантитела (Caschen et al, 1993; Rajatanavin et al, 1989). У собак с аутоантителами к тиреоидным гормонам, как правило, имеются и аутоантитела к тиреоглобулину, но не наоборот (Kemppainen, Young, 1992). Поэтому при массовых обследованиях на лимфоцитарный тиреоидит лучше ориентироваться на аутоантитела к тиреоглобулину.
134 • ГИПОТИРЕОЗ
Аутоантитела к тиреоглобулину
Аутоантитела к тиреоглобулину обнаруживаются в сыворотке 34-59% собак с гипотиреозом (Haines et al, 1984; Vollset, Larsen, 1987; Beale et al, 1990; Thacker et al, 1992). Такие аутоантитела были выявлены у 6 из 7 собак с лимфоцитарным тиреоидитом (по данным биопсии щитовидной железы) и ни у одного из 5 животных с атрофией щитовидной железы (Beale, Thorres, 1991). Аутоантитела к тиреоглобулину обычно присутствуют одновременно с аутоантителами к Т3 и Т4 (Thacker et al, 1992) и чаще обнаруживаются в пробах сыворотки с низким содержанием тиреоидных гормонов (Beale et al, 1990; Thacker et al, 1992), что подтверждает их связь с лимфоцитарным тиреоидитом и гипотиреозом.
Аутоантитела к тиреоглобулину определяют различными способами, включая пассивную гемагглютинацию, фиксацию комплемента, флуоресценцию, твердофазный ИФА и метод радиоиммунопреципитации (Nachreiner et al, 1998). В настоящее время наиболее широко используется ИФА. Методы, применявшиеся в 1980-х годах, давали слишком много ложноположительных результатов: аутоантитела к тиреоглобулину обнаруживались у 14—47% собак, находившихся в эутиреоидном состоянии (Haines et al, 1980; Vollset, Larsen, 1987). При использовании новейших вариантов ИФА ложноположительные результаты получают гораздо реже (Iversen et al, 1998; Nachreiner et al, 1998). По данным одного из исследований, чувствительность и специфичность современного варианта ИФА для определения аутоантител к тиреоглобулину у собак составляют соответственно 91 и 97% (Iversen et al, 1998). Высокая чувствительность и специфичность достигается в тех случаях, когда положительные пробы по оптической плотности по меньшей мере вдвое превосходят отрицательный контроль (Nachreiner et al, 1998). Именно этот вариант ИФА применяется в настоящее время в большинстве коммерческих лабораторий.
Результаты, получаемые при использовании современного набора (Oxford Biomedical Research), разделяют на положительные, отрицательные и сомнительные. Положительные и отрицательные контрольные пробы тестируют всегда вместе с испытываемыми пробами сыворотки или плазмы крови, и оценка результатов основана на данных отрицательного контроля. Положительными считаются любые пробы, оптическая плотность которых при определении на фотометре как миниму вдвое превышает усредненную оптическую плотность отрицательных контрольных проб. Отрицательными считаются любые пробы, оптическая плотность которых превышает отрицательный контроль менее чем на два стандартных отклонения, а сомнительными - те, оптическая плотность которых превышает усредненную оптическую плотность
отрицательного контроля более чем на два стандартных отклонения, но меньше, чем вдвое.
Присутствие в сыворотке аутоантител к тиреоглобулину указывает на поражение щитовидной железы, но ничего не говорит о тяжести или степени воспалительного процесса в ней. Этот показатель не отражает функцию щитовидной железы и не должен служить единственным критерием диагноза гипотиреоза. У собак с доказанным гипотиреозом результаты определения аутоантител к тиреоглобулину могут быть отрицательными, а у эутиреоидных животных могут оказаться положительными. Присутствие таких антител подтверждает обусловленный лимфоцитарным тиреоидитом гипотиреоз только в тех случаях, когда у собаки имеются соответствующие симптомы и признаки, а содержание тиреоидных гормонов в крови снижено.
Определение аутоантител к тиреоглобулину можно использовать для оценки риска лимфоцитарного тиреоидита перед вязкой животного. При обнаружении таких антител следует провести повторное исследование за несколько месяцев до вязки. Значение этого показателя в качестве предвестника будущего гипотиреоза остается неизвестным. При годичном наблюдении за 171 собакой с аутоантителами к тиреоглобулину и нормальными уровнями свТ4 и ТТГ в сыворотке гипотиреоз развился примерно у 20% животных; у 15% антитела исчезли и концентрации свТ4 и ТТГ не менялись, а остальные 65% оставались положительными (или сомнительными) по аутоантителам, но содержание свТ4 и ТТГ у них также не изменилось (Graham et al, 2001b).
Аутоантитела к тиреоидным гормонам
Аутоантитела к тиреоидным гормонам также считаются показателем лимфоцитарного тиреоидита и возможного развития гипотиреоза у собак. При исследовании 28794 сывороток собак с клиническими признаками гипотиреоза такие антитела были обнаружены в 6,3% проб (Nachreiner et al., 2002). Аутоантитела только к Т3 присутствовали в 4,64% проб, только к Т4- в 0,63%, а к обоим гормонам одновременно - в 1,03% проб. Частота обнаружения аутоантител к тиреоидным гормонам находится в обратной зависимости от возраста животных, при этом у самок они встречаются гораздо чаще, чем у самцов, а у кастрированных самцов и самок - гораздо чаще, чем у интактных. Выявлены и породы с повышенным риском образования этих аутоантител (см. табл. 3-3).
В некоторых лабораториях при исследовании параметров функции щитовидной железы всегда определяют аутоантитела к Т3 и Т4. Однако такое определение показано лишь собакам с неожиданным изменением уровня тиреоидных гормонов в сыворотке крови. Аутоантитела к тиреоидным гормонам мешают точному определению концентраций Т3 и Т4 в сыворотке (Young et al, 1985; см.
ГИПОТИРЕОЗ
135
рис. 3-14). Характер помех зависит от системы разделения связанных и свободных гормонов в РИА. При использовании неспецифических систем разделения (сульфат аммония, активированный уголь) уровни гормонов оказываются заниженными, а при одноэтапном разделении в покрытых антителами пробирках - завышенными. При использовании большинства коммерческих наборов для определения Т4 присутствие аутоантител в сыворотке завышает концентрацию гормона. Это завышение бывает настолько значительным, что у собак с гипотиреозом можно ошибочно диагностировать гипертиреоз. Завышенные результаты получают и при определении уровня свТ4 с помощью прямого РИА (без диализа) (Kemppainen et al, 1996). Проведение диализа (например, МРД) исключает возможность завышения результатов, поскольку антитела не проникают сквозь полупроницаемую мембрану. Поэтому при подозрении на присутствие аутоантител к Т4 вместо общего Т4 следует определять свободный гормон методом МРД. К счастью, ошибки возникают при исследовании менее 1 % сывороток (Nachreiner et al, 2002).
Как и аутоантитела к тиреоглобулину, аутоантитела к тиреоидным гормонам свидетельствуют о патологии щитовидной железы, но ничего не говорят о тяжести или прогрессировании воспалительного процесса в ней и не характеризуют ее функцию. Присутствие этих аутоантител само по себе не может служить основанием для диагноза гипотиреоза. Они могут отсутствовать у собак с подтвержденным гипотиреозом и определяться у эутиреоидных животных (Rajatanavin et al, 1989). У собак с клиническими и лабораторными признаками гипотиреоза присутствие аутоантител к Т3 или Т4 указывает на причину этого состояния (лимфоцитарный тиреоидит).
ФАКТОРЫ, ИЗМЕНЯЮЩИЕ ПОКАЗАТЕЛИ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Точная интерпретация показателей функции щитовидной железы - одна из самых больших диагностических трудностей клинической эндокринологии у собак. На исходные концентрации тиреоидных гормонов и ТТГ влияет множество факторов (табл. 3-15). Большинство из них снижает уровни тиреоидных гормонов и повышает содержание ТТГ, и если эти показатели рассматривать в отрыве от клинических данных, то можно ошибочно диагностировать гипотиреоз. Согласно нашему опыту, самые частые причины снижения исходной концентрации тиреоидных гормонов в сыворотке эутиреоидных собак включают синдром эутиреоидной патологии, применение различных лекарственных средств (особенно глюкокортикоидов) и случайные колебания этих концентраций. В каждом конкретном случае могут играть роль и другие факторы, и все это необходимо учитывать при трактовке получаемых результатов.
ТАБЛИЦА 3-15. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОКАЗАТЕЛИ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У СОБАК
Возраст Обратно пропорциональная зави-
симость
до 3 мес. Повышенный уровень Т4
взрослые (старше 6 лет) Сниженный уровень Т4
Размеры тела Обратно пропорциональная зависимость
малые (< 10 кг) Повышенный уровень Т4
крупные (> 30 кг) Порода Сниженный уровень Т4
Борзые (например, грейха- Уровни общего и свободного Т4
унды) ниже нормы, установленной для собак; содержание ТТГ в норме
Пол Не влияет
Время суток Не влияет
Прибавка веса/ожирение Повышает
Потеря веса/голодание Снижает уровень общего, но не свободного Т4
Тяжелые физические на- Повышают уровень Т, снижают
грузки содержание ТТГ и не влияют на уровень свобдного Т4
Эструс (эстрогены) Не влияет на уровень Т4
Беременность (прогестерон) Повышает уровень Т4
Хирургические операции/ анестезия Снижают уровень Т4
Сопутствующие заболева- Снижают уровни общего и свобод-
ния* Лекарственные препараты ного Т4; содержание ТТГ возрастает, снижается или не меняется в зависимости от болезни
Кломипрамин Снижает уровни общего и свободного Т4; на содержание ТТГ не влияет
Капрофен Снижает уровни общего и свободного Т4 и ТТГ
Этодолак Не влияет
Глюкокортикои ды Снижают уровни общего и свободного Т4; у большинства собак снижают или не влияют на содержание ТТГ
Фуросемид Снижает уровень Т4
Метимазол Снижает уровни общего и свободного Т4; повышает содержание ТТГ
Фенобарбитал Снижает уровни общего и свободного Т4; задерживает повышение уровня ТТГ
Фенилбутазон Снижает уровень Т4
Калия бромид Не влияет
Прогестагены Снижают уровень Т4
Пропилтиоурацил Снижает уровни общего и свободного Т4; повышает содержание ТТГ
Цефалексин Не влияет
Сульфаниламиды Снижают уровни общего и свободного Т4; повышают содержание ТТГ
Соли иоподовой кислоты Повышают уровень Т4, снижают уровень Т3
Потребление йода с диетой При избытке уровни общего и свободного Т4 снижаются; содержание ТТГ возрастает
Аутоантитела к тиреоидным Повышают или снижают уровень
гормонам Т4, не влияя на содержание свободного Т4 и ТТГ
* Степень снижения концентрации общего и свободного Т4 прямо зависит от тяжести и системного характера болезни.
136
ГИПОТИРЕОЗ
(n = 237) (n = 164) (n = 222) (n = 120) (n = 196) (n = 106)
Возраст
(n = 237) (n = 164) (n = 222) (n = 120) (n = 199) (n = 106)
Возраст
Рис. 3-28. Средние (M ± m) концентрации Т3 (А) и Т4 (Б) в сыворотке собак разного возраста. Между показателями, помеченными разными буквами, имеются достоверные (р < 0,05) различия. (По: Reimers TJ et al: Am J Vet Res 51 454, 1990.)
Возраст
У эутиреоидных собак средние уровни Т4 и Т3 в сыворотке крови изменяются с возрастом. У щенков в возрасте до 6 недель средняя концентрация Т4 в сыворотке выше, чем в возрасте от 6 недель до 1 года (рис. 3-28; Reimers et al., 1990; Ray, Howanitz, 1984; Weller et al., 1983). В дальнейшем концентрация T4 продолжает снижаться. По данным одного из исследований, у собак 6-11 лет она в среднем на 50% ниже, чем у сосунков (Reimers et al., 1990). Однако даже у самых старых животных этот показатель превышал 1,0 мкг%.
Что касается уровня Т3 в сыворотке, то тенденция к его снижению с возрастом, по-видимому, отсутствует. В одном из исследований наименьшая концентрация Т3 была обнаружена у собак в возрасте до 12 недель. К годовалому возрасту она повышалась, а затем вновь несколько снижалась (рис. 3-28; Reimers et al, 1990). Однако различия между 3-месячными и 11-летними животными были минимальными и, вероятно, не имели клинического значения.
Данные о влиянии возраста на содержание свТ4 и ТТГ в сыворотке собак отсутствуют.
Порода/размеры тела
У здоровых собак с разными размерами тела средние уровни Т4 и Т3 в сыворотке различаются (рис. 3-29; Reimers et al, 1990). В зависимости от размеров тела животных среднего возраста разделяли на 3 группы. Группа маленьких собак (средний вес 7,1 кг) включала пуделей, биглей и цвергшнауцеров;
группа средних (вес 23,3 кг) - английских пойнтеров, английских сеттеров и сибирских хаски, а группа крупных (средний вес 30,6 кг) - черно-под-палых кунхаундов, лабрадоров-ретриверов, доберманов-пинчеров и немецких овчарок. У маленьких собак средняя концентрация Т4 в сыворотке была выше, чем у животных двух других групп. Одна
породы породы породы (п = 246) (п = 418) (п = 407)
Размер собак
Рис. 3-29. Средние (М ± т) концентрации Т3 и Т4 в сыворотке у собак мелких (средний вес тела 7,1 кг), средних (средний вес тела 23,3 кг) и крупных пород (средний вес тела 30, 6 кг). Между показателями, помеченными разными буквами, имеются достоверные (р < 0,05) различия. По: ReimersTJ et al: Am J Vet Res 51:454, 1990.
породы породы породы (п = 246) (п = 420) (п = 408)
Размер собак
ГИПОТИРЕОЗ • 137
ко концентрация Т3 оказалась наибольшей у собак среднего размера. Данных о зависимости уровней свТ4 и ТТГ от размеров собаки не имеется.
Нормальные концентрации общего и свТ4 в сыворотке могут зависеть и от породы собак. Нормы обычно устанавливают по результатам исследования больших групп животных (средняя величина ± 2 стандартных отклонения) независимо от породы. Однако у щенков грейхаундов нормальные концентрации общего и свободного Т4 в сыворотке (при измерении методом МРД) были ниже, чем у щенков других пород (Gaughan, Bruyette, 2001; Hill et al, 2001). Например, по данным Gaughan и Bruyette (2001), нормальная базальная концентрация Т4 в сыворотке крови у 61 грейхаунда составляла 13,9 ± 6,3 нмоль/л (М ± SD), тогда как у здоровых щенков других пород - 25,7 ± 6,9 нмоль/л (см. таблицу перевода единиц в систему СИ на обороте обложки). Концентрации ТТГ в сыворотке щенков разных пород не различались. Эти данные свидетельствуют о необходимости установления нормальных уровней тиреоидных гормонов для отдельных пород собак. Пока этого не сделано, диагноз гипотиреоза следует основывать на данных анамнеза, физикального обследования, анализа крови и результатах биохимического исследования сыворотки.
Пол и фазы астрального цикла
Без учета фаз астрального цикла у самок половые различия в уровне тиреоидных гормонов в сыворотке собак обнаружить не удается (Reimers et al, 1990). При исследовании 550 сук и 515 кобелей средние концентрации гормонов (М ± т) оказались равными: Т4 - 2,11 ± 0,04 и 2,08 ± 0,04 мкг%, а Т3 - 0,94 ±0,01 и 0,92 ± 0,01 нг/мл соответственно.
Тестостерон снижает содержание ТТГ и уровень Т4 в сыворотке, но практически не влияет на концентрацию свТ4 (Wenzel, 1981). Влияние тестостерона на показатели функции щитовидной железы у собак остается неясным. Кастрация кобелей грейхаундов резко повышала уровень общего Т4 в сыворотке, не влияя на концентрацию свТ4 и ТТГ (Hill et al, 2001). В то же время введение тестостерона сукам грейхаундов не сказывалось не только на уровнях свТ4 и ТТГ, но и на содержании общего Т4 (Gaughan, Bruyette, 2001).
Концентрации Т4 и Т3 в сыворотке сук зависят от уровня прогестерона (но не эстрогенов). Содержание тиреоидных гормонов в фазе диэструса было выше, чем в фазах анэструса и проэструса и при лактации у сук или чем у самцов (Reimers et al, 1984). В другом исследовании у собак с гиперэстро-генизмом не было обнаружено изменений базальных уровней Т4 и Т3 в сыворотке крови, но ответ Т4 на ТТГ оказался несколько сниженным (Gosselin et al, 1980). Считается, что прогестерон (содержание которого возрастает в диэструсе независимо от беременности) увеличивает способность белков плазмы связывать тиреоидные гормоны, приводя к
повышению концентраций Т4 и Т3 в сыворотке крови (Wenzel, 1981).
Может ли повышение уровня Т4 под влиянием прогестерона маскировать гипотиреоз? Можно ли предполагать гипотиреоз у сук, когда концентрация Т4 у них находится на нижней границе нормы? Пока эти вопросы остаются без ответов, диагноз гипотиреоза у сук в диэструсе следует устанавливать с учетом данных анамнеза, физикального обследования и всех других показателей.
Суточный ритм
Было предположение о существовании у собак суточного ритма секреции тиреоидных гормонов с пиком в середине дня, но подтвердить это не удается (Kemppainen, Sartin, 1984; Miller et al, 1992). He обнаруживается и суточный ритм секреции ТТГ (Bruner et al., 1998). Однако возможны спорадические и непредсказуемые подъемы и спады концентраций всех этих гормонов в сыворотке (см. ниже). По-видимому, точность оценки функции щитовидной железы не зависит от времени отбора проб крови.
Случайные колебания
У здоровых собак, животных с гипотиреозом, а также с другими заболеваниями отмечены случайные импульсные колебания базальных уровней Т , Т3 и ТТГ в сыворотке крови (рис. 3-22 и 3-30; Kemppainen, Sartin, 1984; Miller et al, 1992; Bruner et al, 1998; Kooistra et al, 2000b). Это может иметь клиническое значение, поскольку в отдельных пробах сыворотки здоровых собак иногда обнаруживаются концентрации Т4 и ТТГ характерные для гипотиреоза (Miller et al, 1992; Bruner et al, 1998), а в пробах собак с гипотиреозом - нормальные показатели. Однако в отсутствие антител к Т4, мешающих определению этого гормона методом РИА, его содержание в сыворотке при гипотиреозе обычно остается ниже границ нормальных флуктуаций концентрации гормона. Способные ввести в заблуждение случайные колебания чаще обнаруживаются у собак с синдромом эутиреоидной патологии, чем у здоровых животных (см. ниже). Частота выявления измененных показателей при эутиреозе или нормальных при гипотиреозе зависит также от установленных в лаборатории границ нормы (см. раздел «Интерпретация результатов»). Данные о возможности флуктуаций уровня свТ4 у собак (при его определении методом МРД) отсутствуют.
Сопутствующие заболевания (синдром эутиреоидной патологии)
Введение. Синдромом эутиреоидной патологии называют снижение концентрации тиреоидных гормонов в сыворотке при различных заболеваниях при сохранении эутиреоидного состояния. К снижению концентрация тиреоидных гормонов может приводить торможение секреции ТТГ вследствие
138 • ГИПОТИРЕОЗ
Рис. 3-30. Концентрации Т3 и Т4 в разное время суток у 4 здоровых собак. Обратите внимание на отсутствие закономерных колебаний в течение суток и случайное попадание показателей в область низких значений, что может привести к ошибочному диагнозу гипотиреоза.
подавления функции гипоталамуса или гипофиза, угнетение синтеза Т4, снижение связывающей способности белков плазмы (например, ТСГ), угнетение дейодирования Т4 в Т3 или любое сочетание этих факторов (Wartofsky, Burman, 1982). Считается, что снижение уровня общего, а часто и свТ4 в таких случаях имеет приспособительное значение, отражая стремление организма к замедлению обмена веществ в периоды болезни. Само по себе это не означает гипотиреоза. Изменения большинства показателей функции щитовидной железы в таких условиях характерны не для какого-либо определенного заболевания, а зависят лишь от его тяжести и степени катаболизма, отражая целый спектр приспособительных реакций (Kaptein, 1988; Kantorow-itz et al, 2001). При системных заболеваниях уровни тиреоидных гормонов в сыворотке снижаются в большей степени, чем, например, при кожных (Nelson et al, 1991), при этом чем тяжелее заболевание, тем больше этот эффект (рис. 3-31). Результаты проб с ТТГ и ТРГ в таких условиях также могут указывать на гипотиреоз. Однако излечение исходных болезней нормализует показатели стимулирующих проб (см. рис. 3-25).
Концентрация Т4 в сыворотке собак с нетиреоидными заболеваниями часто находится в пределах 0,5-1,0 мкг%, а при тяжелых состояниях (например, при кардиомиопатии или тяжелой анемии) может быть и ниже 0,5 мкг%. Изменения уровней свТ4 и ТТГ менее постоянны и зависят, вероятно, от патофизиологических механизмов болезни. Содержание свТ4 в сыворотке больных собак обычно снижается слабее, чем уровень общего гормона (Peterson et al, 1997; Kantorowitz et al, 2001), но при тяжелом забо
левании и этот показатель бывает ниже 0,5 нг/мл. Уровень ТТГ остается нормальным или возрастает в зависимости от изменения концентрации свТ4 и влияния болезни на функцию гипофиза. В последнем случае уровень ТТГ либо не меняется (несмотря на падение концентрации свТ4), либо даже резко снижается. Если же болезнь не нарушает реакции гипофиза на снижение уровня свТ4, то содержание ТТГ увеличивается и может превышать 1,0 нг/мл. В целом, уровень ТТГ у собак с синдромом эутиреоидной патологии чаще остается в нормальных границах, чем концентрации общего и свТ4 (рис. 3-31). Так, из 223 собак с нетиреоидными заболеваниями характерное для гипотиреоза повышение уровня ТТГ отмечалось примерно у 8% животных, тогда как снижение концентрации свТ4- у 22%, а общего Т4 - у 31% (Kantorowitz et al, 2001).
Из наблюдений за людьми с тяжелыми заболеваниями следует, что степень снижения концентрации тиреоидных гормонов в сыворотке крови может определять прогноз (Slag et al, 1981; Kaptein et al, 1982). Чем эта концентрация ниже, тем выше смертность. Аналогичная зависимость существует и при синдроме эутиреоидной патологии у собак и кошек (Peterson, Gamble, 1990; Elliott et al, 1995).
Лечение синдрома эутиреоидной патологии должно быть направлено на основное заболевание. После его устранения концентрации тиреоидных гормонов в сыворотке нормализуются. Применение левотироксина в таких случаях вряд ли оправдано. Назначение Т4 или Т3 людям с тяжелыми заболеваниями и синдромом эутиреоидной патологии не улучшает их состояния (Becker et al, 1982; Brent, Hershman, 1986). В настоящее время нет доказательств эффек-
ГИПОТИРЕОЗ
139
60-|----------------------------------------------------г
сн----------------------------------------Lq
Легкие Средней Тяжелые
А (66) тяжести (95) (62)
50
Легкие Средней Тяжелые (66) тяжести (95) (62)
Рис. 3-31. Концентрации общего Т4 (А), св14 (Б) и ТТГ (В) в сыворотке у 223 собак с нетирсоидными заболеваниями, сгруппированные в соответствии с тяжестью заболевания. Т-образные линии для каждого прямоугольника щрани-чивают основной массив данных, которые в большинстве случаев находятся в пределах нормальных колебаний показателя. В каждый прямоугольник включены данные с 25-го по 75-ый процентиль. Горизонтальные линии в каждом прямоугольнике - медиана. Светлые кружки - данные, выходящие за указанные пределы колебаний. В скобках указано число собак в каждой группе. Затемненная область-диапазон нормальных значений показателя. Из: Kantorowitz LB et al: JAMA 219:765, 2001.
В
тивности тиреоидных гормонов при синдроме эутиреоидной патологии. Так как этот синдром может представлять собой защитную реакцию организма, большинство авторов не рекомендуют использовать тиреоидные гормоны при лечении больных людей.
У собак с синдромом эутиреоидной патологии применение этих гормонов обычно остается без последствий, и мы в таких случаях (особенно при тяжелых заболеваниях и в отсутствие других признаков гипотиреоза) воздерживаемся от их применения.
140 • ГИПОТИРЕОЗ
Кожные болезни. При многих кожных заболеваниях у собак приходится исключать гипотиреоз. Пока неясно, сопровождаются ли кожные болезни синдромом эутиреоидной патологии (со снижением концентрации тиреоидных гормонов в сыворотке до гипотиреоидного уровня) и, если так, то какие из них наиболее часто вызывает этот синдром. При таких распространенных кожных болезнях, как пиодермия и аллергический дерматит (в том числе вследствие укусов блох), средняя концентрация тиреоидных гормонов в сыворотке, как правило, остается в норме (Slade et al, 1984; Nelson et al, 1991; Beale et al, 1992). Пограничные с гипотиреозом уровни общего и свТ4 наблюдаются лишь в отдельных случаях. Однако в зависимости от нижней границы нормы, установленной в данной лаборатории, иногда выявляются показатели, характерные для гипотиреоза (см. раздел «Интерпретация результатов»). Неизвестно, обусловлено ли это синдромом эутиреоидной патологии, случайными колебаниями уровня тиреоидных гормонов или какими-то иными факторами.
Системные болезни. При системных болезнях у собак, как правило, развивается синдром эутиреоидной патологии с характерными для гипотиреоза снижением концентрации общего и свТ4 и повышением содержания ТТГ (Nelson et al, 1991; Peterson et al, 1997; Ramsey et al, 1997; Scott-Moncrieff et al, 1998; Kantorowitz et al, 2001). Степень снижения концентрации тиреоидных гормонов в сыворотке прямо зависит от тяжести болезни. По нашим данным, синдромом эутиреоидной патологии у собак часто сопровождаются почечные и печеночные заболевания, сердечная недостаточность, тяжелые инфекции, иммунная патология (например, гемолитическая анемия) и диабетический кетоацидоз. В этих случаях трудно быть уверенным в диагнозе гипотиреоза, особенно если основанием для него служит лишь какой-либо один из показателей функции щитовидной железы. Нормальные результаты гормональных исследований свидетельствуют об эутиреозе, но их изменение вовсе не обязательно подтверждает диагноз гипотиреоза. Системные болезни очень часто искажают результаты таких исследований, но низкие уровни общего и свТ4 с одновременным повышением концентрации ТТГ встречаются в таких ситуациях довольно редко (у 1,8% из 225 собак с нетиреоидными заболеваниями) (Kantorowitz et al, 2001). Показатели функции щитовидной железы наиболее информативны при их совместном анализе, что особенно важно в случае системных заболеваний (см. «Диагностика»)
Сахарный диабет. У биглей, выращенных в питомнике, была обнаружена связь между гипотиреозом и инсулинозависимым сахарным диабетом. Кроме того, у собак с диабетом аутоантитела к тиреоглобулину выявляются чаще, чем у здоровых животных (Haines et al, 1984). Сопутствующий гипотиреоз может быть также причиной резистентности к инсулину у животных с инсулинозави
симым сахарным диабетом (Ford et al, 1993). При плохой компенсации диабета диагностировать гипотиреоз довольно трудно. Многие симптомы и признаки гипотиреоза (сонливость, слабость, эндокринное облысение, липемия и гиперхолестеринемия) встречаются у собак с плохо компенсированным сахарным диабетом в отсутствие гипотиреоза. Полагаться на результаты определения уровней тиреоидных гормонов в сыворотке в таких случаях также нельзя, так как их снижение может быть следствием синдрома эутиреоидной патологии. У больных сахарным диабетом типа I концентрация тиреоидных гормонов в сыворотке может быть сниженной даже в отсутствие гипотиреоза (Gilani et al, 1984). По нашим данным, то же наблюдается и у собак с инсулинозависимым сахарным диабетом. Поэтому уровни тиреоидных гормонов и ТТГ у собак с диабетом следует определять лишь после компенсации.диабета.
Гиперкортицизм. Эндогенные и экзогенные глюкокортикоиды часто снижают концентрации Т4, Т3 и свТ4 в сыворотке крови собак (Peterson et al, 1984; Nelson et al, 1991; Ferguson, Peterson, 1992). Это может быть связано с рядом причин (табл. 3-16): торможением секреции ТТГ, снижением связывания Т4 белками сыворотки, снижением образования и распада Т3, а также нарушением 51-дейодирования Т4 на периферии (Kemppainen et al, 1983; Ferguson, Peterson, 1992). Собаки с приобретенным спонтанным гиперкортицизмом предрасположены к развитию вторичного гипотиреоза с соответствующим снижением базальных концентраций тиреоидных гормонов. Среди животных со спонтанным гиперкортицизмом, у которых исследовали функцию щитовидной железы, мы находили существенное снижение уровня общего и свТ4 в сыворотке примерно в 60% случаев. Содержание ТТГ у этих собак менялось по-разному. Почти у 75% собак с низкой концентрацией тиреоидных гормонов уровни ТТГ были резко сниженными или нормальными, и лишь у 25% они превышали 0,6 нг/мл. Аутоантитела к тиреоглобулину отсутствовали во всех случаях. Лечение гиперкортицизма должно устранять вторичный гипотиреоз и нормализовать концентрацию тиреоидных гормонов в крови. Левотироксин в таких
ТАБЛИЦА 3-16. ВОЗМОЖНЫЕ ПРИЧИНЫ ИЗМЕНЕНИЯ УРОВНЯ ТИРЕОИДНЫХ
ГОРМОНОВ ПОД ВЛИЯНИЕМ ГЛЮКОКОРТИКОИДОВ
Снижение активности б'-монодейодиназы* Снижение сродства белков плазмы к Т4 и Т3 Снижение внутриклеточного связывания Т4 и Т3 Увеличение скорости метаболического клиренса Т4 Снижение скорости метаболического клиренса Т3 и рТ3 Угнетение секреции ТТГ (вторичный гипотиреоз)** Угнетение секреции ТРГ____________________
*) Основное изменение у человека
** ) Основное изменение у собак
ГИПОТИРЕОЗ • 141
случаях показан лишь тогда, когда не удается устранить гиперкортицизм, или если у собак имеются симптомы гипотиреоза и возникают подозрения на сопутствующий первичный гипотиреоз.
У собак с эндокринной алопецией приходится дифференцировать гиперкортицизм и гипотиреоз. Обычно это легко сделать, учитывая данные анамнеза (полидипсия, полиурия, полифагия характерны для гиперкортицизма, но не для гипотиреоза), наличие дополнительных признаков, результаты анализа крови, мочи и биохимические сдвиги в сыворотке (например, повышение активности щелочной фосфатазы). Значение анамнеза и физикального обследования при этих состояниях невозможно переоценить. В большинстве случаев отличить гиперкортицизм от гипотиреоза удается еще на дому, до получения результатов лабораторных исследований. Однако иногда ни анамнез, ни физикальное обследование, ни обычные анализы крови и мочи не помогают дифференцировать эти состояния. В таких случаях у собак с признаками синдрома Кушинга во избежание ошибочной диагностики гипотиреоза приходится исследовать не только показатели функции щитовидной железы, но и содержание кортизола в моче (отношение кортизол/креатинин) и проводить пробу с АКТГ. Введение левотироксина таким животным либо не дает эффекта, либо способствует проявлению других симптомов (например, полиурии и полидипсии), что уже не оставляет сомнений в диагнозе гиперкортицизма.
Температура тела и окружающей среды
У дворовых собак на о. Хоккайдо (Япония) исследовали сезонные колебания уровня тиреоидных гормонов в крови (Oohashi et al, 2001). Содержание Т4 снижалось в январе и возрастало в августе-сентябре. Значительных сезонных колебаний уровня ТТГ не отмечалось. Неизвестно, существуют ли такие колебания у домашних собак и зависят ли они от региона проживания, перепадов температуры или изменений длительности светового дня. Острое охлаждение увеличивает концентрации ТТГ и тиреоидных гормонов у крыс и, возможно, у человека, а острое воздействие высокой температуры снижает уровни ТТГ, Т4 и Т3, одновременно повышая содержание рТ3 в сыворотке (Wartofsky, Burman, 1982). Концентрации Т4, Т3, рТ3 и ТТГ изменяются также при гипо- и гипертермии, но неясно, связано ли это с колебаниями температуры тела или с другими факторами, характерными для синдрома эутиреоидной патологии.
Ожирение
У эутиреоидных собак при ожирении наблюдались повышенные концентрации Т3 и Т4 в сыворотке (Gosselin et al, 1980). Считается, что это связано не с самим ожирением, а с повышенным потреблением калорий. Ожирение, по-видимому, не оказывает
сколько-нибудь специфического влияния на функцию щитовидной железы (Wartofsky, Burman, 1982). Согласно нашим наблюдениям, ожирение не препятствует диагностике гипотиреоза у собак; гипотиреоз и в этих случаях проявляется снижением общего и свободного Т4 и повышением уровня ТТГ.
Голодание и кахексия
У человека при голодании значительно падает концентрация Т3 в сыворотке крови, увеличивается концентрация рТ3, но уровни Т4 и ТТГ не меняются (Wartofsky, Burman, 1982). Возобновление питания, особенно богатая углеводами пища, быстро нормализуют обмен Т3. В основе этих изменений лежит нарушение конверсии Т4 в Т3 вследствие угнетения периферической 5'-дейодиназы (Borst et al, 1983). У крыс наблюдалось и снижение секреции Т4 щитовидной железой. У биглей голодание в течение 36 ч не влияло на концентрации Т4 и Т3 в сыворотке (Reimers et al, 1986), но после 48 ч голодания содержание Т3 у собак снижалось (deBruijne et al, 1981). При кахексии у животных уровни Т4и Т3, но не свТ4, были значительно ниже нормы (Vail et al, 1994), причем степень этого снижения была пропорциональна степени потери веса. Снижение уровня тиреоидных гормонов в сыворотке связывают с тяжестью заболевания, вызвавшего кахексию, и с нарушением питания.
Физические нагрузки
У собак физические нагрузки в аэробных или анаэробных условиях практически не влияют на концентрацию тиреоидных гормонов. Через 5 мин после кратковременных гонок у грейхаундов наблюдалось повышение уровня Т4 в сыворотке, но содержание свТ4 и ТТГ не изменялось (Hill et al, 2001). У ездовых собак, выдержавших изнурительную гонку на Аляске, концентрации Т4, Т3 и рТ3 оставались на базальном уровне (Case et al, 1993). У биглей после длительного бега на тредмиле уровень Т4 в сыворотке оказывался несколько ниже (на 13%), чем у собак, не испытывавших физических нагрузок, но содержание свТ4 и Т3 не менялось (Arokoski et al, 1993).
Лекарственные препараты
Хотя наши представления о влиянии различных лекарственных препаратов на содержание тиреоидных гормонов и ТТГ в сыворотке крови собак постепенно расширяются (табл. 3-15), очень многое еще остается неясным. Поэтому, пока не будет доказано обратное, следует предполагать, что любое лекарственное средство может обладать таким эффектом у собак, особенно, если оно изменяет концентрацию тиреоидных гормонов в сыворотке у человека (табл. 3-17), а анамнез, клинические и лабораторные данные не подтверждают диагноз гипотиреоза.
142
ГИПОТИРЕОЗ
ТАБЛИЦА 3-17. НЕКОТОРЫЕ ЛЕКАРСТВЕННЫЕ И ДИАГНОСТИЧЕСКИЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА БАЗАЛЬНУЮ КОНЦЕНТРАЦИЮ ТИРЕОИДНЫХ ГОРМОНОВ У ЧЕЛОВЕКА И, ВОЗМОЖНО, У СОБАК
Снижение уровней Повышение уровней
Т, и/или Т, Т, и/или Т. 4 3
Амиодарон (Т3) Амиодарон (Т4)
Андрогены Эстрогены
Контрастные средства для 5-Фторурацил
холецистографии
Диазепам Галотан
Дофамин Инсулин
Флуниксин Наркотические аналгетики
Фуросемид Рентгеноконтрастные
средства (соли иоподовой
кислоты) (Т4)
Глюкокортикоиды Тиазиды
Гепарин
Имидазол
Йодид
Тиамазол
Митотан
Нитропруссид
Пенициллин
Фенобарбитал
Фенотиазины
Фенилбутазон
Фенитоин
Примидон
Пропранолол
Пропилтиоурацил
Рентгеноконтрастные
средства (соли иоподовой
кислоты) (Т3)
Салицилаты
Сульфаниламиды (сульфа-
метоксазол)
Производные сульфанилмо-
чевины
Глюкокортикоиды. Среди средств, влияющих на концентрацию тиреоидных гормонов в сыворотке, чаще всего применяются глюкокортикоиды. При введении экзогенных глюкокортикоидов показатели функции щитовидной железы изменяются так же, как и при спонтанном гиперкортицизме. Содержание общего и свТ4, а также Т3 нередко снижается до уровня, характерного для гипотиреоза. Это объясняют угнетением резорбции коллоида фолликулярными клетками щитовидной железы, усилением связывания Т4 белками плазмы, торможением периферической конверсии Т4 в Т3 или подавлением гипофизарной секреции ТТГ (при хроническом действии глюкокортикоидов) (Woltz et al, 1984; Kaptein et al, 1992; Moore et al, 1993). Уровень ТТГ в сыворотке обычно остается в пределах нормальных колебаний, так как установление нижней их границы современными методами невозможно. Степень и длительность снижения концентрации тиреоидных гормонов зависят от вида глюкокортикоидов, их дозы, способа и продолжительности введения. Чем выше доза и чем дольше применяются эти препараты, тем ниже падает уровень тиреоидных гормонов в крови.
Поскольку глюкокортикоиды используют с лечебной целью при различных внутренних и кожных болезнях, перед исследованием функции щитовидной железы крайне важно выяснить, не получает ли животное эти препараты. В противном случае можно ошибочно диагностировать гипотиреоз. Если они вводились недавно, то определение базального уровня тиреоидных гормонов в сыворотке необходимо отложить и уж во всяком случае крайне осторожно относиться к получаемым результатам. Нормальные концентрации Т , свТ4 и ТТГ в таких случаях подтверждают эутиреоз, но низкие уровни Т4 и свТ4 на фоне повышенной концентрации ТТГ указывают на гипотиреоз только тогда, когда с таким диагнозом согласуются клинические признаки, и ему не противоречат результаты других исследований. В идеальном случае следовало бы отменить глюкокортикоиды и повторить определение тиреоидных гормонов и ТТГ через 4-8 недель.
Клинические признаки гипотиреоза у собак могут появиться лишь после длительного введения им больших доз глюкокортикоидов при лечении хронических болезней (например, аутоиммунных). Развивающийся в таких случаях вторичный гипотиреоз требует лечения левотироксином.
Противосудорожные средства. Терапевтические дозы фенобарбитала снижают у собак концентрации Т4 и свТ4 в сыворотке до гипотиреоидного уровня (Gaskill et al, 1999; Kantorowitz et al, 1999; Gieger et al, 2000; Muller et al, 2000). Хотя механизм такого снижения остается несяным, полагают, что оно обусловлено индукцией микросомных ферментов, ускоряющих обмен и экскрецию Т4. Наступающее с задержкой повышение уровня ТТГ в таких случаях может быть связано с нарушением механизма обратной связи в системе гипофиз-щитовид-ная железа. После отмены фенобарбитала содержание ТТГ быстро нормализуется, но восстановление концентраций Т4 в сыворотке может затягиваться до 4 недель (Gieger et al, 2000).
Бромид (в силу своего сходства с йодидом) мог бы нарушать поглощение или органификацию йода в щитовидной железе. Однако in vitro показано, что бромид не включается в тиреоглобулин и не влияет на синтез тиреоидных гормонов (Taurog, Dorris, 1991). Применение бромида при судорогах у 8 собак существенно не влияло на концентрации общего и свТ4, Т3 и ТТГ в сыворотке крови (Kantorowitz et al, 1999).
Сульфаниламиды. Эти препараты нарушают синтез тиреоидных гормонов, угнетая активность тиреоидной пероксидазы. Их эффект зависит от дозы и длительности применения (Doerge, Decker, 1994). Тиреоидная пероксидаза ответственна за окисление йодида, йодирование остатков тирозина в тиреоглобулине и конденсацию йодтирозинов. У собак, получавших сульфаниламидные препараты (сульфаметоксазол, сульфадиазин), снижался уровень тиреоидных гормонов и повышалось содержание ТТГ в сыворотке крови (Hall et al, 1993; Torres
ГИПОТИРЕОЗ
143
et al, 1996; Gookin et al, 1999). Концентрации тиреоидных гормонов падали до гипотиреоидного уровня через 1-2 недели, а содержание ТТГ возрастало через 2-3 недели после начала лечения сульфаниламидными препаратами (Hall et al, 1993; Cambell et al, 1995; Williamson et al, 2002). Хроническое введение этих препаратов может сопровождаться и клиническими проявлениями гипотиреоза. Возрастание уровня ТТГ в крови обусловлено снижением концентраций общего и свТ4 (по механизму обратной связи). Это возрастание может приводить к гиперплазии щитовидной железы и развитию зоба (Torres et al, 1996). Нормализация показателей функции щитовидной железы наблюдается через 1-2 недели, а иногда лишь через 8-12 недель, после отмены сульфаниламидов (Hall et al, 1993; Williamson et al, 2002). Введение сульдиазина в сочетании с триметопримом на протяжении последних 4 недель беременности не сказывается на функции щитовидной железы новорожденных щенков (Post et al, 1993).
Нестероидные противовоспалительные средства. Нестероидные противовоспалительные средства (НПВС) могут снижать содержание тиреоидных гормонов и ТТГ в сыворотке крови человека и других видов (Bishnoi et al, 1994). Это объясняют нарушением связывания тиреоидных гормонов с белками, нарушением поглощения тиреоидных гормонов печенью и замедлением их дейодирования (Topliss et al, 1989; Wang et al, 1999). Действие НПВС зависит от конкретного вещества. Так, введение собакам этодолака в течение 4 недель не влияло на уровень тиреоидных гормонов или ТТГ в сыворотке крови (Panciera, Johnston, 2002). В то же время, введение карпрофена в течение 5 недель приводило к небольшому, но статистически достоверному снижению концентраций Т4 и ТТГ (Ferguson et al, 1999). Уровень свТ4 также снижался, но его снижение было недостоверным.
Аутоантитела к тиреоидным гормонам
Присутствие в сыворотке аутоантител к тиреоидным гормонам препятствует точному определению содержания Т3 и Т4 методами РИА, часто приводя к неожиданным результатам определений (Young et al, 1985; см. рис. 3-14). Характер влияния аутоантител зависит от способа разделения свободных и связанных гормонов. При использовании большинства коммерческих наборов РИА уровень Т4 в сыворотке оказывается завышенным. Такое завышение может быть настолько большим, что у гипотиреоидных собак получаются результаты, совместимые с гипертиреозом. Аналогичное завышение результатов наблюдается при определении содержания свТ4 методом прямого РИА (без диализа) (Kemppainen et al, 1996). Этого не происходит при определении свТ4с использованием диализа (например, метода МРД), поскольку аутоантитела не проникают сквозь полупроницаемую мембрану. В некоторых лаборатори
ях при исследовании функции щитовидной железы обязательно определяют и аутоантитела к тиреоидным гормонам. Мы считает это нужным лишь в тех случаях, когда результаты определения концентрации Т3 или Т4 в сыворотке не соответствуют предполагаемому диагнозу. Вместо исследования аутоантител можно определять содержание свТ4 с помощью МРД. К счастью, искажение результатов определения Т4, которое могло бы иметь клиническое значение, встречается менее чем в 1% случаев (Nachreiner et al, 2002).
БИОПСИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Гистологическое исследование биоптатов щитовидной железы позволяет выяснить характер ее поражения. Такое исследование легко обнаруживает лимфоцитарный тиреоидит или тяжелую атрофию железы, и у собак с соответствующими клиническими признаками и диагностическими показателями подтверждает наличие первичного гипотиреоза. К сожалению, на основании гистологических данных не всегда можно судить о функции щитовидной железы, особенно при недостаточно четких клинических и лабораторных данных. Вторичный гипотиреоз, первичную атрофию и гиперплазию фолликулярного эпителия (особенно на ранних стадиях их развития) трудно отличить от вариантов нормы. На гистологическое строение щитовидной железы могут влиять и сопутствующие заболевания.
Щитовидная железа у собак имеет небольшие размеры, которые при лимфоцитарном тиреоидите или атрофии могут меняться. Обычно она расположена на дорсолатеральной поверхности трахеи и не всегда на одном и том же уровне. Поэтому биопсию, как правило, проводят хирургически. Как показывает наш опыт, при тонкоигольной аспирационной биопсии под контролем УЗИ обычно получают либо недостаточно материала, либо он загрязнен кровью. При проведении хирургической биопсии следует учитывать возможность осложнений общей анестезии (падение артериального давления, длительный период выхода из наркоза из-за замедленного распада наркотического вещества) и во избежание гипокальциемии надо стремиться сохранить кровоснабжение хотя бы одной паращитовидной железы. Удаление одной доли щитовидной железы с прилежащими к ней паращитовидными железами в таких случаях обеспечивает получение достаточного материала, минимальную кровопотерю и сохранение функции двух паращитовидных желез. Удаленную ткань помещают в жидкость Боуэна на 4-6 ч, а затем фиксируют 10%-ным забуфе-ренным формалином (Belshaw, 1983).
Эта инвазивная процедура недешево обходится владельцу собаки, отнимает много времени у ветеринара и не гарантирует получение диагностически важных сведений. Мы считаем, что недостатки хирургической биопсии щитовидной железы пере-
144 • ГИПОТИРЕОЗ
вешивают ее диагностическое значение и не рекомендуем эту операцию для установления диагноза гипотиреоза.
ДИАГНОСТИКА
Соответствующие рекомендации базируются на материалах проходившего в 1996 г. Международного симпозиума по гипотиреозу у собак (Canine Practice, vol. 77, 1997) и приведены в таблице 3-12. Для установления диагноза гипотиреоза (особенно если его основывают на концентрациях тиреои i-ных гомонов в сыворотке) абсолютно необходимо присутствие клинических признаков заболеваний. Дополнительными признаками служат нерегенеративная анемия и особенно повышенный уровень холестерине! в сыворотке. В качестве ориентировочного показателя часто используют концентрацию Т,. поскольку ее определение относительно дешево и может проводиться в «домашних» условиях. Не следует забывать, однако, что концентрация Т4 зависит от многих факторов, особенно от синдрома эутиреоидной патологии. Нормальный уровень Т„ в сыворотке крови почти всегда свидетельствует об эутиреоидном состоянии животного. Исключение составляют очень немногие собаки с лимфоцитарным тиреоидитом, у которых титр аутоантител к Т4 настолько высок, что препятствует определению этого гормона. Концентрация Т4 ниже 0,5 мкг% в сочетании с гиперхолестеринемией и наличием характерных клинических признаков подтверждает диагноз гипотиреоза, особенно в отсутствие у животного системных заболеваний. Для установления окончательного диагноза необходимо выяснить реакцию собаки на пробное лечение левотироксином. Дополнительные диагностические исследования (например, определение свТ4 и ТТГ в сыворотке) оправданы в следующих случаях: 1) если уровень Т4 ниже 1,0 мкг0 о, но гиперхолестеринемия отсутствует, а клинические признаки и данные физикального обследования неубедительны; 2) если животное страдает тяжелым системным заболеванием и высока вероятность синдрома эутиреоидной патологии; 3) если собака получала лекарственные средства, снижающие содержание Т
Одновременное исследование нескольких показателей функции щитовидной железы дает более подробную информацию о состоянии гипофизарнотиреоидной системы. Во многих диагностических лабораториях сразу определяют не менее двух из следующих показателей: уровни общего и свТ4 (методами РИА или МРД), Tv свободного Т и рТ (методом МРД), ТТГ и титры аутоантител к тиреоглобулину. В нашей клинике «тиреоидная панель» включает определения общего и свТ4 (методом МРД), ТТГ и аутоантител к тиреоглобулину. При нормальных концентрациях Т4, свТ и ТТГ гипотиреоз исключают. Низкие уровни общего и свТ4 на фоне повышенного содержания ТТГ у собаки с соответствующими клиническими и биохимическими
признаками убедительно свидетельствуют о гипотиреозе, особенно если у животного нет системных заболеваний и не применялись определенные лекарственные средства. Присутствие аутоантител к тиреоглобулину говорит о том, что причиной гипотиреоза является лимфоцитарный тиреоидит.
К сожалению, отдельные показатели часто не согласуются друг с другом. В таких случаях решение об использовании левотироксина принимают на основании клинических признаков и результатов биохимических анализов. Концентрация свТ в сыворотке, измеренная методом МРД. - единственный показатель, точно отражающий функцию щитовидной железы; диагностическое значение этого показателя намного превосходит значение уровня общего Т4. Результаты определения TTI подтверждают вероятность эутиреоза или гипотиреоза только в тех случаях, когда они согласуются с результатами определения концентрации св! в сыворотке, и не должны рассматриваться в качестве единственного показателя функции щитовидной железы. Низкий уровень свТ^ на фоне нормального содержания ТТГ обнаруживается примерно у 20% собак с гипотиреозом, а высокие концентрации ТТГ наблюдаются и у собак с синдромом эутиреоидной патологии (Scott-Moncrieff et al, 1998; Kantorowitz et al, 2001). Нормальный уровень свТ. на фоне повышенного содержания ТТГ может указывать на ранние, компенсированные стадии гипотиреоза, но в таких условиях клинические признаки этого заболевания должны отсутствовать. Аутоантитела к тиреоглобулину указывают на наличие лимфоцитарного тиреоидита и никак не характеризуют функцию щитовидной железы. Их присутствие усиливает подозрение на гипотиреоз в случаях низких концентраций общего и свободного Т , но при нормальном уровне последних клинические признаки гипотиреоза могут отсутствовать. Аналогично трактуется и присутствие аутоантител к тиреоидным гормонам. При расхождении отдельных показателей приходится решать, начинать ли лечение левотироксином или через некоторое время повторно определить эти показатели. Решение должно зависеть от клинических признаков заболевания и результатов определения концентрации свТ4 методом МРД.
Интерпретировать результаты определения уровней Т , свТ и ТТГ в сыворотке подчас довольно сложно. Из-за высокой стоимости таких анализов и ненадежности их результатов многие ветеринарные врачи и владельцы собак предпочитают сразу начинать пробное лечение. Этот диагностический прием допустим лишь при уверенности, что введение тиреоидных гормонов не причинит вреда животному. Реакции на пробное лечение левотироксином неспецифичны. Положительный эффект левотироксина может иметь место не только при гипотиреозе, но и при любом другом заболевании, «чувствительном к тироксину». В силу своего анаболического действия тиреоидные гормоны могут
ГИПОТИРЕОЗ • 145
улучшать состояние собак и при нормальной функции щитовидной железы. Это в наибольшей степени отражается по-видимому, на качестве шерсти животного. Стимулируя переход волосяных фолликулов из стадии телогена в анаген, тиреоидные гормоны улучшают качество шерсти даже у эутиреоидных собак (Gunaratnam. 1986; Credille et al, 2001). Поэтому при положительной реакции на пробную терапию тиреоидные гормоны нужно постепенно отменять. Если это приво шт к возобновлению клинических признаков болезни, то гипотиреоз можно считать доказанным; в таких случаях вновь назначают тиреоидные гормоны. Если же клинические признаки после отмены пробного лечения не возобновляются, то предполагают «чувствительное к тироксину» заболевание. Положительный эффект может быть связан и с другими лечебными мероприятиями (например, действием антибиотиков или выведением блох).
Диагностика на фоне ранее проводившегося лечения. 1 [когда приходится решать, действительно ли у собаки, получающей тиреоидные гормоны, имеется гипотиреоз. Введение Т4 или Г* здоровым животным подавляет секрецию ТТГ и вызывает агрофию тиреотрофов гипофиза с последующей агрофией щитовидной железы. Концентрации Т Т3 и ТТГ в сыворотке при этом резко снижаются. Степень их снижения зависит от выраженности атрофии щитовидной железы. Содержание общего и свТ4 остается на гипотиреоидном уровне в течение длительного времени после отмены лечения. Показатели функции щитовидной железы в таких случаях приобретают диагностическое значение лишь после полного восстановления активности гипофизарно-тиреоидной системы. Это время зависит от длительности, дозы и частоты введения тиреоидных гормонов и индивидуальных особенностей животною Как правило, лечение отменяют за 4 недели, а лучше за 6-8 недель до исследования ;ункции щитовг поп железы? “ '
Диагност ика у щенков. Для диагностики врожденного гипотиреоза используют описанные выше подходы. Однако концентрация ТТГ в сыворотке крови зависит от причины гипотиреоза. При первичной недостаточности щитовидной железы (например, при нарушении органификации йода) и интакгности гипоталамо-гипофизарной системы уровень ТТГ должен быть повышенным. Если же гипотиреоз обусловлен дисфункцией гипоталамуса или гипофиза, то концентрация ТТГ в сыворотке снижена или вообще не поддается определению. Выяснению локализации дефекта способствует определение уровней ТТГ и тиреоидных гормонов после введения 1РГ.
ЛЕЧЕНИЕ
При подтвержденном гипотиреозе показано лечение тиреоидными гормонами. Их назначают также в качестве пробной терапии собакам с предполо-
ТАБЛИЦА 3-18. НЕКОТОРЫЕ ПРЕПАРАТЫ ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ГИПОТИРЕОЗА У ЧЕЛОВЕКА И СОБАК
Син * етические препараты
leeomupoKt ин
Натриевая соль левотироксина AmTech в таблетках (Phoenix Scientific)
Жевательные таблетки для собак (Paia-Tech)
Жевательные таблетки Heska (Heska)
Левотаб (Vetus)
Лсвотирои 1 (Forest)
Левоксит (Jones Pharma)
Жевательные таблетки нутривед Т-4 (Vcdco)
Солоксин (Jones Pharma)
Сингроид (Knoll)
Т иро-Форм (Vet-A-Mix)
I иро-L (Vct-A-Mix)
Тиро-Таб (Vet-A-Mix)
I ирозин (Vedco)
Тироксин-L (Butler)
I ирозин (Phoenix)
Унитрои i (Jerome Stevens Pharma)
Лиоти юниИ
Цитомел ь (Jones Pharma)
Левотироксин + лиотиронин
Гиролар (Rhone-Poulenc Rorer)
Препараты животного происхождения
Высх шенная щитовидная же 1еза
Армор Тироид (Forest)
S-P-T (Fleming)
Гироид USP (несколько компании
жительным диагнозом гипотиреоза для проверки клинической реакции. В обоих случаях применяют синтетические препараты тироксина (табл. 3-18). При вторичном гипотиреозе в зависимости от его причины могут потребоваться и другие методы лечения.
Начальная терапия натриевой солью левотироксина (синтетическим Т4)
Синтетический левотироксин - препарат выбора при начальном лечении гипотиреоза (табл. 3-19). Поскольку в периферических тканях Т4 превращается в метаболически более активный Т3, его введение внутрь должно приводить к нормализации уровней не только самого Т но и Т3 и ТТГ в крови. Вначале выбирают определенный синтетически! препарат левотироксина для животных. Так как содержание гормона в некоторых препаратах может быть значительно меньшим, чем указано на этикетке (Fish et al, 1987), следует использовать лишь препараты с заранее известной эффективностью.
Согласно рекомендациям, выработанным на Международном симпозиуме по гипотиреозу у собак в августе 1996 г (Canine Practice, vol. 77, 1997), начинать лечение следует с натриевой соли левотироксина, которую дают в дозе 0,02 мг/кг веса (максимум 0,8 мг) каждые 12 ч. Эти дозировки примерно соответствуют средним расчетным потребностям тиреоидэктомированных собак в тироксине (0,018
146
ГИПОТИРЕОЗ
ТАБЛИЦА 3-19. РЕКОМЕНДАЦИИ ПО НАЧАЛЬНОЙ ТЕРАПИИ И КОНТРОЛЮ ЗА ХОДОМ ЛЕЧЕНИЯ ГИПОТИРЕОЗА У СОБАК
Начальная терапия
Следует использовать марку натриевой соли левотироксина, одобренную для применения у собак.
Начальная разовая доза должна составлять 0,02 мг/кг веса тела, но не больше 0,8 мг.
Начальная частота введения препарата - каждые 12 ч.
Первая проверка эффективности терапии
Реакцию на лечение следует оценивать через 6-8 недель после его начала.
Концентрации Т4 или свободного Т4 (методом равновесного диализа) и ТТГ в сыворотке следует определять через 4-6 ч после введения очередной дозы левотироксина.
Концентрации Т4 или свободного Т4 в эти сроки должны быть нормальными или повышенными.
Концентрация ТТГ должна находиться в пределах нормальных колебаний.
Определение концентраций Т4 или свободного Т4 (методом равновесного диализа) непосредственно до введения очередной дозы левотироксина необязательно, но рекомендуется при применении препарата 1 раз в день.
Концентрации Т4 или свободного Т4 должны находиться в пределах нормальных колебаний.
Согласно рекомендациям Международного симпозиума по гипотиреозу у собак, состоявшегося в августе 1996 г. (Canine Practice, vol. 77,1997).
Т4 - тироксин; ТТГ - тиреотропный гормон.
мг/кг) (Ferguson, Hoenig, 1997). У собак левотироксин всасывается в ЖКТ хуже, чем у человека, и это объясняет необходимость использования большей дозы. Некоторые авторы считают, что дозы левотироксина следует рассчитывать, исходя из величины основного обмена, а не веса тела животного (Chastain, 1982). Основной обмен теснее связан с площадью поверхности тела, чем с весом. У маленьких собак поверхность тела и основной обмен больше, чем у крупных, и поэтому их потребность в левотироксине выше. При таком расчете доза препарата должна составлять 0,5 мг/м2. Тем не менее, мы предпочитаем назначать левотироксин, исходя из веса животного.
Период полужизни (Т1/2) левотироксина зависит от его дозы и частоты введения. Чем доза и частота введения выше, тем Т1/2 короче (Nachreiner et al, 1993). При одно- и двукратном в сутки введении левотироксина в дозе 22 мкг/кг его Т в сыворотке (± SD) составлял соответственно 9,0 ± 5,9 и 8,6 ± 3,1 ч (Nachreiner et al, 1993). При введении этой дозы максимальная концентрация Т4 в сыворотке достигалась через 3,8 ± 2 ч после введения препарата. Следует отметить, что при однократном введении левотироксина максимальные концентрации Т4 в сыворотке были выше, а минимальные - ниже, чем при двукратном его введении. В результате при однократном введении препарата концентрация Т4 в сыворотке крови на протяжении нескольких часов оказывалась выше физиологической; дробное же
введение обеспечивало более близкое к физиологическому содержание гормона в сыворотке. Как уже отмечалось, Международный симпозиум по гипотиреозу у собак рекомендовал начинать лечение с введения левотироксина каждые 12 часов. Из-за вариабельности всасывания и скорости метаболизма препарата его дозы и частоту введения можно изменять, пока не будет достигнут удовлетворительный клинический эффект. Такая вариабельность делает необходимым контроль за ходом лечения.
Назначение левотироксина дважды в сутки особенно оправдано в случаях пробной терапии, когда препарат вводят для подтверждения диагноза гипотиреоза. У одних собак клинические признаки исчезают при двукратном введении левотироксина, у других - при однократном (Ferguson, Hoenig, 1997). Двукратное введение должно покрыть потребности животных обеих групп, тогда как однократное поможет лишь собакам с менее быстрым метаболизмом и более длительным эффектом гормона. Физиологические механизмы адаптации, как правило, препятствуют развитию тиреотоксикоза у собак, получающих левотироксин чаще или в большей, чем необходимо, дозе. К таким механизмам относится замедление всасывания гормона в ЖКТ, насыщение связывающих белков (что ускоряет клиренс тиреоидных гормонов) и ускорение распада Т4 (вследствие повышения скорости основного обмена) (Nachreiner, Refsal, 1992; Nachreiner et al, 1993).
При сопутствующих болезнях у животных, когда активация обмена веществ нежелательна, начальные дозы левотироксина могут быть более низкими. Классический пример - кардиомиопатия. Тиреоидные гормоны увеличивают основной обмен и потребление кислорода, повышают частоту сердечных сокращений и укорачивают время заполнения желудочков сердца. Необходимость более быстрой доставки кислорода к периферическим тканям, наряду с хронотропным эффектом тиреоидных гормонов, резко увеличивает нагрузку на плохо функционирующий миокард и может привести к декомпенсации кровообращения и появлению признаков сердечной недостаточности. Применение меньших начальных доз левотироксина (например, 25% от рекомендуемой дозы один раз в сутки) позволяет животным «адаптироваться» к действию гормона и сводит к минимуму его потенциально вредный эффект. Через 3-4 недели дозы препарата можно начать постепенно увеличивать.
Левотироксин всасывается в основном в подвздошной и толстой кишках. Всасывание зависит от лекарственной формы гормона (в желатиновых капсулах или на альбуминовом носителе) и от содержимого кишечника, в том числе белков плазмы, растворимых компонентов пищи и кишечной флоры. Все это может связывать левотироксин и тормозить его всасывание. У человека при приеме левотироксина внутрь в кровь попадает от 40 до 80% гормона. У собак такого рода исследования не проводились, но необходимость применения более высоких доз
ГИПОТИРЕОЗ
147
свидетельствует о меньшем всасывании препарата. Вариабельность этого процесса - один из поводов для контроля за ходом лечения. Усиленное связывание левотироксина в просвете кишечника снижает клинический эффект терапии (табл. 3-20).
Реакция на терапию левотироксином
Об эффекте лечения можно судить нс раньше, чем через 6-8 недель после его начала. Правильное лечение устраняет все клинические признаки и биохимические сдвиги, связанные с гипотиреозом (рис. 3-32). Уже во время первой недели терапии возрастает психическая и физическая активность животных (табл. 3-21), что служит важным показателем правильности диагноза гипотиреоза. У собак с эндокринной алопеций на первом месяце лечения может отмечаться усиление роста шерсти, но полное восстановление се роста и уменьшение гиперпигмен гании кожи обычно происходит через
ТАБЛИЦА 3-20. ВОЗМОЖНЫЕ ПРИЧИНЫ НЕДОСТАТОЧНОЙ КЛИНИЧЕСКОЙ РЕАКЦИИ НА ЛЕЧЕНИЕ НАТРИЕВОЙ СОЛЬЮ ЛЕВОТИРОКСИНА (СИНТЕТИЧЕСКИМ Т4)
Несоблюдение режима терапии
Применение неактивного и ш просроченного средства
Применение некоторых нспантстованных препаратов левотироксина
Недостаточная дозировка левотироксина
Недостаточная частота введения препарата
Недостаточная активность таблеток*
Низкая биологическая доступность (например, при пару шепни всасывания в ЖКТ)
Неправильное время оценки реакции
Ошибочный диагноз гипотиреоза
Другое заболевание с аналогичными клиническими проявлениями (например, аллергический дерматит)
“ Активность таблетки - реальное количество действующего вещества, а не указанное на этикетке.
Рис. 3-32. Л - 7-летняя мальтийская болонка (кобель) с гипотиреозом и сахарным диабетом Б - та же собака через 3 месяца после начала лечения левотироксином. Обратите внимание на значительное улучшение общего вида и шерсти.
Рис. 3-33. Л - 8-лстний кастрированный бигль (кобель) с гипотиреозом. Владелец обратил внимание на ожирение. сонливость и физическую слабость собаки. Ее вес составлял 31 кг. Б - та же собака через 6 месяцев после начала лечения левотироксином и применения способствующей похуданию диеты Владелец сообщи и о шачительном улучшении темперамента и активности собаки. Ее все снизился до 19 кг.
148 • ГИПОТИРЕОЗ
ТАБЛИЦА 3-21. ОЖИДАЕМЫЙ СРОК ПРОЯВЛЕНИЯ КЛИНИЧЕСКОЙ РЕАКЦИИ НА ЛЕЧЕНИЕ НАТРИЕВОЙ СОЛЬЮ ЛЕВОТИРОКСИНА У СОБАК С ГИПОТИРЕОЗОМ
Клинические показатели Ожидаемые сроки улучшения
Психическая и физическая ак-
тивность 2-7 дней
Липемия и лабораторные пара-
метры 2-4 нед.
Кожные нарушения 2-4 мес.
Неврологические нарушения 1-3 мес.
Нарушения сердечно-сосудистой
системы 1-2 мес.
Нарушения половой функции 3-10 мес.
несколько месяцев. Вначале облысение может даже усиливаться, так как выпадает много волос, находящихся в фазе телогена. В течение первых двух месяцев после начала лечения уменьшается и степень ожирения (рис. 3-33). Ослабление неврологических симптомов впервые отмечается через 1-2 недели. Однако срок полного их исчезновения непредсказуем и часто превышает 3 месяца. Улучшение деятельности сердца обычно наблюдается через 4-8 недель.
Отсутствие эффекта левотироксина
Отсутствие улучшения клинического состояния в течение 8 недель после начала лечения может иметь разные причины (табл.3-20). Наиболее очевидная из них - ошибочный диагноз гипотиреоза. Так как кортизол снижает концентрацию тиреоидных гормонов в крови, за гипотиреоз можно принять гиперкортицизм, если он не сопровождается полиурией и полидипсией. Другая частая причина ошибочного диагноза - скрытые сопутствующие заболевания, изменяющие показатели функции щитовидной железы. Однако сопутствующие заболевания (например, аллергические поражения кожи, гиперчувствительность к укусам блох) нередко развиваются у собак на фоне гипотиреоза, и если они остаются нераспознанными, то маскируют эффект лечения. Во всех случаях плохой реакции на левотироксин необходимо тщательно пересмотреть показания к его применению и пытаться выяснить наличие сопутствующих заболеваний. Следует также проверить, соблюдается ли режим терапии, не используется ли препарат с просроченным сроком действия или непатентованное средство и не нарушено ли всасывание левотироксина в кишечнике.
Контроль за ходом лечения
Контроль за ходом лечения включает оценку клинической реакции на введение тиреоидных гормонов
и определение концентраций Т4 и ТТГ в сыворотке крови до или после введения левотироксина (или и до и после введения). Эти определения проводят через 4-8 недель после начала лечения, в любой момент при появлении симптомов тиреотоксикоза или в случаях недостаточной реакции на терапию. Уровни Т4 и ТТГ в сыворотке следует определять также через 2-4 недели после изменения режима лечения у собак с недостаточной клинической реакцией на препарат.
При двухразовом введении левотироксина концентрации Т4 и ТТГ определяют через 4-6 ч после его введения, а при одноразовом - непосредственно перед и через 4-6 ч после введения препарата (Nachreiner, Refsal, 1992). Получаемые данные позволяют оценить правильность режима лечения и скорость всасывания левотироксина. Определение свТ4 методом МРД обходится дороже и, по-видимому, целесообразно только при наличии аутоантител к Т4. Если у собаки, получающей тиреоидные гормоны, присутствуют такие аутоантитела, то уровень Т4 не может служить показателем эффективности лечения, тогда как на результаты определения свТ4 с использованием диализа (например, методом МРД) аутоантитела к тиреоидным гормонам не влияют. Их присутствие не мешает действию вводимого гормона.
Уровни Т4 и ТТГ в сыворотке после введения левотироксина, а также рекомендации по изменению режима терапии приведены на рис. 3-34. При правильном режиме терапии концентрация Т4 в сыворотке через 4-6 ч после введения левотироксина должна находиться у верхней границы нормы (2,5-4,5 мкг%) или превышать ее, а концентрация ТТГ - оставаться в пределах нормы (т.е. ниже 0,6 нг/мл). После этого срока уровень Т4 в сыворотке может снижаться. После введения левотироксина концентрация Т4 в сыворотке нарастает, достигая максимума через 4-6 ч, а затем снижается, пока не будет введена следующая таблетка (Nachreiner et al, 1993). Чем дальше время отбора пробы крови отстоит от 4-6 ч после введения левотироксна, тем ниже оказывается концентрация Т4 в сыворотке. В идеальном случае во всех пробах сыворотки независимо от времени их получения концентрация Т4 должна превышать 1,5 мкг%. На уровень Т4 после введения гормона могут влиять также фармакологические средства, сопутствующие заболевания и, вероятно, диета. Предварительные результаты показывают, что при введении непатентованных препаратов левотироксина и жевательных таблеток (Heska Corp, Ft. Collins, CO) максимальные концентрации T4 оказываются ниже, чем при использовании солоксина (King Pharmaceuticals Inc., США). Они снижаются и при одновременном применении глюкортикоидов и при потреблении богатой клетчаткой диеты (Johnson et al, 1999; Graham, 2002).
Уровни T4 в сыворотке после введения очередной дозы гормона часто превышают норму. Ретроспективная оценка этих уровней у 100 собак с
Т4:
ТТГ.
Рис. 3-34. Рекомендации по лечению гипотиреоза и контролю за ходом лечения у собак. Из: Nelson RW, Couto GC: Small Animal Internal Medicine. 3rd ed. St. Louis, Mosby-Year Book, 2003, p 708.
ГИПОТИРЕОЗ
150
ГИПОТИРЕОЗ
гипотиреозом, получавших левотироксин и отобранных по случайному принципу, показала, что через 6 ± 1 ч после введения препарата концентрации Т4 в сыворотке находились в пределах нормы у 54%, были выше ее у 41% и ниже - у 5% животных. Все собаки получали левотироксин дважды в сутки в средней дозе 0,018 ± 0,007 мг/кг (М ± SD), и у всех них лечение было эффективным. Ни у одного животного из тех, у кого уровень Т4 в сыворотке после приема левотироксина превышал норму, не отмечалось признаков тиреотоксикоза. Концентрация Т3 после приема левотироксина у собак этой группы оставалась нормальной, что указывает на существование адаптивных реакций, направленных на предотвращение тиреотоксикоза (Nachreiner, Refsal, 1992). Поэтому возрастание уровня Т4 в эти сроки сверх нормальных величин не является абсолютным показанием к снижению дозы левотироксина, особенно в отсутствие клинических признаков тиреотоксикоза. Тем не менее, если концентрация Т4 превышает 6,0 мкг%, мы рекомендуем снизить дозу препарата.
Самая трудная диагностическая проблема возникает, вероятно, в тех случаях, когда при пробном лечении левотироксином при подозрении на гипотиреоз клинический эффект незначителен, концентрация Т4 в сыворотке после каждой дозы препарата достигает нормы или превышает ее, а уровень ТТГ оказывается ниже 0,6 нг/мл. При оценке необходимой степени возрастания концентрации Т4 следует учитывать его уровень до введения очередной дозы препарата. Если он не достигает 1 мкг%, а после приема левотироксина оказывается лишь на нижней границе нормы (например, ниже 2 мкг%), то отсутствие клинического эффекта скорее всего связано с недостаточностью терапии. В этих случаях нужно увеличить дозу или частоту введения левотироксина и через 2-А недели вновь исследовать уровень Т4 в сыворотке до и после приема очередной дозы, одновременно оценивая клиническую эффективность терапии. Если же концентрация Т4 в сыворотке до и после введения очередной дозы препарата превышает 1,5 мкг%, то следует искать другие причины недостаточного эффекта лечения. Согласно нашему опыту, сохранение плохого состояния животных в большинстве таких случаев обусловлено другими заболеваниями, которые к началу лечения остались нераспознанными. При отсутствии клинического эффекта левотироксина и нормальном уровне Т4 в сыворотке применение лиотиронина, как правило, бесполезно.
Тиреотоксикоз
При передозировке левотироксина тиреотоксикоз у собак редко развивается, поскольку физиологические адаптационные механизмы снижают всасывание гормона в ЖКТ и ускоряют его выведение через печень и почки (Nachreiner, Refsal, 1992). Тем не менее, при введении очень больших количеств
левотироксина, при врожденном более длинном Т гормона в плазме крови (особенно у собак, получающих левотироксин дважды в сутки) и при нарушении метаболизма тиреоидных гормонов (например, при почечной или печеночной недостаточности) тиреотоксикоз все же может развиться. В очень редких случаях это наблюдается и у собак, получающих небольшие количества левотироксина. Причина такой повышенной чувствительности к гормону неизвестна.
Клинические признаки тиреотоксикоза включают одышку, возбудимость, агрессивность, полиурию, полидипсию, полифагию и снижение веса. Диагноз подтверждается высокими уровнями тиреоидных гормонов в сыворотке крови. Однако иногда эти уровни остаются в пределах нормы у собак с признаками тиреотоксикоза и могут превышать норму в отсутствие признаков тиреотоксикоза. В случае появления признаков тиреотоксикоза следует изменить дозу и/или частоту введения левотироксина. При тяжелых клинических признаках тиреотоксикоза иногда приходится отменять лечение на несколько дней. Если эти признаки действительно связаны с передозировкой левотироксина, то снижение его дозы уже через 1-3 дня приводит к их исчезновению. Через 2-4 недели после этого рекомендуется проверить эффективность терапии гипотиреоза.
Пробная терапия натриевой солью лиотиронина (синтетическим Т3)
Натриевая соль лиотиронина (цитомель, Jones Pharma, St Louis, МО) не является средством выбора для начальной терапии гипотиреоза. Введение лиотиронина нормализует уровень Т3 в сыворотке, но концентрация Т4 еще больше снижается. Это часто ошибочно расценивают как подтверждение диагноза гипотиреоза. На самом же деле, падение концентрации Т4 в сыворотке обусловлено снижением его секреции щитовидной железой из-за ингибирующего действия лиотиронина на секрецию гипофизарного ТТГ; кроме того, лиотиронин не превращается в Т . Концентрации Т4 в сыворотке снижается и у здоровых собак, получающих лиотиронин. В отличие от этого, левотироксин превращается в Т3, и поэтому лечение этим препаратом нормализует содержание в сыворотке не только Т4, но и Т3 и обеспечивает максимально близкую к норме внутриклеточную концентрацию Т3 во всех тканях, т.е. эутиреоз.
Лечение лиотиронином показано в тех случаях, когда у собак с подтвержденным гипотиреозом не удается достичь клинического эффекта с помощью левотироксина, что, скорее всего, объясняется нарушением всасывания препарата в кишечнике. О нарушении всасывания левотироксина следует думать тогда, когда концентрация Т4 в сыворотке остается низкой, уровень ТТГ - высоким, и содержание Т4 после введения очередной дозы левотирокси
ГИПОТИРЕОЗ • 151
на не возрастает. Нельзя забывать и о возможном влиянии аутоантител к тиреоидным гормонам на результаты определения концентрации Т4 методом РИА. У человека Т3 (в отличие от Т4) практически полностью всасывается в кишечнике (95% против 40-80%). Это обусловлено меньшим сродством кишечного содержимого (особенно секретируемых в просвет кишечника белков плазмы) к Т3.
Натриевую соль лиотиронина применяли у собак с нормальной концентрацией Т4, но сниженным уровнем Т3 в сыворотке, считая, что у таких животных нарушено превращение Т4 в Т3. Однако установлено, что такие животные либо здоровы, либо у них имеется синдром эутиреоидной патологии, либо, наконец, в их сыворотке присутствуют аутоантитела к Т занижающие результаты определения этого гормона. Нарушение периферической конверсии Т4 в Т3 не доказано ни у одного вида, включая собак. Теоретически, такой дефект, скорее всего, должен быть врожденным и приводить либо к ранней гибели щенков, либо к развитию кретинизма. Для лечения собак с нормальной концентрацией Т4 и низким уровнем Т3 в сыворотке крови следует сначала использовать левотироксин.
Если все же применяют лиотиронин, то начинают с введения 4-6 мкг/кг веса тела каждые 8 ч. Т]/2 и максимальные концентрации лиотиронина (как и левотироксина) в плазме крови у разных собак различны. У большинства животных Т лиотиронина составляет 5-6 ч, а максимальная концентрация после его введения достигается через 2-5 ч. При улучшении клинического состояния собак препарат можно вводить всего дважды в сутки. Возобновление признаков заболевания требует возвращения к трехразовому введению лиотиронина.
Пробы крови для контроля за ходом лечения берут непосредственно перед и через 2-4 ч после введения очередной дозы. При таком лечении необходимо определять концентрацию Т3 в сыворотке крови. Если дозы лиотиронина достаточны, то концентрация Т4 в сыворотке животных очень низкая или не поддается определению, поскольку Т3 по механизму отрицательной обратной связи подавляет активность сохранившейся ткани щитовидной железы и не превращается в Т4. Режим введения лиотиронина корректируют так же, как и левотироксина. У собак, получающих адекватные дозы лиотиронина, концентрация Т3 в сыворотке до и после введения очередной дозы должна находиться в нормальных пределах.
Комбинированные препараты Т4/Т3
Существуют синтетические препараты, содержащие левотороксин вместе с лиотиронином (см. табл. 3-18). Отношение Т4/Т3 в них обычно составляет 4:1, что имитирует соотношение гормонов, секретируемых щитовидной железой человека (Rosychuk, 1982). Мы не рекомендуем использо
вать комбинированные препараты по следующим причинам: 1) скорость метаболизма левотироксина и лиотиронина различна, и поэтому они должны вводиться с разной частотой; 2) лечение левотироксином обеспечивает нормальные концентрации как Т4, так и Т3 в сыворотке крови и (3) при применении комбинированных препаратов уровень Т3 в сыворотке может возрастать настолько, что появятся симптомы тиреотоксикоза. Кроме того, комбинированные синтетические препараты обычно дороже, чем левотироксин или лиотиронин.
Грубые гормональные препараты животного происхождения
К препаратам животного происхождения относятся высушенная щитовидная железа (тиреоидин) и тиреоглобулин. Препараты высушенной щитовидной железы получают путем очистки, сушки и измельчения бычьей или свиной железы, освобожденной от соединительной ткани и жира. Тиреоглобулин получают из очищенных экстрактов замороженной свиной железы.
Биологическая активность таких препаратов непостоянна и может оказаться недостаточной, что обусловливает слабую реакцию в начале их применения или рецидив клинических признаков гипотиреоза. Согласно Фармакопее США, содержание йода в препаратах животного происхождения должно составлять 0,17-0,23%, и в них не должны присутствовать ни неорганический йод, ни посторонние йодированные вещества. Однако требования к содержанию Т4 или Т3 не определены (Rosychuk, 1982). К сожалению, гормональная активность препарата может не соответствовать содержанию в нем йода и зависеть от вида животного, от которого получена щитовидная железа, способов ее обработки и влияния сезонных, географических и диетических факторов. Например, свиная щитовидная железа содержит больше Т3, чем бычья или овечья. На активность высушенной щитовидной железы влияет также присутствие в ней биологически инертных моно- и дийодтирозинов и йодированного казеина. Наконец, при длительном хранении такие препараты в разной степени теряют свою биологическую активность.
Гормональные препараты животного происхождения не рекомендуются для лечения гипотиреоза у собак. Тем не менее, их иногда применяют, и не безуспешно. В этих случаях используют 15-20 мг высушенной щитовидной железы на 1 кг веса тела один раз в сутки (Rosychuk, 1982). Таблетки следует измельчать и смешивать с небольшим количеством пищи.
ПРОГНОЗ
Прогноз гипотиреоза зависит от причины заболевания. Адекватная терапия обеспечивает нормальную продолжительность жизни животных и устраняет
152
ГИПОТИРЕОЗ
большинство, если не все, клинические проявления гипотиреоза. Прогноз для больных щенков (при кретинизме) зависит от степени изменения костей и суставов к моменту начала лечения. Многие клинические проявления гипотиреоза и в этих случаях поддаются терапии, но нарушенное формирование костей и суставов может приводить к развитию дегенеративного остеоартрита (Saunders, Jezyk, 1991; Greco et al, 1991). Последний чаще поражает кости с дисгенезией эпифизов. Такие кости легче ломаются, развивается дистрофия суставов и остеохондроз. В результате происходит искривление костей
с подвывихами в местах сочленения плеча и предплечья и нарушается биомеханика.
У собак с вторичным гипотиреозом вследствие врожденных дефектов или разрушения гипофиза прогноз гораздо хуже. Сокращение продолжительности жизни при врожденных дефектах гипофиза (например, при гипофизарной карликовости) обусловлено главным образом частыми заболеваниями в раннем возрасте (см. гл. 2). Причиной приобретенного вторичного гипотиреоза являются обычно объемные процессы в области гипофиза, которые могут распространяться на ствол мозга.
ГИПОТИРЕОЗ У КОШЕК
Приобретенный первичный гипотиреоз у кошек встречается редко, а случаи вторичного и третичного гипотиреоза вообще не описаны. В ветеринарной литературе можно найти описания отдельных случаев гипотиреоза у кошек, причем иногда диагноз основывают лишь на клинических впечатлениях, а не на результатах определения уровня тиреоидных гормонов в сыворотке крови. Надежные доказательства заболевания приводятся только в нескольких публикациях, касающихся гипотиреоза, приобретенного в зрелом возрасте (Rand et al, 1993), и врожденного (Arnold et al, 1984; Sjollema et al, 1991; Jones et al, 1992). В отличие от этого, ятрогенный гипотиреоз у кошек, развивающийся после лечения гипертиреоза, достаточно хорошо известен.
Поскольку при анализе крови во многих коммерческих лабораториях определяют уровень Т4 в сыворотке, низкие его концентрации обнаруживаются все чаще. Обычно такие анализы производят по другим поводам (например, при системных заболеваниях), и обнаружение низких уровней Т4 подчас ставит ветеринара в тупик. В подавляющем большинстве случаев снижение концентрации Т4 в сыворотке оказывается следствием синдрома эутиреоидной патологии, а не гипотиреоза.
ЭТИОЛОГИЯ
Ятрогенный гипотиреоз. Ятрогенный гипотиреоз у кошек развивается обычно после лечения гипертиреоза и встречается гораздо чаще, чем приобретенный гипотиреоз. Ятрогенный гипотиреоз бывает следствием двусторонней тиреоидэктомии, лечения радиоактивным йодом или передозировки антитиреоидных средств. В зависимости от способов лечения гипертиреоза уровень тиреоидных гормонов в плазме падает ниже нормы либо за несколько часов (после операции), либо через несколько суток (при использовании антитиреоидных
средств) или через несколько недель и даже месяцев (при радиойодтерапии). Единственные признаки гипотиреоза у большинства кошек - снижение активности (сонливость) и прибавка в весе. Эти изменения нередко нравятся владельцам животных, ранее страдавших гипертиреозом, и если сонливость выражена не слишком сильно, а анорексия или поражения кожи отсутствуют, то к заместительной терапии тиреоидными гормонами не прибегают.
Гипотиреоз, развивающийся в зрелом возрасте. Спонтанно развившийся первичный гипотиреоз у кошек зрелого возраста наблюдается редко. Имеется описание одной кошки с лимфоцитарным тиреоидитом и клиническими признаками гипотиреоза (Rand et al, 1993). При гистологическом исследовании щитовидной железы после смерти животных обнаруживают ряд изменений, характерных для приобретенного гипотиреоза, в том числе атрофию, лимфоцитарный тиреоидит, амилоидоз, кисты ультимобронхиальных тел, фолликулярные кисты и зоб (ссылки на литературу см. Feldman, Nelson, 1987). Это свидетельствует о возможности более частого существования гипотиреоза у кошек, но неизвестно, имелись ли у животных с такими гистологическими изменениями клинические признаки гипотиреоза при жизни.
Врожденный гипотиреоз. Врожденный первичный гипотиреоз, приводящий к карликовости с нарушением пропорций тела, встречается у кошек чаще, чем гипотиреоз, приобретенный в зрелом возрасте. Среди причин этого состояния находили нарушение биосинтеза тиреоидных гормонов, особенно дефект органификации йода (Sjollema et al, 1991; Jones et al, 1992), и дисгенезию щитовидной железы (Peterson, 1989). Нарушения биосинтеза тиреоидных гормонов часто приводят к образованию зоба. Такие нарушения выявлены у семейства абиссинских кошек с врожденным гипотиреозом (Jones et al, 1992). При скрещивании больных животных между
ГИПОТИРЕОЗ • 153
ТАБЛИЦА 3-22. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГИПОТИРЕОЗА У КОШЕК
Гипотиреоз, развившийся в зрелом возрасте Врожденный гипотиреоз
Сонливость Непропорциональная
Потеря аппетита карликовость
Ожирение Отставание в росте
Кожные проявления Крупная голова
Сухая себорея Короткая толстая шея
Сухая тусклая шерсть Короткие лапы
Легкое выпадение шерсти Сонливость
Медленное отрастание шерсти Апатия
Эндокринное облысение Запоры
Облысение ушей Гипотермия
Утолщение кожи Брадикардия
Слизистый отек (микседема) Шерсть, как у котенка
морды Позднее прорезывание
Нарушения половой функции зубов
Отсутствие циклов
Дистоция
Брадикардия
Легкая гипотермия
собой гипотиреоз имел место у всего помета, тогда как при скрещивании больных кошек со здоровыми рождались фенотипически нормальные котята. Это указывает на аутосомно-рецессивное наследование гипотиреоза у кошек данного семейства. Иногда причиной гипотиреоза у котят, содержавшихся на чисто мясной диете, был дефицит йода.
КЛИНИЧЕСКИЕ ПРИЗНАКИ
Гипотиреоз, развивающийся в зрелом возрасте. Клинические признаки гипотиреоза у кошек перечислены в таблице 3-22. Самые распространенные среди них - сонливость, апатия и ожирение. Сонливость и апатия могут достигать тяжелой степени. Кожные проявления очень разнообразны и часто обусловлены неопрятностью животных. Шерсть становится взъерошенной, спутанной, с колтунами и себореей. Она легко выпадает и плохо отрастает, что приводит к облысению ушей, мест трения, спины и основания хвоста (Peterson, 1989; Rand et al, 1993; Scott et al, 2001). Иногда лысеют также боковые поверхности шеи, грудь и живот. В одном случае наблюдался слизистый отек (микседема) морды, придававший животному одутловатый вид (Rand et al, 1993). При обследовании обнаруживаются также брадикардия и легкая гипотермия.
Врожденный гипотиреоз. Клинические признаки врожденного гипотиреоза у кошек сходны с таковыми у собак. Больные котята при рождении выглядят нормальными, но к 6-8-недельному возрасту, как правило, отстают в росте. Через несколько месяцев становится очевидной непропорциональность развития. Котята отличаются крупной головой, короткой и толстой шеей и короткими лапами. Характерны сонливость, психическая вялость, запоры, гипотермия, брадикардия и долгое сохранение молочных зубов (Arnold et al, 1984; Pe
terson, 1989; Sjollema et al, 1991; Jones et al, 1992). Животные покрыты в основном подшерстком, на фоне которого выделяются редкие и тонкие остевые волоски. При рентгенографии обнаруживаются такие же изменения, что и у собак с врожденным гипотиреозом.
ПОКАЗАТЕЛИ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Функцию щитовидной железы у кошек в отличие от собак исследуют для того, чтобы отличить гипертиреоз, а не гипотиреоз, от нормы. Поэтому значение многих показателей, информативных у собак, для кошек остается неясным. В большинстве случаев функцию щитовидной железы у кошек оценивают на основании концентраций общего и свободного Т4 в сыворотке крови.
Базальная концентрация Т4 в сыворотке крови. Определение концентрации Т4 в сыворотке крови является, по-видимому, наиболее надежным способом доказательства гипотиреоза при наличии соответствующих клинических признаков, особенно если до этого животных лечили от гипертиреоза. Методы РИА, используемые для определения уровня Т4 у собак, пригодны и для кошек; Reimers et al, 1981). В норме этот показатель у кошек колеблется в пределах 1-4 мкг%, хотя в разных лабораториях могут быть установлены разные диапазоны нормальных значений. В отличие от щенков, содержание Т4 в сыворотке котят не отличается от такового у взрослых животных (Zerbe et al, 1998).
При гипотиреозе концентрация Т4 не должна достигать нижней границы нормы, установленной в данной лаборатории, и в идеальном случае должна быть ниже 0,5 мкг%. К сожалению, низкая концентрация Т4 в сыворотке сама по себе не подтверждает наличия гипотиреоза. Типичные для гипотиреоза уровни Т4 могут обнаруживаться и при других заболеваниях или введении лекарственных веществ (например, глюкокортикоидов) (рис. 3-35). Трактовать результаты определения концентрации Т4 у кошек, как и у собак, следует с учетом данных анамнеза и физикального обследования, которые позволяют заподозрить эу- или гипотиреоз. Поскольку у кошек даже при эутиреозе концентрация Т4 в сыворотке может снижаться до 1 мкг% (а иногда и ниже 0,5 мкг%) под действием различных факторов, особенно сопутствующих заболеваний, мы ориентируемая на этот показатель лишь в тех случаях, когда он не выходит за пределы нормы и тем самым подтверждает эутиреоз. Низкие же концентрации Т4 в сыворотке указывают на вероятность гипотиреоза только у животных с соответствующим анамнезом и наличием характерных клинических признаков. В отсутствие таких признаков можно думать о синдроме эутиреоидной патологии.
Базальная концентрация Т3 в сыворотке крови. Уровень Т3 в сыворотке крови у кошек обычно не определяют. С одной стороны, достаточно убе-
154
ГИПОТИРЕОЗ
дительные данные можно получить при исследовании концентрации Т4, а с другой, как установлено у собак, концентрация Т3 - не слишком надежный показатель гипотиреоза. На основании его величины отличить эутиреоз от гипотиреоза у кошек, по-видимому, не менее трудно, чем у собак. Концентрацию Т в сыворотке у кошек можно определять геми же методами РИА, что и у собак (Reimers et al, 1981). Нормальные величины колеблются в пределах 0,7-1,1 нг%, хотя разные лаборатории устанавливают собственные нормы. У котят до 5-недельно-го возраста этот показатель ниже, чем у взрослых кошек (Zerbe et al, 1998).
Теоретически, уровень Т4 в сыворотке при гипотиреозе должен быть ниже нижней границы нормы, установленной в данной лаборатории. Однако нормальный уровень этого показателя у животных с соответствующим анамнезом, характерными симптомами и низкой концентрацией Lb сыворотке не исключае! диагноза гипотиреоза. Точно так же, низкий уровень Т3 у кошек при нормальной концентрации Т4 в сыворотке не доказывает наличия гипотиреоза, особенно в отсутствие других признаков этого состояния.
Базальная концентрация свТ4 в сыворотке. Концентрацию св’13 у здоровых кошек определяли
методами РИА (Sparkes et al, 1991), равновесного диализа (Mooney et al, 1996a) и МРД (Peterson et al, 2001). Хотя точность результатов, получаемых с помощью РИА и МРД, не сравнивалась, лучше ориентироваться на данные МРД (Nichols Institute, San Juan Capistrano, CA), диагностическая значимость которых доказана для собак. Нормальные величины этого показателя у кошек находятся в пределах 1-4 нг% (но могут различаться в разных лабораториях). У котят базальная концентрация свТ4 в сыворотке не отличается от таковой у взрослых кошек (Zerbe et al. 1998). При гипотиреозе этот показатель должен быть ниже нижней границы нормы (в идеальном случае ниже 0,5 нг%). Сама по себе низкая концентрация свТ4, как и общего Т4? не может служить доказательством гипотиреоза. Факторы, не связанные с функцией щитовидной железы (особенно сопутствующие заболевания и введение глюкокортикоидов), могут снижать содержание свТ4 до гипотиреоидного уровня (рис. 3-35). Однако эти факторы влияют на данный показатель не столь значительно, как на уровень общего Т4, причем у некоторых эутиреоидных кошек с сопутствующими заболеваниями концентрация свТ возрастает, а не снижается (Mooney et al, 1996а; Peterson et al, 2001). Вероятно, у кошек этот показатель обладает большей чувстви-
Рис. 3-35. Концентрации общего (А) и свТ4 (Б) в сыворотке у 221 кошки с нетиреоидными заболеваниями, сгруппированные в соответствии с тяжестью заболевания У 65 кошек заболевание было легким, у 83 - средней тяжести и у 73 - тяжелым. Т-образные линии для каждого прямоугольника ограничивают основной массив данных, которые в большинстве случаев находятся в пределах диапазона нормальных концентраций. В каждый прямоугольник включены данные с 25-го по 75-ый процентиль. Горизонтальные линии в каждом прямоугольнике - медиана. Светлые кружки - данные, выходящие за указанные пределы колебаний. Затемненная область - диапазон нормальных концентраций. Из: Peterson ME et al: JAMA 218:529, 2001.
ГИПОТИРЕОЗ • 155
тельностью и специфичностью, чем уровень общего Т4 (что установлено и для собак).
Базальная концентрация ТТГ в сыворотке крови. В настоящее время не существует метода, которым можно было бы определять уровень именно кошачьего ТТГ. Однако были попытки определять его у кошек иммунорадиометрическим методом, предложенным для собак. По данном одного из предварительных исследований, измеренный этим методом уровень ТТГ в сыворотке 50 здоровых кошек находился в пределах 0-0,32 нг/мл (Graham et al, 2000). У 47 кошек с гипотиреозом уровень ТТГ был ниже этих границ и в большинстве случаев вообще не поддавался определению (Graham et al, 2000; Otero et al, 2002). При гипотиреозе, развившемся у кошек после тиреоидэктомии или радиойодтерапии (по поводу гипертиреоза), содержание ТТГ в сыворотке возрастало. При лечении гипертиреоза тиамазолом наблюдалась обратная зависимость между концентрацией Т4 и частотой обнаружения повышенных уровней ТТГ в сыворотке крови. В этих работах не обследовали кошек со спонтанно развившимся гипотиреозом или животных с нетиреоидными заболеваниями. Тем не менее, результаты предварительных исследований показывают, что коммерческие наборы для имму-норадиометрического определения ТТГ у собак можно использовать при подозрении на гипотиреоз и у кошек.
Показатели лимфоцитарного тиреоидита. Данные об аутоантителах к тиреоглобулину и тиреоидным гормонам у кошек в литературе отсутствуют.
Факторы, влияющие на базальные концентрации тиреоидных гормонов. У кошек еще предстоит оценить влияние многих из тех факторов, которые изменяют концентрации тиреоидных гормонов в сыворотке собак. Данные о влиянии возраста, пола и породы противоречивы. В одном из исследований установлено, что уровень Т4 и (в меньшей степени) Т3 у кошек обоего пола примерно до 5-летнего возраста снижается, а затем вновь возрастает. У самок (интактных и кастрированных) содержание Т4, но не Т3, было значительно выше, чем у самцов, и уровень Т3, но не Т4, у породистых кошек был существенно выше, чем у обычных беспородных коротко- и длинношерстных животных (Thoday et al, 1984). Однако во всех случаях концентрация тиреоидных гормонов в сыворотке оставалась в пределах нормальных величин. По другим данным, у котят до 12-недельного возраста уровни общего и свободного Т4 не отличались от таковых у взрослых кошек, тогда как содержание Т3 до 5-недельного возраста было ниже, чем у взрослых (Zerbe et al, 1998). Имеются также сообщения об отсутствии какого-либо влияния возраста, пола и/или породы на концентрацию тиреоидных гормонов в сыворотке кошек (ссылки см. Feldman and Nelson, 1987). Суточные колебания уровня тиреоидных гормонов у кошек, по-видимому, отсутствуют, по
этому не имеет значения, в какое время дня брать у них пробы крови для определения гормонов (Ное-nig, Ferguson, 1983).
Наибольшее значение имеют факторы, способные снижать концентрацию Т4 при эутиреозе до гипотиреоидного уровня, а именно: синдром эутиреоидной патологии и введение лекарственных веществ. Развитие этого синдрома установлено и у кошек (Peterson, Gamble, 1990; Mooney et al, 1996a; Peterson et al, 2001). Как и у собак, уровни Т4и Т3 в таких случаях снижаются чаще, чем содержание свТ4, причем между степенью снижения этих показателей и тяжестью заболевания существует прямая зависимость (рис. 3.35). Чем тяжелее заболевание, тем более вероятно падение содержания тиреоидных гормонов до гипотиреоидного уровня. В таких условиях концентрация общего Т4 может быть ниже 0,5 мкг%, а свТ4- ниже 0,5 нг/мл. У отдельных животных на фоне снижения уровня общего Т4 концентрация свТ4, измеренная методом равновесного диализа, возрастала. В одном из исследований, это наблюдалось у 12% из 98 кошек с нетиреоидными заболеваниями (Mooney et al, 1996а), а в другом - у 6,3% из 221 кошки (Peterson et al, 2001). Заболевания, вызывающие такие изменения в уровне тиреоидных гормонов, включали сахарный диабет, желудочно-кишечные расстройства, патологию печени, почечную недостаточность и опухоли. Причина возрастания концентрации свТ4 у некоторых больных кошек неизвестна, но может заключаться в снижении связывания гормона с белками и/или нарушении процессов его выведения из крови.
Влияние лекарственных веществ на концентрацию тиреоидных гормонов в сыворотке у кошек изучалось редко. К лекарственным веществам, способным снижать содержание этих гормонов до гипотиреоидного уровня, относятся глюкокортикоиды и антитиреоидные средства (тиамазол и пропилтиоурацил). Однако аналогичным действием, наверное, обладают и многие другие вещества. Поэтому, пока не будет доказано обратное, возможность такого эффекта следует предполагать для любого лекарственного средства, особенно для тех, которые снижают концентрацию тиреоидных гормонов в сыворотке человека и собак (см. табл. 3-17), а также в тех случаях, когда ни анамнез, ни клинические данные не подтверждают наличия гипотиреоза.
Стимулирующая проба с ТТГ. Показания к проведению пробы с ТТГ, ее схемы и интерпретация результатов у кошек и собак одни и те же. К сожалению, инъекционные препараты ТТГ слишком дороги, чтобы их можно было использовать у животных. Ниже приводится краткое описание этой пробы (подробности см. во 2-ом издании монографии).
Имеется несколько вариантов пробы с ТТГ у кошек (табл. 3-23). Мы используем тот же вариант, что и у собак, т.е. внутривенно вводим 0,1 ME ТТГ на 1 кг веса животного (как правило, 0,5 ME на животное), а кровь для определения уровня Т4 берем до и через 6 ч после введения ТТГ. Концентрация
156 • ГИПОТИРЕОЗ
ТАБЛИЦА 3-23. НЕКОТОРЫЕ СХЕМЫ СТИМУЛИРУЮЩИХ ПРОБ С ТТГ И ТРГ У КОШЕК
Способ введения* Время отбора проб крови (ч) Нормальный результат Ссылка
Доза ТТГ 5 ME в/м, п/к До и через 10-12 ч Удвоение уровня Т4 Scott, 1980
1 МЕ/кг в/в До и через 6 ч Уровень Т4 > 4 мкг%; Hoenig, Ferguson, 1983
2,5 ME в/м До и через 8-12 ч возрастание уровня Т4 на 2,5 мкг% Удвоение уровня Т4 Kemppainen et al, 1984
1МЕ в/в До и через 4 ч Удвоение уровня Т4 Peterson et al, 1983
1 ME в/в До и через 7 ч Удвоение уровня Т4 Sparkes et al, 1991
5 ME в/в До и через 4 ч Удвоение уровня Т4 Di Bartola, Tarr, 1989
0,5 МЕ/кг в/в До и через 6 ч Удвоение уровня Т4 Mooney et al, 1996b
ТРГ 0,1 мг в/в 0,4 Возрастание уровня Т4 Sparkes et al, 1991
0,1 мг/кг в/в 0,6 больше, чем на 40% Удвоение уровня Т4 Lothrop et al, 1984
0,1 мг/кг в/в 0,4 Возрастание уровня Т4 Peterson et al, 1994
больше, чем на 50%
*) в/м - внутримышечно, п/к - подкожно, в/в - внутривенно
Т3 при этом исследуется лишь в отдельных случаях, При эутиреозе содержание Т4 в сыворотке после введения ТТГ должно увеличиваться на 2-3 мкг% и превышать 3 мкг%. При гипотиреозе же этот показатель должен возрастать очень слабо и оставаться ниже нормы (т.е. ниже 1 мкг%). Если после введения ТТГ уровень Т4 находится в пределах 1-3 мкг%, то результаты пробы теряют диагностическое значение. Это может отражать как ранние стадии гипотиреоза, так и влияние других заболеваний или лекарственных веществ.
Стимулирующая проба с ТРГ. Показания к проведению этой пробы и интерпретация ее результатов у кошек не отличаются от описанных для собак. Проба с ТРГ может заменять пробу с ТТГ. Однако, не говоря уже о малой доступности инъекционных препаратов ТРГ, наш опыт свидетельствует о частых осложнениях этой пробы у кошек и о трудностях трактовки ее результатов, поскольку уровень Т4 после введения ТРГ возрастает очень слабо, а ответ ТТГ на ТРГ значительно ослабляют нетиреоидные заболевания.
Кошкам обычно вводят внутривенно по 0,1 мг ТРГ на 1 кг веса тела, а кровь для определения уровня Т4 в сыворотке берут через 4-6 ч после введения ТРГ (табл. 3-23; Lothrop et al, 1984; Sparkes et al, 1991). При введении большей дозы ТРГ могут возникать побочные эффекты, включающие одышку, слюнотечение, рвоту, дефекацию, мочеиспускание, миоз и тахикардию (Lothrop et al, 1984; Tomsa et al, 2001). Если функция гипофизарно-тиреоидной системы не нарушена, то уровень Т4 в сыворотке после введения ТРГ должен возрастать на 1-2 мкг%, или превышать его исходную концентрацию больше, чем на 50%. Отсутствие такой реакции свидетельствует либо о нарушении функции этой системы, либо о наличии других заболеваний (Tomsa et al, 2001). При нормальных результатах пробы с ТТГ нарушение ответа на ТРГ указывает на патологию гипофиза.
ДИАГНОСТИКА
Диагноз гипотиреоза у кошек следует устанавливать, исходя из данных анамнеза и физикального и клинического обследования с учетом концентрации тиреоидных гормонов в сыворотке крови. Частота гиперхолестеринемии и нормоцитарной нормохромной нерегенеративной анемии у взрослых кошек с самопроизвольно развившимся гипотиреозом неизвестна, но при ятрогенном (т.е. после тиреоидэктомии или радиойодтерапии) или врожденном гипотиреозе такие нарушения могут иметь место. Поэтому, как и у собак, мы определяем в крови общее количество форменных элементов, а также уровень холестерина и Т4 в сыворотке. Нормальная концентрация Т4 подтверждает эутиреоз. Низкий уровень этого гормона у кошек, перенесших тиреоидэктомию или радиойодтерапию, а также у малорослых котят с нарушенными пропорциями тела позволяет диагностировать гипотиреоз. Окончательный диагноз требует оценки реакции животных на пробную терапию левотироксином. Лечение левотироксином кошек с ятрогенным гипотиреозом показано лишь при наличии соответствующих клинических симптомов. Без этого лечить животных с низким уровнем Т4 в сыворотке необязательно.
Поскольку приобретенный первичный гипотиреоз у кошек встречается редко и, как показывает наш опыт, низкая концентрация Т4 в сыворотке взрослых кошек почти всегда обусловлена синдромом эутиреоидной патологии или другими привходящими факторами, диагноз гипотиреоза нельзя устанавливать только на основании сниженного уровня Т если, конечно, животных до того не лечили по поводу гипертиреоза. Обнаружив низкую концентрацию Т4, следует определить уровень свТ4 методом равновесного диализа. Если у кошек с соответствующими клиническими признаками и отсутствием других заболеваний этот показатель оказывается ниже 0,5 нг/мл, то диагноз гипотиреоз
ГИПОТИРЕОЗ
157
становится гораздо более вероятным. Некоторые авторы доказывают наличие гипотиреоза результатами стимулирующих проб с ТТГ или ТРГ. Мы же предпочитаем оценивать реакцию на пробную терапию, особенно в отсутствие тяжелых нетиреоидных заболеваний. При этом необходимо помнить, что реакция на пробную терапию левотироксином неспецифична и сама по себе не служит доказательством гипотиреоза. После исчезновения клинических симптомов препарат следует постепенно отменять. Возобновление симптомов и их исчезновение после повторного лечения левотироксином свидетельствует о гипотиреозе.
ЛЕЧЕНИЕ И ПРОГНОЗ
Гипотиреоз у кошек лечат так же, как у собак. Для этого рекомендуется натриевая соль левотироксина в начальной дозе 0,05-0,1 мг один раз в сутки. Клиническую реакцию на лечение оценивают не раньше, чем через 4-6 недель. В дальнейшем продолжают следить за состоянием животных и уровнем тиреоидных гормонов в сыворотке крови (см. раздел «Контроль за ходом лечения»). Лечение должно устранять клинические признаки гипотиреоза, не приводя к появлению признаков гипертиреоза. Это достигается обычно при поддержании концентрации Т4 в сыворотке в пределах 1,0-3,0 мкг%, что может потребовать модификации доз и частоты введения левотироксина. Если после 4-6 недель лечения концентрация тиреоидных гормонов в сыворотке нормализуется, но клиническое состояние животного не улучшается, то следует пересмотреть диагноз.
Прогноз гипотиреоза у кошек зависит от причины заболевания и возраста, в котором появились его симптомы. Правильное лечение первичного гипотиреоза взрослых кошек обеспечивает нормальную продолжительность их жизни. Левотироксин устраняет практически все клинические проявления заболевания. Прогноз для котят с врожденным гипотиреозом менее благоприятен и зависит от тяжести костных нарушений к моменту начала лечения. Лечение и в этом случае устраняет многие клинические симптомы, но патология костно-мышечной системы может сохраняться, а иногда становиться даже более выраженной.
ЛИТЕРАТУРА
Гипотиреоз у собак
Allbritton AR: Autoimmune disease and vaccination? Vet Allergy Clin Immunol 4:16, 1996.
Arokoski J, et al: Effects of aerobic long distance running training (up to 40 km/day) of 1-year duration on blood and endocrine parameters of female Beagle dogs. Eur J Appl Physiol Occup Physiol 67:321, 1993.
Avgeris S, et al: Plasma von Willebrand factor concentration and thyroid function in dogs. JAVMA 196:921, 1990.
Barrie J, et al: Plasma cholesterol and lipoprotein concentrations in the dog: the effects of age, breed, gender and endocrine disease. J Small Anim Pract 34:507, 1993.
Beale KM, et al: Prevalence of antithyroglobulin antibodies detected by en-zymelinked immunosorbent assay of canine serum. JAVMA 196:745, 1990.
Beale K, et al: Serum thyroid hormone concentrations and thyrotropin responsiveness in dogs with generalized dermatologic disease. JAVMA 201:1715, 1992.
Beale K, et al: Correlation of racing and reproductive performance in Greyhounds with response to thyroid function testing. JAAHA 28:263, 1992.
Beale KM, Torres S: Thyroid pathology and serum antithyroglobulin antibodies in hypothyroid and healthy dogs. J Vet Intern Med 5:128, 1991.
Becker RA, et al: Hypermetabolic low triiodothyronine syndrome of burn injury. Crit Care Med 10:870, 1982.
Behrend EN, et al: Effect of storage conditions on Cortisol, total thyroxine, and free thyroxine concentrations in serum and plasma of dogs. JAVMA 212:1564, 1998.
Belshaw BE: Thyroid diseases. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1592.
Bichsel P, et al: Neurologic manifestations associated with hypothyroidism in four dogs. JAVMA 192:1745, 1988.
Bilezikian JP, Loeb JN: Increased myocardial beta-receptor and adrenergic responsiveness. Endocr Rev 4:3378, 1983.
Bishnoi A, et al: Effects of commonly prescribed nonsteroidal antiinflammatory drugs on thyroid hormone measurements. Am J Med 96:235, 1994.
Borst GC, et al: Fasting decreases thyrotropin responsiveness to thyrotropinreleasing hormone: A potential cause of misinterpretation of thyroid function tests in the critically ill. J Clin Endocrinol Metab 57:380, 1983.
Bowen D, et al: Autoimmune polyglandular syndrome in a dog: A case report. JAAHA 22:649, 1986.
Branam JE, et al: Radioisotope imaging for the evaluation of thyroid neoplasia and hypothyroidism in a dog. JAVMA 180:1077, 1982.
Braund KG, et al: Hypothyroid myopathy in two dogs. Vet Pathol 18:589, 1981.
Brent GA, Hershman JM: Thyroxine therapy in patients with severe nonthy-roidal illnesses and low serum thyroxine concentration. J Clin Endocrinol Metab 63:1, 1986.
Bromel C, et al: Ultrasonographic evaluation of the thyroid gland in Golden Retrievers (abstract). JVIM 15:297, 2001.
Bromel C, et al: Ultrasonographic evaluation of the thyroid gland in canine breeds predisposed for hypothyroidism (abstract). JVIM, 16:632, 2002.
Bruner JM, et al: Effect of time of sample collection on serum thyroidstimulating hormone concentrations in euthyroid and hypothyroid dogs. JAVMA 212:1572, 1998.
Budsberg SC, et al: Thyroxine-responsive unilateral forelimb lameness and generalized neuromuscular disease in four hypothyroid dogs. JAVMA 202:1859, 1993.
Calvert CA, et al: Congestive cardiomyopathy in Doberman Pinscher dogs. JAVMA 181:598, 1982.
Calvert CA, et al: Thyroid-stimulating hormone stimulation tests in cardio-myopathic Doberman Pinschers: A retrospective study. JVIM 12:343, 1998.
Campbell KL, Davis CA: Effects of thyroid hormones on serum and cutaneous fatty acid concentrations in dogs. AJVR 51:752, 1990.
Campbell KL, et al: Effects of trimethoprim/sulfamethoxazole on thyroid physiology in dogs. Proceedings, 11th Annual AAVD/ACVD Meeting, 1995, p 55.
Case 5, et al: Effects of the Iditarod Sled Dog Race on serum thyroid hormones and body composition. Arctic Med Res 52:113, 1993.
Castillo VA, et al: Changes in thyroid function in puppies fed a high iodine commercial diet. Vet Journal 161:80, 2001.
Chastain CB: Canine hypothyroidism. JAVMA 181:349, 1982.
Chastain CB, et al: Myxedema coma in two dogs. Canine Pract 9:20, 1982.
Chastain CB, et al: Congenital hypothyroidism in a dog due to an iodide organification defect. Am J Vet Res 44:1257, 1983.
Chastain CB, et al: Anti-triiodothyronine antibodies associated with hypothyroidism and lymphocytic thyroiditis in a dog. JAVMA 194:531, 1989.
Chastain CB, Schmidt B: Galactorrhea associated with hypothyroidism in intact bitches. JAAHA 16:851, 1980.
Chen Y: Effect of thyroxine on the immune response of mice in vivo and in vitro. Immunol Commun 9:260, 1980.
Conaway DH, et al: The familial occurrence of lymphocytic thyroiditis in Borzoi dogs. Am J Med Genet 22:409, 1985a.
Conaway DH, et al: Clinical and histological features of primary progressive, familial thyroiditis in a colony of Borzoi dogs. Vet Pathol 22:439, 1985b.
Cortese L, et al: Hyperprolactinaemia and galactorrhoea associated with primary hypothyroidism in a bitch. J Small Anim Pract 38:572, 1997.
Credille KM , et al: The effects of thyroid hormones on the skin of Beagle dogs. JVIM 15:539, 2001.
Crocker AD, Cameron DL: Evidence for post-synaptic changes mediating increased behavioural sensitivity to dopamine receptor agonists in hypothyroid rats. Prog Neuro-Psychopharmacol Biol Psyciat 12:607, 1988.
Dalton RG, et al: Hypothyroidism as a cause of acquired von Willebrand’s disease. Lancet 1:1007, 1987.
de Bruijne J, et al: Fat mobilization and plasma hormone levels in fasted dogs. Metabolism 30:190, 1981.
Delauche AJ, et al: Nemaline rods in canine myopathies: 4 case reports and literature review. JVIM 12:424, 1998.
Dewey CW, et al: Neuromuscular dysfunction in five dogs with acquired myasthenia gravis and presumptive hypothyroidism. Prog Vet Neurol 6:117, 1995.
Dixon RM, et al: Serum thyrotropin concentrations: A new diagnostic test for canine hypothyroidism. Vet Rec 138:594, 1996.
158
ГИПОТИРЕОЗ
Dodds WJ: Estimating disease prevalence with health surveys and genetic screening. Adv Vet Sci Comp Med 39:29, 1995.
Dodman NH, et al: Animal behavior case of the month. JAVMA 207:1168, 1995.
Doerge DR, Decker CJ: Inhibition of peroxidase-catalyzed reactions by arylamines: Mechanism for the anti-thyroid action of sulfamethazine. Chem Res Toxicol 7:164, 1994.
Dowell RT, et al: Beta-adrenergic receptors, adenylate cyclase activation, and myofibril enzyme activity in hypothyroid rats. Am J Physiol 266:H2527, 1994.
Drvota V, et al: Downregulation of the thyroid hormone receptor subtype mRNA levels by amidarone during catecholamine stress in vitro. Biochem Biophys Res Commun 211:991, 1995.
Duclos DD, et al: Prognosis for treatment of adult onset demodicosis in dogs: 34 cases. JAVMA 204:616, 1994.
Eigenmann JE: Diagnosis and treatment of dwarfism in a German Shepherd dog. JAAHA 17:798, 1981.
Eisenbarth GS, Jackson RA: The immunoendocrinopathy syndromes. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 10th ed. Philadelphia, WB Saunders, 1992, p 1555.
Elliott DA, et al: Thyroid hormone concentrations in critically ill canine intensive care patients. J Vet Emerg Crit Care 5:17, 1995.
Evinger JV, et al: Thyrotropin-releasing hormone stimulation testing in healthy dogs. Am J Vet Res 46:1323, 1985.
Extein IR, Gold MS: Thyroid hormone potentiation of tricyclics. Psychosomatics 29:166, 1988.
Ferguson DC: Thyroid function tests in the dog: Recent concepts. Vet Clin North Am 14:783, 1984.
Ferguson DC, Peterson ME: Serum free thyroxine concentrations in spontaneous canine hyperadrenocorticism. Fourth Annual Veterinary Medical Forum, Washington DC, 1986, p 14.
Ferguson DC, Peterson ME: Serum free and total iodothyroinine concentrations in dogs with hyperadrenocorticism. Am J Vet Res 53:1636, 1992.
Ferguson DC, Hoenig M: Re-examination of dosage regimens for L-thyroxine (T4) in the dog: bioavailability and persistence of TSH suppression (abstract). JVIM 11:120, 1997.
Ferguson DC, et al: Carprofen lowers total T4 and TSH, but not free ^concentrations in dogs (abstract). JVIM 13:243, 1999.
Fish LH, et al: Replacement dose, metabolism, and bioavailability of levothyroxine in the treatment of hypothyroidism. Role of triiodothyronine in pituitary feedback in humans. N Engl J Med 316:764, 1987.
Ford SL, et al: Insulin resistance in three dogs with hypothyroidism and diabetes mellitus. JAVMA 202:1478, 1993.
Frank LA: Comparison of thyrotropin-releasing hormone (TRH) to thyrotropin (TSH) stimulation for evaluating thyroid function in dogs. JAAHA 32:481, 1996.
Froelich PA, Meserve LA: Altered growth patterns and depressed pituitary growth hormone content in young rats: Effects of pre- and post-natal thiouracil administration. Growth 16:296, 1982.
Gaschen F, et al: Recognition of triiodothyronine-containing epitopes in canine thyroglobulin by circulating thyroglobulin autoantibodies. Am J Vet Res 54:244, 1993.
Gaskill CL, et al: Effects of phenobarbital treatment on serum thyroxine and thyroid-stimulating hormone concentrations in epileptic dogs. JAVMA 215:489, 1999.
Gaughan KR, Bruyette DS: Thyroid function testing in Greyhounds. AJVR 62:1130,2001.
Gaynor AR, et al: Risk factors for acquired megaesophagus in dogs. JAVMA 211:1406, 1997.
Gerritsen RJ, et al: Relationship between atrial fibrillation and primary hypothyroidism in the dog. Vet Quart 18:49, 1996.
Gieger TL, et al: Thyroid function and serum hepatic enzyme activity in dogs after phenobarbital administration. JVIM 14:277, 2000.
Gilani B, et al: Thyroid hormone abnormalities at diagnosis of insulindependent diabetes mellitus in children. J Pediatr 105:218, 1984.
Gookin JL, et al: Clinical hypothyroidism associated with trimethoprimsulfadiazine administration in a dog. JAVMA 214:1028, 1999.
Gosselin SJ, et al: Biochemical and immunological investigation on hypothyroidism in dogs. Can J Comp Med 44:158, 1980.
Gosselin SJ, et al: Lymphocytic thyroiditis in dogs: Induction with a local graft-versus-host reaction. Am J Vet Res 42:1856, 1981a.
Gosselin SJ, et al: Histopathologic and ultrastructural evaluation of thyroid lesions associated with hypothyroidism in dogs. Vet Pathol 18:299, 1981b.
Gosselin SJ, et al: Induced lymphocytic thyroiditis in dogs: Effect of intrathy-roidal injection of thyroid autoantibodies. Am J Vet Res 42:1565, 1981c.
Graham PA: Thyroid replacement therapy: The numbers game. Proceedings, 20th ACVIM Forum, Dallas, TX, 2002, p 678.
Graham PA, et al: Lymphocytic thyroiditis. Vet Clin North Am 31:915, 2001a.
Graham PA, et al: A12-month prospective study of 234 thyroglobulin antibody positive dogs which had no laboratory evidence of thyroid dysfunction (abstract). J Vet Intern Med 15:298, 2001b.
Greco DS: Polyendocrine gland failure in dogs. Vet Med 95:477, 2000.
Greco DS, et al: Juvenile-onset hypothyroidism in a dog. JAVMA 187:948, 1985.
Greco DS, et al: Congenital hypothyroid dwarfism in a family of Giant Schnau-zers. J Vet Intern Med 5:57, 1991.
Greco DS, et al: The effect of levothyroxine treatment on resting energy expenditure of hypothyroid dogs. J Vet Intern Med 12:7, 1998.
Green ST, Ng J-P: Hypothyroidism and anaemia. Biomed Pharmacother 40:326, 1988.
Greenspan FS: The thyroid gland. In Greenspan FS and Gardner (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/ McGraw Hill, 2001, p 201.
Gross TL, Ihrke PJ, Walder EJ: Veterinary Dermatopathology. A Macroscopic and Microscopic Evaluation of Canine and Feline Skin Disease. St Louis, Mosby-Year Book, 1992.
Gunaratnam P: The effects of thyroxine on hair growth in the dog. J Small Anim Pract 27:17, 1986.
Haber RS, Loeb JN: Selective induction of high-oubain-affinity isoforms of Na*-K*-ATPase by thyroid hormone. Am J Physiol 255:E912, 1988.
Haines DM, et al: Survey of thyroglobulin autoantibodies in dogs. Am J Vet Res 45:1493, 1984.
Haines DM, Penhale WJ: Antibodies to pancreatic islet cells in canine diabetes mellitus. Vet Immunol Immunopathol 8:149, 1985.
Hall I A, et al: Effect of trimethoprim/sulfamethoxazole on thyroid function in dogs with pyoderma. JAVMA 202:1959, 1993.
Hamann F, et al: Pituitary function and morphology in two German Shepherd dogs with congenital dwarfism. Vet Rec 144:644, 1999.
Hargis AM, et al: Relationship of hypothyroidism to diabetes mellitus, renal amyloidosis, and thrombosis in pure-bred Beagles. Am J Vet Res 42:1077, 1981.
Hawthorn MH, et al: Effect of thyroid status on beta-adrenoreceptors and calcium channels in rat cardiac and vascular tissue. Naunyn Schmiedebergs Arch Pharmacol 337:539, 1988.
Hayashizaki Y, et al: Deoxyribonucleic acid analysis of five families with familial inherited thyroid stimulating hormone deficiency. Clin Endocrinol Metab71:792, 1990.
Henik RA, Dixon RM: Intravenous administration of levothyroxine for treatment of suspected myxedema coma complicated by severe hypothermia in a dog. JAVMA 216:713, 2000.
Henley WN, et al: Hypothyroidism increases serotonin turnover and sympathetic activity in the adult rat. Can J Physiol Pharmacol 69:205, 1991.
Hess RS, et al: Association between hypothyroidism, diabetes mellitus, and hyperadrenocorticism and development of atherosclerosis in dogs (abstract). JVIM 16:360, 2002.
Hill RC, et al: Effects of racing and training on serum thyroid hormone concentrations in racing Greyhounds. AJVR 62:1969, 2001.
Horney BS, et al: Evaluation of an automated, homogeneous enzyme immunoassay for serum thyroxine measurement in dog and cat serum. Vet Clin Path 28:20, 1999.
Hymes K, et al: Easy bruising, thrombocytopenia, and elevated platelet immunoglobulin G in Graves’ disease and Hashimoto’s thyroiditis. Ann Intern Med 94:27, 1981.
Indrieri RJ, et al: Neuromuscular abnormalities associated with hypothyroidism and lymphocytic thyroiditis in three dogs. JAVMA 190:544, 1987.
Iversen L, et al: Development and validation of an improved enzyme-linked immunosorbent assay for the detection of thyroglobulin autoantibodies in canine serum samples. Dorn Anim Endocr 15:525, 1998.
Iversen L, et al: Biological variation of canine serum thyrotropin (TSH) concentration. Vet Clin Path 28:16, 1999.
Jaggy A, et al: Neurological manifestations of hypothyroidism: A retrospective study of 29 dogs. J Vet Intern Med 8:328, 1994.
Joffe RT: A perspective on the thyroid and depression. Can J Psychiatry 35:754, 1990.
Johnson C, et al: Effect of 13,l-induced hypothyroidism on indices of reproductive function in adult male dogs. JVIM 13:104, 1999.
Johnson RJ, et al: A pharmacokinetic comparison of two commercially available L-thyroxine products (abstract). JVIM 13:245, 1999.
Johnstone JB, et al: Thyroid supplementation effect on plasma von Willebrand factor/factor Vlll in Doberman Pinschers [abstractl. J Vet Intern Med 7:130, 1993.
Kantrowitz LB, et al: Serum total thyroxine, total triiodothyronine, free thyroxine, and thyrotropin concentrations in epileptic dogs treated with anticonvulsants. JAVMA 214:1804, 1999.
Kantrowitz LB, et al: Serum total thyroxine, total triiodothyronine, free thyroxine, and thyrotropin concentrations in dogs with nonthyroidal illness. JAVMA 219:765, 2001.
Kaplan MM, et al: Prevalence of abnormal thyroid function test results in patients with acute medical illnesses. Am J Med 72:9, 1982.
Kaptein EM: Thyroid hormone metabolism in nonthyroidal illness. Proceed ACVIM, Washington DC, 1988, p 643.
Kaptein EM, et al: Peripheral serum thyroxine, triiodothyronine, and reverse triiodothyronine kinetics in the low thyroxine state of acute nonthyroidal illness. J Clin Invest 69:526, 1982.
Kaptein EM, et al: Relationship of altered thyroid hormone indices to survival in nonthyroidal illnesses. Clin Endocrinol 16:565, 1982.
Kaptein EM, et al: Effects of prednisone on thyroxine and 3,5,3’- triiodothyronine metabolism in normal dogs. Endocrinology 130:1669, 1992.
Kelly MJ, Hill JR: Canine myxedema stupor and coma. Comp Cont Ed Pract Vet 6:1049, 1984.
Kemppainen RJ, et al: Effects of prednisone on thyroid and gonadal endocrine function in dogs. J Endocrinol 96:293, 1983.
ГИПОТИРЕОЗ
159
Kemppainen RJ, Sartin JL: Evidence for episodic but not circadian activity in plasma concentrations of adrenocorticotrophin, Cortisol, and thyroxine in dogs. J Endocrinol 103:219, 1984. Kemppainen RJ, Young DW: Canine triiodothyronine autoantibodies. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders, 1992, p 327.
Kemppainen RJ, et al: Autoantibodies to triiodothyronine and thyroxine in a Golden Retriever. JAAHA 32:195, 1996.
Kern TJ, et al: Horner’s syndrome in dogs and cats: 100 cases (1975-1985). JAVMA 195:369, 1989.
Kern TJ, Riis RC: Ocular manifestations of secondary hyperlipidemia associated with hypothyroidism and uveitis in a dog. JAAHA 16:907, 1980.
Kintzer PP, Peterson ME: Thyroid scintigraphy in small animals. Semin Vet Med Surg Small Anim 6:131, 1991.
Klein I: Thyroid hormone and the cardiovascular system. Am J Med 88:631, 1990.
Kooistra HS, et al: Polyglandular deficiency syndrome in a Boxer dog: Thyroid hormone and glucocorticoid deficiency. Vet Quart 17:59, 1995.
Kooistra HS, et al: Combined pituitary hormone deficiency in German Shepherd dogs with dwarfism. Domest Anim Endocrinol 19:177, 2000a.
Kooistra HS, et al: Secretion pattern of thyroid-stimulating hormone in dogs during euthyroidism and hypothyroidism. Dorn Anim Endocr 18:19, 2000b.
Lantz GC, et al: Transsphenoidal hypophysectomy in the clinically normal dog. Am J Vet Res 49:1134, 1988.
Larsen PR, et al: Relationships between circulating and intracellular thyroid hormones: Physiological and clinical implications. Endocrinol Rev 2:87, 1981.
Larsen PR, et al: The thyroid gland. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 389.
Larsson MG: Determination of free thyroxine and cholesterol as a new screening test for canine hypothyroidism. JAAHA 24:209, 1988.
Lee DE, et al: Effects of hyperlipemia on radioimmunoassays for progesterone, testosterone, thyroxine, and Cortisol in serum and plasma samples from dogs. Am J Vet Res 52:1489, 1991.
Li Wl, et al: Effects of thyrotropin-releasing hormone on serum concentrations of thyroxine and triiodothyronine in healthy, thyroidectomized, thyroxine- treated, and propylthiouracil-treated dogs. Am J Vet Res 47:163, 1986.
Liu S, et al: Clinical and pathologic findings in dogs with atherosclerosis: 21 cases (1970-1983). JAVMA 189:227, 1986.
Lothrop CD, et al: Canine and feline thyroid function assessment with the thyrotropin-releasing hormone response test. Am J Vet Res 45:2310, 1984a.
Lothrop CD, et al: Diagnosis of canine pituitary-thyroid dysfunction with the thyrotropin releasing hormone (TRH) stimulation test. Proceedings of the 12th Annual Scientific Program, American College of Veterinary Internal Medicine, Washington DC, 1984b, p 32.
Lum SMC, et al: Peripheral tissue mechanism for maintenance of serum triiodothyronine values in a thyroxine-deficient state in man. J Clin Invest 73:570, 1984.
Lumsden JH, et al: Prevalence of hypothyroidism and von Willebrand’s disease in Doberman Pinschers and the observed relationship between thyroid, von Willebrand, and cardiac status. JVIM 7:115, 1993 (abstract).
Lurye JC, et al: Evaluation of an in-house enzyme-lined immunosorbent assay for quantitative measurement of serum total thyroxine concentration in dogs and cats. JAVMA 221:243, 2002.
Marca MC, et al: Evaluation of canine serum thyrotropin (TSH) concentration: Comparison of three analytical procedures. J Vet Diag Invest 13:106, 2001.
Maruo T, et al: The role of maternal thyroid hormones in maintaining early pregnancy in threatened abortion. Acta Endocrinol 127:118, 1992.
Meij BP, et al: Thyroid-stimulating hormone responses after single administration of thyrotropin-releasing hormone and combined administration of four hypothalamic releasing hormones in Beagle dogs. Dorn Anim Endocr 13:465, 1996.
Meij BP, et al: Results of transsphenoidal hypophysectomy in 52 dogs with pituitary-dependent hyperadrenocorticism. Vet Surg 27:246, 1998.
Meric SM, et al: Serum thyroxine concentrations after radioactive iodine therapy in cats with hyperthyroidism. JAVMA 188:1038, 1986.
Miller AB, et al: Serial thyroid hormone concentrations in healthy euthyroid dogs, dogs with hypothyroidism, and euthyroid dogs with atopic dermatitis. Br Vet J 148:451, 1992.
Miller CW, et al: Echocardiographic assessment of cardiac function in Beagles with experimentally produced hypothyroidism. J Ultrasound Med (Suppl) 3:157, 1984.
Milne KL, Hayes HM: Epidemiologic features of canine hypothyroidism. Cornell Vet 71:3, 1981.
Montgomery T, et al: Comparison of five analog RlAs for free thyroxine in dogs (abstract). J Vet Intern Med 5:128, 1991.
Monzani et al: Subclinical hypothyroidism: Neurobehavioral features and beneficial effect of L-thyroxine treatment. Clin Invest 71:367, 1993.
Mooney CT, Anderson TJ: Congenital hypothyroidism in a Boxer dog. J Small Anim Pract 34:31, 1993.
Moore GE, et al: Effects of oral administration of anti-inflammatory doses of prednisone on thyroid hormone response to thyrotropin-releasing hormone and thyrotropin in clinically normal dogs. AJVR 54:130, 1993.
Morkin E, et al: Studies on the use of thyroid hormone and a thyroid hormone analogue in the treatment of congestive heart failure. Ann Thorac Surg 56:54, 1993. Moruzzi P, et al: Medium-term effectiveness of L-thyroxine treatment in idiopathic dilated cardiomyopathy. Am J Med 101:461, 1996.
Muller GH, et al: Cutaneous endocrinology. In Muller GH, et al (eds): Small Animal Dermatology, 3rd ed. Philadelphia, WB Saunders, 1983, p492.
Muller PB, et al: Effects of long-term phenobarbital treatment on the thyroid and adrenal axis and adrenal function tests in dogs. JVIM 14:157, 2000.
Nachreiner RF: New thyroid function tests. Vet Diagn News (Michigan State University) 1:3, 1984.
Nachreiner RF, et al: Incidence of T3 and T4 autoantibodies in dogs using a sensitive binding assay. J Vet Intern Med 4:114, 1990.
Nachreiner RF, et al: Pharmacokinetics of L-thyroxine after its oral administration in dogs. Am J Vet Res 54:2091, 1993.
Nachreiner RF, Refsal KR: Radioimmunoassay monitoring of thyroid hormone concentrations in dogs on thyroid replacement therapy: 2,674 cases (1985-1987). JAVMA 201:623, 1992.
Nachreiner RF, et al: Prevalence of autoantibodies to thyroglobulin in dogs with nonthyroidal illness. Am J Vet Res 59:951, 1998.
Nachreiner RF, et al: Prevalence of serum thyroid hormone autoantibodies in dogs with clinical signs of hypothyroidism. JAVMA 220: 466, 2002.
Nelson RW, et al: Serum free thyroxine concentration in healthy dogs, dogs with hypothyroidism, and euthyroid dogs with concurrent illness. JAVMA 198:1401, 1991.
Nesbitt GH, et al: Canine hypothyroidism: A retrospective study of 108 cases. JAVMA 177:1117, 1980.
Neufeld M, et al: Two types of autoimmune Addison’s disease associated with different polyglandular autoimmune (PGA) syndromes. Medicine 60:355, 1981.
Oohashi E, et al: Seasonal changes in serum total thyroxine, free thyroxine, and canine thyroid-stimulating hormone in clinically healthy Beagles in Hokkaido. J Vet Med Sci 63:1241, 2001.
Panciera DL: An echocardiographic and electrocardiographic study of cardiovascular function in hypothyroid dogs. JAVMA 205:996, 1994.
Panciera DL: Conditions associated with canine hypothyroidism. Vet Clin North Am 31:935, 2001.
Panciera DL, et al: Thyroid function tests in euthyroid dogs treated with L-thyroxine. Am J Vet Res 51:22, 1989.
Panciera DL, et al: Quantitative morphologic study of the pituitary and thyroid glands of dogs administered L-thyroxine. Am J Vet Res 51:27, 1990.
Panciera DL, Johnson GS: Plasma von Willebrand factor antigen concentration in dogs with hypothyroidism. JAVMA 205:1550, 1994.
Panciera DL, Johnson GS: Plasma von Willebrand factor antigen concentration and buccal mucosal bleeding time in dogs with experimental hypothyroidism. JVIM 10:60, 1996.
Panciera DL, Johnston SA: Thyroid function tests and plasma proteins in dogs administered etodolac (abstract). JVIM 16:374, 2002.
Penhale WJ, Young PR: The influence of microbial environment on susceptibility to experimental autoimmune thyroiditis. Clin Exp Immunol 72:288, 1988.
Peruccio C: Incidence of hypothyroidism in dogs affected by keratoconjunctivitis sicca. Proceedings of the American Society of Veterinary Ophthalmology, Las Vegas, 1982, p 47.
Peterson ME, et al: Effects of spontaneous hyperadrenocorticism on serum thyroid hormone concentrations in the dog. Am J Vet Res 45:2034, 1984.
Peterson ME, Ferguson DC: Thyroid diseases. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 3rd ed. Philadelphia, WB Saunders, 1989, p 1632.
Peterson ME, Gamble DA: Effect of nonthyroidal illness on serum thyroxine concentrations in cats: 494 cases (1988). JAVMA 197:1203, 1990.
Peterson ME, et al: Pretreatment clinical and laboratory findings in dogs with hypoadrenocorticism: 225 cases (1979-1993). JAVMA 208:85, 1996.
Peterson ME, et al: Measurement of serum total thyroxine, triiodothyronine, free thyroxine, and thyrotropin concentrations for diagnosis of hypothyroidism in dogs. JAVMA 211:1396, 1997.
Peterson ME, et al: Total thyroxine testing: Comparison of an in-house test kit with radioimmuno- and chemiluminescent assays (abstr). J Vet Intern Med 17:396, 2003.
Pisarev MA, Gartner R: Autoregulatory actions of iodine. In Braverman LE, Utiger RD (eds): The Thyroid, 6th ed. Philadelphia, Lippincott, 2000, p 85.
Post K, et al: Lack of effect of trimethoprim and sulfadiazine in combination in mid- to late gestation on thyroid function in neonatal dogs. J Reprod Fertil Suppl 47:477, 1993.
Rajatanavin R, et al: Thyroid hormone antibodies and Hashimoto’s thyroiditis in mongrel dogs. Endocrinology 124:2535, 1989.
Ramsey IK, et al: Thyroid-stimulating hormone and total thyroxine concentrations in euthyroid, sick euthyroid and hypothyroid dogs. J Small Anim Pract 38:540, 1997.
Ray RA, Howanitz P: RIA in thyroid function testing. Diagn Med 7:55, 1984.
Reimers TJ, et al: Effects of storage, hemolysis, and freezing and thawing on concentrations of thyroxine, Cortisol, and insulin in blood samples. Proc Soc Exp Biol Med 170:509, 1982.
Reimers TJ, et al: Effects of reproductive state on concentrations of thyroxine, 3,5,3?-triiodothyronine, and Cortisol in serum of dogs. Biol Reprod 31:148, 1984.
160
ГИПОТИРЕОЗ
Reimers TJ, et al: Effect of fasting on thyroxine, 3,5,37-triiodothyronine, and Cortisol concentrations in serum of dogs. Am J Vet Res 47:2485, 1986.
Reimers TJ, et al: Effects of age, sex, and body size on serum concentrations of thyroid and adrenocortical hormones in dogs. Am J Vet Res 51:454, 1990.
Rogers JS, et al: Factor VIII activity and thyroid function. Ann Intern Med 97:713, 1982.
Rogers WA, et al: Lipids and lipoproteins in normal dogs and in dogs with secondary hyperlipoproteinemia. JAVMA 166:1092, 1975.
Rosychuk RA: Thyroid hormones and antithyroid drugs. Vet Clin North Am [Small Anim Pract] 12:111, 1982.
Rosychuk RA: Dermatologic manifestations of canine hypothyroidism. Hypothyroidism: Diagnosis and Clinical Manifestations. St Petersburg, Daniels Pharmaceuticals Inc, 1998, p 18.
Sainteny F, et al: Thyroid hormones induce hematopoietic pluri-potent stem cell differentiation toward erythropoiesis through the production of pluri-poietin-like factors. Exp Cell Res 187:174, 1990.
Saunders HM, Jezyk PK: The radiographic appearance of canine congenital hypothyroidism: Skeletal changes with delayed treatment. Vet Radiol 32:171, 1991.
Sauve F, Paradis M: Use of recombinant human thyroid-stimulating hormone for thyrotropin stimulation test in euthyroid dogs. Can Vet J 41:215, 2000.
Scott DW, Miller WH, Griffin CE (eds): Muller & Kirk’s Small Animal Dermatology, 6th ed. Philadelphia, WB Saunders Co, 2001, p 780.
Scott-Moncrieff C, et al: Measurement of serum free thyroxine by modified equilibrium dialysis in dogs (abstract). J Vet Intern Med 8:159, 1994.
Scott-Moncrieff JCR, Nelson RW: Change in serum thyroid-stimulating hormone concentration in response to administration of thyrotropin- releasing hormone to healthy dogs, hypothyroid dogs, and euthyroid dogs with concurrent disease. JAVMA 213:1435, 1998.
Scott-Moncrieff JCR, et al: Comparison of serum concentrations of thyroid-stimulating hormone in healthy dogs, hypothyroid dogs, and euthyroid dogs with concurrent disease. JAVMA 212:387, 1998.
Scott-Moncrieff JCR, et al: Evaluation of antithyroglobulin antibodies after routine vaccination in pet and research dogs. JAVMA 221:515, 2002.
Shahrara S, et al: Upregulation of thyroid hormone receptor pr and (32 messenger RNA in the myocardium of dogs with dilated cardiomyopathy or chronic valvular disease. AJVR 60:848, 1999.
Slade E, et al: Serum thyroxine and triiodothyronine concentrations in canine pyoderma. JAVMA 185:216, 1984.
Slag MF, et al: Hypothyroxinemia in critically ill patients as a predictor of high mortality. JAMA245:43, 1981.
Smith C A: Are we vaccinating too much? JAVMA 207:421, 1995.
Strakosch CR, et al: Immunology of autoimmune thyroid diseases. N Engl J Med 307:1499, 1982.
Sullivan P, et al: Altered platelet indices in dogs with hypothyroidism and cats with hyperthyroidism. Am J Vet Res 54:2004, 1993.
Sunthornthepvarakul T, et al: Brief report: Resistance to thyrotropin caused by mutations in the thyrotropin-receptor gene. N Engl J Med 332:155, 1994.
Swanson JW, et al: Neurologic aspects of thyroid dysfunction. Mayo Clin Proc 56:504, 1981.
Szabadi E: Thyroid dysfunction and affective illness. Br Med J 302:923, 1991.
Taurog A, Dorris ML: Peroxidase-catalyzed bromination of tyrosine, thyroglobulin, and bovine serum albumin: Comparison of thyroid peroxidase and lactoperoxidase. Arch Biochem Biophys 287:288, 1991.
Thacker EL, et al: Prevalence of autoantibodies to thyroglobulin, thyroxine, or triiodothyronine and relationship of autoantibodies and serum concentrations of iodothyronines in dogs. Am J Vet Res 53:449, 1992.
Tomer Y: Anti-thyroglobulin autoantibodies in autoimmune thyroid diseases: Cross-reactive or pathogenic? Clin Immunol Immunopathol 82:3, 1997.
Topliss DJ, et al: Uptake of 3,5,3’-triiodothyronine by cultured rat hepatoma cells is inhibitable by nonbile acid cholephils, diphenylhydantoin, and nonsteroidal anti-inflammatory drugs. Endocrinology 124:980, 1989.
Torres SMF, et al: Hypothyroidism in a dog associated with trimethoprimsulfadiazine therapy. Vet Derm 7:105, 1996.
Utiger RD: Decreased extrathyroidal triiodothyronine production in non- thyroidal illness: Benefit or harm? Am J Med 69:807, 1980.
Vail DM, et al: Thyroid hormone concentrations in dogs with chronic weight loss, with special reference to cancer cachexia. JVIM 8:122, 1994.
Vajner L: Lymphocytic thyroiditis in Beagle dogs in a breeding colony: Findings of serum autoantibodies. Vet Med Czech 11:333, 1997.
Valdermarsson 5, et al: Relations between thyroid function, hepatic and lipoprotein lipase activities and plasma lipoprotein concentrations. Acta Endocrinologica 104:50, 1983.
Verge CF: Immunoendocrinopathy syndromes. In Wilson JD, Foster DW, Kro-nenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 1651.
Vollset I, Larsen HJ: Occurrence of autoantibodies against thyroglobulin in Norwegian dogs. Acta Vet Scand 28:65, 1987.
Wang R, et al: Salsalate and salicylate binding to and their displacement of thyroxine from thyroxine-binding globulin, transthyretin, and albumin. Thyroid 9:359, 1999.
Wartofsky L, Burman KD: Alterations in thyroid function in patients with systemic illness: The euthyroid sick syndrome. Endocrinol Rev 3:164, 1982.
Weller RE, Kinnas TC, Stevens D: Basal serum thyroxine concentration and its response to thyroid-stimulating hormone administration decreases with chronologic age in Beagle dogs. Scientific Proceedings, American College of Veterinary Internal Medicine, New York, 1983, p 38.
Wenzel KW: Pharmacological interference with in vitro tests of thyroid function. Metabolism 30:717, 1981.
Werner SC: Normal thyroid physiology. Proceedings of the American Association of Clinical Chemists, July, 1982, p 1.
Williams DA, et al: Validation of an immunoassay for canine thyroidstimulating hormone and changes in serum concentration following induction of hypothyroidism in dogs. JAVMA 209:1730, 1996.
Williamson NL, et al: Effects of short-term trimethoprim-sulfamethoxazole administration on thyroid function in dogs. JAVMA 221:802, 2002.
Woltz HH, et al: Effect of prednisone on thyroid gland morphology on plasma thyroxine and triiodothyronine concentrations in the dog. AJVR 44:2000, 1984.
Young DW, et al: Abnormal canine triiodothyronine-binding factor characterized as a possible triiodothyronine autoantibody. Am J Vet Res 46:1346, 1985.
Гипотиреоз у кошек
Arnold U, et al: Goitrous hypothyroidism and dwarfism in a kitten. JAAHA 20:753, 1984.
DiBartola SP, Tarr MJ: Corticotropin and thyrotropin response tests in Abyssinian cats with familial amyloidosis. JAAHA 25:217, 1989.
Feldman EC, Nelson RW: Canine and Feline Endocrinology and Reproduction. Philadelphia, WB Saunders, 1987.
Graham PA, et al: The measurement of feline thyrotropin (TSH) using a commercial canine immunoradiometric assay (abstract). JVIM 14:342, 2000.
Hoenig M, Ferguson DC: Assessment of thyroid functional reserve in the cat by the thyrotropin-stimulation test. Am J Vet Res 44:1229, 1983.
Jones BR, et al: Preliminary studies on congenital hypothyroidism in a family of Abyssinian cats. Vet Rec 131:145, 1992.
Kemppainen RJ, et al: Endocrine responses of normal cats to TSH and synthetic ACTH administration. JAAHA 20:737, 1984.
Lothrop CD, et al: Canine and feline thyroid function assessment with the thyrotropin-releasing hormone response test. Am J Vet Res 45:2310, 1984.
Mooney CT, et al: Effect of illness not associated with the thyroid gland on serum total and free thyroxine concentrations in cats. JAVMA 208:2004, 1996a.
Mooney CT, et al: Serum thyroxine and triiodothyronine responses of hyperthyroid cats to thyrotropin. AJVR 57:987, 1996b.
Otero T, et al: Serum TSH in hyperthyroid cats pre- and post-therapy (abstract). Proceedings, 12th ECVIM-CA/ESVIM Congress, Munich, Germany, September, 2002, p 173.
Peterson ME: Feline hypothyroidism. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p 1000.
Peterson ME, et al: Feline hyperthyroidism: Pretreatment, clinical, and laboratory evaluation of 131 cases. JAVMA 183:103, 1983.
Peterson ME, et al: Use of the thyrotropin releasing hormone stimulation test to diagnose mild hyperthyroidism in cats. J Vet Intern Med 8:279, 1994.
Peterson ME, Gamble DA: Effect of nonthyroidal illness on serum thyroxine concentrations in cats: 494 cases (1988). J Vet Intern Med 197:1203, 1990.
Peterson ME, et al: Measurement of serum concentrations of free thyroxine, total thyroxine, and total triodothyronine in cat with hyperthyroidism and cats with nonthyroidal illness. JAVMA 218:529, 2001.
Rand JS, et al: Spontaneous adult-onset hypothyroidism in a cat. J Vet Intern Med 7:272, 1993.
Reimers TJ, et al: Validation of radioimmunoassays for triiodothyronine, thyroxine and hydrocortisone (Cortisol) in canine, feline, and equine sera. Am J Vet Res 42:2016, 1981.
Scott DW: Hormonal and metabolic disorders. JAAHA 16:390, 1980.
Scott DW, Miller WH, Griffin CE (eds): Muller & Kirk’s Small Animal Dermatology, 6th ed. Philadelphia, WB Saunders Co, 2001, p 780.
Sjollema BE, et al: Congenital hypothyroidism in two cats due to defective organification: Data suggesting loosely anchored thyroperoxidase. Acta Endocrinol 125:435, 1991.
Sparkes AH, et al: Thyroid function in the cat: Assessment by the TRH response test and the thyrotrophin stimulation test. J Small Anim Pract 32:59, 1991.
Thoday KL, et al: Radioimmunoassay of serum total thyroxine and triiodothyronine in healthy cats: Assay methodology and effects of age, sex, breed, heredity and environment. J Small Anim Pract 25:457, 1984.
Tomsa K, et al: Thyrotropin-releasing hormone stimulation test to assess thyroid function in severely sick cats. JVIM 15:89, 2001.
Zerbe C A, et al: Thyroid profiles in healthy kittens from birth to 12 weeks of age. Proc Annu Meet American College of Veterinary Internal Medicine 16:702, 1998.
Глава 4 ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ОПРЕДЕЛЕНИЕ....................162
ИСТОРИЧЕСКИЙ ОЧЕРК.............162
ПАТОМОРФОЛОГИЯ.................162
Введение.......................162
Доброкачественные опухоли щитовидной железы..............163
Злокачественные опухоли щитовидной железы..............163
ЭТИОЛОГИЯ......................164
Введение.......................164
Возможная роль диеты и факторов внешней среды..................164
Возможная роль аутокринных и паракринных факторов роста.....165
Стимуляторы щитовидной железы в крови или мутации генов........165
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ.........165
Встречаемость..................165
Признаки и механизмы их развития ...165
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.......170
Введение.......................170
Пальпируемое образование на шее (зоб)..........................171
Нарушения функции сердца.......171
Гиперактивность и «легкая возбудимость»..................173
Обезвоживание, кахексия, слабость ..173
Уменьшение размеров почек.......173
Симптом склонения головы
(недостаточность тиамина или калия).......................173
Глазные симптомы................174
ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
В КЛИНИКЕ....................174
Введение.......................174
Общий клинический анализ крови (ОАК)..........................174
Анализ мочи....................175
Биохимия сыворотки крови.......175
Жирный стул (стеаторея)........178
Уровень кортизола в плазме крови ....178
Уровень фруктозамина в сыворотке крови..........................178
Артериальное давление и гипертония 178
Рентгенография................179
Электрокардиография (ЭКГ).....179
Эхокардиография (ЭхоКГ).......182
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА .183
КОНЦЕНТРАЦИЯ ТИРЕОИДНЫХ
ГОРМОНОВ В СЫВОРОТКЕ КРОВИ
(ПОДТВЕРЖДЕНИЕ ДИАГНОЗА).....184
Базальный уровень общего тироксина (Т4) в сыворотке крови............184
«Нормальный» уровень Т4 у кошек с подозрением на гипертиреоз...185
Базальный уровень трийодтиронина (ТЗ)
в сыворотке крови...........187
Базальный уровень свободного Т4 (свТ4) в
сыворотке крови..............187
Проба с Т3 на подавление функции щитовидной железы.............188
Стимулирующая проба с тиреотропным гормоном (ТТГ)................190
Стимулирующая проба с тиролиберином
(ТРГ)........................192
Подтверждение диагноза гипертиреоз 193
ИЗОТОПНОЕ СКАНИРОВАНИЕ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ ..........193
Теоретические предпосылки.....193
Физиология сканирования.......194
Выявляемая ткань..............194
Клиническое значение..........195
УЗИ ОРГАНОВ ШЕИ
(ЩИТОВИДНОЙ ЖЕЛЕЗЫ) ........199
Введение......................199
Результаты....................199
Показания к УЗИ щитовидной железы.200
ОБЩИЕ НАПРАВЛЕНИЯ ТЕРАПИИ.....201
Введение......................201
Гипертиреоз и функция почек...201
ЛЕЧЕНИЕ АНТИТИРЕОИДНЫМИ
СРЕДСТВАМИ (ПРЕПАРАТАМИ ТИОМОЧЕВИНЫ)................204
Механизм действия.............204
Пропилтиоурацил (ПТУ): больше не рекомендуется.......204
Тиамазол.......................204
Карбимазол.....................210
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ..........210
Предоперационная подготовка....210
Анестезия......................211
Методики операции..............211
Недостатки хирургического лечения ..214
Послеоперационное лечение......214
Результаты хирургического лечения ..216
РАДИОЙОДТЕРАПИЯ................216
Теоретические предпосылки......216
Выбор радиоактивного изотопа...216
Цель лечения...................216
Расчет доз.....................216
Способы введения 1311..........219
Радиационная безопасность......219
Преимущества радиойодтерапии (см. табл. 4.10)...............220
Недостатки радиойодтерапии (см. табл. 4.10)...............220
Необходимость в повторном лечении .220
НОВЫЕ СПОСОБЫ ЛЕЧЕНИЯ ПОД КОНТРОЛЕМ УЗИ..................220
Чрескожная инъекция этанола при одностороннем гипертиреозе.....220
Чрескожная инъекция этанола при двустороннем гипертиреозе......221
Чрескожная термокоагуляция ткани...221
ДОПОЛНИТЕЛЬНЫЕ ЛЕЧЕБНЫЕ СРЕДСТВА..............222
Пропранолол....................222
Атенолол.......................223
Стабильный йод.................223
Йодированные рентгеноконтрастные средства.......................223
Г люкокортикоиды...............224
Тиамин.........................224
ГИПЕРТИРЕОЗ НА ФОНЕ ДРУГИХ ЗАБОЛЕВАНИЙ....................224
ПРОГНОЗ........................224
Список сокращений
АД - артериальное давление
ЖКТ - желудочно-кишечный тракт
ОАК - полный анализ крови
ОЦК - объем циркулирующей крови
ПВ - протромбиновое время
ПТГ - паратиреоидный гормон
ПТУ - пропилтиоурацил
СКФ - скорость клубочковой фильтрации
Т - тироксинг
свТ4- свободный Т4
Т, - трийодтирони
ТТГ - тиреотропный гормон, тиреотропин
ЧИЭ - чрескожная инъекция этанола
ЧСС - частота сердечных сокращений
Щитовидная железа впервые была подробно описана Везалием (Vesalius) в XVI в. Томас Уортон (Thomas Wharton, 1614-1673), исходя из ее формы, назвал эту железу греческим словом thyreos (щит). В 1500-х годах впервые была заподозрена связь между увеличением щитовидной железы (зобом)
как возможной причины кретинизма и недостаточностью йода. Швейцарско-немецкий врач Парацельс (Paracelsus, 1493-1541) описал эндемический кретинизм в районе Зальцбурга (Австрия).
Гипертиреоз, обусловленный автономным ростом и функционированием фолликулярных клеток
162 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
щитовидной железы, впервые был описан у человека Генри Пламмером (Henry Plummer) в 1913 г. Клинические наблюдения позволили ему выделить две формы гипертиреоза: экзофтальмический зоб (диффузный токсический зоб) и токсическая аденома. При диффузном токсическом зобе гипертиреоз связан с диффузной гиперплазией щитовидной железы, а при токсической аденоме - с одним или несколькими узлами в железе. При последнем заболевании происходит медленный рост автономно функционирующих фолликулов, и именно с токсической аденомой сходен гипертиреоз у большинства кошек, у которых это клиническое состояние впервые было описано Петерсоном (Peterson) и Хольцворсем (Holzworth) с сотрудниками в 1980 г.
ОПРЕДЕЛЕНИЕ
Эндогенный гипертиреоз (тиреотоксикоз) представляет собой заболевание, обусловленное усиленной выработкой и секрецией щитовидной железой (а следовательно и повышенным содержанием в крови) тироксина (Т4) и трийодтиронина (Т3). Гипертиреоз у человека, хотя и редко, бывает следствием нарушения функции гипоталамуса или гипофиза (Brucker-Davis, 1999). Теоретически, причиной гипертиреоза может быть и активная деструкция щитовидной железы, сопровождающаяся выделением в кровь большого количества тиреоидных гормонов. У кошек же гипертиреоз практически всегда связан с автономной гиперфункцией щитовидной железы (т.е. развивается независимо от патологии гипоталамуса или гипофиза); не описаны и случаи его развития вследствие деструкции щитовидной железы. Таким образом, гипертиреоз у кошек чаще всего обусловлен первичным патологическим процессом в одной или обеих долях щитовидной железы.
ИСТОРИЧЕСКИЙ ОЧЕРК
В последние 20 лет частота выявления гипертиреоза у кошек резко возросла. В 1914 г Карлсон (Carlson) предположил, что у кошек гиперплазия щитовидной железы развивается реже, чем у собак. При вскрытии 3000 кошек аденомы этой железы были обнаружены лишь в 3 случаях (Huquenin, 1927). Шламбергер (Schlumberger) из Института патологии Вооруженных сил сообщил в 1955 г. об одном случае аденокарциномы щитовидной железы у кошек. При исследовании щитовидных желез 54 кошек аденомы были обнаружены в пяти и рак в двух случаях (Clark, Meier, 1958). Однако, как считали авторы, тиреоидный статус животных в этих случаях оставался нормальным.
В 1964 г Лак (Lucke) привел данные аутопсии (с тщательным исследованием щитовидной железы) 75 старых кошек из ветеринарных клиник одного из районов Англии. Ни у одной из них при жизни патологию щитовидной железы не подозревали.
Однако у 27 (36%) этих животных были обнаружены морфологические изменения в ней, включая аденомы (у 23), узловой (аденоматозный) зоб (у 3) и рак (у 1). У двух из 3 кошек с узловым зобом имелись изменения, которые должны были сопровождаться гипертиреозом. Морфологические данные указывают на возрастание частоты патологии щитовидной железы у старых кошек к середине 1960-х годов.
В 1976 г. Лив (Leav) и его коллеги из ветеринарной школы Нидерландов представили обзор клинических и патоморфологических исследований щитовидной железы собак и кошек. Обзор включал результаты аутопсии кошек с 1949 по 1973 гг. Всего были обнаружены 52 опухоли щитовидной железы (47 аденом и 5 раков). Большинство этих опухолей, по-видимому, не имело клинических проявлений. Однако доброкачественные опухоли у 5 кошек имели достаточно большие размеры и выявлялись клинически, а у двух кошек с метастазами рака в регионарные лимфоузлы при жизни имелись признаки нарушения гормонального статуса. Был сделан вывод, что доброкачественные опухоли щитовидной железы у кошек встречаются часто, рак - редко, причем и то, и другое обнаруживается почти исключительно у старых животных.
Гипертиреоз у кошек стал известен ветеринарам лишь после появления двух публикаций (Peterson et al, 1979; Holzworth et al, 1980), что заставило искать у животных клинические признаки этого состояния. В ветеринарной клинике Калифорнийского Университета гипертиреоз у кошек до 1980 г. не выявлялся, но с 1980 по 1985 г. мы наблюдали 125 кошек с клиническим гипертиреозом. В ветеринарном центре Нью-Йорка в течение примерно того же срока гипертиреоз у кошек диагностировали с частотой 3 случая в месяц (Peterson et al, 1983). Согласно обзору 1993 г, общая частота выявления гипертиреоза у кошек составляет 22 случая в месяц (Broussard et al, 1995; Peterson et al., 1995a, 2000). Неясно, продолжает ли частота этого заболевания увеличиваться, но несомненно, что в настоящее время гипертиреоз у кошек часто встречается не только в США, но и в Европе и Японии.
ПАТОМОРФОЛОГИЯ Введение
С тех пор, как диагноз гипертиреоза в ветеринарной практике стал обычным явлением, подробные обзоры по патоморфологии щитовидной железы не публиковались. Однако определенное представление можно составить на основании прежних публикаций. Дополнительные сведения дают результаты исследования удаленной и полученной при аутопсии ткани щитовидной железы. Как и у собак, большинство опухолей этой железы у кошек имеют фолликулярное, плотное или смешанное строение. Доброкачественные опухоли встречаются гораздо чаще, чем злокачественные.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 163
Доброкачественные опухоли щитовидной железы
Многоузловой аденоматозным зоб. По данным обзора 1976 г., многоузловые аденоматозные опухоли редко сопровождались увеличением размеров щитовп (ной железы (Leav et al., 1976), но накопленный с того времени опыт показывает, чго у большинства кошек с гипотиреозом удается прощупать увеличенную железу. Многоузловой аденоматозный зоб - наиболее частая гистологическая находка у кошек с тиреотоксикозом (Carpenter et al., 1987). Одни авторы называют такие изменения аденоматозной гиперплазией, другие - аденомами. Неясно, отражают ли все эти названия (многоузловые аденоматозные опухоли, аденоматозная гиперплазия и аденомы) одно и то же состояние или они чем-то различаются. В большинстве случаев (примерно в 70-75° о) такие «доброкачественные» изменения у кошек обнаруживаются в обеих долях щитовидной железы.
Множественные узелковые образования рассеяны по всей железе. Они состоят из очажков гиперплазированной ткани, и их диаметр колеблется от менее 1 до более 3 см (Peterson. 2000). Железа становится похожей на виноградную 1роздь (рис. 4.1). Большинство узелков имеют солидное строение, но иногда в них присутствуют заполненные жидкостью кисты, или «пустоты» (см. рис. 4.1). Гистологически эти изменения сходны с узелковой гиперплазией или множественным аденоматозным зобом у человека. Неравномерные фолликулы в узелках четко отличаются от нормальной ткани и могут сдавливать окружающую паренхиму. Узелки имеют либо микрофолликулярное строение, либо состоят только из клеток. Рядом с ними часто находят растянутые коллоидом кисты. Фолликулы выстланы кубовидным эпителием.
Аденома. В более редких случаях в щитовидной железе обнаруживается так называемая аденома.
которая увеличивает и деформирует пораженную долю. Обычно одиночные аденомы захватывают большую часть доли. При микроскопическом ис-с юдовании в них обнаруживаются рашой формы фолликулы с разным содержанием коллоида. В одних аденомах выявляются папиллярные выросты эпителия; другие представляют собой очаги компактных клеток, рассеянные по всей пораженной доле. Некоторые аденомы имеют бугристую поверхность, другие - гладкую.
Атипичная аденома. Небольшая группа опухолей обладает отдельными признаками злокачественного роста, но не прорастает в капсулу и сосуды. Пораженная доля щитовидной железы обычно увеличена и деформирована, но в отличие от типичных аденом или аденоматозной гиперплазии покрыта гладкой капсулой. При микроскопическом исследовании в атипичных аденомах находят очаги плотно расположенных фолликулов окруженные толстым слоем клеток. Фолликулы обычно лишены коллоида, а клетки крупнее тех, из которых состоят типичные аденомы.
Злокачественные опухоли щитовидной железы.
Введение. Рак щитовидной железы (основная причина гипертиреоза у собак) встречается лишь у 1-3% больных гипертиреозом кошек. Эти опухоли могут быть инкапсулированными, одиночными и поражать как одну, так и обе доли железы. В других случаях на шее прощупывается множество объемных образовании, и опухоли прорастают в окружающие ткани или дают отдаленные метастазы. Иными словами, рак щитови зной железы может иметь разнообразные проявления.
Фолликулярный рак. Пораженная опухолью доля щитовидной железы увеличена и деформирована Фолликулярный рак встречается относительно редко и обычно не сопровождается симптома-
Рис. 4-1. Л. Многоузловой аденоматозный зоб, имеющий вид сдавленной кисти винограда. Пример двустороннего асимметричного увеличения щитовидной железы. Б. На разрезе большей доли видна полость
164 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ми гипертиреоза. Его ткань состоит из отдельных плотных фолликулов с малым количеством коллоида. Некоторые опухоли менее дифференцированы и состоят из мелких плотных фолликулов, сливающихся с конгломератами клеток. Характерна инвазия в капсулу и сосуды.
Папиллярный рак. Эта форма рака встречается еще реже. Пораженная доля железы в таких случаях обычно не деформируется, и опухоль обнаруживается только при микроскопическом исследовании. Для нее характерны папиллярные выпячивания фиброзно-сосудистой соединительной ткани, покрытые крупными кубовидными опухолевыми клетками; опухоль прорастает в капсулу пораженной доли.
ЭТИОЛОГИЯ Введение
Частота. Начиная с первых описаний в 1979 и 1980 гг, и до начала - середины 1990-х годов частота гипертиреоза у кошек постепенно возрастала. Продолжает ли она увеличиваться, неизвестно. Неизвестно также, связано ли частое выявление этого состояния с повышенным вниманием владельцев кошек к своим питомцам, улучшением диагностических возможностей, увеличением продолжительности жизни животных или с истинным возрастанием частоты гипертиреоза среди них. Вероятно, имеют значение все эти факторы, и в настоящее время гипертиреоз обнаруживается у одной из 300 кошек (Gerber et al, 1994).
Возможные причины. Хотя гипертиреоз у кошек изучен довольно хорошо, его истинная причина все еще остается неизвестной. Поскольку примерно в 70-75% случаев поражаются обе отделенные друг от друга доли щитовидной железы, считают, что развитие тиреотоксикоза связано с влиянием каких-то присутствующих в крови или действующих извне факторов, реализующих свой эффект на фоне исходной предрасположенности к заболеванию. В связи с этим интересно отметить, что искусственные корма для животных впервые появились в середине 1960-х голов на Восточном побережье США и в Калифорнии. Иными словами, первое поколение кошек, выросших на таких кормах, достигло зрелого возраста в конце 1970-х - начале 1980-х годов, т.е. именно тогда, когда в Бостоне, Нью-Йорке, Филадельфии, Лос-Анджелесе и Сан-Франциско были зарегистрированы первые случаи гипертиреоза у этих животных. Возникает вопрос: связано ли развитие гипертиреоза с потреблением искусственного корма?
Возможная роль диеты и факторов внешней среды
Зобогенные вещества. Хотя большинство искусственных кормов для кошек содержит относительно много йода, связь между его содержанием
в диете и гипертиреозом у животных установить не удалось. В искусственных кормах и окружающей среде присутствуют и многие другие зобогенные вещества, которые могли бы вызывать увеличение щитовидной железы и/или гипертиреоз. К ним относятся фталаты, резорцин, полифенолы и полихлорированные дифенилы. Большинство этих углеводородов выводятся из организма в виде глюкуронидов, а у кошек процесс глюкуронидации крайне замедлен (Court, Greenblatt, 2000).
Соя. Зобогенным эффектом может обладать и соя, которую используют в искусственных кормах для кошек в качестве источника высококачественного белка. Соевые изофлавоны, генистеин и даид-зеин, ингибируют йодидпероксидазу - фермент, необходимый для синтеза тиреоидных гормонов (Divi et al, 1997). Соевые изофлавоны также выводятся печенью в виде конъюгатов с глюкуроновой кислотой, и замедление этого процесса могло бы играть роль в развитии зоба и тиреотоксикоза у кошек. В том количестве, в котором эти вещества присутствуют в искусственных кормах, они вполне могут обладать биологическим эффектом (Court, Freeman, 2002). Этот вопрос требует дальнейших исследований.
Эпидемиология. Сообщалось о повышенном риске гипертиреоза у домашних кошек (несиамских пород), содержащихся на консервированном корме и подвергающихся действию противоблошиных средств, инсектицидов, гербицидов и т.п. (Scarlett et al, 1988). В другом исследовании показано, что у кошек двух генетически близких пород (сиамских и гималайских) гипертиреоз развивается реже, чем у животных других пород. Кроме того, отмечено двух-трехкратное возрастание риска этого заболевания среди кошек, содержащихся в основном на консервированном корме. Риск гипертиреоза был увеличен втрое и при использовании подстилок (Kass et al, 1999). Позднее, однако, не было обнаружено зависимости риска гипертиреоза от породы кошек. Применение различных опылителей, гербицидов, пестицидов или противоблошиных средств, равно как и курение в доме, также практически не влияло на риск развития гипертиреоза у животных. В то же время у кошек, предпочитающих консервы с запахом рыбы, печени или гусиных потрохов, этот риск был повышен (Martin et al, 2000).
Селен. В щитовидной железе содержится большее количество селена (на 1 г веса), чем в любом другом органе. Это свидетельствует о важной биологической роли этого микроэлемента. Селен входит в состав глутатионпероксидазы и тиоредоксинредук-тазы, защищающих тиреоциты от окислительного стресса. Поскольку селен является также фактором роста, он мог бы играть роль в развитии токсического узлового зоба у кошек. Концентрация селена в плазме крови кошек из четырех географических регионов, в двух из которых гипертиреоз встречается часто, а в двух - редко, была выше, чем у животных других видов, но это не сказывалось на частоте гипертиреоза. Однако, по мнению авторов, большое
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 165
количество селена в корме может влиять на здоровье кошек (Foster et al, 2001).
Возможная роль аутокринных и паракринных факторов роста
Введение. Факторы роста, или пептиды, стимулирующие пролиферацию клеток, принимают участие в процессах нормального роста и канцерогенеза. Аутокринными называют факторы роста, действующие на те же клетки, в которых они вырабатываются, а паракринными - те, которые вырабатываются в соседних клетках. Для оптимальной реакции клеток требуется, как правило, одновременное действие различных факторов роста. В щитовидной железе присутствуют многие из них, включая тромбоцитарный, эпидермальный и инсулиноподобные факторы роста. Пока неизвестно, влияют ли они на развитие гипертиреоза у кошек (Brown et al, 1992).
G-Белки. Синтез и секреция тиреоидных гормонов регулируются ТТГ. ТТГ взаимодействует с рецепторами на поверхности клеток щитовидной железы (тиреоцитов). Рецепторы ТТГ сопряжены со специфическими белками, принадлежащими к суперсемейству так называемых G-белков. Связывание ТТГ со своим рецептором через G-белки активирует цАМФ-зависимый путь передачи сигнала и тем самым стимулирует рост и дифференцировку тиреоцитов. Нарушение экспрессии G-белков могло бы играть роль в патогенезе гипертиреоза. В аденомах щитовидной железы у кошек с гипертиреозом обнаружено сниженное количество одного из G-белков, который in vitro ингибирует рост и дифференцировку тиреоцитов. Это могло бы ослаблять ингибиторный эффект цАМФ-зависимого каскада в тиреоцитах, приводя к их автономному росту и гиперсекреции Т . Выяснение молекулярных механизмов гипертиреоза должно способствовать более рациональному лечению и профилактике этого заболевания (Hammer et al, 2000).
Стимуляторы щитовидной железы в крови или мутации генов
Не исключено, что гипертиреоз у кошек развивается под влиянием факторов, аналогичных иммуноглобулинам, которые связываются с рецепторами ТТГ и вызывают диффузный токсический зоб у человека (Peterson et al, 1987b). Мутации гена рецептора ТТГ не обнаружены (Pearce et al, 1997). Структура рецептора ТТГ у кошек сходна с таковой у человека. Сыворотки больных с диффузным токсическим зобом, но не кошек с гипертиреозом, активируют рецепторы ТТГ у здоровых кошек (Nguyen et al, 2002). Однако дальнейшие исследования могут выявить и у этих животных активирующие мутации гена рецептора ТТГ или стимулирующие щитовид ную железу иммуноглобулины.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ Встречаемость
Гипертиреоз встречается у кошек разного возраста (от 4 до 22 лет), но чаще всего в возрасте примерно 13 лет. У кошек старше 8 лет он является, по-ви-димому, самым распространенным эндокринным заболеванием, но у животных моложе 4 лет развивается крайне редко (Gordon et al, 2003). Среди кошек с гипертиреозом животные моложе 8 лет составляют менее 5% (рис. 4-2). Частота заболевания не зависит от породы или пола, хотя, как уже отмечалось, у сиамских и гималайских кошек риск гипертиреоза может быть ниже (Thoday, Mooney, 1992а; Broussard et al, 1995; Peterson, 1995a).
Признаки и механизмы их развития
Человек. Большинство симптомов гипертиреоза у кошек напоминает проявления этого заболевания у пожилых (старше 70 лет) людей: похудание, мерцательная аритмия, беспокойство, возбуждение, мышечная слабость и тремор. К более редким симптомам у человека (которые отмечаются менее чем у 50% больных) относятся непереносимость тепла, спутанность сознания, апатия и понос (Martin et al, 1996). Диагностика гипертиреоза в пожилом возрасте сталкивается с большими трудностями, чем у молодых людей, поскольку клинические проявления заболевания бывают менее выраженными и часто маскируются поражением какого-либо одного органа (Maugeri et al, 1996). У человека хорошо известно состояние субклинического гипертиреоза, которое характеризуется либо повышенным уровнем тиреоидных гормонов в отсутствие клинических проявлений заболевания, либо слабо выраженными клиническими признаками на фоне нормальных концентраций Т4 и Т3 в сыворот-
1 2 3 4 5 6 7 8 9 10111213141516171819202122 Возраст кошек
Рис. 4-2. Распределение по возрасту 94 кошек к моменту установления диагноза гипертиреоза; данные Калифорнийского Университета, Дэвис. Средний возраст - 12,9 лет.
166
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ке крови (Toft, 2001). Субклинический гипотиреоз диагностируют примерно у 1% больных старше 60 лет. Существует ли такое состояние у кошек, неизвестно. У большинства кошек с гипертиреозом имеются разнообразные клинические симптомы, отражающие нарушение функции многих органов, хотя в разных случаях преобладают те или иные проявления (Mooney, 1998a,b).
Факторы, влияющие на клинические проявления гипертиреоза
Невнимательность владельцев. Признаки гипертиреоза развиваются медленно, и владелец животного может просмотреть начало заболевания и обратиться к ветеринару лишь на поздней стадии болезни. Согласно нашим данным, более чем в половине случаев владельцы кошек обращаются в ветеринарную клинику лишь через 6 месяцев -1 год после появления первых признаков гипертиреоза. В основном это связано именно с медленным нарастанием симптомов заболевания. Повышенные аппетит и активность считаются признаками здоровья, а отнюдь не болезни. Более серьезные проявления также развиваются медленно и длительное время могут оставаться незамеченными (табл. 4-1). Владельцы кошек осознают, что их питомцы больны, лишь тогда, когда они сильно худеют, или у них возникают другие явные признаки заболевания. Нередко симптомы относят просто на счет старения животного и ищут профессиональной помощи лишь в крайних случаях. Наиболее часто к ветеринарам обращаются по поводу резкого похудания кошек, развития у них полифагии, полидипсии и полиурии, рвоты и/или поноса.
ТАБЛИЦА 4-1. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ЗАБОЛЕВАНИЯ, ОТМЕЧАЕМЫЕ ВЛАДЕЛЬЦАМИ КОШЕК С ГИПЕРТИРЕОЗОМ
Симптом Процент животных
Потеря веса 92
Полифагия 61
Полидипсия/полиурия 47
Повышение активности / беспокойство 40
Расстройства пищеварения (понос, учащен- 4Q
ный стул, обильный стул, стеаторея)
Рвота 38
Кожные изменения (очаговая алопеция, кол-
туны, сухость, жирная себорея, истончение 36
кожи)
Нарушения дыхания (одышка, удушье, ка- 74
шель, чиханье)
Снижение аппетита / анорексия 14
Снижение активности / сонливость 11
Слабость 10
Тремор / судороги 7
Поиски холодного места / непереносимость 5
тепла
Гематурия 2
Склонение головы < 1
Сопутствующие заболевания. Гипертиреоз у кошек проявляется симптомами разной тяжести. Они зависят как от продолжительности самого гипертиреоза, так и от наличия сопутствующих заболеваний. Тиреоидные гормоны влияют практически на все органы и системы, что и определяет разнообразие клинических проявлений гипертиреоза. У одних кошек развиваются признаки дисфункции нескольких органов, у других преобладают симптомы нарушения какого-либо одного из них. Сопутствующие заболевания затемняют клиническую картину гипертиреоза и увеличивают вероятность преимущественного поражения одного из органов. В силу разнообразия признаков болезни наличие или отсутствие какого-либо одного из них не может служить основанием для диагностики гипертиреоза или исключения этого диагноза.
Повышенная настороженность ветеринарных врачей. О возможности развития гипертиреоза у кошек узнали лишь в начале 1980-х годов. Это заболевание, как и всякий новый синдром, вначале диагностировали очень редко, лишь при наличии классических, клинических признаков. По мере того, как ветеринары стали лучше ориентироваться в различных эффектах избытка тиреоидных гормонов, гипертиреоз оказывался все более распространенным заболеванием. «Индекс настороженности» большинства ветеринаров в отношении данного заболевания достаточно высок.
В настоящее время при биохимическом анализе сыворотки обычно определяют и концентрацию Т4. В результате гипертиреоз диагностируется еще на той стадии, когда его клинические признаки менее очевидны, чем это было в 1980-х годах (Broussard et al, 1995; Kintzer, 1995; Mooney, 1998a; Bucknell, 2000) (см. табл. 4-1). Сказанное отнюдь не умаляет диагностического значения данных анамнеза и физикального обследования. Наоборот, именно они служат основанием для более углубленных исследований, позволяющих установить диагноз.
Потеря веса и полифагия
Описание признака. Похудание и полифагия - самые распространенные признаки гипертиреоза у кошек. Та или иная степень похудания отмечается примерно у 90% больных животных. Потеря веса, по словам их владельцев, может быть небольшой или очень выраженной. У небольшого процента животных развивается тяжелая кахексия (рис. 4-3). Похудание происходит постепенно, и это трудно заметить при постоянном наблюдении за кошкой. Его обычно замечают лишь тогда, когда животное теряет больше 10% веса; когда же вес уменьшается более чем на 20%, говорят о кахексии (Mooney, 1998b).
Повышенный аппетит бывает при многих заболеваниях. Это крайне важный анамнестический признак, поскольку если потеря веса сочетается с полифагией, то дифференциальную диагностику можно проводить с меньшим числом заболеваний,
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 167
Рис. 4-3. А. 13-летняя кошка с гипертиреозом; типичное для данного заболевания истощение. Б. Та же кошка через 2 месяца после восстановления эутиреоза. В. Кошка с гипертиреозом, предпочитающая лежать на холодном полу, а нс на теплой шерстяное подстилке, Г. Кошка с гипертиреозом. Симптом вентрофлексии головы, позволяющий предполагать недостаточность тиамина и калия. (Г - фотография д-ра Jane Turret, Pacifica, CA.)
чем в случаях похудания на фоне анорексии (Mooney, 1998b; табл. 4-2). У кошки, ранее отличавшейся крайней разборчивостью в еде, может появиться прекрасный аппетит, и хозяина это только радует. В других случаях кошки остаются постоянно голодными и, съев свою порцию, набрасываются на еду, приготовленную для других домашних животных. Одному из наших клиентов приходилось кормить свою немецкую овчарку в отдельной комнате, чтобы не дать больной кошке отнимать у нее еду. Иногда ранее ленивых и послушных кошек приходится держать за дверью, пока хозяева едят. Иначе животные прыгают на стол, пытаясь утащить кусок пищи.
Механизм развития. Основное следствие гипертиреоза - повышенное расходование энергии в процессе физиологических функций и физической работы, которые при этом выполняются с низкой эффективностью. Энергетические затраты компенсируются потреблением большего количества пищи, мобилизацией энергетических запасов
и повышенным потреблением кислорода. Тем не менее, хронический дефицит кал ори й сохраняется. У человека при гипертиреозе усиливается как синтез, гак и распад тканевых белков, но последний в гораздо большей степени. Отрицательный азотистый баланс проявляется потерей веса, атрофией и слабостью мышц, а также некоторым снижением концентрации альбумина в сыворотке крови. Точ-
ТАБЛИЦА 4-2. ЗАБОЛЕВАНИЯ КОШЕК, СОПРОВОЖДАЮЩИЕСЯ ПАЛИФАГИЕЙ И ПОТЕРЕЙ ВЕСА
’ ипертиреоз
Сахарный диабет
Плохое качество или недостаточность нищи
Заболевания желудочно-кишечного тракта
Нарушения всасывания
Нарушения переваривания пищи
1 иперкортицизм [сахарный диабет]
168 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ный механизм повышения аппетита неизвестен. Примерно у 6% кошек с гипертиреозом отмечаются периоды снижения аппетита (см. раздел «Снижение аппетита (апатичный гипертиреоз)»).
Полидипсия и/или полиурия
Описание признака. Количества потребляемой воды и выделяемой мочи у кошек с гипертиреозом колеблются в широких пределах. Более половины владельцев животных (но меньший процент, чем в 1980-х годах) вообще не отмечают изменений этих показателей, но многие все же говорят о резком их увеличении (Broussard et al, 1995). Обращать внимание на это крайне важно, так как такие признаки позволяют сузить диагностический поиск. Похудание может быть вызвано множеством причин, но лишь определенные заболевания сопровождаются выраженными полидипсией и полиурией.
Механизм развития. При гипертиреозе возрастают почечный кровоток и скорость клубочковой фильтрации (СКФ), усиливаются также процессы реабсорбции и/или секреции в почечных канальцах (Peterson, Randolph, 1989; Mackovic-Basic, Kleeman, 1991). Нарушения почечных функций неспецифичны для гипертиреоза, но азотемия характерна для кошек с этим заболеванием. Почечная недостаточность является одной из причин полиурии/поли-дипсии, но на фоне гипертиреоза она может проявляться позднее, так как возрастание почечного кровотока на некоторое время компенсирует нарушенную функцию почек (см. раздел «Госпитальная диагностика, азот мочевины и креатинин в крови»). Уменьшение перфузии почек после устранения гипертиреоза может «демаскировать» исходную почечную недостаточность.
У многих кошек с гипертиреозом полидипсия и полиурия развиваются в отсутствие признаков почечной недостаточности. Нарушение способности концентрировать мочу в таких случаях связано, вероятно, с повышением кровотока в мозговом веществе почек, что приводит к снижению концентрационного градиента по обе стороны мембраны канальцев (Spaulding, Utiger, 1981). У человека при тиреотоксикозе ограничение приема жидкости (до появления признаков обезвоживания) обычно выявляет нарушение способности почек концентрировать мочу. У некоторых больных снижается осмоляльность сыворотки, что указывает на первичное нарушение механизма жажды. Поскольку у таких больных имеет место непереносимость тепла в сочетании с физической и психической лабильностью, нельзя исключить и возможности первичной (психогенной) полидипсии в этих случаях.
Возбуждение, гиперактивность, агрессивное поведение и тремор
Признаки. Гипертиреоз часто сопровождается возбуждением и гиперкинезом, что обусловлено,
по-видимому, прямым влиянием тиреоидных гормонов на нервную систему. Это наблюдается как у человека, так и у кошек. При обследовании больных тиреотоксикозом у 76% из них обнаруживается тремор и у 3 8% - генерализованная гиперрефлексия (Duyff et al, 2000). «Нервозность» при гипертиреозе у кошек проявляется беспокойством, раздражительностью и/или агрессивным поведением (см. табл. 4-1). Многие больные кошки почти постоянно находятся в движении. Иногда у них отмечают дрожь или тремор. Удивительно, что владельцы животных часто не замечают этого. При опросе владельцев можно выяснить, что их кошки все время двигаются, мало спят и быстро просыпаются. В редких случаях наблюдаются очаговые или генерализованные судороги (Joseph, Peterson, 1993).
Механизм развития. Эмоциональная лабильность - один из наиболее ярких симптомов тиреотоксикоза у человека. Больные легко теряют самообладание и часто совершают хаотические движения. Они не могут сидеть спокойно, постоянно барабанят пальцами по столу, постукивают ногами и меняют позу. Их движения быстры, суетливы, размашисты и зачастую бесцельны (Utiger, 1987). Все это может отражать повышение адренергической активности, поскольку адреноблокаторы несколько смягчают такие проявления. Кровоток в головном мозге возрастает, но из-за уменьшения артерио-венозной разницы в содержании кислорода его поглощение тканью не меняется. Это соответствует данным об отсутствии влияния тиреоидных гормонов на потребление кислорода тканью головного мозга in vitro.
Понос, рвота и обильный стул
Описание признака. Нарушения функции ЖКТ чаще всего проявляются полифагией и потерей веса. Стул может быть частым, мягким, обильным и зловонным. Нередко возникает рвота (примерно у 40% кошек с гипертиреозом). Реже отмечают анорексию и водную диарею. Обычно это характерно для тяжелого гипертиреоза или независимых от него нарушений пищеварения. Боли в животе, возникающие у некоторых больных тиреотоксикозом, естественно не могут служить признаком гипертиреоза у кошек. Как и многие другие проявления этого заболевания у кошек, изменения со стороны ЖКТ в настоящее время отмечаются реже, чем в 1980-х годах (Broussard et al, 1995). Однако это не умаляет их диагностического значения.
Механизм развития. Рвота может быть результатом прямого действия тиреоидных гормонов на хеморецепторы триггерной зоны. У кошек, которые жадно или много едят, причиной рвоты может быть острое растяжение желудка. Рвота у кошек с гипертиреозом чаще наблюдается в тех случаях, когда они живут в окружении себе подобных, что заставляет их быстрее поглощать пищу. Одно из главных нарушений со стороны ЖКТ - усиление
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 169
перистальтики, приводящее к быстрому опустошению желудка и уменьшению времени прохождения пищи по тонкой и толстой кишке (Papasouliotis et al, 1993; Schlesinger et al, 1993). Это и лежит в основе учащения дефекации и поноса.
Примерно в 25% случаев тиреотоксикоза у человека и реже у кошек нарушаются процессы всасывания в кишечнике, в результате чего в стуле увеличивается количество жира. Это может быть связано и с избыточным потреблением жира из-за полифагии. Иногда возникают обратимые нарушения экзокринной функции поджелудочной железы, но недостаточность пищеварительных ферментов - относительно редкая причина стеатореи при гипертиреозе. Снижение секреции трипсина поджелудочной железой находят почти в 50% случаев тиреотоксикоза. Это может объясняться катехоламиноподобными эффектами тиреоидных гормонов.
Выпадение шерсти/неухоженность
Описание признака. У многих кошек с гипертиреозом наблюдаются изменения шерстяного покрова, хотя владельцы относительно редко обращают на это внимание. Неопрятное поведение животных приводит к появлению колтунов и себореи, тогда как чрезмерно частое «умывание» может вызывать облысение. Такого рода изменения отмечаются почти у 40% кошек с гипертиреозом (см. табл. 4-1). Как и многие другие признаки гипертиреоза, эти проявления в настоящее время обнаруживаются реже, чем несколько лет назад, причем некоторые авторы отмечают резкое снижение их частоты (с 50% в 1983 г до 9% в 1993 г.) (Peterson, 1995а; Broussard et al, 1995). Классическая двусторонняя и симметричная «эндокринная» алопеция без зуда наблюдается редко. Многие кошки демонстрируют неопрятное поведение и не приводят свою шерсть в порядок. Некоторые владельцы видели, как их кошки клочьями выдирали у себя шерсть (довольно редкий признак). Это может быть следствием непереносимости тепла - характерного признака тиреотоксикоза у человека.
Механизм развития. Кожные изменения при гипертиреозе у человека обусловлены ускорением синтеза белка, расширением сосудов и повышенной теплопродукцией. В результате кожа становится теплой и влажной. Характерно также истончение волос; иногда видны участки облысения. Типичное для тиреотоксикоза повышение температуры кожи можно прощупать на участках облысения и у кошек (см. раздел «Непереносимость тепла и стресса»).
Одышка и респираторный дистресс-синдром
Описание признака. Кошки обычно не дышат ртом, но это часто наблюдается при выраженной гипертермии, застойной сердечной недостаточнос
ти, заболеваниях дыхательных органов и гипертиреозе. Дыхание через рот, одышку или периодическую гипервентиляцию в покое отмечают более чем у 10% кошек с гипертиреозом. Эти признаки проявляются чаще (более чем в 20% случаев; см. табл. 4-1) во время стресса (при перевозке в машине, ограничении движений, кратковременной игре с другими кошками) и могут указывать на сердечную недостаточность.
Механизм развития. При гипертиреозе у человека наблюдаются уменьшение жизненной емкости легких, снижение их растяжимости и увеличение объема дыхания (Ingbar, 1991). Все это обусловлено слабостью дыхательной мускулатуры и повышенным образованием СО2. Парциальное напряжение кислорода (рО2) в альвеолах и артериальной крови, равно как и рСО2, обычно не изменяется. Дыхательная реакция на гипероксемию и гиперкапнию возрастает. Слабость дыхательной мускулатуры при гипертиреозе у кошек регистрируется на фоне гипокалиемии, что подчеркивает необходимость контролировать уровень калия в сыворотке крови (Nemzek et al, 1994).
Снижение аппетита (апатичный гипертиреоз)
Описание признака. Примерно у 14% кошек с гипертиреозом владельцы отмечают потерю аппетита (см. табл. 4-1). В некоторых случаях снижение аппетита или полная анорексия развиваются у животных, которые до этого месяцами отличались прожорливостью, и сочетаются с резким похуданием, истощением и слабостью мышц. Таким образом, снижение аппетита отражает прогрессирующее ухудшение состояния кошки. Иногда периоды полифагии чередуются с периодами анорексии.
Механизм развития. При тиреотоксикозе у человека плохой аппетит или анорексия наблюдаются в редких случаях. Эта форма заболевания у человека носит специальное название апатичного тиреотоксикоза и характеризуется безразличным отношением к окружающему и резко выраженной депрессией (Peake, 1986). Такие больные обычно крайне истощены. Отчасти это состояние связано с нарушением психики. Нередко имеет место и сердечно-сосудистая патология. Причиной депрессии и анорексии может быть характерная для тиреотоксикоза недостаточность тиамина (см. раздел «Физикальное обследование»),
У кошек со сниженным аппетитом и резкой слабостью часто выявляются сердечные аритмии и застойная сердечная недостаточность. Нередко, однако, играют роль и другие тяжелые нетиреоидные заболевания. Почти у всех кошек с апатичным гипертиреозом обнаруживают поражения почек, сердца или опухоли (Peterson, 2000). Как уже отмечалось, у небольшого числа таких животных наблюдается недержание головы, что может быть связано с тиаминовой недостаточностью, гипокали
170 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
емией или просто со слабостью мышц (рис. 4-3, Г) (Mooney, 1998а).
Слабость и сонливость
Описание признака. Менее чем у 15% кошек с гипертиреозом наблюдается снижение активности, слабость, утомляемость и сонливость (см. табл. 4-1). Некоторые животные становятся вялыми и слабыми лишь после того, как в течение 6-18 месяцев отличались гиперактивностью и беспокойством. В отдельных случаях владельцы раньше всего обращают внимание именно на слабость кошки. У одних животных с хроническим гипертиреозом наблюдаются приступы атаксии, другие все хуже и хуже прыгают. Иногда слабость выражена настолько, что кошку приходится кормить с рук, а в редких случаях - через зонд.
Слабость и утомляемость - частые спутники тиреотоксикоза у человека. На слабость мышц (преимущественно проксимальных мышц ног) жалуются 67% больных, а у 19% обнаруживаются симметричные нарушения чувствительности и снижение дистальных сухожильных рефлексов (Duyff et al, 2000). Больные быстро устают, и это мешает их обычной деятельности. Из-за слабости мышц шеи они часто ходят с опущенной головой. Объективные признаки локального поражения мышц обычно отсутствуют. В самых тяжелых случаях больные лишаются способности вставать со стула или кровати.
Механизм развития. Биохимическая основа мышечной слабости неизвестна; возможно, это простое следствие потери веса и усиления катаболических процессов. Иногда слабость развивается из-за гипокалиемии. У кошек с гипертиреозом и мышечной слабостью необходимо постоянно следить за концентрацией калия в сыворотке крови, чтобы вовремя начать соответствующее лечение (Nemzek et al, 1994). Мышечная слабость при тиреотоксикозе может быть связана также с нарушением фосфорилирования креатина в мышцах. Воспалительные изменения в биоптатах мышц обычно отсутствуют, хотя описаны случаи атрофии и инфильтрации мышц жировыми клетками и лимфоцитами. При электромиографии находят снижение длительности потенциалов действия и увеличение процента полифазных потенциалов. В некоторых случаях причиной мышечной слабости может быть недостаточность тиамина.
Непереносимость тепла и стресса
Описание признака. Некоторые владельцы кошек отмечают у своих питомцев непереносимость тепла. Здоровые кошки, как правило, укладываются спать на нагретых солнцем участках пола, вблизи радиаторов отопления, горящих каминов или на еще теплых капотах машин. Поэтому когда они спят в холодной ванне или на холодном полу,
то это сразу бросается в глаза (рис. 4-3,В). Хотя такое поведение наблюдается лишь у 5% кошек с гипертиреозом (см. табл. 4-1), некоторые владельцы говорят о том, что их питомцы всегда ищут холодные места.
В ряде случаев кошки не переносят не только жару, но и разного рода стрессы. Даже короткая поездка в машине, купание, посещение корабельной каюты или ветеринарной клиники вызывает у них резкую слабость. Они крайне чувствительны, и попытки обследования могут значительно ухудшать их состояние, вызывать нарушения дыхания или даже остановку сердца. Это всегда следует иметь в виду при проведении диагностических или лечебных процедур.
Механизм развития. Непереносимость тепла и неспособность справляться со стрессом - классические признаки тиреотоксикоза у человека. Избыточная теплопродукция проявляется небольшим повышением температуры тела, что можно наблюдать и у кошек. Многие эффекты избытка тиреоидных гормонов (усиление калоригенеза, гликогенолиза и липолиза, тахикардия) напоминают эффекты адреналина. Больше того, некоторые клинические проявления тиреотоксикоза, такие, как непереносимость тепла, усиленная потливость (у человека), тремор и тахикардия, становятся менее выраженными при применении антиадренер-гических средств, которые либо снижают запасы катехоламинов в тканях, либо блокируют их действие. Это может говорить о повышении адренергической активности при тиреотоксикозе. Однако синтез катехоламинов при этом заболевании не повышен, их содержание в сыворотке и активность дофамин-р-гидроксилазы снижены, экскреция с мочой нормальна. Тем не менее, тиреоидные гормоны увеличивают число адренорецепторов в некоторых тканях, что может повышать их чувствительность к катехоламинам.
Склонение головы
Симптом склонения головы упоминался в разделе «Снижение аппетита (апатичный гипертиреоз)» и рассматривается подробнее в разделе «Физикальное обследование».
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ Введение
Многие признаки заболевания, о которых говорят владельцы кошек, отчетливо видит и ветеринарный врач. Однако если такие проявления, как похудание, пятнистое облысение или изменение шерсти (см. табл. 4-1) более очевидны для владельца, то другие, как, например, гиперактивность более заметны ветеринару. Тщательное физикальное исследование позволяет выявить и дополнительные признаки гипертиреоза. Способность обнаруживать их может зависеть от опыта работы с животными (табл. 4-3).
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 171
ТАБЛИЦА 4-3. ДАННЫЕ ФИЗИКАЛЬНОГО ИССЛЕДОВАНИЯ КОШЕК С ГИПЕРТИРЕОЗОМ
Признак ПР°ЦСИТ
_________________________________________кошек
Пальпируемая щитовидная железа 91
Худоба 71
Тахикардия (> 240 уд/мин) 48
Гиперактивность / трудности при обслсдова-
48 НИИ
Сердечный шум 41
Кожные изменения (очаговая алопеция, колтуны, сухость, жирная себорея, истончение кожи)
Малый размер почек 26
Повышенная ректальная температура 14
Сердечный ритм галопа 12
Повышенная пугливость 12
Обезвоживание / кахектичный вид 11
Агрессивное поведение 8
Экстрасистолия 8
Отросшие когти 2
Угнетенное состояние / слабость 2
Недержание головы< 1
Рис. 4-4. На выстриженной передней поверхности шеи кошки виден крупный зоб (стрелка). Даже в таких случаях зоб можно нс выявить при физикальном обследовании.
Пальпируемое образование на шее (зоб)
Различия между нормой и гипертиреозом. У здоровых кошек доли щитовидной железы расположены позади и сбоку перстневидного хряща гортани, достигают своими нижними краями нескольких первых колец трахеи, и не пальпируются. При гипертиреозе же, непременно сопровождающемся увеличением одной или обеих долей железы (зобом), их удастся прощупать почти у 90% животных. Появление на шее пальпируемых образований не патогномонично иля гипертиреоза, так как они отмечаются у некоторых кошек без клинических признаков этого заболевания и могут вообще не иметь отношения к щитовидной железе. Однако поскольку у многих животных с такими образованиями, в конце концов, все же развиваются клинические признаки гипертиреоза, за этими кошками следует продолжать наблюдение (Graves, Peterson. 1990, 1992).
Доли щитовидной железы связаны с трахеей рыхлой соединительной тканью и поэтому при увеличении веса (вследствие аденоматозной гиперплазии или опухоли) могут опускаться в грудную клетку и располагаться в переднем средостении О загрудинном зобе следует думать при каждом случае гипертиреоза в отсутствие пальпируемого образования, хотя небольшой зоб, даже при его обычном расположении, удается прощупать далеко не всегда. Сама процедура тщательной пальпации у возбужденных животных сопряжена со значительными трудностями.
Методика пальпаторного исследования. Размеры и форму долей щитовидной железы у кошек определяют так же, как пальпируют подколенные лимфоузлы, осторожно манипулируя большим и указательным пальцем. Это необходимо делать при любом обследовании животных, так как иногда
можно обнаружить на шее ранее непредполагаемые образования. Кроме того, в процессе пальпации ветеринар приучает кошку к себе.
Голову кошки осторожно удерживают в приподнятом положении, а большой и указательный палец другой руки помещают по обе стороны трахеи в яремные бороздки у входа в грудную полость. Кончиками пальцев, не отрывая их от кожи и слегка надавливая, скользят вверх по трахее и обратно к входу в грудную клетку. Увеличенная щитовидная железа обычно прощупывается как относительно подвижный подкожный узелок (примерно вдвое меньше подколенного лимфоузла). В большинстве случаев гипертиреоза у кошек железа имеет размеры чечевичного зерна или косточки лимона. Однако иногда прощупываются и более крупные образования. В одном случае зоб достигал размеров 4x7 х 10 см (Hofmeister et al, 2001). Когда щитовидную железу удается прощупать, то она как бы «ускользает» из-под пальцев.
После смачивания шеи животного спиртом и ее натяжения зоб нередко становится заметным даже владельцам кошки. Нажим при этом должен позволять узелку скользить под пальцами, но в то же время быть достаточным для его прощупывания. Шерсть на шее для наглядности можно сбрить, а кожу смочить (рис. 4-4). Визуализация зоба позволяет проводить пальпацию с большей уверенностью.
Нарушения функции сердца
Тахикардия, сердечные шумы, экстрасистолия и ритм галопа. У многих кошек с гипертиреозом обнаруживаются признаки сердечного заболевания, включающие систолические шумы, тахикардию и ритм галопа. Реже отмечаются арит-
172 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
мии и признаки застойной сердечной недостаточности (одышка, глухие тоны сердца и асцит).
Из-за худобы животного тоны сердца становятся относительно громкими, что сразу позволяет заподозрить сердечное расстройство. Кроме того, у кошек часто отмечается тахикардия, особенно при сравнении с частотой сердечных сокращений у собак. Частый пульс (более 240 уд/мин) характерен не только для гипертиреоза, но и для возбужденного состояния животных, а также для некоторых первичных поражений сердца. На последние может указывать экстрасистолия в сочетании с дефицитом пульса, ритмом галопа, шумами в сердце и плевральным выпотом (приглушающим сердечные тоны), но то же самое может иметь место и при тиреотоксикозе. Экстрасистолы отражают, по-видимому, раздражение миокарда вследствие недостатка кислорода, а шумы - дилатационную или гипертрофичесекую форму кардиомиопатии, развивающейся при хроническом тиреотоксикозе. Галопирующий ритм может быть проявлением сердечной недостаточности любой этиологии. Таким образом, при тиреотоксикозе наблюдаются многие клинические признаки сердечного заболевания (см. табл. 4-3). Поэтому такие признаки у кошек зрелого возраста сразу же должны наводить на мысль о гипертиреозе. Нельзя упускать из виду и того, что гипертиреоз и заболевания сердца могут существовать одновременно.
При преобладании признаков сердечно-сосудистых или легочных заболеваний необходимо держать в уме полный перечень расстройств, требующих дифференциальной диагностики (в том числе и гипертиреоз). Такие сопутствующие признаки патологии сердца, как одышка, глухие тоны и асцит более характерны для первичного сердечного заболевания, чем для гипертиреоза. Тиреотоксикоз у кошек может сопровождаться различными нарушениями миокарда, особенно кардиомиопатией. При этом гипертрофическая ее форма встречается гораздо чаще, чем дилатационная. Любая форма кардиомиопатии может приводить к сердечной недостаточности, но при гипертиреозе у кошек причиной тяжелой сердечной недостаточности чаще бывает именно дилатационная форма кардиомиопатии (Jacobs, Panciera, 1992).
Как и многие другие клинические признаки гипертиреоза у кошек, сердечно-сосудистые нарушения в настоящее время встречаются реже, чем в 1980-х годах. Высокая настороженность в отношении гипертиреоза привела к тому, что это заболевание теперь диагностируется на более ранних стадиях развития и при менее тяжелых его проявлениях.
Механизм развития. Гипертиреоз сопровождается гипердинамической формой расстройства кровообращения, при которой возрастает минутный объем сердца и снижается сосудистое сопротивление. Это состояние обусловлено прямым действием тиреоидных гормонов на сердечную мышцу в сочетании с усилением симпатических влияний на мио
кард. Минутный объем возрастает также вследствие ускорения обменных процессов и повышения кислородных потребностей различных тканей. Низкое периферическое сопротивление кровотоку в сочетании с увеличением ОЦК (из-за задержки натрия и воды почками) приводит к перегрузке объемом, что и вызывает расширение полостей сердца. Увеличение его работы может приводить и к гипертрофии миокарда.
При гипертиреозе у человека возрастание частоты сердечных сокращений, ударного и минутного объема сердца происходит на фоне снижения периферического сопротивления. Эти изменения обусловлены положительным инотропным и хронотропным действием тиреоидных гормонов и ростом потребностей периферических тканей в кислороде (из-за характерного для тиреотоксикоза повышения основного обмена). Артерио-венозная разница по кислороду остается нормальной или даже уменьшается (Spaulding, Utiger, 1981). Несмотря на увеличения минутного объема сердца, региональный кровоток изменяется по-разному. Он возрастает в коже (из-за повышенной необходимости в теплоотдаче), мышцах, головном мозге и коронарном круге, но не в печени. Другие приспособительные механизмы, направленные на увеличение доставки кислорода к тканям, включают увеличение количества эритроцитов и концентрации в них 2,3-дифосфоглицерата.
Полагают, что инотропный и хронотропный эффекты тиреоидных гормонов обусловлены в основном активацией системы аденилатциклаза-цАМФ в миокарде вследствие повышения ее чувствительности к катехоламинам. Хотя тиреоидные гормоны могут активировать эту систему и независимо от катехоламинов, все же адренергическим механизмам принадлежит, по-видимому, важная роль в развитии многих сердечных нарушений при тиреотоксикозе, в том числе синусовой тахикардии и предсердных аритмий. Адреноблокаторы ослабляют гемодинамические проявления тиреотоксикоза, не влияя на уровень тиреоидных гормонов в крови. Повышенная концентрация последних может усиливать адренергические влияния на сердце либо за счет прямой активации симпатической нервной системы, либо за счет повышения чувствительности миокарда к таким влияниям. Концентрация катехоламинов в плазме и моче при тиреотоксикозе у человека не возрастает, и поэтому более вероятно повышение чувствительности к этим гормонам. Это может объясняться увеличением числа 0-адренорецепторов в сердце под действием избытка тиреоидных гормонов (Tse et al, 1980).
Тиреоидные гормоны индуцируют в сердце синтез миозина, обладающего повышенной АТФазной активностью (Chizzonite et al., 1982; bitten et al., 1982). Поскольку АТФазная активность миозина имеет прямое отношение к сократимости сердечной мышцы, это отчасти объясняет увеличение производительности миокарда при гипертиреозе.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 173
Гиперактивность и «легкая возбудимость»
Лишь около 40% владельцев кошек отмечают гиперактивность у своих питомцев при развитии у них гипертиреоза (см. табл. 4-1), тогда как, по мнению ветеринаров, это наблюдается более часто (см. табл. 4-3). Объективная оценка ветеринаров, по-видимому, более надежна. Владельцам кошек, наблюдающих за ними изо дня в день, трудно заметить постепенные изменения поведения животных. Кошки и в норме очень активны, и этот признак привлекает меньшее внимание владельцев, чем резкая потеря веса, рвота или понос. Некоторые кошки с гипертиреозом настолько возбудимы и слабы, что при ограничении их свободы, необходимом для обследования, взятия крови или рентгеноскопии, у них развивается коллапс. Об этом нельзя забывать.
Обезвоживание, кахексия, слабость
Описание признака. Потеря веса, вероятно, наиболее явный признак гипертиреоза. Неудивительно, что он отмечается более чем у 90% кошек с гипертиреозом. Этот классический признак легко обнаруживается и больше всего беспокоит владельцев животных. Однако частота кахексии (резкого истощения) и/или «обезвоживания» при гипертиреозе у кошек, которая в 1986 г. превышала 60%, за последние несколько лет снизилась примерно до 10% (см. табл. 4-3), что, по-видимо-му, объясняется появлением методов диагностики гипертиреоза у животных на более ранних стадиях заболевания. С кахексией связана и физическая слабость животных, которая может быть признаком как хронического гипертиреоза, так и сопутствующих заболеваний.
Механизм развития. Потеря веса сопровождается прогрессивным уменьшением эластичности и тургора кожи. Во многих случаях это принимают за признак умеренного или выраженного обезвоживания. Однако медленное расправление кожных складок у большинства животных связано не с обезвоживанием, а просто с потерей веса. Если все же заместительная жидкостная терапия необходима, то ее следует проводить медленно и при тщательном наблюдении за состоянием животного. Слабость может отражать характерную для хронического гипертиреоза атрофию мышечной ткани, но она развивается также при сердечных и многих других заболеваниях (например, при поражении почек и кишечника). Причиной слабости может быть и недостаточность тиамина или выраженная гипокалиемия.
Уменьшение размеров почек
Описание признака. Обнаруживаемое при пальпации уменьшение размеров почек характерно не для гипертиреоза, а для почечной недостаточности. При наличии у взрослой кошки полидипсии,
полиурии, потери веса, рвоты и анорексии следует предполагать первичную почечную недостаточность. Функция почек нарушена у многих старых кошек с гипертиреозом, и это делает клиническую картину более сложной. Как и признаки сердечных заболеваний, симптомы почечной недостаточности у старых кошек должны вызывать подозрение на тиреотоксикоз.
Клиническое значение. Как отмечалось выше (см. раздел «Полидипсия и/или полиурия»), нарушение почечной функции у кошек с гипертиреозом значительно затрудняет выбор лечения. Казалось бы, при легком гипертиреозе и нарушении функции почек у старых кошек снижать уровень тиреоидных гормонов в крови нельзя, так как это может уменьшать СКФ и способствовать нарастанию азотемии. Однако повышенная при гипертиреозе СКФ может ускорять наступление необратимых изменений в почках. Если так, то гипертиреоз должен способствовать развитию хронической почечной недостаточности (ХПН), и раннее его эффективное лечение должно замедлять прогрессирование патологии почек. Эти вопросы рассматриваются в разделе, посвященном терапии гипертиреоза. Однако еще до назначения постоянной терапии рекомендуется проверить влияние пероральных антитиреоидных средств на показатели почечной функции.
Симптом склонения головы (недостаточность тиамина или калия)
Описание признака. У небольшого числа кошек с гипертиреозом наблюдается выраженное склонение головы (вентрофлексия) (см. рис. 4-3,Г). Голову животного легко приподнять, но она тут же опускается вновь. Обычно этому сопутствует анорексия, легкая атаксия и мидриаз, т.е. характерные признаки тиаминовой или калиевой недостаточности. Симптом склонения головы отмечается и при повышении артериального давления у кошек, но неизвестно, существует ли между этими явлениями причинно-следственная связь. Если так, то артериальная гипертония могла бы быть причиной инсульта, сопровождающегося вентрофлексией головы (Maggio et al, 2000) (см. раздел «Артериальное давление и гипертония»).
Механизм развития. Витаминная недостаточность при гипертиреозе может быть следствием полиурии, нарушения всасывания в кишечнике, поноса, рвоты и анорексии. Недостаточность тиамина проявляется резким изменением физического состояния кошек, в том числе вентрофлексией головы. При дефиците этого витамина возникают повреждения в сером веществе ствола мозга (вокруг мозгового желудочка), архимозжечка и коры больших полушарий. Лечение тиамином следует проводить у каждой кошки с соответствующими проявлениями. Ежедневное внутримышечное введение тиамина гидрохлорида в дозе 1-2 мг обычно улучшает состояние животного. Парентеральное введение тиа
174
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
мина продолжают до тех пор, пока кошка не начнет есть нормально. После этого комплекс витаминов группы В добавляют в пищу животного в течение всего срока коррекции гипертиреоза.
При мышечной слабости (независимо от наличия симптома склонения головы) до начала лечения тиамином необходимо проверить концентрацию калия в сыворотке крови. Снижение уровня калия вследствие рвоты, поноса, анорексии или полиурии может вызывать те же клинические признаки, что и недостаточность тиамина. Исследование сыворотки позволяет быстро обнаружить гипокалиемию. Лечение в таких случаях проводят путем парентерального введения обогащенных калием растворов (Lievesly, Gruffydd-Jones, 1989; Willard, 1989; Nemzek et al, 1994).
Глазные симптомы
См. также раздел «Артериальное давление и гипертония».
Введение. Гипертиреоз является одной из наиболее распространенных причин артериальной гипертонии у кошек. Признаком системной гипертонии может быть ретинопатия, и при ее обнаружении необходимо искать причины и средства специфической терапии. При исследовании 69 кошек с гипертензивной ретинопатией у 38 причину гипертонии установить не удалось, у 26 из этих 38 животных имелась легкая азотемия, а у 12 функция почек оставалась нормальной. ХПН была диагностирована в 22 случаях, а гипертиреоз - в 5 (Maggio et al, 2000). Хотя гипертиреоз сопровождается ретинопатией не так часто, как «первичная» гипертония или хроническая почечная недостаточность, ветеринар должен учитывать возможность этого заболевания, когда к нему приносят внезапно ослепших кошек или животных с отеком, кровоизлиянием или отслойкой сетчатки (см. раздел «Артериальное давление и гипертония»).
Распространенность. При офтальмологическом исследовании (включая биомикроскопию со щелевой лампой и непрямую офтальмоскопию) 100 кошек с гипертиреозом и 30 контрольных животных не было обнаружено увеличения частоты глазных нарушений при гипертиреозе. Только у двух кошек с гипертиреозом имелись изменения сетчатки, которые можно было отнести на счет гипертензивной ретинопатии: кровоизлияние в сетчатку и ее частичное отслоение с выпотом в подлежащие ткани. Был сделан вывод, что при гипертиреозе у кошек глазная патология встречается редко (Van der Woerdt, Peterson, 2000).
ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ В КЛИНИКЕ
Введение
У кошек с гипертиреозом могут нарушаться функции многих органов и систем, причем это не обязательно связано с тиреотоксикозом (табл. 4-4).
ТАБЛИЦА 4-4. НАРУШЕНИЯ, ВЫЯВЛЯЕМЫЕ ПРИ РУТИННОМ ЛАБОРАТОРНОМ ОБСЛЕДОВАНИИ КОШЕК С ГИПЕРТИРЕОЗОМ
Показатель Процент кошек
Анализ крови
Эритроцитоз 39
Повышение гематокрита 27
Лейкоцитоз 19
Лимфопения 22
Эозинопения 13
Биохимический анализ сыворотки
Повышение аланинаминотрасферазы 85
Повышение щелочной фосфатазы 62
Азотемия (повышение уровня азота мочевины) 26
Повышение уровня креатинина 23
Г иперфосфатемия 18
Электролитные сдвиги 11
Г иперби лирубинемия 3
Гипергликемия 5
Анализ мочи
Удельный вес > 1,035 63
Удельный вес < 1,015 4
Глюкозурия 4
Признаки воспаления / инфекция 2
Ветеринар должен учитывать возможность сопутствующих заболеваний, поскольку некоторые из них требуют первоочередного внимания. Помимо диагностики гипертиреоза, необходимо провести исследования, помогающие выявить сопутствующую патологию. Минимальный набор таких исследований включает общий клинический анализ крови, биохимический анализ сыворотки крови, определение в ней концентрации Т4 и анализ мочи. Целесообразно также провести рентгенографию грудной клетки, снять ЭКГ, измерить артериальное давление (АД) и выполнить ряд других исследований. Хотя в последнее время гипертиреоз диагностируется на более ранних стадиях заболевания, еще до того, как владельцы животных заметят появление серьезных осложнений, тем не менее, относительная частота выявления сдвигов в лабораторных показателях за последние 5-10 лет почти не изменилась. Обычные лабораторные исследования позволяют диагностировать гипертиреоз с большой уверенностью и помогают обнаружить сопутствующие заболевания. Специфические пробы на функцию щитовидной железы дают надежные результаты и относительно недороги.
Общий клинический анализ крови (ОАК)
Эритроциты. При гипертиреозе у кошек число эритроцитов, гематокрит и другие параметры крови обычно не меняются (см. табл. 4-4). В 40-50% случаев все же можно обнаружить небольшое увеличение гематокрита (Broussard et al, 1995). Увеличение числа эритроцитов, по-видимому, прямо связано с тиреотоксикозом, поскольку это наблюдается
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 175
у человека, а также у собак, получавших большие дозы тиреоидных гормонов. Эритроцитоз может быть следствием как непосредственного влияния тиреоидных гормонов на красный росток в костном мозге, так и их эффекта, опосредованного 0-адрено-рецепторами. Тиреоидные гормоны стимулируют также продукцию эритропоэтина (Mooney, 1998а), который увеличивает содержание в крови макроэритроцитов, вызывая ускорение дифференцировки эритроцитов и сокращая время их созревания (Ре-schle, 1980).
Макроцитоз отмечается у 20% кошек с гипертиреозом (Broussard et al, 1995). Это объясняет увеличение гематокрита при нормальном числе эритроцитов и нормальной концентрации гемоглобина. Масса эритроцитов может возрастать в ответ на рост потребностей в кислороде или увеличение основного обмена. Повышение потребностей в кислороде может быть опосредовано через повышение секреции эритропоэтина. Кроме того, при тиреотоксикозе в эритроцитах возрастает содержание 2,3-дифосфоглицерата, который, связываясь с гемоглобином и стабилизируя его восстановленную форму, способствует диссоциации кислорода из гемоглобина.
Редко осложняющая гипертиреоз у человека анемия может быть следствием истощения костного мозга или недостаточности железа и других микроэлементов (Mooney, 1998а). У кошек образуются и тельца Гейнца (ChristophMer, 1989). При гипертиреозе у кошек анемия развивается крайне редко, и поэтому прежде чем начинать лечение гипертиреоза, необходимо выяснить ее причину.
Лейкоциты. У кошек с гипертиреозом можно обнаружить типичную стрессорную реакцию, характеризующуюся лейкоцитозом, нейтрофилией (со сдвигом влево), лимфопенией и эозинопенией. У наших животных нейтрофильный лейкоцитоз выявлялся не часто, а когда имел место, то обычно не был связан с активной бактериальной инфекцией.
Тромбоциты и свертывание крови. При тиреотоксикозе у человека количество тромбоцитов и механизмы свертывания крови не меняются. Однако зачастую повышается концентрация фактора VIII (возможно, вследствие адренергической активации). Это может способствовать внутрисосудистому тромбозу. Для гипертиреоза у кошек кровотечения, нарушения свертывания крови или тромбозы нехарактерны. Размеры тромбоцитов увеличиваются, но общее их количество и гематокрит остаются нормальными (Sullivan et al, 1993).
Анализ мочи
Результаты. Анализ мочи - интегральная часть диагностического исследования. Примерно в 33% случаев гипертиреоза у кошек обнаруживается повышение уровня азота мочевины или концентрации креатинина в крови. Часто отмечают также полидипсию и полиурию (см. табл. 4-1, 4-3 и 4-4). Все
это заставляет подозревать нарушение функции почек. Однако многие из таких изменений становятся понятными после подтверждения гипертиреоза. Удельный вес мочи колеблется от 1,006 до более 1,060.
Клиническое значение. Удельный вес мочи позволяет отличить преренальную уремию от первичного поражения почек и помогает диагностировать такие заболевания, как сахарный диабет и инфекции мочевых путей. У многих кошек с гипертиреозом анализ мочи выявляет некоторую степень почечной недостаточности; у меньшего их числа находят признаки инфекции или сахарного диабета. Как отмечалось выше, очень трудно решить, в каком случае лечение гипертиреоза окажет благоприятный эффект, а в каком лишь ухудшит состояние почек. В таких условиях требуется сугубая осторожность и тщательное наблюдение.
Биохимия сыворотки крови
Активность печеночных ферментов
Результаты. Изменение активности ферментов печени - один из наиболее частых биохимических сдвигов, обнаруживаемых при гипертиреозе у кошек (см. табл. 4-4). Активность аланинаминотрансферазы и щелочной фосфатазы в сыворотке крови повышена более чем в 75% случаев, а увеличение активности хотя бы одного из этих ферментов обнаруживают более чем в 90% случаев. Обычно такие сдвиги выражены слабо или умеренно (100—400 МЕ/л при норме 100 МЕ/л). Если активность этих ферментов превышает 500 МЕ/л, то следует предполагать серьезное сопутствующее заболевание. В таких случаях показаны УЗИ и биопсия печени. У некоторых кошек с высокой активностью печеночных ферментов в сыворотке мы при биопсии обнаруживали гепатохолангит или лимфосаркому. Столь же вероятна патология костной ткани.
Нарушение обмена костной ткани (костные изоферменты). Судя по результатам определений у человека, при тиреотоксикозе (независимо от его причины) имеется та или иная степень потери костной массы (Jodar et al, 1997). В сыворотке обычно находят повышение уровня костных изоферментов щелочной фосфатазы, остеокальцина, кальция и фосфора (Duda et al, 1988). Такое ускорение обмена костной ткани объясняют прямым действием тиреоидных гормонов на костные клетки.
При гипертиреозе у кошек активность щелочной фосфатазы в сыворотке возрастает за счет как костных, так и печеночных изоферментов (Homey et al, 1994). При исследовании 36 кошек со спонтанным гипертиреозом у всех было обнаружено повышение костных изоферментов щелочной фосфатазы. Уровень остеокальцина был повышен у 44% этих животных. Активность костных изоферментов щелочной фосфатазы и уровень остеокальцина не коррелировали с концентрацией Т4 в сыворотке. Общая концентрация кальция оставалась в пределах нор
176 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
мы, но в 50% случаев обнаруживалось снижение уровня ионизированного кальция в сыворотке (Archer, Taylor, 1996). Авторы этого и последующего исследований (Foster, Thoday, 2000) заключили, что гипертиреоз у кошек сопровождается нарушением обмена костной ткани, и что при гипертиреозе печень является лишь одним из двух источников щелочной фосфатазы сыворотки. Клинические проявления нарушенного обмена костной ткани при гипертиреозе у кошек не описаны.
Нарушения функции печени. Небольшие изменения показателей функции печени находят у 33-60% больных с гипертиреозом (Guriek et al, 1997; Biscoveanu, Hasinski, 2000). Повышение активности печеночных ферментов может зависеть от прямого токсического действия тиреоидных гормонов на печень, от нарушений питания и кровообращения, а также от сопутствующих инфекций. Главной причиной считают гипоксию печени. Потребление кислорода органами брюшной полости возрастает, хотя кровоток в этой области не увеличивается, что обусловливает возрастание артерио-венозной разницы по кислороду. Дефицит кислорода в условиях повышения основного обмена и недостаточности калорий приводит к истощению запасов гликогена в печени.
Нарушение функций печени может объясняться и застоем крови в этом органе из-за сердечной недостаточности. Изменения показателей функции печени у человека не препятствуют назначению антитиреоидных средств, и поэтому до излечения гипертиреоза не следует принимать специальных мер к их устранению (Utiger, 2002а). В отсутствие тяжелого тиреотоксикоза или застойной сердечной недостаточности печень обычно сохраняет нормальное гистологическое строение.
В биоптатах печени у кошек с гипертиреозом мы находили увеличенное содержание пигмента в гепатоцитах, агрегаты воспалительных клеток в портальной области и очаги жировой дегенерации. В отдельных случаях обнаруживались небольшие участки некроза. При тяжелом тиреотоксикозе иногда выявлялась жировая инфильтрация в центральных дольках наряду с участками фиброза в портальной области, лимфоцитарной инфильтрацией и пролиферацией желчных протоков. Жировые инфильтраты могут указывать на развитие липидоза печени, особенно у кошек с анорексией. Повышение активности аланинаминотрансферазы в сыворотке является специфическим показателем некроза печени как у человека, так и у кошек. Успешное лечение гипертиреоза обычно нормализует активность печеночных ферментов независимо от их происхождения (Mooney et al, 1992а).
Уровень глюкозы в крови
Результаты. У кошек при остром стрессе концентрация глюкозы в крови резко увеличивается, достигая 400-500 мг%. Считается, что это резуль
тат острого выброса адреналина. Гипертиреоз формирует хронический, а не острый стресс, и именно поэтому, вероятно, у большинства животных уровень глюкозы в крови остается в норме (см. табл. 4-4). В тех редких случаях (5%), когда у кошек с гипертиреозом находили концентрацию глюкозы в крови выше 200 мг%, одновременно имел место и сахарный диабет.
Механизм развития. У человека поддержание физиологических функций при характерном для тиреотоксикоза повышенном расходе энергии требует потребления большего количества пищи и кислорода, равно как и утилизации запасов энергетических веществ. Это изменяет углеводный, липидный и белковый обмен. Всасывание глюкозы в кишечнике и скорость ее образования из гликогена, лактата, глицерина и аминокислот увеличиваются. Повышенная утилизация глюкозы мышцами и жировой тканью приводит к истощению запасов гликогена в печени. Содержание глюкозы в крови и ответ инсулина на пероральную нагрузку глюкозой обычно остаются нормальными. Однако при гипертиреозе у кошек, как и у человека, можно обнаружить некоторое нарушение толерантности к глюкозе, обусловленное, вероятно, резистентностью периферических тканей к инсулину (Hoenig, Ferguson, 1989). Подобно диэструсу и гиперкортицизму, гипертиреоз усугубляет нарушения секреции инсулина. У кошек с предсуществующим сахарным диабетом ускоряется распад инсулина, что требует увеличения дозы экзогенного гормона (см. раздел «Фрукто-замин в сыворотке крови»).
Азот мочевины и креатинин
Результаты. Гипертиреоз у кошек может сопровождаться как увеличением, так и снижением почечного кровотока, СКФ, а также канальцевой реабсорбции и секреции. До начала лечения трудно определить, у кого из животных почечный кровоток повышен, а у кого снижен. Единственный клинический признак, который мог бы указывать на нарушение функции почек, это полиурия. Полидипсия, потеря веса и кажущееся обезвоживание у старых животных встречаются не только при гипертиреозе, но и при сахарном диабете, почечной недостаточности и других заболеваниях. Повышение уровня азота и креатинина в крови у кошек требует дифференциальной диагностики. Легкая или умеренная азотемия обнаруживается более чем в 25% случаев гипертиреоза (см. табл. 4-4). Особую трудность представляют вопросы лечения гипертиреоза у кошек с нарушенными показателями почечной функции. Более подробно эта проблема рассматривается ниже.
Механизм развития. Развитие азотемии при гипертиреозе обусловлено, вероятно, не одной, а несколькими причинами. Тиреоидные гормоны обладают диуретическим действием, и способность почек концентрировать мочу может нарушаться вследствие повышения почечного кровотока и сни
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 177
жения концентрации растворенных веществ в мозговом веществе почек. Однако важную роль может играть также усиленный распад белка и пререналь-ная уремия, обусловленная снижением минутного объема сердца. Некоторые животные страдают заболеванием почек одновременно с гипертиреозом, и почечная патология может маскировать проявления гипертиреоза. У других минутный объем снижен вследствие первичного заболевания сердца. Поэтому к каждому животному с гипертиреозом и азотемией следует подходить индивидуально. Поскольку у многих кошек со сниженной СКФ устранение гипертиреоза ухудшает функцию почек (Graves et al, 1994; DiBartola et al, 1996), рекомендуется пробное лечение тиамазолом. Если показатели почечной функции при этом улучшаются, то можно использовать более радикальные методы лечения гипертиреоза (операцию или радиойодтерапию). Если же эти показатели ухудшаются, то нужно попытаться подобрать такие меры для ослабления симптомов гипертиреоза, которые не усиливали бы азотемию.
Кальций, фосфор и паратиреоидный гормон (ПТГ)
Результаты. При исследовании 30 кошек с нелеченым гипертиреозом было обнаружено снижение концентраций ионизированного кальция и креатинина в плазме (Barber, Elliott, 1996). У большинства животных с гипертиреозом уровень общего кальция в сыворотке не менялся, но содержание фосфата и паратиреоидного гормона (ПТГ) было значительно повышено (см. табл. 4-4). У 77% кошек диагностирован гиперпаратиреоз, причем уровень ПТГ в плазме крови в 19 раз превышал верхнюю границу нормы. Как отмечалось выше, при гипертиреозе у кошек обнаруживается тенденция к повышению концентраций остеокальцина и 1,25-витамина D (Archer, Taylor, 1996). В связи с более ранней диагностикой гипертиреоза за последние 5-10 лет доля животных с гиперфосфатемией снизилась с почти 50% до 10-20%.
Азотемия или гиперфосфатемия у старых кошек с полиурией, полидипсией и потерей веса указывает на хроническую почечную недостаточность. Однако то же самое может быть следствием гипертиреоза. Азотемию при гипертиреозе обнаруживают чаще, чем изменения концентраций кальция и фосфора в сыворотке. Гиперфосфатемия выявляется не у всех кошек с почечной недостаточностью.
Механизм развития
Человек. Зависимость нарушений костного и минерального обмена от активности щитовидной железы достаточно сложна. Изменения структуры кости и обмена кальция и фосфора считаются следствием прямого действия тиреоидных гормонов на костную ткань. Отчасти эти изменения обусловлены повышением активности остеокластов и высвобождением кальция, что подтверждено опытами на
культуре ткани. Гистоморфометрия меченных тетрациклином биоптатов кости у больных тиреотоксикозом обнаруживает увеличение числа активно перестраивающихся костных единиц, что приводит к отрицательному балансу костной ткани (Eriksen et al, 1985). Это сопровождается высвобождением кальция, который по механизму отрицательной обратной связи угнетает функцию паращитовидных желез и обусловливает гипопаратиреоз (Fraser et al, 1991). Усиленная резорбция костного кальция может приводить к компенсаторному снижению концентрации 1,25-витамина D в сыворотке (Spaulding, Utiger, 1981). Снижение функции паращитовидных желез должно сопровождаться торможением всасывания кальция в ЖКТ, усилением экскреции кальция с мочой и калом и повышением реабсорбции фосфата в почечных канальцах. В результате уровень фосфата в сыворотке возрастает, а концентрация кальция остается нормальной или снижается. Определенную роль может играть и кальцитонин, который серетируется щитовидной железой и действует противоположно ПТГ.
Кошки. Результаты исследования 30 кошек с нелеченым гипертиреозом (Barber, Elliott, 1996) в корне отличаются от данных, полученных в наблюдениях на людях. У кошек в 77% случаев был обнаружен не гипо-, а гиперпаратиреоз, развившийся, по-видимому, вследствие гиперфосфатемии и снижения уровня ионизированного кальция в сыворотке. Сочетание эффектов избытка ПТГ и тиреоидных гормонов может иметь серьезные последствия для состояния костной ткани. Высокие концентрации фосфата способствуют кальцификации мягких тканей, что, в свою очередь, должно сказываться на функции почек. Однако, согласно литературным и нашим данным, костная патология и кальцификация мягких тканей для кошек с гипертиреозом не характерны. Таким образом, значение гиперпаратиреоза при гипертиреозе у кошек остается неясным.
Холестерин
При гипертиреозе у кошек концентрация холестерина в сыворотке крови обычно находится в норме. Клиренс холестерина и триглицеридов при гипертиреозе возрастает в большей степени, чем синтез этих соединений, что приводит к некоторому снижению их содержания в сыворотке. Одновременно усиливается и липолиз, в результате чего в плазме увеличивается концентрация свободных жирных кислот.
Общий белок и альбумин
Концентрация белков в сыворотке крови у кошек при гипертиреозе обычно не меняется. Хотя это и не имеет особого диагностического значения, но помогает исключить диагноз обезвоживания у некоторых очень худых и истощенных животных.
178 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Калий и натрий
По нашим данным, концентрации натрия и калия в сыворотке крови остаются нормальными почти у всех кошек с гипертиреозом. Если и обнаруживались изменения, то они, как правило, были незначительными, хотя при тяжелой гипокалиемии отмечалась резкая мышечная слабость, проявляющаяся в частности вентрофлексией головы. В случаях слабости мышц у кошек с гипертиреозом следует определять концентрацию электролитов в сыворотке и проводить лечение, направленное на коррекцию выявленных сдвигов. Общее содержание воды и калия в организме обычно снижено (вероятно, из-за уменьшения массы тела в результате потери жира), но содержание натрия имеет тенденцию к повышению.
Жирный стул (стеаторея)
У многих страдающих поносом кошек с гипертиреозом нарушены процессы всасывания в кишечнике, и в стуле содержится большое количество жира (стеаторея). Нарушения всасывания со стеатореей при тиреотоксикозе у человека объясняют относительной недостаточностью трипсина, вырабатываемого поджелудочной железой, а само снижение секреции панкреатических ферментов считается следствием катехоламиноподобных эффектов тиреоидных гормонов. Экскреция жира с калом зависит и от содержания жира в пище, и стеаторея особенно выражена у тех кошек, которые потребляют жирный корм (Peterson et al, 1983). У таких животных суточная экскреция жира с калом в 2-15 раз превышает верхнюю границу нормы. Процент жира, всасываемого в кишечнике, остается постоянным при любом его содержании в пище. Средний процент усвоенного жира рассчитывается по разнице между количествами потребленного и выведенного жира, деленной на количество потребленного жира. При тиреотоксикозе у кошек этот показатель значительно снижен (Peterson et al, 1983). Поэтому в механизме стеатореи играет роль характерная для тиреотоксикоза полифагия.
Уровень кортизола в плазме крови
В одном из исследований (Liu et al, 1984) у 33% кошек с гипертиреозом была обнаружена гиперплазия коры надпочечников, которая вообще-то редко наблюдается у этих животных. Секреция кортизола и альдостерона при тиреотоксикозе у человека возрастает вследствие ускорения метаболического клиренса этих гормонов. Поэтому гиперплазия коры надпочечников может представлять собой компенсаторную реакцию. Данные об уровне кортизола в плазме крови у кошек с гипертиреозом отсутствуют, но гипертиреоз редко сопровождается симптомами гиперкортицизма.
Уровень фруктозамина в сыворотке крови
Фруктозамин образуется в результате необратимой реакции между глюкозой и белками плазмы крови. Считается, что концентрация фруктозамина в сыворотке крови отражает средний уровень глюкозы за предшествующие 1-2 недели. Однако содержание фруктозамина зависит и от метаболизма сывороточных белков, и нарушение белкового обмена при гипертиреозе может сказываться на уровне фруктозамина. Проверка этого предположения показала, что концентрация фруктозамина в сыворотке при гипертиреозе у кошек значительно снижена (Reusch, Tomsa, 1999). Такое снижение было найдено у 50% гипертиреоидных кошек. При этом концентрация фруктозамина не зависела от содержания белков в плазме. Лечение гипертиреоза сопровождалось повышением уровня фруктозамина. Был сделан вывод, что снижение концентрации фруктозамина при гипертиреозе обусловлено ускорением распада белка и не зависит от содержания глюкозы в крови. Поэтому при развитии сахарного диабета на фоне гипертиреоза (или наоборот) концентрация фруктозамина в сыворотке не может служить надежным показателем тяжести течения или компенсации диабета. Этот показатель не позволяет также отличить сахарный диабет от стрессорной гипергликемии у кошек с гипертиреозом (Reusch, Tomsa, 1999).
Артериальное давление и гипертония
У старых кошек может развиваться гипертония (стабильный уровень систолического АД 160-170 мм рт. ст. или выше) (Henik, 1997). Истинная частота этого состояния неизвестна, поскольку АД может возрастать из-за испуга животного при доставке его в ветеринарную клинику («эффект белого халата») (Belew et al, 1999). Тем не менее, возможность развития гипертонии у кошек с ХПН, сердечно-сосудистыми заболеваниями, а также в отсутствие явной патологии (первичная гипертония) не вызывает сомнений. При гипертиреозе ее обнаруживают менее часто (Kobayashi et al, 1990; Littman, 1994; Bodey, Samson, 1998). На артериальную гипертонию у кошек указывает гиперемия кончиков ушей и слизистых. Более серьезными ее проявлениями могут быть поражения сетчатки глаз (кровоизлияния, отек, частичная или полная отслойка, дегенерация) (Stiles et al, 1994; Maggio et al, 2000; Elliott et al, 2001). У некоторых животных развиваются нарушения мозгового кровообращения («инсульт»), приводящие к потере ориентации, вестибулярным расстройствам, атаксии, судорогам, ступору, тремору, парапарезу и вентрофлексии головы.
У кошек из «группы риска» рекомендуется сразу же определять АД и исследовать глазное дно. К группе риска относятся и животные с гипертиреозом (независимо от наличия азотемии). Считается, что артериальная гипертония при гипертиреозе связана с активацией 0-адренорецепторов, приводящей
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 179
к тахикардии, повышению сократимости миокарда, системному расширению сосудов и стимуляции системы ренин-ангиотензин-альдостерон. Легкое или умеренное повышение АД было отмечено у 87% кошек с гипертиреозом (Kobayashi et al, 1990). Среди животных с артериальной гипертонией гипертиреоз встречается относительно редко. Кроме того, при обследовании большого числа кошек с гипертиреозом слепота не обнаруживалась (Peterson et al, 1983). Однако это исследование было проведено задолго до того, как начали измерять АД у гипертиреоидных кошек. Позднее при офтальмологическом исследовании (включая биомикроскопию со щелевой лампой и непрямую офтальмоскопию) у 100 кошек с гипертиреозом и 30 контрольных животных не было найдено разницы в частоте глазных нарушений (Van der Woerdt, Peterson, 2000). У двух кошек с гипертиреозом обнаруживались изменения в сетчатке, которые можно было отнести на счет гипертензивной ретинопатии (кровоизлияние и очаговая отслойка с выпотом в подлежащую ткань). Авторы заключили, что глазные нарушения при гипертиреозе - редкое явление.
Тем не менее, артериальную гипертонию следует подозревать у всех кошек с гипертиреозом и при малейшей возможности измерять у них АД. При обнаружении гипертонии нужно следить за АД и состоянием глаз в процессе лечения. Эффективным гипотензивным средством в таких условиях оказывается амиодипина бесулат, вводимый внутрь в дозах 0,625-1,25 мг каждые 12-24 ч (Henik et al, 1997; Maggio et al, 2000; Elliott et al., 2001). Исследуется действие и других гипотензивных средств.
Рентгенография
При тиреотоксикозе могут поражаться многие органы и системы, включая сердце, легкие, печень и почки. Для оценки состояния этих органов проводят рентгеновское исследование грудной и брюшной полостей. Учитывая частое поражение сердечнососудистой системы, особенно показана рентгенография грудной клетки. Ее следует проводить у животных с явными нарушениями дыхания, одышкой или удушьем, глухими тонами сердца, тахикардией или шумами в сердце.
Отличить кардиомиопатию от гипертиреоза достаточно трудно, и рентгенография грудной клетки не помогает этому. И при кардиомиопатии, и при гипертиреозе на рентгенограмме далеко не всегда имеются изменения. Почти в 50% случаев гипертиреоза обнаруживается та или иная степень кар-диомегалии. Гораздо реже (< 5%) находят признаки застойной сердечной недостаточности с отеком легких и/или выпотом в плевральную полость (рис. 4-5) (Jacobs et al, 1986). Несмотря на неспецифич-ность данных рентгенографии, они все же способствуют пониманию клинических проявлений у отдельного животного и выработке плана лечения. Обнаружив плевральный или перикардиальный вы
пот и отек легких, необходимо начать лечение независимо от наличия первичной или вторичной кардиомиопатии. Диуретические средства или прямое дренирование плевральной полости могут спасти жизнь животного (см. рис. 4-5).
Наиболее надежный метод определения типа кардиомиопатии в каждом отдельном случае - это ЭхоКГ (Bond, 1986; Jacobs et al, 1986; Jacobs, Pan-ciera, 1992). При гипертрофической кардиомиопатии обычно помогают диуретические средства и Р-адреноблокаторы (например, пропранолол). Дилатационная кардиомиопатия и застойная сердечная недостаточность требуют, помимо диуретиков, введения средств, повышающих силу сокращений миокарда (дигоксин). Поскольку оборудование для проведения ЭхоКГ есть не всюду, рекомендуется использовать рентгенографию и при обнаружении плеврального выпота проводить дренирование, а при отеке легких применять диуретические средства. Такой подход облегчает состояние большинства животных. В этих случаях целесообразно обратиться к помощи коллег, располагающих оборудованием для ЭхоКГ (см. ниже раздел «Эхокар-диграфия»).
Электрокардиография (ЭКГ)
Результаты. Гипертиреоз у кошек сопровождается рядом признаков поражения сердца - сонливостью, одышкой, тахикардией, экстрасистолией с дефицитом пульса, ритмом галопа, шумами в сердце, кардиомегалией и/или явной застойной сердечной недостаточностью. Все это отражается на ЭКГ. Регистрация ЭКГ имеет важное диагностическое значение не только при подтвержденном гипертиреозе, но и при подозрении на него. Некоторые изменения на ЭКГ подтверждают диагноз гипертиреоза, тогда как другие указывают на необходимость неотложной терапии независимо от их причины.
ЭКГ-сдвиги, наблюдаемые при тиреотоксикозе у кошек, перечислены в таблице 4-5 и показаны на рис. 4-6 - 4-8. Наиболее часто обнаруживается тахикардия (более 240 уд/мин) и повышение амплитуды
ТАБЛИЦА 4-5.
ЭЛЕКТРОКАРДИОГРАФИЧЕСКИЕ СДВИГИ У КОШЕК С ГИПЕРТИРЕОЗОМ ДО
ЛЕЧЕНИЯ
Изменения на ЭКГ Процент
_____________________________________________кошек
Синусовая тахикардия 42
Повышенная амплитуда зубца R (II отведение) 22
Отклонение электрической оси сердца вправо
(блокада правой ножки пучка Гиса)
Предсердные экстрасистолы 5
Отклонение электрической оси сердца влево
(передняя блокада левой ножки пучка Гиса)
Расширение комплекса QRS 4
Предсердная тахикардия или фибрилляция
предсердий
Желудочковые экстрасистолы 1
180 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Рис. 4-5. Приведенные рентгенограммы показывают, что 1) состояние кошек с тиреотоксикозом может быстро ухудшаться, особенно при стрессе, и 2) сердечная недостаточность при гипертиреозе затрудняет диагностику и лечение. А и Б. Боковая и дорсовентральная рентгенограммы грудной клетки кошки с гипертиреозом. Видна легкая кардиомегалия. В и Г. Развившийся у той же кошки через 3 дня респираторный дистресс-синдром потребовал срочной повторной рентгеногрфии. Видно уплотнение корней, указывающее на кардиогенный отек легких (стрелки). Д и Е. Снимки сделаны через 7 дней после первой рентгенографии и через 4 дня после начала лечения фуросемидом и пропранололом.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 181
Рис. 4-6. Электрокардиограмма кошки с тиреотоксикозом. Видно увеличение амплитуды зубца R во II о гве-дении (это наблюдалось во всех отведениях) и отклонение электрической оси на 30°, свидетельствующее об увеличении левых отделов сердца.
Рис. 4-7. Электрокардиограмма кошки с тиреотоксикозом. Видны нормальные амплитуды комплексов Р-QRS-T. В то же время при шписи ритма видны три предсердные экстрасистолы (стрелки) и учащение сердечных сокращений (300 уд/мин).
зубца R во II отведении (более 1,0 мВ), хотя в настоящее время такие изменения наблюдаются реже, чем в 1980-х годах (Boussard et al, 1995). Среди аритмий отмечаются предсердные и желудочковые экстрасистолы, а также фибрилляция предсердий. В более раннем исследовании находили также желудочковую тахикардию, бигеминию, преждевременное возбуждение желудочков и предсердную тахикардию (Peterson et al. 1983). Хотя бы одно изменение на ЭКГ обнаруживается более чем в 50% случаев
гипертиреоза у кошек, а два и больше - более чем в 33% случаев. Между частотой сердечных сокращений (ЧСС), увеличением амплитуды зубца R и исходным уровнем Т4 в сыворотке имеется тесная корреляция. Успешное лечение тиреотоксикоза устраняет большинство ЭКГ-сдвигов. Однако у некоторых животных нарушения сердечной деятельности сохраняются, и в этих случаях впоследствии обнаруживается гипертрофическая или дилатационная форма кардиомиопатии (застойная сердечная недо-
182 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
! . I
1 ! !
Рис. 4-8. Электрокардиограмма кошки с тиреотоксикозом. Вицна увеличенная амплитуда зубцов R и предсердная экстрасистола (стречка).
ста точность). Тиреотоксикоз при сопутствующем сердечном заболевании лечить особенно трудно.
Поскольку признаки сердечно-сосудистых нарушении иногда преобладают в клинической картине гипертиреоза, ЭКГ приобретает важнейшее диагностическое значение. Хотя ЭКГ не позволяет отличить первичное поражение сердца от вторичного, она помогае г понять причину некоторых симптомов, особенно аритмий. У старых кошек с заболеванием сердца необходимо проверять функцию щитовидной железы, а при гипертиреозе - состояние сердечно-сосудистой системы. Определение концентрации Т4 в сыворотке крови особенно показано при наличии клинических, ЭКГ или рентгенографических признаков гипертрофической кардиомиопатии у кошек среднего возраста или старых, особенно при на шчии у них других симптомов гипертиреоза - потери веса, полифагии, повышенной возбудимости или поноса (см. табл. 4-1 и 4-3).
Механизм развития. Синусовая тахикардия - самый частый признак, выявляемый на электрокардиограмме при тиреотоксикозе как у человека, так и у кошек (Williams, Braunwald, 1980). К факторам, изменяющим при гипертиреозе функцию сердца (и соответственно ЭКГ), относятся прямое действие тиреоидных гормонов на миокард, их взаимодействие с симпатической нервной системой, а также компенсаторные реакции (в ответ на изменение обмена веществ). Многие ЭКГ-сдвиги можно объяснить катехоламинзависимыми механизмами. Косвенным доказательством этому служит частичное устранение тахиаритмий при введении Р-адре-ноблокаторов в отсутствие влияний последних на уровень тиреоидных гормонов в крови (Bond, 1986; Jacobs, Pancicra, 1992). В сердце при тиреотоксикозе у человека и крыс часто находят очаги некроза, круглоклсточную инфильтрацию и фиброз. Эти
изменения объясняют и нарушения проводимости, выявляемые иногда при ЭКГ у кошек.
Эхокардиография (ЭхоКГ)
ЭхоКГ внесла радикальные изменения в диагностику и лечение сердечно-сосудистых заболеваний у собак и кошек. В зависимости от характера сердечной патологии и/или изменения объема полостей сердца и толщины их стенок различают 4 группы нарушений: 1) гипердинамию миокарда, 2) гипертрофическую кардиомиопатию, 3) застойную (дилатационную) кардиомиопатию и (4) отсутствие сердечной патологии (Bond, 1988; Jacobs, Panciera, 1992). ЭхоКГ позволяет оценить толщину стенок миокарда и межжелудочковой перегородки, форму и функцию клапанов, сократительную способность желудочков и предсердий, а также скорость и силу сердечных сокращений.
К числу изменений ЭхоКГ, часто обнаруживаемых при гипертиреозе у кошек, относятся гипертрофия левого желудочка, утолщение межжелудочковой перегородки и расширение левых отделов сердца. Повышенная сократимость миокарда проявляется ускоренным укорочением его круговых волокон и ускорением фракции выброса (рис. 4-9) (Bond et al, 1988). Дилатационная форма кардиомиопатии выявляется реже. Ее признаки включают снижение сократимости миокарда и выраженное расширение полостей желудочков. В таких случаях при рентгенографии часто обнаруживаются признаки застойной сердечной недостаточности (Jacobs et al, 1986; Bond et al, 1988).
Обнаружение «гипердинамии миокарда» подтверждает диагноз гипертиреоза. ЭхоКГ в сочетании с рентгенографией грудной клетки и ЭКГ помогает выработать план лечения. Изменения размеров
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
183
Рис. 4-9. А. Нсселсктивная ангиограмма кошки с гипертрофической кардиомиопатией, типичной для гипертиреоза. Левое предсердие (LA) расширено, полость левого желудочка мала, а папиллярные мышцы (стрелки) и стенки левого желудочка утолщены. Б. На ЭхоКГ по правой окологрудинной длинной оси видно легкое расширение левого предсердия (LA) и выраженное утолщение перегородки и стенки левого желудочка. LV - левый желудочек, АО - аорта. А, из: Рох PR: In: Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 3rd ed. Philadelphia, WB Saunders, 1989, p 1113; Б. из: Sisson DD, Thomas WP: In\ Ettinger SJ. Feldman EC (eds): Textbook of Veterinary Internal Medicine, 4’h ed. Philadelphia. WB Saunders, 1995. p 1019.
желудочков и предсердий, толщины их стенок и скорости сокращений миокарда были выявлены у 29 из 30 кошек с гипертиреозом (Bond et al, 1983). Длительное введение высоких доз Т4 здоровым животным вызывало массивную гипертрофию обоих желудочков; при этом вес правого желудочка возрастал на 60%, а вес левого - на 86%.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Диагностика гипертиреоза в ветеринарной практике достаточно сложна. Это состояние сопровождается
многочисленными проявлениями, не специфическими для тиреотоксикоза. Кроме того, часто обнаруживаются поражения других органов и систем, которые могут быть как первичными, так и вторичными. Результаты анализа крови, рентгенографии, ЭКГ и ЭхоКГ, как правило, также неспецифичны. Поэтому необходима высокая настороженность в отношении этого распространенного эндокринного заболевания, особенно у кошек старше 8 лег. Как следует из таблицы 4-6, список заболеваний, от которых следует дифференцировать гипертиреоз, весьма обширен.
ТАБЛИЦА 4-6. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПЕРТИРЕОЗА У КОШЕК
Возможные заболевания Основные признаки, встречающиеся и при runepnipeoie
Нетиреоидные эндокринные заболевания Сахарный диабет Гиперкортицизм (редко) Несахарный диабет (редко) Акромегалия (редко Почечные заболевания Полидипсия, полиурия, полифагия, потеря веса Поли дипсия, полиурия, полифагия, потеря веса Полидипсия, полиурия, небольшая потеря веса Полидипсия, полиурия, полифагия Полидипсия, полиурия, анорексия, потеря веса, повышение
Заболевания сердца и сердечная недостаточность Гипертрофическая кардиомиопатия Дилатационная кардиомиопатия Идиопатическая аритмия уровня азота мочевины в крови Респираторный дистресс-синдром, потеря веса, тахикардия, шум, аритмия, рентгенолог ические изменения, ЭКГ- и ЭхоКГ-сдвиги нсспецифичны для гипертиреоза
Заболевания желудочно-кишечного тракта Экзокринная недостаточность поджелудочной железы Диффузные поражения желудочно-кишечного тракта Воспалительные Рак (включая лимфосаркому) Заболевания печени Воспалительные Рак Легочные заболевания Обильный зловонный стул, потеря веса, полифагия Понос, рвота, анорексия, хроническая потеря веса Повышение активности печеночных ферментов Респираторный дистресс-синдром, удушье
184 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Рис. 4-10. Средние величины и колебания уровней Т4 (Л) и Т (Ь) в сыворотке крови при их однократном определении у кошек с гипертиреозом. У 75°о животных показатели находятся в прямоугольниках, причем средние величины лежат в пределах ограничительных линии. Обратите внимание, что практически у всех кошек с гипертиреозом уровень Т4 в сыворотке повышен или находится на верхней границе нормы тогда как уровень является менее чувствительным показателем. Затемненная область - диапазон нормальных значений, а светло-серая - «пограничная» или «диагностически незначимая» область.
КОНЦЕНТРАЦИЯ ТИРЕОИДНЫХ ГОРМОНОВ В СЫВОРОТКЕ КРОВИ (ПОДТВЕРЖДЕНИЕ ДИАГНОЗА)
Базальный уровень общего тироксина (Т4) в сыворотке крови
Значение показателя. В ветеринарии функцию щитовидной железы оценивают обычно по концентрациям Т4 и Т3 в сыворотке крови. Хотя эти концентрации могут меняться и в отсутствие заболевании щитовидной железы (Utiger, 1980; L arsen ex al, 1981), по уровню Т4 в сыворотке, даже при однократном его определении, можно с уверенностью судить о наличии у кошек гипертиреоза. Наши и литературные данные свидетельствуют о том, что этот показатель надежнее отражает наличие гипертиреоза, чем концентрация Т3 (рис. 4-10) (Broussard et al, 1995; Peterson, 1995a). В коммерческих ветеринарных лабораториях определение уровня Т4 в настоящее время входит в число обязательных биохимических исследований сыворотки. Это оказывает существенную помощь ветеринарным врачам.
С накоплением опыта удалось выработать общую точку зрения, согласно которой критериями гипертиреоза у кошек являются: 1) наличие клинических признаков, соответствующих данному заболеванию, 2) пальпируемый узел в шитовидной железе и 3) повышенная концентрация Т4 в сыворотке крови. Таким образом, при подозрении на гипертиреоз начинать исследования следует с определения именно базальной концентрация Т4 в сыворотке. Существует общее мнение, что методы определения Т3 не обладают чувствительностью,
необходимой для надежного скринингового теста. По данным недавнего исследования, уровень общего Т4 в сыворотке превышал норму в 91° о случаев гипертиреоза у кошек и лишь в 9е о случаев оставался в пределах нормальных величин (Peterson et al, 2001). Концентрация же Т3 в сыворотке оказалась повышенной только у 67% животных с гипертиреозом, а у 33% не выходила за пределы нормальных колебании. Современные рекомендации сводятся к тому, что при нормальном уровне Т4 у кошек с подозрением на гипертиреоз следует, во-первых, провести повторное определение этого гормона и, во-вторых, определить концентрацию свТ4 в сыворотке (рис. 4-11).
Методы определения. Методы определения Т4 в сыворотке крови широко доступны. В большинстве коммерческих лабораторий использует наборы РИА для определения Т4 у человека. Пригодность многих из них для определения Г4 у кошек не вызывает сомнений. В настоящее время все большую популярность приобретают неизотопные автоматизированные системы определения этого гормона. Ветеринарам совершенно необходимо знать нормативы, разработанные в тех лабораториях, куда отсылаются пробы сыворотки, а не ориентироваться на литературные данные. В каждой лаборатории должны быть получены свои нормативы для каждого набора.
При явном гипертиреозе можно использовать и полуколичественные методы определения уровня Т4 (Mooney, 1998а). Однако в одном из исследований были обнаружены существенные расхождения результатов, получаемых методом твердофазного
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 185
Диагноз Подозрение сохраняется?
исключен (а) Определение свТ4
(б) Выждать нескольких месяцев а)Определить уровень общего Т4 б) Определить уровень свободного Т4
(в) Сканирование щитовидной железы
Рис. 4-11. Алгоритм диагностики гипертиреоза у кошек
иммуноферментного анализа и РИА (Lurye et al, 2002). По мнению авторов, «домашний» набор для иммуноферментного анализа не обладает достаточной точностью.
Колебания уровня Т4 в сыворотке крови. Результаты однократного определения концентрации Т4 в сыворотке подтверждают диагноз гипертиреоза у кошек более чем в 90% случаев, особенно при наличии соответствующих клинических признаков. Хотя уровень Т4 у кошек с гипертиреозом колеблется в значительных пределах, он все же постоянно превышает норму (Peterson et al, 1987а). Иными словами, при всех колебаниях концентрации Т4 в сыворотке у животных с гипертиреозом, даже самая низкая концентрация этого гормона намного превышает норму (рис. 4.12). Поэтому, с диагностической точки зрения, колебания уровня Т4 не имеют значения. Исключение составляют кошки с легким гипертиреозом (т.е. минимальными клиническими признаками заболевания). В этих случаях концентрация Т4 может и не выходить за пределы нормальных колебаний. Диагноз гипертиреоза нельзя исключать, исходя только из «нормального»
уровня Т4, особенно при наличии соответствующих клинических признаков и пальпируемого образования на шее. Прежде чем исключить этот диагноз, необходимо повторить (и, возможно, не один раз) определения Т4 и свТ4 или использовать другие подходы к исследованию функции щитовидной железы (например, супрессивный тест с Т3).
«Нормальный» уровень Т4 у кошек с подозрением на гипертиреоз
Что считать нормой? Согласно данным недавних обзоров, «нормальная» концентрация Т4 в сыворотке обнаруживается при первом исследовании у 2-10% кошек с подтвержденным гипертиреозом (McLoughlin et al, 1993; Broussard et al, 1995; Peterson et al, 2001). Это может быть связано с недостаточным пониманием подходов к установлению «нормальных» границ колебания показателя во многих лабораториях. По данным нашей лаборатории, например, нормальные уровни Т4 в сыворотке у кошек колеблются в пределах 0,8-2,0 мкг%. У очень небольшого процента здоровых
186 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Рис. 4-12. Флуктуации концентрации Т4 в сыворотке крови у кошек с гипертиреозом. Концентрация Т4в сыворотке крови колеблется и у здоровых и у гипертиреоидых кошек. При значительном повышении уровня Т4 все его величины обычно находятся выше границ нормальных колебании {штриховая циния), но у кошек с «пограничными» значениями уровня Т4 его величины могут оказаться «диагностически незначимыми» и лишь иногда превышать норму {пунктирная или сплошная зиния). Темно-серая область--диапазон нормальных колебаний; светло-серая - область «диа( ностичсски незначимых» показателей.
животных этот уровень превышает 2,0 мкг0о, но не достигает 5,0 мкг%. Для гипертиреоза характерны величины более 5 мкг%. Однако у гипертиреоидных кошек концентрация Т4 может быть и в пределах 2,0-5,0 мкг%. Такие величины мы считаем «сомнительными» или «пограничными», поскольку они встречаются в норме, при гипертиреозе, а также при других тяжелых заболеваниях на фоне гипертиреоза. При обнаружении таких концентраций Т4 диагноз гипертиреоза следует подтверждать данными анамнеза и физикального обследования, а также на основании клинического опыта врача.
Почему при гипертиреозе у кошек концентрация т4 может быть «нормальной»? Нормальные или «пограничные» концентрации Т4 в сыворотке
(1,5-4,0 мкг%) у многих кошек с гипертиреозом могут объясняться тем, что исследование проводится на ранних стадиях заболевания или при слабой его выраженности. Не исключено, что по мере прогрессирования гипертиреоза концентрация Т4 будет возрастать и в конце концов достигнет диагностически значимого уровня (Graves, Peterson, 1992; Peterson, 1995а).
Следует подчеркнуть, что ни один лабораторный показатель не обладает такой надежностью и убедительностью, как данные анамнеза и физикального обследования. Если эти данные убеждают ветеринара в наличии у кошки гипертиреоза, то диагноз нельзя отвергать на основании «сомнительной» концентрации Т4 в сыворотке, и анализ необходимо повторить. И наоборот, в отсутствие клинических данных, указывающих на гипертиреоз, к результатам лабораторных исследований следует подходить скептически.
«Нормальные» концентрации Т4 в сыворотке у животных с клиническими признаками гипертиреоза могут объясняться либо колебаниями уровня гормона, либо снижением его концентрации под влиянием сопутствующих нетиреоидных заболеваний (Peterson, 1995а). Первая возможность рассматривалась выше. Что же касается второй, то у любой тяжело больной кошки, у которой концентрация Т4 в сыворотке крови близка к верхней границе нормы, следует подозревать гипертиреоз (Mooney, 1998; см. следующий раздел).
Влияние нетиреоидных заболеваний на уровень общего Т4 в сыворотке крови. При исследовании 98 кошек без заболеваний щитовидной железы (эутиреоз) в одном случае была найдена несоответственно высокая концентрация Т4 в сыворотке (в «пограничных» пределах), в 21 случае - низкая концентрация гормона и в остальных 78 -абсолютно нормальная (Mooney et al, 1996а). По другим данным, среди 221 больной кошки в состоянии эутиреоза повышенная концентрация Т4 в сыворотке не была выявлена ни у одного животного, а у 38% кошек уровень гормона был снижен (рис. 4-13) (Peterson et al, 2001). Таким образом, нетиреоидные заболевания могут снижать концентрацию Т4 в сыворотке. Остается неясным, однако, снижают ли они уровень гормона и при гипертиреозе, как предполагается некоторыми авторами (Peterson, Gamble, 1990). Из 110 кошек с гипертиреозом у 14 концентрация Т4 в сыворотке колебалась в пределах 2,5—4,0 мкг%, причем у 10 из этих 14 животных обнаружены сопутствующие заоолевания (McLoughlin et al, 1993). Их устранение сопровождалось повышением концентрации общего Т4 до «гипертиреоидного» уровня.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 187
Выводы (см. рис. 4.11). При подозрении на легкий гипертиреоз у кошек с «сомнительными» концентрациями Т4 в сыворотке рекомендуется повторить анализ, а также исключить нетиреоидные заболевания. Поскольку концентрация тиреоидных гормонов колеблется нс по часам, а по суткам, повторные определения следует производить лишь через несколько дней или недель после получения первого результата (Peterson et al, 1997а). Если уровень Т4 остается «сомнительным», а подозрения на гипертиреоз сохраняются, то следует повторить анализ после устранения любого негиреоидного заболевания, определить концентрацию свТ4 в сыворотке или провести стимулирующую пробу с ТРГ.
Базальный уровень трийодтиронина (Т3) в сыворотке крови
Трийодтиронин (Т3) - биологически активный тиреоидный гормон. Однако щитовидная железа собак и кошек секретирует в основном Т , который превращается в Т в периферических клетках. Поэтому Т4 можно считать «прогормоном» или предшествен-
Рис. 4-13. Концентрации Т( в сыворотке у 172 клинически здоровых кошек, 917 кошек с нелеченым гипертиреозом и 221 кошки с нетиреоидными заболеваниями. В прямоугольниках заключены показатели с 25-го по 75-ыи процентиль, или средняя половина всех показателей. Горизонтальные линии в прямоугольниках - медиана. Т-образными линиями над и под каждым прямоугольником ограничены основные массивы данных; в большинстве случаев эти линии совпадают с границами колебания показателя. Величины, выходящие за эти пределы, показаны кружочками. Затемненная область -диапазон нормальных колебаний уровня Т4 в сыворотке. Из: Peterson ME et al, J Am Vet Med Assoc 218:529, 2001.
ником T3 (см. гл. 3). Результаты однократного определения концентрации Т4 в сыворотке крови дают наиболее надежное представление о функции щитовидной железы у кошек с подозрением на гипертиреоз (Peterson et al, 1988; McLoughlin et al 1993). Концентрация T в сыворотке остается нормальной у 25-33% животных с подтвержденным гипертиреозом (см. рис. 4-10), и одновременное с Т4 определение этого гормона не имеет никаких диагностических преимуществ перед определением одного Т4.
Базальный уровень свободного Т4 (свТ4) в сыворотке крови
Введение. В большинстве коммерческих лабораторий у собак и кошек определяют концентрацию общего Г в сыворотке. Это показатель суммарного содержания связанного с белками (более 99% общего его количества) и свободного гормона (менее 1%). Однако в клетки проникает только свободная фракция Т4, и именно она представляет собой «активный» гормон (или активный «нрогормон» для Т3). На концентрацию тиреоидных гормонов в сыворотке крови влияют многие заболевания, не затрагивающие непосредственно функцию щитовидной железы (нетиреоидныезаболевания). Концентрация общего Т зависит от состояния обмена веществ, связывания гормона с транспортными белками плазмы крови, поступления его в клетки и связывания с внутриклеточными белками. Общепринято, что определение концентрации свободного гормона (свТ4) в сыворотке позволяет исключить влияние нетиреоидных заболеваний и получить более точное представление о функции щитовидной железы, чем лает определение уровня общего гормона.
Методы определения. Наиболее надежным методом определения концентрации свТ, считается метод равновесного диализа. Другие методы, особенно с использованием аналогов гормона, дают лишь приблизительные результаты (Paradis, Page, 1996; Mooney, 1998а). С увеличением их надежности и уменьшением стоимости анализов такие альтернативные методы будут, по-видимому, применяться шире.
Результаты: специфичность и чувствительность. В одном из ранних исследований у всех кошек с гипертиреозом находили повышенные концентрации Г. в сыворотке, но результаты определения свТ4 были не столь постоянными (Ferguson et al, 1989). Позднее, однако, показано, что определение концентрации св Г. (диапазон нормальных концентраций от 15 до 48 пмоль/л) методом равновесного ниализа позволяет диагностировать гипертиреоз у кошек с «пограничными» значениями уровня общего Т. (Peterson et al, 1995). Диагностически значимые (повышенные) концентрации общего Т4 обнаруживались у 60° о из 26 обследованных животных, тогда как повышенные уровни свТ4 (от 41 до 144 пмоль/л) - в 96% случаев. По данным того же исследования, концентрация св Г оказалась
188 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
повышенной у 5% кошек с нормальной функцией щитовидной железы, но тяжелыми нетиреоидными заболеваниями.
О значении определений уровня свТ4 у кошек свидетельствуют еще две публикации. В общей сложности обследовали 319 больных животных с эутиреозом. Гипертиреоза не было ни у одной кошки. «Пограничный» (т.е. чуть повышенный) уровень обще! о Т4 в сыворотке был обнаружен только в о (ном случае, а концентрация свТ4 оказалась повышенной у 25 из 319 кошек (8%), т.е. результаты определения свТ4 в этих случаях противоречили диагнозу (Mooney et al, 1996а; Peterson et al, 2001). Следует также напомнить, что уровень общего Т4 был повышен у 91°о кошек с подтвержденным гипертиреозом (91% правильных и 9% ошибочных результатов), в то время как концентрация свТ4 была повышена у 98,5° о этих животных (1,5% ошибочных результатов) (Peterson et al, 2001). Таким образом, уровень свТ4 в сыворотке - более чувс-твите (ъный показатель гипертиреоза у кошек, т.е. у животных с этим заболеванием повышенные концен грации свТ4 обнаруживаются чаще, чем повышенные уровни общего Т4. Однако по специфичности этот показатель уступает уровню общего Т , так как его повышение может иметь место и у животных без гипертиреоза (рис. 4-14).
Норма Гипертиреоз Другие заболевания
Рис. 4-14. Концентрации свТ4 в сыворотке у 172 клинически здоровых кошек, 917 кошек с нелеченым гипертиреозом и 221 кошки с нетиреон изыми заболеваниями. Данные представлены как на рис. 4.13. (Из: Peterson ME et al, J Am Vet Med Assoc 218:529, 2001).
Выводы. Определение концентрации свТ4 в сыворотке методом равновесного диализа помогает установить диагноз при сильном подозрении на гипертиреоз в тех случаях, когда уровень общего Т4 при повторных его определениях не выходит за пределы нормальных колебаний (см. рис. 4-11). У таких животных, как правило, имеется «легкий» гипертиреоз (рис. 4.15) (Peterson et al, 2001), и определение концентрации свТ4 в этих случаях подтверждает диагноз. В то же время нельзя упускать из виду, что энный показатель менее специфичен, и его повышение может иметь место и у кошек с нетиреоидными заболеваниями. Тем не менее, определения концентрации св Г4 широко и с успехом применяются на практике (Peterson et al, 1995, 2001).
Проба с Т3 на подавление функции щитовидной железы
История вопроса. У человека при подозрении на гормональную недостаточность издавна проводят провокационные (стимулирующие) пробы, а при подозрении на избыток гормонов - пробы на подавление функции соответствующих эндокринных желез (супрессивные пробы) (Utiger, 1986). При нормальном состоянии гифизарно-тиреоидной системы введение тиреоидных гормонов подавляет секрецию гипофизарного ТТГ (отрицательная обратная связь) и тем самым должно снижать продукцию эндогенных тиреоидных гормонов. В норме введение Г, снижает концентрацию Т4 в сыворотке. Это надежно отражает угнетение функции щитовидной железы, так как Т3 в организме не превращается в Т .
При гипертиреозе секреция тиреоидных гормонов автономна, т.е. не зависит от регуляторных влиянии гипофиза. Введение Т3 при гипертиреозе не должно сказываться на концентрации Т4 в сыворотке крови, так как секреция Т'11 и без того угнетена. Супрессивная проба с Т3 помогает отличить
Рис. 4-15. Концентрации T4, T3 и свТ4 в сыворотке у 205 кошек с легким гипертиреозом (т.е. с уровнем Т4 менее 66 нмоль/л). Данные представлены как на рис. 4.13. Из. Peterson ME et al., J Am Vet Med Assoc 218: 529, 2001.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 189
ТАБЛИЦА 4-7. ОБЫЧНО ПРИМЕНЯЕМЫЕ СХЕМЫ ИССЛЕДОВАНИЯ ФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У КОШЕК*
Супрессивная проба с Т3 Стимулирующая проба с ТТГ Стимулирующая проба с тиролиберииом
Препарат Цитобин Бычий или человеческий ТТГ Тиролиберин
Доза 25 мг каждые 8 ч. Всего 7 доз 0,5 МЕ/кг (бычий) 0,025 - 0,2 мг (человеческий) 0,1 мг/кг
Способ введения Перорально В/в В/в
Время отбора крови До и через 2-4 ч после последней дозы 0 и 6 ч 0и4ч
Определяемый показатель Интерпретация Общие Т3 и Т4 Общий Т4 Общий Т4
а) эутиреоз < 20 нмоль/л со снижением > 50% > 100% > 60%
б) гипертиреоз > 20 нмоль/л ± снижение < 50% Практическое отсутствие подъема выше исходного уровня < 50%
Ссылки Peterson et al., 1990 Mooney et al., 1996 Peterson et al., 1994
Ориентировочные величины. Каждая лаборатория должна исходить из собственных показателей «нормы». В/в - внутривенно; ТТГ - тиреотропин, ТРГ - тиреотропин рилизинг-гормон
животных с нормальной гипофизарно-тиреоидной системой от тех, у кого секреция тиреоидных гормонов происходит автономно, т.е., вероятно, имеется гипертиреоз. Положительным фактором является относительно короткий период полужизни Т3 в сыворотке кошек (6^8 ч) (Broome et al, 1987; Hays et al, 1988; Peterson et al, 1990).
Протокол. Вначале берут пробу крови для определения уровней Т4 и Т3 в сыворотке крови. Затем владельца кошки инструктируют относительно правил введения Т3 (лиотиронин (цитомель), Jones Medical Industries, США). Начиная со следующего утра, Т3 следует вводить внутрь по 25 мкг три раза в сутки в течение 2 суток. На третьи сутки утром вводят седьмую дозу Т3 (25 мкг), и кошку вновь приносят в клинику для отбора второй пробы крови. Кровь берут через 2-4 ч после введения последней (седьмой) дозы лиотиронина (Peterson et al, 1990) и опять определяют концентрации Т3 и Т4в сыворотке. Во избежание возможных ошибок, связанных с использованием разных наборов, пробы крови, полученные до и после введения лиотиронина, следует направлять в лабораторию одновременно (табл. 4-7).
Интерпретация результатов
Изменение уровня Т4 в сыворотке крови. У здоровых кошек концентрация Т4 в сыворотке после семикратного введения лиотиронина резко падает. При тиреотоксикозе такого снижения практически не происходит. Аналогичные результаты наблюдаются даже у животных с легким гипертиреозом, у которых исходный уровень Т4 в сыворотке находится на верхней границе нормы или лишь незначительно превышает ее (рис. 4-16 и 4-17). У здоровых кошек концентрация Т4 после введения Т3, как правило, не достигает 1,5 мкг%, а у животных с гипер
тиреозом - превышает 2,0 мкг%. Концентрации в интервале 1,5- 2,0 мкг% следует считать диагностически незначимыми. Процент снижения уровня Т4 - показатель менее надежный, чем абсолютные величины, хотя снижение более чем на 50% наблюдается только в отсутствие гипертиреоза (Peterson et al, 1990; Refsal et al, 1991). Предложенная для расчета «нормального» ответа Т4 формула (уровень Т4 после введения Т3 - 10,5 х уровень Т4до введения Т ) (Refsal et al, 1991) не повышает ни надежности, ни чувствительности или специфичности диагностики (рис. 4-18). Как и для любого эндокринного показателя, каждая лаборатория должна устанавливать собственные нормативы, а не ориентироваться на данные литературы.
Изменение уровня Т} в сыворотке крови. Концентрацию Т3 в сыворотке определяют не для оценки состояния гипофизарно-тиреоидной системы, а лишь для проверки правильности введения лиотиронина. При правильно проведенной пробе концентрация Т3 должна возрастать у всех кошек независимо от функции их щитовидной железы (рис. 4-19). Если реакция Т4 отсутствует, но уровень Т3 не возрастает, то владелец кошки, по-видимому, не выполнил условия проведения пробы, и ее результатам доверять нельзя (Peterson, 1995а).
Выводы. Супрессивная проба с Т3 помогает отличить эутиреоз от легкого гипертиреоза при «сомнительных» результатах определения концентрации Т4 в сыворотке. Недостатками этой пробы являются длительность ее проведения (трое суток) и необходимость полагаться на аккуратность владельца при семикратном введении лиотиронина (Peterson et al, 1990; Refsal et al, 1991). Поэтому на практике данную пробу проводят редко. В большинстве случаев можно ограничиться повторными определениями уровня общего Т4 или определением концентрации свТ4 в сыворотке.
190
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Юп
Здоровые животные Кошки с нетиреоидными заболеваниями
Кошки с гипертиреозом
Рис. 4-16. Концентрации общего Т4 в сыворотке до и после супрессивной пробы с Тг Обратите внимание на резкое снижение уровня Т4 у здоровых кошек и животных с нетиреоидными заболеваниями и отсутствие ответа при гипертиреозе. В прямоугольниках находится 75 о результатов, а полный разброс колебаний ограничен Т-образными линиями.
Здоровые Кошки с не- Кошки с ги-кошки тиреоидными пертиреозом заболеваниями
Рис. 4-17. Снижение уровня Т4 в сыворотке крови после введения семи доз Т, в течение 2,5 суток (в %). Обратите внимание на значительное (более чем на 50%) снижение уровня Т4 у здоровых кошек и кошек с нетиреоидными заболеваниями и практическое отсутствие снижения при гипертиреозе.
Стимулирующая проба с тиреотропным гормоном (ТТГ)
Протокол. Пробу с ТТГ широко используют при оценке функции щитовидной железы у собак. Ее можно проводить и у кошек (см. табл. 4-7). Проба сводится к определению уровня Т4 в сыворотке крови до и после введения ТТГ. Предложено несколько схем проведения этой пробы. Самые последние рекомендации включают внутривенное введение рекомбинантного человеческого ТТГ в дозах 0,025-0,2 мг с определением концентрации общего Т4 в сыворотке непосредственно перед и через 6-8 ч после введения ТТГ (Stegeman et al, 2003).
Интерпретация результатов. При явно повышенном уровне Т4 в сыворотке проба с ТТГ не нужна. Предполагалось, что при гипертиреозе реакция на ТТГ выражена слабее, чем в норме (Peterson, 1984), и поэтому кошки с «сомнительными» концентрациями Т4 и с подозрением на гипертиреоз, если он у них действительно имеется, должны слабо отвечать или вовсе не отвечать на экзогенный ТТГ. В дальнейшем, однако, было показано, что результаты прироста уровня Т4 после введения ТТГ (в абсолютных величинах или процентах) у кошек с эу- и гипертиреозом в значительной степени перекрываются.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
191
Исходные уровни Т4 в сыворотке
реоз заболе-
Б вания
Рис. 4-18. А. Зависимость ответа Т4 на Т3 (лиотиронин) от исходной концентрации Т4 в сыворотке крови (в абсолютных величинах) у 44 клинически здоровых кошек, 77 кошек с гипертиреозом и 22 кошек с нетиреоидными заболеваниями. Пунктирные линии - стандартные дискриминационные функции, отличающие кошек с гипертиреозом от животных двух других групп. Б. Баллы (значения D), рассчитанные с помощью стандартного дискриминационного анализа базальных концентраций Т4 и их изменений в ответ на введение лиотиронина у кошек трех групп. Значения D рассчитывались по формуле: D = Т4 (нмоль/л) после введения лиотиронина - (0,5) исходный Т4 (нмоль/л). В прямоугольники заключены показатели с 25-го по 75-ый процентиль (средняя половина всех данных). Горизонтальные линии в прямоугольниках - медианы. Т-образные линии ограничивают основные массивы данных и в большинстве случаев отражают пределы колебаний показателей. Показатели, выходящие за эти пределы, представлены открытыми кружочками. Для перевода значений Т4 из нмоль/л в мкг% нужно разделить приведенную величину на 12,87. Из: Peterson ME: In: Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 4th ed. Philadelphia, WB Saunders, 1995, p 1974.
Норма Гиперти- Другие реоз заболевания
Норма Гиперти- Другие реоз заболевания
Рис. 4-19. Концентрации Т3 в сыворотке до (А) и после (Б) введения лиотиронина 44 клинически здоровым
кошкам, 77 кошкам с гипертиреозом и 22 кошкам с нетиреоидными заболеваниями. Данные представлены
как на рис. 4.13. Из: Peterson ME et al, J Vet Intern Med 4:233, 1990.
192 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Проба не рекомендуется. Установлено, что многие кошки с легким гипертиреозом и нормальной концентрацией Т4 в сыворотке реагируют на ТТГ точно так же, как здоровые животные (Mooney et al, 1992b, 1996b; Peterson, 1995a; Mooney, 1998a). Проба с ТТГ может укрепить подозрения на гипертиреоз у собак и кошек, но ее результаты не имеют диагностического значения.
Стимулирующая проба с тиролиберином (ТРГ)
Введение. Вместо громоздкой супрессивной пробы с Т3 у человека в настоящее время проводят стимулирующую пробу с ТРГ. Эта проба проводится в течение одного дня и у здоровых людей всегда сопровождается приростом уровня ТТГ в сыворотке. При гипертиреозе на фоне хронического подавления секреции ТТГ ответ на ТРГ ослаблен или вообще отсутствует (Utiger, 1986).
Протокол. Хотя у кошек можно определять ТТГ, при проведении пробы с ТРГ (см. табл. 4-7) ориентируются не на ответ ТТГ (как у человека), а на прирост концентрации Т4 в сыворотке крови (Peterson, 1991; Peterson et al., 1994). Кровь для определения уровня этого гормона берут до и через 4 ч после внутривенного введения ТРГ. Можно использовать препараты - TRH (0,5 мг в ампуле, для инъекций) производства фирмы Hoechst-Roussel Pharmaceuticals, США,; Thypinon (0,5 мг в ампуле, для инъекций) производства Abbott Diagnostics, США или Thytropar производства Armour Pharma
ceutical, США. Препараты вводятся в дозе 0,1 мг/кг веса тела. ТРГ может вызывать побочные реакции, включающие саливацию, рвоту, одышку и дефекацию, которые проявляются сразу же после введения гормона и могут продолжаться в течение 4 часов. Побочные эффекты связаны с активацией центральных холинергических и катехоламинергичес-ких механизмов, а также с прямым воздействием нейрогормона ТРГ на специфические рецепторы (Holtman et al, 1986; Beleslin et al, 1987a,b).
Интерпретация результатов. У здоровых кошек и животных с нетиреоидными заболеваниями концентрация Т4 в сыворотке крови через 4 часа после внутривенного введения ТРГ возрастает, как минимум, вдвое. При легком гипертиреозе уровень Т4 увеличивается гораздо слабее или вообще не увеличивается (рис. 4-20 и 4-21). Уровень Т3 в сыворотке возрастает менее постоянно, и определять его не рекомендуется. При гипертиреозе концентрация Т4 после введения ТРГ превышает исходную менее чем на 50%. Возрастание более чем на 60% наблюдается только у здоровых животных и кошек с нетиреоидными заболеваниями. Степень прироста в интервале 50-60% следует считать диагностически незначимой (Peterson et al, 1994; Tomsa et al, 2001).
Помимо процента изменения уровня Т4 в сыворотке, реакцию на ТРГ можно оценивать в наномолях на литр (показатель D). Этот показатель вычисляют следующим образом: 2,2 х базальный уровень Т4 - уровень Т4 после введения тиролиберина. Величина меньше 20 считается нормальной, а больше 30 - доказательством гипертиреоза. Интервал
Рис. 4-20. Концентрации Т4 в сыворотке до (А) и после (Б) введения ТРГ у 31 клинически здоровой кошки, 35 кошек с гипертиреозом и 15 кошек с нетиреоидными заболеваниями. Данные представлены как на рис. 4-13. Из: Peterson ME et al, J Vet Intern Med 8:279, 1994.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 193
между 20 и 30 не имеет диагностического значения (Peterson et al, 1994; Peterson, 1995a).
Выводы. Результаты пробы с ТРГ не менее надежны, чем результаты супрессивной пробы с Т3, но проба с ТРГ проводится гораздо быстрее, и ее результаты не зависят от правильности введения таблеток лиотиронина (Sparkes et al, 1991; Peterson, 1995a). Однако повторные определения уровня общего Т4 и, если необходимо, свТ4 (методом равновесного диализа) в сыворотке менее трудоемки, дешевле и не сопровождаются побочными эффектами, характерными для ТРГ. Поэтому мы предпочитаем использовать именно эти показатели.
Подтверждение диагноза гипертиреоз
Подозрения на гипертиреоз должны основываться на данных анамнеза и физикального обследования. Крайне важно тщательно пальпировать область шеи, особенно у входа в грудную клетку. Если имеет место загрудинный зоб, то осторожное надавливание на вход в грудную клетку позволяет переместить щитовидную железу обратно на шею, где ее можно прощупать. Щитовидная железа поддается пальпации у большинства кошек с гипертиреозом. В противном случае увеличенная щитовидная железа может располагаться в средостении, но нельзя упускать из виду, что отмеченные владельцем признаки заболевания животного могут иметь другие причины (см. табл. 4-6).
Рис. 4-21. Увеличение концентрации Т4 (в %) в сыворотке крови после введения ТРГ у 31 клинически здоровой кошки, 35 кошек с гипертиреозом и 15 кошек с нетиреоидными заболеваниями. Данные представлены как на рис. 4-13. Из: Peterson ME et al, J Vet Intern Med 8:279, 1994.
Диагноз гипертиреоза обычно подтверждают результатами однократного определения концентрации Т4 в сыворотке. Если же эти результаты не подтверждают клинического впечатления, анализ следует повторить через несколько дней или недель, дополнительно определяя концентрацию свТ4 в сыворотке. Можно провести и другие исследования (например, супрессивную пробу с Т3). Выжидание в течение 2-8 недель (хотя необходимость в этом возникает редко) обычно позволяет выявить повышенные концентрации Т4 (общего и/или свободного). Однако отсутствие такого повышения у кошки с клиническими проявлениями гипертиреоза не исключает этот диагноз. Состояние животного обычно ухудшается довольно медленно, и выжидание в течение некоторого времени вполне оправдано.
Если результаты определения концентрации Т4 (общего и свободного) не подтверждают гипертиреоза, можно провести пробы с Т3, с ТРГ или сканирование щитовидной железы с радиоактивными изотопами. Наконец, для подтверждения диагноза можно использовать пробное лечение тиамазолом. Однако к пробной терапии следует прибегать лишь в последнюю очередь, после исключения всех других возможных причин клинических проявлений. Хирургическое вмешательство для осмотра щитовидной железы в неподтвержденных случаях гипертиреоза не рекомендуется. Как отмечалось выше, такие животные обычно не молоды и истощены, и операция сопряжена с определенным риском.
ИЗОТОПНОЕ СКАНИРОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Теоретические предпосылки
Сканирование щитовидной железы может дать сведения о патогенезе гипертиреоза и помочь разработке плана лечения. Для сканирования.(получения изображения) долей щитовидной железы применяют различные радиоактивные изотопы. Фолликулярные клетки железы поглощают и концентрируют радиоактивные изотопы йода (1311 и 1231) точно так же, как стабильный йод. Любой из этих изотопов в конечном счете включается в тирозиновые остатки тиреоглобулина, а затем - в Т3 и Т4.
Фолликулярные клетки поглощают и концентрируют также технеций-99т (пертехнетат, 99тТсО4). Ион пертехнетата по своим размерм и форме настолько похож на йодид, что захватывается йодид-концентрирующим механизмом щитовидной железы, но не подвергается органификации и поэтому не задерживается в железе. Таким образом, поглощение "тТсО4 отражает состояние механизма захвата йода, но не саму функцию щитовидной железы. Ряд других эпителиальных структур (слюнные железы, слизистая ЖКТ) также концентрируют пертехнетат, не связывая его с органическими соединениями и не запасая в ткани (Nap et al, 1994). Пертехнетат выводится из организма почками.
194 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ТАБЛИЦА 4-8. РАДИОАКТИВНЫЕ ИЗОТОПЫ, ПРИМЕНЯЕМЫЕ ПРИ СКАНИРОВАНИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Изотоп Цена/ доступность Энергия у-излучения (кэ-В) Вре мя от инъекции до сканирования Физический перио д полураспада Риск зля персонала
Иод-131 Недорогой/доступен 364 24 часа 8,1 суток Есть
Иод-123 Дорогой менее доступен 159 4 часа 13,3 часа Небольшое!
9QmTcOd (пертехнетат) Недорогои/дос гупен 140 20 мин 6,0 часа Нет
Физиология сканирования
Выбор радиоактивного изотопа. Прекрасное изображение щитовидной железы можно получить с помощью всех трех радиоактивных изотопов (1311, I и пертехнетата), но по ряду причин чаще всего используют именно пертехнетат (табл. 4-8). 1311 относительно недорог и легко доступен, однако в силу длительного периода его полураспада (8,1 суток) сканирование приходится проводить лишь через 24 часа после его введения. Кроме того, 1 1 обладает мощным у-излучением (364 кэВ), которое рассеивается и недостаточно улавливается коллиматором. 1311 испускает и Р-частицы, которые не попадают в камеру, но увеличивают лучевую нагрузку на организм и щитовидную железу. Риск облучения лабораторного работника делает этот изотоп менее пригодным для повседневной работы (Beck et al, 1985).
,231 имеет меньший период полураспада (13,3 ч), его у-излучение обладает меньшей энергией (159 кэВ), дает лучшее изображение и не испускает Р-частиц. Сканирование можно начинать через 4 часа после введения этого изотопа. Кроме того, с его помощью у человека лучше выявляется рак щитовидной железы (Mandel et al, 2001). Однако 1231 достаточно дорог, что сираничивает его использование (Beck et al, 1985).
Большинство исследователей изотопом выбора для сканирования щитовидной железы у человека и кошек считают менее дорогой пертехнетат (Beck et al, 1985). Он имеет короткий период полураспада (6 часов), быстро поглощается щитовидной железой, и сканирование можно начинать уже через 20 минут после его введения. Пертехнетат обладает низко-энергетическим у-излучением (140 кэВ), не испускает Р-частиц и создает наименьшую лучевую нагрузку на щитовидную железу.
Качество изображения превосходно при использовании каждого из изотопов, но на фоне лечения гипертиреоза антитиреоидными средствами радиоактивный йод не позволяет получать изображения щитовидной железы, поскольку эти соединения препятствуют органификации йодида и конденсации йо тирозильных остатков. В то же время механизм захвата Йонов сохраняется, и поэтому пертехнетат продолжает накапливаться в щитовидной железе и позволяет получать ее изображение, даже на фоне полной блокады синтеза тиреоидных гормонов. Как показывают исследования на здоровых
кошках, после недавней отмены тиамазола захват радиоактивного йода и пертехнетата щитовидной железой усиливается, и это следует иметь в виду при интерпретации результатов сканирования (Nieckarz, Daniel, 2001).
Протокол. Сканирование щитовидной железы производят после внутривенного введения меченого пертехнетата [5-35 МБк (0,1-1,0 мКи)]. Выжидают некоторое время, за которое изотоп концентрируется в щитовидной железе (и других тканях). Это время может быть достаточно малым (15-20 минут) или очень большим (46 часов). Оптимальным считается интервал в 60 минул между иньек-цией изотопа и сканированием (Nap et al 1994). Во время сканирования животное помещают под (или над) сцинтилляционным счетчиком, улавливающим излучение и записывающим его на пленку или бумагу. В течение примерно 30 секунд кошку удерживают в неподвижном положении и по сканограмме определяют основные источники радиоактивного излучения в организме (рис. 4-22).
Выявляемая ткань
При сканировании получают изображение всей функционирующей тиреоидной ткани. Эта проце-
Рис. 4-22. Сканограмма с технецисм-99ш у здоровой кошки. Обратите внимание на сходство размеров и интенсивности излучения щитовидной (прямая стрелка) и слюнных желез (изогнутая стрелка).
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 195
дура позволяет отличить функционирующие участки щитовидной железы от нефункционирующих. Пертехнетат концентрируется главным образом в трех тканях: долях щитовидной железы, слюнных железах и слизистой ЖКТ. На рис. 4-22 показаны размеры и форма щитовидных и слюнных желез у здоровых кошек. В норме параметры поглощения изотопа этими железами соотносятся как 1:1. У большинства кошек с гипертиреозом картина совершенно иная, и ее обычно легко интерпретировать (Peterson, Yoshioka, 1983; Beck et al. 1985; Kintzer, Peterson, 1991; Mooney et al, 1992c). В одном из ис
следований накопление изотопа у двух кошек обнаруживалось не только в упомянутых тканях, но и в ткани бронхогенного рака (Cook et al, 1993).
Клиническое значение
Односторонняя гиперфункция щитовидной железы. Результаты сканирования щитовидной железы непосредственно влияют на выбор методов лечения, которые подробно рассматриваются ниже. Примерно в 15-20% случаев гипертиреоза у кошек активна и гипертрофирована только одна доля щи-
Рис. 4-23. Сканограмма с технецием 99m у кошки с тиреотоксикозом и односторонней опухолью щитовидной железы. Сравните интенсивность излучения щитовидной {прямая стрелка) и слюнных желез {изогнутая стрелка)
Рис. 4-24. А и Б. Сканограмма с технецием 99m у кошки с тиреотоксикозом и двусторонней симметричной аденомой щитовидной железы.
196 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Рис. 4-25. Сканограмма с технецием 99m у кошки с тиреотоксикозом и двусторонней асимметричной аденомой щитовидной железы.
товидной железы. Обычно в ней присутствует одиночная аденома. Вторая же доля не функционирует, атрофируется и не выявляется при сканировании (рис. 4-23). Аденоматозная гиперплазия тиреоидной гкани более характерна для двусторонней патологии. Атрофия второй доли обусловлена угнетением секреции ТТГ вследствие усиления функции пораженной доли. При одностороннем заболевании и расположении щитовидной железы на шее рекомендуется удалять пораженную долю (после предварительного курса лечения антитиреоидными средствами).
Двусторонняя гиперфункция. Поражение обеих долей щитовидной железы наблюдается у кошек более чем в 70% случаев гипертиреоза. Однако юлько у 10-15% таких животных обе доли изменены одинаково (рис. 4-24). Прощупать два образования разных размеров удается редко, но при сканировании это легко обнаружить. Обычно имеет место асимметричное поражение долей щитовидной железы (рис. 4-25 и 4-26). Более чем в 10% случаев одна доля сильно увеличена, а вторая крайне мала, хотя и видна на сканограмме. Невооруженным глазом отличить одностороннее поражение от асимметричного двустороннего во время операции довольно трудно.
У некоторых кошек увеличена даже меньшая из пораженных долей, но у других она содержит лишь небольшое количество аденоматозной (гиперплазированной) ткани и может казаться атрофированной (рис. 4-27). Сканирование в таких случаях позволяет избежать хирургической ошибки. При обнаружении любой тиреоидной ткани на контрлатеральной стороне следует предполагать наличие в ней аденомы. Односторонняя аденома по механизму отрицательной обратной связи должна приводить к пол
ной атрофии второй доли. Поэтому все выявленные при сканировании активные ткани независимо от их числа, размеров и локализации следует считать аденоматозными или раковыми.
Если операция проводится после сканирования, то xnpypi должен знать, необходима ли односторонняя или двусторонняя тиреоидэктомия, и где локализована ткань, подлежащая удалению. Иными словами, не следует полагаться на зрительное впечатление. При поражении обеих долей щитовидной железы вместо операции можно использовать пероральные антитиреоидные средства или радиойодте-рапию. Последняя является оптимальным методом лечения в таких случаях.
Загрудинный зоб. Примерно у 3% кошек с гипертиреозом и отсутствием пальпируемого образования на шее измененная тиреоидная ткань локализована в переднем средостении. В таких случаях сканирование опять-таки оказывает неоценимую диагностическую помощь (рис. 4-28). Трудно решить, имеется ли при этом эктопическая тиреоидная ткань или увеличенная щитовидная железа под собственно!! тяжестью просто опустилась в грудную клетку. В любом случае таких животных следует лечить антитиреоидными средствами или радиоактивным йодом. Операция для осмотра переднего средостения достаточно сложна и, как правило, не рекомендуется.
Функционирующая злокачественная опухоль щитовидной железы. При обнаружении более двух участков поглощения изотопа, каждый из которых по размерам превышает слюнные железы, следует предполагать наличие функционирующего рака щитовидной железы (рис. 4-29). Его частота среди кошек с гипертиреозом составляет примерно 3%. У некоторых животных вначале выявляются только
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
197
Рис. 4-26. Сканограмма с технецием 99m у кошки с тиреотоксикозом и двусторонней асимметричной аде номой щитовидной железы. Обратите внимание, что более крупная доля расположена ниже меньшей, т.е. иначе, чем на рис. 4-25, где обе доли расположены рядом.
*/
Б
Рис. 4-27. Дорсовентральная (А) и боковая (Б) сканограммы с технецием 99m. Видна крупная масса тирс-оиднои ткани в переднем средостении и сразу над ней небольшая активная щитовидная железа (стр< 1ка на рис. А). При таком расположении аномальной ткани кошек лучше всего лечигь радиоактивным иодом. Небольшое количество пертехнетата попало под кожу (строка на рис. Ь).
198 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
В г
Рис. 4-28. Боковая (А) и дорсовентральная (Б) сканограммы с пертехнетатом у кошки с гипертиреозом. Видна крупная щитовидная железа в области шеи (большая изогнутая стрелка на рис. А) и меньшая по размерам аденоматозная тиреоидная ткань в переднем средостении (маченъкая изогнутая стрелка). Видны также накапливающие пертехнетат слюнные железы и слюна (маленькая прямая стрелка) и слизистая желудка (бо 1ыиая при мая стрелка). На боковой (В) и дорсовентральной (Г) сканограммах другой кошки видно крупное образование в области шеи (изогнутые стрелки), смещающее нормальную щитовидную железу (прямые стрелки). Это образование оказалось раком слюнной железы. Таким образом, не все выявляемые образования в области шеи представляют собой тиреоидную ткань.
один или два узла, что подчеркивает необходимость гистологического исследования удаленной ткани во всех случаях. Раковая ткань, если она обнаруживается при сканировании, функционально активна. Иногда это называют «горячими» узлами. Частота нефункционируюших раков неизвестна. Их ткань не вырабатывает тиреоидных гормонов и не поглощает пертехнетат. При сканировании в области щитовидной железы находят нерадиоактивные участки. Такне узлы называют «холодными». Рак может прорастать в соседние ткани и давать метастазы.
Однако накапливающие пертехнетат образования не всегда представляют собой тиреоидную ткань. Как упоминалось выше, в двух случаях накопление изотопов было обнаружено в ткани бронхогенного рака легких (Cook et al, 1993).
Сканирование с пертехнетатом - лучший из доступных в ветеринарии способов выявления метастазов функционирующего рака щитовидной железы. Лечение в таких случаях представляет трудную задачу. Антитиреоидные средства не оказывают цитотоксического действия и поэтому практически
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 199
Рис. 4-29. А Сканограммы с технецием 99m. При тиреотоксикозе у кошки обнаруживаются множественные очаги гиперактивной тиреоидной ткани. Такая картина может отражать как функционирующий рак щитовидной железы, прорастающий в ткани шеи и переднего средостения, так и множественный аденоматоз тиреоидное ткани, в том числе и эктопической. В таких случаях лучшим способом лечения должна была бы быть радиойодтерапия. Б. Сканограмма с технецием 99m. При тиреотоксикозе у кошки выявляются множественные функционирующие очаги тиреоидной ткани. В данном случае обнаружен рак щитовидном железы с прорастанием в окружающие ткани шеи (прямая стрелка) и диффузными метастазами в легочной паренхиме (изогнутая стрелка).
бесполезны. При операции очень часто не удается удалить всю измененную ткань. Наиболее перспективна радиойодтерапия, поскольку радиоактивный йод накапливается в любой гиперфункционирую-щей тиреоидной ткани где бы она ни локализовалась. Однако раковая ткань поглощает и задерживает йод менее эффективно, чем нормальная или аденоматозная, и поэтому требуются гораздо большие дозы радиоактивного йода. В ряде случаев удавалось добиться успеха путем хирургического удаления основной пораженной ткани с последующим введением больших доз радиоактивного йода (Guptill et al, 1995).
Тиреоидная ткань на шее и в средостении. Для хирурга наиболее трудны те случаи гипертиреоза у кошек, когда один крупный гиперактивный и пальпируемый узел располагается в области шеи, а второй - в переднем средостении (см. рис. 4-28). Если операция производится без предварительного сканирования, то хирург удаляет только видимый ему узел, и гипертиреоз в таких случаях либо сохраняется, либо рецидивирует.
Сканирование в диагностике и терапии. Сканирование щитовидной железы в качестве метода диагностики можно использовать у кошек с клиническими признаками гипертиреоза, но с нормальными или «сомнительными» уровнями общего и свободного Т4 в сыворотке. В норме размеры щитовидной и слюнных желез соотносятся как 1:1 (см. рис. 4-22), но при гипертиреозе это отношение увеличивается (Beck et al, 1985). В такой ситуации сканирование щитовидной железы могло бы помочь диагностике г ипертиреоза и указать на расположение измененной ткани. По сканограмме можно также определить объем узла и на этом основании
рассчитать необходимую дозу радиоактивного йода (Forrest et al, 1996), хотя такие расчеты не всегда точны.
УЗИ ОРГАНОВ ШЕИ (ЩИТОВИДНОЙ ЖЕЛЕЗЫ) Введение
Ветеринарные специалисты давно используют УЗИ как надежный неинвазивный и высоко информативный метод. Вначале этот метод применяли в основном для оценки состояния органов брюшной полости и миокарда, но он находит все более широкое применение и при исследовании органов шеи (см. гл. 16 «Гиперкальциемия») (Wisner et al, 1991,1994). УЗИ шеи проводят обычно без анестезии или седативных средств; лучше всего использовать датчик 10 МГц. Информативность УЗИ более какого-лиоо другого диагностического метода в ветеринарии зависит от опыта исследователя.
Результаты
При исследовании 6 здоровых кошек и 14 животных с гипертиреозом была выявлено значительное различие в расчетном объеме щитовидной железы между животными двух групп. Опытному исследователю практически всегда удается локализовать нормальные и измененные доли щитовидной железы. Установлена тесная корреляция между данными УЗИ и сканирования. Мы легко обнаруживаем измененную долю щитовидной железы при одностороннем гипертиреозе и обе доли при двустороннем. При отдаленной локализации эктопической тиреоиднои ткани или метастазов рака шитовидной железы УЗИ не может заменить сканирование, но в
200 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
целом йог метод гораздо более доступен и экономичен
В норме доли щитовидной железы выглядят тонкими веретенообразными структурами с умеренной и равномерной эхогенностью (рис. 4-30). Они примыкают к медиальным поверхностям сонных артерий с каждой стороны и окружены тонкими гиперэхогенными фасциями, создающими дополнительную I раницу. Краниальные и каудальные концы каждой доли внутри этих фасций обычно сужаются, что подчас делает их неразличимыми. Размер каждой доли легче всего измерять по длинной оси. В норме длина каждой доли колеблется в пределах 15-25 мм, а расчетный объем составляет 40-140 мм3 (табл. 4-9) (Wisner et al, 1994).
При гипертиреозе доли щитовидной железы равномерно увеличены и вытянуты. Наружные их края иногда слегка деформированы и/или плохо отграничены от окружающей ткани. Паренхима несколько менее эхогенна, чем окружающая ткань и при I ипергиреозе, как правило, меньше, чем в норме. Хотя в большинстве случаев структура измененных желез гомогенна, иногда обнаруживается ее «пятнистость». По нашим приблизительным
оценкам, у 10% кошек с гипертиреозом увеличенные доли щитовидной железы содержат кисты, которые не отражают ультразвук и легко выявляются при УЗИ. Строение и форма кист бывают разными; некоторые из них однокамерные, тогда как другие разделены одной или несколькими перегородками. Измененные доли щитовидной же тезы нередко сохраняют нормальную длину, но более округлы и утолщены, в силу чего их расчетный объем превышает норму, колеблясь от 140 до 1000 мм3 (см. рис. 4-30 и табл. 4-9) (Wisner et al, 1994; Goldstein et al, 2001; Wells et al, 2001).
Показания к УЗИ щитовидной железы
УЗИ внача ie использовали для определения положения щитовидной железы на шее и для ориентировочной диагностики гипертиреоза В дальнейшем этот метод позволил применять новые способы лечения. Мы не рекомендуем проводить УЗИ с целью диагностики гипертиреоза. Анамнез, физикальное и лабораторные исследования и определение уровней общего и свободного Т4 в сыворотке крови дают достаточно данных для установления диа1 поза. Ре-
рис. 4-30. А. УЗИ щитовидной железы здоровой кошки (Т - щитовидная железа; С - сонная артерия). Б. Увеличенная щитовидная железа у кошки с гипертиреозом. В. Большая киста щитови щои железы у кошки с I ииертиреоюм.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 201
ТАБЛИЦА 4-9. ЛИНЕЙНЫЕ РАЗМЕРЫ (ММ) И ОБЪЕМ (ММ3) ЛЕВОЙ И ПРАВОЙ ДОЛЕЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У КОШЕК В НОРМЕ И ПРИ ГИПЕРТИРЕОЗЕ
Левая доля (М ± SE) Правая доля (М ± SE)
Длина Высота Ширина Объем* Длина Высота Ширина Объем*
Контроль (п=6) 20,5 ± 1,6 3,3+0,8 2,5б 89±23 20,3±1,6 3,0+0,6 2,56 80+19
Гипертиреоз (п = 14) 20,2+3,6 5,5±2,4 5,7±2,1 382+312 21,9+4,4 8,1±3,0 7,7+2,4 782+449
’Объем рассчитан по формуле для удлиненного эллипсоида, л/6 (длина х высота х ширина)
6Ширина долей в норме произвольно принята за 2,5 мм, поскольку ее невозможно определить с помощью УЗИ.
зультаты УЗИ в этом отношении гораздо менее надежны. В то же время УЗИ обеспечивает прекрасную возможность локализовать доли щитовидной железы и провести инъекционные процедуры (см. раздел «Новые способы лечения под контролем УЗИ»),
ОБЩИЕ НАПРАВЛЕНИЯ ТЕРАПИИ Введение
Лечение гипертиреоза направлено на устранение избыточной секреции тиреоидных гормонов. Для лечения гипертиреоза у кошек широко применяют три метода (рис. 4-31), каждый из которых имеет свои преимущества и недостатки (табл. 4-10). Ингибировать синтез тиреоидных гормонов можно с помощью медикаментозных средств, и такой подход легко индивидуализировать, подбирая дозы препаратов, необходимые каждому животному. Однако медикаментозная терапия требует введения препарата до трех раз в сутки на протяжении длительного времени. С другой стороны, транзи-торность эффекта такой терапии можно считать и преимуществом, так как это позволяет убедиться в правильности диагноза гипертиреоза. К радикальным методом лечения относятся хирургическая операция и радиойодтерапия.
Выбор метода лечения в каждом конкретном случае зависит от многих факторов, включая возраст кошки, наличие у нее сердечно-сосудистых, почечных и других заболеваний, а также возможность обратиться к опытному хирургу или получить радиоактивный йод. Владелец кошки может и не захотеть следовать совету ветеринара. Во многих случаях перед радикальным лечением целесообразно провести пробный курс терапии тиамазолом или карбимазолом (внутрь или чрескожно).
Гипертиреоз и функция почек
Введение. Оценка клинического состояния и лечение старых животных с гипертиреозом при наличии ХПН - сложная задача. Снижение концентрации Т4 в сыворотке при нетиреоидных заболеваниях, в частности ХПН, затрудняет диагностику гипертиреоза. С другой стороны, гипертиреоз сопровождается повышением СКФ и тем самым приводит к снижению уровня азота мочевины и креатинина в крови, маскируя имеющуюся почечную
недостаточность. Уровень креатинина в сыворотке при гипертиреозе снижается и вследствие потери веса и уменьшения массы мышечной ткани, что также маскирует нарушение функции почек. Лечение гипертиреоза может ухудшать функцию почек, т.е. приводить к состоянию, гораздо более опасному.
Патофизиология. При гипертиреозе возрастает минутный объем сердца и снижается периферическое сосудистое сопротивление. Вследствие этого повышается почечный кровоток и СКФ. Введение Т4 здоровым животным в течение 30 дней приводит к возрастанию как почечного кровотока, так и СКФ (Adams et al, 1997а). Повышение СКФ обусловливает снижение уровня креатинина в сыворотке крови, но ускорение распада белка при гипертиреозе может повышать содержание азота мочевины в крови. Хотя устранение гипертиреоза на фоне ХПН может ухудшать функцию почек, не исключена и причинная роль гипертиреоза в развитии ХПН у старых животных. У здоровых кошек почти 60% перфузионного давления в почках приходится на капиллярное ложе клубочков (DiBartola, Brown, 2000). Гипертиреоз часто сопровождается системным повышением АД, и при нарушении механизмов ауторегуляции значительная часть повышенного давления падает на почечные клубочки. В результате давление в них увеличивается, фильтрация усиливается, а это способствует склерозу клубочков и прогрессированию почечной недостаточности.
Считается, что лечить легкий гипертиреоз у старых кошек с ХПН не следует, так как снижение концентрации тиреоидных гормонов в таких условиях способствует развитию азотемии и уремии. Однако, как мы видели, гипертиреоз, сопровождаясь повышением СКФ, может ухудшать состояние почек, т.е. становиться фактором, предрасполагающим к развитию ХПН у старых животных. Поэтому лечение гипертиреоза на ранних стадиях должно замедлять развитие ХПН.
Ухудшение почечной функции после устранения гипертиреоза. У некоторых кошек лечение гипертиреоза сопровождается резким ухудшением почечной функции (Graves et al, 1994). Через 30 дней после двусторонней тиреоидэктомии в таких случаях СКФ снижалась в среднем с 2,5 до 1,5 мл/ мин/кг. Концентрации креатинина в сыворотке и азота мочевины в крови увеличивались с 1,3 до 2,0 мг% и с 27 до 35 мг% соответственно. По данным другого исследования, через 30-90 дней после one-
Рис. 4-31. Алгоритм лечения гипертиреоза у кошек. Подчеркивается возможное неблагоприятное влияние лечения на функцию почек.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 203
ТАБЛИЦА 4-10. ПРЕИМУЩЕСТВА И НЕДОСТАТКИ ТРЕХ ОСНОВНЫХ ФОРМ ЛЕЧЕНИЯ ГИПЕРТИРЕОЗА У КОШЕК
Форма лечения Преимущества Недостатки
Операция 1. Как правило, купирует гипертиреоз 2. Щитовидную железу легко осмотреть 3. Относительно недорогой вид лечения 4. Не требует сложного оборудования 5. Постоянное «излечение» 1. Опасность наркоза у старых и слабых кошек 2. Наркоз может обострить нарушения других органов и систем 3. Ятрогенный гипопаратиреоз 4. Ятрогенный гипотиреоз 5. Владельцы кошек не всегда соглашаются на операцию 6. Индукция тиреотоксикоза 7. Повреждение возвратных гортанных нервов 8. Невозможность удалить всю измененную тиреоидную ткань 9. Постоянство результатов лечения
Пероральные антити- 1. Как правило, купирует гипертиреоз 1. Побочные эффекты:
реоидные препараты 2. Недорогой вид лечения 3. Небольшой размер таблеток 4. Не требует наркоза и операции 5. Не требует дорогого оборудования 6. Не требует госпитализации 7. Обратимые результаты лечения а) анорексия б) рвота в) угнетенное состояние/сонливость г) тромбоцитопения д)гранулоцитопения 2. Необходимость ежедневного введения препарата 3. Ятрогенный гипотиреоз 4. Транзиторный эффект
Радиойодтерапия 1. Как правило, купирует гипертиреоз 2. Однократное введение изотопа в большинстве случаев, не требует применения таблеток 3. Не требует наркоза и операции 4. Быстрое снижение уровня тиреоидных гормонов 5. Постоянное «излечение» 1. Необходимость сложного оборудования 2. Опасна для персонала и не всегда доступна 3. Необходимость длительной госпитализации до полного выведения изотопа 4. Ятрогенный гипотиреоз 5. Необходимость повторного введения изотопа в 2-5% случаев 6. Постоянство результатов лечения
рации, радиойодтерапии или лечения тиамазолом концентрации креатинина и азота мочевины в крови возрастали с 1,6 до 2,2-2,4 мг% и с 30 до 36-37 мг% (DiBartola et al, 1996).
Изменения функции почек оценивали также у 22 кошек со спонтанным гипертиреозом после введения радиоактивного йода (Adams et al, 1997b). ХПН до начала лечения имела место у 9 животных, а после лечения у 13. О почечной недостаточности судили по уровню азота мочевины в крови более 30 мг% и/или концентрации креатинина в сыворотке более 1,8 мг% на фоне снижения удельного веса мочи (менее 1,035). У 7 из 22 кошек, у которых почечная недостаточность отсутствовала, СКФ до лечения превышала 2,25 мл/мин/кг, а у остальных 15 была ниже этой величины. У двух из них лечение не привело к снижению уровня тиреоидных гормонов и к развитию ХПН. У остальных 13, у которых уровень тиреоидных гормонов снижался, выявлялась и почечная недостаточность. Эти данные свидетельствуют не только о связи между лечением гипертиреоза и ухудшением функции почек, но и о том, что определение СКФ позволяет выявить скрытую почечную недостаточность и заранее предвидеть, в каких случаях лечение гипертиреоза приведет к существенному снижению почечной функции.
Выявление «скрытой» почечной недостаточности по величине СКФ. Концентрации азота мочевины в крови и креатинина в сыворотке изме
няются обратно пропорционально СКФ и косвенно отражают ее величину. Однако эти показатели относительно инертны, так как их возрастание обнаруживается лишь при потере 75% функционирующей массы почек. Поэтому почечная недостаточность может иметь место и в отсутствие биохимических изменений в сыворотке. Кроме того, эти показатели зависят не только от функционирующей массы почек и кровотока, но и от других факторов. Таким образом, СКФ - более надежный показатель состояния почек, чем уровень азота мочевины и креатинина в сыворотке. При гипертиреозе СКФ увеличивается, а его лечение сопровождается снижением СКФ. По величине этого показателя можно предвидеть увеличение уровней азота мочевины и креатинина в сыворотке после устранения гипертиреоза.
Определять СКФ по клиренсу инулина или экзогенного креатинина у кошек технически сложно. Такие определения занимают много времени и требуют применения анестезии для катетеризации мочевых путей. Определение клиренса меченого диэтилентриаминопентаацетата невозможно без соответствующего оборудования. В то же время определение клиренса иогексола достаточно просто и не требует специальных приборов и приспособлений. Иогексол - это рентгеноконтрастное вещество, по клиренсу которого можно судить о СКФ. Его вводят в количестве 2 мл/кг веса тела (при концентрации йода 300 мг/мл) через установленный внуг-
204 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ривенно катетер (Becker et al, 2000). Спустя 150,195 и 240 минут берут пробы крови; в каждой из них определяют концентрацию йода в сыворотке и по этим данным рассчитывают величину СКФ (Kruger et al, 1998; Braselton et al, 1997).
По такой схеме рассчитывали СКФ до и после лечения гипертиреоза у кошек тиамазолом (Adams et al, 1997b). Восстановление эутиреоза у 10 из 12 кошек сопровождалось снижением СКФ примерно на 50%. У двух из 12 кошек повысился и уровень креатинина в сыворотке. В этих двух случаях СКФ после лечения оказалась ниже 1 мл/мин/кг. По мнению авторов, СКФ ниже 2,25 мл/мин/кг позволяет прогнозировать ухудшение почечной функции после устранения гипертиреоза. Однако клиренс иогек-сола, по-видимому, не слишком надежно отражает СКФ. У трех из 12 кошек расчетная СКФ до лечения была меньше 2,25 мл/мин/кг, и во всех этих случаях уровень азота мочевины в крови после достижения эутиреоза превышал 30 мг%. Такое же повышение азота мочевины после лечения наблюдалось и у 5 кошек, у которых СКФ исходно была больше 2,25 мл/ мин/кг. Самое большое возрастание концентрации азота мочевины в крови отмечено у кошки со второй по величине исходной СКФ (Becker et al, 2000).
Выводы. Судя по имеющимся данным, по величине СКФ до лечения можно прогнозировать развитие почечной недостаточности после устранения гипертиреоза. Однако такие прогнозы недостаточно точны. Поэтому лучше, вероятно, до радикального лечения гипертиреоза проводить пробный курс терапии тиамазолом (Becker et al, 2000). Эффект тиамазола, по-видимому, полностью обратим. При развитии явной почечной недостаточности гипертиреоз либо не следует лечить вовсе, либо применять такие дозы тиамазола, которые не ухудшают функцию почек. Рекомендуемая нами схема применения тиамазола обсуждается в следующем разделе.
ЛЕЧЕНИЕ АНТИТИРЕОИДНЫМИ СРЕДСТВАМИ (ПРЕПАРАТАМИ ТИОМОЧЕВИНЫ) Механизм действия
На рис. 4-32 показано строение тиоурацила, пропилтиоурацила (ПТУ) и тиамазола - трех наиболее широко применяемых препаратов тиомочевины. Эти вещества не обладают цитотоксическим действием и не приводят к окончательному излечению гипертиреоза. ПТУ и тиамазол блокируют синтез тиреоидных гормонов, угнетая органификацию йодида и конденсацию йодтиронинов с образованием Т4 и Т3 (Franklyn, 1994). Не совсем ясно, обусловлен ли этот эффект ингибированием йодидпероксидазы (тиреоидной пероксидазы) или присоединением антитиреоидных препаратов к тиреоглобулину и блокадой образования тиронина. ПТУ, кроме всего прочего, нарушает периферическое дейодирование Т4 и образование Т3; тиамазол таким действием не обладает. Ни одно из этих соединений не влияет ни
н
сн3
Тиамазол
Тиоурацил Пропилтиоурацил
Рис. 4-32. Структура антитиреоидных препаратов (тиокарбамидов), ингибирующих органификацию йодида.
на йодидный насос (который обеспечивает накопление йодида в клетках щитовидной железы), ни на секрецию ранее образованных тиреоидных гормонов (Peterson, 1995а). Карбимазол превращается в организме в тиамазол и поэтому действует как тиамазол.
При введении внутрь антитиреоидные средства быстро всасываются и распределяются в объеме, близком к общему объему воды в организме. У человека Т1/2 ПТУ в плазме крови составляет 1-2 часа, причем 80% вещества выводится с мочой уже в первые сутки (McDougall, 1981). Другие пути выведения препарата имеют гораздо меньшее значение. Период полужизни тиамазола в плазме человека колеблется от 4 до 14 часов, и две трети введенного количества этого препарата выводятся с мочой за 48 ч. Эффекты ПТУ и тиамазола зависят от введенной дозы и их концентрации в щитовидной железе, а не от периодов их полужизни в циркуляции. Поэтому оба вещества действуют дольше, чем находятся в плазме крови. Оба они избирательно накапливаются в щитовидной железе, и вводить их чаще, чем через каждые 8 часов, не следует.
Пропилтиоурацил (ПТУ): больше не рекомендуется
В ветеринарной литературе имеется много упоминаний об использовании ПТУ. Это вещество очень эффективно блокирует синтез тиреоидных гормонов у кошек и поэтому устраняет гипертиреоз (Bradley, Feldman, 1982). Однако ПТУ вызывает довольно много побочных эффектов, включая анорексию, рвоту, сонливость, аутоиммунную гемолитическую анемию и тромбоцитопению (Peterson et al, 1984; Aucoin et al, 1985,1988). В силу этого, а также потому, что тиамазол не менее эффективен, но оказывает меньше побочных эффектов, ПТУ больше не рекомендуется применять у кошек.
Тиамазол
Показания. Тиамазол применяют при гипертиреозе в трех случаях. Во-первых, его можно использовать для нормализации уровня Т4 в сыворотке и оценки влияния устранения гипертиреоза на функцию почек («пробное лечение», см. рис. 4-31). Если функция почек улучшается или остается стабильной, то можно прибегнуть к более радикальным способам лечения (операции или радиойодтера-пии). Во-вторых, тиамазол можно применять как
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
205
средство предоперационной подготовки или во время длительной госпитализации, необходимой для радиойодтерапии. Кошки, получающие этот препарат, прибавляют в весе и у них смягчаются или исчезают многие тяжелые симптомы гипертиреоза. Наконец, в-третьих, тиамазол можно использовать в качестве единственного средства кратковременного или длительного лечения гипертиреоза (см. рис. 4-31 и 4-33).
Преимущества. Пероральная терапия тиамазо-лом обладает многими преимуществами по сравнению с хирургическим лечением или радиойод-терапией (см. табл. 4-10). Широкое применение тиамазола связано с его относительной дешевизной, доступностью (обычно через любую ветеринарную аптеку) и простотой введения. Лечение не требует ни сложного оборудования, ни длительной госпитализации. Препарат можно применять при гипертиреозе даже у старых кошек, причем это может делать сам владелец животного. Кроме того, новые методы позволяют вводить тиамазол не только внутрь, но и чрескожно (Trepanier et al, 2003b).
Применение тиамазола не сопряжено с риском развития постоянного гипотиреоза или гипопаратиреоза. Важнее всего то, что любой эффект препарата (положительный или отрицательный) практически всегда исчезает после отмены лечения. Тиамазол переносится кошками лучше, чем ПТУ, и может считаться препаратом выбора для пробной терапии, предоперационной подготовки и/или длительного лечения гипертиреоза. Карбимазол не менее эффективен и переносится животными еще лучше. Однако поскольку в США лицензирован тиамазол, он и рассматривается здесь. В тех странах, где легко получить карбимазол, целесообразно применять именно этот препарат.
Протокол перорального введения тиамазола. Рекомендуемый нами способ представляет собой более осторожный вариант протокола, предлагаемого другими авторами (Trepanier et al, 199 la,b; Tho-day, Mooney, 1992b; Peterson, Aucoin, 1993; Peterson, 1995a, 2000). Он направлен на постепенное устранение гипертиреоза и одновременное снижение частоты побочных эффектов терапии. Гипертиреоз
Рис. 4-33. Алгоритм мониторинга кошек с гипертиреозом при лечении тиамазолом
206 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
у кошек - хроническое и прогрессирующее заболевание, и необходимость в остром его устранении возникает крайне редко. Кроме того, хотя побочные эффекты при применении тиамазола встречаются реже и менее тяжелы, чем при использовании ПТУ, всегда следует стремиться к минимизации любого отрицательного эффекта. При введении тиамазола в начальных дозах меньше 10-15 мг/сутки побочные эффекты развиваются реже и проявляются слабее.
Мы рекомендует начинать лечение с 2,5 мг (половины таблетки) дважды в сутки на протяжении 2 недель. При серьезных опасениях по поводу побочных эффектов мы часто начинаем лечение даже с дозы 2,5 мг один раз в сутки (или по 1,25 мг дважды в сутки) и никогда не используем дозу больше 5 мг в сутки. Если, по мнению владельца животного, побочные эффекты отсутствуют, то дозу тиамазола на следующие 2 недели нужно увеличить до 2,5 мг трижды в сутки (или 5 мг утром и 2,5 мг вечером; можно и наоборот).
По завершении 4-недельного периода «пробной терапии» кошку нужно показать ветеринару, который не только ознакомится с анамнезом и произведет обследование, но и направит кровь в лабораторию для анализа и определения концентрации Т4 в сыворотке. Пробы крови нужно брать через 4-6 часов после введения животному очередной дозы тиамазола. Если уровень Т4 в сыворотке окажется близким к норме, дозы препарата можно оставить прежними на протяжении следующих 2-6 недель, после чего их адекватность нужно проверить вновь. Если уровень Т4 ниже нормы, то дозы необходимо уменьшить. Если же гипертиреоз сохраняется, то суточные дозы следует продолжать увеличивать на 2,5 мг через каждые 2 недели. После устранения гипертиреоза можно начать применение тиамазола по схеме для длительной терапии. Появление любого неблагоприятного эффекта требует отмены препарата хотя бы на время. Когда такие эффекты исчезнут, можно подумать о других методах лечения или о продолжении использования тиамазола в меньших дозах.
Для устранения гипертиреоза у кошек в большинстве случаев требуются дозы от 5 до 7,5 мг/ сутки. Препарат особенно эффективен при его введении 2-3 раза в сутки (Trepanier et al, 2003а). Иногда приходится вводить более 10 мг/сутки, но при соблюдении описанной схемы необходимость в таких дозах возникает не часто. Очень редко встречаются животные особо резистентные к тиамазолу, которым приходится вводить до 20 мг/сутки этого препарата. Согласно нашим наблюдениям, дозы, требующиеся подавляющему большинству кошек с гипертиреозом, редко превышают 12,5-15 мг/сутки. Резистентность к тиамазолу чаще всего кажущаяся и связана с нарушением схемы введения препарата. Если доза в 10 мг/сутки и более не приводит к снижению концентрации Т4 в сыворотке, то необходимо проверить, вводится ли препарат в нужное время.
Наружное применение тиамазола. Современные правила разрешают вносить тиамазол в мази для наружного применения. Концентрация тиамазола в них может быть разной, но наиболее часто применяют мазь с содержанием тиамазола 20 мг/ мл. Ее обычно выпускают в тюбиках по 1 мл. Владелец кошки надевает резиновую перчатку, выдавливает нужную дозу на палец и втирает препарат в ушную раковину животного. По разным данным, эффективность такого способа может быть большей, меньшей или равной эффективности перорального лечения. При втирании 5 здоровым кошкам тиамазола в лецитиновом геле с плурониксом содержание препарата в крови, как правило, было очень низким. Однако у одной кошки биологическая доступность тиамазола при наружном применении оказалась такой же, как и при его пероральном введении (Hoffmann et al, 2002).
В целом, при чрескожном применении тиамазола препарат всасывается несколько медленнее и во многих случаях действует не столь эффективно, как при введении внутрь. В первые 4 недели различия в эффективности практически не заметны. Чрескожный препарат столь же часто вызывает зуд, изменения в печени и крови, но слабее действует на ЖКТ. У некоторых кошек на ушах (месте нанесения мази) появляются струпья и эритема. Однако это редко препятствует дальнейшему применению препарата. Владельцу нужно указать на необходимость попеременного втирания мази в оба уха и удаления ее избытка после каждого нанесения (Trepanier et al, 2003b). Пока не будут получены другие данные, мы рекомендуем тщательно втирать мазь и через 30-120 минут удалять ее избыток. Начинать следует с дозы 1 мг один раз в сутки в течение 2 недель, а в следующие 2 недели - дважды в сутки. В дальнейшем дозы можно увеличивать, как при введении препарата внутрь. Однако необходимо учитывать возможные различия в составе мази. Владельцу животного такой способ лечения может казаться более удобным, чем введение таблеток, но пока мазь остается нестандартизированной, эта форма лечения требует особого внимания.
Гипертиреоз на фоне нарушения функции почек. В ряде случаев гипертиреоз у кошек диагностируется на фоне повышенных концентраций азота мочевины и креатинина в крови. Даже определяя СКФ, невозможно точно предвидеть, у кого из животных лечение гипертиреоза улучшит, а у кого ухудшит состояние почек. Поэтому схема лечения таких кошек должна отличаться от описанной выше. Иными словами, перед использованием радикальных методов (операции или радиойодтерапии) следует провести пробный курс лечения тиа-мазолом (см. рис. 4-31 и 4-33).
При почечной недостаточности лечение начинают с 2,5 мг тиамазола, вводимого один раз в сутки в течение 2 недель (или по 1,25 мг дважды в сутки). В последующие 2 недели препарат вводят по 2,5 мг дважды в сутки. Через 4 недели у животных
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 207
определяют уровни Т4, азота мочевины, креатинина и фосфата в сыворотке. Если концентрация Т4 оказывается близкой к норме, а показатели почечной функции улучшаются, можно либо продолжить терапию тиамазолом, либо провести радикальное лечение (тиреоидэктомия или радиоактивный йод). Однако если на фоне снижения уровня Т4 показатели функции почек ухудшаются, лечение гипертиреоза лучше прекратить. В таких случаях пероральную терапию (эффект которой полностью обратим) отменяют, следят за состоянием почек и объясняют владельцу ситуацию. Некоторые кошки с гипертиреозом чувствуют себя гораздо лучше без лечения (см. рис 4-31 и 4-33). Однако мы редко поступаем таким образом. Обычно удается подобрать дозы тиамазола, которые не усугубляют состояние почек. Задача заключается в том, чтобы по возможности свести к минимуму клинические проявления гипертиреоза, исключив при этом возможность прогрессирования почечной недостаточности. Продолжение введения тиамазола в меньших дозах, чем требуется для достижения эутиреоза, полезно кошке и успокаивает ее владельца.
Наблюдения в течение первых трех месяцев терапии. Тиамазол может вызывать побочные эффекты (табл. 4-11). При осторожном продолжении лечения малыми дозами препарата (см. выше) такие реакции наблюдаются редко. Однако они все же встречаются, и раннее их выявление позволяет избежать катастрофических последствий. До начала лечения следует провести лабораторные исследования (общий анализ крови, биохимический анализ сыворотки и анализ мочи) Побочные эффекты, если они возникают, практически всегда проявляются в первые 4-8 недель. Поэтому в течение первых 8-12 недель терапии проводят повторные ис
следования. Некоторые авторы советуют повторно исследовать животных уже через 2 недели после начала лечения, но если терапию начинают с 2,5 или 5,0 мг тиамазола в сутки, то побочные реакции не развиваются. Поэтому через 2 недели мы просто осведомляемся о состоянии кошки по телефону и рекомендуем принести животное в клинику для повторного исследования лишь через 4 недели после начала лечения. При каждом исследовании необходимо определять концентрацию Т4 в сыворотке. Как отмечалось выше, особое внимание следует уделять активности ферментов печени, показателям почечной функции, а также числу эритроцитов, лейкоцитов и тромбоцитов. Изменение любого из этих параметров, свидетельствующее о токсичности препарата, требует его отмены до тех пор, пока показатели не нормализуются.
Кошек, получающих тиамазол более 3 месяцев, необходимо повторно обследовать с интервалами в 3-6 месяцев. В эти сроки побочные реакции, хотя и редко, но встречаются. Не исключено, что со временем владелец кошки отступает от схемы введения препарата. Поэтому важно следить за уровнем Т4 в сыворотке. При каждом повторном обследовании необходимо проверять вес кошки, опрашивать владельца о ее состоянии и тщательно осматривать ее. Получаемые при этом сведения помогают оценить необходимость дополнительных исследований.
Сроки оценки эффективности лечения. Концентрация Т4 в сыворотке при введении тиамазола должна измениться уже в первую неделю. Исследование через 2 недели после начала лечения или после каждого изменения дозы позволяет оценить действие препарата (дальнейшего падения уровня Т4 со временем обычно не происходит). Если применяемые дозы восстанавливают эутиреоз, концен-
ТАБЛИЦА 4-11. ПОБОЧНЫЕ ЭФФЕКТЫ АНТИТИРЕОИДНЫХ СРЕДСТВ ПРИ ЛЕЧЕНИИ ГИПЕРТИРЕОЗА У КОШЕК
Препарат Побочные эффекты Примерная частота (%) Время проявления Необходимое лечение
Тиамазол Рвота, анорексия, угнетенное состояние 15 < 4 недель Обычно транзиторное
Эозинофилия, лейкопения, лимфоцитоз 15 < 8 недель Обычно транзиторное
Самоцарапание 2 < 4 недель Отмена и глюкокортикоидная терапия
Агранулоцитоз, тромбоцитопения <5 < 3 месяцев Отмена иглюкокортикоидная терапия
Поражение печени (анорексия, повышение активности аланинаминотрансферазы и щелочной фосфатазы) <2 < 2 месяцев Отмена иглюкокортикоидная терапия
Появление антиядерных антител >50 > 6 месяцев Уменьшение суточной дозы
Злокачественная миастения Редко <16 недель Отмена и глюкокортикоидная терапия
Карбимазол Рвота, анорексия, угнетенное состояние 10 < 3 недель Обычно транзиторное
Эозинофилия, лейкопения, лимфоцитоз 5 < 2 недель Обычно транзиторное
Самоцарапание Редко < 4 нед Отмена и глюкокортикоидная терапия
Стабильный Йод Саливация и анорексия Редко Немедленно Изменение лекарственной формы
208 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
трация Т4 в сыворотке нормализуется уже в первые одну-две недели или раньше. Как отмечалось выше, разным кошкам требуются разные дозы тиамазола: одним достаточно 2.0 -2,5 мг/сутки, а другие нуждаются в 10- 12,5 мг/сутки. Наибольший эффект наблюдается при введении препарата дважды в сутки (Trepanier et al, 2003а). Описанная схема дает прекрасную возможность подобрать каждому животному нужную дозу. Реакцию на лечение оценивают по степени нормализации уровня Т4 в сыворотке.
Однако к кинический эффект тиамазола практически всегда проявляется позднее (рис. 4-34). Владельцы животных обычно замечают улучшение состояния своих питомцев лишь через 2-6 недель после нормализации уровня Т4 в сыворотке, и их следует предупреждать об этом, чтобы не вызвать преждевременного разочарования в действенности терапии 11ри использовании вышеописанного протокола с введением малых доз препарата клиническое улучшение может наступить только через много недель. Мы считаем, что преимущества такой схемы перевешивают опасности, связанные с более агрессивной терапией, и поэтому крайне важно объяснять владельцам животных, чего им следует ожидать.
Схема длительного лечения. После восстановления эутиреоза с помощью двух-трехразово-го в сутки введения препарата владельцы кошек, планирующие продолжать пероральную терапию, предпочитают переходить на одно-двухразовое введение таблеток. Уменьшение кратности введения тиамазола не должно сказываться на общей суточной его дозе. Например, трехразовое введение 2,5 мг препарата можно заменить введением 5 мг
утром и 2,5 мг вечером или однократным введением 7,5 мг. Через 4-8 недель владельцы кошек способны сами оценить эффективность измененном схемы лечения. Более ранние оценки реакции на лечение чреваты ошибками.
При переходе на менее частое введение тиамазола клинические проявления заболевания могут возобновиться, и владельцы кошек должны следить за этим. Достаточные эффект достигается обычно при введении препарата дважды в сутки. Однократное введение неэффективно (Trepanier et al, 2003а). Период полужизни тиамазола в сыворогке не превышает 4—6 ч (Trepanier et al, 1991 a,b). Однако, как показывают исследования у человека, тиамазол сохраняется в щитовидной железе в течение почти 20 часов (Cooper, 1984). Поскольку антитиреоидные средства угнетают синтез гормонов только после того, как накапливаются в щитовидном железе, ни режим их введения, ни продолжительность эффекта не зависят от периода их полужизни в крови.
При любом ухудшении состояния животного в условиях данного режима терапии следует обращаться к ветеринару, который обследует кошку и уточнит, какой схемы лечения придерживается владелец. Необходимо проверить часы введения тиамазола. При подозрении на недостаточно частое введение препарата, проверять уровень Г4 в сыворотке крови лучше всего перед введением очередной дозы. Это помогает выяснить, сохраняется ли эффект тиамазола в интервалах между его введением. Изменить дозировку или частоту введения препарата относительно легко. Если препарат трудно постоянно вводить внутрь, то можно подумать о его наружном применении.
40-1
36-
8
28-
о о о
Время (месяцы)
Рис. 4.34. Концентрации Т4 в сыворотке крови у 64 кошек с гипертиреозом до начала и в ходе длительного лечения тиамазолом. Горизонтальные линии - средние величины Цифры в скобках - число кошек, получавших терапию в течение указанного времени. Из: Peterson ME ct al, J Vet Intern Med 2:150, 1988.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 209
Недостатки
Ежедневное введение. Пероральная терапия гипертиреоза имеет ряд недостатков и иногда чревата серьезными последствиями. Однако чаще всего приходится сталкиваться с нежеланием владельцев вводить препарат кошкам внутрь несколько раз в сутки. Зачастую это просто невозможно, особенно если лечение продолжается долго. Постоянно голодным кошкам с гипертиреозом легко добавлять таблетки в пищу, но по мере устранения гипертиреоза голод уменьшается, и животные объедают корм вокруг таблетки. Поэтому препарат приходится вводить насильно. Кошки начинают прятаться от хозяев, кусаться и царапаться. В таких случаях следует обращаться к ветеринару, который поможет подобрать наружный препарат (см. предыдущий раздел).
Гипотиреоз. В процессе кратковременного или длительного лечения тиамазолом концентрация Т4 в сыворотке нередко падает ниже нормы, хотя у большинства кошек она остается в границах нормы (Peterson et al, 1988). Владельцы часто не обращают внимания на клинические признаки гипотиреоза (или не знают о них) и продолжают вводить прежние дозы препарата. Тиамазол в отличие от ПТУ не ингибирует 5’-дейодирование Т4 и его превращение в Т3 (Utiger, 1987). Поскольку биологически активен именно Т3, сохранение его концентрации объясняет отсутствие признаков гипотиреоза при некотором снижении уровня Т4 в сыворотке. При возникновении таких признаков следует просто уменьшить дозу тиамазола на 25-50% и через 4-8 недель повторно обследовать животное.
Побочные эффекты. Сравнительно легкие побочные эффекты тиамазола отмечаются у 10-15% кошек (Peterson, 1995а, 2000). Большинство таких эффектов проявляется в первые 4-6 недель лечения. После 2-3 месяцев терапии они возникают гораздо реже. Побочные эффекты включают обычно анорексию, рвоту и сонливость (Graves, 1995) и, как правило, исчезают самопроизвольно и не требуют отмены лечения.
Описанный выше консервативный подход к антитиреоидной терапии позволяет резко снизить частоту побочных эффектов. При введении малых начальных доз и их медленном увеличении такие эффекты отмечаются менее чем в 3% случаев. Желудочно-кишечные проявления требуют отмены препарата до полного их исчезновения. Затем возобновляют лечение меньшими дозами. Стремление избежать побочных эффектов путем начала лечения с малых доз вполне оправдано.
Иногда кошки, получающие тиамазол, царапают себе голову и шею. Как и большинство других побочных эффектов, это наблюдается обычно в первые 4-8 недель лечения. Хотя глюкокортикоиды несколько смягчают кожные повреждения, тиамазол все же следует отменить до их полного исчезновения или использовать в таких случаях
альтернативные методы лечения (операцию или радиойодтерапию).
Биохимические и гематологические побочные эффекты. Возможность развития разнообразных побочных эффектов требует повторного обследования животных через 4 недели после начала антитиреоидной терапии; в дальнейшем обследования нужно повторять каждые 2 недели (см. выше). Если побочные эффекты возникают при применении тиамазола, то они, скорее всего, будут иметь место и при использовании других антитиреоидных средств (ПТУ или карбимазола). Хотя эти вещества не действуют на почки, само устранение гипертиреоза может ухудшать почечную функцию (см. предыдущие разделы).
У небольшого процента животных, получающих тиамазол, наблюдаются поражения печени, сопровождающиеся анорексией, рвотой, сонливостью, желтухой и изменением (иногда резким) активности аланинаминотрасферазы и щелочной фосфатазы в сыворотке. Все эти клинические и биохимические сдвиги могут сохраняться в течение многих дней и недель после отмены препарата. В таких случаях следует предложить альтернативные способы лечения гипертиреоза. Если же единственно приемлемым средством остается тиамазол, то его нужно применять в крайне низких дозах и очень осторожно их увеличивать.
Тиамазол может вызывать легкую эозинофилию, лимфоцитоз и транзиторную лейкопению. Эти осложнения (особенно эозинофилия) могут быть связаны с нарушениями ЖКТ. К более серьезным осложнениям относится выраженная тромбоцитопения (число тромбоцитов менее 75000/мм3), которая может сопровождаться кровотечениями из носа и/или рта, а также агранулоцитоз (число лимфоцитов менее 2000/мм3). Последний нередко проявляется повышением температуры тела, анорексией, сонливостью и местными или системными инфекциями (Peterson et al, 1988; Sneng et al, 1999). Аутоиммунная гемолитическая анемия при лечении тиамазолом развивается менее чем в 0,1% случаев (Peterson, 1995а). Антиядерные антитела обнаруживаются почти у 50% кошек, получающих антитиреоидные средства дольше 6 месяцев, но их значение остается неясным (Graves, 1995). Коагулопатия, связанная с введением тиамазола, у кошек наблюдается крайне редко. Белок, индуцируемый К-авитаминозом (PIVKA), точнее отражает ее существование, чем такие показатели, как протромбиновое время (ПВ) или активированное частичное тромбопластиновое время (АЧТВ). У некоторых кошек с гипертиреозом нарушения свертывания крови имеют место еще до начала лечения (Randolph et al, 2000).
При обнаружении любого из серьезных осложнений необходимо отменить тиамазол и принять соответствующие меры (внутривенная жидкостная терапия, переливание крови и/или антибиотикоте-рапия). Отмена тиамазола обычно приводит к быс
210
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
трому (в течение 7 суток) исчезновению неблагоприятных реакций (Peterson et al, 1988). Поскольку некоторые из них представляют угрозу для жизни животного, вместо возобновления пероральной терапии следует прибегнуть к тиреоидэктомии или лечению радиоактивным йодом.
Карбимазол
Введение. В Западной Европе и Великобритании тиамазол не производится, и альтернативой ПТУ служит карбимазол (Нео-Мерказол, Англия), который не выпускается в США. Карбимазол - это еще одно производное тиомочевины, многие годы с успехом применяемое при гипертиреозе у человека. В организме это вещество превращается в тиамазол. Карбимазол в дозе 5 мг действует примерно так же, как 3 мг тиамазола. Это объясняет разницу в рекомендуемых дозах обоих веществ и частоте их побочных эффектов (Mooney et al, 1992а; Peterson, Aucoin, 1993).
Дозы. Рекомендуемая схема применения карби-мазола - по 5 мг внутрь три раза в сутки. Уровень Т4 в сыворотке при этом у большинства кошек нормализуется через 1-2 недели, а клиническое улучшение отмечается обычно через 2-3 недели (Mooney et al, 1992а). В отличие от тиамазола, одно- или двухразовое введение карбимазола в сутки в первые недели лечения, по-видимому, менее эффективно, чем трехразовое. Тем не менее, длительное двухразовое его применение оказывалось успешным. Мы предпочитаем в первые 7 суток вводить карбимазол по 2,5 мг два раза в сутки, а в следующие 3 недели по 5 мг два раза в сутки. После этого необходимо проверить концентрацию Т4 в сыворотке, определить другие показатели и в соответствии с ними подобрать дозу более точно. Однако для длительного лечения гипертиреоза у кошек следует продолжать вводить по 5 мг препарата дважды в сутки (Mooney, 1998а). Пока не будет доказано обратное, мы считаем, что такой режим позволяет снизить частоту побочных эффектов и в то же время обеспечить устранение гипертиреоза.
Побочные эффекты. Большинство побочных эффектов карбимазола развивается в первые 3 месяца после начала лечения. Карбимазол безвкусен, тогда как тиамазол обладает горьким вкусом. Это, по-видимому, объясняет меньшую частоту анорексии и рвоты у кошек, получающих карбимазол. Однако при введении этого вещества в дозе 5 мг три раза в сутки рвота и сонливость в первые 3 недели лечения все же возникают примерно у 10% кошек. Использование меньших доз и введение препарата 2 раза в сутки должны снизить процент животных, у которых развиваются эти побочные эффекты. В 5% случаев в начале лечения отмечается легкий и транзиторный лимфоцитоз, эозинофилия или лейкопения. Такой симптом, как царапанье головы и шеи, если и наблюдается, то обычно лишь в первые 6 недель лечения. В этих случаях, как прави
ло, необходимо отказаться от введения препарата (Mooney, 1998а; Bucknell, 2000).
Более серьезные побочные эффекты при применении карбимазола пока не встречались (Mooney, 1998а). Тем не менее, возможность развития агранулоцитоза и/или тромбоцитопении исключить нельзя, и поэтому необходимо проверять число лейкоцитов и тромбоцитов в крови. Анализ крови следует производить только при появлении клинических признаков таких осложнений. Изменения со стороны печени и антиядерные антитела (без системных проявлений синдрома волчанки), которые описаны при применении тиамазола, в случаях использования карбимазола не наблюдались. Применение этого средства часто приводит к падению концентрации Т4 ниже нормы, что не сопровождается клиническими признаками гипотиреоза. Отсутствие таких признаков может быть связано с сохранением нормальной концентрации Т3 вследствие его образования из Т4 на периферии или преимущественной секреции Т3 щитовидной железой (Mooney, 1998а).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ Предоперационная подготовка
Тиамазол. Во избежание осложнений во время и после операции животных необходимо тщательно обследовать; при выявлении застойной сердечной недостаточности, аритмий, почечных заболеваний (см. выше), да и просто резкого истощения (кахексии) следует провести соответствующее лечение. Осложнения операции и анестезии можно свести к минимуму предварительным устранением тиреотоксикоза.
С этой целью на протяжении 6-12 недель применяют тиамазол (внутрь или местно), добиваясь эутиреоза. Рекомендуется придерживаться вышеописанной «консервативной» схемы медикаментозной терапии. Медленное увеличение доз препарата затягивает предоперационную подготовку, но зато позволяет в большинстве случаев избежать возникновения побочных эффектов. Об эффективности терапии судят по нормализации уровня Т4 в сыворотке и явному улучшению клинического состояния животных. Оценка клинического состояния основывается на субъективных впечатлениях не только владельцев кошек, но и ветеринаров. Успешное лечение всегда сопровождается прибавкой в весе. При тяжелом гипертиреозе кратковременный курс пероральной терапии безопаснее, чем немедленная операция. Терапия в течение 6-12 недель оказывается в большинстве случаев достаточной и, кроме того, позволяет выявить тех животных, у которых устранение тиреотоксикоза ухудшает состояние почек (см. рис. 4-31 и 4-33).
Калия йодид, йодат и пропранолол, вводимые перорально. В некоторых случаях положительный эффект оказывает введение кошкам за 8-10 дней до операции по 1 капле насыщенного раствора калия
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 211
йодида (KI) в день. Этот раствор блокирует секрецию тиреоидных гормонов и уменьшает кровенаполнение щитовидной железы, что облегчает оперативное вмешательство (McDougall, 1981; Franklyn, 1994). Во избежание сильного слюнотечения каплю раствора можно вводить в небольших желатиновых капсулах, которые быстро проглатываются кошкой (Peterson, 1995а). Собственного опыта такого лечения у нас нет.
Для купирования гипертиреоза и аритмий перед операцией применяли сочетание калия йодата с пропранололом (Foster, Thoday, 1999). Однако такое сочетание может вызывать ряд побочных эффектов и осложнений. Мы продолжаем рекомендовать для предоперационной подготовки осторожное лечение тиамазолом или карбимазолом.
Пропранолол и другие 0-блокаторы. Кошкам с выраженной тахикардией или наджелудочковыми тахиаритмиями вводят пропранолол. Этот препарат должен снижать частоту сердечных сокращений и повышать ударный и минутный объем сердца. При гипертиреозе у человека 0-блокаторы (пропранолол, метопролол, атенолол и надолол) смягчают некоторые симптомы и признаки заболевания (например, тремор, тревожность и сердцебиения) быстрее, чем антитиреоидные средства (Franklyn, 1994).
Общее руководство. За день до операции состригают волосы на шее, чтобы сократить время анестезии. Непосредственно перед и во время операции внутривенно вводят физиологический раствор, избегая при этом перегрузки жидкостью, что могло бы ухудшить состояние сердца. Задача предоперационной подготовки (включая лечение тиамазолом и пропранололом) заключается в том, чтобы животное легло на операционный стол в максимально возможном стабильном состоянии. Это позволяет избежать многих осложнений операции. Операцию следует производить, хорошо подготовив к ней животное, а ни в коем случае не наспех.
Анестезия
Общие соображения. После купирования гипертиреоза пероральными средствами можно использовать распространенные схемы наркоза. В условиях повышенного основного обмена ускоряется всасывание, распределение, поглощение тканями и инактивация анестетиков. Кроме того, некоторые кошки с гипертиреозом остаются худыми даже после 6-12-недельного лечения тиамазолом. Все это требует тщательной проверки веса животного перед введением любого медикаментозного средства.
Премедикация и вводный наркоз. Нельзя использовать вещества, стимулирующие или усиливающие адренергическую активность, т.е. способные вызывать тахикардию или аритмии. Наоборот, следует применять средства, предотвращающие эти эффекты. Используемая нами процедура наркоза достаточно проста. Проявления гипертиреоза, связанные с активацией автономной нервной системы,
снимаются ацепромазином (0,1 мг/кг, внутримышечно). Антихолинергические средства (например, атропин) также должны быть исключены, так как они вызывают синусовую тахикардию и усиливают аритмогенное действие наркоза. Иногда вместо атропина применяют гликопиррония бромид.
Ксилозин и кетамин не используются, и некоторые хирурги предпочитают галотану изофлуран. Мы же обычно, помещая кошку после премедикации в специальную камеру для анестезии, применяем галотан, окись азота и кислород. Изофлуран - не менее эффективное средство для ингаляционного наркоза. При его использовании кошки быстро засыпают и просыпаются, что сильно сокращает время наркоза. Основной недостаток этого анестетика - высокая стоимость. Для вводного наркоза и интубации животного можно применять и тиамилал натрия. После интубации наркоз поддерживают ингаляционными средствами. Всегда следует стремиться к сокращению времени наркоза, во время которого необходимо постоянно наблюдать за состоянием животного. В качестве успокоительного средства можно использовать меперидин (демерол) в дозе 2-4 мг/кг, внутримышечно. Это вещество вводят некоторым агрессивным и беспокойным кошкам при простых манипуляциях.
Мониторинг. Тщательный мониторинг является необходимым условием операции. С помощью пищеводного стетоскопа или непрерывной регистрации ЭКГ и частых измерений артериального давления можно распознать надвигающуюся катастрофу и во время принять профилактические меры. Самые частые причины смерти во время операции - аритмии с последующей остановкой сердца. Под рукой всегда должны находиться пропранолол и лидокаин. Пропранолол можно разводить стерильной водой (1 мг в 10 мл). При возникновении тахикардии одномоментно вводят внутривенно от 0,25 до 1,0 мг этого препарата (Mooney, 1998а). Обычно достаточно одной дозы, действие которой продолжается 10-30 минут. Если аритмия возобновится, можно повторить введение пропранолола. К введению лидокаина прибегают лишь в последнюю очередь, поскольку он может вызвать у кошек метгемоглобинемию. Начальные дозы составляют 0,5-2,0 мг/кг, внутривенно. В случае успеха введение лидокаина повторяют каждые 10-30 минут. Лучше, чтобы за состоянием животного во время наркоза наблюдал не только хирург. Тщательное наблюдение должно продолжаться до полного выхода кошки из наркоза.
Методики операции
Общее руководство. Хирургическое удаление чрезмерно активной тиреоидной ткани, вероятно, наиболее частый метод лечения гипертиреоза в ветеринарной практике. Хирургическая ревизия передней области шеи осуществляется относительно просто, занимает не много времени и поэтому обходится недорого. Нормальные доли щитовидной
212 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Рис. 4-35. Фотография операционного поля при тиреоидэктомии у кошки с гипертиреозом. Обратите внимание на паращитовидную железу, расположенную у кончика зажима Алисы
железы имеют бледный желтоватый цвет, тогда как при аденоме или аденоматозной гиперплазии они выглядят коричневыми или красно-коричневыми. Необхо uimo осмотреть ткани шеи от подъязычной области (выше обычного расположения шитовидной железы) до входа в грудную полость, уделяя особое внимание гемостазу (Holzworth et al, 1980). После выделения и ревизии всей видимой на глаз тиреоидной ткани следует найти наружные паращитовидные железы, чтобы не повредить их во время операции (см. рис. 4-35). Эти железы обычно расположены в рыхлой фасции у верхнего полюса каждой доли, но иногда локализуются посредине или у нижнем о края прилежащей тиреоидной ткани. Внутренние паращитовидные железы, как правило, находятся в голще паренхимы долей щитовидной железы на том или ином уровне. Наружные пара
щитовидные железы гораздо меньше долей щитовидной железы и отличаются от них более светлым цветом и округлой формой. Доли щитовидной железы с прилегающими паращитовидными железами лежат в шейных «желобках», в каждом из которых расположены также сонная артерия, яремная вена и возвратная ветвь гортанного нерва (Birchard, 1998).
Одностороннее и двустороннее поражение. Более чем в 70% случаях гипертиреоза у кошек патологический процесс захватывает обе доли щитовидной железы, и поэтому у большинства животных приходится выполнять двустороннюю тиреоидэктомию. Однако доли железы часто увеличены в разной степени, и меньшая доля не поддается пальпации. Поэтому решение относительно необходимости одно- или двусторонней тиреоидэктомии, как правило, принимается уже во время операции. В случаях односторонней патологии наблюдается атрофия второй доли, но отличить ее от нормальной удается не всегда.
Наша клиника обладает неоценимой возможностью сканирования щитовидной железы до операции. Пользуясь результатами сканирования, хирург заранее точно знает, какую ткань нужно удалить. В отсутствие сканограммы, если хирург не уверен в акгивности меньшей доли, мы рекомендуем удалять только увеличенную долю (см. рис. 4-23 - 4-29). Если удается обнаружить только одну долю (рис. 4-36), то решение принять просто. Если увеличены обе доли, то обе они и подлежат удалению. Во избежание гипопаратиреоза предлагалось при двустороннем поражении удалять одну долю целиком, а вторую - наполовину. Однако такой подход чреват высокой вероятностью сохранения или ре-цидивирования гипертиреоза.
Субкапсулярная и экстракапсулярная тиреоидэктомия. Описаны две хирургические методики, и обе модифицированы с целью повысить шансы устранения гипертиреоза и сохранения паращитовидных желез. Первоначально предложенная мето-
Рис. 4-36. А. Фотография щитовидной железы (свет лая стрелка) при операции у кошки с «односторонним» I ипергиреозом. Темная стрелка - трахея. Б. Полностью удаленная одиночная аденома.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 213
Рис. 4-37. А. Интракапсулярная тиреоидэктомия. Капсулу щитовидной железы разрезают и удаляют пораженную долю (по модифицированной методике удаляют и часть капсулы). Б. Экстракапсулярная тиреоидэктомия. Долю щитовидной железы удаляют вместе с капсулой, сохраняя кровоснабжение наружных паращитовидных желез (по модифицированной методике используют не лигатуры, а биполярную каутеризацию). Из: Mooney СТ: In: Torrance AG, Mooney CT (eds): Manual of Small Animal Endocrinology, 2nd ed. British Small Animal Veterinary Association, 1988a, p 115.
дика субкапсулярной тиреоидэктомии заключалась в разрезе капсулы щитовидной железы и удалении пораженной доли, отделяемой от капсулы тупым путем. Капсула при этом оставалась на месте. Такой способ позволял сохранить паращитовидные железы, но приводил к рецидиву гипертиреоза вследствие роста прикрепленной к капсуле ткани (Swalec, Birchard, 1990; Mooney, 1998а). Методика экстра-капсулярной тиреоидэктомии исходно предполагала удаление доли вместе с капсулой после перевязки верхней щитовидной артерии с попыткой сохранения кровоснабжения прилежащей паращитовидной железы. Эта методика снижала вероятность рецидива гипертиреоза, но повышала риск послеоперационного гипопаратиреоза. Обе методики были модифицированы (рис. 4-37). При субкапсулярном подходе после экстирпации тиреоидной ткани удаляют большую часть капсулы. Если же выбирают экстракапсулярную методику, то вместо перевязки артерии производят биполярную «точечную» элек-трокаутеризацию, что в большей степени предохраняет паращитовидные железы от повреждения (Welches et al, 1989). Чаще пользуются модифицированной экстракапсулярной методикой, так как такая операция занимает меньше времени и сопровождается меньшим кровотечением, которое скрывает от хирурга операционное поле (Mooney, 1998а).
Послеоперационный рецидив гипертиреоза. Недостатком любой операции (но в большей степени свойственным субкапсулярной тиреоидэктомии) является невозможность удаления всей аденоматозной ткани щитовидной железы. При использовании опи
санных выше модификаций рецидивы гипертиреоза случаются довольно редко (Swalec, Birchard, 1990).
Аутотрансплантация паращитовидной железы для предотвращения ятрогенного гипопаратиреоза (гипокальциемии)
Введение. Послеоперационная гипокальциемия - одно из наиболее серьезных осложнений двусторонней тиреоидэктомии. В зависимости от методики операции это осложнение наблюдается в 6-82% случаев (Birchard et al, 1984; Flanders et al, 1987; Welches et al, 1989). Слабая и транзиторная гипокальциемия у большинства кошек с сохраненными паращитовидными железами считается следствием обеднения костной ткани кальцием при хроническом тиреотоксикозе. После успешной операции (даже односторонней) кости восстанавливают свои запасы кальция, и его концентрация в сыворотке несколько дней остается низкой (McDougall, 1981). Эту легкую гипокальциемию (уровень кальция в сыворотке 7,0-9,0 мг%) следует отличать от тяжелой острой или прогрессирующей гипокали-циемии, обусловленной ятрогенным гипопаратиреозом и требующей специального лечения. Такая гипокальциемия связана, по всей вероятности, с транзиторным или постоянным повреждением (или удалением) паращитовидных желез.
Аутотрансплантация паращитовидной железы. Аутотрансплантацией называют пересадку ткани с одного места на другое у одной и той же особи. В данном случае речь идет об аутотрансплантации наружной паращитовидной железы на место, отдаленное от ее нормального расположе
214 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ния. У человека такая процедура производится давно (Shaha et al, 1991). Она предполагает тщательное отделение наружной паращитовидной железы от окружающих тканей. Крайне важно очистить ее от всех аденоматозных клеток щитовидной железы. Затем паращитовидную железу нарезают на кусочки не более 3 мм в диаметре. Эти кусочки рекомендуется помещать в ложе одной из подъязычно-грудинных мышц, хотя можно выбрать любое другое место. Брюшко мышцы прошивают шелком, чтобы отметить место пересадки. В первую неделю после операции гипокальциемия может сохраняться, но через 7-14 дней трансплантат обычно начинает функционировать (Padgett et al, 1998). Мы рекомендует производить аутотрансплантацию паращитовидной железы во всех случаях двусторонней тиреоидэктомии, но это можно делать и при односторонней операции.
Недостатки хирургического лечения
Хирургическое лечение гипертиреоза имеет ряд недостатков (см. табл. 4-10). Во-первых, тиреотоксикоз чаще развивается у старых кошек, и они крайне истощены и слабы. Во-вторых, у этих животных часто нарушена функция других органов (главным образом, сердца и почек), что увеличивает опасность наркоза. В-третьих, многие владельцы отказываются от операции своих питомцев из-за дороговизны этого метода или страха перед наркозом. В-четвертых, операция чревата многими осложнениями, включая повреждение возвратного гортанного нерва (с изменением голоса), синдром Хорнера, послеоперационный гипопаратиреоз с угрожающей жизни гипокальциемией и постоянный гипотиреоз. Наконец, гипертиреоз после субтотальной тиреоидэктомии может сохраниться или рецидивировать (Flanders et al, 1987; Welches et al, 1989; Swalec, Birchard, 1990; Birchard, 1991). У человека операция без предварительного лечения антитиреоидными средствами может привести к развитию тиреотоксического криза. У кошек это осложнение не описано.
Частота осложнений в большой мере зависит от опытности хирурга, тщательности обследования перед наркозом и качества предоперационной подготовки животного. Своевременное выявление и лечение сопутствующих заболеваний, сохранение или пересадка паращитовидных желез и максимальное сокращение времени наркоза резко уменьшают риск осложнений. Однако некоторые владельцы отвергают любой вариант хирургического лечения своих кошек. Поэтому методы терапии всегда нужно предварительно обсуждать с хозяевами животных.
Послеоперационное лечение
Кратковременный мониторинг. После операции тщательно регистрируют объемы вводимой жидкости и выделенной мочи. Жидкостную тера
пию следует прекращать по возможности раньше. Чтобы вовремя обнаружить отек легких, аритмии и другие нарушения сердечно-сосудистой системы, периодически прослушивают сердце, снимают ЭКГ и измеряют артериальное давление.
Мониторинг уровня кальция в сыворотке, лечение тетании
Введение. После двусторонней тиреоидэктомии следует в течение 4-7 суток определять концентрацию кальция в сыворотке не менее одного раза в день. Как отмечалось выше, легкая и транзиторная гипокальциемия после операции развивается довольно часто. Ятрогенный (послеоперационный) гипопаратиреоз характеризуется падением уровня кальция ниже 7,0 мг%. После двусторонней операции необходимо в течение 4-7 суток тщательно следить за состоянием животного, ожидая появления клинических признаков тетании (табл. 4-12). Перед началом ее лечения следовало бы убедиться в наличии гипокальциемии, определив концентрацию кальция в сыворотке крови. Однако в случае острого криза с клиническими признаками тетании кальций необходимо давать немедленно, не дожидаясь результатов анализа (Peterson, 1992). При тяжелой гипокальциемии (уровень кальция в сыворотке ниже 6,5 мг%) независимо от наличия ее клинических признаков, помимо кальция, вводят внутрь витамин D (диагностика и лечение гипокальциемии подробно рассматриваются в гл. 17).
Витамин D? Мы располагаем опытом применения различных препаратов витамина D. Эргокальциферол [витамин D2 (Дриздол) Winthrop-Breon Laboratories, США] - недорогой препарат, выпускаемый в растворе, который можно вводить кошкам. Введение внутрь по 10000 ME раз в сутки повышает уровень кальция в сыворотке, но эффект проявляется лишь через 5-21 дней. Накапливаясь в жировой ткани, эргокальциферол может вызывать гиперкальциемию. Последние дозы препарата можно вводить с большими интервалами (1 раз в 7-14 дней), Тем не менее, мы не рекомендуем вводить его кошкам с послеоперационной гипокальциемией.
Дигидротахистерол [Roxane Laboratories, США; Гитакерол (раствор для приема внутрь), Winthrop-Breon Laboratories, США] стоит дороже, чем витамин D2, но действует быстрее: повышение уровня кальция в сыворотке наблюдается уже через 1-7 дней. Этот препарат обладает менее продолжительным действием, чем эргокальциферол, что
ТАБЛИЦА 4-12. ПРИЗНАКИ ГИПОКАЛЬЦИЕМИИ У КОШЕК
Беспокойство
«Раздражительность»
Изменение поведения
Мышечные спазмы или боли
Тремор, особенно мышц морды и ушей
Тетания
Судороги
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 215
снижает риск его накопления в тканях и развития длительной гиперкальциемии. Обычно его вводят внутрь в течение 3 дней по 0,03 мг/кг один раз в день. В последующие 4 дня вводят по 0,02 мг/кг/ день, а затем дозу вновь снижают. При использовании раствора эффект достигается чаще и раньше, чем при применении таблетированной формы.
Витамин Df Витамин D3 [кальцитриол (рокат-рол), Roche, США] обладает рядом преимуществ перед более дешевыми препаратами. Он быстрее начинает действовать, быстрее выводится из организма при передозировке, и его эффект более постоянен. Дозы для кошек составляют 2,5-10 нг/кг/ сутки. Препарат выпускается в капсулах по 0,25 и 0,5 мкг, и мы вводим по одной капсуле (0,25 мкг) каждые 48 ч (Graves, 1995). Выпускается и кальцитриол для инъекций (см. гл. 17).
Кальциевые добавки. Существует ряд препаратов кальция лактата и кальция карбоната. Кошкам вводят по 0,5-3 г кальция в сутки. Обычно достаточно давать по половине или целой таблетке два-три раза в сутки. При резко выраженной тетании и невозможности введения кальция внутрь можно внутривенно вводить кальция глюконат. Раствор вводят медленно под контролем ЭКГ во избежание брадикардии и аритмий. Затем кальция глюконат, смешанный с равным объемом физиологического раствора, можно вводить подкожно 2-4 раза в сутки в той же дозе, в которой его вводили внутривенно (обычно 1- 5 мл). Кальция хлорид ни при каких обстоятельствах подкожно вводить нельзя, так как он вызывает раздражение и некроз тканей.
Транзиторный гипопаратиреоз. Длительность явного гипопаратиреоза в разных случаях различна. Одни кошки нуждаются в лечении только несколько дней, тогда как другие - пожизненно. Транзиторный характер послеоперационного гипопаратиреоза предвидеть трудно. На фоне терапии витамином D и кальцием период восстановления функции паращитовидных желез может продолжаться дни, недели и месяцы. Это может быть связано либо с восстановлением активности паращитовидных желез, обратимо поврежденных при операции, либо с началом функционирования дополнительной паратиреоидной ткани. Не исключено также, что регулирующие обмен кальция механизмы «приспосабливаются» к отсутствию паратиреоидного гормона (Flanders et al, 1991).
Заместительная терапия витамином D может препятствовать восстановлению секреции паратиреоидного гормона и даже вызывать гиперкальциемию. Нельзя заранее предвидеть, как долго та или иная кошка будет нуждаться в витамине D. Поэтому необходимо либо следить за концентрацией кальция в сыворотке, либо постепенно уменьшать дозы витамина у всех животных. Начинать снижать дозы следует через несколько дней или недель, и весь этот процесс должен продолжаться не менее 8-16 недель. Задача заключается в том, чтобы поддерживать концентрацию кальция в сыворотке на
уровне, достаточном для предотвращения тетании (8,5-9,5 мг%), но в тоже время не препятствующем восстановлению функции сохранившейся паратиреоидной ткани. При наличии дополнительной паратиреоидной ткани лечение следует полностью отменить через несколько недель или месяцев после операции.
Гипотиреоз
Субтотальная тиреоидэктомия. После субтотальной тиреоидэктомии у кошек уровень Т4 в сыворотке крови некоторое время может оставаться ниже нормы. В таких случаях заместительная терапия тиреоидными гормонами не показана. Через 1-3 месяца оставшаяся атрофированная тиреоидная ткань начинает функционировать нормально. Введение тиреоидных гормонов лишь затягивает период роста и восстановления функции этой ткани.
Тотальная тиреоидэктомия. Через 24-48 часов после тотальной тиреоидэктомии концентрация тиреоидных гормонов в плазме часто падает ниже нормы. Однако это не является абсолютным показанием к началу заместительной гормональной терапии. По контрасту с прежним состоянием животных хозяева обычно обращают внимание на сонливость и ожирение кошек (см. гл. 3). Кожные признаки гипотиреоза развиваются относительно редко и требуют заместительной терапии тиреоидными гормонами лишь в исключительных случаях. Это может объясняться ростом дополнительной тиреоидной ткани в области шеи или переднего средостения с последующей секрецией тиреоидных гормонов.
При необходимости заместительной гормональной терапии можно использовать синтетический препарат солоксин (Jones Medical Industries, St. Louis, Mo). Обычные дозы для кошек составляют 0,05 - 0,2 мг/сутки. Необходимо помнить, однако, что, как и при лечении витамином D и кальцием, нужда в заместительной гормональной терапии может быть недолгой, поскольку со временем активность тиреоидной ткани восстанавливается. Не ясно, связано ли это с ростом клеток, сохранившихся in situ, или с началом функционирования дополнительной тиреоидной ткани. В любом случае заместительная терапия может подавлять эндогенную секрецию тиреоидных гормонов. Поэтому вводимые дозы гормонов следует постепенно снижать и через 1-3 месяца полностью отменить их, чтобы проверить необходимость дальнейшей терапии.
Рецидив гипертиреоза. Из-за возможности рецидива гипертиреоза у всех перенесших операцию кошек следует один-два раза в год проверять уровень тиреоидных гормонов в сыворотке крови (Welches et al, 1989; Swalec, Birchard, 1990). При возникновении рецидива рекомендуется использовать антитиреоидные средства или радиойодтера-пию. Повторные операции гораздо чаще сопровождаются осложнениями (Welches et al, 1989; Peterson, 1995a). Сканирование, позволяющее определить локализацию функционирующей тиреоидной тка-
216 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
ни, значительно облегчает решение вопроса о повторной операции.
Сохранение гипертиреоза. Иногда односторонняя или даже двусторонняя тиреоидэктомия не приводит к исчезновению клинических признаков гипертиреоза. Это означает, что где-то сохранилась активная тиреоидная ткань. Чаще всего такая ткань располагается в средостении, кпереди от сердца. Радиоизотопное сканирование позволяет обнаружить ее еще до операции, и в этом случае следует выбрать другой способ лечения. Если же этого не было сделано, то сканирование после операции выявляет причину сохранения гипертиреоза. Мы не советуем производить хирургическое обследование грудной полости и предпочитаем проводить сканирование и локализовать опухоль до операции. Идеальный способ лечения в такой ситуации - введение радиоактивного йода. Возможность сохранения гипертиреоза лишний раз подчеркивает необходимость тщательной ревизии передней области шеи вплоть до входа в грудную клетку.
Результаты хирургического лечения
В большинстве ветеринарных клиник операция проходит весьма успешно. Кошки хорошо переносят ее, и гипертиреоз исчезает. Исключение составляют животные с сопутствующими заболеваниями (например, почечной недостаточностью), случаи активной тиреоидной ткани в средостении, односторонняя операция при изменениях и во второй доле, а также рецидивы гипертиреоза в отдаленные сроки. Осложнения наркоза и самой операции зависят от опытности хирурга и тщательности послеоперационного ведения животных. Преимуществами хирургического лечения являются возможность его проведения в большинстве ветеринарных клиник и относительная дешевизна. Операция, как правило, радикально излечивает гипертиреоз, а соблюдение правил предоперационной подготовки и послеоперационной терапии снижает заболеваемость и смертность, связанные с этим способом лечения.
РАДИОЙОДТЕРАПИЯ
Теоретические предпосылки
Клетки щитовидной железы поглощают радиоактивный йод точно так же, как стабильный. При тиреотоксикозе у человека щитовидная железа поглощает из крови более 50% радиоактивного йода. Он накапливается в железе, и его излучение разрушает активные клетки. Соседние ткани остаются интактными, поскольку излучение проникает на очень небольшое расстояние. Важно подчеркнуть, что погибают только активные клетки, а атрофированные получают гораздо меньшую дозу облучения и поэтому сохраняются. Восстановление их функции после гибели основной массы гиперактивной ткани железы в большинстве случаев исключает развитие постоянного гипотиреоза.
Радиоактивный йод для лечения гипертиреоза у человека впервые был применен в 1941 г., а у кошек почти через 40 лет. Радиойодтерапия прекрасно зарекомендовала себя и является методом выбора при гипертиреозе у кошек. В первые 10-15 лет этот способ лечения был малодоступен, но в настоящее время он широко распространен в США и других странах. Его можно использовать и в тех случаях, когда операция не показана (например, у кошек с загрудинным зобом или метастазами рака щитовидной железы) или когда владелец животного категорически отказывается от операции.
Выбор радиоактивного изотопа
Для радиойодтерапии используют йод-131 (период полураспада 8,1 суток). Этот изотоп обладает как р-, так и у-излучением. Основной повреждающий эффект обусловлен p-излучением. Пробег Р-час-тиц в ткани не превышает 2 мм, а средняя длина пробега - 400 мкм. Эти частицы действуют местно, вызывая некроз фолликулярных клеток с последующим фиброзом сосудов и стромы и исчезновением коллоида. Репликация выживших клеток нарушается, и срок их жизни укорачивается. Поэтому эффект радиоактивного йода продолжается длительное время. Паращитовидные железы при таком виде лечения не страдают.
Цель лечения
Целью радиойодтерапии является как можно быстрое устранение гипертиреоза с помощью одной дозы 1311. У человека этого удается добиться в 60-70% случаев, а каждая следующая доза приводит к восстановлению эутиреоза еще у 2/3 оставшихся больных. У кошек одна доза 1311 снижает уровень тиреоидных гормонов в сыворотке уже через несколько дней или недель (рис. 4-38 - 4-40) (Meric et al, 1986; Peterson, Becker, 1995). Результаты радиойодтерапии у животных, по-видимому, лучше, чем у людей.
Расчет доз
Кошки, получавшие до радиойодтерапии антитиреоидные препараты. Большинство специалистов по лучевой терапии не разделяют опасений по поводу того, что предварительный прием антитиреоидных средств снижает захват радиоактивного йода щитовидной железой и тем самым уменьшает эффективность радиойодтерапии. Тем не менее, считается, что больным, которым предстоит лечение радиоактивным йодом, не следует назначать антитиреоидные препараты. Даже если эти препараты не сказываются на действии радиоактивного йода, больных вряд ли следует подвергать риску побочных эффектов пероральной терапии в тех случаях, когда планируется другой вид лечения (Utiger, 2002b). Проспективные и ретрос-
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
217
Время после введения 1311 (сутки)
Рис. 4-38. Концентрации Т4 в сыворотке крови у 10 кошек с гипертиреозом, определяемая через каждые 12 ч после введения 1311. Обратите внимание на быстрое снижения уровня гормона. Затемненная область - диапазон нормальных значений. (Из: Meric S et al: J Am Vet Med Assoc 188:1038, 1986.)
Рис. 4-39. Концентрации Т4 в сыворотке крови у 31 кошки с гипертиреозом, получавших ,311. Определения проводились до введения изотопа, через 4 и 8 дней после его введения (примерное время выписки из клиники) и через 1 месяц. Обратите внимание на быстрое снижение уровня гормона. Пустые кру> очки - концентрации Т4 у трех кошек, у которых через 1 месяц после лечения сохранился гипертиреоз. Затемненная область - дипазон нормальных значений. Из: Meric S, et al: J Am Vet Med Assoc 188:1038, 1986.
До лечения 7-25 дни 2-3 месяца 6-12 месяцев (524) (524) (519) (502)
Рис. 4-40. Концентрации Г4 в сыворотке крови у 524 кошек с гипертиреозом до и в разнос время после введения радиоактивного иода. Данные представлены как на рис. 4.13. Из: Peterson ME: hi: Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5’h cd. Philadelphia, WB Saunders, 2000, p 1400.
218 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
пективные исследования показывают, что предварительный прием тиамазола в течение недель или месяцев не снижает эффективности терапии 1311 у больных гипертиреозом (Marcocci et al, 1990; Ime-sis et al, 1998; Andrade et al, 2001). To же, по-видимому, справедливо и для кошек (Smith et al, 1994, 1995). Однако ПТУ все же снижает эффективность радиойодтерапии у человека (Hancock et al, 1997; Imesis et al, 1998).
Расчет дозы 131I с помощью введения следовых количеств изотопа. До введения терапевтической дозы 1311 можно исследовать его поглощение и выведение с помощью следовых количеств этого изотопа. Доза облучения щитовидной железы зависит от захвата йода, размеров железы и эффективного периода полураспада радиоизотопа. Необходимая доза облучения щитовидной железы у кошек составляет 150 Гр. Для точного расчета вводимой дозы используют следующую формулу:
Доза 13'I (мкКи) =
20000 рад/г х вес щитовидной железы (г) х Т1/21311 (160рад/мкКи) (% ПРЙ) (100 х Тфф)
где Т1/2- период полураспада 1311; ПРЙ - поглощение радиоактивного йода щитовидной железой; Тфф - эффективный период полураспада изотопа у кошки; 160 рад/мкКи - уровень излучения 1311.
Несмотря на столь сложный расчет, окончательная доза облучения, получаемая щитовидной железой, непостоянна. В одном из исследований она колебалась от 7100 до 64000 рад (Turrel et al, 1984). Чем выше исходный уровень Т4 в сыворотке, тем, по-видимому, реже однократная доза 1311 приводит к успеху. В соответствии с изложенной формулой вводимая доза 1311 может колебаться от 1 до 10 мКи (от 37 до 370 мБк). Радиоактивный йод можно вводить внутрь, подкожно и внутривенно. При использовании такой схемы примерно у 80% кошек эутиреоз восстанавливается в первые 3 месяца, а в большинстве случаев в течение одного месяца (см. рис. 4-38 и 4-39) (Turrel et al, 1984; Meric et al, 1986; Broome et al, 1988). Остальным животным приходится либо вводить вторую дозу 1311, либо применять другие методы лечения.
Недостатком расчета кинетики 1311 в щитовидной железе является необходимость дополнительных расходов на анестезию или седативные средства и на более длительную госпитализацию животного. Согласно нашему опыту, работа со следовыми количествами 1311 в большинстве случаев не требует применения анестезирующих или седативных средств. Больше того, как мы видели, расчет вводимой дозы не исключает резких колебаний степени облучения щитовидной железы и не дает преимуществ по сравнению с введением одной стандартной дозы. Эффективность радиойодтерапии с использовани
ем расчетной дозы у человека не отличается от эффективности введения фиксированной дозы в 5 или 10 мКи (Franklyn, 1994). Поэтому при гипертиреозе у человека используют и фиксированные дозы (Jar-lov et al, 1995).
Определение дозы 1311 по концентрации т4 в сыворотке и тяжести гипертиреоза. Этот способ позволяет обойтись без исследования кинетики 1311 в щитовидной железе. Кошкам вводят перорально, подкожно или внутривенно от 2 до 6 мКи (74-222 мБк; 1 Ки = 3,7 х 1010 Бк) (Peterson, Becker, 1995). Исходя из тяжести клинических признаков гипертиреоза, субъективной оценки размеров щитовидной железы и концентрации Т4 в сыворотке, используют низкие (2,5-3,5 мКи), средние (3,5—4,5 мКи) или высокие (4,5-6,5 мКи) дозы 131I (Jones et al, 1991; Meric, Rubin, 1990; Peterson, 1995a,b, 2000; Peterson, Becker, 1995). При таком лечении более 500 кошек сохранение гипертиреоза через 6 месяцев было отмечено менее чем у 2% животных; в этих случаях пришлось вводить вторую дозу 1311 (см. рис. 4-40). Только у 2% животных клинические и лабораторные данные указывали на развитие гипотиреоза. У такого же процента кошек (2%) в интервале от 1 до 6 месяцев возникал рецидив гипертиреоза. Таким образом, этот способ расчета вводимой дозы 1311 достаточно эффективен и более прост, чем расчет на основании кинетических исследований. Исключается также необходимость в дополнительном применении седативных или анестезирующих средств.
В течение последних 10 лет мы используем именно такой способ определения дозы 13 Ч. Основываясь на перечисленных выше критериях (концентрации Т4 в сыворотке в момент диагноза, размерах доли или долей щитовидной железы и тяжести клинических проявлений гипертиреоза) мы произвольно вводим кошках подкожно от 3 до 8 мКи (Theon, 2002), подразделяя дозы на низкие (3^1 мКи), средние (4-6 мКи) и высокие (6-8 мКи). Большинство животных получают по 4—5 мКи. Результаты этой схемы радиойодтерапии превосходны. Сохранение или рецидивы гипертиреоза наблюдаются реже, чем при использовании меньших доз 1311. Интересно, что более низкой оказывается и частота гипотиреоза.
Лечение большими дозами 1311. Введение очень больших доз радиоактивного йода (10-30 мКи) почти всегда приводит к полной деструкции не только аденоматозной, но и нормальной ткани щитовидной железы. Использование таких доз резко увеличивает риск гипотиреоза. При этом обычно требуется более длительная госпитализация животных, так как большая доза медленнее выводится из организма. Высокие дозы применяют, как правило, у кошек с гистологически подтвержденным функционирующим раком щитовидной железы, поскольку чем выше доза, тем больше вероятность деструкции всех злокачественных клеток (Turrel et al, 1988; Theon, 2002).
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 219
Гистологически подтвержденный рак щитовидной железы. Рак щитовидной железы обнаруживается всего в 2-3% случаев гипертиреоза у кошек. У некоторых таких животных при сканировании выявляются одиночные или двусторонние узлы, «типичные» для аденоматозной гиперплазии или аденомы. У большинства же кошек при раке щитовидной железы сканирование обнаруживает многочисленные крупные узлы неправильной формы или отдаленные метастазы. При подтвержденном раке лучше всего использовать именно радиойодтерапию, поскольку 1311 разрушает раковую ткань независимо от ее локализации. С другой стороны, при раке йод концентрируется и задерживается в клетках щитовидной железы хуже, чем при аденоме или аденоматозной гиперплазии. Большинство онкологов применяют очень высокие дозы радиоактивного йода (10-30 мКи) (Guptill et al, 1995; Theon, 2002).
При раке щитовидной железы у кошек с успехом используют комбинированное лечение: хирургическое удаление основной массы опухоли с последующим введением большой дозы радиоактивного йода (Peterson, Becker, 1995; Guptill et al, 1995). Как отмечалось выше, при введении высокой дозы 1311 следует рассчитывать на более длительную госпитализацию, так как экскреция радиоактивного вещества в таких случаях требует более длительного времени. Однако поскольку злокачественная ткань поглощает йод слабее нормальной, изотоп быстро выводится из организма, и владелец может забрать свою кошку после относительно недолгой госпитализации. Однако длительная госпитализация улучшает прогноз.
Способы введения 1311
Сравнение внутривенного и подкожного способов введения 1311, проведенное на двух группах кошек (более 80 животных в каждой), не выявило различий в эффективности радиойодтерапии, но подкожное введение сопряжено с меньшим риском облучения персонала и меньше травмирует животных. Через 4 года после введения радиоактивного йода в эутиреоидном состоянии находилось примерно по 85% кошек каждой группы. Позднее у 6% животных появились клинические признаки гипотиреоза (Theon et al, 1994). Введение изотопа внутрь, обычно применяемое у человека, для кошек не рекомендуется, поскольку повышает риск облучения персонала. Однако в некоторых клиниках с успехом используют пероральное введение 1311 в желатиновых капсулах (Weichselbaum et al, 2003).
Радиационная безопасность
В клинике. Кошки, получившие 1311, служат источником опасного излучения для человека и других животных. При любой работе с этим изотопом необходимо соблюдать правила радиационной бе
зопасности. В течение 1-3 недель после введения 1311 следует всячески ограничивать контакт человека с облученными животными. В клинике должно быть помещение исключительно для животных, получивших радиоактивный изотоп. Каждую кошку содержат в отдельной клетке, и пока ее наружное излучение не упадет ниже 45 миллирентген/час, всю мочу и кал собирают в специальный контейнер для радиоактивных отходов. Доступ персонала в помещение для таких животных должен быть ограничен. Необходима защитная одежда и дозиметрический контроль. Нельзя работать с животными без перчаток. Кошек госпитализируют в среднем на 7-10 дней после введения изотопа и возвращают их хозяевам, когда моча и кал становятся безопасными. Точный срок необходимой изоляции таких животных определить трудно (Weichselbaum et al, 2003).
После клиники. Владельцев следует инструктировать в отношении правил обращения с животными в течение нескольких недель после радиойодтерапии. На каждую кошку нужно надеть бирку с уведомлением о том, что ей недавно был введен радиоактивный изотоп, и что ее нельзя брать на руки. В первые 2-3 недели пребывания кошки в домашних условиях лица старше 45 лет должны держаться от нее на расстоянии не меньше 1 м (за исключением коротких периодов необходимого ухода). Лицам моложе 45 лет не следует подходить к животному ближе, чем на 2 м, а дети до 18 лет и беременные женщины вообще не должны контактировать с ним. Кошку нужно держать в особом помещении или на привязи, а ее подстилка должна быть покрыта пластиком. Изотоп выводится с мочой, и поэтому подстилки необходимо убирать как радиоактивный материал. После контакта с кошкой, ее миской или подстилкой нужно тщательно мыть руки. Соблюдение этих правил в течение 2-3 недель после госпитализации животного сводит к минимуму воздействие радиации на человека.
Длительное наблюдение и прогноз
Повторные обследования и гипотиреоз. Вначале кошку необходимо показывать ветеринару каждые 2-3 месяца. Во время таких визитов ветеринар опрашивает хозяина о состоянии животного, проводит физикальное обследование и определяет концентрацию Т4 в сыворотке. При передозировке 1311 может развиться гипотиреоз, который лечат L-тироксином (0,05-0,1 мг внутрь 1-2 раза в сутки). Отсутствие клинического улучшения и сохранение высокого уровня Т4 в сыворотке через 3-6 месяцев служит показанием для введения повторной дозы 1311. Необходимость в третьей дозе возникает крайне редко.
Прогноз заболевания. У человека для устранения гипертиреоза требуется в среднем 1,4—2 дозы 131I (Holm et al, 1981). Радиойодтерапия у кошек, по-видимому, более эффективна, так как через 3 месяца после введения одной дозы эутиреоз восстанавливается у 95% животных. В случаях сохранения гипертиреоза (5%) обычно исходно имеются большие
220 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
опухоли, тяжелые признаки заболевания и очень высокие концентрации Т4 в сыворотке (Peterson, Becker, 1995). Введение 1311 не приводит к повреждению каких-либо органов, кроме щитовидной железы.
Прогноз выживания. Длительные наблюдения за состоянием более 200 кошек, получавших 1311 по поводу гипертиреоза в отсутствие других заболеваний (Slater et al, 2001), показали, что продолжительность жизни у самцов меньше, чем у самок. Прогностическим фактором является и возраст животного в момент введения изотопа: молодые кошки после облучения жили дольше, чем старые. Например, через 5 лет после радиойодтерапии осталось в живых 28% 10-летних самцов и лишь 4% 16-летних. Десятилетние самки выживали в течение 5 лет в 42% случаев. Средний возраст кошек к моменту смерти составлял 15 лет (с колебаниями от 10 лет до 21 года). Непосредственными причинами смерти чаще всего оказывались заболевания почек (41%) и злокачественные опухоли (16%).
Преимущества радиойодтерапии (см. табл. 4.10)
Введение 1311 не травмирует кошек старшего возраста и, как правило, не требует применения анестезирующих, седативных или каких-либо иных средств, а также хирургических вмешательств (Peterson, 1995b, 2000). Необходимые предосторожности, особенно при подкожном введении изотопа, позволяют избежать облучения персонала (Theon et al, 1994). Радиойодтерапия оказывается успешной у большого числа животных, и единственным ее побочным эффектом остается гипотиреоз, который развивается крайне редко и практически никогда не требует лечения (Theon et al, 1994; Peterson, Becker, 1995). Эффект наступает быстро (Meric et al, 1986). Определять точную дозу вводимого 1311 с помощью компьютерной технологии не обязательно. Результаты радиойодтерапии, по-видимому, не зависят от предшествующего или текущего лечения пероральными антитиреоидными средствами.
Недостатки радиойодтерапии (см. табл. 4-10)
Лечение радиоактивным йодом, как и все другие формы терапии, не лишено недостатков. Этот способ лечения не везде доступен и требует знания правил радиационной безопасности и применения дорогого и сложного оборудования. После введения 1311 необходима госпитализация животных в течение 7-10 суток, что волнует некоторых владельцев и, кроме того, обходится довольно дорого. В отдельных случаях устранение тиреотоксикоза требует повторного введения 1311.
Необходимость в повторном лечении
Примерно в 2-5% случаев гипертиреоза у кошек 1311 приходится вводить дважды (Peterson, 1995а,b;
Peterson, Becker, 1995). Как и любая другая форма лечения, радиойодтерапия несовершенна. Недостаточная реакция на первую дозу 1311 может быть связана с ошибкой при выборе дозы, тяжестью гипертиреоза, большими размерами и высокой активностью щитовидной железы, наличием злокачественных клеток и быстрым выведением изотопа. Во всех этих случаях повторное введение 1311, как правило, оказывается эффективным.
НОВЫЕ СПОСОБЫ ЛЕЧЕНИЯ ПОД КОНТРОЛЕМ УЗИ
Чрескожная инъекция этанола при одностороннем гипертиреозе
Введение. В последние годы при первичном гиперпаратиреозе или гипертиреозе у человека с успехом применяют чрескожную инъекцию этанола (ЧИЭ) под контролем УЗИ (Livraghi et al, 1990; Lippi et al, 1996; Monzani et al, 1997; Bennedbaek et al, 1997). Этанол вызывает коагуляционный некроз и тромбоз сосудов в ткани. ЧИЭ с прекрасными результатами применялось и у собак с первичным гиперпаратиреозом (см. гл. 16). Поскольку этот вид терапии требует лишь кратковременной анестезии (менее 30 минут) и обходится дешевле, было решено оценить его эффективность и при гипертиреозе у кошек. ЧИЭ проводили 8 животным с «односторонним» гипертиреозом.
Результаты. Данные сканирования щитовидной железы и УЗИ шеи у этих 8 кошек подтверждали диагноз. Животных наркотизировали, и область шеи готовили как для операции. Под контролем УЗИ в увеличенную долю щитовидной железы вводили иглу. Рассчитывали объем узла, в шприц набирали 100%-ный раствор этанола в количестве, равном половине объема узла, и соединяли шприц с иглой. Дозу этанола выбирали с таким расчетом, чтобы он полностью инфильтрировал пораженную долю железы (по данным УЗИ). Затем иглу удаляли, и животное просыпалось. У 2 из 8 кошек имелись кистозные узлы щитовидной железы. В этих случаях перед введением этанола кистозную жидкость отсасывали шприцом. Количество введенного этанола составляло от 50 до 100% объема пораженной доли.
Через 48 часов после этой процедуры концентрация Т4 в сыворотке у всех 8 кошек снижалась до нормы (на рис. 4-41 приведены 4 случая). Каждая кошка находилась под наркозом менее 30 минут, и через 5 дней после процедуры никаких неблагоприятных системных эффектов не наблюдалось. Только в 2 случаях хозяева отмечали изменение голоса своих питомцев. У одной кошки через 6 недель голос восстановился, но у второй изменение голоса сохранилось. Все животные оставались в эутиреоидном состоянии, по меньшей мере, на протяжении 18 месяцев (рис. 4-41). Был сделан вывод об эффективности этого способа лечения гипертиреоза (Goldstein et al, 2001).
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
221
Рис. 4-41. Концентрации общего (мкг%) и свободного (нг%) Т4 в сыворотке крови до и в разные сроки после чрескожной инъекции этанола (через 1,2 и 3 дня, 2,3 и 6 недель и 2,4, 6 и 9 месяцев). На каждом графике приведены данные, полученные у отдельной кошки. Из: Goldstein RE, et al: J Am Vet Med Assoc 218:1298, 2001.
Чрескожная инъекция этанола при двустороннем гипертиреозе
Успех ЧИЭ при одностороннем гипертиреозе позволил применить этот метод лечения и при поражении обеих долей щитовидной железы. Методика процедуры не отличалась от описанной выше. Первая кошка погибла через 12 ч после ЧИЭ. Учитывая сообщение о параличе гортанного нерва после аналогичного лечения (Walker, Schaer, 1998), летальный исход, скорее всего, был связан с двусторонним параличом этих нервов. Поэтому следующим 7 кошкам этанол вводили только в наиболее увеличенную долю щитовидной железы. У некоторых животных развился транзиторный односторонний паралич гортанного нерва. Эутиреоз удалось восстановить у всех 7 кошек, но он сохранялся не дольше 6 месяцев (рис. 4-42). Таким образом, при двустороннем гипертиреозе ЧИЭ применять не следует, поскольку эта процедура не обеспечивает длительного выздоровления и сопряжена с риском тяжелых побочных эффектов.
Чрескожная термокоагуляция ткани
Введение. Одновременно с ЧИЭ мы испытывали и другой способ лечения гипертиреоза, а именно термокоагуляцию ткани щитовидной железы. У
Юз
Рис. 4-42. Концентрации Т4 у одной кошки с гипертиреозом в течение 64 недель после первой инъекции этанола. Обратите внимание на транзиторный характер реакции после каждого введения этанола. Черные стрелки - инъекции этанола в левую долю щитовидной железы. Пунктирная стрелка - инъекция этанола в правую долю. Горизонтальными пунктирными линиями ограничен диапазон нормальных колебаний концентрации Т4 (от 1,1 до 3,9 мкг%). Из: Wells AL et al: Am Vet Med Assoc 218:1293, 2001.
222 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
человека аналогичный способ применялся при небольших опухолях печени, молочной и предстательной железы (Livraghi et al, 1999; Jiao et al, 1999; Dja-van et al, 1999; Jeffrey et al, 1999). Таким способом достигается температурный некроз ткани у кончика иглы, что имеет ряд преимуществ перед ЧИЭ. Повреждается только та ткань, которая расположена вокруг неизо шрованной части иглы; местное кровоснабжение остается интактным. Это позволяет в гораздо большей степени контролировать размеры повреждения и исключает рассеивание эффекта. По мерс накопления опыта термокоагуляция в нашей клинике становится методом выбора при лечении собак с первичным гиперпаратиреозом (Pollard et al, 2001) (см. гл. 16).
Эффективность униполярной электрокоагуляции оценивали у 9 кошек с гипертиреозом: у 4 с односторонним и у 5 с двусторонним увеличением долей щитовидной железы. Процедура проводилась под контролем УЗИ, как при ЧИЭ. Наркоз, положение животных и их подготовка также не отличались от таковых при ЧИЭ. Неизолированным оставался только кончик иглы. Под контролем УЗИ иглу вводили в увеличенную долю щитовидной железы или в наиболее крупную из них (при двустороннем поражении). Убедившись в правильном положении иглы, на нее подавали высокочастотные электрические импульсы с энергией 10 Вт, увеличивая ее при необходимости до 30 Вт. Достижение цели контролировалось резким повышением эхогенности ткани (рис. 4-43). Некротизированная ткань приобретала на экране белый цвет и пенистый вид. Она очень напоминала лопнувшее кукурузное зерно.
Результаты. У 4 кошек с увеличением одной из долей щитовидной железы проводили термокоагуляцию каждо! о узла. У трех из этих кошек эутиреоз сохранялся в течение 4, 7 и 19 месяцев соответственно. У одной кошки с рецидивом заболевания процедуру проводили повторно, после чего животное оставалось в эутиреоидном состоянии на протяжении 9 месяцев. В одном случае, несмотря на снижение уровня Т4 в сыворотке, эутиреоза достичь не удалось. После термокоагуляции наиболее
крупного узла при двустороннем поражении у двух кошек эутиреоз сохранялся в течение 7 и 9 месяцев соответственно. У двух таких кошек термокоагу-ляция узлов не имела успеха, но после повторной процедуры эутиреоз у них сохранялся на протяжении 2 и 9 месяцев. У пятой кошки с двусторонним гипертиреозом термокоагуляцию повторяли трижды. Уровень Т4 у нее резко снизился уже после первой процедуры, а каждая последующая восстанавливала эутиреоз на 5 месяцев. У 2 из 9 животных развился синдром Хорнера, который через 2 месяца разрешился спонтанно. Таким образом, униполярная термо коагуляция позволяет на время избавить кошек от гипертиреоза (Mallcry et al, 2002). В настоящее время мы оцениваем эффективность биполярной теормокоагуляции, которая, по предварительным данным, дает лучшие результаты.
ДОПОЛНИТЕЛЬНЫЕ ЛЕЧЕБНЫЕ СРЕДСТВА
Пропранолол
Теоретические предпосылки. Пропранолол - это р-адрсноблокатор, чаще всего применяемый при гипертиреозе у человека. Он не оказывает прямого действия на щитовидную железу и поэтому не приводит к восстановлению эутиреоза. Описан случай тиреотоксичсского криза на фоне приема пропранолола. Пропранолол ингибирует превращение Т4 в 1 и у больных тиреотоксикозом уменьшает тахикардию, повышает сократимость миокарда, ослабляет тремор, тревожность, возбудимость, потливость, непереносимость тепла, миопатию и уменьшает потерю веса (McDougall, 1981).
У кошек с тиреотоксикозом при ЭхоКГ часто регистрируется гипердинамия миокарда без значительного расширения камер сердца. Многие нарушения кровообращения в таких случаях связаны с тахикардией. У 12% животных ЭКГ обнаруживает признаки гипертрофической кардиомиопатии, и лишь у немногих (3%) выявляется дилатационная кардиомиопатия. В случаях гипердинамии миокар-
Рис. 4-43. Гиперэхогенность тиреоидной ткани после ее высокочастотной термокоагуляции, данные УЗИ. А. Узел в щитовидной железе, который предстоит коагулировать. Б. Введение иглы в узел. В. Повышенная эхогенность коагулированной тиреоидной ткани.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК • 223
да, гипертрофической кардиомиопатии, тахикардии или наджелудочковых тахиаритмий введение пропранолола может замедлять пульс, снижать конечное диастолическое давление в левом желудочке, увеличивать время наполнения желудочков, а также уменьшать кислородные потребности миокарда и градиент давления на выходе из сердца.
Повышенная концентрация тиреоидных гормонов при гипертиреозе увеличивает число 0-адрено-рецепторов в сердце, что и обусловливает, вероятно, положительный хронотропный и инотропный эффекты этих гормонов. Однако пропранолол уменьшает не только ЧСС, но и частоту дыхания, а также снижает АД и возбудимость. У большинства кошек с гипертиреозом пропранолол ослабляет сердечнососудистые сдвиги, но при застойной кардиомиопатии лучше применять препараты наперстянки, а не пропранолол.
Дозы. Кошкам пропранолол вводят перорально в дозах от 2,5 мг дважды в сутки до 5 мг трижды в сутки. Это вещество быстро всасывается в ЖКТ, и его период полужизни в плазме крови составляет 3-6 часов. В каждом отдельном случае подбирают дозы с учетом конкретной цели терапии. Для устранения тахикардии или аритмий требуется постепенно увеличивать дозы пропранолола (см. раздел «Предоперационная подготовка»]). Эффект препарата следует оценивать по клинической реакции и результатам периодически проводимой ЭКГ. На ЭКГ должно обнаруживаться снижение ЧСС и/или частоты предсердных экстрасистол. Пропранолол угнетает работу сердца, и при сердечной недостаточности его следует применять с крайней осторожностью. При застойной сердечной недостаточности используют фуросемид в сочетании с другими средствами.
При экспериментальном гипертиреозе период полужизни пропранолола не меняется (Jacobs et al, 1997). У кошек с гипертиреозом после введения этого вещества внутрь максимальная его концентрация в плазме, фракционное всасывание и площадь под кривой концентрации были выше, чем у здоровых животных. Это свидетельствует о возрастании биологической доступности пропранолола при тиреотоксикозе, которая превышает 100%, по-видимому, за счет его кишечно-печеночного кругооборота. Данные этого исследования указывают на необходимость применения меньших, чем обычно, доз пропранолола у некоторых кошек с гипертиреозом.
Атенолол
Атенолол обладает некоторыми преимуществами, так как он более избирательно действует на [3, -адренорецепторы, его эффект продолжается дольше, и этот препарат выпускается и в форме сиропа. Атенолол вводят кошкам в дозах 6,25-12,5 мг в сутки. Начинать нужно с низкой дозы, постепенно увеличивая ее до появления эффекта. Это вещество не
льзя начинать вводить непосредственно перед наркозом. Сначала нужно подобрать адекватную дозу (Mooney, Thoday, 2000).
Стабильный йод
Для синтеза тиреоидных гормонов в щитовидной железе необходимо небольшое количество йодида, Кратковременный (в течение 1 -2 недель) прием больших доз йодида вызывает у здоровых людей транзиторный гипотиреоз. При гипертиреозе йодид быстро снижает концентрацию тиреоидных гормонов в сыворотке. На 7—14 день после начала его приема не только ослабевают клинические признаки гипертиреоза, но и уменьшаются размеры и кровенаполнение щитовидной железы.
Однако с помощью йодида редко удается достичь полной ремиссии гипертиреоза или купировать его дольше, чем на несколько недель. Йодид тормозит свою собственную органификацию, снижает секрецию ранее образованных тиреоидных гормонов и оказывает тормозящее влияние на другие процессы в щитовидной железе. Он занимает скромное, но вполне определенное место в арсенале средств лечения гипертиреоза: йодид в дозе 500 мг назначают внутрь при тиреотоксическом кризе у человека. Мы не наблюдали острых тиреотоксических кризов у кошек, но используем насыщенный раствор KI, наряду с антитиреоидными средствами, для предоперационной подготовки животных. По 1-2 капли этого раствора вводят раз в день, начиная за 10 дней до операции. Из-за неприятного вкуса раствор помещают в небольшие желатиновые капсулы (Peterson, Turrel, 1986).
Йодированные рентгеноконтрастные средства
Пероральные средства для холецистографии (например, кальция иподат) ингибируют периферическую конверсию Т4 в Т3, тормозят синтез Т4 и ослабляют эффект ТТГ. Блокада превращения Т4 в Т3 была показана при ятрогенном гипертиреозе у кошек, причем побочных эффектов иподат практически не имел. Из 12 кошек с самопроизвольно развившимся гипертиреозом, которые получали кальция иподат, у 8 наблюдался положительный эффект. Через 2 недели после начала введения этого вещества концентрация общего Т4 в сыворотке снижалась до нормы и держалась на этом уровне в течение 14 недель. У животных улучшалось клиническое состояние, увеличивался вес тела, снижались ЧСС и АД. У 4 из 8 этих кошек эффект сохранялся в течение 6 месяцев, но у двух на 14-ой неделе развился рецидив гипертиреоза. Отсутствие клинической реакции на иподат, даже при удвоении его дозы, наблюдалось у животных с тяжелым течением заболевания, у которых уровень общего Т4 в сыворотке не снижался (Murray, Peterson, 1997). Кальция иподат можно использовать вместо стабильного йода
224 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
при кратковременной подготовке кошек к операции (Mooney, Thoday, 2000).
Глюкокортикоиды
Избыток глюкокортикоидов, по-видимому, прямо действует на гипоталамус или гипофиз, приводя к торможению секреции ТТГ. Глюкокортикоиды могут также способствовать образованию из Т4 не Т3, а реверсивного Т3 (рТ3). Не исключено и непосредственное влияние глюкокортикоидов на щитовидную железу, особенно при гипертиреозе. У больных тиреотоксикозом прием глюкокортикоидов снижает концентрации Т4, Т3 и тиреоглобулина в сыворотке крови. Для лечения гипертиреоза у кошек глюкокортикоиды не применялись.
Тиамин
У кошек с признаками тиаминовой недостаточности введение тиамина резко улучшает состояние. Тиаминовая недостаточность и ее лечение подробнее рассматривались выше (см. раздел «Симптом склонения головы (недостаточность тиамина или калия)».
ГИПЕРТИРЕОЗ НА ФОНЕ ДРУГИХ ЗАБОЛЕВАНИЙ
С одной из наиболее трудных диагностических проблем ветеринары сталкиваются, по-видимому, в случаях одновременного присутствия у кошек гипертиреоза и других тяжелых заболеваний. Гипертиреоз у старых кошек может развиваться на фоне первичных заболеваний сердца, почечной недостаточности, новообразований кишечника (особенно лимфосаркомы), сахарного диабета и гиперкортицизма (см. табл. 4-5). Важно подчеркнуть, что признаки этих заболеваний могут имитировать или усиливать некоторые проявления гипертиреоза. Возможность таких заболеваний всегда следует иметь в виду при обследовании старых животных, даже при наличии у них пальпируемых образований на шее и подтвержденного гипертиреоза.
Диагноз гипертиреоза подтверждается повышенными концентрациями Т3 и Т4 в сыворотке крови. Соответствующее лечение (тиамазол, операция или радиоактивный йод) должно устранять проявления болезни. Если же, несмотря на нормализацию уровня тиреоидных гормонов, клиническое состояние животного не улучшается, то следует искать другую болезнь, имитирующую гипертиреоз. Иначе диагноз останется ошибочным, лечение будет неправильным, и все это, помимо прочего, окажет неблагоприятное психологическое воздействие не только на владельца кошки, но и на ветеринара.
ПРОГНОЗ
Прогноз зависит от физического состояния животного к моменту установления диагноза, равно как
от его возраста, пола и поражения других органов. Поскольку все три основных способа лечения гипертиреоза достаточно эффективны, мы настоятельно рекомендуем владельцам не оставлять своих питомцев без лечения. Ожидаемая продолжительность жизни кошки при любом из видов терапии составляет в среднем 2 года. Конечно, колебания этого показателя крайне велики, и на прогнозе сказывается тот факт, что гипертиреоз - заболевание старых кошек (Peterson, 1995а; Peterson, Becker, 1995; Slater et al, 2001).
Важным прогностическим фактором является гистологическое строение и активность узлов щитовидной железы. В отличие от собак, у которых опухоли этой железы обычно не сопровождаются гипертиреозом, у кошек такие опухоли, как правило, секретируют избыточные количества тиреоидных гормонов и изменяют клиническое состояние животных. Очевидно, что при аденоматозной гиперплазии щитовидной железы прогноз лучше, чем при раке этого органа.
Долговременный прогноз зависит и от вида лечения. Старых истощенных кошек с двусторонним поражением щитовидной железы лучше всего лечить радиоактивным йодом. Невозможность использовать этот вид терапии может ухудшить прогноз. Последний зависит также от переносимости животными антитиреоидных средств, применяемых в качестве основного вида лечения или для предоперационной подготовки. Успех лечения во многом определяется опытом хирурга, осложнениями наркоза и массой других факторов. Тем не менее, лечение гипертиреоза улучшает долговременный прогноз.
ЛИТЕРАТУРА
Adams WH, et al: Investigation of the effects of hyperthyroidism on renal function in the cat. Can J Vet Res 61:53, 1997a.
Adams WH, et al: Changes in renal function in cats following treatment of hyperthyroidism using ”4. Vet Radiol Ultrasound 38:231, 1997b.
Andrade VA, et al: Methimazole pretreatment does not reduce the efficacy of radioiodine in patients with hyperthyroidism caused by Graves’ disease. J Clin Endocrinol Metab 86:3488, 2001.
Archer FJ, Taylor SM: Alkaline phosphatase bone isoenzyme and osteocalcin in the serum of hyperthyroid cats. Can Vet J 37:735, 1996.
Aucoin DP, et al: Propylthiouracil-induced immune-mediated disease in cats. J Pharmacol Exp Ther 234:13, 1985.
Aucoin DP, et al: Dose dependent induction of anti-native DNA antibodies by propylthiouracil in cats. J Arthr Rheum 31:688, 1988.
Barber PJ, Elliott J: Study of calcium hemostasis in feline hyperthyroidism. J Small Anim Pract 37:575, 1996.
Beck KA, et al: The normal feline thyroid: Technetium pertechnetate imaging and determination of thyroid to salivary gland radioactivity ratios in 10 normal cats. Vet Radiol 26:35, 1985.
Becker TJ, et al: Effects of methimazole on renal function in cats with hyperthyroidism. J Am Anim Hosp Assoc 36:215, 2000.
Beleslin DB, et al: Nature of salivation produced by thyrotropin-releasing hormone (TRH). Brain Res Bull 18:463, 1987a.
Beleslin DB, et al: Studies of thyrotropin-releasing hormone (TRH)-induced defecation in cats. Pharmacol Biochem Behav 26:639, 1987b.
Belew AM, et al: Evaluation of the white-coat effect in cats. J Vet Intern Med 13:134, 1999.
Bennedbaek FN, et al: Percutaneous ethanol injection therapy in the treatment of thyroid and parathyroid diseases. Eur J Endocrinol 136:240, 1997.
Birchard SJ: Thyroidectomy and parathyroidectomy in the dog and cat. Probl Vet Med 3:277, 1991.
Birchard SJ: Thyroidectomy in the cat. In Peterson ME (ed): Hyperthyroidism. Daniels Pharmaceuticals Monograph, 1998, p 15.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
225
Birchard SJ, et al: Surgical treatment of feline hyperthyroidism: Results of 85 cases. J Am Anim Hosp Assoc 20:705, 1984.
Biscoveanu M, Hasinski S: Abnormal results of liver function tests in patients with Graves’ disease. Endocr Pract 6:367, 2000.
Bodey AR, Samson J: Epidemiological study of blood pressure in domestic cats. J Small Anim Pract 39:567, 1998.
Bond BR: Hyperthyroid heart disease in cats. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1986, p 399.
Bond BR, et al: Echocardiographic evaluation of 30 cats with hyperthyroidism (abstract). American College of Veterinary Internal Medicine Science Proceedings, New York, 1983.
Bond BR, et al: Echocardiographic findings in 103 cats with hyperthyroidism. J Am Vet Med Assoc 192:1546, 1988.
Bradley RA, Feldman EC: Propylthiouracil treatment of feline hyperthyroidism (abstract). American College of Veterinary Internal Medicine Science Proceedings, 1982.
Braselton WE, et al: Measurement of serum iohexol by determination of iodine with inductively coupled plasma atomic emission spectroscopy. Clin Chem 43:1429, 1997.
Broome MR, et al: Peripheral metabolism of thyroid hormones and iodide in healthy and hyperthyroid cats. Am J Vet Res 48:1286, 1987.
Broome MR, et al: Predictive value of tracer studies for 1J’I treatment in hyperthyroid cats. Am J Vet Res 49:193, 1988.
Broussard JD, et al: Changes in clinical and laboratory findings in cats with hyperthyroidism from 1983 to 1993. J Am Vet Med Assoc 206:302, 1995.
Brown RS, et al: Thyroid growth immunoglobulins in feline hyperthyroidism. Thyroid 2:125, 1992.
Brucker-Davis F, et al: Diagnosis and treatment outcome of patients with thyrotropin-secreting pituitary tumors. 84:476, 1999.
Bucknell DG: Feline hyperthyroidism: Spectrum of clinical presentations and response to carbimazole therapy. Aust Vet J 78:462, 2000.
Carpenter JL, et al: Tumors and tumorlike lesions. In Holzworth J (ed): Diseases of the Cat: Medicine and Surgery. Philadelphia, WB Saunders, 1987, p 406.
Chizzonite RA, et al: Isolation and characterization of two molecular variants of myosin heavy chain from rabbit ventricle: Change in their content during normal growth and after treatment with thyroid hormone. J Biol Chem 257:2056, 1982.
Christopher MM: Relation of endogenous Heinz bodies to disease and anemia in cats: 120 cases (1978-1987). J Am Vet Med Assoc 194:1089, 1989.
Cook SM, et al: Radiographic and scintigraphic evidence of focal pulmonary neoplasia in three cats with hyperthyroidism: Diagnostic and therapeutic considerations. J Vet Intern Med 7:303, 1993.
Cooper DS: Antithyroid drugs. N Engl J Med 311:1353, 1984.
Court MH, Freeman LM: Identification and concentration of soy isoflavones in commercial cat foods. Am J Vet Res 63:181,2002.
Court MH, Greenblatt DJ: Molecular genetic basis for deficient acetaminophen glucuronidation by cats: UGT1A6 is a pseudo-gene, and evidence for reduced diversity of expressed hepatic UGT1A isoforms. Pharmacogenetics 10:355, 2000.
DiBartola SP, Brown SA: The kidney and hyperthyroidism. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p 337.
DiBartola SP, et al: Effects of treatment of hyperthyroidism on renal function in cats. J Am Vet Med Assoc 208:875, 1996.
Divi RL, et al: Antithyroid isoflavones from soybean: Isolation, characterization, and mechanisms of action. Biochem Pharmacol 54:1087, 1997.
Djavan B, et al: Outcome analysis of minimally invasive treatments for benign prostatic hypertrophy. Tech Urol 5:12, 1999.
Duda RJ, et al: Concurrent assays of circulating bone GLA-protein and bone alkaline phosphatase: Effects of age, sex, and metabolic bone disease. J Clin Endocrinol Metab 66:951, 1988.
Duyff RF, et al: Neuromuscular findings in thyroid dysfunction: A prospective clinical and electrodiagnostic study. J Neurol Neurosurg Psychiatry 68:750, 2000.
Elliott J, et al: Feline hypertension: clinical findings and response to antihypertensive treatment in 30 cases. J Small Anim Pract 42:122, 2001.
Eriksen EF, et al: Trabecular bone remodeling and bone balance in hyperthyroidism. Bone 6:421, 1985.
Ferguson DC, et al: Serum free and total iodothyronine concentrations in normal cats and cats with hyperthyroidism. J Vet Intern Med 3:121, 1989.
Flanders JA, et al: Feline thyroidectomy: A comparison of postoperative hypocalcemia associated with three different surgical techniques. Vet Surg 16:362, 1987.
Flanders JA, et al: Functional analysis of ectopic parathyroid activity in cats. Am J Vet Res 52:1336, 1991.
Forrest U, et al: Feline hyperthyroidism: Efficacy of treatment using volumetric analysis for radioiodine dose calculation. Vet Radiol Ultrasound 37:141, 1996.
Foster DJ, Thoday KL: Use of propranolol and potassium iodate in the presur-gical management of hyperthyroid cats. J Small Anim Pract 40:307, 1999.
Foster DJ, Thoday KL: Tissue sources of serum alkaline phosphatase in 34 hyperthyroid cats: A qualitative and quantitative study. Res Vet Sci 68:89, 2000.
Foster DJ, et al: Selenium status of cats in four regions of the world and comparison with reported incidence of hyperthyroidism in cats in those regions. Am J Vet Res 62:934, 2001.
Franklyn JA: The management of hyperthyroidism. N Engl J Med 330:1731, 1994.
Fraser WD, et al: Intact parathyroid hormone concentration and cyclic AMP metabolism in thyroid disease. Acta Endocrinol 124:652, 1991.
Gerber H, et al: Etiopathology of feline toxic nodular goiter. Vet Clin North Am (Small Anim Pract) 24:541, 1994.
Goldstein RE, et al: Percutaneous ethanol injection for treatment of unilateral hyperplastic thyroid nodules in cats. J Am Vet Med Assoc 218:1298, 2001.
Gordon JM, et al: Juvenile hyperthyroidism in a cat. J Am Anim Hosp Assoc 39:67, 2003.
Graves TK: Complications of treatment and concurrent illness associated with hyperthyroidism in cats. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders, 1995, p 369.
Graves TK, Peterson ME: Diagnosis of occult hyperthyroidism in cats. Probl Vet Med 2:683, 1990.
Graves TK, Peterson ME: Occult hyperthyroidism in cats. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XL Philadelphia, WB Saunders, 1992, p 334.
Graves TK, et al: Changes in renal function associated with treatment of hyperthyroidism in cats. Am J Vet Res 55:1745, 1994.
Guptill L, et al: Response to high-dose radioactive iodine administration in cats with thyroid carcinoma that had previously undergone surgery. J Am Vet Med Assoc 207:1055, 1995.
Gurlek A, et al: Liver test abnormalities in hyperthyroidism before and during PTU therapy. J Clin Gastroenterol 24:180, 1997.
Hammer KB, et al: Altered expression of G proteins in thyroid gland adenomas obtained from hyperthyroid cats. Am J Vet Res 61:874, 2000.
Hancock LD, et al: The effect of propylthiouracil on subsequent radioactive iodine therapy in Graves’ disease. Clin Endocrinol 47:425, 1997.
Hays MT, et al: A multicompartmental model for iodide, thyroxine, and triiodothyronine metabolism in normal and spontaneously hyperthyroid cats. Endocrinology 122:2444, 1988.
Henik RA, et al: Treatment of systemic hypertension in cats with amlodipine besylate. J Am Anim Hosp Assoc 33:226, 1997.
Hoenig M, Ferguson DC: Impairment of glucose tolerance in hyperthyroid cats. J Endocrinol 121:249, 1989.
Hoffman SB, et al: Bioavailability of transdermal methimazole in a pluronic lecithin organogel (PLO) in healthy cats. J Vet Pharmacol Therap p. 189, 2002.
Hofmeister E, et al: Functional cystic thyroid adenoma in a cat. J Am Vet Med Assoc 219:190, 2001.
Holm LE, et al: Cure rate after ,3’l therapy for hyperthyroidism. Acta Radiol 20:161, 1981.
Holtman JR, et al: Central respiratory stimulation produced by thyrotropinreleasing hormone in the cat. Peptides 7:207, 1986.
Holzworth J, et al: Hyperthyroidism in the cat: Ten cases. J Am Vet Med Assoc 46:345, 1980.
Horney BS, et al: Agarose gel electrophoresis of alkaline phosphatase isoenzymes in the serum of hyperthyroid cats. Vet Clin Pathol 23:98, 1994.
Imesis RE, et al: Pretreatment with propylthiouracil but not methimazole reduces the therapeutic efficacy of iodine-131 in hyperthyroidism. J Clin Endocrinol Metab 83:685, 1998.
Ingbar DH: The respiratory system in thyrotoxicosis. In Braverman LE, Utiger RD (eds): The Thyroid: A Fundamental and Clinical Text, 6th ed. Philadelphia, JB Lippincott, 1991, p 744.
Jacobs G, Panciera D: Cardiovascular complications of feline hyperthyroidism. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders, 1992, p 756.
Jacobs G, et al: Congestive heart failure associated with hyperthyroidism in cats. J Am Vet Med Assoc 188:52, 1986.
Jacobs G, et al: Pharmacokinetics of propranolol in healthy cats during euthyroid and hyperthyroid states. Am J Vet Res 58:398, 1997.
Jarlov AE, et al: Calculated versus fixed dose of RAI for the treatment of hyperthyroidism. Clin Endocrinol 43:325, 1995.
Jeffrey SS, et al: Radiofrequency ablation of breast cancer: first report of an emerging technology. Arch Surg 134:1064, 1999.
Jiao LR, et al: Clinical short-term results of radiofrequency ablation in primary and secondary liver tumors. Am J Surg 177:303, 1999.
Jodar E, et al: Hyperthyroidism-induced bone loss. Clin Endocrinol 47:279, 1997.
Jones BR, et al: Radioiodine treatment of hyperthyroidism in cats. N Z Vet J 39:71, 1991.
Joseph RJ, Peterson ME: Review and comparison of neuromuscular and central nervous system manifestations of hyperthyroidism in cats and humans. Prog Vet Neurol 3:114, 1993.
Kass PH, et al: Evaluation of environmental, nutritional, and host factors in cats with hyperthyroidism. J Vet Intern Med 13:323, 1999.
Kintzer PP: Diagnosis of feline hyperthyroidism. Vet Previews 2:7, 1995.
Kintzer PP, Peterson ME: Thyroid scintigraphy in small animals. Semin Vet Med Surg (Small Anim) 6:131, 1991.
Kobayashi DL, et al: Hypertension in cats with chronic renal failure and hyperthyroidism. J Vet Intern Med 4:58, 1990.
Kruger JM, et al: Putting GFR into practice: Clinical applications of iohexol clearance. Proceedings of the 15th Annual Veterinary Medical Forum. American College of Veterinary Internal Medicine, 1998.
226 • ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
Larsen PR, et al: Relationships between circulating and intracellular thyroid hormones: Physical and clinical implications. Endocr Rev 2:87, 1981.
Lievesly P, Gruffydd-Jones TJ: Episodic collapse and weakness in cats. Vet Ann 29:261, 1989.
Lippi F, et al: Treatment of solitary autonomous thyroid nodules by percutaneous ethanol injection: Results of an Italian multicenter study. J Clin Endocrinol Metab 81:3261, 1996.
Litten RZ, et al: Altered myosin isozyme patterns from pressure overloaded and thyrotoxic rabbit hearts. Circ Res 50:856, 1982.
Liftman MP: Spontaneous systemic hypertension in 24 cats. J Vet Intern Med 8:79, 1994.
Liu S, et al: Hypertrophic cardiomyopathy and hyperthyroidism in the cat. J Am Vet Med Assoc 185:52, 1984.
Livraghi T, et al: Treatment of autonomous thyroid nodules with percutaneous ethanol injection: preliminary results. Radiology 175:827, 1990.
Livraghi T, et al: Small hepatocellular carcinoma: Treatment with radiofrequency ablation versus ethanol ablation. Radiology 210:655, 1999.
Lurye JC, et al: Evaluation of an in-house enzyme-linked immunosorbent assay for quantitative measurement of serum total thyroxine concentration in dogs and cats. J Am Vet Med Assoc 221:243, 2002.
Mackovic-Basic M, Kleeman CR: The kidneys and electrolyte metabolism in thyrotoxicosis. In Braverman LE, Utiger RD (eds): The Thyroid: A Fundamental and Clinical Text, 6th ed. Philadelphia, JB Lippincott, 1991, p 771.
Maggio F, et al: Ocular lesions associated with systemic hypertension in cats: 69 cases (1985-1998). J Am Vet Med Assoc 217:695, 2000.
Mallery K, et al: Percutaneous ultrasonographically guided radiofrequency heat ablation for treatment of hyperthyroidism in cats. J Vet Intern Med 16:360, 2002 (abstract).
Mandel SJ, et al: Superiority of iodine-123 compared with iodine-131 scanning for thyroid remnants in patients with differentiated thyroid carcinoma. Clin Nucl Med 26:6, 2001.
Marcocci C, et al: A reappraisal of the role of methimazole and other factors on the efficacy and outcome of radioiodine therapy of Graves' hyperthyroidism. J Endocrinol Invest 13:513, 1990.
Martin FIR, et al: Hyperthyroidism in elderly hospitalized patients. Med J Australia 164:200, 1996.
Martin KM, et al: Evaluation of dietary and environmental risk factors for hyperthyroidism in cats. J Am Vet Med Assoc 217:853, 2000.
Maugeri D, et al: Elevated thyroid hormone levels and hyperthyroidism in the elderly. Arch Geront Geriat 22:145, 1996.
McDougall IR: Treatment of hyper- and hypothyroidism. J Clin Pharmacol 21:365, 1981.
McLoughlin MA, et al: Influence of systemic nonthyroidal illness on serum concentrations of thyroxine in hyperthyroid cats. J Am Anim Hosp Assoc 29:227, 1993.
Meric SM, Rubin SI: Serum thyroxine concentrations following fixed-dose radioactive iodine treatment in hyperthyroid cats: 62 cases (1986-1989). J Am Vet Med Assoc 197:621, 1990.
Meric SM, et al: Serum thyroxine concentrations after radioactive iodine therapy in cats with hyperthyroidism. J Am Vet Med Assoc 188:1038, 1986.
Monzani F, et al: Five-year follow up of percutaneous ethanol injection for the treatment of hyperfunctioning thyroid nodules: a study of 117 patients. Clin Endocrinol 46:9, 1997.
Mooney CT: Feline hyperthyroidism. In Torrance AG, Mooney CT (eds): Manual of Small Animal Endocrinology, 2nd ed. British Small Animal Veterinary Association, 1998a, p 115.
Mooney CT: The elderly cat with weight loss. In Torrance AG, Mooney CT (eds): Manual of Small Animal Endocrinology, 2nd ed. British Small Animal Veterinary Association, 1998b, p 31.
Mooney CT, Thoday KL: CVT Update: Medical treatment of hyperthyroidism in cats. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p 333.
Mooney CT, et al: Carbimazole therapy of feline hyperthyroidism. J Small Anim Pract 33:228, 1992a.
Mooney CT, et al: The value of thyrotropin (TSH) stimulation in the diagnosis of feline hyperthyroidism. Proceedings of the British Small Animal Veterinary Association, 1992b.
Mooney CT, et al: Qualitative and quantitative thyroid imaging in feline hyperthyroidism using technetium-99m as pertechnetate. Vet Radiol 33:313, 1992c.
Mooney CT, et al: Effect of illness not associated with the thyroid gland on serum total and free thyroxine concentrations in cats. J Am Vet Med Assoc 208:2004, 1996a.
Mooney CT, et al: Serum thyroxine and triiodothyronine responses of hyperthyroid cats to thyrotropin. Am J Vet Res 57:987, 1996b.
Murray LAS, Peterson ME: Ipodate treatment of hyperthyroidism in cats. J Am Vet Med Assoc 211:63, 1997.
Nap AMP, et al: Quantitative aspects of thyroid scintigraphy with pertechnetate (”mTcO4) in cats. J Vet Intern Med 8:302, 1994.
Nemzek JA, et al: Acute onset of hypokalemia and muscular weakness in four hyperthyroid cats. J Am Vet Med Assoc 205:65, 1994.
Nguyen LQ, et al: Serum from cats with hyperthyroidism does not activate feline thyrotropin receptors. Endocrinology 143:395, 2002.
Nieckarz JA, Daniel GB: The effect of methimazole on thyroid uptake of pertechnetate and radioiodine in normal cats. Vet Radiol Ultrasound 42:448, 2001.
Padgett SL, et al: Efficacy of parathyroid gland autotransplantation in maintaining serum calcium concentrations after bilateral thyroparathyroidectomy in cats. J Am Anim Hosp Assoc 34:219, 1998.
Papasouliotis K, et al: Decreased orocaecal transit time, as measured by the exhalation of hydrogen in hyperthyroid cats. Res Vet Sci 55:115, 1993.
Paradis M, Page CT: Serum free thyroxine concentrations measured by chemiluminescence in hyperthyroid and euthyroid cats. J Am Anim Hosp Assoc 32:489, 1996.
Peake RL: Recurrent apathetic hyperthyroidism. Arch Intern Med 141:258, 1986.
Pearce SH, et al: Mutational analysis of the thyrotropin receptor gene in sporadic and familial feline thyrotoxicosis. Thyroid 7:923, 1997.
Peschle C: Erythropoiesis. Anna Rev Med 31:303, 1980.
Peterson ME: Feline hyperthyroidism. Vet Clin North Am (Small Anim Pract) 14:809, 1984.
Peterson ME: Use of a thyrotropin-releasing hormone (TRH) stimulation test as an aid in the diagnosis of mild hyperthyroidism in cats. J Vet Intern Med 5:129, 1991.
Peterson ME: Hypoparathyroidism and other causes of hypocalcemia in cats. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XL Philadelphia, WB Saunders, 1992, p 376.
Peterson ME: Hyperthyroidism. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders, 1995a, p 1466.
Peterson ME: Radioactive iodine (Radioiodine) treatment for hyperthyroidism in cats. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders, 1995b, p 372.
Peterson ME: Hyperthyroidism. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5“' ed. Philadelphia, WB Saunders, 2000, p 1400.
Peterson ME, Aucoin DP: Comparison of the disposition of carbimazole and methimazole in clinically normal cats. Res Vet Sci 54:351, 1993.
Peterson ME, Becker DV: Radioiodine treatment of 524 cats with hyperthyroidism. J Am Vet Med Assoc 207:1422, 1995.
Peterson ME, Gamble DA: Effect of nonthyroidal disease on serum thyroxine concentrations in cats: 494 cases (1988). J Am Vet Med Assoc 197:1203, 1990.
Peterson ME, Randolph JF: Endocrine diseases. In Sherding RG (ed): The Cat: Diagnosis and Clinical Management. New York, Churchill Livingstone, 1989, p 1095.
Peterson ME, Turrel JM: Feline hyperthyroidism. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1986, p 1026.
Peterson SL, Yoshioka MM: The use of technetium-99m pertechnetate for thyroid imaging in a case of feline hyperthyroidism. J Am Anim Hosp Assoc 19:1015, 1983.
Peterson ME, et al: Spontaneous hyperthyroidism in the cat abstract. Am Coll Vet Intern Med 1979, p 108 (abstract).
Peterson ME, et al: Electrocardiographic findings in 45 cats with hyperthyroidism. J Am Vet Med Assoc 180:934, 1982.
Peterson ME, et al: Feline hyperthyroidism: Pretreatment clinical and laboratory evaluation of 131 cases. J Am Vet Med Assoc 103:103, 1983.
Peterson ME, et al: Propylthiouracil-associated hemolytic anemia, thrombocytopenia, and antinuclear antibodies in cats with hyperthyroidism. J Am Vet Med Assoc 184:806, 1984.
Peterson ME, et al: Serum thyroid hormone concentrations fluctuate in cats with hyperthyroidism. J Vet Intern Med 1:142, 1987a.
Peterson ME, et al: Lack of circulating thyroid stimulating immunoglobulins in cats with hyperthyroidism. Vet Immunol Immunopathol 16:277, 1987b.
Peterson ME, et al: Methimazole treatment of 262 cats with hyperthyroidism. J Vet Intern Med 2:150, 1988.
Peterson ME, et al: Triiodothyronine (T3) suppression test: An aid in the diagnosis of mild hyperthyroidism in cats. J Vet Intern Med 4:233, 1990.
Peterson ME, et al: Use of the thyrotropin-releasing hormone (TRH) stimulation test to diagnose mild hyperthyroidism in cats. J Vet Intern Med 8:279, 1994.
Peterson ME, et al: Determination of free T4 by dialysis as an aid in diagnosis of mild hyperthyroidism in cats. J Vet Intern Med 9:183, 1995 (abstract).
Peterson ME, et al: Measurement of serum concentrations of free thyroxine, total thyroxine, and total triiodothyronine in cats with hyperthyroidism and cats with nonthyroidal disease. J Am Vet Med Assoc 218:529, 2001.
Pollard RE, et al: Percutaneous ultrasonographically guided radiofrequency heat ablation for treatment of primary hyperparathyroidism in dogs. J Am Vet Med Assoc 218:1106, 2001.
Randolph JF, et al: Prothrombin, activated partial thromboplastin, and proteins induced by vitamin К absence or antagonists: Clotting times in 20 hyperthyroid cats before and after methimazole treatment. J Vet Intern Med 14:56, 2000.
Refsal KR, et al: Use of the triiodothyronine suppression test for diagnosis of hyperthyroidism in ill cats that have a serum concentration of iodothyronines within normal range. J Am Vet Med Assoc 199:1594, 1991.
Reusch CE, Tomsa K: Serum fructosamine concentration in cats with overt hyperthyroidism. J Am Vet Med Assoc 215:1297, 1999.
Scarlett JM, et al: Feline hyperthyroidism: A descriptive and case-control study. Prev’VetMed 6:295, 1988.
Schlesinger DP, et al: Use of breath hydrogen measurement to evaluate oro-cecal transit time in cats before and after treatment for hyperthyroidism. Can Vet J 57:89, 1993.
ГИПЕРТИРЕОЗ (ТИРЕОТОКСИКОЗ) У КОШЕК
227
Shaha AR, et al: Parathyroid autotransplantation during thyroid surgery. J Surg Oncol 46:21, 1991.
Sheng WH, et al: Antithyroid drug-induced agranulocytosis and infectious complications. QJ Med 92:455, 1999.
Slater MR, et al: Long-term health and predictors of survival for hyperthyroid cats treated with iodine-131. J Vet Intern Med 15:47, 2001.
Smith TA, et al: Pretreatment thyroxine concentrations and pertechnetate scans as a predictor of radioiodine treatment success. J Vet Intern Med 8:159, 1994 (abstract).
Smith TA, et al: Radioiodine treatment outcome in hyperthyroid cats: Effects of prior methimazole treatment. J Vet Intern Med 9:183, 1995 (abstract).
Sparkes AK, et al: Thyroid function in the cat: Assessment by the TRH response test and the thyrotropin stimulation test. J Small Anim Pract 32:59, 1991.
Spaulding SW, Utiger RD: The thyroid: Physiology, hyperthyroidism, hypothyroidism, and the painful thyroid. In Felig P, et al (eds): Endocrinology and Metabolism. New York, McGraw-Hill, 1981, p 281.
Stegemen JR, et al: Use of recombinant human thyroid-stimulating hormone for thyrotropin-stimulation testing of euthyroid cats. Am J Vet Res 64:149, 2003.
Stiles J, et al: The prevalence of retinopathy in cats with systemic hypertension and chronic renal failure or hyperthyroidism. J Am Anim Hosp Assoc 30:564, 1994.
Sullivan P, et al: Altered platelet indices in dogs with hypothyroidism and cats with hyperthyroidism. Am J Vet Res 54:2004, 1993.
Swalec KM, Birchard SJ: Recurrence of hyperthyroidism after thyroidectomy in cats. J Am Anim Hosp Assoc 26:433, 1990.
Theon AP, Personal communication, 2002.
Theon AP, et al: A prospective randomized comparison of intravenous versus subcutaneous administration of radioiodine for treatment of feline hyperthyroidism: A study of 120 cats. Am J Vet Res 55:1734, 1994.
Thoday KL, Mooney CT: Historical, clinical and laboratory features of 126 hyperthyroid cats. Vet Rec 131:257, 1992a.
Thoday KL, Mooney CT: Medical management of feline hyperthyroidism. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1992b, p 338.
Toft AD: Subclinical hyperthyroidism. N Engl J Med 345:512, 2001.
Tomsa K, et al: Thyrotropin-releasing hormone stimulation test to assess thyroid function in severely sick cats. J Vet Intern Med 15:89, 2001.
Trepanier LA, et al: Pharmacokinetics of intravenous and oral methimazole following single- and multiple-dose administration in normal cats. J Vet Pharmacol Ther 14:367, 1991a.
Trepanier LA, et al: Pharmacokinetics of methimazole in normal cats and cats with hyperthyroidism. Res Vet Sci 50:69, 1991b.
Trepanier LA, et al: Efficacy and safety of once versus twice daily administration of methimazole in cats with hyperthyroidism. J Am Vet Med Assoc 222:954, 2003.
Trepanier LA, et al: Efficacy and safety of transdermal versus oral methimazole. AC VIM Forum, 2003.
Tse J, et al: Thyroxine induced changes in characteristics in b-adrenergic receptors. Endocrinology 107:6, 1980.
Turrel JM, et al: Radioactive iodine therapy in cats with hyperthyroidism. J Am Vet Med Assoc 184:554, 1984.
Turrel JM, et al: Thyroid carcinoma causing hyperthyroidism in cats: 14 cases (1981-1986). J Am Vet Med Assoc 193:359, 1988.
Utiger RD: Decreased extrathyroidal triiodothyronine production in nonthyroidal illness: Benefit or harm? Am J Med 69:807, 1980.
Utiger RD: Tests of thyroregulatory mechanisms. In Ingbar SH, Braverman LE (eds): The Thyroid: A Fundamental and Clinical Text, 6th ed. Philadelphia, JB Lippincott, 1986, p 511.
Utiger RD: The thyroid: Physiology, hyperthyroidism, hypothyroidism, and the painful thyroid. In Felig P, et al (eds): Endocrinology and Metabolism, 2nd ed. New York, McGraw-Hill, 1987, p 389.
Utiger RD: Commentary on “Methimazole pretreatment does not reduce the efficacy of radioiodine in patients with hyperthyroidism caused by Graves' disease.” Clinical Thyroidology 13:42, 2002a.
Utiger RD: Commentary on “Abnormal results of liver function tests in patients with Graves’ disease.” Clinical Thyroidology 13:42, 2002b.
Van der Woerdt A, Peterson ME: Prevalence of ocular abnormalities in cats with hyperthyroidism. J Vet Intern Med 14:202, 2000.
Walker MC, Schaer M: Percutaneous ethanol treatment of hyperthyroidism in a cat. Feline Pract 26:10, 1998.
Weichselbaum RC, et al: Evaluation of relationships between pretreatment patient variables and duration of isolation for radioiodine-treated hyperthyroid cats. Am J Vet Res 64:425, 2003.
Welches CD, et al: Occurrence of problems after three techniques of bilateral thyroidectomy in cats. Vet Surg 18:392, 1989.
Wells AL, et al: Use of percutaneous ethanol injection for treatment of bilateral hyperplastic thyroid nodules in cats. J Am Vet Med Assoc 218:1293, 2001.
Willard MD: Disorders of potassium homeostasis. Vet Clin North Am (Small Anim Pract) 19:241, 1989.
Williams GH, Braunwald E: Endocrine and nutrition disorders and heart disease. In Bra.unwald E (ed): Heart Disease: A Textbook of Cardiovascular Medicine. Philadelphia, WB Saunders, 1980, p 1835.
Wisner ER, et al: Normal ultrasonographic anatomy of the canine neck. Vet Radiol Ultrasound 32:185, 1991.
Wisner ER, et al: Ultrasonographic examination of the thyroid gland of hyperthyroid cats: comparison to ”mTc scintigraphy. Vet Radiol Ultrasound 35:53, 1994.
КЛАССИФИКАЦИЯ ОПУХОЛЕЙ........229
Данные аутопсии и клинические наблюдения....................229
Физикальное исследование и клинические признаки..........229
Случайно обнаруживаемые узлы щитовидной железы.............229
НЕФУНКЦИОНИРУЮЩИЕ ОПУХОЛИ ИЛИ НЕТОКСИЧЕСКИЕ УЗЛЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У СОБАК С ЭУТИРЕОЗОМ ИЛИ
Глава 5
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
ГИПОТИРЕОЗОМ.................230
Определение....................230
Патогенез......................230
Патоморфология.................231
Доброкачественные опухоли щитовидной железы............232
Злокачественные опухоли щитовидной железы.......................232
Дифференциальная диагностика...247
Лечение: крупные инвазивные (неподвижные) опухоли без видимых метастазов у собак с эутиреозом или гипотиреозом (рис. 5-14).........247
Лечение: мелкие инвазивные (неподвижные) опухоли без видимых метастазов у собак с эутиреозом или гипотиреозом (рис. 5-14)........250
Лечение: неинвазивные (подвижные) опухоли без видимых метастазов у собак с эу- или гипотиреозом (рис. 5-14).....................251
Лечение: Злокачественные опухоли щитовидной железы с метастазами у собак с эутиреозом или гипотиреозом (рис. 5-15).....................252
Прогноз у собак с опухолями щитовидной железы, находящихся в состоянии эутиреоза или гипотиреоза......252
ФУНКЦИОНАЛЬНО АКТИВНЫЕ ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ (ТИРЕОТОКСИКОЗ, ГИПЕРТИРЕОЗ) ..253
Введение.....................253
Клинические признаки.........254
Физикальное исследование......254
Обследование в клинике........254
Стратегии лечения (рис. 5-16).255
Прогноз......................257
МЕДУЛЛЯРНЫЙ РАК ЩИТОВИДНОЙ
ЖЕЛЕЗЫ (С-КЛЕТОЧНАЯ ОПУХОЛЬ, ПАРАФОЛЛИКУЛЛЯРНЫЙ
РАК, ПЕРВИЧНАЯ
ГИПЕРКАЛЬЦИТОНИНЕМИЯ).......257
ОПУХОЛИ ЭКТОПИЧЕСКОЙ ТИРЕОИДНОЙ
ТКАНИ.......................258
Список сокращений
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
МЭН - множественная эндокринная неоплазия
ТТГ - тиреотропный гормон
ЭКГ - электрокардиограмма
ЭхоКГ - эхокардиограмма
У человека в щитовидной железе часто обнаруживаются узлы. В США их находят примерно у 4% взрослого населения (соотношение женщины/муж-чины 4:1). У маленьких детей их частота составляет менее 1%, у детей в возрасте 11-18 лет - около 1,5% и у лиц старше 60 лет - примерно 5%. Однако распространенность рака щитовидной железы невелика. По данным Третьего Национального Обзора по Раку, в США раком щитовидной железы ежегодно заболевают 0,004% населения. Таким образом, большинство узлов щитовидной железы у человека доброкачественные (Greenspan, 2001). Статистические данные в отношении собак резко отличаются от таковых у человека.
Щитовидная железа у собак и кошек, состоящая из двух долей, в норме не пальпируется. Однако опухоли этой железы у животных обоих видов легко прощупываются. Если у кошек, особенно старше 8 лет, доброкачественные узлы щитовидной железы - обычное явление, то у собак объемные образования этой железы встречаются лишь в отдельных случаях, но часто оказываются злокачественными. У собак на долю опухолей щитовидной железы приходится 1^4% всех новообразований (Priester, McKay, 1980; Birchard, Roesel, 1981; Loar, 1986;
Wheeler, 1989; Ogilvie, 1996; Waters, Scott-Moncrieff, 1998). Ветеринары хорошо знакомы с заболеваниями щитовидной железы у кошек. Владельцы собак, как и кошек, все чаще обращаются в ветеринарные клиники по поводу опухолей щитовидной железы у своих питомцев. Однако состояние собак и кошек с опухолями этой железы существенно различается (табл. 5-1). У подавляющего большинства кошек такие опухоли доброкачественные и сопровождаются гипертиреозом, тогда как у собак, как правило, они имеют злокачественный характер и не приводят к гипертиреозу.
Почти в каждой публикации, посвященной «общим заболеваниям» у собак, упоминается большое число животных с опухолями щитовидной железы. Если у кошек клинически значимые новообразования этой железы выявлены относительно недавно (только в 1980-х годах), то у собак они известны давно. Клинические проявления таких опухолей у этих видов животных на удивление различны. Опухоли щитовидной железы у кошек обычно функционально активны, не прорастают в окружающие ткани и представляют собой относительно небольшие аденоматозные узлы. У собак же чаще всего обнаруживаются крупные функционально неак-
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 229
ТАБЛИЦА 5-1.СРАВНЕНИЕ ОПУХОЛЕЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У СОБАК И КОШЕК
Собаки Кошки
Частота Невысокая Достаточно высокая
Процент злокачественных опухолей 80-90% <5%
Местная инвазия Часто Редко
Метастазирование Часто (особенно при крупных опухолях) Редко
Процент гипертиреоза Сочетание: < 10% > 95%
с заболеваниями сердца Редко Довольно часто
с заболеваниями почек Редко Часто
Виды лечения Операция Наружное облучение пучком высокой энергии Доксорубицин Цисплатин Операция Радиоактивный йод Тиамазол Карбимазол
тивные и инвазивные раковые опухоли. Животным обоих видов требуется лечение, но те его формы, которые с успехом применяются у кошек, далеко не всегда эффективны у собак (см. табл. 5-1). Более 90% клинически выявляемых опухолей щитовидной железы у собак представляют собой рак. Столь высокая частота злокачественных опухолей отчасти связана с поздней диагностикой, так как в большинстве случаев еще доброкачественные аденомы щитовидной железы у собак функционально неактивны, не сопровождаются клиническими проявлениями и слишком малы, чтобы их можно было прощупать.
КЛАССИФИКАЦИЯ ОПУХОЛЕЙ
Данные аутопсии и клинические наблюдения
По данным ветеринарных патологоанатомов, среди новообразований щитовидной железы, обнаруживаемых у собак при аутопсии, на долю доброкачественных опухолей (аденом) приходится 30-50% (Brodey, Kelly, 1968; Leav et al, 1976). Такие опухоли обычно имеют небольшие размеры, неинвазивны и клинически не проявляются. Поэтому, хотя со времени этих публикаций прошло более 25 лет, приведенные данные нельзя считать устаревшими. Доброкачественные опухоли обычно случайно обнаруживаются при аутопсии. С другой стороны, клинические наблюдения свидетельствуют о том, что почти все опухоли щитовидной железы у собак злокачественны; в значительном проценте случаев они достаточно велики и поддаются пальпации, прорастают в окружающие ткани и сопровождаются тяжелыми симптомами (Mooney, 1998;
Lurye, Behrend, 2001; Withrow, MacEwen, 2991). Доброкачественные опухоли, как и нормальные доли щитовидной железы, не пальпируются. Они подвижны, имеют овальную форму и, как правило, поражают одну долю железы. В отличие от этого, раковая опухоль легко прощупывается, имеет грубо дольчатую поверхность и спаяна с окружающими тканями. Примерно треть этих опухолей поражает обе доли щитовидной железы, и две трети опухолей локализованы в одной доле. Опухоли слабо капсу-лированы, содержат много кровеносных сосудов и часто прорастают в трахею, пищевод, мышцы шеи и местные сосуды.
Физикальное исследование и клинические признаки
Общепринято, что доброкачественные опухоли щитовидной железы (аденом) у собак, как правило, функционально неактивны. Поскольку такие опухоли невелики, подвижны, неинвазивны и неактивны, они не имеют клинических проявлений. Иными словами, ни у владельцев собаки, ни у ветеринарного врача нет оснований подозревать наличие опухоли у собаки. Большинство ветеринаров при физикальном исследовании собак не пальпируют область шеи или проводят лишь поверхностное ощупывание. Кроме того, размеры доброкачественной опухоли обычно настолько малы, что пальпировать ее не удается.
Злокачественные же опухоли у собак в большинстве случаев достаточно велики. Владельцы собак обращаются к ветеринару чаще всего тогда, когда замечают у своих питомцев крупную опухоль на шее, затрудненное глотание или нарушения дыхания, например, одышку (даже в покое), изменение тембра лая, громкое дыхание, кашель или явное удушье, особенно при возбуждении или физическом напряжении. В таких случаях ветеринар должен тщательно прощупать область шеи животного. Поскольку размеры опухоли обычно велики, ее, как правило, удается прощупать. Дополнительная трудность заключается в том, что рак щитовидной железы у собак сопровождается неспецифическими симптомами (плохим аппетитом, потерей веса, рвотой, сонливостью и т.п.), которые не всегда служат поводом для пальпации шеи.
Случайно обнаруживаемые узлы щитовидной железы
Согласно литературным данным, небольшие доброкачественные или даже злокачественные опухоли щитовидной железы у собак часто не имеют никаких клинических проявлений и при физикальном исследовании остаются нераспознанными. В последние годы, однако, диагностические подходы к различным клиническим состояниям собак существенно изменились, и в результате возросло число животных, у которых такие опухоли обнару
230 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
живаются случайно. Особая роль при этом принадлежит УЗИ области шеи.
В нашей клинике УЗИ шеи - обычный компонент диагностического исследования при целом ряде клинических состояний у собак. Эта процедура проста, легко доступна и обходится не дороже, чем рентгенография или стандартные анализы крови и мочи. УЗИ шеи проводятся при любых нарушениях дыхания или одышке, особенно при подозрении на патологию верхних дыхательных путей или на паралич гортани. Показаниями к такому исследованию являются, естественно, и гиперкальциемия, особенно в случаях первичного гиперпаратиреоза, а также затруднения глотания, срыгивание и множество других нарушений. Это привело к частому выявлению опухолей щитовидной железы.
Примерно 40% «инциденталом» (т.е. случайно обнаруживаемых при УЗИ новообразований) оказываются доброкачественными аденомами, и большинству клиницистов не удается их прощупать. При гистологическом исследовании примерно в 60% случаев обнаруживается рак. В ближайшие 5-10 лет можно ожидать увеличения частоты выявления скрытых опухолей щитовидной железы. Их идентификация на относительно ранних стадиях позволяет рассчитывать также на большую эффективность хирургического, лучевого или медикаментозного лечения. Об этом не следует забывать, знакомясь с содержанием данной главы. Как и все другие области знаний, ветеринарная медицина непрерывно развивается, и приводимые здесь примеры могут представлять собой наихудшие из возможных сценариев. Чем большее количество таких опухолей будет диагностироваться раньше, чем они достигнут крупных размеров, начнут легко пальпироваться и проявляться тяжелейшими клиническими симптомами, тем успешнее будет лечение и благоприятнее прогноз.
НЕФУНКЦИОНИРУЮЩИЕ ОПУХОЛИ ИЛИ НЕТОКСИЧЕСКИЕ УЗЛЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У СОБАК С ЭУТИРЕОЗОМ ИЛИ ГИПОТИРЕОЗОМ
Определение
Любое увеличение щитовидной железы независимо от его причины называют зобом. Две доли щитовидной железы представляют собой небольшие образования, расположенные по бокам трахеи. В норме у собак они не пальпируются. Если доли, а также любой узел в щитовидной железе удается прощупать, то это означает наличие зоба или какого-либо иного серьезного заболевания и требует пристального внимания. Пальпирумая тиреоидная ткань у собаки зрелого возраста заставляет предполагать опухоль щитовидной железы. Зоб у собак чаще всего обусловлен односторонним нефункционирующим или «слабо функционирующим» раком, который не сопровождается признаками гипер
тиреоза. В отдельных случаях зоб у новорожденных или молодых щенков может быть следствием йодной недостаточности или врожденного дефекта синтеза и секреции тиреоидных гормонов. Аутоиммунный тиреоидит у собак редко бывает причиной пальпируемого зоба.
Патогенез
Введение. Точная причина опухолей щитовидной железы, как и большинства любых других опухолей, неизвестна. Имеющиеся данные свидетельствуют о связи новообразований щитовидной железы с 1) дефицитом или избыточным потреблением йода, 2) хронически повышенной секрецией ТТГ, 3) воздействием ионизирующей радиации и 4) генетическими нарушениями и экспрессией онкогенов. У некоторых пожилых людей медленно растущий папиллярный рак вдруг начинает расти быстро и превращается в недифференцированный или анапластический рак. У человека это легко диагностировать по быстрому ускорению роста небольшого узла. В ряде случаев «внезапное» увеличение размеров небольшого узла обнаруживается и у собак. Такой «поздний анапластический сдвиг» - возможная причина смерти от папиллярного рака щитовидной железы. Папиллярный рак во многих случаях секретирует тиреоглобулин, который может служить маркером рецидива или метастазирования опухоли (Greenspan, 2001).
Дефицит и избыток йода. Результаты ранних эпидемиологических исследований указывали на увеличение частоты рака щитовидной железы у людей, проживающих в условиях дефицита йода. Однако другие авторы не подтверждают этого (Ко-nig et al, 1981). Напротив, рак щитовидной железы, особенно папиллярная его форма, распространен среди жителей территорий с высоким содержанием йода в окружающей среде, например, в Исландии и на Гавайях (Verschueren, Goslings, 1992). Что касается собак, то ни экспериментальные данные, ни клинические наблюдения не позволяют сделать определенного заключения по этому вопросу.
ТТГ и ростовые факторы. Функция фолликулярных клеток щитовидной железы зависит в основном от ТТГ (Roger, Dumont, 1982). Однако роль ТТГ в процессах роста этой железы неочевидна, и мнения о его роли в генезе опухолей щитовидной железы у человека противоречивы. У собак концентрация рецепторов и их сродство к ТТГ в нормальной и раковой ткани щитовидной железы одинаковы (Verschueren et al, 1992а). Таким образом, рак этого органа у собак, по-видимому, сохраняет чувствительность к ростовому эффекту ТТГ. Однако у человека корреляция между рецепторным связыванием ТТГ и увеличением размеров щитовидной железы довольно низкая (Darbre, King, 1987). Во многих случаях опухоли, связывающие ТТГ и отвечающие на него повышением активности аденилатциклазы, не уменьшаются в размерах после
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 231
Гиперфункциони-рующая аденома
Аберрантное метилирование ДНК
Фолли-
Фоллику-
_ Анапластический рак
Рис. 5-1. Молекулярные дефекты, ассоциирующиеся с развитием и прогрессией опухолей щитовидной железы у человека (представлено на основании данных о частоте конкретных мутаций при различных опухолях) (И з: Greenspan, 2001.)
снижения концентрации ТТГ в сыворотке крови путем подавления его секреции L-тироксином (Saltiel et al, 1981).
Ионизирующая радиация. Связь между облучением и раком щитовидной железы у человека известна с конца 1940-х - начала 1950-х годов. Высокая частота рака этого органа среди жителей регионов, где выпадали радиоактивные осадки, например на Маршалловых островах (Conard, 1984), подтверждает причинную роль радиоактивного йода. Короткоживущие изотопы йода (1321 и ,351) представляют большую опасность, чем широко используемый ,31I(Verschueren, 1992а).
Онкогены. Экспрессии онкогенов при раке щитовидной железы у человека посвящены многие исследования. Мутации генов обнаружены в клетках как доброкачественных, так и шокачсственных опухолей (рис. 5.1). Активирующие мутации гена gsp или гена рецептора ТТГ в фолликулярных клетках щитовидной железы ассоциируются с ускорением роста железы и повышением ее функции. В доброкачественных фолликулярных аденомах находят аберрантное метилирование ДНК, активацию онкогена ras и мутацию гена MEN1, расположенного на хромосоме 1 lql3. К развитию фолликулярного рака может приводить потеря гена-супрессора ЗР, а последующая потеря гена-супрессора Р53 обусловливает прогрессию опухоли в анапластический рак. Мутации онкогенов ret и trk ассоциируются с развитием папиллярного рака. И в этом случае потеря гена-супрессора Р53 может способствовать превращению опухоли в анапластический рак. Все это свидетельствует о возможности превращения доброкачественных опухолей в злокачественные или дифференцированного рака в недифференцированный. Действительно, в биоптатах застарелого узлового зоба у пожилых людей, у которых один из узлов начинает быстро расти, обнаруживаются признаки перехода папиллярного или фолликулярного рака в анапластический (Suarez et al, 1988; Bos, 1989; Lemoine et al, 1990; Wynford-Thomas, 1997; Komminoth, 1997; Schlumberger, 1998; Hanna
et al, 1999; Greenspan, 2001). Этот феномен называют «поздним анапластическим сдвигом», и он упомянут во введении к данному разделу. У собак подобные исследования не проводились.
Патоморфология
Данные морфологии и клиники. Процент злокачественных и доброкачественных опухолей щитовидной железы, обнаруживаемых при аутопсии собак, примерно одинаков. У собак злокачественные опухоли встречаются чаще, чем у других видов. Кроме того, при аутопсии доброкачественные опухоли обнаруживаются чаще, чем при клиническом обследовании. При жизни собак такие опухоли обычно остаются нераспознанными, гак как они функционально неактивны, достаточно малы и не имеют клинических проявлений. Злокачественные же опухоли, как правило, крупнее, сопровождаются заметными для хозяев клиническими признаками и легко пальпируются. Как отмечалось выше, с распространением УЗИ шеи в качестве диагностического метода при различных заболеваниях у собак можно ожидать более частого прижизненного выявления «инциден галом» щитовидной железы. При использовании этого метода должна возрасти частота клинической диагностики не только доброкачественных, но и небольших злокачественных опухолей.
Дифференциальная диагностика злокачественных и доброкачественны? опу колей щитовидной железы. Как и при большинстве опухолей эндокринных тканей, отличить доброкачественную опухоль щитовидной железы от злокачественной по цитологическим признакам довольно трудно. Такие критерии, как атипия клеток и их митотическая активность далеко не всегда надежны. Хорошо дифференцированный фолликулярный рак в ряде случаев удается отличить от доброкачественной аденомы только по гистологическим признакам - инвазии в сосуды или в капсулу (Hedinger et al, 1988; Verschueren, Goslings, 1992). Поскольку вете-
232 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
ринары-практики относительно часто диагностируют злокачественные опухоли, многие патоморфологи при исследовании биоптатов или операционного материала дают заключения типа «рак, пока не будет доказано обратное».
Доброкачественные опухоли щитовидной железы
Внешний вид и клинические признаки. Доброкачественные опухоли (аденомы) щитовидной железы у собак обычно представляют собой небольшие плотные очаговые образования, которые трудно обнаружить при жизни. С внедрением УЗИ шеи в диагностическую практику частота их выявления должна возрасти. Остается неясным, почему аналогичные опухоли у кошек функционально активны, тогда как у собак они, как правило, либо полностью неактивны, либо продуцируют нормальное количество тиреоидных гормонов. В нашей клинике такие опухоли у собак диагностируются обычно лишь на основании данных УЗИ. Клинические признаки наблюдаются гораздо реже: владелец собаки может обратить внимание на опухоль у нее на шее, затрудненное дыхание или глотание (Loar, 1986; Lawrence et al, 1991).
Аденомы щитовидной железы у собак часто представлены одиночными, четко отграниченными узлами мягковатой консистенции с плохо различимой капсулой. Солидные аденомы имеют округлую или овальную форму, кремовый или красновато-коричневый цвет; их диаметр колеблется от нескольких миллиметров до нескольких сантиметров, и они могут сдавливать окружающую нормальную тиреоидную ткань. Стенки крупных кистозных аденом растянуты желтоватой жидкостью с примесью крови (Belshaw, 1983; Сареп, 1985). Изнутри они имеют гладкую или шероховатую выстилку. По своему виду аденомы щитовидной железы у собак отличаются от «аденоматозной гиперплазии», характерной для кошек с гипертиреозом. Хотя в последнем случае также можно обнаружить мелкие узелки, похожие на аденомы у собак, все же опухоли у кошек чаще напоминают смятую гроздь винограда, на разрезе которой видны многочисленные кисты или полости.
Гистология. Под микроскопом в мелких солидных аденомах щитовидной железы у собак видны фолликулы разной формы и размеров. Кистозные структуры, обнаруживаемые в некоторых опухолях, окружены плотной фиброзной тканью с тяжами, разделяющими группы клеток, расположенных компактно или в виде фолликулов. Не исключено, что кровоизлияния ограничивают рост аденом, что и определяет их макро- или микроскопический вид (Belshaw, 1983; Сареп, 1985). Хотя существование доброкачественных опухолей щитовидной железы у собак не вызывает сомнений, любую опухоль, обнаруживаемую при клиническом обследовании, следует считать злокачественной, пока не будет до
казано обратное. Высокая частота злокачественных опухолей щитовидной железы и агрессивное их течение требуют от ветеринара быстрых действий. Такой подход обеспечивает лучший шанс на излечение животного.
Злокачественные опухоли щитовидной железы
Введение. Рак щитовидной железы у собак обычно представляет собой крупную плотную опухоль. В ее злокачественной природе часто можно убедиться невооруженным глазом при операции или аутопсии по прорастанию в соседние структуры. Очень часто такие опухоли распространяются на пищевод, трахею, шейные мышцы, нервы и сосуды щитовидной железы. Однако в просвет трахеи или пищевода они проникают крайне редко. При первом обращении к ветеринару отдаленные метастазы обнаруживаются у 40-60% животных (Jeglum, Whereat, 1983; Harari et al, 1986; Withrow, MacEwen, 2001). Чаще всего они выявляются в легких или регионарных лимфоузлах. По данным аутопсии, метастазы имеют место в 60-80% случаев рака щитовидной железы (Сареп, 1985; Verschueren et al, 1992b). Расхождения между данными клинического обследования и аутопсии объясняются тем, что аутопсия, как правило, производится на значительно более поздних стадиях заболевания, чем клиническая диагностика. Таким образом, частота метастазирования весьма велика. Кроме того, при гистологическом исследовании обнаруживаются и мелкие метастазы, которые невозможно выявить с помощью рентгенографии, УЗИ и других диагностических методов.
Выявление метастазов. Метастазы чаще всего локализуются в легких, заглоточных лимфоузлах и печени (Lurye, Behrend, 2001). Лимфа от щитовидной железы оттекает, главным образом, в краниальном направлении, и поэтому увеличенные лимфоузлы обычно расположены краниально и медиально от первичного опухолевого очага. Иногда поражаются лимфоузлы с обеих сторон. Метастазы могут находиться также в надпочечниках, почках, у основания сердца, в селезенке, костях и костном мозге, предстательной железе, головном и спинном мозге (Harmelin et al, 1993; Verschueren et al, 1992b; Lurye, Behrend, 2001). Заключение о доброкачественности или злокачественности опухоли щитовидной железы зависит от ответа на два вопроса: 1) присутствует ли аналогичная ткань в регионарных лимфоузлах, легких или других органах и имеются ли признаки местной инвазии в окружающие структуры? и (2) Какова микроскопическая картина ткани? В редких случаях небольшие злокачественные опухоли напоминают аденомы. Любая удаленная хирургом опухоль требует гистологического исследования.
Гистология. На злокачественный характер опухоли указывает плеоморфизм ее клеток, но диагноз
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 233
рака основывают главным образом на признаках прорастания капсулы или сосудов. Эти признаки могут быть выраженными недостаточно четко, и в диагностике рака не следует полагаться только на данные микроскопического исследования. Окончательная трактовка этих данных требует тесного контакта патоморфолога с клиницистом, который располагает сведениями о макроскопических признаках инвазии опухоли в окружающие ткани, ее васкуляризации и другой важной информацией.
Злокачественные опухоли щитовидной железы из фолликулярных клеток в зависимости от характера их роста обычно подразделяют на фолликулярные, компактные (солидные), папиллярные, компактно-фолликулярные и недифференцированные (анапластические) (табл. 5-2). Кроме того, ветеринары-онкологи используют классификацию опухолей по клиническим стадиям, разработанную ВОЗ (табл. 5-3). Рак щитовидной железы у собак чаще всего состоит из клеток, часть которых образует фолликулы, а другая часть расположена компактно. Поэтому его называют «смешанно-клеточным», «компактно-фолликулярным» или «солидно-фолликулярным» раком. Чисто фолликулярный рак обнаруживается несколько реже, а наименьший процент приходится на долю чисто компактного рака. Недифференцированный (анапластический) рак встречается примерно у 10% собак с опухолями щитовидной железы. Папиллярный рак у собак находят в редких случаях. Рак щитовидной железы может развиваться и из парафолликулярных клеток (С-клеточный, или медуллярный рак), но у собак эта форма рака встречается не часто. В прошлом, вероятно, многие случаи такого рака оставались нераспознанными (см. следующий раздел), и применение иммуноцитохомической окраски должно способствовать более частому выявлению этой гистологической формы злокачественной опухоли. Реже всего ветеринары-клиницисты распознают доброкачественные опухоли (аденомы). Однако, как уже отмечалось, широкое применение УЗИ шеи должно привести к росту показателя распространенности таких опухолей. Для точной характеристики клеточного происхождения опухоли могут потребоваться электронномикроскопические и иммуногистохимические исследования.
Иммуногистохимия. Иммуногистохимичекие методы позволяют выяснить происхождение практически любой опухоли, в том числе и опухоли щитовидной железы. Окрашивание антителами к тиреоглобулину, кальцитонину, кальцитониноподобному пептиду и нейрон-специфической энолазе способствует выявлению медуллярного рака у собак (Moore et al, 1984; Holscher et al, 1986; Leblanc et al, 1991). По присутствию этих соединений удается различить 4 типа клеток: одни из них окрашиваются антителами к тиреоглобулину, вторые - к кальцитонину и кальцитониноподобному пептиду, третьи - к соматостатину, а четвертые не содержат маркеров. Это указывает на возможное общее про-
ТАБЛИЦА 5.2. ГИСТОЛОГИЧЕСКИЙ ДИАГНОЗ У 237 СОБАК С ПРИЖИЗНЕННО ВЫЯВЛЕННЫМИ ОПУХОЛЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Гистология опухоли Число Процент
Компактно-фолликулярный рак 77 32
Фолликулярный рак 56 24
Компактный (солидный) рак 41 17
Недифференцированный (анапласти- 28 12
ческий) рак
Парафолликулярный (С-клеточный) 20 9
рак
Фолликулярная аденома 15 6
Метастазы или местная инвазия 163 69
ТАБЛИЦА 5-3. КЛИНИЧЕСКИЕ СТАДИИ ОПУХОЛЕЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У СОБАК
Т: Первичный очаг
ТО Отсутствие признаков опухоли
Т1 Максимальный диаметр опухоли < 2 см: Т1а - подвижная, Tib - неподвижная
Т2 Максимальный диаметр опухоли 2-5 см: Т2а - подвижная, Т2Ь - неподвижная
ТЗ Максимальный диаметр опухоли > 5 см: ТЗа - подвижная, ТЗЬ - неподвижная
N: Регионарные лимфоузлы (РЛУ)
NO Отсутствие признаков поражения РЛУ
N1 Ипсилатеральное поражение РЛУ. Nla - подвижные, Nib - неподвижные
N2 Двустороннее поражение РЛУ. N2a - подвижные, N2b - неподвижные
М: Отдаленные метастазы
МО Отсутствие признаков отдаленных метастазов
МЮтдаленные метастазы выявлены
Стадии т N М
I Т1а,Ь NO МО
II ТО N1 МО
Т1а,Ь N1
Т2а,Ь NO или Nla
III Любая ТЗ Любая N МО
Любая Т Любая Nb
IV Любая Т Любая N Ml
РЛУ - подчелюстные и поверхностные шейные лимфоузлы. Поражение означает наличие гистологических признаков инвазии опухоли.
По: Owen LN (ed): The TNM Classification of Tumors in Domestic Animals, Geneva, World Health Organization, 1980.
похождение фолликулярных и парафолликулярных клеток, что подтверждается присутствием смешанных фолликулярных и парафолликулярных опухолей у человека, крупного рогатого скота и лошадей. У собак такие опухоли не обнаружены (Ljungberg et al, 1983; Ljunberg, Nilsson, 1985; Tateyama et al, 1988; Leblanc et al, 1990,1991).
С помощью только световой микроскопии медуллярный рак трудно отличить от других опухолей тиреоидной ткани, что, по-видимому, и привело к мнению о малой распространенности этого рака среди собак с опухолями щитовидной железы. Сообщалось, что на его долю приходится менее 5% таких опухолей (Patnaik, Lieberman, 1991; Leblanc
234 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
et al, 1991). Однако с помощью специфического иммуногистохимического окрашивания было показано, что доля медуллярного рака среди опухолей щитовидной железы у собак значительно выше и достигает 36% (Carver et al, 1995). Кроме того, выяснилось, что гистологическая классификация опухолей не дает оснований для прогноза (Brodey, Kelly, 1968; Mitchell et al, 1979; Harari et al, 1986; Klein et al, 1988; Ogilvie, 1996). Прогноз при медуллярным раке может быть благоприятнее, чем у животных с фолликулярным раком. Медуллярный рак реже метастазирует в отдаленные органы и чаще оставляет капсулу интактной. Успех хирургического удаления таких опухолей достигается в 83% случаев, тогда как при фолликулярном раке - только в 52% (Carver et al, 1995).
Частота. По данным ряда авторов, на долю опухолей щитовидной железы у собак приходится от 1 до 4% всех новообразований. При этом учитывается, что некоторые опухоли щитовидной железы в силу своих малых размеров и отсутствия клинических проявлений не распознаются при жизни и выявляются только при аутопсии. Такие опухоли могут сочетаться с другими новообразованиями. Одновременное присутствие у одной и той же собаки опухолей разных органов раньше считалось простой случайностью.
Синдромы множественной эндокринной неоплазии (МЭН). Ветеринарная медицина многое почерпнула из опыта наблюдений на человеке. Врачам часто удается выявить семейный характер заболевания и на этом основании оценить вероятность его развития у конкретного человека. Это справедливо и в отношении заболеваний щитовидной железы, в том числе ее опухолей. Поэтому аналогии с клинической медициной могут быть весьма полезными для ветеринарии. Например, медуллярный рак у человека примерно в 80% случаев представляет собой «спорадическое» заболевание, а в 20% имеет семейный характер, т.е. в этих случаях речь может идти о генетической предрасположенности к раку. Различают 4 варианта семейного медуллярного рака щитовидной железы. Ветеринарам следует учитывать эти данные, диктующие необходимость тщательного обследования собак даже после обнаружения рака щитовидной железы. Действительно, у некоторых собак одновременно существуют и другие опухоли, Прежде чем тратить время, деньги и силы на лечение какого-либо одного заболевания, необходимо убедиться, что у животного отсутствуют другие серьезные болезни.
Некоторые из четырех семейных синдромов у человека, частью которых является медуллярный рак щитовидной железы, могут иметь место и у собак. Эти 4 синдрома включают: 1) семейный медуллярный рак без сопутствующей эндокринной патологии; 2) множественную эндокринную неоплазию типа 2А (МЭН Па), куда входят медуллярный рак щитовидной железы, феохромоцитома и гиперпаратиреоз; 3) множественную эндокринную неопла
зию типа 2Б (МЭН ПЬ) - медуллярный рак, феохромоцитома и множественные невромы слизистых и (4) МЭН 2, который, кроме синдрома МЭН, проявляется локальным опухолевидным амилоидозом кожи с зудом. Гены, ответственные за эти семейные синдромы, картированы в центромерной области хромосомы 10, где расположен протоонкоген ret (ген тирозинкиназы рецепторного типа). У больных с такими синдромами в этом гене обнаруживаются мутации в экзонах (кодирующая часть гена) 10, 11 или 16 (Greenspan, 2001). При выявлении у больного медуллярного рака щитовидной железы необходимо искать эту опухоль и другие проявления синдрома МЭН 2 у всех членов семьи. Помимо выявления признаков медуллярного рака, носительство мутаций можно установить путем анализа ДНК в лейкоцитах периферической крови с помощью полимеразной цепной реакции (ПЦР), исследования полиморфизма длин рестрикционных фрагментов (ПДРФ) и семейных ДНК-маркеров. Обнаружение носительства патологии способствует ранней диагностике и лечению тяжелых заболеваний.
У собак одновременно с опухолями щитовидной железы иногда имеются опухоли и других эндокринных органов (табл. 5-4). Без генетических исследований невозможно решить, отражают ли эти случаи «семейную» патологию, аналогичную известным синдромам МЭН у человека. Предполагается, что у многих из таких собак сочетание опухо-
ТАБЛИЦА 5-4. ГИСТОЛОГИЧЕСКИЕ ПРИЗНАКИ СИНДРОМА МНОЖЕСТВЕННОЙ ЭНДОКРИННОЙ НЕОПЛАЗИИ (МЭН) У 63 СОБАК С ОПУХОЛЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Гистологический диагноз ,
собак
Аденома щитовидной железы и хемодектома 2
Фолликулярный рак щитовидной железы и адено- 4 ма коры надпочечников
Фолликулярный рак щитовидной железы и рак 4 коры надпочечников
Фолликулярный рак щитовидной железы, аденома 12
гипофиза и гиперплазия коры надпочечников
Фолликулярный (3) или компактно-фолликуляр- 6
ный (3) рак щитовидной железы и гиперплазия/ аденома паращитовидных желез
Компактно-фолликулярный рак щитовидной желе- 11
зы, аденома гипофиза и гиперплазия коры надпочечников
Фолликулярная аденома щитовидной железы, фе- 3 охромоцитома, аденома гипофиза и гиперплазия коры надпочечников
Фолликулярная аденома щитовидной железы и 4 аденома коры надпочечников
Парафолликулярный (С-клеточный) рак щитовид- 4 ной железы, опухоль гипофиза и феохромоцитома
Парафолликулярный (С-клеточный) рак щитовид- 7 ной железы, феохромоцитома и аденома паращитовидной железы
Компактно-фолликулярный рак щитовидной желе- 6 зы и аденома паращитовидной железы
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 235
лей является случайным. Следует отметить, однако, что мы наблюдали 7 собак, у которых медуллярный рак щитовидной железы сочетался с феохромоцитомой и первичным гиперпаратиреозом (аденомой паращитовидной железы), т.е. состояние животных соответствовало критериям МЭН Па. У ряда других собак опухоли щитовидной железы также сочетались с опухолями в других эндокринных органах (см. табл. 5-4). Эти 63 собаки принадлежали к 27 разным породам. Возможность одновременного поражения многих эндокринных органов у собак и кошек подчеркивает необходимость детального диагностического обследования животных с пальпируемой опухолью щитовидной железы.
Встречаемость. Опухоли щитовидной железы наиболее часто развиваются у собак во второй половине жизни. Средний возраст животных с такими опухолями (как доброкачественными, так и злокачественными) составляет примерно 10 лет. Возрастные колебания довольно широки, но опухоли щитовидной железы почти никогда не встречаются у собак моложе 5 лет (рис. 5-2). По данным одного небольшого питомника для биглей, у животных в возрасте 8-12 лет такие опухоли развивались с частотой 1,1% в год, а в возрасте 12-15 лет - 4% в год (Haley et al, 1989).
Собаки обоего пола заболевают с приблизительно равной частотой (Harari et al, 1986). Напротив, для человека характерна большая заболеваемость у женщин, среди которых в любом возрасте рак щитовидной железы встречается примерно в 4 раза чаще, чем среди мужчин (Greenspan, 2001). К породам, подверженным особенно высокому риску этой патологии, относят боксеров, биглей и золотистых ретриверов (Harari et al, 1986; Verschueren, 1992). По нашим данным, опухоли щитовидной железы чаще всего встречаются у метисов и лабрадоров-ретриверов, хотя наблюдались и у собак других пород (табл. 5-5). Создается впечатление, что частота выявления таких опухолей зависит от популярности породы в конкретном регионе.
Возраст (годы)
Рис. 5-2. Возраст к моменту диагностики опухоли щитовидной железы у 69 собак. Средний возраст около 10 лет.
ТАБЛИЦА 5-5. РАСПРЕДЕЛЕНИЕ 237 СОБАК С ОПУХОЛЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
__________ПОПОРОДАМ
Порода Число Процент
Метисы 32 13
Лабрадор-ретривер 22 9
Золотистый ретривер 17 7
Боксер 15 6
Австралийская овчарка 14 6
Немецкая овчарка 14 6
Пудель 14 6
Такса 12 5
Ротвейлер 12 5
Бигль 12 5
Доберман-пинчер 10 4
32 другие породы (меньше 10 63 27
случаев у каждой)
Клинические признаки. Хозяева собак с нетоксическим зобом (без гипертиреоза) обычно обращаются к ветеринару либо потому, что увидели или нащупали у своих питомцев опухоль на шее, либо потому, что у животных появились клинические признаки заболевания. Разные авторы описывают разные проявления рака щитовидной железы у собак. Наиболее частым поводом обращения к ветеринару несомненно служит появление опухоли на передней поверхности шеи животного. Хозяева, ласкающие или расчесывающие своих собак, могут обратить внимание на какую-то «припухлость» в области глотки (рис. 5-3) с одной или обеих сторон. Опухоли щитовидной железы в большинстве случаев располагаются чуть ниже трахеи, но крупные опухоли часто занимают большее пространство или (реже) находятся у входа в грудную клетку.
Некоторое время такие опухоли медленно увеличиваются в размерах и не вызывают никаких симптомов. Более 75% случаев прижизненной диагностики опухоли щитовидной железы приходится на собак, у которых такая опухоль была замечена хозяином или обнаружена при обследовании животного по другим поводам (табл. 5-6). Среди клинических признаков отмечались кашель, одышка (особенно в покое), респираторный дистресс-синдром, затрудненное глотание (дисфагия), изменение звука лая (дисфония), потеря веса, апатия и угнетенное состояние, рвота, срыгивание, анорексия или явное снижение аппетита, полидипсия, полиурия, гиперактивность, понос, повышение аппетита, отек морды и очевидная боль или дискомфорт (табл. 5-6). Понятно, что владельцы собак обращаются к ветеринару через разное время после обнаружения у животных опухоли или клинических проявлений болезни. К нам приводили собак и в тот же день, когда замечали у них опухоль на шее, и даже через 36 месяцев после этого (в среднем через 2-6 недель).
Удивительно, но многие владельцы не замечают никаких изменений состояния своих питомцев. Выше уже отмечалось широкое применение УЗИ шеи в диагностике. Мы обычно применяем этот метод у собак с подозрением на паралич гортани
236 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
и первичный гиперпаратиреоз. Набирая животных для контрольной группы («здоровые» собаки старше 5 лег) с целью проведения УЗИ шейной области, мы в ряде случаев обнаруживали у них «инциден-таломы» щитовидной железы. Дополнительно была отобрана группа, у которых при обычном анализе крови (просто для оценки возрастных изменений) случайно выявлялась гиперкальциемия (первичный гиперпаратиреоз). Почти все собаки, включенные в наше исследование опухолей щитовидной железы без каких-либо клинических проявлений, были набраны из этих двух групп.
Физикальное исследование. У большинства животных с раком щитовидной железы имелся нетоксический зоб, т.е. опухоль оказывалась функционально неактивной и не приводила к гипертиреозу. Физикальное обследование мало что добавляло к признакам, отмеченным владельцами собак. Многие собаки казались совершенно здоровыми, особенно при сравнении с гипертиреоидными кош-
ТАБЛИЦА 5-6. НАБЛЮДАВШИЕСЯ ХОЗЯЕВАМИ КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ У 237 СОБАК С ОПУХОЛЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Признак_______________________________Процент собак
Видимая опухоль на шее 78
Кашель 34
Одышка (даже в покое) 32
Затрудненное дыхание (респираторный 28
дистресс-синдром)
Затрудненное глотание (дисфагия) 23
Изменение тембра лая (дисфония) 14
Потеря веса 14
Апатия/угнетенное состояние 13
Отсутствие явных признаков 12
Рвота/срыгивание 11
Анорексия/снижение аппетита 11
Полидипсия/полиурия 10
Повышенная активность 9
Понос 9
Повышенный аппепп 3
Отек морды 2
Явный дискомфорт в области шеи 2
Рис. 5-3. А. Фотография выбритой передней поверхности шеи собаки с большим явным зобом (стрелки) (фото j-pa Jane Turrel). Б. Крупная опухоль щитовидной железы у собаки (вид сбоку). Сзади опухоль ограничена ошейником. В. Крупная смещающая трахею опухоль щитовидной железы в операционном поле. Г. Удаленная опухоль щитовидной железы.
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 237
ками. Следует подчеркнуть два важных аспекта. Во-первых, прежде чем давать владельцу какие-либо рекомендации относительно диагноза, лечения и прогноза, ветеринар должен быть уверен в полноте проведенного физикального исследования животного. Во-вторых, ветеринар должен пытаться оценить размеры опухоли и выяснить степень ее инвазивноеги. По возможности, следует определить подвижность пальпируемого образования, которое нужно считать опухолью щитовидной железы, пока не будет доказано обратное.
Большинство опухолей щитовидной железы представляют собой плотные асимметричные и безболезненные узлы с неровной поверхностью. Если поражены обе доли железы, то они обычно увеличены в разной степени. Чаще всего такие опухоли прощупываются в области нормального расположения щитовидной железы - на поверхности трахеи или ниже (у кошек железа локализована ниже и легче смещается при пальпации) (см. рис. 5-3). Опухоли, как правило, неподвижны и погружены в окружающую ткань. Из-за спаянности с ней пальпировать нижнюю и медиальную поверхность образования обычно не удается. Неровная форма опухоли не всегда указывает на рак, но ее неподвижность, как правило, свидетельствует о местной инвазии и должна вызывать сильные подозрения на ее злокачественный характер.
У некоторых собак отмечалась инспираторная или экспираторная одышка. Явная кахексия (рис. 5-4), угнетенное состояние или обезвоживание наблюдались лишь у немногих животных. Собаки обычно выглядели бодрыми и активными, цвет слизистых у них сохранялся, время заполнения капилляров было нормальным, лихорадка отсутствовала. Шерсть часто была сухой и гусклой, но облысение отмечалось редко. Тоны сердца оставались нормальными, а осмотр пасти, глаз, ушей и пальпация живота не выявляли каких-либо отклонений от нор
мы. Иногда отмечалось увеличение подчелюстных лимфоузлов вследствие метастазов или обструкции лимфатических путей.
Обследование в клинике. Гемограмма (общий клинический анализ крови), биохимический анализ сыворотки и анализ мочи. Исходные результаты этих исследований играют незначительную роль в диагностике или лечении опухолей щитовидной железы у собак. Анемия встречалась менее чем в 10° о случаев, и, как правило, была легкой, нормоцитарной и нерегенеративной. Лейкоцитоз отмечался лишь у нескольких животных. Небольшое повышение уровня азота мочевины и активности печеночных ферментов в сыворотке было обнаружено нами соответственно у 14 и 24% собак. В одном из исследований повышение активности печеночных ферментов было найдено у 7 из 21 животного с опухолью щитовидной железы без тиреотоксикоза (Harari et al, 1986). Это нельзя расценивать как указание на метастазы в печени. У трех собак с раком щитовидной железы была выявлена паранеоплас -тическая гиперкальциемия. При анализе мочи диагностически значимых изменений не было.
Хотя результаты перечисленных исследований не помогают диагностике опухолей щитовидной железы, не позволяют отличить доброкачественные опухоли от злокачественных и не характеризуют стадию заболевания, они все же чрезвычайно важны. Возраст собаки с такими опухолями (доказанными, подозреваемыми или установленными позднее) обычно превышает 8 лет, а в этом возрасте могут иметь место заболевания многих органов и систем. Возможность сопутствующих заболеваний и множественных эндокринных опухолей нельзя недооценивать. Нормальные результаты анализов позволяют рассчитывать на относительную безопасность наркоза. Кроме того, при выявлении сразу нескольких заболеваний могут возникать сомнения в необходимости первоочередной операции на щи-
Рмс. 5-4. А. Истощенная 9-летняя немецкая овчарка с гипертиреозом, вызванным функционально активным раком щитовидной железы. Б. Худой 12-летний лабрадор-метис с легким гипертиреозом вследствие функционально активного рака щитовидной железы.
238 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
товидной железе. Иногда приходится одновременно лечить каждое из выявленных заболеваний.
Рентгенография. При любом подозрении на опухоль щитовидной железы необходимо провести рентгенографию грудной клетки. В одном из исследований рентгенография выявила метастазы в легких у всех 4 собак, у которых метастазы впоследствии были найдены при аутопсии (Birchard, Roesel, 1981). В другой работе с помощью рентгенографии грудной клетки легочные метастазы были обнаружены у 38% собак с раком щитовидной железы (На-rari et al, 1986). Мы выявили у 11 собак метастазы в основании сердца и у 40 из 73 животных - в легких. По нашим данным, рентгенография грудной клетки обнаруживает метастазы в легких примерно в 50% случаев. У многих собак с положительными данными рентгенографии и у некоторых из тех, у кого такое исследование было неинформативным, отдаленные метастазы обнаруживались с помощью сканирования с радиоактивным пертехнетатом натрия. Данные рентгенографии и тщательной пальпации или биопсии лимфоузлов помогают владельцу принять решение относительно возможности лечения его собаки. Отчасти это помогает и ветеринару определить стадию заболевания животного и дать обоснованный совет его владельцу.
Рентгенография области шеи способствует выявлению небольших новообразований в случаях нечетких результатов физикального исследования. Такое исследование помогает оценить степень смещения соседних органов и обнаружить прорастание опухоли в гортань или трахею. Мы вместо рентгенографии шеи или брюшной полости обычно используем УЗИ. Однако у нескольких собак с метастазами в печени на рентгенограммах обнаруживались неровные контуры этого органа. Таким образом, при подозрении на рак щитовидной железы следует проводить рентгенографию
Электрокардиография (ЭКГ) и/или эхокардиография (ЭхоКГ). ЭКГ необходима во всех случаях обнаружения сердечных аритмий. При шумах в сердце или признаках сердечной недостаточности показаны рентгенография грудной клетки, ЭхоКГ и/или ЭКГ. У собак с нетоксическим зобом функция сердца обычно остается нормальной. Исключение составляют животные с заболеваниями сердца, независимыми от опухоли щитовидной железы.
УЗИ. Оборудование и положение животного. Исследование долей щитовидной железы требует применения высокочастотных датчиков (7,5—10 МГц). С увеличением частоты датчика улучшается пространственное разрешение и удается выявить меньшие структуры и более тонкие анатомические детали. Даже у крупных собак глубина залегания щитовидной железы редко превышает 4 см (максимальная глубина проникновения ультразвука при датчике с частотой 10 МГц). При начальном исследовании области шеи наши специалисты используют линейный датчик с частотой 5-10 МГц при полосе сканирования 38 мм. Затем производят бо
лее детальное исследование при апертуре датчика 26 мм. Датчики с переменной частотой имеют преимущества перед датчиками с одной стандартной частотой, поскольку обеспечивают большее пространственное разрешение поверхностных структур. Для улучшения качества изображения структур, расположенных на большей глубине, можно затем использовать датчик с меньшей частотой (Wisner et al, 1991; Wisner, Nyland, 1998).
Шерсть с передней части шеи необходимо тщательно сбрить. Остатки шерсти снижают качество изображения. Собаку укладывают на спину по возможности прямо на стол с V-образным углублением с мягкой подстилкой. Шею следует слегка наклонить вбок или вниз. Обычно можно обойтись без седативных средств, и единственное, что требуется, это удерживать животное в нужном положении. Однако при крупном зобе такое положение и давление датчика может вызывать тяжелую одышку. Поэтому некоторых собак лучше исследовать под наркозом в условиях интубации (Wisner, Nyland, 1998).
Нормальная анатомия, проекции и показания. В норме доли щитовидной железы расположены тотчас под дугой перстневидного хряща. У здоровых собак среднего веса они имеют вид уплощенных образований с размерами приблизительно 5,0 х 1,5 х 0,5 см (рис. 5-5). Важным внутренним ориентиром служат общие сонные артерии, которые лежат по бокам и чуть сверху долей щитовидной железы. Строение этих долей оценивают в двух стандартных проекциях. В случаях особенно крупных опухолей в области шеи могут потребоваться и дополнительные проекции (Wisner et al, 1991). Очевидным показанием к УЗИ щитовидной железы или шеи является необходимость выяснения источника, локализации и строения краев опухоли, которую не удается дифференцировать клинически. УЗИ применяют и для того, чтобы установить одно- или двусторонний характер поражения щитовидной железы. Поскольку многие опухоли на шее развиваются именно из щитовидной железы, и у собак они часто оказываются злокачественными, данные УЗИ должны помочь владельцам принять решение относительно лечения своих питомцев (Wisner et al, 1994).
Дифференциальная диагностика опухолей шеи. УЗИ нередко позволяет отличить опухоль щитовидной железы от других объемных процессов. Опухоль на передней поверхности шеи может представлять собой рак или аденому щитовидной железы, увеличенный подчелюстной, заглоточный или шейный лимфоузел, целлюлит, абсцесс или гранулему, опухоль слюнных желез, а также такие новообразования, как рабдомиосаркому, лейомиосаркому и опухоль сонного гломуса (Wisner et al, 1994). При обследовании собак с опухолью шеи следует сначала попытаться с помощью УЗИ идентифицировать обе доли щитовидной железы. Нередко это позволяет сразу выяснить источник опухоли. Однако крупные опухоли могут нарушать нормальную анатомию структур шеи и затруднять оценку пер-
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
239
А
Передняя щитовидная артерия
Паращитовидная железа
Доля щитовидной железы Задняя щитовидная артерия Общая сонная артерия
Рис. 5-5. Л. Вначале для выявления щитовидной железы датчик располагают по ее длинной оси в яремной борозде, получая изображение между фронтальной и парасагиттальной проекциями. Анатомическим ориентиром служит общая сонная артерия с той же стороны. Б. Нормальная доля щитовидной же юзы выглядит как равномерно и умеренно эхогенная структура {стрелки). Она окружена гонкой гпперэхогенной фасцией. В. По короткой оси доля щитовидной железы {бо чьшие сп юшные стрелки} выглядит как треугольная структура кнаружи от общей сонной артерии {малые сплошные стрелки). При УЗИ левой доли можно увидеть и пищевод, имеющий неправильную форму и расположенный медиально и дорсально по отношению к доле щитовидной железы {открытые стрелки). H3:Wisner ER, Nyland TG: Ultrasonography of the thyroid and parathyroid glands. Vet Clin N Amer: Sni Anim Pract 28:973, 1998.
240 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
внчного очага. В то же время, лимфоузлы и опухоли слюнных желез довольно легко отличить от долей щитовидной железы по локализации (обычно выше и сбоку от них) и эхогенности. Слюнные железы, например, обладают равномерной низкой эхогенностью и характерной внутренней структурой.
Эхография рака щитовидной жезезы. Поскольку гкань рака щитовидной железы обычно функционально неактивна, опухоль к моменту диагноза, как правило, достигает больших размеров. Такие опухоли могут быть инкапсулированными или иметь нечеткие края (рис. 5-6). Их паренхима обладает меньшей эхогенностью по сравнению с нормальной тиреоидной тканью и может быть негомогенной. Иногда в ней присутствуют множественные кисты или участки минерализации. Опухолевая ткань обычно хорошо васкуляризирована; вокруг и внутри нее часто располагается крупное артериальное сплетение, которое можно определить по пульсации с помощью цветного допплеровского исследования. У некоторых собак в опухоли имеются (или развиваются после операции» артерио-венозные шунты (Wisner et al, 1994; Wisner, Nyland, 1998).
Рак щитовидной железы может быть двусторонним, прорастать в фасции или сосуды шеи. Тщательное исследование краев опухоли помогает оценить перспективы ее хирургического лечения. В редких случаях рак прорастает в стенку пищевода, вызывая дисфагию. Это лучше всего видно при исследовании с барием. Хотя в большинстве случаев УЗИ позволяет установить диагноз рака щитовидной железы, иногда требуется подтверждение дан
ными аспирационной или пункционной биопсии. Учитывая обильное кровоснабжение раковой ткани, такую биопсию следует проводить под контролем УЗИ, чтобы избежать повреждения крупных сосудов.
Случайно обнаруживаемые опухоли щитовид-ной жезезы. Как отмечалось выше, УЗИ используется при диагностике многих заболеваний, в том числе и у собак без пальпируемых новообразований на шее. Это приводит к неожиданному выявлению опухолей щитовидной железы. Примерно в 40-50% случаев такие нечаянно обнаруженные опухоли оказываются аденомами, а в остальных - карциномами. Поэтому случайно обнаруженные опухоли необходимо тщательно исследовать.
Сканирование с радиоактивным пертехнетатом. Схема исследования. Сцинтш рафию шеи и грудной полости проводят с помощью гамма-камеры в пределах 1 часа после внутривенного введения 2-4 мКи ООтТс-пертехнетага. Меченый пертехнетат поглощается любыми клетками, способными накапливать йод, в том числе и клетками тиреоидной ткани. Обычно сканирование проводят по 1 минуте в левой и правой боковых, передней и задней проекциях (Marks et al., 1994).
Интерпретация. Пертехнетат накапливается в тиреоидной ткани, слюнных железах и слизистой желудка (рис. 5-7). Таким образом можно охарактеризовать размеры и степень инвазии опухолей, а также метастазы, предположительно содержащие клетки щитовидной железы. Считается, что результаты сканирования с пертехнетатом не отражают функцию тиреоидной ткани (т.е. не позволяют су-
Рис. 5-6. А. Инкапсулированный рак щитовидной железы у собаки. Железа резко увеличена, ее паренхима гетсрогснна, края четко очерчены. Б. Рак щитовидной железы с плохо различимыми краями. Железа увеличена. паренхима гетсрогснна (кончики стрелок). Кроме того, имеются признаки прорастания опухоли в окружающую ткань (стрелки). Из: Wisner ER, Nyland TG: Ultrasonography of the thyroid and parathyroid glands. Vet Clin N Amer: Sm Anim Pract 28:973, 1998.
ОПУХОЛИ ЩИТОВИДНОМ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 241
Рис. 5-7. Сканограммы щитовидной железы с пертехнетагом у здоровой собаки. Боковая (А) и дорсовентральная (Б) проекции Доли щитовидной железы (прямая стрелка) по размерам сходны со слюнными железами (изогнутая стрелка). В. Нормальная доля щитовидной железы в области шеи и эктопическая тиреоидная ткань в области переднего средостения (изогнутые стрелки) у собаки с одной удаленной долей щитовидной железы. Видны слюнные железы (открытая стрелка) и желудок (прямая стрелка), поскольку в них также накапливается пертехнетат.
дить о наличии эу-, гипо- или гипертиреоза), а дают представление лишь о ее нормальной или аномальной локализации и степени местной инвазии и метастазирования (Turrel et al, 1987; Rijnberk, 1996). Однако недавние исследования (Balogh et al, 1998), равно как и наш опыт, позволяют утверждать, что с помощью сканирования можно получить определенные сведения и о функции щитовидной железы.
Поглощение изотопа считается нормальным, если изображение щитовидной железы по размерам и плотности сходно с изображением околоушных слюнных желез и желудка (см. рис. 5-7). Появление на сканограмме шеи двух симметричных образований нормального размера указывает на нормальное состояние щитовидной железы. В одном из наших исследований у собак с опухолями этой железы был обнаружен двоякий характер накопления пертехнетата. Тип I характеризовался гомогенной областью накопления с четкими краями (рис. 5-8), тогда как при типе И накопление было гетерогенным, и его края были размытыми (рис. 5-9). Очаги поглощения изотопа в грудной полости или в других участках шеи е высокой вероятностью указывают на метастазы опухоли (Marks et al, 1994).
Результаты сканирования у собак с опухолями щитовидной железы. По нашим данным, сканирование с пертехнетатом выявляло патологию у всех 29 собак с опухолями щитовидной железы. У 11 животных регистрировалось накопление типа I, а у 18 - типа II. Из этих 29 собак у 24 была обнаружена аденокарцинома щитовидной железы; из них у 9 имела место сканограмма типа I и у 15 - сканограмма типа II. Из трех животных с недифференциро
ванным раком щитовидной железы в одном случае накопление изотопа соответствовало типу I, а в двух - типу II. У одной собаки с аденомой щитовидной железы обнаружено накопление изотопа по типу I и у одной с С-клеточным раком - по типу II. Чаще всего (у 13 из 29 собак) на сканограмме выявлялась односторонняя опухоль с повышенным поглощением изотопа (Marks et al, 1994). Поглощение изотопа одной долей щитовидной железы было обнаружено у 21 из 29 собак; у 5 собак изотоп поглощали обе доли, а у 3 очаги поглощения располагались в отдалении от места нормальной локализации щитовидной железы (рис. 5-10). При хирургической ревизии у 24 из 29 собак опухоль обнаруживалась именно там, где она выявлялась при сканировании.
Если метастазы сохраняют способность к захвату йода, то они должны выявляться при сканировании с пертехнетатом. Этот метод позволяет также увидеть эктопические очаги тиреоидной ткани (нормальной или опухолевой). У 2 из 29 собак имелись рентгенологические признаки метастазов в легких, но сканирование с пертехнетатом выявило эти метастазы только у одной (рис. 5-11) (Marks et al, 1994). Таким образом, клетки опухолей тиреоидной ткани не всегда сохраняют способность к поглощению йода. Метастазы, не поглощающие йод (особенно отдаленные), при сканировании не выявляются. Поэтому сканирование тиреоидной ткани считается относительно специфичным. но недостаточно чувствитсзъным методом выявления метастазов. Если отдаленные метастазы не обнаруживаются при сканировании, то это еще не означает. что их нет.
242 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
Б
д
Рис. 5-8. На сканограммах с пертехнетатом у 3 собак с опухолями щитовидной железы видно гомогенное поглощение изотопа с четкими краями (тип I) У двух собак (Би Г) как доли щитовидной железы (прямые стрелки), так и слюнные железы (изогнутые стрелки) поглощают изотоп. У одной из них - с двусторонним фолликулярным раком щитовидной железы - видна крупная опухоль (А - боковая и Б - дорсовентральная проекции), частично накапливающая изотоп. Собака оставалась в эутиреоидном состоянии. В и Д. Сканограммы с пертехнетатом у собаки с гипертиреозом и односторонней крупной (прямая стрелка) функционально активной опухолью (фолликулярный рак) щитовидной железы, накапливающей пертехнетат в гораздо большей степени, чем слюнные железы (изогнутая стрелка). В - боковая и Д - дорсовентральная проекции.
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 243
В
Рис. 5-9. Сканограмма с пертехнетатом у двух собак с раком щитовидной железы. Видно гетерогенное поглощение изотопа с «размытыми» краями (тип II) в области шеи (щитовидная железа - прямые стрелки*, слюнные железы - изогнутые стрелки). Типичная картина местной инвазии опухоли в соседние ткани. Боковая (А) и вентродорсальная (Б) проекции Несмотря на поглощение изотопа опухолью, собака оставалась в эутиреоидном состоянии. В. Сканограмма у собаки с опухолью щитовидной железы, сопровождающейся гипертиреозом (передняя проекция).
Сканирование и гистология («горячие» и «холодные» узлы). В ткани фолликулярного рака сохраняются мелкие фолликулы с минимальным содержанием коллоида. Такой рак можно отличить от фолликулярной аденомы только по инвазии в капсулу или сосуды. Особое внимание именно к фолликулярному раку обусловлено тем. что у человека (и, вероятно, у собак) он часто сохраняет способность концентрировать йод и, хотя и реже, синтезировать Т4 и Т . У человека функционирующая опухоль щитовидной железы почти всегда представляет собой фолликулярный рак (Greenspan, 2001). Такие опухоли, а. возможно, и их метастазы с большей вероятностью должны накапливать пертехнетат и выявляться при сканировании.
В отличие от человека, у собак с опухолями щитовидной железы (независимо от их гистологической классификации) сканирование практически
всегда обнаруживает патологию. Узлы, накапливающие пертехнетат и выявляющиеся на сканограммах, обычно называют «горячими». Предполагается, что такие опухоли (см. рис. 5-8 - 5-10) легче поддаются лечению радиоактивным йодом, чем «холодные», которые не накапливают пертехнетат (см. рис. 5-11). «Горячие» узлы чаще оказываются функционирующими, тогда как «холодные», как правило, функционально неактивны. Теоретически, нефункционирующие опухоли не должны накапливать ни пертехнетат, ни йод (см. рис. 5-11) и хуже поддаются радиойодтерапии. Корреляция между эффективностью радиойодтерапии и поглощением пертехнетата опухолью у собак изучена недостаточно. Согласно нашему опыту, чувствительность опухоли к радиоактивному йоду выше в случаях накопления ею пертехнетата. Поэтому при наличии «горячих» узлов стоит подумать об использовании
244 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
Рис. 5-10. Рентгенограмма (А) и сканограмма (Б) у собаки с аденокарциномой щитовидной же юзы и метастазами в 1егких. Пунктиром на сканограмме показаны границы грудной клетки
радиойодтерапии. Однако лечение злокачественных опухолей радиоактивным йодом в нашей клинике редко оказывалось успешным.
Выявленные нами опухоли шитовидной железы в большинстве случаев прорастали в окружающие ткани, разрушали или смещали их. Такие опухоли, несмотря на способность накапливать пертехнетат, обычно были функционально неактивными, т.е. не секретировали тиреоидные гормоны. Аденомы щитовидной железы редко проявляются клинически и при сканировании с пертехнетатом их трудно отличить от карциномы или нормальной тиреоиднои ткани. Они накапливают пертехнетат так же, как злокачественные опухоли типа I (рис. 5-12). Однако, как уже неоднократно отмечалось, широкое применение УЗИ и раннее выявление новообразований щитовидной железы резко увеличивают частоту прижизненной диагностики доброкачественных опухолей. Они могут реагировать на радиойодтера-пию лучше, чем злокачественные опухоли.
Из 29 наблюдавшихся нами собак с опухолями щитовидной железы у 20 изотоп накапливался в этой железе больше, чем в слюнных железах, у 8 - меньше, а у 1 -примерно в той же степени. Интересно, что повышенное накопление изотопа регистрировалось у всех 6 животных с гипертиреозом, у 10 из 16 с эутиреозом и у 2 из 3 с гипотиреозом (см. рис. 5-8 - 5-10) (Marks et al, 1994). Таким образом, по степени накопления радиоактивного изотопа опухолями щитовидной железы нельзя судить о функциональном состоянии ткани, равно как и о
доброкачественной или злокачественной природе опухоли. Как отмечалось выше, способность ткани накапливать пертехнетат не всегда связана с ее способностью отвечать на радиойодтерапию.
Показатели функции щитовидной железы и их влияние на характер лечения. Концентрации Т4 и Т3 в сыворотке крови. Результаты определения уровня тиреоидных гормонов в сыворотке, как и радиоизотопного сканирования, у собак с опухолями щитовидной железы непостоянны. Несмотря на доступность дешевизну и надежность измерения содержания Т4 и Т. в сыворотке, отнюдь не это определяет тактику лечения больных со злокачественной опухолью щитовидной железы (Greenspan, 2001). Ветеринары используют данные о содержании тиреоидных гормонов в сыворотке лишь для оценки состояния собаки в данный момент (эу-, гипо- или гипертиреоз), но не для рекомендаций в отношении лечения.
При многих опухолях щитовидной железы количество оставшейся нормальной тиреоидной ткани достаточно для поддержания животного в состоянии эутиреоза или легкого гипотиреоза. По нашим и литературным данным, у 55- 60% собак с опухолями щитовидной железы концентрация тиреоидных гормонов в сыворотке остается нормальной (т.е. животные находятся в эутиреоидном состоянии). В 30-35° о случаев имеет место гипотиреоз, обусловленный деструкцией нормальной тиреоидной ткани нефункционирующей опухолью (рис. 5-13). Считают, что у собак со злокачественными опу-
ОПУХОЛИ ЩИТОВИДНОМ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
245
Б
Рис. 5-11. Рентгенограмма (\) и сцинтиграмммы грудной клетки (Б) и области шеи (В) у собаки с недифференцированным раком щитовидной железы и метастазами в легких. Метастаз в легких виден на рентгенограмме (стрс лка), но не на сцинтиграмме грудной клетки. Границы грудной клетки показаны на сцинтиграмме пунктирбм. Легочный метастаз накапливает минимальное количество и зотопа (стрелки). Дорсовснтральн ая (Г) проекция, а также об 1асть шеи и грудной клетки (Д) на сцинтиграмме у собаки с гипертиреозом, раком щитовидной железы и накапливающими изотоп метастазами в легких. Участки накопления изотопа (на рис. Г и Д) выглядят белыми пятнами. Ви (ны слюнные железы (прямая стрелка), желудок (открытые наконечники стрелок), щитовидная железа в области шеи (сплошные наконечники стрелок) и легочные метастазы (изогнутые стрс ски).
246 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
Рис. 5-13. Процент гипотиреоидных, эутиреоидных и гипертиреоидных (по клиническим данным и результатам определения уровня Т, в сыворотке крови) собак с клинически выявленной опухолью щитовидной железы
С *4
Рис. 5-12. Сканограммы у собаки с гипертиреозом вследствие одиночной функционально активной фолликулярной аденомы щитовидной железы. А - боковая, Б -дорсовентраль-ная проекции. Обратите внимание на околоушные слюнные железы (изогнутые стрелки) и аденому щитовидной железы (прямые стрелки). Удаление аденомы при операции привело к полному устранению клинических признаков. За пятилетний срок наблюдения рецидивов не наблюдалось.
холями гипотиреоз встречается редко, а когда это имело место, то опухоль развивалась на фоне ранее существовавшего гипотиреоза (Mooney, 1998).
Однако наш опыт говорит о довольно частом развитии гипотиреоза вследствие разрушения нормальной тиреоидной ткани злокачественной опухолью или продукции ею больших количеств неактивных соединений. Эти йодированные белки, не действующие на периферии, могли бы ингибировать секрецию ТТГ, приводя к вторичной атрофии нормальной тиреоидной ткани (Loar, 1986). Некоторые авторы находили гипертиреоз почти у 20" Ь собак с опухолями щитовидной железы; мы же отмечали это только в 10° о случаев (см. рис. 5-13).
Значение концентраций тиреоидных гормонов в сыворотке крови. Концентрации Т и Т в сыворотке следует определять у всех собак с подоз
реваемой или доказанной опухолью щитовидной железы. Результаты этих определений могут повлиять на общую схему лечения животных и помогают понять причину клинических проявлений (при гипотиреозе, например, можно устранить сонливость и апатию, а при гипертиреозе -потерю веса, нарушения функции сердца и пищеварения). Даже специфические лечебные мероприятия могут зависеть от того, имеется ли у собаки гипертиреоз или опухоль не обладает функциональной активностью. Проба с ТТГ в таких случаях практически не дает дополнительной информации, и необходимость в ее проведении возникает редко.
Биопсия щитовидной железы. Несмотря на возможность пальпации многих опухолей щитовидной железы, их биопсия сопряжена с определенными трудностями. Опухоль содержит большое количество сосудов, и при биопсии, как аспирационной, так и пункционной, нередко возникает кровотечение. Можно предположить, что чем тяжелее кровотечение при биопсии, тем больше вероятность именно тиреоидного происхождения опухоли (Thompson et al, 1980). Возможность обильного кровотечения препятствует широкому применению пункционной биопсии. Мы рекомендуем тонкоигольную аспирационную биопсию иглой 21-23-го диаметра и только под контролем УЗИ. Биопсия, как правило, позволяет отличить опухоль щитовидной железы от абсцесса, кисты, лимфоузла или мукоцеле слюнной железы.
Количество клеток опухоли, получаемое при тои-коигольной аспирационной биопсии, вариабельно, и пробы почти всегда содержат примесь крови. Из-за хрупкости опухолевых фолликулярных клеток в пробе присутствует много изолированных ядер,
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 247
но кластеры интактных клеток напоминают железистые структуры. Тонкоигольная биопсия обычно позволяет убедиться в том, что опухоль состоит из тиреоидной ткани, хотя ее злокачественную природу доказать трудно. Если цитологический анализ указывает на опухоль щитовидной железы, можно составить план лечения. Если же результаты анализа не позволяют установить диагноз, то можно попытаться провести пункционную биопсию иглой большего диаметра. Однако, как свидетельствует наш опыт, с помощью такого безопасного, простого и неинвазивного метода, как УЗИ, почти всегда удается выяснить, имеет ли опухоль тиреоидное происхождение. Для подтверждения диагноза можно провести сканирование щитовидной железы, но, как отмечалось выше, результаты такого исследования не всегда надежны.
Дифференциальная диагностика
Опухоли на передней поверхности шеи у собак могут представлять собой аденому или карциному щитовидной железы, подчелюстные, заглоточные или шейные лимфоузлы (увеличенные вследствие плоскоклеточного рака миндалин или метастазов рака других опухолей ротовой полости или органов шеи), целлюлит, абсцессы или гранулемы (например, вокруг инородных тел), опухоли или воспаление слюнных желез, а также другие новообразования, включающие рабдомиосаркому, лейомиосаркому и опухоли каротидного гломуса (Wisner et al, 1994). В перикарде или у основания сердца могут иметь место инфекционные и гранулематозные процессы, опухоли хеморецепторных или барорецепторных органов, гемангиосаркома, мезотелиома, лимфосаркома или опухоли аберрантной тиреоидной ткани (Loar, 1986).
Лечение: крупные инвазивные (неподвижные) опухоли без видимых метастазов у собак с эутиреозом или гипотиреозом (рис. 5.14)
Введение. При обширных или инвазивных опухолях, сохранении большой массы раковой ткани после операции или при неоперабельных опухолях у человека применяют наружное облучение (Parsons et al, 1994). Возможности лечения крупных и инвазивных опухолей щитовидной железы у собак ограничены. Полное хирургическое удаление таких опухолей невозможно без резекции ряда жизненно важных структур (гортани, трахеи, пищевода, возвратного гортанного нерва и оболочки сонных артерий) (Flanders, 1994). Радиойодтерапия неэффективна даже в случаях гиперфункционирующей опухоли, накапливающей радиоактивные изотопы. Лечение функционально активного рака щитовидной железы на поздних стадиях большими дозами радиоактивного йода (более 2,22 х 109 Бк) в лучшем случае дает паллиативный эффект. По данным од
ного из исследований, у 4 собак, которые получали радиоактивный йод (1311) один или два раза, время жизни без рецидивов составляло от 3 до 29 месяцев (в среднем 8 месяцев) (Adams et al, 1995). У одной собаки, получавшей 1311 три раза, это время составило 17 месяцев (Peterson et al, 1989). Применение различных химиотерапевтических средств также не приводит к излечению или хотя бы к длительной ремиссии. Медленная регрессия рака щитовидной железы после облучения обусловливает и высокий риск метастазирования.
Несмотря на это, мы все же пытаемся лечить таких собак, поскольку у многих из них при этом улучшается состояние и увеличивается выживаемость. Так как большинство клинически выявляемых опухолей щитовидной железы имеет злокачественную природу, решение относительно терапии следует принимать по возможности быстро. Эти опухоли обычно находятся на стадиях Tib, Т2Ь или ТЗЬ (см. табл. 5-3). В таких случаях следует оценить возможности операции, химиотерпии, радиойодтерапии или наружного облучения кобальтовой «пушкой». Выбор метода лечения практически не зависит от гормональной активности опухоли (рис. 5-14).
Высоковольтное облучение. Материал и методы. Наше мнение об этой форме лечения собак с инвазивным раком щитовидной железы базируется на результатах недавно проведенного исследования (Theon et al, 2000). Использованы также данные литературы. Средний срок выживания 13 собак, перенесших наружное облучение, составил 96 недель (с колебаниями от 6 до 247 недель; Brearley et al, 1999). По данным другого ретроспективного исследования, проведенного на 8 животных, средний срок выживания после наружного облучения пучком высокой энергии превысил 2 года (Pack et al, 2001). Эти внушающие оптимизм данные можно сопоставить с нашими наблюдениями над 25 собаками с гистологически подтвержденным дифференцированным раком щитовидной железы. Животные с гистологическими, цитологическими или рентгенографическими признаками местных или отдаленных метастазов, а также с рецидивами опухоли в исследование не включались. У 9 собак имелись компактноклеточные опухоли, у 8 - фолликулярный рак и у 8 - смешанные фолликулярно-компактноклеточные аденокарциномы. Возраст животных колебался от 3 до 18 лет (в среднем 10 лет). Собаки принадлежали к разным породам. У 11 животных на основании данных пальпации, УЗИ и рентгенографии опухоли были признаны неоперабельными, а у 14 резекция оказалась безуспешной. Обе доли щитовидной железы были увеличены у 16 собак и одна доля - у 9. У 6 из 25 собак диагностировали гипотиреоз, тогда как остальные находились в эутиреоидном состоянии (Theon et al, 2000).
Сканирование с "mTcO4 было проведено у 20 из 25 животных. У остальных 5 из-за предшествующих попыток резекции опухоли сканирование не прово-
248 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
Опухоль щитовидной железы у собак с эутиреозом или гипотиреозом
• Рентгенография (грудная клетка ± брюшная полость)
• УЗИ (области шеи и живота)
• КТ или МРТ (шея, грудная клетка, живот)
• Сканирование щитовидной железы с пертехнетатом
Отсутствие отдаленных метастазов
1) Сканирование с пертехнетатом
2) УЗИ шеи
1) «Пятнистое» поглощение изотопа (горячий или холодный узел)
2) Нечеткие края
3) Отсутствие капсулы
4) Обильное кровоснабжение
1) Равномерное поглощение изотопа
2) Четкие края
3) Наличие капсулы
4) Умеренное кровоснабжение
Небольшая опухоль
Крупная опухоль
Операция не показана
____________±_ Тиреоидэктомия
Высоковольтное облучение
Значительное уменьшение размеров опухоли
Высоковольтное облучение
Высоковольтное облучение ± химиотерапия
Успешная операция
Гистология
Аденома
Рак
Варианты:
1) Повторное наружное облучение
2) Попытка тиреоидэктомии
3) Химиотерпия А. Доксорубицин Б. Цисплатин
Размеры опухоли не изменились
Дальнейшее облучение
Присутствие раковых клеток на краях опухоли
Химиотерапия
При повторных исследованиях:
1) сканирование щитовидной железы
2) УЗИ шеи
При повторных исследованиях:
1) рентгенография грудной клетки
2)сканирование щитовидной железы
3) УЗИ
Высоковольтное облучение области шеи
Рис. 5-14. Алгоритм лечения опухоли щитовидной железы без видимых метастазов у собак с эутиреозом или гипертиреозом.
дили. По данным сканирования, у 7 собак была поражена одна доля, у 8 - обе и у 5 имелись опухоли по средней линии шеи с инвазией в хрящи гортани. У 7 собак выявлялись четко отграниченные области гомогенного поглощения изотопа и у 13 границы радиоактивности были нечеткими. Из последних 13 случаев в 9 отмечено диффузное распределение изотопа в опухоли, а в 4 - неравномерное его поглощение с «пустыми» участками. Каждую собаку облучали кобальтом так, чтобы поглощенная доза составляла 48 Гр за 12 сеансов по схеме 3 дня в неделю. Компьютерный план облучения в каждом отдельном случае был составлен с учетом различных факторов (контура шеи, данных рентгенографии, КТ или МРТ и УЗИ).
Результаты. Средний срок жизни без рецидивов у этих 25 собак составил 45 месяцев и не зависел от возраста, пола, гистологического типа и
стадии прогрессии опухоли, стороны поражения и характера накопления "тТсО4. Время до максимального уменьшения размеров опухоли колебалось от 8 до 22 месяцев. Лечение оказалось безуспешным у 14 собак (у остальных 11 признаки роста опухоли отсутствовали на протяжении более 4 лет). В трех случаях основной причиной отсутствия эффекта была местная прогрессия опухоли, в четырех случаях (без клинических признаков прогрессии опухоли) причиной были метастазы. Метастазы в легких выявлены у 5 собак, у одной из них имелись метастазы и в костях. В трех случаях метастазы локализовались в брюшной полости. У собак с двусторонней опухолью риск метастазирования был в 16 раз выше, чем у животных с односторонним поражением. Предшествующие попытки резекции не влияли на риск появления метастазов (Theon et al, 2000).
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 249
Продолжительность жизни. Высоковольтное облучение является достаточно эффективным методом лечения местного рака щитовидной железы у собак, даже на поздних его стадиях. Облучение не обеспечивает радикального излечения от инвазивного рака, но в большом проценте случаев продлевает жизнь. У 72% животных период безре-цидивной выживаемости превышал 150 недель. В отсутствие лечения срок жизни собак с аналогичными опухолями после установления диагноза колеблется от 2 до 38 недель (Verschueren et al, 1992b). Средняя продолжительность жизни собак при химиотерапии цисплатином составляет 28 недель (медиана 14 недель) (Fineman et al, 1998). Доксорубицин обеспечивал 50%-ное уменьшение размеров опухоли только у 3 из 13 собак (Ogilvie et al, 1989), а митоксантрон давал лишь кратковременный паллиативный эффект (Ogilvie et al, 1991).
Ветеринары и владельцы собак не должны рассчитывать на уменьшение размеров опухоли в ближайшие месяцы, даже в случаях успеха лучевой терапии. Исчезновение опухоли или максимальное уменьшение ее размеров наблюдается лишь через 8-22 месяца. Клиенты должны знать об этом и, как и ветеринары, вооружиться терпением. Медленное уменьшение размеров опухоли может создать неверное впечатление о ее радиорезистентности. У людей прогноз после наружного облучения при папиллярном раке щитовидной железы лучше, чем при фолликулярном. У собак же гистологический тип опухоли, по-видимому, не имеет прогностического значения.
Метастазы после облучения. В этом разделе рассматривался план лечения собак без видимых метастазов к моменту диагноза. По нашим данным, отдаленные метастазы после облучения чаще появлялись у тех собак, у которых отсутствовал местный эффект (т.е. в облученной области шеи возобновлялся рост опухоли). Иными словами, основное значение имеет лучевое воздействие на первичный опухолевый очаг. Кроме того, успешное местное воздействие предотвращало появление поздних (более чем через 12 месяцев), но не ранних (менее, чем через 6 месяцев) метастазов. Ранние метастазы, выявляемые у собак в случаях уменьшения первичного опухолевого очага, скорее всего, имелись еще до установления диагноза, и поэтому местное облучение не влияло на их рост. Поздние же отдаленные метастазы возникали, очевидно, вследствие неэффективности воздействия на первичный очаг.
Побочные эффекты облучения. Облучение сопровождалось рядом побочных эффектов. Острые осложнения включали воспаление слизистой пищевода, трахеи или гортани, что проявлялось хрипотой и кашлем у 12 и дисфагией у 8 собак. Обычно эти осложнения хорошо переносились и спонтанно исчезали. Фиброз кожи и постоянное облысение наблюдались у 6 собак, а хронический трахеит с сухим кашлем у четырех. Из 19 животных, находившихся в эутиреоидном состоянии, у
двух через 13 и 29 месяцев развился гипотиреоз, а у одной еще и гипопаратиреоз. Латентный период развития гипотиреоза в данных случаях оказался большим, чем сообщалось ранее в отношении одной собаки, перенесшей облучение после операции (Kramer et al, 1994). На основании столь немногочисленных наблюдений трудно сделать окончательный вывод, но все же комбинированное лечение, по всей вероятности, ускоряет развитие гипотиреоза и увеличивает частоту этого осложнения. У человека облучение области головы и шеи (при попадании щитовидной железы в поле облучения) часто приводит к гипотиреозу. Субклинический гипотиреоз - самое распространенное осложнение такой терапии (Nyshiyama et al, 1996). Какие-либо угрожающие жизни осложнения лучевой терапии опухолей щитовидной железы отсутствуют. Это явно отличается от хирургической резекции опухоли, которая сопряжена с высоким риском осложнений. Из 20 собак с крупной подвижной злокачественной опухолью щитовидной железы, 5 погибло от осложнений операции (Klein et al, 1995).
Радиоактивный йод. Радиоактивный йод при неоперабельных опухолях щитовидной железы у собак не вызывает заметной регрессии первичного очага и без повторного введения не продлевает жизнь животных (Peterson et al, 1989; Adams et al, 1995). Наши данные в этом отношении сходны с результатами других исследователей. Большинство собак с дифференцированными опухолями щитовидной железы находятся в эутиреоидном или гипотиреоидном состоянии, а в таких условиях радиойодтерапия практически неэффективна. Для ее успеха опухоль должна длительное время сохранять способность поглощать и задерживать йод (что проверяется с помощью следовых количеств 1311). Только это позволяет рассчитывать на возможность гибели опухолевых клеток от больших доз радиоактивного изотопа. Как показывает наш опыт, ткань рака щитовидной железы в большинстве случаев плохо накапливает йод, и поэтому при таких опухолях данная форма терапии неприменима.
Химиотерапия. Введение. При раке щитовидной железы у собак применялись различные химиотерапевтические средства. Частичный эффект (т.е. уменьшение объема опухоли более чем вдвое) при использовании доксорубицина или цисплатина наблюдался у 30-50% животных (Jeglum, Whereat, 1983; Post, Maudlin, 1992; Fineman et al, 1998). Однако такое лечение не продлевало жизнь собакам. В настоящее время химиотерапии отводят меньшую роль, чем высоковольтному облучению или операции (см. рис. 5-14), которые дают больше шансов на излечение или длительное выживание, хотя полностью удалить или разрушить опухоль удается не часто. Поэтому химиотерапия приобретает значение в качестве дополнительной меры. Она показана в тех случаях, когда попытки полного удаления или разрушения опухоли наружным пучком оказываются безуспешными, когда имеются отдаленные мета
250 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
стазы или когда размеры первичного очага таковы, что позволяют предполагать местную инвазию или наличие метастазов, даже если они и не выявляются при обследовании. При опухоли диаметром более 4 см вероятность метастазов крайне высока (Verschueren et al, 1992b).
Доксорубицин и «комбинированная» терапия. При раке щитовидной железы у человека наиболее эффективным химиотерапевтическим средством является доксорубицин (адриамицин, Adria Laboratories, Inc, США), который применяют как отдельно, так и в комбинации с цисплатином (Shi-maoka et al, 1985; Ahuja, Ernst, 1987). Исчезновение местного опухолевого очага (даже на поздних стадиях рака) наблюдалось также при сочетании низких доз доксорубицина с лучевой терапией (Kim, Leeper, 1987). Средняя выживаемость 8 собак при сочетании доксорубицина с облучением наружным пучком составила 11 месяцев (Post, Mauldin, 1992). Однако мы получили гораздо лучшие результаты, что связано, вероятно, с разными критериями отбора животных для такого лечения. Применение цисплатина и митоксантрона дает менее постоянный эффект (Ogilvie et al, 1991; Fineman et al, 1998). Мало обнадеживают и результаты применения таких средств, как блеомицин, винкристин, этопозид и метотрексат (Poster et al, 1981; Spanos et al, 1982; Hoskin, Harmer, 1987; Tallroth et al, 1987).
Реакция на химиотерапию у собак с опухолями щитовидной железы различна. Доксорубицин у большинства животных задерживает рост опухоли и иногда несколько уменьшает ее размеры. Однако полная ремиссия наблюдается лишь в редких случаях. Средний срок жизни 10 собак после лечения одним доксорубицином составлял 37 недель (Je-glum, Whereat, 1983). Доксорубицин вводили собакам внутривенно в дозе 30 мг/м2 поверхности тела каждые 2-6 недель (Ogilvie et al, 1989). Лечение продолжали до наступления полной ремиссии или появления тяжелых побочных эффектов. По данным этого исследования, примерно у 25% собак наблюдалась полная ремиссия или отчетливое уменьшение размеров опухоли. Некоторым животным вводили доксорубицин в сочетании с циклофосфамидом (циклоксан, Bristol-Myers Oncology Division, Syracuse, США) и/или винкристином (онковин, Ely Lilly and Со, США). Такую комбинированную терапию можно попытаться использовать, если один доксорубицин не действует.
Токсичность. Одно из отрицательных свойств доксорубицина заключается в том, что он повышает токсичность наружного облучения. Поэтому такие сочетания применять нельзя. Кроме того, доксорубицин оказывает токсическое воздействие на сердце. К острым побочным эффектам этого вещества относятся также анафилактические реакции, нарушения функции ЖКТ, артериальная гипотония и сердечные аритмии (Susaneck, 1983a,b). При возникновении таких реакций, особенно анафилактических, применяют дифенилгидрамина
гидрохлорид (бенадрил, Parke-Davis, Morris Plains, США). Хронические неблагоприятные реакции на доксорубицин включают потерю веса, анорексию, гипоплазию костного мозга, облысение, атрофию яичек и кардиомиопатию.
Выводы. Лечение неподвижных опухолей щитовидной железы. Четких правил любого специфического лечения опухолей щитовидной железы у собак не существует. Проведено еще слишком мало исследований по применению того или иного вида лечения при разных типах опухолей, чтобы можно было дать надежные рекомендации. При обширных неоперабельных опухолях у человека показано наружное облучение пучком высокой энергии. Его применяют также в случаях прорастания опухоли в соединительную ткань или обширной инфильтрации шейных лимфоузлов (Grigsby, Luk, 1998). Наши данные говорят о том, что наружное облучение занимает важное место в арсенале лечебных воздействий у собак с дифференцированными неоперабельными опухолями щитовидной железы в отсутствие видимых отдаленных метастазов (см. рис. 5.14). Это совпадает с результатами применения наружного облучения у людей с неоперабельными опухолями. Послеоперационное облучение при дифференцированном раке щитовидной железы у человека (в тех случаях, когда полную резекцию осуществить не удавалось) обеспечивало 5-летнюю выживаемость у 78% больных (Tubiana et al, 1985). Таким образом, исходя из наблюдений на людях и нашего опыта, в случаях неполной резекции дифференцированных опухолей щитовидной железы у собак целесообразно использовать послеоперационное наружное облучение оперированного участка. Оно показано также при неоперабельных опухолях, поскольку может привести к уменьшению массы опухоли, что позволит в дальнейшем удалить ее хирургически (см. рис. 5-14).
Лечение: мелкие инвазивные (неподвижные) опухоли без видимых метастазов у собак с эутиреозом или гипотиреозом (рис. 5-14)
Весьма соблазнительно попытаться удалить небольшие опухоли щитовидной железы хирургическим путем, даже если они спаяны с окружающими тканями шеи. Однако удалить их полностью очень трудно. Большинство ветеринарных онкологов и хирургов признают, что операция - далеко не идеальный способ лечения собак с неподвижными опухолями щитовидной железы любых размеров. Поэтому то, что говорилось выше о применении высоковольтного облучения наружным пучком, справедливо и в случаях мелких инвазивных опухолей. Однако после значительного уменьшения объема опухоли и в отсутствие метастазов можно подумать и об операции. При выявлении отдаленных метастазов для продления жизни животного можно использовать химиотерапию в качестве пал
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 251
лиативного средства. Операция при этом показана лишь при наличии признаков сдавления окружающих органов (дисфагии или одышки), но ее эффект в лучшем случае будет паллиативным.
Лечение: неинвазивные (подвижные) опухоли без видимых метастазов у собак с эутиреозом или гипотиреозом (рис. 5-14)
Успех лечения рака щитовидной железы у собак зависит от состояния первичного очага. Как уже отмечалось, одна операция в большинстве случаев не приводит к ликвидации первичной опухоли из-за ее прорастания в окружающие ткани. Однако подвижные опухоли полностью удалять удается. Подвижность опухоли лучше всего определять у анестезированных собак, так как у бодрствующего животного она может казаться спаянной с глубокими структурами шеи (Withrow, MacEwen, 2001). Резекция таких опухолей в отсутствие видимых метастазов не только устраняла первичный очаг, но и снижала частоту появления метастазов, которые были выявлены лишь у 2 из 20 собак (Klein et al, 1995). Это показывает, что ликвидация первичного очага снижает вероятность появления метастазов. Наши данные подтверждают такое заключение. Таким образом, если результаты тщательного обследования (см. следующий раздел) свидетельствуют о возможности оперативного лечения, то значительное продление жизни животного становится вполне достижимой целью.
Отбор животных для операции. Вначале необходимо провести тщательное обследование животных. Подвижные опухоли должны при пальпации легко смещаться относительно соседних структур, и в этом следует убедиться на наркотизированной собаке. Для дальнейшей характеристики опухоли лучше всего использовать УЗИ шеи и сканирование щитовидной железы с радиоактивным пертехнетатом. УЗИ позволяет выяснить «глубину» распространения опухоли и проверить, действительно ли она не прорастает в соседние ткани. Кроме того, с помощью УЗИ можно оценить степень васкуляризации опухоли. Убедившись в подвижности опухоли, наличии капсулы и не слишком большом количестве сосудов в ней, следует затем провести сканирование щитовидной железы. При равномерном поглощении пертехнетата, четких границах изображения и вероятной сохранности капсулы железы можно рекомендовать операцию. В случае же обилия сосудов, отсутствия капсулы или нечетких границ опухоли и «пятнистом» распределении изотопа в ней операция не рекомендуется. В этих случаях используют способы лечения, которые применяются при неподвижных опухолях.
Операция. Инкапсулированные подвижные опухоли щитовидной железы удалять легко, и операция, даже без дополнительных воздействий, может надолго продлить жизнь собакам. Выбор именно хирургического лечения зависит от подвижности
опухоли и отсутствия метастазов. Возраст и порода собак в этом отношении играют меньшую роль. Не имеет значения и тип опухоли, поскольку ее гистологическое строение практически не влияет на срок жизни после операции (Klein et al, 1995). При крупной опухоли часто приходится делать разрез непосредственно над ней, чтобы облегчить доступ к удаляемой ткани (см. рис. 5-3). Верхнюю щитовидную артерию необходимо перевязать у места ее отхождения от сонной артерии. Рекомендуется также перевязывать нижнюю щитовидную артерию и вену.
Прорастание опухоли в соседние ткани, как правило, препятствует ее полному удалению. Это наблюдается даже при таких опухолях, которые кажутся окруженными капсулой и подвижными. Инвазия в сосуды затрудняет остановку кровотечения и также препятствует полному удалению опухоли. У собаки с местными нарушениями свертывания крови после операции могут развиться системные коагулопатии. Владельцы животных должны быть предупреждены о возможности осложнений операции. Тем не менее, даже неполное удаление опухоли в ряде случаев значительно облегчает состояние животных. Ради полноты резекции опухоли можно решиться на одностороннее удаление яремной вены, сонной артерии и вагосимпатического ствола (с развитием одностороннего синдрома Горнера). Двусторонняя резекция может приводить к параличу гортани и/или увеличению размеров пищевода.
Настойчивое стремление к полному удалению инвазивной опухоли, особенно двусторонней, чревато повреждением возвратных гортанных нервов, паращитовидных желез и нормальной тиреоидной ткани. Если все эти структуры смещены, то их трудно распознать и сохранить. Уменьшение массы опухоли приносит пользу, но героические попытки удалить всю злокачественную ткань сопряжены со значительными трудностями и могут быть крайне опасными. Даже при тщательном соблюдении критериев отбора животных для удаления подвижной опухоли щитовидной железы иногда приходилось производить трахеостомию, что указывает на возможный инвазивный характер таких опухолей или, по меньшей мере, их тесное сращение с трахеей или обоими возвратными гортанными нервами. Это подчеркивает крайнюю важность соблюдения критериев отбора животных для хирургического лечения (см. рис. 5-14).
Послеоперационное наблюдение. Кальций и тиреоидные гормоны. До и после операции необходимо определить концентрацию кальция в сыворотке крови, чтобы оценить сохранность паращитовидных желез. Гипопаратиреоз после резекций щитовидной железы развивается не часто (менее чем в 10% случаев), но возможность его развития исключить невозможно. После обширной двусторонней операции уровень кальция следует определять, по меньшей мере, раз в день в течение 5-7 дней. При любых признаках гипопаратиреоза (гипокальциемии) применяют витамин D и каль
252 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
ций (см. гл. 17). В нашей практике у собак с опухолями щитовидной железы после повреждения паращитовидных желез во время операции редко наблюдались случаи спонтанного восстановления их функции. Пытаясь удалить крупную инвазивную опухоль щитовидной железы, хирург должен тщательно взвесить все «за» и «против» чрезмерного радикализма. Через 1-5 недель после операции проверяют концентрацию Т4 в сыворотке, и в зависимости от клинического состояния животного начинают заместительную гормональную терапию.
Гистология. Для выработки плана последующего лечения совершенно необходимо исследовать гистологическое строение удаленной ткани (см. рис. 5-14). Если патоморфолог убежден в доброкачественности опухоли и полноте ее удаления, шансы на полное излечение собаки весьма велики. Для полной уверенности в таких случаях через 6 и 12 месяцев следовало бы повторить сканирование и УЗИ шеи. Если же морфолог делает заключение о злокачественном характере опухоли, то даже при ее иссечении в пределах здоровых тканей необходимо периодически (2-4 раза в год) проводить физикальное обследование, рентгенографию грудной клетки, УЗИ шеи и живота и сканирование щитовидной железы. В случаях злокачественной опухоли с «грязными» краями (т.е. неполной ее резекции и возможном сохранении опухолевых клеток в операционном поле) требуются более активные меры. В такой ситуации мы рекомендует наружное облучение всего ложа опухоли с последующей химиотерапией и периодическим обследованием животного, включая рентгенографию грудной клетки, УЗИ шеи и живота и сканирование щитовидной железы.
Лечение: Злокачественные опухоли щитовидной железы с метастазами у собак с эутиреозом или гипотиреозом (рис. 5-15)
Метастазы, часто присутствующие уже в момент диагноза, считаются основной причиной гибели собак с такими опухолями. Разные авторы приводят различные данные о проценте животных, у которых отдаленные метастазы обнаруживаются при первичном обследовании (Harari et al, 1986; Miles et al, 1990). Выявив метастазы, мы все же рекомендуем некоторым владельцам собак согласиться на паллиативное лечение их питомцев. Важно, чтобы владельцы собак понимали значение паллиативной терапии, которая направлена только на устранение боли и облегчение состояния животного. На излечение в таких случаях рассчитывать не приходится.
Обнаружив метастазы, ветеринар должен выяснить причины, заставившие владельца животного обратиться за помощью. Если у собаки имеются клинические проявления, связанные с самой опухолью (одышка, дисфагия, кашель и т.п.), то лечение должно быть направлено на уменьшение массы опухоли. Для этого можно использовать любой из трех существующих методов: 1) частичную тире
оидэктомию, 2) наружное облучение или 3) химиотерапию. Возможно и сочетание перечисленных методов. В любом случае шансы на излечение крайне малы. Следует повторить, что задача любого из этих подходов или их сочетания заключается лишь в облегчении состояния животного. Если собака остается в удовлетворительном состоянии, то чаще всего прибегают к химиотерапии. Обычно применяют доксорубицин, но можно использовать также цисплатин и другие химиотерапевтические препараты.
Прогноз у собак с опухолями щитовидной железы, находящихся в состоянии эутиреоза или гипотиреоза
Гистоморфологическая стадия. Отдаленные метастазы при первом обследовании выявляются у 30-60% и более собак с раком щитовидной железы (Jeglum, Whereat, 1983; Harari et al, 1986). Единственно значимым прогностическим фактором у оперированных животных является гистоморфологическая стадия опухоли (оцениваемая по наличию капсулы, инвазии в сосуды, степени полиморфизма клеточных ядер и частоте митозов) (Verschueren et al, 1992b). Гистологическая классификация опухоли, порода собаки, пол, возраст и концентрация тиреоидных гормонов и тиреоглобулина в сыворотке имеют гораздо меньшее прогностическое значение (Klein et al, 1988; Verschueren et al, 1992b). Определенную роль играет клиническая стадия рака щитовидной железы (см. табл. 5-3), но ветеринары редко учитывают что-либо иное, кроме наличия метастазов.
Размеры опухоли. По данным одного из исследований, при объеме злокачественной опухоли меньше 23 см3 метастазы при аутопсии обнаруживаются только у 14% собак; при объеме опухоли от 23 до 100 см3 - у 74% и при объеме более 100 см3 - у всех 100% животных (Leav et al, 1976). Таким образом, чем меньше объем опухоли, тем лучше прогноз, и при опухолях небольших или средних размеров оправданы радикальные подходы к лечению. Объем опухолей, обнаруженных при операции 47 собак, в среднем превышал 80 см3. Небольшие злокачественные опухоли щитовидной железы, по-видимому, редко обнаруживаются при клиническом обследовании. Однако, как отмечалось выше, широкое использование УЗИ шеи должно обеспечить более раннюю диагностику опухолей. На многие вопросы, касающиеся прогноза для собак, леченных различными способами, можно будет ответить лишь после проведения длительных проспективных исследований.
Доброкачественные и злокачественные опухоли. Хирургическое удаление аденом щитовидной железы с большой вероятностью обеспечивает излечение животных. К сожалению, такие опухоли в ветеринарной практике встречаются, а тем более распознаются при жизни, редко (Lawrence et aL, 1991). В большинстве случаев речь идет о крупных функци-
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 253
Рис. 5-15. Алгоритм лечения опухоли щитовидной железы при наличии метастазов у собак с эутиреозом или гипотиреозом.
онально неактивных и злокачественных опухолях. Однако и в таких случаях УЗИ шеи позволяет поставить диагноз до того, как опухоль приобретет огромные размеры и начнет метастазировать. В целом, прогноз для собак с функционально неактивными опухолями щитовидной железы сомнительный или неблагоприятный. Это связано со следующими факторами: инвазивным характером таких опухолей, их частым метастазированием, возрастом животного в момент диагностики, высокой стоимостью операции, химиотерапии или облучения, побочными эффектами всех этих воздействий и отсутствием статистики случаев излечения. Значение типа опухоли для прогноза неизвестно. На небольшом материале не удалось найти разницы в продолжительности жизни у собак с опухолями компактного и смешанного строения (Harari et al, 1986).
Злокачественные опухоли щитовидной железы после операции часто рецидивируют. Рецидивы в оперированной или противоположной доле обнаруживались в интервале от 1 до 54 месяцев после первой операции. У нескольких собак рецидив опухоли появлялся через 6-24 месяца и после повторной операции. Хотя эти данные не внушают оптимизма, они все же свидетельствуют о том, что многие соба
ки могут прожить дольше 2 лет после соответствующего первичного диагноза.
ФУНКЦИОНАЛЬНО АКТИВНЫЕ ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ (ТИРЕОТОКСИКОЗ, ГИПЕРТИРЕОЗ)
Введение
Большинство собак с опухолями щитовидной железы находятся в эутиреоидном или гипотиреоидном состоянии, и лишь примерно у 10% из них обнаруживается гипертиреоз (см. рис. 5-14) (Rijnberk, 1996; Verschueren, 1992). Опухоли в таких случаях почти всегда злокачественные. Хотя у собак встречаются и функционально активные аденомы щитовидной железы, частота доброкачественных опухолей, сопровождающихся гипертиреозом, довольно низка (Lawrence et al, 1991; Marks et al, 1994). Поэтому, пока не будет доказано обратное, любую опухоль щитовидной железы у собаки с гипертиреозом следует считать злокачественной. В отличие от этого, у кошек на долю злокачественных опухолей, сопровождающихся гипертиреозом, приходится менее 5%. Автономно функционирующая опухоль
254 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
щитовидной железы - единственная причина развития гипертиреоза у собак. Заболевания, подобные аутоиммунному тиреоидиту или диффузному токсическому зобу у человека, у собак не встречаются. При диффузном токсическом зобе секреция тиреоидных гормонов стимулируется антителами, взаимодействующими с рецепторами ТТГ на мембране фолликулярных клеток щитовидной железы. В результате происходит диффузная гиперплазия обеих долей железы и развивается зоб.
При гипертиреозе у собак в щитовидной железе обнаруживают не диффузную гиперплазию, а очаги неоплазии с атрофией окружающей тиреоидной ткани. Если бы причиной гипертиреоза была избыточная секреция ТТГ или стимуляция его рецепторов антителами, то следовало бы ожидать диффузную гиперплазию ткани щитовидной железы. Кроме того, при функционирующих опухолях «здоровая» ткань не накапливает йод и поэтому не выявляется при изотопном сканировании. Однако введение ТТГ в течение нескольких дней восстанавливает активность нераковых клеток и позволяет увидеть нормальную ткань при последующем сканировании. По логике вещей, при этом заболевании стадия нормальной функции щитовидной железы должна сменяться стадией, когда тиреоидные гормоны секретируются и нормальными, и опухолевыми клетками (компенсированная стадия опухоли), а затем (по мере угнетения секреции ТТГ по механизму отрицательной обратной связи) - только раковыми клетками (декомпесированная стадия).
Клинические признаки
Клинические признаки гипертиреоза у собак сходны с таковыми у кошек. Они включают потерю веса, полидипсию, полиурию, полифагию, рвоту, обильный мягкий стул, повышенную активность или нервозность, слабость, ухудшение качества шерсти, непереносимость тепла, одышку и дрожь. Однако у кошек все эти признаки появляются на фоне гораздо меньшего увеличения щитовидной железы, чем у собак. Хозяева заболевших кошек лишь очень редко замечают зоб у своих питомцев, тогда как при гипертиреозе у собак их владельцы обычно сообщают ветеринару о «припухлости» на шее животного. В ряде случаев именно опухоль на шее собаки служат поводом для обращения к ветеринару. Иногда таким поводом являются признаки сдавления окружающих тканей: нарушения дыхания (кашель, одышка, респираторный дистресс-синдром) или глотания. У некоторых собак заболевание развивается очень медленно, и эти признаки могут проявиться через много дней или месяцев, а иногда и лет (подробнее см. гл. 4).
Физикальное исследование
Данные физикального исследования собак с гипертиреозом, также не отличаются от таковых у боль
ных кошек. Собаки выглядят худыми, а иногда и истощенными (см. рис. 5-4). Обычно наблюдается атрофия мышц и можно предполагать обезвоживание, хотя снижение тургора кожи, скорее всего, связано с резким похуданием и уменьшением слоя подкожного жира. В типичных случаях имеется тахикардия с экстрасистолами или без них. Одышка у собак может возникать без видимой причины, а беспокойство животного часто затрудняет его обследование. Одышка, респираторный дистресс-синдром и затрудненное глотание могут быть следствием сдавления трахеи и/или пищевода опухолью, но бывают и проявлениями тиреотоксикоза. Нередко у собаки отмечается и слабость.
Тщательная пальпация шеи обычно позволяет обнаружить опухоль щитовидной железы. Нормальная щитовидная железа не пальпируется. Функционирующие опухоли, как правило, меньше по объему и менее очевидны для хозяина и ветеринарного врача, чем нефункционирующие. В первом случае их диаметр обычно остается в пределах 2-5 см, и при тщательной пальпации они кажутся подвижными (Verschueren, 1992). Судя по нашему опыту, пальпаторно отличить функционирующую опухоль от нефункционирующей невозможно. На наличие гипертиреоза скорее указывает общий вид собаки вкупе с наблюдениями хозяина. Диагноз подтверждают результатами определения концентрации тиреоидных гормонов в сыворотке крови.
Обследование в клинике
При пальпируемой опухоли на шее собаки, особенно если ее хозяин сообщает и о других признаках (потере веса, рвоте), показано полное клиническое обследование. Изменения лабораторных показателей у собак с гипертиреозом те же, что и у кошек. Повышение уровня Т4 в сыворотке подтверждает диагноз гипертиреоза, причиной которого следует считать функционирующий рак щитовидной железы. Окончательное подтверждение диагноза можно получить с помощью тонкоигольной аспирационной биопсии и цитологического анализа или гистологического исследования ткани опухоли, удаленной под контролем УЗИ или при операции. При любой опухоли щитовидной железы следует производить рентгенографию грудной клетки и (желательно) брюшной полости. Обязательно проводят УЗИ шеи и, если возможно, области живота. Такие исследования помогают обнаружить метастазы и оценить объем самой опухоли. По размерам опухоли можно в определенной мере судить о степени ее злокачественности. Опухоли объемом 23 - 100 см3 оказывались злокачественными в 74% случаев, а объемом более 100 см3 - в 100% случаев. Кроме того, УЗИ позволяет выявить прорастание опухоли в окружающие ткани и ее обильное кровоснабжение. Каждый из этих признаков повышает вероятность злокачественного характера опухоли и уменьшает надежды на возможность излечения животного хирургическим путем.
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
255
Стратегия лечения (рис. 5-16)
Процесс принятия решения. После выявления у собаки опухоли щитовидной железы и гипертиреоза необходимо провести ряд дополнительных исследований и, в частности, проверить наличие метастазов, которые обычно локализуются в легких и местных лимфоузлах, но могут присутствовать также в брюшной полости и костях (Bentley et al, 1990). Для этого лучше всего использовать рентгенографию грудной клетки и УЗИ шеи, с последующим УЗИ области живота. Метастазы в брюшной полости этим методом выявляются лучше, чем с помощью рентгенографии. Как уже отмечалось, УЗИ позволяет оценить не только размеры опухоли, но и ее инвазивность и степень кровоснабжения. Мы редко используем КТ или МРТ, но обычно проводим сканирование щитовидной железы с радиоактивным пертехнетатом с целью выяснения характера накопления изотопа (равномерное или «пятнистое»), четкости изображения краев опухоли, наличия капсулы и метастазов.
Отсутствие метастазов и подвижность опухоли. Равномерное накопление изотопа, четкие края и сохранность капсулы. Это наиболее благоприятная ситуация. Собака с подвижной опухолью и равномерным накоплением пертехнетата в ней - идеальный кандидат на хирургическое лечение. К операции в таких случаях прибегают потому, что любая опухоль может быть злокачественной, а подвижную опухоль легко удалить полностью. Описанная картина характерна и для аденомы щитовидной железы, сопровождающейся гипертиреозом, но доброкачественные аденомы встречаются редко (Lawrence et al, 1991). Поэтому во всех таких случаях рекомендуется операция. После тиреоидэктомии первоочередное значение приобретает гистологический анализ удаленной ткани. Если опухоль удалена полностью и она оказалась аденомой, то излечение практически гарантировано. После операции целесообразно периодически (каждые 6 месяцев?) проводить повторные обследования, тщательно выясняя состояние собаки, определяя концентрацию Т4 в сыворотке, проводя УЗИ шеи и
Рис. 5-16. Алгоритм лечения собак с гипертиреозом при наличии опухоли щитовидной железы
256 • ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
(по возможности) радиоизотопное сканирование. Отсутствие патологии при каждом обследовании позволяет увеличивать интервалы между посещениями ветеринарного врача.
Применение антитиреоидных средств в качестве основного способа лечения не рекомендуется, поскольку эти препараты не обладают цитотоксичностью. Однако в неоперабельных случаях или при рецидивах опухоли после операции, радиойодтерапии или химиотерапии мы все же применяем антитиреоидные средства для устранения симптомов гипертиреоза. При этом мы используем тот же подход, что и при гипертиреозе у кошек, т.е. введение 2,5 мг тиамазола дважды в сутки с постепенным увеличением дозы для купирования клинических признаков и поддержания концентрации Т4 в сыворотке на уровне 1-2 мкг%.
Другая возможная ситуация - рак щитовидной железы, удаленный с «чистыми» краями, т.е. гистолог не находит злокачественных клеток по краям удаленной опухоли. Последующие лечебные мероприятия в таких случаях не всегда ясны. Поскольку после операции не исключено появление метастазов, минимум, что необходимо, это повторные обследования животного с использованием тех же методов, как после удалении функционирующей аденомы. Однако при повторных обследованиях следовало бы проводить также рентгенографию грудной клетки и УЗИ брюшной полости, чтобы по возможности раньше обнаружить метастазы. Некоторые авторы рекомендуют в этих случаях облучать область шеи пучком высокой энергии. Облучение нужно начинать сразу же после заживления операционной раны.
Еще один вариант - когда после операции гистолог обнаруживает рак с «грязными» краями, т.е. когда наиболее вероятно сохранение злокачественных клеток в операционном поле. Это не означает, что хирург плохо справился со своим делом. Скорее всего, в таких случаях инвазивная опухоль имела множество отростков, которые невозможно отличить от нормальной ткани даже самому опытному хирургу. В этой ситуации можно попытаться разрушить всю оставшуюся тиреоидную ткань радиоактивным йодом (если она поглощает 1311), применить наружное облучение пучком высокой энергии или использовать химиотерапию.
Отсутствие метастазов и спаянность опухоли с тканями шеи. «Пятнистое» поглощение изотопа опухолью с нечеткими краями и отсутствием видимой капсулы. Понятно, что этот вариант достаточно плох. Такие опухоли обычно прорастают в окружающие ткани и практически не поддаются полному удалению. Поэтому операция в этих случаях - далеко не идеальный способ лечения. Прежде всего, при наличии гипертиреоза следует проверить способность опухоли поглощать и накапливать 1311. Если это происходит, то рекомендуется радиойодтерапия. Другие возможности включают частичную тиреоидэктомию (обычно
не рекомендуется), наружное облучение шеи и химиотерапию. Использование радиоактивного йода предполагает необходимость повторных исследований с определением концентраций Т4 в сыворотке крови и сканированием щитовидной железы (с пертехнетатом). Эти исследования должны ответить на два вопроса: устранен ли гипертиреоз и предотвращено ли прогрессирование рака.
Применение радиоактивного йода (1311) при опухолях щитовидной железы у человека и собак основано на предположении о способности раковых клеток поглощать этот изотоп из крови, накапливать и задерживать его. Внутреннее облучение должно убивать злокачественные клетки. Хотя раковые клетки поглощают йод хуже, чем нормальные, они более чувствительны к разрушающему действию радиации. У человека именно радиойодтерапия - наиболее эффективный способ уничтожения раковых клеток, сохранившихся после субтотальной или тотальной тиреоидэктомии.
Радиойодтерпию проводят разными способами. Можно часто вводить малые дозы 1311 или с меньшей частотой - более высокие дозы (Beierwaltes et al, 1982; Gershengom, Robbins, 1987). Этот метод лечения наиболее эффективен у собак с функционально активными опухолями щитовидной железы. Как отмечалось выше, клетки фолликулярного рака часто сохраняют способность накапливать йод даже в отсутствие гипертиреоза. В ветеринарной литературе отсутствует детальная оценка этой формы терапии. Однако все более широкое использование радиоизотопного сканирования должно привести и к более частому применению радиойодтерапии при опухолях, накапливающих пертехнетат и йод (Peterson et al, 1989; Verschueren, 1992). Следует еще раз подчеркнуть необходимость предварительных кинетических исследований с 1311, поскольку большинство опухолей щитовидной железы у собак плохо поглощают, накапливают и удерживают йод, что ограничивает возможности радиойодтерапии.
В тех случаях, когда кинетические исследования с 1311 позволяют предвидеть неэффективность радиойодтерапии, следует использовать паллиативные средства. Можно подумать также о наружном облучении или химиотерапии. При этом нельзя забывать, что доксорубицин увеличивает токсичность облучения. Поэтому химиотерапию проводят лишь после завершения курса лучевой терапии. Операция показана только для устранения симптомов сдавления органов шеи (при затрудненном дыхании или глотании). Прогноз в таких случаях неблагоприятный. В зависимости от состояния собаки ее хозяин сам должен решать, нужно ли использовать агрессивные методы лечения или подумать об эвтаназии.
Наличие метастазов (рис. 5-15). Как и следовало бы ожидать, наличие метастазов сопряжено с крайне неблагоприятным прогнозом. Операция в таких случаях показана только для устранения симптомов местного давления опухоли на трахею или
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК • 257
пищевод. Лучшее, что можно сделать в этой ситуации, это проверить, способна ли опухолевая ткань (как первичный очаг, так и метастазы) поглощать и удерживать 1311. Если предварительные кинетические исследования свидетельствуют о сохранении такой способности, то следует попытаться провести радиойодтерапию. Можно подумать и о химиотерапии, хотя шансы на продление жизни животного с помощью медикаментозных средств хуже, чем при радиойодтерапии (если, конечно, опухоль и ее метастазы поглощают изотоп).
Прогноз
Прогноз при функционально активных опухолях щитовидной железы не лучше и не хуже, чем в тех случаях, когда собаки находятся в эутиреоидном или гипотиреоидном состоянии. Поскольку речь почти всегда идет о злокачественной опухоли, прогноз может быть самым мрачным. Однако агрессивная комбинированная терапия позволяет рассчитывать на лучший прогноз, чем в случаях нефункционирующих опухолей. Этот оптимизм базируется на способности функционально активных опухолей поглощать и накапливать йод, что увеличивает вероятность положительного эффекта радиойодтерапии. Кроме того, как уже неоднократно подчеркивалось, широкое использование УЗИ шеи при диагностическом обследовании собак с нарушениями дыхания или глотания, гиперкальциемией и т.д. позволяет диагностировать опухоли щитовидной железы на более ранних стадиях. Лабораторные исследования при явном или субклиническом гипертиреозе также могут обеспечить более раннее выявление опухоли. Некоторые из таких опухолей могут представлять собой еще доброкачественные аденомы. Таким образом, независимо от функциональной активности опухолей щитовидной железы у собак можно ожидать улучшения долговременного прогноза.
МЕДУЛЛЯРНЫЙ РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ (С-КЛЕТОЧНАЯ ОПУХОЛЬ, ПАРАФОЛЛИКУЛЛЯРНЫЙ РАК, ПЕРВИЧНАЯ ГИПЕРКАЛЬЦИТОНИНЕМИЯ)
Медуллярный рак развивается из парафолликулярных, или С-клеток щитовидной железы. У человека на долю этого рака приходится от 4 до 12% случаев всех видов рака щитовидной железы. Такие опухоли, как правило, инкапсулированы и состоят из компактной массы круглых, многогранных или удлиненных клеток, растущих в гиалиновой строме, которая содержит амилоид (Gershengom, Robbins, 1987). Частота С-клеточного рака щитовидной железы у собак неизвестна. Одни авторы обнаружили его у 7 из 200 собак с опухолями щитовидной железы, а другие у двух из 141 животного. Однако результаты недавнего исследования говорят о том, что в прошлом этот вид рака мог оставаться нераспоз
нанным (Carver et al, 1995). Мы диагностировали парафолликуллярный рак или аденому у 12 из 75 собак с опухолями щитовидной железы (см. табл. 5-2). В настоящее время известно, что с помощью только световой микроскопии трудно отличить медуллярный рак от других видов рака щитовидной железы. Применение специфических иммуноцитохимических красителей позволяет выявлять этот вид рака гораздо чаще. Такие опухоли могут иметь более благоприятный прогноз, поскольку они реже метастазируют. Кроме того, они окружены капсулой и легче поддаются полному удалению при операции (Carver et al, 1995).
Клинические синдромы, связанные с нарушением секреции кальцитонина, в ветеринарной практике распознаются редко. Медуллярный рак - единственная известная причина хронической гиперсекреции этого гормона. Кальцитонин открыт в 1961 г Коппом, который сделал вывод о его существовании на основании опытов на собаках. Однако медуллярный рак у человека был известен с 1951 г. В 1959 г. было выяснено его гистологическое строение, и с этого времени в медицинской литературе описаны сотни случаев медуллярного рака щитовидной железы.
Известно, по крайней мере, пять синдромов с медуллярной опухолью: 1) спорадический несемейный медуллярный рак, 2) семейный изолированный медуллярный рак, 3) семейный медуллярный рак в сочетании с феохромоцитомой, 4) семейный медуллярный рак в сочетании с феохромоцитомой и гиперпаратиреозом (МЭН типа Па и ПЬ) и 5) МЭН с множественными невромами слизистых (Gershengom, Robbins, 1987).
Кальцитонин действует преимущественно на кости, замедляя процессы как резорбции, так и костеобразования. При хронической гиперсекреции этого гормона преобладает последний эффект. Кальцитонин должен резко снижать концентрацию кальция в сыворотке крови, но у людей и собак с медуллярным раком щитовидной железы концентрация кальция остается нормальной или лишь слегка уменьшается. Таким образом, в условиях замедления процессов ремоделирования костной ткани минеральный обмен может и не меняться. Среди немногих собак с медуллярным раком щитовидной железы значительная гипокальциемия наблюдалась только у одной.
Наиболее ярким клиническим проявлением медуллярного рака у собак может быть понос (Rijnberk, 1996). Считается, что диарея является результатом секреции серотонина и/или простагландинов опухолью. Иногда поводом обращения к ветеринару служит гипокальциемическая тетания. В одном случае владелец просто заметил опухоль на шее своей собаки (Patnaik et al, 1978). Основные выводы, которые можно сделать из изложенного, сводятся к тому, что (а) при любом обследовании собаки необходимо тщательно пальпировать шею и (б) медуллярный рак - редкая причина гипокаль
258
ОПУХОЛИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
циемии у собак. При медуллярном раке применяют те же методы лечения, что и при других опухолях щитовидной железы.
ОПУХОЛИ ЭКТОПИЧЕСКОЙ ТИРЕОИДНОЙ ТКАНИ
Тиреоидная ткань у здоровых собак может располагаться вне долей щитовидной железы. Ее находили и в корне языка, и в основании сердца. Неудивительно, что опухоли могут развиваться и из этих эктопических очагов тиреоидной ткани, в том числе в перикардиальной сумке или сразу над сердцем. Мы наблюдали случай рака (функционально неактивного), исходящего из корня языка при нормальных долях щитовидной железы в области шеи. Опухоль в ротовой полости мешает животным есть и пить, а опухоль в основании сердца, сдавливая трахею, нарушает дыхание и может вызывать кровоизлияния в плевральную полость или перикард.
ЛИТЕРАТУРА
Adams WH, et al: Treatment of differentiated thyroid carcinoma in seven dogs utilizing 13,l. Vet Radiol 36:417, 1995.
Ahuja S, Ernst H: Chemotherapy of thyroid cancer. J Endocrinol Invest 10:303, 1987.
Balogh L, et al: Thyroid volumetric measurement and quantitative thyroid scintigraphy in dogs. Acta Veterinaria Hungarica 46:145, 1998.
Beierwaltes WH, et al: Survival time and “cure" in papillary and follicular thyroid carcinoma with distant metastases: Statistics following University of Michigan therapy. J Nucl Med 23:561, 1982.
Belsha’w BE: Thyroid diseases. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1983, p 1592.
Bentley JF, et al: Metastatic thyroid solid-follicular carcinoma in the cervical portion of the spine of a dog. JAVMA 197:1498, 1990.
Birchard SJ, Roesel OF: Neoplasia of the thyroid gland in the dog: A retrospective study of 16 cases. JAAHA 17:369, 1981.
Bos J: Ras-oncogenes in human neoplasms. Cancer Res 49:4682, 1989.
Brearley MJ, Hayes AM: Hypofractionated radiation therapy for invasive thyroid carcinoma in dogs: A retrospective analysis of survival. J Sm Anim Pract 40:206, 1999.
Brodey RS, Kelly DF: Thyroid neoplasms in the dog. A clinicopathologic study of 57 cases. Cancer 22:406, 1968.
Capen CC: The endocrine glands. In Jubb KVF, et al (eds): Pathology of Domestic Animals, 3rd ed. Orlando, FL, Academic Press, vol 3, p 237, 1985.
Carver JR, et al: A comparison of medullary thyroid carcinoma and thyroid adenocarcinoma in dogs: A retrospective study of 38 cases. Vet Surg 24:315, 1995.
Conard RA: Late effects in Marshall Islanders exposed to fallout 28 years ago. In Boice JD, Fraumeni JE (eds): Radiation Carcinogenesis: Epidemiology and Biological Significance. New York, Raven Press, 1984, p 54.
Darbre PD, King RJB: Progression to steroid insensitivity can occur irrespective of the presence of functional steroid receptors. Cell 51:521, 1987.
Fineman LS, et al: Cisplatin chemotherapy for treatment of thyroid carcinoma in dogs: 13 cases. JAm Vet Med Assoc 34:109, 1998.
Flanders J A. Surgical therapy of the thyroid. Vet Clin North Am: Sm Anim Pract 24:607, 1994.
Gershengorn MC, Robbins J: Thyroid neoplasia. In Green WL (ed): The Thyroid. New York, Elsevier, 1987, p 293.
Greenspan FS: The thyroid gland. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology. 6th ed. San Francisco, Lange Medical Books/ McGraw-Hill, 2001, p201.
Grigsby PW, Luk KH: Thyroid. In Perez C A, Brady LW, (eds): Principles and practice of radiation oncology. 3rd ed. Philadelphia: Lippincott-Raven, 1998,p1157.
Haley PJ, et al: Thyroid neoplasms in a colony of Beagle Dogs. Vet Pathol 26:438, 1989.
Hanna NN, et al: Advances in the pathogenesis and treatment of thyroid cancer. CurrOpin Oncol 11:42, 1999.
Harari J, et al: Clinical and pathologic features of thyroid tumors in 26 dogs. JAVMA 188:1160, 1986.
Harmelin A, et al: Canine medullary thyroid carcinoma with unusual distant metastases. J Vet Diagn Invest 5:284, 1993.
Hedinger C, et al: Histological typing of thyroid tumors. WHO International Histologic Classification of Tumours, 2nd ed. Berlin, Springer-Verlag, 1988.
Holscher MA, et al: Ectopic thyroid tumour in a dog: Thyroglobulin, calcitonin, and neuron-specific enolase immunocytochemical studies. Vet Pathol 23:778, 1986.
Hoskin PJ, Harmer C: Chemotherapy for thyroid cancer. Radiother Oncol 10:187, 1987.
Jeglum KA, Whereat A: Chemotherapy of canine thyroid carcinoma. Compend Contin Educ Pract Vet 5:96, 1983.
Kim JH, Leeper RD: Treatment of locally advanced thyroid carcinoma with combination doxorubicin and radiation therapy. Cancer 60:2372, 1987.
Klein MK, et al: Canine thyroid carcinomas: A retrospective review of 64 cases. Vet Cancer Soc Newsletter 12:7, 1988.
Klein MK, et al: Treatment of thyroid carcinoma in dogs by surgical resection alone: 20 cases (1981-1989). JAVMA206:1007, 1995.
Komminoth P: The RET proto-oncogene in medullary and papillary thyroid carcinoma, molecular features, pathophysiology and clinical implications. Virchows Arch 431:1, 1997.
Konig MP, et al: Thyroid cancer in regions of endemic goitre. In Andreoli M, et al (eds): Advances in Thyroid Neoplasia. Rome, Field Education Italia, 1981, p177.
Kramer RW, et al: Hypothyroidism in a dog after surgery and radiation therapy for a functional thyroid adenocarcinoma. Vet Radiol Ultrasound 35:132, 1994.
Lawrence D, et al: Hyperthyroidism associated with a thyroid adenoma in a dog. JAVMA 199:81, 1991.
Leav I, et al: Adenomas and carcinomas of the canine and feline thyroid. Am J Pathol 83:61, 1976.
Leblanc B, et al: Immunocytochemistry of thyroid C-cell complexes in dogs. Vet Pathol 27:445, 1990.
Leblanc B, et al: Immunocytochemistry of canine thyroid tumours. Vet Pathol 28:370, 1991.
Lemoine NR, et al: Partial transformation of human thyroid epithelial cells by mutant Ha-ras oncogene. Oncogene 5:1833, 1990.
Ljungberg O, et al: A compound follicular-parafollicular cell carcinoma of the thyroid: Anew tumour entity? Cancer 52:1053, 1983.
Ljungberg O, Nilsson PO: Hyperplastic and neoplastic changes in ultimobran-chial remnants and in parafollicular (C) cells in bulls: A histologic and immunohistochemical study. Vet Pathol 22:95, 1985.
Loar AS: Canine thyroid tumors. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders Co, 1986, p 1033.
Lurye JC, Behrend E: Endocrine tumors. Vet Clin N Amer: Sm Anim Pract 31:1095,2001.
Marks SL, et al: “mTc-pertechnetate imaging of thyroid tumors in dogs: 29 cases (1980-1992). JAVMA 204:756, 1994.
Miles KG, et al: A retrospective evaluation of the radiographic evidence of pulmonary metastatic disease on initial presentation in the dog. Vet Radiol 31:79, 1990.
Mitchell M, et al: Canine thyroid carcinomas: clinical occurrence, staging by means of scintiscans, and therapy of 15 cases. Vet Surg 8:112, 1979.
Mooney CT: Canine thyroid tumours and hyperthyroidism. In Torrence AG, Mooney CT (eds): BSAVA Manual of Small Animal Endocrinology, 2nd ed. United Kingdom, British Small Animal Veterinary Association, 1998.
Moore FM, et al: Thyroglobulin and calcitonin immunoreactivity in canine thyroid carcinomas. Vet Pathol 21:168, 1984.
Nishiyama K, et al: A prospective analysis of subacute thyroid dysfunction after neck irradiation. Int J Radiat Oncol Biol Phys 34:439, 1996.
Ogilvie GK, et al: Phase II evaluation of doxorubicin for treatment of various canine neoplasms. JAVMA 195:1580, 1989.
Ogilvie GK, et al: Toxicoses associated with administration of mitoxantrone to dogs with malignant tumors. JAVMA 198:1613, 1991.
Ogilvie GK: Tumors of the endocrine system. In Withrow SJ, MacEwen E (eds): Small Animal Clinical Oncology, 2nd ed. Philadelphia, WB Saunders Co, 1996, pp316.
Owen LN: Clinical stages (TNM) of canine tumours of the thyroid gland. In Owen LN (ed): TNM Classification of Tumours in Domestic Animals. Geneva, World Health Organization, 1980.
Pack LA, et al: Definitive radiation therapy for infiltrative thyroid carcinoma in dogs. Vet Radiol Ultrasound 42:471, 2001.
Parsons JT, et al: Carcinoma of the thyroid. In Million RR (ed): Management of head and neck cancer: A multidisciplinary approach. 2nd edition. Philadelphia: JB Lippincott Co, 1994, pp 785.
Patnaik AK, et al: Canine medullary carcinoma of the thyroid. Vet Pathol 15:590, 1978.
Patnaik AK, Lieberman PH: Gross, histologic, cytochemical, and immunocytochemical study of medullary thyroid carcinoma in sixteen dogs. Vet Pathol 28:223, 1991.
Peterson ME, et al: Radioactive iodine treatment of a functional thyroid carcinoma producing hyperthyroidism in a dog. J Vet Intern Med 3:20, 1989.
Post GS, Mauldin GN: Radiation and adjuvant chemotherapy for the treatment of thyroid adenocarcinoma in dogs. In Proceedings of the 12th Annual Veterinary Cancer Society Conference, Asilomar, CA, 1992.
Poster DS, et al: Current status of chemotherapy in the treatment of advanced carcinoma of the thyroid gland. Cancer Clin Trials 4:301, 1981.
ОПУХОЛИ ЩИТОВИДНОМ ЖЕЛЕЗЫ И ГИПЕРТИРЕОЗ У СОБАК
259
Priester WA, McKay FW: The occurrence of tumours in domestic animals. National Cancer Institute Monograph 54, NIH Publication No. 80-2046. Bethesda, National Institute of Health, 1980.
Rijnberk A: Thyroids. In Rijnberk A (ed): Clinical Endocrinology of Dogs and Cats. Dordrecht, The Netherlands, Kluwer Academic, 1996, pp 35.
Roger PP, Dumont JE: Epidermal growth factor controls the proliferation and differentiation of canine thyroid cells in primary culture. FEBS Let 144:209, 1982.
Saltiel AR, et al: Thyrotropin receptor-adenylate cyclase function in human thyroid neoplasms. Cancer Res 41:2360, 1981.
Schlumberger M: Papillary and follicular thyroid carcinoma. N Engl J Med 338:297, 1998.
Schneider AB: Radiation-related thyroid cancer. In Ingbar SH, Braverman LE (eds): Werner’s The Thyroid. A Fundamental and Clinical Text, 5th ed. Philadelphia, JB Lippincott, 1986, p 801.
Shimaoka K, et al: A randomized trial of doxorubicin versus doxorubicin plus cisplantinum in patients with advanced thyroid carcinoma. Cancer 56:2155, 1985.
Spanos GA, et al: Pre-operative chemotherapy for giant cell carcinoma of the thyroid. Cancer 50:2252, 1982.
Suarez HG, et al: Detection of activated ras oncogenes in human thyroid carcinomas. Oncogene 2:403, 1988.
Susaneck SJ: Thyroid tumors in the dog. Comp Cont Educ Vet Pract 5:35, 1983a.
Susaneck SJ: Doxorubicin therapy in the dog. JAVMA 182:70, 1983b.
Tallroth E, et al: Multimodality treatment in anaplastic giant cell thyroid carcinoma. Cancer 60:1428, 1987.
Tateyama S, et al: The ultimobranchial and its hyperplasia or adenoma in equine thyroid gland. Jpn J Vet Sci 50:714, 1988.
Theon AP, et al: Prognostic factors and patterns of treatment failure in dogs with unresectable differentiated thyroid carcinomas treated with megavoltage irradiation. JAVMA216:1775, 2000.
Thompson EJ, et al: Fine-needle aspiration cytology in the diagnosis of canine thyroid carcinoma. Can Vet J 21:186, 1980.
Tubiana M, et al: External radiotherapy in thyroid cancers. Cancer 55:2062, 1985.
Turret JM, et al: Canine thyroid tumors. In Morgan R (ed): Handbook of Veterinary Medicine. New York, Churchill Livingstone, 1987.
Verschueren CP: Clinico-pathological and endocrine aspects of canine thyroid cancer. Ph.D. Thesis, Utrecht, The Netherlands, 1992.
Verschueren CP, Goslings BM: Comparative aspects of thyroid cancer. Ph.D. Thesis, Utrecht, The Netherlands, 1992, p95.
Verschueren CP, et al: Thyrotropin receptors in normal and neoplastic (primary and metastatic) canine thyroid tissue. J Endocrinol 132:461, 1992a.
Verschueren CP, et al: Evaluation of some prognostic factors in surgically treated canine thyroid carcinomas. Ph.D. Thesis, Utrecht, The Netherlands, 1992b,p 11.
Waters CB, Scott-Moncrieff JC: Cancer of endocrine origin. In Morrison WB (ed): Cancer in Dogs and Cats: Medical and Surgical Management, 1st ed. Baltimore, Williams & Wilkins, 1998, pp 599.
Wheeler SL: Endocrine tumors. In Withrow SJ, MacEwen EG (eds): Clinical Veterinary Oncology. Philadelphia, JB Lippincott, 1989, p 253.
Wisner ER, et al: Ultrasonographic evaluation of cervical masses in the dog and cat. Vet Radiol Ultrasound 35:310, 1994.
Wisner ER, et al: Normal ultrasonographic anatomy of the canine neck. Vet Radiol 32:185, 1991.
Wisner ER, Nyland TG: Ultrasonography of the thyroid and parathyroid glands. Vet Clin N Amer: Sm Anim Pract 28:973, 1998.
Withrow SJ, MacEwen EG: Tumors of the endocrine system. In Withrow and MacEwen: Small Animal Clinical Oncology, 3rd ed. Philadelphia, WB Saunders Co, 2001, p 423.
Wynford-Thomas D: Origin and progression of thyroid epithelial tumors: Cellular and molecular mechanisms. Horm Res 47:145, 1997.
Часть III
НАДПОЧЕЧНИКИ
rJrW'j4iJ‘Hi",«'rt r4(j'!«'lf W Ms W l!,.‘ ' 'd Л', i'1'l Nyi,,'/ , rl, r J ’ г ' < , 11 Ч1 ,
Г лава 6
ГИПЕРКОРТИЦИЗМ (СИНДРОМ
КУШИНГА) У СОБАК
РЕГУЛЯЦИЯ СЕКРЕЦИИ ГЛЮКОКОРТИКОИДОВ................263
Кортикотропин рилизинг- гормон (КРГ)..........263
Адренокортикотропный гормон (АКТГ) 265
Стероиды.......................266
ПАТОФИЗИОЛОГИЯ.................268
Гиперкортицизм, зависимый от гипофиза (ГЗГ)...............268
Гиперкортицизм, вызванный опухолью надпочечников (ГОН).............272
Сидром эктопической секреции АКТГ.273
Узловая гиперплазия надпочечников..273 Односторонние и двусторонние опухоли надпочечников..................273
Гипофизарная опухоль в сочетании с синдромом Кушинга.............274
ПАТОЛОГИЯ......................274
Гипофиз........................274
Гиперплазия коры надпочечников...275
Опухоли надпочечников..........275
ВСТРЕЧАЕМОСТЬ..................276
Возраст........................276
Пол............................276
Порода/вес тела................276
АНАМНЕЗ........................277
Существенные расстройства, отсутствующие в анамнезе........277
Общие сведения.................277
Полиурия и полидипсия..........279
Полифагия......................279
Большой живот..................279
Мышечная слабость, сонливость и хромота.......................280
Кожные маркеры гиперкортицизма....281
Ожирение.......................284
Дыхательные расстройства.......284
Тестикулярная атрофия у самцов и расстройство циклов у самок...286
Миотония (ложная миотония).....287
Лицевой паралич................287
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.......287
Обзор..........................287
Г иперпигментация..............287
Г епатомегалия.................287
Атрофия семенников, анэструс и гипертрофия клитора...........288
Эктопический кальциноз.........288
Кровоточивость.................289
Синдром внезапной приобретенной дегенерации сетчатки (СПДС).....289
Острая слабость вследствие нетравматического разрыва опухолевидной надпочечниковой массы...........................289
РУТИННЫЕ АНАЛИЗЫ КРОВИ И МОЧИ..289
Общие подходы..................289
Общий клинический анализ крови (ОАК)..............289
Глюкоза и инсулин в сыворотке крови 289
Азот мочевины в крови (AM).......291
Аланинаминотрансфераза (АЛТ).....291
Щелочная фосфатаза в сыворотке крови
(ЩФС).........................291
Холестерин, триглицериды и липемия 292
Фосфаты в сыворотке крови.....293
Желчные кислоты...............293
Электролиты в сыворотке крови...293
Амилаза и липаза..............293
Анализ мочи...................294
Тестирование функции щитовидной железы..............295
РЕНТГЕНОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ................295
Общие подходы...................295
Брюшная полость...............296
Г рудная клетка.................296
Скелет........................297
Дистрофический (эктопический) кальциноз......................297
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ БРЮШНОЙ ПОЛОСТИ................298
Визуализация надпочечников как способ тестирования их функции ...298
Здоровые собаки...............298
Собаки с синдромом Кушинга и непредвиденной опухолевидной надпочечниковой массой.........298
ОСЛОЖНЕНИЯ ПРИ
ГИПЕРКОРТИЦИЗМЕ.............302
Гипертензия...................302
Пиелонефрит...................303
Мочевые камни.................304
Застойная сердечная недостаточность................304
Панкреатит....................304
Сахарный диабет...............305
Легочная тромбоэмболия (ЛТЭ)....305
Гипофизарные «макроопухоли» и нарушения в центральной нервной системе........................309
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА .312
Общие сведения..................312
Врожденные портосистемные шунты ..312
Введение фенобарбитала..........312
СПЕЦИФИЧЕСКАЯ ОЦЕНКА СИСТЕМЫ
ГИПОФИЗ-КОРА НАДПОЧЕЧНИКОВ...313
Общие подходы.................313
Эндокринологические исследования ..313
СКРИНИНГОВЫЕ ИССЛЕДОВАНИЯ:
ПОДТВЕРЖДЕНИЕ ГИПЕРКОРТИЦИЗМА.............313
Общие сведения..................313
Чувствительность и специфичность ...315
Базальная концентрация кортизола в плазме крови.................315
Отношение концентраций кортизола
и креатинина в моче (КОР/КРЕ).315
Провокационная проба с АКТГ...318
Скрининговое исследование с дексаметазоном (проба с низкими дозами дексаметазона)..........322
Концентрация 17-гидроксипрогестерона в плазме крови...................326
Другие скрининговые тесты....328
ДИСКРИМИНАЦИОННЫЕ ПРОБЫ: ДИФФЕРЕНЦИАЦИЯ ЗАВИСИМОГО ОТ ГИПОФИЗА И ВЫЗВАННОГО ОПУХОЛЬЮ
НАДПОЧЕЧНИКОВ ГИПЕРКОРТИЦИЗМА.............329
Ингибирующая проба с низкими дозами дексаметазона (ПНДД).........329
Концентрация эндогенного АКТГ.330
Ингибирующая проба с высокими дозами дексаметазона (ПВДД).........332
Отношение концентраций кортизола и креатинина в моче (КОР/КРЕ) для дифференциации ГЗГ и ГОН.....334
Пробы с кортикотропин рилизинг-гормоном (КРГ) и вазопрессином (АДГ)..........335
Проба с метирапоном.............335
Рентгенологические исследования ....335
Ультразвуковое исследование брюшной полости......................335
Компьютерная (КТ) и магнитно-резонансная (МРТ) томография.335
Радиоизотопное сканирование надпочечников................340
ЛЕЧЕНИЕ - ОБЩИЕ ПОДХОДЫ.......340
Общая характеристика..........340
Терапия без выявления причины заболевания..................341
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ.........342
Гиперкортицизм, вызванный опухолью надпочечников................342
Гиперкотицизм, зависимый от гипофиза..................348
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
СИНДРОМА КУШИНГА С
ИСПОЛЬЗОВАНИЕМ о,р’-ДДД.......349
Гиперкотицизм, зависимый от гипофиза.....................349
Функционально-активные опухоли коры надпочечников...........359
Поддерживающая терапия с использованием о,р’-ДДД......360
Прогноз у собак с ГЗГ при терапии о,р’-ДДД.........361
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ С
ИСПОЛЬЗОВАНИЕМ КЕТОКОНАЗОЛА. 362
Общая характеристика..........362
Протокол лечения синдрома Кушинга у собак......................362
Результаты....................362
Показания (таблица 6-16)......363
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ С
ИСПОЛЬЗОВАНИЕМ ТРИЛОСТАНА.... 364
Общая характеристика: люди......364
Общая характеристика: собаки....364
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
С ИСПОЛЬЗОВАНИЕМ ДРУГИХ
ЛЕКАРСТВЕННЫХ СРЕДСТВ.......365
Ципрогептадин.................365
Бромокриптин..................365
Метирапон и аминоглютетимид...365
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 263
Этомидат.......................366
L-депренил.....................366
Ru486 .........................366
ЛЕЧЕНИЕ - ОБЛУЧЕНИЕ ГИПОФИЗА....367
Собаки с ГЗГ и гипофизарными опухолями, не вызывающими нарушения в центральной нервной системе................367
Собаки с ГЗГ и крупными опухолями гипофиза (синдром гипофизарной макроопухоли)..............368
СПОНТАННАЯ РЕМИССИЯ СИНДРОМА КУШИНГА...........369
ПЕРВИЧНЫЙ ИЗБЫТОК
МИНЕРАЛОКОРТИКОИДОВ: ПЕРВИЧНЫЙ
ГИПЕРАЛЬДОСТЕРОНИЗМ.......369
Люди............................369
Собаки..........................371
Список сокращений
АВП, или АДГ - аргинин-вазопрессин, или аитидиуретический гормон
АКТГ - адренокортикотропный гормон, или кортикотропин
АЛТ - аланинаминотрансфераза
AM - азот мочевины
ГЗГ - гиперкотицизм, зависимый от гипофиза
ГОН - гиперкортицизм, вызванный опухолью надпочечников
ГР - гормон роста
ИФА - иммуноферментный анализ
КОР/КРЕ - отношение концентраций
кортизола и креатинина в моче
КПП - кортикотропин-подобный пептид
КТ - компьютерная томография
КРГ - кортикотропин рилизинг-гормон, или кортиколиберин
ЛГ - лютеинизирующий гормон
ЛПТ - липотропин
ЛТЭ - легочная тромбоэмболия
МРТ - магнитно-резонансная томография
МСГ - меланоцитстиулирующий гормон ОАК - общий клинический анализ крови ПВДП - проба с высокими дозами дексаметазона
ПД- полидипсия
ПНДП - проба с низкими дозами дексам етазона
ПОМК - проопиомеланокортин
ПУ - полиурия
РИА - радиоиммуиологический анализ
СКС - синдром Кушинга у собак
ССК - спонтанный синдром Кушинга
СПДС - синдром внезапно приобретенной дегенерации сетчатки
ТТГ - тиреотропный гормон, тиреотропин
УЗИ - ультразвуковое исследование
ЦНС - центральная нервная система
ЩФС - щелочная фосфатаза сыворотки крови
В 1932 году д-р Гарвей Кушинг описал 8 пациентов с расстройством, которое, как он считал, было «следствием гипофизарной базофилии». У шести из них имелись небольшие базофильные гипофизарные аденомы и клинические признаки избыточной секреции кортизола корой надпочечников. Внимательное изучение этих и выявленных в последующие годы больных показывает, что в основе клинического состояния, в свое время рассматривавшегося как одно заболевание, лежат самые разные причины. Однако все эти состояния, в конечном счете, сводятся к хронически высокой концентрации кортизола в крови. Эпоним синдром Кушинга служит общим термином для обозначения совокупности клинических и химических нарушений, обусловленных хроническим воздействием избыточного количества глюкокортикоидов. Эпоним болезнь Кушинга относится к тем случаям синдрома Кушинга, в которых гиперкортицизм является следствием избыточной секреции адренокортикотропного гормона (кортикотропина, или АКТГ) гипофизом. Иными словами, речь идет о гиперкотицизме, зависимом от гипофиза (ГЗГ). В основе гиперкортицизма (синдрома Кушинга) собак (СКС) также лежат множественные патофизиологические нарушения, но все они сводятся к хроническому избытку кортизола в организме.
Патофизиологическая классификация причин СКС включает: 1) гипофизарные опухоли, продуцирующие и секретирующие избыточное количество АКТГ в сочетании с вторичной гиперплазией коры надпочечников (обычная причина), 2) гипофизарную гиперплазию вследствие избыточной секреции кортикотропин рилизинг-гормона (КРГ), вызванной гипоталамическим расстройством (очень редко бывает у людей и не встречается у собак и кошек), 3) первичный избыток кортизола, который
автономно секретируется аденомой или карциномой коры надпочечников (относительно частая причина) и (4) ятрогенные факторы вследствие передозировки экзогенного АКТГ (очень редко) или избыточной терапии глюкокортикоидами (весьма часто). Разнообразные негипоталамические и негипофизарные опухоли, секретирующие избыточные количества АКТГ, описаны у человека, но не найдены у собак и кошек.
РЕГУЛЯЦИЯ СЕКРЕЦИИ ГЛЮКОКОРТИКОИДОВ
Кортикотропин рилизинг-гормон (КРГ)
По мере накопления знаний о характере портальной циркуляции, «связывающей» гипоталамус и гипофиз, стало ясно, что гипоталамус контролирует секрецию АКТГ аденогипофизом, а АКТГ, в свою очередь, регулирует высвобождение кортизола из коры надпочечников. Кортизол замыкает круг, ингибируя секрецию КРГ и АКТГ (рис. 6-1) по механизму отрицательной обратной связи. Гипоталамус продуцирует полипептид КРГ, состоящий из 41 аминокислотного остатка. Нейроны, секретирующие КРГ, находятся в передней части паравентрикулярных ядер гипоталамуса. КРГ имеет большой период полужизни в плазме крови (приблизительно 60 минут).
У человека секреция КРГ, и как следствие АКТГ, усиливается под воздействием аргинин-вазопрес-сина (АВП) и ангиотензина II. Окситоцин, наоборот, подавляет стимуляцию КРГ секреции АКТГ. Убедительных данных о регуляторной роли АВП, окситоцина и ангиотензина II в механизмах секреции АКТГ у собак нет, но подтверждена важная роль КРГ в регуляции нормальной секреции АКТГ (Kemppainen, Sartin, 1987; Kemppainen et al, 1992).
264
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Прочие
Физический
Психи,- Химический ческий (гипогликемия)
КРГ
«Кортикотроф»
Фиксированная точка
Кортизол, обратная Д1/тг связь (длинная петля) АК ’ *
АКТГ, обратная связь (короткая петля) >
КРГ, ?, другие факторы
АКТГ
?, другие факторы
Ангиотензин
Альдостерон, 18-ОН-кортикостерон
Центральная нервная система
Гипоталамус
Гипофиз
Ренин
Кортизол,кортикостерон, дезоксикортикостерон, прочие
Кора Клубочковая зона
надпочечников
Пучковая и сетчатая зоны
Почка
андрогены, эстрогены, прогестины
Рис. 6-1. Л. Схематическое изображение системы гипоталамус-гипофиз-кора надпочечников, иллюстрирующее усиление секреции кортикотропин рилизинг- гормона (КРГ) под влиянием различных факторов и действии кортизола по механизму отрицательной обратной связи на уровне гипоталамуса и гипофиза. Показано также действие АКТГ на секрецию КРГ по механизму отрицательной обратной связи (короткая петля). Б. Взаимодействие между различными тканями и органами при биосинтезе стероидов коры надпочечников и его регуляция, периферическое поглощение стероидов, их метаболизм и экскреция. Из: Baxter JD, Tyrrell JВ /и: Frlig Р et al, (eds): Endocrinology and Metabolism. New York, McGraw-Hill, 1981, p 396.
ж Свобод-4 ные стероиды
Внеклеточ-А/ Ткане-ное про- вые мем- ^точное пространство браны странство?
Внутрикле
Печень
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 265
Геном
мРНК
Проопиомеланокортин
| N-концевой фрагмент (1-131~)~| | АКТГ (1-39) |
6-Р-ЛПТ (1-91)
| а-МСГ | | КППД| (1-13) (18-39)
|..9-у-ЛПТ~|
(1-58)
| p-эндорфин | (61-91)
| 11 - р-МСГ | |мет-энкефалин|
(41-58) (61-65)
Рис. 6-2. Процессинг проопиомеланокортина (молекулярная масса 28500) с образованием биологически активных пептидных гормонов. Сокращения объяснены в тексте.
Адренокортикотропный гормон (АКТГ)
АКТГ представляет собой пептидный гормон, состоящий из 39 аминокислотных остатков (молекулярная масса 4500), который образуется в результате процессинга более крупной молекулы предшественника проопиомеланокортина (ПОМК), имеющего молекулярную массу 28500. В гипофизарных клетках, синтезирующих АКТГ (кортикотрофах), синтез ПОМК и его процессинг до более мелких, биологически активных фрагментов управляется информационной РНК (мРНК) (рис. 6-2). Функция и роль этих пептидных фрагментов: Р-липотропина, а-меланоцитстимулиру-ющего гормона (а-МСГ), р-МСГ, p-эндорфина и N-концевого пептида все чаще становятся предметом эндокринологических исследований. Большинство этих пептидов в той или иной степени гликозилированы, что является причиной расхождения данных при определении их молекулярной массы и обусловливает характерное базофильное окрашивание кортикотрофов (Aron et al, 2001а).
Два фрагмента из числа изображенных на рис. 6-2 входят в структуру АКТГ и являются побочными продуктами его обмена. а-МСГ идентичен участку АКТГ1-13, а кортикотропиноподобный пептид промежуточной доли (КПП) - АКТГ18-39. У человека ни тот, ни другой пептид не секретируется в виде отдельных гормонов. P-Эндорфин действует как «эндогенный опиат», что предполагает его участие в механизмах болевой чувствительности. Он может также влиять на регуляцию других гипофизарных гормонов и играет роль в нервном контроле дыхания (Aron et al, 2001а). Показано, что концентрация N-концевого фрагмента ПОМК в плазме крови возрастает в условиях гипогликемического стресса. Этот фрагмент, возможно, действует как фактор роста надпочечников и/или усиливает действие АКТГ на стероидогенез. Физиологическая функция Р-ЛПТ до конца не выяснена. Известно, однако, что
секреция Р-ЛПТ и p-эндорфина имеет такую же динамику, как секреция АКТГ, т.е. она усливается в ответ на стресс и гипогликемию и подавляется глюкокортикоидами. Эти гормоны секретируются одновременно с АКТГ. В частности, их концентрация в крови, как и концентрация АКТГ, повышается при болезни Адиссона, гипофизарной болезни Кушинга и синдроме Нельсона (рост гипофизарной опухоли после удаления надпочечников) (Peterson et al, 1988). У собак с автономно секретирующей кортизол опухолью надпочечников концентрация Р-ЛПТ и p-эндорфина снижена по сравнению с нормой.
Секреция КРГ и АКТГ носит пульсирующий характер. У человека ее суточные ритмы характеризуются наличием пика незадолго до пробуждения и постепенным уменьшением секреции в течение дня. У собак такие суточные ритмы не выявлены (Kemppaintn, Sartin, 1984, 1987; Murase et al, 1988). Секреция АКТГ как у людей, так и у животных усиливается в ответ на прием пищи (Aron et al, 2001а). Основная функция АКТГ состоит в стимуляции секреции глюкокортикоидов корой надпочечников. Его стимулирующее действие на секрецию образующихся в надпочечниках минералокортикоидов выражено слабее. Биологическая активность АКТГ обеспечивается N-концевой последовательностью его молекулы (аминокислотные остатки 1-18).
Разнообразные стрессорные воздействия усиливают секрецию АКТГ до уровня, превышающего ее обычные суточные колебания. Концентрация АКТГ и кортизола в плазме крови повышается под влиянием физических, психических и химических стрессорных факторов, таких как боль, травма, гипоксия, гипогликемия, низкая температура, хирургическая операция или пирогенные соединения (Aron et al, 2001а). Усиление секреции АКТГ в условиях стресса опосредуется через вазопрессин и КРГ. Физиологические концентрации кортизола не влияют на ответ АКТГ на стресс, однако, он подавляется высокими дозами экзогенного кортизола.
266 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ТАБЛИЦА 6-1. НОМЕНКЛАТУРА ФЕРМЕНТОВ, УЧАСТВУЮЩИХ В СИНТЕЗЕ СТЕРОИДОВ
Фермент Символ гена Тривиальное название Прежнее название
P450scc CYP11A1 Фермент, отщепляющий боковую цепь холестерина P450scc
3 (1-гидроксистероиддегидрогеназа HSD3B1 HSD3B2 ЗР-гидроксистероиддегидрогеназа 3P-HSD
Р450с17 CYP17 17а-гидроксилаза; 17,20-лиаза Р450с17
Р450с21 CYP21A2 21 (3 -гидрокси лаза Р450с21
P450cllb CYP1B1 110-гидроксилаза Р450с11
P450C11AS CYP11B2 Р450альдо; альдостеронсинтаза, ме-тилоксидаза кортикостерона P450C11AS
Холестерин
Прегненолон
Прогестерон
11-дезоксикортикостерон
Р450-альдостеронсинтаза
Кортикостерон
7 Р450-альдостеронсинтаза
18-гидроксикортикостерон
Р450-альдостеронсинтаза
СН2ОН
Рис. 6-3. Биосинтез стероидов в клубочковой зоне. Стадии от холестерина до 11-дезоксикортикостерона - такие же, как в пучковой и сетчатой зонах. Однако в пучковой зоне отсутствует 17а-гидроксилазная активность, поэтому в ней не образуется кортизол. Превращение кортикостерона в 18-гидроксикортикостерон и альдостерон происходит только в клубочковой зоне. Превращение 11-дезоксикортикостерона в кортикостерон, затем в 18-гидроксикортикостерон и, наконец, в альдостерон катализируется единственным ферментом Р450-альдостеронсинтазой.
Влияние кортизола и синтетических глюкокортикоидов на секрецию АКТГ по механизму отрицательной обратной связи осуществляется на уровне как гипофиза, так и гипоталамуса. При этом имеются два механизма регуляции: «быстрая обратная связь», чувствительная к скорости изменений концентрации кортизола, и «медленная обратная связь», реагирующая на абсолютную концентрацию кортизола. Первый из этих механизмов, по-видимому, не связан с внутриядерными процессами, так как его высокую скорость нельзя объяснить влиянием кортикостероидов на транскрипцию специфической мРНК АКТГ в клеточных ядрах. Второй механизм включается позднее, его действие осуществляется на уровне ядра и приводит к последующему снижению биосинтеза АКТЕ Эффект медленной отрицательной обратной связи оценивается в ингибирующей пробе с дексаметазоном. Помимо регуляции кортикостероидами по механизму отрицательной обратной связи, АКТГ с помощью того же механизма (по короткой петле), подавляет собственную секрецию, как показано на рис. 6-1 (Aron et al, 2001а).
Стероиды
Зоны коры надпочечников и их продукты. Кортизол и альдостерон - это основные гормоны, секретируемые корой надпочечников. Гистологически кора состоит из трех зон. Схема стероидогенеза в надпочечниках была установлена путем анализа участвующих в нем ферментов, большинство которых принадлежит к семейству цитохром-Р450 оксигеназ (табл. 6-1). В клубочковой и обеих внутренних зонах действуют разные ферменты, поэтому кора надпочечников представлена двумя самостоятельными отделами, каждый из которых имеет свои механизмы регуляции и продукты секреции.
В наружной клубочковой зоне (zona glomerulosa) синтезируется альдостерон, а активность 17а-гид-роксилазы (новое название СУР 17) в ней незначительна, что исключает биосинтез кортизола и андрогенов. В то же время только в клетках клубочковой зоны содержатся ферменты, необходимые для дегидрирования 18-гидроксикортикостерона и синтеза альдостерона. Последний контролируется, главным образом, ренин-ангиотензиновой системой и концентрацией калия в крови (см. рис. 6-1,Б и рис. 6-3). Средняя пучковая зона (zona fasciculata') - самая объемная среди трех зон коры надпочечни-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
• 267
СНз с=о
Холестерин
P450scc
C=Oi
Прегненолон СН3
О
3₽-гидроксисте-роиддегидрогена-за/изомераза
Прогестерон СНгОН
С=О
Р450с21
С=О
р450с11
О
Кортикостерон О
11-Дезоксикортикостерон
СНгОН
НО
О
О
С=О___
г-ОН
17а-гидрокси-прогестерон СН2ОН
С=О
ОН
17а-гидрокси-прегненолон
СН3
СН3 I 3
С=О г-ОН
НО
Дегидроэпиандростерон сульфат
Дегидроэпиандростерон
О
11-дезоксикортизол СНгОН
С=О
"ОН
Кортизол
(7) Сульфокиназа
О
Андростендион
Рис. 6-4. Биосинтез стероидов в коре надпочечников. Показаны пути биосинтеза глюкокортикоидов, минералокортикоидов и андрогенов надпочечников, а также химическая структура этих стероидов и их предшественников. Кружками показаны ферменты, катализирующие отдельные стадии биосинтеза. Номенклатура стероидогенных ферментов дана в табл. 6-1.
ков, функционирует как одно целое с внутренней сетчатой зоной (zona reticularis)', в этих зонах образуются кортизол и андрогены. Только клетки этих двух зон, содержащие 17а-гидроксилазную активность (СУР 17), синтезируют 17а-гидроксипрегне-нолон и 17а-гидроксипрогестерон - предшественники кортизола и андрогенов надпочечников (рис. 6-4). Эти зоны контролируются, главным образом, АКТГ. Лимитирующей стадией стероидогенеза в коре надпочечников служит превращение холестерина в прегненолон, а основное действие АКТГ направлено на активацию аденилатциклазы, что приводит к увеличению содержания циклического аденозинмонофосфата (цАМФ) и активации внутриклеточных фосфопротеинкиназ (рис. 6-5) (Aron et al, 2001b).
Стероидогенез. Кортизол, альдостерон, андрогены и эстрогены являются «стероидами». Синтез этих стероидов начинается с воздействия соответствующих ферментов на холестерин (см. рис. 6-3 и 6-4). Главными источниками холестерина в надпочечниках являются циркулирующие в кровяном русле липопротеины, хотя он также синтезируется из ацетата в самих железах. Примерно 80% холестерина поступает в надпочечники с липопротеинами низкой плотности (ЛНП). Небольшая фракция свободного холестерина в надпочечниках предназначена для быстрого ответа на стероидогенную стимуляцию. При стимуляции усиливается
11 -дезокси- _ 17-ОН-пре-кортизол гненолон
ГЭР
Рис. 6-5. Механизм действия АКТГ на клетки, секретирующие кортизол, в двух внутренних зонах коры надпочечников. Связывание АКТГ со специфическим рецептором (Р) сопровождается активацией аденилатциклазы (АЦ) через посредство аппарата Гольджи (АГ). В результате возрастает продукция циклического АМФ, который активирует протеинкиназу А; последняя фосфорилирует гидролазу эфира холестерина (ХЭГ) и, таким образом, усиливает ее активность. В результате увеличивается продукция свободного холестерина, который превращается в прегненолон в митохондриях. Обратите внимание, что на последующих стадиях стероидогенеза происходит постоянный обмен продуктами биосинтеза между митохондриями и гладким эндоплазматическим ретикулумом (ГЭР). ЛНП - липопротеины низкой плотности.
268 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
также гидролиз резервных эфиров холестерина до свободного холестерина, увеличивается поступление липопротеинов из плазмы крови и возрастает биосинтез холестерина de novo. Быстрый ответ на стимуляцию опосредуется через стероидогенный острый регуляторный белок (СтБ). Этот митохондриальный фосфопротеин усиливает транспорт холестерина с наружных на внутренние мембраны митохондрий (Aron et al, 2001b).
Превращение холестерина в прегненолон является лимитирующей стадией стероидогенеза в надпочечниках и главным местом действия АКТГ в этих органах. Это превращение осуществляется в митохондриях посредством двукратного фосфорилирования с последующим отщеплением боковой цепи холестерина (см. рис. 6-5). Этот процесс катализируется единственным ферментом - СУР11А1; на каждой его стадии необходимы молекулярный кислород и пара электронов. Синтезированный прегненолон выводится из митохондрий. В этой главе основное внимание уделяется кортизолу. Он синтезируется в процессе 17а-гидроксилирования в гладком эндоплазматическом ретикулуме (Aron et al, 2001b). Стадии синтеза кортизола показаны на рис. 6-4. Синтез кортизола происходит непрерывно, и у собак базальная концентрация кортизола в крови составляет от 1 до 5 мкг/100 мл.
Регуляция секреции. АКТГ служит тропным гормоном для пучковой и сетчатой зон коры надпочечников. Его поступление в кору вызывает быстрый синтез и секрецию кортизола и андрогенов. В свою очередь, секреция АКТГ регулируется гипоталамусом и ЦНС посредством нейротрансмиттеров, КРГ и аргинин-вазопрессина. Концентрация кортизола в крови возрастает через несколько минут после введения АКТГ. При этом усиливается биосинтез рибонуклеиновых (РНК) и дезоксирибонуклеиновых (ДНК) кислот и образование белка. Хроническая стимуляция АКТГ вызывает гипертрофию и гиперплазию коры надпочечников. Напротив, недостаточность АКТГ приводит к уменьшению биосинтеза стероидов и сопровождается атрофией коры надпочечников, снижением их веса и уменьшением содержания белка и нуклеиновых кислот (Aron et al, 2001b).
ПАТОФИЗИОЛОГИЯ
Гиперкортицизм, зависимый от гипофиза (ГЗГ)
Патология у человека. «Секретирующие АКТГ гипофизарные опухоли имеются практически у всех пациентов с (гипофизарной) болезнью Кушинга» (Aron et al, 2001а, 2001b). Обычно это доброкачественные аденомы менее 10 мм в диаметре. Около половины таких опухолей имеют диаметр 5 мм и меньше; описаны также микроаденомы размером до 1 мм. Опухоли у лиц с болезнью Кушинга представляют собой базофильные или хромофобные аденомы, которые могут возникнуть в любой части аденогипофиза.
Примерно 15-25% секретирующих АКТГ опухолей имеют большие размеры и инвазивную природу. Встречаются также злокачественные опухоли. Диффузная гиперплазия кортикотрофов аденогипофиза, или аденоматозная гиперплазия (развивающаяся, как полагают, из-за избытка КРГ), встречается редко и с трудом поддается идентификации. Гиперплазия пучковой и сетчатой зон обусловливает утолщение надпочечниковых желез у людей с болезнью Кушинга, тогда как объем клубочковой зоны остается нормальным. В отдельных случаях секретирующие АКТГ аденомы гипофиза вызывают двустороннюю узловую гиперплазию коры надпочечников. При этом в диффузно гиперплазированных железах формируются один или несколько узлов разного размера, от микроскопических до имеющих несколько сантиметров в диаметре, хотя чаще всего встречаются множественные мелкие узлы (Aron et al, 2001b).
Гипофизарный контроль и механизм обратной связи. У нормальных индивидуумов (людей и животных) секреция АКТГ носит неупорядоченный, эпизодический характер. Такое впечатление, впрочем, обманчиво. На самом деле, несмотря на эпизодическое высвобождение из гипофиза, АКТГ очень тонко регулирует концентрацию кортизола в плазме крови, поддерживая ее на требуемом для гомеостаза уровне. Таким образом, секреция отнюдь не «произвольна». Наиболее частым нарушением при ГЗГ является хроническое повышение частоты и амплитуды секреторных «выбросов» АКТГ. Хронически избыточная секреция АКТГ вызывает высвобождение аномально больших количеств кортизола и, в конечном итоге, приводит к гиперплазии коры надпочечников. Торможение секреции АКТГ из гипофизарной аденомы по механизму обратной связи физиологической или аномально высокой концентрацией глюкокортикоидов относительно неэффективно (рис. 6-6). ГЗГ не мог бы развиться, если бы глюкокортикоиды «нормально» ингибировали секрецию АКТГ по механизму отрицательной обратной связи. У собак со спонтанной болезнью Кушинга в результате эпизодической секреции АКТГ и, следовательно, кортизола концентрация обоих гормонов в крови колеблется, но зачастую не выходит за рамки диапазонов, считающихся нормальными в большинстве лабораторий (рис. 6-7).
«Нормальные» концентрации кортизола при гиперкортицизме. Оценивая продукцию кортизола у людей и собак с гиперкортицизмом, например, по его суточной экскреции с мочой, легко убедиться в избыточной секреции этого стероида. Избыточная секреции кортизола в сочетании с отсутствием суточных колебаний его секреции (если таковые имеются у собак) приводит к манифестации синдрома Кушинга. Избыточную секрецию кортизола довольно трудно выявить при разрозненных измерениях его базальной концентрации. Как показано на рис. 6-7, у большинства собак с гиперкортицизмом концентрация кортизола в любой данный момент
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 269
А Гипоталамус
Кортизол (отрицательная обратная связь)
Б Гипоталамус
В Гипоталамус
АКТГ (понижение)
Функционально активная
опухоль коры надпочечников
Рнс. 6-6. Система гипофиз-надпочечники у здоровых собак (А), собак с ГЗГ (Б) и собак с ГОН (В), н — Надпочечник, Г — Гипофиз, КРГ - кортикотропин рилизинг- гормон. Из: Feldman ЕС: /и: Ettinger S (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1673.
остается в пределах «нормы». Его избыток у собак с синдромом Кушинга становится очевидным при измерении «площади под кривой концентрации кортизола в плазме крови», которая отражает изменение секреции во времени, особенно если результаты сравниваются с аналогичными данными для здоровых собак. В течение суток собака или кошка с гиперкортицизмом подвергается значительно большему воздействию кортизола, чем нормальное животное. Это хроническое и устойчивое нарушение служит причиной клинического синдрома, обусловленного избытком кортизола.
Утрата гипоталамического контроля. Одним из показателей избыточной секреции АКТГ служит отсутствие реакции на стресс, когда такие стимулы как гипогликемия или хирургическая операция не вызывают дальнейшего увеличения концентрации АКТГ и кортизола. Хронический гиперкортицизм угнетает функцию гипоталамуса и секрецию КРГ. Это приводит к прекращению гипоталамической регуляции секреции АКТГ (Aron et al, 2001а), возможно, из-за подавления функции гипоталамуса и продукции АКТГ в результате хронически высокой концентрации кортизола. Таким образом, хронический гиперкортицизм является причиной утраты гипоталамической регуляции секреции АКТГ (Aron et al, 2001b; van Wijk et al, 1992).
Частота встречаемости гипофизарных опухолей. От 80 до 85% собак со спонтанно развившимся синдромом Кушинга имеют ГЗГ, т.е. избыточную секрецию АКТГ гипофизом, которая вызывает двустороннюю гиперплазию коры надпочечников и повышенную концентрацию глюкокортикоидов в плазме крови (Feldman, 1983 а-с). Данные о частоте обнаружения гипофизарных опухолей у собак с ГЗГ противоречивы, по-видимому, из-за различий как в квалификации патологоанатомов и тщательности обследования, так и в качестве микросрезов и их окрашивания в лабораториях, проводящих гистологические исследования. Сообщалось, что более 90% собак с ГЗГ имеют гипофизарные опухоли (Zerbe, 1992). Эти данные соответствуют нашим наблюдениям: мы обнаружили опухоли гипофиза практически у 100% собак со спонтанным зависимым от гипофиза синдромом Кушинга.
Передняя и задняя доли гипофиза. У людей и собак гипофиз поделен на две хорошо различимые доли: переднюю (pars distalis) и заднюю (pars nervosa). Однако у собак, в отличие от человека, между передней и задней долями гипофиза имеется разделяющая их промежуточная доля (pars intermedia) (Peterson et al, 1982a), образованная клетками двух разных типов (Halmi et al, 1981; Jackson et al, 1981). Окрашивание преобладающего типа клеток (А-клеток) при иммуногистохимическом исследовании выявляет присутствие в них большого количества а-МСГ и незначительного количества АКТГ. Другая клеточная популяция промежуточной доли (В-клетки) содержит большие количества АКТГ и мало а-МСГ. Интенсивность окрашивания В-клеток промежуточной доли на АКТГ сопоставима с окрашиванием АКТГ-продуцирующих клеток передней доли (Peterson et al, 1986).
Регуляция синтеза ПОМК (предшественника АКТГ, см. рис. 6-2) в передней доле гипофиза и, следовательно, синтеза и секреции АКТГ осуществляется, с одной стороны, путем стимуляции КРГ а, с другой стороны, ингибирования глюкокортикоидами коры надпочечников. Секреторная активность промежуточной доли подавляется дофамином, который высвобождается из аркуатного ядра гипоталамуса, и стимулируется серотонином и КРГ. Передняя доля гипофиза лишена нервной регуляции и контролируется кортикотропин рилизинг-гормо-ном (КРГ), поступающим в нее из гипоталамуса через портальные сосуды гипофиза. Относительно бедная сосудами промежуточная доля иннервирована и контролируется серотонинэргическими и дофаминэргическими волокнами головного мозга (Peterson et al, 1982а; Peterson, 1984).
Почти у всех собак с ГЗГ имеется гипофизарная аденома, чаще всего локализованная в передней доле. Однако у некоторых собак с гиперкортицизмом были диагностированы аденомы «А-клеток» или «В-клеток» промежуточной доли. В исключительных случаях гиперкортицизм может быть вызван гиперплазией гипофиза. При обследовании отдельных особей выявляется еще более запутанная картина: встречаются животные с двумя гипофизарными аденомами, локализованными в разных
270 •
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Концентрация кортизола в плаз- Концентрация кортизола в плазме крови (мкг/100 мл) ме крови (мкг/100 мл)
В Время Г Время
8:00 9:00 10:00 11:00 Полдень 1:00 2:00 3:00 4:00
Д Время
Рис. 6-7. А. Средняя концентрация кортизола в плазме крови. Определение проводили каждые 30 мин на протяжении 8 часов у 15 здоровых собак (группа I), 30 собак с зависимым от гипофиза синдромом Кушинга (ГЗГ; группа II) и 18 собак с синдромом Кушинга, вызванным опухолью коры надпочечника (ГОН; группа III). Обратите внимание, что концентрация кортизола у собак с синдромом Кушинга значительно выше, чем у здоровых животных, однако, все показатели остаются в пределах нормы. Значительные индивидуальные колебания концентрации кортизола в плазме крови во времени иллюстрируются результатами ее определения у трех здоровых собак (Б), у трех собак с ГЗГ (В) и у трех собак с ГОН (Г). Д. Изменение средней концентрации кортизола в плазме крови во времени у 15 здоровых собак (группа I), у 30 нелеченых собак с ГЗГ (группа II), у 15 собак с ГЗГ, не отвечавшим на терапию о,р’-ДДД (группа III) и у 25 собак с ГЗГ, хорошо компенсированным терапией о,р’-ДДД (группа IV).
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 271
концен- кортизола корти- корти- эндо-
трация в пробе с зола в зола в генного
кортизола АКТГ ПНДД ПВДД АКТГ
Рис. 6-8. Средние (±SD) концентрации кортизола и АКТГ в плазме крови 12 собак с опухолями передней доли гипофиза, вызывавшими зависимый от гипофиза гиперкортицизм (ГЗГ) (не заштриховано), и 12 других собак с опухолями промежуточной доли гипофиза, вызывавшими ГЗГ (заштриховано). Концентрации гормонов у собак обеих групп достоверно не раличались. Следовательно, их определение в базальных условиях и в пробах с АКТГ или с низкими (пост-ПНДД) и высокими (пост-ПВДД) дозами дексаметазона не позволяют дифференцировать животных с разной локализацией гипофизарных опухолей. Концентрации эндогенного АКТГ в крови также достоверно не отличались в обеих группах животных с ГЗГ.
долях, и собаки, у которых одновременно имеется и опухоль, и гиперплазия гипофиза. У небольшого числа животных описаны функционально-активные гипофизарные карциномы. Нетрудно заметить, что гипофизарный «гиперкортицизм» представляет собой синдром, обусловленный множественными причинами (Peterson et al, 1986; Peterson, 1987). Однако конечный результат этих нарушений одинаков. Хроническая избыточная продукция гипофизарного АКТГ вызывает гиперплазию коры надпочечников и, как следствие, хронический системный избыток кортизола, симптомы которого сходны независимо от лежащего в ею основе патологического процесса или источника стероида.
Предпринимались попытки дифференцировать собак с опухолями передней доли гипофиза и с опухолями А- и В-клеток промежуточной доли. Было высказано предположение, что у животных с опухолями передней доли или с опухолями В-клеток промежуточной доли имеется избыток эндогенного АКТГ, но высокие дозы глюкокортикоидов подавляют повышение концентрации кортизола в плазме крови, в то время как секреторная активность опухолей А-клеток промежуточной доли глюкокортикоидами не подавляется (Peterson et al, 1986; Peterson, 1987). Наш опыт не подтверждает это наблюдение: нам не удавалось легко идентифицировать причину расстройства на основании прижизненного тестирования (рис. 6-8) (Leroy, Feldman. 1989). Кроме того, на результаты прижизненного тестирования могут влиять многие другие факторы (например, возраст и порода животного, продолжительность заболевания, размер опухоли, се доброкачественная
или злокачественная природа). Однако эта дискуссия в настоящее время имеет лишь теоретический интерес.
Этиология ГЗГ. Раньше в качестве причин ГЗГ рассматривались первичная патология гипофиза - АКТГ-секретирующая аденома (Aron et al, 2001b) и расстройства ЦНС, приводящие к избыточной стимуляции гипофизарных кортикотрофов КРГ и другими гипоталамическими факторами (Krieger, 1983). Предполагалось, что хроническая стимуляция гипофизарных кортикотрофов гипоталамическим КРГ может индуцировать повышенную секрецию АКТГ, гипофизарную «гиперплазию» и, в конечном итоге, неопластическое перерождение части кортикорофов и развитие «поликлональной» опухоли. Было, однако, показано, что в спинномозговой жидкости собак с ГЗГ концентрация КРГ снижена, а концентрация АКТГ остается нормальной несмотря на избыточную секрецию кортизола (van Wijk et al, 1992). При гистологическом исследовании тканей собак с ГЗГ чаще всего выявляются аденомы передней доли гипофиза, что служит наилучшим доказательством роли гипофизарных опухолей в качестве первичной и автономной причины заболевания.
Мы полагаем также, что больные с синдромом Кушинга могут служить прекрасной и точной моделью этого клинического состояния у собак. Почти все одинаково тщательно оценивавшиеся данные свидетельствуют о том, что у людей с гипофизарнозависимым синдромом Кушинга имеются первичные гипофизарные нарушения, а патологические изменения в гипоталамусе (при наличии таковых)
Til • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
возникают вследствие избытка кортизола. При зависимом от гипофиза синдроме Кушинга имеют место следующие эндокринные аномалии: (1) избыточная секреция АКТГ с двусторонней гиперплазией надпочечников и гиперкортизолемией; (2) отсутствие суточных ритмов секреции АКТГ и кортизола; (3) отсутствие ответа АКТГ и кортизола на стресс (например, на гипогликемию или хирургическую операцию); (4) нарушение механизма отрицательной обратной связи при регуляции секреции АКТГ глюкокортикоидами и (5) сниженный ответ гормона роста (ГР), тиреотропного гормона (ТТГ) и гонадотрофов на стимуляцию (Aron et al, 2001а).
Еще одно доказательство того, что гипофизарный синдром Кушинга является следствием первичного нарушения гипофиза, основывается на высокой частоте гипофизарных аденом, реакции на их удаление (у людей и собак) и интерпретации гипоталамических расстройств как вторичных последствий гиперкортизолемии. У людей и собак с нормализовавшимся после удаления гипофизарных опухолей состоянием практически не бывает рецидивов. Если бы причиной заболевания служило гипоталамическое расстройство, рецидивы были бы общим явлением, потому что в этом случае должен был бы возобновиться рост опухоли. Кроме того, исследования, проведенные на молекулярном уровне, показали, что почти все кортикотрофные аденомы имеют моноклональную природу (Gicquel et al, 1992; Biller, 1994; Faglia, 1994; Orth, 1995). Это предполагает, что спонтанно развивающаяся гипофизарная аденома секретирует избыточные количества АКТГ и индуцируемая АКТГ гиперкор-тизолемия подавляет нормальную функцию гипоталамо-гипофизарной системы и высвобождение КРГ, устраняя тем самым гипоталамическую регуляцию АКТГ и кортизола (Aron et al, 2001а).
Число собак, у которых якобы имелась гипофизарная гиперплазия (предполагающая гипоталамическое расстройство в качестве первопричины интенсивной стимуляции гипофизарных корти-котрофов) весьма невелико, если таковые вообще существуют. Если гиперплазия гипофиза и бывает у собак, то этот факт недостаточно документирован в литературе. Теоретически допустимо, хотя и маловероятно, что аденомы возникают вторично, в результате длительной нервной стимуляции корти-котрофов. Однако трудно объяснить, как при одном и том же гипоталамическом расстройстве опухоль возникает то в передней, то в промежуточной долях гипофиза, регуляция которых столь значительно отличается.
Другим подтверждением теории первичности гипофизарного синдрома Кушинга у собак служат результаты клинических испытаний разнообразных лекарственных средств, направленных на коррекцию гипоталамических расстройств. Антисерото-ниновый препарат ципрогептадин давал терапевтический эффект только у трех из 24 собак с ГЗГ и только у одной из этих трех произошло полное
излечение (Drucker, Peterson, 1980; Stolp et al, 1984). Терапия дофаминовым агонистом бромокриптином оказалась успешной только у одной из 7 собак с ГЗГ (Peterson, 1987). Дофаминовые агонисты L-де-пренил и перголид оказались неэффективными при лечении гипофизарного синдрома Кушинга у собак (Reusch et al, 1999; Tobin et al, 1998). В свете этих данных вызывает серьезное сомнение заявление Bruyette и соавторов (1997) и Peterson (1999) о безопасности и потенциальной эффективности указанной медикаментозной терапии. Есть все основания считать, что ГЗГ может быть обусловлен несколькими различными физиопатогенетическими механизмами, однако, его гипоталамическое происхождение до сих пор не получило строгого научного подтверждения.
Влияние избытка глюкокортикоидов на гипофизарную функцию. Следствием избытка глюкокортикоидов, помимо системных эффектов, является угнетение нормальной гипофизарной и гипоталамической функции, в том числе высвобождения ТТГ, гормона роста (ГР) и гонадотропинов -лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). Угнетение секреции этих тропных гормонов приводит к обратимому вторичному гипотиреозу (ТТГ), отсутствию циклов у самок и тестикулярной атрофии у самцов (ФСГ и ЛГ), задержке роста щенков (ГР), а также к низкорослости у детей.
Гиперкортицизм, вызванный опухолью надпочечников (ГОН)
Первичные опухоли коры надпочечников, как аденомы, так и карциномы, по-видимому, развиваются автономно. Такие функционально активные опухоли независимо от контроля со стороны гипофиза секретируют большие количества кортизола. Избыток стероидов в крови ингибирует продукцию гипоталамического КРГ и тем самым подавляет секрецию АКТГ. Автономно секретируемые глюкокортикоиды по механизму отрицательной обратной связи подавляют также продукцию остальных пептидных компонентов ПОМК, за исключением а-МСГ (Peterson et al, 1986). Следствием такого хронического ингибирования становится атрофия коры непораженного опухолью надпочечника и всех нормальных клеток пораженной железы (см. рис. 6-6).
Процессы, приводящие к образованию опухолей коры надпочечников, изучены недостаточно. Высказывалось предположение о важной роли в этих процессах молекулярных дефектов, включая мутации рецепторов кортикотропных факторов. Однако структурные дефекты генов, кодирующих рецепторы кортикотропина, в опухолях коры надпочечников не были обнаружены (Reicke et al, 1997). Тем не менее, в некоторых из них имеются рецепторы кишечного ингибирующего полипептида, рецепторы вазопрессина, Р-адренергические рецепторы и
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
273
совсем недавно были идентифицированы рецепторы иммунных клеток и продуцируемых ими цитокинов (Lacroix et al, 1997; Willenberg et al, 1998). В частности, в условиях клональной экспансии особой популяции клеток коры надпочечников в них были обнаружены высокие локальные концентрации интерлейкина-1 в сочетании с аберрантной экспрессией его рецепторов 1 типа. Это может служить предпосылкой развития опухоли.
Секреция кортизола опухолями коры надпочечников носит неупорядоченный, эпизодический характер (см. рис. 6-7). В то же время в большинстве, если не во всех этих опухолях сохраняются рецепторы АКТГ, поскольку они усиливают синтез и секрецию кортизола в ответ на введение экзогенного АКТГ. Такие опухоли обычно не отвечают на изменение состояния гипоталамо-гипофизарной системы под воздействием дексаметазона и подобных ему фармакологических средств. До сих пор не найдены надежные клинические и биохимические признаки, по которым можно было бы отличить собаку или кошку с активной надпочечниковой аденомой от носителя карциномы. Единственным более или менее достоверным критерием служит несколько больший размер карциномы по сравнению с аденомой (Reusch, Feldman, 1991).
Синдром эктопической секреции АКТГ
У собак синдром эктопической секреции АКТГ неизвестен. У человека он включает группу разных опухолей, синтезирующих и секретирующих АКТГ, что, в конце концов, приводит к гиперплазии коры надпочечников и гиперкортицизму. К числу опухолей, вызывающих синдром эктопической секреции АКТГ у человека, относятся карцинома овсяновидных клеток (мелкоклеточная карцинома) легких, тимома, опухоли панкреатических островков, карциноидные опухоли (легких, кишечника, поджелудочной железы и яичников), медуллярная карцинома щитовидной железы, феохромоцитома и мелкие легочные опухоли (Arioglu et al, 1998; Aronet al, 2001b). Когда такие опухоли синтезируют и секретируют избыточные количества биологически активного АКТГ, одновременно образуются и выделяются в кровь родственные АКТГ пептиды, Р-ЛПТ, 0-эндорфин, а также неактивные фрагменты АКТЕ В секретирующих АКТГ эктопических опухолях присутствует также КРГ- подобная активность, однако ее поступление в кровь до сих пор не наблюдалось и физиологическая роль опухолевого КРГ остается неясной (Tyrrell et al, 1991; Bertagna, 1994; Becker, Aron, 1994).
Узловая гиперплазия надпочечников
Почти у 20% лиц с гиперплазией коры надпочечников имеет место ее макроузловая форма. По-видимому, почти все эти люди страдают зависимой от гипофиза болезнью Кушинга. Обычно у них сильно
увеличены один или оба надпочечника, в коре которых имеются множественные узлы разного размера (Bertagna, 1992). Двусторонняя узловая гиперплазия надпочечников хорошо известна и у собак и кошек; она диагностируется у 5 -10% животных с гиперкортицизмом. Патогенез этого синдрома не выяснен, хотя практически у всех собак и кошек, как и у человека, он, по-видимому, является анатомическим вариантом ГЗГ.
В редких случаях у людей развивается независимая от АКТГ двусторонняя узловая гиперплазия коры надпочечников (Malchoff et al, 1989; Samuels, Lariaux, 1994). Очевидно, некие отличные от АКТГ факторы стимулируют формирование аномальных клеток коры. Обследование отдельных лиц с одной из форм данного синдрома выявило клинические признаки гиперкортицизма, узловую гиперплазию коры надпочечников, пониженную концентрацию кортизола в крови в утренние часы и низкую чувствительность надпочечников к экзогенному АКТГ (Lacroix et al, 1992; Reznik et al, 1992). Секреция кортизола у этих пациентов усиливалась после приема пищи на фоне аномально высокой чувствительности коры надпочечников к обычному пост-прандиальному увеличению секреции кишечного ингибирующего полипептида (КИП) (Hamet et al, 1987). Ввиду низкой гомологии КИП и АКТГ представляется маловероятной такая модификация рецепторов АКТГ, чтобы они приобрели способность связывать КИП (Bertagna, 1992)
Односторонние и двусторонние опухоли надпочечников
Двусторонние опухоли коры надпочечников. Гиперкортицизм, обусловленный двусторонней неоплазией коры надпочечников, у собак встречается редко. Из четырех таких собак у трех были двусторонние аденомы надпочечников и у одной - двусторонние карциномы. При исследовании 15 собак с синдромом Кушинга, вызванным активными опухолями коры надпочечников, у трех (20%) опухоли имелись в обеих железах (Hoerauf, Reusch, 1999). Тем не менее, мы думаем, что частота двусторонних опухолей надпочечников на самом деле значительно ниже приведенной в этом исследовании. В таких случаях гиперкортицизм должен быть подтвержден данными анамнеза и физикального обследования, клинико-патологическими нарушениями, результа-татами проб с АКТГ и низкими дозами дексаметазона. Неоплазию коры надпочечников дифференцируют от ГЗГ по отсутствию подавления уровня кортизола в плазме крови после введения больших доз дексаметазона, практическому отсутствию эндогенного АКТГ и наличию опухолевидной массы, выявляемой при ультразвуковом исследовании надпочечников (Ford et al,1993; Hoerauf, Reusch, 1999). Обзор данного клинического состояния представлен в разделе настоящей главы, посвященной ультразвуковому исследованию.
274 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Опухоль коры надпочечников и феохромоцитома. У нескольких собак мы обнаружили феохромоцитому (опухоль мозгового вещества) в одном надпочечнике и опухоль коры в другом. Такое сочетание затрудняет диагностику, так как УЗИ выявляет двустороннюю адреномегалию, а эндокринологические исследования предполагают наличие опухоли коры надпочечников (Von Dehn et al., 1995). Данное клиническое состояние не типично, но и отнюдь не редко. Вероятно, оно будет выявляться еще чаще по мере все более широкого использования ультразвукового метода в диагностике. Обзор этой формы заболевания представлен в разделе настоящей главы, посвященной ультразвуковому исследованию.
Гипофизарная опухоль в сочетании с синдромом Кушинга
Описаны несколько собак, имевших одновременно функционально активную опухоль коры надпочечников и микроаденому или макроаденому гипофиза (Greco et al, 1999). Эндокринный статус этих животных позволял предположить гиперкортицизм. Однако попытки дифференцировать гиперкортицизм, зависимый от гипофизарных и надпочечниковых опухолей, с помощью эндокринологического исследования приводят к противоречивым или неоднозначным результатам. В целом, такое состояние встречается чрезвычайно редко. Обзор этого синдрома, методов его диагностики и лечения представлен в разделе настоящей главы, посвященной диагностике заболеваний надпочечников.
ПАТОЛОГИЯ
Гипофиз
Микроаденомы. У 80-85% собак развитие ги-перкортицизмома связано с заболеванием гипофиза. По разным данным частота гистологически диагностируемых опухолей гипофиза колеблется от 20 до 100% (Meijer, 1980; McNicol, 1987). У собак, как и у человека, гипофизарные опухоли могут иметь менее 1 мм в диаметре.
Показано, что примерно 50% собак с гипофизарной болезнью Кушинга ко времени установления диагноза имели опухоли менее 3 мм в диаметре. У остальных обследованных собак с ГЗГ, особенно в отсутствие нарушений со стороны ЦНС, размер опухолей достигал 3-12 мм (Bertoy et al, 1995). Для распознавания некоторых гипофизарных опухолей требуется тщательное приготовление микросрезов, специальные красители, опыт и большое терпение. Поскольку все эти условия имеются далеко не всегда, данные о встречаемости гипофизарных опухолей у собак с ГЗГ явно занижены. Крупные опухоли более 3 мм в диаметре без труда распознаются визуально и поэтому выявляются чаще, чем более мелкие.
Большинство гипофизарных опухолей, секретирующих АКТГ, относятся к микроаденомам, поскольку их диаметр не превышает 1 см (Aron et al, 2001а). Обычно они не инкапсулированы, но могут быть окружены сжатыми нормальными клетками гипофиза. При рутинном гистологическом окрашивании такие опухоли обычно состоят из компактных слоев сильно гранулированных базофильных клеток, распределенных по синусоиде. Секретирующие АКТГ клетки аденомы характеризуются признаком Крука, т.е. наличием зоны околоядер-ной гиалинизации, которая образуется в результате хронического воздействия высоких концентраций кортизола на кортикотрофы. Электронная микроскопия выявляет секреторные гранулы размером от 200 до 700 нм.
Количество таких гранул в отдельных клетках бывает разным.
Макроаденомы. Многие собаки с ГЗГ (по меньшей мере, 10%, но более вероятно свыше 20%) имеют крупные гипофизарные опухоли (Duesberg et al, 1995). Макроаденома - это опухоль, видимая при визуальном осмотре гипофиза и имеющая более 1 см в диаметре. Такие опухоли могут инвазировать или сдавливать окружающие структуры по мере своего роста и распространения за пределы турецкого седла. Обычно опухолевая ткань разрастается дорсально, захватывая гипоталамус и вызывая соответствующие клинические симптомы. Поскольку турецкое седло собак имеет скорее форму блюдца, а не чашки (как у человека), опухоль по мере разрастания не поражает его костную стенку. Для того чтобы проникнуть в вышележащие структуры мозга увеличивающейся опухолевой массе не нужно вступать в контакт с костной тканью.
При рутинном гистологическом исследовании такие опухоли могут выглядеть хромофобными, но обычно они содержат АКТГ и родственные ему пептиды. Злокачественные гипофизарные опухоли встречаются нечасто.
Гиперплазия гипофиза. Диффузная гиперплазия кортикотропных клеток гипофиза возможна, но встречается крайне редко. Она может быть следствием избыточной стимуляции аденогипофиза КРГ. Не исключено, однако, что гистологический диагноз неверен. У большинства собак, которым приписывается гипофизарная гиперплазия, имеются опухоли гипофиза. Сходная ситуация наблюдается у человека. Хирургическое удаление опухоли гипофиза у людей обычно приводит к исчезновению симптомов гиперкортицизма, что исключает диагноз гиперплазии, поставленный на основании результатов гистологического исследования (Aron et al, 2001а). Особенно важно идентифицировать вторичную гиперплазию, которая является следствием синдрома Кушинга гипоталамической этиологии, так как это определяет выбор метода лечения. Для коррекции гипоталамического расстройства необходима дорогостоящая медикаментозная терапия, применение которой в его отсутствие не оправдано. Назначе
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 275
ние лечебных средств при невыясненной природе гиперплазии не только влечет за собой большие ненужные расходы, но и вселяет необоснованные надежды. Поскольку они обычно не оправдываются, владелец животного испытывает разочарование и даже вынужден прибегать к эвтаназии своего питомца, чего можно было бы избежать при правильном диагнозе и лечении (Braddock, 2002).
Гиперплазия коры надпочечников
Типичная двусторонняя гиперплазия. Этот гистологический диагноз ставят после выявления хронической гиперсекреции АКТГ, связанной с ГЗГ. Общий вес надпочечников обычно несколько больше нормального. Судя по гистологической картине, гиперплазия в равной степени затрагивает компактные клетки сетчатой зоны и светлые клетки пучковой зоны. В результате увеличивается толщина всей коры. Как указывалось ранее, картина клубочковой зоны обычно остается нормальной. Электронная микроскопия не выявляет существенных ультраструктурных изменений (Aron et al, 2001b).
Узловая гиперплазия надпочечников. В разделе по патофизиологии отмечалось, что данное недостаточно изученное расстройство относительно редко встречается у собак и кошек с гиперкорти-цизмом. У людей с этим заболеванием надпочечники увеличены, иногда весьма значительно. В коре четко видны множественные узлы, вызывающие ее расширение. Обычно узлы имеют желтую окраску, при гистологическом исследовании они напоминают светлые клетки пучковой зоны. Гистологическая картина остальной коры такая же, как при простой гиперплазии надпочечников. Узловая гиперплазия коры, вместо более обычного «диффузного» увеличения, обусловлена длительной гиперсекрецией АКТГ, которая почти всегда связана с ГЗГ. У людей, собак и кошек такие очаговые узлы визуализируются при УЗИ, компьютерной (КТ) и магнитно-резонансной (МРТ) томографии. Их изображения на сканограммах можно ошибочно принять за опухоли надпочечников, что иногда приводит к назначению ненужной и бесполезной хирургической операции на одном из надпочечников. У людей удаление секретирующей АКТГ гипофизарной опухоли почти всегда приводит к регрессии узлов и исчезновению гиперкортицизма (Aron et al, 2001b). Вероятно, данный синдром имеется у большого процента собак и кошек, которым ставят диагноз ГЗГ в сочетании с опухолью коры надпочечников.
Опухоли надпочечников
Трудности классификации. Хорошо известны трудности гистологической классификации эндокринных тканей. Нередко патологам не удается различить нормальные и гиперплазированные ткани. Столь же нелегко дифференцировать диффузную гиперплазию и аденоматозную гиперплазию (аде
номы). Более того, некоторые аденомы трудно отличить от карциномы того или иного типа, а опухоль коры надпочечников от опухоли их мозгового вещества (феохромоцитомы). Описаны собаки с опухолью коры в одном надпочечнике и феохромоцитомой в другом, что значительно затрудняет клиническую и патологоанатомическую диагностику (Von Dehn et al, 1995). В связи с этим, хорошо налаженные взаимоотношения между клиницистами и патологами позволяют последним учитывать клинические и лабораторные данные и облегчают получение нужной и достоверной информации. Возможности патологоанатомической диагностики расширяются также благодаря появлению новых красителей, специфичных для отдельных гормонов и типов клеток.
Аденомы. Аденомы надпочечников собак, как правило, инкапсулированы, различимы невооруженным глазом, их размер колеблется от 1 до 6 см и обычно составляет около 75% размера нормальной почки. Микроскопически в них преобладают клетки пучковой зоны, хотя имеются также типичные клетки сетчатой зоны. Приблизительно половина аденом коры надпочечников частично кальцифицированы (Reusch, Feldman, 1991). В литературе описаны три собаки с двусторонними аденомами надпочечников (Ford et al, 1993).
Карциномы. Карциномы надпочечников бывают очень крупных размеров. Обычно они больше половины нормальной почки, но могут достигать одинаковой с нею и даже большей величины. Карциномы обычно не капсулированы, однако, сильно васкуляризированы, нередко подвержены некрозу, геморрагии и кистозной дегенерации.
Примерно в половине случаев надпочечниковые карциномы кальцифицированы (Reusch, Feldman, 1991). Гистологическая картина карцином чрезвычайно разнообразна. Они могут быть доброкачественными или характеризоваться выраженным плеоморфизмом. Наличие васкулярной или капсулярной инвазии, так же как локальное разрастание, служит признаком малигнизации. Карциономы коры надпочечников могут распространяться на прилегающие структуры (почки и/или их кровеносные сосуды, печень, нижнюю полую вену, аорту и забрюшинное пространство) либо метастазировать с кровотоком в печень и легкие. Описана собака с двусторонними карциномами коры надпочечников (Ford et al, 1993).
Непораженный надпочечник. Корковая ткань, соприкасающаяся с функционально активной аденомой или карциномой надпочечника, а также ткани контралатеральной железы атрофируются. Несмотря на значительное истончение коры и утолщение капсулы неповрежденного опухолью надпочечника, он еще хорошо различим при ультразвуковом исследовании. Отчасти это может объясняться сохранением нормальных медуллярной ткани и клубочковой зоны, а также постоянным совершенствованием методов УЗИ. Гистологическое исследование выявляет практически полное отсутствие сетчатой зоны, а оставшаяся кора состоит в основ-
276 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ном из клеток пучковой зоны. Структура клубочковой зоны обычно остается нормальной.
ВСТРЕЧАЕМОСТЬ
Возраст
1 иперкортицизм - это болезнь собак среднего и старшего возраста. Общепризнанно, что почти все собаки с ГЗГ или с функционально активными опухолями коры надпочечников старше 6 лет, а более 75% этих собак старше 9 лет (медиана 11,4 года) (Reusch, Feldman, 1991). Диагноз гиперкортицизма у любой собаки моложе 6 лет вызывает сомнение не потому, что допущена ошибка, а потому, что это заболевание практически не встречается у молодых животных. Поэтому ветеринарный врач должен убедиться в правильности диагноза, прежде чем назначать лечение. Необходима дифференциальная диагностика гиперкортицизма от заболеваний, имеющих сходную клиническую и биохимическую картину (например, от сахарного диабета), а также от заболеваний, которые могут приводить к избыточной продукции кортизола (портосистемные шунты или ятрогенный синдром Кушинга) (Sterczer et al, 1998). Мы наблюдали только пять собак с синдромом Кушинга, которым на момент установления диагноза было меньше 2 лет (рис. 6-9 и 6-10).
Собаки с гиперкортицизмом, вызванным функционально активными опухолями надпочечников, в целом старше животных, страдающих ГЗГ. Возраст большинства из них ко времени установления диагноза составлял 6-16 лет (медиана 11,6 лет), причем более 90° о этих животных были старше 9 лет (Reusch, Feldman, 1991).
Пол
От 55 до 60% собак с ГЗГ и 60-65% животных с активными опухолями коры надпочечников - суки (Reusch, Feldman, 1991).
ТАБЛИЦА 6-2. ПОРОДЫ СОБАК, У КОТОРЫХ ЧАЩЕ ВСЕГО РАЗВИВАЕТСЯ ГИПЕРКОРТИЦИЗМ ЗАВИСИМЫЙ ОТ ГИПОФИЗА (ВСЕ1 О 750 СОБАК)
Порода Число Процент
Пудели (разные породы) 119 16%
Таксы 84 11%
Терьеры (разные формы) 76 19%
Бигли 54 7%
Немецкие овиарки 48 6%
Лабрадоры-ретриверы 38 5%
Австралийские овчарки 36 5%
Мальтийские болонки 30 4%
Спаниели (разные породы) 28 4%
Шнауцеры 22 3%
Лхаса апсо 22 3%
Чихуахуа 19 2%
Ьостон-терьеры 18 2%
Золотистые ретриверы 15 2%
Ши-тцу 14 2%
Боксеры 12 2%
Другие породы (38 пород) 115 16%
Порода/вес тела
Гиперкортицизм, зависимый от гипофи ia. Собаки, у которых диагностировали ГЗГ, относятся к следующим породам: пудели (разные виды), таксы, терьеры (разные виды), бигли и немецкие овчарки. Сообщалось о повышенном риске заболевания ГЗГ у бостон-терьеров и боксеров. Как видно из табл. 6-2, ГЗГ встречается фактически у всех пород собак. Приблизительно 75° о собак с ГЗГ имеют вес менее 20 кг (Reusch, Feldman, 1991). Это подтверждает мнение, согласно которому ГЗГ чаше поражает собак небольшого размера. В то же время почти 50% собак с опухолями коры надпочечников неся г более 20 кг.
Гиперкортицизм надпочечникового генеза. В исследованной нами группе собак со спонтанным гиперкортицизмом, вызванным функционально активной опухолью коры надпочечников, преобладали той-пудели (и другие разновидности пуделей), немецкие овчарки, таксы, лабрадоры-ретриверы и разнообразные терьеры (табл. 6-3). Примерно 45-50% собак
Рис. 6-9. Годовалая собака с гиперкортицизмом, зависимым от гипофиза (слева) и нормальная взрослая собака Обратите внимание на маленький рост и недоразвитый шерстяной покров больной собаки. Из: Feldman ЕС: hr. Ettinger S (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1675.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 277
Рис. 6-10. А. Бсспоро тая собака в возрасте 18 месяцев с гипсркортицизмом. Б. Та же собака (слева) и з юро-вая собака из того же помета В. Та же собака через 5 месяцев после начала терапии о,р'-ДДД Г. Шестимесячная немецкая овчарка с гиперкортицизм. Д. Та же собака через 4 года в отсутствие лечения. Е. Та же собака через 4 месяца после начала терапии.
с активными опухолями весили более 20 кг. Относительное количество особей этого веса среди собак с аденомами и карциномами на шочечников было примерно одинаковым (Rcusch, Feldman, 1991).
АНАМНЕЗ
Существенные расстройства, отсутствующие в анамнезе
Прежде чем приступить к обсуж хению всех расстройств, имеющихся у собак с гиперкортищвмом, целесообразно рассмотреть нарушения, которых у них нет. Как правило, гиперкортицизм у собак нс считается угрожающим для жизни или даже тяже
лым состоянием. Хозяева почти никогда нс замечают снижения у таких животных аппетита , тошноту, рвоту, диарею, кашель, чихание, боль, судороги или кровотечение. Мы обследовали более 2000 собак и практически не наблюдали панкреатит или недостаточность функции почек (табл. 6-4). У большинства собак с синдромом Кушинга клиническая симптоматика развивалась очень медленно. Обычно эти симптомы носили стертый характер и не вызывали беспокойст ва у хозяев животных.
Общие сведения
Гиперкортицизм у взрослых собак. Хроническое воздействие избыточного количества кортизо-
278
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ТАБЛИЦА 6-3. ПОРОДЫ СОБАК, У КОТОРЫХ ЧАЩЕ ВСЕГО ВСТРЕЧАЮТСЯ ФУНКЦИОНАЛЬНО АКТИВНЫЕ АДЕНОМЫ И КАРЦИНОМЫ КОРЫ НАДПОЧЕЧНИКОВ, ВЫЗЫВАЮЩИЕ ГИПЕРКОРТИЦИЗМ (ВСЕГО 102 СОБАКИ)
Порода Процент
Пудели (разные породы) 16%
Немецкие овчарки 12%
Таксы 11%
Лабрадоры-ретриверы 10%
Терьеры (разные породы) 8%
Кокер-спаниели 5%
Аляскинские маламуты 4%
Бостон-терьеры 4%
Ши-тцу 4%
Боксеры 3%
Колли 3%
Английские спрингер- спаниели 3%
Австралийские овчарки 3%
Другие породы 15%
ТАБЛИЦА 6-4. РАССТРОЙСТВА, ОТСУТСТВУЮЩИЕ У СОБАК С ГИПЕРКОРТИЦИЗМОМ
Плохой аппетит/анорексия
Рвота
Диарея
Чихание
Кашель
Желтуха
Зуд
Боли
Хромота вследствие воспаления суставов
Судороги
Кровотечения
Почечная недостаточность
Панкреатит
Недостаточность функции печени
Иммунные расстройства
ТАБЛИЦА 6-5. ИСХОДНЫЙ АНАМНЕЗ СОБАК ГИПЕРКОРТИЦИЗМОМ
Полидипсия/полиурия
Полифагия
Большой живот
Повышенная утомляемость (мышечная
слабость)
Учащенное дыхание или одышка
Сонливость
Ожирение
Алопеция (не затрагивающая голову и дис-
тальные поверхности конечностей)
Кожный кальциноз
Анэструс
Атрофия семенников
Непереносимость жары
Акне (кожные инфекции, комедоны)
Гиперпигментация кожи
Экзофтальм
ла зачастую приводит к появлению классической комбинации мало заметных или ярко выраженных клинических признаков. Многие расстройства, связанные с повышенной концентрацией кортизола в крови, действительно сопровождаются «драматическими» клиническими проявлениями. К числу наиболее частых симптомов избыточной продукции кортизола (спонтанной или ятрогенной) относятся полидипсия, полиурия, полифагия, большой живот, алопеция, пиодерма, мышечная слабость, одышка и сонливость. Следует, однако, иметь в виду, что у собак с гиперкортицизмом клинические симптомы могут быть разными.
Лишь небольшой процент собак с «Кушингом» имеют почти все перечисленные симптомы; у большинства развиваются лишь некоторые из них (табл. 6-5). Гиперкортицизм - это клиническое расстройство, и у страдающих им животных имеется ряд сопутствующих клинических признаков. Мы подчеркиваем этот факт, потому что некоторые ветеринары рекомендуют начинать лечение синдрома Кушинга до появления клинических симптомов. Мы же считаем, что пока правомочность такого подхода не доказана тщательными независимыми исследованиями, он должен рассматриваться как необоснованный и даже опасный. Главная цель лечения синдрома Кушинга состоит в устранении его клинической симптоматики. Если клинические признаки заболевания отсутствуют, независимо от результатов биохимических анализов, диагноз синдром Кушинга не может считаться правильным.
Клинические признаки синдрома Кушинга являются следствием комбинированного глюко-неогенного, липолитического, катаболического, противовоспалительного и иммунодепрессивного действия глюкокортикоидных гормонов в различных органах. Заболевание развивается незаметно и характеризуется вялым течением. Хозяева заболевших животных обычно наблюдают типичные для гиперкортицизма изменения в течение периода от 6 месяцев до 6 лет, предшествующего установлению окончательного диагноза. Столь продолжительный интервал между появлением клинических признаков заболевания и обращением к ветеринарному врачу объясняется тем, что обычно они развиваются очень медленно и постепенно, и их нередко приписывают простому «старению» собаки. Владелец осознает необходимость ветеринарной помощи только тогда, когда больше не может мириться с изменением состояния собаки или узнает о нем со слов людей, которые редко видят животное (и потому объективно отмечают изменения, не замечаемые хозяином из-за их медленного развития). Чаще всего его побуждает обратиться к специалисту появление полидипсии/полиурии, полифагии, сонли-вости/одышки или изменения шерстяного покрова. Некоторые авторы сообщают о перемежающемся характере этих симптомов, с периодами ремиссии и рецидивов (Peterson et al, 1982b). Мы такого не наблюдали.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
279
Некоторые владельцы собак с ГЗГ или быстро растущими опухолями коры надпочечников отмечают острое возникновение и быстрое развитие клинических симптомов. Чаще всего оказывается, что долгое время они просто не обращали внимания на изменения состояния. Собаки способны компенсировать некоторые расстройства до тех пор, пока они не станут явными или пока хозяин не обнаружит, что изменения зашли слишком далеко. Наиболее наглядным примером такой ситуации служит полиурия у собак, которая может оставаться не замеченной до тех пор, пока животных держат вне дома. Однако, как только собаку берут в дом, владелец воспринимает полиурию как неожиданное, острое и явное расстройство. Между тем, оно не является таковым (в отличие от полиурии при диабете). Продолжительность и характер клинической симптоматики не могут служить надежными ориентирами для дифференциальной диагностики гиперкортицизма гипофизарного и надпочечникового генеза.
Гиперкортицизм у молодых собак. Гиперкортицизм чаще всего развивается у собак 6-8 лет и старше (средний возраст на момент установления диагноза превышает 11 лет). Мы выявили это заболевание только у пяти собак в первые 6-18 месяцев жизни (см. рис. 6-10). В дополнение к типичным симптомам болезни (т.е. полиурии/полидипсии, алопеции) у молодых собак отмечаются задержка роста и большой живот. У детей и подростков в такой ситуации также происходит отставание в росте и увеличение веса тела (Leinung, Zimmerman, 1994; Magiakou et al, 1994).
Полиурия и полидипсия
Полиурия и полидипсия - весьма обычные симптомы гиперкортицизма; именно они чаще всего побуждают владельцев животных обращаться за ветеринарной помощью. Полиурия причиняет гораздо больше неудобств, чем полидипсия. Как упоминалось выше, многие животные с этими расстройствами, ранее содержавшиеся вне дома, не способны удерживать мочу в течение ночи. Хозяевам приходится выводить их или позволять мочиться в доме, что быстро становится неприемлемым. Полидипсия и полиурия развиваются у 80-85% особей с ССК. При всем разительном сходстве течения гиперкортицизма у людей и собак, у первых полидипсия и полиурия не являются типичными клиническими проявлениями избыточной продукции кортизола.
Нормальное потребление воды у собак составляет в среднем 40-60 мл/кг веса тела. По сведениям, полученным от хозяев, животные с полидипсией и гиперкортицизмом пьют в 2-10 раз больше. Причина полидипсии до сих пор не выяснена. По мнению некоторых исследователей, она является следствием нарушения действия антидиуретического гормона (АДГ) под влиянием кортизола на уровне собирательных почечных канальцев (т.е. одной из форм нефрогенного несахарного диабета). Предпо
лагается также, что кортизол может повышать скорость клубочковой фильтрации и, таким образом, индуцировать диурез. По данным одной группы авторов, натриуретический пептид предсердия не является причиной полиурии (Vollmar et al, 1991), тогда как другие исследователи наблюдали увеличение концентрации этого пептида в крови людей с синдромом Кушинга (Yamaji et al, 1988).
Наш опыт показывает, что многие (но не все) собаки с полиурией и гиперкортицизмом страдают одной из форм несахарного диабета центрального генеза (недостаточностью АДГ). Такие животные реагируют на введение природного, а в последнее время и синтетического АДГ значительным снижением продукции мочи и потребления воды. Следовательно, действие кортизола на активность АДГ является наиболее вероятной причиной полиурии и полидипсии (Raff, 1987; Hughes, 1992).
Простое сдавливание задней доли гипофиза опухолью передней доли, так же как сдавливание гипоталамуса или его ножки, редко служит причиной несахарного диабета даже у собак с большой гипофизарной опухолью.
Полифагия
Обычно владельцы животных рассматривают повышенный аппетит своих питомцев как признак здоровья и, несмотря на другие отклонения, не обращаются за помощью к ветеринару Однако полифагия может причинять неудобства, поскольку собаки с синдромом Кушинга таскают пищу, едят отбросы, постоянно клянчат еду, а иногда становятся агрессивными, стремясь завладеть кормом или спрятать его. Считается, что повышение аппетита является прямым следствием усиленной продукции глюкокортикоидов. Этот эффект свойствен только собакам и отсутствует при избытке кортизола у кошек и людей. Полифагия имеет место более чем у 90% собак с синдромом Кушинга. Наиболее обычной причиной снижения аппетита или анорексии у собак с синдромом Кушинга является крупная гипофизарная опухоль, сдавливающая прилегающие структуры.
Иногда антиинсулиновое действие глюкокортикоидов может индуцировать субклинический (а в отдельных случаях и клинически выраженный) сахарный диабет. При этом у собак повышается аппетит как компенсация «голодания». По нашим данным, только 5% собак с синдромом Кушинга имеют явный сахарный диабет.
Большой живот
«Пузатая» фигура с отвислым животом - обычный облик человека с гиперкортицизмом. Этот классический признак встречается и более чем у 80% собак с указанным синдромом. Считают, что он является следствием суммарного прироста веса органов брюшной полости и ослабления ее мышечной
280 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
стенки под воздействием катаболического действия кортизола. Увеличение веса отчасти объясняется перераспределением жира, поступающего в сальник из других частей тела, отчасти - развитием гепатомегалии, а отчасти - чрезмерным растяжением мочевого пузыря.
Механизм перераспределения жира не вполне понятен, но результатом его является накопление больших жировых отложений в брюшной области. Причиной отвислого живота служит накопление брюшного жира и увеличение веса и размера печени (вторичное следствие действия кортизола), а также большой и хронически наполненный мочевой пузырь и истончение мышечной стенки (результат прямого действия кортизола). Накопление мочи частично обусловлено увеличением ее продукции (полиурия), а частично - уменьшением способности полностью опорожнять мочевой пузырь, ослабленный катаболическим действием кортизола в сочетании с выработанной у большинства собак привычкой мочиться только вне дома. Уменьшение толщины брюшной стенки и, следовательно, мышечная слабость обусловлены распадом белков. Брюшные мышцы, ослабленные под влиянием глю
кокортикоидов, просто не могут предотвратить выпячивание живота, как показано на рис. 6-11 и 6-12.
Мышечная слабость, сонливость и хромота
Обычные проявления. Мышечная слабость, сонливость и хромота редко вызывают серьезное беспокойство у владельцев животных. Собаки с гиперкортицизмом обычно сохраняют способность вставать на ноги и совершать небольшие прогулки. У маленьких собак мышечная слабость часто проявляется в неспособности подниматься по лестнице, запрыгивать на предметы домашней обстановки или в машину. При этом многие животные легко спускаются по лестнице, спрыгивают с мебели или выскакивают из машины. Зачастую владелец даже не замечает изменившегося поведения собаки, приписывая его избалованноеги или старению. Нередко уменьшается способность собак выдерживать физические нагрузки. Животные с гиперкортицизмом могут ходить, но устают при беге или длительных прогулках. Как и в случае растяжения брюшной стенки, мышечная слабость, по крайней мере, частично является следствием потери ткани в
Рис. 6-11. А. Пудель с гиперкортицизмом зависимым от гипофиза (ГЗГ). Фотография иллюстрируез «отвислый живот» и алопецию, не затрагивающую голову и дистальные поверхности ног. Б. Собака с Г31 Фотография иллюстрирует «отвислый живот» при синдроме Кушинга. Собака была пострижена владельцем за год до обследования. Обратите внимание на отсутствие роста шерсти. Из: Feldman ЕС: In: Ettinger S (ed): Textbook of Veterinary Internal Medicine, 2nd cd. Philadelphia, \\ В Saunders, 1983, p 1677.
Рис. 6-12. А. Собака с гиперкортицизмом. Б. У той же собаки в положении на боку хороню ви ден отвислый живот, характерный для гиперкортицизма
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 281
Рис. 6-13. Перелом гребня большеберцовой кости (А) у 18-месячной собаки с синдромом Кушинга (см. рис. 6-10) с частично закрывшимися эпифизами. Гиперкортицизм задерживает закрытие эпифизов у молодых собак; обратите внимание на нормальное коленное сочленение (Б).
процессе катаболизма белка. У собак с синдромом Кушинга эта потеря достигает 75-85%. Сонливость, по-ви шмому, есть отражение мышечной слабости и уменьшения мышечной массы. Многие собаки с гиперкортицизмом отличаются повышенной возбудимостью, но при этом мало активны. Этот слабый симптом большинство владельцев животных также принимают за признак старения.
Более выраженные, но менее обычные проявления. Иногда мышечная слабость бывает настолько сильной, что собака не может подняться на ноги, ей трудно стоять, она подолгу лежит, что приводит к появлению пролежней. Последние чаще появляются у крупных собак с синдромом Кушинга вследствие постоянного лежания и большого веса. При хроническом гиперкортицизме часто наблюдаются разрыв передней крестообразной связки и хромота при надколенном вывихе. У одной из наших собак с синдромом Кушинга произошел усталостный перелом эпифиза гребня большеберцовой кости, который нс сросся в молодом возрасте (рис. 6-13). У другой собаки имел место нетравматический разрыв обеих икроножных мышц (рис. 6-14) - явление, отмечаемое также при ятрогенной болезнь Кушинга (Rewerts et al, 1997).
Хромота до и после лечения. Многие старые собаки страдают хроническим дегенеративным заболеванием суставов и артритом. Гиперкортицизм может маскировать свойственные этим заболеваниям признаки, подавляя воспалительные процессы. Успешное лечение синдрома Кушинга «демаскирует» некоторые из таких скрытых признаков и возрастные заболевания суставов, о чем владельца животного следует предупредить до начала терапии.
Кожные маркеры гиперкортицизма
Алопеция и зуд. Количество имеющихся в литературе сообщений о случаях алопеции и других кожных расстройств у собак с гиперкортицизмом определяется степенью интереса авторов к данной проблеме. Одна группа дерматологов выявила кожные расстройства у всех 60 обследованных собак с гиперкортицизмом. при этом 80° о страдали той или иной формой алопеции, а у 25% имелся зуд, вызванный себореей, кожным кальцинозом, демодикозом или пиодермой (White et al, 1989). В то же время специалисты по внутренним болезням пишут, что у части собак с гиперкортицизмом отсутствуют выраженные дерматологические нарушения (Peterson, 1984; Reusch, Feldman, 1991). В любом случае, кожные расстройства у собак
Рис. 6-14. Собака с разрывом икроножных мышц, характерное вторичное явление при гиперкоргицизме.
282 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-15. А. Такса с ГЗГ и тяжелой двусторонней алопецией. Б. Та же собака через 2 месяца после начала терапии о,р’-ДДД. Из: Feldman ЕС: In: Ettinger S (ed): Textbook of Veterinary Internal Medicine, 2nd cd. Philadelphia, WB Saunders, 1983, p 1677.
распространены весьма широко, но обычно не сопровождаются зудом.
Владельцев собак часто беспокоит выпадение шерсти у их питомцев. Этот медленный процесс начинается в местах, наиболее подверженных трению (например, над выступающими частями скелета), и постепенно распространяется на боковые поверхности тела, живот и промежность. В конце концов, развивается тяжелая алопеция (рис. 6-15), при которой шерсть сохраняется только на голове и дистальной поверхности конечностей. У некоторых собак, особенно часто у такс, выпадает шерсть на ушах и у основания ушных раковин. Атрофия воло-
Рис. 6-16. Собака с симметричной двусторонней алопецией и гиперпигментации на боках и бедрах. (Из: Feldman ЕС: /и: Fttmger SJ (cd): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1677).
сяных фолликулов нередко захватывает открывающиеся в них сальные железы; при этом в атрофированных фолликулах накапливается кератин.
«Эндокринная алопеция» может быть связана с нарушениями функции щитовидной железы, яичников и семенников или продукции гормона роста, а также с гиперкортицизмом (см. гл. 2). Любое из этих расстройств, особенно гиперкортицизм, может привести к тяжелой или легкой (рис. 6-15 и 6-16) двусторонней симметричной алопеции, либо к нарушению роста и ухудшению состояния шерстяного покрова (рис. 6-17 и 6-18). Двусторонняя симметричная алопеция бывает и у кошек с синдромом Кушинга (рис. 6-19), но реже, чем у собак. Алопеция не все!да бывает двусторонней и симметричной и может не захватывать все туловище.
Отсутствие роста выбритом шерсти. При атрофии волосяного фолликула нарушается прикрепление к нему стержня волоса, что объясняет выпадение последнего и невозможность возобновления его роста. Выбритая шерсть растет медленно или
Рис. 6-17. Лабрадор-ретривер с гиперкортицизмом, вызванным функционально активной опухолью коры надпочечника, вторичной алопецией и ухудшением состояния шерстяного покрова. Обратите также внимание на отвислый живот. Из: Feldman ЕС: In: Ettinger S (cd): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1678.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 283
Рис. 6-18. Фотография крупным планом собаки, показанной на рис. 6-17.
Шерсть на затылке была выбрита за 8 месяцев до фотографирования перед удалением небольшой кожной опухоли. Обратите внимание на отсутствие роста новой шерсти и хорошо заметные послеоперационные шрамы, сформировавшиеся вследствие слабого заживления раны с образованием «стрий». Из: Feldman ЕС: br. Ettinger S (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia. WB Saunders, 1983, p 1679.
Рис. 6-19. Кошка с ГЗГ и необычным (для кошек) характером симметричной двусторон ней алопеции.
не растет совсем (см. рис. 6-11, Б и 6-18), а вновь отросшие волосы тонки, редки и хрупки.
Тонкая кожа, п иодерм а, себорея и демодикоз. Характерными последствиями гиперкортицизма у собак и кошек являются истончение кожи, медленное заживление ран (рис. 6-20) и повышенная чувствительность к инфекции. Кожа у таких животных тонкая и морщинистая, под ней иногда четко видны кровеносные сосуды. Кроме того, вокруг сосков и
Рис. 6-20. А. Восьмилетняя беспородная собака, получавшая хроническую глюкокортикоидную терапию. Б. Открытые незаживающие раны на вентральной поверхности живота. Плохое заживление ран, по-видимому, является следствием хронической глюкокортикоидной терапии.
вдоль спинной срединной линии нередко заметны заполненные кератином волосяные фолликулы (ко-медоны), иногда они просматриваются и в других частях туловища. IТиодерма регистрируется у 55° о собак с гиперкортицизмом. Кожная инфекция чаще всего локализуется вдоль срединой линии спины. Иногда она протекает в тяжелой форме, особенно если развивается в зонах гиперпигментации. Ситуация осложняется обычным при гиперкортицизме подавлением иммунной системы.
У взрослых животных демодикоз обусловлен ятрогенным и спонтанным гиперкортицизмом. Это заболевание встречается нечасто у взрослых собак и очень редко у собак с синдромом Кушинга. Одной из причин демодикоза является подавление иммунной системы, например, после противораковой терапии или при избытке кортизола. Поэтому при обнаружении у взрослой собаки клещей рода Demodex следует обследовать ее на наличие признаков синдрома Кушинга (Hillier, Deusch, 2002).
В одном из исследований истончение кожи было зарегистрировано у 13°о собак с гиперкортици шом. Более 33° о животных имели ту или иную форму себореи. а комедоны были обнаружены у 5° о собак (White et al, 1989). Как указывалось выше, у многих крупных собак с мышечной слабостью, значи-
284 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
гельную часть времени проводящих в лежачем положении, появляются пролежни, которые нередко инфицируются и очень медленно заживают или не заживают совсем. Для устранения пролежней необходимы лечение синдрома Кушинга и тщательный уход за животными, в частности использование мягкой подстилки во избежание дальнейшего травмирования.
Кровотечения, недостаток подкожного жира, стрии. Повышенная хрупкость тонкой кожи сочетается с хрупкостью подкожных сосудов. Венопункция (рис. 6-21) и другие мелкие травмы могут сопровождаться сильным кровотечением. Мы наблюдали ряд сук. которым до появления признаков синдрома Кушинга была произведена овариогис-терэктомия и у которых металлические швы вдоль вентральной срединной линии начинали кровоточить по мере развития гиперкортицизма (рис. 6-22, А и Б). Ситуация усугублялась из-за уменьшения объема подкожной ткани как следствия синдрома Кушинга. Раны заживали плохо, с образованием тонких, хрупких рубцов, напоминавших стрии у человека (рис. 6-22, В). Нередко заживающие кожные раны снова расходились из-за недостатка фиброзной ткани в месте образования рубца.
Кожный кальциноз и метапластическая ос-сификация кожи. Отложение кальция в коже и подкожных тканях встречается нечасто, но достаточно хорошо известно у собак с синдромом Кушинга. Отложения имеют вид твердых бляшек неправильной формы, локализованных в толще коже или под ней. Создается впечатление, что в зонах отложения кожа и подлежащие слои замещены кос I ной тканью. Обычно отложения кальция (известные как calcinosis cutis) локализуются в височных областях, вдоль срединной линии спины, на шее, вентральной поверхности живота и в пахе (рис. 6-23). Calcinosis cutis характеризуется дистрофическим отложением кальция. Механизм этого процесса ю конца не ясен, но, возможно, включает фазу преобразования растворенных ионов кальция и фосфатов в кристаллические агрегаты, которые затем оседают на матрицах кожного коллагена и эластина. Аналогичная кожная аномалия у людей, известная как метапластическая оссификация, характеризуется образованием в коже метапластических остеоидов.
Описаны две собаки с метапластической осси-фикацией кожи всле ютвис ятрогенного синдрома Кушинга. Костная метаплазия может рассматриваться как самостоятельный синдром или как вариант calcinosis cutis. У одной из двух собак имелись поверхностные зоны минерализации коллагена, отделенные от глубже лежащих слоев костной метаплазии. Исследование кожных биоптатов, полученных при жизни и после смерти обеих собак, выявило множественные остеоидные спикулы или минерализованные слоистые костные структуры с выстилкой из остеобластов и реже из остеокластов. Центральная часть некоторых очагов кожного
Рис. 6-21. Собака с гиперкортицизмом, у которой дважды брали пробы крови из яремной вины. Из: Feldman FC: In: Ettinger S (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1679.
обызвествления содержала элементы костного мозга или гаверсовы каналы с кровеносными сосудами (Frazier et al, 1998).
Ожирение
Хозяева собак с гиперкортицизмом часто жалуются на «прибавку веса» у животных. На самом деле увеличение веса при этом заболевании обычно не очень значительно. Скорее имеет место перераспределение жира, о чем говорилось выше, и появление отвислого живота, что делает собаку зрительно более полной. Общее ожирение является одним из классических симптомов синдрома Кушинга (см. рис. 6-11, 6-12 и 6-15). У собак и людей оно развивается за счет уменьшения мышечной и жировой массы на конечностях и в подкожных тканях. Истинное ожирение имеет место менее чем у половины всех собак.
Дыхательные расстройства
Одышка
Дифференциальная диагностика. У собак с гиперкортицизмом нередко огмечается одышка или учащенное дыхание (тахипноэ). Существует несколько объяснений этого явления. Одно простое и логическое предположение основывается на концепции, согласно которой у собак с синдромом
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 285
Рис. 6-22. А. Кровоточивость в зоне разреза для овариогистерэктомии. Собака была оперирована за 9 лет до фотографирования, а кровотечения начались спустя 8,5 лет. Б. Зона кровоточивости крупным планом. Кровотечение вдоль металлического шва, усугублявшееся из-за уменьшения количества подкожного жира, который обычно подстилает шов. В: Тонкий, хрупкий шов, характерный для плохого зажив гения ран у собак с гиперкортицизмом и напоминающий стрии у человека.
Кушинга слитком велики жировые отложения в грудной области, уменьшена мышечная масса и ослаблены мышцы, принимающие участие в дыхании. Любой из этих факторов может служить причиной тахипноэ. Нарушение механизмов вентиляции еще более усугубляется повышенным давлением жировых отложений в области живота на диафрагму и сопутствующей гепатомегалией. Однако владельцы относительно редко жалуются на кашель у собак. Другими причинами рассматриваемых дыхательных расстройств могу г быть минерализация интерстициальное легочной ткани, заболевание легких или тромбоэмболия.
Легкие дыхательные расстройства усиливаются из-за значительного уменьшения резервного объема выдоха и расслабления грудной стенки, приводящего к затруднению дыхания. У таких собак обычно отмечают спадение трахеи (особенно частое у мелких пород), что в сочетании с дистрессом выдоха и увеличением веса органов брюшног полости, сдавливающих диафрагму, может вызывать выраженное расстройство дыхания. Описанное состояние часто
развивается также в тех случаях, когда у собаки с отвислым животом имеется хронический порок митрального и/или трехстворчатого клапанов сердца. Оно еще более осложняется в условиях стрсссорно-го возбуждения или физической нагрузки. В ветеринарной литературе имеются сообщения о синдроме сильного ожирения, альвеолярной гиповентиляции цианоза, вторичной полицитемии и сердечной недостаточности. Такое клиническое состояние у человека называется пикквикским синдромом. Характерная для этого синдрома симптоматика часто наблюдается у собак с синдромом Кушинга.
Легочная сцинтиграфия. При микроскопическом исследовании более чем у 90° о собак со спонтанно развившимся синдромом Кушинга выявляется минерализация интерстициальной ткани легких. У четырех собак с этим синдромом минерализация легочной ткани была диагностирована с помощью рентгенографии грудной клетки или по изменениям на сканограммах, полученных методом отложенной сцинтиграфии kocthof фазы (Berry et al, 1994). Предполагается, что изменения в интерстиииальнои
286 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-23. А и Б. Зона выраженного изменения кожи вследствие calcinosis cutis. В. Рентгено! рамма, на которой видны дорсальная срединная линия (прямая стрелка), кальциноз крайней плоти (светлая кривая стрелка) и кальцифицированные бедренные артерии (темные кривые стрелки).
соединительной ткани легких, вызванные постоянной избы 1 очной продукцией кортизола, приводят к дистрофической минерализации и, таким образом, уменьшают насыщение крови кислородом.
В более позднем исследовании, включавшем 21 собаку, использовали рентгенографию, анализ газового состава крови и два разных типа сцинтиграфии легких (Berry et al, 2000). У семи собак обнаружили гипоксемию, у 15 - рентгенологические признаки минерализации бронхов, а у шести - тяжелое генерализованное поражение интерстициальной легочной ткани. Две из этих шести собак входили в группу животных с гипоксемией и имели ренл сноконтрастную интерстициальную ткань, что свидетельствовало о процессе минерализации в легких. Таким образом, у некоторых собак с ГЗГ минерализация может способствовать развитию гипоксемического состояния.
Тромбоэмболия. Тромбоэмболия-хорошо известное явление у собак и людей с синдромом Кушинга (Burns et al, 1981; Small et al, 1983; Dennis,
1993). У собак с легочной тромбоэмболией развивается либо хроническая симптоматика, либо острое, тяжелое расстройство дыхания. Вопросы патогенеза и лечения тромбоэмболии рассматриваются в разделе «Легочная тромбоэмболия (ЛТЭ)».
Тестикулярная атрофия у самцов и расстройство циклов у самок
Кобели с синдромом Кушинга обычно имеют небольшие, мягкие, рыхлые семенники, а у сук с тем же заболеванием прекращаются эстральные циклы. Зачастую продолжительность анэструса отражает длительность гиперкортицизма. Хозяев очень редко беспокоят изменения репродуктивной системы собак, поскольку многие такие животные стары и/или кастрированы. Владельцы некастрированных животных либо нс подозревают о наличии расстройства, либо приписывают упомянутые нарушения старению животного.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 287
Более подробное обсуждение репродуктивных расстройств можно найти в главе «Физикальное обследование».
Миотония (ложная миотония)
У отдельных собак с гиперкортицизмом развивается выраженная миотония, характеризующаяся устойчивым сохранением мышечной контрактуры после прекращения произвольного усилия (это явление было отмечено у восьми из более 2000 обследованных нами собак с синдромом Кушинга). В анамнезе этих животных имелись указания на скованную походку (особенно вследствие слабой подвижности задних конечностей) в сочетании с другими признаками синдрома Кушинга. Одна из этих собак вообще нс могла двигать задними ногами (рис. 6-24). Ригидность мускулатуры задних конечностей легко выявляется при наружном осмотре животных. Электромиография выявляет аномальные высокочастотные миотонические разряды. Результаты гистологического, электронномикроскопического и гистохимического исследований мышечной ткани некоторых собак с «миотонией Кушинга» свидетельствуют о невоспалительной дегенеративной миопатии. Вероятность улучшения этого состояния при коррекции синдрома Кушинга не поддастся прогнозу. Причина данного необычного явления при гиперкортицизме неизвестна.
Лицевой паралич
Изредка у собак с синдромом Кушинга развивается одно- или двусторонний лицевой паралич. Это клиническое состояние не изучено. Обзор других неврологических проблем представлен в главе, посвященной нарушениям в центральной нервной системе.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Обзор
Физикальное обследование типичной «кушингоидной собаки» выявляет крепкую, необезвоженную особь с типичной окраской слизистых оболочек и нормальным эмоциональным состоянием. При этом обычно подтверждаются многие признаки заболевания, замеченные владельцем собаки: большой живот, одышка, ожирение, двусторонняя симметричная алопеция, кожная инфекция и комедоны (волосяные фолликулы, заполненные кератином и иными продуктами распада), которые, как правило, окрашены в черный цвет и бросаются в глаза. Другие изменения, не замеченные владельцем, но выявляемые специалистом, включают гиперпигментацию, тестикулярную атрофию и гепатомегалию. Реже встречаются эктопическая кальцификация, гипертрофия клитора и кровоточивость (табл. 6-6). Количество и тяжесть этих изменений значительно
Рис. 6-24. Одиннадцатилетняя собака с гиперкортицизмом и ложной миотонией, приведшей к выраженной ригидности мускулатуры задних конечностей и неспособности ходить
варьируют. Одни собаки имеют только какой-нибудь один из перечисленных признаков, а у других их число может доходить до десяти.
Г иперпигментация
Гиперпигментация может быть диффузной или локальной (см. рис. 6-10, Д и 6-15, А). Гистологическое исследование выявляет повышенное количество меланоцитов в роговичном слое, базальном эпидермисе и кожных тканях. Гиперпигментация регистрируется у собак с синдромом Кушинга как гипофизарного, так и надпочечникового генеза. Маловероятно поэтому, что единственной причиной гиперпигментации является избыточная секреция а-МСГ - побочного продукта биосинтеза АКТГ (см. рис. 6-2).
Гепатомегалия
Увеличенная печень - это классический симптом гиперкортицизма у собак, который вносит свой вклад в увеличение живота. Обычно у таких собак печень имеет большие размеры, бледную окраску,
ТАБЛИЦА 6-6. РЕЗУЛЬТАТЫ ФИЗИКАЛЬНОГО ИССЛЕДОВАНИЯ СОБАК С ГИПЕРКОРТИЦИЗМОМ
Тонкая кожа
Симметричная двусторонняя алопеция Акне (кожные инфекции, комедоны) Гиперпигментация кожи
Кожный кальциноз
Большой живот
Уменьшение мышечной массы конечностей
Гепатомегалия
Одышка
Кровоточивость
Экзофтальм
Атрофия семенников
Гипертрофия клитора
288
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
рыхлую структуру и сильно вздута. Слабая мускулатура брюшной стенки облегчает выявление гепатомегалии при пальпировании. У некоторых собак печень так велика, что заставляет ветеринара предполагать наличие опухоли. Помимо физикального обследования, гепатомегалия диагностируется с помошью рентгенологического и ультразвукового исследований. Если у собаки с подозрением на синдром Кушинга гепатомегалия отсутствует или печень имеет маленький размер, то следует подозревать другое расстройство или серьезное сопутствующее заболевание (например, дефект полой вены) (Sterczer et al, 1998).
Гистологические изменения, выявляемые в биоптатах печени собак со спонтанным или ятрогенным избытком глюкокортикоидов, достаточно постоянны. При обнаружении группы таких изменений заболевание, скорее всего, вызвано избытком стероидных гормонов и дифференциальная диагностика включает мало других возможных причин болезни. К этим гистологическим изменениям относятся центрилобулярная вакуолизация гепатоцитов с образованием нескольких или, зачастую, одной большой вакуоли, вызывающей смещение ядра на периферию клетки. В околопортальных гепатоцитах накапливается гликоген. Окрашивание Суданом III не выявляет отложения липидов. Некроз гепатоцитов выражен слабо (Badylak, Van Vleet, 1981). Результаты ультраструктурных исследований гепатоцитов собак со «стероидной ге-патопатией» свидетельствуют о прогрессирующих изменениях плазматических мембран и других субклеточных органелл, массированном накоплении гликогена и небольшом количестве митохондрий в гепатоцитах (Rutgers et al, 1955; Badylak, Van Vleet, 1981). Вакуолизация гепатоцитов, сама по себе, может быть обусловлена разнообразными факторами. «Стероидная гепатопатия» предполагает хронически повышенную концентрацию глюкокортикоидов в крови, однако она развивается не у всех собак с синдромом Кушинга.
Атрофия семенников, анэструс и гипертрофия клитора
Общие сведения. Андрогены надпочечников (андростендион, дегидроэпиандростерон и сульфат дегидроэпиандростерона) обладают низкой биологической активностью. Эти стероиды играют, главным образом, роль предшественников в процессах периферического синтеза активных андрогенных гормонов: тестостерона и дигидротестостерона. Часть сульфата дегидроэпиандростерона, секретируемого надпочечниками, поступает в периферические ткани, где превращается в дегидроэпиандростерон, который вместе с дегидроэпиандростероном, синтезируемым в коре надпочечников, преобразуется в андростендион. Образующийся андростендион и является непосредственным предшественником активных андрогенов (Aron et al, 2001b).
Самцы. Высокая концентрация кортизола в крови по механизму отрицательной обратной связи подавляет секрецию гипофизарных гонадотропинов (ЛГ и ФСГ) (Meij et al, 1997а, 1997с). Это приводит к тестикулярной атрофии, снижению либидо и уменьшению концентрации тестостерона в крови у кобелей. При этом понижается секреция андрогенов из семенников и усиливается их секреция надпочечниками. Однако образование тестостерона из андрогенов надпочечников не превышает 5% его общей продукции. Поэтому физиологический эффект синтезируемых в надпочечниках андрогенов у самцов весьма невелик, тогда как снижение андрогенов в семенниках имеет серьезные последствия. Конечным результатом этого процесса является «феминизация» самцов. Было показано, что средняя концентрация тестостерона в плазме крови здоровых кобелей составляет в среднем 4,7 нг/мл, а у собак с синдромом Кушинга она значительно меньше (1,2 нг/мл) (Feldman, Tyrrell, 1982).
Самки. У самок при гиперкортицизме, как и у самцов, секреция гипофизарных гонадотропинов снижена по механизму отрицательной обратной связи. Это приводит к подавлению нормальной функции яичников и продолжительному анэструсу. У сук с ГЗГ развивается гиперпролактинемия, которая, по-видимому, тоже способствует угнетению функции яичников (Meij et al, 1997а, 1997с). Продукция андрогенов в яичниках остается нормальной, тогда как вклад надпочечников в общую продукцию андрогенов при синдроме Кушинга у сук возрастает. Периферическое превращение надпочечниковых андрогенов является причиной повышенной продукции активных стероидов и вирилизации самок. У некоторых сук с этим расстройством имеет место гипертрофия клитора, а у одной описаны околоанальные аденомы и гипер-тестостеронемия, обусловленные гиперкортицизмом (Dow et al, 1988). Средняя концентрация тестостерона в плазме крови здоровых сук составляет 20 пг/мл, а у сук с ССК гораздо выше и достигает 30 пг/мл (Feldman, Tyrrell, 1982).
Эктопический кальциноз
В дополнение к кожному кальцинозу вследствие гиперкортицизма, возможна эктопическая кальцификация колец трахеи и стенок бронхов (см. раздел «Дыхательные расстройства»), почек, и иногда главных артерий и вен (рис. 6-23,В). У одних собак эктопическое обызвествление можно выявить только гистологическими методами, тогда как у других оно заметно при рентгенографии или УЗИ. У двух собак с гиперкортицизмом описана кальцифицирующая лентовидная кератопатия - синдром, при котором в пространстве между веками заметно поверхностное горизонтальное помутнение роговицы сероватого цвета (Ward et al, 1989).
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 289
Кровоточивость
Повышенная кровоточивость является одним из «классических» симптомов синдрома Кушинга у человека. У собак она отмечается нечасто, но может иметь место после венопункции или любой травмы (см. рис. 6-21 и 6-22). Это объясняет трудность заживления ран при данном заболевании, которая обусловлена подавлением грануляции ткани под воздействием избыточного количества глюкокортикоидов (см. рис. 6-20 и раздел «Кожные маркеры гиперкортицизма»).
Синдром внезапной приобретенной дегенерации сетчатки (СПДС)
СПДС - это поражение сетчатки неизвестной этиологии, которое приводит к неожиданной и необратимой слепоте у взрослых собак. Синдром характеризуется невоспалительной дегенерацией и утратой фоторецепторов сетчатки. Имеется предположение о связи СПДС с гиперкортицизмом (Mattson et al, 1992). В нашей клинике на протяжении 9-летне-го периода (с 1990 до 1998 г.г.) была обследована группа из 44 собак с СПДС.
16 из них имели в анамнезе, а также по данным физикального исследования и/или биохимического анализа сыворотки крови как минимум одно расстройство, характерное для синдрома Кушинга. У восьми из этих 16 собак (18% от общего состава группы) синдром Кушинга был подтвержден, по меньшей мере, в одном эндокринологическом скрининговом исследовании (Holt et al, 1999). Возможно, однако, что внезапная слепота просто побуждает некоторых собак слишком много пить и есть, и между нею и синдромом Кушинга нет никакой связи. В любом случае наши данные свидетельствуют о необходимости тщательного опроса владельцев собак с СПДС относительно признаков синдрома Кушинга, а также исследования мочи и биохимического профиля сыворотки у этих животных.
Острая слабость вследствие нетравматического разрыва опухолевидной надпочечниковой массы
Нетравматический разрыв опухоли надпочечников случается редко. У всех 4 собак с разрывом опухоли отмечались выраженная сонливость, слабость и обесцвечивание слизистых оболочек. Физикальное обследование выявило боль в животе. У двух из четырех собак имелись карциномы надпочечников, а у одной из этих двух - слабые признаки гиперкортицизма в анамнезе до появления острых симптомов заболевания. Все 4 собаки страдали острым внутрибрюшинным или забрюшинным кровотечением, требовавшим неотложной поддерживающей терапии с последующей срочной диагностической операцией на органах брюшной полости (Whittemore et al, 2001). При всей редкости такого осложнения,
оно представляет собой одну из немногих ситуаций (наряду с легочной тромбоэмболией), при которой у собаки с синдромом Кушинга может развиться острое, угрожающее жизни состояние.
«РУТИННЫЕ» АНАЛИЗЫ КРОВИ И МОЧИ
Общие подходы
Состояние любой собаки с подозрением на гиперкортицизм (ССК) подлежит тщательной оценке, которая должна предшествовать назначению гормональной терапии. Предположительный диагноз ССК всегда ставится на основании изучения анамнеза и результатов физикального обследования. Клинико-патологическое исследование собак с подозрением на ССК включает общий клинический анализ крови (ОАК), анализ и посев мочи и биохимический анализ сыворотки с целью определения ферментов печени, тестирования функции почек, измерения концентраций кальция, фосфора, натрия, калия, холестерина, глюкозы, общего белка, альбумина и общего билирубина в плазме крови. В дополнение к анализу крови и мочи проводят УЗИ брюшной полости (отдавая ему предпочтение перед рентгенологическим исследованием).
В случае обнаружения при этих скрининговых исследованиях большого числа нарушений, характерных для синдрома Кушинга, ветеринар ставит соответствующий предварительный диагноз (табл. 6-7). Для его подтверждения и выяснения причины заболевания клиенту предлагают провести более сложные и дорогостоящие исследования. Результаты первоначального обследования не только помогают ветеринару правильно вести дальнейшую диагностику, но и направляют его внимание на возможные сопутствующие нарушения. Последние могут быть как типичными для гиперкортицизма (например, инфекции мочевого тракта), так и неожиданными (например, врожденная сердечная недостаточность). В любом случае их нельзя игнорировать.
Общий клинический анализ крови (ОАК)
Избыточная продукция кортизола приводит к нейтрофилии и моноцитозу вследствие усиливаемой им капиллярной демаргинации этих клеток и последующей блокады их нормального выведения из циркуляции. Лимфопения скорее всего является результатом индуцированного кортизолом лимфолиза, а эозинопения - следствием секвестрации эозинофилов костным мозгом. Такое изменение содержания лейкоцитов получило название «стрессорной реакции». Количество лимфоцитов и эозинофилов снижено примерно у 80% собак с гиперкортицизмом; а у 20-25% собак повышено общее количество лейкоцитов. Количество эритроцитов остается в норме, хотя иногда отмечается слабая полицитемия, обусловленная описанными в предыдущих разделах нарушениями дыхания, а у самок допол-
290 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ТАБЛИЦА 6-7. ХАРАКТЕРНЫЕ ДЛЯ ГИПЕРКОРТИЦИЗМА ГЕМАТОЛОГИЧЕСКИЕ РАССТРОЙСТВА, ИЗМЕНЕНИЯ БИОХИМИЧЕСКОГО ПРОФИЛЯ СЫВОРОТКИ И СВОЙСТВ МОЧИ, НАРУШЕНИЯ, ВЫЯВЛЯЕМЫЕ ПРИ РЕНТГЕНОГРАФИИ И УЗИ*.
Тест Нарушение
Общий клиничес- Выраженный лейкоцитоз
кий анализ крови Нейтрофилия Лимфопения Эозинопения Эритроцитоз, слабый (самки)
Биохимический Повышенная активность щелочной
анализ сыворотки фосфатазы (иногда очень высокая)
крови Повышенная активность АЛТ (СГПТ) Повышенная концентрация холестерина Повышенная концентрация глюкозы натощак Повышенная или нормальная концентрация инсулина Повышенная концентрация желчных кислот Пониженная концентрация AM Липемия
Анализ мочи Удельный вес мочи менее 1,015, часто менее 1,008 Инфекция мочевого тракта Гликозурия (менее чем в 10% случаев)
Рентгенологическое Гепатомегалия
и ультразвуковое Выраженная контрастность органов
исследования брюшной полости Отвислый живот Растянутый мочевой пузырь Остеопороз Кожный кальциноз, дистрофическая кальцификация Обызвествление надпочечников (обычно опухоли надпочечников) Застойная сердечная недостаточность (редко) Легочная тромбоэмболия (редко) Обызвествление трахеи и главных бронхов Метастазирование легких карциномой надпочечников
Прочие Низкие концентрации Т3 и Т4 Ответ на ТТГ параллельный нормальному, но показатели до и после стимуляции могут быть снижены Гипертензия
* Указанные изменения не встречаются одновременно у одного и того же животного
нительно стимуляцией костного мозга андрогенами. У многих собак с ССК количество тромбоцитов увеличено и иногда превышает 5ОООООх1О3/мкл. Физиологическое значение такого тромбоцитоза неизвестно.
Глюкоза и инсулин в сыворотке крови
Глюкокортикоиды стимулируют глюконеогенез в печени, повышают концентрацию глюкозы в кро
ви и уменьшают ее периферическую утилизацию, т.е. действуют как антагонисты инсулина. По этой причине у собак с гиперкортицизмом концентрация глюкозы натощак обычно несколько повышена, что, однако, не имеет клинических последствий. Умеренное противодействие инсулину и слабая гипергликемия легко выявляются путем определения содержания гликозилированного гемоглобина. Количество гликозилированного гемоглобина, которое коррелирует со средней концентрацией глюкозы в крови на протяжении предшествовавшего периода, увеличено у собак со спонтанным синдромом Кушинга в отсутствие явного сахарного диабета (Elliott et al, 1997).
У небольшого числа собак с синдромом Кушинга имеется явный сахарный диабет. Гликозурия развивается, когда превышен порог резорбции глюкозы почками (180-220 мг/100 мл). Проводилось сравнительное исследование уровня глюкозы и инсулина у здоровых собак и животных с синдромом Кушинга без диабета (не имевших глюкозы в моче). У первых средняя концентрация инсулина в крови в утренние часы натощак составляла 12 мкЕд/мл, а у собак со спонтанно развившимся гиперкортицизмом 38 мкЕд/мл. Концентрация глюкозы в плазме крови собак этих групп составляла соответственно 85 и 111 мг/100 мл (Feldman, Tyrrell, 1982).
Эти данные были подтверждены в последующем исследовании, в котором у собак с синдромом Кушинга определяли содержание С-пептида. С-пептид играет роль «связки», соединяя две аминокислотные цепи инсулина в процессе его синтеза. Поскольку С-пептид является частью молекулы проинсулина, он синтезируется и высвобождается панкреатическими В-клетками одновременно с инсулином в эквимолярных количествах. Внутривенное введение глюкагона восьми собакам с синдромом Кушинга вызывало аномально высокое повышение концентрации глюкозы, С-пептида и инсулина в плазме крови (Montgomery et al, 1996). Это подтверждает справедливость гипотезы, согласно которой хронический избыток кортизола в крови, вызывающий ССК, индуцирует у собак «состояние преддиабета». У большинства собак с синдромом Кушинга повышенная секреция инсулина частично компенсирует нарушенную толерантность к углеводам, но может быть недостаточна для полной нормализации гликемии. Это нарушение обычно устраняется при успешной терапии синдрома Кушинга.
Несмотря на все сказанное, определение концентрации инсулина в сыворотке крови у собак натощак для уточнения диагностики сомнительных случаев гиперкортицизма приносит мало пользы. Ее повышение имеет место менее чем у половины животных с этим заболеванием (Feldman, Tyrrell, 1982; Montgomery et al, 1996). Кроме того, любое повышение уровня инсулина следует рассматривать как неспецифический признак, который может быть обусловлен самыми разными причинами.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 291
Азот мочевины в крови (AM)
Стимулируемый глюкокортикоидами диурез сопровождается непрерывной потерей азота мочевины из крови с мочой. Полиурия является обычным расстройством, и у большинства собак обусловлена, по-видимому, обратимой формой центрального несахарного диабета. У всех старых собак необходимо проводить дифференциальную диагностику полидипсии, полиурии и удельного веса мочи в пределах 1,008-1,020 от нарушения функции почек. Поскольку у большинства собак с синдромом Кушинга концентрация AM (также как креатинина) остается в норме или понижена, анализ биохимического профиля сыворотки позволяет быстро исключить почечную недостаточность.
Тем не менее, иногда у собак гиперкортицизм сочетается с недостаточностью функции почек. В таких случаях после подтверждения синдрома Кушинга основную трудность вызывает выбор терапии, поскольку синдром Кушинга благоприятствует функционированию почек. Иными словами, синдром Кушинга может быть единственной причиной сохранения у собаки аппетита, поддержания веса тела и гидратации. Лечение такой собаки может принести больше вреда, чем пользы, вызвав снижение аппетита, уменьшение скорости почечного кровотока и/или просто утрату неуловимого ощущения «благополучия». Мы не назначаем лечение собакам с синдромом Кушинга и сопутствующей почечной недостаточностью, если только не имеется веских оснований для отступления от этого принципа.
Аланинаминотрансфераза (АЛТ)
При СКС активность АЛТ, как правило, слабо увеличена (<400 МЕ/л). Считается, что это происходит вследствие набухания гепатоцитов, накопления гликогена или изменения скорости кровотока в печени. Некроз гепатоцитов - второстепенный, но существенный признак «стероидной гепатопатии», также встречается достаточно часто и может быть причиной слабого повышения активности АЛТ (Badylak, VanVleet, 1981).
Щелочная фосфатаза в сыворотке крови (ЩФ)
Источники. Щелочные фосфатазы (ЩФ) сыворотки крови представляют собой группу ферментов крови, катализирующих гидролиз фосфатных эфиров. Основным источником ЩФ в крови служит печень; небольшое количество ЩФ поступает в кровь из костной ткани. ЩФ из обоих источников имеет период полужизни в крови около 3 дней. ЩФ из кишечника, плаценты и почек в кровь не поступает, так как период ее полужизни обычно не превышает нескольких минут (Hoffmann et al, 1988).
Скорость продукции ЩФ у собак с гиперкортицизмом возрастает вследствие отложения гликоге
на в печени и вакуолизации, влияющих на желчные протоки (Solter et al, 1994b). Избыток циркулирующего кортизола увеличивает содержание ЩФ в сыворотке крови, но при этом концентрация желчных кислот в печени не возрастает, и поэтому вряд ли они влияют на продукцию и выделение фермента в кровь. Другими причинами повышения концентрации ЩФ в сыворотке служат рост костей у молодых собак, первичная гепатопатия, вызывающая холестаз (воспаление, цирроз, липидоз), панкреатит, сахарный диабет, аномальная остеолитическая активность (гиперпаратиреоз, опухоли костной ткани: саркомы и карциномы), а также образование изоферментов ЩФ под воздействием противосудорожных лекарственных средств и стероидов.
Индуцируемая кортикостероидами щелочная фосфатаза. Главной причиной повышения активности ЩФ в крови у собак при гиперкорти-цизме является индукция синтеза ее специфических изоформ в печени эндогенными или экзогенными глюкокортикоидами. Синтез ЩФ в почках и слизистой кишечника усиливается также у собак, получающих преднизон (Wiedmeyer et al, 2002). У собак с гиперкортицизмом от 70 до 100% ЩФ сыворотки крови представлено печеночной ЩФ, специфически индуцируемой стероидами. Субклеточным источником этого изофермента ЩФ являются мембраны гепатоцитов, выстилающих внутрипеченочные желчные протоки. Этот индуцируемый кортикостероидами изофермент ЩФ имеется только у собак (Teske et al, 1989). Активность ЩФ служит одним из наиболее распространенных биохимических маркеров, используемых при скрининге на наличие заболеваний печени. Возможность различать индуцируемый стероидами и печеночные изоферменты ЩФ может иметь важное диагностическое значение. Надежным способом дифференциации этих изоферментов является термическая инактивация (Teske et al, 1989). Если установлено индуцируемое стероидами повышение активности ЩФ в сыворотке крови, можно не продолжать дальнейшее лабораторное исследование с целью характеристики расстройства печени.
Увеличение активности ЩФ в сыворотке крови является наиболее частым нарушением, выявляемым в ходе лабораторных исследований при ССК (Teske et al, 1989). Активность ЩФ повышена у 90-95% собак с гиперкортицизмом (см. табл. 6-7). Примерно у 85% животных с ССК активность ЩФ превышает 150 МЕ/л; нередко она бывает выше 1000 МЕ/л, а в группе собак, обследованных в нашей клинике, она составляла в среднем около 1100 МЕ/л. Активность ЩФ не коррелирует ни с тяжестью синдрома Кушинга, ни с реакцией на терапию, ни с прогнозом заболевания. Кроме того, у некоторых собак с гиперкортицизмом концентрация ЩФ остается в норме. Причина разной концентрации ЩФ в сыворотке крови собак с синдромом Кушинга остается неясной.
292 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Несколько исследований было посвящено оценке клинической значимости определения активности индуцируемой стероидами щелочной фосфатазы (ИСЩФ). Эти исследования дали довольно сходные результаты. В частности, чем больше повышение активности ЩФ в сыворотке крови, тем достовернее результаты определения ИСЩФ.
Концентрация ИСЩФ повышена почти у всех собак с синдромом Кушинга, поэтому метод считается весьма чувствительным. В то же время он неспецифичен (рис. 6-25). Концентрация ИСЩФ возрастает не только при первичных гепатопатиях, но и при других эндокринных заболеваниях (например, при сахарном диабете), а также при использовании противосудорожных препаратов, таких как фенобарбитал, фенитоин и примидон (Muller et al, 2000а, 2000b). Однако главная трудность при аномально высокой концентрации ИСЩФ состоит в невозможности дифференцировать три заболевания, которые обычно путают со спонтанным гиперкортицизмом, а именно: ятрогенный синдром Кушинга, сахарный диабет и гипотиреоз (рис. 6-25). Большинство исследователей пришли к выводу, что если ИСЩФ в сыворотке крови отсутствует, то диагноз гиперкортицизм можно исключить. Од
нако повышенная концентрация этого изофермента может быть вызвана самыми разными факторами и потому должна рассматриваться в качестве неспецифического показателя (Oluju et al, 1984; Teske et al, 1989; Jensen, Poulsen, 1992; Wilson, Feldman, 1992; Solter et al, 1994a, 1994b).
Холестерин, триглицериды и липемия
Стимуляция липолиза глюкокортикоидами приводит к повышению концентраций липидов и холестерина в крови. Высокая концентрация холестерина обнаружена у 90% обследованных собак с синдромом Кушинга. Примерно у 10% таких животных она не превышает 250 мг/100 мл, у 15% составляет от 250 до 300 мг/100 мл, а у 75% выше 300 мг/100 мл (рис. 6-26) (Ortega et al, 1995а). Липемия (т.е. гипертриглицеридемия) встречается, по меньшей мере, столь же часто, как повышенная концентрация сывороточного холестерина (рис. 6-26), и может влиять на точность измерений некоторых других параметров сыворотки (в зависимости от используемой методики). К числу таких параметров относятся количество эритроцитов, содержание гемоглобина, эритроцитарный индекс, общее содержание белков
тицизм коидами
тицизм коидами
Рис. 6-25. А. Активность индуцируемой стероидами щелочной фосфатазы (ИСЩФ) в сыворотке крови у собак со спонтанным гиперкортицизмом, у животных, получающих хроническую глюкокортикоидную терапию, у собак с заболеванием печени или сахарным диабетом (приведены средние значения и разброс). Б. Отношение прироста концентрации ЩФ под действием стероидов (в процентах) к общей концентрации ЩФ в тех же четырех группах собак. Из графиков следует, что ИСЩФ может служить чувствительным маркером синдрома Кушинга (у собак с этим заболеванием ее концентрация сильно увеличена), однако тест не специфичен (такие же изменения концентрации ЩФ могут быть при других патологиях).
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 293
в плазме, содержание альбумина, общего билирубина, щелочной фосфатазы, кальция, фосфора, амилазы, липазы, натрия и задержка сульфобромофталеина (СБФ).
Фосфат в сыворотке крови
Гипофосфатемия регистрируется примерно у трети собак с гиперкортицизмом (Peterson, 1984). Она может быть следствием индуцированного глюкокортикоидами усиления экскреции фосфатов с мочой. Однако у нас создалось впечатление, что нижний предел нормальной концентрации фосфата в сыворотке крови сильно отличается в различных лабораториях. Возможно, этим объясняется, что концентрация фосфата в сыворотке почти всех обследованных нами собак со спонтанно развившимся синдромом Кушинга была в пределах нормы. Сложнее обстоит дело с собаками, у которых подозревают синдром Кушинга при повышенной концентрации фосфатов в сыворотке. Чаще всего повышение концентрации фосфатов объясняют недостаточностью функции почек, что, однако, чрезвычайно редко встречается у собак с син । ромом Кушинга. Вопросы лечения собак при сочетании почечной недостаточности и синдрома Кушинга кратко рассмотрены выше в разделе «Азот мочевины в крови (AM)».
Желчные кислоты
При многих заболеваниях печени количественное определение желчных кислот считается эквивалентом теста толерантности к аммиаку. Содержание желчных кислот несколько повышено примерно у 30% собак с ССК (Reusch, 2005). Патология печени у животных с синдромом Кушинга, если и имеется, то обычно выражена слабо не имеет существенно
го клинического значения и обратима при правильной терапии. Результаты тестирования функции печени не позволяют дифференцировать собак с первичным печеночным расстройством от животных с гиперкортицизмом.
Электролиты в сыворотке крови
Слабые нарушения концентрации натрия (повышение) и калия (понижение) в сыворотке крови не имеют существенной диагностической и клинической значимости и встречаются лишь у небольшого процента собак с синдромом Кушинга. Определение концентрации электролитов в сыворогке крови приобретает большое значение в тех случаях, когда на фоне лечения гиперкортицизма у собаки возникают анорексия, рвота или диарея, поскольку в этой ситуации изменения в содержании электролитов характерные для надпочечниковой недостаточности (болезни Аддисона), могут угрожать жизни животного.
Амилаза и липаза
Панкреатит встречается исключительно редко у собак с синдромом Кушинга. При наличии симптомов панкреатита нарушения со стороны желудочно-кишечного тракта вероятнее всего являются проявлениями «помоечного гастрита», так как у собак развивается полифагия, и они способны есть все без разбора. Сочетание воспалительного заболевания (панкреатита) и избытка противовоспалительного гормона (кортизола) маловероятно. Поэтому любое воспалительное заболевание у животных с ССК - большая редкость и должно порождать сомнение: либо воспаление диагностировано ошибочно, либо отсутствует синдром Кушинга. В повседневной ветеринарной практике содержание липазы и амилазы в сыворотке крови определяют далеко не всегда.
Рис. 6-26. Концентрации холестерина, триглицери чов, холестерина липопротеинов низкой плотности (ЛИП), очень низкой плотности (ЛОПП) и высокой плотности (ЛВП) в сыворотке крови здоровых собак, собаь с нелеченым синдромом Кушинга, с плохо и хорошо компенсированным спонтанным синдромом Кушинга
294 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Анализ мочи
Концентрация. Анализ мочи - один из наиболее важных этапов первичного обследования собак с полиурией или полидипсией (ПУ/ПД). Крайне желательно, чтобы пробы мочи у животных с подозрением на ПУ/ПД собирали сами хозяева накануне посещения ветеринарной клиники (можно брать пробы и в ходе первичного осмотра животного). Чаще всего при анализе пробы выявляется разбавление мочи (удельный вес ниже 1,020), в нашей клинике это наблюдается в 85% случаев. У большого процента таких собак удельный вес произвольно взятых проб мочи не превышал 1,015.
Другие исследователи реже обнаруживали разбавленную мочу, вероятно, потому, что пробы брали через несколько часов или дней после госпитализации животных. Некоторые собаки с синдромом Кушинга перестают много пить в непривычных условиях (в ветеринарной клинике), и снижение потребления воды сказывается на удельном весе мочи. Измерение потребления воды в клинике не рекомендуется, поскольку не дает достоверных данных, необходимых для целей диагностики. В условиях лишения воды собаки с синдромом Кушинга могут концентрировать мочу до удельного веса, значительно превышающего осмоляльность плазмы (1,025-1,035), хотя эта способность к концентрации остается ниже, чем у здоровых собак. Заблаговременное взятие пробы мочи владельцем собаки служит простым способом повышения точности определения ее удельного веса. Оно позволяет также подтвердить подозрение о наличии у животного ПУ/ПД, оценить наличие или отсутствие сахарного диабета (что занимает не более 30 секунд при использовании тест-полосок) и синдрома Кушинга. Ту же пробу можно использовать для определения отношения концентраций кортизола и креатинина в моче, не опасаясь искажения результатов, которое возможно при проведении анализов в условиях клиники.
Глюкоза. В дополнение к определению удельного веса, в пробе мочи определяют концентрацию глюкозы. Ее повышение отмечается примерно у 5% собак с синдромом Кушинга и свидетельствует о наличии явного сахарного диабета. Диабет следует лечить независимо от наличия или отсутствия гиперкортицизма у животного.
Протеинурия/гипертензия/гломерулопатия. У собак с синдромом Кушинга нередко развивается протеинурия. В исследовании, включавшем 67 животных без пиурии или инфекции мочевого тракта (Hurley, Vaden, 1998), отношение концентраций белка и креатинина (Б/К) в моче собак с нелеченым синдромом Кушинга было в среднем выше, чем у собак с хорошо компенсированным ГЗГ. При этом отношение Б/К было увеличенным (>1) у 46% собак с нелеченым ГЗГ, у 31% с плохо компенсированным ГЗГ и у 63% с нелеченым синдромом Кушинга, вызванным опухолью коры надпочечников.
В последнем случае оно достигало значения 2,3. В то же время это отношение было повышено только у 21% собак с хорошо компенсированным ГЗГ и у 33% собак, у которых хирургическое удаление опухоли надпочечников привело к исчезновению синдрома Кушинга. Только у пяти собак отношение Б/К было весьма высоким (до 5-13) и ни у одной не превышало 13. Таким образом, протеинурия — частое явление у собак с синдромом Кушинга. В другом исследовании (Ortega et al, 1996) изучали небольшую группу из 16 собак и выявили сходный процент животных с протеинурией, хотя величина отношения Б/К не внушала столь серьезных опасений (в среднем 1,2). При обнаружении протеинурии, независимо от ее тяжести, ветеринар должен измерить кровяное давление у собаки и сделать посев мочи, поскольку протеинурия может быть следствием инфекции мочевого тракта.
В настоящее время доказано, что гломерулопатия с потерей белка широко распространена у собак с синдромом Кушинга. При этом протеинурия редко бывает тяжелой (в противном случае необходимо выявить иную причину) и почти никогда не сопровождается выраженной гипоальбуминемией или гипопротеинемией, поэтому ее не соотносят с наличием отечности, асцита или плеврального выпота. Предстоит выяснить, связана ли потеря белка с другими известными расстройствами при синдроме Кушинга, такими как пиелонефрит (сепсис) и тромбоэмболия. Правда, в одном из исследований (Ortega et al, 1996) было показано, что адекватная компенсация синдрома Кушинга приводит к снижению кровяного давления и отношения Б/К, а при плохо контролируемом заболевании эти параметры высокие. Гистологическое исследование почечной ткани от семи собак, включенных в это исследование, выявило диффузный гломерулосклероз у пяти особей. Концентрация кортизола в крови после стимуляции АКТГ достоверно коррелировала с величиной кровяного давления и отношением Б/К. Иными словами, чем слабее ответ кортизола на стимуляцию АКТГ, тем ниже кровяное давление и отношение Б/К. Поэтому у собак с синдромом Кушинга обычны гипертензия и протеинурия, и они могут служить иллюстрацией причинно-следственных отношений. Рассмотренные параметры подлежат оценке у больных собак, а успешное лечение синдрома Кушинга должно приводить к их частичной нормализации. Тем не менее, гипертензия и протеинурия у некоторых собак сохраняются даже после устранения гиперкортицизма.
Инфекция мочевого тракта (ИМТ). Во взятой владельцем собаки пробе мочи (вне станционара) определяют удельный вес, содержание глюкозы, белка и других компонентов мочи. Поскольку инфекция мочевого тракта (ИМТ) является частым следствием синдрома Кушинга, производят посев мочи, полученной посредством пункции мочевого пузыря. При первичном обследовании ИМТ выявляется почти у 40-50% собак с синдромом Ку-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 295
шинга (Forrester et al, 1999). Одним из характерных признаков синдрома Кушинга является подавление воспалительного процесса избытком присутствующего в крови кортизола. По этой причине у многих собак с гиперкортицизмом и ИМТ отсутствуют странгурия, ноллакиурия, обесцвечивание мочи и леикозурия. Микроскопическое исследование выявляет присутствие бактерий в моче большинства, хотя не всех, животных. Отсутствие бактерий не исключает наличия инфекции или ее последствии, и посев мочи при СКС должен быть рутинной составляющей получения «базы данных». В посевах содержатся хорошо известные бактерии и их чувствительност ь такая же, как при любой другом ИМТ (Forrester et al, 1999).
Существует несколько возможных объяснений широкого распространения инфекции при синдроме Кушинга. Во-первых избыток глюкокортикоидов подавляет иммунную систему, что повышает риск инфицирования. Во-вторых, несмотря на большой объем мочи у собак с полиурией, они пытаются дождаться выгула. Это обстоятельство, в сочетании с характерной для синдрома Кушинга мышечной слабостью, обусловливает хроническое растяжение мочевого пузыря, которое, в свою очередь, служит причиной задержки остаточной мочи даже при усиленном диурезе. Наконец, было показано, что разбавление мочи повышает чувствительность к инфекции нижних отделов мочевого тракта (Lulich, Osborne, 1994). У многих собак с синдромом Кушинга в мочевом пузыре постоянно присутствует разбавленная моча, которая служит благоприятным субстратом для роста бактерий в условиях подавленной функции иммунной системы. Лечение ИМТ имеет важное значение, олнако в некоторых случаях представляет весьма трудную задачу из-за неправильного выбора антибиотиков неудовлетворительного контроля синдрома Кушинга или наличия сопутствующего пиелонефрита.
Тестирование функции щитовидной железы
Нарушения функции щитовидной железы, предполагающие наличие гипотиреоза, имеют важное значение при СКС из-за общности ряда клинических симптомов обоих расстройств (апатия, двусторонняя симметричная незудящая алопеция, прирост веса, гиперхолестеринемия). Такое перекрывание может затруднить диагностику, особенно в отсутствие явных полиурии и полидипсии. Заместительная терапия тиреоидными гормонами у собак с синдромом Кушинга обычно нс вызывает нежелательных последствий; напротив, некоторые животные становятся более активными. Однако из-за отсутствия лечения первичного расстройства, его симптоматика (полифагия, полиурия, полидипсия, одышка) сохраняется Это должно подсказагь ветеринару, что заболевание животного не исчерпывается гипотиреозом.
Хронический гиперкортицизм (ятрогенный или спонтанный) угнетает секрецию ГТГ гипофизом и
Время (часы) после введения ТТГ
Рис. 6-27. Концентрации тироксина (Т4) до и после введения тиреотропного гормона (ТТГ) здоровым собак ам и собакаг с гиперкортицизмом. У собак обеих групп концентрация Т4 повышается параллельно, но при синдроме Кушинга эго увеличение может быть как нормальным, так и ниже нормы.
вызывает вторичный гипотиреоз (Torres et al, 1991; Meij et al, 1997c). Кроме того, в условиях гиперкортицизма изменяется связывание тиреоидных гормонов с белками крови ускоряется обмен этих гормонов и уменьшатся дейодирование тироксина (Т4) до трийодтиронина (Т3) (см. гл. 3). Примерно у 70% собак со спонтанным гиперкортицизмом понижена базальная концентрация Т и/или Тг в сыворотке крови. Введение ТТГ повышает концентрацию Т4 параллельно ее увеличению у здоровых животных, однако она нс достигает нормального уровня (рис. 6-27) (Ferguson, 1984; Peterson et al, 1984) (см. гл. 3). У большинства собак с синдромом Кушинга понижена концентрация как общего Т так и свободного Т4 в сыворотке крови. По-видимому, снижение концентрации тиреоидных гормонов в крови обусловлено уменьшением их секреции и усилением их обмена при синдроме Кушинга (Ferguson. Peterson. 1986).
РЕНТГЕНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Общие подходы
При обследовании собак с подтвержденным i ипер-коргицизмом или при подозрении на это заболевание, необходимо изучить рентгенограммы брюшной полости (при невозможности ее ультразвукового исследования) и грудной клетки. Кроме того, в поисках изменений, ассоциированных с синдромом Кушинга, ветеринарный врач должен помнить, что
296 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
это заболевание обычно развивается у собак старшего возраста; поэтому рентгенофафия может одновременно выявить серьезные сопутствующие (возможно, субклинические) заболевания.
Брюшная полость
Гепатомегалия и контрас гноен». Рентгенологическое исследование выявляет гепатомегалию примерно у 80-90% собак с синдромом Кушинга, причем слабое, умеренное и сильное увеличение размеров печени встречаются с равной частотой. Явной связи между степенью гепатомегалии и продолжительностью заболевания нс установлено (Huntley et al, 1982; Pennick et al, 1988). Изображения, полученные у собак и кошек с гиперкортицизмом, обычно отличаются высокой контрастностью благодаря отложениям жира в области живота (главным образом, в сальнике). Отвислый живот отмечается у 60% собак с синдромом Кушинга.
Мочевой пузырь. Рентгенография выявляет растяжение мочевого пузыря. Выше отмечалось, что у некоторых собак с ССК развивается атония мочевого пузыря, что препятствует его полному опорожнению. У многих животных после «полного» диуреза накануне рентгенологического исследования брюшной полости в мочевом пузыре все же остается то или иное количество жидкости (рис. 6-28).
Надпочечники. Пожалуй, самой важной, хотя и реже всего выявляемой при рентгенологическом исследовании брюшной полости аномалией является опухолевидная масса в надпочечниках. Ее редко удастся идентифицировать, поскольку опухоли
надпочечников имеются всего у 10-20% собак со спонтанным гиперкортицизмом и лишь половина этих новообразований подвергается обызвествлению, без которого невозможна их визуализация. Кальцифицированы примерно 50% аденом и карцином надпочечников.
При рентгенологическом исследовании брюшной полости 23 собак с синдромом Кушинга, вызванным опухолью надпочечников, опухолевидные массы были обнаружены у 14 животных (Pennick et al, 1988). Тринадцать из 14 опухолей были кальцифицированы, при этом 7 из них оказались аденомами, а остальные карциномами (см. рис. 6-28 и 6-29). Другое исследование включало 35 собак с опухолями коры надпочечников. У 22 собак были карциномы, из которых 12 были идентифицированы как минерализованные карциномы, а одна нскальци-фицированная карцинома выглядела как скопление мягкой ткани. У семи из 13 собак опухоли были представлены кальцифицированными аденомами коры надпочечников. У 16 собак в надпочечниках имелись некальцифицированные тканевые массы, и только одну из них удалось выявить при рентгенологическом исследовании (Reusch, Feldman, 1991). В одной из работ авторы пришли к выводу, что опухоли, имеющие меньше 2 см в диаметре, мало вероятно выявить рентгенографически, но визуализация некальцифицированных опухолей с диаметром больше 2 см вполне вероятна (Vborhout et al, 1990а).
Грудная клетка
Минерализация и интерстиций. Минерализация бронхов, колец трахеи и генерализованная
Рис. 0-28. Рентгенограммы, полученные в латеральной (А) и вентродореалыюй (Б) проекциях у собаки с активно функционирующей опухолью коры надпочечника, вызвавшей гиперкортицизм. Обратите внимание на обызвествление опухоли (показана стрелками), гепатомегалию, расширенный (атоничный) мочевой пузырь и выраженную контрастность вследствие мобилизации жира. Из: Feldman FC: br. Ettinger S (cd): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1683.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 297
Рис. 6-29. Рентгенограмма брюшной полости, полученная r латеральной проекции у собаки с большой, кальцифицированной, активно функционирующей опухолью коры надпочечника (показана с грелками).
пролиферация легочной интерстициальной ткани - наиболее частые патологические изменения, выявляемые у собак с синдромом Кушинга при рентгенологическом исследовании грудной клетки. У собак с тахипноэ они встречаются чаще, чем у животных без дыхательных расстройств. В одном из исследований минерализация бронхов была обнаружена почти у 75°о животных с ССК и примерно у четверти собак имела место генерализованная пролиферация легочной интерстициальной ткани (Berry et al, 2000). Установлена достоверная корреляция между рснтгеноконтрастностью интерстициальной ткани и наличием гипоксемии.
Еще одно нарушение, часто выявляемое при рентгенологическом исследовании грудной клетки, - минерализация колец трахеи.
Мегастазы и тромбоэмболия. Анализ рентгенограмм должен включать выявление возможного метастазирования легких карциномой коры надпочечников, которое имеет место у некоторых собак. После проникновения метастазов в легкие удаление первичной опухоли надпочечников нс имеет смысла, нс говоря уже о высокой стоимости и опасности такой операции. Если обнаружены метастазы других опухолей, необходимо проанализировать ситуацию и разъяснить сс хозяину животного, прежде чем начинать дорогостоящие и трудоемкие диагностику и лечение ССК. В этом случае синдром Кушинга может оказаться не столь важным с точки зрения долгосрочных последствий заболевания и состояния животного, как опухоль легких.
Другой редкой, но опасной патологией является легочная тромбоэмболия У большинства собак с этой патологией рентгенологическое исследование выявляет аномальную картину грудной полости двух разных типов: гиповаскулярные легочные
области и альвеолярные легочные инфильтраты. Рентгенопрозрачные гиповаскулярные области представляют собой зоны слабого наполнения кровеносными сосудами, лежащие дистально по отношению к местам тромбозов. Альвеолярные инфильтраты бывают изолированными или множественными и соответствуют зонам внутрилегоч-ного агелектаза, геморрагий и инфарктов. У собак с легочной тромбоэмболией обнаружены увеличение главного сегмента легочной артерии, правосторонняя кардиомегалия и плевральный выпот (Fluckiger, Gomez, 1984; Bunch et al., 1989; Klein et al., 1989; LaRue, Murtaugh, 1990).
Скелет
Oci сопения. При гиперкортицизме остеопения развивается в результате гиперкальциурии, уменьшения всасывания кальция в кишечнике и непосредственного воздействия кальция на костную ткань. У собак остеопения обычно протекает в слабой форме и не имеет клинического значения. Рентгенография недостаточно чувствительна для измерения плотности костей. Она обсуждается в данном разделе потому, что рутинное рентгенологическое исследование скелета нередко применяется для выявления остеопении, хотя является весьма грубым инструментом для этой цели. Плотность костей должна уменьшиться больше чем на треть, прежде чем остеопения может быть выявлена этим методом. Показано, что ожирение, часто встречающееся у собак с синдромом Кушинга, может дать ложную картину остеопении (Schwartz et al, 2000). Хромота, вызванная болями в костях или патологическим переломом, обычно отсутствует, за исключением случаев синдрома Кушинга у животных препубертатного возраста. В этих редких случаях возможны переломы эпифизов или неза-крытие зон роста (см. рис. 6-13).
Череп. Рентгенография черепа не рекомендуется. При необходимости такого исследования его проводят под наркозом. Разрушения костной стенки турецкого седла, наблюдаемого у некоторых людей при разрастании гипофизарной опухоли, у собак не происходит благодаря особенностям анатомического строения (более плоское и открытое седло).
Дистрофический (эктопический) кальциноз
Кожный кальциноз и обызвествление подкожных тканей можно выявить с помощью рентгенографии (см. раздел «Анамнез» и рис. 6-23). Признаки кальциноза имеются менее чем у 5° о собак с ССК. Еще меньше животных с рентгенологически выявляемой дистрофической кальцификацией почечной лоханки, печени, слизистой кишечника или ветвей брюшной аорты. Эктопическая кальцификация зачастую распространяется на кольца трахеи и главные бронхи. Однако минерализация этих структур развивается и у здоровых стареющих собак, но
298 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
обычно без существенных клинических последствий (Widmer, Guptill, 1995).
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ БРЮШНОЙ ПОЛОСТИ
Визуализация надпочечников как способ тестирования их функции
УЗИ брюшной полости является рутинным методом визуализации надпочечников у человека, причем изображения 85% здоровых желез были получены почти 20 лет назад (Hamper et al, 1987). Сейчас их количество значительно возросло (Aron et al, 2001b). Методика визуализации нормальных надпочечников собак и кошек непрерывно улучшалась на протяжении последнего десятилетия по мере накопления опыта специалистами-рентгенологами и совершенствования оборудования (Voorhout et al, 1990b; Nyland, 1995). В настоящее время визуализация обоих надпочечников у здоровых собак и кошек является рутинным клиническим методом, при условии, что поведение животных не препятствует тщательному исследованию брюшной полости (Grooters et al, 1995). Успешность ультразвукового исследования, вероятно как никакого другого метода, непосредственно зависит от квалификации оператора (Widmer, Guptill, 1995; Grooters et al, 1995). Ветеринарные специалисты могут оценивать собственную работу и работу своих коллег по качеству визуализации надпочечников у здоровых собак.
Здоровые собаки
Имеется множество публикаций, касающихся применения ультразвука для оценки состояния надпочечников у здоровых собак. Для тщательного исследования каждой железы сканирование следует проводить с вентральной поверхности живота в поперечной, продольной и косой проекциях (Kantorowitz et al, 1986). Лежащие выше надпочечников сегменты кишечника, особенно когда они или привратник заполнены газом, могут искажать результаты исследования, так же как впалая грудь у некоторых пород собак. Левый надпочечник легче визуализировать благодаря его локализации ка-удально по отношению к правому (Grooters et al, 1995). Опытные операторы отмечают, что в целом существует приемлемая корреляция между результатами макроскопического и ультрасонографического измерения надпочечников, особенно толщины правой и левой желез. В большинстве случаев удается различить корковое и медуллярное вещество. Размеры надпочечников не зависят от пола животного. Предпринимались попытки установить корреляцию размеров надпочечников с весом и площадью поверхности тела (Douglass et al, 1997), однако не ясно, имеет ли такая корреляция клиническую значимость.
Собаки с синдромом Кушинга и непредвиденной опухолевидной надпочечниковой массой
Общие сведения. В нашей клинике «рутинная» оценка состояния собак с гиперкортицизмом включает УЗИ брюшной полости, которое совершенно вытеснило рентгенологическое исследование. Существует несколько причин изменения стратегии обследования животных и использования ультразвуковых сканограмм вместо рентгенографической визуализации. Ультрасонография превосходит рентгенологический метод по количеству получаемой информации. Благодаря обилию работы наши радиологи накопили огромный опыт, к тому же они располагают самым современным оборудованием и на протяжении многих лет неизменно работают на самых последних моделях аппаратуры, выпускаемых промышленностью. Другой уникальной характеристикой нашей клиники является постоянная доступность ультразвуковых исследований, стоимость которых для наших клиентов не превышает стоимости рентгенографии брюшной полости. Такая ситуация резко отличается от практики работы многих частных лечебниц, где стоимость обследования выше или откуда клиента могут направить в другое учреждение за неимением собственного оборудования.
Ограничения, правильное и неправильное применение ультрасонографии. Многочисленные исследования подтверждают ценность УЗИ как инструмента диагностики синдрома Кушинга у собак и кошек (Poffenbarger et al, 1988; Voorhout, 1990b; Voorhout et al, 1990b; Reusch, Feldman, 1991; Barthez et al, 1995). По нашему мнению, чрезвычайно важно оценить изменения, происходившие в этой области на протяжении последних 5-10 лет. Данные, полученные ранее этого периода, не всегда соответствуют современному состоянию ультразвуковой диагностики. Все говорит о непрерывном повышении компетентности рентгенологов и специалистов общего профиля, использующих данный метод. На заре ультразвуковой диагностики сама возможность распознавать надпочечники на сонограммах считалась большим достижением; сейчас - это рутинная процедура. В прошлом визуализация одного или обоих надпочечников интерпретировалась как доказательство их аномального увеличения и подразумевала наличие у собаки синдрома Кушинга. Теперь дела обстоят иначе.
Мы полагаем, что сонограммы надпочечников можно использовать для дифференциальной диагностики гиперкортицизма, зависимого от гипофиза и зависимого от опухолей надпочечников. По нашему твердому убеждению, УЗИ брюшной полости не может служить методом скрининга на наличие синдрома Кушинга, по крайней мере, до тех пор, пока не будет доказано обратное. Чувствительность и особенно специфичность, ультразвукового метода не отвечают требованиям, предъявляемым к
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 299
диагностике этого расстройства. Поэтому диагноз синдрома Кушинга, поставленный на основании результатов УЗИ, следует считать ошибочным и некорректным. Необходимо дальнейшее совершенствование метода для повышения достоверности получаемых с его помощью данных. Мы рассматриваем результаты УЗИ брюшной полости как исключительно ценный компонент нашей рутинной базы данных.
Основное назначение УЗИ брюшной полости. УЗИ брюшной полости выполняет две главные функции:
1. Оно является инструментом пополнения «рутинной базы данных», используемой для оценки состояния брюшной полости и выявления предполагаемых (гепатомегалия) и непредвиденных (мочевые камни, опухолевидные массы в органах, кисты) нарушений у собак с подозрением на наличие синдрома Кушинга.
2. УЗИ используется для определения размера и формы надпочечников. Обнаружение надпочечников нормальных размеров или билатерально увеличенных надпочечников, сохранивших нормальную форму, у собаки с диагнозом синдром Кушинга, установленным на основании других показателей, служит убедительным доказательством надпочечниковой гиперплазии, обусловленной заболеванием гипофиза. Выявление в одном из надпочечников изолированной опухолевидной массы аномальной формы, сдавливающей или инвазирующей соседние структуры (например, полую вену, печень, почки), при малых размерах другой железы («тонкий» или невизуализируе-мый надпочечник) предполагает наличие функционально активной опухоли у собаки с диагнозом синдром Кушинга, установленным на основании других показателей. При подозрении на опухоль надпочечников УЗИ может быть превосходным методом скрининга на метастазирование печени или других органов, инвазию опухоли в полую вену и иные структуры либо сдавливание прилегающих тканей.
Синдром Кушинга, зависимый от гипофиза или от опухолей надпочечников
Гиперкортицизм зависимый от гипофиза (ГЗГ). У собак и кошек с ГЗГ проводят рутинную визуализацию обоих надпочечников. Обычно надпочечники имеют «относительно» сходные (нормальные или увеличенные) размеры (табл. 6-8). О размере надпочечников лучше всего судить по ширине левой железы, для которой верхний предел нормы равен 7,5 мм. По данным одного из исследований, чувствительность и специфичность этого параметра при оценке увеличения надпочечников у собак с гиперкортицизмом составляла соответственно 81 и 100% (Barthez et al, 1995). Однако по мере совершенствования аппаратуры и накопления опыта этот параметр может измениться.
Толщина надпочечников у собак с ГЗГ значительно больше, чем у здоровых животных. Вследствие утолщения железы выглядят припухлыми. Обычно у животных с ГЗГ сохраняется нормальная форма левого надпочечника, напоминающая плод арахиса, и овальная форма правой железы (Grooters et al, 1996). Кроме того, у таких собак надпочечники гомогенны и гипоэхогенны, в отличие от прилегающего коркового слоя почек (Gould et al, 2001). Лишь у отдельных животных с ГЗГ надпочечники имеют гетерогенную паренхиму и очаги повышенной эхогенности. Такая структура может указывать на наличие узловой гиперплазии, которую следует отличать от опухоли (Grooters et al, 1996). Дифференциацию лучше проводить, исходя из эндокринного статуса животного, нежели полагаясь только на результаты УЗИ.
Наличие нормального или слегка увеличенного левого надпочечника в отсутствие визуализации правого не является строго специфичным показателем для дифференциации ГЗГ и ГОН. Визуализация правого надпочечника значительно труднее, поэтому ее положительный результат дает больше оснований для подозрения на наличие опухоли.
ТАБЛИЦА 6-8. А. СРАВНЕНИЕ РАЗМЕРОВ НАДПОЧЕЧНИКОВ ПО ДАННЫМ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ БРЮШНОЙ ПОЛОСТИ У 20 ЗДОРОВЫХ СОБАК, 20 СОБАК С НЕЭНДОКРИННЫМИ ЗАБОЛЕВАНИЯМИ И 22 СОБАК С ГЗГ
Параметр Здоровые собаки Собаки с неэндокринными заболеваниями Собаки с ГЗГ
Среднее Диапазон SD Среднее Диапазон SD Среднее Диапазон
Возраст (годы) 5,2 0,6-13,2 4,1 11,7 7,6-15,4 10,2 7-13,1
Вес (кг) 19,6 4,4-38,8 9 18 2,4-40 17,3 3,8-43
Диаметр аорты (мм) 9,3 6,1-12,4 1,8 9 4,9-12,4 8,9 5,2-13
Длина почки (мм) Левый надпочечник 58,5 36,8-80,5 12 57,7 26,8-76,7 58,1 37,5-82,7
Длина (мм) 24,9 14,5-33,4 6 23 15,6-30,5 27,1 13,4-40,3
Максимальный диаметр (мм) 6,2 5,1-7,4 0,8 6,9 3,8-10,6 9,2 4,9-13,2
Минимальный диаметр (мм) Правый надпочечник 5,2 3-6,5 0,9 5,5 3,7-9 8 8 4,8-12,6
Длина (мм) 22,4 14-31,1 5,2 22 12,2-28,1 4,3 26 2,8-34,6
Максимальный диаметр (мм) 5,7 3,6-8,1 1,2 6,5 3,8-11 1,9 8,6 3,9-13,9
Минимальный диаметр (мм) 4,1 1,8-6,7 1,2 5,2 3,4-9 1,4 6,8 3,4-12,1
300 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Б. ЧУВСТВИТЕЛЬНОСТЬ И СПЕЦИФИЧНОСТЬ ИЗМЕРЕНИЯ НАДПОЧЕЧНИКОВ С ПОМОЩЬЮ УЗИ В КАЧЕСТВЕ ДИАГНОСТИЧЕСКОГО ТЕСТА НА ГЗГ, ОПРЕДЕЛЕННЫЕ НА ОСНОВАНИИ ИССЛЕДОВАНИЯ 22 СОБАК С ГЗГ И 20 СОБАК С НЕЭНДОКРИННЫМИ ЗАБОЛЕВАНИЯМИ. РЕЗУЛЬТАТ ИЗМЕРЕНИЯ КАЖДОГО ПАРАМЕТРА (ДЛИНА, МАКСИМАЛЬНЫЙ И МИНИМАЛЬНЫЙ ДИАМЕТР) ОЦЕНИВАЛИ КАК ПОЛОЖИТЕЛЬНЫЙ ИЛИ ОТРИЦАТЕЛЬНЫЙ, ИСХОДЯ ИЗ СООТВЕТСТВУЮЩИХ МАКСИМАЛЬНЫХ ВЕЛИЧИН, ПОЛУЧЕННЫХ ДЛЯ 20 ЗДОРОВЫХ ЖИВОТНЫХ.
Размер Чувствительность (%) Специфичность (%)
Левый надпочечник
Длина 18 100
Максимальный диаметр 77 80
Минимальный диаметр 73 85
Правый надпочечник
Длина 24 100
Максимальный диаметр 68 80
Минимальный диаметр 55 90
Гиперкортицизм, обусловленный опухолью надпочечников (ГОН). В случае заметного увеличения размеров или изменения формы одного из надпочечников, либо инвазии или сдавливания им окружающих тканей при невозможности визуализировать другую железу, весьма вероятно наличие опухоли (рис. 6-30). При УЗИ брюшной полости опухоли надпочечников выглядят очень большими, имеют округлую или «неправильную округлую» форму (Gould et al, 2001). По мере совершенствования аппаратуры и приобретения опыта исследователям удается визуализировать атрофированные надпочечники. При одновременной визуализации контрлатеральной железы (что случается все чаще) ее толщина и ширина обычно меньше нормальной величины, тогда как длина сокращается незначительно. Медуллярная часть такого «тонкого» надпочечника выглядит более или менее нормально, тогда как корковый слой необычно узок. Опухоль может образоваться в любом из двух надпочечников.
Определение злокачественности опухоли надпочечников носит спекулятивный характер. Исследование Besso с соавторами (1977) продемонстрировало повышенный риск малигнизации массы толщиной более 2 см и малигнизацию всех опухолевидных масс толщиной свыше 4 см. Оказалось также, что форма опухолевидных надпочечниковых масс не позволяет отличить их от патологических изменений иного гистологического типа. Узловые поражения чаще отмечались при наличии аденом, гиперплазии или метастазов. Эхогенность не являлась специфической характеристикой поражений того или иного типа. Минерализация и двусторонняя локализация опухолей имели место независимо от их злокачественной или доброкачественной природы. Васкулярная инвазия чаще, но не всегда развивалась при злокачественных поражениях.
При исследовании 15 собак с зависимым от надпочечников синдромом Кушинга во всех случаях удалось визуализировать обе железы, причем у трех особей были обнаружены двусторонние опухоли (Hoerauf, Reusch, 1999). У 12 собак с односторонними опухолями длина и толщина противоположного
надпочечника оставались практически такими же, как у здоровых животных. Односторонние опухоли чаще локализовались в правом надпочечнике. Хотя это исследование проведено на небольшой группе собак, тем не менее, оно расширяет наши знания и указывает на необходимость постоянной оценки новой информации. При обсуждении данного сообщения было выражено недоумение в связи с сохранением нормальных размеров свободного от опухоли второго надпочечника. Автор обсуждения считает, что такой надпочечник должен был бы заметно атрофироваться еще до появления клинических признаков гиперкортицизма. Он указывает также, что помимо атрофии пучковой и сетчатой зон коры в результате хронического подавления эндогенной секреции АКТГ, синтезируемый в коре надпочечника кортизол может оказывать трофическое действие на мозговое вещество путем индукции фенилэтаноламин-М-метилтрансферазы, катализирующей метилирование норадреналина до адреналина. Делается вывод, что должны атрофироваться и корковая, и медуллярная зоны непораженного опухолью надпочечника. Возможно, новые исследования помогут прояснить этот вопрос.
Непредвиденное обнаружение увеличенных надпочечников или изолированной опухолевидной массы. Чем шире используются сложные технические средства для оценки состояния органов брюшной полости, тем чаще выявляются непредвиденные нарушения. Непредвиденные опухолевидные массы были обнаружены в надпочечниках 2% лиц, обследованных с помощью КТ, УЗИ и МРТ (Aron, Ross, 1992). Проводится непрерывная оценка оптимальных способов исследования и наблюдения пациентов с такими аномалиями, поскольку у большинства из них отсутствуют гормон-секретирующие опухоли и малигнизация, требующие соответствующей терапии (Ross, Aron, 2990; Bencsik et al., 1995).
Если изучение анамнеза, физикальное и рутинное клинико-патологическое обследование собаки или кошки с увеличенными надпочечниками или опухолевидной массой не выявили признаков синдрома Кушинга, дальнейшая эндокринологическая
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 301
Рис. 6-30. А. Схематическое изображение надпочечника в поперечной проекции, полученное при УЗИ (Б) обызвсств венной карциномы коры надпочечника собаки с гиперкортицизм. В. Схематическое изображение гиперплазированной коры надпочечника, полученное при УЗИ (Г) собаки с ГЗГ. Д. Схематическое изображение гиперпла зированной коры противоположного надпочечника, полученное при УЗИ (Е) той же собаки с двусторонней гиперплазией. Врезки в левом верхнем углу диаграмм А, В и Д показывают положение и ориентацию датчика в вентральной области живота. V — Вентральная проекция, Сг — Краниальная проекция, Са — Каузальная проекция, D — Дорсальная проекция, R — вправо L — влево (см. продолжение).
оценка не рекомендуется. В отсутствие синдрома Кушинга следует обеспечить мониторинг обнаруженной опухоли либо удалить ее. Некоторые «надпочечниковые массы» на самом деле представляют собой нормальную ткань. Необходима также дифференциальная диагностика от надпочечниковой кисты, миелолипомы, кровоизлияния, неактивной (т.е. не продуцирующей гормоны) первичной опухоли, феохромоцитомы, метастазирующей опухоли и гра-нуломы. Мы отдаем предпочтение хирургическому лечению бессимптомных собак с опухолевидной надпочечниковой массой, прорастающей в жизненно важные структуры (в частности, в полую вену).
При обнаружении неинвазивной опухолевидной массы у бессимптомных собак мы обычно рекомендуем повторное ультразвуковое исследование спустя 4 недели. Если в течение этого времени масса существенно не изменилась, советуем повторить обследование собаки еще через 3 месяца а затем проводить его каждые 6-12 месяцев. В настоящее время у нас под наблюдением находится более 30 таких собак. Вскрытие умерших животных выявило нефункционирующие и клинически несущественные опухоли или грануломы у 40%, отсутствие неопластического роста у 30% и феохромоцитомы у 30° п собак. Клиническая значимость феохромо-
302 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-30 (продолжение). Ж. Левый надпочечник здоровой собаки в сагиттальной проекции (длина 2,40 см). J. Правый надпочечник собаки с гиперкортицизмом (1 — длина 2,41 см, 2 — ширина 1,15 см). 111. Опухоль левого надпочечника собаки с синдромом Кушинга (1 — длина 4,48 см, 2 — ширина 3,26 см). Диаграммы А, В и Д любезно предоставлены д-ром Brett Kantrowitz (Davis, СА); изображения Б, Г и Е: из: Kantrovvitz BV et al, Vet Radiol, 27:15, 1986; изображения Ж, 3 и И любезно предоставлены д-рами Paul Barthez и Tom Nyland (Davis, CA).
цитомы (индукция ею любых нарушений) у этих собак не установлена.
ОСЛОЖНЕНИЯ ПРИ ГИПЕРКОРТИЦИЗМЕ
При первоначальном обследовании большинство собак с гиперкортицизмом находятся в стабильном состоянии и осложнения отсутствуют. Однако возможны вторичные нарушения, вызванные длительным воздействием избытка стероидов. В некоторых случаях они могут иметь катастрофические последствия.
Гипертензия
Пациенты с синдромом Кушинга. Умеренная, устойчивая гипертензия зарегистрирована более чем у 90% лиц со спонтанным гиперкортицизмом. Гипертензия обусловлена многими факторами, включая избыточную секрецию ренина (белка крови, высвобождающего ангиотензин I), активацию ренин-ангиотен шновой системы альтернативными стимуляторами, повышенную чувствительность сосудов к прессорным воздействиям (катехоламинам и адренергическим агонистам), уменьшение продукции сосудорасширяющих простагландинов и усиление секреции минералокортикоидов, синтезируемых вне клубочковой зоны надпочечников (Melby, 1989). У людей с синдромом Кушинга по
вышается концентрация дезоксикортикостерона в плазме крови (Yamaji et al, 1988).
Измерение кровяного давления у собак. Методы измерения кровяного давления у собак отрабатывались в многочисленных исследованиях, в том числе с использованием прямых и косвенных оценок у анестезированных, неанестсзированных и получавших седативные препараты животных. Измерения производились у животных в разных положениях с применением различных типов инструментов (Stelicn, Rapoport, 1999). В условиях ветеринарной клиники необходимы простые, быстрые, практичные и недорогие способы определения кровяного давления. Анестезирующие и седативные средства влияют на кровяное давление и потому обесценивают результаты измерения.
Недавние исследования показали, что средняя величина систолического, диастолического и среднего артериального давления, измеренная у собак инвазивными и неинвазивными методами без применения седативных средств в условиях клиники и в присутствии хозяев, сопоставима с величинами, полученными у адаптированных, обученных или получавших седативные препараты животных. Тем нс менее, результаты, получаемые с помощью нсинвазивных методов, не всегда точно отражают истинную картину (Stepien, Rapoport, 1999). Более того, хотя в одном из исследований частота сердечных сокращений у собак в клинике была выше,
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 303
чем в домашних условиях, величина кровяного давления достоверно не отличалась (Remillard et al, 1991). Следует также иметь в виду, что показатели кровяного давления зависят от возраста, пола, породы и темперамента животных, их общего состояния, характера физических нагрузок и, в меньшей степени, рациона. Отличия этого параметра у собак разных пород столь значительны, что было предложено в дополнение к среднему нормальному диапазону кровяного давления, установить разные критерии гипертензии для индивидуальных пород (Bodey, Michell, 1996).
Собаки с синдромом Кушинга. Рандомизированное тестирование выявило гипертензию у 50% собак с синдромом Кушинга (Nichols, 1992). Было показано, что средние величины систолического, диастолического и среднего артериального давления у здоровых собак составляют соответственно 150, 90 и 105 мм рт.ст., а у собак с синдромом Кушинга соответственно 162-180, 116-120 и 135-145 мм рт.ст. (Kallet, Cowgill, 1982; Ortega et al, 1996).
Ortega и соавторы (1996) провели непрямое измерение систолического, диастолического и среднего артериального кровяного давления у 77 собак с синдромом Кушинга. Среднее артериальное и диастолическое давление оказались наиболее высокими у собак с нелеченым или плохо компенсированным заболеванием. После успешной адреналэктомии собак с ранее нелеченым гиперкортицизмом, вызванным опухолями надпочечников, все показатели кровяного давления снизились. В этом исследовании в качестве условных критериев гипертензии были выбраны величины систолического, диастолического и среднего артериального давления, превышавшие соответственно 160, 100 и 120 мм рт.ст. Руководствуясь этими критериями, гипертензию диагностировали у 86% собак с нелеченым синдромом Кушинга и у 81% с неудовлетворительно контролируемым заболеванием. У 12% животных этой группы имела место «тяжелая гипертензия» (систолическое давление выше 190 мм рт.ст., диастолическое давление выше 130 мм рт.ст.). Для сравнения, гипертензией страдали 40% собак с хорошо компенсированным ГЗГ. Удаление опухоли надпочечников приводило к нормализации показателей кровяного давления у всех собак.
В этом же исследовании была установлена корреляция между величиной кровяного давления и отношением содержания белка и креатинина в моче, а именно, чем выше было кровяное давление, тем больше были потери белка с мочой и тем вероятнее поражение клубочкового аппарата почек. У части, но не у всех собак гипертензия устранялась после успешного лечения гиперкортицизма (Ortega et al, 1996). По-видимому, у собак, у которых кровяное давление оставалось высоким, гипертензия была вызвана факторами, не связанными с гиперкортицизмом. Концентрация альдостерона в плазме крови (до и после введения экзогенного АКТГ)
была максимальной при нелеченом ГЗГ, практически нормальной при хорошо компенсированном заболевании и промежуточной при плохо контролируемом синдроме Кушинга (Ortega et al, 1996). Эти данные предполагают связь между синдромом Кушинга, гиперальдостеронизмом и системной гипертензией.
Вопросы терапии и рекомендации. Гипертензия вызывает беспокойство из-за связанных с нею специфических проблем. Так, например, она может вызвать слепоту вследствие внутриглазного кровоизлияния и/или отслоения сетчатки (Littman et al, 1988). Гипертензия может привести к усилению гипертрофии левого желудочка и застойной сердечной недостаточности либо вызвать гломерулопатию, которая, в свою очередь, увеличивает потерю белка с мочой. У 75% собак с синдромом Кушинга отношение содержания белка и креатинина в моче превышает 1,0 (в среднем оно составляет 2,3 при норме менее 1,0) (Ortega et al, 1996). В частности, теряются белки, играющие важную роль в свертывании крови (антитромбин III), что предрасполагает собак с синдромом Кушинга к тромбоэмболии. Хотя прямое определение артериального кровяного давления остается наиболее достоверным и простым способом его оценки, все шире применяется и совершенствуется аппаратура для его непрямых измерений.
При установлении синдрома Кушинга у собак показано измерение кровяного давления. Исследователи согласны в том, что у части собак с тяжелой гипертензией возникает риск развития таких нежелательных явлений, как поражение сосудов сетчатки и почек (Bodey, Michell, 1996; Ortega et al, 1996). С другой стороны, потеря зрения чрезвычайно редкое явление у собак с нелеченым гиперкортицизмом. Столь же редко у таких животных снижается концентрация общего белка и альбумина в сыворотке крови, несмотря на экскрецию белка с мочой (отношение белок/креатинин в моче выше 1,0). Учитывая сказанное, мы рекомендуем мониторинг кровяного давления у собак с гиперкортицизмом и, напротив, не рекомендуем коррекцию гипертензии до компенсации основного заболевания. У многих собак кровяное давление нормализуется после устранения синдрома Кушинга. В случае сохранения гипертензии ее терапия зависит от уровня кровяного давления и наличия других нарушений, которые могут быть ее причиной.
Пиелонефрит
У собак с синдромом Кушинга нередки инфекции мочевого тракта, которые могут распространяться на почки. Пониженная устойчивость к инфекции может быть следствием подавления миграции нейтрофилов и макрофагов к пораженным участкам под воздействием глюкокортикоидов. Разбавление мочи также повышает чувствительность нижнего отдела мочевого тракта к инфекциям, но уменыпа-
304 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ет подверженность пиелонефриту (Lulich, Osborne, 1994). Тем не менее, тяжелые хронические инфекции, независимо от удельного веса мочи, повышают риск возникновения пиелонефрита и нарушения почечной функции у собак с синдромом Кушинга. Симптомы пиелонефрита включают поллакиурию, дисурию и гематурию. Следует помнить, однако, что противовоспалительное действие глюкокортикоидов не только создает предрасположенность собак к пиелонефриту, но и маскирует проявление многих клинических симптомов. Подозрение на пиелонефрит усиливается при невозможности устранить инфекцию мочевого тракта, особенно в условиях терапии соответствующими антибиотиками после купирования ССК. Безуспешное лечение синдрома Кушинга предрасполагает животное к повторным инфекциям мочевого тракта и не может служить указанием на поражение его «верхних» отделов. Антибиотики выбирают на основании оценки чувствительности возбудителя в посевах мочи, полученной посредством пункции мочевого пузыря.
Мочевые камни
У людей гиперкортицизм может вызвать усиление экскреции кальция с мочой, что, в свою очередь, повышает риск формирования уролитов, содержащих кальций. Повышенная частота инфекций мочевого тракта также способствует образованию мочевых камней. Дисурия как основной признак мочекаменной болезни и сопутствующее воспаление могут явно не проявляться (т.е. быть маскированы), поскольку большие количества глюкокортикоидов препятствуют воспалительному процессу. Лишь очень немногие собаки с синдромом Кушинга имеют мочевые камни, содержащие фосфат или оксалат кальция. В обследованной нами группе инкапсулированные конкременты были обнаружены менее чем у 2% животных. Это весьма убедительные данные, учитывая, что в нашей клинике практически все собаки с синдромом Кушинга обследовались с помощью ультразвукового сканирования, которое является прекрасным способом выявления камней в мочевом тракте.
В исследовании Hess и соавторов (1998) шестнадцать из 20 собак с синдромом Кушинга и мочекаменной болезнью имели кальциевые камни (13 - оксалатные, одна - апатитовые, четыре - стру-витовые, одна - камни смешанного химического состава (карбонат-апатит-струвит) и еще одна - камни из фосфорноватистокислого кальция). По статистике при ССК риск образования кальциевых уролитов повышается в 10 раз. Авторы заключают, что своевременный диагноз и адекватное лечение синдрома Кушинга позволяют снизить частоту образования мочевых камней. Однако, принимая во внимание низкую частоту их встречаемости, этот довод нельзя считать основанием для назначения терапии синдрома Кушинга всем без исключения собакам.
Застойная сердечная недостаточность
Одним из последствий избыточной продукции глюкокортикоидов является вторичная гипертензия, обусловленная гиперволемией, которая повышает рабочую нагрузку на миокард и приводит к его гипертрофии. Застойная сердечная недостаточность возникает по мере повышения тяжести гипертензии и задержки жидкости. Кроме того, синдром Кушинга зачастую развивается у собак среднего и старшего возраста, принадлежащих к породам, которые предрасположены к приобретению хронического порока митрального и/или трехстворчатого клапанов сердца. Теоретически, комбинированный эффект недостаточности сердечных клапанов, гипертензии и гиперкортицизма должен приводить к перегрузкам миокрада. Однако, несмотря на указанную предрасположенность, застойная недостаточность сердца редко встречается у собак с синдромом Кушинга. Рентгенологическое исследование грудной клетки часто выявляет кардиомегалию в сочетании с увеличением левого желудочка. Не менее часто гипертрофия левого желудочка диагностируется на основании анализа кардиограммы по наличию увеличенного зубца R и пролонгированного комплекса QRS. Отек легких бывает редко.
Собаки с синдромом Кушинга в сочетании с застойной сердечной недостаточностью слабо отвечают на терапию. Диуретики следует применять с осторожностью, поскольку многие из этих животных страдают полиурией и полидипсией. Кроме того, диуретики могут индуцировать предрасположенность собак с ССК к гипокалиемии и/или алкалозу. Лечение застойной недостаточности сердца и гипертензии дает наилучшие результаты, если первоначально направлено на устранение первичной причины этих заболеваний - гиперкортицизма. Адекватная терапия синдрома Кушинга способствует нормализации кровяного давления, что обеспечивает контроль сердечно-сосудистых осложнений в отсутствие специфической терапии сердечной недостаточности. У собак, которым такая терапия все же показана, ее эффективность повышается при одновременном лечении синдрома Кушинга.
Панкреатит
Считают, что собаки с гиперкортицизмом «предрасположены» к панкреатиту. Хотя ряд аспектов синдрома Кушинга оправдывает такое мнение (в частности, гиперлипидемия, гиперхолестеринемия и инфекция), наш опыт свидетельствует о редкости панкреатита у собак с гиперкортицизмом. Описаны немногочисленные случаи возникновения панкреатита после сложных операций удаления надпочечников. Принимая во внимание, что собаки с гиперкортицизмом обладают неумеренным аппетитом и едят практически все, что могут проглотить, включая отбросы, странно, что не все из них страдают «помоечным гастритом».
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 305
Хотя гастрит встречается у таких собак, но не так часто, как можно было бы ожидать.
Сахарный диабет
Диагностика сахарного диабета у собак не вызывает затруднений.
Сложнее выявить гиперкортицизм, однако клиническая картина синдрома Кушинга настолько характерна, что он достаточно просто распознается у большинства собак с сопутствующим сахарным диабетом. Возникновение диабета на фоне хорошо контролируемого синдрома Кушинга легко обнаружить по внезапному обострению жажды, увеличению продукция мочи и содержанию в ней глюкозы. Гораздо труднее выяснить, имеется ли ССК у собаки с явным сахарным диабетом.
Главным ориентиром в условиях практической работы служит «инсулинорезистентность». Однако «резистентность» - это субъективное понятие, она имеет место при самых разных заболеваниях, большинство которых встречается намного чаще, чем синдром Кушинга (см. гл. 11). Гораздо надежнее опираться на клиническую картину. Соответствует ли она синдрому Кушинга? Этот вопрос заслуживает тщательного рассмотрения, поскольку клинические признаки (полидипсия/полиурия, полифагия, гепатомегалия), результаты ОАК (увеличение количества лейкоцитов и характер лейкограммы при стрессе), биохимический профиль сыворотки (повышение концентрации холестерина, щелочной фосфатазы и аланинаминотранферазы), данные рентгенологического (гепатомегалия) и ультразвукового исследований довольно сходны при обоих заболеваниях. Моча животных с сахарным диабетом обычно более концентрирована, чем у собак с сочетанной патологией; при обоих заболеваниях повышается чувствительность животных к инфекции. Мы обращаем особое внимание на эти факты, ибо считаем, что число собак с диабетом, у которых одновременно находят синдром Кушинга и назначают его лечение, завышено по сравнению с истинным числом животных, имеющих СКС.
Провокационная проба с АКТГ и ингибирующая проба с низкими дозами дексаметазона являются относительно специфичными методами диагностики гиперкортицизма и помогают дифференцировать изолированный сахарный диабет от диабета в сочетании с синдромом Кушинга. В то же время отношение концентраций кортизола и креатинина в моче - весьма неспецифичный и потому ненадежный показатель, который не рекомендуется использовать в диагностических целях. Правильное проведение скрининговых тестов повышает их достоверность. Диагностика гиперкортицизма у собак с сахарным диабетом облегчается при наличии таких признаков СКС как двусторонняя симметричная алопеция, кожный кальциноз, отвислый живот, низкая концентрация AM и креатинина при удельном весе мочи менее 1,020, адреномегалия и
непредвиденно высокая потребность в экзогенном инсулине. По нашему мнению, изучение анамнеза и физикальное обследование являются наиболее чувствительными и специфичными методами диагностики синдрома Кушинга у собак.
Потребность в инсулине, сама по себе, недостаточна, чтобы подозревать наличие синдрома Кушинга у собак с сахарным диабетом.
Легочная тромбоэмболия (ЛТЭ)
Этиология. Легочная тромбоэмболия (ЛТЭ) представляет собой осложнение гиперкоагуляции, гемостаза и повреждения эндотелиальной выстилки кровеносных сосудов (LaRue, Murtaugh, 1990). ЛТЭ и глубокий венозный тромбоз следует рассматривать как компоненты одного и того же процесса. Легочная эмболия бывает разной тяжести - от случайной, клинически несущественной до обширной обтурации сосудов, завершающейся внезапной смертью. У людей гиперкоагуляция приводит к окклюзии венозных сосудов ног, тазовой полости и плеча с распространением сгустков в проксимальном направлении. Формирующиеся в этих глубоких венах тромбы могут переноситься в легочные артерии и блокировать их. Закупорка легочных артерий и секреция тромбоцитами вазоактивных соединений, в частности серотонина, уменьшают сопротивление легких. Вследствие сопутствующего увеличения мертвого пространства в альвеолах и перераспределения кровотока появляются зоны пониженного вентиляционно-перфузионного соотношения, ухудшается газообмен и высвобождаются рецепторы раздражителей, стимулирующих альвеолярную гипервентиляцию. Рефлекторное сужение бронхов усиливает сопротивление воздушному потоку. Отек легких (при наличии такового) уменьшает их растяжимость. По мере увеличения постнагрузки в правом желудочке усиливается давление на его стенки, что может вызвать расширение, дисфункцию и ишемию желудочка (Goldhaber, 1998).
ЛТЭ является потенциальным осложнением гиперкортицизма и ряда других расстройств, таких как разнообразные неоплазии, белок-теряющие нефропатии, почечная недостаточность, панкреатит, сепсис, сахарный диабет, а также филяриоза, травмы, сложных хирургических операций и т.д. (табл. 6-9). И у людей и у собак с синдромом Кушинга тромбоэмболия как минимум связана с «состоянием гиперкоагуляции», которое характерно для этого заболевания. Риск осложнений ЛТЭ у людей с синдромом Кушинга в 4 раза выше, чем в общей популяции (Small et al, 1983; Meaney et al, 1997). Частота глубоких венозных тромбозов в популяции не превышает 1%, а у госпитализированных больных с синдромом Кушинга колеблется от 7 до 25% (McLeod, 1991). Особенно выражена предрасположенность к тромбозам у пациентов, перенесших хирургическую операцию по поводу синдрома Ку-
306 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-31. Результаты оценки свертываемости крови, сви детельствующие о предрасположенности собак с гиперкортицизмом (ССК) к тромбоэмболии. А. Сывороточные прокоагуляционные факторы определялись у 30 здоровых собак, служивших контролем, и у 56 собак с ССК. Б. Результаты определения антитромбина и громбин-антитромбинового комплекса у 30 контрольных собак и 56 собак с ССК. Звездочкой (*) помечены статистически достоверные различия, вертикальные линии указывают величину стандартной ошибки.
ТАБЛИЦА 6-9. ПЕРВИЧНЫЕ
КЛИНИЧЕСКИЕ РАССТРОЙСТВА У 29 СОБАК С ЛЕГОЧНОЙ ТРОМБОЭМБОЛИЕЙ*
Гемолитическая анемия, обусловленная нарушениями в иммунной системе
Неоплазия
Системное бактериальное заболевание
Сепсис
Пневмония
Пиоторакс
Эндокардит
Гиперкортицизм
Амилоидоз (белок-теряющая нефропатия)
Кардиомиопатия
Увеличение размеров пищевода_______________
По: Johnson et al, 1999.
шинга (Reitmeyer et al, 2002). Факторами, предрасполагающими к тромбозам у собак с синдромом Кушинга, служат ожирение, гипертензия, повышение гематокрита, ведущее к сосудистому стазу, сепсис и длительное пребывание в лежачем положении.
В исследовании, включавшем 55 собак со спонтанным синдромом Кушинга, было отмечено значи-тельноеповышениесодсржанияпрокоагуляционных факторов 11, V, VII, IX, X, XII и фибриногена (Jacobi et al, 2001). Содержание природного антитромботи-ческого антитромбина было значительно снижено, а содержание тромбин-антитромбиновых (ТАТ) комплексов - маркеров субклинического тромбоза возрастало (рис. 6-31). Эти данные сходны с результатами, полученными в более ранней, ио нс столь
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 307
исчерпывающей работе (Feldman B.F. et al, 1982, 1986), а также в исследовании на людях (Patrassi et al, 1985). TAT комплексы образуются сразу вслед за продукцией тромбина и служат субклиническими маркерами его биосинтеза. Некоторые авторы рекомендуют использовать этот фактор в качестве суррогатного маркера клинической тромбоэмболии. Хотя было показано ингибирование фибринолитической активности у людей с синдромом Кушинга, аналогичного ингибирования у собак не наблюдается, и, по-видимому, это явление нетипично для состояния гиперкоагуляции (Jacoby et al, 2001).
Встречаемость, анамнез и физикальное исследование. ЛТЭ может развиться у собак любого пола, возраста и породы. Она имеет разнообразные клинические проявления, которые выявляются при физикальном обследовании. Это объясняется двумя причинами: во-первых, почти исключительно вторичной природой заболевания (см. табл. 6-9) и, во-вторых, сопутствующей эмболией в других тканях, помимо легочной. Почти у всех обследованных нами собак с синдромом Кушинга и ЛТЭ с началом острых эпизодов эмболии были хирургически удалены опухоли надпочечников. Значительно меньшее число собак с ЛТЭ получали медикаментозное лечение о,р’-ДДД Однако в целом. ЛТЭ была редка в нашей группе собак с синдромом Кушинга. При наличии ЛТЭ у собак должны развиваться острые дыхательные расстройства, ортопноэ и, реже, яремный пульс. Одышка может быть следствием гипоксии и/или плевритных болей (Bums et al, 1981; King et al, 1985). Особенно часто при вторичной ЛТЭ у собак появляются неврологические расстройства. По данным Johnson и соавторов (1999). только пять из 29 владельцев собак обратились за ветеринарной помощью специально по поводу дыхательных расстройств, хотя обследование выявило их у 17 животных этой группы.
Результаты лабораторных анализов, рентгенологического исследования грудной полости и эхокардиографии. В одном из проведенных исследований каких-либо лабораторных показателей, патогномоничных для ЛТЭ у собак выявить не удалось. Многочисленные нарушения, установленные при лабораторных анализах, были либо вызваны первичным заболеванием, либо носили неспецифический характер. К их числу относятся анемия, увеличение количества лейкоцитов, концентрации AM и креатинина, повышение активности ЩФ и ала-нинаминотрансфсразы. Отмечено также снижение концентраций натрия, калия и альбумина в крови (Johnson et al, 1999). Рентгенологическое исследование грудной полости является важным компонентом характеристики любых случаев учащенного дыхания, хотя у животных с ЛТЭ его результаты неоднозначны. С помощью рентгенографии можно обнаружить плевральный выпот, утрату легочной артерии, альвеолярные инфильтраты, кардиомега-лию, рентгенопрозрачные зоны в легких и увеличение главной легочной артерии либо подтвердить от-
Рис. 6-32. Рентгенограмма грудной полости, полученная в дорсовентральной проекции у собаки с легочной тромбоэмболией, вызвавшей формирование очага повышенной плотности, границы которого показаны стрелками.
сутствие каких-либо нарушений (Fluckiger, Gomez, 1984; Johnson et al, 1999). С другой стороны, возможны увеличение диаметра легочных артерий, отсутствие перфузии обтурированной сосудистой сети и избыточная перфузия ее непораженных отделов (рис. 6-32) (см. обсуждение в раз деле «Рентгенологические исследования»). Нормальные рентгенограммы грудной полости у страдающих одышкой больных в отсутствие окклюзии крупных дыхательных путей могут быть получены и при легочной тромбоэмболии.
У людей с ЛТЭ допплеровская эхокардиография является относительно специфическим и чувствительным методом, позволяющим получить нужную информации. Так, различные нарушения были выявлены у 94% лиц с ангиографически подтвержденной легочной эмболией и только у 13°о пациентов со сходными клиническими симптомами, но без ЛТЭ. У больных с подтвержденной эмболией значительно чаще отмечались расширение правого желудочка (отношение объемов правого и левою желудочков >0,6), быстрая регургитация через трехстворчатый клапан (>2,5 м сек) и парадоксальное движение перегородки (Nazeyrollas et al, 1995). У собак с ЛТЭ эхокардиография давала нормальные результаты либо выявляла избыточное давление в правом желудочке, а быстрая регургитация при недостаточности трехстворчатого клапана создавала впечатление легочной гипертензии (Johnson et al, 1999). Идентификация характерных эхокардиографических признаков или тромбоза правого предсердия у собак с подозрением на ЛТЭ служит неинвазивным способом подтверждения диагноза ЛТЭ в ветеринарной практике (Johnson et al, 1999).
Анализ газового состава крови. ЛТЭ приводит к гипоксемии прежде всего из-за несоответствия
308 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
вентиляции и перфузии, хотя физиологическое шунтирование и увеличение мертвого пространства также способствуют уменьшению содержания кислорода в артериальной крови (West, 1992). Гипоксемия имеет место почти у 75% людей с ЛТЭ, а у 95% возрастает альвеолярно-артериальный градиент кислорода (Stein et al, 1991). Расчет альвеолярно-артериального градиента позволяет оценить вклад альвеолярной гиповентиляции в артериальную гипоксемию, но не дифференцирует несоответствие вентиляции и перфузии от других причин гипоксемии. При дыхании атмосферным воздухом у собак с ЛТЭ отмечается гипоксемия и увеличивается альвеолярно-артериальный градиент кислорода. Однако эти изменения не являются специфическими индикаторами нарушенного газообмена и их нельзя использовать в качестве единственного показателя ЛТЭ. У собак с ЛТЭ часто наблюдается гипокапния.
Дыхание кислородом устраняет гипоксемию, обусловленную несоответствием вентиляции и перфузии, ухудшением диффузии или альвеолярной гиповентиляцией. При ЛТЭ степень повышения парциального давления артериального кислорода (РаО2) зависит от объема блокированных сосудов (в процентах к общему), концентрации вдыхаемого кислорода и распределения зон нарушенного вентиляционно-перфузионного соотношения в легких. «Чувствительность к кислороду» и у людей и у собак весьма индивидуальна. По-видимому, это связано с формированием внутрилегочных шунтов, когда обструкция охватывает более половины всей поверхности сосудистого русла; такое шунтирование ведет к подмешиванию венозной крови и снижает чувствительность к кислороду (Johnson et al, 1999).
Диагностика. Легочная тромбоэмболия устанавливается на основании клинической картины заболевания, результатов физикального обследования, гематологических и биохимических параметров, рентгенограммы грудной клетки, данных эхокардиографии, измерения кровяного давления и анализа газового состава артериальной крови. Однако все эти показатели неспецифичны для ЛТЭ и могут оказаться в норме. Их ценность (за исключением результатов газового анализа) состоит в возможности исключить другие патологические процессы, имеющие сходные с ЛТЭ проявления. У людей с подозрением на ЛТЭ первичной диагностической процедурой является вентиляционно-перфузионное сканирование. Однако только у 27% таких пациентов этот метод позволяет поставить точный диагноз. У большинства больных сканирование дает неопределенный результат и для подтверждения или исключения ЛТЭ приходится проводить легочную ангиографию. Следует отметить, что инвазивный характер и высокая стоимость этой операции ограничивают ее применение даже у людей. Недавно была продемонстрирована высокая диагностическая эффективность МРТ-ан-гиографии, которая не требует применения ионизи
рующего излучения и контрастных йодированных материалов (Meaney et al, 1997).
Несмотря на недостаточно высокую чувствительность и специфичность, легочная ангиография и радиоизотопное сканирование используются для подтверждения тромбоза у собак (рис. 6-33). Отсутствие нарушений перфузии практически исключает легочную тромбоэмболию. Чем больше в легких вентилируемых зон с пониженной перфузией, выявляемых при сцинтиографии, и чем больше их размер, тем выше вероятность тромбоэмболии. Сегментное или более обширное нарушение перфузии в нормально вентилируемых легочных зонах при отсутствии рентгенографических признаков легочного заболевания - наиболее ценные диагностические показатели ЛТЭ (Dennis, 1993).
Лечение. Патогенез спонтанно приобретенной легочной тромбоэмболии у собак мало изучен. В экспериментальных условиях легочные эмболы начинают рассасываться без всякого лечения в течение нескольких часов после возникновения и через несколько дней полностью исчезают (Dennis et al, 1993). При спонтанной ЛТЭ у собак наблюдается устойчивое повышение протромбина и, как следствие, могут нарушаться механизмы фибринолиза. Задача терапии состоит в коррекции протромбина и снижении интенсивности гемодинамических и внутрилегочных процессов, обусловливающих заболеваемость и смертность (Dennis et al, 1993).
Накануне хирургической операции больным назначают аспирин, чтобы свести к минимуму риск тромбоза (Reitmeyer, 2002). Терапия включает применение общих поддерживающих средств, антикоагулянтов и кислорода. Антикоагулятны вводят согласно следующему протоколу: гепарин внутривенно (100-200 МЕ/кг), а затем подкожно в той же дозе через каждые 6 часов (с целью пролонгации активированного парциального тромбопластинового времени в 1,5-2 раза по сравнению с нормой) и/или кумарин (варфарин) перорально, сначала в дозе 0,2 мг/кг, затем ежедневно по 0,05-0,1 мг/кг до увеличения протромбинового времени в 1,5-2 раза по сравнению с нормой; эффект достигается через 2-7 дней введения препаратов (Rush, 1990; Dennis, 1993). Варфарин обладает потенциальным тромбогенным действием в течение нескольких первых дней, этот эффект нейтрализуется противосвертывающей активностью гепарина. Подавление свертывающей системы крови полностью предотвращает дальнейший рост существующих и образование новых тромбов, которые могут усугубить нарушение сердечно-сосудистой и дыхательной функций. Гепарин и кумарин непосредственно не растворяют существующие тромбы. В экспериментальных условиях стрептокиназа и рекомбинантный тканевый активатор плазминогена быстро растворяли легочные эмболы у собак (Shiftman et al, 1988). Клиническое испытание фибринолитических средств на четырех собаках со спонтанной ЛТЭ показало их эффективность при небольшом
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 309
Б
Рис. 6-33. Сканограммы легких здоровой собаки (А) и собаки с гиперкортицизмом и легочной тромбоэмболией (Б). Стрелками показаны области с пониженным включением радиоактивности.
числе побочных эффектов (Ramsey et al, 1996). В то же время значение стрептокиназы как средства устранения крупных блокирующих легочных эмбол в ветеринарной практике не установлено (Johnson et al, 1999). Самым опасным осложнением фибринолитической терапии, как и антикоагуляционной терапии, являются угрожающие жизни кровотечения (Dennis, 1993).
Прогноз. Прогноз ЛТЭ от осторожного до угрожающего. Выздоровление у собак, если оно происходит. обычно занимает 7-10 дней, после чего можно отменить поддерживающую оксигенотерапию. Это дорогостоящее лечение часто не дает желаемого результата.
Гипофизарные «макроопухоли» и нарушения в центральной нервной системе
Пазофизиологня. Иногда ГЗГ возникает как следствие крупной функционально активной опухоли гипофиза с диаметром более 1 см или мелких опухолей, которые могут расти в период от постановки диагноза и на протяжении терапии. Такие массы, разрастающиеся в дорсальном направлении, могут сдавливать или инвазировать гипоталамус и другие структуры, расположенные над турецким седлом, инвагинировать «ножку гипофиза», соединяющую гипоталамус и гипофиз, или расширять инфундибулярный карман и левый желудочек мозга. Клиническая симптоматика у собак с «макроопухолями» часто отражает как эндокринные, так и анатомические изменения. Эндокринные проявления типичны для синдрома Кушинга. Избыток кор
тизола подавляет биосинтез и/или секрецию всех гипофизарных гормонов, что крайне затрудняет выявить гипопитуитаризм как следствие разрушения гипофиза опухолью.
Очень трудно предсказать, какие размеры юлж-на иметь гипофизарная опухоль, чтобы вызвать клинические симптомы. Мы обследовали более 100 собак с недавно диагностированным нелеченым ГЗГ, у которых не было клинических признаков крупной внутричерепной опухоли. С помощью КТ или МРТ были получены сканограммы мозга каждой особи. Примерно у 40% собак были визуализированы опухолевидные гипофизарные массы, а у 60% - опухоли гипофиза, имевшие максимальную высоту от 4 до 13 мм. Визуализация большинства опухолей не представляла труда. Статистические исследования, проведенные другой группой исследователей, свидетельствуют о корреляции между размером гипофизарной опухоли и результатами эндокринных исследований (Kooistra et al. 1997). Даже если эти статистические данные отвечают действительности, ни одно из эндокринных или клинических исследований не позволяет с уверенностью дифференцировать собак с крупными и мелкими (менее 4 мм) гипофизарными опухолями (рис. 6-34) (Kipperman et al. 1992; Bcrtoy et al, 1995). Поэтому не следует проводить КТ или МРТ, исходя только из результатов эндокринологических тестов. Мы рекомендуем сканирование собак с нелеченым или недавно диагностированным ГЗГ, не имеющих клинических признаков крупной гипофизарной опухоли, в следующих случаях: (1) при наличии соответствующей аппаратуры, (2) при подтверж-
310 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ния АКТГ
10.—j---------10
4 часа пос- 8 часов после ле введения введения
низкой дозы низкой дозы
дексаметазона дексаметазона
Рис. 6-34. А. Концентрация кортизола в плазме крови через 1 час после внутримышечною введения 0,25 мг синтетического АКТГ и через 4 и 8 часов после внутривенной инъекции 0,01 мг дсксамегазона/кг у собак с ГЗГ. (Треугольники обозначают животных, не имевших видимой опухоли в гипофизе при визуализации методом магнитно-резонансной томографии (МРТ), кружки — животных с опухолевидной массой, выявленной при МРТ; заштрихованы области нормальных величин). Б. Концентрация кортизола в плазме крови через 8 часов после внутривенного введения 0,1 мг дексамстазона/кг (слева) и базальные концентрации эндогенного АКТГ (справа). Ромбы в левой части графика обо тачают собак, у которых МР1 не выявила опухоли гипофиза. Темные ромбы и темные кружки обозначают собак, у которых концентрация кортизола в плазме крови после введения дексаметазона была ниже 50% базальной величины, а светлые ромбы и светлые кружки — животных, у которых после инъекции дексаметазона концентрация кортизола превышала 50°о базальной величины. В целом, приведенные графики показывают, что результаты эндокринологического тестирования не могут служить достоверными показателями размера гипофизарной опухоли у собак с ГЗГ. Из Bcrtoy ГН et al, J Am Vet Med Assoc, 206:651, 1995.
га
Опухоли Опухоль Опухоли Опухоль нет нет
300 s
ьЮ
250
ф
200
го
150
100
ос
к
га
50
го
ф
0
Базальная проба
8 часов после введения низкой дозы
дексаметазона
0
ф
о
Б
денном синдроме Кушинга и (3) при согласии владельца собаки оплатить сканирование. После этого можно планировать лечение и длительное наблюдение собаки с ГЗГ с учетом ее индивидуальных особенностей.
Мы принимали участие в нескольких дополнительных исследованиях собак с ГЗГ у которых симптоматика была обусловлена растущей опухолью гипофиза. Каждая из собак с подобными симптомами имела увеличивающуюся в размерах внутричерепную опухоль высотой 1 мм или больше; такие же симптомы имелись у животных с опухолями, максимальный диаметр которых достигал 8-9 мм (Deusch, 2005). В то же время некоторые животные с подобными опухолями не имели клинически выраженных признаков, свидетельствующих о наличии растущей внутричерепной опухоли. Как и прежде, ни одно из клинических или эндокринологических исследований не позволяло дифференцировать собак с гипофизарными опухолями малого и большого размера либо собак с клиническими признаками внутричерепной опухоли от животных, не имевших таких симптомов (рис. 6-35) (Kipperman et al, 1992: Duesberg et al, 1995).
Клинические симптомы. Первые признаки неврологических расстройств у собак чаще всего выражены слабо, но постепенно они становятся все более заметными для хозяина, однако не для ветеринара. Поэтому важно иметь представление о способности владельца распознавать изменения в поведении животного. Самыми заметными первыми признаками являются «вялость», апатия и по
теря аппетита. Со временем эти отклонения могут перерасти в анорексию, беспокойство, изменение привычных форм поведения, задержку реакции на раздражители и кратковременные (или длительные) эпизоды нарушения ориентации. Сходные признаки характерны для многих вызванных иными причинами состояний (например, передозировка о,р’-ДДД). Более существенные с диагностической точки зрения симптомы у собак с макроопухолями включают изменения психики (притупление эмоций, ступор), атаксию, тетрапарез и бесцельные перемещения (рис. 6-36 и табл. 6-10). У небольшого процента собак с гиперкортицизмом развивается лицевой паралич, который, однако, обусловлен избытком кортизола, а не гипофизарной опухолью, даже если ее размеры весьма значительны.
Реже встречаются такие неврологические расстройства как нистагм, вертячка, сжимание головы, изменения поведения, судороги, слепота и кома. Анизокория и страбизм наблюдаются редко и могут быть следствием повреждения черепных нервов. У некоторых собак может быть ошибочно диагностирована слепота, так как нервная тупость приводит к неадекватной реакции на зрительные стимулы (отсутствие чувства опасности). В случае сильного сдавливания гипоталамуса появляются, хотя и редко, расстройства, связанные с дисфункцией вегетативной нервной системы. К их числу относятся адипсия, нарушение терморегуляции, блуждающий сердечный ритм и неспособность преодолеть сонливость. Эти расстройства относят к терминальным признакам.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
311
• Опухоли диам >1 см
Кортизол после введения низкой дозы дексаметазона
Кортизол после введения высокой дозы дексаметазона
Эндогенный АКТГ
Кортизол после введения АКТГ
• С неврологическими расстройствами
Эндоген- Кортизол ныи АКТГ после введения
Кортизол Кортизол после после вве-введения дения вы-низкой сокой дозы дозы де- дексамета-ксамета- зона зона
Кортизол (мкг/100 мл)
Рис. 6-35. Базальная концентрация эндогенного АКТГ и концентрация кортизола в плазме крови в пробах с АКТГ, низкими и высокими дозами дексаметазона у собак с ГЗГ, вызванным гипофизарными опухолями диаметром 1 см или более и менее 1 см (А) и тс же параметры у собак с неврологическими расстройствами вследствие растущей опухоли гипофиза и без неврологических расстройств (Б). Приведенные графики показывают, что результаты эндокринологического тестирования не имеют прогностической ценности для определения размеров опухоли у собак с ГЗГ.
Диагностика. Число собак, у которых макроопухоль гипофиза была выявлена до установления диагноза ССК, не превышает 20° о, у 20-30° о животных она была обнаружена через 30-60 дней после начала лечения ССК, а у 40-60° о - спустя 6 и более месяцев (рис. 6-37). Диагностика макроопухолей базируется на исключении сопутствующего заболевания или передозировки о,р’-ДДД. которые могут вызывать сходные симптомы. Результаты эндокринологических исследований не коррелируют с размером гипофизарной опухоли (см. рис. 6-34 и 6-35) (Kipperman et al, 1992; Bertoy et al, 1995; Deusberg et al, 1995). Подтверждение диагноза возможно только с помощью современных методов визуализации опухолей (КТ или МРТ). Результаты визуализации и лечения с использованием изотопа кобальта обсуждаются в соответствующих разделах.
ТАБ ЛИЦА 6-10. КЛИНИЧЕСКИЕ СИМПТОМЫ РАСТУЩЕЙ ОПУХОЛИ ГИПОФИЗА У СОБАК С ГИПЕРКОРТИЦИЗМ*
Вялость, апатия Атаксия
Ухудшение аппетита (плохой аппетит)/анорексия (отсутствие аппетита) Беспокойное поведение Утрата нормальной активности Задержка реакции на различные раздражители Дезориснтация/бесцсльные перемещения Изменение психического состо- яния Притупление чувствительности Ступор Тетрапарез Нистагм Вертячка Сжимание головы Изменение поведения Слепота Судороги Кома Адипсия Утрата терморегуляции Неравномерное сердцебиение
* Перечислены в порядке убывания частоты встречаемости
Клинические симптомы: синдром гипофизарной макроопухоли
Вялость Отсутствие Дезориен- Бесцельные
± апатия аппетита/ тация перемещения/
анорексия изменение по-
ходки/ слепота?
Клинические симптомы, синдром
Рнс. 6-36. Диаграммы (А и Б), иллюстрирующие наиболее частые клинические симптомы, которые отмечаются ветеринарами и владельцами собак с крупными опухолями гипофиза, вызывающими нарушения в центральной нервной системе (обратите внимание на разную процентную шкалу на диаграммах).
312
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
У 10-20% до начала терапии
Сроки диагностирования «макроопухо-левого синдрома»
- У 50% через 6 месяцев после начала терапии
У 20-30% в течение 30-60 дней после
начала терапии
Рис. 6-37. Диаграмма, иллюстрирующая развитие неврологических расстройств у собак с ГЗГ вследствие растущей опухоли гипофиза в разные сроки после установления диагноза и начала медикаментозной терапии
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Общие сведения
Окончательный диагноз должен строго соответствовать совокупности клинических признаков, зарегистрированных в анамнезе, и результатам физикального исследования собак с гиперкортицизмом. Однако, как следует из табл. 6-11, некоторые заболевания имеют такую же клиническую симптоматику и лабораторные показатели, как СКС. Наиболее очевидна необходимость дифференциальной диагностики СКС от сахарного диабета, акромегалии, несахарного диабета, недостаточности функции печени и почек, пиелонефрита, гипотиреоза, гипертиреоза, опухоли клеток Сертоли и гиперкальциемии. Эндокринная алопеция и гиперпигментация, имеющиеся у «взрослых собак с приобретенной недостаточностью гормона роста», могут имитировать дерматологические признаки гиперкортицизма.
Врожденные портосистемные шунты
У некоторых собак с портосистемными шунтами под воздействием избыточной продукции кортизола развиваются полиурия и полидипсия. В исследовании, включавшем 22 собаки с подтвержденными врожденными портосистемными шунтами, отношение концентраций кортизола и креатинина в моче до закрытия шунтов составляло 13,4x106, а после хирургической коррекции уменьшилось до 3,9x10‘6 (Sterczer et al, 1998). Одновременно увеличились удельный вес мочи и связывание кортизола с кортизол- связывающим глобулином. Таким образом, нет необходимости дифференцировать гиперкортицизм от врожденных портосистемных шунтов, так как именно они являются причиной повышения концентрации кортизола в крови.
ТАБЛИЦА 6-11. ДИФФЕРЕНЦИ АЛЬНАЯ ДИАГНОСТИКА СИНДРОМА КУШИНГА У СОБАК И ОСНОВНЫЕ ПЕРЕКРЫВАЮЩИЕСЯ ПОКАЗАТЕЛИ
Дифференциальный диагноз Показадели, общие с синдромом Кмнинга собак
Сахарный диабет Почечное заболевание Заболевание печени Гипотиреоз Опухоль клеток Сертоли Пиелонефрит Г иперкальциемия Нссахарный диабет нефрогенный центральный Первичная (психогенная) полидипсия Акромегалия Асцит Про гивосудорожная терапия ПД ПУ/полифагия Повышение активности ЩФ и АЛТ, концентрации глюкозы и холестерина в крови Гепатомегалия Инфекция мочевою тракта ПД/ПУ Гепатомегалия Повышение активности ЩФ и АЛТ, показатели тестирования функции печени Двусторонняя симметричная алопеция Прирост веса тела Г иперхолес терпнем ия Двусторонняя симметричная алопеция Хроническая рецидивирующая инфекция мочевого трак i а ПД/ПУ ПД/ПУ ПД/ПУ ПД/ПУ ПД/ПУ ПД/ПУ, полифагия Плохое состояние шерстяного покрова Повышение активности ЩФ, боЛЬШОИ ЖИВО! Мышечная слабость, стридор Повышение концентрация глю- ко зы в крови Гепатомегалия Большой живот (возможны затруднения при пальпировании) ПД/ПУ, сонливость, полифагия Повышение активности ЩФ, АЛТ и концентрации кортизола в плазме крови
ПД - полидипсия, ПУ - полиурия, ЩФ - щелочная фосфатаза. АЛТ —аланинаминотрансфераза
Введение фенобарбитала
Введение фенобарбитала собакам может сопровождаться побочными эффектами, которые имеют такие же клинические проявления, как и спонтанный гиперкортицизм. К их числу относятся полидипсия, полиурия и полифагия. Ситуация еще более усложняется из-за того, что фенобарбитал вызывает повышение активности щелочной фосфатазы в сыворотке крови (Foster et al, 2000b; Muller et al. 2000b). У нас создалось впечатление, что фенобарбитал может влиять на концентрацию кортизола в плазме крови и тем самым на результаты диагностических тестов гиперкортицизма, но это трудно подтвердить в клинических исследованиях (Dyer ct al, 1994; Chauvet et al, 1995; Fostccr et al, 2000a;
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 313
Mukker et al, 2000а). Мы полагаем также, что хроническое введение фенобарбитала влияет на эффективность терапии о,р’-ДДД. Мы по-прежнему считаем, что при подозрении на ССК собакам, получающим фенобарбитал, следует его отменить (с заменой бромистым калием или без нее) до начала диагностических исследований или терапии. Иногда отмена фенобарбитала приводит к исчезновению клинических симптомов гиперкортицизма и сопутствующих биохимических нарушений.
СПЕЦИФИЧЕСКАЯ ОЦЕНКА СИСТЕМЫ ГИПОФИЗ-КОРА НАДПОЧЕЧНИКОВ
Общие подходы
База данных. После постановки предварительного диагноза гиперкортицизма у собаки или кошки на основании результатов опроса хозяина, физикального обследования, лабораторных анализов (ОАК, анализ мочи и биохимический анализ сыворотки крови), рентгенологического и/или ультразвукового исследований, клиницист обычно пытается подтвердить диагноз. В случае необходимости (и при возможности) следует выяснить этиологию заболевания (гипофизарную или надпочечниковую). Как отмечалось выше, собакам, получающим фенобарбитал, следует его отменить (с заменой бромистым калием или без нее) до начала диагностических исследований или терапии.
Определение гормонов. В первую очередь следует определить концентрацию кортизола в плазме (или сыворотке) крови или моче. Кортизол определяют флюорометрическим, радиоиммунологи-ческим (РИА), твердофазным иммуноферментным (ИФА) и хемилюминесцентным методами, а также с помощью высокоэффективной жидкостной хроматографии. Коммерческие наборы для РИА находят широкое применение благодаря надежности, относительно низкой стоимости и простоте в обращении. Для определения кортизола в моче применяются те же методы, что для определения его концентрации в плазме крови. Все чаще используются коммерческие наборы для определения АКТГ, хотя АКТГ менее стабилен, чем кортизол, а стоимость его определений выше. Имеются также коммерческие наборы для количественного определения альдостерона.
Взятие проб для определения кортизола. Взятые для определения кортизола пробы крови помещают в пробирку с гепарином, чтобы предотвратить свертывание, хотя измерения в сыворотках столь же достоверны. Сразу после получения проб гепаринизированную кровь центрифугируют, а отделившуюся плазму переносят в чистый сосуд и замораживают. (Behrend et al, 1998). Поскольку концентрация кортизола в замороженной плазме или сыворотке остается постоянной в течение длительного времени (месяцы, а возможно и годы), рекомендуется все пробы направлять в лабораторию
охлажденными или замороженными. Благодаря стабильности кортизола в плазме гемолиз или кратковременное хранение образцов в тепле не сказывается на результатах анализа (Reimers et al, 1991). Гемолиз, липемия или гипербилирубинемия существенно не влияют на результаты определения кортизола с помощью ИФА (Lucena et al, 1998).
Для проведения анализа из каждой пробы берут как минимум по1 мл плазмы; этот объем более чем достаточен для определений в двух повторах. Во всех случаях следует придерживаться рекомендаций лаборатории, в которой проводят измерения.
Определение альдостерона в плазме крови. Для количественного определения альдостерона в плазме крови собак и кошек с помощью РИА пригодны несколько коммерческих наборов. Однако получаемые при этом данные редко используют в диагностике гиперкортицизма. У многих собак с гиперкортицизмом ответ альдостерона на стимуляцию АКТГ сильно увеличен, и его концентрация возрастает параллельно концентрации кортизола (Golden, Lothrop, 1988; Ortega et al, 1995b). Концентрацию альдостерона целесообразно определять при подозрении на специфические расстройства, связанные с нарушением его секреции. Первичный гиперальдостеронизм редко встречается у собак.
Эндокринологические исследования
В целом, оценка состояния животных с гиперкортицизмом осуществляется в два этапа (рис. 6-38). Первый состоит в подтверждении или исключении диагноза гиперкортицизм (синдром Кушинга). Этот этап очень важен и должен быть доведен до конца. Ко второму этапу приступают только в случае подтверждения наличия гиперкортицизма. Его цель состоит в дифференциации ГЗГ и гиперкортицизма, зависимого от опухоли надпочечников (ГОН).
СКРИНИНГОВЫЕ ИССЛЕДОВАНИЯ: ПОДТВЕРЖДЕНИЕ ГИПЕРКОРТИЦИЗМА
Общие сведения
Скрининговые тесты на гиперкортицизм или ССК проводят с целью дифференцировать собак с синдромом Кушинга и без него. Выбор метода скрининга имеет важное значение, поскольку он позволяет установить, надо ли лечить собаку. Для рутинного скринингового исследования применяют стимулирующую пробу с АКТГ, пробу с низкими дозами дексаметазона и определение отношения концентраций кортизола и креатинина в моче. Следует, однако, подчеркнуть, что, как показывает наш опыт, наиболее чувствительными и специфичными методами диагностики являются изучение анамнеза и физикальное исследование. Эти методы, а также результаты эндокринологических биохимических исследований (ОАК, биохимический профиль сы-
314
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Удаление (в случае Подтвержденная надпочечни- Опухоль надпочечника не подтверждения ковая опухоль неустановлен- подтверждена Синдром опухоли) ной локализации Кушинга подтвержден
I
Хирургическая операция
Рис. 6-38. Протокол диагностической оценки собак и кошек с подозрением на гиперкортицизм.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 315
воротки и анализ мочи) служат основой для выбора терапии. Ни в коем случае нельзя назначать лечение собак с синдромом Кушинга на основании только результатов лабораторных анализов. Синдром Кушинга - это клиническое состояние со своей клинической симптоматикой. В отсутствие симптоматики лечение нецелесообразно.
Чувствительность и специфичность
Чувствительность метода определяется числом больных с данным заболеванием, у которых он выявляет присущие заболеванию признаки. Специфичность метода определяется числом пациентов без данного заболевания, у которых он выявляет характерные для этого заболевания диагностические признаки. Эта концепция подразумевает, что ни одно скрининговое исследование не может всегда давать только правильные результаты. Иными словами, не существует методов со стопроцентной специфичностью и чувствительностью. Как указывалось, «обычные способы оценки функции гипофиза и надпочечников у собак с не-надпочечнико-вой патологией могут давать ложноположительные результаты, предполагающие наличие гиперкортицизма». Поскольку любое рутинное скрининговое исследование, будь то стимулирующая проба с АКТГ, проба с низкими дозами дексаметазона или определение отношения концентраций кортизола и креатинина в моче, может дать ложноположительный результат, окончательный диагноз ни в коем случае не должен базироваться на результатах только одного и даже нескольких тестов, особенно если отсутствуют классические клинические симптомы гиперкортицизма или известно, что у собаки имеется другая ненадпочечниковая патология (Kaplan etal., 1995).
Базальная концентрация кортизола в плазме крови
Определение базальной (утренней) концентрации кортизола в плазме крови не имеет самостоятельной ценности для подтверждения гиперкортицизма у собак. Это становится очевидным при анализе уровня кортизолемии у недавно переболевших или подвергавшихся анестезии животных (Church et al, 1994). Хотя средняя базальная концентрация кортизола у собак с ССК достоверно выше, чем у здоровых собак, она все же обычно остается в пределах нормы (см. рис. 6-7). Это объясняется эпизодическим характером секреции АКТГ и кортизола. Частые выбросы кортизола в кровь обусловливают огромное количество пиков и плато его уровня в течение суток, в результате чего концентрация АКТГ в плазме крови колеблется в широких пределах (от 0,5 до 6,0 мкг/100 мл).
У собак с гиперкортицизмом увеличивается не только частота, но и амплитуда пиков секреции кортизола. В большинстве случаев концентрация кор
тизола после каждого выброса близка к нормальным значениям, однако повышенное число выбросов на протяжении суток создает избыток гормона. Иными словами, если определить площадь под кривой концентрации кортизола у собак с синдромом Кушинга, как показано на рис. 6-7, то она окажется намного больше, чем у здоровых животных. Такая хроническая, неослабевающая продукция избыточного количества кортизола на протяжении месяцев или лет приводит к клиническому синдрому гиперкортицизма.
Отношение концентраций кортизола и креатинина в моче (КОР/КРЕ)
Сбор и анализ суточных проб мочи. Традиционно концентрацию кортизола определяют в аликвотах проб мочи, собранных в течение 24 часов. Полученную величину обычно умножают на суточный объем мочи, что позволяет оценить общее количество гормона, продуцируемого на протяжении суток. Эта методика десятилетиями служила «золотым стандартом» при диагностике гиперкортицизма у людей и до сих пор остается наиболее надежным способом подтверждения диагноза (Orth, 1995). Она была предложена после разработки первых методов определения кортизола в конце 1940-х годов. На первых этапах в моче определяли метаболиты кортизола; логическим продолжением стало использование этого метода для определения концентрации самого кортизола, после того как стало понятно, что именно кортизол обусловливает синдром, носящий имя д-ра Кушинга.
Следует иметь в виду, что у людей с гиперкортицизмом, в отличие от собак с ССК, полиурии обычно не бывает и объем собираемой мочи относительно невелик. При определении кортизола в моче отсутствуют проблемы, порождаемые его эпизодической секрецией, с которыми приходится сталкиваться при анализе проб крови. Рекомендуется определять концентрацию свободного кортизола, поскольку это обеспечивает быстрое получение данных, удобных для клинического использования. Определение кортизола предпочтительнее определения его метаболитов. Суточные пробы мочи при добавлении консерванта стабильны при хранении в холодильнике (Baxter, Tyrrell, 1981). Несмотря на преимущества этого метода, он редко применяется в диагностике собак и кошек из-за трудности сбора суточной мочи у животных. Но если ее удается собрать, результаты определений вполне надежны.
Отношение концентраций кортизола и креатинина в моче.
Общие сведения. Результаты измерений концентрации кортизола в пробах мочи, получаемых через каждые 2 часа, позволяют точно оценить функциональное состояние гипофизарно-надпочечниковой системы у человека (Allin et al, 1984). Как показали последующие работы, отношение концентраций кортизола и креатинина (КОР/КРЕ) в разовых
316 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
ТАБЛИЦА 6-12. ЧУВСТВИТЕЛЬНОСТЬ, СПЕЦИФИЧНОСТЬ И ДИАГНОСТИЧЕСКАЯ ТОЧНОСТЬ СКРИНИНГОВЫХ ЭНДОКРИНОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ У СОБАК С ГИПЕРКОРТИЦИЗМОМ*.
Проба Параметр(%) Исследование
1 2 3 4 5
ПНДД Чувствительность 100 100 96 85 —
Специфичность 73 44 70 73 —
Диагностическая точность 92 58 89 83 —
Провоци- Чувствительность 89 80 95 — —
рующая Специфичность 82 86 91 — —
проба с АКТГ Диагностическая точность 87 84 93 — —
Отношение Чувствительность 50 75 — 99 100
КОР/КРЕ Специфичность 100 24 — 77 22
Диагностическая точность 59 37 — 91 76
АКТГ - кортикотропин, ПНДД - ингибирущая проба с низкими дозами дексаметазона, Отношение КОР/КРЕ - отношение концентраций кортизола и креатинина в моче, «—» исследование не проводилось
Исследование: 1. Zerbe et al, 1987; 2. Kaplan et al, 1995; 3. Van Liew et al, 1997; 4. Rijnberk et al, 1988; 5. Feldman, Mack, 1992
рандомизированных пробах мочи помогает выявить лиц с гиперкортицизмом (Atkinson et al, 1985; Contreras et al, 1986). Аналогичные исследования на собаках продемонстрировали возможность использования отношения КОР/КРЕ для скрининга на гиперкортицизм у животных (Stolp et al, 1983; Rijnberk et al, 1988a).
Чувствительность и специфичность. Отдельные группы исследователей, определявших отношение КОР/КРЕ в моче, пришли к разным выводам относительно его диагностической ценности (см. табл. 6-12). Общепринято, что отношение КОР/КРЕ позволяет легко различать здоровых собак и животных с гиперкортицизмом, т.е. это «чувствительный» тест (Jones et al, 1990). Одна группа исследователей рекомендует это отношение как единственный необходимый показатель для диагностики синдрома Кушинга, основываясь, отчасти, на том, что ветеринарный врач сумеет исключить остальные заболевания посредством изучения анамнеза, физикального исследования и базы данных (Rijnberk et al., 1988а).
Другие авторы, также продемонстрировавшие чувствительность данного метода, хотя и не вполне удовлетворительную (Kaplan et al, 1995), считают его неспецифичным. Согласно их данным, 79% (Smiley, Peterson, 1993) и 76% (Kaplan et al, 1995) собак с умеренным или тяжелым не-надпочечнико-вым заболеванием имели такое же отношение КОР/ КРЕ, как и собаки с синдромом Кушинга. Наше исследование также показало, что отношение КОР/ КРЕ является чувствительным, но неспецифичным показателем. Достаточно сказать, что оно отлича
ется от нормального как у собак с синдромом Кушинга, так и у большинства животных с сахарным и несахарным диабетом, пиометрой, гиперкальциемией и недостаточностью функции печени (рис. 6-39) (Feldman, Mack, 1992).
Ряд более поздних работ был посвящен оценке отношения КОР/КРЕ с использованием разных методов определения кортизола, включая флюоресцентный поляризационный иммуноанализ (ФПИА) (Kolevska, Svoboda, 2000) и ИФА (Jensen et al, 1997). Во всех случаях отношение КОР/КРЕ оказалось весьма чувствительным показателем, подтверждавшим диагноз ССК. Его специфичность в одном из этих исследований составила 85%, однако авторы использовали для сравнения значительно более широкий, чем ранее диапазон нормальных величин (Jensen et al, 1997). Методические различия весьма серьезно сказывались на результатах измерения кортизола в моче и на выборе диапазона нормальных величин для каждого исследования. Поэтому каждая лаборатория должна всегда использовать собственные референтные показатели, соответствующие применяемой методике. Во всех исследованиях, имевших целью оценку специфичности и чувствительности отношения КОР/КРЕ, отмечали значительное перекрывание результатов, полученных на собаках со спонтанным гиперкортицизмом и не-надпочечниковыми заболеваниями. Это побудило авторов для окончательного подтверждения диагноза рекомендовать применение провокационной пробы с АКТГ и ингибирующей пробы с низкими дозами дексаметазона (Jensen et al, 1977; Kolevsla, Svoboda, 2000).
Ввиду высокой чувствительности отношения КОР/КРЕ, выявленной в ряде цитированных исследований, было высказано соображение о возможности его применения в качестве отрицательного прогностического показателя. Иными словами, нормальное значение этого отношения практически исключает наличие ССК. Из этого следует, что отношение КОР/КРЕ разумно использовать в тех случаях, когда имеется лишь слабое подозрение на ССК или если животное нельзя госпитализировать для проведения необходимых диагностических тестов. При всем том, не существует идеальных методов, и любой тест может давать как ложноположительные, так и ложноотрицательные результаты (Zerbe, 2000а).
Сбор мочи дома и в клинике. В одном из исследований было показано, что отношение КОР/КРЕ повышается, если мочу для его определения получают в условиях ветеринарной клиники, во время стационарного ортопедического обследования или при госпитализации на протяжении нескольких дней (Van Vonderen et al, 1998). Авторы пришли к выводу, что пробы мочи для определения отношения КОР/КРЕ хозяева собак должны собирать дома, чтобы избежать стресса у животных при транспортировке в клинику или во время процедур, предшествующих взятию проб, что может привести к полу-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 317
Б
3000
Здоровые Собаки с гипер- Собаки с полиурией/
собаки кортицизмом полидипсией
Здоровые ГЗГ Подозревае- Ненадпочечниковое
собаки (31) (25) мый ГЗГ (21) заболевание (28)
Рис. 6-39. V Отношение концентраций кортизола и креатинина в моче (КОР КРЕ) у здоровых собак, собак со спонтанным гиперкортицизмом и собак с полиурией полидипсией в отсутствие гиперкортицизма. Приведенные данные показывают, что отношение КОР КРЕ является чувствительным, но неспецифичным диагностическим показателем синдрома Кушинга и не может служить единственным параметром для подтверждения диагноза. Б. Отношение КОР KPI у здоровых собак, собак с гиперкортицизмом (ГЗГ), собак, у которых сначала подозревали, но впоследствии не обнаружили ГЗГ, и у собак с различными заболеваниями ненадпочечникового происхождения. В скобках указано число собак в каждой группе. Столбиками показаны диапазоны интерквартилей от 25 до 75 процентилей (средняя половина данных). Горизонтальная линия через столбики — медиана. «Усы» представляют основную массу данных, которые в большинстве случаев укладываются в диапазон. Значения, гежащие за его пределами, обозначены кружками (для каждого такого случая приведено точное значение). Диаграммы показывают, что отношение КОР КРЕ является чувстви-те гьным, но неспецифичным показателем синдрома Кушинга. \ - из: Mack ER, Feldman ЕС: J Am Vet Med Assoc 197:1603, 1990), В - из: Smiley LE, Peterson ME: J Vet Intern Med 7:163, 1993.
чению ложных, характерных для гиперкортицизма показателей. Создастся, однако, впечатление, что авторы пытаются подогнать полученные результаты под свою гипотезу. Па опубликованных графиках не показаны нормальные величины КОР/КРЕ. Между тем, сопоставление полученных данных с референтными показателями ставит под сомнение необходимость сбора мочи в домашних условиях, т.е. приводит к противоположному выводу (рис. 6-40).
Независимо от этого каж тому владельцу собаки, страдающей полиурией, частым или нарушенным
мочеиспусканием, рекомендуется самому собирать се мочу накануне посещения ветеринарного учреждения. К числу преимуществ такого подхода относится возможность быстрой диагностики сахарного шабета, полиурии и заболеваний мочевого тракта. Кроме того, в настоящее время отношение КОР/КРЕ нс рекомендуется использовать в качестве единственного показателя для подтверждения гиперкортицизма. При скрининге на синдром Кушинга у собак следует прежде всего ориентироваться на анамнез, клинико-патологическую «базу
318 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-40. А. Отношение концентраций кортизола и креатинина в моче (КОР/КРЕ) у 19 здоровых собак до и после посещения ветеринарной клиники для ежегодной вакцинации. Стрелкой указано время визита в клинику. Горизонтальная линия — верхняя граница нормы. Б. Отношение КОР/КРЕ у 12 собак до и после осмотра в специализированном ортопедическом центре. Стрелкой указано время визита в центр. Горизонтальная линия — верхняя граница нормы. Увеличение отношения КОР/КРЕ на 3 день у одной из собак, скорее всего, было связано с дополнительным посещением ветеринарной клиники. В. Отношение КОР/КРЕ у 9 здоровых собак до, во время и после госпитализации в клинике продолжительностью 1,5 дня. Горизонтальная линия — верхняя граница нормы.
данных», физикальное обследование и результаты проб с АКТГ и низкими дозами дексаметазона.
Провокационная проба с АКТГ
Общая характеристика. Провокационная проба с АКТГ является общепринятым скрининговым тестом для подтверждения диагноза гиперкортицизм у собак. Эта проба технически проста, безопасна, относительно недорога и не отнимает много времени (определение длится 1-2 часа). Интересно, что при обследовании людей с подозрением на гормональную недостаточность обычно используют стимулирующие пробы, а при обследования лиц с избыточной продукцией гормонов повсеместно применяются ингибирующие пробы. Любопытно, что в ветеринарии для диагностики синдрома Кушинга применяют пробу, которая не используется для той же цели у людей. Критическая переоценка результатов провоцирующей пробы с АКТГ в пос
ледние несколько лет выявила ее достоинства и недостатки.
Теоретическое обоснование. У собак с ГЗГ развивается гиперплазия коры надпочечников вследствие хронической, избыточной стимуляции АКТГ Гиперплазированные надпочечники способны синтезировать и секретировать аномально высокие количества кортизола. Аналогичной способностью продуцировать и секретировать избыточный кортизол обладают функционально активные опухоли коры надпочечников (аденомы и карциномы). Иными словами, у собак с ГЗГ и ГОН может быть повышен ответ на стимулирующее действие АКТГ. Если это действительно так, и если при обоих заболеваниях надпочечники сохраняют чувствительность к АКТГ, то собак с синдромом Кушинга можно выявить на основании результатов провокационной пробы с АКТГ.
Протокол. Имеется множество протоколов провокационной пробы с АКТГ (табл. 6-13). Пробу
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 319
ТАБЛИЦА 6-13. ПРОТОКОЛЫ ПРОБЫ С АКТГ (КОРТИКОТРОПИНОМ) ДЛЯ ОЦЕНКИ РЕЗЕРВА ГЛЮКОКОРТИКОИДОВ В КОРЕ НАДПОЧЕЧНИКОВ
Препарат АКП Доза Способ введения Время определения кортизола после стимуляции Ссылка
Гель АКТГ 1,0 МЕ/кг Внутримышечно 2 часа Watson et al, 1998
Гель АКТГ 2,2 ME/ki Внутримышечно 2 часа Watson et al, 1998
Синтетический АКТГ 0.25 mi собака Внутримышечно 1 час Feldman et al, 1982
Синтетический АКТГ 0,25 мг/собака Внутривенно 1 час Hansen et al, 1994
Синтетический АКТ! 5 мг/кг Внутривенно 1 час Greco et al, 1998; Frank et al, 2000
Синтетический AKTI 5 или 10 мг/кг Внутривенно 1 час Kcrl ct al 1999; Frank, Oliver, 1998
Источники геля АКТГ: HP АСТНаг, 80 ME'мл, производства Rhone-Poulenc Rorcr Pharm Inc. Collegeville. США; АСТИ gel, производства Butler Co, США; Синтетический АКТГ, производства \mphaster Pharm, США.
можно ставить в любое время суток без предварительной подготовки животного. Достоверные результаты получают при внутримышечном введении АКТГ в виде геля в дозах 1,0 или 2,2 МЕ/кг (Watson et al., 1998). Пробы плазмы, полученной из гепаринизированной крови для анализа кортизола, берут до и спустя 2 часа после инъекции геля АКТГ. Можно использовать синтетические препараты АКТГ (тетракосактрин, козинотропин, кортрозин). Мы рекомендуем вводить АКТГ внутримышечно в дозе 0?25 мг (1 флакон) на животное независимо от веса тела и брать пробы крови до инъекции и через 1 час после нее. Можно вводить АКТГ внутривенно (Hansen et а, 1994).
Козинотропин следует вводить внутривенно в дозах 1, 5 или 10 мкг/кг (вместо 0,25 мг на животное) (Kcrl et al, 1999; Frank et al, 2000). При применении таких низких доз во флаконе остается часть неиспользованного препарата, который можно развести до требуемой концентрации и хранить в пластмассовых шприцах при -20 °C без потери биологической активности в течение, по меньшей мере, 6 месяцев (Frank. Oliver, 1998). Однако козинотропин поставляется во флаконах для одноразового использования и потому не содержит консервантов, тормозящих развитие бактерий. Поэтому при хранении замороженного препарата имеется риск его бактериального загрязнения.
Гель АКТГ и синтетические препараты АКТГ максимально стимулируют секрецию гормонов из резервного пула коры надпочечников. Эти препараты и соответствующие протоколы взаимозаменяемы без ущерба для результатов определений и достоверности диагноза (Feldman et al, 1982; Watson et al, 1998). Любая провоцирующая проба должна удовлетворять критерию максимальной стимуляции секреторной функции коры надпочечников. Секреция гормонов надпочечников после введения экзогенного АКТГ должна усиливаться более значительно, чем под воздействием транспортировки животного в ветеринарную клинику, условий стационара, венопункции и иных процедур. Эффект АКТГ должен нейтрализовать влияние всех остальных провоцирующих факторов. Препарат АКТГ в форме геля дешевле синтетических препаратов
АКТГ, но его стмулирующий эффект проявляется медленнее, он не всегда доступен и может обладать разной биологической активностью (Greco et al., 1998). Синтетические препараты АКТГ легче получить (хотя иногда их тоже приходится ждать), и их активность постоянна.
Результаты
Здоровые собаки. Каждая лаборатория юлжна ориентироваться на собственные показатели нормы. В то же время результаты определения концентрации кортизола в плазме крови, получаемые во многих лабораториях, достаточно близки, поскольку используются сходные методы и протоколы. Диапазон базальной концентрации кортизола «в норме» составляет 0,5-6,0 мкг/100 мл, а его нормальная концентрация после стимуляции АКТГ обычно колеблется от 6 до 17 мкг/100 мл (рис. 6-41).
Уровень кортизола после стимуляции в пределах от 17 до 22 мкг/100 мл считается пограничным, а при более высоких концентрациях предполагают
трация кортизола в кортизола после
плазме крови стимуляции
Время
Рис. 6-41. Средняя концентрация иммунореактивною кортизола в плазме крови (результаты РИА, ±2SD) до и через 1 час после введения синтетического АКТГ у здоровых собак (контроль), собак со спонтанным и с ятрогенным гиперкортицизмом.
320 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
наличие гиперкортицизма. Выше указывалось, однако, что ответ животных в пробе с АКТГ не вполне специфичен и поэтому не заменяет тщательного анамнеза и физикального обследования при диагностике заболевания.
Базальные концентрации и соотношения. Важно подчеркнуть, что увеличение концентрации кортизола после стимуляции, выраженное в процентах к базальной концентрации или в виде отношения, неинформативно. Следует использовать только абсолютные концентрации кортизола после стимуляции АКТГ. Фактически нет необходимости определять базальную концентрацию кортизола до начала пробы. Единственным основанием для ее измерения является традиция, и мы не уверены, что это хорошая традиция. Концентрация кортизола в крови щоровой собаки до начала пробы с АКИ может составлять 1,5 мкг/100 мл. а после стимуляции 14,0 мкг/100 мл (т.е. повышаться более чем в 9 раз). В другом случае концентрации кортизола до и после стимуляции могут равняться соответственно 6,5 и 8,5 мкг/100 мл (повышение в 0,3 раза). Точно так же у собак с синдромом Кушинга концентрация кортизола до стимуляции АКТГ может составлять 3 мкг/100 мл, а после стимуляции 27 мкг/100 мл (т.е. повышаться в 9 раз) или соответственно 17,0 и 22,1 мкг/100 мл (повышение в 0,3 раза). У собаки с гиперкортицизмом концентрация кортизола до начала пробы может быть 0,1 мкг/100 мл и повышаться до 0,9 мкг 100 мл (т.е. в 9 раз) после стимуляции. Отношение концентраций кортизола до и после стимуляции AKTI представляет интерес во многих отношениях, но его использование при интерпретации результатов тестирования не рекомендуется.
Гиперкортицизм зависимый от гипофиза (ГЗГ). Примерно у 30% собак с ГЗГ концентрация кортизола после стимуляции АКТГ достигает 22 мкг/100 мл, т.е. аномально повышена. Еще у 30% животных она находится на пограничном уровне от 17 до 22 мкг/100 мл, а у 40% не превышает пределов нормы. Поэтому мы считаем, что провоцирующая проба с АКТГ недостаточно чувствительна для диагностики спонтанно развившегося ГЗГ у собак. Интересно, что такое же процентное соотношение было получено у людей с ГЗГ. Именно из-за низкой чувствительности пробу с АКТГ не используют в диагностических целях в медицинской практике. В других исследованиях чувствительность этой пробы была выше указанной здесь (Kaplan et al, 1995; Van Licw et al, 1997).
Результаты провокационной пробы с АКТГ у собак с ГЗГ и с функционально активными опухолями коры надпочечников не отличаются. Следовательно, проба с АКТГ может использоваться как скрининговый тест для диагностики синдрома Кушинга (рис. 6-42). Помимо небольших затрат времени на проведение этой пробы, она является единственным способом идентификации собак с ятрогенным синдромом Кушинга, у которых базальная концентрация кортизола находится на ниж-
Базальная концен- Концентрация кортизо-трация кортизола ла после стимуляции
Время
Рис. 6-42. Концентрация кортизола в плазме крови до и через 1 час после введения синтетического А К ГГ у собак с активно функционирующими опухолями коры надпочечников. Приведенные данные свидетельствуют о большом разбросе концентраций кортизола у разных собак с опухолями надпочечников. Заштрихованная область - величины, полученные у здоровых собак.
нем пределе нормы или ниже ее и практически не изменяется после введения экзогенного АКТГ (см. рис. 6-41). Кроме того, в ветеринарии проба с АКТГ остается единственным средством мониторинга эффективности терапии.
Провокационная проба с АКТГ может использоваться как скрининговый тест на СКС. При получении явно аномальных результатов необходима дифференциальная диагностика ГЗГ и ГОН. Если полученные величины остаются в пределах нормального или «пограничного» диапазона, следует провести пробу с низкими дозами дсксамстаюна. Если же эту пробу использовали в самом начале для подтверждения диагноза СКС, го до назначения терапии рекомендуется провести пробу с АКТГ, чтобы получить «базальную» величину как точку отсчета для последующего мониторинга.
Опухоли коры надпочечников. Автономно функционирующие опухоли коры надпочечников секретируют избыточные количества кортизола, которые подавляют продукцию и секрецию эндогенного АКТГ. У собак с гиперкортицизмом, вызванным опухолями надпочечников, концентрация АКТГ в сыворотке крови должна быть низкой или ниже чувствительности метода определения (см. рис. 6-6). Подавление секреции эндогенного АКТГ приводит к атрофии нормальной (не пораженной опухолью) ткани коры надпочечников. Однако, несмотря на автономную функцию опухолевых клеток, в них сохраняются поверхностные рецепторы АКТГ и внутриклеточные механизмы, обеспечивающие ответ на этот гормон. Приблизительно у
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 321
60% собак с ГОН концентрация кортизола в ответ на стимуляцию АКТГГ значительно повышается (до «пограничного» или явно высокого уровня). Приблизительно у 40% собак с ГОН ответ на АКТГ находится в пределах нормы (см. рис. 6-42) и у небольшого числа собак он может быть очень слабым или вообще отсутствовать. Возможно, у последних опухоли синтезируют иные, нежели кортизол, стероиды. В связи с этим целесообразно определять концентрацию 17а-гидроксипрогестерона в крови (см. раздел с описанием соответствующей методики), однако прежде следует провести пробу с низкими дозами дексаметазона.
При повторных пробах с АКТГ у некоторых собак могут быть получены другие величины базальной и/или индуцированной концентрации кортизола, отличные от результатов первой пробы. Некоторые собаки с опухолями коры надпочечников нормально отвечают на экзогенный АКТГ в одной пробе и аномально, либо совершенно иначе, при повторном тестировании (Feldman, 1981; Peterson et al, 1982b). В одном из исследований у 44% собак с аденомой надпочечников ответ на стимуляцию АКТГ был выше нормы. Гипертрофированный ответ был зарегистрирован также у 69% собак с карциномой коры надпочечников, при этом он был примерно в четыре раза выше, чем у животных с аденомами. Таким образом, максимальное повышение концентрации кортизола в пробе с АКТГ имело место у собак с карциномами надпочечников (Peterson et al, 1982b). Однако в другом исследовании не было столь существенного различия в ответе на АКТГ у собак с аденомами и карциномами коры надпочечников (Feldman, 1983b).
Проба с АКТГ остается ценным инструментом скрининговых исследований. Она позволяет идентифицировать собак с ГОН, хотя, как и в случае ГЗГ, ответ на АКТГ может оказаться в пределах нормы. Иными словами, эта проба не позволяет дифференцировать ГЗГ и ГОН.
Ятрогенный синдром Кушинга. Одно из преимуществ провокационной пробы с АКТГ для скрининговых исследований собак с подозрением на синдром Кушинга состоит в том, что она позволяет надежно идентифицировать животных с ятрогенным заболеванием. У собак, регулярно получающих глюкокортикоиды, могут появиться все клинические симптомы спонтанного гиперкортицизма. Это наблюдалось при терапии препаратами глюкокортикоидов для инъекций, для перорального, топического и даже офтальмологического применения (Roberts et al, 1984; Zenoble, Kemppainen, 1987; Eichenbaum et al, 1988; Glaze et al, 1988; Murphy et al, 1990; Romantowski, 1990; Moore, Hoenig, 1992). Этот вопрос чрезвычайно актуален в контексте скрининговых исследований, поскольку далеко не все владельцы животных понимают, насколько важно знать, какие препараты получают их питомцы, и информировать об этом специалистов при обращении в ветеринарное учреждение.
Если клинические признаки и результаты рутинных лабораторных анализов указывают на наличие у собаки синдрома Кушинга и при этом у нее низкая базальная концентрация кортизола, а ответ на АКТГ слабый или отсутствует, то весьма вероятно ятрогенное происхождение заболевания (см. рис. 6-41). Никакой другой тест, кроме пробы с АКТГ, не позволяет отличить ятрогенный СКС от спонтанного. Уместно заметить, что у получающих глюкокортикоиды больных функцию гипофизарно-надпочечниковой системы нельзя достоверно оценить ни на основании дозы или продолжительности терапии, ни на основании базальной концентрации кортизола в плазме крови (Schlaghecke et al, 1992).
Терапия о,р’-ДДД. о,р’-ДДД (митотан, лизод-рен) и низорал (кетоконазол) часто применяются для лечения собак с гиперкортицизмом. Первый препарат используется гораздо чаще, чем второй. В обоих случаях провокационная проба с АКТГ является единственным способом эффективного мониторинга терапии. Не существует других путей оценки функционального резерва коры надпочечников и получения достоверной информации об адекватности выбранного лечения. Применение провоцирующей пробы с АКТГ при лечении синдрома Кушинга обсуждается в разделе «Поддерживающая терапия с использованием о,р’-ДДД».
Общие выводы. Провокационная проба с АКТГ помогает диагностировать ССК более чем у половины собак с ГОН и почти у 60% собак с ГЗГ. У многих собак с ГОН и ГЗГ результаты пробы остаются в норме. Если у собаки имеются клинические признаки гиперкортицизма, то наличие этого заболевания нельзя исключать на основании нормальных или «пограничных» результатов пробы с АКТГ (Feldman, 1983b). Более того, результаты этой пробы не позволяют ни дифференцировать ГЗГ и ГОН, ни отличить собак с аденомами коры надпочечников от животных с карциномами. Проба с АКТГ является сравнительно простым, достоверным и безопасным скрининговым тестом, проводимым с целью диагностической оценки собак с подозрением на гиперкортицизм. Постановка пробы до начала терапии позволяет получить информацию, которая может использоваться при мониторинге состояния животного в процессе и после лечения. Провокационная проба с АКТГ является единственным способом надежной идентификации ятрогенного синдрома Кушинга.
Сахарный диабет. Весьма непросто отличить собак, болеющих сахарным диабетом, от животных, имеющих одновременно диабет и синдром Кушинга. При хорошо компенсированном диабете эндокринологические исследования дают нормальные результаты (Zerbe et al, 1988). В то же время считается, что хроническое заболевание, в частности диабет, может влиять на результаты оценки функции коры надпочечников. Это вполне вероятно, но нуждается в подтверждении, так как в одном из исследований только у 14% собак с ненадпочечниковыми заболеваниями наблюдали аномальную
322 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
стимуляцию секреции кортизола в пробе с АКТГ (Kaplan et al, 1995). У собак с лимфосаркомой лишь одна из 42 провоцирующих проб индуцировала аномальную секрецию кортизола, а в двух других были получены «пограничные» показатели секреции (Gieger et al, 2002). Таким образом, хотя результаты теста при плохо компенсированном диабете в отсутствие синдрома Кушинга иногда могут вводить в заблуждение, в большинстве случаев проба с АКТГ дает надежную информацию. Тем не менее, в этой ситуации диагноз гиперкортицизма нуждается в подтверждении, во-первых, аномальными результатами в двух или более скрининговых тестах и, во-вторых, наличием клинических симптомов синдрома Кушинга. «Инсулинорезистентность» - неспецифический показатель и сама по себе не является достаточным основанием для назначения лечения синдрома Кушинга.
Хроническое (неэндокринное) заболевание. Как указывалось выше, не все собаки с гиперкортицизмом отвечают на стимуляцию АКТГ аномальным или «диагностически значимым» усилением секреции кортизола. Точнее, результаты пробы с АКТГ можно использовать в качестве диагностического показателя гиперкортицизма менее чем у 35% собак. Примерно такова же частота получения «пограничных» значений концентрации кортизола в этой пробе. Однако, «диагностически значимые» результаты получают не только у собак с гиперкортицизмом. У девяти из 59 особей (15%) с ненадпочечниковыми заболеваниями и у одной из 42 с хронической патологией (лимфосаркома) результаты пробы с АКТГ предполагали диагноз синдром Кушинга (соответственно Kaplan et al, 1995 и Gieger et al, 2002). Всегда существует опасность ошибки, если диагноз ставится с использованием лишь одного теста.
Противосудорожные средства. См. раздел «Дифференциальная диагностика» в этой главе.
Ошибочные результаты. Результаты отдельных тестов могут приводить к диагностическим ошибкам из-за неправильного обращения с препаратами АКТГ, нарушения процедуры их введения, получения плазмы или проведения контрольных измерений. Такие ошибки встречаются при работе с собаками, у которых имеются клинические симптомы ССК, подтвержденного рутинными исследованиями в условиях стационара. Если возникают сомнения в достоверности результатов того или иного теста, его следует повторить или провести другое скрининговое исследование, например пробу с низкими дозами дексаметазона.
Скрининговое исследование с дексаметазоном
(проба с низкими дозами дексаметазона)
Теоретическое обоснование
Здоровые собаки. Гипофизарный АКТГ, секреция которого регулируется гипоталамусом, стиму
лирует биосинтетическую активность коры надпочечников и секрецию глюкокортикоидов, повышая их концентрацию в крови. Эти стероиды через механизм отрицательной обратной связи подавляют секрецию АКТГ (см. рис. 6-6). Взаимодействие между гипофизом и надпочечниками представляет собой постоянно действующую систему положительной и отрицательной стимуляции, которая поддерживает концентрации кортизола в плазме крови на физиологическом уровне, необходимом для сохранения нормального гомеостаза.
Внутривенное введение относительно низких (0,01 или 0,015 мг/кг веса тела) доз дексаметазона (как и введение любого глюкокортикоида) тормозит секрецию гипофизарного АКТГ, что, в свою очередь, приводит к подавлению эндогенной секреции кортизола в течение последующих 24-48 часов (Toutain et al, 1983). У нормальных собак после введения дексаметазона концентрация кортизола в плазме крови уменьшается в течение 2-3 часов до уровня ниже 1-1,4 мкг/100 мл (в зависимости от лаборатории).
Хотя по литературным данным эти величины представляют верхнюю границу нормы, но почти у всех собак в отсутствие стресса или заболевания (собаки с ССК не считаются «больными»), а также у собак без ССК концентрация кортизола в плазме падает ниже 0,7 мкг/100 мл. Синтетический глюкокортикоид дексаметазон используют не только в силу его активности, но и потому что он не дает перекрестной реакции при определении кортизола, что позволяет оценивать его эффект in vivo. Функцию гипофизарно-надпочечниковой системы оценивают, вводя дексаметазон и регистрируя в течение последующих 2-3 часов концентрацию кортизола в плазме крови, которая опускается намного ниже 1,4 мкг/100 мл и держится на этом уровне более 8 часов (рис. 6-43,А). Именно этот 8-часовой показатель меньше 1,0 или 1,4 мкг/100 мл принят в качестве нормы в большинстве лабораторий. Концентрация кортизола выше 1,4 мкг/100 мл предполагает диагноз ССК.
Гиперкортицизм, зависимый от гипофиза (ГЗГ). Секреция АКТГ функционально активными опухолями гипофиза приводит к гиперплазии коры надпочечников вследствие хронически избыточной стимуляции. Логически, гипофизарные опухоли у собак с ГЗГ должны обладать известной резистентностью к действию кортизола по механизму отрицательной обратной связи. В противном случае избыток кортизола в плазме крови вызывал бы подавление секреции АКТГ и препятствовал развитию ГЗГ. Поэтому введение низких доз дексаметазона животным с ГЗГ не должно подавлять секрецию гипофизарного АКТГ опухолями и, следовательно, не должно снижать концентрацию кортизола в плазме крови.
Гиперкортицизм, вызванный опухолью надпочечников (ГОН). Функционально активные опухоли коры надпочечников автономно секретируют
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 323
Концентрация кортизола в плазме Концентрация кортизола в плазме
крови (мкг/мл) крови (мкг/мл)
Рис. 6-43. Средняя концентрация кортизола в плазме крови до и после введения низкой дозы дексаметазона. А. 27 здоровых собак; Б. 48 собак с опухолями коры надпочечников, В. 130 собак с ГЗГ; Г. Собаки, у которых хотя бы при одном измерении уровень кортизола после введения дексаметазона был ниже 1,4 мкг/100 мл (всего 54 собаки, отобранные из 178 собак с синдромом Кушинга, все с ГЗГ) и Д. Собаки с синдромом Кушинга, у которых хотя бы при одном измерении концентрация кортизола после введения дексаметазона составляла меньше 50% базальной величины (всего 95 собак, отобранных из 178 собак с синдромом Кушинга, все с ГЗГ). Обратите внимание, что на графиках Б, В, Г и Д представлены две кривые. Одна из них иллюстрирует результаты, полученные при использовании препарата дексаметазона в форме фосфорнокислого натрия (пунктирная линия), а другая — при использовании дексаметазона в полиэтиленгликоле (сплошная линия). Различия между результатами определений после введения обоих препаратов статистически недостоверны.
кортизол. Поскольку этот кортизол синтезируется и секретируется в избыточных количествах, он индуцирует клинически выраженный синдром Кушинга и подавляет секрецию эндогенного АКТГ. Секреция кортизола опухолями не контролируется АКТГ. Дексаметазон уменьшает концентрацию кортизола в
крови, ингибируя секрецию АКТГ гипофизом. Однако синтез и секреция АКТГ уже подавлены в результате автономной секреторной активности опухоли коры надпочечников. Поэтому введение дексаметазона собакам с такими опухолями не вызывает снижения концентрации кортизола (рис. 6-43,Б).
324 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Быстрый клиренс дексаметазона. Отсутствие снижения концентрации кортизола у собак с синдромом Кушинга, особенно при ГЗГ, объясняется не только «резистентностью» к дексаметазону, но и высокой скоростью его метаболического клиренса. Почти у 75% собак с синдромом Кушинга дексаметазон выводится из крови менее чем за 8 (обычно 3-6) часов вместо 24^48 часов у здоровых животных. Иными словами, скорость его клиренса при ССК возрастает. В результате концентрация кортизола в крови временно уменьшается (через 4 часа после введения дексаметазона), но через 8 часов возвращается к прежнему уровню (Lothrop, Oliver, 1984; Kemppainen, Peterson, 1993).
Протокол. Определяют утреннюю базальную концентрацию кортизола в плазме или сыворотке крови (норму для данной лаборатории), а затем внутривенно вводят дексаметазон в дозе 0,01 мг/кг. При введении дозы 0,015 мг/кг получаются практически такие же результаты, как при введении 0,01 мг/кг (Mack, Feldman, 1990). Для инъекций используют препарат дексаметазона в форме фосфорнокислого натрия или дексаметазон в полиэтиленгликоле (Azium, производство Schering-Plough, Union, NJ) (Mack, Feldman, 1990). Пробы крови для определения кортизола берут через 8 часов после инъекции (Feldman, 1983а). Для целей скрининга нет необходимости анализировать пробы, взятые в промежуточные сроки, хотя иногда рекомендуется брать дополнительную пробу через 4 часа после введения дексаметазона (см. раздел, посвященный дискриминационным тестам). До проведения анализа полученные пробы хранят при низкой температуре или замороженными.
Результаты пробы
Собаки без синдрома Кушинга в отсутствие стресса. У здоровых собак концентрация кортизола в плазме крови через 8 часов после введения дексаметазона не превышает 1,0 мкг/100 мл (обычно менее 0,7 мкг/100 мл). Как показано на рис. 6-43, А, введение дексаметазона здоровым животным неизменно приводит к снижению концентрации кортизола через 3-8 часов. В ряде исследований специфичность пробы с дексаметазоном оценивали на собаках с разными заболеваниями. Мы не рекомендуем использовать данную пробу для обследования любой больной собаки, даже если у нее подозревают синдром Кушинга. Поэтому не совсем понятно, зачем с ее помощью тестировать больных собак без синдрома Кушинга. Наш опыт оценки результатов пробы с дексаметазоном на собаках с полиурией и полидипсией либо с алопецией, в стабильном состоянии и в отсутствие стресса и синдрома Кушинга, свидетельствует о ее высокой специфичности. Таким образом, эта проба и чувствительна и специфична.
Гиперкортицизм зависимый от гипофиза. У собак с ГЗГ концентрация кортизола в плазме крови
через 8 часов после введения дексаметазона была неизменно выше 1,0-1,4 мкг/100 мл. Концентрации кортизола в диапазоне от 1,0 до 1,4 мкг/100 мл диагностически не значимы, поэтому для подтверждения диагноза гиперкортицизма следует ориентироваться на другие показатели. Вместе с тем, такие результаты пробы, разумеется, нельзя считать «нормальными». Проба с низкими дозами дексаметазона позволяет надежно различать собак с гиперкортицизмом и животных без синдрома Кушинга. Ее результаты подтверждают наличие синдрома Кушинга более чем у 99% собак с ГЗГ (Feldman et al, 1996). У таких животных обычно имеют место два типа ответа на низкие дозы дексаметазона.
Один из них нетрудно предсказать, зная физиологическую основу теста, а именно отсутствие ингибирующего действия дексаметазона на секрецию АКТГ из автономно функционирующей опухоли гипофиза, вследствие чего концентрация кортизола в плазме крови через 4 и 8 часов после инъекции практически не изменяется. Понятие «практически неизменная» концентрация кортизола в данном случае означает, что через 4 и 8 часов после введения дексаметазона она превышает базальную концентрацию, равна ей или снижена, но остается выше 50% базальной величины. Например, концентрация кортизола 2,5 мкг/100 мл через 4 и 8 часов после инъекции дексаметазона при базальной концентрации 4 мкг/100 мл означает «отсутствие подавления». Аналогично при том же базальном уровне кортизола интерпретируются концентрации 4,0 или 5,5 мкг/100 мл спустя 4 и 8 часов после инъекции. Подобный характер изменений уровня кортизола весьма типичен и отмечается приблизительно у 33% собак с ГЗГ. Иными словами, концентрация кортизола через 4 часа после введения дексаметазона остается не ниже 1,4 мкг/100 мл (абсолютная величина), а через 4 и 8 часов снижается не более чем на 50% базальной величины. Эти показатели соответствуют диагнозу гиперкортицизма, но не позволяют дифференцировать ГЗГ и ГОН.
Другой обычный ответ на введение низких доз дексаметазона собакам с ГЗГ — это «уменьшение» концентрации кортизола в плазме крови, которое должно соответствовать одному из трех следующих критериев: 1) концентрация кортизола ниже 1,4 мкг/100 мл через 4 часа после инъекции, 2) концентрация кортизола составляет менее 50% его базальной концентрации через 4 часа после инъекции и 3) концентрация кортизола составляет менее 50% его базальной концентрации через 8 часов после введения дексаметазона. Такое «уменьшение» имеет место примерно у 65% собак с ГЗГ. Почти у 100% этих животных концентрация кортизола спустя 8 часов после инъекции дексаметазона превышает 1,4 мкг/100 мл. Следовательно, результаты оценки уровня кортизола через 8 часов после введения дексаметазона соответствуют диагнозу гиперкортицизм практически у всех собак с ГЗГ. Это
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 325
свидетельствует о высокой чувствительности пробы с низкими дозами дексаметазона. В описанных условиях дексаметазон подавляет биосинтез АКТГ в гипофизе в течение всего 3-6 часов после инъекции, т.е. на протяжении значительно меньшего периода, чем у нормальных животных. Это различие отражает повышенную скорость его метаболизма у собак с синдромом Кушинга (Mack, Feldman, 1990; Feldman et al, 1996).
Гиперкортицизм, вызванный опухолью надпочечников. Интерпретация результатов определения концентрации кортизола через 8 часов после введения дексаметазона одинакова при ГЗГ и ГОН, т.е. при ГОН она также должна быть равна или выше 1,4 мкг/100 мл. Но в отличие от большинства собак с ГЗГ, у животных с ГОН концентрация кортизола не подавляется ни в какие сроки после инъекции дексаметазона (рис. 6-43, Б). Единственным исключением является «кажущееся подавление», связанное с необычно частыми флуктуациями концентрации кортизола, и взятие пробы в какой-то момент может совпасть с ее временным падением до нуля (Feldman et al, 1996). Концентрация кортизола в крови собак подвержена колебаниям как при нормальной функции гипофизарно-надпочечниковой системы, так и при ее нарушении. Недавно опубликованное сообщение (Norman et al, 1999) о подавлении дексаметазоном секреторной активности опухолей коры надпочечников у восьми собак представляется совершенно нетипичным. Мы склонны думать, что ни одна их этих собак на самом деле не имела автономных кортизол-продуцирующих опухолей. Это мнение основывается на результатах обследования более 300 животных с автономным ССК, индуцированным подтвержденными аденомами или карциномами коры надпочечников. Ни у одной их этих собак проба с низкими дозами дексаметазона не вызывала уменьшения концентрации кортизола в крови. Более того, не существует физиологических предпосылок для проявления ингибирующего действия дексаметазона у собак с автономными секретирующими кортизол опухолями коры надпочечников, которые вызывают ССК. Следовательно, если результаты пробы с низкими дозами дексаметазона не оправдали ожиданий, это означает одно из двух: либо ожидания не соответствовали истине, либо была допущена ошибка при проведении пробы.
Сахарный диабет. Как отмечалось ранее, у собак без синдрома Кушинга и с хорошо компенсированным сахарным диабетом результаты оценки эндокринной функции коры надпочечников обычно находятся в пределах нормы. При плохо компенсированном диабете эти результаты обычно также укладываются в принятый в лаборатории нормальный диапазон, хотя у небольшого процента животных могут выходить за его пределы. Мы обследовали несколько собак с плохо компенсированным диабетом без клинических признаков синдрома Кушинга.
Хотя проба с низкими дозами дексаметазона давала у этих собак аномальные результаты, у них так и не развилась клиническая симптоматика, характерная для синдрома Кушинга, и вскрытие не выявило признаков гиперкортицизма. Эта небольшая группа собак служит хорошей иллюстрацией одного важного принципа, а именно: диагноз синдром Кушинга нельзя ставить только на основании результатов эндокринологических тестов.
Чувствительность, специфичность и ошибочные результаты. Следует помнить, что ни один диагностический тест не является идеальным, и проба с низкими дозами дексаметазона не составляет исключения. У собак, которые по данным анамнеза, физикального исследования и анализа «базы данных» имели синдром Кушинга (ССК), чувствительность пробы с дексаметазоном приближалась к 99% (т.е. у 99% животных с ССК были получены аномальные результаты). Собранные нами, но неопубликованные данные также указывают на высокую чувствительность данной пробы. Аномальные результаты регистрируются менее чем у 5% «здоровых» собак с полиурией и полидипсией (обусловленными сахарным и несахарным диабетом, гиперкальциемией и хронической почечной недостаточностью). Суммируя имеющиеся данные о чувствительности и специфичности пробы с низкими дозами дексаметазона, мы приходим к выводу, что ее диагностическая ценность выше ценности провоцирующей пробы с АКТГ или отношения КОР/КРЕ в моче. По нашему мнению, эти три метода являются «взаимодополняющими».
Как и в случае провокационной пробы с АКТГ, результаты скрининга с использованием пробы с дексаметазоном могут приводить к неверным выводам. Из 59 обследованных собак с ненадпочечниковым заболеванием нормальное подавление секреции кортизола отсутствовало у 22 (37%) и 33 (56%) соответственно через 4 и 8 часов после введения дексаметазона (Kaplan et al, 1994). Вполне вероятно, однако, что для этого исследования была неправильно выбрана группа животных. Мы не рекомендуем проводить эндокринологические исследования больных собак с достаточно обоснованным подозрением на наличие ССК. Такие исследования следует отложить до стабилизации состояния животного, отчасти потому что результаты тестирования будут более достоверными, а отчасти из-за того, что больным собакам не следует назначать терапию синдрома Кушинга.
Лечение противосудорожными препаратами может привести к необычным изменениям концентрации кортизола в крови собак и невозможности ее нормального подавления (Chauvet et al, 1995). Стресс при купании, госпитализации, болезни и множество других факторов также могут нарушать ингибирующее действие дексаметазона. Ятрогенные стероиды длительное время сохраняются в крови, затрудняя регистрацию ингибирующего действия дексаметазона, поскольку существующие
У1Ь • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
методы определения кортизола измеряют содержание как эндогенных, так и ятрогенных глюкокортикоидов (но не дексаметазона). При любом подозрении на ятрогенное заболевание следует провести провокационную пробу с АКТГ (см. рис. 6-41). Результаты пробы с низкими дозами дексаметазона в большей степени зависят от разнообразных воздействий, чем результаты пробы с АКТГ. При интерпретации данных, получаемых с помощью обеих проб, следует помнить, что ни та, ни другая не гарантируют от ошибок. Пробы с АКТГ и низкими дозами дексаметазона применяются для подтверждения подозрения на то или иное заболевание. Наиболее ценную информацию для первоначального скрининга дают изучение анамнеза и физикальное исследование.
Концентрация 17-гидроксипрогестерона в плазме крови
Общие сведения. Спонтанно развившийся гиперкортицизм у собак рассматривается как заболевание, при котором избыточная продукция кортизола является следствием одного из двух процессов: (1) усиленного биосинтеза АКТГ в гипофизарной опухоли, который стимулирует секрецию аномально больших количеств кортизола из коры надпочечников и, в конечном итоге, вызывает гиперплазию коры (ГЗГ) или (2) автономного функционирования надпочечниковой аденомы или карциномы, секретирующей избыточные количества кортизола и служащей причиной его аномально высокой концентрации в крови (ГОН). В обоих случаях, помимо кортизола, могут синтезироваться и секретироваться другие стероидные гормоны. Так, например, кора надпочечников с нарушенной функцией может секретировать избыточные количества 11-дезоксикортизола, дезоксикортикостерона, альдостерона, прогестерона, 17а-гидроксипрогестерона, эстрогенов и андрогенов. Однако в секрете таких надпочечников практически неизменно преобладает кортизол, тогда как содержание его разнообразных предшественников увеличивается далеко не всегда. Возможно, описанные изменения физиологических процессов объясняют, почему у некоторых собак с ССК имеется гипертензия, а у других она не развивается, или почему одни страдают полиурией и полидипсией, а у других эти расстройства отсутствуют. Они также помогают лучше понять другие «вариации на тему» синдрома Кушинга у собак.
Таким образом, у собак и кошек с атипичным синдромом Кушинга могуть быть нарушены одна или несколько стадий биосинтеза стероидов из-за относительной недостаточности того или иного фермента, участвующего в образовании кортизола. В таких случаях имеет место «блокада» стероидогенеза и накапливаются большие количества специфических предшественников кортизола, тогда как реакция последнего на АКТГ и дексаметазон остается нормальной. Подобная ситуация объясняет
невозможность подтверждения синдрома Кушинга у отдельных собак рутинными скрининговыми эндокринологическими исследованиями, несмотря на наличие всех признаков этого заболевания в анамнезе и при физикальном исследовании.
Опухоли коры надпочечников. Опухоль коры надпочечников образуется в процессе неопластического роста той или иной клеточной линии. Такие клетки могут синтезировать один или несколько гормонально активных стероидов. При этом в зависимости от синтетической способности клеток один или несколько стероидов образуются в избыточном количестве. Эти выводы подтверждаются тем обстоятельством, что одни (большинство) опухолей коры надпочечников синтезируют кортизол, тогда как в других образуется альдостерон. Имеются также сообщения о биосинтезе других, нежели кортизол и альдостерон, стероидов в некоторых опухолях надпочечников человека. В частности, были описаны пациенты без симптомов синдрома Кушинга, у которых неожиданно обнаружили опухоль надпочечника и резкое повышение концентрации 17-гидроксипрогестерона в крови после введения экзогенного АКТГ (Turton et al, 1992; Bondanella et al, 1997).
Прогестерон образуется в коре надпочечников из холестерина через стадии биосинтеза прегненолона и 17-гидроксипрогестерона (см. рис. 6-3 и 6-4).
В норме в кровеносное русло поступает лишь небольшое количество синтезированного прогестерона. У отдельных больных с опухолями коры надпочечников нарушение биосинтеза стероидных гормонов охарактеризовано достаточно подробно (Orth et al, 1998). В некоторых опухолях отсутствуют ферменты, необходимые для нормального стероидогенеза. Это приводит к накоплению большого количества предшественников стероидных гормонов на стадиях, непосредственно предшествующих этапам, заблокированным из-за дефицита соответствующих ферментов. В результате предшественники поступают в кровь и индуцируют определенные клинические симптомы либо включаются в альтернативные метаболические процессы и могут вызвать избыточную продукцию других стероидных соединений. Полагают, что ферментативная недостаточность описанного типа является уникальной характеристикой той или иной опухоли; в период, предшествовавший ее возникновению, гормональный синтез мог проходить нормально (Toth et al, 2000). Однако в ряде случаев, по-видимому, имеет место наследственная частичная ферментативная недостаточность, которая клинически не проявляется до появления опухоли.
У некоторых людей с гормон-секретирующи-ми опухолями коры надпочечников клинические проявления отсутствуют, тогда как у других развиваются клинические расстройства, которые купируются адреналэктомией (Orth et al, 1998). Иногда больные могут давать нормальный ответ на низкие дозы дексаметазона. Одна собака, у которой декса
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 327
метазон подавлял секрецию кортизола, имела гормонально активную опухоль коры надпочечников, продуцирующую половые гормоны (Syme et al, 2001). Некоторые прогестины обладают собственной высокой глюкокортикоидной активностью. С другой стороны, повышение концентрации прогестинов может сопровождаться клиническими расстройствами вследствие вытеснения кортизола из комплекса со связывающим его белком (Juchem et al, 1990; Selman et al, 1997). В результате образуется избыток «свободного» кортизола на фоне нормальной или пониженной общей концентрации гормона в крови. Свободный кортизол метаболически активен и при повышении концентрации может вызывать клинические симптомы.
Гиперкортицизм зависимый от гипофиза. Вероятность синтеза и секреции атипичных стероидных гормонов у собак с ГЗГ должна быть невелика по той простой причине, что АКТГ в основном стимулирует биосинтез и высвобождение кортизола. Почему у взрослого животного, неспособного синтезировать такой жизненно важный гормон как кортизол, гипокортицизм не развился в молодом возрасте? Столь же интересно, что хронически повышенная концентрация прогестерона в плазме крови встречается не так уж редко. Все здоровые самки с нормально протекающими эструсом и ди-эструсом имеют чрезвычайно высокую концентрацию прогестерона на протяжении от 60 до 90 дней и более. Зачастую она приближается к концентрации этого гормона в анэструсе либо в 50-100 раз превосходит ее, и такое физиологическое состояние может сохраняться месяцами. У сук в диэстру-се обычно отсутствуют полидипсия, полиурия, полифагия, мышечная слабость, одышка, выпадение шерсти, отвислый живот и другие симптомы. Правда, некоторые авторы наблюдали эту патологию у отдельных особей с ГЗГ (Ristic et al, 2002). Таким образом, физиологическое действие 17-гидрокси-прогестерона значительно отличается от действия прогестерона.
Ветеринарные данные. Описана собака с опухолью коры надпочечников, секретировавшей дезоксикортикостерон (Reine et al, 1999). В двух других сообщениях было описано по две собаки с опухолями коры надпочечников, секретировавшими большие количества 17-гидроксипрогестерона в ответ на введение экзогенного АКТГ (Norman et al, 1999; Syme et al, 2001). У всех четырех животных имелись клинические признаки, заставлявшие подозревать ССК, однако концентрация кортизола в их крови после стимуляции АКТГ была ниже, чем у здоровых животных. Такое сочетание клинических симптомов и результатов пробы с АКТГ предполагает избыток ятрогенного кортизола в качестве первичного дифференциального диагноза, хотя теоретически в опухолях могли просто отсутствовать рецепторы АКТГ. Кроме того, ятрогенное заболевание не объясняет присутствия опухолевидной массы. Собаки с опухолями коры надпочечников, кото
рые не отвечали на введение АКТГ, описывались и ранее (Reusch, Feldman, 1991).
Вслед за сообщениями об опухолях коры надпочечников, вызывавших повышение концентраций половых гормонов в крови животных, появились публикации об использовании результатов измерения 17-гидроксипрогестерона для диагностики ГЗГ. Были описаны пять собак, у которых диагноз ГЗГ был поставлен почти исключительно на основании повышенного ответа 17-гидроксипрогестерона на стимуляцию экзогенным АКТГ (Frank et al, 2001).
Еще одно сообщение касалось четырех разных групп собак (Ristic et al, 2002). Одна группа включала животных, у которых концентрация кортизола в плазме крови аномально повышалась под воздействием экзогенного АКТГ, в другой имела место аномальная реакция в пробе с низкими дозами дексаметазона, в третьей группе результаты скрининговых тестов были неоднозначны, а в четвертой все рутинные пробы давали нормальные результаты. У собак всех четырех групп концентрация 17-гидроксипрогестерона после стимуляции АКТГ отличалась от нормальной. Некоторые собаки с ССК были признаны «нетипичными», поскольку ответ кортизола в провокационном тесте с АКТГ укладывался в нормальные пределы. Однако такие же нормальные результаты были получены в пробе с АКТГ у 40% «типичных» собак с СКС.
Таким образом, чувствительность этой пробы недостаточно высока, и ее результаты не дают основания рассматривать собак, нормально отвечающих на стимуляцию экзогенным АКТГ, как «нетипичных». У людей, собак и кошек с синдромом Кушинга нормальная реакция в пробе с АКТГ бывает часто, поэтому в медицине эта проба не используется в диагностических целях. Семь собак были признаны «нетипичными», поскольку у них ответ кортизола в тестах стимуляции и подавления был «нормальным» или на пограничном уровне. Четверо из этих животных имели опухоли коры надпочечников, что, по нашему мнению, вполне логично (концентрация кортизола у них оставалась пониженной на всем протяжении исследования, и дексаметазон не вызывал ее дальнейшего понижения). Тем не менее, трем остальным собакам был поставлен диагноз ГЗГ, несмотря на то, что в провокационной пробе с АКТГ и в пробе с низкими дозами дексаметазона были получены нормальные результаты. Правильность диагноза была подтверждена данными определения 17-гидроксипрогестерона в плазме крови после стимуляции АКТГ. Такие собаки нуждаются в более углубленном обследовании. Однако уже сейчас можно сказать, что у некоторых собак определение концентрации 17-гидроксипрогестерона в дополнение к скринингу на ССК повышает достоверность диагноза, тогда как в других случаях приводит к необоснованному назначению лечения животным, у которых ССК отсутствует.
Протокол и нормальные показатели. Протокол использования результатов определения
328 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
17-гидроксипрогестерона для целей диагностики достаточно прост. Рутинную пробу с АКТГ проводят, как описано выше в данном разделе. В дополнение к концентрациям кортизола в сыворотках или плазме крови, полученных до и после стимуляции, измеряют уровень 17-гидроксипрогестерона. В одном из исследований использовали гепаринизированную плазму, а определения проводили с помощью твердофазного РИА (Coat-A-Count 17а-OH-progesterone, производства Diagnostic Products Corp.). Нижний предел чувствительности метода равнялся 0,33 нг/мл. Диапазон нормальных концентраций 17-гидроксипрогестерона до введения АКТГ составлял от менее 0,33 до 0,63 нг/мл, а после стимуляции 0,33-1,82 нг/мл, причем величины, превышавшие 1,32 нг/мл, рассматривались как положительный результат пробы (Ristic et al, 2002). В другом исследовании были приняты несколько другие показатели нормы, а именно, 0-0,4 нг/мл до введения АКТГ и 0,4^1,5 нг/мл после стимуляции (Frank et al, 2001). В одном исследовании у собак с СКС концентрация 17-гидроксипрогестерона после введения экзогенного АКТГ была в пределах 1,5-12,5 нг/мл (медиана менее 4 нг/мл) (Ristic et al, 2002), а в другом исследовании средние величины составляли 1,3 и 4,2 нг/мл соответственно до и после стимуляции (Frank et al, 2001).
Мы установили нормальные диапазоны концентрации 17а-гидроксипрогестерона после стимуляции экзогенным АКТГ для здоровых собак (табл. 6-14). Они базируются на расчете средних стандартных отклонений (±2 SD) результатов измерений у 21 здорового кобеля и 20 сук. Из 22 кобелей с ССК у девяти концентрация 17а-гидроксипрогестерона была в пределах установленного диапозона, у шести она соответствовала «пограничным», а у семи - аномальным значениям. Среди 20 сук с ССК 13 имели нормальную концентрацию 17а-гидрокси-
ТАБЛИЦА 6-14. КОНЦЕНТРАЦИЯ 17а-ГИДРОКСИПРОГЕСТЕРОНА ПОСЛЕ ВВЕДЕНИЯ АКТГ У ЗДОРОВЫХ СОБАК И СОБАК СО СПОНТАННО РАЗВИВШИМСЯ ГИПЕРКОРТИЦИЗМОМ
Кобели Суки
Нормальная концентрация <3,58 (п= 21) <7,98 (п = 20)
Пограничная концентрация 3,58-4,40 7,98-10,48
Аномальная концентрация >4,40 >10,48
ГЗГ (п=12) (п=13)
Число собак с нормальной 4 8
концентрацией Число собак с пограничной 3 3
концентрацией Число собак с аномальной 5 2
концентрацией ГОН (п=10) (п = 7)
Число собак с нормальной 5 5
концентрацией Число собак с пограничной 3 1
концентрацией Число собак с аномальной 2 1
концентрацией
прогестерона, у четырех она была «пограничной», а у трех - аномальной. Таким образом, нарушение стимулирующего действия АКТГ на секрецию 17а-гидроксипрогестерона имело место у 10 (24%) из 42 обследованных собак (см. табл. 6-14). Необходимы дальнейшие исследования для выяснения значимости данного метода в диагностике ССК.
Другие скрининговые тесты
Изоферменты щелочной фосфатазы. См. раздел «Щелочная фосфатаза в сыворотке крови», где обсуждается использование результатов определения изоферментов ЩФ в качестве скринингового теста.
Высокоэффективная жидкостная хроматография и определение концентрации свободного кортизола в плазме крови. Эти методы не всегда доступны, дороги и сложны для повседневного применения в сравнении с коммерческими наборами РИА. Кроме того, они не обладают существенными преимуществами перед более традиционными и широко используемыми методиками.
Комбинированная проба с дексаметазоном и АКТГ. В качестве единственного, быстрого и относительно недорогого теста, дающего информацию о состоянии гипофиза и активности надпочечников, была предложена комбинация проб подавления секреции кортизола дексаметазоном и ее стимуляции АКТГ (Zerbe, 2000а). Однако ни мы, ни многие другие авторы не рекомендуем использовать такую комбинированную пробу, поскольку она, в сущности, представляет собой сочетание двух несовершенных методик и дает менее достоверные результаты, чем каждая из них в отдельности (Feldman, 1985, 1986). Если все же решают сочетать пробу с низкими дозами дексаметазона и провоцирующую пробу с АКТГ (что крайне нежелательно), то сначала проводят рутинную пробу с дексаметазоном и сразу же после отбора крови через 8 часов вводят АКТГ. Некоторые авторы рекомендуют протокол, согласно которому сначала проводят пробу с высокой дозой дексаметазона и завершают исследование провоцирующей пробой с АКТГ (Zerbe, 2000а).
Биопсия печени. При ССК обычно тестируют функцию печени и активность ее ферментов, которые часто нарушены. По этой причине собакам со слабо выраженными признаками ССК нередко ставят предварительный диагноз первичной гепа-топатии. По мере все более широкого использования чрескожной биопсии печени увеличивается возможность получения ее ткани для патологического исследования. У собак с ССК или получающих экзогенные глюкокортикоиды обычно имеются гистологические признаки «индуцированной глюкокортикоидами» или «стероидной» гепатопатии. Это состояние гистологически характеризуется центрилобулярной вакуолизацией, перивакуолярным накоплением гликогена в гепатоцитах и очаговым центрилобулярным некрозом. Некоторые авторы
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 329
рекомендуют обследовать на наличие синдрома Кушинга всех собак с такой гистологической картиной биоптатов печени. Мы тоже считаем это целесообразным, но только в отношении животных, у которых имеются клинические симптомы ССК. «Стероидная гспатопатия» встречается только у собак и не отмечена ни у одного другого вида животных (Rutgers et al, 1995).
Вакуолярная гспатопатия ассоциируется с множеством других расстройств (например, с токсикозом или желчным стазом). «Индуцированная стероидами гспатопатия» - это весьма специфическое клиническое состояние, обусловленное хроническим воздействием глюкокортикоидов. Поэтому биопсию печени можно использовать в качестве метода скрининга для идентификации собак с синдромом Кушинга. Однако выявление «стероидной гепато-патии» нс позволяет дифференцировать избыточную продукцию стероидов природного и ятрогенного происхождения. К числу других недостатков рутинного использования биоптатов печени в скрининговых исследованиях относятся возможные инфекционные осложнения и слабое заживление раны из-за системного эффекта ССК. Очевидным преимуществом является возможность выявления типичной для ССК собак гепатомегалии с помощью непосредственной чрескожной биопсии
ДИСКРИМИНАЦИОННЫЕ ПРОБЫ: ДИФФЕРЕНЦИАЦИЯ ЗАВИСИМОГО ОТ ГИПОФИЗА И ВЫЗВАННОГО ОПУХОЛЬЮ НАДПОЧЕЧНИКОВ ГИПЕРКОРТИЦИЗМА
Ингибирующая проба с низкими дозами дексаметазона (ПНДД)
Общие сведения. Измерение концентрации кортизола в плазме крови через 8 часов после
введения низкой дозы дексаметазона в настоящее время принято в качестве достоверного, специфичного и чувствительного метода для скрининга на ССК. В большинстве лабораторий нормой считаются концентрации кортизола ниже 1 или ниже 1,4 мкг/100 мл через 8 часов после инъекции дексаметазона. Равные этим или более высокие концентрации кортизола указывают на наличие ССК. На основании исследований эффективности ПНДД рекомендуется также отбирать пробы крови через 4 часа, но не с целью скрининга, а для дифференциации ГЗГ и ГОН (Mack, Feldman, 1990; Feldman et al, 1996). У 60- 65% собак с ГЗГ дексаметазон вызывает временное понижение секреции гипофизарного АКТГ, но продолжительность его ингибирующего действия нс превышает 3- 6 часов по сравнению с 24-48 часами у здоровых собак. В то же время дексаметазон нс подавляет секрецию АКТГ у собак с ГОН. поэтому временное снижение концентрации кортизола в плазме крови после введения низких доз дексаметазона служит обоснованием диагноза ГЗГ и исключает ГОН.
Протокол и определения. Как указывалось ранее, сначала определяют базальную концентрацию кортизола в сыворотке или плазме крови, а затем внутривенно вводят дексаметазон в дозе 0,01 мг/ кг. Пробы крови отбирают через 4 и 8 часов после инъекции. Исследования показали что результаты определения кортизола через 4 часа можно использовать в целях «дискриминации», а через 8 часов -как для «дискриминации», так и для «скрининга». Результаты ПНДД позволяют дифференцировать ГОИ при условии, если концентрация кортизола ниже 1,4 мкг/100 мл через 4 часа или ниже половины ее базальной величины через 4 или 8 часов после введения дексаметазона (рис. 6-44) (Feldman et al, 1996).
До введения Через 4 часа Через 8 часов Время после введения дексаметазона (часы)
Время после введения дексаметазона (часы)
Рис. 6-44. Критерии подавления секреции кортизола после введения дексаметазона для дифференциации ГЗГ и ГОН у собак. V Подавлением считается снижение концентрации кортизола в плазме крови до уровня ниже 1,4 мкг/100 мл через 4 часа после введения низкой дозы дексаметазона (ПНДД) или ниже 1 4 мкг/100 мл через 4 и 8 часов после введения высокой дозы дексаметазона (ПВДД). Б. Подавлением считается снижение концентрации кортизола ю уровня ниже 50% ее базальной величины через 4 и 8 часов после ПНДД (0,01 мг/кг внутривенно) или после ПВДД (0,1 мг/кг).
А
330 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
35/178 < 1 4
79/178 < 50%
0 I-----------
4 часа
178/178 >1.4 '3
---------- 50
34/178 < 50%
8 часов
Число собак, у которых имело место подавление = 88/178 (49%) 88/88 = ГЗГ
отсутствие подавления 30/30, все с ГОН
отсутствие подавления 60/148 (40% собак с ГЗГ)
Рис. 6-45. Результаты пробы с низкой дозой дексаметазона (ПНДД) у 178 собак со спонтанным синдромом Кушинга. Заштрихованная область — результаты, свидетельствующие о подавлении секреции кортизола в ПНДД (< 1,4 мкг/100 мл или < 50“о базальной величины) через 4 или 8 часов после инъекции, что соответствует диагнозу ГЗГ, в отличие от ГОН. Как следует из графика, подавление, соответствующее, по крайней мере, одному из трех критериев, отмечено у 88 из 178 собак и все 88 страдали Г 31 Таким образом, подавление имело место у 60°о собак с ГЗГи ни у одной собаки с опухолями коры надпочечников. У всех 178 собак концентрация кортизола в плазме крови через 8 часов после введения дексаметазона оставалась выше 1,4 мкг/100 мл, что подтверждает диагноз гиперкоргицизма.
Результаты. Примерно у 25% собак с ГЗГ концентрация кортизола в пробах крови через 4 часа после введения дексаметазона, не превышала 1,4 мкг/100 мл, а в пробах, взятых через 8 часов, была выше или равна 1,4 мкг/100 мл (т.е. соответствовала диагнозу ССК) (Feldman et al, 1996). Приблизительно у 50°о животных с ГЗГ концентрация кортизола в пробах крови, полученных через 4 часа после введения дексаметазона, была ниже половины базальной величины, и у 25°о собак она оставалась ниже этого уровня через 8 часов. Почти у 99% собак с ССК концентрация кортизола в пробах, взятых через 8 часов после инъекции дексаметазона, соответствовала диагнозу (>1,4 мкг/100мл). Примерно у 60-65% собак с ГЗГ степень подавления секреции кортизола соответствовала по меньше мере одному из вышеперечисленных условий (рис. 6-45) (Feldman et al, 1966). В этом исследовании только у двух из 35 собак с ГОН дексаметазон заметно снижал секрецию кортизола, однако, у обеих собак концентрация кортизола в плазме крови оставалась в пределах «пограничных» величин, что легко объясняется ее флуктуациями.
Примерно у 35-40° о собак с ГЗГ подавление секреции кортизола дексаметазоном не удовлетворяло вышеперечисленным условиям. Результаты ПНДД у этих собак были сходны с таковыми у животных с синдромом Кушинга, вызванным опухолью коры надпочечников. Следовательно, отсутствие подавления является неспецифическим показателем, который согласуется с диагнозом ССК, но не позволяет дифференцировать расстройства гипофизарного и надпочечникового происхождения. Диагноз синц-
ром Кушинга ставится собакам, у которых подозрение на ССК основано на результатах физикального исследования, изучения анамнеза и исходной базы данных, а концентрация кортизола через 8 часов после ПНДД равна или превышает 1,4 мкг/100 мл. Животные, у которых в ПНДД наблюдается «подавление» секреции кортизола, соответствующее хотя бы одному из указанных условий, имеют ГЗГ (рис. 6-44). Этот диагноз можно подтвердить другими дискриминационными пробами, но в этом нет необходимости.
Концентрация эндогенного АКТГ
Теоретическое обоснование. При анализе причин, вызывающих развитие спонтанного или ятрогенного гиперкортицизма (см. рис. 6-6), очевидна необходимость определения концентрации эндогенного АКТГ. В случаях опухоли коры надпочечников или ятрогенного синдрома Кушинга секреция АКТГ понижена, тогда как ГЗГ обусловлен избыточной секрецией АКТЕ. При диагностике гиперкортицизма у людей и собак результаты определения концентрации АКТЕ не используются, поскольку в большинстве случаев она остается в пределах нормы. В то же время, коль скоро подтвержден диагноз синдром Кушинга, концентрация эндогенного АКТЕ' является ценным показателем для дифференциации больных с ГОП и ГЗГ.
Протокол. Секреция АКТГ гипофизом носит пульсирующий характер, поэтому его концентрация в плазме крови постоянно меняется. У людей на эти изменения накладываются суточные колебания, что обусловливает повышенную частоту выбросов в ранние утренние часы по сравнению с их более низкой частотой и амплитудой в ночное время (Van Cautcr, Refctoff, 1985). Протокол получения проб крови для определения эндогенного АКТГ у собак заимствован из медицинской литературы. Для уменьшения влияния стрессорных факторов и времени суток на результаты измерений кровь следует брать между 8 и 9 часами угра после ночи, проведенной животным в стационаре. Если была проведена провоцирующая проба с АКТГ, кровь для определения эндогенного АКТГ рекомендуется брать через сутки после се завершения.
Взятую для определения АКТ! ’ пробу необходимо немедленно обработать, так как гормон быстро исчезает из свежей цельной крови. Во избежание получения ошибочных результатов не следует даже на короткое время оставлять пробу при комнатной температуре. Во время сбора, центрифугирования и хранения пробы нельзя допускать се контакта со стеклянными поверхностями, поскольку они легко адсорбируют АКТЕ Мы собираем пробы в охлажденные силиконовые пробирки, обработанные этилен диаминтетраацетатом (ЭДТА), быстро центрифугируем их, переносим плазму в пластмассовые пробирки и храним се в замороженном виде до проведения анализа. Другие авторы добавляют
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 331
в обработанные ЭДТА пробирки ингибитор протеиназ апротинин, способствующий сохранению АКТГ, и не считают, что контакт проб со стеклом или температура оказывают существенное влияние на результаты измерений (Kemppainen et al, 1994а, 1994b). При хранении проб в пластмассовых пробирках при -20 °C АКТГ остается стабильным в течение месяца или более (Hegstad et al, 1990).
Методы определения и нормальные концентрации. После признания значения измерений эндогенного АКТГ они находят все более широкое распространение при обследовании пациентов. В настоящее время имеется большое количество различных коммерческих наборов для определения АКТГ у людей с помощью РИА. К счастью, некоторые из них позволяют равно эффективно оценивать концентрацию АКТГ в крови у собак (Nelson et al, 1985; Hegstad et al, 1990). Стоимость определений умеренно высокая. Любой метод, используемый в ветеринарии, следует проверить на данном виде животных и получить данные у контрольных животных. Базальная концентрация АКТГ у здоровых собак составляет в среднем 25-35 пг/мл при колебаниях от 10 до 70 пг/мл (рис. 6-46).
Здоровые Собаки с Собаки
собаки ГЗГ с ГОН
Рис. 6-46. Концентрация эндогенного АКТГ в плазме крови у здоровых собак, собак с функционально активными аденомами или карциномами коры надпочечников и собак с ГЗГ. Столбиками показаны диапазоны интерквартилей от 25 до 75 перцентилей (средние значения). Горизонтальная линия через столбики — медиана. «Усы» представляют основную массу данных, которые в большинстве случаев укладываются в диапазон. Данные, лежащие за его пределами, обозначены кружками.
Результаты
Гиперкортицизм, вызванный опухолью надпочечников (ГОН). У собак со спонтанным гиперкортицизмом концентрация эндогенного АКТГ ниже 10 пг/мл (или ниже чувствительности метода определения) является веским основанием для подозрения на наличие функционально активных опухолей коры надпочечников (см. рис. 6-46). У животных с ятрогенным гиперкортицизмом концентрация эндогенного АКТГ также не превышает 10 пг/мл, однако провоцирующая проба с АКТГ позволяет выявить основное заболевание (см. рис. 6-41). В одном из исследований было проведено 62 измерения концентрации эндогенного АКТГ у 41 собаки с опухолями коры надпочечников, вызвавшими синдром Кушинга. В 36 пробах (58%) концентрация АКТГ была ниже чувствительности метода. В остальных 26 пробах она колебалась от 10 до 44 пг/мл. У двадцати девяти собак из 41 (70%) концентрация АКТГ по меньшей мере в одной пробе была ниже определяемого уровня. Она была ниже определяемого уровня и в 22 из 39 проб (56%) от собак с карциномами ив 14 из 23 проб (61%) от животных с аденомами коры надпочечников (Resch, Feldman, 1991). В течение последующих 10 лет со времени опубликования этих данных проводимые нами определения АКТГ в крови собак с ГОН давали такие же результаты - АКТГ либо не обнаруживался, либо его концентрация была на нижнем пределе нормы. Эти наблюдения были подтверждены недавними исследованиями (Gould et al, 2001).
Гиперкортицизм зависимый от гипофиза (ГЗГ). Концентрация эндогенного АКТГ на уровне 45 пг/мл или выше предполагает наличие ГЗГ. Диагноз этого заболевания должен исходно базироваться на результатах изучения анамнеза и физикального исследования, а затем подтверждаться соответствующими скрининговыми тестами. У 85-90% собак с ГЗГ концентрация эндогенного АКТГ в крови превышает 45 пг/мл (см. рис. 6-46). Приблизительно у 35^45% собак с ГЗГ концентрация эндогенного АКТГ выше верхнего уровня чувствительности наборов, обычно используемых в ветеринарии. Почти 55% животных с этим заболеванием имеют концентрацию АКТГ от 45 до 70 пг/мл, а у 15% обследованных нами животных с ГЗГ она составляла 10-45 пг/мл, т.е. не имела диагностической значимости. Лишь в исключительно редких случаях концентрация эндогенного АКТГ у собак с ГЗГ была ниже 10 пг/мл.
Диагностически незначимые результаты. У собак с ССК концентрация эндогенного АКТГ выше 10 пг/мл, но ниже 45 пг/мл не имеет диагностического значения (см. рис. 6-46). При концентрациях АКТГ в этом диапазоне следует либо повторить анализ, либо провести дифференциальную диагностику ГЗГ и ГОН с помощью других методов, описанных в настоящем разделе. Если при повторном анализе концентрация АКТГ остается ниже
332 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
10 пг/мл. наиболее вероятен диагноз ГОН. Если же концентрация АКТГ оказывается равной 45 пг/мл или выше, можно подозревать ГЗГ У животных с концентрацией АКТГ между 10 и 45 пг/мл при повторном анализе трудно установить тот или иной диагноз. В этих случаях стратегию терапии выбирают на основании результатов ультразвукового и рентгенологического исследования брюшной полости, ПНДД (дискриминационная проба), а также концентрации кортизола в крови в пробе с высокими дозами дексаметазона или результатов более сложных методов визуализации (ядерное сканирование, КТ и МРТ).
Ингибирующая проба с высокими дозами дексаметазона (ПВДД)
Теоретическое обоснование. Собаки с ССК отличаются аномальной резистентностью гипофизарно-надпочечниковой системы к блокирующему действию глюкокортикоидов и/или повышенной скоростью выведения глюкокортикоидов из кровяного русла. Опухоли коры надпочечников функционируют автономно, т.е. не зависят от регуляторного действия гипофиза, как следует из их способности полностью подавлять секрецию АКТГ и при этом непрерывно синтезировать и секретировать большие количества кортизола. Дексаметазон, независимо от вводимой дозы, никогда нс подавляет секрецию кортизола корой надпочечников, если его источником служат автономно функционирующие опухоли. Напротив, при ГЗГ имеет место хроническая, избыточная секреция АКТГ продуцируемого опухолью гипофиза. 11нгибирующсе действие глюкокортикоидов на секрецию АКТГ гипофизарной опухолью весьма
С9
Ф
X СП
со го
I? (D
ГО
ф ф <2
О СП
59/178 < 1.4
88/178 < 50%
59/178 < 1.4
88/178 < 50%
4 часа
8 часов
с
Число собак, у которых имело место подавление = 109/178 108/109 = ГЗГ
Рис. 6-47. Результаты ингибирующей пробы с высокими догами дексаметазона (ПВДД, 0,1 мг/кг внутривенно с взятием проб мере i 4 и 8 часов после инъекции) у 178 собак со спонтанно развившимся i иперкортицизмом. Заштрихованная область представляет рсгультаты измерений, свидетельствующие о подавлении секреции кортизола до уровня ниже 1,4 мкг/100 мл или ниже 50% базальной величины через 4 или 8 часов после инъекции. Обратите внимание, что подавление имело место у 109 из П8 собак и 108 из этих 109 собак имели ГЗГ, а у одной бы ia обнаружена опухоль надпочечника. ПВДД является достоверным, но нс идеальным методом дифференциальной диагностики ГЗГ и ГОП у собак. Подавления не наблюдалось у 40 из 148 собак с ГЗГ и у 29 из 30 животных с ГОП.
изменчиво и может зависить от дозы стероидов. У большинства, но не у всех людей с ГЗГ секреторная активность опухолей подавляется достаточно высокими дозами дексаметазона. У большинства собак с ГЗГ введение дексаметазона в возрастающих дозах, в конечном счете, также приводит к подавлению секреции гипофизарного АКТГ.
Протокол. При проведении пробы с высокими дозами дексаметазона (ПВДД) кровь рекомендуется брать до и через 4 и 8 часов после внутривенной инъекции дексаметазона в дозе 0,1 мг/кг веса тела (Feldman, 1983b, 1985; Feldman et al, 1996).
Для инъекций используют препарат дексаметазон натрий фосфат или дексаметазон в полиэтиленгликоле. Ингибирование секреции кортизола (рис. 6-47) оценивают по любому из следующих четырех критериев: концентрация кортизола меньше 50° о ее базальной величины или ниже 1,4 мкг/100 мл через 4 или 8 часов после инъекции дексаметазона ( Feldman et al, 1996).
Результаты
Опухоли коры надпочечников (ГОН). Введение высоких доз дексаметазона не снижает секрецию кортизола у собак с ГОН (см. стр. 6-47) (Feldman, 1983b, 1985; Feldman et al, 1996). Между тем, уровень кортизола в плазме крови подвержен колебаниям, поэтому существует опасность принять естественное снижение базальной концентрации кортизола за «подавление» его секреции. Правда, такой результат данной пробы у собак встречается крайне редко.
Гиперкортицизм зависимын от гипофиза (ГЗГ). ПВДД подавляет секрецию гипофизарного АКТГ независимо от его источника: гиперплазированных клеток или функционально активных опухолей (аденом и карцином). Примерно у 60° о собак с ГЗГ концентрация кортизола в плазме крови через 4 и 8 часов после введения высокой дозы дексаметазона была ниже 50° о базальной величины (см. рис. 6-47). Сходный результаг был получен при использовании дексаметазона в дозе 1,0 мг/кг. Почти у 40° о собак с ГЗГ концентрация кортизола через 4 и 8 часов после инъекции большой дозы дексаметазона была ниже 1,4 мг/кг (см. рис. 6-47). У 75° о животных результаты ПВДД удовлетворяли критериям «подавления» (концентрация кортизола менее 50°о базальной величины через 4 и 8 часов после введения дексаметазона и ниже 1,4 мкг/100 мл через 4 и 8 часов) (см. рис. 6-44; Feldman et al, 1996). Собаки с ССК, у которых после введения дексаметазона в дозе 0,1 мг/кг подавление секреции кортизола соответствовало одному из четырех критериев, по всей вероятности, имели ГЗГ. Секреция кортизола не подавлялась в ПВДД примерно у 25° о собак с ГЗГ и практически у 100% собак с опухолями коры надпочечников (Feldman, 1985; Feldman et al, 1996).
Неизвестно, почему у одних собак с ГЗГ высокие дозы дексаметазона полностью подавляют сек-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 333
рецию кортизола, тогда как другие резистентны к нему. У части этих животных опухоли развиваются из ткани промежуточной доли гипофиза, которая регулируется нервной, а не эндокринной системой. Это может объяснять относительно слабое подавление их активности дексаметазоном (Peterson, 1987). Кроме того, в ряде исследований было показано, что чем крупнее гипофизарная опухоль, тем меньше вероятность подавления секреции кортизола как высокими, так и низкими дозами дексаметазона (Kemppainen, Zenoble, 1985; Safarty et al, 1988; Dow et al, 1990; Galac et al, 1997). Мы наблюдали частичную, но не полную корреляцию между размером гипофизарных опухолей и влиянием дексаметазона на секрецию кортизола (Nelson et al, 1989; Kipperman et al, 1992; Bertoy et al, 1995; Duesberg et al, 1995). Попадаются как собаки с микроопухолями гипофиза, секреторная активность которых не подавляется дексаметазоном, так и животные с макроопухолями, подавляемыми дексаметазоном, и бывает наоборот. Таким образом, результаты могут перекрываться, так как реакция опухолей разного размера на дексаметазон значительно варьирует (см. рис. 6-34 и 6-35).
Множественные пробы. До последнего времени в литературе не существовало единого мнения относительно целесообразности взятия проб через 2, 3, 4 и 6 часов или в другое время после введения высокой дозы дексаметазона. Все авторы подчеркивают важность анализа проб, полученных через 8 часов после инъекции. В исследовании 148 собак с ГЗГ «подавление» в ПВДД было
зарегистрировано у 108 особей (см. рис. 6-44, Б). У 90 животных концентрация кортизола была понижена как через 4, так и через 8 часов после инъекции, у девяти - только через 8 часов, а у других девяти - только через 4 часа. У шести собак последней группы подавление секреции кортизола через 4 часа после введения дексаметазона ранее отмечалось в ПНДД. Таким образом, результаты определения кортизола через 4 часа после введения высоких доз дексаметазона оказались информативными только у трех из 148 собак с ГЗГ (2%), которых тестировали с помощью как ПНДД, так и ПВДД, и только у трех из 178 собак с синдромом Кушинга (1,7%) (рис. 6-48; Feldman et al, 1996). Наш опыт показывает, что важно отбирать пробы крови до начала тестирования и через 8 часов после введения дексаметазона; брать пробы в другие сроки необязательно.
Выводы. Обычно проводят парные пробы с низкими и высокими дозами дексаметазона с интервалом в 24 часа. При исследовании 178 собак с ССК у 148 из них был выявлен ГЗГ. У 109 из 148 собак отмечено снижение секреции кортизола в ПВДД, а у 86 собак из этих 109 (79%) она подавлялась также в ПНДД (при оценке по трем критериям, как показано на рис. 6-44,А) (рис. 6-49; Feldman et al, 1996).
У всех собак с опухолями коры надпочечников концентрация кортизола в ПНДД не снижалась, поэтому рекомендуется проводить ПНДД. Если у собак синдром Кушинга (т.е. концентрация кортизола через 8 часов после инъекции дексаметазона >1,4 мкг/100 мл), а реакция в пробе с дексаметазо-
Рис. 6-48. Результаты пробы с высокой дозой дексаметазона. Подавление концентрации кортизола в ПВДД наблюдалось у 108 из 148 собак с ГЗГ. Из графика следует, что у 86 из этих 108 собак концентрация кортизола подавлялась также в ПНДД, что устраняло необходимость ПВДД в этой группе. Среди 22 собак, у которых подавление концентрация кортизола имело место в ПВДД, но отсутствовало в ПНДД, только у трех концентрация кортизола снижалась через 4 часа после введения дексаметазона, а у остальных 19 — через 8 часов. Таким образом, при использовании ПНДД в качестве первичного диагностического теста ПВДД имеет важное, но ограниченное значение и следует использовать показатели кортизолемии только в пробах плазмы крови, полученных через 8 часов после ведения дексаметазона.
334 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-49. А. Из 178 собак со спонтанно развившимся гиперкортицизмом, которым проводили ПНДД и ПВДД, у 111 подавление концентрации кортизота соответствовало, по меньшей мерс, одному из семи критериев, приведенных на рис. 6-44. Из этих 111 животных НО имели ГЗГ. У 29 из 30 собак (97°о) с опухолями коры надпочечников (ГОН) подавления, соответствовавшего хотя бы одному из семи критериев, нс наблюдалось. Подавление отсутствовало также у 38 из 148 собак с ГЗГ (26°о). Б. У 86 собак из 109, у которых имело место подавление концентрации кортиюла в ПВДД (79°о), подавление наблюдалось и в ПНДД. Следовательно, если собаки с подозрением на Г31 обследуются в ПНДД, то примерно у 60% »тих животных нет необходимости проводить ПВДД.
ном удовлетворяет одному из грех критериев на рис. 6-44, то диагноз ГЗГ установлен и нет необходимости проводить ПВДД. Если в ПНДД «подавление» отсутствует, то прибегают к «дискриминационной пробе».
Ингибирующие пробы с низкими и высокими дозами дексаметазона широко используются в ветеринарной практике. У любой собаки с синдромом Кушинга, отвечающей в ПВДД уменьшением концен грации кортизола в плазме крови, весьма вероятно наличие ГЗГ. Отсутствие подавления секреции кортизола в соответствии с одним из семи критериев, как показано на рис. 6-44,А и Б, следует рассматривать как неубедительный результат. Подавление обычно отсутствует у собак с опухолями коры надпочечников и в редких случаях у животных с ГЗГ.
Отношение концентраций кортизола и креатинина в моче (КОР/КРЕ) для дифференциации ГЗГ и ГОН
Общеизвестно, что отношение КОР/КРЕ может быть аномально высоким не только при гиперкортицизме, но и при других заболеваниях. Иными словами, этот показатель не очень специфичен. Однако благодаря высокой чувствительности его можно использовать как для скрининга, так и для дифференциальной диагностики.
В исследовании, включавшем 160 собак с СКС (Galac et al, 1997), хозяева животных в течение двух последовательных дней брали пробы мочи для последующего определения отношения КОР/КРЕ. После взятия второй пробы собаки трижды с интервалами в 8 часов получали перорально дексаметазон в дозе 0.1 мг/кг. Третью пробу мочи брали через 8 часов после введения последней дозы дексаметазо
на. Обычно первые две пробы мочи брали в утренние часы и сразу после получения второй пробы начинали вводить дексаметазон. Его вторую и третью дозы вводили соответственно в полдень и вечером того же дня. Третью пробу мочи брали утром следующего дня. Таким образом, пробы мочи брали в утренние часы трех последовательных дней. Диагноз ГЗГ ставили в том случае, когда отношение КОР/ КРЕ в третьей пробе мочи было меньше 50° о его средней величины в двух первых пробах, которую принимали за базальный уровень. Если отношение КОР/КРЕ оставалось больше 50% базальной величины, дифференциация была невозможна (как и в любом тесте подавления). Явное снижение отношения КОР/КРЕ имело место у 80 из 111 собак с ГЗГ (72%), т.е. приблизительно так же часто, как в пробах с низкими и высокими дозами дексаметазона. Вместе с тем, диагностическая значимость отношения КОР/КРЕ зависит от точности выполнения владельцами животных требований протокола, касающихся сроков введения дексаметазона. Подавление отсутствовало у всех собак с ГОН и у 27% особей с ГЗГ (Galac etal, 1997).
Важно помнить, что при ССК базальная величина отношения КОР/КРЕ является высокочувствительным, но низкоспецифичным показателем. Полому при диагностике ССК его следует использовать в сочетании с анализом клинической симптоматики и биохимического профиля сыворотки, результатами ОАК, исследования мочи, проб с АКТГ и с низкими и высокими дозами дексаметаюна. У собак с подтвержденным таким образом диагнозом СКС снижение отношения КОР/КРЕ под воздействием дексаметазона больше чем на 50% его базальной величины свидетельствует о наличии ГЗГ. Если такого снижения нет, результат нс считается диагностически значимым.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 335
Пробы с кортикотропин рилизинг-гормоном (КРГ) и вазопрессином (АДГ)
Гипофизарные опухоли, секретирующие АКТГ, обычно сохраняют известную долю чувствительности к КРГ и АДГ, в отличие от нечувствительных опухолей коры надпочечников. Изменение концентраций АКТГ и кортизола в плазме крови в ответ на введение КРГ и АДГ оценивали у 16 здоровых собак, 16 животных с ГЗГ и у пяти с ГОН (van Wijk et al, 1994). Авторы пришли к заключению, что собаки с ГЗГ сильнее отвечают на АДГ, чем на КРГ и что характер ответа позволяет отличить их от животных с ГОН. Тем не менее, практическое использование обеих проб ограничено их высокой стоимостью, малой доступностью КРГ и АДГ и сложностью анализа АКТГ.
Проба с метирапоном
Метирапон блокирует действие 11 Р-гидроксилазы, участвующей в синтезе стероидов в надпочечниках. Поэтому у здоровых собак он снижает концентрацию кортизола в плазме крови и приводит к накоплению 11-дезоксикортизола, так как продолжается стимуляция надпочечников АКТГ. Метирапон вводят перорально четыре раза с интервалами в 6 часов в дозе 25 мг/кг. Пробы крови для анализа кортизола и 11-дезоксикортизола берут до начала теста и через 6 часов после последнего введения метира-пона. В случае уменьшения концентрации кортизола под воздействием метирапона и одновременного повышения концентрации 11-дезокскортизола ставят диагноз ГЗГ. Если же после четырехкратного введения метирапона уменьшаются концентрации обоих стероидов, гиперкортицизм скорее всего обусловлен опухолью коры надпочечников (Zerbe etal, 1986, 2000b).
Рентгенологические исследования
См. раздел «Рентгенологическое исследование» в данной главе.
Ультразвуковое исследование брюшной полости
См. раздел «Ультразвуковое исследование брюшной полости» в данной главе.
Компьютерная (КТ) и магнитно-резонансная (МРТ) томография
Собаки с ГЗГ, имеющие клинические признаки гипофизарной макроопухоли. Визуализация с посмощью МРТ и КТ находит все более широкое применение в ветеринарии. Нижеследующие разделы посвящены вопросам практического использования этих высокоточных современных методов диагностики. Выбор между КТ и МРТ определя
ется доступностью и стоимостью того и другого метода в конкретной ситуации. Хотя МРТ имеет определенные преимущества при выявлении слабо выраженных нарушений, главное назначение обоих методов при обследовании собак с ГЗГ и клиническими признаками крупной гипофизарной опухоли состоит в идентификации более выраженных аномалий, в частности опухолей крупнее 8-10 мм в диаметре. На период работы над этой книгой мы располагали сканограммами гипофизарной области более 200 собак с ГЗГ, полученными с помощью КТ и МРТ. По мере накопления опыта мы, как и другие группы ветеринаров, все лучше понимаем природу данного заболевания и добиваемся улучшения качества сканограмм.
Собаки с недавно диагностированным ГЗГ без признаков макроопухоли. Еще одна группа собак, для обследования которых мы рекомендуем использовать КТ и МРТ, включает животных с недавно выявленным, обычно нелеченым ГЗГ, у которых отсутствуют симптомы макроопухоли гипофиза. Такая рекомендация основывается на нашем опыте работы с собаками, отличающимися очень высокой степенью риска возникновения крупной, угрожающей жизни опухоли. Иными словами, результаты КТ или МРТ входят в «базу данных» для собак с ГЗГ. Использование обоих методов лимитируется такими причинами, как высокая стоимость, трудная доступность и риск анестезии. Если бы эти методы были широко доступны, бесплатны и не требовали анестезии, их можно было бы рекомендовать для сканирования всех собак с ГЗГ. Обоснованием применения томографии служит тенденция увеличения размеров гипофизарной опухоли вплоть до 4-кратного на протяжении 12-36 месяцев после установления диагноза ГЗГ.
Если в гипофизе собаки отсутствует видимая опухолевидная масса (т.е. опухоль с максимальным диаметром менее 3^4 мм), то клинические симптомы, связанные с ее ростом, проявятся нескоро. Даже в случае двух- или трехкратного увеличения опухоли ее максимальный диаметр не превысит 8-10 мм, поэтому опасность ее распространения на жизненно важные структуры и возникновения соответствующих клинических симптомов весьма невелика. Повторное сканирование таких собак не рекомендуется, и их владельцев следует поставить в известность о том, что опухоль может достичь больших размеров лишь в отдаленном будущем.
В случае визуализации у собаки с ГЗГ опухолевой массы с максимальным диаметром 3-7 мм назначают обычную терапию ГЗГ, включающую о,р’-ДДД, и через 12-24 месяца повторяют сканирование. Если оно выявляет увеличение опухоли в 2^4 раза, состояние животного оценивают как угрожающее и назначают радиотерапию.
При наличии опухолевидной массы с максимальным диаметром 8 мм или более медикаментозной терапии ГЗГ должно предшествовать облучение гипофиза. Увеличение размера такой опухоли
336 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
на 50 или 100° о создает серьезные, угрожающие жизни проблемы. Если ее максимальный диаметр не превышает 12 мм и клинические проявления отсутствуют, то наилучшим способом уменьшения ее размеров является облучение (Goossens et al, 1998; Theon, Feldman, 1998). Несмотря на прекрасные результаты, полученные нами у таких собак с помощью облучения, это не исключало необходимости медикаментозной терапии гиперкортицизма.
Компьютерная томография
Доступность. Внедрение КТ произвело небольшую техническую революцию в современной медицине и ветеринарии (Bailey, 1986; Turrel et al, 1986). Вначале этот сложный диагностический метод использовался только в ветеринарных институтах или был доступен через посредство небольшого числа ветеринарных специалистов, работавших в сотрудничестве с местными больницами. В настоящее время его доступность возрастает, все более отвечая запросам владельцев животных. Хотя никто не высказывает серьезных сомнений относительно диагностической ценности результатов КТ, этот метод не лишен недостатков. Помимо высокой стоимости эксплуатации оборудования, работа с ним и интерпретация компьютерных данных требуют соответствующей подготовки ветеринарных врачей и врачей-радиологов. Проведение КТ требует анестезии животных, которая длится от 30 минут до 2 часов. Прав а, с появлением новых гелиевых томографов время проведения исследования, а с ним и продолжительность анестезии, сократились.
Гипофиз человека. Компьютерные томограммы нормального гипофиза человека были получены несколько десятилетий назад и послужили основой для разработки новых методов диагностики гипофизарных расстройств. Создание оборудования для КТ с высокой разрешающей способностью, ускоряющего процедуру визуализации, обеспечило возможность выявления микроопухолей гипофиза у людей. Изменения, связанные с наличием опухолевых масс, включают четко очерченные рентгенопрозрачные области, соседствующие с высококонтрастными зонами железы, выпуклость ее верхнего края, отклонение воронки гипоталамуса от нормального положения, смещение капиллярного ложа гипофиза (характерный признак) и эрозию костной ткани вплоть до дна турецкого седла (Bonneville et al, 1983).
Гипофиз здоровых собак. При проведении КТ гипофиза собаки обычно находятся под наркозом до и после введения контрастного вещества (например, растворимого в воде йодированого соединения). Использование КТ в ветеринарии предшествовало исследованиям, в которых были установлены нормальные показатели для здоровых собак и кошек. Эти данные начали появляться в литературе спустя годы после внедрения КТ в клиническую практику. В одном из исследований максимальное контрастное усиление гипофиза было зарегистрировано уже через 10-30
Рис. 6-50. Компьютерная томограмма брюшной полости собаки с функционально активной опухолью коры надпочечника (показана длинной темной стрелкой), подвергшейся обы шествлению (короткая темная стрелка). Благодаря концентрации контрастного вещества хорошо различимы почки (ма юнькие светлые стрелки) и ободочная кишка (большая светлая стрелка).
секунд после введения контрастного вещества (Love et al, 2000). Форма гипофиза менялась в процессе сканирования. Благодаря интенсивной контрастности в первые 30-50 секунд было получено изображение гипофиза в форме перевернутого треугольника с неровным дорсальным краем. По мере продолжения визуализации становилась заметной периферическая контрастная кромка вокруг более рентгенопрозрачной зоны в центральной части железы.
В другом недавнем исследовании динамическая КТ 55 собак с ГЗГ выявила хорошо выраженное усиление контрастности нейрогипофиза («гипофизарный прилив») у 36 особей. У 24 собак наблюдали смещение «прилива», свидетельствовавшее о наличии аденомы, что впоследствии было подтверждено хирургически и гистологически у 18 из 24 животных. У 19 собак имело место аномальное диффузное усиление контрастности. Результаты КТ были подтверждены у 13 из этих 19 собак при хирургической операции и у всех 19 животных при гистологическом исследовании. Авторы пришли к заключению, что «динамическое сканирование» должно быть включено в протоколы КТ гипофизов собак с ГЗГ, поскольку такой подход позволяет идентифицировать аденому или диффузное поражение этого органа (van der Vlugt-Meijer et al, в печати).
Надпочечники. Компьютерная томография представляет собой метод нсинвазивной визуализации анатомических структур в различных частях тела. У собак и кошек с синдромом Кушинга она позволяет дифференцировать животных с нормальными надпочечниками оз животных, имеющих одну (рис. 6-50) или обе (рис. 6-51) увеличенные железы (Emms et al, 1986; Widmer, Guptill, 1995). Как метод выявления опухолей коры надпочечников у собак КТ более чувствительна, чем рентгенологическое исследование брюшной полости (Vborhout et al, 1990а). Чувствительность ультразвукового исследования сопоставима с чувствительностью нефрото-мографии (Vborhout, 1990b; Vborhout et al, 1990a).
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
337
Рис. 6-51. Компьютерные томограммы брюшной полости собаки с двустороннее гиперплазией коры надпочечников. Последовательное сканирование в направлении от краниальной к каудальной области (сканограммы от А до ) ) выявило сначала правый надпочечник (кривая белая стрелка) и правую почку (маленькая белая стрелка), а затем левый надпочечник (большая светлая стрелка) и левую почку (маленькая светлая стрелка), смешенные кзачи от правосторонних структур.
Рис. 6-52. Компьютерные томограммы го ювы, демонстрирующие большие гипофизарные опухоли (кривые темные стрелки) у собаки (А) и кошки (Б) с I ЗГ Прямой темной стрелкой показан череп, а кривой светлой стрелкой — височные мышцы
338 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-53. Компьютерная томограмма головы, на которой заметны расширенные желудочки мозга (стрелка), у собаки с гиперадренали jmom и блокадой тока спинномозговой жидкости вызванными гипофизарной опухолью.
Компьютерная томография гипофиза при ГЗГ. Примерно 40-50° о собак с ГЗГ имеют микроаденомы в отсутствие видимых нарушений в гипофизарной области. Диагностическая точность КТ при выявлении опухолей гипофиза у людей с ГЗГ почти такая же, как у собак (40%) (Klibanski, Zervas, 1991). Большинство собак с ГЗГ, которым показана КТ гипофиза, имеют клинические симптомы, свидетельствующие о наличии большой внутричерепной опухолевидной массы. При необходимости оценить роль крупной опухоли в качестве причины клинической симптоматики у таких собак (и кошек) КТ дает вполне удовлетворительные результаты. В то же время отрицательный результат КТ из-за невозможности визуализации микроопухоли позволяет исключить участие крупнот) опухоли в развитии клинических симптомов. КТ обладает очень высокой точностью при визуализации больших опухолей (рис. 6-52) и расширения желудочков мозга под воздействием опухолевидных масс гипофиза и7или гипоталамуса (рис. 6-53).
В нашей клинике имеется аппаратура для КТ и МРТ. Стоимость КТ ниже, поэтому ее чаще используют для обследования собак с хорошо выраженными симптомами ГЗГ. Преимуществом МРТ при выявлении слабых расстройств у собак с ГЗГ можно пренебречь.
Визуализация методом магнитно-резонансной томографии
Общие сведения. МРТ является важным инструментом диагностики нарушений в ЦНС у людей и находит все более широкое применение для выявления заболеваний других органов. Ее часто сравнивают с КТ, перед которой она имеет ряд преимуществ, включая более высокую контрастность тканей, отсутствие артефактов, обусловленных влиянием элементов скелета, возможность визуализировать сосуды, отсутствие ионизирующей радиации и применение более безопасных контрастных материалов. В первое время существенным
недостатком МРТ была большая продолжительность сканирования, однако современная аппаратура позволяет значительно ускорить исследование. Для диагностики внутричерепных опухолей желательно иметь Т1-взвешенные изображения с контрастным усилением гадолинием. МРТ отдается предпочтение перед КТ при выявлении сопутствующих опухолям явлений, таких как отеки, кисты, васкуляризация, геморрагия или некроз (Edelman, Warach, 1993). Несколько сообщений об использовании МРТ у собак свидетельствуют о высокой точности и чувствительности этого метода (Kraft et al, 1989; Kornegay, 1990).
В одном из недавних исследований были получены MPT-сканограммы гипофизарной области 96 здоровых собак весом 13-45 кг (Kippenes et al, 2001). Наружный осмотр и гистологическое исследование гипофизов при аутопсии нс выявили выраженных изменений. Размер гипофизов определяли на Т1 -взвешенных сканограммах, полученных в поперечной проекции после введения контрастного материала (гадолиния). Средняя высота гипофизов (±SD) равнялась 5,1 мм (±0,9 мм) при средней ширине 6,4 мм (±1,1 мм). Были вычислены коэффициенты корреляции размеров гипофизов с размерами мозга и весом тела, а также размеров мозга с весом тела. На Т1-взвешенных изображениях у 64% собак в центре гипофиза имелась гиперконтрастная область.
Протокол. МРТ собак и кошек сначала проводили на базе местной клинической больницы, а в течение последних 5 лет - в нашей ветеринарной клинике. Обычно собаки получали большие количества седативных средств в форме множественных внутривенных инъекций низких доз смеси кетамина и диазепама через каждые 10-15 мин на протяжении всего периода сканирования. Это облегчало интубацию для уменьшения подвижности легких и повышения качества изображений. Такой способ введения седативных средств не вызывал острых или хронических нарушений даже у сильно ослабленных собак с крупными внутричерепными опухолями. В последнее время мы проводим МРТ под общим наркозом, также без серьезных нежелательных последствий.
Собаки с нелеченым ГЗГ в отсутствие нарушений в ЦНС. Приблизительно у 40-50% собак с нелеченым ГЗГ без признаков внутричерепных опухолевидных масс были получены нормальные MPT-сканограммы мозга, а у остальных собак обнаружены сравнительно небольшие, но легко визуализируемые опухоли гипофиза. Видимые массы имели максимальную высоту от 4 до 13 мм (рис. 6-54). Большинство их распространялось за пределы дорсальной границы турецкого седла и отличалось повышенной контрастностью. У некоторых собак отмечено расширение латеральных желудочков мозга, однако это явление интерпретировалось как возрастное изменение, а не как следствие обструктивной гидроцефалии (Bcrtoy et al, 1995, 1996).
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
339
седло Трахея
А
Рис. 6-54. Ориентация поперечного (А) и сагиттального (вдоль срединной линии) (К) разрезов головы по тайным МРГ и видимые на них анатомические структуры (см. продолжение).
Рис. 6-54 (продолжение). В. МРТ головы собаки с ГЗГ и нормальной структурой гипофизарной области. Г. МРТ головы собаки с ГЗГ, вы званным относительно небольшой опухолевидной массой размером 7 мм (показана стрелками). Д. МРТ головы собаки с ГЗГ, вызванным опухолевидной массой размером 11 мм (показано стрелкой). Из: Bertoy ЕН et al: J Am Vet Med Assoc 206:651. 1995.
340 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Собаки с нелеченым ГЗГ: наблюдения через год. Мы имели возможность оценить влияние терапии и/или фактора времени на рост опухоли гипофиза у 21 собаки с ГЗГ, которых обследовали с помощью МРТ в течение года после установления первоначального диагноза. Одиннадцать животных имели видимые опухоли на момент постановки диагноза; все они, кроме одной собаки, получали о,р’-ДДД. Три из 11 собак с видимыми опухолями погибли в течение года, причем две из них имели признаки опухолевого роста (ко времени начала медикаментозной терапии диаметр гипофизарных опухолей у них превышал 1 см).
Восемь из 11 собак, имевших видимые опухоли гипофиза, повторно обследовали с помощью МРТ через год после первого сканирования. У четырех из них размер опухоли практически не изменился (максимальный диаметр 7-9 мм при первом и повторном сканировании), а у четырех других увеличился (с 5, 6, 8 и 11 мм при установлении диагноза соответственно до 10, 9, 11 и 14 мм спустя год). У двух собак, имевших самые крупные опухоли (11 и 14 мм в диаметре) развились соответствующие клинические симптомы. Наиболее интенсивный рост опухоли (с 5 до 10 мм) происходил у собаки, не получавшей медикаментозного лечения. Повторное сканирование проводилось также у 5 из 10 собак, у которых ко времени установления диагноза отсутствовали видимые опухоли. У двух из них спустя год появились видимые опухоли размером 6 и 7 мм.
Выводы, к которым мы пришли по завершении исследования и которых придерживаемся в настоящее время, состоят в следующем: 1) у 15-25% собак с ГЗГ имеется риск развития неврологических расстройств и угрожающих жизни состояний вследствие роста гипофизарных опухолей; 2) у 15-25% собак группы риска развития крупных, клинически значимых опухолей соответствующие нарушения развиваются на протяжении первых 6-18 месяцев после установления диагноза ГЗГ вследствие продолжающейся экспансии опухоли; 3) терапия о,р’-ДДД не оказывает существенного влияния на скорость роста опухолей; 4) неврологические расстройства обусловлены почти исключительно опухолями, имеющими диаметр 10 мм или более; 5) всем собакам с ГЗГ, у которых диаметр гипофизарной опухоли достигает 8 мм и более, показано облучение гипофиза; 6) изучение КТ и MPT-сканограмм гипофизов собак с ГЗГ, не имеющих клинических симптомов, вызываемых растущими опухолями, позволяет выявить животных с повышенной вероятностью их развития (Bertoy at al, 1995, 1996).
Собаки с ГЗГ и признаками внутричерепной опухоли. Мы использовали МРТ для обследования более 100 собак с ГЗГ и признаками внутричерепной опухоли. Их средний возраст составлял 9,5 лет (меньше среднего возраста собак с ГЗГ), а средний вес тела 24 кг (больше, чем средний весу собак с ГЗГ). MPT-сканограммы позволили точно устано
вить размер и природу опухоли у каждой собаки. Качество визуализации повышалось при введении контрастного материала (гадолиния ДТПК). Максимальная высота опухолей составляла от 8 до 31 мм (рис. 6-55). Все опухоли разрастались в дорсальном направлении далеко за пределы турецкого седла. В ряде случаев рост опухолей приводил к поднятию дна третьего желудочка или сжатию гипоталамуса. У небольшого числа собак имелось подозрение на обструктивную гидроцефалию. На всех сканограммах отсутствовали признаки обусловленного опухолями некроза или геморрагии (Duesberg et al, 1995).
Оценка больных с непредвиденными опухолевидными массами в надпочечниках. См. раздел «Ультразвуковое исследование брюшной полости» в данной главе.
Радиоизотопное сканирование надпочечников
Имеются сообщения о визуализации надпочечников здоровых собак и животных с синдромом Кушинга с помощью гамма-камеры. Животным внутривенно вводили меченый йодом-131 19-хо-лестерин. У здоровых собак оказалась возможной раздельная визуализация обоих надпочечников. На полученных изображениях легко различались нормальные, гиперплазированные и содержавшие активные опухоли надпочечники. Кроме того, анализ этих изображений позволял правильно выбрать место хирургического вмешательства с целью удаления опухоли. Широкое использование гамма-камеры ограничивается ее высокой стоимостью, применением радиоактивных соединений и специфическими условиями работы с этой аппаратурой. Кроме того, диагностика с помощью этого метода не отвечает современным требованиям, принимая во внимание наличие таких высокочувствительных и надежных средств, как КТ и МРТ.
ЛЕЧЕНИЕ - ОБЩИЕ ПОДХОДЫ
Общая характеристика
Приблизительно 80-85% собак со спонтанным гиперкортицизмом имеют ГЗГ, а 15-20% - функционально активные опухоли коры надпочечников. Выбор способа лечения определяется причиной, вызвавшей синдром Кушинга (опухоль гипофиза или надпочечников), и опытом ветеринарного врача. В идеале желательно знать, имеет собака ГЗГ или опухоль надпочечника, однако такое знание не всегда безусловно необходимо (см. следующий раздел: «Терапия без выявления причины заболевания»). Разумеется, всегда следует попытаться получить соответствующую информацию. Вместе с тем понятно, что полная диагностическая оценка каждого животного не всегда возможна. Имеется несколько вариантов выбора лечения, включая медикаментозную терапию и сложную хирургическую операцию.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 341
Рис. 6-55. А. MPT-сканограмма, полученная в поперечной проекции после контрастирования гадолинием у семилетнего бультерьера с ГЗГ, вызванным опухолевидной массой размером 2,4 см (показана стрелкой). У собаки развились признаки дезориентации и атаксии. Б. Сагиттальный разрез мозга вдоль срединной линии у той же собаки (по данным МРТ), на котором видна тканевая масса с повышенной контрастностью, растущая из гипофизарной ямки (показана стрелками). Масса давит на дно лежащего над ней третьего желудочка. В. MPT-сканограмма, полученная после контрастирования гадолинием у восьмилстнсго бостон-терьера с ГЗГ и признаками дезориентации, атаксии и вертячки.
Очень большое значение имеет взаимопонимание между врачом и хозяином животного с гиперкортицизмом на протяжении всего длительного периода терапии. Следует подробно обсудить отдельные варианты медикаментозного и хирургического лечения, включая его потенциальные осложнения и возможности владельца. Последний должен понимать, что далеко не всегда удается восстановить нормальный эндокринный статус собаки или кошки. После лечения у животного может сохраниться гормональная недостаточность или избыточная продукция гормонов; предупрежденный об этом владелец легче смирится с возможной неудачей. Знание им существа проблемы и достижение взаимопонимания стоят усилий, затрачиваемых на разъяснение патофизиологических основ того или иного заболевания в понятной для непрофессионала форме.
Терапия без выявления причины заболевания
Спонтанный гиперкортицизм - весьма распространенное заболевание. Не исключено, что ветеринарный врач, подозревающий у животного наличие ССК. проведет его обследование в условиях стационара. включая анализ базы данных и результатов скрининговых исследований, но не сможет отличить заболевание надпочечникового происхождения от гипофизарного расстройства. Подобная ситуация возможна, если врач нс владеет методами дифференциальной диагностики ГЗГ н ГОП, если нет условий для проведения соответствующих проб или пробы дали сомнительные результаты либо, наконец, если хозяин животного не в состоянии оплатить расходы на необходимые диагностические процедуры. Как следует вести себя в такой ситуации?
342 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Существуют два подхода. Можно направить клиента к другому специалисту или в другое учреждение, где могут провести более тонкое исследование. В альтернативном случае следует исходить из того, что у большинства собак с ССК имеется ГЗГ с сопу гствующей двусторонней гиперплазией коры надпочечников, и они отвечают на терапию о,р’-ДДД. В этом случае весьма высока вероятность правильного диагноза и благоприятного исхода лечения. Кроме того, ветеринарный врач получает возможность дифференцировать ГЗГ от ГОН по реакции на терапию о,р’-ДДД (быстрое достижение контроля заболевания в первом случае и резистентность к о.р’-ДДД во втором).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Гиперкортицизм, вызванный опухолью надпочечников
Предоперационная оценка
Прогноз. Собаки с диагнозом ГОН имеют благоприятный прогноз, если возможно хирургическое удаление опухоли и если они выживают в течение 2 недель после операции. Разумеется, это очень сомнительные «если». В случае подтверждения синдрома Кушинга и наличия опухоли коры надпочечников, следует попытаться локализовать опухоль и исключить метастазирование. С помощью рентгенологического исследования брюшной полости удастся локализовать до 50% опухолей благодаря их большому размеру или обызвествлению (см. рис. 6-28 и 6-29), однако для этой цели лучше вос
пользоваться УЗИ, которое позволяет выявить пораженные ткани, инвазию сосудов и возможное метастазирование органов брюшной полости, а также инвазию или компрессию отдельных органов или сосудов. Хирургическое вмешательство на органах брюшной полости можно планировать лишь после предварительного ультразвукового исследования, которое должно проводиться только высококвалифицированным и опытным хирургом.
Визуализация и метастазы. Метастазы опухолей коры надпочечников обычно поражают печень и/или легкие. Необходимо провести рентгенологическое исследование грудной полости (рис.6-56). Весьма ценным инструментом прогнозирования и обнаружения метастаюв является УЗИ печени. Для подтверждения подозрения на метастазирование проводят биопсию печени под контролем ультразвука. Мы обнаружили метастазы почти у 10% собак с синдромом Кушинга, вызванным опухолью коры надпочечников, при первом же поступлении в нашу клинику.
Скрининговые исследования, включающие рентгенографию, УЗИ и КТ, позволяют также определить размеры опухоли. Мелкие опухоли (рис. 6-57, см. также рис. 6-28) чаще бывают доброкачественными и их легче удалить, чем крупные (рис. 6-58, см. также рис. 6-29). Как правило, «мелкой» опухолью коры надпочечников условно считают новообразование в половину размера нормальной почки или меньше, а «крупной» - опухоль размером с почку или больше. Исходя из такой условной классификации, можно принять, что большинство мелких опухолей - хорошо инкапсулированные
Рис. 6-56. Рентгенограммы грудной полости, полученные в латеральной (А) и дорсовентральной (Ь) проекциях у собаки с гиперкортицизмом, вызванным опухолью коры надпочечников, которая метастазировала в легкие.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 343
Рис. 6-57. Небольшая функционально активная аденома коры надпочечников.
аденомы, которые легче удалить, чем крупные. Последние обычно представляют собой слабо инкапсулированные карциномы, с трудом поддающиеся резекции. Правда, некоторые карциномы коры надпочечников имеют небольшие размеры. Во всех случаях необходимо гистологическое исследование опухолей.
КТ представляет собой неинвазивный метод определения размеров и формы надпочечников и может также использоваться для выявления метастазирования (Voorhout et al, 1990а; Windmer, Guptill, 1995; Zerbe, 2000b; Hill, Scott-Voncrief, 2000). Для правильной интерпретации КТ-сканограмм необходим соответствующий опыт и хорошее знание секционной анатомии. Основными недостатками, препятствующими рутинному использованию этого метода визуализации, являются его малая доступность. высокая стоимость и необходимость анестезии. МРТ обеспечивает более точную, чем КТ идентификацию опухолевидных масс в надпо
чечниках, их метастазирования и инвазии сосудов. По мере повышения доступности и снижения стоимости МРТ может стать методом выбора для диагностической визуализации.
Отбор животных для хирургического лечения. Цель предварительной предоперационной оценки состоит в отборе животных для хирургического удаления опухоли. Оценка базируется на результатах физикального исследования и мнении опытного ветеринарного врача. Кроме того, она должна включать измерение системного кровяного давления, определение отношения концентраций белка и креатинина в моче и уровня антитромбина III в сыворотке крови. Если у собаки повышены первые два показателя и/или очень низкая концентрация антитромбина III, риск тромбоэмболии значительно выше, чем у других животных с синдромом Кушинга (Ortega et al, 1995; Jacoby et al, 2001). Нет сомнения, что риск развития тромбоэмболии у собак с ССК особенно велик во время анестезии и продолжительной операции на органах брюшной полости. Терапия кетоконазолом или о,р’-ДДД, проводимая в течение 1 -3 месяцев до операции, у собак с высоким риском послеоперационных осложнений вследствие анестезии и хирургического стресса снимает многие проблемы, обусловленные характерным для синдрома Кушинга ослаблением животных. Одновременно следует провести лечение сопутствующих заболеваний (например, инфекции). Данный подход хорошо известен, однако мы редко встречали собак, которым накануне операции требовалась такая терапия.
Хирургический доступ. Рекомендуется операция с межреберным (боковым) доступом или лапа-ратомия вдоль срединной линии живота. Последний способ обеспечивает доступ к обоим надпочечникам и полную оценку состояния органов брюшной полости, в первую очередь печени, а также выявление метастазов и других нарушений (Scavelli et al,
Рис. 6-58. Карциномы коры надпочечников умеренного (А) и большого (Б) размера (показаны стрелками), плотно сросшиеся с прилегающей почкой.
344 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Кожа
Левая почка
Второй поясничный позвонок
Эпаксиальные мышцы
Сублюм барные мышцы
Сублюм-барные мышцы
Правая почка
Селезенка
Печень
Наружная косая мышца живота
/ III Нисходя-/// щая петля <1 толстой \ " кишки
Поперечная \ мышца Внутренняя косая мышца живота
Левый надпочечник
Полая вена
Правый надпочечник
Поджелудочная железа
Брюшина
Нисходящий отдел двенадцатиперстной кишки
Аорта |
Cisterna chyli
Рис. 6-59. А. Анатомическая диаграмма, показывающая расположение надпочечников собаки и хирургический доступ к каждой железе через межреберные разрезы (пунктирная линия). Б. Фотография собаки с гиперкортицизмом, вызванным опухолью коры надпочечников, удаленной через межреберный доступ. Из: Johnson D: J Am Vet Med Assoc, 170:1093, 1977.
1986; Emms et al, 1987; Anderson et al, 2001). Любую аномальную ткань вырезают или берут ее пробу на биопсию. При этом, однако, возможны проблемы с заживлением ран в тканях, длительное время подвергавшихся воздействию избыточных концентраций кортикостероидов. Положение усугубляется наличием на вентральной поверхности тела шва, несущего вес прилегающих тканей. Кроме того, доступ к надпочечникам затруднен из-за большого количества брюшного жира у собак с синдромом Кушинга в сочетании с дорсальной и медиальной локализацией надпочечников относительно почек (рис. 6-59). Тем не менее, в практической работе мы часто прибегаем к лапаротомии вдоль срединной линии живота. Наши хирурги оптимизируют опе
рацию, дополняя ее межреберным разрезом, если собака имеет большую опухолевидную массу или если опухоль с трудом поддается визуализации, поражает сосуды (чаще всего полую или почечную вены), прорастает или сдавливает печень.
Межреберный забрюшинный разрез при адреналэктомии обеспечивает удобный подход к надпочечнику, расположенному со стороны разреза (Van Sluijs et al, 1995). Он позволяет избежать проблем, связанных с заживлением раны при наложении вентрального шва. несущего вес окружающих тканей, и трудностей, обусловленных большими отложениями жира в брюшной области. Кроме того, этот способ облегчает доступ к надпочечнику, расположенному в области полой вены и аорты (рис. 6-59). К
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 345
числу его явных недостатков относятся, во-первых, возможность осмотра только одного надпочечника и прилегающей зоны (доступ к другому надпочечнику требует закрытия первого разреза и повторения операции) и, во-вторых, невозможность оценки метастазирования печени и большинства других органов брюшной полости.
Оба хирургических подхода подробно описаны в нескольких руководствах по ветеринарии, и мы на них не останавливаемся (Johnson, 1983). При обнаружении опухоли коры надпочечников обычно предпринимают попытку ее полной резекции. Однако хирург может столкнуться с крупной опухолевой массой или опухолью, прорастающей в окружающие ткани и потому неоперабельной. В этой ситуации следует удалить как можно больше опухолевой ткани, которая необходима для гистологического подтверждения диагноза, а уменьшение объема опухоли может улучшить эндокринный статус собаки или кошки.
Ведение операционного и послеоперационного периодов (рис. 6-60).
Глюкокортикоидная терапия. Автономная секреция кортизола опухолью коры надпочечника подавляет продукцию АКТГ в гипофизе по механизму отрицательной обратной связи. В результате значительно атрофируются нормальные клетки пораженной железы, а также секретирующие кортизол клетки сетчатой и пучковой зон противоположного надпочечника. Подавление продукции эндогенного АКТГ опухолью может вызвать также атрофию клубочковой зоны, в которой синтезируется альдостерон. Хирургическое удаление опухоли должно индуцировать острый гипокортицизм. Во время анестезии необходима поддерживающая внутривенная инфузия жидкости (физиологического или рингеровского раствора). После обнаружения хирургом опухоли надпочечника в инфузионный флакон добавляют дексаметазон из расчета 0,05-0,1 мг/ кг веса тела. Его вводят в течение 6 часов, а затем обычно дважды повторяют вливание в течение того же дня. В последующем дексаметазон вводят подкожно два или три раза в день до тех пор, пока не появится возможность перорального введения без риска вызвать рвоту.
Альтернативный вариант терапии состоит в непрерывном введении гидрокортизона-хемисук-цината с помощью инфузионного насоса со скоростью 625 мкг/кг/час во время и после операции. Теоретически гидрокортизон обладает глюкокортикоидной и минералокортикоидной активностью, хотя последняя, по нашим наблюдениям, не очень высока. Мы не советуем применять гидрокортизон, а рекомендуем дексаметазон. Некоторые исследователи предлагают вводить кортикостероиды в течение 1-2 часов до адреналэктомии. На самом деле в этом нет необходимости, и такой подход может оказаться вредным. Ятрогенные стероиды создают
у собак предрасположенность к усилению гипертензии и гидратации, а также повышают риск тромбоэмболии.
После успешного выхода из анестезии собаки должны по-прежнему получать дексаметазон в сочетании с минералокортикоидами или без них в соответствии с протоколом терапии гиперкортицизма (см. гл. 8). Дексаметазон следует вводить в возрастающих дозах (от 0,01 до 0,1 мг/кг) в составе жидкости для внутривенной инфузии или подкожно 2-4 раза в день (мы обычно производим двукратную подкожную инъекцию дексаметазона сразу после операции и трижды вводим его на следующий день).
Продолжительность парентеральной терапии обычно не превышает 24-72 часов, поскольку к этому времени большинство собак начинают нормально есть и пить и не получают внутривенных вливаний жидкости. В этих условиях начинают терапию пероральными средствами. Как только собаки начинают самостоятельно есть и пить, им вводят перорально преднизон в дозе 0,25-1,0 мг /кг дважды в день на протяжении 2 дней (более высокую дозу мелким собакам, низкую - крупным особям). По мере нормализации аппетита дозы преднизона уменьшают, если при этом у собак отсутствуют рвота и диарея. Возможен следующий протокол снижения доз для мелких собак: сначала 0,5 мг/кг дважды в день в течение 2 дней, затем 0,25 мг/кг дважды в день на протяжении 3 недель, затем 0,25 мг/кг раз в день в течение 3 недель, затем 0,25 мг/кг через день на протяжении 1 месяца и, наконец, 0,25 мг/кг раз в три дня в течение 1 месяца. Обычно глюкокортикоидная терапия затягивается на 3-6 месяцев с постепенным понижением ее дозы до очень низких значений. После перехода на введение преднизона раз в два или три дня возможен перерыв, в течение которого животные не получают медикаментозное лечение.
Минералокортикоидная терапия. В послеоперационном периоде необходим тщательный мониторинг кровяного давления, концентраций AM, электролитов и глюкозы в крови. Примерно у 15— 20% наших собак после операции развивались слабые гипокалиемия и/или гипернатриемия, которые постепенно нормализовались по мере уменьшения доз экзогенных стероидов и восстановления у собак способности самостоятельно принимать пищу. При концентрации натрия в сыворотке крови ниже нормы и/или концентрации калия выше нормы назначают минералокортикоидную терапию. Слабые гиперкалиемия и гипонатриемия развивались у 40% наших собак спустя 24-48 часов после операции. Почти у всех животных эти отклонения носили временный характер и сохранялись не более 1-2 дней. Однако прогнозировать их тяжесть и продолжительность не представляется возможным. Поэтому, учитывая мягкое действие минералокортикоидной терапии, ее назначают, когда концентрация натрия в сыворотке крови опускается ниже 135 мэкв/л, а
346
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-60. Протокол ведения периоперационного периода для собак при хирургическом удалении опухоли коры надпочечника.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 347
концентрация калия поднимается выше 6,5 мэкв/л, либо когда недостаточность минералокортикоидов сохраняется более 72 часов.
Некоторые собаки получали флюдрокортизо-на ацетат перорально в дозе 0,02 мг/кг (см. раздел «Поддерживающая терапия» в гл. 8). Минералокортикоиды дают собакам дважды в день, оценивая целесообразность продолжения терапии перед введением каждой очередной дозы. Обычно ее отменяют по истечении 2-7 дней, но в случае рецидива гиперкалиемии или гипонатриемии возобновляют. Дозировку флюдрокортизона ацетата постепенно уменьшают по аналогии с протоколом терапии преднизоном. Иногда (примерно в 10% случаев) собакам, нуждающимся в минералокортикоидной терапии, вводят дезоксикортикостерон пивалат (ДОКП), как описано в гл. 8. Лишь очень немногим их этих животных назначают вторую инъекцию через 25 дней после первой. В этом случае дозу ДОКП уменьшают вдвое, а при необходимости третьей инъекции (спустя 50 дней) она составляет лишь четверть первоначальной дозы. На протяжении терапии ДОКП концентрацию электролитов в крови определяют каждые 7-10 дней. Лишь в редких случаях требуется четвертая инъекция ДОКП.
Глюкокортикоидная и минералокортикоидная терапия: выводы. Глюкокортикоидную и минералокортикоидную терапию назначают с учетом индивидуальных особенностей животных; «огульный» подход недопустим. Провоцирующую пробу с АКТГ рекомендуется проводить на утро после операции, до введения назначенной на этот день дозы дексаметазона. Очень низкие концентрации кортизола до и после введения АКТГ (менее 1 мкг%) служат показателем успешной операции, хотя никогда нельзя исключать наличия функционально неактивных метастазов. При неудачном исходе операции результаты пробы с АКТГ не изменяются по сравнению с дооперационным периодом и терапию экзогенными глюкокортикоидами не назначают. Низкие концентрации кортизола указывают на необходимость терапии и служат базовыми показателями при мониторинге ее эффективности.
Глюкокортикоидную терапию продолжают до тех пор, пока проба с АКТГ не будет давать показатели, соответствующие нижнему пределу нормы (на это может потребоваться 2-5 месяцев).
В идеальном случае глюкокортикоиды вводят через день на протяжении 4—8 недель после операции и в течение 3-6 месяцев терапию отменяют. Этот период достаточен для нормализации функции гипофизарно-надпочечниковой системы. В дополнение к терапии проводят пробы с АКТГ, чтобы определить срок ее окончания. При появлении у собаки признаков заболевания, апатии или потери аппетита следует увеличить дозы глюкокортикоидов либо проконтролировать уровень электролитов в сыворотке крови в условиях пробы с АКТГ или без нее. Нормальные результаты пробы указывают на необходимость отмены стероидной терапии.
Профилактика болей. За сутки до хирургического удаления опухоли коры надпочечников на кожу собаки помещают фентаниловый пластырь. По нашему опыту, это дает прекрасный анальгези-рующий эффект и не вызывает депрессии. Мы настоятельно рекомендуем воздерживаться от любой седативной терапии, после которой собака остается лежать в течение нескольких часов, так как это значительно повышает риск тромбоэмболии.
Профилактика тромбоэмболии. У собак с гиперкортицизмом после анестезии и длительного пребывания в положении лежа в связи с хирургической операцией повышен риск развития тромбоэмболии. Мы провели оценку четырех стратегий терапии таких животных. В одной группе собаки во время и после операции получали дексаметазон. Животным другой группы во время операции и в течение 4-6 часов после нее производили инфузию гидрокортизона, а дексаметазон вводили вечером того же дня и на следующий день. В третьей группе собакам во время операции вводили дексаметазон, плазму (как источник антитромбина III) и гепарин (35 ЕД/кг в инфузируемой плазме); в той же дозе гепарин два раза вводили подкожно после операции и, в уменьшающихся дозах, на протяжении последующих 4 дней. На пятый день производили внутривенную инфузию гидрокси-этилированного крахмала (хетастарча) в количестве 10-20 мл/кг в течение 6 часов. Считается, что однократная инфузия хетастарча снижает вероятность развития тромбоэмболии (Smiley, Garvey, 1994). Собакам четвертой группы внутривенно инфузировали гидрокортизон во время операции, а после нее - гидрокортизон, плазму, гепарин и крахмал. Тромбоэмболия наиболее часто развивалась у животных, получавших только гидрокортизон, а реже всего - при сочетанном введении дексаметазона, плазмы, гепарина и крахмала. В настоящее время мы рекомендуем именно последний терапевтический режим.
Результаты (прогноз). Среди 223 собак, у которых мы обнаружили активно функционирующие опухоли коры надпочечников, 208 животных имели одностороннее поражение, и 144 из них были оперированы. Девять собак были эвтаназированы во время операции после идентификации неоперабельной опухолевой массы. 29 собак погибли во время операции или вскоре после нее в результате операционных осложнений (кровотечений), послеоперационного сепсиса или тромбоэмболии. У 61 из 106 собак с успешным исходом операции были удалены карциномы.
У собак, выживших в течение первых четырех недель после «успешной» операции, прогноз вполне благоприятен (если нет метастазов). Некоторые оперированные (с рецидивами) и неоперированные животные получали медикаментозную терапию. Ожидаемая продолжительность жизни у оперированных собак составляла в среднем примерно 36 месяцев. Не следует забывать, что их средний воз
348 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
раст ко времени хирургического лечения достигал 11,1 лет, поэтому ожидаемая продолжительность жизни и не могла быть больше указанной. Большинство животных, переживших операцию и сохранивших жизнеспособность на протяжении последующих 4 недель, впоследствии погибают вне связи с синдромом Кушинга или бывшей у них карциномы коры надпочечников. Собаки с аденомами имеют более благоприятный прогноз. В целом они живут дольше, однако у некоторых из них диагноз аденома, поставленный на основании результатов гистологического исследования, оказался ошибочным: на самом деле у них была карцинома. Выше уже говорилось о трудности правильной идентификации и классификации эндокринных опухолей. В связи с этим не рекомендуется давать владельцам животных твердые заверения относительно риска метастазирования или ожидаемой продолжительности жизни.
Неоперабельные опухоли, опасность анестезии или явное метастазирование. Некоторым собакам с ССК и опухолями коры надпочечников хирургическое лечение не назначают. Это бывает в случаях обнаружения при КТ, рентгене или УЗИ большой неоперабельной опухолевидной массы или метастазов в легких, печени или других органах, при крайней слабости животного, которое может не вынести операции, или если владелец животного отказывается от операции. Таким собакам назначают медикаментозное лечение.
Внутрибрюшинное и забрюшинное кровотечение. Внутрибрюшинные и забрюшинные кровотечения могут быть вызваны травмой или спонтанно развивающимся заболеванием. Самыми распространенными нетравматическими причинами забрюшинного кровотечения являются нарушения свертываемости крови, разрыв пораженных сосудов, миграция чужеродных тел или разрыв опухоли почки. Недавно мы наблюдали четырех собак, у которых внутрибрюшинное и забрюшинное кровотечение было связано с нетравматическим разрывом опухоли надпочечника. В более раннем сообщении была описана собака, у которой кровотечение из опухоли надпочечника сопровождалось тремором на протяжении 3 дней, «сгорбленностью», болями в животе и изменением психического состояния (Vandenbergh et al, 1992). У наших четырех собак мы отмечали общую слабость, тяжелую сонливость, обесцвечивание слизистых оболочек и боли в животе. Физикальное, рентгенологическое и ультразвуковое исследования выявили у них признаки опухолевидной массы или кровоизлияния в брюшной полости или забрюшинном пространстве (Whittemore et al, 2001). Несмотря на внутривенное введение жидкости и дополнительную поддерживающую терапию, состояние брюшной полости этих животных и прогрессивное ухудшение их общего клинического состояния потребовали срочной хирургической операции.
Гиперкортицизм зависимый от гипофиза
Г ипофизэктомия
Общая характеристика. В идеале лечение ГЗГ у собак должно быть направлено на устранение причины заболевания, т.е. на удаление или разрушение секретирующих АКТГ опухолей гипофиза. Такие опухоли имеют первичное происхождение, не связанное с нарушением функции гипоталамуса (van Wijk et al, 1992). У людей с гипофизарной опухолью в области турецкого седла, вызывающей синдром Кушинга, наилучшим считается ее селективное микрохирургическое удаление с использованием транссфеноидального подхода (Mampalam et al, 1988; Melby, 1988; Thomer et al, 1992). Трудности и осложнения этой операции подробно описаны в работе Landlot (1990).
У собак также описано успешное удаление гипофиза как источника АКТГ при ГЗГ (Lantz et al, 1988; Niebauer, Evans, 1988; Niebauer et al, 1990). Такие операции должны проводиться только очень опытными специалистами. Для точной предоперационной локализации опухоли и определения ее размера используют КТ и МРТ. Появление нового нейрохирургического инструментария позволило усовершенствовать методику транссфеноидальной гипофизэктомии у собак (Meij et al, 1997b). Описаны ее осложнения (Schwartz, 1996). В проспективном исследовании 52 собак с ГЗГ, перенесших гипофизэктомию, проводили оценку результатов операции, включая выживаемость животных, продолжительность ремиссии, частоту рецидивов, послеоперационные осложнения. Приведены сравнительные данные об исходе операции в двух группах собак, включавших по 26 животных каждая (Meij etal, 1998).
Результаты (Meij et al, 1997a, 1997b и 1998). Предоперационная KT позволила оценить размер гипофизарных опухолей (28 крупных и 24 меньшего размера) и установить их местоположение относительно анатомических структур, используемых в качестве ориентиров во время операции. Предварительная локализация гипофиза с помощью КТ имеет важное значение независимо от формы и размера черепа. Небная кость затрудняла хирургический доступ, однако он был возможен у круглоголовых собак с крайним ростральным положением гипофиза. Пять собак погибли во время операции, у четырех была проведена неполная гипофизэктомия. Спустя год в живых осталось 84% оперированных собак, через два года - 80%. У 43 из 52 собак была достигнута ремиссия синдрома Кушинга. Рецидивы отмечены у пяти животных.
Наиболее серьезными послеоперационными осложнениями были слабая преходящая гипернатриемия (вследствие преходящего ятрогенного несахарного диабета), временное уменьшение или прекращение слезоотделения (в 25 глазах 18 собак), перманентный или продолжительный несахарный диабет (соответственно у 5 и 9 особей) и вторич
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 349
ный гипотиреоз. Продукция слезной жидкости нормализовалась у всех, кроме одной, собак в среднем через 10 недель после операции. Во второй группе собак (включавшей 26 из 52 особей) продолжительность госпитализации была меньше, нарушение слезоотделения реже, выживаемость выше, а послеоперационная смертность ниже, чем в первой группе. Базальные концентрации АКТГ, пролактина, кортизола, ГР, ЛГ и ТТГ через 8 недель после операции значительно снизились по сравнению с предоперационным периодом. Функции системы гипофиз-кора надпочечников нормализовались. Результаты послеоперационной КТ не коррелировали с ремиссией или последующими рецидивами синдрома Кушинга.
В более позднем сообщении тех же авторов приведены данные о хирургическом лечении 84 собак с ГЗГ. Положительные результаты были получены в 86% случаев, включая операции, проведенные ранее до приобретения хирургами большого опыта гипофизэктомии (Meij et al, 2002), когда частота неполной резекции опухоли и гибели животных была значительно выше, чем в последующем (Meij et al, 1998). В целом, результат хирургического лечения был сопоставим с успешностью медикаментозной терапии.
Выводы. Нейрохирурги, проводящие гипофи-зэктомию, должны понимать, что уверенность и мастерство, необходимые для успеха этой операции, приобретаются с опытом. Они должны иметь представление о ее наиболее частых осложнениях и уметь как можно раньше распознавать их с целью быстрого и эффективного устранения. Чувствительным показателем для подтверждения ремиссии или рецидивов синдрома Кушинга служит отношение концентраций кортизола и креатинина в моче. Одним из эффективных способов лечения ГЗГ является микрохирургическая транссфеноидальная гипофизэктомия. Мы считаем ее методом выбора для лечения этого заболевания у собак. Единственной причиной, препятствующей ее «рутинному» использованию, может быть отсутствие у нейрохирурга соответствующего опыта.
Адреналэктомия. ГОН приводит к двусторонней гиперплазии надпочечников. Удаление обоих надпочечников ведет к полному исчезновению симптомов синдрома Кушинга. В то же время эта сложная хирургическая операция представляет большую опасность для больного животного с нарушенной иммунной системой и медленным заживлением ран. Как и в случае гипофизэктомии, риск может быть сведен к минимуму при наличии у хирурга достаточного опыта. Вместе с тем, оперированные животные на протяжении всей жизни нуждаются в терапии гипокортицизма (см. гл. 8) и в любой момент возможно резкое обострение гипоадренализ-ма. Учитывая это, мы считаем нецелесообразным подвергать животных операции, тем более что «медикаментозная адреналэктомия» легко достигается с помощью терапии о,р’-ДДД.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ СИНДРОМА КУШИНГА С ИСПОЛЬЗОВАНИЕМ о,р’-ДДД
Гиперкортицизм зависимый от гипофиза
Первоначальная химиотерапия с использованием о,р’-ДДД
Общая характеристика. После того как Schechter и его сотрудники в 1973 году впервые предложили химиотерапию с использованием о,р’-ДДД, этот препарат стал наиболее популярным средством лечения собак с ССК. Системное действие о,р’-ДДД (митотана или лизодрена), который является химическим производным инсектицида ДДТ, было впервые показано Nelson и Woodard в 1949 году. При введении собакам этот препарат вызывал прогрессивный тяжелый некроз пучковой и сетчатой зон. В 1975 году Kirk и Jensen подтвердили способность о,р’-ДДД индуцировать частичный или полный некроз клубочковой зоны. Другие патологические процессы ограничивались умеренной или тяжелой жировой дегенерацией, центрилобулярной атрофией и гиперемией печени. Больше никаких клинически значимых изменений ни в печени, ни в других органах о,р’-ДДД не вызывал.
Интересно, что здоровые собаки относительно резистентны к вызывающему некроз надпочечников действию о,р’-ДДД. В одном из исследований, проведенных в 1940-ых г.г., о,р’-Д ДД вводили четырем собакам в дозе 50 мг/кг на протяжении 5 дней в неделю. Две из них погибли спустя 20 и 21 месяц после начала терапии. Третью собаку подвергли эвтаназии через 21 месяц, а четвертая прожила 38 месяцев. В исследовании 1975 года о,р’-ДДД в дозе 50 мг/кг ежедневно вводили 10 собакам. Одна из них погибла спустя 124 дня, а другая через 147 дней. Остальные восемь животных оставались клинически здоровыми до эвтаназии спустя 36-150 дней после начала ежедневного введения препарата. Однако биохимическое исследование выявило у них уменьшение секреторного резерва коры надпочечников и ее разрушение через 3-10 дней после начала введения о,р’-ДДД несмотря на отсутствие выраженных клинических расстройств.
Вывод из исследований по применению о,р’-ДД Д очевиден: нормальная кора надпочечников собак быстро разрушается, однако нормальные животные выживают в течение длительного времени при минимальном уровне ее функциональной активности. Собаки с гиперплазией коры надпочечников, по-видимому, более чувствительны к повреждающему действию о,р’-ДДД, обычно реагируют на него через 5-9 дней после начала терапии и часто заболевают с симптомами гипоадренализма, если препарат не отменяют сразу после появления первых признаков реакции. Если у собаки с ГЗГ потребность в ежедневном введении о,р’-ДДД превышает 21 день, следует проверить правильность диагноза. Причинами «резистентности» могут быть 1) собака не получает препарат; 2) наличие опухоли коры
350
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
надпочечников; 3) препарат не всасывается из желудочно-кишечного тракта; 4) сопутствующая терапия, влияющая на действие о,р’-ДДД (например, введение фенобарбитала); 5) ошибочный диагноз и, реже, резистентная форма ГЗГ (см. раздел «Отсутствие реакции на о,р’-ДДД»),
Предварительные исследования: аппетит. Прежде чем приступать к терапии о,р’-ДДД, хозяин собаки и ветеринар должны оценить ряд клинических признаков, таких как внешний вид животного, активность, суточное потребление воды и аппетит. В последующем это поможет оценить эффективность терапии, выявить ее побочное действие и новые расстройства, в частности, вызванные растущей опухолью гипофиза. Ветеринар должен помнить, что ни одной собаке с пониженным аппетитом или анорексией, рвотой или диареей ни в коем случае нельзя назначать о,р’-ДДД.
Аппетит собаки, несомненно, является наиболее важным и достоверным признаком при мониторинге начальной (нагрузочной) стадии терапии о,р’-ДДД. Все без исключения собаки с ГЗГ должны получать о,р’-ДДД от хозяев в домашних условиях. Не допускается терапия о,р’-ДДД в условиях стационара. Уменьшение аппетита бросается в глаза раньше, чем любой другой эффект о,р’-ДДД. Дома собака получает корм в более естественной обстановке, хозяин лучше знает ее привычки и быстрее ветеринарного врача заметит их изменение. Ниже будет показано, что уменьшение аппетита является наиболее чувствительным критерием для завершения «нагрузочной фазы» терапии. У 80-85% собак продолжительность «нагрузочной фазы» составляет от 5 до 9 дней. Небольшое число животных (примерно 10%) отвечают на о,р’-ДДД уже через 3-5 дней после начала его введения. Менее чем 10%
ТАБЛИЦА 6-15. ИНФОРМАЦИЯ ДЛЯ ВЛАДЕЛЬЦЕВ ЖИВОТНЫХ
Терапия о,р’-ДДД при гипофизарном синдроме Кушинга
Гиперкортицизм (синдром Кушинга) - это клиническое состояние, обусловленное избыточным содержанием кортизола в организме. У некоторых собак с этим заболеванием имеется опухоль в одном или обоих надпочечниках, продуцирующая кортизол. У Вашей собаки, как у более чем 80% других собак со спонтанно приобретенной формой этого заболевания, имеется небольшая опухоль у основания мозга, в органе, называемом гипофизом. Гипофиз контролирует функцию надпочечников. Опухоль гипофиза вызывает избыточную продукцию кортизола, которая приводит к появлению симптомов (зависимого от гипофиза синдрома Кушинга), легко распознаваемых владельцами животных. Наиболее распространенными симптомами у собак с синдромом Кушинга являются обильное мочеиспускание и избыточное потребление воды, непомерный аппетит, выпадение шерсти, мышечная слабость, отвислый живот, одышка, истончение кожи и сонливость. Почти у всех собак с синдромом Кушинга имеется, по меньшей мере, один или несколько перечисленных симптомов, однако полный их набор очень редко встречается у одного и того же животного. Ветеринарный врач устанавливает диагноз синдром Кушинга на основании результатов разнообразных тестов и исследований. При подтверждении такого диагноза назначается терапия о,р’-ДДД.
Во время Второй Мировой войны исследователи изучали инсектицид ДДД, пытаясь получить высокотоксичное соединение. Было синтезировано производное ДДТ (о,р’-ДДД, иначе лизодрен, или митотан). Оказалось, что это химическое соединение разрушает у собак клетки коры надпочечников, продуцирующие кортизол. Препарат успешно использовали для лечения тысяч собак с синдромом Кушинга. Следует, однако, помнить, что о,р’-ДДД - это токсичное соединение, которое требует соответствующего обращения. Мы используем следующий простой протокол терапии о,р’-ДДД. За один-два дня до ее начала животное дважды в день получает 1/3 обычного суточного рациона (т.е. каждые 24 часа съедает 2/3 привычного количества корма). Это еще больше усиливает у собаки чувство голода, но это ненадолго (мы не рекомендуем о,р’-ДДД для лечения собак с плохим аппетитом). Спустя 1-2 дня после ограниченного кормления собаке дважды в день дают о,р’-ДДД из расчета 25 мг/кг веса тела (собаке весом 22 фунта 2 раза в день дают по полтаблетки о,р’-ДДД; таблетка содержит 500 мг активного вещества). Препарат дают сразу после еды. Поэтому накормите собаку, заметьте время, которое потребовалось ей, чтобы полностью съесть корм, а затем дайте о,р’-ДДД (препарат лучше всасывается, когда желудок полный).
Необходимо наблюдать за собакой во время еды, чтобы вовремя закончить введение о,р’-ДДД. Препарат дают до тех пор, пока у животного сохраняется повышенный аппетит. Как только Вы заметите, что собака стала есть меньше, ПРЕКРАТИТЕ давать о,р’-ДДД. Понижение аппетита может проявляться в увеличении времени, за которое собака полностью съедает корм, она может съедать только половину корма или отрываться от еды, чтобы напиться или просто раз-другой взглянуть на Вас (хозяина), прежде чем съест всю предложенную порцию. Иными словами, собака не должна отвлекаться во время еды, потому что любая пауза служит сигналом для прекращения введения о,р’-ДДД. Другими сигналами для отмены препарата служат уменьшение потребления воды, появление рвоты, понос или вялость и апатия. В то же время, снижение аппетита обычно предшествует появлению более серьезных расстройств. Чаще всего реакция на препарат проявляется через 5-9 дней после начала лечения, иногда спустя 1-3 дня и еще реже более чем через 14 дней.
Нельзя давать собакам о,р’-ДДД более 8 дней подряд без оценки действия препарата. Оценку должен проводить ветеринарный специалист, она продолжается 1-2 часа. Обычно мы начинаем давать собаке о,р’-ДДД в воскресенье, планируя оценку его действия через 8 дней (т.е. в понедельник). Более 85% владельцев животных прекращают вводить препарат в четверг, пятницу, субботу или воскресенье, а в понедельник приводят собаку к ветеринару для оценки ее состояния. Если он считает, что терапия дала положительный результат, то можно снять ограничения в еде. Ваша собака до конца жизни должна получать о,р’-ДДД. Начальная поддерживающая доза о,р’-ДДД обычно составляет примерно 50 мг/кг в неделю (собака весом 22 фунта должна получать четверть таблетки о,р’-ДДД четыре раза в неделю). Эта доза может быть увеличена или уменьшена в зависимости от результатов оценки эффективности поддерживающей терапии через 1 месяц после ее начала и последующих оценок, проводимых каждые 2-4 месяца. В этих условиях средняя собака (достигшая возраста 11,5 лет на момент установления диагноза) выживает в течение приблизительно 30 месяцев (хотя некоторые особи живут всего несколько недель, а другие 6-10 лет). Дольше всех живут собаки, которым обеспечен должный уход и тщательное ветеринарное наблюдение, однако, не следует сбрасывать со счетов и счастливый случай. Пристальное наблюдение за животным и регулярная оценка его состояния специалистом значительно способствуют увеличению продолжительности жизни.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
351
собак о,р’-ДДД приходится ежедневно вводить в течение 9 дней и более.
Мы советуем владельцам собак давать им треть нормального суточного рациона дважды в день, т.е. в нагрузочной фазе терапии животное должно ежедневно получать 2/3 суточного рациона (табл. 6-15). Такое снижение потребления корма еще больше повышает аппетит у этих животных, которые обычно и без того испытывают острейшее чувство голода. После этого хозяин должен следить за собакой, отмечая любое снижение аппетита (обычно даже простая пауза во время еды служит основанием для завершения данной стадии терапии). Задача состоит в том, чтобы прекратить введение о,р’-ДДД задолго до развития анорексии. Ежедневное двукратное введение о,р’-ДДД собакам во время или сразу после еды не только является способом мониторинга, но и усиливает всасывание препарата (Watson et al, 1987).
Было бы совершенно неестественно (и, по нашему мнению, неправильно) вводить о,р’-ДДД собакам с синдромом Кушинга, не имеющим прекрасного или даже «зверского» аппетита. Плохой аппетит или анорексия ставят под сомнение правильность диагноза и требуют выявления сопутствующих расстройств, обусловливающих отсутствие «прекрасного» аппетита. Если же диагноз ГЗГ поставлен правильно, а сопутствующие нарушения не выявлены, то причиной плохого аппетита или анорексии может быть крупная опухоль гипофиза (макроопухолевый синдром).
Потребление воды. После завершения диагностических исследований в условиях стационара собаку с гиперкортицизмом и полидипсией возвращают владельцу для контроля потребления воды. Если владелец держит несколько собак, то следует оценить потребление ими воды, пока животное с синдромом Кушинга находится в стационаре. Вычитая полученную величину из общего количества воды, выпитой всеми собаками, рассчитывают ее потребление собакой с синдромом Кушинга после возвращения в привычные домашние условия. Для повышения точности оценки потребление воды определяют в течение двух-четырех суток, получая, таким образом, средний показатель в качестве базового для мониторинга последующей терапии.
Правильно проинструктированные хозяева животных обычно предоставляют достаточно достоверную информацию. Для оценки потребления воды можно использовать любую мерную посуду, но мы рекомендуем для этой цели обычную кухонную кружку с известным объемом, поскольку она вмещает удобное в обращении количество жидкости (1 кружка = 240 мл; нормальное потребление воды <66 мл/кг/день). В литературе указывается, что нормальное суточное потребление воды собаками достигает 100 мл/кг, но, по нашему мнению, эта цифра завышена. Почти у 20% собак с ГЗГ полидипсия отсутствует. Подобно животным с полидипсией, они могут получать лечение в домашних условиях. Отсутствие полидипсии означает лишь, что при мони
торинге на начальной стадии терапии определяют одним параметром меньше. При этом сохраняется оценка потребления корма. В случае необходимости до начала терапии измеряют также концентрации AM, натрия и калия в крови. Эти показатели можно контролировать и во время терапии.
Начало терапии о,р’-ДДД: нагрузочная фаза (рис. 6-61). Терапию начинают дома с введения о,р’-ДДД (лизодрен, Bristol-Myers Oncology Division, США) в общей суточной дозе 50 мг/кг, которую дают собаке в два приема. Глюкокортикоиды не рекомендуются, однако некоторые ветеринары советуют хозяевам собак на всякий случай иметь таблетки преднизолона или преднизона (мы не рекомендуем нашим клиентам прибегать к терапии глюкокортикоидами). Владельцы животных должны быть хорошо осведомлены о характере действия о,р’-ДДД и проинструктированы относительно сроков прекращения терапии (см. табл. 6-15). Лизодрен отменяют в следующих случаях: 1) при появлении у собаки любых признаков снижения аппетита (даже небольшой паузы во время еды, чтобы выпить воды или отреагировать на голос хозяина); 2) если собака с полидипсией в течение суток выпивает менее 66 мл воды/кг; 3) при рвоте; (4) при поносе; (5) если животное выглядит необычно вялым. Особенно важны два первые показания к отмене терапии, поскольку эти явления встречаются чаще других и почти всегда указывают на опасность передозировки. Однако и остальные перечисленные признаки свидетельствуют о необходимости прекращения терапии.
о,р’-ДДД обладает высокой активностью, поэтому нельзя целиком полагаться на то, что хозяин собаки точно выполнит все полученные предписания. Количество предоставляемого ему на первое время о,р’-ДДД никогда не должно превышать 7 или 8 суточных доз. Высокая активность препарата в сочетании с тесным взаимодействием владельца животного и ветеринара обеспечивает успешное устранение всех симптомов гиперкортицизма. Ветеринарный врач или его помощник должны ежедневно получать от владельца устную информацию о состоянии собаки, начиная со второго дня терапии. При таком подходе владелец постоянно ощущает заинтересованность специалиста, что побуждает его более внимательно следить за поведением животного. Следует рекомендовать кормить собаку два раза в день, всякий раз давая небольшие количества пищи, как указано выше (по одной трети нормального суточного рациона за один раз). Аппетит собаки оценивают перед каждым введением о,р’-ДДД. Если собака с полидипсией или без нее быстро съедает корм, следует продолжать терапию. Если же потребление корма 1) замедляется, 2) в еде появляются паузы или 3) животное отказывается от корма, следует воздержаться от дальнейшего введения о,р’-ДДД до консультации с врачом. Обычно начальную нагрузочную фазу терапии завершают при снижении у собаки аппети-
352
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-61. Протокол терапии о,р’-ДДД при гиперкортицизме.
та или после уменьшения суточного потребления воды до 66 мл/кг и ниже.
Потребление воды у собак с полидипсией может нормализоваться в течение 2 дней после начала терапии, однако иногда процесс нормализации занимает 30-45 (в среднем 9-14) дней. Контроль за потреблением воды необходимо продолжать до тех пор, пока оно не понизится до 66 мл/кг/день или менее. Снижение обычно заметно через 1-2 недели после начала введения о,р’-ДДД, однако, как правило, потребление воды нормализуется только после появления признаков снижения аппетита. Мы гораздо больше полагаемся на сообщения хозяев о потреблении корма их собаками, чем на результаты измерения ими объема потребляемой воды.
Через 1-4 дня после начала терапии у небольшого числа собак появляются слабые признаки раздражения желудка или системного расстройства, вызванные о,р’-ДДД, к числу которых относятся анорексия, рвота, диарея, общая слабость и сонливость. При появлении любого из этих признаков следует прекратить терапию до осмотра собаки ве
теринаром. Наиболее вероятной причиной их появления всего через несколько дней после начала терапии является прекращение действия о,р’-ДДД или его введение животным на пустой желудок. Ветеринар должен точно установить, когда собака получала о,р’-ДДД, а хозяин - давать ей о,р’-ДДД только после еды. Некоторые владельцы удерживают небольшое количество из единовременно предлагаемого собаке корма и, если она с жадностью съедает его, дают оставшуюся часть, предварительно добавив в нее о,р’-ДДД. Если рвота или потеря аппетита являются следствием повышенной чувствительности к о,р’-ДДД, а не признаком передозировки, может оказаться полезным дальнейшее дробление дозы; иногда требуется на несколько дней прервать введение о,р’-ДДД. Рекомендуется начинать терапию в воскресенье. Тогда, если спустя несколько дней развивается заболевание, можно получить ветеринарную помощь до окончания рабочей недели.
Ветеринарный мониторинг. Помимо получения ежедневных сообщений от хозяина собаки по
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 353
телефону, ветеринар должен осмотреть животное через 8-9 дней после начала терапии или раньше, если животное теряет аппетит до истечения указанного периода. При повторном осмотре анализируются данные анамнеза и физикального обследования и проводится провоцирующая проба с АКТГ. Отношение концентраций кортизола и креатинина в моче недостаточно информативно для целей мониторинга (Reusch et al, 1995; Angles et al, 1997; Guptill et al, 1997; Randolph et al, 1998). Иногда целесообразно определять концентрации AM, натрия и калия в сыворотке, хотя эти показатели редко отклоняются от нормы, и мы обычно не измеряем их. Если в ответ на терапию у животного появляются выраженные клинические симптомы (или если владелец затрудняется интерпретировать возникшие изменения), следует прекратить введение о,р’-ДДД до оценки результатов пробы с АКТГ. Последняя необходима и в отсутствие симптомов, однако в этом случае терапия может быть продолжена (см. рис. 6-61).
Цель терапии. Цель терапии о,р’-ДДД состоит в нормализации клинического состояния животного. В нашей лаборатории она считается достигнутой, если концентрация кортизола в плазме крови до стимуляции АКТГ не выше 5 мкг/100 мл, а после стимуляции составляет 1 мкг/100 мл или более, но не превышает 5 мкг/100 мл (рис. 6-62, А-Г). Обычно это происходит, когда собака теряет аппетит или суточное потребление воды уменьшается до 66 мл/ кг или ниже.
Если у собаки, у которой до начала лечения ответ на АКТГ был нормальным или повышенным, после начальной фазы терапии результаты пробы с АКТГ находятся в пределах нормы (концентрация кортизола 6-15 мкг/100 мл после введения АКТГ; рис. 6-62,Е-И), то это указывает на определенное клиническое улучшение, хотя и не на полную нормализацию состояния животного (некоторые признаки синдрома Кушинга могут сохраняться). Это обусловлено устойчивым нарушением функции гипофизарно-надпочечниковой системы (см. рис. 6-7). Терапия митотаном не влияет на активность секретирующих АКТГ опухолей гипофиза. Они продолжают выделять более или менее значительные количества этого гормона (Nelson et al, 1985), что служит причиной избыточного содержания кортизола в крови на протяжении большей части суток. Задача поддерживающей терапии у таких животных состоит сначала в снижении, а потом в сохранении концентрации кортизола в плазме крови (после введения экзогенного АКТГ) на уровне 1 мкг/100 мл или выше, но ниже 5 мкг/100 мл.
Оценка целесообразности продолжения терапии «нагрузочной дозой» о,р’-ДДД. Если у собаки с ССК после первых 8-9 дней введения о,р’-ДДД ответ на экзогенный АКТГ находится в норме или повышен, следует продолжать терапию. Обычно ее проводят в течение еще 3-7 дней, причем этот дополнительный период короче для собак с выражен
ной (хотя и не адекватной) реакцией на АКТГ. Пробу с АКТГ повторяют каждые 7-10 дней до тех пор, пока не нормализуется концентрация кортизола в ответ на стимуляцию. Собственно говоря, число повторных проб никогда не бывает слишком большим, так как у большинства собак (почти у 95%) реакция проявляется в первые 5-9 дней и практически у всех - к 14 дню после начала терапии.
Средняя продолжительность ежедневного введения «нагрузочной дозы». Большинство собак отвечает на о,р’-ДДД в течение 5-9 дней после начала его введения, менее 3% - уже через 2 или 3 дня и столько же более чем через 21 день. В среднем реакция проявляется через 6,4 дня. Среди обследованных нами собак 80% отвечали на терапию через 5-9 дней после ее начала, а 90% - через 2-10 дней. Следует подчеркнуть важность индивидуального подхода при проведении терапии о,р’-ДДД. По-видимому, невозможно прогнозировать, как долго продлится лечение и какое количество о,р’-ДДД достаточно для разрушения коры надпочечников.
Введение глюкокортикоидов в «нагрузочной фазе». В ветеринарной литературе описаны два разных протокола начальной или «нагрузочной» стадии терапии о,р’-ДДД: с одновременным введением глюкокортикоидов и без него. Каждый протокол имеет свои преимущества и недостатки.
Без введения глюкокортикоидов. Мы не рекомендуем вводить глюкокортикоиды по следующим причинам: 1) тесное взаимодействие ветеринара и владельца животного в сочетании со знанием критериев прекращения терапии дает достаточно хорошие клинические результаты; 2) на фоне введения глюкокортикоидов ни ветеринар, ни его клиент не могут определить, достаточно или много о,р’-ДДД было дано собаке; 3) поскольку невозможно определить срок прекращения начальной фазы терапии на основании клинических показателей, ветеринару приходится ориентироваться на результаты провоцирующей пробы с АКТГ; однако за 1-2 дня до ее проведения следует прекратить введение глюкокортикоидов, иначе при определении кортизола будет измеряться концентрация перорально введенного препарата, а не эндогенного стероида; 4) если глюкокортикоиды вводились из-за передозировки о,р’-ДДД, их отмена может вызвать криз; 5) одновременное введение глюкокортикоидов не устраняет признаки недостаточности кортизола у многих собак, получающих оба препарата (Kintzer, Peterson, 1991); 6) проще критически оценить необходимость глюкокортикоидной терапии.
Частота передозировки о,р’-ДДД с появлением соответствующей клинической симптоматики у собак, одновременно получающих глюкокортикоиды, выше, чем в отсутствие последних. Это объясняется возможностью заметить слабые клинические изменения уже в начале терапии и прекратить ее до введения избыточного количества о,р’-ДДД. Нельзя недооценивать значение наблюдений за животными в домашних условиях, поскольку хозяева прекрасно
354 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Первые 7 дней
Первые 7 дней
С 8 по 30 день после начала терапии
С 31 по 90 день после начала терапии
С 91 по 180 день после начала терапии
С 91 по 180 день после начала терапии
Рис. 6-62. Результаты пробы с АКТГ и средние дозы о,р’-ДДД в группе из 12 собак с ГЗГ (А) до и через 7 (Б), 30 (В), 90 (Г) и 180 (Д) дней после начала терапии. Сравните с результатами той же пробы у 12 собак с гиперкортицизмом, вызванным опухолями коры надпочечников, сопоставимых по возрасту, весу тела и дозировкам о,р’-ДДД (Е-3). Приведенные данные показывают, что собаки с ГЗГ более чувствительны к терапии о,р’-ДДД, чем животные с опухолями коры надпочечников
Доза митотана (мг/кг/день) Доза митотана (мг/кг/день) Доза митотана (мг/кг/день) Доза митотана (мг/кг/день)
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 355
знают своих питомцев и сразу же видят проявления токсического действия препарата - производного инсектицида ДДТ. Только 7% из обследованных нами собак потребовалась временная глюкокортикоидная терапия (по сравнению с 35% животных, получавших глюкокортикоиды) (Kintzer, Peterson, 1991). Хроническая болезнь Аддисона развилась менее чем у 2% наших собак (по сравнению с 5,5% животных, получавших глюкокортикоидную терапию). Появление признаков недостаточности кортизола служит сигналом для окончания терапии. Сразу после этого проводят пробу с АКТГ, а затем начинают вводить глюкокортикоиды. Однако реакция на глюкокортикоиды также является признаком передозировки о,р’-ДДД.
Введение глюкокортикоидов. Введение глюкокортикоидов во время «нагрузочной фазы» имеет ряд преимуществ: 1) введение глюкокортикоидов (обычно в дозе 0,5 мг/кг веса/день в два приема) одновременно с о,р’-ДДД дает достаточно хорошие результаты; 2) о,р’-ДДД может оказывать побочные эффекты, а глюкокортикоиды их снимают или сводят к минимуму; 3) улучшение состояния животных было очевидно для их хозяев, не взирая на глюкокортикоидную терапию; 4) перорально вводимые глюкокортикоиды не влияют на результаты тестов, если их введение прервать за сутки до тестирования (Kintzer, Peterson, 1991).
Потребность в глюкокортикоидах. Глюкокортикоидная терапия показана при появлении у собак признаков анорексии, рвоты, диареи, общей слабости и апатии. Таким животным назначают глюкокортикоиды, если они не получали их на начальной стадии терапии о,р’-ДДД. Если же глюкокортикоиды уже вводились, то может потребоваться увеличение их дозы, хотя рвота может быть вызвана разными причинами. Это справедливо как для поддерживающей фазы терапии, так и для собак с хорошо контролируемым заболеванием, испытывающих сильный стресс (болезнь, травма, элективная хирургическая операция). Преднизон вводят в дозе 0,1-0,5 мг/кг дважды в день на протяжении 2 дней. У собак с клиническими симптомами, вызванными передозировкой о,р’-ДДД, улучшение состояния отмечают уже через несколько часов после введения преднизона. При невозможности пероральной терапии из-за рвоты жидкости и глюкокортикоиды вводят парентерально. Глюкокортикоиды вводят в рекомендуемых высоких дозах два дня, после чего дозу снижают на 50% и вводят еще два дня (при сохранении ежедневного двукратного введения), потом их вводят однократно в течение трех дней, затем через день в течение 7-10 дней и, наконец, отменяют. При наличии рецидивов терапию возобновляют в тех же или более высоких дозах.
Плановая индукция хронического гипокор-тицизма: плановая медикаментозная адреналэктомия. Благоприятные отдаленные результаты лечения иногда обусловлены непредвиденным возникновением гипокортицизма (в отсутствие тяже
лого заболевания животного). Это обстоятельство дало основание некоторым ветеринарным специалистам предложить лечить всех собак с гиперкортицизмом путем направленного полного разрушения коры надпочечников. Такие животные на протяжении всей жизни должны получать заместительную терапию для компенсации надпочечниковой недостаточности. Протокол терапии предусматривает ежедневное введение о,р’-ДДД в течение 25-35 последовательных дней в дозе 50-75 мг/кг (даже 100 мг/кг для карликовых пород). Указанные дозы каждый день вводят с кормом в 3-4 приема, для того чтобы «свести к минимуму неврологические расстройства и обеспечить хорошее всасывание в кишечнике». На третий день терапии о,р’-ДДД начинают введение кортизона (2 мг/кг дважды в день), минералокортикоида (флюдрокортизона, 0,0125 мг/ кг) и хлористого натрия (0,1 г/кг), и эти препараты вводят на протяжении всей оставшейся жизни собаки. Дозу преднизона постепенно уменьшают после завершения режима ежедневного введения (Rijnberg, Belshow, 1988).
Этот протокол имеет ряд недостатков (Den Hertog et al, 1999). Во-первых, он сопровождается нежелательными эффектами, которые вызывают необходимость временного или полного прекращения терапии митотаном или приводят к гибели 40% собак. Согласно одному из сообщений, такие нежелательные эффекты включали анорексию (у 28% собак), рвоту (27%), общую слабость (19%), депрессию (11%) и диарею (4%). На протяжении периода лечения погибли 15 из 129 собак (7 из-за гипокортицизма). Почти у 40% животных, получавших такое лечение, в течение первых 12-18 месяцев после его окончания развился рецидив синдрома Кушинга (Den Hertog et al, 1999). Это свидетельствует о необходимости периодического проведения провоцирующей пробы с АКТГ, как и при традиционных способах терапии. К тому же описанный протокол гораздо дороже обычного лечения из-за высокой стоимости флюдрокортизона и ДОКП. Наконец, собаке с хорошо контролируемым синдромом Кушинга, которой несколько раз в неделю или в месяц вводят о,р’-ДДД, не угрожает ухудшение состояния, если будет пропущена очередная доза препарата. В то же время животное с гипокорти-цизмом нуждается в непрерывной терапии. Мы не рекомендуем использовать описанный протокол.
Потребность в глюкокортикоидах и минералокортикоидах. Считают, что о,р’-ДДД не повреждает клубочковую зону, поэтому продукция минералокортикоидов сохраняется, несмотря на разрушение пучковой и сетчатой зон надпочечников. Собаки, у которых появляется слабость, анорексия и/или рвота в отсутствие нарушений баланса электролитов, нуждаются в срочной терапии глюкокортикоидами. Изменение соотношения электролитов, свидетельствующее о недостаточности минералокортикоидов (повышение концентрации калия и уменьшение концентрации натрия в сыворотке),
356 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Рис. 6-63. Павильон с ГЗГ до (А) и через 6 недель (Б) после начала терапии о.р’-ДДД, завершившейся появлением нового «щенячьего» шерстяного покрова. В. Та же собака с нормальным шерстяным покровом взрослого типа через 10 недель после терапии.
может быть вызвано случайной передозировкой о.р’-ДДД. Животным с таким расстройством показана сочетанная глюкокортикоидная и минералокортикоидная терапия (см. гл. 8). Однако случаи такой сильной передозировки редки (менее 2°о среди обследованных нами собак, получавших о,р’-ДДД от своих хозяев). В условиях терапии о,р’-ДДД недостаточность глюкокортикоидов у собак носит временный характер, тогда как индуцированная им болезнь Аддисона (комбинированная недостаточность глюкокортикоидов и минералокортикоидов) зачастую перманентна.
Очередность нормализации клинических симптомов и биохимических нарушений. Собаки с ГЗГ быстро реагируют на терапию о,р’-ДДД. Первой и наиболее очевидной реакцией является снижение аппетита, которое обычно происходит через 5-9 дней после начала лечения. Хозяева собак нередко сообщают о повышении их активности в течение первой или второй недели на фоне
уменьшения потребления во ;ы и продукции мочи. Другие клинические симптомы исчезают гораздо позже. Мышечная сила восстанавливается в течение нескольких дней и даже недель. Одновременно уменьшаются размеры живота. Для снижения тяжести алопеции, истончения кожи, кальциноза и одышки требуются недели и месяцы. У собак с нарушениями шерстяного покрова может развиться себорея в сочетании с дальнейшим ухудшением состояния шерсти, обострением алопеции и зуда, что может продолжаться 1-2 месяца, пока не отрастет новая здоровая шерсть. У некоторых особей восстановлению нормального шерстяного покрова предшествует фаза «щенячей шерсти» (рис. 6-63), а у отдельных собак после терапии резко изменяется его окраска (рис. 6-64). Через 1-2 месяца после успешного завершения лечения у сук восстанавливается астральный цикл; правда, почти все наши собаки были подвергнуты овариэктомии задолго до возникновения ССК.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 357
Рис. 6-64. Фотографии пу деля с ГЗГ до (А) начала терапии о.р’-ДДД и (Б) мере} 2 месяца после ее завершения; у собаки резко изменилась окраска шерсти. В Рени зив через 4 гота после терапии Г. После возобновления терапии о,р’-ДДД Д. Мелкая беспородная собака с ГЗГ до начала терапии о,р’-ДДД и (Е) спустя 2 месяца после се окончания; у собаки ре жо и вменилась окраска шерсти.
f 1счезновению нарушений в отдельных органах и системах под влиянием терапии предшествует нормализация внешнего вида собак с синдромом Кушинга. Для восстановления нормальной концентрации холестерина и активности ферментов печени в плазме крови требуются месяцы. Активность ферментов печени может вообще не восстановиться из-за слабого, но продолжающегося воздействия о,р’-ДДД на этот орган. У людей о,р’-ДДЦ вызывал повышение холестерина в крови (Vassilopoulou-
Sellin, Samaan, 1991; Maher et al 1992; Gebhardt et al, 1993). По этой причине активность печеночных ферментов в крови нельзя использовать в качестве показателя успешности терапии. Показатели кровяного давления улучшаются на протяжении 3 6 месяцев после окончания терапии о,р’-ДДД. 1 ипер-тензия исчезает не у всех собак, так как она может быть не связана с ССК. Инфекции мочевого тракта излечиваются очень быстро, но могут иметь затяжной характер из-за пиелонефрита задержки мочи в
358 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
мочевом пузыре или наличия мочевых камней. Потери белка с мочой, о которых судят по величине отношения белок/креатинин, обычно уменьшаются спустя 4-6 месяцев после начала терапии (Ortega et al, 1996).
Возникновение и рецидивы сопутствующих расстройств во время терапии. Противовоспалительное и иммуносупрессивное действие кортизола часто маскирует сопутствующие расстройства у собак с синдромом Кушинга. Лечение ССК с помощью о,р’-ДДД или других средств может способствовать проявлению или рецидивированию этих «скрытых» расстройств. Возможно, чаще всего гиперкортицизм маскирует дегенеративный артрит и повышенную чувствительность к укусам блох. Нередко радость хозяев собак в связи с исчезновением полиурии и полидипсии омрачается появлением хромоты, зуда и других аллергических реакций.
Коррекция гиперкортицизма у людей сопровождается, хотя и нечасто, острыми аутоиммунными заболеваниями (Colao et al, 2000). Сходные расстройства, например гемолитическая анемия и тромбоцитопения, встречаются у собак. Такие иммунные нарушения маскируются синдромом Кушинга, но проявляются после его успешного лечения. Мы также наблюдали собак, у которых после терапии ССК быстро развивалась лимфосаркома или неоплазия тучных клеток. В таких случаях рекомендуется прекратить лечение синдрома Кушинга и предпринять лечение сопутствующего заболевания. Для этой цели используют азатиоприн, циклофосфамид и, при необходимости, преднизон. Нет причин отказываться от назначения глюкокортикоидов собакам с синдромом Кушинга.
Отсутствие ответа на о,р’-ДДД. Терапия о,р’-ДДД редко бывает неэффективной. Этот препарат весьма активен и обладает способностью разрушать пучковую и сетчатую зоны. Существует несколько причин неудачной терапии:
1. Собака, которой поставлен диагноз ГЗГ, на самом деле имеет опухоль коры надпочечников (аденому или карциному). Эти опухоли относительно резистентны к цитотоксическому действию о,р’-ДДД (см. рис. 6-62).
2. Используется инактивированный препарат; его замена свежими таблетками о,р’-ДДД позволяет восстановить эффективность лечения.
3. Введение о,р’-ДДД без пищи значительно снижает его всасывание в желудочно-кишечном тракте (всасывание улучшается при введении о,р’-ДДД с любым кормом, но особенно с жирным). Если же препарат вводят с пищей, а его эффект все равно отсутствует, мы советуем хозяину собаки измельчить таблетку, суспендировать полученный порошок в теплом (но не горячем) кукурузном масле и смешать эту суспензию с кормом. Известно, что собаки быстро отвечают на такой способ введения о,р’-ДДД.
4. Ветеринаров часто начинает беспокоить отсутствие эффекта терапии спустя 14 дней после ее на
чала. Следует помнить, однако, что лишь очень небольшому (в процентном отношении) числу животных требуется ежедневное введение препарата до 15-20 дней; возможно, таким собакам нужно повысить суточную дозу о,р’-ДДД до 100-150 мкг/кг (вместо обычной 50 мг/кг/день).
5. Реакция на терапию отсутствует у собак с ошибочно поставленным диагнозом; ошибка возможна при любом заболевании, имитирующем гиперкортицизм, в том числе у животных, получающих противосудорожную терапию (см. табл. 6-11).
6. Терапия неэффективна у собак с ятрогенным синдромом Кушинга.
7. Ответ на терапию о,р’-ДДД может отсутствовать у собак, получающих фенобарбитал. Однако после перевода животных на альтернативный противосудорожный препарат (например, бромистый калий) отмечается типичная реакция на о,р’-ДДД.
Прежде чем прекращать неудачную терапию о,р’-ДВД, следует проанализировать все возможные причины отсутствия ее эффекта. Нам практически никогда не приходилось отменять о,р’-ДДД. Если все же не удается добиться желаемого результата, назначают терапию трилостаном или кетоконазолом либо предпринимают двустороннюю адреналэктомию. Возможна и другая терапевтическая тактика (как описано ниже).
Лечение сопутствующего сахарного диабета и ГЗГ.
Общие сведения. Если у собаки гиперкортицизм сочетается с сахарным диабетом, необходимо лечить оба заболевания. Такая комбинированная патология встречается нечасто: только около 5% собак с ССК имеют сопутствующий сахарный диабет. Инсулинотерапию следует начинать, не дожидаясь окончания диагностики гиперкортицизма и результатов соответствующих исследований. Большинство животных с синдромом Кушинга и сахарным диабетом инсулинорезистентны вследствие избыточного содержания кортизола в крови, поэтому им необходимы высокие дозы инсулина. Некоторые собаки с ССК нуждаются в консервативной инсулинотерапии или в инъекциях низких доз инсулина. Такие животные имеют наибольший шанс обрести инсулинонезависимость после успешной терапии о,р’-ДДД. Ветеринар не должен стремиться к «оптимальной» компенсации диабета у собаки с ССК. Это обусловлено двумя причинами: во-первых, трудно контролировать диабет у собаки с системным антагонизмом инсулину, обусловленным избыточной продукцией кортизола (что может вызвать разочарование у владельца животного), и, во-вторых, если достигнут эффективный «контроль гликемии», то после устранения избытка кортизола могут возникнуть серьезные проблемы с передозировкой инсулина. По этим причинам дозу инсулина следует подбирать так, чтобы она обеспечивала профилактику кетоацидоза (начальная консерва
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 359
тивная доза 0,5 Ед/кг нейтрального протамин-инсу-лина или инсулина ленте дважды в день).
Доза о,р’-ДДД. Примерно у 5% собак с синдромом Кушинга имеется сахарный диабет (т.е. устойчивые гипергликемия и гликозурия натощак). Для лечения таких животных мы используем тот же протокол, что и для собак с синдромом Кушинга без диабета (ежедневное введение о,р’-ДДД в дозе 50 мг/кг, разделенной на два приема, без глюкокортикоидов). Следует, однако, иметь в виду, что при синдроме Кушинга имеет место антагонизм инсулину. Успешное снижение концентрации циркулирующего кортизола приводит к снижению резистентности к инсулину и соответствующему уменьшению потребности в инсулине. Без коррекции дозы инсулина это обстоятельство может стать причиной гипогликемии.
Протокол терапии и мониторинга. Лечение собаки с синдромом Кушинга на фоне сахарного диабета предъявляет повышенные требования как к ее хозяину, так и к ветеринару. Нередко такие животные получают инсулин в суточной дозе, превышающей 2,0 ЕД/кг. Следует разъяснить владельцу сложность терапии этой сочетанной патологии. И владелец, и ветеринар должны помнить, что по мере постепенного уменьшения тяжести ССК под воздействием о,р’-ДДД снижается и резистентность к инсулину. Необходим мониторинг обоих заболеваний. Владелец должен, по меньшей мере, два или три раза в день брать у собаки пробы мочи на всем протяжении «нагрузочной фазы» терапии о,р’-ДДД. В каждой пробе определяют содержание глюкозы. При любом отрицательном результате анализа дозу инсулина снижают не менее чем на 10-20%. Контроль гиперкортицизма у таких животных достигается в течение 5-9 дней после начала введения о,р’-ДДД.
Провокационную пробу с АКТГ повторяют не позднее 7 дня после начала терапии о,р’-ДДД для ее своевременного прекращения во избежание передозировки. Протокол повторного тестирования включает следующие пункты: 1) собака получает корм от хозяина в домашних условиях; 2) собаку доставляют в ветеринарную клинику между 7 и 9 часами утра; 3) определяют концентрацию глюкозы в крови, после чего хозяин вводит собаке инсулин под наблюдением ветеринара; 4) концентрацию глюкозы продолжают определять каждые 1-2 часа в течение дня; 5) пробу с АКТГ проводят в конце дня за 1-2 часа до прихода хозяина за собакой. Этот пятистадийный протокол позволяет получить ответ на два главных вопроса: каким образом терапия о,р’-ДДД влияет на контроль гликемии (концентрацию глюкозы в крови, дозы инсулина) и как она влияет на гиперкортицизм.
Заслуживает упоминания одно исключение из данного протокола: инсулин отменяют, если концентрация глюкозы при первом (утреннем) измерении не превышает 200 мг/100мл. После этого продолжают ее мониторинг на протяжении остальной части дня, чтобы выяснить, следует ли продолжать
введение инсулина и если следует, то в какой дозе. Большинству собак, имеющих концентрацию глюкозы в крови ниже 200 мг/100 мл, инсулин больше не требуется либо его доза должна быть значительно снижена (мы часто снижаем ее на 50% по сравнению с последней предшествовавшей дозой).
Прогноз. Приблизительно 5% животных с синдромом Кушинга и сахарным диабетом не испытывают потребности в инсулине после успешной терапии о,р’-ДДД, а еще у 80% контроль диабета облегчается и дозы инсулина значительно снижаются. Для остальных собак дозу нейтрального про-тамин-инсулина снижают в минимальной степени, однако ее действие на концентрацию глюкозы в крови заметно усиливается. Если никаких изменений не наблюдается, следует пересмотреть первоначальный диагноз гиперкортицизма.
Функционально-активные опухоли коры надпочечников
Общая характеристика. Идеальным способом лечения собак с функционально активными опухолями коры надпочечников, вызывающими гиперкортицизм (ГОН), является удаление опухолей. Однако часть таких опухолей неоперабельна, либо метастазирует ко времени установления диагноза, а некоторые собаки слишком ослаблены и могут не перенести столь сложную операцию. Наконец, владельцы отдельных собак по разным причинам не дают согласия на операцию. В таких случаях назначают о,р’-ДДД, разрушающий надпочечники (Rijnberk et al, 1993). Мы сравнивали протоколы терапии о,р’-ДД Д для собак с ГЗГ и опухолями коры надпочечников. При использовании равных доз о,р’-ДДД (50 мг/кг ежедневно) животные с ГОН оказались более резистентными к его действию (см. рис. 6-62) (Feldman et al, 1992). В то же время некоторые из них хорошо отвечали на обычные дозы о,р’-ДДД, а чувствительность резистентных собак повышалась при увеличении доз препарата (Kintzer, Peterson, 1994).
Протокол. Мы рекомендуем один и тот же протокол терапии о,р’-ДДД для собак с ГЗГ и ГОН. Начальная доза составляет 50 мг/кг, ее вводят в два приема ежедневно. Если после первых 7-10 дней терапии проба с АКТГ выявляет улучшение, но концентрация кортизола после стимуляции не достигла нормального уровня (>1 мкг/100 мл и меньше 5 мкг/100 мл), то препарат в той же дозе вводят еще 10 дней. Если же результаты пробы с АКТГ до и после начала терапии не отличаются, то дозу о,р’-ДДД увеличивают до 75-100 мг/кг/день. По истечении дополнительных 7-10 дней терапии повторяют провоцирующую пробу с АКТГ. Отсутствие существенного улучшения после второго 7-10-дневного периода «нагрузочной фазы» свидетельствует о необходимости продолжения терапии на протяжении еще 7-10 дней той же или удвоенной дозой о,р’-ДДД. Впоследствии продолжительность «на
360 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
грузочной фазы» и дозировки о,р’-ДДД подбирают индивидуально для каждого животного.
Результаты. Через 10-14 дней после начала терапии о,р’-ДДД у 43% из 32 собак с опухолями коры надпочечников ответ на АКТГ в провоцирующей пробе увеличился. Несмотря на сопутствующую глюкокортикоидную терапию, у 60% животных наблюдались побочные эффекты вследствие токсичности высоких доз о,р’-ДДД и/или низкой концентрации кортизола. В одном исследовании более чем у 60% животных с опухолями коры надпочечников, получавших о,р’-ДДД, ответ на терапию оценивался как хороший или очень хороший (Kintzer, Peeterson, 1994). Однако у 63% из 32 собак имелись рецидивы, у 60% - побочные эффекты, а средняя продолжительность жизни в условиях терапии не превышала 16 месяцев.
Резистентность к о,р’-ДДД и гистологическая оценка. Характер клинической реакции на терапию не оставляет сомнений в том, что опухоли коры надпочечников относительно более устойчивы к цитотоксическому действию о,р’-ДДД по сравнению с животными, имеющими гиперплазию коры вследствие ГЗГ. Это наблюдение подтверждается результатами гистологических исследований тканей, полученных от собак обеих групп. В коре надпочечников (особенно ее пучковой зоне) у собак с ГЗГ вскоре после начала терапии о,р’-ДДД отмечали такие характерные изменения, как острый коллапс, некроз и геморрагия. В условиях хронической терапии о,р’-ДДД у животных развивались фиброз, атрофия и дегенерация коры надпочечников, а иногда формировались гиперпластические узлы. У многих других особей имела место деструкция коры и имелись признаки ее гиперплазии.
В отличие от этого, большинство сообщений о собаках с опухолями коры надпочечников, получавших аналогичное лечение, содержит описание выраженных гистологических признаков неопластического роста. Патологи обычно отмечают потенциально злокачественную природу этих опухолей (как аденом, так и карцином) (Feldman et al, 1992; Kintzer, Peterson, 1994). Во многих случаях отсутствует упоминание о деструкции или некрозе корковой ткани. Эти наблюдения подтверждают концепцию, согласно которой опухоли коры надпочечников обладают повышенной устойчивостью к цитотоксическому действию о,р’-ДДД.
Поддерживающая терапия с использованием о,р’-ДДД
Общие сведения. После завершения начальной «нагрузочной фазы» с ежедневным введением о,р’-ДДД и достижения разрушения коры надпочечников, о котором свидетельствуют снижение аппетита, уменьшение потребления воды и результаты провоцирующих проб с АКТГ, начинают поддерживающую терапию. У собак с ГЗГ о,р’-ДДД не действует на опухоль гипофиза, поэтому избыточная секреция
АКТГ продолжается или даже усиливается (Nelson et al, 1985). В случае невозможности продолжения терапии о,р’-ДДД возобновляется гиперплазия надпочечников и рецидивируют соответствующие симптомы. Такое обострение заболевания может произойти через несколько недель после прекращения терапии, но чаще через 2-24 месяца.
Протокол
Рутинное долгосрочное лечение. До начала поддерживающей терапии выбирают соответствующий протокол, изменяя его с учетом индивидуальных особенностей животного. Собаки с нормальной реакцией на ежедневное введение о,р’-ДДД и концентрацией кортизола в крови после стимуляции АКТГ ниже 1 мкг/100 мл в течение первых 2 недель не получают никакого лечения. После этого им начинают вводить о,р’-ДДД в дозе, которая рекомендуется для собак с концентраций кортизола после стимуляции выше 1 мкг/100 мл, но ниже 3 мкг/100 мл. Поддерживающую терапию таким собакам назначают в дозе 25 мг о,р’-ДДД/кг в неделю. Животным, имеющим концентрацию кортизола в пробе с АКТГ выше 3 мкг/100 мл, дозу о,р’-ДДД увеличивают до 50 мг/кг в неделю. В обоих случаях настоятельно рекомендуется разделить полную недельную дозу о,р’-ДДД на суточные дозы применительно к специфическим условиям терапии. Например, если собаке предписана одна таблетка о,р’-ДДД в неделю, следует давать ей по четверти таблетки в течение 4 дней. При таком подходе, если повторное тестирование выявляет некоторое занижение дозировки, назначают еще четверть таблетки для приема на пятый день. Напротив, в случае передозировки, уменьшают частоту введения о,р’-ДДД до двух или трех раз в неделю.
Пробу с АКТГ проводят через 1 и 3 месяца после начала поддерживающей терапии. Если концентрация кортизола в плазме крови после стимуляции поднимается до 5 мкг/100 мл или выше, то еженедельную дозу о,р’-ДДД увеличивают, как правило, на 25%. В условиях консервативной терапии состояние одних животных остается стабильным на протяжении месяцев и даже лет, но другим приходится ежедневно вводить о,р’-ДДД в довольно высоких дозах. Очень важен индивидуальный терапевтический подход к каждой собаке. Рецидивы клинической симптоматики, характерной для гиперкортицизма, устраняют повышением доз о,р’-ДДД после подтверждения обострения заболевания в пробе с АКТГ. Во всех случаях возобновления полидипсии и/или полиурии, замеченных хозяином, собаку необходимо обследовать на наличие сахарного диабета, недостаточности функции почек или другой возможной патологии (см. табл. 6-11). При явном рецидиве ССК назначают высокие дозы поддерживающей терапии или возобновляют «нагрузочный режим». Нам, однако, редко приходилось повторять нагрузочный протокол.
Состояние многих собак, получающих о,р’-ДДД, остается достаточно стабильным в условиях
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 361
поддерживающей терапии. Тем не менее, рекомендуется каждые 3-4 месяца проводить физикальное обследование и пробу с АКТГ. Результаты тестирования позволяют ветеринарному врачу корректировать режим терапии в случае выявления субклинических расстройств. Если концентрация кортизола в плазме крови после стимуляции АКТГ остается ниже 1 мкг/100 мл, то дозу о,р’-ДДД уменьшают, а если она превышает 5 мкг/100 мл, то дозу увеличивают. При возникновении апатии и анорексии на фоне низкой концентрации кортизола (даже если в пробе с АКТГ она превышает 1 мкг/100 мл) терапию о,р’-ДДД на время отменяют, а после возобновления используют более низкие дозы.
Стресс. Если в условиях терапии о,р’-ДДД собака испытывает то или иное стрессорное воздействие (например, болезнь, травма, элективная хирургическая операция), введение препарата следует прекратить и назначить глюкокортикоидную терапию, обычно в дозе 0,2 мг /кг (с поправкой на состояние собаки). У собак с ГЗГ, получающих адекватное лечение, сохраняется функциональный резерв надпочечников, достаточный для поддержания повседневного существования, но не обеспечивающий выживание в условиях сильного стресса. Ни в коем случае нельзя давать о,р’-ДДД животным, получающим глюкокортикоиды.
Передозировка о,р’-ДДД. Передозировка о,р’-ДД Д - обычное явление. У большинства собак, получающих избыточные дозы о,р’-ДДД (по данным литературы от 20 до 50% леченых собак), имеются слабые, преходящие признаки передозировки, которые исчезают в течение нескольких дней после отмены препарата или через несколько часов после начала введения глюкокортикоидов. У небольшого числа собак (менее 2%) развивается перманентная болезнь Аддисона, которая характеризуется не только низкими концентрациям кортизола в крови до и после стимуляции АКТГ, но также гиперкалиемией и гипонатриемией. Таким животным показана глюкокортикоидная и минералокортикоидная терапия на протяжении всей жизни.
В более типичных и менее тяжелых случаях передозировки о,р’-ДДД у собак развиваются анорексия, сонливость или атаксия, появляются слабость рвота и/или диарея. Изменения биохимического профиля сыворотки крови, результатов ОАК и анализа мочи обычно незначительны, тем не менее, эти анализы необходимы. Самым простым способом подтверждения диагноза является введение собакам преднизона в дозе около 0,2 мг/кг. Улучшение состояния в течение последующих 1-3 (иногда 6-12) часов свидетельствует об имевшей место передозировке о,р’-ДДД, и его введение следует на время прекратить. Сначала преднизон вводят в дозе, снимающей все симптомы передозировки, а затем на протяжении последующих 10-21 дней постепенно уменьшают его дозу. Введение о,р’-ДД Д не возобновляют до тех пор, пока у собаки сохраняется потребность в преднизоне. Если после отмены
преднизона состояние собаки остается стабильным в течение 2 недель, ей снова начинают давать о,р’-ДДД, но в меньшей дозе, чем раньше.
Нарушения ЦНС, индуцируемые о,р’-ДДД.
У некоторых собак о,р’-ДДД, вызывает изменения в ЦНС. Сопутствующая симптоматика включает слепоту, атаксию, вялость, нарушение ориентации в пространстве, вертячку, бесцельные перемещения и сжимание головы. Однако мы считаем, что это случается крайне редко, если вообще случается. Наиболее вероятной причиной таких явлений, как нервная тупость, бесцельное поведение и снижение аппетита у собак, получающих о,р’-ДДД, является растущая опухоль гипофиза (см. табл. 6-10). По данным литературы, индуцированные о,р’-ДДД нарушения в ЦНС носят преходящий характер и продолжаютя не более 12^18 часов после введения каждой очередной дозы о,р’-ДДД. Они регистрируются через 3-24 месяца после начала терапии и могут купироваться снижением общей дозы или более частым введением небольших количеств о,р’-ДДД.
Прогноз у собак с ГЗГ при терапии о,р’-ДДД
Мы наблюдали более 1500 собак с ГЗГ, которые получали терапию о,р’-ДДД. У погибших животных средняя продолжительность жизни после установления диагноза и начала терапии составляла 31,6 месяца. При расчете этой величины учитывались небольшой процент животных, которые жили всего несколько дней, и несколько собак, проживших более 10 лет. Не следует забывать, что средний возраст собак с ГЗГ при назначении терапии превышал 11 лет, поэтому маловероятно, что любое другое лечение могло бы обеспечить им более долгую жизнь (известно, что собаки в среднем живут 14 лет). Хотя многих владельцев собак радует, что их питомцы живут «дольше, чем положено», хотелось бы напомнить, что главной целью терапии является лечение ССК и нормализация состояния животных. Конечно, при лечении собак моложе 10 лет цель состоит в продлении их жизни более чем на 30 месяцев, однако такая задача невыполнима в случае собак, которым на момент установления диагноза было 12-13 лет. Прогноз улучшается при тщательном наблюдении хозяина за состоянием собаки и выполнении всех процедур, предписанных протоколом.
Рецидивы случаются нередко. У 35% из наших 1500 собак зарегистрирован, по меньшей мере, один эпизод рецидива слабых или умеренных симптомов гиперкортицизма, который потребовал увеличения поддерживающей дозы. Нам практически никогда не приходилось назначать вторую «нагрузочную» дозу о,р’-ДДД. Среди погибших животных, у 37% имелись расстройства, связанные с гиперкортицизмом (в частности, тромбоэмболия, застойная недостаточность сердца, инфекция или диабетический кетоацидоз). В то же время более 20% (возможно даже 30%) собак погибли из-за растущей опухоли
362 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
гипофиза. Нередки также случаи передозировки о,р’-ДДД. Небольшая передозировка имела место у 5% собак на начальной стадии терапии, а на протяжении всего периода лечения избыточные дозы о,р’-ДДД получили 32% животных. Смертность от передозировки не превышала 1%.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ С ИСПОЛЬЗОВАНИЕМ КЕТОКОНАЗОЛА
Общая характеристика
Кетоконазол (низорал; производства Janssen Pharmaceutica Inc, США) - производное имидазола, представляет собой противогрибковый препарат с широким спектром действия, активный при пероральном применении. В пикомолярных концентрациях он ингибирует С 14-метилирование ланостерина до эргостерина и, таким образом, прерывает рост грибковой оболочки (Vanden Bossche et al, 1990). Препарат эффективен при лечении глубоких грибковых инфекций. При повышенных концентрациях в крови он влияет на биосинтез стероидов, взаимодействуя с имидазольным кольцом и цитохромами Р450 различных стероидогенных ферментных систем млекопитающих. Введение низких доз кетоконазола in vivo вызывает значительное снижение концентрации андрогенов в крови, а его высокие концентрации подавляют секрецию кортизола (Engeelhardt et al, 1991). Ингибирующее действие кетоконазола на биосинтез стероидов используется в терапевтических целях для лечения гирсутизма, прогрессирующего рака простаты, преждевременного полового созревания и синдрома Кушинга (Sonino et al, 1985; Contreras et al, 1985; Loli et al, 1986; McCance et al, 1987).
Протокол лечения синдрома Кушинга у собак
Сначала кетоконазол вводят в дозе 5 мг/кг дважды в день на протяжении 7 дней. В отсутствие изменений аппетита или признаков желтухи дозу увеличивают до 10 мг/кг дважды в день. По истечении еще 14 дней терапии проводят пробу с АКТГ (через несколько часов после последней дозы кетоконазола) и анализируют полученный результат вместе с данными анамнеза и физикального обследования. Если желаемый контроль ССК достичь не удалось, дозу кетоконазола увеличивают до 15 мг/кг дважды в день. Мы редко используем дозу выше 20 мг/кг два раза в день. Требуемое состояние одних животных можно бесконечно долго поддерживать, используя дозу кетоконазола 10 мг/кг, тогда как другим необходима доза 15 мг/кг. Потребность в той или иной дозе определяют по результатам опроса хозяина собаки, физикального обследования, биохимического анализа сыворотки и провоцирующей пробы с АКТГ. Концентрация кортизола в плазме крови до и после стимуляции АКТГ не должна превышать 5
мкг/100 мл. У большинства собак клиническая ремиссия не достигается при дозах кетоконазола менее 30 мг/кг в день.
Результаты
Мы проверяли эффективность кетоконазола более чем у 60 собак с ССК, в том числе животных с ГЗГ и ГОН. Во всех случаях использовали вышеописанный протокол с введением кетоконазола в виде двух ежедневных доз по 15 мг/кг каждая. В большинстве случаев действие препарата сохранялось на протяжении 8-16 часов. Двукратное в течение дня введение кетоконазола оказалось более эффективным, чем однократное. Лабораторные исследования выявили быстрое снижение концентрации кортизола в крови и его ответа на АКТГ примерно у 75-80% животных (рис. 6-65). У собак, получавших кетоконазол более 2 месяцев, наблюдали значительное улучшение общего клинического состояния, о котором свидетельствовало уменьшение потребления воды, продукции мочи, аппетита, одышки, и веса тела. Одновременно возобновлялся рост шерсти и восстанавливалась мышечная сила. Признаки токсического действия кетоконазола отмечались редко. Основным последствием передозировки был гипокортицизм (Feldman et al, 1990).
Примерно 20-25% собак не отвечают на лечение кетоконазолом из-за его плохой абсорбции в кишечнике. Хотя такое объяснение справедливо для ряда собак, но должны быть и другие причины, так как у некоторых собак концентрация кортизола в сыворотке крови до и после введения АКТГ увеличивается, если они получают кетоконазол. После отмены препарата концентрация кортизола возвращается к ее уровню до начала лечения. Основными недостатками (табл. 6-16) применения кетоконазола являются его высокая стоимость, отсутствие ответа у части собак и необходимость его ежедневного двукратного введения на протяжении всей жизни животного.
ТАБЛИЦА 6-16. КЕТОКОНАЗОЛ
Показания к применению
1. Подготовка собаки к хирургической операции
2. Альтернативная терапия для собак с метастазирующей опухолью коры надпочечников или с другими противопоказаниями к хирургическому лечению
3. Альтернативная терапия для собак, не переносящих о,р’-ддд
4. Уточнение диагноза синдром Кушинга
5. Невозможность или отсутствие других способов лечения
Недостатки
1. Необходимость введения дважды в день на протяжении неопределенно длительного времени
2. Высокая стоимость
3. Отсутствие ответа у 20-25% животных (плохое всасывания препарата?)
4. Опасность передозировки
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
363
Дни после начала терапии кетоконазолом
Дни после начала терапии кетоконазолом
Рис. 6-65. А. Средние суточные концентрации кортизола у 15 здоровых собак (пунктирная линия), 18 собак с нелеченым гиперкортицизмом (9 с ГЗГ и 9 с ГОН - сплошная линия с темными кружками) и 18 собак с гиперкортицизмом после получения первой дозы кетоконазола (сплошная линия со светлыми кружками). Результаты свидетельствуют о сильно выраженном и быстром ингибирующем действии кетоконазола на биосинтез кортизола. Б. Результаты провоцирующей пробы с АКТГ (средние концентрации кортизола в плазме крови) у собак со спонтанно развившимся ГЗГ до и спустя 5, 60, 180 и 360 дней после начала терапии кетоконазолом. Цифры над показателями указывают число собак, обследованных в каждый данный период. Это число уменьшалось со временем, поскольку некоторые владельцы животных переходили на терапию о,р’-ДДД из-за высокой стоимости кетоконазола. В. Результаты провоцирующей пробы с АКТГ (средние концентрации кортизола в плазме крови) у собак со спонтанно развившимся ГОН до и через 5, 60, 180 и 360 дней после начала терапии кетоконазолом. Цифры над каждым набором показателей указывают число собак, обследованных в каждый период. Это число также уменьшалось со временем по вышеуказанной причине.
Показания (табл. 6-16)
Благодаря низкой токсичности и слабому действию на продукцию минералокортикоидов кетоконазол является привлекательным (хотя и дорогостоящим) вариантом медикаментозного лечения гиперкортицизма собак. Препарат широко применяется в медицине. Его ингибирующее действие на ферментативную активность полностью обратимо. Кетоконазол можно использовать в качестве альтернативы о,р’-
ДДД при лечении собак со злокачественными, крупными или инвазивными опухолями надпочечников в случае противопоказаний к их хирургическому удалению и необходимости паллиативной терапии. Мы использовали этот препарат для предоперационной стабилизации состояния животных, поскольку он быстро снижает уровень кортизола в крови. Назначение кетоконазола оправдано некоторым собакам, которые не переносят о,р’-ДДЦ ни в каких дозах, хотя, по нашим данным, это встречается крайне
364 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
редко. Реакцию на кетоконазол можно использовать как диагностический тест в дополнение к другим методам скрининга на гиперкортицизм. В этом случае кетоконазол служит блокатором ферментов с небольшой продолжительностью действия. Другим преимуществом является возможность оценки его действия без повреждения тканей. Несмотря на все сказанное, мы редко применяли кетоконазол в течение нескольких последних лет, главным образом, потому что нам удавалось получать очень хорошие результаты с помощью терапии о,р’-ДДД.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ С ИСПОЛЬЗОВАНИЕМ ТРИЛОСТАНА
Общая характеристика: люди
Трилостан - это гормонально неактивный препарат стероидной природы для приема внутрь. Трилостан конкурентно ингибирует 30-гидроксистеро-иддегидрогеназу, катализирующую превращение прегненолона в прогестерон и 17- гидроксипрегненолона в 17-гидроксипрогестерон в коре надпочечников. Из прогестерона и 17-гидроксипрогестерона в дальнейшем образуются кортизол, альдостерон и андростендион (см. рис. 6-4). Таким образом, ингибируя биосинтез прогестерона и 17-гидроксипрогестерона, трилостан блокирует продукцию различных конечных продуктов стероидогенеза в надпочечниках, гонадах и плаценте (Potts et al, 1984). Установлено, что для ингибирования синтеза стероидов в надпочечниках требуются более низкие дозы трилостана, чем для подавления стероидогенеза в других органах. В условиях in vivo трилостан преобразуется в активный метаболит 17-кетотри-лостан, биологическое действие которого в 1,7 раза выше, чем у исходного соединения (Robinson et al, 1984). У людей терапия трилостаном дает хороший эффект при гормонально-зависимых опухолях и гиперальдостеронизме (Griffing, Melby, 1989; Geldof et al, 1995; Ibrahim, Buzdar, 1995). Правда, реакция на трилостан при гиперальдостеронизме значительно варьирует. Некоторые авторы сообщают о выраженном терапевтическом действии препарата, тогда как другие получили неоднозначные результаты. В настоящее время трилостан редко используют для лечения больных с гиперкортицизмом (Komanicky et al, 1978; Dewis et al, 1098).
Общая характеристика: собаки
В первом кратком сообщении о применении трилостана для лечения ССК у собак были описаны четыре особи с ГЗГ и одна с ГОН. Животным вводили трилостан в дозах от 2,6 до 4,8 мг/кг веса/день в течение 3-7 месяцев. У всех собак имела место выраженная клиническая реакция на трилостан с исчезновением симптомов заболевания в отсутствие побочных эффектов (Hurley et al, 1998). Во втором сообщении тех же авторов шесть собак с ССК по
лучали трилостан в дозах от 3 до 30 мг/кг/веса ежедневно на протяжении 7 месяцев. И в этом случае состояние животных улучшалось после начала лечения, однако у трех из них развились рецидивы, несмотря на продолжавшееся введение трилостана (Ramsey, Hurley, 2000). Было также показано, что после введения трилостана 10 собакам происходит снижение базальной концентрации кортизола, которое сохраняется в течение 13 часов, и в течение 20 часов отсутствует ответ на стимуляцию АКТГ (Neiger, Hurley, 2001).
Более поздние исследования были посвящены оценке терапии трилостаном у собак с ГЗГ (Ruckstuhl, 2002; Neiger et al, 2002). Исследование, проводившееся в Швейцарии (Ruckstuhl et al, 2002), включало 11 собак. Начальная доза трилостана составляла 30 мг/день для собак весом менее 5 кг и 50 мг/кг для более крупных собак. В пересчете на вес тела эти дозы составляли от 3,9 до 9,2 мг/кг (в среднем 6,25 мг/кг веса тела). Одна из задач терапии состояла в получении концентраций кортизола в пределах 1,0-2,5 мкг/100 мл после стимуляции АКТГ. Для достижения этой цели дозы трилостана в случае необходимости корректировались. В большинстве случаев коррекция сводилась к повышению доз на 20-30 мг/кг, и к концу лечения, которое продолжалось 6 месяцев, они составляли от 4 до 16 мг/кг/день (в среднем около 6 мг/кг/день). У всех собак терапия приводила к снижению тяжести полиурии, полидипсии и одышки, а также нормализации мышечной силы. Тяжесть полифагии уменьшилась у девяти из 10 животных, а у 9 из 11 собак улучшалось состояние шерстяного покрова. Через 6 месяцев после начала терапии 9 из 11 собак были признаны полностью выздоровевшими, а состояние двух остальных улучшилось. У всех животных УЗИ брюшной полости выявило увеличение размера надпочечников. Четыре собаки получали трилостан не менее года, а у трех собак лечение продолжалось в течение двух и более лет. Побочное действие трилостана было выражено слабо: у одной собаки имела место сонливость, а у другой рвота. Побочные эффекты устранялись временным прекращением введения трилостана и назначением преднизона. Авторы исследования пришли к заключению, что трилостан является эффективным и безопасным средством для лечения собак с ГЗГ.
В исследовании, которое проводилось в Австралии (Braddock, 2002), трилостан давали 31 собаке весом от 4 до 42 кг, имевшим ГЗГ. Как и в исследовании швейцарских авторов, животные хорошо отвечали на терапию, которая продолжалась в среднем около года. Было подтверждено, что для необходимого подавления секреторной функции коры надпочечников отдельным собакам требовались индивидуальные и сильно отличавшиеся дозы трилостана (общие и в пересчете на килограмм веса тела). Ко времени последнего тестирования собаки получали в 1,4-7,8 раз более высокие дозы, чем при назначении терапии. У многих из них изначально
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 365
высокая чувствительность к трилостану оказалась кратковременной, и дозы приходилось увеличивать до тех пор, пока не достигалась эффективная «долгосрочная доза», которая оставалась постоянной для каждой особи, и в дальнейшем ее повышение не требовалось. Как и при любой другой терапии, ее успех в большой мере зависел от опыта работы ветеринарного врача с данным препаратом. Так, для достижения удовлетворительного контроля ГЗГ у первых 10 собак потребовалось почти 90 дней, тогда как при лечении последних 10 животных сопоставимый результат был получен в среднем за 40 дней. Средняя доза трилостана, обеспечивавшая эффективный контроль ГЗГ, составляла 19,4 мг/кг при ежедневном одноразовом введении (в среднем 16,7 мг/кг, диапазон: от 5,3 до 50 мг/кг). Автор пришел к выводу, что окончательную «долгосрочную дозу» для каждой особи можно установить только по прошествии периода первоначальной высокой чувствительности собак к трилостану. Рекомендуемая начальная доза терапии составила 10 мг/кг при колебаниях в сторону ее уменьшения или увеличения (20-30 мг на собаку) в зависимости от результатов пробы с АКТГ, которую ставили через 3-8 часов после введения трилостана. Чаще всего контроль ГЗГ достигался при дозах 16-19 мг/кг, причем для больших собак они были ниже в пересчете на килограмм веса, чем для маленьких. В качестве показателей эффективности терапии при ее мониторинге использовали клиническую реакцию животных на трилостан, результаты провоцирующих проб с АКТГ и отношение концентраций кортизола и креатинина в моче. Недостатком этого метода лечения является его высокая стоимость, которая в 2-4 раза превышает стоимость терапии о,р’-ДДД. Указывается также, что трилостан можно использовать для лечения собак с опухолями коры надпочечников, вызывающими гиперкортицизм.
Трилостан официально зарегистрирован в Великобритании под коммерческим названием «вето-рил» в качестве лечебного средства для собак. Препарат, используемый в медицине, имеет название «модренал». Согласно имеющимся рекомендациям, начальная доза трилостана должна составлять 30 мг в день при его назначении собакам весом менее 5 кг, 60 мг/день при весе животных от 5 до 20 кг и 120 мг/день при весе более 20 кг. Состояние животных оценивают через 1, 3, 6 и 13 недель после начала терапии, а затем через 6 и 12 месяцев. Каждая оценка включает анализ данных анамнеза, физикального обследования и результатов проб с АКТГ, которые проводят через 2-6 часов после введения трилостана. Целью терапии является достичь концентрации кортизола в плазме или сыворотке крови 1-2 мкг/100 мл. У некоторых собак стабильное состояние сохраняется в течение длительного времени при концентрациях кортизола менее
1 мкг/100 мл. Считают, что такие величины характеризуют минимальный уровень кортизолемии, тогда как среднесуточные концентрации кортизола
выше. Альтернативное объяснение состоит в том, что в сыворотке накапливаются предшественники, обладающие некоторой биологической активностью, но не определяемые при количественном анализе кортизола (Reusch, в печати).
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ С ИСПОЛЬЗОВАНИЕМ ДРУГИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Ципрогептадин
Теоретически повышение концентрации серотонина в ЦНС может быть связано с избыточной секрецией гипофизарного АКТГ и, следовательно, с усилением секреторной активности надпочечников. Ципрогептадин (периактин, производство Merck Scarp & Dohme, США) - препарат, обладающий ан-тисеротониновой, антигистаминовой и антихоли-нергической активностью, применялся для лечения ГЗГ у людей и собак без особого успеха (Drucker, Peterson, 1980; Aron et al, 2001a). Хотя известно несколько случаев клинической и биохимической ремиссии болезни Кушинга, достигнутой с помощью ципрогептадина, который обладает седативными свойствами, повышает аппетит и ускоряет прирост веса тела, тем не менее, обычно он не оказывает терапевтического действия у людей с опухолями гипофиза, секретирующими АКТГ. Опубликовано исследование (Peterson, Drucker, 1978), в котором только у одной из 10 собак с ГЗГ имела место «полная ремиссия», а в другом исследовании (Stolp et al, 1984) улучшения не было ни у одной из девяти включенных в него собак.
Бромокриптин
Бромокриптин (парлодел, производства фирмы «Sandoz, Inc., East Hanover», США) является агонистом дофамина, который подавляет секрецию АКТГ гипофизом, однако его применение для лечения зависимой от гипофиза болезни Кушинга у людей редко приводит к ремиссии. В медицине этот препарат используется, главным образом, для терапии гиперпролактинемии. Из-за слабой терапевтической эффективности бромокриптин не рекомендуется для лечения синдрома Кушинга у собак и кошек (Rijnberk et al, 1988b).
Метирапон и аминоглютетимид
Метирапон - ингибитор 110-гидроксилазной активности, и аминоглютетимид, ингибирующий превращение холестерина в прегненолон, использовали для подавления избыточной секреции кортизола. Стоимость обоих препаратов достаточна высока. Их применение сопровождается увеличением концентрации АКТГ, которое может значительно превосходить ингибирующее действие этих препаратов на ферментативные системы. У человека оба
366 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
препарата оказывают побочное действие на желудочно-кишечный тракт. При сочетанном введении метирапона и аминоглютетимида эффективность контроля гиперкортицизма выше, чем при их раздельном применении, а частота побочных эффектов уменьшается. Тем не менее, имеются сообщения о благоприятном действии монотерапии метирапоном при синдроме Кушинга у людей (Totani et al, 1990; Verheist et al, 1991). В настоящее время не представляется возможным давать какие-либо рекомендации относительно раздельного или сочетанного использования метирапона и аминоглютетимида для лечения собак с синдромом Кушинга, хотя в одной публикации сообщалось о снижении концентрации кортизола в плазме крови здоровых собак под действием аминоглютетимида (Lacoste et al, 1989). Его терапевтический эффект отмечен также у 12 собак с ГЗГ (Castill et al, 1996). Метирапон применяли для лечения гиперкортицизма у двух кошек (Daley et al, 1993; Moore et al, 2000). Следует сказать, что метирапон не всегда имеется в продаже.
Этомидат
Этомидат - это производное имидазола, подобное кетоконазолу. Он применяется как анестезирующее средство очень короткого действия. Кроме того, он является сильным кратковременным ингибитором биосинтеза кортизола в надпочечниках человека (Drake et al, 1998), собак (Dodam et al, 1990) и кошек (Moon et al, 1997). Как блокатор ферментативной активности в коре надпочечников, препарат в 10 раз сильнее кетоконазола. Его ингибирующее действие сохраняется на протяжении 6 часов после введения и может приводить к надпочечниковой недостаточности (Absalom et al, 1999). Хотя этомидат успешно использовали в случаях неотложного лечения эндокринных психозов и тяжелых осложнений гиперфункции надпочечников, его применение для лечения собак и кошек ограничено из-за его высокой активности, короткой продолжительности действия и необходимости парентерального введения.
L-депренил
Применение L-депренила (селегелина, анипри-ла) разрешено для лечения болезни Паркинсона у людей и ГЗГ у собак. L-депренил необратимо ингибирует фермент моноаминоксидазу типа В и тем самым способствует нормализации уровня дофамина у людей с болезнью Паркинсона. Секреция АКТГ отчасти контролируется гипоталамическим КРГ по механизму положительной обратной связи и отчасти дофамином по механизму отрицательной обратной связи. Высказано предположение, что ГЗГ обусловлен нарушением регуляторного механизма отрицательной обратной связи, что приводит к избыточной продукции и секреции АКТГ. Повышая концентрацию дофамина, L-депренил уменьшает образование АКТГ и, таким образом, контролирует
синдром Кушинга. Следует подчеркнуть, что L-депренил распадается на амфетамин и метамфетамин. Поэтому эффекты, приписываемые этому препарату, на самом деле могут быть вызваны продуктами его обмена и не связаны с его непосредственным действием на систему гипофиз-кора надпочечников. Кроме того, существуют серьезные сомнения относительно безопасности клинического применения L-депренила, поскольку в 1998 году он числился третьим в перечне лекарственных средств, оказывающих нежелательное действие на человека, Управления по контролю за качеством пищевых продуктов, медикаментов и косметических средств США.
В одном из поисковых исследований (Bruyette et al, 1998) L-депренил перорально вводили семи собакам с ГЗГ в дозе 2,0 мг/кг/день. У пяти из них было отмечено полное или частичное исчезновение симптомов заболевания после двух месяцев лечения. Однако результаты этого исследования не вызывают доверия, поскольку они финансировались изготовителем препарата и не были опубликованы ни в одном из изданий, рецензирующих поступающие статьи. В то же время было проведено несколько более обширных исследований, результаты которых заставляют серьезно усомниться в эффективности L-депренила как средства терапии ГЗГ у собак. В одном независимом проспективном исследовании (Reusch et al, 1999) лечение L-депренилом десяти собак с ГЗГ привело к некоторому улучшению состояния только у двух животных, но и у них ответ на терапию не отличался постоянством. Авторы пришли к заключению, что L-депренил нельзя рекомендовать для лечения ГЗГ у собак (Reusch, в печати). В другом проспективном сравнительном исследовании, которое проводилось в Австралии, были отобраны две равные по численности группы собак для введения им трилостана или L-депренила. Распределение собак по группам было рандомизированным. После того как у 13 собак, получавших L-депренил, не было отмечено никакого улучшения, лечение «было прекращено по этическим соображениям» (Braddock, 2002). Делается вывод, что L-депренил нельзя использовать для лечения ГЗГ у собак.
Ru486
Ru486 (мифепристон) - это 19-норстероид, обладающий антипрогестероновой активностью благодаря способности конкурентно ингибировать связывание прогестерона со специфическими рецепторами. По этому же механизму он подавляет действие глюкокортикоидов, связываясь с их рецепторами. Конечным результатом действия Ru486 является блокада ингибирующего действия кортизола на секрецию АКТГ по механизму отрицательной обратной связи, а также подавление системного действия кортизола. Поэтому у людей, получающих Ru486 в дозе 4—6 мг/кг, развиваются симптомы недостаточности кортизола (включая общую слабость, тошноту и рвоту), несмотря на повышенные концентрации
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 367
АКТГ и кортизола в плазме крови. Концентрация кортизола возрастает из-за уменьшения его связывания, а не из-за изменения его биосинтеза и/или секреции. Введение мифепрестона улучшало клинические проявления гиперкортицизма более чем у 50% больных с синдромом Кушинга, вызванным опухолью надпочечника, а также у лиц, у которых источником АКТГ являлся не гипофиз, а иной орган (т.е. имелась «эктопическая» секреция АКТГ, до сих пор не наблюдавшаяся у собак и кошек). В отличие от этого, у пациентов с ГЗГ ответ на лечение мифепристоном не постоянен, поскольку избыток АКТГ у них так велик, что перекрывает эффект блокады рецепторов (Laue et al, 1990; Silvestre et al, 1990; Spitz, Bardin, 1993).
ЛЕЧЕНИЕ - ОБЛУЧЕНИЕ ГИПОФИЗА
Собаки с ГЗГ и гипофизарными опухолями, не вызывающими нарушения в центральной нервной системе
Имеющиеся данные показывают, что радиотерапия гипофизарных опухолей дает хороший результат только у 50-60% людей с ГЗГ. Клинические симптомы заболевания исчезают на протяжении 2-5 лет, а рецидивы редки (Halberg, Shekine, 1987; Littley et al, 1990; Tran et al, 1991; Murayama et al, 1992; Estrada et al, 1997). В одном из сообщений описано облучение гипофиза в качестве основного метода лечения шести собак с ГЗГ и видимой опухолевидной массой в гипофизе (Goossens et al, 1998). Ни у одной из этих собак не было клинических признаков, предполагавших наличие крупной опухоли, хотя при МРТ были обнаружены опухоли с максимальной высотой от 3 до 14 (в среднем 6,5) мм. Источником радиации служила установка для облучения кобальтом-60, суммарная доза облучения каждой собаки, составлявшая 44 Гр, была поделена на 11 равных фракций. У одной собаки клинические симптомы гиперкортицизма после облучения не изменялись, у двух других состояние улучшалось, но не «нормализовалась», а у трех признаки заболевания исчезали через 4 недели после курса радиотерапии, но рецидивировали спустя соответственно 6, 9 и 12 месяцев. Результаты провоцирующей пробы с АКТГ и величина отношения концентраций кортизола и креатинина в моче не коррелировали с клинической симптоматикой. У двух собак максимальная высота гипофизарных опухолей через 1 год после завершения облучения уменьшилась с 8 до 6 мм. У четырех особей максимальная высота опухолей до начала радиотерапии составляла 3-4 мм, а спустя год после нее МРТ не выявляла видимых опухолевых масс (Goossens et al, 1998). После завершения этого исследования радиотерапию провели еще 12 собакам со сходными клиническими симптомами, у которых максимальная высота гипофизарных опухолей достигала 8 мм и более. Результаты облучения были аналогичны полученным ранее - размер
опухолей значительно уменьшался, однако нормализация состояния носила временный характер и в течение двух лет вновь появлялись симптомы гиперкортицизма.
Рекомендации. Учитывая весьма небольшое число животных (18), получавших радиотерапию в обоих упомянутых исследованиях, выводы следует делать с большой осторожностью. В настоящее время мы считаем целесообразным сканирование гипофизов собак с диагнозом ГЗГ методами КТ и МРТ, даже в отсутствие клинических признаков крупной опухоли. Мы отдаем себе отчет в том, что стоимость такого сканирования достаточно высока, однако некоторые владельцы животных готовы оплатить соответствующие расходы. Предлагаются следующие варианты лечения: 1) если у собаки отсутствует видимая опухоль гипофиза, можно рекомендовать медикаментозную терапию о,р’-ДДД или другим подходящим препаратом, после которой нет необходимости повторно оценивать состояние гипофизарной области; 2) при наличии опухоли с максимальной высотой от 3 до 7 мм назначают терапию о,р’-ДДД или другим препаратом, а спустя 12-18 месяцев проводят повторное сканирование гипофиза; 3) при наличии видимой опухоли высотой 8 мм или более показано облучение гипофиза, а медикаментозную терапию проводят только в тех случаях, когда клинические признаки гиперкортицизма сохраняются в течение 3-6 месяцев после завершения радиотерапии или когда они рецидивируют после более или менее длительного периода нормализации.
В основе этих рекомендаций лежат гипотетические соображения. Принимается, в частности, что средняя продолжительность жизни собак в условиях лечения гиперкортицизма составляет 30 месяцев. Второе допущение состоит в том, что в течение этого времени размер средней гипофизарной опухоли увеличивается в два или три раза. При невозможности визаулизации опухоли (т.е. когда ее исходная максимальная высота не превышает 3 мм) даже трехкратное увеличение ее размера, скорее всего, не приведет к развитию тяжелой клинической симптоматики. Отсюда рекомендация медикаментозной терапии синдрома Кушинга без последующей оценки состояния гипофиза. Если же у собаки на момент постановки диагноза имеется опухоль с максимальной высотой 8 мм или более, ее клинические проявления будут заметны еще до удвоения размеров гипофизарной массы.
В связи с этим в качестве метода первичной терапии рекомендуется облучение такой опухоли. Если же максимальная высота опухоли составляет 3-7 мм, то увеличение ее размеров в два или три раза может иметь либо не иметь клинических последствий. Поэтому рекомендуется медикаментозное лечение ГЗГ с повторной оценкой состояния гипофизарной области через 12-18 месяцев. Такой период предлагается на основании имеющегося опыта, поскольку повторную оценку необходимо
368 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
провести, прежде чем возможное увеличение размеров опухоли приведет к появлению клинических симптомов заболевания. Следует еще раз напомнить, что приведенные рекомендации основаны на результатах наблюдений за ограниченным числом животных и могут быть изменены после получения новых данных в нашей и других клиниках.
Собаки с ГЗГ и крупными опухолями гипофиза (синдром гипофизарной макроопухоли)
Общие сведения
Определение. Результаты, полученные нами с помощью МРТ (Bertoy et al, 1995) и КТ, показывают, что приблизительно 50% собак с ГЗГ без нарушений ЦНС имеют видимые опухоли гипофиза с максимальной высотой от >3 мм до <14 мм. Однако, в контексте ГЗГ термин «макроопухоль» не подразумевает «видимую» опухоль. Он скорее обозначает наличие опухоли, которая вследствие своих размеров, локализации и/или инвазивного характера служит причиной нарушений в ЦНС. Клиническая симптоматика, эндокринологические исследования и методы диагностики макроопухолевого синдрома рассматривались в разделах «Патология», «Гипофизарные макроопухоли и нарушения в центральной нервной системе» и «Визуализация методом магнитно-резонансной томографии». Макроопухо-левый синдром регистрируется все чаще и чаще по мере развития методов его идентификации и совершенствования методов диагностики (появление КТ и МРТ). Согласно существующим оценкам, у 10— 15% собак с ГЗГ развивается клиническая симптоматика, обусловленная ростом опухолей гипофиза. Однако более реалистичной представляется цифра 20-30%. Основным методом лечения таких животных является облучение гипофиза. В настоящее время успех радиотерапии непостоянен. Большинство собак, подвергшихся облучению, имели внутричерепные опухоли очень большого размера и сильно выраженные клинические симптомы. Эффективность терапии будет повышаться по мере развития методов идентификации ранних стадий заболевания, что позволит проводить облучение небольших опухолей у менее ослабленных животных.
Диагностика нелеченого и впервые выявленного ГЗГ. Подозрение на наличие крупной внутричерепной опухоли у собаки с нелеченым ГЗГ возникает в случае резкого понижения ее общей активности или аппетита в сочетании с другими признаками синдрома Кушинга. У небольшого числа (10-20%) обследованных нами собак макроопухоли гипофиза были обнаружены до начала лечения ГЗГ (см. рис. 6-37 и 6-55). Обследование животных должно подтвердить диагноз ГЗГ и попытаться выяснить причины анорексии (например, недостаточность почечной функции, панкреатит, тяжелая гепатопатии). В случае невозможности установить причину анорексии назначают КТ или МРТ гипофиза.
Диагностика у собак с ранее выявленным и леченым ГЗГ. Признаки анорексии у собак, получавших терапию по поводу ГЗГ, всегда предполагают в качестве ее источника гиперкортицизм или сопутствующее расстройство (пока не будет найдена иная причина). В этом случае необходимо отменить всякую медикаментозную терапию (о,р’-ДДД, кетоконазол, трилостан), провести диагностику возможных сопутствующих системных заболеваний (таких как почечная недостаточность или панкреатит), поставить провоцирующую пробу с АКТГ и начать терапию преднизоном. Если вся полученная в ходе этих процедур информация исключает наличие сопутствующего расстройства или передозировку того или иного препарата, и если кортизон не вызывает быстрой нормализации клинической симптоматики, возникает подозрение на наличие внутричерепной опухоли. «Макроопухолевый сидром» выявляется как в течение нескольких дней, так и спустя годы после начала терапии ГЗГ (см. рис. 6-37).
Клинические наблюдения. Установлена достоверная положительная корреляция между относительными размерами опухоли (т.е. ее размером в сравнении с размерами свода черепа) и тяжестью неврологических расстройств. Достоверная отрицательная корреляция имеет место между относительными размерами опухолей и ремиссией неврологических расстройств после радиотерапии; иными словами, чем крупнее опухоль, тем меньше вероятность улучшения неврологической симптоматики. Несмотря на достоверную корреляцию концентрации эндогенного АКТГ в плазме крови с относительными размерами опухоли, эти статистические данные далеко не всегда имеют клиническую значимость. Независимым прогностическим фактором для общей продолжительности жизни собак служит тяжесть неврологических проявлений, т.е. чем тяжелее неврологические расстройства, тем менее благоприятен прогноз. В наших ранних исследованиях мы облучали собак в общей дозе 44— 48 Гр через день на протяжении 4 недель; доза каждого облучения составляла 4 Гр (Theon, Feldman, 1998). В последнее время мы проводим 16 сеансов облучения ежедневно с понедельника по пятницу, сохраняя прежнюю суммарную дозу (48 Гр). Эта более агрессивная форма радиотерапии позволяет ускорить ответ, однако повышает риск повреждения окружающих гипофиз тканей.
Ветеринар, которому приходится сталкиваться с лечением гиперкортицизма, должен уметь распознавать клинические симптомы растущей опухоли гипофиза независимо от используемого протокола терапии. Следует помнить, что ранние проявления опухоли могут быть очень слабыми. При физикальном исследовании собаки ветеринар может не обнаружить никаких признаков гипофизарной опухоли, тогда как хозяин собаки сообщает о выраженной сонливости, снижении аппетита, «бесцельном поведении», «спутанности сознания» и «нарушении ориентации». Все эти изменения, скорее все
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК • 369
го, являются ранними проявлениями гипофизарной опухоли, и такие животные имеют наиболее благоприятный прогноз в случае своевременного проведения адекватной радиотерапии.
Клиническое значение. Радиотерапия оказалась эффективным способом лечения относительно мелких опухолей, и чем раньше ее начать, тем лучше прогноз. Диагностика с применением КТ и МРТ гипофиза у возможно большего числа собак с ГЗГ и последующая радиотерапия в качестве основного метода лечения позволяют увеличить продолжительность жизни животных с опухолями с высотой 8 мм и более. Однако эта рекомендация пока предварительная, для ее подтверждения необходимы дополнительные клинические исследования и результаты отдаленных наблюдений за лечеными животными.
Успешность терапии. Успешность терапии не зависит исключительно от источника фотонов (ко-бальт-60 или линейный ускоритель), суммарной или ежедневной дозы облучения гипофиза. При всей важности этих факторов решающее значение имеет время установления диагноза. У собаки с тяжелой клинической симптоматикой и крупной гипофизарной опухолью (более 2 см в диаметре) прогноз гораздо менее благоприятен, чем у собаки со слабыми проявлениями небольшой опухоли (1,2-1,5 см в диаметре). Нет сомнения, что сканирование мозга с помощью КТ и МРТ у всех собак с ГЗГ и последующая радиотерапия выявленных таким образом гипофизарных опухолей являются ценными методами диагностики и лечения животных с данным заболеванием. Однако в настоящее время такой подход неосуществим. Поэтому мы рекомендуем пока ограничиться облучением собак с опухолями размером 8 мм и более.
СПОНТАННАЯ РЕМИССИЯ СИНДРОМА КУШИНГА
У людей спонтанная ремиссия синдрома Кушинга хорошо документирована. Нельзя исключить возможность аналогичного явления и у собак ГЗГ. Мы наблюдали пять особей, у которых данные анамнеза, физикального и эндокринологического исследований предполагали наличие ГЗГ. Их не лечили, так как по мнению владельцев состояние животных улучшалось. Последующее обследование выявило исчезновение всех признаков ГЗГ. Было высказано предположение, что у собак этой группы произошла эмболизация гипофизарных микроаденом, что послужило причиной нормализации их эндокринного статуса.
ПЕРВИЧНЫЙ ИЗБЫТОК МИНЕРАЛОКОРТИКОИДОВ: ПЕРВИЧНЫЙ ГИПЕРАЛЬДОСТЕРОНИЗМ
Люди
Этиология. Первичный гиперальдостеронизм чаще всего возникает вследствие изолированной
односторонней аденомы надпочечника или двусторонней гиперплазии коры надпочечников (Ganguly, 1998). Реже причиной гиперальдостеронизма является карцинома надпочечников. Патогенез гиперплазии клубочковой зоны не изучен. У людей с гиперплазией коры надпочечников обычно ставится диагноз идиопатический гиперальдостеронизм (White, 1994).
Необходимо различать первичный и вторичный гиперальдостеронизм; последний может быть обусловлен сердечно-сосудистым заболеванием, недостаточностью функции почек или тяжелым гепатоцеллюлярным расстройством.
Патологическая физиология. У человека повышенная продукция альдостерона аномально измененной клубочковой зоной коры надпочечников (при наличии аденомы, карциномы или гиперплазии) индуцирует процессы, которые в конечном итоге приводят к первичному гиперальдостеронизму. Избыточная продукция альдостерона сопровождается задержкой натрия, увеличением внеклеточного объема жидкости и повышением общего содержания натрия в организме. Увеличение объема плазмы и количества внеклеточной жидкости определяется рецепторами растяжения, которые входят в состав юкстагломерулярного комплекса, а задержка натрия - macula densa. В случае первичного усиления продукции альдостерона подавляется активность рениновой системы, что служит индикатором данного расстройства. Первичный гиперальдостеронизм - это заболевание клубочковой зоны надпочечников, клетки которой не синтезируют кортизол. Поэтому гиперальдостеронизм может сопровождаться, но может и не сопровождаться нарушениями продукции или обмена кортизола.
Помимо усиления задержки натрия (вследствие которой его концентрация в крови обычно находится на верхней границе нормы), при гиперальдостеронизме происходит потеря калия, приводящая к снижению общего содержания калия в организме и его концентрации в крови. Переход калия из внутриклеточной среды во внеклеточную жидкость вызывает обратный ток ионов водорода, усиление их экскреции почками и системный алкалоз. При умеренной потере калия снижается толерантность к углеводам и появляется резистентность к антидиуретическому гормону (вазопрессину). При более значительной потере нарушается функция барорецепторов. Усиленное образование альдостерона приводит к активированию всей биосинтетической системы, в результате в крови больных с продуцирующими альдостерон аденомами коры надпочечников возрастают концентрации предшественников стероидов, таких как дезоксикортикостерон, кортикостерон и 18-гидроксикортикостерон.
Клиническая симптоматика. У людей с гиперальдостеронизмом развиваются неспецифические клинические симптомы. Заболевание чаще встречается у женщин, чем у мужчин и лишь изредка - у детей. В отдельных случаях оно протекает абсо
370 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
лютно бессимптомно, у других больных имеются такие симптомы как гипертензия (головные боли) или гипокалиемия (дневная и ночная полиурия, мышечные судороги). Иногда вследствие тяжелой гипокалиемии развиваются выраженная мышечная слабость, парестезия, алкалоз, жажда, тетания или параличи. Известны больные, в анамнезе которых отсутствуют специфические симптомы, но имеются жалобы на неспецифические расстройства, такие как быстрая утомляемость, общая слабость, пониженная жизнестойкость, апатия и ночная полиурия. В ходе физикального исследования некоторых пациентов может быть выявлена непредвиденная гипертензия. Величина кровяного давления у больных первичным гиперальдостеронизмом может быть от нормальной до очень высокой (Ganguly, 1998).
Диагностические пробы. При первоначальном обследовании людей, страдающих гипертензией, необходимо определить концентрацию калия в сыворотке крови. Перед этим следует обязательно оценить суточное потребление пищевой соли, поскольку оно в значительной степени определяет концентрацию калия в крови. Перевод пациента на рацион с низким содержанием натрия снижает потери калия и способствует нормализации уровня калиемии. По мере уменьшения количества ионов натрия, доступных для всасывания, замедляется секреция калия в дистальных почечных канальцах. При нормальной функции почек и избыточной продукции альдостерона солевая нагрузка уменьшает тяжесть гипокалиемии. Нормокалиемия при гиперальдостеронизме бывает, но довольно редко. Нормальная (142-156 мЭкв/л) или повышенная концентрация натрия в крови на фоне гипокалиемии и низкого гематокрита (вследствие увеличения количества внеклеточной жидкости и объема плазмы из-за задержки натрия) может служить показателем избытка минералокортикоидов. Кроме гипокалиемии, признаками первичного гиперальдостеронизма, служат неспособность концентрировать мочу, нарушение толерантности к глюкозе и алкалоз.
После подтверждения гипокалиемии следует оценить состояние ренин-ангиотензиновой системы путем рандомизированного определения активности ренина в плазме крови. При ее нормальном или повышенном уровне у пациентов, которые на протяжении трех недель не получали диуретических препаратов, диагноз первичного гиперальдостеронизма маловероятен. Он, однако, вполне возможен при пониженной активности ренина.
Продукцию альдостерона лучше всего оценить, измеряя его суточную экскрецию с мочой в условиях адекватного потребления натрия. Для определения общей продукции достаточно измерить содержание 18-глюкуронида альдостерона или тетрагидроальдостерона. Условия сбора проб крови должны обеспечивать получение достоверной диагностической информации. Хотя результаты определений альдостерона в плазме крови отражают его концентрацию только на момент измерения, у под
готовленного соответствующим образом пациента они позволяют вполне достоверно оценить продукцию минералокортикоидов. Определения альдостерона в пробах крови и мочи следует проводить на фоне потребления пациентом рациона с высоким содержанием хлористого натрия. Соблюдение этого требования очень важно, поскольку при любом понижении содержания натрия продукция альдостерона и его концентрация в плазме крови обычно увеличиваются. Измерение уровня альдостерона в моче позволяет достоверно оценить нарушение его продукции и имеет преимущество перед его определением в плазме крови. В то же время показатели суточной экскреции альдостерона с мочой не позволяют дифференцировать аденому от гиперплазии.
Дифференциальная диагностика аденомы и гиперплазии коры надпочечников неообходима, поскольку хирургическое лечение показано в первом случае, но не во втором. Определение концентрации альдостерона в плазме крови является не только источником информации для диагностики гиперальдостеронизма, но также основой для дифференциальной диагностики различных патологических процессов. Концентрацию альдостерона в плазме крови пациента измеряют в 8 часов утра после проведенной в постели ночи (не менее 6 часов) и ежедневного потребления 120 мЭкв натрия на протяжении, по меньшей мере, четырех предшествовавших дней. Полученные результаты позволяют дифференцировать больных с альдостерон-секретирующими опухолями надпочечников и лиц с гиперплазией коры. Концентрация альдостерона выше 20 нг/100 мл служит показателем аденомы, а более низкий уровень альдостеронемии свидетельствует о гиперплазии.
В норме после двух или четырех часов пребывания в стоячем положении должна активироваться рениновая система и соответственно должна увеличиваться концентрация альдостерона в плазме крови. В то же время у 90% людей с аденомой коры надпочечников в этой ситуации концентрация альдостерона не изменяется, либо уменьшается, а у пациентов с гиперплазией коры почти всегда возрастает. Это различие позволяет с высокой точностью дифференцировать одно заболевание от другого. Такое различие объясняется глубоким подавлением активности рениновой системы при избыточной продукции альдостерона аденомой надпочечника. У пациентов с гиперплазированной корой надпочечника высокая чувствительность пораженной железы к очень слабому, но все же ощутимому повышению уровня ренина после перехода в положение стоя обусловливает увеличение концентрации альдостерона в плазме крови.
Лечение. Выбор терапии в значительной степени зависит от точности диагностики. Пациентам с продуцирующими альдостерон аденомами коры надпочечников в отсутствие противопоказаний к хирургическому вмешательству показана односторонняя адреналэктомия. После снижения кровяно
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
371
го давления и коррекции гипокалиемии введением спиронолактона состояние больных удивительно напоминает состояние оперированных пациентов. Правда, после операции снижение выражено сильнее, по-видимому, благодаря более значительному уменьшению объема внеклеточной жидкости, Частота послеоперационного излечения гипертензии, обусловленной аденомой коры надпочечников, весьма высока - в некоторых группах больных она достигает 50%, а у остальных пациентов гипертензия снижается.
У больных с гиперальдостеронизмом невыясненного происхождения гипертензия и гипокалиемия обычно эффективно контролируются ведением одного спиронолактона. Благодаря столь выраженному терапевтическому действию этого препарата, антигипертензивную терапию другими лекарственными средствами обычно отменяют.
Патология. Первичный гиперальдостеронизм ассоциируется с некоторыми другими патологическими состояниями. Более чем у 50% больных с этим расстройством, перенесших хирургическую операцию, была обнаружена односторонняя аденома коры надпочечников. Случаи двусторонних опухолей редки. Типичную аденому обычно узнают по характерному желтовато-золотистому цвету. Зачастую рядом с ней обнаруживают более мелкие сателлитные опухоли. Довольно трудно различать микроузловую и макроузловую гиперплазию коры надпочечников. При наличии аденомы прилегающая к ней железа может подвергаться тотальной гиперплазии. Возможна также гиперплазия противоположного надпочечника, однако нарушений биосинтеза и секреции альдостерона после удаления первичной аденомы не наблюдается (Biglieri, Kater, 1983).
Собаки
Мы наблюдали трех собак с первичным гиперальдостеронизмом. Они принадлежали к следующим породам: бигль, карликовый пудель и доберман-пинчер. На момент установления диагноза возраст этих животных составлял соответственно 8, 9 и11 лет. Хозяева всех трех собак жаловались прежде всего на их эпизодическую слабость, а концентрация сывороточного калия при первичном исследовании проб крови не превышала 3 мЭкв/л. Было проведено всестороннее лабораторное обследование двух из этих животных, включая определение концентрации альдостерона в плазме крови. Она оказалась очень высокой (более 3000 пмоль/л), но резко понизилась после хирургического удаления опухоли. Одна собака имела аденому, а две другие - карциному коры надпочечников. Одна была подвергнута эвтаназии до начала какого-либо лечения, а состояние двух остальных по данным биохимического и клинического обследования нормализовалось после хирургического лечения. У одной собаки, имевшей аденому надпочечника, нормальное
состояние сохранялось на протяжении последующих 24 месяцев, а у второй спустя 24 месяца развился рецидив тяжелой гипокалиемии и мышечной слабости на фоне обширного метастазирования. Обе собаки прожили более 4 лет после операции. Нам известны еще только два случая первичного гиперальдостеронизма у собак (Breitschwerdt et al, 1985; Rijnberk et al, в печати).
ЛИТЕРАТУРА
Absalom A, et al: Adrenocortical function in critically ill patients 24 hours after a single dose of etomidate. Anaesthesia 54:861, 1999.
Allin RE, et al: The elucidation of adrenal-cortical status by measuring 2-hour urinary free Cortisol levels. Clin Chim Acta 143:17, 1984.
Anderson CR, et al: Surgical treatment of adrenocortical tumors: 21 cases (1990-1996). J Am Anim Hosp Assoc 37:93, 2001.
Angles JM, et al: Use of urine corticoid:creatinine ratio versus adreno-cor-ticotropic hormone stimulation for monitoring mitotane treatment of pituitary-dependent hyperadrenocorticism in dogs. J Am Vet Med Assoc 211:1002, 1997.
Arioglu E, et al: Cushing’s syndrome caused by corticotropin secretion by pulmonary tumorlets. N Engl J Med 339:883, 1998.
Aron DC, Ross NS: Evaluation of patients with an incidentally discovered adrenal mass. Proceedings of the Tenth ACVIM Forum, San Diego, Calif, 1992, p 193.
Aron DC, et al: Anterior pituitary gland. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/ McGraw-Hill, 2001a, p 100.
Aron DC, et al: Glucocorticoids and adrenal androgens. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001b, p 334.
Atkinson AB, et al: Cyclical Cushing’s disease: Two distinct rhythms in a patient with a basophil adenoma. J Clin Endocrinol Metab 60:328, 1985.
Badylak SF, Van Vleet JF: Sequential morphologic and clinicopathologic alterations in dogs with experimentally induced glucocorticoid hepato- pathy. Am J Vet Res,42:1310, 1981.
Badylak SF, Van Vleet JF: Tissue gamma-glutamyl transpeptidase activity and hepatic ultrastructural alterations in dogs with experimentally induced glucocorticoid hepatopathy. Am J Vet Res 42:649, 1982.
Bailey MQ: Use of x-ray-computed tomography as an aid in localization of adrenal masses in the dog. J Am Vet Med Assoc 188:1046, 1986.
Barthez P, et al: Ultrasonographic evaluation of the adrenal glands in normal dogs and in dogs with hyperadrenocorticism. J Am Vet Med Assoc 207:1180, 1995.
Baxter JD, Tyrrell JB: The adrenal cortex. In Felig P, et al (eds): Endocrinology and Metabolism. New York, McGraw-Hill, 1981, p 385.
Becker M, Aron DC: Ectopic ACTH syndrome and CRH-mediated Cushing’s syndrome. Endocrinol Metab Clin North Am 23:585, 1994.
Behrend EN, et al: Effect of storage conditions on Cortisol, total thyroxine, and free thyroxine concentrations in serum and plasma of dogs. J Am Vet Med Assoc 212:1564, 1998.
Bencsik ZS, et al: Incidentally detected adrenal tumours (incidentalomas): histological heterogeneity and differentiated therapeutic approach. J Intern Med 237:585, 1995.
Berry CR, et al: Pulmonary mineralization in four dogs with Cushing's syndrome. Vet Radiol Ultrasound 35:10, 1994. Berry CR, et al: Frequency of pulmonary mineralization and hypoxemia in 21 dogs with pituitary dependent hyperadrenocorticism. J Vet Intern Med 14:151, 2000.
Bertagna X: New causes of Cushing’s syndrome. N Engl J Med 327:1024, 1992.
Bertagna X: Pro-opiomelanocortin-derived peptides. Endocrinol Metab Clin North Am 23:467, 1994.
Bertoy EH, et al: Magnetic resonance imaging of the brain in dogs with recently diagnosed but untreated pituitary-dependent hyperadreno-corti-cism. J Am Vet Med Assoc 206:651, 1995.
Bertoy EH, et al: One-year follow-up evaluation of magnetic resonance imaging of the brain in dogs with pituitary-dependent hyperadreno-corticism. J Am Vet Med Assoc 208:1268, 1996.
Besso JG, et al: Retrospective ultrasonographic evaluation of adrenal lesions in 26 dogs. Vet Radiol Ultrasound 38:448, 1997.
Biglieri EG, Kater CE: Mineralocorticoids. In Greenspan FS, Forsham PH (eds): Basic and Clinical Endocrinology. Los Altos, Calif, Lange Medical Publications, 1983, p 295.
Biller BMK: Pathogenesis of pituitary Cushing’s syndrome: Pituitary versus hypothalamic. Endocrinol Metab Clin North Am 23:547, 1994.
Bodey AR, Michell AR: Epidemiological study of blood pressure in domestic dogs. J Small Anim Pract 37:116, 1996.
Bondanella M, et al: Evaluation of hormonal function in a series on incidentally discovered adrenal masses. Metabolism 46:107, 1997.
Bonneville JF, et al: Dynamic computed tomography of the pituitary gland: the “tuft sign.” Radiology 149:145, 1983.
Braddock JA: Investigation of some alternative therapies for management of pituitary-dependent hyperadrenocorticism in the dog. Master’s Thesis, Sidney, Australia, 2002, University of Sydney.
372
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
Breitschwerdt ЕВ, et al: Idiopathic hyperaldosteronism in a dog. J Am Vet Med Assoc 187:841, 1985.
Bruyette DS, et al: L-Deprenyl therapy of canine pituitary-dependent hyperadrenocorticism. J Vet Intern Med 7:114, 1993 (abstract).
Bruyette DS, et al: Management of canine pituitary-dependent hyperadrenocorticism with L deprenyl. Vet Clin North Am (Small Anim Pract) 27:273, 1997.
Bunch SE, et al: Idiopathic pleural effusion and pulmonary thromboembolism in a dog with autoimmune hemolytic anemia. J Am Vet Med Assoc 195:1748, 1989.
Burns MG, et al: Pulmonary artery thrombosis in three dogs with hyperadrenocorticism. J Am Vet Med Assoc 178:388, 1981.
Castill V, et al: Aminoglutethimide: Therapeutic alternative in canines with Cushing’s disease (hypophysis dependent). [Spanish] Avan Cienc Vet 11:93, 1996.
Chauvet AE, et al: Effects of phenobarbital administration on results of serum biochemical analyses and adrenocortical function tests in epileptic dogs. J Am Vet Med Assoc 207:1305, 1995.
Church DB, et al: Effect of nonadrenal illness, anaesthesia and surgery on plasma Cortisol concentrations in dogs. Res Vet Sci 56:129, 1994.
Colao A, et al: Successful treatment of Cushing’s disease evokes thyroid autoimmunity. Clin Endocrinol 53:13, 2000.
Contreras LN, et al: Urinary Cortisol in the assessment of pituitary-adrenal function: Utility of 24-hour and spot determinations. J Clin Endocrinol Metab 62:965, 1986.
Contreras P, et al: Adrenal rest tumor of the liver causing Cushing’s syndrome: Treatment with ketoconazole preceding an apparent surgical cure. J Clin Endocrinol Metab 60:21, 1985.
Daley CA, et al: Use of metyrapone to treat pituitary-dependent hyperadrenocorticism in a cat with large cutaneous wounds. J Am Vet Med Assoc 202:956, 1993.
Den Hertog E, et al: Results of nonselective adrenocorticolysis by o,p’-DDD in 129 dogs with pituitary-dependent hyperadrenocorticism. Vet Rec 144:12, 1999.
Dennis JS: Clinical features of canine pulmonary thromboembolism. Compend Cont Ed Sm Anim Pract 15:1595, 1993.
Dewis P, et al: Experience with trilostane in the treatment of Cushing’s syndrome. Clin Endocrinol 18:533, 1983.
Dodam JR, et al: Duration of etomidate-induced adrenocortical suppression during surgery in dogs. Am J Vet Res 51:786, 1990.
Douglass JP, et al: Ultrasonographic adrenal gland measurements in dogs without evidence of adrenal disease. Vet Radiol Ultrasound 38:124, 1997.
Dow SW, et al: Perianal adenomas and hypertestosteronemia in a spayed bitch with pituitary-dependent hyperadrenocorticism. J Am Med Assoc 192:1439, 1988.
Dow SW, et al: Response of dogs with functional pituitary macroadenomas and macrocarcinomas to radiation. J Small Anim Pract 31:287, 1990.
Drake WM, et al: Emergency and prolonged use of intravenous etomidate to control hypercortisolemia in a patient with Cushing’s syndrome and peritonitis. J Clin Endocrinol Metab 83:3542, 1998.
Drucker WD, Peterson ME: Pharmacologic treatment of pituitary-dependent canine Cushing’s disease. Program of the Sixty-Second Annual Meeting of the Endocrine Society, San Francisco, 1980, p 89 (abstract).
Duesberg CA, et al: Magnetic resonance imaging for diagnosis of pituitary macrotumors in dogs. J Am Vet Med Assoc 206:657, 1995.
Dyer KR, et al: Effects of short- and long-term administration of phenobarbital on endogenous ACTH concentration and results of ACTH stimulation tests in dogs. J Am Vet Med Assoc 205:315, 1994. Edelman RR, Warach S: Magnetic resonance imaging. N Engl J Med 328:708, 1993.
Eichenbaum JD, et al: Effect in large dogs of ophthalmic prednisolone acetate on adrenal gland and hepatic function. J Am Anim Hosp Assoc 24:705, 1988.
Elliott DA, et al: Glycosylated hemoglobin concentrations in the blood of healthy dogs and dogs with naturally developing diabetes mellitus, pancreatic (3-cell neoplasia, hyperadrenocorticism, and anemia. J Am Vet Med Assoc 211:723, 1997.
Emms SG, et al: Evaluation of canine hyperadrenocorticism using computed tomography. J Am Vet Med Assoc 189:432, 1986.
Engelhardt D, et al: The influence of ketoconazole on Cortisol secretion in Cushing’s syndrome. Acta Endocrinol (Suppl) (Copenh) 256:281, 1983 (abstract).
Estrada J, et al: The long-term outcome of pituitary irradiation after unsuccessful transsphenoidal surgery in Cushing’s disease. N Engl J Med 336:172, 1997.
Faglia G: Epidemiology and pathogenesis of pituitary adenomas. Acta Endocrinol 129(suppl 1 ):1, 1994.
Feldman BF, et al: Thrombotic disease in canine Cushing’s syndrome. American College of Veterinary Internal Medicine Scientific Proceedings, Salt Lake City, 1982, p 84 (abstract).
Feldman BF, et al: Hemostatic abnormalities in canine Cushing’s syndrome. Res Vet Sci 41:228, 1986.
Feldman EC: The effect of functional adrenocortical tumors on plasma Cortisol and corticotropin concentrations in dogs. J Am Vet Med Assoc 178:823, 1981.
Feldman EC: Comparison of ACTH response and dexamethasone suppression as screening tests in canine hyperadrenocorticism. J Am Vet Med Assoc 182:505, 1983a.
Feldman EC: Distinguishing dogs with functioning adrenocortical tumors from dogs with pituitary-dependent hyperadrenocorticism. J Am Vet Med Assoc 183:195, 1983b.
Feldman EC: The adrenal cortex. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983c, p 1650.
Feldman EC: Evaluation of a combined dexamethasone suppression/ACTH stimulation test in dogs with hyperadrenocorticism. J Am Vet Med Assoc 187:49, 1985.
Feldman EC: Evaluation of a 6-hour combined dexamethasone suppression/ ACTH stimulation test in dogs with hyperadrenocorticism. J Am Vet Med Assoc 189:1562, 1986.
Feldman EC, Mack RE: Urine cortisokcreatinine ratio as a screening test for hyperadrenocorticism in dogs. J Am Vet Med Assoc 200:1637, 1992.
Feldman EC, Tyrrell JB: Plasma testosterone, plasma glucose, and plasma insulin concentrations in spontaneous canine Cushing’s syndrome. The Endocrine Society, Salt Lake City, 1982, p 343 (abstract).
Feldman EC, et al: Comparison of aqueous porcine ACTH with synthetic ACTH in adrenal stimulation tests of the female dog. Am J Vet Res 43:522, 1982.
Feldman EC, et al: Plasma Cortisol response to ketoconazole administration in dogs with hyperadrenocorticism. J Am Vet Med Assoc 197:71, 1990.
Feldman EC, et al: Comparison of mitotane treatment for adrenal tumor versus pituitary-dependent hyperadrenocorticism in dogs. J Am Vet Med Assoc 200:1642, 1992.
Feldman EC, et al: Use of low- and high-dose dexamethasone tests for distinguishing pituitary dependent from adrenal tumor hyperadrenocorticism. J Am Vet Med Assoc 209:772, 1996.
Ferguson DC: Thyroid function tests in the dog: Recent concepts. Vet Clin North Am (Small Anim Pract) 14:783, 1984.
Ferguson DC, Peterson ME: Serum free thyroxine concentrations in spontaneous canine hyperadrenocorticism. American College of Veterinary Internal Medicine Scientific Proceedings, Washington, DC, 1986 (abstract).
Fluckiger AAA, Gomez JA: Radiographic findings in dogs with spontaneous pulmonary thrombosis or embolism. Vet Radiol 25:124, 1984.
Ford SL, et al: Hyperadrenocorticism caused by bilateral adrenocortical neoplasia in dogs: Four cases (1983-1988). J Am Vet Med Assoc 202:789, 1993.
Forrester SD, et al: Retrospective evaluation of urinary tract infection in 42 dogs with hyperadrenocorticism or diabetes mellitus or both. J Vet Intern Med 13:557, 1999.
Foster SF, et al: Effect of phenobarbitone on the low-dose dexamethasone suppression test and the urinary corticoidxreatinine ratio in dogs. Aust Vet J 78:19, 2000a.
Foster SF, et al: Effects of phenobarbitone on serum biochemical tests in dogs. Aust Vet J 78:23, 2000b.
Frank LA, Oliver JW: Comparison of serum Cortisol concentrations in clinically normal dogs after administration of freshly reconstituted versus reconstituted and stored frozen cosyntropin. J Am Vet Med Assoc 212:1569, 1998.
Frank LA, et al: Cortisol concentrations following stimulation of healthy and adrenopathic dogs with two doses of tetracosactrin. J Small Anim Pract 41:308,2000.
Frank LA, et al: Steroidogenic response of adrenal tissues after administration of ACTH to dogs with hypercortisolemia. J Am Vet Med Assoc 218:214, 2001.
Frazier KS, et al: Multiple cutaneous metaplastic ossification associated with iatrogenic hyperglucocorticoidism. J Vet Diagn Invest 10:303, 1998.
Galac S, et al: Urinary corticoidxreatinine ratios in the differentiation between pituitary dependent hyperadrenocorticism and hyperadrenocorticism due to adrenocortical tumour in the dog. Vet Q 19:17, 1997.
Ganguly A: Primary hyperaldosteronism. N Engl J Med 339:1828, 1998.
Gebhardt DOE, et al: Mitotane (o,p’-DDD) administration raises the serum level of high-density lipoprotein (HDL) in normotriglyceridemia. Horm Metab Res 25:440, 1993.
Geldof AA, et al: Inhibition of 3b-hydroxysteroid-dehydrogenase: an approach for prostate cancer treatment? Anticancer Res 15:1349, 1995.
Gicquel C, et al: Monoclonality of corticotroph macroadenomas in Cushing’s disease. J Clin Endocrinol Metab 75:472, 1992.
Gieger TL, et al: Lymphoma as a model for chronic illness: Effects on adrenocortical function tests. J Vet Intern Med 16:374, 2002 (abstract).
Glaze MB, et al: Ophthalmic corticosteroid therapy: Systemic effects in the dog. J Am Vet Med Assoc 192:73, 1988.
Golden DL, Lothrop CD: A retrospective study of aldosterone secretion in normal and adrenopathic dogs. J Vet Intern Med 2:121, 1988.
Goldhaber SZ: Pulmonary embolism. N Engl J Med 339:93, 1998.
Goossens MMC, et al: Efficacy of cobalt 60 radiotherapy in dogs with pituitarydependent hyperadrenocorticism. J Am Vet Med Assoc 212:374, 1998.
Gould SM, et al: Use of endogenous ACTH concentration and adrenal ultrasonography to distinguish the cause of canine hyperadrenocorticism. J Small Anim Pract 42:113, 2001.
Greco DS, et al: Pharmacokinetics of exogenous corticotropin in normal dogs, hospitalized dogs with nonadrenal illness, and adrenopathic dogs. J Vet Pharmacol Therap 21:369, 1998.
Greco DS, et al: Concurrent pituitary and adrenal tumors in dogs with hyperadrenocorticism: 17 cases (1978-1995). J Am Vet Med Assoc 214:1349, 1999.
Griffing GT, Melby JC: Reversal of diuretic-induced secondary hyperaldosteronism and hypokalemia by trilostane, an inhibitor of adrenal steroidogenesis. Metabolism 38:353, 1989.
Grooters AM, et al: Ultrasonographic parameters of normal canine adrenal glands: Comparison to necropsy findings. Vet Radiol Ultrasound 36:126, 1995.
Grooters AM, et al: Ultrasonographic characteristics of the adrenal glands in dogs with pituitary dependent hyperadrenocorticism: Comparison with normal dogs. J Vet Intern Med 10:110, 1996.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
373
Guptill L, et al: Use of the urine cortisohcreatinine ratio to monitor treatment response in dogs with pituitary-dependent hyperadrenocorticism. J Am Vet Med Assoc 210:1158, 1997.
Halberg FE, Sheline GE: Radiotherapy in the treatment of pituitary tumors. Endocrinol Metab Clin North Am 16:667, 1987.
Halmi NS, et al: Pituitary intermediate lobe in the dog: Two cell types and high bioactive adrenocorticotropin content. Science 211:72, 1981.
Hamet P, et al: Cushing’s syndrome with food-dependent periodic hormono-genesis. Clin Invest Met 10:530, 1987.
Hamper UM, et al: Primary adrenocortical carcinoma: Sonographic evaluation with clinical and pathologic correlation in 26 patients. Am J Roentgenol 148:915, 1987.
Hansen BL, et al: Synthetic ACTH (cosyntropin) stimulation tests in normal dogs: comparison of intravenous and intramuscular administration. J Am Anim Hosp Assoc 30:38, 1994.
Hegstad RL, et al: Effect of sample handling on adrenocorticotropin concentration measured in canine plasma, using a commercially available radioimmunoassay kit. Am J Vet Res 51:1941, 1990.
Hess RS, et al: Association between hyperadrenocorticism and development of calcium containing uroliths in dogs with urolithiasis. J Am Vet Med Assoc 212:1889, 1998.
Hill K, Scott-Moncrieff JC: Tumors of the adrenal cortex causing hyperadrenocorticism. Vet Med pg 685, 2001.
Hillier A, Desch CE: Large-bodied Demodex mite infestation in 4 dogs, J Am Vet Med Assoc 220:623, 2002.
Hoerauf A, Reusch C: Ultrasonographic characteristics of both adrenal glands in 15 dogs with functional adrenocortical tumors. J Am Anim Hosp Assoc 35:193, 1999.
Hoffmann WE, et al: A technique for automated quantification of canine glucocorticoid-induced isoenzyme of alkaline phosphatase. Vet Clin Pathol 17:66, 1988.
Holt E, et al: The prevalence of hyperadrenocorticism in dogs with sudden acquired retinal degeneration (SARD). J Vet Intern Med 13:272, 1999 (abstract).
Hughes D: Polyuria and polydipsia. Compend Contin Educ 14:1161, 1992.
Huntley K, et al: The radiological features of canine Cushing’s syndrome: A review of forty-eight cases. J Small Anim Pract 23:369, 1982.
Hurley KJ, Vaden SL: Evaluation of urine protein content in dogs with pituitary-dependent hyperadrenocorticism. J Am Vet Med Assoc 212:369, 1998.
Hurley KJ, et al: The use of trilostane for the treatment of hyperadrenocorticism in dogs. J Vet Intern Med 12:210, 1998 (abstract).
Ibrahim NK, Buzdar AU: Aromatase inhibitors: current status. Am J Clin Oncol 18:407, 1995.
Jackson S, et al: Nature and control of peptide release from the pars intermedia. In Evered (ed): Peptides of the Pars Intermedia. London, Pitman, 1981, p141.
Jacoby RC, et al: Biochemical basis for the hypercoagulable state seen in Cushing’s syndrome. Arch Surg 139:1003, 2001.
Jensen AL, Poulsen JSD: Preliminary experience with the diagnostic value of the canine corticosteroid-induced alkaline phosphatase isoenzyme in hypercorticism and diabetes mellitus. J Vet Med Series A 39:342, 1992.
Jensen AL, et al: Evaluation of the urinary cortisohcreatinine ratio in the diagnosis of hyperadrenocorticism in dogs. J Small Anim Pract 38:99, 1997.
Johnson LR, et al: Pulmonary thromboembolism in 29 dogs: 1985-1995. J Vet Intern Med 13:338, 1999.
Johnston DE: Adrenalectomy in the dog. In Bojrab MJ (ed): Current Techniques in Small Animal Surgery. Philadelphia, Lea & Febiger, 1983, p 386.
Jones CA, et al: Changes in adrenal Cortisol secretion as reflected in the urinary Cortisol/creatinine ratio in dogs. Dorn Anim Endocr 7:559, 1990.
Juchem M, Pollow K: Binding of oral contraceptive progestogens to serum proteins and cytoplasmic receptor. Am J Obstet Gynecol 163:2171, 1990.
Kallet A, Cowgill LD: Hypertensive states in the dog. Proceedings of the American College of Veterinary Internal Medicine, Salt Lake City, 1982, p 79.
Kantrowitz BM, et al: Adrenal ultrasonography in the dog. Vet Radiol 27:15, 1986.
Kaplan AJ, et al: Effects of disease on the results of diagnostic tests for use in detecting hyperadrenocorticism in dogs. J Am Vet Med Assoc 207:445, 1995.
Kemppainen RJ, Peterson ME: Circulating concentration of dexamethasone in healthy dogs, dogs with hyperadrenocorticism, and dogs with nonadrenal illness during dexamethasone suppression testing. Am J Vet Res 54:1765, 1993.
Kemppainen RJ, Sartin JL: Evidence for episodic but not circadian activity in plasma concentrations of adrenocorticotropin, Cortisol and thyroxine in dogs. J Endocrinol 103:219, 1984.
Kemppainen RJ, Sartin JL: Differential regulation of peptide release by the canine pars distalis and pars intermedia. Front Horm Res 17:18, 1987.
Kemppainen RJ, Zenoble RD: Non-dexamethasone-suppressible, pituitarydependent hyperadrenocorticism in a dog. J Am Vet Med Assoc 187:276, 1985.
Kemppainen RJ, et al: Regulation of adrenocorticotropin secretion from cultured canine anterior pituitary cells. Am J Vet Res 53:2355, 1992.
Kemppainen RJ, et al: Aprotinin preserves immunoreactive adrenocorticotropin in canine plasma. J Vet Intern Med 8:163, 1994a (abstract).
Kemppainen RJ, et al: Preservative effect of aprotinin on canine plasma immunoreactive adrenocorticotropin concentrations. Dorn Anim Endocr 11:355, 1994b.
Kerl ME, et al: Evaluation of a low-dose synthetic adrenocorticotropic hormone stimulation test in clinically normal dogs and dogs with naturally developing hyperadrenocorticism. J Am Vet Med Assoc 214:1497, 1999.
King RR, et al: Pulmonary function studies in a dog with pulmonary thromboembolism associated with Cushing’s disease. J Am Anim Hosp Assoc 21:555, 1985.
Kintzer PP, Peterson ME: Mitotane (o,p’-DDD) treatment of 200 dogs with pituitary-dependent hyperadrenocorticism. J Vet Intern Med 5:182, 1991.
Kintzer PP, Peterson ME: Mitotane (o,p’DDD) treatment of dogs with cortisol-secreting adrenocortical neoplasia: 32 cases (1980-1992). J Am Vet Med Assoc 205:54, 1994.
Kippenes H, et al: Mensuration of the normal pituitary gland from magnetic resonance images in 96 dogs. Vet Radiol Ultrasound 42:130, 2001.
Kipperman BS, et al: Pituitary tumor size, neurologic signs, and relation to endocrine test results in dogs with pituitary-dependent hyperadrenocorticism: 43 cases (1980-1990). J Am Vet Med Assoc 201:762, 1992.
Kirk GR, Jensen HE: Toxic effects of o,p’-DDD in the normal dog. J Am Anim Hosp Assoc 11:765, 1975.
Klein MK, et al: Pulmonary thromboembolism associated with immunemedi-ated hemolytic anemia in dogs: Ten cases (1982-1987). J Am Vet Med Assoc 195:246, 1989.
Klibanski A, Zervas NT: Diagnosis and management of hormone-secreting pituitary adenomas. N Engl J Med 324:822, 1991.
Kolevska F, Svoboda M: Immunoreactive Cortisol measurement in canine urine and its validity in hyperadrenocorticism diagnosis. Acta Vet Brno 69:217, 2000.
Komanicky P, et al: Treatment of Cushing’s syndrome with trilostane (WIN 24,540), an inhibitor of adrenal steroid biosynthesis. J Clin Endocrinol Metab 47:1042, 1978.
Kooistra HS, et al: Correlation between impairment of glucocorticoid feedback and the size of the pituitary gland in dogs with pituitary-dependent hyperadrenocorticism. J Endocrinol 152:387, 1997.
Kornegay JN: Imaging brain neoplasms, computed tomography and magnetic resonance imaging. Vet Med Rep 2:372, 1990.
Kraft SL, et al: Canine brain anatomy on magnetic resonance images. Vet Radiol 30:147, 1989.
Krieger DT: Physiopathology of Cushing’s disease. Endocr Rev 4:22, 1983.
Lacoste D, et al: Effect of 3-week treatment with [d-Trp, des-Gly-NH21 LHRH ethylamide, aminoglutethimide, ketoconazole, or flutamide alone or in combination on testicular, serum, adrenal and prostatic steroid levels in the dog. J Steroid Biochem 33:233, 1989.
Lacroix A, et al: Gastric inhibitory polypeptide-dependent Cortisol hypersecretion: A new cause of Cushing’s syndrome. N Engl J Med 327:974, 1992.
Lacroix A, et al: Propranolol therapy for ectopic b-adrenergic receptors in adrenal Cushing’s syndrome. N Engl J Med 337:1429, 1997. Landolt AM: Transsphenoidal surgery of pituitary tumors: Its pitfalls and complications. Prog Neurol Surg 13:1, 1990.
Lantz GC, et al: Transsphenoidal hypophysectomy in the clinically normal dog. Am J Vet Res 49:1134, 1988.
LaRue MJ, Murtaugh RJ: Pulmonary thromboembolism in dogs: 47 cases (1986-1987). J Am Vet Med Assoc 197:1368, 1990.
Laue L, et al: Effect of chronic treatment with the glucocorticoid antagonist RU 486 in man: Toxicity, immunological, and hormonal aspects. J Clin Endocrinol Metab 71:1474, 1990.
Leinung MC, Zimmerman D: Cushing’s syndrome in children. Endocrinol Metab Clin North Am 23:629, 1994.
Leroy J, Feldman EC: Clinical comparison of dogs with pituitary-dependent hyperadrenocorticism of pars distalis versus pars intermedia origin. Proceedings of the Seventh AC VIM Forum, San Diego, Calif, 1989, p 1034 (abstract).
Littley MD, et al: Long-term follow-up of low-dose external pituitary irradiation for Cushing's disease. Clin Endocrinol (Oxf) 33:445, 1990.
Liftman MP, et al: Spontaneous systemic hypertension in dogs: Five cases (1981-1983). J Am Vet Med Assoc 193:486, 1988.
Loli P, et al: Use of ketoconazole in the treatment of Cushing’s syndrome. J Clin Endocrinol Metab 63:1365, 1986.
Lothrop CD, Oliver JW: Diagnosis of canine Cushing’s syndrome based on multiple steroid analysis and dexamethasone turnover kinetics. Am J Vet Res 45:2304, 1984.
Love NE, et al: The computed tomographic enhancement pattern of the normal canine pituitary gland. Vet Radiol Ultrasound 41:507, 2000.
Lucena R, et al: Effects of haemolysis, lipaemia and bilirubinaemia on an enzyme-linked immunosorbent assay for Cortisol and free thyroxine in serum samples from dogs. Vet J 156:127, 1998.
Lulich JP, Osborne CA: Bacterial infections of the urinary tract. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Medicine. Philadelphia, WB Saunders, 1994, p 1775.
Mack RE, Feldman EC: Comparison of two low-dose dexamethasone suppression protocols as screening and discrimination tests in dogs with hyperadrenocorticism. J Am Vet Med Assoc 197:1603, 1990.
Magiakou MA, et al: Cushing’s syndrome in children and adolescents. N Engl J Med 331:629, 1994.
Maher VMG, et al: Possible mechanism and treatment of o,p’-DDD-induced hypercholesterolemia. Q J Med 305:671, 1992.
Malchoff CD, et al: Adrenocorticotropin-independent bilateral macronodular adrenal hyperplasia: An unusual cause of Cushing’s syndrome. J Clin Endocrinol Metab 68:855, 1989.
Mampalam TJ, et al: Transsphenoidal microsurgery for Cushing’s disease: A report of 216 cases. Ann Intern Med 109:487, 1988.
Mattson A, et al: Clinical features suggesting hyperadrenocorticism associated with sudden acquired retinal degeneration syndrome in a dog. J Am Anim Hosp Assoc 28:199, 1992.
McCance DR, et al: Clinical experience with ketoconazole as a therapy for patients with Cushing’s syndrome. Clin Endocrinol 27:593, 1987.
374
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
McLeod МК: Complications following adrenal surgery. J Natl Med Assoc 83:161, 1991.
McNicol AM: Pituitary morphology in canine pituitary-dependent hyperadrenocorticism. Front Horm Res 17:71, 1987.
Meaney JFM, et al: Diagnosis of pulmonary embolism with magnetic resonance angiography. N Engl J Med 336:1422, 1997.
Meij BP, et al: Residual pituitary function after transsphenoidal hypophysectomy in dogs with pituitary-dependent hyperadrenocorticism. J Endocrinol 155:531, 1997a.
Meij BP, et al: Transsphenoidal hypophysectomy in Beagle dogs: Evaluation of a microsurgical technique. Vet Surg 26:295, 1997b.
Meij BP, et al: Alterations in anterior pituitary function of dogs with pituitarydependent hyperadrenocorticism. J Endocrinol 154:505, 1997c.
Meij BP, et al: Results of transsphenoidal hypophysectomy in 52 dogs with pituitary-dependent hyperadrenocorticism. Vet Surg 27:246, 1998.
Meij BP, et al: Progress in transsphenoidal hypophysectomy for treatment of pituitary-dependent hyperadrenocorticism in dogs and cats. Molec Cell Endocrinol 197:89, 2002.
Meijer JC: Canine hyperadrenocorticism. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders, 1980, p 975.
Melby JC: Therapy of Cushing’s disease: A consensus for pituitary microsurgery. Ann Intern Med 109:445, 1988.
Melby JC: Clinical Review 1: Endocrine hypertension. J Clin Endocrinol Metab 69:697, 1989.
Montgomery TM, et al: Basal and glucagon-stimulated plasma C-peptide concentrations in healthy dogs, dogs with diabetes mellitus, and dogs with hyperadrenocorticism. J Vet Intern Med 10:116, 1996.
Moon PF: Cortisol suppression in cats after induction of anesthesia with etomidate compared with ketamine-diazepam combination. Am J Vet Res 58:868, 1997.
Moore GE, Hoenig M: Duration of pituitary and adrenocortical suppression after long-term administration of antiinflammatory doses of prednisone in dogs. Am J Vet Res 53:716, 1992.
Moore LE, et al: Hyperadrenocorticism treated with metyrapone followed by bilateral adrenalectomy in a cat. J Am Vet Med Assoc 217:691, 2000.
Muller PB, et al: Effects of long-term phenobarbital treatment on the thyroid and adrenal axis and adrenal function tests in dogs. J Vet Intern Med 14:157,2000a.
Muller PB, et al: Effects of long-term phenobarbital treatment on the liyer in dogs. J Vet Intern Med 14:165, 2000b.
Murase T, et al: Measurement of serum glucocorticoids by high-performance liquid chromatography and circadian rhythm patterns of the Cortisol value in normal dogs. Jpn J Vet Sci 50:1133, 1988.
Murayama M, et al: Long term follow-up of Cushing’s disease treated with reserpine and pituitary irradiation. J Clin Endocrinol Metab 75:935, 1992.
Murphy CJ, et al: Iatrogenic Cushing’s syndrome in a dog caused by topical ophthalmic medications. J Am Anim Hosp Assoc 26:640, 1990.
Nazeyrollas P, et al: Diagnostic accuracy of echocardiography-Doppler in acute pulmonary embolism. Int J Cardiol 47:273, 1995.
Neiger R, Hurley K: Twenty-four-hour Cortisol values in dogs with hyperadrenocorticism on trilostane. J Small Anim Pract 42:376, 2001 (abstract).
Neiger R, et al: Trilostane treatment of 78 dogs with pituitary-dependent hyperadrenocorticism. Vet Rec 150:799, 2002.
Nelson AA, Woodard G: Severe adrenal cortical atrophy (cytotoxic) and hepatic damage produced in dogs by feeding 2,2-bis (parachlorophenyl)-l, 1-trichloroethane (DDD or TDE). Arch Pathol 48:387, 1949.
Nelson RW, et al: Effect of o,p’-DDD therapy on endogenous ACTH concentrations in dogs with hypophysis-dependent hyperadrenocorticism. Am J Vet Res 46:1534, 1985.
Nelson RW, et al: Pituitary macroadenomas and macroadenocarcinomas in dogs treated with mitotane for pituitary-dependent hyperadrenocorticism: 13 cases (1981-1986). J Am Vet Med Assoc 194:1612, 1989.
Nichols R: Concurrent illness and complications associated with canine hyperadrenocorticism. Proceedings of the Tenth ACVIM Forum, San Diego, Calif, 1992, p 357.
Niebauer GW, Evans SM: Transsphenoidal hypophysectomy in the dog: A new technique. Vet Surg 17:296, 1988.
Niebauer GW, et al: Study of long-term survival after transsphenoidal hypophysectomy in clinically normal dogs. Am J Vet Res 51:677, 1990.
Norman EJ, et al: Dynamic adrenal function testing in eight dogs with hyperadrenocorticism associated with adrenocortical neoplasia. Vet Rec 144:551, 1999.
Nyland T: Personal communication, May 2003.
Oluju MP, et al: Simple quantitative assay for canine steroid-induced alkaline phosphatase. Vet Rec 115:17, 1984.
Ortega T, et al: Evaluation of fasting serum lipid profiles in dogs with Cushing’s syndrome. J Vet Intern Med 9:182, 1995a (abstract).
Ortega T, et al: Plasma aldosterone concentrations in dogs before and after o,p’-DDD therapy for pituitary-dependent hyperadrenocorticism. J Vet Intern Med 9:182, 1995b (abstract).
Ortega T, et al: Systemic arterial blood pressure and urine protein/creatinine ratio in dogs with hyperadrenocorticism. J Am Vet Med Assoc 209:1724, 1996.
Orth DN: Cushing’s syndrome. N Engl J Med 332:791, 1995.
Orth DN, et al: The adrenal cortex. In Wilson JD, Forster DW (eds): Williams Textbook of Endocrinology. 9th ed. Philadelphia, WB Saunders, 1998, p 590.
Patrassi GM, et al: Further studies on the hypercoagulable state of patients with Cushing’s syndrome. Thromb Haemost 54:518, 1985.
Penninck DG, et al: Radiologic features of canine hyperadrenocorticism caused by autonomously functioning adrenocortical tumors: 23 cases (1978- 1986). J Am Vet Med Assoc 192:1604, 1988.
Peterson ME: Hyperadrenocorticism. Vet Clin North Am (Small Anim Pract) 14:731, 1984.
Peterson ME: Pathophysiology of canine pituitary-dependent hyperadrenocorticism. Front Horm Res 17:37, 1987.
Peterson ME: Medical treatment of pituitary-dependent hyperadrenocorticism in dogs: Should L deprenyl ever be used? J Vet Intern Med 13:289, 1999 (editorial).
Peterson ME, Drucker WD: Cyproheptadine treatment of spontaneous pitu-itary-ACTH dependent canine Cushing’s disease. Clin Res 26:703A, 1978 (abstract).
Peterson ME, et al: Immunocytochemical study of the hypophysis in 25 dogs with pituitary-dependent hyperadrenocorticism. Acta Endocrinol 101:15, 1982a.
Peterson ME, et al: Plasma Cortisol response to exogenous ACTH in 22 dogs with hyperadrenocorticism caused by an adrenocortical neoplasia. J Am Vet Med Assoc 180:542, 1982b.
Peterson ME, et al: Effects of spontaneous hyperadrenocorticism on serum thyroid hormone concentrations in the dog. Am J Vet Res 45:2034, 1984.
Peterson ME, et al: Plasma immunoreactive pro-opiomelanocortin peptides and Cortisol in normal dogs and dogs with Addison’s disease and Cushing’s syndrome: Basal concentrations. Endocrinology 119:720, 1986.
Poffenberger EM, et al: Gray-scale ultrasonography in the diagnosis of adrenal neoplasia in dogs: Six cases (1981-1986). J Am Vet Med Assoc 192:228, 1988.
Potts GO, et al: Trilostane, an orally active inhibitor of steroid biosynthesis. Steroids 32:257, 1978.
Raff H: Glucocorticoid inhibition of neurohypophyseal vasopressin secretion. Am J Physiol 252-.R635, 1987.
Ramsey CC, et al: Use of streptokinase in four dogs with thrombosis. J Am Vet Med Assoc 209:780, 1996.
Randolph JF, et al: Use of the urinary corticoid:creatinine ratio for monitoring dogs with pituitary-dependent hyperadrenocorticism during induction treatment with mitotane (o,p’-DDD). Am J Vet Res 59:258, 1998.
Reicke M, et al: Deletion of the adrenocorticotropin receptor gene in human adrenocortical tumors: Implications for tumorigenesis. J Clin Endocrinol Metab 82:3054, 1997.
Reimers TJ, et al: Effects of hemolysis and storage on quantification of hormones in blood samples from dogs, cattle, and horses. Am J Vet Res 52:1075, 1991.
Reine NJ, et al: Deoxycortisone-secreting adrenocortical carcinoma in a dog. J Vet Intern Med 13:386, 1999.
Reitmeyer M, et al: The neurosurgical management of Cushing’s disease. Molec Cell Endocrinol 197:73, 2002.
Remillard RL, et al: Variance of indirect blood pressure measurements and prevalence of hypertension in clinically normal dogs. Am J Vet Res 52:561, 1991.
Reusch CE: Hyperadrenocorticism. In Ettinger SE and Feldman EC (eds): Textbook of Veterinary Internal Medicine, 6th ed. Philadelphia, Saunders, 2005.
Reusch CE, Feldman EC: Canine hyperadrenocorticism due to adrenocortical neoplasia. J Vet Intern Med 5:3, 1991.
Reusch CE, et al: Monitoring of individual response to o,p’-0DD during initial therapy in dogs with pituitary dependent hyperadrenocorticism. J Vet Intern Med 9:186, 1995 (abstract).
Reusch CE, et al: The efficacy of L-deprenyl in dogs with pituitary-dependent hyperadrenocorticism. J Vet Intern Med 13:291, 1999.
Rewerts JM, et al: Atraumatic rupture of the gastrocnemius muscle after corticosteroid administration in a dog. J Am Vet Med Assoc 210:655, 1997.
Reznik Y, et al: Food-dependent Cushing’s syndrome mediated by aberrant adrenal sensitivity to gastric inhibitory polypeptide. N Engl J Med 327:981, 1992.
Rijnberk A, Belshaw BE: An alternative protocol for the medical management of canine pituitary-dependent hyperadrenocorticism. Vet Rec 122:486, 1988.
Rijnberk A, et al: Assessment of two tests for the diagnosis of canine hyperadrenocorticism. Vet Rec 122:178, 1988a.
Rijnberk A, et al: Effects of bromocriptine on corticotropin, melanotropin, and corticosteroid secretion in dogs with pituitary-dependent hyperadrenocorticism. J Endocrinol 118:271, 1988b.
Rijnberk A, et al: Corticoid production by four dogs with hyperfunctioning adrenocortical tumours during treatment with mitotane (o,p'-DDD). Vet Rec 131:484, 1993.
Rijnberk A, et al: Aldosteronoma in a dog with polyuria as the leading symptom. J Vet Intern Med (in press).
Ristic JME, et al: The use of 17-hydroxyprogesterone in the diagnosis of canine hyperadrenocorticism. J Vet Intern Med 16:433, 2002.
Roberts SM, et al: Effect of ophthalmic prednisolone acetate on the canine adrenal gland and hepatic function. Am J Vet Res 45:1711, 1984.
Robinson DT, et al: The bioavailability and metabolism of trilostane in normal subjects: A comparative study using high-pressure liquid chromatographic and quantitative cytochemical assays. J Steroid Biochem 21:601, 1984.
Romantowski J: Iatrogenic adrenocortical insufficiency in dogs. J Am Vet Med Assoc 196:1144, 1990.
Ross NS, Aron DC: Hormonal evaluation of the patient with an incidentally discovered adrenal mass. N Engl J Med 323:1401, 1990.
Ruckstuhl NS, et al: Results of clinical examinations, laboratory tests, and ultrasonography in dogs with pituitary-dependent hyperadrenocorticism treated with trilostane. Am J Vet Res 63:506, 2002.
Rush JE: Vascular disease. Proceedings of the Eighth ACVIM Forum, Washington, DC, 1990, p281.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У СОБАК
375
Rutgers НС, et al: Subcellular pathologic features of glucocorticoid-induced hepatopathy in dogs. Am J Vet Res 56:898, 1995.
Safarty 0, et al: Neurologic, endocrinologic, and pathologic findings associated with large pituitary tumors in dogs: Eight cases (1976-1984). J Am Vet Med Assoc 193:854, 1988.
Samuels MH, Loriaux DL: Cushing’s syndrome and the nodular adrenal. Endocrinol Metab Clin North Am 23:555, 1994.
Scavelli TD, et al: Results of surgical treatment for hyperadrenocorticism caused by adrenocortical neoplasia in the dog: 25 cases (1980-1984). J Am Vet Med Assoc 189:1360, 1986.
Schechter RD, et al: Treatment of Cushing’s syndrome in the dog with an ad-renocorticolytic agent (o,p’-DDD). J Am Vet Med Assoc 162:629, 1973.
Schlaghecke R, et al: The effect of long-term glucocorticoid therapy on pituitary-adrenal responses to exogenous corticotropin-releasing hormone. N Engl J Med 326:226, 1992.
Schwartz A: Endocrine surgery. In Lipowitz AJ, et al (eds): Complications in Small Animal Surgery: Diagnosis, Management, Prevention. Baltimore, Williams & Wilkins, 1996, p 287.
Schwarz T, et al: Osteopenia and other radiographic signs in canine hyperadrenocorticism. J Small Anim Pract 41:491, 2000.
Selman PJ, et al: Effects of progestin administration on the hypothalamic-pituitary-adrenal axis and glucose homeostasis in dogs. J Reprod Fertil Suppl 51:345, 1997.
Shiftman F, et al: Treatment of canine embolic pulmonary hypertension with recombinant tissue plasminogen activator: Efficacy of dosing regimes. Circulation 19:214, 1988.
Silvestre L, et al: Voluntary interruption of pregnancy with mifepristone (RU486) and a prostaglandin analogue. N Engl J Med 322:645, 1990.
Small M, et al: Thromboembolic complications in Cushing’s syndrome. Clin Endocrinol 19:503, 1983.
Smiley LE, Garvey MS: The use of hetastarch as adjunct therapy in 26 dogs with hypoalbuminemia: A phase two clinical trial. J Vet Intern Med 8:195, 1994.
Smiley LE, Peterson ME: Evaluation of a urine cortisolxreatinine ratio as a screening test for hyperadrenocorticism in dogs. J Vet Intern Med 7:163, 1993.
Solter PF, et al: Assessment of corticosteroid-induced alkaline phosphatase isoenzyme as a screening test for hyperadrenocorticism in dogs. J Am Vet Med Assoc 203:534, 1994a.
Solter PF, et al: Hepatic total 3-alpha-hydroxy bile acid concentration and enzyme activities in prednisone-treated dogs. Am J Vet Res 55:1086, 1994b.
Sonino N, et al: Prolonged treatment of Cushing’s disease by ketoconazole. J Clin Endocrinol Metab 61:718, 1985.
Spitz IM, Bardin CW: Mifepristone (RU486): A modulator of progestin and glucocorticoid action. N Engl J Med 329:404, 1993.
Stein PD, et al: Clinical, laboratory, roentgenographic, and electrocardiographic findings in patients with acute pulmonary embolism and no preexisting cardiac or pulmonary disease. Chest 100:598, 1991.
Stepien RL, Rapoport GS: Clinical comparison of three methods to measure blood pressure in nonsedated dogs. J Am Vet Med Assoc 215:1623, 1999.
Sterczer A, et al: Fast resolution of hypercortisolism in dogs with portosystemic encephalopathy after surgical shunt closure. Res Vet Sci 66:63, 1998.
Stolp R, et al: Urinary corticoids in the diagnosis of canine hyperadrenocorticism. Res Vet Sci 34:141, 1983.
Stolp R, et al: Results of cyproheptadine treatment in dogs with pituitarydependent hyperadrenocorticism. J Endocrinol 101:311, 1984.
Syme HM, et al: Hyperadrenocorticism associated with excessive sex hormone production by an adrenocortical tumor in two dogs. J Am Vet Med Assoc 219:1725, 2001.
Teske E, et al: Separation and heat stability of the corticosteroid-induced and hepatic alkaline phosphatase isoenzymes in canine plasma. J Chromatogr 369:349, 1986.
Teske E, et al: Corticosteroid-induced alkaline phosphatase isoenzyme in the diagnosis of canine hypercorticism. Vet Rec 125:12, 1989.
Theon AP, Feldman EC: Megavoltage irradiation of pituitary macrotumors in dogs with neurologic signs. J Am Vet Med Assoc 213:225, 1998.
Thorner MO, et al: Approach to pituitary disease. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 8th ed. Philadelphia, WB Saunders, 1992, p 246.
Tobin R, et al: Treatment of pituitary-dependent hyperadrenocorticism in dogs using pergolide mesylate. J Vet Intern Med 12:245, 1998 (abstract).
Torres SMF, et al: Effect of oral administration of prednisolone on thyroid function in dogs. Am J Vet Res 52:412, 1991.
Totani Y, et al: Effect of metyrapone pretreatment on adrenocorticotropin secretion induced by corticotropin-releasing hormone in normal subjects and patients with Cushing’s disease. J Clin Endocrinol Metab 70:798, 1990.
Toth M, et al: Comparative analysis of plasma 17-hydroxyprogesterone and Cortisol responses to ACTH in patients with various adrenal tumors before and after unilateral adrenalectomy. J Endocrinol Invest 23:287, 2000.
Toutaih PL, et al: Pharmacokinetics of dexamethasone and its effect on adrenal gland function in the dog. Am J Vet Res 44:212, 1983.
Tran LM, et al: Radiation therapy of pituitary tumors: Results in 95 cases. Am J Clin Oncol 14:25, 1991.
Turret JM, et al: Computed tomographic characteristics of primary brain tumors in 50 dogs. J Am Vet Med Assoc 188:851, 1986.
Turton DB, et al: Incidental adrenal nodules: Association with exaggerated 17 hydroxyprogesterone response to adrenocorticotropic hormone. J Endocrinol Invest 15:789, 1992.
Tyrrell JB, et al: Glucocorticoids and adrenal androgens. In Greenspan FS (ed): Basic and Clinical Endocrinology, 3rd ed. Los Altos, Calif, Lange Medical Publications, 1991, p 323.
Van Cauter E, Refetoff S: Evidence for two subtypes of Cushing’s disease based on the analysis of episodic Cortisol secretion. N Engl J Med 312:1343, 1985.
van der Vlugt-Meijer RH, et al: Dynamic computed tomography of the pituitary gland in dogs with pituitary-dependent hyperadrenocorticism (Cushing’s disease). J Am Vet Med Assoc (in press).
Van Liew CH, et al: Comparison of results of adrenocorticotropic hormone stimulation and low dose dexamethasone suppression tests with necropsy finding in dogs: 81 cases (1985-1995). J Am Vet Med Assoc 211:322, 1997.
Vein Sluijs FJ, et al: Results of adrenalectomy in 36 dogs with hyperadrenocorticism caused by adrenocortical tumour. Vet Q 17:113, 1995.
Van Vonderen IK, et al: Influence of veterinary care on the urinary corticoid: creatinine ratio in dogs. J Vet Intern Med 12:431, 1998.
van Wijk PA, et al: Corticotropin-releasing hormone and adrenocorticotropic hormone concentrations in cerebrospinal fluid of dogs with pituitarydependent hyperadrenocorticism. Endocrinology 131:2659, 1992.
van Wijk PA, et al: Responsiveness to corticotropin-releasing hormone and vasopressin in canine Cushing’s syndrome. Eur J Endocrinol 130:410, 1994.
Vanden Bossche H, et al: From 14a-demethylase inhibitors in fungal cells to androgen and estrogen biosynthesis inhibitors in mammalian cells. Bio-chem Soc Trans 18:10, 1990.
Vandenbergh GGD, et al: Haemorrhage from a canine adrenocortical tumour: Aclinical emergency. Vet Rec 13:539, 1992.
Vassilopoulou-Sellin R, Samaan A: Mitotane administration: An unusual cause of hypercholesterolemia. Horm Metab Res 23:619, 1991.
Verheist JA, et al: Short- and long-term responses to metyrapone in the medical management of 91 patients with Cushing’s syndrome. Clin Endocrinol 35:169, 1991.
Vollmar AM, et al: Atrial natriuretic peptide concentration in dogs with congestive heart failure, chronic renal failure, and hyperadrenocorticism. Am J Vet Res 52:1831, 1991.
Von Dehn BJ, et al: Pheochromocytoma in 6 dogs with naturally acquired hyperadrenocorticism: 1982-1992. J Am Vet Med Assoc 207:322, 1995.
Voorhout G: Cisternography combined with linear tomography for visualization of the pituitary gland in healthy dogs. Vet Radiol 31:68, 1990a.
Voorhout G: X-ray-computed tomography, nephrotomography, and ultrasonography of the adrenal glands of healthy dogs. Am J Vet Res 51:625, 1990b.
Voorhout G, et al: Assessment of survey radiography and comparison with x-ray computed tomography for detection of hyperfunctioning adrenocortical tumors in dogs. J Am Vet Med Assoc 196:1799, 1990a.
Voorhout G, et al: Nephrotomography and ultrasonography for the localization of hyperfunctioning adrenocortical tumors in dogs. Am J Vet Res 51:1280, 1990b.
Ward DA, et al: Band keratopathy associated with hyperadrenocorticism in the dog. J Am Anim Hosp Assoc 25:583, 1989.
Watson ADJ, et al: Systemic availability of o,p’-DDD in normal dogs, fasted and fed, and in dogs with hyperadrenocorticism. Res Vet Sci 43:160, 1987.
Watson ADJ, et al: Plasma Cortisol responses to three corticotrophic preparations in normal dogs. Aust Vet J 76:255, 1998.
West JB: Pulmonary Pathology. The Essentials, 4th ed. Baltimore, Williams & Wilkins, 1992, p51.
White PC: Disorders of aldosterone biosynthesis and action. N Engl J Med 331:250, 1994.
White SD, et al: Cutaneous markers of canine hyperadrenocorticism. Compend Contin Educ 11:446, 1989.
Whittemore JC, et al: Nontraumatic rupture of an adrenal gland tumor causing intraabdominal or retroperitoneal hemorrhage in four dogs. J Am Vet Med Assoc 219:329, 2001.
Widmer WR, Guptill L: Imaging techniques for facilitating diagnosis of hyperadrenocorticism in dogs and cats. J Am Vet Med Assoc 206:1857, 1995.
Wiedmeyer CE, et al: Alkaline phosphatase expression in tissues from glucocorticoid-treated dogs. Am J Vet Res 63:1083, 2002.
Willenberg HS, et al: Aberrant interleukin-1 receptors in a cortisol-secret-ing adrenal adenoma causing Cushing’s syndrome. N Engl J Med 339:27, 1998.
Wilson SM, Feldman EC: Diagnostic value of the steroid-induced isoenzyme of alkaline phosphatase in the dog. J Am Anim Hosp Assoc 28:245, 1992.
Yamaji T, et al: Plasma levels of atrial natriuretic hormone in Cushing’s syndrome. J Clin Endocrinol Metab 67:348, 1988.
Zenoble RD, Kemppainen RJ: Adrenocortical suppression by topically applied corticosteroids in healthy dogs. J Am Vet Med Assoc 191:685, 1987.
Zerbe CA: Etiology of pituitary dependent hyperadrenocorticism. Proceedings of the Tenth AC VIM Forum, San Diego, Calif, 1992, p 360.
Zerbe CA: Screening tests to diagnose hyperadrenocorticism in cats and dogs. Compend Contin Educ 22:17, 2000a.
Zerbe CA: Differentiating tests to evaluate hyperadrenocorticism in dogs and cats. Compend Contin Educ 22:149, 2000b.
Zerbe CA, et al: Use of metyrapone for differentiation of spontaneous hyperadrenocorticism in the dog. American College of Veterinary Internal Medicine Scientific Proceedings, Washington, DC, 1986 (abstract).
Zerbe C A, et al: Adrenal function in 15 dogs with insulin-dependent diabetes mellitus. J Am Vet Med Assoc 193:454, 1988.
Г лава 7
ГИПЕРКОРТИЦИЗМ (СИНДРОМ
КУШИНГА) У КОШЕК
ЭТИОЛОГИЯ.......................377
Ятрогенный синдром Кушинга......377
Спонтанный синдром Кушинга у кошек (ССКК).......................378
ВСТРЕЧАЕМОСТЬ (ВОЗРАСТ, ПОЛ, ПОРОДА)......................378
ДЛИТЕЛЬНОСТЬ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ, ОСНОВНЫЕ ЖАЛОБЫ И ОБЩИЙ АНАМНЕЗ..............378
Длительность клинических проявлений...................378
Основные жалобы владельцев животных..........379
Наблюдения владельцев........380
НАРУШЕНИЯ, ВЫЯВЛЯЕМЫЕ ПРИ
ФИЗИКАЛЬНОМ ОБСЛЕДОВАНИИ......380
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ АНАМНЕСТИЧЕСКОГО АНАЛИЗА И
ФИЗИКАЛЬНОГО ОБСЛЕДОВАНИЯ.... 381
Полиурия и полидипсия...........381
Потеря веса.....................382
Мышечная слабость, сонливость, отвислый живот, кровоточивость....382
Загибание кончиков ушей.........382
Кожные расстройства.............382
НАРУШЕНИЯ, ВЫЯВЛЯЕМЫЕ ПРИ
РУТИННЫХ КЛИНИЧЕСКИХ АНАЛИЗАХ (ОБЩИЙ КЛИНИЧЕСКИЙ АНАЛИЗ КРОВИ, БИОХИМИЧЕСКИЙ АНАЛИЗ СЫВОРОТКИ КРОВИ, АНАЛИЗ МОЧИ)384
Общий клинический анализ крови (ОАК)...........384
Биохимический анализ сыворотки крови и анализ мочи................384
ЭНДОКРИНОЛОГИЧЕСКИЕ СКРИНИНГОВЫЕ ТЕСТЫ...........388
Отношение концентраций кортизола и креатинина в моче (КОР/КРЕ)..388
Провокационная проба с АКТГ....390
Проба с низкими дозами дексаметазона................393
ДИСКРИМИНАЦИОННЫЕ ПРОБЫ ДЛЯ ДИФФЕРЕНЦИАЦИИ ЗАВИСИМОГО ОТ ГИПОФИЗА И ВЫЗВАННОГО ОПУХОЛЬЮ НАДПОЧЕЧНИКОВ СИНДРОМА КУШИНГА........................396
Ингибирующая проба с высокими дозами дексаметазона (ПВДД).........396
Определение концентрации эндогенного АКТГ.............399
Рентгенологическое исследование брюшной полости..............401
Ультразвуковое исследование брюшной полости..............401
Биопсия под контролем ультразвукового исследования.402
КОМПЬЮТЕРНАЯ (КТ) И МАГНИТНО-
РЕЗОНАНСНАЯ (МРТ) ТОМОГРАФИЯ .403
Общие сведения..................403
Здоровые кошки..................403
Результаты....................403
Выводы........................404
ЛЕЧЕНИЕ ГИПЕРКОРТИЦИЗМА
ЗАВИСИМОГО ОТ ГИПОФИЗА......404
Гипофизэктомия................404
Облучение гипофиза............406
Медикаментозная терапия.......407
Двусторонняя адреналэктомия...408
ЛЕЧЕНИЕ ГИПЕРКОРТИЦИЗМА, ВЫЗЫВАЕМОГО ОПУХОЛЯМИ
НАДПОЧЕЧНИКОВ...............410
Общая характеристика..........410
Хирургическое лечение и ведение периоперационного периода.....410
Клинический опыт..............411
Прогноз.......................411
ПЕРВИЧНЫЙ ГИПЕРАЛЬДОСТЕРОНИЗМ
У КОШЕК (ОПУХОЛИ НАДПОЧЕЧНИКОВ
СЕКРЕТИРУЮЩИЕ АЛЬДОСТЕРОН)...412
Общая характеристика..........412
Клинический опыт..............412
Выводы........................413
ПЕРВИЧНЫЕ ОПУХОЛИ НАДПОЧЕЧНИКОВ,
СЕКРЕТИРУЮЩИЕ ПРОГЕСТЕРОН, У КОШЕК ....................413
Общая характеристика..........413
Клинический опыт..............415
Выводы........................416
Список сокращений
АГТ - аминоглютетинид
АКТГ - адренокортикотропный гормон
AM - азот мочевины
ГЗГ - гиперкортицизм зависимый от гипофиза
ГОН - гиперкортицизм, обусловленный
опухолью надпочечников
ДОКП - дезоксикортикостерона пивалат о,р’-ДДД - митотан
КОР/КРЕ - отношение концентрации кортизола к концентрации креатинина в моче
КРГ - кортикотропин рилизинг-гормон
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
ОАК - общий клинический анализ крови
ПВДД - проба с высокими дозами дексаметазона
ПД - полидипсия
ПНДД - проба с низкими дозами дексаметазона
ПУ - полиурия
ССКК - спонтанный синдром Кушинга у кошек
Т4 - тироксин
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
В 1932 году д-р Гарвей Кушинг представил сообщение, в котором описал группу лиц с расстройством, которое, как он считал, было «следствием гипофизарной базофилии». Последующие клинические, биохимические и гистологические исследования этих пациентов показали, что все они имели синдром, обусловленный хроническим воздействием повышенной концентрации кортизола в крови. Эпоним синдром Кушинга служит «рамочным термином» для обозначения данного клинического состояния (гиперкортицизма) у людей, а с
недавних пор и у животных. Хронический избыток кортизола может быть результатом ятрогенного эффекта введения кортизола, но может развиваться спонтанно. Поэтому патофизиологическая классификация причин синдрома Кушинга включает несколько разных клинических состояний. Развитие синдрома Кушинга может быть вызвано, помимо ятрогенных факторов, гипофизарной опухолью, продуцирующей избыточное количество АКТГ, что приводит к гиперплазии коры надпочечников и избыточной секрецией кортизола. Другой частой при-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 377
чиной спонтанного заболевания животных служит автономно функционирующая опухоль коры надпочечников, секретирующая избыточные количества кортизола. Ниже будет показано, что опухоли коры надпочечников синтезируют и другие стероидные гормоны, помимо кортизола. У кошек были обнаружены такие опухоли, которые одновременно с кортизолом продуцировали избыточные количества прогестерона и альдостерона.
Установлено, что опухоли гипофиза, секретирующие АКТГ, образованы единственной линией аберрантных клеток, которые автономно продуцируют и выделяют большие количества АКТГ, что, в свою очередь, приводит к хроническому избытку кортизола и гиперплазии коры надпочечников. Это не очень частое, но хорошо известное расстройство у людей. Еще реже у человека встречаются автономные первичные опухоли коры надпочечников, секретирующие кортизол, которые также обусловливают избыток этого гормона в организме. Ятрогенный избыток кортизола, вызванный хроническим введением экзогенного АКТГ, до сих пор не встречался, однако хроническая глюкокортикоидная терапия является частой причиной синдрома Кушинга. Известны и другие формы данного синдрома, но они довольно редки и не имеют существенного значения в ветеринарии.
Ветеринария, в частности ветеринария собак и кошек, в большой степени базируется на результатах, полученных при изучении клинических состояний, диагностике и лечении заболеваний человека. Исследования, проведенные врачами, весьма полезны и для ветеринаров, и человек как модель очень часто используется в ветеринарии. Во многих случаях данные, полученные на людях, применяются к собакам, а после оценки результатов переносятся на кошек. В некоторых ситуациях болезни кошек аналогичны болезням собак, а в других - болезням людей. Конечно, ряд заболеваний специфичен для кошек. Что же касается гиперкортицизма (синдрома Кушинга), то здесь у кошек больше общего с людьми, чем с собаками. Самое большое сходство в частоте встречаемости гиперкортицизма - это заболевание весьма распространено среди собак, но довольно редко у людей и кошек.
Мы полагаем, что гиперкортицизм у людей, собак и кошек вызван сходными физиологическими причинами. Поэтому читатели, интересующиеся вопросами прикладной физиологии и патогенетическими механизмами данного заболевания, могут обратиться к соответствующим разделам в гл.6. В настоящей главе основное внимание сосредоточено на обзоре клинических особенностей гиперкортицизма у кошек. Чтобы обсуждение было более продуктивным, мы дополнили данные, полученные в нашей клинике на 46 кошках со спонтанным гиперкортицизмом, информацией еще о 24 животных, почерпнутой из литературных источников (Immink et al, 1992; Daley et al, 1993; Goossens et al, 1995; Warson, Heritage, 1998; Moore et al, 2000a; Meij et al, 2001).
Таким образом, обсуждение базируется на результатах исследований 70 животных. Мы использовали литературные данные, появившиеся не ранее 1992 г. Такой выбор гарантирует, что все животные были обследованы с применением современных, надежных методов, а полученные результаты интерпретировались в свете принятых в настоящее время концепций диагностики и лечения гиперкортицизма. До 1900 г было лишь несколько сообщений о кошках с этим заболеванием (Meijer et al, 1978; Peterson, Steele, 1986; Zerbe et al, 1987; Nelson et al, 1998). Кроме того, при отборе публикаций мы пользовались следующими критериями: каждое животное должно было иметь клинические симптомы, характерные для синдрома Кушинга, а каждый диагноз - подтвержден данными соответствующих скрининговых тестов, результатами гистологического исследования и визуализации с использованием соответствующих современных методов, таких как компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). Сообщения, не отвечавшие перечисленным критериям, не использовались.
ЭТИОЛОГИЯ
Ятрогенный синдром Кушинга
Среди многих видовых различий выделяется частота заболеваемости ятрогенным синдромом Кушинга, который очень широко распространен среди людей и собак, но редко встречается у кошек. Это отчасти объясняется относительной «нечувствительностью» кошек к отрицательному или патологическому побочному действию глюкокортикоидов при их хроническом введении. Нам известны только три сообщения о кошках с ятрогенным синдромом Кушинга, опубликованных в литературе на протяжении последних 10 лет. В отличие от этого, число сообщений о людях и собаках с ятрогенным синдромом Кушинга весьма значительно.
Были опубликованы результаты нескольких лабораторных исследований, в которых кошкам экспериментально вводили глюкокортикоиды. У животных, которые получали эти препараты в течение 4 недель, при физикальном исследовании были выявлены некоторые расстройства, однако изменения гематологических и биохимических характеристик отсутствовали (Scott et al, 1979; Scott et al, 1982). При введении глюкокортикоидов в течение 9 месяцев или дольше отмечали полиурию, полидипсию, полифагию, увеличение живота, истончение кожи и загибание кончиков ушей. У некоторых животных увеличивались размеры печени, уменьшалась мышечная масса, появлялись кровоподтеки и повышалась хрупкость кожи (Scott et al, 1982). Отмечалась также тенденция к возникновению слабых гипергликемии и гиперхолестеринемии, накоплению гликогена в гепатоцитах и вакуолярной гепатопа-тии. У некоторых лабораторных кошек топическое
378 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
применение глюкокортикоидов индуцировало катаракту (Brightman, 1982; Zhan et al, 1992). Мышечная слабость, обусловленная введением глюкокортикоидов, была в наибольшей степени вызвана их воздействием на быстро сокращающиеся волокна (Robinson, Clamann, 1988).
Описаны три кошки, принадлежащие частным владельцам, у которых хронический избыток глюкокортикоидов давал ятрогенный эффект. Эти животные получали глюкокортикоидную терапию по поводу стоматита, инфекционного перитонита кошек (ИПК) и зуда ( Greene et al, 1995; Schaer, Ginn, 1999; Ferasin, 2001). Во время последнего обращения за ветеринарной помощью одна из этих кошек была в тяжелом состоянии вследствие ИПК. К числу наиболее характерных клинических симптомов, вызванных хроническим введением глюкокортикоидов, у всех трех животных относились большой живот, уменьшение мышечной массы, плохое состояние шерстяного покрова и ломкость кожи, которая приводила к повышенной кровоточивости, разрывам и истончению кожи. У двух кошек была повышена активность печеночных ферментов и развилась вакуолярная гепатопатия, что напоминало ситуацию у собак с тем же заболеванием. Основной вывод из трех цитированных сообщений состоит в том, что ятрогенный синдром Кушинга - редкое заболевание у кошек. Кроме того, некоторые клинические симптомы у кошек, хронически получающих экзогенные стероиды, отсутствуют у кошек со спонтанно развившимся синдромом Кушинга.
Спонтанный синдром Кушинга у кошек (ССКК)
Спонтанный синдром Кушинга у кошек (ССКК) обусловлен теми же причинами, что у людей и собак. Было предположено, что относительно редкая встречаемость спонтанного заболевания у кошек по сравнению с собаками объясняется их резистентностью к побочным эффектам глюкокортикоидной терапии. Но если избыток глюкокортикоидов вызывает лишь несколько клинических симптомов, то на каком основании может возникнуть подозрение именно на ССКК? С другой стороны, при оценке «на глаз» спонтанное заболевание регистрируется у кошек примерно столь же часто, как у людей, хотя люди более чувствительны к действию глюкокортикоидов. Поэтому мы полагаем, что кошки просто реже заболевают спонтанным синдромом Кушинга, чем собаки.
Как бы то ни было, большинство (примерно 80%) кошек с ССКК страдают гиперкортицизмом зависимым от гипофиза (ГЗГ), а остальные (около 20%) гиперкортицизмом, обусловленным опухолями коры надпочечников (ГОН). У кошек с ГЗГ имеет место автономная секреция АКТГ, синтезируемого гипофизарной аденомой (описано также несколько случаев карциномы гипофиза у кошек). Приблизительно половина гипофизарных опухолей
имеет микроскопические размеры, а остальные достаточно велики, так что их можно увидеть с помощью КТ или МРТ, либо легко идентифицировать невооруженным глазом во время хирургической операции или при патологоанатомическом исследовании (обычно их максимальный диаметр превышает З-4 мм). Примерно у 50% кошек автономно функционирующие опухоли коры надпочечников представлены аденомами, а у другой половины - карциномами.
ВСТРЕЧАЕМОСТЬ (ВОЗРАСТ, ПОЛ, ПОРОДА)
Гиперкортицизм - это болезнь взрослых и старых кошек. Средний возраст 39 кошек с диагнозом ГЗГ составлял 10,7 лет (диапазон от 5 до 16 лет) (табл. 7-1). Средний возраст 12 животных с активно функционирующими опухолями коры надпочечников равнялся 12 годам (диапазон от 8 до 15 лет). Средний возраст всех 51 животных был около 11 лет. Среди них было 25 самцов и 26 самок. Почти все животные с диагнозом ССКК были кастрированы. Гиперкортицизм описан у кошек самых разных пород. Как видно из табл. 7-2, чаще всего ССКК встречался у беспородных короткошерстных кошек (31 из 51 или 61%). Вместе с беспородными длинношерстными кошками их общее число составляло 38 (75%).
ДЛИТЕЛЬНОСТЬ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ, ОСНОВНЫЕ ЖАЛОБЫ И ОБЩИЙ АНАМНЕЗ
Длительность клинических проявлений
В имеющихся в нашем распоряжении материалах данные о длительности клинических проявлений ССКК или сроках, в течение которых от владельцев поступали соответствующие жалобы, имеются для
ТАБЛИЦА 7-1. ВОЗРАСТ КОШЕК (51 ОСОБЬ)* НА МОМЕНТ УСТАНОВЛЕНИЯ ДИАГНОЗА ГИПЕРКОРТИЦИЗМА
Возраст (годы)
5
6
7
8
9
10
11
12
13
14
15
16 Средний
Число кошек с гиперкортицизмом зависимым от гипофиза
i
5
2
3
3
4
4
5
3
4
2
3 10,7 года
Число кошек с гиперкортицизмом, вызванным опухолью коры надпочечников
1
2
1
3
1
2
2
12 лет
*) Средний возраст 51 особи — 10,9 лет.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 379
ТАБЛИЦА 7-2. ПОРОДЫ КОШЕК, У КОТОРЫХ ВСТРЕЧАЕТСЯ СПОНТАННЫЙ СИНДРОМ КУШИНГА (ВСЕГО 51 КОШКА)
Порода ГЗГ* гон*
Число Процент Число Процент
Беспородная короткошерстная 23 59 8 67
Беспородная длинношерстная 6 15 1 8
Сиамская 2 5 1 8
Персидская 2 5 1 8
Абиссинская 2 5 —
Европейская короткошерстная 2 5 — —
Девон Рекс 1 3 — —
Японская короткохвостая — — 1 88
Русская голубая 1 3 — —
Всего 39 12
*) Здесь и далее: ГЗГ - гиперкортицизм, зависимый от гипофиза; ГОН - гиперкортицизм, обусловленный опухолью надпочечников
43 кошек (табл. 7-3). Симптоматика ССКК сохранялась на протяжении периода от одного месяца до года и более. У 41 из 43 обследованных кошек с ГЗГ или ГОН длительность клинических проявлений не превышала одного года.
Основные жалобы владельцев животных
Полезно различать «главные жалобы владельцев животных» от «наблюдений владельцев». Главная жалоба - это основная причина, побуждающая владельца обратиться за ветеринарной помощью. Само собой разумеется, что вывод, к которому приходит ветеринар после анализа этой жалобы, далеко не всегда подтверждает ее обоснованность. Столь же очевидно, что окончательное заключение на основании результатов тщательного физикального обследования может совершенно не совпадать с главной жалобой владельца.
Основной среди жалоб, поступивших от владельцев 48 кошек с ССКК, была «трудность регулировать сахарный диабет» (у 26 животных, 54%). Чаще всего сахарный диабет не поддавался компенсации с помощью инсулинотерапии, и у животных сохра-
ТАБЛИЦА 7-3. ПРОДОЛЖИТЕЛЬНОСТЬ КЛИНИЧЕСКОЙ СИМПТОМАТИКИ, ПРЕДШЕСТВУЮЩЕЙ УСТАНОВЛЕНИЮ ДИАГНОЗА ГИПЕРКОРТИЦИЗМА У КОШЕК (43 КОШКИ)
Продолжительность (месяцы) Число кошек с ГЗГ Число кошек с ГОН
1 2 —
2 5 1
3 5 1
4 3 2
5 3 2
6 3 1
7 1 3
8 2 —
9 1 —
10 2 —
11 — —
12 2 2
Более 12 2 —
нялись устойчивая полиурия, полидипсия и/или полифагия (табл. 7-4). Реже владельцы жаловались на неудовлетворительную компенсацию диабета, когда они замечали у животных снижение веса тела или отсутствие его прироста, а также сонливость и недостаточно тщательный уход за шерстью. Однако из рассказов владельцев было не всегда ясно, в какой степени они связывают возникновение любого из этих нарушений непосредственно с неудовлетворительным контролем сахарного диабета. Нередко владельцы обращались в клинику для углубленного обследования животных после того, как на уровне первичной ветеринарной помощи многократно менялись тип и дозы инсулина в попытке добиться адекватной компенсации диабета.
Среди рассматриваемых в настоящем разделе 48 кошек сахарный диабет был у 37. У 11 из этих 37 особей заболевание было хорошо компенсировано с помощью инсулинотерапии. Владельцы 8 из 11 кошек, не имевших диабета, жаловались, главным образом, на полиурию (ПУ) и/или полидипсию (ПД). Другие основные жалобы были очень разнообразны, но относительно редки (см. табл. 7-4).
ТАБЛИЦА 7-4. ОСНОВНЫЕ
ЖАЛОБЫ ВЛАДЕЛЬЦЕВ КОШЕК С ОКОНЧАТЕЛЬНЫМ ДИАГНОЗОМ
ГИПЕРКОРТИЦИЗМА (ВСЕГО 48 КОШЕК, ИЗ КОТОРЫХ 37 ИМЕЛИ САХАРНЫЙ
ДИАБЕТ)
Жалоба ГЗГ (36 ГОН (12
____________________________кошек )___кошек)
Инсулинорезистентный сахарный диабет (ПД, ПУ, ПФ)* Полиурия, полидипсия (у 11 ко- 22 4
шек без сахарного диабета) 6 2
Ломкость кожи (разрывы) 3 3
Снижение веса тела 2 —
Сонливость 2 2
Алопеция/отсутствие возобнов- 2 2
ления роста шерсти Диарея 2 —
Общая слабость 1 —
Рвота 1 —
Увеличение живота 1 1
Отсутствие ухода за шерстью 1 -
*) ПД - полидипсия, ПУ - полиурия, ПФ - полифагия
380
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
Они включали ломкость кожи (разрывы) у шести кошек (12%), сонливость у четырех, алопеция или отсутствие роста выбритой шерсти еще у четырех кошек.
Наблюдения владельцев
Сводка имеющихся наблюдений. Данные наблюдений за состоянием животных получены от владельцев 62 кошек с диагнозом ССКК (табл. 7-5).
К числу наиболее обычных расстройств относятся ПУ/ПД у 51 кошки (82%), полифагия у 42 (68%), снижение веса или отсутствие его прироста у 32 (52%), сонливость или «слишком долгий сон» у 29 (47%). Жалобы на проблемы с кожным покровом поступали 61 раз. Они включали сильно повышенную ломкость кожи или ее разрывы у шести кошек, а также отсутствие возобновления выбритой шерсти (обычно после венопункции или УЗИ брюшной полости). Кроме того, владельцы отмечали, что животные слишком тщательно или, наоборот, слабо ухаживают за шерстью, а ее состояние ухудшается и шерсть становится необычно грубой. У некоторых кошек имелись множественные дерматологические расстройства, тогда как у других они полностью отсутствовали. Владельцы 21 кошки с ГЗГ (из общего числа 50 или 42%) и 3 кошек с ГОН (из общего числа 12 или 25%) не наблюдали никаких кожных расстройств или изменения состояния шер
ТАБЛИЦА 7-5. РАССТРОЙСТВА, ОТМЕЧАЕМЫЕ ВЛАДЕЛЬЦАМИ КОШЕК СО СПОНТАННЫМ ГИПЕРКОРТИЦИЗМОМ (ВСЕГО 62 КОШКИ )
сти. Сходство наблюдений владельцев кошек с ГЗГ и ГОН лишний раз подчеркивает наличие общего знаменателя ССКК у всех этих животных - хронического воздействия избыточной концентрации кортизола в крови.
Существует мнение, что клинические признаки гиперкортицизма обычно не выявляются владельцами кошек или ветеринарами до тех пор, пока у животных с ССКК не разовьются симптомы сахарного диабета. Результаты настоящего обзора подтверждают, что в большинстве случаев это мнение вполне справедливо. Тем не менее, некоторые из признаков ССКК могут предшествовать проявлениям сахарного диабета, а у некоторых кошек с ССКК диабет вообще отсутствует. Поэтому вероятность ССКК нельзя исключать при анамнестическом анализе и физикальном обследовании животных без сахарного диабета. У недиабетических кошек диагноз ССКК возможен на основании таких нарушений, как истончение и ломкость кожи, «отвислый живот», мышечная атрофия, общая слабость, ПУ/ПД и изменение состояния шерстяного покрова.
НАРУШЕНИЯ, ВЫЯВЛЯЕМЫЕ ПРИ ФИЗИКАЛЬНОМ ОБСЛЕДОВАНИИ
Таблица 7-6 содержит перечень нарушений, выявленных при физикальном обследовании 62 кошек с ГЗГ и ГОН. Как и следовало ожидать, многие вышеописанные жалобы владельцев подтверждались специалистами при физикальном обследовании. К числу наиболее распространенных расстройств относятся явное увеличение размеров живота у 41
Расстройство ГЗГ (50 кошек) ГОН (12 кошек) ТАБЛИЦА 7-6. НАРУШЕНИЯ,
Число Процент Число Процент ВЫЯВЛЕННЫЕ ПРИ ФИЗИКАЛЬНОМ
Полиурия, полидипсия 40 80 11 92 ОБСЛЕДОВАНИИ КОШЕК СО
Полифагия 34 68 8 67 СПОНТАННЫМ ГИПЕРКОРТИЦИЗМОМ
Уменьшение веса тела 26 52 6 50 (ВСЕГО 62 КОШКИ)
Сонливость
(увеличение 22 44 7 58 Нарушения ГЗГ (50 кошек ) ГОН (12 кошек)
продолжительности сна) Число Про- Число Про-
Общая слабость Алопеция/ 1R Тб 3 25 цент цент
Увеличение жи- 64
отсутствие возобновления 17 34 10 83 вота (отвислый живот) 32 9 75
роста шерсти Мышечная атро- 32 64 7 58
Прекращение ухода за шерстью Жесткая шерсть 10 9 20 18 4 2 33 17 фия Истончение кожи Неухоженный шер- 28 28 56 56 10 5 83 42
Уменьшение стяной покров
аппетита 4 8 2 17 Выпадение шерсти 12 24 2 17
Ломкая кожа Гепатомегалия 9 18 3 25
(разрывы) 3 6 3 25 Разрывы кожи 7 14 1 8
Увеличение веса Стопохождение 7 14 2 17
тела, отвислый 3 6 2 17 Повышенная кро- 6 12 з 25
живот воточивость
Чрезмерный уход Себорея 2 4 4 33
за шерстью Пальпируемая опу-
Диарея 2 4 — холь в надпочеч- — — 2 17
Рвота 1 2 — — никах
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 381
особи (66° о, рис. 7-1, Л и Б), мышечная атрофия у 39 (63%), истончение кожи у 38 (61%) и «неухоженная» шерсть у 33 кошек (53%). Реже отмечались выпадение шерсти, гепатомегалия, разрывы кожи, стопохождение (задние конечности), кровоточивость и себорея. В одном сообщении описаны две кошки с ГОН, у которых пальпировалась внутри-брюшная масса, оказавшаяся (при последующем исследовании) неопластической надпочечниковой железой (Mink et al, 1992). Такие случаи обнаружения пальпируемой опухоли коры надпочечников у кошек считаются достаточно редкими.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ АНАМНЕСТИЧЕСКОГО АНАЛИЗА И ФИЗИКАЛЬНОГО ОБСЛЕДОВАНИЯ
Полиурия и полидипсия
Полиурия и полидипсия (ПУ/ПД), полифагия и уменьшение веса тела являются основными признаками сахарного диабета. Поскольку у большинства кошек с ССКК имеется также сахарный диабет (обычно как следствие избыточной продукции кортизола, приводящей к инсулинорезистентности).
наличие ПУ/ПД представляется вполне естественным. Тем не менее, некоторые кошки с ССКК нс болеют диабетом.
Полиурия и полидипсия - весьма обычные клинические признаки у собак с повышенной концентрацией кортизола в крови. Поскольку у собак с гиперкортицизмом сопутствующий сахарный диабет встречается нечасто, считают, что полидипсия и полиурия развиваются у них вторично, как следствие нссахарного диабета центрального или нефрогенного генеза, обусловленного избыточной концентрацией кортизола в крови. Несмотря на частую встречаемость ПУ/ПД у собак (нередко единственная жалоба владельцев), это расстройство гораздо реже регистрируется у людей со спонтанным или ятрогенным избытком кортизола. Точно также это побочное явление редко отмечается у кошек, у которых оно может быть связано с несахарным диабетом (при отсутствии гликозурии).
Восемь из 11 кошек с ССКК без сахарного диабета, по мнению их владельцев, имели ПУ/ПД. Интерпретация этих случаев осложнялась тем обстоятельством, что у подавляющего большинства собак с гиперкортицизмом удельный вес произвольно взятых проб мочи не превышал 1,024, а одновремен-
Рис. 7-1. А. Двенадцатилетний koi с синдромом Кушинга кошачьих (ССКК). Обратите внимание на «неухоженный» шерстяной покров. Б. Обратите внимание на внешний вид животного и истончение кожи. (Шерсть на животе была выбрита для проведения ультразвукового исследования)
382 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
но определявшиеся концентрации азота мочевины (AM) и креатинина в сыворотках были нормальными или пониженными. В отличие от этого только небольшой процент проб мочи, полученных от 58 кошек с ССКК (50 с ГЗГ и 8 с ГОН), имел удельный вес ниже 1,024 (только у 5 особей или 9%). У всех пяти кошек концентрация AM и/или креатинина в сыворотках крови была повышена. Таким образом, ПУ/ПД отмечаются почти исключительно у кошек с гликозурией или заболеванием почек. Не исключено также, что у некоторых кошек имели место преходящие инсулинорезистентность, гликозурия и/или вторичные ПУ/ПД. Гипергликемия и гликозурия могут не проявляться во время обследования животных в условиях стационара.
Полифагия - обычное явление у собак в отсутствие сахарного диабета. Однако природа этого явления как следствия избыточной продукции кортизола еще до конца не понята и, во всяком случае, оно не представляет серьезной проблемы, связанной с хроническим воздействием кортизола у людей и кошек.
Потеря веса
У большинства кошек с ССКК снижение веса является следствием сахарного диабета. Это классический клинический признак диабета у особей любого вида. Относительная или абсолютная недостаточность инсулина при этом заболевании приводит к нарушению утилизации глюкозы и физиологическому состоянию, которое аналогично голоданию. Организм отвечает на это состояние усилением биосинтеза глюкозы в печени из продуктов распада мышечной и жировой ткани, а уменьшение массы мышц и жира, в свою очередь, приводит к снижению веса тела. Поскольку большинство кошек с ССКК страдают сахарным диабетом и поскольку в большинстве случаев он недостаточно контролируется (что бы ни думали по этому поводу владельцы животных или ветеринары), прирост веса происходит медленно или отсутствует. Некоторые животные остаются худыми, несмотря на большой живот, а другие продолжают терять вес даже в условиях инсулиновой терапии. Почти во всех случаях, когда владелец животного с ССКК замечает снижение веса или отсутствие его прироста, имеет место сопутствующий сахарный диабет. Считается, что у животных без диабета вес тела уменьшается вследствие катаболизма белка под воздействием избыточного количества кортизола. Снижение веса или худоба кошки являются важными признаками ССКК, которые используются в целях дифференциальной диагностики инсулинорезистентности и акромегалии - состояния, при котором вес увеличивается.
Мышечная слабость, сонливость, отвислый живот, кровоточивость
Эти клинические признаки непосредственно связаны с физиологическим действием кортизола.
Индуцируемый кортизолом катаболизм белков ведет к распаду мышечной ткани, что служит причиной общей слабости и сонливости, которые заметны хозяину животного. Кроме того, у некоторых кошек с ССКК развивается стопохождение, которое нередко связано с нейропатией, сопутствующей сахарному диабету. Хроническое воздействие кортизола легко распознается также по перераспределению жира, приводящему к уменьшению его содержания в различных частях тела и преимущественному отложению в брюшной области (брыжейке). Это классическое расстройство, общее для людей, собак и кошек. Отложение брюшного жира в сочетании с уменьшением мышечной массы обусловливает такую характерную черту как отвислый живот - классический признак синдрома Кушинга у всех видов. Отвислый живот - это клиническое проявление увеличения веса содержимого брюшной полости, который давит на ослабленную мускулатуру брюшной стенки (см. рис. 7-1, А и Б).
Кортизол, помимо прочего, ухудшает заживление ран, так как усиливает ломкость кровеносных сосудов и подавляет фиброзную реакцию на травму. Потеря подкожного жира (мобилизируемого в брюшную область) и хрупкость кровеносных сосудов, которые из-за уменьшения жировой прослойки оказываются лежащими ближе к поверхности тела, создают предпосылки для усиления кровоточивости и, таким образом, нарушают нормальный процесс заживления ран. У многих кошек кровотечения после венопункции или стрижки представляют серьезную опасность.
Загибание кончиков ушей
Одним из проявлений катаболического эффекта избыточной секреции кортизола служит общее уменьшение прочности связок, сухожилий и хрящевых структур. В частности, первые сообщения о синдроме Кушинга у кошек содержали описание «загибания кончиков ушей». Тем не менее, мы не нашли указаний на этот клинический признак в использованных для настоящего обзора материалах наблюдений за 70 кошками с ССКК. Таким образом, хотя уменьшение прочности ушного хряща и могло быть причиной загибания кончиков ушей, это, по-видимому, встречается нечасто или просто не привлекает внимания ветеринаров.
Кожные расстройства
Двусторонняя симметричная незудящая алопеция является обычным и характерным клиническим симптомом синдрома Кушинга у собак, но нетипична для кошек. Алопеция, которую наблюдают многие владельцы кошек с ССКК, обусловлена отсутствием возобновления роста шерсти, выбритой ветеринаром, или выпадением волос в процессе нормального или чрезмерного ухода за шерстяным
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 383
покровом (рис. 7-2, А и Б). Трудно судить, в какой степени «избыточный» уход за шерстью является действительно аномальным явлением Должен ли владелец бить тревогу, если кошка чистит шерсть как обычно и тем нс менее, теряет ее? Или если она вылизывает себя чаще, чем обычно? Отсутствие восстановления потерянной шерсти, скорее всего, является следствием атрофии волосяных фолликулов в результате которой нарушается фиксация в них стержня волоса. Вновь отрастающая шерсть тоньше нормальной, редкая и отличается повышенной ломкостью.
Типичными следствиями хронически избыточной продукции кортизола являются истончение кожи (рис. 7-3, А и Б), плохое заживление ран и повышенная чувствительность к инфекции. Эти расстройства усугубляются подавлением функции иммунной системы у животных с синдромом Кушинга. У собак с этим заболеванием ломкость кожи не является типичным клиническим признаком, в то время как у людей она хорошо известна и описана также у кошек, хотя встречается у них нечасто (рис. 7-4, А и Б; см. табл. 7-5 и 7-6). Рассматриваемые кожные расстройства весьма опасны и могут приводить к общему заражению крови, создавая угрозу жизни пораженному животному. Истончение кожи является проявлением катаболического действия кортизола.
Рис. 7-3. А. Одиннадцатилетний кот с ССКК. У животного имелась опухоль, секретирующая прогестерон. Б. Обратите внимание на истончение кожи, которое иногда обусловлено хроническим действием избыточных количеств кортизола.
Рис 7-2. А. Десятилетняя кошка с ССКК. Б Обратите внимание на выпадение волос, которое иногда обусловлено хроническим воздействием избыточных количеств кортизола.
Рис. 7-4. Л. Разрыв кожи у 15-летнего кота с ССКК. Б. Ломкость кожи у 10-летнего кота, которая иногда обусловлена хроническим действием избыточных количеств кортизола.
384 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
НАРУШЕНИЯ, ВЫЯВЛЯЕМЫЕ ПРИ РУТИННЫХ КЛИНИЧЕСКИХ АНАЛИЗАХ (ОБЩИЙ КЛИНИЧЕСКИЙ АНАЛИЗ КРОВИ, БИОХИМИЧЕСКИЙ АНАЛИЗ СЫВОРОТКИ КРОВИ, АНАЛИЗ МОЧИ)
Ветеринарные врачи, имеющие дело с мелкими животными (собаками и кошками), хорошо знакомы с синдромом Кушинга. Это объясняется, главным образом, большим числом показаний к применению кортикостероидов для лечения разнообразных клинических расстройств у собак. В связи с широко практикуемым применением глюкокортикоидной терапии ветеринары хорошо знают ее эффекты и побочное действие, которое приводит к тем же клиническим признакам и нарушениям лабораторных показателей, которые отмечаются при ятрогенном или спонтанном синдроме Кушинга у собак. Поэтому при обследовании собаки с синдромом Кушинга ветеринар ожидает найти ПУ/ПД, изос-тенурию/гипостенурию, находящуюся на нижней границе нормы или низкую концентрацию AM в сыворотке крови и концентрацию креатинина на нижней границе нормы. Одновременно повышаются активность щелочной фосфатазы и аланинаминотрансферазы и концентрация холестерина в крови. Можно смело утверждать, что большинство ветеринаров были бы удивлены, не обнаружив у собаки со спонтанным или индуцированным глюкокортикоидами синдромом Кушинга многих, если не всех указанных изменений. Уместно напомнить, что «общим знаменателем» спонтанного и ятрогенного синдрома Кушинга является хроническое воздействие избыточных количеств циркулирующих в крови глюкокортикоидов. Исходя из этого, можно с уверенностью говорить, что синдром Кушинга у кошек развивается и протекает не так, как у собак. Различия этого клинического состояния у обоих видов животных, по меньшей мере, столь же значительны, как его сходство.
Общий клинический анализ крови (ОАК)
Результаты общего клинического анализа крови (ОАК) у 45 кошек со спонтанно развившимся гиперкортицизмом представлены в табл. 7-7. Важной характерной чертой этих результатов является отсутствие постоянства в наблюдаемых отклонениях. В самом деле, ни один из полученных показателей нельзя назвать «классическим». Большинство кошек с ССКК имели «стрессорную лейкограмму» (нейтрофилию в сочетании со снижением относительного количества лимфоцитов и эозинофилов). У 24 кошек (53%) содержание нейтрофилов не превышало 86%, у 25 (56%) процентное содержание лимфоцитов было ниже 5%, а у 26 кошек (58%) - содержание эозинофилов составляло менее 2% общего количества лейкоцитов. Таким образом, лейкограммы отражали стрессорное воздействие, но далеко не во всех случаях. Ни у одной из кошек
не была зарегистрирована лейкопения, у одной имелась тромбоцитопения, а у четырех - анемия. Только у одной из последних четырех особей показатель гематокрита был ниже 24% (16%).
Биохимический анализ сыворотки крови и анализ мочи
Ферменты печени. Во введении к данному разделу обсуждаются аномальные результаты рутинных биохимических тестов у собак со спонтанным и ятрогенным синдромом Кушинга. Данные тех же тестов, полученные у кошек, разительно отличаются (табл. 7-8). Наиболее распространенным биохимическим нарушением у собак является резкое повышение активности щелочной фосфатазы сыворотки (ЩФС) (в среднем выше 1000 МЕ/л). В то же время активность ЩФС была увеличена только у трех из 43 (7%) кошек с ССКК. Аналогично, слабое или умеренное повышение активности аланинаминотрансферазы (АЛТ) в сыворотке крови было зарегистрировано более чем у половины обследованных собак, но только у 12 из 43 кошек (28%). Несколько кошек с повышенной активностью АЛТ имели тяжелую сопутствующую гепатопатию, не связанную с синдромом Кушинга. У собак со спонтанным или ятрогенным избытком продукции кортизола нередко развивается «стероидная гепатопа-тия», а также значительно возрастает концентрация в крови «индуцированного стероидом» изофермента ЩФС. Ни одно из этих изменений, типичных
ТАБЛИЦА 7-7. РЕЗУЛЬТАТЫ КЛИНИЧЕСКОГО АНАЛИЗА КРОВИ У КОШЕК СО СПОНТАННЫМ ГИПЕРКОРТИЦИЗМОМ
Параметр ГЗГ (38 кошек) ГОН (7 кошек)
Число Процент Число Процент
Лейкоциты <6000
6000 - 17000 24 63 3 43
17000 - 25000 8 21 3 43
>25000 6 16 1 14
Нейтрофилы, % <75 6 16
76-85 12 32 3 43
>86 20 53 4 57
Лимфоциты, % <5 20 53 5 71
6-15 16 42 2 30
>15 2 5 — —
Эозинофилы, % <2 22 58 4 57
3-6 10 26 3 43
>7 6 16 — —
Тромбоциты <180 000 1 14
180 000-400000 30 79 4 57
> 400 000 8 21 2 30
Гематокрит <27 2 2 2 30
28-35 22 58 2 30
36-46 14 37 3 43
>47 - - - -
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 385
ТАБЛИЦА 7-8. БИОХИМИЧЕСКИЙ ПРОФИЛЬ СЫВОРОТКИ КРОВИ И АНАЛИЗ МОЧИ У КОШЕК СО СПОНТАННЫМ ГИПЕРКОРТИЦИЗМОМ (43 КОШКИ)
ГЗГ (32 кошки) ГОН (11 кошек)
Показатель Диапазон нормальных Число с Число с Число с Число с Число с Число с
величин нормаль- низкими ВЫСОКИМИ нормаль- НИЗКИМИ высокими
ными показате- показате- ными показате- показате-
показате- лями лями показате лями лями
лями лями
Анализ сыворотки Щелочная фосфатаза 14-71 МБ 31 1 9 2
АЛТ 28 - 106 МБ 20 — 12 9 — —
Альбумин 2,7 - 3,9 г/100 мл ) 27 5 — 8 3 2
Глобулин 2,9 - 4,3 г/100 мл 14 — 18 7 — 4
Общий белок 5,6 - 8,4 г/100 мл 25 — 7 9 — 2
AM 18 - 33 мг/100 мл 14 — 18 6 — 5
Креатинин (от 0,9 до 1,8 мг/100 мл 21 1 10 7 — 4
Холестерин 89 - 258 мг/100 мл 20 — 12 10 — 1
Глюкоза (от 73 до 134 мг/100 мл ) — 4 28 2 2 7
Кальций 9,4- 11,4 мг/100 мл 28 4 — 8 3 —
ро. 3,2 - 6,3 мг/100 мл 28 2 2 8 — 3
ТСО, 15-25 ммоль/л 25 4 3 11 — —
К 3,6 - 5,3 ммоль/л 32 — — 10 1 —
Na 145 - 156 ммоль/л 30 2 — 9 — 2
т4 1,0 - 2,5 мкг/100 мл 28 4 - 9 - 2
Анализ мочи Удельный вес
<1,010 — — — 1
1,020-1,040 — 26 — 6
>1,041 Белок - 6 — 3
Отсутствует — 13 — 3
Следы — 11 — 2
Более значитель- — 8 — 5
ные количества
Бактерии
Отсутствуют — 31 — 9
Присутствуют - 1 - 1
АЛТ - аланинаминотрансфераза, AM - азот мочевины, Т - тироксин
для собак с синдромом Кушинга, не наблюдалось у людей или кошек, хотя у кошек с ССКК иногда развивается «стероидная гепатопатия», сопровождающаяся увеличением размеров печени и вакуоля-ризацией гепатоцитов.
Концентрация холестерина и Т4 в сыворотке крови. Увеличение концентрации холестерина в сыворотке крови регистрируется у 60-70% собак с синдромом Кушинга, из них менее 5% животных болеют сахарным диабетом. В отличие от этого, концентрация холестерина была повышена только у 13 из 43 кошек с ССКК (30%), и у всех 13 был диагностирован сахарный диабет. Гиперкортицизм и сахарный диабет являются двумя классическими причинами повышения концентрации холестерина в крови. Избыток кортизола в крови по механизму отрицательной обратной связи снижает секрецию гипофизарного ТТГ, что приводит к вторичному гипотиреозу, который служит еще одной классической причиной гиперхолестеринемии. Считается, что гипотиреоз в сочетании с прямым липолитическим действием глюкокортикоидов, концентрация которых увеличена при синдроме Кушинга, обусловливает увеличение концентрации холестерина, типичное для собак с гиперкортицизмом в отсутствие сахарного диабета. Однако концентрация Т4 в
сыворотке была ниже нормальной величины только у четырех из 43 (9%) кошек с ССКК, что делает мало приемлемым приведенное выше объяснение гиперхолестеринемии, встречающейся у части этих животных. Кошки с ССКК были эутиреоидными, и только у трех из них отмечались клинические признаки заболевания щитовидной железы (во всех случаях на вскрытии был выявлен гипотиреоз). Несмотря на возможность возникновения тиреоидной патологии у любой кошки, она нетипична для животных с ССКК.
Азот мочевины и креатинин в крови, удельный вес мочи. Возможно, у собак с синдромом Кушинга наиболее постоянны нарушения, связанные с полиурией и полидипсией. У подавляющего большинства таких животных удельный вес мочи меньше 1,020 (особенно в пробах взятых в домашних условиях). У многих собак удельный вес мочи не превышает 1,014, а у 30% он ниже 1,008. Иными словами, у собак с этим заболеванием полиурия - весьма обычное явление и одна из двух наиболее распространенных причин обращения за ветеринарной помощью (другая - выпадение шерсти). В случаях, когда полиурия не поддается лечению, владельцы собак нередко прибегают к эвтаназии. Кроме того, при синдроме Кушинга у собак сни
386 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
жены концентрации AM и креатинина в сыворотке крови до нижней границы нормы или ниже ее. Такое уменьшение является классическим клиническим признаком синдрома Кушинга у собак. Важно подчеркнуть, что повышение концентраций AM или креатинина у собак с данным заболеванием не только встречается крайне редко, но и служит серьезным противопоказанием к проведению терапии. У таких животных аппетит зависит от избытка кортизола, а лечение синдрома Кушинга противопоказано во избежание демаскирования почечной недостаточности и ее клинических проявлений (включая потерю аппетита).
Данные биохимического анализа сыворотки крови у кошек с ССКК, представленные в табл. 7-8, значительно отличаются от результатов, полученных у собак с синдромом Кушинга. У всех обследованных 43 кошек концентрация AM в крови оставалась в пределах нормального диапазона, а концентрация креатинина была ниже нормы только у одной кошки. Также только у одной из 43 кошек удельный вес мочи в произвольно взятых пробах был ниже 1,020. У этой особи одновременно имелись изостенурия и почечная недостаточность. Кроме того, у 23 из 43 животных (53%) на момент диагностирования синдрома Кушинга была аномально повышена концентрация AM в крови, а у 14 из этих 23 особей (32%) была увеличена концентрация креатинина. Эти данные позволяют предполагать, что полидипсия и полиурия, имевшиеся у большинства кошек с ССКК, были обусловлены сахарным диабетом, хронической почечной недостаточностью или сочетанием обоих заболеваний.
Были описаны кошки с ССКК и ПУ/ПД, клиническое или лабораторное обследование которых не подтверждало наличия сопутствующих сахарного диабета и/или почечной недостаточности. Число таких животных неизвестно, однако сам этот факт говорит о том, что иногда гиперкортизолемия может приводить к развитию ПУ/ПД. С одной стороны, такая ситуация не исключена, но с другой стороны, можно предполагать, что у некоторых из этих кошек периодически развивается гипергликемия, приводящая к эпизодической гликозурии и, как следствие, к эпизодической вторичной полиурии. Одной из причин гипергликемии у отдельных кошек в отсутствие сахарного диабета могут служить стрессорные факторы. Индуцируемое ими клиническое состояние затрудняет различие животных с устойчивой (за исключением периодов стресса) эугликемией и с физиологической гипергликемией вследствие гиперкортизолемии. Даже определение гликозилированного гемоглобина или концентрации фруктозамина не позволяет достоверно идентифицировать кошек с периодической гипергликемией. Нет, однако никаких оснований предполагать, что у любой кошки с ССКК имеется физиологический синдром, подобный состоянию, напоминающему несахарный диабет, который столь обычен у собак с синдромом Кушинга. Это
состояние приводит к разбавлению мочи, что редко встречается у кошек с ССКК.
Калий и натрий в сыворотке крови. Владельцы кошек с ССКК нередко жалуются на общую слабость животных, которая, по всей вероятности, является непосредственным результатом катаболизма мышечной ткани под воздействием глюкокортикоидов. Одним из следствий этого процесса может быть предрасположенность кошек к развитию гипокалиемии. В то же время лишь у одной из 43 кошек было отмечено снижение концентрации калия в крови и только у двух уменьшение концентрации натрия ниже нормального уровня.
Протеинурия, кальций, альбумин, глобулин и общий белок в сыворотке крови. У семи из 43 обследованных животных (16%) была выявлена слабая гипокальциемия (по результатам определения общей концентрации кальция в сыворотке крови), что, по-видимому, объясняется относительно высокой частотой хронической почечной недостаточности у кошек с гиперкортицизмом. У всех особей с гипокальциемией одновременно была понижена концентрация альбумина в сыворотке. Протеинурия была выявлена у 26 из 43 особей (60%) и, по всей вероятности, могла быть причиной гипоаль-буминемии и гипокальциемии. Однако гипоальбу-минемия была установлена только у восьми из 43 кошек (17%) и все они имели концентрацию альбумина в сыворотках крови выше 2,2 г/100 мл. Небезынтересно также отметить, что лишь у двух из 43 кошек с ССКК концентрация альбумина в сыворотке была выше концентрации глобулина. У 22 животных (52%) концентрация глобулина в сыворотке крови была выше нормы. Это может объясняться нормальным ответом на хроническое воздействие антигенов у всех старых кошек. Однако степень этой гиперглобулинемии была такова, что у девяти из 43 кошек (22%) развилась гиперпротеинурия.
Инфекции мочевого тракта. Инфекции мочевого тракта у кошек с ССКК встречались нечасто (у двух из 43 особей или у 3%). Возможно, это связано с тем, что большинство животных, поступавших для ветеринарного обследования, получали антибиотики в предшествовавшем периоде. Однако и в этом случае ситуация отличалась от наблюдавшейся у собак со спонтанно развившимся гиперкортицизмом. У собак частота инфекций мочевого тракта была значительно выше, хотя многим из них также ранее проводилась антибактериальная терапия.
Концентрация глюкозы в крови. Вероятно, самым неожиданным результатом рутинных биохимических тестов является результат определения концентрации глюкозы в рандомизированых пробах крови кошек с ССКК. Поскольку у большинства животных с ССКК имеется сопутствующий сахарный диабет, повышенный уровень глюкозы был предсказуем. Следует, однако иметь в виду, что у 10 особей из 43 диабет отсутствовал. 32 из 33 особей с сахарным диабетом, включенных в таблицу 7-8, на момент установления диагноза ССКК получали
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 387
экзогенный инсулин. Поэтому неудивительно, что у шести кошек, которым вводили инсулин, рандомизированное определение глюкозы крови выявило гипогликемию. Удивительно другое - только у двух из 43 кошек с ССКК концентрация глюкозы в крови была в пределах нормы, причем у одной из них был сахарный диабет и она получала инсулин в день тестирования. У 10 из 11 кошек с ССКК, которые не получали инсулинотерапию, анализ рандомизированных проб крови в период госпитализации, во время которой был диагностирован синдром Кушинга, выявил гипергликемию. Таким образом, можно предполагать, что концентрация глюкозы в крови кошек с синдромом Кушинга редко сохраняется в нормальных пределах.
Гипогликемия и дозы инсулина. Как было указано выше, у 6 из 43 кошек с ССКК на момент взятия проб крови для биохимического анализа сыворотки была гипогликемия. Все эти животные страдали сахарным диабетом и в день тестирования получали инсулин. Четыре из шести характеризовались обследовавшими их ветеринарами и хозяевами как «инсулинорезистентные». Дозы инсулина в пересчете на животное или на килограмм веса тела значительно отличались. При обследовании любой группы собак или кошек с сахарным диабетом, получающих инсулин, никогда не следует исключать возможности эпизодов гипогликемии. В то же время, мы полагаем, что постоянное увеличение дозы инсулина с целью «контроля» гипергликемии у кошек с сахарным диабетом (как рекомендуют некоторые ветеринары) может быть опасно. Наш опыт показывает, что индивидуальные дозы инсулина, превышающие 2,2 ЕД/кг, небезопасны. Мы не сомневаемся, что некоторые кошки, резистентные к низким дозам инсулина, могут отвечать на очень высокие дозы, однако, «резистентность» (если она имеет место у конкретного животного), по нашему мнению, является преходящим состоянием. Иными словами, тяжесть инсулинорезистентности колеблется, т.е. «прибывает и убывает». Если это действительно так, то доза инсулина, вводимая в период резистентности, может в другое время вызвать эффект передозировки. В нашей клинике мы наблюдали кошек с ССКК с тяжелыми, угрожающими жизни гипогликемическими реакциями на инсулин. Поэтому мы советуем ни в коем случае не вводить кошкам инсулин в дозах выше 2,3 ЕД/кг веса тела.
Гипергликемия. Среди 43 кошек, включенных в табл. 7-8, у 35 на момент взятия проб крови была гипергликемия. Двадцать шесть из 35 животных с гипергликемией болели сахарным диабетом, а 25 из этих 26 получали инсулин и, в частности, в день тестирования. Поскольку считается, что большинство кошек с ССКК инсулинорезистентны, гипергликемия у некоторых из них не является неожиданностью. Однако инсулинорезистентность не во всех случаях объясняет наличие гипергликемии у этих животных. Ее дополнительной причиной может быть неудовлетворительная компенсация диабета,
как из-за неправильных действий владельца животного, так и просто из-за наличия ССКК. Еще одно возможное объяснение гипергликемии состоит в том, что пробы крови были получены до начала или после окончания периода активного действия инсулина. Наконец, у любого из этих животных гипергликемия может быть вызвана не только сахарным диабетом, но и влиянием стрессорных факторов.
У 9 из 35 кошек с гипергликемией сахарный диабет отсутствовал. У скольких из этих девяти животных гипергликемия была обусловлена стрессорны-ми воздействиями во время взятия проб крови? Не менее интересно знать, сколько кошек этой группы имели ту или иную степень инсулинорезистентности вследствие невыявленного сахарного диабета. Ответов на эти вопросы нет, но вполне вероятно, что, по меньшей мере, некоторые из этих животных относятся к той или другой категории.
Сахарный диабет. Сахарный диабет - одно из наиболее частых заболеваний в ветеринарии мелких животных и, наряду с гипертиреозом, самое распространенное эндокринное расстройство у кошек. В отличие от этого, кошачий гиперкортицизм, или ССКК, считается необычным или редким заболеванием. Нельзя утверждать, что ССКК встречается исключительно у кошек с инсулинорезистентным сахарным диабетом, он может развиться и в отсутствие диабета. Вместе с тем, подозрение на ССКК чаще возникает у кошек с инсулинорезистентнос-тью, нежели у животных с отвислым животом или выраженной сонливостью. Однако подтверждение диагноза ССКК сразу объясняет наличие таких клинических признаков, как истончение и ломкость кожи, алопеция, ПУ/ПД, отсутствие роста шерсти после стрижки или выбривания.
Одна из задач, стоящих перед ветеринаром, состоит в том, чтобы выяснить, какая из кошек с плохо компенсированным сахарным диабетом действительно инсулинорезистентна и у какой из инсулинорезистентных особей имеется ССКК. У многих кошек, обследованных нами в условиях ветеринарной клиники, была выявлена гипергликемия, индуцированная стрессорными воздействиями. Большинство животных с неудовлетворительно компенсированным сахарным диабетом имели клинические расстройства, обусловленные неправильными действиями владельцев. Определение содержания гликозилированного гемоглобина или концентрации фруктозамина в сыворотке помогает идентифицировать таких особей, однако достоверность этих методов оставляет желать лучшего.
Еще одну группу кошек с плохо компенсированным сахарным диабетом составляют животные, получавшие инсулин с очень короткой продолжительностью действия. У них сохраняются клинические симптомы заболевания и нередки эпизоды гипергликемии, которую в любое время дня гораздо проще выявить, чем эугликемию. Другими причинами неудовлетворительного контроля сахарного диабета или инсулинорезистентности у кошек с диабетом
388 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
служат разнообразные сопутствующие клинические состояния, препятствующие действию инсулина. К их числу относятся панкреатит и другие несептические воспалительные заболевания, инфекции, а также ряд иных патологий (например, неоплазия или сердечное заболевание). Наконец, необходима диагностика таких относительно редких сопутствующих состояний как акромегалия, наличие антиин-сулиновых антител или гиперкортицизм.
Мы рекомендуем ветеринарам, испытывающим трудности при попытках контролировать диабетическое состояние, в первую очередь установить возможную причину затруднений. Прежде всего, следует отдавать себе отчет в том, что данные исследований в условиях стационара далеко не всегда совпадают с наблюдениями, сделанными владельцем животного в домашней обстановке. При длительном мониторинге результатов лечения сахарного диабета у кошек единственным и важнейшим источником необходимой информации являются сообщения их хозяев. Если владелец удовлетворен результатами терапии, то его мнению следует отдавать предпочтение перед данными клинических тестов, за исключением документированных случаев гипогликемии. Гипергликемия, вызванная процессом тестирования животного в условиях стационара, является весьма обычным явлением, поэтому дифференциальная диагностика не должна ограничиваться обследованием кошек, заведомо находящихся под воздействием стресса.
Кроме того, ветеринар должен учитывать все возможные ошибки владельца животного. К числу наиболее распространенных относятся неправильный выбор препарата инсулина, ошибки при перемешивании и заполнении шприца, неправильный выбор шприца, применение препаратов инсулина с истекшим сроком действия, отсутствие навыка инъекций. Во время каждого визита в ветеринарную клинику владелец животного должен производить инъекции инсулина, используемого им в домашних условиях, под наблюдением специалиста, чтобы последний мог проконтролировать правильность его действий. Если у ветеринара нет замечаний по процедуре инъекций, он должен убедиться, что владелец животного применяет инсулин требуемого качества, т.е. не слишком активный, как это иногда случается с препаратами нейтрального протамин-инсулина или инсулина ленте, и не инактивированный, что бывает при использовании протамин-цинк инсулина или инсулина ультраленте. Следует также выяснить наличие сопутствующих заболеваний и их возможное влияние на действие вводимого инсулина. К числу таких заболеваний относятся кожная инфекция и инфекция мочевого тракта, не говоря уже о множестве других потенциально опасных инфекций, скрытых или явных, или любое воспалительное состояние, например, панкреатит (как один из большого числа других явных и латентных воспалительных процессов). Чувствительность к инсулину может снижаться также при наличии опухоли,
сердечного заболевания или иной патологии. В последнюю очередь в качестве факторов, обусловливающих инсулинорезистентность, рассматриваются антиинсулиновые антитела, избыточная продукция прогестерона, акромегалия и ССКК.
Гипертензия, У кошек редко измеряют кровяное давление, поэтому данные о частоте гипертензии у этих животных при ятрогенной или спонтанной ги-перкортизолемии немногочисленны. Известно, однако, что гипертензия широко распространена среди людей со спонтанным гиперкортицизмом. Исходя из того, что гиперкортицизм кошек более сходен с тем же заболеванием у людей, чем у собак, мы предполагаем, что гипертензия может быть обычным следствием ССКК. Долгосрочные эффекты гипертензии у кошек также недостаточно изучены, однако, вполне возможно, что хронический избыток кортизола в крови оказывает неблагоприятное воздействие на состояние и функцию почек у этих животных.
ЭНДОКРИНОЛОГИЧЕСКИЕ СКРИНИНГОВЫЕ ТЕСТЫ
В диагностике ССКК используют несколько гормональных проб. Чаще всего применяют пробы с АКТГ или высокими дозами дексаметазона (ПВДД) и определение отношения концентраций кортизола и креатинина в моче (КОР/КРЕ). Каждый из этих методов имеет свои преимущества и недостатки. Не следует, однако, забывать, что идеальных тестов не существует. Особенно важно помнить об этом ввиду неблагоприятного прогноза синдрома Кушинга у кошек. Последнее обстоятельство побуждает некоторых владельцев прибегать к эвтаназии их питомцев, вместо того чтобы лечить ССКК. Кроме того, наиболее эффективными методами лечения таких животных являются гипофизэктомия, хирургическое удаление надпочечников или облучение гипофиза. Стоимость всех этих операций весьма высока, а их доступность ограничена из-за необходимости специального оборудования и/или подготовки персонала ветеринарных клиник. Ни хирургическое вмешательство, ни радиотерапия не являются вполне безопасными способами лечения. Поэтому диагноз ССКК должен ставиться только при наличии соответствующей клинической симптоматики в сочетании с результатами эндокринологических исследований, подтверждающими диагноз.
Отношение концентраций кортизола и креатинина в моче (КОР/КРЕ)
Общие сведения. Определение отношения КОР/КРЕ в моче служит скрининговым тестом для различения больных с синдромом Кушинга и без этого синдрома. Описание метода и показания к его применению подробно изложены в гл.6. Следует сказать, что «золотым стандартом» скринингового теста для выявления синдрома Кушинга у людей всегда считалось определение общей экскреции
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 389
кортизола с мочой на протяжении 24 часов. Достоверность результатов тестирования значительно повышается в случае повторных определений. Экскреция кортизола с суточной мочой отражает его секрецию надпочечниками во времени, а ее оценка позволяет избежать неудобств, связанных с постоянными колебаниями его концентрации в крови. Определение кортизола в суточной моче является надежным способом оценки нормальной или повышенной секреторной функции надпочечников.
Упрощенным вариантом довольно громоздкой процедуры сбора суточной мочи является использование произвольно взятых разовых проб мочи, определение содержания в них кортизола и креатинина и расчет отношения их концентраций (отношения КОР/КРЕ). Однако, несмотря на удобство получения показателя КОР/КРЕ как для животных, так и для ветеринаров, многие специалисты продолжают анализировать кортизол в суточных пробах мочи. Значение отношения КОР/КРЕ хорошо изучено на собаках. Но эта методика имеет как положительные, так и отрицательные стороны, и ее рекомендуют использовать только ветеринары, имеющие эндокринологическую подготовку, но не другие специалисты. Приверженцы методики особо подчеркивают такие ее преимущества, как низкая стоимость, техническая простота, легкость интерпретации результатов и высокая чувствительность (в том числе высокая прогностическая ценность отрицательных показателей). Последнее достоинство отмечают практически все специалисты, которые критически оценивали эффективность использования отношения КОР/КРЕ для диагностики спонтанного синдрома Кушинга у собак. Иными словами, у подавляющего числа собак с этим заболеванием (97-99%) отношение КОР/КРЕ в моче нарушено. Таким образом, если у собаки имеется подозрение на синдром Кушинга, то аномальное отношение КОР/КРЕ подтверждает возможность такого диагноза.
Вместе с тем, противники этого метода указывают на то, что аномальное отношение КОР/КРЕ не является специфическим показателем синдрома Кушинга. Так, например, это отношение часто отклоняется от нормы у собак с полиурией и полидипсией независимо от вызвавшей их причины, будь то сахарный или несахарный диабет, почечная недостаточность, гиперкальциемия, пиометра или нарушение функции печени. Таким образом, отношение КОР/КРЕ может соответствовать синдрому Кушинга и у животных без этой патологии.
Литературные данные. Авторы ранних исследований при сравнении отношения КОР/КРЕ в моче у собак и кошек столкнулись с парадоксальной ситуацией, обусловленной разницей скорости экскреции кортизола с мочой у этих видов животных. Парадокс состоял в том, что отношение КОР/КРЕ у кошек оказалось непропорционально высоким в сопоставлении с относительно слабой экскрецией введенного им меченого кортизола. У здоровых собак с мочой экскретировалось больше кортизола, чем у
здоровых кошек. Было предположено, что высокое отношение КОР/КРЕ у здоровых кошек на фоне относительно слабой общей экскреции обусловлено повышенной скоростью клубочковой фильтрации и/или низкой интенсивностью реабсорбции свободного кортизола в почках. В связи с этим отношение концентрации неизмененного кортизола к концентрации его конъюгатов и метаболитов в моче кошек выше, чем у собак (Goossens et al, 1995).
Целесообразно рассмотреть мнение многих ветеринаров-исследователей о низкой специфичности отношения КОР/КРЕ в моче при его использовании в качестве единственного диагностического показателя синдрома Кушинга у кошек. В одном из исследований было установлено, что величина этого отношения зависит от физиологического состояния животного (Henry et al, 1996). Результаты определений у здоровых кошек не зависели от возраста и пола животных и не отличались у кастрированных и интактных особей. Отношение КОР/КРЕ у больных кошек было выше, чем у здоровых животных, что, как и в случае с собаками, свидетельствовало о недостаточной специфичности данного показателя. Анализ отношения КОР/КРЕ у 16 больных кошек показал, что у трех особей его величина была характерна для гиперкортицизма (3,6 х 10 5 или выше), а у семи оценивалась как «пограничная» (от 1,0 до 3,6 х 10 5). Таким образом, у 10 из 16 кошек отношение КОР/КРЕ соответствовало диагнозу гиперкортицизм. Хотя данное исследование показало, что отношение КОР/КРЕ в моче больных кошек было достоверно выше, чем у здоровых, однако, оно не включало животных с ССКК. По этой причине в нем не проводилось прямое сравнение данных для кошек всех трех групп: здоровых, больных и имеющих ССКК (Henry et al, 1996).
Нам неизвестны какие-либо другие исследования, в которых оценивалась специфичность отношения КОР/КРЕ для кошек. Поэтому было бы преждевременно делать вывод о нецелесообразности применения этого показателя в диагностических целях. Напротив, мы рекомендуем пользоваться им, особенно в тех случаях, когда хозяин кошки имеет возможность брать пробы ее мочи в домашних условиях, например, используя лишь небольшую подстилку или заменив ее неабсорбирующим жидкость материалом для облегчения сбора мочи. Сбор проб в домашней обстановке значительно снижает вероятность получения ложных результатов анализа вследствие стрессорного воздействия аналогичной процедуры в условиях ветеринарной клиники. Следует отметить, что в случаях кошек с подтвержденным отсутствием гиперкортицизма, но имеющих отдельные клинические симптомы этого заболевания, результаты определения отношения КОР/КРЕ внушают меньше доверия. Необходимо исследовать кошек именно этой группы, чтобы выработать конкретные рекомендации относительно целесообразности использования отношения КОР/ КРЕ в целях диагностики.
390 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
Интерпретация результатов тестирования. Диапазон нормальных величин отношения КОР/ КРЕ был предложен на основании результатов двух исследований. В одном из них за норму было принято отношение КОР/КРЕ в моче менее 3,6 х 10 5 (Goossens et al, 1995), а в другом - менее 2,8 х 10 ~5 (Henry et al, 1996). При использовании первого показателя следует помнить, что он несколько превышает соответствующий показатель у собак (< 1,0 или < 1,3 х 10 5). Исходя из результатов этих двух исследований, а также нашего собственного опыта, можно считать, что отношение КОР/КРЕ 3,6 х ПУ5 или выше можно использовать для подтверждения диагноза ССКК у кошек с клиническими симптомами этого заболевания. Кроме того, мы рекомендуем рассматривать величины отношения КОР/КРЕ в диапазоне от 1,3 х 10'5до 3,6 х 10‘5 у животных с соответствующей симптоматикой в качестве «пограничных». У кошек с таким отношением КОР/КРЕ в моче возможен спонтанный гиперкортицизм.
Результаты. Как видно из таблиц 7-9 и 7-10, мы имели возможность сравнить отношение КОР/КРЕ у 37 кошек с подтвержденным диагнозом ССКК. Двадцать четыре кошки были обследованы в нашей клинике, а данные об остальных 13 кошках с хорошо документированным ССКК взяты из опубликованных сообщений (6 кошек из Goosens et al, 1995 и 7 из Meij et al, 2001). У 29 из этих 37 животных был диагностирован ГЗГ, а у восьми - гиперкортицизм, вызванный функционально активной опухолью коры надпочечников (ГОН). В общей сложности у 29 из 37 кошек (78%) отношение КОР/КРЕ превышало нормальную величину 3,6 х 10'5 (24 из них имели ГЗГ, а 5 - ГОН). Еще у 7 кошек (19%) величины отношения КОР/КРЕ лежали в «пограничном» диапазоне (4 особи с ГЗГ и 3 - с ГОН). Таким обра
зом, имеются результаты определений отношения КОР/КРЕ у 8 кошек с ГОН и у 28 из 29 животных с ГЗГ. Величины, считавшиеся «пограничными», превышали приблизительный нормальный показатель для собак (менее 1,3 х 10 '5). Только у одной кошки с ГЗГ отношение КОР/КРЕ оставалось в пределах нормы. Таким образом, отношение КОР/КРЕ является чувствительным диагностическим показателем синдрома Кушинга у кошек, сопоставимым в этом отношении с аналогичным показателем для собак. Мы не оценивали его специфичность, но полагаем, что такая оценка также может дать результаты, сходные с полученными у собак.
Выводы. Определение отношения КОР/КРЕ является чувствительным диагностическим показателем, помогающим различать кошек с ССКК и животных без этого заболевания. Поскольку специфичность этого показателя специально не оценивалась, остаются сомнения относительно его диагностической ценности. При решении вопроса о целесообразности определения отношения КОР/ КРЕ рекомендуется ориентироваться на результаты анамнестического анализа и физикального исследования. Взятые вместе, все три подхода составляют основу диагностики ССКК. В случае неуверенности в точности поставленного диагноза рекомендуется провести пробу с низкими дозами дексаметазона.
Провокационная проба с АКТГ
Общие сведения. Провокационная проба с АКТГ была рекомендована для диагностики синдрома Кушинга у собак более 35 лет назад. Недавно ее стали использовать и для оценки состояния кошек с подозрением на гиперкортицизм. Физиологические основы этой пробы и целесообразность ее
ТАБЛИЦА 7-9. РЕЗУЛЬТАТЫ ЭНДОКРИНОЛОГИЧЕСКИХ СКРИНИНГОВЫХ ТЕСТОВ У КОШЕК СО СПОНТАННО РАЗВИВШИМСЯ ЗАВИСИМЫМ ОТ ГИПОФИЗА СИНДРОМОМ КУШИНГА
КОР/КРЕ* Концентрация кортизола в плазме крови (мкг%) в пробе с низкими дозами дексаметазона Концентрация кортизола в плазме крови (мкг%) в провоцирующей пробе с АКТГ
До вве- Через 4ч Через 8 ч До введе- Первый Второй или
дения после вве- после вве- НИЯ образец последний об-
дения дения крови разец крови
Нормальный диапазон < 3,6 х 10 5 0-5 <1,4 < 1,4 0-5 5-15 5-15
«Пограничный диапазон» 1,3-3,6 х IO 5 - 0,9-1,3 0,9-1,3 - 15-19 5-19
Число обследованных кошек 29 37 37 34 43 32 43
Число нормальных 1 2 0 17 21 27
результатов Число «пограничных» 4 0 0 3 3
результатов Число показателей,
соответствующих синдрому Кушинга 24 — 35 34 - 8 13
Диапазон результатов тестирования 0,3-77 х IO 5 1,5-14,5 0.5-14,9 1,7-14,0 1,5-22,3 5,4-32,7 5-36
Среднее ± SD 11,5 ± 14 х 10-5 5,7 ± 2,8 4,9 ± 3,2 3,3+ 3,0 6,6 ± 4 14,9 ± 6,7 16,5 ± 8,7
Медиана 8,0 х 10-5 5,2 4,1 4,8 5,8 12,9 14,1
*) КОР/КРЕ — отношение концентраций кортизола и креатинина в моче.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
391
ТАБЛИЦА 7-10. РЕЗУЛЬТАТЫ ЭНДОКРИНОЛОГИЧЕСКИХ СКРИНИНГОВЫХ ТЕСТОВ У КОШЕК С ГИПЕРКОРТИЦИЗМОМ, ВЫЗВАННЫМ АКТИВНО ФУНКЦИОНИРУЮЩИМИ ОПУХОЛЯМИ КОРЫ НАДПОЧЕЧНИКОВ
КОР/КРЕ Концентрация кортизола в плазме крови (мкг%) в пробе с низкими дозами дексаметазона Концентрация кортизола в плазме крови (мкг%) в провоцирующей пробе с АКТГ
До пробы Через 4 Через 8 часа часов До пробы Первый Второй или образец последний образец
Нормальный диапазон < 3,6 х IO 5 0,5 < 1,4 < 1,4 0-5 5-15 5-15
«Пограничный диапазон» 1,3 3,6 х 10'5 — 0,9-1,3 0,9-1,3 — 15-19 5-19
Число обследованных кошек 8 8 6 8 8 6 8
Число нормальных ре- 0 5 0 0 5 4 4
зультатов Число «пограничных» 3 0 0 1
результатов Число показателей, соот-
ветствующих синдрому Кушинга 5 — 6 8 - 1 4
Диапазон результатов тестирования 1,1-16 х IO'5 1,5-11,0 1,5-14,6 1,8-10,2 2,6-11,8 2,7-50,0 3,3-52,8
Среднее + SD 6,4 ± 5,8 4,9 ± 2,9 5,2 ± 3,5 4,9 ± 2,7 5,2 ± 3,4 17,3 ±16,9 22,3 ± 18,2
Медиана 3,8 4,1 4,1 5,5 3,7 13,1 21,5
применения подробно обсуждались в гл. 6. Важно подчеркнуть, что провокационные пробы широко применяются для подтверждения диагноза при обследовании людей с синдромами эндокринной недостаточности, например, при подозрении на гипокортицизм (болезнь Аддисона). У больных с синдромами избыточной гормональной активности обычно используют ингибирующие пробы (в частности, при гиперкортицизме или синдроме Кушинга). Такой подход основан на подтвержденной специфичности и чувствительности этих проб.
В настоящее время одни ветеринары, проводящие клинические исследования, считают возможным применение провокационной пробы с АКТГ в диагностических целях, тогда как другие сомневаются в ее достоверности. Первые обосновывают свое мнение такими аргументами как быстрота получения результатов (в течение 1-2 часов в зависимости от используемого препарата АКТГ), необходимость всего двух венопункций, простота интерпретации данных, относительно низкая стоимость и высокая специфичность аномальных результатов пробы для гиперкортицизма. Кроме того, проба с АКТГ является единственным средством дифференциальной диагностики ятрогенного и спонтанного гиперкортицизма и единственным способом мониторинга отдаленных результатов медикаментозной терапии данного заболевания. Противники метода утверждают, что его чувствительность и специфичность недостаточны для долгосрочного применения.
Из сказанного ясно, что провокационная проба с АКТГ имеет как достоинства, так и недостатки, которые соответственно расширяют и ограничивают сферу ее применения. По нашему мнению, главный недостаток этой пробы применительно к диагностике гиперкортицизма у животных состоит в недостаточной чувствительности, т.е. именно в том, что лимитирует ее использование у людей. Иначе говоря,
у животных со спонтанным гиперкортицизмом проба с АКТГ нередко дает нормальные результаты, что может приводить к ошибочному исключению синдрома Кушинга из числа заболеваний, объясняющих наличие тех или иных расстройств у собак и кошек и требующих дифференциальной диагностики.
Литературные данные. Проведено довольно много исследований, в которых оценивали диагностическую ценность провокационной пробы с АКТГ для лабораторных и домашних кошек. В одной из самых ранних работ сравнивали эффекты двух разных доз синтетического АКТГ (козинтропина) и природного гормона при введении здоровым домашним кошкам. Синтетический АКТГ вводили внутримышечно в дозах 125 или 250 мкг на животное, и определяли содержание кортизола в крови до и через 15, 30, 60, 90 и 120 минут после инъекции (Smith, Feldman, 1987). Реакция животных на обе дозы синтетического АКТГ существенно не различалась, однако у двух кошек препарат вызвал рвоту и депрессивное состояние, сохранявшееся на протяжении нескольких часов после инъекции высокой дозы. Ввиду сходства эффектов двух доз, авторы рекомендовали проводить пробу с более низкой дозой АКТГ. Концентрация кортизола в плазме крови достигала максимальной величины через 30 и 60 минут после инъекции, и ее следует определять в эти два срока. Диапазон нормальных концентраций кортизола, рассчитанный с использованием средней квадратичной ошибки, составлял 6,2 ± 18,8 мкг% спустя 30 или 60 минут после внутримышечного введения АКТГ.
Другая группа исследователей оценивала реакцию на внутривенное введение тетракосактрина (АКТГ) у лабораторных кошек. Однократная инъекция животным 125 мкг тетракосактрина вызывала максимальное увеличение концентрации кортизола в плазме крови через 180 мин (Sparkes et al, 1990).
392 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
Более продолжительное действие внутривенных инъекций было подтверждено в другой работе, в которой сравнивали действие 125 мкг АКТГ после его внутривенного и внутримышечного введения. Было показано, что после внутривенного введения концентрация кортизола в плазме крови повышалась до более высокого уровня и эффект сохранялся дольше, чем после внутримышечных инъекций. Максимальную концентрацию кортизола регистрировали через 60-90 минут после внутривенного введения АКТГ (Peterson, Kemppainen, 1992а). Дополнительное исследование не выявило достоверных различий реакции кошек на козинтропин и тетракосактрин при внутривенном введении препаратов. Поскольку у нескольких животных имела место задержка ответа на АКТГ, авторы рекомендовали брать пробы крови для определения кортизола не только через 60-90 минут (как рекомендовалось ранее), но и через 120-180 минут после инъекции (Peterson, Kemppainen, 1992b). В последующей работе те же авторы вводили козинтропин в дозах 1,25, 12,5 и 125 мкг. Увеличение концентрации кортизола в плазме крови после инъекции каждой из указанных доз было примерно одинаковым, но эффект дольше сохранялся при использовании наиболее высокой дозы (Peterson, Kemppainen, 1993).
Одно из исследований было специально посвящено оценке провокационной пробы с АКТГ на модели домашних кошек с избыточным весом. Тетракосактрин вводили в дозах 125 или 250 мкг. Авторы задались целью проверить достоверность данных, полученных в предшествовавших исследованиях, поскольку большинство из них проводилось на относительно молодых и худых лабораторных животных, тогда как ССКК чаще развивается у более старых, страдающих ожирением домашних кошек. Полученные в этом исследовании результаты (как и ранее опубликованные данные) свидетельствуют о том, что для подтверждения или исключения диагноза ССКК достаточно однократного определения кортизола в пробе крови, взятой через 60 минут после введения АКТГ. Одновременно было показано, что повышение дозы АКТГ не вызывает дополнительного увеличения концентрации кортизола, но способствует поддержанию индуцированного уровня кортизолемии на протяжении более длительного времени. Пожалуй, самым важным итогом исследования оказался тот факт, что у страдающих ожирением домашних кошек АКТГ повышал концентрацию кортизола в крови в такой же степени, как у животных других групп (Schoeman et al, 2000). Хотя с возрастом у кошек усиливается активность системы гипоталамус-гипофиз-кора надпочечников (Goossens et al., 1995), это, по-ви-димому, не оказывает существенного влияния на результаты провокационной пробы с АКТГ.
Небольшие отличия нормальных показателей кортизолемии после введения АКТГ, полученных в разных исследованиях, могут быть обусловлены
использованием козинтропина в одних случаях и тетракосактрина в других, применением высоких и низких доз АКТГ и/или разными способами их введения (внутривенно или внутримышечно). Однако ни одно из цитированных исследований не дало ответа на ключевой вопрос: можно ли использовать провокационную пробу с АКТГ для обследования кошек с подозрением на спонтанный гиперкортицизм в любое время?
Интерпретация результатов тестирования. На основании рассмотренных выше результатов оценки провокационной пробы с АКТГ и нашего собственного опыта, мы считает целесообразным при диагностике синдрома Кушинга в дополнение к статистически выведенным «нормальным» и «аномальным» показателям принимать во внимание «пограничные» значения индуцированной АКТГ кортизолемии. Основываясь на наших первых исследованиях и последующем на протяжении ряда лет периодическом обследовании более 100 домашних кошек, мы пришли к выводу, что «аномальной» следует считать индуцированную АКТГ концентрацию кортизола, превышающую 19 мкг%. В ряде других исследований были приняты несколько более низкие или высокие «аномальные» величины, однако, они либо были получены без применения методов статистического анализа, либо существенно не отличались от принятых в наших исследованиях. При использовании более низких нормальных показателей существует опасность снижения специфичности пробы и, следовательно, ошибочного диагноза ССКК у животных, не имеющих этого заболевания. Как показано в одной из вышеупомянутых работ, которая была проведена на беспородных кошках без ССКК, базальная концентрация кортизола в их крови (до введения АКТГ) достигала 13 мкг%, а после стимуляции возрастала до 19,7 мкг% (Schoeman et al, 2000).
Следовательно, при использовании в качестве диагностического показателя слишком низкой базальной концентрации кортизола некоторым кошкам может быть ошибочно поставлен диагноз синдром Кушинга. У других кошек индуцированные в пробе с АКТГ концентрации кортизола следует рассматривать как «пограничные», поскольку ни одной из кошек, включенных в это исследование, не был поставлен диагноз ССКК.
Принятые пределы «нормальной» концентрации кортизола после стимуляции АКТГ составляли от 5 до 15 мкг% как для первой, так и для второй пробы, а «пограничные» значения в обоих случаях - от 15 до 19 мкг%. Диагноз синдром Кушинга ставился при индуцированной АКТГ концентрации кортизола больше или равной 19 мкг%. Сорок три из 51 кошки, включенных в данный обзор, были обследованы в нашей клинике; в качестве препарата АКТГ использовался козинтропин (синтетический АКТГ, чаще всего применяемый в США), а пробы крови для анализа кортизола у большинства животных получали через 30 и 60 минут после инъекции.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 393
Результаты. Результаты провокационной пробы с АКТГ получены у 51 кошки с подтвержденным ССКК. Сорок три кошки были обследованы в нашей клинике, а данные для остальных восьми животных взяты из литературы (одна кошка - из Immink et al, 1992, пять из - Watson, Heritage, 1998 и одна - из Moore et al, 2000). У 38 кошек пробы крови брали дважды, а у 13 - только один раз после введения АКТГ. Если у кошки брали только одну пробу крови после введения АКТГ, то полученный результат сравнивали с результатом второй пробы у животных, от которых кровь получали дважды (см. табл. 7-9 и 7-10). Нормальные концентрации кортизола после стимуляции АКТГ были зарегистрированы в общей сложности у 31 из 51 особи, т.е. 61% животных с ССКК имели нормальные результаты пробы с АКТГ. У трех из общего числа кошек (6%) обнаружены «пограничные» концентрации кортизола, а у 17 (33%) его концентрация была 19 мкг% или выше. Следует отметить, что данные для 5 из 51 кошки, взятые из исследования (Watson, Heritage, 1998), значительно отклонялись от нормальных показателей. В то же время наш опыт позволяет утверждать, что обнаружение у пяти из пяти кошек с ССКК (100%) крайне аномальных результатов в пробе с АКТГ совершенно нетипично. Если этих животных исключить, то эффективность пробы окажется значительно ниже, и провокационная проба с АКТГ не будет представлять ценности для диагностики ГЗГ или ГОН, поэтому мы не рекомендуем использовать ее в целях диагностики ССКК у кошек.
При обследовании кошек с диагнозом ГЗГ результаты определения концентрации кортизола в пробе с АКТГ оказались нормальными у 27 из 43 особей (63%), «пограничными» у 3 (7%) и явно аномальными у 13 (30%) особей. При объединении животных с «пограничными» и явно аномальными результатами в одну группу, число кошек с ГЗГ, у которых ответ на АКТГ был выше нормального уровня, достигало 16 (37%), а у 63% животных ответ был в пределах нормы. Аналогичный анализ результатов пробы с АКТГ у животных с ГОН выявил нормальный ответ у 4 из 8 кошек (50%) и явно аномальный ответ у четырех остальных особей.
У 38 кошек с подтвержденным гиперкортицизмом кровь для анализа в стимулирующей пробе с АКТГ брали дважды, что позволило рассчитать «среднее» увеличение концентрации кортизола (см. табл. 7-9 и 7-10). У 25 (66%) кошек (с ГЗГ или ГОН) ответ на стимуляцию АКТГ был в пределах нормы, у 4 (10%) получены «пограничные» результаты, а 9 (24%) реагировали на АКТГ явно аномальным повышением уровня кортизола. Таким образом, явно аномальные или «пограничные» показатели концентрации кортизола после стимуляции АКТГ были получены в общей сложности у 13 из 38 кошек (34%). У 32 кошек с подтвержденным диагнозом ГЗГ были взяты также промежуточные пробы крови. У 21 из них (66%) индуцированная концентрация кортизола оставалась в нормальных преде
лах, так же как и у четырех из шести (67%) животных с ГОН. Эти данные свидетельствуют о низкой диагностической ценности анализа промежуточной пробы крови в провоцирующем тесте с АКТГ.
Выводы. Провоцирующая проба с АКТГ имеет свои достоинства. Однако такие ее преимущества, как техническая простота, быстрота получения результатов, легкость их интерпретации и относительно низкая стоимость сводятся на нет двумя важными обстоятельствами. Во-первых, имеющиеся данные свидетельствует о низкой чувствительности этой пробы, а во-вторых, такие методы как определение отношения КОР/КРЕ и ПНДД явно превосходят ее по эффективности. Недостатки пробы с АКТГ становятся особенно очевидны, если принять во внимание, что у большинства кошек с ССКК она дает нормальные результаты.
Несмотря на сказанное, провокационная проба с АКТГ остается единственным инструментом для подтверждения ятрогенного синдрома Кушинга. Не следует, однако, забывать, что этот синдром широко распространен среди собак, но редко встречается у кошек. Применение пробы с АКТГ для мониторинга отдаленных результатов медикаментозной терапии синдрома Кушинга, как это имеет место у собак, невозможно у кошек, большинству которых назначают хирургическое лечение или радиотерапию. Наконец, высокая специфичность аномальных результатов провокационной пробы с АКТГ для подтверждения диагноза синдрома Кушинга у собак не доказана для кошек. Оценку пробы с АКТГ проводили на 15 кошках, у которых на момент исследования и в течение последующих 12 месяцев ССКК отсутствовал (Schoeman et al, 2000). При использовании в качестве диагностического показателя низкую концентрацию кортизола в плазме крови после стимуляции АКТГ нескольким из них был ошибочно поставлен диагноз ССКК. Таким образом, специфичность пробы с АКТГ для диагностики синдрома Кушинга у кошек вызывает сомнение. Наш вывод прост: пробу с АКТГ не следует использовать для диагностики кошек с подозрением на гиперкортицизм.
Проба с низкими дозами дексаметазона
Общие сведения. Скрининговая проба с низкими дозами дексаметазона (ПНДД) была рекомендована для диагностики синдрома Кушинга у собак более 15 лет назад. Недавно ее предложили использовать для оценки состояния кошек с подозрением на гиперкортицизм. Физиологические основы этой пробы и ее значение для целей диагностики подробно обсуждались в гл. 6. Провокационные пробы широко применяются для подтверждения диагноза при обследовании людей с синдромами эндокринной недостаточности, например, при подозрении на гипокортицизм (болезнь Аддисона). У больных с синдромами избыточной гормональной активности для той же цели обычно используют ингибирую
394 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
щие пробы (в частности, при гиперкортицизме или синдроме Кушинга). Ингибирующая проба с низкими дозами дексаметазона широко применяется в медицине при скрининге на синдром Кушинга, а ее чувствительность и специфичность почти столь же высоки, как у теста суточной экскреции кортизола с мочой. То же самое можно сказать о применении ПНДД в диагностических целях у собак.
В основе ПНДД лежит подавление секреции кортизола низкими дозами дексаметазона у здоровых людей, кошек или собак. После инъекции дексаметазон поступает в кровь и распространяется по всему телу, в частности, в гипоталамус и гипофиз. Дексаметазон связывается со специфическими рецепторами в гипоталамусе и ингибирует биосинтез и секрецию кортикотропин рилизинг-гормона, что, в свою очередь, приводит к подавлению биосинтеза и секреции гипофизарного АКТГ. Недостаток АКТГ приводит к угнетению синтеза и секреции кортизола в коре надпочечников. Секреция кортизола начинает снижаться в течение 30-60 мин после введения дексаметазона, достигает минимума через 120 минут и остается низкой, пока продолжается действие дексаметазона. У собак он подавляет активность системы гипоталамус-гипофиз-кора надпочечников в среднем на протяжении 30 часов. Таким образом, у здоровых собак через 4 и 8 часов после введения дексаметазона концентрация кортизола в крови должна быть значительно понижена. Дексаметазон традиционно используется в качестве глюкокортикоида в ингибирующих пробах. Ранее применялись преднизон и преднизолон, но они, в отличие от дексаметазона, перекрестно реагируют с кортизолом.
Важнейшим критерием достоверности скринингового теста или пробы с дексаметазоном является устойчивое подавление активности системы гипоталамус-гипофиз-кора надпочечников как у здоровых особей, так и у особей без заболеваний органов, входящих в состав этой системы. В основе этого требования лежат физиологические особенности организма при ГЗГ или ГОН. В случае опухоли коры надпочечников, вызывающей гиперкортицизм (ГОН), опухолевая ткань автономно секретирует кортизол, который не только вызывает соответствующие клинические симптомы, но и хронически подавляет секрецию АКТГ нормальным гипофизом. Поэтому у животных с ГОН дексаметазон не может вызвать подавление продукции кортизола вследствие ингибирования секреции гипофизарного АКТГ, так как она и без того угнетена кортизолом из опухолевой ткани. В случае ГЗГ имеется автономно функционирующая опухоль гипофиза, секретирующая АКТГ. Гипофиз, содержащий такую опухоль, утрачивает чувствительность к ингибирующему действию дексаметазона.
Таким образом, низкие дозы дексаметазона «подавляют» функцию системы гипоталамус-гипофиз-кора надпочечников у здоровых животных, тогда как особи с естественно развившимся синдромом
Кушинга резистентны к его ингибирующему действию. Кроме того, при гиперкортицизме сокращается продолжительность действия дексаметазона. В частности, у собак с гиперкортицизмом она не превышает 3-6 часов по сравнению с 30 часами у здоровых животных, как указывалось выше. Поэтому, даже если первичная опухоль гипофиза сохраняет чувствительность к дексаметазону и, следовательно, подавляется им, ее активность снижается ненадолго. Предполагается, что действие дексаметазона у кошек сходно с таковым у собак.
Протокол тестирования и литературные данные. Сначала для обследования кошек с помощью ингибирующей или «скрининговой» пробы с низкими дозами дексаметазона использовали протокол, ранее разработанный для собак. В соответствии с этим протоколом животным внутривенно вводили дексаметазон в дозе 0,01 мг/кг веса тела и спустя 4 и 8 часов определяли концентрацию кортизола в плазме крови. Однако в последующем доза дексаметазона была увеличена до 0,1 мг/кг, поскольку 15-20% здоровых кошек не отвечали на введение меньшего количества препарата (Smith, Feldman, 1987). Как указывалось выше, в основе ПНДД лежит способность дексаметазона подавлять функцию системы гипоталамус-гипофиз-кора надпочечников практически у всех здоровых особей. Другим клинически важным критерием, которому должна удовлетворять проба с дексаметазоном, является выбор адекватной дозы препарата, обеспечивающей достаточную для выявления данного заболевания чувствительность метода. Иными словами, такая доза не должна вызывать снижения концентрации кортизола в плазме крови кошек с ССКК; резистентностью к действию дексаметазона должны обладать не только кошки с ГОН (теоретически, все такие особи), но также все или почти все особи с ГЗГ. У последних такая резистентность может быть истинной, но может быть следствием короткой продолжительности действия дексаметазона. Исходя из перечисленных критериев, низкая доза для внутривенного введения дексаметазона была выбрана равной 0,1 мг/кг, с определением концентрации кортизола в плазме крови через 4 и 8 часов после инъекции.
Интерпретация результатов тестирования. Как и в случаях определения отношения КОР/КРЕ и провокационной пробы с АКТГ, нормальные показатели для пробы с низкими дозами дексаметазона были рассчитаны на основании результатов, полученных более чем на 100 кошках. Все включенные в исследование здоровые кошки содержались в домашней обстановке и почти все были старше 5 лет. Самцы и самки были представлены примерно в равном числе, все они были ранее кастрированы. Мы считали целесообразным при диагностике синдрома Кушинга принимать во внимание «пограничные» значения индуцированной дексаметазоном кортизолемии, в дополнение к статистически выведенным «явно аномальным» показателям. Ус
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 395
тановление диапазона нормальных концентраций кортизола в ПНДД требовалось для повышения чувствительности и специфичности пробы. Использование «пограничных» значений оказалось чревато снижением чувствительности метода, зато повышало его специфичность. Статистически выведенные нормальные показатели концентрации кортизола в крови через 4 и 8 часов после введения дексаметазона составляли 0,8 мкг% или меньше, а «явно аномальными» считались концентрации 1,4 мкг% и выше. «Пограничные» показатели лежали в диапазоне от 0,9 до 1,3 мкг%.
У кошек, которые удовлетворяли нашим критериям включения в исследование, имелись как клинические признаки, так и гистологические изменения, характерные для гиперкортицизма. Они были обследованы с помощью ПНДД (0,1 мг/кг) в соответствии с вышеописанным протоколом. Как указывалось ранее, мы не рекомендуем дозу 0,01 мг/кг, которая предусмотрена протоколом, используемым при обследовании собак.
Результаты ПНДД при ее использовании в качестве скринингового теста. Сорок пять кошек удовлетворяли критериям включения в исследование ПНДД как скринингового теста на ССКК. Тридцать семь из 45 имели подтвержденный диагноз ГЗГ, а 8 - диагноз ГОН. Тридцать семь из включенных в исследование кошек были обследованы в нашей клинике, а данные об остальных 8 животных взяты из литературных источников (о двух - из Immink et al, 1992; о трех - из Goossens et al, 1995; и еще о трех - из Meij et al, 2001). У двух наших кошек (обе с ГОН) кровь брали только перед введением дексаметазона и спустя 8, но не 4 часа. У 6 кошек, взятых из двух сообщений (Goossens et al, 1995 и Meij et al, 2001), пробы крови были получены до введения дексаметазона и через 4, но не 8 часов после него. Таким образом, для 37 кошек были получены данные о концентрации кортизола в базальных условиях и через 4 и 8 часов после введения дексаметазона, для двух - в базальных условиях и через 8 часов после инъекции, а для шести - в базальных условиях и через 4 часа после введения дексаметазона (см. табл. 7-9 и 7-10).
У всех 39 кошек с ССКК (100%) концентрация кортизола в крови в ПНДД через 8 часов после внутривенной инъекции 1 мг дексаметазона/кг веса тела была явно аномальной и превышала 1,4 мкг%. У 41 особи из 43, от которых кровь была получена через 4 часа после введения дексаметазона, концентрация кортизола в крови была выше 1,4 мкг%, а у двух оставшихся - ниже 0,9 мкг%. У всех кошек с ГЗГ и ГОН концентрация кортизола через 8 часов после инъекции была «явно аномальной». Это свидетельствовало не только о «высокой чувствительности» пробы, но и о ее более высокой чувствительности по сравнению с провокационной пробой с АКТГ и с определением отношения КОР/КРЕ. «Явно аномальная» концентрация кортизола в плазме крови через 4 часа после внутривенной инъекции декса
метазона была зарегистрирована у всех животных с ГОН и у 35 из 37 особей с ГЗГ. Обеим кошкам, у которых концентрация кортизола в ПНДД через 4 часа после инъекции была ниже 0,9 мкг%, поставлен диагноз ГЗГ. Такой результат часто бывает у собак с ГЗГ, у которых подавление секреции кортизола дексаметазоном может отмечаться через 4 часа после его введения и отсутствовать через 8 часов.
Если использовать абсолютную концентрацию кортизола в плазме крови менее 0,9 мкг% через 4 часа после введения дексаметазона в качестве критерия для дифференциальной диагностики ГЗГ (подавление) и ГОН (отсутствие подавления), то ПНДД оказывается несостоятельной в 35 случаях ГЗГ из 37 (см. нижеследующую дискуссию о преимуществах измерения изменений уровня кортизола в процентах по сравнению с оценкой абсолютной концентрации кортизола). Однако применение ПНДД в такой форме не рекомендуется. В соответствии с нашей рекомендацией, т.е. при использовании ПНДД только в качестве скринингового теста, следует вводить дексаметазон в дозе 0,1 мг/ кг. Полученные нами результаты свидетельствуют о 100% чувствительности пробы, хотя читатель должен помнить, что не бывает идеальных методов. Более того, высокая чувствительность ПНДД как скринингового теста еще не означает, что он столь же высокоспецифичен.
Результаты ПНДД (0,1 мг/кг) как «дискриминационного» теста. Поскольку проба с введением 0,1 мг дексаметазона/кг используется в качестве дискриминационного теста у собак для дифференциальной диагностики ГЗГ и ГОН, представляется целесообразным оценить возможность ее применения и для дифференциальной диагностики у кошек с ССКК. Этот вопрос подробно рассмотрен в гл. 6. Проще всего использовать дискриминационный тест, принимая в качестве критерия подавления секреции кортизола снижение его концентрации более чем на 50% по сравнению с базальной величиной через 4 и 8 часов после введения дексаметазона. Поскольку опухоль надпочечников синтезирует и секретирует кортизол автономно (т.е. независимо от гипофизарного АКТГ) и поскольку дексаметазон ингибирует секреторную функцию гипофиза, кошки с ГОН не должны отвечать на его введение уменьшением концентрации кортизола в плазме крови, независимо от дозы препарата. В то же время секреторная активность некоторых (но не всех) гипофизарных опухолей может подавляться большими дозами дексаметазона. Поэтому дискриминационный тест применяют только после установления у кошки ССКК на основании клинической симптоматики, результатов рутинных лабораторных исследований и соответствующих скрининговых тестов. В этом случае «подавление» в соответствии с ранее описанными критериями будет означать наличие у животного ГЗГ. Отсутствие «подавления» будет служить дополнительным подтверждением диагноза ССКК, но не позволит дифференцировать ГЗГ от
396 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
ГОН, так как дексаметазон не снижает секрецию кортизола не только у кошек с ГОН, но и у части животных с ГЗГ
Результаты обследования 45 кошек в ПНДД (при дозе дексаметазона 0,1 мг/кг) свидетельствуют о его высокой эффективности в качестве «скринингового теста» для выявления ССКК. В то же время только у 8 из 37 кошек с ГЗГ (22%) концентрация кортизола в плазме крови через 4 или 8 часов после введения дексаметазона снизилась более чем на 50% по сравнению с ее базальным уровнем. У всех 8 животных «подавление» наблюдалось через 4 часа после инъекции дексаметазона, причем у двух кошек концентрация кортизола была ниже 0.9 мкг%. Таким образом, у 29 кошек с ГЗГ и у всех восьми с ГОН спустя 4 или 8 часов после введения дексаметазона «подавление» отсутствовало. «Подавление», понимаемое как уменьшение концентрации кортизола в крови более чем на 50% ее базальной величины, может свидетельствовать о наличии ГЗГ у кошки с ССКК, однако чувствительность этого метода невелика.
Выводы. Проба с 0,1 мг дексаметазона/кг является эффективным скрининговым тестом (со 100% чувствительностью), однако его ценность для различения ГЗГ и ГОН не высока. Специфичность ПНДД не оценивалась. В качестве скринингового теста ПНДД превосходит как определение отношения КОР/КРЕ, так и провокационную пробу с АКТГ. Мы настоятельно рекомендуем использовать ПНДД для скрининга кошек с ССКК. Мы также рекомендуем проводить определение отношения КОР/КРЕ в моче кошек, взятой хозяевами животных в домашних условиях. Его можно использовать для подтверждения диагноза (в нашей клинике он не применяется для этой цели) или для выявления животных с ССКК и их отбора для скрининга с помощью ПНДД (применяется в нашей клинике).
ДИСКРИМИНАЦИОННЫЕ ПРОБЫ ДЛЯ ДИФФЕРЕНЦИАЦИИ ЗАВИСИМОГО ОТ ГИПОФИЗА И ВЫЗВАННОГО ОПУХОЛЬЮ НАДПОЧЕЧНИКОВ СИНДРОМА КУШИНГА
После установления гиперкортицизма можно использовать различные тесты для дифференциальной диагностики ГЗГ и ГОН. Необходимость дифференциальной диагностики этих клинических состояний обусловлена разными подходами к их лечению. В идеале опухоли надпочечников подлежат хирургическому удалению, тогда как возможности их медикаментозной терапии весьма ограничены. То же самое относится к гипофизарным опухолям. Альтернативным способом является облучение гипофиза. Для лечения ГЗГ у кошек используются разнообразные схемы терапии, однако ни одна из них не дает устойчивого положительного результата в отличие от благоприятного исхода терапии у людей и собак. Для обследования собак используют четыре дискриминационных теста. К их числу относятся
проба с низкими дозами дексаметазона (0,01 мг/кг, для целей скрининга), проба с высокими дозами дексаметазона (0,1 мг/кг), определение концентрации эндогенного АКТГ и УЗИ брюшной полости. КТ и МРТ представляют собой потенциально ценные дискриминационные методы, однако они редко используются из-за необходимости специального оборудования и анестезирования животных.
Каждый из тестов, широко применяемых для обследования собак, имеет свои преимущества и недостатки. При использовании тех же тестов для обследования кошек приобретают значение их иные свойства. Эффективность пробы с низкими дозами дексаметазона (0,1 мг/кг) в качестве дискриминационного теста обсуждалась в предыдущем разделе. Она оказалась весьма незначительной, поскольку только у 8 из 37 обследованных животных с ГЗГ полученные данные соответствовали диагнозу. Ниже будут рассмотрены результаты трех других тестов. Наряду с кошками, обследованными в нашей клинике, в обсуждение включены животные с подтвержденным гиперкортицизмом, описанные в публикациях других авторов, которые использовали сходные протоколы и методы.
Ингибирующая проба с высокими дозами дексаметазона (ПВДД)
Общие сведения. ПВДД имеет ограниченное применение при обследовании людей и собак. Физиологической основой пробы служит ингибирующее действие дексаметазона на секрецию эндогенного кортизола корой надпочечников вследствие подавления продукции и секреции гипоталамического кортикотропин рилизинг-гормона (КРГ) и, следовательно, биосинтеза и секреции гипофизарного АКТГ. Кроме того, дексаметазон угнетает синтез и секрецию АКТГ, действуя непосредственно на гипофиз. Снижение продукции АКТГ ведет к снижению биосинтеза и секреции кортизола в коре надпочечников. Действие дексаметазона продолжается до 30 часов у здоровых собак, и все это время концентрация кортизола в плазме крови и моче остается ниже нормы.
Опухоли коры надпочечников функционируют автономно и потому совершенно не зависят от регуляторного действия гипофиза. Более того, у людей с активно функционирующими опухолями надпочечников секретирующие АКТГ клетки гипофиза атрофируются. Следовательно, дексаметазон, независимо от введенной дозы, не может угнетать секрецию кортизола такими опухолями у людей и животных. Напротив, высокие дозы дексаметазона могут подавлять секрецию АКТГ некоторыми (но не всеми) опухолями гипофиза, хотя они тоже функционируют «более или менее» автономно. Таким образом, люди или животные с подтвержденным синдромом Кушинга, у которых в ПВДД уменьшается концентрация кортизола в плазме крови и в моче, обычно имеют ГЗГ, тогда как во всех случаях
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 397
ГОН и в ряде случаев ГЗГ такое подавление отсутствует. В любой популяции людей или собак с ГЗГ в 20-25% случаев никакие дозы дексаметазона не вызывают подавления секреции кортизола.
Протокол ПВДД в «условиях стационара». Мы использовали протокол ПВДД с введением дозы дексаметазона, которая в 10 раз превышала его дозу в ПНДД. Для кошек эта доза, вводимая внутривенно, составляла 1,0 мг/кг. Кортизол определяли в плазме крови до и через 4 и 8 часов после инъекции дексаметазона. Следует напомнить, что до проведения дискриминационного теста необходимо подтвердить наличие у кошки гиперкортицизма (ССКК). Результаты тестирования анализировали с использованием четырех критериев: 1) снижение концентрации кортизола в плазме крови более чем на 50% по сравнению с базальной величиной через 4 часа после введения дексаметазона; 2) концентрация кортизола ниже 1,4 мкг% через 4 часа после инъекции; 3) снижение концентрации кортизола в плазме крови более чем на 50% по сравнению с базальной величиной через 8 часов после введения дексаметазона и 4) концентрация кортизола ниже 1,4 мкг% спустя 8 часов после инъекции. Если удовлетворяется хотя бы один из этих критериев «подавления», результат ПВДД свидетельствует о наличии ГЗГ. Если не
удовлетворяется ни один из этих четырех критериев, результат пробы считается незначимым.
Протокол ПВДД в «домашних условиях». Альтернативный метод проведения ПВДД состоит в определении отношения КОР/КРЕ в моче (Goossens et al, 1995; Meij et al, 2001). В этом случае пробу целиком проводит владелец животного, не доставляя его в ветеринарную клинику. Владелец в течение двух последовательных дней собирает мочу кошки, что нетрудно сделать, предварительно убрав из ящика большую часть обычной подстилки или заменив ее неабсорбирующей жидкость аквариумной галькой. После получения второй пробы мочи, владелец трижды с интервалами в 8 часов дает кошке перорально дексаметазон по 0,1 мг/кг, а именно в 8 часов утра, 4 часа дня и 12 часов ночи (Goosens et al, 1995). Можно давать дексаметазон дважды, в 4 часа дня и в 12 часов ночи (Meij et al, 2001). На третье утро хозяин берет еще одну пробу мочи и передает все три пробы для анализа в ветеринарную лабораторию. Для интерпретации результатов ПВДД сначала определяют отношение КОР/КРЕ в двух первых утренних пробах мочи. Этот анализ представляет собой скрининговый тест для подтверждения диагноза ССКК. Среднюю величину двух определений принимают за «базальную концент-
ТАБЛИЦА 7-11. РЕЗУЛЬТАТЫ ИНГИБИРУЮЩЕЙ ПРОБЫ С ВЫСОКИМИ ДОЗАМИ ДЕКСАМЕТАЗОНА И КОНЦЕНТРАЦИЯ ЭНДОГЕННОГО АКТГ В ПЛАЗМЕ КРОВИ У КОШЕК СО СПОНТАННЫМ ГИПЕРКОРТИЦИЗМОМ
Концентрация кортизола в плазме крови (мкг%) в пробе с высокими дозами дексаметазона Концентрация эндогенного АКТГ (пг/мл)
Через 4 часа Через 8 часов
Гиперкортицизм зависимый от гипофиза (ГЗГ)
Нормальный диапазон для ГЗГ 0-5 <1,4 <1,4 10-60
«Пограничный диапазон» для ГЗГ — — — 10-45
Результаты, соответствующие ГЗГ — <1,4 или < 50% — >45
(определение) Число обследованных кошек 35 базальной величины 24 35 45
Число неопределенных результатов — 11 20 3
(соответствующих ГЗГ или ГОН)
Число результатов, соответствующих — 13 15 42
ГЗГ
Разброс результатов тестирования 2,4-39,0 0,2-15 0,1—25,8 38-3653
Среднее (± SD) 8,8 ± 8,8 3,0 ± 3,6 4,9 +6,2 457 ± 619
Медиана 5,3 0,9 2,4 221
Гиперкортицизм, вызываемый опухолями коры надпочечников (ГОН)
Нормальный диапазон для ГОН 0-5 4,4 < 1,4 10-60
«Пограничный диапазон» для ГОН — — — 10-45
Результаты, соответствующие ГОН — > 4,4 или > 50% — Ниже чувствительности
(определение) Число обследованных кошек 5 базальной величины 4 5 метода определения 6
Число неопределеннных результатов — 0 0 0
(соответствующих ГЗГ или ГОН)
Число результатов, соответствующих — 4 5 6
ГОН
Разброс результатов тестирования 3,0-7,1 3,7-6,1 4,4-6,1 Все ниже чувствительное-
Среднее (+ SD) 5,1 + 1,6 5,0 + 0,8 5,0 ± 0,7 ти метода определения
Медиана 4,9 4,7 4,7 —
398 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
рацию». Если в третьей утренней пробе отношение КОР/КРЕ меньше 50% базальной величины, значит, животное отвечает на действие дексаметазона («подавление»), и это считается показателем ГЗГ, тогда как отсутствие «подавления» предполагает диагноз либо ГОН, либо ГЗГ.
Результаты. Как следует из табл. 7-11, результаты ПВДД были получены для 40 кошек с ССКК. Все 40 включенных в оценку животных обследовались в нашей клинике и все получали дексаметазон в дозе 1,0 мг/кг. У 24 кошек с подтвержденным ГЗГ и 4 с подтвержденным ГОН кортизол определяли до и через 4 часа после введения дексаметазона. Еще у И кошек с ГЗГ и одной с ГОН определяли концентрацию кортизола в крови через 8 часов после инъекции, но не через 4 часа. Подавление секреции кортизола в ПВДД служило показателем ГЗГ, а отсутствие подавления свидетельствовало о наличии ГОН либо ГЗГ.
У 13 из 24 кошек (54%) концентрация кортизола в крови понижалась через 4 часа после введения дексаметазона, что предполагало наличие у них ГЗГ. У всех 13 действительно было диагностировано это заболевание. Иными словами, снижение уровня кортизола в плазме крови через 4 часа после начала ПВДД служило специфическим показателем ГЗГ. Как и ожидалось, у четырех кошек с ГОН подавление концентрации кортизола через 4 часа после введения дексаметазона отсутствовало. Столь же ожидаемым было отсутствие ответа через 4 часа после начала пробы у части кошек с ГЗГ (у 11 из 24 или 46%). Таким образом, отсутствие подавления концентрации кортизола в плазме крови спустя 4 часа после введения дексаметазона было неспецифическим показателем и отмечалось у животных как с ГЗГ, так и с ГОН.
У 15 из 40 кошек (38%) через 8 часов после введения дексаметазона наблюдали уменьшение концентрации кортизола в крови, свидетельствовавшее о наличии ГЗГ. Все 15 действительно имели это заболевание. Таким образом, ПВДД позволила правильно идентифицировать ГЗГ у 15 из 35 кошек (43%), и подавление секреции кортизола через 8 часа после начала тестирования являлось специфическим показателем ГЗГ. Как и ожидалось, у пяти кошек с ГОН через 8 часов после введения дексаметазона концентрация кортизола в крови не снижалась, так же как она не снижалась у части кошек с ГЗГ (у 20 из 35 или 57%). Таким образом, отсутствие подавления секреции кортизола в плазме крови спустя 8 часов после введения дексаметазона было неспецифическим показателем и отмечалось у животных как с ГЗГ, так и с ГОН. Следует отметить, что результаты определения кортизола через 8 часов после введения дексаметазона были получены для всех 24 кошек с ГЗГ, у которых концентрация кортизола определялась также через 4 часа и, дополнительно, еще для 11 кошек с ГЗГ. Однако только у двух особей из этой дополнительной группы было обнаружено снижение концентрации кортизола в крови через 8 часов
после начала тестирования. Все 13 кошек, удовлетворявших, по меньшей мере, одному из двух критериев для подавления секреции кортизола через 4 часа после введения дексаметазона, удовлетворяли также, по крайней мере, одному из двух критериев ее подавления спустя 8 часов. Это заставляет пересмотреть мнение о необходимости получения проб крови у кошек через 4 и 8 часов после введения дексаметазона. Как и у собак, представляется целесообразным, брать пробы крови только через 4 часа после инъекции, потому что проба через 8 часов не дает дополнительной информации.
Результаты: ПВДД в домашних условиях. ПВДД в домашних условиях было проведено у 13 кошек (табл. 7-12). Все 13 кошек имели ГЗГ, и данные о них взяты из литературных источников (о шести из Goosens et al, 1995, о семи-из Meij et al, 2001). У 10 из 13 кошек (77%) отношение КОР/КРЕ в моче после введения дексаметазона понижалось по сравнению со средним базальным отношением. Этот результат, по мнению авторов первого из указанных исследований, был значительно более достоверным, чем результат ингибирующей пробы с дексаметазоном в дозе 0,1 мг/кг (Goossens et al, 1995). Кроме того, эти результаты оказались лучше, чем результаты, полученные нами при тестировании 35 кошек с помощью ПВДД. Еще важнее то обстоятельство, что данный тест могут полностью проводить сами хозяева кошек, что снижает как его стоимость, так и стрессорное воздействие на животных.
Выводы. ПВДД, проводимая в условиях стационара, технически проста, недорога и безопасна для животных, а получаемые результаты легко поддаются интерпретации. Подавление секреции кортизола в этой пробе свидетельствует о наличии ГЗГ. В соответствии с ее протоколом рекомендуется определять концентрацию кортизола в образцах плазмы крови, получаемых перед внутривенным введением кошкам 1,0 мг дексаметазона/кг и через 4 часа после инъекции. Поскольку дексаметазон в дозе 0,1 мг/кг вызывал подавление секреции кортизола только у 8 из 37 животных с ГЗГ (22%), делается вывод, что его использование в дозе 1,0 мг/кг более эффективно выявляет кошек с ГЗГ как через 4 часа после инъекции (13 из 24 или 54%), так и через 8 часов (15 из 35 или 43%).
У всех кошек с ГОН снижение концентрации кортизола в оба эти срока отсутствовало, так же как у отдельных особей с ГЗГ. Следовательно, отсутствие уменьшения секреции кортизола в ПВДД у кошек следует рассматривать, как недоказательный результат, так же как у собак и у людей.
ПВДД легче проводить в домашней обстановке, чем в условиях стационара. То же самое относится к интерпретации получаемых результатов. Кроме того, результаты, полученные для 13 кошек с ГЗГ (подавление у 77%) были лучше результатов, полученных на 24 кошках с ГЗГ, у которых концентрацию кортизола в крови определяли в условиях стационара через 4 и 8 часов после введения декса-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 399
ТАБЛИЦА 7-12. РЕЗУЛЬТАТЫ ИНГИБИРУЮЩЕЙ ПРОБЫ С ВЫСОКИМИ ДОЗАМИ ДЕКСАМЕТАЗОНА У 13 КОШЕК ПРИ ИСПОЛЬЗОВАНИИ ПРОТОКОЛА ОПРЕДЕЛЕНИЯ ОТНОШЕНИЯ КОР/КРЕ В ДОМАШНИХ УСЛОВИЯХ. ПОДАВЛЕНИЕМ СЧИТАЛИ УМЕНЬШЕНИЕ ОТНОШЕНИЯ КОР/КРЕ БОЛЬШЕ ЧЕМ НА 50% ЕГО СРЕДНЕЙ БАЗАЛЬНОЙ ВЕЛИЧИНЫ, РАССЧИТАННОЙ ПО ДАННЫМ ДВУХ ОПРЕДЕЛЕНИЙ
Кошка № Первое базальное отношение КОР/КРЕ (хЮ-5) Второе базальное отношение КОР/КРЕ (хЮ5) Средняя величина КОР/КРЕ (хЮ5) Отношение КОР/КРЕ после введения дексаметазона (хЮ5) Соответствие результата ГЗГ
1 13,9 14,5 14,2 1,3 Да
2 3,7 6,4 5,1 0,5 Да
3 7,5 8,2 7,8 9,2 Нет
4 12,5 15,5 14,0 4,1 Да
5 10,4 10,3 10,35 2,6 Да
6 22,8 31,6 27,2 1,8 Да
7 — — 27,2 1,8 Да
8 — — 8,0 11,7 Нет
9 — — 11,9 0,5 Да
10 — — 7,3 1,7 Да
11 — — 7,2 2,7 Да
12 — — 10,5 11,9 Нет
13 - — 7,7 0,7 Да
КОР/КРЕ - отношение концентраций кортизола и креатинина в моче, ГЗГ - гиперкортицизм зависимый от гипофиза. По: Goossens et al, 1995 и Meij et al, 2001.
метазона (подавление соответственно у 54 и 43%). Таким образом, если владельцы животных могут самостоятельно вводить дексаметазон, то целесообразно рекомендовать им протокол ПВДД в домашних условиях как для скрининга, так и для дифференциальной диагностики. Этот протокол обычно не вызывает технических сложностей, относительно недорог, безопасен для животных (меньше кровоподтеков и не травмирует кожу), его результаты более достоверны и легче поддаются интерпретации по сравнению с ПВДД в условиях стационара. Хотя при использовании ПНДД в условиях клиники результаты скрининга несколько более достоверны, чем при определении отношения КОР/КРЕ в моче, собранной хозяевами животных, протокол ПВДД в домашних условиях в целом предпочтительнее обследования животных в ветеринарной клинике.
Определение концентрации эндогенного АКТГ
Общие сведения. Концентрацию эндогенного АКТГ в плазме крови уже более 30 лет определяют для повышения точности дифференциации ГЗГ и ГОН у людей, страдающих синдромом Кушинга. Первое сообщение об определении уровня АКТГ в качестве дискриминационного теста при обследовании собак с синдромом Кушинга было опубликовано в 1981 году (Feldman, 1981). В нескольких сообщениях о кошках с ССКК также имеются данные о концентрации эндогенного АКТГ в плазме крови. Физиологическим обоснованием данного метода служат различия патологических процессов при ГЗГ и ГОН. При ГОН активность автономно функционирующих опухолей коры надпочечников приводит к снижению концентрации эндогенного АКТГ в плазме крови. Напротив, при ГЗГ име
ет место избыточная концентрация АКТГ, которая приводит к гиперплазии коры надпочечников и усиленной секреции кортизола. К достоинствам метода определения эндогенного АКТГ относятся необходимость взятия только одной пробы крови, относительно высокая достоверность получаемых результатов и легкость их интерпретации. В то же время, он имеет следующие недостатки: метод дорогой, кровь необходимо собирать в пластмассовые или силиконовые градуированные пробирки, содержащие соответствующий антикоагулянт, и сразу центрифугировать, контакт проб со стеклом недопустим и их следует хранить в замороженном виде до начала анализа. Наконец, гормон нестабилен, что снижает достоверность результатов его определения в пробах, доставляемых в лабораторию. Кроме того, получаемые результаты не всегда позволяют дифференцировать ГЗГ и ГОН. Перечисленные недостатки на фоне все более широкого использования УЗИ брюшной полости ограничивают применение определения концентрации эндогенного АКТГ в диагностических целях.
Интерпретация результатов теста. Мы накопили известный опыт определения концентрации эндогенного АКТГ в плазме крови собак, который показывает, что результаты часто бывают достаточно информативными. Концентрация АКТГ в плазме крови здоровых собак колеблется в пределах от 10 до 80 пг/мл. У собак с ГЗГ этот диапазон составляет 45-450 пг/мл, а у животных с ГОН уровень эндогенного АКТГ в крови бывает от неопределяемо низкого до 45 пг/мл. Таким образом, этот показатель перекрывается у здоровых собак и собак с ГЗГ или ГОН в диапазоне от 10 до 45 пг/мл.
Именно по этой причине данный метод используют для дифференциальной диагностики, а не как скрининговый тест. Кроме того, у собак с ГОН и
400 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
с ятрогенным синдромом Кушинга концентрация эндогенного АКТГ может быть ниже чувствительности метода.
Диапазон нормальных концентраций эндогенного АКТГ в плазме крови кошек был установлен на основании результатов наших предыдущих исследований (Smith, Feldman, 1987) и данных, полученных при обследовании еще 140 здоровых кошек обоего пола старше 5 лет (все животные были кастрированы). Было установлено, что в норме концентрация АКТГ колеблется в пределах 10-60 пг/мл. Концентрация эндогенного АКТГ ниже чувствительности метода определения (< 10 пг/мл) указывает на наличие ГОН, а концентрация выше 45 пг/мл условно принята в качестве показателя ГЗГ (по аналогии с собаками). Таким образом, концентрации эндогенного АКТГ в плазме крови кошек в диапазоне от 10 до 45 пг/мл не имеют диагностической значимости.
Результаты. Данные о концентрации эндогенного АКТГ в плазме крови были получены от 51 кошки с ССКК. 38 из них были обследованы в нашей клинике, а сведения об остальных 13 животных взяты из литературы (о шести - из Goosens et al, 1995 и о семи - из Meij et al, 2001). Все 13 кошек последней группы имели ГЗГ, 32 из обследованных нами животных страдали ГЗГ, а у остальных шести был диагностирован ГОН. Из таблицы 7-11 следует, что при определении эндогенного АКТГ были получены очень четкие результаты. У всех шести кошек с ГОН (100%) АКТГ в крови практически отсутствовал. У сорока двух из 45 особей (93%) с ГЗГ концентрация АКТГ была выше 45 пг/мл, что соответствовало диагнозу. У трех кошек с ГЗГ результаты определения концентрации эндогенного АКТГ были признаны диагностически незначимыми (соответственно 38, 40 и 41 пг/мл), хотя они отличались от полученных у кошек с ГОН. Учитывая, что диапазон диагностически незначимых концентраций АКТГ был выбран достаточно произвольно и что у всех кошек с ГОН концентрация АКТГ была ниже чувствительности метода, возможно, имеет смысл пересмотреть показатели, сопоставимые с диагнозом ГЗГ. Как бы то ни было, результаты определения концентрации эндогенного АКТГ в плазме крови кошек оказались весьма обнадеживающими, поскольку они соответствовали диагнозу, по меньшей мере, у 48 из 51 кошек с ГЗГ (94%).
У большинства собак с ГЗГ концентрация эндогенного АКТГ в плазме крови колеблется от 45 до 450 пг/мл, при этом приблизительно у 40% животных этой группы она остается в пределах нормальных величин (45-80 пг/мл), а у 40% составляет 80-450 пг/мл. Примерно у 20% собак с ГЗГ результаты определения эндогенного АКТГ в плазме крови не имеют диагностической значимости (попадают в диапазон от 20 до 45 пг/мл). Почти у 50% собак с ГОН АКТГ в крови не определяется, что подтверждает диагноз, а у другой половины собак результаты определения не имеют диагностической
значимости. Для сравнения, у собак со спонтанным гипокортицизмом (болезнью Аддисона) концентрация эндогенного АКТГ в плазме крови колеблется от 500 до 5000 пг/мл, что явно отличается от концентрации эндогенного АКТГ в крови собак с ГЗГ (т.е. результаты определений АКТГ при этих патологиях редко перекрываются).
У 25 из 45 кошек с ГЗГ концентрация эндогенного АКТГ в плазме крови была сходна с таковой у собак с ГЗГ (от 45 до 450 пг/мл). Однако у 17 из 45 кошек с ГЗГ (38%) концентрация АКТГ превышала 450 пг/ мл, составляя в среднем 1002±731 пг/мл при колебаниях от 487 до 3850 пг/мл. Мы не знаем, почему так велико число кошек с ГЗГ, у которых столь сильно повышена концентрация эндогенного АКТГ (выше 450 пг/мл). Не потому ли, что гипофизарные опухоли продуцируют избыточные количества АКТГ, или метод дает менее достоверные результаты, чем у собак, или существуют какие-то иные причины? Очень высокие концентрации эндогенного АКТГ были зарегистрированы не только у обследованных нами кошек, но и в исследованиях Meij с соавторами (2001). Эти авторы указывают, что у одной кошки результат определения АКТГ в плазме крови имму-норадиометрическим методом составлял лишь 20% величины, полученной методом с использованием поликлональных антител. Возможно, эти антитела ошибочно принимали за АКТГ какие-то другие молекулы. Не исключено, что гипофизарные опухоли секретируют предшественник АКТГ проопиоме-ланокортин (ПОМК) или пептиды - производные ПОМК, которые узнаются поликлональными антителами как АКТГ. Аналогичная ситуация была отмечена у собак (Goosens et al, 1995).
И у собак, и у кошек клетки промежуточной доли гипофиза, или pars intermedia (PI), иммуноцитохимически гетерогенны. Иммуноположительная окраска некоторых из них свидетельствует об их способности синтезировать АКТГ, подобно кортикотрофам передней доли гипофиза (pars distalis, PD). Кроме того в промежуточной доле гипофиза АКТГ расщепляется с образованием а-МСГ и кортикотропин-подоб-ного пептида. Окрашивание этих меланотропных клеток промежуточной доли выявляет присутствие а-МСГ, а не АКТГ (Halmi, Krieger, 1983, Rijnberk, 1996 ). Авторы высказали предположение, что концентрация а-МСГ должна быть повышена в плазме крови кошек с аденомой промежуточной доли (Meij et al., 2001). Однако на самом деле максимальную концентрацию а-МСГ они обнаружили у животных с аденомами аденогипофиза. Они объяснили это снятием супрессии гена, который кодирует расщепляющий АКТГ фермент (проконвертазу 2), в процессе неопластической трансформации кортикотрофов PD (Low et al, 1993). Согласно другому объяснению, некоторые аденомы PD формируются из разреженной популяции меланоцитов PD, как это имеет место у людей (Coates et al, 1986). Однако у собак лишь небольшое число аденом PD по данным иммуноцитохимического исследования содержат а-
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 401
МСГ (Peterson et al, 1982). У кошек, в отличие от собак, установить происхождение аденомы (в PI или PD ) иммуноцитохимически невозможно, поскольку эти опухоли положительно окрашиваются как на АКТГ, так и на а-МСГ.
Выводы. Правильный диагноз ГОН или ГЗГ на основании результатов определения эндогенного АКТГ в плазме крови был установлен у 48 из 51 кошек с ССКК (94%). Определение эндогенного АКТГ имело диагностическую ценность у всех 6 кошек с ГОН. Однако общее число обследованных животных с ГОН было невелико, и для оценки чувствительности этого метода необходимы дополнительные исследования. У трех из 45 включенных в исследование кошек с ГЗГ концентрация эндогенного АКТГ составляла 38^45 пг/мл, т.е. была несколько ниже «диагностической концентрации». В то же время, у 42 из 45 животных с ГЗГ полученные результаты соответствовали диагнозу. В общей сложности у 48 из 51 особи результаты были «правильными», и не было животных с «неправильными» результатами. Полученные данные показывают, что определение эндогенного АКТГ в плазме крови можно использовать для дифференциальной диагностики ГЗГ и ГОН у кошек с ССКК.
Рентгенологическое исследование брюшной полости
Рентгенологические исследования кошек с ССКК выявляют такие же изменения, как у собак. Они включают четкую контрастность благодаря жировым отложениям в брыжейке, отвислый живот и гепатомегалию, которая у кошек обычно является следствием сахарного диабета, в отличие от собак, у которых она чаще обусловлена воздействием стероидов. Читатели, интересующиеся рентгенологическими исследованиями, могут обратиться к соответствующему разделу в гл. 6, где описаны изменения, выявляемые с помощью этого метода у собак с синдромом Кушинга. В данном разделе мы ограничиваемся кратким обсуждением, поскольку рентгенологическое исследование брюшной полости в настоящее время все чаще уступает место ультразвуковому как главному инструменту оценки состояния брюшной полости при обследовании кошек с диагностированным или предполагаемым ССКК. Главная причина вытеснения рентгенологического исследования ультразвуковым состоит в том, что первое не позволяет визуализировать надпочечники, если они не кальцифицированы или не имеют чрезмерно больших размеров (и то, и другое состояние встречаются редко). В то же время надпочечники собак и кошек легко визуализируются при использовании ультразвуковой аппаратуры. Принимая во внимание, что стоимость ультразвукового исследования не намного выше рентгенологического, естественно выбирать метод, позволяющий получить максимальное количество информации.
Ультразвуковое исследование брюшной полости
Общие сведения. До недавнего времени публикаций о результатах УЗИ надпочечников у кошек были довольно мало. Отчасти это объяснялось тем простым обстоятельством, что заболевания надпочечников у кошек встречаются относительно редко. Кроме того, было широко распространено мнение о трудности визуализации надпочечников с помощью УЗИ. Тем не менее, на протяжении последних 10-15 лет этот метод приобретал все большую популярность в качестве инструмента диагностики в ветеринарии мелких животных. По мере все большего использования ультразвуковой диагностики разнообразных патологических состояний у собак и кошек ветеринары накапливали опыт и необходимые навыки.
Применительно к спонтанному гиперкортициз-му (синдрому Кушинга) визуализация надпочечников стала весьма эффективным средством дифференциальной диагностики ГЗГ и ГОН. У собак с ГЗГ оба надпочечника имеют примерно одинаковые размеры, при этом они могут быть увеличены или иметь нормальные размеры. С другой стороны, у собак с ГОН один надпочечник обычно выглядит как некая «масса», тогда как другой очень мал или вообще не определяется. Предполагается, что такая же ситуация имеет место у кошек с подтвержденным или подозреваемым ССКК.
Литературные данные. Методы визуализации надпочечников совершенствовались по мере улучшения знаний об ориентации тканей, приобретения операторами необходимых навыков и модернизации оборудования (Barthez et al, 1995; Horauf, Reusch, 1995). Одно из исследований было проведено на анестезированных кошках (Cartee, Finn-Bodner, 1993). Однако в общей медицинской практике анестезия никогда не применяется при УЗИ и впоследствии было проведено исследование на 20 здоровых неанестезированных кошках. Были получены четкие изображения обоих надпочечников у всех кошек и определены их размеры без применения анестезии и седативых средств. Правый и левый надпочечники имели практически идентичные размеры и сходную удлиненную либо овальную и бобовидную форму (табл. 7-13, Zimmer et al, 2000). Эти авторы нашли, что в целом надпочечники кошек менее эхогенны, чем окружающие их ткани, а правую железу технически труднее визуализировать, чем левую. У шести из 20 кошек в надпочечниках были различимы две зоны, центральная и периферическая, причем первая была более эхогенна, чем вторая. Авторы указывают также, что у здоровых кошек надпочечники визуализировались легче, чем у здоровых собак.
Результаты. Данные, полученные при УЗИ брюшной полости и попытках визуализации надпочечников у кошек с ССКК, суммированы в табл. 7-14. В исследование была включена 41 кошка. Тридцать
402 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
ТАБЛИЦА 7-13. ДЛИНА И ШИРИНА НАДПОЧЕЧНИКОВ, ИЗМЕРЕННЫЕ С ПОМОЩЬЮ УЗИ У 20 ЗДОРОВЫХ НЕАНЕСТЕЗИРОВАННЫХ КОШЕК
Число кошек Параметр Длина правого надпочечника Ширина правого надпочечника Длина левого надпочечника Ширина левого надпочечника
20 Диапазон (см) 0,7-1,4 0,3-0,45 0,45-1,3 0,3-0,5
Медиана (см) 1,0 0,4 0,9 0,4
Из: Zimmer et al, 2000.
пять из этих животных были обследованы в нашей клинике, а данные об остальных шести почерпнуты из литературных источников (одна кошка из Daley et al, 1993, четыре из Watson, Herrtage, 1998 и одна из Moore et al, 2000). В отличие от эндокринологических данных, результаты УЗИ мелких животных требуют индивидуального анализа, поскольку они в значительной степени субъективны и очень сильно зависят от квалификации и опыта оператора, а также от качества оборудования.
Принимая во внимание это ограничение, полученные результаты можно считать вполне удовлетворительными. Исходно предполагалось, что кошки с ГЗГ должны иметь нормальные или увеличенные надпочечники равного размера, а у кошек с ГОН в одном надпочечнике должна присутствовать опухолевидная масса, а другой должен быть маленьким или не визуализироваться. Согласно этим критериям, «правильные» результаты УЗИ были получены у 38 из 41 кошек (83%) (см. табл. 7-14). У трех (7%) исследование ничего не дало, поскольку вообще не выявило надпочечниковой ткани (у двух кошек с ГЗГ и у одной с
ТАБЛИЦА 7-14. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ УЛЬТРАЗВУКОВОГО
ИССЛЕДОВАНИЯ БРЮШНОЙ ПОЛОСТИ У 41 КОШКИ СО СПОНТАННЫМ
ГИПЕРКОРТИЦИЗМОМ
Возможный результат Число кошек
Кошки с ГОН П - опухоль, 3
(9 животных) Л - маленький Л - опухоль, 0 П - маленький П - опухоль, 2 Л - не визуализируется Л - опухолевидная масса, П - не 2 визуализируется Оба надпочечника увеличены 1 Оба надпочечника не визуализи- 1 руются
Кошки с ГЗГ Оба надпочечника имеют нормаль- 5
(32 животных) ные размеры Оба надпочечника увеличены 22 Л - нормальный или увеличенный, 2 П- не визуализируется П - нормальный или увеличенный, 1 Л - не визуализируется Оба надпочечника не визуализи- 2 руются
ГОН - гиперкортицизм, обусловленный опухолями коры надпочечников, ГЗГ - гиперкортицизм зависимый от гипофиза, П - правый надпочечник, Л - левый надпочечник
ГОН). У четырех животных из 41 (10%) были получены неоднозначные результаты. Так, три из 32 кошек (9%) с ГЗГ имели один нормальный или увеличенный, а другой невизуализируемый надпочечники, что было бы сопоставимо с диагнозом ГОН, однако у всех трех особей был диагностирован ГЗГ. У одной из 9 кошек с ГОН при УЗИ было выявлено увеличение обоих надпочечников, но во время хирургической операции в одном из них была обнаружена опухоль (позднее гистологически идентифицированная как карцинома коры надпочечников), а противоположный надпочечник имел маленькие размеры и был атрофирован.
У 27 из 32 кошек с ГЗГ (84%) были визуализированы относительно равные по размеру надпочечники, т.е. у этих 27 животных УЗИ оказалось эффективным дискриминационным методом. Односторонняя опухоль при наличии второго надпочечника маленького или неподдающегося визуализации размера была обнаружена у 7 из 9 кошек с ГОН (78%). Это так же подтверждает, что УЗИ можно использовать в качестве дискриминационного диагностического теста. Ранее указывалось, что с помощью УЗИ удалось правильно идентифицировать ГЗГ или ГОН в общей сложности у 34 из 41 кошки с ССКК (83%). Учитывая субъективный характер УЗИ, результаты могли бы быть значительно лучше, если бы исследование проводилось одним опытным специалистом и на новейшем ультразвуковом оборудовании. Но даже независимо от этих соображений, УЗИ брюшной полости является прекрасным методом дифференциальной диагностики ГЗГ и ГОН у кошек. Небесполезно также еще раз напомнить читателю, что результаты УЗИ субъективны, а его успешность меняется в зависимости от обстоятельств. Маловероятно, что любое масштабное исследование позволит получить только правильные данные.
Биопсия под контролем ультразвукового исследования
В некоторых сообщениях о применении УЗИ для оценки состояния кошек с ССКК говорится об успешной чрескожной биопсии опухоли надпочечников. Однако в эти исследования были заведомо включены животные с подозрением на ССКК. Учитывая высокий риск кровотечения, мы сомневаемся в целесообразности получения данных таким методом, несмотря на то, что биопсия проводилась под контролем УЗИ.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 403
КОМПЬЮТЕРНАЯ (КТ) И МАГНИТНО-РЕЗОНАНСНАЯ (МРТ) ТОМОГРАФИЯ
Общие сведения
У кошек с сахарным диабетом причиной устойчивой гипергликемии может служить заниженная доза инсулина, ошибка владельца животного при его введении или при выполнении других процедур, вторичное повышение уровня глюкозы в крови после индуцированной инсулином гипогликемии (эффект Сомоги), быстрый обмен введенного инсулина или резистентность к нему, обычно обусловленная первичным или сопутствующим заболеванием. «Инсулинорезистентность» (истинная или ложная) является наиболее частым явлением, заставляющим ветеринара подозревать ССКК у кошек. Выше в этой главе указывалось, что другими причинами, вызывающими подозрение на ССКК при дифференциальной диагностике, служат хрупкая кожа, изменение отношения КОР/КРЕ в моче, выраженная кровоточивость и т.п. Термином инсулинорезистентный сахарный диабет обозначают клинический синдром, при котором обычно применяемые адекватные дозы инсулина не вызывают желаемого снижения концентрации глюкозы в крови. Не существует определенной абсолютной дозы инсулина, которую можно было бы использовать в качестве критерия чувствительности животного к этому гормону. Тем не менее, кошки с сахарным диабетом обычно считаются инсулинорезистентными, если концентрация глюкозы в крови не опускается ниже 300 мг/100 мл в любые сроки после введения инсулина в дозе 2,2 ЕД/кг или выше.
Существуют две эндокринологические причины инсулинорезистентно сти у кошек с сахарным диабетом: акромегалия и гиперкортицизм (ССКК). Наиболее частой причиной обоих этих заболеваний у кошек является функционально активная опухоль гипофиза. Подходы к диагностике акромегалии обсуждались в гл. 2, а вопросы диагностики ССКК рассматриваются в настоящем разделе. Мы рекомендуем подтвердить наличие того или иного заболевания, прежде чем приступать к исчерпывающему исследованию ССКК с помощью КТ или МРТ. Эти методы обеспечивают неинвазивную визуализацию внутричерепных опухолей, однако они требуют специального оборудования, применения анестезии и больших затрат. У нас нет собственного большого опыта визуализации органов брюшной полости с помощью КТ или МРТ у кошек с ССКК и поэтому мы не обсуждаем здесь этот вопрос.
МРТ является методом выбора при диагностическом исследовании гипофизарной области у людей, так как обладает более высокой разрешающей способностью при выявлении анатомических структур и обеспечивает более выраженное контрастирование мягких тканей, чем КТ (Chakere et al, 1989; Stein et al, 1989). Кроме того, при визуализации средней и каудальной ямок мозга с помощью МРТ
снижается риск получения артефактов (Kaufman, 1984). Этот метод позволяет также получать изображения, ориентированные в любой плоскости, что имеет важное значение при обследовании ямок мозга. Выбор таких сложных методов как КТ или МРТ в качестве диагностических инструментов для кошек с подозрением на ССКК определяется необходимостью выяснить наличие или отсутствие опухолевидной массы в гипофизе. Как показывает наш опыт, и КТ и МРТ позволяют надежно визуализировать гипофизарные опухоли с диаметром более 3 мм. Таким образом, если ветеринар считает необходимым проведение таких исследований, но располагает только одним из двух методов, он может использовать имеющуюся возможность. Если же доступны оба метода томографии, следует отдать предпочтение менее дорогостоящему или требующему менее продолжительной анестезии.
Здоровые кошки
Недавно были установлены размеры гипофиза у здоровых кошек. Измерения проводились на сканограммах, полученных в поперечной и сагиттальной плоскостях методом МРТ после введения гадолиния (контрастного материала) 17 кошкам. Возраст животных составлял от 1 года до 15 лет, а вес тела от 2,9 до 6,5 кг. Длина и ширина гипофизов составляли в среднем соответственно 0,54±0,06 и 0,5±0,08 см. Средняя высота гипофизов на сканограммах, полученных в поперечном и сагиттальном планах, равнялась соответственно 0,33±0,05 см, а средний объем 0,05 см3. Объем гипофиза не коррелировал с весом или возрастом животных. Изображение гипофиза на сканограммах, полученных до введения контрастного вещества, соответствовало «сигналу средней интенсивности», тогда как после его введения имело место равномерное усиление контрастности (Wallack et al, 2003).
Результаты
Данные, полученные в нашей клинике и имеющиеся в литературе, немногочисленны. Сканограммы мозга и гипофиза были получены от 27 кошек с ССКК, имевших подтвержденный диагноз ГЗГ (табл. 7-15). Четырнадцать сканограмм были получены при обследовании кошек с ССКК (ГЗГ) в нашей клинике, а 13 других - в ветеринарной школе Утрехта, Нидерланды (шесть кошек описаны Goosens et al, 1995, а семь - Meji et al, 2001). Видимая опухоль гипофиза (от 5 до 11 мм в диаметре) была обнаружена у 15 из 27 кошек с ГЗГ (15%) (рис. 7-5). Примерно таким же был процент выявления видимой опухоли у собак с ГЗГ на момент установления диагноза. При обследовании 13 кошек из Утрехта с применением КТ опухоли гипофиза были обнаружены у 6 особей (46%). Из 14 кошек, обследованных в нашей клинике, опухоли визуализировались у 9 (64%). Девять наших кошек были обследованы с помощью
404 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
Рис. 7-5. Компьютерная гомограмма (КТ) гипофизарной облает головного мозга кошки с гиперкортицизмом зависимым от гипофиза, на которой видна опухоль.
К Г (опухоли были обнаружены у шести), а из пяти кошек, обследованных с применением МРТ. опухоли были визуализированы у трех.
Мы полагаем, что остальные кошки с подтверж-:енным диагнозом ГЗГ также имели гипофизарные опухоли, однако их размер был меньше порога определения КТ и МРТ.
Выводы
Визуализация гипофиза выполняет несколько важных задач. Во-первых, КТ и МРТ помогают подтвердить диагноз ССКК. Однако такой способ иа-гностики слишком дорог и менее чувствителен, чем ПНДД и отношение КОР/КРЕ в моче (стоимость этих тестов значительно ниже, и они не требуют анестезии животного). Сканирование с помощью КТ и МРТ можно использовать в качестве дискриминационных тестов для дифференциации ГЗГ и ГОН у кошек с ССКК. Но и в этом случае такой подхо i слишком дорог и мало чувствителен, поскольку кошки с ГОН и почти половина кошек с ГЗГ могут иметь нормальные сканограммы, которые нс дадут никакой дополнительной информации, кроме предположения о маленьком размере гипофизарной опухоли у кошки с ГЗГ.
ТАБЛИЦА 7-15. РЕЗУЛЬТАТЫ КОМПЬЮТЕРНОЙ (КТ) И МАГНИТНО-РЕЗОНАНСНОЙ (МРТ) ТОМОГРАФИИ У 27 КОШЕК* С СИНДРОМОМ КУШИНГА (ССКК) И ПОДТВЕРЖДЕННЫМ ГИПЕРКОРТИЦИЗМОМ ЗАВИСИМЫМ от ГИПОФИЗА (ГЗГ)
Результат! КТ-сканирование МРТ-сканиро-ванне
Нормальные (отсутствие 10 кошек 2 кошки
опухоли) Видимая опухоль (макси- 12 кошек 3 кошки
мальный диаметр 5-11 мм) Всего 22 кошки 5 кошек
* Данные о 14 кошках взяты из серии UC Davis, о семи — из Meij et al, 2001 и о шести — из Goosens et al, 1995.
Мы рекомендуем испольювать КТ и МРТ в качестве предварительного скринингового исследования у кошек, которым назначены гипофизэктомия или облучение гипофиза. Оба метода можно применять для оценки состояния кошек с ССКК с сопутствующими признаками нарушений ЦНС. Правда, такие нарушения вследствие увеличения размеров гипофиза документированы у людей и собак, но до сих пор не описаны у кошек.
ЛЕЧЕНИЕ ГИПЕРКОРТИЦИЗМА ЗАВИСИМОГО ОТ ГИПОФИЗА
С течением времени мы все больше узнаем о клинической симптоматике и нарушениях рутинных лабораторных показателей у кошек с ССКК. Успешно используются соответствующие скрининговые тесты для подтверждения этого диагноза, а также методы дифференциальной диагностики ГЗГ и ГОП. Стало ясным, в каких ситуациях необходима дифференциальная диагностика ССКК, и как более точно идентифицировать это заболевание. Ниже обсуждаются различные стратегии лечения ССКК. К их числу относятся хирургическое удаление гипофиза или надпочечников, облучение гипофиза и медикаментозная терапия. Однако еще не разработаны протоколы лечения, гарантирующие его успешный исход. Ни один из предложенных способов не апробирован на достаточно большой группе кошек, что препятствует обоснованному заключению о целесообразности или нецелесообразности его широкого клинического применения. Эта область ветеринарной практики находится пока в периоде становления. С другой стороны, мы полагаем, что некоторые из имеющихся методов имеют хорошую перспективу стать успешными рутинными способами лечения (например, гипофизэктомия), тогда как другие малоперспективны (терапия митотаном или о,р‘-ДДД), а потенциальную ценность третьих еще предстоит выяснить. Диагностика ССКК ставит перед ветеринаром волнующую задачу: с одной стороны, это редкое клиническое состояние, а с другой стороны, оно привлекает все больше внимания. Кроме того, у большинства кошек ССКК протекает тяжело, с большой долей вероятности может привести к фатальному исходу и требует больших расходов на лечение.
Гипофизэктомия
Общие сведения. Методом выбора для лечения ГЗГ у людей является хирургическое удаление гипофизарной опухоли, которая секретирует избыточные количества АКТГ и, таким образом, является главной причиной заболевания (Mclby, 1988; Thomer et al. 1992). Появляется все больше данных, свидетельствующих о том, что у людей и собак такие опухоли имеют первично гипофизарное происхождение, а нс являются следствием чрезмерно высокой активности гипоталамуса (Scholtcn-Stoof,
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 405
1992; Van Wijk et al, 1992). Если опухоли гипофиза действительно первичны, их удаление должно приводить к радикальному излечению. Если же этиологической причиной ГЗГ является нарушение функции гипоталамуса, то успешная хирургическая операция будет сопровождаться рецидивами ГЗГ. У людей рецидивы ГЗГ после успешной гипофизэктомии не зарегистрированы. Аналогичная хирургическая операция является идеальным методом лечения собак и кошек с ГЗГ. Протокол этой микрохирургической процедуры был описан в ранних сообщениях Meij et al (1997, 1998) на примере 52 собак и уже тогда свидетельствовал о перспективности ее использования.
Гипофизэктомию у кошек применяли в физиологических и фармакологических исследованиях (Reaves et al, 1981; Sallanon et al, 1988). Кроме того, подробно описана микрохирургическая операция селективного удаления переднего отдела гипофиза через транссфеноидальный доступ как компонент повышения квалификации нейрохирургов (Snyckers, 1975). Приобретя опыт микрохирургической гипофизэктомии у собак с ГЗГ, нидерландские исследователи приступили к оценке эффективности этой операции у кошек. Успех этой работы был обусловлен несколькими причинами. Прежде всего, на ней было сосредоточено все внимание ведущего хирурга (Bjorn Meij), которому удалось объединить усилия коллектива научно-исследовательского учреждения (Университета Утрехта, Нидерланды) для разработки данного метода. Исследователи объясняют большую долю своего успеха тщательной предоперационной визуализацией гипофиза с помощью КТ. Они также подчеркивают большое значение совершенствования техники операции на базе последних достижений в области производства нейрохирургического инструментария, а также важную роль профилактики и лечения послеоперационных осложнений (Meij et al, 1997).
Техника операции. Исследовательская группа Университета Утрехта впервые сообщила о результатах транссфеноидальной гипофизэктомии на примере семи кошек со спонтанно развившимся ГЗГ (Meij et al, 2001). Следует иметь в виду, что эти результаты могут отличаться от ожидаемых при операциях на большем числе животных после приобретения хирургами соответствующего опыта. С одной стороны, семь особей с любым заболеванием не составляют репрезентативную группу. С другой стороны, ГЗГ у кошек - это довольно редкая патология, поэтому исследования неизбежно должны были начаться на ограниченном количестве животных (как их начинал д-р Кушинг на небольшом числе пациентов). Поэтому мы приветствовали эту работу как первый шаг на пути к более широкому клиническому применению данного метода.
Семь упомянутых кошек были прооперированы между 1994 и 1998 г.г. (Meij et al, 2001). Вес животных составлял 2,6-6,5 кг, в группу входил один самец. Диагноз гиперкортицизм, а затем ГЗГ был
установлен на основании результатов вышеописанных скрининговых и дискриминационных тестов. В предоперационном периоде у каждой особи были получены КТ-сканограммы, контрастное усиление которых позволило измерить высоту и ширину гипофиза. Длину гипофиза определяли по серии изображений, содержавших срез железы. Для облегчения локализации гипофиза во время операции последовательно анализировали КТ-сканограммы и измеряли расстояние между гипофизом и другими анатомическими структурами, служившими ориентирами для хирурга (Meij et al, 1997). Предварительная визуализация гипофиза значительно облегчала проведение операции, позволяя выбрать оптимальное положение трепанационного сверла в операционном поле (Meij et al, 2001). Оперируемую кошку располагали грудиной вниз, после разреза мягкого неба и затем сращенной с надкостницей слизистой оболочки (мукопериостеума) обнажали клиновидную кость. Формирование доступа к гипофизарной ямке завершали с помощью сверла и перфоратора, разрезали твердую мозговую оболочку и тщательно осматривали гипофиз.
Результаты. Летальных исходов во время операции не было. Однако одна кошка не вышла из наркоза, у нее сохранялось коматозное состояние, и она погибла. Патоморфологическое исследование выявило у этой кошки ССКК, поликистоз почек и тяжелый фиброз поджелудочной железы. Другая кошка повторно поступила в клинику через 2 недели после гипофизэктомии в связи с рецидивом хронической диареи. Позднее у нее появились неврологические расстройства и она тоже погибла. После вскрытия у нее была диагностирована злокачественная лимфома кишечника. У пяти других кошек после операции полностью исчезли симптомы клинического и химического гиперкортицизма (ССКК). У одной из них спустя 19 месяцев развился рецидив ССКК на фоне удовлетворительного клинического состояния, и она неожиданно погибла через 28 месяцев после начала лечения. У другой кошки после операции сформировалась хроническая ороназальная фистула, которую не лечили, так как она не беспокоила кошку. Через 6 месяцев после гипофизэктомии у этой особи появились анемия и анорексия и ее подвергли эвтаназии по просьбе владельца. Ороназальная фистула имелась еще у одной гипофизэктомированной кошки, а затем у нее развился гнойный ринит. Несмотря на попытки хирургической коррекции этого дефекта, кошка имела рецидивирующие инфекции носовой полости и среднего уха; она была эвтаназирована через 8 месяцев после гипофизэктомии. Послеоперационная продолжительность жизни у двух кошек составляла соответственно 15 и 46 месяцев, и ко времени подготовки публикации они оставались в состоянии полной ремиссии. У двух из пяти кошек, остававшихся жизнеспособными в течение длительного времени после операции, гипофизэктомия купировала симптомы сахарного диабета (Meij et al, 2001).
406 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
Выводы. Гипофизэктомии было подвергнуто очень небольшое число кошек.
Однако можно не сомневаться, что по мере накопления опыта гипофизэктомия станет методом выбора для лечения кошек с ГЗГ, каким она является для людей и собак. В то же время применение этого метода лимитируется рядом факторов, которые включают наличие соответствующих навыков у хирурга, оборудования и инструментов, а также условий для послеоперационного ухода за животными. Ожидается, что по мере накопления опыта станет возможным избирательное удаление АКТГ-секретирующей опухоли без травмирования непораженной части гипофиза.
Облучение гипофиза
Общие сведения. Радиотерапия - это применение ионизирующей радиации для локального или регионального облучения больных со злокачественными и иногда доброкачественными опухолями. Ветеринары-онкологи используют ее также для оценки состояния направляемых на лечение животных. Задача радиотерапии состоит в устранении опухоли без повреждения нормальной структуры и функции ткани (Theon, 2000). Для этой цели обычно используют установку, в которой источником излучения фотонов служит изотоп кобальта (Со-60) или линейный ускоритель фотонов. Обычно радиотерапия состоит в дробной обработке опухоли заранее установленной дозой излучения на протяжении нескольких недель. В настоящее время мы осуществляем оценку эффективности облучения в общей дозе 48 Гр, которое проводится в форме 15 сеансов по 3-4 Гр каждый пять раз в неделю. Облучаемое животное должно быть совершенно неподвижным, поэтому необходима анестезия.
Основной принцип клинической радиотерапии состоит в том, что она должна оказывать благотворное действие на облучаемое животное, даже если ее исход не всегда поддается точному прогнозированию. Поэтому единственным противопоказанием к ее проведению служит неспособность собаки или кошки перенести 15-кратную анестезию на протяжении 3 недель. Мы убедились также, насколько важен быстрый выход животных из наркоза, так как это дает им дополнительное время для еды накануне обязательной отмены корма за несколько часов до следующей анестезии.
Клинический опыт (собаки). Мы имеем противоречивый опыт лечения собак с ГЗГ посредством облучения гипофизарных опухолей. Эта тема подробно обсуждалась в гл. 6. С одной стороны, можно с уверенностью говорить, что собаки с ГЗГ, имеющие опухоли гипофиза с максимальным диаметром 4-12 мм в отсутствие нарушений со стороны ЦНС, имеют хорошие шансы выдержать многократное облучение, приводящее к значительному уменьшению размеров гипофизарной массы. С другой стороны, радиотерапия не всегда сопровождается
исчезновением симптоматики, характерной для гиперкортицизма. У некоторых собак признаки синдрома Кушинга купируются полностью, но лишь на время, примерно на 6-12 месяцев, а затем, как правило, развиваются рецидивы заболевания. У других собак клиническое улучшение не сопровождается полным исчезновением симптомов синдрома Кушинга. Наконец, у животных третьей группы радиотерапия вызывает значительное уменьшение размеров опухоли, не влияя на клинические проявления синдрома Кушинга. Таким образом, многие собаки, у которых облучение гипофиза привело к уменьшению опухоли, нуждаются в дополнительной медикаментозной терапии для более полного купирования симптоматики синдрома Кушинга. У собак с нарушениями в ЦНС вследствие большого размера опухоли исход радиотерапии менее предсказуем. У одних собак наступает значительное улучшение, тогда как у других эффект облучения отсутствует. Отдельные животные с большой гипофизарной опухолью не выдерживают облучения и погибают.
Клинический опыт (кошки). У нас накоплен весьма скромный опыт лечения кошек с ГЗГ путем облучения гипофизарной опухоли. Только четыре кошки, получавшие радиотерапию, оставались под наблюдением в течение достаточно длительного времени, чтобы можно было оценить отдаленные результаты лечения. У каждой из них имелись клинические признаки ГЗГ, а у двух из четырех был также инсулинорезистентный сахарный диабет. В дополнение к скрининговым и дискриминационным тестам для подтверждения диагноза сначала ССКК, а потом ГЗГ трех кошек обследовали с помощью КТ и одну с помощью МРТ. У всех были обнаружены видимые опухоли гипофиза с максимальным диаметром от 5 до 11 мм, которые подвергались 15-кратному облучению на протяжении 3 недель. У одной кошки реакция на радиотерапию отсутствовала, и спустя 7 месяцев она была подвергнута эвтаназии из-за сохранявшихся симптомов сахарного диабета и ломкости кожи. У двух кошек без диабета облучение сопровождалось улучшением клинического состояния, у них снизился вес тела, повысилась общая активность и улучшилось состояние кожного покрова. Тем не менее, одна из них погибла по неизвестной причине спустя 3 месяца после завершения лечения, а другая погибла через 14 месяцев в результате почечной недостаточности. У четвертой, самой молодой кошки (в возрасте 8 лет на момент установления диагноза) отмечали хорошую реакцию на облучение гипофиза, выражавшуюся в полном исчезновении симптомов сахарного диабета. Эта кошка прожила более 26 месяцев после окончания облучения.
Однако группа из 4 животных слишком мала, чтобы делать какие-либо определенные выводы относительно эффективности радиотерапии (недавно она была назначена еще двум кошкам, но результаты лечения оценивать преждевременно). Итак, об
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
407
лучение гипофиза имеет перспективы стать вполне приемлемым методом лечения ГЗГ у кошек, но для вынесения окончательного суждения предстоит обследовать значительно большее число животных.
Медикаментозная терапия
Митотан. Имеется несколько протоколов медикаментозного лечения кошек, страдающих ГЗГ, с использованием митотана (лизодрена, о,р’-ДДД), которые давали тот или иной, но всегда кратковременный эффект. Длительного эффекта терапия о,р’-ДДД не оказывает (Peterson, 1998). Интересно отметить, что пациенты с ГЗГ, как и кошки, далеко не столь чувствительны к о,р’-ДДД и не так хорошо реагируют на терапию, как собаки (терапевтическое применение о,р’-ДДД подробно обсуждалось в гл. 6). При введении о,р’-ДДД клинически здоровым кошкам только у половины животных препарат подавлял секреторную функцию надпочечников (Zerbe et al, 1987). Таким образом, собаки представляют необычный пример высокой чувствительности к о,р’-ДДД, которой не наблюдается ни у людей, ни у кошек. Несмотря на высказываемые опасения относительно возможного действия хлорированных углеводородов на кошек, мы не наблюдали отрицательных проявлений препарата. Проблема скорее состоит в недостаточно выраженном действии о,р’-ДДД у этих животных. Наш опыт лечения кошек митотаном ограничивается четырьмя особями. Это слишком небольшое число, даже с учетом сведений о еще нескольких кошках, получавших митотан, которые нам сообщили в ходе неформальных обсуждений с другими специалистами. Почти во всех случаях терапию митотаном назначали в ежедневной дозе 50 мг/кг, которую делили на две части и вводили перорально. Эта доза не вызывала существенного подавления функции надпочечников и не снижала тяжести клинических симптомов ССКК (Peterson et al, 1994; Duesberg, Peterson, 1997). Удвоение дозы не приводило к повышению эффективности лечения. Поэтому мы не рекомендуем применять о,р’-ДДД для лечения ССКК у кошек.
Кетоконазол. Кетоконазол представляет собой производное имидазола для приема внутрь в качестве противогрибкового препарата широкого спектра действия. Он дает хороший эффект при лечении микозов у человека и животных благодаря ингибированию (в пикомолярных концентрациях) С 14-метилирования ланостерина до эргостерина, которое прерывает рост грибковой оболочки. При повышенных концентрациях в крови млекопитающих он подавляет также биосинтез стероидов (действие этого препарата более подробно рассмотрено в гл. 6). Введение кетоконазола в дозах, обычно рекомендуемых для терапии грибковых инфекций, значительно снижает концентрацию андрогенов в крови, а его высокие концентрации подавляют секрецию кортизола (Engelhardt et al, 1991). Кетоконазол является наиболее эффективным лекарственным средством
для лечения ГЗГ у людей при приеме внутрь. В то же время у собак его терапевтическое действие не столь последовательно и радикально. Полагают, что пониженная активность кетоконазола обусловлена, по крайней мере частично, отсутствием всасывания препарата в желудочно-кишечном тракте примерно у 20-25% собак.
Кетоконазол не всегда подавляет функцию коры надпочечников у здоровых кошек и у кошек с гиперкортицизмом. Введение четырем здоровым котам кетоконазола в дозе 30 мг/кг ежедневно на протяжении 30 дней не вызывало существенных изменений концентрации тестостерона и кортизола в плазме крови. Концентрация тестостерона несколько понизилась в течение первых 7 дней терапии, но у двух из четырех животных практически восстановилась до первоначального уровня к 30 дню (Willard et al, 1986). Ранее было показано, что в той же дозе кетоконазол эффективен у собак. Наш собственный опыт ограничивается применением кетоконазола для лечения спонтанного ГЗГ у пяти кошек. У трех из них наблюдали умеренную, но недостаточную реакцию на терапию. У одной реакция отсутствовала, а еще у одной через несколько недель после начала введения кетоконазола развилась тяжелая тромбоцитопения. Неизвестно, правда, была ли она вызвана кетоконазолом или имела иное происхождение. Как бы то ни было, мы не очень рекомендуем применять кетоконазол для лечения ССКК у кошек.
Этомидат. Этомидат представляет собой анестезирующее средство для внутривенного введения с короткой продолжительностью действия, которое применяется для наркоза у самых разных видов животных. Поскольку он оказывает минимальное отрицательное воздействие на сердечно-сосудистую систему, этомидат чаще всего используют для анестезии больных в критическом состоянии, при наличии сердечно-сосудистого заболевания, а также при высоком риске развития гиповолемии или шока.
Было показано, что введение этомидата подавляет функцию надпочечников у людей, кошек и собак. У кошек секреторная активность коры надпочечников значительно снижалась в течение двух часов наркоза и еще в течение часа после прекращения его действия (Moon, 1997). Введение данного препарата с целью анестезии создает дополнительный риск для кошек, находящихся в критическом состоянии. В то же время медленно высвобождаемая форма препарата может стать эффективным средством терапии гиперкортицизма у кошек.
Метирапон и аминоглютетимид. Метирапон (производства Novartis, США) представляет собой препарат для перорального применения, который блокирует 11 p-гидроксилазу, катализирующую превращение 11-дезоксикортизола в кортизол. Аминоглютетимид или цитадрен (производства CIBA Pharmaceutical Company, США) - еще один блокатор ферментативной активности, ингибирующий превращение холестерина в прегненолон (мы вводили его только одной кошке, но некоторые ве
408 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
теринары использовали его более широко под нашим наблюдением). Предшественники кортизола биологически неактивны или обладают низкой активностью, поэтому подавление отдельных стадий биосинтеза кортизола может привести к устранению его избытка в плазме крови при спонтанном синдроме Кушинга. Людям с синдромом Кушинга назначают медикаментозное терапию такими препаратами, как метирапон, с целью подготовки их к хирургической операции, снижения гиперкор-тизолемии перед облучением гипофиза или при паллиативном лечении при наличии метастазов (Verheist et al, 1991). Установлена терапевтическая эффективность метирапона у людей с ГЗГ и ГОН. При хроническом введении этого препарата людям изредка отмечаются нежелательные побочные эффекты, среди которых преобладает преходящая ги-покортизолемия. Главный недостаток метирапона состоит в индукции компенсаторного повышения концентрации эндогенного АКТГ, что нивелирует блокаду биосинтеза кортизола в коре надпочечников (Orth, 1978).
Нам неизвестны публикации об использовании метирапона в лечении спонтанного синдрома Кушинга у собак. Имеются сообщения о применении этого препарата у нескольких кошек с ССКК, а наш собственный опыт ограничивается его введением четырем кошкам. Все они хорошо отвечали на терапию и побочных эффектов не было (кроме гипогликемии). То же наблюдалось и у двух описанных в литературе кошек, которым метирапон вводили перорально дважды в день в дозе 30-70 мг/кг (Daley et al, 1993; Moore et al, 2000b). Мы рекомендуем давать животным препарат, по возможности начиная с минимально эффективных доз, на протяжении 2-4 недель, а затем повторно оценить их клиническое состояние, в том числе с помощью провокационной пробы с АКТГ. Следует помнить, что эту пробу необходимо проводить на фоне терапии. В случае необходимости дозу метирапона постепенно увеличивают. Мы не советуем вводить метирапон в количествах более 70 мг/кг дважды в день, хотя имеются сообщения о применении и более высоких доз. Правда, в этих случаях наблюдали рвоту и потерю животными аппетита, что могло быть следствием передозировки метирапона и требовало прекращения терапии. Такие побочные эффекты отсутствовали при использовавшихся нами дозах метирапона. (Дозировки и тактика применения аминоглютетимида описаны в разделе «Первичные опухоли надпочечников, синтезирующие прогестерон, у кошек» в настоящей главе).
Субъективное улучшение состояния отмечали, по меньшей мере, еще у трех кошек, получавших метирапон. Одна из них находилась под наблюдением на протяжении 10 месяцев после терапии, но потом выпала из поля зрения ветеринаров (Nelson et al, 1988). Другую кошку мы наблюдали в течение 6 месяцев, но затем ее владелец отказался от продолжения наблюдений. Впоследствии эта кош
ка успешно перенесла двустороннюю адреналэктомию в другой клинике и жила еще несколько лет без симптомов гиперкортицизма. Третья кошка с ССКК и сахарным диабетом получала метирапон всего 21 день. За время лечения у ее хозяина возникло подозрение на гипогликемию, и он снизил дозу инсулина. У этой особи также улучшилось состояние шерстяного покрова, уменьшились размеры живота и печени и исчезли признаки абсцесса на морде. Повторные провокационные пробы с АКТГ не выявили явных изменений; вместе с тем, было отмечено улучшение активности ферментов печени. В последующем эта кошка успешно перенесла двустороннюю адреналэктомию (Moore et al, 2000а). У одной из двух дополнительно обследованных кошек лечение метирапоном также привело к некоторому улучшению клинического состояния (Peterson, 1988). У другой имело место временное снижение базальной и индуцированной экзогенным АКТГ концентрации кортизола и уменьшение тяжести клинической симптоматики; в последующем была проведена успешная адреналэктомия (Daley et al, 1993).
В случае эффективной терапии метирапоном должно происходить уменьшение базальной и индуцированной экзогенным АКТГ концентрации кортизола и снижение тяжести клинических проявлений заболевания. Поскольку продолжительность лечения метирапоном практически у всех кошек была короткой, нет четких данных об увеличении концентрации эндогенного АКТГ и снятия блокады его секреции кортизолом. По этой причине терапию метирапоном считают успешной, если она приводит к клиническому улучшению и обеспечивает возможность хирургической операции с целью полного и окончательного излечения заболевания. В целом, применение метирапона для лечения ССКК у кошек остается перспективным способом краткосрочного снижения гиперкортизолемии в ходе предоперационной подготовки. Прежде чем рекомендовать этот препарат для долгосрочного применения, необходимо накопить соответствующий опыт.
Трилостан. Действие трилостана при его введении людям и собакам с гиперкортицизмом рассматривается в гл. 6. Данных о применении этого препарата у кошек нет.
Двусторонняя адреналэктомия
Общие сведения. Наш опыт свидетельствует о том, что двусторонняя адреналэктомия является наилучшим способом долгосрочного излечения кошек с ГЗГ. Следует, однако, иметь в виду, что у нас не было возможности исследовать ни долгосрочный, ни краткосрочный эффекты гипофизэктомии, а наш опыт облучения гипофиза ограничен. Выше указывалось, что гипофизэктомия является «методом выбора» для лечения ГЗГ как у людей, так и у различных видов животных. Однако мы сами не
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 409
практикуем гипофизэктомию, и для нас двусторонняя адреналэктомия остается наиболее надежным способом долгосрочного излечения. Такие операции проводятся в Северной Америке повсеместно. Протокол хирургической операции и медикаментозного лечения кошек в предоперационном и послеоперационном периодах не отличается от такового для собак (см. гл. 6), поэтому в данном разделе приводится лишь его краткое описание.
Протокол: предоперационная и послеоперационная терапия. Обычно кормление животных прекращают за 12 часов до операции. Животным внутривенно вводят консервативные объемы жидкости (при наличии диабета - 2,5 или 5%-ный раствор декстрозы). Обязательно также парентеральное введение антибиотиков, выбор которых в идеале должен определяться характером инфекции. Кошкам, нуждающимся в инсулине, утром в день операции вводят половину его обычной дозы. Как только хирург приступает к удалению первого надпочечника, животному следует внутривенно ввести дексаметазон в дозе 0,2 мг/кг. Такую же дозу вводят внутримышечно по завершении операции, а между 22.00 и 24.00 часами повторяют введение дексаметазона в дозе 0,1 мг/кг. На следующий день дексаметазон вводят дважды подкожно, до начала перорального введения преднизона, которое начинают примерно через сутки после того, как оперированная кошка начинает есть, и прием пищи не вызывает рвоты. Также по завершении операции внутримышечно вводят дезоксикортикостерона пи-волат (ДОКП) (производства Novartis, США) в дозе 2,2 мг/кг. Введение ДОКП в той же дозе повторяют подкожно через 21 и 25 дней, а в последующем его дозировки и сроки введения подбирают индивидуально в зависимости от клинического состояния животного (см. гл. 8). Сразу после окончания операции, а также вечером того же дня и на следующее утро определяют концентрации электролитов в крови, а затем повторяют определение ежедневно до возвращения кошки владельцу или до тех пор, пока она не начнет есть без признаков рвоты.
Протокол: хирургическая операция. Процедура адреналэктомии подробно описана в литературе. Если результаты дискриминационных тестов свидетельствуют о наличии ГЗГ, подлежат удалению оба надпочечника. В тех случаях, когда дискриминационные тесты предварительно не проводились или были получены неопределенные результаты, хирург оказывается перед выбором: если у кошки имеется явная опухоль надпочечника, особенно при атрофии противоположной железы, следует удалить только опухоль; если же оба надпочечника имеют нормальные размеры и форму, следует проверить достоверность диагноза ГЗГ. По нашему мнению, ни одно животное нельзя подвергать «исследовательской» операции с целью выяснения причины гиперкортицизма. Диагноз должен основываться на результатах дискриминационных тестов (в первую очередь, скрининговой ПНДД и
определения отношения КОР/КРЕ в моче), которые в сочетании с данными анамнестического анализа и физикального исследования должны удовлетворять критериям ССКК. При таком подходе к диагностике и принятию решений обнаружение «кажущихся нормальными надпочечников» просто подтверждает диагноз ГЗГ и свидетельствует о необходимости удаления обеих желез.
Протокол: послеоперационный период. Хирургическое лечение гиперкортицизма у собак и кошек всегда чревато послеоперационными осложнениями. Те из них, которые приводят к фатальному исходу или побуждают ветеринара рекомендовать эвтаназию, крайне болезненно воспринимаются как самим специалистом и хозяином животного, так и техническим или иным вспомогательным персоналом ветеринарного учреждения. Поэтому следует разъяснить потенциальную опасность таких осложнений всем лицам, принимающим участие в лечении животного, и прежде всего его хозяину, который и эмоционально и по финансовым соображениям больше других заинтересован в судьбе своего питомца. К числу наиболее тяжелых возможных осложнений относятся сепсис, панкреатит, тромбоэмболия, растрескивание кожи вследствие ее повышенной ломкости (в местах хирургического вмешательства или прежних кожных травм) и недостаточность функции коры надпочечников (Duesberg et al, 1995). Особенно часто развивается сепсис вследствие основного заболевания (синдром Кушинга предрасполагает к инфекции из-за подавления иммунной системы избытком кортизола), плохого состояния кожи или хирургической операции в брюшной полости. Мы наблюдали сепсис у 40% прооперированных кошек, несмотря на крайне осторожное обращение с тканями и тщательные меры по заживлению ран до, во время и после операции. В нашей практике сепсис и растрескивание кожи были основными причинами болезненности и смертности оперированных кошек. Частоту послеоперационных осложнений можно снизить правильной медикаментозной терапией синдрома Кушинга в предоперационном периоде с использованием таких средств, как метирапон.
Клинический опыт. Опыт хирургического лечения двусторонней гиперплазии коры надпочечников у кошек с ГЗГ пока еще невелик, а реакция животных на эту операцию бывает очень разной. Практически все операции завершались успешно, и животные сохраняли жизнеспособность. Частота послеоперационных осложнений была довольно высокой, однако в большинстве случаев они не приводили к смерти животных. Мы располагаем данными о 21 кошке с ГЗГ, которые подвергались двусторонней адреналэктомии: 15 из них были оперированы в нашей клинике, а шесть в других клиниках (четыре - Watson, Heritage, 1998, одна - Daley et al, 1993 и одна - Moore et al, 2000a). Результаты лечения восьми наших кошек были опубликованы (Duesberg et al, 1995).
410 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
У 13 из 21 кошек, которые перенесли двустороннюю адреналэктомию, исчезли все клинические симптомы ССКК. Все они прожили месяцы или больше года после операции, а 9 из них оставались здоровыми при последнем обследовании. В это число входили четыре кошки, оперированные в нашей клинике, которые и по сей день живы и здоровы, и по одной кошке из каждого из трех цитированных исследований (Watson, Heritage, 1998; Daley et al, 1993 и Moore et al, 2000a). У трех наших кошек и у одной из сообщения Watson и Heritage полностью исчезли симптомы ССКК. Все они прожили более года и, как мы думаем, умерли вне связи с этим заболеванием (у двоих имелась почечная недостаточность, у одной карцинома поджелудочной железы, а причину смерти последней установить не удалось).
Пять животных погибли сравнительно скоро после операции. Одна кошка была найдена мертвой в своей клетке через 24 часа после операции, а еще одна умерла спустя 20 дней в результате недостаточности почечной функции (Watson, Heritage, 1998). Две кошки умерли от заражения крови через месяц после операции; у обеих имело место сильное растрескивание кожи и генерализованная инфекция. Их агрессивное лечение оказалось безуспешным. Пятая кошка погибла из-за подтвержденной легочной тромбоэмболии спустя 3 недели после операции. Еще три из наших кошек хорошо перенесли операцию, после которой у них исчезли симптомы ССКК; тем не менее, они умерли в течение нескольких следующих месяцев. Одна погибла спустя 4 месяца в результате тяжелого заболевания, вызванного крупной опухолью в брюшной полости (на вскрытии после эвтаназии у нее была обнаружена карцинома поджелудочной железы). Смерть двух других животных последовала после криза, вызванного надпочечниковой недостаточностью, соответственно через 3 и 6 месяцев после адреналэктомии.
Выводы. Полное излечение ССКК маловероятно даже в случае успешно проведенной двусторонней адреналэктомии. У таких животных довольно велик риск лапаротомии. Его можно уменьшить при правильном отборе кошек для хирургического лечения, надлежащей предоперационной подготовке, сокращении до минимума продолжительности операции и сопутствующей анестезии и тщательном уходе за оперированными животными. В то же время у многих старых кошек имеются тяжелые заболевания других органов. По-видимому, именно по этой причине большинство поступавших в нашу клинику кошек с ССКК никогда не получало лечения.
При всем том, двусторонняя адреналэктомия остается наилучшим способом устойчивого излечения ССКК, пока не получит более широкого распространения гипофизэктомия или не будет повышена эффективность облучения гипофиза. В качестве альтернативного подхода можно использовать новые методы медикаментозной терапии (трилостаном?), которые обладают известными преимуществами по сравнению с применяемыми в настоящее время.
ЛЕЧЕНИЕ ГИПЕРКОРТИЦИЗМА, ВЫЗЫВАЕМОГО ОПУХОЛЯМИ НАДПОЧЕЧНИКОВ
Общая характеристика
Хирургическое лечение является оптимальным способом лечения людей, собак и кошек с синдромом Кушинга, вызываемым опухолями коры надпочечников. К сожалению, самые разнообразные факторы препятствуют широкому использованию этого подхода. Возможно, самой частой причиной отказа хозяина кошки от операции является его высокая стоимость в сочетании с неблагоприятным прогнозом. Все хирургические и сопутствующие процедуры очень дорого обходятся хозяевам животных. Многие из них, сопоставив расходы и высокую вероятность неблагоприятного исхода лечения в целом, отказываются от операции. Тем из нас, кто занимается ветеринарной практикой на базе «образовательных лечебных учреждений», приходится иметь дело с наиболее требовательными клиентами, соглашающимися на такие способы лечения своих питомцев, которые далеко не всегда выбирают другие хозяева кошек. Поэтому число кошек, получающих лечение (в процентном отношении) в нашей клинике, не отражает ситуации, которая имеет место в частной ветеринарной практике. Важнейшее значение имеет также отбор животных для хирургического лечения, так как такая инвазивная процедура просто противопоказана многим кошкам с ССКК. Хирургическое лечение не рекомендуется при наличии метастазов или тяжелого сопутствующего заболевания. Некоторые надпочечниковые опухоли неоперабельны из-за большого размера, тканевой или сосудистой инвазии либо особенностей локализации. В таких случаях единственной альтернативой хирургическому вмешательству является медикаментозная терапия.
Хирургическое лечение и ведение периоперационного периода
Односторонняя адреналэктомия кошек с ССКК и опухолью коры надпочечников обеспечивает наиболее длительный лечебный эффект. Протокол ведения периоперационного периода в целом такой же, как при двусторонней адреналэктомии. Дексаметазон в дозе 0,2 мг/кг следует вводить внутривенно после того, как хирург идентифицировал опухоль и приступил к ее удалению. Не следует вводить глюкокортикоиды раньше этого времени, так как до завершения резекции опухоли у животного сохраняется гиперкортизолемия, а дексаметазон начинает действовать сразу после его инъекции. Вместе с тем считается, что удаление опухоли одного надпочечника во всех случаях вызывает гипокортизолемию вследствие атрофии секретирующих глюкокортикоиды клеток остающейся (противоположной) железы. После того как кошка начинает самостоятельно
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
411
есть и пить (в отсутствие рвоты), парентеральные инъекции дексаметазона заменяют пероральным введением преднизона. Начальная доза последнего составляет примерно 1-2 мг в день на животное. Спустя неделю дозу преднизона начинают постепенно уменьшать и в течение 2-3 месяцев снижают до требуемой конечной величины.
Потребность в заместительном введении минералокортикоидов, в отличие от глюкокортикоидов, после односторонней адреналэктомии не поддается прогнозированию, поскольку одна железа сохраняется in situ. Наш опыт лечения собак (гораздо более значительный, но сходный с опытом работы на кошках) показывает, что большинство оперированных животных не нуждается в заместительной терапии минералокортикоидами. Поэтому мы рекомендуем измерять концентрацию натрия и калия в сыворотке (или плазме) крови сразу после завершения адреналэктомии и еще раз между 10 и 12 часами вечера того же дня. Если результаты измерений остаются в пределах нормы для данной лаборатории, определение электролитов следует продолжать ежедневно, до тех пор, пока животное не сможет самостоятельно есть и пить, и прием пищи не будет вызывать рвоту. В случае уменьшения концентрации натрия и/или повышения концентрации калия (независимо от сроков этих изменений) животным назначают дезоксикортикостерона пиволат (ДОКП) внутримышечно в начальной дозе 2,2 мг/кг. Повторное введение ДОКП можно отложить по меньшей мере на 21 день, чаще на 25 дней. Поскольку у оперированных кошек сохраняется один нормальный (хотя и атрофированный) надпочечник, нет необходимости в непрерывной заместительной терапии. Поэтому вторая доза ДОКП может составлять лишь половину первой; третью дозу уменьшают еще на 50% или вообще отменяют.
Помимо лечения расстройств, обусловленных дисфункцией надпочечников, приходится корректировать разнообразные сопутствующие нарушения. Коррекция включает, в частности, введение жидкости для поддержания требуемого уровня гидратации. Жидкостная терапия должна быть достаточно агрессивной с учетом возможности развития послеоперационного панкреатита у отдельных животных, но не должна сопровождаться избыточной нагрузкой на ослабленную сердечно-сосудистую систему. Мы отдаем себе отчет в том, что давать общие рекомендации гораздо легче, чем лечить таких животных на практике. Тем не менее, именно общие рекомендации, подчеркивающие важность индивидуализации терапии, представляются наиболее разумным подходом к решению проблемы в условиях, когда предлагаемые конкретные указания не могут быть применены к лечению всех особей. Лечение сахарного диабета при его наличии у кошек с ССКК представляет собой довольно сложную задачу. Коррекцию доз глюкокортикоидной терапии следует проводить с учетом снижения тяжести ин-сулинорезистентности, и ветеринар должен прогно
зировать возможные изменения потребности в инсулине, чтобы не допустить тяжелой гипогликемии вследствие введения его избыточных количеств. Исключительно важно обеспечить заживление ран, профилактику и лечение инфекций. Нельзя переоценить значение чуткой, любовной заботы о больной кошке, однако она не должен мешать ее выздоровлению. Поэтому ветеринар должен убедиться, что животному обеспечен надлежащий уход и, в то же время, требуемый для излечения покой. Для профилактики тромбоэмболии у таких кошек мы следуем протоколу, который описан в главе 6.
Клинический опыт
Для хирургического лечения в нашу клинику поступили только восемь кошек с опухолями коры надпочечников. Пять из них до этого не получали никакого лечения для контроля ССКК, двух лечили метирапоном и одну аминоглютетимидом. Все восемь кошек перенесли операцию, но одна погибла спустя неделю из-за расхождения хирургического шва и обширной раневой инфекции, а другая от панкреатита. Одна кошка, погибшая через 3 месяца после операции вследствие почечной недостаточности, в раннем послеоперационном периоде чувствовала себя нормально и не имела симптомов гиперкортицизма. Две кошки полностью оправились после операции и прожили около года без признаков ССКК. Одна из них умерла от сердечной недостаточности, а другая была подвергнута эвтаназии вследствие тяжелого вторичного заболевания, вызванного карциномой поджелудочной железы. Три из восьми кошек прожили более года. У всех трех полностью купировались симптомы ССКК, однако, у одной из них они появились вновь примерно через 10 месяцев после операции. Повторное обследование выявило опухоль в оставшемся надпочечнике, в связи с чем была проведена еще одна адреналэктомия. Таким образом, оперированные в нашей клинике кошки имели в общей сложности девять опухолей коры надпочечников: четыре аденомы и 5 карцином. Ни у одной из них до операции не проводилось гистологическое исследование. Во время операции и после нее локальное или отдаленное метастазирование отсутствовало.
Прогноз
Гиперкортицизм - серьезное заболевание кошек, имеющее от осторожно оптимистического до неблагоприятного прогноз. Заболеваемость и смертность среди леченых и нелеченых кошек с гиперкортицизмом обусловлены отрицательным воздействием хронической гиперкортизолемии на состояние кожи (хрупкость), эндокринную функцию поджелудочной железы (сахарный диабет) и иммунной системы. Лечение гиперкортицизма требует больших расходов, сопровождается стрессор-ным воздействием на животное и переживаниями у
412 • ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
его хозяина, и при этом не гарантирует успеха. Хирургическое вмешательство на органах брюшной полости далеко не всегда приводит к желаемому результату из-за трудности проведения операции на кошках, сильно ослабленных сопровождающими ССКК патологическими процессами, описанными в предшествующих разделах. Возможности облучения гипофиза ограничены недостатком специального оборудования, высокой стоимостью процедуры и необходимостью многократной анестезии в соответствии с протоколом радиотерапии. Гипофизэктомия также проводится нечасто, так как требует соответствующей квалификации хирурга и, как и облучение, сопряжена с большими затратами и осложняется тяжелым клиническим состоянием животных. Различные способы лечения (односторонняя и двусторонняя адреналэктомия, облучение гипофиза и гипофизэктомия) могут быть признаны «успешными» менее чем у 50% кошек, проживших более года после операции. Не следует забывать, что большинство кошек с ССКК до операции никогда не получали никакого лечения. Леченые животные лучше других переносили хирургическую операцию. Поэтому в число 50% особей, выживших в течение года (по оптимистической оценке), не входят ранее не леченые животные.
ПЕРВИЧНЫЙ ГИПЕРАЛЬДОСТЕРОНИЗМ У КОШЕК (ОПУХОЛИ НАДПОЧЕЧНИКОВ, СЕКРЕТИРУЮЩИЕ АЛЬДОСТЕРОН)
Общая характеристика
Главная функция альдостерона в организме состоит в регуляции гомеостаза натрия и калия в сыворотке крови и в поддержании нормального внутрисосудистого объема жидкости. Альдостерон является основным минералокортикоидом, который синтезируется и секретируется клубочковой зоной коры надпочечников. Синтез и секреция альдостерона регулируются уровнем калия в крови и активностью ренин-ангиотензиновой системы. Увеличение концентрации калия в крови стимулирует высвобождение альдостерона надпочечниками. Снижение кровяного давления, воспринимаемое сначала чувствительными клетками почек, индуцирует биосинтез и секрецию ренина, который, в свою очередь, усиливает стимулирующее действие ангиотензина на секрецию альдостерона. Образующийся альдостерон поступает в кровь, вызывает экскрецию калия и благоприятствует накоплению натрия. Задерживая натрий, альдостерон косвенно способствует сохранению воды, что приводит к увеличению объема крови и повышению кровяного давления.
Избыточная продукция альдостерона может быть первичной или вторичной. Первичный гипе-ралъдостеронизм определяется как «автономная секреция гормона аномальными клетками коры надпочечников». У людей такие аномальные клетки обычно обнаруживаются в аденомах коры над
почечников, хотя имеются также в карциномах и гиперплазированной ткани надпочечников, обладающей автономной секреторной функцией (White, 1994). Вторичный гиперальдостеронизм развивается как следствие некоторых заболеваний, в частности почечных или сердечных, при которых усиливается биосинтетическая активность нормальных клеток коры надпочечников, и они продуцируют избыточное количество альдостерона. Иными словами, у людей первичный гиперальдостеронизм характеризуется избыточной концентрацией альдостерона в крови, снижением концентрации ренина, гипокалиемией, усиленной экскрецией калия с мочой и повышенным кровяным давлением. Избыток альдостерона сопровождается задержкой натрия, увеличением объема внеклеточной жидкости и повышением общего содержания натрия в организме, хотя его концентрация в крови может оставаться нормальной. Увеличение объема внеклеточной жидкости и плазмы распознается рецепторами растяжения, которые входят в состав юкстагломерулярного аппарата, а задержка натрия - «плотным пятном» (macula densa). Поэтому в случае первичного усиления продукции альдостерона подавляются биосинтез и секреция ренина, что служит показателем данного заболевания.
Первичный гиперальдостеронизм - это заболевание клубочковой зоны надпочечников, клетки которой не синтезируют кортизол. Поэтому гиперальдостеронизм не сопровождается нарушениями продукции кортизола, его обмена и/или концентрации в плазме крови. Однако по мере усиления биосинтеза избыточных количеств альдостерона происходит активирование всего пути биосинтеза стероидов в надпочечниках. В результате в крови больных с продуцирующими альдостерон аденомами коры надпочечников возрастают концентрации стероидов-пред-шественников, таких как дезоксикортикостерон, кортикостерон и 18-гидроксикортикостерон.
В дополнение к задержке натрия и уменьшению концентрации калия в сыворотке крови снижается общее содержание калия в организме. Из постоянного резервного внутриклеточного пула калий перемещается во внеклеточную жидкость; таким путем организм пытается поддержать его нормальную концентрацию в крови. В результате этого процесса усиливается внутриклеточный транспорт и экскреция почками водородных ионов, что приводит к системному алкалозу. Интересно отметить, что умеренная потеря калия сопровождается уменьшением толерантности к углеводам (как показывает тест толерантности к глюкозе) и снижением чувствительности к антидиуретическому гормону (вазопрессину, АДГ).
Клинический опыт
Медицинская помощь больным первичным гиперальдостеронизмом необходима, в основном, в связи с расстройствами, обусловленными гипока
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 413
лиемией. Они включают быструю утомляемость, пониженную жизнестойкость, общую слабость, ноктурию и «апатию». В случаях тяжелой гипокалиемии у больных появляется прогрессирующая жажда и признаки алкалоза. Гипертензия - другое серьезное расстройство, сопутствующее первичному гиперальдостеронизму. Обычно она остается незамеченной и выявляется только при физикальном исследовании больных. Величина кровяного давления у таких пациентов колеблется от нормальной до очень высокой.
Клинические признаки первичного гиперальдостеронизма у кошек рассматриваются здесь на примере пяти животных, описанных в литературе (Eger et al, 1983; Flood et al, 1999; Moore et al, 2000b; Rijnberk et al, 2001). Известно, что это заболевание у кошек встречается редко, но имеет много общего с аналогичным расстройством у человека. Ветеринары время от времени сталкиваются с этой патологией при обнаружении опухоли надпочечников во время рутинного ультразвукового исследования брюшной полости старых или больных кошек. Первичный гиперальдостеронизм следует учитывать при дифференциальной диагностике кошек с неопределенной опухолью надпочечников.
Возраст пяти кошек с первичным гиперальдостеронизмом (две самки и три самца) составлял соответственно 10, 12, 13, 17 и 20 лет (табл. 7-16). Все животные были кастрированы. Хозяева кошек чаще всего отмечали следующие клинические симптомы: общую слабость (у четырех особей), шейную вентрофлексию, полиурию и/или полидипсию, уменьшение веса, снижение аппетита (каждое из этих нарушений имелось у двух кошек), атаксию, утрату зрения, ноктурию и большой живот (каждое из этих нарушений имелось у одной кошки). При физикальном исследовании в ветеринарной клинике у двух кошек были выявлены мышечная атрофия, отвислый живот, шейная вентрофлексия, отслоение сетчатки, расширение зрачка и сердечные шумы. У всех пяти кошек имелась гипокалиемия, у трех гипертензия, у двух алкалоз, у двух сопутствующий сахарный диабет, у двух повышенная концентрация азота мочевины в крови и у двух из четырех кошек изостенурия (по данным рандомизированного измерения удельного веса мочи, который колебался от 1,008 до 1,015; у отдельных особей он составлял 1,009, 1,015, 1,022 и 1,031). Также у всех обследованных кошек была значительно повышена концентрация альдостерона в сыворотке крови (Yu, Morris, 1998). Активность ренина в плазме крови у трех из четырех кошек оставалась в норме, а у двух была понижена (у одной особи активность ренина определяли дважды). УЗИ, проводившееся у четырех кошек, во всех случаях выявило опухоль надпочечников. У трех особей под контролем УЗИ была проведена аспирационная биопсия опухолевой массы, и исследование биоптатов показало наличие гормонально активных опухолей. У двух кошек их удалили хирургическим путем, но толь
ко у одной операция прошла успешно. Остальные животные на протяжении разного времени получали заместительную терапию препаратами калия и антигипертензивное лечение. По крайней мере, у двух из пяти кошек были выявлены метастазы опухоли коры надпочечников.
Выводы
Первичный гиперальдостеронизм представляет собой редкое заболевание кошек среднего и более старшего возраста. Самым характерным клиническим симптомом этого заболевания является мышечная слабость. Подозрение на гиперальдостеронизм возникает в случаях устойчивой гипокалиемии, выявляемой при повторных обследованиях животных с опухолями надпочечников, которые были идентифицированы при УЗИ брюшной полости. Прогноз заболевания от осторожно оптимистического до неблагоприятного ввиду сопутствующей гипертензии и мышечной слабости, возможности лечения исключительно хирургическими методами и высокой стоимости такого лечения, неоперабельности некоторых специфически локализованных опухолей, их инвазии в окружающие ткани и наличия метастазов.
ПЕРВИЧНЫЕ ОПУХОЛИ НАДПОЧЕЧНИКОВ, СЕКРЕТИРУЮЩИЕ ПРОГЕСТЕРОН, У КОШЕК
Общая характеристика
Как указывалось в гл. 6, у человека опухоли коры надпочечников, помимо кортизола и альдостерона, секретируют и другие стероидные соединения. Повышение концентрации таких «необычных» стероидов, продуцируемых опухолями, в крови людей приводит к эндокринным расстройствам, которые встречаются нечасто, но хорошо документированы. У людей и собак описаны опухоли коры надпочечников, секретирующие избыточные количества прогестерона (подробные данные об этом синдроме приведены в соответствующих разделах гл. 6). Период полужизни природного прогестерона в крови не превышает нескольких минут; у многих млекопитающих он является предшественником андрогенов, эстрогенов и кортизола. В крови прогестерон взаимодействует с альбумином и белками, связывающими кортизол и половые гормоны. Хроническое увеличение его концентрации в плазме крови может приводить к избыточному содержанию «свободного» кортизола, поскольку прогестерон конкурирует с кортизолом за связывающие белки, и в результате к усилению действия глюкокортикоидов. Все сказанное справедливо в отношении людей и собак, однако неизвестно, в какой степени это относится к кошкам (Selman et al, 1996). У последних прогестерон является антагонистом глюкокортикоидов, подавляя функцию системы гипоталамус-гипо-физ-кора надпочечников (Selman et al, 1994). Тем
ТАБЛИЦА 7-16. НЕКОТОРЫЕ КЛИНИЧЕСКИЕ ХАРАКТЕРИСТИКИ И РЕЗУЛЬТАТЫ АНАЛИЗОВ, ПОЛУЧЕННЫЕ У 5 КОШЕК С ДИАГНОЗОМ ПЕРВИЧНЫЙ ГИПЕРАЛЬДОСТЕРОНИЗМ (КОШКА 1: EGER ET AL (1983), КОШКИ 2 И 3: FLOOD ET AL (1999), КОШКА 4: MOORE ET AL (2002), КОШКА 5: RIJNBERK ET AL (2001)*
Клинические симптомы или результаты физикального исследования Анализ сыворотки КД Опухоль при УЗИ ХЛ? Гистология
Кошка № Возраст Пол Слабость Вентрофлексия ПУ/ ПД Слепота Расширение зрачка К Na Альдостерон Ренин
1 17 Ж/О + г H тт Но Но Но Нет кк + м
2 20 Ж/О + + + + T тт н 230 Да Да КК
3 10 М/К + + н тт н 250 Да Нет АБ: энд. опухоль
4 13 М/К + + н тт г 135 Да Нет АБ: энд. опухоль
5 12 М/К + + 4- н тт н4 190 Да Да КК + М
* Ж/О - овариэктомированная кошка; М/К — кастрированный кот; + - животное имеет данный симптом; 1 - ниже нормы; Т- выше нормы; ТТ - значительно выше нормы; Н -норма, КК + М - карцинома коры надпочечников и метастазы; АБ - аспирационная биопсия, К - концентрация калия, Na - концентрация натрия; УЗИ - ультразвуковое исследование; КД - кровяное давление; ХЛ - хирургическое лечение; ПУ/ПД - полиурия/полидипсия; Но - показатель не определялся; энд. опухоль - эндокринная опухоль. Величина кровяного давления представлена как результат непрямого измерения в мм рт.ст.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
ТАБЛИЦА 7-17. НЕКОТОРЫЕ КЛИНИЧЕСКИЕ ХАРАКТЕРИСТИКИ И РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ АНАЛИЗОВ, ПОЛУЧЕННЫЕ У ТРЕХ КОШЕК С ДИАГНОЗОМ ПРОГЕСТЕРОН-СЕКРЕТИРУЮЩАЯ КАРЦИНОМА КОРЫ НАДПОЧЕЧНИКОВ (КОШКА 1: BROOD, GRIFFIN (1999), КОШКА 2: ROSSMEISL ET AL (2000)*
Концентрация кортизола (мкг%) в пробе с АКТГ Концентрация кортизола (мкг%) в ПНДД Концентра ци на (нг-мл) в п я прогестеро-робе с АКТГ
№ кота Возраст (годы) Пол До введения Через 30 мин Через 60 мин До введения Через 4ч Через 6-8 ч До введения АКТГ После введения АКТГ АКТГ Опухоль при УЗИ? ХЛ? АГТ? Гисто логия
1 7 М/К 2,2 — 4,4 1,7 1,3 1,1 3,6 27,6 — Да Да Нет КК
2 7 М/К 1,0 2,7 2,4 2,7 — 1,2 13,2 15,5 — Да Нет Да КК
3 9 М/К 2,8 2,7 3,3 1,5 1,5 1,8 4,7 Но <1 Да Да Да КК
*) М/К - кастрированный кот; ПНДД - проба с низкими дозами дексаметазона; АКТГ - концентрация эндогенного АКТГ в плазме крови; УЗИ - ультразвуковое исследование; ХЛ - хирургическое лечение; АГТ - аминоглютетимид; КК - карцинома коры надпочечников
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК • 415
не менее, лекарственные средства, подобные прогестерону, могут стимулировать активность глюкокортикоидов. Так, например, прогестерон является мощным антагонистом инсулина.
Клинический опыт
Мы располагаем сведениями о трех кошках с диагнозом секретирующей прогестерон карциномы коры надпочечников. Две из них были описаны в литературе (Bord, Griffin, 1999; Rossmeisl et al, 2000), а одна входила в нашу группу кошек с опухолями надпочечников. Основные клинические данные этих животных представлены в табл. 7-17. Все три особи были нестарыми (7, 7 и 9 лет) кастрированными самцами, и все имели сходные кожные расстройства, в том числе прогрессирующую незудящую симметричную алопецию, тонкую, ломкую, часто кровоточащую кожу (в одном случае имел место разрыв кожи при слабом надавливании на нее), сальную, неряшливую шерсть на незатронутых алопецией участках тела. У одного из котов в соскобах шерсти были обнаружены Demodex cati. У владельца одного кота основное беспокойство вызывала алопеция, а у хозяев двух других животных - плохо компенсированный сахарный диабет. У одного кота периодически отмечались гипергликемия и гликозурия. Сочетание кожных расстройств и сопутствующего метаболического заболевания служило причиной гиперкортицизма, который следует учитывать как возможное первичное заболевание при дифференциальной диагностике.
Ни у одного из трех котов не было выявлено серьезных отклонений от нормы результатов ОАК и биохимического анализа сыворотки, за исключением устойчивой гипергликемии и глюкозурии у двух животных. У одного кота была несколько повышена концентрация AM в плазме крови. Представляют интерес данные эндокринологических исследований (см. табл. 7-17), поскольку у всех трех животных базальная концентрация кортизола в крови была на нижней границе нормы и оставалась ниже нормы после стимуляции АКТЕ Как показывает наш опыт, такая ситуация довольно обычна у кошек с опухолями коры надпочечников, поскольку более чем у половины животных с гиперкортицизмом, независимо от его происхождения, проба с АКТГ дает нормальные или заниженные результаты (см. табл. 7-9 и 7-10). Обратите внимание, что среди восьми кошек с функционально активными секретирующими кортизол опухолями коры надпочечников, данные о которых включены в табл. 7-10, некоторые имели повышенный уровень кортизола в крови, тогда как у других он был ниже нормального. По этой причине мы не рекомендуем использовать провокационную пробу с АКТГ в целях диагностики гиперкортицизма у кошек. У всех трех котов, имевших секретирующие прогестерон опухоли, базальная концентрация прогестерона в крови была аномально высокой, и стимуляцию проводить не
следовало. По данным одного сообщения, базальная концентрация прогестерона у здорового кота составляла 0,06 нг/мл по сравнению с 3,6 нг/мл у животного с опухолью коры надпочечников (Boord, Griffin, 1999), а по данным другого сообщения, диапазон базальных концентраций прогестерона у здоровых кошек находится в пределах <0,03-0,35 нг/мл, в то время как у кота с опухолью надпочечников она была 13,2 нг/мл (Rossmeist et al, 2000). У обследованного нами кота базальная концентрация прогестерона в плазме крови равнялась 4,7 нг/мл по сравнению с менее 0,3 нг/мл у здоровых животных. Таким образом, не было необходимости в стимулирующей пробе.
Результаты скрининговой пробы с низкими дозами дексаметазона, полученные у тех же трех котов, свидетельствовали о наличии гиперкортицизма, так как спустя 4, 6 и 8 часов после введения препарата концентрации кортизола в плазме крови превышали величину 0,8 мг%, принятую за норму в нашей лаборатории. Правда, у одного кота кортизолемия подавлялась дексаметазоном более чем на 50%, что противоречило наличию функционально активной опухоли коры надпочечников. У другого кота концентрация эндогенного АКТГ была ниже порога чувствительности метода. С помощью УЗИ брюшной полости в надпочечниках всех трех животных была обнаружена опухоль. Это подчеркивает важность УЗИ брюшной полости у собак и кошек с подозрением на заболевание надпочечников.
Двум из трех котов проводили терапию аминоглютетимидом (АГТ, цитадреном, производства CIBA Pharmaceutical Company, Summit, США). В обоих случаях препарат вводили перорально дважды в день по 6 мг/кг веса тела. Общая продолжительность лечения одного из животных составляла около 2 месяцев (Rossmeisl et al, 2000), а другого (леченого в нашей клинике) 1 месяц. Терапию проводили в порядке подготовки животных к хирургическому удалению опухоли. АГТ является ингибитором десмолазы (CYP1A1), которая расщепляет боковую цепь холестерина (см. гл. 6). Этот фермент отвечает за превращение холестерина в прегненолон в процессе биосинтеза стероидных гормонов в коре надпочечников. Поскольку ингибирующее действие АГТ проявляется на ранних стадиях стероидогенеза, оно, в конечном итоге, должно приводить к уменьшению продукции эстрогенов, андрогенов, глюкокортикоидов и минералокортикоидов. АГТ редко применяется для медикаментозной терапии гиперкортицизма у людей. Его побочное действие выражено слабо и сводится к анорексии, тошноте и сыпи. Длительное введение АГТ не показано людям из-за его стимулирующего действия на секрецию гипофизарного АКТГ, избыток которого может нейтрализовать блокаду ферментативной активности. У одного из котов реакция на терапию АГТ проявлялась через 2 недели после ее начала, но спустя 6 недель была выражена слабее. Мы давали АГТ нашему коту в течение 6 недель, и он очень хоро
416
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
шо отвечал на терапию. Наблюдалось значительное улучшение клинического состояния, исчезли такие нарушения, как истончение и ломкость кожи и симптомы сахарного диабета. Но самым удивительным было то, что по мере улучшения состояния у кота заметно увеличивались молочные железы. Мы полагаем, что такое действие АГТ было обусловлено быстрым снижением концентрации прогестерона в плазме крови что, в свою очередь, приводило к усилению секреции пролактина. После прекращения терапии АГТ наши хирурги успешно удалили опухоль надпочечника. Удачно прошла операция и у другого рассматриваемого здесь кота (Boord, Griffin, 1999). Оба кота после операции жили больше года и не имели в отдаленном периоде ни сахарного диабета, ни других заболеваний.
Выводы
У кошек редко встречаются секретирующие прогестерон опухоли коры надпочечников. Однако их наличие нельзя исключать ни у одной из кошек с клиническими симптомами гиперкортицизма. Если у обследуемых животных отношение КОР/КРЕ в моче или результаты скрининговой пробы с низкими дозами дексаметазона остаются в пределах нормы или близки к ней, целесообразно и рентабельно определить базальный уровень прогестерона. Такая рекомендация выглядит вполне логичной, когда УЗИ брюшной полости выявляет у обследуемого животного опухоль надпочечников. В этом случае методом выбора является хирургическое удаление опухоли, а при необходимости медикаментозной терапии в предоперационном периоде ее следует проводить с использованием аминоглютетимида.
ЛИТЕРАТУРА
Barthez PY, et al: Ultrasonographic evaluation of the adrenal glands in dogs. J Am Vet Med Assoc 207:1180, 1995.
Boord M, Griffin C: Progesterone secreting adrenal mass in a cat with clinical signs of hyperadrenocorticism. J Am Vet Med Assoc 214:666, 1999.
Brightman AH: Ophthalmic use of glucocorticoids. Vet Clin North Am Small Anim Pract 12:33, 1982.
Cartee RE, Finn-Bodner ST: Ultrasound examination of the feline adrenal gland. J Med Sonography 9:327, 1993.
Chakere DW, et al: Magnetic resonance imaging of pituitary and parasellar abnormalities. Radio Clin North Am 27:265, 1989.
Coates PJ, et al: The distribution of immunoreactive-melanocyte-stimulating hormone cells in the adult human pituitary gland. J Endocrinol 111:335, 1986.
Daley CA et al: Use of metyrapone to treat pituitary-dependent hyperadrenocorticism in a cat with large cutaneous wounds. J Am Vet Med Assoc 202:956, 1993.
Duesberg CA et al: Adrenalectomy for treatment of hyperadrenocorticism in cats: 10 cases (1988-1992). J Am Vet Med Assoc 207: 1066, 1995.
Duesberg CA, Peterson ME: Adrenal disorders in cats. Vet Clin North Am Small Anim Prac 27:321, 1997.
Eger CE, et al: Primary aldosteronism (Conn’s syndrome) in a cat: A case report and review of comparative aspects. J Small Anim Pract 24:293, 1983. Engelhardt D, et al: The influence of ketoconazole on human adrenal steroidogenesis: Incubation studies with tissue slices. Clin Endocrinol 35:163, 1991.
Feldman EC: The effect of functional adrenocortical tumors on plasma Cortisol and corticotropin concentrations in dogs. J Am Vet Med Assoc 178:823, 1981.
Ferasin L: Iatrogenic hyperadrenocorticism in a cat following a short therapeutic course of methylprednisolone acetate. J Feline Medicine and Surgery 3:87, 2001.
Flood SM, et al: Primary hyperaldosteronism in two cats. J Am Anim Hosp Assoc 35:411, 1999.
Goossens MMC, et al: Urinary excretion of glucocorticoids in the diagnosis of hyperadrenocorticism in cats. Domestic Anim Endocrinol 12:355, 1995.
Green CE, et al: Iatrogenic hyperadrenocorticism in a cat. Feline Pract 23:7, 1995. Halmi NS, Krieger D: Immunocytochemistry of ACTH-related peptides in the hypophysis. In Bhatnagar AS (ed): The Anterior Pituitary Gland. New York, Raven Press, 1983, pp 1-15.
Henry CJ, et al: Urine cortisolxreatinine ratio in healthy and sick cats. J Vet Int Med 10:123, 1996.
Horauf A, Reusch C: Darstellung der nebennieren mittels ultraschall: Untersu-chungen bei gesunden hunden, hunden mit nicht endokrinen Erkrankungen sowie mit Cushing-Syndrom. Kleintierpraxis 40: 337, 1995.
Immink WFGA, et al: Hyperadrenocorticism in four cats. Veterinary Quarterly 14:81, 1992.
Kaufman B. Magnetic resonance imaging of the pituitary gland. Radio Clin North Am 22:795, 1984.
Low MJ, et al: Post-translational processing of pro-opiomelanocortin (POMC) in mouse pituitary melanotroph tumors induced by a POMC-Simian virus 40 large T antigen transgene. J Biol Chem 268:24967, 1993.
Meij BP, et al: Transsphenoidal hypophysectomy in beagle dogs: Evaluation of a microsurgical technique. Vet Surg 26:295, 1997.
Meij BP, et al: Results of transsphenoidal hypophysectomy in 52 dogs with pituitary-dependent hyperadrenocorticism. Vet Surg 27:246, 1998.
Meij BP, et al: Transsphenoidal hypophysectomy for treatment of pituitarydependent hyperadrenocorticism in 7 cats. Veterinary Surgery 30:72, 2001.
Meijer JC, et al: Cushing’s syndrome due to adrenocortical adenoma in a cat. Tijdschr Diergeneesk 103:1048, 1978.
Melby JC: Therapy of Cushing’s disease: A consensus for pituitary microsurgery. Ann Int Med 109:445, 1988.
Moon PF: Cortisol suppression in cats after induction of anesthesia with etomidate, compared with ketamine-diazepam combination. Am J Vet Res 58:868, 1997.
Moore LE, et al: Hyperadrenocorticism treated with metyrapone followed by bilateral adrenalectomy in a cat. J Am Vet Med Assoc 217:691, 2000a.
Moore LE, et al: Use of abdominal ultrasonography in the diagnosis of primary hyperaldosteronism in a cat. }Am Vet Med Assoc 217:213, 2000b.
Nelson RW et al: Hyperadrenocorticism in cats: Seven cases (1978-1987). J Am Vet Med Assoc 193:245, 1988.
Orth DN: Metyrapone is useful only as adjunctive therapy in Cushing’s disease. Ann Intern Med 89:128, 1978.
Peterson ME: Endocrine disorders in cats: four emerging diseases. Compend Contin Educ Pract Vet 10:1353, 1988.
Peterson ME: Feline hyperadrenocorticism. In Manual of Small Animal Endocrinology, 2nd ed. Torrance AG, Mooney CT (eds). British Small Animal Veterinary Association, Cheltenham, 1998, pp 215.
Peterson ME, Kemppainen RJ: Comparison of intravenous and intramuscular routes for administering cosyntropin for corticotropin stimulation testing in cats. Am J Vet Res 53:1392, 1992a.
Peterson ME, Kemppainen RJ: Comparison of the immunoreactive plasma corticotropin and Cortisol responses to two synthetic corticotropin preparations (tetracosactrin and cosyntropin) in healthy cats. Am J Vet Res 53:1752, 1992b.
Peterson ME, Kemppainen RJ: Dose response relation between plasma concentrations of corticotropin and Cortisol after administration of incremental doses cosyntropin for corticotropin stimulation testing in cats. Am J Vet Res 54:300, 1993.
Peterson ME, Steele P: Pituitary-dependent hyperadrenocorticism in a cat. J Am Vet Med Assoc 189:680, 1986.
Peterson ME, et al: Immunocytochemical study of the hypophysis in 25 dogs with pituitary-dependent hyperadrenocorticism. Acta Endocrinol (Copenh) 101:15, 1982.
Peterson ME, et al: Endocrine diseases. In Sherding RG (ed): The Cat: Diagnosis and Clinical Management, 2nd ed. New York, Churchill Livingstone, pp 1404.
Reaves TA Jr, et al: Vasopressin release by nicotine in the cat. Peptides 2:13, 1981.
Rijnberk A: Pituitary-dependent hyperadrenocorticism. In Rijnberk A (ed): Clinical Endocrinology of Dogs and Cats. Dordrecht, The Netherlands, Kluwer Academic Publishers, 1996, pp 74-83. Rijnberk A, et al: Hyperaldosteronism in a cat with metastasised adrenocortical tumour. Vet Quart 23:38, 2001.
Robinson AJ, Clamann HP: Effects of glucocorticoids on motor units in cat hindlimb muscles. Muscle and Nerve 11:703, 1988.
Rossmeisl JH, et al: Hyperadrenocorticism and hyperprogesteronemia in a cat with an adrenocortical adenocarcinoma. J Am Anim Hosp Assoc 36:512, 2000.
Sallanon M, et al: Hypophysectomy does not disturb the sleep-waking cycle in the cat. Neurosci Lett 88:173, 1988.
Schaer M, Ginn PE: Iatrogenic Cushing’s syndrome and steroid hepatopathy in a cat. J Am Anim Hosp Assoc 35:48, 1999.
Schoeman JP, et al: Cortisol response to two different doses of intravenous synthetic ACTH (tetracosactrin) in overweight cats. J Small Anim Pract 41:552,2000.
Scholten-Sloof BE, et al: Pituitary-dependent hyperadrenocorticism in a family of Dandle Dinmont terriers. J Endocrinol 135:535, 1992.
Scott DW, et al: Some effects of short-term methylprednisolone therapy in normal cats. Cornell Vet 69:104, 1979.
Scott DW, et al: Iatrogenic Cushing’s syndrome in the cat. Fel Pract 12:30, 1982.
ГИПЕРКОРТИЦИЗМ (СИНДРОМ КУШИНГА) У КОШЕК
417
Scott DW, et al: Iatrogenic Cushing’s syndrome in the cat. Feline Pract 12:30, 1982.
Selman PJ, et al: Progestin treatment in the dog, II. Effects on the hypothalamic-pituitary-adrenocortical axis. Eur J Endocrinol 131:422, 1994.
Selman PJ, et al: Binding specificity of medroxyprogesterone acetate and proligestone for the progesterone and glucocorticoid receptor in the dog. Steroids 61:133, 1996.
Smith MC, Feldman EC: Plasma endogenous ACTH concentrations and plasma Cortisol responses to synthetic ACTH and dexamethasone sodium phosphate in healthy cats. Am J Vet Res 48:1719, 1987.
Snyckers FD: Transsphenoidal selective anterior hypophysectomy in cats for microsurgical training. Technical note. J Neurosurgery 43:774, 1975.
Stein AL, et al: Computed tomography versus magnetic resonance imaging for the evaluation of suspected pituitary adenomas. Obstet Gynecol 73:996, 1989.
Theon A: Practical Radiation Therapy. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5th ed. Philadelphia, WB Saunders Co, 2000, pp 489.
Thorner MO, et al: Approach to pituitary disease. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 8th ed. Philadelphia, WB Saunders Co, 1992, pp 246.
Van Wijk PA, et al: Corticotropin-releasing hormone and adrenocorticotropic hormone concentrations in cerebrospinal fluid of dogs with pituitarydependent hyperadrenocorticism. Endocrinology 131:2659, 1992.
Verheist JA, et al: Short and long-term responses to metyrapone in the medical management of 91 patients with Cushing’s syndrome. Clin Endocrinol 35:169, 1991.
Wallach ST, et al: Mensuration of the pituitary gland from magnetic resonance images in 17 cats. Vet Radiol Ultrasound 44:278, 2003.
Watson PJ, Heritage ME: Hyperadrenocorticism in six cats. J Small Anim Pract 39:175, 1998.
White PC: Disorders of aldosterone biosynthesis and action. N Engl J Med 331:250, 1994.
Willard MD et al: Effect of long-term administration of ketoconazole in cats. Am J Vet Res 47:2510, 1986.
Yu S, Morris JG: Plasma aldosterone concentration of cats. The Veterinary Journal 155:63, 1998.
Zerbe C A, et al: Hyperadrenocorticism in a cat. J Am Vet Med Assoc 190:559, 1987a.
Zerbe CA, et al: Effect of nonadrenal illness on adrenal function in the cat. Am J Vet Res 48:451, 1987b.
Zhan GL, et al: Steroid glaucoma: Corticosteroid-induced ocular hypertension in cats. Exp Eye Research 54:211, 1992.
Zimmer C, et al: Ultrasonographic examination of the adrenal gland and evaluation of the hypophyseal-adrenal axis in 20 cats. J Small Anim Pract 41:156,2000.
Г лава 8
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
ИСТОРИЯ ОТКРЫТИЯ И ИЗУЧЕНИЯ.....418
ЭТИОЛОГИЯ.......................419
Первичная недостаточность коры надпочечников.............419
Вторичная недостаточность коры надпочечников.............422
ПАТОФИЗИОЛОГИЯ.................423
Общие сведения.................423
Минералокортикоиды.............423
Глюкокортикоиды................424
Половые гормоны................427
Тяжесть поражения коры надпочечников.............427
ВСТРЕЧАЕМОСТЬ..................428
Частота заболевания............428
Клинический материал...........428
Пол............................428
Возраст........................428
Порода.........................428
АНАМНЕЗ........................429
Субъективность мнения владельцев...429
Разная тяжесть клинических признаков..........429
Клинические признаки при гормональной недостаточности...430
Классическое неустойчивое течение заболевания....................430
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.......430
КЛИНИЧЕСКАЯ ПАТОЛОГИЯ..........431
Количество эритроцитов.........431
Количество лейкоцитов..........431
Электролиты в сыворотке крови: «классические» гипонатриемия и гиперкалиемия................432
Содержание азота мочевины и креатинина в крови, анализ мочи ...439 Концентрация глюкозы в сыворотке
крови (гипогликемия)........440
Концентрация кальция в сыворотке крови (гиперкальциемия)........440
Кислотно-щелочной статус......442
Кровяное давление.............442
Функция печени: содержание альбумина, холестерина, азота мочевины и глюкозы в крови..............442
РЕНТГЕНОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ................444
Микрокардия...................444
Увеличение размеров пищевода....444
ЭЛЕКТРОКАРДИОГРАФИЧЕСКОЕ
ИССЛЕДОВАНИЕ..................444
Физиология гиперкалиемии и деятельности сердца..........444
Применение электрокардиографии.... 447
ГОРМОНАЛЬНЫЕ ИССЛЕДОВАНИЯ:
ПОДТВЕРЖДЕНИЕ ДИАГНОЗА........447
Концентрация кортизола в плазме крови.................447
Концентрация альдостерона в плазме и сыворотке крови..............450
Концентрация эндогенного АКТГ в плазме крови.................452
ЛЕЧЕНИЕ СОБАК
В СОСТОЯНИИ «КРИЗА».........454
Общие сведения................454
Г иповолемия/гипотензия.......455
Глюкокортикоиды...............457
Нарушение баланса электролитов..457
Ацидоз........................459
Ответ на терапию..............459
Сопутствующие проблемы........460
ДЛИТЕЛЬНАЯ (ПОДДЕРЖИВАЮЩАЯ) ТЕРАПИЯ СОБАК С ПЕРВИЧНЫМ ГИПОКОРТИЦИЗМОМ...............461
Назначение....................461
Минералокортикоиды............461
Глюкокортикоиды...............465
Заместительное введение соли..466
ДЛИТЕЛЬНАЯ (ПОДДЕРЖИВАЮЩАЯ) ТЕРАПИЯ СОБАК С ВТОРИЧНЫМ ГИПОКОРТИЦИЗМОМ...............466
Спонтанное заболевание........466
Ятрогенное заболевание: передозировка о,р’-ДДД........466
Ятрогенное заболевание: отмена хронической глюкокортикоидной терапии.......................466
ПРОГНОЗ.......................466
ГИПОКОРТИЦИЗМ У КОШЕК.........466
Этиология.....................466
Встречаемость и клинические признаки..........466
Нарушения лабораторных, рентгенологических и электрокардиографических показателей...................467
Подтверждение диагноза: концентрация кортизола в плазме крови......467
Концентрация эндогенного АКТГ в плазме крови................468
Лечение.......................469
Прогноз.......................469
Список сокращений
АДГ - антидиуретический гормон, аргинин-вазопрессии
АКТГ - адренокортикотропный гормон
AM - азот мочевины
ГЗГ - гиперкортицизм зависимый от гипофиза
ДВСК - диссеминированное
внутрисосудистое свертывание крови ДОКА - дезоксикортикостерона ацетат ДОКП - дезоксикортикостерона пивалат
ПАК — полный анализ крови
РИА - радиоиммунологический анализ
СКФ - скорость клубочковой фильтрации
УЗИ - ультразвуковое исследование
ЭКГ - электрокардиография
ИСТОРИЯ ОТКРЫТИЯ И ИЗУЧЕНИЯ
Анатомы давно знали о существовании «надпочечниковых желез», однако их значение стало понятно только после того, как Томас Аддисон описал у человека клинический синдром, который он связал с нарушением функции надпочечников (Addison, 1855). В число описанных им симптомов входили «анемия, общая слабость, истощение, выраженное ухудшение сердечной деятельности и раздражимость желудка». На вскрытии обычно обнаружива
ли либо туберкулезное разрушение, либо атрофию надпочечниковых желез. В то время не существовало никаких способов лечения этих расстройств, и они приводили к смерти больного. Примерно тогда же, когда Томас Аддисон описал клиническую картину надпочечниковой недостаточности, Браун-Секвард установил, что адреналэктомия вызывает гибель экспериментальных животных, и, таким образом, получил документальное доказательство необходимости надпочечников для под держания жизнедеятельности организма (Brown-Sequard, 1856).
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 419
В 1930 году из коры надпочечников были получены грубые липидные экстракты, которые содержали вещества, предотвращавшие гибель адреналэк-томированных кошек. Потом такие экстракты стали вводить людям для лечения недостаточности функции коры надпочечников. К сожалению, эффект такого лечения был незначителен, так как действие экстрактов оказалось весьма кратковременным. Они содержали мало кортизола, о чем в то время еще не знали. В 1933 г Loeb показал, что одной из основных причин аддисоновой болезни является недостаточность натрия и что введение солевых растворов перорально или через прямую кишку положительно влияет на состояние больных.
В 1942 году Thom и его сотрудники установили возможность поддерживающей терапии путем введения синтетического дезоксикортикостерона ацетата (ДОКА) больным с недостаточностью функции коры надпочечников. Терапевтический эффект соли и дезоксикортизона был обусловлен коррекцией электролитного баланса и сопутствующей дегидратации. Однако положительный эффект этой терапии наблюдался только при частичной надпочечниковой недостаточности, но не при тяжелой форме заболевания (Nelson, 1980).
Выделение кортизола и кортикостерона из надпочечников свиней и крупного рогатого скота способствовало более углубленному пониманию природы недостаточности функции коры надпочечников. Получение первых препаратов гормонов в 1937 году занимало много времени и стоило дорого, но при этом была показана важная роль обоих соединений (в отличие от дезоксикортикостерона) в обмене углеводов и поддержании жизнедеятельности организма. Наконец, осуществление лабораторного синтеза кортизона и кортизола обеспечило их широкую доступность и произвело революцию в терапии гипокортицизма. При введении в достаточно больших дозах эти гормоны не только позволяли сохранять жизнь больным с гипокортицизмом, развившимся спонтанно или в результате удаления надпочечников, но и помогали в стрессовых ситуациях. К середине 1950-х годов кортизол был выделен из крови и было показано, что он является одним из основных продуктов секреции коры надпочечников у людей и собак.
Установление химической структуры кортизола быстро повлекло за собой разработку методов определения его концентраций в сыворотке и моче. Функция коры надпочечников стала еще более понятной после открытия в начале 1950-х годов гормона, обеспечивающего задержку соли в организме, и андрогенов. В конечном итоге, все известные гормоны, образующиеся в коре надпочечников, были подразделены на три главные группы: глюкокортикоиды (кортизол), минералокортикоиды (альдостерон) и андрогены.
Спонтанная недостаточность функции коры надпочечников у собак впервые была описана в качестве самостоятельного заболевания в 1953 году.
В 1970-х годах в ветеринарной литературе стали появляться сначала короткие, а затем и серийные сообщения на эту тему. После 1980 г количество подобных публикаций продолжало расти, способствуя более углубленному пониманию патогенеза аддисоновой болезни у собак, а также подходов к ее диагностике и лечению. У кошек это заболевание было впервые описано в 1980-х годах; с тех пор объем данных об этом расстройстве у кошачьих значительно увеличился.
ЭТИОЛОГИЯ
Гипокортицизм - это синдром, который обычно развивается в результате поражения коры обоих надпочечников (рис. 8-1). Клинические признаки недостаточной секреции глюкокортикоидов и минералокортикоидов (первичная недостаточность коры надпочечников) проявляются после разрушения более 85-90% клеток коры. Реже встречаются нарушения функции гипоталамо-гипофизарной системы, сопровождающиеся пониженной секрецией адренокортикотропного гормона (АКТГ). В отсутствие АКТГ кора надпочечников атрофируется (хотя сохраняется ее клубочковая зона), что приводит к уменьшению секреции глюкокортикоидов (или вторичной надпочечниковой недостаточности). Изолированный гипоальдостеронизм у человека - редкое заболевание и чаще всего обусловлено нарушением секреторной функции почек. Ренинемический гипоальдостеронизм в отсутствие глюкокортикоидной недостаточности был описан у собаки с гемодектомой основания сердца (Lobetti, 1998).
Первичная недостаточность коры надпочечников
Иммунозависимое (аутоиммунное) заболевание. Идиопатическая надпочечниковая недостаточность - наиболее обычный диагноз, который ставят собакам с нарушенной секреторной функцией коры надпочечников, поскольку в большинстве случаев не удается выяснить точную причину заболевания. Известно, однако, что оно чаще всего встречается у сук молодого и среднего возраста и по многим признаком напоминает аналогичное расстройство у человека. Самой распространенной причиной гипокортицизма у людей является разрушение клеток коры надпочечников, опосредованное иммунной системой (табл. 8-1). У женщин оно отмечается в 4 раза чаще, чем у мужчин (Findling, Tyrrell, 1991). Гистологическое исследование надпочечниковой ткани, полученной в активной фазе заболевания, выявляет картину обширной, но весьма вариабельной инфильтрации коры надпочечников лимфоцитами, плазматическими клетками и макрофагами. В процессе дальнейшего развития заболевания нормальная корковая ткань замещается фиброзной тканью (Findling et al, 1997).
420
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
В
Кортизол (отрицательная обратная связь)
Пониженная секреция кортизола
Гипоталамус
Пониженная секреция АКТГ
Пониженная секреция кортизола
Гипоталамус
Резкое прекращение хронического введения ятрогенных кортикостероидов
Пониженная секреция АКТГ
Рис. 8-1. Ось гипофиз-надпочечники у здоровых собак (А); у собак с утраченной функцией коры надпочечников и избыточной секрецией АКТГ вследствие отсутствия отрицательной обратной связи (наиболее часто встречающаяся форма гипокортицизма) (Б); у собак с недостаточностью секреции АКТГ и вторичной атрофией коры надпочечников, особенно пучковой и сетчатой зон (В); у собак, которым хронически вводили избыток экзогенных глюкокортикоидов, что привело к недостаточной секреции гипофизарного АКТГ и вторичной атрофии коры надпочечников (Г). А - Надпочечник, Р - Гипофиз, КРГ - кортикотропин рилизинг-гормон. (Из: Feldman ЕС: In Ettinger SJ (ed.): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1667).
ТАБЛИЦА 8-1. ПРИЧИНЫ ПЕРВИЧНОЙ И ВТОРИЧНОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ У ЛЮДЕЙ
Первичная надпочечниковая недостаточность
Вторичная надпочечниковая недостаточность
Медленное начало
Гипофизарная или метастазирующая опухоль**
Краниофарингиома* *
Операция на гипофизе или его облучение
Лимфоцитарный гипофизит**
Саркоидоз**
Гистоцитоз X**
Синдром пустого турецкого седла
Опухоли гипоталамуса**
Долгосрочная глюкокортикоидная терапия
Аутоиммунный адреналит (изолированный или как компонент аутоиммунного полигландулярного синдрома 1 и 2 типов)*
Туберкулез
Адреномиелонейропатия
Системная грибковая инфекция (например, гистоплазмоз, криптококкоз, бластомикоз)
СПИД (условно-патогенная инфекция цитомегаловирусом, бактериями или простейшими, саркома Капоши)
Метастазирующая карцинома (легких, молочных желез, почек), лимфома
Изолированная глюкокортикоидная недостаточность (часто семейная)
Быстрое начало
Надпочечниковое кровотечение, некроз или тромбоз при Послеродовой гипофизарный некроз (синдром Шихена) менингококковом или иного происхождения сепсисе, на- Некроз или кровотечение в гипофизарную макроаденому рушениях свертываемости крови или антифосфолипидном Травма головы, повреждение ножки гипофиза** синдроме либо вследствие терапии варфарином Хирургическая операция на гипофизе или надпочечниках в
___________________________________________________ связи с синдромом Кушинга (временное состояние)_______ (Из: Oelkers (1996), с разрешения)
* Аутоиммунный полигландулярный синдром 1 типа проявляется, прежде всего, в форме надпочечниковой недостаточности, гипопаратиреоза и кожно-слизистого кандидоза. Основными проявлениями аутоиммунного полигландулярного синдрома 2 типа являются недостаточность функции коры надпочечников, аутоиммунное тиреоидное заболевание и инсулинозависимый сахарный диабет.
* * Часто в сочетании с несахарным диабетом
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 421
Весьма вероятно, что у большинства собак и кошек со спонтанным гипокортицизмом также имеет место опосредуемое иммунными механизмами разрушение клеток коры надпочечников (Schaer et al, 1986; Reusch, 2000). У собак с гипокортицизмом при гистологическом исследовании наиболее часто выявляется идиопатическая атрофия всех слоев коры надпочечников. Поскольку вскрытие недавно заболевших собак производится редко, то возможность наблюдения активного воспалительного процесса весьма ограничена. Большинство животных с гипокортицизмом либо погибают, оставаясь недоступными для последующего патоморфологического исследования, либо выживают благодаря проведению соответствующей терапии после установления диагноза. Независимо от продолжительности лечения кора надпочечников у таких собак и кошек остается атрофированной или фиброзной и инфильтрация в ней отсутствует. Гипофиз у таких животных функционирует нормально (Boujon et al, 1994).
В настоящее время стали широко доступны методы определения антител к клеткам коры надпочечников, с помощью которых можно установить индуцируемое иммунной системой разрушение клеток коры у людей, которым прежде ставился диагноз идиопатическая надпочечниковая недостаточность. В исследованиях на больших группах собак с описываемым синдромом такие методы не использовались, хотя имеются отдельные упоминания об определении антинадпочечниковых антител у этих животных (Kooistra et al, 1995).
Множественные индуцируемые иммуной системой расстройства.
У людей опосредуемое иммунной системой (аутоиммунное) разрушение коры надпочечников обычно ассоциируется с другими иммунными расстройствами. Описаны два разных аутоиммуных эндокринологических заболевания, включающих поражение надпочечников - это аутоиммунные полигландулярные синдромы I и II типа. Типичный синдром I типа является аутосомно-рецессивным расстройством, которое обычно проявляется в детском возрасте. Оно включает надпочечниковую недостаточность, гипопаратиреоз и хронический кандидоз, поражающий кожу и слизистые оболочки. Более часто встречается полигландулярный синдром II типа, известный также как синдром Шмидта. Он включает надпочечниковую недостаточность, тиреоидит и инсулинозависимый сахарный диабет (см. гл. 3). Оба синдрома могут сопровождаться нарушением функции яичников. Кроме того, аутоиммунный гипокортицизм ассоциируется с алопецией, синдромами пониженного всасывания, витилиго и злокачественной анемией. Одно или более из этих сопутствующих расстройств регистрируются у 40-53% пациентов с аддисоновой болезнью (Baxter, Tyrrel, 1981; Oelkers, 1996).
Циркулирующие антитела к различным эндокринным органам и другим тканям регистрируются чаще, чем клинически выраженное заболевание
(табл. 8-2). При аутоиммунной аддисоновой болезни аутоантигенами-мишенями служат участвующие в стероидогенезе ферменты, к числу которых относятся 17а-гидроксилаза, 21а-гидроксилаза и фермент, расщепляющий боковую цепь холестерина. Важнейшим аутоантигеном при изолированной болезни Аддисона и полигландулярных синдромах обоего типа является 21а-гидроксилаза (Chen et al, 1996; Soderbergh et al, 1996; Reusch, 2000). Эти данные предполагают вероятность участия генетических факторов в патогенезе полигландулярных заболеваний. Среди обследованных нами 187 собак с первичной недостаточностью коры надпочечников 28 животных имели, по меньшей мере, еще одну эндокринопатию. У 16 из них был диагностирован гипотиреоз, у 14 сахарный диабет, у трех гипопаратиреоз и у двух азооспермия (у нескольких собак имелось более двух сопутствующих эндокринных расстройств). Часто выявлялись нарушения функции печени. Представляют интерес собаки, у которых спонтанный гипокортицизм сочетался с лимфоцитарными/плазмоцитарными (иммуноза-висимыми?, аутоиммунными?) желудочно-кишечными расстройствами и/или с почечной гломерулопатией (гломерулонефропатией, обусловленной отложением иммунных комплексов).
В ветеринарной литературе имеется несколько сообщений об аутоиммунном полигландулярном заболевании (Bowen et al, 1986; Kooistra et al, 1995). Любая эндокринная недостаточность может быть обусловлена аутоиммунной деструкцией. Предстоит исследовать, является ли аутоиммунное расстройство причиной гипокортицизма у большинства собак, носит ли оно наследственный характер, и имеется ли у собак с гипокортицизмом предрасположенность к другим расстройствам, возникновение которых опосредуется иммунной системой.
Другие причины первичного гипокортицизма. К числу необычных (редких?) причин недостаточности функции коры надпочечников у собак относятся ее разрушение вследствие гра-
ТАБЛИЦА 8-2. ЧАСТОТА ОБНАРУЖЕНИЯ АУТОАНТИТЕЛ В КРОВИ ЛЮДЕЙ С
НЕДОСТАТОЧНОСТЬЮ ФУНКЦИИ КОРЫ НАДПОЧЕЧНИКОВ АУТОИММУННОГО ПРОИСХОЖДЕНИЯ*
Тип клеток Частота (%)
Надпочечники 64
Щитовидная железа
Цитоплазма 45
Тиреоглобулин 22
Желудок
Париетальные клетки 30
Внутренний фактор 9
Паращитовидная железа 26
Гонады 17
Островковые клетки 8
* (По: Tyrrell JB et al: Glucocorticoids and Adrenal Androgens. In: Greenspan FS (ed): Basic and Clinical Endocrinology, 3rd ed. Philadelphia, WB Saunders Co, 1991, p 323.)
422 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
нуломатоза, в частности гистоплазмоза и бластомикоза, геморрагические инфаркты (вследствие травмы, токсического действия варфарина или других коагулопатий), метастазирование надпочечников, амилоидоз коры надпочечников, травмы (при несчастных случаях), а также ятрогенные факторы (хирургическое удаление надпочечников, резкое прекращение хронической глюкокортикоидной терапии или передозировка адренокортиколитического препарата о,р’-ДДД, который применяется для лечения гиперкортицизма). Заслуживает внимания, что у людей с гипокортицизмом, обусловленным кровотечением или метастазированием надпочечников, при УЗИ или компьютерной томографии часто выявляется двустороннее, иногда значительное увеличение надпочечников (Tyrrell et al, 1991).
Вторичная недостаточность коры надпочечников
Спонтанное заболевание. Помимо патологических процессов, которые специфически поражают надпочечники, уменьшение биосинтеза и секреции кортикостероидов, особенно глюкокортикоидов, может быть обусловлено снижением продукции АКТГ в гипофизе (см. рис. 8-1). Вторичная недостаточность функции коры надпочечников может быть вызвана также пониженной секрецией кортикотропин рили-зинг-гормона (КРГ) гипоталамусом. Деструктивные изменения в гипоталамусе или гипофизе, приводящие к недостаточности АКТГ и/или КРГ, обычно являются следствием неоплазии, и реже вызываются травмой или воспалительным процессом (Velardo et al, 1992; Thodou et al, 1995) (см. табл. 8-1). У людей с вторичным заболеванием (особенно при большой площади поражения в гипоталамусе и/или гипофизе) редко встречается изолированная надпочечниковая недостаточность. Обычно одновременно нарушается функция других гормон-продуци-рующих систем. Кроме того, гипокортицизм обычно сопровождается нейрологическими или офтальмологическими симптомами, которые могут либо предшествовать ему, либо развиваются как следствие надпочечниковой недостаточности.
Ятрогенные причины
Общие. Надпочечниковая недостаточность, развивающаяся вследствие введения экзогенных кортикостероидов, - обычное явление у мелких животных, поступающих на ветеринарное обследование или лечение, хотя она редко сопровождается клинически выраженными симптомами (см. рис. 8-1). Вторичная атрофия коры надпочечников может возникнуть у любого комнатного животного, которому хронически вводят кортикостероиды в количес
твах, достаточных для подавления функции гипоталамо-гипофизарной системы. Снижение секреторной активности коры надпочечников отмечается через несколько дней после начала введения кортикостероидов в дозах, угнетающих продукцию АКТГ. Чувствительность к этому подавлению различна у отдельных животных, поэтому у одних ятрогенный синдром Кушинга быстро развивается при введении относительно низких доз экзогенных кортикостероидов, тогда как другие животные не реагируют даже на высокие дозы гормонов. Восстановление функции надпочечников после такого подавления происходит постепенно (в течение нескольких недель) после прекращения введения гормона, причем этот процесс, по-видимому, затягивается в случае использования стероидных препаратов с пролонгированным действием (см. табл. 8-2).
Глюкокортикоиды, подавляющие функцию коры надпочечников. В ветеринарной практике используется большое число различных глюкокортикоидов. Следует помнить, что любой глюкокортикоид, ингибирующий секрецию гипофизарного АКТГ, может вызвать атрофию коры надпочечников. Последняя чаще всего имеет место после хронического введения глюкокортикоидов, независимо от вида используемого препарата или способа его введения. Угнетение гипофизарной функции наблюдали не только при инъекциях или пероральном приеме глюкокортикоидов, но и после их топического применения по назначению дерматолога, офтальмолога или отоларинголога (Roberts et al, 1984; Moriello et al, 1998; Murphy et al, 1990). Глюкокортикоиды подавляют функцию гипофиза и у кошек. Сообщалось о развитии атрофии коры надпочечников после введения кошкам мегестрола ацетата (прогестагена) (Chastain et al, 1982).
Оценки относительной биологической эффективности клинических аналогов кортикостероидов отличаются, однако в целом, как показали исследования, преднизон и преднизолон в пять раз сильнее подавляют секрецию АКТГ, чем кортизол. Аналогичная активность дексаметазона в 50-150 раз выше, поэтому он может вызвать атрофию коры надпочечников даже в сравнительно небольших дозах. Однако наиболее мощными препаратами, применяемыми в ветеринарии для одновременного подавления функции гипофизарно-надпочечниковой и иммунной систем у мелких животных, являются кортикостероиды длительного действия («депонируемые») для инъекций, например, бетаметазон. Показано, что однократная инъекция такого длительно действующего препарата достаточна для подавления функции гипофиза и коры надпочечников у собак на протяжении 5 недель (Kemppainen et al, 1981 и 1982).
Через сколько времени следует тестировать функцию гипофизарно-надпочечниковой системы? К счастью, у большинства собак, получающих глюкокортикоиды на протяжении того или иного
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 423
периода, прекращение терапии не сопровождается никакими отрицательными последствиями. Для выявления ятрогенного подавления функции гипофизарно-надпочечниковой системы можно использовать провокационную пробу с АКТГ. Во избежание ошибок при интерпретации результатов тестирования или причин снижения секреции кортизола под воздействием терапии, рекомендуется проводить пробу с АКТГ не ранее двух недель (иногда спустя два месяца) после отмены глюкокортикоидной терапии (Moore, Hoenig, 1992).
ПАТОФИЗИОЛОГИЯ
Общие сведения
С физиологической точки зрения кора надпочечников подразделяется на две функционально важные зоны. Наружная или клубочковая зона синтезирует и секретирует альдостерон и контролируется, главным образом, ангиотензином. Внутренняя зона синтезирует и секретирует глюкокортикоиды. Она состоит из гистологически отличающихся пучковой и сетчатой зон (рис. 8-2) (Reusch, 2000).
Минералокортикоиды
Физиологическое действие. Минералокортикоиды контролируют гомеостаз натрия, калия и воды. Они стимулируют всасывание натрия, хлоридов и воды, а также экскрецию калия в эпителиальных тканях, в том числе в слизистой кишечника, слюнных и потовых железах и в почках.
Основным местом приложения действия минералокортикоидов являются почечные канальцы. Альдостерон усиливает всасывание натрия и хлоридов в проксимальных извитых канальцах, а также всасывание натрия в дистальных извитых канальцах с одновременным выведением из них калия (Nelson, 1980).
Система ренин-ангиотензин. Секреция альдостерона непосредственно контролируется ренин-ан-гиотензиновой системой. Эта система тесно связана с юкстагломерулярным аппаратом почек, который включает в себя юкстагломерулярные клетки, окружающие афферентные артериолы клубочков в корковом слое почек, и группу специфически окрашивающихся клеток, которые образуют плотное пятно (macula densa) и локализуются в дистальных извитых канальцах. Юкстагломерулярные клетки представляют собой специализированные миоэпителиальные клетки, окутывающие афферентные клубочковые артериолы и служащие в качестве миниатюрных датчиков давления. Они осуществляют мониторинг почечной перфузии, воспринимая изменения давления на стенки артериол по степени их деформации. Падение наполняемости сосудов при кровотечении, введении диуретиков или ограничении потребления соли ощущается юкстагломерулярными клетками как уменьшение натяжения
стенок сосудов, и в ответ на этот стимул клетки усиливают биосинтез и секрецию ренина.
Ренин, в свою очередь, действует на а2-глобулин плазмы крови, который образуется в печени. При этом высвобождается декапептид ангиотензин I. В легких ангиотензин-превращающий фермент отщепляет от ангиотензина I два аминокислотных остатка, что приводит к образованию ангиотензина II, который обладает мощным сосудосуживающим действием и непосредственно стимулирует секрецию альдостерона. Повышение концентрации альдостерона в плазме крови усиливает задержку натрия и, тем самым, способствует увеличению объема внеклеточной жидкости, увеличивает почечную перфузию и подавляет секреторный сигнал (рис. 8-3) (Ganong, 1981; White, 1994).
Нормальный эффект концентрации калия в плазме крови. Независимо от ренин-ангиотен-зиновой системы секреция альдостерона может регулироваться концентрацией калия в плазме крови. При введении в надпочечниковую артерию раствора, содержащего ионы калия, сразу же возрастает концентрация альдостерона в венозной крови надпочечников. Иными словами, калий непосредственно стимулирует продукцию альдостерона, по-видимому, благодаря трансмембранному действию. Эта система опосредуемой через калий регуляции секреции альдостерона функционирует параллельно ренин-ангиотензиновой системе и обладает примерно равной стимулирующей активностью, но ее значение в условиях in vivo, возможно, не столь велико как у системы регуляции почечной перфузии.
Нормальное действие АКТЕ Высвобождение альдостерона стимулируется также АКТГ, хотя этот гормон не играет ведущей роли в регуляции секреции минералокортикоидов из клубочковой зоны надпочечников. Скорее всего, его значение при физиологических условиях в большинстве случаев невелико и он служит «разрешающим» сигналом секреции альдостерона (Tyrrell et al, 1991).
Патофизиология недостаточности минералокортикоидов
Гипонатриемия и гипохлоремия. При недостаточности функции коры надпочечников отсутствие секреции альдостерона нарушает способность организма удерживать натрий и хлориды и экскретировать калий. В результате развиваются гипонатриемия, гипохлоремия и гиперкалиемия. При соблюдении правильного режима потребления натрия и хлоридов слабая недостаточность альдостерона не имеет никаких или почти никаких серьезных неблагоприятных последствий. Однако в случаях недостатка натрия в рационе при изменении режима питания или анорексии либо при его потерях вследствие рвоты и/или диареи состояние животных резко ухудшается. Продолжающееся выведение натрия и хлоридов через желудочно-кишечный тракт и почки может привести к серьезно
424 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
му понижению общего содержания соли в организме и одновременно к значительному уменьшению объема жидкости.
Теоретически потери натрия и хлоридов не могут происходить без сопутствующей потери воды. Поэтому нарушение задержки натрия и хлоридов сопровождается уменьшением внеклеточного объема жидкости что, в свою очередь, приводит к прогрессивному развитию гиповолемии и гипотензии, уменьшению минутного объема сердца и, в конечном итоге, к снижению перфузии почек и других тканей. Снижение скорости клубочковой фильтрации (СКФ) вызывает преренальную азотемию, повышенную продукцию ренина и слабый метаболический ацидоз. Этот синдром обычно сопровождается снижением веса тела, общей слабостью, миокардией и депрессией.
Антидиуретический гормон и концентрация мочи. Гипотензия и дегидратация, являющиеся следствиями недостаточности альдостерона, вызывают усиление секреции гипофизарного аргинин-ва-зопрессина (АВП, или антидиуретический гормон, АДГ)), чтобы компенсировать потери жидкости. АДГ стимулирует задержку воды, но при этом усугубляет гипонатриемию и гипохлоремию вследствие разбавления. Этот физиологический процесс не считается главным фактором гипокортицизма, поскольку у собак с данным заболеванием моча и без того относительно сильно разбавлена (удельный вес от 1,010 до 1,025), несмотря на дегидратацию и азотемию. Гипонатриемия способствует разбавлению мочи, поскольку натрий является существенным компонентом градиента концентрации в медуллярном веществе почек. Кроме того, гипонатриемия, по-видимому, нарушает стимуляцию секреции АДГ вследствие снижения осмоляльности сыворотки. Поэтому уменьшение концентрации ионов натрия (и хлоридов) подавляет действие естественных осмотических стимулов и способствует разбавлению мочи даже в условиях дегидратации (Tyler et al, 1987).
Гиперкалиемия. Прогрессивное увеличение гиперкалиемии является результатом уменьшения перфузии почек, которое вызывает снижение скорости клубочковой фильтрации и подавляет обмен катионов в дистальных извитых почечных канальцах. Гиперкалиемия может усиливаться в условиях метаболического ацидоза, при котором ионы калия переходят из внутриклеточного во внеклеточное пространство. Наиболее выраженным проявлением гиперкалиемии является нарушение сердечной функции под влиянием этих анионов. Гиперкалиемия уменьшает возбудимость миокарда, увеличивает продолжительность его рефракгерности и замедляет проводимость. Гипоксия, развивающаяся как следствие гиповолемии и слабой перфузии тканей, усиливает возбудимость миокарда. Эти нарушения находят отражение на электрокардиограмме. При повышении концентрации калия в плазме крови выше 10 мэкв/л возможна фибрилляция желудочков или остановка сердца.
Холестерин
Прегненолон
Прогестерон
11-дезоксикортикостерон
Р450альдо
Кортикостерон
Р450альдо
18-гидроксикортикостерон
Р450альдо
СН2ОН
Рис. 8-2. А. Биосинтез стероидов в клубочковой зоне надпочечников. Стадии от холестерина до 11-дезоксикортикосте-рона те же самые, что в пучковой и сетчатой зонах. Однако в клубочковой зоне отсутствует 17а-гидроксилаза, поэтому в ней не образуется кортизол. Только в пучковой зоне происходит превращение кортикостерона в 18-гидроксикорти-костерон и альдостерон. Один и тот же фермент Р450альдо катализирует превращение 11-дезоксикортикостерон -> кортикостерон -> 18-гидроксикортикостерон —> альдостерон.
Ацидоз. В результате нарушения реабсорбции ионов бикарбоната и хлорида в почечных канальцах развивается слабый метаболический ацидоз. Другой его причиной является неспособность слабо перфузируемых почек экскретировать отработанные продукты обмена веществ и ионы водорода.
Гл юкокорти кои д ы
Общие сведения: физиологическое действие. Секреция глюкокортикоидов контролируется гипо-таламо-гипофизарной системой посредством ме-
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
425
Рис. 8-2 (продолжение). Ь Основные пути биосинтеза стероидов в коре надпочечников. Подчеркнуты наиболее важные секретируемые соединения. 1 - Холестеролдссмолаза (фермент, расщепляющий боковую цепь холестерина, p450scc), 2 - Зр-гидроксистерои nei идрогеназа. 3 - 21р-гидроксилаза (Р450с21), 4 - 1 lp-ги троксилаза (3450с! 1), 5 - альдостсронсинтетаза, 6 - 17а-гитроксилаза (Р450с17), В клубочковой зоне, синтезирующей альдостерон, отсутствует 17а-гидроксилаза и поэтому нс образуются 17сс-гидрок-сипрщ неполон и 17а-гидроксипрогсстсрон, служащие предшественниками кортизола и андрогенов надпочечников. В пучковой и сетчатой зонах синтезируются кортизол, андрогены и небольшое количество эстрогенов. В этих двух зонах отсутствует альдостсронсинтетаза, поэтому не происходит превращение 11-дезоксикортикостерона в альдостерон.
ханизма отрицательной обратной связи. В гипоталамусе синтезируется, а затем секретируется КРГ, который стимулирует высвобождение АКТГ из гипофиза. АКТГ, в свою очередь, усиливает биосинтез и секрецию глюкокортикоидов в надпочечниках. По мере увеличения концентрации глюкокортикоидов в плазме крови они по механизму отрицательной обратной связи подавляют секрецию КРГ и АКТГ (см. рис. 8-1) (Ganong, 1981). Главным физиологическим фактором, который влияет на секрецию АКГГ, служит метаболизм кортизола; он частично подавляет действие механизма отрицательной обратной связи и вызывает высвобождение КРГ. Другим важным фактором, регулирующим секрецию АКТГ, является стресс (Nelson, 1980) Наличие суточных колебаний концентрации АКТГ, хорошо документированное у людей, еще нс получило достоверного подтверждения у собак.
Глюкокортикоиды (кортизол ) действуют практически на все ткани тела. Коргизол выполняет жизненно важную функцию поддержания сосудистого тонуса целостности эндотелия, проницаемости сосудов и распределения имеющейся в организме воды по сосудистой сети (Lamberts et al, 1997).
Кортизол усиливает сосудосуживающее действие катехоламинов и регулирует секрецию АКТГ КРГ и АДГ по механизму отрицательной обратной связи. Кортизол играет важную роль в обмене углеводов и белков, по крайней мерс, отчасти благодаря стимулирующему действию на глюконеогенез и синтез гликогена в печени и мышечной ткани. Он подавляет периферическое включение и утилизацию глюкозы, осуществляет контроль лимфоидной ткани и иммунной системы путем подавления воспалительных процессов, стимулирует эритроцитоз, поддерживает нормальное кровяное давление и противодействует влиянию стрессорных факторов (Oelkers, 1996). Боль повышение температуры и гиповолемия всегда вызываюг усиление секреции АКТГ и кортизола. Так, в ходе хирургических операций происходит быстрое увеличение концентраций АКТГ и кортизола в крови, которые постепенно нормализуются на протяжении последующих 24-48 часов. Пациентам, получающим стероидную терапию по поводу хронического аутоиммунного или воспалительного заболевания, требуются меньшие дополнительные количества кортикостерон job в случае возникновения более тяжелого расстроис-
426
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
А
Холестерин
17-ОН-прегненолон
Холестериндес-молаза
Б
"" 1 р, Прегненолон
30-гидроксистероид р _ .
дегидрогеназа е-1..........*-..............
I Прогестерон i......I..............
| Дезоксикортикостерон I.....I"
Кортикостерон
**** Андрогены
21-гидроксилаза
11р-гидроксилаза
18-гид роксилаза
18-ОН-кортикостерон
.....»
Альдостерон
17-ОН-Прогестерон
11 -Дезоксикортизол
♦..............
Кортизол
110-гид рокси л аза
Сетчатая зона
18-оксидаза
Полуацеталь Альдегид
Альдостерон
Клубочковая зона
Кортизол
Рис. 8-3. А. Регуляция внутрисосудистого объема и концентрации калия в плазме крови ренин-ангиотензин-альдостероновой системой. Уменьшение внутрисосудистого объема вызывает увеличение секреции ренина юкстагломерулярным аппаратом, что приводит к усилению превращения ангиотензиногена в ангиотензин I, а затем в ангиотензин II. Последний действует на клубочковую зону надпочечников, где индуцирует активность альдостеронсинтетазы и, следовательно, секрецию альдостерона. Гиперкалиемия также вызывает усиление активности альдостеронсинтетазы. Альдостерон действует на дистальные канальцы почек, усиливая всасывание в них натрия и, как следствие, экскрецию калия (К). Аббревиатура АПФ обозначает ангиотензин-превращающий фермент, а стрелки перед словом или символом, направленные вверх и вниз, указывают на повышение или понижение. Б. Пути биосинтеза стероидов в надпочечниках. Показаны пути образования альдостерона и кортизола из холестерина. Химическая структура этих соединений приведена соответственно в нижней и верхней частях рисунка. Альдостерон существует в двух конформациях (как 18-альдегид и полуацеталь), которые свободно переходят одна в другую; в физиологических условиях преобладает полуацеталь. Слева перечислены ферменты, катализирующие отдельные стадии биосинтеза; три последние ферментативные реакции превращения, необходимые для биосинтеза альдостерона, осуществляются одним и тем же ферментом — альдостеронсинтетазой (CYP11B2). Показаны также процессы превращения, происходящие в клубочковой и сетчатой зонах. (Из: White PC: N Engl J Med 331:250, 1994).
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
427
тва или в ходе предоперационной подготовки, чем больным, получающим заместительную терапию в связи с недостаточностью функции коры надпочечников (Lamberts et al, 1997).
Патофизиология симптомов, сопутствующих недостаточной секреции кортизола
Недостаточность кортизола. Нарушение секреции глюкокортикоидов может быть следствием разрушения коры надпочечников или дисфункции гипоталамуса и/или гипофиза, приводящей к недостаточной продукции КРГ и соответственно АКТГ. Кортизол необходим для поддержания разнообразных физиологических функций. Недостаток его секреции независимо от причины может вызывать различные нарушения деятельности желудочно-кишечного тракта, включая анорексию, рвоту, боли в животе и уменьшение веса тела. Одновременное угнетение энергетического обмена обусловлено нарушением глюконеогенеза и жирового обмена, уменьшением утилизации жиров и истощением резерва гликогена в печени. Оно может привести к возникновению гипогликемии натощак. Указанные процессы могут сопровождаться психическими изменениями, такими как снижение общей активности и сонливость. Уменьшение экскреции воды, не содержащей натрий, приводит к гипонатриемии. При первичной надпочечниковой недостаточности сохраняется естественная секреция гипофизарного АКТГ. Одним из наиболее показательных симптомов гипокортицизма является нарушение толерантности к стрессорным воздействиям, поэтому его клинические проявления зачастую выражены значительно сильнее, когда животное оказывается в условиях стресса.
Недостаточность АКТГ. При вторичной надпочечниковой недостаточности, вызванной нарушением функции гипоталамуса и/или гипофиза, важно сохранить нормальную деятельность ренин-ангиотензиновой системы. Отсюда необходимость поддержания электролитного баланса. То же самое относится к случаям резкого прекращения хронического введения кортикостероидов собакам. Вводимые экзогенные кортикостероиды подавляют секрецию АКТГ посредством механизма отрицательной обратной связи, что приводит к вторичной атрофии коры надпочечников, не затрагивающей, однако, клубочковую зону. К числу клинических симптомов недостаточности кортизола относятся сонливость, потеря аппетита, рвота, диарея, уменьшение веса тела и общая слабость. При заболевании могут проявляться все эти симптомы или отдельные из них.
Ятрогенная недостаточность кортизола в результате терапии о,р’-ДДД. Ятрогенный гипокортицизм, индуцированный, например, введением адренокортиколитического препарата о,р’-ДВД, может вызвать у собак такие же физиологические изменения, как при спонтанном заболевании. С помощью пробы с АКТГ было показано, что введение о,р’-ДДД здоровым собакам быстро приводит
к гипокортизолемии. Тем не менее, типичные клинические признаки гипокортицизма развиваются у них не так быстро, как можно было бы ожидать на основании результатов тестирования. Если собакам одновременно давать противосудорожный препарат фенобарбитал, то они становятся относительно резистентны к действию о,р’-ДДЦ.
Собаки с гиперкортицизмом зависимым от гипофиза (ГЗГ) довольно чувствительны к о,р’-ДДД. Признаки недостаточности кортизола развиваются у них быстро и сохраняются длительное время. Этот препарат может полностью разрушить кору надпочечников, однако при соблюдении предписанного режима его применения такое случается редко (см. гл. 6). Кетоконазол - блокатор, прерывающий биосинтез кортизола, может вызвать тяжелую, но обратимую недостаточность этого гормона при ежедневном введении в дозах около 30 мг/кг.
Половые гормоны
В сетчатой зоне коры надпочечников образуются и секретируются андрогены, эстрогеноподобные соединения и глюкокортикоиды. Физиологическая роль образующихся в надпочечниках андрогенов и/или эстрогенов остается неясной. У животных с первичной надпочечниковой недостаточностью клинические проявления нарушенной секреции андрогенов и эстрогенов отсутствуют.
Тяжесть поражения коры надпочечников
Патогенез. Считается, что клинические симптомы надпочечниковой недостаточности проявляются после разрушения, по меньшей мере, 90% коры надпочечников. В физиологических условиях аутоиммунное разрушение коры надпочечников происходит постепенно и сначала приводит к возникновению «синдрома частичной недостаточности». Этот синдром характеризуется уменьшением функционального резерва надпочечников и проявлением клинических симптомов только в условиях стресса (см. табл. 8-1). Стрессорными факторами служат травма, хирургическая операция, инфекция и даже психогенные стимулы, например, помещение собаки в питомник. В отсутствие стресса базальная секреция гормона может быть достаточна для обеспечения близкой к нормальной концентрации электролитов в плазме крови на фоне минимального проявления симптомов заболевания. В таких случаях подтверждение диагноза возможно только с помощью тестов, позволяющих оценить резервную функцию коры надпочечников. По мере продолжающегося разрушения коры секреция гормона становится недостаточной даже в обычных, нестрессорных условиях, что может привести к возникновению истинного метаболического криза в отсутствие явных провоцирующих факторов.
Сроки разрушения отдельных зон коры надпочечников. У собак с первичной надпочечнико
428 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
вой недостаточностью все три зоны коры надпочечников разрушаются примерно с одинаковой скоростью. Иными словами, недостаточность секреции альдостерона (с сопутствующей клинической симптоматикой и проявлениями нарушенного электролитного равновесия) и недостаточность глюкокортикоидов (с соответствующими клиническими проявлениями) развиваются параллельно. Поэтому провоцирующую пробу с АКТГ применяют с целью непосредственной оценки способности надпочечников синтезировать кортизол и косвенной оценки их способности продуцировать альдостерон. Чрезвычайно редко клубочковая зона, секретирующая альдостерон, поражается сильнее, чем сетчатая и пучковая зоны, секретирующие кортизол (Lobetti, 1998). С другой стороны, у собак с нормальной концентрацией электролитов в крови слабый ответ кортизола на введение экзогенного АКТГ может быть обусловлен хроническим введением глюкокортикоидов, либо, что бывает гораздо реже, недостаточной секреций гипофизарного АКТГ.
ВСТРЕЧАЕМОСТЬ
Частота заболевания
Статистика заболевания гипокортицизмом (болезнью Аддисона) отражает примерное число вновь диагностируемых случаев. Согласно существующим оценкам, к частнопрактикующему ветеринару ежегодно поступает в среднем 1400-1600 собак, а частота болезни Аддисона составляет приблизительно 0,5 на 1000 животных, то есть на каждых двух специалистов ежегодно приходится, по меньшей мере, один новый случай гипокортицизма (Kelch et al, 1998). Если заболевание лечить, то прогноз весьма благоприятен, и у животных в целом сохраняется нормальная продолжительность жизни - в среднем около 7 лет при отсчете от среднего возраста, в котором обычно диагностируется эта болезнь. Эти расчеты свидетельствуют о том, что в каждый данный момент под наблюдением среднестатистического ветеринарного врача находится несколько собак, получающих терапию по поводу болезни Аддисона.
Клинический материал
Гипокортицизм - довольно редкое эндокринное заболевание у собак и еще реже встречается у кошек. В настоящий раздел включены данные, полученные нами при обследовании 205 собак со спонтанно развившимся гипокортицизмом, а также данные о 76 и 225 собаках, взятые из двух опубликованных обзоров (Willard et al, 1982, Peterson et al, 1996). Таким образом, данная группа, состоящая в общей сложности из 506 животных с гипокортицизмом, очевидно, достаточно типична, чтобы делать те или иные обобщения по поводу рассматриваемого заболевания.
Пол
Группа из 506 собак включала 349 (69%) сук и 91 (18%) кастрированного кобеля. Преобладание сук характерно для заболеваний собак, индуцируемых иммунной системой, поэтому состав данной группы может служить лишним подтверждением аутоиммунной природы большинства случаев гипокортицизма у этих животных (Melian, Peterson, 1996). В исследовании, посвященном критической оценке данного вопроса, было показано, что вероятность заболевания гипокортицизмом у самок примерно вдвое выше, чем у самцов. Следует также отметить, что кастрированные суки и кобели заболевали почти в три раза чаще, чем интактные животные соответствующего пола (Kelh et al, 1998).
Возраст
Гипокортицизм может возникнуть у собаки в любом возрасте, однако чаще всего он диагностируется у животных молодого и среднего возраста. Среди рассматриваемых здесь 506 собак были животные от 4 недель до 16 лет, а средний возраст собак на момент установления диагноза составлял примерно 4-5 лет. Согласно статистическим данным, у собак вероятность развития аддисоновой болезни в возрасте до 4 лет ниже, чем в возрасте от 7 до 14 лет. Тем не менее, в представленной группе из 506 собак на момент установления диагноза гипокортицизма примерно 76% животных были моложе 7 лет.
Порода
Предполагается, что некоторые породы собак явно предрасположены к гипокортицизму. В то же время практически все авторы отмечают, что беспородные собаки заболевают чаще чистопородных, а в опубликованных материалах упоминается принадлежность больных животных к самым разнообразным породам. В нашей группе беспородные собаки составляли 24% (122 собаки). Кроме того, частота встречаемости других пород может просто отражать их популярность среди населения (табл. 8-3).
Тем не менее, соответствующий статистический анализ имеющихся данных показывает, что отдельные породы характеризуются повышенным риском заболевания гипокортицизмом (см. табл. 8-3). Этот факт был установлен путем сопоставления частоты аддисоновой болезни у собак каждой данной породы и в общей обследованной популяции. К группе повышенного риска относятся датский дог, пудель (той-пудель, миниатюрный и обыкновенный пудели) и уэст-хайленд-уайт-терьер. В число пород с пониженным риском заболевания попали бостон-терьер, йоркширский терьер и лхаса апсо, а также беспородные собаки. Бассеты, сенбернары и португальские водяные собаки, по-видимому, также характеризуются повышенным риском заболевания гипокортицизмом, однако он не поддается точной
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 429
ТАБЛИЦА 8-3. ПОРОДЫ СОБАК, ЗАБОЛЕВАЮЩИХ ГИПОКОРТИЦИЗМОМ*
А. Наиболее часто заболевающие породы Беспородные
Той-пудель и карликовый пудель Лабрадор-ретривер
Ротвейлер
Обыкновенный пудель Немецкая овчарка Доберман-пинчер Золотистый ретривер Уэст-хайленд-уайт-терьер Дог
Б. Породы с повышенным риском заболевании
Датский дог
Уэст-хайленд-уайт-терьер
Бородатая колли
Пудели (той-пудель, карликовый и обыкновенный пудели) Бассет
В. Породы с низким риском заболевания
Бостон-терьер
Далматин Бультерьер Боксер Померанский шпиц Йоркширский терьер Шелти (шетландская овчарка) Лхаса апсо
Г. Породы с возможной генетической предрасположенностью к гипокортицизму
Обыкновенный пудель
Португальская водяная собака Бородатая колли
Лабрадор-ретривер___________________________________
*(Из: Kelch WJ, 1966, публикуется с разрешения)
оценке из-за сравнительно низкого распространения этих пород и соответственно небольшого числа зарегистрированных случаев заболевания. Не вполне ясен также вопрос о предрасположенности лабрадор-ретриверов к заболеванию гипокортицизмом. В одном из исследований сообщалось о высоком риске заболеваемости у этой породы, однако, более строгий анализ не выявил ни повышенной, ни пониженной степени риска (Kelch et al, 1998).
Высказывалось предположение о генетической предрасположенности некоторых пород собак к аддисоновой болезни. В одном из исследований была продемонстрирована высокая частота наследования гипокортицизма у бородатых колли (Oberbauer et al, 2002).Считается, что обыкновенные пудели, португальские водяные собаки и лабрадор-ретри-веры также имеют генетическую предрасположенность к этому заболеванию (см. табл. 3-8). Кроме того, имеются сообщения о родственных группах собак с болезнью Аддисона. Наличие семейной предрасположенности предполагается у обыкновенных пуделей, португальских водяных собак, ле-онбергеров, лабрадор-ретриверов и других пород (Auge, 1985; Shaker et al, 1988; Smallwood, Barsanti, 1995). Предварительные результаты проводящегося
в настоящее время исследования свидетельствуют, в частности, о возможной генетической предрасположенности к гипокортицизму у обыкновенных пуделей.
АНАМНЕЗ
Субъективность мнения владельцев
Возможность получать от владельцев животных всю информацию, относящуюся к уходу за питомцами и заботе об их здоровье, является, по-видимому, самым важным, хотя и недооцениваемым источником необходимых для диагностики материалов. Ветеринар должен понимать, что некоторые владельцы при всей их наблюдательности и исполнительности имеют слабое представление о том, какое состояние следует считать «нормальным» для их питомцев. Самым ярким примером могут служить хозяева тяжело больной двухлетней суки сенбернара, обратившиеся за ветеринарной помощью с жалобами на ее недомогание в течение последних двух дней и утверждавшие, что до этого животное было совершенно здоровым. У этой собаки был диагностирован гипокортицизм, и ей было предписано соответствующее лечение. По словам хозяев, через неделю после завершения стационарного лечения собака снова стала агрессивной и игривой, у нее восстановился прекрасный аппетит, а энергия и активность стали выше, чем когда-либо ранее. Только тогда они осознали, что большую часть жизни собака была «больна», хотя у нее отсутствовали симптомы, требовавшие обращения к специалисту. Этот пример показывает, насколько важно для ветеринара уметь задавать вопросы и анализировать ответы, имея в виду, что владельцы животных далеко не всегда предоставляют всю необходимую информацию.
Разная тяжесть клинических признаков
Проявление каждого данного клинического признака может значительно варьировать, поэтому оценка его тяжести полностью зависит от субъективного мнения владельца больного животного. Основные жалобы владельцев на состояние собак, у которых в конечном итоге диагностируется гипокортицизм, сводятся к анорексии или снижению аппетита, сонливости или депрессии, уменьшению веса тела или истощению, общей слабости, рвоте и/или срыгиванию пищи, поносу (иногда с дегтеобразным или кровавым стулом) и/или коллапсу (табл. 8-4). Эти симптомы выражены нечетко и зачастую свидетельствуют о наличии более обычных для мелких животных заболеваний, включая почечные, желудочно-кишечные или инфекционные. Патогномо-нические признаки отсутствуют. Как отмечалось выше, степень проявления некоторых или всех этих симптомов индивидуальна. Подозрение на гипокортицизм можно считать подтвержденным только
430 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
ТАБЛИЦА 8-4. ОСНОВНЫЕ РАССТРОЙСТВА, ОТМЕЧАВШИЕСЯ ВЛАДЕЛЬЦАМИ 506 СОБАК С ГИПОКОРТИЦИЗМОМ (ДАННЫЕ АНАМНЕЗА)
Признак Частота (%)
Плохой аппетит или анорексия 88
Сонливость или депрессия 85
Кахексия 82
Рвота или срыгивание пищи 68
Общая слабость 51
Потеря веса 40
Диарея 35
Нестабильное течение заболевания 25
Полиурия 17
Дрожь или озноб 17
Коллапс 10
Боли в животе 8
после дифференциальной диагностики. Сопоставление данных о встречаемости надпочечниковой недостаточности, анамнеза и результатов физикального исследования с наблюдениями, заставляющими подозревать ее наличие у данного животного, в большинстве случаев позволяет поставить правильный диагноз и провести адекватное лечение.
Клинические признаки при гормональной недостаточности
Любой из клинических признаков, перечисленных в табл. 8-4, может быть прямым следствием недостаточной секреции глюкокортикоидов и/или минералокортикоидов. Анорексия, рвота, срыгивание пищи, сонливость, общая слабость, частый и жидкий, а также дегтеобразный и кровавый стул, боли в животе могут быть следствием изолированной глюкокортикоидной недостаточности. Однако проявления этих расстройств усиливаются при одновременном изменении концентраций натрия и калия в плазме крови. Одним из следствий перечисленных нарушений является потеря веса, а неустойчивое (с переменной тяжестью) течение заболевания отражает прогрессирующую, но необязательно абсолютную недостаточность гормонов коры надпочечников. Полиурия развивается в результате избыточной экскреции натрия с мочой, которая приводит к «вымыванию» одного из растворенных соединений, образующих градиент концентрации в медуллярном веществе почек. Дрожь и озноб у собак с гипокортицизмом являются следствием мышечной слабости, вызванной снижением концентрации натрия в плазме крови.
Классическое неустойчивое течение заболевания
Важным клиническим признаком в анамнезе животного, вызывающим подозрение на болезнь Аддисона, является указание на неустойчивое течение заболевания или эпизодический характер его проявлений. Однако этот классический признак отмеча
ется только у 25% собак с гипокортицизмом. Изменения тяжести заболевания попросту ускользают от внимания большинства владельцев животных. Правда, в отдельных случаях спонтанного гипокортицизма хозяева наблюдают эпизодическое ухудшение состояния собаки, появление слабости и депрессию, которые продолжаются в течение от 2 до 52 недель, предшествующих установлению окончательного диагноза. Такие животные балансируют на грани нормы и тяжелого заболевания, которое может развиться внезапно или постепенно. Периоды удовлетворительного состояния нередко отмечаются после неспецифической ветеринарной терапии, которая обычно включает лечение кортикостероидами и/или парентеральное введение жидкости.
Собаки с надпочечниковой недостаточностью чаще всего поступают к ветеринару в состоянии острого «аддисонова» криза или прогрессирующего, нередко перемежающегося, заболевания. Однако у большинства собак с гипокортицизмом, независимо от его продолжительности, болезнь протекает не остро, а хронически. Обычно владельцы наблюдают прогрессирующие или эпизодические проявления заболевания на протяжении двух или более недель. Многие животные, в первый раз поступающие к ветеринару в состоянии острой надпочечниковой недостаточности, ранее имели хроническое, прогрессирующее и нелеченое заболевание надпочечников или гипофиза. Его слабые клинические проявления либо оставались незамеченными, либо не вызывали беспокойства у хозяев животных. Анамнестические данные, которые удается получить у владельцев, доставляющих собак в ветеринарное учреждение в состоянии острого приступа, обычно не отличаются от информации, которую предоставляют хозяева животных с легким заболеванием. Единственное различие состоит в жалобах на тяжесть депрессии, слабости и других нарушений. Некоторые собаки настолько слабы, что их приносят на руках.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Физикальное исследование собак, входящих в сформированную нами группу, не выявило иных последовательных нарушений, кроме «общей болезненности». Неудивительно поэтому, что слабые признаки «депрессии», сонливости, похудения и слабости были наиболее обычными клиническими проявлениями у всех 506 собак с аддисоновой болезнью (табл. 8-5). Дегидратация, шок или коллапс, гипотермия, брадикардия и слабая пульсация бедренной артерии были зарегистрированы лишь у небольшого числа животных. При осмотре прямой кишки или измерении ректальной температуры иногда выявляли мелену и/или наличие крови в испражнениях. В ветеринарной литературе имеются сведения о болях в животе, гипотермии и кахексии, однако мы редко наблюдали эти явления и не нашли упоминания о них в публикациях, данные ко-
ТАБЛИЦА 8-5. НАРУШЕНИЯ, ВЫЯВЛЕННЫЕ ПРИ ОБЩЕМ КЛИНИЧЕСКОМ ОБСЛЕДОВАНИИ 506 СОБАК С ГИПОКОРТИЦИЗМОМ
Признак Частота (%)
Депрессия или сонливость 87
Кахексия 82
Общая слабость 66
Дегидратация 41
Шок или коллапс 24
Брадикардия 22
Слабая пульсация бедренной артерии 22
Наличие неизмененной крови в испраж- 17
нениях, дегтеобразный стул
Пониженная температура 15
Боли в животе 7
торых используются в настоящем разделе (Willard et al, 1982; Peterson, 1996).
Тщательное физикальное исследование имеет важнейшее значение для оценки состояния любого животного. При гипокортицизме, как и при других заболеваниях, оно позволяет получить данные о тяжести расстройства. Однако специалист не всегда может понять причину заболевания без дополнительной информации. Для установления окончательного диагноза необходимо собрать подробный анамнез, тщательно проанализировать его и правильно выбрать соответствующие функциональные тесты.
КЛИНИЧЕСКАЯ ПАТОЛОГИЯ
Количество эритроцитов
Для недостаточности функции надпочечников характерна нормоцитарная нормохромная анемия в сочетании со слабой или неретикулоцитарной вторичной реакцией на подавление функции костного мозга в условиях гипокортицизма. Однако, первичный общий клинический анализ крови (ОАК) может не выявить анемию, если у животного имеет
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 431
место гемоконцентрация, обусловленная дегидратацией (табл. 8-6). После регидратации у такой особи обычно появляются типичные признаки слабой анемии, обусловленной гипокортицизмом, при показателе гематокрита 20-35%.
Если выраженную анемию обнаруживают уже при первичном физикальном исследовании, а животное поступило в состоянии «аддисонова» криза, регидратация может привести к снижению содержания эритроцитов до угрожающего жизни уровня. Тяжелая анемия обычно вызвана хроническим подавлением функции костного мозга и/или острой либо тяжелой желудочно-кишечной геморрагией. Желудочно-кишечное кровотечение может быть специфическим следствием глюкокортикоидной недостаточности. В этих случаях основным компонентом его терапии является переливание свежей цельной крови или эритроцитарной массы (Medinger et al, 1993).
Количество лейкоцитов
Общее количество лейкоцитов. Общее количество лейкоцитов в крови собак с гипокортицизмом может быть в норме или слегка повышено. У большинства животных оно остается в пределах нормы. У собак нашей группы дифференциальный подсчет лейкоцитов не выявил существенных отклонений. Увеличение количества этих клеток, возможно, отражает реакцию гранулоцитов на сопутствующую бактериальную инфекцию (см. табл. 8-6).
Эозинофилы. Сообщения о абсолютной эозинофилии у собак с гипокортицизмом редко встречаются в ветеринарной литературе. Хотя по мнению некоторых специалистов, эозинофилия является весьма распространенным явлением, однако большинство авторов рассматривает ее как непостоянный признак гипокортицизма. При первичном обследовании эозинофилы отсутствовали у 14% из 506 собак, однако только у 10% из них была установлена абсолютная эозинофилия. У остальных животных как относительное, так и абсолютное количество эозинофилов оставалось в пределах нормы.
Наличие нормального количества эозинофилов у больных собак имеет важное значение, поскольку предполагает возможность реакции на стрессорные
ТАБЛИЦА 8-6. РЕЗУЛЬТАТЫ ОБЩЕГО КЛИНИЧЕСКОГО АНАЛИЗА КРОВИ У СОБАК С ГИПОКОРТИЦИЗМОМ
Параметр Нормальный диапазон Болезнь Аддисона
Средняя величина Уменьшение в % Увеличение в % Диапазон
Гематокрит
- при поступлении 37-55% 39% 34 10 15-57
- через 24 часа 37-55% 28; 71 0 8-40
Количество лейко- 6-17 х 103 11 2 12 4-32
цитов
Нейтрофилы 60-77% 62% 4 13 45-84
Лимфоциты 12-30% 28% 7 13 8-44
Эозинофилы 2-10% 8% 14 10 0-41%
432 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
ТАБЛИЦА 8-7. ВОЗМОЖНЫЕ ПРИЧИНЫ ЭОЗИНОФИЛИИ У СОБАК И КОШЕК
Паразитарные болезни
Дирофиляриоз
Желудочно-кишечное заболевание
Кожное заболевание
Прочие
Астма
Непаразитарные кожные заболевания Опухоль тучных клеток
Гипокортицизим (болезнь Аддисона) Заболевание матки
Эозинофильный миозит
Эозинофильные пневмония/ринит/конъюнктивит Эозинофильный энтероколит (аллергический колит) Эозинофильная лейкемия
Комплекс эозинофильной грануломы Эозинофильный васкулит
Реакция на лекарственные средства
воздействия без участия или со слабым участием этих клеток, если у животных не нарушена функция коры надпочечников. В то же время сохранение нормального количества эозинофилов у больных особей или в условиях стресса может служить основанием для подозрения на гипокортицизм. Нельзя забывать, что относительная или абсолютная эозинофилия может иметь место и при многих других заболеваниях и что ее можно использовать для дифференциальной диагностики с целью объяснения возникновения данного заболевания или установления его причины (табл. 8-7) (Rothenberg, 1998). Присутствие или отсутствие эозинофилов следует рассматривать как неспецифический и малочувствительный показатель наличия гипокортицизма у того или иного животного.
Лимфоциты. Одна из реакций животного с нормальной функцией коры надпочечников на стрес-сорное воздействие состоит в усилении секреции кортизола. Глюкокортикоиды уменьшают количество лимфоцитов в крови. Поэтому у больных животных или особей с нелеченым гипокортицизмом относительное и абсолютное количество лимфоцитов повышено. Как и в случае с эозинофилами, это увеличение не является показателем устойчивых, чувствительных или специфических изменений, рассматриваемых в качестве классических проявлений гипокортицизма (см. табл. 8-6), однако этот параметр служит одним из «ключей» к оценке состояния надпочечниковой функции. Подозрение на гипокортицизм возникает в тех случаях, когда у больной собаки сохраняется нормальное или повышенное количество лейкоцитов. Лимфоцитоз был зарегистрирован у 13% из наших 506 собак с гипокортицизмом, а у 80% их абсолютное количество оставалось в норме.
Модифицированная проба Торна. До появления общедоступных и простых методов измерения концентрации кортизола в плазме крови применялись косвенные способы оценки функции коры надпочечников. К их числу относились методы
определения изменений количества лейкоцитов и/или процентного содержания отдельных типов лейкоцитов после инъекции АКТГ. «Модифицированная проба Торна» (названная так по имени д-ра G.W.Thom, описавшего ее в 1948 г) была пересмотрена, и было предложено брать у собак пробы крови до и через 4 часа после введения АКТГ. У собак с нормальной функцией коры надпочечников инъекция АКТГ вызывает увеличение отношения количества нейтрофилов к количеству лимфоцитов, по меньшей мере, на 30% и снижение количества эозинофилов не менее чем на 50% (Chastain et al, 1989). Эта проба была рекомендована в качестве простого и легко доступного способа оценки необходимости определения концентрации кортизола в плазме крови. Однако мы не используем ее в своей работе.
Электролиты в сыворотке крови: «классические» гипонатриемия и гиперкалиемия
Патофизиология изменений содержания электролитов в сыворотке крови. Классические изменения концентрации электролитов при аддисоновой болезни включают гипонатриемию, гипохлоремию и гиперкалиемию. Эти нарушения обусловлены в первую очередь недостаточностью альдостерона, которая приводит к неспособности почек удерживать натрий или экскретировать калий. Гипонатриемия развивается, прежде всего, в результате выведения натрия почками. Экскреция натрия сопровождается потерей воды, что в совокупности приводит к гипонатриемии и дегидратации, если эти потери не компенсируются дополнительным потреблением жидкости. В определенной степени дегидратация может маскировать снижение уровня натрия, как слабое, так и тяжелое. При недостаточности гормонов коры надпочечников усиливается поступление натрия в клетки из внеклеточного пространства и одновременно уменьшается концентрация внутриклеточного калия. Гиперкалиемия развивается как следствие двух процессов: перехода калия из внутриклеточного во внеклеточное пространство и понижения его экскреции с мочой. Первый из этих процессов обусловлен отсутствием действия кортизола на натриево-калиевый насос, с помощью которого обычно поддерживается трансмембранный градиент концентрации (Nelson, 1980).
Гипоальдостеронизм и ацидоз способствуют переходу калия из внутриклеточной во внеклеточную жидкость. Снижение его обмена на натрий в дистальных почечных канальцах приводит к уменьшению его экскреции с мочой и усилению выведения с ней натрия. Такой сдвиг электролитного равновесия между внутри- и внеклеточной жидкостями можно отчасти корректировать введением кортизола, однако для предотвращения потерь натрия через почки и избыточной задержки калия необходим альдостерон или другие минералокортикоиды (Tyrrell et al, 1991).
ГИПСЖОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 433
Натрий. При диагностике аддисоновой болезни у собак концентрация натрия в сыворотке бывает в норме или снижена вплоть до 106 мэкв/л (табл. 8-8). Из 483 собак с первичным гипокортициз-мом у 417 (86%) ко времени постановки диагноза концентрация натрия в сыворотке была ниже 142 мэкв/л. Кроме того, у 8 из 23 собак с явной недостаточностью АКТГ (вторичной надпочечниковой недостаточностью) была выявлена гипонатриемия. В отдельном исследовании были описаны 60 собак с гипокортицизмом, у которых средняя концентрация натрия на момент установления диагноза составляла 128 мэкв/л (Lynn et al, 1993). Эта величина близка к средней концентраций натрия у 506 собак нашей группы.
Калий. Концентрация калия в сыворотке крови у собак при гипокортицизме может колебаться от нормальной до очень высокой, приводящей к клинически выраженным нарушениям сердечного ритма (см. табл. 8-8). У 460 из 483 собак с гипокортицизмом (95%) концентрация калия была выше 5,5 мэкв/л. Еще у 60 собак, у которых мы недавно установили гипокортицизм, средняя концентрация калия в сыворотке крови составляла 7,2 мэкв/л (по сравнению с 7,0 мэкв/л у 506 животных основной группы). Ни у одной из 23 собак с явной недостаточностью АКТГ гиперкалиемии не было.
Отношение концентраций натрия и калия: величина и ограничения. Отношение концентраций натрия и калия часто используется в качестве диагностического показателя в случаях подозрения на недостаточность надпочечниковой функции или для специфического выявления животных с этим заболеванием. В норме величина этого отношения составляет от 27:1 до 40:1. Однако у собак с первичным гипокортицизмом она зачастую не превышает 27:1 и может быть ниже 20:1. Определение концентрации сывороточных электролитов у собак с подозрением на надпочечниковую недостаточность очень важно. При выявлении классических нарушений концентрации электролитов или
гиперкалиемии в отсутствие понижения концентрации натрия, либо в противоположной ситуации (уменьшение концентрации натрия без повышения уровня калия) показана немедленная терапия. При этом подразумевается, что лечение назначается по поводу аддисоновой болезни и необходимо для спасения жизни животного.
В случаях, когда предварительный диагноз гипокортицизма, поставленный на основании результатов определения концентрации электролитов в сыворотке крови, оказывается неверным, предписанная неотложная терапия редко приносит вред. Агрессивное лечение гипокортицизма существенно не отличается от назначаемого при угрожающих жизни заболеваниях почек или желудочно-кишечного тракта. Следует, однако, помнить об ограниченных возможностях диагностики гипокортицизма исключительно на основании данных определения электролитов. Ориентация на эти показатели в качестве единственного диагностического критерия надпочечниковой недостаточности может приводить к ошибочным заключениям, если не принимаются во внимание три ниже перечисленные фактора (см. три следующие раздела). Первый и наиболее важный из них, - это медленное, прогрессирующее развитие первичной надпочечниковой недостаточности у большинства собак. Второй - сохранение секреции альдостерона у животных с нарушенной гипофизарной функцией. Третий - гиперкалиемия и гипонатриемия не являются патогномоничными признаками надпочечниковой недостаточности (рис. 8-4 и 8-5).
Определение электролитов в сыворотке крови не всегда позволяет поставить окончательный диагноз
Бессимптомное заболевание. Надпочечниковая недостаточность может начинаться как бессимптомное заболевание, которое с течением времени постепенно прогрессирует. Однако в клинической практике чаще приходится сталкиваться с острыми надпочечниковыми кризами. Результаты опре-
ТАБЛИЦА 8-8. ОТДЕЛЬНЫЕ БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ КРОВИ У 506 СОБАК С ГИПОКОРТИЦИЗМОМ
Параметр Нормальный диапазон Болезнь Аддисона
Средняя величина Уменьшение в % Увеличение в % Диапазон
Концентрация натрия (мэкв/л) 142-155 128 84 0 106-150
Концентрация калия (мэкв/л) 4,1-5,5 7,0 0 92 4,7-10,8
Отношение концентраций натрия и калия >27 18 91 0 11,2-34,1
Концентрация AM (мг/100 мл)
До начала лечения 13-28 81 3 90 7-321
Через 24 часа 13-28 26 4 24 8-194
Концентрация креатинина (мг/100 мл) 0,8-1,9 3,1 0 61 1,5-8,3
Концентрация глюкозы (мг/100 мл) 70-110 80 23 8 10-547
Общий СО2 в венозной крови 18-24 16 46 3 9-21
Концентрация общего белка (мг/100 мл) 5,5-7,8 6,4 14 10 4,3-8,2
Концентрация альбумина (мг/100 мл) 2,8-3,9 2,9 14 4 1,6-4,4
Концентрация холестерина (мг/100 мл) 140-240 166 11 11 31-788
Концентрация кальция (мг/100 мл) 9,6-11,7 11,1 12 29 6,6-15,9
Удельный вес мочи — 1,018 <1,030 в 88% 0 1,005-1,044
случаев
434
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
( Гиперкалиемия (концентрация сы-I вороточного калия >5,5 мэкв/л)
Мочевой пузырь нормального или маленького размера
Большой, растянутый мочевой пузырь
Ложная гиперкалиемия
Повышенное поглощение
Перераспределение калия
Окклюзия нижнего отдела мочевого тракта
Шпиц Акита
Гемолизированная проба крови
Выраженный лейкоцитоз
(>100000 мм3)
Выраженный тромбоцитоз (>1000000 мм3)
Избыточное пероральное поступление
Избыточное поступление парентеральным путем
Желудочно-кишечное заболевание
Метаболический или дыхательный ацидоз
Массированное повреждение мягкой ткани Гиперкалиемический периодический паралич
Пониженная экскреция калия
Камни в мочеиспускательном канале
Опухоль мочеиспускательного канала
Слизистая/минерализован-ная пробка в мочеиспускательном канале
Грануломатозный уретрит
Инородное тело в мочеиспускательном канале
Стриктура в мочеиспускательном канале
Повторное определение концентрации К+ в сыворотке и меры по коррекции вышеуказанных нарушений
I
При нормокалиемии не требуется никаких дальнейших действий
1. Олигурическая почечная недостаточность 2. Анурическая почечная недостаточность 3. Разрыв мочевого пузыря 4. Закупорка мочеточника? (особенно у кошек) Почечная недостаточность Гипокортицизм Плевральный выпот Передозировка антагонистов альдостерона
Азотемия
Нормальная концентрация натрия в сыворотке
Пустой мочевой пузырь
Азотемия Нормальная концентрация натрия в сыворотке
Нормальное неполнение
Азотемия
Низкая концентрация не-трия в сыворотке
Мочевой пузырь наполняется с восстановлением кровяного давления
мочевого пузыря
Хилезный выпот Многократное дренирование
Отсутствие азотемии
Возможно уменьшение концентрации натрия в сыворотке
Нормельное наполнение мо-
Отсутствие езо-темии
Введение одного из этих препаратов
чевого пузыря
Рис. 8-4. Алгоритм дифференциальной диагностики гиперкалиемии и определения ее причин
деления электролитов в сыворотке крови зависят от тяжести проявлений заболевания в период тестирования. Типичные нарушения электролитного баланса у собак обычно имеют место на фоне тяжелого течения аддисоновой болезни. Но если
у той же собаки определение концентрации электролитов проводится непосредственно перед проявлением явного заболевания, оно дает нормальные результаты. Следует отметить, что у небольшого числа собак с первичной аддисоновой болезнью со-
ТАБЛИЦА 8-9. НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПАРАМЕТРЫ СЫВОРОТОК 23 СОБАК СО СПОНТАННЫМ ВТОРИЧНЫМ ГИПОКОРТИЦИЗМОМ
Параметр Нормальный диапазон Средняя величина Уменьшение в % Увеличение в % Диапазон
Концентрация натрия (мэкв/л) 142-155 135 34 0 122-150
Концентрация калия (мэкв/л) 4,1-5,1 5,1 0 4 4,9-5,7
Отношение концентраций натрия и калия >-27:1 26 43 0 24-28
Концентрация AM (мг/100 мл) 13-28 32 3 57 22-44
Концентрация глюкозы (мг/100 мл) 70-110 68 43 0 18-84
Избыточная гидратация
Гиперпротеинемия (синдром повышенной вязкости?)
Дегидратация
Опухоль
Гипонатриемия (концентрация Na* <140 мэкв/л)
Липемия в отсутствие других расстройств
Дегидратация
Гипергликемия и гликозурия
Артефакт?
Сахарный диабет
1. Правильный диагноз основного заболевания
2. Жидкостная терапия
1. Множественная миелома?
2. Другая опухоль
Повторное определение натрия натощак
Лечение по показаниям:
1. Введение инсулина
2. Введение жидкостей при необходимости
3. Коррекция ацидоза
4. Правильная диагностика основного заболевания
--------1________
Застойная сердечная недостаточность
Недостаточность функции печени
Нефротический синдром
Кашель Одышка Отек легкого
-альбумин +
-Холестерин ±
-Глюкоза +
-AM в крови ±
-асцит ±
-гипостенурия ±
^Холестерин 4-Сывороточный альбумин Протеинурия Отечность
^Отношение белка и креатинина в моче
Первичное желудочно-кишечное заболевание
Рвота
Диарея
Исключение заболевания других систем органов
Гиперкалиемия
'' AM в крови 4-глюкоза ±
Са ±
f эозинофилы ± удельный вес мочи <1,025
Почечная недостаточность 1. ТАМ в крови 2. i Креатинин 3. Изостенурия 4. ТФосфат
Биопсия или сканирование печени
Портосистемный анастомоз
Рвота?
Диарея?
Провокационная проба с АКТГ
Да
Коррекция нарушений содержания жидкостей и электролитов
Гипокортицизм
Да
Не-
Лечение по показаниям
Хирургическая операция
Лечение по показаниям
Рис. 8-5. Алгоритм дифференциальной диагностики
гипонатриемии и определения ее причин
1. Вернитесь к началу диаграммы
2. Первичное желудочно-кишечное заболевание?
3. Почечная недостаточность?
4. Печеночная недостаточность?
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 435
436 • ГИПСЖОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
храняется нормальная концентрация электролитов в сыворотке крови, а у отдельных животных с вторичной надпочечниковой недостаточностью развивается гипонатриемия.
Среди 483 собак с первичной недостаточностью функции коры надпочечников, составляющих рассматриваемую в данной главе группу, только 17 (4%) имели нормальную концентрацию электролитов ко времени установления диагноза (табл. 8-8). У 12 из этих 17 особей типичные нарушения баланса электролитов развились в период от нескольких недель до нескольких месяцев после начала глюкокортикоидной терапии (без сопутствующего введения минералокортикоидов). Это столь необычное явление - сохранение нормальной концентрации сывороточных электролитов у собак с гипокортицизмом, наблюдалось и другими исследователями (Rogers et al, 1991; Bartges, Nielson, 1992; Schaer, 1994; Peterson et al, 1996). Однако такая ситуация не распространяется на животных с вторичной атрофией коры надпочечников вследствие недостаточности гипофизарного АКТГ. Достоверность диагноза болезнь Аддисона у собак с нормальной концентрацией электролитов повышается при использовании результатов провокационной пробы с АКТГ. Главная трудность состоит в подтверждении возникшего на основании клинических наблюдений подозрения на наличие аддисоновой болезни и принятии решения о проведении этой пробы в тех случаях, когда результаты определения концентрации электролитов не дают оснований предполагать наличие гипокортицизма.
Недостаточность гипофизарного АКТГ (вторичная недостаточность функции коры надпочечников). В большинстве случаев нарушения концентрации электролитов в сыворотке крови обусловлены неадекватной секрецией минералокортикоидов. Клинический синдром, развивающийся у животных вследствие нарушения секреции гипофизарного АКТГ, отражает только недостаточность глюкокортикоидов. При гипокортизолемии развиваются характерные желудочно-кишечные, обменные и психические расстройства, отмечаемые как владельцами животных, так и ветеринарами; однако, эти изменения отсутствуют при гипоальдостеронизме.
При вторичной надпочечниковой недостаточности обычно не происходит уменьшения объема жидкости, дегидратации или изменения концентрации калия, так как АКТГ слабо влияет на секрецию альдостерона. Гипотензии также обычно не бывает, за исключением случаев острого заболевания. Гипонатриемия была документирована у 8 из 23 собак рассматриваемой группы и могла быть следствием задержки воды, анорексии, рвоты и/или диареи. Неспособность экскретировать воду после нагрузки ею не всегда сопровождается гиперкалиемией. Наиболее характерными клиническими проявлениями являются общая слабость, сонливость, анорексия и иногда рвота. Могут появиться боли в суставах,
мышцах и/или животе. Гипогликемия встречается нечасто (табл. 8-9). Возможны острая декомпенсация и шок.
Недостаточность АКТГ может быть следствием первичного поражения гипофиза (травма, инфекция, рак) либо развивается вторично после резкой отмены длительной кортикостероидной терапии (рис. 8-1). Животные с вторичной надпочечниковой недостаточностью клинически неотличимы от собак с первичной надпочечниковой недостаточностью, почечными или желудочно-кишечными заболеваниями. Только внимательное изучение анамнеза может навести ветеринара на мысль о возможной вторичной недостаточности функции коры надпочечников.
Гипокортицизм, вызванный терапией мито-таном (о,р’-ДДД).
Передозировка о,р’-ДДД при лечении гиперкортицизма (синдрома Кушинга) приводит к гипокор-тицизму. Возможно, это наиболее частая причина гипокортицизма у собак, с которой сталкиваются ветеринарные врачи. Клинические симптомы этого состояния включают депрессию, анорексию, рвоту и диарею, тогда как концентрация электролитов в сыворотке крови обычно (но не всегда) остается в норме. Пучковая и сетчатая зоны коры надпочечников, в которых синтезируется кортизол, более чувствительны к цитотоксическому действию о,р’-ДДД, чем клубочковая зона, в которой образуется альдостерон. Передозировка о,р’-ДДД может вызвать классическую «болезнь Аддисона» вследствие разрушения всех трех зон коры и привести к гипонатриемии и гиперкалиемии.
Дифференциальная диагностика гиперкалиемии (см. рис. 8-4). У собак и кошек следует различать гиперкалиемию, связанную с гипокортицизмом, от гиперкалиемии вненадпочечникового происхождения. Хотя острая терапия этого нарушения в обоих случаях одинакова (если не считать животных с непроходимостью мочевых путей, которую необходимо устранить), ветеринар должен убедиться в правильности диагноза, прежде чем назначать пожизненное лечение.
Болезни мочевых путей. Наиболее частыми причинами гиперкалиемии вненадпочечникового происхождения являются почечная недостаточность, окклюзия мочеиспускательного канала, его разрыв или разрыв мочевого пузыря. Эти нарушения препятствуют нормальной экскреции калия. Хроническая почечная недостаточность у собак и кошек редко приводит к гиперкалиемии, за исключением случаев анурии или олигурии. Тяжелая гиперкалиемия может быть вызвана разрывом мочевого пузыря и/или авульсией мочеточника. В обоих случаях происходит утечка мочи в брюшную полость, что нарушает экскрецию калия и мочевины, и в результате их концентрация значительно увеличивается (Roth, Tyler, 1999).
Желудочно-кишечное заболевание. Желудочно-кишечные расстройства также могут вызывать
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 437
нарушения баланса электролитов, характерные для аддисоновой болезни. Такое нарушение документировано у собак с паразитарными заболеваниями кишечника (трихоцефалезом и анкилостомозом) или кишечными инфекциями (сальмонеллезом), прободением язвы двенадцатиперстной кишки или заворотом желудка (DiBartola, 1989; DiBartola et al, 1985; Roth, Tyler, 1999). Сходные изменения концентрации электролитов в сыворотке крови были отмечены у некоторых щенков с парвовирусной инфекцией или чумой плотоядных. Гиперкалиемия в сочетании с гипонатриемией или без нее может быть следствием тяжелого синдрома пониженного всасывания. У собак с трихоцефалезом, гипонатриемией и гиперкалиемией концентрация альдостерона в плазме крови не понижается (Graves et al, 1994).
Ацидоз, панкреатит и/или травма. Быстрое высвобождение внутриклеточного калия и последующая гиперкалиемия могут быть результатом тяжелого ацидоза или усиленного разрушения тканей после хирургической операции, травмы с размозжением тканей или обширной инфекции. Реже причинами гиперкалиемии служат панкреатит, диабетический кетоацидоз и тромбоз аорты у кошек, а также острый некроз скелетных мышц после теплового удара или длительных физических нагрузок у кошек и собак. Эти расстройства могут сопровождаться также уменьшением почечной экскреции калия.
Плевральный выпот. В ряде случаев гиперкалиемия и гипонатриемия развиваются у собак с хилезным плевральным выпотом после повторного дренирования плевры (Willard et al, 1991). Сходные нарушения концентрации электролитов в сыворотке крови были выявлены у собак с несептическим нехилезным выпотом (Zenger, 1992). Частота таких нарушений, по-видимому, невелика, поскольку гиперкалиемия в сочетании с гипонатриемией была обнаружена только у двух из 17 собак с экспериментально индуцированным хилотораксом (Fossum,
Birchard, 1986; Willard et al, 1991). Гиперкалиемия и гипонатриемия могут быть следствием невозможности поступления натрия из почечного канальца в клетки дистального нефрона, что является причиной снижения всасывания натрия и последующей экскреции калия в почечные канальцы (Rose, 1984; Willard et al, 1991).
Другие заболевания. Низкое отношение концентрации натрия к концентрации калия в сыворотке крови, выявленное у собак с пиометрой, возможно, было следствием ацидоза, желудочно-кишечных расстройств и сильного обезвоживания. Описано развитие гиперкалиемии в сочетании с гипонатриемией у трех сук английской борзой на завершающей стадии беременности (Schaer et al, 2000), а также у трех собак с диссеминированой неоплазией, у двух животных с застойной сердечной недостаточностью и у одной собаки, отравившейся грибами (Roth, Tyler, 1999). Недостаточность функции печени может сопровождаться аналогичными изменениями концентрации электролитов, возможно, в результате нарушения функции ренин-ангиотензин-альдосте-роновой системы (Church, устное сообщение, 2000).
Ятрогенные факторы и/или медикаментозная терапия. Избыточное потребление калия редко приводит к гиперкалиемии, за исключением больных с почечной недостаточностью. Гиперкалиемия развивается также при чрезмерно повышенной концентрации калия в жидкостях для внутривенных вливаний, при использовании солевых заменителей и при парентеральном питании с применением растворов с высоким содержанием калия. Диуретики, сохраняющие калий в организме, ингибиторы анги-отензин-превращающего фермента и нестероидные противовоспалительные препараты также могут вызывать слабую гиперкалиемию (Willard, 1998). У людей гипотиреоз вызывает снижение почечного кровотока и скорости клубочковой фильтрации и индуцирует гипонатриемию (Baajafer et al, 1999).
ТАБЛИЦА 8-10. КОНЦЕНТРАЦИЯ ЭЛЕКТРОЛИТОВ В ЭРИТРОЦИТАХ, СВЕЖЕЙ И ХРАНИВШЕЙСЯ ПЛАЗМЕ КРОВИ*
Собака № Порода Возраст (годы) Пол Концентрация К" в эритроцитах (мэкв/л) Na+/K+ в плазме крови
Хранение 0 часов (мэкв/л) Хранение 24 часа (мэкв/л)
1 Акита 2,5 К 69 161/3,9 148/16,4
2 Акита 4 К 71 160/4,1 142/23,8
3 Акита 5 с 65 159/4,5 145/17,2
4 Акита 2 к 6.0 166/4,0 164/5,6
5 Акита 2 с 4.0 158/3,9 159/4,9
6 Акита 5 к 76 152/3,4 131/21,0
7 Акита 5 к 68 154/4,4 147/14,2
8 Акита 6 О/С 70 151/5,1 146/17,0
9 Японский тоса 2 с 5,0 154/4,0 152/4,2
10 Немецкая овчарка М 7 К/К 3,5 156/4,6 152/5,2
11 Спрингер-спаниель 9 О/С 3,5 151/3,9 152/4,4
12 Английский бульдог 9 к 4,5 152/4,0 152/5,3
13 Лабрадор-ретривер М 9 О/С 5,0 152/4,7 149/5,5
14 Кеесхонд 3 месяца с 5,5 145/4,4 147/5,6
Данные предоставлены Lisa Degen, DVM.
М - Метис, О/С- овариэктомированная сука, К/К- кастрированный кобель
438 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
Артефакты. Повышение концентрации калия в сыворотке in vitro происходит при гемолизе или замораживании проб крови, а также при задержке отделения эритроцитов от плазмы. Другой артефакт связан с тяжелой гипернатриемией, которая может быть причиной ложного увеличения концентрации калия при измерениях с использованием сухих реагентов (Ames, 1986). В качестве еще одной причины гиперкалиемии рассматривается гипертония (Willard, 1989). При чрезмерно высоком лейкоцитозе (более 100000 мм3) или тромбоцитозе (более 1000000 мм3) в процессе свертывания крови в сыворотку может высвобождаться достаточно большое количество калия, что приводит к получению ложно завышенных результатов. В этом случае концентрация калия в сыворотке нарастает in vitro по мере свертывания крови.
Артефакт: шпицы Акита. Эти собаки имеют необычно высокую концентрацию калия в эритроцитах. Так, в одном исследовании высокая концентрация калия в эритроцитах была обнаружена у 6 из 8 собак этой породы (табл. 8-10). Анализ их плазмы крови после ее хранения в холодильнике более 4 часов в контакте с эритроцитами дал картину ложной гиперкалиемии (Rich et al, 1986). По мере увеличения времени хранения плазмы в контакте с эритроцитами возрастала концентрация калия (ложная гиперкалиемия) и параллельно снижался уровень натрия в плазме.
Дифференциальная диагностика гипонатриемии (табл. 8-11 и рис. 8-5).
Спонтанные заболевания. Гипонатриемия ассоциируется не только с гипокортицизмом, но и с другими клиническими состояниями, такими как поражение почечных канальцев, нефротический синдром и постобтурационный диурез. Осмотический диурез, например, при сахарном диабете, также может вызвать потерю большого количества натрия с мочой. Гипергликемия приводит к обострению гипонатриемии, так как способствует переходу воды из внутриклеточного во внеклеточное пространство. Гипонатриемия может быть следствием недостаточного потребления натрия, особенно когда она сочетается с большими потерями этого элемента с мочой (Adrogue, Madias, 2000). Тяжелая гипонатриемия описана у собак с серьезными заболеваниями желудочно-кишечного тракта, приводящими к анорексии, рвоте и/или диарее. К числу таких заболеваний относятся язва желудка или двенадцатиперстной кишки, паразитарные или вирусные инфекции, а также любое расстройство, вызывающее геморрагический гастроэнтерит. Все они сопровождаются значительными потерями натрия.
Вторичная гипонатриемия может быть следствием нарушений, приводящих к отеку (в дополнение к нефротическому синдрому), в частности застойной сердечной недостаточности или микседемы при тяжелом гипотиреозе. Гипонатриемия ассоциируется
ТАБЛИЦА 8-11. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ТЯЖЕЛОЙ ГИПЕРКАЛИЕМИИ И/ИЛИ ГИПОНАТРИЕМИИ У СОБАК И КОШЕК*
I. Гипокортицизм
И. Заболевание почек и мочевого тракта
А. Первичная острая почечная недостаточность
Б. Хроническая тяжелая олигурическая или анурическая почечная недостаточность
В. Непроходимость мочеиспускательного канала продолжительностью более 24 часов
Г. Осмотический или индуцированный диуретиками диурез
Д. Истечение мочи в брюшную полость
III. Тяжелая недостаточность функции печени
А. Цирроз
Б. Неоплазия
IV. Тяжелое желудочно-кишечное заболевание, в том числе А. Паразитарная инфекция
1. Власоглавами
2. Аскаридами
3. Сальмонеллами
Б. Вирусный энтерит (парвовирусная инфекция)
В. Заворот желудка
Г. Прободение двенадцатиперстной кишки
V. Тяжелый метаболический или респираторный ацидоз, в том числе
А. Диабетический кетоацидоз
Б. Панкреатит
VI. Плевральный выпот
А. Специфический хилезный выпот?
Б. Вызван повторным дренированием?
VII. Застойная сердечная недостаточность (гипонатриемия)
А. Прогрессирующая
Б. Острая
VIII. Массированное повреждение ткани
А. Травма с размозжением тканей
Б. Обширная инфекция
В. Гемолиз
IX. Первичная полидипсия
X. Артефакты
А. Гиперкалиемия
1. Хранение крови и гемолиз (особенно у собак породы акита)
2. Избыточный лейкоцитоз или тромбоцитоз
3. Тяжелая гипернатриемия
Б. Гипонатриемия
1. Липемия
2. Рацион с низким содержанием солей в сочетании ________с повторной флеботомией_____________________ * Большинство перечисленных заболеваний (отличных от гипокортицизма) не связаны с нарушениями электролитного баланса, однако, такие нарушения были документированы.
также с первичным полидипсическим расстройством и с нарушением секреции АДГ (см. гл. 1).
Ятрогенные причины. Гипонатриемия может быть вызвана внутривенной инфузией чрезмерно больших объемов жидкости, содержащей неадекватные количества натрия, применением препаратов, индуцирующих осмотический диурез (например, глюкозы) или частым повторным дренированием плеврального выпота. Сообщалось о тяжелой гипонатриемии (120 мэкв/л) у собаки, перенесшей четырнадцать ежедневных флеботомий
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 439
подряд (примерно по 15 мл/кг/день) при содержании на рационе с низким содержанием соли (Tyler et al, 1987).
Липемия. Липемия может приводить к ложному понижению концентрации натрия в плазме крови вследствие вытеснения большого объема водной фазы, в которой находится ионизированный натрий. При анализе липемической плазмы получают лишь небольшое количество водной фазы, что приводит к занижению результатов определения натрия. При пересчете концентрации натрия на объем водной фазы, а не цельной плазмы, обычно получают нормальный результат. В связи с этим при липемии целесообразно определять концентрацию натрия в сыворотке, а не в плазме крови.
Выводы. Определение профиля электролитов в сыворотке крови имеет важнейшее диагностическое значение при подозрении на гипокортицизм у собак. Результаты такого определения можно использовать для подтверждения предварительного диагноза и особенно для коррекции терапии. В то же время, эти данные сами по себе не позволяют поставить окончательный диагноз гипокортицизма (см. табл. 8-11). Это возможно только на основании определения концентрации кортикостероидов и оценки функционального резерва коры надпочечников. Алгоритмы дифференциальной диагностики при гипонатриемии и гиперкалиемии приведены в табл. 8-11, на рисунках 8-4 и 8-5.
Содержание азота мочевины и креатинина в крови, анализ мочи
Азот мочевины (AM) в крови. Снижение перфузии почек является непосредственным результатом гиповолемии, которая, в свою очередь, вызывает гипотензию и уменьшает минутный объем сердца. Эти нарушения обусловлены хроническим выведением повышенных количеств жидкости через почки при натриевом диурезе, острой потерей жидкости при рвоте и диарее, а также вследствие пониженного потребления натрия с пищей. У собак с вторичным гипокортицизмом в результате уменьшения перфузии почек и сопутствующего снижения скорости клубочковой фильтрации развивается преренальная азотемия. Концентрация AM в крови может увеличиваться также вследствие желудочно-кишечного кровотечения, которое нередко имеет место при аддисоновой болезни. При желудочно-кишечной геморрагии усиливается продукция аммиака в толстом кишечнике; он всасывается в портальной системе и превращается в мочевину в печени. Концентрация AM у собак с гипокортицизмом чрезвычайно вариабельна и может превышать 200 мг/100 мл.
При первоначальном обследовании 483 собак с первичным гипокортицизм азотемия была выявлена у 435 особей (90%). Среди 23 собак с вторичной недостаточностью функции коры надпочечников концентрация AM в крови на момент установле
ния диагноза была повышена у 13 (57%) (см. табл. 8-8 и 8-9). После регидратации и восстановления адекватного объема крови концентрация AM должна нормализоваться. Однако быстрая нормализация происходит не всегда, что может указывать на неадекватную инфузионную терапию, первичную недостаточность функции почек или их поражение, вызванное пониженной перфузией на протяжении длительного периода с последующей почечной ишемией (см. табл. 8-8).
Креатинин в сыворотке крови. Концентрация креатинина в сыворотке крови при гипокортицизме нарушается реже, чем концентрация AM, а если и повышается, то не так сильно. Одним из объяснений такого различия является желудочно-кишечное кровотечение, часто наблюдаемое при аддисоновой болезни. Это кровотечение поставляет субстрат для продукции аммиака, который затем всасывается в портальную циркуляцию и превращается в мочевину в печени. По этой причине концентрация AM в крови выше той, которую можно было бы предвидеть на основании концентрации креатинина в сыворотке. Среди 506 собак 90% на момент установления диагноза имели азотемию, но концентрация креатинина была повышена только у 61%. Кроме того, средняя концентрация AM, составлявшая 81 мг/100 мл, почти на 300% превышала верхнюю границу нормы. В то же время средняя концентрация креатинина равнялась 3,1 мг/100 мл и лишь примерно на 50% превышала максимальную нормальную величину. Важно проводить определения уровня AM и креатинина в крови в сочетании с анализом мочи.
Анализ мочи. У собак с ненарушенной функцией почек, а также при наличии преренальной уремии вследствие дегидратации и уменьшения минутного объема сердца удельный вес мочи должен превышать 1,030. У животных с первичной недостаточностью почечной функции удельный вес мочи остается на изостенурическом уровне или приближается к нему (от 1,008 до 1,020). Однако у большинства собак с гипокортицизмом способность концентрировать мочу снижена, так как хроническая потеря натрия с мочой вызывает уменьшение его содержания в медуллярном слое почек. Одновременно нарушаются нормальный градиент концентрации в мозговом веществе и всасывание воды в собирательных почечных канальцах. В результате у некоторых собак с гипокортицизмом и преренальной азотемией удельный вес мочи такой же, как у животных с первичной почечной недостаточностью (1,008-1,020) (см. табл. 8-8). Среди 506 собак, включенных в данный анализ, 88% на момент установления диагноза имели мочу с удельным весом ниже 1,030; у 90% этих животных установлена сопутствующая азотемия. Таким образом, сочетание повышенной концентрации AM в крови и изостенурии у больного животного ставит диагностическую дилемму. Не забывая об аддисоновой болезни, следует постоянно помнить, что подтвердить или исключить ее можно только с помощью определения концентрации кортизола
440 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
в плазме крови, потому что «база данных» у собак с почечной и надпочечниковой недостаточностью имеет определенное сходство.
Параметры почечной функции и реакция на терапию. Повышенные концентрации AM и креатинина в сыворотке крови у собак, которые по наблюдениям их хозяев имеют клинические проявления, соответствующие гипокортицизму или почечной недостаточности, могут дезориентировать ветеринара и поставить его в трудное положение. Ситуация еще более осложняется, если и у ветеринара есть основания подозревать гипокортицизм, а назначение агрессивной инфузионной терапии не приводит к быстрому (в течение 12-24 часов) снижению уровня AM и креатинина. Известно, что у большинства собак с гипокортицизмом концентрация AM в крови быстро нормализуется. Однако у отдельных животных имеет место поражение почек, вызванное их слабой перфузией или гипоксией вследствие первичного заболевания, и такое поражение может разрешаться очень медленно. Некоторые собаки одновременно страдают гипокортицизмом и почечным заболеванием, что служит еще одним объяснением увеличения концентраций AM и креатинина, которые не понижаются даже под воздействием агрессивной инфузионной терапии.
Неспособность собак с гипокортицизмом усиливать продукцию мочи в условиях агрессивной инфузионной терапии случается нечасто и должна насторожить ветеринара. Большинство таких животных на самом деле страдают полиурией. Олигурия или анурия, по всей вероятности, являются следствием сильного обезвоживания, гипотензии и критического снижения перфузии почек. Восстановление объема внеклеточной жидкости до нормального уровня приводит к усилению перфузии и продукции мочи. Тем не менее, при анурии или олигурии возможны сопутствующие заболевания почек и сердца. У других собак имеет место задержка диуреза до нормализации кровяного давления, поддерживаемого с помощью инфузионной терапии. Измерение непрямого венозного давления, прямого артериального давления и центрального венозного давления помогает понять причины олигурии и анурии. Олигурия в сочетании с низким центральным венозным давлением или гипотензией свидетельствует о низкой эффективности инфузионной терапии и сохранении слабой перфузии почек. В то же время наличие олигурии или анурии на фоне повышенного центрального венозного давления или гипертензии служит показателем введения избыточного количества жидкости. В этом случае следует подозревать первичное нарушение почечной или сердечной функции.
Концентрация глюкозы в сыворотке крови (гипогликемия)
Патофизиология. Глюкокортикоиды усиливают продукцию глюкагона и глюкозы в печени и
одновременно понижают включение и утилизацию глюкозы в периферических тканях (Tyrrell et al, 1991). При недостаточности глюкокортикоидов образование глюкозы в печени снижается, но повышается чувствительность рецепторов инсулина в периферических клетках. Взятые вместе, эти факторы обусловливают предрасположенность животных с гипокортицизмом к развитию гипогликемии. При аддисоновой болезни у человека гипогликемия у детей встречается чаще, чем у взрослых, и ассоциируется с голоданием, повышенной температурой, инфекцией, тошнотой и/или рвотой (Tyrrell et al, 1991). Соответствующее снижение секреции инсулина в ответ на низкую концентрацию сахара в крови и возобновление приема пищи позволяют уменьшить тяжесть гипогликемии.
Частота встречаемости. Гипогликемия (концентрация глюкозы в крови ниже 70 мг/100мл) была выявлена у 106 (22%) из 483 собак с первичным гипокортицизмом и у 10 (43%) из 23 собак с вторичным гипокортицизмом (см. табл. 8-8 и 8-9). Гипогликемические судороги наблюдались редко и были зарегистрированы владельцами собак и ветеринарами только у 14 из 506 животных. У 16 собак имелись другие клинические проявления (например, атаксия и нарушение ориентации), которые могли быть вызваны гипогликемией. У 40 собак на момент установления диагноза концентрация глюкозы в крови была выше 200 мг/100 мл вследствие сопутствующего сахарного диабета.
Дифференциальная диагностика. Гипогликемия всегда затрудняет диагностику. В то же время, при подтвержденных случаях этого расстройства процедура дифференциальной диагностики занимает относительно немного времени (табл. 8-12, см. также гл. 4). У взрослых животных низкий уровень глюкозы в крови может быть вызван разными причинами: сепсисом, гепатопатией, инсулин-сек-ретирующей опухолью, неэндокринной опухолью (например, опухолью печени, лейомиомой либо лейомиосаркомой), гипокортицизмом или передозировкой инсулина (Bennish et al, 1990; Walters, Drobatz, 1992; Levy, 1994; Beaudry et al, 1995; Thompson et al, 1995; Bagley et al, 1996). Концентрацию глюкозы в крови следует измерять у всех собак с установленной недостаточностью функции коры надпочечников или с подозрением на нее. Сразу после выявления гипогликемии собаке необходимо ввести 2,5-5%-ный раствор декстрозы, который обычно готовят, добавляя требуемое количество 50%-ной декстрозы в рингеровский или обычный физиологический раствор. Как правило, концентрация сахара в крови нормализуется через 24-48 часов после начала глюкокортикоидной терапии.
Концентрация кальция в сыворотке крови (гиперкальциемия)
Патофизиология. До сих пор нет убедительного физиологического объяснения возникновения ги-
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
441
ТАБЛИЦА 8-12. КЛАССИФИКАЦИЯ ГИПОГЛИКЕМИИ НАТОЩАК
I. Эндокринная
А. Избыток инсулина или инсулиноподобных факторов
1. Инсулин-продуцирующие опухоли островковых клеток
2. Внепанкреатические опухоли, продуцирующие и секретирующие инсулиноподобные соединения
3. Ятрогенная - передозировка инсулина
Б. Недостаточность гормона роста
1. Гипопитуитаризм, сопровождающийся недостаточностью нескольких тропных гормонов (например, АКТГ и гормона роста)
2. Изолированная недостаточность гормона роста
В. Недостаточность кортизола
1. Гипокортицизм
2. Гипопитуитаризм
3. Изолированная недостаточность АКТГ
II. Гепатическая
А. Врожденная
1. Сосудистые анастомозы
2. Гликогеновая болезнь
Б. Приобретенная
1. Шунтирование сосудов
2. Хронический фиброз (цирроз)
3. Некроз печени, вызванный токсинами или возбудителями инфекций
4. Инфильтративное заболевание (неоплазия)
III. Субстратная
А. Внепанкреатические опухоли, утилизирующие большое количество глюкозы Б. Гипогликемия щенков
В. Инфекция
1. Тяжелый сепсис
2. Тяжелый лейкоцитоз
Г. Уремия
Д. Желудочно-кишечная
1. Голодание вследствие паразитарной инфекции, нарушения всасывания и т.п.
2. Нарушение пищеварения
Е. Тяжелая полицитемия
IV. Прочее
А. Артефакты: образцы крови хранились с эритроцитами Б. Тяжелая почечная гликозурия
В. Применение лекарственных средств (салицилатов, этанола, сульфонилмочевинных препаратов)
перкальциемии, которая иногда отмечается у собак с аддисоновой болезнью. Установлена выраженная, но не полная корреляция между гиперкалиемией и гиперкальциемией у собак со спонтанно развившимся заболеванием, а также у животных, перенесших адреналэктомию или после передозировки о,р’-ДДД. Иными словами, существует взаимосвязь между тяжестью гипокортицизма, дегидратацией, гиперкалиемией и наличием гиперкальциемии. Возможными механизмами развития гиперкальциемии могут служить накопление в крови связывающих кальций белков, повышение их сродства к кальцию, уменьшение почечного клиренса и усиление мобилизации кальция в результате активации остеоци-тов (Montoll et al, 1992; Peterson et al, 1996).
Уровень кальция быстро снижается после введения глюкокортикоидов, что предполагает связь между гиперкальциемией и глюкокортикоидной
недостаточностью. В больших дозах глюкокортикоиды подавляют всасывание кальция в кишечнике, действуя как антагонисты витамина Д. Таким образом, недостаточность кортизола может приводить к усилению всасывания кальция в кишечнике и, следовательно, к гиперкальциемии. Тем не менее, наблюдения за адреналэктомированными собаками, получавшими корм с высоким или низким содержанием кальция, не выявили существенной разницы в тяжести гиперкальциемии (Feldman, Nelson, 1987).
Повышенная активность паращитовидных желез, вероятно, не играет важной роли в этиологии гиперкальциемии, поскольку их удаление не предотвращает возникновения этого расстройства у адреналэктомированных собак. Гиперпротеинемия вследствие дегидратации и гемоконцентрации, по-видимому, также не является этиологическим фактором. При гиперкальциемии у животных увеличивается концентрация как свободных ионов кальция, так и неионного кальция, связанного с сывороточными белками. Кроме того, не удалось установить корреляцию между концентрациями общего кальция и общего белка или альбумина в крови собак с гипокортицизмом (Peterson, Feldman, 1982).
Одной из вероятных причин гиперкальциемии при надпочечниковой недостаточности может быть уменьшение почечной экскреции кальция. Для адреналэктомированных собак характерно избыточное всасывание кальция в почечных канальцах, что подтверждается устойчивым понижением его концентрации в моче несмотря на гиперкальциемию. У людей с недостаточностью функции коры надпочечников всасывание кальция в почечных канальцах также повышено на фоне нарушения его экскреции с мочой (Tyrrell et al, 1991). Наконец, введение экзогенного кортизона приводит к снижению концентрации кальция в плазме крови благодаря усилению его выведения с мочой.
Дифференциальная диагностика. Важно помнить о существовании взаимосвязи между гипер-
ТАБЛИЦА 8-13.ДИФФЕРЕНЦИАЛБНАЯ ДИАГНОСТИКА ГИПЕРКАЛЬЦИЕМИИ
Молодые растущие животные
Первичная почечная недостаточность Лимфосаркома
Опухоли апокриновой железы (анального мешка)
Некоторые злокачественные опухоли, метастазирующие в кости
Опухоли молочных желез
Множественная миелома
Первичный гиперпаратиреоз
Аденома
Карцинома
Различные карциномы (редкие)
Тиреоидная
Вагинальная
Легочная
Печеночная
Гипокортицизм
Гипервитаминоз Д (ятрогенный) Липемия
442 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
кальциемией и недостаточностью функции коры надпочечников, поскольку многие клинические проявления последней (рвота, потеря веса, анорексия, дегидратация, полидипсия и полиурия) сходны с таковыми при гиперкальциемии иного происхождения, включая гиперкальциемию, обусловленную злокачественными новообразованиями, первичным гиперпаратиреозом и почечными заболеваниями (табл. 8-13). Вероятность недостаточности коры надпочечников следует принимать во внимание во всех случаях дифференциальной диагностики гиперкальциемии, особенно когда имеет место нарушение концентрации других сывороточных электролитов, характерное для гипокортицизма.
Частота встречаемости. Среди 483 обследованных собак с первичным гипокортицизмом гиперкальциемия ко времени первичного обследования имелась у 142 (29%) животных (см. табл. 8-8). Чаще всего гиперкальциемия развивается у животных с тяжелыми формами надпочечниковой недостаточности, причем ее уровень обычно (хотя и не всегда) пропорционален степени дегидратации и изменения концентрации других сывороточных электролитов. В исследовании, проводившемся на 40 собаках с гиперкальциемией, было установлено, что аддисонова болезнь являлась второй по значимости причиной этого расстройства и обусловливала 25% случаев (Elliot et al, 1991; Heritage, 1998). В группе обследованных нами собак с гипокортицизмом частота гиперкальциемии была ниже, чем у животных с лимфосаркомой, хронической недостаточностью почечной функции или первичным гиперпаратиреозом, но, тем не менее, оставалась достаточно высокой.
Кислотно-щелочной статус
Патофизиология. Гипоальдостеронизм приводит к уменьшению секреции водородных ионов в почечных канальцах (Nelson, 1980). Это нарушение в сочетании с гипотензией и слабой перфузией тканей, по всей вероятности, служит причиной слабого ацидоза, регистрируемого у многих собак, страдающих приступами гипокортицизма. Кислотно-щелочной статус определяют путем измерения концентрации газов в артериальной крови и общей двуокиси углерода в венозной крови. Ацидоз, выявляемый при гипокортицизме, редко требует специального лечения. Перфузия почек нормализуется посредством введения соответствующего количества жидкости и заместительной минералокортикоидной терапии, что, в свою очередь, приводит к усилению экскреции водородных ионов с мочой. Обычно это устраняет необходимость парентерального введения бикарбоната.
Частота встречаемости. Слабый или умеренный метаболический ацидоз является частым осложнением гипокортицизма у собак. Примерно у половины наших 506 собак с гипокортицизмом концентрация бикарбоната в сыворотке крови была
ниже 17 мэкв/л (см. табл. 8-8). У большинства животных ацидоз был выражен относительно слабо, а концентрация бикарбоната колебалась от 13 до 17 мэкв/л. Менее чем у 10% собак был тяжелый ацидоз с концентрацией бикарбоната в сыворотке от 9 до 12 мэкв/л, что требовало заместительного введения бикарбоната.
Лечение. При невозможности оценить кислотно-щелочной баланс у собак с недостаточностью функции коры надпочечников назначать терапию бикарбонатом не рекомендуется. Если концентрация бикарбоната в сыворотке крови составляет 12 мэкв/л или меньше, в инфузионную жидкость добавляют четверть расчетного количества недостающего бикарбоната и производят ее вливание на протяжении шести часов. После этого повторно определяют концентрацию бикарбоната в сыворотке. Если она остается на уровне 12 мэкв/л или ниже, пересчитывают требуемое количество бикарбоната и снова вводят его четвертую часть на протяжении 6 часов. Мы используем эту схему для лечения диабетического кетоацидоза, однако она эффективна и в случаях ацидоза у животных с недостаточностью функции коры надпочечников (более подробно дозировки бикарбоната рассматриваются в гл. 13).
Кровяное давление
Приблизительно 90% людей с нелеченым гипокортицизмом имеют гипотензию, которая может вызывать ортостатическую симптоматику и/или обморок. При тяжелом хроническом заболевании или при остром кризе практически всегда в положении лежа отмечаются гипотензия или шок (Tyrrell et al, 1991). В настоящее время ветеринария находится на пороге внедрения измерения кровяного давления у собак и кошек в повседневную практику. Основным препятствием на этом пути в течение десятилетий оставалось отсутствие надежного, недорогого и простого в обращении оборудования, пригодного для проведения измерений у собак и кошек (причем одна из главных трудностей заключалась в очень разных размерах этих животных). Нет сомнения, что у собак и кошек с гипокортицизмом обычно развивается гипотензия и что во время «криза» она создает угрозу жизни животного. Мы наблюдали гипотензию у собак с тяжелой аддисоновой болезнью при поступлении в нашу клинику, а также у некоторых животных после начала поддерживающей терапии. Гипотензия всегда обусловлена неадекватной заместительной терапией минералокортикоидами и иногда неадекватной глюкокортикоидной терапией.
Функция печени: содержание альбумина, холестерина, азота мочевины и глюкозы в крови
Общие сведения. У некоторых собак с тяжелыми заболеваниями почек или органов желудочно-
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 443
ТАБЛИЦА 8-14. ПЕРЕКРЫВАЮЩИЕСЯ КЛИНИЧЕСКИЕ И ЛАБОРАТОРНЫЕ ДАННЫЕ: ГИПОКОРТИЦИЗМ В СРАВНЕНИИ С ДРУГИМИ ЗАБОЛЕВАНИЯМИ
1. Почечное заболевание
А. Уменьшение веса тела, плохой аппетит, рвота, диарея Б. Увеличение концентрации AM и креатинина в крови, ацидоз, низкое содержание альбумина
В. Удельный вес мочи 1,008-1,020 (в период заболевания) Г. Реакция на внутривенное введение жидкостей
2. Желудочно-кишечное заболевание
А. Потеря веса, плохой аппетит, рвота, диарея
Б. Пониженная концентрация альбумина в сыворотке крови
В. Нарушение биохимических показателей сыворотки, корректируемое внутривенной инфузией жидкости Г. Аномальные результаты биопсии
3. Заболевание печени
А. Потеря веса, плохой аппетит, рвота, диарея
Б. Пониженные концентрации альбумина, холестерина, глюкозы и, возможно, AM в крови
В. Маленький размер печени по данным ультразвукового или рентгенологического исследований
Г. Нарушение активности ферментов печени ± аномальные результаты функциональных проб Д. Асциты (редко)
Е. Аномальные результаты биопсии печени
кишечного тракта в анамнезе, при физикальном и/или клинико-патологическом исследовании выявляются нарушения, характерные для гипокортицизма и наоборот (табл. 8-14). Это обстоятельство значительно затрудняет диагностику, тем более что почечные и желудочно-кишечные расстройства у собак встречаются относительно чаще, чем гипокортицизм. Сложности возникают также в тех случаях, когда у животных с гипокортицизмом при клинико-патологическом, рентгенологическом или ультразвуковом исследовании обнаруживаются нарушения, предполагающие наличие гепатопатии.
Результаты тестирования функции печени
Критерии. Для идентификации собак с тяжелой гепатопатией ветеринарные врачи используют пять главных критериев, помимо определения активности печеночных ферментов. Эти критерии включают гипоальбуминемию (< 2,8 г/100 мл), гипохолесте-ринемию (<140 мг/100 мл), гипогликемию (< 70 мг/100 мл), низкую концентрацию AM в крови (<13 мг/100 мл) и малые размеры печени или микроге-патию, которая субъективно диагностируется при рентгенологическом или ультразвуковом исследовании.
Результаты. Анализ данных, полученных при обследовании 205 собак нашей группы с гипокортицизмом, показал, что клиническое состояние 44 (21%) животных соответствовало двум или более из вышеперечисленных критериев нарушения функции печени (см. табл. 8-14). Тридцать шесть собак имели гипоальбуминемию (средний уровень 2,1
мг/100 мл, диапазон от 1,4 до 2,5 мг/100 мл), у 35 выявлена гипохолестеринемия (средний уровень 111 мг/100 мл, диапазон от 72 до 125 мг/100мл), у 9 - гипогликемия (средний уровень 28 мг/100 мл, диапазон от 11 до 44 мг/100мл), у 7 - пониженная концентрация AM в крови (средний уровень
10 мг/100 мл, диапазон от 7 до 12 мг/100 мл) и у 37 имелась микрогепатия. У многих из этих животных была повышена активность печеночных ферментов в сыворотке крови - аланинаминотрансферазы (АЛТ) и/или щелочной фосфатазы (ЩФ). У четырех собак зарегистрировано нарушение концентрации желчных кислот натощак и после кормления, а еще у четырех получены аномальные результаты в тесте толерантности к аммиаку. У девяти собак была проведена биопсия печени, которая выявила неспецифический (лимфоцитарный/ плазмацитарный) гепатит у шести из них и фиброз у трех. О сходных нарушениях (микрогепатии и/ или пониженной концентрации сывороточного альбумина) сообщают и другие авторы (van den Broek, 1992; Levy, 1994; Hardy, 1995; Langlais-Burgess et al, 1995).
Интерпретация результатов. Как указывалось выше, опасность развития гипогликемии существует у всех собак с гипокортицизмом, поскольку при недостаточности глюкокортикоидов понижается мобилизация глюкозы из печени. Точно также нарушение активности печеночных ферментов считается весьма вероятным следствием любого гиповолемического или гипотензивного состояния, приводящего к тканевой гипоксии. Труднее объяснить возникновение четырех других расстройств, сопровождающих гипокортицизм у собак (снижение концентраций альбумина, холестерина и AM, а также уменьшение размеров печени). Гипо-альбуминемия может быть вызвана потерями крови через желудочно-кишечный тракт, энтеропатией, приводящей к потере белка, нарушением ассимиляции или гепатопатией.
Сочетание нарушений функции печени и коры надпочечников может объясняться иммунной атакой на оба органа. Аутоиммунная болезнь Аддисона у людей нередко сопровождается другими нарушениями иммунной системы (в частности, полиглан-дулярным аутоиммунным (ПГА) синдромом); возможен также хронический гепатит (Bethune, 1989). Последнее наблюдение подтверждается обнаружением неспецифического гепатита у некоторых собак нашей группы с гипокортицизмом; более того, фиброз, выявленный у трех животных, мог быть конечным результатом хронического гепатита. С другой стороны, заболевание печени может быть следствием хронической, субклинической надпочечниковой недостаточности и связанными с нею гипотензии, нарушением тканевой перфузии и/или глюкокортикоидной и минералокортикоидной недостаточности. У некоторых собак недостаточность функции печени представляет собой самостоятельное заболевание. Независимо от причины
444 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
патологии, ветеринар должен всегда иметь в виду потенциальную взаимосвязь между надпочечниковой недостаточностью и гепатопатией у отдельных животных.
У 24 из 36 собак с гипокортицизмом, сопровождавшимся глюкокортикоидной недостаточностью (18 из 205 наших собак и еще 18 из недавно опубликованного исследования), была установлена пониженная концентрация холестерина в крови (Lifton et al, 1996). Было предположено, что это нарушение вызвано уменьшением всасывания жира в отсутствие действия глюкокортикоидов. Известно также, что АКТГ увеличивает концентрацию свободного холестерина благодаря усилению активности холестеролэстеры с одновременным подавлением холестерилсинтетазы (Tyrrell et al, 1991). При понижении концентрации АКТГ, типичном для вторичного гипокортицизма, может возникнуть гипохолестеринемия. Из указанных выше 36 собак 21 имела пониженную концентрацию альбумина в сыворотке крови, 11 - гипогликемию, а у 15 была снижена концентрация общего сывороточного белка. Концентрация AM в крови была снижена только у 5 животных.
Лечение. Собаки нашей группы с нарушениями функции печени получали лечение исключительно с целью коррекции гипокортицизма. Специфическая терапия гепатопатии не проводилась. При повторном обследовании этих животных было отмечено улучшение всех клинических показателей, характеризующих течение аддисоновой болезни и гепатопатии. Первоначальная терапия неизменно включала заместительное введение глюкокортикоидов, поэтому можно предположить, что именно они оказывали благотворное действие на функцию печени. Отдаленные наблюдения за собаками с заболеванием обоих органов не выявили существенных отличий их состояния по сравнению с животными, у которых гипокортицизм не сопровождался нарушениями печеночной функции.
РЕНТГЕНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Микрокардия
У собак с гипокортицизмом и тяжелой гиповолемией латеральная рентгенография грудной клетки нередко выявляет микрокардию, сплющивание и уменьшение диаметра нисходящей аорты и сужение задней полой вены (рис. 8-6). Сходная рентгенологическая картина получена у некоторых собак с менее выраженной симптоматикой, ограничивающейся, например, общей слабостью, депрессивным состоянием и сонливостью. Наличие таких расстройств подтверждает предварительный диагноз надпочечниковой недостаточности; они были выявлены примерно у 25-35% собак с гипокортицизмом (Peterson et al, 1996). Следует, однако, помнить, что уменьшение размеров сердца является ничем иным как общим признаком гиповолемии и шока. Необ
ходимо также с осторожностью интерпретировать результаты латеральной рентгенографии, полученные при обследовании собак с глубокой грудной клеткой, таких как ирландский волкодав или борзые. Нередко у собак этих пород длина сердца недостаточно велика для его контакта с грудиной.
Увеличение размеров пищевода
В одном из исследований, включавшем 225 собак с гипокортицизмом, была выявлена единственная особь с увеличенными размерами пищевода (Peterson et al, 1996). Среди обследованных нами 205 животных с гипокортицизмом было семь особей с расширением пищевода. В настоящее время неизвестно, почему у некоторых собак с аддисоновой болезнью увеличиваются размеры этого органа. Было высказано предположение, что это нарушение может быть результатом действия аномальных концентраций натрия и калия в крови на мембранный потенциал клеток и функцию нейромышечного аппарата (Burrows, 1987). У всех наших собак с гипокортицизмом и расширением пищевода размеры последнего возвращались к норме после глюкокортикоидной терапии. В то же время сообщалось о двух собаках с гипокортицизмом и увеличенными размерами пищевода, у которых не было никаких отклонений в концентрации электролитов в сыворотке крови (Bartges, Nielson, 1992; Whitley, 1995). При обследовании собак с вторичным гипокортицизмом у четырех из 11 особей рентгенограммы грудной клетки свидетельствовали об увеличении размеров пищевода (Lifton et al, 1996). Однако ни у одной из 18 собак нашей группы с вторичным гипокортицизмом пищевод не был увеличен. Предполагается, что причиной расширения пищевода является недостаточность кортизола и связанная с нею мышечная слабость, поскольку глюкокортикоидная терапия приводит к нормализации размеров данного органа.
ЭЛЕКТРОКАРДИОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ
Физиология гиперкалиемии и деятельность сердца
При умеренной гиперкалиемии (концентрация калия в крови от 5,7 до 6,5 мэкв/л) отмечается небольшое и преходящее усиление электрической проводимости сердечной мышцы. Однако в случае увеличения концентрации калия (К+) выше этого уровня проводимость сердечной мышцы падает. Анализ электрокардиограмм (ЭКГ) иногда выявляет «заострение» Т-зубцов на фоне умеренного увеличения концентрации калия в сыворотке крови. Кроме того, при повышении концентрации К+ до 6,5-7,5 мэкв/л удлиняется P-R интервал. Зубец Р в конце концов исчезает, когда уровень гиперкалиемии превышает 7,5-8,0 мэкв/л. При таких концен-
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
445
Рис. 8-6. А. Рентгенограммы трехлетнего родезийского рнджбека, доставленного в клинику в шоковом состоянии вследствие гипокортипизма. Обратите внимание на маленькие размеры сердца на обоих снимках и слабую васкуляризацию легких в результате его недостаточной работы. Кроме того, у этой собаки произошло некоторое уплощение грудной аорты вследствие гиповолемии и недостаточной сердечной деятельности. Б. Поперечный вид грудной клетки у 5-летней собаки с гипокортицизмом и микрокардией, уплощенной полой веной и расширенным и заполненным воздухом пищеводом. Расширение пищевода, редко встречающееся при гипокортицизме. возможно, отражает мышечную слабость вследствие тяжелой гиперкалиемии и носит обратимый характер при а декватной гормональной терапии основного заболевания.
трациях калия происходит расширение комплекса QRS и нарушается регулярность R- R интервалов. На этой стадии может появиться «синусно-желудочковая» проводимость.
Последовательные изменения в проводящей системе миокарда по мере увеличения концентрации калия в сыворотке крови до 7,5-8,0 мэкв/л включают задержку проводимости в предсердно-желудочковом узле с последующим ускорением проведения импульса водителями ритма, задержку проводимости в системе Гиса-Пуркинье и задержку сокращения желудочковой мышцы. По мере продолжающегося нарастания концентрации калия в крови развивается асистолия и наступает остановка сер ща. Результаты регистрации ЭКГ
пучка Гисса и его ветвей свидетельствуют о том. что асистолия чаще всего является следствием блокады дистальной проводящей системы. Периферическая ЭКГ выявляет регулярные или нерегулярные ритмы на фоне расширенных комплексов QRS. Несмотря на то, что морфология комплексов QRS предполагает аритмии желудочкового происхождения, было установлено, что на самом деле нарушение ритмов происходит на уровне синусов и узлов. Поскольку гиперкалиемия редко встречается как изолированное расстройство, следует принимать во внимание, что ее эффекты могут модулироваться сопутствующими нарушениями электролитного баланса, в первую очередь, изменениями концентрации натрия и кальция.
446 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
Рнс. 8-7. Серийные сегменты ЭКГ, полученных у двух собак с гипокортицизмом и гиперкалиемией. Сегменты А и \А иллюстрируют воздействие тяжелой гиперкалиемии (концентрация калия в сыворотке крови у первой собаки 8,6 мэкв/л, а у второй 9,4 мэкв л). Обратите внимание на отсутствие видимых Р-зубцов, короткие и широкие комплексы QRS и на отсутствие чрезмерного увеличения амплитуды Т-зубцов. На ЭКГ А виден также необычного вида QRS комплекс, следующий за комплексом QRS более традиционной формы. Этот необычный комплекс отражает запаздывание желудочковой экстрасистолы, которое может быть следствием гипоксии и или гиперкалиемии. Сегменты Б и ББ ЭКГ получены у тех же собак, что и сегменты А и АА, соответственно, и были сняты приблизительно через 1 час после начала внутривенною введения нормального физиологического раствора в качестве единственного терапевтического средства. Концентрация ка 1ия в сыворотке уменьшилась соответст венно до 7,6 и 7,9 мэкв/л. Следует отметить два важных обстоятельства: (1) в обоих случаях имело место улучшение электрокардиограммы с восстановлением зубцов Р, увеличением частоты сердечных сокращений и исчезновением запаздывания желудочковых экстрасистол и (2) сохранялись отдельные нарушения, в первую очередь, удлинение P-R интервалов (блокада сердца первой степени), которое свидетельствует о наличии г иперкалисмии как само по себе, так и особенно в сочетании с расширением компзскса QRS и сокращением Q-T интервала. Имеется множество других причин продления Р - R интервалов. Сегменты В и ВВ отражают значительное снижение концентрации калия, соответственно до 6,2 и 5,0 мэкв л. Интервал P-R и зубцы Р, комплекс QRS и зубцы Л уменьшаются, R-зубцы становятся выше. Г. ЭКГ той же собаки, что и ЭКГ А. Концентрация калия в сыворотке крови 5,6 мэкв/л и видно заострение зубца Т. (Из: Feldman ЕС: In Ettinger SJ (cd): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1664).
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 447
Применение электрокардиографии
ОБЩИЕ СВЕДЕНИЯ. Гиперкалиемия обычно сопровождается выраженными изменениями на ЭКГ (рис. 8-7). Действительно, характер ЭКГ отражает наиболее существенные проявления гиперкалиемии, которые имеют ключевое значение для оценки ее тяжести. В то же время необходимо помнить, что гипокортицизм является лишь одной из нескольких возможных причин гиперкалиемии. В любом случае обнаружение гиперкалиемии требует принятия мер для устранения ее угрожающих жизни последствий. ЭКГ является наиболее простым и быстрым из существующих способов скрининга в условиях стационара, и никакой другой метод не позволяет с такой легкостью следить за состоянием пациента в процессе терапии.
Раннее выявление гиперкалиемии, которое во многих случаях осуществляется с помощью ЭКГ, позволяет немедленно начинать лечение, не дожидаясь результатов лабораторного анализа сывороточных электролитов. Выраженная гиперкалиемия независимо от вызвавшей ее причины является неотложным состоянием, требующим срочной коррекции. ЭКГ не только служит эффективным инструментом ранней диагностики гиперкалиемии, но и позволяет специалисту осуществлять быстрый и надежный мониторинг эффективности терапии. По мере коррекции гиперкалиемии исчезают обусловленные ею изменения на электрокардиограмме.
Слабая гиперкалиемия (концентрация К+ в сыворотке крови от 5,6 до 6,5 мэкв/л). Самые ранние изменения, видимые на ЭКГ, включают уменьшение частоты сердечных сокращений и заострение Т-зубца; они появляются, когда концентрация сывороточного калия превышает 5,5 мэкв/л. Эти изменения могут быть столь незначительными, что их трудно распознать; прежде всего, они проявляются в форме укорочения Q-T интервала. Характерные высокие и узкие Т-зубцы появляются раньше возникновения на ЭКГ поддающихся измерению изменений комплекса QRS. Уменьшение скорости сердечных сокращений и изменение формы Т-зубцов отмечаются не во всех случаях слабой гиперкалиемии. Изменения Т-зубцов были зарегистрированы только у 15% собак с гиперкалиемией, включенных в нашу группу, а брадикардия (т.е. скорость сердечных сокращений менее 80 ударов в минуту) у 33% животных. По мере увеличения концентрации калия выше 7,0 мэкв/л некоторые Т-зубцы утрачивали классическую «заостренную» форму (если таковая имелась ранее), так как изменения, возникавшие в результате нарушения внутрижелудочковой проводимости, маскировали первичную деформацию этих зубцов. Брадикардия, выявляемая на ранних ЭКГ, иногда исчезала после увеличения концентрации сывороточного калия до 7,0-7,5 мэкв/л и выше, поскольку развивавшаяся гипоксия вызывала увеличение скорости сердечных сокращений.
Умеренная гиперкалиемия (концентрация К* от 6,6 до 7,5 мэкв/л). Замедление внутрижелудочкового проведения импульса обусловливает изменение комплекса QRS после того, как концентрация сывороточного калия превысит 6,5 мэкв/л. В этом случае изменение формы Т-зубца и равномерное расширение комплекса дают основание для постановки предварительного диагноза гиперкалиемии. Расширение комплекса QRS и уменьшение амплитуды R-зубца имели место соответственно у 32% и 47% собак, включенных в рассматриваемую группу. По мере дальнейшего повышения концентрации сывороточного калия длительность комплекса QRS прогрессивно увеличивалась. Таким образом, существует грубая корреляция между длительностью комплекса QRS и тяжестью гиперкалиемии.
Умеренная до тяжелой гиперкалиемия (концентрация К+ от 7,0 до > 8,5 мэкв/л). Если концентрация калия в сыворотке крови превышает 7,0 мэкв/л, амплитуда Р-зубца уменьшается, а его длительность увеличивается вследствие замедленного проведения импульса в предсердиях. Длительность Р-R интервала также возрастает из-за замедления проведения в предсердно-желудочковом узле. После увеличения концентрации сывороточного калия выше 8 мэкв/л Р-зубец может исчезнуть. Это классическое нарушение ЭКГ легко распознается и служит основанием для постановки предварительного диагноза гиперкалиемии. Увеличение длительности Р-R интервала было зарегистрировано у 45% собак нашей группы, а Р-зубец отсутствовал еще у 47%. Иными словами, эти нарушения имели место в общей сложности у 92% животных с гипокортицизмом. В отсутствие Р-зубца возможен ошибочный диагноз фибрилляции предсердий, особенно при непостоянной скорости желудочковых сокращений.
Тяжелая гиперкалиемия (концентрация К+ более 8,5 мэкв/л). Дальнейшее увеличение концентрации калия сопровождается изменением S-T сегмента. После повышения концентрации калия до 11-14 мэкв/л ЭКГ может выявить желудочковую асистолию или фибрилляцию желудочков. Мы редко наблюдали эти явления у собак нашей группы с гипокортицизмом, возможно, из-за того, что максимальная концентрация сывороточного калия у них не превышала 10,8 мэкв/л (см. табл. 8-8).
ГОРМОНАЛЬНЫЕ ИССЛЕДОВАНИЯ: ПОДТВЕРЖДЕНИЕ ДИАГНОЗА
Концентрация кортизола в плазме крови
Базальная концентрация кортизола в плазме крови. Концентрация кортизола в плазме и моче при гипокортицизме обычно бывает ниже нормы. Однако базальную концентрацию кортизола в крови нельзя использовать в качестве диагностического показателя из-за значительных колебаний тяжести надпочечниковой недостаточности и из-за того, что большинство референтных показателей базальной
448 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
ТАБЛИЦА 8-15. ПРОТОКОЛЫ ПРОВОКАЦИОННОЙ ПРОБЫ С АКТГ (КОРТИКОТРОПИНОМ) ДЛЯ ОЦЕНКИ РЕЗЕРВА ГЛЮКОКОРТИКОИДОВ В КОРЕ НАДПОЧЕЧНИКОВ1
Препарат АКТГ Доза Способ введения Определение кортизола до инъекции Время определения кортизола после инъекции
Синтетический АКТГ (кортрозин*) 0,25 мг (для собак) внутримышечно Да 1 час
Синтетический АКТГ (кортрозин*) 0,125 мг (для кошек) внутримышечно или внутривенно Да 30 + 60 мин
Свиной АКТГ (кортигель-40* *) 2,2 МЕ/кг (для собак) внутримышечно Да 2 часа
Свиной АКТГ (кортигель-40**) 2,2 МЕ/кг (для кошек) внутримышечно Да 1 и 2 часа
'Пробу следует проводить во всех случаях «криза» у собаки или кошки, независимо от времени суток.
* Кортрозин (козинтропин) производства Organon Pharmaceuticals, США.
** Кортигель-40 (инъекция репозитола кортикотропина; Фармакопея США) производства Savage Laboratories, США.
концентрации кортизола лежат на пределе чувствительности методов определения. Для диагностики гипокортицизма необходимо тестирование функционального резерва коры надпочечников с помощью провокационной пробы с АКТГ (т.е. определения концентрации кортизола в плазме крови до и после введения АКТГ).
Стероиды мочи. Определение суточной экскреции 17-гидроксикортикостероидов с мочой является достаточно надежным методом подтверждения гипокортицизма, однако сбор суточных проб мочи у собак, переведенных из привычных домашних условий в метаболические клетки, весьма затруднителен для ветеринара, если вообще возможен. Кроме того, такое определение не позволяет выявить функциональный резерв коры надпочечников. С той же проблемой ветеринарные врачи сталкиваются при определении отношения концентраций кортизола и креатинина в разовых пробах мочи, когда величина этого отношения может быть понижена, но не отражает функционального состояния надпочечников. Более того, результаты определения этого отношения в рандомизированных пробах мочи считаются недостаточно надежными для подтверждения диагноза гипокортицизма. Единственным достоверным методом подтверждения гипокортицизма (болезни Аддисона) является провокационная проба с АКТГ.
Провокационная проба с АКТГ: «золотой стандарт»
Протокол. Определение концентрации кортизола в плазме крови до и после стимуляции коры надпочечников экзогенным АКТГ повсеместно используется в качестве наиболее надежной методики и служит «золотым стандартом» при диагностике гипокортицизма у людей, собак и кошек. Провокационная проба с АКТГ одинаково пригодна для использования в стационарных и амбулаторных условиях, так как занимает мало времени (1 или 2 часа) и требует только двукратного взятия проб крови.
Для стимуляции коры надпочечников используют либо синтетический АКТГ (кортрозин, производства Amphastar Pharm., США), либо природный АКТГ (экстракт свиных гипофизов: кортигель-40,
производства Savage Laboratories, США). При использовании синтетического АКТГ пробы крови у собак следует брать до и через 1 час после его внутримышечного или внутривенного введения в дозе 0,25 мг (независимо от веса животного). При введении геля АКТГ пробы крови берут до и через 2 часа после внутримышечной инъекции в дозе 2,2 МЕ/кг. В ряде исследований было показано, что доза синтетического АКТГ 0,25 мг является слишком высокой. Однако такая доза содержится в одном флаконе, поэтому мы рекомендуем ее для внутримышечного введения. У кошек пробы крови следует брать до и спустя 30 и 60 минут после введения синтетического АКТГ (внутримышечно или внутривенно в дозе 0,125 мг/животное), а при использовании природного АКТГ - до и спустя 60 и 120 минут после внутримышечной инъекции в дозе 2,2 МЕ/кг.
При интерпретации результатов проб с АКТГ разного происхождения (синтетического или природного) их рассматривают как равноценные (табл. 8-15) (Feldman et al, 1982). Тест с АКТГ дает достоверные результаты при его проведении в любое время дня. Пробы венозной крови для определения кортизола собирают в гепаринизированные пробирки, центрифугируют и полученную плазму замораживают до проведения анализа. При подозрении на наличие у кошки или собаки надпочечникового криза пробу с АКТГ проводят сразу после поступления животного в ветеринарную клинику независимо от времени суток. При проведении пробы следует руководствоваться принятыми в данной лаборатории нормативами, касающимися объема проб плазмы или сыворотки и правил работы с ними. Скорость деградации кортизола в течение первых 5 дней после получения проб плазмы или сыворотки низкая, но после этого срока значительно возрастает (Olson et al, 1981). Для определения концентрации кортизола в плазме крови собак используют различные коммерческие наборы. В Северной Америке чаще всего применяются радиоиммунологические методы (РИА). Каждая лаборатория устанавливает собственные показатели нормальной концентрации кортизола. Пока не рекомендуется использовать
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 449
ТАБЛИЦА 8-16. КОНЦЕНТРАЦИИ КОРТИЗОЛА В ПЛАЗМЕ КРОВИ ДО И ПОСЛЕ СТИМУЛЯЦИИ ЭКЗОГЕННЫМ СИНТЕТИЧЕСКИМ АКТГ И КОНЦЕНТРАЦИЯ ЭНДОГЕННОГО АКТГ В ПЛАЗМЕ КРОВИ СОБАК* СО СПОНТАННОЙ НЕДОСТАТОЧНОСТЬЮ ФУНКЦИИ КОРЫ НАДПОЧЕЧНИКОВ
Концентрация кортизола в плазме крови (мкг/100 мл) Концентрация ЧКТГ в плазме крови (пг/мл)
Число собак До стимуляции Через 60 минут До введения После введения
1 руина 1 Средние величины Диапазон 407 0,9 0,1 2,0 1,0 0.1-2.0 1134 >1000 (52%) 105 < 3-240
1 ру нпа 2 Средние величины Диапазон Нормальный диапазон Нормальная средняя величина 23 0.9 0,1-2,0 0,5-5,5 2.2 1,1 0,1-3,1 5,0 17,0 9,6 12,7 <3-53 10-80 38
*Данная группа включает 205 собак из продолжающейся серии Калифорнийского Университета и 220 собак из работы Peterson et al (1996).
Группа 1 - собаки с первичным заболеванием коры надпочечников, г руина 2 - собаки с гипофизарным заболеванием,
твердофазный иммуноферментный метод (ELISA) для диагностики аддисоновой болезни в стационарных условиях.
Результаты, Для подтверждения недостаточности функции коры надпочечников используется единственный критерий: аномально низкая концентрация кортизола в плазме крови в провокационной пробе с АКТГ, проведенной в соответствии с апробированным протоколом (см. табл. 8-15). Нормальная концентрация кортизола после введения АКТГ служит доказательством отсутствия надпочечниковой недостаточности, а неадекватная реакция на провоцирующую пробу (концентрация кортизола в плазме менее 2,0 мкг/100 мл) подтверждает диагноз (табл. 8-16).
В период с января 1988 но январь 2002 мы выявили спонтанный гипокортицизм у 205 собак (у 18 из них было установлено нарушение секреции гипофизарного АКТГ и вторичное нарушение секреции кортизола). Мы приводим здесь данные, начиная с 1988 года, потому что все последующие определения концентрации кортизола в плазме крови этих животных проводились с помощью одного и того же метода РИА. При использовании этого метода в норме концентрация кортизола составляла 0,5-5,5 мкг/100 мл, а после стимуляции АКТГ - 5,0-17,0 мкг/100 мл.
Мы объединили 220 собак из работы (Peterson et al, 1996) и 187 наших собак со спонтанно развившимся первичным гипокортицизмом. У каждой из этих 407 собак концентрация кортизола в плазме крови до и после введения АКТГ была 2,0 мкг/100 мл или ниже. Более 75° о этих животных после стимуляции имели концентрацию кортизола ниже 1 мкг/100 мл (см. табл. 8-16, а также рис. 8-8). Таким образом, ни у одной из 407 собак с диагнозом болезнь Аддисона концентрация кортизола в плазме после введения АКТГ не достигала даже 2,1-5,0 мкг/100 мл, тогда как его нормальная (референтная) концентрация в аналогичных условиях находится в диапазоне от 5,0 до 17,0 мкг/100 мл. Из этого сле
дует, что обнаружение концентрации кортизола в пределах 2,1-5,0 мкг/100 мл может служить основанием для подозрения на гипокортицизм, но не доказательством его наличия. Кроме того, примерно у 75% из 407 собак с первичным гипокортицизмом концентрация кортизола после стимуляции АКТГ оставалась на базальном уровне или еще более понижалась. В тех случаях, когда концентрация кортизола возрастала после введения АКТГ, се увеличение было очень слабым (см. табл. 8-16).
У пяти собак с вторичной надпочечниковой недостаточностью в исследовании Peterson и соавторов (1996) и у 18 собак нашей группы базальная концентрация кортизола в плазме крови была 2,0 мкг/100 мл или ниже. Максимальная концентрация кортизола у этих 23 животных после введения АКТГ не превышала 3,1 мкг/100 мл, т.е. была лишь несколько выше, чем у собак с первичной недоста-
кортизола стимуляции
Время
Рис. 8-8. Радиоиммунологическое определение концентрации кортизола в плазме крови до и после введения экзогенного АКТГ здоровым собакам и собакам с гипокортицизмом. Заштрихованная область соответствует диапазону нормальных концентраций (средняя величина ± 2SD).
450
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
Рис. 8-9. Алгоритм дифференциальной диагностики различных причин аномально пониженной концентрации кортизола в плазме крови в условиях провокационного теста с АКТГ с использованием результатов определения эндогенной концентрации АКТГ в плазме крови.
точностью функции коры надпочечников, причем у 21 собаки она была 2,0 мкг/100 мл или ниже.
Таким образом, у 428 из 430 собак с первичной и вторичной недостаточностью функции коры надпочечников концентрация кортизола в плазме до и после введения АКТГ оставалась равной 2,0 мкг/100 мл или была еще меньше. В другом исследовании, проведенном на 18 собаках с вторичным гипокортицизмом, данные для отдельных особей не приводятся, однако средняя концентрация кортизола после стимуляции АКТГ была ниже 2,0 мкг/100 мл, а ее максимальная величина не превышала 4,4 мкг/100 мл (Litton et al, 1996).
Ограничения. Результаты пробы со стимуляцией АКТГ не позволяют дифференцировать собак со спонтанным первичным гипокортицизмом, животных с вторичным гипокортицизмом вследствие заболевания гипофиза или ятрогенного эффекта хронической кортикостероидной терапии и животных с первичным разрушением коры в результате передозировки о,р’-ДДД (рис. 8-9).
При первичной надпочечниковой недостаточности имеет место деградация клеток коры, что приводит к аномальным результатам тестирования. При вторичной недостаточности функции надпочечников, достаточно тяжелой, чтобы вызвать соответствующие клинические проявления, имеет
место значительная атрофия коры вследствие хронического недостатка АКТГ, обусловленного заболеванием гипофиза (например, его аутоиммунным поражением, травмой или опухолью), или длительного введения экзогенных кортикостероидов (см. табл. 8-9). Независимо от причины, атрофированные клетки утрачивают способность отвечать на однократное введение АКТГ, хотя в конечном итоге они поддаются стимуляции при повторных инъекциях АКТГ или его хронической инфузии (Lamb et al, 1994). У собак с первичным разрушением клеток коры надпочечников продолжительная инфузия АКТГ не усиливает секрецию кортизола.
Концентрация альдостерона в плазме и сыворотке крови
Общие сведения. Измерение концентрации кортизола в плазме крови до и после введения экзогенного АКТГ для выявления и подтверждения гипокортицизма позволяет также косвенно оценить функцию всей коры надпочечников. Однако концентрация кортизола не всегда отражает концентрацию альдостерона в крови. Теоретически, прямое количественное определение альдостерона должно давать информацию для дифференциальной диагностики первичного заболевания (сниже-
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
451
Здоровые Здоровые Собаки с Собаки с Собаки с Собаки с Собаки с Собаки с собаки до собаки гипокор- гипокор- недоста- недоста- гипокорти- гипокорти-
введения после тициз- тицизмом точностьюточностью цизмом и цизмом и АКТГ введения мом до после АКТГ до АКТГ нормальной нормальной
АКТГ введения введения введения после концентра- концентраци-АКТГ АКТГ АКТГ введения цией элект- вй электро-АКТГ ролитовдо литов после
введения введения
АКТГ АКТГ
Рис. 8-10. Концентрация альдостерона в плазме крови здоровых собак, собак со спонтанным первичным гипокортицизмом, собак с недостаточностью АКТГ и собак с первичным гипокортицизмом и нормальной концентрацией электролитов в сыворотке крови на момент установления диагноза.
ние уровня альдостерона и кортизола) и вторичного расстройства (снижение концентрации кортизола на фоне нормального уровня альдостерона).
Определение концентрации альдостерона в крови не проводилось по той простой причине, что данные об уровне кортизола обеспечивали получение необходимой диагностической информации, а общедоступных методов определения альдостерона до относительно недавнего времени не было. Коммерческие наборы для количественного определения кортизола существуют уже несколько десятилетий. Следует отметить также, что результаты определения уровня альдостерона в крови людей зависят от потребления натрия, а также от условий проведения измерений: в положении стоя или лежа. В ветеринарной практике эти факторы трудно контролировать, поэтому результаты измерения альдостерона потенциально менее достоверны, чем результаты определения кортизола.
Протокол тестирования, методы и результаты измерений у людей. Имеется несколько коммерческих наборов для определения концентрации альдостерона с помощью РИА. В настоящее время мы используем твердофазный РИА, предназначенный для количественного определения альдостерона в неэкстрагированных сыворотках (Coat-A-Count Aldosterone, производства Diagnostic Products Corp., США). У кошек и собак определения проводятся как натощак, так и после кормления, а для
проведения провокационной пробы с АКТГ не требуется никакой специальной подготовки животных. АКТГ стимулирует высвобождение альдостерона и используется для оценки способности коры надпочечников синтезировать и секретировать этот гормон. Протокол пробы с АКТГ для оценки секреции альдостерона не отличается от такового для кортизола, за исключением того, что пробы собирают в пробирки для свертывания крови и сыворотку отделяют от клеток. Результаты определений в сыворотке и гепаринизированной плазме существенно не отличаются, а взятые до и после введения АКТГ пробы крови можно использовать для измерения концентраций как альдостерона, так и кортизола.
Пробы можно хранить при температуре от +2 до +8 °C в течении 7 дней или замороженными при -20 °C на протяжении до двух месяцев. Тяжелая желтуха, гемолиз, липемия и концентрация белка в плазме крови не влияют на результаты определения альдостерона. У людей потребление с пищей большого количества натрия приводит к снижению уровня альдостерона, а низкое потребление повышает его. Нормальная базальная концентрация альдостерона в плазме крови человека при ее измерении в положении стоя составляет 40-310 пг/мл, а в положении лежа от 10 до 160 пг/мл. Результаты измерений в пикограммах на миллилитр (пг/мл) можно выразить в нанограммах на 100 миллилитров (нг/100 мл), поделив полученный ре
452 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
зультат на 10. Пикограммы на миллилитр можно перевести в пикомоли на литр, (пмоль/л), умножив результат на 2,775 (см. внутреннюю сторону передней обложки).
Результаты у собак
Здоровые собаки. Имеется всего несколько сообщений, в которых приводятся данные о концентрации альдостерона в плазме крови собак (Willard et al, 1987; Golden, Lothrop, 1988). В нашей лаборатории были проведены определения у 32 здоровых животных (Ortega et al, 1995). Средняя базальная концентрация альдостерона в сыворотке крови составляла 49 пг/мл (диапазон от 2 до 96 пг/мл). После введения АКТГ средняя концентрация равнялась 306 пг/ мл при колебаниях от 146 до 519 пг/мл (рис. 8-10).
Первичный гипокортицизм. У 55 собак со спонтанным первичным гипокортицизмом, гипонатриемией и гиперкалиемией средняя базальная концентрация альдостерона в плазме крови составляла 0,2 пг/мл при колебаниях от 0,1 до 1,0 пг/мл (в 42 из 55 случаев она равнялась 0,1 пг/мл, что соответствует порогу чувствительности метода определения). После введения АКТГ средняя концентрация альдостерона повышалась до 12 пг/мл (диапазон от 0,1 до 91 пг/мл), при этом у 36 из 55 собак она равнялась 0,1 пг/мл, а у 19 собак была от 9 до 91 пг/мл (см. рис. 8-10).
Первичный гипокортицизм, нормальная концентрация электролитов в сыворотке крови. Мы имели возможность определить концентрацию сывороточного альдостерона у пяти собак с первичным гипокортицизмом, которые ко времени установления диагноза (т.е. на момент проведения провокационной пробы с АКТГ) имели нормальную концентрацию электролитов в крови. Гипонатриемия и гиперкалиемия, как и ожидалось, развились через один месяц у трех собак и через 3 месяца у двух других особей. Однако на протяжении всего периода, пока концентрация электролитов сохранялась в нормальных пределах, уровень альдостерона у этих собак был таким же, как при классическом нарушении баланса сывороточных электролитов. Базальная концентрация альдостерона колебалась от 0,1 до 6,0 пг/мл, а после введения АКТГ - от 0,1 до 87 пг/мл. Эти величины превышали соответствующие средние значения для собак с типичной аддисоновой болезнью, но были достоверно ниже нормальных показателей (см. рис. 8-10). Всем пяти собакам в конце концов была предписана минералокортикоидная терапия.
Вторичный гипокортицизм. Концентрацию альдостерона определяли также у 14 из 18 собак с клиническими симптомами гипокортицизма, которые имели нормальную концентрацию электролитов и низкие концентрации кортизола в сыворотке крови до и после введения экзогенного АКТГ на фоне чрезвычайно низкой концентрации эндогенного АКТГ в крови. Ни одной из этих собак не требовалась минералокортикоидная терапия. Интересно, что у 10 из них концентрация альдостерона также
была низкой. В базальных условиях она составляла 0.1-11 пг/мл, а после стимуляции АКТГ - от 1 до 94 пг/мл (см. рис. 8-10). У четырех других животных концентрация альдостерона до и после введения АКТГ оставалась в нормальных пределах.
Выводы. Создается впечатление, что определение концентрации сывороточного альдостерона у собак с гипокортицизмом или подозрением на него имеет чисто академический интерес. Логично предположить, что этот метод можно использовать для дифференциации животных с первичным заболеванием надпочечников и вторичной атрофией клеток коры вследствие недостаточности функции гипоталамуса и/или гипофиза. У той небольшой группы собак, у которых мы определяли концентрацию альдостерона в сыворотке крови, полученные результаты не имели диагностической ценности. Представляет интерес провести определение альдостерона у большего числа собак с классической аддисоновой болезнью, у животных с этим заболеванием, сохраняющих нормальную концентрацию электролитов в сыворотке, и у собак с нарушениями функции гипоталамо-гипофизарной системы.
Концентрация эндогенного АКТГ в плазме крови
Общие сведения. Концентрация эндогенного АКТГ в плазме крови может дать информацию о локализации нарушения в гипоталамо-гипофизарной системе, однако, в большинстве случаев результаты ее определения имеют не столько практический, сколько теоретический интерес. Как следует из рис. 8-1 и 8-9, у собак с первичной недостаточностью функции коры надпочечников сохраняется механизм отрицательной обратной связи, посредством которого передаваемый сигнал приводит к усилению высвобождения АКТГ из гипофиза и увеличению его концентрации в крови. Аналогичный механизм действует у животных, получавших адренокорти-колитический препарат о,р’-ДДД. Однако у собак с вторичной надпочечниковой недостаточностью вследствие гипофизарного расстройства секреция АКТГ снижена, и его концентрация в плазме крови находится на нижней границе нормы или ниже ее. Хроническая недостаточность АКТГ (вследствие заболевания гипофиза или хронического введения экзогенных кортикостероидов) приводит к атрофии коры надпочечников.
Доступность наборов для определения АКТГ и работа с пробами крови. В настоящее время стало возможным рутинное определение концентрации АКТГ в плазме крови с использованием коммерческих наборов РИА (производства Nichols Institute, США). Мы используем эту методику уже на протяжении десяти лет. Антитела к N-концевому фрагменту молекулы АКТГ получают у кроликов, используя в качестве антигена Zn-кортикотропин. Эти антитела специфически взаимодействуют с участком 19-24 молекулы АКТГ. Пробы крови, взя
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 453
тые для определения АКТГ, подлежат немедленной обработке, так как гормон быстро исчезает из свежей крови (период полужизни около 25 минут). Во избежание получения ложно заниженных результатов пробы не следует оставлять при комнатной температуре даже на короткое время. Во время сбора, фракционирования и хранения проб нельзя допускать их контакта со стеклянными поверхностями, потому что АКТГ обладает выраженной адгезией к стеклу, что также ведет к ошибочно низким результатам его определения. Поэтому кровь следует собирать в силиконовые пробирки, добавляя в них ЭДТА в качестве антикоагулянта. Использование несиликонизированных пробирок приводит к получению заниженных результатов. При определении концентрации АКТГ вышеуказанным набором РИА производства Nichols Institute гепаринизированную плазму не используют. Для сохранения исходной концентрации АКТГ пробы обрабатывают в пластмассовых пробирках и хранят в замороженном виде при очень низкой температуре. Каждая лаборатория, проводящая определения АКТГ, должна иметь собственные показатели его нормальной концентрации.
Результаты
Здоровые собаки и собаки с первичным гипокортицизмом. В нашей лаборатории диапазон нормальных концентраций эндогенного АКТГ в плазме крови собак составляет от 10 до 80 пг/мл. Из 180 собак, у которых, начиная с 1988 года был диагностирован спонтанно развившийся первичный гипокортицизм, у 165 собак концентрация АКТГ была сильно увеличена (рис. 8-11) и превышала 450 пг/
мл, а у 141 из них была выше 1000 пг/мл. Величина 450 пг/мл заслуживает особого внимания, поскольку у собак с секретирующими АКТГ гипофизарными опухолями, приводящими к гиперкортицизму, концентрация эндогенного АКТГ в крови обычно колеблется в пределах от 45 до 450 пг/мл. Это означает, что у собак с первичным гипокортицизмом, у которых гипофиз функционирует нормально, но из-за отсутствия или недостаточного содержания кортизола нарушена обратная связь между гипофизом и надпочечниками, концентрация эндогенного АКТГ значительно выше, чем у животных с опухолями гипофиза, продуцирующими АКТГ.
Интересно отметить, что у 15 из 180 собак со спонтанным первичным гипокортицизмом концентрация эндогенного АКТГ в плазме крови была от 100 до 450 пг/мл. Поскольку АКТГ секретируется эпизодически, эти величины, по-видимому, отражают физиологическую ситуацию. При этом не обнаружено никаких явных признаков, которые позволяли бы отличать собак с относительно небольшим и чрезвычайно высоким уровнем АКТГ в плазме крови.
Повышенная концентрация эндогенного АКТГ и нормальная концентрация электролитов. У восьми собак с первичным гипокортицизмом и повышенной концентрацией эндогенного АКТГ в плазме крови концентрация электролитов в сыворотке на момент установления диагноза оставалась в пределах нормы. У пяти из них в течение 1-3 месяцев после установления диагноза развились гипонатриемия и гиперкалиемия и им потребовалась заместительная минералокортикоидная терапия. В
ность
Рис. 8-11. Концентрация эндогенного АКТГ в плазме крови здоровых собак; собак с первичной надпочечниковой недостаточностью, обусловившей отсутствие отрицательной обратной связи между надпочечниками и гипофизом; собак с недостаточностью секреции гипофизарного АКТГ (вторичная надпочечниковая недостаточность), вызвавшей атрофию коры надпочечников; собак, получавших избыточные дозы адренокорти-колитического препарата о,р’-ДДД, и собак, получавших хроническую глюкокортикоидную терапию.
454
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
то же время у трех других собак, получавших только глюкокортикоиды, сохранялась нормальная концентрация электролитов в сыворотке крови. Таким образом, аномально низкая концентрация кортизола в плазме крови до и после введения АКТГ наряду с повышенной концентрацией эндогенного АКТГ почти всегда свидетельствуют о том, что животному потребуется как глюкокортикоидная, так и минералокортикоидная заместительная терапия, так как, по всей вероятности, оно страдает первичной недостаточностью функции коры надпочечников (болезнью Аддисона) (см. рис. 8-11). Вместе с тем, не все 100% этих животных нуждались в введении минералокортикоидов. Следует отметить, что у всех восьми вышеупомянутых собак была аномально понижена концентрация альдостерона в сыворотке крови, т.е. результаты этого теста не могут служить достоверным показанием к назначению заместительного введения минералокортикоидов.
Вторичный гипокортицизм. Мы определяем вторичный гипокортицизм как недостаточность функции коры надпочечников, которая устанавливается на основании аномально низкой концентрации кортизола в плазме крови до и после введения экзогенного АКТГ, низкой или на нижнем пределе нормы концентрации эндогенного АКТГ при нормальной концентрации электролитов в сыворотке, и явной потребности в хронической заместительной глюкокортикоидной, но не минералокортикоидной терапии. Для уточнения этого необычного диагноза следует убедиться, что собаке не вводили никаких стероидов на протяжении нескольких последних недель, поскольку сходные результаты тестирования могут быть получены после отмены хронически вводившихся глюкокортикоидов (или иных стероидов).
Состояние 18 из 205 обследованных нами собак отвечало критериям вторичного гипокортицизма, и им был поставлен соответствующий диагноз. У 10 животных эндогенный АКТГ в плазме крови не определяли, а у 8 его концентрация не превышала 7-35 пг/мл. Состояние всех 18 животных стабилизировалось после проведения заместительной глюкокортикоидной терапии. Тем не менее, концентрация альдостерона в сыворотке крови у 10 из 14 собак оставалась низкой. Это свидетельствует о выраженном влиянии недостаточности АКТГ на секрецию альдостерона, о связи недостаточности альдостерона с недостатком кортизола или об ошибочности диагноза. Как и во всех других случаях гипокортицизма, возможность длительного выживания животных определяется поведением их владельцев, которые должны обеспечивать своевременное введение лекарственных средств и контролировать стабильность состояния животных.
Эффект терапии. Лечение гипокортицизма должно приводить к снижению чрезмерно высокого уровня эндогенного АКТГ в плазме крови собак с аддисоновой болезнью. У некоторых животных через несколько месяцев после начала замести
тельной терапии отмечалось резкое уменьшение концентрации АКТГ, возможно, под воздействием вводимых стероидных препаратов на гипофиз по механизму отрицательной обратной связи.
Выводы. Определение концентрации эндогенного АКТГ в плазме крови собак с гипокортицизмом представляет, главным образом, академический интерес. Тем не менее, при наличии у собаки с гипокортицизмом нормальной концентрации электролитов в сыворотке в сочетании с чрезмерно высоким уровнем АКТГ можно говорить о первичном расстройстве функции коры надпочечников. У такого животного весьма вероятно развитие как минералокортикоидной, так и глюкокортикоидной недостаточности. Даже если на момент постановки диагноза такая собака имеет нормальную концентрацию натрия и калия в сыворотке крови, ветеринар вправе ожидать нарушения электролитного баланса в дальнейшем. Поэтому рекомендуется раз в 2-3 месяца определять концентрацию электролитов (или чаще, если у собаки имеются нежелательные клинические проявления). В случае необходимости назначают заместительную минералокортикоидную терапию. Напротив, при нормальной концентрации сывороточных электролитов и недостаточной продукции эндогенного АКТГ у собак с гипокортицизмом сохраняется секреция минералокортикоидов. У таких животных гомеостаз электролитов в сыворотке остается нормальным, и им показана только глюкокортикоидная терапия.
ЛЕЧЕНИЕ СОБАК В СОСТОЯНИИ «КРИЗА»
Общие сведения
Основные положения. Своевременное назначение терапии имеет жизненно важное значение для собаки или кошки при острой недостаточности функции коры надпочечников или при подозрении на нее. Обычно термином «криз» обозначают критическое состояние заболевания собаки или кошки, обусловленное сочетанием тяжелых гипотензии, гиперкалиемии, гипонатриемии и дегидратации. Если концентрация сывороточных электролитов, нарушения ЭКГ, данные анамнеза и физикального исследования заставляют подозревать наличие ад дисоновой болезни, терапия должная быть направлена на коррекцию этого расстройства. При острой недостаточности функции коры надпочечников задачей лечения является: (1) коррекция гипотензии и гиповолемии, (2) улучшение функции сосудистой системы в целом и обеспечение быстрого поступления глюкокортикоидов в организм, (3) коррекция уровня электролитов в сыворотке крови, (4) коррекция ацидоза, (5) лечение гипогликемии (при наличии таковой) и (6) подтверждение диагноза (табл. 8-17).
Ятрогенный гипокортицизм, вызванный введением о,р’-ДДД. Гиперкортицизм у собак встречается гораздо чаще, чем гипокортицизм. Предпочтительным способом лечения первого из
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 455
ТАБЛИЦА 8-17. ЛЕЧЕНИЕ ОСТРОЙ НАДПОЧЕЧНИКОВОЙ НЕДОСТАТОЧНОСТИ (ГИПОКОРТИЦИЗМА)
Начальная терапия
1. Жидкости: инъекция раствора хлористого натрия, Фармакопея США (нормальный физиологический раствор; вначале вводятся «шоковые» дозы) а) 40-80 мл/кг/час, первые 1-2 часа
б) 90-120 мл/кг/24 часа, следующие 1-2 дня
2. Определение базальной концентрации кортизола и ее изменения после стимуляции АКТГ
3. Введение глюкокортикоидов (после завершения пробы с АКТГ)
а) Натрия сукцинат преднизолона, от 4 до 20 мг/кг внутривенно
б) Натрия сукцинат гидрокортизона, от 0,5 до 0,625 мг/ кг/час, внутривенная инфузия
в) Дексаметазон (от 0,05 до 0,1 мг/кг в инфузионном растворе)
4. Введение минералокортикоидов: дезоксикортикостерона пивалат (ДОКП), 2,2 мг/кг внутримышечно
5. По показаниям, внутривенное введение глюкозы и инсулина для быстрого снижения концентрации калия в сыворотке крови (требуется редко, при концентрации сывороточного К+ выше 8,5 мэкв/л)
6. Ацидоз: внутривенное введение бикарбоната в количестве 25% от расчетной дозы в течение первых 6 часов терапии (требуется редко, при концентрации эндогенного бикарбоната в сыворотке крови менее 12 мэкв/л)
Указания
1. Повторяйте определение концентрации электролитов, глюкозы, и СО2 в крови с интервалами в 6-8 часов
2. Контролируйте продукцию мочи
3. По возможности проводите ЭКГ
4. По возможности проводите прямое определение общего кровяного давления и центрального венозного давления
Последующая терапия
1. Введение жидкости до восстановления у собаки способности самостоятельно есть и пить
2. Введение глюкокортикоидов: инъекции дексаметазона до начала перорального введения преднизона (обычно в низких дозах)
3. Введение минералокортикоидов: ДОКП один раз в 25 дней или флюдрокортизон перорально
4. Введение бикарбоната: дозу подбирают в зависимости от концентрации СО, в крови
этих заболеваний является терапия о,р’-ДДД. Как и в любом другом случае, возможна передозировка этого лекарственного средства. Ее последствия у собак проявляются как на начальной стадии лечения, так и в поддерживающей фазе терапии. Одним из показателей передозировки о,р’-ДДД служит концентрация кортизола в плазме крови менее 1,0-1,5 мкг/100 мл до и после введения АКТГ.
Если у собаки имеются клинические признаки недостаточности кортизола (в частности, анорексия, рвота, диарея и/или общая слабость) при нормальных концентрациях натрия и калия, она должна отвечать на глюкокортикоидную терапию, которую затем продолжают на протяжении нескольких недель. В случаях, когда те же клинические симптомы развиваются у собак, получающих о,р’-ДДД на фоне гиперкалиемии и гипонатриемии, то помимо
глюкокортикоидов им назначают и минералокортикоидную терапию. Схема лечения таких животных не отличается от схемы, рекомендуемой для собак со спонтанным гипокортицизмом. Несмотря на известные случаи обратимой недостаточности минералокортикоидов, вызванной введением о,р’-ДДД, большинство животных нуждаются в пожизненном лечении (см. гл. 6).
Гиповолемия/гипотензия
Протокол (рис. 8-12). Поскольку смерть при ги-покортицизме нередко происходит из-за спадения сосудов и шока (не связанного с гиперкалиемией), необходима, прежде всего, быстрая коррекция гиповолемии. В яремную или краниальную вену собаки вживляют катетер. До и сразу после его установки берут пробу крови для определения концентрации электролитов и кортизола, что позволяет выбрать режим терапии и поставить окончательный диагноз. После этого проводят пробу с АКТГ, вводя внутримышечно 0,25 мг кортрозина (см. табл. 8-15). Одновременно начинают внутривенную инфузию 0,9% нормального физиологического раствора со скоростью 40-80 мл/кг/час в течение первых 1-2 часов. По истечении этого времени скорость введения раствора увеличивают до 90-120 мл/кг/час для обеспечения 1,5-2-кратного превышения необходимого уровня поддерживающей инфузии, и продолжают вводить раствор на протяжении еще 36-48 часов (Reusch, 2000).
Описана собака с гипокортицизмом, у которой после внутривенного введения физиологического раствора развилась неврологическая симптоматика (Brady et al, 1999). Тем не менее, данные о возможности неврологических расстройств вследствие инфузионной терапии сомнительны. Более того, по необъясненным причинам описанная собака не получала минералокортикоиды по меньшей мере в течение 7 дней, а инфузия ей физиологического раствора производилась непрерывно. Между тем, после повышения концентрации натрия в сыворотке крови до нормального уровня (обычно через 12-24 часа после начала инфузии) физиологический раствор необходимо заменить рингеровским раствором. Мы по-прежнему рекомендуем внутривенную терапию физиологическим раствором для спасения жизни собак в состоянии криза аддисоновой болезни.
Объем. Общий объем жидкости, вводимой больной собаке или кошке, подбирают и корректируют на основании оценки тяжести дегидратации, продукции мочи и потери жидкости как в ходе естественных процессов, так и при рвоте и/или диарее. Прекрасным способом мониторинга является измерение кровяного давления. Необходимо тщательно контролировать продукцию мочи, чтобы исключить анурическую или олигурическую почечную недостаточность. Это зачастую требует вживления мочевого катетера, обеспечивающего точное изме
456
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
рение продукции с одночасовыми интервалами. На основании результатов определения концентрации кортизола в плазме крови, полученных в провокационной пробе с АКТГ, назначают дополнительную гормональную терапию минералокортикоидами или глюкокортикоидами (см. рис. 8-12).
Выбор жидкости. Жидкостью выбора для внутривенной инфузии является нормальный физиологический раствор (0,9%-ный раствор хлористого натрия, который помогает корректировать гиповолемию, гипонатриемию и гипохлоремию, а также увеличивает объем внутрисосудистой жидкости, улучшает кровяное давление и перфузию тканей). Коррекция гиперкалиемии осуществляется благодаря простому разбавлению внутрисосудистой
жидкости (так как вводимый раствор не содержит калия), а также вследствие улучшения почечной перфузии и клубочковой фильтрации. В принципе, введение жидкостей, содержащих калий, противопоказано, однако оно проводится, если нет более подходящего материала для внутривенной инфузии. Обычный и обогащенный лактатом рингеров-ские растворы содержат небольшое количество калия (4 мэкв/л). Их введение животным с гиперкалиемией приводит к уменьшению концентрации калия в плазме крови благодаря эффекту разбавления и усилению почечной перфузии. При наличии анурии назначают терапию дофамином или другими средствами. Как указывалось ранее, после достижения нормальной или близкой к ней концент
Рис. 8-12. Алгоритм неотложной (в условиях криза) терапии собак (или кошек) с подозрением на гипокортицизм.
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 457
рации сывороточных электролитов рекомендуется инфузия рингеровского раствора.
При выявлении гипогликемии или подозрении на нее к жидкости для внутривенной инфузии добавляют 50%-ный раствор глюкозы с целью получения конечного 5%-ного раствора декстрозы. Присутствие декстрозы в изотонической инфузионной жидкости дает гипертонический раствор, который лучше вводить в яремную, а не в более мелкую краниальную вену. Вживление катетера в яремную, а не в краниальную или подкожную вену более целесообразно и для измерения центрального венозного кровяного давления. Следует подчеркнуть, что внутривенное введение нормального физиологического раствора является важнейшим компонентом всего терапевтического режима (см. рис. 8-12).
Глюкокортикоиды
В состоянии аддисонова криза для обеспечения собак глюкокортикоидами мы рекомендуем внутривенно вводить раствор дексаметазона или его натрий-фосфатной соли в дозах от 0,5 до 2,0 мг/кг, повторяя инфузию через каждые 2-6 часов. Для внутривенного вливания используют также натрия сукцинат метилпреднизолона, который вводят в дозе 1-2 мг/кг и инфузию также повторяют каждые 2-6 часов. В качестве альтернативы используют гидрокортизона хемисукцинат или гидрокортизона фосфат в дозах от 2 до 4 мг/кг, которые вводят внутривенно в течение 2-4 минут, повторяя инфузию через каждые 8 часов. Натрия сукцинат гидрокортизон следуют вводить со скоростью 0,5-0,625 мг/кг/час. Такая инфузия обеспечивает требуемую концентрацию кортизола в крови собак, однако неизвестно, обеспечивает ли она адекватную минералокортикоидную активность (Church et al, 1999). Провокационную пробу с АКТГ проводят до начала введения глюкокортикоидов (см. рис. 8-12).
Внутривенная инфузия жидкости является достаточным терапевтическим средством в первые часы (до завершения ответа АКТГ). Если глюкокортикоидная терапия исходно включала введение быстродействующего, растворимого в воде препарата, то в последующем рекомендуется использовать дексаметазон. Его начальная доза для внутривенной инфузии может составлять 0,5-1 мг/кг, а в последующем инфузию дополняют введением дексаметазона в дозах 0,05-0,1 мг/кг два или три раза в день. Это обеспечивает непрерывное поступление в организм собаки требуемого количества глюкокортикоида до тех пор, пока не появится возможность безопасно перевести ее на пероральную терапию (см. табл.8-17).
Нарушение баланса электролитов
Идентификация. Прямое измерение концентрации электролитов в сыворотке крови является специфическим и чувствительным методом диа
гностики гиперкалиемии и гипонатриемии. Быстрым альтернативным способом выявления тяжелой гиперкалиемии (наиболее опасного нарушения электролитного баланса) служит ЭКГ (см. рис. 8-7). Отсутствие зубца Р в сочетании с низкой частотой сердечных сокращений может свидетельствовать о тяжелой гиперкалиемии. Наличие такой аномалии на электрокардиограмме означает, что концентрация калия в крови превышает 7,5 мэкв/л. Необходима дифференциальная диагностика в первую очередь от фибрилляции предсердия, которая обычно ассоциируется с тахикардией в отсутствие рвоты или диареи. В то же время и надпочечниковая недостаточность, и фибрилляция предсердий сопровождаются общей слабостью, сонливостью, анорексией и уменьшением веса тела.
Введение солевого раствора. При концентрациях калия ниже 6,5 мэкв/л следует с особой осмотрительностью подходить к назначению терапии, а при его концентрациях выше 7,5 мэкв/л собакам и кошкам рекомендуется интенсивное лечение. В случаях тяжелой гиперкалиемии быстрое начало терапии может спасти животное. Внутривенная инфузия нормального 0,9%-ного физиологического раствора является надежным способом быстрого снижения концентрации калия в крови. Практически все собаки, которых мы лечили в состоянии острой недостаточности функции коры надпочечников, получали нормальный 0,9%-солевой раствор (содержавший глюкозу или без нее) в течение первого часа. Такой подход, сам по себе, приводил к быстрому улучшению клинических и биохимических показателей, а также ЭКГ. Внутривенная инфузия физиологического раствора быстро устраняла угрожавшие жизни осложнения гипокортицизма, такие как гипонатриемия, гипохлоремия, гиповолемия, гипотензия, гиперкалиемия или азотемия.
Практическая терапия. Быстрая внутривенная инфузия солевого раствора (с глюкозой и/или бикарбонатом либо без них) в течение первого часа после начала терапии неизменно приводит к улучшению клинического состояния собак благодаря увеличению объема крови, кровяного давления и концентрации сывороточного натрия с одновременным уменьшением концентрации калия и нормализацией ЭКГ. Концентрация калия в крови понижается благодаря эффекту разбавления солевым раствором (не содержащим калия) и улучшению перфузии почек. Усиление почечного кровотока еще больше способствует высвобождению калия в мочу. При проведении инфузионной терапии с применением бикарбоната натрия повышается уровень натриемии и усиливается поступление ионов калия во внутриклеточное пространство. Нам не приходилось использовать инсулин или кальций для лечения собак в состоянии острой надпочечниковой недостаточности.
Минералокортикоидная терапия
Общие сведения. В дополнение к внутривенной инфузии жидкости, содержащей либо не содержа
458 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
щей глюкозу и/или бикарбонат натрия, для поддержания электролитного равновесия необходимо вводить минералокортикоиды. Мы начинаем минералокортикоидную терапию сразу после завершения провокационной пробы с АКТГ.
Дезоксикортикостерона пивалат (ДОКП). Этот препарат рекомендуется для проведения поддерживающей терапии у собак и кошек с гипокортицизмом. Мы используем дозу 2,2 мг/кг веса тела, которую вводим внутримышечно или подкожно с интервалами в 25 дней. При неотложной терапии гипокортикоидного криза внутримышечные инъекции ДОКП являются высоко эффективным и надежным средством. При внутримышечных инъекциях ДОКП одновременно с внутривенной инфузией нормального солевого раствора удавалось в течение 6-24 часов нормализовать электролитный баланс практически у всех собак с гипокортицизмом. Отрицательных побочных эффектов ДОКП при этом ни разу не наблюдалось. Естественная защита в случаях передозировки обеспечивается секрецией натриуретического пептида предсердия (Ramsay, 1991; Chow et al, 1993; Kaplan, Peterson, 1995). Таким образом, в случаях тяжело больных собак с подозрением на гипокортицизм настоятельно рекомендуется внутривенное вливание жидкости в сочетании с внутримышечными инъекциями ДОКП.
Гидрокортизон. Кортизол для инъекций (гидрокортизона хемисукцинат или гидрокортизона фосфат) служит надежным средством терапии гипокортикоидного криза у людей. Кортизол для инъекций представляет собой глюкокортикоид, обладающий достаточно сильно выраженной способностью удерживать натрий и компенсировать минералокортикоидную недостаточность (Tyrrell et al, 1991). Основываясь на имеющемся опыте использования гидрокортизона хемисукцината у людей, мы вводили этот препарат нескольким собакам с гипокортицизмом.
Рекомендуемая начальная доза гидрокортизона для собак составляет 1,25 мг/кг веса и вводится внутривенно, после чего препарат продолжают вводить тем же способом в количестве 0,5-1,0 мг/кг через каждые 6 часов. На второй день дозу снижают до 0,1-0,25 мг/кг 4 раза в день, а затем до 0,1-0,25 мг/кг перорально дважды в день. Одновременно по показаниям вводят минералокортикоид (см. раздел, посвященный долгосрочной терапии). У нас нет уверенности, что действие минералокортикоидов при их одновременном введении с гидрокортизоном, наблюдавшееся у людей, столь же устойчиво воспроизводится у собак. Мы наблюдали более выраженную минералокортикоидную активность при использовании ДОКП и глюкокортикоидную активность при использовании дексаметазона.
Флюдрокортизона ацетат (флоринеф). Этот препарат обычно применяют для долгосрочной поддерживающей терапии у собак с гипокортицизмом. Хотя у собак этот препарат всасывается медленнее, чем у людей, он обладает сравнительно сильно вы
раженной минералокортикоидной активностью. Тем не менее, флоринеф редко используют для устранения гипокортикоидного криза. Он выпускается только в таблетированной форме, а животные, которым показано его введение, обычно слишком тяжело больны (в частности, страдают рвотой или притуплением чувствительности), чтобы получать пероральные препараты. В кризисных ситуациях в качестве минералокортикоида следует использовать ДОКП для инъекций.
Лечение глюкозой и инсулином. В тех редких случаях, когда инфузия нормального 0,9%-ного физиологического раствора не обеспечивает достаточно быстрого снижения концентрации калия в сыворотке крови и велика опасность гибели животного вследствие гиперкалиемии, для снижения уровня калия дополнительно внутривенно вливают 10%-ный раствор глюкозы. В течение первых 30-60 минут его вводят в количестве 4-10 мл/кг, обычно одновременно с физиологическим раствором. Включение глюкозы в клетки сопровождается поступлением в них калия из внутрисосудистых жидкостей.
Подкожная или внутривенная инфузия обычного (кристаллического) инсулина в дозах от 0,06 до 0,125 ЕД/кг веса тела усиливает включение глюкозы в клетки. Во избежание гипогликемии на каждую единицу обычного инсулина необходимо вводить, по меньшей мере, 20 мл 10%-ного раствора глюкозы. Несмотря на то, что такой подход действительно позволяет снизить концентрацию калия в крови, наш опыт свидетельствует о достаточной эффективности внутривенного вливания одного физиологического раствора без привлечения дополнительных терапевтических средств. Мы не используем ни глюкозу, ни глюкозу в комбинации с инсулином для лечения собак и кошек с недостаточностью функции коры надпочечников.
Лечение кальцием. Для устранения острой гиперкалиемии рекомендуется внутривенная инфузия 10%-ного раствора кальция глюконата. Его медленно вводят из расчета 0,5-1,0 мг/кг веса тела на протяжении 10-20 минут, что обеспечивает «защиту» миокарда от разрушающего действия гиперкалиемии. Это, в свою очередь позволяет выиграть время для использования других терапевтических средств, снижающих концентрацию калия. Во время инфузии кальция необходимо непрерывно контролировать работу сердца с помощью ЭКГ. При появлении любых признаков аритмии введение кальция прекращают. Однако и в этом случае наш опыт показывает, что желаемый клинический эффект может быть получен с помощью введения только физиологического раствора без привлечения дополнительных терапевтических средств.
Лечение бикарбонатом натрия. Как будет показано ниже, бикарбонат натрия также можно использовать для снижения концентрации калия в сыворотке крови. Комбинированная инфузия бикарбоната натрия и 0,9%-ного нормального физиологического раствора, содержащего декстрозу
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 459
в количестве, достаточном для получения 5%-ного раствора глюкозы, применяется для неотложного устранения тяжелой гиперкалиемии у животных с недостаточностью функции коры надпочечников.
Ацидоз
Необходимость терапии. У собак в состоянии гипокортикоидного криза обычно имеет место слабый метаболический ацидоз, при котором терапия бикарбонатом натрия не требуется. При более тяжелом ацидозе показано добавление бикарбоната в жидкость для внутривенного вливания.
Инфузионная терапия сама по себе устраняет слабый ацидоз благодаря коррекции гиповолемии, улучшению тканевой перфузии и клубочковой фильтрации. Обычно она не дополняется введением экзогенного бикарбоната натрия до тех пор, пока концентрация эндогенного бикарбоната в сыворотке не опустится ниже 12 мэкв/мл. Если невозможно провести газовый анализ артериальной крови, то для оценки недостатка оснований измеряют концентрацию СО2 в венозной крови и полученную величину вычитают из нормального значения этого показателя (приблизительно 22 мэкв/л). До проведения газового анализа крови у тяжело больных собак и кошек дефицит оснований можно принять равным 10 мэкв/л. Тогда количество бикарбоната натрия в миллиэквивалентах, необходимое для коррекции ацидоза, определяют, используя следующее уравнение:
Дефицит (мэкв/л) =
(вес тела в кг) (0,3) (дефицит оснований).
Собаки и кошки с аддисоновой болезнью далеко не всегда нуждаются в полной заместительной дозе бикарбоната натрия. Обычно рекомендуется добавлять в жидкость для внутривенной инфузии 25% расчетной дозы, вводя ее в течение первых 6-8 часов терапии. По истечении этого срока повторно оценивают кислотно-щелочной баланс животного. Собакам редко приходится парентерально вводить дополнительное количество бикарбоната. Мы не рекомендуем опрометчивое применение бикарбоната натрия. Его не следует использовать, когда общая концентрация СО2 в венозной крови или концентрация бикарбоната в сыворотке крови превышает 12 мэкв/л.
Дополнительные преимущества терапии бикарбонатом. Внутривенное введение бикарбоната натрия не только помогает корректировать метаболический ацидоз, но позволяет также повысить концентрацию натрия в крови, одновременно понижая уровень гиперкалиемии. Бикарбонат служит буфером водородных ионов, уменьшает их внутриклеточную концентрацию, повышает внутриклеточную концентрацию калия и таким образом приводит к уменьшению его внеклеточной концентрации (рис. 8-13).
Ответ на терапию
Первые несколько часов. Практически у всех собак с гипокортицизмом, которые сначала (на протяжении нескольких первых часов) получают внутривенную инфузию жидкости, а затем глюкокортикоиды и минералокортикоиды, клиническое
Рис. 8-13. Перераспределение водородных ионов и калия во внеклеточной ((внеКЖ) и внутриклеточной ((внуКЖ) жидкостях в ответ на изменение pH внеКЖ. Алкалоз: 1 — Уменьшение концентрации Н+; 2 - Ионы Н+ выходят из клеток вдоль нисходящего градиента их концентрации, а К~ поступают в клетки, обеспечивая поддержание электронейтральности; 3 — Это способствует развитию гипокалиемии, ассоциирующейся с алкалозом. Ацидоз: 1 — Увеличение концентрации Н+; 2 — Н+ поступают в клетки вдоль нисходящего градиента их концентрации, a IC выходит из клеток, обеспечивая поддержание электронейтральности; 3 — Это вызывает сдвиг электролитного баланса и приводит к гиперкалиемии, ассоциирующейся с ацидозом. Размер стрелок отражает степень изменения по сравнению с нормой. (Из: Gabow Р: In Schrier RW (ed): Renal and Electrolyte Disorders. Boston, Little Brown & Co., 1976).
460 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
состояние быстро улучшается. В течение первых двух часов агрессивной инфузионной терапии у животных нередко восстанавливается способность стоять и ходить, даже если до этого они выглядели чрезвычайно ослабленными. У них очень быстро возобновляется желание общаться с хозяевами, появляется интерес к окружающему миру, нормальная потребность есть и пить. Как правило, результаты ЭКГ, определения концентрации электролитов и азота мочевины в крови хорошо коррелируют с полной или частичной нормализацией клинической картины. Наличие реакции на инфузионную терапию, само по себе, является показателем недостаточности функции коры надпочечников и служит подтверждением соответствующего диагноза, потому что при большинстве других заболеваний собак (тяжелых почечных, печеночных и желудочно-кишечных расстройствах) не происходит столь резко выраженной нормализации клинических признаков и биохимических показателей.
Первые 24-48 часов. Если результаты первоначального обследования собаки предполагают, что она находится в критическом состоянии и ставится предварительный диагноз гипокортицизма, то внутривенное введение жидкости необходимо продолжать в течение, по меньшей мере, 48 часов. Корм и воду в этом случае предлагают собаке не ранее 24 часов после начала терапии даже при выраженном улучшении ее клинического состояния. Если животное адекватно отвечает на инфузионную терапию в первые сутки после ее начала, скорость введения жидкости по истечении этого срока следует уменьшить на 50%. Одновременно животному позволяют пить небольшими порциями каждые 1-2 часа.
Первые 2-7 дней
Жидкости. Если на протяжении первых суток после начала агрессивной инфузионной терапии и поддерживающего введения гормонов у собаки отсутствует рвота, ей каждые несколько часов дают небольшое количество воды. Если животное не отказывается пить, а рвота отсутствует в течение еще 12 часов, ему предлагают корм, также небольшими порциями, одновременно продолжая уменьшать объем вводимой внутривенно жидкости. Обычно мы даем собакам смесь обезжиренного творога и вареного риса в соотношении 50:50 или 25:75. В отсутствие рвоты на протяжении 12-24 часов после приема пищи можно отменить внтуривенную инфузию.
В случае возобновления рвоты следует прекратить пероральный прием любых продуктов и снова начать внутривенное введение жидкости в количествах, эквивалентных «поддерживающему» объему или превышающих его. Если же рвота отсутствует, но у собаки нет аппетита и/или она отказывается пить, то продолжение инфузионной терапии должно обеспечить нормальный уровень гидратации. После достижения последнего собаке снова дают корм и/или воду каждые 12-24 часа, пока у нее не восстановится нормальный аппетит. Следует попы
таться выяснить причину замедленного выздоровления животного. Чаще всего у таких собак имеются желудочно-кишечные (язвы, кровотечения) или почечные (азотемия) расстройства, которые в дальнейшем исчезают.
Глюкокортикоиды. Ежедневные внутривенные инъекции дексаметазона (в форме растворов для внутривенного или подкожного введения) следует продолжать до тех пор, пока животное не начнет нормально есть и пить и пока не появится возможность перевести его на пероральную терапию преднизоном без риска ухудшения состояния. Мы применяем дексаметазон в дозах 0,01-0,05 мг/кг дважды в день. Введение преднизона обычно начинаем в дозе примерно 0,22 мг/кг также два раза в день. Эту дозу постепенно уменьшаем с тем, чтобы установить потребность данной особи в этом препарате для долгосрочной терапии. Обычная ежедневная доза поддерживающей терапии для собаки весом 20 кг составляет от 1,25 мг до 2,5 мг.
Минералокортикоиды. Если в качестве минералокортикоида используется ДОКП, необходимо повторно определять концентрацию электролитов в сыворотке через 12 или 25 дней после очередного введения препарата, а следующую инъекцию производить спустя 25 дней после предыдущей. На основании полученных результатов проводят коррекцию дозы и частоты введения ДОКП. В случае использования флюдрокортизона ацетата для перорального применения его вводят в дозе приблизительно 0,02 мг/кг два раза в день ежедневно (сведения об этих двух препаратах приводятся в разделе, посвященном долгосрочной терапии).
Общие положения. После прекращения инфузионной терапии собака должна оставаться в стационаре под наблюдением специалиста на протяжении, по меньшей мере, 24-48 часов. По истечении этого срока, если состояние животного в условиях пероральной терапии остается удовлетворительным, его возвращают хозяину, продолжая наблюдение в течение еще 7-14 дней. При этом проводят полное физикальное исследование, ЭКГ и анализы крови, включая определение концентраций AM, глюкозы, натрия и калия. В случае нормальных результатов анализов и физикального исследования дальнейший контроль состояния животного проводят ежемесячно на протяжении следующего полугодия, а потом один раз в 3-6 месяцев.
Сопутствующие проблемы
Недостаточность глюкокортикоидов. У собак с гипокортицизмом, получающих только минералокортикоидные препараты (ДОКП), могут развиваться слабо выраженные расстройства в форме потери аппетита, сонливости и депрессии, которые сразу привлекают внимание хозяев. Общий анализ крови не всегда позволяет установить причину этих слабых реакций на терапию, поскольку концентрация электролитов в сыворотке и показатели почеч
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 461
ной функции остаются нормальными, хотя общее состояние животного внушает опасение его владельцу. В отличие от флоринефа, ДОКП не обладает глюкокортикоидной активностью. Значительное клиническое улучшение обычно достигается назначением, дополнительно к минералокортикоиду, низких доз преднизона (0,22 мг/кг дважды в день) на протяжении 2-4 недель.
Отсутствие эффекта глюкокортикоидной терапии предполагает множество других причин описанных слабых расстройств. К их числу относятся вяло текущие нарушения функции желудочно-кишечного тракта и почек. Нормализация состояния собак и кошек с тяжелой анемией порой занимает несколько недель. То же самое относится к животным с сильно выраженной мышечной слабостью и потерей веса. В связи с этим иногда требуется дополнительное время для достижения желаемого эффекта терапии, хотя основные показатели состояния животных нормализуются гораздо раньше. При правильном проведении лечения наступает полное выздоровление животного, что и является целью терапии.
Желудочно-кишечные кровотечения/анемия. У собак с гипокортицизмом обычно имеются желудочно-кишечные расстройства, в том числе анорексия, рвота и диарея. В таких случаях в рвотных массах и кале обнаруживают большое количество крови, либо свежей, либо измененной под воздействием кишечных соков (мелена). При болезни Аддисона у некоторых животных развиваются тяжелые язвы желудочно-кишечного тракта, что продлевает период выздоровления; иногда язвы сопровождаются сильной кровопотерей. Изредка возникает необходимость в переливании крови, что подтверждает потенциальную опасность описываемых нарушений. В связи с этим рекомендуется воздерживаться от назначения собакам с болезнью Ад дисона лекарственных средств, способных спровоцировать образование язв (Medinger et al, 1993). У некоторых животных происходит дальнейшее ухудшение состояния, приводящее к диссеминированному внутрисосудистому свертыванию крови (ДВСК, или так называемое «приближение смерти»). Это обстоятельство лишний раз подчеркивает необходимость агрессивного лечения собак с подозрением на наличие аддисоновой болезни.
Почечное заболевание. Нарушения показателей почечной функции является классическим сопутствующим признаком болезни Аддисона. Они развиваются как следствие гиповолемии, гипотензии и недостаточной почечной перфузии. Показатели функции почек обычно быстро нормализуются под воздействием терапии - коррекция достигается в течение 2-48 часов после ее начала. Тяжелая и/или хроническая аддисонова болезнь может вызывать поражение почек, которое сохраняется в течение длительного времени, но редко переходит в хроническое заболевание. Кроме того, при желудочно-кишечном кровотечении концентрация AM в крови
возрастает в большей степени, чем концентрация креатинина. Поэтому одновременная оценка обоих этих параметров позволяет ветеринару судить о степени нарушения функции почек и тяжести желудочно-кишечного кровотечения. В последнем случае концентрация AM иногда повышается на фоне нормальной концентрации креатинина либо отношение концентраций AM и креатинина превышает 20:1.
Гепатопатия. Были описаны собаки с аддисоновой болезнью и одновременной гепатопатией. Неизвестно, вызваны ли оба заболевания сопутствующим аутоиммунным расстройством. В процессе лечения аддисоновой болезни признаки гепатопа-тии постепенно исчезают.
В условиях применения глюкокортикоидов невозможно сколько-нибудь длительное сохранение заболевания печени, и большинство показателей ее функции нормализуются в течение 1-2 месяцев после начала лечения аддисоновой болезни.
Неврологические расстройства. Имеется сообщение о демиелинизации нервного волокна у двух собак с тяжелой гипонатриемией вследствие заражения власоглавом. Высказано предположение, что демиелинизация была обусловлена избыточной терапией гипонатриемии (O’Brien et al, 1994). У собак с аддисоновой болезнью это расстройство не зарегистрировано. Во всяком случае, описанный уровень коррекции гипонатриемии не может считаться слишком высоким, напротив, он ниже рекомендуемого нами.
ДЛИТЕЛЬНАЯ (ПОДДЕРЖИВАЮЩАЯ) ТЕРАПИЯ СОБАК С ПЕРВИЧНЫМ ГИПОКОРТИЦИЗМОМ
Назначение
Поддерживающую терапию назначают после того, как состояние собаки или кошки нормализуется в результате парентерального лечения. Животное должно иметь хороший аппетит в отсутствие диареи, рвоты, слабости и депрессии. Кроме того, концентрация электролитов в сыворотке должна оставаться в нормальных пределах. Ветеринар и владелец животного имеют возможность выбрать альтернативные способы долгосрочной минералокортикоидной терапии: либо инъекции один раз в 25 дней, либо ежедневное пероральное введение препарата (табл. 8-18).
Минералокортикоиды
Инъекции дезоксикортикостерона (ДОКП) каждый 25-ый день. ДОКП (перкортен-V, производства Novartis Animal Health, США) представляет собой триметилацетат дезоксикортикостерона в форме микрокристаллической суспензии, обладающий пролонгированным действием. При внутримышечных инъекциях ДОКП сохраняет минерало-
462 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
Рис. 8-14. Биохимические параметры сывороток 60 собак, получавших дезоксикортикостсрона пивалат (ДОКП) внутримышечно для ючения i ипокортици 1ма. А. Верхний график — Концентрация натрия в сыворотке крови. Средний график — Концентрация калия в сыворотке крови. Нижний график — Концентрация азота мочевины в крови. Б. Биохимические параметры сывороток девяти собак, получавших ДОКП для лечения вновь диаг ностированного гипокортицизма. Верхний, средний и нижний графики показывают изменения тех же параметров, что в А. Заштрихованные области - диапазон нормальных концентраций соответствующих параметров. Результаты представлены в виде средних величин ± SD. Из: Lynn R et al: J Am Vet Med Assoc, 202:392, 1993.
ТАБЛИЦА 8-18. ДОЛГОСРОЧНАЯ ТЕРАПИЯ ПЕРВИЧНОЙ НЕДОСТАТОЧНОСТИ ФУНКЦИИ КОРЫ НАДПОЧЕЧНИКОВ
М и нералокортикоид Глюкокортикоиды
Минералокортикоид
Гл юкокорти кои д
Гидрокорги юн
Флюдрокортизон
Дезоксикортикостсрона пивалат для инъекций, ежемесячные внутримышечные или подкожные инъекции в дозе приблизительно 2 мг/кг
Преднизон по показаниям: 2,5-10 мг ежедневно или через день
Или
Приблизительно 0,1 мг флюдрокортизона на 5 кт веса тела (это количество делится на две ежедневные дозы)
Преднизон по показаниям: 2,5-10 мг ежедневно или через день
Или
Приблизительно 0,125 мг/кг веса тела ежедневно (3/4 или 2/3 общего количества в первой половине дня, а остальное - во второй)
По показаниям: приблизительно 0,05 мг на 5 кг веса тела (это количество делится на две ежедневные дозы)
Дозы вводимых перорально минералокортикоидов делят на две части, чтобы предотвратить рвоту, гак как единовременное введение общей дозы вызывает острые желудочно-кишечные расстройства Клинические наблюде- Повторяют каждые 3-6 месяцев
ния
Введение соли 11ериоды стресса
Поддерживают нормальные вес и активность животного
Поддерживают нормальную концентрацию электролитов и AM в крови Дополнительное введение соли в рацион собак нс требуется
Увеличивают дозу глюкокортикоидной терапии
Важнейшее значение имеет обучение хозяев живо!ны\ - »
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 463
Рис. 8-15. Биохимические параметры сывороток: концентрации натрия (А), калия (Б) и азота мочевины в крови (В) у 12 собак, получавших ДОКП для лечения гипокортицизма. Отдельно показаны средние (± разброс) величины для животных с впервые (пунктирные кривые) и ранее (сплошные кривые) установленным диагнозом. Нормальные значения показаны сплошными горизонтальными прямыми линиями. Отклоняющиеся значения обозначены квадратными значками (для собак с впервые установленным диагнозом) и точками (для собак с ранее установленным диагнозом) выше и ниже границ соответствующего диапазона. На 75 день у одной собаки имела место гиперкалиемия, на 64 и 75 дни у нее же зарегистрирована азотемия. Эти нарушения были устранены введением ДОКП с интервалами в 21 вместо 25 дней.
кортикоидную активность на протяжении примерно 25 дней. До начала 1950-ых годов, т.е. до появления флюдрокортизона для перорального введения, ДОКП применяли при лечении аддисоновой болезни у людей. Рекомендуемая начальная доза для собак составляет 2,2 мг/кг, ее вводят внутримышечно или подкожно один раз в 25 дней (см. табл. 8-18 и рис. 8-14 и 8-15) (Lynn, Feldman, 1993; McCabe et al, 1995). Владельцы животных, как правило, обучаются самостоятельно вводить препарат, причем основное внимание следует обращать на строгое соблюдение протокола подкожных инъекций. Терапия ДОКП обычно дополняется низкими дозами глюкокортикоидов (0,22 мг преднизона/кг дважды в день в качестве начальной дозы).
Некоторые авторы рекомендуют начинать терапию низкими дозами ДОКП (приблизительно 1,7 мг/кг каждый 25-й день) вопреки рекомендации изготовителя вводить препарат в количестве 2,2 мг/кг раз в 25 дней (Kintzer, Peterson, 1997). Единственным основанием для такого подхода может быть желание уменьшить расходы на лечение. Однако наш опыт свидетельствует о том, что соблюдение
рекомендаций компании-производителя обеспечивает устойчивую нормализацию уровня электролитов в сыворотке крови. Несмотря на достаточно хороший терапевтический эффект низких доз ДОКП у отдельных собак, единственный эпизод заболевания вследствие применения заниженных доз может свести на нет экономию денежных средств.
Мониторинг. Состояние всех животных, получающих ДОКП, необходимо контролировать, используя данные анамнеза, физикального исследования и определения концентрации натрия, калия и AM в крови. Повторные оценки следует проводить примерно через 12 и 25 дней после каждой из первых двух или трех инъекций ДОКП. Целью терапии является нормализация параметров крови и полное выздоровление животного. Повторные оценки его состояния через 12, а также через 40 дней служат для определения адекватности дозы препарата. Если она не приводит к нормализации уровня электролитов, следующую дозу ДОКП необходимо увеличить на 5 или 10% по сравнению с предыдущей. Однако такое случается очень редко, поэтому ветеринар должен проверить тщательность перемеши
464 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
вания материала для инъекций и/или правильность набора в шприц требуемого количества препарата хозяином животного.
Проверки через 25 и 50 дней имеют целью оценить адекватность частоты инъекций. В маловероятной ситуации, когда определение концентрации сывороточных электролитов дает нормальный результат через 12 дней после инъекции и аномальный спустя 25 дней, следует сократить интервал между инъекциями. Если же концентрация электролитов остается в нормальных пределах на протяжении всех 25 дней, можно попытаться увеличить интервал между инъекциями ДОКП на 1 день в каждом последовательном цикле. Однако наш опыт, основанный на лечении 175 собак, показывает, что введение ДОКП раз в месяц дает хорошие результаты менее чем у 10% животных.
После подбора подходящей дозы ДОКП рекомендуется дважды в год контролировать эффективность терапии. Это позволяет владельцу следить за состоянием животного и предоставлять ветеринару необходимые для мониторинга данные. Например, изменение веса тела собаки может служить основанием для коррекции дозы ДОКП.
ДОКП представляет собой минералокортикоид, практически лишенный глюкокортикоидной активности. Поэтому всем собакам и кошкам, получающим этот препарат, рекомендуется дополнительно вводить глюкокортикоид в качестве компонента поддерживающей терапии. Ветеринару настоятельно рекомендуется назначать для этой цели физиологическую дозу глюкокортикоида. В частности, дозировки, используемые для подавления иммунной системы или воспалительного процесса, значительно превосходят потребность в глюкокортикоидах у собак и кошек с аддисоновой болезнью.
Преимущества. ДОКП является высокоэффективным препаратом. Практически у всех получавших его собак (мы сами лечили 175 животных и участвовали в исследованиях, включавших еще более 100 собак) концентрация натрия и калия в сыворотке крови нормализовалась ко времени первой оценки их состояния через 12 дней после инъекции (см. рис. 8-14). В большинстве случаев лечение начинали с рекомендуемой исходной дозы ДОКП и не изменяли ее на протяжении последующего многолетнего периода терапии, если не считать ее коррекции в связи с приростом веса тела, который обычно отмечается при лечении животных с аддисоновой болезнью. Зарегистрирован единственный случай небольшой передозировки препарата, однако полидипсия и полиурия прекратились после уменьшения дозы.
Хозяева собак не испытывали затруднений при подкожном введении ДОКП раз в 25 дней. При этом затраты на лечение были меньше или сопоставимы с расходами на пероральную терапию. Побочные эффекты, подобные наблюдавшимся при использовании флюдрокортизона, отсутствовали. Случаи полидипсии, полиурии и недержания мочи обычно были
обусловлены передозировкой преднизона, и снижение его дозы быстро снимало эти расстройства.
Недостатки. Как и в большинстве случаев заместительной гормональной терапии, дозировки ДОКП могут быть разными. Дозу ДОКП необходимо подбирать, исходя из потребностей каждой особи. Рекомендуемая доза давала хороший эффект у 58 из 60 первых собак, которым вводили этот препарат. Однако у двух животных та же доза обеспечивала желаемый терапевтический эффект только в течение 22 или 23 дней, после чего у них появлялись признаки гипокортицизма. Сокращение интервала между инъекциями до 21 дня давало требуемый клинический результат (Lynn et al, 1993).
В группе из 175 находившихся под нашим наблюдением собак терапия ДОКП оказалась безуспешной в двух случаях. В последующем состояние этих животных удалось контролировать пероральным введением флюдрокортизона. «Неудачи» столь редки, что мы склонны приписывать их некачественному смешиванию материала для инъекций и/ или нарушению техники инъекции. Поэтому следует обучать владельцев животных правилам смешивания, набора препарата в шприц и его введения. Хозяину собаки или кошки, не имеющему таких навыков, приходится всякий раз обращаться за помощью к ветеринару для проведения инъекций, что является явным недостатком по сравнению с пероральной терапией.
Ежедневная пероральная терапия с использованием флюдрокортизона ацетата
Дозировки. Флюдрокортизона ацетат (флоринеф, E.R. Squibb & Sons, США) чаще всего применяется для лечения гипокортицизма у людей (Tyrrell et al., 1991). Для терапии гипокортицизма у собак он используется уже более 20 лет (Feldman, Nelson, 198). В каждой таблетке содержится 0,1 мг минералокортикоида. Рекомендуемая начальная доза составляет 0,01 мг/кг в день, которую дают в два приема ежедневно. Собаке со средним весом 20 кг каждый день требуется 6 таблеток (см. табл. 8-18). Интересно, что доза флюдрокортизона для людей с аддисоновой болезнью составляет в среднем 0,05-ОД мг (по полтаблетки в день). Поскольку человеку требуется значительно меньшая доза этого препарата, чем собаке, предполагается, что у животных флюдрокортизон либо плохо всасывается, либо быстрее метаболизируется.
Мониторинг. В начальном периоде терапии концентрацию электролитов в сыворотке крови измеряют каждые 1-2 недели, пока состояние животного не стабилизируется. Задача терапии состоит в поддержании уровня электролитов в пределах нормального диапазона. Повторные оценки состояния включают физикальное исследование, наблюдение за ходом выздоровления и анализ сывороток на содержание натрия, калия и AM (концентрация AM используется для грубой оценки объема крови и тканевой перфузии). Такое обследование проводят
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 465
два или три раза в году. По возможности рекомендуется также контролировать системное кровяное давление.
Наш опыт показывает, что часто приходится несколько увеличивать дозы флюдрокортизона ацетата в течение первых 6-18 месяцев терапии. Такая коррекция позволяет компенсировать продолжающееся разрушение коры надпочечников либо изменение характера всасывания и/или обмена препарата. Впоследствии доза флюдрокортизона обычно уже не меняется.
Преимущества. Главным преимуществом использования таблетированного препарата является простота обнаружения и коррекции неправильной дозировки благодаря легкости изменения режима его ежедневного введения. Большинству владельцев собак не составляет труда соблюдать такой режим терапии. Кроме того, необходимость ежедневного введения лекарства служит постоянным напоминанием хозяину, что у его питомца имеется серьезное, угрожающее жизни заболевание и что его существование зависит от поведения владельца. Препарат продается практически в любой обычной аптеке.
Недостатки. Терапия флюдрокортизона ацетатом для перорального применения имеет ряд серьезных недостатков. Этот препарат обладает не только выраженной глюкокортикоидной, но и минералокортикоидной активностью, что затрудняет подбор правильной дозы. Глюкокортикоидная активность таит в себе опасность передозировки и индукции соответствующих клинических нарушений, тогда как минералокортикоидное действие флюдрокортизона препятствует нормализации уровня электролитов. По этой причине у некоторых собак развиваются клинические симптомы, характерные для ятрогенного синдрома Кушинга (в частности, полидипсия, полиурия и недержание мочи) на фоне аномальных концентраций натрия и калия в крови. При выборочной оценке концентрации сывороточных электролитов у 51 собаки в условиях адекватного контроля состояния животных флюдрокортизоном мы фиксировали гипонатриемию, гиперкалиемию и/или пониженную величину отношения натрия и калия в сыворотках крови у 84% особей. Кроме того, гораздо более высокие дозы флюдрокортизона ацетата, необходимые собакам по сравнению с людьми, значительно удорожают их лечение.
Нарушение концентрации электролитов в сыворотке может быть обусловлено несоблюдением предписанного режима терапии, введением неадекватного количества флюдрокортизона с целью снижения затрат на его приобретение, побочными эффектами, неудовлетворительным качеством мониторинга и просто незначительными колебаниями физиологической реакции животного. Осложнения возможны, когда целью терапии является нормализация концентрации электролитов в сыворотке крови. В этой ситуации дозы флюдрокортизона ацетата
могут увеличиваться до появления признаков избытка глюкокортикоидов, среди которых наиболее частыми являются полиурия, полидипсия и недержание мочи. Кроме того, по мере повышения дозы существенно возрастает стоимость лечения. Все эти недостатки устраняются переводом животного с терапии флюдрокортизоном на инъекции ДОКП. В таких случаях мы обычно начинаем вводить ДОКП на фоне постепенного уменьшения дозы флюдрокортизона ацетата на протяжении первых 4—5 дней. Действие ДОКП проявляется очень быстро (в течение нескольких часов), и мы не наблюдали рецидивов клинических симптомов, свидетельствующих о наличии гипокортицизма во время переходного периода.
Гидрокортизон. Нам не удалось получить хороших результатов при хроническом введении препаратов гидрокортизона собакам с гипокортицизмом (см. табл. 8-18).
Глюкокортикоиды
Общие лечебные мероприятия. Практически все собаки и кошки с аддисоновой болезнью, которых мы лечили препаратами ДОКП, одновременно получали небольшие количества преднизона. В то же время менее половины собак, получавших флюдрокортизона ацетат в качестве минералокортикоида, нуждались в заместительной глюкокортикоидной терапии. Состояние некоторых животных, которым вводили минералокортикоид, было не вполне удовлетворительным, однако, концентрация электролитов в сыворотке крови у них была в норме. В этих случаях введение минимальных доз преднизона или преднизолона (0,1-0,22 мг/кг дважды в день в начальном периоде) часто позволяло улучшить состояние животных. Их владельцы быстро замечали наступившее улучшение, причем стоимость лечения была невелика, а побочное действие столь низких доз незначительно (см. табл. 8-18).
Терапия стрессорных состояний: рабочие собаки; разведение. Некоторые собаки с аддисоновой болезнью являются «рабочими животными», т.е. используются для охоты или участвуют в полевых испытаниях. Обычно мы рекомендуем владельцам собак сохранять привычные для них формы активности. Однако владельцы должны помнить о необходимости более тщательного наблюдения за состоянием таких животных по сравнению со здоровыми животными, и при появлении признаков сильного утомления собакам надо дать отдохнуть. В день предстоящей физической нагрузки или стресса рекомендуется ввести собаке двойную дозу глюкокортикоида. Помимо прочих расстройств у нее может развиться гипогликемия. Риск подобных осложнений уменьшается в условиях дополнительной глюкокортикоидной терапии (Syme, Scott-Moncrief, 1998). Мы обычно не настаиваем на исключении собак с болезнью Аддисона из программ вязки.
466 • ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
Заместительное введение соли
Таблетированную соль или подсоленный корм редко используют для повышения эффективности контроля гипонатриемии. Большинство собак, получающих коммерческие пищевые рационы, не испытывают недостатка соли. Тем не менее, имеются сообщения о благотворном действии дополнительного заместительного введения соли (Schaer, 1980). Оно, в частности, позволяет уменьшить необычно высокие дозы флюдрокортизона. Мы обычно не рекомендуем заместительное введение соли.
ДЛИТЕЛЬНАЯ (ПОДДЕРЖИВАЮЩАЯ) ТЕРАПИЯ СОБАК С ВТОРИЧНЫМ ГИПОКОРТИЦИЗМОМ
Спонтанное заболевание
У собак с вторичным гипокортицизмом обычно отсутствуют признаки минералокортикоидной недостаточности, хотя концентрация альдостерона у некоторых из этих животных может быть ниже нормы. Ежедневное введение глюкокортикоидов в указанных выше дозах, как правило, бывает достаточно для контроля клинической симптоматики этого заболевания. Ветеринарный врач должен периодически (три или четыре раза в год) определять концентрацию электролитов в сыворотке крови у находящейся под его наблюдением собаки, потому что у отдельных животных с недостаточностью гипофизарной функции в конечном итоге развиваются гипонатриемия и гиперкалиемия. У таких собак имеет место первичная недостаточность функции коры надпочечников (Rogers et al, 1981; Sadek, Schaer, 1996; Dunnn, Heritage, 1998).
Ятрогенное заболевание: передозировка о,р’-ДДД
Собак с симптомами гипокортицизма после терапии о,р’-ДДД обычно успешно лечат глюкокортикоидами, хотя в большинстве случаев потребность в них носит лишь временный характер. Правильность диагноза подтверждается результатами провокационной пробы с АКТГ. Лечение таких собак рассматривается в разделе, посвященном гипокортикоидно-му кризу. Для исключения минералокортикоидной недостаточности следует контролировать концентрацию электролитов в сыворотке крови.
Ятрогенное заболевание: отмена хронической глюкокортикоидной терапии
В случае возникновения ятрогенной гипокортизоле-мии, вызванной резкой отменой хронически вводившихся глюкокортикоидов, ее устраняют повторным назначением глюкокортикоидной терапии. Для этой цели используют преднизон, количество которого постепенно уменьшают на протяжении 1-2 месяцев.
Мы обычно как можно быстрее (в течение недели) понижаем дозу глюкокортикоидов до физиологического уровня (приблизительно 0,25 мг/кг ежедневно). Если ее введение хорошо переносится животным в течение недели в отсутствие рецидивов клинической симптоматики, то препарат начинают вводить не ежедневно, а через день. Через две недели переходят на введение глюкокортикоида раз в три дня, а еще через 2 или 3 недели прекращают терапию. Если после очередного снижения дозы клинические симптомы рецидивируют, дозу повышают до предшествовавшей величины. Если же это не помогает устранить проявления заболевания, рекомендуется полная переоценка состояния животного.
ПРОГНОЗ
Прогноз гипокортицизма у собак вполне благоприятен независимо от выбора препарата для заместительной минералокортикоидной терапии, но необходимы объединенные усилия владельца и ветеринара при лечении больного животного. В этом случае жизнь собаки протекает нормально, лишь с небольшими ограничениями или даже без них. Самым важным фактором, определяющим эффективность долгосрочной терапии, является уровень знаний владельца животного. Ветеринар должен подробно рассказать ему о заболевании и предупредить о возможных последствиях кажущегося незначительным расстройства. Все владельцы должны иметь глюкокортикоидные препараты для введения собакам в случае стресса. Некоторые из них всегда держат под рукой быстродействующие глюкокортикоиды для парентерального применения в неотложных ситуациях. Ветеринар должен быть своевременно осведомлен о повышении потребности в глюкокортикоидах у собаки с гипокортицизмом, подвергающейся хирургической операции или другому стрессорному воздействию, а также при заболеваниях, не связанных с нарушениями функции коры надпочечников.
ГИПОКОРТИЦИЗМ У КОШЕК
Этиология
У кошек первичный гипокортицизм встречается редко. После первой публикации об этом заболевании у кошачьих в 1983 году, в ветеринарной литературе было описано меньше 40 новых случаев (Johnessee etal, 1983; Freudiger, 1986; Peterson et al, 1989; Berger, Reed, 1993; Parnell et al, 1999). Ятрогенный вторичный гипокортицизм может развиться как следствие длительного введения экзогенных глюкокортикоидов или мегестрола ацетата, хотя такое действие этих соединений отмечается довольно редко.
Встречаемость и клинические признаки
Возраст кошек с болезнью Аддисона колеблется от 1,5 до 14 лет. Все описанные до настоящего вре
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 467
мени животные с этим заболеванием представлены беспородными короткошерстными или длинношерстными кошками. Число самцов и самок среди больных животных примерно одинаково, все они были кастрированы.
Клинические признаки гипокортицизма у кошек и результаты общего обследования сходны с таковыми у собак (табл. 8-19). По сообщениям владельцев симптомы заболевания проявляются на протяжении периода от нескольких дней до 3—4 месяцев. Чаще всего хозяева больных кошек отмечают сонливость, депрессию, анорексию и уменьшение веса. Реже заболевание сопровождается рвотой, изменчивым клиническим состоянием, полиурией и полидипсией, а также реакцией на неспецифическую терапию, в частности на введение внутривенных жидкостей или глюкокортикоидов в предшествовавшем периоде. Диарея не развивается (Peterson et al, 1989).
При физикальном исследовании кошек с гипокортицизмом чаще всего выявляют депрессию, общую слабость, дегидратацию, понижение температуры, медленное заполнение капиллярной сети и слабую пульсацию бедренной артерии. Реже регистрируются коллапс, неспособность вставать на ноги, брадикардия и боли в животе (Peterson et al, 1989).
Нарушения лабораторных, рентгенологических и электрокардиографических показателей
Гематологические нарушения встречаются нечасто и включают слабо выраженную анемию. Изредка развиваются лимфоцитоз или эозинофилия. У всех кошек с гипокортицизмом имеет место гипонатриемия, и у всех, кроме одной, была зарегистрирована гиперкалиемия (табл. 8-20). Также практически у всех больных животных отмечали гипохлоремию, азотемию и гиперфосфатемию. Кроме того, у всех кошек отношение концентраций натрия и калия в сыворотке было ниже 24:1. Тяжесть гиперкалиемии обычно меньше, чем у собак, а концентрация калия в сыворотке крови колеблется от 5,4 до 7,6 мэкв/л. У трех из 10 кошек обнаружен слабый ацидоз, а у одной - гиперкальциемия при концентрации кальция в сыворотке 14 мг/100 мл. У одной из находившихся под нашим наблюдением особи развилась гипогликемия. Дифференциальная диагностика гипогликемии у кошек проводится таким же образом, как у собак (Thompson et al, 1995).
Удельный вес мочи у 7 из 10 кошек со спонтанной аддисоновой болезнью был ниже 1,030. У всех десяти животных имели место дегидратация и азотемия. Концентрация AM в крови колебалась от 31 до 80 мг/100 мл, составляя в среднем 55 мг/100 мл. Эти данные подтверждают несостоятельность предварительного диагноза почечной недостаточности у кошек с подобными результатами тестирования. Как и у собак, сходство клинической симптоматики, результатов физикального исследования и лабораторных анализов при
ТАБЛИЦА 8-19. РЕЗУЛЬТАТЫ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ ЗА 10 КОШКАМИ С ПЕРВИЧНЫМ ГИПОКОРТИЦИЗМОМ*
Клинические симптомы Количество кошек (%)
Жалобы владельцев (данные анамнеза)
Сонливость и/или депрессия 10 (100)
Анорексия 10 (100)
Потеря веса 9(90)
Рвота 4(40)
Неустойчивое течение заболевания 4 (40)
Реакция на предшествующую терапию 3(30)
Полиурия и/или полидипсия 3(30)
Результаты физикального обследования
Депрессия 10 (100)
Общая слабость 9(90)
Дегидратация 9(90)
Гипотермия 8(80)
Медленное заполнение капиллярной сети 5(50)
Слабый пульс 5(50)
Коллапс и/или неспособность вставать на 3(30)
НОГИ
Брадикардия 2(20)
Боли в животе 1(Ю)
*Из: Peterson et al : Primary hyperadrenocorticism in ten cats. J Vet Intern Med, 3:55, 1989.
широко распространенных заболеваниях почек и реже встречающейся недостаточности функции коры надпочечников затрудняют диагностику гипокортицизма у кошек.
Рентгенологическое исследование грудной клетки выявило микрокардию у пяти кошек. Обнаружение этого неспецифического нарушения подтверждает наличие дегидратации, гиповолемии и гипотензии у этих животных. Другие сердечнососудистые расстройства не установлены. Среди выявленных отклонений на электрокардиограмме заслуживают внимания синусовая брадикардия у двух кошек и преждевременное сокращение предсердий у одной кошки. Характерные изменения Т и Р-зубцов, Р-R интервала и комплексов QRS, свойственные собакам с гиперкалиемией, у этих кошек отсутствовали, что могло объясняться относительно низким уровнем гиперкалиемии.
Подтверждение диагноза: концентрация кортизола в плазме крови
Протокол. «Золотым стандартом» при диагностике гипокортицизма у кошек, также как у собак и людей, служит провокационная проба с АКТГ. Однако протокол ее проведения у кошек несколько отличается от протокола у собак. При использовании синтетического АКТГ (кортрозина) внутримышечно вводят половину содержимого флакона (0,125 мг) и пробы крови берут непосредственно перед инъекцией, а также через 30 и 60 минут после нее. При использовании геля АКТГ его вводят внутримышечно в дозе 2,2 ЕД/кг, а пробы крови получают до инъекции и спустя 60 и 120 мин после нее.
468
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
ТАБЛИЦА 8-20. РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ АНАЛИЗОВ У 10 КОШЕК С ГИПОКОРТИЦИЗМОМ*
Параметр Средняя величина +SD Диапазон Нормальный диапазон
Гематокрит (%) 29,5+5,8 21,2-39,2 25-38
Количество эритроцитов х 106/мкл 6,4+1,5 4,6-9,0 6-8,5
Гемоглобин (г/100 мл) 10,3+1,7 7,3-12,6 8-15
Лейкоциты/мкл 11,656+4335 7200-20100 7000-15000
Зрелые нейтрофилы 7586+3514 4320-15875 3500-11250
Палочкоядерные 144+151 0-344 0-450
Лимфоциты 3348+2233 1118-8410 1400-6000
Эозинофилы 598+935 145-3015 1490-1400
Моноциты 178+204 0-612 70-600
Глюкоза (мг/100 мл) 99,2+24,9 71-139 70-150
Аланинаминотрансфераза (МЕ/л) 62,0+21,0 43-100 10-80
Щелочная фосфатаза (МЕ/л) 36,0+29,7 10-108 10-80
Общий билирубин (мг/100 мл) 0,39+023 0,1-0,8 0-0,5
Общий белок (мг/100 мл) 6,5+0,8 5,6-7,5 5,3-7,9
Альбумин (мг/100 мл) 2,9+0,5 2,3-3,5 2,3-3,8
Азот мочевины в крови (мг/100 мл) 55,6+16,5 31-80 5-30
Креатинин (мг/100 мл) 3,2+1,5 1,6-6,0 0,5-1,5
Общий СО2 (мэкв/л) 18,6+3,8 13-24 16-25
Неорганический фосфор (мг/100мл) 7,3+0,94 6,1-9,1 3,0-6,0
Кальций (мг/100 мл) 10,7+3,4 8,6-14,0 7,6-11,0
Натрий (мэкв/л) 130,6+8,1 111-138 140-155
Калий (мэкв/л) 6,2+0,6 5,4-7,6 3,5-5,5
Хлориды (мэкв/л) 96,3+9,7 74-108 100-120
Отношение концентраций натрия и калия 21,0+1,7 17,9-23,7 >26
Удельный вес мочи 1,028+0,0014 1,008-1,045 1,001-1,080
Кортизол (мкг/100 мл)
Базальная концентрация 0,26+028 0,1-0,8 0,5-5,О**
Через 1 час после стимуляции АКТГ 0,29+0,37 0,1-1,1 4,5-13,0**
Через 2 часа после стимуляции АКТГ 0,39+0,44 0,1-1,3 4,0-14,5**
Концентрация АКТГ в плазме крови (пг/мл) 3767+2667 500-8000 10-125***
* Из: Peterson et al: Primary adrenocorticism in ten cats. J Vet Intern Med, 6 3:55, 1989; использовано с разрешения издателей.
** Провокационная проба с АКТГ проводилась у 33 клинически здоровых кошек. Результаты представлены как средние величины + SD. Концентрация кортизола до стимуляции, спустя 1 и 2 часа после введения АКТГ составляла соответственно 2,1±1,5 мкг/100 мл, 7,9+2,9 мкг/100 мл и 8,1+2,7 мкг/100 мл.
*** Концентрацию иммунореактивного АКТГ в плазме крови определяли у 50 клинически здоровых кошек. Средняя концентрация + SD равнялась 36,7+36,0 пг/мл.
SD - стандартное отклонение, АКТГ - адренокортикотропный гормон.
Результаты. У кошек, как у собак и людей, диагноз гипокортицизма подтверждают или отвергают на основании данных пробы с АКТГ. Ее ожидаемые результаты у кошек с гипокортицизмом не отличаются от таковых у собак, а именно, до введения АКТГ концентрация кортизола в плазме крови очень низкая или ниже определяемой и не изменяется после инъекции АКТГ. Как и у собак, результаты всех определений концентрации кортизола в плазме крови кошек с аддисоновой болезнью до и после введения АКТГ не превышали 2,0 мкг/100 мл (см. табл. 8-20). При этом концентрация кортизола до введения АКТГ колебалась от 0,1 до 0,8 мкг/100 мл при норме 0,5-5,0 мкг/100 мл, а через 1 и 2 часа после инъекции АКТГ была соответственно 0,1-1,1 и 0,1-1,3 мкг/100 мл при норме 4,5 -13,0 мкг/100 мл (табл.8-20) (Peterson et al, 1989).
Дифференциальная диагностика. Дифференциальная диагностика при нарушениях концентрации натрия и калия в сыворотке крови проводится с целью исключения желудочно-кишечных заболеваний, нарушений почечной функции и асцита (Bissett et al, 2001). При низкой концентрации кортизола в плазме крови необходима дифференциальная диагностика таких клинических
состояний, как спонтанный гипокортицизм, последствия хронического введения глюкокортикоидов или мегестрола ацетата (Chastain et al, 1982), а также введения АКТГ. Кроме того, необходимо дифференцировать гипокортицизм от лимфомы, поскольку эта форма рака встречается достаточно часто, а недавно было продемонстрировано возможное участие надпочечников в механизмах ее патогенеза (Parnell et al, 1999).
Концентрация эндогенного АКТГ в плазме крови
Результаты. Концентрацию АКТГ в плазме крови измеряли у семи из 10 кошек со спонтанным гипокортицизмом. У всех кошек концентрация АКТГ была очень высокой, что указывало на первичное поражение коры надпочечников и отсутствие отрицательной обратной связи между надпочечниками и гипофизом. Концентрации АКТГ колебались в пределах от 500 до 8000 пг/мл при среднем значении 3767 пг/мл (нормальная концентрация от менее 10 до 125 мг/мл, см. табл. 8-20).
Дифференциальная диагностика. При аномально низкой концентрации кортизола в плазме
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 469
крови кошек на фоне значительного повышения уровня эндогенного АКТГ необходима дифференциальная диагностика гипокортицизма от любого другого расстройства, вызывающего разрушение коры надпочечников, в частности, спонтанных аутоиммунных процессов, травмы или лимфомы. Приведенные выше результаты определения концентрации АКТГ получают также при блокаде биосинтеза и/или секреции кортизола, например, вследствие лечения кетоконазолом, который подавляет образование кортизола.
Хроническое введение кошкам глюкокортикоидов или прогестогенов (мегестрола ацетата) также приводит к снижению концентрации кортизола в плазме крови до уровня ниже чувствительности методов его определения (Middleton et al, 1987). Однако в этом случае уровень кортизола снижается вследствие того, что данные препараты ингибируют секрецию АКТГ гипофизом, что приводит к атрофии коры надпочечников. Таким образом, у кошек снижается концентрация и кортизола, и АКТГ. При этом имеет место вторичная атрофия коры надпочечников, тогда как концентрация электролитов в сыворотке обычно остается в норме благодаря сохранению ренин-ангиотензин-альдостероновой системы, на которую АКТГ оказывает слабое влияние. Любые процессы, приводящие к изменению гипофизарной секреции АКТГ (например, травма, опухоль или воспаление гипофиза), дают сходные результаты эндокринных тестов.
Лечение
Лечение кошек в состоянии гипокортикоид-ного криза. Принципы терапии гипокортикоидного криза у кошек и собак одинаковы. На ранних стадиях лечения используют агрессивное внутривенное введение нормального 0,9% физиологического раствора в дозе 40 мл/кг на протяжении 2—4 часов. Тем самым устраняют дефицит жидкости и нормализуют кровяное давление. После этого продолжают поддерживающее введение жидкости (из расчета примерно 60 мл/кг/день), количество которой постепенно уменьшают, пока у животного не восстановится способность самостоятельно есть и пить в отсутствие рвоты или диареи. Недостаточность глюкокортикоидов компенсируется внутривенным или внутримышечным введением дексаметазона в дозе от 0,1 до 2 мг/кг каждые 6-12 часов. В идеале до начала введения глюкокортикоидов проводят провокационный тест с АКТГ. Минералокортикоиды (ДОКП) вводят внутримышечно в дозе 2,2 мг/кг один раз в каждые 25 дней.
Медленная реакция на терапию является одним из признаков, который отличает гипокортицизм у кошек от гипокортицизма у собак. Состояние сонливости, слабости и депрессии сохраняется у кошек на протяжении первых 3-5 дней терапии. Трех из 10 кошек пришлось подвергнуть эвтаназии через 2-5 дней после начала лечения, поскольку состоя
ние животных не улучшалось. Возможно, они бы выжили, если бы лечение продолжили.
Долгосрочная (хроническая) терапия. Хроническая терапия кошек, как и в случаях неотложного лечения, проводится так же, как у собак. Для целей долгосрочной минералокортикоидной терапии используют ДОКП для инъекций или флюдрокортизона ацетат, который вводят перорально в дозе 0,5-0,10 мг дважды в день. При наличии показаний к заместительной глюкокортикоидной терапии обычно используют преднизон в количестве от 0,5 до 2,0 мг/кг веса, поделенном на две ежедневные дозы. В дополнение к анализу сведений, периодически получаемых от хозяина кошки относительно ее реакции на терапию, регулярно проводят физикальное исследование животного. Кроме того, настоятельно рекомендуется определять концентрацию электролитов и AM в крови. Как и у собак, это облегчает подбор адекватной дозы препарата.
Прогноз
Кошки с гипокортицизмом могут жить долго. Наилучших результатов добиваются хозяева (как и владельцы собак), настроенные на агрессивное лечение своих питомцев и уделяющие ему должное внимание. Важное значение имеют частые повторные оценки состояния животного с целью своевременной коррекции дозировки используемых лекарственных средств и частоты их введения. В группе из 7 кошек, находившихся под наблюдением после выведения их из состояния гипокортикоидного криза, шесть кошек оставались живыми на протяжении в среднем 34 месяцев (Peterson et al, 1989).
ЛИТЕРАТУРА
Addison Т: On the constitutional and local effects of disease of the suprarenal capsules. London, Highley, 1855.
Adrogue HJ, Madias NE: Hyponatremia. N Engl J Med 342:1581, 2000.
Ames Technical Information on Seralyzer Reflectance Photometer: A quantitative strip test for potassium in serum or plasma. 1986.
Auge P: Addison’s disease in littermates. Vet Med 80:43, 1985.
Baajafer FS, et al: Hyponatremia and hypercreatinemia in short-term uncomplicated hypothyroidism. J Endocrinol Invest 22:35, 1999.
Bagley RS, et al: Hypoglycemia associated with intraabdominal leimyoma and leimyosarcoma in six dogs. J Am Vet Med Assoc 208:69, 1996.
Bartges J, Nielson D: Reversible megaesophagus associated with atypical primary hypoadrenocorticism in a dog. J Am Vet Med Assoc 201:889, 1992.
Baxter JD, Tyrrell JB: The adrenal cortex. In Felig P, et al (eds): Endocrinology and Metabolism. New York, McGraw-Hill, 1981, p 385.
Beaudry D, et al: Hypoglycemia in four dogs with smooth muscle tumors. J Vet Intern Med 9:415, 1995.
Bennish ML, et al: Hypoglycemia during diarrhea in childhood. N Engl J Med 322:1357, 1990.
Berger SL, Reed J: Traumatically induced hypoadrenocorticism in a cat. J Am Anim Hosp Assoc 29:337, 1993.
Bethune JE: The diagnosis and treatment of adrenal insufficiency. In DeGroot LJ (ed): Endocrinology, 2nd ed. Philadelphia, WB Saunders, 1989, p 1647.
Bissett SA, et al: Hyponatremia and hyperkalemia associated with peritoneal effusion in four cats. J Am Vet Med Assoc 218:1590, 2001.
Boujon CE, et al: Pituitary gland changes in canine hypoadrenocorticism: A functional and immunocytochemical study J Comp Pathol 111:287, 1994.
Bowen D, et al: Autoimmune polyglandular syndrome in a dog: A case report. J Am Anim Hosp Assoc 22:649, 1986.
Brady CA, et al: Severe neurologic sequelae in a dog after treatment of hypoadrenal crisis. J Am Vet Med Assoc 215:222, 1999.
Burrows C: Reversible megaesophagus in a dog with hypoadrenocorticism. J Small Anim Pract 28:1073, 1987.
470
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА)
Chastain СВ, et al: Adrenocortical suppression in cats administered megestrol acetate. American College of Veterinary Internal Medicine Scientific Proceedings, Salt Lake City, 1982, p 54 (abstract).
Chastain CB, et al: A screening evaluation for endogenous glucocorticoid deficiency in dogs: A modified Thorn test. J Am Anim Hosp Assoc 25:18, 1989.
Chen S, et al: Autoantibodies to steroidogenic enzymes in autoimmune polyglandular syndrome, Addison’s disease, and premature ovarian failure. J Clin Endocrinol Metab 81:1871, 1996.
Chow E, et al: Toxicity of desoxycorticosterone pivalate given at high dosages to clinically normal Beagles for six months. Am J Vet Res 54:1954, 1993.
Church DB: personal communication, 2002. Church DB, et al: Plasma Cortisol concentrations in normal dogs given hydrocortisone sodium succinate. Aust Vet J 77;316, 1999. DiBartola SP: Hyponatremia. Vet Clin North Am (Small Anim Pract) 19:215, 1989.
DiBartola SP, et al: Clinicopathologic findings resembling hypoadrenocorticism in dogs with primary gastrointestinal disease. J Am Vet Med Assoc 187:60, 1985.
Dunn KJ, Herrtage ME: Hypoadrenocorticism in a Labrador retriever. J Small Anim Pract 39:90, 1998.
Elliott J, et al: Hypercalcemia in the dog: A study of 40 cases. J Small Anim Pract 32:564, 1991.
Feldman EC, Nelson RW: Canine and Feline Endocrinology and Reproduction. Philadelphia, WB Saunders, 1987.
Feldman EC, et al: Comparison of aqueous porcine ACTH with synthetic ACTH in adrenal stimulation tests of the female dog. Am J Vet Res 43:522, 1982.
Findling JW, Tyrrell JB: Anterior pituitary gland. In Greenspan FS (ed): Basic and Clinical Endocrinology, 3rd ed. San Mateo, Calif, Appleton & Lange, 1991, p 79.
Findling JW, et al: Glucocorticoids and adrenal androgens. In Greenspan FS, Strewler GJ (eds): Basic and Clinical Endocrinology, 5th ed. Stamford, Conn, Appleton & Lange, 1997, p 317.
Fossum TW, Birchard SJ: Lymphangiographic evaluation of experimentally induced chylothorax after ligation of the cranial vena cava in dogs. Am J Vet Res 47:976, 1986.
Freudiger U: Literaturubersicht uber Nebennierenrinden - Erkrankungen der Katze und Beschreibung eines Failes von primarer Nebennierenrinden - In-suffizienz. Schweiz Arch Tierheilk 128:221, 1986.
Ganong WF: Review of Medical Physiology, 10th ed. Los Altos, Calif, Lange Medical Publications, 1981.
Golden D, Lothrop CJ: A retrospective study of aldosterone secretion in normal and adrenopathic dogs. J Vet Intern Med 2:121, 1988.
Graves TK, et al: Basal and ACTH-stimulated plasma aldosterone concentrations are normal or increased in dogs with trichuriasis-pseudohypoadreno-corticism. J Vet Intern Med 8:287, 1994.
Hardy RM: Hypoadrenocorticism. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 4th ed. Philadelphia, WB Saunders, 1995.
Herrtage ME: Hypoadrenocorticism. In Torrence AG, Mooney CT (eds): BSAVA Manual of Small Animal Endocrinology, 2nd ed. BSAVA, United Kingdom, 1998, pp 75-82.
Johnessee JS, et al: Primary hypoadrenocorticism in a cat. J Am Vet Med Assoc 183:881, 1983.
Kaplan AJ, Peterson ME: Effects of desoxycorticosterone pivalate administration on blood pressure in dogs with primary hypoadrenocorticism. J Am Vet Med Assoc 206:327, 1995.
Kelch WJ, et al: Canine hypoadrenocorticism (Addison’s disease). Comp Small Anim Pract 20:921, 1998.
Kemppainen RJ, et al: Adrenocortical suppression in the dog after a single dose of methylprednisolone acetate. Am J Vet Res 42:822, 1981.
Kemppainen RJ, et al: Adrenocortical suppression in the dog given a single intramuscular dose of prednisone or triamcinolone acetonide. Am J Vet Res 43:204, 1982.
Kintzer PP, Peterson ME: Treatment and long-term follow-up of 205 dogs with hypoadrenocorticism. J Vet Intern Med 11:43, 1997.
Kooistra HS, et al: Polyglandular deficiency syndrome in a Boxer dog: Thyroid hormone and glucocorticoid deficiency. Vet Q 17:59, 1995.
Lamb WA, et al: Effect of chronic hypocortisolemia on plasma Cortisol concentrations during intravenous infusions of hydrocortisone sodium succinate in dogs. Res Vet Sci 57:349, 1994.
Lamberts SWJ, et al: Corticosteroid therapy in severe illness. N Engl J Med 337:1285, 1997.
Langlais-Burgess L, et al: Concurrent hypoadrenocorticism and hypo- albu-minemia in dogs: A retrospective study. J Am Anim Hosp Assoc 31:307, 1995.
Levy JK: Hypoglycemic seizures attributable to hypoadrenocorticism in a dog. J Am Vet Med Assoc 204:526, 1994.
Lifton SJ, et al: Glucocorticoid-deficient hypoadrenocorticism in dogs: 18 cases (1986-1995). J Am Vet Med Assoc 209:2076, 1996.
Lobetti RG: Hyperreninaemic hypoaldosteronism in a dog. J S Afr Vet Assoc 69:33, 1998.
Lynn R, Feldman EC: Treatment of hypoadrenocorticism with microcrystalline desoxycorticosterone pivalate. Br Vet J 147:478, 1991.
Lynn R, et al: Efficacy of microcrystalline desoxycorticosterone pivalate for treatment of hypoadrenocorticism in dogs. J Am Vet Med Assoc 202:392, 1993.
McCabe M, et al: Subcutaneous administration of desoxycorticosterone pivalate for the treatment of canine hypoadrenocorticism. J Am Anim Hosp Assoc 31:151, 1995.
Medinger TL, et al: Severe gastrointestinal tract hemorrhage in three dogs with hypoadrenocorticism. J Am Vet Med Assoc 202:1869, 1993.
Melian C, Peterson ME: Diagnosis and treatment of naturally occurring hypoadrenocorticism in 42 dogs. J Am Anim Pract 37:268, 1996.
Middleton D, et al: Suppression of Cortisol response to exogenous adrenocorticotropic hormone and the side effects of glucocorticoid excess in cats during therapy with megestrol acetate and prednisolone. Can J Vet Res 51:60, 1987.
Montoll A, et al: Hypercalcemia in Addison’s disease: Calciotropic hormone profile and bone histology. J Intern Med 232:535, 1992. Moore G, Hoenig M: Duration of pituitary and adrenocortical suppression after long-term administration of antiinflammatory doses of prednisone to dogs. Am J Vet Res 53:716, 1992.
Moriello K, et al: Adrenocortical suppression associated with topical administration of glucocorticoids in dogs. J Am Vet Med Assoc 193:329, 1988.
Murphy CJ, et al: Iatrogenic Cushing’s syndrome in a dog caused by topical ophthalmic medications. J Am Anim Hosp Assoc 26:640, 1990.
Nelson DH: The Adrenal Cortex: Physiological Function and Disease. Philadelphia, WB Saunders, 1980, p 113.
Oberbauer AM, et al: Inheritance of hypoadrenocorticism in Bearded Collies. Am J Vet Res 63:643, 2002.
O’Brien DP, et al: Myelinolysis after correction of hyponatremia in two dogs. J Vet Intern Med 8:40, 1994.
Oelkers W: Adrenal insufficiency. N Engl J Med 335:1206, 1996.
Olson PN, et al: Effects of storage on concentration of hydrocortisone (Cortisol) in canine serum and plasma. Am J Vet Res 42:1618, 1981.
Ortega TM, et al: Plasma aldosterone concentrations in dogs before and after o,p’-DDD therapy for pituitary-dependent hyperadrenocorticism. J Vet Intern Med 9:182, 1995 (abstract).
Parnell NK, et al: Hypoadrenocorticism as the primary manifestation of lymphoma in two cats. J Am Vet Med Assoc 214:1208, 1999.
Peterson ME, Feinman JM: Hypercalcemia associated with hypoadrenocorticism in 16 dogs. J Am Vet Med Assoc 181:802, 1982.
Peterson ME, et al: Primary hypoadrenocorticism in ten cats. J Vet Intern Med 3:55, 1989.
Peterson ME, et al: Pretreatment clinical and laboratory findings in dogs with hypoadrenocorticism: 225 cases (1979-1993). J Am Vet Med Assoc 208:85, 1996.
Ramsay DJ: Renal hormones and endocrine hypertension. In Greenspan FS (ed): Basic and Clinical Endocrinology, 3rd ed. San Mateo, Calif, Appleton & Lange, 1991, p 400.
Reusch CE: Hypoadrenocorticism. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5th ed. Philadelphia, WB Saunders, 2000, pp 1488-1499.
Rich LJ, et al: Elevated serum potassium associated with delayed separation of serum from clotted blood in dogs of the Akita breed. Vet Clin Pathol 15:12, 1986.
Roberts S, et al: Effect of ophthalmic prednisolone acetate on the canine adrenal gland and hepatic function. Am J Vet Res 45:1711, 1984.
Rogers W, et al: Atypical hypoadrenocorticism in three dogs. J Am Vet Med Assoc 179:155, 1981.
Rose BD: Clinical Physiology of Acid-Base Disorders, 2nd ed. New York, McGraw-Hill, 1984, p 567.
Roth L, Tyler RD: Evaluation of low sodium:potassium ratios in dogs. J Vet Diagn Invest 11:60, 1999.
Rothenberg ME: Eosinophilia. N Engl J Med 338:1592, 1998.
Sadek D, Schaer M: Atypical Addison’s disease in the dog: A retrospective survey of 14cases. J Am Anim Hosp Assoc 32:159, 1996.
Schaer M: Hypoadrenocorticism. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1980, p 983.
Schaer M: The atypical addisonian dog. Proceedings of the North American Veterinary Conference, Orlando, FL, 1994, p 219.
Schaer M, et al: Autoimmunity and Addison's disease in the dog. J Am Anim Hosp Assoc 22:789, 1986.
Schaer M, et al: Combined hyponatremia and hyperkalemia mimicking an addisonian crisis in three near-term pregnant Greyhounds. J Vet Intern Med 14:121, 2000.
Shaker E, et al: Hypoadrenocorticism in a family of Standard Poodles. J Am Vet Med Assoc 192:1091, 1988.
Smallwood U, Barsanti J: Hypoadrenocorticism in a family of Leonbergers. J Am Anim Hosp Assoc 31:301, 1995.
Soderbergh A, et al: Adrenal autoantibodies and organ-specific autoimmunity in patients with Addison’s disease. Clin Endocrinol 45:453, 1996.
Syme HM, Scott-Moncrieff JC: Chronic hypoglycemia in a hunting dog due to secondary hypoadrenocorticism. J Small Anim Pract 39:348, 1998.
Thodou E, et al: Lymphocytic hypophysitis: Clinicopathological findings. J Clin Endocrinol Metab 80:2302, 1995.
Thompson JC, et al: Observations on hypoglycaemia associated with a hepatoma in a cat. N Z Vet J 43:186, 1995.
Tyler R, et al: Renal concentrating in dehydrated hyponatremic dogs. J Am Vet Med Assoc 191:1095, 1987.
Tyrrell JB, et al: Glucocorticoids and adrenal androgens. In Greenspan FS (ed): Basic and Clinical Endocrinology, 3rd ed. Philadelphia, WB Saunders, 1991, p323.
ГИПОКОРТИЦИЗМ (БОЛЕЗНЬ АДДИСОНА) • 471
van den Broek A: Serum protein values in canine diabetes mellitus, hypothyroidism and hypoadrenocorticism. Br Vet J 148:259, 1992.
Vance ML: Hypopituitarism. N Engl J Med 330:1651, 1994.
Velardo A, et al: Isolated adrenocorticotropic hormone deficiency secondary to hypothalamic deficit of corticotropin-releasing hormone. J Endocrinol Invest 15:53, 1992.
Walters PC, Drobatz KJ: Hypoglycemia. Comp Small Anim Pract 14:1149, 1992.
White PC: Disorders of aldosterone biosynthesis and action. N Engl J Med 331:250, 1994.
Whitley NT: Megaesophagus and glucocorticoid-deficient hypoadrenocorticism in a dog. J Am Anim Pract 36:132, 1995.
Willard MD: Disorders of potassium homeostasis. Vet Clin North Am (Small Anim Pract) 19:241, 1989.
Willard MD, et al: Canine hypoadrenocorticism: Report of 37 cases and review of 39 previously reported cases. J Am Vet Med Assoc 180:59, 1982.
Willard MD, et al: Evaluation of plasma aldosterone concentrations before and after ACTH administration in clinically normal dogs and dogs with various diseases. Am J Vet Res 48:713, 1987.
Willard MD, et al: Hyponatremia and hyperkalemia associated with idiopathic or experimentally induced chylothorax in four dogs. J Am Vet Med Assoc 199:353, 1991.
Zenger E: Persistent hyperkalemia associated with nonchylous pleural effusion in a dog. J Am Anim Hosp Assoc 28:411, 1992.
Глава 9
ФЕОХРОМОЦИТОМА И
МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ
НЕОПЛАЗИЯ
ФЕОХРОМОЦИТОМА.................472
Этиология......................472
Патофизиология.................473
Встречаемость..................476
Клинические проявления.........476
Физикальное исследование.......478
Клиническая патология..........479
Методы диагностической визуализации .....................
Измерение артериального кровяного давления................
Г ормональные тесты...............
Постановка диагноза...............
Хирургическое лечение.............
Медикаментозное лечение.......491
480 Прогноз........................492
СЛУЧАЙНО ВЫЯВЛЯЕМЫЕ ОПУХОЛИ
483 НАДПОЧЕЧНИКОВ...............492
485 МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ
487 НЕОПЛАЗИЯ (МЭН).............494
487
Список сокращений
АКТГ - адренокортикотропный гормон ВМК - ванилилминдальная кислота КТ - компьютерная томография МИБГ - метайодобензилгуаиидин
МРТ - магнитно-резонансная томография
МЭН - множественная эндокринная неоплазия
ОАК - общий клинический анализ крови
ПЭТ - позитрон-эмиссиониая томография
УЗИ - ультразвуковое исследование 18Р-рФБГ - пара-фторбензидгуанидин ЦНС - центральная нервная система
ФЕОХРОМОЦИТОМА
Феохромоцитома - это опухоль, секретирующая катехоламины, которая развивается из медуллярного вещества надпочечников. В прошлом феохромоцитому чаще всего случайно обнаруживали на вскрытии; при жизни у собак диагноз феохромоцитома ставили редко, а у кошек - очень редко (Schaer, 1980; Twedt, Wheeler 1984; Bouayad et al, 1987; Henry et al, 1993; Gilson et al, 1994). Это отчасти объясняется тем, что у ветеринаров редко возникало подозрение на феохромоцитому из-за ее слабо выраженных и нерегулярных клинических проявлений, которые обычно приписывали более распространенным заболеваниям. Кроме того, не было эффективных методов диагностического скрининга на данное заболевание. После внедрения УЗИ брюшной полости в практику рутинного диагностического обследования больных собак и кошек частота обнаружения опухолевидных масс в надпочечниках увеличилась. Соответственно, на протяжении последнего десятилетия значительно возросло число диагностируемых феохромоцитом. Для иллюстрации этого достаточно сказать, что подозрение на наличие феохромоцитомы при жизни собак, поступавших в нашу клинику с 1984 по 1994 г., подтвердилось только в 11 случаях, тогда как в период между 1996 и 2002 г.г. число подтвержденных случаев достигло 33.
Этиология
Эндокринные клетки медуллярного вещества надпочечников называются хромаффиновыми клет
ками. Они развиваются из нейроэктодермы и отличаются способностью синтезировать, хранить и секретировать катехоламины (адреналин и норадреналин). Хотя большинство хромаффиновых клеток сосредоточено в медуллярном веществе, небольшое их количество находится также вне надпочечников - в симпатических ганглиях и в непосредственной близости от них. Функция вненадпочечниковых хромаффиновых клеток неизвестна. Большинство их деградирует в ходе постнатального развития, однако оставшиеся клетки в дальнейшем могут стать источниками образования опухоли (Young, Landsberg, 1998).
Феохромоцитома - это опухоль, продуцирующая катехоламины, которая образуется из хромаффиновых клеток. Чаще всего феохромоцитома развивается из хромаффиновых клеток медуллярного вещества надпочечников. Она может возникнуть в одном или обоих надпочечниках и является компонентом синдрома множественной эндокринной неоплазии (МЭН). У людей приблизительно 10% секретирующих катехоламины опухолей развиваются из вненадпочечниковых хромаффиновых клеток и называются параганглиомами. Эти опухоли локализуются, главным образом, в пределах брюшной полости, но иногда обнаруживаются также в сердце, задней части средостения, вдоль аорты и вокруг почек или стенок мочевого пузыря (Goldfien, 2001; Young, Landsberg 1998). У собак и кошек параганглиомы встречаются редко (Patnaik et al, 1990; Hines et al, 1993; Barthez et al, 1997; Buchanan et al, 1998 ).
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 473
Обычно феохромоцитомы представляют собой изолированные, медленно растущие, васкуляризованные опухоли, размер которых колеблется от узелков менее 0,5 см в диаметре до крупных масс, диаметр которых достигает 10 см. Описаны феохромоцитомы, поражающие оба надпочечника, и феохромоцитомы, локализованные в одном надпочечнике, в сочетании с опухолью коры контралатеральной железы ( Bouayad et al, 1987; Gilson et al, 1994; von Dehn et al, 1995; Bennett, Norman, 1998). У собак феохромоцитомы считаются злокачественными опухолями (Bouayad et al, 1987). Примерно у 40% собак с феохромоцитомами, обследованных в нашей клинике, опухоль распространялась на прилегающие полую или диафрагмально-брюшную вены либо внедрялась в их полость и/или вызывала ущемление и сдавливание каудальной полой вены. Зарегистрированы также инвазия стенок и/или сужение полости аорты, печеночных вен или сосудов почек и надпочечников (Bouayad et al, 1987). Приблизительно у 30% обследованных нами собак на вскрытии были обнаружены метастазы опухоли. Местами отдаленного метастазирования были печень, легкие, региональные лимфатические узлы, селезенка, сердце, почки, кости, поджелудочная железа, центральная нервная система (ЦНС) и позвоночный канал (Gilson et al, 1994; Barthez et al, 1997).
На основании общих клинических и гистологических признаков феохромоцитому не всегда легко отличить от неоплазии коры надпочечников, особенно при больших размерах опухоли. Для того чтобы установить местонахождение источника опухоли (в корковом или медуллярном слое надпочечников), используют иммуногистохимическое окрашивание на хромогранин А и синаптофизин. Эта методика используется в нашей клинике в качестве рутинного способа обследования при подозрении на медуллярную опухоль надпочечников. Синаптофизин входит в состав оболочки синаптических везикул в нейронах и нейроэндокринных клетках. Хромогранин А - это белок, присутствующий в гранулах секреторных эндокринных клеток, который принимает участие в их стабилизации, определяет характер распределения в них гормонов и регулирует высвобождение последних (Winkler, Fischer-Colbrie, 1992). Хромогранин А является основным компонентом секреторных гранул в медуллярном веществе надпочечников, гипофизе, паращитовидных железах, С клетках щитовидной железы, островках поджелудочной железы, клетках желудочно-кишечного тракта и симпатических нервов (Doss et al, 1998). Но в клетках коры надпочечников хромогранина А нет. Интенсивное и устойчивое положительное окрашивание опухолей на хромогранин А у собак позволяет диагностировать их как феохромоцитомы или хемодектомы. Окрашивание опухолей паращитовидных желез, гипофиза и островковых клеток дает неоднозначные результаты. Некоторые продуцирующие хромогранин А эндокринные клетки секретируют иммунореактивный
хромогранин в кровяное русло одновременно с тем или иным специфическим гормоном (Deftos et al, 1989). Предлагалось использовать определение повышенной концентрации хромогранина А в крови в качестве метода скрининга на наличие продуцирующих пептиды опухолей у человека (О’Connor, Deftos, 1986; Hsiao et al, 1991). Кроме того, по изменению концентрации хромогранина А в плазме крови можно судить о реакции на терапию (Moattari et al, 1989). Сообщения об использовании результатов определения концентрации хромогранина А для идентификации феохромоцитомы у собак и кошек отсутствуют.
Патофизиология
Феохромоцитома - это опухоль тканей симпатической нервной системы. Преганглионарные нервные волокна этой системы являются холинергическими структурами, которые высвобождают ацетилхолин, действующий в качестве нейротрансмиттера. Постганглионарные волокна обладают адренергической активностью и продуцируют норадреналин и дофамин. Медуллярный слой надпочечников можно рассматривать как аналог симпатических постганглионарных нейронов, лишенных аксонов. Обычно мозговое вещество секретирует как адреналин, так и норадреналин. Однако нормальная медуллярная ткань надпочечников содержит большие количества N-метилирующего фермента, преобразующего норадреналин в адреналин, который является преобладающим катехоламином, продуцируемым этими железами (Werbel, Ober, 1955). У собак, кошек и людей на долю адреналина приходится соответственно 60, 70 и 80% всех катехоламинов, образующихся в мозговом веществе надпочечников (Goldfien, 2001). Часть циркулирующего в крови норадреналина поступает также из автономных нервных окончаний. В отличие от этого, большинство феохромоцитом у человека содержат преимущественно норадреналин или его смесь с адреналином и дофамином (Prys-Roberts, 2000). Опухоли редко продуцируют исключительно адреналин (Young, Landsberg, 1998). Параганглиомы обычно секретируют норадреналин. Оценка характера секреции катехоламинов феохромоцитомами у собак и кошек не проводилась.
Несмотря на разный характер биосинтеза и депонирования катехоламинов в феохромоцитомах и нормальной медуллярной ткани надпочечников, имеется значительное морфологическое, физическое и функциональное сходство хромаффиновых гранул в интактной и опухолевой тканях (Johnson et al, 1982; Roizen et al, 1984). Повышенная скорость обмена катехоламинов в некоторых опухолях in vitro и in vivo может свидетельствовать об изменении регуляции их биосинтеза, возможно, вследствие нарушения ингибирования тирозингидроксилазы по механизму отрицательной обратной связи. Основной стадией, лимитирующей скорость биосинтеза
474
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
L-Тирозин
Тирозингид- _ О роксилаза V
* ।
L-Дигидроксифенилаланин '
(ДОФА) ;
। Декарбоксилаза аромати- [ ческих L-аминокислот >
।
Дигидроксифенилэтиламин ]
(ДОФАМИН) ।
Дофамин бета-гид- )
роксилаза i
L-Норадреналин------------------'
Фен илэтаноламин-N-метилтрансфераза
L-Адреналин
Рис. 9-1. Схема биосинтеза катехоламинов. Адреналин образуется в медуллярном веществе надпочечников, в нейронах центральной нервной системы и в периферических ганглиях, где он играет роль нейротрансмиттера. Норадреналин является основным регулятором биосинтеза катехоламинов, ингибируя активность тирозингидроксилазы по механизму обратной связи ( HsiTwedt DC, Wheeler SL: Vet Clin North Am [Small Animal Pract] 1984; 14:767.)
катехоламинов, является гидроксилирование тирозина ферментом тирозингидроксилазой (рис. 9-1). Цитоплазматический норадреналин, как правило, непосредственно тормозит активность тирозингидроксилазы и таким путем контролирует продукцию катехоламинов (Young, Landsberg, 1998). Стимуляция симпатических нервов снимает подавление тирозингидроксилазы норадреналином по механизму отрицательной обратной связи, поскольку и резервный, и вновь синтезируемый норадреналин высвобождается из клеток во внеклеточное пространство. Возрастающая в результате этого ферментативная активность снова усиливает биосинтез норадреналина. В феохромоцитомах норадреналин в обычной концентрации не подавляет активность тирозингидроксилазы. Кроме того, скорость оборота катехоламинов в опухолях значительно повышена, что препятствует ингибированию активности тирозингидроксилазы по механизму отрицательной обратной связи.
Механизмы высвобождения катехоламинов из феохромоцитомы до конца не выяснены. В отличие от нормальных надпочечников в феохромоцитомах отсутствует иннервация, поэтому секреция катехо-
ТАБЛИЦА 9-1. ОТДЕЛЬНЫЕ ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ КАТЕХОЛАМИНОВ НА РАЗЛИЧНЫЕ ОРГАНЫ*
Эффекторный орган Тип рецептора Реакция
Глаза
Радиальная мышца радужной оболочки Сердце Синсусово-предсердный узел Альфа-1 Сокращение (расширение зрачка)
Бета-1 Ускорение сердцебиения
Предсердия Бета-1 Увеличение сократительной актив-
Предсердно-желудочковый узел и проводящая система ности и скорости проведения
Бета-1 Увеличение скорости проведения
Желудочки Бета-1 Увеличение сократительной актив-
Артериолы ности и скорости проведения
Коронарные, скелетной мускулатуры, почек, органов брюшной Альфа-1 Сужение сосудов
ПОЛОСТИ
Кожи и слизистых оболочек, мозга, легких и слюнных желез Бета-2 Расширение сосудов
Системные вены Альфа-1 Сужение сосудов
Альфа-1 Сужение сосудов
Гладкая мускулатура бронхов Бета-2 Расширение сосудов
Бета-2 Расширение бронхов
Желудок
Подвижность Сфинктеры Альфа, бета-2 Альфа Уменьшение подвижности Повышение тонуса
Кишечник
Подвижность Альфа, бета-2 Снижение подвижности
Сфинктеры Альфа Повышение тонуса
Экзокринная поджелудочная железа Альфа Подавление секреции
Печень Альфа-1, бета-2 Стимуляция гликогенолиза и глюко-
неогенеза
Почки Альфа-1 Стимуляция глюконеогенеза
Альфа-2 Торможение ответа на вазопрессин
Мочевой пузырь Бета Стимуляция секреции ренина
Мышца-сжиматель Бета-2 Расслабление
Треугольная область и сфинктер Альфа Сокращение
Матка Альфа Сокращение
Бета-2 Расслабление
Жировая ткань Бета-2, бета-3 Стимуляция липолиза
Мышцы Альфа-2 Торможение липолиза
Бета-2 Стимуляция гликогенолиза
*По: Goldfien F: Adrenal medulla. In: Greenspan FS, Gardner DG (eds) Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 407.
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 475
ТАБЛИЦА 9-2. ОСНОВНЫЕ ЭФФЕКТЫ КАТЕХОЛАМИНОВ НА ГОРМОНАЛЬНУЮ СЕКРЕЦИЮ *
Эндокринная железа Гормон Рецептор кате- Влияние на
коламинов секрецию
Островки поджелудочной железы
Альфа-клетки Глюкагон Альфа Усиление
Бета Усиление
Бета-клетки Инсулин Альфа Уменьшение
Бета Усиление
Дельта клетки Соматостатин Альфа Уменьшение
Бета Усиление
РР клетки Панкреатический полипептид Альфа Уменьшение
Бета Усиление
Щитовидная железа
Фолликулы т т 4» 3 Альфа Уменьшение
Бета Усиление
С клетки Кальцитонин Альфа Уменьшение
Бета Усиление
Кора надпочечников
Пучковая зона Кортизол ? Усиление
Андростендион Бета Усиление
Клубочковая зона Альдостерон Дофаминовые Уменьшение
Бета Усиление
Привратниковая полость желудка и двенадцати- Гастрин Бета Усиление
перстная кишка Почки
Юкстагломерулярный аппарат Ренин Бета Усиление
Околоканальцевые клетки (?) Эритропоэтин Бета Усиление
Яичники и плацента Прогестерон Бета Усиление
Клетки гранулезы или желтое тело Окситоцин Бета Усиление
Тека-клетки Андрогены Бета Усиление
Семенники Тестостерон Бета Усиление
Шишковидная железа Мелатонин Бета Усиление
Сердце, предсердие Натриуретический пептид предсердия Альфа и бета Усиление
* IIo:Young JB, Landsberg L: Catecholamines and the adrenal medulla. In: Wilson JD, Foster DW, Kronenberg HM, Larsen RR (eds). Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 695.
ламинов не может индуцироваться нервными импульсами, а ее усиление в ответ на такие физиологические воздействия, как пониженное кровяное давление, слабая тканевая перфузия, гипоксия, гипогликемия, страх или стресс носит чрезвычайно изменчивый и непредсказуемый характер. Непосредственное сдавливание опухоли, манипуляции с ней во время хирургического вмешательства и разнообразные фармацевтические средства могут вызвать секрецию катехоламинов. Непонятно, почему некоторые феохромоцитомы секретируют катехоламины непрерывно, а другие только эпизодически.
Клинические проявления феохромоцитомы постулируются на основании известных физиологических и фармакологических эффектов катехоламинов (табл. 9-1 и 9-2). Такие катехоламины, как адреналин, норадреналин и дофамин, оказывают биологический эффект путем взаимодействия с соответствующими рецепторами в тканях-мишенях. Существует два класса рецепторов катехоламинов (альфа [а] и бета [Ц] рецепторы), которые взаимодействуют с адреналином и норадреналином.
а-Рецепторы, в свою очередь, подразделяются на al и а2-рецепторы, а [3-рецепторы - на pi, [32 и рЗ-рецепторы. al-Рецепторы опосредуют самые разные эффекты, которые сильнее всего проявляются в гладкой мускулатуре, включая сужение сосудов, расслабление стенок кишечника, стимуляцию маточных сокращений и расширение зрачков
(Young, Landsberg, 1998; Goldfien, 2001). a2-Pe-цепторы локализуются на пресинаптических симпатических нейронах, холинергических нейронах в кишечнике и нейронах ЦНС, участвующих в регуляции функции сердечно-сосудистой системы, а также на тромбоцитах и стенках кровеносных сосудов. а2-Рецепторы опосредуют торможение секреции норадреналина из адренергических нейронов и ацетилхолина из холинергических нейронов. Кроме того, они усиливают ответ барорецепторов на вазодепрессоры, который опосредуется через центральные регуляторные нейроны, оказывают влияние на агрегацию тромбоцитов и механизмы сужения сосудов. [3-Рецепторы прежде всего опосредуют стимуляцию катехоламинами сердечной деятельности, расширения бронхов и кровеносных сосудов. [31-Рецепторы служат медиаторами стимуляции сердца и липолиза, а через [32-рецепторы опосредуется бронходилатация, расширение сосудов и пресинап-тическая стимуляция высвобождения норадреналина из симпатических нейронов. (33-Рецепторы преимущественно участвуют в механизмах регуляции энергетических затрат и липолиза.
Действие катехоламинов осуществляется через специфические рецепторы. Считается, что адреналин и норадреналин в равной степени взаимодействуют с al-, a2- и [31-рецепторами, тогда как [32-рецепторы в большей степени стимулируются адреналином, а [33- рецепторы, наоборот, норадре
476 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
налином. Реакция отдельных тканей на катехоламины зависит от количества и типа рецепторов этих соединений, присутствующих на клеточных мембранах, а также от соотношения рецепторов разных типов и их пороговой чувствительности в данной ткани (табл. 9-1 и 9-2). Так, например, гладкомышечная ткань, окружающая кровеносные сосуды, содержит al- и 02-рецепторы катехоламинов. Первые преобладают, когда концентрация катехоламинов в крови увеличивается, что приводит к сужению сосудов и повышению кровяного давления. Такая ситуация типична при наличии феохромоцитомы.
Действие катехоламинов прекращается при их активном включении в нервные окончания или превращении этих гормонов в ходе обменных процессов в неактивные производные, которые затем выводятся через почки. Обмен норадреналина и адреналина до метанефрина, норметанефрина и, в конечном итоге, до ванилилминдальной кислоты осуществляется двумя ферментативными системами печени: моноаминоксидазой и катехол-О-метил-трансферазой (Young, Landsbrtg, 1998). Экскреция перечисленных продуктов обмена с мочой отражает количество катехоламинов, высвобождающихся из адренергических тканей и феохромоцитомы.
Встречаемость
Феохромоцитома чаще всего обнаруживается у более старых собак. По данным наблюдений в нашей клинике средний возраст 98 собак с опухолями этого типа составлял 11 лет (диапазон от 1 до 18 лет) (рис. 9-2). Феохромоцитомы одинаково часто диагностировались у животных обоего пола. 57 обследованных нами собак с феохромоцитомами были интактными или кастрированными кобелями, а 41 - интактными или овариэктомированными суками. Предрасположенности отдельных пород к развитию феохромоцитомы не выявлено, хотя в нашей группе эти опухоли чаще всего встречались у карликовых пуделей, немецких овчарок, боксеров, золотистых
Возраст (годы)
Рис. 9-2. Распределение 98 собак с феохромоцитомой по возрасту. Средний возраст и его медиана на момент установления диагноза составляли 11 лет.
ТАБЛИЦА 9-3. РАСПРЕДЕЛЕНИЕ 98 СОБАК С ФЕОХРОМОЦИТОМОЙ ПО ПОРОДАМ.
Порода_________________________________Число собак
Карликовый пудель 10
Немецкая овчарка 10
Боксер 7
Золотистый ретривер 6
Лабрадор-ретривер 5
Доберман-пинчер 5
Шелти 5
Метисы 5
Цвергшнауцер 4
Такса 3
Дог 3
Сибирская лайка 2
Чау-чау 2
Далматин 2
Ротвейлер 2
Спрингер-спаниель 2
Веймаранер 2
Прочие (по одной особи каждой породы )23
ретриверов, лабрадор-ретриверов, доберман-пинчеров и шелти (табл. 9-3). Повышенная частота обнаруженияи феохромоцитомы у животных перечисленных пород, по-видимому, просто отражает популярность этих пород в нашем регионе.
Случай феохромоцитомы надпочечников был описан у 11-летней беспородной короткошерстной кошки (Henry et al, 1993). Другая опухоль была случайно обнаружена при УЗИ брюшной полости 15-летней короткошерстной кошки одновременно с аденокарциномой апокриновой железы (Chun et al, 1997). Вненадпочечниковая феохромоцитома (параганглиома) описана у кастрированной короткошерстной беспородной кошки (Patnaik et al, 1990). Параганглиома была локализована вблизи левого надпочечника, но не распространялась на него, а плотно прилегала к почечной капсуле.
Клинические проявления
Клиническая симптоматика и другие изменения, обнаруживаемые при физикальном исследовании животных, являются следствием разрастания опухоли и ее метастазирования либо результатом избыточной секреции катехоламинов (табл. 9-4). Наиболее обычными клиническими симптомами феохромоцитомы являются общая слабость и эпизодическая сердечно-сосудистая недостаточность. Менее выраженными признаками, которые, тем не менее, замечаются владельцами животных и обнаруживаются при физикальном исследовании, служат перемежающаяся возбудимость, ускорение сердечного ритма и сильное сердцебиение, тяжелая одышка или учащенное дыхание, полиурия и полидипсия. Полируия и полидипсия могут быть вызваны избыточной секрецией катехоламинов или развиваются вследствие недостаточности функции почек при блокаде почечного кровотока тромбом опухолевого происхождения. Продукция чрезмерно большого количества катехоламинов может привести также к тяжелой системной гипертензии, которая, в свою
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 477
ТАБЛИЦА 9-4. ЧАСТОТА КЛИНИЧЕСКОЙ СИМПТОМАТИКИ У 40 СОБАК С ФЕОХРОМОЦИТОМАМИ БЕЗ СОПУТСТВУЮЩИХ ЗАБОЛЕВАНИЙ
Клинический симптом Число собак Процент
Эпизоды сердечно-сосудистой 13 33
недостаточности *
Общая слабость * 12 30
Частое или затрудненное дыха- 12 30
ние*
Полиурия/полидипсия 10 25
Сонливость 10 25
Рвота 9 23
Отсутствие аппетита 8 20
Беспокойство/ возбуждение/ 6 15
хождение*
Диарея 4 10
Растяжение брюшной стенки 4 10
Кровотечение (носовое, глазное 4 10
или из десен)
Внезапная слепота 3 8
Тремор* 3 8
Потеря веса 3 8
Тахикардия, сильное сердцебие- 2 5
ние*
Отек задних конечностей 2 5
Болезненный живот 2 5
Адипсия 1 3
Отсутствие клинической симпто- 4 10
матики
* По сообщениям владельцев животных данное расстройство имеет перемежающийся характер.
очередь, чревата внезапной слепотой из-за кровоизлияния в сетчатку и ее отслоения. Кроме того, развиваются симптомы, обусловленные спонтанной геморрагией в ретроперитонеальном пространстве, брюшной полости или отдельных ее органах, а также неврологические расстройства, являющиеся результатом кровотечения из мозговых сосудов, носовой и ротовой полостей (Gilson et al, 1994; Williams et al, 2001; Whittemore et al, 2001).
Секреция катехоламинов носит спорадический и непредсказуемый характер. Поэтому обусловленные феохромоцитомой клинические симптомы и системная гипертензия проявляются как пароксизмальные явления и обычно не наблюдаются во время обследования животного специалистом. Кроме того, клиническая симптоматика зачастую выражена слабо и нечетко, имеет неспецифический характер и потому нередко приписывается иным, нежели феохромоцитома, причинам. Нередко дифференциальная диагностика феохромоцитомы не проводится до тех пор, пока УЗИ брюшной полости не выявит присутствие опухоли в надпочечниках (см. раздел «Случайно выявляемые опухоли надпочечников»). Феохромоцитома может быть также случайно и неожиданно обнаружена при патологоанатомическом исследовании умершего животного. Она может приводить к острой сердечно-сосудистой недостаточности, вызывать смерть в результате внезапного, массивного и длительного высвобождения большого количества катехоламинов из опухолевой ткани или индуцировать периодические
клинические проявления в форме эпизодов сердечно-сосудистой недостаточности, учащенного дыхания или сильного сердцебиения, которые заставляют предполагать наличие феохромоцитомы во время первичного обследования животного.
Ретроспективная оценка состояния 98 собак с феохромоцитомами, поступивших а нашу клинику, показала, что опухоль была случайно обнаружена при вскрытии 22% особей и оказалась неожиданной находкой у 33% животных, подвергшихся эвтаназии по причине сопутствующего заболевания. Кроме того, она явилась причиной внезапной смерти у 14% собак и была случайно идентифицирована у 5% животных при УЗИ брюшной полости или анестезии (в частности по резкому повышению кровяного давления). У 26% из 98 собак феохромоцитома была основным заболеванием, требовавшим дифференциальной диагностики. У этих собак во время первичного обследования были выявлены клинические признаки, свидетельствовавшие о наличии феохромоцитомы (перемежающиеся эпизоды сердечно-сосудистой недостаточности, повышенная возбудимость, ускорение сердечного ритма, тяжелая тахикардия и учащенное дыхание). Подозрение на наличие феохромоцитомы еще более усиливалось после обнаружения опухоли при УЗИ брюшной полости.
К сожалению, многие клинические проявления феохромоцитомы выражены слабо и нечетко и нередко сопутствуют иным, более обычным заболеваниям. Кроме того, феохромоцитома часто развивается одновременно с другими, нередко серьезными расстройствами (табл. 9-5). В результате многие клиницисты сосредоточивают внимание на более знакомых им нарушениях и могут пропустить наличие феохромоцитомы, что приводит к катастрофическим последствиям.
Было высказано предположение о наличии корреляции между размером феохромоцитомы и тяжестью ее клинических проявлений (Bouayad et al, 1987). Наш опыт показывает, что небольшие четко оконтуренные феохромоцитомы, нередко вызывающие лишь минимальное увеличение размеров надпочечников, чаще всего обнаруживаются случайно при УЗИ брюшной полости или на вскрытии погибших животных. В то же время, собаки с клиническими симптомами, предполагающими наличие феохромоцитомы, обычно имеют легко идентифицируемую опухоль надпочечников, которая зачастую сдавливает ближайшие кровеносные сосуды или прорастает в них. Феохромоцитома была случайно обнаружена при УЗИ или на вскрытии у 11 собак из 54, у которых мы диагностировали эту опухоль за последнее время. У 9 (82%) из этих 11 особей феохромоцитома либо не идентифицировалась с помощью УЗИ, либо представляла собой хорошо очерченную опухолевую массу очень небольшого размера (менее 1,5 см в диаметре). Только у 8 (19%) из 43 собак с клиническими симптомами феохромоцитомы при УЗИ брюшной полости была
478 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
ТАБЛИЦА 9-5. СОПУТСТВУЮЩИЕ РАССТРОЙСТВА, ВЫЯВЛЕННЫЕ У 58 ИЗ 98 СОБАК С ФЕОХРОМОЦИТОМОЙ.
Генерализованные расстройства Новообразования
Сахарный диабет Аденома коры надпочечни-
Синдром Кушинга * ков *
Увеличение пищевода Астроцитома
Недостаточность функции Аденокарцинома желчных
печени путей
Панкреатит Фибросаркома
Недостаточность функции Гемангиома
почек Гепатоцеллюлярная карци-
Пиелонефрит, цистит нома
Застойная сердечная недо- Гистоцитома
статочность Лейомиома
Атеросклероз Лимфома
Заболевание межпозвоноч- Аденокарцинома молочной
ных дисков железы
Шейная спондилопатия Опухоль тучных клеток
Дегенеративная миелопатия Меланома
Воспаление среднего уха Аденокарцинома носовой
Гнойный ринит ПОЛОСТИ
Воспаление легких Остеосаркома, хондросар-
Травматические переломы кома
Дегенеративное заболевание Аденокарцинома поджелу-
суставов дочной железы * Макроаденома гипофиза* Первичный гиперпаратиреоз Рабдомиосаркома Семинома Опухоль клеток Сертоли Плоскоклеточная карцинома Тимома Тиреоидная аденокарцинома
* Сопоставимы с множественной эндокринной неоплазией (МЭН) у человека.
выявлена опухоль диаметром менее 2,0 см. У остальных 35 собак была крупная, легко обнаруживаемая опухоль, которая изменяла форму надпочечников и нередко сдавливала окружающие тканевые структуры или прорастала в них.
Физикальное исследование
Результаты физикального исследования собак с феохромоцитомами весьма разнообразны и отчасти зависят от секреторной активности опухолей во время осмотра животных, размера опухоли и наличия сопутствующих патологий. Как показывает наш опыт, эти результаты часто незначительны, а обнаруживаемые нарушения скорее отражают довольно большой возраст животных (например, заболевание зубов, наличие липомы или слабые митральные шумы), нежели присутствие феохромоцитомы. Выявляемые характерные для феохромоцитомы нарушения, как правило, обусловлены избыточной секрецией катехоламинов и включают дыхательные (например, частое или затрудненное дыхание), сердечно-сосудистые (тахикардия, сердечная аритмия, слабая пульсация бедренной артерии) или мышечно-скелетные (общая слабость, уменьшение мы-
ТАБЛИЦА 9-6. ЧАСТОТА НАРУШЕНИЙ, ВЫЯВЛЕННЫХ ПРИ ФИЗИКАЛЬНОМ ИССЛЕДОВАНИИ 40 СОБАК С ФЕОХРОМОЦИТОМОЙ БЕЗ СОПУТСТВУЮЩИХ ЗАБОЛЕВАНИЙ*
Нарушение Число собак Процент собак
Затрудненное или учащенное дыхание 15 38
Общая слабость 9 23
Тахикардия 7 18
Похудение, истощение мышечной 6 15
массы
Сердечные аритмии 6 15
Кровотечение (носовое, глазное или 6 15
из десен)
Слабый пульс 4 10
Обесцвечивание слизистых оболочек 4 10
Боли в животе 4 10
Асцит 4 10
Сонливость 3 8
Пальпируемая опухоль в брюшной 2 5
ПОЛОСТИ
Шоковое состояние 2 5
Слепота, отслоение сетчатки 2 5
Отек нижних конечностей 1 3
Дрожь, мышечный тремор 1 3
Неспособность стоять 1 3
Воспаление переднего отдела сосудис- 1 3
той оболочки глаза
Слабо выраженные нарушения 15 38
* Исключая гериатрическую патологию (липомы, зубные заболевания и нерегулярные сердечные шумы).
щечной массы) расстройства (табл. 9-6). Сердечная аритмия обусловлена преждевременными сокращениями желудочков, сердечной блокадой третьей степени и предсердной тахикардией.
Из 40 обследованных животных опухоль в брюшной полости пальпировалась только у 5% собак, периферические отеки и асцит зарегистрированы у 10%, а боли при пальпации живота еще у 10%. Ни у одной из собак с болями при пальпации живота в брюшной полости не была найдена пальпируемая опухоль. Задержка жидкости чаще всего являлась следствием локальной инвазии и окклюзии каудальной полой вены прилегающей опухолью, что было подтверждено при хирургической операции или на вскрытии у 40% из обследованных нами 98 собак и у всех особей с асцитом или периферическим отеком (Schoeman, Stidworthy, 2001). Известно также, что закупорка задней полой вены может вызывать растяжение подкожных вен вентральной брюшной стенки (Twedt, Wheeler, 1984).
Тяжелая, устойчивая гипертензия может вызвать расширение зрачков, кровоизлияние в сетчатку или слепоту, однако, у обследованных нами собак это наблюдалось относительно редко. Интересно отметить, что у двух собак было слабое, но постоянное носовое кровотечение, а у двух других слабое персистирующее кровотечение в местах небольшой операции, которая была проведена в первую неделю после поступления животных в нашу клинику; еще у одной собаки отмечалось слабое постоянное кровотечение десен. Мы полагаем, что эти явления
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 479
были связаны с повышением кровяного давления. Другие авторы отмечали неврологические симптомы, в том числе судороги, качание головы, нистагм и косоглазие (Twedt, Wheeler, 1984; Gilson et al, 1994). Неврологическая симптоматика, включая боли в спине, атаксию и парез задних конечностей, наблюдалась также у четырех собак с метастазирующей вненадпочечниковой параганглиомой (Hines et al, 1993) и у двух животных с метастазирующей феохромоцитомой (Platt et al, 1998).
Клиническая патология
Не существует каких-либо устойчивых изменений показателей общего клинического анализа крови (ОАК), биохимического профиля сыворотки или состава мочи, которые бы вызывали подозрение на наличие феохромоцитомы. Примерно у 30% обследованных нами собак с феохромоцитомой результаты ОАК и биохимического анализа сыворотки были в пределах нормы и не было признаков сопутствующих заболеваний. Отсутствие изменений гематологических параметров помогает при дифференциальной диагностике секретирующих катехоламины опухолей от опухолей надпочечников, секретирующих кортизол или альдостерон. Наиболее заметным отклонением у наших собак с феохромоцитомой была слабая тромбоцитопения (обычно в пределах 150000 - 200000/мкл), зарегистрированная приблизительно у 20% животных, однако, корреляции между наличием геморрагии и уровнем тромбоцитопении не было. Менее чем у 10% животных отмечалась легкая форма нерегенеративной анемии (показатель гематокрита 25-35%), слабая гемоконцентрация (показатель гематокрита
45-55%) и нейтрофильный лейкоцитоз. Причина этих отклонений и последствия их взаимосвязи с феохромоцитомой неизвестны. Слабая нерегенеративная анемия может быть обусловлена хроническим заболеванием или сопутствующим феохромоцитоме расстройством. Повышение гематокрита, по всей вероятности, отражает уменьшение объема плазмы крови, но может быть следствием стимулируемого катехоламинами высвобождения эритропоэтина из почек или секреции эритропоэтин-по-добного белка, синтезируемого феохромоцитомой.
Биохимический анализ сыворотки крови при феохромоцитоме часто выявляет увеличение активности щелочной фосфатазы и аланинаминотрансферазы, гипоальбуминемию, гиперхолестеринемию и азотемию. Эти изменения при ретроспективном исследовании были обнаружены соответственно у 80, 60, 45, 25 и 25% из 61 животных (Barthez et al, 1997). Однако, когда в расчет брали собак только с феохромоцитомой без серьезных сопутствующих заболеваний, то частота указанных нарушений снизилась соответственно до 40, 10, 5, 15 и 10%. К сожалению, эти изменения биохимического профиля сыворотки мало помогают установлению диагноза феохромоцитомы. Как показывает наш опыт, не существует достоверной корреляции между изменениями активности ферментов печени и наличием в ней метастазов. У большинства обследованных нами собак с феохромоцитомой, которые по данным посмертного патоморфологического исследования имели метастазы в печени, активность ферментов печени была в норме.
Концентрация глюкозы в крови животных с феохромоцитомой колебалась от 120 до 180 мг/100 мл, а глюкозурия отсутствовала примерно у 20% собак.
Рис. 9-3. Схема мобилизации катехоламинами энергетических ресурсов печени, жировой ткани и скелетной мускулатуры. Прямые эффекты катехоламинов усиливаются путем подавления действия инсулина и стимуляции глюкагона (хотя это не требуется для проявления эффекта катехоламинов). + - стимуляция, — ингибирование. Из: Bondy РК, Rosenberg LE (ed): Metabolic Control and Disease, 8th ed. Philadelphia, WB Saunders Co, 1980, 1621:1693.
480 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
Аналогичные данные приводятся в других работах (Twedt, Wheeler, 1984; Barthez et al, 1997). У людей с феохромоцитомой бывает нарушена толерантность к углеводам и повышена концентрация глюкозы в крови натощак (Young, Landsberg, 1998). Адреналин прямо и косвенно стимулирует гликогенолиз в печени и глюконеогенез в печени и почках, а также обеспечивает мышечную ткань альтернативным источником энергии путем мобилизации мышечного гликогена и стимуляции липолиза. Кроме того, адреналин мобилизует предшественники глюконеогенеза, в частности лактат, аланин и глицерин, и ингибирует утилизацию глюкозы в чувствительных к инсулину тканях, таких как скелетная мускулатура (рис. 9-3) (Cryer, 1993; Karam, 2001). Нарушение толерантности к углеводам, отмечаемое у людей с феохромоцитомой, в большинстве случаев выражено слабо и не требует коррекции. Интересно, что у трех из 98 обследованных собак с феохромоцитомой был выявлен сопутствующий инсулинозависимый сахарный диабет, а еще у двух - тяжелый диабетический кетоацидоз. У одной собаки на момент установления диагноза феохромоцитомы диабет был хорошо компенсирован. Неизвестно, влияют ли антиинсулиновые эффекты катехоламинов (и если да, то каким образом) на развитие диабетического кетоацидоза у собак с феохромоцитомами. Возможно, у этих собак предиабетическое состояние (например, патология островков и уменьшение количества бета-клеток) уже было в период развития феохромоцитомы. В этом случае индуцированная катехоламинами инсулинорезистентость повысила потребность в дополнительной продукции инсулина, которая не удовлетворялась в условиях ослабленной секреторной способности островковых клеток. Тяжесть последовавшей гипергликемии зависела от степени нарушения функции островков и инсулинорезистентности. При дифференциальной диагностике мы всегда учитываем феохромоцитому в качестве возможной причины слабого контроля гликемии и кетоацидоза у собак и кошек с сахарным диабетом.
Протеинурия, которая была зарегистрирована примерно у 15% собак с феохромоцитомой без каких-либо сопутствующих заболеваний, была единственным устойчивым нарушением, выявляемым при анализе мочи. Удельный вес мочи колебался от 1,004 до 1,041 ив среднем составлял 1,022. Обнаружение гипостенурии и изостенурии у отдельных животных подтверждало сообщение владельцев этих собак о наличии полидипсии и полиурии (см. табл. 9-4). Катехоламины, особенно норадреналин, ингибируют секрецию вазопрессина из гипофиза в процессе непрессорного взаимодействия с артериальными барорецепторами (Young, Landsberg, 1998). Гемодинамические факторы и индуцируемое катехоламинами подавление ответа почечных собирательных канальцев на вазопрессин также могут способствовать развитию полиурии и полидипсии (Krothapalli et al, 1983).
Методы диагностической визуализации
Ультразвуковое исследование брюшной полости. УЗИ брюшной полости играет ключевую роль в диагностике феохромоцитомы. Клинические проявления феохромоцитомы носят эпизодический и весьма неопределенный характер, а физикальное исследование обычно не позволяет уверено идентифицировать опухоль, при том что клиницисты редко подозревают наличие феохромоцитомы в отсутствие ее неоспоримых признаков. Чаще всего ее диагностируют только после обнаружения опухоли в надпочечниках при проведении УЗИ брюшной полости во время рутинного клинического обследования больных собак или кошек. УЗИ является эффективным инструментом для выявления опухолевой ткани. Ее обнаружение побуждает клинициста обратиться к материалам анамнеза, физикального исследования и первичного анализа крови, а также провести необходимые диагностические тесты с целью выявления функционально активной опухоли и наиболее вероятного источника ее возникновения (см. раздел «Случайно выявляемые надпочечниковые массы»).
При наличии феохромоцитомы УЗИ брюшной полости чаще всего выявляет увеличение размеров одного из надпочечников (т.е. опухоль) при сохранении нормальной величины контралатеральной железы (рис. 9-4). В отличие от этого, у собак с гиперкортицизмом надпочечникового происхождения имеет место одностороннее увеличение надпочечника и уменьшение размеров (т.е. атрофия) противоположной железы (рис. 9-5, см. гл. 6). Среди наших собак с феохромоцитомой почти 85% имели хорошо выраженную опухоль в одном из надпочечников, а у остальных асимметричные размеры надпочечников позволяли предполагать наличие опухоли в более крупной железе. Феохромоцитома может одновременно развиваться и в обоих надпочечниках; в таких случаях УЗИ выявляет двустороннюю опухоль (см. рис. 9-8) (Gilson et al, 1994; Barthez et al, 1997). Кроме того, феохромоцитома иногда встречается вместе с опухолью коры надпочечников, что создает серьезные трудности как при диагностике, так и при лечении этих новообразований (von Dehn et al, 1995; Bennett, Norman, 1998). Хотя нормальный размер надпочечников не исключает наличия феохромоцитомы, наш опыт свидетельствует о положительной корреляции между размерами опухоли и тяжестью ее клинических проявлений. Мелкие феохромоцитомы (размером менее 1 см) обычно обнаруживаются лишь случайно при аутопсии погибших животных.
УЗИ брюшной полости позволяет также получить важную информацию относительно метастазирования опухоли или ее локальной инвазии в окружающие структуры, такие как почки или каудальная полая вена. У собак феохромоцитома часто прорастает в прилегающие кровеносные сосуды, особенно в каудальную полую вену и диафрагмаль-
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
481
Рис. 9-4. Ультразвуковое изображение надпочечников 10-летней оваритктомированной суки бишон-фриза, поступившей в ветеринарную клинику в связи с внезапно начавшейся рвотой. А. Неожиданное обнаружение опухоли с максимальным диаметром 1,4 см в правом надпочечнике (показана стрелками).
Б. Левый надпочечник нормальной формы и размера с максимальным диаметром 0.6 см (показан стрелками). Нормальные ра змсры левого надпочечника свидетельствуют о присутствии в правой железе либо феохромоцитомы, либо функционально неактивной опухоли. Результаты рутинных анализов крови и диагностических тестов на i иперкортицизм у этой собаки оказались нормальными. Гистологическое исследование опухо гевой ткани правого надпочечника подтвердило наличие феохромоцитомы. Из: Nelson RW: Disorders of the Adrenal Gland. In: Nelson RW, Couto CG (eds). Small Animal Internal Medicine, 3d cd. St. Louis, Mosby Inc., 2003, p 786.
Рис. 9-5. Ультразвуковое изображение надпочечников 11-летнсго кастрированного кобеля золотистою ретривера с гиперкортицизмом надпочечникового происхождения. А. Опухоль правого надпочечника, секретирующая кортизол (показана стрелками). Максимальный диаметр опухоли 1,6 см. Б. Выраженная атрофия левого на (почечника (показан стрелками и крестиками) вследствие отсутствия секреции гипофизарного iK ГГ из-за подавления механизма отрицательной обратной связи опухолью коры контралатерального надпочечника. Максимальный диаметр левого надпочечника не превышал 0,2 см. Из: Nelson RW, Disorders of the Adrenal Gland. In: Nelson RW, Couto CG (eds). Small Animal Internal Medicine, 3d ed. St. Louis, Mosby Inc, 2003, p ‘785.
но-брюшную вену, что приводит к тромбозу опухолевого происхождения (рис. 9-6) (Twedt. Wheeker, 1984; Bouayad et al, 1987; Kyles et al, 2003). В одном из исследовании чувствительность и специфичность УЗИ брюшной полости при выявлении опухолевых тромбозов у собак с опухолями надпочечников достигали соответственно 82 и 86° о (Kyles et al., 2003). Опухолевый тромбоз может стать причиной асцита, который также выявляется при УЗИ брюшной полости.
Рентгенологическое исследование брюшной и грудной полостей. Рентгенография брюшной полости менее эффективна, чем УЗИ в качестве инструмента идентификации адреномегалии. У 11 из 30 (37°о) обследованных нами собак с феохромоцитомой рентгенологическое исследование брюшной полости выявило краниальную опухоль в области надпочечников. У двух особей (7%) было отмечено обызвествление опухоли. Попутно при рентгенологическом исследовании этих 30 живот-
482 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
Рис. 9-6. Ультразвуковое исследование брюшной полости 14-летнего пуделя На одном из полюсов левого надпочечника (А) обнаружена узловая опухоль, распространяющаяся на каудальную полую вену (Б). Гистологическое исследование опухолевой ткани позволило идентифицировать ее как феохромоцитому. CVC — кау дельная полая вена, ADR — надпочечник.
ных были обнаружены гепатомегалия, смещение или аномальные очертания почек и увеличение каудальной полой вены. Согласно одному из сообщений, кальцификация надпочечников имеет место у 50° о собак с новообразованиями в корковом слое железы но редко отмечается у собак с феохромоцитомой (Lamb et al, 1991). Нарушения, выявляемые при рентгене грудной полости, включают генерализованную кардиомегалию, увеличение правого или левого желудочков, отек и застойные явления в легких. По всей вероятности, эти нарушения обусловлены системной гипертензией. Сообщалось об обнаружении узловых образований в легких, позволявших предполагать метастазирование этих органов, примерно у 10% обследованных собак (Gilson et al, 1994; Barthez et al, 1997).
Компьютерная (KT) и магнитно- резонансная (MPT) томография. KT и MP i представляют собой неинвазивные методы получения изображений надпочечников и прилегающих к ним структур с целью характеристики формы, архитектоники, размеров и симметрии этих желез, определения очертаний опухолей и выявления их прорастания в окружающие ткани, а также для обнаружения метастазирования (рис. 9-7 и 9-8) (Rosenstein, 2000). Было показано, что у людей визуализация методом МРТ является более чувствительным, по сравнению с КТ, методом определения степени опухолевого тромбоза (Goldfarb et al, 1990). Мы используем сканирование брюшной полости с помощью КТ и МРТ для подтверждения наличия опухоли в надпочечниках в тех случаях, когда УЗИ не позволяет поставить диагноз, а также для идентификации опухолевого тромбоза и прорастания опухоли в окружающие органы перед назначением адреналэктомии. Более подробные сведения о применении этих технически совершенных методов приведены в разделах «Рентгенологическое исследование», «Ультразвуковое исследование брюшной полости» в гл. 6.
Специалитированные исследования. Исторически внутривенную урографию и артериогра
фию используют для выявления опухолей надпочечников, которые инвазируют краниальные полюса почек или вызывают смещение почек. Венографию применяют также для идентификации сдавливания, смещения или окклюзии каудальной полой вены (1'wedt, Wheeler, 1984; Barthez et al, 1997). В последнее время эти методы вытесняются УЗИ, КТ и МРТ.
Метайодобензилгуанидин (МИБГ) является структурным аналогом производного кванетидина и по химической струкгуре сходен с норадреналином. Он избирательно захватывается адренергическими нейронами и мозговой тканью надпочечников, концентрируется в нейросекреторных депонирующих гранулах хромаффиновых клеток, слабо связывается с постсинаптическими рецепторами и не вызывает (или вызывает слабую) фармакологическую реакцию (Sisson, 1986). Использование МИБГ, меченого йодом-131 или йодом-123, и применение гамма-камеры позволяет визуализировать хромаффино-вую ткань (Sisson et al, 1981). Применение ядерной сцинтиографии с использованием меченого МИБГ у людей дает возможность выявить местоположение надпочечниковой, эктопической или диссеминированной феохромоцитомы ( Sisson et al, 1981; Fischer et al, 1984; Thompson et al, 1984; Hanson et al, 1991). Чувствительность и специфичность сканирования с использованием меченного МИБГ' для выявления феохромоцитомы у людей составляют соответственно 77-88 и 88-100% (Shapiro et al, 1985; Werbel, Ober, 1995). При этом причиной получения ложноположительных результатов является, в первую очередь, накопление МИБГ в нормальной надпочечниковой ткани (Gough et al, 1985). Ложноотрицательные результаты приписывают либо слишком быстрому включению и секреции нейросекреторных гранул, либо отсутствию накопления норадреналина и уменьшению количества нейросекреторных гранул в опухолевых клетках (Tobes et al, 1985; Hanson et al, 1991). Было сообщение об эффективном использовании сцинтиографии с применением меченого
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 483
Рис. 9-7. Л. Компьютерная томограмма области левого надпочечника 10-летней овариэктомированной суки ротвейлера, на которой видна масса мягкой ткани неправильной формы, расположенная медиально по отношению к левой почке (пока 1ана стрелкой). Эта масса была удалена хирургическим путем, а ее гистоло! ичсс-кос исследование показало, что она является феохромоцитомой.
Б. Компьютерная томограмма области правого надпочечника той же собаки, юмонстрирующая норма 1ьные размеры этой железы (показана стрелкой).
Рис. 9-8. А. Компьютерная томограмма области правого надпочечника 10-летнего кастрированного кобеля афганской борзой с множественной эндокринной неоплазией, на которой видна масса мягкой ткани неправильной формы размером 6 х 7 см (показана сплошной темной стрелкой), расположенная медиально по отношению к правой ночке (покачана сплошной светлой стрелкой) и распространяющаяся на каудальную полую вену (показана пунктирной стрелкой).
Б. Компьютерная томограмма области левого надпочечника той же собаки, демонстрирующая увеличение его размеров до 3 х 3 см. Левый надпочечник имеет овальную форму с плавными контурами. На вскрытии были обнаружены двусторонняя феохромоцитома, аденома коры левого надпочечника, тиреоидная карцинома и гиперплазия паращитовидных желез.
йодом-123 МИБГ для идентификации феохромоцитомы в правом надпочечнике йоркширского терьера (Berry et al, 1993). р-Фторобензилгуанидин, меченый фтором-18 (18Р-рФБГ ), представляет собой аналог норадреналина, специально синтезированный для целей позитрон-эмиссионной томографии (ПЭТ), которая предназначена для визуализации опухолей нейроэндокринных органов, в том числе феохромоцитом. Применение 18Б-рФБГ позволило идентифицировать феохромоцитому у двух собак и доказать отсутствие опухоли у одной собаки, у которой ее подозревали. В последнем случае правильность
диагноза и наличие интактных надпочечников было подтверждено при последующей операции и гистологическом исследовании ткани, полученной при биопсии (Berry et al, 2002).
Измерение артериального кровяного давления
Всем собакам и кошкам с феохромоцитомой показано измерение системного артериального кровяного давления. Для этой цели используют несколько методов. В их числе прямое опреде юние
484 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
с помощью иглы или наполненного жидкостью катетера, соединенных с датчиком давления, и непрямое неинвазивное измерение с использованием надувной манжеты, которую одевают на ногу или хвост животного и подсоединяют либо к осциллометрическому преобразователю, например, прибору для мониторинга кровяного давления в ветеринарии (Dinamap, производства Critikon Inc, США) или допплеровскому ультразвуковому детектору, например, модели 811 (Parks Medical Electronics, Inc., США) или артериозонду 1010 (производства Hoffman-LaRoche, США). Результаты измерения кровяного давления с помощью допплеровского ультразвукового метода или осциллометрическим методом хорошо коррелируют с результатами, получаемыми посредством прямого определения. Для повышения точности измерений их необходимо повторять несколько раз (5 или 10), выводя среднюю величину. Беспокойство и стресс, связанные с обследованием в условиях ветеринарной клиники, могут спровоцировать ложное повышение кровяного давления у некоторых собак (так называемый «эффект белого халата»). Поэтому рекомендуется по возможности снизить до минимума напряжение, испытываемое животным перед и во время проведения физикального исследования или диагностических тестов.
Определение величины нормального кровяного давления у собак затруднительно, как из-за зависимости его величины от возраста, пола, породы и других факторов у здоровых животных, так и из-за воздействия различных заболеваний на величину давления (Bodey, Mitchell, 1996). Тем не менее, исследователи придерживаются единого мнения, согласно которому гипертензией считается устойчивое повышение систолического давления выше 160 мм рт. ст. и/или устойчивое увеличение диастолического давления выше 100 мм рт.ст. Гипертензия в отсутствие азотемии и нарушений функции коры может иметь место при самых разных заболеваниях у собак, включая феохромоцитому (табл. 9-7). К сожалению, секреция катехоламинов этой опухолью и, следовательно, системная гипертензия носят эпизодический характер. Отсутствие системной гипертензии у собак с соответствующими клиническими признаками не исключает наличия феохромоцитомы. Повышение кровяного давления было зарегистрировано у 11 (38%) из 29 находившихся под нашим наблюдением собак, у которых феохромоцитома была единственным заболеванием. Иными словами, у них не было сопутствующих патологий, которые могли бы повлиять на величину кровяного давления, в частности, таких как гиперкортицизм, почечная недостаточность или сахарный диабет. В исследованиях других авторов гипертензия была зарегистрирована у 43-50% собак, которым измеряли кровяное давление (Twedt, Wheeler, 1984; Barthez et al, 1997). Эти данные совпадают с результатами, полученными у людей с феохромоцитомой, среди которых от 25 до 40% испытыва-
ТАБЛИЦА 9-7. ПРИЧИНЫ УСТОЙЧИВОЙ ГИПЕРТЕНЗИИ У ЛЮДЕЙ, СОБАК И КОШЕК.
Люди Собаки и кошки
«Эссенциальная» или пер- «Эссенциальная» или пер-
вичная причина вичная причина
Паренхимальное заболевание Паренхимальное заболевание
почек почек
Сосудистое заболевание Сосудистое заболевание
почек почек
Г иперкортицизм Г иперкортицизм
Первичный гиперальдосте- Первичный гиперальдосте-
ронизм ронизм
Гипертиреоз Гипертиреоз
Гипотиреоз Гипотиреоз
Феохромоцитома Феохромоцитома
Сахарный диабет Сахарный диабет
Синдром неадекватной сек- Синдром неадекватной сек-
реции антидиуретического реции антидиуретического
гормона гормона
Заболевание печени Заболевание печени
Ожирение Ожирение
Повышенное потребление Повышенное потребление
СОЛИ соли
Гиперкальциемия, гиперпа- Хроническая анемия (у
ратиреоз Ренин-секретирующая опухоль Акромегалия Заболевание ЦНС Повышенная вязкость/поли-цитемия Сужение аорты Г иперэстрогенизм Беременность Применение оральных контрацептивных средств кошек)
ли перемежающееся (а не постоянное) повышение кровяного давления (Young, Landsberg, 1998). В идеале, владелец собаки должен измерять кровяное давление в то время, когда, по его мнению, у животного появляются соответствующие клинические симптомы. К сожалению, на момент поступления в ветеринарную клинику такие симптомы у собак обычно отсутствуют. Альтернативным способом выявления гипертензии у собаки с подозрением на феохромоцитому на фоне в целом нормотензивного состояния является серийное измерение кровяного давления либо в течение суток, либо на протяжении нескольких последовательных дней.
У собак с системной гипертензией средняя величина систолического, диастолического и общего артериального давления составляла соответственно 193, 119 и 145 мм рт.ст. при ее колебаниях соответственно от 102 до 230, от 102 до 145 и от 133 до 166 мм. рт.ст. Лечение таких животных было направлено на устранение эффектов феохромоцитомы, при этом ни одна из собак не получала антигипертензивные препараты. У многих людей с феохромоцитомой реакция на обычную антигипертензивную терапию оценивается как неудовлетворительная. Такая рефрактерность может служить диагностическим признаком феохромоцитомы. В то же время, отдельные больные с феохромоцитомой отвечают на такие а-адренер-
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 485
ТАБЛИЦА 9-8. УКАЗАНИЯ ПО ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ БИОХИМИЧЕСКИХ ТЕСТОВ ПРИ ФЕОХРОМОЦИТОМЕ У ЛЮДЕЙ
Тест Норма Диагностический уровень Чувствитель ность Специфичность
Концентрация норадреналина в плазме крови < 0,5 нг/мл > 2 нг.мл 58%-85% 88%-99%
Концентрация адреналина в плазме крови Суточная экскреция с мочой: < 0,1 нг/мл > 0,4 нг.мл 33%-62% 79%-94%
Норадреналин < 75 нг/24 ч увеличение в 1,5-2 раза 70%-90% 54%-98%
Адреналин < 25 нг/24 часа увеличение в 1,5-2 раза 50%-75% 84%-98%
Метанефрин < 0,4 мг/24 часа увеличение в 1,5-2 раза 58%-97% 96%-99%
Норметанефрин < 0,9 мг/24 часа увеличение в 1,5-2 раза 90%-97% 58%-98%
Метанефрин + норметанефрин < 1,3 мг/24 часа увеличение в 1,5-2 раза 97%—100% 84%-98°/о
Ванилилминдальная кислота < 8,0 мг/24 часа увеличение в 1,5-2 раза 64%-90% 87%-98%
По: Werbel SS, Ober КР: Pheochromocytoma/ Update on diagnosis, localization, and management. Med Clin N Amer 79:131, 1995.
гические блокаторы, как феноксибензамин, празозин и лабеталол (Young, Landsberg, 1998).
Гормональные тесты
Важное значение для диагностики феохромоцитомы у человека имеет оценка продукции и экскреции катехоламинов. Биохимический анализ обычно включает определение концентрации катехоламинов и продуктов их обмена в плазме крови и моче в базальных условиях. Термином феохромоцитома определяют гетерогенную группу гормон-секретирующих опухолей, поэтому ни один анализируемый показатель не обеспечивает 100%-ной чувствительности диагностики, так же как не существует единого мнения среди специалистов, работающих с феохромоцитомами, относительно оптимального теста для выявления этого новообразования. Многие авторы предпочитают измерять у людей концентрацию свободных катехоламинов (т.е. адреналина, норадреналина и дофамина) в суточных пробах мочи с помощью высокоэффективной жидкостной хроматографии (Prys-Roberts, 2000). Другие определяют в суточной моче метанефрины и эквивалент свободных катехоламинов (Young, Landsberg, 1998). К сожалению, малая доступность, техническая сложность и высокая стоимость этих методов ограничивают их применение в ветеринарии. В связи с этим прижизненная диагностика феохромоцитомы у собак обычно базируется на результатах осмотра во время хирургической операции и гистопатологического исследования опухоли надпочечников. Тем не менее, перечисленные методы определения катехоламинов заслуживают обсуждения, поскольку они обычно используются в медицине, упоминаются в ветеринарной литературе и в будущем могут найти более широкое применение при обследовании животных.
Концентрация катехоламинов в плазме крови. Диагностическая ценность определения базальной концентрации катехоламинов в плазме крови с целью выявления феохромоцитомы зависит отчасти от характера клинической симптоматики и устойчивости гипертензии. У людей с постоянно повышенным кровяным давлением и клиническими симптомами феохромоцитомы концентрация катехоламинов и продуктов их обмена в плазме,
как правило, явно повышена. В то же время у лиц с редкими и кратковременными приступами болезни, перемежающимися с периодами ее бессимптомного течения, подтверждение диагноза представляет собой более трудную задачу. Несмотря на продукцию большого количества катехоламинов во время коротких эпизодов обострения заболевания, их концентрация в плазме крови во время обследования может оказаться нормальной (Duncan et al, 1988; Goldfien, 2001). С другой стороны, повышенное возбуждение животного в стрессорных условиях взятия проб крови, наряду с сопутствующим заболеванием, может вызвать временное повышение концентрации катехоламинов до уровня, наблюдающегося при феохромоцитоме (Jones et al, 1980). У людей измерение базальной концентрации катехоламинов в плазме крови иногда показано при пограничных результатах их определения в моче (см. ниже). У лиц с нормальным кровяным давлением общая концентрация катехоламинов в плазме крови обычно составляет от 0,1 до 0,5 нг/мл. Базальный уровень катехоламинов выше 2 нг/мл (12 нмоль/л) подтверждает диагноз феохромоцитомы, тогда как концентрация ниже 0,5 нг/мл (3 нмоль/л) практически исключает его (табл. 9-8) (Werbel, Ober, 1995; Young, Landsberg, 1998). Сообщения о проведении подобных измерений у собак и кошек отсутствуют.
Катехоламины и продукты их превращения в моче. Определение катехоламинов и продуктов их превращения в моче является одним из наиболее часто используемых методов диагностики феохромоцитомы у людей. Увеличение экскреции катехоламинов и их метаболитов с мочой служит основанием для постановки диагноза феохромоцитома. К числу продуктов превращения катехоламинов, содержание которых определяют в моче, относятся метанефрин, норметанефрин и ванилил-миндальная кислота (ВМК) (рис. 9-9) (Werbel, Ober, 1995; Young, Landsberg, 1998). Катехоламины и их метаболиты определяют в суточной моче или рандомизированных пробах и результаты выражают в микрограммах креатинина на миллилитр. Поскольку секреция катехоламинов в большинстве случаев носит эпизодический характер, лучше определять их содержание в суточной моче, а не в рандомизированных пробах (Duncan et al, 1988).
486 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
Конъюгаты с глю-
Конъюгаты с глюкуронидами или сульфатами
4 комт
куронидами или сульфатами
Норметанефрин
МАО
Норадреналин^^ Мда
3,4- Дигидроксимин- КОМТ дальная кислота ’
Адреналин
Конъюгаты с глюкуронидами или сульфатами
МАО
КОМТ
Метанефрин
МАО
Ванилилминдаль-ная кислота
Рис. 9-9. Основные пути метаболической деградации норадреналина и адреналина. Конъюгация катехоламинов и продуктов их обмена происходит в печени и желудочно-кишечном тракте. Катехоламины и их метаболиты в основном экскретируются с мочой, хотя печень также принимает участие в их выведении. КОМТ-катехол-О-метилтрансфераза, МАО — моноаминоксидаза. Из: Levine RI, Landsberg L. In: Bondy PK, Rosenberg LE, Duncan’s Disease of Metabolism, 7th ed. Philadelphia, WB Saunders Co, 1974, p 1196.
Для более точной постановки диагноза желательно одновременно определять два или более этих соединений в моче (см. табл. 9-8). Количество экскретируемых с мочой свободных катехоламинов и их метаболитов зависит от активности синтезирующих и метаболизирующих эти соединения ферментов в опухоли и от интенсивности экскреторной функции почек. Эти факторы могут быть ответственны за ложноположительные и ложноотрицательные результаты анализа.
При получении проб мочи у людей и их подготовке к анализу принимаются меры предосторожности с целью повышения точности и достоверности результатов оценки экскреции катехоламинов и продуктов их превращения (Young, Landsberg, 1998). Пробы следует брать у пациента в состоянии покоя, в отсутствие приема лекарственных средств или недавнего введения контрастных веществ для рентгенографии. Большинство методов анализа достаточно специфичны и требуют минимального ограничения диеты. Наименее специфичен метод определения ВМК, который дает в некоторых лабораториях до 10-15% ложноположительных результатов, если пациенты потребляли продукты и напитки, содержавшие ваниль, такие как бананы, орехи или фрукты. Наконец, пробы мочи необходимо подкислять (до pH ниже 3,0) и держать на холоду во время и после сбора. Обычно мочу собирают в 15 мл 6 N соляной кислоты, которую можно получить в любой клинической лаборатории, проводящей соответствующие анализы.
Общее содержание адреналина, норадреналина и дофамина в суточных пробах мочи здоровых людей обычно ниже соответственно 0,02 мг/24 часа, 0,08 мг/24 часа и 0,4 мг/24 часа (Goldfien, 2001). У большинства пациентов с феохромоцитомой эти величины вдвое выше. В норме концентрации метанеф-рина, норметанефрина и ВМК обычно составляют 0,4 мг/24 часа, 0,9 мг/24 часа и 8 мг/24 часа соответственно. У людей с феохромоцитомами имеет
место избыточная экскреция этих метаболитов с мочой, уровень которой нередко втрое превосходит соответствующие нормальные показатели. Тем не менее, некоторым людям с нечастыми и кратковременными эпизодами гипертензии и клинических проявлений феохромоцитомы, которые чередуются с длительными периодами бессимптомного течения заболевания, поставить диагноз трудно. Диагностика осложняется тем обстоятельством, что общее количество катехоламинов, экскретируемых с мочой на протяжении суток, может быть довольно близким к нормальному, в отличие от пациентов, опухоли которых непрерывно секретируют катехоламины и их метаболиты (Goldfien, 2001).
В ветеринарной литературе описаны лишь отдельные случаи определения концентрации катехоламинов и их метаболитов в моче животных. Имеется, в частности, сообщение о проведении таких измерений у двух собак, хотя диагностическая ценность полученных данных сомнительна. У одной из обследованных в нашей клинике собак концентрация катехоламинов в моче была повышена и снизилась после удаления опухоли. Достоверность диагностики феохромоцитомы на основании результатов определения экскреции катехоламинов с мочой у собак и кошек до сих пор критически не оценивалась.
Ингибирующие и провокационные пробы. До появления точных биохимических методов определения концентрации катехоламинов и их метаболитов диагностику феохромоцитомы у людей осуществляли посредством введения различных химических агентов. Например, ингибирующая проба с клонидином позволяла дифференцировать повышение концентрации катехоламинов в плазме крови вследствие секреторной активности феохромоцитомы и повышение, вызванное стрессом. Другой способ заключался в стимуляции секреции катехоламинов феохромоцитомой для провокации значительного повышения кровяного давления,
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 487
например, посредством введения гистамина или глюкагона (Young, Landsberg, 1989). Однако многие из этих проб были недостаточно чувствительны и специфичны, а также вызывали тяжелые нежелательные реакции. В настоящее время они считаются устаревшими, им на смену пришло определение концентрации катехоламинов и продуктов их превращения в моче. Более подробную информацию об этих методах можно почерпнуть из второго издания книги «Canine and Feline Endocrinology and Reproduction» («Эндокринология и репродукция собак и кошек»).
Постановка диагноза
Важное значение для правильной диагностики феохромоцитомы имеют опыт и квалификация клинициста, позволяющие ему своевременно предположить наличие опухоли. Нет никаких устойчивых отклонений в показателях ОАК, биохимического анализа сыворотки или мочи, которые позволяли бы заподозрить феохромоцитому. Наиболее ценными признаками для обоснования предварительного диагноза являются: наличие в анамнезе острых или спорадических случаев сердечно-сосудистой недостаточности, общей слабости, периодов сильного сердцебиения, сильной одышки или учащенного дыхания (часто эпизодических); идентификация других нарушений дыхательной и сердечной функций или зрительных расстройств (например, кровоизлияния в сетчатку вследствие системного повышения кровяного давления) во время физикального исследования; выявление системной гипертензии (особенно пароксизмальной) и обнаружение опухоли в надпочечниках при УЗИ брюшной полости. Наличие гипертензии у собаки с опухолью в надпочечнике в отсутствие азотемии и нарушений функции коркового вещества встречается при самых разнообразных заболеваниях, включая феохромоцитому. К сожалению, секреция катехоламинов этой опухолью и, следовательно, повышение кровяного давления носят эпизодический характер. Невозможность подтвердить системную гипертензию не исключает диагноз феохромоцитомы у собаки, имеющей соответствующие клинические признаки.
Еще одним подтверждением феохромоцитомы является выявление при УЗИ односторонней ад-реномегалии (т.е. опухоли надпочечника) при сохранении нормального размера контралатеральной железы. Проведение УЗИ для определения размеров надпочечников у собак и кошек с системной гипертензией, по-видимому, является наилучшим методом скрининга на феохромоцитому, хотя обнаружение желез нормального размера также не исключает ее присутствия (von Dehn et al, 1995). УЗИ позволяет получить информацию относительно метастазирования или локальной инвазии опухоли в окружающие структуры, в частности каудальную полую вену. Правда, обнаружение локальной инвазии или опухолевого тромбоза, само по себе, не
доказывает наличия феохромоцитомы. В недавнем ретроспективном исследовании опухолевые тромбы были обнаружены у 6 (56%) из 11 собак с феохромоцитомой и у 6 (21%) из 28 собак с опухолью коры надпочечников (Kyles et al, 2003). Особенно важно иметь в виду, что результаты УЗИ брюшной полости, возможно, в большей степени, чем результаты любого другого используемого в ветеринарии метода диагностики, зависят от опыта и квалификации оператора. Во всех случаях подозрения на опухоль надпочечников необходимо консультироваться с квалифицированным рентгенологом или врачом, имеющим соответствующий опыт работы.
При выявлении опухоли в надпочечниках следует исключить другие варианты диагноза, особенно опухоль коры надпочечников, приводящей к гиперкортицизму, или функционально неактивную опухоль (см. табл. 9-10). У одной и той же особи могут одновременно развиваться и феохромоцитома и опухоль коры надпочечников (von Dehn et al, 1995), что значительно затрудняет их диагностику и лечение. Многие клинические признаки (например, частое или затрудненное дыхание или общая слабость), а также изменения кровяного давления, часто встречающиеся у собак с гиперкортицизмом, сходны с таковыми у животных, с феохромоцитомой, хотя у последних регистрируются реже. Поэтому в случае обнаружения у собаки опухоли в надпочечниках важно сначала исключить гиперкортицизм, используя соответствующие гормональные пробы (см. гл. 6), а затем уже сосредоточиться на феохромоцитоме.
Для уточнения предварительного диагноза феохромоцитомы можно использовать результаты определения концентраций катехоламинов и их метаболитов в моче, но это редко применяют при обследовании собак и кошек. В результате, прижизненный окончательный диагноз у этих животных основывается, главным образом, на материалах гистологического исследования опухолевой ткани, полученной при ее резекции.
Хирургическое лечение
Обзор. Методом выбора для лечения феохромоцитомы является предварительная медикаментозная терапия для устранения последствий избыточной адренергической стимуляции и затем хирургическое удаление опухоли. Успешность химиотерапии и радиотерапии при лечении феохромоцитомы у людей относительно невысока (Keiser et al, 1985; Averbuch et al, 1988), а сообщения о применении этих методов для лечения злокачественной феохромоцитомы у собак и кошек отсутствуют. Терапия митотаном (о,р’-ДДД) не дает желаемого эффекта при опухолях медуллярной ткани надпочечников и поэтому не рекомендуется. Хроническое медикаментозное лечение показано, главным образом, для контроля избыточной секреции катехоламинов и в меньшей степени - для уменьшения риска локаль
488 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
ной инвазии или метастазирования опухоли надпочечников в другие органы.
Критерии отбора собак для хирургического лечения феохромоцитомы не установлены. При отборе принимаются во внимание возраст животных, размеры опухоли, наличие или отсутствие инвазии опухоли в окружающие структуры (например, в полую вену) и метастазов, а также возможное влияние сопутствующего заболевания на эффективность анестезии. В отсутствие другого заболевания, локальной инвазии или метастазирования опухоли вероятность успешного исхода операции повышается. Посмертное исследование 23 (33%) из 70 обследованных нами собак с феохромоцитомой выявило гистологическую картину метастатической болезни. Места метастазирования включали каудальную полую вену, печень, легкие, региональные лимфатические узлы, сердце, селезенку, почки, кости, поджелудочную железу и ЦНС (Barthez et al, 1997). Как и в случае многих других эндокринных опухолей, уменьшение размеров феохромоцитомы после хирургической операции (даже при обнаружении во время операции метастазов) повышает эффективность медикаментозной терапии, улучшает качество жизни собаки или кошки и продлевает их жизнь. Наличие опухолевого тромбоза не является, само по себе, абсолютным противопоказанием к адреналэктомии или венотомии. В одной из недавних публикаций сообщается о выживании 9 из 11 собак после адреналэктомии (в том числе всех пяти особей, не имевших опухолевого тромбоза) и четырех из 6 собак с тромбозом полой вены (Kyles et al, 2003).
Предоперационная подготовка. При проведении анестезии и манипуляциях на опухоли во время операции возможны серьезные осложнения, угрожающие жизни животного (рис. 9-10; von Dehn et al, 1995). Наибольшее беспокойство вызывают эпизоды острой, тяжелой гипертензии, во время которых систолическое артериальное давление поднимается выше 300 мм рт.ст., а также эпизодическая тяжелая тахикардия (частота сердечных сокращений более 250 в минуту), аритмия и кровотечения. Для предотвращения тяжелых клинических проявлений гипертензии в предоперационном периоде, уменьшения часто присутствующей гиповолемии и оптимизации условий для проведения анестезии показана а-адренергическая блокада (Desmonts, Marty, 1984; Hull, 1986). Предоперационная терапия с применением а-адренергической блокады позволяет снизить периоперационную смертность, связанную с хирургическим удалением феохромоцитомы у людей, до 0-6% по сравнению с 13-45% в отсутствие блокады (Roizen et al, 1983; Lucon, 1997). Целесообразность такого подхода подтверждается обнаружением у многих больных с феохромоцитомой гиповолемии в предоперационном периоде (Roizen, 1981).
Феноксибензамин (дибензилин производства компании SmithKline Beecham) является неизбира
тельным и неконкурентным антагонистом а-адре-норецепторов, который широко применяется при необходимости а-адренергической блокады. У людей начальная доза этого препарата составляет 0,25 мг/кг веса для приема внутрь дважды в день; необходимо ее постепенное ежедневное увеличение до нормализации кровяного давления и уменьшения тяжести клинических проявлений заболевания. В соответствии с протоколом лечения гипертензии у собак с феохромоцитомой, принятым в нашей клинике, животные получают феноксибензамин в предоперационном периоде и фентоламин во время операции. Начальная доза феноксибензамина составляет 0,25 мг/кг веса дважды в день. К сожалению, у многих собак с феохромоцитомой, поступающих в ветеринарную клинику, имеются лишь эпизодические клинические проявления опухоли и гипертензии, что затрудняет коррекцию дозы феноксибензамина по мере нормализации их общего состояния и кровяного давления. Кроме того, указанная дозировка зачастую недостаточна для предотвращения значительного повышения кровяного давления во время операции. Поэтому мы постепенно увеличиваем количество получаемого собакой феноксибензамина, повышая его дозу один раз в несколько дней, до появления клинических признаков гипотензии (в форме сонливости, общей слабости и/или сосудистой недостаточности), либо отрицательных побочных эффектов (например, рвоты) или до достижения максимальной дозы препарата (2,5 мг/кг дважды в день). К хирургическому лечению рекомендуется приступать через 1-2 недели после начала медикаментозной терапии. Феноксибензамин продолжают вводить вплоть до проведения операции. Однако даже введение а-адренерги-ческих блокаторов в предоперационном периоде не позволяет полностью избежать осложнений во время и после операции. Поэтому для успешного исхода хирургического лечения первостепенное значение имеет тщательный периоперационный мониторинг состояния животного.
Доксазозин (Cardura, Pfizer Inc., США), конкурентный избирательный агонисто al-адренорецепторов, с успехом применяется для предоперационной подготовки больных с феохромоцитомой (Prys-Roberts, 2000). Доксазозин характеризуется хорошей биологической доступностью (> 70%) и длительным действием, что позволяет вводить его пациентам один раз в день. Благодаря его способности избирательно блокировать al-адренорецепторы, он не оказывает нежелательного действия, связанного с блокадой а2-адренорецепторов, такого как снятие ингибирования высвобождения норадреналина из симпатических нервных окончаний в сердце. В одном из последних исследований было показано, что эффективность контроля кровяного давления в предоперационном периоде с помощью доксазозина была, по меньшей мере, такой же, как при использовании феноксибензамина у больных с феохромоцитомами. К тому же доксазозин ока-
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 489
Частота сердечных сокра- Артериальное кровяное
щений (число ударов/мин ) давление (мм рт. ст.)
Рис. 9-10. Результаты прямого измерения артериального систолического и диастолического кровяного давления до начала анестезии (До), во время ее индукции ( время 0) и во время удаления феохромоцитомы у 16-летнего кастрированного кобеля колли (А) и у 12-летнего кобеля уэст-хайленд-уайт-терьера (Б). Обратите внимание на неожиданное возникновение гипертензии во время индукции анестезии у колли и во время хирургических манипуляций на феохромоцитоме у обеих собак, а также на исчезновение гипертензии после удаления опухоли. (*) — начало операции на опухоли, (+)— завершение резекции опухоли.
зывал меньше нежелательных побочных эффектов (Prys-Roberts, Famdon, 2002). В нашей клинике док-сазозин пока еще не применялся для лечения феохромоцитомы у собак и кошек.
В случае тяжелой тахикардии назначают терапию антагонистами p-адренергических рецепторов, такими как пропранолол в дозах от 0,2 до 1,0 мг/кг для приема внутрь трижды в день или атенолол (0,2-1,0 мг/кг) перорально один или два раза в день на протяжении предоперационного периода. Пропранолол можно давать только после начала а-адренергической блокады, потому что ингибирование опосредуемого через р-адренергические рецепторы расширения сосудов в скелетной мускулатуре создает риск тяжелой гипертензии (Young, Landsberg, 1998).
Анестезия и внутриоперационные осложнения. При подозрении на феохромоцитому необходимо до начала наркоза предупредить об этом анестезиолога. Анестезия, особенно в самом ее начале, а также манипуляции на опухоли во время операции чреваты угрожающими жизни осложнениями (von Dehn et al, 1995), из которых наибольшее опасение внушают эпизоды острой, тяжелой гипертензии при величине систолического артериального давления более 300 мм рт.ст. (см. рис. 9-10), эпизодическая тяжелая тахикардия при частоте сердечных
сокращений более 250 в минуту, сердечная аритмия и кровотечения. Эти осложнения могут возникнуть несмотря на введение а-адренергических блокаторов в предшествовавшем периоде. В связи с этим необходим тщательный мониторинг электрической активности сердца с помощью ЭКГ и артериального кровяного давления на всем протяжении анестезии и в течение 24—48 часов после завершения операции. Оценка этих параметров позволяет быстро выявить необходимость поддерживающей терапии и своевременно начать ее в случаях возникновения сердечной аритмии, гиповолемии и/или нарушений кровяного давления.
Теоретически следует избегать назначения лекарственных средств, которые вызывают высвобождение гистамина, обладают ваголитической и симпатомимической активностью, повышают чувствительность миокарда к катехоламинам либо вызывают прессорную реакцию при введении больным с феохромоцитомами (табл. 9-9; Hull, 1986). Несмотря на возможные осложнения, связанные с применением многих премедикационных и анестезирующих препаратов и способов анестезии, практически все они с успехом применяются в медицине при хирургическом удалении феохромоцитомы, хотя действие всех этих средств сопровождается преходящим нарушением сердечного ритма во вре-
490 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
ТАБЛИЦА 9-9. ПРЕПАРАТЫ ДЛЯ ПРЕАНЕСТЕЗИИ И АНЕСТЕЗИИ, СЧИТАЮЩИЕСЯ БЕЗОПАСНЫМИ И ПОТЕНЦИАЛЬНО БЕЗОПАСНЫМИ ПРИ ИСПОЛЬЗОВАНИИ У ЛЮДЕЙ С ФЕОХРОМОЦИТОМОЙ.
Безопасные Потенциально опасные
Алфентанил Атракуриум
Бензодиазепины Атропин
Энфлуран Хлорпромазин
Этомидат Кураре
Фентанил Дроперидол
Изофлуран Галламин
Окись азота Галотан
Пентотал Метокурин
Суфентанил Морфин
Векурониум Панокурониум
Сукцинилхолин
Суксаметониум
мя операции (Roizen et al, 1982). Выбор способа анестезии не является решающим фактором, определяющим успех операции у людей и состояние больных после резекции феохромоцитомы. Гораздо большее значение имеют такие факторы, как выбор оптимальной медикаментозной терапии в предоперационном периоде (особенно типа а-адренерги-ческой блокады), тщательная и постепенная анестезия, адекватный мониторинг состояния больного (особенно на начальных этапах наркоза), правильность действий хирурга и хорошее взаимопонимание между хирургом и анестезиологом.
Схема анестезии, применяемая в настоящее время в нашей клинике, предусматривает введение оксиморфона и атропина либо гликопирролата в качестве преанестетиков, фентанилцитрата и диазепама или мидазолама для индукции анестезии и изофлурана с фентанилцитратом для обеспечения сбалансированной под держивающей анестезии. Использование такой схемы позволяет нам избежать многих осложнений во время индукции анестезии у собак, подвергающихся хирургической операции по поводу феохромоцитомы. В то же время внут-риоперационные осложнения остаются довольно частым явлением; они включают пароксизмальную гипертензию и гипотензию, пароксизмальную тахикардию и сердечную аритмию. Накопленный нами опыт свидетельствует о важности адекватного мониторинга состояния животных, особенно во время манипуляций на опухоли или при окклюзии каудальной полой вены.
Непрерывный мониторинг центрального венозного давления и прямое измерение артериального кровяного давления помогают своевременно выявлять гипертензию или гипотензию. Гипотензию во время операции корректируют уменьшением дозы или отменой фентоламина, снижением концентрации вдыхаемого препарата и/или быстрым увеличением внутрисосудистого объема путем введения кристаллоидных жидкостей, экспандеров объема плазмы или цельной крови. В связи с тем, что гипо
тензия обычно лучше корректируется при увеличении объема, чем при введении сосудосуживающих препаратов, прессорную терапию фенилэфрином, al-адренергическим препаратом короткого действия, прекращают до снятия гипотензии (Young, Landsberg, 1998).
Для контроля гипертензии во время операции вводят внутривенно фентоламин (производства Novartis, США), конкурентный блокатор а-адре-нергических рецепторов с кратковременным действием. Начальная нагрузочная доза фентоламина составляет 0,1 мг/кг веса, а затем его внутривенно инфузируют с постоянной скоростью, начиная с 1-2 мкг/кг веса в минуту. В случае возникновения гипотензии уменьшают дозу или отменяют введение фентоламина, назначают al-адренергический агонист фенилэфрин и/или увеличивают внутрисосудистый объем посредством введения кристаллоидных жидкостей, экспандеров объема плазмы или цельной крови.
Если гипертензия, тахикардия или аритмия желудочков сохраняются, несмотря на адекватную a-адренергическую блокаду, рекомендуется внутривенное введение эсмолола - а-адренергическо-го антагониста короткого действия. Сначала внутривенно вводят нагрузочную дозу 0,1 мг/кг, после чего эсмолол инфузируют на всем протяжении операции с постоянной скоростью, начиная с 50-70 мкг/кг/мин.
К сожалению, собаки с феохромоцитомой нередко имеют сопутствующие заболевания (см. табл. 9-5), для лечения которых также необходимо проведение операции под общим наркозом. Часто у таких собак феохромоцитому не подозревают до тех пор, пока ее угрожающие жизни осложнения не проявятся во время анестезии при операции по другому поводу. У нас было несколько собак, у которых феохромоцитому и не подозревали, но индукция анестезии для проведения лечебных мероприятий в связи с другим заболеванием (радиотерапии новообразования и удаления хрусталика при катаракте) внезапно вызвала тяжелую системную гипертензию и/или сердечную аритмию. Таким образом, наш опыт лишний раз подчеркивает важность адекватного мониторинга состояния собак при проведении анестезии.
Особенности хирургического лечения, послеоперационные осложнения и исход операций. Техника хирургических операций по удалению опухолей надпочечников описана в руководствах по ветеринарной хирургии и не рассматривается в этой книге. Хирургическая резекция феохромоцитом достаточно сложна с технической точки зрения. Объем исследования в пределах операционного поля зависит от результатов предоперационной локализации опухоли и наблюдений во время операции. Хотя в большинстве случаев феохромоцитома у собак поражает только один надпочечник, необходим тщательный осмотр обеих желез и прилегающих к ним областей, а также симпатической нервной цепи,
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 491
проходящей вокруг брюшной аорты. Кроме того, с целью выявления участков метастазирования рекомендуется внимательно оценить состояние каудальной полой вены, диафрагмально-абдоминальной вены, региональных лимфатических узлов и других находящихся в брюшной полости органов, особенно печени. Результаты гистологического исследования феохромоцитомы не позволяют предсказать ее малигнизирующую активность. Поэтому ее всегда оценивают во время хирургической операции. Колебания артериального кровяного давления и пульса, как и тяжесть гипертензии и тахикардии после удаления феохромоцитомы обычно уменьшаются,. Подозрение на метастазирование возникает в тех случаях, когда после операции кровяное давление не снижается, либо сохраняются его нерегулярные, но явно выраженные подъемы. В случае удаления обоих надпочечников врач должен предусмотреть назначение заместительной кортикостероидной терапии (см. гл. 8).
Послеоперационные осложнения наблюдаются часто и включают гипертензию, сердечную аритмию, дыхательные расстройства и кровотечения (Kyles et al,2003). Восемь из 17 собак, которым в нашей клинике была произведена адреналэктомия в связи с феохромоцитомой, погибли во время операции или в течение 10 дней после нее (Barthez et al, 1997). Две собаки погибли в результате прекращения сердечно-сосудистой деятельности в процессе операции, две другие подверглись эвтаназии после выявления обширного метастазирования и еще одна - из-за невозможности удалить первичную опухоль. Три собаки погибли вследствие хирургических осложнений (расстройство дыхания и сепсис) либо подверглись эвтаназии из-за отсутствия улучшения в первые 10 дней после операции. Отдаленное наблюдение за двумя оперированными собаками оказалось невозможным после их передачи хозяевам, еще одна особь погибла через 6 месяцев, а две другие спустя 3 года после операции и вне связи с ней. Одна собака прожила 3,25 года после удаления метастазирующей феохромоцитомы, а три других оставались живыми и здоровыми на протяжении 3 лет.
Медикаментозное лечение
Контроль кровяного давления и аритмий. Целью медикаментозной терапии в предоперационном периоде является стабилизация метаболического состояния животного, сведение к минимуму развития сердечных аритмий и тяжелой гипертензии во время операции, а также контроль клинических проявлений, обусловленных избыточной секрецией катехоламинов у животных с метастатической или неоперабельной опухолью. Первые две из этих задач рассматривались в разделе, посвященном хирургическому лечению феохромоцитомы. Хроническая медикаментозная терапия предназначена, в первую очередь, для предупреждения и/или устранения
последствий избыточной секреции катехоламинов и в меньшей степени для профилактики локальной инвазии опухоли и метастазирования ею других органов. С этой целью применяется блокатор а-адренергических рецепторов феноксибензамин. Необходимые дозы препарата зависят от состояния животного и не поддаются прогнозированию. Мы обычно начинаем вводить феноксибензамин в дозе 0,25 мг/кг дважды в день, а в последующем постепенно увеличиваем ее по мере необходимости до исчезновения того или иного симптома или до появления нежелательных побочных эффектов (см. раздел «Предоперационная подготовка»). Некоторым собакам требуется дополнительная терапия 0-адренергическими антагонистами, такими как пропранолол или атенолол, для уменьшения тяжести персистирующей тахикардии. Но следует помнить, что эти препараты можно назначать только после начала а-адренергической блокады. В отсутствие последней введение 0-адренергических антагонистов может спровоцировать тяжелую гипертензию.
Активное подавление биосинтеза катехоламинов теоретически должно служить эффективным способом снижения их секреции феохромоцитомой. а-Метилметатирозин (метирозин производства DemseR, Merck Sharp and Dohme, США) ингибирует активность тирозингидроксилазы и тем самым блокирует реакцию превращения тирозина в дофамин, лимитирующую скорость биосинтеза катехоламинов (см. рис. 9-1) (Fraser, 1979). а-Метилметати-розин применялся для ингибирования образования катехоламинов в феохромоцитоме. Его ежедневное введение пациентам с этой опухолью в дозах от 0,3 до 4,0 г на 40-80% снижало биосинтез катехоламинов (Fraser, 1979). Однако токсическое действие этого препарата на почечные и нервные ткани ограничивает его применение для лечения метастазирующей феохромоцитомы у больных людей при невозможности хирургического удаления опухоли. Данных об использовании а-метилметатирозина для лечения феохромоцитомы у собак нет.
Радиотерапия и химиотерапия. Поскольку приблизительно 90% феохромоцитом у людей представляют собой доброкачественные новообразования, методом выбора для их лечения является адреналэктомия, которая обычно дает хорошие результаты (Young, Landsberg, 1998). При злокачественных феохромоцитомах предпочтение, по возможности, также отдается их хирургическому удалению. Фактически никакой другой подход, кроме оперативного вмешательства, не обеспечивает эффективного лечения злокачественной феохромоцитомы. Радиотерапия может оказаться полезной как средство облегчения болей и уменьшения тяжести поражения костной ткани (Keiser et al, 1985). Для лечения некоторых пациентов со злокачественными феохромоцитомами использовалась радиоиммунотерапия с применением меченного йодом-131 метайодобензилгуанидина (МИБГ). В подробном обзоре 116 пациентов с этой опухолью,
492 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
которым многократно вводили Н,1-МИБГ, сообщается об улучшении клинической симптоматики у 7б% больных и уменьшении размеров опухоли на 50° о у 30° о пациентов (Loh et al, 1997). Хотя этот препарат применяли для визуализации феохромоцитом у собак, сообщений об его использовании для лечения этих опухолей у собак и кошек до сих пор не было.
Некоторый успех был достигнут при комбинированной терапии феохромоцитомы у людей с использованием циклического циклофосфамида, винкристина и дакарбазина (Keiser et al, 1985; Averbuch et al, 1988). В одном из этих исследований такая сочетанная терапия приводила к частичному или полному улучшению клинического состояния у 57°о из 14 пациентов со злокачественными метастазирующими феохромоцитомами (Averbuch et al, 1988). Улучшение наблюдалось в течение 7-34 месяцев (в среднем 21 месяц). Частичное или полное улучшение биохимических показателей имело место у 79° о больных. Сведения о химиотерапии злокачественной феохромоцитомы у собак и кошек отсутствуют.
Прогноз
Прогноз феохромоцитомы в известной мере зависит от размеров опухоли, наличия метастазирования и или локальной инвазии в прилегающие кровеносные сосуды и соседние органы (в частности, почки), возможности избежать периоперационных осложнений в случае адреналэктомии, а также от наличия и характера сопутствующего заболевания. При операбельных опухолях прогноз от осторожного до благоприятного. Наши собаки, перенесшие операцию и выжившие в ближайшем послеоперационном периоде, прожили в последующем от 2 месяцев до более 3 лет. Если нет метастазов, удалось избежать периоперационных осложнений, и сопутствующие заболевания отсутствуют, то собака может прожить достаточно долго (от года до 2 лет). Терапия а-адрснергическими блокаторами в предоперационном периоде и проведение операции квалифицированными хирургами и анестезиологами, имеющим опыт работы на надпочечниках, помогает избежать потенциально серьезных периоперационных осложнений, связанных с анестезией и манипуляциями на опухоли. Собаки, получающие медикаментозную терапию, живут более года с момента установления диагноза феохромоцитомы, если опухоль имеет небольшие размеры (менее 3 см в щаметре) и не распространяется на прилегающие сосуды, а лечение блокаторами а-адренергических рецепторов юстаточно эффективно для сведения к минимуму отрицательного воздействия эпизодов избы точной секреции катехоламинов опухолью. Большинство собак умирает или подвергается эвтаназии из-за осложнений, вызванных продукцией чрезмерно большого количества катехоламинов, сопутствующим опухолевым тромбозом либо ме
тастазированием или инвазией феохромоцитомы в окружающие органы.
СЛУЧАЙНО ВЫЯВЛЯЕМЫЕ ОПУХОЛИ НАДПОЧЕЧНИКОВ
На протяжении последнего десятилетия УЗИ стало рутинным методом характеристики структуры мягких тканей в брюшной полости. Одним из последствий широкого применения УЗИ органов брюшной полости стало неожиданное выявление опухолевидных масс в надпочечниках (рис. 9-11). Клиническая значимость таких находок зависит от этиологии новообразований и в случае истинной опухоли от ее функциональной активности и степени малиг-низации. Большинство случайно обнаруживаемых посторонних масс в надпочечниках собак и кошек представляют собой доброкачественные, функционально неактивные опухоли либо не неопластические образования (например, грануломы). Основное количество функционирующих новообразований надпочечников представляют собой либо опухоли коры, секретирующие кортизол, либо опухоли медуллярного вещества, секретирующие катехоламины. Существует общее правило, согласно которому любую надпочечниковую массу следует рассматривать как неоплазию, пока не доказана ее иная природа. Адреналэктомия является методом выбора в случаях функционально активных или злокачественных опухолей, но она не всегда показана, если опухоль имеет небольшие размеры, доброкачественная и функционально неактивная. К сожалению, определение доброкачественной или злокачественной природы опухоли надпочечников до се удаления и гистологического исследования представляет известную трудность. Критериями малигнизации
Рис. 9-11. Ультразвуковое изображение брюшной полости 13-летней овариэктомированной суки шелковистого терьера, поступившей в ветеринарную клинику в связи с внезапно начавшейся рвотой. Во время ультразвукового исследования на одном из полюсов левого надпочечника (показан стрелкой) была неожиданно обнаружена опухоль диаметром 1,2 см. Размеры правого надпочечника оставались нормальными, также как результаты рутинных анализов крови, диагностических тестов на гиперкортицизм и и шерений артериального кровяного давления. Этиология опухоли неизвестна.
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
493
ТАБЛИЦА 9-10. ОПУХОЛИ НАДПОЧЕЧНИКОВ, ОБНАРУЖЕННЫЕ У СОБАК И КОШЕК
Секретируемый гормон Вид Клинический синдром Диагностические тесты
Функционально неактивная опухоль надпочечников Отсутствует Собака*, кошка Диагностика методом исключения Гистопатология
Функционально актив- Кортизол Собака* Гиперкортицизм, Провокационная проба с АКТГ - опре-
ная опухоль коры надпочечников кошка синдром Кушинга деление концентрации кортизола. Ингибирующая проба с низкими дозами дексаметазона
Альдостерон Кошка*, собака Г иперальдостеронизм, синдром Конна Определение К и Na в сыворотке крови. Стимуляция АКТГ - измерение концентрации альдостеона
Прогестерон Предшествен ники стероидных гормонов Кошка*, собака Синдром, имитирующий гиперкортицизм Измерение концентрации прогестерона в сыворотке крови
17-гидрокси-прогестерон Собака Синдром, имитирующий гиперкортицизм Провокационная проба с АКТГ - измерение концентраций предшественников стероидных гормонов
Дезоксикортикостерон Собака Синдром, имитирующий гиперальдостеронизм Провокационная проба с АКТГ - измерение концентраций предшественников стероидных гормонов
Функционально активная опухоль медуллярной ткани надпочечников Адреналин Собака, кошка Феохромоцитома Диагностика методом исключения Г истопатология
* Чаще всего страдающий вид
Из: Nelson RW, Couto CG: Small Animal Internal Medicine. St. Louis. Mosby, 2003, p 811
могут служить размеры новообразования, его инвазия в окружающие органы и кровеносные сосуды, а также наличие дополнительных нарушений, выявляемых с помощью УЗИ брюшной полости и рентгенографии грудной клетки. Чем больше размер опухоли, тем больше вероятность ее малигнизации и метастазирования, независимо от результатов ультразвукового и рентгенологического исследований. Цитологическое или гистологическое исследование материала, получаемого посредством аспирационной или пункционной биопсии опухоли под контролем ультразвукового сканирования, позволяет установить ее доброкачественный или злокачественный характер, а также источник неоплазии, т.е. кору или медуллярное вещество надпочечников (Chun et al, 1997; Rosenstein, 2000).
Опухоль надпочечников может быть функционально активной (т.е. продуцирующей и секретирующей тот или иной гормон) или неактивной. У собак и кошек происходит избыточная секреция кортизола, катехоламинов, альдостерона, прогестерона и предшественников стероидных гормонов (табл. 9-10). Наиболее обычные функционально активные опухоли надпочечников секретируют кортизол (например, при первичном гиперкортицизме) или катехоламины (феохромоцитома). Альдосте-рон-секретирующие опухоли надпочечников, вызывающие первичный гиперальдостеронизм (синдром Конна), у собак и кошек встречаются нечасто. Подозрение на наличие такой опухоли возникает при появлении у животного соответствующих клинических симптомов, а именно сонливости, общей
слабости, гипернатриемии, тяжелой гипокалиемии (при концентрации калия в крови менее 3,0 мэкв/л) и системной гипертензии. Функционально активные опухоли, развивающиеся из сетчатой зоны коры надпочечников могут продуцировать избыточные количества эстрогенов, тестостерона или прогестерона, однако в настоящее время наиболее часто встречаются опухоли, секретирующие прогестерон (Boord, Griffin, 1999; Rossmeisl et al, 2000; Syme et al, 2001). Избыточная секреция прогестерона опухолями у кошек приводит к развитию сахарного диабета и синдрома ломкой кожи кошачьих, который характеризуется прогрессивным усилением тяжести атрофических изменений дермы и эпидермиса, развитием эндокринной очаговой алопеции и уменьшением прочности кожи на разрыв. Внешние проявления такой опухоли сходны с клинической картиной гиперкортицизма, что вызывает необходимость дифференциальной диагностики этих заболеваний. У кошек с прогестерон-секретирующей опухолью в одном надпочечнике система гипофиз-кора надпочечников функционирует нормально или угнетена, тогда как размеры и форма контралатеральной железы по данным УЗИ брюшной полости остаются неизменными. Для постановки окончательного диагноза необходимо подтвердить повышение концентрации прогестерона в плазме крови.
Функционально активные опухоли, продуцирующие избыточные количества того или иного промежуточного продукта биосинтеза кортикостероидов, редко встречаются у собак и кошек. У одной собаки была обнаружена карцинома коры надпо
494
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
чечников, секретирующая дезоксикортикостерон (Reine et al, 1999). Дезоксикортикостерон является предшественником альдостерона, обладает минералокортикоидной активностью и взаимодействует с рецепторами альдостерона. Основными клиническими проявлениями карциномы у данной особи были общая слабость, выраженная гипокалиемия и системная гипертензия. Концентрация дезоксикортикостерона в плазме крови этой собаки была повышена, а альдостерон практически не определялся. У собак описаны также опухоли надпочечников, секретирующие 17-гидроксипрогестерон и прогестерон (Ristic et al, 2000). Первый из этих стероидов служит предшественником кортизола. Симптоматика заболевания и данные физикального исследования у этих животных предполагали наличие гиперкортицизма, результаты тестирования системы гипофиз-кора надпочечников свидетельствовали о ее нормальной или подавленной функции, а концентрация 17-гидроксипрогестерона в плазме крови до и после стимуляции АКТГ была повышена.
Для оценки функционального статуса случайно выявленной опухоли надпочечников необходимо сопоставить клиническую симптоматику, результаты физикального исследования животного, рутинных анализов крови и мочи и соответствующих гормональных тестов. Для исключения гиперкортицизма определяют отношение концентраций кортизола и креатинина в моче, проводят стимулирующую пробу с АКТГ и ингибирующую пробу с низкими дозами дексаметазона. При наличии общей слабости и тяжелой гипокалиемии в дополнение к измерению уровня кортизола в пробе с АКТГ определяют концентрацию альдостерона в плазме крови. Мы обычно не проводим специальных гормональных тестов для выявления феохромоцитомы. Если гормональные тесты с целью диагностики гиперкортицизма и определение концентрации электролитов в сыворотке дают нормальные результаты, а клиническая симптоматика предполагает наличие феохромоцитомы, мы идентифицируем опухоль как феохромоцитому и начинаем лечение антагонистом а-адре-нергических рецепторов.
Если же на фоне нормальных результатов гормональных тестов и нормальной концентрации сывороточных электролитов клинические признаки феохромоцитомы отсутствуют, но животному показана адреналэктомия, мы ставим предварительный диагноз феохромоцитома и начинаем введение феноксибензамина в порядке предоперационной подготовки.
Если гормональные тесты с целью выявления гиперкортицизма дают нормальные результаты, концентрация сывороточных электролитов не нарушена и отсутствуют клинические признаки и тяжелая гипертензия, указывающие на феохромоцитому, адреналэктомия является факультативным вариантом лечения. Теоретически, хирургическое удаление злокачественной опухоли обеспечивает максимальную продолжительность жизни собаки или
кошки. Однако, принимая решение о проведении адреналэктомии, ветеринар должен учесть возраст и общее клиническое состояние животного, размер и инвазивность опухоли, а также вероятность ее метастазирования. Обычно хирургическое лечение не показано старым собакам и кошкам, особенно если сопутствующее заболевание повышает связанный с анестезией риск до неприемлемого уровня, когда имеет место метастазирование или когда велика вероятность серьезных осложнений из-за большого размера и инвазивного характера опухоли. Кроме того, адреналэктомию не назначают при небольших размерах опухоли (менее 3 см в диаметре), которая предположительно не обладает функциональной активностью, а животное-носитель (собака или кошка) здорово. Альтернативный подход, используемый в таких случаях, состоит в следующем. Сначала определяют скорость роста опухоли с помощью повторного УЗИ брюшной полости с интервалами в 1,2,4 и 6 месяцев (рис. 9-12). Если размер опухолевой массы не изменяется, последующие исследования проводят раз в 4-6 месяцев. В случае роста опухоли назначают адреналэктомию.
МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ (МЭН)
Группу наследственных синдромов, включающих аномальный рост доброкачественных или злокачественных опухолей в эндокринных тканях, объединяют под общим названием множественная эндокринная неоплазия (МЭН) (Gardner, 2001). Опухоли могут быть функционально активными (т.е. продуцировать гормональные соединения, вызывающие специфичные для избытка одного из них клинические симптомы) или неактивными. Различают три основных синдрома множественной эндокринной неоплазии: МЭН 1, МЭН 2А и МЭН 2В (табл. 9-11) (Gagel, 1998; Gardner, 2001). У людей описаны также синдромы МЭН смешанного типа, сочетающие в себе черты МЭН 1, МЭН 2А и МЭН 2В (Сапсе, Wells, 1985; Gagel, 1998).
МЭН 1 и МЭН 2 у людей имеют ряд общих признаков. Во-первых, клетки, вовлекаемые в неопластический процесс, представлены одним или несколькими специфическими типами, продуцирующими полипептиды или биогенные амины (т.е. АПУД-клетками, накапливающими предшественники биогенных аминов и осуществляющими их декарбоксилирование). Исключение составляют липомы, относящиеся к МЭН 1, а также нейромы слизистых и полипы толстого кишечника, относящиеся к МЭН 2. Другим общим свойством этих синдромов является гистологическая эволюция клеток от гиперплазии до аденомы, а в отдельных случаях до карциномы. Третьим общим признаком является многоцентровый процесс развития гиперплазии, в ходе которого каждый очаг опухоли формируется из единственного клеточного клона (Arnold et al, 1988). Наконец, каждый из перечисленных синдромов на-
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
495
Рис. 9-12. А - Улыразвуковос изображение брюшной полости десятилетней овариэктомированиой беспородной суки, поступившей в ветеринарную клинику в связи с внезапно появившимися рвотой, диареей и сонливостью. Во время УЗИ на одном из полюсов левою надпочечника (показан стрелками) была нсожи данно обнаружена опухоль диаметром 1,4 см. Размеры правого надпочечника оставались нормальными, также как результаты рутинных анализов крови, диагностических тестов на гиперкортицизм и измерении артериального кровяного давления. Ультразвуковое исследование опухоли неоднократно повторялось на протяжении двух последующих ют. Через один (Б) и два (В) года диаметр новообразования составлял соответственно 1,8 и 2,0 см. Все это время собака оставалась здоровой и тестирование функции коры надпочечников давало нормальные результаты. Собака живет уже более трех лет после обнаружения у нес опухоли без признаков какого-либо заболевания. Этиология опухоли неизвестна.
следуется по аутосомно-доминантному типу. В то же время в основе развития синдромов МЭН лежат разные механизмы. МЭН 1 возникает в результате наследственной мутации гена супрессора опухолей - меняна, который локализован на длинном плече хромосомы 11 (Gardner, 2001). Этот ген регулирует ряд важных аспектов роста, дифференцировки и гибели клеток, а утрата обеих его копий (аллелей) приводит к неконтролируемому клеточному росту. В отличие от этого происхождение синдромов МЭН 2А и МЭН 2В связано с активацией RET протоонкогена, локализованного на хромосоме 10 (Marsh et al, 1996: Pasini et al, 1996). Две наиболее распростра
ненные мутации этого протоонкогена активируют рецепторы тирозинкиназы, вызывая гем самым нерегулируемый рост клеток, ассоциирующихся с МЭН 2 (Gagcl, 1998). Показано, что экспрессия мутированного RET протоонкогена у транстснных мышей индуцировала гиперплазию С-клеток и образование С-карцином, морфологическое строение которых было сходно с таковым у людей с синдромом МЭН 2 (Michiels et al. 1997).
МЭН типа I. Термином МЭН 1 обозначают семейное расстройство, обусловленное сочетанием гиперплазии или неоплазии паращитовидной, поджелудочной и гипофизарной желез (см. табл. 9-11).
496 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
ТАБЛИЦА 9-11. СРАВНЕНИЕ КЛИНИЧЕСКИХ ХАРАКТЕРИСТИК ОСНОВНЫХ СИНДРОМОВ МНОЖЕСТВЕННОЙ ЭНДОКРИННОЙ НЕОПЛАЗИИ У ЧЕЛОВЕКА.
Эндокринное расстройство МЭН1 МЭН2А МЭН2В
Гиперпаратиреоз 90%-95% 25% Редко
Опухоли эндокринной поджелудочной железы 30%-80% — —
Аденомы гипофиза 20%-25% — —
Подкожные липомы 30% — —
Тиреоидная аденома Редко — —
Аденомы надпочечников 40% — —
Карциноидная опухоль 20% — —
Медуллярная карцинома щитовидной железы — 80%-100% 100%
Феохромоцитома — 40% 50%
Нейромы слизистых — — 100%
Кишечные ганглионейромы — — Более 40%
Марфаноподобный хабитус — — 75%
Наследование Аутосомно-доминан- Аутосомно-доминан- Аутосомно-доминан-
тное тное тное
Чаще всего МЭН 1 проявляется в форме гиперпаратиреоза, сопровождающегося гиперкальциемией (Gagel, 1998). Наиболее обычной гистологической характеристикой этого синдрома является поли-гландулярная гиперплазия паращитовидных желез, хотя на поздних стадиях заболевания у людей она может дополняться аденоматозными изменениями. Методом выбора для лечения гиперпаратиреоза при МЭН 1 является хирургическая операция. Рецидивы гиперкальциемии весьма нередки, по-видимому, не столько из-за наличия изолированных функционально активных аденом, сколько вследствие «гиперпластической» природы паратиреоидного расстройства (Rizzoli et al, 1985).
Вторым по частоте встречаемости клиническим проявлением синдрома МЭН 1 является неоплазия островковых клеток поджелудочной железы. Несмотря на то, что опухоль панкреатических островковых клеток нередко проявляется как клинический синдром, обусловленный продукцией всего одного гормона (например, инсулина), для большинства таких опухолей характерна одновременная гиперплазия различных типов клеток и продукция сразу нескольких пептидов и биогенных аминов (Pilato et al, 1988; Gardner, 2001). Гастринома, вызывающая синдром Золлингера-Эллисона, который характеризуется повышенной секрецией желудочной кислоты вследствие избыточной продукции гастрина опухолью (см. гл. 15), является одной из основных причин заболеваемости и смертности при МЭН 1 у человека. Усиление продукции гастрина было выявлено примерно у 50-60% больных с функционально активными опухолями поджелудочной железы, которые ассоциируются с МЭН 1 (Eberle, Grun, 1981). Инсулинома, служащая причиной гипогликемии, является второй по частоте встречаемости опухолью островковых клеток поджелудочной железы. Она составляет приблизительно 20% всех функционально активных панкреатических опухолей у больных с синдромом МЭН 1 (Gradner, 2001). Значительно более редкими компонентами этого синдрома у человека являются опухоли поджелудочной железы, секретирующие глюкагон (глюкагономы), панкреатический полипептид (полипептидомы) и
вазоактивный кишечный полипептид (который вызывает синдром водянистого стула) (см. гл. 15).
Более половины больных с МЭН 1 имеют гипофизарные опухоли (Eberle, Grun, 1981). В основном, это многоочаговые новообразования, к числу которых относятся пролактиномы (встречающиеся наиболее часто), опухоли, продуцирующие гормон роста (соматотропиномы), и опухоли, синтезирующие АКТГ (кортикотропиномы). Клиническими следствиями этих неоплазий служат соответственно галакторея, акромегалия и синдром Кушинга.
МЭН типа 2А. Синдром МЭН 2А характеризуется двусторонней и многоцентровой медуллярной карциномой щитовидной железы, односторонней или двусторонней феохромоцитомой и, реже, гиперплазией или аденоматозом паращитовидных желез (см. табл. 9-1) (Gagel, 1998). Медуллярная тиреоидная карцинома представляет собой многоцентровую неоплазию парафолликулярных или С клеток щитовидной железы. Самым ранним наблюдаемым проявлением этой опухоли в щитовидной железе человека является гиперплазия С клеток, которая затем развивается в узловую гиперплазию, микроскопическую медуллярную тиреоидную карциному и, в конце концов, в явную медуллярную тиреоидную карциному (DeLellis et al, 1986). Эти изменения имеют многоцентровую природу и нередко сопровождаются аномальными гистологическими изменениями нескольких типов в одной или обеих долях щитовидной железы.
Хромаффинная ткань надпочечников у людей с синдромом МЭН 2А претерпевает такие же гистологические изменения, как и С клетки щитовидной железы, в том числе гиперплазию, диффузную экспансию медуллярного вещества и развитие феохромоцитомы (Gagel, 1998). Обычно на фоне гиперплазированной хромаффинной ткани развиваются как изолированные, так и множественные феохромоцитомы, которые поражают один или оба надпочечника. Их клинические проявления обусловлены избыточной секрецией катехоламинов.
Гиперпаратиреоз, который является причиной гиперкальциемии, встречается у 10-20% людей со зрелой формой синдрома МЭН 2А (Cance, Wells,
ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ • 497
1985). Гистологическое исследование ткани паращитовидных желез, полученной от больных с этим расстройством, обычно выявляет нерегулярное формирование аденоматозных структур на фоне гиперплазии железистой ткани (Carney et al, 1980). Этот процесс аналогичен тому, который приводит к гистологическим изменениям С клеток.
МЭН типа 2В. Термином МЭН 2В обозначают комбинацию медуллярной карциномы щитовидной железы и феохромоцитомы в сочетании с множественными нейромами слизистых и кишечными ган-глионейромами (см. табл. 9-11). Отличительным признаком этого синдрома является наличие характерных нейром слизистой оболочки в дистальной части языка, на губах и в подконъюктивальных областях, а также на всем протяжении желудочно-кишечного тракта (Gagel, 1998). Клиническое течение этого синдрома у больных с медуллярной тиреоидной карциномой носит более агрессивный характер, чем при синдроме МЭН 2А, а метастатическая болезнь может развиться даже у детей в возрасте до 1 года (Telander et al, 1986). Почти у половины больных с данным расстройством встречается односторонняя или двусторонняя феохромоцитома, гистологически сходная с опухолью мозгового вещества надпочечников при синдромоме МЭН 2А (Hubner, Holschneider, 1987).
МЭН у собак и кошек. У собак и кошек синдромы, напоминающие МЭН у человека, встречаются редко. Тем не менее, в ветеринарной литературе имеются описания отдельных случаев. Так, имеется сообщение о медуллярной карциноме щитовидной железы, феохромоцитоме и гиперплазии паращитовидных желез у 15-летнего жесткошерстного фокстерьера (Peterson et al, 1982). Описанный синдром сопоставим с МЭН 2А у человека. Опубликованы также данные о различных вариантах синдрома МЭН, в том числе у 4 собак с тиреоидной неоплазией и аденомой надпочечников (Hayes, Fraumeni, 1975), у 14-летнего йоркширского терьера с феохромоцитомой и первичным гиперпаратиреозом (Wright et al, 1995), у десятилетнего шнауцера с гипофизарной опухолью, синтезирующей АКТГ, двусторонними опухолями коры надпочечников и феохромоцитомой (Thuroczy et al, 1998) и у 12-летней беспородной собаки с зависимым от гипофиза гиперкортицизмом (Walker et al, 2000). Среди собак обследованной нами группы у 63 были обнаружены опухоли, поражавшие одну или более эндокринных желез, помимо опухоли щитовидной железы (см. табл. 5-4). Неясно, имелись ли у этих особей семейные заболевания, сходные с синдромами МЭН, либо расстройства, аналогичные МЭН смешанного типа (перекрывающиеся синдромы), либо просто случайно совпавшие множественные нарушения. Как бы то ни было, сам факт наличия нескольких эндокринных опухолей у одной и той же собаки или кошки (независимо от того, являются ли они компонентами МЭН или нет) подчеркивает важность исчерпыва
ющего диагностического обследования животных с эндокринными неоплазиями.
У людей каждый компонент того или иного синдрома МЭН развивается независимо, а его клинические проявления в рамках отдельных синдромов существенно отличаются, хотя при МЭН 1 преобладающим является гиперпаратиреоз, а при МЭН 2А и 2В - медуллярная тиреоидная карцинома (Leshin, 1985). Аналогичная тенденция прослеживалась в обследованной нами группе собак и кошек с синдромами МЭН. Иными словами, эндокринная опухоль того или иного типа сопровождалась специфическими клиническими симптомами и клинико-патологическими нарушениями, характер которых не зависел от сопутствующих эндокринных опухолей. Лечение разнообразных проявлений МЭН по большей части проводится так же, как лечение аналогичных расстройств, когда они встречаются в спорадической форме.
ЛИТЕРАТУРА
Arnold A, et al: Monoclonality and abnormal parathyroid hormone genes in parathyroid adenomas. N Engl J Med 318:658, 1988.
Averbuch SD, et al: Malignant pheochromocytoma: Effective treatment with a combination of cyclophosphamide, vincristine, and dacarbazine. Ann Intern Med 109:267, 1988.
Barthez PY, et al: Pheochromocytoma in dogs: 61 cases (1984-1995). J Vet Intern Med 11:272, 1997.
Bennett PF, Norman EJ: Mitotane (o,p’-DDD) resistance in a dog with pituitary-dependent hyperadrenocorticism and phaeochromocytoma. Aust Vet J 76:101, 1998.
Berry CR, et al: Use of ’“iodine metaiodobenzylguanidine scintigraphy for the diagnosis of a pheochromocytoma in a dog. Vet Rad Ultrasound 34:52, 1993.
Berry CR, et al: Imaging of pheochromocytoma in two dogs using p-[”Flfluo-robenzylguanidine. Vet Rad Ultrasound 43:183, 2002.
Bodey AR, Michell AR: Epidemiological study of blood pressure in domestic dogs. J Small Anim Pract 37:116, 1996.
Boord M, Griffin C: Progesterone secreting adrenal mass in a cat with clinical signs of hyperadrenocorticism. J Am Vet Med Assoc 214:666, 1999.
Bouayad H, et al: Pheochromocytoma in dogs: 13 cases (1980-1985). J Am Vet Med Assoc 191:1610, 1987.
Buchanan JW, et al: Left atrial paraganglioma in a dog: Echocardiography, surgery, and scintigraphy. J Vet Intern Med 12:109, 1998.
Cance WG, Wells SA, Jr. Multiple endocrine neoplasia type Ha. Curr Probl Surg 22:1, 1985.
Carney JA, et al: The parathyroid glands in multiple endocrine neoplasia type 2b. Am J Pathol 99:387, 1980.
Chun R, et al: Apocrine gland adenocarcinoma and pheochromocytoma in a cat. J Am Anim Hosp Assoc 33:33, 1997.
Cryer PE: Catecholamines, pheochromocytoma and diabetes. Diabetes Rev 1:309, 1993.
Deftos LJ, et al: Human pituitary tumors secrete chromogranin-A. J Clin Endocrinol Metab 68:869, 1989.
DeLellis RA, et al: Multiple endocrine neoplasia (MEN) syndromes: cellular origins and interrelationships. Int Rev Exp Pathol 28:163, 1986.
Desmonts JM, Marty J. Anaesthetic management of patients with phaeochromocytoma. J Anaesth 56:781, 1984.
Doss JC, et al: Immunohistochemical localization of chromogranin A in endocrine tissues and endocrine tumors in dogs. Vet Pathol 35:312, 1998.
Duncan MW, et al: Measurement of norepinephrine and 3,4- dihydroxyphenylglycol in urine and plasma for the diagnosis of pheochromocytoma. N Engl J Med 319:136, 1988.
Eberle F, Grun R. Multiple endocrine neoplasia, type I (MEN I). Ergeb Inn Med Kinderheilkd 46:76, 1981.
Fischer M, et al: Scintigraphic localization of phaeochromocytomas. Clin Endocrinol 20:1, 1984.
Fraser DG. Alpha-MPT and pheochromocytoma. Drug Intel Clin Pharm 13:597, 1979.
Gagel RF: Multiple endocrine neoplasia. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 1627.
Gardner DG: Multiple endocrine neoplasia. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw Hill, 2001, p 792.
498 • ФЕОХРОМОЦИТОМА И МНОЖЕСТВЕННАЯ ЭНДОКРИННАЯ НЕОПЛАЗИЯ
Prys-Roberts C, Farndon JR: Efficacy and safety of doxazosin for perioperative management of patients with pheochromocytoma. World J Surg 19:26, 2002. Reine NJ, et al: Deoxycorticosterone-secreting adrenocortical carcinoma in a dog. J Vet Intern Med 13:386, 1999.
Ristic JME, et al: The use of 17-hydroxyprogesterone in the diagnosis of canine hyperadrenocorticism. J Vet Intern Med 16:433, 2002.
Rizzoli R, et al: Primary hyperparathyroidism in familial multiple endocrine neoplasia type I. Long-term follow-up of serum calcium levels after parathyroidectomy. Am J Med 78:467, 1985.
Roizen MF: Preoperative evaluation of patients with diseases that require special preoperative evaluation and intraoperative management. In Miller RE (ed): Anesthesia (Vol 1). New York, Churchill Livingstone, 1981, p. 21.
Roizen MF, et al: A prospective randomized trial of four anesthetic techniques for resection of pheochromocytoma. Anesthesiology 57:A43, 1982 (abstract).
Roizen MF, et al: The effect of alpha-adrenergic blockade on cardiac performance and tissue oxygen delivery during excision of pheochromocytoma. Surgery 94:941, 1983.
Roizen MP, et al: Characterization of the monoamine uptake system in catecholamine storage vesicles isolated from a pheochromocytoma taken from a child. Biochem Pharmacol 33: 2245, 1984.
Rosenstein DS: Diagnostic imaging in canine pheochromocytoma. Vet Rad Ultrasound 41:499, 2000.
Rossmeisl JH, et al: Hyperadrenocorticism and hyperprogesteronemia in a cat with an adrenocortical adenocarcinoma. J Am Anim Hosp Assoc 36:512, 2000.
Schaer M. Pheochromocytoma in a dog: A case report. J Am Anim Hosp Assoc 16:583, 1980.
Schoeman JP, Stidworthy MF: Budd-Chiari-like syndrome associated with an adrenal phaeochromocytoma in a dog. J Small Anim Pract 42:191, 2001.
Shapiro B, et al: lodine-131 metaiodobenzylguanidine for the locating of suspected pheochromocytoma: experience in 400 cases. J Nucl Med 26:576, 1985.
Sisson JC, Wieland DM: Radiolabeled meta-iodobenzylguanidine: pharmacology and clinical studies. Am J Physiol Imaging 1:96, 1986.
Sisson JC, et al: Scintigraphic localization of pheochromocytomas. N Engl J Med 305:12, 1981.
Syme HM, et al: Hyperadrenocorticism associated with excessive sex hormone production by an adrenocortical tumor in two dogs. J Am Vet Med Assoc 219:1725, 2001.
Telander RL, et al: Results of early thyroidectomy for medullary thyroid carcinoma in children with multiple endocrine neoplasia type 2. J Pediatr Surg 21:1190, 1986.
Thompson NW, et al: Extra-adrenal and metastatic pheochromocytomas, the role of ,3,l-meta-iodobenzyl-guanidine in localization and management. World J Surg 8:605, 1984.
Thuroczy J, et al: Multiple endocrine neoplasias in a dog: Corticotrophic tumour, bilateral adrenocortical tumours, and pheochromocytoma. Vet Quart 20: 56, 1998.
Tobes MC et al: Comparison of the in vitro pharmacodynamics of metaiodobenzylguanidine (MIBG) to the in vivo scintigraphy. Nucl Med Commun 6:585, 1985.
Twedt DC, Wheeler SL. Pheochromocytoma in the dog. Vet Clin North Am [Small Animal Pract] 14:767, 1984.
von Dehn BJ, et al: Pheochromocytoma and hyperadrenocorticism in dogs: Six cases (1982-1992). J Am Vet Med Assoc 207:322, 1995.
Walker MC, et al: Multiple endocrine neoplasia type 1 in a crossbred dog. J Small Anim Pract 41:67, 2000.
Werbel SS, Ober KP: Pheochromocytoma. Update on diagnosis, localization, and management. Med Clin N Amer 79:131, 1995.
Whittemore JC, et al: Nontraumatic rupture of an adrenal gland tumor causing intra-abdominal or retroperitoneal hemorrhage in four dogs. J Am Vet Med Assoc 219:329, 2001.
Williams JE, et al: Pheochromocytoma presenting as acute retroperitoneal hemorrhage in a dog. J Vet Emerg Critic Care 11:221, 2001.
Winkler H, Fischer-Colbrie R: Chromogranin A and B: The first 25 years and future perspectives. Neuroscience 49:497, 1992.
Wright KN, et al: Diagnostic and therapeutic considerations in a hypercal-cemic dog with multiple endocrine neoplasia. J Am Anim Hosp Assoc 31-156, 1995.
Young JB, Landsberg L: Catecholamines and the adrenal medulla. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p. 665.
Gilson SD, et al: Pheochromocytoma in 50 dogs. J Vet Int Med 8:228, 1994.
Goldfarb DA, et al: Magnetic resonance imaging for assessment of vena caval tumor thrombi: A comparative study with venacavography and computerized tomography scanning. J Urol 144:1100, 1990.
Goldfien A: Adrenal medulla. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw Hill, 2001, p 399.
Gough IR, et al: Limitations ofl-MIBG scintigraphy in locating pheochromocytomas. Surgery 98:115, 1985.
Hanson MW, et al: lodine,3,-labeled metaiodobenzylguanidine scintigraphy and biochemical analysis in suspected pheochromocytoma. Arch Intern Med 151:1397, 1991.
Hayes HM, Fraumeni JF: Canine thyroid neoplasms: Epidemiologic features. J Natl Cancer Inst 55:931, 1975.
Henry CJ, et al: Adrenal pheochromocytoma. J Vet Int Med 7:199, 1993. Hines ME, et al: Metastasizing extra-adrenal paraganglioma with neurological signs in four dogs. J Comp Path 108:283, 1993.
Hsiao RJ, et al: Chromogranin A storage and secretion: Sensitivity and specificity for the diagnosis of pheochromocytoma. Medicine 70:33, 1991.
Hubner A, Holschneider AM. Multiple endocrine neoplasias in three generations. Langenbecks Arch Chir 372:747, 1987.
Hull CJ. Phaeochromocytoma. Diagnosis, preoperative preparation and anaesthetic management. BrJAnaesth 58:1453, 1986.
Johnson RG, et al: Catecholamine transport and energy-linked function of chromaffin granules isolated from a human pheochromocytoma. Biochem Biophys Acta 716:366, 1982.
Jones DH, et al: The biochemical diagnosis, localization and follow up of pheochromocytomas: The role of plasma and urinary catecholamine measurements. QJ Med 49:341, 1980.
Karam JH: Hypoglycemic disorders. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/Mc-Graw-Hill, 2001, p699.
Keiser HR, et al: Treatment of malignant pheochromocytoma with combination chemotherapy. Hypertension 7(suppl): 118, 1985.
Krothapalli RK, et al: Modulation of the hydro-osmotic effect of vasopressin on the rabbit cortical collecting tubule by adrenergic agents. J Clin Invest 72:287, 1983.
Kyles AE, et al: Evaluation of the surgical management of adrenal tumoras-sociated tumor thrombi in dogs: 40 cases (1994-2001). J Am Vet Med Assoc 223:654, 2003.
Lamb CR, et al: Diagnosis of calcification on abdominal radiographs. Vet Radiol 32:211, 1991.
Leshin M: Multiple endocrine neoplasia. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 7th ed. Philadelphia, WB Saunders Co, 1985, p. 1274.
Loh КС, et al: The treatment of malignant pheochromocytoma with iodine-131 metaiodobenzylguanidine (,31I-MIBG): A comprehensive review of 116 reported patients. J Endocrinol Invest 20:648, 1997.
Lucon AM, et al: Pheochromocytoma: Study of 50 cases. J Urol 157:1208, 1997.
Marsh DJ, et al: The identification of false positive responses to the pentagastrin stimulation test in RET mutation negative members of MEN 2A families. Clin Endocrinol 44: 213, 1996.
Michiels FM, et al: Development of medullary thyroid carcinoma in transgenic mice expressing the RET protooncogene altered by a multiple endocrine neoplasia type 2A mutation. Proc Natl Acad Sci USA 94:3330, 1997.
Moattari AR, et al: Effects of Sandostatin on plasma chromogranin-A levels in neuroendocrine tumors. J Clin Endocrinol Metab 69:902, 1989.
O'Connor DT, Deftos LJ. Secretion of chromogranin A by peptide-producing endocrine neoplasms. N Engl J Med 314:1145, 1986.
Pasini B, et al: RET mutations in human disease. Trends Genet 12: 138, 1996.
PatnaikAK, et al: Extra-adrenal pheochromocytoma (paraganglioma) in a cat.
J Am Vet Med Assoc 197:104, 1990.
Peterson ME, et al: Multiple endocrine neoplasia in a dog. J Am Vet Med Assoc 180:1476, 1982.
Pilato FP, et al: Nonrandom expression of polypeptide hormones in pancreatic endocrine tumors. An immunohistochemical study in a case of multiple islet cell neoplasia. Cancer 61:1815, 1988.
Piatt SR, et al: Pheochromocytoma in the vertebral canal of two dogs. J Am Anim Hosp Assoc 34:365, 1998.
Prys-Roberts C: Phaeochromocytoma-recent progress in its management. Br J Anaes 85:44, 2000.
Г лава 10
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
ХИМИЯ ГЛЮКОКОРТИКОИДОВ.......499
БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ.......500
Молекулярные механизмы.......500
Промежуточный обмен..........502
Влияние на другие ткани......502
Влияние на функцию эндокринных органов..........503
Противовоспалительные свойства.504
ИСТОЧНИК.....................507
ПРОДОЛЖИТЕЛЬНОСТЬ ДЕЙСТВИЯ ....507
ВСАСЫВАНИЕ...................507
Модифицирующие факторы.......507
Способы введения.............508
ПРЕПАРАТЫ ГЛЮКОКОРТИКОИДОВ ....509
Взаимосвязь между структурой и активностью................509
Препараты для перорального введения.....................509
Препараты для парентерального введения.......................510
Комбинированные препараты......512
Новые стероиды.................512
ПОКАЗАНИЯ К ТЕРАПИИ............512
Ненадпочечниковые заболевания..512
Цели глюкокортикоидной терапии.512
Воспаление и аллергия..........513
Иммунные расстройства..........514
Неоплазия, гиперкальциемия и хроническое паллиативное лечение........................514
Шок.............................514
Заболевания центральной нервной системы (ЦНС)..................515
НЕБЛАГОПРИЯТНЫЕ ЭФФЕКТЫ........515
Кровотечение и прободение желудка и кишечника....................515
Сепсис.........................516
Панкреатит.....................517
Ятрогенный синдром Кушинга и болезнь Аддисона............517
Вакцинация....................519
Параметры печени..............519
Влияние на терапию сахарного диабета.............519
Задержка натрия и гипертензия.520
Беременность и фертильность...520
Функция щитовидной железы.....520
Задержка роста................520
ПРИМЕНЕНИЕ ГЛЮКОКОРТИКОИДОВ
В ДИАГНОСТИЧЕСКИХ ТЕСТАХ.....520
ГЛЮКОКОРТИКОИДНЫЕ ПРЕПАРАТЫ И ИХ ДОЗЫ.....................520
Список сокращений
АДГ - антидиуретический гормон, вазопрессин
АКТГ - адренокртикотропный гормон
ГГНС - гипоталамо-гипофизарно-надпочечниковая система
ГР - гормон роста
ПМН - полиморфноядерные нейтрофилы
ПТГ - паратиреоидный гормон
ТРГ - тиреотропин рилизинг-гормон
ТТГ - тиреотропный гормон
ЦНС - центральная нервная система
Кора надпочечников, т.е. наружный слой надпочечниковых желез, секретирует гормоны, необходимые для обеспечения нормальных процессов обмена веществ. Жизнь какое-то время продолжается при полном прекращении функции коры надпочечников, однако при этом происходят тяжелые метаболические расстройства, и организм совершенно утрачивает способность отвечать на физиологические стимулы и воздействие факторов окружающей среды. У любого животного с тяжелой недостаточностью гормонов коры надпочечников шансы на выживание практически отсутствуют. С другой стороны, при избыточной продукции гормонов коры надпочечников организм сохраняет жизнеспособность, хотя в этом случае также развиваются серьезные, угрожающие жизни нарушения обмена веществ. Жизненно важное значение коры надпочечников определяется ее ключевой ролью в регуляции биосинтеза и секреции группы гормонов, каждый из которых представляет собой стероидное соединение. В коре надпочечников синтезируются и секретируются две основные группы стероидных гормонов: минералокортикоиды и глюкокортикоиды. Глюкокортикоиды являются также самыми распространенными в ветеринарной практике лекарственными препаратами.
ХИМИЯ ГЛЮКОКОРТИКОИДОВ
Известно более 50 природных стероидов, которые синтезируются и секретируются корой надпочечников, но лишь некоторые из них обладают биологической активностью. Все гормоны коры надпочечников относятся к производным циклопентанпергидрофенантренового кольца (рис. 10-1). К числу этих соединений относятся андрогены, глюкокортикоиды и минералокортикоиды. Все надпочечниковые стероиды, за исключением андрогенов, содержат 21 атом углерода, а,Р-ненасыщенный кетон в кольце А и а-кетольную цепь (-СОСН2ОН ), сопряженную с кольцом D. Эти соединения отличаются по степени окисления и гидроксилирования углеродных атомов в положениях 11, 17 и 19. Стероиды, образующиеся в коре надпочечников, подразделяют на минералокортикоиды и глюкокортикоиды. Преобладающее биологическое действие первых состоит в регуляции обмена воды и электролитов, тогда как вторые участвуют в обмене белков и углеводов.
Клинические наблюдения свидетельствуют о том, что у человека противовоспалительная активность стероидов коры надпочечников коррелирует с их глюкокортикоидной активностью. Минерало-
500 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
Гидрокортизон (кортизол)
Рис. 10-1. А. Стероидное ядро. Б. Структура кортизола. Кружками обведены группировки, существенные для проявления глюкокортикоидной активности.
кортикоидная активность связана с нежелательными побочными эффектами, такими как задержка натрия или отечность. Синтетические стероиды, обладающие более высокой глюкокортикоидной и менее выраженной минералокортикоидной активностью по сравнению с кортизолом, производятся в коммерческих масштабах. В молекуле всех надпочечниковых стероидов имеется 3-кетогруппа и ненасыщенная связь между 4 и 5 углеродными атомами (рис. 10-1).
Наличие дополнительных ненасыщенных связей в кольце А усиливает противовоспалительную активность стероидов, но уменьшает их способность задерживать натрий. Так, противовоспалительное действие преднизолона в 4 раза сильнее, чем у кортизола, тогда как его минералокортикоидная активность не превышает 0,8 (рис. 10-1). Для проявления высокой глюкокортикоидной (но не минералокортикоидной) активности необходимо присутствие кислорода в положении 11 стероидной молекулы. 11 Р-гидроксильная группа придает молекуле более высокую активность, чем 11-кетогруппа, которая в организме превращается в более активную [3-гид-роксильную группировку. 17а-группа также важна для проявления глюкокортикоидной активности. 21-гидроксильная группа необходима для проявления минералокортикоидных свойств стероидов, но не влияет на их глюкокортикоидную активность. Введение метильной или гидроксильной группировки в положение 16 стероидной молекулы значительно снижает ее минералокортикоидную активность, но лишь немного уменьшает глюкокортикоидное и противовоспалительное действие. По этой причине параметазон (16а-метил), бетаметазон (1бр-метил), дексаметазон (16а-метил) и триамцинолон (16а-гидрокси) не обладают сколько-нибудь значимой минералокортикоидной активностью (см. рис. 10-2).
Рис. 10-2. Синтетические кортикостероиды. Структурные различия между синтетическими преднизолоном и дексаметазоном.
6а-Метилирование имеет непредсказуемые последствия. Оно вызывает усиление минералокортикоидной активности кортизола, но практически лишает этой активности преднизолон. Введение атома фтора в положение 9а повышает как глюкокортикоидную, так и минералокортикоидную активность, однако этот эффект не проявляется при одновременном замещении в положениях 6 и 16 (Osol, 1980).
БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
Молекулярные механизмы
Глюкокортикоиды получили свое название потому, что участвуют в регуляции обмена глюкозы. Согласно современным представлениям, их действие осуществляется путем связывания со специфическими цитозольными рецепторами, которые имеются практически во всех тканях и опосредуют большинство известных биологических эффектов глюкокортикоидов. Изменение структуры синтетических глюкокортикоидов позволило синтезировать соединения с более высокой глюкокортикоидной активностью, чем у исходных природных стероидов. Увеличение активности глюкокортикоидов достигается повышением их сродства к специфическим рецепторам и замедлением клиренса в плазме крови, что увеличивает продолжительность их действия на ткани-мишени. Многие синтетические глюкокортикоиды практически лишены минералокортикоидной активности, поэтому не вызывают задержку натрия, гипертензию или гипокалиемию.
После проникновения через клеточную мембрану глюкокортикоидный гормон связывается
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 501
Цитоплазма
Зрелая мРНК
I
Белок
I
Ответ на стероид
Рис. 10-3. Отдельные этапы действия стероидных гормонов. После активации внутриклеточных рецепторов стероидными гормонами образовавшийся комплекс связывается в ядре и стимулирует биосинтез мРНК. Р - Рецептор, С - Сгероидный гормон. (Из: Aron DC et al hr. Greenspan FS, Gardner DG (eds). Basic and Clinical Endocrinology, 6,h ed, New York, Lange Medical Books McGraw-Hill, 2001, p 334).
с присутствующим в цитозоле специфическим белковым рецептором (рис 10-3). Эти белки, по-видимому, образуются в клеточном ядре, откуда перемещаются в цитозол в ответ на поступление в клетку глюкокортикоида. После образования стероид-рецепторного комплекса он снова входит в клеточное ядро, где взаимодействует с акцепторными местами ядерного хроматина. В активации глюкокортикоидами их специфических рецепторов, по-видимому, участвует белок теплового шока hsp90 (heat shock protein), имеющий молекулярную массу 90 килодальтон (кД). Часть молекулы рецептора, связывающаяся с ДНК, представляет собой обогащенный цистеином домен, который после образования хелатного комплекса с цинком приобретает конформацию, получившую название «цинковый палец». Комплекс глюкокортикоида с рецептором связывается со специфическими участками ядерной ДНК, которые известны как регуляторные элементы глюкокортикоидов. Это взаимодействие индуцирует экспрессию специфических генов и транскрипцию специфической информационной рибонуклеиновой кислоты (мРНК). Синтезируемый на мРНК белок осуществляет характерное для данного глюкокортикоида действие, которое может носить стимулирующий или ингибирующий характер в зависимости от природы специфического гена и ткани-мишени.
Несмотря на сходство глюкокортикоидных рецепторов во многих тканях, белки, син тезируемые в отдельных тканях в ответ на действие глюкокортикоидов, значительно различаются благодаря экспрессии специфических генов. Механизмы, определяющие столь высокую специфичность регуляции, неизвестны.
Анализ клонированных комплементарных ДНК рецепторов глюкокортикоидов человека выявил весьма высокую гомологичность аминокислотных последовательностей рецепторов глюкокортикоидов и рецепторов других стероидных гормонов (включая минералокортикоиды, эстрогены и прогестерон), а также рецепторов тиреоидных гормонов и онкогена v-erb A (Aron et al 2001). Связывающий стероиды домен рецепторов глюкокортикоидов обусловливает высокую специфичность их взаимодействия, однако некоторые глюкокортикоиды, такие как кортизол или кортикостерон, связываются с рецепторами минералокортикоидов с таким же сродством, как альдостерон. Специфичность рецепторов минералокортикоидов обсспечи вастся экспрессией 11 Р-гидроксистероиддегидрогеназы в классических чувствительных к минералокортикоидам тканях. Этот фермент инактивирует глюкокортикоиды и его экспрессия в других тканях может защищать их от чрезмерного воздействия этих гормонов (Aron et al, 2001).
Уникальная активность глюкокортикоидов может быть обусловлена и другими механизмами,
502 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
отличающимися от вышеописанного. Наиболее ярким примером является торможение глюкокортикоидами секреции АКТГ по механизму так называемой «быстрой обратной связи». Этот эффект проявляется уже через несколько минут после введения глюкокортикоидов, поэтому его нельзя объяснить типичной индукцией РНК и биосинтеза белка. Скорее всего, этот механизм обратной связи связан с изменениями секреторной функции клеток или их мембран.
Промежуточный обмен
В целом, глюкокортикоиды ингибируют биосинтез ДНК. Кроме того, в большинстве тканей они подавляют также биосинтез РНК и белка и ускоряют катаболизм белков. Это действие глюкокортикоидов поставляет субстраты для промежуточного обмена, однако ускорение катаболических процессов одновременно обусловливает неблагоприятное действие гормонов на мышечную, костную, лимфатическую и соединительную ткани. В отличие от этого, в печени глюкокортикоиды усиливают биосинтез РНК и белка (Aron et al, 2001).
Действие глюкокортикоидов на промежуточный обмен можно коротко охарактеризовать следующим образом: (1) у сытых животных оно проявляется в минимальной степени; однако, натощак глюкокортикоиды обеспечивают поддержание нормальной концентрации глюкозы в плазме крови, усиливая интенсивность глюконеогенеза, отложение гликогена и периферическое высвобождение субстрата; (2) в печени глюкокортикоиды стимулируют продукцию глюкозы, а также биосинтез РНК и белка; (3) действие глюкокортикоидов на мышечную ткань носит преимущественно катаболический характер - они уменьшают включение и обмен глюкозы, тормозят биосинтез белка и усиливают высвобождение аминокислот; (4) в жировой ткани глюкокортикоиды стимулируют липолиз; (5) при недостаточности глюкокортикоидов развивается гипогликемия, тогда как при их избыточной продукции возможны гипергликемия, гиперинсулинемия, истощение мышечной массы и увеличение массы тела в сочетании с нарушением распределения жировых отложений (Tyrrell et al, 1991).
Влияние на другие ткани
Соединительная ткань. Избыточное количество глюкокортикоидов вызывает подавление активности фибробластов, потерю коллагена и уменьшение массы соединительной ткани. В результате происходит истончение кожи, развивается кровоточивость и ухудшается заживление ран.
Костная ткань. Физиологическая роль глюкокортикоидов в обмене костной ткани и поддержании гомеостаза кальция до конца не ясна. Известно, тем не менее, что при избытке глюкокортикоиды подавляют формирование костной ткани, уменьшая
клеточную пролиферацию, биосинтез РНК, белка, коллагена и гиалуроната. Одновременно глюкокортикоиды оказывают непосредственное стимулирующее действие на клетки, вызывая резорбцию костной ткани, что усиливает процессы остеолиза и экскрецию гидроксипролина с мочой. Кроме того, глюкокортикоиды усиливают действие паратиреоидного гормона (ПТГ) и 1,25-дигидроксивитамина Д3 на костную ткань, что еще более способствует ее резорбции.
Обмен кальция. Глюкокортикоиды значительно уменьшают всасывание кальция в кишечнике, что приводит к снижению его концентрации в сыворотке крови. Это вызывает вторичное усиление секреции ПТГ с целью поддержания нормального уровня кальция посредством стимуляции резорбции костной ткани. Кроме этого, глюкокортикоиды могут непосредственно усиливать секрецию ПТГ. Механизм понижения всасывания кальция в кишечнике неизвестен, хотя показано, что он не связан с уменьшением биосинтеза или концентрации в сыворотке продуктов обмена витамина Д. В частности, в присутствии избыточного количества глюкокортикоидов концентрация 1,25-дигидроксивитамина Д остается нормальной и даже возрастает. Усиление биосинтеза 1,25-дигидроксивитамина Д может быть следствием снижения концентрации фосфора в сыворотке крови, увеличения концентрации ПТГ в крови и непосредственной индукции активности почечной la-гидроксилазы. Глюкокортикоиды также усиливают экскрецию кальция с мочой, поэтому кальциурия является характерным показателем избыточной продукции кортизола у человека. Пониженное всасывание фосфатов в почечных канальцах служит причиной фосфатурии и уменьшения концентрации фосфатов в крови (Aron et al, 2001).
Рост и развитие. Глюкокортикоиды вызывают ускорение развития отдельных органов и их систем в период внутриутробного развития, а также дифференцировку плодных тканей, однако, механизм их участия в этих процессах неизвестен. Как указывалось ранее, глюкокортикоиды, в основном, ингибируют рост, и их стимулирующие эффекты могут быть обусловлены их взаимодействием с другими факторами роста. Примерами стимулирующего действия этих стероидов в процессе развития организма служат стимуляция продукции поверхностно активных веществ в легких плода и ускорение формирования ферментативных систем печени и органов желудочно-кишечного тракта.
Избыток глюкокортикоидов вызывает задержку роста у детей, щенков и котят. Это неблагоприятное действие на молодой организм является одним из основных осложнений глюкокортикоидной терапии. Торможение роста может быть результатом прямого действия глюкокортикоидов на костные клетки, хотя не менее важное значение имеет индуцируемое ими снижение секреции гормона роста (ГР) и биосинтеза соматомедина (инсулиноподобного ростового фактора).
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 503
Действие на сердечно-сосудистую систему. Глюкокортикоиды могут стимулировать работу сердца (минутный объем) и сосудистый тонус путем усиления действия других сосудосуживающих соединений, в частности, катехоламинов. По этой причине недостаточность глюкокортикоидов в состоянии стресса может привести к рефракторному шоку. Напротив, избыток глюкокортикоидов вызывает повышение кровяного давления вне связи с их возможной минералокортикоидной активностью.
Функция почек. Действие стероидов на водный обмен и электролитный баланс (задержка натрия и воды, гипокалиемия и гипертензия) осуществляется через рецепторы минералокортикоидов или рецепторы глюкокортикоидов. Полиурия и полидипсия, вызванные избыточной продукцией глюкокортикоидов, характерны для собак и могут быть обусловлены торможением секреции вазопрессина (АДГ, антидиуретический гормон) и/или нарушением действия АДГ в клетках почечных канальцев. У людей и кошек полиурия и полидипсия при избытке глюкокортикоидов развиваются редко. Интересно также, что недостаточность функции коры надпочечников у собак сопровождается утратой способности почек концентрировать мочу.
Центральная нервная система (ЦНС). Глюкокортикоиды легко проникают в мозг. Их физиологическая функция в ЦНС изучена недостаточно. Известно, однако, что избыток глюкокортикоидов оказывает весьма сильное влияние на поведение и познавательную способность у человека (Tyrrell et al, 1991).
Эритроциты. Глюкокортикоиды слабо влияют на количество эритроцитов и гемоглобина. У собак с синдромом Кушинга и аддисоновой болезнью они вызывают соответственно слабую полицитемию и анемию, однако эти изменения имеют, по всей вероятности, вторичный характер и обусловлены нарушениями обмена и/или секреции андрогенов.
Лейкоциты. Глюкокортикоиды влияют как на подвижность, так и на функцию лейкоцитов. Их количество под воздействием глюкокортикоидов возрастает благодаря повышению скорости высвобождения полиморфноядерных нейтрофилов (ПМН) из костного мозга, увеличению периода полужизни циркулирующих в крови ПМН и ингибированию их выхода за пределы внутрисосудистого пространства. Глюкокортикоиды уменьшают количество циркулирующих лимфоцитов, моноцитов и эозинофилов, способствуя их миграции из сосудистого русла. Кроме того, они тормозят поступление воспалительных клеток (ПМН, моноцитов и лимфоцитов) к местам повреждения ткани. По-видимому, это и является основным механизмом противовоспалительного действия глюкокортикоидов и причиной повышенной чувствительности к инфекциям при хронической терапии глюкокортикоидами (Aron et al, 2001).
Влияние на функцию эндокринных органов
Ятрогенное подавление функции надпочечников. Функцию гипоталамо-гипофизарно-над-почечниковой системы (ГГНС) у здоровых собак можно подавить в среднем на 32 часа посредством однократной внутривенной инъекции дексаметазона в дозе 0,1 мг/кг. Более низкие дозы этого препарата вызывают менее длительное угнетение функции ГГНС, что свидетельствует о зависимости ингибирующего действия дексаметазона от дозы (Kemppainen, Sartin, 1984). Кортизол обычно подавляет активность ГГНС на 12-24 часа, а ингибирующее действие преднизолона сохраняется на протяжении приблизительно 12-36 часов (табл. 10-1). Функция коры надпочечников нарушается после введения практически любого глюкокортикоидного препарата. Глазные капли и препараты для топического нанесения на кожу служат хорошими примерами лекарственных средств на основе стероидов, которые при повторном введении в течение нескольких дней или более длительного периода накапливаются в тканях и, в конце концов, подавляют функцию ГГНС на много недель (Roberts et al, 1984; Zenoble, Kemppainen, 1987).
Введение глюкокортикоидов в течение нескольких дней или нескольких недель редко приводит к длительным клинически значимым изменениям, однако хроническая терапия любым кортикостероидным препаратом может привести к атрофии коры надпочечников (ятрогенному гипокортицизму). Вместе с тем, различия индивидуальной чувствительности кошек и собак к действию экзогенных глюкокортикоидов столь значительны, что приходится отдельно оценивать реакцию каждой особи на терапию (Brockus et al, 1999).
После прекращения хронического введения глюкокортикоидов нормальная функция коры над-
ТАБЛИЦА 10-1. ПРОДОЛЖИТЕЛЬНОСТЬ ДЕЙСТВИЯ ПРИРОДНЫХ И
СИНТЕТИЧЕСКИХ ГЛЮКОКОРТИКОИДОВ ПОСЛЕ ИХ ПЕРОРАЛЬНОГО ИЛИ ВНУТРИВЕННОГО ВВЕДЕНИЯ.
Препарат Продолжительность
действия
С короткой продолжительностью действия
Гидрокортизон <12 часов
Кортизон <12 часов
С промежуточной продолжительностью действия
Преднизон 12-36 часов
Преднизолон 12-36 часов
Метилпреднизолон 12-36 часов
Триамцинолон 12-36 часов
Длительно действующие Бетаметазон >48 часов
Дексаметазон >48 часов
Флуметазон >48 часов
Параметазон >48 часов
504 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
почечников у собак и кошек довольно быстро восстанавливается. Результаты пробы с АКТГ обычно нормализуются в течение нескольких недель после отмены терапии. Мы практически никогда не прибегаем к постепенному уменьшению дозы глюкокортикоидов, когда их введение собакам и кошкам становится нецелесообразным, но попросту прекращаем вводить их животным. Напротив, в тех случаях, koi щ есть основания опасаться появления признаков ятрогенного гипокортицизма, дозу вводимых для его устранения кортикостероидов следует медленно понижать на протяжении нескольких недель, но зл о приходится делать чрезвычайно редко. (Обсуждение вопросов, связанных с подавлением функции Г ГНС, будет продолжено в разделе «Побочные эффекты»).
Функция щитовидной железы. Базальная концентрация тиретропного гормона (ТТГ) в крови человека в условиях хронической глюкокортикоидной терапии обычно остается в норме, но его ответ на стимулирующее действие тиреотропин рилизинг-гормона (ТРГ) зачастую нарушается. Концентрация тироксина (Т4) в сыворотке крови в большинстве случаев понижается вследствие уменьшения продукции тироксин-связывающего глобулина, однако, уровень свободного Т4 не изменяется. Концентрации общего и свободного Tt молуг быть понижены из-за недостаточного превращения Т4 в Т при одновременном увеличении образования реверсивного Тг Несмотря на все эти изменения, клинические проявления гипотиреоза отсутствуют (Aron et al, 2001).
У собак, которым вводят глюкокортикоиды, и у животных со спонтанно развившимся гиперкортицизмом концентрация общего и свободного Т4 в
Время после введения ТТГ (часы)
Рис. 10-4 Проба с тиреотропным гормоном (ТТГ) у з торовых собак и собак со спонтанным гиперкортицизмом
сыворотках крови может быть понижена и ли оставаться на нижней границе нормы. Концентрация 1 в сыворотке в ответ на стимуляцию ТТГ меняется параллельно ее изменению в норме, но при этом возрастает значительно слабее, чем у здоровых животных (рис. 10-4). Клинические и биохимические изменения, обусловленные хроническим избытком глюкокортикоидов, сходны с таковыми при гипотиреозе и включают сонливость, общую слабость, дерматологические нарушения и гиперхолестеринемию. Тем не менее, ни одно из этих расстройств не требует специального лечения, поскольку они устраняются коррекцией избытка кортизола (Woltz et al, 1983).
Функция половых желез. Глюкокортикоиды влияют на продукцию гонадотропина и функцию половых желез. У самцов они подавляют секрецию гонадотропинов, что приводит к снижению концентрации циркулирующего тестостерона и атрофии семенников. У самок глюкокортикоиды подавляют функцию гипоталамо-гипофизарной системы, о чем свидетельствует нарушение эстральных циклов.
Противовоспалительные свойства
Обзор. О способности глюкокортикоидов предотвращать или подавлять воспалительные процессы можно судить не только по таким видимым невооруженным взглядом признакам, как отсутствие дальнейшего повышения температуры, исчезновение покраснения, припухлости и болезненности, но и по результатам микроскопического исследования пораженных тканей. Глюкокортикоиды тормозят воспалительные процессы на ранних стадиях отека, отложение фибрина, расширение капилляров, миграцию лейкоцитов и фагоцитарную активность. Помимо этого, они ослабляют тяжесть поздних проявлений воспаления, таких как пролиферация капилляров, пролиферация фибробластов, отложение коллагена, а еще позднее - процессы рубцевания ( Gilman et al, 1980; Aron et al, 2001).
Глюкокортикоиды подавляют воспалительную реакцию независимо от индуцирующих ее факторов, будь то облучение, механическое или химическое воздействие, инфекция или опосредуемый иммунной системой процесс. Терапия воспалительных заболеваний глюкокортикоидами носит паллиативный характер, в том смысле, что они необязательно устраняют их первичную причину, но уменьшают сопутствующую клиническую симптоматику. Эта способность подавлять воспалительные процессы делает глюкокортикоиды ценными лекарственными средствами. Однако те же самые свойства обусловливают опасность глюкокортикоидной терапии, потому что могут маскировать клинические проявления болезнетворного процесса. Воспаление, позволяющее клиницисту идентифицировать и контролировать ход заболевания в отсутствие введения экзогенных кортикостероидов, может быть полностью подавлено последними.
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 505
В результате продолжение болезни и дальнейшее усиление ее тяжести остаются незамеченным. Как при любой другой терапии, преимущества лечения глюкокортикоидами необходимо взвешивать относительно потенциального риска их использования в той или иной конкретной ситуации.
Кролики, крысы, мыши и человек более чувствительны к противовоспалительному и/или иммуносупрессорному действию глюкокортикоидов по сравнению с собаками и кошками. Поэтому результаты исследований, проведенных на первых четырех видах в условиях in vitro и даже на здоровых животных, нельзя экстраполировать на собак и кошек со спонтанно развившимся заболеванием (Papich, Davis, 1989).
Тем не менее, было установлено несколько эффектов глюкокортикоидов, общих для всех видов животных. Они включают, в частности, уменьшение миграции полиморфноядерных нейтрофилов к местам воспаления и подавление активации лимфоцитов. Глюкокортикоиды уменьшают проницаемость сосудов и скорость образования простагландинов, простациклинов, тромбоксанов и лейкотриенов (Papich, Davis, 1989).
Нейтрофилы.
Влияние на мембраны. Классическим проявлением противовоспалительного действия глюкокортикоидов является уменьшение поступления ПМН в пораженные ткани. Вскоре после введения фармакологической дозы глюкокортикоида развивается нейтрофилия как вследствие усиленного высвобождения зрелых клеток из соответствующего пула в костном мозге, так и благодаря увеличению биологической полужизни ПМН (MacDonald, 2000). Кроме того, снижается выход клеток из кровеносных сосудов в процессе диапедеза. Поскольку созревание нейтрофилов завершается в течение всего нескольких часов, ингибирование их выхода из сосудов сопровождается быстрым развитием нейтрофилии. Предполагается, что механизм такого ингибирования состоит в изменении конфигурации клеточной поверхности, которое препятствует локализации нейтрофилов вблизи сосудистых стенок и прикреплению к ним. По-видимому, истинным противовоспалительным эффектом глюкокортикоидов является стабилизация лизосомальных мембран (Cupps, Fauci, 1982; Meuleman, Katz, 1985; Papich, Davis, 1989).
Фагоцитоз. Глюкокортикоиды угнетают фагоцитарную активность нейтрофилов и их способность разрушать бактерии. Ингибирующее действие глюкокортикоидных гормонов на бактерицидную активность осуществляется через подавление окислительного обмена, снижение слияния нейтрофильных гранул с лизосомами, а также через изменение pH в лизосомах фагоцитов. Независимо от механизма действия глюкокортикоиды повышают чувствительность к инфекциям, так как они нарушают способность организма убивать бактерии (Papich, Davis, 1989).
Лимфоциты. Популяция лимфоцитов состоит из циркулирующего и нециркулирующего пулов. Клетки циркулирующего пула свободно перемещаются между внутрисосудистым и внесосудистым пространством (лимфатические узлы, селезенка, костный мозг и грудной проток). После введения глюкокортикоидов происходит перераспределение лимфоцитов этого пула, которые переходят во внесосудистое пространство. Глюкокортикоиды в большей степени влияют на распределение Т-лим-фоцитов, чем В-лимфоцитов (Т-клетки составляют приблизительно 70% всего циркулирующего пула). Различие чувствительности разных типов лимфоцитов к глюкокортикоидам пока не поддается объяснению, однако, может быть обусловлено способностью В-клеток более интенсивно метаболизировать эти стероиды по сравнению с Т-лимфоцитами (Cupps, Fauci, 1982; Kehrl, Fauci, 1983; Papich, Davis, 1989). Кроме того, клетки-хелперы, или индукторы, (CD4) более чувствительны к действию глюкокортикоидов, чем цитотоксические клетки-супрессоры (CD8). Стероиды ингибируют также продукцию интерлейкина-2, что приводит к торможению пролиферации и цитотоксической активности лимфоцитов, а также угнетают функцию ростовых факторов В-лимфоцитов (BCGF), подавляя пролиферацию этих клеток (MacDonald, MacDonald, 2000). Уменьшение количества циркулирующих лимфоцитов и их пролиферативной способности под воздействием глюкокортикоидов препятствует участию этих клеток в иммунологических и/или воспалительных реакциях. Дополнительно было показано, что глюкокортикоиды понижают чувствительность лимфоцитов к действию митогенов, ингибируют биосинтез лимфокинов и трансформацию лимфоцитов, понижают способность последних узнавать антигены (Cupp, Fauci, 1982; Meuleman, Katz, 1985; Papich, Davis, 1989).
Непосредственное действие глюкокортикоидов на В-лимфоциты выражено слабо, однако они косвенным путем изменяют их функцию, влияя на акцессорные клетки. Для полной экспрессии функции лимфоцитов необходима сложная комбинация взаимодействий между Т-клетками, макрофагами, антигенами и клетками-медиаторами (Nossal, 1987). Обычные терапевтические дозы глюкокортикоидов не препятствуют развитию и проявлению нормальных иммунологических реакций у животных в ответ на вакцинацию или антигены из других источников (Meuleman, Katz, 1985), но по мере увеличения доз кортикостероидов концентрации иммуноглобулинов IgG, IgA и, в меньшей степени, IgM понижаются. Биосинтез IgE при этом не изменяется.
Исследования на людях показали, что повторное ежедневное введение кортикостероидов длительного действия, таких как дексаметазон, подавляет образование антител. Этот эффект не наблюдается при введении через день противовоспалительных доз кортикостероидов с промежуточной продолжительностью действия, например преднизолона
506 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
(Papich, Davis, 1989). Глюкокортикоиды индуцируют эозинопению, которая, по всей вероятности, является следствием изменения распределения эозинофилов между отдельными тканями. Литическое и токсическое действие эозинофилов до сих пор не доказано (MacDonald, 2000).
Макрофаги. Моноядерные клетки выполняют несколько жизненно важных функций. Во-первых, они являются акцессорными клетками, представляющими антигены в процессе индукции гуморального и клеточно-опосредованного иммунного ответа. Во-вторых, они функционируют в качестве «профессиональных» фагоцитов, уничтожающих возбудителей бактериальных, вирусных и грибковых инфекций. Вместе с антителами макрофаги могут убивать опухолевые клетки. Наконец, они очищают организм от стареющих клеток, в первую очередь, от эритроцитов, а также принимают участие в перестройке костной ткани, заживлении ран и обмене поверхностно-активных соединений (сурфактантов) в легких (MacDonald, 2000).
Моноциты и макрофаги (акцессорные лимфоциты), по-видимому, более чувствительны к действию глюкокортикоидов, чем нейтрофилы. В терапевтических дозах кортикостероиды снижают фагоцитоз и бактерицидную активность, а также нарушают способность макрофагов и моноцитов осуществлять трансформацию антигенов, которая необходима для представления антигена В-клеткам, и подавляют биосинтез клеточных медиаторов, таких как интерлейкин-1 (ИЛ-1). Кортикостероиды не только ингибируют образование лимфокинов, но и понижают чувствительность к ним различных типов клеток (Cupps, Fauci, 1982; Dinarello, Mier, 1987; Papich, Davis, 1989). Глюкокортикоиды подавляют продукцию фактора некроза опухолей (ФНО) и, тем самым, влияют на течение самых разнообразных воспалительных процессов. Один из основных противовоспалительных эффектов глюкокортикоидов состоит в уменьшении накопления моноядер-ных фагоцитов в очагах воспаления. Это может происходить за счет снижения хемотактических факторов другими клетками, в том числе Т-лимфо-цитами, вокруг популяции моноядерных клеток. Не исключено, что определенная роль в этом процессе принадлежит ингибирующему действию стероидов на ферментативную активность. Имеются также сообщения о подавлении активности цитокинов, в частности, ИЛ-1, интерферона-у (ИФН-у) и ФНО/ кахектина (Cohn, 1991; Scott et al, 1995).
Базофилы и тучные клетки. Глюкокортикоиды снижают количество циркулирующих базофилов, по всей вероятности, подавляя их образование. Одновременно они уменьшают число тучных клеток в слизистых оболочках, тогда как подтип тучных клеток, имеющийся в соединительной ткани, менее чувствителен к действию глюкокортикоидов. Снижение количества тучных клеток, скорее всего, является результатом ингибирования активности ИЛ-3 или специфического ростового фактора туч
ных клеток. Не исключено прямое действие глюкокортикоидов на тучные клетки. Подвижность базофилов под воздействием стероидов значительно уменьшается. Некоторые исследователи высказывают предположение, что стероиды непосредственно ингибируют образование и секрецию медиаторов воспалительного процесса в тучных клетках, или это может быть простым следствием уменьшения числа тучных клеток. Угнетение ответа на антигены глюкокортикоидами для топического применения также может осуществляться путем снижения количества тучных клеток или доступности антигенов в тканях, содержащих тучные клетки (Butterfield, Gleich, 1989; Munck, Guyre, 1989 ).
Обмен арахидоновой кислоты. Повреждение клеточных оболочек индуцирует простагландинлейкотриеновый каскад, что, в свою очередь, приводит к активации мембранной фосфолипазы А2, которая осуществляет биосинтез арахидоновой кислоты. Из арахидоновой кислоты под воздействием ферментов циклооксигеназы и липооксиге-назы образуются простациклин, тромбоксан и лейкотриены. Считается, что противовоспалительное действие глюкокортикоидов опосредуется белками, синтез которых они индуцируют в тканях-мишенях. Это действие частично состоит в уменьшении продукции промежуточных провоспалительных метаболитов, в первую очередь, производных арахидоновой кислоты. Простагландины 12 и Е2 в сочетании с лейкотриенами В4, С4, D4 и Е4 отвечают за конечную воспалительную реакцию, которая модулируется понижением интенсивности обмена арахидоновой кислоты.
В целом, антифосфолипазный эффект глюкокортикоидов индуцируется благодаря вовлечению в этот процесс вторых посредников - белков, называемых липокортинами. Эти белки подавляют активность клеточной фосфолипазы А и, таким образом, уменьшают высвобождение арахидоновой кислоты и всех образующихся из нее медиаторов воспалительной реакции, т.е. простагландинов, простациклинов, тромбоксанов и лейкотриенов.
Липокортины регулируют также внутриклеточный обмен фосфолипаз. Арахидоновая кислота секретируется клетками различного типа после их стимуляции природными нейротрасмиттерами и некоторыми лекарственными средствами. В естественных условиях липокортины перевариваются протеазами. Они способствуют созреванию Т-супрессоров и ингибируют пролиферацию Т-клеток под воздействием митогенов. Кроме того, Р-липокортины оказывают зависимое от дозы ингибирующее действие на острую фазу цитотоксических Т-клеток. Они уменьшают также антитело-зависимую цитотоксичность естественных клеток-киллеров и защищают различные ткани от комплемент-опосредованного лизиса (Cupps, 1989; Flower, 1989; Hirata, 1989).
Влияние на кровеносные сосуды. Благотворное действие глюкокортикоидов при введении животным в шоковом состоянии, при отеке мозга или
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 507
при других формах воспаления обусловлено «стабилизацией целостности микрососудистой системы». Благодаря этому феномену задерживается развитие отека и выход клеток из внутрисосудистого пространства в окружающие ткани (транссудация). Эти эффекты обусловлены подавлением действия нейтрофилов и уменьшением биосинтеза простагландинов. Было предположено, что глюкокортикоиды играют роль антагонистов вазоактивных соединений, таких как гистамин и кинины, и тем самым они обеспечивают защиту от токсического действия свободных кислородных радикалов, которые выделяются при воспалении. Представляет интерес также тот факт, что глюкокортикоиды ингибируют высвобождение активаторов плазминогена из макрофагов, которое является компонентом каскада реакций, сопровождающих воспалительное заболевание. Это очень важный эффект глюкокортикоидов, поскольку активированный плазмин переваривает опорные ткани сосудистых стенок и усиливает их проницаемость (Papich, Davis, 1989).
Заключение. Иммуносупрессорные и противовоспалительные эффекты глюкокортикоидов обусловлены их способностью модулировать сложные взаимодействия между клетками и медиаторами клеточной функции. Противовоспалительная активность глюкокортикоидов связана, в первую очередь, с их действием на лейкоциты. Такое действие по самой своей природе имеет иммуносупрессивный характер. По этой причине фармакологические препараты на основе глюкокортикоидов являются высокоэффективными средствами для лечения иммунных заболеваний и вызываемых ими расстройств. Вместе с тем, глюкокортикоиды повышают чувствительность организма к инфекциям.
ИСТОЧНИК
Несмотря на возможность экстракции природных кортикостероидов из надпочечниковой ткани животных, большинство этих соединений получают синтетическим путем. Исходными материалами для химического синтеза глюкокортикоидов служат либо холевая кислота, которую получают из тканей крупного рогатого скота, либо стероидные соединения группы сапогенинов, в первую очередь, диосгенин. Последний присутствует в растениях, относящихся к семействам лилиевых и диоскорей-ных (Meyers et al, 1980). Дальнейшая модификация атомов углерода в положениях 1, 2, 6, 9, 16 и некоторых других в молекуле стероидов позволяет получать большое число коммерческих фармацевтических препаратов, обладающих специфическими свойствами. Химическое строение каждого синтетического стероида определяет его биологическую активность и продолжительность действия (см. рис. 10-2). Лечебный эффект препаратов синтетических глюкокортикоидов в большой степени зависит также от способа их введения и природы фармакологических носителей, входящих в их состав.
ПРОДОЛЖИТЕЛЬНОСТЬ ДЕЙСТВИЯ
Продолжительность действия лекарственных средств обычно оценивается на основании периода их полужизни в плазме крови, т.е. времени, в течение которого концентрация введенного препарата уменьшается на 50%. Такой подход подразумевает, что все особи обладают одинаковой способностью выводить препарат из организма. Однако есть все основания считать, что индивидуальные отличия такой способности, особенно у собак и кошек, весьма значительны. Кроме того, в случае с глюкокортикоидами следует различать период их полужизни в плазме крови и еще более важный показатель - продолжительность «биологической полужизни», который означает длительность действия данного препарата. Поскольку в большинстве случае действие глюкокортикоидов осуществляется посредством индукции белкового синтеза, их биологическая активность лучше всего коррелирует с продолжительностью биологической полужизни индуцируемого специфического белка или белков. Именно период биологической полужизни следует учитывать, предписывая тот или иной режим глюкокортикоидной терапии (см. табл. 10-1).
Считается, что продолжительность биологической полужизни кортизона и гидрокортизона менее 12 часов, тогда как у преднизона, метилпреднизона и триамцинолона она составляет 12-26 часов. Параметазон, флуметазон, бетаметазон и дексаметазон имеют период биологической полужизни более 48 часов. Продолжительность биологического действия отдельных глюкокортикоидных препаратов зависит от способа их введения, клинического состояния больного и многих других факторов (Behrend, Kemppainen, 1997).
ВСАСЫВАНИЕ
Модифицирующие факторы
Процесс всасывания того или иного лекарственного средства влияет на интенсивность и продолжительность его биологического действия. Поэтому для достижения желаемого терапевтического эффекта варьируют дозы препарата или интервалы между введением последовательных доз (Gilman et al, 1980). Активность того или иного препарата зависит от его способности связываться с рецептором и продолжительности действия образующегося комплекса в ткани-мишени. Рецепторы сходным образом отвечают на разные глюкокортикоиды; различие в активности, например, преднизолона и дексаметазона заключается в том, что равный терапевтический эффект достигается при более низких дозах дексаметазона.
К числу других факторов, влияющих на всасывание лекарственных средств, относятся их растворимость, степень разбавления, концентрация, характер переноса с кровотоком к месту всасыва-
508
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
ТАБЛИЦА 10-2. НЕКОТОРЫЕ ХАРАКТЕРИСТИКИ ОБЫЧНЫХ СПОСОБОВ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Способ введения Характер всасывания Специальные показания Ограничения и меры предосторожности
Внутривенный Всасывание не является лимитирующим фактором Практически немедленный эффект Показан в неотложных ситуациях Позволяет титровать дозы препарата Годится для введения больших объемов и соединений, вызывающих раздражение (при условии разбавления) Повышенный риск нежелательного побочного действия Как правило, необходимо медленное введение раствора Не пригоден для введения масляных растворов и нерастворимых веществ
Подкожный Быстрое всасывание препаратов из водных растворов Медленное, непрерывное всасывание депонируемых препаратов Годится для введения суспензий некоторых нерастворимых соединений и для имплантации твердых гранул Не годится для введения больших объемов При введении раздражающих соединений возможны болезненные ощущения и некроз
Внутримышечный Быстрое всасывание препаратов из водных растворов Медленное, непрерывное всасывание депонируемых препаратов Пригоден для введения умеренных объемов, препаратов с масляными носителями и некоторых соединений, вызывающих раздражение Несовместим с одновременной терапией антикоагулянтами Может затруднять интерпретацию результатов некоторых диагностических тестов (например, с креатинфосфокиназой)
Пероральный Характер всасывания зависит от многих факторов (см. текст) Самый удобный и экономичный путь; обычно безопаснее других способов введения Требует особых форм контакта с пациентом Неравномерное и неполное всасывание плохо растворимых, медленно абсорбируемых или нестабильных препаратов
ния, особенности абсорбирующей поверхности и способ введения. Препараты, вводимые в водных растворах, всасываются быстрее, чем вводимые в масляных растворах и суспензиях, либо в твердом виде. При введении в высоких концентрациях лекарственные препараты всасываются быстрее, чем из разбавленных растворов. Уменьшение скорости кровотока, индуцируемое сосудосуживающими средствами, шок или другие болезнетворные факторы могут приводить к замедлению всасывания, особенно из мест подкожных инъекций. Всасывание происходит быстрее с больших поверхностей, таких как эпителий легочных альвеол или слизистая кишечника, чем при введении препаратов в изолированные участки тканей, например, внутримышечно (Gilman et al, 1980).
Способы введения
Каждый способ введения лекарственных средств имеет свои преимущества и недостатки. Сравнительная характеристика ряда основных способов введения, используемых для достижения системного эффекта лекарственных препаратов, приведена в табл. 10-2.
Препараты для приема внутрь. Прием внутрь является самым распространенным способом введения лекарственных средств. Одновременно это самый безопасный, удобный и экономичный путь. Его основными недостатками являются повышен
ная вероятность рвоты вследствие раздражения слизистых оболочек желудочно-кишечного тракта, разрушение некоторых препаратов под воздействием кислого желудочного сока, нерегулярный характер всасывания из-за присутствия в желудке пищи и других лекарственных средств, а также необходимость особых форм контакта ветеринара с животным и его владельцем. Кроме того, введенные перорально препараты, прежде чем достигнут кровяного русла, подвергаются воздействию ферментов, выделяемых слизистыми оболочками желудочно-кишечного тракта, кишечной бактериальной флорой или печенью.
Препараты для инъекций. Инъекции лекарственных средств имеют ряд очевидных преимуществ перед их пероральным введением. В некоторых случаях парентеральное введение абсолютно необходимо для обеспечения всасывания препарата в активной форме. Всасывание инъецированного препарата обычно происходит быстрее и более предсказуемо, чем после его приема внутрь. Это позволяет точнее подобрать терапевтически эффективную дозу. Именно парентеральная терапия зачастую необходима в неотложных ситуациях. Вместе с тем, препараты для инъекций имеют ряд недостатков. Начать с того, что во избежание занесения инфекции инъекции следует производить в асептических условиях Возможно случайное внутрисосудистое введение лекарственного средства, когда в этом нет необходимости. Инъекции причи
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 509
няют боль и, кроме того, требуют повышенных расходов (Gilman et al, 1980).
Препараты для топического применения. Глюкокортикоиды для топического нанесения используются в дерматологической практике в виде самых разнообразных лекарственных форм и содержат разные биологически активные стероидные соединения. Топическая терапия позволяет применять мощные глюкокортикоиды в больших концентрациях непосредственно в местах поражения при минимальном системном эффекте. Важно, однако, помнить, что после топического нанесения глюкокортикоидов происходит их системное всасывание, которое может сопровождаться нежелательными последствиями. Всасывание таких препаратов особенно усиливается при воспалении, наложении окклюзионных повязок или зажимов на пораженные участки кожи. Другие факторы, влияющие на эффективность действия стероидов для топического применения, включают концентрацию глюкокортикоидов, природу аддитивного компонента, входящего в состав лекарственного средства, анатомическую область его нанесения, площадь обработанной поверхности и частоту применения (Behrend, Kemppainen, 1977).
Эфиры ацетонида и валерата связываются в пораженной коже и усиливают действие глюкокортикоидов. Такие высоко активные фторированные препараты, как бетаметазон, дексаметазон, триамцинолон и флюоцинолон (флуцинар), следует применять только для краткосрочного лечения, так как они обладают очень высокой биологической активностью. Для хронической терапии применяются стероидные средства короткого действия. Топические стероиды выпускаются в самых разнообразных лекарственных формах, включая кремы, мази, лосьоны, пены, гели, растворы, шампуни и ополаскиватели. Благодаря противовоспалительной активности они нередко включаются в состав антибактериальных средств, предназначенных для лечения заболеваний органов зрения и слуха.
ПРЕПАРАТЫ ГЛЮКОКОРТИКОИДОВ
Взаимосвязь между структурой и активностью
Важной структурной характеристикой глюкокортикоидов, которая определяет их биологическую активность, является наличие гидроксильной группы при СП, кетонов при СЗ и С20 и двойной связи между четвертым и пятым углеродными атомами (см. рис. 10-1 и 10-2). Добавление еще одной двойной связи между первым и вторым атомами углерода, введение метильной группировки в положения С6 или С16 либо фтора в С9 приводит к увеличению продолжительности биологической полужизни глюкокортикоидов, снижению их минералокортикоидной активности и значительному усилению противовоспалительного действия.
Глюкокортикоиды принадлежат к числу лекарственных средств наиболее широко (вплоть до злоупотребления?) используемых в ветеринарной практике. Достаточно хорошо изучены их действие, показания к применению, побочные эффекты и токсичность. Тем не менее, остается большая путаница в вопросах, касающихся свойств и фармакокинетики отдельных препаратов этого класса, доступных для практикующих ветеринаров. Кортикостероиды не обладают биологической активностью, если в их молекуле отсутствует требуемая функциональная группа. Так, например, часто применяемые кортизон и преднизон содержат кетоновую группировку при СИ, которая необходима для проявления противовоспалительной активности стероида. В печени оба стероида восстанавливаются до активных форм, содержащих в этом положении гидроксильную группу (т.е. соответственно до гидроксикортизона и преднизолона). Поэтому собакам с гепатопатией или с подозрением на нее назначают не преднизон, а преднизолон. Для проявления биологического действия стероидов, имеющих 11-гидроксильную группу, предварительное метаболическое превращение не требуется. К числу таких соединений относится дексаметазон (см. рис. 10-2). Превращение других глюкокортикоидов в активную форму происходит очень быстро, и 11-кетостероиды эффективны при их систематическом применении. Стероидные препараты, которые требуют предварительной метаболической активации в печени, не пригодны для топического или местного применения.
Препараты для перорального введения
Терапия пероральными средствами предпочтительна при большинстве системных заболеваний. Таблетки являются наиболее обычной лекарственной формой, предназначенной для приема внутрь. Таблетированные препараты быстро всасываются уже в ротовой полости, а период их полужизни в плазме крови относительно непродолжителен. Как указывалось ранее, длительность биологического действия глюкокортикоидов (оцениваемая по подавлению функции гипоталамуса и/или гипофиза), в отличие от многих других лекарственных средств, непосредственно не коррелирует с периодом их полужизни в плазме; обычно оно продолжается в течение некоторого времени после заметного снижения концентрации препарата в крови. Глюкокортикоиды действуют путем усиления транскрипции информационной и рибосомальной РНК в разных клетках, поэтому они оказывают разнообразные эффекты и обладают разной продолжительностью действия.
По продолжительности биологического эффекта глюкокортикоиды подразделяют на препараты с коротким, промежуточным и длительным действием. Продолжительность активности глюкокортикоидов отчасти зависит от способа их введения. Внутривенная инъекция стероидных соединений
510 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
Натрия сукцинат
Натрия фосфат
Ацетат
Ацетонид
Рис. 10-5. Эфиры глюкокортикоидов. Структура глюкокортикоидных эфиров, образованных путем связывания с углеродным атомом в положении 21.
обычно сопровождается особенно быстрым началом терапевтического действия при минимальной продолжительности полужизни данного соединения. Напротив, после приема внутрь терапевтический эффект развивается медленно, зато сохраняется гораздо дольше благодаря большей продолжительности полужизни препарата. Длительность действия зависит также от характера всасывания того или иного лекарственного средства. Так, например, у суспензий, предназначенных для инъекций, она весьма значительна вследствие низкой скорости их всасывания.
Препараты для парентерального введения
В ветеринарии чаще всего используются три типа глюкокортикоидных препаратов для парентерального введения: водные растворы растворимых стероидных эфиров, растворы свободных стероидных спиртов и суспензии нерастворимых стероидных эфиров.
Водные растворы растворимых стероидных эфиров. Эти растворы предназначены для внутривенных или внутримышечных инъекций. Их активные ингредиенты быстро абсорбируются из мест внутримышечного введения (табл. 10-3). Чаще всего используются эфиры фосфата натрия или сукцината натрия (рис. 10-5). Эти растворимые в воде, быстро действующие препараты являются средствами выбора для лечения острых болезненных состояний, при которых требуются большие дозы лекарствен
ных средств, например, при эндотоксическом шоке, отеке мозга или травматическом повреждении ЦНС. Глюкокортикоиды данного типа характеризуются быстрым началом действия (в течение нескольких минут после введения), которое затем продолжается от 12 до 72 часов. В ветеринарной практике наиболее часто применяются дексаметазон натрия фосфат (стерильный раствор в концентрации 4 мг/ мл) и преднизолон натрия сукцинат (производства SoluDeltaCortef; The Upjohn Со., США).
Растворы свободных стероидных спиртов. Растворы свободных стероидных спиртов очень редко используются в ветеринарной практике. Относительно плохо растворимые свободные стероидные спирты выпускаются в форме стерильных разбавленных растворов. В качестве растворителя используется 40%-ный полиэтиленгликоль. Эти средства предназначены для внутримышечных и внутривенных инъекций. Они быстро абсорбируются в местах внутримышечного введения (в течение нескольких минут после инъекции), но несколько медленнее, чем растворимые эфиры. Их эффект сохраняется от 12 до 72 часов. Хотя эти препараты предписываются и для внутривенных инъекций, слишком высокие их дозы могут отрицательно сказаться на функции ЦНС из-за присутствия в них большого количества полиэтиленгликоля. Вследствие повышенного риска побочных эффектов свободных стероидных спиртов, при необходимости лечения острых расстройств высокими дозами
ТАБЛИЦА 10-3. ОБЩАЯ ПРОДОЛЖИТЕЛЬНОСТЬ ДЕЙСТВИЯ РАЗЛИЧНЫХ ВВОДИМЫХ ВНУТРИМЫШЕЧНО СТЕРОИДНЫХ ЭФИРОВ
Стероидный эфир Время всасывания после Продолжительность
____________________внутримышечного введения______действия___________
Натрия сукцинат От нескольких минут до несколь- Несколько часов ких часов
Натрия фосфат От нескольких дней до нескольких От нескольких дней до
Ацетат недель нескольких недель
Диацетат Несколько недель Несколько недель
Ацетонид Пивалат
Наиболее часто используемое активное начало________________
Дексаметазон, бетаметазон, гидрокортизон, метилпреднизолон, преднизолон, преднизон Флюоцинолон, изофлюпредон, триамцинолон, метилпреднизолон, бетаметазон Дезоксикортикостерон, триамцинолон
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
511
ТАБЛИЦА 10-4. ШИРОКО ПРИМЕНЯЕМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ ГЛЮКОКОРТИКОИДЫ
Глюкокортикоид Препараты системного действия Препараты для топического применения
Бетаметазон Бетазон * Гентоцин дурафилм *, Гентоцин топикал * или Гентоцин отик * Отомакс* Топаген*
Дексаметазон Азиум * Верен + Трезадерм ++
Флуметазон Флукорт # Анаприм #
Флюоцинолон Синалар #, Синалар отик #, Нео-синалар #
Гидрокортизон Кортеф / || ||, Кортисут ~
Гидрокортон ++ /1| || Кортиспрей ** Форте-топикал / Эпи-отик НС ~
Необацимикс-Н * Нео-предеф /
Изофлюпредон Метилпреднизолон Медрол / Солу-медрол /1| || Депо-медрол /
Преднизон/преднизолон Делтазон /1| || Хлоразон ++++
Метикортен * Прелой ++++ |||| Солу-дельта-кортеф / Ликвиклор с церуменом ++++
Триамцинолон Веталог ## Панолог ## Веталог ##
Из.-Behrend EW, Kemppainen RJ.1997
* производства Schering.
+ производства Bio-Ceutic.
++ производства Merck AgVet (ветеринарный продукт) или Merck (для медицинского применения).
# производства Syntex.
/ производства Upjohn.
~ производства Allerderm,
** производства DVM.
@ производства Muro.
++++ производства EVSco.
## производства Solvay
|| || Разрешен только для медицинского применения.
глюкокортикоидов вместо них применяют растворы хорошо растворимых стероидных эфиров. Наиболее популярными стероидными спиртами являются дексаметазон ( производства Azium, Schering Corp., США) и подобные ему лекарственные средства, выпускаемые различными фармацевтическими фирмами в дозировках 2 мг/мл, а также флуметазон, фасованный по 0,5 мг/мл, производства компании Flucort Dimond Laboratories, США (табл. 4-10).
Суспензии нерастворимых стероидных эфиров. Суспендированные препараты показаны, главным образом, для введения непосредственно в поврежденные ткани или внутрисуставно с целью достижения длительного терапевтического эффекта. К сожалению, такие длительно действующие глюкокортикоидные препараты для инъекций нередко пытаются использовать для получения системного эффекта. В связи с этим они относятся к числу ветеринарных средств, которые чаще всего назначаются необоснованно и правила применения которых постоянно нарушаются. Всасывание этих препаратов ограничено растворимостью их активных ингредиентов в тканевых жидкостях в местах инъекций. Иными словами, фактором, лимитиру
ющим интенсивность абсорбции суспензии нерастворимых стероидных эфиров, является скорость растворения их твердых частиц. Как правило, эти частицы очень медленно всасываются тканями в местах их введения. Глюкокортикоиды, входящие в состав суспендированных препаратов, имеют относительно короткий период полужизни, однако их медленное всасывание из-за присутствия в составе аддитивных компонентов обеспечивает длительное терапевтическое действие даже при невысоких дозах. Описываемые средства нельзя вводить внутривенно, и они не дают желаемого терапевтического эффекта при клинических состояниях, коррекция которых требует быстрого действия лекарственного средства и его высокой концентрации в плазме крови (например, при шоке). Чаще всего в качестве суспендированных эфирных препаратов используются ацетаты, диацетаты, ацетониды и пивалаты.
Суспензии стероидных эфиров требуют осторожного обращения и хранения. При слишком высокой или низкой температуре в них образуются крупные кристаллы и понижается доля мелких частиц, что приводит к уменьшению общей поверхности суспендированных частиц и замедляет их
512 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
растворение. Кроме того, крупные кристаллы вызывают раздражение при внутрисуставном введении суспензий. К числу наиболее часто используемых стероидных эфиров для инъекций относятся суспензия метилпреднизолона ацетата, поступающая в продажу в дозировках 20 мг/мл и 50 мг/мл (депо-медрол, производства The Upjohn Со., США); суспензия 9с1-фторопреднизолона ацетата, фасованная по 2 мг/мл (предеф 2Х, производства The Upjohn Со.,США); суспензия триамцинолона ацетонида по 6 мг/мл (производства ER Squibb & Sons, США) и суспензия триамцинолона диацетата в дозировках по 40 мг/мл производства компании Lederle Laboratoriesm Wayne, США (см. табл. 10-4).
Показанием для назначения перечисленных препаратов, как правило, служит необходимость введения глюкокортикоидов непосредственно в пораженные ткани или суставы; для других целей они используются редко (см. табл. 10-3). Применение этих средств для устранения таких расстройств, как зуд у собак и кошек, неразумно, за исключением случаев слишком беспокойных или постоянно обитающих вне помещения кошек, которых хозяева видят лишь изредка. Аналогичный противовоспалительный эффект можно достигнуть глюкокортикоидными препаратами более короткого действия для перорального введения. Применение последних позволяет по мере необходимости изменять дозировки, постепенно уменьшая их вплоть до отмены терапии, а также свести к минимуму подавление нормальной функции гипофизарно-надпочечниковой системы и избежать необходимости повторных инъекций и сопутствующих им отрицательных побочных эффектов.
Комбинированные препараты
Противоречивое отношение к применению фиксированных доз комбинированных препаратов, содержащих один или более антибактериальных агентов в сочетании со стероидом, обусловлено тремя причинами: (1) разницей дозировок (введение рекомендованной дозы одного компонента может привести к занижению дозы или передозировке других составляющих комбинированного продукта); (2) разной продолжительностью эффективного действия и токсической активности компонентов смеси и (3) отсутствием документированных данных, подтверждающих терапевтическую эффективность комбинированных препаратов с фиксированной дозой. Несмотря на эти противоречия, комбинированные фармацевтические продукты находят широкое применении в ветеринарии мелких животных (Ford, 1984). Мы, однако, не рекомендуем использовать лекарственные средства подобного типа.
Новые стероиды
Тотальное подавление функции гипоталамо-гипофи-зарной системы и многие другие эффекты, индуциру
емые введением стероидов, стимулировали попытки получить более «безопасные» лекарственные формы на основе этих соединений. Уже на протяжении многих лет для лечения астмы у людей применяется бу-десонид. Этот предназначенный для вдыхания препарат был модифицирован с целью его использования в терапии собак и кошек. Одним из преимуществ буде-сонида является его практически полная деградация при первом же проходе через портальную систему печени. Было показано, что у людей системные эффекты будесонида составляют только 10% эффектов эквипотенциальной дозы преднизолона.
Будесонид довольно успешно применялся для лечения воспалительных кишечных заболеваний у собак и кошек, однако, его оптимальная доза так и не установлена. Кроме того, у получающих этот препарат животных иногда развивается «стероидная гепатопатия» несмотря на ограниченное число побочных эффектов. Не следует забывать, что «стероидная гепатопатия» встречается только у собак и ни разу не была зарегистрирована у кошек и людей. Стероидная гепатопатия не приводит к недостаточности функции печени и не вызывает никаких других клинических симптомов; она проявляется только как увеличение размеров этого органа, сопровождающееся типичными гистологическими изменениями его ткани.
Рекомендуемая эмпирическая доза будесонида для введения собакам и кошкам составляет соответственно 3 и 1 мг дважды в день, однако, фармакокинетические данные для обоснования этой рекомендации отсутствуют. В Европе для лечения воспалительного заболевания кишечника у людей (болезнь Крона) разработана лекарственная форма будесонида в оболочке. Оболочка предотвращает разрушение активного ингредиента до его поступления в дистальный отдел тонкого кишечника. Целесообразность применения этого препарата при аналогичном заболевании животных сомнительна, поскольку оно нередко носит более диффузный характер, чем у человека (Hall, 2002).
ПОКАЗАНИЯ К ТЕРАПИИ
Ненадпочечниковые заболевания
В таблице 10-5 представлен неполный перечень заболеваний собак и кошек, при которых применение глюкокортикоидов дает хороший терапевтический эффект. Этот перечень составлен на основании модифицированного списка аналогичных ненадпочечниковых заболеваний человека, исходя из того, что глюкокортикоиды пригодны для лечения сходных клинических состояний у различных биологических видов (Goldfein, 1994; Behrend, Kemppainen, 1997).
Цели глюкокортикоидной терапии
Ветеринар во всех случаях должен пытаться контролировать заболевание минимально эффективными
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
513
ТАБЛИЦА 10-5. НЕПОЛНЫЙ ПЕРЕЧЕНЬ ТЕРАПЕВТИЧЕСКИХ ПОКАЗАНИИ К ПРИМЕНЕНИЮ ГЛЮКОКОРТИКОИДОВ ПРИ НЕНАДПОЧЕЧНИКОВЫХ ЗАБОЛЕВАНИЯХ
Аллергические заболевания
Ангионевротический отек
Астма
Контактный или паразитарный дерматит
Реакция на лекарственные средства
Артрит, бурсит, тендосиновит
Патологические изменения сосудистого коллагена
(мышечно-скелетные)
Системная красная волчанка
Полимиозит
Ревматоидный артрит
Идиопатический полиартрит
Гематологические расстройства/иммунные заболевания
Аутоиммунная гемолитическая анемия
Лейкемия
Идиопатическая тромбоцитопения
Множественная миелома
Гломерулонефрит
Глазные болезни
Острый увеит
Аллергический конъюнктивит
Хориоидит
Ретробульбарный неврит
Желудочно-кишечные заболевания
Воспалительное кишечное заболевание
Региональный энтерит
Язвенный колит
Хронический гепатит
Расширение лимфатических сосудов
Гингивит и стоматит кошачьих
Гиперка льциемия
Лимфосаркома
Множественная миелома
Многосистемные
Тепловой удар
Шок
Опухоли
Опухоли ЦНС
Инсулинома
Опухоль тучных клеток
Лейкемия, лимфосаркома, множественная миелома
Неврологические расстройства
Острая травма
Отек мозга
Грануломатозный менингоэнцефалит
Заболевание межпозвонковых дисков
Расстройства вестибулярного аппарата
Легочные заболевания
Аспирационная пневмония
Бронхиальная астма
Хронический/аллергический бронхит
Чувствительность к дирофиляриозу
Эозинофильная гранулома
Нарушение вдыхания
Инфильтрация легких эозинофилами
Почечные расстройства
Некоторые нефротические синдромы
Некоторые белок-теряющие нефропатии
Кожные заболевания
Атопический дерматит
Грибовидный микоз
Пузырчатка и другие расстройства, связанные с нарушением иммунитета
Себорейный дерматит
Гнойно-травматическое поражение кожи
Эозинофильно-грануломатозный комплекс кошачьих
Инфекционные заболевания
Грамотрицательная септицемия
Сильное воспаление
дозами пероральных препаратов с короткой продолжительностью действия. По возможности, назначают их прием через день, а не ежедневно (Spencer et al., 1980). Не существует никаких убедительных доказательств того, что время суток имеет критическое значение для введения того или иного лекарственного средства (Kemppainen et al, 1981 и 1982). Назначая глюкокортикоиды для устранения клинической симптоматики, нельзя забывать о необходимости одновременного специфического лечения вызвавшего ее заболевания (например, блошиной аллергии).
Воспаление и аллергия
В ветеринарной практике приходится сталкиваться с самыми разнообразными аллергическими и
легкими воспалительными расстройствами. Несмотря на ряд общих подходов к терапии этих состояний, всегда следует принимать во внимание их специфические особенности. В большинстве случаев для достижения противовоспалительного эффекта у мелких животных назначают преднизон или преднизолон в дозе 0,55 мг/кг перорально через каждые 12 часов ( Ferguson, Hoenig, 1995). Кошки менее чувствительны к действию глюкокортикоидов, чем собаки, поэтому при сходных состояниях им назначают вдвое большую дозу. Обычно животные обоих видов быстро отвечают на глюкокортикоидную терапию, и для полного проявления клинического действия того или иного препарата требуется не более 5-7 дней (Behrend, Kemppainen, 1997).
514 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
Иммунные расстройства
У собак и кошек чаще всего встречаются следующие иммунные (аутоиммунные?) расстройства: заболевания суставов, гломерулопатия, гемолитическая анемия, тромбоцитопения, системная красная волчанка, дерматологические и другие заболевания. Рекомендуемые для их лечения дозы глюкокортикоидов составляют от 2,2 до 6,6 мг/кг для ежедневного введения дробными порциями; препараты вводят внутрь два или три раза в день. Некоторые ветеринары добиваются особенно хороших результатов, вводя тем же способом дексаметазон в дозах от 0,6 до 2,2 мг/кг. Прием глюкокортикоидов внутрь является наилучшим способом терапии для большинства собак и кошек благодаря его простоте и минимальным нежелательным реакциям со стороны желудочно-кишечного тракта. Введение глюкокортикоидов в начальной дозе продолжают до тех пор, пока не появятся признаки клинического улучшения, которое обычно наблюдается спустя несколько дней после начала терапии. По мнению некоторых авторов, для достижения иммуносупрессорного эффекта необходимо вводить глюкокортикоиды на протяжении 10 - 28 дней (Behrend, Kemppainen, 1997).
После нормализации клинического состояния животных дозу глюкокортикоидов постепенно уменьшают до полной отмены терапии. Количество схем для снижения дозы стероидов почти столь же велико как число ветеринаров, лечащих эти заболевания. Согласно одному из протоколов, используемых в нашей клинике, начальную дозу препарата уменьшают наполовину в течение 2 недель, сохраняя двукратный суточный режим ее введения. Затем через каждые две недели дозу последовательно уменьшают еще на 50%, потом переходят на одноразовый режим ее введения, затем ежедневно вводят половину разовой дозы, а в дальнейшем переводят животное на терапию через день и, наконец, через каждые два дня (см. раздел «Глюкокортикоидные препараты и их дозировки»). Накануне каждого очередного снижения дозы животное обследуют, чтобы убедиться в наличии клинической ремиссии. В случае рецидива заболевания дозу препарата увеличивают вплоть до ее исходной величины.
Если глюкокортикоидная терапия не приводит к существенному улучшению состояния животного, рекомендуются дополнительные лечебные мероприятия. В этом случае, наряду с введением глюкокортикоидов в соответствии с описанным выше протоколом, проводят супрессивную терапию более мощными лекарственными средствами. Чаще всего для этой цели используют циклофосфамид, азатиоприн, а с недавнего времени и циклоспорин (Cook et al, 1994).
Неоплазия, гиперкальциемия и хроническое паллиативное лечение
Глюкокортикоиды используют в качестве «химиотерапии» разных типов опухолей, к числу ко
торых относятся лимфосаркома, множественная миелома и опухоли тучных клеток. Глюкокортикоиды могут непосредственно воздействовать на эти новообразования. У собак и кошек эти кортикостероиды, по-видимому, не оказывают токсического действия на нормальные лимфоциты, но могут вызывать лимфоцитолиз неопластических клеток (Papich, Davis 1989). Глюкокортикоиды применяют также для хронического паллиативного лечения и для коррекции гиперкальциемии. В дозах, обладающих противовоспалительным действием, они снижают тяжесть воспалительного процесса и/или боли, которые сопутствуют многим формам рака (Behrend, Kemppainen, 1989). Чрезвычайно важно помнить, что глюкокортикоидную терапию следует назначать только после подтверждения наличия неоплазии или установления причины гиперкальциемии. Эти препараты могут изменять цитологические характеристики таких клеток, как лимфоциты, и, тем самым, затруднять дальнейшее диагностическое исследование. Следует также иметь в виду, что собаки гораздо более устойчивы, чем люди к неблагоприятным последствиям гиперкальциемии (см. гл. 17), что во многих случаях устраняет необходимость их «неотложного» лечения.
Шок
Общий подход. Шок - это острое состояние, характеризующееся нарушением кровяного давления и, как следствие, тканевой перфузии. Основные компоненты лечения шоковых состояний включают, во-первых, внутривенное вливание жидкостей для восстановления объема крови, нормализации кровяного давления и тканевой перфузии и, во-вторых, выяснение причины шока для устранения или коррекции первичных нарушений. Глюкокортикоиды рассматриваются как вспомогательные средства при терапии геморрагического и септического шока, однако нет единого мнения относительно целесообразности их применения при этих состояниях.
Геморрагический шок. Глюкокортикоидная терапия этого клинического состояния дает благоприятные результаты, поскольку кортикостероиды способствуют поддержанию целостности микро-сосудистой системы и улучшают кровоснабжение жизненно важных органов. В дополнение к этому глюкокортикоиды стабилизируют клеточные мембраны, повышая их устойчивость к токсическому действию кислородных радикалов, которые образуются в ходе ишемического процесса (Papich, Davis 1989). Обычным способом терапии геморрагического шока является внутривенное введение преднизона или метилпреднизолона в дозах от 15 до 30 мг/ кг либо инъекции дексаметазона (4-8 мг/кг). Действие глюкокортикоидной терапии в этих условиях усиливается при ее назначении как можно раньше после возникновения шока.
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 515
Септический шок. Если собакам и кошкам, находящимся в состоянии септического шока, вводить глюкокортикоиды в сочетании с антибиотиками, то вызываемое глюкокортикоидами улучшение микроциркуляции способствует поступлению антибиотиков в пораженные ткани. Кроме того, глюкокортикоиды оказывают благотворное действие на целостность микрососудистой системы и ингибируют образование метаболитов арахидоновой кислоты (Greisman, 1982; Hinshaw et al, 1982). Большинство ветеринаров назначает глюкокортикоиды в таких же дозах, которые используются при лечении геморрагического шока. Как и в последнем случае, критическое значение имеет как можно раннее начало терапии. Шок - это острое, угрожающее жизни состояние. Поэтому необходимо иметь в виду, что выгоды кратковременной глюкокортикоидной терапии для спасения животного перевешивают риск вызываемого ими усиления бактериемии или развития тяжелого сепсиса при долгосрочном введении.
Заболевания центральной нервной системы (ЦНС)
Механизм действия и показания к применению. Установлено благотворное действие глюкокортикоидов при некоторых заболеваниях ЦНС. Считается, что эти стероиды защищают клеточные оболочки от токсической активности свободных кислородных радикалов, обеспечивают сохранение целостности микрососудистой системы, стабилизируют тесные межклеточные связи в пределах ЦНС, замедляют формирование отека и понижают внутричерепное давление благодаря уменьшению образования спинномозговой жидкости (Pappich, Davis, 1989). Кортикостероиды препятствуют развитию опосредуемой норадреналином ишемии и предотвращают перекисное окисление свободных кислородных радикалов в миелине и мембранах сосудов, глии и нервной ткани. Столь разнообразное действие глюкокортикоидов позволяет использовать их для лечения большого числа заболеваний головного и спинного мозга.
«Вазогенный отек» после травмы является одним из неврологических расстройств, для лечения которых, вероятно, наиболее часто используются глюкокортикоиды. Это травматическое поражение чаще всего является следствием протрузии или коллапса межпозвонкового диска. «Травма» ЦНС может быть также следствием несчастного случая, новообразования, кровоизлияния или абсцесса. Кроме того, кортикостероиды оказывают благотворное действие при введении собакам с асептическим менингитом (включая гранулематозный менингоэнцефалит), чувствительным к стероидам гнойным менингитом и некротизирующим васкулитом ЦНС (Meric et al, 1986; Meric, 1988). Причины трех последних заболеваний до сих пор не установлены.
Доза. Неудивительно, что между специалистами-неврологами нет единого мнения, какой из глюкокортикоидных препаратов считать наиболее эффективным. Это объясняет существование большого числа рекомендуемых терапевтических протоколов. Гидрокортизон (в дозе 300 мг/кг), метилпреднизолон, преднизон и преднизолон (в дозах от 10 до 30 мг/кг), а также дексаметазон (4,0-8,0 мг/кг) обычно вводят собакам и кошкам в форме внутривенных инъекций (Haskins, 1992). Рекомендуется от двух до шести ежедневных инъекций, в связи с чем общая доза того или иного глюкокортикоида значительно варьирует (Braughler, Hall, 1982; Hall, Braughler, 1982; Hankes et al, 1985; Hoerlein et al, 1985). Собаки с асептическим менингитом обычно хорошо отвечают на терапию понижающимися дозами преднизолона после его ежедневных инъекций в количестве 2-4 мг/кг. Положительная реакция развивается чрезвычайно быстро, и состояние животного иногда значительно улучшается уже через несколько часов после первой инъекции (Meric, 1988).
НЕБЛАГОПРИЯТНЫЕ ЭФФЕКТЫ
Преимущества глюкокортикоидной терапии следует сопоставлять с риском ее неблагоприятных последствий. Некоторые из основных нежелательных эффектов не токсичны по своей природе; они скорее сводятся к усилению ожидаемого действия глюкокортикоидов и проявляются, например, в форме синдрома Кушинга собак. Другие отрицательные результаты глюкокортикоидной терапии (например, сепсис, поражение слизистой желудочно-кишечного тракта или выкидыш) также могут быть обусловлены известными и ожидаемыми физиологическими эффектами этих кортикостероидов и не связаны с их токсической активностью.
Кровотечение и прободение желудка и кишечника
Патофизиология. Глюкокортикоиды нарушают защитные механизмы слизистых оболочек и поэтому являются факторами риска язвенной болезни и/или прободения желудка и кишечника у животных. Существует мнение, что кортикостероидная терапия создает у домашних животных предрасположенность к развитию язв в желудочно-кишечном тракте вследствие уменьшения образования слизи, изменения ее биохимического состава в желудке и усиления продукции желудочной кислоты (Toombs etal, 1980 и 1986; Piper et al, 1991; Rohrer et al, 1999a и 1999b). Маловероятно, однако, что глюкокортикоиды служат единственной причиной этих желудочно-кишечных расстройств. Экспериментальные исследования на собаках показали, что глюкокортикоиды действительно вызывают разрушение барьера, которым являются слизистые оболочки (Soijonen et al, 1983). Эти соединения нередко сти
516 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
мулируют секрецию гастрина G клетками желудка и ухудшают кровоснабжение его слизистой оболочки. Гипергастринемия, избыточное содержание желудочной кислоты и ишемия желудка, в свою очередь, способствуют эрозии желудочной стенки и образованию язвы. У собак с задержкой прохождения содержимого через кишечник (например, при поражении спинного мозга или первичной патологии кишечника) задержка кала усиливает физико-химическую травму клеток слизистой желудка. В дополнение к этому глюкокортикоиды подавляют обновление клеток слизистой. Эти факторы в сочетании с действием глюкокортикоидов на соединительную ткань и воспалительный процесс повышают риск катастрофической желудочно-кишечной эрозии (Toombs et al, 1980).
Клиническая картина. Кортикостероидная терапия у собак, применявшаяся после нейрохирургического лечения, приводила к осложнениям со стороны желудочно-кишечного тракта у 50 животных из 257 в одном исследовании и у 20 из 72, включенных в другое исследование (Moore, Withrow, 1982; Sorjonen et al, 1983). Аналогичные материалы были представлены в недавних сообщениях (Rohrer 1999а и 1999b). Осложнения проявлялись в форме панкреатита и желудочно-кишечных кровотечений, изъязвления и прободения. Самым катастрофическим из этих нарушений является прободение ободочной кишки. Оно привело к гибели 13 собак, получавших кортикостероиды, 10 из которых нуждались в нейрохирургическом лечении, и двенадцати из них была проведена серьезная операция (Toombs et al, 1986).
Для глюкокортикоидной терапии чаще всего использовался дексаметазон, который 12 собак получали в кумулятивной дозе 6,4 мг/кг ежедневно на протяжении 5 дней (Toombs et al, 1986). Наиболее частыми клиническими симптомами у этих животных были депрессия, анорексия и рвота. Они развивались примерно за день до смерти, которая наступала через 4-8 недель после хирургической операции. Со времени публикации этого исследования ситуация улучшилась, поскольку стало ясно, что эти осложнения являются следствием глюкокортикоидной терапии. Теперь ветеринары по возможности назначают консервативную терапию и контролируют развитие осложнений со стороны желудочно-кишечного тракта. Несмотря на это в одном из исследований применение метилпреднизолона натрия сукцината привело к желудочному кровотечению у всех собак, получавших этот препарат (Behren, Kemppainen, 1997).
Дексаметазон и метилпреднизолон натрия сукцинат являются мощными противовоспалительными стероидами, которые часто вызывают желудочно-кишечные нарушения при введении собакам более 2 или 3 дней. Эти стероиды могут настолько изменять признаки прободения внутренних органов, что его обнаружение становится затруднительным или вообще невозможным вплоть до завершения терапии (Leramo et al, 1982). У получающих эти пре
параты животных абсцесс наблюдается редко, зато часто развиваются генерализованный перитонит, грамотрицательная септицемия и эндотоксичес-кий шок. Дополнительное лечение нестероидными противовоспалительными средствами повышает вероятность желудочно-кишечного кровотечения и формирования язвы у получающих стероиды животных, поскольку оно нарушает зависимые от простагландинов защитные механизмы в стенках кишечника (Stewart et al, 1980). Ни введение синтетического аналога простагландинов мизопростола, ни Н2 блокатор ранитидин не предотвращали желудочное кровотечение (Daley, 1993; Rohrer et al, 1999a и 1999b).
В случаях собак с повышенным риском развития осложнений со стороны желудочно-кишечного тракта (при терапии дексаметазоном или другими стероидами во время пребывания в стационаре в связи с необходимостью нейрохиругического лечения), рекомендуется следующее: (1) замена дексаметазона на преднизолон или преднизон; (2) максимальное сокращение продолжительности кортикостероидной терапии; (3) отмена последующего или одновременного введения препаратов, обладающих ульцерогенным действием; (4) устранение задержки кала в предоперационном периоде; (5) отказ от применения клизмы на протяжении первой недели после операции и (6) коррекция задержки мочи посредством непрерывной декомпрессии мочевого пузыря (с помощью закрытой дренажной системы) вместо его повторного мануального опорожнения (Toombs et al, 1986).
Сепсис
Патофизиология. Кортикостероиды блокируют формирование и проявление клеточного иммунитета, снижая количество циркулирующих лимфоцитов и моноцитов. Одновременно происходит избирательное понижение общего количества Т-лимфоцитов. Стероиды блокируют индуцируемую антигенами сенсибилизацию лимфоцитов и подавляют реакцию моноцитов на хемотакгические продукты лимфоцитов. Подавление глюкокортикоидами фагоцитоза благоприятствует выживанию бактерий и препятствует их выведению из организма.
Кортикостероиды снижают образование интерферона у некоторых животных с естественно приобретенной вирусной инфекцией. Совершенно очевидно, что введение стероидов вызывает серьезное нарушение защитных механизмов у носителей инфекции, причем последствия такого нарушения не поддаются прогнозированию (Calvert, Greene, 1986; Bone et al, 1987; Hinshaw et al, 1987).
Показания к применению. Назначение кортикостероидов животным, получающим антибактериальные препараты, оправдано в тех случаях, когда у получающих стероиды собак и кошек появляется приобретенная инфекция или когда в условиях лечения антибиотиками сохраняется нарушение вое-
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ • 517
палительной реакции на инфекцию. В то же время преобладание осложняющей инфекции у собак и кошек в условиях долгосрочной глюкокортикоидной терапии не означает обязательного назначения антибактериальных препаратов любому животному, получающему кортикостероиды. При возникновении инфекции глюкокортикоидную терапию можно не прерывать, но следует обеспечить регулярное наблюдение за состоянием животных, поскольку кортикостероиды маскируют многие клинические проявления инфекционных заболеваний.
Несмотря на всю важность воспалительного компонента защитного механизма у носителя инфекции, он может оказывать разрушительное действие, например, при энцефалите, менингите, миокардите, пневмонии или миозите. Подавление воспалительного процесса глюкокортикоидами лишний раз подчеркивает их важную терапевтическую роль на ранних стадиях инфекции. До сих пор отсутствуют четкие указания по применению этих лекарственных средств при подтвержденной или предполагаемой инфекции, а их назначение и использование нередко основываются исключительно на результатах субъективной оценки клинического состояния животного тем или иным ветеринаром (Ford, 1984). Задача кортикостероидной терапии у животных с инфекционными заболеваниями состоит в подавлении острого, тяжелого и иногда угрожающего жизни воспалительного процесса. Для достижения максимального эффекта лечение следует начинать на ранних стадиях воспаления и продолжать менее 7 дней (Ford, 1984). Обычно для этой цели применяют кортикостероиды с короткой или промежуточной продолжительностью действия. Исключение составляет введение дексаметазона животным с острым воспалением головного мозга.
Ограничения. Одновременное введение антибактериального препарата и кортикостероида является примером фармакологической дихотомии. Антибиотики специально предназначены для устранения инфекции, тогда как кортикостероиды подрывают нормальный защитный механизм у ее носителя. Клинические показания к сочетанной антибактериальной и глюкокортикоидной терапии у мелких животных весьма ограничены. Такая форма лечения применяется в ветеринарной практике, но к ней следует прибегать только в тех случаях, когда известен возбудитель инфекции и имеется специфический антимикробный агент, а краткосрочная (до 7 дней) глюкокортикоидная терапия может уменьшить тяжесть и даже полностью предотвратить поражение ткани в ходе инфекционного процесса и воспаления. Совершенно очевидно, что нельзя без достаточных оснований назначать кортикостероиды при подтвержденной или предполагаемой инфекции (Ford, 1984). Поскольку глюкокортикоидная терапия маскирует природные индикаторы инфекции и нарушает соответствующие защитные механизмы, необходим тщательный и регулярный мониторинг состояния больного животного незави
симо от сопутствующего введения антибиотиков. У собак, получающих хроническую глюкокортикоидную терапию, особенно часто встречаются инфекции мочеполового тракта, кожи и легких.
Панкреатит
Установлена тесная взаимосвязь между глюкокортикоидной терапией и развитием панкреатита. Эта связь особенно наглядно подтверждается увеличением вязкости панкреатического секрета у кроликов (Steinberg, Lewis, 1981). Однако у собак вязкость секрета поджелудочной железы повышалась только при ее перфузии 400 мг метилпреднизолона. В дозе 200 мг (которая чрезвычайно высока сама по себе) этот препарат не изменял вязкость секрета (Kimura et al, 1979). Литературные данные по этому вопросу немногочисленны и неубедительны (Behrend, Kemppainen, 1997). Более того, ни у одной из 24 экспериментальных собак, которым вводили дексаметазон в различных «клинически принятых» дозах, панкреатит не развивался (Parent, 1982).
Панкреатит редко развивается у собак, получающих кортикостероиды по онкологическим показаниям, а также у собак со спонтанно развившимся гиперкортицизмом. Введение глюкокортикоидов может вызвать увеличение концентрации липазы в сыворотке в отсутствие панкреатита, поэтому использование результатов оценки активности этого фермента в сыворотке крови может приводить к неверным выводам. Наконец, глюкокортикоидная терапия на фоне неврологических расстройств может быть фактором риска развития панкреатита, хотя нет никаких доказательств прямой связи такого лечения с возникновением панкреатита (Behrend, Kemppainen, 1997).
Ятрогенный синдром Кушинга и болезнь Аддисона
Клиническая симптоматика. У большинства собак, получающих глюкокортикоиды на протяжении 1-2 недель, развиваются полидипсия, полиурия, полифагия и затрудненное дыхание, которые иногда отмечаются в течение нескольких часов после введения первой дозы кортикостероидов. Это обычные побочные эффекты, индуцируемые стероидами, и они исчезают после уменьшения дозы или отмены препаратов. Для развития более хронических расстройств под воздействием избыточных количеств глюкокортикоидов (алопеции, инфекций мочевого тракта, гепатомегалии, общей слабости, медленного заживления ран и многих других) требуется более длительное введение препаратов, обычно в течение нескольких недель или месяцев.
Биохимические изменения. В дополнение к появлению явных клинических признаков, системное действие хронического избытка глюкокортикоидов сопровождается изменением общей картины крови и химического состава сывороток, аномальными
518 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
результатами анализов мочи и рентгенологических исследований. Биохимические нарушения, характерные для синдрома Кушинга, могут появиться уже через несколько часов после начала глюкокортикоидной терапии. С другой стороны, у некоторых животных хроническое введение фармакологических доз глюкокортикоидов не сопровождается или почти не сопровождается биохимическими изменениями. Таким образом, существуют выраженные индивидуальные различия реакции собак на эти лекарственные средства.
Нежелательное действие стероидных препара юв. Ятрогенный синдром Кушинга чаще всего развивается после многократных инъекций препаратов глюкокортикоидов длительного действия. К сожалению, эти лекарственные средства для парентерального введения, вызывающие устойчивый клинический эффект, нефизиологичны, и их медицинское применение неоправданно, нежелательно и во mhoi их случаях противопоказано. В частности, они абсолютно непригодны для долгосрочного лечения системных заболеваний. Однако ятрогенный синдром Кушинга у собак может развиться после терапии практически любым глюкокортикоидным препаратом, поэтому необходимо исключительно осторожно подходить к использованию глюкокортикоидов кратковременного действия для инъекций и перорального введения, а также препаратов для топического нанесения и применения в офтальмологии (Roberts et al, 1984).
Подтверждение диагноза. Наличие ятроюнно-го синдрома Кушинга подтверждают с помощью провокационной пробы с АКТЕ Введение глюкокортикоидов подавляет секрецию гипофизарного АКТГ и с течением времени приводит к атрофии коры надпочечников. Поэтому проба с АКТГ при
кортизола стимуляции
Время
Рис. 10-6. Результаты провокационной пробы с АКТГ у здоровых собак, собак со спонтанным гиперкортицизмом и собак с ятрогенным синдромом Кушинга. Ятрогенный синдром Кушинга является синонимом ятрогенного гипокортицизма.
ятрогенном синдроме Кушинга зачастую выявляет пониженную базальную концентрацию кортизола в плазме крови (на нижнеи границе нормы или ниже ее) и низкий ответ кортизола на АКТГ (рис. 10-6). Степень потери чувствительности надпочечников к стимуляции зависит от дозы глюкокортикоидов, продолжительности их введения и индивидуальной реакции. В случае выявления аномального ответа в пробе с АКТГ у собак и кошек в условиях хронической стероидной терапии ставится диагноз ятрогенного синдрома Кушинга.
Лечение. После резкого прекращения введения собакам экзогенных кортикостероидов и при остром стрессе в условиях консервативной глюкокортикоидной терапии у животных могут быстро развиться симптомы ятрогенной гипокортизоле-мии. В этом смысле ятрогенный синдром Кушинга и ятрогенный гипокортицизм представляют собой разные последствия одного явления - хронической глюкокортикоидной терапии. За редкими исключениями, состояние собак с ятрогенным синдромом Кушинга в конечном счете нормализуется после прекращения введения глюкокортикоидных препаратов. После длительного подавления функции гипоталамо-гипофизарно-надпочечниковой системы в результате продолжительного введения глюкокортикоидов она может полностью восстановиться всего за один месяц или, по крайней мере, в течение нескольких месяцев. Для этою необходимо либо резко прекратить терапию (когда отсутствуют симптомы гипокортизолемии), либо прогрессивно уменьшать дозы вводимых глюкокортикоидов (если их резкая отмена может вызвать анорексию, рвоту или необычное состояние апатии). При выборе последнего подхода животное в идеале должно получать глюкокортикоиды через день на протяжении 1-3 месяцев с назначением дополнительной терапии в периоды сильного стресса (например, при возникновении нового заболевания, травме, хирургическом вмешательстве или транспортировке). Количество вводимого собаке глюкокортикоида должно быть несколько меньше физиологической заместительной дозы. Тогда препарат обеспечивает поддержку жизнедеятельности, не препятствуя восстановлению функции коры надпочечников.
Кошки. Введение кошкам экзогенных глюкокортикоидов может приводить и действительно приводит к подавлению функции гипоталамо-ги-пофизарно-надпочечниковой системы (Scott, 1980 и 1982). Прекращение глюкокортикоидной терапии у кошек редко сопровождается появлением клинических симптомов ятрогенного синдрома Кушинга или гипокортицизма. Тем нс менее, введение им слишком высоких, нефизиологичных доз метилпреднизолона на протяжении всего 7 дней вызывало уменьшение концентрации кортизола в плазме крови (Crager et al, 1994). Применение прогестагенов (еще одного типа стероидных препаратов) также приводило к развитию гипокортицизма у кошек (см. гл. 8).
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
519
Вакцинация
Как указывалось выше, лекарственные препараты на основе глюкокортикоидов являются мощными противовоспалительными средствами. В то же время они практически не препятствуют формированию антител. Поэтому глюкокортикоидная терапия не является противопоказанием к вакцинации, если она необходима собаке или кошке (Cohn, 1991).
Параметры печени
Наиболее распространенным биохимическим нарушением у собак в условиях глюкокортикоидной терапии является повышение активности щелочной фосфатазы в сыворотке крови. При этом «верхний предел» такого увеличения под воздействием природных глюкокортикоидов или ятрогенного эффекта экзогенных препаратов отсутствует. Практически любой глюкокортикоид может вызвать острое и весьма значительное усиление активности щелочной фосфатазы вследствие индукции ее уникальной печеночной изоформы (см. гл. 6). Хотя степень изменения ферментативной активности зависит от дозы глюкокортикоида, она практически не поддается прогнозированию из-за значительной индивидуальной вариабельности у собак. То же самое можно сказать о влиянии продолжительности терапии и способа введения глюкокортикоидов на характер индукции щелочной фосфатазы. Поэтому лучше просто говорить, что глюкокортикоиды усиливают активность щелочной фосфатазы независимо от типа стероида, его дозы, длительности или пути введения. Кроме того, глюкокортикоидная терапия обычно, хотя и в меньшей степени, повышает активность аланинаминотрансферазы (АЛТ) и у-глютамилтрансферазы (ГГТ), а также концентрацию холестерина в крови. Одновременно она снижает концентрацию азота мочевины (AM) в крови, отчасти вследствие индукции полиурии и полидипсии (с изостенурией или гипостенурией). Изменяются также показатели функции печени (в частности, концентрация желчных кислот натощак и после еды). Все эти нарушения могут появиться уже через несколько дней после начала терапии. Однако они носят обратимый характер и исчезают после отмены глюкокортикоидов.
Влияние на терапию сахарного диабета
Глюкокортикоиды обладают сильной антиинсу-линовой активностью, т.е. являются антагонистами инсулина, и потому могут влиять на результаты лечения сахарного диабета. Иногда стероиды «провоцируют» диабет, хотя, вероятно, в этих случаях уже имеется «предиабетическое состояние» (Jeffers et al, 1991). Помимо этого, стероиды стимулируют деградацию белков и катаболическое превращение аминокислот в глюкозу, что повышает потребность организма в инсулине. Влияние на терапию сахар
ного диабета оказывают как глюкокортикоидные средства для топического применения (например, глазные мази и кожные кремы), так и препараты, предназначенные для приема внутрь или парентерального введения. У большинства собак со спонтанным синдромом Кушинга нарушается толерантность к глюкозе и развивается резистентность к инсулину (Feldman, Tyrrell, 1982). В то же время введение глюкокортикоидов здоровым собакам на протяжении 3-4 недель не вызывает ни гипергликемии, ни нарушения толерантности к глюкозе или развития инсулинорезистентности (Wolfsheimer et al, 1986). Это не удивительно, поскольку считается, что для появления таких нарушений у здоровых животных необходимо введение глюкокортикоидов в течение весьма длительного времени. Установлено, что в среднем собаки со спонтанным синдромом Кушинга к моменту установления окончательного диагноза уже имели это заболевание в течение 12 месяцев.
У некоторых домашних животных больных сахарным диабетом развиваются нарушения, требующие краткосрочной или долгосрочной глюкокортикоидной терапии. Когда глюкокортикоидная терапия показана собаке или кошке с сахарным диабетом, надо использовать препараты с короткой продолжительностью действия и в минимальных дозах, обеспечивающих контроль данного расстройства. При краткосрочной глюкокортикоидной терапии (в течение 1 или 2 недель) возможно нарушение компенсации диабета, но владельцу животного следует разъяснить, что такое ухудшение носит временный характер, и что в отсутствие глюкокортикоидной терапии могут возникнуть серьезные проблемы в связи с полидипсией, полиурией и полифагией. У собаки или кошки может развиться резистентность к инсулину, однако, случаи кетоацидоза редки, если только не возникает инфекционное или какое-либо иное серьезное заболевание. Дозировка инсулина не нуждается в коррекции, напротив, рекомендуется сохранять обычную дозу вплоть до отмены снижающей ее эффективность глюкокортикоидной терапии. Если же необходима долгосрочная глюкокортикоидная терапия, то ежедневные дозы инсулина следует увеличить, чтобы обеспечить адекватный контроль сахарного диабета. Степень такого повышения может быть различной, и доза инсулина подбирается на основании показателей, используемых для оценки контроля диабетического состояния, индивидуально для каждого животного, как описано в гл. 11 и 12.
У кошек, получающих глюкокортикоидную терапию, толерантность к глюкозе, по-видимому, нарушается чаще, чем в тех же условиях у собак. Сахарным диабетом страдает большинства кошек со спонтанным синдромом Кушинга. Введение экзогенных глюкокортикоидов сопровождается гипергликемией даже при использовании низких доз препаратов кратковременного действия (Middleton, Watson, 1985; Middleton et al, 1987).
520 • ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
Задержка натрия и гипертензия
Большинство глюкокортикоидов обладают столь низкой минералокортикоидной активностью, что у получающих их животных практически отсутствуют нарушения, связанные с задержкой натрия в организме. Тем не менее, глюкокортикоиды могут индуцировать гипертензию, которая, в свою очередь, сопровождается большим числом нежелательных явлений. Гипертензия оказывает неблагоприятное воздействие на функцию почечных клубочков, усиливая потерю белка, и может стать причиной кровоточивости, отслоения сетчатки или сердечных заболеваний.
Беременность и фертильность
Введение глюкокортикоидов щенным собакам со сроком беременности более 20 дней может спровоцировать выкидыш всех или только нескольких плодов спустя 2-5 дней после начала терапии. Предполагается, что глюкокортикоиды, действуя по механизму отрицательной обратной связи, подавляют секрецию гонадотропинов гипофизом, что делает невозможным сохранение беременности. Прерывание беременности происходит при введении глюкокортикоидов в дозах, которые применяются для лечения иммунных заболеваний, острых аллергических реакций и других серьезных расстройств. Реакция животных на такую терапию индивидуальна, как и в случае других побочных эффектов, индуцируемых экзогенными кортикостероидами.
Надежным средством для прерывания беременности у собак считается дексаметазон. Его введение 20 собакам во всех случаях вызвало выкидыш при сроках беременности от 28 до 51 дня. Дексаметазон вводили внутрь на протяжении 7,5-10 дней в уменьшающихся дозах, начиная с 0,4-0,6 мг/кг (Zone et al, 1995).
Подавление глюкокортикоидами секреции гипофизарных гонадотропинов может сказываться на плодовитости собак и кошек. Уменьшение секреции фолликулостимулирующего и лютеинизирующего гормонов сопровождается нарушениями эстраль-ного цикла у самок, а также атрофией семенников и олигоспермией у самцов (см. раздел «Биологическое действие»), К счастью, эти нарушения обычно имеют обратимый характер и исчезают после прекращения глюкокортикоидной терапии.
Функция щитовидной железы
См. раздел «Биологическое действие».
Задержка роста
См. раздел «Биологическое действие».
ПРИМЕНЕНИЕ ГЛЮКОКОРТИКОИДОВ В ДИАГНОСТИЧЕСКИХ ТЕСТАХ
Гиперкортицизм. Глюкокортикоиды, в первую очередь, дексаметазон, применяются для целей ск
рининга и в ингибирующих пробах при диагностическом обследовании собак и кошек с подозрением на гиперкортицизм. Эти тесты подробно описаны в гл. 6 и 7.
Лимфосаркома. В ветеринарные учреждения иногда поступают животные с неспецифическими заболеваниями или специфическими биохимическими нарушениями (например, с тяжелой гиперкальциемией), причины которых неясны. Одной из таких причин может быть лимфосаркома. У таких животных результаты скрининговых тестов могут быть в норме. Несмотря на серьезность некоторых из этих расстройств, их иногда не удается диагностировать с помощью рентгенологических методов или исследования материала, получаемого при пункционной или аспирационной биопсии лимфатических узлов, костного мозга, печени или селезенки. Можно попытаться провести комплексную диагностическую и терапевтическую оценку действия высоких доз глюкокортикоидов. Если при этом клиническое состояние собаки или кошки быстро улучшается или если концентрация кальция в сыворотке крови снижается до нормы, то, скорее всего, у животного имеется лимфосаркома, множественная миелома или какая-нибудь другая опухоль, чувствительная к действию стероидов (см. гл. 17).
Однако такое применение кортикостероидов отнюдь не приветствуется и не рекомендуется. Специфический диагноз следует устанавливать до введения глюкокортикоидов кошке или собаке (Rosenthal, 1982; Rosenthal, Wilke, 1983).
ГЛЮКОКОРТИКОИДНЫЕ ПРЕПАРАТЫ И ИХ ДОЗЫ
Как следует из табл. 10-6, глюкокортикоидные препараты отличаются по характеру противовоспалительного действия и уровню минералокортикоидной активности. Эти факторы, наряду с продолжительностью биологического действия, стоимостью, типом лекарственной формы и возможностью соблюдения рекомендаций по ее применению, необходимо принимать во внимание при выборе вида терапии. При определении доз и режима введения препаратов клиницист должен учитывать, характер заболевания, данные анамнеза и индивидуальные особенности животного (Соррос, 1984). Во многих случаях количество глюкокортикоидного препарата, необходимое для поддержания терапевтического эффекта, меньше дозы, которая требуется для индукции желаемой клинической реакции. Минимально возможную дозу для получения ожидаемого эффекта обычно определяют посредством постепенного уменьшения начальной дозы до появления признаков обострения заболевания (McDonald, Langston, 1995).
Поскольку глюкокортикоидная монотерапия или комбинированная терапия глюкокортикоидами и другими лекарственными средствами используется для лечения самых разнообразных заболеваний,
ТАБЛИЦА 10-6. СРАВНЕНИЕ ДЕЙСТВИЯ РАЗЛИЧНЫХ КОРТИКОСТЕРОИДНЫХ ПРЕПАРАТОВ
Препарат Относительная активность Эквивалентная пероральная доза (мг) Доступные препараты
Глюкокортикоидная Топическая Минералокортикоидная Для приема внутрь Для инъекций Для топического применения
С короткой продолжительностью действия 25, 50 и 125 мг/мл Различные формы
Гидрокортизон 1 1 1 20 Сироп: 2 мг/мл Таблетки: 5, 10, 20 и 25 мг
Кортизон 0,8 0 С промежуточной продолжительностью действия 0,8 25 Таблетки: 5,10, и 25 мг 25, 50 мг/мл Глазная мазь Глазные капли
Преднизон 4 0 0,3 5 Таблетки: 1, 2,5, 5, 10, 20 и 50 мг Капсулы: 1,25 мг — —
Преднизолон 5 4 0,3 5 Таблетки: 5 мг 20, 25,40, 50 и 100 мг/мл Кремы, глазные мази и растворы, аэрозоли
Метилпреднизолон 5 5 0 5 Таблетки: 2, 4 и 16 мг Пилюли: 2 и 4 мг 20, 50, 62,5 и 80 мг/мл Порошок: 500 и 1000 мг/фла- кон Кремы и мази
Триамцинолон 5 5-100 0 4 Таблетки: 1, 2, 4, 8 и 16 мг Сироп: 0,4 и 0,8 мг/мл 5,10, 20, 25 и 40 мг/мл Мази, лосьон, пена, аэрозоль и крем
Длительно действующие
Бетаметазон 24-40 10 0 0,6 Таблетки: 0,5 и 0,6 мг Сироп, пилюли 4 и 6 мг/мл Мазь, крем, гель, аэрозоль, лосьон
Дексаметазон 30 10 0 0,75 Эликсир: 0,05 и 0,1 мг/мл Таблетки: 0,25, 0,5, 0,75, 1,0,1,5 и 4 мг 1, 2,4, 5 и 8 мг/мл То же, что для бетаметазона
Параметазон 10 - 0 2 Таблетки: 1, 2 и 6 мг 5 и 20 м/мл —
Минералокортикоиды
Флюдрокортизон 10 10 250 2 Таблетки: 0,1 мг 3 мг/мл Глазная суспензия Мазь
Дезоксикортикортикос-терон 0 0 20 0 Средства под язык: 1,5 мг В масле: 5, 10 и 50 мг/мл Таблетки —
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
522
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
невозможно дать точные рекомендации по выбору дозировок этих препаратов. Продолжительность терапии может составлять всего 5-14 дней при таких расстройствах, как астма или острые кожные аллергические реакции, либо до 2-6 месяцев при лечении аутоиммунной гемолитической анемии, системной красной волчанки или других тяжелых заболеваний, обусловленных нарушением функции иммунной системы.
При поступлении в нашу клинику животных с такими заболеваниями мы чаще всего начинаем с назначения фармакологической терапии преднизолоном, рекомендуя ежедневные дозы от 2,2 до 6 мг/кг. Чем больше размер животного, тем ниже первоначальная доза в пересчете на вес тела. При использовании дексаметазона его доза обычно составляет 1/4-1/10 дозы преднизолона. В последующем ее постепенно уменьшают каждую неделю или раз в две недели. Так, например, при назначении преднизолона в исходной дозе 50 мг/день предлагается следующая схема:
1-я неделя: 50 мг/день (возможно дробное введение)
2-я неделя: 25 мг/день
3-я и 4-я недели: 50 мг через день
5-я и 6-я недели: 25 мг через день
7-я и 8-я недели: 12,5 мг через день
9-я и 10-я недели: 7,5 мг через день
11-я и 12-я недели: 2,5 мг через день
Некоторым собакам и кошкам следует вводить физиологические заместительные дозы глюкокортикоидов, например, когда у животного в результате удаления функционально активной опухоли коры надпочечников сохраняются только нефункционирующие, атрофированные клетки коры. В этих случаях дексаметазон вводят внутримышечно или подкожно, сначала в количестве примерно 0,01-0,02 мг/кг два-четыре раза в день, а потом постепенно уменьшают дозу. После восстановления способности самостоятельно есть и пить животное переводят на пероральный прием преднизона и снова постепенно понижают его дозу (см. гл. 6).
Практически при всех внутренних болезнях предпочтительно использовать лекарственные средства кратковременного действия для приема внутрь. При лечении тяжелых заболеваний следует избегать использования длительно действующих препаратов для инъекций. Мы обычно назначаем препараты для двукратного в течение суток приема внутрь. Рекомендации других авторов давать глюкокортикоиды собакам по утрам, а кошкам вечером выглядят слишком академичными.
ЛИТЕРАТУРА
Aron DC, et al: Glucocorticoids and adrenal androgens. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 334.
Behrend EN, Kemppainen RJ: Glucocorticoid therapy. Vet Clin North Am 27:187, 1997.
Bone RC, et al: A controlled clinical trial of high-dose methylprednisolone in the treatment of severe sepsis and septic shock. N Engl J Med 317:653, 1987.
Braughler JM, Hall ED: Correlation of methylprednisolone levels in cat spinal cord with its effects on sodium potassium ATPase, lipid peroxidation, and alpha motor neuron function. J Neurosurg 56:838, 1982.
Brockus CW, et al: Effect of alternate-day prednisolone administration on hypophyseal-adrenocortical activity in dogs. Am J Vet Res 60:698, 1999.
Butterfield JH, Gleich GJ: Antiinflammatory effects of glucocorticoids on eosinophils and neutrophils. In Schleimer RP, Claman HN, Oronsky A (eds): Antiinflammatory Steroid Action: Basic and Clinical Aspects. New York, Academic Press, 1989, p 13.
Calvert C A, Greene CE: Bacteremia in dogs: Diagnosis, treatment, and prognosis. Compend Contin Educ 8:179, 1986.
Cohn LA: The influence of corticosteroids on host defense mechanisms. J Vet Intern Med 5:95, 1991.
Cook AK, et al: Effect of oral cyclosporine in dogs with refractory immun-emediated anemia or thrombocytopenia. J Vet Intern Med 8:170, 1994 (abstract).
Coppoc GL: Relationships of the dosage form of a corticosteroid to its therapeutic efficacy. J Am Vet Med Assoc 185:1098, 1984.
Crager CS, et al: Adrenocorticotropic hormone and Cortisol concentrations after corticotropin-releasing hormone stimulation testing in cats administered methylprednisolone. Am J Vet Res 55:704, 1994.
Cupps TR: Effects of glucocorticoids on lymphocyte function. In Schleimer RP, Claman HN, Oronsky A (eds): Antiinflammatory Steroid Action: Basic and Clinical Aspects. New York, Academic Press, 1989, p 132.
Cupps TR, Fauci AS: Corticosteroid-mediated immunoregulation in man. Immunol Rev 65:133, 1982.
Daley CA: Effects of ranitidine on prednisone-induced hemorrhagic gastritis in dogs, master’s thesis, Auburn, Ala, 1993, Auburn University.
Dinarello CA, Mier JW: Lymphokines. N Engl J Med 317:940, 1987.
Feldman EC, Tyrrell JB: Plasma testosterone, plasma glucose, and plasma insulin concentrations in spontaneous canine Cushing’s syndrome. The Endocrine Society, Salt Lake City, 1982, p 343 (abstract).
Ferguson DC, Hoenig M: Glucocorticoids, mineralocorticoids, and steroid synthesis inhibitors. In Adams HR (ed): Veterinary Pharmacology and Therapeutics, 7th ed. Ames, Iowa, Iowa State University Press, 1995, p 622.
Flower RJ: Glucocorticoids and the inhibition of phospholipase A. In Schleimer RP, Claman HN, Oronsky A (eds): Antiinflammatory Steroid Action: Basic and Clinical Aspects. New York, Academic Press, 1989, p 409.
Ford RB: Concurrent use of corticosteroids and antimicrobial drugs in the treatment of infectious diseases in small animals. J Am Vet Med Assoc 185:1142, 1984.
Gilman AG, et al: The Pharmacologic Basis of Therapeutics, 6th ed. New York, Macmillan, 1980, p 1470.
Goldfein A: Adrenocorticosteroids and adrenocortical antagonists. In Katzung BG (ed): Basic and Clinical Pharmacology, 5th ed. Norwalk, Conn, Appleton & Lange, 1994, p 543.
Greisman SE: Experimental gram-negative bacterial sepsis: Optimal methylprednisolone requirements for prevention of mortality not preventable by antibiotics alone. Proc Soc Exp Biol Med 170:436, 1982.
Hall ED, Braughler JM: Effects of intravenous methylprednisolone in spinal cord peroxidation and sodium and potassium ATPase reactivity. J Neurosurg 57:247, 1982.
Hall EJ: Inflammatory bowel disease: Recent advances. Proceedings of the North America Veterinary Conference, Orlando, FL, 2002, pp 264-266.
Hankes GH, et al: Pharmacokinetics of prednisolone sodium succinate and its metabolites in normovolemic and hypovolemic dogs. Am J Vet Res 46:476, 1985.
Haskins SC: Management of septic shock. J Am Vet Med Assoc 200:1915, 1992.
Hinshaw LB, et al: Review update: Current management of the septic shock patient-experimental basis for treatment. Circ Shock 9:543, 1982.
Hinshaw LB, et al: Effect of high-dose glucocorticoid therapy on mortality in patients with clinical signs of systemic sepsis. N Engl J Med 317:659, 1987.
Hirata F: The role of lipocortins in cellular function as a second messenger of glucocorticoids. In Schleimer RP, Claman HN, Oronsky A (eds): Antiinflammatory Steroid Action: Basic and Clinical Aspects. New York, Academic Press, 1989, p 67.
Hoerlein BF, et al: Evaluation of naloxone, crocetin, thyrotropin-releasing hormone, methylprednisolone, partial myelotomy, and hemilaminectomy in the treatment of acute spinal cord trauma. J Am Anim Hosp Assoc 21:67, 1985.
Jeffers JG, et al: Diabetes mellitus induced in a dog after administration of corticosteroids and methylprednisolone pulse therapy. J Am Vet Med Assoc 199:77, 1991.
Kehrl JH, Fauci AS: The clinical use of glucocorticoids. Ann Allergy 50:2, 1983.
Kemppainen RJ, et al: Adrenocortical suppression in the dog after a single dose of methylprednisolone acetate. Am J Vet Res 42:822, 1981. Kemppainen RJ, et al: Adrenocortical suppression in the dog given a single intramuscular dose of prednisone or triamcinolone acetonide. Am J Vet Res 42:204, 1982.
Kemppainen RJ, Sartin JL: Effects of single intravenous doses of dexamethasone on baseline Cortisol concentration and responses to synthetic ACTH in healthy dogs. Am J Vet Res 45:742, 1984.
ГЛЮКОКОРТИКОИДНАЯ ТЕРАПИЯ
523
Kimura Т, et al: Steroid administration with acute pancreatitis: Studies with an isolated, perfused canine pancreas. Surgery 85:520, 1979.
Leramo OB, et al: Massive gastroduodenal hemorrhage and perforation in acute spinal cord injury. Surg Neurol 17:186, 1982.
MacDonald JM: Glucocorticoid Therapy. In Ettinger SJ, Feldman EC (eds). Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders, 2000, p307.
McDonald RK, Langston VC: Use of corticosteroids and nonsteroidal antiinflammatory agents. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders, 1995.
Meric S: Canine meningitis: A changing emphasis. J Vet Intern Med 2:26, 1988.
Meric S, et al: Necrotizing vasculitis of the spinal pachyleptomeningeal arteries in three Bernese Mountain Dog littermates. J Am Anim Hosp Assoc 22:459, 1986.
Meuleman J, Katz P: The immunologic effects, kinetics, and use of glucocorticoids. Med Clin North Am 69:805, 1985.
Meyers FH, et al: Review of Medical Pharmacology, 7th ed. Los Altos, Calif, Lange Medical Publications, 1980, p 353.
Middleton DJ, Watson ADJ: Glucose intolerance in cats given short-term therapy of prednisolone and megestrol acetate. Am J Vet Res 46:2623, 1985.
Middleton DJ, et al: Suppression of Cortisol responses to exogenous adrenocortical hormone, and the occurrence of side effects attributable to glucocorticoid excess, in cats during therapy with megestrol acetate and prednisolone. Can J Vet Res 51:60, 1987.
Moore RW, Withrow SJ: Gastrointestinal hemorrhage and pancreatitis associated with intervertebral disk disease in the dog. J Am Vet Assoc 180:1443, 1982.
Munck A, Guyre PM: Glucocorticoid actions on monocytes and macrophages, /n Schleimer RP, Claman HN, Oransky A (eds): Antiinflammatory Steroid Action: Basic and Clinical Aspects. New York, Academic Press, 1989, p 199.
Nossal GJV: The basic components of the immune system. N Engl J Med 316:1320, 1987.
Osol A: Remington’s Pharmaceutical Sciences, 16th ed. Easton, Pa, Mack Publishing, 1980, p 898.
Papich MG, Davis LE: Glucocorticoid therapy. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p 54.
Piper JM, et al: Corticosteroid use and peptic ulcer disease: role of nonsteroidal antiinflammatory drugs. Ann Intern Med 114:735, 1991.
Roberts SM, et al: Effect of ophthalmic prednisolone acetate on the canine adrenal gland and hepatic function. Am J Vet Res 45:1711, 1984.
Rohrer CR, et al: Gastric hemorrhage in dogs given high doses of methylprednisolone sodium succinate. Am J Vet Res 60:977, 1999a.
Rohrer CR, et al: Efficacy of misoprostol in prevention of gastric hemorrhage in dogs treated with high doses of methylprednisolone sodium succinate. Am J Vet Res 60:982, 1999b.
Rosenthal RC: Hormones in cancer therapy. Vet Clin North Am (Small Anim Pract) 12:67, 1982.
Rosenthal RC, Wilke JR: Glucocorticoid therapy. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p 854.
Scott DW: Systemic glucocorticoid therapy. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders, 1980, p 988.
Scott DW: Iatrogenic Cushing’s syndrome in the cat. Feline Pract 12:30, 1982.
Scott DW, et al: Dermatologic therapy: Hormonal agents. In Small Animal Dermatology. Philadelphia, WB Saunders, 1995, p 240.
Sorjonen DC, et al: Effects of dexamethasone and surgical hypotension on the stomach of dogs: Clinical, endoscopic, and pathologic evaluations. Am J Vet Res 44:1233, 1983.
Spencer KB, et al: Adrenal gland function in dogs given methylprednisolone. AmJ Vet Res 41:1503, 1980.
Steinberg WM, Lewis JH: Steroid-induced pancreatitis: Does it really exist? Gastroenterology 81:799, 1981.
Stewart THM, et al: Ulcerative enterocolitis in dogs induced by drugs. J Pathol 131:363, 1980.
Toombs JP, et al: Colonic perforation following neurosurgical procedures and corticosteroid therapy in four dogs. J Am Vet Med Assoc 177:68, 1980.
Toombs JP, et al: Colonic perforation in corticosteroid-treated dogs. J Am Vet Med Assoc 188:145, 1986.
Tyrrell JB, et al: Glucocorticoids and adrenal androgens, /n Greenspan FS (ed): Basic and Clinical Endocrinology, 3rd ed. San Mateo, Calif, Appleton & Lange, 1991, p 323.
Wolfsheimer KJ, et al: Effects of prednisolone on glucose tolerance and insulin secretion in the dog. Am J Vet Res 47:1011, 1986.
Woltz HH, et al: Effect of prednisone on thyroid gland morphology and plasma thyroxine and T3 levels in dogs. Am J Vet Res 44:2000, 1983.
Zenoble RD, Kemppainen RJ: Adrenocortical suppression by topically applied corticosteroids in dogs. J Am Vet Med Assoc 191:685, 1987.
Zone M, et al: Termination of pregnancy in dogs by oral administration of dexamethasone. Theriogenology 43:487, 1995.
Часть IV
ЭНДОКРИННАЯ ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Глава 11
САХАРНЫЙ ДИАБЕТ У СОБАК
КЛАССИФИКАЦИЯ И ЭТИОЛОГИЯ....526
ПАТОФИЗИОЛОГИЯ...............532
ВСТРЕЧАЕМОСТЬ................533
АНАМНЕЗ......................533
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.....534
УСТАНОВЛЕНИЕ ДИАГНОЗА САХАРНЫЙ ДИАБЕТ..............534
КЛИНИКО-ПАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ ...................535
ЛЕЧЕНИЕ НЕКЕТОНОВОГО
САХАРНОГО ДИАБЕТА..........538
Инсулинотерапия..............538
Диетотерапия.................542
Физическая нагрузка..........547
Пероральные сахаропонижающие препараты....................547
Выявление и лечение сопутствующих расстройств..................550
Первоначальный подбор режима инсулинотерапии..............551
МОНИТОРИНГ КОМПЕНСАЦИИ ДИАБЕТА......................552
Анамнез и физикальное исследование.................552
Определение концентрации фруктозамина в сыворотке крови ...553
Определение концентрации
гликозилированного гемоглобина в крови.....................555
Мониторинг уровня глюкозы в моче ... 556
Гликемическая кривая............556
Роль фруктозамина сыворотки крови в агрессивном поведении, возбуждении и стрессе у собак.............562
ИНСУЛИНОТЕРАПИЯ ПРИ
ХИРУРГИЧЕСКОЙ ОПЕРАЦИИ........562
ОСЛОЖНЕНИЯ ИНСУЛИНОТЕРАПИИ.... 563
Симптоматическая и бессимптомная гипогликемия..................563
Рецидивирующие или устойчивые клинические симптомы..........564
Занижение доз инсулина........565
Передозировка инсулина и контррегуляция глюкозы (феномен Сомоги)..............565
Кратковременный эффект инсулина ..567
Продолжительное действие инсулина 568
Неадекватная абсорбция инсулина ....568
Антитела к инсулину в крови.....568
Аллергические реакции на инсулин ... 570
Сопутствующие расстройства, вызы-
вающие инсулинорезистентность ...571
ХРОНИЧЕСКИЕ ОСЛОЖНЕНИЯ
САХАРНОГО ДИАБЕТА.............578
Катаракта.......................579
Увеит, связанный с помутнением хрусталика.....................580
Диабетическая ретинопатия......580
Диабетическая невропатия.......580
Диабетическая нефропатия.......581
Системная гипертензия..........581
ТРАНСПЛАНТАЦИЯ ОСТРОВКОВ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ.........582
ПРОГНОЗ........................584
Список сокращений
АКТГ - адренокортикотропный гормон
ДГК - декарбоксилаза глутаминовой кислоты
ДКА - диабетический кетоацидоз
ИЗСД - инсулинозависимый сахарный диабет
ИНЗСД — инсулинонезависимый сахарный диабет
ЛНП - липопротеины низкой плотности
ЛОНП - липопротеины очень низкой плотности
НЭПЖ - недостаточность экзокринной функции поджелудочной железы
ОАК - общий клинический анализ крови
ПЦИ - протамин-цинк-инсулин
РИА - радиоиммунологический анализ
СД 1 - сахарный диабет 1 типа
СД 2 - сахарный диабет 2 типа
Т„ - тироксин
ТПИ - трипсиноподобная
иммунореактивность
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
Эндокринная поджелудочная железа состоит из островков Лангерганса, рассеянных подобно «небольшим островам в море» экзокринных секреторных ацинарных клеток. Островки состоят из клеток четырех типов, которые различаются по характеру окрашивания, морфологическому строению и гормональной продукции и секреции. Это - альфа-клетки, секретирующие глюкагон; бета-клетки, секретирующие инсулин; дельта-клетки, секретирующие соматостатин, и F клетки, которые секретируют панкреатический полипептид. Поражение любой из этих клеточных линий приводит либо к избытку, либо к недостаточности соответствующего гормона в крови. Наиболее распространенным заболеванием эндокринной поджелудочной железы у собак и кошек является сахарный диабет, который
развивается вследствие абсолютной или относительной недостаточности инсулина в результате его пониженной продукции и секреции бета-клетками. Собаки и кошки примерно одинаково часто болеют сахарным диабетом; заболеваемость у этих животных составляет один случай на 100-500 особей (Panciera et al, 1990).
КЛАССИФИКАЦИЯ И ЭТИОЛОГИЯ
Классификация сахарного диабета у собак и кошек заимствована из классификации этого заболевания у человека: в зависимости от патофизиологических механизмов и обусловленных ими патологических изменений в бета-клетках, различают диабет 1 и 2 типов.
САХАРНЫЙ ДИАБЕТ У СОБАК • 527
ТАБЛИЦА 11-1. СТАДИИ РАЗВИТИЯ ИНДУЦИРОВАННОГО ИММУННОЙ
СИСТЕМОЙ ИНСУЛИНОЗАВИСИМОГО САХАРНОГО ДИАБЕТА У ЧЕЛОВЕКА
Стадия 1. Генетическая предрасположенность Стадия 2. Инициирующий фактор
Стадия 3. Активный аутоиммунный процесс и нормальная секреция инсулина
Стадия 4. Активный аутоиммунный процесс и нарушенная секреция инсулина
Стадия 5. Явный диабет с остаточной секрецией инсулина Стадия 6. Явный диабет с полным разрушением бета-клеток
Сахарный диабет 1 типа. Сахарный диабет 1 типа (СД1) обусловлен сочетанием генетической предрасположенности и аутоиммунного поражения бета-клеток, приводящего к прогрессирующей недостаточности инсулина вплоть до полного прекращения его продукции (Eisenbarth, 1986; Palmer, McCulloch, 1991). При диабете 1 типа вырабатываются аутоантитела к различным компонентам островков поджелудочной железы, в том числе к инсулину, бета-клеткам и декарбоксилазе глютаминовой кислоты (ДГК) (Srikanta et al, 1985; Verge et al, 1996; Gorus et al, 1997). Аутоантитела к инсулину, бета-клеткам и ДГК обычно определяют при диагностике сахарного диабета, но они присутствуют в крови еще на ранних стадиях развития СД1 до появления гипергликемии или других клинических признаков заболевания (Verge et al, 1996; Gorus et al, 1997). Скрининг на аутоантитела к инсулину, бета-клеткам и ДГК используется для выявления животных с повышенным риском СД1. Обнаружение аутоантител к ДГК или положительные результаты определения всех трех типов аутоантител служат наиболее достоверным показателем высокого риска развития СД1 (Tuomilehto et al, 1994; Schatz et al, 1994; Hagopian et al, 1995).
Индуцируемое иммунной системой разрушение панкреатических островков у человека концептуально подразделяется на шесть стадий, начиная с генетической предрасположенности (табл. 11-1) (Eisenbarth, 1986). На второй стадии запускаются события, приводящие к последующей аутоиммунной атаке на бета-клетки. Факторы окружающей среды, вызывающие аутоиммунные процессы, направленные на бета-клетки, точно неизвестны, однако, таковыми могут быть лекарственные средства или возбудители инфекций. Интересно, что в качестве одного из таких факторов у человека рассматривается кормление новорожденных коровьим молоком. У некоторых людей с впервые диагностированным инсулинозависимым сахарным диабетом (ИЗСД) имеются антитела к сывороточному альбумину крупного рогатого скота и к пептидному фрагменту этого альбумина, состоящему из 17 аминокислотных остатков. Была высказана гипотеза, согласно которой питание коровьим молоком в раннем детском возрасте может привести к разрушению бета-клеток вследствие молекулярной
мимикрии белков, содержащихся в этом молоке, и белка бета-клеток (Karjalainen et al, 1992; Savilahti et al, 1993; Gerstein, 1994). Однако другие исследователи относятся к этой гипотезе со скептицизмом (Atkinson et al, 1993). Стадия 3 - это период активных аутоиммунных процессов, однако еще сохраняется нормальная секреция инсулина. Иммунная атака на бета-клетки продолжается на стадии 4 и приводит к прогрессивному снижению стимулирующего действия глюкозы на продукцию инсулина, хотя еще поддерживается эугликемия. Явный (клинический выраженный) сахарный диабет развивается на стадии 5 даже в условиях продолжающейся остаточной секреции инсулина. Стадия 6 характеризуется полным разрушением бета-клеток. В результате пациент становится зависимым от инсулина, который необходим для поддержания нормального уровня гликемии, предотвращения кетоацидоза и обеспечения жизнеспособности. Исходя из современной концепции сахарного диабета, можно постулировать, что у собак это заболевание проходит через такие же стадии, как и у человека. К сожалению, у этих животных обычно не удается выявить сахарный диабет ранее 5-й или 6-й стадии, когда инсулинотерапия становится абсолютно необходимой (рис. 11-1).
Сахарный диабет 2 типа. Отличительными чертами сахарного диабета 2 типа (СД2) являются резистентность к инсулину и «дисфункция» бета-клеток (Reaven, 1988; Leahy, 1990). Считается, что эти дефекты имеют генетическую природу и возникают на десять или более лет раньше развития гипергликемии и клинических признаков СД2; они сопровождаются неблагоприятными эффектами, последствия которых еще более усиливаются под влиянием факторов окружающей среды или других воздействий, например, ожирения (Warram et al, 1990; Martin et al, 1992). Между врачами-диабе-тологами до сих пор не утихают споры по поводу того, какое расстройство - резистентность к инсулину или нарушение секреции инсулина запускает каскад процессов, приводящих к манифестации клинически явного сахарного диабета. Известно, что резистентность печени к инсулину как возможное следствие повышенной концентрации жирных кислот в крови портальной системы приводит к избыточной базальной продукции глюкозы и развитию гипергликемии натощак (DeFronzo et al, 1989; Groop et al, 1989; Bergman, Mittleman, 1998; Massilon et al, 1997). Резистентность мышечной ткани к инсулину препятствует стимулирующему действию эндогенного инсулина усиливать включение в нее глюкозы во время и после приема пищи, что, в свою очередь, приводит к аномально высокой концентрации глюкозы в крови после еды (Mitrakou et al, 1990). Резистентность мышечной ткани к инсулину может быть следствием нарушения функции рецепторов инсулина, механизмов передачи сигнала рецепторов, транспорта и фосфорилирования глюкозы, биосинтеза гликогена и/или окисле-
528 • САХАРНЫЙ ДИАБЕТ У СОБАК
ф
2 т
<0 с;
со 1.4 -
2.4--
2.0--
Рис. 11-1. А. Схема превращения проинсулина (вверху) в инсулин. В результате протеолитического расщепления проинсулина образуются эквимолярные концентрации С-пептида и инсулина, которые хранятся в секреторных гранулах бета-клеток. Б. Средняя концентрация С-пептида до и после внутривенного введения 1 мг глюкагона 24 здоровым собакам (пунктирная линия со светлыми кружками), 35 собакам с сахарным диабетом и низкой базальной концентрацией С-пептида (пунктирная линия с треугольниками), 7 собакам с сахарным диабетом и повышенной базальной концентрацией С-пептида (сплошная линия с крестиками) и 8 собакам со спонтанно развившимся гиперкортицизмом (сплошная линия с темными кружками). * - р < 0,05 по сравнению с базальной величиной; + - р < 0,05 по сравнению с соответствующим периодом у здоровых собак. (Б: из: Nelson RW: Diabetes mellitus. Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine 4th ed. Philadelphia, WB Saunders Co, 1995, p 1511.)
ния глюкозы (DeFronzo, 1997). Снижение секреции инсулина также играет важную роль в патогенезе нарушения толерантности к глюкозе у человека при СД2 (Polonsky, 1995). Во время теста толерантности к глюкозе у животных общее количество секретируемого инсулина может быть повышено, понижено или сопоставимо с его нормальным уровнем натощак. Тем не менее, даже в случае усиленной секреции инсулина его оказывается недостаточно, чтобы преодолеть тяжелую инсулинорезистентность и высокую гипергликемию (Saad et al, 1989). Секреция инсулина прогрессивно уменьшается по мере увеличения концентрации глюкозы в крови, и когда уровень гликемии натощак начинает превышать 180-200 мг/100 мл, ответ инсулина в тесте толерантности к глюкозе становится недостаточным и в абсолютной величине.
Для компенсации СД2 у людей введение экзогенного инсулина обычно не требуется. Контроль заболевания, как правило, достигается соблюдением соответствующей диеты, дозированной физической нагрузкой и приемом пероральных сахаропонижающих препаратов. В то же время некоторым пациентам с СД2 при тяжелых формах инсулино-резистентности или нарушения функции бета-клеток инсулинотерапия может быть необходима. Таким образом, лица с диабетом 2 типа могут иметь ИЗСД или инсулинонезависимый сахарный диабет
(ИНЗСД). У собак и кошек с ожирением также выявлено наличие инсулинорезистентности и пониженной секреции инсулина (Nelson et al, 1990; Appleton et al, 2001). Общепризнанно, что у этих животных ожирение является одним из факторов, способствующих развитию сахарного диабета (Panciera et al, 1990; Scarlett, Donoghue, 1998). Пониженная чувствительность к инсулину была зарегистрирована и в группе кошек без ожирения. В процессе дальнейших наблюдений за ними было установлено, что в случае последующего ожирения риск развития нарушения толерантности к глюкозе у них был выше, чем у животных, у которых ожирение происходило на фоне нормальной чувствительности к инсулину (Appleton et al, 2001). Авторы высказали предположение, что у кошек, входивших в первую группу, был также повышен риск возникновения явного сахарного диабета. Роль генетических факторов, если таковые имеются, в изменении чувствительности к инсулину и повышении риска развития сахарного диабета у кошек нуждается в уточнении.
Инсулинозависимый и инсулинонезависимый сахарный диабет. Подразделение сахарного диабета человека на 1 и 2 типы основывается на семейном анамнезе заболевания, его клинической симптоматике, результатах иммунологического анализа (т.е. выявлении циркулирующих аутоантител к бета-клеткам и инсулину) и функционалы
САХАРНЫЙ ДИАБЕТ У СОБАК
529
ных проб с использованием стимуляторов секреции инсулина (Unger, Foster, 1998). В отличие от этого, классификация диабета на инсулинозависимый и инсулинонезависимый базируется на потребности в инсулинотерапии или отсутствии таковой с целью контроля уровня гликемии, предотвращения кетоацидоза и обеспечения выживания больного. Пациенты с ИЗСД должны получать инсулин, чтобы избежать развития кетоацидоза, тогда как при ИНЗСД контроль гликемии и профилактика кетоацидоза достигаются с помощью соответствующей диеты, физических упражнений и применения пероральных сахаропонижающих препаратов. В Соединенных Штатах приблизительно 10% больных диабетом имеют инсулинозависимое заболевание 1 типа. Примерно 90% больных страдают диабетом 2 типа, который может быть как инсулинозависимым, так и инсулинонезависимым, в зависимости от тяжести инсулинорезистентности и нарушения функции бета-клеток.
В случае собак и кошек клинически более оправдано классифицировать сахарный диабет как инсулинозависимый и инсулинонезависимый вместо того, чтобы подразделять его на заболевание 1 и 2 типов. У животных материалы семейного анамнеза, как правило, недоступны, а клинические проявления не позволяют дифференцировать диабет 1 и 2 типов, особенно у кошек (Nelson et al, 1993). К тому же пробы со стимуляторами секреции инсулина обычно не проводятся, а если проводятся, то дают дезориентирующие результаты (Kirk et al, 1993). Простые и достоверные методы определения аутоантител при диабете 1 типа у собак и кошек также отсутствуют. В силу перечисленных причин ветеринары обычно подразделяют диабет у собак и кошек на ИЗСД и ИНЗСД, исходя из потребности животных в инсулинотерапии. Иногда это приводит к путанице, так как у некоторых больных животных, особенно у кошек, первоначально развившийся ИНЗСД постепенно переходит в ИЗСД, тогда как у других имеют место повторные взаимопереходы ИНЗСД и ИЗСД по мере того как усиливаются или уменьшаются тяжесть инсулинорезистентности и нарушения функции бета-клеток. Наличие таких изменений диабетического состояния (т.е. ИЗСД и ИНЗСД) становится понятным, если принять во внимание, что поражение панкреатических островков может быть слабее или сильнее, может прогрессировать либо оставаться стабильным и от этого зависит способность поджелудочной железы секретировать инсулин, что чувствительность отдельных тканей к инсулину может быть различной в зависимости от наличия или отсутствия сопутствующих воспалительных или инфекционных заболеваний, неопластического процесса или гормональных нарушений, что, наконец, все эти факторы влияют на потребность животного в инсулине, дозы инсулинотерапии и легкость или трудность компенсации диабетических расстройств. Использование результатов определения концентрации инсулина в сыво
ротке крови для дифференциальной диагностики ИЗСД и ИНЗСД обсуждается на стр 537.
Инсулинозависимый сахарный диабет у собак. Как показывает наш опыт, практически у всех собак на момент выявления сахарного диабета имеет место инсулинозависимое заболевание. ИЗСД характеризуется наличием гипоинсулинемии, отсутствием повышения концентрации эндогенного инсулина в крови в ответ на введение стимуляторов его секреции (таких как глюкоза или глюкагон), невозможностью эффективного контроля гликемии с помощью диеты и/или пероральных сахаропонижающих препаратов, и, наконец, абсолютной потребностью в экзогенном инсулине для поддержания приемлемого уровня концентрации глюкозы. Причины ИЗСД у собак недостаточно известны, однако, это заболевание, без сомнения, имеет многофакторную природу (табл. 11-2). Наличие семейных случаев сахарного диабета у собак, а также результаты анализа родословных кеесхондов свидетельствуют о наличии генетической предрасположенности к сахарному диабету у одних пород и ее отсутствии у других (см. табл. 11-3; Guptill et al, 1999; Hess et al, 2000a). Самыми характерными патологическими изменениями у собак с сахарным диабетом являются уменьшение общего количества и размера бета-клеток, понижение числа бета-клеток в отдельных островках и водяночная баллоннирующая дегенерация оставшихся клеток (см. рис. 12-1, стр. 591). У некоторых собак имеет место экстремальная форма заболевания, обусловленная врожденной абсолютной недостаточностью функции бета-клеток и гипоплазией либо аплазией островков поджелудочной железы (Alejandro et al, 1998; Atkins et al, 1988).
Менее выраженные изменения панкреатических островков и бета-клеток у взрослых собак создают предрасположенность к развитию сахарного диабета под воздействием таких явлений и факторов ок-
ТАБЛИЦА 11-2. ПОТЕНЦИАЛЬНЫЕ
ЭТИОПАТОГЕНЕТИЧЕСКИЕ ФАКТОРЫ САХАРНОГО ДИАБЕТА У СОБАК И КОШЕК
Собаки Кошки
Генетические факторы Островковый амилоидоз
Аутоиммунный инсулит Ожирение
Панкреатит Панкреатит
Ожирение Сопутствующее гормональ-
Сопутствующее гормональ- ное расстройство
ное расстройство Г иперкортицизм
Г иперкортицизм Акромегалия
Избыточная секреция гор- Гипертиреоз
мона роста в диэструсе Медикаментозная терапия
Гипотиреоз Мегестрола ацетат
Медикаментозная терапия Глюкокортикоиды
Глюкокортикоиды Инфекция
Инфекция Сопутствующее заболевание
Сопутствующее заболевание Почечная недостаточность
Почечная недостаточность Сердечное заболевание
Сердечное заболевание Гиперлипидемия (?)
Г иперлипидемия Генетические факторы (?)
Островковый амилоидоз (?) Аутоиммунный инсулит (?)
530 • САХАРНЫЙ ДИАБЕТ У СОБАК
ТАБЛИЦА 11-3. РИСК РАЗВИТИЯ САХАРНОГО ДИАБЕТА У СОБАК РАЗЛИЧНЫХ ПОРОД ПО РЕЗУЛЬТАТАМ АНАЛИЗА ВЕТЕРИНАРНОЙ БАЗЫ ДАННЫХ (ВБД) ЗА ПЕРИОД С 1970 ПО 1993 Г.Г. *+
Порода Число случаев Контроль Соотношение
Австралийский терьер 33 3 9.39
Шнауцер 96 14 5.85
Цвергшнауцер 426 88 5.10
Бишон-фриз 39 И 3.03
Шпиц 34 10 2.90
Фокстерьер 88 28 2.68
Карликовый пудель 712 244 2.49
Самоедская лайка 159 56 2.42
Керн-терьер 61 23 2.26
Кеесхонд 47 18 2.23
Мальтийская болонка 42 20 1.79
Той-пудель 186 90 1.76
Лхаса апсо 85 47 1.54
Йоркширский терьер 96 57 1.44
Беспородные 1755 1498 1.00 (кон-
трольная
группа)
Английский спрингер- 62 77 0.69
спаниель
Ирландский сеттер 66 84 0.67
Бигль 70 94 0.64
Английский сеттер 29 41 0.60
Бассет 28 43 0.56
Ротвейлер 37 62 0.51
Бостон-терьер 27 45 0.56
Доберман-пинчер 103 180 0.49
Лабрадор-ретривер 199 375 0.45
Австралийская пастушья 32 62 0.44
собка
Кокер-спаниель 77 186 0.35
Золотистый ретривер 91 274 0.28
Шелти 27 109 0.21
Колли 25 104 0.21
Немецкая овчарка 68 317 0.18
* Из: Guprill L et al: Is canine diabetes on the increase? In: Recent Advances in Clinical Management of Diabetes Mellitus, lams Company, Dayton, Ohio, 1999, p 24.
+ ВБД содержит материалы 24 ветеринарных учебных заведений США и Канады. Анализируемые случаи были получены при первом обращении в ветеринарные клиники хозяев 6078 собак с диагнозом сахарный диабет и 5922 произвольно выбранных животных с другими заболеваниями, поступившими в те же клиники в том же году. В таблицу включены только те породы, среди которых зарегистрировано более 25 случаев сахарного диабета.
ружающей среды, как возбудители инфекционных заболеваний, ожирение, панкреатит, лекарственные препараты и болезни, вызывающие уменьшение секреции инсулина. Эти факторы могут индуцировать дегенерацию бета-клеток вследствие хронической инсулинорезистентности или высвобождение белков бета-клеток, которые индуцируют аутоиммунную деструкцию островков (Nerup, 1994). Исследование антител к бета-клеткам у собак с сахарным диабетом дало противоречивые результаты. Одни авторы сообщают о присутствии этих аутоантител у животных с впервые выявленным ИЗСД (Hoenig, Dawe, 1992), тогда как в другом исследовании аутоантител не обнаружили (Haines, 1986). Кроме того, у страдающих сахарным диабетом собак был описан
иммунозависимый инсулит (Alejandro et al, 1998). Вполне вероятно, что аутоиммунные процессы в сочетании с факторами окружающей среды могут играть роль в инициировании и развитии сахарного диабета у собак.
У собак с сахарным диабетом нередко отмечаются клинические признаки панкреатита, который некоторые авторы считают причиной возникновения диабета после разрушения островков поджелудочной железы. В то же время гистологические исследования выявляют панкреатит только у 30-40% собак, страдающих сахарным диабетом. Разрушение бета-клеток вследствие панкреатита служит убедительным объяснением возникновения гипоинсулинемического сахарного диабета. Тем не менее, существуют, по-видимому, более сложные факторы, вызывающие это заболевание у собак в отсутствие явного поражения экзокринной поджелудочной железы.
Инсулинонезависимый сахарный диабет у собак. У собак описано нарушение толерантности к углеводам, вызванное ожирением (Mattheeuws et al, 1984). В островках поджелудочной железы некоторых особей, страдающих сахарным диабетом, были обнаружены небольшие количества амилоида. Тем не менее, ИНЗСД у этих животных очень редко диагностируется на основании клинических проявлений. Описана ювенильная форма сахарного диабета собак, весьма сходная с диабетом взрослого типа у детей - подклассом ИНЗСД. Результаты определения концентрации С-пептида в плазме крови в пробах со стимуляторами секреции инсулина также предполагают, что у небольшой части собак с сахарным диабетом сохраняются функционирующие бета-клетки (см. рис. 11-1). С-пептид связывает две цепи инсулина в молекуле проин-сулина и секретируется в кровяное русло в эквимолярных инсулину концентрациях. Повышенная концентрация С-пептида в плазме крови у собак с диабетом свидетельствует либо о тяжелой форме заболевания 2 типа, либо о сохранении остаточной функциональной активности бета-клеток на фоне диабета 1 типа. К сожалению, при наличии клинических признаков диабета взрослого типа у молодых животных или способности в той или иной степени секретировать С-пептид состояние собак весьма напоминает ИЗСД в том отношении, что все эти животные нуждаются в экзогенном инсулине для контроля гипергликемии.
Преходящий диабет у собак. Преходящий, или обратимый диабет у собак встречается крайне редко, чаще всего при субклиническом течении заболевания у животных, получающих лекарственные препараты - антагонисты инсулина (например, глюкокортикоиды), или на самых ранних стадиях клинических состояний, которые сопровождаются подавлением секреции или действия инсулина (в частности, в фазе диэструса у самок либо при гиперкортицизме). У таких собак масса бета-клеток уменьшена, но их функциональная активность еще
САХАРНЫЙ ДИАБЕТ У СОБАК • 531
достаточна для поддержания толерантности к углеводам в отсутствие резистентности к инсулину; однако, в условиях антагонизма инсулину они уже не способны секретировать количество гормона, необходимое для поддержания эугликемического состояния. Раннее выявление и коррекция такого антагонизма помогают восстановить эугликемию без длительной инсулинотерапии. В случае невозможности быстрой коррекции количество бета-клеток прогрессивно уменьшается, что в конечном итоге приводит к возникновению ИЗСД и необходимости контроля гипергликемии с помощью экзогенного инсулина в течение всей оставшейся жизни. К числу дополнительных причин преходящего, или обратимого ИЗСД относятся ИНЗСД и «медовый месяц» ИЗСД. У людей в течение нескольких первых недель или месяцев после манифестации ИЗСД отмечается временное усиление секреции эндогенного инсулина и уменьшение потребности в экзогенном гормоне. Этот период называется медовым месяцем (Rossetti et al, 1990). У некоторых собак с впервые
выявленным сахарным диабетом также развивается синдром, напоминающий медовый месяц ИЗСД у человека. В это время удается хорошо контролировать уровень глюкозы в крови животных дозами инсулина, которые значительно меньше теоретически необходимых (ниже 0,2 ЕД/кг на одну инъекцию) (рис. 11-2). Легкость компенсации диабетического состояния на этих ранних стадиях заболевания, по-видимому, объясняется сохранением остаточной функции бета-клеток на момент установления диагноза (см. рис. 11-1) и уменьшением токсического действия глюкозы после начала инсулинотерапии (см. стр. 594). Продолжающееся разрушение оставшихся функционально активных бета-клеток сопровождается утратой ими способности секретировать эндогенный инсулин и нарастанием потребности в экзогенном инсулине для компенсации сахарного диабета. В результате затрудняется адекватная коррекция гипергликемии, а инсулин приходится вводить в дозах, которые обычно используются для целей полномасштабной инсулинотерапии, т.е.
t
Рис. 11-2. Гликемическая кривая кобеля весом 32 кг, получавшего подкожные инъекции комбинированного препарата НПХ инсулинов крупного рогатого скота и свиньи в дозе 0,3 ЕД/кг (сплошная линия с темными кружками). Гликемическая кривая была получена вскоре после начала инсулинотерапии. Через 5 месяцев эффективность гликемического контроля снизилась и возобновились клинические проявления диабета, несмотря на увеличение дозы инсулина до 0,6 ЕД/кг (пунктирная линия с темными кружками). Животное было обследовано в связи с подозрением на инсулинорезистентность. Доза инсулина была признана заниженной, а ее повышение до 1,0 ЕД/кг привело к нормализации гликемического контроля (сплошная линия со светлыми кружками). Стрелка указывает время инъекции инсулина и кормления животного.
532 • САХАРНЫЙ ДИАБЕТ У СОБАК
0,5-1,0 ЕД/кг на инъекцию. Такое увеличение потребности в инсулине обычно наблюдается спустя 6 месяцев после начала лечения.
Вторичный диабет у собак. Вторичный сахарный диабет представляет собой нарушение толерантности к глюкозе вследствие сопутствующих заболеваний или применения лекарственных средств, подавляющих секрецию инсулина или противодействующих его активности. Примерами вторичного диабета служат метаболические расстройства у сук в диэструсе и у кошек, получающих мегес-трола ацетат (прогестерон). Вначале у некоторых таких животных имеет место гиперинсулинемия. Однако при продолжении воздействия антагониста инсулина, функция бета-клеток прогрессивно ухудшается, что в конечном итоге приводит к возникновению сахарного диабета, как правило, ИЗСД. Если удалось излечить антагонистическое заболевание, а бета-клетки еще остались, то устойчивый, клинически выраженный диабет может не развиться. Тем не менее, у животных с эугликемией после устранения такого заболевания или отмены лекарственного препарата-антагониста инсулина сохраняется потенциальная опасность возникновения «субклинического» диабета. Поэтому для предотвращения явного сахарного диабета следует воздерживаться от применения антагонистов инсулина и обеспечить профилактику заболеваний, отрицательно влияющих на его секрецию.
У взрослых сук диабет иногда возникает в диэструсе или во время беременности, возможно потому, что прогестерон является антагонистом инсулина (см. стр .[526]). В этих случаях диабет либо спонтанно разрешается после того, как концентрация прогестерона в крови понизится до уровня, характерного для анэструса, либо сохраняется на протяжении всей оставшейся жизни животного и требует постоянного введения инсулина. Диабет, развивающийся у собак в диэструсе или во время щеннос-ти, напоминает гестационный диабет у человека. Гестационный диабет встречается исключительно у женщин и характеризуется тем, что заболевание (или нарушение толерантности к глюкозе) проявляется только во время беременности (Unger, Foster, 1998). После ее окончания явный диабет может стать пожизненным клиническим состоянием, перейти в субклиническое расстройство с нарушенной толерантностью к глюкозе либо завершиться нормализацией толерантности. В последнем случае риск возникновения явного диабета на протяжении последующей жизни женщины составляет от 10 до 40% в зависимости от степени ожирения. У собак с переходным диабетом, развившимся в диэструсе, значительно повышается вероятность возникновения устойчивого ИЗСД в следующей фазе эструса. По этой причине все особи с «гестационным» диабетом подлежат овариэктомии в возможно более ранние сроки после выявления заболевания.
В случае установления диагноза сахарного диабета подразумевается, что собака имеет ИЗСД, и ей
назначают инсулинотерапию, даже если есть основания предполагать наличие вторичного диабета. В связи с высокой частотой ИЗСД у собак с впервые выявленным диабетом обычно нет необходимости определять концентрацию инсулина в сыворотках крови ни в базальных условиях, ни в пробах со стимуляцией его секреции глюкозой или глюкагоном (см. табл. 12-1, стр. 596). У подавляющего числа собак с впервые выявленным сахарным диабетом инсулин в сыворотке либо ниже определяемого уровня, либо его концентрация не превышает половины нормальной величины (т.е. ниже 12 мкЕД/мл), что характерно для ИЗСД и гипоинсулинемии. Определение концентрации инсулина в сыворотке крови у собак с впервые выявленным сахарным диабетом может иметь прогностическую ценность в случаях подозрения на вторичное происхождение заболевания (в частности, у интактных сук в диэструсе или при тяжелом остром панкреатите). Концентрация инсулина в сыворотке, превышающая на одно среднее квадратичное отклонение (SD) ее среднюю нормальную величину (в нашей лаборатории более 18 мкЕД/мл), предполагает сохранение функционально активных бета-клеток, вероятность вторичной природы заболевания и возможность отмены инсулинотерапии при условии выявления и коррекции причины антагонизма инсулину. В подобных случаях рекомендуется вводить собакам инсулин с целью коррекции гипергликемии и уменьшения воздействия «стресса» на бета-клетки до тех пор, пока не будут устранены факторы, препятствующие нормальной секреции и действию инсулина. Теоретически токсическое действие глюкозы может сказываться на точности определения концентрации инсулина в сыворотках крови как собак, так и кошек с сахарным диабетом (см. стр. 594) (Nelson et al, 1998а). Однако наличие синдрома токсичности глюкозы при диабете у собак до сих пор окончательно не доказано, отчасти из-за того, что ко времени установления диагноза у большинства этих животных имеется истинная гипоинсулинемия.
ПАТОФИЗИОЛОГИЯ
Сахарный диабет является следствием относительной или абсолютной недостаточности секреции инсулина бета-клетками. Недостаток инсулина, в свою очередь, вызывает снижение утилизации глюкозы, аминокислот и жирных кислот в различных тканях, ускорение гликогенолиза и глюконеогенеза в печени, а также усиленное накопление глюкозы в кровяном русле, что служит причиной гипергликемии. Глюкоза, поступающая с пищей, также накапливается в крови. В конце концов, количество циркулирующей глюкозы увеличивается настолько, что превосходит способность клеток почечных канальцев полностью выводить ее из клубочкового ультрафильтрата; в результате развивается гликозурия. У собак это обычно происходит после того, как концентрация глюкозы в крови превысит
САХАРНЫЙ ДИАБЕТ У СОБАК • 533
180-220 мг/100 мл. У кошек пороговая величина всасывания глюкозы подвержена более значительным колебаниям и составляет от 200 до 280 мг/100 мл. Гликозурия является причиной осмотического диуреза и сопровождается полиурией. Обезвоживание организма предотвращается благодаря компенсаторной полидипсии. Уменьшение периферической утилизации поступающей с пищей глюкозы приводит к потере веса, так как организм пытается компенсировать кажущееся «голодание».
Количество потребляемой пищи регулируется в процессе взаимодействия между «центром насыщения» в вентромедиальных ядрах гипоталамуса и «пищевым центром», локализованным в его латеральных отделах (Ganong, 1991). Пищевой центр индуцирует пищевое поведение. Он функционирует постоянно, однако после еды его активность временно подавляется центром насыщения. Количество глюкозы, поступающей в клетки центра насыщения, служит сигналом, который непосредственно влияет на чувство голода. Чем меньше это количество, тем острее чувство голода и наоборот (Ganong, 1991). Способность глюкозы проникать в клетки центра насыщения зависит от инсулина. При сахарном диабете в условиях относительной или абсолютной недостаточности инсулина глюкоза не поступает в эти клетки, поэтому центр насыщения теряет способность подавлять активность пищевого центра. Результатом является полифагия, которая развивается несмотря на гипергликемию.
Сахарный диабет характеризуется четырьмя классическими признаками: полиурией, полидипсией, полифагией и уменьшением веса тела. Тяжесть этой симптоматики прямо зависит от уровня гипергликемии. Обнаружив указанные расстройства, владелец животного обычно обращается за помощью в ветеринарную клинику. К сожалению, не вес хозяева собак и кошек замечают признаки заболевания, поэтому у нелеченых животных может, в конце концов, развиться диабетический кетоацидоз
(ДКА). Патофизиология ДКА подробно рассматривается в гл. 13.
ВСТРЕЧАЕМОСТЬ
У большинства собак сахарный диабет диагностируется в возрасте от 4 до 14 лет. Пик заболеваемости приходится на возраст от 7 до 10 лет. Ювенильная форма диабета встречается редко и чаще всего регистрируется у животных в возрасте до 1 года. Суки болеют диабетом примерно вдвое чаще, чем кобели. Наличие семейных случаев сахарного диабета у собак, а также результаты анализа родословных кеесхондов свидетельствуют о генетической предрасположенности к сахарному диабету у одних пород и отсутствии таковой у других (см. табл. 11-3; Guptill et al, 1999; Hess et al. 2000a). Показатели предрасположенности отчасти зависят от популярности той или иной породы. Так, например, эпидемиологические исследования продемонстрировали пониженный риск развития сахарного диабета у лабрадоров-ретриверов. тогда как материалы нашей клиники свидетельствуют о том, что данное заболевание чаще всего регистрируется у собак именно этой породы. Мы объясняем это ее высокой популярностью в обслуживаемом нами регионе.
АНАМНЕЗ
В анамнезе подавляющего большинства собак с сахарным диабетом имеются все классические симптомы этого заболевания: полидипсия, полиурия, полифагия и уменьшение веса тела. Однако полиурия и полидипсия возникают только после того, как гипергликемия приводит к гликозурии. Иногда владелец собаки обращается за ветеринарной помощью в связи с внезапно возникшей у животного слепотой, обусловленной развитием катаракты (рис. 11-3). Классические признаки сахарного диабета могут остаться незамеченными или хозяин собаки
Рис. 11-3. А Двусторонняя катаракта, вызвавшая слепоту у собаки с сахарным диабетом. Б. Зрелая катаракта с шовными линиями у колли с сахарным диабетом.
534 • САХАРНЫЙ ДИАБЕТ У СОБАК
может не считать их заслуживающими внимания. Если владелец животного не замечает клинических проявлений развивающегося диабета, а ухудшение зрения в связи с помутнением хрусталика отсутствует, возникает риск появления системных признаков заболевания, таких как прогрессирующая кетонемия и метаболический ацидоз (см. стр. 639). Промежуток времени между началом проявления ранних клинических признаков сахарного диабета и развитием ДКА непредсказуем и может составлять от нескольких дней до нескольких недель.
Сбор и анализ полного анамнеза имеют чрезвычайно важное значение даже у собак с «явным» диабетом, позволяя выявить и оценить сопутствующее заболевание, которое практически всегда имеется на момент установления диагноза сахарного диабета.
Клиницист должен неизменно задаваться вопросом: «Почему именно сейчас у собаки появились клинические признаки сахарного диабета?». У многих животных антагонизм действию инсулина, обусловленный такими сопутствующими заболеваниями и явлениями, как панкреатит, бактериальная инфекция, последний эструс, застойная сердечная недостаточность или гиперкортицизм, служит последним толчком, приводящим к развитию явного диабета. Выявление и лечение сопутствующих заболеваний необходимо для успешной терапии сахарного диабета у собак, а тщательный анализ анамнестических данных составляет первый этап процедуры их диагностики.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Первостепенное значение тщательного физикального исследования каждой собаки с подозрением на наличие сахарного диабета отчасти определяется высокой частотой сопутствующих заболеваний, которые влияют на успешность лечения основного расстройства. Результаты физикального исследования собак с впервые выявленным сахарным диабетом зависят от наличия или отсутствия ДКА и тяжести последнего, а также от продолжительности диабета с момента его возникновения до установления диагноза и от природы сопутствующего заболевания. Обследование собак с некетоновым диабетом не выявляет классических признаков этой патологии. Многие такие животные имеют избыточный вес, но во всех других отношениях их физическое состояние остается нормальным. Собаки с большой продолжительностью нелеченого диабета иногда теряют вес, однако это редко приводит к истощению, если только оно не вызывается сопутствующим расстройством (например, при недостаточности экзокринной функции поджелудочной железы). Возможно также появление сонливости, уменьшение густоты шерстяного покрова, сухость, ломкость и отсутствие блеска шерсти, шелушение кожи вследствие гиперкератоза. Индуцированный диабетом печеночный липидоз может стать причиной гепатомегалии. Другим нарушением, часто
выявляемым при физикальном исследовании собак с сахарным диабетом, является изменение свойств хрусталика в связи с развитием катаракты. У собак с ДКА возникают дополнительные расстройства (см. стр. 639).
УСТАНОВЛЕНИЕ ДИАГНОЗА САХАРНОГО ДИАБЕТА
Диагноз сахарный диабет ставится на основании соответствующей клинической симптоматики, т.е. полидипсии, полиурии, полифагии, уменьшения веса тела и устойчивых гипергликемии и гликозурии натощак. С целью быстрого подтверждения диагноза измеряют концентрацию глюкозы в плазме крови с помощью портативного глюкометра и определяют содержание сахара в моче, используя реактивные полоски (тест-полоски KetoDiastix; Ames Division, Miles Laboratories Inc., CHIA). Одновременное выявление кетонурии позволяет установить диагноз диабетический кетоз или кетоацидоз.
Для установления сахарного диабета важно подтвердить наличие гипергликемии и гликозурии, поскольку первая позволяет дифференцировать диабет и первичную почечную гликозурию, а вторая - диабет и другие причины гипергликемии (табл. 11-4). Индуцированная стрессом гипергликемия весьма часто встречается у кошек и изредка регистрируется у собак, особенно у гиперактивных особей, отличающихся повышенной возбудимостью и агрессивностью. Более подробные сведения о гипергликемии при стрессорных воздействиях приведены на стр. 620.
Слабая гипергликемия (т. е. концентрация глюкозы в плазме крови от 130 до 180 мг/100мл) не сопровождается клиническими проявлениями и обычно выявляется случайно и неожиданно. Если у собаки со слабой гипергликемией имеются также
ТАБЛИЦА 11-4. ПРИЧИНЫ
ГИПЕРГЛИКЕМИИ У СОБАК И КОШЕК
Сахарный диабет *
«Стресс» (у кошек) *
Кормление (пищевой рацион, содержащий моносахариды, дисахариды и пропиленгликоль)
Г иперкортицизм *
Акромегалия (у кошек)
Диэструс (у собак)
Феохромоцитома (у собак)
Панкреатит
Опухоль экзокринной поджелудочной железы Недостаточность почечной функции Медикаментозная терапия * Глюкокортикоиды Прогестагены Мегестрол ацетат Тиазидные диуретики
Жидкости, содержащие декстрозу *
Парентеральное кормление *
Травма головы_________________________________
* Частая причина
САХАРНЫЙ ДИАБЕТ У СОБАК • 535
полиурия и полидипсия, следует ее обследовать с целью выявления других расстройств, помимо клинически выраженного диабета, в первую очередь, гиперкортицизма. Слабая гипергликемия бывает у некоторых собак на протяжении 2 часов после потребления мягкого, влажного корма (Holste et al, 1989), в состоянии «стресса», на ранних стадиях сахарного диабета и при наличии расстройств, вызывающих инсулинорезистентность (см. стр. 571). Диагностика последних необходима в тех случаях, когда слабая гипергликемия сохраняется у собак натощак в отсутствие стрессорных воздействий. Этим животным не следует назначать инсулино-терапию, поскольку у них отсутствует клинически выраженный сахарный диабет.
КЛИНИКО-ПАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ
Общая характеристика диагностического обследования. В случае установления сахарного диабета рекомендуется тщательная оценка общего состояния здоровья собаки. Его цель состоит в выявлении любого заболевания, которое могло вызвать нарушение толерантности к углеводам или способствовать ее возникновению (например, гиперкортицизм), либо быть следствием нарушенной толерантности к углеводам (бактериальный цистит), либо указывает на необходимость изменения терапии (панкреатит). Минимальный объем лабораторных исследований любой «здоровой» собаки с некетоновым диабетом должен включать ОАК, биохимический анализ крови и анализ мочи, включая культивирование ее бактериальной флоры. В случае выявления сахарного диабета у интактных сук определяют концентрацию прогестерона в сыворотке независимо от характера эстральных циклов. По возможности проводят УЗИ брюшной полости с целью выявления панкреатита, адреномегалии и пиометры у интактных сук, а также патологических изменений в печени и мочевых путях (т.е. нарушений, характерных для пиелонефрита или цистита). Поскольку у собак с сахарным диабетом относительно часто одновременно бывает и панкреатит, то при невозможности проведения УЗИ желательно измерить уровень липазы или трипсиноподобной иммунореактивности (ТПР) в сыворотке крови. Базальную и стимулируемую концентрацию инсулина в сыворотке крови обычно не определяют. После анализа анамнестических данных и результатов физикального исследования, а также в случаях выявления кетоацидоза может понадобиться дополнительное тестирование. Лабораторные исследования собак с гликозурией и кетонурией обсуждаются в гл. 13. Потенциальные клинико-патологические нарушения перечислены в табл. 11-5.
Общий клинический анализ крови. У животных с неосложненным сахарным диабетом результаты ОАК обычно остаются в норме. В случаях дегидратации у собак возможна слабая полицитемия. Увеличение количества лейкоцитов может быть
ТАБЛИЦА 11-5. КЛИНИКОПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ, ОБЫЧНЫЕ У СОБАК И КОШЕК С НЕОСЛОЖНЕННЫМ САХАРНЫМ ДИАБЕТОМ
Общий клинический анализ крови:
Обычно нормальный
Нейтрофильный лейкоцитоз и токсические нейтрофилы при наличии панкреатита или инфекции
Биохимический анализ сыворотки:
Гипергликемия
Г перхолестеринемия
Гипертриглицеридемия (липемия)
Повышенная активность аланинаминотрансферазы
(обычно < 500 МЕ/л)
Повышенная активность щелочной фосфатазы
(обычно < 500 МЕ/л)
Анализ мочи:
Удельный вес мочи обычно >1,025
Гликозурия
Кетонурия разной тяжести
Протеинурия Бактериурия
Дополнительные анализы:
Гиперлипаземия при наличии панкреатита Гиперамилаземия при наличии панкреатита Трипсиноподобная иммунореактивность в сыворотке крови обычно в норме
Низкая при недостаточности экзокринной функции поджелудочной железы
Высокая при остром панкреатите
Нормальная или повышается при хроническом панкреатите
Вариабельная базальная концентрация инсулина в сыворотке крови
ИЗСД: низкая или нормальная
ИНЗСД: низкая, нормальная или повышенная
Индуцированная инсулинорезистентность: слабая, нор-мальная или тяжелая____________________________
ИЗСД - инсулинозависимый сахарный диабет, ИНЗСД - инсулинонезависимый сахарный диабет
следствием сопутствующего инфекционного процесса или тяжелого воспалительного заболевания, особенно при наличии панкреатита. Обнаружение токсичных или дегенеративных нейтрофилов либо значительное увеличение относительного числа незрелых нейтрофилов подтверждает роль инфекционного процесса в качестве причины лейкоцитоза.
Биохимический профиль сыворотки крови. Частота и тяжесть выраженных изменений биохимического профиля сыворотки крови зависят от продолжительности нелеченого диабета и сопутствующих заболеваний, помимо гипергликемии и гиперхолестеринемии. Самым распространенным нарушением является усиление активности ала-нинтрансаминазы и щелочной фосфатазы (ЩФ) в плазме крови, а также гиперхолестеринемия. Активность печеночных ферментов обычно повышается незначительно (менее 500 МЕ/л); это увеличение является следствием липидоза печени. В случае
536
САХАРНЫЙ ДИАБЕТ У СОБАК
повышения активности ЩФ сыворотки выше 500 МЕ/л возникает подозрение на сопутствующий гиперкортицизм, особенно если другие лабораторные исследования также выявляют изменения, связанные с гиперкортицизмом (см. гл.6). Активность аланинаминотрансферазы выше 500 ME /л может свидетельствовать об иных, помимо гепатического липидоза, формах гепатопатии, особенно когда имеются другие отклонения эндогенной функции печени (например, пониженное содержание азота мочевины, гипоальбуминемия, повышенная концентрация желчных кислот в сыворотке и т.д.). Увеличение концентрации общего билирубина в сыворотке крови может указывать на нарушение проходимости внепеченочных желчных протоков, вызванное сопутствующим панкреатитом. В случае необходимости для выявления заболевания печени проводят УЗИ брюшной полости и гистологическое исследование биоптатов печеночной ткани.
Концентрации AM и креатинина в сыворотке при неосложненном диабете обычно остаются в норме. Их увеличение может быть следствием либо первичной недостаточности функции почек, либо преренальной уремии, вызванной обезвоживанием. Первичная почечная недостаточность развивается в результате гломерулосклероза - специфического поражения, которое у людей широко распространено как осложнение, обусловленное гипергликемией, но у собак встречается нечасто (см. раздел «Диабетическая нефропатия», стр [532]). Определение удельного веса мочи помогает дифференцировать первичную почечную недостаточность от преренальной уремии.
У животных с ДКА весьма обычны изменения концентрации электролитов в сыворотке и показателей кислотно-щелочного баланса. Они рассматриваются в разделе, посвященном терапии тяжелого кетоацидозного диабета (см. стр. 653).
Анализ мочи. К числу характерных для сахарного диабета аномальных явлений, выявляемых при анализе мочи, относятся гликозурия, кетону-рия, протеинурия и бактериурия на фоне сопутствующих пиурии и гематурии или без них. У собак с неосложненным диабетом обычно имеется гликозурия, но кетонурия отсутствует. В то же время следовые или небольшие количества кетонов могут присутствовать в моче относительно здоровых собак. При высоком содержании кетонов в моче у собак с системными признаками заболевания, такими как сонливость, рвота, диарея или дегидратация, ставится диагноз ДКА и назначается соответствующее лечение.
Наличие гликозурии и ее тяжесть необходимо принимать во внимание при интерпретации результатов определения удельного веса мочи. Несмотря на полиурию и полидипсию, удельный вес мочи у собак с нелеченым сахарным диабетом обычно колеблется от 1,025 до 1,035, что отчасти объясняется присутствием в ней большого количества глюкозы. Эмпирически установлено, что гликозурия порядка
2%, или 4+, выявляемая с помощью соответствующих тест-полосок, приводит к завышению результатов рефракометрического определения удельного веса мочи на 0,008-0,010. В связи с этим, когда ее удельный вес не превышает 1,020, а гликозурия составляет 2%, можно говорить о сопутствующих полиурии и полидипсии, которые, скорее всего, являются следствием гиперкортицизма или почечной недостаточности.
Протеинурия может быть следствием инфекции мочевого тракта или поражения почечных клубочков в результате разрыва базальной мембраны (Struble et al, 1998). В связи с высокой частотой инфекционных заболеваний необходимо тщательное исследование мочевого осадка с целью выявления нарушений, характерных для той или иной инфекции, в том числе изменений содержания лейкоцитов и эритроцитов, а также уровня бактериурии. Отсутствие гноя в моче не исключает инфекции мочевых путей (McGuire et al, 2002). Поскольку сахарный диабет у собак довольно часто сопровождается инфекциями мочевого тракта, во всех случаях впервые диагностированного заболевания (независимо от результатов рутинного анализа) пробы мочи, полученные посредством надлобковой пункции мочевого пузыря в асептических условиях, высевают и тестируют чувствительность бактериальной флоры (Hess et al, 2000b).
Концентрация холестерина и триглицеридов в сыворотке крови. Гиперлипидемия и явная липемия являются весьма частыми расстройствами при нелеченом сахарном диабете. Некомпенсированный диабет сопровождается повышением концентрации триглицеридов, холестерина, липопротеинов, хиломикронов и свободных жирных кислот в крови (DeBowes, 1987). Гипертриглицеридемия служит причиной липемии, которая выявляется при анализе проб периферической крови. Гипертриглицеридемия с увеличением концентрации хиломикронов и триглицеридов во фракции липопротеинов очень низкой плотности (ЛОНП) является результатом недостаточности инсулина и связанным с этим снижением активности липопротеиновой липазы (Eckel, 1989). Фермент липопротеинлипаза катализирует обмен обогащенных триглицеридами ЛОНП и хиломикронов. Причинами повышения концентрации триглицеридов ЛОНП являются также их избыточная продукция в печени (вызванная высокой концентрацией свободных жирных кислот в крови), ожирение и высококалорийный рацион (Massillon et al, 1997; Unger, Foster, 1998).
Концентрация холестерина в крови при сахарном диабете повышена, но в меньшей степени, чем концентрация триглицеридов. У людей увеличение концентрации холестерина липопротеинов низкой плотности (ЛНП) происходит в силу различных причин, включая усиление биосинтеза ЛНП из ЛОНП, недостаточную активность рецепторов ЛНП, уменьшение скорости клиренса ЛНП и избыточное потребление насыщенных жирных кислот
САХАРНЫЙ ДИАБЕТ У СОБАК
537
с пищей (Howard et al,1987; Unger, Foster, 1998). В то же время концентрация холестерина липопротеинов высокой плотности (ЛВП) у людей обычно снижена, по-видимому, вследствие высокой скорости их распада (Witzum et al, 1982). Сочетание высокой концентрации холестерина ЛНП и низкой концентрации холестерина ЛВП может способствовать ускоренному развитию атеросклеротического заболевания сосудов и ишемической болезни сердца, которые являются отдаленными осложнениями сахарного диабета у человека (Garg, Grundy, 1990). Сходные сердечно-сосудистые осложнения иногда имеют место у собак и кошек с диабетом (Hess et al, 2002). К счастью, большинство расстройств липидного обмена поддается коррекции с помощью инъекций инсулина и диетотерапии.
Ферменты поджелудочной железы. У собак с впервые диагностированным сахарным диабетом проводят анализ крови с целью выявления возможного панкреатита, особенно в тех случаях, когда недоступно УЗИ брюшной полости. Чаще всего рекомендуется определение концентрации липазы и трипсиноподобной иммунореактивности (ТПИ) в сыворотке крови. Теоретически у собак с сопутствующим активным панкреатитом концентрации липазы и ТПИ должны быть выше нормы. К сожалению, эти показатели не всегда коррелируют с наличием или отсутствием панкреатита (Hess et al, 1998). Концентрация панкреатических ферментов может быть повышена у собак с гистологически нормальной поджелудочной железой и оставаться без изменения на фоне гистологически подтвержденного воспаления этой железы, особенно если воспалительный процесс носит хронический характер и не отличается большой тяжестью. По этой причине результаты определения липазы и ТПИ всегда следует интерпретировать с учетом материалов анамнеза, физикального исследования и результатов дополнительных лабораторных тестов. Как показывает наш опыт, УЗИ брюшной полости является единственным надежным диагностическим инструментом для выявления панкреатита у собак. Его рекомендуется проводить, когда данные анамнеза, физикального исследования и лабораторных анализов дают основание предполагать наличие панкреатита. Сопутствующий диабету панкреатит диктует необходимость проведения интенсивной инфузионной терапии и назначения легко усвояемой диеты с низким содержанием жиров, что не обязательно в иной ситуации. Выявление хронического панкреатита имеет также важное прогностическое значение, поскольку позволяет выбрать наиболее успешную тактику контроля гликемии и продления жизни животного (см. стр. 576).
Измерение ТПИ в сыворотке используется также для диагностики недостаточности экзокринной функции поджелудочной железы, которая иногда развивается при сахарном диабете как следствие хронического панкреатита (Wiberg et al, 1999; Wiberg, Westermarck, 2002). Подозрение на недо
статочность экзокринной функции поджелудочной железы у собак возникает в тех случаях, когда сахарный диабет с трудом поддается компенсации с помощью инсулинотерапии, а животное теряет вес вплоть до истощения, несмотря на полифагию (см. стр. 576).
Концентрация тироксина в сыворотке крови. Иногда ветеринару приходится периодически оценивать концентрацию тироксина (Т4) в сыворотке крови у собаки с сахарным диабетом, либо потому что такие определения являются частью рутинного исследования биохимического профиля крови, либо в случае подозрения на наличие гипотиреоза после анализа анамнестических данных, клинической симпотоматики и результатов физикального исследования. Интерпретировать результаты определения Т4 нужно осторожно, особенно у собак с впервые выявленным сахарным диабетом и сопутствующим заболеванием, например, панкреатитом или инфекцией. В отсутствие сопутствующего расстройства концентрация Т4 при сахарном диабете обычно остается нормальной. Однако чем сильнее тяжесть диабета и сопутствующего заболевания, тем больше вероятность снижения уровня Т причем не столько из-за гипотиреоза, сколько вследствие синдрома эутиреоидной патологии (см. рис. 3-25, стр. 131). У собак с впервые выявленным сахарным диабетом и низкой концентрацией Т4 в сыворотке крови мы, как правило, прежде всего лечим основное заболевание, а после достижения адекватного контроля гликемии проводим повторные определения уровня Т . В случаях обоснованного подозрения на наличие гипотиреоза при установлении диагноза сахарного диабета мы определяем концентрацию свободного Т4 и тиреотропина (ТТГ) в сыворотке до назначения терапии левотироксином натрия. Влияние сопутствующего заболевания и медикаментозной терапии на концентрацию тиреоидных гормонов в крови, а также диагностические тесты для выявления гипотиреоза у собак более подробно рассматриваются в гл. 3.
Концентрация инсулина в сыворотке крови. Измерение концентрации инсулина в крови в базальных условиях или после стимуляции не является частью рутинной оценки клинического состояния собак с впервые выявленным сахарным диабетом (см. табл. 12-1, стр. 596). Теоретически обнаружение повышенной концентрации эндогенного инсулина (более 18 мкЕД/мл) в сыворотках крови собак с впервые диагностированным сахарным диабетом предполагает наличие вторичного диабета на ранних стадиях его развития, особенно если одновременно имеется (и лечится) сопутствующее заболевание, антагонистичное инсулину (см. стр. 594). К сожалению, точная интерпретация результатов определения инсулина затрудняется вследствие ингибирующего действия гипергликемии (т.е. токсичности глюкозы) на функцию бета-клеток (Nelson et al, 1998а). Повышенная концентрация инсулина свидетельствует о сохранении функционально ак-
538 • САХАРНЫЙ ДИАБЕТ У СОБАК
ТАБЛИЦА 11-6. РАЗЛИЧИЯ В ПОСЛЕДОВАТЕЛЬНОСТИ АМИНОКИСЛОТНЫХ ОСТАТКОВ В МОЛЕКУЛАХ ИНСУЛИНА СОБАКИ И КОШКИ В СОПОСТАВЛЕНИИ С ИНСУЛИНАМИ В КОММЕРЧЕСКИХ ПРЕПАРАТАХ
Сравнение с инсулином собаки Сравнение с инсулином КОШКИ
Вид Положение аминокислотного остатка А8 А10 А18 ВЗО Вид Положение аминокислотного остатка А8 А10 А18 ВЗО
Собака Thr Не Asn Ala Кошка Ala Vai His Ala
Свинья Thr Не Asn Ala Крупный рогатый скот Ala Vai Asn Ala
Человек Thr Не Asn Thr Свинья Thr He Asn Ala
Крупный рогатый скот A la Vai Asn Ala Человек Thr lie Asn Thr
Отличающиеся аминокислотные остатки в инсулинах собак и кошек по сравнению с коммерческими препаратами инсулина выделены курсивом.
тивных бета-клеток, хотя их существование не исключается и при низком уровне инсулина в крови (менее 12 мкЕД/мл). Такая ситуация нередко имеет место у больных диабетом кошек (см. стр. 594). Вместе с тем, рутинное определение концентрации инсулина в сыворотке крови в диагностических целях не оправдано с точки зрения необходимых затрат, поскольку у подавляющего большинства собак с впервые выявленным сахарным диабетом имеет место ИЗСД, а концентрация инсулина обычно не превышает половины нормальной величины или ниже определяемого уровня. Исключение составляют животные на ранних стадиях вторичного диабета, большинство которых суки, находящиеся в фазе диэструса.
Важно предварительно оценить достоверность используемого метода радиоиммунологическо-го определения инсулина (РИА) для данного вида животных и установить диапазон нормальных значений. Коммерческие эндокринологические лаборатории применяют РИА, предназначенные для определения инсулина у человека. К счастью, инсулины собаки и человека имеют почти идентичную аминокислотную последовательность (табл. 11-6). Поэтому РИА, разработанные для определения инсулина у человека, дают хорошие результаты и при определении инсулина у собак. Это, однако, не относится к кошкам.
ЛЕЧЕНИЕ НЕКЕТОНОВОГО САХАРНОГО ДИАБЕТА
Задачи терапии. Главной целью терапии является устранение замеченных владельцем животного клинических нарушений, обусловленных гипергликемией и гликозурией. Устойчивость клинической симптоматики и развитие хронических осложнений (табл. 11-7) положительно коррелируют с тяжестью и продолжительностью гипергликемии. Уменьшение колебаний концентрации глюкозы в крови и поддержание близкого к нормальному уровня гликемии позволяет максимально ослабить тяжесть клинических проявлений сахарного диабета и предотвратить развитие его осложнений, вызванное неудовлетворительной компенсацией.
У собак с диабетом указанная цель достигается посредством адекватной инсулинотерапии, диетотерапии и дозированных физических нагрузок, а также профилактикой или лечением сопутствующих воспалительных и инфекционных заболеваний, неопластического процесса или гормональных расстройств.
Наряду с попытками нормализовать концентрацию глюкозы в плазме крови ветеринарный врач обязан принимать меры, исключающие развитие гипогликемии, которая является тяжелым осложнением инсулинотерапии с потенциально фатальным исходом. Гипогликемия чаще всего развивается при введении животным избыточных количеств инсулина. Следует найти оптимальную тактику агрессивной инсулинотерапии, обеспечивающую максимально эффективный контроль концентрации глюкозы в крови при минимальном риске возникновения гипогликемии.
Инсулинотерапия
Препараты инсулина. Коммерческие препараты инсулина отличаются по быстроте, продолжительности и интенсивности действия после подкожного введения (табл. 11-8). К числу наиболее
ТАБЛИЦА 11-7. ОСЛОЖНЕНИЯ САХАРНОГО
ДИАБЕТА У СОБАК И КОШЕК
Обычные
Редкие
Ятрогенная гипогликемия
Устойчивые полиурия, полидипсия и потеря веса тела
Катаракта (у собак)
Бактериальные инфекции, особенно инфекции мочевых путей
Панкреатит
Кетоацидоз
Липидоз печени
Периферическая нейропатия (у кошек)
Периферическая нейропатия (у собак)
Гломерулонефропатия, гломерулосклероз
Ретинопатия
Недостаточность экзокринной функции поджелудочной железы
Парез желудка
Диабетическая диарея
Диабетическая дермопатия, т.е. поверхностный некро-литический дерматит (у собак)
САХАРНЫЙ ДИАБЕТ У СОБАК
539
ТАБЛИЦА 11-8. СВОЙСТВА ПРЕПАРАТОВ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНСУЛИНА, ВВОДИМЫХ СОБАКАМ И КОШКАМ С САХАРНЫМ ДИАБЕТОМ*, И КОМБИНИРОВАННЫХ ПРЕПАРАТОВ ПЦИ КРУПНОГО РОГАТОГО СКОТА И СВИНЬИ, ВВОДИМЫХ КОШКАМ С ДИАБЕТОМ
Тип инсулина Способ введения Начало действия Время максимальной эффективности (часы) Продолжительность действия (часы)
Собаки Кошки Собаки Кошки
Обычный кристалли- в/в Немедленно 0,5-2 0,5-2 1-4 1-4
ческий инсулин в/м Через 10-30 мин 1-4 1-4 3-8 3-8
п/к Через 10-30 мин 1-5 1-5 4-10 4-10
НПХ (изофан) * п/к Через 0,5-2 часа 2-10 2-8 6-18 4-12
Ленте ** п/к Через 0,5-2 часа 2-10 2-10 8-20 6-18
Ультраленте п/к Через 0,5-8 часов 4-16 4-16 8-24 6-24
ПЦИ *** п/к Через 0,5-4 часа - 4-14 - 6-20
* Такими же свойствами обладает очищенный свиной инсулин; активность комбинированных препаратов инсулина свиньи и крупного рогатого скота ниже, а продолжительность действия может быть больше, чем у рекомбининтного человеческого инсулина.
** Препарат выбора для начала лечения сахарного диабета у собак.
*** Препарат выбора для начала лечения сахарного диабета у кошек.
в/в - внутривенно, в/м - внутримышечно, п/к - подкожно
часто используемых инсулинов длительного действия относятся изофан (НПХ), ленте, ультраленте и протамин-цинк-инсулины (ПЦИ). НПХ и ПЦИ содержат белок рыб протамин и цинк, которые замедляют всасывание инсулина и, таким образом, увеличивают продолжительность его действия (Davidson et al, 1991). Инсулины семейства ленте отличаются содержанием цинка и размером кристаллов цинк-инсулина, что позволяет регулировать скорость их абсорбции из мест подкожного введения. Чем крупнее кристаллы, тем ниже скорость абсорбции и дольше продолжительность действия. В составе инсулиновых препаратов этой группы посторонних белков, таких как протамин, нет. Инсулин ультраленте представляет собой микрокристаллический препарат длительного действия, а инсулин ленте - это смесь, состоящая из трех частей аморфного инсулина короткого действия и семи частей длительно действующего микрокристаллического инсулина. Инсулин ленте считается препаратом со средней продолжительностью действия, хотя у некоторых собак его повышенная концентрация в плазме крови после подкожной инъекции может сохраняться на протяжении более 14 часов (Graham et al, 1997).
Комбинированные препараты инсулина. Для имитации естественного повышения концентрации инсулина в портальной крови во время и сразу после еды были предложены смеси инсулинов короткого и пролонгированного действия, позволяющие свести к минимуму гипергликемию, индуцируемую приемом пищи. НПХ инсулин можно смешивать с обычным кристаллическим инсулином, быстродействие которого сохраняется при условии, если он вводится сразу после приготовления смеси. Имеются стабильные смеси, содержащие 70% НПХ и 30% обычного инсулина либо 50% НПХ и 50% обычного инсулина (например, хумилин 70/30 производства Eli Lilly and Со., США или микстард НМ 70/30 производства Nordisk-USA, США). Име-
500-?
400-
300 -
200-
100-
0 | | грл--.-., t
08.00 Полдень 16.00 20.00
f
Рис. 11-4. А. Гликемическая кривая карликового пуделя, получавшего рекомбинантный человеческий инсулин ленте в дозе 6 ЕД/кг веса тела (•) и рекомбинантный человеческий 70/30 НПХ/кристаллический инсулин в дозе 3 ЕД/кг веса тела подкожно (•) Б. Гликемическая кривая кошки весом 8 кг, получавшей рекомбинантный человеческий инсулин ультраленте (•) в дозе 4 ЕД, и рекомбинантный человеческий 70/30 НПХ/кристаллический инсулин в дозе 4 ЕД/кг веса тела подкожно (•). Стрелка указывает время инъекции инсулина и кормления животного ( Из: Nelson RW: Diabetes mellitus. Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine 4th ed. Philadelphia, WB Saunders Co, 1995, p 1528 ).
540 • САХАРНЫЙ ДИАБЕТ У СОБАК
ющийся у нас опыт свидетельствует о достаточно высокой активности этих смесей, подкожное введение которых сопровождается быстрым (в течение 60-90 минут) снижением концентрации глюкозы в крови (рис. 11-4). В то же время продолжительность их действия невелика (менее 8 часов). Мы обычно используем смеси препаратов инсулина в крайних случаях, когда более традиционные препараты не обеспечивают достаточно эффективного контроля гликемии. Как сказано, быстрое действие обычного инсулина сохраняется при введении в смеси с НПХ инсулином, но утрачивается в случае смешивания с инсулином ленте, поскольку обычный инсулин связывается избыточным количеством цинка, присутствующим в последнем препарате (Galloway, 1988).
Аналоги инсулина. В последнее время получило распространение использование рекомбинантных ДНК для получения аналогов человеческого инсулина с пониженной или повышенной скоростью всасывания. Аналоги инсулина быстрого действия включают лиспро-инсулин (хумалог, производства Eli Lilly and Со, США и аспарт-инсулин производства Nordisk-USA, США). Скорость абсорбции человеческого инсулина лимитируется из-за образования гексамеров инсулиновых молекул, которое происходит при высокой концентрации инсулина в жидкостях для инъекций (Brange et al, 1988). Поступление инсулина в кровяное русло из места его введения возможно только после диссоциации гексамеров, которая протекает достаточно медленно. Замена определенных аминокислотных остатков в молекуле инсулина позволяет снизить тенденцию инсулина к самоассоциации, не нарушая кинетику его взаимодействия со специфическими рецепторами. Лиспро-инсулин получают модификацией природной аминокислотной последовательности В-цепи путем перестановки пролина и лизина в положениях соответственно 28 и 29, а аспарт-инсулин - посредством замены пролина в положении 28 В-цепи на аспарагиновую кислоту (Maarten et al, 1997; Lindholm et al, 2002). В результате этих модификаций лиспро- и аспарт-инсулины ведут себя в растворах как мономеры и характеризуются быстрым всасыванием, ускоренным фармакодинамическим действием и меньшей его продолжительностью по сравнению с обычным кристаллическим инсулином короткого действия (Howey et al, 1994; Home et al, 1997; Lindholm et al, 1999 ). В настоящее время лиспро-инсулин и аспарт-инсулин являются препаратами выбора для введения перед приемом пищи с целью контроля концентрации глюкозы в крови после еды у больных сахарным диабетом. Обычно эти инсулины вводят трижды в день перед каждым основным приемом пищи (завтрак, обед и ужин). Возможность применения этих препаратов для лечения сахарного диабета у собак, если таковая и существует, требует дополнительного исследования. Из-за чрезвычайно короткой продолжительности действия лиспро- и аспарт-инсулинов их, вероятно, придется вводить в сочетании с инсулинами дли
тельного действия, чтобы обеспечить адекватный контроль гликемии.
Гларгин-инсулин (лантус, производства Aventis Pharmaceuticals, США) представляет собой аналог с большой продолжительностью действия, который отличается от человеческого инсулина замещением аспарагиновой кислоты на глицин в положении 21 A-цепи и введением двух дополнительных аргининовых остатков в С-концевую последовательность В-цепи (Pieber et al, 2000). Следствием этих модификаций явился сдвиг изоэлектрической точки с 5,4 в сторону нейтрального pH, что привело к повышению растворимости аналога в слабокислой среде по сравнению с нативным человеческим инсулином и уменьшению его растворимости при физиологическом значении pH. В результате гларгин-инсулин образует микропреципитаты в подкожных тканях в местах инъекций, из которых он медленно высвобождается в небольших количествах. У человека постепенное, но устойчивое высвобождение гларгина из микропреципитатов обеспечивает относительно стабильную во времени концентрацию инсулина в сыворотке на протяжении 24 часов в отсутствие выраженных пиков в ее суточном профиле. Способность гларгина снижать уровень глюкозы сходна с таковой у человеческого инсулина; действие этого препарата после подкожной инъекции начинается медленнее, чем у НПХ инсулина, и продолжается дольше (Owens et al, 2000). В настоящее время рекомендуется использовать гларгин в качестве базального инсулина (т.е. инсулина с устойчивым длительным действием для подавления образования глюкозы в печени), который вводится один раз в день перед отходом ко сну. Его вводят больным сахарным диабетом в сочетании с быстродействующими аналогами инсулина или с пероральными сахаропонижающими препаратами (Rosenstock et al, 2000; Rosenstock et al, 2001).
В предварительном исследовании фармакокинетики и фармакодинамики гларгин-инсулина, ПЦИ и свиного ленте-инсулина у девяти здоровых кошек оценивались следующие показатели: начало действия препарата, минимальная концентрация глюкозы в крови, время повышения концентрации глюкозы до первоначального уровня, среднесуточная концентрация глюкозы в плазме крови и площадь под суточной гликемической кривой. После введения гларгин-инсулина и ПЦИ большинство определявшихся параметров существенно не различались (Marshall, Rand, 2002). Аналогичных исследований на кошках, страдающих сахарным диабетом, не проводили. Как показывают наши наблюдения, у большинства собак и кошек с диабетом, которым вводили гларгин-инсулин, его действие сохранялось на протяжении 10—16 часов. Мы до сих пор не сталкивались со случаями неадекватной абсорбции этого препарата, как это описано для инсулина ультраленте (см. стр. [571]), хотя нельзя исключить, что эта проблема возникнет по мере все более широкого применения гларгина. В настоящее время
САХАРНЫЙ ДИАБЕТ У СОБАК • 541
мы назначаем гларгин-инсулин собакам и кошкам с диабетом, у которых не удается добиться его компенсации с помощью инсулина НПХ короткого действия или инсулина ленте, и кошкам, у которых ПЦИ не дает желаемого эффекта (см. стр. 567 и 624). Исходя из нашего текущего опыта, мы не рассматриваем гларгин-инсулин в качестве препарата выбора для лечения сахарного диабета у собак и кошек.
Инсулины разных видов животных и человека. Для введения больному клиницист выбирает конкретный препарат, относящийся к тому или иному типу инсулина (НПХ, ленте, ультраленте). Со времени внедрения инсулинотерапии в клиническую практику использовались комбинированные препараты инсулинов свиньи и крупного рогатого скота (например, илетин 1 производства Eli Lilly and Со, США), очищенные инсулины из тех же источников (илетин II производства Eli Lilly and Со, США) и рекомбинантные человеческие инсулины (в частности, хумилин производства Eli Lilly and Со, США). В комбинированных препаратах инсулинов свиньи и крупного рогатого скота на долю последнего приходится примерно 90% общего содержания гормона. В настоящее время более 95% больных диабетом, нуждающихся в инсулинотерапии, получают препараты рекомбинантного человеческого инсулина, а большинство остальных - очищенный свиной инсулин. Коммерческое производство комбинированных препаратов инсулинов свиней и крупного рогатого скота, а также очищенного инсулина крупного рогатого скота в Соединенных Штатах значительно сократилось. Наличие на рынке тех или иных видов препаратов инсулина определяется, в первую очередь, повышенным спросом на человеческий инсулин, поэтому именно этот препарат используется для лечения диабета почти у всех собак и у большинства кошек. К счастью, хроническое введение больным собакам рекомбинантного человеческого и очищенного свиного инсулинов редко вызывает образование антиинсулиновых антител (см. стр. 568) (Feldman et al, 1983; Harb-Hauser et al, 1998). В отличие от этих препаратов инсулин крупного рогатого скота обладает антигенной активностью и вызывает образование антител у 40-65% собак с сахарным диабетом (Feldman et al, 1983; Harb-Hauser et al, 1998; Davison et al, 2003).
Вероятность формирования антиинсулиновых антител определятся различием пространственной структуры и аминокислотных последовательностей вводимого и эндогенного инсулинов. Аминокислотные последовательности инсулинов человека, крупного рогатого скота и собаки несколько различаются (см. табл. 11-6) (Halden et al, 1986; Ganong, 1991), однако конформация эпитопов инсулина имеет большее значение, чем линейная последовательность аминокислотных остатков. Антитела к инсулину, индуцируемые у человека введением экзогенного гормона, дают перекрестную реакцию с гомологичным инсулином и связываются только
с инсулиновыми молекулами, сохраняющими интактную конформацию (Thomas et al, 1985; Thomas et al, 1988; Nell, Thomas, 1989). В одном из недавних исследований, проводившихся для изучения образования антиинсулиновых антител у собак с сахарным диабетом в ответ на введение инсулина крупного рогатого скота, антитела взаимодействовали, в основном, с цельной молекулой инсулина, а не с отдельными А и В-цепями (Davison et al, 2003). Наблюдалась также перекрестная реакция с гомологичным инсулином. Как ни странно, В-цепь оказалась более реактивным компонентом молекулы инсулина, чем A-цепь. Причина разной антигенной активности обеих цепей неизвестна, тем более что инсулины собаки и крупного рогатого скота отличаются по аминокислотной последовательности именно А-цепи.
Антитела к инсулину могут влиять на фармакокинетику введенного экзогенного инсулина посредством нескольких механизмов, которые либо усиливают, либо ослабляют фармакодинамическую реакцию. Так, эти антитела могут усиливать и пролонгировать фармакодинамический эффект гормона, выполняя функцию его носителей, или уменьшать действие инсулина в результате нейтрализации гормона (Bolli et al, 1984; Marshall et al, 1988; Lahtela et al, 1997). В то же время антитела не всегда влияют на зависимость эффекта инсулина от дозы и на контроль гликемии (Lindholm et al, 2002). Наш опыт показывает, что образование антиинсулиновых антител у собак с сахарным диабетом может иметь как положительные последствия, увеличивая продолжительность действия инсулина, так и отрицательные, снижая способность гормона поддерживать желаемый уровень гликемии. В экстремальных случаях образование антител становится причиной тяжелой инсулинорезистентности (см. стр. 568). Сокращение времени действия чаще отмечается при использовании рекомбинантного человеческого инсулина, нежели препаратов, содержащих инсулин крупного рогатого скота, возможно, из-за отсутствия образования антиинсулиновых антител. Следует, однако, помнить, что отрицательное воздействие этих антител на эффективность контроля гликемии перевешивает потенциальные преимущества препаратов, содержащих инсулин крупного рогатого скота, обусловленные продлением действия гормона.
Недавно появились коммерческие комбинированные препараты ПЦИ свиньи и крупного рогатого скота для лечения сахарного диабета у кошек (см. стр. 601). Эти препараты не рекомендуются для рутинной терапии диабета у собак из опасения образования антител к инсулину крупного рогатого скота (см. выше). На рынках Канады и Европы имеется очищенный свиной инсулин ленте (канин-сулин производства Intervet, Канада) для введения собакам с сахарным диабетом, однако он еще не разрешен для применения в Соединенных Штатах Управлением по контролю за качеством пищевых
542 • САХАРНЫЙ ДИАБЕТ У СОБАК
продуктов, медикаментов и косметических средств США. Инсулины собаки и свиньи имеют идентичные аминокислотные последовательности (см. табл. 11-6) (Hallden et al, 1986; Ganong, 1991). Иммуногенность и продолжительность действия препаратов свиного инсулина сходны с таковыми рекомбинантного человеческого инсулина (Feldman et al, 1983; Harb-Hauser et al, 1998). Теоретически, очищенный свиной инсулин ленте и рекомбинантный человеческий инсулин ленте должны обладать одинаковой эффективностью.
Рекомендации по первоначальной инсулинотерапии. Инсулины со средней продолжительностью действия, такие как ленте или НПХ, являются препаратами выбора для контроля гликемии у собак с сахарным диабетом (см. табл. 11 -8). Во избежание снижения эффективности гормона вследствие образования специфических антител рекомендуется использовать препараты рекомбинантного человеческого инсулина (см. стр. 568). Инсулинотерапию начинают с введения препаратов ленте или НПХ на базе рекомбинантного человеческого инсулина в дозах примерно 0,25 ЕД/кг дважды в день. Одновременно начинают диетотерапию (см. ниже). Мы предпочитаем с самого начала производить двукратные в течение суток инъекции, поскольку более 90% больных собак требуется именно такой режим терапии указанными препаратами рекомбинантного человеческого инсулина (Hess, Ward, 2000). Кроме того, введение низких доз инсулина дважды в день с самого начала терапии облегчает достижение желаемого качества контроля концентрации глюкозы в крови и уменьшает риск развития гипогликемии или феномена Сомоги (см. стр. 565). Напротив, эффективная регуляция уровня гликемии затрудняется, а вероятность возникновения гипогликемии и эффекта Сомоги увеличивается, если собаку с плохо компенсированным диабетом переводят с однократной высокой дозы инсулина на двукратные в течение суток инъекции его произвольной дозы.
Диетотерапия
Диетотерапия играет важную роль в лечении сахарного диабета у собак. Подбор состава кормов и режима кормления проводится с целью снижения степени ожирения, обеспечения постоянного времени кормления и калорийности корма и сведения к минимуму увеличения концентрации глюкозы в крови после еды (табл. 11-9) (Nelson, Lewis, 1990). Наиболее существенными мерами, благоприятствующими улучшению контроля гликемии, являются снижение тяжести ожирения и увеличение содержания клетчатки в корме.
Пищевая клетчатка. Пищевой рацион с повышенным содержанием клетчатки (пищевых волокон) создает благоприятные возможности для лечения ожирения и улучшения контроля гликемии при сахарном диабете (Nelson et al, 1991; Nelson et al, 1998b). Предложено несколько объяснений замед-
ТАБЛИЦА 11-9. РЕКОМЕНДАЦИИ ПО ДИЕТОТЕРАПИИ САХАРНОГО ДИАБЕТА У СОБАК
1. Состав рациона
Повышенное содержание клетчатки (см. табл. 11-10)
Содержание легко усвояемых углеводов более 45% общей метаболизируемой энергии
Содержание жиров менее 30% метаболизируемой энергии
2. Консервированный и/или сухой измельченный корм, исключение продуктов, содержащих моносахариды, дисахариды и пропиленгликоль
3. Калорийность и ожирение
Среднее потребление калорий для старых собак: 40-60 ккал/кг
Коррекция суточного потребления калорий в зависимости от индивидуальных потребностей животного
Устранение ожирения посредством:
Усиления ежедневной физической нагрузки
Уменьшения потребления калорий
Перевод животного на низкокалорийный рацион с низким содержанием жиров и высоким - пищевых волокон, рекомендуемый при сахарном диабете, или на низкокалорийный рацион с низким содержанием жиров и высоким - пищевых волокон, предназначенный для снижения веса тела
4. Режим кормления
Поддержание постоянной калорийности корма
Соблюдение графика кормления животного
Кормление в период действия инсулина
Скармливание половины общего суточного количества калорий при каждой инъекции инсулина
Разрешение животным-«кусочникам» брать корм по же-ланию в дневное и ночное время
ления пищевыми волокнами всасывания глюкозы в кишечнике и соответствующего повышения эффективности контроля гликемии у собак с сахарным диабетом. К их числу относятся задержка опорожнения желудка, замедление всасывания компонентов пищи в кишечнике, по всей вероятности вследствие влияния на диффузию глюкозы в направлении его ворсинок, влияние клетчатки на высвобождение регуляторных гормонов желудочно-кишечного тракта в кровяное русло (Meyer et al, 1988; Anderson et al, 1991; Nuttal, 1993). Особенно большое значение имеет способность клетчатки формировать вязкие гели и тем самым замедлять конвекционный перенос глюкозы и воды на всасывающую поверхность кишечника (Nuttal, 1993). Более вязкие растворимые волокна, такие как клейковина или пектины, замедляют диффузию глюкозы в большей степени, чем менее вязкие (как лигнин или целлюлоза). В связи с этим их включение в пищевой рацион человека считается более целесообразным для улучшения контроля гликемии (Anderson, Akanji, 1991; Nuttal, 1993). Однако, по мнению других авторов, для этой цели одинаково пригодны пищевые волокна обоих типов (Villaume et al, 1984; Vaaler, 1986). Исследования на собаках с сахарным диабетом выявили уменьшение уровня гипергликемии при включении в их корма повышенного количества растворимых и нерастворимых пищевых волокон (рис. 11-5) (Nelson et al, 1991, 1998b; Graham et al,
САХАРНЫЙ ДИАБЕТ У СОБАК • 543
1994). Большинство коммерческих продуктов для собак с высоким содержанием клетчатки включают преимущественно нерастворимые пищевые волокна, хотя сейчас появляются рационы, содержащие смесь растворимых и нерастворимых волокон (табл. 11-10). Количество клетчатки в разных коммерческих продуктах может составлять от 3 до 25% сухого вещества (нормальный рацион содержит менее 2% пищевых волокон в пересчете на сухой вес). В целом, контролю уровня гликемии у собак с сахарным диабетом наиболее способствует использование кормов, содержащих 12% и более нерастворимых пищевых волокон или 8% и более смеси растворимых и нерастворимых волокон.
Выбор типа клетчатки для больной собаки (в случае необходимости) диктуется чувствительностью животного к возможным осложнениям диетотерапии, весом тела, клиническим состоянием и природой сопутствующего заболевания (например, панкреатита или почечной недостаточности), в лечении которых важная роль принадлежит составу рациона и режиму питания. Наиболее частыми клиническими осложнениями диетотерапии с использованием больших количеств нерастворимых пищевых волокон являются увеличение частоты дефекации, запоры (в том числе стойкие), гипогликемия, начиная с 1-й или 2-й недели после повышения содержания клетчатки в пищевом рационе, и отказ животных от пищи (табл. 11 -11). К числу осложнений диетотерапии с использованием растворимых пищевых волокон относятся мягкий или водянистый стул, обильный метеоризм, гипогликемия спустя 1-2 недели после включения волокон в корм и отказ от пищи. В случае твердого стула и запоров при содержании в корме большого количества нерастворимой клетчатки, его заменяют на рацион, включающий смесь
ТАБЛИЦА 11-11. ЧАСТЫЕ ОСЛОЖНЕНИЯ ПРИ ДИЕТЕ С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ КЛЕТЧАТКИ
Уменьшение или отсутствие аппетита из-за невкусною или однообразного корма
Повышенная частота дефекации
Запоры, в том числе стойкие (вызываемые нерастворимыми волокнами)
Мягкий стул и понос (вызываемые растворимыми волокнами) Уменьшение веса тела
Гипогликемия
нерастворимых и растворимых волокон или только растворимые волокна (например, нс содержащий сахара метамуцил или консервированную тыкву). Этим достигается смягчение стула. Напротив, при мягком или водянистом стуле, а также метеоризме у собак, получающих большое количество растворимых пищевых волокон, их относительное содержание в корме уменьшают, добавляя нерастворимые волокна.
Собака может отказаться от корма, содержащего повышенное количество клетчатки, сразу или через нескольких месяцев после начала диетотерапии. В первом случае собаку следует постепенно переводить с обычного рациона на диету с невысоким содержанием волокон, увеличивая его по мере привыкания животного к новому составу корма. Отказ от пищи с высоким содержанием клетчатки в отдаленном периоде обычно вызван ее однообразием. Проблема устраняется чередованием разных типов кормов и использованием смесей волокнистых продуктов. Состав рациона с повышенным содержанием пищевых волокон всегда следует иметь в виду при дифференциальной диагностике причин снижения аппетита у собак с сахарным диабетом.
400
08 00 Полдень 16.00 20.00 Полночь 04.00 08.00
▲ Время
Рис. 11-5. Средняя (± стандартная ошибка) концентрация глюкозы в сыворотках крови 11 собак со спонтанно развившимся сахарным диабетом, получавших корм с высоким содержанием нерастворимых пищевых волокон (целлюлозы; сплошная линия) и их низким содержанием (пунктирная линия). Стрелка указывает время инъекции и кормления (половина суточного количества калорий); *) - р < 0,05 по сравнению с низковолокнистым кормом. ( Из: Nelson RW et al: Effect of dietary insoluble fiber on glycemic control in dogs with naturally occurring diabetes mellitus. JAVMA, 212, 280,1980).
544 • САХАРНЫЙ ДИАБЕТ У СОБАК
ТАБЛИЦА 11-10. ПРИМЕРНЫЙ СОСТАВ НЕКОТОРЫХ КОММЕРЧЕСКИХ КОРМОВ С ВЫСОКИМ СОДЕРЖАНИЕМ КЛЕТЧАТКИ ДЛЯ СОБАК
Грубая клетчатка * Углеводы ** Жиры ** Белки ** Калории (на одну кормушку) ***
Prescription Diet r/d Консервированный 26 45 22 33 249
Сухой 24 49 21 30 205
Prescription Diet w/d Консервированный 14 54 29 16 390
Сухой 17 62 19 19 226
Purina ОМ Консервированный 19 17 28 55 189
Сухой 11 47 16 37 276
Science Diet Light Консервированный 10 58 24 18 364
Сухой 14 62 18 20 295
Purina DCO Сухой 8 45 32 24 320
Waltham Glucomodulation Control Diet Консервированный 10 55 11 34 339
Сухой 5 62 10 28 316
lams Eukanuba Optimum Weight Control Сухой 3 53 21 26 253
* В пересчете на сухой вес корма.
** В пересчете на процент общей метаболизируемой энергии, содержащейся в углеводах, жирах и белках.
*** В пересчете на килокалории общей метаболизируемой энергии на одну кормушку (15 унций), а для сухих кормов - на объем полностью заполненной стандартной миски (8 унций).
Корма с высоким содержанием клетчатки не следует предлагать худым или истощенным собакам с сахарным диабетом в виду их низкой калорийности, так как это не только препятствует приросту веса, но может привести к его дальнейшему уменьшению. Для того чтобы восстановить вес худой собаки с диабетом, сначала обычно добиваются нормализации гликемии с помощью инсулинотерапии, а затем назначают поддерживающую диетотерапию с использованием высококалорийного рациона, содержащего небольшое количество клетчатки. После нормализации веса тела эту диету постепенно заменяют рационом с прогрессивно нарастающим количеством волокнистых продуктов.
Пищевые белки. Проблема оптимального содержания белка в пищевом рационе больных диабетом остается дискуссионной, поскольку их благоприятное или неблагоприятное действие может проявляться как при ограниченном, так и при свободном потреблении (Wylie-Rosett, 1988; Malik, Jaspan, 1989). Хотя белки являются не столь мощными стимуляторами секреции инсулина как глюкоза, изменение их содержания в пище сказывается на эффективности компенсации метаболических расстройств при диабете, поскольку они влияют на доступность субстратов глюконеогенеза и продукцию контррегуляторных гормонов (Spillar et al, 1987; Krezowski et al, 1986; Henry, 1994).
Потребление избыточного количества белка в течение длительного времени, особенно в сочетании с избытком фосфора и натрия, способствует прогрессированию диабетической нефропатии у человека (Hostetter et al, 1982; Brenner et al, 1982).
Напротив, рацион с низким содержанием белка препятствует развитию почечного заболевания при сахарном диабете или замедляет его (Friedman, 1982). Вопрос о влиянии неограниченного потребления белка у собак и кошек остается открытым, однако при выявлении нарушения функции почек рекомендуется уменьшить содержание белка в пищевом рационе (Harte et al, 1994; Devaux et al, 1996). Принимая во внимание частое сочетание сахарного диабета и почечной недостаточности, целесообразно назначать такую диету, которая удовлетворяет, но не превышает суточной потребности животных в белке. Иными словами, на долю белков в корме собак должно приходиться не более 30% метаболизируемой энергии. В случае недостаточности почечной функции потребление белка должно быть еще более ограничено.
Пищевые жиры. Нарушение жирового обмена - обычное явление у собак с сахарным диабетом. Оно сопровождается повышением концентрации холестерина, триглицеридов, липопротеинов, хиломикронов и свободных жирных кислот в сыворотке крови, а также служит причиной гепатического липидоза, атеросклероза и предрасположенности к развитию панкреатита (DeBowes et al, 1987; Hess et al, 2002). Скармливание собакам большого количества жиров вызывает инсулинорезистентность и усиливает продукцию глюкозы в печени, а у здоровых животных угнетает функцию бета-клеток (Massillon et al, 1997; Kaiyala et al, 1999). Эти наблюдения подтверждают целесообразность использования кормов с низким содержанием жира, доля которого не должна превышать 30% общей метабо
САХАРНЫЙ ДИАБЕТ У СОБАК
545
лизируемой энергии. Рацион с низким содержанием жиров позволяет свести к минимуму риск возникновения панкреатита, помогает контролировать некоторые проявления гиперлипидемии и понизить общую калорийность пищи с целью уменьшения веса тела животного и предотвращения его повторного увеличения (Remillard, 1999). С другой стороны, худым и истощенным собакам, болеющим сахарным диабетом, следует назначать рацион с повышенным содержанием жиров.
Калорийность и ожирение. Ожирение вызывает нарушение толерантности к глюкозе у собак (Mattheeuws et al, 1984) и является важным фактором, определяющим ответ на инсулинотерапию у животных с сахарным диабетом. Снижение веса тела благоприятствует нормализации толерантности к глюкозе, по-видимому, благодаря уменьшению тяжести индуцированной ожирением инсулинорезистентности (Wolfsheimer et al, 1993). Снижение веса обычно достигается комбинацией уменьшения калорийности пищи, использования низкокалорийных кормов с высоким содержанием клетчатки и физических нагрузок для увеличения расхода энергии.
Следует определить вес собаки и рассчитать конечный идеальный вес. Для расчета используют данные о весе животного из медицинских документов за период, когда оно находилось в отличном физическом состоянии, или таблицы весов собак различных пород. Важно, чтобы намечаемое снижение веса было реалистичным и достижимым - в противном случае владелец собаки перестанет выполнять предписания, направленные на достижение поставленной цели. Если идеальный вес тела составляет менее 15% действительного веса животного, снижение веса до желаемой величины следует проводить постепенно. Сначала ставится задача уменьшить вес собаки на 15%. После этого добиваются снижения веса еще на какую-то величину и так далее, пока он не достигнет идеального уровня. Для снижения веса на 15% собака должна ежесуточно получать 55 х [исходный вес тела (кг) 0,75] ккал (Elliott, 2003). При таком режиме питания вес тела уменьшается на 15% в течение примерно 12 недель. Расчетную калорийность пищи, необходимую для такого уменьшения, сравнивают с текущим суточным потреблением калорий, данные о котором получают из диетического анамнеза. Большинство домашних животных потребляют больше калорий, чем необходимо для уменьшения веса тела на 15%. Однако, если количество калорий, необходимых для снижения веса, в действительности меньше их текущего суточного потребления, следует повторно проанализировать диетический анамнез в поисках источника лишних калорий. В отсутствие таковых суточное потребление калорий необходимо уменьшить на 15-20%. По указанным выше причинам для больных диабетом собак с ожирением рекомендуется диета с пищевыми волокнами, хотя существует несколько рационов, предназначенных специально для снижения веса у этих животных.
Количество предлагаемого собакам корма определяют посредством деления суточной потребности в калориях на число калорий, содержащихся в данном объеме корма. Количество корма за один прием и сроки еды зависят, с одной стороны, от режима введения инсулина данному животному, а с другой, от наличия свободного времени у его владельца (см. раздел «График кормления» в правой колонке). Помимо снижения суточного потребления калорий, следует делать все возможное, чтобы увеличить расход энергии собакой под воздействием физической нагрузки.
В ходе реализации программы снижения веса следует каждые две недели оценивать физическое состояние собаки. Для этого ее взвешивают и анализируют диетический анамнез. В идеале каждую неделю животное должно терять от 1 до 2% веса.
Если скорость его снижения превышает 2% в неделю, необходимо повысить калорийность корма на 10-15%. Если вес не снижается, нужно проверить диету для выявления источника дополнительных калорий. В отсутствие такого источника суточное потребление калорий уменьшают еще на 10-15%. Когда идеальный вес тела достигнут, суточное потребление калорий корректируют и животное переводят на рацион, предназначенный для поддержания веса (например, Prescription Diet W/D, Hill’s Pet Products, Topeka, KS или lams Eukanuba Optimum Weight Control, производства lams Co, США).
Режим кормления. Режим кормления составляют таким образом, чтобы усилить действие инсулина и свести к минимуму риск постпрандиальной гипергликемии. Вероятность последней определяется, с одной стороны, количеством еды, потребляемой за один прием, а с другой стороны, скоростью всасывания глюкозы и других компонентов пищи в кишечнике, а также эффективностью действия эндогенного и экзогенного инсулина во время еды. При наличии в крови инсулина, способного нейтрализовать поступающую с пищей глюкозу, собака должна получать корм в соответствии с ее суточной потребностью в калориях. Если во время еды экзогенный инсулин еще сохраняет свою активность, то постпрандиальное увеличение концентрации глюкозы в крови незначительно или отсутствует. Напротив, кормление собаки с сахарным диабетом после того как инсулин утратил метаболическую активность, приводит к увеличению концентрации глюкозы спустя 1-2 часа после приема пищи (рис. 11-6). В этом случае необходимо сменить препарат инсулина, либо привести в соответствие время его введения и время кормления.
Обычно собака, которой дважды в день вводят экзогенный инсулин, вместе с каждой инъекцией получает равные количества корма. Если инсулин вводят раз в день, то вместе с инъекцией собаке предлагают корм в количестве, эквивалентном половине ее суточной потребности в калориях, а вторую половину дают приблизительно через 8-10 часов. К сожалению, собаки едят по-разному. Одни
546 • САХАРНЫЙ ДИАБЕТ У СОБАК
Рис. 11-6. Средняя концентрация глюкозы в крови (сплошная линия) и инсулина в сыворотке (пунктирная линия) у 8 собак с сахарным диабетом, получавших раз в день подкожные инъекции комбинированного препарата НПХ инсулинов крупного рогатого скота и свиньи. Продолжительность действия НПХ инсулина была незначительной, что привело к длительным периодам гипергликемии, начиная сразу после вечернего кормления. Стрелка указывает время инъекции инсулина, *) - время кормления равными количествами пищи. ( Из: Nelson RW: Diabetes mellitus. Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine 4th ed. Philadelphia, WB Saunders Co, 1995, p 1525).
очень разборчивы и едят урывками в течение всего дня, тогда как другие чрезвычайно прожорливы и сразу съедают все, что находят в миске. Последних надо кормить, как описано выше. Разборчивые же собаки не желают есть много и быстро. Это значительно осложняет положение владельцев, которым предписано добиваться, чтобы собака съела весь корм, предлагаемый после инъекции инсулина. Можно, однако, исходить из принципа, согласно которому повторное кормление небольшими порциями на протяжении времени действия инсулина скорее позволит свести к минимуму гипергликемический эффект каждого приема пищи, чем скармливание большой порции за один раз. Тогда собаке, которая есть урывками, можно разрешить принимать пищу по желанию, если это поможет контролировать колебания концентрации глюкозы в плазме крови. Иными словами, собака, привыкшая есть понемногу, может сохранять свойственное ей поведение. Корм должен быть доступен животному с момента каждой очередной инъекции инсулина, и она должна сама выбирать, сколько и когда есть. Аналогичные условия необходимо обеспечить во время следующей инъекции инсулина.
Модификации диетотерапии. Сахарный диабет часто протекает на фоне сопутствующих заболеваний, таких как почечная или сердечная недостаточность. Диетотерапия применяется для лечения разнообразных патологических состояний. По возможности, желательно подобрать один вариант диеты для коррекции всех имеющихся нарушений.
Если же это не получается, то приоритет отдается диетотерапии наиболее серьезного расстройства. Например, диетотерапия хронической почечной недостаточности, сердечной недостаточности или рецидивирующего панкреатита более важна, чем диетотерапия сахарного диабета. При сочетании указанных заболеваний последняя считается вспомогательной, а контроль уровня глюкозы обеспечивается введением инсулина независимо от состава корма.
Острый и хронический панкреатит, а также недостаточность экзокринной функции поджелудочной железы (НЭПЖ) тесно связаны с наличием сахарного диабета у собак. К счастью, многие принципы диетотерапии сахарного диабета, панкреатита и НЭПЖ весьма сходны (табл. 11-12). После уменьшения тяжести панкреатита под воздействием легкоусвояемой пищи с низким содержанием жиров многие собаки, страдающие этим расстройством в сочетании с сахарным диабетом, хорошо переносят рационы с высоким содержанием пищевых волокон. Такие же корма рекомендуются для собак с НЭПЖ (Lewis et al, 1987). Исследования in vitro показали, что некоторые волокнистые продукты подавляют ферментативную активность, однако целлюлоза, которая особенно часто вводится в состав обогащенных клетчаткой коммерческих кормов для собак, не влияет на активность ферментов (Dutta, Hlasko, 1985). Клинические испытания, продемонстрировавшие отрицательное действие пищевых волокон in vivo, не включали больных сахарным
САХАРНЫЙ ДИАБЕТ У СОБАК • 547
ТАБЛИЦА 11-12. СРАВНЕНИЕ ОБЩИХ РЕКОМЕНДАЦИИ ПО ДИЕТОТЕРАПИИ САХАРНОГО ДИАБЕТА, ПАНКРЕАТИТА И НЕДОСТАТОЧНОСТИ ЭКЗОКРИННОЙ ФУНКЦИИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ У СОБАК И КОШЕК
Характеристика корма Сахарный диабет Панкреатит Недостаточность экзокринной функции поджелудочной железы
Усвояемость Содержание жиров Содержание углеводов Содержание белка Режим кормления Калорийность Нормальная Низкое Высокое От нормального до умеренно ограниченного Дважды в день при каждой инъекции инсулина Коррекция во избежание ожирения Высокая Низкое От нормального до низкого Умеренно ограниченное Кормление часто небольшими порциями Коррекция во избежание ожирения Высокая Низкое От нормального до низкого Нормальное Кормление часто небольшими порциями Коррекция во избежание ожирения
диабетом собак и кошек с сопутствующей НЭПЖ. Можно ли устранить это неблагоприятное воздействие пищевых волокон путем перорального введения панкреатических ферментов, неизвестно. Мы с успехом использовали рационы с повышенным содержанием волокнистых продуктов для кормления нескольких собак и кошек с сахарным диабетом и НЭПЖ, однако, необходимы дополнительные исследования для оценки действия таких продуктов при такой сочетанной патологии.
Физическая нагрузка
Физическая нагрузка необходима для поддержания желаемого уровня гликемии у собак с диабетом, она помогает снизить вес и устранить резистентность к инсулину, индуцированную ожирением. Кроме того, физическая нагрузка способствует понижению концентрации глюкозы в крови благодаря усилению мобилизации инсулина из мест инъекции. Это ее действие осуществляется, по-видимому, посредством нескольких механизмов, в том числе путем увеличения скорости притока крови и лимфы (и, таким образом, скорости доставки инсулина) в работающие мышцы, стимуляции транслокации (т.е. повышающей регуляцией) транспортеров глюкозы (в первую очередь, GLUT4) в мышечных клетках, а также повышения эффективности действия глюкозы (усиления мобилизации глюкозы при гипергликемии на фоне базальной концентрации инсулина) (Femqvist et al, 1986; Galante et al, 1995; Phillips et al, 1996; Nishida et al, 2001). Собакам c сахарным диабетом необходима рутинная ежедневная нагрузка, желательно в одно и то же время суток. Спорадические изматывающие упражнения могут вызвать тяжелую гипогликемию, и их следует избегать. Животным, подвергающимся такой нагрузке (например, рабочим собакам в сезон охоты), следует уменьшать дозу вводимого инсулина в те дни, когда их предполагается использовать в условиях, требующих больших энергетических затрат. Степень снижения дозы инсулина для предотвращения гипогликемии определяется методом проб и ошибок. Мы рекомендуем сначала понизить дозу на 50%, а в дальнейшем коррекцию проводить с учетом симптомов гипогликемии и тяжести поли
дипсии и полиурии на протяжении последующих 24-48 часов. В связи с этим владельцы животных должны уметь распознавать признаки гипогликемии и держать наготове источники глюкозы (такие как сироп Каро, сладости или корм), чтобы иметь возможность устранить гипогликемию в случае необходимости.
Пероральные сахаропонижающие препараты
Обзор. В Соединенных Штатах для лечения ИНЗСД у людей разрешено применение следующих пяти классов пероральных сахаропинижаю-щих препаратов: препараты сульфонилмочевины, меглитиниды, бигуаниды, тиазолидиндионы и ингибиторы а-глюкозидазы. Механизм действия этих лекарственных средств состоит в стимуляции секреции инсулина поджелудочной железой, повышении чувствительности различных тканей к инсулину или замедлении всасывания глюкозы в кишечнике после еды (DeFronzo, 1999). Кроме того, используются хром и ванадий - микроэлементы, повышающие тканевую чувствительность к инсулину. Пероральные сахаропонижающие препараты не используются в повседневной клинической практике для лечения сахарного диабета у собак, отчасти потому что эти животные обычно страдают ИЗСД, и к моменту установления диагноза у большинства из них уже имеется гипоинсулинемия. В этих условиях препараты, стимулирующие секрецию инсулина поджелудочной железой, бесполезны, поскольку бета-клетки уже разрушены. Лекарственные средства, повышающие чувствительность тканей к действию инсулина, проявляют свою активность только при наличии инсулина в крови. Поэтому они также непригодны для первичной терапии гипоинсули-немического диабета у собак. Наконец, препараты, замедляющие всасывание глюкозы в кишечнике после еды, улучшают контроль гипергликемии у животных, болеющих сахарным диабетом, однако так же малоэффективны в качестве средств первичной терапии, к тому же они дорогие и часто вызывают побочные реакции (см. ниже характеристику акарбозы). К настоящему времени критическая оценка терапевтической эффективности у собак
548
САХАРНЫЙ ДИАБЕТ У СОБАК
проведена только для ингибиторов а-глюкозидазы и хрома. Дополнительная информация о пероральных сахаропонижающих препаратах приведена в гл. 12 (стр. 568).
И hi иби юры альфа-i л юкозидазы. Акарбо-за (прекоза, производства Bayer, West Haven, СТ) представляет собой набор сложных олигосахаридов бактериального происхождения, которые конкуренте ингибируют а-глюкозидазы (глюкоамилазу, сукразу, мальтазу и изомальтазу), локализованные в ворсинчатом эпителии кишечника (Lembcke et al, 1985; Balfour, McTavish, 1993). Подавление активности л их ферментов приводит к задержке переваривания сложных углеводов и дисахаридов до моносахаридов. Угнетение ферментативной активности сопровождается усилением переваривания углеводов в подвздошной и в меньшей степени в ободочной кишке. Особенно важно то обстоятельство, что при этом замедляется всасывание глюкозы из кишечною тракта и уменьшается постпранди-альная концентрация как глюкозы, так и инсулина в крови. Контрольные клинические исследования
показали, что введение акарбозы людям с ИЗСД и ИНЗСД значительно повышает эффективность регуляции уровня гликемии (Rios, 1994; ConifT et al., 1995; Kelley et al, 1998). Акарбоза значительно снижала концентрацию глюкозы после приема пищи, концентрацию гликозилированных белков в крови и суточную потребность в инсулине. В недавно завершенных исследованиях, проводившихся на здоровых и больных сахарным диабетом собаках с использованием плацебо в качестве контроля, было установлено, что у здоровых собак акарбоза вызывает уменьшение всасывания глюкозы и секреции инсулина после еды, а у больных собак позволяет уменьшить суточную дозу инсулина и снижает среднюю концентрацию глюкозы в крови в течение 8-часовых интервалов между взятием проб и концентрацию гликозилированных белков (рис. 11-7; Robertson et al., 1999; Nelson et al., 2000).
Результаты этих исследований позволяют сделать вывод, что акарбоза улучшает контроль уровня глюкозы в крови у некоторых собак с ИЗСД. Вместе с тем, этот препарат примерно у 35% собак вызывал
Доза акарбозы (мг/собака)
КГН (мг/100 мл)
Ц Плацебо
Акарбоза
Рис. 11-7. А. Средняя общая секреция инсулина у 5 здоровых собак в течение первых 6 часов после получения корма и плацебо или 25, 50, 100 и 200 мг акарбозы. Линии над столбиками - стандартная ошибка. *) - р < 0,05 ио сравнению с плацебо. (Из: Robertson J et al. Effects of the a-glucosidase inhibitor acarbose on postprandial serum glucose and insulin concentrations in healthy dogs, rkm J Vet Res, 60:541, 1999 ). Б. Концентрация глюкозы натощак (КГН), ее средняя концентрация на протяжении 8-часового периода (СКГ-8ч) и содержание общего гликозилированного гемоглобина (Gly Hgb) в крови 5 собак с инсулинозависимым сахарным диабегом, получавших инсулин и плацебо (черные столбики) или инсулин и акарбозу (заштрихованные столбики) в течение 2 месяцев ио рандомизированной схеме. Линии над столбиками - стандартная ошибка. *) - р < 0,05 но сравнению с п 1ацебо.
САХАРНЫЙ ДИАБЕТ У СОБАК • 549
Концентрация глюкозы в крови (мг/100 мл )
Рис. П-8. Средняя (± стандартная ошибка) концентрация глюкозы в сыворотках крови 13 собак с инсулинозависимым сахарным диабетом до введения инсулина и кормления (время 0) и спустя 10 часов после инъекции одного инсулина (пунктирная линия) или введения инсулина одновременно с трипиколинатом хрома (сплошная линия). На протяжении первых 3 месяцев собаки получали только инсулин, а в последующие 3 месяца инсулин и трипиколинат хрома. Суммарную среднюю концентрацию глюкозы в плазме крови рассчитывали, исходя из всех соответствующих средних величин, полученных для отдельных особей в течение 10-часовых периодов сбора проб крови в 1, 2 и 3 месяце каждого триместра. Стрелка указывает время введения инсулина или инсулина + хрома пиколината. ( Из: Shchachter S et al: Oral chromium picolinate and control of glycemia in insulin-treated diabetic dogs. J Vet Intern Med, 15:379, 2001 ).
побочные эффекты в форме диареи и уменьшения веса в результате пониженной ассимиляции углеводов (Robertson et al, 1999; Nelson et al, 2000). Диарея часто развивалась после введения больших доз акарбозы (100-200 мг/собака), но обычно прекращалась в течение 2-3 дней после отмены препарата. Из-за наличия побочного действия и высокой стоимости акарбозу целесообразно использовать только для лечения собак с плохо компенсированным сахарным диабетом, у которых не удается установить причину устойчивой гипергликемии, а инсулино-терапия, сама по себе, недостаточно эффективно устраняет клинические симптомы заболевания. Независимо от веса собаки начальные дозы акарбозы должны быть невысокими (от 12,5 до 25 мг с каждым приемом пищи). Преимущества этого препарата обусловлены его взаимодействием с компонентами корма; его следует вводить только во время еды. Если у собаки в течение 2 недель после начала введения акарбозы в дозах 12,5-25 мг клиническое состояние не улучшается, разовую дозу акарбозы увеличивают сначала до 50 мг (для крупных собак весом более 25 кг), а затем в случае необходимости до 100 мг. Следует, однако, помнить, что с повышением дозы акарбозы возрастает вероятность ее нежелательного побочного действия.
Хром. Хром - это широко распространенный в природе химический элемент, который в условиях in vitro обладает инсулиноподобной активностью. Механизм его действия точно неизвестен, однако, в целом он сводится к повышению чувствительности отдельных тканей к инсулину, которое, по всей вероятности, осуществляется на пострецепторном уровне (Anderson, 1992; Striffler et al., 1995). Хром не повышает концентрацию инсулина в крови, но
является важным кофактором его действия, а недостаточность хрома приводит к инсулинорезистент-ности. Данные о действии хрома на толерантность к глюкозе и контроль гликемии у больных диабетом людей носят противоречивый характер. В некоторых исследованиях было установлено благотворное влияние терапии пиколинатом хрома на эффективность гликемического контроля при ИНЗСД (Mosop, 1983; Evans, 1989; Anderson et al, 1997), тогда как другие авторы не наблюдали такого эффекта (Rabinowitz et al, 1983; Abraham et al, 1992). В одном из исследований было показано, что добавление в корм хрома пиколината улучшало результаты теста толерантности к внутривенному введению глюкозы у здоровых собак по сравнению с собаками, которым не давали хром (Spears et al, 1998). По данным других исследований добавление в корм хрома пиколината не влияло на толерантность к глюкозе ни у собак с ожирением во время терапии с целью уменьшения их веса (Cross et al, 2000), ни у кошек с ожирением или без него после 6 недель скармливания этого препарата (Cohn et al, 1999). В нашей клинике также недавно было проведено исследование влияния хрома пиколината на качество контроля гликемии у собак, получающих экзогенный инсулин (Schachter et al, 2001). Концентрацию глюкозы в крови определяли ежемесячно на протяжении 6 месяцев; пиколинат хрома вводили перорально в течение последних 3 месяцев в дозах 200-400 мг дважды в день. Было установлено, что этот препарат не влиял ни на результаты ОАК, биохимического анализа сыворотки и анализа мочи, ни на эффективность контроля уровня гликемии у собак с сахарным диабетом (рис. 1-8). На кошках с сахарным диабетом аналогичные исследования не проводились.
550 • САХАРНЫЙ ДИАБЕТ У СОБАК
В Соединенных Штатах пиколинат хрома считается компонентом лечебного питания и продается в аптеках и специализированных магазинах диетических продуктов. Препарат недорог и не обладает токсическим действием при приеме внутрь. Хотя предварительные исследования не выявили благотворного действия пиколината хрома на контроль уровня гликемии, его введение собакам с плохо компенсированным сахарным диабетом может быть рекомендовано в тех случаях, когда инсулинотерапия, сама по себе, недостаточно эффективна. Пиколинат хрома входит в состав одного из коммерческих рационов, предназначенных для оптимизации регулирования веса у больных сахарным диабетом собак (Eukanuba Optimum Weight Control, производства lams Co, США), который в настоящее время продается в Соединенных Штатах.
Лекарственные травы, пищевые добавки и витамины. Все больше больных, особенно с сахарным диабетом 2 типа, начинают использовать альтернативные способы терапии, включающие лекарственные травы, пищевые добавки и витамины, в сочетании с более традиционными методами лечения, описанными выше, или вместо них. Основной целью альтернативной терапии является снижение концентраций глюкозы, триглицеридов и холестерина в крови, задержка развития отдаленных осложнений сахарного диабета и улучшение общего состояния больных (табл. 11-13; Roszler, 2001). Ожидаемый эффект зависит от вида используемых лекарственных трав, пищевых добавок или витаминов и состоит в задержке всасывания пищевых продуктов в желудочно-кишечном тракте, повышении чувствительности к инсулину и стимуляции его секреции, изменении характера липидного обмена, улучшении кровообращения и подавлении действия оксидантов. Терапевтическая ценность некоторых лекарственных трав, пищевых добавок и витаминов (таких как женьшень, хром, рыбий жир и листовик) была предметом критических исследований, тогда как применение других средств этой группы основывается, главным образом, на опыте народной медицины и приметах (Pastors et al, 1991; Striffler et al, 1995; Vuksan et al, 2001). В настоящее время хром и ванадий являются единственными добавками, целесообразность применения которых была критически оценена на собаках и кошках с сахарным диабетом (см. стр. [504]). Такие же исследования необходимы, прежде чем лекарственные травы, пищевые добавки и витамины можно будет рекомендовать для целей альтернативной терапии сахарного диабета. Интутитивно представляется мало вероятным, чтобы эти средства, перечисленные в табл. 11-13, могли оказывать существенный терапевтический эффект у собак с сахарным диабетом, потому что эти продукты применяются, главным образом, для лечения ИНЗСД и задержки развития хронических осложнений диабета, а и то и другое редко бывает у собак. У кошек описаны случаи ИНСЗД и периферической диабетической
ТАБЛИЦА 11-13. ЛЕКАРСТВЕННЫЕ ТРАВЫ, ПИЩЕВЫЕ ДОБАВКИ И ВИТАМИНЫ, ИСПОЛЬЗУЕМЫЕ ПРИ ЛЕЧЕНИИ САХАРНОГО ДИАБЕТА У ЛЮДЕЙ.
ПРИВЕДЕННЫЕ ДОЗЫ РЕКОМЕНДУЮТСЯ БОЛЬНЫМ ДИАБЕТОМ
Для коррекции гипергликемии
Альфа-липоевая кислота (100-600 мг ежедневно)
Витамин С (250-1000 мг ежедневно)
Витамин Е (800 ME ежедневно)
Хром (400 мкг ежедневно)
Ванадий (5-25 мг ежедневно)
Семена пажитника
(Trigonella sp.) (5-30 г ежедневно) Американский и азиатский
женьшень (200 мг ежедневно)
Gymnema sylvestre (200 мг дважды в день)
Семена Psyllium sp.
Сассафрас (Sassafras officinale) (по j чайной ложки ежедневно)
Для профилактики ишемической болезни сердца
Витамин С
Витамин Е
Кверсетин (100 мг трижды в день)
Для улучшения кровообращения
Gingko biloba
Пикногенол
Для коррекции гиперлипидемии
Витамин Е
Энотеровое масло (200-500 мг ежедневно)
Рыбий жир (например, омега-3-жирные кислоты)
Селен (400 мкг ежедневно )
Для профилактики катаракты
Альфа-липоевая кислота
Витамин С
Для профилактики ретинопатии
Витамин Е
Пикногенол (экстракт сосновой коры)
Антиоксиданты
Альфа-липоевая кислота
Витамин А (100-400 между-нар.ед ежедневно)
Витамин С
Витамин Е
Пикногенол
Кверцетин
Селей
Для профилактики и уменьшения болей при невропатии
Альфа-липоевая кислота
Витамин В6 (не более 10 мг
ежедневно)
Капсацин (кайенский перец), мазь для топического применения
Энотеровое масло______________________________________
Из: Roszler J: Herbs, supplements, and vitamins. What to try, what to buy.
Diabetes Interviews August, 2001, p 45.
нейропатии. Тем не менее, хроническое действие лекарственных трав, пищевых добавок и витаминов у хищников может значительно отличаться от такового у всеядных из-за различий в характере обмена активных ингредиентов этих продуктов. Поэтому необходима предварительная оценка их эффективности и безопасности.
Выявление и лечение сопутствующих расстройств
Впервые выявляемый сахарный диабет обычно ассоциируется с сопутствующими заболеваниями
САХАРНЫЙ ДИАБЕТ У СОБАК • 551
и введением препаратов-антагонистов инсулина (Hess et al, 2000b; Peikes et al, 2001). И сопутствующие расстройства, и антагонисты инсулина могут влиять на чувствительность отдельных тканей к инсулину. Чувствительность понижается в результате уменьшения количества специфических рецепторов на поверхности клеточных мембран, изменения сродства рецепторов к инсулину и нарушения некоторых пострецепторных процессов, принимающих участие в активации транспортной системы глюкозы (Unger, Foster, 1998). Потеря чувствительности тканей к инсулину является причиной инсулиноре-зистентности, тяжесть которой отчасти зависит от этиологии расстройства (см. стр. [524]). Инсулинорезистентность может быть слабой и легко преодолеваться увеличением доз инсулина, но может быть очень тяжелой и приводить к выраженной устойчивой гипергликемии независимо от типа и дозы вводимого инсулина. Некоторые причины ин-сулинорезистентности вполне очевидны на момент установления диагноза сахарного диабета, в частности, ожирение или применение лекарственных препаратов - антагонистов инсулина (например, глюкокортикоидов). Другие причины не столь очевидны, и для их выяснения приходится проводить тщательное диагностическое обследование. В принципе любой сопутствующий воспалительный, инфекционный, гормональный или неопластический процесс может вызвать резистентность к инсулину и повлиять на эффективность инсулинотерапии. Выявление и лечение сопутствующего заболевания являются неотъемлемыми компонентами успешного контроля сахарного диабета. У собак с впервые выявленным диабетом важнейшее значение имеет тщательный анализ анамнестических данных, физикальное исследование и исчерпывающая оценка диабетических расстройств (см раздел «Клиникопатологические нарушения»).
Первоначальный подбор режима инсулинотерапии
Для подбора вида и дозы инсулина собакам с сахарным диабетом требуется несколько дней. Поэтому для завершения диагностического обследования и начала инсулинотерапии животных с впервые выявленным заболеванием обычно помещают в стационар на 24 - 48 часов. Во время госпитализации концентрацию глюкозы в крови, как правило, определяют во время инъекции инсулина, а также в 11.00,14.00 и 17.00. Цель этих измерений - выявить гипогликемию (т.е. концентрацию глюкозы менее 80 мг/100 мл) у тех собак, которые отличаются необычной чувствительностью к действию инсулина.
При наличии гипогликемии собаке при отправке домой назначают пониженную дозу инсулина. Коррекция дозы не требуется, если в течение этих первых дней инсулинотерапии у собаки сохраняется гипергликемия. При этом первом обследовании в ветеринарной клинике не ставится задача обес
печить максимально эффективный контроль гликемии перед передачей животного хозяину. Цель состоит в том, чтобы начать устранение обменных расстройств, вызванных сахарным диабетом, дать возможность собаке привыкнуть к инъекциям инсулина и изменению характера питания и научить ее владельца вводить животному инсулин, а также предоставить ему несколько дней, чтобы привыкнуть к новому стилю общения с собакой в домашних условиях. Подбор окончательной дозы инсулина производится после дополнительных обследований больного животного, когда и собака, и ее хозяин свыкнутся с регулярными инъекциями гормона.
Собак с сахарным диабетом обычно обследуют раз в неделю, до тех пор пока не будет отработан наиболее эффективный режим инсулинотерапии. В начале терапии мы информируем владельца животного о том, что потребуется около месяца, чтобы подобрать оптимальную схему введения инсулина, если нет сопутствующего заболевания. Одновременно ему разъясняют задачи инсулинотерапии. На протяжении этого месяца обычно приходится изменять тип, дозу и частоту инъекций инсулина, и владелец собаки должен быть готов к таким изменениям. Во время каждого обследования обсуждаются субъективные наблюдения владельца, касающиеся количества потребляемой собакой воды, продукции мочи и общего состояния животного, проводится полное физикальное исследование, регистрируется изменение веса и анализируются результаты серийных определений концентрации глюкозы в крови в период между 7.00-9.00 и 16.00-18.00. Полученные данные используются для коррекции режима инсулинотерапии, намечается дата очередного обследования на следующей неделе для внесения дальнейших изменений в режим терапии, и животное возвращается хозяину. Качество контроля гипергликемии считается удовлетворительным после устранения клинических проявлений сахарного диабета, стабилизации веса тела и нормализации общего состояния животного и его поведения в домашних условиях, при этом хозяин должен быть доволен результатами лечения, а концентрация глюкозы в плазме крови на протяжении суток должна быть от 100 до 250 мг/100 мл.
Повседневный контроль уровня глюкозы зависит от многих факторов, в том числе от изменений характера инъекций инсулина, его всасывания из мест введения, физической нагрузки и факторов, влияющих на чувствительность к инсулину (таких как стресс, сопутствующее воспаление или инфекция). Как следствие, со временем приходится изменять (увеличивать или уменьшать) дозы инсулина, необходимые для поддержания требуемого уровня гликемии (рис. 11-9). Тем не менее, на протяжении первых нескольких месяцев терапии в домашних условиях следует использовать фиксированную дозу инсулина. Коррекция инсулинотера-
552 • САХАРНЫЙ ДИАБЕТ У СОБАК
500-1
О J------,-------------,-------------,------------,
08.00 Полдень 16.00 20.00
Рис. 11-9. Гликемические кривые овариэктомированной кошки весом 7 кг, получавшей комбинированный препарат ленте инсулина крупного рогатого скота и свиньи в дозе 1,2 ЕД/кг, через 1 месяц после начала инсулинотерапии (сплошная линия с темными кружками), тот же препарат в дозе 0,6 ЕД/кг через 4 месяца (пунктирная линия с темными кружками ) и в дозе 0,8 ЕД/кг через 10 месяцев (пунктирная линия со светлыми кружками). Обратите внимание на изменение доз инсулина, необходимое для эффективного контроля гликемии. Стрелка указывает время подкожной инъекции инсулина и кормления животного.
пии допускается только после консультации владельца животного с ветеринаром.
Подбор доз инсулина является рутинной процедурой и завершается выбором диапазона «безопасных» доз инсулина, обеспечивающих эффективный контроль уровня гликемии. Дозы, выходящие за пределы этого «безопасного» диапазона, обычно вызывают признаки гипогликемии или гипергликемии. Завершив подбор доз инсулина и убедившись в способности владельца животного распознавать признаки гипогликемии и гипергликемии, ему разрешают самостоятельно слегка изменять дозы гормона на основании наблюдений за состоянием животного. Тем не менее, он не должен отклоняться от заданного диапазона доз. Если же дозы на верхней или нижней границе этого диапазона не обеспечивают устранения симптомов сахарного диабета, то хозяин собаки должен обратиться к ветеринару для проведения дополнительной коррекции дозировок.
МОНИТОРИНГ КОМПЕНСАЦИИ ДИАБЕТА
Главная цель инсулинотерапии состоит в устранении клинической симптоматики сахарного диабета
и предотвращении обусловленных им нарушений. К числу последних относятся слепота в связи с развитием катаракты, рецидивирующий кетоз и неудовлетворительный контроль гипергликемии вследствие сопутствующей инфекции, воспаления, неоплазии или гормонального расстройства. Тяжелые хронические осложнения сахарного диабета у человека, такие как нефропатия, сосудистые заболевания или ишемическая болезнь сердца, развиваются на протяжении нескольких десятилетий и поэтому редко встречаются у собак. В связи с этим собакам не требуется полная нормализация концентрации глюкозы в крови. Состояние большинства животных остается удовлетворительным на фоне относительно слабого проявления диабетической симптоматики, если концентрация глюкозы в их крови находится на уровне от 100 до 250 мг/100 мл; такое положение устраивает и их хозяев.
Анамнез и физикальное исследование
Самыми важными исходными показателями при оценке качества контроля гипергликемии являются субъективное мнение владельца об общем состоя-
САХАРНЫЙ ДИАБЕТ У СОБАК • 553
нии животного и тяжести клинических проявлений сахарного диабета, а также результаты физикального исследования и степень стабильности веса тела (Briggs et al., 2000). Если владелец удовлетворен результатами лечения, а физикальное исследование подтверждает эффективность контроля гликемии и вес животного остается постоянным, то можно говорить об адекватной компенсации сахарного диабета. Мы предпочитаем беседовать с владельцами и проводить физикальное обследование животных в утренние часы (между 7.00 и 9.00) за час до введения инсулина или раньше, и в это же время берем пробы крови для определения концентрации глюкозы и фруктозамина (см. ниже) в крови. У большинства собак с хорошо компенсированным сахарным диабетом концентрация глюкозы в плазме крови, определенная между 7.30 и 9.30 за 1 час или раньше до инъекции инсулина, должна составлять 150-250 мг/100 мл. Концентрация глюкозы в ранние утренние часы менее 150 мг/100 мл при кажущемся хорошо компенсированном диабете свидетельствует о возможном развитии гипогликемии через несколько часов после введения инсулина, которая может протекать бессимптомно либо вызывать клиническую симптоматику, которая остается нераспознанной владельцем животного. В этом случае показано измерение концентрации фруктозамина в сыворотке крови. Ее низкая величина (например, менее 350 мкмоль/л) свидетельствует о наличии периодов гипогликемии и необходимости уменьшить дозу инсулина. Такая ситуация предполагает неудовлетворительный контроль гликемии, и необходимо провести дополнительные диагностические мероприятия (в частности, получение гликемической кривой и определение концентрации фруктозамина, а также тестов для выявления сопутствующего заболевания). Кроме того, может потребоваться изменение режима инсулинотерапии, если хозяин собаки отмечает клинические проявления сахарного диабета (т.е. полиурию, полидипсию, сонливость и симптомы гипогликемии). Физикальное исследование выявляет признаки, свидетельствующие о неудовлетворительном контроле уровня глюкозы (например, потерю веса или истощение, плохое состояние шерстяного покрова), при этом собака теряет вес на фоне концентрации глюкозы в плазме крови в ранние утренние часы выше 300 мг/100 мл (Briggs et al, 2000).
Повышенная концентрация глюкозы в крови сама по себе не является свидетельством слабого контроля гликемии. Выраженная гипергликемия может быть следствием стресса или возбуждения животного и не отражает его чувствительности к инсулину. Иными словами, наличие гипергликемии может привести к ошибочному выводу о неудовлетворительной компенсации сахарного диабета (см. стр. [567]). В случае расхождения данных анамнеза, физикального исследования и определения концентрации глюкозы в крови или если животное проявляет признаки беспокойства, ведет себя аг
рессивно, возбуждено или напугано, а результаты определения глюкозы вызывают сомнение, приходится измерять уровень фруктозамина в сыворотке крови, чтобы получить дополнительный материал для оценки контроля гликемии.
Определение концентрации фруктозамина в сыворотке крови
Фруктозамины представляют собой гликозилированные белки крови, определение которых используется для мониторинга гипергликемии у больных сахарным диабетом собак и кошек (Reusch et al, 1993; Crenshaw et al, 1996; Elliott et al, 1999).
Фруктозамины образуются в процессе необратимого, неферментативного и независимого от инсулина связывания глюкозы с белками крови. Они имеются в крови всех людей и животных. Концентрация фруктозаминов в сыворотке служит маркером средней концентрации глюкозы на протяжении периода циркуляции белка в крови, который составляет от 1 до 3 недель в зависимости от его природы (Kawamoto et al, 1991).
Степень гликозилирования сывороточных белков непосредственно зависит от концентрации глюкозы в крови: чем выше был средний уровень глюкозы на протяжении 2-3 предшествовавших недель, тем больше концентрация фруктозаминов и наоборот. Уровень фруктозаминов в крови не изменяется в случае острого повышения концентрации глюкозы под воздействием, например, стресса или возбуждения (Lutz et al, 1995). Концентрацию сывороточных фруктозаминов можно измерять в процессе рутинной оценки качества контроля гликемии, которая проводится каждые 3-6 месяцев, а также для выявления воздействия стресса или возбуждения на концентрацию глюкозы в плазме крови, объяснения расхождений между результатами анализа анамнестических данных, физикального исследования и серийных определений концентрации глюкозы и для характеристики эффективности коррекции инсулинотерапии (см. стр. 616). Концентрация фруктозаминов в сыворотке крови возрастает при ухудшении контроля гипергликемии у собак и кошек с сахарным диабетом и снижается, когда качество контроля улучшается (см. рис. 12-17, стр. 616).
Сыворотку крови, в которой определяют фрук-тозамин, можно замораживать и в таком виде транспортировать в лабораторию на следующий день. Замораживание существенно не влияет на результаты определений, тогда как хранение сывороток при комнатной температуре в течение ночи может привести к занижению концентрации фруктозамина на 10% (Jensen, 1992). Концентрацию фруктозамина определяют автоматическим колориметрическим методом с использованием красителя тетразолия хлорида (Baker et al, 1985). Установлена линейная зависимость между концентрациями общих белков, альбумина и фруктозамина в сыворотке крови.
554 • САХАРНЫЙ ДИАБЕТ У СОБАК
У здоровых и, возможно, больных сахарным диабетом собак при гипопротеинемии (концентрация общего белка менее 5,5 г/100 мл) и гипоальбуми-немии (концентрация альбумина менее 2,5 г/100 мл) концентрация фруктозамина может быть ниже нормального уровня (Fluckiger et al, 1987; Loste, Narcam 1999; Reusch, Habererm 2001). Аналогичное уменьшение концентрации фруктозамина в сыворотке крови наблюдается при гиперлипидемии (концентрация холестерина выше 380 мг/100 мл и триглицеридов выше 150 мг/100 мл) и азотемии (концентрация азота мочевины в крови выше 28 мг/100 мл и креатинина выше 1,7 мг/100 мл) (Reusch, Haber, 2001). У здоровых собак при гипер-протсинемии и гипербилирубинемии концентрация фруктозамина в сыворотке крови существенно не отличается от нормы.
В нашей лаборатории диапазон нормальных концентраций фруктозамина в сыворотке крови, определенный у здоровых собак с устойчиво нормальным уровнем гликемии, составляет от 225 до 365 мкмоль/л (Briggs et al, 2000). У собак с впервые выявленным сахарным диабетом концентрация сывороточного фруктозамина составляет от 320 до 850 мкмоль/л. Нормальная концентрация фруктозамина у некоторых собак с сахарным диабетом свидетельствует о том, что тяжелая гипергликемия, достаточная для проявления клинических признаков заболевания, сохранялась у них на протяжении лишь короткого периода времени до установления диагноза.
При интерпретации результатов определения фруктозамина у собак с сахарным диабетом следует иметь в виду, что гипергликемия, как правило, имеет место даже при хорошо компенсированном заболевании (табл. 11-14). Большинство владельцев собак удовлетворены результатами лечения, если удается поддерживать концентрацию фруктозамина в сыворотке крови на уровне 350-450 мкмоль/л. Уровень
ТАБЛИЦА 11-14. ПОДГОТОВКА ПРОБ, МЕТОД ОПРЕДЕЛЕНИЯ И НОРМАЛЬНЫЕ КОНЦЕНТРАЦИИ ФРУКТОЗАМИНА В СЫВОРОТКЕ КРОВИ СОБАК В НАШЕЙ ЛАБОРАТОРИИ
11роба крови Подготовка пробы
Метод
Факторы, влияющие на результаты анализа
Диапазон нормальных концентраций
Интерпретация результатов у собак с диабетом
Высокоэффективный контроль
Хороший контроль
Удовлетворительный контроль
Неудов ютвори тельный контроль
Продолжительная гипогли-
Фруктозамин______________
1-2 мл сыворотки
До проведения анализа хранить в замороженном виде Автоматическое колориметрическое определение с использованием нитроголубою тетразолия хлорила Гипопротеинемия и гипо-альбуминемия (занижение результатов), азотемия (занижение), гиперлипидемия (занижение), хранение при комнатной температуре (занижение)
225-365 мкмоль/л
350-400 мкмоль/л
400 450 мкмоль/л 450-500 мкмоль/л
>500 мкмоль/л
<300 мкмоль/л
кем и я
выше 500 мкмоль/л свидетельствует о неадекватной компенсации диабета, а при концентрациях фруктозамина более 600 мкмоль/л можно говорить о серьезных недостатках контроля гликемии. Если концентрация фруктозамина остается на нижнем пределе нормы (т.е. меньше 300 мкмоль/л) или ниже нормальной величины, то можно предполагать, что у собаки имели место длительные периоды гипогликемии. При наличии у собаки клинических призна-
СКГ-8ч
(мг/100 мл + SD)
Фруктозамин (мкмоль/л + SD)
Gly Hgb (% + SD)
Рис. 11-10. Средняя концентрация глюкозы в плазме крови, измерявшаяся на протяжении 8-часового периода (СКГ-8ч). концентрация фруктозамина и общего гликозилированного гемоглобина в крови (Gly Hgb) у 10 собак с сахарным диабетом при неудовлетворительном контроле уровня гликемии вследствие феномена С смоги (заштрихованные столбики) и у 12 собак с сахарным диабетом при неудовлетворительном контроле уровня гликемии вследствие инсулинорезистентности, индуцированной гиперкортицизмом (черные столбики). Обратите внимание на сходство уровня гликозилированного гемоглобина у собак обеих групп. Хотя у собак с феноменом Сомоги средняя концентрация глюкозы в день гипогликемии была относительно низкой, ее увеличение в последующие дни обусловливало повышение содержания гликозилированного гемоглобина
САХАРНЫЙ ДИАБЕТ У СОБАК 555
ков сахарного диабета (т.е. полиурии, полидипсии, полифагии и уменьшения веса тела) в сочетании с концентрацией сывороточного фруктозамина ниже 400 мкмоль/л, в отсутствие гипопротеинурии и гипоальбуминурии, возникает подозрение на феномен Сомоги (контррегуляцию глюкозы) (см. табл. 11-14). Повышенная концентрация фруктозамина (например, более 500 мкмоль/л) предполагает плохой контроль гликемии и необходимость коррекции дозы инсулина. Вместе с тем, такое повышение не позволяет установить причину расстройства (рис. 11-10). Прежде чем проводить коррекцию инсулинотерапии, необходимо провести серийное определение концентрации глюкозы в крови (см. раздел «Гликемическая кривая», стр. 556).
Определение концентрации гликозилированного гемоглобина в крови
Гликозилированный гемоглобин (Gly Hb) представляет собой гликозилированный белок, образующийся в процессе необратимого неферментативного и независимого от инсулина связывания глюкозы с гемоглобином в эритроцитах. Содержание Gly Hb в крови служит маркером средней концентрации глюкозы на протяжении периода жизни эритроцита в крови, который у собак составляет примерно ПО дней (Jain, 1993). Степень гликозилирования гемоглобина непосредственно зависит от концентрации глюкозы в крови: чем выше была концентрация глюкозы в течение последних 3-4 месяцев, тем выше содержание гликозилированного гемоглобина и наоборот. Для мониторинга эффективности лечения сахарного диабета у людей используют определение Gly Hb, а не фруктозамина. Это отчасти обусловлено тем обстоятельством, что больные диабетом самостоятельно контролируют концентрацию глюкозы в крови и ежедневно корректируют дозу инсулина, а определение Gly Hb позволяет оценить уровень гликемии на протяжении более длительного периода, чем определение фруктозамина (соответственно 3~4 месяца и 2-3 недели). В отличие от этого, у собак и кошек с сахарным диабетом для контроля уровня гликемии чаще оценивают концентрацию фруктозамина.
С одной стороны, соответствующие наборы коммерчески более доступны, а с другой, они удобнее для характеристики влияния изменений режима инсулинотерапии на качество компенсации диабета у раздражительных животных, так как концентрация фруктозамина изменяется быстрее, чем концентрация Gly Hb.
У собак и кошек имеются три фракции Gly Hb: основная, связывающая глюкозу фракция (Gly НЬА1с) и две минорные фракции, не обладающие связывающей способностью (Gly НЬА1а и Gly HbAlb) (Hasegawa et al, 1991, 1992). Для характеристики качества контроля гликемии у больных сахарным диабетом людей обычно измеряют концентрацию Gly НЬА1с, тогда как у собак и кошек оп
ределяют концентрацию либо всех трех фракций, т.е. общего Gly Hb (Elliott et al, 1997), или только Gly HbAlc (Marca et al, 2000; Marca, Loste, 2001). Показано, что большинство методов определения концентрации общего Gly Hb дают клинически достоверные результаты для оценки качества компенсации сахарного диабета (Mahaffey, Cornelius, 1982; Elliott et al, 1997). Однако у собак с острой гипергликемией некоторые методы определения общего Gly Hb могут дать завышенные результаты. Аналогичное исследование методов определения Gly НЬА|с для оценки качества контроля гликемии у собак с диабетом не проводилось.
Gly Hb определяют в цельной крови, которую собирают в пробирки с ЭДТА. При хранении проб крови в холодильнике в течение недели концентрация Gly Hb существенно не изменяется. У собак концентрацию Gly Hb в крови измеряли с помощью аффинной хроматографии (Wood, Smith, 1982; Elliott et al, 1997), колориметрического анализа (Mahaffey, Cornelius, 1981), высокоэффективной жидкостной хроматографии на ионообменниках (Hasegawa et al, 1991) и иммунотурбидометрического метода (Marca, Loste, 2001). Мы определяем общий Gly Hb методом аффинной хроматографии, так как получаемые при этом результаты не зависят от наличия острой гипергликемии (Elliott et al., 1997). Существующие методы определения Gly Hb разработаны для обследования людей. Поэтому прежде чем использовать их у собак, необходимо оценить достоверность определений и получить нормальные показатели для этих животных. Как показывает наш опыт, некоторые методы определения Gly Hb, особенно с использованием стационарного автоматического анализатора для быстрого измерения концентрации Gly НЬА1с у людей с сахарным диабетом, не обеспечивают требуемой точности анализа Gly Hb у собак и кошек. Любой фактор, изменяющий продолжительность жизни эритроцитов, может повлиять на результаты определения Gly Hb. При анемии и полицитемии можно получить соответственно ложно заниженные и завышенные величины (Elliott et al, 1997). При интерпретации результатов измерения уровня Gly Hb необходимо принимать во внимание показатель гематокрита.
В нашей лаборатории нормальными показателями содержания общего Gly Hb в крови собак при определении с помощью аффинной хроматографии считаются 1,7-4,9%. Этот диапазон установлен при анализе уровня Gly Hb у здоровых животных с устойчиво нормальной концентрацией глюкозы в плазме крови (Elliott et al, 1997). У собак с впервые выявленным сахарным диабетом содержание общего Gly Hb в крови колеблется от 6,0 до 15,5%. При интерпретации получаемых данных следует принимать во внимание тот факт, что даже при видимо адекватной компенсации диабета у собак нередко сохраняется гипергликемия (табл. 11-15). Большинство владельцев собак удовлетворены результатами инсулинотерапии, если содержание об-
556 • САХАРНЫЙ ДИАБЕТ У СОБАК
ТАБЛИЦА 11-15. ПОДГОТОВКА ПРОБ, МЕТОД ОПРЕДЕЛЕНИЯ И НОРМАЛЬНЫЕ КОНЦЕНТРАЦИИ ОБЩЕГО ГЛИКОЗИЛИРОВАННОГО ГЕМОГЛОБИНА В КРОВИ СОБАК В НАШЕЙ ЛАБОРАТОРИИ
Общий гликозилированный гемоглобин
Проба крови 1-2 мл цельной крови в ЭД ТА
Подготовка пробы До проведения анализа хра-
нить в замороженном виде
Метод Аффинная хроматография и
гемолизаты из эритроцитов собак
Факторы, влияющие на ре- Хранение при комнатной
зультаты анализа температуре (занижение результатов), хранение при 4° С больше 7 дней (занижение), анемия (гематокрит < 35%) (занижение)
Диапазон нормальных кон- От 1,7% до 4,9%
центраций Интерпретация результатов у собак с диабетом Высокоэффективный конт- От 4% до 5%
роль Хороший контроль От 5% до 6%
Удовлетворительный конт- От 6% до 7%
роль Неудовлетворительный кон- >7%
троль Продолжительная гипогли- <4%
кемия
щего Gly Hb в крови животных остается на уровне 4-6%. Величины выше 7% свидетельствуют о неадекватной компенсации диабета, а содержание общего Gly Hb более 8% указывает на серьезные недостатки лечения. Концентрации общего Gly Hb ниже 4% в отсутствие анемии предполагают наличие длительных периодов гипогликемии у собак с сахарным диабетом. В случаях повышения содержания общего Gly Hb, например, выше 7%, можно говорить о слабом контроле гликемии и необходимости коррекции доз инсулина. Вместе с тем, такое повышение не позволяет установить причину расстройства (рис. 11-10). Для того чтобы изменить дозы инсулина, следует провести серийные определения концентрации глюкозы в крови (см. раздел «Гликемическая кривая», правая колонка).
Мониторинг уровня глюкозы в моче
У собак с сахарным диабетом и рецидивирующими кетозом или гипогликемией полезно время от времени определять уровень сахара с моче с целью выявления устойчивой негативной гликозурии или кетонурии. Мы не рекомендуем владельцам животных ежедневно корректировать дозу инсулина в зависимости от результатов анализа утренних проб мочи, за исключением случаев, когда ее следует уменьшать при рецидивах гипогликемии и устойчивой негативной гликозурии. Наш опыт показывает, что осложнения, возникающие у собак с сахарным диабетом, в подавляющем большинстве случаев
обусловлены неправильными действиями владельцев, введенных в заблуждение результатами анализа утренних проб мочи. В связи с этим мы рекомендуем определять глюкозу в множественных пробах мочи, получаемых в течение суток или в вечерние часы (например, по выходным дням). У собак с хорошо компенсированным сахарным диабетом сахар в моче должен отсутствовать на протяжении большей части каждого 24-часового периода. Сохранение гликозурии в дневное и ночное время служит показателем неадекватной компенсации диабета и требует более полной оценки качества его контроля с использованием методов, описанных в данном разделе.
Гликемическая кривая
Если анамнестические данные, физикальное исследование, изменение веса тела и концентрация фруктозамина в крови предполагают необходимость изменения режима введения инсулина, следует построить гликемическую кривую с помощью серийных определений концентрации глюкозы в крови. Такая кривая служит ориентиром для внесения поправок в протокол инсулинотерапии, при условии что результаты измерения уровня глюкозы достаточно достоверны и не искажены сопутствующими стрессорными воздействиями, агрессивным поведением или возбуждением животного (см. стр. 619). Серийные измерения концентрации глюкозы в крови в обязательном порядке проводятся на начальных стадиях инсулинотерапии, а затем периодически для оценки эффективности лечения, даже если клиническое состояние животных в домашних условиях не вызывает беспокойства. Кроме того, такие определения необходимы для восстановления адекватного гликемического контроля у собак после появления клинических признаков гипергликемии или гипогликемии. Использование анамнестических данных, результатов физикального исследования, определения концентрации фруктозамина в сыворотке крови и взвешивания собаки, позволяет уточнить необходимость построения гликемической кривой и по возможности снизить количество серийных определений концентрации глюкозы в крови и, соответственно, венопункций, а также сокращает время пребывания животного в стационаре. Помимо этого, сводится к минимуму отрицательная реакция животного на повторное взятие крови (и, следовательно, стрессорное воздействие) и повышается вероятность получения значимых показателей уровня гликемии в процессе серийных определений концентрации глюкозы в крови.
Протокол построения гликемической кривой в условиях ветеринарной клиники. При оценке качества контроля гликемии ветеринарный врач должен придерживаться тех же режимов введения инсулина и кормления собаки, которые использует ее хозяин. Пробы крови для измерения концентрации глюкозы следует брать каждые 1-2 часа на
САХАРНЫЙ ДИАБЕТ У СОБАК • 557
Рис. 11-11. Средняя концентрация глюкозы в крови у 8 собак с сахарным диабетом после введения НПХ инсулина (время инъекции указано стрелкой) и кормления равными объемами еды в 8 часов утра и 6 часов вечера (сплошная линия) либо в отсутствие кормления (пунктирная линия); сбор проб производился на протяжении 24 часов. ( Из: Nelson RW, Couto CG: Essentials of Small Animal Internal Medicine. St.Louis, Mosby-Year Book, 1992, p 572).
протяжении суток. Если собака ест небольшими порциями, хозяин должен кормить ее дома, а не в клинике. Отсутствие у животных аппетита сильно сказывается на результатах серийных определений концентрации глюкозы (рис. 11-11). Если обычное время введения инсулина собаке падает на период менее 1 часа до ее поступления в клинику, то хозяин должен произвести инъекцию уже в стационаре (используя свои собственные шприц и инсулин) после первоначального определения концентрации глюкозы. Помощник ветеринарного врача должен внимательно проконтролировать всю процедуру введения инсулина. Если владелец собаки обычно вводит ей инсулин до 6.00, то он должен доставить ее в клинику к началу приема. Важно сохранить рутинную процедуру повседневного общения с собакой и не рисковать получить недостаточно точные результаты определения концентрации глюкозы в крови из-за потери собакой аппетита в условиях ветеринарной клиники или введения инсулина в необычное время. Исключение составляют случаи, когда клиницист хочет убедиться в правильности проведения инъекций владельцем животного с использованием инсулина, а не физиологического раствора.
Концентрацию глюкозы в крови обычно определяют с помощью стационарного анализатора или портативных глюкометров. Имеющиеся в продаже модели глюкометров дают результаты, весьма близкие к получаемым стандартными методами (например, глюкозооксидазным или гексокиназным), хотя могут систематически завышать или занижать истинный уровень глюкозы (рис. 11-12; Cohn et al, 2000; Wess, Reusch, 2000a). Наш опыт показывает, что большинство портативных приборов обычно дают заниженные результаты определения глюкозы по сравнению со стандартными методами. Это может приводить к неправильной постановке диагноза гипогликемии или создавать ошибочное впе
чатление, что качество контроля гликемии лучше, чем на самом деле. В результате такой «ошибки» будет предписана слишком низкая доза инсулина, что приведет к сохранению клинической симптоматики заболевания, несмотря на «приемлемые» результаты определения концентрации глюкозы.
Серийные измерения концентрации глюкозы в крови через каждые 1-2 часа на протяжении суток дают возможность клиницисту установить эффективность инсулинотерапии, определить время снижения уровня глюкозы до минимальной величины, время максимального действия инсулина и его продолжительность, а также амплитуду колебаний концентрации глюкозы у животного. Однократное или двукратное измерение концентрации глюкозы не дает достоверной информации для оценки эффективности используемой дозы инсулина (рис. 11-13). Неудовлетворительная компенсация сахарного диабета на протяжении длительного периода нередко является следствием неправильной оценки действия инсулина на основании результатов всего одного или двух измерений концентрации глюкозы.
В идеале, целью инсулинотерапии сахарного диабета у собак является поддержание концентрации глюкозы в крови на уровне 100-250 мг/100 мл как в дневное, так и в ночное время. Но это очень трудная, а в отдельных случаях невыполнимая задача. Принимая окончательное решение о необходимости коррекции инсулинотерапии, всегда следует учитывать отзывы хозяина о состоянии и поведении животного в домашних условиях в сочетании с результатами физикального исследования, изменениями веса тела и концентрации фруктозамина, а также данными серийных определений концентрации глюкозы в крови. Состояние многих собак с сахарным диабетом остается удовлетворительным, несмотря на устойчивую концентрацию глюкозы в крови почти 200 мг/100 мл и даже несколько выше 300 мг/100 мл.
Протокол построения гликемической кривой в домашних условиях. Гипергликемия, вызванная стрессорным воздействием, либо связанная с агрессивным поведением или возбуждением животного, является единственной серьезной проблемой, осложняющей построение гликемической кривой по результатам серийных определений концентрации глюкозы в крови, особенно у кошек. Стресс ослабляет действие инсулина, вследствие чего концентрация глюкозы остается повышенной, несмотря на присутствие в крови адекватного количества гормона. Это служит причиной передозировки экзогенного инсулина и, как следствие, гипогликемии, феномена Сомоги и неудовлетворительного качества контроля гликемии. Наиболее мощными факторами, индуцирующими стрессорную гипергликемию, являются госпитализация и множественные венопункции. Альтернативой построению гликемической кривой в условиях ветеринарной клиники служит проведение аналогичной процедуры в домашних условиях. Для этой цели берут
558
САХАРНЫЙ ДИАБЕТ У СОБАК
Разница (ммоль/л) i । । 1 1 1 । । । 1 i । 1 i i i i А •
••••> Ух " ’• • •••••! « е
1 2 4 6 8 10 12 14 16 18 20 22 24 26 28 3 Референтный метод (ммоль/л) 0
ГО
s г
8-r
7-
6-
5-
4-
3-
2-
1-
0"
г»
-3'
-4'
-5'
-6-
-7-
-8-t—I—I—।—।—।—I—।—t—।—।—i—i—г—т—
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30
Референтный метод (ммоль/л)
Рис. 11-12. Разброс расхождений данных при определениях концентрации глюкозы с помощью четырех портативных глюкометров и стандартным методом в сопоставлении с ее определением референтным методом в пробах крови 170 собак. ( Из: Wess G, Reusch С: Evaluation of five portable blood glucose meters for use in dogs. JAVMA, 216:203, 2000).
серийные пробы крови посредством прокола уха или губы животного и определяют в них концентрацию глюкозы с помощью портативного бытового глюкометра. При этом используются тест-полоски, кончиком которых хозяин собаки или кошки касается капли крови на ухе или губе животного (Wess, Reusch, 2000b). Обычно эту методику применяют, когда результаты измерения концентрации глюкозы в крови, полученные в условиях стационара, вызывают сомнение. Более подробная информация о мониторинге уровня гликемии в домашних условиях приведена на стр. 618.
Интерпретация гликемической кривой. Результаты серийных определений концентрации глюкозы в крови позволяют ветеринару оценить эффективность и продолжительность действия введенного инсулина (рис. 11-14). В идеале, все показатели, полученные между двумя инъекциями инсулина, должны оставаться в пределах диапазо
на от 100 до 250 мг/100 мл. Обычно концентрация глюкозы повышается до максимальной величины ко времени каждой очередной инъекции инсулина, однако такое случается далеко не всегда.
Наиболее важная информация, получаемая при серийных определениях концентрации глюкозы в крови, включает эффективность действия инсулина, его продолжительность и степень максимального снижения уровня глюкозы. В первую очередь оценивают, обеспечивает ли инсулин понижение концентрации глюкозы. При оценке эффективности инсулина принимают во внимание дозу инсулина, максимальную концентрацию глюкозы в плазме крови и гликемический дифференциал, т.е. разницу между максимальной и минимальной концентрациями глюкозы. Например, разница между максимальной и минимальной концентрациями глюкозы порядка 50 мг/100 мл считается приемлемой, если уровень гликемии колеблется в пределах от 120
сахарный диабет у собак
559
Концентрация глюкозы в крови (мг/100 мл)
Рис. 11-13. Гликемические кривые, полученные у таксы, которой вводили рекомбинантный человеческий инсулин ленте в дозе 0,8 ЕД/кг дважды в день (сплошная линия), карликового пуделя, получавшего рекомбинантный человеческий инсулин ленте в дозе 0.6 ЕД/кг дважды в день (пунктирная линия), терьера-метиса, получавшего рекомбинантный человеческий инсулин ленте в дозе 1,1 ЕД/кг дважды в день (точечная линия). Собак кормили и вводили им инсулин в 8 часов утра. Анализ гликемических кривых свидетельствует о короткой продолжительности действия инсулина у таксы, занижении его дозы у карликового пуделя и на-зичии феномена Сомоги у терьера-метиса. Обратите внимание, что концентрация глюкозы в 14.00 и 16.00 у всех трех собак была практически одинаковой, и ее определение в эти сроки не имело диагностической ценности. (Из: Nelson RW, Couto CG: Small Animal Internal Medicine, 3d ed., St. Louis. Mosby Inc., 2003, p 741).
пределить концентрацию руктозамина в сыворотке
Какова была минимальная концентрация глюкозы?
>14 часов
I
> 500 мкмоль/л
< 450 мкмоль/л
______________
Возможны феномен Сомоги или стрессовая гипергликемия
Перейти на двукратное в течение суток введение инсулина короткого действия, перейти на инъекции используемого инсулина один раз в день
।------------------------
Какова доза инсулина?
< 1,0 ЕД/кг
1 ЕД/кг
Возможны занижение дозы инсулина, феномен Сомоги и причины неэффективности инсулина (см табл. 11-16)
Увеличить дозу инсулина и повторить определение глюкозы через 7-14 дней
В отсутствие улучшения возможны феномен Сомоги и факторы, снижающие эффективность инсулина (см. табл. 11-16)
Повторить определение глюкозы спустя 7-14 дней
[ <450
мкмоль/л
_1______,
Изменение отсутствует
>500 мкмоль/л
I— III. — ---ш
♦
Возможны феномен Сомоги или низкая доза инсулина
Повторить определение глюкозы спустя 7-14 дней
Рис. 11-14. Алгоритм интерпретации результатов серийных определений концентрации глюкозы в плазме крови для построения гликемической кривой. ( Из: Nelson RW Couto CG: Small Animal Internal Medicine. 3d ed., St. Louis, Mosby Inc, 2003, p 742).
560 • САХАРНЫЙ ДИАБЕТ У СОБАК
до 170 мг/100 мл, но неприемлема, когда уровень гликемии составляет 350-400 мг/100 мл. Точно так же, разница между максимальной и минимальной концентрациями глюкозы в 100 мг/100 мл служит показателем эффективности действия инсулина, если последний вводится в дозе 0,4 ЕД/кг веса тела, но предполагает наличие инсулинорезистентности при дозе 2,2 ЕД/кг.
Причиной недостаточно эффективного снижения концентрации глюкозы в крови может быть низкая доза инсулина, что вызывает необходимость дифференцировать истинное отсутствие эффекта от резистентности к инсулину (см. раздел «Рецидивирующие или устойчивые клинические симптомы», стр. 564). В принципе, для собак с сахарным диабетом заниженной считается доза инсулина менее 1,0 ЕД/кг, а при дозах от 1,0 до 1,5 ЕД/кг на одну инъекцию возможны как занижение дозы, так и инсулинорезистентность. Ветеринар всегда должен принимать во внимание возможность феномена Сомоги, особенно у собак миниатюрных и карликовых пород, а также учитывать воздействие стресса на результаты определения концентрации глюкозы в крови.
Если установлено, что инсулин эффективно понижает уровень глюкозы в крови, то оценивают следующий параметр - величину максимального уменьшения концентрации глюкозы (т.е. ее минимальную концентрацию). В идеальном случае она должна снижаться до 100-125 мг/100 мл. Если минимальная концентрация глюкозы превышает 150 мг/100 мл, следует увеличить дозу инсулина, а при минимальной концентрации 80 мг/100 мл или ниже - уменьшить дозу. В последнем случае дозу инсулина обычно понижают на 10-25%. При необходимости введения собаке большого количества инсулина (например, более 2,2 ЕД/кг на инъекцию), возможно наличие сопутствующих феномена Сомоги или инсулинорезистентности. В этой ситуации может потребоваться повторное диагностическое обследование для установления причины резистентности (см. стр. 571) и/или возобновление инсулинотерпии в дозе, первоначально назначавшейся для снижения концентрации глюкозы (см. стр. 538). Эффективность контроля гликемии снова оценивают спустя 7-14 дней после начала введения новой дозы инсулина, корректируя ее по мере необходимости.
Продолжительность действия инсулина оценивают в тех случаях, когда минимальная концентрация глюкозы в крови превышает 80 мг/100 мл, а введение инсулина не сопровождается быстрым снижением уровня гликемии. Оценка не проводится при минимальной концентрации глюкозы ниже 80 мг/100 мл или в случае ее быстрого уменьшения из-за возможной индукции феномена Сомоги, которая может привести к ложному уменьшению длительности действия инсулина (см. стр. 565).
Продолжительность эффекта инсулина грубо определяется как время с момента его инъекции
Рис. 11-15. А. Гликемическая кривая пуделя-метиса, получавшего рекомбинантный человеческий инсулин НПХ в дозе 1,1 ЕД/кг дважды в день ( сплошная линия). Инсулин вводили в 8 часов утра, корм давали в 8 часов утра и в 6 часов вечера. К полночи возобновлялась гипергликемия (концентрация глюкозы превышала 225 мг/100 мл). Продолжительность действия инсулина составляла приблизительно 17 часов. Перевод животного на комбинированный ультраленте инсулин свиньи и крупного рогатого скота в дозе 1,3 ЕД/кг раз в день приводил к улучшению гликемического контроля (пунктирная линия). Б. Гликемическая кривая терьера-метиса, получавшего комбинированный НПХ инсулин свиньи и крупного рогатого скота в дозе 1,0 ЕД/кг (сплошная линия). Инсулин вводили в 8 часов утра, корм давали в 8 часов утра и в 6 часов вечера. Обратите внимание на уровень глюкозы в крови после кормления. Примерно к 9 часам вечера возобновлялась гипергликемия (концентрация глюкозы более 225 мг/100 мл). Продолжительность действия инсулина составляла приблизительно 13 часов.
Перевод животного на комбинированный ультраленте инсулин свиньи и крупного рогатого скота в дозе 1,3 ЕД/кг дважды в день с 12-часовыми интервалами и кормление одновременно с инъекциями приводили к улучшению контроля гликемии (пунктирная линия). (Из: Nelson RW, Couto CG. Essentials of Small Animal Internal Medicine. St. Louis, Mosby-Year Book, 1992, p 570 ).
до максимального снижения концентрации глюкозы и затем до ее очередного подъема выше 200-250 мг/100 мл (рис. 11-15). Продолжительность действия инсулинов ленте и НПХ почти у 90% собак с сахарным диабетом составляет 10-14 часов, что диктует необходимость их двукратного введения на протяжении суток. Если продолжительность действия инсулина не превышает 10 часов, у собак обычно сохраняются клинические симптомы диабета (см. стр. 567). Если же она больше 14 часов, а инъекции инсулина производятся дважды в день, то могут развиться гипогликемия и феномен Сомоги (рис. 11-16).
САХАРНЫЙ ДИАБЕТ У СОБАК
561
Концентрация глюкозы в крови (мг/100 мл)
Рис. 11-16. Кривые концентрации глюкозы в крови у 3 собак с сахарным диабетом, получавших рекомбинантный человеческий инсулин ленте дважды в день, которые иллюстрируют разную продолжительность его действия у отдельных собак. У всех животных инсулин эффективно снижал концентрацию глюкозы до минимальной величины от 100 до 175 мг/100 мл. Однако продолжительность действия инсулина у одной из собак с удовлетворительным контролем гликемии составляла примерно 12 часов (идеальная продолжительность; сплошная линия), а у другой с устойчиво неудовлетворительным контролем - 8 часов (слишком короткое действие; точечная линия). Третья собака имела в анамнезе дни с эффективным и неэффективным контролем уровня гликемии; у нее продолжительность действия инсулина превышала 12 часов, т.е. была чрезмерно большой, а данные анамнеза предполагали наличие феномена Сомоги (пунктирная линия). (Из: Nelson RW, Couto CG: Small Animal Internal Medicine, 3d ed., St. Louis, Mosby Inc., 2003, p. 743 ).
Нередко при смене типа инсулина приходится одновременно менять и дозу гормона. Необходимость коррекции дозы инсулина диктуется не только самим фактом применения препарата нового типа, но и иной степенью снижения уровня глюкозы в крови до минимальной величины после его введения. Инсулины длительного действия, такие как ультраленте, ПЦИ или гларгин, обладают не столь мощным действием, как препараты с промежуточной продолжительностью действия (например, НПХ или ленте). Для сопоставимого уменьшения концентрации глюкозы в крови доза инсулина, обладающего относительно слабой активностью, должна быть больше, чем доза высоко активного инсулина (см. рис. 12-11, стр. 602). При переходе с более активного на менее активный препарат дозу инсулина обычно не меняют, если минимальная концентрация глюкозы в крови составляет от 80 до 120 мг/100 мл, а если она превышает 120 мг/100 мл, то дозу увеличивают приблизительно на 10%. При замене менее активного инсулина на более активный препарат дозу повышают примерно на 10%, если минимальная концентрация глюкозы не опускается ниже 150 мг/100 мл, не изменяют дозу, когда минимальный уровень гликемии составляет 120-150 мг/100 мл, и уменьшают дозу на 10% при
минимальной концентрации глюкозы от 80 до 120 мг/100 мл. Через 7-14 дней после начала лечения новым типом инсулина оценивают его эффект и в зависимости от полученного результата корректируют дозу.
Воспроизводимость гликемической кривой. Воспроизводимость гликемической кривой зависит от индивидуальных особенностей животного. У некоторых собак результаты серийных определений концентрации глюкозы в крови значительно отличаются в разные дни или месяцы. Характер этих колебаний отчасти зависит от количества вводимого инсулина и интенсивности его абсорбции из места подкожного введения, а также от взаимосвязи между активностью инсулина, составом рациона, физическими нагрузками, стрессорными воздействиями, эмоциональным состоянием животного, сопутствующим заболеванием и секрецией контррегуляторных гормонов (в частности, глюкагона, адреналина, кортизола и гормона роста). У других собак результаты серийных определений концентрации глюкозы изо дня в день и из месяца в месяц остаются относительно постоянными. Отсутствие такого постоянства затрудняет работу многих ветеринаров, но оно отражает непосредственное воздействие всех факторов, влияющих на концентрацию глюкозы в крови при сахарном диабете. С целью уменьшения этого влияния больным диабетом людям рекомендуется ежедневный самоконтроль уровня гликемии и соответствующая коррекция дозы инсулина. Несомненно, что в будущем, по мере совершенствования методов мониторинга гликемии в домашних условиях, аналогичный подход будет все чаще использоваться при лечении собак и кошек. В настоящее время первоначальная оценка качества контроля гликемии основывается на мнении хозяина о состоянии здоровья животного и результатах периодического обследования. Серийные определения концентрации глюкозы показаны в случаях неудовлетворительного контроля гликемии. Цель серийных измерений - получить представление о действии инсулина у животных с диабетом и, в идеале, выяснить причину слабой компенсации диабетических расстройств (например, слишком короткая продолжительность действия инсулина).
Мы предпочитаем модифицировать режим инсулинотерапии на основании результатов единственной гликемической кривой. При первоначальной оценке результатов коррекции инсулинотерапии мы обычно полагаемся на отзывы хозяев относительно клинической реакции их питомцев на введение инсулина и на изменение концентрации фруктозамина в сыворотке (см. стр. 553). В тех случаях, когда не удается добиться желаемого эффекта, мы повторяем серийное определение концентрации глюкозы, однако редко проводим его на протяжении нескольких последовательных дней, так как такие измерения способствуют развитию стрес-сорной гипергликемии. Кроме того, информация,
562 • САХАРНЫЙ ДИАБЕТ У СОБАК
содержащаяся в предшествовавшей гликемической кривой, никогда не воспроизводится при повторных измерениях, особенно если они проводятся с интервалом в несколько недель и даже месяцев или когда у собаки имеются рецидивы клинических симптомов. Всякий раз при получении гликемической кривой следует придерживаться принятого протокола серийных измерений концентрации глюкозы в крови.
Значение концентрации фруктозамина в сыворотке крови при агрессивном поведении, возбуждении и стрессе у собак
Гликемическая кривая, полученная у животных в состоянии возбуждения, при агрессивном поведении или в условиях стресса, содержит недостоверную информацию, поскольку может отражать состояние индуцированной гипергликемии. В этих случаях клиницист должен выяснить возможную причину отсутствия гипогликемического действия инсулина (например, неправильный выбор типа препарата или его дозы), произвести соответствующую коррекцию режима терапии и оценить ее последствия, исходя из изменения концентрации фруктозамина в сыворотке крови. Более подробные сведения об использовании результатов измерения концентрации фруктозамина у животных с сахарным диабетом и индуцированной стрессом гипергликемии можно найти на стр. 619.
ИНСУЛИНОТЕРАПИЯ ПРИ ХИРУРГИЧЕСКОЙ ОПЕРАЦИИ
При показаниях к хирургическому лечению операцию собаки с сахарным диабетом следует отложить до стабилизации ее клинического состояния и достижения адекватной компенсации диабета с помощью инсулинотерапии. Исключение составляют случаи, когда операция необходима для устранения причины резистентности к инсулину (например, овариогистерэктомия у сук в диэструсе) или для спасения животного в угрожающей жизни ситуации. Хирургическая операция на собаке с хорошо компенсированным сахарным диабетом сама по себе не более опасна, чем у животных без диабета. Фактором риска является лишение пищи в перио-перационном периоде на фоне продолжающегося введения инсулина. Кроме того, стрессорное воздействие оказывает анестезия, а операция индуцирует высвобождение диабетогенных гормонов, которые, в свою очередь, провоцируют кетогенез (см. гл. 13, стр. 635). В периоперационном периоде следует продолжать инъекции инсулина с целью предотвращения тяжелой гипергликемии и снижения до минимума образования кетонов. Для профилактики гипогликемии на фоне прекращения кормления в периоперационном периоде уменьшают дозу инсулина и, в случае необходимости, производят
внутривенное вливание декстрозы. Для коррекции выраженной гипергликемии (т.е. повышения концентрации глюкозы в крови до 300 мг/100 мл и более) вводят обычный кристаллический инсулин в форме внутримышечных инъекций или непрерывной внутривенной инфузии. Частый контроль уровня глюкозы и соответствующая коррекция режима инсулинотерапии необходимы для профилактики гипогликемии и тяжелой гипергликемии на протяжении периоперационного периода.
Мы используем следующий протокол в периоперационном периоде. За день до операции собака или кошка получает обычную дозу инсулина и привычный корм. Кормление прекращается после 22.00. На следующее утро до инъекции инсулина измеряется концентрация глюкозы в крови. Если она не превышает 100 мг/100 мл, инъекция отменяется, однако, производится внутривенная инфузия 2,5% или 5%-ного раствора декстрозы. Если концентрация глюкозы составляет 100-200 мг/100 мл, вводят четверть обычной для данного животного дозы инсулина и начинают внутривенно вливать раствор декстрозы. Если же концентрация глюкозы выше 200 мг/100 мл, вводят половину обычной дозы инсулина и внутривенную инфузию декстрозы не начинают до тех пор, пока концентрация глюкозы не опустится ниже 150 мг/100 мл. Во всех трех случаях уровень глюкозы определяют через каждые 30-60 мин на протяжении операции. Цель всех этих процедур состоит в поддержании концентрации глюкозы в плазме крови на уровне 150-250 мг/100 мл в течение всего периоперационного периода. Для предотвращения или устранения гипогликемии и тяжелой гипергликемии проводят соответственно внутривенную инфузию 2,5% или 5%-ного раствора декстрозы или периодические инъекции кристаллического инсулина. В тех случаях, когда концентрация глюкозы в плазме крови превышает 300 мг/100 мл, вливание декстрозы следует прекратить и спустя 30 и 60 мин повторно измерить уровень глюкозы. Если он остается выше 300 мг/100 мл, внутримышечно вводят кристаллический инсулин в дозе, эквивалентной приблизительно 20% инсулина длительного действия, который до этого обычно использовался в домашних условиях. Последующие инъекции кристаллического инсулина следует производить не чаще чем каждые 4 часа, корректируя дозу по результатам определения концентрации глюкозы после первой инъекции.
На следующий день после хирургической операции собаку или кошку обычно переводят на режим инсулинотерапии и кормления, который был принят в предоперационном периоде. Если животное не в состоянии принимать пищу, производят внутривенную инфузию раствора декстрозы и каждые 6-8 часов внутривенно вводят кристаллический инсулин. После возобновления самостоятельного питания используют рутинные режимы инсулинотерапии и кормления.
сахарный диабет у собак
563
ОСЛОЖНЕНИЯ ИНСУЛИНОТЕРАПИИ
Симптоматическая и бессимптомная гипогликемия
Гипогликемия - обычное осложнение инсулинотерапии. Она может быть симптоматической или бессимптомной. У собак и кошек, страдающих сахарным диабетом, бессимптомная гипогликемия бывает чаще, чем симптоматическая. Симптоматическая гипогликемия обычно развивается после резкого повышения дозы инсулина, при перекрывании действия избыточных доз инсулина, вводимых дважды в день во время необычно интенсивной физической нагрузки и после долгого отсутствия аппетита. В этих ситуациях тяжелая гипогликемия может развиться прежде, чем проявится профилактический или компенсаторный эффект контррегуляторных факторов (таких как глюкагон, кортизол, адреналин и/или гормона роста). Симптомы гипогликемии включают сонливость, общую слабость, наклонение головы, атаксию, судороги и кому. Частота и тяжесть этих клинических проявлений зависят от скорости понижения концентрации глюкозы в крови и тяжести гипогликемии. Симптоматическая гипогликемия купируется введением глюкозы в составе корма и сахарной воды либо внутривенной инфузией раствора декстрозы (см. гл. 14, стр. 702). Следует указать владельцу животного на необходимость прекратить вводить инсулин при появлении симптомов гипогликемии до возобновления гипергликемии и гликозурии. Для регистрации появления гликозурии хозяин собаки должен определять содержание сахара в ее моче в домашних условиях. Последующая коррекция дозы инсулина производится достаточно произвольно. Как правило, сначала ее уменьшают на 25-50%, а затем вносят необходимые поправки в режим терапии, исходя из клинической картины и концентрации глюкозы в плазме крови. Отсутствие гликозурии после эпизода гипогликемии предполагает возвращение собаки в состояние инсулинонезависимого диабета или нарушение контррегуляторных механизмов (см. ниже).
Асимптотическую гипогликемию обычно обнаруживают при проведении серийных определений концентрации глюкозы с целью построения гликемической кривой. Концентрация фруктозамина менее 350 пмоль/л (нормальный диапазон 225-365 мкмоль/л) также свидетельствует о наличии гипогликемии. В то же время отсутствие признаков гипогликемии при серийных определениях концентрации глюкозы или при снижении концентрации фруктозамина до нижней границы нормы не исключают наличия ее асимптоматической формы, отчасти из-за индуцируемого ею явления контррегуляции (феномена Сомоги) и преходящей инсули-норезистентности (см. стр. 565). Для устранения асимптоматической гипогликемии уменьшают дозу инсулина (обычно на 10-20%) и оценивают последующую клиническую реакцию наряду с измене
ниями концентрации фруктозамина и глюкозы в сыворотке крови (в отсутствие стресса).
Если эпизоды гипогликемии повторяются несмотря на снижение дозы инсулина, возможно, имеет место перекрывание эффектов последовательных инъекций инсулина или снова развивается инсулинонезависимый сахарный диабет. Перекрывание эффектов инсулина происходит, когда действие каждой из двух ежедневно вводимых больному животному доз сохраняется гораздо дольше 12 часов (см. стр. 568). Подозрение на переход ИЗСД в ИНЗСД возникает в том случае, если устойчивая гипогликемия сохраняется на фоне введения низких доз инсулина один раз в день, концентрация глюкозы в крови до инъекции ниже 200 мг/100 мл, а концентрация фруктозамина ниже 350 мкмоль/ л или определение глюкозы в моче с помощью тест-полосок дает отрицательные результаты. Эти показатели свидетельствуют о поступлении инсулина в кровяное русло из эндогенного источника, сохранении части панкреатических бета-клеток или наличии сопутствующего заболевания, которое вызывает транзиторную инсулинорезистентность. Спонтанное исчезновение инсулинозависимого состояния - редкое явление у собак и обычно служит показателем вторичного диабета (см. стр. 532).
Нарушение контррегуляции глюкозы. Секреция диабетогенных гормонов, в первую очередь адреналина и глюкагона, стимулирует высвобождение глюкозы из печени и помогает нейтрализовать тяжелую гипогликемию. У людей нарушенный контррегуляторный ответ на гипогликемию выявляется в течение первого года после диагноза ИЗСД (White et al, 1983). Вследствие этого, когда концентрация глюкозы в крови приближается к 60 мг/100 мл, компенсаторная реакция организма на увеличение концентрации сахара в крови отсутствует и развивается продолжительная гипогликемия. Ослабление контррегуляторного ответа на гипогликемию показано и у собак с ИЗСД (Duesberg et al, 1955). При нарушении контррегуляции глюкозы при диабете гипогликемия представляет собой значительно более серьезную проблему, чем при нормальной контррегуляции. Ухудшение контррегуляции глюкозы можно подозревать у собак с диабетом, отличающихся исключительно высокой чувствительностью к низким дозам инсулина или затяжной гипогликемией после введения инсулина в приемлемых дозах.
Отсутствие аппетита. Здоровые собаки и кошки, а также животные с хорошо компенсированным сахарным диабетом имеют прекрасный аппетит.
Отказ от предлагаемого корма сам по себе не может служить показанием к отмене инсулинотерапии. Большинство собак и кошек с сахарным диабетом берут корм в течение двух часов после инъекции инсулина, когда концентрация глюкозы в их крови начинает снижаться. Если же у них отсутствует аппетит или развиваются другие симптомы дисфункции органов желудочно-кишечного тракта
564 • САХАРНЫЙ ДИАБЕТ У СОБАК
(например, рвота), следует откорректировать режим терапии или отменить ее до осмотра животного ветеринаром. Наиболее обычными причинами уменьшения аппетита у собак и кошек с сахарным диабетом служат панкреатит, кетоацидоз, бактериальная инфекция (особенно распространяющаяся на мочевые пути), новообразования, разборчивость в еде и однообразный рацион, содержащий волокнистые продукты. На основании результатов физикального исследования назначают соответствующие диетические и терапевтические режимы.
Рецидивирующие или устойчивые клинические симптомы
Рецидивирующие или устойчивые клинические симптомы сахарного диабета, такие как полиурия, полидипсия, полифагия и потеря веса, очевидно, являются самыми распространенными «осложнениями» инсулинотерапии у собак с диабетом. Сохранение устойчивой клинической симптоматики или ее рецидивов предполагает слабую эффективность инсулина либо резистентность к инсулину. Низкая эффективность инсулинотерапии у собак с сахарным диабетом обычно обусловлена слабой биологической активностью экзогенного гормона или нарушением правил его введения владельцами животных, неправильным выбором вида и дозы инсулина, частоты его инъекций или нарушением чувствительности животного к инсулину вследствие сопутствующих воспаления, инфекционного заболевания, неопластического процесса либо гормонального расстройства (т.е. инсулинорезистентности). Следует учитывать и возможность неправильного выбора критериев оценки контроля гликемии, что может приводить к ошибочному заключению о неадекватной компенсации диабета. Часто такой вывод делается на основании завышенных результатов определения концентрации глюкозы в крови, предполагающих слабую эффективность инсулинотерапии. Такие завышенные данные обычно получают у собак, испытывающих стрессорное воздействие, однако, они не отражают истинную чувствительность животного к инсулину (см. стр. 620). При обследовании собаки с подозрением на ослабленную реакцию на инсулин важно критически проанализировать все параметры, используемые для оценки качества контроля гликемии. При этом особое внимание следует обратить на отзывы владельца о состоянии и поведении животного в домашних условиях, результаты физикального исследования и изменения веса тела (см. раздел «Мониторинг компенсации диабета», стр. 552). Если данные анамнестического анализа, физикального исследования, повторного взвешивания и определения фруктозамина свидетельствуют о плохой компенсации диабета, следует выяснить причины этого, начиная с оценки техники введения инсулина хозяином животного и биологической активности используемого препарата.
Проблемы, связанные с введением инсулина хозяином животного и активностью препарата. Использование биологически неактивного инсулина (например, с просроченным сроком действия, хранившимся в теплом месте или перемешанного встряхиванием) и шприцов, не соответствующих концентрации препарата (например, шприца U-100 с U-40 инсулином), либо нарушение техники его введения (из-за неумения обращаться со шприцом и правильно делать инъекции) служит причиной неадекватных дозировок инсулина. Это объясняет устойчивость и рецидивы клинической симптоматики сахарного диабета у ряда животных, а также повышение концентраций фруктозамина и глюкозы в их крови. Проблемы, возникающие в связи с неправильным введением инсулина или использованием биологически неактивных препаратов, выявляются и устраняются соответственно путем проверки действий хозяев животных при проведении инъекций и назначением нового, неразбавленного препарата инсулина с последующим повторным измерением концентрации глюкозы в крови на протяжении суток. Кроме того, исследуют кожную и подкожную ткань из мест введения инсулина. У некоторых собак с диабетом в местах хронических инъекций развиваются слабое воспаление, отек или утолщение дермиса и подлежащих тканей; эти изменения могут сопровождаться нарушениями всасывания инсулина после его подкожного введения (см. раздел «Аллергические реакции на инсулин», стр. 571).
Замораживание или нагревание приводит к инактивации инсулина во флаконе. Хотя при «комнатной температуре» инактивации не происходит, мы рекомендуем владельцам животных хранить препараты инсулина в дверце холодильника в условиях постоянства окружающей среды. Общим правилом инсулинотерапии сахарного диабета у людей является замена старого флакона с инсулином на новый раз в месяц, дабы исключить применение препаратов с пониженной активностью и/или нарушенной стерильностью. Некоторые ветеринары предлагают придерживаться аналогичной практики в отношении инсулинов для собак и кошек. Мы не наблюдали клинически значимой потери активности инсулина при его хранении в постоянных условиях (т.е. в холодильнике) и при соблюдении правил применения. Поэтому мы обычно не рекомендуем нашим клиентам ежемесячно покупать новый флакон инсулина, особенно когда состояние собаки или кошки с диабетом остается удовлетворительным. Тем не менее, мы проверяем активность инсулина во вновь приобретенном флаконе в тех случаях, когда у собаки или кошки развивается рецидив симптоматики сахарного диабета, особенно если владелец животного использовал более 75% имеющегося у него препарата.
Разведение инсулина - это широко распространенная практика, в первую очередь, с целью получения его очень малых доз для собак и кошек
САХАРНЫЙ ДИАБЕТ У СОБАК
565
с невысокой потребностью в экзогенном гормоне. Хотя в литературе отсутствуют сведения об исследовании сроков годности разбавленных инсулиновых препаратов, мы рекомендуем производить их замену через каждые 4-8 недель. Даже при выполнении всех предписаний по разведению и технике инъекций некоторые животные получают недостаточное количество инсулина при использовании разведенных препаратов. Этот недостаток устраняется назначением препаратов, обладающих полной биологической активностью. Для собак, которым назначены низкие дозы инсулина, следует использовать шприцы U-100 на 0,3 мл с инсулином U-100, обладающим полной биологической активностью.
Проблемы, связанные с режимом инсулинотерапии. Самыми распространенными факторами, обусловливающими недостаточно эффективный контроль гликемии, являются занижение дозировок инсулина, феномен Сомоги, уменьшение продолжительности действия инсулинов ленте и НПХ, а также однократное на протяжении суток введение инсулина. В этих случаях следует пересмотреть применяемый режим введения инсулина и внести в него необходимые изменения с целью повышения эффективности терапии, особенно если по данным анамнеза и физикального исследования у животного нет сопутствующего заболевания, вызывающего резистентность к инсулину.
Занижение доз инсулина
У большинства собак, получающих инсулин в дозах менее 1,0 ЕД/кг веса тела дважды в день, удается добиться адекватного контроля уровня гликемии. Неправильно выбранная доза в сочетании с ее введением один раз на протяжении суток служит наиболее частой причиной сохранения устойчивой клинической симптоматики. Обычно дозы инсулина менее 1,0 ЕД/кг, вводимые дважды в день, считаются заниженными. При подозрении на занижение дозы ее следует постепенно увеличить до 1-5 единиц на инъекцию (в зависимости от размера собаки). Результат изменения дозы оценивается на основании отзыва хозяина о клинической реакции животного, измерения концентраций фруктозамина и серийных определений концентрации глюкозы в крови. Если контроль уровня глюкозы остается неудовлетворительным даже при дозах инсулина более 1,0-1,5 ЕД/кг на инъекцию при введении его через каждые 12 часов, следует установить другие причины отсутствия ожидаемого эффекта терапии и/или резистентности к инсулину. Однако при увеличении доз инсулина существует опасность развития гипогликемии и феномена Сомоги, особенно у собак карликовых и миниатюрных пород (см. ниже). Риск их развития можно свести к минимуму путем постепенного повышения дозы инсулина и тщательного мониторинга эффекта терапии.
Передозировка инсулина и контррегуляция глюкозы (феномен Сомоги)
Высокие дозы инсулина могут вызвать выраженную гипогликемию и индуцировать контррегуляцию глюкозы (феномен Сомоги) и преходящую инсулинорезистентность. Феномен Сомоги развивается как следствие естественной физиологической реакции на гипогликемию, индуцированную избыточным количеством инсулина. Когда концентрация глюкозы в крови постепенно опускается ниже 65 мг/100 мл или когда она быстро падает до любого минимального уровня, развившаяся гипогликемия стимулирует гликогенолиз в печени и секрецию диабетогенных гормонов (в первую очередь, адреналина и глюкагона). В результате концентрация глюкозы снова повышается, проявления гипогликемии сводятся к минимуму и в течение 12 часов после начала контррегуляции глюкозы возникает состояние гипергликемии. Такой эффект отчасти объясняется тем, что у собак с сахарным диабетом секреция эндогенного инсулина недостаточна, чтобы блокировать прогрессивное повышение концентрации глюкозы в крови (рис. 11-17; см. раздел «Гипогликемия и контррегуляторный ответ», стр 679) (Cruer, Polonsky, 1998; Karam, 2001). На следующее утро концентрация глюкозы может быть чрезвычайно высокой (400-800 мг/100 мл), а ее содержание в моче, определяемое с помощью тест-полосок, устойчиво держаться на уровне 1-2 г/100 мл. В случае коррекции суточной дозы инсулина по результатам измерения концентрации глюкозы в утренних пробах мочи (особенно в отсутствие таких явных признаков гипогликемии, как общая слабость, атаксия, нетипичное поведение или судороги) она может оказаться заниженной, и животное будет получать
f Время (часы)
Рис. 11-17. Концентрация глюкозы в плазме крови у керн-терьера весом 6,1 кг после введения комбинированного препарата НПХ инсулина крупного рогатого скота и свиньи (20 ЕД- сплошная линия, 4 ЕД - пунктирная линия) в 8 часов утра. Собака получала корм в 8 часов утра и 6 часов вечера. Стрелка указывает время инъекции инсулина. (Из: Feldman ЕС, Nelson RW: Insulin-induced Hypoglycemia in Diabetic Dogs YAVMA, 180:1432, 1982).
566 • САХАРНЫЙ ДИАБЕТ У СОБАК
недостаточное количество гормона. Это неизбежно заставит хозяина собаки повысить дозу на следующее утро; в результате получится замкнутый круг и состояние гипергликемии будет все более усугубляться. Незамеченная короткая продолжительность действия инсулина в сочетании с коррекцией его дозы на основании концентрации глюкозы в утренних пробах мочи традиционно является наиболее частой причиной феномена Сомоги. Поэтому мы не рекомендуем изменять дозы инсулина на основании уровня глюкозы в утренней моче.
Признаки гипогликемии обычно выражены слабо и не распознаются владельцами животных. В клинической картине сахарного диабета преобладают симптомы гипергликемии. Дозы инсулина, способные индуцировать феномен Сомоги, могут быть разными и непредсказуемы. Подозрение на феномен Сомоги чаще всего возникает у слабо компенсированных собак, которым за одну инъекцию вводят до 2,2 ЕД инсулина/кг веса тела. Однако, такой же эффект могут вызвать дозы инсулина менее 0,5 ЕД/кг на инъекцию. Особенно высокой чувствительностью к развитию феномена Сомоги под воздействием заниженных доз инсулина отличаются собаки карликовых и миниатюрных пород. Тем не менее, это расстройство следует подозревать у всех собак и кошек с плохо компенсированным сахарным диабетом независимо от получаемых ими доз инсулина.
Диагноз феномен Сомоги ставится в случаях гипогликемии (концентрация глюкозы в крови ниже 65 мг/100 мл), переходящей в гипергликемию (концентрация глюкозы более 300 мг/100 мл) после введения инсулина (Feldman, Nelson, 1982). Наличие феномена Сомоги можно также предполагать при быстром падении концентрации глюкозы в крови независимо от ее конечной минимальной величины (например, падение с 400 мг/100 мл до 100 мг/100 мл в течение 2-3 часов). Если продолжительность действия инсулина превышает 12 часов, гипогликемия обычно развивается в ночное время после инъекции вечерней дозы инсулина, тогда как на следующее утро концентрация глюкозы в крови обычно превышает 300 мг/100 мл (рис. 11-18). Концентрация фруктозамина в сыворотке крови у собак с феноменом Сомоги колеблется в пределах от 300 до 600 мкмоль/л и не поддается прогнозированию (см. рис. 11-10). Концентрация фруктозамина менее 400 мкмоль/100 л у собак с сахарным диабетом и признаками его неудовлетворительной компенсации заставляет предполагать развитие феномена Сомоги. Высокая концентрация сывороточного фруктозамина отражает слабый контроль гликемии, но ничего не говорит о причинах гипергликемии. Одной из таких причин может быть феномен Сомоги.
К сожалению, диагностика феномена Сомоги сопряжена с определенными трудностями, отчасти из-за воздействия диабетогенных гормонов на концентрацию глюкозы в плазме крови после контррегуляторного эпизода. Секреция диабетогенных
Концентрация глюкозы в крови (мг/100 мл)
Рис. 11-18. Кривые концентрации глюкозы в крови у 3 собак со слабо компенсированным сахарным диабетом, получавших рекомбинантный человеческий инсулин ленте дважды в день, которые иллюстрируют типичный характер гликемических кривых, предполагающих наличие феномена Сомоги. У одной из собак минимальная концентрация глюкозы была меньше 80 мг/100 мл, после чего быстро увеличивалась (сплошная линия). У другой (пунктирная линия) наблюдалось быстрое снижение концентрации глюкозы в течение первых 2 часов после введения инсулина, за которым следовало ее столь же быстрое увеличение; быстрое падение уровня глюкозы стимулировало контррегуляцию, хотя минимальная концентрация глюкозы оставалась выше 80 мг/100 мл. У третьей собаки (точечная линия) характер гликемической кривой сам по себе не вызывал подозрения на феномен Сомоги. Однако введение ей инсулина приводило к снижению концентрации глюкозы примерно на 300 мг/100 мл в течение дня, и к моменту вечерней инъекции инсулина она была значительно ниже, чем в 8 часов утра. В случае аналогичного уменьшения концентрации глюкозы при введении инсулина в вечернее время возможны гипогликемия и феномен Сомоги в ночные часы. Это объясняет существенное повышение концентрации глюкозы в утренние часы и в целом неудовлетворительную компенсацию диабетического состояния. (Из: Nelson RW, Couto CG: Small Animal Internal Medicine. St. Louis, Mosby-Inc, 2003, p 745).
гормонов на фоне феномена Сомоги может индуцировать инсулинорезистентность, которая сохраняется на протяжении 24—72 часов после эпизода гипогликемии. Серийное определение концентрации глюкозы для построения гликемической кривой в день контррегуляции позволяет выявить гипогликемию и диагностировать феномен Сомоги. Если же серийные определения глюкозы в крови проводятся в день, когда преобладает резистентность к инсулину и гипогликемия отсутствует, то доза инсулина может оказаться неоправданно завышенной в связи с высоким уровнем глюкозы в крови (см. рис. 12-21, стр. 624). Иногда диагноз ставится, исходя из ответа на инсулинотерапию (при улучшении клинической симптоматики после снижения дозы инсулина несмотря на высокую концентрацию глюкозы в крови по данным серийных измерений). Более подробные сведения о резистентности к инсулину, индуцируемой при феномене Сомоги, приведены на стр. 679.
Для устранения феномена Сомоги следует понизить дозу инсулина. Степень уменьшения зависит
САХАРНЫЙ ДИАБЕТ У СОБАК • 567
от количества инсулина, которое животное получало на момент выявления феномена Сомоги. Если собаке вводили «приемлемую» дозу инсулина, т.е. 1,0 ЕД/кг веса на одну инъекцию или менее, то ее снижают на 10-25%. Если же доза инсулина была выше 1,0 ЕД/кг, следует повторно отрегулировать уровень гликемии, вводя инсулин в дозе, рекомендованной в начале лечения, т.е. 0,25 ЕД/кг дважды в день. Оценку качества гликемического контроля (см. стр. 552) проводят спустя 1-2 недели после начала введения новой дозы инсулина и по ее результатам осуществляют дополнительную коррекцию режима терапии.
Кратковременный эффект инсулина
Продолжительность действия рекомбинантных человеческих инсулинов типа ленте и НПХ у большинства собак составляет от 10 до 14 часов, а эффективный контроль гликемии достигается с помощью двукратных на протяжении суток инъекций этих препаратов (см. рис. 11-6). Однако у некоторых животных продолжительность действия инсулинов ленте и НПХ не превышает 10 часов, т.е. значительно короче, чем необходимо для предотвращения эпизодов гипергликемии и устойчивых клинических проявлений сахарного диабета. У таких особей определение гликозурии в утренние часы с помощью тест-полосок постоянно дает значения около 1 г/100 мл или выше. Владельцы таких животных обычно жалуются на полиурию, полидипсию и уменьшение веса тела, что побуждает их менять суточные дозировки инсулина на основании результатов определения концентрации глюкозы в утренних пробах мочи. В большинстве случаев прогрессивное увеличение дозы инсулина в ответ на устойчивую гликозурию в утренние часы приводит к появлению у собак феномена Сомоги. Концентрация фруктозамина в крови варьирует, но обычно
Менее активный Гларгин
превышает 500 мкмоль/л. Диагностическим показателем кратковременного действия инсулина служит развитие гипергликемии (концентрации глюкозы выше 250 мг/100 мл) в течение 6-10 часов после его инъекции, причем минимальная концентрация глюкозы остается выше 80 мг/100 мл (см. рис. 11-16). Для установления диагноза клиницист должен проанализировать результаты повторных определений концентрации глюкозы в крови на протяжении суток (см. стр. 556). Однократное или двукратное измерение концентрации глюкозы в дневное время обычно недостаточно для целей диагностики. Оно позволяет выявить нормальный уровень сахара в крови или слабую гипергликемию, однако, получаемые таким образом данные не отражают проблем, с которыми сталкиваются владельцы животных и не позволяют установить вызвавшие их причины. Правда, однократное или двукратное определение концентрации глюкозы в дневные часы позволяет выявить тяжелую гипергликемию, но этого недостаточно для дифференциации кратковременного эффекта инсулина от феномена Сомоги или инсулиновой резистентности. При небольшой продолжительности действия инсулина диагноз можно поставить только на основании результатов серийных определений концентрации глюкозы в крови. Терапия включает перевод животного на двукратные в течение суток инъекции препарата с большой продолжительностью действия (например, на инсулин ультраленте или гларгин) (рис. 11-19) или увеличение частоты введения инсулина (т.е. переход на трехкратные в течение суток инъекции, если продолжительность действия используемого препарата не превышает 8 часов). Не рекомендуется вводить собакам комбинированные препараты ПЦИ свиньи и крупного рогатого скота из-за возможного образования антител к инсулину (см. ниже). Оценку качества контроля уровня гликемии (см. стр. 552) проводят через 1-2 недели после начала введения новой
Максимальная продолжительность действия
: Ультраленте ;
Протамин-цинк инсулин i
; Ленте Ё
НПХ Ё
70% НПХ, !
Ё 30% обыЧНОГО :
; кристаллического инсулина :
Ё 50% НПХ, Ё
Ё 50% обычного ;
Ё кристаллического инсулина Ё
; Обычный кристаллический Ё
инсулин ▼
у Минимальная продолжи-
Более активный Инсулин лиспро, аспарт тельность действия
Рис. 11-19. Классификация типов коммерческих препаратов инсулина на основании их активности и продолжительности действия. Обратите внимание на обратную зависимость между активностью и длительностью действия. (Из: Nelson RW, Couto CG: Small Animal Internal Medicine. St. Louis, Mosby Inc, 2003, p 747 ).
568 • САХАРНЫЙ ДИАБЕТ У СОБАК
дозы инсулина и в случае необходимости проводят дальнейшую коррекцию режима инсулинотерапии. Более подробные сведения о способах выявления и устранения последствий недостаточной продолжительности действия инсулина у собак с сахарным диабетом приводятся в разделе «Интерпретация гликемической кривой», стр. 559.
Продолжительное действие инсулина
У некоторых собак с сахарным диабетом инсулины ленте и НПХ действуют дольше 12 часов, и их введение дважды в день может индуцировать гипогликемию или феномен Сомоги. У таких животных после введения инсулина в утренние часы концентрация глюкозы в крови снижается до минимальной величины обычно ко времени вечерней инъекции гормона, а на следующее утро уровень гликемии, как правило, превышает 300 мг/100 мл (см. рис. 11-16). Еще одним проявлением большой продолжительности действия инсулина является постепенное снижение концентрации глюкозы между двумя последовательными инъекциями. Эффективность гипогликемического действия инсулина в отдельные дни может быть разной, по-видимому, вследствие колебаний концентрации диабетогенных гормонов, секреция которых была индуцирована в предшествовавшем периоде гипогликемии. Концентрация фруктозамина также изменяется, но обычно превышает 500 мкмоль/л. Эффективность лечения частично определяется продолжительностью действия инсулина. Суточную гликемическую кривую получают в утренние часы после однократной инъекции инсулина и кормления собаки в обычное время. Результаты серийных определений концентрации глюкозы позволяют ветеринарному врачу оценить продолжительность действия инсулина (см. раздел «Интерпретация гликемической кривой», стр. 559). Если она не превышает 16 часов, то снижают дозу того же препарата в вечернее время по сравнению с утренней дозой или назначают вместо него инъекции инсулина короткого действия дважды в день (см. рис. 11-19). Если же продолжительность действия составляет 16 часов или более, животное переводят на однократные в течение суток инъекции длительно действующего инсулина либо назначают инсулин НПХ или ленте утром и обычный инсулин в вечернее время (через 16-18 часов после утренней инъекции). Цель применения инсулинов разного типа на протяжении суток состоит в увеличении продолжительности их суммарного действия до 24 часов. Так, например, если продолжительность действия инсулина ленте составляет примерно 16 часов, а обычного инсулина 6-8 часов, то сочетанное применение препаратов того и другого типа обеспечивает общую продолжительность действия около 22-24 часов. Различия активности инсулинов с большой и промежуточной продолжительностью действия по сравнению с обычным инсулином обусловливают необходимость введения разных
доз в утреннее и вечернее время. Обычный инсулин обладает более высокой активностью, поэтому его гипогликемическое действие, сопоставимое с таковым инсулинов НПХ, ленте и ультраленте, достигается при меньших дозах.
Неадекватная абсорбция инсулина
Медленное или неадекватное всасывание инсулинов ультраленте и гларгина из мест их подкожного введения является серьезной проблемой у собак с сахарным диабетом. Это не относится к скорости абсорбции инсулинов НПХ и ленте. Данные о неадекватном всасывании инсулинов с большой продолжительностью действия приведены на стр. 626.
Антитела к инсулину в крови
Все коммерческие препараты инсулинов эффективны при введении собакам с сахарным диабетом. Инсулин обладает иммуногенными свойствами, и образующиеся к нему антитела могут как усиливать и продлевать фармакодинамическое действие гормона, выступая в качестве его носителя, так и нейтрализовать инсулин и тем самым ослаблять его эффект (Bolli et al, 1984; Marshall et al, 1988; Lahtela et al, 1997). По другим данным, антитела к инсулину могут и не оказывать никакого влияния на выбор доз инсулина и качество контроля диабета (Lindholm et al, 2002). Наш опыт показывает, что образование антител к инсулину у собак с сахарным диабетом может отрицательно сказываться на эффективности лечения, затруднять поддержание желаемого уровня гликемии и в экстраординарных случаях вызывать тяжелую инсулинорезистентность (рис. 11-20). Помимо этого, антитела к инсулину могут быть причиной неупорядоченных колебаний концентрации глюкозы в плазме крови; при этом нарушается корреляция между сроками введения инсулина и изменениями концентрации глюкозы (рис. 11-21). По-видимому, такие колебания вызваны нерегулярными и непредсказуемыми изменениями содержания свободного (т.е. не связанного антителами) инсулина в кровяном русле (Bolli et al, 1984). У больных сахарным диабетом людей антитела могут совершенно неожиданно вызывать тяжелую, угрожающую жизни гипогликемию. Мы наблюдали сходный синдром у собак с диабетом, получавших комбинированный препарат инсулинов свиньи и крупного рогатого скота.
Антитела к инсулину образуются при многократных инъекциях чужеродного инсулина. Различия пространственной структуры и аминокислотной последовательности экзогенного инсулина по сравнению с собственным эндогенным гормоном приводят к образованию антител. При этом конформационное положение эпитопов (антигенных участков молекулы) имеет более важное значение, чем линейная последовательность аминокис
САХАРНЫЙ ДИАБЕТ У СОБАК • 569
лотных остатков (Thomas et al, 1985; Thomas et al, 1988; Nell, Thomas, 1989; Davison et al, 2001). Чем больше вводимый инсулин отличается от эндогенного инсулина животного, тем больше вероятность образования антител в значительных, внушающих опасение количествах. Инсулины собаки, свиньи и рекомбинантный человеческий инсулин имеют сходные аминокислотные последовательности, поэтому последний не должен обладать выраженной антигенной активностью при введении собакам (Feldman et al, 1983; Ganong, 1991). С помощью твердофазного иммуноферментного анализа (ИФА) антиинсулиновые антитела были обнаружены примерно у 5% собак, получавших рекомбинантный человеческий инсулин (Harb-Hauser et al, 1998).
В отличие от этого, аминокислотные последовательности инсулинов собаки и крупного рогатого скота различаются, и антитела к инсулину были обнаружены у 65% собак, получавших только инсу-
лин крупного рогатого скота (Davison et al, 2003), и приблизительно у 40-50% собак, которым вводили комбинированные препараты инсулинов свиньи и крупного рогатого скота, на 90% состоящие из свиного инсулина (Haines, 1986; Harb-Hauser et al, 1998). Как показывает наш опыт, наличие антител к инсулину в сыворотках крови собак с сахарным диабетом сопровождается нерегулярным и зачастую неудовлетворительным контролем гликемии, невозможностью поддерживать ее на желаемом уровне на протяжении достаточно длительного времени, необходимостью часто корректировать дозы инсулина и повышенной вероятностью возникновения тяжелой резистентности к инсулину (т.е. устойчивой концентрации глюкозы в крови выше 400 мг/100 мл). Введение собакам рекомбинантного человеческого инсулина обеспечивает гораздо более стабильный контроль уровня глюкозы на протяжении длительного времени. Перевод на этот
Рис. 11-20. Концентрация глюкозы и инсулина в сыворотке крови у овариэктомированной собаки весом 7,6 кг, получавшей подкожные инъекции комбинированного препарата ленте инсулинов крупного рогатого скота и свиньи в дозе 1,1 ЕД/кг (сплошная линия). У собаки имелись тяжелая полиурия и полидипсия и значительная потеря веса. Через 48 часов после прекращения терапии базальная концентрация инсулина превышала 1000 мкЕД/мл. Это заставило предположить наличие антиинсулиновых антител и побудило перевести животное на инъекции рекомбинантного человеческого инсулина. Через 2 недели после перевода улучшилась клиническая симптоматика, а также гликемическая кривая, полученная через 4 недели, в течение которых собаке вводили рекомбинантный человеческий ленте инсулин в дозе 0,9 ЕД/кг (пунктирная линия), обеспечивший эффективный контроль гликемии. Высказано предположение, что после терапии рекомбинантным человеческим препаратом антиинсулиновые антитела, искажавшие результаты радиоиммунологического определения, исчезли, что позволило более точно оценивать изменения концентрации инсулина в крови. Стрелка указывает время введения инсулина и кормления собаки.
570 • САХАРНЫЙ ДИАБЕТ У СОБАК
препарат животных, ранее получавших комбинированный инсулин свиньи и крупного рогатого скота и имевших антиинсулиновые антитела, приводил к исчезновению антител через 4-6 недель (по результатам ИФА). Мы рекомендуем использовать рекомбинантный человеческий инсулин для лечения сахарного диабета у собак, дабы избежать проблем, связанных с эффективностью инсулина и, по-види-мому, вызванных циркулирующими антиинсулино-выми антителами.
В редких случаях предполагают образование антител к инсулину у собак с плохо компенсированным сахарным диабетом даже при введении им рекомбинантного инсулина человека, если не удается выявить иные причины неудовлетворительного контроля уровня гликемии. Для подтверждения
400-1
о J--1------1-----1------1-----1------1-----1
08.00 Полдень 16.00 20.00 Полночь 04.00 08.00
Рис. 11-21. Концентрация глюкозы в крови кобеля весом 50 кг, получавшего подкожные инъекции комбинированного препарата ленте инсулинов крупного рогатого скота и свиньи в дозе 0,7 ЕД/кг ( сплошная линия ). Обратите внимание на неупорядоченные колебания концентрации глюкозы. Собака ослепла из-за образования катаракты, имела тяжелую полиурию, полидипсию и значительно пониженный вес тела. Через 24 часа после прекращения терапии базальная концентрация инсулина в сыворотке крови составляла 825 мкЕД/мл. Это заставило предположить наличие антиинсулиновых антител и перевести животное на инъекции рекомбинантного человеческого инсулина. Через 1 месяц после начала введения собаке рекомбинантного человеческого ленте инсулина в дозе 0,5 ЕД/кг, обеспечившего эффективный контроль уровня гликемии, клиническая симптоматика и гликемическая кривая (пунктирная линия) улучшились и прекратились неупорядоченные колебания концентрации глюкозы.
наличия антител, связывающих инсулин, следует использовать методы, апробированные для этой цели на собаках с сахарным диабетом, хотя соответствующие коммерческие наборы в настоящее время труднодоступны. Циркулирующие антиинсулиновые антитела могут влиять на результаты определений концентрации инсулина в сыворотке крови с помощью РИА таким же образом, как антитела к тиреоидным гормонам влияют на результаты РИА при определении концентраций Т3 и Т4 (см. рис. 3-14, стр. 122). Знание этого повышает внимание клиницистов к антиинсулиновым антителам как возможной причине инсулинорезистентности. В нашей лаборатории для измерения концентрации инсулина в сыворотке крови применяется система монофазного разделения в пробирках с нанесенными на стенки антителами к этому гормону. Наличие антител к инсулину в пробах крови служит причиной сильного завышения результатов при определении его концентрации с помощью РИА. В отсутствие антител, влияющих на результаты РИА, у собак и кошек с сахарным диабетом концентрация сывороточного инсулина через 24 часа после введения экзогенного гормона обычно ниже 50 мкЕД/мл. В то же время, при наличии антител, искажающих результаты РИА, концентрация инсулина через 24 часа после инъекции экзогенного гормона обычно выше 400 мкЕД/мл и может быть больше 1000 мкЕД/мл (см. рис. 11-20). При обнаружении антител к инсулину у собак, получающих рекомбинантный человеческий инсулин, следует рассмотреть целесообразность использования препарата более высокой степени очистки (например, обычного кристаллического инсулина) и/или перевода животного на очищенный свиной инсулин. Поскольку действие обычного кристаллического инсулина после подкожной инъекции сохраняется на протяжении примерно 6-8 часов, при лечении сахарного диабета у собак и кошек в домашних условиях его следует вводить через каждые 8 часов.
Аллергические реакции на инсулин
Выраженные аллергические реакции на инсулин отмечаются почти у 5% людей с сахарным диабетом. Они проявляются в форме покраснения кожи, зуда, уплотнения тканей в местах инъекций инсулина и иногда системных нарушений, сопровождающихся крапивницей, ангионевротическим отеком или анафилаксией (Unger, Foster, 1998). Помимо этого, подкожные ткани в местах введения инсулина претерпевают атрофические или гипертрофические изменения, включая липоатрофию и липодистрофию. В анамнезе многих людей с сахарным диабетом и аллергическими реакциями на инсулин имеются данные о повышенной чувствительности и к другим лекарственным средствам. Сообщений об аллергических реакциях на инсулин у собак и кошек с диабетом мало. Болезненность инъекций инсулина обычно обусловлена не отрицательной
САХАРНЫЙ ДИАБЕТ У СОБАК • 571
реакцией на гормон как таковой, а нарушением техники его введения или неправильным выбором места инъекции. Хроническое введение инсулина в один и тот же участок тела может вызвать воспаление или утолщение кожи и подкожных тканей, так же как иммунную реакцию на инсулин либо на другой присутствующий во флаконе белок (в частности, протамин). Воспаление или утолщение кожи и подкожных тканей ухудшает абсорбцию инсулина, что приводит к рецидивам клинических проявлений сахарного диабета. Эта проблема снимается периодическим изменением мест инъекций. Иногда у собак и кошек в местах инъекций инсулина развиваются очаговая подкожная отечность или набухание тканей, которые могут служить проявлениями аллергической реакции на экзогенный гормон. В таких случаях животное переводят на более гомологичный препарат инсулина (очищенный свиной инсулин для собак и очищенный инсулин крупного рогатого скота для кошек) либо на препарат с более высокой степенью очистки (например, обычный кристаллический инсулин). Тем самым сводится к минимуму вероятность иммунной реакции на чужеродный инсулин или на присутствующие в препарате белковые примеси. Нам до сих пор не удалось подтвердить наличие системных аллергических реакций на инсулин у собак и кошек.
Сопутствующие расстройства, вызывающие инсулинорезистентность
Инсулинорезистентность - это состояние, при котором нормальное количество инсулина вызывает слабую биологическую реакцию. Инсулинорезистентность является следствием нарушений, имеющих место как до взаимодействия инсулина с его рецепторами (т.е. на пререцепторном уровне), так и после этого взаимодействия (т.е. на пострецепторном уровне) (Ihle, Nelson, 1991). Пререцепторные нарушения связаны с уменьшением концентрации свободного, метаболически активного инсулина, его разрушением и образованием антиинсулиновых антител. Нарушения на уровне рецепторов включают изменение их концентрации и связывающей способности, а также образование антител к инсу-лин-рецепторным комплексам. Клинически трудно различить пострецепторные и рецепторные нарушения и нередко имеются и те и другие. У собак и кошек рецепторные и пострецепторные нарушения обычно приписывают ожирению или избыточной секреции гормонов антагонистов инсулина, таких как кортизол, глюкагон, адреналин, гормон роста, прогестерон или тиреоидные гормоны.
Реакция на ту или иную дозу инсулина не может служить критерием резистентности к инсулину. Терапевтическую эффективность препаратов инсулина у собак с сахарным диабетом оценивают посредством сопоставления их дозы в пересчете на вес тела и качества контроля уровня гликемии. У большинства этих животных приемлемый глике
мический контроль (т.е. концентрация глюкозы в крови в пределах от 100 до 250 мг/100 мл) достигается при двукратном на протяжении суток введении инсулинов с большой или промежуточной продолжительностью действия в дозах менее 1,0 ЕД/кг веса тела. Подозрение на наличие инсули-норезистентности возникает в тех случаях, когда контроль уровня гликемии остается неудовлетворительным несмотря на введение инсулина в дозах более 1,5 ЕД/кг, когда для поддержания концентрации глюкозы в крови на уровне ниже 300 мг/100 мл требуется дополнительное количество инсулина (т.е. дозы свыше 1,5 ЕД/кг) (рис. 11-22) и когда не удается добиться стабильного контроля гликемии, а потребность в инсулине на протяжении нескольких недель терапии постоянно изменяется (рис. 11-23). Если концентрация глюкозы во время ее серийных измерений не опускается ниже 300 мг/100 мл, то это свидетельствует, хотя и не обязательно, об ин-сулинорезистентности. Гликемическая кривая, характерная для состояния инсулинорезистентности, может быть получена также при индуцированной стрессом гипергликемии, феномене Сомоги и других явлениях, сопровождающих инсулинотерапию (табл. 11-16). В то же время снижение концентрации глюкозы в плазме крови ниже 300 мг/100 мл может иметь место при заболеваниях, вызывающих относительно слабую инсулинорезистентность. У животных с инсулинорезистентностью концентрация фруктозамина в сыворотке крови обычно превышает 500 мкмоль/л, а в случаях тяжелой и устойчивой инсулинорезистентности может возрастать до 700 мкмоль/л и более. К сожалению, повышенная концентрация фруктозамина отражает лишь слабый контроль уровня гликемии и не является показателем инсулинорезистентности как таковой.
Тяжесть инсулинорезистентности отчасти определяется ее этиологией. Она может быть слабой и устраняться повышенными дозами инсулина, но может быть очень тяжелой и сопровождаться выраженной гипергликемией независимо от вида и дозы вводимого инсулина. Ряд причин инсулинорезистентности вполне очевиден уже при выявлении сахарного диабета (в частности, ожирение или введение препаратов - антагонистов инсулина, таких как глюкокортикоиды и мегестрола ацетат). Другие причины устанавливаются с трудом в процессе всестороннего диагностического обследования. В принципе, инсулинорезистентность может быть вызвана любым сопутствующим воспалительным или инфекционным заболеванием, гормональным расстройством или неопластическим процессом; в любом случае она снижает эффективность инсулина (см. табл. 11-16). Как показывает наш опыт, эффективность инсулинотерапии у собак чаще всего понижается при таких сопутствующих сахарному диабету клинических состояниях, как тяжелая форма ожирения, гиперкортицизм, хронический панкреатит, недостаточность функции почек, кожная
572
• САХАРНЫЙ ДИАБЕТ У СОБАК
Рис. 11-22. Гликемические кривые кобеля весом 12 кг с сахарным диабетом и нелеченым гипотиреозом, который получал рекомбинантный человеческий инсулин ленте в дозе 2,2 ЕД/кг (сплошная линия). Большое количество инсулина, требовавшееся для снижения концентрации глюкозы в крови, предполагало наличие инсулинорезистентности. Эффективность гликемического контроля удалось повысить назначением терапии натрия левотироксином (пунктирная линия), которая позволила также снизить дозу инсулина до 0,9 ЕД/кг. Стрелка указывает время инъекции инсулина и кормления животного.
1
Рис. 11-23. Гликемические кривые 9-летней кошки с сахарным диабетом и рецидивирующими симптомами панкреатита (сонливостью, отсутствием аппетита, полиурией, полидипсией и снижением веса тела). При возобновлении панкреатита повышалась концентрация глюкозы в плазме крови (сплошная линия). При исчезновении признаков панкреатита концентрация глюкозы понижалась до допустимого уровня (пунктирная линия). Гликемические кривые были получены, когда кошке дважды в день делали подкожные инъекции инсулина ультраленте в дозах 4 ЕД (сплошная и пунктирная линии без кружков) и инъекции инсулина ленте в дозе 3 ЕД (сплошная и пунктирная линии с темными кружками). Обратите внимание, что сопутствующий панкреатит снижал эффективность контроля гликемии. Стрелка указывает время инъекций инсулина и кормления животного.
сахарный диабет у собак
573
ТАБЛИЦА 11-16. ИЗВЕСТНЫЕ ПРИЧИНЫ НЕЭФФЕКТИВНОСТИ ИНСУЛИНА ИЛИ РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ У СОБАК И КОШЕК С САХАРНЫМ ДИАБЕТОМ
Связанные с инсулиноте-рапией___________________
Использование неактивного инсулина
Использование разбавленного инсулина
Нарушение техники инъекций
Использование неадекватной дозы
Феномен Сомоги
Неправильный выбор частоты введения инсулина
Нарушение абсорбции инсулина, особенно при использовании препаратов типа ультраленте
Избыточное количество антиинсулиновых антител
Обусловленные сопутству-ющим заболеванием_________
Применение диабетогенных препаратов
Г иперкортицизм
Диэструс (у сук)
Акромегалия (у кошек)
Инфекция, особенно ротовой полости и мочевых путей
Гипотиреоз (у собак) Гипертиреоз (у кошек) Недостаточность функции почек
Недостаточность функции печени
Сердечная недостаточность Глюкагонома (у собак) Феохромоцитома Хроническое воспаление, особенно панкреатит
Недостаточность экзокринной функции поджелудочной железы
Тяжелое ожирение Г иперлипидемия Опухоли
инфекция, инфекции ротовой полости и мочевых путей и гиперлипидемия. Кроме того, на эффективность инсулина влияют такие факторы, как введение лекарственных средств, обладающих диабетогенной активностью (глюкокортикоидов), диэструс или наличие антиинсулиновых антител у животных, получающих инсулин крупного рогатого скота.
Исчерпывающий анамнестический анализ и тщательное физикальное обследование являются наиболее важными способами выявления сопутствующих сахарному диабету заболеваний. Страдает ли собака тяжелой формой ожирения? Получает ли она лекарственные препараты, оказывающие диабетогенное действие? Подвергалась ли собака овариэктомии, а если нет, то когда была последняя течка? Замечал ли хозяин какие-либо клинические признаки, свидетельствующие о наличии сопутствующего расстройства (например, гематурию или влагалищные выделения)? Нарушения, выявляемые в процессе физикального исследования, также могут служить подтверждением антагонизма действию инсулина или инфекционного процесса и, таким образом, облегчать диагностическую оценку состояния животного. Если анамнестический анализ и/или физикальное исследование не выявляют существенных сопутствующих отклонений, дальнейший скрининг с целью их идентификации проводится на основании данных ОАК, биохимического анализа сыворотки, определения концентрации прогестерона (у интактных самок), УЗИ брюшной полости и анализа мочи в сочетании с ее посевом на культуральную среду. Необходимость дополни-
ТАБЛИЦА 11-17. ДИАГНОСТИЧЕСКИЕ МЕТОДЫ ОЦЕНКИ РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ У СОБАК И КОШЕК ПРИ
САХАРНОМ ДИАБЕТЕ
ОАК, биохимический анализ сыворотки, анализ мочи Культивирование проб мочи
Определение активностей липазы и амилазы в сыворотке крови (показатели панкреатита)
Определение трипсиноподобной иммунореактивности в сыворотке крови (показатель недостаточности экзокринной функции поджелудочной железы и панкреатита)
Пробы для оценки функции коры надпочечников: провокационная проба с АКТГ (выявление спонтанного и ятрогенного гиперкортицизма) ингибирующая проба с низкими дозами дексаметазона (выявление спонтанного гиперкортицизма)
Пробы для оценки функции щитовидной железы: определение общего и свободного тироксина в сыворотке крови (выявление гипотиреоза или гипертиреоза) определение эндогенного ТТГ (выявление гипотиреоза) провокационная проба с ТТГ (выявление гипотиреоза) провокационная проба с тиреотропин рилизинг-гормоном (выявление гипотиреоза и гипертиреоза) ингибирующая проба с трийодотиронином (выявление гипертиреоза)
Определение концентрации прогестерона в сыворотке крови (показатель диэструса у интактных сук)
Определение концентраций гормона роста или инсулиноподобного фактора роста 1 в сыворотке крови (выявление акромегалии)
Определение концентрации инсулина в сыворотке крови через 24 часа после прекращения инсулинотерапии (выявление антиинсулиновых антител)
Определение концентрации триглицеридов в сыворотке крови (показатель гиперлипидемии)
Ультразвуковое исследование брюшной полости (выявление адреномегалии, опухолей надпочечников, панкреатита и опухолей поджелудочной железы)
Рентгенография грудной полости (выявление кардиомегалии и новообразований)
Компьютерная и магнитно-резонансная томография (выяв-ление опухоли гипофиза)
тельного тестирования определяется результатами указанных скрининговых процедур (табл. 11-17).
Ожирение. Ожирение вызывает вторичную обратимую резистентность к инсулину вследствие понижения содержания рецепторов инсулина, уменьшения сродства их связывания с гормоном и нарушения внутриклеточных процессов обмена глюкозы на пострецепторном уровне (Trugila et al, 1985). Снижение веса тела повышает чувствительность тканей к инсулину, по-видимому, благодаря снижению индуцируемой ожирением инсулино-резистентности. По возможности, следует корректировать вес тела животных с помощью соответствующего рациона (см. стр. 544) и физических нагрузок. Контроль уровня гликемии позволяет уменьшить тяжесть гипергликемии, обусловленной сочетанным эффектом ожирения, неправильного питания и неадекватной инсулинотерапии. Однако нормализация концентрации глюкозы невозможна, если инсулинорезистентность обусловлена сопутствующими диабету воспалительными, инфекцион
574 • САХАРНЫЙ ДИАБЕТ У СОБАК
ными и неопластическими процессами либо гормональными расстройствами.
Прогестерон. Независимо от характера астральных циклов в анамнезе, у всех интактных собак с впервые диагностированным или плохо компенсированным диабетом нельзя исключать наличие инсулинорезистентности, обусловленной диэструсом. В фазе диэструса в крови повышается концентрация прогестерона, который является прямым антагонистом инсулина и, кроме того, стимулирует секрецию гормона роста. Прогестерон препятствует связыванию инсулина с рецепторами и уменьшает поступление глюкозы в ткани (Ryan, Enns, 1988). Антагонистическое инсулину действие гормона роста обусловлено уменьшением количества рецепторов инсулина и торможением транспорта глюкозы, возможно, в результате изменения экспрессии генов транспортеров глюкозы (Moller, Flier, 1991). Введение собакам прогестогенов (например, медроксипрогестерона ацетата) также усиливает секрецию гормона роста (Eigenmann, Rijnberk, 1981; Eigenmann et al, 1983).
Тяжесть инсулинорезистентности, обусловленной диэструсом, быстро возрастает по мере увеличения концентрации ростового гормона в плазме крови под воздействием высвобождающегося из желтых тел прогестерона. Столь же быстро уменьшается способность инсулина снижать концентрацию глюкозы в крови, несмотря на его введение в дозах, значительно превышающих 2,2 ЕД/кг на инъекцию. Это может привести к развитию угрожающего жизни диабетического кетоацидоза. В такой ситуации рекомендуется быстро выявить повышение концентрации прогестерона в крови и провести овариогистерэктомию. В большинстве коммерческих лабораторий гормонального анализа концентрация прогестерона в сыворотке крови выше 2 нг/мл принята в качестве показателя диэструса. Понижение концентрации прогестерона до величины, наблюдающейся в анэструсе, устраняет стимуляцию секреции гормона роста; такое понижение происходит в результате спонтанной регрессии желтых тел, после овариогистерэктомии или прекращения введения экзогенного прогестерона. Эффективность инсулинотерапии обычно повышается через 7 дней после овариогистерэктомии или отмены прогестерона. После снижения концентрации гормона роста до нормальной базальной величины у сук, сохраняющих достаточное количество функционально активных бета-клеток, толерантность к углеводам нормализуется (см. раздел «Вторичный диабет у собак», стр. 532).
Гиперкортицизм. Гиперкортицизм, как спонтанный, так и вызванный введением экзогенных глюкокортикоидов, является одной из наиболее частых причин тяжелой инсулинорезистентности у собак с сахарным диабетом (табл. 11-18). Глюкокортикоиды противодействуют инсулину как в гепатоцитах, так и в периферических клетках. Они могут индуцировать инсулинорезистентность, не-
ТАБЛИЦА 11-18. ПРИЧИНЫ ИНСУЛИНОРЕЗИСТЕНТНОСТИ И ИХ ЧАСТОТА У ПРОИЗВОЛЬНО ОБСЛЕДОВАННЫХ 65 СОБАК И 54 КОШЕК С САХАРНЫМ ДИАБЕТОМ (ДАННЫЕ U.C. DAVIS ЗА ПЕРИОД С 1990 ПО 1995 Г.Г.)
Причина Собаки с сахарным диабетом Кошки с сахарным диабетом
Г иперкортицзим 38% 17%
Акромегалия - 19%
Бактериальная инфекция 16% 9%
Диэструс 8% -
Недостаточность функции почек, печени или сердца 6% 15%
Гипотиреоз 9% -
Гипертиреоз - 9%
Применение диабетогенных лекарственных средств 3% 9%
Хронический панкреатит 5% 6%
Недостаточность экзокринной функции поджелудочной железы 5% 4%
Антиинсулиновые антитела 5% 2%
Глюкагонома 4% -
Феохромоцитома 2% -
Различные новообразования - 9%
посредственно уменьшая число или активность транспортеров глюкозы, или косвенно, повышая концентрацию глюкагона и свободных жирных кислот в крови (Moller, Flier, 1991). Подавление утилизации глюкозы клетками под действием глюкокортикоидов не сопровождается изменениями на уровне рецепторов инсулина.
У многих собак одновременно развиваются спонтанный гиперкортицизм и сахарный диабет. Нередко встает вопрос о том, какое из этих расстройств первично. Ответ на него до сих пор не получен, однако, мы полагаем, что сначала развивается гиперкортицизм, а симптомы субклинического диабета становятся явными вследствие инсулинорезистентности, обусловленной аномально высокой гормональной активностью коры надпочечников. Во всех случаях первым диагностируется сахарный диабет, отчасти потому, что первичное диагностическое обследование по поводу полиурии и полидипсии включает ОАК, анализ биохимического профиля сыворотки и мочи, которые сразу же выявляют гипергликемию и гликозурию. Выявляемые при физикальном исследовании характерные для гиперкортицизма нарушения, такие как эндокринная алопеция, истончение кожи или увеличение размеров живота, обычно еще не проявляются к моменту диагноза сахарного диабета; они идентифицируются спустя несколько недель по мере усиления тяжести гиперкортицизма. Гепатомегалия, гиперхолестеринемия или изменение активности печеночных ферментов обычно приписываются наличию диабета. Ранними индикаторами гиперкортицизма
САХАРНЫЙ ДИАБЕТ У СОБАК • 575
у собак с сахарным диабетом являются активность щелочной фосфатазы в сыворотке крови выше 500 МЕ/л, удельный вес мочи ниже 1.020 (особенно при наличии гликозурии) и адреномегалия, выявляемая при УЗИ брюшной полости. Эффективность контроля уровня гликемии у собак с диабетом и нелеченым гиперкортицизмом весьма вариабельна и частично зависит от тяжести и продолжительности гиперкортизолемии. На ранних стадиях развития гиперкортицизма у собак с сахарным диабетом может сохраняться чувствительность к инсулину, и диабет хорошо поддается компенсации обычными дозами гормона. Однако с течением времени (через несколько месяцев) становится все труднее контролировать уровень глюкозы, и, в конце концов, развивается тяжелая инсулинорезистентность. У всех собак с плохо компенсированным диабетом, независимо от результатов физикального исследования или рутинных диагностических тестов, следует предполагать наличие гиперкортицизма, если инсу-линотерапия не дает желаемого эффекта.
При интерпретации результатов тестирования функции системы гипофиз-кора надпочечников (например, стимулирующей пробы с АКТГ, ингибирующей пробы с низкими дозами дексаметазона или оценки отношения концентраций кортизола и креатинина в моче) следует принимать во внимание влияние плохо компенсированного сахарного диабета на секреторную активность коры надпочечников. В одном из исследований при тестировании функции коры надпочечников у 15 собак с хорошо компенсированным сахарным диабетом были получены нормальные результаты (Zerbe et al, 1988). В отличие от этого, у многих обследованных нами животных с плохо компенсированным диабетом тестирование функции надпочечников с помощью одной или нескольких диагностических проб свидетельствовало о наличии гиперкортицизма, хотя вскрытие выявило нормальное состояние гипофиза и надпочечников. У собак с плохо, а иногда и с хорошо компенсированным сахарным диабетом отмечается несколько повышенный ответ кортизола в пробе с АКТГ (т.е. концентрация кортизола в крови после введения АКТГ достигает 18-24 мкг/100 мл), высокое отношение концентраций кортизола и креатинина в моче и, реже, отсутствие подавления секреции кортизола до уровня ниже 1,5 мкг/100 мл в ингибирующей пробе с низкими дозами дексаметазона. Можно думать, что эти показатели являются следствием хронического «стресса», обусловленного неудовлетворительной компенсацией сахарного диабета и связанных с этим проблем. Поскольку стрессорное воздействие плохо компенсированного диабета может влиять на результаты тестирования функционального состояния системы гипофиз-кора надпочечников, диагноз гиперкортицизма должен всегда базироваться на комплексном анализе данных анамнеза, физикального исследования, тестирования функции гипофизарно-надпочечниковой системы и УЗИ. Следует также принимать во вни
мание имеющиеся клинические симптомы и иные признаки, заставляющие предполагать наличие гиперкортицизма. Решение о необходимости терапии принимается, исходя из этиологии данного заболевания (гипофизарного или надпочечникового происхождения), тяжести его клинических проявлений, наличия или отсутствия инсулинорезистентности и качества контроля гликемии. Терапия может быть противопоказана при установлении диагноза зависимого от гипофиза гиперкортицизма, особенно в отсутствие клинических проявлений заболевания и явной инсулинорезистентности при удовлетворительном контроле гликемии. Вопросы диагностики и лечения гиперкортицизма у собак исчерпывающе изложены в гл. 6.
Бактериальные инфекции. Хорошо известно пагубное влияние сахарного диабета на заболеваемость и смертность при инфекционных заболеваниях у человека (Bertoni et al, 2001). Не менее часто инфекционные заболевания поражают собак и кошек с сахарным диабетом; по-видимому, диабет сходным образом повышает чувствительность к инфекциям у животных и у людей (Hess et al, 2000b; Peikes et al, 2001). Постулируются следующие механизмы повышения чувствительности к инфекциям при сахарном диабете: ухудшение кровоснабжения вследствие сопутствующих микроангиопатии и атеросклероза, которые снижают поступление кислорода, фагоцитов и антител к месту инфекции; нарушение гуморального иммунитета вследствие подавления образования антител; аномальный хемотаксис нейтрофилов; расстройство фагоцитоза и механизмов внутриклеточной гибели возбудителей; нарушение клеточного иммунитета (Possilli, Leslie, 1994; McMahon, Abistrian, 1995; Joshi et al, 1999). Многие из этих дефектов защитной реакции животных устраняются, по крайней мере, частично при улучшении контроля уровня гликемии.
У людей с бактериальными инфекциями на фоне сахарного диабета развиваются устойчивая гипер-глюкагонемия и инсулинорезистентность (Nelson, 1989). Антиинсулиновое действие глюкагона в основном ограничивается печенью, где он стимулирует глюконеогенез, гликогенолиз и кетогенез, однако, он также может нарушать транспорт глюкозы в периферических тканях (Moller, Flier, 1991). Значение глюкагона как фактора развития инсулинорезистентности у собак и кошек с сахарным диабетом требует уточнения. Лечение клинических проявлений тяжелой бактериальной инфекции (особенно когда она поражает мочевые пути, кожу и ротовую полость) улучшает гликемический контроль.
Бактериальные инфекции обычно выявляются в ходе физикального исследования, при проведении ОАК, анализа мочи и иногда в посевах проб крови. Учитывая высокую частоту бактериальных инфекций при сахарном диабете, целесообразно в тех случаях, когда не удается установить причину инсулинорезистентности, оценить влияние пробной терапии антибиотиками на эффективность
576 • САХАРНЫЙ ДИАБЕТ У СОБАК
гликемического контроля. В этих условиях мы рекомендуем введение бактерицидного антибиотика с широким спектром действия, например, амоксициллина клавуланата (амоксиклава) в течение 10-14 дней и проведение повторной оценки качества контроля гликемии до окончания терапии.
Почечная недостаточность. Недостаточность почечной функции и сахарный диабет - обычные гериатрические заболевания, которые часто сосуществуют, особенно у старых кошек. Нарушение функции почек может развиваться как осложнение диабета (в частности, диабетическая нефропатия, см. стр. 581) либо независимо на фоне диабета у животных старшего возраста. По мере ухудшения работы почек у людей с сахарным диабетом и сопутствующей нефропатией увеличивается риск тяжелой гипогликемии вследствие уменьшения скорости почечного клиренса инсулина и продукции глюкозы в почках в процессе глюконеогенеза (см. стр. 678) (Stumvoll et al, 1997; Rave et al, 2001). Одновременно подавляется реакция тканей на действие инсулина (т.е. понижается их чувствительность к инсулину), что приводит к ухудшению метаболического контроля диабетического состояния (Eidemak et al, 1995). Для собак и кошек с сахарным диабетом и сопутствующей почечной недостаточностью характерны повышенная продолжительность действия инсулина, резистентность к инсулину, и реже гипогликемия. Взаимосвязь между развитием и тяжестью почечной недостаточности, тяжестью инсулинорезистентности и уменьшением скорости почечного клиренса инсулина служит причиной непредсказуемых колебаний эффективности контроля гликемии и потребности животных в инсулине. Такая ситуация ставит сложные задачи перед ветеринаром и владельцем животного. Более того, сопутствующая недостаточность почечной функции больше не позволяет полагаться на достоверность такого важного показателя контроля диабета, как тяжесть полиурии и полидипсии. В большинстве таких случаев основное внимание уделяется лечению почечной недостаточности, а режим инсулинотерапии модифицируется с целью достижения максимально возможной компенсации диабета. Одновременно стараются предотвратить гипогликемию, при этом надо понимать, что обеспечить удовлетворительную компенсацию в данных условиях будет трудно, а полиурия и полидипсия останутся независимо от качества гликемического контроля.
Хронический панкреатит. Хронические воспалительные процессы затрудняют контроль гликемии. Самым частым таким заболеванием у собак и кошек с сахарным диабетом является панкреатит. Хронический панкреатит был выявлен при посмертном вскрытии почти у 35% собак и 50% кошек, болевших диабетом (Alejandro et al, 1988; Goosens et al, 1995). Большинство этих животных имели сходный анамнез, характеризовавшийся неудовлетворительной компенсаций диабетических расстройств,
часто меняющейся потребностью в инсулине, частым повышением концентрации глюкозы в плазме крови до уровня выше 300 мг/100 мл, наличием эпизодов сонливости и отсутствия аппетита и жалобами со стороны хозяев на «плохое самочувствие» их питомцев (см. рис. 11-23). Безуспешные попытки разрешить эти проблемы вынуждали, в конце концов, прибегать к эвтаназии многих собак и кошек. Диагностика хронического панкреатита затруднительна - необходим комплексный анализ клинической симптоматики, результатов физикального исследования, концентрации липазы, ТПИ в сыворотке крови, данных УЗИ поджелудочной железы и других характеристик, предполагающих наличие этого заболевания (см. раздел «Ферменты поджелудочной железы» а стр. 537). Столь же трудно добиться желаемой реакции животных на терапию, включая внутривенное вливание жидкостей, изменение режима питания и введение преднизона в подавляющих воспаление дозах. Состояние многих собак и кошек с хроническим панкреатитом остается неудовлетворительным несмотря на проводимое лечение.
Недостаточность экзокринной функции поджелудочной железы. Недостаточность экзокринной функции поджелудочной железы (НЭПЖ) относительно редкое осложнение сахарного диабета, которое, по-видимому, развивается как следствие хронического панкреатита. Наш опыт показывает, что большинство собак с диабетом и НЭПЖ плохо отвечают на инсулинотерапию. К тому же они прогрессивно теряют в весе, несмотря на «зверский» аппетит, что, в конце концов, приводит к истощению, и имеют преимущественно мягкий стул вместо характерного для классической НЭПЖ обильного стула с неприятным запахом. При пальпации живота может выявляться слабое диффузное утолщение тонкого кишечника. Для установления диагноза НЭПЖ у собак с диабетом требуется определение ТПИ в сыворотке крови, которая при НЭПЖ ниже 2,5 мкг/л (Widberg et al, 1999; Widberg, Westermarck, 2002). Лечение посредством заместительного введения ферментов поджелудочной железы, метронидазола и, в случае необходимости, легко усвояемой диеты с низким содержанием жиров позволяет улучшить клиническую симптоматику и контроль гликемии, а зачастую и снизить суточную потребность в инсулине.
Гипотиреоз. Инсулинорезистентность была выявлена у собак с гипотиреозом, который купировался заместительной терапией тиреоидными гормонами (Ford et al, 1993). Предлагаются весьма противоречивые механизмы нарушения толерантности к углеводам, обусловленного недостаточностью тиреоидных гормонов. Большинство авторов считают, что эти механизмы включают нарушение стимуляции инсулином транспорта и обмена глюкозы на пострецепторном уровне (Amer et al, 1984; Pedersen et al, 1988). Влияние недостаточности тиреоидных гормонов на секрецию инсулина и его рецепторы неясно.
САХАРНЫЙ ДИАБЕТ У СОБАК • 577
По данным разных авторов, секреция инсулина может быть как увеличена, так и снижена в этих условиях, равно как и количество рецепторов инсулина и их сродство к гормону может быть увеличено, снижено или оставаться неизменным (Czech et al, 1980; Amer et al, 1984; Pedersen et al, 1988). Другие факторы, ассоциирующиеся с гипотиреозом и сахарным диабетом, в частности ожирение и гиперлипидемия, могут также вносить свой вклад в развитие инсулинорезистентности (см. ниже).
При интерпретации результатов измерения концентрации Т4 в сыворотке крови следует принимать во внимание качество контроля уровня глюкозы у собаки, тяжесть сопутствующего заболевания и возможное влияние этих факторов на функцию щитовидной железы (например, на возникновение синдрома эутиреоидной патологии, см. раздел «Концентрация тироксина в сыворотке крови», стр. 122). Низкая концентрация Т4 в сыворотке сама по себе не может служить подтверждением гипотиреоидного состояния у собак. Если результаты анамнестического анализа, физикального исследования, рутинного анализа крови и измерения концентрации Т4 дают веские основания подозревать наличие у животного гипотиреоза, мы проводим повторное определение концентраций Т4 и ТТГ, прежде чем назначаем терапию натрия левотироксином. Влияние сопутствующего заболевания и медикаментозной терапии на концентрацию тиреоидных гормонов в сыворотке крови, а также диагностические пробы для выявления гипотиреоза у собак более подробно рассматриваются в гл. 3.
При назначении собакам натрия левотироксина следует уменьшить дозу инсулина и на протяжении первого месяца терапии проводить еженедельный мониторинг эффективности контроля гликемии (см. рис. 11-22). Если по мере снижения тяжести индуцированной гипотиреозом инсулинорезистентности развивается гипогликемия, может потребоваться дальнейшее уменьшение дозы инсулина. В одном из сообщений указывается, что у собак с гипотиреозом потребность в инсулине снижалась на 50-60% через 2 недели после начала лечения натрия левотироксином (Ford et al, 1993).
Феохромоцитома, глюкагонома и другие опухоли. У 5-10% поступивших в нашу клинику собак резистентность к инсулину была обусловлена опухолями, которые не приводили к гиперкортицизму (см. табл. 11-18). Возникновение инсулинорезистентности у собак с диабетом и глюкагономой или феохромоцитомой может объясняться избыточной секрецией диабетогенных гормонов (соответственно глюкагона и катехоламинов). Влияние глюкагона на эффективность гликемического контроля и действие инсулина обсуждается в разделе, посвященном бактериальным инфекциям (см. выше) и в гл. 15. Катехоламины действуют как прямо, так и опосредованно, стимулируя гликогенолиз в печени и глюконеогенез в печени и почках. Они способствуют обеспечению мышечной ткани энергией из
альтернативного источника, мобилизуя хранящийся в ней гликоген и усиливая липолиз. Кроме того, они вызывают мобилизацию предшественников глюконеогенеза (таких как лактат, аланин и глицерин) и подавляют утилизацию глюкозы чувствительными к инсулину тканями, в частности мышечной (Moller, Flier, 1991; Cryer, 1993; Karam, 2001).
У людей с феохромоцитомой нарушение толерантности к углеводам обычно выражено слабо и не требует специальной коррекции, отчасти благодаря тому, что избыточная секреция катехоламинов носит эпизодический характер и непродолжительна. Хотя феохромоцитома может понижать эффективность действия инсулина у собак с сахарным диабетом, тяжелая инсулинорезистентность развивается нечасто, по-видимому, в силу тех же причин, что и у человека, т.е. эпизодического характера избыточной секреции катехоламинов и ее небольшой продолжительности. Обнаружение опухолей в поджелудочной железе и надпочечниках при УЗИ брюшной полости заставляет подозревать наличие соответственно глюкагономы и феохромоцитомы, особенно если другие диагностические тесты не подтверждают наличия гиперкортицизма. Дополнительные методы диагностики феохромоцитомы и глюкагономы рассматриваются соответственно в гл. 9 и 15.
Лимфома и опухоль тучных клеток - наиболее обычные неэндокринные опухоли, встречающиеся у собак и кошек с инсулинорезистентным сахарным диабетом. Механизмы нарушения контроля гликемии при диабете у животных с неэндокринными опухолями изучены недостаточно, но, несомненно, связаны с нарушениями секреции диабетогенных гормонов, функции печени, липидного обмена и/ или чувствительности тканей к действию инсулина (Vail et al, 1990; Ogilvie et al, 1997).
Гипертриглицеридемия. У больных сахарным диабетом собак часто наблюдается липемия натощак. Липемия является следствием гипертриглицеридемии, которая у людей и собак связана с инсули-норезистентностью и нарушенной толерантностью к углеводам. Гипертриглицеридемия может нарушать сродство рецепторов к инсулину, вызывать уменьшение количества рецепторов по принципу понижающей регуляции и служить причиной нарушения действия инсулина на пострецепторном уровне (Bieger et al, 1984; Berlinger et al, 1984). Усиление гепатической продукции глюкозы под воздействием гиперлипидемии в сочетании с ин-сулинорезистентностью снижает толерантность к углеводам. Резистентность к инсулину вследствие гипертриглицеридемии чаще всего встречается у собак с сахарным диабетом на фоне развивающегося гипотиреоза, а также у больных диабетом цвер-гшнауцеров с идиопатической гиперлипопротеине-мией. Однако она может возникнуть и у животных с плохо компенсированным диабетом и сопутствующей устойчивой липемией.
Гипертриглицеридемию подтверждают путем измерения концентрации триглицеридов в пробах
578 • САХАРНЫЙ ДИАБЕТ У СОБАК
крови, которые желательно брать через 24 часа после последнего кормления животного. В нашей лаборатории верхней границей нормальной концентрации триглицеридов в сыворотке крови у здоровых собак считается 150 мг/100 мл. Гипертриглицеридемия может быть следствием других расстройств, но возможна и первичная идиопатическая гиперлипидемия (см. табл. 3-10, стр. 117).
К сожалению, гипертриглицеридемия весьма часто встречается у собак при неудовлетворительной компенсации сахарного диабета, что затрудняет дифференциальную диагностику гипертриглицеридемии, обусловленной слабой компенсацией диабета, и гипертриглицеридемии, развивающейся независимо от диабета. В качестве общего правила можно считать, что концентрация триглицеридов при плохо компенсированном сахарном диабете обычно не превышает 500 мг/100 мл. При ее более значительном повышении, особенно до 800 мг/100 мл следует предполагать наличие сопутствующего заболевания, вызывающего усиленное образование триглицеридов, в первую очередь, панкреатита, гипотиреоза и первичной гиперлипидемии. Однако сопутствующее заболевание, приводящее к гиперлипидемии, не исключается и при концентрации триглицеридов ниже 800 мг/100 мл (Armstrong, Ford, 1989).
Ограничение потребления жиров является краеугольным камнем терапии гипертриглицеридемии у животных. В связи с этим необходимо проанализировать диетический анамнез и внести соответствующие изменения в состав пищевого рациона, с тем чтобы он содержал не более 20% жиров в пересчете на метаболизируемую энергию. Следует с осторожностью назначать лекарственные препараты, так как все они обладают потенциальным токсическим действием. В принципе, медикаментозная терапия не рекомендуется собакам при концентрации триглицеридов в сыворотке менее 500 мг/100 мл. Для устранения гипертриглицеридемии у людей применяются лекарственные средства нескольких типов, однако, данные об их использовании для той же цели у собак немногочисленны. Ниацин в дозе 100 мг в день понижает концентрацию триглицеридов в сыворотке крови благодаря уменьшению высвобождения жирных кислот из адипоцитов и продукции частиц ЛОНП. При этом часто отмечаются такие нежелательные явления, как рвота, диарея, эритема, зуд и нарушение печеночной функции. Производные фибровой кислоты (клофибрат, безафибрат, гемфиброзил, ципрофибрат и фенофибрат) также снижают концентрацию триглицеридов в крови, стимулируя активность липопротеинлипазы. В сочетании с понижением концентрации свободных жирных кислот это приводит к уменьшению биосинтеза субстратов ЛОНП (Garg, 1994; Haffner, 1998). У человека фибраты обычно вызывают понижение концентрации триглицеридов в плазме крови на 20-40%. Гемфиброзил, вводимый собакам в дозе 200 мг/день, вызывал такие побочные эффекты как
боль в животе, рвота, диарея и нарушение функции печени (Elliott, 2003). Статины (ловастатин, симвастатин, правастатин, алювастатин, церивастатин и атровастатин) ингибируют активность гидрокси-метилглютарил коэнзим A (HMG-CoA) редуктазы и поэтому в первую очередь подавляют обмен холестерина (Garg, Grundy, 1988; Haffner, 1988). Однако у людей статины на 10-15% понижают концентрацию триглицеридов в крови. К числу их побочных эффектов относятся сонливость, диарея, мышечные боли и токсическое действие на печень.
Врожденные дефекты на рецепторном и пострецепторном уровнях. У людей с сахарным диабетом описаны два типа генетических синдромов, вызывающих тяжелую инсулинорезистентность. Синдром инсулинорезистентности А типа характеризуется наличием выраженной эндогенной ги-перинсулинемии, acanthosis nigricans и (у женщин постпубертатного возраста), гиперандрогенизма яичникового генеза (Moller, Flier, 1991). Синдром А типа обусловлен мутациями рецепторов инсулина и другими нарушениями действия инсулина на клетки-мишени. Синдром инсулинорезистентности В типа вызывается аутоантителами к рецепторам инсулина. Обычно у людей с этим синдромом сахарный диабет компенсирован неудовлетворительно, имеют место acanthosis nigricans и (у женщин в пременопаузе) яичниковый гиперандрогенизм. Принимая во внимание, что аутоантитела к рецепторам инсулина могут действовать как агонисты и как антагонисты, у людей с синдромом типа В может иметь место гипогликемия натощак в сочетании с постпранидиальной гипергликемией или без нее; возможно также чередование инсулинорезистентного диабета, его ремиссии и гипогликемии (Moller, Flier, 1991). У большинства больных с синдромом В типа данные лабораторных анализов и клинические признаки указывают на системное аутоиммунное заболевание.
У собак и кошек с сахарным диабетом еще предстоит документально подтвердить наличие первичных дефектов на рецепторном и пострецепторном уровнях. Подозрение на такие расстройства возникает после того, как исключены все другие причины инсулинорезистентности, доказана абсорбция инсулина из мест его подкожного введения и достигнуто минимальное улучшение качества контроля гликемии с помощью инсулиновых препаратов с пониженной антигенной активностью. Однако терапия затруднена, и обычно для достижения хоть какого-то контроля гликемии требуется прогрессивное увеличение доз инсулина.
ХРОНИЧЕСКИЕ ОСЛОЖНЕНИЯ САХАРНОГО ДИАБЕТА
Осложнения сахарного диабета (например, катаракта) или его терапии (индуцированная инсулином гипогликемия) нередки у собак (см. табл. 11-17). Чаще всего у них развивается слепота и передний
САХАРНЫЙ ДИАБЕТ У СОБАК • 579
увеит вследствие развития катаракты, хронического панкреатита, рецидивирующих инфекций, гипогликемии и кетоацидоза.
Многие владельцы собак не решаются начать лечение впервые диагностированного сахарного диабета, так как они знают о возникновении хронических осложнений у человека и опасаются, что та же участь ожидает их питомцев. Тяжелые хронические осложнения сахарного диабета (такие как нефропатия, васкулопатия и ишемическая болезнь сердца) развиваются у людей на протяжении 10-20 лет или более. По этой причине они редко встречаются у больных диабетом собак. Сахарный диабет обычно выявляется у старых собак, продолжительность жизни которых после установления диагноза не превышает 5 лет. Как показывает наш опыт, владельцы собак обычно решаются на лечение у них диабета, если преодолевают страх перед возможностью появления таких же хронических осложнений, как у людей с этим заболеванием.
Предполагаемые патогенетические механизмы развития отдаленных осложнений сахарного диабета у человека (ретинопатии, нефропатии, нейропатии и ишемической болезни сердца) обычно подразделяются на три следующие категории: (1) зависящие от концентрации глюкозы, в том числе нарушения обмена полиолов (например, сорбитола) и избыточное гликозилирование циркулирующих и связанных с мембранами белков; (2) сосудистые механизмы, включая нарушения в эндотелии и опорных клетках, таких как перициты в сетчатке и мезангиальные клетки в почечных клубочках, а также гиперфильтрацию и внутрипочечную гипертензию; (3) другие механизмы, в том числе нарушение функции тромбоцитов и факторов роста, а также генетические факторы (Nathan, 1993). Некоторые из постулируемых патогенетических механизмов участвуют в развитии только одного осложнения или единственной фазы того или иного осложнения. Патофизиологические механизмы хронических осложнений сахарного диабета у собак и кошек охарактеризованы недостаточно, однако считается, что они сопоставимы с аналогичными механизмами у человека.
Катаракта
Катаракта - частое и одно из наиболее существенных отдаленных осложнений сахарного диабета у собак (см. рис. 11-3). Высокая частота развития катаракты, по-видимому, частично обусловлена тяжелой гипергликемией у многих животных несмотря на инсулинотерапию. Ретроспективное исследование 132 собак с диабетом, находившихся под наблюдением в университетской ветеринарной клинике, показало, что катаракта была обнаружена у 14% животных на момент установления диабета и развилась спустя 60, 170, 370 и 470 дней соответственно у 25, 50, 75 и 80% собак (Beam et al, 1999). У кошек, в отличие от собак, катаракта как ослож
нение сахарного диабета встречается редко, что, вероятно, объясняется особенностями патогенеза диабетической катаракты, в котором ведущая роль принадлежит осмотическим изменениям в хрусталике. Хрусталик проницаем для глюкозы, которая свободно поступает в него из окружающей водной среды. В нормальных условиях глюкоза превращается в молочную кислоту в процессе анаэробного гликолиза. Однако при повышении концентрации глюкозы происходит насыщение гликолитических ферментов, в результате чего ее обмен идет по поли-ольному пути с образованием сорбитола и фруктозы (Feldman, Nelson, 1987). Полиольный путь состоит из двух последовательных реакций, в ходе которых глюкоза сначала восстанавливается альдозоредук-тазой до сорбитола, после чего сорбитол окисляется до фруктозы сорбитолдегидрогеназой. Высокая концентрация глюкозы в хрусталике стимулирует активность альдозоредуктазы, что приводит к усилению ее обмена по полиольному пути (Muirhead, Hothersall, 1995). Сорбитол и фруктоза не проникают свободно через клеточную оболочку и потому действуют в качестве мощных гидрофильных агентов, вызывая приток воды в хрусталик. Это, в свою очередь, приводит к набуханию последнего, разрыву его волокон и, в конечном итоге, к образованию катаракты. В исследованиях in vitro наблюдалось подобное поглощение глюкозы хрусталиком собак и кошек независимо от возраста животных, но активность альдозоредуктазы в хрусталике старых кошек была значительно меньше, чем у молодых кошек или у собак (Richter et al, 2002). Пониженная альдозоредуктазная активность и высокий уровень заболеваемости сахарным диабетом именно среди старых кошек могут отчасти объяснять, почему у кошек диабетическая катаракта развивается редко.
Процесс образования катаракты, раз начавшись, становится необратимым и быстро прогрессирует. Собаки с нормальным зрением могут ослепнуть в течение нескольких дней, месяцев или лет. Опасность быстрого развития катаракты особенно велика при неудовлетворительной компенсации диабета и значительных флуктуациях концентрации глюкозы в плазме крови. Хороший контроль уровня глюкозы и минимальные колебания ее концентрации задерживают развитие катаракты. В случае слепоты, вызванной катарактой, строгая регуляция уровня гликемии теряет актуальность.
Слепоту устраняют путем удаления пораженного хрусталика, что приводит к восстановлению зрения у 75-80% собак. При этом успех операции зависит от ряда факторов, включая качество гликемического контроля, наличие изменений в сетчатке или увеита, индуцированного поражением хрусталика. В идеале, операции по удалению катаракты должен предшествовать максимально эффективный контроль уровня глюкозы при нормальном состоянии сетчатки. Приобретенная дегенерация сетчатки, сопровождающаяся ухудшением зрения, представляет собой более серьезную проблему у старых со
580 • САХАРНЫЙ ДИАБЕТ У СОБАК
бак с диабетом, нежели диабетическая ретинопатия (см. ниже). К счастью, приобретенная дегенерация сетчатки маловероятна у старых собак, которые сохранили зрение вплоть до начала образования катаракты. Перед удалением катаракты желательно провести электроретинографию для оценки функции сетчатки.
Исследование, в котором было проведено сравнение результатов операции и частоты осложнений факоэмульсификации у собак с сахарным диабетом и без него, не выявило клинически значимых различий между животными обеих групп (Bagley, Lavach, 1994). Однако, по нашим данным, частота послеоперационного язвенного кератита у собак с диабетом выше, чем у животных без диабета. Некоторые язвы роговой оболочки имели рецидивирующую природу либо оказались трудноизлечимыми. Развитие патологических изменений в роговице у собак с сахарным диабетом непосредственно зависело от степени компенсации диабета (Yee et al, 1985). Чувствительность всех участков роговой оболочки у собак с диабетом была значительно ниже, чем у нормогликемических собак, не страдавших диабетом (Good et al, 2003). Ключевая роль в защите роговицы принадлежит ее нервам, которые участвуют в регуляции слезоотделения, смыкания век, биосинтеза коллагена и поддержании целостности и функциональной активности эпителиальных клеток (Baker et al, 1993; Marfurt, 2000). Считается, что нарушение сенсорных свойств роговицы служит компонентом диффузной нейропатии, затрагивающей периферическую сенсорно-двигательную нервную систему у больных диабетом людей и животных (см. стр. 630) и может влиять на заживление поврежденной роговицы и образование в ней рецидивирующих и не поддающихся лечению язв у собак с сахарным диабетом.
Увеит, связанный с помутнением хрусталика
В процессе эмбриогенеза хрусталик формируется внутри собственной капсулы. В результате его структурные белки не представляются иммунной системе организма и иммунотолерантность к ним не развивается (van der Woerdt et al, 1992). При образовании и реабсорбции катаракты белки хрусталика становятся доступными для местной иммунной системы глаза, которая распознает их как «чужие», следствием чего являются воспаление и увеит. Наличие увеита в сочетании с реабсорбирующейся, перезрелой катарактой может отрицательно сказываться на успешности ее хирургической коррекции. В связи с этим необходимо устранить увеит до операции (Bagley, Lavach, 1995). Лечение увеита направлено на снижение воспаления и предупреждение дальнейшего повреждения внутри глаза. С этой целью чаще всего применяют офтальмологические кортикостероидные препараты для топического нанесения. Вместе с тем, системная
абсорбция топических кортикостероидов может противодействовать инсулину и, таким образом, препятствовать эффективному контролю гликемии при сахарном диабете, особенно у собак карликовых и миниатюрных пород. Альтернативой кортикостероидной терапии служит топическое применение нестероидных противовоспалительных средств, в частности 0,03% флурбипрофена (производства Allergam Pharmaceuticals, США) или циклоспорина. Препараты этой группы, хотя и менее активны, чем кортикостероиды, но не влияют на эффективность контроля уровня глюкозы.
Диабетическая ретинопатия
Диабетическая ретинопатия редко развивается у собак и кошек. Существует тесная корреляция между субоптимальным контролем уровня гликемии и возникновением ретинопатии (Engerman, Кет, 1987). Офтальмоскопическое исследование сетчатки при ретинопатии выявляет микроаневризмы, кровоизлияния, варикозные и шунтированные капилляры (Heritage et al, 1985; Ono et al, 1986). Гистологические изменения включают утолщение базальной мембраны капилляров, исчезновение перицитов, капиллярные шунты и микроаневризмы. Считается, что эти изменения являются следствием ишемии сетчатки. Скорость кровотока в сетчатке уменьшается в результате повышения вязкости крови, засорения сосудов остатками эритроцитов, агрегации последних, повышения концентрации фибриногена и подавления фибринолиза (Unger, Foster, 1998). Данные о роли полиольного пути обмена глюкозы в развитии ретинопатии противоречивы. Результаты одного из исследований, проводившихся на собаках с сахарным диабетом, позволяют думать, что избыточная продукция и накопление полиолов не являются ключевыми факторами в патогенезе ретинопатии (Engerman, Кет, 1993). К сожалению, быстрое развитие катаракты зачастую препятствует оценке состояния сетчатки у собак с диабетом. Поскольку частота катаракты у этих животных весьма значительна, во всех случаях впервые диагностированного диабета необходимо исследовать сетчатку. Это позволит убедиться в ее нормальном функционировании и отсутствии видимых нарушений, так как в последующем такая оценка может оказаться невозможной из-за возникновения катаракты и необходимости хирургического удаления хрусталика, что противопоказано собакам с достаточно серьезными изменениями в сетчатке, которые сами по себе могут привести к слепоте. Для характеристики состояния сетчатки накануне операции можно провести электроретинографию.
Диабетическая невропатия
Невропатия является частым осложнением сахарного диабета у кошек и довольно редко встречается у собак (Braund, Steiss, 1982; Katherman, Braund,
САХАРНЫЙ ДИАБЕТ У СОБАК • 581
1983; Johnson et al, 1983). Диабетическая невропатия чаще протекает субклинически, а не в тяжелой форме, и не сопровождается выраженными признаками. Как показывает наш опыт, клинические симптомы диабетической невропатии обычно проявляются у собак, болеющих диабетом в течение пяти или более лет. Клиническая симптоматика и результаты физикального исследования, подтверждающие наличие сопутствующей диабету невропатии у собак, включают общую слабость, изменение походки с постукиванием костяшками пальцев, мышечную атрофию, подавление рефлексов конечностей и нарушение ортостатической реакции. По существу она представляет собой дистальную полиневропатию, которая характеризуется сегментарной демиелинизацией и ремиелинизацией и аксональной дегенерацией и регенерацией. Электрофизиологические исследования выявляют потенциалы фибрилляции и положительные острые волны, свидетельствующие о денервации мышц, и эпизодические потенциалы фасцикуляции и необычные высокочастотные разряды (Steiss et al, 1981). Одновременно уменьшается скорость проводимости моторных и сенсорных нервов. Лечение, как таковое, отсутствует. Дополнительную информацию о диабетической невропатии можно найти в гл. 12, стр. 630.
Диабетическая нефропатия
Имеются отдельные сообщения об обнаружении диабетической нефропатии у собак, однако, как правило, она редко распознается на основании клинических проявлений. Значительно чаще нарушение почечной функции встречается у кошек. В одном из исследований оно было зарегистрировано у 10 из 54 (19%) кошек (Goossens et al, 1995). У большинства этих животных гистологическое исследование почечной ткани выявило гломерулосклероз. Гистопатологические данные, подтверждающие диабетическую нефропатию, включают мембранную гломерулонефропатию со слиянием отростков подоцитов, утолщение базальных мембран в почечных клубочках и канальцах, увеличение массы мезангиального матрикса, субэндотелиальные отложения, гломерулярный фиброз и гломерулосклероз (Steffes et al, 1982; Jaeraj et al, 1984). Патогенетический механизм диабетической нефропатии неизвестен, но, по-видимому, имеет множественный характер. Начальными нарушениями могут служить хроническая интергломерулярная гипертензия и гиперперфузия почек, которые индуцируются хронической гипергликемией (Clark, Lee, 1995). Повышение внутриклубочкового давления приводит к отложению белка в мезангии. Утолщение базальной мембраны почечных клубочков также является следствием быстрого увеличения образования мембран (Unger, Foster, 1998). Расширяющийся мезангий, в конце концов, внедряется в субэндотелиальное пространство и просвет клубочковых
капилляров, вызывая тем самым замедление кровотока в почечных клубочках и скорости фильтрации. В конечном итоге развиваются гломерулосклероз и почечная недостаточность.
Клиническая симптоматика зависит от тяжести гломерулосклероза и функциональной способности почек экскретировать продукты обмена веществ. Сначала диабетическая нефропатия проявляется в форме тяжелой протеинурии (преимущественно альбуминурии), которая является следствием дисфункции клубочков. По мере утяжеления гломерулярной патологии скорость клубочковой фильтрации прогрессивно снижается, что приводит к развитию азотемии и, в конце концов, уремии. Выраженная фиброзная дегенерация почечных клубочков способствует развитию сначала олигурической, а затем анурической почечной недостаточности. Специфические методы лечения диабетической нефропатии отсутствуют, если не считать тщательной компенсации сахарного диабета, консервативной медикаментозной терапии почечной недостаточности и контроля системной гипертонии. Прогрессирование гломерулосклероза зависит от качества контроля диабета. По мере улучшения гликемического контроля частота микрососудистых нарушений в почечных клубочках снижается (Nyberg et al, 1987; Wiseman et al, 1985).
Системная гипертензия
У человека сахарный диабет и гипертензия, как правило, сочетаются, что удваивает риск развития угрожающего жизни сердечно-сосудистого заболевания (Sowers, Zemel, 1990). По разным оценкам гипертензией страдают от 40% до 80% больных сахарным диабетом, и ее частота коррелирует с продолжительностью диабета. Тяжесть гипертензии зависит от контроля гликемии. При неудовлетворительном контроле в анамнезе у больных повышено систолическое кровяное давление. По данным одного из недавних исследований, частота гипертензии среди 50 собак с сахарным диабетом, получавших инсулин, составила 46%; критерием гипертензии считалась величина систолического, диастолического и среднего кровяного давления, превышавшая соответственно 160, 100 и 120 мм рт.ст. (Struble et al, 1998). Гипертензия ассоциировалась с большой продолжительностью диабета и повышенным отношением содержания альбумина и креатинина в моче. Диастолическое и среднее кровяное давление было особенно высоким у давно болеющих животных. В то же время корреляции между величиной кровяного давления и качеством контроля гликемии не выявлено.
Механизм возникновения гипертензии у больных диабетом людей неизвестен. Предполагается, что гипертензия и индуцируемые диабетом нарушения, такие как задержка натрия, васкулопатии и нефропатия повышают кровяное давление (Weidman et al, 1993). Неясно, однако, является ли гипертен
582 • САХАРНЫЙ ДИАБЕТ У СОБАК
зия следствием имеющегося субклинического заболевания почек или предрасполагает к развитию нефропатии и микроальбуминурии. Возможными причинами гипертензии у собак с сахарным диабетом могут быть расстройства липидного обмена, приводящие к нарушению свойств сосудистой стенки и генерализованной клубочковой гиперфильтрации, либо опосредуемая иммунной системой микроангиопатия, поражающая базальные мембраны (Dukes, 1992).
ТРАНСПЛАНТАЦИЯ ОСТРОВКОВ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Несмотря на значительное продление жизни больных сахарным диабетом после появления в 1920-х годах доступного инсулина для инъекций, вводимый подкожно экзогенный гормон характеризуется нефизиологичной фармакокинетикой и не имитирует нормальную пульсирующую секрецию инсулина бета-клетками под воздействием соответствующей стимуляции. В результате изменяется характер обменных процессов, что приводит к развитию хронических осложнений сахарного диабета. В последнее десятилетие был достигнут значительный прогресс в области трансплантации островковых клеток поджелудочной железы. Все большее число экспериментальных данных свидетельствует о том, что трансплантация эндокринной поджелудочной железы приводит к нормализации уровня сахара в крови и обеспечивает физиологическую секрецию инсулина (Southerland et al, 1984). Основным препятствием на пути успешной трансплантации остается отторжение пересаженной ткани. В настоящее время усилия исследователей направлены на предотвращение отторжения посредством иммуномодуляции аллотрансплантатов и самих реципиентов либо путем защиты пересаживаемых чужеродных островков от воздействия иммунной системы хозяина; одновременно разрабатываются методы терапии, направленные на предотвращение рецидивирующего аутоиммунного процесса в пересаженной островковой ткани.
Главная задача трансплантации островов поджелудочной железы состоит в исключении или уменьшении частоты и тяжести отдаленных осложнений сахарного диабета, поэтому ее целесообразность для комнатных животных находится под вопросом. Собаки и кошки, страдающие этим заболеванием, живут недолго, и даже у особей, продолжительность жизни которых превышает нормальную, не успевают развиться осложнения, обычные у людей с ИЗСД. В связи с этим проблема трансплантации островковой ткани этим животным стоит далеко не так остро, как у человека. Тем не менее, нельзя исключить возможность такой пересадки в будущем, при условии дальнейшего совершенствования технологии.
Пересадка цельной поджелудочной железы.
Первая пересадка поджелудочной железы челове
ку была осуществлена Kelly и Lollehei в 1966 году. После 1980 года число таких операций неуклонно увеличивалось и к настоящему времени достигло весьма внушительной величины. Самым распространенным методом является пересадка дуоденального сегмента поджелудочной железы, который анастомозируют к мочевому пузырю (University of Michigan, 1988; Southerland et al, 1989; Palmer, 1990). Дренирование трансплантата через мочевой пузырь обеспечивает выведение продуктов секреции экзокринного панкреаса. Мониторинг концентрации амилазы в моче позволяет своевременно выявить ее уменьшение, которое является ранним и чувствительным индикатором отторжения трансплантата. Значительный риск ранних послеоперационных осложнений, а также отдаленных осложнений иммуносупрессорной терапии, которые развиваются у 30-40% пациентов, перенесших трансплантацию поджелудочной железы, не позволяют точно прогнозировать исход этой операции. Поэтому многие хирурги проводят ее только больным с терминальными стадиями диабетической нефропатии, которые нуждаются в пересадке почек.
Пересадка островков поджелудочной железы. Пересадка изолированных островков Лангерганса представляет собой весьма привлекательную альтернативу трансплантации цельной поджелудочной железы для устранения диабетических расстройств. Пересадка островковых клеток значительно менее опасна для больного, она дает возможность модулировать иммуногенные свойства донорской ткани с целью уменьшения объема последующей иммуносупрессорной терапии, снижает затраты на операцию и позволяет провести ее на большем числе больных. В последнее десятилетие были предложены методы выделения островковых клеток, значительно повысившие их выход из донорской поджелудочной железы. Успешные пересадки островков, позволившие устранить проявления сахарного диабета, были проведены на мелких лабораторных животных, собаках и у небольшого числа людей (Soon-Shiong et al, 1993).
Островки поджелудочной железы служат мощными антигенными стимулами и без подавления иммунной реакции реципиента, как правило, отторгаются в течение 5-12 дней после пересадки (Alejandro et al, 1988). Интенсивность иммуносупрессивной терапии, необходимой для предотвращения отторжения трансплантатов, непосредственно зависит от числа доноров, от которых берется материал для пересадки. Иными словами, после пересадки клеток от одного донора объем иммуносупрессии значительно меньше, чем при пересадке клеток от трех доноров. Положение еще более осложняется тем обстоятельством, что, как показали многочисленные исследования, продолжительность жизни активного трансплантата зависит от количества пересаженных островков (Alejandro et al, 1988; Dafae, Uinik, 1990). Чем больше пересажено островков, тем эффективнее контролируется
САХАРНЫЙ ДИАБЕТ У СОБАК • 583
уровень глюкозы как в ближайшем, так и в отдаленном послеоперационном периоде. Однако для пересадки «идеального» количества островков их нередко приходится получать от трех и даже пяти доноров (Alejandro et al, 1988; Tattersall, 1989).
Хотя использование тканей от нескольких доноров обеспечивает лучшую компенсацию диабета, необходимость усиления иммуносупрессии может принести вред реципиенту. Кроме того, получение тканей от нескольких доноров представляет этическую проблему, так как требует гибели нескольких собак для спасения жизни одной, которую можно было бы поддерживать инсулинотерапией. В заключение следует отметить, что иммуносупрессия такими препаратами, как циклоспорин, отнюдь не безобидна. Длительное введение циклоспорина собакам приводит к появлению множественных расстройств, таких как потеря веса, папилломатоз, анемия, гипоальбуминемия и поликлональные гам-мопатии (Feldman, Alejandro, 1980). Наконец, и без того неблагоприятная ситуация еще более осложняется тем, что для предотвращения отторжения пересаженных островков концентрация циклоспорина в крови должна быть такой высокой, что на самом деле может оказаться губительной для «защищаемых» островков (Alejandro et al, 1989).
Иммунопротекция пересаженных островков. В попытках избежать иммунного отторжения пересаженных островков поджелудочной железы и/
или необходимости иммуносупрессорной терапии было разработано немало методических подходов. Один из них состоит в применении так называемого микроинкапсулирования. Первое сообщение об этом новом методе появилось в журнале «Science» в 1980 году. Он позволяет полностью изолировать каждый жизнеспособный островок, заключив его в полупроницаемую мембрану. Эта микрокапсуляр-ная мембрана состоит из нетоксичного полисахарида - перекрестносвязанного алгината и проницаема для мелких молекул, таких как глюкоза или инсулин, но совершенно непроницаема для таких крупных молекул как иммуноглобулины (Soon-Shiong et al, 1992). Пересаженная в такой оболочке ткань практически «невидима» для иммунной системы реципиента. Результаты, полученные на группе собак со спонтанным ИЗСД, подтвердили потенциальную ценность технологии микроинкапсулирования (Soon-Shiong et al, 1992). В настоящее время для пересадки используются аллотрансплантаты (т. е. ткани от доноров того же биологического вида, что и реципиент). Микроинкапсулированные островки поджелудочной железы, полученные от здоровых особей, подсаживали в брюшную полость 12 домашних собак со спонтанным сахарным диабетом. Через 8-12 часов после пересадки концентрация глюкозы в плазме их крови снизилась до нормы или еще ниже. Эугликемия сохранялась на протяжении 1-6 (в среднем 3,5) месяцев (рис. 11-24). После во
Рис. 11-24. Концентрация глюкозы в плазме крови натощак (мг/100 мл) по данным ежедневного мониторинга после внутрибрюшинной инъекции свободных островковых аллотрансплататов (п = 3) или инкапсулированных островков (п = 6) собакам со спонтанно развившимся сахарным диабетом. У реципиентов свободных островков происходило их быстрое отторжение с возобновлением гипергликемии через 5,7+3,7 дней после имплантации. В отличие от этого у собак, которым имплантировали инкапсулированные островки, эугли-кемическое состояние и отсутствие потребности в инсулине сохранялись в среднем на протяжении 105 дней. ( Из: Soon-Shiong Р et al: Successful reversal of spontaneous diabetes in dogs by intraperitoneal microencapsulated islets. Transplantation, 54:769, 1992.)
584
САХАРНЫЙ ДИАБЕТ У СОБАК
зобновления инсулинозависимого состояния у пяти из этих животных им была произведена повторная трансплантация, которая оказалась столь же успешной, как и первая.
Трансплантация микроинкапсулированных островков поджелудочной железы позволила собрать исключительно ценную информацию по данной проблеме. Вместе с тем она требует забоя донора или проведения чрезвычайно сложной хирургической операции для получения панкреатической ткани. Поэтому пересадка аллотрансплантатов человеку имеет крайне ограниченные возможности и ее не следует проводить у собак. В то же время разработка методов использования островков Лангерганса из поджелудочной железы свиней дала бы богатый источник материала для более широкого применения этой новой технологии для лечения сахарного диабета. После внедрения в медицину она могла бы использоваться и в ветеринарии.
ПРОГНОЗ
Прогноз сахарного диабета у собак и кошек в известной степени зависит от отношения хозяев животных к их лечению, эффективности контроля уровня гликемии, наличия и возможности устранения сопутствующих заболеваний (например, панкреатита) и успешности предотвращения хронических осложнений диабета (см. табл. 11-7). Средняя продолжительность жизни собак после постановки диагноза сахарного диабета составляет 3 года. Эта цифра не совсем корректна, так как диабет обычно выявляется у собак в возрасте 7-10 лет, а смертность на протяжении шести последующих месяцев весьма значительна из-за сопутствующих угрожающих жизни расстройств, таких как кетоацидоз, острый панкреатит и недостаточность функции почек. Вместе с тем, некоторые собаки с диабетом, выжившие в течение первых 6 месяцев, в дальнейшем живут более 5 лет; при этом качество жизни большинства из них остается вполне удовлетворительным, если хорошее взаимодействие владельца и ветеринара обеспечивает им должный уход и ветеринарное обслуживание.
Обычно быстрая гибель собак после выявления у них сахарного диабета обусловлена тяжелым кетоацидозом, сопутствующим заболеванием (например, тяжелым панкреатитом или почечной недостаточностью), либо нежеланием владельца лечить животное. Смерть через несколько недель или месяцев после начала терапии диабетических расстройств бывает связана с отсутствием адекватного контроля уровня гликемии; в результате сохраняется устойчивая клиническая симптоматика, развиваются хронические осложнения диабета (например, слепота вследствие катаракты) и не связанные с ним расстройства. В свою очередь, отсутствие адекватного контроля обусловлено низкой эффективностью инсулинотерапии или инсулинорезис-тентностью, вызванной антагонизмом действию
инсулина, который может оставаться нераспознанным на протяжении нескольких недель или месяцев после установления диагноза сахарного диабета.
ЛИТЕРАТУРА
Abraham AS, et al: The effects of chromium supplementation on serum glucose and lipids in patients with and without non-insulin-dependent diabetes. Metabolism 41:768, 1992.
Alejandro R, et al: Advances in canine diabetes mellitus research: Etiopathol-ogy and results of islet transplantation. JAVMA 193:1050, 1988.
Alejandro J, et al: Effects of cyclosporin on insulin and C-peptide secretion in healthy Beagles. Diabetes 38:698, 1989.
Anderson JW, Akanji AO: Dietary fiber-An overview. Diabetes Care 14:1126, 1991.
Anderson JW, et al: Metabolic effects of high carbohydrate, high fiber diets for insulin dependent diabetic individuals. Am J Clin Nutr 54:930, 1991.
Anderson RA: Chromium, glucose tolerance, and diabetes. Biol Trace Element Res 32:19, 1992.
Anderson RA, et al: Elevated intakes of supplemental chromium improve glucose and insulin variables in individuals with type 2 diabetes. Diabetes 46:1786, 1997.
Appleton DJ, et al: Insulin sensitivity decreases with obesity, and lean cats with low insulin sensitivity are at greatest risk of glucose intolerance with weight gain. J Feline Med Surg 3:211, 2001.
Armstrong PJ, Ford RB: Hyperlipidemia. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1046.
Arner P, et al: Influence of thyroid hormone level on insulin action in human adipose tissue. Diabetes 33:369, 1984.
Atkins CE, et al: Morphologic and immunocytochemical study of young dogs with diabetes mellitus associated with pancreatic islet hypoplasia. Am J Vet Res 49:1577, 1988.
Atkinson MA, et al: Lack of bovine responsiveness to bovine serum albumin in insulin-dependent diabetes. N Engl J Med 329:1853, 1993.
Bagley LH, Lavach JD: Comparison of postoperative phacoemulsification results in dogs with and without diabetes mellitus: 153 cases (1991-1992). J Am Vet Med Assoc 205:1165, 1994.
Baker JR, et al: Use of protein-based standards in automated colorimetric determinations of fructosamine in serum. Clin Chem 31:1550, 1985.
Balfour JA, McTavish D: Acarbose: An update of its pharmacology and therapeutic use in diabetes mellitus. Drugs 46:1025, 1993.
Baker KS, et al: Trigeminal ganglion neurons affect corneal epithelial phenotype. Influence of type VII collagen expression in vitro. Invest Ophthalmol Vis Sci 34:137, 1993.
Beam S, et al: A retrospective-cohort study on the development of cataracts in dogs with diabetes mellitus: 200 cases. Vet Ophthalmology 2:169, 1999.
Bergman RN, Mittleman SD: Central role of the adipocyte in insulin resistance. J Basic Clin Physiol Pharmacol 9:205, 1998.
Berlinger JA, et al: Lipoprotein-induced insulin resistance in aortic endothelium. Diabetes 33:1039, 1984.
Bertoni AG, et al: Diabetes and the risk of infection-related mortality in the U.S. Diabetes Care 24:1044, 2001.
Bieger WP, et al: Diminished insulin receptors on monocytes and erythrocytes in hypertriglyceridemia. Metabolism 33:982, 1984.
Bolli GB, et al: Abnormal glucose counterregulation after subcutaneous insulin in insulin-dependent diabetes mellitus. N Engl J Med 310:1706, 1984.
Brange J, et al: Monomeric insulins obtained by protein engineering and their medical implications. Nature 333:679, 1988.
Braund KG, Steiss JE: Distal neuropathy in spontaneous diabetes mellitus in the dog. Acta Neuropathol (Berl) 57:263, 1982.
Brenner BM, et al: Dietary protein intake and the progressive nature of kidney disease: The role of hemodynamically mediated glomerular injury in the pathogenesis of progressive glomerular sclerosis in aging, renal ablation and intrinsic renal disease. N Engl J Med 307:652, 1982.
Briggs C, et al: Reliability of history and physical examination findings for assessing control of glycemia in dogs with diabetes mellitus: 53 cases (1995-1998). J Am Vet Med Assoc 217:48, 2000.
Clark CM, Lee DA: Prevention and treatment of the complications of diabetes mellitus. N Engl J Med 332:1210, 1995.
Cohn LA, et al: Effects of chromium supplementation on glucose tolerance in obese and nonobese cats. Am J Vet Res 60:1360, 1999.
Cohn LA, et al: Assessment of five portable blood glucose meters, a point-of-care analyzer, and color test strips for measuring blood glucose concentration in dogs. J Am Vet Med Assoc 216:198, 2000.
Coniff RF, et al: Reduction of glycosylated hemoglobin and postprandial hyperglycemia by acarbose in patients with NIDDM. A placebo-controlled dose-comparison study. Diabetes Care 18:817, 1995.
Crenshaw KL, et al: Serum fructosamine concentration as an index of glycemia in cats with diabetes mellitus and stress hyperglycemia. J Vet Intern Med 10:360, 1996.
Cryer PE: Catecholamines, pheochromocytoma and diabetes. Diabetes Rev 1:309, 1993.
сахарный диабет у собак
585
Cryer РЕ, Polonsky KS: Glucose homeostasis and hypoglycemia. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 939.
Czech MP, et al: Effect of thyroid status on insulin action in rat adipocytes in skeletal muscle. J Clin Invest Med 66:574, 1980. Dafae DA, Uinik Al: Is pancreas transplantation for insulin-dependent diabetes mellitus worthwhile? N Engl J Med 322:1608, 1990.
Davidson JK, et al: Insulin therapy. In Davidson JK (ed): Clinical Diabetes Mellitus: A Problem Oriented Approach. New York, Thieme Medical Publishers, 1991, p266.
Davison LJ, et al: Anti-insulin antibodies in dogs with naturally occurring diabetes mellitus. J Immunol Immunopathol 91:53, 2003.
DeBowes U: Lipid metabolism and hyperlipoproteinemia in dogs. Comp Cont Ed 9:727, 1987.
DeFronzo RA: Pathogenesis of type 2 diabetes: Metabolic and molecular implications for identifying diabetes genes. Diabetes Rev 5:177, 1997.
DeFronzo RA: Pharmacologic therapy for type 2 diabetes mellitus. Ann Intern Med 131:281, 1999.
DeFronzo RA, et al: Fasting hyperglycemia in non-insulin dependent diabetes mellitus: Contributions of excessive hepatic glucose production and impaired tissue glucose uptake. Metabolism 38:387, 1989.
Devaux C, et al: What role does dietary protein restriction play in the management of chronic renal failure in dogs? Vet Clin North Am 26:1247, 1996.
Duesberg C, et al: Impaired counterregulatory response to insulin-induced hypoglycemia in diabetic dogs [abstractl. J Vet Intern Med 9:181, 1995.
Dukes J: Hypertension: A review of the mechanisms, manifestations and management. J Small Anim Pract 33:119, 1992.
Dutta SK, Hlasko J: Dietary fiber in pancreatic disease: Effect of high fiber diet on fat malabsorption in pancreatic insufficiency and in vitro study of the interaction of dietary fibers with pancreatic enzymes. Am J Clin Nutr 41:517, 1985.
Eckel RH: Lipoprotein lipase. A multifunctional enzyme relevant to common metabolic diseases. N Engl J Med 320:1060, 1989.
Eidemak I, et al: Insulin resistance and hyperinsulinaemia in mild to moderate progressive chronic renal failure and its association with aerobic work capacity. Diabetologia 38:565, 1995.
Eigenmann JE, Rijnberk A: Influence of medroxyprogesterone acetate (Pro-vera) on plasma growth hormone levels and on carbohydrate metabolism. I. Studies in the ovarlohysterectomized bitch. Acta Endocrinol 98:599, 1981.
Eigenmann JE, et al: Progesterone-controlled growth hormone overproduction and naturally occurring canine diabetes and acromegaly. Acta Endocrinol 104:167, 1983.
Eisenbarth GS: Type I diabetes mellitus. A chronic autoimmune disease. N Engl J Med 314:1360, 1986.
Elliott DA: Disorders of metabolism. In Nelson RW, Couto CG (eds): Small Animal Internal Medicine, 3rd ed. St Louis, Mosby, 2003, p 816.
Elliott DA, et al: Glycosylated hemoglobin concentrations in the blood of healthy dogs and dogs with naturally developing diabetes mellitus, pancreatic b-cell neoplasia, hyperadrenocorticism, and anemia. J Am Vet Med Assoc 211:723, 1997.
Elliott DA, et al: Comparison of serum fructosamine and blood glycosylated hemoglobin concentrations for assessment of glycemic control in cats with diabetes mellitus. J Am Vet Med Assoc 214:1794, 1999.
Engerman RL, Kern TS: Progression of incipient diabetic retinopathy during good glycemic control. Diabetes 36:808, 1987.
Engerman RL, Kern TS: Aldose reductase inhibition fails to prevent retinopathy in diabetic and galactosemic dogs. Diabetes 42:820, 1993.
Evans GW: The effect of chromium picolinate on insulin controlled parameters in humans. Internat J Biosoc Med Res 11:163, 1989.
Feldman EC, et al: Reduced immunogenicity of pork insulin in dogs with spontaneous insulin-dependent diabetes mellitus [abstract]. Diabetes 32(Suppl 1 ):153A, 1983.
Feldman EC, Alejandro R: Red blood cell and serum biochemical alterations in dogs receiving long term cyclosporin (CsA) therapy. Transplantation 45:837, 1988.
Feldman EC, Nelson RW: Insulin-induced hyperglycemia in diabetic dogs. JAVMA 180:1432, 1982.
Feldman EC, Nelson RW: Canine and Feline Endocrinology and Reproduction. Philadelphia, WB Saunders Co, 1987.
Fernqvist E, et al: Effects of physical exercise on insulin absorption in insulindependent diabetics: A comparison between human and porcine insulin. Clin Physiol 6:489, 1986.
Fluckiger R, et al: Evaluation of the fructosamine test for the measurement of plasma protein glycation. Diabetologia 30:648, 1987.
Ford SL, et al: Insulin resistance in three dogs with hypothyroidism and diabetes mellitus. JAVMA 202:1478, 1993.
Friedman EA: Diabetic nephropathy: Strategies in prevention and management. Kidney Int 21:780, 1982.
Galante P, et al: Acute hyperglycemia provides an insulin-independent inducer for GLUT4 translocation in C2C12 myotubes and rat skeletal muscle. Diabetes 44:646, 1995.
Galloway J A: Chemistry and clinical use of insulin. In Galloway J A, et al (eds): Diabetes Mellitus. Indianapolis, Eli Lilly, 1988, p 105.
Ganong WF: Review of Medical Physiology, 15th ed. San Mateo, C A, Appleton &Lange, 1991.
Garg A: Management of dyslipidemia in IDDM patients. Diabetes Care 17:224, 1994.
Garg A, Grundy SM: Lovastatin for lowering cholesterol levels in non-in-sulindependent diabetes mellitus. N Engl J Med 318:81, 1988. Garg A, Grundy SM: Management of dyslipidemia in NIDDM. Diabetes Care 13:153, 1990.
Gerstein HC: Cow’s milk exposure and type 1 diabetes mellitus. Diabetes Care 17:13, 1994.
Good KL, et al: Corneal sensitivity in dogs with diabetes mellitus. Am J Vet Res 64:7, 2003.
Goossens M, et al: Response to therapy and survival in diabetic cats [abstract]. J Vet Intern Med 9:181, 1995.
Gorus FK, et al: IA-2-auto-antibodies complement GAD-65-autoantibodies in new-onset IDDM patients and help predict impending diabetes in their siblings. Diabetologia 40:95, 1997.
Graham PA, et al: Canned high fiber diet and postprandial glycemia in dogs with naturally occurring diabetes mellitus. J Nutri 124:27125, 1994.
Graham PA, et al: Pharmacokinetics of a porcine insulin zinc suspension in diabetic dogs. J Small Anim Pract 38:434, 1997.
Groop LC, et al: Glucose and free fatty acid metabolism in non-insulindepen-dent diabetes mellitus. Evidence for multiple sites of insulin resistance. J Clin Invest 84:205, 1989.
Gross KL, et al: Dietary chromium and carnitine supplementation does not affect glucose tolerance in obese dogs. JVIM 14:345, 2000 (abstr).
Guptill L et al: Is canine diabetes on the increase? /n Recent Advances in Clinical Management of Diabetes Mellitus, lams Company, Dayton, Ohio, 1999, p 24-27.
Hagopian WA, et al: Glutamate decarboxylase-, insulin-, and islet cell-antibodies and HL typing to detect diabetes in a general population-based study of Swedish children. J Clin Invest 95:1505, 1995.
Haines DM: A re-examination of islet cell cytoplasmic antibodies in diabetic dogs. Vet Immunol Immunopathol 11:225, 1986.
Haffner SM: Management of dyslipidemia in adults with diabetes. Diabetes Care 21:160, 1998.
Hallden G, et al: Characterization of cat insulin. Arch Biochem Biophys 247:20, 1986.
Harb-Hauser M, et al: Prevalence of insulin antibodies in diabetic dogs. J Vet Intern Med 12:213, 1998 (abstr).
Harte J, et al: Dietary management of naturally occurring chronic renal failure in cats. J Nutr 124:26605, 1994.
Hasegawa S, et al: Glycated hemoglobin fractions in normal and diabetic dogs measured by high performance liquid chromatography. J Vet Med Sci 53:65, 1991.
Hasegawa S, et al: Glycated hemoglobin fractions in normal and diabetic cats measured by high performance liquid chromatography. J Vet Med Sci 54:789, 1992.
Henry RR: Protein content of the diabetic diet. Diabetes Care 17:1502, 1994.
Herrtage ME, et al: Diabetic retinopathy in a cat with megestrol acetatein-duced diabetes. J Small Anim Pract 26:595, 1985.
Hess RS, Ward CR: Effect of insulin dosage on glycemic response in dogs with diabetes mellitus: 221 cases (1993-1998). J Am Vet Med Assoc 216:217, 2000.
Hess RS, et al: Clinical, clinicopathologic, radiographic, and ultrasonographic abnormalities in dogs with fatal acute pancreatitis: 70 cases (1986-1995). J Am Vet Med Assoc 213:665, 1998.
Hess RS, et al: Breed distribution of dogs with diabetes mellitus admitted to a tertiary care facility. J Am Vet Med Assoc 216:1414, 2000a.
Hess RS, et al: Concurrent disorders in dogs with diabetes mellitus: 221 cases (1993-1998). J Am Vet Med Assoc 217:1166, 2000b.
Hess RS, et al: Association between hypothyroidism, diabetes mellitus, and hyperadrenocorticism and development of atherosclerosis in dogs (abstr). J Vet Intern Med 16:360, 2002.
Hoenig M, Dawe DL: A qualitative assay for beta cell antibodies. Preliminary results in dogs with diabetes mellitus. Vet Immunol Immunopathol 32:195, 1992.
Holste LC, et al: Effect of dry, soft moist, and canned dog foods on postprandial blood glucose and insulin concentrations in healthy dogs. Am J Vet Res 50:984, 1989.
Home PD, et al: Comparative pharmacokinetics of the novel rapid-acting insulin analogue, insulin aspart, in healthy volunteers. Eur J Clin Pharmacol 55:199, 1999.
Hostetter TH, et al: The case for intrarenal hypertension in the initiation and progression of diabetic and other glomerulopathies. Am J Med 72:375, 1982.
Howard BV, et al: Integrated study of low density lipoprotein metabolism and very low density lipoprotein metabolism in non-insulin-dependent diabetes. Metabolism 36:870, 1987.
Howey DC, et al: Lys(B28)Pro(B29)-human insulin: A rapidly absorbed analog of human insulin. Diabetes 43:396, 1994.
Ihle SL, Nelson RW: Insulin resistance and diabetes mellitus. Comp Cont Educ 13:197, 1991.
Jacobs MA, et al: Metabolic efficacy of preprandial administration of Lys(B28),Pro(B29) human insulin analog in IDDM patients. A comparison with human regular insulin during a three-meal test period. Diabetes Care 20:1279, 1997.
586 • САХАРНЫЙ ДИАБЕТ У СОБАК
Jain NC: Erythrocyte physiology and changes in disease. In Jain NC (ed): Essentials of veterinary hematology. Philadelphia: WB Saunders Co, 1993; 133.
Jensen AL: Serum fructosamine in canine diabetes mellitus. An initial study. Vet Res Commun 16:1, 1992. Jeraj K, et al: Immunofluorescence studies of renal basement membranes in dogs with spontaneous diabetes. Am J Vet Res 45:1162, 1984.
Johnson CA, et al: Peripheral neuropathy and hypotension in a diabetic dog. JAVMA 183:1007, 1983.
Johnson RN, et al: Relationship between albumin and fructosamine concen-ration in diabetic and non-diabetic sera. Clin Chim Acta 164:151, 1987.
Joshi N, et al: Infections in patients with diabetes mellitus. N Engl J Med 341:1906, 1999.
Kaiyala KJ, et al: Reduced 13-cell function contributes to impaired glucose tolerance in dogs made obese by high-fat feeding. Am J Physiol 277(Endo-crinol Metab 40):E659-E667, 1999.
Karam JH: Hypoglycemic disorders. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/Mc-Graw-Hill, 2001, p 699.
Karjalainen J, et al: A bovine albumin peptide as a possible trigger of insulindependent diabetes mellitus. N Engl J Med 327:302, 1992.
Katherman AE, Braund KG: Polyneuropathy associated with diabetes mellitus in a dog. JAVMA 182:522, 1983.
Kawamoto M, et al: Relation of fructosamine to serum protein, albumin, and glucose concentrations in healthy and diabetic dogs. Am J Vet Res 53:851, 1992.
Kelley DE, et al: Efficacy and safety of acarbose in insulin-treated patients with type 2 diabetes. Diabetes Care 21:2056, 1998.
Kirk CA, et al: Diagnosis of naturally acquired type-l and type-ll diabetes mellitus in cats. Am J Vet Res 54:463, 1993.
Krezowski PA, et al: The effect of protein ingestion on the metabolic response to oral glucose in normal individuals. Am J Clin Nutr 44:847, 1986.
Lahtela JT, et al: Severe antibody-mediated human insulin resistance: Successful treatment with the insulin analog lispro. Diabetes Care 20:71, 1997.
Leahy JL: Natural history of (3-cell dysfunction in NIDDM. Diabetes Care 13:992, 1990.
Lembcke B, et al: Effect of 1-desoxynojirimycin derivatives on small intestinal disaccharidase activities and on active transport in vitro. Digestion 31:120, 1985.
Lewis L, et al: Small Animal Clinical Nutrition, 3rd ed. Topeka, KS, Mark Morris Associates, 1987.
Lindholm A, et al: Improved postprandial glycemic control with insulin as-part. A randomized double-blind cross-over trial in type 1 diabetes. Diabetes Care 22:801, 1999.
Lindholm A, et al: Immune responses to insulin aspart and biphasic insulin aspart in people with type 1 and type 2 diabetes. Diabetes Care 25:876, 2002.
Loste A, Marca MC: Study of the effect of total serum protein and albumin concentrations on canine fructosamine concentration. Can J Vet Res 63:138, 1999.
Lutz TA, et al: Fructosamine concentrations in hyperglycemic cats. Can Vet J 36:155, 1995.
Mahaffey EA, Cornelius LM: Evaluation of a commercial kit for measurement of glycosylated hemoglobin in canine blood. Vet Clin Path 10:21, 1981.
Mahaffey EA, Cornelius LM: Glycosylated hemoglobin in diabetic and nondiabetic dogs. JAVMA 180:635, 1982.
Malik RL, Jaspan JB: Role of protein in diabetes control. Diabetes Care 12:39, 1989.
Marca MC, Loste A: Glycosylated haemoglobin in dogs: Study of critical difference value. Res Vet Sci 71:115, 2001.
Marca MC, et al: Blood glycated hemoglobin evaluation in sick dogs. Can J Vet Res 64:141, 2000.
Marfurt C: Nervous control of the cornea. In Burnstock G, Sillito AM (eds): Nervous control of the eye. Amsterdam: Harwood Academic Publishers, 2000, p 41.
Marshall MO, et al: Development of insulin antibodies, metabolic control and (3-cell function in newly diagnosed insulin dependent diabetic children treated with monocomponent human insulin or monocomponent porcine insulin. Diabetes Res 9:169, 1988.
Marshall RD, Rand JS: Comparison of the pharmacokinetics and pharmacodynamics of glargine, protamine zinc and porcine lente insulins in normal cats [abstrl. J Vet Intern Med 16:358, 2002.
Martin BC, et al: Role of glucose and insulin resistance in development of type 2 diabetes mellitus: Results of a 25-year follow-up study. Lancet 340:925, 1992.
Massillon D, et al: Induction of hepatic glucose-6-phosphatase gene expression by lipid infusion. Diabetes 46:153, 1997.
Mattheeuws D, et al: Diabetes mellitus in dogs: Relationship of obesity to glucose tolerance and insulin response. Am J Vet Res 45:98, 1984.
McGuire NC, et al: Detection of occult urinary tract infections in dogs with diabetes mellitus. J Am Anim Hosp Assoc 38:541, 2002.
McMahon MM, Bistrian BR: Host defenses and susceptibility to infection in patients with diabetes mellitus. Infect Dis Clin North Am 9:1, 1995.
Meyer JH, et al: Intragastric versus intralntestinal viscous polymers and glucose tolerance after liquid meals of glucose. Am J Clin Nutr 48:260, 1988.
Mitrakou A, et al: Contribution of abnormal muscle and liver glucose metabolism to post-prandial hyperglycemia in NIDDM. Diabetes 39:1381, 1990.
Moller DE, Flier JS: Insulin resistance. Mechanisms, syndromes, and implications. N Engl J Med 325:938, 1991.
Mossop RT: Effects of chromium (III) on fasting glucose, cholesterol, and cholesterol HDL levels in diabetics. Cent Afr J Med 29:80, 1983.
Muirhead RP, Hothersall JS: The effect of phenazine methosulphate on intermediary pathways of glucose metabolism in the lens at different glycaemic levels. Exp Eye Res 61; 619, 1995.
Nathan DM: Long-term complications of diabetes mellitus. N Engl J Med 328:1676, 1993.
Nell LJ, Thomas JW: Human insulin autoantibody fine specificity and H and L chain use. J Immunol 142:3063, 1989.
Nelson RW: Disorders of the endocrine pancreas. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 3rd ed. Philadelphia, WB Saunders Co, 1989, p 1676.
Nelson RW, Lewis LD: Nutritional management of diabetes mellitus. Semin Vet Med Surg 5:178, 1990.
Nelson RW, et al: Effects of dietary fiber supplementation on glycemic control in dogs with alloxan-induced diabetes mellitus. Am J Vet Res 52:2060, 1991.
Nelson RW, et al: Effect of an orally administered sulfonylurea, glipizide, for treatment of diabetes mellitus in cats. JAVMA 203:821, 1993.
Nelson RW, et al: Transient clinical diabetes mellitus in cats: 10 cases (1989-1991). J Vet Intern Med 13:28, 1998a.
Nelson RW, et al: Effect of dietary insoluble fiber on control of glycemia in dogs with naturally acquired diabetes mellitus. JAVMA212:380, 1998b.
Nelson RW, et al: Effect of the [3-glucosidase inhibitor acarbose on control of glycemia in dogs with naturally acquired diabetes mellitus. JAVMA 216:1265, 2000.
Nerup J: On the pathogenesis of IDDM. Diabetologia 37(suppl 2):S82, 1994.
Nishida Y, et al: Effect of mild exercise training on glucose effectiveness in healthy men. Diabetes Care 24:1008, 2001.
Nuttall FQ: Dietary fiber in the management of diabetes. Diabetes 42:503, 1993.
Nyberg G, et al: Impact of metabolic control in progression of clinical diabetic nephropathy. Diabetologia 30:82, 1987.
Ogilvie GK, et al: Alterations in carbohydrate metabolism in dogs with nonhe-matopoietic malignancies. Am J Vet Res 58:277, 1997.
Ono K, et al: Fluorescein angiogram in diabetic dogs. Jpn J Vet Sci 48:1257, 1986.
Owens DR, et al: Pharmacokinetics of ’“(-labeled insulin glargine (HOE901) in healthy men-comparison with NPH insulin and the influence of different subcutaneous injection sites. Diabetes Care 23:813, 2000.
Palmer JP: Current management of Type I diabetes: Insulin, transplantation and immunotherapy. 42nd Postgraduate Assembly, The Endocrine Society 1, 1990.
Palmer JP, McCulloch DK: Prediction and prevention of IDDM-1991. Diabetes 40:943, 1991.
Panciera DL, et al: Epizootiologic patterns of diabetes mellitus in cats: 333 cases (1980-1986). JAVMA 197:1504, 1990.
Pastors JG, et al: Psyllium fiber reduces rise in postprandial glucose and insulin concentrations in patients with non-insulin-dependent diabetes. Am J Clin Nutr 53:1431, 1991.
Pedersen O, et al: Characterization of the insulin resistance of glucose utilization in adipocytes from patients with hyper- and hypothyroidism. Acta Endocrinol 119:228, 1988.
Peikes H, et al: Dermatologic disorders in dogs with diabetes mellitus: 45 cases (1986-2000). J Am Vet Med Assoc 219:203, 2001.
Phillips SM, et al: Increments in skeletal muscle GLUT-1 and GLUT-4 after endurance training in humans. Am J Physiol 270:E456, 1996.
Pieber TR, et al: Efficacy and safety of HOE 901 versus NPH insulin in patients with type 1 diabetes. Diabetes Care 23:157, 2000.
Polonsky KS: Lilly Lecture 1994. The (3-cell in diabetes: From molecular genetics to clinical research. Diabetes 44:705, 1995.
Possilli P, Leslie RDG: Infection and diabetes: Mechanisms and prospects for prevention. Diabet Med 11:935, 1994.
Rabinowitz MB, et al: Effects of chromium and yeast supplements on carbohydrate and lipid metabolism in diabetic men. Diabetes Care 6:319, 1983.
Rave K, et al: Impact of diabetic nephropathy on pharmacodynamic and pharmacokinetic properties of insulin in type 1 diabetic patients. Diabetes Care 24:886, 2001.
Reaven GM: Role of insulin resistance in human disease. Diabetes 37:1595, 1988.
Remillard RL: Nutritional management of diabetic dogs. Compend Contin Educ Pract Vet 21:699, 1999.
Reusch CE, et al: Fructosamine: A new parameter for diagnosis and metabolic control in diabetic dogs and cats. J Vet Int Med 7:177, 1993.
Reusch CE, Haberer B: Evaluation of fructosamine in dogs and cats with hypo-or hyperproteinaemia, azotaemia, hyperlipidaemia and hyperbilirubinae-mia. Vet Rec 148:370, 2001.
Richter M, et al: Aldose reductase activity and glucose-related opacities in incubated lenses from dogs and cats. Am J Vet Res 63:1591, 2002.
Rios MS: Acarbose and insulin therapy in type I diabetes mellitus. Eur J Clin Invest 24:36, 1994.
САХАРНЫЙ ДИАБЕТ У СОБАК
587
Robertson J, et al: Effects of the (3-glucosidase inhibitor acarbose on postprandial serum glucose and insulin concentrations in healthy dogs. AJVR 60:541, 1999.
Rosenstock J, et al: Basal insulin glargine (HOE901) versus NPH insulin in patients with type 1 diabetes on multiple daily insulin regimens. Diabetes Care 23:1137, 2000.
Rosenstock J, et al: Basal insulin therapy in type 2 diabetes: 28-week comparison of insulin glargine (HOE901) and NPH insulin. Diabetes Care 24:631, 2001.
Rossetti L, et al: Glucose toxicity. Diabetes Care 13:610, 1990.
Roszler J: Herbs, supplements and vitamins: What to try, what to buy. Diabetes Interviews August, 2001, p 45.
Ryan EA, Enns L: Role of gestational hormones in the induction of insulin resistance. J Clin Endocrinol Metab 67:341, 1988.
Saad MF, et al: Sequential changes in serum insulin concentration during development of non-insulin-dependent diabetes. Lancet 1:1356, 1989.
Savilahti E, et al: Increased levels of cow’s milk and (3-lactoglobulin antibodies in young children with newly diagnosed IDDM. Diabetes Care 16:984, 1993.
Scarlett JM, Donoghue S: Associations between body condition and disease in cats. J Am Vet Med Assoc 212:1725, 1998.
Schachter S, et al: Oral chromium picolinate and control of glycemia in insu-lintreated diabetic dogs. J Vet Intern Med 15:379, 2001.
Schatz D, et al: Islet celt antibodies predict insulin-dependent diabetes in United States school children as powerfully as in unaffected relatives. J Clin Invest 93:2403, 1994.
Soon-Shiong P, et al: Successful reversal of spontaneous diabetes in dogs by intraperitoneal microencapsulated islets. Transplantation 54:769, 1992.
Soon-Shiong P, et al: Long-term reversal of diabetes by the injection of immunoprotected islet cells. Proceed Natl Acad Sci 90:5843, 1993.
Spears JW, et al: Influence of chromium on glucose metabolism and insulin sensitivity. In Reinhart GA, Carey DP (eds): Recent Advances in Canine and Feline Nutrition, Vol II. Wilmington, Ohio, Orange Frazer Press, 1998, p 97.
Spiller GA, et al: Effect of protein dose on serum glucose and insulin response to sugars. Am J Clin Nutr 45:474, 1987.
Srikanta S, et al: Assay for islet cell antibodies: Protein A-monoclonal antibody method. Diabetes-34:300, 1985.
Steffes MW, et al: Diabetic nephropathy in the uninephrectomized dog: Microscopic lesions after one year. Kidney Int 21:721, 1982.
Steiss JE, et al: Electrodiagnostic analysis of peripheral neuropathy in dogs with diabetes mellitus. Am J Vet Res 42:2061, 1981.
Striffler JS, et al: Chromium improves insulin response to glucose in rats. Metabolism 44:1314, 1995.
Struble AL, et al: Systemic hypertension and proteinuria in dogs with naturally occurring diabetes mellitus. J Am Vet Med Assoc 213:822, 1998.
Stumvoll M, et al: Renal glucose production and utilization: New aspects in humans. Diabetologia 40:749, 1997.
Sutherland DER, et al: One hundred pancreas transplants at a single institution. Ann Surg 200:414, 1984.
Sutherland DER, et al: Results of pancreas-transplant registry. Diabetes 38(Suppl 1 ):46, 1989.
Tattersail R: Is pancreas transplantation for insulin-dependent diabetes mellitus worthwhile? N Engl J Med 321:112, 1989.
Thomas JW, et al: Heterogeneity and specificity of human anti-insulin antibodies determined by isoelectric focusing. J Immunol 134:1048, 1985.
Thomas JW, et al: Spectrotypic analysis of antibodies to insulin A and В chains. Mol Immunol 25:173, 1988.
Truglia JA, et al: Insulin resistance: Receptor and post-binding defects in human obesity and non-insulin-dependent diabetes mellitus. Am J Med 979(Suppl 2B):13, 1985.
Tuomilehto J, et al: Antibodies to glutamic acid decarboxylase as predictors of insulin-dependent diabetes mellitus before clinical onset. Lancet 343:1383, 1994.
Unger RH, Foster DW: Diabetes mellitus. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 973.
University of Michigan Pancreas Transplant Evaluation Committee: Pancreatic transplantation as treatment for IDDM. Diabetes Care 11:669, 1988.
Vail DM, et al: Alterations in carbohydrate metabolism in canine lymphoma. J Vet Intern Med 4:8, 1990.
Verge CF, et al: Prediction of type 1 diabetes in first-degree relatives using a combination of insulin, GAD and ICA512bcd/IA-2 autoantibodies. Diabetes 45:926, 1996.
Villaume C et al: Long-term evolution of the effect of bran ingestion on mealinduced glucose and insulin responses in healthy men. Am J Clin Nutr 40:1023, 1984.
Vaaler S. Diabetic control is improved by guar gum and wheat bran supplementation. Diabetic Med 3:230, 1986.
van der Woerdt A et al: Lens-induced uveitis in dogs: 151 cases (1985-1990). J Am Vet Med Assoc 201:921, 1992.
Vuksan V, et al: American ginseng (Panax quinquefolius L) attenuates postprandial glycemia in a time-dependent but not dose-dependent manner in healthy individuals. Am J Clin Nutr 73:753, 2001.
Warram JH, et al: Slow glucose removal rate and hyperinsulinaemia precede the development of type II diabetes in the offspring of diabetic patients. Ann Intern Med 113:909, 1990.
Weidman P, et al: Pathogenesis and treatment of hypertension associated with diabetes mellitus. Am Heart J 125:1498, 1993.
Wess G, Reusch C: Evaluation of five portable blood glucose meters for use in dogs. J Am Vet Med Assoc 216:203, 2000a.
Wess G, Reusch C: Capillary blood sampling from the ear of dogs and cats and use of portable meters to measure glucose concentration. J Small Anim Pract 41:60, 2000b.
White NH, et al: Identification of type I diabetic patients at increased risk for hypoglycemia during intensive therapy. N Engl J Med 308:485, 1983.
Wiberg ME, et al: Serum trypsinlike immunoreactivity measurement for the diagnosis of subclinical exocrine pancreatic insufficiency. J Vet Intern Med 13:426, 1999.
Wiberg ME, Westermarck E: Subclinical exocrine pancreatic insufficiency in dogs. J Am Vet Med Assoc 220:1183, 2002.
Wiseman MJ, et al: Effect of blood glucose control on increased glomerular filtration rate and kidney size in insulin-dependent diabetes. N Engl J Med 312:617, 1985.
Witzum JL, et al: Nonenzymatic glucosylation of high-density lipoprotein accelerates its catabolism in guinea pigs. Diabetes 31:1029, 1982.
Wolfsheimer KJ, et al: The effects of caloric restriction on IV glucose tolerance tests in obese and non-obese beagle dogs. Proceedings of the American College of Veterinary Internal Medicine, Washington, DC, 1993, p 926.
Wood AW, Smith JE: Elevation rate of glycosylated hemoglobins in dogs after induction of experimental diabetes mellitus. Metab 31:906, 1982.
Wylie-Rosett J: Evaluation of protein in dietary management of diabetes mellitus. Diabetes Care 11:143, 1988.
Yee RW, et al: Corneal endothelial changes in diabetic dogs. Curr Eye Res 4:759, 1985.
Zerbe C A, et al: Adrenal function in 15 dogs with insulin-dependent diabetes mellitus. JAVMA 193:454, 1988.
Глава 12
САХАРНЫЙ ДИАБЕТ У КОШЕК
КЛАССИФИКАЦИЯ И ЭТИОЛОГИЯ....589
ПАТОФИЗИОЛОГИЯ...............597
ВСТРЕЧАЕМОСТЬ................597
АНАМНЕЗ......................597
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.....598
ДИАГНОСТИКА САХАРНОГО ДИАБЕТА..598 КЛИНИКО-ПАТОЛОГИЧЕСКИЕ
НАРУШЕНИЯ..................599
ЛЕЧЕНИЕ НЕКЕТОНОВОГО
САХАРНОГО ДИАБЕТА..........601
Задачи терапии...............601
Первоначальная инсулинотерапия.601
Диетотерапия.................603
Выявление и контроль сопутствующих нарушений......606
Пероральные сахаропонижающие препараты....................606
Первоначальный подбор режима инсулинотерапии..............614
МОНИТОРИНГ КОМПЕНСАЦИИ ДИАБЕТА.....................614
Обзор.........................614
Анамнез и физикальное исследование614 Определение концентрации
фруктозамина в сыворотке крови ...615 Определение концентрации
гликозилированного гемоглобина... 616
Мониторинг уровня глюкозы в моче ...617 Гликемическая кривая..........617
Значение фруктозамина в сыворотке крови при стрессе у кошек
с сахарным диабетом.........620
ИНСУЛИНОТЕРАПИЯ ПРИ
ХИРУРГИЧЕСКОЙ ОПЕРАЦИИ......621
ОСЛОЖНЕНИЯ ИНСУЛИНОТЕРАПИИ ....621
Обзор.........................621
Стрессорная гипергликемия.....621
Гипогликемия..................622
Передозировка инсулина и контррегуляция глюкозы (феномен Сомоги)...............623
Занижение дозы инсулина..........623
Кратковременный эффект инсулина ..624
Продолжительное действие инсулина 624
Неадекватная абсорбция инсулина ....625
Антитела к инсулину в крови......626
Сопутствующие расстройства, вызывающие инсулинорезистентность.........626
Изменения потребности в инсулине... 629 ХРОНИЧЕСКИЕ ОСЛОЖНЕНИЯ САХАРНОГО
ДИАБЕТА......................630
Диабетическая невропатия.......630
ПРОГНОЗ........................632
Список сокращений
ДГК - декарбоксилаза глутаминовой кислоты
ДКА - диабетический кетоацидоз
ИЗСД - инсулинозависимый сахарный диабет
ИНЗСД - инсулинонезависимый сахарный диабет
ИФР-1 - инсулиноподобный фактор роста-1 НПХ - нейтральный протамин Хагедорна ОАК - общий клинический анализ крови ПЦИ - протамин-цинк-инсулин
СД 1 - сахарный диабет 1 типа
СД 2 - сахарный диабет 2 типа
Т„ - тироксин
ТПИк - трипсиноподобная
иммунореактивность кошачьих УЗИ - ультразвуковое исследование
Сахарный диабет встречается у собак и кошек с одинаковой частотой, которая по разным данным составляет от 1 случая на 100 особей до 1 случая на 500 особей (Panciera et al, 1990). Исторически у ветеринаров сложился одинаковый подход к диагностике и лечению диабета у животных обоих видов. Между тем, научные исследования и клинический опыт последних двух десятилетий со всей очевидностью показали, что сахарный диабет у собак и кошек во многих отношениях протекает по-разному, и незнание или недооценка этих различий ставит в трудное положение как владельцев животных, так и ветеринаров. В частности, у кошек, в отличие от собак, нередко сохраняется довольно значительная популяция остаточных функционально активных бета-клеток, что объясняет балансирование некоторых особей на грани инсулинозависимого и инсулинонезависимого диабета. Это, в свою очередь, открывает возможности для лечения отдельных животных пероральными сахаропонижающими средствами. В отличие от собак, кошки являются в высшей степени «симпатоадреналовыми» животны
ми, т.е. быстро отвечают выбросом катехоламинов на стресс, возбуждение, испуг или агрессию. Поэтому традиционный контроль эффективности терапии сахарного диабета на основании концентрации глюкозы в крови у кошек зачастую ненадежен, так как гипергликемия может быть вызвана стрессом. При введении инсулина в дозах, считающихся безопасными для лечения сахарного диабета, у кошек чаще, чем у собак развиваются гипогликемия и феномен Сомоги; в результате устойчиво сохраняется неудовлетворительная компенсация диабета. Подбор эффективного режима терапии сахарного диабета у кошек весьма затруднителен. К числу факторов, влияющих на тактику и успешность терапии, относятся степень утраты активных панкреатических бета-клеток, чувствительность тканей к инсулину, наличие или отсутствие токсического действия глюкозы, скорость абсорбции и продолжительность действия введенного экзогенного инсулина, а также сопутствующие заболевания. В данной главе первостепенное внимание уделяется характерным особенностям сахарного диабета у
САХАРНЫЙ ДИАБЕТ У КОШЕК • 589
кошек. Общая информация по отдельным аспектам этого заболевания (таких как классификация диабета, обзор видов инсулина и т.д.) была представлена в гл. 11. Там же приведены обширные дополнительные материалы, ориентирующие читателя в вопросах, решение которых требует одинаковых подходов у собак и кошек.
КЛАССИФИКАЦИЯ И ЭТИОЛОГИЯ
Сахарный диабет 1 и 2 типов
Этиология сахарного диабета 1 и 2 типов (СД1 и СД 2) обсуждается на стр. 526. У человека СД 1 характеризуется сочетанием генетической предрасположенности и аутоиммунного поражения бета-клеток, которые являются причиной прогрессирующей и, в конечном итоге, полной недостаточности инсулина. Появлению гипергликемии и клинических симптомов заболевания обычно предшествует образование антител к инсулину, антигенам бета-клеток и декарбоксилазе глютаминовой кислоты (ДГК). Данные о СД 1 у кошек весьма немногочисленны. У двух особей была описана лимфоцитарная инфильтрация островков поджелудочной железы в сочетании с амилоидозом и вакуолизацией (Nakayama et al, 1990), что предполагает возможную иммунную природу заболевания. Однако инсулиты очень редко встречаются у кошек с сахарным диабетом. Следует также отметить, что антитела к инсулину и бета-клеткам не были обнаружены у 26 животных с впервые диагностированным и нелеченым сахарным диабетом (Hoenig et al, 2000а). Следовательно, у большинства кошек возникновение сахарного диабета не индуцировано иммунной системой.
У людей СД 2 характеризуется наличием инсулинорезистентности и «нефункциональных» бета-клеток. Резистентность печени к инсулину приводит к избыточной базальной продукции глюкозы в печени и гипергликемии натощак. Аналогичная резистентность мышечной ткани препятствует проявлению стимулирующего действия эндогенного инсулина на транспорт и утилизацию глюкозы, что является причиной значительного повышения пост-прандиального уровня сахара в крови. Пониженная секреция инсулина в ответ на введение ее стимуляторов (например, глюкозы) обусловливает состояние инсулиновой недостаточности, тяжесть которой зависит от тяжести инсулинорезистентности и сопутствующей гипергликемии. У людей лечение СД 2 обычно не требует введения инсулина - контроль заболевания обеспечивается подбором адекватной диеты, физической нагрузки и пероральных сахаропонижающих препаратов. Инсулинотерапия назначается лишь некоторым больным СД 2 с тяжелыми инсулинорезистентностью и дисфункцией бета-клеток.
Инсулинорезистентность и нарушение секреции инсулина было выявлено у кошек с ожирением;
амилоидоз островковых клеток зарегистрирован у животных с инсулинозависимым (ИЗСД) и инсулинонезависимым (ИНЗСД) сахарным диабетом (Yano et al, 1981а, 1981b; Nelson et al, 1990; Appleton et al, 2001). Эти же расстройства имеются у людей с СД 2. Показано, что у кошек нормального веса с пониженной чувствительностью к инсулину развивающееся впоследствии ожирение сопряжено с более высоким риском нарушения толерантности к глюкозе, чем у животных нормального веса, у которых ожирение возникло на фоне высокой чувствительности к инсулину (Appleton et al, 2001). Роль генетических факторов в развитии СД 2 у кошек до сих пор не выяснена. Тем не менее, данные, полученные Апплетоном и его сотрудниками, свидетельствуют о сходстве этиологии СД 2 у людей и кошек, включая генетическую предрасположенность, инсулинорезистентность, нарушение секреции инсулина, амилоидоз островков и факторы окружающей среды.
У кошек, как и у человека, сахарный диабет, несомненно, является многофакториальным заболеванием. Тяжесть деструкции панкреатических островков, а также наличие, тяжесть и обратимость сопутствующего заболевания, вызывающего снижение чувствительности к инсулину, являются, по-видимому, основными факторами, которые определяют возникновение и течение сахарного диабета и зависимость его коррекции от экзогенного инсулина у кошек. К числу сопутствующих нарушений, обусловливающих резистентность к инсулину, относятся ожирение, хронический панкреатит и другие хронические воспалительные заболевания и инфекции, а также гипертиреоз, гиперкортицизм и акромегалия. Идентификация и коррекция сопутствующих нарушений, влияющих на чувствительность к инсулину, имеют решающее значение для успеха лечения диабета у кошек. Повышение чувствительности к инсулину способствует сохранению инсулинонезависимого или преходящего диабетического состояния у животных с частично утраченными бета-клетками поджелудочной железы (см. раздел «Преходящий сахарный диабет у кошек»), В связи с этим, клинически более целесообразно и, возможно, более правильно классифицировать сахарный диабет у кошек как ИЗСД и ИНЗСД, а не как СД 1 и СД 2 (обоснование такого подхода обсуждается на стр. 528).
Подразделение больных диабетом кошек на животных с ИЗСД и ИНЗСД, исходя из потребности в инсулинотерапии, может быть причиной недоразумений. У некоторых особей исходно имеется ИНЗСД, который с течением времени переходит в ИЗСД. Состояние других животных характеризуется чередованием ИЗСД и ИНЗСД в соответствии с изменениями тяжести инсулинорезистентности и нарушения функции бета-клеток. Причина выраженных колебаний диабетического статуса (ИЗСД или ИНЗСД) становится вполне понятной, если учесть следующие обстоятельства: патологические
590 • САХАРНЫЙ ДИАБЕТ У КОШЕК
изменения в островках могут быть слабыми или тяжелыми, прогрессирующими или стабильными; способность островков секретировать инсулин зависит от степени этих изменений и может со временем уменьшаться; чувствительность тканей к инсулину меняется, зачастую в зависимости от наличия или отсутствия сопутствующих воспалительных или инфекционных заболеваний, неопластического процесса или гормональных расстройств; наконец, все эти факторы влияют на потребность кошек в инсулине, а также определяют выбор его дозы и возможность контроля диабета.
Инсулинозависимый сахарный диабет у кошек
ИЗСД является наиболее частой клинически распознаваемой формой сахарного диабета у кошек. По данным нашей клиники, примерно у 70% кошек с впервые диагностируемым диабетом выявляется именно ИЗСД. Животные с ИЗСД не реагируют на изменение рациона или введение пероральных сахаропонижающих средств и нуждаются в экзогенном инсулине для контроля уровня гликемии и предотвращения кетоацидоза. К числу обычных гистологических изменений, обнаруживаемых у кошек с ИЗСД, относятся островковый амилоидоз (см. раздел «Инсулинонезависимый сахарный диабет у кошек»), вакуолизация и дегенерация бета-клеток и хронический панкреатит (рис. 12-1) (O’Brien et al, 1986; Jonson et al, 1989; Goosens et al, 1998). Причина дегенерации бета-клеток у кошек неизвестна. Хронический панкреатит встречается у больных диабетом кошек гораздо чаще, чем считалось раньше. В одном из исследований при некроскопии признаки панкреатита в прошлом или перед смертью были выявлены у 19 (51%) из 37 кошек с сахарным диабетом (Goossens et al, 1998). Создается впечатление, что панкреатит может служить причиной разрушения островков поджелудочной железы у некоторых особей с ИЗСД. Однако у других кошек с этим заболеванием отсутствуют амилоидоз, воспаление или дегенерация панкреатических островков, зато при иммуногистохимическом исследовании выявляется уменьшение общего числа островков и/или количества содержащих инсулин бета-клеток. Это свидетельствует о наличии дополнительных механизмов развития сахарного диабета у кошек. Аутоиммунное разрушение бета-клеток, по-видимому, не играет существенной роли в этиологии сахарного диабета у этих животных (см. обсуждение в предшествующем разделе), а значение генетических факторов не выяснено.
У некоторых кошек зависимость от инсулина имеется уже во время первого выявления гипергликемии и клинических признаков диабета, вероятно, из-за относительно быстрого разрушения бета-кле-ток. У других животных бета-клетки разрушаются медленно и постепенно теряют способность секретировать инсулин. В этих случаях на начальных эта
пах гипергликемию и симптомы сахарного диабета удается контролировать без применения инсулина (иными словами, имеет место ИНЗСД). Однако по мере прогрессирования патологического процесса, вызывающего гибель бета-клеток, способность секретировать инсулин полностью утрачивается и развивается ИЗСД. Продолжительность периода между установлением диагноза ИНЗСД и его переходом в ИЗСД не поддается прогнозированию и в определенной степени зависит от вида и скорости развития патологического процесса в островках, а также от обратимости сопутствующего заболевания, вызывающего инсулинорезистентность (см. обсуждение в следующем разделе).
Инсулинонезависимый сахарный диабет у кошек
Клинически выраженный ИНЗСД у кошек встречается чаще, чем у собак. В нашей клинике он был диагностирован у 30% от общего числа обследованных кошек с сахарным диабетом. Многофакториальный этиопатогенез ИНЗСД не подлежит сомнению. У человека важнейшими патологическими факторами ИНЗСД являются ожирение, генетические нарушения и амилоидоз островков поджелудочной железы (Truglia et al, 1985; Johnson et al, 1989; Leahy, 1990). По-видимому, эти же факторы играют роль в возникновении сахарного диабета у кошек. Согласно современным представлениям о патогенезе этого заболевания у кошек, различие между ИЗСД и ИНЗСД состоит, прежде всего, в разной степени поражения бета-клеток, тяжести и/ или обратимости сопутствующей инсулинорезис-тентности. У большинства кошек с ИЗСД и ИНЗСД имеют место островковый амилоидоз, вакуолярная дегенерация бета-клеток и гипоплазия островков поджелудочной железы (Goosens et al, 1998; Nelson et al, 1998). Чем сильнее поражены островки, тем больше вероятность возникновения ИЗСД, независимо от наличия или отсутствия сопутствующей инсулинорезистентности (рис. 12-2). С другой стороны, чем меньше тяжесть поражения островков, тем сильнее возрастает роль сопутствующей инсулинорезистентности в развитии заболевания по одному из двух вариантов: ИЗСД или ИНЗСД. Чем выше тяжесть и меньше вероятность обратного развития заболевания, приводящего к инсулинорезистентности, тем более вероятно, что у кошки с исходно слабым поражением островков появится зависимость от инсулина, и наоборот. Колебания тяжести инсулинорезистентности, как это имеет место при хроническом панкреатите, приводят к тому, что животное попеременно находится в состоянии ИЗСД и ИНЗСД в зависимости от усиления или ослабления воспалительного процесса в поджелудочной железе. Устойчивая инсулинорезистентность усугубляет патологические процессы в островках и вызывает переход от ИНЗСД к ИЗСД по мере того, как прогрессивная утрата бета-клеток сопровожда-
САХАРНЫЙ ДИАБЕТ У КОШЕК • 591
Рис. 12-1. Гистологическая картина островков поджелудочной железы. А Тяжелый амилоидоз островков у кошки с инсулинозависимым сахарным диабетом (ИЗСД) (окраска гематоксилином и юзином, х100). Ь. Тяжелая вакуолярная дегенерация островковых клеток. Панкреатическая ткань была получена при посмертном вскрытии спустя 28 месяцев после установления у кошки диагноза сахарный диабет и через 20 месяцев после перехода инсулинонсзависимого сахарного диабета (ИНЗСД) в ИЗСД (окраска гематоксилином и эозином, х500). В. Хронический панкреатит у кошки с ИЗСД. Воспалительный инфильтрат (показан стрелкой) состоит преимущественно из лимфоцитов и плазматических клеток с небольшим количеством нейтрофилов (окраска гематоксилином и эозином, х!25). Г. Тяжелый хронический панкреатит с явлениями фиброза у кошки с ИЗСД. Животное было подвергнуто эвтаназии в связи с устойчивой клинической симптоматикой, включавшей вялость, отсутствие аппетита и неудовлетворительную компенсацию сахарного диабета (окраска гематоксилином и юзином, х100). (Г - из: Nelson RW, Cuoto CG: Small Animal Internal Medicine, 3d ed., St. Louis, Mosby, 2003, p 749).
ется все более выраженной недостаточностью инсулина (см. рис. 12-2 и рис. 12-3) (Nelson et al, 1998; Hoenig et al, 2000b).
Отложение амилоида в островках поджелудочной железы кошек представляет собой характерное патологическое явление, тяжесть которого усиливается с возрастом животных (Johnson et al, 1989; Lutz et al, 1994). У кошек с сахарным диабетом число панкреатических островков, содержащих амилоид, а также количество амилоида в индивидуальных островках значительно больше, чем у животных без иабета, что может свидетельствовать о причинной связи между амилоидозом и сахарным
диабетом (Yano et al, 1981а и 1981b). У людей с ИНЗСД и у взрослых кошек с сахарным диабетом основным компонентом амилоида, выделяемого из ткани поджелудочной железы, является островковый амилоидный полипептид (ОАПП), или ами-лин (Johnson et al, 1989). Человеческий и кошачий ОАПП имеют сходную аминокислотную последовательность (Westermark et al 1987а), а иммуно-электронное микроскопическое исследование выявило присутствие ОАПП в секреторных гранулах бета-клеток как у людей, так и у кошек (Westermark et al, 1987b; Johnson et al, 1988). Амилин и инсулин секретируются бета-клетками одновременно
592
САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-2. Панкреатический амилоидоз. А. Слабо выраженный амилоидоз островков (показан стрелкой) и вакуолярная дегенерация у кошки с ИНЗСД, получавшей диетотерапию и глипизид (окраска гематоксилином и юзином, х200). Б. Тяжелый островковый амилоидоз (прямая стрелка) у кошки с ИНЗСД, перешедшим в ИЗСД. Биопсия поджелудочной железы производилась после развития ИЗСД. Видны остаточные бета-клетки, содержащие инсулин (кривые стрелки) (окраска иммунопероксидазным методом, х100).
Рис. 12-3. Гистологическая картина островков поджелудочной железы у кошки с сахарным диабетом. Биопсия, проводившаяся в рашые сроки на протяжении заболевания, выявила прогрессивную дегенерацию островков. А. Слабая вакуолярная дегенерация островковых клеток. Ткань поджелудочной железы была получена через 6 недель после установления диагноза ИНЗСД, когда кошка хорошо отвечала на диетотерапию и введение глипизида (окраска гематоксилином и эозином, х400). Б. Тяжелая вакуолярная дегенерация островковых клеток. Панкреатическая ткань была получена при посмертном вскрытии спустя 28 месяцев после установления у кошки сахарного диабета и через 20 месяцев после перехода ИНЗСД в ИЗСД и перевода на инсулин. Животное погибло в результате развившейся метасташрующей аденокарциномы экзокринной поджелудочной железы (окраска гематоксилином и эозином, х500).
(Lutz, Rand, 1996), и стимуляторы секреции инсулина вызывают также высвобождение амилина. Амилин действует как нейроэндокринный гормон и вызывает ряд глюкорегуляторных эффектов, которые в сумме дополняют действие инсулина на постпрандиальную концентрацию глюкозы. Так, амилин замедляет скорость поступления пищевых веществ из желудка в тонкий кишечник, где происходит их всасывание, подавляет стимуляцию секреции глюкагона после приема пищи и ускоряет насыщение (Young et al, 1996; Gedulin et al, 1997). Имеются данные, хотя и неоднозначные, что в фармакологических концентрациях амилин может индуцировать инсулинорезистснтносгь. (Johnson el al, 1990; Kassir et al, 1991). Хронически повышенная секреция инсулина и амилина, имеющая место при ожирении и других инсулинорезистенгных состояниях, приводит к агрегации и отложению амилина в островках в форме амилоида (см. рис. 12-2). Образующиеся при этом амилоидные фибриллы обладают цитотоксической активностью и обусловливают апоптоз островковых клеток, что приводит к уменьшению секреции инсулина (Lorenzo et al, 1994; O’Brien et al, 1995; Hiddinga, Eberhardt, 1999). В случае прогрессирующего отложения амилоида (например, при состояниях устойчивой инсулинорезистентности, как при ожирении) продолжающееся разрушение островковых клеток, в конце концов, приводил к развитию сахарного диабета (рис. 12-4). От тяжести амилоидоза в известной степени зависит, будет ли это ИЗСД или ИНЗСД (см. рис. 12-2). Полное разрушение островков ведет к развитию ИЗСД и обусловливает потребность в инсулине на протяжении всей жизни кошки. При частичном их разрушении клинически выраженный диабет может развиться, но может и не развиться, соответственно животное будет или не будет нуждаться в инсулине для контроля гипергликемии, а начавшаяся инсу-линотерапия приведет или не приведет к возникновению преходящего диабета. Продолжающееся
САХАРНЫЙ ДИАБЕТ У КОШЕК • 593
Инсулинорезистентность (например, вследствие ожирения или введения преднизолона)
Усиление секреции инсулина
Т
Усиление секреции амилина
Прогрессивное отложение амилоида в островковых клетках
Т
Разрушение островков
Рис. 12-4. Схема взаимосвязи между инсулинорезистентнос-тью, секрецией амилина и отложением амилоида в клетках поджелудочной железы. Секреция инсулина усиливается, чтобы компенсировать инсулинорезистентность, индуцируемую факторами окружающей среды, лекарственными средствами - антагонистами инсулина и сопутствующим заболеванием. Поскольку секреция инсулина сопровождается высвобождением амилина, концентрация последнего в условиях инсулинорезистентности также возрастает. Если повышенная секреция амилина приобретает устойчивый характер, то происходит его агрегация и образование амилоида в островковых клетках.
отложение амилоида способствует переходу от субклинического диабетического состояния к ИНЗСД и, в конечном итоге, к ИЗСД.
Наличие и тяжесть инсулинорезистентности - важные факторы, влияющие на характер клинической картины у кошек с частично разрушенными островками поджелудочной железы. Инсулинорезистентность приводит к увеличению потребности в инсулине, которая у некоторых животных не удовлетворяется из-за уменьшения количества островковых клеток. Чем сильнее инсулинорезистентность и больше количество разрушенных островков, тем выше вероятность возникновения гипергликемии. В свою очередь, устойчивая гипергликемия подавляет функцию оставшихся бета-клеток, усугубляя гипоинсулинемию и вызывая дальнейшее повышение концентрации глюкозы в крови (см. раздел «Преходящий диабет у кошек»). Потребность в повышенной секреции инсулина в условиях инсулинорезистентности способствует усилению патологического процесса в поджелудочной железе и сопровождается дальнейшим сокращением популяции активных бета-клеток. Любое хроническое инсулинорезистентное расстройство приводит к уменьшению популяции этих клеток и оказывает губительное воздействие на их функциональную активность, способствуя, таким образом, возникновению ИЗСД или ИНЗСД. Примерами подобных расстройств у кошек являются ожирение, хронический панкреатит, акромегалия, гиперкортицизм, а также длительное введение глюкокортикоидов и мегестрола ацетата.
Индуцированное ожирением нарушение толерантности к углеводам представляет собой классическое инсулинорезистентное состояние, которое ассоциируется с ИНЗСД у человека и считается потенциальной причиной сахарного диабета у кошек (Panciera et al, 1990; Scarlett, Donoghue, 1998). Ожирение вызывает обратимую резистентность к инсулину вследствие уменьшения числа его рецепторов, понижения их сродства к гормону и нарушения действия инсулина на пострецепторном уровне (Trugila et al, 1985). У кошек с ожирением описаны нарушение толерантности к глюкозе и аномальный ответ секреции инсулина на стимуляцию (Nelson et al, 1990; Appleton et al, 2001). При этом первоначальная задержка секреции инсулина сменяется ее аномально высокой интенсивностью (рис. 12-5), что напоминает характер секреции инсулина у людей с ИНЗСД. Нарушения, вызывающие инсулинорезистентность, имеют обратимую природу и купируются коррекцией ожирения. Это лишний раз подтверждает важное значение профилактики и лечения ожирения в качестве компонентов терапии сахарного диабета (рис. 12-6) (Biourge et al, 1997; Fettman et al, 1998). Эффективность гипогликемического действия инсулина повышается по мере снижения веса тела. Благодаря этому у некоторых кошек исчезает потребность в инсулине и сахарный диабет может перейти в исходную субклиническую форму.
Лептин является специфическим гормоном жировых клеток, который функционирует в качестве «адипостата» - он отвечает на энергетические запросы организма и регулирует энергетические запасы. Это его действие осуществляется, главным образом, посредством модуляции экспрессии гипоталамических нейропептидов, регулирующих пищевое поведение и вес тела (Havel, 2001). У некоторых видов животных, в том числе у собак и кошек, была установлена положительная корреляция между концентрацией иммунореактивного лептина в сыворотке крови и общим количеством жира в организме (Backus et al, 2000; Appleton et al, 2000; Sagawa et al, 2002). В связи с обнаружением высокой концентрации лептина при ожирении было высказано предположение о резистентности к нему животных с аномально большим весом. Некоторые исследователи видят причинную связь между лептином и индуцируемой ожирением инсу-линорезистентностью (Segal et al, 1996; Zimmet et al, 1998). Недавно появилось сообщение об обратной зависимости между концентрацией лептина и чувствительностью к инсулину у кошек, у которых исследовали толерантность к глюкозе до и после увеличения веса тела. Авторы высказали предположение, что у кошек с ожирением повышение концентрации лептина может вносить свой вклад в снижение чувствительности к инсулину (Appleton et al, 2002а). Однако инсулин является мощным стимулятором синтеза лептина, поэтому не исключено, что при резистентности к инсулину компенсаторное
594 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-5. Концентрация глюкозы (А) и инсулина (Б) в сыворотке крови кошек с нормальным весом тела (п = 9) и при ожирении (п = 6) после внутривенного введения глюкозы в дозе 0,5 г/кг веса тела. Результаты представлены в виде средних величин ± средняя квадратичная ошибка (SEM) (Из: Nelson RW et al: Glucose tolerance and insulin response in normal weight and obese cats. Am J Vet Res, 51:1357,1990).
увеличение секреции инсулина может стимулировать продукцию лептина, что приводит к увеличению его концентрации в крови (Havel, 2000).
Другим специфическим гормоном адипоцитов является адипонектин, который, по мнению некоторых исследователей, служит связующим звеном между ожирением и инсулинорезистентностью. Полагают, что адипонектин играет важную роль в регуляции действия инсулина и энергетического гомеостаза (Havel, 2002). Этот гормон уменьшает продукцию глюкозы в печени и усиливает ее утилизацию в мышечной ткани (Berg et al, 2001; Fruebis et al, 2001). У людей нормального веса и при ожирении установлено обратное соотношение между концентрациями адипонектина и лептина в плазме крови. У тучных пациентов концентрация адипонектина в крови понижена; она отрицательно коррелирует с концентрацией инсулина натощак и положительно - с чувствительностью к инсулину (Weyer et al, 2001). Наконец, у обезьян уменьшение концентрации адипонектина в плазме крови совпадает с началом снижения чувствительности к инсулину, возникновением инсулинорезистентности и развитием СД 2 (Hotta et al, 2001).
Транзиторный сахарный диабет у кошек
Примерно у 20% кошек сахарный диабет протекает как преходящее заболевание, сохраняясь обычно в течение 4-6 недель после установления диагноза и начала лечения. У таких животных нормализуется концентрация глюкозы в плазме крови, исчезают гликозурия и клинические симптомы диабета, что позволяет отменить инсулинотерапию. Некоторым
кошкам после первого приступа диабета экзогенный инсулин может больше никогда не понадобиться, тогда как у других постоянная зависимость от инсулина сохраняется на протяжении нескольких недель и даже месяцев после исчезновения начальных признаков диабета. На основании результатов недавнего исследования группы кошек с транзиторным сахарным диабетом, мы предлагаем гипотезу, согласно которой эта форма заболевания представляет собой субклиническое состояние, которое проявляется клинически в случае стрессор-ных воздействий на поджелудочную железу. Таким стрессорными факторами могут служить сопутствующее заболевание, препятствующее проявлению действия инсулина (в частности, хронический панкреатит), или введение антагонистов инсулина, в первую очередь таких, как глюкокортикоиды или мегестрола ацетат (рис. 12-7) (Nelson et al, 1998). Кошки с транзиторным сахарным диабетом имеют те или иные нарушения в панкреатических островках (амилоидоз, вакуолярная дегенерация) и значительно меньшую популяцию бета-клеток по сравнению со здоровыми животными, в результате чего они неспособны компенсировать инсулинорезистентность, что и приводит к интолерантности к углеводам. Происходит необратимое подавление секреторной активности бета-клеток, связанное, по всей вероятности, с нарушенной толерантностью к углеводам. Хроническая гипергликемия нарушает секрецию инсулина бета-клетками и индуцирует периферическую инсулинорезистентность, способствуя угнетению системы транспорта глюкозы и вызывая нарушение действия инсулина на последующих стадиях утилизации глюкозы. Совокуп-
САХАРНЫЙ ДИАБЕТ У КОШЕК
595
Инъекция глюкозы
Время (мин)
глюкозы
Рис. 12-6. Средняя концентрация глюкозы (А) и инсулина (Б) (+SEM) в сыворотках 12 кошек после внутривенного введения глюкозы в дозе 0,5 г/кг веса тела в начале исследования (базальная кривая), через 9 ± 2 месяцев после прироста веса, после голодания в течение 5-6 недель (потеря веса) и через 5 недель после прекращения голодания (восстановление), a-в: Точки, помеченные разными буквами, обозначают достоверные различия (р < 0,05) между отдельными периодами времени. Обратите внимание на увеличение интоле-рантности к глюкозе, несмотря на усиление секреции инсулина при увеличении веса тела и на улучшение толерантности и повышение секреции эндогенного инсулина в ответ на введение глюкозы при уменьшении веса. (Из: Biourge V et al: Effect of weight gain and subsequent weight loss on glucose tolerance and insulin response in healthy cats. J Vet Intern Med,. 11:86, 1997).
ность этих явлений обозначают термином токсичность глюкозы (Unger, Grundy, 1985; Rossetti et al, 1990). Одновременно нарушается ответ бета-кле-ток на воздействие стимуляторов секреции инсулина; иными словами, имитируется состояние, имеющее место при ИЗСД (рис. 12-8). В принципе, токсичность глюкозы имеет обратимый характер и устраняется коррекцией гипергликемии. Задача клинициста - поставить правильный диагноз и начать соответствующую терапию сахарного диабета и выявленных расстройств, препятствующих нор
мальному действию инсулина. Лечение приводит к снижению гипергликемии и инсулинорезистентности, ослабляет блокирующие эффекты гипергликемии, улучшает функцию бета-клеток, восстанавливает секрецию инсулина и купирует клиническое состояние, обусловленное ИЗСД (см. рис. 12-7 и рис. 12-8). Потребность в инсулине в будущем определяется поражением островков. Если оно прогрессирует (как, например, при амилоидозе), то в конечном итоге слишком большая потеря бета-кле-ток приведет к постоянному ИЗСД.
596
САХАРНЫЙ ДИАБЕТ У КОШЕК
У кошки имеется патология поджелудочной железы и субклинический диабет
I
Воспаление, инфекция, неоплазия, гормональное расстройство и лекарственные средства противо- - ч
действуют эффекту инсулина 1
I
Нарушение толерантности к углеводам и разви- ।
тие гипергликемии ]
I
Токсичность глюкозы приводит К ИЗСД I
I :
Инсулинотерапия и коррекция (контроль) сопутс- ;
твующих заболеваний
I :
Контроль гипергликемии .
I •
Устранение токсичности глюкозы 1
I i
Восстанавливается функция бета-клеток и исче- ।
зает инсулинорезистентность •
I i
Исчезает потребность в инсулине и проходит !
ИЗСД 1
I :
Кошка возвращается к состоянию субклиническо-_□
го диабета
Рис. 12-7. Последовательность событий в ходе возникновения и исчезновения эпизода инсулинозависимого диабета у кошек с транзиторным сахарным диабетом.
Вторичный сахарный диабет у кошек
См. раздел «Вторичный сахарный диабет у собак».
Дифференциальная диагностика ИЗСД и ИНЗСД
Кошек обычно приводят в ветеринарную клинику только после того, как у них появляются явные признаки сахарного диабета, беспокоящие хозяев. Поэтому у большинства животных на момент установления диагноза имеются гипергликемия натощак и гликозурия независимо от типа диабета. После установления диабета клиницист прежде всего рассматривает возможность ИНЗСД. В связи с высокой частотой встречаемости ИНЗСД и тран-зиторного диабета возникает ряд важных вопросов, касающихся целесообразности инсулинотерапии. Для поддержания требуемого уровня гликемии некоторым кошкам достаточно правильно подобрать соответствующий режим кормления и пероральные сахаропонижающие средства. Поэтому важно уметь проспективно дифференцировать ИЗСД и ИНЗСД. У человека для этой цели используют пробы со стимуляторами секреции инсулина (табл. 12-1). К сожалению, измерение базальной и стимулированной концентрации инсулина в сыворотке крови не дает необходимой информации для дифференциации
ТАБЛИЦА 12-1. ПРОТОКОЛЫ ТЕСТИРОВАНИЯ СЕКРЕТОРНОГО ОТВЕТА ИНСУЛИНА
Внутривенный тест на толерантность к глюкозе (ВВТТГ)
1. Госпитализация за 24 часа до тестирования
2. Вживление катетера в яремную или медиальную подкожную вену для сведения к минимуму стресса при получении множественных проб крови. Проведение ВВТТГ не ранее чем через 24 часа после вживления катетера.
3. Отмена всех лекарственных средств, кроме жизненно необходимых, за 24-48 часов до тестирования.
4. Отмена кормления на ночь.
5. Взятие проб крови для определения базальных концентраций глюкозы и инсулина за 5-15 минут до и непосредственно перед введением глюкозы.
6. Внутривенное введение глюкозы в дозе 0,5 г (собаке) и 1,0 г (кошке) на килограмм веса тела в течение 30 секунд. Нельзя использовать один и тот же катетер для введения глюкозы и взятия проб крови.
7. Взятие проб крови для определения концентраций глюкозы и инсулина через 1, 10, 15, 30, 45 , 60, 90 и 120 минут после введения глюкозы.
Тест на толерантность к глюкозе при внутривенном введении глюкагона
Стадии 1-5 как при ВВТТГ.
6. Внутривенное введение глюкагона в дозе 0,5 г (собаке) и 1,0 г (кошке) в течение 30 секунд.
7. Взятие проб крови для определения концентраций глюкозы и инсулина через 1, 10, 20, 30, 45 и 60 минут после инъекции.
Пероральный тест на толерантность к глюкозе
Стадии 1-5 как при ВВТТГ.
6. Пероральное введение глюкозы в дозе 50 г (100 мл 50%-ного водного раствора глюкозы) через желудочный зонд.
7. Взятие проб крови для определения концентраций глюкозы и инсулина через 1,10, 20, 30,45 и 60 минут после введения глюкозы.
Тест на толерантность к глюкозе при внутривенном введении аргинина
Стадии 1-5 как при ВВТТГ.
6. Внутривенное введение 0,1 г L-аргинина гидрохлорида на килограмм веса тела в течение 30 секунд.
7. Взятие проб крови для определения концентраций глюкозы и инсулина через 2, 4, 6, 8, 10, 20 и 30 минут после вве-дения аргинина.
ИЗСД и ИНЗСД у кошек (Nelson et al, 1993; Kirk et al, 1993). Концентрация инсулина натощак или после введения того или иного стимулятора, превышающая среднюю нормальную концентрацию на одно стандартное отклонение (более 18 мкЕД/мл в нашей лаборатории), предполагает сохранение функционирующих бета-клеток и наличие ИНЗСД. К сожалению, кошки, у которых в последующем диагностируют ИЗСД, и многие особи с ИНЗСД при первичном обследовании имеют низкую базальную концентрацию инсулина и не отвечают на стимуляцию глюкозой или глюкагоном (Nelson et al, 1993; Kirk et al, 1993; Nelson et al, 1998). Недостаточность инсулина у кошек с развивающимся ИНЗСД, по-видимому, является результатом сопутствующей токсичности глюкозы (см. раздел «Транзиторный диабет у кошек»). Ввиду трудности оценки функции
САХАРНЫЙ ДИАБЕТ У КОШЕК
597
Рис. 12-8. Средняя (± SD) концентрация инсулина в сыворотке крови до и после внутривенного введения 0,5 мг глюкагона у 10 здоровых кошек, 10 кошек с клинически выраженным транзиторным сахарным диабетом при установлении диагноза и после устранения его клинических проявлений и у 6 кошек с устойчивым инсулинозависимым диабетом на момент установления диагноза, а - р < 0,05 по сравнению с базальной величиной, б - р < 0,05 по сравнению с соответствующим моментом времени у здоровых кошек, в - р < 0,05 по сравнению с соответствующим моментом времени у кошек с клинически выраженным сахарным диабетом, г - р < 0,05 по сравнению с соответствующим моментом времени у кошек с устойчивым инсулинозависимым диабетом. Стрелкой показано время введения глюкагона. (Из: Nelson RW et al: Transient clinical diabetes mellitus in cats: 10 cats [1998-1991]. J Vet Intern Med, 13:28, 1998).
бета-клеток в пробах co стимуляторами секреции инсулина, дифференциальную диагностику ИЗСД и ИНЗСД у кошек нередко проводят ретроспективно, после того как ветеринарный врач через несколько недель сможет оценить реакцию животного на проводимую терапию и установить его потребность в инсулине. Первоначальное решение о назначении инсулинотерапии или пероральных сахаропонижающих препаратов принимается, исходя из тяжести клинической симптоматики, наличия или отсутствия кетоацидоза, общего состояния животного и пожеланий владельца.
ПАТОФИЗИОЛОГИЯ
Патофизиология сахарного диабета у собак и кошек имеет общие черты и подробно рассмотрена в гл. 11. Единственное существенное различие состоит в большей вариабильности пороговой величины концентрации глюкозы в крови для почечных канальцев, после которой начинается ее экскреция с мочой у кошек. У собак глюкоза появляется в моче, когда ее концентрация в крови превышает 180-220 мг/100 мл. Средняя пороговая величина для кошек составляет 290 мг/100 мл, но при этом у отдельных животных она колеблется от 200 до 300 мг/100 мл. По этой причине у разных кошек, в отличие от со
бак, клинические признаки сахарного диабета могут проявляться при разных концентрациях глюкозы в крови, и при одной и той же концентрации глюкозы у кошек диабет может протекать бессимптомно, а у собак быть клинически выражен.
ВСТРЕЧАЕМОСТЬ
Сахарный диабет может развиться у кошек любого возраста, однако в большинстве случаев он впервые выявляется у животных старше 6 лет (в среднем в 10 лет). Чаще всего болеют кастрированные коты. Частота заболеваемости не зависит от породы, хотя в Австралии среди больных сахарным диабетом животных особенно велико число бирманских кошек (Pancuera et а., 1990; Rand et al, 1997).
АНАМНЕЗ
Больные сахарным диабетом собаки и кошки имеют сходный анамнез, особенности которого обсуждаются в гл. 11. Самые большие неудобства владельцам кошек причиняет «слежавшаяся подстилка» и необходимость часто менять ее, поскольку животные страдают полиурией, сопутствующей сахарному диабету. К числу других клинических проявлений относятся инертность, утрата общи-
598 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-9. А. Стопохожденис у кошки с сахарным диабетом и недостаточностью экзокринной функции поджелудочной железы. Ь. Устранение слабости нижних конечностей и стопохождения после улучшения гликемического контроля посредством коррекции дозы инсулина и начала заместительного введения панкреатических ферментов.
тельности, уменьшение прыгучести, слабость задних конечностей, развитие стопохождения, прекращение ухода за шерстью, вследствие чего она становится сухой, утрачивает блеск, выглядит свалявшейся и неопрятной (рис. 12-9). Если хозяин кошки не замечает эти изменения или нс придает им значения, то у нее могут возникнуть системные симптомы заболевания, как, например, прогрессирующая кетонемия и метаболический ацидоз (см. гл. 13, стр. 639). Время между появлением первых клинических признаков заболевания и развитием диабетического кетоацидоза (ДКА) нс поддается прогнозированию.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Результаты физикального исследования зависят от наличия ДКА и его тяжести, а также от природы любых других сопутствующих расстройств. При нскстоновом диабете физикальное исследование не выявляет классических признаков заболевания. У многих кошек с сахарным диабетом имеется избыточный вес, но во всех других отношениях они выглядят здоровыми. Некоторые кошки с большой продолжительностью нелеченого диабета теряют вес, но редко выглядят истощенными, если нет сопутствующего расстройства (например, гипертиреоза). Животные с впервые диагностированным или плохо компенсированным сахарным диабетом часто перестают ухаживать за шерстью, она становится сухой и утрачивает блеск. Индуцированный диабетом печеночный липидоз может привести к гепатомегалии. При возникновении диабетической невропатии у кошек уменьшается прыгучесть, появляется слабость в задних конечностях или намечается тенденция к стопохождению, когда животное при ходьбе касается пола скакательными суставами. При пальпации выявляется повышенная жесткость дистальных мышц задних ног, зачастую кошки не дают проводить пальпацию или иные манипуляции
на задних конечностях из-за болей, сопутствующих невропатии. Сообщалось и о других нарушениях у кошек с ДКА (см. гл. 13, стр. 639).
ДИАГНОСТИКА САХАРНОГО ДИАБЕТА
И у собак, и у кошек диагностика сахарного диабета основывается на выявлении соответствующих клинических симптомов, гипергликемии и гликозурии (см. стр. 534). Для кошек характерна преходящая, индуцируемая стрсссорными воздействиями гипергликемия, при которой концентрация глюкозы в крови может превышать 300 мг/100 мл (см. стр. 619). К сожалению, стресс является субъективным состоянием, которое нс поддастся точной количественной оценке, не всегда легко распознается, и реакция на стрессорное воздействие индивидуальна. У животных с индуцированной стрессом гипергликемией гликозурия обычно отсутствует, потому что временное повышение концентрации глюкозы в крови препятствует ее накоплению в моче до уровня, выявляемого современными методами. Поэтому при диагностике сахарного диабета у кошки ветеринар должен всегда пытаться выявить устойчивую гипергликемию или гликозурию. В сомнительных ситуациях «стрессированную» кошку возвращают владельцу, дав указание измерять содержание глюкозы в моче в привычных животному домашних условиях. Альтернативный подход состоит в определении концентрации фруктозамина в сыворотке крови (см. стр. 615), увеличение которой подтверждает наличие устойчивой гипергликемии. Однако у некоторых кошек с симптоматическим сахарным диабетом, развившимся незадолго до обращения владельца за ветеринарной помощью, концентрация фруктозамина остается на верхней границе нормы (Elliott et al, 1999). После установления наличия сахарного диабета проводят дифференциальную диагностику ИЗСД и ИНЗСД (см. раздел «Диагностика ИЗСД и ИНЗСД»).
САХАРНЫЙ ДИАБЕТ У КОШЕК • 599
КЛИНИКО-ПАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ
Данные, используемые для установления диагноза сахарного диабета, не содержат информацию о функциональном состоянии панкреатических островков, наличии токсичности глюкозы, секреторной способности поджелудочной железы или тяжести и обратимости сопутствующей инсулинорезистентности. Концентрация инсулина в крови более 18 мкЕД/мл у кошек с впервые диагностируемым, нелеченым сахарным диабетом позволяет предположить наличие активно функционирующих бета-клеток и частичное разрушение островков. С другой стороны, низкий уровень инсулина или его отсутствие в крови не исключает, что утрачена только часть островковых клеток, поскольку концентрация циркулирующего гормона может быть понижена из-за гипергликемии (Kirk et al, 1993; Nelson et al, 1998). Сам по себе диагноз сахарного диабета не дает полного представления о состоянии животного. Для того чтобы установить тип заболевания (ИЗСД, ИНЗСД или транзиторный диабет), необходимо выявить сопутствующие расстройства, которые могут влиять на чувствительность тканей к инсулину, и оценить реакцию на терапию. Минимальный объем лабораторных исследований для любой кошки с сахарным диабетом включает общий клинический анализ крови (ОАК), биохимический анализ сыворотки, определение концентрации тироксина в крови и анализ мочи с посевом ее проб для выявления бактериурии. По возможности, УЗИ брюшной полости должно стать рутинной процедурой диагностической оценки, так как у кошек с сахарным диабетом высока частота хронического панкреатита. Определение базальной и стимулируемой секреции инсулина не относятся к рутинным тестам из-за токсичности глюкозы. По завершении анамнестического анализа, физикального исследования или выявления кетоацидоза может понадобиться дополнительное тестирование.
Собаки и кошки с сахарным диабетом имеют сходные клинико-патологические нарушения, которые обсуждаются на стр. 534 и перечислены в табл. 11-5 на стр. 535. Специального упоминания заслуживают необходимость оценки состояния функции щитовидной железы и экзокринной поджелудочной железы у кошек, а также проблемы, связанные с применением радиоиммунологических методов определения концентрации инсулина крови.
Концентрация тироксина в сыворотке крови
Концентрацию тироксина (Т4) следует измерять у всех кошек гериатрического возраста, страдающих сахарным диабетом. Такая необходимость отчасти обусловлена тем, что у старых особей весьма обычен гипертиреоз, в щитовидной железе нередко формируются небольшие пальпируемые узлы (как правило, не функционирующие), а гипертиреоз мо
жет приводить к инсулинорезистентности (Hoenig, Ferguson, 1988; Hoenig et al, 1992). При интерпретации результатов определения Т4 в сыворотке крови ветеринар должен принимать во внимание качество контроля уровня гликемии на момент обследования и тяжесть любого сопутствующего расстройства. При неудовлетворительной компенсации диабета, особенно на фоне сопутствующего заболевания, результаты определения концентрации Т4 в крови обычно ложно занижены вследствие синдрома эутиреоидной патологии. Как правило, повышенная концентрация Т4 (> 4 мкг/100 мл) свидетельствует о наличии гипертиреоза, а концентрация, соответствующая нижней половине нормального диапазона, или меньше нормальной величины (т.е. <2,0 мкг/100 мл), указывает на эутиреоидное состояние или синдром эутиреоидной патологии. Труднее интерпретировать концентрации Т, укладывающиеся в верхнюю половину нормального диапазона, из-за возможного торможения функции оси гипофиз-щи-товидная железа при неконтролируемом сахарном диабете. Такой уровень Т4 соответствует эутиреоидному состоянию или слабому гипертиреозу, при котором секреция Т4 подавлена до верхнего уровня нормы. Для более полной оценки функционального состояния щитовидной железы проводят дополнительное диагностическое обследование (например, определение свободного Т4 в сыворотке или сканирование щитовидной железы с использованием пертехнетата натрия). Интерпретация результатов определения Т4 у кошек с подозрением на гипертиреоз более подробно рассматривается в гл. 4.
Ферменты поджелудочной железы
Острый и особенно хронический панкреатит - частые спутники сахарного диабета у кошек. Во всех случаях впервые диагностируемого диабета у этих животных рекомендуется проводить анализы крови, предназначенные для выявления панкреатита, особенно если нет возможности провести УЗИ. Обычно рекомендуется определять концентрации липазы и трипсиноподобной иммунореактивности кошачьих (ТПИк) в сыворотке крови. Теоретически, у кошек с сопутствующим диабету острым панкреатитом эти параметры должны быть повышены. Но, к сожалению, далеко не всегда имеется четкая корреляция между концентрациями липазы и ТПИк и наличием или отсутствием панкреатита, особенно если тяжесть воспалительного процесса невелика и он носит хронический характер (Swift et al, 2000; Gerhardt et al, 2001). Результаты определения липазы и ТПИк всегда следует интерпретировать в контексте данных анамнеза, физикального исследования и дополнительных лабораторных анализов. В нашей клинике, оснащенной современным ультразвуковым оборудованием, наилучшим и единственным методом диагностики панкреатита у кошек является УЗИ брюшной полости (рис. 12-10). Мы считаем этот метод компонентом рутинно-
600 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-10. А. Ультразвуковое исследование брюшной полости кошки с сахарным диабетом и острым панкреатитом: видны диффузное увеличение поджелудочной железы и ее генерализованная гипоэхогснность (показано стрелками), свидетельствующие об остром воспалении и отеке. Животное поступило в клинику после острого появления сонливости, вялости, анорексии и рвоты. Контроль уровня гликемии был неудовлетворительным на протяжении нескольких недель, предшествовавших обследованию. Б. Ультразвуковое исследование брюшной полости кошки с сахарным диабетом и хроническим панкреатитом: видны диффузное увеличение поджелудочной железы и ее смешанная (гипоэхо!синая и гиперэхогенная) структура (показана стрелками), свидетельствующие о воспалении и фиброзе. Животное поступило в клинику в связи с появлением слабых признаков сонливости, потери аппетита и неустойчивым характером гликемического контроля.
го диагностического обследования всех животных с впервые выявленным или плохо компенсированным диабетом. Наличие сопутствующего острого панкреатита у кошек с впервые диагностированным сахарным диабетом может служить дополнительным указанием на необходимость интенсивной инфузионной терапии или коррекции рациона, которые в иной ситуации не были бы назначены. Кроме того, выявление хронического панкреатита имеет важное значение для успешного мониторинга и прогнозирования результатов контроля уровня гликемии, а также для оценки продолжительности жизни животных (см. стр. 576).
Данные определения ТПИк в сыворотке используются также для диагностики недостаточной функции экзокринной поджелудочной железы - относительно редкого осложнения сахарного диабета, которое, согласно существующим представлениям, является следствием хронического панкреатита (Steiner, Williams, 2000). Подозрение на нарушение экзокринной функции возникает у худых или истощенных (несмотря на полифагию) кошек с сахарным диабетом, который не поддается компенсации с помощью инъекций инсулина.
Концентрация инсулина в сыворотке крови
В нашей практической работе определение концентрации инсулина в сыворотке крови в базальных условиях или после стимуляции его секреции не является рутинной диагностической процедурой при вновь выявляемых случаях сахарного диабета у кошек. Теоретически, повышенная концентрация эндогенного инсулина (более 18 мкЕД/мл) у кошек с впервые выявленным диабетом может быть отве
том на введение пероральных сахаропонижающих препаратов или следствием преходящего диабета. Вероятность этого особенно велика при наличии и лечении сопутствующего заболевания, препятствующего проявлению нормального действия инсулина. К сожалению, подавление функции бета-клеток при гипергликемии (т.е. токсичность глюкозы) нередко приводит к снижению концентрации инсулина в крови у животных, которым впоследствии ставится диагноз ИНЗСД (см. раздел «Транзитор-ный сахарный диабет у кошек») (Nelson et al, 1998). Наличие функционирующих бета-клеток, показателем которого служит повышенная концентрация инсулина, не следует исключать и в случае его низкой концентрации (менее 12 мкЕД/мл). Поскольку у большинства кошек, которым впоследствии ставится диагноз ИНЗСД, концентрация инсулина в крови понижена, ее рутинное определение экономически не оправдано.
Радиоиммунологический метод (РИА) определения инсулина должен годиться именно для кошек. Коммерческие эндокринные лаборатории используют РИА, предназначенные для определения человеческого инсулина, аминокислотная последовательность которого существенно отличается от таковой кошачьего инсулина (см. табл. 11-6, стр. 538), и многие наборы РИА для определения инсулина в сыворотках человека не могут быть использованы для кошек (Lutz, Rand, 1993). Интересно, что при исследовании фармакокинетических свойств инсулинов свиньи, крупного рогатого скота или рекомбинантного человеческого инсулина у кошек использовали РИА, которые не идентифицировали кошачий инсулин, чтобы исключить влияние последнего на результаты определений (Wallace et al, 1990).
САХАРНЫЙ ДИАБЕТ У КОШЕК • 601
ЛЕЧЕНИЕ НЕКЕТОНОВОГО САХАРНОГО ДИАБЕТА
Задачи терапии
Целью терапии сахарного диабета как у собак, так и кошек является устранение наблюдаемых владельцем расстройств, являющихся следствием гипергликемии и гликозурии, поддержание «нормального» состояния животного при стабильном весе тела, и предотвращение осложнений (см. табл. 11-7, стр. 538). Эти цели обычно достигаются адекватной инсулинотерапией, подбором рациона, физическими нагрузками, применением пероральных сахаропонижающих препаратов и/или профилактикой и лечением сопутствующих воспалительных и инфекционных заболеваний, неопластических процессов или гормональных расстройств. Успешность избранной тактики терапии, в конечном счете, зависит, с одной стороны, от содержания в поджелудочной железе бета-клеток, сохранивших функциональную активность, а с другой стороны, от индивидуальной реакции животного на проводимое лечение.
Необходимость нормализации уровня глюкозы в плазме крови не вызывает сомнения, однако ветеринар всегда должен предупреждать владельца животного об опасности возникновения гипогликемии, которая является серьезным, а иногда и фатальным осложнением терапии диабета. Чаще всего гипогликемическое состояние развивается при излишне интенсивной инсулинотерапии. Ветеринар должен тщательно сопоставить преимущества «жесткого» контроля уровня гликемии с помощью инъекций инсулина и риск возникновения гипогликемии.
В связи с высокой частотой встречаемости ИНЗСД у кошек возникает важный вопрос о целесообразности инсулинотерапии этого заболевания. У некоторых животных удается добиваться адекватного контроля гликемии посредством модификации рациона, применения пероральных сахаропонижающих средств и/или лечения сопутствующих заболеваний. Очевидно, что лучше всего было бы провести дифференциальную диагностику ИЗСД и ИНЗСД путем оценки функции бета-клеток. К сожалению, определение базальной или стимулируемой концентрации инсулина в сыворотке крови не позволяет надежно различить ИЗСД и ИНЗСД у кошек. Поэтому дифференциальная диагностика ИЗСД и ИНЗСД нередко осуществляется ретроспективно после оценки реакции животного на проводимую терапию. Первоначальное решение о назначении инсулина или пероральных препаратов принимается на основании тяжести клинической симптоматики, наличия или отсутствия кетоацидоза, общего состояния животного и пожеланий его хозяина.
Первоначальная инсулинотерапия
Формы и типы коммерческих препаратов инсулина обсуждаются в гл. 11 (см. стр. 539). Реакция кошек
с сахарным диабетом на введение экзогенного инсулина совершенно непредсказуема. Ни один из существующих видов инсулина не способен постоянно и эффективно поддерживать необходимый уровень гликемии даже при двукратных инъекциях на протяжении суток. После прекращения выпуска протамин-цинк-инсулина (ПЦИ) около десяти лет назад для лечения сахарного диабета у кошек применяются нейтральный протамин Хагедорна (НПХ), инсулины ленте и ультраленте на основе рекомбинантного человеческого инсулина. Среди всех коммерческих препаратов инсулин ультраленте обладает наибольшей продолжительностью действия, но и наименьшей активностью (см. рис11-19, стр. 576 и рис. 12-11). Несмотря на длительное действие, ультраленте в большинстве случаев приходится вводить дважды в день, а характер его абсорбции в месте введения не обеспечивает адекватного контроля гликемии у 25% кошек. Инсулины ленте и НПХ обладают более высокой активностью, быстрее и более последовательно всасываются после подкожной инъекции, чем ультраленте. К сожалению, продолжительность действия инсулинов ленте и НПХ гораздо меньше 12 часов, поэтому двукратные в течение суток инъекции этих препаратов не обеспечивают желаемого контроля гликемии (см. табл. 11-8, стр. 539). Несмотря на различие аминокислотных последовательностей инсулинов кошки и человека, терапия рекомбинантными препаратами человеческого инсулина не сопровождается образованием сколько-нибудь значительного количества антиинсулиновых антител, препятствующих контролю гликемии у кошек (см. стр. 626).
В настоящее время имеется препарат IDEXX, выпускаемый компанией Westbrook в концентрации 40 ЕД/мл (U40), который представляет собой ПЦИ на основе инсулинов свиньи и крупного рогатого скота и изготавливается по технологии, разработанной первым производителем ПЦИ. Этот инсулин лучше всасывается из мест введения, чем инсулин ультраленте, и обладает более длительным действием, чем НПХ инсулин. Однако время достижения минимального уровня глюкозы сильно варьирует и более чем у 80% кошек с сахарным диабетом это происходит в течение 9 часов после инъекции (Nelson et al, 2001). Мы обычно вводим ПЦИ дважды в день. В одном из недавних исследований была показана очень высокая эффективность ПЦИ, значительно улучшавшего качество контроля гликемии у кошек с впервые диагностированным и плохо компенсированным сахарным диабетом, которые ранее получали инсулины ультраленте или НПХ (рис. 12-12) (Nelson et al, 2001). Сравнение эффективности инсулинов ПЦИ и ленте не проводилось. ПЦИ не применяется у собак из-за высокой вероятности образования антител к инсулину крупного рогатого скота, входящего в состав препарата (см. стр. 568). Антиинсулиновые антитела могут препятствовать действию инсулина.
602 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-11. Гликемические кривые у кота весом 5 кг, получавшего подкожные инъекции комбинированного инсулина свиньи и крупного рогатого скота типа ультраленте (сплошная линия) и ленте (пунктирная линия) по 0,6 ЕД/кг каждого. При равной дозе инсулин ленте обладал более выраженным гипогликемическим действием, чем ультраленте. Стрелкой показано время инъекции инсулина и кормления.
Инсулин гларгин (лантус; производства Aventis Pharmaceuticals, США) представляет собой препарат длительного действия, образующий в местах инъекций микропреципитаты, из которых происходит медленное высвобождение инсулина (см. стр. 539). У человека медленное, постепенное высвобождение инсулина гларгина из таких микропреципитатов обеспечивает относительно постоянную, без выраженных пиков концентрацию гормона в крови на протяжении 24 часов. В настоящее время этот препарат рекомендуется в качестве базового инсулина (т.е. длительно действующего инсулина для устойчивого подавления продукции глюкозы в печени) для однократного введения больным сахарным диабетом перед отходом ко сну (Rosenstock et al, 2000 и 2001). В предварительном сравнительном исследовании действия гларгина и ПЦИ у здоровых кошек было показано сходство большинства фармакокинетических и фармакодинамических характеристик обоих препаратов, включая начало проявления гипогликемического эффекта, минимальный уровень гликемии, время возвращения концентрации глюкозы к базальному уровню, сред
несуточную концентрацию глюкозы и площадь под суточной гликемической кривой (Marshall, Rand, 2002). На кошках с сахарным диабетом это еще не изучали. По нашим данным, продолжительность действия инсулина гларгина у большинства больных диабетом кошек колеблется от 10 до 16 часов. Мы пока не сталкивались с проблемой неудовлетворительной абсорбции этого препарата из мест введения, как это имеет место при использовании инсулина ультраленте. Правда, нельзя исключить, что такая проблема возникнет по мере накопления опыта работы с инсулином гларгином. В настоящее время мы рассматриваем возможность применения гларгина для лечения кошек, у которых не удается добиться желаемой компенсации диабета из-за слишком короткого действия инсулинов НПХ, ленте и ПЦИ (см. стр. 624). Основываясь на предшествующем опыте, мы не считаем инсулин гларгин препаратом выбора для лечения сахарного диабета у кошек.
Невозможно предсказать, какой именно тип инсулина окажется наиболее эффективным у той или иной особи. Выбор препарата для первоначальной
САХАРНЫЙ ДИАБЕТ У КОШЕК
603
Рис. 12-12. Средняя концентрация глюкозы в крови 67 кошек с инсулинозависимым сахарным диабетом, получавших различные дозы протамин-цинк-инсулина (ПЦИ) дважды в день на протяжении 45 дней. Стрелкой показан момент ежедневных инъекций инсулина и кормления (половина суточного рациона), которые производились за 1 час до первого измерения концентрации глюкозы. Средняя (+SD) ежедневная доза инсулина составляла 0,4 ± 0,1 ЕД/кг веса тела на 7-й день (сплошная линия); 0,7 + 0,2 ЕД/кг на 14-й день (штриховая линия); 0,8 ± 0,3 ЕД/кг на 30-й день (пунктирно-штриховая линия) и 0,9 ± 0,4 ЕД/кг на 45-й день (пунктирная линия), а - р < 0,05 по сравнению с величиной, полученной на 7-й день; б -р < 0,05 по сравнению с величиной, полученной на 14-й день; в - р < 0,05 по сравнению с величиной, полученной на 30-й день. (Из: Nelson RW et al: Efficacy of protamine zinc insulin for the treatment of diabetes mellitus in cats. JAVMA, 218:38, 2001).
терапии в конечном счете определяется опытом и предпочтениями ветеринарного врача. В настоящее время мы рекомендуем использовать либо инсулин ленте на основе рекомбинантного человеческого инсулина, либо комбинированный препарат ПЦИ крупного рогатого скота и свиньи. Доза инсулина составляет 1 ЕД на животное дважды в день. Одновременно следует начинать диетотерапию (см. ниже). Поскольку подавляющему большинству больных сахарным диабетом кошек (более 80-90%) приходится делать двукратные на протяжении суток инъекции рекомбинантного человеческого инсулина ленте или ПЦИ, мы предпочитаем назначать двукратное введение этих препаратов с самого начала терапии. Такой подход облегчает достижение желаемого качества контроля гликемии и снижает вероятность возникновения гипогликемии и феномена Сомоги (см. стр. 623), поскольку уже на начальных этапах лечения используется низкая доза инсулина.
Диетотерапия
Общие принципы диетотерапии сахарного диабета изложены на стр. 542 (табл. 12-2). Применительно к кошкам особого внимания заслуживает обсуждение ожирения, режимов кормления и состава кормов.
ТАБЛИЦА 12-2. РЕКОМЕНДАЦИИ ПО ДИЕТОТЕРАПИИ САХАРНОГО ДИАБЕТА У КОШЕК
I. Состав корма (см. табл. 12-3)
Вариант 1: Умеренное содержание углеводов и жиров, высокое содержание клетчатки
Вариант 2: Высокое содержание белков, низкое содержание углеводов и клетчатки
Вариант 3: Высокое содержание жиров, низкое содержание углеводов и клетчатки
Разные варианты кормов можно чередовать
Не поддается прогнозированию, какой из кормов в наибольшей степени улучшит контроль гликемии
II. Рекомендации по кормлению животных
Давайте кошке консервированный и/или измельченный корм
Избегайте давать корм, содержащий моносахариды, дисахариды или пропиленгликоль
III. Калорийность кормов и ожирение
Среднесуточное потребление калорий старыми кошками должно составлять 30-50 ккал/кг
Калорийность корма следует подбирать, исходя из индивидуальных особенностей животного
При наличии ожирения его устраняют снижением ежедневного потребления калорий или использованием кормов, специально предназначенных для уменьшения веса тела
IV. Режим кормления
Необходимо обеспечить постоянство калорийности корма
Необходимо кормить животных в фиксированное время
Необходимо давать корм в пределах продолжительности действия инсулина
Вместе с каждой инъекцией инсулина животное должно получать половину суточного количества калорий
Кошкам, которые едят понемногу в течение всего дня и/или ночи, следует сохранить свойственный им режим кормления
Ожирение
Больные сахарным диабетом кошки часто страдают ожирением, прежде всего из-за свободного доступа к сухому корму. Ожирение вызывает обратимую инсулинорезистентность, которая исчезает после коррекции веса (см. рис. 12-6, стр. 595) (Nelson et al, 1990; Biourge et al, 1997). Снижение веса облегчает контроль уровня глюкозы, и некоторые животные возвращаются к исходному состоянию субклинического диабета. Общие принципы коррекции ожирения у кошек сходны с таковыми у собак и обсуждаются на стр. 542. Лечение ожирения у кошек затрудняется тем, что ограничения суточного потребления калорий приходится добиваться при невозможности существенного увеличения энергетических затрат (т.е. повышения физической нагрузки). Оптимальный вес кошек колеблется от 3,5 до 5 кг. Очень важно определить реальную возможность уменьшения веса данной особи, чтобы эта задача оказалась выполнимой для ее хозяина. Если идеальный вес кошки на 15% меньше ее действительного веса, следует избрать постадийную
604 • САХАРНЫЙ ДИАБЕТ У КОШЕК
тактику снижения последнего. При этом сначала добиваются уменьшения веса на 15%. После этого переходят к следующему этапу диетотерапии и так далее, до достижения идеального показателя. Для первоначального уменьшения веса на 15% кошка должна получать рацион из расчета 30 х (исходный вес тела в килограммах) килокалорий в день (Elliott, 2003). При таком режиме кормления потеря 15% веса происходит за 18 недель. Если расчетное количество калорий для достижения данной цели оказывается меньше их реального суточного потребления, следует снова проанализировать диетический анамнез для выявления и устранения источника дополнительных калорий. В отсутствие такового суточное потребление калорий необходимо уменьшить на 15-20%. Несмотря на наличие ряда рационов, специально разработанных для снижения веса тела у кошек, по изложенным ниже причинам рекомендуется использовать корма с повышенным содержанием пищевых волокон и белков.
Известную трудность представляет ситуация, когда в доме содержится несколько кошек, из которых только одна страдает ожирением. Лучше всего кошек кормить в отдельных помещениях, но это не всегда возможно. Как правило, ожирелые кошки не могут прыгать. Поэтому кормушку для здоровых кошек целесообразно ставить на возвышение, куда они могли бы запрыгивать, либо в картонную коробку с высокими стенками. В такой коробке проделывают отверстие, в которое пролезает кошка нормального веса, но которое недостаточно широко для растолстевшего животного. Это позволяет отдельно кормить кошек разного веса (Elliott, 2003).
Кошек, у которых добиваются снижения веса, следует обследовать каждые две недели. При этом их взвешивают, оценивают состояние тела в баллах и анализируют состав и калорийность корма. В идеальном случае животное должно терять примерно 1 % веса в неделю. Более быстрое снижение веса повышает риск липидоза почек. Если скорость снижения веса превышает 2% в неделю, следует на 10-15% увеличить калорийность корма. Если же вес не уменьшается, повторно анализируют диетический анамнез с целью выявления дополнительных калорий. Если их не находят, снижают потребление калорий еще на 10-15%.
Режим кормления
Кошки едят по-разному - одни сразу съедают весь предлагаемый корм, а другие едят понемногу в течение всего дня и/или ночи. Главной целью диетотерапии является уменьшение влияния приема пищи на постпрандиальную концентрацию глюкозы в плазме крови (см. раздел «Режим кормления», стр. 545). Поедание корма небольшими порциями в течение 12 часов оказывает меньшее воздействие на уровень глюкозы, чем потребление полного количества калорий в один прием. Одновременно с каждой инъекцией инсулина кошке предлагают
половину общего суточного количества калорий, и эту еду она может съесть, когда пожелает. Попытки заставить кошку, привыкшую есть небольшими порциями, съесть все сразу, обычно заканчиваются неудачей и не оправданы, если она будет иметь доступ к еде на протяжении последующих 12 часов. Такой же подход применяется для собак с сахарным диабетом, которые едят урывками.
Содержание в корме углеводов, белков и клетчатки
На протяжении последнего десятилетия рекомендуется вводить в корма кошек, болеющих сахарным диабетом, повышенное количество клетчатки при умеренном ограничении содержания жиров (например, Prescription Diet w/d, Hill’s Pet Products, Topeka, CIIIA). Такие рекомендации основаны на результатах исследований, продемонстрировавших лучший контроль гликемии у животных, которые получали консервированный корм, включавший 12% нерастворимой клетчатки (целлюлозы) в пересчете на сухое вещество, по сравнению с кошками, получавшими корм без пищевых волокон (рис. 12-13) (Nelson et al, 2000). Соответственно у кошек, содержавшихся на рационе с пищевыми волокнами, оказалось возможным значительно снизить суточную дозу инсулина. Как и у собак с диабетом, основные нежелательные явления при скармливании кошкам кормов с высоким содержанием нерастворимых волокон включали повышенную частоту дефекации, потерю аппетита из-за невкусного, однообразного корма и запоры разной степени тяжести.
В настоящее время существующие рекомендации по кормлению кошек с сахарным диабетом стали предметом особенно пристального внимания, в том числе из-за наметившегося в последнее десятилетие увеличения частоты панкреатита, ожирения и воспалительных кишечных расстройств у этих животных. Кошки - по преимуществу хищные животные, поэтому содержание белков в их пищевом рационе должно быть больше, чем у всеядных собак и человека (Morris, 2002). Активность ферментов печени, участвующих в фосфорилировании глюкозы для ее последующего окисления или хранения (глюкокиназы, гексокиназы) или превращения в гликоген для депонирования в печени (гликогенсинтетазы) у кошек ниже, чем у всеядных хищников (Zoran, 2002). Пониженная активность указанных ферментов предполагает, что основными источниками энергии для кошек являются не крахмал, а потребляемые жиры и аминокислоты, необходимые для глюконеогенеза. По той же причине можно говорить о наличии у кошек с сахарным диабетом предрасположенности к высокому постпрандиальному уровню гликемии после поедания обогащенного углеводами корма, и наоборот. Для таких животных рекомендуются два типа кормов с пониженным содержанием углеводов: Purina DM производства Ralston Purina(CHIA) и Science
САХАРНЫЙ ДИАБЕТ У КОШЕК • 605
Рис. 12-13. Средняя (+SD) концентрация глюкозы в крови 16 кошек со спонтанно приобретенным сахарным диабетом до кормления (00.08 часов) и через 12 часов после введения инсулина вместе с кормом, содержавшим большое (штриховая линия) и малое (сплошная линия) количество нерастворимых пищевых волокон. Средняя концентрация глюкозы в сыворотке рассчитана по результатам всех измерений на протяжении 12-часового периода для каждой кошки спустя 6, 12, 18 и 24 недели после скармливания того и другого рациона. Стрелкой показано время введения инсулина и кормления (половина суточного рациона).
Знак * указывает на статистически достоверное различие (р < 0,05) по сравнению с соответствующей величиной, полученной после скармливания рациона с низким содержанием пищевых волокон. (Из: Nelson RW et al: Effect of dietary insoluble fiber on control of glycemia in cats with naturally acquired diabetes mellitus. J Am Vet Med Assoc 216:1082, 2000).
Diet Feline Growth производства Hill’s Pet Products (США). Первый из них содержит большое количество белков при низком содержании углеводов и клетчатки, а второй обогащен жирами при низком содержании углеводов и клетчатки (табл. 12-3). В одном из исследований было установлено, что содержание кошек с сахарным диабетом на высокобелковом и низкоуглеводном рационе позволило повысить эффективность гликемического контро
ля и одновременно снизить суточную потребность в инсулине у четырех из 9 находившихся под наблюдением животных; одной из этих четырех кошек даже отменили инсулинотерапию (Frank et al, 2001). К концу исследования еще двум особям пытались отменить инсулин, однако у них повысилась концентрация фруктозамина в сыворотке крови соответственно до 811 и 635 мкмоль/л (диапазон нормальных концентраций составляет 175 - 400 мкмоль/л), а средняя концентрация глюкозы в плазме крови на протяжении 6-8 часов возросла до 485 и 458 мг/100 мл. Имеется сообщение об улучшении клинической симптоматики сахарного диабета и снижении концентрации глюкозы натощак и фруктозамина у 13 кошек, получавших рацион с высоким содержанием жиров и низким содержанием углеводов; четырем из этих кошек оказалось возможным отменить инсулинотерапию (Bennett et al, 2001). В другом исследовании кошкам с сахарным диабетом также давали корм с низким содержанием углеводов и высоким содержанием жиров в сочетании с акарбозой, ингибитором а-глюкозидазы (см. стр. 548), что приводило к улучшению качества контроля гликемии (Mazzaferro et al, 2000). При анализе состава рациона с повышенным количеством пищевых волокон, эффект которого критически оценивался в работе (Nelson et al, 2000), оказалось, что в нем содержалось на 7% меньше углеводов и на 5% больше белков в пересчете на количество метаболизируемой энергии, чем в служившем контролем корме с низким содержанием клетчатки. Это различие в содержании углеводов и белков могло внести свой вклад в улучшение гликемического контроля при использовании диеты с высоким содержанием клетчатки.
Основной целью всех перечисленных исследований было добиться снижения всасывания углеводов в желудочно-кишечном тракте путем либо подавления переваривания крахмала (введением акарбозы), либо ингибирования всасывания глюкозы в кишечнике (скармливанием пищевых волокон), либо путем уменьшения потребления углеводов (благодаря
ТАБЛИЦА 12-3. ПРИМЕРНОЕ СОДЕРЖАНИЕ ПИЩЕВЫХ ВЕЩЕСТВ В НЕКОТОРЫХ КОММЕРЧЕСКИХ КОРМАХ, ИСПОЛЬЗУЕМЫХ ПРИ ЛЕЧЕНИИ САХАРНОГО ДИАБЕТА У КОШЕК
Корм Г рубая клетчатка* Углеводы* Жиры* Белки* (на упаковку или кормушку) Калорийность**
Prescription Diet w/d
Консервированный 13 22 39 39 148
Сухой 9 37 23 40 246
Purina DM
Консервированный 4 7 44 49 194
Сухой 1 11 37 52 592
Science Diet Feline Growth
Консервированный 1 7 60 33 230
Сухой 1 21 50 29 510
* В процентах от сухого вещества корма
+ В процентах от метаболизируемой энергии углеводов, жиров и белков
++ В килокалориях метаболизируемой энергии на упаковку (5,5 унций) консервированного корма, а для сухих кормов - на полный стандартный объем кормушки (8 унций)
606 • САХАРНЫЙ ДИАБЕТ У КОШЕК
использованию кормов с низким содержанием углеводов). Интуитивно самым эффективным способом сведения к минимуму утилизации углеводов в желудочно-кишечном тракте является использование кормов с низким содержанием углеводов. О благотворном действии, если оно имеет место, включения в такие рационы большого количества белков и жиров в настоящее время ничего неизвестно. Неясно, какое влияние может оказывать потребление большого количества белка на развитие кетоза или диабетической нефропатии, на достижение ощущения сытости или поддержание постоянного веса тела. Также неизвестно, как влияет и влияет ли вообще высокое содержание жиров в рационе на развитие ожирения, печеночного липидоза, хронического панкреатита, инсулинорезистентности или увеличение продукции глюкозы в печени вследствие образования свободных жирных кислот, бета-оксимасляной кислоты и гипертриглицеридемии, особенно у старых кошек с пониженной концентрацией липопротеинов и низкой активностью печеночной липазы (Roden et al, 1996; Massillon et al, 1997; Butterwick et al, 2001). В настоящее время все три рациона, перечисленные в табл. 12-3, считаются пригодными для диетотерапии сахарного диабета у кошек. Непредсказуемо, какой из них окажет наиболее благоприятное действие на контроль уровня глюкозы у того или иного больного животного. В связи с этим первоначальный выбор корма зависит от предпочтений и личного опыта ветеринара или владельца кошки. Если при использовании одного режима кормления появляются нежелательные явления или, несмотря на коррекцию инсулинотерапии, сохраняется неудовлетворительная компенсация диабета, следует перейти на другой режим.
Выявление и контроль сопутствующих нарушений
В принципе, любое сопутствующее воспалительное или инфекционное заболевание, гормональное расстройство или неопластический процесс могут вызвать инсулинорезистентность и отрицательно сказаться на эффективности инсулинотерапии (см. стр. 551). Выявление и лечение сопутствующих нарушений имеет большое значение для успешного лечения сахарного диабета у кошек. Для идентификации факторов, влияющих на качество компенсации сахарного диабета, во всех случаях впервые диагностированного заболевания проводят тщательный анамнестический анализ, физикальное обследование и полную диагностическую оценку, включая ОАК, биохимический анализ сыворотки, определение концентрации Т4 в крови, анализ мочи и УЗИ брюшной полости.
Пероральные сахаропонижающие препараты
Пероральные сахаропонижающие препараты используются, прежде всего, для лечения ИНЗСД, т.е. той формы диабета, которая редко встречается у собак, но обычна для кошек (см. раздел «Этиология», стр. 590). В Соединенных Штатах для лечения ИНЗСД у людей разрешены следующие пять классов пероральных средств: препараты сульфонилмоче-вины, меглитиниды, бигуаниды, тиазолидиндионы и ингибиторы а-глюкозидазы (табл. 12-4). Механизм действия всех этих веществ состоит в стимуляции секреции инсулина поджелудочной железой, повышении чувствительности тканей к инсулину
ТАБЛИЦА 12-4. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ, ЭФФЕКТИВНОСТЬ И ПОБОЧНОЕ ДЕЙСТВИЕ ПЕРОРАЛЬНЫХ САХАРОПОНИЖАЮЩИХ ПРЕПАРАТОВ У КОШЕК И СОБАК С САХАРНЫМ ДИАБЕТОМ
Тип препарата Механизм действия Показания к применению Эффективность Побочное действие Частота побочного действия
Препараты Стимулируют ИНЗСД Реакция на терапию У кошек: рвота, Менее чем у 15%
сульфонилмочеви- секрецию у кошек; не пока- примерно у 25% желтуха, усиление леченых живот-
ны (например, глипизид или глибурид) инсулина зан собакам кошек активности печеночных ферментов, гипогликемия ных
Меглитиниды (например, репа-глинид)' Стимулируют секрецию инсулина Возможно, у кошек с ИНЗСД Неизвестна Неизвестно Неизвестна
Бигуаниды (напри- Повышают чувс- Возможно, у кошек Реакция на терапию У кошек: отсутствие У кошек: обычны
мер, метформин) твительность к инсулину с ИНЗСД менее чем у 25% кошек; реакция у собак неизвестна аппетита, рвота, уменьшение веса тела при дозах > 75 мг; у собак: неизвестно
Тиазолидиндионы (например, ро-зиглитазон или пиоглитазон) Повышают чувствительность к инсулину Неизвестно Неизвестна Неизвестно Неизвестна
Ингибиторы Замедляют Вспомогательная У кошек неизвестна; У кошек неизвестно; у У кошек: неиз-
а-глюкозидазы всасывание терапия для со- у собак зависит от собак диарея, умень- вестна; у собак:
(например, акар-боза) глюкозы в кишечнике бак и, возможно, кошек дозы шение веса тела 35% леченых животных
САХАРНЫЙ ДИАБЕТ У КОШЕК • 607
или замедлении всасывания глюкозы после приема пищи. Кроме того, микроэлементы хром и ванадий также повышают чувствительность тканей к инсулину. Из всех пероральных сахаропонижающих средств наиболее полно изучено действие сульфонилмочевинных препаратов на кошек.
Препараты сульфонилмочевины
Сульфонилмочевинные препараты (например, гли-пизид или глибурид) наиболее часто используются для лечения сахарного диабета у кошек (табл. 12-5) (DeFronzo, 1999). Основной их эффект заключается в стимуляции секреции инсулина бета-клетками (табл. 12-4) (Gerich, 1989; Miller et al, 1992), поэтому их действие на качество гликемического контроля возможно только при условии сохранения хотя бы остаточной функциональной активности бета-клеток. Внепанкреатические эффекты сульфонилмочевинных препаратов включают повышение чувствительности тканей к инсулину либо путем усиления связывания инсулина с рецепторами, либо стимулируя действие гормона на пострецепторном уровне, а также увеличение утилизации глюкозы и торможение распада гликогена в печени и снижение гепатической экстракции инсулина (Gerich, 1989; Jaber et al, 1990; DeFronzo, 1999). Эти внепанкреатические эффекты являются следствием как непосредственного действия самих препаратов, так и вторичным результатом индуцируемой ими секреции инсулина.
Глипизид. Лечение сульфонилмочевинным препаратом глипизидом (глюкортил, производство Pfizer, США) с успехом применялось в качестве альтернативы инсулинотерапии у кошек с впервые выявленным сахарным диабетом (Nelson et al, 1993; Feldman et al, 1997). Клиническая реакция животных на такое лечение может быть ярко выраженной (падение концентрация глюкозы в крови ниже 200 мг/100 мл), частичной (улучшение клинической симптоматики на фоне сохраняющейся гипергликемии) или полностью отсутствовать. По-видимому, получавшие глипизид животные силь-
ТАБЛИЦА 12-5. ПЕРОРАЛЬНЫЕ ПРЕПАРАТЫ СУЛЬФОНИЛМОЧЕВИНЫ, ПРИМЕНЯЕМЫЕ В США
Родовое название Торговое название Относительная активность
Препараты первого поколения Толбутамид Орназ 1
Ацетогексамид Димелор 2,5
Толазамид Толиназ 5
Хлорпропамид Диабенез 6
Препараты второго поколения Глипизид Глюкотрол 1000
Глибурид Микроназ, 150
ДиаБета
но различались по количеству функционирующих бета-клеток - от их полного разрушения (как при тяжелом ИЗСД) до практически нормальной популяции (при слабом ИНЗСД), что и объясняло наблюдавшиеся различия терапевтического эффекта (от крайне низкого до очень высокого). У кошек с частичной реакцией на лечение глипизидом сохранялись функционально активные бета-клетки, однако, их количество было недостаточным для того, чтобы уменьшить концентрацию глюкозы в крови до уровня ниже 200 мг/100 мл. У этих животных могли иметь место тяжелый ИНЗСД или ранние стадии ИЗСД. Наш опыт показывает, что терапия глипизидом улучшает клиническую симптоматику и снижает гипергликемию примерно у 30% кошек, страдающих сахарным диабетом.
Выбор критериев. Не существует достоверных параметров, которые позволяли бы заранее предсказать реакцию кошек на терапию глипизидом. Высокая концентрация инсулина в крови перед кормлением животного и ее повышение в ответ на стимуляцию предполагают наличие ИНЗСД и вероятность хорошей реакции на глипизид. В то же время, отсутствие этих признаков не исключает ни наличия ИНЗСД, ни возможности получения хороших результатов при использовании данного препарата (Nelson et al, 1993). При отборе кошек для лечения глипизидом следует, в первую очередь, полагаться на ветеринарную оценку общего состояния животного, тяжести клинических проявлений заболевания, наличия или отсутствия кетоацидоза и/или других осложнений сахарного диабета (например, нейропатии), а также учитывать пожелания владельца.
Бесспорными кандидатами на назначение терапии глипизидом являются кошки, входящие в три перечисленные ниже группы. Первая включает особей с сахарным диабетом, владельцы которых категорически против инъекций инсулина. Во вторую входят кошки, у которых периодически изменяется потребность в инсулине (т.е. животные с транзиторным сахарным диабетом). Третья группа объединяет особей, нуждающихся в инъекциях инсулина для компенсации сахарного диабета, но высоко чувствительных к действию экзогенного гормона, следствием чего являются часто повторяющиеся эпизоды гипогликемии и необходимость использования очень низких доз инсулина (менее 1 ЕД один или два раза в день). Следует иметь в виду, что пероральные сахаропонижающие препараты неэффективны в качестве средств для нормализации уровня гликемии у инсулинорезистентных кошек с плохо компенсированным сахарным диабетом.
Побочное действие. К числу побочных эффектов терапии глипизидом относятся гипогликемия, рвота вскоре после приема препарата, повышение активности ферментов печени в сыворотке крови и желтуха (Nelson et al, 1993; Feldman et al, 1997). Частота побочных эффектов не превышает 15% и может быть еще ниже, если на начальных стадиях
608 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Время (мин)
Рис. 12-14. Средняя концентрация инсулина в сыворотке крови после перорального введения плацебо и трех доз гл и п изида (2,5, 5,0 и 10 мг) 10 здоровым кошкам. Плацебо - сплошная линия, 2,5 мг - штриховая линия с квадратами, 5,0 мг - пунктирно-штриховая линия с треугольниками, 10 мг - пунктирная линия с ромбами. (Из: Miller АВ et al: Effect of glipizide on serum insulin and glucose concentrations in healthy cats. Res Vet Sci 52:177, 1992).
терапии применять низкие дозы препарата. Отмена препарата устраняет гипогликемию, изменения активности печеночных ферментов и желтуху. Повышение ферментативной активности в сыворотке может быть следствием их утечки из поврежденных или погибших гепатоцитов, однако ее истинная причина до сих пор не выяснена. При наличии у кошек реакции со стороны печени терапию глипизидом следует прекратить, а после нормализации ферментативной активности и исчезновения желтухи ее можно возобновить, используя более низкие дозы препарата. У некоторых особей индуцированные глипизидом нарушения функции печени не рецидивируют, тогда как у других они повторяются независимо от дозы препарата.
Одним из теоретически возможных побочных эффектов хронической терапии глипизидом является ускоренная утрата функционально активных бета-клеток вследствие стимулирующего действия этого препарата на секрецию амилина и усиление тяжести амилоидоза (см. рис. 12-14) (см. также раздел «Инсулинонсзависимый сахарный диабет»). Терапия сахарного диабета у человека с помощью хронического введения препаратов сульфонилмо-чевины дает противоречивые результаты. Первоначальное успешное действие препарата на протяжении по меньшей мере 6 месяцев сменяется полным отсутствием его эффекта у 5-35% больных диабетом людей (так называемая вторичная неэффективность) (Lebovitz, 1990). Это может быть связано с индивидуальными характеристиками пациента (например, неправильным режимом питания или воздействием стрессорных факторов), с особенностями терапевтического режима (неадекватные
дозы препарата, его недостаточное всасывание в желудочно-кишечном тракте) или со спецификой заболевания (прогрессирующее поражение панкреатических островков или наличие инсулинорезистентности) (Groop, 1992). Неизвестно, как влияют сульфонилмочевинные препараты на факторы, определяющие специфические особенности заболевания. В большинстве проведенных исследований концентрация иммунореактивного инсулина в плазме крови не изменялась либо понижалась на протяжении нескольких месяцев или лет терапии (Gerich, 1989; Groop, 1992). В других исследованиях было выявлено постоянное усиление секреции инсулина в условиях хронической терапии препаратами сульфонилмочсвины (Lebovitz, 1990; Fajans, Brown, 1993).
Вторичная неэффективность терапии сахарного диабета наблюдалась и у получавших глипизид кошек (Nelson et al, 1993), хотя неизвестно, какую роль сам препарат играет в ускорении исчезновения своего эффекта. Недавно было проведено исследование на искусственной модели сахарного диабета у кошек, созданной путем частичной (около 50° о) панкреаэктомии с последующими на протяжении 4 месяцев ежедневными инъекциями гормона роста и пероральным введением дексаметазона. Эти животные в течение 18 месяцев получали глипизид. У трех из четырех включенных в исследование кошек наблюдали соответственно слабое до умеренного отложение амилоидов в островках поджелудочной железы, а у одной - умеренное до тяжелого ваку-олярное перерождение островков. Аналогичные изменения происходили соответственно у одной и трех кошек, которым на протяжении 18 месяцев
САХАРНЫЙ ДИАБЕТ У КОШЕК • 609
вводили НПХ инсулин (Hoenig et al, 2000b). Эти данные свидетельствуют, что глипизид может провоцировать прогрессивное отложение амилоида в островках поджелудочной железы в результате стимуляции секреции инсулина и амилина. Означает ли это, что глипизид не следует применять для лечения сахарного диабета у кошек? Чтобы ответить на этот вопрос, следует обратиться к обоснованиям терапевтического применения этого препарата. Глипизид не имеет преимуществ перед инсулино-терапией с точки зрения стоимости лечения, затрат времени на него, клинической эффективности или частоты ее повторных оценок ветеринаром. Тем не менее, в первое время после выявления у животного сахарного диабета он обеспечивает более приемлемый для хозяина вариант лечения (таблетки вместо инъекций). Не будь этого препарата, большинству владельцев животных, которые категорически отказываются делать инъекции инсулина своим питомцам, пришлось бы прибегнуть к эвтаназии. В то же время, многие из них не возражают против использования пероральных лекарственных средств. По прошествии нескольких недель после начала лечения глипизидом хозяева животных легче соглашаются на введение инсулина в случае отсутствия ожидавшегося эффекта безинъекционной терапии. Мы считаем, что реальным преимуществом глипи-зида является возможность сохранить жизнь большому числу кошек, предоставив их владельцам альтернативу инъекциям инсулина и, тем самым, избавив их от необходимости поспешного выбора между жизнью и смертью их питомцев с впервые выявленным сахарным диабетом.
Протокол лечения. Больным диабетом кошкам глипизид начинают давать в дозе 2,5 мг дважды в день вместе с кормом (при условии, что у животных нет признаков кетоза, а физикальное исследование выявляет относительно нормальное физическое состояние) (рис. 12-15). На протяжении первого месяца терапии проводят еженедельное обследование животных. При этом всякий раз оценивают анамнестические данные, результаты физикального исследования, взвешивания, измерений концентрации глюкозы и кетоновых тел в моче, а также уровня глюкозы в крови. Если в течение двух недель после начала терапии побочные эффекты отсутствуют (табл. 12-6), то дозировку глипизида увеличивают до 5,0 мг дважды в день. Препарат продолжают вводить до тех пор, пока у кошки сохраняется стабильное состояние, средние концентрации глюкозы и фруктозамина в плазме крови поддерживаются на приемлемом уровне (соответственно ниже 300 мг/100 мл и 500 мкмоль/л), а владелец удовлетворен результатами лечения. В случае появления эугликемии или гипогликемии, глипизид отменяют или снижают его дозу, а спустя одну неделю повторно определяют концентрацию глюкозы, чтобы оценить необходимость продолжения лечения. Если после уменьшения дозы препарата или его отмены из-за развившейся гипогликемии
у животного возникает рецидив гипергликемии, дозу глипизида снова увеличивают или возобновляют его введение. Глипизид отменяют и кошек переводят на инсулинотерапию, если клиническая симптоматика диабета и общее состояние животного ухудшаются, развивается кетоацидоз или периферическая невропатия, а концентрации глюкозы и фруктозамина через 1-2 месяца после начала терапии остаются соответственно выше 300 мг/100 мл и 500 мкмоль/л и владелец не удовлетворен результатами лечения. У некоторых особей глипизид утрачивает эффективность через несколько недель или месяцев после начала его применения; в этих случаях для адекватной компенсации сахарного диабета приходится назначать инсулин. По-видимому, необходимость замены глипизида на инсулин обусловлена прогрессивным усугублением тяжести патофизиологических процессов, например, отложением амилоида в островках поджелудочной железы. Чем быстрее развиваются эти процессы, тем меньше продолжительность эффективного терапевтического действия глипизида.
Возможные результаты терапии. Результаты терапии глипизидом бывают разными. Чаще всего желаемый контроль гликемии и клинических симптомов сахарного диабета не достигается. В таких случаях глипизид отменяют и животных переводят на инсулин. При отсутствии адекватного контроля уровня глюкозы у людей с сахарным диабетом, по-
ТАБЛИЦА 12-6. ПОБОЧНЫЕ ЭФФЕКТЫ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА ГЛИПИЗИДОМ У КОШЕК
Побочные эффекты Рекомендации
Рвота в течение Обычно рвота ослабевает в течение
1 часа после 2-5 дней после начала терапии гли-
введения пизидом; при тяжелой рвоте следует уменьшить дозу или частоту введения препарата; терапию отменяют при сохранении рвоты на протяжении более 1 недели
Повышенная ак- Сначала терапию продолжают, контро-
тивность фер- лируя активность ферментов в крови
ментов печени каждые 1-2 недели; ее отменяют в слу-
в сыворотке чае появления клинических признаков
крови заболевания (сонливость, уменьшение аппетита, рвота) или повышения активности аланинаминотрансферазы выше 500 ME /л
Желтуха Прекращают введение глипизида; в случае исчезновения признаков желтухи (обычно в течение 2 недель после отмены препарата) терапию возобновляют, понизив дозу и частоту введения глипизида; ее окончательно отменяют в случае рецидива желтухи
Гипогликемия Прекращают введение глипизида и спустя неделю повторно определяют концентрацию глюкозы в крови; в случае рецидива гипергликемии терапию возобновляют, понизив дозу и частоту введения глипизида
Протокол терапии глипизидом
------------!------------
Начальная доза глипизида (2,5 мг дважды в день)
Рис. 12-15. Алгоритм лечения больных сахарным диабетом кошек с использованием перорального сульфонилмочевинного препарата глипизида.
О' .Л о
САХАРНЫЙ ДИАБЕТ У КОШЕК
САХАРНЫЙ ДИАБЕТ У КОШЕК • 611
лучающих препараты сульфонилмочевины, можно применить комбинированную терапию этими средствами и инсулином, которая дает более выраженный клинический эффект, чем одна инсулино-терапия (Lebovitz, Pasmantier, 1990; Bailey, Mezitis, 1990). В ходе сочетанной терапии у некоторых больных вырабатывается чувствительность к монотерапии производными сульфонилмочевины, возможно, благодаря уменьшению токсичности глюкозы под воздействием инсулина. К сожалению, у нас нет аналогичного опыта применения комбинированной терапии сахарного диабета у кошек, не отвечающих на глипизид. Сочетанное введение глипизида и инсулина этим животным, по-видимому, не влияет на потребность в инсулине и не облегчает гликемический контроль. Интересно, что у некоторых кошек, не отвечавших на лечение глипизидом, со временем спонтанно исчезала потребность в инсулине.
Реже удается контролировать концентрацию глюкозы в крови и клинические проявления сахарного диабета с помощью одного глипизида. Кошек, у которых глипизид вызывает подобные улучшения, подразделяют на «полностью» и «частично» отвечающих особей. Первые имеют практически нормальную концентрацию глюкозы в плазме крови, их клиническое состояние характеризуется как удовлетворительное, а гликозурия отсутствует. К этой категории относились почти 15% кошек, поступавших на лечение в нашу клинику. Для предотвращения гипергликемии им было достаточно перорального лечения, либо у них отпадала необходимость в терапии и сохранялась эугликемия.
Другие 15-20% кошек относились к группе «частично» отвечавших особей. Они характеризовались стабильным весом тела или его приростом, не страдали полидипсией или полиурией, а их общее состояние не внушало беспокойства владельцам. Настораживала только повышенная концентрация глюкозы в крови, составлявшая в среднем 200-300 мг/100 мл. Однако у многих входивших в данную группу кошек средняя концентрация глюкозы до начала лечения была выше 400 мг/100 мл. При поддержании ежедневного уровня глюкозы ниже 300 мг/100 мл на протяжении большей части суток ее концентрация оставалась ниже величины, при которой возможно ее поступление в мочу, а клинические проявления сахарного диабета отсутствовали или были сведены к минимуму. Вот уже больше 7 лет мы успешно лечим кошек обеих групп, отличающихся по реакции на глипизид, и не сталкиваемся со случаями диабетической невропатии или значительной потери веса.
В то же время, у некоторых «полностью» или «частично» отвечающих на глипизид кошек этот препарат со временем утрачивает эффективность и, в конце концов, им приходится назначать инсулин. Продолжительность периода между началом лечения таких животных глипизидом и их переводом на инсулин может составлять от нескольких недель до трех лет и более и не поддается прогнозированию.
У большинства животных потребность в инсулине сохраняется на протяжении всей оставшейся жизни, хотя иногда дозы гормона приходится периодически менять в ту или иную сторону. Предполагается, что ИНЗСД переходит в ИЗСД в результате усугубления тяжести патофизиологических процессов (например, усиления отложений амилоида в островках поджелудочной железы), которые и являются основной причиной возникновения сахарного диабета у кошек (Nelson et al, 1998). Чем выше скорость развития этих процессов, тем короче эффективное действие глипизида.
Глибурид. Глибурид (ДиаБета, производства Hoechst-Roussel, США или микроназ производства Kalamazoo, США) - еще один препарат группы производных сульфонилмочевины, который действует подобно глипизиду (DeFronzo, 1999). Продолжительность его эффекта дольше, чем у глипизида, поэтому обычно его вводят один раз в день, а не дважды, как глипизид (Groop, 1992; Birkeland et al, 1994). Наш опыт применения этого препарата для лечения сахарного диабета у кошек невелик. В странах, где глипизид недоступен, можно рекомендовать терапию глибуридом в дозе 0,625 мг (половина таблетки, содержащей 1,25 мг препарата), которую вводят один раз в день. Глибурид не отличается от глипизида по характеру побочного действия и реакции кошек на терапию.
Меглитиниды
Репаглинид (прандин, производства Novo Nordisk) является единственным имеющимся на рынке препаратом группы меглитинидов. Подобно производным сульфонилмочевины он стимулирует секрецию инсулина (DeFronzo, 1999) и вызывает такое же снижение уровня глюкозы в крови при введении больным с ИНЗСД (Wolffenbuttel, Landgraff, 1999). Побочные эффекты репаглинида у человека включают гипогликемию и увеличение веса тела, однако, эпизоды гипогликемии случаются реже, чем при терапии препаратами сульфонилмочевины (Damsbo et al, 1999). При лечении ИНЗСД у людей репаглинид используют как средство монотерапии или в сочетании с метформином (Mosses et al, 1999). Данных о действии репаглинида у страдающих сахарным диабетом кошек нет.
Бигуаниды
Самым распространенным препаратом этого класса пероральных сахаропонижающих средств является метформин (глюкофаг, производства Bristol-Myers Squibb, США). Механизм действия метформина отличается от такового сульфонилмочевинных препаратов. Он не влияет непосредственно на бета-клет-ки, но способствует контролю гликемии, повышая чувствительность печени и периферических тканей к инсулину (Bailey, Turner, 1996; DeFronzo, 1999). Кроме того, метформин подавляет глюконеогенез
612 • САХАРНЫЙ ДИАБЕТ У КОШЕК
и гликогенолиз в печени, причем уменьшение гепатической продукции глюкозы тесно коррелирует со снижением концентрации глюкозы в плазме крови натощак. Одновременно метформин стимулирует обмен глюкозы в мышечной ткани благодаря повышению ее чувствительности к инсулину. Конечным результатом его действия является снижение концентрации глюкозы в крови в отсутствие гипогликемии. Наиболее обычными побочными эффектами метформина являются расстройства со стороны желудочно-кишечного тракта, включая ощущение дискомфорта, уменьшение аппетита, рвоту и диарею (DeFronzo, Goodman, 1995). Весьма неприятным последствием применения метформина у больных сахарным диабетом является тяжелый лактоацидоз, однако, считается, что это осложнение развивается очень редко (Bailey, Turner, 1996). Для первоначальной терапии ИНЗСД у человека метформин может использоваться как сам по себе, так и в сочетании с препаратами сульфонилмочевины или инсулином.
При введении метформина людям с сахарным диабетом его концентрация в плазме крови колеблется от 0,5 до 2,0 мкг/мл (Sheen, 1996; Sambol et al, 1996). При введении кошкам в дозах от 25 до 50 мг концентрация метформина в их крови сначала снижается до такого же уровня, как в аналогичных условиях у человека, а через 12 часов после введения он практически исчезает из циркуляции (рис. 12-16) (Michels et al, 1999; Nelson et al, в печати). Через 1-4 часа после введения препарата в дозах более 75 мг/животное могут появиться вялость, сонливость и рвота. При введении здоровым кошкам в дозах 25 или 50 мг дважды в день в течение 3 недель метформин не влиял на показатели крови и не вызывал лактоацидоз, но у всех животных периодически наблюдались уменьшение аппетита и рвота, а к концу эксперимента у большинства кошек снижался вес тела (Nelson et al, в печати). Монотерапия метфор-
Рис. 12-16. Средняя (+SD) концентрация метформина в плазме крови в разное время после его перорального введения в дозе 50 мг пяти здоровым кошкам. Диапазон терапевтических концентраций метформина в плазме крови у людей с сахарным диабетом составляет 0,5-2,0 мкг/мл. (Из: Nelson RW et al: Evaluation of oral antihyperglycemic drug metformin in normal and diabetic cats. J Vet Intern Med. (в печати).
мином, проведенная у небольшого числа кошек с впервые диагностированным сахарным диабетом, не оказывала положительного эффекта; более того, ее пришлось прекратить из-за прогрессивно ухудшавшейся клинической симптоматики и развития кетоацидоза (Nelson et al, в печати). У единственной кошки из этой группы, отвечавшей на введение метформина, концентрация инсулина в сыворотке крови натощак до начала терапии составляла 20 мкЕД/мл, тогда как у остальных она не превышала 5 мкЕД/мл. Эти наблюдения подтверждают мнение о том, что вызываемое метформином повышение чувствительности тканей к инсулину проявляется только при адекватной концентрации гормона в крови. Поэтому метформин не действует у кошек с низкой концентрацией инсулина вследствие утраты бета-клеток или нарушения их функциональной активности под воздействием токсического действия глюкозы (см. стр. [544]).
К сожалению, результаты первых исследований, имевших целью оценку эффективности метформина у здоровых и больных сахарным диабетом кошек, не были продолжены, и возможность его применения для лечения кошек остается неясной. В настоящее время в США метформин продается в форме таблеток по 500 мг. Для введения кошкам таблетки должны быть заключены в капсулу (по 25 или 50 мг препарата). Данные об оценке действия метформина в качестве средства вспомогательной терапии слабо компенсированного сахарного диабета у получающих инсулин кошек или собак отсутствуют.
Тиазолидиндионы
Тиазолидиндионы - это новый класс лекарственных препаратов для лечения сахарного диабета, которые повышают чувствительность тканей-мишеней к инсулину, но не влияют на его секрецию. Тиазолидиндионы связываются с недавно открытыми рецепторами, которые получили название «рецепторы-у, активируемые пролифераторами пероксисом». В процессе этого взаимодействия усиливается экспрессия транпортеров глюкозы (Berger et al, 1996; Plosker, Faukds, 1999). Тиазолидиндионы повышают чувствительность к инсулину в печени, мышечной и жировой тканях, что приводит к подавлению биосинтеза глюкозы в печени, усилению ее обмена в мышцах и уменьшению концентрации свободных жирных кислот в крови (DeFronzo, 1999). Первым коммерческим препаратом этого класса в США стал троглитазон (резулин, производства Parke-Davis, США), который предназначался для монотерапии или сочетанного применения с сульфонилмочевинными средствами, метформином или инсулином при лечении ИНЗСД у людей (Plasker, Faulds, 1999). Несмотря на неоднократные заявления о революционизирующей роли троглитазона в лечении сахарного диабета, клинические исследования показали, что монотерапия этим препаратом у человека менее
САХАРНЫЙ ДИАБЕТ У КОШЕК • 613
эффективна, чем терапия производными сульфонилмочевины или метформином (DeFronzo, 1999). Самым тяжелым побочным эффектом троглитазона оказалась гибель больных вследствие недостаточности функции печени (Gitlin et al, 1998). Это случалось настолько часто, что Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (FDA) было вынуждено запретить его продажу в США. Другими соединениями класса тиазолидиндионов, которые недавно появились на рынке фармацевтических продуктов США, являются пиоглитазон, или актос, производимый компанией Takeda Pharmaceuticals America (США) и розиглитазон (авандия, производства SmithKline, США). Их сахаропонижающая активность по меньше мере столь же высока, как у троглитазона (Patel et al, 1997; Grossman, Lessem, 1997). Розиглитазон был разрешен для монотерапии или комбинированной (в сочетании с метформином) терапии сахарного диабета, а пиоглитазон - для монотерапии и в комбинации с производными сульфомочевины, метформином или инсулином.
Было проведено исследование фармакокинетики троглитазона после его внутривенного или перорального введения здоровым кошкам (Michels et al, 2000). В целом, характер распределения троглитазона в организме кошек оказался таким же, как у человека, однако, стационарный объем распределения был меньше, так же как биодоступность препарата после его перорального введения (7 ± 3%). На основании результатов изучения фармакокинетики троглитазона у здоровых кошек можно сделать вывод, что для достижения такой же его концентрации в плазме крови, которая обеспечивает терапевтический эффект у человека, доза препарата при пероральном введении должна составлять 20-40 мг/ кг один или два раза в день. Исследования фармакокинетики троглитазона у собак не проводились. В целом, значение тиазолидиндионов для лечения сахарного диабета у кошек и собак требует дальнейших исследований.
Хром
Хром - это широко распространенный микроэлемент, обладающий инсулиноподобным действием in vitro. Точный механизм этого действия неизвестен, но в целом оно сводится к повышению чувствительности тканей к действию инсулина, вероятно, на пострецепторном уровне (Anderson, 1992; Striffler et al, 1995). Хром является важным кофактором действия инсулина, а его недостаточность приводит к инсулинорезистентности. Данные о влиянии хрома трипиколината на толерантность к глюкозе у кошек противоречивы. Одни исследования не выявили его действия ни у здоровых особей, ни при наличии ожирения, тогда как в других было установлено слабое, но достоверное и зависимое от дозы препарата улучшение толерантности к глюкозе у кошек без ожирения (Cohn et al, 1999;
Appleton et al, 2002b). В группе собак с ИЗСД пероральное введение хрома пиколината не повышало качество контроля гликемии (Schachter et al, 2001). Данных об эффективности этого соединения у кошек с сахарным диабетом нет. Дополнительная информация об активности хрома приводится в гл. 11 (стр. 549).
Ванадий
Ванадий - еще один широко распространенный микроэлемент, обладающий инсулиноподобным действием in vitro (Brichard et al, 1989). Механизм действия ванадия неизвестен, но предполагается, что его эффект осуществляется на пострецепторном уровне, стимулируя обмен глюкозы (Brichard, Henquin, 1995; Goldfine et al, 1995). Ванадий не повышает концентрацию инсулина в крови. Несмотря на противоречивые данные о биологическом действии ванадия, установлено, что он снижает потребность в инсулине у больных с ИЗСД и улучшает гликемический контроль при ИНЗСД (Goldfine et al, 1995; Cohen et al, 1995). Неопубликованные результаты предварительных исследований, полученные д-ром Греко (Greco) и его сотрудниками, свидетельствуют о том, что после 4 недель введения ортованадата здоровым кошкам с питьевой водой значительно уменьшалось среднесуточное потребление ими жидкости на фоне эпизодов рвоты и диареи. Во всех остальных отношениях переносимость препарата была хорошей. Введение ортованадата с питьевой водой кошкам с сахарным диабетом на протяжении 4 недель приводило к уменьшению концентрации глюкозы в плазме крови и устраняло клинические проявления заболевания. Качество контроля уровня глюкозы в группе больных диабетом кошек, получавших ПЦИ в сочетании с дипиколинатом ванадия, было лучше, чем у животных, которым вводили только ПЦИ (Plotnick et al, 1995; Fondacaro et al, 1999; Greco, 2000). Результаты этих исследований свидетельствуют о том, что ванадий можно использовать в качестве альтернативного средства терапии на ранних стадиях ИНЗСД у кошек. Рекомендуемая доза составляет 0,2 мг/кг/день при ежедневном введении с кормом или водой. Основными побочными эффектами являются рвота и снижение аппетита. Случаи отдаленного токсического действия обусловлены накоплением металла в некоторых органах, включая кости, печень и почки. У одной кошки, получавшей препарат ванадия на протяжении 1 года, развилась острая почечная недостаточность; после отмены препарата функция почек восстановилась (Greco, 2000).
Акарбоза
Акарбоза является конкурентным ингибитором а-амилазы в поджелудочной железе и а-глюкозидазы в щеточной каемке слизистой тонкого кишечника. Она замедляет переваривание сложных углеводов и
614 • САХАРНЫЙ ДИАБЕТ У КОШЕК
полисахаридов, а также всасывание глюкозы в желудочно-кишечном тракте (см. стр. [504]). Альтернативой терапии акарбозой для больных сахарным диабетом кошек является перевод животных на рацион с низким содержанием углеводов (табл. 12-3).
Лекарственные травы, пищевые добавки и витамины
См. стр. 550.
Первоначальный подбор режима инсулинотерапии
Тактика первоначального подбора режима инсулинотерапии для собак и кошек с сахарным диабетом одинакова и обсуждается на стр. 551. На начальном этапе ее задача состоит в улучшении клинического состояния животного, при этом стараются избежать гипогликемии. Кошку обычно приходится обследовать в течение одной-двух недель, прежде чем удается подобрать эффективный режим терапии. При каждом посещении ветеринарной клиники оцениваются сообщения владельца кошки о потреблении ею воды, продукции мочи и общем состоянии животного, проводятся физикальное исследование и серийные определения концентрации глюкозы в плазме крови между 7-9 и 16-18 часами, регистрируются изменения веса. На основании полученных данных корректируется текущий режим терапии, животное возвращается домой и назначается время следующего обследования через 1-2 недели для оценки последствий изменения терапевтического режима. Качество гликемического контроля признается удовлетворительным, если исчезают клинические проявления сахарного диабета, кошка выглядит здоровой и общительной, имеет постоянный вес тела, концентрация глюкозы в крови по возможности поддерживается на уровне между 100 и 300 мг/100 мл на протяжении суток, а ее владелец удовлетворен результатами лечения. В связи с риском возникновения феномена Сомоги при относительно низких дозах инсулина (2-3 ЕД на инъекцию) (см. стр. 623), мы рекомендуем хозяевам кошек вводить фиксированную дозу инсулина после достижения приемлемого качества контроля уровня глюкозы. Мы не советуем им корректировать режим инсулинотерапии без предварительной консультации с ветеринаром.
МОНИТОРИНГ КОМПЕНСАЦИИ ДИАБЕТА
Обзор
Основная задача инсулинотерапии состоит в устранении клинических проявлений сахарного диабета и профилактике его наиболее частых осложнений. К числу таких осложнений относятся общая слабость, атаксия и стопохождение вследствие периферической невропатии, потеря веса, плохое состо
яние шерстяного покрова из-за прекращения ухода за ним, гипогликемия, рецидивирующий кетоз и ухудшение гликемического контроля из-за сопутствующих инфекций, воспалительного процесса, неоплазии и/или гормональных расстройств. Угрожающие жизни хронические осложнения сахарного диабета (такие как нефропатия, заболевания сосудов, ишемическая болезнь сердца) развиваются на протяжении нескольких десятков лет и потому редко встречаются у кошек. В связи с этим снижение концентрации глюкозы в крови до практически нормального уровня не является главной задачи терапии сахарного диабета у этих животных. Большинство владельцев вполне удовлетворены, а большинство кошек выглядят здоровыми и не имеют симптомов заболевания при концентрации глюкозы в плазме крови от 100 до 300 мг/100 мл.
Методы компенсации сахарного диабета у собак и кошек не отличаются и обсуждаются на стр. 552. Существенное влияние на качество компенсации оказывает повышенная чувствительность кошек к стрессорному воздействию частого взятия проб крови в условиях ветеринарной клиники, следствием чего является индуцированная гипергликемия (см. стр. 619). Однажды появившись, гипергликемия становится постоянной проблемой, и результаты определения концентрации глюкозы больше не могут считаться надежным показателем. Ветеринар должен принимать все необходимые меры для предотвращения возникновения гипергликемии у кошек под воздействием стресса. Кошки не нуждаются в исключительно тщательной компенсации сахарного диабета, а получение гликемических кривых требуется только при необходимости изменения терапевтического режима. О качестве контроля гликемии судят на основании субъективного мнения владельца кошки об ее общем физическом состоянии и тяжести клинических проявлений диабета, прыгучести и уходе за шерстью, а также по результатам физикального исследования и взвешивания животного. В отсутствие индуцированной стрессом гипергликемии серийные определения концентрации глюкозы в крови проводят только в случаях впервые диагностированного или плохо компенсированного сахарного диабета. При подозрении на индуцированную гипергликемию серийные определения концентрации глюкозы проводят в пробах крови, получаемых владельцем животного в более спокойной домашней обстановке (путем прокола маргинальной вены в ушной раковине кошки), а не в пробах, взятых в условиях ветеринарной клиники. Альтернативным способом оценки является определение концентрации фруктозамина в последовательно взятых пробах крови в сочетании с анализом анамнестических данных и результатов физикального исследования.
Анамнез и физикальное исследование
При оценке качества контроля уровня гликемии наиболее важными исходными показателями являют
САХАРНЫЙ ДИАБЕТ У КОШЕК
615
ся субъективное мнение владельца кошки о ее общем физическом состоянии и тяжести клинических проявлений заболевания, а также результаты физикального исследования и взвешивания животного. Если владелец удовлетворен результатами лечения, физикальное исследование подтверждает адекватность гликемического контроля, а вес животного остается стабильным, делается вывод о хорошей компенсации сахарного диабета. В качестве дополнительного, объективного показателя гликемического контроля является концентрация фруктозамина в сыворотке крови (см. ниже).
При подозрении на неудовлетворительный контроль диабета необходимо провести дополнительные диагностические мероприятия (включая получение гликемической кривой и пробы на наличие сопутствующих расстройств) или изменить режим терапии. Подобная необходимость возникает, если владелец животного жалуется на появление клинических признаков гипергликемии или гипогликемии (таких как полиурия, полидипсия, общая слабость, вялость и/или атаксия) либо периферической невропатии (уменьшение прыгучести, общая слабость, атаксия и тенденция к стопохождению). Дополнительными показателями неудовлетворительного контроля уровня гликемии служат соответствующие результаты физикального исследования (уменьшение веса тела или истощение, плохое состояние шерстяного покрова и т.д.).
Определение концентрации фруктозамина в сыворотке крови
Фруктозамины представляют собой гликозилированные белки крови, определение которых используется для мониторинга качества контроля гликемии у больных сахарным диабетом собак и кошек (Reusch et al, 1993; Crenshaw et al, 1996; Elliott et al, 1999). Фруктозамины образуются в процессе необратимого, неферментативного и независимого от инсулина связывания глюкозы с белками крови и присутствуют в крови всех людей и животных. Концентрация фруктозаминов служит маркером средней концентрации глюкозы на протяжении периода жизни белка в крови, который составляет от 1 до 3 недель в зависимости от его природы (Kawamoto et al, 1991). Степень гликозилирования белков непосредственно связана с концентрацией глюкозы в крови: чем выше средняя величина последней на протяжении 2-3 предшествовавших недель, тем выше концентрация сывороточных фруктозаминов и наоборот. Уровень фруктозаминов в крови не изменяется в случае острого повышения концентрации глюкозы под воздействием, например, стресса или возбуждения (Lutz et al, 1995; Crenshaw et al, 1996; Plier et al, 1998; Elliott et al, 1999). Концентрацию фруктозаминов можно определять в процессе рутинной оценки контроля гликемии, которая проводится каждые 3-6 месяцев, а также для выявления воздействия стресса или возбуждения на концент
рацию глюкозы в крови, объяснения расхождений между результатами анализа анамнестических данных, физикального исследования и серийных определений концентрации глюкозы и для характеристики эффективности коррекции инсулинотерапии (см. стр. 619). Концентрация фруктозаминов в крови возрастает при ухудшении контроля гликемии и снижается при его улучшении (рис. 12-17).
Методы обращения с пробами крови, предназначенными для определения концентрации фруктозамина, приведены на стр. 553. В нашей лаборатории диапазон нормальных концентраций фруктозамина у кошек составляет от 190 до 365 мкмоль/л. В таких концентрациях фруктозамин присутствует в крови здоровых животных с устойчиво нормальным уровнем глюкозы (Briggs et al, 2000). У кошек с впервые выявленным сахарным диабетом концентрация фруктозамина находится в пределах от 350 до 730 мкмоль/л (Elliott et al, 1999). Нормальная концентрация фруктозамина у некоторых кошек с сахарным диабетом свидетельствует о том, что тяжелая гипергликемия, достаточная для проявления клинических признаков заболевания, сохранялась у них на протяжении лишь непродолжительного периода, предшествовавшего установлению диагноза. Подходы к интерпретации результатов определения фруктозамина у кошек и собак с сахарным диабетом одинаковы и изложены на стр. 553 (табл. 12-7). При гипопротеинемии (содержание общего белка менее 5,5 г/100 мл) или гипоальбуминемии (содержание альбумина менее 2,5 г/100 мл) у здоровых и, возможно, у больных диабетом кошек концентрация фруктозамина в сыворотке крови может быть ниже
ТАБЛИЦА 12-7. МЕТОДЫ РАБОТЫ С ПРОБАМИ И НОРМАЛЬНЫЕ
КОНЦЕНТРАЦИИ ФРУКТОЗАМИНА В СЫВОРОТКЕ КРОВИ У КОШЕК, ПРИНЯТЫЕ В НАШЕЙ ЛАБОРАТОРИИ
Параметр
Образец крови
Хранение проб
Метод
Факторы, влияющие на результаты определений
Дополнительная информация
1-2 мл, после свертывания получают сыворотку
Пробы хранят замороженными до проведения анализа
Автоматический колориметрический анализ с использовани-
ем тетразолия хлорида Гипопротеинемия и гипо-альбуминемия (занижение результатов); хранение проб
при комнатной температуре (завышение результатов)
190-365 мкмоль/л
Нормальный диапазон Интерпретация результатов,
полученных у кошек с сахарным диабетом Отличный контроль Хороший контроль Удовлетворительный контроль Плохой контроль Продолжительная гипогликемия
350-400 мкмоль/л
400-450 мкмоль/л
450-500 мкмоль/л
500 мкмоль/л
300 мкмоль/л
616 • САХАРНЫЙ ДИАБЕТ У КОШЕК
400-1
3.0-1
Рис. 12-17. Средняя концентрация глюкозы в крови в течение 12 часов после подкожного введения инсулина, средняя концентрация гликозилированного гемоглобина и фруктозамина в крови у 12 кошек с плохо компенсированным диабетом до (tzzzzn) и спустя 6,5 ± 2,4 недели после () улучшения гликемического контроля, а также у 20 здоровых кошек (essssj). * = р < 0,01 по сравнению с показателями, полученными после улучшения гликемического контроля.
нормальной (Reusch, Haberer, 2001). В отличие от этого гиперпротеинемия, гиперальбуминемия, азотемия или гипербилирубинемия не влияют на концентрацию фруктозамина у здоровых кошек.
Определение концентрации гликозилированного гемоглобина
Гликозилированный гемоглобин (Gly Hb), как и фруктозамины, образуется в процессе необратимого, неферментативного и независимого от инсулина связывания глюкозы с гемоглобином в эритроцитах. Содержание Gly Hb в крови служит маркером средней концентрации глюкозы на протяжении периода жизни эритроцита в крови, который у кошек составляет примерно 70 дней (Jain, 1993). Степень гликозилирования гемоглобина прямо пропорциональна концентрации глюкозы в крови: чем больше величина последней в течение предшествовавших 2-3 месяцев, тем выше содержание Gly Hb и наоборот (Elliott et al, 1999; Hoenig, Ferguson, 1999). В целях мониторинга долгосрочной эффективности лечения сахарного диабета у людей используют определение Gly Hb, а не фруктозамина, поскольку больные диабетом самостоятельно контролируют концентрацию глюкозы в крови и ежедневно корректируют дозу инсулина, а определение Gly Hb позволяет оценить уровень гликемии на протяжении более длительно
го периода, чем определение фруктозамина (соответственно 3-4 месяцев и 2-3 недель). В отличие от этого, у кошек с сахарным диабетом для контроля уровня гликемии чаще определяют концентрацию фруктозамина. Отчасти это связано с большей доступностью коммерческих наборов и с тем, что концентрация фруктозамина, которая изменяется быстрее, чем концентрация Gly Hb, лучше отражает влияние изменений режима инсулинотерапии на качество компенсации диабета у раздражительных животных. Сведения о фракциях Gly Hb, работе с пробами крови и методах определения концентрации Gly Hb приведены на стр. 555. В нашей лаборатории нормальными показателями содержания общего Gly Hb в крови кошек при определении методом аффинной хроматографии считаются 0,9-2,5%. Этот диапазон установлен при анализе уровня Gly Hb у здоровых животных с устойчиво нормальной концентрацией глюкозы в крови (Elliott et al, 1997). У кошек с впервые выявленным сахарным диабетом содержание общего Gly Hb в крови составляет от 1,2 до 4,7%. Нормальная концентрация Gly Hb у некоторых кошек с впервые выявленным сахарным диабетом свидетельствует о том, что заболевание развилось у них незадолго до установления диагноза. Причина в целом более низкого процентного содержания Gly Hb у кошек по сравнению с собаками неизвестна. Такое различие может быть
САХАРНЫЙ ДИАБЕТ У КОШЕК
617
следствием более короткой продолжительности жизни эритроцитов у кошек, разной проницаемости оболочек эритроцитов для глюкозы либо различий в аминокислотном составе и/или конформации молекул гемоглобина у животных обоих видов, которые определяют количество связывающих мест глюкозы (Hasegawa et al, 1992; Christopher et al, 1995; Elliott et al, 1997). Подходы к интерпретации результатов определения общего Gly Hb в крови кошек и собак с сахарным диабетом одинаковы и обсуждаются на стр. 556 (табл. 12-8).
Мониторинг уровня глюкозы в моче
Периодическое определение уровня сахара в моче в домашних условиях помогает выявить гликозу-рию или кетонурию у кошек с сахарным диабетом и рецидивирующим кетозом, выявить рецидивы гликозурии после восстановления инсулинонезависимого диабетического состояния, оценить тяжесть гликозурии у кошек, получающих пероральные сахаропонижающие препараты, а также облегчает дифференциальную диагностику преходящей и устойчивой гипергликемии у животных с подозрением на индуцированную стрессом гипергликемию. Во всех этих случаях пробы мочи можно брать в любое время суток. Небольшое количество мочи можно получить, если уменьшить объем подстилки в ящике для кошки или временно заменить ее неабсорбирующим жидкость материалом (например, мелкой аквариумной галькой). Альтернативно можно оценивать содержание глюкозы в моче по изменению окраски тест-полосок (Glucotest Feline
ТАБЛИЦА 12-8. МЕТОДЫ РАБОТЫ С ПРОБАМИ И НОРМАЛЬНЫЕ КОНЦЕНТРАЦИИ ОБЩЕГО
ГЛИКОЗИЛИРОВАННОГО ГЕМОГЛОБИНА В СЫВОРОТКЕ КРОВИ У КОШЕК, ПРИНЯТЫЕ В НАШЕЙ ЛАБОРАТОРИИ
Параметр Дополнительная информация
Образец крови 1-2 мл цельной крови в ЭДТА
Хранение образца В холодильнике до определе-
Метод НИЯ Аффинная хроматография и
Факторы, влияющие на гемолизат кошачьих эритроцитов Хранение при комнатной
результаты температуре (занижение),
Нормальный диапазон хранение при 4° С дольше 7 дней (занижение), анемия (гематокрит <35%) (занижение) 0,9 - 2,5%
Интерпретация результатов при диабете у кошек
Прекрасный контроль 1,0 - 2,0%
Хороший контроль 2,0 -2,5%
Удовлетворительный 2,5-3,0%
контроль
Плохой контроль >3,0%
Длительная гипоглике- <1,0%
МИЯ
ЭДТА - этилендиаминтетрауксусная кислота
Urinary Glucose Detection System производства Ralston Purina, США). Устойчивая гликозурия свидетельствует о неудовлетворительной компенсации сахарного диабета и необходимости более полной оценки качества контроля с помощью описанных в данном разделе методов. Мы никогда не рекомендуем ежедневно корректировать дозу инсулина в зависимости от результатов измерения концентрации глюкозы в пробах мочи кошек, страдающих сахарным диабетом.
Гликемическая кривая
Если анализ анамнестических данных, физикального исследования, взвешивания животного и определения концентрации сывороточного фруктозамина указывают на необходимость коррекции режима инсулинотерапии, следует построить гликемическую кривую с помощью серийных определений концентрации глюкозы в крови. Такая кривая служит ориентиром для внесения поправок в протокол инсулинотерапии при условии, что результаты измерения уровня глюкозы не искажены сопутствующими стрессорными воздействиями, агрессивным поведением или возбуждением животного (см. стр. 619). Гликемическая кривая позволяет рационализировать подходы к коррекции инсулинотерапии. Серийные измерения концентрации глюкозы в крови в обязательном порядке проводятся на начальных стадиях инсулинотерапии у кошек и необходимы для восстановления требуемого уровня контроля гликемии в случае возникновения гипер- или гипогликемического состояния. Использование анамнестических данных, результатов физикального исследования, изменений веса тела и определения концентрации фруктозамина для того, чтобы выяснить необходимость построения гликемической кривой, позволяет снизить число серийных определений концентрации глюкозы в крови, уменьшить количество венепункций и сократить время пребывания животного в стационаре. При этом сводится к минимуму отрицательная реакция животного на повторное взятие крови (и, следовательно, стрессорное воздействие на него) и повышается вероятность получения достоверных показателей уровня глюкозы в процессе серийных определений.
Протокол построения гликемической кривой в условиях ветеринарной клиники
Протокол построения гликемической кривой в условиях ветеринарной клиники для кошек и собак с сахарным диабетом одинаков и описан на стр. 556. Мы предпочитаем получать пробы крови у кошек посредством прокола маргинальной вены в ушной раковине (см. ниже). По нашим наблюдениям, кошки значительно легче переносят такую процедуру, чем повторные венопункции, что сводит к минимуму риск возникновения индуцируемой стрессом гипергликемии.
618
САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-18. Техника прокола маргинальной ушной вены для определения концентрации глюкозы в крови. А. На ушную раковину на 2-3 минуты накладывают смоченную теплой водой ткань для стимуляции кровотока. Б. На периферии наружной стороны ушной раковины находят маргинальную вену. Один из ее участков смазывают небольшим количеством вазелина и прокалывают вмонтированным в портативный глюкометр скарификатором. Между ушной раковиной и фиксирующим ее пальцем помещают марлевый тампон, чтобы предотвратить случайный прокол пальца, если скарификатор пройдет ушную раковину насквозь. Нанесение вазелина позволяет получить хорошо сформированную шарообразную каплю крови по мере выделения последней из прокола. В. На вену вблизи места прокола надавливают пальцем, чтобы усилить выделение крови. К обра зовавшейся капле прикладывают тест-полоску до поступления на нес такого количества крови, которое необходимо для активации глюкометра. (Из: Nelson RW, Cuoto CG: Small Animal Internal Medicine, 3d ed. St. Louis, Mosby, 2003, p 759).
Протокол построения гликемической кривой в домашних условиях
Альтернативой построению гликемической кривой по результатам серийных измерений концентрации глюкозы в условиях ветеринарной клиники является проведение аналогичных определений в домашних условиях. Пробы крови для этой цели получают посредством прокола маргинальной вены в ушной раковине и определяют концентрацию глюкозы с помощью портативного бытового глюкометра. При этом используется тест-полоска, кончиком которой хозяин животного касается капли крови на ухе (Glucometer Elite XL, производства Bayer Corp, США) (рис. 12-18). При проколе ушной вены нет необходимости в жесткой физической иммобили
зации кошки во время взятия пробы, что сводит к минимуму испытываемые животным дискомфорт и стрессорное воздействие. Точность определения концентрации глюкозы в крови, полученной путем прокола ушной вены или венопункции, примерно одинаковая (Weiss, Reusch, 2000а; Thompson et al, 2002). Однако измерение концентрации глюкозы с помощью портативного бытового глюкометра может давать завышенные, а еще чаще заниженные результаты по сравнению с получаемыми референтными методами (см. стр. 557) (Weiss, Reusch, 2000b). Возможность такой ошибки, обусловленной самой конструкцией бытового глюкометра, необходимо всегда принимать во внимание при интерпретации полученных результатов. В интернете имеется несколько веб-сайтов (например, www.
САХАРНЫЙ ДИАБЕТ У КОШЕК • 619
Рнс. 12-19. Начальная компенсация инсулинозависимого сахарного диабета у кошки Мэн Кун весом 6,5 кг с использованием результатов измерения концентрации глюкозы в крови ее владельцем в домашних условиях методом прокола ушной вены, изображенным на рис. 18. Животное сначала получало инъекции ПЦИ в дозе 2 ЕД дважды в день. После увеличения дозы инсулина до 3 ЕД (сплошная линия) или 5 ЕД (штриховая линия) дважды в день клинические симптомы заболевания сохранялись, а концентрация глюкозы оставалась высокой. Инъекции ПЦИ в дозе 6 ЕД дважды в день (пунктирная линия) купировали клинические симптомы и обеспечивали приемлемый контроль гликемии. Стрелкой показано время введения инсулина и кормления (половина суточного потребления калорий).
sugarcats.net/sites/hany/), в которых даны подробное описание техники прокола ушной вены для неспециалистов и информация об опыте владельцев животных, использовавших разные типы портативных глюкометров. Выявив у кошки сахарный диабет, мы сообщаем ее хозяину название веб-сайта, просим посетить его и выясняем, готов ли он проводить мониторинг гликемии у кошки в домашних условиях. Мы не жалеем времени на обучение лиц, согласившихся проводить такой мониторинг. Мы обучаем их технике взятия крови, консультируем относительно частоты проведения серийных определений концентрации глюкозы для построения гликемической кривой (желательно не чаще одного раза каждые 2-А недели), количества проб и времени их взятия (обычно во время введения инсулина и через 3, 6, 9 и 12 часов). Нам удается получать прекрасные результаты, применяя методику прокола ушной вены у кошек (рис. 12-19). Она позволяет значительно уменьшить стрессорное воздействие на животное и максимально повысить достоверность измерений концентрации глюкозы в крови. При этом самой существенной проблемой является чрезмерное усердие владельцев животных, старающихся как можно чаще проводить определения. Аналогичный подход используется при построении гликемической кривой у собак, для чего пробы крови получают посредством прокола ушной раковины или губы. Однако мы гораздо реже прибегаем к проведению мониторинга гликемии в домашних условиях у собак, поскольку у них индуцируемая стрессом гипергликемия далеко не столь частое явление, как у кошек.
Во время прокола маргинальной вены в ушной раковине кошка лежит на животе и иммобилизация сводится к удержанию ее в этом положении. Находят маргинальную вену и с целью усиления перфузии на 15-30 секунд покрывают ее предварительно
смоченной в теплой воде марлей или другой тканью. На место будущего прокола наносят тонкий слой вазелина, что позволяет получить хорошо сформированную каплю крови и препятствует ее растеканию по шерсти. Ухо фиксируют пальцем, прокалывают маргинальную вену автоматическим скарификатором (например, скарификатором Microlet производства Bayer Diaganostics, Bayer Corp., Elkhart, Ind., США) и при необходимости слегка сгибают ушную раковину, способствуя образованию капли крови. Прикладывают к ней тест-полоску, предварительно вставленную в глюкометр и определяют концентрацию глюкозы (см. рис. 12-18). Место прокола зажимают пальцем до прекращения кровотечения. Пункция кожи редко вызывает у животного болезненное ощущение, а место взятия крови едва заметно даже после неоднократных проколов вены. Решающее значение для получения хорошо сформированной капли крови имеет нанесение тонкой вазелиновой пленки на место будущего прокола. Использование небольшого тампона (ватного шарика или марлевой подушечки) при фиксации ушной раковины пальцем предотвращает его случайный прокол, если скарификатор проходит ушную раковину насквозь. Образованию полноценной капли крови препятствует дегидратация животного; с этой проблемой иногда сталкиваются при работе с кошками, у которых вследствие неудовлетворительной компенсации сахарного диабета развивается выраженная гипергликемия или тяжелые полиурия и полидипсия. Подкожное введение таким животным жидкости улучшает кровообращение в ушной раковине. При определении концентрации глюкозы следует использовать только такие модели портативных бытовых глюкометров, в которых вставленная тест-полоска имеет достаточно длинный свободный конец, позволяющий прикоснуться к образовавшейся капле крови.
620 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Интерпретация гликемической кривой
Интерпретация результатов серийных определений концентрации глюкозы не отличается для кошек и собак и изложена на стр. 559. В идеале, все показатели, полученные между двумя инъекциями инсулина, должны оставаться в диапазоне от 100 до 300 мг/100 мл. Наиболее важная информация, получаемая при анализе гликемической кривой, включает эффективность действия инсулина, его продолжительность и степень максимального снижения уровня глюкозы. Если эффективность инсулина недостаточна для снижения концентрации глюкозы, клиницист должен рассмотреть возможность занижения дозировки гормона и/или наличия индуцированной стрессом гипергликемии, а также дифференцировать истинное отсутствие эффективности от потенциальной инсулинорезистентности (см. раздел «Рецидивирующие или устойчивые клинические симптомы», стр. 564). В общем случае занижение дозы инсулина может иметь место, если она меньше 1,0 ЕД/кг веса на одну инъекцию. Если терапевтический эффект инсулина отсутствует при его более высокой дозе, следует исключить инсулинорезистентность и рассмотреть вероятность развития феномена Сомоги (см. стр. 623).
В тех случаях, когда инсулин эффективно понижает уровень глюкозы, ее минимальная концентрация должна составлять 100-125 мг/100 мл. Если минимальная концентрация глюкозы превышает 150 мг/100 мл, следует увеличить дозу инсулина, а при минимальной концентрации 80 мг/100 мл или ниже - уменьшить дозу. В последнем случае степень снижения дозы инсулина зависит от его количества, которое было введено животному во время построения гликемической кривой. Если доза инсулина была «приемлемой» (т.е. меньше 1,0 ЕД/кг на одну инъекцию), то ее обычно понижают на 10-25%. Если же кошка получала большую дозу инсулина (более 1,5 ЕД/кг на инъекцию), контроль гликемии надо начать заново, используя дозу инсулина, рекомендованную первоначально для снижения концентрации глюкозы (см. стр. 542). Эффективность контроля снова оценивают спустя 7-14 дней после начала введения новой дозы инсулина и корректируют ее по мере необходимости.
Продолжительность действия инсулина оценивают в тех случаях, когда минимальная концентрация глюкозы в крови превышает 80 мг/100 мл, а введение инсулина не приводит к ее быстрому снижению. Продолжительность эффекта инсулина грубо определяется как время с момента его инъекции до максимального уменьшения концентрации глюкозы и затем до ее очередного увеличения выше 250 мг/100 мл (рис. 11-15, стр. 560). Клиническая симптоматика сахарного диабета у кошек обычно сохраняется, если продолжительность действия инсулина не превышает 10 часов (см. стр. 623). Если же она больше 14 часов, а инсулин
вводится дважды в день, то могут развиться гипогликемия или феномен Сомоги (рис. 11-16, стр. 561). В случае слишком длительного или слишком короткого действия инсулина обычно приходится менять тип препарата или частоту инъекций. При назначении нового типа инсулина часто необходимо изменить и дозу гормона. Указания по изменению доз инсулина при переходе на новый препарат приводятся на стр. 560.
Воспроизводимость гликемической кривой
См. стр. 561.
Значение определения концентрации фруктозамина в сыворотке крови при стрессе у кошек с сахарным диабетом
Использование результатов определения концентрации фруктозамина в сыворотке крови для оценки качества контроля гликемии обсуждается на стр. 615. Концентрация фруктозамина не зависит от острых кратковременных подъемов уровня глюкозы в крови (Lutz et al, 1995; Crenshaw et al, 1996). В отличие от концентрации глюкозы, концентрация сывороточного фруктозамина у раздражительных или стрессированных кошек с сахарным диабетом достоверно и объективно отражает состояние гликемического контроля на протяжении двух-трех предшествовавших недель. При обследовании таких животных ветеринар должен сформулировать обоснованное предположение о возможной причине выявленного нарушения (например, неправильный выбор типа инсулина или его низкая доза) и внести соответствующие коррективы в проводимую терапию. При оценке эффективности проведенной коррекции также следует руководствоваться результатами определения концентрации сывороточного фруктозамина. Поскольку белки сыворотки имеют относительно короткий период полужизни, концентрация фруктозамина довольно быстро (в течение 2-3 недель) изменяется в ответ на изменения эффективности гликемического контроля. Быстрое изменение этого параметра способствует выявлению улучшения или ухудшения качества контроля гликемии у раздраженных, напуганных или испытывающих стрессорное воздействие кошек, у которых определение концентрации глюкозы не позволяет получить достоверную информацию. При изменении режима инсулинотерапии рекомендуется измерять концентрацию фруктозамина до и через 2-3 недели после его коррекции. Если коррекция привела к улучшению контроля гликемии, то концентрация фруктозамина должна понизиться (см. рис. 12-17). Если же она не изменилась или возросла, проводится повторная коррекция инсулинотерапии, и через 2-3 недели снова проводят контрольное определение концентрации фруктозамина.
САХАРНЫЙ ДИАБЕТ У КОШЕК • 621
ИНСУЛИНОТЕРАПИЯ ПРИ ХИРУРГИЧЕСКОЙ ОПЕРАЦИИ
Методы поддержания жизнеспособности собак и кошек с сахарным диабетом во время хирургической операции одинаковы и обсуждаются на стр. 562.
ОСЛОЖНЕНИЯ ИНСУЛИНОТЕРАПИИ
Обзор
У больных сахарным диабетом собак и кошек инсулинотерапия сопровождается сходными осложнениями (см. стр. 563), приводящими к ухудшению контроля уровня гликемии. Неудовлетворительный гликемический контроль отражает слабую компенсацию сахарного диабета, целью которой являются устранение клинических симптомов заболевания, нормализация общего состояния животного и профилактика осложнений как самого диабета, так и его терапии. Показателями плохой компенсации диабета у кошек служат устойчивые или рецидивирующие полиурия, полидипсиия и полифагия, инертность и пониженная общительность, прогрессивная потеря веса тела вплоть до истощения (исключение составляют кошки с акромегалией), прекращение ухода за шерстью, периферическая невропатия, вызывающая общую слабость, утрату прыгучести, стопохождение и атаксию, а также клинические признаки гипогликемии.
Неудовлетворительный контроль диабета обычно обусловлен одной из двух главных причин - невозможностью устранить гипергликемию или невозможностью избежать гипогликемии. Осложнения инсулинотерапии у кошек чаще всего обусловлены рецидивирующей гипогликемией, передозировкой инсулина, приводящей к развитию феномена Сомоги, неправильной оценкой гликемического контроля из-за индуцированной стрессом гипергликемии, нарушенной абсорбцией инсулина длительного действия или применением инсулина с недостаточной продолжительностью действия, а также инсулино-резистентностью, вызванной сопутствующим воспалительным и/или гормональным заболеванием (чаще всего хроническим панкреатитом). Несмотря на различия этиологии, клинических проявлений и методов лечения этих осложнений, все они имеют общий исход: явный сахарный диабет у животных и чувство разочарования и безысходности у их владельцев.
Стрессорная гипергликемия
Преходящая гипергликемия - частое явление у раздраженных, напуганных или испытывающих другие стрессорные воздействия кошек. Она развивается как следствие повышенной секреции катехоламинов, а у животных, оказывающих сопротивление при проведении ветеринарного обследования и
сопутствующих ему процедур, - как результат увеличения продукции лактата и, возможно, глюкозы в печени (Feldhahn et al, 1999; Rand et al, 2002). В типичных случаях концентрация глюкозы в плазме крови таких кошек превышает 200 - 300 мг/100 мл. Поэтому на основании только результатов измерения концентрации глюкозы этим животным может быть ошибочно поставлен диагноз сахарный диабет. Благодаря преходящему характеру индуцируемой стрессом гипергликемии она не успевает проявиться клинически, и определение концентрации глюкозы в моче обычно дает отрицательные результаты, что не соответствует диагнозу диабета.
Стрессорная гипергликемия у больных сахарным диабетом кошек характеризуется весьма значительным повышением концентрации глюкозы в плазме крови, несмотря на введение инсулина, что серьезно затрудняет точную оценку эффективности инсулинотерапии. К сожалению, серийный сбор проб крови для получения гликемической кривой оказывает сильное стрессорное воздействие на животных, особенно при частом повторении этой процедуры, как это случается, например, на протяжении первого месяца после начала лечения впервые диагностированного сахарного диабета или при неудовлетворительной компенсации заболевания. Большинство больных диабетом кошек плохо переносят частые венопункции, под воздействием которых у них в конце концов меняется характер, причем чаще всего развиваются агрессивность и стрессорная гипергликемия. Индукция гипергликемии происходит по-разному, но чаще всего она впервые появляется во время взятия проб крови, а в последующем уже в самом начале визита в клинику или госпитализации и, наконец, уже в автомашине по дороге в клинику. При этом концентрация глюкозы в крови может оставаться выше 400 мг/100 мл в течение всего дня, повышаясь еще до первой в этот день венопункции, несмотря на введение инсулина (рис. 12-20). Если ветеринар не сумеет понять, что концентрация глюкозы в крови увеличилась в результате стресса, он приходит к ошибочному заключению о неудовлетворительной компенсации диабета и неизбежно изменяет режим терапии, как правило, повышая дозу инсулина и назначая повторное взятие серии проб крови через 1-2 недели. Образуется порочный круг, и в конечном итоге развивается феномен Сомоги, появляются клинические признаки гипогликемии и дается рекомендация обследовать животное на наличие инсулинорезистентности. Неумение распознавать стрессорную гипергликемию является одной из основных причин неправильной оценки качества гликемического контроля у страдающих сахарным диабетом кошек.
Подозрение на стрессорную гипергликемию возникает в случаях явного недомогания, агрессивного поведения или сопротивления кошки при попытках ее иммобилизации и взятии крови. Тем не менее, стрессорная гипергликемия может иметь место и у таких кошек, которые легко позволяют извлечь себя
622 •
САХАРНЫЙ ДИАБЕТ У КОШЕК
500 п
О -1------1--------------1-------------1--------------1
08.00 Полдень 16.00 20.00
t
Рис. 12-20. Гликемические кривые у кота весом 5,3 кг, получавшего 2 ЕД рекомбинантного человеческого инсулина ультраленте (сплошная линия с темными кружками), через 2 недели после начала инсулинотерапии, 2 ЕД рекомбинантного человеческого инсулина ультраленте (пунктирная линия) спустя 2 месяца и 6 ЕД рекомбинантного человеческого инсулина ультраленте (сплошная линия со светлыми кружками) спустя 4 месяца. Дозу инсулина постепенно повышали, исходя из результатов анализа очередной гликемической кривой. По наблюдениям владельца животного, клинические проявления диабета были минимальными независимо от дозы инсулина, у кота сохранялся постоянный вес, а содержание гликозилированного гемоглобина при повторном определении через 4 месяца составляло 2,2%. С каждым новым поступлением в клинику животное становилось все более раздражительным и капризным, что свидетельствовало о наличии стрессорной гипергликемии и объясняло причину расхождений между концентрацией глюкозы в крови и другими показателями, использовавшимися для оценки качества контроля гликемии. Стрелкой показано время введения инсулина и кормления.
из клетки и не оказывают сопротивления во время венопункций. Такое поведение объясняется напу-ганностью животного, которое, вместо того чтобы вести себя агрессивно, забивается вглубь клетки; нередко у него расширяются зрачки, а тело становится дряблым и обвислым. Наличие стрессорной гипергликемии можно заподозрить также в тех случаях, когда оценка качества контроля гликемии на основании данных анамнестического анализа, физикального исследования и взвешивания животного не соответствует результатам прямого определения концентрации глюкозы в его крови. То же самое относится к ситуациям, при которых у кошек с нормальной концентрацией глюкозы в утренних пробах крови (т.е. 150-200 мг/100 мл) она прогрессивно увеличивается на протяжении остального дня (см. рис. 12-20). Однажды развившись, стрессорная гипергликемия приобретает устойчивый характер, и
результаты определений концентрации глюкозы в плазме крови становятся недостоверными. При подозрении на стрессорную гипергликемию вместо гликемической кривой, построенной на основании результатов серийных определений концентрации глюкозы в условиях ветеринарной клиники, следует ориентироваться на результаты аналогичных измерений, которые проводит владелец животного в более спокойной домашней обстановке (см. стр. 618), или на данные последовательного определения концентраций фруктозамина (см. стр. 620). Полученные результаты сравнивают с результатами анамнестического анализа и физикального обследования.
Гипогликемия
Гипогликемия является весьма распространенным осложнением инсулинотерапии (см. обсуждение
САХАРНЫЙ ДИАБЕТ У КОШЕК • 623
на стр. 563). У страдающих диабетом кошек симптоматическая гипогликемия чаще всего возникает после резкого и значительного повышения дозы инсулина, после неожиданного уменьшения тяжести сопутствующей инсулинорезистентности, при выраженном перекрывании действия двукратных на протяжении суток инъекций инсулина, после длительного периода пониженного аппетита и после исчезновения потребности в инсулине у получающих его животных. В этих ситуациях тяжелая гипогликемия может развиться раньше, чем диабетогенные гормоны (такие как глюкагон, кортизол, адреналин и гормон роста) компенсируют и нормализуют пониженную концентрацию глюкозы в крови. Прежде всего, необходимо отменить введение инсулина до восстановления гипергликемии, а затем возобновить его, уменьшив предшествовавшую дозу на 25-50%. Если эпизоды гипогликемии сохраняются несмотря на снижение дозы инсулина, они могут быть обусловлены слишком большой продолжительностью действия гормона либо исчезновением зависимости от него. Гипогликемия, вызванная пролонгированным действием инсулина, является результатом двукратного в течение суток введения препарата с длительностью действия значительно больше 12 часов. Таким действием могут обладать препараты ПЦИ, инсулины ультраленте и гларгин, тогда как период активности ленте и НПХ инсулинов обычно меньше (см. стр. 624).
О переходе в инсулинонезависимое состояние можно говорить в том случае, когда гипогликемия сохраняется несмотря на введение небольших количеств инсулина (т.е. 1 ЕД или менее на инъекцию) один раз в день, когда концентрация глюкозы в крови до инъекции инсулина постоянно остается ниже 150 мг/100 мл, когда концентрация фруктозамина не превышает 350 мкмоль/л (при норме 190-365 мкмоль/л) или когда определение глюкозы в моче с помощью тест-полосок постоянно дает отрицательные результаты. При инъекциях инсулинов с большой или промежуточной продолжительностью действия один или два раза в сутки очень трудно поддерживать концентрацию глюкозы в крови на уровне менее 150 мг/100 мл. Все перечисленные выше сценарии предполагают наличие в крови эндогенного инсулина, частичного (а не полного) разрушения островков поджелудочной железы и, возможно, токсичности глюкозы на момент выявления сахарного диабета (см. стр. 594) (Nelson et al, 1998). Чувствительность к инсулину повышается также при успешной коррекции сопутствующих расстройств, обнаруженных в ходе диагностики сахарного диабета. Во всех этих случаях следует прекратить инсулинотерапию и изменить рацион кошки, чтобы свести к минимуму вероятность рецидива гипергликемии (см. раздел «Диетотерапия», стр. 603). При периодических появлениях и исчезновениях гипергликемии следует оценить целесообразность назначения глипизида (см. раздел «Препараты сульфонилмочевины», стр. 606)
Передозировка инсулина и контррегуляция глюкозы (феномен Сомоги)
Феномен Сомоги обсуждается на стр. 565. Аналогичное состояние, характеризующееся значительными колебаниями концентрации глюкозы в крови, после которых на протяжении нескольких дней сохраняется устойчивая гипергликемия, встречается и у кошек с сахарным диабетом (рис. 12-21) (McMillan, Feldman, 1986). Роль контррегуляторных гормонов в развитии феномена Сомоги еще предстоит выяснить. Передозировка инсулина, вызывающая контррегуляцию глюкозы, является одной из наиболее частых причин инсулинорезистентности и неудовлетворительного контроля гликемии у кошек. Контррегуляция глюкозы индуцируется при дозах инсулина от 2 до 3 ЕД на инъекцию. По мере того как ветеринар пытается справиться с устойчивыми клиническими проявлениями заболевания и непрерывно возрастающими концентрациями глюкозы и фруктозамина, доза инсулина может быть в конце концов доведена до 10-15 ЕД на инъекцию. Если у животного периоды удовлетворительного контроля уровня гликемии на протяжении 1-2 дней сменяются периодами неудовлетворительного контроля длительностью в несколько дней, возникает подозрение на развитие инсулинорезистентности вследствие контррегуляции глюкозы. Концентрация фруктозамина при этом изменяется непредсказуемо, но обычно она выше 500 мкмоль/л. Это подтверждает плохой контроль гликемии, но не указывает на его причину. Для установления диагноза животное приходится госпитализировать на несколько дней и провести серийные определения концентрации глюкозы, что, в свою очередь, чревато развитием стрессорной гипергликемии. Мы предпочитаем альтернативный подход, состоящий в уменьшении дозы инсулина на 1-2 ЕД с оценкой клинической реакции животного его владельцем на протяжении последующих 2-5 дней. Если наблюдается ухудшение клинической симптоматики диабета, мы предпринимаем поиск иной причины резистентности к инсулину. Если же хозяин сообщает об отсутствии изменений состояния животного или улучшении симптоматики, мы рекомендуем еще больше уменьшить дозу инсулина. Еще один способ состоит в том, чтобы сразу снизить дозу инсулина до 1 ЕД на инъекцию, вводимой два раза в день.
Занижение дозы инсулина
У большинства кошек удается добиться удовлетворительной компенсации диабета введением инсулина в дозе 1 ЕД или ниже два раза в день. Неправильно подобранная доза инсулина при ее введении один раз в день является весьма распространенной причиной устойчивого характера клинических проявлений сахарного диабета. В принципе, всегда следует иметь ввиду возможность занижения дозы инсулина, если она не превышает 1 ЕД/кг веса на
624 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-21. Гликемические кривые, полученные в течение двух последовательных дней у кота весом 5,2 кг, которому подкожно вводили комбинированный препарат ПЦИ свиньи и крупного рогатого скота в дозе 4 Ед. Гликемическая кривая, полученная в первый день, характерна для феномена Сомоги, а во второй - для заниженной дозы инсулина или инсулинорезистентности. Возможно, что высвобождение диабетогенных гормонов в период гипогликемии в первый день отрицательно сказалось на эффективности действия инсулина на следующий день. Стрелкой показано время введения инсулина и кормления.
инъекцию и вводится дважды в день. При подозрении на занижение дозы ее следует постепенно, еженедельно увеличивать на 0,5-1 ЕД на инъекцию. При этом эффективность коррекции инсулинотерапии оценивают по изменению клинического состояния, отмечаемому владельцем животного, и на основании результатов измерения концентрации фруктозамина в крови или анализа гликемической кривой. Прежде чем принимать решение об увеличении дозы инсулина выше 1 ЕД/кг на инъекцию, клиницист должен исключить другие причины отсутствия эффекта инсулина и инсулинорезистентности, прежде всего феномен Сомоги и хронический панкреатит.
Кратковременный эффект инсулина
Короткая продолжительность действия инсулина (менее 10 часов) несмотря на его двукратное введение, весьма часто отмечается у кошек с сахарным диабетом, (см. стр. 567) (Moise, Reimers, 1983; Wallace et al, 1990). Обычно это наблюдается при использовании препарата НПХ и реже при использовании инсулинов ленте. У некоторых больных животных длительность действия инсулинов обоих типов не превышает 8 часов (см. табл. 12-8,
стр. 547). В результате у таких кошек ежедневно в течение нескольких часов случаются периоды выраженной гипергликемии (концентрация глюкозы в крови более 300 мг/100 мл), а их владельцы жалуются на уменьшение веса животных, устойчивую полиурию и полидипсию, а также общую слабость, обусловленную периферической нейропатией. Вывод о недостаточно продолжительном эффекте инсулина делается на основании концентрации глюкозы в крови выше 250 мг/100 мл через 6-10 часов после инъекции инсулина при ее минимальной величине более 80 мг/100 мл (см. рис. 11-16, стр. 561). Если продолжительность эффекта каждой инъекции не превышает 8 часов, то следует перейти на другой тип инсулина (например, ПЦИ, ленте или гларгин) или чаще вводить используемый препарат (например, три раза в сутки). Через 1-2 недели после коррекции оценивают эффективность гликемического контроля и, в случае необходимости, вносят дополнительные изменения в режим инсулинотерапии.
Продолжительное действие инсулина
Проблемы, связанные с чрезмерно длительным действием инсулина, обсуждаются на стр. 568. Такие проблемы возникают при введении дважды в
САХАРНЫЙ ДИАБЕТ У КОШЕК • 625
Рис. 12-22. Доза инсулина (столбики) и средняя концентрация глюкозы в крови на протяжении 12 часов после подкожного введения инсулина (кружки) у пяти кошек, получавших комбинированные препараты инсулина ультраленте крупного рогатого скота и свиньи (столбики с диагональной штриховкой и темные кружки) и инсулина ленте крупного рогатого скота и свиньи (столбики с горизонтальной штриховкой и светлые кружки).
день препаратов инсулина, действие которых превышает 12 часов (ультраленте, ПЦИ или гларгина; продолжительность действия НПХ и ленте инсулинов обычно меньше). Перекрывание эффектов последовательных инъекций инсулина, в конечном счете, приводит к клинически выраженной гипогликемии и, еще чаще, к развитию феномена Сомоги. Кошки относительно редко страдают от излишней продолжительности действия инсулина; мы наблюдали это меньше чем у 10% особей, обследованных в связи с неудовлетворительным контролем гликемии. Показателями перекрывающегося действия инъекций инсулина служат снижение концентрации глюкозы до минимальной величины через 10 часов или позднее после введения инсулина либо ее постепенное понижение на протяжении последовательных инъекций (см. рис. 11-16, стр. 561). Если возникает подозрение, что причиной неудовлетворительного контроля уровня гликемии у кошек с сахарным диабетом является слишком длительное действие инсулина, необходимо уменьшить частоту инъекций препаратов ПЦИ, ультраленте и гларгина или заменить их препаратами с меньшей продолжительностью действия, такими как НПХ или ленте инсулины для ежедневного двукратного введения.
Неадекватная абсорбция инсулина
Медленная или неадекватная абсорбция инсулина из мест его подкожного введения - весьма частое явление у кошек с сахарным диабетом, получающих инсулин ультраленте, характеризующийся медленным началом и большой продолжительностью действия (Broussard, Peterson, 1994; Bertoy et al, 1995). Примерно у 25% животных, обследованных в нашей клинике, инсулин ультраленте слишком
медленно всасывался из мест подкожного введения и потому не обеспечивал желаемого качества гликемического контроля. У этих кошек концентрация глюкозы в крови может начать снижаться только через 6-10 часов или позже после введения гормона. Еще чаще происходит лишь незначительное уменьшение концентрации глюкозы несмотря на введение инсулина в дозах 8-12 ЕД на животное через каждые 12 часов. В результате уровень глюкозы остается выше 300 мг/100 мл на протяжении большей части дня. У таких кошек мы получали хорошие результаты, переводя их с инсулина ультраленте на двукратные в течение суток инъекции инсулина ленте или ПЦИ (рис. 12-22) (Bertoy et al, 1995). Во избежание гипогликемии при замене типа инсулина дозу препарата понижают, обычно до величины, исходно использовавшейся для компенсации сахарного диабета. Продолжительность действия инсулина уменьшается по мере увеличения его активности. Это обстоятельство служит причиной недостаточной длительности терапевтического эффекта ряда препаратов и может затруднять лечение больного животного (см. рис. 11-19, стр. 568). Мы не сталкивались с такой проблемой при использовании инсулина гларгина; следует, однако, отметить, что у нас пока не велик опыт работы с этим препаратом.
Абсорбция инсулина из мест подкожного введения может ухудшаться в результате утолщения кожи или воспалительного процесса в ней, вызванного хроническими инъекциями в одну и ту же часть тела (см. раздел «Аллергические реакции на инсулин», стр. 570). Периодическая смена мест введения инсулина позволяет решить эту проблему. Редкой причиной отсутствия эффекта инсулина у больных сахарным диабетом людей является его деградация в месте подкожной локализации (Schade,
626 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Duckworth, 1986). Полагают, что абсорбции инсулина на таких участках предшествует его разрушение под воздействием местных протеаз. В результате даже после введения большого количества инсулина его концентрация в крови остается на базальном уровне. Диагностика синдрома подкожной резистентности к инсулину основывается на следующих показателях: (1) наличие резистентности к гипогликемическому действию подкожных инъекций инсулина при сохранении нормальной чувствительности к его внутривенному введению; (2) отсутствие повышения концентрации инсулина в крови после подкожных инъекций больших количеств гормона и (3) усиление деградации инсулина в подкожных тканях. Для лечения данного расстройства рекомендуется изменить способ введения инсулина либо использовать добавки, предотвращающие его ферментативную деградацию и/или ускоряющие подкожный кровоток (Freidenberg et al, 1981).
Антитела к инсулину в крови
Влияние антиинсулиновых антител на качество контроля гликемии рассматривается на стр. 568. К счастью, такие антитела нечасто образуются у кошек, получающих экзогенный человеческий инсулин, несмотря на разницу аминокислотных последовательностей этого гормона у человека и кошачьих (см. табл. 11-6, стр. 538) (Hallden et al, 1986). Как ни странно, в двух исследованиях были выявлены примерно одинаковые частота образования и титры антиинсулиновых антител в сыворотках крови кошек, получавших рекомбинантный человеческий инсулин и инсулин крупного рогатого скота (Harb-Hauser et al, 1998; Hoenig et al, 2000a). Этот результат свидетельствует о том, что конформация молекул инсулинов разного происхождения играет более важную роль в индукции образования антиинсулиновых антител, чем линейная последовательность субединиц гормона (Thomas et al, 1985 и 1988; Nell, Thomas, 1989). К счастью, титры антител к инсулину у большинства обследованных кошек были низкими, антитела редко персистировали, а их присутствие не сказывалось на эффективности контроля диабета (Harb-Hauser et al, 1998). Эти наблюдения показывают, что у кошек, получающих препараты рекомбинантного человеческого инсулина, образующиеся антитела редко оказывают такое же влияние на качество гликемического контроля, как у собак (см. стр. 568). Имеющийся у нас опыт показывает, что явная инсулинорезистентность, обусловленная присутствием антиинсулиновых антител, развивается менее чем у 5% кошек с сахарным диабетом, получающих рекомбинантный человеческий инсулин. Замена этого препарата на ПЦИ, содержащий инсулины свиньи и крупного рогатого скота, позволяет улучшить контроль гликемии, если причиной низкой эффективности инсулина являются присутствующие в крови антиин-сулиновые антитела.
Сопутствующие расстройства, вызывающие инсулинорезистентность
Определение и этиология инсулинорезистентности рассматриваются на стр. 571. О наличии инсулинорезистентности у кошек нельзя судить по их ответу на ту или иную дозу инсулина. У большинства кошек приемлемый уровень контроля гликемии достигается при введении инсулинов с большой или промежуточной продолжительностью действия в дозе <1,0 ЕД/кг веса тела дважды в день. Подозрение на инсулинорезистентность возникает, когда введение инсулина в дозах более 1,5 ЕД/кг не дает желаемого снижения гипергликемии, когда для поддержания концентрации глюкозы в крови на уровне 300 мг/100 мл приходится вводить избыточные количества гормона (т.е. более 1,5 ЕД/кг) или когда не удается добиться стабильного контроля уровня гликозы, что вынуждает еженедельно изменять дозу инсулина (см. рис. 11-23, стр. 572). Если концентрация глюкозы в крови не опускается ниже 300 мг/100 мл при ее серийном определении, это может свидетельствовать, хотя и не окончательно, о наличии инсулинорезистентности. Гликемическая кривая, характерная для животных с инсулинорезистентностью, может быть получена также при стрессорной гипергликемии или неудовлетворительной инсулинотерапии (см. раздел «Осложнения инсулинотерапии», стр. 563 и табл. 11-16, стр. 570). Кроме того, при расстройствах, вызывающих относительно слабую инсулинорезистентность, концентрация глюкозы в плазме крови может опуститься ниже 300 мг/100 мл. Концентрация фруктозамина в сыворотке у кошек с инсулинорезистентностью обычно превышает 500 мкмоль/л, а в тяжелых случаях достигает 700 мкмоль/л и более. К сожалению, высокая концентрация фруктозамина указывает всего лишь на неудовлетворительный контроль уровня гликемии и не является показателем инсулинорезистентности как таковой.
Действие инсулина у кошек зависит от многих факторов (см. табл. 11-16, стр. 570). Как показывает наш опыт, наиболее распространенными сопутствующими сахарному диабету расстройствами, влияющими на эффективность инсулинотерапии, являются тяжелая форма ожирения, акромегалия, гиперкортицизм, хронический панкреатит, недостаточность функции почек и инфекции ротовой полости. Тяжесть инсулинорезистентности отчасти определяется ее этиологией. Она может быть слабо выраженной и легко преодолеваться при повышении дозы инсулина (например, при ожирении или почечной недостаточности), но может быть очень тяжелой и приводить к устойчивой гипергликемии (при концентрации глюкозы более 400 мг/100 мл) независимо от вводимой дозы и типа инсулина, как в случаях акромегалии или гиперкортицизма. Кроме того, тяжесть инсулинорезистентности может изменяться во времени, следствием чего является нестабильный контроль гликемии (как при хроническом панкреатите). Некоторые причины инсули-
САХАРНЫЙ ДИАБЕТ У КОШЕК • 627
норезистентности вполне очевидны уже при установлении диагноза диабета, в частности, ожирение или применение лекарственных препаратов - антагонистов инсулина (например, глюкокортикоидов или мегестрола ацетата). Другие причины не столь явны, и для их выяснения приходится проводить тщательное диагностическое обследование. Важнейшее значение для диагностики сопутствующих заболеваний имеют исчерпывающий анализ анамнестических данных и тщательное физикальное исследование. Последнее позволяет выявлять расстройства или инфекционные процессы, препятствующие проявлению действия инсулина, что облегчает ветеринару дальнейшую диагностику. Если же данные анамнеза и физикального исследования не дают указания на наличие сопутствующего заболевания, то необходимо провести дополнительные скрининговые исследования: ОАК, определение биохимического профиля сыворотки и концентрации Т4 в сыворотке крови, УЗИ брюшной полости, рутинный и бактериологический анализ мочи. Объем дополнительных исследований зависит от результатов первичного скрининга (см. табл. 11-17).
Многие причины инсулинорезистентности при сахарном диабете сходны у собак и кошек; они рассматриваются на стр. 571. Заболевания, заслуживающие особого внимания у кошек, обсуждаются ниже.
Ожирение
Ожирение является одной из самых частых причин инсулинорезистентности. Взаимосвязь между ожирением, инсулинорезистентностью и развитием сахарного диабета обсуждается на стр. [543]. Ожирение вызывает сравнительно слабую инсулинорезистентность, и требуемый контроль гликемии обычно достигается простым увеличением дозы инсулина. К счастью, индуцируемая ожирением инсулинорезистентность имеет обратимый характер и устраняется после снижения веса. У отдельных кошек наблюдалось даже спонтанное исчезновение инсулинорезистентности без коррекции ожирения. Лечение ожирения рассматривается на стр. 603.
Хронический панкреатит
Смотри стр. 576.
Почечная недостаточность
Смотри стр. 576.
Бактериальные инфекции
Смотри стр. 575.
Гипертиреоз
Инсулинорезистентность была выявлена у кошек с сахарным диабетом и сопутствующим гиперти
реозом и устранялась после коррекции гипертиреоидного состояния. Предполагается несколько механизмов непереносимости углеводов при гипертиреозе. Они включают уменьшение биосинтеза и секреции инсулина, снижение сродства рецепторов инсулина к гормону, нарушение действия инсулина на пострецепторном уровне и непропорциональное усиление секреции проинсулина бета-клетками (Pedersen et al, 1988; Hoenig, Ferguson 1988; Hoenig et al, 1992). Диагностика гипертиреоза основывается на результатах анамнестического анализа, физикального исследования и определения концентрации тироксина в сыворотке, а также субъективных подозрений ветеринарного врача, базирующихся на клинических признаках. В случае необходимости дополнительно проводят определение концентрации свободного Т4 в сыворотке и сканирование с применением пертехнетата натрия (см. гл. 4). При интерпретации результатов определения концентрации Т4 следует принимать во внимание качество контроля гликемии у животного, тяжесть другого сопутствующего заболевания и возможное ингибирующее воздействие этих факторов на функцию щитовидной железы, особенно при слабом гипертиреозе. Нормальная концентрация Т4 в сыворотке, особенно соответствующая верхнему пределу нормы, не исключает гипертиреоидного состояния у кошек. Мы выявили несколько случаев инсулинорезистентности у кошек со слабо выраженным гипертиреозом при концентрации общего Т4 в сыворотке крови в диапазоне от 2,5 до 3,5 мкг/100 мл (при норме 1,0—4,0 мкг/100 мл).
Если в качестве возможной причины неудовлетворительного гликемического контроля подозревается гипертиреоз, но его диагноз под вопросом (например, минимальные клинические проявления гипертиреоза, пальпируемые узлы в щитовидной железе, концентрации общего Т4 в диапазоне 2,5-3,5 мкг/100 мл), препаратом выбора для начальной терапии является метимазол. Его начинают вводить, снизив дозу инсулина и контролируя концентрацию глюкозы в крови один раз в неделю на протяжении первого месяца лечения, чтобы избежать развития гипогликемии (рис. 12-23). В случае возникновения гипогликемии по мере устранения обусловленной гипертиреозом инсулинорезистентности может потребоваться дальнейшее уменьшение дозы инсулина.
Прогестогены
При хроническом введении прогестерона (например, в форме мегестрола ацетата) или при наличии секретирующей прогестерон опухоли коры надпочечников возможно развитие инсулинорезистентности и сахарного диабета (Boord, Griffin, 1999; Rossmeisl et al, 2000). Развитие интолерантности к углеводам под воздействием прогестерона обусловлено его внутренней антагонистичной инсулину активностью. У кошек, в отличие от собак, прогестерон не стимулирует секрецию гормона роста
628 • САХАРНЫЙ ДИАБЕТ У КОШЕК
Рис. 12-23. Гликемические кривые у кота весом 7,4 кг с сахарным диабетом и нелеченым слабо выраженным гипертиреозом, получавшего 7 ЕД комбинированного инсулина ленте свиньи и крупного рогатого скота (сплошная линия). После начала терапии метимазолом качество гликемического контроля улучшилось, а доза инсулина была понижена до 5 ЕД (пунктирная линия). Стрелкой показано время введения инсулина и кормления.
(Peterson, 1987). В то же время он вызывает синдром ломкой кожи кошачьих, который характеризуется прогрессивным усилением тяжести атрофических явлений в дермисе и эпидермисе, развитием гормонально-зависимой очаговой алопеции и частыми разрывами кожного покрова (см. рис. 7-3, стр. 383). Клинические проявления избыточной секреции прогестерона напоминают симптомы кошачьего гиперкортицизма, от которого, прежде всего, необходимо дифференцировать индуцируемую прогестероном инсулинорезистентность (см. гл. 7). У кошек с секретирующей прогестерон опухолью коры надпочечника функция гипофизарно-надпочечниковой системы остается нормальной или подавлена, а УЗИ брюшной полости не выявляет изменений размера и формы противоположной железы. Диагноз ставится на основании повышенной концентрации прогестерона в плазме крови. В большинстве коммерческих лабораторий гормонального анализа концентрация прогестерона выше 2 нг/мл считается показателем наличия секретирующей прогестерон опухоли коры надпочечника. Адреналэктомия или прекращение введения экзогенного прогестерона приводят к уменьшению его концентрации в
крови, способствуют коррекции инсулинорезистентности и улучшению компенсации сахарного диабета. При достижении концентрации прогестерона менее 1 нг/мл у кошек, у которых сохранилось достаточное количество функционально активных бета-клеток, уровень глюкозы в крови снижается и могут исчезнуть признаки инсулинозависимого сахарного диабета.
Трудно предсказать, какие из кошек, получающих прогестерон, предрасположены к развитию диабета, когда он проявится и пройдет ли после отмены прогестерона. У многих кошек, у которых диабет развился, по-видимому, уже была патология островков, снижена популяция бета-клеток и был субклинический диабет еще до начала лечения прогестероном. Развитие клинического сахарного диабета и его обратимость определяются тяжестью поражения островков поджелудочной железы во время введения прогестогенов, дозой прогестагена и длительностью лечения. Мы рекомендуем хозяевам кошек, получающих прогестогены, периодически определять глюкозу в моче их питомцев и при появлении глюкозурии прекратить давать прогестогены.
Г иперкортицизм
Гиперкортицизм редко развивается у старых кошек, его возникновение тесно связано с наличием сахарного диабета и гипофизарными макропухоля-ми, и он может служить причиной тяжелой инсулинорезистентности (Elliott et al, 2000). У кошек с гиперкортицизмом обычны клинические признаки плохо компенсированного диабета, а тяжесть инсулинорезистентности зависит от тяжести нарушения надпочечниковой функции. На ранних стадиях гиперкортицизма у кошек может сохраняться чувствительность к инсулину, хотя для адекватного контроля уровня гликемии его приходится вводить в повышенных дозах и, в конце концов, развивается тяжелая инсулинорезистентность (Duesberg et al, 1995). Необходимо дифференцировать инсулинорезистентность, обусловленную гиперкортицизмом и обусловленную акромегалией. Гиперкортицизм, в отличие от акромегалии, ослабляет организм. Он сопровождается прогрессивной потерей веса вплоть до истощения и атрофическими изменениями в дермисе и эпидермисе, результатом которых является повышенная ломкость кожи, ее истончение, появление язв и разрывов (т.е. синдром ломкой кожи кошачьих) (см. рис. 7-4, стр. 383). Большинство нарушений, выявляемых при рутинных анализах крови и мочи, характерно для сопутствующего плохо компенсированного сахарного диабета. Обычные маркеры гиперкортицизма у собак (например, повышенная активность щелочной фосфатазы и изостенурия) редко встречаются у кошек с сахарным диабетом. В зависимости от этиологии гиперкортицизма УЗИ брюшной полости выявляет либо двустороннюю адреномегалию, либо опухоль
САХАРНЫЙ ДИАБЕТ У КОШЕК • 629
надпочечника(ов). Для постановки окончательного диагноза необходимо тестирование функции системы гипофиз-кора надпочечников, определение величины отношения концентраций кортизола и креатинина в моче и проведение ингибирующей пробы с дексаметазоном. Методом выбора лечения гиперкортицизма у кошек в настоящее время является адреналэктомия. После коррекции избыточной продукции кортикостероидов уменьшается потребность в инсулине и облегчается контроль гликемии. В одном из исследований у кошек через 2-4 месяца после адреналэктомии исчезли нарушения, выявлявшиеся ранее при физикальном исследовании, а спустя 2-8 месяцев у четырех из шести кошек инсулинозависимый диабет сменился инсулинонезависимым (Duesberg et al, 1995). Более подробные сведения о гиперкортицизме у кошек изложены в гл. 7.
Акромегалия
Акромегалия - это довольно редкое заболевание старых кошек. Ее возникновение тесно связано с наличием сахарного диабета, она может вызывать тяжелую инсулинорезистентность и часто обусловлена гипофизарными макроопухолями (Peterson et al, 1990; Elliott et al, 2000). Сначала в клинической картине акромегалии у кошек преобладают признаки плохо компенсированного сахарного диабета. Конституционные изменения (см. табл. 2-14, стр. 80) на первых стадиях заболевания выражены нечетко и зачастую остаются незамеченными хозяевами животных и ветеринарами. Однако с течением времени эти изменения, обусловленные анаболическим действием хронически секретируемого инсулиноподобного фактора роста-1 (ИФР-I), начинают доминировать в клинической картине, особенно увеличение размеров тела, prognathia inferior (выступание вперед нижней челюсти) и прирост веса тела, несмотря на плохо контролируемый сахарный диабет. Параллельно развивается тяжелая инсулинорезистентность, но акромегалия, в отличие от гиперкортицизма, не сопровождается синдромом ломкой кожи кошачьих или прогрессивным снижением веса. Большинство нарушений, выявляемых во время рутинных анализов крови и мочи, обусловлено наличием сопутствующего плохо компенсированного сахарного диабета. Хотя для окончательного диагноза акромегалии необходимо установить повышенную концентрацию гормона роста (ГР) в крови, коммерческих наборов для проведения соответствующих определений у кошек не существует. По этой причине диагноз в большинстве случаев ставится на основании следующих показателей: (1) наличие конституционных изменений (увеличение размеров тела, головы и некоторых органов, выступание вперед нижней челюсти) на фоне инсулинорезистентного сахарного диабета; (2) устойчивое повышение, а не снижение, веса тела в сочетании с неудовлетворительно компенсированным сахарным диабетом; (3) повышение концентрации ИФР-I в
сыворотке крови на фоне инсулинорезистентности и характерной для акромегалии клинической симптоматики и (4) наличие опухоли гипофиза, выявленной с помощью контрастной компьютерной или магнитно-резонансной томографии. Обнаружение гипофизарной опухоли подтверждает диагноз акромегалии даже у кошек с нормальной функцией системы гипофиз-кора надпочечников.
В настоящее время акромегалию лечат кобальтовой телетерапией. Однако результат ее непредсказуем - от полного отсутствия эффекта до частичного уменьшения размера гипофизарной опухоли и/или снижения концентрации ГР в сыворотке и повышения чувствительности к инсулину или до значительного уменьшения объема опухоли, нормализации секреции ГР и исчезновения инсулинорезистентности, а у отдельных кошек восстанавливается состояние субклинического диабета. Более подробные данные об акромегалии у кошек представлены в гл. 2.
Изменения потребности в инсулине
Одним из самых неприятных моментов в ходе инсулинотерапии является неожиданная утрата контроля уровня гликемии у ранее хорошо компенсированных кошек с ИЗСД. В типичной ситуации клиническое состояние кошек удается хорошо контролировать постоянными дозами инсулина на протяжении нескольких недель или месяцев, а затем у них внезапно вновь появляются клинические симптомы сахарного диабета (полиурия, полидипсия, уменьшение веса тела, вялость и сонливость). Иногда эти расстройства не очень заметны, и увеличение дозы инсулина помогает устранить их, но лишь на короткое время (от нескольких дней до недель), но затем они проявляются вновь и снова ослабевают при дальнейшем повышении дозы инсулина. Если этот процесс прогрессирует, вводимые дозы инсулина могут в конце концов превысить 1,5-2,0 ЕД/кг на одну инъекцию, что в той или иной мере обеспечивает контроль клинических проявлений диабета, но этот контроль непостоянен и его эффективность не поддается прогнозированию, а дозу инсулина приходится постоянно менять, чтобы снова восстановить стабильный уровень гликемии. Несмотря на неудовлетворительную компенсацию сахарного диабета на протяжении нескольких недель или месяцев и постоянно повышенную концентрацию глюкозы в плазме крови, может совершенно неожиданно возникнуть гипогликемическое состояние с падением концентрации глюкозы ниже 60 мг/100 мл. У многих кошек частое обследование и взятие крови в условиях ветеринарной клиники, в конце концов, приводит к стрессорной гипергликемии, что еще больше осложняет задачу как ветеринара, так и владельца животного.
Накопленный нами опыт показывает, что наиболее вероятным объяснением неожиданной утраты контроля гликемии у кошек с ее стабильным уров
630 • САХАРНЫЙ ДИАБЕТ У КОШЕК
нем на протяжении длительного предшествовавшего периода служит развитие сопутствующего заболевания, вызывающего инсулинорезистентность. Обычно такое расстройство выражено слабо, оно либо спонтанно исчезает, либо его тяжесть со временем изменяется. Чаще всего это воспалительные заболевания, например, слабый хронический панкреатит, которые обычно остаются незамеченными ни ветеринаром, ни владельцем животного. У кошек, получающих фиксированную дозу инсулина, возникновение инсулинорезистентности приводит к гипергликемии и возобновлению клинических симптомов сахарного диабета. Повышение дозы инсулина улучшает гликемический контроль, поскольку тяжесть инсулинорезистентности еще невелика, но по мере ее усиления для нормализации уровня глюкозы требуются все более и более высокие дозы инсулина. Однако если инсулинорезистентность ослабевает либо полностью исчезает, то появляется неожиданная опасность развития у кошки симптоматической гипогликемии или, чаще, феномена Сомоги, который закрепляет неудовлетворительный контроль диабетического состояния. По сути дела, происходит следующее: инсулинорезистентность, однажды появившись, приводит к утрате контроля гликемии, что приобретает необратимый характер из-за феномена Сомоги, возникшего, в свою очередь, в результате передозировки инсулина как раз в то время, когда начала уменьшаться тяжесть воспалительного процесса и инсулинорезистентности. Таким образом, в случае неожиданного появления клинических симптомов сахарного диабета у кошек с хорошей компенсацией диабета в предшествовавшем периоде следует внимательно проанализировать анамнестические данные, результаты физикального исследования и гликемическую кривую, а также (по показаниям) провести диагностическое исследование с целью выявления сопутствующих расстройств, вызывающих инсулинорезистентность (см. табл. 11-6, стр. 573). Во всех случаях, когда тщательное диагностическое обследование кошки не позволило установить причину неожиданного ухудшения гликемического контроля, особенно если этому предшествовало произвольное увеличение доз инсулина, следует иметь в виду возможность развития феномена Сомоги.
ХРОНИЧЕСКИЕ ОСЛОЖНЕНИЯ САХАРНОГО ДИАБЕТА
У кошек с сахарным диабетом нередки осложнения как самого заболевания (например, периферическая нейропатия), так и его терапии (индуцированная инсулином гипогликемия) (см. табл. 11-7, стр. 538). Чаще всего приходится иметь дело с гипогликемией, хроническим панкреатитом, потерей веса, прекращением ухода за шерстью (что делает ее сухой, тусклой и неухоженной), и периферической невропатией задних конечностей, которая проявляется в форме мышечной слабости, утраты прыгучести,
стопохождении и атаксии. Кроме того, у кошек повышен риск возникновения кетоацидоза. Большинство серьезных осложнений сахарного диабета у человека, таких как нефропатия, ангиопатия, ишемическая болезнь сердца, развиваются на протяжении 10-20 лет и более, поэтому они редко встречаются у кошек. Сахарный диабет - это болезнь старых кошек, многие из которых не проживают и 5 лет после установления диагноза (Goossens et al, 1998). Наш опыт показывает, что владельцы таких животных обычно «берутся» ухаживать за своими питомцами, как только перестают опасаться появления хронических осложнений, сопровождающих сахарный диабет у человека. Предполагаемые патогенетические механизмы развития отдаленных осложнений сахарного диабета рассматриваются на стр. 578.
Многие хронические осложнения сахарного диабета у собак и кошек сходны и обсуждаются на стр. 578. У кошек особого внимания заслуживает диабетическая невропатия, которой посвящен следующий раздел.
Диабетическая невропатия
Это одно из наиболее распространенных хронических осложнений диабета у кошек; при ИЗСД его частота приближается к 10%. Клинические проявления сопутствующей сахарному диабету невропатии включают слабость задних конечностей, уменьшение прыгучести, стопохождение (касание пола или земли скакательными суставами при ходьбе, см. рис. 12-9), мышечную атрофию, особенно в дистальной части задних конечностей, нарушение реакции в ортостатической пробе, повышенную раздражимость при манипуляциях на задних конечностях и стопах (Kramek et al, 1984; Mizisin et al, 2002). Тяжесть клинической симптоматики может усиливаться, вплоть до появления нарушений в передних конечностях. Электрофизиологическое исследование выявляет демиелинизацию на всех уровнях моторных и сенсорных периферических нервов; к тому же и в передних, и в задних конечностях уменьшается скорость проводимости этих нервов и амплитуда мышечных потенциалов действия (Mizisin et al, 1998 и 2002). Чем выше тяжесть клинических проявлений невропатии, тем ниже скорость проводимости моторных и сенсорных нервов и амплитуда мышечных потенциалов действия. При этом скорость проводимости сенсорных нервов понижается в меньшей степени, чем моторных, а нарушения в передних конечностях в целом слабее, чем в задних. Элекгромиографичес-кое исследование обычно не выявляет серьезных отклонений, а если выявляет, то они свидетельствуют о денервации. Наиболее выраженным гистологическим изменением в биоптатах нервной ткани является поражение шванновских клеток в форме увеличения их объема, расщепления миелина и, в конечном итоге, демиелинизации (Mizisin et al,
САХАРНЫЙ ДИАБЕТ У КОШЕК • 631
2002). Полагают, что демиелинизация имеет место на всем протяжении периферической моторно-двигательной нервной оси и служит причиной ранних проявлений диабетической невропатии. В наиболее тяжелых случаях у кошек происходит дегенерация аксонов, сопровождающаяся уменьшением средней плотности миелиновых нервных волокон, морфологическими признаками утраты волокон в биоптатах нервной ткани и умеренной денервацией в мышечной ткани. Вероятно, ранние проявления диабетической невропатии, обусловленные поражением шванновских клеток и демиелинизацией (мышечная слабость, уменьшение прыгучести), предшествуют более серьезным нарушениям, связанным с дегенерацией аксонов (полное стопохождение).
Причина развития диабетической невропатии неизвестна. Для объяснения происхождения этого расстройства у человека предложены васкулярная, аксональная и метаболическая гипотезы (Unger, Foster, 1998). Согласно первой из них, самым ранним дефектом является уменьшение кровоснабжения нервов, приводящее к ишемии и гипоксии нервной ткани (Asbury, 1988; Stevens et al, 1995; Ward, 1995). Аксональная гипотеза постулирует ранние функциональные изменения, такие как замедление транспорта по аксонам, которые сопровождаются их структурной дегенерацией. Возможные метаболические расстройства, приводящие к развитию невропатии, включают: усиление обмена глюкозы по полиольному пути, в результате чего в шванновских клетках и аксонах накапливаются избыточные количества сорбитола и фруктозы и уменьшается содержание миоинозитола (Winegard, 1986; Greene et al, 1988a); гликозилирование структурных белков миелина и тубулина и усиленное образование гликозилированных конечных продуктов (Unger, Foster, 1998); уменьшение активности №+-К+-АТФазы (Scarpini et al, 1993); окислительный стресс вследствие увеличения образования свободных радикалов и/или нарушения действия антиоксидантов (Low et al, 1997) либо индуцированная недостаточность ростовых факторов (Thomas, 1994; Zhuang et al, 1996).
Изменение полиольного обмена может играть роль в развитии диабетической невропатии у кошек. Полиольный механизм включает две последовательные реакции: сначала глюкоза восстанавливается альдозоредуктазой до сорбитола, а затем сорбитол окисляется сорбитолдегидрогеназой до фруктозы. Альдозоредуктаза присутствует в сетчатке, хрусталике, шванновских клетках и почечных сосочках, а накопление полиолов (в частности, сорбитола) может служить одним из патогенетических механизмов катаракты (см. стр. 579), ретинопатии, нефропатии и невропатии (Greene et al, 1988b; Unger, Foster, 1998). Недавно было показано, что у кошек тяжесть диабетической невропатии и электрофизиологических расстройств в наибольшей степени зависит от концентрации глюкозы в плазме крови, что количество воды в нервной тка
ни при диабете значительно выше, чем у здоровых животных, и что содержание глюкозы и фруктозы в нервах соответственно в 8 и 12 раз выше нормы (Mizisin et al, 2002). Сорбитол не был обнаружен в нервной ткани здоровых кошек и был выявлен в небольших количествах у шести из 19 обследованных кошек с сахарным диабетом. Содержание миоинозитола в нервной ткани больных диабетом кошек не превышало 80% его содержания у здоровых животных. Эти наблюдения свидетельствуют об активизации полиольного обмена. Тот факт, что при диабетической невропатии в нервах кошек возрастает содержание глюкозы и фруктозы в отсутствие накопления сорбитола, свидетельствует о повышении активности сорбитолдегидрогеназы при сахарном диабете. Он подтверждает, что нарушение нервной функции у кошек с диабетом обусловлено не столько накоплением полиолов как таковым, сколько последствиями изменений их обмена (Mizisin et al, 2002). Активация полиольного обмена под воздействием гипергликемии сопровождается уменьшением количества миоинозитола - предшественника полифосфоинозитидов, которые являются важными компонентами клеточной мембраны (рис. 12-24) (Winegard, 1986; Greene et al, 1988a и 1988b). Миоинозитол служит также ключевым фактором разнообразной функциональной активности нервных клеток, а понижение его содержания коррелирует с уменьшением скорости нервной проводимости (Forcier et al, 1991; Mizisin, Calcutt, 1991). Для выяснения роли других обменных расстройств, например гликозилирования миелина, в патогенезе диабетической невропатии у кошек необходимы дополнительные исследования.
Гипергликемия
1
Увеличение содержания сорбитола и фруктозы
I
Уменьшение содержания миоинозитола в шванновских клетках и аксонах
I
Угнетение превращения фосфоинозитола
I
Уменьшение активности Ма*-К*-АТФазы
I
Нарушение энергетического обмена
I
Нарушение нервной функции
I
Структурные изменения в нервах
Рис. 12-24. Возможный механизм развития периферической невропатии у кошек с сахарным диабетом, включающий стимуляцию полиольного пути в условиях гипергликемии. Усиление продукции полиолов приводит к уменьшению содержания миоинозитола в мышечной ткани, нарушению нервной функции и, в конечном итоге, к структурным изменениям в нервах.
632
САХАРНЫЙ ДИАБЕТ У КОШЕК
В настоящее время нет методов специфической терапии диабетической невропатии у кошек. Тщательный контроль уровня гликемии снижает риск развития этого осложнения и уменьшает его клинические проявления у человека (Diabetes Control and Complications Trial Research Group [Исследовательская группа по контролю диабета и его осложнений], 1993). Интенсивная инсулинотерапия помогает также повысить нервную проводимость и устранить слабость задних конечностей и стопохождение у кошек с сахарным диабетом (см. рис. 12-9) (Kennedy et al, 1990). Следует, однако, помнить, что отдельные особи по-разному реагируют на интенсивную инсулинотерапию, которая, к тому же, создает повышенный риск гипогликемии. В целом, чем больше продолжительность и тяжесть невропатии, тем меньше вероятность успешного устранения ее симптоматики путем улучшения гликемического контроля. Результаты последнего исследования (Mizisin et al, 2002) позволяют предполагать, что лечение диабетической невропатии у кошек ингибиторами альдозоредуктазы может давать хорошие результаты и заслуживает дальнейшего изучения.
ПРОГНОЗ
Прогноз сахарного диабета у кошек отчасти зависит от готовности и способности владельца проводить необходимые лечебные мероприятия, простоты достижения адекватного гликемического контроля, наличия и природы сопутствующих заболеваний (например, панкреатита или акромегалии) и возможности предотвратить развитие хронических осложнений, обусловленных диабетом (см. табл. 11-7, стр. 538). В целом, долгосрочный прогноз сахарного диабета у кошек осторожный. В ретроспективном исследовании 53 из 92 кошек с диабетом погибли через 0-84 месяца после установления диагноза (Goossens et al, 1998). Средний срок выживания и его медиана у этих 53 животных составляли соответственно 25 и 17 месяцев. Одиннадцать животных погибли во время первой госпитализации в результате тяжелого кетоацидоза и сопутствующего заболевания (в частности, почечной недостаточности), 39 кошек оставались живыми на протяжении от 2 до 66 (в среднем 23) месяцев после установления диагноза. Данные о сроках выживания могут вводить в заблуждение, поскольку на момент установления диагноза возраст кошек обычно составляет от 8 до 12 лет, а их смертность в последующие 6 месяцев достаточно высока из-за сопутствующих, угрожающих жизни и неконтролируемых заболеваний (таких как кетоацидоз, острый панкреатит, почечная недостаточность или гиперкортицизм). Как показывает наш опыт, у кошек, выживших в течение первых 6 месяцев после выявления сахарного диабета, хорошее качество жизни сохраняется более 5 лет несмотря на заболевание.
ЛИТЕРАТУРА
Anderson RW: Chromium, glucose tolerance, and diabetes. Biol Tr Elem Res 32:19, 1992.
Appleton DJ, et al: Plasma leptin concentrations in cats: reference range, effect of weight gain and relationship with adiposity as measured by dual energy x-ray absorptiometry. J Fel Med Surg 2:191, 2000.
Appleton DJ, et al: Insulin sensitivity decreases with obesity, and lean cats with low insulin sensitivity are at greatest risk of glucose intolerance with weight gain. J Fel Med Surg 3:211, 2001.
Appleton DJ, et al: Plasma leptin concentrations are independently associated with insulin sensitivity in lean and overweight cats. J Fel Med Surg 4:83, 2002a.
Appleton DJ, et al: Dietary chromium tripicolihate supplementation reduces glucose concentrations and improves glucose tolerance in normal-weight cats. J Fel Med Surg 4:13, 2002b.
Asbury AK: Understanding diabetic neuropathy N Engl J Med 319:577, 1988.
Backus RC: Relationship between serum leptin immunoreactivity and body fat mass as estimated by use of a novel gas-phase Fourier transform infrared spectroscopy deuterium dilution method in cats. Am J Vet Res 61:796, 2000.
Bailey CJ, Turner RC: Metformin. N Engl J Med 334:574, 1996.
Bailey TS, Mezitis NHE: Combination therapy with insulin and sulfonylureas for type 2 diabetes. Diabetes Care 13:687, 1990.
Bennett N, et al: Comparison of a low carbohydrate versus high fiber diet in cats with diabetes mellitus. J Vet Intern Med 15:297, 2001 (abstract).
Berg AH, et al: The adipocyte-secreted protein АсгрЗО enhances hepatic insulin action. Nat Med 7:947, 2001.
Berger J, et al: Thiazolidinediones produce a conformational change in paroxysmal proliferator-activated receptor-8 binding and activation correlated with antidiabetic actions in db/db mice. Endocrinology 137:4189, 1996.
Bertoy EH, et al: Treatment of diabetes mellitus with Lente insulin in 12 cats. J Am Vet Med Assoc 206:1729, 1995.
Biourge V, et al: Effect of weight gain and subsequent weight loss on glucose tolerance and insulin response in healthy cats. J Vet Intern Med 11:86, 1997.
Birkeland KI, etal: Long-term, randomized, placebo-controlled, double-blind therapeutic comparison of glipizide and glyburide. Diabetes Care 17:45, 1994.
Boord M, Griffin C: Progesterone secreting adrenal mass in a cat with clinical signs of hyperadrenocorticism. J Am Vet Med Assoc 214:666, 1999.
Brichard SM, Henquin J: The role of vanadium in the management of diabetes. Trends Pharmacol Sci 16:265, 1995.
Brichard SM, et al: Long-term improvement of glucose homeostasis by vanadate in obese hyperinsulinemic fa/fa rats. Endocrinology 125:2510, 1989.
Broussard JD, Peterson ME: Comparison of two Ultralente insulin preparations with protamine zinc insulin in clinically normal cats. Am J Vet Res 55:127, 1994.
Butterwick RF, et al: Influence of age and sex on plasma lipid and lipoprotein concentrations and associated enzyme activities in cats. Am J Vet Res 62:331, 2001.
Christopher MM, et al: Heinz body formation associated with ketoacidosis in diabetic cats. J Vet Intern Med 9:24, 1995.
Cohn LA, et al: Effects of chromium supplementation on glucose tolerance in obese and nonobese cats. Am J Vet Res 60:1360, 1999.
Cohen N, et al: Oral vanadyl sulfate improves hepatic and peripheral insulin sensitivity in patients with non-insulin-dependent diabetes mellitus. J Clin Invest 95:2501, 1995.
Crenshaw KL, et al: Serum fructosamine concentration as an index of glycemia in cats with diabetes mellitus and stress hyperglycemia. J Vet Intern Med 10:360, 1996.
Damsbo P, et al: A double-blind, randomized comparison of meal-related glycemic control by Repaglinide and glyburide in well-controlled type 2 diabetic patients. Diabetes Care 22:789, 1999.
DeFronzo RA: Pharmacologic therapy for type 2 diabetes mellitus. Ann Intern Med 131:281, 1999.
DeFronzo RA, Goodman AM: Efficacy of metformin in patients with noninsulin-dependent diabetes mellitus. The Multicenter Metformin Study Group. N Engl J Med 333:541, 1995.
Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 329:977, 1993.
Duesberg CA, et al: Adrenalectomy for treatment of hyperadrenocorticism in cats: ten cases (1988-1992). J Am Vet Med Assoc 207:1066, 1995.
Elliott DA: Disorders of metabolism, /n Nelson RW, Couto CG (eds): Small Animal Internal Medicine, 3rd ed. St’Louis, Mosby, 2003, p 816.
Elliott DA, et al: Glycosylated hemoglobin concentration for assessment of glycemic control in diabetic cats. J Vet Intern Med 11:161, 1997.
Elliott DA, et al: Comparison of serum fructosamine and blood glycosylated hemoglobin concentrations for assessment of glycemic control in cats with diabetes mellitus. J Am Vet Med Assoc 214:1794, 1999.
Elliott DA, et al: Prevalence of pituitary tumors among diabetic cats with insulin resistance. J Am Vet Med Assoc 216:1765, 2000.
Fajans SS, Brown MB: Administration of sulfonylureas can increase glucosein-duced insulin secretion for decades in patients with maturity-onset diabetes of the young. Diabetes Care 16:1254, 1993.
сахарный диабет у кошек
633
Feldhahn JR, et al: The effect of interday variation and a short-term stressor on insulin sensitivity in clinically normal cats. J Fel Med Surg 1:233, 1999.
Feldman EC, et al: Intensive 50-week evaluation of glipizide administration in 50 cats with previously untreated diabetes mellitus. J Am Vet Med Assoc 210:772, 1997.
Fettman MJ, et al: Effects of weight gain and loss on metabolic rate, glucose tolerance, and serum lipids in domestic cats. Res Vet Sci 64:11, 1998.
Fondacaro JV, et al: Treatment of feline diabetes mellitus with protamine zinc analine insulin (PZI) alone compared with PZI and oral vanadium dipicolinate. J Vet Intern Med 13:244, 1999 (abstract).
Forcier NJ, et al: Cellular pathology of the nerve microenvironment in galactose intoxication. J Neuropathol Exp Neurol 50:235, 1991.
Frank G, et al: Use of a high-protein diet in the management of feline diabetes mellitus. Vet Therapeutics 2:238, 2001.
Freidenberg GR, et al: Diabetes responsive to intravenous but not subcutaneous insulin: effectiveness of aprotinin. N Engl J Med 305:363, 1981.
Fruebis J, et al: Proteolytic cleavage product of 30 kDa adipocyte comple-mentrelated protein increases fatty acid oxidation in muscle and causes weight loss in mice. Proc Natl Acad Sci USA 98:2005, 2001.
Gedulin BR, et al: Dose-response for glucagonostatic effect of amylin in rats. Metabolism 46:67, 1997.
Gerhardt A, et al: Comparison of the sensitivity of different diagnostic tests for pancreatitis in cats. J Vet Intern Med 15:329, 2001.
Gerich JE: Oral hypoglycemic agents. N Engl J Med 321:1231, 1989.
Gitlin N, et al: Two cases of severe clinical and histologic hepatotoxicity associated with troglitazone. Ann Intern Med 129:36, 1998.
Goldfine AB, et al: In vivo and in vitro studies of vanadate in human and rodent diabetes mellitus. Mol Cell Biochem 153:217, 1995.
Goossens MMC, et al: Response to insulin treatment and survival in 104 cats with diabetes mellitus (1985-1995). J Vet Intern Med 12:1, 1998.
Greco DS: Treatment of non-insulin-dependent diabetes mellitus in cats using oral hypoglycemic agents. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p 350.
Greene DA, et al: Pathogenesis and prevention of diabetic neuropathy. Diabetes Metab Rev 4:201, 1988a.
Greene DA, et al: Are disturbances of sorbitol, phosphoinositide, and Na*-K*-ATPase regulation involved in pathogenesis of diabetic neuropathy? Diabetes 37:688, 1988b.
Groop LC: Sulfonylureas in NIDDM. Diabetes Care 15:737, 1992.
Grossman S, Lessem J: Mechanisms and clinical effects of thiazolidinediones. Exp Opin Invest Drugs 6:1025, 1997.
Hallden G, et al: Characterization of cat insulin. Arch Biochem Biophys 247:20, 1986.
Harb-Hauser M, et al: Prevalence of insulin antibodies in diabetic cats. J Vet Intern Med 12:245, 1998 (abstract).
Hasegawa S, et al: Glycated hemoglobin fractions in normal and diabetic cats measured by high-performance liquid chromatography. J Vet Med Sci 54:789, 1992.
Havel PJ: Role of adipose tissue in body weight regulation: mechanisms regulating leptin production and energy balance. Proc Nutri Soc 59:359,2000.
Havel PJ: Peripheral signals conveying metabolic information to the brain: short-term and long-term regulation of food intake and energy homeostasis. Exp Biol Med 226:963, 2001.
Havel PJ: Control of energy homeostasis and insulin action by adipocyte hormones: leptin, acylation stimulating protein, and adiponectin. Curr Opin Lipidol 13:51, 2002.
Hiddinga HJ, Eberhardt NL: Intracellular amyloidogenesis by human islet amyloid polypeptide induces apoptosis in COS-1 cells. Am J Pathol 154:1077, 1999.
Hoenig M, Ferguson DC: Impairment of glucose tolerance in hyperthyroid cats. J Endocrinol 121:249, 1988.
Hoenig M, Ferguson DC: Diagnostic utility of glycosylated hemoglobin concentrations in the cat. Domest Anim Endocrinol 16:11, 1999.
Hoenig M, et al: Glucose tolerance and insulin secretion in spontaneously hyperthyroid cats. Res Vet Sci 53:338, 1992.
Hoenig M, et al: Beta cell and insulin antibodies in treated and untreated diabetic cats. Vet Immunol Immunopathol 77:93, 2000a.
Hoenig M, et al: A feline model of experimentally induced islet amyloidosis. Am J Pathol 157:2143, 2000b.
Hotta K, et al: Circulating concentrations of the adipocyte protein adiponectin are decreased in parallel with reduced insulin sensitivity during the progression to type 2 diabetes in rhesus monkeys. Diabetes 50:1126, 2001.
Jaber LA, et al: An evaluation of the therapeutic effects and dosage equivalents of glyburide and glipizide. J Clin Pharmacol 30:181, 1990.
Jain NC: Erythrocyte physiology and changes in disease. In Jain NC (ed): Essentials of Veterinary Hematology. Philadelphia, WB Saunders, 1993, pl33.
Johnson KH, et al: Itnmunolocalization of islet amyloid polypeptide (IAPP) in pancreatic beta cells using peroxidase antiperoxidase (PAP) and protein A gold techniques. Am J Pathol 130:1, 1988.
Johnson KH, et al: Islet amyloid, islet amyloid polypeptide, and diabetes mellitus. N Engl J Med 321:513, 1989.
Johnson KH, et al: The putative hormone islet amyloid polypeptide (IAPP) induces impaired glucose tolerance in cats. Biochem Biophys Res Commun 167:507, 1990.
Kassir AA, et al: Lack of effect of islet amyloid polypeptide in causing insulin resistance in. conscious dogs during euglycemic clamp studies. Diabetes 40:998, 1991.
Kawamoto M, et al: Relation of fructosamine to serum protein, albumin, and glucose concentrations in healthy and diabetic dogs. Am J Vet Res 53:851, 1992.
Kennedy WR, et al: Effects of pancreatic transplantation on diabetic neuropathy. N Engl J Med 322:1031, 1990.
Kirk CA, et al: Diagnosis of naturally acquired type 1 and type 2 diabetes mellitus in cats. Am J Vet Res 54:463, 1993.
Kramek BA, et al: Neuropathy associated with diabetes mellitus in the cat. J Am Vet Med Assoc 184:42, 1984.
Leahy JL: Natural history of В-cell dysfunction in NIDDM. Diabetes Care 13:992, 1990.
Lebovitz HE: Oral hypoglycemic agents. In Rifkin H, Porte D (eds): Ellenberg and Rifkin’s Diabetes Mellitus: Theory and Practice, 4th ed. New York, Elsevier, 1990, p 554.
Lebovitz HE, Pasmantier RM: Combination insulin-sulfonylurea therapy. Diabetes Care 13:667, 1990.
Lorenzo A, et al: Pancreatic islet cell toxicity of amylin associated with type 2 diabetes mellitus. Nature 368:756, 1994.
Low PA, et al: The roles of oxidative stress and antioxidant treatment in experimental diabetic neuropathy. Diabetes 46(suppl 2):S38, 1997.
Lutz TA, Rand JS: Comparison of five commercial radioimmunoassay kits for the measurement of feline insulin. Res Vet Sci 55:64, 1993.
Lutz TA, Rand JS: Plasma amylin and insulin concentrations in normoglycemic and hyperglycemic cats. Can Vet J 37:27, 1996.
Lutz TA, et al: Frequency of pancreatic amyloid deposition in cats from southeastern Queensland. Aust Vet J 71:254, 1994.
Lutz TA, et al: Fructosamine concentrations in hyperglycemic cats. Can Vet J 36:155, 1995.
Marshall RD, Rand JS: Comparison of the pharmacokinetics and pharmacodynamics of glargine, protamine zinc, and porcine Lente insulins in normal cats. J Vet Intern Med 16:358, 2002 (abstract).
Massillon D, et al: Induction of hepatic glucose-6-phosphatase gene expression by lipid infusion. Diabetes 46:153, 1997.
Mazzaferro EM: Treatment of feline diabetes mellitus with a high protein diet and acarbose. J Vet Intern Med 14:345, 2000 (abstract).
McMillan FD, Feldman EC: Rebound hyperglycemia following overdosing of insulin in cats with diabetes mellitus. J Am Vet Med Assoc 188:1426, 1986.
Michels GM, et al: Pharmacokinetics of the antihyperglycemic agent metformin in cats. Am J Vet Res 60:738, 1999.
Michels GM, et al: Pharmacokinetics of the insulin-sensitizing agent troglitazone in cats. Am J Vet Res 61:775, 2000.
Miller AB, et al: Effect of glipizide on serum insulin and glucose concentrations in healthy cats. Res Vet Sci 52:177, 1992.
Mizisin AP, Calcutt NA: Dose-dependent alterations in nerve polyols and (Na*-K*)-ATP’ase activity in galactose intoxication. Clin Exp Metab 40:1207, 1991.
Mizisin AP, et al: Myelin splitting, Schwann cell injury, and demyelination in feline diabetic neuropathy. Acta Neuropathol 95:171, 1998.
Mizisin AP, et al: Neurological complications associated with spontaneously occurring feline diabetes mellitus. J Neuropathol Exp Neurol 61:872, 2002.
Moise NS, Reimers TJ: Insulin therapy in cats with diabetes mellitus. J Am Vet Med Assoc 182:158, 1983.
Morris JG: Idiosyncratic nutrient requirements of cats appear to be dietin-duced evolutionary adaptations. Nutr Res Rev 15:153, 2002.
Moses R, et al: Effect of Repaglinide addition to metformin monotherapy on glycemic control in patients with type 2 diabetes. Diabetes Care 22:119, 1999.
Nakayama H, et al: Pathological observations in six cases of feline diabetes mellitus. Jpn J Vet Sci 52:819, 1990.
Nell LJ, Thomas JW: Human insulin autoantibody fine specificity and H and L chain use. J Immunol 142:3063, 1989.
Nelson RW, et al: Glucose tolerance and insulin response in normal weight and obese cats. Am J Vet Res 51:1357, 1990.
Nelson RW, et al: Effect of an orally administered sulfonylurea, glipizide, for treatment of diabetes mellitus in cats. J Am Vet Med Assoc 203:821, 1993.
Nelson RW, et al: Transient clinical diabetes mellitus in cats: 10 cases (1989-1991). J Vet Intern Med 13:28, 1998.
Nelson RW, et al: Effect of dietary insoluble fiber on control of glycemia in cats with naturally acquired diabetes mellitus. J Am Vet Med Assoc 216:1082, 2000.
Nelson RW, et al: Efficacy of protamine zinc insulin for treatment of diabetes mellitus in cats. J Am Vet Med Assoc 218:38, 2001.
Nelson RW, et al: Evaluation of the oral antihyperglycemic drug metformin in normal and diabetic cats. J Vet Intern Med (in press).
O'Brien TD, et al: Immunohistochemical morphometry of pancreatic endocrine cells in diabetic, normoglycaemic, glucose-intolerant, and normal cats. J Comp Pathol 96:357, 1986.
O’Brien TD, et al: Intracellular amyloid associated with cytotoxicity in COS-1 cells expressing human islet amyloid polypeptide. Am J Pathol 147:609, 1995.
Panciera DL, et al: Epizootiologic patterns of diabetes mellitus in cats: 333 cases (1980-1986). J Am Vet Med Assoc 197:1504, 1990.
634
САХАРНЫЙ диабет у кошек
Patel J, et al: BRL 49653 (a thiazolidinedione) improves glycemic control in NIDDM patients. Diabetes 46:150A, 1997 (abstract).
Pedersen 0, et al: Characterization of the insulin resistance of glucose utilization in adipocytes from patients with hyper- and hypothyroidism. Acta Endocrinol 119:228, 1988.
Peterson ME: Effects of megestrol acetate on glucose tolerance and growth hormone secretion in the cat. Res Vet Sci 42:354, 1987.
Peterson ME, et al: Acromegaly in 14 cats. J Vet Intern Med 4:192, 1990.
Plier ML, et al: Serum fructosamine concentration in nondiabetic and diabetic cats. Vet Clin Pathol 27:34, 1998.
Plosker GL, Faulds D: Troglitazone: a review of its use in the management of type 2 diabetes mellitus. Drugs 57:409, 1999.
Plotnick AN, et al: Oral vanadium compounds: preliminary studies on toxicity in normal cats and hypoglycemic potential in diabetic cats. J Vet Intern Med 9:181, 1995 (abstract).
Rand JS, et al: Overrepresentation of Burmese cats with diabetes mellitus. Aust Vet J 75:402, 1997.
Rand JS, et al: Acute stress hyperglycemia in cats is associated with struggling and increased concentrations of lactate and norepinephrine. J Vet Intern Med 16:1213, 2002.
Reusch CE, Haberer B: Evaluation of fructosamine in dogs and cats with hypo-or hyperproteinaemia, azotaemia, hyperlipidaemia, and hyper- bilirubi-naemia. Vet Rec 148:370, 2001.
Reusch CE, et al: Fructosamine: a new parameter for diagnosis and metabolic control in diabetic dogs and cats. J Vet Intern Med 7:177, 1993.
Roden M, et al: Mechanism of free fatty acid-induced insulin resistance in humans. J Clin Invest 97:2859, 1996.
Rosenstock J, et al: Basal insulin glargine (HOE901) versus NPH insulin in patients with type 1 diabetes on multiple daily insulin regimens. Diabetes Care 23:1137, 2000.
Rosenstock J, et al: Basal insulin therapy in type 2 diabetes: 28-week comparison of insulin glargine (HOE901) and NPH insulin. Diabetes Care 24:631, 2001.
Rossetti L, et al: Glucose toxicity. Diabetes Care 13:610, 1990.
Rossmeisl JH, et al: Hyperadrenocorticism and hyperprogesteronemia in a cat with an adrenocortical adenocarcinoma. J Am Anim Hosp Assoc 36:512, 2000.
Sagawa MM, et al: Correlation between plasma leptin concentration and body fat content in dogs. Am J Vet Res 63:7, 2002.
Sambol NC, et al: Pharmacokinetics and pharmacodynamics of metformin in healthy subjects and patients with non-insulin-dependent diabetes mellitus. J Clin Pharmacol 36:1012, 1996.
Scarlett JM, Donoghue S: Associations between body condition and disease in cats. J Am Vet Med Assoc 212:1725, 1998.
Scarpini E, et al: Decrease of nerve Naf),KC)-ATPase activity in the pathogenesis of human diabetic neuropathy. J Neurol Sci 120:159, 1993.
Schachter S, et al: Oral chromium picolinate and control of glycemia in insulin-treated diabetic dogs. J Vet Intern Med 15:379, 2001.
Schade DS, Duckworth WC: In search of the subcutaneous insulin resistance syndrome. N Engl J Med 315:147, 1986.
Segal KR, et al: Relationship between insulin sensitivity and plasma leptin concentration in lean and obese men. Diabetes 45:988, 1996.
Sheen AJ: Clinical pharmacokinetics of metformin. Clin Pharmacol 30:359, 1996.
Steiner JM, Williams DA: Serum feline trypsin-like immunoreactivity in cats with exocrine pancreatic insufficiency. J Vet Intern Med 14:627, 2000.
Stevens MJ, et al: The aetiology of diabetic neuropathy: the combined roles of metabolic and vascular defects. Diabet Med 12:566, 1995.
Striffler JS, et al: Chromium improves insulin response to glucose in rats. Metabolism 44:1314, 1995.
Swift NC, et al: Evaluation of serum feline trypsin-like immunoreactivity for the diagnosis of pancreatitis in cats. J Am Vet Med Assoc 217:37, 2000.
Thomas JW, et al: Heterogeneity and specificity of human anti-insulin antibodies determined by isoelectric focusing. J Immunol 134:1048, 1985.
Thomas JW, et al: Spectrotypic analysis of antibodies to insulin A and В chains. Mol Immunol 25:173, 1988.
Thomas PK: Growth factors and diabetic neuropathy. Diabet Med 11:732, 1994.
Thompson MD, et al: Comparison of glucose concentrations in blood samples obtained with a marginal ear vein nick technique versus from a peripheral vein in healthy cats and cats with diabetes mellitus. J Am Vet Med Assoc 221:389,2002.
Truglia JA, et al: Insulin resistance: receptor and postbinding defects in human obesity and non-insulin-dependent diabetes mellitus. Am J Med 979(suppl2B):13, 1985.
Unger RH, Foster DW: Diabetes mellitus. In Wilson JD, et al (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 973.
Unger RH, Grundy S: Hyperglycemia as an inducer as well as a consequence of impaired islet cell function and insulin resistance: implications for the management of diabetes. Diabetologia 28:119, 1985.
Wallace MS, et al: Absorption kinetics of regular, isophane, and protamine zinc insulin in normal cats. Domest Anim Endocrinol 7:509, 1990.
Ward JD: Biochemical and vascular factors in the pathogenesis of diabetic neuropathy. Clin Invest Med 18:267, 1995.
Wess G, Reusch C: Capillary blood sampling from the ear of dogs and cats and use of portable meters to measure glucose concentration. J Small Anim Pract 41:60,2000a.
Wess G, Reusch C: Assessment of five portable blood glucose meters for use in cats. Am J Vet Res 61:1587, 2000b.
Westermark P, et al: Islet amyloid in type 2 human diabetes mellitus and adult diabetic cats is composed of a novel putative polypeptide hormone. Am J Pathol 127:414, 1987a.
Westermark P, et al: Islet amyloid polypeptide-like immunoreactivity in the islet В cells of type 2 (non-insulin-dependent) diabetic and nondiabetic individuals. Diabetologia 30:887, 1987b.
Weyer C, et al: Hypoadiponectinemia in obesity and type 2 diabetes: close association with insulin resistance and hyperinsulinemia. J Clin Endocrinol Metab 86:1930, 2001.
Winegrad Al: Does a common mechanism induce the diverse complications of diabetes? Banting Lecture, 1986. Diabetes 36:396, 1986.
Wolffenbuttel BHR, Landgraf R: A 1-year, multicenter, randomized, doubleblind comparison of Repaglinide and glyburide for the treatment of type 2 diabetes. Diabetes Care 22:463, 1999.
Yano BL, et al: Feline insular amyloid: incidence in adult cats with no clin-ico- pathologic evidence of overt diabetes mellitus. Vet Pathol 18:310, 1981a.
Yano BL, et al: Feline insular amyloid: association with diabetes mellitus. Vet Pathol 18:621, 1981b.
Young AA, et al: Dose-responses for the slowing of gastric emptying in a rodent model by glucagon-like peptide (7-36)NH2, amylin, cholecystokinin, and other possible regulators of nutrient uptake. Metabolism 45:1, 1996.
2huang HX, et al: Insulin-like growth factors reverse or arrest diabetic neuropathy: effects on hyperalgesia and impaired nerve regeneration in rats. Exp Neurol 140:198, 1996.
2immet P2, et al: Is there a relationship between leptin and insulin sensitivity independent of obesity? A population-based study i-n the Indian Ocean nation of Mauritius. Int J Obesity 22:171, 1998.
2oran DL: The carnivore connection to nutrition in cats. J Am Vet Med Assoc 221:1559,2002.
ПАТОГЕНЕЗ И ПАТОФИЗИОЛОГИЯ...635
ВСТРЕЧАЕМОСТЬ................640
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.................640
УСТАНОВЛЕНИЕ ДИАГНОЗА ДИАБЕТИ-
ЧЕСКИЙ КЕТОЗ И КЕТОАЦИДОЗ..641
ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ В СТАЦИОНАРЕ...................642
Глава 13
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
ТЕРАПИЯ «ЗДОРОВЫХ» ЖИВОТНЫХ С ДИАБЕТИЧЕСКИМ КЕТОЗОМ.....652
ТЕРАПИЯ БОЛЬНЫХ ЖИВОТНЫХ С
ДИАБЕТИЧЕСКИМ КЕТОАЦИДОЗОМ..653
Инфузионная терапия...........653
Лечение бикарбонатом..........660
Инсулинотерапия...............661
Сопутствующие заболевания.....665
Осложнения терапии............669
ПРОГНОЗ.......................671
ГИПЕРОСМОЛЯРНЫЙ НЕКЕТОНОВЫЙ
САХАРНЫЙ ДИАБЕТ...............672
Патогенез.......................672
Клиническая характеристика......673
Терапия.........................673
Список сокращений
АЛТ - аланинаминотрансфераза
AM - азот мочевины
ACT - аспартатаминотрансфераза
ВКЖ - внеклеточная жидкость ВнуКЖ - внутриклеточная жидкость
ДГНС - диабетический гиперосмолярный некетоновый сахарный диабет
ДК - диабетический кетоз
ДКА - диабетический кетоацидоз
ЛТЭ - легочная тромбоэмболия
ПТГ - паратиреоидный гормон
СЖК - свободные жирные кислоты
СКФ - скорость клубочковой фильтрации
СМЖ - спинномозговая жидкость
ТКК - трикарбоиовые кислоты
ЦВД - центральное венозное давление
ЦНС - центральная нервная система
Диабетический кетоацидоз (ДКА) является серьезным осложнением сахарного диабета. До появления доступного инсулина в 1920-ых годах ДКА неизменно завершался гибелью больного. Даже после открытия инсулина это расстройство имело самый неблагоприятный прогноз, а смертность от него среди людей составляла от 10 до 30%. Несмотря на появление все новых данных о патофизиологии ДКА и внедрение новых методов лечения его последствий, смертность, обусловленная ДКА, остается на уровне 5-10% (Wagner et al, 1999; Masharani, Karam, 2001). Лечение ДКА сопряжено с большими трудностями в значительной степени потому, что он оказывает неблагоприятное воздействие на многие органы и часто сопровождается весьма тяжелыми нарушениями, которые, в первую очередь, и обусловливают высокую смертность при этом заболевании. До сих пор не удается понизить частоту развития ДКА у людей, имеющиеся методы терапии дают сомнительные результаты, и многие больные по-прежнему становятся жертвами этого осложнения сахарного диабета. В настоящем разделе обобщены современные представления о патофизиологии и способах лечения ДКА у собак и кошек.
ПАТОГЕНЕЗ И ПАТОФИЗИОЛОГИЯ
Образование кетоновых тел. Кетоновые тела являются продуктами окисления неэтерифициро-ванных, или свободных жирных кислот (СЖК), в
печени и служат источниками энергии для многих тканей в периоды недостатка глюкозы. Высвобождаемые из жировой ткани СЖК поглощаются печенью, причем интенсивность этого процесса зависит от концентрации СЖК в плазме крови. В печени они включаются в триглицериды, метаболизируются в цикле трикарбоновых кислот (ТКК) до СО2 и воды либо преобразуются в кетоновые тела (Hood, Tannen, 1994; Kitabchi et al, 2001). Окисление СЖК приводит к образованию ацетоацетата. В присутствии НАДФ-Н ацетоацетат восстанавливается до бета-оксимасляной кислоты. Ацетон образуется в результате спонтанного декарбоксилирования ацетоацетата (рис. 13-1). Кетоновые тела: ацетоацетат, бета-оксимасляная кислота и ацетон, являются субстратами энергетического обмена во многих тканях, не говоря уже о том, что они обеспечивают поддержание биосинтетических процессов в мозге новорожденных (Zammit, 1994). Обмен кетоновых тел интегрирован с обменом других субстратов энергетического обмена. Тем не менее, их избыточная продукция, как например при некомпенсированном сахарном диабете, приводит к накоплению этих соединений в кровяном русле и к развитию кетоаци-дотического кетоза или ацидоза.
Роль недостаточности инсулина. Продукция кетоновых тел зависит, в первую очередь, от доступности СЖК и кетогенной активности печени (McGarry et al, 1989; Zammit, 1994). Усиление биосинтеза кетоновых тел требует изменения двух
636 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Мышца
Белок
кисло
Аланин Лактат
Глюкозу ^Гликоген
Глицерин
СЖК
[Адреналин]
|Кортизол|
Глюкоза
₽-Окисление
‘СО.
ЛсСодОксало- Ацетил.СоА
Мевалонат
002 и вода
Ацетоацетат СоА
Ацето-ацетат ' СоА *
Цикл Кребса
р-онв
Гликоген
Кортизол
Гормон роста
Несколько
стадии
Липопротеины очень низкой плотности (ЛОНП)
Ацетоацетат (АсАс)
Ацетон
итохондрия
Ацил-
карни-тин
Глицерин
Аланин Лактат СЖК Пируват Ацил-Сок ных кист
Пируват Ацил-СоА жир-
х Адипоцит Тригли- X цериды
Свободные жирные кис-Х4-*- лоты (СЖК) |уГлицеринх?
Кровоток
Адреналин
-ОНВ L НАД+ [-НАД iCA
Бета-ги^оксибутират
добный пептид
Ацетон
Холестерин .. Фосфо- /
Несколько Окса- ^энолпи- ' гтялий noaMe- РУват / стадии тат 1 j .
1 Глюко-/X \
• I зо-З-/
2-Фосфоглицерат,фосфат «•-*-Дигидрс)ксиацетонфосфат
I ' t t !
З-фосфоглицерат ^^►1,3-дифос- а-Фосфог-
4 г । ^фоглицерат ллицерат АДФ1 аТ/*' *
АТФ
Глицерин /
{Адреналин 1 Глюкагон J Кортизол
Рис. 13-1. В ответ на самые разные стрессорные ситуации, такие как сепсис, сердечная недостаточность и панкреатит, организм усиливает продукцию глюкорегуляторных гормонов: инсулина, глюкагона, адреналина, кортизола и гормона роста. В результате недостаточности инсулина при сахарном диабете в печени, мышечной и жировой тканях отсутствует противодействие глюкогенным эффектам гормонов стресса. Это приводит к избыточному образованию кетонов, распаду жировой и мышечной тканей и развитию классического катаболического состояния.
важных параметров промежуточного обмена: (1) усиления мобилизации СЖК из резервных триглицеридов жировой ткани и (2) переключения печеночного обмена с биосинтеза жиров на их окисление и кетогенез (Hood, Tannen, 1994; Kitabchi et al, 2001). Инсулин является мощным ингибитором липолиза и окисления СЖК (Groop et al, 1989). Относительная или абсолютная недостаточность инсулина сопровождается усилением липолиза, что повышает доступность СЖК для печени и, тем самым, способствует усилению кетогенеза. Практически у всех собак и кошек с ДКА имеется относительная или абсолютная недостаточность инсулина. При обнаружении кетоацидоза во время первичного обследования животных с устойчивым сахарным диабетом после прекращения введения им экзогенного инсулина или особей с впервые выявленным диабетом концентрация инсулина в крови оказывается очень низкой или он вообще не определяется. У некоторых собак и кошек концентрация инсулина остается на уровне, наблюдаемом у нормальных животных без диабета натощак (т.е. примерно 5-20 мкЕД/мл), но этот уровень оказывается совершенно
недостаточным в условиях тяжелой гипергликемии («относительная» недостаточность инсулина).
У некоторых собак и кошек с сахарным диабетом кетоацидоз развивается несмотря на ежедневное введение им инсулина и его высокую концентрацию в крови. Недостаточность инсулина сама по себе не может служить единственной физиологической причиной ДКА. У животных этой группы имеет место «относительная» недостаточность инсулина. Возможно, у них развивается инсулинорезистентность как результат повышенной концентрации контррегуляторных гормонов (таких, как адреналин, глюкагон, кортизол и/или гормон роста) или нарушаются обменные процессы (увеличиваются концентрации СЖК и аминокислот, возникает метаболический ацидоз и т.п.). Способность поддерживать нормальный гомеостаз глюкозы отражает равновесие между чувствительностью организма к инсулину и количеством инсулина, секретируемого бета-клетками или вводимого экзогенно. По мере развития инсулинорезистентности потребность в инсулине может превысить ежедневно вводимую дозу гормона, что является предпосылкой развития ДКА (рис. 13-2).
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 637
Рис. 13-2. Патогенез ДКА. Иллюстрация взаимосвязи между недостаточностью инсулина и инсулинорезис-тентностью в процессе развития кетоацидотического состояния.
Нормальный диапазон
(1,78±4нг/мл)
Инсулин Глюкагон | Кортизол
Катехоламины Гормон роста
Рис. 13-3. Концентрации инсулина и контррегуляторных гормонов в плазме крови (±SEM) при ДКА. ДКА характеризуется относительной недостаточностью инсулина и избытком гормонов стресса. Концентрация кортизола в плазме крови повышена у всех животных, поступающих в клинику с диагнозом ДКА. Несмотря на то, что при кетоацидозе средняя концентрация гормона роста также имеет тенденцию к повышению, у многих особей она возрастает только после начала инсулинотерапии и инфузионной терапии. (Из: Schade DS et al: Diabetic ketoacidosis: Pathogenesis, prevention, and therapy. In: Schade DS et al (eds): Diabetic Coma. Albuquerque, University of New Mexico Press, 1981, p 84).
Роль контррегуляторных гормонов. В крови людей с ДКА обычно повышены концентрации контррегуляторных гормонов, в частности, адреналина, глюкагона, кортизола и/или гормона роста, а также уровень СЖК и аминокислот (рис. 13-3; Luzi et al, 1988). Увеличение концентрации контррегуляторных гормонов вызывает инсулинорезистентность, стимулирует липолиз, усиливает поступление СЖК в кровяное русло и приводит к сдвигу обмена СЖК в печени с преимущественного синтеза жиров на их окисление и образование кетоновых тел (рис. 13-3) (McGarry et al, 1989 ; Zammit, 1994). Глюкагон считается самым мощным кетогенным гормоном. Повышение его продукции сопровождается кетозом, а ее уменьшение тормозит образование кетоновых тел при уже развившемся кетозе (Hood, Tannen, 1994) . Глюкагон оказывает непосредственное воздействие на процессы кетогенеза в печени. Вместе с тем, это его действие в значительной степени зависит от доступности соответствующих субстратов. Кетогенез может развиваться и в отсутствие глюкагона. Важными модуляторами
кетогенеза являются также катехоламины, в первую очередь, благодаря их стимулирующему действию на липолиз. И глюкагон, и адреналин вносят свой вклад в развитие инсулинорезистентности, ингибируя стимулируемое инсулином включение глюкозы в мышечную ткань и индуцируя образование глюкозы в печени путем усиления гликогенолиза и глюконеогенеза (Cherrington et al, 1987; Cryer, 1993) . Кортизол и гормон роста стимулируют липолиз в условиях абсолютной или относительной недостаточности инсулина (см. рис. 13-1), блокируют действие инсулина в периферических тканях (Bratusch-Marrain et al, 1982; Boyle, 1993) и усиливают стимулирующее действие адреналина и глюкагона на продукцию глюкозы в печени (Sherwin et al, 1980). Увеличение концентрации СЖК в плазме крови и их окисления сопровождается подавлением стимулируемого инсулином включения глюкозы в мышечную ткань и повышением интенсивности глюконеогенеза в печени (Thiebaud et al, 1982; Ferrannini et al, 1983). Сочетание недостаточности инсулина и избыточного количества контррегуляторных гормонов приводит к усилению катаболизма белков. Увеличение концентрации аминокислот в плазме крови приводит к ослаблению действия инсулина в мышцах и обеспечивает дополнительное количество субстратов для глюконеогенеза (Tessari et al, 1985). Конечным результатом всех этих гормональных нарушений является усугубление неблагоприятных последствий инсулиновой недостаточности вследствие повышения тяжести инсулинорезистентности, стимуляции липолиза с образованием кетоновых тел и усиления глюконеогенеза, способствующего дальнейшему нарастанию концентрации глюкозы в крови. Комбинация этих факторов, в конце концов, приводит к появлению клинической симптоматики ДКА.
Продукция контррегуляторных гормонов в организме усиливается при самых разных заболеваниях и стрессорных ситуациях. Хотя такой ответ организма обычно оказывает благоприятное действие, при ДКА активность этих гормонов в качестве антагонистов инсулина, как правило, приводит к усилению гипергликемии и кетонемии, провоцируя ацидоз, потерю жидкости и гипотензию. Тяжесть возникающего при этом состояния организма усиливается в процессе восходящей по спирали мета-
Рис. 13-4. Взаимосвязь между патофизиологическими механизмами, приводящими к диабетическому кетоацидозу (ДКА). АК - Аминокислоты, СЖК - Свободные жирные кислоты, К - Калий, АсАс - Ацетоацетат, р-ОНВ - бета-оксимасляная кислота.
о ио 00
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 639
болической декомпенсации (рис. 13-4). Только у небольшого числа собак и кошек с ДКА отсутствует то или иное сопутствующее заболевание, например, панкреатит, инфекция, почечная недостаточность или гормональное расстройство. Эти заболевания усиливают секрецию контринсулярных гормонов. Так, инфекция вызывает значительное увеличение продукции кортизола и глюкагона, сердечная недостаточность и травма приводят к повышению концентрации глюкагона и катехоламинов в крови, а повышение температуры индуцирует секрецию глюкагона, гормона роста, катехоламинов и кортизола (Kandel, Aberman, 1983; Feldman, Nelson, 1987). Выявление и лечение нарушений, сопутствующих ДКА, имеет важное клиническое значение и предопределяет успешность терапии ДКА (см. рис. 13-2).
Физиологические последствия повышенной продукции кетоновых тел. Физиологические расстройства, сопровождающие ДКА, являются прямым следствием относительной или абсолютной недостаточности инсулина, гиперкетонемии и гипергликемии (табл. 13-1). Превращение СЖК в кетоновые тела в действительности может рассматриваться как положительный обменный процесс, если продолжается на протяжении сравнительно небольшого периода. С физиологической точки зрения, сахарный диабет является ни чем иным, как состоянием голода. При недостатке глюкозы кетоновые тела служат источниками энергии для многих тканей. Однако прогрессивно нарастающее содержание глюкозы и кетонов в плазме крови, в конце концов, превышает пороговую способность почечных клубочков реабсорбировать эти соединения и выводить их с мочой. В результате развивается осмотический диурез. В процессе развития ДКА у человека с мочой ежедневно теряется от 150 до 200 г глюкозы, а экскреция кетонов составляет в среднем 20-30 г ( Luzi et al, 1988 ; Ennis et al, 1994). Потеря каждого грамма глюкозы с продуктами почечной экскреции приводит к дополнительному увеличению осмотического давления раствора на 6 мОсм. Вследствие низкого молекулярного веса кетонов их экскреция в еще большей степени усиливает осмотическую нагрузку в пересчете на 1 грамм. В конечном итоге она обусловливает от одной трети до половины осмотического диуреза у людей с ДКА (DeFronzo et al, 1994; Kitabchi et al, 2001). Более того, отрицательный заряд кетоновых тел даже при максимально высокой кислотности мочи делает неизбежной экскрецию положительно заряженных ионов (в частности, натрия, калия, кальция и магния) для поддержания электрической нейтральности мочи. Общая осмолярная нагрузка, обусловленная только глюкозой и кетонами, может достигать 1500-2000 мОсм; эта величина в 2-3 раза выше, чем нормальные суточные потери осмоляльности мочи (DeFronzo et al, 1994). Усиление экскреции сопровождается ухудшением реабсорбции воды в проксимальных почечных канальцах и петле Генле, что приводит к уменьшению концентрации
ТАБЛИЦА 13-1. ПАТОФИЗИОЛОГИЧЕСКИЕ НАРУШЕНИЯ ПРИ ДИАБЕТИЧЕСКОМ КАТОАЦИДОЗЕ
Гипергликемия Гиперкетонемия Недостаточность инсулина
Осмотический Осмотический Потеря электроли-
диурез диурез тов и жидкости
Натрий Натрий Натрий
Калий Калий Вода
Вода Вода Фосфат
Кальций Кальций
Фосфат Фосфат
Внутриклеточная Метаболический Отрицательный
дегидратация ацидоз азотистый баланс
натрия и хлоридов в просвете канальцев, увеличению градиента концентрации для их реабсорбции и, тем самым, к подавлению транспорта из просвета в кровь. Конечным результатом этих расстройств является избыточное выведение электролитов и воды, приводящее к уменьшению объема и недостаточной перфузии тканей.
Недостаток инсулина сам по себе также способствует избыточной почечной экскреции воды и электролитов. Физиологическое повышение концентрации инсулина в плазме крови благоприятствует увеличению реабсорбции солей и воды как в проксимальном, так и в дистальном отделах нефрона, а также усиливает всасывание фосфатов в проксимальных канальцах (DeFronzo et al, 1994) . Напротив, при недостаточности инсулина возрастает экскреция воды и электролитов; это приводит к повышению скорости протеолиза белков, угнетению их синтеза и отрицательному азотному балансу (DeFronzo, Ferrannini, 1992). Состав мочи у больных с осмотическим диурезом сходен с составом полу-нормального солевого раствора. Иными словами, потери воды, как правило, превышают потери натрия. Одновременно теряется большое количество калия и фосфора, что затрудняет лечение основного заболевания. Несмотря на увеличение экскреции кальция и магния, потеря этих элементов обычно не сказывается на эффективности терапии ДКА.
Образование кетоновых тел в печени сопровождается продукцией эквивалентного количества водородных ионов, которые нейтрализуют концентрацию бикарбоната в плазме крови. По мере продолжающегося накопления кетонов в крови буферные системы организма испытывают чрезмерные перегрузки, что приводит к повышению концентрации водородных ионов и уменьшению концентрации бикарбоната в крови и развитию метаболического ацидоза. Одновременно происходит дальнейшая потеря воды и электролитов в результате повторяющихся эпизодов рвоты и диареи в сочетании с недостаточным потреблением жидкости; эти расстройства нередко возникают вслед за повышением тяжести метаболического ацидоза (рис. 13-4). Следствием значительных потерь воды и электролитов являются уменьшение объема и недостаточная перфузия тканей, падение скорости клу
640 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
бочковой фильтрации (СКФ), повышение тяжести преренальной азотемии и обезвоживание организма. При уменьшении СКФ собаки и кошки с гипергликемией утрачивают способность экскретировать глюкозу и, в меньшей степени, водородные ионы. В результате этого происходит ускоренное накопление глюкозы и кетоновых тел во внутрисосудистом пространстве, что еще более повышает уровень гипергликемии и кетонемии и усугубляет тяжесть метаболического ацидоза (см. рис. 13-4). Нарастание концентрации глюкозы в крови сопровождается повышением осмоляльности плазмы, а возникающий в результате этого осмотический диурез вызывает дальнейшее увеличение осмоляльности вследствие более значительной экскреции воды по сравнению с экскрецией солей. Высокая осмоляльность плазмы сопровождается потерей воды клетками и их дегидратацией, что служит причиной вялости больного животного и может вызвать кому. Тяжелейшие метаболические последствия ДКА, в том числе выраженный ацидоз, гиперосмоляльность, непременный осмотический диурез, дегидратация и нарушение электролитного баланса, в конце концов, приобретают угрожающий жизни характер.
ВСТРЕЧАЕМОСТЬ
ДКА является серьезным осложнением сахарного диабета, которое наиболее часто выявляют у собак и кошек в процессе диагностики диабета. Реже ДКА развивается у животных в условиях неадекватной инсулинотерапии диабета, и его развитию способствуют инфекции, воспалительные заболевания и гормональные нарушения. У собак и кошек ДКА встречается практически с такой же частотой, как некетоновый диабет (см. гл. 11 и гл. 12). В большинстве случаев ДКА является заболеванием животных среднего и старшего возраста, хотя может развиться в любом возрасте. У собак ДКА чаще регистрируется среди самок, а у кошек - среди самцов. У животных обоих видов заболеваемость ДКА не зависит от породы.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Результаты анамнестического анализа и физикального исследования у собак и кошек с ДКА сугубо индивидуальны, что частично объясняется прогрессирующей природой заболевания и разной продолжительностью времени между возникновением ДКА и обращением владельцев животных за ветеринарной помощью. Тяжесть ДКА при обращении к ветеринарному врачу колеблется от кетонурии на фоне в целом нормального состояния животных, сохранения аппетита и отсутствия метаболического ацидоза (т.е. диабетического кетоза, или ДК) до кетонурии в сочетании с выраженным диабетическим ацидозом (т.е. ДКА), клинически ярко выраженными симптомами заболевания и высоким риском его фатального исхода.
Сначала у животных развиваются типичные клинические признаки неосложненного сахарного диабета (полиурия, полидипсия, полифагия и потеря веса), однако, на этой стадии они либо остаются незамеченными, либо владельцы не придают им серьезного значения. Системные симптомы заболевания (вялость, анорексия, рвота) появляются на фоне прогрессирующей кетонемии и метаболического ацидоза, причем их тяжесть непосредственно связана с тяжестью метаболического ацидоза и природой других заболеваний (например, панкреатита или инфекции), которые нередко сопутствуют основному расстройству. Невозможно предсказать, сколько времени пройдет между началом клинического проявления сахарного диабета и появлением системных признаков ДКА. Нам приходилось видеть больных диабетом собак и кошек, которые вполне нормально существовали без инсулинотерапии на протяжении более полугода. Однако как только начинали развиваться кетонемия, кетонурия и метаболический ацидоз, у них в течение одной недели появлялись тяжелые клинические симптомы заболевания.
При поступлении тяжело больного животного в ветеринарную клинику его хозяин иногда ничего не может сказать о признаках, которые предшествовали более явным и в данный момент вызывающим большое беспокойство симптомам. Однако при более дотошном опросе владельца животного относительно прежнего клинического состояния его питомца, выясняется, что собака или кошка имеет в анамнезе классический сахарный диабет с его типичными проявлениями - полиурией, полидипсией, полифагией и уменьшением веса. Иногда приходится приложить немало усилий, чтобы получить подобную информацию от расстроенного хозяина. Поскольку диабет часто сопровождается сопутствующими заболеваниями, клиницист не должен жалеть времени, чтобы, в конце концов, получить подробные сведения о состоянии всех органов и систем животного. Некоторые из них (например, пиометра, недостаточность почечной функции или гиперкортицизм) сопровождаются такими же нарушениями, как ДКА, или могут индуцировать обменные расстройства, в конечном итоге приводящие к ДКА, как у животных с впервые диагностированным диабетом, так и уже получающих инсулин.
Важнейшее значение имеет полное и тщательное физикальное исследование любого животного с кетоацидозом (см. рис. 13-2) . Во время первоначального осмотра необходимо сосредоточить внимание на оценке состояния гидратации, наличии нарушений со стороны центральной нервной системы (ЦНС) и тщательном поиске исходной причины декомпенсации диабета, вызвавшей появление кетоацидоза. Собаки и кошки с сахарным диабетом нередко страдают сопутствующими инфекциями, пиометрой, панкреатитом, холангиогепатитом, почечной недостаточностью или сердечными заболеваниями либо имеют другие патологические из
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 641
менения, препятствующие нормальному действию инсулина (Bruskiewicz et al, 1997). Исчерпывающий анализ анамнестических данных, результатов физикального и лабораторных исследований в большинстве случаев помогает определить сопутствующие расстройства и, следовательно, выбрать адекватную тактику терапии, повысив, тем самым, вероятность успешного лечения.
Физикальное исследование обычно выявляет обезвоживание, депрессию, слабость, учащенное дыхание, рвоту и реже сильный запах ацетона в выдыхаемом воздухе. При тяжелом метаболическом ацидозе дыхание может быть замедленным и глубоким (дыхание Куссмауля). Наблюдаемые нарушения функции желудочно-кишечного тракта, такие как рвота, вздутие живота и боли в брюшной области, следует дифференцировать от сходной симптоматики, связанной с панкреатитом, перитонитом и иными абдоминальными расстройствами. Рвота и боли в животе, сопровождающие ДКА, обычно характеризуются острым началом и развиваются уже после диагностики сахарного диабета. Напротив, наличие в анамнезе болей в животе и рвоты на протяжении нескольких дней или недель до проведения обследования может свидетельствовать о самостоятельном заболевания органов брюшной полости, прежде всего хроническом панкреатите. Физикальное исследование собак или кошек с ДКА может выявить и другие нарушения, нередко встречающиеся при неосложненном сахарном диабете, например, катаракту или невропатию (см. гл. И, стр. 534 и гл. 12, стр. 598).
ДИАГНОСТИКА ДИАБЕТИЧЕСКОГО КЕТОЗА И КЕТОАЦИДОЗА
Диагностика сахарного диабета основывается на выявлении соответствующих клинических признаков (т.е. полиурии, полидипсии, полифагии и уменьшении веса тела), а также на наличии устойчивых проявлений гипергликемии натощак и гликозурии. Для быстрого подтверждения диагноза определяют концентрацию глюкозы в плазме крови с помощью портативных глюкометров (см. стр. 556) и концентрацию глюкозы в моче, используя тест-полоски (например, Keto-Diastix производства Ames Division, Miles Laboratories Inc., США). Одновременное выявление кетонурии позволяет диагностировать диабетический кетоз или кетоацидоз. На следующей стадии проводят дифференциальную диагностику ДКА и ДК. С помощью тест-полосок для анализа мочи на наличие кетонурии определяют содержание ацетоацетата и ацетона. Если кетонурии нет, а подозрение на ДКА или ДК остается, измеряют концентрацию ацетона и ацетоацетата в крови с помощью таблеток Acetest (Ames Division, Miles Laboratories Inc., США) или концентрацию бета-оксимасляной кислоты с помощью настольного химического анализатора. Нитропруссидные реагенты, применяемые
для быстрого выявления кетоацидемии и кетоацидурии (Acetest и Ketostix), идентифицируют только кетоновые группы (-С=О), т.е. ацетоацетат и ацетон. Среди кетоновых тел, образующихся при ДКА у человека, преобладает бета-оксимасляная кислота. Отношение концентраций бета-оксибу-тирата и ацетоацетата может колебаться от 3:1 до 20:1 в зависимости от тяжести гиповолемии, тканевой гипоксии и лактоацидоза (Li et al, 1980; Goldstein, 1995).
При сосудистой недостаточности повышение концентрации молочной кислоты может вызвать сдвиг окислительно-восстановительного равновесия в сторону преимущественного образования бета-оксибутирата за счет снижения биосинтеза легко идентифицируемого ацетоацетата. Теоретически, при использовании тест-полосок для анализа мочи или методов анализа крови на основе нитропруссидного реагента можно получить заниженные результаты при тяжелой гиперкетонемии или вообще не выявить ДКА или ДК. В одном исследовании была обнаружена разная концентрация бета-окси-бутирата в сыворотке крови собак с некетоновым сахарным диабетом, ДКА и ДК. Можно полагать, что измерение уровня этого соединения в крови животных может оказаться полезным для диагностики и мониторинга эффективности терапии кетоза и кетоацидоза у собак с сахарным диабетом (рис. 13-5; Duarte et al, 2002).
Необходимость интенсивной диагностики и лечения собак и кошек с ДКА диктуется, в первую очередь, результатами анамнестического анализа и физикального исследования. Диагностика тяжелого ДКА проводится при наличии у собак или кошек системных признаков заболевания (вялости, рвоты, потери аппетита) и выявлении при физикальном исследовании дегидратации, депрессивного состояния, слабости и/или дыхания Куссмауля, при концентрации глюкозы в плазме крови выше 500 мг/100 мл либо при тяжелом метаболическом ацидозе (устанавливаемом по концентрации общего СО2 в венозной крови или бикарбоната в артериальной крови менее 12 мэкв/л). Следует, однако, иметь в виду, что результаты анамнестического анализа и физикального исследования являются субъективными, а быстрое получение данных о кислотно-щелочном статусе животного может оказаться невозможным. Поэтому предварительный диагноз тяжелого ДКА зачастую основывается на обнаружении глюкозы и кетоновых тел в моче больной собаки или кошки. Для выбора оптимального режима ухода за таким животным необходимо провести дальнейшее диагностическое обследование, однако, терапию можно и должно проводить, не дожидаясь его завершения.
Предварительный диагноз ДК ставят собакам и кошкам с сахарным диабетом, которые внешне выглядят здоровыми, но в их моче обнаруживаются глюкоза и кетоновые тела. При физикальном исследовании таких животных серьезные расстройства не выявляются, системные признаки заболевания
642 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Рис. 13-5. Концентрация Р-оксибутирата (Р-ОНВ) в сыворотке крови у собак с диабетическим кетоацидозом (ДКА) и диабетическим кетозом (ДК). На малом графике (Б) показаны концентрации Р-ОНВ у собак с некетоновым сахарным диабетом ( НКД) в сопоставлении с нормальными величинами (темная область). (Из: Duarte R et al: Accuracy of serum P-hydroxybutyrate measurements for the diagnosis of diabetic ketoacidosis in 116 dogs. J Vet Intern Med 16:411, 2002).
выражены слабо или отсутствуют, а метаболический ацидоз еще не развился или слабо проявляется (т.е. общая концентрация СО2 в венозной крови или бикарбоната в артериальной крови превышает 16 мэкв/л). Собаки и кошки с ДК не нуждаются в срочной агрессивной терапии, но их следует отличать от животных с критическими обменными нарушениями. Животным с сахарным диабетом и кетозом, которые внешне выглядят здоровыми, может быть назначено консервативное лечение, обычно без применения инфузионной терапии. В отличие от этого, собакам и кошкам с тяжелым ДКА требуется интенсивная терапия, предусматривающая альтернативные подходы в зависимости от характера нарушений различных параметров, оцениваемых в ходе лечения.
ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ В СТАЦИОНАРЕ
Общие положения. Лабораторное обследование «здоровых» собак и кошек с сахарным диабетом проводится одинаково вне зависимости от наличия или отсутствия кетоза (см. гл. И, стр. 535 и гл. 12, стр. 599). Животным с кетозным диабетом обычно назначают консервативное лечение, в отличие от животных с крайне тяжело протекающим ДКА. Для разработки адекватного терапевтического протокола при кетоацидотическом диабете ветеринар должен провести серию необходимых анализов. Без этого нельзя правильно оценить метаболический статус животного и получить достаточную информацию о специфических расстройствах, нуждаю
щихся в коррекции. Минимальный набор включает анализ мочи, определение показателя гематокрита, концентраций глюкозы и общего белка в плазме крови, общей концентрации углекислого газа в венозной крови и кислотно-щелочного равновесия в артериальной крови, концентрации азота мочевины (AM), креатинина и электролитов в сыворотке крови (Na, К, Са, РО4).
Указанные анализы необходимы для быстрой оценки состояния животного и назначения ему интенсивного лечения. Их результаты позволяют выбрать адекватный способ инфузионной терапии, а также методы коррекции нарушений электролитного баланса, ацидоза и дисфункции почек. Для более полной клинической характеристики могут потребоваться инструментальные исследования, такие как диагностическая визуализация или электрокардиографическое исследование, а также дополнительные лабораторные анализы. Вместе с тем, «кетоацидотический профиль» содержит всю информацию, необходимую для начала неотложной и адекватной терапии.
Анализ и посевы мочи
Анализ мочи выполняет сразу несколько задач. В первую очередь, это выявление гликозурии и ке-тонурии. Если у больной собаки или кошки в состоянии дегидратации обнаруживается гликозурия или кетонурия, то ставится диагноз ДКА. При этом начинают инфузионную терапию (см. стр. 655), а тем временем для подтверждения диагноза проводят определение концентрации глюкозы в крови и
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 643
электролитов в сыворотке, а также оценку кислотно-щелочного равновесия.
Во многих случаях важную роль в возникновении ДКА играют инфекции мочевого тракта. Выявление бактериурии, гематурии и пиурии при анализе мочи подтверждает инфицирование мочевых путей и свидетельствует о необходимости культивирования проб мочи. По возможности, пробы для культивирования получают проколом мочевого пузыря. В связи с высокой частотой инфекций мочевого тракта у поступающих в нашу клинику собак и кошек с ДКА, мы обычно делаем посевы мочи независимо от результатов ее рутинного анализа. Протеинурия может быть следствием инфекции мочевых путей или поражения почечных клубочков в результате нарушения целостности базальной мембраны. Определение отношения концентраций белка и креатинина в пробах мочи в отсутствие инфекции или воспаления помогает оценить степень клинической значимости протеинурии.
Другим важным проявлением ДКА является азотемия, а определение удельного веса мочи в пробах, полученных до начала инфузионной терапии, позволяет дифференцировать преренальную азотемию от первичной почечной недостаточности. Оценку результатов измерения удельного веса мочи у собак и кошек следует проводить с учетом тяжести гликозурии и степени дегидратации. При наличии клинически выраженного обезвоживания организма на фоне нормальной функции почек удельный вес мочи составляет 1,030. Удельный вес ниже 1,020 может свидетельствовать о первичной недостаточности почечной функции или наличии сопутствующего заболевания, обусловливающего возникновение вторичного нефрогенного несахарного диабета (например, гиперкортицизма). Глико-зурия приводит к увеличению удельного веса мочи при его рефрактометрическом определении. Как показывает опыт, гликозурия порядка 2%, или 4+, определяемая с помощью тест-полосок, увеличивает удельный вес мочи на 0,008-0,010 (по данным рефрактометрии).
Олигурическая или анурическая почечная недостаточность является нечастым, но очень серьезным осложнением ДКА. Тяжелая гипергликемия (при концентрации глюкозы в крови более 500 мг/100 мл) обычно сопровождается значительным снижением СКФ вследствие первичного почечного заболевания или сильного обезвоживания организма и ухудшения перфузии почек. В этих условиях особенно важное значение приобретает тщательный мониторинг продукции мочи у животных с тяжелым ДКА. Несмотря на предрасположенность больных диабетом животных к инфекции, при тяжелом ДКА настоятельно рекомендуется вживлять в мочевой пузырь катетер, присоединенный к закрытой системе сбора мочи. Такая система нужна для определения объема мочи, образующейся в течение первых 12 часов терапии, что позволяет быстро выявить анурическую или олигурическую
почечную недостаточность и оперативно принять меры по нормализации СКФ и продукции мочи. Последняя возрастает после коррекции дегидратации и достижения нормоволемии у собак и кошек с тяжелой преренальной азотемией и пониженной СКФ. После восстановления нормальной продукции мочи катетер удаляют.
Минимальная база данных (кетоацидотический профиль)
Концентрация глюкозы в крови. Средняя концентрация глюкозы в крови собак и кошек с ДКА составляет около 500 мг/100 мл, хотя возможны колебания от 200 мг/100 мл до величин, наблюдающихся, например, при гиперосмолярной коме, когда концентрация глюкозы превышает 1000 мг/100 мл (рис. 13-6). Из-за избыточной продукции глюкозы в печени собак и кошек с ДКА и, как правило, относительной или абсолютной недостаточности инсулина вполне вероятно, что уровень гипергликемии зависит, в первую очередь, от тяжести дегидратации и сопутствующего уменьшения СКФ (Foster, McGarry, 1983). Имеющиеся данные свидетельствуют о том, что концентрация глюкозы в крови повышается до аномально высокой величины (более 500 мг/100 мл) только в тех случаях, когда объем внеклеточной жидкости (ВКЖ) уменьшается до уровня, при котором нарушается экскреция мочи и выведение с ней глюкозы. Было показано значительное снижение концентрации глюкозы в крови людей с ДКА, которым вводили только жидкость, не вводя при этом инсулин (Owen et al, 1981). Аналогичная
с ДКА с ДКА
Рис. 13-6. Средняя концентрация глюкозы в плазме крови и ее колебания при установлении диагноза диабетический кетоацидоз у 72 собак и 20 кошек.
644 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Рис. 13-7. Действие жидкостной терапии в течение часа в отсутствие инъекций инсулина у четырех собак с тяжелым диабетическим кетоацидозом
картина имеет место у собак и кошек (рис. 13-7). У больных сахарным диабетом людей установлена связь между максимально достижимой концентрацией глюкозы в плазме крови и степенью уменьшения СКФ (табл. 13-2; Kandel, Aberman, 1983).
Исходная концентрация глюкозы в крови отчасти предопределяет агрессивность инфузионной и инсулиновой терапии на начальном этапе, а также сроки введения содержащих глюкозу жидкостей. Чем выше концентрация глюкозы, тем больше осмоляльность плазмы и серьезнее риск отека мозга у животного в случае неожиданного падения осмоляльности. Поэтому в первые часы после начала терапии скорость снижения концентрации глюкозы должна быть как можно меньше. При концентрации глюкозы близкой к 250 мг/100 мл во внутривенно вводимую жидкость необходимо добавлять декстрозу, чтобы избежать гипогликемии в условиях продолжающейся инсулинотерапии. Чем ближе концентрация глюкозы к величине 250 мг/100 мл,
ТАБЛИЦА 13-2. МАКСИМАЛЬНЫЕ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ В
СЫВОРОТКАХ КРОВИ ЛЮДЕЙ С САХАРНЫМ ДИАБЕТОМ ПРИ ДАННОЙ СКОРОСТИ КЛУБОЧКОВОЙ ФИЛЬТРАЦИИ
Скорость клубочковой фильтрации (мл/мин) Концентрация глюкозы в сыворотке крови (мг/100 мл)
108 400
72 600
54 800
36 1200
27 1600
Из: Kandel G, Aberman A: Selected developments in the understanding of diabetic ketoacidosis. Can Med Assoc J 128:392, 1983.
с ДКА с ДКА
Рис. 13-8. Средняя концентрация бикарбоната в плазме крови и ее колебания при установлении диагноза диабетический кетоацидоз у 72 собак и 20 кошек.
тем быстрее нужно вводить содержащую ее жидкость особенно в условиях инсулиновой терапии. Если исходная концентрация глюкозы составляет 500 мг/100 мл или выше, содержащую глюкозу жидкость обычно начинают вводить не ранее чем через нескольких часов после начала инфузионной и инсулиновой терапии.
Кислотно-щелочное равновесие. Метаболический кетоацидоз является одним из основных клинических нарушений при ДКА и прямым следствием избыточного накопления кетоновых тел в кровяном русле. Это накопление может достигать уровня, превышающего буферную способность крови и приводить, тем самым, к увеличению концентрации водородных ионов в артериальной крови, понижению концентрации бикарбоната и прогрессивному усилению тяжести метаболического ацидоза (рис. 13-8).
Неспособность почек адекватно компенсировать избыточную кислотную нагрузку у животных с ДКА отчасти объясняется физико-химическими свойствами бета-оксимасляной кислоты и ацетоацетата. Почечный барьер для этих кислот весьма низкий, поэтому даже при небольшом превышении их нормальной концентрации в крови они интенсивно экскретируются с мочой. Иными словами, избыточный синтез этих кислот в печени быстро приводит к перегрузке ими почечных канальцев, и создается ситуация, при которой имеющееся количество кислот превосходит способность почек переводить их в мочу. Кроме того, и ацетоацетат и бета-оксибутират являются относительно сильными кислотами (рКа соответственно 3,58 и 4,70). Поэтому даже при ми-
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 645
ТАБЛИЦА 13-3. КОНЦЕНТРАЦИЯ НСО3, pH И рСО2 В АРТЕРИАЛЬНОЙ КРОВИ ПРИ ПРОСТОМ ОСТРОМ НАРУШЕНИИ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ
Клиническое состояние рн Артериальное рСО, Общая концентрация венозного СО, = [НСО, ] *
Ацидоз
Дыхательный 4
Метаболический 4 4 44
Алкалоз
Дыхательный 7 44 4
Метаболический Т т П
*) Концентрация общего СО2 в венозной крови равна концентрации бикарбоната в артериальной крови
Двойные стрелки обозначают основное изменение
нимальных значениях pH мочи они экскретируются главным образом в форме солей натрия и калия. В результате одновременно теряются большие количества бикарбоната.
Диагностика ацидоза не вызывает затруднений при использовании результатов газового анализа артериальной крови или определения общего СО2 в венозной крови животных (табл. 13-3). При ДКА степень изменений обоих этих показателей зависит от продолжительности и тяжести гиперкетонемии на момент поступления собаки или кошки в ветеринарную клинику. Величина pH в артериальной крови может колебаться от 7,2 до 6,6. При pH менее 7,0 ДКА носит угрожающий жизни характер, а его лечение часто не дает желаемого результата. Отношение к специфической терапии ацидоза, обусловленного ДКА, крайне противоречиво. Доводы за и против назначения бикарбоната животным с тяжелым ДКА обсуждаются на стр. 660.
Концентрация натрия в сыворотке крови. Концентрация натрия в сыворотке крови отражает относительное содержание этого элемента и воды в организме. За редким исключением собаки и кошки с ДКА испытывают значительный дефицит общего натрия независимо от его уровня в крови. Среди 72 обследованных собак с ДКА у 62% была зарегистрирована гипонатриемия и только у 7% - гипернатриемия (рис. 13-9). Точно так же из 42 находившихся под наблюдением кошек с ДКА 80% имели пониженную, а 5% повышенную по сравнению с нормой концентрацию натрия в крови (Bruskiewicz et al, 1997).
Гипонатриемия является следствием повышенной потери натрия с мочой, которая имеет место при индуцированном гликозурией и кетонурией осмотическом диурезе. Поскольку инсулин усиливает реабсорбцию натрия в дистальной части нефрона, его отсутствие приводит к вымыванию натрия на уровне почек. Гиперглюкагонемия, рвота и диарея также способствуют потерям натрия при ДКА (Foster, McGarry, 1983) . Тяжелая гипертриглицеридемия может иногда приводить к видимой гипонатриемии. Тяжелая гипертриглицеридемия распознается по наличию липемии сетчатки при офтальмоскопическом исследовании либо массированной липемии при визуальном осмотре сыворотки или плазмы крови. Физиологический и рингеровский растворы содержат натрий в количестве, достаточном для адекватной компенсации даже его значительного дефицита, поэтому их рекомендуют использовать для первоначальной инфузионной терапии с целью лечения тяжелого ДКА (см. стр. 555).
Для оценки тяжести гипонатриемии у собак и кошек с ДКА важно получить данные об уровне
Рис. 13-9. Средние концентрации натрия и калия в сыворотке крови и их колебания при установлении диагноза диабетический кетоацидоз у 72 собак и 20 кошек.
646 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Рис. 13-10. Перераспределение ионов водорода, калия и фосфата между внеклеточной (ВКЖ) и внутриклеточной ( ВнуКЖ) жидкостями в ответ на уменьшение pH ВКЖ (например, при ацидозе), увеличение концентрации глюкозы и осмоляльности в ВКЖ и перемещение воды из ВнуКЖ в ВКЖ с последующей коррекцией ацидоза и переносом глюкозы и электролитов внутрь клеток при введении инсулина. А. Нормальный pH ВКЖ. Б. Увеличение концентрации Н+ в ВКЖ при ацидозе, сопровождающееся перемещением Н+ внутрь клеток вдоль нисходящего градиента концентрации. Увеличение концентрации глюкозы и осмоляльности в ВКЖ вызывает выход воды, IC и РО4+2 во внеклеточное пространство. В. Уменьшение концентрации Н+ в ВКЖ в результате коррекции ацидоза, сопровождающееся выходом Н+ во внеклеточное пространство. Введение инсулина и коррекция ацидемии индуцируют транспорт глюкозы, К+ и РО4’2 внутрь клеток, приводя, тем самым, к понижению концентрации К+ и РО4'2 в ВКЖ.
гипергликемии. Поскольку в отсутствие инсулина глюкоза слабо проникает в клетки, увеличение ее концентрации в ВКЖ создает трансмембранный осмотический градиент, что приводит к выходу воды из клеток и соответствующему снижению концентрации натрия в плазме крови. В целом, каждое повышение концентрации глюкозы в сыворотке на 100 мг/100 мл по сравнению с ее нормальной величиной вызывает понижение концентрации натрия примерно на 1,6 мэкв/л (DiBartola, 2000). Напротив, когда введение экзогенного инсулина стимулирует транспорт глюкозы в клетки, вслед за нею в клетки поступает и вода, что приводит к увеличению концентрации натрия в плазме крови.
Концентрация калия в сыворотке крови. Обезвоживание клеток происходит по мере того, как гипергликемия и потеря воды вызывают повышение осмотического давления плазмы и ВКЖ и способствуют дальнейшему выведению воды из клеток. Вместе с водой клетки теряют калий, который также выходит во внеклеточное пространство (рис. 13-10; Kitabchi et al, 2001). Этот процесс еще более усиливается из-за наличия ацидоза и распада внутриклеточных белков, вызванного недостаточностью инсулина. Дефицит инсулина также ведет к замедлению поступления калия внутрь клеток. Осмотический диурез, обусловленный гликозурией и кетонурией, сопровождается выведением большого количества калия с мочой. Вторичный гиперальдостеронизм, индуцированный уменьшением объема плазмы, в сочетании с потерями калия через желудочно-кишечный тракт и уменьшением его потребления с кормом способствует дальнейшему усилению недостаточности калия в организме (Kitabchi et al, 2001). В конечном счете, многие собаки и кошки с ДКА испытывают острый дефицит калия. Его концентрация в сыворотке крови может быть пониженной, нормальной или аномально высокой в за
висимости от продолжительности заболевания, состояния почек или питания в предыдущем периоде. У большинства животных до появления ДКА концентрация калия находится в норме или понижена (см. рис. 13-9). Из 72 собак и 42 кошек, страдавших ДКА, на момент установления диагноза гипокалиемия была соответственно у 43 и 67%, а гиперкалиемия - у 10 и 7% (Bruskiewicz et al, 1997).
Знание концентрации калия в сыворотке крови и состояния почечной функции имеет первостепенное значение для решения вопроса о целесообразности агрессивного заместительного введения калия в составе жидкостей для внутривенной инфузии. Животные с полиурическим ДКА предрасположены к тяжелой гипокалиемии, тогда как олигурия и анурия предрасполагают к тяжелой гиперкалиемии. Введение инсулина стимулирует транслокацию калия из ВКЖ во внутриклеточную жидкость (ВнуКЖ), что в сочетании с его потерей через почки и желудочно-кишечный тракт приводит к тяжелой гипокалиемии на протяжении первых 24-48 часов лечения ДКА. Обнаружение гипокалиемии у собаки или кошки при первичном обследовании требует интенсивной заместительной терапии посредством внутривенного введения содержащих калий жидкостей с целью восполнения его дефицита и предотвращения дальнейшего усугубления гипокалиемии (см. стр. 656).
Азот мочевины и креатинин в крови. При ДКА обычно повышаются концентрации азота мочевины (AM) и креатинина в крови (рис. 13-11). Оба эти параметра используются как индикаторы степени уменьшения объема плазмы. Их оценка в сочетании с определением удельного веса мочи и отношения концентраций кальция и фосфора в сыворотке позволяет дифференцировать сопутствующие первичную почечную недостаточность и преренальную азотемию. Кроме того, исходные концентрации AM или креатинина могут служить
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
647
s
о
ф о s то н о т ТО к
си
ф
о
0
200-
150-
100-
50-
1.050-
1.040-
О
g 1.030-
ф £1.020-
1.010-
мальный диапазон
72 собаки 20 кошек сДКА сДКА
1.000
72 собаки 20 кошек
сДКА сДКА
Рис. 13-11. Средняя концентрация азота мочевины в крови, ее колебания и удельный вес мочи при установлении диагноза диабетический кетоацидоз у 72 собак и 20 кошек.
контрольными показателями при характеристике эффективности жидкостной терапии. Быстрое уменьшение уровня AM в крови свидетельствует о правильности выбора данного вида жидкостной терапии, достаточной продукции мочи и наличии у собаки или кошки преренальной азотемии. Сохранение повышенной концентрации AM или ее слишком медленное снижение предполагает слабую эффективность терапии или наличие первичной почечной недостаточности.
Повышение концентрации креатинина может быть ложным из-за влияния на результаты его определения присутствующего в крови ацетоацетата (одного из кетоновых тел). При концентрации ацетоацетата в сыворотке от 8 до 10 ммоль/л концентрация креатинина ложно повышается на 3-4 мг/100 мл при ее определении с помощью автоматического анализатора фирмы Beckman и на 1-2 мг/100 мл при использовании анализатора фирмы Technicon. Если концентрацию сывороточного креатинина определяют вручную, результаты измерения не зависят от концентрации кетоновых тел (Molitch et al, 1980; Nanji, Campbell, 1981).
Осмоляльность сыворотки крови. Гиперосмоляльность сыворотки является возможным тяжелым осложнением ДКА, оказывающим сильное воздействие на функцию ЦНС и сознание. Из всех факторов, способствующих возникновению ступора и других нарушений сознания, включая концентрацию глюкозы и кетоновых тел в крови, а также pH артериальной крови, осмоляльность сыворотки наиболее тесно связана с состоянием сознания у пациентов с ДКА. «Затемненное сознание» - это в высшей степени субъективное определение состояния
человека, поэтому идентификация аналогичного явления у собак и кошек остается областью догадок и предположений. Тем не менее, ветеринары и владельцы обычно легко выявляют наличие «депрессии» у этих животных. По нашему опыту, тяжесть данного состояния грубо коррелирует со степенью гиперосмоляльности.
К счастью, тяжелая гиперосмоляльность (более 400 мОсм/кг) редко встречается у собак и кошек с ДКА, отчасти благодаря обычно сопутствующей гипонатриемии (см. рис. 13-9). Концентрация натрия в сыворотке крови и, в меньшей степени, калия и глюкозы служат главными детерминантами эффективной осмоляльности сыворотки. Гиперосмоляльность обычно устраняют, назначая внутривенное введение изотонической жидкости и инсулинотерапию. Коррекцию гиперосмоляльного состояния следует производить постепенно, чтобы свести к минимуму переход воды из внеклеточного во внутриклеточное пространство.
Многие ветеринарные клиники, особенно оказывающие большой объем неотложной помощи, оснащены необходимым оборудованием для прямого измерения осмоляльности сывороток или плазмы крови. Осмоляльность сыворотки можно рассчитать и косвенным путем, исходя из связанных с ней параметров, и использовать полученный результат для выбора адекватной инфузионной или инсулиновой терапии. Эффективную осмоляльность сыворотки или плазмы крови находят по следующей формуле:
Осмоляльность = 2(Na+ + К+) + 0,5 (глюкоза)
(мОсм/кг) (мэкв/л) (мг/100 мл)
648 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
В состоянии инсулиновой недостаточности замедление внутриклеточного транспорта глюкозы в зависимых от инсулина тканях и увеличение ее концентрации во внеклеточном пространстве способствуют созданию осмотического градиента между ВКЖ и ВнуКЖ. По этой причине концентрация глюкозы включена в формулу для расчета эффективной осмоляльности. В отличие от этого, мочевина по-прежнему свободно проникает через клеточную мембрану независимо от уровня инсулинемии, поэтому ее концентрация не учитывается при расчете эффективной осмоляльности сыворотки. Нормальная эффективная осмоляльность сывороток у собак и кошек составляет от 280 до 300 мОсм/кг.
Анионная разница. Метаболический ацидоз, обусловленный гиперкетонемией, представляет собой ацидоз с анионным интервалом, который следует отличать от аналогичного состояния, вызываемого другими факторами (такими как лактоацидоз, почечная недостаточность, интоксикация этиленгликолем) и от гиперхлоремического ацидоза (Narins et al, 1994). Анионную разницу рассчитывают, вычитая сумму измеренных концентраций отрицательно заряженных анионов - хлоридов и бикарбоната из суммы концентраций наиболее важных положительно заряженных катионов - натрия и калия. Нормальная анионная разница для собак и кошек составляет 12-16 мэкв/л (Feldman, Rosenberg, 1981). Ее значение выше 16 мэкв/л указывает на наличие ацидоза с анионным интервалом. Неизмеренные анионы, которые в норме также влияют на величину анионного интервала, включают альбумин и другие сывороточные белки, сульфаты, фосфаты и разнообразные органические кислоты.
В типичных случаях у собак и кошек с сахарным диабетом анионная разница колеблется от 20 до 35 мэкв/л, а ее увеличение выше базального уровня приблизительно соответствует уменьшению концентрации сывороточного бикарбоната (Adrogue et al, 1982). Самые разнообразные факторы могут вызывать нарушение нормальной стехиометрии между задержкой кислоты, увеличением анионного интервала и уменьшением концентрации бикарбоната в сыворотке (табл. 13-4). Такое нарушение обычно при ДКА, поскольку выведение кетонов (анионов) с мочой вызывает непропорционально большое снижение концентрации бикарбоната в сыворотке по сравнению с увеличением анионной разницы. В этих случаях недостающий кетоанион
ТАБЛИЦА 13-4. ВЛИЯНИЕ ОБЫЧНЫХ ОБМЕННЫХ НАРУШЕНИЙ НА РАСЧЕТНУЮ ВЕЛИЧИНУ АНИОННОЙ РАЗНИЦЫ*
Увеличенная анионная разница
Диабетический кетоацидоз
Лактоацидоз
Тканевая ишемия и/или гипоксемия Сепсис
Злокачественная опухоль
Лекарственные средства
Идиопатические причины
Хроническая почечная недостаточность
Лекарственные препараты
Салицилаты
Этиленгликоль
Другие
Нормальная анионная разница
Диарея
Почечно-канальцевый ацидоз
Гиперхлоремический ацидоз
Соляная кислота или ее предшественники (т.е. хлорид аммо-ния и другие)_____________________________________
* Эти расстройства часто ассоциируются с метаболическим ацидозом
заменяется хлоридом, и ацидоз с анионным интервалом зачастую включает компонент гиперхлоремического ацидоза (табл. 13-5; Adrogue et al, 1982 и 1984). Собаки и кошки, у которых уменьшается объем крови, обычно имеют чистый ацидоз с анионным интервалом, потому что понижение СКФ и способности почечных клубочков реабсорбировать натрий ограничивает выведение кетоновых тел с мочой. И наоборот, животным с ДКА, у которых сохраняется нормальное всасывание соли и воды, удается избежать значительного уменьшения объема крови. Такие особи характеризуются разной степенью тяжести гиперхлоремического ацидоза из-за экскреции с мочой кетоновых солей и сопровождающей ее задержки хлоридов (табл. 13-5).
Полная база данных
Общий клинический анализ крови. Общий клинический анализ крови (ОАК) при неосложненном ДКА обычно выявляет лейкоцитоз в отсутствие токсических нейтрофилов (Bruskiewicz et al, 1997). Лейкоцитоз может быть и вторичным, т.е. следствием высвобождения «гормонов стресса»
ТАБЛИЦА 13-5. ПРИМЕРЫ КОНЦЕНТРАЦИЙ ЭЛЕКТРОЛИТОВ В СЫВОРОТКЕ КРОВИ И СООТВЕТСТВУЮЩЕЙ АНИОННОЙ РАЗНИЦЫ ПРИ АЦИДОЗЕ
Натрий (мэкв/л) Калий (мэкв/л ) Хлорид (мэкв/л) Бикарбонат (мэкв/л) Анионная разница (мэкв/л)
Норма 142 4 108 22 12
Гиперхлоремический ацидоз 142 4 118 12 12
Ацидоз с анионной разницей 142 4 108 12 22
Анионная разница = Na - (Cl + бикарбонат).
Нормальная анионная разница составляет от 12 до 16 мэкв/л
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 649
или тяжелого воспалительного процесса, особенно на фоне панкреатита. Количество лейкоцитов, превышающее 30000/мл, наличие токсических или дегенеративных нейтрофилов или выраженный сдвиг влево в сторону преобладания незрелых клеток подтверждает роль тяжелого воспалительного и/или инфекционного процесса как причины лейкоцитоза. Количество эритроцитов и показатель гематокрита должны соответствовать уровню гемоконцентрации как вторичному результату дегидратации. Падение гематокрита ниже 35% у этих животных, для которых характерно уменьшение объема плазмы, предполагает потерю крови или значительное подавление кроветворной функции костного мозга, или другие нарушения, приводящие к анемии.
Ферменты печени и общий билирубин. Клинико-патологические изменения, затрагивающие функцию печени, весьма часто встречаются у собак и кошек с ДКА. Обычно они обусловлены печеночным липидозом, панкреатитом, тяжелым ацидозом, гиповолемией, гипоксией, сепсисом и реже непроходимостью внепеченочных желчных протоков, хроническим гепатитом или холангиогепатитом (см. стр. 667). Одновременно повышаются концентрации аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и щелочной фосфатазы (ЩФ) в сыворотке крови (см. стр. 535). Реже возрастают концентрации желчных кислот натощак и общего билирубина в сыворотке крови, а желтуха развивается еще реже. У некоторых собак и кошек не удается установить специфическую причину аномального профиля печеночных ферментов. Достоверной корреляции между концентрацией ферментов печени в сыворотке крови и наличием или тяжестью гепатопатии не выявлено.
Ферменты поджелудочной железы. Поскольку острый и хронический панкреатит очень часто встречается у собак и кошек в сочетании с ДКА, во всех случаях диагностическое обследование должно быть направлено на его выявление (Bruskiewicz et al, 1997). Как показывает наш опыт, УЗИ брюшной полости является единственным оптимальным способом диагностики панкреатита у собак и кошек с ДКА (см. рис. 12-10, стр. 600). Также рекомендуется определение концентраций липазы и трипсиноподобной иммунореактивности (ТПИ) в сыворотке крови. Теоретически у собак и кошек с активным воспалительным процессом в поджелудочной железе концентрации липазы и ТПИ в сыворотке крови должны быть повышены. К сожалению, оба этих показателя не всегда точно коррелируют с наличием или отсутствием панкреатита (Hess et al, 1998; Swift et al, 2000; Gerhardt et al, 2001). Концентрация панкреатических ферментов может быть повышена у собак и кошек с гистологически подтвержденным нормальным состоянием поджелудочной железы и оставаться в пределах нормы у животных с гистологическими признаками воспаления железы, особенно если воспалительный процесс слабо выражен и имеет хронический характер. По этой причине
результаты определения концентраций липазы и ТПИ всегда следует интерпретировать в контексте данных анамнеза, физикального исследования и дополнительных лабораторных анализов. Обнаружение панкреатита у собак и кошек с ДКА имеет важное значение с точки зрения выбора способов первоначальной инфузионной терапии и последующей диетотерапии, а также прогноза заболевания. К счастью, агрессивная инфузионная терапия является краеугольным камнем лечения как ДКА, так и панкреатита, поэтому в большинстве случаев лечение одного из этих заболеваний благоприятно сказывается на клиническом течении другого.
Кальций и фосфор. У собак с сахарным диабетом или у кошек с «неосложненным» ДКА обычно сохраняются нормальные концентрации кальция и фосфора в сыворотке крови. При сопутствующем нарушении почечной функции концентрация кальция, как правило, остается в норме, но концентрация фосфора повышается. При панкреатите возможна слабая вторичная гипокальциемия, обусловленная резким усилением поступления кальция в мягкие ткани (например, в мышечную ткань) в результате нарушения целостности клеточных оболочек, изменения секреции тиреокальцитонина или тканевой чувствительности к паратиреоидному гормону, гипомагниемии, гипопротеинемии и отложения кальция в бляшках сапонифицированного жира. Гиперкальциемия указывает на наличие сопутствующего заболевания, в том числе на хроническую недостаточность почечной функции (см. гл. 16).
Следует обращать внимание на концентрацию фосфора в сыворотке крови у животных с ДКА, особенно в течение первых 24 часов после начала терапии. В условиях гипергликемии и гиперосмоляльности фосфор, вместе с калием, переходит из внутриклеточного во внеклеточное пространство (см. рис. 13-10; Kitabchi et al, 2001). Осмотический диурез со временем приводит к усиленному выведению фосфора с мочой. При этом его концентрация в сыворотке может быть повышенной, пониженной или оставаться нормальной в зависимости от продолжительности заболевания и состояния почечной функции. До начала терапии у большинства собак и кошек с ДКА концентрация фосфора находится в норме или понижена. Гипофосфатемия (концентрация фосфора <3,0 мг/100 мл) была обнаружена при первичном обследовании у 24% из 72 собак и у 48% из 42 кошек с ДКА (Bruskiewicz et al, 1997). В отличие от этого, гиперфосфатемия (концентрация фосфора > 6,0 мг/100 мл) имела место у 14% и 26% соответственно собак и кошек с ДКА, причем в большинстве случаев она сочеталась с почечной недостаточностью. Инсулин вызывает заметную транслокацию фосфора из ВКЖ во ВнуКЖ. В течение суток после начала терапии может произойти сильное падение концентрация фосфора (до <1 мг/100 мл) в результате эффекта разбавления, обусловленного жидкостной терапией, и продолжающегося выведения фосфора через почки
650 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
и желудочно-кишечный тракт (Willard et al, 1987). Клинические симптомы гипофосфатемии появляются при концентрации фосфора в сыворотке ниже 1,5 мг/100 мл. При этом симптомы могут быть выражены по-разному, а у многих животных тяжелая гипофосфатемия протекает бессимптомно. Уменьшение концентрации фосфора в сыворотке сказывается, прежде всего, на функции кровеносной и нейромышечной систем собак и кошек (Forrester, Moreland, 1989) . Наиболее частым и тяжелым ее последствием является гемолитическая анемия. Кроме того, гипофосфатемия сопровождается уменьшением концентрации АТФ в эритроцитах и/или изменением липидного компонента их мембран. Последнее снижает устойчивость эритроцитов к механическим воздействиям, что приводит к гемолизу (Shilo et al, 1985; Adams et al, 1993). Гемолиз обычно не выявляется до тех пор, пока концентрация фосфора в сыворотке не опустится до 1 мг/100 мл или ниже. Нераспознанная вовремя и нелеченая гемолитическая анемия приобретает угрожающий для жизни характер. Нейромышечные расстройства включают мышечную слабость, атаксию и судороги; вторичным результатом кишечной непроходимости являются анорексия и рвота. При появлении клинических признаков гемолиза или падении концентрации фосфора ниже 1,5 мг/100 мл необходимо лечение фосфор-содержащими препаратами (см. стр. 658).
Магний. Осмотический диурез при ДВА. может сопровождаться значительными потерями магния с мочой и возникновением гипомагниемии (т.е. концентрация общего магния в сыворотке крови менее 1,75 мг/100 мл, а концентрация ионизированного магния менее 1,0 мг/100 мл при его измерении в сыворотке с помощью ионо-селективного электрода) (Norris et al, 1999). Характер переноса магния между ВКЖ и ВнуКЖ сходен с характером транспорта калия в том отношении, что факторы, индуцирующие переход калия во ВнуКЖ (такие как алкалоз, инсулин или инфузия глюкозы), оказывают такое же действие и на транспорт магния. Во время лечения ДКА концентрации общего и ионизированного магния могут снижаться до очень низкого уровня (соответственно менее 1 мг/100 мл и 0,5 мг/100 мл) в результате эффекта разбавления, обусловленного жидкостной терапией, или транспорта магния во ВнуКЖ под воздействием инсулинотерапии (Norris et al, 1999). Гипомагниемия обычно клинически не проявляется до тех пор, пока концентрация общего магния в сыворотке не опустится ниже 1,0 мг/100 мл. Но даже и при такой низкой концентрации у многих животных гипомагниемия протекает бессимптомно. Недостаточность магния может вызывать ряд неспецифических клинических признаков, включая вялость, анорексию, мышечную слабость (в том числе дисфагию и одышку), мышечную фас-цикуляцию, судороги, атаксию и кому ( Martin et al, 1993 ; Abbott, Rude, 1993 ; Dhupa, Proulx, 1998). Гипомагниемия у животных сопровождается гипо
калиемией, гипонатриемией и гипокальциемией, хотя частота нарушений концентрации этих электролитов разная у кошек и собак. Эти нарушения могут способствовать клиническому проявлению гипомагниемии. Магний является кофактором многих ферментативных процессов, проходящих с участием АТФ; одним из самых важных среди них является №+,К+-АТФазный насос. Недостаточность магния приводит к выведению калия из организма, а развивающаяся при этом гипокалиемия может оказаться резистентной к заместительной терапии. Кроме того, при дефиците магния подавляется секреция ПТГ из паращитовидных желез, что служит причиной гипокальциемии (Bush et al, 2001). Недостаток магния вызывает падение потенциала покоя на мембранах клеток миокарда и, тем самым, повышает возбудимость волокон Пуркинье, способствуя в дальнейшем возникновению сердечной аритмии (Abbot, Rude, 1993). Электрокардиограммы, полученные на фоне гипомагниемии, характеризуются удлинением интервала PR, расширением комплекса QRS, уменьшением сегмента ST и заострением зубца Т. К числу нарушений сердечного ритма, обусловленных недостаточностью магния, относятся фибрилляция предсердий, желудочковая фибрилляция, наджелудочковая и желудочковая тахикардия. Наконец, гипомагниемия предрасполагает к развитию сердечной аритмии у животных, получающих препараты наперстянки.
К сожалению, оценка уровня магниемии у животных затруднена из-за отсутствия быстрых, простых и точных методов определения общего магния. Только около 1% всего имеющегося в организме магния находится в сыворотке, поэтому результаты определения магния в сыворотке не всегда отражают его общее содержание в организме. Концентрация этого элемента в сыворотке может оставаться нормальной, несмотря на его недостаток в клетках. В крови магний присутствует в трех основных формах: в виде ионов, в комплексе с анионами и в составе белковых комплексов. Концентрация ионизированного магния, измеряемая с помощью ионо-селективного электрода, наиболее точно отражает общее содержание этого элемента в организме и поэтому именно этому методу отдается предпочтение перед определением общего магния в сыворотке (Norris et al, 1999b). К счастью, гипомагниемия обычно не имеет клинических проявлений у животных с ДКА и ее заместительная терапия с использованием экзогенного магния не проводится, если только у собак и кошек не возникают осложнения, обусловленные дефицитом магния (такие, как постоянно сонливое состояние, анорексия или рефракторная гипокалиемия).
Холестерин и триглицериды. У собак и кошек в отсутствие лечения ДКА нередко развиваются гиперлипидемия и явная липемия, обусловленная гипертриглицеридемией. Механизм возникновения гиперлипидемии описан в гл. 11, стр. 536. Большинство нарушений липидного обмена купи
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 651
руются интенсивной инсулинотерапией и диетотерапией.
В зависимости от методов, используемых в той или иной лаборатории, гипертриглицеридемия, приводящая к липемии, может влиять на результаты ряда рутинных биохимических анализов (табл. 13-6). Кроме того, липемия может индуцировать гемолиз, который, в свою очередь, тоже искажает результаты ряда определений. Эти возможные искажения следует принимать во внимание при интерпретации данных биохимических анализов у собак и кошек с ДКА и гиперлипидемией.
Диагностическая визуализация. Диабетическому кетоацидозу у собак и кошек часто сопутствуют другие заболевания, такие как острый и хронический панкреатит, пиометра, холангиоге-патит, сердечная недостаточность и бактериальная пневмония. Многие из этих заболеваний придают обменным расстройствам, свойственным ДКА, необратимый характер, и успешное лечение ДКА невозможно без их диагностики и устранения. Для подтверждения патологических изменений, обнаруженных при анамнестическом анализе или физикальном исследовании, а также для выявления новых нарушений неоценимое значение имеют рентгенологическое исследование брюшной и грудной полостей, а также УЗИ брюшной полости. В нашей клинике эти исследования проводятся при любом диагностическом обследовании больных собак и кошек с ДКА, но обычно после анализа наиболее важных результатов лабораторных исследований (например, кетоацидотического профиля) и начала лечения ДКА.
Электрокардиографическое исследование (ЭКГ). ЭКГ остается одним из самых дешевых, простых и информативных методов выявления сердечной аритмии и мониторинга изменений концентрации калия в сыворотке во время терапии ДКА. Применение ЭКГ особенно полезно для диагностики тяжелых гипогликемии или гипергликемии в тех
клиниках, которые из-за недостатка средств не располагают стационарными химическими анализаторами для частых повторных определений концентрации калия в сыворотке крови. При поступлении животного с ДКА в ветеринарную клинику у него берут пробу крови для измерения исходной концентрации калия (до начала лечения) и проводят полное ЭКГ во II отведении. Полученную характеристику сердечного ритма сопоставляют с результатом параллельного определения уровня калия в крови и используют в качестве «калибровочного» параметра. Сравнение с ним вновь получаемых показателей сердечного ритма позволяет определить соответствующую каждому из них концентрацию калия в сыворотке.
Основное внимание до и после начала терапии ДКА должно уделяться гипокалиемии. Исчерпывающие данные о результатах ЭКГ при гиперкалиемии представлены в гл. 8. Необходимо подчеркнуть, что гипокалиемия обычно вызывает лишь слабые изменения ЭКГ, особенно когда концентрация калия превышает 3 мэкв/л (табл. 13-7, рис. 13-12). При концентрации калия от 2,5 до 3,0 мэкв/л изменения ЭКГ выражены сильнее, а при его концентрациях ниже 2,5 мэкв/л они имеют место практически у всех обследуемых животных.
Наиболее значительным электрофизиологическим изменением при гипокалиемии является постепенное смещение волны реполяризации от систолы к диастоле. При этом на ЭКГ особенно заметно удлинение интервала Q-T. Дополнительные изменения ЭКГ включают прогрессивное подавление сегмента S-Т, уменьшение амплитуды зубца Т и волну реполяризации, следующую за зубцом Т (зубец U). При тяжелой гипокалиемии возрастают длительность и амплитуда комплекса QRS. Считается, что диффузное расширение комплекса QRS происходит в результате общего замедления скорости проведения в желудочковом отделе миокарда или волокнах Пуркинье. Одновременно увеличиваются ширина и амплитуда зубца Р и несколько удлиняется интервал
ТАБЛИЦА 13-6. ВЛИЯНИЕ ЛИПЕМИИ НА СОДЕРЖАНИЕ КЛИНИЧЕСКИ ЗНАЧИМЫХ ПАРАМЕТРОВ* В СЫВОРОТКАХ КРОВИ СОБАК И КОШЕК
Ложно завышенные показатели Ложно заниженные показатели
Сыворотка собак Сыворотка кошек Сыворотка собак Сыворотка кошек
Общий билирубин Общий билирубин Креатинин Креатинин
Конъюгированный билирубин Конъюгированный билирубин Общий СО2 Общий СО2
Фосфор Щелочная фосфатаза + Глюкоза + Общий белок ++ Липаза АЛТ Фосфор Щелочная фосфатаза + Глюкоза + Общий белок ++ Холестерин Азот мочевины АЛТ
Из: Jacobs RM et al: Effects of bilirubinemia, hemolysis, and lipemia on clinical chemistry analytes in bovine, canine, equine, and feline sera. Can Vet J, 33:605, 1992.
*) Определения производились с использованием анализатора Coulter DACOS (Coulter Diagnostics, США) .
+) Искажение результатов только при очень высоких концентрациях липидов.
++ ) При измерениях рефрактометрическим методом.
АЛТ - аланинаминотрансфераза.
652
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Высокий и расширенный зубец Р, удлиненный интервал PR
Рис. 13-12. Влияние уровня калия в сыворотке крови на профиль электрокардиограммы (ЭКГ). Для наглядности изменения представлены в увеличенном масштабе. На практике эти изменения могут быть весьма незначительными, что указывает на необходимость иметь базальные показатели ЭКГ наряду с результатами одновременного определения концентрации калия.
ТАБЛИЦА 13-7.
ЭЛЕКТРОКАРДИОГРАФИЧЕСКИЕ ИЗМЕНЕНИЯ, ОБУСЛОВЛЕННЫЕ ГИПОКАЛИЕМИЕЙ И ГИПЕРКАЛИЕМИЕЙ
У СОБАК И КОШЕК
Гипокалиемия
Уменьшение амплитуды зубца Т Подавление сегмента S-T Удлинение интервала Q-T Выраженный зубец U
Аритмии
Наджелудочковая Желудочковая
Г иперкалиемия
Заостренный зубец Т Уплощенный зубец Р Удлинение интервала P-R Удлинение интервала QRS Уменьшение амплитуды зубца R Брадикардия
Полная сердечная блокада Желудочковые аритмии Остановка сердца
Р-R. При гипокалиемии возможны также преждевременные сокращения желудочков и предсердия.
ТЕРАПИЯ «ЗДОРОВЫХ» ЖИВОТНЫХ С ДИАБЕТИЧЕСКИМ КЕТОЗОМ
У больных сахарным диабетом собак и кошек может развиться кетонурия, но отсутствовать метаболический ацидоз (т.е. диабетический кетоз, ДК). Если нет клинических проявлений плохо компенсированного диабета, такие животные выглядят относительно здоровыми. ДК может иметь место у собак и кошек с впервые диагностируемым сахарным диабетом или в условиях инсулинотерапии. В последнем случае наличие кетонурии свидетельствует о слабой эффективности инсулинотерапии обычно из-за неправильного выбора режима лечения и/или появления сопутствующего диабету заболевания или расстройства (например, инертности, плохого аппетита или рвоты). Мы обычно лечим собак и кошек с ДК и без системных признаков заболевания кристаллическим инсулином с короткой продолжительностью действия (производства Eli Lilly and Со, США), вводя его подкожно через каждые
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 653
8 часов до исчезновения кетонурии. Кристаллический инсулин обладает высокой активностью, поэтому его начальная доза 0,1-0,2 ЕД/кг на инъекцию ниже рекомендуемой дозы препаратов инсулина, обладающих более продолжительным действием. Для сведения к минимуму риска гипогликемии владелец животного, получающего инсулинотера-пию, должен давать ему треть суточного рациона во время каждой инъекции препарата. Дальнейшую коррекцию дозы инсулина осуществляют на основании результатов определения концентрации глюкозы в крови (см. стр. 551 и 601). Одновременно контролируют концентрацию кетоновых тел в моче. При удовлетворительном контроле гликемии концентрация кетоновых тел в крови и моче понижается. Хотя время, необходимое для купирования кетонурии, сильно варьирует, у большинства собак и кошек кетоновые тела исчезают из мочи в течение 3-5 дней после начала введения кристаллического инсулина трижды в день. Однако у некоторых животных прекращение избыточной продукции кетоновых тел в печени происходит не ранее чем через несколько недель после начала терапии. Такая длительная кетонурия или ее рецидивы свидетельствуют о наличии сопутствующего заболевания, вызывающего инсулинорезистентность и/или гиперглюкагонемию.
Собак и кошек с сахарным диабетом и кетозом мы всегда госпитализируем, чтобы начать терапию ежедневными трехкратными инъекциями кристаллического инсулина в условиях стационара. После подбора дозы кристаллического инсулина, обеспечивающей приемлемый контроль уровня гликемии, мы возвращаем животное владельцу и даем ему указание придерживаться избранного режима терапии, особенно если кетонурия еще сохраняется. После ее устранения и при условии стабильного состояния животного мы предлагаем перейти на двукратное в течение суток введение инсулина с большей продолжительностью действия (см. гл. 11 и 12). Начальная доза такого препарата эмпирически выбирается равной дозе кристаллического инсулина, которую животное получает на момент замены, а в последующем она корректируется на основании реакции животного на новый препарат.
ТЕРАПИЯ БОЛЬНЫХ ЖИВОТНЫХ С ДИАБЕТИЧЕСКИМ КЕТОАЦИДОЗОМ (ТАБЛ. 13-8)
Цель лечения комнатных животных с тяжелым ДКА состоит в том, чтобы (а) обеспечить его адекватным количеством инсулина для нормализации нарушенного промежуточного обмена, (б) восполнить потери воды и электролитов, (в) устранить ацидоз, (г) выявить факторы, вызвавшие данное заболевание, (д) при необходимости обеспечить животное углеводным субстратом. Адекватная терапия не преследует цель как можно быстрее нормализовать состояние больного животного. Чрез
мерно агрессивная терапия может вызвать столь же нежелательные изменения осмотического давления и биохимических параметров, как и сам болезнетворный процесс, а слишком быстрое изменение жизненно важных процессов может быть таким же или еще более вредным, чем отсутствие изменений. Успех терапии более вероятен при постепенной, например, в течение 36-48 часов нормализации нарушенных показателей.
Инфузионная терапия (рис. 13-13)
Инфузионная терапия является первым этапом лечения ДКА. Восполнение недостатка жидкости в организме и поддержание нормального водного баланса имеют первостепенное значение для сохранения адекватной работы сердца, нормального кровяного давления и кровоснабжения всех тканей. Особенно большое значение имеет улучшение почечного кровотока. Помимо общего благоприятного действия на обезвоженное животное, жидкостная терапия помогает устранить недостаточность общего натрия и калия в сыворотке, ослабить депрессивное действие инсулина на концентрацию калия и снизить уровень глюкозы в крови даже в отсутствие инъекций инсулина (см. табл. 13-7) . Введение жидкости усиливает экскрецию глюкозы благодаря повышению скорости клубочковой фильтрации и выделения мочи, а также подавляет секрецию диабетогенных гормонов, стимулирующих гипергликемию. Постепенное уменьшение концентрации глюкозы в плазме крови в сочетании с заменой глюкозы натрием в ВКЖ позволяет свести к минимуму внутриклеточный транспорт воды под воздействием резкого снижения осмоляльности ВКЖ и тем самым предотвратить отек мозга (см. стр. 670). К сожалению, инфузионная терапия сама по себе не приводит к уменьшению концентрации ацетоацетата и бета-оксимасляной кислоты и не снижает тяжести метаболического ацидоза (Foster, McGarry, 1983; Lebovitz, 1995). В связи с этим сохраняется потребность в инсулине.
Состав и скорость введения жидкостей. Выбор жидкости для первоначального парентерального введения определяется состоянием электролитного баланса животного, концентрацией глюкозы в крови и осмоляльностью. За редким исключением, все собаки и кошки с ДКА испытывают острый дефицит общего натрия независимо от его концентрации в сыворотке (см. стр. 645). Считается, что избыточная экскреция натрия с мочой является следствием осмотического диуреза, индуцируемого гликозурией и кетонурией, а также недостаточностью инсулина. Инсулин усиливает реабсорбцию натрия в дистальном отделе почечного нефрона, а в отсутствие этого гормона происходит потеря натрия. Гиперглюкагонемия, рвота и диарея еще больше усиливают экскрецию натрия при ДКА.
Для первоначальной инфузии обычно используют 0,9%-ный (физиологический) раствор, содержа-
654
ДИАБЕТИЧЕСКИМ КЕТОАЦИДОЗ
ТАБЛИЦА 13-8. ПЕРВОНАЧАЛЬНОЕ ЛЕЧЕНИЕ СОБАК И КОШЕК С ТЯЖЕЛЫМ ДИАБЕТИЧЕСКИМ КЕТОАЦИДОЗОМ
Инфузионная терапия
Жидкость: сначала 0,9% физиологический раствор.
Скорость: сначала 60-100 мл/24 часа с последующей коррекцией по результатам оценки степени дегидратации, продукции мочи и устойчивой потери жидкости.
Заместительное введение калия: исходя из концентрации К+ в сыворотке крови; если она неизвестна, то сначала на каждый литр жидкости добавляют 40 мэкв КС1.
Заместительное введение фосфора: проводится, если концентрация фосфора в сыворотке крови <1,5 мг/100 мл или развивается гемолитическая анемия; исходная скорость внутривенной инфузии 0,01-0,03 ммоль/кг/час в составе бескальциевых жидкостей (например, 0,9% физиологического раствора).
Заместительное введение декстрозы: не показано, пока концентрация глюкозы в крови не приблизится к 250 мг/100 мл, после чего начинают инфузию 5% раствора декстрозы.
Терапия бикарбонатом
Показание: проводится, если концентрация бикарбоната в плазме крови < 12 мэкв/л или концентрация общего СО2 в венозной крови < 12 ммоль/л; если она неизвестна, то бикарбонат вводят только один раз после значительного ухудшения состояния животного.
Количество: мэкв НСО3’ = вес тела (кг) х 0,4 х (12 - концентрация НСО3‘ в сыворотке животного) х 0,5; если концентрации НСО3‘ или общего СО2 в крови животного неизвестны, то используют формулу (10 - концентрация НСО3‘) вместо (12 - концентрация НСО3)
Введение: бикарбонат добавляют в жидкости для внутривенной инфузии и вводят их на протяжении 6 часов; не допускается болюсная инфузия.
Повторное введение: проводится только в том случае, если концентрация бикарбоната в плазме крови через 6 часов после начала терапии остается ниже 12 мэкв/л
Инсулинотерапия
Препарат: кристаллический инсулин
Способ введения: Прерывистые в/м инъекции - начальная доза 0,2 Ед/кг в/м, затем 0,1 Ед/кг в/м каждый час до концентрации глюкозы в крови ~ 250 мг/100 мл, затем переход на п/к инъекции кристаллического инсулина каждые 6-8 часов. Внутривенная инфузия низких доз инсулина - начальная скорость 0,05-0,1 Ед/кг/час в 0,9% растворе NaCl (через отдельную инфузионную систему со шприцевым или инфузионным насосом) с последующей коррекцией скорости по результатам ежечасных измерений концентрации глюкозы в крови; затем переход на п/к инъекции кристаллического инсулина каждые 6-8 часов до концентрации глюкозы ~ 250 мг/100 мл.
Уменьшение дозы инсулина для в/м инъекций и в/в инфузии в течение первых 2-3 часов, если на момент установления диагноза у животного имела место гипокалиемия.
Цель: постепенное понижение концентрации глюкозы в крови, желательно со скоростью около 75 мг/100 мл/час до уровня менее 250 мг/100 мл.
Вспомогательная терапия
ДКА часто сопровождается панкреатитом; пероральная и агрессивная инфузионная терапия обычно не рекомендуется.
При ДКА нередки сопутствующие инфекции; обычно показано парентеральное введение антибиотиков с широким спектром действия.
В зависимости от природы сопутствующего заболевания может понадобиться дополнительная терапия.
Мониторинг состояния пациента
Сначала определение концентрации глюкозы в крови каждые 1-2 часа; затем коррекция инсулинотерапии и инфузия раствора декстрозы до концентрации глюкозы ~ 250 мг/100 мл.
Оценка состояния гидратации, дыхательной функции и частоты пульса каждые 2-4 часа; коррекция режима инфузионной терапии на основании полученных результатов.
Определение концентрации электролитов в сыворотке крови и общего СО2 в венозной крови каждые 6-12 часов; коррекция режима инфузионной терапии и введение бикарбоната на основании полученных результатов.
Ежедневное взвешивание, определение показателя гематокрита, температуры и кровяного давления.
Дополнительный мониторинг в зависимости от характера сопутствующего заболевания
щий необходимое количество калия, (если электролитный состав сыворотки не диктует необходимости введения иной жидкости) (рис. 13-14). Большинство собак и кошек с ДКА испытывают серьезный недостаток общего натрия, который наилучшим образом восполняется инфузией физиологического (0,9%-ного) раствора даже при осмоляльности более 390 мОсм/кг. В связи с низким содержанием натрия в организме животные не страдают даже при весьма
заметном увеличении осмоляльности несмотря на возможное значительное повышение концентрации глюкозы в плазме крови. Осмоляльность сыворотки можно измерить непосредственно или рассчитать по формуле, приведенной на стр. 647. Если нет физиологического (0,9%-ного) раствора, используют другие заместительные растворы кристаллоидов, такие как стандартный рингеровский раствор, рин-геровский раствор, содержащий лактат, Plasma-
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
655
Рис. 13-13. Схема внутривенного введения жидкостей для лечения ДКА у собак и кошек.
Lyte 148 (Baxter Healthcare Corporation, США) или Normosol-R (Abbott Laboratories, США). Все эти растворы несколько отличаются по электролитному составу, но ни один не содержит столько натрия, сколько 0,9%-ный физиологический раствор (табл. 13-9).
Содержащий лактат рингеровский раствор обогащен лактатом, а растворы Plasma-Lyte и Normosol-R содержат ацетат. В процессе метаболизма лактат и ацетат превращаются в бикарбонат. Теоретические противопоказания к использованию растворов кристаллических веществ, содержащих лактат, основываются, главным образом, на опасении по
вышения его концентрации в сыворотках крови в результате инфузии. Лактат метаболизируется в печени теми же путями, что и кетоны, поэтому гипер-кетонемия угнетает его обмен. Инфузия содержащих лактат жидкостей приводит к увеличению его концентрации в кровяном русле, а поскольку лактат является отрицательно заряженным ионом, его выделение с мочой сопровождается дальнейшим усилением экскреции натрия и калия (Macintire, 1995). Тем не менее, наш опыт показывает, что применение содержащего лактат рингеровского раствора не оказывает выраженного негативного действия на профилактику осложнений или купирование ДКА
656 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
ТАБЛИЦА13-9. СОСТАВ ЭЛЕКТРОЛИТОВВ КОММЕРЧЕСКИХ ИНФУЗИОННЫХ ЖИДКОСТЯХ
Жидкость Na* (мэкв/л) С1 (мэкв/л) К* (мэкв/л) Глюкоза (г/л) Буфер* (мэкв/л) Осмолярность (мОсм/л)
0,9% солевой раствор* 154 154 0 0 0 308
0,45% солевой раствор* 77 77 0 0 0 154
Стандартный рингеровский раствор* 147 156 4 0 0 310
Лактат-содержащий рингеровский раствор* 130 109 4 0 28 (Л) 273
Plasma-Lyte 148* 140 98 5 0 27(A) 23 (Г) 294
Normosol-R** 140 98 5 0 27(A) 23 (Г) 294
5% раствор декстрозы* 0 0 0 50 0 252
*) Используемые буферы: А - ацетат, Г - глюконат, Л - лактат.
+) производства Baxter Healthcare Corporation,США.
++) производства Abbot Laboratories, США.
у собак и кошек. Его можно использовать вместо физиологического раствора с целью сведения к минимуму нагрузки хлоридами у животных с гиперхлоремическим ацидозом, возникшим во время лечения ДКА.
Гипотонические жидкости (например, 0,45%-ный солевой раствор) редко используют для инфузии собакам или кошкам с ДКА даже при наличии тяжелой гиперосмоляльности. Они не обеспечивают ни поступления адекватного количества натрия для коррекции его недостаточности, ни восстановления нормального водного баланса или стабилизации кровяного давления. В отличие от этого, изотонические жидкости способствуют увеличению объема крови, усиливают тканевую перфузию и повышают СКФ (Lebovitz, 1995; Kitabchi, Wall, 1995). Быстрая инфузия гипотонической жидкости вызывает быстрое снижение осмоляльности ВКЖ, которое, в свою очередь, индуцирует переход воды из внеклеточного во внутриклеточное пространство, что приводит к отеку мозга, нарушению психической деятельности и, в конце концов, к коме (см. стр. 670). Для устранения гиперосмоляльности лучше всего использовать изотонические жидкости и рациональную инсулинотерапию.
Скорость введения жидкостей. Объем и скорость первоначальной инфузии жидкости зависят от тяжести шока, тяжести дегидратации, потребности животного в под держивающей терапии, концентрации белков в плазме крови, наличия или отсутствия сердечного заболевания. Степень обезвоживания организма собаки или кошки с ДКА обычно составляет от 6 до 12%. Цель заместительного введения жидкости состоит в коррекции дегидратации на протяжении 24 часов и одновременно в удовлетворении общей потребности организма в жидкости и компенсации ее текущих потерь. Быстрая инфузия обычно не рекомендуется, если только животное не находится в состоянии шока. После выведения его из этого критического состояния следует уменьшить скорость инфузии для того, чтобы медленно, но стабильно устранить дисбаланс жидкости. Начальную скорость введения жидкости эмпирически выбирают таким образом, чтобы она в 1,5-2 раза
превышала скорость поддерживающей инфузионной терапии (т.е. 60-100 мл/кг/24 часа). В последующем ее корректируют на основании результатов частой оценки степени гидратации, продукции мочи, тяжести азотемии, устойчивого характера рвоты и диареи.
Мониторинг инфузионной терапии. Необходимо контролировать как скорость, так и эффект введения жидкости. Избыточная инфузионная терапия может привести к перенасыщению организма водой, отеку легких и другим формам локализации жидкости в «третьем пространстве» с вытекающими из этого серьезными последствиями. Результатом неадекватной инфузии жидкости может быть недостаточно интенсивная перфузия тканей на протяжении длительного периода, гипоксия, сохранение ранее возникшего панкреатита, устойчивая преренальная азотемия и, возможно, возникновение первичной почечной недостаточности. При оценке эффективности инфузионной терапии руководствуются как объективными, так и субъективными критериями. К числу последних относятся тревожное состояние животного, скорость пульса, степень увлажненности слизистых оболочек, время исчезновения белого пятна (после надавливания на кожу), пульсовое давление и кожный тургор. Эти показатели подлежат мониторингу, обязательна также частая аускультация легких и сердца. Для объективной оценки проводят серийные измерения артериального давления, как непосредственно, так и косвенно с использованием допплерографии, а также центрального венозного давления (ЦВД), продукции мочи, веса тела и осмоляльности сыворотки. ЦВД должно оставаться ниже 10 см Н2О. Кроме того, собаки и кошки в условиях голодания должны ежедневно терять от 0,5 до 1% веса.
У животных с тяжелым кетоацидозом очень важное значение имеет контроль продукции мочи. Индуцируемая сахарным диабетом гломерулярная микроангиопатия и/или гемодинамические эффекты кетоацидоза могут приводить к олигурической или анурической почечной недостаточности. Отсутствие образования мочи на протяжении нескольких часов после начала инфузионной терапии слу-
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
657
Рис. 13-14. Калиевая терапия ДКА.
жит тревожным сигналом, который должен быть своевременно воспринят и служит основанием для принятия решительных мер. Если появились сомнения в способности животного нормально продуцировать мочу, в мочевой пузырь вводят катетер, соединенный с закрытой системой сбора жидкости. Пальпация мочевого пузыря не является точным методом оценки продукции мочи, важно обеспечить ее регулярный и более достоверный мониторинг. По истечении первой фазы инфузионной терапии продукция мочи должна быть не меньше 1,0 - 2,0 мл/кг веса тела в течение 1 часа. В случае ее очень слабой продукции необходимо убедиться
в проходимости мочевого катетера и оценить адекватность проводимой терапии (измерив, например, ЦВД и/или артериальное кровяное давление, либо проанализировав субъективные признаки избыточного или недостаточного количества жидкости в организме) . После этого предпринимают попытку нормализовать продукцию мочи, в частности, посредством введения диуретиков или инфузии дофамина (см. стр. 664).
Важным подспорьем инфузионной терапии служат частые (лучше всего через каждые 6-8 часов на протяжении ее начальной стадии) измерения концентрации натрия и калия в сыворотке, общего СО2
658 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
в венозной крови или газовый анализ артериальной крови. Неотъемлемым компонентом инфузионной терапии является коррекция нарушенного баланса электролитов. Если после первых 6-8 часов терапии концентрация натрия составляет от 140 до 155 мэкв/л, инфузионную жидкость следует заменить на стандартный или содержащий лактат рингеров-ский раствор, содержание натрия в котором ниже, чем в обычном физиологическом растворе (см. табл. 13-9). Если же концентрация натрия в сыворотке падает ниже 140 мэкв/л, то животное должно получать обычный 0,9% физиологический раствор. При концентрации натрия более 155 мэкв/л производят инфузию 0,45%-ного солевого раствора или смесь физиологического раствора и 5%-ного раствора декстрозы в соотношении 50:50. Иногда замену одного инфузионного раствора другим приходится повторять несколько раз на протяжении первых 24 часов терапии.
Заместительное введение калия (см. рис. 13-14). Большинство собак и кошек с ДКА испытывают дефицит общего калия в организме, прежде всего из-за значительных потерь этого элемента вследствие осмотического диуреза, ассоциирующегося с гликозурией и кетонурией. Многие животные с ДКА имеют исходно нормальную или пониженную концентрацию калия в сыворотке (см. рис. 13-9, и стр. 645). У отдельных животных она может быть повышенной, низкой или нормальной в зависимости от продолжительности заболевания, состояния почечной функции или характера питания. Во время терапии ДКА концентрация калия в сыворотке понижается в результате регидратации (эффект разбавления), индуцируемого инсулином включения калия (вместе с глюкозой) в клетки, продолжающихся потерь мочи и коррекции ацидемии (перехода калия во ВнуКЖ). Собаки и кошки с гипокалиемией нуждаются в интенсивной заместительной терапии с целью восполнения недостаточности калия и предотвращения прогрессирования угрожающего жизни состояния после начала инсулинотерапии. Нормальный физиологический раствор не содержит калия, а в рингеровском растворе его концентрация составляет 4 мэкв/л, поэтому в эти жидкости следует внести дополнительное количество калия, особенно если его исходная концентрация в сыворотке была нормальной или пониженной. Однако в случаях олигурической почечной недостаточности калий следует вводить только после восстановления нормальной клубочковой фильтрации, увеличения продукции мочи и устранения гиперкалиемии.
В идеале, количество калия, необходимое для введения животным, определяется на основании результатов прямого измерения его концентрации в сыворотке (табл. 13-10). Если это невозможно, то на каждый литр инфузионной жидкости добавляют калий в количестве 40 мэкв/л (36 мэкв/л в ринге-ровский раствор). В дальнейшем количество калия корректируют на основании определения его кон-
ТАБЛИЦА 13-10. РУКОВОДСТВО ПО ЗАМЕСТИТЕЛЬНОМУ ВВЕДЕНИЮ КАЛИЯ В СОСТАВЕ ЖИДКОСТЕЙ ДЛЯ ВНУТРИВЕННОЙ ИНФУЗИИ
СТАНДАРТНОЕ РУКОВОДСТВО РУКОВОДСТВО ДЛЯ ДКА
Концентрация Добавка К* на Добавка К* на литр
К* (мэкв/л) литр жидкости ЖИДКОСТИ
>5,0 Выжидание Выжидание
4,0-5,5 10 20-30
3,5-4,0 20 30-40
3,0-3,5 30 40-50
2,5-3,0 40 50-60
2,0-3,5 60 60-80
<2,0 80 80
Общее количество ежечасно вводимого калия не должно превышать 0,5 мэкв/кг
центрации в сыворотке, которое желательно проводить через каждые 6 или 8 часов, добиваясь нормализации уровня электролитов и общего состояния животного. Альтернативный подход состоит в периодическом использовании ЭКГ для выявления изменений, свидетельствующих о гиперкалиемии или гипокалиемии (см. табл. 13-7). Если до начала инфузионной терапии параллельно провести ЭКГ и измерить концентрацию калия в крови, то в ходе последующего наблюдения можно использовать ЭКГ в качестве недорогого и достаточно надежного способа выявления нежелательных изменений уровня калия.
Заместительное введение фосфата. В зависимости от продолжительности заболевания и состояния почечной функции концентрация фосфора в сыворотках собак и кошек может быть нормальной, повышенной или пониженной, но у большинства собак и кошек с ДКА до начала жидкостной терапии она находится в норме или понижена. В течение 24 часов после начала инфузии концентрация фосфора в сыворотке может упасть до очень низкого уровня (менее 1 мг/100 мл) вследствие эффекта разбавления крови вводимой жидкостью, внутриклеточного транспорта фосфора и его продолжающейся потери через почки и желудочно-кишечный тракт (Willard et al, 1987). Гипофосфатемия в первую очередь сказывается на активности гематологической и нервномышечной систем кошек и собак (Forrester, Moreland, 1989) . Особенно часто развивается гемолитическая анемия, которая может принять угрожающий характер, если ее вовремя не распознать и не лечить (см. стр. 671). Нередки также общая слабость, атаксия и судороги. В то же время у многих особей тяжелая гипофосфатемия может протекать бессимптомно.
Терапия фосфатами показана собакам и кошкам, имеющим клинические проявления гемолиза, или если концентрация фосфора в сыворотке крови ниже 5 мг/100 мл. Фосфаты натрия и калия вводят в состав инфузионных жидкостей в количестве 3 ммоля фосфата и либо 4.4 мэкв калия, либо 4 мэкв натрия на миллилитр. Рекомендуемые дозы замес
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 659
тительной терапии фосфатами составляют от 0,01 до 0,03 ммоль/кг/час в инфузионных жидкостях, не содержащих кальция (например, 0,9%-ный раствор хлористого натрия) (Willard, 1987). При тяжелой гипофосфатемии дозу фосфатов приходится увеличивать до 0,03-0,12 ммоль/кг/час (Nichols, Crenshaw, 1995). Поскольку количество фосфата, необходимое для нормализации состояния животного и его ответа на терапию, предугадать невозможно, важное значение приобретает мониторинг концентрации фосфора в сыворотке крови. В первой фазе терапии ее определяют каждые 8-12 часов и на основании полученных результатов корректируют дозу вводимого фосфата. К числу побочных эффектов избыточного введения фосфата относятся ятрогенная гипокальциемия и сопутствующие нервномышечные расстройства, гипернатриемия, гипотензия и метастатическое обызвествление (Forrester, Moreland, 1989). Одновременно с измерением концентрации фосфора следует определять общий или, что еще лучше, ионизированный кальций, и в случае выявления гипокальциемии скорость инфузии фосфатов снижают. Собакам и кошкам с гиперкальциемией, гиперфосфатемией, олигурией или подозрением на тканевую некротизацию заместительное введение фосфора противопоказано. Его также не следует проводить, пока не будет установлено состояние почечной функции животных и измерена концентрация фосфора в их сыворотке.
Целесообразность внутривенного введения содержащих фосфаты жидкостей в течение первых 24-48 часов инфузионной терапии для предотвращения развития тяжелой гипофосфатемии оценивается неоднозначно, и решение зависит от имеющегося у отдельных специалистов опыта. Рутинная заместительная терапия фосфатами редко практикуется для лечения ДКА у человека, отчасти потому, что несколько проведенных исследований не выявили каких-либо существенных клинических преимуществ введения фосфата; более того, чрезмерно агрессивная терапия может приводить к гипокальциемии с явлениями тетании (Becker et al, 1983; Fisher, Kitabchi, 1983; Masharani, Karam, 2001). Терапия низкими дозами инсулина, описанная ниже, помогает снизить внутриклеточный транспорт фосфатов, а частое измерение концентрации фосфора в сыворотке крови обеспечивает раннее выявление нежелательных изменений его уровня. Аргументы в пользу рутинного введения фосфатов, особенно при их низкой исходной концентрации, основываются на опасении возникновения гемолитической анемии и желании избежать этого осложнения. Влияние профилактического заместительного введения фосфатов на частоту гемолитической анемии у собак и кошек с ДКА не изучалось. Если принимается решение о необходимости профилактического введения фосфатов, то его проводят либо независимо, используя приведенные выше дозировки, либо фосфаты включают в состав инфузионных жидкостей для заместитель
ной терапии калием. В последнем случае 5-10 мэкв калия, приходящегося на литр жидкости, должно быть представлено фосфатом калия, а остальное его количество - хлоридом калия. Концентрацию фосфора в сыворотке крови измеряют через каждые 8-12 часов после начала инфузии и вносят необходимые поправки в дозировку фосфатов.
Заместительное введение магния. Гипомагниемия - частое явление при ДКА у собак и кошек. Нередко ее тяжесть усиливается во время терапии ДКА, но после излечения этого заболевания нормализуется без дополнительной терапии (Norris et al,1999). Гипомагниемия обычно протекает бессимптомно, за исключением случаев, когда концентрация общего и ионизированного магния опускается ниже соответственно 1,0 и 0,5 мг/100 мл, но даже при столь малых концентрациях магния многие собаки и кошки остаются асимптоматичными (см. стр. 650). До сих пор неизвестно, оказывает ли гипомагниемия влияние на возникновение и терапию ДКА. Также отсутствуют исследования, которые позволили бы дать рекомендации по заместительной терапии магнием у собак и кошек с ДКА; пока такого рода терапию назначают эмпирически. В нашей клинике не проводится рутинное лечение гипомагниемии у собак и кошек с ДКА. Исключение составляют животные, у которых после 24—48 часов внутривенной инфузии жидкостей и инсулина появляются такие устойчивые симптомы, как вялость, анорексия, общая слабость или рефрактерные гипокалиемия и гипокальциемия, а другие возможные причины их возникновения, кроме гипомагниемии, отсутствуют.
Имеются солевыерастворысульфата(8,13 мэкв/г) или хлорида (9,25 мэкв/г) магния для парентерального введения. Начальная доза магния для внутривенной инфузии в первый день составляет 0,75-1,0 мэкв/кг; ее вводят в составе 5%-ного инфузионного водного раствора декстрозы (Dhupa,1995; Hansen, 2000). В случае необходимости заместительную терапию магнием продолжают в дозе, равной половине начальной дозы, на протяжении еще 3-5 дней. До начала введения необходимо оценить функцию почек, а при наличии азотемии уменьшить дозу магния на 50-75%.
Введение магния животным, получающим кар-диогликозиды наперстянки, может привести к серьезным нарушениям проводимости. Магний несовместим с растворами, содержащими бикарбонат натрия, кальций, гидрокортизон или добутамина гидрохлорид. Концентрацию общего и, предпочтительно, ионизированного магния определяют в крови через каждые 12-24 часа после начала терапии и вносят необходимые коррективы в скорость инфузии. Цель заместительной терапии состоит в нормализации уровня общего и ионизированного магния в сыворотке крови. Парентеральное введения магния сульфата может вызывать выраженную гипокальциемию, вплоть до возникновения потребности в заместительной терапии кальцием. К числу других
660 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
нежелательных последствий инфузии магния относятся гипотензия, атриовентрикулярная блокада и блокада ножки пучка Гиса, а в случае передозировки - расстройство дыхания и остановка сердца. При передозировке магния показаны внутривенные инъекции глюконата кальция в дозах от 10 до 50 мг/кг.
Лечение бикарбонатом (рис. 13-15)
Не существует единого мнения относительно целесообразности применения бикарбоната для коррекции ацидоза при ДКА. Сторонники терапии бикарбонатом утверждают, что она необходима для коррекции неблагоприятных последствий ацидоза. Тяжелый ацидоз нарушает связывание инсулина со специфическими рецепторами, ухудшает работу сердца и провоцирует аритмию, а также вызывает расширение сосудов и, как следствие, гипотензию, подавление ЦНС и расстройство дыхания. Кроме того, ацидоз индуцирует сужение сосудов почек и брыжейки, что предрасполагает животных к острому некрозу почечных канальцев и ишемической болезни кишечника. При нарушении почечной функции ацидоз стимулирует развитие гиперкалиемии, уменьшает буферный резерв и провоцирует выраженные клинические симптомы, такие как анорексия, тошнота и рвота (Whittaker et al, 1981; Feldman, Nelson, 1987). Уменьшение буферного резерва является одной из наиболее серьезных проблем у кошек и собак с тяжелым ацидозом при ДКА, поскольку даже небольшие изменения концентрации углекислоты и бикарбоната в сыворотке могут приводить к угрожающим жизни отклонениям pH крови.
Аргументам в пользу применения бикарбоната в терапевтических целях противопоставляют возможные опасные последствия его введения животным. Так, введение бикарбоната натрия может индуцировать обострение гипокалиемии, ухудшать снабжение тканей кислородом вследствие повышения сродства к нему гемоглобина, вызвать избыточную нагрузку натрием и «обратный» алкалоз, способствовать чрезмерному снижению pH спинномозговой жидкости (СМЖ), нарушать функцию ЦНС и задерживать уменьшение концентраций лактата и кетоновых тел в крови ( Hale et al, 1984; Hood, Taimen, 1994; Kitabchi et al, 2001). В дополнение к этому от величины pH зависит кетогенез в печени и при уменьшении pH снижается продукция бета-оксимасляной кислоты и ацетоацетата (Okuda et al, 1986а; Farfoumoux et al, 1987). Введение инсулина и жидкостей облегчает тяжесть ацидоза благодаря окислению кетоновых тел и экскреции водородных ионов с мочой (Owen et al, 1980); при этом различий в скорости нормализации состояния при ацидозе у человека и животных, получающих и не получающих бикарбонат натрия, не выявлено (Lever, Jaspan, 1983; Morris et al, 1986; Viallon et al, 1999), хотя в одном из исследований терапия бикарбонатом задерживала исчезновение признаков кетоза у людей с ДКА (Okuda et al, 1996b).
При выяснении необходимости терапии бикарбонатом следует исходить из клинического состояния животных, учитывая при этом концентрации бикарбоната в плазме или общего СО2 в венозной крови. Заместительное введение бикарбоната не рекомендуется, когда его концентрация в плазме (или концентрация общего СО2 в венозной крови) составляет 12 мэкв/л или выше, особенно если животное возбуждено. У таких собак и кошек величина pH в СМЖ остается нормальной или почти нормальной. В этих случаях для коррекции ацидоза лучше использовать инсулинотерапию или инфузионную терапию. Улучшение почечной перфузии способствует выведению кетокислот с мочой, а инсулинотерапия значительно уменьшает их продукцию. Ацетоацетат и бета-оксимасляная кислота представляют собой метаболически лабильные анионы; в процессе обмена 1 мэкв кетокислоты образуется 1 мэкв бикарбоната.
Терапию бикарбонатом рекомендуется начинать при его концентрации в плазме крови 11 мэкв/л или ниже (или когда концентрация общего СО2 в венозной крови меньше 12 мэкв/л). Многие такие животные находятся в состоянии глубокой депрессии, по-видимому, из-за сопутствующего тяжелого ацидоза ЦНС, который с трудом поддается коррекции у собак и кошек. Единственный безопасный протокол терапии состоит в постепенном устранении метаболического ацидоза в периферической циркуляции посредством внутривенного заместительного введения жидкостей, что позволяет избежать существенного изменения pH СМЖ. Данный протокол предусматривает лишь частичную компенсацию недостаточности бикарбоната на протяжении первых 6 часов инфузионной терапии.
Дефицит бикарбоната (т.е. количество миллиэквивалентов бикарбоната, исходно необходимое для коррекции ацидоза до критического уровня 12 мэкв/л на протяжении 6 часов) рассчитывают по следующей формуле:
Бикарбонат (мэкв) = вес тела (кг) х 0,4 х (12 - концентрация бикарбоната у данной особи) х 0,5
или, если концентрация бикарбоната в плазме крови животного неизвестна, по формуле:
Бикарбонат (мэкв) = вес тела (кг) х 2
Разница между действительной концентрацией сывороточного бикарбоната и ее критической величиной 12 мэкв/л является тем параметром, который подлежит коррекции у животных с ДКА. Если концентрация бикарбоната в крови животного неизвестна, то за показатель недостаточности оснований, подлежащий коррекции, принимают величину 10. Коэффициент 0,4 используется для поправки на объем ВКЖ, в котором распределен бикарбонат (40% веса тела). Коэффициент 0,5 - это половина требуемой дозы бикарбоната для внутривенного
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 661
Рис. 13-15. Терапия ДКА бикарбонатом.
введения. При использовании описываемого подхода животное получает консервативную дозу бикарбоната на протяжении 6-часового периода. Ни в коем случае нельзя вводить бикарбонат струйно (Ryder, 1984). По истечении 6 часов после начала терапии повторно оценивают кислотно-щелочной статус животного и рассчитывают новую дозу бикарбоната. Необходимость в дальнейшем заместительном введении бикарбоната отпадает после увеличения его концентрации в плазме крови выше 12 мэкв/л.
Инсулинотерапия
Инсулинотерапия имеет решающее значение в лечении кетоацидоза. Инсулин ингибирует липолиз и мобилизацию СЖК из триглицеридов в жировой ткани и тем самым уменьшает количество субстрата, необходимого для образования кетоновых тел. Кроме того, инсулин индуцирует сдвиг обменных процессов с окисления жиров и кетогенеза в сторону биосинтеза жиров, подавляет глюконеогенез в печени и усиливает обмен глюкозы и кетонов в тканях (Hood, Taimen, 1994; DeFronzo et al, 1994). Конечным результатом его действия является снижение концентрации глюкозы и кетонов в крови и моче, уменьшение осмотического диуреза и потерь электролитов и коррекция метаболического ацидоза. Избыточная инсулинотерапия может вызвать гипокалиемию, гипофосфатемию и гипогликемию
в течение первых 24 часов после ее начала. Эти эффекты можно свести к минимуму с помощью адекватной инфузионной терапии, частого мониторинга концентрации электролитов и глюкозы в крови, а также модификацией первоначально избранного протокола инсулинотерапии для тех собак и кошек, у которых на момент установления диагноза ДКА уже имелась гипокалиемия.
Решение о времени начала инсулинотерапии каждый ветеринар принимает, исходя из личного опыта. Следует, однако, помнить, что первым этапом в лечении ДКА должна быть адекватная инфузионная терапия (см. стр. 655). Позднее начало инсулинотерапии способствует проявлению положительного эффекта инфузионной терапии еще до того, как инсулин вызовет снижение концентраций глюкозы, калия и фосфора в крови. Вопрос в том, насколько можно задержать начало инсулинотерапии. Мы обычно начинаем ее через 1-2 часа после начала инфузии жидкости. Решение о продлении этого срока, как и о первоначальной дозе инсулина, принимается на основании результатов определения уровня электролитов в сыворотке. Если концентрация калия в сыворотке находится в пределах нормы, мы приступаем к инсулинотерапии, как описано ниже. Если же имеется гипокалиемия, начало инсулинотерапии откладывается еще на 1-2 часа, чтобы дать время для нормализации уровня калия под воздействием заместительного введения
662 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Рис. 13-16. Влияние способа введения инсулина на снижение концентрации глюкозы и кетонов в плазме крови у людей с ДКА. Внутривенное введение инсулина приводило к ускоренному (в течение первых 2 часов) уменьшению концентрации глюкозы и кетонов в крови. В более поздние сроки различия между способами введения отсутствовали. (Из: DeFronzo R.A. et al: Diabetic ketoacidosis. A combined metabolic-nephrologic approach to therapy. Diabetes Rev 2:223, 1994)
жидкости; можно понизить исходную дозу инсулина для уменьшения внутриклеточного транспорта калия и/или фосфора. Чем выше тяжесть гипокалиемии, тем больше мы склонны к задержке начала инсулинотерапии и снижению исходной дозы инсулина. Тем не менее, мы считаем, что во всех случаях ее следует начинать не позднее 4 часов после начала жидкостной терапии. Если в течение нескольких часов не удается получить данные о концентрации сывороточных электролитов, следует на несколько часов отложить инсулинотерапию, а начальную дозу инсулина уменьшить во избежание развития тяжелой гипокалиемии.
Эффект инсулина снижается при наличии сопутствующего заболевания, препятствующего проявлению его действия, и бывает необходимо сначала устранить это заболевание, чтобы повысить эффективность терапии кетоацидоза (например, у сук в фазе диэструса, см. стр. 668). Однако отменять инсулинотерапию не следует. Трудно предвидеть, какое количество инсулина может быть необходимо тому или иному животному. Поэтому лучше всего использовать препараты быстрого и короткого действия, так как это позволяет оперативно корректировать дозу и частоту введения инсулина в зависимости от индивидуальной потребности собаки или кошки. Указанным критериям отвечает быстродействующий кристаллический инсулин (Nelson et al, 1990), который и рекомендуется использовать для лечения ДКА.
Протоколы инсулинотерапии ДКА предусматривают ежечасные внутримышечные инъекции (Chastain, Nichols, 1981), непрерывную внутривенную инфузию низких доз инсулина (Macintire, 1993) или его прерывистое подкожное и внутримышечное введение (Feldman, 1980). Все три пути введения (внутривенно, внутримышечно и подкожно) эффективно понижают содержание глюкозы и ке
тонов в крови (рис. 13-16). Существует множество аргументов в пользу того или иного способа введения инсулина на начальной стадии инсулинотерапии. Наш опыт свидетельствует о хороших результатах прерывистых внутримышечных инъекций. Этот протокол отличается простотой, надежностью и стабильностью, а также позволяет избежать трудностей, присущих протоколам внутривенного и подкожного введения инсулина. Успешность лечения ДКА не зависит от способа введения инсулина; гораздо большее значение имеет адекватная терапия любого сопутствующего ДКА заболевания (см. табл. 13-8).
Методика ежечасного внутримышечного введения инсулина (рис. 13-17). Собакам и кошкам с ДКА сначала вводят нагрузочную дозу обычного инсулина, равную 0,2 ЕД/кг, а затем каждые 1-2 часа по 0,1 ЕД/кг. При наличии или опасении гипокалиемии количество инсулина в первых двух-трех инъекциях уменьшают на 25-50%. Инсулин вводят в мышцы задних ног, чтобы он поступал именно в мышечную, а не в жировую или подкожные ткани. При необходимости введения очень низких доз препарат обычного инсулина разводят с кратностью 1:10 специальными разбавителями, поставляемыми изготовителями инсулина, и используют инсулиновые шприцы U100 объемом 0,3 мл.
В результате инсулинотерапии концентрация инсулина в сыворотке обычно возрастает примерно до 100 мкЕД/мл и удерживается на этом уровне (рис. 13-18). В такой концентрации инсулин ингибирует липолиз, глюконеогенез и гликогенолиз, а также стимулирует утилизацию глюкозы и кетонов в тканях ( Barrett, DeFronzo, 1984; Feldman, Nelson, 1987). Концентрацию глюкозы в плазме крови следует измерять ежечасно с помощью стационарного химического анализатора или портативного глюкометра, используя получаемые ре-
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
663
Рис. 13-17. Протокол инсулинотерапии ДКА.
зультаты для коррекции дозы инсулина (см. рис. 13-17). Цель первоначальной инсулинотерапии состоит в медленном понижении концентрации глюкозы в крови до 200-250 мг/100 мл, желательно в течение 6-10 часов. В идеале концентрация глюкозы должна снижаться на 50 мг/100 мл в час (Wagner et al, 1999). Такая скорость обеспечивает умеренное стабильное снижение уровня гликемии
без существенных изменений осмоляльности. Уменьшение концентрации глюкозы эффективно способствует прекращению липолиза и поступлению СЖК для биосинтеза кетонов. В то же время концентрация глюкозы снижается быстрее, чем концентрация кетонов (Barrett, DeFronzo, 1984; Yeates, Blaufuss, 1990). Обычно коррекция гликемии достигается в течение 12 часов после начала
664 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
инсулинотерапии, тогда как признаки кетоза исчезают только спустя 48-72 часа.
После снижения концентрации глюкозы в крови примерно до 250 мг/100 мл ежечасное введение инсулина прекращают и переходят на внутримышечные инъекции обычного инсулина через каждые 4-6 часов. В условиях нормальной гидратации инсулин вводят подкожно каждые 6 8 часов. При этом первоначальная доза обычно составляет 0,1-0,3 ЕД/кг, а в дальнейшем се корректируют на основании результатов определения концентрации глюкозы в крови. На этом этапе вводимая внутривенно жидкость должна содержать достаточное количество 50°о-ного раствора декстрозы, чтобы обеспечить конечную концентрацию декстрозы 5%. С этой целью на каждый литр инфузионной жидкости добавляют 100 мл 50°о-ной декстрозы. Концентрацию глюкозы в крови необходимо поддерживать на уровне 150-300 мг/100 мл до тех пор, пока состояние животного нс стабилизируется и оно не начнет нормально есть. Если же концентрация глюкозы опускается ниже 150 мг/100 мл или поднимается выше 300 мг/100 мл, дозу инсулина соответственно увеличивают или уменьшают. Введение декстрозы помогает свести к минимуму вероятность возникновения гипогликемии и придерживаться избранного графика инъекций инсулина. Задержка введения инсулина задерживает коррекцию кстоацидотического состояния.
Инсулины с большей продолжительностью действия (например, НПХ, ленте или ПЦИ) не следует использовать до тех пор, пока у животного нс стабилизируется общее состояние, не восстановится нормальное пищевое поведение на фоне постоянства водного баланса без внутривенной инфузии жидкости и не исчезнут признаки ацидоза, азотемии или дефицита электролитов. Начальная доза препаратов инсулина длительного действия должна быть такой же, как доза обычного инсулина, используемая на момент перехода на новый тип препарата. В последующем ее корректируют, исходя из клинической реакции животного на изменение терапии и результатов определения глюкозы.
Методика непрерывной инфузии низких доз инсулина. Непрерывная внутривенная инфузия кристаллического инсулина так же эффективно снижает концентрацию глюкозы в крови. Выбор ежечасного внутримышечного введения или непрерывной внутривенной инфузии определяется, в первую очередь, личным опытом и предпочтениями клинициста, техническим оснащением клиники и доступностью инсулиновых насосов. Для получения инфузионного раствора кристаллический инсулин в количестве 2,2 ЕД/кг для собак и 1,1 ЕД кг для кошек добавляют в 250 мл 0,9%-ного солево! о раствора, который сначала вводят со скоростью 10 мл час, используя инфузионную систему, отдельную от системы для введения жидкостей (Church, 1983; Macintire, 1993 ) . Это обеспечивает поступление инсулина в кровь кошек и собак
Время (часы)
Рис. 13-18. Средняя концентрация инсулина в сыворотке крови у восьми собак с ДКА после внутримышечною вве ния кристаллического инсулина в дозе 0,2 ЕД/кг (время 0), а штсм по 0,1 ЕД/кг ежечасно (сплошная линия), и у шести собак с ДКА до и после непрерывной внутривенной инфузии кристаллического инсулина с помощью педиатрической капельницы (пунктирная линия). Введение инсулина собакам обеих групп было прекращено после 4 часов терапии. Отрезками указано время внутримышечных инъекций инсулина; заштрихованная область - идеальная концентрация инсулина в сыворотке при лечении ДКА.
со скоростью соответственно 0,05 и 0,1 ЕД/кг/час и его концентрацию в плазме от 100 до 200 мкЕД/ мл (Macintire, 1993). Поскольку инсулин обладает адгезивностью к стеклу и пластмассам, через инфузионную систему следует сначала пропустить примерно 50 мл содержащей его жидкости, а затем начинать введение раствора инсулина животному При наличии у животного гипокалиемии в течение первых 2-3 часов инсулин вводят более медленно. Следует использовать два разных катетера: один для введения инсулина, a ipyrort, центральный, катетер для введения жидкости и взятия проб крови. Постоянство скорости введения инсулина достигается с помощью инфузионного или шприцевого насоса. Педиатрические капельницы не обеспечивают стабильной скорости инфузии, особенно когда нет возможности достаточно часто проводить мониторинг введения жидкости (см. рис. 13-18). Цель непрерывной инфузионной терапии такая же, как при внутримышечных инъекциях - гарантировать непрерывное поступление инсулина в количестве, обеспечивающем постепенное снижение концентрации глюкозы в крови. Эта цель наилучшим об-
ДИАБЕТИЧЕСКИМ КЕТОАЦИДОЗ • 665
разом достигается применением инфузионных или шприцевых насосов.
Скорость инфузии инсулина корректируют на основании результатов ежечасного определения концентрации глюкозы в крови. В идеале она должна каждый час уменьшаться на 50 мг/100 мл (Wagner et al, 1999). После того как концентрация глюкозы в крови достигнет примерно 250 мг/100 мл, инфузию прекращают и переходят на внутримышечные инъекции обычного инсулина через каждые 4-6 часов. В условиях нормальной гидратации инсулин вводят подкожно каждые 6-8 часов, как описано в протоколе ежечасных внутримышечных инъекций инсулина.
Альтернативный подход состоит в продолжении внутривенной инфузии инсулина (с более низкой скоростью во избежание гипогликемии) до момента, когда станет возможен переход на препарат более длительного действия. После достижения концентрации глюкозы 250 мг/100 мл в вводимую внутривенно жидкость добавляют декстрозу, как описано выше.
Методика прерывистого внутримышечного и подкожного введения инсулина. Терапия прерывистыми внутримышечными инъекциями инсулина с последующими подкожными инъекциями была описана в 1980 году (Feldman, 1980). Несмотря на ее успешное применение в нашей клинике на протяжении многих лет, мы перешли на терапию с использованием ежечасных внутримышечных инъекций и непрерывной внутривенной инфузии инсулина. Методика прерывистых внутримышечных инъекций менее трудоемка, чем другие способы инсулинотерапии, но такие инъекции вызывают слишком быстрое понижение концентрации глюкозы в крови и потому создают повышенный риск развития гипогликемии. При использовании данной методики начальная доза кристаллического инсулина для внутримышечных инъекций составляет 0,25 ЕД/кг и вводится через каждые 4 часа, но обычно внутримышечно инсулин вводят только один или два раза. Как только восстанавливается гидратация животного, переходят на подкожные инъекции через каждые 6-8 часов. Начинать с подкожного введения не рекомендуется из-за слабой абсорбции инсулина из мест инъекций у дегидратированных собак и кошек. Дозы инсулина для подкожного и внутримышечного введения подбирают в соответствии с концентрацией глюкозы в крови, которую сначала определяют ежечасно после первой же внутримышечной инъекции. В идеале она должна каждый час снижаться на 50 мг/100 мл (Wagner et al, 1999). По достижении требуемого уровня гликемии дозу инсулина уменьшают на 25-50%. После того как концентрация глюкозы в крови понизится примерно до 250 мг/100 мл, в вводимую внутривенно жидкость добавляют декстрозу, как описано в протоколе для ежечасных внутримышечных инъекций инсулина.
Сопутствующие заболевания
Лечение ДКА требует устранения сопутствующих патологических состояний, нередко достаточно серьезных. ДКА у собак и кошек часто сопровождается острым и хроническим панкреатитом, бактериальными инфекциями, холангиогепатитом, нарушением почечной функции и сердечной деятельности, а также гормональными нарушениями антагонистичными действию инсулина; среди последних особенно важное значение имеют ятрогенный или спонтанный гиперкортицизм и диэструс (Bruskiewicz et al, 1997). При некоторых сопутствующих заболеваниях приходится модифицировать терапию ДКА (например, инфузионную терапию при сопутствующей сердечной недостаточности) и/или использовать дополнительную терапию (с применением антибиотиков). Однако ни при каких условиях нельзя отказываться от инсулинотерапии или откладывать ее начало, потому что только с ее помощью можно устранить кетоацидоз. Если нет необходимости в пероральном введении лекарственных средств, следует продолжать инсулинотерапию и поддерживать требуемый уровень гликемии посредством внутривенной инфузии раствора декстрозы. В случае антагонизма действию инсулина со стороны сопутствующего заболевания необходимо принимать меры по повышению эффективности инсулинотерапии и устранению кетоацидоза.
Панкреатит. У собак и кошек с ДКА всегда следует иметь ввиду возможность острого или хронического панкреатита. Диагностика панкреатита ни в коем случае не должна ограничиваться только определением концентрации липазы в сыворотке крови; необходимо учитывать соответствующие клинические проявления заболевания, результаты физикального исследования и биохимического анализа сыворотки, гематологические нарушения и данные анализа мочи. При рентгенологическом исследовании обращают особое внимание на отсутствие четкой картины в правой краниальной части брюшной полости на фоне непроходимости заполненной газом двенадцатиперстной кишки. С помощью УЗИ выявляют увеличение размеров поджелудочной железы и ее гипоэхогенную или смешанную эхогенную структуру в сочетании со слабо или сильно выраженной непроходимостью желчных протоков либо в отсутствие таковой (см. рис. 12-10, стр. 600).
Краеугольным камнем в лечении и ДКА и панкреатита является инфузионная терапия. Поскольку большинство собак и кошек с ДКА страдают анорексией, им в течение первых 24-72 часов после госпитализации обычно не предлагают корм, что благотворно сказывается и на течении панкреатита. Собакам с сахарным диабетом в порядке поддержки может потребоваться системное или периферическое парентеральное питание. В еще большей степени это относится к кошкам, у которых бывают затяжные периоды рвоты, а такая поддержка в из
666 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
вестной степени позволяет предотвратить развитие синдрома гепатического липидоза. Как только собака или кошка начинают самостоятельно есть, следует модифицировать режим их питания в соответствии с диетотерапией панкреатита. Дальнейшие поправки в диету вносятся на основании результатов оценки клинического состояния животных в домашних условиях. Частой причиной смерти в первые дни после начала терапии ДКА является тяжелый некротизирующий панкреатит. Невозможность предотвратить рецидивы обострения хронического панкреатита служит одной из причин, заставляющих хозяев животных прибегать к эвтаназии их питомцев (Goossens et al, 1998). Профилактика таких рецидивирующих приступов имеет решающее значение для продления жизни больных диабетом животных. У собак эта цель достигается, в первую очередь, соответствующей диетотерапией. Факторы, индуцирующие панкреатит у кошек, пока мало изучены, и роль диетотерапии в профилактике рецидивов панкреатита неизвестна.
Бактериальные инфекции и сепсис. Иммуносупрессорный эффект сахарного диабета в сочетании с увеличением концентрации глюкозы в крови и других жидкостях тела предрасполагает животных к бактериальной инфекции (McMahon, Bistrian, 1995; Joshi et al, 1999). Чаще всего у этих животных развиваются инфекции мочевого тракта. На втором месте стоят инфекции ротовой полости, кожи и дыхательной системы (Hess et al, 2000; Peikes et al, 2001) . У животных, ослабленных диабетом и/ или сопутствующим ему тяжелым заболеванием (в частности, некротизирующим панкреатитом), а также при несоблюдении правил асептики во время проведения диагностических и лечебных процедур (например, при вживлении мочевых или венозных катетеров) может развиться угрожающий жизни сепсис. Клиницист никогда не должен исключать возможности инфекционного заболевания у собаки или кошки с ДКА. У всех таких животных берут пробы мочи на бактериологичское исследование. По клиническим показаниям или результатам лабораторных анализов проводят также культивирование крови, смешанных проб жидкостей, СМЖ и различных тканей. Мы обычно с самого начала назначаем всем поступающим в клинику животным терапию бактерицидными антибиотиками с широким спектром действия, а затем вносим необходимые изменения в терапевтический режим, исходя из результатов культивирования биологических жидкостей и тканей и тестирования на чувствительность к антибиотикам.
Почечная недостаточность. Гломерулярная микроангиопатия, развивающаяся под воздействием сахарного диабета, вызывает прогрессирующий фиброз почечных клубочков и, в конечном итоге, гломерулосклероз (см. гл. 11, стр. 581). На начальных стадиях диабетической нефропатии отмечается протеинурия, которая завершается развитием полиурической почечной недостаточности. Усиление тя
жести гломерулярного фиброза и склероза приводит к терминальной олигурической или анурической почечной недостаточности. Наш опыт свидетельствует о высокой частоте олигурии у собак и кошек, страдающих одновременно ДКА и почечной недостаточностью. Это отчасти обусловлено сопутствующими гемодинамическими эффектами кетоацидоза, некротизирующего панкреатита или длительной тяжелой дегидратации в дополнение к индуцированной диабетом гломерулярной микроангиопатии. Прогноз сопутствующей почечной недостаточности у больных собак и кошек с ДКА может быть от осторожного до угрожающего в зависимости от способности животного продуцировать мочу.
В случае обнаружения почечной недостаточности у животных с ДКА всегда возникает подозрение на наличие олигурии. Необходимо в течение первых 4-6 часов после начала лечения контролировать продукцию мочи. Неспособность продуцировать мочу в течение первых нескольких часов инфузионной терапии или в течение 1-2 часов после нормализации кровяного давления служит тревожным сигналом и требует принятия решительных мер. В мочевой пузырь вживляют катетер, соединенный с закрытой системой сбора жидкости. Пальпация мочевого пузыря не может считаться надежным методом оценки продукции мочи. Поэтому важно обеспечить ее регулярный и более достоверный контроль. После регидратации животного продукция мочи должна быть не меньше 1,0-2,0 мл/кг в течение 1 часа. В случае ее очень низкой продукции необходимо убедиться в проходимости мочевого катетера и оценить адекватность жидкостной терапии (измерив, например, ЦВД и/или артериальное кровяное давление, либо проанализировав субъективные признаки избыточного или недостаточного количества жидкости в организме). Если у животного имеется гипотензия, ЦВД сильно понижено (< 1-2 см Н2О), а объем жидкости недостаточен, следует увеличить скорость ее инфузии на протяжении еще 1-2 часов. В течение этого времени необходимо тщательно контролировать продукцию мочи, уровень ЦВД и артериального давления, а также следить, чтобы скорость введения жидкости не была слишком высокой.
Если на фоне адекватной инфузионной терапии сохраняется анурия или олигурия, следует попытаться индуцировать или увеличить продукцию мочи с помощью диуретиков, маннитола и/или дофамина. Мы сначала прибегаем к струйному введению маннитола, за которым следует его инфузия с постоянной скоростью. Доза струйного вливания составляет 0,5 г/кг внутривенно, ее вводят на протяжении 10-20 минут. Продукция мочи должна усилиться в течение 30 минут. При улучшении диуреза мы переходим на внутривенную инфузию маннитола с постоянной скоростью 1 мг/кг/мин, используя для этой цели отдельную инфузионную систему со шприцевым или инфузионным насосом. Водный раствор маннитола разбавляют до концентрации 12,5%, до
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 667
бавляя 5%-ный раствор декстрозы (т.е. разводя 25%-ный раствор маннитола в соотношении 1:1), чтобы уменьшить его концентрацию и осмоляльность и увеличить объем вводимой жидкости. При введении в солевой раствор и при смешивании с хлором, калием или продуктами крови маннитол выпадает в осадок, поэтому следует избегать использования таких смесей (Dhupa, Shaffran, 1995).
Если в течение 30 мин после струйного введения маннитола продукция мочи не увеличивается, приступают к внутривенной инфузии фуросемида и дофамина вместо маннитола собакам и фуросемида кошкам. Дофамин (интропин, производства Faulding, США) является предшественником норадреналина (см. рис. 9-1, стр. 474). У собак он вызывает расширение сосудов и может действовать синергически с фуросемидом при стимуляции образования мочи. Считается, что у кошек отсутствуют рецепторы дофамина в почках. Собакам дофамин водят со скоростью от 2 до 5 мкг/кг/мин после разведения в физиологическом или рингеровском растворе. Его нельзя добавлять в растворы, содержащие бикарбонат натрия, потому что в этом случае происходит инактивация препарата. Обычно 50 мг дофамина разводят в 500 мл инфузионной жидкости, получая, таким образом, раствор, содержащий 100 мкг дофамина на миллилитр. Эту смесь используют исключительно для введения дофамина, а инфузионная терапия должна проводиться другой жидкостью. Лучше всего вводить раствор дофамина с помощью инфузионного насоса через отдельную систему для вливания жидкостей. В случае терапии фуросемидом его добавляют в раствор дофамина и одновременно вводят оба препарата. Начальная доза фуросемида для инфузии с постоянной скоростью составляет 0,1 мг/кг/час при максимальной величине 1 мг/кг/час (Dhupa, Shaffran, 1995).
Усиление продукции мочи должно наступить в течение 30-60 минут после начала внутривенной инфузии. Если улучшение не наступает, дозы дофамина и фуросемида можно увеличить, но это может вызвать тахикардию и/или тахиаритмию. Появление тахикардии и/или тахиаритмии означает, что доза дофамина слишком велика и потенциально опасна. В случае избыточного диуреза скорость инфузии дофамина и/или фуросемида следует медленно снижать в течение 12-24 часов, пока нормальная продукция мочи не станет возможной в условиях одной инфузионной терапии.
Если вышеприведенное лечение не дает результата, остаются только перитонеальный диализ или гемодиализ.
Гепатит и холангиогепатит. Гепатический ли-пидоз часто сопутствует диабету у собак и кошек, но обычно протекает бессимптомно и не требует специального лечения, помимо того, что назначается для терапии основного заболевания. Гораздо большее беспокойство вызывает гепатит. Подозрение на острый или хронический гепатит, а также на холангиогепатит возникает при появлении при
знаков желтухи, увеличении активности ферментов печени в сыворотке (до уровня, превышающего их активность при гепатическом липидозе, см. стр. 535) или при аномальных результатах тестирования эндогенной функции печени (т.е. при обнаружении гипоальбуминемии, гипохолестеринемии или повышенного содержания желчных кислот). Острый и хронический гепатит или холангиогепатит следует иметь ввиду, если у животных с сахарным диабетом сохраняются устойчивые признаки анорексии и вялости, несмотря на устранение метаболических расстройств, связанных с ДКА. Гепатит и холангиогепатит нередко сочетаются с панкреатитом. Для диагностики заболевания печени проводят УЗИ брюшной полости и гистологическое исследование биоптатов печеночной ткани. Как и в случаях ДКА и панкреатита, методом выбора для первоначального лечения острого и хронического гепатита или холангиогепатита у собак и кошек является инфузионная терапия. Возможна также неспецифическая терапия антибиотиками и лактулозой или диетотерапия, особенно при подозрении на энцефалопатию печени. С целью поддержания приемлемого клинического состояния животных, особенно кошек, с устойчивой анорексией прибегают к их принудительному кормлению, а также используют назогастральный или эзофа-гостомический зонды. Системное и периферическое парентеральное питание необходимо собакам и кошкам с затяжными периодами рвоты. Выбор дополнительной терапии зависит от конкретного диагноза (например, хронический и острый гепатит, лимфоцитарный или плазмацитарный холангиогепатит и т.п.).
Гормональные расстройства, вызывающие инсулинорезистентность. Инсулинорезистентность обусловлена многими заболеваниями, сопутствующими ДКА у собак и кошек. Тяжесть инсулинорезистентности сильно варьирует в зависимости от вызвавших ее причин (см. гл. 11 стр. 571 и гл. 12 стр. 626). К счастью, многие расстройства сопровождаются лишь слабо выраженной инсу-линорезистентностю, и у животных сохраняется чувствительность даже к низким дозам инсулина, используемым в первые 24-72 часа, благодаря чему тяжесть кетоацидоза прогрессивно уменьшается. Основные исключения составляют слабая инсулинорезистентность у интактных сук в фазе диэструса и инсулинорезистеность, обусловленная гиперкортицизмом. Акромегалия так же вызывает тяжелую инсулинорезистентность у кошек, но она редко сопровождается кетонурией, несмотря на невозможность контроля гликемии массированными дозами инсулина. Хотя инсулин тормозит липолиз и ограничивает доступность СЖК для образования кетоновых тел, он, видимо, не обеспечивает регуляцию продукции глюкозы в печени и/или усиление ее утилизации в тканях в той степени, какая необходима для адекватного контроля уровня гликемии у кошек с акромегалией.
668 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Диэструс. Прогестерон, биосинтез которого значительно усиливается в фазе диэструса астрального цикла собак, является антагонистом инсулина и стимулирует секрецию гормона роста. Последний, в свою очередь, вызывает тяжелую инсулинорезистентность и создает опасность возникновения угрожающего жизни ДКА (см. гл. 11 стр. 574). Индуцированную диэструсом инсулинорезистентность устранить очень трудно, если не невозможно, даже при введении массированных доз кристаллического инсулина. В результате еще больше усугубляются обусловленные ДКА обменные расстройства, что, в конце концов, приводит к гибели животного.
При выявлении ДКА у интактных сук никогда нельзя исключать наличия у них диэструса и пиометры, независимо от характера получаемой от владельца собаки информации относительно особенностей ее эстрального цикла. После начала терапии ДКА необходимо провести ультразвуковое и рентгенологическое исследование брюшной полости с целью выявления пиометры. Одновременно определяют концентрацию прогестерона в крови твердофазным иммуноферментативным методом, который позволяет быстро получить необходимые данные (см. гл. 20). Концентрация прогестерона в крови более 2 нг/мл является диагностическим показателем активности желтых тел в яичниках и подтверждает наличие диэструса. В этом случае показана овариогистерэктомия, настолько неотложная, насколько это возможно по соображениям безопасности. Время операции выбирают исходя из тяжести клинической симптоматики.
Состояние тяжело больных собак с ДКА необходимо предварительно стабилизировать посредством инфузионной терапии, терапии кристаллическим инсулином и парентеральным введением антибиотиков в течение 6-24 часов до операции. В нашей клинике время между обнаружением пиометры или диэструса и проведением овариогистерэктомии, как правило, не превышает 24 часов. Тяжесть инсулинорезистентности обычно начинает уменьшаться спустя одну неделю после операции, а у некоторых собак даже исчезают симптомы ИЗСД.
У кошек не всегда удается оценить тяжесть индуцируемой во время диэструса инсулинорезистентности и ее влияние на чувствительность ДКА к инсулинотерапии, отчасти из-за того, что прогестерон не стимулирует секрецию гормона роста у этих животных (Peterson, 1987). Прогестерон связывается с рецепторами глюкокортикоидов и может вызвать инсулинорезистентность, но у кошек инсулинорезистентность, возникшая вследствие диэструса, редко имеет серьезные клинические последствия, возможно, благодаря ее небольшой тяжести и преходящего увеличения концентрации прогестерона в плазме крови. В отличие от этого, инсулинорезистентность, обусловленная хронической избыточной продукцией прогестерона (как например, при введении экзогенных прогестагенов или при наличии секретирующей прогестерон
опухоли), может привести к развитию сахарного диабета и клиническому синдрому, имитирующему гиперкортицизм кошачьих (см. гл. 7; Boord, Griffin, 1999; Rossmeisl et al, 2000 ).
Экзогенные глюкокортикоиды. Глюкокортикоиды стимулируют липолиз, усиливают катаболизм белков и превращение аминокислот в глюкозу в печени и почках; одновременно они ограничивают утилизацию глюкозы в зависимых от инсулина тканях (Cryer, Polonsky, 1998). Такое ограничение может быть обусловлено изменением взаимодействия инсулина с его рецепторами на поверхности клеток, нарушением действия инсулина на пострецепторном уровне и/или изменением количества и эффективности внутриклеточных транспортеров глюкозы (Homer et al, 1987; Wolfsheimer, Peterson, 1991). Развивающаяся в результате этих процессов инсулинорезистентность препятствует лечению кетоацидоза. Глюкокортикоиды в принципе не следует давать собакам и кошкам с ДКА, и если они были назначены ранее, их следует отменить. Это в равной степени касается глюкокортикоидных препаратов для перорального, внутриглазного, накожного или внутриушного введения. Исключение составляют глюкокортикоидные средства, предназначенные для лечения угрожающих жизни расстройств, например, опосредуемых иммунной системой. В этих случаях глюкокортикоиды назначают в минимальных дозах, необходимых для поддержания жизнеспособности, или по возможности используют альтернативные лекарственные средства, такие как азатиоприн для лечения иммунных заболеваний или нестероидные противовоспалительные препараты для лечения увеита (см. гл. 11 стр. 580). Кроме того, клиницист должен быть готов компенсировать действие глюкокортикоидов введением дозы инсулина, превышающей необходимую для коррекции ДКА в обычных условиях.
Спонтанный гиперкортицизм. Гиперкортицизм представляет собой хорошо известное расстройство, свойственное собакам и кошкам с сахарным диабетом, которое может быть обнаружено у животных с впервые диагностированными ДК или ДКА или с персистирующей кетонурией на фоне инсулинотерапии. Гиперкортицизм индуцирует инсулинорезистентность таким же образом, как экзогенные глюкокортикоиды (см. выше). Его выявляют с помощью определенного набора диагностических тестов и в случае подтверждения диагноза назначают соответствующее лечение (см. гл. 6). Несмотря на уменьшение эффективности инсулина при гиперкортицизме, его введение следует продолжить с целью подавления липолиза и продукции кетоновых тел, а также для предотвращения дальнейшего увеличения тяжести кетоацидоза. Успешный контроль гиперкортицизма способствует устранению кетоза.
Лечение гиперкортицизма у собак и кошек с кетоацидозом несколько затруднено из-за потенциальной неточности результатов диагностических тестов при выявлении этого расстройства у тяжело
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 669
больных животных (Kaplan et al, 1995). Основной целью терапии является стабилизация состояния и, по возможности, устранение кетонемии и кетону-рии посредством внутривенной инфузии жидкостей и инсулинотерапии. Обычно для достижения этой цели требуется от 24 до 72 часов. Диагностику гиперкортицизма проводят только после того, как нормализуется общее состояние и восстановится обычное пищевое поведение собаки или кошки, нормализуется баланс электролитов и исчезнет метаболический ацидоз. При выявлении гиперкортицизма мы полагаемся на результаты провокационной пробы с АКТГ, ингибирующей пробы с низкими дозами дексаметазона и УЗИ брюшной полости. Мы не определяем отношение концентраций кортизола и креатинина в моче из-за высокой частоты ложноположительных результатов у больных собак и кошек. Мы также не используем ингибирующую пробу с высокими дозами дексаметазона, учитывая неблагоприятные последствия, к которым может привести введение больших количеств глюкокортикоидов таким хрупким животным, как кошки. Мы избегаем также вводить о,р’-ОДД собакам с ДКА и зависимым от гипофиза гиперкортицизмом до тех пор, пока у них не нормализуются общее состояние и баланс электролитов, они не начнут самостоятельно есть и не исчезнут дегидратация и метаболический ацидоз. Иногда мы прибегаем к терапии кетоконазолом для контроля уровня кортизола и снижения тяжести инсулинорезистентности у больных собак, если кетоацидоз не удается устранить посредством традиционной терапии (т.е. инфузии жидкостей и инсулина).
Легочная тромбоэмболия. Предрасполагающими факторами тромбоэмболии у собак и кошек с ДКА служат некоторые часто сопутствующие ДКА патологические состояния, включая панкреатит, гиперкортицизм, гломерулонефропатию, сепсис, сердечные расстройства и неопластические процессы. Формированию тромба способствуют стаз кровотока, повреждение сосудистого эндотелия, изменение агрегации тромбоцитов и активности факторов свертывания крови, а также уменьшение концентрации антитромбина III (LaRue, Murtaugh, 1990; Ewensteim, 1997; Jacoby et al, 2001). Чаще всего развивается легочная тромбоэмболия (ЛТЭ), которая характеризуется острым увеличением частоты дыхания и тяжелой одышкой. Это состояние следует в первую очередь дифференцировать от бактериальной и аспирационной пневмонии, которые легко выявляются при рентгенологическом исследовании грудной клетки. Диагностика ЛТЭ основывается на клинической симптоматике, результатах рентгенологического исследования и газового анализа артериальной крови. Во многих случаях легкие выглядят на рентгенограммах вполне нормальными. Вместе с тем, рентгенологическое исследование выявляет такие аномалии, как слабо просматривающиеся легочные артерии (обычно в каудальных долях легких), зоны очагового или диф
фузного затемнения в интерстициальной и альвеолярной ткани, рентгенопрозрачные зоны, в которых отсутствует кровоснабжение, плевральный выпот и правостороннее увеличение сердца (Fluckiger, Gomez, 1984; Hawkins, 2003). Газовый анализ артериальной крови позволяет обнаружить гипоксемию и гипокапнию (Bums et al, 1981). Для подтверждения диагноза ЛТЭ проводят ангиографическое исследование и перфузионное сканирование легких. Лечение этого угрожающего жизни расстройства состоит в обеспечении животному полного покоя, помещении его в обогащенную кислородом среду, подкожных инъекциях гепарина и/или тромболитических средств и настоек (см. гл. 6, стр. 305).
Осложнения терапии
Лечение ДКА часто сопровождается осложнениями, которые в большинстве случаев являются следствием слишком агрессивной терапии, неудовлетворительного мониторинга ее эффективности и пренебрежения своевременной повторной оценкой ряда важных биохимических параметров (табл. 13-11). ДКА представляет собой сложное патологическое состояние, которое в отсутствие должной компенсации часто приводит к гибели животного. Чтобы свести к минимуму вероятность осложнений и повысить успешность терапии, необходимы постепенная, в течение 36-48 часов нормализация нарушенных показателей, частый (по меньшей мере, 3 или 4 раза в день) контроль физического и
ТАБЛИЦА 13-11. ЧАСТЫЕ ОСЛАЖНЕНИЯ В ПРОЦЕССЕ ЛЕЧЕНИЯ ДИАБЕТИЧЕСКОГО КЕТОАЦИДОЗА У СОБАК И КОШЕК
Гипогликемия вследствие введения избыточного количества инсулина или неадекватного количества глюкозы
Гипокалиемия вследствие введения неадекватного количества калия
Гипофосфатемия и гемолитическая анемия вследствие введения неадекватного количества фосфата
Гипернатриемия вследствие инфузии избыточного количества физиологического раствора или недостаточного потребления жидкости
Устойчивая олигурия вследствие неадекватного или слишком медленного введения жидкостей
Устойчивая гипотензия вследствие неадекватного или слишком медленного введения жидкостей
Отек мозга или неврологические нарушения из-за слишком быстрого снижения уровня глюкозы и/или осмоляльности крови
Парадоксальный церебральный ацидоз и неврологические нарушения вследствие слишком быстрого введения бикарбоната
670 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
психического состояния животных и своевременный анализ основных биохимических параметров (концентрации глюкозы в крови, соотношения электролитов в сыворотке и газового состава крови). На протяжении первых 24 часов концентрацию глюкозы измеряют каждые 1-2 часа, а определение концентрации электролитов и газовый анализ крови проводят каждые 6-8 часов. Режим терапии инфузионными жидкостями, инсулином или бикарбонатом обычно приходится три-четыре раза изменять на протяжении первых 24 часов после ее начала. Неспособность уловить изменения в состоянии ДКА и соответствующим образом скорректировать дальнейшее лечение может привести к серьезным осложнениям. Наиболее частые их них рассматриваются ниже.
Гипогликемия. Гипогликемия - весьма обычное явление в первые дни терапии, особенно если у собаки или кошки имеется анорексия или нарушена способность переваривать поступающую с пищей глюкозу и, таким образом, нейтрализовать гипогликемическое действие инсулина. Задача инсулинотерапии, независимо от способа введения гормона, состоит в постепенном понижении концентрации глюкозы в плазме крови до 200-250 мг/100 мл, желательно на протяжении 8-10-часового периода. К сожалению, эта задача трудновыполнима, и концентрация глюкозы может опуститься до значительно более низкого уровня. С целью предупреждения гипогликемии необходимо каждый час измерять концентрацию глюкозы в крови с помощью стационарного химического анализатора или портативного глюкометра. Когда концентрация глюкозы приближается к 250 мг/100 мл, в раствор инсулина для внутривенного введения добавляют 50%-ную декстрозу, получая ее 5%-ный раствор. В случае гипогликемии (концентрация глюкозы ниже 80 мг/100 мл) либо появления клинических симптомов гипогликемии животным внутривенно вводят аликвоты 50%-ного раствора декстрозы (по 0,5-3,0 мл) до тех пор, пока для поддержания концентрации глюкозы на уровне выше 80 мг/100 мл не окажется достаточным введения 5%-ного раствора декстрозы. Инсу-линотерапия также требует внесения изменений, но ее следует продолжать, так как отмена инсулинотерапии затрудняет устранение кетоацидоза.
Состояние центральной нервной системы (отек мозга). Отек мозга может возникнуть в результате накопления избыточного количества воды во время терапии ДКА. Обычно это происходит в случае быстрого снижения концентрации глюкозы в крови или после инфузии большого количества гипотонической жидкости (например, 0,45%-ного солевого раствора). В условиях инсулиновой недостаточности уменьшается транслокация глюкозы из ВКЖ во ВнуКЖ. Накопление глюкозы в ВКЖ вызывает значительное увеличение осмоляльности этой жидкости. Быстрое увеличение концентрации глюкозы в ВКЖ может привести к дегидратации клеток, поскольку в ответ на повышение осмоляль
ности ВКЖ в нее из ВнуКЖ перемещается вода. Обезвоживание нервных клеток в ЦНС индуцирует неврологические расстройства. Нейроны ЦНС продуцируют осмотически активные соединения, такие как лактат, сорбитол, миоинозитол и йодогенные осмоли, которые компенсируют повышенную осмоляльность СМЖ и препятствуют дегидратации клеток. Эти внутриклеточные соединения индуцируют диффузию воды в клетку, если осмоляльность внутриклеточной среды превышает осмоляльность ВКЖ. У животных с тяжелой гипергликемией йодогенные осмоли в нейронах не создают осмотического градиента, поскольку имеется равновесие между гиперосмотическим внеклеточным (индуцированным глюкозой) и гипоосмотическим внутриклеточным (индуцированным йодогенными осмолями) пространством. Однако быстрое уменьшение концентрации глюкозы в плазме крови и улучшение почечной перфузии под воздействием интенсивной инфузионной терапии и введения экзогенного инсулина могут вызвать столь же быстрое снижение осмоляльности ВКЖ. В ВКЖ имеется относительный избыток накопившейся свободной воды, способной диффундировать в клетки мозга, в которых внутренняя среда гиперосмоляльна вследствие присутствия йодогенных осмолей. Таким образом, быстрое уменьшение концентрации глюкозы в крови может завершиться отеком мозга и нарушением функции ЦНС. В связи с этим, прежде чем приступать к терапии, ветеринар должен составить представление о состоянии ЦНС животного. Если во время терапии животное находится в угнетенном состоянии и испытывает депрессию, значит, у него слишком быстро снижается концентрация глюкозы крови и развивается отек мозга.
Наиболее эффективным средством лечения отека мозга является маннитол (см. стр. 666). Обычно рекомендуется также введение дексаметазона, однако неизвестно, как он действует на животных с сахарным диабетом. Дополнительно можно использовать пассивную гипервентиляцию с целью снижения давления двуокиси углерода и уменьшения скорости церебрального кровотока. Основной вывод из проведенных исследований состоит в целесообразности медленной, но прогрессивной терапии с целью профилактики отека мозга.
Тяжелые гипернатриемия и гиперхлоремия. У животных с ДКА иногда развиваются тяжелая гипернатриемия и гиперхлоремия (см. рис. 13-9) в результате недостатка воды (т.е. ее слабого потребления) в сочетании с непропорционально большими потерями воды с мочой по сравнению с экскрецией электролитов. Выведение большого количества воды при избытке электролитов в крови приводит к гипертонической дегидратации, т.е. состоянию обезвоживания с небольшим числом признаков, характерных для тяжелой недостаточности жидкости в организме (Edwards et al, 1983). Усиливающаяся гипернатриемия в сочетании с гипергликемией вызывает тяжелую гиперосмоляльность (более
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
671
400 мОсм/кг) и нарушение функции ЦНС. Ранние клинические проявления гипернатриемии включают раздражительность, общую слабость и атаксию, но по мере увеличения ее тяжести ступор переходит в кому и судороги. Выраженность этих симптомов и их прогрессирование зависят от скорости развития, тяжести и продолжительности гипернатриемии. Терапия должна быть направлена на компенсацию недостатка жидкости и ее продолжающихся потерь и, по возможности, на снижение этих потерь (см. гл. 1, стр. 35, где приведены подробные рекомендации по устранению гипернатриемической, гипертонической дегидратации).
Важно учитывать возможные артефакты при определении концентрации натрия. Так, при тяжелой липемии может создаваться ложное впечатление увеличения концентрации натрия в сыворотке, поскольку липемия приводит к вытеснению натрия в нелипемический объем сыворотки, в то время как на самом деле концентрация натрия остается нормальной. Гипергликемия также влияет на определяемый уровень натрия. При увеличении концентрации глюкозы в сыворотке на 100 мг/100 мл выше нормальной величины определяемая концентрация натрия уменьшается примерно на 1,6 мэкв/л. Так, если у собаки с концентрацией глюкозы 500 мг/100 мл была определена концентрация натрия 135 мэкв/ л, то «истинная» концентрация натрия составляет примерно 142 мэкв/л (DiBartola, 2000).
Тяжелая гипокалиемия. В течение первых 48 часов после начала терапии ДКА велик риск развития тяжелой гипокалиемии (концентрации калия в крови ниже 2,0 мэкв/л). Причины возникновения этого состояния рассматриваются на стр. 658. Самым характерным клиническим признаком гипокалиемии является общая слабость скелетной мускулатуры. У кошек отмечаются шейная вентрофлексия, гиперметрия передних конечностей и стопохождение с опорой на всю плюсну. К числу сердечных расстройств, обусловленных гипокалиемией, относятся уменьшение сократительной активности миокарда и минутного объема сердца, а также нарушения сердечного ритма. Обменные расстройства включают гипокалиемическую нефропатию, сопровождающуюся хроническим тубулоинтерстициальным нефритом, нарушение почечной функции и азотемию, которые клинически проявляются в форме полиурии, полидипсии и нарушенной способности концентрировать мочу. Гипокалиемическая полимиопатия характеризуется повышением активности сывороточной креатинкиназы и нарушением электромиографической картины. Клиническими проявлениями паралитической непроходимости кишечника служат вздутие живота, анорексия, рвота и запоры (DiBartola, de Morais, 2000). У кошек сильнее всего выражены гипокалиемическая нефропатия и полимиопатия. Они, по-ви-димому, более чувствительны к неблагоприятному воздействию гипокалиемии, чем собаки. Если у кошек клинические симптомы заметны уже при кон
центрации калия от 3,0 до 3,5 мэкв/л, то у собак они могут не проявляться до тех пор, пока она не опустится ниже 2,5 мэкв/л. Иногда гипокалиемию упускают из виду как причину характерных клинических расстройств, ошибочно приписывая их другим часто встречающимся нарушениям, в частности, панкреатиту. Важное значение для идентификации и профилактики гипокалиемии имеют первоначальная интенсивная заместительная терапия препаратами калия, частое определение концентрации электролитов в сыворотке и соответствующая коррекция терапии на основании полученных результатов.
Гемолитическая анемия. Опасная для жизни гемолитическая анемия развивается в течение первых 72 часов после начала терапии как следствие гипофосфатемии (см. стр. 659) (Willard et al, 1987; Adams et al, 1993; Bruskewicz et al, 1997) . Механизм индуцированного гипофосфатемией гемолиза неизвестен. Гемолиз может быть следствием недостаточности в эритроцитах аденозинтрифосфата (АТФ), который необходим для сохранения целостности клеточной мембраны, вторичного нарушения функции натрий-калиевого насоса в результате пониженного содержания АТФ и сопутствующего ему осмотического лизиса или изменения липидных компонентов мембран эритроцитов (Shilo et al, 1985; Adams et al, 1993).
У собак и кошек гемолитическая анемия, вызванная уменьшением концентрации фосфора в сыворотке крови, может протекать очень тяжело при показателе гематокрита меньше 15% ( Willard et al, 1987; Adams et al, 1993). Ее дополнительным признаком, выявляемым при ОАК, служит наличие сфероцитов и телец Хейнца в сочетании с гемоглобинемией. Лечение включает внутривенное введение фосфатов (см. стр. 659) и в случае необходимости переливание крови. Краеугольным камнем профилактики гемолитической анемии является предупреждение гипофосфатемии. С этой целью необходимо проводить регулярный мониторинг концентрации фосфора на протяжении первых 24-48 часов терапии ДКА и в случае обнаружения гипофосфатемии дополнять ее внутривенной инфузией жидкостей, содержащих фосфаты натрия и калия.
ПРОГНОЗ
ДКА остается одним из самых трудных для лечения метаболических расстройств в ветеринарной практике. Следует постоянно иметь в виду все факторы, осложняющие его лечение, и помнить, что его успех предопределяется рациональным сочетанием жидкостной терапии, инсулинотерапии и заместительного введения калия. Без постоянного, внимательного наблюдения и мониторинга состояния животного велика вероятность безуспешности лечения.
Смертность людей, страдающих ДКА, остается высокой (от 5 до 10%), однако, метаболические
Ы1 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
осложнения кетоацидоза редко являются ее непосредственной причиной (DeFronzo et al, 1994; Wagner et al, 1999). Устойчиво высокая смертность связана с другими расстройствами, которые усиливают тяжесть ДКА (например, инфекциями или панкреатитом). Уровень смертности среди собак и кошек с ДКА примерно одинаков (Macintire, 1993; Bruskiewicz et al, 1997). He лишне повторить, что при первичном анамнестическом анализе и физикальном исследовании следует уделять повышенное внимание выявлению факторов, которые могут вызывать обострение эпизодов ДКА. Такими факторами, в первую очередь, могут быть пневмония, сепсис, панкреатит и гормональные расстройства, индуцирующие инсулинорезистентность, которые часто не имеют клинических проявлений во время первичного обследования.
Несмотря на все меры предосторожности и тщательное лечение, в ряде случаев не удается избежать фатального исхода ДКА у животных. В одном из исследований в ходе первоначальной терапии 21 собаки с ДКА погибло 6 (29%) животных, основной причиной смерти было тяжелое сопутствующее заболевание (Macintire, 1993). В нашей клинике во время первичной госпитализации погибло или было эвтаназировано почти 25% собак и кошек с признаками тяжелого ДКА (Bruskiewicz et al, 1997). Обычно животные умирали в результате серьезного сопутствующего заболевания (в том числе от олигурической почечной недостаточности и некротизирующего панкреатита), тяжелого метаболического ацидоза (pH < 7) или развившихся в период терапии осложнений (например, отека мозга). Несмотря на это, рациональная терапия в сочетании с тщательным мониторингом состояния больных собак и кошек позволяет достигнуть основной цели лечения диабетического кетоацидоза - нормализации клинического состояния животного.
ГИПЕРОСМОЛЯРНЫЙ НЕКЕТОНОВЫЙ САХАРНЫЙ ДИАБЕТ
Диабетический гиперосмолярный некетоновый синдром (ДГНС) - относительно редкое осложнение сахарного диабета у собак и кошек. Синдром характеризуется тяжелой гипергликемией (концентрация глюкозы в плазме крови выше 600 мг/100 мл), гиперосмоляльностью (более 350 мОсм/кг) и дегидратацией в отсутствие выраженного кетоза. Прогрессивно усиливающаяся вялость на фоне все более возрастающей гиперосмоляльности в конечном итоге приводит к ступору и коме. Это состояние нередко сопровождается нарушением почечной функции и застойной сердечной недостаточностью; оба эти расстройства ухудшают прогноз заболевания. Дополнительными факторами, способствующими усилению тяжести ДГНС, служат сепсис, панкреатит и глюкокортикоидная терапия. ДГНС представляет собой серьезную диагностическую и лечебную проблему, поскольку часто приводит к гибели больных животных.
Патогенез
Патогенетические механизмы ДГНС сходны с таковыми диабетического кетоацидоза. Они заключаются в уменьшении утилизации глюкозы в мышечной, жировой и печеночной тканях вследствие частичной или полной инсулиновой недостаточности, которая одновременно приводит к гипер-глюкагонемии и усилению продукции глюкозы в печени. В результате развивается гипергликемия, сопровождающаяся гликозурией и осмотическим диурезом с неизбежной потерей воды. При ДГНС в поджелудочной железе сохраняется небольшое количество функционально активных бета клеток, которые продолжают секретировать инсулин, но его количество недостаточно для устранения гипергликемии. Однако секретируемый инсулин, по-видимому, ингибирует липолиз, предотвращая развитие кетоза (см. стр. 635). Поэтому, хотя низкая величина отношения инсулин:глюкагон способствует усилению кетогенеза в печени, ограниченная доступность СЖК (предшественников кетонов) из периферических источников лимитирует скорость образования кетонов (Ennis et al, 1994). Резистентность печени к глюкагону также может служить причиной отсутствия кетоза при ДГНС (Yen et al, 1980; Azain et al, 1985).
Если собака или кошка утрачивает способность выпивать обычное количество жидкости из-за сопутствующего острого или хронического заболевания (например, панкреатита) или интенсивно теряет воду (например, при лечении диуретиками сопутствующей застойной сердечной недостаточности), развивается тяжелая дегидратация. В результате уменьшаются объем плазмы, скорость клубочковой фильтрации и почечная экскреция глюкозы, что приводит к увеличению концентрации глюкозы в крови и осмоляльности плазмы. При повышении осмоляльности из нейронов мозга выводится вода, что служит причиной ослабления психической деятельности и дальнейшего уменьшения потребления жидкости. Все более возрастающие вялость, осмотическое давление и дефицит жидкости в организме создают порочный круг и являются причиной почечной недостаточности, которая, в конце концов, приводит к коме и смерти животного.
Гипергликемия при ДГНС, достигающая 600-1600 мг/100 мл, выражена гораздо сильнее, чем при ДКА (300-800 мг/100 мл). Увеличение концентрации глюкозы в крови при ДГНС, как и при ДКА, является следствием ее повышенной продукции в печени в сочетании с уменьшением ее утилизации в тканях. Однако более высокая гипергликемия при ДГНС обусловлена двумя дополнительными факторами. Во-первых, при этом заболевании уменьшается продукция мочи, что препятствует выведению большого количества глюкозы (Foster, McGarry, 1989). Во-вторых, отсутствие кетоза при ДГНС не дает возможности раннего выявления клинических признаков. В результате гипергликемия при ДГНС
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ • 673
прогрессирует в течение более длительного времени, чем при ДКА, и владелец животного обращается за ветеринарной помощью только после появления явных признаков тяжелой гиперосмоляльности (вялости и сонливости) либо клинических проявлений сопутствующих расстройств.
У некоторых собак и кошек с ДГНС сохраняется ацидоз, несмотря на низкую концентрацию кетокислот либо их отсутствие в плазме крови или моче. Одной из причин расхождения между ожидаемой и реальной ситуациями является то обстоятельство, что анализ мочи и плазмы с использованием обычных тест-полосок или реагентов не выявляет бета-оксимасляную кислоту (одну из двух основных кетокислот). Нераспознанный кетоацидоз - редкое явление у собак и кошек. Еще одной причиной ацидоза при некетоновом диабете у этих животных является лактоацидоз. Молочная кислота является конечным продуктом анаэробного обмена глюкозы. Главным источником этой кислоты служат эритроциты (в которых отсутствуют ферменты аэробного окисления), скелетная мускулатура, кожа и мозг. Молочная кислота выводится через печень и, в меньшей степени, почки, где она сначала преобразуется в пируват, а затем снова в глюкозу (этот процесс происходит в присутствии кислорода). Лактоацидоз возникает в том случае, когда избыток молочной кислоты накапливается в крови. Это может происходить в результате ее чрезмерно высокой продукции (при тканевой гипоксии), слабого выведения из организма (при почечной недостаточности) или при обоих расстройствах (сосудистая недостаточность). Подобно человеку, собаки и кошки с лактоацидозом тяжело болеют, у них развиваются сепсис, анемия, заболевания легких и печени и почечная недостаточность.
Клиническая характеристика
Клинические симптомы. ДГНС развивается незаметно, но в течение нескольких дней или недель ему предшествуют признаки сахарного диабета, такие как полиурия, полидипсия, полифагия и уменьшение веса тела. Одновременно появляются слабость, анорексия и вялость, обычно в сочетании с уменьшением потребления воды. Наличие дополнительных клинических симптомов зависит от присутствия или отсутствия сопутствующих заболеваний. Физикальное исследование нередко выявляет сильное обезвоживание. Больные животные обычно инертны, находятся в депрессивном или фактически в коматозном состоянии. Имеется прямая взаимосвязь между степенью гиперосмоляльности и тяжестью неврологической симптоматики. Характерны гипотермия и задержка исчезновения белого пятна. Дыхание Куссмауля наблюдается только при тяжелом метаболическом ацидозе (лактоацидозе).
Результаты лабораторных анализов. Лабораторные исследования выявляют тяжелую гипергликемию с концентрацией глюкозы крови от 600
до 1600 мг/100 мл. Практически все обследованные нами животные с ДГНС имели тяжелую пре-ренальную или ренальную азотемию. У всех были истощены резервы калия несмотря на то, что концентрация калия в сыворотках могла быть нормальной, повышенной или пониженной. Концентрация натрия также могла быть разной. При умеренной дегидратации эффект разбавления и потери натрия с мочой приводили к снижению концентрации натрия в сыворотке крови до уровня ниже 130 мэкв/л. Такая относительная гипонатриемия в известной степени защищала организм животного от избыточной гиперосмоляльности. Однако по мере усиления дегидратации концентрация натрия в сыворотке возрастала и могла превышать 145 мэкв/л, что влекло за собой повышение осмоляльности до 400 мОсм/л и более. Гиперосмоляльность - неизменный спутник ДГНС. Осмоляльность измеряют путем определения точки замерзания плазмы с помощью осмометра, или рассчитывают по формуле, приведенной на стр. 647. При интерпретации данных определения концентрации натрия в сыворотке крови у собак и кошек с ДГНС следует принимать во внимание возможное искажение результатов при тяжелой гипергликемии (см. стр. 645).
При ДГНС кетоз обычно отсутствует. У людей слабый кетоз наблюдается в период голодания (Ennis et al, 1994), однако, он не типичен для собак и кошек. Ацидоз не является компонентом гипергликемического гиперосмоляльного состояния, но может возникнуть, обычно в форме лактоацидоза, как следствие сопутствующего заболевания (см. раздел «Патогенез»), При лактоацидозе уменьшаются концентрация бикарбоната в плазме крови и pH артериальной крови. Кроме того, имеет место «анионная разница» (см. стр. 647). Следует исключить все другие причины метаболического ацидоза с анионной разницей (см. табл. 13-4). Диагноз лактоацидоза ставится после определения концентрации лактата в плазме крови.
Терапия
Лечение ДГНС преследует ту же цель, что и терапия ДКА, - коррекция тяжелой дегидратации, восполнение потери электролитов, обеспечение достаточным количеством инсулина для нормализации промежуточного обмена, компенсация гиперосмоляльного состояния и устранение факторов, осложняющих течение заболевания. Приоритетной задачей является восстановление внутрисосудистого объема и нормального количества электролитов с помощью внутривенной инфузии изотонических жидкостей. Осмоляльность нормализуется посредством снижения концентрации глюкозы в крови и компенсации дефицита воды. Сначала проводят жидкостную терапию с целью снижения концентрации глюкозы; инсулин не вводят до тех пор, пока не будет восстановлен внутрисосудистый объем и стабилизировано кровяное давление. Первостепен
674 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
ное значение имеют тщательные клинические наблюдения и лабораторные анализы, позволяющие оценить реакцию животных на терапию.
Исключительно важная роль в устранении ДГНС принадлежит инфузионной терапии, которая является основным лечебным мероприятием в течение первых 4-6 часов. Этот период обычно характеризуется тяжелой недостаточностью воды, натрия и калия, выраженной гипергликемией и гиперосмоляльностью отчасти потому, что отсутствие кетоацидоза и связанных с ним системных проявлений заболевания позволяет ДГНС оставаться нераспознанным на протяжении длительного времени, что, естественно, задерживает обращение за ветеринарной помощью. Несмотря на тяжелую гиперосмоляльность, для первоначальной инфузионной терапии обычно используют изотонический (0,9%) солевой раствор, содержащий необходимое количество калия. Это позволяет устранить дегидратацию и улучшить тканевой кровоток, а также стабилизировать кровяное давление, повысить СКФ, стимулировать гликозурию, понизить концентрацию глюкозы в плазме крови и заменить глюкозу натрием в ВКЖ. Конечным результатом всех этих изменений является медленное снижение гиперосмоляльности ВКЖ, что сводит до минимума риск отека мозга (см. стр. 670). Половина расчетного дефицита жидкости с учетом ее количества, необходимого для поддержания требуемого уровня гидратации, должна быть компенсирована в течение первых 12 часов инфузионной терапии, а остальное - на протяжении последующих 24 часов.
Принципы заместительной терапии недостаточности калия и фосфора, принятые при ДКА, применимы и к ДГНС (см. стр. 658 и 659). Большинство собак и кошек с ДГНС страдают также почечной недостаточностью (обычно олигурической) и имеют гиперкалиемию, гиперфосфатемию и/или нарушенную способность экскретировать вводимый калий. Заместительная терапия калием и фосфором может назначаться только после определения их концентрации в сыворотке и оценки состояния почечной функции и продукции мочи. Обычно первоначальная инфузионная жидкость содержит 20 мэкв/л калия в виде хлорида. Последующая коррекция режима терапии осуществляется на основании результатов измерения концентрации электролитов в сыворотке, которое должно проводиться достаточно часто, чтобы иметь возможность быстро идентифицировать возникающие проблемы.
Начало инсулинотерапии следует отложить (обычно на 4-6 часов) до появления признаков улучшения состояния, включая коррекцию дегидратации, стабилизацию кровяного давления, увеличение продукции мочи, снижение гипергликемии и гиперосмоляльности и восстановление баланса электролитов. При ДГНС потребность в инсулинотерапии не так выражена, как при ДКА, отчасти потому, что продукция кетонов и ее последствия для обменных процессов несущественны либо от
сутствуют. Метаболический ацидоз, если имеет место при ДГНС, чаще всего имеет форму лактоацидоза, который можно корректировать с помощью инфузионной терапии. Инсулинотерапия может вызвать слишком быстрое уменьшение концентрации глюкозы в крови и падение осмоляльности ВКЖ, что способствует развитию отека мозга (см. стр. 670). Инсулин вводится так же, как при ДКА (см. стр. 661). Однако дозы инсулина при его почасовых внутримышечных инъекциях или скорость введения при непрерывной внутривенной инфузии необходимо вначале уменьшить на 50%, чтобы не допустить резкого падения концентрации глюкозы в крови и резкого понижения осмоляльности ВКЖ. В последующем проводят коррекцию дозы инсулина, исходя из скорости снижения уровня глюкозы. В оптимальном варианте концентрация глюкозы в плазме крови должна каждый час понижаться на 50 мг/100 мл. Вместе с тем следует иметь в виду, что скорость падения уровня гликемии с трудом поддается прогнозированию и контролю, отчасти из-за индивидуальной чувствительности животных к инсулину. После снижения концентрации глюкозы до 250 мг/100 мл в раствор для внутривенного введения необходимо добавить декстрозу до ее конечной 5%-ной концентрации.
Важнейшее значение для успеха терапии имеет мониторинг продукции мочи, кровяного давления, концентрации глюкозы, электролитов и AM в крови. Как и в случае кетоацидоза, клиницист должен добиться устойчивой (но не резкой) коррекции гиперосмоляльности, гипергликемии и дегидратации с одновременной стимуляцией диуреза для снижения концентрации AM в крови. Нельзя также забывать, что животные с ДГНС тяжело больны и должны находиться под пристальным наблюдением.
Прогноз в целом неблагоприятен. Основной причиной смерти животных в нашей клинике является почечная недостаточность.
ЛИТЕРАТУРА
Abbott LG, Rude RK: Clinical manifestations of magnesium deficiency. Miner Electrolyte Metab 19:314, 1993.
Adams LG, et al: Hypophosphatemia and hemolytic anemia associated with diabetes mellitus and hepatic lipidosis in cats. J Vet Intern Med 7:266, 1993.
Adrogue HJ, et al: Plasma acid-base patterns in diabetic ketoacidosis. N Engl J Med 307:1603, 1982.
Adrogue HJ, et al: Diabetic ketoacidosis: Role of the kidney in acid-base homeostasis reevaluated. Kidney Int 25:591, 1984.
Azain MJ, et al: Contributions of fatty acid and sterol synthesis to triglyceride and cholesterol secretion by the perfused rat liver in genetic hyperlipemia and obesity. J Biol Chem 260:174, 1985.
Barrett EJ, DeFronzo RA: Diabetic ketoacidosis: Diagnosis and treatment. Hosp Pract 19:89, 1984.
Becker DJ, et al: Phosphate replacement during treatment of diabetic ketosis. Effects on calcium and phosphorus homeostasis. Am J Dis Child 137:241, 1983.
Boord M, Griffin C: Progesterone secreting adrenal mass in a cat with clinical signs of hyperadrenocorticism. J Am Vet Med Assoc 214:666, 1999.
Boyle PJ: Cushing’s disease, glucocorticoid excess, glucocorticoid deficiency, and diabetes. Diabetes Rev 1:301, 1993.
Bratusch-Marrain PR, et al: The effect of growth hormone on glucose metabolism and insulin secretion in man. J Clin Endocrinol Metab 55:131, 1982.
Bruskiewicz KA, et al: Diabetic ketosis and ketoacidosis in cats: 42 cases (1980-1995). J Am Vet Med Assoc 211:188, 1997.
диабетический кетоацидоз
675
Burns MG, et al: Pulmonary artery thrombosis in three dogs with hyperadrenocorticism. JAVMA 178:388, 1981.
Bush WW, et al: Secondary hypoparathyroidism attributed to hypomagnesemia in a dog with protein-losing enteropathy. J Am Vet Med Assoc 219:1732, 2001.
Chastain CB, Nichols CS: Low-dose intramuscular insulin therapy for diabetic ketoacidosis in dogs. JAVMA 178:561, 1981.
Cherrington AD, et al: Insulin, glucagon, and glucose as regulators of hepatic glucose uptake and production in vivo. Diabetes Metab Rev 3:307, 1987.
Church DB: Diabetes mellitus. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 838.
Cryer PE: Catecholamines, pheochromocytoma, and diabetes. Diabetes Rev 1:309, 1993.
Cryer PE, Polonsky KS: Glucose homeostasis and hypoglycemia. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 939.
DeFronzo RA, et al: Diabetic ketoacidosis. A combined metabolic-nephrologic approach to therapy. Diabetes Rev 2:209, 1994.
DeFronzo RA, Ferrannini E: Insulin action in vivo: Protein metabolism. In Alberti KGMM, et al (eds): International Textbook of Diabetes Mellitus. Chichester, UK, Wiley, 1992, p 467.
Dhupa N: Magnesium therapy. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders Co, 1995, p. 132.
Dhupa N, Shaffran N: Continuous rate infusion formulas. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 4th ed. Philadelphia, WB Saunders Co, 1995, p 2130.
Dhupa N, Proulx J: Hypocalcemia and hypomagnesemia. Vet Clin North Am Small Anim Pract 28:587, 1998.
DiBartola SP: Disorders of sodium and water. In DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders Co, 2000, p 45.
DiBartola SP, de Morais HA: Disorders of potassium. In DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders Co, 2000, p 83.
Duarte R, et al: Accuracy of serum (3-hydroxybutyrate measurements for the diagnosis of diabetic ketoacidosis in 116 dogs. J Vet Intern Med 16:411, 2002.
Edwards DF, et al: Hypernatremic, hypertonic dehydration in the dog with diabetes insipidus and gastric dilatation-volvulus. JAVMA 182:973, 1983.
Ennis ED, et al: The hyperosmolar hyperglycemic syndrome. Diabetes Rev 2:115, 1994.
Ewensteim BM: Antithrombotic agents and thromboembolic disease. N Engl J Med 337:1383, 1997.
Farfournoux P, et al: Mechanisms involved in ketone body release by rat liver cells: Influence of pH and bicarbonate. Am J Physiol 252:G200, 1987.
Feldman BF, Rosenberg DP: Clinical use of anion and osmolal gaps in veterinary medicine. JAVMA 178:396, 1981.
Feldman EC: Diabetic ketoacidosis in dogs. Comp Cont Educ 11:456, 1980.
Feldman EC, Nelson RW: Canine and Feline Endocrinology and Reproduction. Philadelphia, WB Saunders Co, 1987.
Ferrannini E, et al: Effect of free fatty acids on glucose production and utilization in man. J Clin Invest 72:1737, 1983.
Fisher JN, Kitabchi AE: A randomized study of phosphate therapy in the treatment of diabetic ketoacidosis. J Clin Endocrinol Metab 57:177, 1983.
Fluckiger MA, Gomez JA: Radiographic findings in dogs with spontaneous pulmonary thromboembolism or embolism. Vet Radiol 25:124, 1984.
Forrester SD, Moreland KJ: Hypophosphatemia. Causes and clinical consequences. J Vet Intern Med 3:149, 1989.
Foster DW, McGarry JD: The metabolic derangements and treatment of diabetic ketoacidosis. N Engl J Med 309:159, 1983.
Foster DW, McGarry JD: Acute complications of diabetes: Ketoacidosis, hyperosmolar coma, lactic acidosis. In DeGroot LJ (ed): Endocrinology, 2nd ed. Philadelphia, WB Saunders Co, 1989, p 1439.
Gerhardt A, et al: Comparison of the sensitivity of different diagnostic tests for pancreatitis in cats. J Vet Intern Med 15:329, 2001.
Goldstein DE: Tests of glycemia in diabetes. Diabetes Care 18:896, 1995.
Goossens MMC, et al: Response to insulin treatment and survival in 104 cats with diabetes mellitus (1985-1995). J Vet Intern Med 12:1, 1998.
Groop LC, et al: Effect of insulin on oxidative and non-oxidative pathways of glucose and FFA metabolism in NIDDM. Evidence for multiple sites of insulin resistance. J Clin Invest 84:205, 1989.
Hale RJ, et al: Metabolic effects of bicarbonate in the treatment of diabetic ketoacidosis. BrMed J 289:1035, 1984.
Hansen B: Disorders of magnesium. In DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders Co, 2000, p. 175.
Hawkins EC: Disorders of the Pulmonary Parenchyma. In Nelson RW, Couto CG (eds): Small Animal Internal Medicine, 3rd ed. St Louis, Mosby Inc, 2003, p. 299.
Hess RS, et al: Clinical, clinicopathologic, radiographic, and ultrasonographic abnormalities in dogs with fatal acute pancreatitis: 70 cases (1986-1995). J Am Vet Med Assoc 213:665, 1998.
Hess RS, et al: Concurrent disorders in dogs with diabetes mellitus: 221 cases (1993-1998). J Am Vet Med Assoc 217:1166, 2000.
Hood VL, Tannen RL: Maintenance of acid-base homeostasis during ketoacidosis and lactic acidosis. Implications for therapy. Diabetes Rev 2:177, 1994.
Horner HC, et al: Dexamethasone causes translocation of glucose transporters from the plasma membrane to an intracellular site in human fibroblasts. J Biol Chem 262:17696, 1987.
Jacoby RC, et al: Biochemical basis for the hypercoagulable state seen in Cushing’s syndrome. Arch Surg 136:1003, 2001.
Joshi N, et al: Infections in patients with diabetes mellitus. N Engl J Med 341:1906, 1999.
Kandel G, Aberman A: Selected developments in the understanding of diabetic ketoacidosis. Can Med Assoc J 128:392, 1983.
Kaplan AJ, et al: Effects of disease on the results of diagnostic tests for use in detecting hyperadrenocorticism in dogs. J Am Vet Med Assoc 207:445, 1995.
Kitabchi AE, Wall BM: Diabetic ketoacidosis. Med Clin North Am 79:9, 1995.
Kitabchi AE, et al: Management of hyperglycemic crises in patients with diabetes. Diabetes Care 24:131, 2001.
LaRue MJ, Murtaugh RJ: Pulmonary thromboembolism in dogs: 47 cases (1986-1987). J Am Vet Med Assoc 197:1368, 1990.
Lebovitz HE: Diabetic ketoacidosis. Lancet 345:767, 1995.
Lever N, Jaspan J: Sodium bicarbonate therapy in severe diabetic ketoacidosis. Am J Med 75:263, 1983.
Li PK, et al: Direct, fixed time kinetic assays for (3-hydroxybutyrate and acetoacetate with a centrifugal analyzer or a computer-baked spectrophotometer. Clin Chem 26:1713, 1980.
Luzi L, et al: Metabolic effects of low-dose insulin therapy on glucose metabolism in diabetic ketoacidosis. Diabetes 37:1470, 1988.
Martin L, et al: Magnesium in the 1990’s: Implications for veterinary critical care. J Vet Emerg Crit Care 3:105, 1993.
Masharani U, Karam JH: Pancreatic hormones and diabetes mellitus. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, McGraw-Hill, 2001, p 623.
Macintire DK: Treatment of diabetic ketoacidosis in dogs by continuous low-dose intravenous infusion of insulin. JAVMA 202:1266, 1993.
Macintire DK: Emergency therapy of diabetic crises: Insulin overdose, diabetic ketoacidosis, and hyperosmolar coma. Vet Clin North Am Small Anim Pract 25:639, 1995.
McGarry JD, et al: Regulation of ketogenesis and the renaissance of carnitine palmitoyltransferase. Diabetes Metab Rev 5:271, 1989.
McMahon MM, Bistrian BR: Host defenses and susceptibility to infection in patients with diabetes mellitus. Infect Dis Clin North Am 9:1, 1995.
Molitch ME, et al: Spurious serum creatinine elevations in ketoacidosis. Ann Intern Med 93:290, 1980.
Morris LR, et al: Bicarbonate therapy in severe diabetic ketoacidosis. Ann Intern Med 105:836, 1986.
Nanji A A, Campbell DJ: Falsely elevated serum creatinine values in diabetic ketoacidosis-clinical implications. Clin Biochem 14:91, 1981.
Narins RG, et al: The metabolic acidoses. In Maxwell MH, Kleeman CR (eds): Clinical Disorders of Fluid and Electrolyte Metabolism. New York, McGraw-Hill, 1994, p 769.
Nelson RW, et al: Absorption kinetics of regular insulin in dogs with alloxan-induced diabetes mellitus. Am J Vet Res 51:1671, 1990.
Nichols R, Crenshaw KL: Complications and concurrent disease associated with diabetic ketoacidosis and other severe forms of diabetes mellitus. Vet Clin N Amer Small Anim Pract 25:617, 1995.
Norris CR, et al: Serum total and ionized magnesium concentrations and urinary fractional excretion of magnesium in cats with diabetes mellitus and diabetic ketoacidosis. J Am Vet Med Assoc 215:1455, 1999.
Norris CR, et al: Effect of a magnesium-deficient diet on serum and urine magnesium concentrations in healthy cats. Am J Vet Res 60:1159, 1999b.
Okuda Y, et al: Time course of ketone body production in the isolated perfused rat liver in response to various stimuli. Endocrinol Jpn 33:827, 1986a.
Okuda Y, et al: Counterproductive effects of sodium bicarbonate in diabetic ketoacidosis. J Clin Endocrinol Metab 81:314, 1996.
Owen OE, et al: Effects of therapy on the nature and quantity of fuels oxidized during diabetic ketoacidosis. Diabetes 29:365, 1980.
Owen OE, et al: Renal function and effects of partial rehydration during diabetic ketoacidosis. Diabetes 30:510, 1981.
Peikes H, et al: Dermatologic disorders in dogs with diabetes mellitus: 45 cases (1986-2000). J Am Vet Med Assoc 219:203, 2001.
Peterson ME: Effects of megestrol acetate on glucose tolerance and growth hormone secretion in the cat. Res Vet Sci 42:354, 1987.
Rossmeisl JH, et al: Hyperadrenocorticism and hyperprogesteronemia in a cat with an adrenocortical adenocarcinoma. J Am Anim Hosp Assoc 36:512, 2000.
Ryder RE: Lactic acidosis: High-dose or low-dose bicarbonate therapy? Diabetes Care 7:99, 1984.
Sherwin RS, et al: Epinephrine and the regulation of glucose metabolism. Effect of diabetes and hormonal interactions. Metabolism 29(Suppl 1 ):1146, 1980.
Shilo S, et al: Acute hemolytic anemia caused by severe hypophosphatemia in diabetic ketoacidosis. Acta Haematol 73:55, 1985.
Swift NC, et al: Evaluation of serum feline trypsin-like immunoreactivity for the diagnosis of pancreatitis in cats. J Am Vet Med Assoc 217:37, 2000.
Tessari P, et al: Hyperaminoacidemia reduces insulin-mediated glucose disposal in healthy man. Diabetologia 28:870, 1985.
Thiebaud D, et al: Effect of long chain triglyceride infusion on glucose metabolism in man. Metabolism 21:1128, 1982.
676 • ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ
Viallon A, et al: Does bicarbonate therapy improve the management of severe diabetic ketoacidosis? Crit Care Med 27:2690, 1999.
Wagner A, et al: Therapy of severe diabetic ketoacidosis: zero-mortality under very-low-dose insulin application. Diabetes Care 22:674, 1999.
Whittaker J, et al: Impaired insulin binding in diabetic ketoacidosis. Diabetologia 21:563, 1981.
Willard MD, et al: Severe hypophosphatemia associated with diabetes mellitus in six dogs and one cat. JAVMA 190:1007, 1987.
Wolfsheimer KJ, Peterson ME: Erythrocyte insulin receptors in dogs with spontaneous hyperadrenocorticism. Am J Vet Res 52:917, 1991.
Yeates S, Blaufuss J: Managing the animal in diabetic ketoacidosis. Focus Crit Care 17:240, 1990.
Yen TT, et al: Hepatic insensitivity to glucagon in ob/ob mice. Res Commun Chem Pathol Pharmacol 30:29, 1980.
Zammit VA: Regulation of ketone body metabolism: A cellular perspective. Diabetes Rev 2:132, 1994.
ЭТИОЛОГИЯ.....................677
ПАТОФИЗИОЛОГИЯ................678
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА.....683
Встречаемость.................683
Анамнез.......................683
Физикальное исследование......684
КЛИНИКО-ПАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ....................684
Глава 14
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОГЛИКЕМИИ НАТОЩАК.....685
МЕТОДЫ ДИАГНОСТИКИ ГИПОГЛИКЕМИИ: ПРИОРИТЕТЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ..............691
ПОДТВЕРЖДЕНИЕ ДИАГНОЗА ИНСУЛИН-СЕКРЕТИРУЮЩЕЙ
ОПУХОЛИ БЕТА-КЛЕТОК............693
Триада Уиппла....................693
Определение базальных концентраций инсулина и глюкозы.............693
Отношение концентраций инсулина и глюкозы......................694
Провокационные пробы...........695
ДИАГНОСТИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ... 695
Рентгенологическое исследование ....695
Ультразвуковое исследование......695
Сцинтиография..................696
ЛЕЧЕНИЕ ОПУХОЛЕЙ БЕТА-КЛЕТОК ....696
Сопоставление хирургического и медикаментозного лечения....696
Хирургическое лечение...........697
Медикаментозная терапия острого гипогликемического криза .702
Медикаментозная терапия хронической гипогликемии..................703
ПРОГНОЗ.......................706
ИНСУЛИН-СЕКРЕТИРУЮЩИЕ ОПУХОЛИ
БЕТА-КЛЕТОК У КОШЕК ........707
SffiiWI I1 Г I 1 h 'll ' ,1 IP л г' I I ,' , ,I, <(' "и , n' '!?'" Il 'I r-л", v 'ir -Г ,r W I "« f 1 1Л1 (A 'hr i Ш ,14ft ' Jijt ft, V ««МИЛ in ‘ Wr-i1"»,' WW 'A » J* я W, Vx J'A I,,1, / f
Список сокращений ИРФ-П - инсулииоподобный ростовой ЦНС - центральная нервная система
АКТГ - адренокортикотропный гормон фактор II
АТФ - аденозинтрифосфат ОАК - общий клинический анализ крови
Инсулин-секретирующие опухоли бета-клеток были впервые описаны у собак в 1935 году (Slye, Wells, 1935). На протяжении последующих 68 лет в ветеринарной литературе появилось множество публикаций, касающихся клинических проявлений, диагностики, лечения и патогенеза опухолей бета-клеток у этих животных. Но хотя это заболевание хорошо документировано и имеются отработанные методы диагностики инсулин-секретирующих новообразований бета-клеток, оно нечасто встречается у собак и еще реже у кошек.
ЭТИОЛОГИЯ
Функционально активные опухоли, развивающиеся из островковых бета-клеток поджелудочной железы, представляют собой злокачественные новообразования, которые секретируют инсулин вопреки ингибирующему эффекту гипогликемии. Тем не менее, опухоли бета-клеток не вполне автономны и отвечают на провоцирующие стимулы (например, на глюкозу) высвобождением инсулина, нередко в весьма больших количествах. Иммуногистохимическое исследование показало, что опухоли бета-клеток часто бывают мультигормональными и могут продуцировать разные гормоны, включая панкреатический полипептид, соматостатин, глюкагон, серотонин и гастрин (Hawkins et al, 1987; O’Brien et al, 1987; Minkus et al, 1997). Однако наиболее обычным продуктом неопластических кле
ток является инсулин, и клинические проявления неоплазии обусловлены прежде всего гипогликемией, вызванной избытком инсулина.
Соотношение злокачественных и доброкачественных процессов. Опухоли бета-клеток у собак печально известны скрытым характером малигни-зации. Имеется явное расхождение между упорядоченной организацией хорошо дифференцированных клеток, редкостью фигур митоза, характерных для большинства опухолей островковых клеток и частым метастазированием опухолей бета-клеток (Kruth et al, 1982). Дифференциальная диагностика злокачественных и доброкачественных опухолей базируется на выявлении метастазов во время хирургической операции или при посмертном вскрытии либо на регистрации рецидивов гиперинсу-линемии спустя недели и месяцы после удаления «одиночной» панкреатической опухоли. Перспективным методом дифференциальной диагностики метастазирующих и неметастазирующих опухолей бета-клеток является визуализация опухолевой ткани (Minkus et al, 1997).
Вероятность малигнизации опухолей бета-кле-ток у собак часто недооценивается. Между тем, как показывает наш опыт, большинство таких опухолей имеет злокачественную природу, а во время хирургических операций у этих животных почти всегда обнаруживаются микроскопические или видимые невооруженным глазом метастазы. Чаще всего очагами метастазирования служат региональные лим
678 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
фатические сосуды и узлы (дуоденальные, брыжеечные, печеночные, селезеночные), а также печень и перипанкреатический сальник. Метастазирование легких встречается редко. У большинства собак через несколько недель или месяцев после хирургического удаления опухоли развиваются рецидивы гипогликемии. Частое обнаружение метастазов во время первичного обследования больных собак отчасти объясняется тем, что неоплазия островковых бета-клеток клинически проявляется и замечается владельцем животного гораздо позднее возникновения самой опухоли; кроме того, проходит довольно много времени, прежде чем владелец, убедившись в наличии заболевания, обращается за ветеринарной помощью. У большинства собак клиническая симптоматика имела место на протяжении 1-6 месяцев до поступления в клинику.
ПАТОФИЗИОЛОГИЯ
Бета-клетки островков поджелудочной железы контролируют и поддерживают необходимую концентрацию глюкозы в крови. Глюкоза поступает в них, в отличие от многих других клеток, без посредничества инсулина. По достижении концентрации глюкозы в крови несколько выше 110 мг/100 мл начинается секреция инсулина, который понижает уровень глюкозы до нормальной физиологической величины, т.е. до 70-110 мг/100 мл. Падение концентрации глюкозы ниже 60 мг/100 мл вызывает подавление биосинтеза и секреции инсулина, что, в свою очередь, ограничивает утилизацию глюкозы в тканях и приводит к повышению ее концентрации в крови до нормального физиологического уровня. Небольшие колебания секреции инсулина обеспечивают поддержание концентрации глюкозы в пределах достаточно узкого диапазона.
Поддержание эугликемии у здоровых собак
Обменные процессы и функциональная активность клеток зависят от их снабжения содержащимися в крови богатыми энергией соединениями. Поступающие в организм экзогенные носители энергии в форме пищевых белков, жиров и углеводов обеспечивают поддержание клеточного обмена на протяжении 4-8 часов. По окончании постпрандиального периода энергия для обменных процессов поступает из эндогенных источников, в первую очередь из печени, которая продуцирует глюкозу (рис. 14-1). Сначала глюкоза образуется в печени благодаря распаду хранящегося в ней гликогена, т.е. в процессе гликогенолиза. При голодании резерв гликогена в печени у собак истощается медленно в течение 2-3 дней, а у человека всего за 24 часа (de Bruijne, 1982). По мере увеличения постпрандиального периода и уменьшения количества резервного гликогена продукция глюкозы в печени усиливается путем глюконеогенеза из предшественников, таких как аминокислоты (особенно аланин и глутамин), лактата
и глицерина (Rothman et al, 1991). Эти субстраты поступают в печень из соответствующих периферических резервов. Мышцы и другие структурные ткани являются поставщиками аминокислот, в первую очередь аланина; форменные элементы крови поставляют лактат - конечный продукт гликолиза, а жировая ткань служит источником глицерина, который образуется в процессе липолиза триглицеридов (Karam, 2001). Окисление свободных жирных кислот, высвобождающихся из жировых клеток во время липолиза, служит источником необходимой для глюконеогенеза энергии, а также субстратом для образования кетоновых тел (т.е. ацетоацетата и бета-оксимасляной кислоты), которые являются альтернативными носителями энергии для ЦНС во время длительного голодания. Жирные кислоты считаются основными медиаторами гепатического глюконеогенеза (Karam, 2001).
Биосинтез глюкозы в печени зависит от поступления в нее необходимого количества субстратов, включая некоторые аминокислоты, глицерин и свободные жирные кислоты, мобилизуемые из мышечной и жировой тканей (Cryer, Polonsky, 1998). К числу других необходимых условий продукции глюкозы относятся адекватное кровоснабжение печени, нормальное функционирование гепатоцитов, извлекающих субстраты из кровяного русла, и полный набор гепатических ферментов, осуществляющих преобразование этих неуглеводных предшественников в глюкозу.
В корковом веществе почек также имеются ферменты, необходимые для биосинтеза и выделения глюкозы в кровяное русло, хотя во время голодания из этого источника поступает всего 5% общего количества глюкозы (Stumvoll et al, 1995; Gerich et al, 2001). Тем не менее, продукция глюкозы в почках регулируется, и при определенных обстоятельствах (например, в условиях контррегуляции глюкозы или при недостаточной функции печени) вклад по-
♦ Глюкоза в плазме и/или —I
потребление калорий
ин
♦
♦Липолиз
«=Ж,Я 'Глик»™,
♦Глюконеогенез
♦ Продукция глюкозы (печень)
.Утилизация глю-’ козы (жировая и мышечная ткани)
Эугликемия
Рис. 14-1. Изменения уровня гормонов и субстратов для поддержания эугликемии и предотвращения гипогликемии у здоровых особей во время голодания. Снижение концентрации инсулина в плазме крови является ключевым гормональным изменением, приводящим к усилению продукции глюкозы и уменьшению ее утилизации. Секреция инсулина, в свою очередь, снижается при небольшом понижении уровня глюкозы в плазме крови (на 5-10 мг/100 мл) и/или уменьшении потребления калорий.
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
679
чек в общую продукцию глюкозы может достигать 40%. Почки не являются хранилищем гликогена, и глюкоза в них образуется только за счет глюконеогенеза, причем основным субстратом для синтеза глюкозы является глутамин, а не аланин, как в печени. Помимо вклада в гомеостаз глюкозы во время голодания, почки участвуют в контррегуляции глюкозы в периоды гипогликемии. Глюкагон не влияет на почки, но контррегуляторное увеличение продукции адреналина стимулирует глюконеогенез в корковом веществе почек (Stumvall et al, 1995; Gerich et al, 2001).
Для поддержания гомеостаза глюкозы и предотвращения гипогликемии необходима нормально функционирующая эндокринная система. Инсулин является главным гипогликемическим гормоном. Он подавляет эндогенную продукцию глюкозы и стимулирует ее утилизацию в тканях. Контррегуляторные гормоны, повышающие концентрацию глюкозы, представлены глюкагоном, гормоном роста, адреналином и кортизолом. Эти гормоны усиливают продукцию глюкозы, стимулируя гликогенолиз и глюконеогенез, а также подавляют утилизацию глюкозы в тканях (Cryer, Polonsky, 1998).
Гипогликемия и контррегуляторный ответ
Если у собак или кошек концентрация глюкозы в плазме крови, определенная случайно в течение дня или натощак, ниже 60 мг/100 мл, это должно настораживать. Хотя это не обязательно указывает на органическое заболевание, все же «нормальным» животным не свойственно снижение концентрации глюкозы ниже указанного уровня. Поэтому, установив наличие устойчивой гипогликемии и исключив возможные артефакты, можно говорить о том, что падение концентрации глюкозы вызвано органическим заболеванием (см. стр. 685). Нарушение любой стадии биосинтеза глюкозы в печени может сопровождаться гипогликемией и соответствующими клиническими проявлениями. К такому же результату приводит нарушение ключевых этапов биосинтеза и хранения глюкозы.
ЦНС полностью зависит от содержания глюкозы в плазме крови и в условиях нормального метаболизма противостоит его уменьшению посредством четко организованной системы нейрогенных и гормональных реакций, направленных на мобилизацию резервов гликогена и жира с целью повышения уровня гликемии (табл. 14-1 и 14-2). Запасы гликогена в печени и глюконеогенез в печени и почках служат непосредственными источниками глюкозы для ЦНС, а образование жирных кислот из триглицеридов обеспечивает энергией большие массы скелетной мускулатуры, сердечную мышцу, корковое вещество почек, печень и другие ткани, которые используют жирные кислоты в качестве основного «топлива». Этот механизм позволяет сохранить глюкозу для использования зависимыми от нее тка-
ТАБЛИЦА 14-1. РЕАКЦИЯ АВТОНОМНОЙ НЕРВНОЙ СИСТЕМЫ НА ГИПОГЛИКЕМИЮ
Альфа-адренергические эффекты
Ингибирование секреции эндогенного инсулина
Стимуляция сужения периферических сосудов, приводящая к усилению кровотока в мозге
Бета-адренергические эффекты
Стимуляция гликогенолиза в печени и мышцах
Стимуляция секреции глюкагона
Стимуляция липолиза (образования свободных жирных кислот)
Уменьшение включения глюкозы в мышечную ткань
Стимуляция работы сердца, приводящая к усилению мозгового кровотока
Эффекты катехоламинов мозгового вещества надпочечников
Усиление альфа- и бета-адренергических эффектов
Холинэргические эффекты
Стимуляция секреции панкреатического полипептида
Усиление двигательной функции желудка
Индукция чувства голода___________________________
По: Karam JH: Hypoglycemic disorders. In: Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 702
ТАБЛИЦА 14-2. ОТВЕТ ИНСУЛИНА И КОНТРРЕГУЛЯТОРНЫХ ГОРМОНОВ НА ГИПОГЛИКЕМИЮ
Инсулин: пониженная секреция
Ослабление стимуляции бета-клеток из-за низкой концентрации глюкозы
Ингибирование секреции глюкозы альфа-адренергической нервной системой и адреномедуллярными катехоламинами
Глюкагон: повышенная секреция
Прямая стимуляция альфа-клеток низкими концентрациями глюкозы
Стимуляция секреции глюкагона бета-адренергической нервной системой и адреномедуллярными катехоламинами
Катехоламины: повышенная секреция
Прямая стимуляция симпатической нервной системы низкими концентрациями глюкозы
Прямая секреция катехоламинов из мозгового вещества надпочечников в ответ на низкую концентрацию глюкозы
АКТГ и кортизол: повышенная секреция
Прямая стимуляция секреции гипофизарного АКТГ в ответ на низкую концентрацию глюкозы
Стимуляция гипофизарно-надпочечниковой системы симпатической нервной системой
Гормон роста: повышенная секреция
Прямая стимуляция секреции гормона роста в ответ на низ-кую концентрацию глюкозы
нями, а также ЦНС, эритроцитами, костным мозгом и медуллярным веществом почек (Karam, 2001). Начальным событием в каскаде процессов, обеспечивающих эндогенную продукцию глюкозы, является
680 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
снижение ее концентрации в крови, которая, в конце концов, опускается ниже критического уровня (приблизительно до 65 мг/100 мл). Это индуцирует ответ вегетативной нервной системы и секрецию контррегуляторных гормонов с целью обеспечения мозга адекватным количеством глюкозы.
Гормоны являются наиболее важными регуляторами глюкозы, а глюкоза - основной детерминантой секреции глюкорегуляторных гормонов. В свою очередь, инсулин является главным гипогликемическим гормоном. Гипогликемия ингибирует секрецию инсулина и приводит, таким образом, к усилению мобилизации энергии из ее резервных источников, (в частности, посредством гликогенолиза и липолиза); одновременно стимулируется глюконеогенез и кетогенез в печени и глюконеогенез в почках и уменьшается утилизация глюкозы зависимыми от инсулина тканями (Cryer, Polonsky, 1998; Karam, 2001). Глюкагон, адреналин, гормон роста и кортизол представляют собой контррегуляторные, увеличивающие уровень глюкозы в крови гормоны (см. табл. 14-2). Индуцируемая инсулином гипогликемия вызывает увеличение концентраций глюкагона, адреналина и норадреналина в плазме крови на начальных стадиях контррегуляторной реакции, тогда как секреция гормона роста и кортизола начинает возрастать позднее. Глюкагон является ключевым контррегуляторным гормоном, который обеспечивает выход из острой гипогликемии, хотя его влияние при хронической гипогликемии менее выражено (Cryer, Gerich, 1985). В ответ на падение уровня глюкозы альфа-клетки поджелудочной железы высвобождают глюкагон в систему портального кровообращения печени; он действует исключительно на печень, активируя в ней гликогенолиз и глюконеогенез (Cryer, Polonsky, 1998). Продукция глюкозы в этом органе возрастает в течение нескольких минут после начала действия глюкагона.
Адренергическая катехоламиновая реакция также играет важную роль в нейтрализации гипогликемии. Адреналин действует как непосредственно, так и опосредованно, стимулируя гликогенолиз в печени и глюконеогенез в печени и почках. Он снабжает мышцы альтернативными источниками энергии, вызывая распад гликогена в мышечной ткани и стимулируя липолиз. Он также мобилизует предшественники глюконеогенеза (лактат, аланин и глицерин) и ингибирует утилизацию глюкозы чувствительными к инсулину тканями (в частности, скелетной мускулатурой) (Cryer, 1993; Karam, 2001). Кортизол и гормон роста, по-видимому, играют незначительную роль в острой реакции на гипогликемию. Повышенная концентрация кортизола в крови на протяжении длительного периода стимулирует липолиз, усиливает катаболизм белков и превращение аминокислот в глюкозу и снижает утилизацию глюкозы в тканях под действием инсулина. Гормон роста также стимулирует липолиз и противодействует инсулину в мышечных клетках. Однако гипергликемическое действие кортизола и гормона
роста проявляется не ранее чем через несколько часов после эпизода гипогликемии (Cryer, Polonsky, 1998). Кортизол и гормон роста также принимают участие в механизмах защиты организма от продолжительной гипогликемии (Boyle, Cryer, 1991).
Адренергическая нейрогенная реакция на гипогликемию непосредственно повышает концентрацию глюкозы в плазме крови и индуцирует секрецию гормонов, усиливающих адренергическую мобилизацию энергетических запасов (см. табл. 14-1). У собак важным контррегуляторным фактором является ауторегуляция продукции глюкозы в печени (Cryer, Polonsky, 1998). Иными словами, скорость биосинтеза глюкозы в печени обратно пропорциональна ее концентрации в плазме крови независимо от влияния нервных или гормональных регуляторных механизмов.
Регуляция секреции инсулина у здоровых собак
Отношение концентраций инсулина и глюкозы в крови остается постоянным даже во время продолжительного голодания (De Braijne et al, 1981). Бета-клетки островков поджелудочной железы служат главным инструментом мониторинга и регуляции концентрации глюкозы в плазме крови. Поступление глюкозы в бета-клетки, в отличие от большинства других типов клеток, не зависит от инсулина. После того как ее концентрация в плазме крови возрастает примерно до ПО мг/100 мл, скорость секреции инсулина также увеличивается, что приводит к снижению уровня гликемии. Падение концентрации глюкозы ниже 60 мг/100 мл подавляет секрецию инсулина, что, в свою очередь, ограничивает ее утилизацию в тканях; в результате уровень глюкозы в крови повышается.
Секреция инсулина у собак с опухолями бета-клеток
У собак и кошек опухоли бета-клеток поджелудочной железы автономно синтезируют и секретируют инсулин вне связи с уровнем гипогликемии. В результате при гипогликемии утилизация глюкозы тканями продолжается, ее концентрация в крови прогрессивно понижается, и, в конце концов, появляются клинические симптомы гипогликемии. Начало их проявления зависит от скорости падения уровня глюкозы и тяжести гипогликемии. Так, например, при постепенном уменьшении концентрации глюкозы до 35 мг/100 мл на протяжении достаточно длительного периода (нескольких недель) вероятность клинической симптоматики гипогликемии значительно меньше, чем при быстром снижении гликемии до того же уровня в течение нескольких часов.
Продолжение секреции инсулина во время гипогликемии способствует развитию ее клинической симптоматики у собак с опухолью бета-клеток
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 681
при голодании или физических нагрузках. Секретирующие инсулин опухоли бета-клеток сохраняют чувствительность к разнообразным факторам, которые стимулируют секрецию инсулина у здоровых животных. Более того, секреторный ответ усиливается, что усугубляет тяжесть гипогликемии. В частности, ее клинические симптомы появляются даже после еды или после внутривенного введения глюкозы с целью коррекции ее пониженной концентрации (см. стр. 683).
Механизм индуцируемой инсулином гипогликемии
Инсулин-секретирующие опухоли и сопутствующая им гиперинсулинемия приводят к нарушению гомеостаза глюкозы, замедляя ее высвобождение из печени и усиливая утилизацию в чувствительных к инсулину тканях (мышечной и жировой). Инсулин препятствует усилению продукции глюкозы в печени, лимитируя концентрацию в крови субстратов глюконеогенеза путем подавления активности ферментов, участвующих в мобилизации аминокислот из мышечной ткани и глицерина из жировой ткани. Кроме того, он снижает активность гепатических ферментов, необходимых для глюконеогенеза и гликогенолиза. Инсулин также уменьшает концентрацию глюкозы в крови путем стимуляции ее включения и утилизации в печени, мышцах и жировой ткани. Таким образом, инсулин усиливает утилизацию глюкозы, уже присутствующей во внеклеточном пространстве, и одновременно подавляет ее образование в печени. Конечным результатом его действия является снижение концентрации глюкозы в крови благодаря ее интенсивной утилизации в тканях (соответствующие литературные источники приведены в работе Feldman, Nelson, 1987).
Происхождение клинических симптомов
Глюкоза служит главным источником энергии для ЦНС. Запасы углеводов в нервной ткани ограничены, и функция нервных клеток обеспечивается непрерывным поступлением глюкозы в ЦНС извне. Уменьшение ее концентрации в крови до уровня ниже критического вызывает нарушение функции нервной системы. При недостатке глюкозы у млекопитающих в первую очередь страдает кора головного мозга. Потребность в энергии метаболически более медленных вегетативных центров ствола мозга меньше, чем у коры, и их функция нарушается позднее.
Глюкоза поступает в нейроны ЦНС, главным образом, в процессе диффузии и независимо от инсулина. Поскольку клеточные мембраны непроницаемы для таких гидрофильных молекул, как глюкоза, клеткам необходимы белки-носители, которые транспортируют глюкозу через липидные бислои в цитозол. Такие независимые от источников энергии транспортеры, помогающие глюкозе
ТАБЛИЦА 14-3. ТРАНСПОРТЕРЫ ГЛЮКОЗЫ, ИДЕНТИФИЦИРОВАННЫЕ У ЧЕЛОВЕКА
Название Основные места экспрессии Сродство к глюкозе*
GLUT 1 Сосудистая система мозга, эритроциты, все ткани Высокая (Км = 1 ммоль/л)
GLUT 2 Печень, В-клетки поджелудочной железы, серозные поверхности кишечника и почек Низкая (Км = 15-20 ммоль/л)
GLUT3 Нейроны мозга и все ткани Высокая (Км < 1 ммоль/л)
GLUT 4 Мышцы, жировые клетки Средняя (Км = 2,5-5 ммоль/л)
GLUT 5 Тощая кишка, печень, сперматозоиды Средняя (Км = 6 ммоль/л)
Из: Masharani U, Karam JH: Pancreatic hormones and diabetes mellitus. In: Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 630.
*) Км - концентрация глюкозы в плазме крови, при которой транспортер проявляет 50% максимальной транспортной активности; Км обратно пропорциональна сродству транспортера к глюкозе.
диффундировать через клеточные мембраны, имеются во всех клетках, за исключением кишечных и почечных. У человека известно, по крайней мере, пять таких «посредников транспорта глюкозы», обозначаемых, в порядке их идентификации, как GLUT 1 - GLUT 5 (Masharani, Karam, 2001) (табл. 14-3). GLUT 1 присутствует во всех тканях, обладает очень высоким сродством к глюкозе и опосредует ее базальное включение. Кроме того, он является важным компонентом кровеносной системы головного мозга (гематоэнцефалического барьера) и обеспечивает адекватный транспорт циркулирующей глюкозы в ЦНС (рис. 14-2). GLUT 3 - главный транспортер глюкозы на поверхности нейронов; он также отличается очень высоким сродством к глюкозе и отвечает за ее переход из спинномозговой жидкости в нервные клетки.
Транспорт и утилизация глюкозы в нервных клетках не зависят от концентрации инсулина в крови. Однако недостаток глюкозы для обеспечения процессов внутриклеточного окисления в нейронах в условиях гиперинсулинемии приводит к уменьшению содержания богатых энергией фосфорилированных соединений, в частности аденозинтрифосфата (АТФ). Это, в свою очередь, вызывает изменения, характерные для гипоксии, повышенной проницаемости сосудов, их расширения, вазоспазма и отека. Кислородная недостаточность приводит к гибели нейронов. При острой гипогликемии гистологические изменения наиболее выражены в коре мозга, базальных ганглиях, гиппокампе и вазомоторных центрах (см. перечень соответствующих литературных источников в работе Feldman, Nelson, 1987). Хотя гипогликемия имеет наиболее серьезные последствия для головного мозга, она нередко приводит к дегенерации и демиелиниза-
682
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
Хроническая гипергликемия Гематоэнцефалический барьер
Глюкоза
Глюкоза
Глюкоза
Глюкоза
Глюкоза
Глюкоза
GLUT 1
Глюкоза
GLUT3 GLUT3 Нейроны
GLUT3
Нормальная концентрация глюкозы
Гематоэнцефалический барьер
Глюкоза
Глюкоза
Глюкоза
GLUT 1
---►GLUT 1
GLUT 1
GLUT3
GLUT3
GLUT3
Нейроны
ТАБЛИЦА 14-4. КЛИНИЧЕСКИЕ СИМПТОМЫ ИНСУЛИН-СЕКРЕТИРУЮЩЕЙ ОПУХОЛИ У 91 СОБАКИ
Клинические симптомы Число собак Процент
Судороги 51 56
Общая слабость 43 47
Коллапс 27 30
Атаксия 17 19
Мышечные подергивания 16 18
Слабость задних конечностей 15 16
Депрессия, вялость 15 16
Необычное поведение 11 12
Полифагия 6 7
Полиурия и полидипсия 6 7
Увеличение веса тела 6 7
Диарея 4 4
Обморок 3 3
Нервозность 3 3
Наклонение головы 3 3
Анорексия 3 3
Недержание мочи 2 2
Слепота 2 2
Одышка 1 1
Глюкоза
Частая гипогликемия
Гематоэнцефалический барьер
GLUT1 /
GLUT1 (2l
GLUT 1
GLUT 1
GLUT 1
GLUT 1
Глюкоза
GLUT3
GLUT3
GLUT3
Нейроны
Рис. 14-2. Гликемическая регуляция транспортеров глюкозы. В средней части рисунка показан нормальный компонент транспортера глюкозы-1 (GLUT 1) с высоким сродством к глюкозе на сосудистых клетках ЦНС во время эугликемии. Соответствующее количество глюкозы диффундирует через гематоэнцефалический барьер и транспортируется в нейроны другим транспортером с высоким сродством к глюкозе (GLUT 3). Верхняя и нижняя части рисунка иллюстрируют, соответственно, процесс адаптации при хронической гипергликемии посредством уменьшения содержания GLUT 1 (вверху) и при хронической гипогликемии посредством увеличения содержания GLUT 1 (внизу).
(Из: Karam JH: In Greenspan FS, Gardner DG (eds.): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/ McGraw, 2001, p. 701.
ции периферических нервов (Braund et al, 1987). Другие важные системы органов, включая сердце, почки и печень, также зависят от поступления в них глюкозы. Тем не менее, острое понижение концентрации глюкозы в крови в первую очередь индуцирует клинические симптомы нарушений в ЦНС, а дисфункция других систем и органов проявляется позднее.
Тяжелая гипогликемия на протяжении длительного времени приводит к необратимым изменениям в мозге. В то же время, собаки редко погибают во время эпизодов гипогликемии. Гипогликемия служит мощ-
ным стимулом для высвобождения контррегуляторных гормонов, которые действуют как антагонисты инсулина и стимулируют повышение концентрации глюкозы в плазме крови (см. раздел «Гипогликемия и контррегуляторный ответ», стр. 679).
Клинические проявления гипогликемии являются следствием недостаточного поступления глюкозы в мозг (нейрогликопении) и стимуляции симпатоадреналовой системы. Типичные для собак признаки нейрогликопении включают вялость, общую слабость, атаксию, необычное поведение, конвульсии и кому (табл. 14-4). К числу клинических симптомов, индуцируемых стимуляцией симпатоадреналовой системы, относятся мышечный тремор, нервозность, беспокойство и чувство голода. У человека симптомы, связанные с высвобождением катехоламинов, нередко предшествуют проявлениям нейрогликопении и служат ранними предвестниками приближающегося приступа гипогликемии (Karam, 2001). Эта ситуация иллюстрирует быстрый ответ катехоламинов на гипогликемию и частично объясняет, почему у собак с инсулин-секретирующими опухолями не всегда развиваются генерализованные судороги во время голодания.
Клиническая симптоматика гипогликемии зависит от ее тяжести и продолжительности. Животные с хронической и/или рецидивирующей натощак гипогликемией могут в течение длительного времени переносить низкие концентрации глюкозы в крови (20-30 мг/100 мг) без видимых внешних проявлений. Однако дальнейшее незначительное снижение уровня глюкозы часто приводит к появлению симптомов гипогликемии. Как полагают, «процесс адаптации» к тяжелой хронической гипогликемии включает «повышающую регуляцию» транспортера GLUT 1 с высоким сродством к глюкозе в клетках кровеносных сосудов, образующих гематоэнцефалический барьер (см. рис. 14-2) (Karam, 2001).
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
683
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Встречаемость
Секретирующие инсулин опухоли чаще всего развиваются у собак среднего и старшего возраста. Возраст 97 животных в нашей серии на момент выявления такой опухоли колебался от 3 до 14 лет и в среднем составлял 9,8 года (медиана 10 лет) (рис. 14-3). Зависимости частоты развития опухолей от пола и породы собак не выявлено (табл. 14-5). Хотя мы чаще всего диагностировали такие опухоли у лабрадоров-ретриверов, немецких овчарок и золотистых ретриверов, такая ситуация, вероятно, отражает не столько предрасположенность именно этих пород к возникновению инсулин-секретирующих опухолей, сколько их популярность в нашем регионе. В целом, опухоли бета-клеток у крупных собак развиваются чаще, чем у мелких. Однако при назначении обследования животного с гипогликемией на наличие инсулин-секретирующей опухоли ни в коем случае нельзя ориентироваться на его размер. Мы находили подобные опухоли даже у таких маленьких собак, как померанский шпиц.
Анамнез
Одни владельцы собак с инсулин-секретирующи-ми опухолями обращаются за ветеринарной помощью спустя год и более после начала клинических проявлений заболевания, а другие уже через день после их возникновения. Однако в большинстве случаев животные с такими опухолями поступают в ветеринарную клинику через 1-6 месяцев после появления клинических симптомов. В группе из 30 собак, которых нам довелось обследовать в самое последнее время, период между появлением признаков заболевания и обращением в нашу лечебницу составлял от 2 дней до 12 месяцев (в среднем 3 месяца).
Клинические признаки инсулин-секретирующей опухоли обычно обусловлены нейрогликопенией (гипогликемией) и повышением концентрации ка-
20
Возраст (годы)
Рис. 14-3. Возраст 97 собак при установлении диагноза инсулин-секретирующей опухоли островковых клеток.
ТАБЛИЦА 14-5. ЧАСТОТА ОБНАРУЖЕНИЯ ОПУХОЛЕЙ ОСТРОВКОВЫХ КЛЕТОК У 89
СОБАК РАЗНЫХ ПОРОД
Порода Число собак Процент
Лабрадор-ретривер 12 13
Золотистый ретривер 10 11
Немецкая овчарка 7 8
Ирландский сеттер 6 7
Терьеры (фокстерьер, керри-блю-терьер, уэст-хайленд-уайт-терьер, норвич-терьер) 6 7
Пудель 6 7
Колли 5 6
Кокер-спаниель 5 6
Беспородные собаки 5 6
Доберман-пинчер 3 3
Боксер 3 3
Бородатая колли 3 3
Ротвейлер 3 3
Самоедская лайка 2 2
Другие породы (по одной собаке каждой породы) 13 15
техоламинов в крови. Заболевание проявляется в форме судорог, общей слабости, коллапса, атаксии, фасцикулярных подергиваний мышц и необычного поведения (см. табл. 14-4). Одной из характерных особенностей гипогликемии, независимо от причины расстройства, является ее эпизодический характер. Перемежающиеся эпизоды гипогликемии длятся всего нескольких секунд или минут, поскольку тут же включаются компенсаторные контррегуляторные механизмы, которые реагируют на понижение концентрации глюкозы в крови и вызывают ее увеличение. При неадекватной работе этих механизмов по мере дальнейшего падения уровня гликемии могут возникнуть судороги, которые чаще всего носят кратковременный характер и продолжаются от 30 секунд до 5 минут. Судороги могут стимулировать дальнейшее усиление секреции катехоламинов и включать другие контррегуляторные механизмы, которые приведут к увеличению концентрации глюкозы выше критического уровня.
Как уже говорилось, клиническая симптоматика зависит от тяжести и продолжительности гипогликемии. Хотя собаки с хронической гипогликемией натощак или с ее повторяющимися эпизодами, по-видимому, способны переносить низкую концентрацию глюкозы в плазме крови (до 20-30 мг/100 мл) на протяжении длительного времени, дальнейшее, даже самое незначительное снижение уровня глюкозы может привести к появлению признаков гипогликемии. Поэтому голодание, волнение, физическая нагрузка или поедание корма могут сами по себе индуцировать клинические проявления гипогликемии. У здоровых собак во время физических нагрузок равновесие между усиливающейся утилизацией глюкозы в мышцах, уменьшением ее утилизации другими тканями и увеличением продукции в печени обеспечивает поддержание нормоглике-мии, что, в свою очередь, создает условия для нормального функционирования мозга. В той же ситу
684 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
ации у собак с инсулин-секретирующей опухолью утилизация глюкозы продолжается не только в мышечной, но и во всех остальных тканях, поскольку инсулин выделяется автономно и непрерывно. Одновременно уменьшается высвобождение глюкозы из печени. Это значительно повышает риск тяжелой гипогликемии, что подтверждают многие владельцы животных, которые связывают появление клинических симптомов этого расстройства у своих собак с повышенной физической активностью: прыжками, играми, длительными прогулками и т.п. Считается, что аналогичный механизм лежит в основе развития симптомов гипогликемии при волнении или возбуждении животных.
Опухоли бета-клеток обычно отвечают на повышение концентрации глюкозы в крови усилением секреции инсулина. Поедание корма стимулирует высвобождение инсулина, которое может быть избыточным и приводить к постпрандиальной гипогликемии с проявлениями ее клинических симптомов на протяжении последующих 2-6 часов.
Физикальное исследование
Физикальное исследование собак с инсулин-сек-ретирующими опухолями нередко оказывается на удивление мало информативным, особенно когда клинические симптомы гипогликемии отмечались на протяжении нескольких месяцев до обследования. Большинство выявляемых нарушений имеют неспецифический характер, хотя и согласуются с наличием гипогликемии (табл. 14-6). Чаще всего отмечаются слабость и вялость. В находившейся под нашим наблюдением группе собак эти признаки наблюдались соответственно у 40% и 20% особей. Во время обследования возможны эпизоды судорожной активности или коллапс, однако, такие случаи редки. У собак обычно отсутствуют посторонние пальпируемые структуры, если не считать таких возрастных образований, как липомы. У некоторых животных отмечается прирост веса, обусловленный, по-видимому, анаболическим действием инсулина. Отсутствие аномалий при физикальном исследовании, особенно у старых, крупных собак, подтверждает наличие инсулин-секретирующей опухоли.
ТАБЛИЦА 14-6. РЕЗУЛЬТАТЫ ФИЗИКАЛЬНОГО ИССЛЕДОВАНИЯ 52 СОБАК С ИНСУЛИН-СЕКРЕТИРУЮЩИМИ ОПУХОЛЯМИ
Результат физикального исследования Число собак Процент
Общая слабость 22 42
Вялость 10 19
Коллапс 6 12
Судороги 4 8
Тремор 4 8
Заторможенность 4 8
Периферическая нейропатия 3 6
Ожирение 2 4
Отсутствие нарушений 24 46
Периферическая невропатия. У собак с опухолями, секретирующими инсулин, описаны периферические невропатии (Shahar et al, 1985; Braund et al, 1987; van Ham et al, 1997). Диапазон их клинических проявлений, выявляемых при физикальном исследовании, весьма широк: от парапареза до тетрапареза, от парезов до паралича лицевых мускулов, от гипорефлексии до арефлексии, гипотонии и атрофии аппендикулярных, жевательных и/или лицевых мышц. Поражаются также сенсорные нервы. Сообщалось о случаях субклинической полиневропатии (Braund et al, 1987). Начало клинических проявлений невропатии может быть острым (через несколько дней после ее возникновения) или постепенным (в течение нескольких недель или месяцев). Электродиагностическое исследование выявляет аномальные спонтанные потенциалы (например, положительные острые волны или фиб-рилляционные потенциалы) и замедление скорости нервной проводимости (Braund et al, 1987). Анализ спинномозговой жидкости (СМЖ) не выявляет аномалий (van Ham et al, 1997). Гистопатологическое исследование моторных и сенсорных нервов выявляет тяжелый некроз аксонов, потерю нервных волокон и демиелинизацию-ремиелинизацию разной степени (Braund et al, 1987; Schrauwen et al, 1996; van Ham et al, 1997). Изменения в мышцах отражают процесс нейрогенной атрофии. Патогенез полиневропатии не выяснен. Она может быть вызвана метаболическими расстройствами в нервной ткани, обусловленными хронической и тяжелой гипогликемией или некоторыми другими связанными с опухолью нарушениями обмена, может быть результатом индуцированного иммунной системой паранеопластического синдрома вследствие наличия общих антигенов в опухолевой и нервной тканях, или вызвана разрушающими нервы токсическими факторами, которые продуцируются опухолью (Kudo, Noguchi, 1985; Das, Hochberg, 1999; Heckmann et al, 2000). Лечение состоит в хирургическом удалении опухоли островковых бета-клеток (Jeffery et al, 1994). Терапия преднизоном (в начальной дозе 1 мг/кг ежедневно) также может улучшить клиническую симптоматику (van Ham et al, 1997). Коррекция гипогликемии сама по себе не всегда устраняет клинические проявления периферической невропатии (Bergman et al, 1994).
КЛИНИКО-ПАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ
После анализа анамнестических данных и физикального исследования инсулин-секретирующая опухоль, как правило, остается недиагностирован-ной, более того, даже не возникает подозрения на ее присутствие. В анамнезе большинства таких собак имеются эпизоды слабости и судорог, которые могут быть обусловлены самыми разными органическими расстройствами (табл. 14-7). Минимальный набор диагностических мероприятий для таких животных включает общий клинический анализ крови
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 685
ТАБЛИЦА 14-7. НЕПОЛНЫЙ ПЕРЕЧЕНЬ МНОГОЧИСЛЕННЫХ НАРУШЕНИЙ, ПРИВОДЯЩИХ К ЭПИЗОДИЧЕСКОЙ СЛАБОСТИ (ВКЛЮЧАЯ СУДОРОГИ)
Нервномышечные расстройства
Инфекции: вирусный энцефалит (собачья чума), криптококкоз, токсоплазмоз
Врожденные: гидроцефалия
Травма
Приобретенные: myasthenia gravis (тяжелая псевдопарали-тическая миастения), столбняк, дискоспондилит, идиопатический полирадикулоневрит (паралич кунхаундов), полимиозит, полиартрит
Неоплазия
Токсикоз: свинцовое отравление
Идиопатическая эпилепсия
Идиопатическая полиневропатия
Сердечно-сосудистые расстройства
Врожденные: анатомические дефекты
Приобретенные: тахиаритмии или брадиаритмии, филяриа-тоз, бактериальный эндокардит
Новообразование: гемангиосаркома
Коагулопатия (индуцированная варфарином)
Метаболические нарушения
Гепатическая энцефалопатия
Г ипокальциемия
Полицитемия
Гипокортицизм
Синдром повышенной вязкости
Феохромоцитома
Гипогликемия
Гипокалиемия
Анемия
(ОАК), биохимический анализ сыворотки и анализ мочи с целью выявления одного из нарушений, перечисленных в табл. 14-7. До установления окончательного диагноза не следует назначать лечение, за исключением случаев неотложной терапии.
Результаты ОАК и анализа мочи у собак с инсу-лин-секретирующими опухолями обычно остаются нормальными. Биохимический профиль сыворотки, как правило, также не изменяется, если не считать пониженной концентрации глюкозы. Правда, некоторые авторы выявляли гипоальбуминемию, гипофосфатемию и гипокалиемию, а также увеличение активности щелочной фосфатазы и аланинаминотрансферазы (Leifer et al, 1986), однако рассматривали эти изменения как неспецифические и не способствующие постановке точного диагноза. Не установлено корреляции между повышением активности ферментов печени и наличием опухоли поджелудочной железы, метастазирующей в печень.
Единственным постоянным изменением биохимического профиля сыворотки является низкая концентрация глюкозы. Ее средняя величина в группе находившихся под нашим наблюдением 97 собак составляла 42 мг/100 мл при индивидуальных колебаниях от 15 до 78 мг/100 мл. Медиана концентрации глюкозы равнялась 38 мг /100 мл. В рандомизированных пробах крови 87 из 97 собак (90%)
уровень глюкозы был ниже 60 мг/100мл. Иногда у собак с секретирующими инсулин опухолями концентрация глюкозы могла быть 70-80 мг/100 мл, но все равно гипогликемия оставалась причиной эпизодических приступов слабости и судорожной активности. При подозрении на гипогликемию проводят пробу с голоданием и ежечасным определением концентрации глюкозы в плазме крови. Голодание в течение 8 часов или менее позволило продемонстрировать гипогликемию в 33 из 35 испытаний у 31 собаки с инсулин-секретирующими опухолями. Некоторым животным приходилось увеличивать продолжительность голодания. Лишь в редких случаях голодание на протяжении 12 часов и более не выявляло гипогликемию у собак с инсулин-секретирующими опухолями.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОГЛИКЕМИИ НАТОЩАК
Гипогликемия определяется как концентрация глюкозы в плазме крови ниже 60 мг/100 мл. Обычно она является следствием усиленной утилизации глюкозы нормальными (как при гиперинсулинемии) или опухолевыми клетками, нарушения глюконеогенеза и гликогенолиза в печени (например, при портальном анастомозе), недостатка контррегуляторных гормонов (кортизола, глюкагона или других), неадекватного поступления с кормом глюкозы и других субстратов, необходимых для глюконеогенеза (например, при анорексии у щенков или у собак мелких пород) или сочетания перечисленных нарушений, что наблюдается, например, при сепсисе (табл. 14-8) (Service, 1995). Ятрогенная гипогликемия нередко развивается после передозировки инсулина при лечении сахарного диабета.
Врожденное заболевание печени
Самой частой причиной индуцируемой печенью гипогликемии являются нарушения в портальной системе. Гипогликемия развивается несмотря на соответствующее уменьшение концентрации инсулина в крови из-за истощения запасов печеночного гликогена и неспособности клеток печени поддерживать адекватный глюконеогенез. Нарушения в портальной системе, как правило, наблюдаются у худых или истощенных собак и кошек моложе 3 лет; помимо потери веса, им могут сопутствовать любые нарушения, перечисленные в табл. 14-4. Отмечаются также индуцируемые гепатической энцефалопатией асциты, желтуха и дополнительные неврологические симптомы. Нарушения поведения могут усиливаться после поедания богатого белком корма или введения некоторых лекарственных средств (анестетиков, транквилизаторов или диуретиков). Дополнительные признаки, подтверждающие наличие данного расстройства и выявляемые при ОАК, анализе мочи и сыворотки, включают микроцитоз, гипоальбуминемию, гипохолестеринемию, умень-
686 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
ТАБЛИЦА 14-8. КЛАССИФИКАЦИЯ ГИПОГЛИКЕМИИ НАТОЩАК
I. Эндокринная
А. Избыточная продукция инсулина или инсулиноподобных факторов
1. Инсулин-продуцирующая опухоль островковых клеток
2. Внепанкреатические опухоли, секретирующие инсулиноподобные вещества (например ИРФ-П* *)
3. Ятрогенные факторы - передозировка инсулина Б. Недостаточность гормона роста
1. Гипофизарная гипоплазия
2. Гипофизарная киста
В. Недостаточность кортизола
1. Вторичный гипокортицизм
2. Первичный гипокортицизм
Г. Недостаточность глюкагона
1. Хронический панкреатит?
2. Аденокарцинома экзокринной поджелудочной железы?
II. Гепатическая
А. Врожденная
1. Сосудистые анастомозы
2. Гликогенез
Б. Приобретенная
1. Сосудистые анастомозы
2. Хронический фиброз (цирроз)
3. Некроз печени: токсины, возбудители инфекций
4. Первичная или метастазирующая опухоль
III. Субстратная
А. Внепанкреатические опухоли (например, лейомиосаркома)
Б. Эндотоксическая или индуцированная сепсисом
В. Гипогликемия натощак при беременности
Г. Неонатальная или ювенильная гипогликемия
Д. Уремия
Е. Тяжелое недоедание
Ж. Тяжелая полицитемия
IV. Прочее
А. Артефакт
1. Длительное хранение цельной крови
2. Использование портативных глюкометров
Б. Ятрогенные факторы - передозировка инсулина
*) ИРФ-П - инсулиноподобный фактор роста И.
шение концентрации азота мочевины и общего билирубина в крови, появление кристаллов аммония биурата, аномальную пре- и постпрандиальную концентрацию желчных кислот, а также уменьшение размеров печени по данным рентгена и УЗИ брюшной полости. Для подтверждения диагноза используют исследование биоптатов печени, ангиографию, ядерную сцинтиографию и идентификацию шунтирования посредством ультразвукового сканирования и диагностической лапаротомии.
Гликогенез представляет собой редкую врожденную патологию печени у собак, при которой причиной гипогликемии является нарушение превращения гликогена в глюкозу из-за врожденной абсолютной или относительной недостаточности одного из ферментов, необходимых для катаболизма гликогена. Гликогенез Ш типа (болезнь Кори), обусловленный недостаточностью амило-1,6-глю-козидазы, был обнаружен у щенков с клиническими проявлениями тяжелой гепатомегалии (вследс-
твие накопления гликогена), мышечной слабостью и неудовлетворительным общим состоянием (рис. 14-4) (Hardy, 1989). Гликогенез 1атипа (ГГ-la), или болезнь Гирке, является следствием недостаточности глюкозо-6-фосфатазы в результате мутации гена этого фермента. ГГ-1абыл выявлен у мальтийских болонок, и была создана модель этого заболевания у гибридов мальтийской болонки и биглей (Впх et al, 1995; Kishnani et al, 2001). У щенков с ГГ-la наблюдали тремор, слабость и неврологические расстройства на фоне гипогликемии. Биохимические нарушения включали гипогликемию натощак, гиперлактацидемию, гиперхолестеринемию, гипертриглицеридемию и гиперурикемию. У больных щенков развивалась прогрессирующая гепатомегалия, гистологическая картина которой характеризовалась выраженной диффузной гепатоцеллюлярной вакуолизацией. Одной из диагностических проб, предназначенных для выявления гликогеновой болезни, служит тест толерантности к глюкагону. У собак с гликогеновой болезнью I и III типов концентрация глюкозы в плазме крови после инъекции экзогенного глюкагона обычно не возрастает. В медицине для подтверждения диагноза проводят гистологическое исследование биоптатов печени и оценивают активность специфических печеночных ферментов, но в ветеринарии эти методы используют редко.
Приобретенная дисфункция печени
Гипогликемия может быть следствием тяжелого поражения печени под воздействием первичной или метастазирующей опухоли, бактериальной инфекции, гепатотоксина (особенно при хроническом введении противосудорожных средств), травмы или, что бывает чаще всего, тяжелого и хронического фиброза (цирроза) печени и приобретенного анастомоза ее сосудов. Существует множество потенциальных причин хронического фиброза печени у старых собак и кошек. Гипогликемия возникает из-за недостаточной функциональной активности печеночной ткани, необходимой для сохранения гликогена или поддержания глюконеогенеза на уровне, достаточном для обеспечения нормальной концентрации глюкозы в крови во время голодания. Концентрация инсулина в сыворотке уменьшается по мере понижения уровня глюкозы, однако, само по себе это может оказаться недостаточным для предотвращения расстройств печени. ОАК, биохимический анализ сыворотки и анализ мочи выявляют дополнительные нарушения, предполагающие недостаточность печеночной функции. Они включают микроцитоз, гипоальбуминемию, гипо-холестеринемию, снижение азота мочевины в крови, увеличение концентрации общего билирубина, появление кристаллов аммония биурата в моче, аномальные концентрации желчных кислот до и после приема пищи, изменение размеров печени по данным рентгенографии брюшной полости, ано-
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 687
Гликоген
®t 4®
Глюкозо-1-фосфат
Ф
®
Глюкоза
Хлюкозо-6-фосфаг
ф Гексокиназа/глюкокиназа
® Гликогенсинтаза
® Фосфофруктокиназа
@ Пируваткиназа
© Пируваткарбоксилаза
® Фофоэнолпируваткар-боксикиназа
0 Фруктозо-1,6-дифос-фатаза
® Глюкозо-6-фосфатаза
® Фосфорилаза
Фруктозо-6-фосфат
®f 4®
Фру ктозо-1,6-фосфат
Фосфоэнолпируват
4®
Лактат
Аланин
кислот
—а-Кетоглютарат
ксалоацетат
Цикл три- х Ж” арбоновых Цитрат
Глицерин
Триглицериды
Жирные кислоты
Ацетил-СоА
Кетоны
Глутамин
Рис. 14-4. Схема обмена глюкозы. (Из: Cryer РЕ, Polonsky KS: hr. Wilson JD et al (eds): Williams Textbook of Endocrinology, 9lh ed. Philadelphia, W.B. Saunders, 1988, p 940).
мальные размеры и эхоструктуру печени при УЗИ. Биопсия печени позволяет подтвердить наличие тяжелого фиброза или цирроза и даже установить его причину (например, новообразование). Однако в большинстве случаев этиология фиброза или цирроза печени остается невыясненной.
Недостаточность коры надпочечников (болезнь Аддисона)
Гипогликемия у собак с гипокортицизмом обусловлена недостаточной секрецией глюкокортикоидов, которые необходимы для стимуляции продукции и мобилизации глюкозы в печени (см. гл. 8). При этой патологии гипогликемия развивается несмотря на сопутствующее уменьшение концентрации инсулина в крови. Последнее должно сопровождаться усилением глюконеогенеза в печени с целью компенсации гипогликемии. Биосинтез глюкозы обычно стимулируется глюконеогенными гормонами. В их отсутствие (например, при гипокортицизме) может возникнуть гипогликемия (Sherwin, Felig, 1981). Гипокортицизм чаще всего отмечается у собак среднего и молодого возраста, причем у сук чаще, чем у кобелей. К числу выявляемых в процессе скрининга аномалий, предполагающих наличие гипокортицизма, относятся увеличение относительного количества эозинофилов и лимфоцитов, слабо выраженная нерегенеративная анемия, слабая до тяжелой преренальная азотемия, гиперкалиемия, гипонатриемия и гиперкальциемия. Рентгенографическое исследование грудной клетки может выявить изменения, свидетельствующие о гиповолемии (например, микрокардию), а электрокардиографическое исследование - изменения, обуслов
ленные гиперкалиемией. Диагноз подтверждается аномальными результатами провокационной пробы с АКТГ.
Недостаточность глюкагона
Глюкагон является ключевым контррегуляторным гормоном, который обеспечивает выход из острой гипогликемии (Cryer, Gerich., 1985). В ответ на уменьшение концентрации глюкозы в плазме крови альфа-клетки островков поджелудочной железы начинают секретировать глюкагон в портальную циркуляцию; он действует исключительно на печень, стимулируя глюконеогенез и гликогенолиз (Cryer, Polonsky, 1998). Продукция глюкозы в печени возрастает спустя несколько минут после воздействия глюкагона. Нарушение биосинтеза или секреции глюкагона препятствует проявлению нормального контррегуляторного ответа на снижение концентрации глюкозы в крови и предрасполагает к развитию гипогликемии. Классическим последствием неспособности распознавать гипогликемию у людей с сахарным диабетом является синдром, вызванный недостаточностью секреции глюкагона и катехоламинов, что приводит к нарушению контррегуляции, тяжелой гипогликемии и диабетической коме (Gerich et al, 1985; Mokan et al, 1994; Meyer et al, 1998). У человека известна также изолированная недостаточность глюкагона, вызывающая гипогликемию, однако это расстройство встречается редко (Cryer, Polonsky, 1998). Обычно глюкагоновая недостаточность развивается на фоне избыточной продукции инсулина, уменьшения секреции катехоламинов или повышения чувствительности тканей к действию инсулина. Сочетание этих нарушений
688 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
приводит к гипогликемии. Мы наблюдали гипогликемию у собак и особенно у кошек с панкреатитом и аденокарциномой экзокринной ткани поджелудочной железы. По нашему мнению, деструктивные процессы, обусловленные этими заболеваниями, могут вызывать недостаточность глюкагона и/или аномальную секрецию инсулина.
Гипопитуитаризм
Важными контррегуляторными гормонами, влияющими на биосинтез и секрецию глюкозы в печени, являются также кортизол и гормон роста (см. стр. 679). Нарушение способности гипофиза секретировать АКТГ и/или гормон роста оказывает неблагоприятное влияние на гомеостаз глюкозы и предрасполагает животных к гипогликемии, особенно натощак или при голодании. Как и при первичном гипокортицизме, секреция инсулина снижается в соответствии с уменьшением уровня глюкозы в крови, но этого недостаточно для предотвращения клинических проявлений гипогликемии. Недостаточность гормона роста - редкая причина гипогликемии и чаще всего имеет место у молодых немецких овчарок (врожденный дефект) или у собак с приобретенной гипофизарной недостаточностью, обусловленной злокачественным ростом, травмой или воспалением. Для диагностики этого клинического состояния используют тест со стимуляцией секреции гормона роста (см. гл. 2). Недостаточная секреция гипофизарного АКТГ приводит к атрофии пучковой зоны коры надпочечников, уменьшению секреции кортизола и развитию вторичного гипокортицизма. У животных с вторичным гипокортицизмом скрининговые лабораторные исследования не выявляют классических аномалий. У таких собак отмечается слабая нерегенеративная анемия и гипогликемия натощак, однако, концентрация электролитов в сыворотке крови обычно остается в норме. Провокационная проба с АКТГ и определение базальной концентрации эндогенного АКТГ в крови позволяют диагностировать вторичный гипокортицизм (см. гл. 8).
Опухоли других клеток
У человека опухоли иных типов клеток, нежели бета-клетки, приводящие к гипогликемии, обычно имеют мезенхимальную природу (например, лейомиосаркома или фибросаркома). Реже гипогликемия индуцируется опухолями эпителиального (гепатома или карциноиды) либо гемопоэтического (лимфома, множественная миелома) происхождения (Cryer, Polonsky, 1998). У собак гипогликемия также связана с самыми разными опухолями (табл. 4-9). По данным нашей клиники, наиболее частыми новообразованиями такого типа являются гепатоцеллюлярная карцинома, гепатома, лейомиома, лейомиосаркома и опухоли, интенсивно метастазирующие в печень.
ТАБЛИЦА 14-9. ГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ ВНЕПАНКРЕАТИЧЕСКИХ ОПУХОЛЕЙ, АССОЦИИРУЮЩИХСЯ С ГИПОГЛИКЕМИЕЙ, ПО ДАННЫМ ВЕТЕРИНАРНОЙ ЛИТЕРАТУРЫ, НАЧИНАЯ С 1977 ГОДА
Эпителиального происхождения 16 собак
Гепатоцеллюлярная карцинома 11 собак
Гепатома 2 собаки
Метастатическая карцинома молочных желез 1 собака
Аденокарцинома слюнных желез 1 собака
Карцинома легких 1 собака
Мезенхимального происхождения 22 собаки
Лейомиосаркома 10 собак
Печени 3 собаки
Желудка 3 собаки
Тонкой кишки 2 собаки
Селезенки 2 собаки
Лейомиома 10 собак
Желудка 6 собак
Тонкой кишки 4 собаки
Гемангиосаркома 2 собаки
Селезенки 1 собака
Печени 1 собака
Различного происхождения 3 собаки
Плазмацитома 1 собака
Лимфоцитарная лейкемия 1 собака
Метастатическая меланома 1 собака
Патогенез гипогликемии, вызываемой опухолями клеток, отличных от бета-клеток, изучен недостаточно, но, без сомнения, имеет многофакторную природу. Предполагаемые механизмы включают избыточную утилизацию глюкозы опухолевой тканью, ослабление глюконеогенеза и гликогенолиза в результате вызванного опухолью разрушения печени, подавление контррегуляторного ответа, предотвращающего гипогликемию, или секрецию инсулиноподобного пептида, который снижает концентрацию глюкозы в крови, стимулируя ее утилизацию нормальными клетками (Cryer, Polonsky, 1998). У человека усиленная утилизация глюкозы в сочетании с неадекватной или низкой продукцией глюкозы в печени часто играет роль в развитии гипогликемии под воздействием опухолей, отличных от бета-клеток. Непанкреатические опухоли редко продуцируют инсулин в количествах, достаточных для выявления обычным радиоиммунологическим методом (Khan, 1980). У большинства больных с такими опухолями и гипогликемией секреция инсулина подавлена (Scully et al, 1983). Точно так же у собак с непанкреатическими опухолями концентрация инсулина в крови ниже нормы или он вообще не определяется. Этим они отличаются от животных с гипогликемией, индуцированной опухолями бета-клеток, у которых концентрация инсулина выше нормы (Beaudry et al, 1995; Bagley et al, 1996; Bellah, Ginn, 1996).
Считается, что у многих людей с мезенхимальными опухолями или гепатоцеллюлярной карциномой в патогенезе гипогликемии играет роль избыточная продукция инсулиноподобного ростового
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 689
фактора-П (ИРФ-П) (Merimee, 1986; LeRoith et al, 1992; Fukuda et al, 1994; Daughaday, 1995). Главным органом, определяющим концентрацию ИРФ в циркуляции, является печень, но они образуются и в других, самых разных тканях, в первую очередь, в мезенхимальных клетках (D’Ercole et al, 1984; Ваггеса et al, 1992). Это согласуется с мезенхимальным происхождением большинства вызывающих гипогликемию опухолей. У пациентов с индуцированной опухолью гипогликемией значительно снижено содержание комплекса с молекулярной массой 150 кД (тройной комплекс ИРФ-П, инсулиноподобный ростовой фактор-связывающего белка 3 (ИРФСБ-3) и кислотно-лабильной субъединицы), который служит основным транспортером ИРФ-П в кровяном русле (сведения о ИРФСБ-3 см. на стр. 51). В результате этого основная часть ИРФ-П транспортируется в составе меньшего комплекса, который легче проникает в ткани-мишени, и увеличена концентрация свободного ИРФ-П в сыворотке. ИРФ-П является структурным гомологом проинсулина, обладает инсулиноподобным действием и способен связываться с рецепторами инсулина, вызывая гипогликемию. Кроме того, ИРФ-П подавляет секрецию глюкагона и гормона роста, что тоже может способствовать развитию гипогликемии (Cryer, Polonsky, 1998).
Сходный патофизиологический механизм гипогликемии был установлен у собаки с лейомиомой желудка и гипогликемией (Boari et al, 1995), у которой концентрация ИРФ-П в сыворотке крови до хирургической операции была повышена, а после удаления опухоли нормализовалась, как и концентрация глюкозы. Иммуногистохимическое исследование с окрашиванием опухолевой ткани выявило в ней повышенное содержание ИРФ-П (5,7 нмоль/кг ткани по сравнению с 1,1 -3,7 нмоль/кг в здоровой ткани желудочной стенки). Методом гибридизации in situ была показана экспрессия информационной РНК (мРНК) ИРФ-П в опухолевой ткани. Оценка распределения молекулярных форм ИРФ-П в кровяном русле показала, что иммунореактивность ассоциировалась преимущественно с фракцией 50 кДа, а не 150 кДа; после удаления опухоли характер распределения ИРФ-П нормализовался. Это говорит о том, что у данной собаки гипогликемия была вызвана избыточной продукцией ИРФ-П, который циркулировал в крови в более низкомолекулярной форме, а потому легче проникал через стенки капилляров и оказывал инсулиноподобное действие на ткани-мишени.
Другое исследование включало четырех собак с гипогликемией, обусловленной опухолью гладкой мускулатуры. Иммуногистохимическое исследование опухолевой ткани на присутствие инсулина во всех четырех случаях дало отрицательные результаты, но в трех опухолях был выявлен глюкагон (Beaudry et al, 1995). Содержащие глюкагон опухоли были локализованы в желудке или в тощей кишке, а в опухоли в селезенке глюкагон отсутствовал. Гладкомышечные клетки нормальной ткани, окру
жавшей опухоли, не содержали глюкагона. Клиническая значимость этих наблюдений пока не ясна, принимая во внимание, что глюкагон должен повышать, а не понижать концентрацию глюкозы.
Одни собаки с гипогликемией, вызванной непанкреатическими опухолями, поступают в ветеринарную клинику с явными клиническими симптомами гипогликемии, тогда как у других она выявляется только при биохимическом анализе сыворотки. В большинстве случаев такие опухоли локализованы в печени или брюшной полости. Для их идентификации у собак и кошек необходимо тщательное физикальное исследование, рентген грудной клетки и брюшной полости, УЗИ брюшной полости и гистопатологическая характеристика биоптатов опухолей. Причинная связь между опухолями неостровковых клеток и гипогликемией окончательно устанавливается по исчезновению гипогликемии после хирургического удаления новообразования.
Неонатальная и ювенильная гипогликемия
Плод непрерывно получает глюкозу через плаценту и для поддержания ее нормальной концентрации в крови не нуждается в собственной продукции глюкозы в процессе глюконеогенеза. В отличие от этого, источником глюкозы для новорожденных служит глюконеогенез и гликогенолиз в их печени; эти процессы предотвращают гипогликемию, которая может возникнуть даже при непродолжительном голодании. Ограниченные запасы гликогена в печени, малая мышечная масса, отсутствие жировой ткани и соответственно достаточного количества свободных жирных кислот в качестве альтернативного источника энергии создают для новорожденных опасность появления гипогликемии уже в течение нескольких часов голодания (Chastain, 1990). Считают, что у человека гипогликемия новорожденных обусловлена ослаблением глюконеогенеза вследствие задержки индукции одного или нескольких ферментов, лимитирующих скорость этого процесса (Cryer, Polonsky, 1998). Такая задержка может быть причиной гипогликемии и у щенков и котят.
Гипогликемия нередко возникает на фоне гипотермии, сепсиса, голодания, синдрома токсичного молока или комбинации этих явлений. При любом заболевании щенка или котенка необходимо измерить концентрацию глюкозы в крови. Для предупреждения или устранения гипогликемии перорально вводят глюкозу (например, 0,01 мл 5-10%-ного раствора на грамм веса тела), продолжая частое кормление, естественное или через соску.
Гипогликемия обычна для собак мелких и миниатюрных пород в возрасте до 6 месяцев. По аналогии с детьми в качестве ее причины предполагается недостаточность аланина (Chew et al, 1982). У человека скорость высвобождения аланина из мышечной ткани определяет интенсивность глюконеогенеза во время голодания. Щенки с ювенильной гипогликемией зачастую находятся в состоянии тя
690 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
желого стресса. Это, в первую очередь, относится к недавно приобретенным щенкам, которые еще не адаптировались к перемене обстановки и режима питания. У них обычны желудочно-кишечные расстройства (рвота, диарея и анорексия), связанные или не связанные с наличием паразитов. Такие щенки выглядят хрупкими и беспомощными, они поступают в ветеринарную клинику с симптомами общей слабости, депрессии, коллапса, атаксии, ступора, судорог, гипотермии и/или жидкого стула. Внутривенное введение глюкозы быстро улучшает их состояние, а частое кормление предотвращает рецидивы. Гипогликемия практически прекращается после достижения размеров и веса взрослых животных. Если же признаки расстройства сохраняются, следует провести обследование с целью выявления дополнительного заболевания, которое может быть причиной гипогликемии.
Эндотоксическая и септическая гипогликемия
Эндотоксическая и септическая гипогликемия относительно редко встречается у собак и кошек (Breitschwerdt et al. 1981). Патогенез индуцируемой сепсисом гипогликемии до конца не исследован, однако, как полагают, он связан с усилением утилизации глюкозы в тканях и одновременным уменьшением ее продукции в печени (Naylor, Kronfeld, 1985; Hargrove et al, 1988a и 1988b). Факторы, обусловливающие усиление утилизации глюкозы и снижение ее биосинтеза также неизвестны. Предполагается, что повышение интенсивности утилизации глюкозы в тканях может быть следствием индуцируемого сепсисом образования инсулиноподобных соединений, увеличения секреции инсулина бета-клетками под воздействием интерлейкина-1, стимуляции внутриклеточного транспорта глюкозы цитокинами, а также усиленного использования глюкозы бактериями и нейтрофилами (Commens et al, 1987; del Ray, Besedovsky, 1987). Основная доля утилизации глюкозы приходится на богатые макрофагами ткани таких органов, как печень, селезенка и подвздошная кишка (Mezaros et al, 1988). Еще 25% ее общего количества утилизируется в скелетной мускулатуре (Mezaros et al, 1987). Уменьшение образования глюкозы может быть следствием нарушения окислительного обмена в печени, усиления анаэробного гликолиза, гипоксии гепатоцитов или нарушения поступления субстратов в печень в условиях сепсиса (см. перечень литературы в работе Feldman, Nelson, 1987). Гликогенолиз может уменьшаться под воздействием эндотоксинов, которые вызывают истощение печеночных и мышечных резервов гликогена и, кроме того, могут нарушать глюконеогенез в печени.
По нашим наблюдениям индуцируемая сепсисом гипогликемия чаще всего ассоциируется с парвовирусной инфекцией, абсцессом печени или предстательной железы, геморрагическим гастро
энтеритом, пиотораксом, пиометрой или грамотри-цательной септицемией. Подозрение на индуцированную сепсисом гипогликемию возникает, если у животного с пониженной концентрацией глюкозы в крови имеется тяжелое инфекционное заболевание или выраженный лейкоцитоз (более 30000 клеток/ мкл). Диагностика септической гипогликемии основывается на выявлении и идентификации инфекции в процессе физикального исследования, ОАК, рентгенологического и ультразвукового исследований, на результатах бактериального культивирования и исчезновении гипогликемии после проведения соответствующей терапии антибиотиками. При наличии у собаки или кошки с гипогликемией тяжелой инфекции поиск других причин низкой концентрации глюкозы обычно не требуется, за исключением случаев, когда результаты скрининговых тестов предполагают наличие дополнительных расстройств или если гипогликемия не устраняется адекватной антибактериальной терапией.
Почечная недостаточность
Влияние нарушений почечной функции на концентрацию глюкозы в плазме крови собак или кошек непредсказуемо. Обычно она остается нормальной. Тем не менее, гипогликемия может развиться в результате индуцированных уремией интолеран-тности к углеводам и инсулинорезистентности у собак и кошек с нарушенной секрецией инсулина (см. гл. 11). По альтернативному сценарию уремия при почечной недостаточности может привести к гипогликемии вследствие нарушений углеводного обмена, контррегуляции уровня глюкозы и снижения глюконеогенеза в почках (Edwards et al, 1987; Gerich et al, 2001). Уменьшение продукции глюкозы в почках само по себе не ведет к гипогликемии, потому что нормогликемия поддерживается благодаря высвобождению глюкозы из печени (см. стр. 679). Вероятно, главной причиной гипогликемии при почечной недостаточности является нарушение биосинтеза глюкозы в печени вследствие ослабления глюконеогенеза и гликогенолиза, ограниченной доступности необходимых субстратов, неадекватного ответа контррегуляторных гормонов или сочетания этих факторов (Fischer et al, 1986). Снижение калорийности корма и скорости деградации и/или экскреции инсулина в почках также могут вносить свой вклад в развитие гипогликемии.
Сердечное заболевание
У людей тяжелая сердечная недостаточность разной этиологии бывает причиной гипогликемии, но у собак и кошек такие случаи неизвестны. Патогенез гипогликемии при сердечных расстройствах неясен. Предполагается патогенетическая роль застойных явлений в печени, кахексии, недостаточности субстратов глюконеогенеза или гипоксии печени (Cryer, Polonsky, 1998).
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 691
Полицитемия
При тяжелой полицитемии (показатель гематокрита выше 65%) гипогликемия может быть результатом усиленной утилизации глюкозы очень большим количеством эритроцитов. Такое усиление может привести к истощению резерва гликогена. Полицитемия бывает первичной (т.е. истинная полицитемия, или истинный эритроцитоз) или вторичной. Вторичная полицитемия обусловлена либо нарушениями, приводящими к хронической системной гипоксии (в частности, врожденный сброс крови «справа налево»), либо хронической почечной гипоксией (например, опухоль почки), либо опухолями, продуцирующими эритропоэтин.
Артефактная гипогликемия
Причиной артефактной гипогликемии может быть слишком длительное хранение проб крови до отделения сыворотки или плазмы. Во время хранения цельной крови при комнатной температуре утилизация глюкозы клетками крови продолжается, в результате чего ее концентрация снижается со скоростью 10 мг/100 мл/час (Chew et al, 1982). Особенно интенсивно обмен глюкозы протекает в эритроцитах и лейкоцитах собак и кошек при эритроцитозе, лейкоцитозе или сепсисе. При хранении проб крови в течение 24 часов при 4 °C концентрация глюкозы может уменьшиться на 20 мг/100 мл. Чтобы свести к минимуму риск артефактного снижения концентрации глюкозы, пробы цельной крови, предназначенные для ее определения, необходимо центрифугировать сразу (в течение 1 часа) после взятия, а полученную сыворотку или плазму хранить в холодильнике или заморозить. Точное определение глюкозы возможно только в сыворотках или плазме, хранившихся в холодильнике или в морозильнике. Первые предпочтительно анализировать не позднее чем через 24 часа после получения, хотя и через 48 часов можно получить достаточно точные результаты.
Для сбора проб плазмы с целью последующего определения в них глюкозы предлагалось использовать пробирки, обработанные фтористым натрием. Фтор подавляет внутриклеточную утилизацию глюкозы, ингибируя ферментативную активность. К сожалению, при сборе проб в такие пробирки обычно происходит гемолиз, что в сочетании с некоторыми техническими проблемами лабораторного анализа приводит к небольшому занижению истинной концентрации глюкозы. По этой причине мы не используем пробирки, обработанные фтористым натрием.
В обычной ветеринарной практике концентрацию глюкозы часто измеряют в цельной крови сразу после получения пробы с помощью портативного глюкометра (например, Bayer Glucometer Elite-XL, производства Bayer, США). Следует помнить, что многие портативные приборы дают заниженные
значения концентрации глюкозы по сравнению со стационарными аппаратами, в которых глюкоза определяется глюкозооксидазным или гексокиназ-ным методом (см. рис. 11-12, стр. 558). Неучиты-вание возможности такой «ошибки» может стать причиной неправильной постановки диагноза гипогликемии. В то же время, точность определений концентрации глюкозы большинством портативных глюкометров тем выше, чем больше тяжесть гипогликемии. Как показывает наш опыт, если концентрация глюкозы в крови по данным измерения портативным глюкометром не превышает 40 мг/100 мл, то ее истинная величина обычно ниже 60 мг/100 мл. Если же такое измерение дает результат 50-60 мг/100 мл, то истинная концентрация глюкозы превышает 60 мг/100 мл, а нередко и 70 мг/100 мл. При концентрации глюкозы порядка 40-50 мг/100 мл по данным измерения портативными глюкометрами ее истинная величина может быть как выше, так и ниже 60 мг/100 мл.
Лабораторные ошибки возможны при любом методе определения, поэтому целесообразно подтвердить наличие гипогликемии анализом повторной пробы, прежде чем предпринимать более сложные и дорогие исследования.
Ятрогенная гипогликемия
Единственными широкодоступными средствами для понижения концентрации глюкозы в плазме крови являются инсулин и пероральные сульфонилмочевинные препараты (например, глипизид или глибурид). Частой причиной гипогликемии у человека является самоконтроль уровня глюкозы с помощью инъекций инсулина. В ветеринарии лечение сахарного диабета препаратами инсулина также всегда чревато опасностью возникновения гипогликемии у больного животного. Правда, трудно представить ситуацию, когда владелец собаки или кошки вводит ей инсулин без предварительной консультации с ветеринаром.
МЕТОДЫ ДИАГНОСТИКИ ГИПОГЛИКЕМИИ: ПРИОРИТЕТЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ
Во всех случаях обнаружения гипогликемии ее необходимо подтвердить, прежде чем приступать к более углубленному диагностическому обследованию с целью установления причины расстройства. Тщательный анамнез животного в сопоставлении с результатами физикального и рутинных гематологических исследований (ОАК, биохимический анализ сыворотки и анализ мочи) позволяют выяснить причину гипогликемии (см. рис. 14-5). У щенков и котят гипогликемия обычно является идиопатическим расстройством или обусловлена неполноценным питанием, недостаточностью функции печени (например, при наличии портального анастомоза) или сепсисом. У молодых взрослых собак и кошек
Эпизодическая слабость или судороги в анамнезе
... +
Первичная оценка
Обменные расстройства
Первичное сердечное заболевание
Подтвержденная гипогликемия
Анемия. Большое количество ядерных эритроцитов
Неврологическое заболевание
Токсины
1. Полицитемия
2. Гипо- или гиперкортицизм
3. Гипо- или гиперкальциемия
4. Гепатопатия
5. Легочное заболевание
6. Гипо- или гипертиреоз
1. Шумы
2. Аритмия
3. Цианоз
4. Полицитемия
5. Аномальные результаты рентгенографии
6. Аномальная ЭКГ
Молодые
1. Свинцовое отравление (базофильная зернистость)
2. Прочие
Взрослые
1. Геманги-осаркома
2. Прочие
1. Симптомы нарушений в ЦНС (периодические или устойчивые)
2. Анализ крови не указывает на обменные нарушения
3. Отсутствие сердечного заболевания
1. Первичное заболевание ЦНС
2. Травма
3. Нейромышечные расстройства разного происхождения
Очень редко при недоедании или голодании
4 Азот мочевины в крови (±)
4 Холестерин (±)
4 Альбумин (±)
-I- Размер печени (±)
Т Ферменты печени (±)
Полицитемия (подтвержденная)
Количество лейкоцитов
Т Калий
4- Натрий
Тестирование функции печени
1. Истинная
2. Эритропоетиновая опухоль
3. Сердечное заболевание
1. Желчные кислоты
2. Толерантность к аммиаку Нарушенная —«г—1-----Нормальная
Старая собака
Молодая собака
Гистохимическое исследование
1. Инфекция (сепсис)
2. Опухоль
Аномальный результат пробы с АКТГ
I
Гипокортицизм
Молодая собака (< 5 лет)
Отсутствие инсулина в крови на фоне гипогликемии
Нормальные результаты других скрининговых тестов
Номальный.
тат пробы с АКТГ
резуль-
Явная неоплазия
1. Почечная недостаточность
2. Гепатопатия |
3. Необычное желудочно-кишечное расстройство
Старая собака (> 6 лет)
1. Биопсия
2. Гистохимическое исследование
3. Сканирование печени
4. Диагностическая лапароскопия
I
1. Гистохимическое исследование
2. Сканирование печени
3. Биопсия
4. Диагностическая лапаротомия
I------Нарушенная-----
Печени3 Нормальный печени разМер печени
i
1. Гипофизарная ----ч
недостаточность
2. Гипокортицизм ----.
f-З. Гликогеноз (± охотничьи собаки)
4. Лимфосаркома или
, другие раковые
опухоли ▼
Отсутствие инсулина в кро- Нормальный или повы-
ви на фоне гипогликемии шейный уровень инсули-
Н ►Повторное определение На на фоне гипогликемии
▼ инсулина при гипогликемии
1. Гипокортицизм (включая передозировку о,р'-ДДД)
2. Внепанкреатическая опухоль
3. Тяжелая гепатопатия^
Тестирование функции печени
Инсулин-секретирую-щая опухоль л +
Диагностическая медикаментоз-
лапаротомия наятерапия
1. Цирроз
2. Опухоль
3. Прочее
1. Врожденный анастомоз сосудов
2. Хронический активный гепатит
Проба с АКТГ
1. Повторная дифференциальная диагностика гипогликемии
2. Хронический активный гепатит?
Аномальный результат теста толерантности к глюкагону
Рис. 14-5. Алгоритм диагностики эпизодической слабости и (в большем объеме) гипогликемии
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 693
ее причинами также являются нарушение функции печени, гипокортицизм или сепсис, а у более старых животных - чаще всего печеночная недостаточность, опухоли островковых бета-клеток или вне-панкреатических тканей, гипокортицизм и сепсис.
Обычно гипогликемия выражена слабо (т.е. концентрация глюкозы в крови превышает 45 мг/100 мл); зачастую она только случайно выявляется при обследовании собак и кошек с гипокортицизмом или недостаточностью функции печени. Нередко гипогликемия сопровождается сопутствующими патологическими нарушениями, такими как гипонатриемия и гиперкалиемия у животных с болезнью Аддисона, нарушение активности ферментов печени, гипохолестеринемия, гипоальбуминемия и низкий уровень азота мочевины (AM) в крови у животных с недостаточностью функции печени. Для подтверждения диагноза проводят провокационную пробу с АКТГ или тестирование функции печени, в частности определение желчных кислот до и после кормления животного. Тяжелая гипогликемия (менее 40 мг /100 мл) чаще всего развивается у новорожденных или маленьких котят и щенков (особенно миниатюрных пород), а также у взрослых животных при наличии сепсиса, опухоли островковых бета-клеток или внепанкреатической ткани (обычно аденокарциномы или лейомиосаркомы). Сепсис легко выявляется при физикальном исследовании животного и по аномальным результатам ОАК, которые включают нейтрофильный лейкоцитоз (обычно > 30000 клеток/мкл), повышенное содержание незрелых клеток или признаки токсичности. Внепанкреатические опухоли устанавливаются в процессе физикального исследования, рентгенографии грудной клетки или УЗИ брюшной полости. Физикальное исследование собак, как правило, не позволяет обнаружить опухоль бета-клеток, если не считать таких признаков гипогликемии, как, например, общая слабость. Рутинные анализы крови также не выявляют ничего, кроме гипогликемии. Для подтверждения наличия опухоли бета-клеток измеряют базальную концентрацию инсулина в сыворотке, если концентрация глюкозы в крови не превышает 60 (лучше 50) мг/100 мл.
ПОДТВЕРЖДЕНИЕ ДИАГНОЗА ИНСУЛИН-СЕКРЕТИРУЮЩЕЙ ОПУХОЛИ БЕТА-КЛЕТОК: ОПРЕДЕЛЕНИЕ ИНСУЛИНА В СЫВОРОТКЕ КРОВИ
При диагностике инсулин-секретирующей опухоли сначала следует подтвердить наличие гипогликемии, а затем документировать нарушение секреции инсулина и идентифицировать опухоль панкреатической железы с помощью УЗИ или диагностической лапаротомии. Учитывая возможную необходимость дифференциальной диагностики гипогликемии разной этиологии (см. табл. 14-8), предварительный диагноз инсулин-секретирующей опухоли часто ставят на основании анамнес
тического анализа, результатов физикального исследования и отсутствия аномальных изменений, за исключением связанных с гипогликемией, при рутинном гематологическом тестировании.
Триада Уиппла
В 1935 году было опубликовано сообщение, описывающее инсулин-секретирующие опухоли поджелудочной железы как самостоятельное клиническое явление, в котором обсуждались три критерия, используемые для подтверждения диагноза (Whipple, Grantz, 1935). Эти критерии, известные в настоящее время как триада Уиппла, включают: (1) симптомы, возникающие после голодания или физической нагрузки; (2) концентрацию глюкозы в сыворотке крови во время этих симптомов ниже 50 мг/100мл; (3) исчезновение указанных симптомов после введения глюкозы. К сожалению, эта триада имеет место при гипогликемии, вызываемой самыми разными причинами, и потому является неспецифичным диагностическим показателем.
Определение базальных концентраций инсулина и глюкозы
Теория, Диагноз инсулин-секретирующей опухоли ставится на основании результатов определения концентрации инсулина в крови во время эпизода гипогликемии. У здоровых животных гипогликемия подавляет секрецию инсулина, и степень подавления прямо зависит от уровня гипогликемии. Но подавления не происходит или оно слабо выражено, если инсулин секретируется автономными клетками опухоли, потому что такие клетки менее чувствительны к гипогликемии, чем нормальные бета-клетки. У всех собак, имеющих инсулин-секретирующие опухоли, концентрация инсулина в крови превышает величину, соответствующую данной концентрации глюкозы. Относительную гиперин-сулинемию легче всего идентифицировать на фоне низкой концентрации глюкозы в крови (желательно < 50 мг/100 мл). Если на фоне низкой концентрации глюкозы концентрация инсулина находится в верхней половине нормального диапазона или превышает его (обычно > 10 мкЕД/мл), делают вывод об относительном или абсолютном избытке инсулина, обусловленном секретирующей его опухолью, нечувствительной к гипогликемии.
Протокол определения. У большинства собак с инсулин-секретирующими опухолями гипогликемия носит устойчивый характер. При концентрации глюкозы в плазме крови ниже 60 мг/100 мл (особенно ниже 50 мг/100 мл) следует направить сыворотку в коммерческую ветеринарную эндокринологическую лабораторию для более точного измерения концентраций инсулина и глюкозы. Если же концентрация глюкозы в крови превышает 60 мг/100 мл, собаку на период от 4 до 12 часов лишают пищи для индукции гипогликемии и все это
694 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
ТАБЛИЦА 14-10. ИНТЕРПРЕТАЦИЯ БАЗАЛЬНОГО УРОВНЯ ИНСУЛИНА У СОБАК С ГИПОГЛИКЕМИЕЙ ПРИ ПОДОЗРЕНИИ НА ИНСУЛИН-СЕКРЕТИРУЮЩУЮ ОПУХОЛЬ БЕТА-КЛЕТОК
Концентрация инсулина в сыворотке кровн Вероятность опухоли бета-клеток*
>20 мкЕД/мл Высокая
10-20 мкЕД/мл Возможна
5-10 мкЕД/мл Низкая
<5 мкЕД/мл Исключена
*) В идеале, концентрация глюкозы в крови, измеренная с помощью стационарного глюкометра (т.е глюкозооксидазным или гексокиназным методом) должна быть меньше 50 мг/100 мл. Определение проводится в той же пробе, которую передают в лабораторию для измерения концентрации инсулина. При концентрации глюкозы более 60 мг/100 мл результаты определения инсулина диагностически незначимы.
время каждый час измеряют концентрацию глюкозы. Для этой цели в большинстве ветеринарных клиник обычно используют портативные бытовые глюкометры. Принимая во внимание, что результаты определений с помощью таких приборов, как правило, занижены (Cohn et al, 2000; Wess, Reusch, 2000), пробы с концентрацией глюкозы порядка 40 мг/100 мл или меньше направляют в коммерческую аналитическую лабораторию для подтверждения результатов измерений. В течение последующих 1-3 часов собаке несколько раз дают небольшие порции корма, чтобы предотвратить значительные колебания концентрации глюкозы и возможное развитие постпрандиальной реактивной гипогликемии.
Интерпретация результатов. Концентрацию инсулина измеряют в той же пробе крови, что и концентрацию глюкозы (табл. 14-10). Концентрации инсулина и глюкозы у здоровых собак натощак составляют соответственно 5-20 мкЕД/мл и 70-110 мг/100 мл. Концентрация инсулина выше 20 мкЕД/ мл при концентрации глюкозы в той же пробе сыворотки менее 60 мг/100 мл (и особенно менее 50 мг/100 мл) в сочетании с соответствующей клинической симптоматикой и клинико-патологическими изменениями служит убедительным подтверждением наличия инсулин-секретирующей опухоли. Этот же диагноз возможен, если концентрация инсулина находится на верхней границе нормы (10-20 мкЕД/ мл). Если же она находится на нижней границе нормы (5-10 мкЕД/мл), то причиной гипогликемии может быть как инсулин-секретирующая опухоль, так и иное заболевание (рис. 14-6). Внимательный анализ анамнестических данных, результатов физикального и клинико-патологического исследования, УЗИ брюшной полости, а также в случае необходимости повторные измерения концентраций глюкозы и инсулина обычно позволяют установить причину гипогликемии. Из 85 наших собак с гистологически подтвержденной опухолью бета-клеток и концентрацией глюкозы в крови менее 60 мг/100
ток мышц
Рис. 14-6. Концентрация инсулина в сыворотке крови у собак с гипогликемией, вызванной инсулин-секретирующей опухолью бета-клеток, гепатомой или гепатоцеллюлярной карциномой, лейомиосаркомой или сепсисом. Концентрация инсулина на верхней границе нормы (более 10 мкЕД/мл) предполагает наличие опухоли бета-клеток, а на нижней границе нормы (от 5 до 10 мкЕД/мл) не имеет диагностического значения. Затемненные области соответствуют верхней (горизонтальные линии) и нижней (штриховка) областям нормального диапазона.
мл уровень инсулина превышал 20 мкЕД/мл у 62 (73%) особей, был от 10 до 20 мкЕД/мл у 18 (21%) и у 5 (6%) составлял от 5 до 10 мкЕД/мл. Концентрация инсулина ниже нормального уровня (обычно ниже 5 мкЕД/мл) служит показателем инсулинопе-нии и исключает наличие инсулин-секретирующей опухоли. Достоверность идентификации гиперин-сулинемии, не соответствующей данному уровню гипогликемии, зависит от тяжести последней: чем ниже концентрация глюкозы, тем более вероятно выявление неадекватно высокой концентрации инсулина, особенно если последняя остается в пределах нормального диапазона.
Отношение концентраций инсулина и глюкозы
Для характеристики взаимосвязи между концентрациями глюкозы и инсулина в крови и повышения достоверности диагностики инсулин-секретирую-щих опухолей при сомнительных результатах лабораторных анализов (например, при маргинальной гипогликемии на фоне нормальной концентрации инсулина) было предложено сопоставлять уровни глюкозы и инсулина в форме отношений инсулин: глюкоза, глюкоза:инсулин или откорректированного отношения инсулин: глюкоза. Последнее отношение используется чаще всего. Оно определяется по следующей формуле:
Инсулин в сыворотке крови (мкЕД/мл) х 10 Глюкоза крови (мг/100 мл) - 30
Введение в формулу коэффициента «-30» обусловлено теоретическим положением, согласно которому в сыворотках здоровых людей инсулин не
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 695
определяется, когда концентрация глюкозы не превышает 30 мг/100 мл. Во всех случаях такой низкой концентрации глюкозы в качестве делителя используют число 1. На основании данных, полученных у человека, большинство авторов приходят к выводу, что откорректированное отношение концентраций инсулина и глюкозы выше 30 может служить диагностическим показателем инсулин-секретирующей опухоли. Вместе с тем, этот метод недостаточно специфичен, поскольку данное отношение может быть нарушено и при ином происхождении гипогликемии (Leifer et al, 1986). Наиболее веским аргументом в пользу низкой специфичности данного отношения является определение в крови инсулина, хотя и на нижней границе нормы, несмотря на гипогликемию. Обычно такая ситуация имеет место при опухолях печени или сепсисе. Поэтому мы не полагаемся на отношение концентраций инсулина и глюкозы при интерпретации результатов их определения. Вместо этого мы предпочитаем использовать абсолютную концентрацию инсулина в сыворотке в периоды гипогликемии (см. табл. 14-10) в сочетании с данными анамнестического анализа, физикального и клинико-патологических исследований.
Провокационные пробы
Имеется несколько проб с использованием соединений, стимулирующих секрецию инсулина нормальными и опухолевыми бета-клетками. К их числу относятся тесты толерантности к глюкагону и толбутамиду, пероральный и внутривенный тесты толерантности к глюкозе, а также провокационная проба с адреналином. Определяя концентрацию глюкозы и инсулина через определенное время после введения этих агентов, можно дифференцировать нормальные и опухолевые бета-клетки. Мы не используем ни одну из этих проб для диагностики инсулин-секретирующих опухолей и не рекомендуем другим применять их для этой цели. Советуем читателю обратиться к первому изданию «Эндокринологии и репродукции собак и кошек», где приведены более подробные сведения об использовании провокационных проб у собак с подозрением на опухоли бета-клеток.
ДИАГНОСТИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ
Рентгенологическое исследование
Рентгенологическое исследование брюшной полости не позволяет выявить продуцирующие инсулин опухоли, отчасти из-за небольших размеров этих новообразований и особенностей анатомической локализации поджелудочной железы. На момент установления диагноза эти опухоли обычно имеют не более 3 см в диаметре. Видимая опухолевая масса в правом краниальном квадранте брюшной полости встречается исключительно редко, также как
смещение органов, прилегающих к поджелудочной железе. Рентгенологическое исследование грудной клетки так же имеет ограниченное значение, прежде всего потому, что опухоли островковых бета-клеток распространяются в легкие только на поздних стадиях заболевания. Чаще всего местами раннего метастазирования служат печень, регионарные лимфатические узлы и перипанкреатический сальник, где рентгенографическое исследование обычно не может обнаружить вызванное опухолью поражение.
Метастазы опухолей островковых бета-клеток появляются в легких лишь на поздних стадиях заболевания. Поэтому рентген грудной клетки с целью установления диагноза и планирования хирургической операции обычно бесполезен.
Ультразвуковое исследование
Ультразвуковая визуализация опухолевой массы в области поджелудочной железы позволяет подтвердить подозрение на наличие опухоли бета-клеток у собак с соответствующей клинической симптоматикой и клинико-патологическими нарушениями (рис. 14-7). Обнаружение поражений в паренхиме печени или перипанкреатической ткани предполагает их метастазирование. Иногда выявляются только метастазы, тогда как сама опухоль не визуализируется. Невозможность идентифицировать опухоль в области поджелудочной железы или места ее метастазирования - весьма обычное явление и не исключает наличия неоплазии бета-клеток. В группе из 44 собак, обследованных в последнее время в нашей клинике, УЗИ выявило неоплазию только у 14 (32%) особей, хотя гистологически и хирургически она была подтверждена у всех без исключения животных. У одной собаки не удалось идентифицировать диффузную инфильтрацию поджелудочной железы опухолью, а у другой - опухолевую массу, которая не была обнаружена и во время хирургического вмешательства. В последнем случае опухоль поджелудочной железы размером 2,3 х 1,3 см была диагностирована лишь спустя год после первичного хирургического обследования. Ультразвуковая визуализация выявляет опухоли в левой доле чаще, чем в теле и в правой доле поджелудочной железы. Более крупные опухоли визуализируются чаще, чем более мелкие, хотя их размеры в значительной степени перекрываются. Так, средний размер опухолей, удаленных после их предварительной локализации с помощью УЗИ, составлял 2,7 х 2,4 см (от 1 х 1 см до 5 х 4 см), а средний размер удаленных опухолей, не выявлявшихся при УЗИ, составлял 1,7 х 1,5 см (от 0,4 х 0,5 до 5 х 2 см). Невозможность идентифицировать панкреатическую опухолевую массу у собак с подозрением на неоплазию бета-клеток посредством УЗИ лишний раз подтверждает целесообразность хирургического исследования с целью выявления мелких операбельных опухолей.
696 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
Рис. 14-7. Ультрасонограммы поджелудочной железы 13-летней борзой (А) и 14-летнего карликового пуделя (Б), на которых видны опухоли островковых бета-клеток (показаны стрелками). В Ультрасонограмма перипанкреатической ткани 5-летнего золотистого ретривера, на которой видна метастазирующая опухоль бета-клеток (показана стрелками).
Сцинтиография
Для визуализации опухолей островковых клеток поджелудочной железы у человека было предложено использовать сцинтиографию рецепторов соматостатина (Kvols et al, 1993; Lamberts et al, 1993). Положительные и отрицательные результаты сканирования коррелировали соответственно с наличием или отсутствием рецепторов соматостатина в образцах опухолевой ткани. Этот метод оказался, однако. недостаточно эффективным для диагностики опухолей островковых бета-клеток у человека, так как выявлял их только в 60-70% случаев (Buetow et al, 1997). Вариабильность результатов сцинтиографии, по-видимому, объясняется присутствием в опухолевых бета-клетках человека нескольких субтипов рецепторов с различной способностью связывать соматостатин и его аналоги (Lamberts et al, 1991; Bruns et al, 1994). He исключено, что положительный результат сцинтиографии предполагает возможность лечения больного аналогом соматостатина октреотидом (см. стр. 704).
В отличие от человека, в секретирующих инсулин опухолях собак обнаружен только один тип рецепторов соматостатина, обладающий высоким сродством к его аналогу октреотиду (Robben et al, 1997). Недавно появилось сообщение о применении сцинтиографии рецепторов соматостатина с применением меченого октреотида или индия (1п-111) пентетреотида для идентификации опухолей бета-клеток у семи собак с неопределенными ре
зультатами УЗИ брюшной полости (Robben et al, 1997; Lester et al, 1999). Сцинтиография рецепторов соматостатина позволила обнаружить первичные инсулин-секретирующие опухоли у пяти из семи животных, а также более крупные метастазы в регионарных лимфатических узлах у всех трех обследованных с этой целью собак и в печени двух из них. У одной собаки данный метод не выявил имевшиеся в печени мелкие метастазы. Несмотря на перспективность применения сцинтиографии рецепторов соматостатина для диагностики инсу-лин-секрстирующих опухолей и прогнозирования возможной реакции на терапию октреатидом, ее применение в обозримом будущем, по-видимому, будет лимитироваться высокой стоимостью меченных радиоизотопами фармацевтических препаратов и необходимостью специального оборудования.
ЛЕЧЕНИЕ ОПУХОЛЕЙ БЕТА-КЛЕТОК
Сопоставление хирургического и медикаментозного лечения
Хирургическое вмешательство, по-видимому, является наилучшим способом диагностики, лечения и прогнозирования инсулин-секрстирующих опухолей у собак. Оно позволяет излечивать животных с одиночными операбельными опухолями. У собак с неоперабельными новообразованиями или явными признаками метастазирования удаление аномальной ткани или максимальное уменьшение ее объема
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
697
нередко приводит к ремиссии заболевания или, по крайней мере, значительно облегчает клиническую симптоматику и улучшает реакцию животного на последующую медикаментозную терапию на протяжении нескольких недель или месяцев. После хирургического обследования с резекцией хотя бы части опухолевой ткани и соответствующего медикаментозного лечения собаки живут дольше, чем при той же терапии без предварительной операции (Tobin et al, 1999). Несмотря на преимущества хирургического метода, он все же является довольно агрессивным способом диагностики и лечения новообразований поджелудочной железы, учитывая большой возраст многих собак к моменту установления диагноза, высокую частоту метастазирования и непредсказуемость исхода операции с точки зрения ее влияния на гипогликемию и клиническую симптоматику. Как правило, мы не настаиваем на хирургическом вмешательстве при опухолях бета-клеток у собак старшего возраста (более 12 лет), а также в случаях выявления интенсивного метастазирования с помощью УЗИ или при заболеваниях, при которых противопоказана анестезия.
Медикаментозное лечение назначают, когда не проводится диагностическая лапаротомия или когда неоперабельная или метастазирующая опухоль вызывает рецидивы клинической симптоматики. Обычно оно проводится в форме неспецифической антигормональной терапии, направленной на повышение концентрации глюкозы в плазме крови и уменьшение частоты клинических проявлений опухолевой активности. Многие собаки с метастазирующими инсулин-секретирующими опухолями живут несколько месяцев и даже более года при условии адекватной медикаментозной терапии. Однако она не обеспечивает «излечения» и не предотвращает метастазирования злокачественных опухолей островковых бета-клеток.
Хирургическое лечение
В этом разделе не описываются конкретные процедуры оперативного лечения инсулин-секретирую-щих опухолей у собак. Необходимые сведения можно найти в соответствующем руководстве (Nelson, Salisbury, 2000). Тем не менее, уместно остановиться на некоторых общих принципах.
Задача: хирургической операции состоит в удалении Максимально большого количества аномальной ткани, а также поддающихся резекции участков метастазирования. Успешность операции отчасти зависит от одновременного проведения инфузионной терапии с использованием декстрозы и правильного ухода за животным в периоперационном периоде с целью предотвращения тяжелой гипогликемии и послеоперационного панкреатита, а также для повышения вероятности благоприятного (без осложнений) исхода лечения. Эвтаназия не рекомендуется при любых результатах хирургического исследования. При соответствующей медикамен
тозной терапии в послеоперационном периоде многие собаки с инсулин-секретирующими опухолями могут жить несколько месяцев и даже больше года.
Ведение предоперационного периода. Прежде чем приступать к операции необходимо защитить животное с инсулин-секретирующей опухолью от тяжелых гипогликемичеких приступов. Эта цель достигается частым кормлением небольшими порциями и введением глюкокортикоидов (табл. 14-11). Накануне операции, во время нее и в первое время после ее окончания проводят непрерывную внутри-
ТАБЛИЦА 14-11. ДОЛГОСРОЧНАЯ МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ИНСУЛИН-СЕКРЕТИРУЮЩИХ ОПУХОЛЕЙ У СОБАК
Стандартная терапия
1. Диетотерапия
а. Три-шесть небольших порций консервированного или сухого корма ежедневно
б. Исключение из состава корма моносахаридов, дисахаридов н полиэтиленгликоля
2. Ограничение физических нагрузок
3. Глюкокортикоидная терапия
а. Преднизон, дважды в день в общей начальной дозе 0.5 мг/кг
б. Постепенное повышение дозы и частоты введения по мере необходимости
в. Цель состоит в контроле клинической симптоматики, а не в достижении эугликемии
г. Назначение альтернативной терапии в случае появления признаков тяжелой ятрогенной гиперкортизоле-мии или отсутствия терапевтического эффекта глюкокортикоидов
Дополнительная терапия
1. Терапия диазоксидом
а. Продолжение стандартной терапии, уменьшение дозы глюкокортикоидов для сведения к минимуму нежелательных явлений
б. Диазоксид, дважды в день в общей начальной дозе 0.5 мг/кг
в. Постепенное повышение дозы и частоты введения по мере необходимости, но не выше 60 мг/кг/день
г. Цель состоит в контроле клинической симптоматики, а не в достижении эугликемии
2. Терапия соматостатином
а. Продолжение стандартной терапии, уменьшение дозы глюкокортикоидов для сведения к минимуму риска нежелательных явлений
б. Октреотид (производства Novartis Pharmaceuticals), 10-50 мкг/собака/день, поделенные на два-три приема, подкожно
3. Терапия стрептозотоцином
а. Продолжение стандартной терапии, уменьшение дозы глюкокортикоидов для сведения к минимуму риска нежелательных явлений
б. 0,9% физиологический раствор на протяжении 3 часов, затем стрептозотоцин в дозе 500 мг/м2 в том же 0.9% растворе внутривенно в течение 2 часов, после этого 0,9% физиологический раствор на протяжении еще 2 часов
в. Введение антиэметиков сразу после стрептозотоцина для устранения позывов на рвоту
г.__Повторение описанного курса каждые 3 недели до устранения гипогликемии или развития нежелательных явлений (панкреатита, почечной недостаточности) Из Nelson RW, Couto CG: Small Animal Internal Medicine. St Louis, Mosby-Year Book, 2003, p 772. ч
698 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
Рис. 14-8. А и Е> Фотографии инсулин-секретирующих опухолей бета-клеток (указаны стрелками).
венную инфузию сбалансированного раствора электролитов, содержащего 2,5 или 5% декстрозы. Такая инфузия не восстанавливает эугликемию, но обеспечивает поступление субстратов, необходимых для норма льного функционирования ЦНС; таким образом, у большинства собак и кошек удается избежать нарушений со стороны ЦНС. Увеличение концентрации декстрозы выше 5% чрезвычайно опасно и его нельзя допускать во избежание избыточной стимуляции панкреатической опухоли и индукции реактивной гипогликемии, которая иногда приводит к фатальному исходу. Внутривенное введение декстрозы следует начинать вечером накануне дня операции, когда собака лишена корма и воды, и продолжать ее на всем протяжении периоперационного периода. Инфузионная терапия до начала операции улучшает кровоток в поджелудочной железе, что сводит к минимуму риск возникновения послеоперационного панкреатита. Цель инфузии декстрозы состоит в предупреждении клинических симптомов гипогликемии и поддержании концентрации глюкозы в плазме крови на уровне выше 35 мг/100 мл. Если ее введение оказывается недостаточным для предотвращения тяжелой гипогликемии, то переходят на непрерывную инфузию глюкагона (см. раздел «Медикаментозная терапия острого гипогликемического криза», стр. 702).
Хирургическая операция. Во время операции хирург должен осмотреть как можно большую площадь поджелудочной железы. Затем следует провести мягкую пальпацию всего органа. Значение аккуратной пальпации трудно переоценить, так как при грубых манипуляциях высока вероятность возникновения тяжелого, потенциально опасного для жизни панкреатита. Проводится также осмотр печени, ближайших лимфатических узлов и сальника с целью выявления их метастазирования.
Частота выявления опухоли. У большинства собак инсулин-секретирующие опухоли хорошо видны хирургу, обследующему поджелудочную же
лезу (рис. 14-8). У некоторых животных опухоль не столь заметна, однако, выявляется при мягкой, но тщательной пальпации железы. Встречаются также множественные панкреатические опухоли. Среди 85 собак с инсулин-секретирующими опухолями, находившихся в нашей клинике, опухоль легко идентифицировалось при хирургическом исследовании у 78 (92%) животных.
Локализация опухоли. Опухоль может находиться в любой части поджелудочной железы (рис. 14-9). Мы ее обнаруживали в правой (дуоденальной) доле железы примерно в 42% случаев, в левой (селезеночной) доле - в 41 % и в центральной части железы - в 17% случаев. У четырех из 85 собак диффузная микроскопическая карцинома островковых клеток была выявлена при гистологическом исследовании произвольно удаленной ткани правой доли поджелудочной железы. У двух из этих че-
Рис. 14-9. Схема локализации инсулин-секретирующих опухолей бета-клеток в поджелудочной железе 78 собак
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 699
тырех собак пальпация поджелудочной железы во время операции выявила ее диффузное утолщение; у двух других животных при визуальном осмотре и пальпации железа выглядела нормальной. Еще у двух из 85 собак ни визуально, ни пальпацией не удалось обнаружить ни опухоли, ни участков метастазирования, и гистологическое исследование части правой доли поджелудочной железы также не дало результата. У одной из этих собак опухоль была обнаружена спустя 1 год после первичного хирургического исследования. Другая собака через 18 месяцев после операции оказалась недоступной для дальнейшего наблюдения. Периодическая оценка ее состояния до этого времени выявляла устойчивую гипогликемию и гиперинсулинемию, однако прямые доказательства наличия опухоли отсутствовали. У одной собаки было увеличение размеров брыжеечного лимфатического узла, прилегающего к поджелудочной железе, хотя саму опухоль найти не удалось. Между тем, гистологическое исследование этого узла после его удаления подтвердило наличие метастазирующей опухоли бета-клеток. После операции у собаки сохранялись устойчивые гипогликемия и гиперинсулинемия.
Локализация опухоли в значительной степени определяет успешность ее резекции. В целом, одиночные опухоли в левой и правой долях поджелудочной железы считаются вполне операбельными, а их удаление сопровождается минимальным повреждением этого органа и низкой частотой послеоперационного панкреатита. В отличие от этого, опухоли в теле поджелудочной железы зачастую распространяются на ее протоки, лимфатические и кровеносные сосуды, поэтому для их удаления необходимо обширное хирургическое вмешательство и иссечение больших объемов ткани. В результате частым осложнением такой операции становится тяжелый и потенциально опасный для жизни панкреатит, лечение которого требует интенсивной и часто длительной терапии. Более того, полное удаление опухоли практически невозможно, и вскоре после операции у собаки появляются рецидивы гипогликемии. В ходе планирования резекции опухоли мы обычно обсуждаем с владельцем животного особенности ее локализации и возможное влияние на исход операции. Если опухоль находится в теле поджелудочной железы, мы настоятельно рекомендуем владельцам отказаться от ее удаления из-за высокой вероятности послеоперационных осложнений. Мы обращаем их внимание на тот факт, что шанс на благополучный исход такой операции составляет один к пяти и что при обнаружении неоперабельной опухоли лучше прибегнуть к медикаментозному лечению, нежели пытаться удалить ее и тем самым подвергнуть животное опасности тяжелого панкреатита.
Невозможность выявления опухоли: использование метиленового синего. Для идентификации опухоли бета-клеток у собак во время операции было предложено внутривенно вводить им краситель метиленовый синий (Fingeroth, Smeak, 1988;
Fingeroth et al, 1988). После внутривенного введения этот азокраситель концентрируется в паращитовидных железах и эндокринной ткани поджелудочной железы, где интенсивно окрашивает гиперфункциональные аденоматозные или карциноматозные области этих органов. Нормальная ткань поджелудочной железы при этом приобретает синевато-серый цвет, тогда как гиперфункциональные зоны окрашиваются более ярко, обычно в красновато-синий цвет. У одной собаки с помощью этого красителя удалось успешно идентифицировать эктопическую опухоль островковых клеток и дифференцировать метастатические узлы от неметастатических в окружающей ткани (Smeak et al, 1988).
Метиленовый синий вводят путем внутривенной инфузии, добавляя необходимое количество красителя в 250 мл нормального изотонического солевого раствора. Общая доза метиленового синего составляет 3 мг/кг (Fingeroth, Smeak, 1988). Раствор вводят в течение 30-40 минут. Максимальное окрашивание эндокринной поджелудочной железы отмечается через 30 минут после начала инфузии. К числу осложнений этой процедуры относятся гемолитическая анемия телец Гейнца, острая почечная недостаточность, ложный цианоз (т.е. синий цвет слизистой оболочки ротовой полости), зеленоватый цвет мочи и, возможно, панкреатит. Обычна гемолитическая анемия, сопровождающаяся падением гематокрита ниже 25% спустя 2-3 дня после операции.
В нашей практике мы обычно не прибегаем к инфузии метиленового синего из опасения послеоперационных осложнений, а также потому, что в подавляющем большинстве случаев нам удается визуально выявлять опухолевую ткань поджелудочной железы при хирургическом исследовании собак с неоплазией бета-клеток. Если же наши хирурги не обнаруживают опухоль, несмотря на наличие у животного гипогликемии и гиперинсулинемии, они удаляют левую или правую часть поджелудочной железы в надежде, что при этом удастся удалить область, в которой локализовано новообразование. Теоретически можно удалить 90% железы без риска вызвать явный диабет или недостаточность ее экзокринной функции.
Места метастазирования. Корреляция размеров и формы опухоли со степенью малигнизации выражена слабо. Для выявления специфических аномалий и участков метастазирования важно провести тщательный осмотр брюшной полости. Чаще всего инсулин-секретирующие опухоли распространяются на регионарные лимфатические узлы и сосуды (дуоденальные, брыжеечные, печеночные и селезеночные), печень и перипанкреатический сальник. Во многих случаях при хирургическом исследовании не удается обнаружить метастазирование. Одиночные опухоли поджелудочной железы обычно удаляют целиком, надеясь полностью «излечить» животное, однако, уже через несколько месяцев у него снова возникают клинические симптомы гиперинсулинемии. Наш опыт показывает, что
700 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
практически все опухоли островковых бета-клеток у собак оказываются злокачественными. К сожалению, начальные проявления их активности выражены слабо и в первое время не вызывают беспокойства у владельцев животных; между появлением клинических признаков опухоли и установлением соответствующего диагноза нередко проходит несколько недель или месяцев. В результате уже при первичном хирургическом исследовании обнаруживаются метастазы.
Рекомендации в случаях метастазирования. Лучше всего удалить все аномальные ткани и по возможности провести их гистологическое исследование. Если полная резекция невозможна, следует максимально уменьшить объем опухоли. Как минимум, хирург должен взять образцы опухолевой ткани для последующего исследования. Кроме того, он должен сопоставить преимущества и недостатки полной или частичной резекции опухоли с риском возможных послеоперационных осложнений. Это очень важно при операциях на поджелудочной железе, потому что активные манипуляции на этом органе или иссечение его тканей может привести к тяжелому, угрожающему жизни панкреатиту. Поскольку для лечения инсулин-секрети-рующих опухолей после хирургической операции можно использовать медикаментозную терапию, эвтаназия во время операции не рекомендуется. Не следует также предпринимать героические усилия, пытаясь во что бы то ни стало полностью удалить аномальную ткань при наличии метастазирования, особенно в случаях повышенного риска послеоперационных осложнений.
Медикаментозная терапия во время операции. Во время операции на поджелудочной железе важнейшее значение имеет мониторинг уровня глюкозы в крови и адекватная инфузионная терапия. Для объективной оценки гликемического статуса животного каждые 30-60 минут определяют концентрацию глюкозы с помощью портативного или стационарного глюкометра. Цель инфузионной терапии состоит не в полной нормализации уровня гликемии, но в поддержании концентрации глюкозы на уровне выше 40 мг/100 мл. При небольших колебаниях уровня глюкозы по мере необходимости корректируют скорость инфузии декстрозы, чтобы предотвратить развитие тяжелой гипогликемии (т.е. концентрации глюкозы в крови ниже 35 мг/100 мл). К счастью, у собак, находящихся в стабильном состоянии, обычная инфузия 5%-ного раствора декстрозы, как правило, достаточна для поддержания концентрации глюкозы в крови выше 35 мг/100 мл во время удаления опухоли бета-клеток. Если же инфузия 5%-ного раствора декстрозы не способна предотвратить тяжелую гипогликемию, то прибегают к инфузии глюкагона с постоянной скоростью (см. раздел «Медикаментозная терапия острого гипогликемического криза», стр. 702).
Адекватная инфузионная терапия непосредственно до, во время и в первое время после опера
ции имеет первостепенное значение для сведения к минимуму риска послеоперационного панкреатита. Пальпация поджелудочной железы и резекция ее ткани приводят к воспалению. Тяжесть последнего зависит от того, насколько аккуратно проводилась пальпация, а также от характера кровообращения в железе и от хирургических мероприятий. Инфузионная терапия до и во время хирургической операции улучшает функционирование всей микрососу-дистой системы поджелудочной железы и позволяет свести к минимуму вероятность развития панкреатита. Мы обычно проводим ее со скоростью 60-100 мл/кг веса в сутки во время операции и на протяжении последующих 24-72 часов, если операция не сопровождается нарушениями, которые могут повлиять на переносимость собакой внутривенно вводимой жидкости (например, сердечной недостаточностью или гипопротеинемией).
Послеоперационные осложнения. Наиболее частыми послеоперационными осложнениями являются панкреатит, гипергликемия и гипогликемия. Вероятность их возникновения непосредственно зависит от квалификации хирурга, локализации опухоли (в периферической или центральной областях железы), наличия метастазов и качества инфузионной терапии в периоперационном периоде.
Панкреатит. Внутривенное введение поли-ионных жидкостей, содержащих 2,5 или 5% декстрозы, со скоростью 60—100 мл/кг/24 часа (в отсутствие пероральной терапии) непосредственно перед, во время и в течение 24-48 часов после операции в сочетании с диетотерапией в последующие несколько недель позволяет свести к минимуму риск возникновения панкреатита. На всем протяжении инфузионной терапии дважды в день измеряют концентрацию электролитов и глюкозы в сыворотке и в случае необходимости корректируют состав вводимой жидкости. Собакам начинают давать воду и легкую пищу, исходя из результатов физикального исследования. Концентрацию панкреатических ферментов (липазы и амилазы) в крови после операции определяют лишь в редких случаях, поскольку, как показывает предыдущий опыт, лечение панкреатита у оперированных собак дает прекрасные результаты и без этих данных. Несмотря на мягкую пальпацию поджелудочной железы во время хирургического исследования, интенсивную инфузионную терапию в периоперационном периоде и адекватную диетотерапию после операции, у 8 (12%) из 69 собак с удаленной опухолью поджелудочной железы развились клинические симптомы острого панкреатита. Он послужил причиной смерти двух из этих восьми животных. В обоих случаях опухоль находилась в теле поджелудочной железы и с трудом поддавалась резекции.
Сахарный диабет. Иногда у собак после удаления инсулин-секретирующей опухоли развивается сахарный диабет, по всей вероятности, вследствие недостаточной продукции инсулина атрофированными бета-клетками. Удаление всех или части опу
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
701
холевых клеток вызывает острую нехватку инсулина. До тех пор пока не восстановится секреторная функция атрофированных нормальных клеток, у оперированного животного сохраняется гипоинсу-линемия и для поддержания эугликемии может потребоваться введение экзогенного гормона. Одно время существовало мнение, что гипергликемия и глюкозурия в послеоперационном периоде служат показателями благоприятного прогноза, поскольку свидетельствуют об эффективном удалении ин-сулин-секретирующих неопластических клеток. Большинство оперированных в нашей клинике собак только временно нуждались в инъекциях экзогенного инсулина, но через несколько недель или месяцев после операции им приходилось назначать лечение в связи с обострением проявлений активности инсулин-секретирующей опухоли.
Послеоперационную инсулинотерапию терапию проводят только в тех случаях, когда гипергликемия и глюкозурия сохраняются на протяжении 2 или 3 дней после прекращения внутривенного введения жидкости, содержащей декстрозу. В начальном периоде инсулинотерапия должна быть консервативной (0.25 ЕД инсулина НПХ или ленте на килограмм веса тела раз в день). В дальнейшем режим инсулинотерапии корректируют на основании клинических показаний и результатов определения концентрации глюкозы в крови (см. гл. 11, стр. 551).
Обычно развивается транзиторный сахарный диабет, продолжающийся от нескольких дней до нескольких месяцев. У большинства собак после удаления опухоли в поджелудочной железе, печени, лимфатических узлах и перипанкреатических тканях все же остаются неопластические бета-клетки, которые продолжают размножаться. В конце концов, плотность их популяции значительно возрастает и становится достаточной для продукции инсулина в количествах, вызывающих рецидив гипогликемии. У таких животных вслед за прекращением сахарного диабета следует период эугликемии разной длительности, которая затем переходит в гипогликемию. О необходимости прекращения инсулинотерапии судят по результатам определения глюкозы в моче владельцем животного. Критериями отмены терапии служат отрицательные результаты определения на фоне исчезновения полиурии и полидипсии. В случае рецидива гипергликемии и глюкозурии инсулинотерапию возобновляют, но в более низких дозах. Лишь у небольшого числа собак после хирургического удаления одиночной инсулин-секретирующей опухоли сохраняется устойчивый сахарный диабет, что предполагает наличие дополнительного нарушения островковых бета-клеток, например, их дегенерации или гипоплазии (см. гл. 11). В нашей клинике постоянный сахарный диабет после удаления инсулин-секретирующей опухоли имел место только у одной собаки. На протяжении 2,5 лет после операции животное ежедневно получало по две инъекции инсулина для
контроля гипергликемии, после чего оказалось недоступным для дальнейшего наблюдения.
Устойчивая гипогликемия. Сохранение устойчивой гипогликемии у собак после удаления опухоли бета-клеток предполагает наличие функционально активных метастазов. В этом случае назначают медикаментозную терапию. На протяжении первых 48-72 часов после операции животным продолжают внутривенно вводить 2,5 или 5%-ный раствор декстрозы с тем, чтобы предотвратить клинические проявления гипогликемии (в первую очередь судорог), не пытаясь добиться полной нормализации уровня гликемии. При возникновении судорог может потребоваться дополнительная терапия (табл. 14-12, см. также раздел «Медикаментозная терапия острого гипогликемического криза», стр. 702). Как можно раньше после завершения операции собаке через каждые 4-6 часов начинают давать небольшие порции корма, сначала предназначенного для
ТАБЛИЦА 14-12. МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ГИПОГЛИКЕМИЧЕСКИХ СУДОРОГ, ВЫЗВАННЫХ ИНСУЛИН-
СЕКРЕТИРУЮЩЕЙ ОПУХОЛЬЮ БЕТА-КЛЕТОК
Судороги в домашних условиях
Действие 1. Смочите десны собаки раствором сахара или вотрите его в десны
Действие 2. При появлении ригидности дайте собаке немного корма
Действие 3. Вызовите ветеринара
Судороги в условиях стационара
Действие 1. Медленно введите внутривенно 1-5 мл 5-%-ного раствора декстрозы в течение 10 минут
Действие 2. При появлении ригидности дайте собаке немного корма
Действие 3. Приступите к долгосрочной медикаментозной терапии (см. табл. 14-11)
Неустранимые судороги в условиях стационара
Действие 1. Введите внутривенно 2,5 или 5%-ный раствор декстрозы в воде со скоростью в 1,5-2 раза выше скорости поддерживающей инфузионной терапии
Действие 2. Добавьте в жидкость для внутривенного введения 0,5-1 мг дексаметазона/кг и вводите ее на протяжении 6 часов: в случае необходимости повторяйте введение каждые 12-24 часа
Действие 3. Введите внутривенно глюкагон (Фармакопея США, Eli Lilly Со.) с постоянной скоростью (при начальной дозе 5-10 нг/кг/мин)
Действие 4. Подкожно вводите аналог соматостатина октреотид (Novartis Pharmaceuticals) в дозе 10-50 мкг по частям два или три раза в день
Действие 5. В отсутствие эффекта предыдущих действий анестезируйте животное пентобарбиталом на срок от 4 до 8 часов, не прекращая вышеописанной терапии; рассмотрите целесообразность ____________удаления функционально активной опухоли (Из: Nelson RW, Couto CG: Small Animal Internal Medicine. St Louis, Mosby-Year Book, 2003, p 774.)
702 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
животных с панкреатитом (например, вареный белый рис и обезжиренный творог). Если частое кормление не устраняет симптомы гипогликемии, назначают дополнительную терапию (см. раздел «Медикаментозная терапия хронической гипогликемии», стр. 703), и только если она не помогает, рекомендуют эвтаназию.
Оценка отдаленных результатов хирургического лечения: удалось ли вылечить собаку? Прогнозирование отдаленного исхода тотального удаления «одиночной» инсулин-секретирующей опухоли представляет собой трудную задачу. В начале самым эффективным и логичным способом оценки вероятности рецидивов неоплазии бета-клеток является периодическое (каждые 1-3 месяца) определение концентрации глюкозы в плазме крови натощак. Пробы крови для этой цели получают через 8-12 часов после последнего кормления собаки. В отсутствие рецидива концентрация глюкозы должна быть постоянно выше 70 мг/100 мл. Более низкий уровень глюкозы указывает на возможность рецидива опухоли. Для подтверждения этого определяют инсулин в сыворотке крови на фоне концентрации глюкозы менее 60 мг/100 мл (см. раздел «Подтверждение диагноза инсулин-секретирующей опухоли бета-клеток», стр. 693).
Медикаментозная терапия острого гипогликемического криза
Обычно острые клинические проявления гипогликемии у собак начинаются в домашних условиях после физической нагрузки, возбуждения или еды, в ближайшем послеоперационном периоде у животных с функционально активными метастазами или неоперабельными опухолями, а также в случаях неоправданно интенсивной инфузионной терапии с введением растворов декстрозы во время гипогликемии. Лечение такого расстройства зависит от тяжести его клинических проявлений и местонахождения собаки (дома или в ветеринарной клинике) и, в первую очередь, включает введение глюкозы либо с кормом и водой, либо посредством внутривенной инфузии 50%-ного раствора декстрозы.
Если владелец собаки сообщает о появлении у нее гипогликемических судорог по телефону, мы не рекомендуем привозить животное в клинику. Владельцу следует объяснить, как, намочив пальцы в сахарной воде (сиропе Каро), втереть ее в слизистую оболочку ротовой полости собаки. Обычно животное с гипогликемией уже через 1-2 минуты реагирует на такую манипуляцию. Во время судорожного приступа нельзя вкладывать в рот собаки руку или какой-либо предмет во избежание укуса. Нельзя также вливать сладкий раствор непосредственно в рот животного, так как он может попасть в легкие. Если животное реагирует на введение глюкозы и способно есть, следует дать ему небольшую порцию обогащенного белком корма. После этого собаке необходимо по возможности
обеспечить покой и специализированную ветеринарную помощь.
В условиях стационара клинические признаки гипогликемии обычно купируют внутривенным вливанием 50%-ного раствора декстрозы. При проведении внутривенной инфузионной терапии важно избежать избыточной стимуляции опухоли, которая может привести к высвобождению в кровяное русло слишком большого количества инсулина и тяжелой реактивной гипогликемии. Возникает порочный круг, когда ветеринар стремится компенсировать гипогликемию все большими и большими объемами 50%-ного раствора декстрозы, а тяжесть расстройства прогрессивно увеличивается. В результате у животного развиваются постоянные судороги, и оно погибает с явлениями отека мозга. При возникновении устойчивых циклов перемежающихся гипогликемии и гипергликемии требуются интенсивная медикаментозная терапия (см. табл. 14-12), которая, однако, не всегда дает желаемый результат.
Циклов гипогликемии и гипергликемии можно избежать, если не допускать быстрого повышения концентрации глюкозы в крови. Декстрозу следует вводить медленно и в небольших количествах, а не в виде быстрой струйной инфузии. Цель инфузионной терапии состоит не столько в нормализации концентрации глюкозы в крови, сколько в устранении клинических симптомов гипогликемии. После того как ее удается достигнуть путем осторожного внутривенного вливания декстрозы, приступают к глюкокортикоидной терапии в условиях частого кормления собаки небольшими порциями пищи (см. табл. 14-11).
Если введение декстрозы не предотвращает тяжелую гипогликемию и не устраняет циклы чередующихся гипогликемии и гипергликемии, проводят инфузию глюкагона с постоянной скоростью. Глюкагон является мощным стимулятором глюконеогенеза и гликогенолиза в печени, и его внутривенное введение с постоянной скоростью служит эффективным способом поддержания нормоглике-мии у собак с опухолями бета-клеток (рис. 14-10) (Fischer et al, 2000). 1 мг лиофилизированного глюкагона (Фармакопея США, производства Eli Lilly Со, США) растворяют в поставляемом в комплекте с ним растворителе и полученный раствор вносят в 1 литр 0,9%-ного физиологического раствора, получая концентрацию глюкагона 1 мкг/мл. Для введения используют шприцевую помпу. Начальная доза глюкагона составляет 5-10 нг/кг в минуту. По мере необходимости ее корректируют, чтобы поддерживать концентрацию глюкозы в плазме крови на уровне 50-100 мг/100 мл. Для прекращения инфузии глюкагона его дозу постепенно уменьшают на протяжении 1-2 дней, контролируя концентрацию глюкозы с целью профилактики тяжелой гипогликемии.
Некоторые собаки и кошки с нарушениями функции ЦНС не отвечают на введение глюкозы или
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 703
Концентрация глюкозы в крови (мг/100 мл)
Дни
Рис. 14-10. Концентрация глюкозы в крови 13-летней овари-эктомированной суки померана до и после хирургического удаления инсулин-секретирующей опухоли бета-клеток. После операции развились панкреатит и тяжелая гипогликемия. С началом внутривенной инфузии глюкагона с постоянной скоростью гипогликемия перешла в устойчивую эуг-ликемию. Дозу глюкагона постепенно понижали с 5-го дня инфузии, кормление небольшими порциями начинали на 7-й день, глюкагон был отменен на 8-й день. Рецидивы тяжелой гипогликемии не повторялись.
глюкагона. Эти нарушения могут быть не связаны с гипогликемией. Тем не менее, при длительной и тяжелой гипогликемии и сопутствующей церебральной гипоксии возможно необратимое поражение головного мозга. Церебральная гипоксия предрасполагает нервную ткань к отечности, так как индуцирует повышение давления в спинномозговой жидкости и вызывает гибель нервных клеток. Прогноз заболевания у животных с такими расстройствами от осторожного до неблагоприятного. Задачей терапии в подобных случаях является постоянное снабжение мозга глюкозой посредством внутривенного введения ее 5%-ного раствора или стимуляции ее эндогенной продукции в печени с помощью инфузии глюкагона с постоянной скоростью. Одновременно проводится противосудорожная терапия диазепамом или более сильными средствами. Наконец, при подозрении на отек мозга вводят маннитол в дозе 1 мг/кг внутривенно (в виде 20%-ного раствора со скоростью 2 мл/кг/мин), фуросемид (0,7 мг/кг, внутривенно струйно, через каждые 4 часа) и глюкокортикоиды (преднизон в форме сукцината натрия внутривенно в дозе 30 мг/ кг, а затем дексаметазон внутривенно в дозе 0,1 мг/ кг дважды в день в течение 3 дней) (Fenner, 1995).
Медикаментозная терапия хронической гипогликемии (см. табл. 14-11)
Основные сведения. Медикаментозное лечение хронической гипогликемии назначают в тех случаях, когда не проводится диагностическая лапаротомия или когда метастазирующая либо неоперабельная опухоль сопровождается соответствующей клинической симптоматикой. Основной целью такой терапии является не достижение эугликемии, а снижение частоты и тяжести острых гипогликемических приступов и их профилактика. Обычно проводят неспецифическую антигормональную терапию. Это
паллиативное лечение, которое направлено на максимальное уменьшение тяжести гипогликемии путем обеспечения постоянного поступления глюкозы из желудочно-кишечного тракта, усиления глюконеогенеза и гликогенолиза в печени и торможения синтеза, секреции и периферического действия инсулина на клетки. Основными составляющими антигормональной терапии являются частое кормление животного и введение ему глюкокортикоидов (см. табл. 14-11). Эффективность терапии повышается после хирургического удаления функционально активной опухоли или уменьшения ее объема. Наилучшие результаты получают в тех случаях, когда удаление проводят вскоре после выявления инсулин-секретирующей опухоли. В нашей клинике было несколько собак, состояние которых улучшилось после хирургического уменьшения объема опухоли, предпринятого из-за невозможности достичь удовлетворительного контроля гипогликемии с помощью медикаментозной терапии. Одна из них трижды подвергалась такой операции и прожила 3 года, прежде чем метастазы поразили легкие.
Аллоксан и стрептозотоцин обладают специфическим токсическим действием на бета-клетки. Их применение для лечения инсулин-секретирующих опухолей у собак лимитируется серьезными побочными эффектами. Тем не менее, недавно был предложен приемлемый протокол терапии стреп-тозотоцином, и в настоящее время проводятся исследования с целью оценки ее эффективности у животных с инсулин-секретирующими опухолями (Moore et al, 2002).
Частое кормление. У собак с опухолями бета-клеток имеет место хронический абсолютный или относительный избыток инсулина. Однако при наличии постоянного источника субстратов инсулина частота гипогликемических эпизодов снижается или они вообще прекращаются. Использование корма, обогащенного жирами, сложными углеводами и клетчаткой, позволяет замедлить опорожнение желудка и всасывание глюкозы из желудочно-кишечного тракта и тем самым предотвратить быстрое повышение ее концентрации в портальной крови, которое приводит к усилению секреции инсулина из поджелудочной железы. В то же время простые сахара интенсивно всасываются и стимулируют секрецию инсулина неопластическими бета-клетками, поэтому их нельзя включать в состав рациона для больных животных. Рекомендуется использовать специальные консервированные или сухие корма для собак, давая их небольшими порциями по три-шесть раз в день. Следует контролировать суточное потребление калорий, поскольку гиперинсулине-мия способствует развитию ожирения. Физические нагрузки должны ограничиваться непродолжительными прогулками на поводке.
Глюкокортикоидная терапия. Терапию глюкокортикоидами назначают, когда диетотерапия больше не устраняет симптомы гипогликемии. Глюкокортикоиды действуют как антагонисты инсулина
704 • ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
на клеточном уровне, стимулируют гликогенолиз в печени и косвенно способствуют поступлению субстратов для глюконеогенеза. Чаще всего используют преднизон, начальная суточная доза которого для перорального введения составляет 0,5 мг/кг; ее дают дважды в день, разделив пополам. Если эта доза достаточна для предупреждения клинических проявлений гипогликемии, ее продолжают вводить без дополнительной коррекции. Если же симптомы гипогликемии сохраняются или рецидивируют, дозу постепенно увеличивают до появления терапевтического эффекта или неприемлемых признаков ятрогенного гиперкортицизма. К числу последних большинство владельцев животных относят выраженную полидипсию, полиурию, прирост веса тела, полифагию или одышку. В случае возникновения таких явлений дозу преднизона уменьшают (но не отменяют), добиваясь максимального понижения тяжести ятрогенных симптомов. В случае необходимости прибегают к терапии диазоксидом или стрептозотоцином.
Терапия диазоксидом. Диазоксид (прогликем, производства Baker Norton Pharmaceuticals, США) представляет собой бензотиадиазидный диуретик, который ингибирует секрецию инсулина, стимулирует глюконеогенез и гликогенолиз в печени и подавляет утилизацию глюкозы в тканях. В сумме эти эффекты обусловливают гипергликемическое действие препарата. Диазоксид не влияет непосредственно на биосинтез инсулина и не обладает цитотоксичным (антинеопластическим) действием. К сожалению, он мало доступен и дорог. Начальная суточная доза диазоксида составляет 10 мг/кг; ее делят пополам и вводят перорально дважды в день. При необходимости более интенсивного контроля гипогликемии дозу постепенно повышают, однако, она не должна превышать 60 мг/кг/день. Терапевтическая эффективность диазоксида возрастает при одновременном введении тиазидных диуретиков. Комплексную терапию этими препаратами назначают в тех случаях, когда один диазоксид не обеспечивает желаемого эффекта. Гидрохлоротиазид вводят дважды в день перорально в общей суточной дозе 2^1 мг/кг.
При лечении диазоксидом стремятся подобрать дозу препарата, обеспечивающую максимальное ослабление или прекращение гипогликемии и ее клинических проявлений. Однако она должна быть достаточно низкой, чтобы избежать гипергликемии (т.е. концентрации глюкозы в крови выше 180 мг/100 мл) и сопутствующих ей симптомов. В ветеринарной литературе лишь изредка появляются сообщения о терапевтическом применении диазоксида (Leifer et al, 1986; Feldman, Nelson, 1987). Из 17 обследованных нами собак с инсулин-секретирующими опухолями 13 хорошо отвечали на терапию диазоксидом, и его действие сохранялось в течение 1,5-20 месяцев. В другой работе хороший терапевтический эффект диазоксида был получен у 9 из 14 собак (Leifer et al, 1986).
Побочное действие диазоксида наиболее часто проявляется в форме анорексии и рвоты. Введение диазоксида с кормом или хотя бы временное понижение дозы препарата, как правило, позволяет снизить частоту желудочно-кишечных расстройств. Другие побочные эффекты этого препарата включают диарею, тахикардию, подавление активности костного мозга, апластическую анемию, тромбоцитопению, панкреатит, сахарный диабет, катаракту, задержку натрия и жидкости (Feldman, Nelson, 1987). Обмен диазоксида происходит в печени, а его продукты выводятся через почки и желчную систему. При сопутствующей дисфункции печени побочное действие диазоксида проявляется быстрее и при более низких дозах препарата.
Терапия соматостатином. Октреотид, выпускаемый компанией Novartis Pharmaceuticals (США), является аналогом соматостатина и подавляет синтез и секрецию инсулина нормальными и неопластическими бета-клетками. Внутривенное введение октреотида вызывает быстрое уменьшение концентрации инсулина и соответствующее повышение концентрации глюкозы в плазме крови собак с инсулин-секретирующими опухолями (рис. 14-11) (Robben et al, 1997). При подкожном введении ингибирующее действие октреотида на секрецию инсулина сохраняется на протяжении нескольких часов (рис. 14-12). Ответ секретирующих инсулин клеток на ингибирующее действие октреоитда у отдельных животных может быть разным и зависит от количества рецепторов соматостатина на поверхности клеток (Lamberts et al, 1990; Simpson et al, 1995). В настоящее время у человека выявлено пять типов таких рецепторов (Kubota et al, 1994). Они отличаются по локализации в различных тканях и сродству к соматостатину и его аналогам (Bruns et al, 1994). У некоторых людей инсулин-секретирующие опухоли содержат такие подтипы рецепторов соматостатина, которые не связывают октреотид или связывают его в небольших количествах; в результате этот препарат не влияет или слабо влияет на концентрацию инсулина и глюкозы в крови (Lamberts et al, 1991 и 1996). Ауторадиографическое исследование инсулин-секретиру-ющих опухолей собак выявило в них толью один подтип рецепторов соматостатина (Robben et al, 1997). Рецепторы этого подтипа обладают высоким сродством к октреотиду. В данном исследовании базальная концентрация инсулина в плазме крови 10 собак существенно различалась, но во всех случаях значительно снижалась после введения им октреотида. Наш опыт показывает, что соматостатин эффективно уменьшает тяжесть гипогликемии приблизительно у 40-50% собак с инсулин-секретирующими опухолями. К сожалению, некоторые особи не отвечают на терапию октреотидом (Lothrop, 1989). В большинстве случаев октреотид хорошо переносится животными при подкожном введении в дозах от 10 до 50 мкг два или три раза в день и может с успехом использоваться для лечения ост
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 705
рой и хронической гипогликемии у многих собак с инсулин-секретирующими опухолями. Побочных эффектов при этих дозах не наблюдалось.
Лекарственные средства для химиотерапии. Для лечения инсулин-секретирующих опухолей у человека используются стрептозотоцин и аллоксан, однако имеется мало сообщений о применении этих соединений в ветеринарной практике. Применение обоих препаратов ограничено их серьезными побочными эффектами, хотя недавно был предложен вполне приемлемый протокол терапии стрептозо-тоцином (Moore et al, 2002).
Стрептозотоцин. Стрептозотоцин - это природное производное нитрозомочевины, избирательно разрушающее бета-клетки поджелудочной железы в результате подавления активности пиридиновых нуклеотидов: никотинамидадениндинук-леотида (НАД) и восстановленного НАД (НАДН). Внутривенное введение стрептозотоцина в дозе 500 мг/м2 на протяжении 5 последовательных дней позволяло уменьшить размер опухоли и улучшить клиническую симптоматику гиперинсулинемии у людей с прогрессирующей карциномой островковых бета-клеток (Moertel et al, 1980). Токсическое действие стрептозотоцина у человека проявляется, главным образом, в форме некроза проксимальных почечных канальцев. Некроз усиливается по мере увеличения дозы препарата, носит кумулятивный характер и может приводить к недостаточности почечной функции. Реже стрептозотоцин вызывает тошноту, рвоту и повышение активности ферментов печени в сыворотке.
В 1970-ых годах Меуег ввел стрептозотоцин двум собакам с подтвержденным гиперинсулинизмом. У одной из них после однократной дозы препарата (1000 мг/кг веса тела), вводившейся внутривенно в течение 1 минуты, развился нефротоксикоз, и спустя 3 недели ее пришлось эвтаназировать. У второй собаки, которой сделали две 30-секундные инъекции стрептозотоцина в дозе 500 мг/м2, отмечалась временная ремиссия гипогликемии, сохранявшаяся на протяжении примерно 50 дней. Интервал между инъекциями составлял 1 неделю, до и после каждой из них производили 20-минутную инфузию маннитола. Третья инъекция через 97 дней после начала терапии привела к нефропатии и гепатопатии, что заставило прибегнуть к эвтаназии. На основании этих результатов стрептозотоцин был признан непригодным для лечения инсулин-секретирующих опухолей у собак.
Недавно был предложен протокол инфузионного диуреза, при котором введение стрептозотоцина собакам с инсулин-секретирующими опухолями сопровождается минимальными побочными эффектами (Moore et al, 2002). Инфузионный диурез позволяет ослабить нефротоксическое действие стрептозотоцина у людей, по-видимому, благодаря сокращению продолжительности контакта препарата с эпителием почечных канальцев (Tobin et al, 1987; Kintzel, 2001). В исследовании Мура (Moore)
Рис. 14-11. Средняя (± SD) концентрация инсулина в сыворотке крови до и после внутривенного введения 100 мкг октреотида у шести собак с инсулин-секретирующими опухолями бета-клеток. Стрелкой показан момент введения октреотида, заштрихованная область - диапазон нормальных концентраций инсулина натощак.
Рис. 14-12. Концентрация инсулина в сыворотке крови до и после подкожного введения 20 мкг октреотида собаке с инсулин-секретирующей опухолью бета-клеток. Стрелкой показан момент введения октреотида, заштрихованная область - диапазон нормальных концентраций инсулина натощак.
и соавторов 0,9%-ный физиологический раствор на протяжении 7 часов вводили со скоростью 18.3 мл/кг/час через периферический катетер. Спустя 3 часа после начала этой процедуры приступали к инфузии стрептозотоцина (заносар, производства Upjohn, США), которая продолжалась 2 часа. Препарат в дозе 500 мг/м2 разводили в соответствующем объеме 0,9%-ного физиологического раствора, скорость инфузии оставалась постоянной на всем ее протяжении. После окончания введения стрептозотоцина инфузию физиологического раствора продолжали с прежней скоростью в течение еще двух часов. Сразу после введения стрптозотоцина производили внутривенную инъекцию буторфанола в дозе 0,4 мг/кг в качестве антиэметика. Описанную процедуру повторяли с трехнедельными интерва
706
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
лами до тех пор, пока сохранялись проявления продолжающегося развития опухоли (т.е. увеличения ее размеров более чем на 50%) и рецидивы гипогликемии либо до появления признаков токсичности стрептозотоцина, требовавших дополнительной поддерживающей терапии.
Было проведено 58 сеансов инфузии стрептозотоцина 17 собакам с инсулин-секретирующими опухолями в разные сроки после хирургической операции (Moore et al., 2002). У 16 из 17 животных имелись метастазы. У одной собаки развилась азотемия, у нескольких других повысилась концентрация аланинаминотрансферазы в сыворотке крови, которая нормализовалась после прекращения терапии. В 18 (31 %) из 58 сеансов введения стрептозотоцина отмечались приступы рвоты, иногда сильные. У двух собак после пятикратного введения стрептозотоцина был диагностирован сахарный диабет, у двух из трех особей быстро исчезла паранеоплас-тическая периферическая невропатия, еще у двух уменьшился размер опухоли. Средняя продолжительность жизни у получавших стрептозотоцин собак была больше, чем у 15 контрольных животных, находившихся на аналогичной стадии заболевания (соответственно 163 и 90 дней), однако это различие было статистически недостоверным. Обе группы не отличались также по продолжительности выживания отдельных особей, которая составляла от 16 до 309 дней у получавших стрептозотоцин собак и от 0 до 426 дней у контрольных животных. Результаты этого исследования свидетельствуют о том, что терапия стрептозотоцином в условиях инфузионного диуреза безопасна для собак и может оказывать благотворное действие на некоторых животных с метастазирующими инсулин-секретирующими опухолями.
Аллоксан. Аллоксан - это нестабильное производное мочевой кислоты, оказывающее прямое токсическое действие на бета-клетки, которое обусловлено, главным образом, изменением проницаемости клеточных мембран (Dublin et al, 1983). Цитотоксическое действие аллоксана пропорционально его дозе. Кроме того, это соединение усиливает глюконеогенез в печени, по-видимому, благодаря стимуляции секреции глюкагона альфа-клетками поджелудочной железы (Dublin et al, 1983).
Применение аллоксана для лечения неоплазии островковых бета-клеток у человека было безуспешным (Sherwin, Felig, 1981). Мы получили неоднозначные результаты при его использовании у восьми собак с метастазирующими инсулин-секретирующими опухолями. Аллоксан вводили животным однократно внутривенно в дозе 65 мг/кг. У четырех из них первоначальная реакция была положительной: в первые 3-5 дней развилась гипергликемия или эугликемия, сохранявшаяся на протяжении нескольких месяцев в отсутствие дополнительной медикаментозной терапии, если не считать частого кормления животных. Однако, в конце концов, у них снова развивалась гипоглике
мия. У одной собаки имела место временная гипергликемия, сменившаяся гипогликемией через 3 недели после введения аллоксана. Еще одна погибла вследствие острой почечной недостаточности, а две другие из-за расстройства дыхания через 24 часа после введения аллоксана.
Токсическое действие аллоксана проявляется в форме некроза почечных канальцев, приводящего к острой почечной недостаточности, синдрома острого расстройства дыхания с быстрым отеком легких и некроза печени. Нефротоксичность препарата зависит от его дозы и, возможно, имеет обратимый характер при условии адекватной инфузионной и поддерживающей терапии. Однократную внутривенную инъекцию аллоксана в дозе 65 мг/кг используют для индукции экспериментального сахарного диабета у здоровых собак. Как показывает наш опыт, внутривенное введение аллоксана таким животным приводит к острому некрозу почечных канальцев и уремии и/или синдрому расстройства дыхания у 10-20% особей. Известно также, что при введении аллоксана в дозе, превышающей диабетогенную, он вызывает некроз и жировую инфильтрацию центральной доли печени.
Другие лекарственные средства. К числу лекарственных препаратов, снижающих вероятность гипогликемических приступов, относятся также пропранолол и фенитоин. Действие этих соединений на собак и кошек с опухолями островковых бета-клеток критически не оценивалось, и мы практически не используем их для лечения таких новообразований.
Фенитоин. Фенитоин является противосудорожным средством, которое подавляет секрецию инсулина бета-клетками и препятствует его действию на периферические ткани (Haetners, Rottiers, 1981). К сожалению, в большинстве случаев фенитоин не обеспечивает эффективный контроль клинических проявлений гипогликемии. После его введения людям с гиперинсулинизмом улучшение отмечалось только у 30% больных (Haemers, Rottiers, 1981). Одновременное применение диазоксида не рекомендуется, так как этот препарат уменьшает концентрацию фенитоина в крови.
Пропранолол. Пропранолол представляет собой бета-адренергический блокатор неизбирательного действия, не обладающий симпатомиметической активностью. Потенциальная возможность его терапевтического применения при опухолях островковых бета-клеток у человека, по-видимому, объясняется его способностью блокировать секрецию инсулина. Однако пропранолол может индуцировать гипогликемию, подавляя глюконеогенез и гликогенолиз в печени, которые в норме индуцируются эндогенными катехоламинами.
ПРОГНОЗ
Ввиду высокой вероятности малигнизации у любой собаки с инсулин-секретирующей опухолью
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА • 707
прогноз заболевания неблагоприятный, в лучшем случае осторожный. Длительность выживания собаки отчасти зависит от готовности ее владельца проводить необходимое лечение. Медиана продолжительности жизни после установления диагноза у животных, получавших медикаментозную терапию, не превышает 74 дней (диапазон от 8 до 508 дней) по сравнению с 381 днем (от 20 до 1758 днями) у животных, которым опухоль удалили хирургическим путем сразу же после ее обнаружения (Tobin et al, 1999). Более короткий срок жизни в случае медикаментозной терапии отчасти связан с большей тяжестью заболевания к моменту его выявления и чувством безнадежности у владельцев животных, что заставляет их прибегать к преждевременной эвтаназии при возобновлении клинической симптоматики.
Влияние хирургического лечения на прогноз данного заболевания зависит от стадии развития опухоли и, в первую очередь, от интенсивности ее метастазирования. В исследовании, проводившемся в нескольких университетах, было показано, что у собак с опухолями, ограниченными поджелудочной железой (стадия I), нормогликемия сохранялась на протяжении в среднем 14 месяцев после хирургической операции, тогда как у животных с метастазами в регионарных узлах (стадия II) или при отдаленном метастазировании (стадия III) - в течение всего 1 месяца (Caywoodet al, 1988). Медиана выживания собак на I и II стадиях развития опухоли составляла примерно 18 месяцев, а на стадии Ш не превышала 6 месяцев. Примерно 50% собак с метастазами в печени (наиболее частое место метастазирования) погибли в течение 6 месяцев и все 100% - через 18 месяцев после установления диагноза.
Согласно нашим наблюдениям, от 10 до 15% собак после хирургического удаления инсулин-секретирующих опухолей умирают или подвергаются эвтаназии в пределах 1 месяца после операции из-за массированного метастазирования, не поддающейся контролю послеоперационной гипогликемии и осложнений, связанных с появлением панкреатита. Еще 20-25% животных умирают или подвергаются эвтаназии в течение 6 месяцев после резекции опухоли также по причине тяжелого метастазирования и рецидива клинически выраженной гипогликемии. Остальные 60-70% собак живут более полугода, а многие и дольше 1 года после операции, после чего у них развивается неконтролируемая гипогликемия и они погибают либо подвергаются эвтаназии. Повторная операция с целью уменьшения объема опухоли улучшает ответ животных на медикаментозную терапию и продлевает жизнь некоторым особям, не отвечавшим на терапию после первичной операции. У отдельных собак с метастазирующими опухолями после дополнительного удаления опухолевой ткани и метастазов отмечается вполне удовлетворительное состояние, и они живут более двух лет.
ИНСУЛИН-СЕКРЕТИРУЮЩИЕ ОПУХОЛИ БЕТА-КЛЕТОК У КОШЕК
У кошек редко встречаются инсулин-секретиру-ющие опухоли. В литературе описаны только три случая неоплазии бета-клеток у этих животных (McMillan, 1985; O’Brien et al, 1990; Hawks et al, 1992), и имеется еще одно дополнительное сообщение о случайном обнаружении такой опухоли при вскрытии кошки, погибшей в результате аденокарциномы панкреатического протока (Carpenter et al, 1987). На протяжении последних 20 лет нам пришлось наблюдать только двух кошек с неоплазией бета-клеток по сравнению с более чем 120 случаями этого же заболевания у собак.
Клинические проявления инсулин-секретирующих опухолей у кошек, по-видимому, существенно не отличаются от таковых у собак. Описанные на настоящее время особи с такими опухолями имели возраст от 12 до 17 лет. Интересно, что три опухоли из четырех были обнаружены у сиамских кошек. Иммуногистохимическое исследование опухолей островковых бета-клеток кошек выявило присутствие в неопластических клетках сразу нескольких гормонов, среди которых преобладал инсулин. Клинические симптомы заболевания, по-видимому, обусловлены в первую очередь гиперинсулинемией и включают судороги, общую слабость, атаксию и подергивание мышц. У всех имевших опухоли кошек зарегистрирована гипогликемия (при концентрации глюкозы в плазме крови ниже 60 мг/100 мл), а у двух особей, у которых измеряли концентрацию инсулина, она была аномально высокой. Наличие опухоли поджелудочной железы было подтверждено у трех кошек, подвергнутых хирургической операции; после удаления опухоли у двух из них исчезли гипогликемия и сопутствующая ей клиническая симптоматика. Эти три кошки умерли соответственно через 5 недель, 18 месяцев и 2 года после хирургической операции. На вскрытии были выявлены метастазы в печени и лимфатических узлах поджелудочной железы.
До накопления необходимого опыта лечения опухолей бета-клеток у кошек представляется целесообразным проводить его таким же образом, как у собак. Необходима дифференциальная диагностика этих опухолей от устойчивой гипогликемии, встречающейся у старых кошек (см. табл. 14-8). Подозрение на наличие неоплазии бета-клеток возрастает после выявления соответствующих признаков в результате анализа анамнестических данных, физикального исследования, клинико-патологического тестирования и диагностической визуализации. Диагноз следует подтвердить выявлением аномально высокой концентрации инсулина в крови на фоне гипогликемии (см. раздел «Подтверждение диагноза инсулин-секретирующей опухоли бета-клеток», стр. 693). Многие коммерческие РИА наборы для определения инсулина дают хорошие результаты при анализе проб крови собак, но не работают у
708
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
кошек (Lutz, Rand, 1993). Поэтому прежде чем использовать их для обследования кошек, необходимо оценить достоверность проводимых измерений.
При подозрении на опухоль бета-клеток у кошки методом выбора является первичное хирургическое исследование. Однако в ряде случаев более целесообразно начать консервативное медикаментозное лечение, в частности для старых кошек, а также в случае выявления метастазирования во время УЗИ или обнаружения сопутствующего заболевания, при котором анестезия противопоказана. Частое кормление животных и введение им глюкокортикоидов являются эффективными способами контроля гиперинсулинемии (Hawks et al, 1992) и должны служить основой медикаментозной терапии хронической гипогликемии. Сведений о применении диазоксида у кошек нет, поэтому его следует назначать с большой осторожностью, пока не будет доказана безопасность препарата для этих животных. Мы вводили довольно большие дозы аналога соматостатина октреотида (200 мкг подкожно) кошкам с акромегалией без каких-либо отрицательных последствий. Дозы октреотида, рекомендуемые для лечения опухолей островковых бета-клеток у собак, должны быть безопасны и для кошек. Тем не менее, его эффективность для лечения таких новообразований у кошек требует уточнения.
ЛИТЕРАТУРА
Bagley RS, et al: Hypoglycemia associated with intraabdominal leiomyoma and leiomyosarcoma in six dogs. J Am Vet Med Assoc 208:69, 1996.
Barreca A, et al: In vitro paracrine regulation of human keratinocyte growth by fibroblast-derived insulin-like growth factors. J Cell Physiol 151:262, 1992.
Beaudry D, et al: Hypoglycemia in four dogs with smooth muscle tumors. J Vet Intern Med 9:415, 1995.
Bellah JR, Ginn PE: Gastric leiomyosarcoma associated with hypoglycemia in a dog. J Am Anim Hosp Assoc 32:283, 1996.
Bergman PJ, et al: Canine clinical peripheral neuropathy associated with pancreatic islet cell carcinoma. Prog Vet Neurol 5:57, 1994.
Boari A, et al: Hypoglycemia in a dog with a leiomyoma of the gastric wall producing an insulin-like growth factor Il-like peptide. Eur J Endocrinol 132:744, 1995.
Boyle PJ, Cryer PE: Growth hormone, Cortisol, or both are involved in defense against but are not critical to recovery from prolonged hypoglycemia in humans. Am J Physiol 260:E395, 1991.
Braund KG, et al: Insulinoma and subclinical peripheral neuropathy in two dogs. J Vet Intern Med 1:86, 1987.
Breitschwerdt EB, et al: Hypoglycemia in four dogs with sepsis. J Am Vet Med Assoc 178:1072, 1981.
Brix A, et al: Glycogen storage disease type la in two littermate Maltese puppies. Vet Pathol 32:460, 1995.
Bruns C, et al: Molecular pharmacology of somatostatin receptor subtypes. Ann N Y Acad Sci 733:138, 1994.
Buetow PC, et al: Islet cell tumors of the pancreas: Clinical, radiological, and pathologic correlation in diagnosis and localization. Radiographics 17:453, 1997.
Carpenter JL, et al: Tumors and tumorlike lesions. In Holsworth J (ed): Diseases of the Cat: Medicine and Surgery. Philadelphia, WB Saunders, 1987, p 406.
Caywood DD, et al: Pancreatic insulin-secreting neoplasms: Clinical, diagnostic, and prognostic features in 73 dogs. J Am Anim Hosp Assoc 24:577, 1988. Chastain CB: Endocrine and metabolic systems. In Hoskins JD (ed): Veterinary Pediatrics. Philadelphia, WB Saunders, 1990, p 249.
Chew DJ, et al: Hyperglycemia and hypoglycemia. In Klenner WR (ed): Quick Reference to Veterinary Medicine. Philadelphia, JB Lippincott, 1982, p 432.
Cohn LA, et al: Assessment of five portable blood glucose meters, a point-of-care analyzer, and color test strips for measuring blood glucose concentration in dogs. J Am Vet Med Assoc 216:198, 2000.
Commens PJ, et al: lnterleukin-1 is a potent modulator of insulin secretion from isolated rat islets of Langerhans. Diabetes 36:963, 1987.
Cryer PE: Catecholamines, pheochromocytoma and diabetes. Diabetes Rev 1:309, 1993.
Cryer PE, Gerich JE: Glucose counterregulation, hypoglycemia, and intensive insulin therapy in diabetes mellitus. N Engl J Med 313:232, 1985.
Cryer PE, Polonsky KS: Glucose homeostasis and hypoglycemia. In Wilson JD, et al (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders, 1998, p 939.
Das H, Hochberg FH: Metastatic neoplasms and paraneoplastic syndromes. In Goetz CG, Pappert EJ (eds): Textbook of Clinical Neurology. Philadelphia, WB Saunders, 1999, p 957.
Daughaday WH: The pathophysiology of IGF-II hypersecretion in non-islet tumor hypoglycemia. Diabetes Rev 3:62, 1995.
Daughaday WH, et al: Synthesis and secretion of insulin-like growth factor II by a leiomyosarcoma with associated hypoglycemia. N Engl J Med 319:1434, 1988.
D’Ercole AJ, et al: Tissue concentration of somatomedin-C: Further evidence for multiple sites of synthesis and paracrine or autocrine mechanisms of action. Proc Natl Acad Sci USA 81:935, 1984.
de Bruijne JJ: Ketone-body metabolism in fasting dogs. Doctoral thesis. University of Utrecht, 1982, The Netherlands.
de Bruijne JJ, et al: Fat mobilization and plasma hormone levels in fasted dogs. Metabolism 30:190, 1981.
del Ray A, Besedovsky H: lnterleukin-1 affects glucose homeostasis. Am J Physiol 253:R794, 1987.
Dublin WE, et al: Experimental and spontaneous diabetes in animals. In El-lenberg M, Rifkin H (eds): Diabetes Mellitus, Theory and Practice, 3rd ed. New York, Medical Examination Publishing, 1983, p 361.
Edwards DF, et al: Hypoglycemia and chronic renal failure in a cat. J Am Vet Med Assoc 190:435, 1987.
Feldman EC, Nelson RW: Canine and Feline Endocrinology and Reproduction. Philadelphia, WB Saunders, 1987.
Fenner WR: Diseases of the brain. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 4th ed. Philadelphia, WB Saunders, 1995, p 578.
Fingeroth JM, Smeak DD: Intravenous methylene blue infusion for intraoperative identification of pancreatic islet cell tumors in dogs. II. Clinical trials and results in four dogs. J Am Anim Hosp Assoc 24:175, 1988.
Fingeroth JM, et al: Intravenous methylene blue infusion for intraoperative identification of parathyroid gland and pancreatic islet cell tumors in dogs. I. Experimental determination of dose-related staining efficacy and toxicity. J Am Anim Hosp Assoc 24:165, 1988.
Fischer JR et al: Glucagon constant-rate infusion: A novel strategy for the management of hyperinsulinemic-hypoglycemic crisis in the dog. J Am Anim Hosp Assoc 36:27, 2000.
Fischer KF, et al: Hypoglycemia in hospitalized patients: Causes and outcomes. N Engl J Med 315:1245, 1986.
Fukuda I, et al: Circulating forms of insulin-like growth factor II (IGF-II) in patients with non-islet cell tumor hypoglycemia. Endocrinol Metab 1:89, 1994.
Gerich J, et al: Hypoglycemia unawareness. Endocr Rev 12:356, 1991.
Gerich JE, et al: Renal gluconeogenesis: Its importance in human glucose homeostasis. Diabetes Care 24:382, 2001.
Haemers S, Rottiers R: Medical treatment of insulinoma. Acta Clin Belg 36:199, 1981.
Hardy RM: Diseases of the liver and their treatment. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 3rd ed. Philadelphia, WB Saunders, 1989, p 1479.
Hargrove DM, et al: Adrenergic blockade does not abolish elevated glucose turnover during bacterial infection. Am J Physiol 254:E16, 1988a.
Hargrove DM, et al: Adrenergic blockade prevents endotoxin-induced increases in glucose metabolism. Am J Physiol 255:E629, 1988b.
Hawkins KL, et al: Immunocytochemistry of normal pancreatic islets and spontaneous islet cell tumors in dogs. Vet Pathol 24:170, 1987.
Hawks D, et al: Insulin-secreting pancreatic (islet cell) carcinoma in a cat. J Vet Intern Med 6:193, 1992.
Heckmann JG, et al: Hypoglycemic sensorimotor polyneuropathy associated with insulinoma. Muscle Nerve 23:1891, 2000.
Jeffery ND, et al: Letter to the editor. Prog Vet Neurol 5:135, 1994.
Kahn CR: The riddle of tumour hypoglycemia revisited. Clin Endocrinol Metab 9:335, 1980.
Karam JH: Hypoglycemic disorders. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/Mc-Graw-Hill, 2001, p 699.
Kintzel PE: Anticancer drug-induced kidney disorders. Drug Safety 24:19, 2001. Kishnani PS, et al: Canine model and genomic structural organization of glycogen storage disease type la (GSD la). Vet Pathol 38:83, 2001.
Kruth SA, et al: Insulin-secreting islet cell tumors: Establishing a diagnosis and the clinical course of 25 dogs. J Am Vet Med Assoc 181:54, 1982.
Kubota A, et al: Identification of somatostatin receptor subtypes and an implication for the efficacy of somatostatin analog SMS 201-995 for treatment of human endocrine tumors. J Clin Invest 93:1321, 1994.
Kudo M, Noguchi T: Immunoreactive myelin basic protein in tumor cells associated with carcinomatous neuropathy. Am J Clin Pathol 84:741, 1985.
Kvols LK, et al: Evaluation of a radio-labeled somatostatin analog (1-123 octreotide) in the detection and localization of carcinoid and islet cell tumors. Radiology 197:129, 1993.
ОПУХОЛИ БЕТА-КЛЕТОК: ИНСУЛИНОМА
709
Lamberts SJW, et al: Parallel in vivo and in vitro detection of functional somatostatin receptors in human endocrine pancreatic tumors: Consequences with regard to diagnosis, localization and therapy. J Clin Endocrinol Metab 71:566, 1990.
Lamberts SJW, et al: The role of somatostatin and its analogs in the diagnosis and treatment of tumors. Endocrinol Rev 12:450, 1991.
Lamberts SJW, et al: Octreotide and related somatostatin analogs in the diagnosis and treatment of pituitary disease and somatostatin receptor scintigraphy. Neuroendocrinology 14:27, 1993.
Lamberts SWJ, et al: Somatostatin analogs: Future directions. Metabolism 45:104, 1996.
Leifer CE, et al: Hypoglycemia associated with non-islet cell tumor in 13 dogs. J Am Vet Med Assoc 186:53, 1985.
Leifer CE, et al: Insulin-secreting tumor: Diagnosis and medical and surgical management in 55 dogs. J Am Vet Med Assoc 188:60, 1986.
LeRoith D, et al: Insulin-like growth factors in health and disease. Ann Intern Med 116:854, 1992.
Lester NV, et al: Scintigraphic diagnosis of insulinoma in a dog. Vet Radiol Ultrasound 40:174, 1999.
Lothrop CD: Medical treatment of neuroendocrine tumors of the gastroenter-opancreatic system with somatostatin. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p 1020.
Lutz TA, Rand JS: Comparison of five commercial radioimmunoassay kits for the measurement of feline insulin. Res Vet Sci 55:64, 1993.
Masharani U, Karam JH: Pancreatic hormones and diabetes mellitus. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books /McGraw-Hill, 2001, p 623.
McMillan F: Functional pancreatic islet cell tumor in a cat. J Am Anim Hosp Assoc 21:741, 1985.
Merimee TJ: Insulin-like growth factors in patients with non-islet cell tumors and hypoglycemia. Metabolism 35:360, 1986.
Meszaros K, et al: Increased uptake and phosphorylation of 2-deoxyglucose by skeletal muscles in endotoxin-treated rats. Am J Physiol 253:E33, 1987.
Meszaros K, et al: In vivo glucose utilization by individual tissues during non-lethal hypermetabolic sepsis. FASEB J 2:3083, 1988.
Meyer C, et al: Effects of autonomic neuropathy on counterregulation and awareness of hypoglycemia in type 1 diabetic patients. Diabetes Care 21:1960, 1998.
Minkus G, et al: Canine neuroendocrine tumors of the pancreas: A study using image analysis techniques for the discrimination of metastatic versus nonmetastatic tumors. Vet Pathol 34:138, 1997.
Moertel CG, et al: Streptozotocin alone compared with streptozotocin plus fluorouracil in the treatment of advanced islet cell carcinoma. N Engl J Med 303:1189, 1980.
Mokan M, et al: Hypoglycemia unawareness in IDDM. Diabetes Care 17:1397, 1994.
Moore AS, et al: Streptozotocin for treatment of pancreatic islet cell tumors in dogs: 17 cases (1989-1999). J Am Vet Med Assoc 221:811, 2002.
Naylor JM, Krohfeld DS: In vivo studies of hypoglycemia and lactic acidosis in endotoxic shock. Am J Physiol 248:E309, 1985.
Nelson RW, Salisbury SK: Pancreatic beta-cell neoplasia. In Birchard SJ, Sherding RG (eds): Saunders Manual of Small Animal Practice, 2nd ed. Philadelphia, WB Saunders, 2000, p 288.
O’Brien TD, et al: Canine pancreatic endocrine tumors: Immunohistochemical analysis of hormone content and amyloid. Vet Pathol 24:308, 1987.
O’Brien TD, et al: Pancreatic endocrine tumor in a cat: Clinical, pathological, and immunohistochemical evaluation. J Am Anim Hosp Assoc 26:453, 1990.
Robben JH, et al: In vitro and in vivo detection of functional somatostatin receptors in canine insulinomas. J Nucl Med 38:1036, 1997.
Rothman DL, et al: Quantitation of hepatic glycogenolysis and gluconeogenesis in fasting humans with ,3C NMR. Science 254:573, 1991.
Schrauwen E, et al: Peripheral polyneuropathy associated with insulinoma in the dog: Clinical, pathological, and electrodiagnostic features. Prog Vet Neurol 7:16, 1996.
Scully RE, et al: Case records of the Massachusetts General Hospital. N Engl J Med 308:30, 1983.
Service FJ: Hypoglycemic disorders. N Engl J Med 332:1144, 1995.
Shahar R, et al: Peripheral neuropathy in a dog with functional islet B-cell tumor and widespread metastasis. J Am Vet Med Assoc 187:175, 1985.
Sherwin RS, Felig P: Hypoglycemia. In Felig P, et al (eds): Endocrinology and Metabolism. New York, McGraw-Hill, 1981, p 869.
Simpson KW, et al: Evaluation of the long-acting somatostatin analogue octreotide in the management of insulinoma in three dogs. J Small Anim Pract 36:161, 1995.
Slye M, Wells HG: Tumor of islet tissue with hyperinsulinism in a dog. Arch Pathol 19:537, 1935.
Smeak DD, et al: Intravenous methylene blue as a specific stain for primary and metastatic insulinoma in a dog. J Am Anim Hosp Assoc 24:478, 1988.
Stumvoll M, et al: Uptake and release of glucose by the human kidney. J Clin Invest 96:2528, 1995.
Tobin MV, et al: Forced diuresis to reduce nephrotoxicity of streptozocin in the treatment of advanced metastatic insulinoma. Br Med J 294:1128, 1987.
Tobin RL, et al: Outcome of surgical versus medical treatment of dogs with beta-cell neoplasia: 39 cases (1990-1997). J Am Vet Med Assoc 215:226, 1999.
van Ham L, et al: Treatment of a dog with an insulinoma-related peripheral polyneuropathy with corticosteroids. Vet Rec 141:98, 1997.
Wess G, Reusch C: Evaluation of five portable blood glucose meters for use in dogs. J Am Vet Med Assoc 216:203, 2000.
Whipple AO, Grantz VK: Adenoma of islet cells with hyperinsulinism. A review. Ann Surg 101:1299, 1935.
КИШЕЧНЫЕ РЕГУЛЯТОРНЫЕ ПЕПТИДЫ 710
КОНЦЕПЦИЯ АПУД.............712
ИНСУЛИНОМА.................713
ФЕОХРОМОЦИТОМА.............713
ГАСТРИНОМА: СИНДРОМ ЗОЛЛИНГЕРА-ЭЛЛИСОНА........713
Глава 15
ГАСТРИНОМА, ГЛЮКАГОНОМА
И ДРУГИЕ АПУДомы
ГЛЮКАГОНОМА (ПОВЕРХНОСТНЫЙ НЕКРОЛИТИЧЕСКИЙ ДЕРМАТИТ)....720
ВИПома:
СИНДРОМ ВЕРНЕРА-МОРРИСОНА ....722
СОМАТОСТАТИНОМА.............722
ОПУХОЛЬ, ПРОДУЦИРУЮЩАЯ
ПАНКРЕАТИЧЕСКИЙ ПОЛИПЕПТИД ..723 КАРЦИНОИДЫ И КАРЦИНОИДНЫЙ
СИНДРОМ..................723
Список сокращений
АКТГ - адренокортикотропный гормон
ВИП — вазоактивный интерстициальный пептид
ПП — панкреатический полипептид
УЗИ - ультразвуковое исследование ЦНС - центральная нервная система
КИШЕЧНЫЕ РЕГУЛЯТОРНЫЕ ПЕПТИДЫ
Классификация и распределение кишечных пептидов. На всем протяжении желудочно-кишечного тракта от пищевода до прямой кишки распределены специализированные эндокринные клетки, которые секретируют пептиды, участвующие в поддержании нормальных физиологических функций пищеварительной системы (табл. 15-1). Помимо специализированных эндокринных клеток, кишечные пептиды находятся в нейронах, локализованных на всех участках желудочно-кишечного тракта (табл. 15-2). В нейронах брюшных органов желудочные пептиды, по-видимому, действуют как нейротрансмиттеры или нейрокринные агенты (Mulvihill, Debas, 2001). Тела этих нейронов находятся в кишечной стенке, обычно в составе подслизистых или миэнтерических сплетений, откуда их отростки тянутся к клеткам слизистой оболочки, гладких мышц, кровеносных сосудов и к другим эндокринным клеткам. Описываемая система брюшных нейронов считается частью вегетативной нервной системы.
Физиологическое действие. Желудочно-кишечные пептиды регулируют подвижность различных отделов желудочно-кишечного тракта, а также секрецию в нем жидкостей и пищеварительных ферментов (см. табл. 15-1). Они обладают также некоторыми тропными эффектами и регулируют обменные процессы и рост тканей желудка и кишечника путем усиления биосинтеза белка, РНК и ДНК, уменьшения катаболизма белков и стимуляции включения аминокислот в клетки (Mulvihill, Debas, 2001). Эти пептиды отличаются сложными и разнообразными взаимодействиями между собой;
они стимулируют или тормозят секрецию друг друга, а также усиливают или подавляют действие друг друга на органы-мишени, входящие в состав пищеварительной системы. В процессе этих сложных взаимодействий обеспечивается оптимальная среда для эффективного переваривания и всасывания питательных веществ. Таким образом, желудочные и кишечные эндокринные клетки сами способны отслеживать изменения в пищеварительном тракте и адекватно отвечать на них. Координированный характер их действия способствует оптимальной ассимиляции поступающих питательных веществ.
Способы транспорта кишечных пептидов. Желудочно-кишечные пептиды доставляются к местам проявления их действия тремя главными путями. Одни пептиды циркулируют в кровяном русле и поступают в ткани-мишени с кровью (эндокринный транспорт), другие высвобождаются в интерстициальную жидкость и действуют на близлежащие клетки (паракринный транспорт), наконец, третьи локализуются внутри нейронов и действуют в качестве нейротрансмиттеров или нейромодуляторов - нейрокринный транспорт (рис. 15-1) (Mulvihill, Debas, 2001). Ряд пептидов транспортируется двумя или тремя способами. Ввиду столь различных механизмов транспорта кишечных пептидов, правильнее называть их регуляторными пептидами, а не гормонами.
Система мозг-кишечник. Установлено, что рассматриваемые пептиды присутствуют не только в специализированных эндокринных клетках желудочно-кишечного тракта, но и в центральной нервной системе (ЦНС). Это открытие послужило основой для формирования концепции церебро-кишечной системы. В ЦНС кишечные пептиды,
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
711
ТАБЛИЦА 15-1. ГОРМОНЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Способ транспорта Основное действие
Эндокри-ный Нейрок-ринный Паракринный
Гастрин + (+) - Секреция желудочной кислоты и пепсина
Холецистокинин + + - Секреция ферментов поджелудочной железы, сокращение желчного пузыря
Секретин + - - Секреция панкреатического бикарбоната
Полипептид, ингибирующий желудочную + - - Усиливает стимулирующее действие глюкозы на секрецию инсулина, ингибирует секрецию желудочной кислоты
секрецию
Вазоактивный интестинальный полипептид - + (+) Расслабляет гладкую мускулатуру, стимулирует секрецию панкреатического бикарбоната
Мотилин + - - Индуцирует подвижность кишечника между эпизодами переваривания пищи
Соматостатин + + + Многочисленные ингибирующие эффекты
Панкреатический полипептид + - (+) Ингибирует секрецию бикарбоната и белка поджелудочной железой
Энкефалины - + (+) Подавляют подвижность кишечника
Субстанция Р - + (+) Стимулирует сокращение гладкой мускулатуры
Гастрин-высвобождаю- - + (+) Стимулирует высвобождение гастрина и холецистокинина
щий пептид
Нейротензин + - (+) Расширяет сосуды
Энтероглюкагон (+) (+) (+) Инкретин, митоген слизистой
Пептид YY + - (+) Ингибирует секрецию бикарбоната и белка поджелудочной железой
НейропептидУ - + - Ингибирует секрецию бикарбоната и белка поджелудочной железой
Пептид, родственный гену кальцитонина - + - Стимулирует секрецию желудочной кислоты и соматостатина
Грелин + - (+) Повышает аппетит, секрецию желудочной кислоты и подвижность желудка
Из: Mulvihill SJ, Debas НТ: In'. Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 604.
( ) - неокончательные данные
ТАБЛИЦА 15-2. РАСПРЕДЕЛЕНИЕ ГОРМОНОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА *
Эндокринная клетка* Локализация Присутствие в кишечных нервах
Гастрин G Полость желудка и двенадцатиперстная кишка Нет
Холецистокинин I Двенадцатиперстная и тощая кишка Да
Секретин S Двенадцатиперстная и тощая кишка Нет
Полипептид, ингибирующий желу- К Тонкий кишечник Нет
дочную секрецию
Вазоактивный интестинальный поли- о, Поджелудочная железа Да
пептид
Мотилин ес2 Тонкий кишечник Нет
Субстанция Р ЕС, Весь желудочно-кишечный тракт Да
Нейротензин N Подвздошная кишка Нет
Соматостатин D Желудок, двенадцатиперстная кишка, поджелудочная железа Да
Энкефалины - Желудок, двенадцатиперстная кишка, желчный пузырь Да
Гастрин-высвобождающий пептид - Желудок, двенадцатиперстная кишка да
Панкреатический полипептид DF Поджелудочная железа Нет
Энтероглюкагон А Поджелудочная железа Нет
Энтероглюкагон L Тонкий кишечник Нет
Пептид YY - Тонкий кишечник, ободочная кишка Нет
Пептид, родственный гену кальцито- - Весь желудочно-кишечный тракт Да
нина
Нейропептид Y - Тонкий кишечник Да
Грелин - Весь желудочно-кишечный тракт, главным образом желудок Неизвестно
Из: Mulvihill SJ, Debas НТ: In-. Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 607.
♦) Обратите внимание, что некоторые пептиды присутствуют как в нервах, так и в эндокринных клетках. ВИП обнаружен только в нервах и, возможно, отсутствует в эндокринных клетках.
+) Эндокринные клетки, содержащие специфический гормон, обозначены буквой.
ЕС - энтерохромаффинная клетка. Клетки, содержащие энкефалины и пептид YY, еще не имеют обозначений.
IXL • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
Паракринный транспорт
Просвет
..вена
Артерия
Мышца
Эндокринный транспорт Просвет
Рис. 15-1. Схематическое изображение стенки тонкого кишечника. Обратите внимание на очень близкое расположение эндокринных клеток и нервов к клеткам слизистой оболочки, кровеносных сосудов и гладкой мускулатуры. Благодаря анатомической близости этих структур местное высвобождение гормонов эндокринными клетками или нервами влияет на секрецию и абсорбцию (клетки слизистой), подвижность (мышцы) и кровоток (кровеносные сосуды). А. Паракринный транспорт - локальное высвобождение посредника вблизи прилегающих клеток-мишеней. Б. Нейрокринный транспорт - высвобождение посредника нервами и его влияние на клетки слизистой, другие эндокринные клетки или гладкие мышцы тонкой кишки и кровеносных сосудов. В. Эндокринный транспорт - высвобождение посредника в кровь и его действие как циркулирующего гормона. (Из: Mulvihill SJ, Debas НТ: In'. Greenspan FS, Baxter JD (eds): Basic and Clinical Endocrinology, 4th ed. Norwalk, C.T. Appleton and Lange, 1994, p 551).
по-видимому, играют важную роль в регуляции различных функций организма, в частности ощущения сытости. Кроме того, нейроны ЦНС взаимодействуют с клетками брюшной нервной системы и оказывают влияние на процессы пищеварения. Многие из этих нейронов обладают пептидэргичес-ким действием. В свою очередь, нейроны брюшной нервной системы осуществляют локальный контроль пищеварения, в том числе процессы всасывания, секреции, подвижности и кровотока. Есть основания полагать, что некоторые труднообъяснимые состояния (например, синдром раздражения кишечника у человека) являются следствием нарушения регуляции функции кишечника брюшной нервной системой и ЦНС.
КОНЦЕПЦИЯ АПУД
Все специализированные клетки, секретирующие пептиды, в том числе эндокринные клетки желудочно-кишечного тракта, имеют целый ряд общих
ультраструктурных и цитохимических характеристик, часть которых отражает способность этих клеток синтезировать и метаболизировать биогенные амины, такие как адреналин, норадреналин, дофамин и серотонин. Из первых букв названий двух таких характеристик (amine precursor uptake and decarboxylation, или накопление и декарбоксилирование предшественников биогенных аминов) был создан акроним APUD (АПУД).
Большинство клеток, обладающих указанными свойствами, находятся в кишечнике и ЦНС (в гипоталамусе и гипофизе), однако, некоторые из них обнаружены также в щитовидной железе (клетки, продуцирующие кальцитонин), паращитовидных железах и плаценте (Mulvihill, Debas, 2001). Несмотря на столь различную локализацию, клетки с описанными характеристиками имеют много общего с точки зрения путей их формирования и функционирования в организме, включая способность продуцировать пептидные гормоны. АПУДома - это опухоль, развивающаяся из АПУД-клеток. Впер-
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы • 713
ТАБЛИЦА 15-3. КЛАССИФИКАЦИЯ АПУДОМ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА И ОСНОВНЫЕ СЕКРЕТИРУЕМЫЕ ИМИ ГОРМОНЫ
Тип опухоли Основные секретируемые гормоны
Инсулинома Феохромоцитома Гастринома ВИ Пома Глюкагонома Соматостатинома Панкреатическая полипеп-тидома Карциноидный синдром Инсулин Адреналин, норадреналин Гастрин Вазоактивный интестинальный полипептид Глюкагон Соматостатин Панкреатический полипептид Серотонин
вые это название было применено к медуллярной карциноме С-клеток щитовидной железы, секретирующей АКТГ (Szijj et al, 1969). В последующем в медицинской и ветеринарной литературе было описано еще несколько разных АПУдом (табл. 15-3). АПУДомы называют по тем эндокринным продуктам, которые они секретируют.
Образующие АПУДому клетки обычно обладают даже более выраженными, характерными для АПУД свойствами, чем исходные клетки. Разные виды нормальных АПУД-клеток легко дифференцировать посредством ультраструктурного анализа их гранул, однако, аналогичный анализ опухолевых клеток далеко не всегда позволяет сделать заключение об их происхождении или судить о природе синтезируемых ими полипептидов. Кроме того, одна опухоль может синтезировать сразу несколько гормонов (Middleton, Watson, 1983).
АПУДомы, секретирующие избыточное количество полипептидов или аминов того же типа, что и клетки, из которых эти опухоли произошли, вызывают «ортоэндокринные» синдромы. Если же опухоль секретирует один или несколько полипептидов, чуждых родительским клеткам, но типичных для АПУД-клеток иных типов, то возникают «параэндокринные» синдромы. В ветеринарии чаще всего приходится сталкиваться с ортоэндок-ринными синдромами, причем в большинстве случаев вызвавшие их АПУДомы представлены инсулиномами, феохромоцитомами и гастриномами. Но несомненно, что по мере того как будут совершенствоваться методы ультраструктурных и иммуноцитохимических исследований на животных, параэндокринные синдромы и опухоли, способные продуцировать разные гормоны, будут выявляться гораздо чаще.
ИНСУЛИНОМА
Секретирующие инсулин опухоли островковых клеток поджелудочной железы являются самыми распространенными АПУДомами у собак, однако, редки у кошек. Опухоли бета-клеток чаще всего встречаются изолированно, хотя могут быть компо
нентом синдрома множественной эндокринной неоплазии (см. гл. 9). Опухоли бета-клеток подробно обсуждаются в гл. 14.
ФЕОХРОМОЦИТОМА
Феохромоцитомы стоят на втором месте по частоте обнаружения у собак, но тоже редко бывают у кошек. Феохромоцитома - это опухоль, которая развивается из хромаффиновых клеток мозгового вещества надпочечников и секретирует катехоламины. Чаще всего она встречается изолированно, но может быть компонентом синдрома множественной эндокринной неоплазии (МЭН). Феохромоцитома и МЭН подробно обсуждаются в гл. 9.
ГАСТРИНОМА:
СИНДРОМ ЗОЛЛИНГЕРА-ЭЛЛИСОНА
Этиология. В 1955 г. Золлингер и Эллисон обнаружили у двух пациентов и описали клиническое состояние, обусловленное гиперсекреторной активностью желудка, множественными желудочными и кишечными язвами и опухолью поджелудочной железы, не затрагивающей бета-клетки. Впоследствии было показано, что такие опухоли продуцируют гастрин (Mulvihill, Debas, 2001), а триада - гипергастринемия, нейроэндокринная опухоль и изъязвление желудка и кишечника - получила название синдром Золлингера-Эллисона (Jensen, Fraker, 1994). Основное действие гастрина состоит в стимуляции секреции желудочной кислоты и роста пристеночных клеток желудка. Гипергастринемия служит причиной усиленной секреции соляной кислоты в желудке, что приводит к образованию язв пищевода, желудка и двенадцатиперстной кишки, нарушает процессы переваривания и всасывания в кишечнике и индуцирует соответствующие клинические симптомы. Первый случай гастриномы у животных, напоминавшей синдром Золлингера-Эллисона, был описан Джоунсом и соавторами в 1976 г. С тех пор в литературе время от времени появляются сообщения о гастриноме у собак и кошек, однако, они довольно редки (Нарре et al, 1980; Drazner, 1981; Middleton, Watson, 1983; Breitschwerdt et al, 1986; English et al, 1988; Eng et al, 1992; Brooks, Watson, 1997; Altschul et al, 1997; Green, Gartrell, 1997).
У человека продуцирующие гастрин опухоли локализованы, главным образом, в поджелудочной железе, проксимальном отделе двенадцатиперстной кишки и полости желудка, хотя их находят и в других местах (Wolfe et al, 1982; Wolfe, Jensen, 1987). Обычно одновременно развивается сразу несколько таких опухолей, они имеют небольшие размеры, отличаются низкой скоростью роста и малигнизаци-ей. Сопутствующая им клиническая симптоматика обусловлена, главным образом, избыточной секрецией гастрина. Некоторые клинические симптомы связаны со злокачественной природой и большим
714 • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
пространственным объемом множественных метастатических опухолей. Метастазы в первую очередь поражают печень, лимфатические узлы и прилегающий сальник. Иногда гастриномы развиваются одновременно с опухолями других эндокринных органов, в таких случаях говорят о синдроме МЭН (см. гл. 9) (Pipeleers-Marichal et al, 1990).
Подобные проявления гастриномы трудно оценить у собак и кошек из-за слишком малого количества сообщений о пораженных ими животных. Тем не менее, среди 24 собак и 4 кошек с синдромом Золлингера-Эллисона, описанных в литературе или наблюдавшихся нами, 21 особь имела опухоль островковых клеток поджелудочной железы, а у четырех были обнаружены множественные панкреатические опухоли. У двух собак опухоль была не в поджелудочной железе, а в регионарных лимфатических узлах; у одной собаки она локализовалась у корня брыжейки (Zerbe, Washabau, 2000; Brooks, Watson, 1997; Green, Gatrell, 1997). В 70% этих случаев имело место метастазировние печени, прилегающих лимфатических узлов, селезенки или брыжейки.
Вопрос о том, какие клетки дают начало гастриномам, остается спорным. Нормальная поджелудочная железа взрослых особей включает четыре типа клеток: А-клетки секретируют глюкагон, В-клетки - инсулин, D-клетки - соматостатин, а F-клетки - панкреатический полипептид. Известно, однако, что у плодов D-клетки помимо соматостатина продуцируют также гастрин. В настоящее время большинство исследователей склоняются к гипотезе, согласно которой функция D-клеток взрослых особей может претерпевать обратное развитие, вследствие чего они начинают секретировать гастрин вместо соматостатина (Krejs, 1998).
Гастриномы могут секретировать и другие гормоны, помимо гастрина, например, инсулин, АКТГ или панкреатический полипептид. Такие опухоли выявлены как у человека, так и у собак и кошек. Описана гастринома собаки, продуцировавшая одновременно гастрин и АКТГ, и гастринома кошки, секретировавшая гастрин, глюкагон и, возможно, холецистокинин (Middleton, Watson, 1983; Feldman, Nelson, 1987). Наличие у человека клинического синдрома, обусловленного избыточной гормональной секрецией того или другого типа клеток в мультигормональной опухоли, еще не означает, что именно эти клетки являются доминирующими в данной опухоли. Точно так же, метастазы мульти-гормональных опухолей необязательно состоят из тех же клеток, активность которых обусловливает наблюдаемую клиническую картину.
Встречаемость. Собаки и кошки с подтвержденными гастриномами были в возрасте от 3 до 12 лет. Средний возраст больных собак составлял около 8 лет. Опухоль, по-видимому, одинаково часто развивается у животных обоего пола и независимо от породы, хотя общее число известных случаев слишком мало, чтобы делать какие-либо окончательные выводы.
ТАБЛИЦА 15-4. ЧАСТОТА КЛИНИЧЕСКИХ СИМПТОМОВ У 24 СОБАК И 3 КОШЕК С ГАСТРИНОМАМИ И СИНДРОМОМ ЗОЛЛИНГЕРА-ЭЛЛИСОНА
Клинический симптом Процент больных животных
Рвота 93
Потеря веса 89
Анорексия 75
Диарея 67
Вялость, депрессия 56
Полидипсия 22
Мелена 22
Лихорадочное состояние 19
Боль в животе 15
Кровавая рвота 15
Кровавый стул 7
Тахикардия 7
Опухоль в брюшной полости 4
Полифагия 4
Стойкие запоры, перемежающиеся с 4
диареей
Клинические симптомы. Почти все клинические симптомы обусловлены избыточной секрецией желудочной кислоты. Чаще всего имеют место рвота, потеря веса, анорексия и диарея (табл. 15-4). Избыточное содержание кислоты в желудке в конечном итоге приводит к образованию язв, которые обычно распространяются и на двенадцатиперстную кишку. Язвы желудка и кишечника были обнаружены во время гастродуоденоскопии, хирургических операций или посмертного вскрытия у 20 (80%) из 25 собак и кошек с гастриномами, причем у четырех животных были прободные язвы (Zerbe, Washabau, 2000; Brooks, Watson, 1997; Altschul et al, Green, Gartell, 1997). Язвы, в свою очередь, служат причиной обычной или кровавой рвоты, мелены, понижения аппетита, потери веса, депрессии и болей в животе. Рефлюкс желудочной кислоты в пищевод может вызвать воспаление и изъязвление его слизистой оболочки, срыгивание пищи, потерю аппетита и снижение веса. Повышенная кислотность содержимого кишечника приводит к диарее, нарушению всасывания и стеаторее, которые могут сопровождаться инактивацией липазы, осаждением желчных солей, нарушением образования хиломикронов и повреждением клеток слизистой кишечника. Кроме этого, гипергастринемия нарушает всасывание воды и электролитов в кишечнике.
Увеличение кислотности в просвете кишечника индуцирует секрецию секретина и холецистокинина. Секретин, в свою очередь, стимулирует высвобождение гастрина из гастриномы, что способствует поддержанию гипергастринемии. Таким образом, образуется цикл, которой закрепляет повышенную кислотность и обусловленную ею патологию.
Физикальное исследование. Результаты физикального исследования частично зависят от длительности заболевания, высокой кислотности, изъязвления и наличия прободной язвы. Выявляемые нарушения у собак и кошек могут быть как отно-
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы • 715
сительно незначительными, так и очень тяжелыми Животные с синдромом Золлингера-Эллисона могут быть летаргическими, худыми до истощения, деги дратированными или находиться в состоянии шока. Слизистые оболочки могут выглядеть бледными из-за анемии вследствие язвенного диатеза. Возможны компенсаторная тахикардия и болезненность живота, выявляемая при пальпации. У одной кошки при пальпации была обнаружена опухоль в брюшной области (Zerbe, Washabau, 2000).
Клиническая патология. У собак и кошек с синдромом Золлингера-Эллисона клинический анализ крови выявляет нейтрофильный лейкоцитоз, гипопротеинемию и регенеративную анемию, которые, по-видимому, вызваны воспалительными процессами в желудочно-кишечном тракте и потерей крови. Нарушения биохимического профиля сыворотки включают гипопротеинемию, гипоальбуминемию, гипокальциемию и небольшое увеличение активности аланинаминотрансферазы и щелочной фосфатазы. Гипокальциемия может быть следствием сопутствующей гипоальбумине-мии или индуцированной гастрином гиперплазии С-клеток щитовидной железы, приводящей к повышению секреции кальция. У собак и кошек, страдающих периодической рвотой, возможно развитие гипокалиемии, гипохлоремии и метаболического алкалоза. Описаны также случаи гипергликемии и гипогликемии неустановленного происхождения; предполагается, что эти расстройства могут быть следствием секреции опухолями других гормонов, таких как АКТГ или инсулин (Zerbe, Washabau, 2000). Результаты анализа мочи обычно дают мало информации. Исследование фекальных масс с использованием окрашивания Суданом выявляет стеаторею, обусловленную накоплением липидов и жирных кислот. Нередко у таких животных имеется дегтсобразный стул, а проба на скрытое кровотечение дает положительный результат.
Диа нос гичсская визуализация. Рентгенологическое исследование брюшной полости обычно дает нормальные результаты. При наличии про-бодног язвы в серозной поверхности оно может выявлять признаки перитонита. Контрастная рентгенография позволяет выявить язвы кишечника и двена щатиперстной кишки, утолщение морщинистых желудочных складок, привратника и/или кишечника а также высокую скорость транспорта бария в кишечнике (Zerbe, Washabau, 2000). При наличии тяжелого сопутствующего воспаления слизисто! пищевода флюороскопия может выявить вторичное увеличение его размеров или аномальную непсристальтическую подвижность. С помощью УЗИ брюшной полости диагностируют утолшение желудочной и кишечном стенок, язвы желудка, панкреатические массы и'или метастазирование. Гастриномы имеют самые разные размеры и бывают микроскопическими (Roche et al, 1982). Отсутствие панкреатических опухолей при УЗИ не исключает наличия гастриномы. Более 90° о проб
Рис. 15-2. Эндоскопическая визуализация кровоточащей язвы (показана стрелкой) в теле желудка собаки с синдромом Золлингера-Эллисона (гастринома).
тканей человеческой гастриномы содержат большое количество рецепторов с высоким сродством к соматостатину. Поэтому использование меченного радиоактивными изотопами аналога соматостатина позволяет успешно визуализировать многие гастриномы, а также выявлять метастазы, существование которых до этого и не предполагалось (Schirmer et al. 1995; Gibril et al, W96). Положительные результаты сканирования позволяют отобрать пациентов, которых можно успешно лечить октреотидом - аналогом соматостатина длительного действия, который ингибирует секрецию гастрина (Ellison et al, 1986). С помощью сцинтиографии с использованием ,ниндий-пснтетреотида гастринома и се метастазы были диагностированы у собаки, и ее лечение октреотидом привело к уменьшению концентрации гастрина в плазме крови (Altschul et al, 1997).
Эндоскопия. Гастродуоденоскопия собак и кошек с синдромом Золлингера-Эллисона позволяет диагностировать тяжелое воспаление и изъязвление слизистой оболочки пищевода, особенно вблизи сердца. Морщинистые складки желудка могут быть утолщены и не спадают даже после вдувания воздуха в его полость. При эндоскопии хорошо заметны гиперемия, эрозия или язвы желудка и двенадцатиперстной кишки (рис. 15-2). Гистологическое исследование биоптатов пищевода, желудка и двенадцатиперстной кишки, полученных во время эндоскопии, выявляет признаки слабого или сильного воспаления, инфильтрацию лимфоцитами, нейтрофилами, плазматическими клетками и/или эозинофилами, а также гипертрофию и фиброз слизистой оболочки желудка и нарушение ее барьерной функции.
Диа1 ноз. Во всех случаях тяжелой желудочно-кишечной симптоматики у собаки или кошки (особенно при рвоте, в том числе кровавой, уменьшении веса тела или мелене) проводят дифференциальную диагностику с целью выявления (или исклю-
716 • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
чения) гастриномы. То же относится к животным, у которых при гастродуоденоскопии были выявлены тяжелые формы язвы желудка или двенадцатиперстной кишки. Вероятно, самым недорогим методом диагностики гастриномы у собак и кошек является УЗИ брюшной полости с целью обнаружения посторонней массы в поджелудочной железе или метастазирования из этого органа в комбинации с последующим хирургическим исследованием железы и окружающих ее структур. Диагноз подтверждается гистологическим и иммуноцитохимическим исследованием ткани, полученной при хирургической операции. Определение концентрации гастрина в сыворотке крови дает дополнительные данные для подтверждения или исключения гастриномы. Его следует проводить до хирургического вмешательства, особенно если УЗИ не выявило опухолевой массы. К сожалению, многие гастрин-секретирую-щие опухоли не превышают 1 см в диаметре, и их невозможно заметить при визуализации стандартными методами. Лапаротомия обычно проводится только в тех случаях, когда возникает подозрение на прободную язву или перитонит, а концентрацию гастрина в сыворотках не определяют просто по причине редкости гастриномы у собак и кошек. В результате большинство животных безосновательно лечат от тяжелого воспалительного заболевания кишечника, эрозии или язв желудка и кишечника ингибиторами секреции желудочной кислоты, протекторами слизистой, антибиотиками и диетой. Многим из этих собак и кошек подобное лечение помогает, и подозрение на гастриному появляется, только если животные резистентны к терапии, направленной на неспецифическое воспаление и язвы желудочно-кишечного тракта, либо если прекращение противоязвенной терапии сопровождается возобновлением прежней клинической симптоматики или рецидивами язвенного поражения желудка и/или кишечника.
Определение концентрации гастрина в сыворотке крови натощак. Обнаружение устойчивой гипергастринемии у кошки или собаки на фоне соответствующей клинической симптоматики служит дальнейшим подтверждением наличия гастриномы. Наиболее надежным способом выявления гипергастринемии является анализ множественных проб крови, полученных натощак в утренние часы. Несмотря на определенные отличия нормальных показателей уровня гастрина, принятых в разных лабораториях, его верхняя граница при определении современными радиоиммунологическими методами и у собак, и у кошек обычно не превышает 100 пг/мл (Altschul et al, 1997; Brooks, Watson. 1997). У собак с синдромом Золлингера-Эллисона концентрация гастрина бывает от 72 до 2780 пг/мл, а у двух кошек она составляла 350 и 1000 пг/мл. У всех, кроме одной, из обследованных на настоящее время собак и у всех кошек с гистологически подтвержденной гастриномой концентрация гастрина в сыворотках, была, по меньшей мере, в 3 раза
ТАБЛИЦА 15-5. НАРУШЕНИЯ, СВЯЗАННЫЕ С ГИПЕРГАСТРИНЕМИЕЙ У ЛЮДЕЙ, СОБАК И КОШЕК
Найдены у собак и кошек Найдены у человека
Гастринома Гастринома
Почечная недостаточность Почечная недостаточность
Закупорка выходного отвер- Закупорка выходного отверс-
стия желудка тия желудка
Ахлоргидрия/гипохлоргид- Ахлоргидрия/гипохлоргидрия
рия Атрофический гастрит
Атрофический гастрит Гиперплазия гастрин-секре-
Расширение желудка/заво- тирующих клеток полости
рот кишок желудка
Заболевание печени Карцинома желудка
Иммунопролиферативная Синдром укороченной тонкой
энтеропатия у басенджей КИШКИ
Антациды Пептическая язва
Антагонисты Н2-рецепторов Феохромоцитома
Ингибиторы протонного Ваготомия
насоса Антациды
Глюкокортикоиды Антагонисты Н2-рецепторов,
ингибиторы протонного
насоса
выше нормы . У одной собаки, которая на протяжении предшествовавшего месяца страдала рвотой и имела хирургически подтвержденную нейроэндокринную опухоль, концентрация гастрина в сыворотке натощак составляла 72 пг/мл по сравнению с нормальной величиной от 10 до 49 пг/мл (Green, Gartell, 1997).
У некоторых людей с подтвержденной гастриномой содержание гастрина в сыворотке может быть в норме (Zimmer et al, 1995). Возможно, такая же ситуация бывает у собак и кошек, особенно на ранних стадиях заболевания, хотя данных об этом нет. Высокая концентрация гастрина натощак подтверждает наличие гастриномы, но не является ее патогномоничным признаком. Гипергастринемия наблюдается при многих других заболеваниях, включая такие, как хроническая недостаточность почечной функции, хронический гастрит, закупорка выходного отверстия желудка, заболевания печени и отсутствие свободной соляной кислоты в желудочном соке (табл. 15-5; Breitschwerdt et al, 1986; Breitschwerdt, 1991; Goldstein et al, 1998). Кроме того, гипергастринемия развивается после введения антагонистов Н2-рецепторов. К счастью, большинство расстройств, приводящих к повышению концентрации гастрина в сыворотке крови, легко дифференцируются от синдрома Золлингера-Эллисона с помощью анализа исходной базы данных и диагностической визуализации.
Пробы на стимуляцию гастрина. Для подтверждения диагноза гастриномы у людей с пограничной концентрацией гастрина натощак и такой же секрецией желудочной кислоты, как при обычной язве двенадцатиперстной кишки, применяют несколько провокационных проб. К их числу относятся пробы с секретином, кальцием, бомбезином и глюкагоном, а также проба с приемом пищи (Wolfe, Jensen, 1987).
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы • 717
Провокационная проба с секретином. Эта проба является самой надежной из перечисленных выше и ей отдается предпочтение при обследовании больных с подозрением на гастриному (Staff et al, 1986). Введение экзогенного секретина значительно сильнее стимулирует секрецию гастрина у людей с гастриномой, чем у здоровых людей (Brady et al, 1987). Кровь берут перед внутривенным струйным введением секретина в дозе 2 ЕД/кг веса тела, а затем через каждые 5 минут в течение получаса после введения. Увеличение концентрации гастрина в сыворотке на 200 пг/мл в течение 15 минут после инъекции служит диагностическим признаком гастриномы (Wolfe, Jensen, 1987). У 80% людей с синдромом Золлингера-Эллисона концентрация гастрина увеличивается через 5-10 минут после введения секретина. У 20% лиц с гастриномой эта проба не дает значимого результата. Для диагностики гастриномы у человека можно определять также концентрацию в крови прогастрина - высокомолекулярного предшественника гастрина (Bardram, 1990).
Опыт применения провокационной пробы с секретином для диагностики гастриномы у собак весьма органичен, а у кошек ее вообще не применяли для этой цели. Согласно имеющимся рекомендациям, собакам и кошкам секретин следует вводить внутривенно в дозе 2 ЕД/кг и определять концентрацию гастрина в пробах, полученных до и через 2, 5, 10, 15 и 30 минут после инъекции (Breitschwerdt et al, 1991). У трех собак с гастриномой концентрация гастрина увеличивалась в 1,4 раза (одна собака) и более чем в 2 раза (две собаки) через 5 ми
нут после введения экзогенного секретина (Zerbe, Washabau, 2000). В отличие от этого, у здоровых собак не указанной породы и у басенджей с имму-нопролиферативной энтеропатией концентрация гастрина медленно снижалась после инъекции секретина (Breitschwerdt et al, 1991).
Провокационная проба с кальцием. Провокационная проба с кальцием является альтернативой пробе с секретином. Как и в предыдущем случае, инфузия кальция стимулирует секрецию гастрина у людей с гастриномой. Однако проба с секретином считается лучше, поскольку она занимает меньше времени, сопровождается меньшим числом побочных эффектов и дает меньше ложноположительных и ложноотрицательных результатов (McGuigan, Wolfe, 1980). Вместе с тем, секретин дороже и не всегда доступен, поэтому проба с кальцием также применяется в диагностике гастриномы.
При проведении провокационной пробы с кальцием его вводят внутривенно струйно на протяжении 1 минуты в дозе 2 мг/кг или непрерывно инфузируют со скоростью 5 мг/кг/час (Zerbe, Washabau, 2000). Пробы крови для анализа отбирают до введения и через 15, 30, 60, 90 и 120 мин после него. Максимальное увеличение уровня гастрина в сыворотках двух собак с гастриномой наблюдали через 60 минут после стимуляции (см. рис. 15-3). В обоих случаях происходило двукратное повышение концентрация гастрина в ответ на стимуляцию кальцием. У одной собаки гастринома была выявлена именно в пробе с кальцием, а не с секретином (см. рис. 15-3). Наиболее информативной для диагностики гастриномы у человека оказалась комби
Рис. 15-3. Увеличение гастрина в плазме крови в ответ на стимуляцию кальцием и секретином у трех собак с гастриномой. А. Обратите внимание на более чем двукратное увеличение концентрации гастрина через 60 минут после инфузии кальция. Б. Обратите внимание на более чем двукратное увеличение концентрации гастрина через несколько минут после стимуляции секретином. Линии с одинаковыми значками показывают изменения у одной и той же собаки. (Из: Zerbe CA., Washabau RJ: Gastrointestinal Endocrine Disease. In: Ettinger SJ, Feldman EC (eds). Textbook of Veterinary Medicine, 4th ed. Philadelphia, WB Saunders Co., 1995), p 1593.)
718 • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
нированная проба с секретином и кальцием (Zerbe, Washabau, 2000). Внутривенная инфузия кальция в дозе 2 мг/кг веса в течение 1 минуты одновременно со струйной инъекцией секретина в дозе 2 ЕД/кг обычно приводит к повышению содержания гастрина в два раза в сыворотке больных с гастриномой.
Тестирование желудочной секреции. У большинства людей, имеющих гастриному, сильно повышена секреция желудочной кислоты. Сбор 15-минутных проб желудочного секрета через оро-гастральный зонд и определение в них желудочной кислоты позволяет выявить ее гиперсекрецию. У здоровых собак базальная продукция желудочной кислоты натощак обычно незначительна. У животных с гастриномой концентрация водородных ионов натощак составляет от 3 до 15 мэкв/час (Нарре etal, 1980). К сожалению, тестирование желудочной секреции недостаточно специфично. Обнаружение избыточной секреции соляной кислоты в желудке отражает не только гипергастринемию любого происхождения (см. табл. 15-5), но и повышенную концентрацию в крови гистамина - еще одного мощного стимулятора функции обкладочных клеток желудочных желез (например, в случае опухоли тучных клеток).
Оценка максимальной секреции соляной кислоты после стимуляции обкладочных клеток бетазо-лом или пентагастрином позволяет дифференцировать гастриному от других источников повышенной кислотности в желудке у пациентов с избыточной базальной продукцией кислоты. Стимуляция максимальной секреции соляной кислоты у здоровой собаки бетаметазолом или пентагастрином вызывает повышение концентрации водородных ионов с 3 до 12 мэкв на протяжении последующих 15 минут (Feldman, Nelson, 1987). У собак с синдромом Золлингера-Эллисона продукция желудочной кислоты и без того близка к максимальной, поэтому стимуляция не вызывает ее дальнейшего повышения или усиливает ее очень слабо.
Лечение. Лечение гастриномы у человека состоит в хирургическом удалении опухоли и подавлении гиперсекреции желудочной кислоты. Для устранения обычного при гастриноме процесса язвообразования в желудке и кишечнике необходимо понизить кислотность (см. ниже), применяя сукралфат (карафат, производства Hoechst-Marion Roussel, США) и мизопростол (цитотек, производства Searle, США). Может оказаться необходимым хирургическое удаление язвы, особенно в случае прободения кишечника.
Хирургическое удаление первичной опухоли. Если метастазы не обнаружены, пациентов с гастриномой обследуют, чтобы выяснить целесообразность резекции опухоли. Коэффициент выживаемости в течение 5 лет после тотального удаления опухоли превышает 90% (Ellison, 1995; Weber et al, 1995; Cadiot et al, 1999). К сожалению, резекция опухоли может не привести к излечению из-за высокой частоты метастазирования к моменту выявле
ния гастриномы (Jensen, Fraker, 1994). Наблюдения на протяжении длительного времени показали, что примерно у 50% пациентов после «полного удаления опухоли» имеют место рецидивы опухолевого роста. До появления агонистов Н2-рецепторов (таких как ранитидин и фамотидин) синдром Золлингера-Эллисона у людей при наличии метастазирования лечили путем тотальной гастрэктомии. После внедрения этих препаратов в клиническую практику наряду с ингибиторами протонного насоса целесообразность хирургического лечения подтвержденной метастазирующей опухоли уже не кажется столь бесспорной, и оно назначается, главным образом, тем пациентам с неоперабельными опухолями, которые не выполняют врачебных предписаний (Landor, 1984; Hirschowitz, 1997). Благодаря тому, что медикаментозная терапия позволяет успешно контролировать гиперсекреторную активность гастриномы, нет смысла оперировать пациентов с неоперабельными новообразованиями. То же можно сказать о собаках и кошках, особенно если учесть, что ко времени первичного обследования 70% животных уже имеют метастазирующую опухоль. Дополнительными аргументами против хирургического вмешательства, помимо злокачественной природы самих опухолей, служат возможность их эктопической локализации, тяжесть клинической симптоматики во время поступления животного в клинику, простота и доступность лечения ингибиторами Н2-рецепторов и протонного насоса.
С другой стороны, имеются не менее убедительные аргументы в пользу хирургического лечения собак и кошек с подозрением на гастриному. Мы отдаем предпочтение хирургической операции в сочетании с медикаментозной терапией. У людей до операции очень трудно точно локализовать опухоль и прогнозировать возможность ее резекции, даже с помощью таких совершенных методов, как УЗИ, компьютерная и магнитно-резонансная томография и ядерная сцинтиография (Landor, 1984; Wolfe, Jensen, 1987; Norton, 1988). Хирургическая операция, возможно, является самым простым и эффективным способом диагностики опухоли, с помощью которого можно одновременно вылечить тех немногих животных, которые имеют изолированную неметастазирующую гастриному (Wolfe et al, 1982; Eng et al, 1992). Но даже при наличии метастазирования уменьшение объема опухоли может способствовать успеху медикаментозного лечения. Не следует подвергать эвтаназии собак и кошек с гастриномой только на том основании, что опухоль носит метастазирующий характер. Известно, что при условии адекватной медикаментозной терапии люди с синдромом Золлингера-Эллисона и метастазирующей опухолью могут жить много лет (Landor, 1984; Weber et al, 1995).
Хирургические методы дают также возможность удалять «глубокие» или прободные язвы. Вероятность язвенной перфорации желудочной или кишечной стенки и последующего развития пери-
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы • 719
ТАБЛИЦА 15-6. ЧАСТОТА СЕРЬЕЗНЫХ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ, ВЫЯВЛЕННЫХ ПРИ ХИРУРГИЧЕСКОЙ ОПЕРАЦИИ ИЛИ ПОСМЕРТНОМ ВСКРЫТИИ У 21 СОБАКИ И 2 КОШЕК С ГАСТРИНОМАМИ И КЛИНИЧЕСКИМИ СИМПТОМАМИ СИНДРОМА ЗОЛЛИНГЕРА-ЭЛЛИСОНА
Патология Число животных Процент животных
Локализация опухоли
Поджелудочная железа 21/22 95
Левая доля 1/16 6
Тело 6/16 38
Правая доля 10/16 63
Печень 13/21 62
Лимфатические узлы 6/21 29
Прочие 5/21 24
Язвы желудка и кишечника 22/23 96
Пищевод 4/21 19
Желудок 10/22 45
Двенадцатиперстная кишка 14/19 74
Тощая кишка 1/18 6
Прободная язва 5/21 24
Гипертрофия желудка 14/19 74
Гиперплазия С-клеток щитовид- 4/9 44
ной железы
Гиперплазия коры надпочечни- 2/9 22
КОВ
Карцинома фолликулярных кле- 1/9 11
ток щитовидной железы
Из: Zerbe CA, Washabau RJ: In-. Ettinger SJ, Feldman EC (eds). Textbook of Veterinary Medicine, 4th ed.. Philadelphia, WB Saunders Co, 2000, p 1505, и каталога клинических случаев Ветеринарной школы Калифорнийского Университета в Дейвисе.
тонита вполне реальна. Язвы желудка и кишечника были обнаружены у 20 (80%) из 25 обследованных собак и кошек с гастриномой, а у 5 из них были прободные язвы (табл. 15-6) (Zerbe, Washabau, 2000). Тяжелобольным животным до принятия решения о хирургическом лечении показано стабилизационное внутривенное вливание жидкости, введение антибиотиков и ингибиторов секреции желудочной кислоты. Однако при подозрении на прободение язвы и перитонит необходимо срочное хирургическое вмешательство.
У 21 из 24 собак и у всех обследованных кошек с гастриномой опухоль развивалась из островковых клеток поджелудочной железы. Множественные панкреатические новообразования имелись у 4 животных. У трех собак во время хирургической операции не были найдены опухоли в поджелудочной железе, но у двух из них они были обнаружены в регионарных лимфатических узлах, а у одной - в корне брыжейки (Brooks, Watson, 1997; Creen, Gatrell, 1997). Ввиду малого размера гастрином и большой вероятности метастазирования во время хирургической операции необходимо обследовать не только поджелудочную железу, но также регионарные лимфатические узлы, печень и перипан-креатическую часть брыжейки; при обнаружении любой аномалии пораженные ткани удаляют или
берут пробы на биопсию. Секретирующие гастрин опухоли чаще всего локализуются в правой доле (у 10 животных) и в теле (у 6 животных) поджелудочной железы. Имеется только одно сообщение об обнаружении опухоли в левой доле железы. Поэтому если не удается установить местонахождение специфического опухолевого узла, то показана резекция правой доли.
Повышенная кислотность в желудке. В настоящее время медикаментозная терапия направлена на подавление избыточной секреции желудочной кислоты антагонистами гистаминовых Н2-рецеп-торов и ингибитором Н+-К+ АТФазы омепразолом. Рецепторы обкладочных клеток желез желудка связывают гастрин, гистамин (Н2-рецепторы) и ацетилхолин. Для максимальной секреции соляной кислоты обкладочными клетками необходима индукция рецепторов всех трех типов соответствующими молекулами. Связывание Н2-рецепторов с их антагонистами блокирует проявление стимулирующего действия гастрина на секрецию соляной кислоты, поскольку все три связывающих рецепторных участка заняты антагонистом и не могут связаться с соответствующим лигандом. Ни гастринома, ни концентрация гастрина в сыворотке крови при этом не изменяются (т.е. сохранятся гипергастринемия). Терапия антагонистами Н2-рецепторов приводит к уменьшению избыточной секреции желудочной кислоты, ослаблению симптомов заболевания и заживлению язв у большинства людей с гастриномой (McCarthy, 1980). Сходное улучшение клинической симптоматики было установлено у нескольких собак и одной кошки с гастриномами (Drazner, 1981; Zerbe, Washabau, 2000). К числу антагонистов Н2-рецепторов гистамина относятся циметидин (та-гамет, производства SmithKline-Beecham, США) для приема внутрь в начальной дозе 10 мг/кг через каждые 6-8 часов; ранитидин (зантак, производства Glaxo Wellcome, США) для приема внутрь в начальной дозе 2,2 мг/кг каждые 12 часов и фа-мотидин (пепцид, производства Merck, США) для приема внутрь в начальной дозе 0,5-1,0 мг/кг один или два раза в сутки. Рекомендуемые дозы перечисленных препаратов следует подбирать индивидуально и периодически корректировать, поскольку их количество, необходимое для подавления продукции желудочной кислоты, может быть самым разным, и у людей со временем возрастает (Jensen, 1984). Больным с гастриномой обычно назначают дозы выше, чем для контроля секреции кислоты в отсутствие опухоли.
Омепразол (прилосек, производства Astra Zenecka, США), более эффективно, чем антагонисты Н2-рецепторов подавляет секрецию желудочной кислоты и в настоящее время является препаратом выбора для достижения ингибирующего эффекта у людей с гастриномами (Jensen, Fraker, 1994; Mulvihill, Debas, 2001). Механизм действия омепразола состоит в подавлении активности Н+-К+ АТФазы в обкладочных клетках желез желудка на
720 • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
заключительной стадии секреции кислоты; иными словами, он действует как ингибитор протонового насоса (Howden, 1991). Омепразол подавляет действие любых стимуляторов секреции желудочной кислоты, тогда как ингибиторы Н2-рецепторов блокируют только действие гистамина. Омепразол является мощным ингибитором секреции желудочной кислоты с большой продолжительностью действия (Lairson et al, 1983) и эффективно улучшает клиническую симптоматику, обусловленную гастриномой у собак (Brooks, Watson, 1997). Начальная доза препарата для собак составляет 0,7-1,0 мг/кг ежесуточно.
Длительно действующий аналог соматостатина октреотид ингибирует высвобождение гастрина, секрецию желудочной кислоты и диарею у людей с гастриномами (Kvols et al, 1987; Maton, 1989; Mulvihill, Debas, 2001). Его иногда назначают пациентам, у которых антагонисты Н2-рецепторов гистамина или омепразол оказались неэффективными. Известен случай применения октреотида в сочетании с фамотидином, сукралфатом и омепразолом для лечения гастриномы у собаки на протяжении 10 месяцев (Lothrop et al, 1989). В другом случае собаке с метастазирующей гастриномой октреотид, фамотидин, сукралфат и омепразол вводили в течение 14 месяцев (Altschul et al, 1997). Доза октреотида составляет от 5 до 20 мкг, вводимых подкожно каждые 8 часов.
Патология, В 25 из 28 известных случаев синдрома Золлингера-Эллисона у собак и кошек имелись первичные опухоли поджелудочной железы, большинство которых локализовалось в теле железы или в ее правой доле (см. табл. 15-6; Zerbe, Washabau, 2000). У четырех животных были обнаружены множественные панкреатические опухоли. Во время хирургической операции у трех собак опухоль поджелудочной железы не была обнаружена, но у двух из них она имелась в регионарных лимфатических узлах, а у третьей в корне брыжейки (Brooks, Watson, 1997; Green, Gatrell, 1997). Результаты вскрытия этих собак не были опубликованы. У 70% обследованных животных имелась метастазирующая опухоль с поражением печени, прилегающих лимфатических узлов, селезенки или брыжейки. Гистологическое исследование выявило организацию опухолевых клеток в форме пластов, тяжей или мелких долек, перемежающихся с фиброзными волокнами или инкапуслированных ими (Нарре et al, 1980; Middleton, Watson, 1983). Одновременно были обнаружены патологические изменения в других системах и органах, возможно, также связанные с гипергастринемией и избыточной секрецией желудочной кислоты (табл. 15-6).
Прогноз. Гастриномы у собак и кошек - это злокачественные опухоли, и долгосрочный прогноз неблагоприятен. У 70% животных на момент диагностики гастриномы уже имело место метастазирование (Zerbe, Washabau, 2000). Примерно треть собак и кошек с этими опухолями погибла или была
эвтаназирована из-за неэффективности терапии, а посмертное вскрытие этих животных подтвердило наличие гастриномы. Хирургическое и/или медикаментозное лечение животных с гастриномами обеспечивало их выживание на протяжении периода от 1 недели до более 2 лет; продолжительность жизни большинства из них после установления диагноза не превышала 8 месяцев (Zerbe, 1992). Правда, в последние годы прогноз заболевания улучшился благодаря появлению лекарственных средств, понижающих кислотность в желудке (таких как фамотидин и омепразол) или предотвращающих развитие язв, либо способствующих их заживлению (например, сукралфат и мизопростол).
ГЛЮКАГОНОМА (ПОВЕРХНОСТНЫЙ НЕКРОЛИТИЧЕСКИЙ ДЕРМАТИТ)
Глюкагономы развиваются из А-клеток островков поджелудочной железы и представляют собой либо самостоятельную патологию, либо компонент МЭН. У человека до 25% глюкагоном имеют доброкачественную природу и локализованы в поджелудочной железе (Mulvihill, Debas, 2001). В остальных случаях к моменту диагностики глюкагономы уже имеется метастазирование, чаще всего в печень, лимфатические узлы, надпочечники и позвонки. Иммуногистохимическое исследование опухолей панкреатических островков собак выявило присутствие глюкагона (Hawkins et al, 1987; O’Brien et al, 1987; Minkus et al, 1997). У всех животных были одиночные глюкагономы (Gross et al, 1990; Torres et al, 1997a; Allenspach et al, 2000). У кошек опухоли данного типа пока не обнаружены.
У человека избыточная секреция глюкагона вызывает расстройство, характеризующееся некро-литической миграторной эритемой, хейлозом, сахарным диабетом, нормоцитозной нормохромной анемией, тромбозом вен, потерей веса и нервнопсихиатрическими симптомами (Krejs, 1998). Первичными проявлениями гиперсекреции глюкагона служат высыпания и некролитическая мигратор-ная эритема. Последняя начинается с появления на коже красных пятен, из которых затем образуются пузыри; они лопаются, затвердевают, а после заживления на их месте возникают зоны пигментации. Участки поражения имеют тенденцию сливаться, захватывая большую площадь кожи, и являются источниками вторичной инфекции.
Сходный синдром - поверхностный некролити-ческий дерматит был описан у 7 собак с секретирующей глюкагон опухолью островков поджелудочной железы и более чем у 40 собак с запущенным заболеванием печени (Walton et al, 1986; Gross et al, 1990, 1993; Bond et al, 1995; Nyland et al, 1996; Torers et al, 1997a; Allenspach et al, 2000). Имеется также описание поверхностного некролитического дерматита у кошки с аденокарциномой поджелудочной железы (Patal et al, 1996). Поверхностный некротический дерматит обычно развивается у со
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы • 721
бак среднего и старшего возраста и характеризуется язвенным эритематозным поражением подушечек лап, кожно-слизистой каймы, половой сферы и выступающих частей тела, таких как локоть и предплюсна (Scott et al, 2001). Подушечки нередко покрыты толстым роговым слоем и растрескиваются. Обычны вторичные инфекции. Гистологическое исследование проб кожи с пораженных участков выявляет признаки эпидермального паракератоти-ческого гиперкератоза и тяжелого внутри- и межклеточного отека с последующим образованием расщелин и везикул под роговым слоем. Гистологическая картина поражений при поверхностном некролитическом дерматите у животных весьма сходна с картиной некролитической миграторной эритемы у человека.
Поражения кожи обусловлены дегенерацией ке-ратиноцитов, которая приводит к ламинарной отечности верхнего слоя эпидермиса и его разрушению (Scott et al, 2001). Патогенетические механизмы некролитической миграторной эритемы у человека и поверхностного некролитического дерматита у животных неизвестны, хотя предполагается, что определенную роль в их возникновении играет клеточное голодание и ряд других нарушений пищевого баланса. По мнению некоторых авторов, известную роль в патогенезе поражений кожи при некролитической миграторной эритеме играют гиперглюкагонемия, гипоаминоацидемия и низкие концентрации незаменимых жирных кислот и цинка (Wood et al, 1983; Krejs, 1998). Гиперглюкагонемия может оказывать непосредственное, но скорее косвенное действие на состояние кожного покрова. Как известно, глюкагон участвует в катаболизме аминокислот и образовании из них глюкозы, поэтому усиление биосинтеза этого гормона может приводить к уменьшению концентрации аминокислот, которое весьма характерно для описываемого синдрома. Снижение концентрации аминокислот сопровождается уменьшением содержания белков в эпидермисе и, в конечном итоге, приводит к некролизу кератиноцитов. Наряду с этим, повышение уровня глюкагона стимулирует биосинтез арахидоновой кислоты в кератиноцитах, усиленное высвобождение которой служит причиной воспаления и некроза (Walton et al, 1986; Gross et al, 1993). У собак с продуцирующими глюкагон опухолями зарегистрирована гипераминоацидемия (Torres et al, 1997а; Allenspach et al, 2000); она наблюдалась также у восьми собак с поверхностным некролитическим дерматитом (Gross et al, 1993). У шести из этих 8 собак состояние пораженной кожи значительно улучшалось после добавления в корм яичного желтка, служившего концентрированным источником белков (Gross et al, 1993). Хирургическое удаление глюкагономы поджелудочной железы у одной собаки привело к исчезновению глюкагоне-мии, гипоаминоацидемии и поражений кожи (Torres etal, 1997а).
Помимо описанных расстройств у собак с глюкагономами развиваются также гипергликемия или
явный сахарный диабет в сочетании со слабо выраженными кишечными расстройствами (Walton et al, 1986). Диабет является следствием диабетогенного действия глюкагона, который избирательно действует на печень, активируя глюконеогенез и гликогенолиз (Cryer, Polonsky, 1998). Диарея возникает как результат действия глюкагона на секреторную функцию слизистой тонкого кишечника (уменьшение всасывающей способности и усиление секреции воды и электролитов) (Krejs et al, 1998).
Наличие секретирующей глюкагон нейроэндокринной опухоли поджелудочной железы подтверждается повышенной концентрацией иммунореактивного глюкагона в плазме крови. У человека она обычно возрастает в 5-10 раз по сравнению с нормой, в частности, до 300-1000 пг/мл (Misra, Baruh, 1983). У пяти собак с гистологически и иммуногистохимически подтвержденной глюкагон-проду-цирующей нейроэндокринной опухолью концентрация этого гормона в плазме крови была в 1,6-18 раз выше ее максимального уровня у здоровых животных (Allenspach et al, 2000). В отличие от этого, у большинства собак с поверхностным некролитическим дерматитом на фоне запущенного заболевания печени сохранялась нормальная концентрация глюкагона в плазме крови (Nyland et al, 1996). УЗИ брюшной полости может идентифицировать панкреатические опухоли или метастазирование в регионарные лимфатические узлы, печень и парапанк-реатические ткани. В то же время, необнаружение посторонних тканевых масс в поджелудочной железе при ультразвуковом исследовании не исключает возможности секретирующей глюкагон опухоли в этом органе. У собак с поверхностным некролитическим дерматитом, вызванным прогрессирующим заболеванием печени, с помощью УЗИ была выявлена четко выраженная ретикулярная, или «сотовая» структура печени. Такой картины у собак с продуцирующими глюкагон новообразованиями не наблюдали (Nyland et al, 1996).
Методом выбора для лечения глюкагономы является хирургическая резекция опухоли, которая может приводить к выздоровлению. Неоперабельные опухоли у человека лечат стрептозоцином, дакарбазином и аналогами соматостатина (Maton, 1989; Nightingale et al, 1999; Mulvihill, Debas, 2001). В отсутствие лечения глюкагономы больные обычно погибают после резкого ухудшения общего состояния, слабости и эпизодов тромбоэмболии. У одной собаки через 45 дней после хирургического удаления метастазирующей глюкагономы поджелудочной железы исчезли гиперглюкагонемия, гипоаминоацидемия и поражения кожи, однако, кожные поражения снова развились спустя 9 месяцев, и животное пришлось подвергнуть эвтаназии (Torres et al, 1997а). Три собаки с панкреатическими глюкагономами умерли вскоре после операции из-за связанных с панкреатитом осложнений (Gross et al, 1990; Bond et al, 1995). Еще три собаки с такими же опухолями были эвтаназированы через соответс
722 • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
твенно 2,4 и 6 недель после установления диагноза в связи с быстрым ухудшением состояния (Miller et al, 1991; Torres et al, 1997b; Allenspach et al, 2000). Паллиативное лечение поверхностного некролити-ческого дерматита, вызванного прогрессирующим заболеванием печени, включает заместительное введение аминокислот внутривенно или перорально (например, введение в корм куриных яиц, применении Prescription Diet а/d, Hill’s Pet Products (производства Topeka, США) и аминозина (производства Abbott Laboratories, США), подкожное введение аналога соматостатина октреотида (сан-достатина, производства Novartis Pharmaceuticals, США), введение в корм незаменимых жирных кислот, применение топических астрингентов, гидротерапию и системную антибактериальную терапию для устранения вторичных микробных инфекций (Byrne, 1999). Прогноз для собак с поверхностным некролитическим дерматитом, обусловленным запущенным заболеванием печени, неблагоприятный (Gross et al, 1993; Byrne, 1999). Средняя продолжительность жизни животных после установления диагноза составляет 5 месяцев, но многие из них погибают через 1-2 месяца.
ВИПома: СИНДРОМ ВЕРНЕРА-МОРРИСОНА
ВИПома была впервые описана у человека Вернером и Моррисоном в 1958 году, но до сих пор не встречалась ни у собак, ни у кошек. Клинические симптомы этого заболевания обусловлены кишечной секрецией жидкости и электролитов под воздействием повышенной концентрации вазоактивного интестинального полипептида (ВИП) в плазме крови, источником которого обычно является опухоль островковых клеток поджелудочной железы (Smith et al, 1998; Soga, Yakuwa, 1998). ВИПома одновременно секретирует ВИП и пептид гисти-дин-метионин (ПГМ), что приводит к высокой концентрации ПГМ в плазме крови (Bloom et al., 1983). ПГМ оказывает такое же стимулирующее действие на слизистую кишечника, как ВИП, и подобно ВИП влияет на клиническую симптоматику заболевания.
ВИПома сопровождается обильным водянистым поносом, значительными потерями калия и бикарбоната с калом, гипокалиемией и слабой секрецией желудочной кислоты или ее отсутствием. Потеря больших количеств бикарбоната с калом может приводить к тяжелому метаболическому ацидозу (Smith et al, 1998; Soga, Yakuwa, 1998). У многих пациентов развивается гиперкальциемия, возможно, вследствие секреции опухолью соединения, подобного паратиреоидному гормону. Гипокалиемия служит причиной нарушения толерантности к глюкозе и изменения чувствительности к инсулину. В среднем от начала появления симптомов заболевания до установления диагноза проходит 3 года (интервал от 2 месяцев до 4 лет) (Krejs, 1987).
Подозрение на ВИПому возникает в случаях тяжелой водянистой диареи и гипокалиемии. Диагноз
подтверждается радиоиммунологическим определением концентрации ВИП в сыворотке крови натощак и гистологическим исследованием опухоли поджелудочной железы, не затрагивающей бета-клетки, но содержащей большое количество ВИП (Krejs, 1987).
В настоящее время ВИПому удаляют хирургическим путем. Прогноз благоприятный, ремиссия достигается почти у 50% больных при условии, что опухоль не слишком разрослась и не метастазирует (Smith et al, 1998; Soga, Yakuwa, 1998). Метастазы в первую очередь проникают в печень и прилегающие лимфатические узлы, ко времени установления диагноза они имеются примерно у трети всех больных. Пациентам с неоперабельными или метастазирующими карциномами назначают стрептозоцин в комбинации с фторурацилом (Nguyen et al, 1999). Описано также применение длительно действующего аналога соматостатина октреотида для лечения больных, не отвечающих на другие виды терапии (Maton et al, 1985; Maton, 1989). Соматостатин понижает концентрацию ВИП в плазме крови больных с ВИПомами (Ruskone et al, 1982). К числу других лекарственных средств, которые иногда оказываются эффективными при ВИПоме, относятся кортикостероиды и индометацин (Deveney, Way, 1983).
СОМАТОСТАТИНОМА
Соматостатинома представляет собой редкую опухоль поджелудочной железы у человека, но пока не встречалась у кошек и собак, хотя иммуноцитохимический анализ выявляет присутствие соматостатина в опухолях островковых клеток собак (Hawkins et al, 1987; O’Brien et al, 1987; Minkus et al, 1997). Данный синдром является следствием секреции соматостатина опухолью островковых D-клеток поджелудочной железы, которая в большинстве случаев имеет злокачественную природу и метастазирует в печень (Mulvihill, Debas, 2001). Клиническая симптоматика заболевания включает нарушение толерантности к глюкозе (вплоть до сахарного диабета слабой тяжести), желчнокаменную болезнь, диарею, стеаторею, гипохлоргидрию и потерю веса (Krejs, 1998). У некоторых пациентов отмечаются гипогликемия, приливы крови и клинические признаки гиперкортицизма (Wright et al, 1980; Penman et al, 1980). Соматостатиномы нередко содержат субпопуляции других эндокринных клеток, что, отчасти, объясняет вариабельность клинической симптоматики у пациентов с этими опухолями. Разнообразие клинических симптомов и общий для многих заболеваний характер основных проявлений соматостатиномы (сахарный диабет, желчнокаменная болезнь, диарея, стеаторея) сильно затрудняют ее прижизненную идентификацию.
Диагностика соматостатином основывается на выявлении соответствующей клинической симптоматики, повышенной концентрации соматостатина в сыворотке и результатах гистологического исследования биоптата или ткани удаленной опу
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы • 723
холи. Для постановки окончательного диагноза необходима иммуногистохимическая характеристика опухоли. Соматостатиномы поджелудочной железы характеризуются медленным ростом и метастазированием в печень и прилегающие лимфатические узлы, которое нередко уже имеется ко времени установления диагноза (Mirsa, Baruh, 1983). Рекомендуется хирургическое удаление опухоли, хотя иногда предпринимаются попытки химиотерапии стрептозоцином.
Соматостатиномы были обнаружены также в желудочно-кишечном тракте (Marcial et al, 1983). Такие опухоли гистологически и клинически отличаются от соматостатином поджелудочной железы. Очень часто они вызывают непроходимость кишечника или желчных протоков с соответствующими клиническими проявлениями. Желудочно-кишечные соматостатиномы редко секретируют соматостатин, что объясняет отсутствие ряда характерных для описываемого синдрома клинических проявлений (Marcial et al, 1983).
ОПУХОЛЬ, ПРОДУЦИРУЮЩАЯ
панкреатический полипептид
Большие количества панкреатического полипептида (ПП) были обнаружены при самых разнообразных опухолях поджелудочной железы, включая гастриномы, ВИПомы, глюкагономы и инсулиномы (Adrian et al, 1986). ПП является вторым по частоте встречаемости гормоном, выявляемым иммуноцитохимическими методами в эндокринных опухолях поджелудочной железы у собак (Zerbe et al, 1989). Этот полипептид используется в качестве маркера при диагностике эндокринных панкреатических опухолей у человека и для мониторинга ответа на терапию при условии его исходно высокой концентрации (Adrian et al, 1986; Krejs, 1998). Определение концентрации ПП в плазме крови используется также для выявления пациентов с повышенным риском развития опухолей, в семейном анамнезе которых имеется множественная эндокринная неоплазия (Tomita et al, 1983).
Опубликовано несколько сообщений, описывающих пациентов с опухолями, секретирующими исключительно ПП (Tomita et al, 1983; Strodel et al, 1984). У лиц с повышенной концентрацией ПП не было признаков, характерных для клинического синдрома. Наиболее частыми симптомами были водянистый стул, боль в животе, желудочно-кишечные кровотечения, уменьшение веса тела и желтуха. Окончательный диагноз устанавливался на основании результатов определения концентрации ПП в плазме крови и иммуногистохимического подтверждения продукции ПП опухолевыми клетками. Увеличение концентрации ПП в крови само по себе не обязательно свидетельствует о наличии продуцирующей его опухоли. Целый ряд других патологических состояний, таких как некоторые воспалительные расстройства, язва две
надцатиперстной кишки, сахарный диабет, недостаточность экзокринной функции поджелудочной железы и нарушение функции почек, также сопровождаются повышением уровня ПП в крови (Oberg et al, 1981; Whitehead, 1980). Для предоперационной идентификации опухоли используются УЗИ и провокационные пробы, как стимулирующие с толбутамидом, пентагастрином и секретином, так и ингибирующие с применением атропина (Strodel et al, 1984). При наличии опухоли рекомендуется ее хирургическое удаление. Основными местами метастазирования служат печень и прилегающие лимфатические узлы.
Несмотря на обнаружение ПП в опухолях островковых клеток собак иммуногистохимическими методами (O’Brien et al, 1987), у них, как и у кошек, до сих пор неизвестны опухоли, секретирующие только этот полипептид. Повышение концентрации ПП в плазме крови наблюдали у одной собаки с эндокринной опухолью поджелудочной железы, в которой методом иммуноцитохимического окрашивания было установлено присутствие нескольких гормонов, в том числе ПП (Zerbe et al, 1989). Клиническое состояние этой собаки позволяло предполагать гастриному (хроническая рвота, гипертрофический гастрит, язва двенадцатиперстной кишки), и у нее были повышены базальные концентрации гастрина, инсулина и ПП в сыворотке крови. Однако провокационные пробы с секретином и кальцием (см. стр. 717) не подтвердили наличие гастриномы, и иммуногистохимическое окрашивание опухолевой ткани на гастрин дало отрицательные результаты. Поскольку концентрация ПП в плазме крови была очень высокой (637000 пг/мл при норме менее 155 пг/мл), а ткани опухоли и метастазов давали сильную положительную реакцию при иммуногистохимическом окрашивании на ПП, авторы предположили, что повышенная продукция ПП могла быть причиной хронической рвоты и развития язв желудка и кишечника у этой собаки (Zerbe et al, 1989).
КАРЦИНОИДЫ И КАРЦИНОИДНЫЙ СИНДРОМ
Карциноидные опухоли возникают из энтерохромаффинных клеток желудочно-кишечного тракта и встречаются на всем его протяжении от желудочно-пищеводного соустья до анального отверстия. У человека вне желудочно-кишечного тракта карциноидные опухоли находили в бронхах и яичниках (Mulvihill, Debas, 2001). Карциноиды подразделяются на переднекишечные (в бронхах и желудке), среднекишечные (в толстом и тонком кишечнике) и заднекишечные (в прямой кишке). Переднекишечные карциноиды секретируют 5-гидрокситрип-тофан, среднекишечные - 5-гидрокситриптамин (серотонин), а в заднекишечных опухолях специфические метаболиты не образуются.
Карциноидный синдром обусловлен систематическим выделением соединений, синтезируемых
724 • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
карциноидными опухолями. Основным медиатором, высвобождающимся из карциноидов, является серотонин, однако, другие медиаторы, такие как брадикинин, простагландины, гистамин и субстанция Р, также играют роль в развитии карциноидного синдрома (Roberts, Oates, 1985). Вещества, секретируемые карциноидами в кровяное русло, метаболизируются в печени, поэтому наличие карциноидного синдрома означает либо первичное нарушение их поступления в системную циркуляцию, либо нарушение функции печени в результате ее метастазирования (Misra, Baruh, 1983; Mulvihill, Debas, 2001).
Наиболее частые клинические симптомы карциноидного синдрома у человека включают пароксизмальные приливы крови к голове и шее и диарею. Последняя, как полагают, обусловлена секрецией серотонина, тогда как приливы крови, по-видимому, вызываются высвобождением тахикининов из опухолевых клеток. Дополнительными клиническими признаками заболевания служат спазм брюшной стенки, бронхоспазм, гипервентиляция и сердечное заболевание. Возможно также развитие стеноза и недостаточности трехстворчатого клапана (Misra, Baruh, 1983; Roberts, Oates, 1985).
У собак карциноидные опухоли были обнаружены в кишечнике, легких и печени (Patniak et al, 1980, 1981; Sykes, Cooper, 1982), а у кошек - в желудке и кишечном тракте. И у тех, и у других опухоли развиваются, в основном, у старых особей - все имеющиеся сообщения касаются животных не моложе 9 лет. Описанные у собак и кошек карциноидные опухоли не приводили к развитию «карциноидного синдрома». Вместо этого, имевшиеся клинические симптомы свидетельствовали о наличии массированного поражения, вызывавшего непроходимость отдельных участков желудочно-кишечного тракта, или метастазирующего рака (табл. 15-7). Метастазы у собак и кошек были обнаружены в регионарных лимфатических узлах, брыжейке, стенке брюшины, легких, поджелудочной железе и печени, а также инвазировали окружающие ткани (Patniak et al, 1980 и 1981).
Диагностика карциноидного синдрома у человека основывается на клинических признаках, выявлении большого количества продуктов превращения серотонина, особенно 5-гидроксииндолуксусной кислоты (ГИУК) в моче, и на результатах гистологического исследования опухолевой ткани, полученной при биопсии или после хирургического удаления новообразования. В большинстве лабораторий за нормальный показатель экскреции ГИУК в человеческой моче принята величина ниже 10 мг/24 часа, тогда как при карциноидном синдроме она бывает от 10 до 600 мг/24 часа (Roberts, Oates, 1985). Результаты измерения концентраций серотонина, гистамина, простагландинов и брадикинина в плазме крови имеют меньшую диагностическую ценность, чем оценка экскреции метаболитов серотонина с мочой (Mulvihill, Debas, 2001).
ТАБЛИЦА 15-7. ЧАСТОТА КЛИНИЧЕСКИХ СИМПТОМОВ У 20 СОБАК И ОДНОЙ КОШКИ С КАРЦИОНИДНЫМИ ОПУХОЛЯМИ
Клинический симптом Процент животных
Потеря веса 52
Анорексия 38
Диарея 38
Асцит 29
Желтуха 24
Полиурия, полидипсия 24
Кишечное кровотечение 10
Видимая ректальная опухоль 10
Рвота 5
Рекомендуется, по возможности, удалять локальные карциноидные опухоли. Эти рекомендации остаются в силе и при наличии метастазирования, особенно в тех случаях, когда имеются клинические проявления карциноида (Que et al, 1995; Krishnamurthy et al, 1996). Наиболее эффективным паллиативным средством для облегчения клинического течения карциноидного синдрома у людей является длительно действующий аналог соматостатина октреотид (Kvols et al, 1986). Успешность терапии этим препаратом достигает 80%. В случае быстро растущей опухоли или индуцированного карциноидом порока сердечных клапанов назначается цитотоксическая химиотерапия. Чаще всего для этой цели используется стрептозоцин в комбинации с флуороурацилом (Roberts, Oates, 1985). Коэффициент выживаемости в течение 5 лет для больных с метастазами составляет 20%. При поражении только регионарных лимфатических сосудов этот показатель достигает 65%, а при локально инвазивном характере опухоли - 95% (Shebani, 1999). Смерть обычно наступает в результате сердечной недостаточности, чрезмерной потери электролитов вследствие диареи или из-за истощения.
ЛИТЕРАТУРА
Adrian ТЕ, et al: Secretion of pancreatic polypeptide in patients with pancreatic endocrine tumors. N Engl J Med 315:287, 1986.
Allenspach K, et al: Glucagon-producing neuroendocrine tumour associated with hypoaminoacidemia and skin lesions. J Sm Anim Pract 41:402, 2000.
Altschul M, et al: Evaluation of somatostatin analogues for the detection and treatment of gastrinoma in a dog. J Sm Anim Pract 38:286, 1997.
Bardram L: Progastrin in serum from Zollinger-Ellison patients. Gastroenterology 98:1420, 1990.
Bloom SR, et al: Diarrhea in VIPoma patients associated with cosecretion of a second active peptide (peptide histidine isoleucine) explained by a single coding gene. Lancet 2:1163, 1983.
Bond R, et al: Metabolic epidermal necrosis in two dogs with different underlying diseases. Vet Rec 136:466, 1995.
Brady CE, et al: Secretin provocation in normal and duodenal ulcer subjects: Is the gastrin rise in Zollinger-Ellison syndrome paradoxic or exaggeration? Dig Dis Sci 32:232, 1987.
Breitschwerdt EB, et al: Hypergastrinemia in canine gastrointestinal disease. J Am Anim Hosp Assoc 22:585, 1986.
Breitschwerdt EB, et al: Gastric acid secretion in Basenji dogs with immuno-proliferative enteropathy. J Vet Intern Med 5:34, 1991.
Brooks D, Watson GL: Omeprazole in a dog with gastrinoma. J Vet Intern Med 11:379, 1997.
Byrne KP: Metabolic epidermal necrosis-hepatocutaneous syndrome. Vet Clin N Amer (Sm Anim Pract) 29:1337, 1999.
Cadiot G, et al: Prognostic factors in patients with Zollinger-Ellison syndrome and multiple endocrine neoplasia type 1. Gastroenterology 116:286, 1999.
ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
• 725
Cryer РЕ, Polonsky KS: Glucose homeostasis and hypoglycemia. In Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 939.
Deveney CW, Way LW: Regulatory peptides of the gut. In Greenspan FS, For-sham PH (eds): Basic and Clinical Endocrinology. Los Altos, C A, Lange Medical Publications, 1983, p 479.
Drazner FH: Canine gastrinoma: A condition analogous to the ZollingerEllison syndrome in man. Calif Vet 11:6, 1981.
Ellison EC: Forty-year appraisal of gastrinoma: Back to the future. Ann Surg 222:511, 1995.
Ellison EC, et al: Characterization of the in vivo and in vitro inhibition of gastrin secretion from gastrinoma by a somatostatin analogue (SMS 201-995). Am J Med 81:56, 1986.
Eng J, et al: Cat gastrinoma and the sequence of cat gastrins. Reg Peptides 37:9, 1992.
English RV, et al: Zollinger-Ellison syndrome and myelofibrosis in a dog. JAVMA 192:1430, 1988.
Feldman EC, Nelson RW: Canine and Feline Endocrinology and Reproduction. Philadelphia, WB Saunders Co, 1987, p 375.
Gibril F, et al: Somatostatin receptor scintigraphy: Its sensitivity compared with that of other imaging methods in detecting primary and metastatic gastrinoma. Ann Intern Med 125:26, 1996.
Goldstein RE, et al: Gastrin concentrations in plasma of cats with chronic renal failure. J Am Vet Med Assoc 213:826, 1998.
Gorden P, et al: Somatostatin and somatostatin analogue (SMS 201-995) in treatment of hormone-secreting tumors of the pituitary and gastrointestinal tract and non-neoplastic diseases of the gut. Ann Intern Med 110:35, 1989.
Green RA, Gartrell CL: Gastrinoma: A retrospective study of four cases (1985-1995). J Am Anim Hosp Assoc 33:524, 1997.
Gross TL, et al: Glucagon-producing pancreatic endocrine tumors in two dogs with superficial necrolytic dermatitis. JAVMA 197:1619, 1990.
Gross TL, et al: Superficial necrolytic dermatitis (necrolytic migratory erythema) in dogs. Vet Pathol 30:75, 1993.
Happe RP, et al: Zollinger-Ellison syndrome in three dogs. Vet Pathol 17:177, 1980.
Hawkins KL, et al: Immunocytochemistry of normal pancreatic islets and spontaneous islet cell tumors in dogs. Vet Pathol 24:170, 1987.
Hirschowitz Bl: Zollinger-Ellison syndrome: pathogenesis, diagnosis, and management. Am J Gastroenterol 92(4 suppl):44S, 1997.
Howden CW: Clinical pharmacology of omeprazole. Clin Pharmacokinet 20:38, 1991.
Jensen RT: Basis for failure of cimetidine in patients with Zollinger-Ellison syndrome. Dig Dis Sci 29:363, 1984.
Jensen RT, Fraker DL: Zollinger-Ellison syndrome: Advances in treatment of gastric hypersecretion and the gastrinoma. J Am Med Assoc 271:1429, 1994.
Krejs GJ: VIPoma syndrome. Am J Med 82(Suppl 5B):37, 1987.
Krejs GJ: Non-insulin-secreting tumors of the gastroenteropancreatic system. /n Wilson JD, Foster DW, Kronenberg HM, Larsen PR (eds): Williams Textbook of Endocrinology, 9th ed. Philadelphia, WB Saunders Co, 1998, p 1663.
Krishnamurthy SC, et al: Primary carcinoid tumor of the liver: Report of four resected cases including one with gastrin production. J Surg Oncol 62:218, 1996
Kvols LK, et al: Treatment of the malignant carcinoid syndrome. Evaluation of a long-acting somatostatin analogue. N Engl J Med 315:663, 1986.
Kvols LK, et al: Treatment of metastatic islet cell carcinoma with somatostatin analogue (SMS 201-995). Ann Intern Med 107:162, 1987.
Landor JH: Control of the Zollinger-Ellison syndrome by excision of primary and metastatic tumor. Am J Surg 147:406, 1984.
Larrson H, et al: Inhibition of gastric acid secretion by omeprazole in the dog and rat. N Engl J Med 85:900, 1983.
Lothrop CD, et al: Medical treatment of neuroendocrine tumors of the gastroenteropancreatic system with somatostatin. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1021.
Marcial MA, et al: Ampullary somatostatinoma: Psammomatous variant of gastrointestinal carcinoid tumor - An immunohistochemical and ultrastruc-tural study. Report of a case and review of the literature. Am J Clin Pathol 80:755, 1983.
Maton PN, et al: Effect of a long-acting somatostatin analogue (SMS 201 -995) in a patient with pancreatic cholera. N Engl J Med 312:17, 1985.
McCarthy DM: The place of surgery in the Zollinger-Ellison syndrome. N Engl J Med 302:1344, 1980.
McGuigan JE, Wolfe MM: Secretin injection test in the diagnosis of gastrinoma. Gastroenterology 79:1324, 1980.
Middleton DJ, Watson AD: Duodenal ulceration associated with gastrin- secreting pancreatic tumor in a cat. MIM, 183:461, 1983.
Miller WH, et al: Necrolytic migratory erythema in a dog with a glucagon-secreting endocrine tumor. Vet Dermatol 2:179, 1991.
Minkus G, et al: Canine neuroendocrine tumors of the pancreas: A study using image analysis techniques for the discrimination of metastatic versus nonmetastatic tumors. Vet Pathol 34:138, 1997.
Misra P, Baruh S: Diagnostic and therapeutic applications of gastrointestinal hormones. In Essman WB (ed): Hormonal Actions in Non-Endocrine Systems. New York, Spectrum Publications, 1983, p 63.
Mulvihill SJ, Debas HT: Regulatory peptides of the gut. In Greenspan FS, Gardner DG (eds): Basic and Clinical Endocrinology, 6th ed. New York, Lange Medical Books/McGraw-Hill, 2001, p 603.
Nguyen HN, et al: Long-term survival after diagnosis of hepatic metastatic VIPoma: report of two cases with disparate courses and review of therapeutic options. Dig Dis Sci 44:1148, 1999.
Nightingale KJ, et al: Glucagonoma syndrome: survival 24 years following diagnosis. Dig Surg 16:68, 1999.
Norton JA: Gastrinoma: advances in localization and treatment. Surg Oncol Clin N Am 7:845, 1998.
Nyland TG, et al: Hepatic ultrasonographic and pathologic findings in dogs with canine superficial necrolytic dermatitis. Vet Radiol Ultra 37:200, 1996.
Oberg K, et al: Update on pancreatic polypeptide as a specific marker for endocrine tumors of the pancreas and gut. Acta Med Scand 210:145, 1981.
O’Brien TD, et al: Canine pancreatic endocrine tumors: Immunohistochemical analysis of hormone content and amyloid. Vet Pathol 24:308, 1987.
Patal A, et al: A case of metabolic epidermal necrosis in a cat. Vet Dermatol 7:221, 1996.
Patniak AK, et al: Canine intestinal adenocarcinoma and carcinoid. Vet Pathol 17:149, 1980.
Patniak AK, et al: Canine hepatic carcinoids. Vet Pathol 18:445, 1981.
Penman E, et al: Molecular forms of somatostatin in normal subjects and in patients with pancreatic somatostatinoma. Clin Endocrinol (Oxf) 12:611, 1980.
Pipeleers-Marichal M, et al: Gastrinomas in the duodenums of patients with multiple endocrine neoplasia type 1 and the Zollinger-Ellison syndrome. N Engl J Med 322:723, 1990.
Que FG, et al: Hepatic resection for metastatic neuroendocrine carcinomas. Am J Surg 169:36, 1995.
Roberts LJ, Oates JA: Disorders of vasodilator hormones: The carcinoid syndrome and mastocytosis. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 7th ed. Philadelphia, WB Saunders Co, 1985, p 1363.
Roche A, et al: Pancreatic venous sampling and arteriography in localizing insulinomas and gastrinomas: Procedure and results in 55 cases. Radiology 145:621, 1982.
Ruskone A, et al: Effect of somatostatin on diarrhea and on small intestinal water and electrolyte transport in a patient with pancreatic cholera. Dig Dis Sci 27:459, 1982.
Schirmer WJ, et al: Indium-lll-pentetreotide scanning versus conventional imaging techniques for the localization of gastrinoma. Surgery 118:1105, 1995.
Scott DW, Miller WH, Griffin CE (eds): Muller & Kirk’s Small Animal Dermatology, 6th ed. Philadelphia, WB Saunders Co, 2001, p 780.
Shebani KO: Prognosis and survival in patients with gastrointestinal tract carcinoid tumors. Ann Surg 229:815, 1999.
Staff JI, et al: Prospective assessment of provocative gastrin tests in 81 consecutive patients with Zollinger-Ellison syndrome (ZES) [abstract! Gastroenterology 90:1637, 1986.
Smith SL, et al: Vasoactive intestinal polypeptide secreting islet cell tumors: A 15-year experience and review of the literature. Surgery 124:1050, 1998.
Soga J, Yakuwa Y: Vipoma/diarrheogenic syndrome: A statistical evaluation of 241 reported cases. J Exp Clin Cancer Res 17:389, 1998.
Strodel WE, et al: Pancreatic polypeptide-producing tumors. Arch Surg 119:508, 1984.
Sykes GP, Cooper BJ: Canine intestinal carcinoids. Vet Pathol 19:120, 1982.
Tomita T, et al: Pancreatic polypeptide-secreting islet cell tumors. A study of three cases. Am J Pathol 113:134, 1983.
Torres SMF, et al: Resolution of superficial necrolytic dermatitis following excision of a glucagon-secreting pancreatic neoplasm in a dog. J Am Anim Hosp Assoc 33:313, 1997a.
Torres S, et al: Superficial necrolytic dermatitis and a pancreatic endocrine tumour in a dog. J Sm Anim Pract 38:246, 1997b.
Walton DK, et al: Ulcerative dermatosis associated with diabetes mellitus in the dog: A report of four cases. JAAHA 22:79, 1986.
Weber HC, et al: Determinants of metastatic rate and survival in patients with Zollinger-Ellison syndrome: A prospective long-term study. Gastroenterology 108:1637, 1995.
Whitehead R: The APUD system - An update. Pathology 12:333, 1980.
Wolfe MM, et al: Extrapancreatic, extraintestinal gastrinoma: Effective treatment by surgery. N Engl J Med 306:1533, 1982.
Wolfe MM, Jensen RT: Zollinger-Ellison syndrome. Current concepts in diagnosis and management. N Engl J Med 317:1200, 1987.
11b • ГАСТРИНОМА, ГЛЮКАГОНОМА И ДРУГИЕ АПУДомы
Wood SM, et al: Glucagonoma syndrome, /n Lefebore PJ (ed): Glucagon II. Hand Book of Experimental Pharmacology, Vol e>6/ll. Stuttgart, Springer-Verlag, 1983, p 411.
Wright J, et al: Pancreatic somatostatinoma presenting with hypoglycemia. Clin Endocrinol (Oxf) 12:603, 1980.
Zerbe CA: Islet cell tumors secreting insulin, pancreatic polypeptide, gastrin, or glucagon, /n Kirk RW, Bonagura GD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders Co, 1992, p 368.
Zerbe CA, et al: Pancreatic polypeptide and insulin-secreting tumor in a dog with duodenal ulcers and hypertrophic gastritis. J Vet Intern Med 3:178, 1989.
Zerbe CA, Washabau RJ: Gastrointestinal endocrine disease. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 5th ed. Philadelphia, WB Saunders Co, 2000, p 1500.
Zimmer T, et al: A duodenal gastrinoma in a patient with diarrhea and normal serum gastrin concentrations. N Engl J Med 333:634, 1995.
Часть V
№1№Я
ПАРАЩИТОВИДНЫЕ ЖЕЛЕЗЫ
Глава 16
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ГИПЕРКАЛЬЦИЕМИЯ
ВВЕДЕНИЕ......................729
ЭТИОЛОГИЯ.....................730
ПАТОФИЗИОЛОГИЯ................730
Система обратной связи кальций-паратиреоидный гормон.........730
Тяжелая гиперкальциемия, резорбция костей и почки......731
Мочевые камни и инфекции мочевого тракта...............732
Избыток и недостаток витамина Д.732
Влияние гиперкальциемии на почки и минерализация мягких тканей.733
Быстрый обмен ПТГ.............733
Кальцитонин...................733
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПТГ
В СЫВОРОТКЕ КРОВИ...........734
История разработки............734
Системы определения ПТГ.......734
Клиническое применение........734
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ
ИОНИЗИРОВАННОГО КАЛЬЦИЯ
В СЫВОРОТКЕ КРОВИ...........735
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ВИТАМИНА Д....................736
ОПРЕДЕЛЕНИЕ ПЕПТИДА, РОДСТВЕННОГО
ПАРАТИРЕОИДНОМУ ГОРМОНУ.....736
Общие сведения................736
Системы определения пептида, родственного паратиреоидному гормону.......................737
Клиническое применение..........737
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
ГИПЕРКАЛЬЦИЕМИИ.............738
Первичный гиперпаратиреоз.....738
Гиперкальциемия при злокачественном росте.........738
Гипервитаминоз Д и интоксикация, вызванная родентицидами.......742
Г ипокортицизм................744
Хроническая почечная недостаточность...............744
Острая почечная недостаточность.746
Алиментарный вторичный гиперпаратиреоз...............746
Септическое заболевание костей, сепсис, шистосомоз и системные микозы ...747
Иммобилизационный остеопороз/ опухоли, метастазирующие в кости.747 Гемоконцентрация, инфузия бикарбоната натрия и переливание плазмы.....747
Гипотермия, задержка плода и эндометрит..................747
Возраст.......................748
Лабораторные ошибки...........748
ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
(ПГПТ) У СОБАК
ВСТРЕЧАЕМОСТЬ.................748
Возраст.......................748
Порода........................748
Наследственные заболевания....748
АНАМНЕЗ: КЛИНИЧЕСКИЕ СИМПТОМЫ.749
Общие сведения..................749
Почечные: почки, мочевой пузырь, мочеиспускательный канал......749
Апатия, депрессия и пониженная активность....................750
Слабость и мышечное истощение.750
Потеря аппетита...............751
Дрожь, подергивание мышц и судороги...............751
Другие (редкие) симптомы......751
Заключение....................752
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ......752
Общий осмотр..................752
Частые нарушения..............752
Офтальмологические расстройства.... 752 Пальпируемые
паратиреоидные опухоли......752
Важность тщательного физикального исследования.....752
КЛИНИЧЕСКАЯ ПАТОЛОГИЯ.........753
Гемограмма....................753
Биохимический профиль сыворотки...753
Анализ мочи...................757
Анализ газового состава крови.757
ЭЛЕКТРОКАРДИОГРАФИЧЕСКОЕ
ИССЛЕДОВАНИЕ................758
РЕНТГЕНОГРАФИЧЕСКОЕ
ИССЛЕДОВАНИЕ................758
Общие сведения................758
Рентгенография грудной клетки.758
Рентгенография брюшной полости
и скелета...................758
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ...759
Шейная область................759
Брюшная полость...............760
ОПРЕДЕЛЕНИЕ ПТГ, ПрПТГ
И ВИТАМИНА Д (КАЛЬЦИТРИОЛА) ...761
РАДИОИЗОТОПНОЕ СКАНИРОВАНИЕ ...762 ИЗБИРАТЕЛЬНЫЙ АНАЛИЗ ПРОБ
ВЕНОЗНОЙ КРОВИ..............762
МЕТОДЫ ДИАГНОСТИКИ
ГИПЕРКАЛЬЦИЕМИИ.............762
Общие сведения................762
Анамнестический анализ
и физикальное исследование..762
Исходная база данных..........765
Оценка состояния лимфатических узлов и костного мозга..............766
Специальные анализы: ПТГ, ПрПТГ и кальцитриол.................767
Операции на шее
в сопоставлении с химиотерапией (поисковой терапией)........767
ОСТРАЯ МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
ГИПЕРКАЛЬЦИЕМИИ...............768
Первичный гиперпаратиреоз
в сопоставлении с другими заболеваниями...............768
Показания.....................769
Жидкосная терапия.............770
Терапия диуретиками (фуросемид)....770
Г люкокортикоиды...............770
Бифосфонаты....................771
Кальцитонин....................772
Пликамицин (митрамицин)........772
Этилендиаминтетрауксусная кислота
ОДТА)........................772
Бикарбонат.....................772
Диализ.........................773
Агонисты рецепторов кальция....773
Заключение.....................773
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПЕРВИЧНОГО
ГИПЕРПАРАТИРЕОЗА.............773
Число пораженных желез.........773
Единичная аденома, гиперпластический узел или карцинома.............773
Множественное увеличение паращитовидных желез...........774
Рецидивы первичного гиперпаратиреоза...............774
Отсутствие опухоли паращитовидных желез при хирургическом исследовании...................774
НОВЫЕ МЕТОДЫ ТЕРАПИИ ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА У СОБАК.......775
Чрескожная обработка этанолом под контролем ультразвука..........775
Чрескожное тепловое облучение под контролем ультразвука......775
ЛЕЧЕНИЕ ГИПОКАЛЬЦИЕМИИ ПОСЛЕ
УСТРАНЕНИЯ ГИПЕРПАРАТИРЕОЗА ..778
Общие сведения.................778
Предоперационная концентрация кальция в сыворотке крови ниже 14 мг/100 мл..............779
Предоперационная концентрация кальция в сыворотке крови выше 14 мг/100 мл..............780
Резистентность к витамину Д/время до проявления эффекта..........780
ПАТОЛОГИЯ......................781
Субъективность интерпретации гистологических данных.........781
Одиночные паратиреоидные опухоли .781
Паратиреоидная ткань в средостении. 783
Наследственный неонатальный первичный гиперпаратиреоз......783
Гистологическая картина паращитовидных желез у животных разных пород...................783
ПРОГНОЗ.........................783
ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ У КОШЕК ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
ГИПЕРКАЛЬЦИЕМИИ У КОШЕК....784
ИДИОПАТИЧЕСКАЯ ГИПЕРКАЛЬЦИЕМИЯ
У КОШЕК....................784
ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
У КОШЕК....................785
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 729
Список сокращений
АДГ - аитидиуретический гормон
AM - азот мочевины
цАМФ - циклический аденозинмонофосфат
ГГЗР - гуморальная гиперкальциемия вследствие злокачественного роста
ИЛ-1 - интерлейкин-1
ИРМ - иммунорадиометрический метод
МЭН - множественная эндокринная неоплазия
ПГТГ - первичный гиперпаратиреоз
ПрПТГ - пептид, родственный паратиреоидному гормону
ПТГ - паратиреоидный гормон
РИА - радиоиммунологический анализ
СКФ - скорость клубочковой фильтрации
ТРФ - трансформирующий фактор ФНО - фактор некроза опухолей ХПН - хроническая почечная недостаточность
ЩФС - щелочная фосфатаза в сыворотке крови
ЭДТА - этилендиаминтетрауксусная кислота
ГИПЕРКАЛЬЦИЕМИЯ
ВВЕДЕНИЕ
Кальций участвует в самых разных жизненно важных внутриклеточных и внеклеточных процессах. Он необходим для осуществления различных ферментативных реакций, транспорта веществ через клеточные мембраны и стабилизации мембран, он играет важную роль в процессах свертывания крови, нервного проведения, нейромышечной передачи, мышечного сокращения, секреции гормонов и формирования костей, в регуляции тонуса гладкой мускулатуры, обмена гликогена в печени, роста и деления клеток (Rosol et al, 2000). Это практически универсальный ионный мессенджер, он проводит поступающие на клеточную поверхность сигналы внутрь клетки (Rasmussen, 1909). Кальций, присутствующий во внеклеточной жидкости, участвует в регуляции функции клеток в различных органах, в том числе в паращитовидных железах, почках и С-клетках щитовидной железы (Brown et al, 1995).
Концентрация ионизированного кальция (физиологически «активного» кальция) в сыворотке крови в норме поддерживается в узких пределах благодаря активности паратиреоидного гормона (ПТГ), который регулирует резорбцию костной ткани, экскрецию кальция через почки и обмен витамина Д (табл. 16-1). ПТГ представляет собой одноцепочечный полипептид, состоящий из 84 аминокислотных остатков, который синтезируется, депонируется и секретируется главными клетками (паратиреоци-тами) четырех паращитовидных, или паратиреоидных желез. Его секреция регулируется концентрацией кальция в сыворотке: высокая концентрация кальция ингибирует секрецию ПТГ, а низкая стимулирует ее (Aurbach et al, 1985а, Brown et al, 1999). Известна аминокислотная последовательность ПТГ человека, собаки, крупного рогатого скота, свиньи, крысы, кошки и кур. Результаты оценки иммунореактивности свидетельствуют о сходстве аминоконцевой последовательности молекул ПТГ большинства видов млекопитающих (Toribio et al, 2002). Установлено, что именно эта часть молекулы связывается с рецепторами ПТГ, локализованными на клеточной поверхности. Карбоксильный конец молекулы, по-видимому, служит только как
проводник ПТГ по внутриклеточному секреторному пути (Orloff, Stewart, 1995). Синтетический 1-34 N-концевой фрагмент ПТГ обладает биологической активностью, но она полностью теряется при минимальной модификации его структуры, особенно при замещении двух первых аминокислотных остатков (Marx, 2000). Действие ПТГ на минеральный обмен осуществляется через его рецепторы 1 типа в органах-мишенях. Связывание ПТГ с рецепторами позволяет регулировать прохождение больших количеств кальция через почки, кости и кишечник (рис. 16-1).
Пептид, родственный паратиреоидному гормону (ПрПТГ), является отдаленным гомологом ПТГ, но не считается истинным гормоном. Он образуется в самых разных тканях и обладает множественным действием как на плод, так и на взрослый организм. Однако он играет центральную роль в патогенезе гуморальной гиперкальциемии при злокачественном росте и служит в качестве «маркера опухолей». После открытия ПрПТГ в начале 1980-х годов его определяют у пациентов с гиперкальциемией при подозрении на рак (Philbrick et al, 1996).
ТАБЛИЦА 16-1. ДИАПАЗОН НОРМАЛЬНЫХ КОНЦЕНТРАЦИЙ ОБЩЕГО И ИОНИЗИРОВАННОГО КАЛЬЦИЯ, ПТГ, ПрПТГ И КАЛЬЦИТРИОЛА В СЫВОРОТКЕ КРОВИ СОБАК И КОШЕК*
Собаки Кошки
Общий кальций (мг/100 мл) 9,0-11,7 8,0-10,5
(ммоль/л) 2,2-3,9 2,0-2,6
Ионизированный кальций (мг/100 мл) 4,6-5,6 4,5-5,5
(ммоль/л) 1,12-1,42 1,1-1,4
Паратиреоидный гормон (пмоль/л) 2-13 0-4
Пептид, родственный паратиреоидному гормону (ПрПТГ) (пмоль/л) <2 <2
1,25-дигидроксивитамин Д (кальцитриол) (пг/мл) Взрослые 20-50 * 20-40*
В возрасте 10-12 недель 60-120* 20-80*
*) Из: Rosol et al, 2001.
730 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Внеклеточный ионизированный кальций
Кость
Рецептор ПТГ
Аутокринно-паракринный механизм
Кровь и другие внеклеточные жидкости
Рецептор кальция
Хрящ и клетки-мишени ПрПТГ во многих других тканях
Рецептор ПТГ
Гис. 16-1. Паратиреоидная система. В левой части рисунка представлен биосинтез паратиреоидного гормона (ПТГ) и пептида, родственного паратиреоидному гормону (ПрПТГ), а в правой части - места приложения их действия. Оба гормона действуют через одни и те же рецепторы (называемые также рецепторами 1 типа). Отрицательная обратная свя1ь с 1,25-дигидроксивитамином Д не показана. Из: Marx SJ: N Engl J Me. 343:1683,2000.
Паратиреоидная клетка
Эндокринный механизм
Рецептор кальция
ПрПТГ
1,25(ОН)2-вита-мин Д
Просвет двенадцатиперстной кишки
Почечный каналец
ЭТИОЛОГИЯ
Главным нарушением при первичном гиперпаратиреозе (ПГПТ) является избыточный синтез и секреция ПТГ аномальными, автономно функционирующими «главными» ^летками паращитовидных желез. Причиной избыточной гормональной продукции обычно бывает одиночная аденома, однако у собак и кошек описаны также аденоматозная гиперплазия одной или более паращитовидных желез и паратиреоидные карциномы. Другие формы гиперпаратиреоза (например, почечный вторичный или алиментарный вторичный гиперпаратиреоз) обычно являются следствием нарушений гомеостаза кальция или фосфора, вызванных неэндокринными расстройствами. Такие расстройства косвенно влияют на паращитовидные железы, вызывая их диффузную гиперплазию (см. раздел «Дифферен
циальная диагностика гиперкальциемии», стр. 738). В зависимости от причины вторичного заболевания концентрация кальция в сыворотке крови может быть низкой, нормальной или повышенной. Первичный гиперпаратиреоз практически всегда сопровождается гиперкальциемиеи, показателями которой являются высокие концентрации общего и или ионизированного кальция в сыворотке крови.
ПАТОФИЗИОЛОГИЯ
Система обратной связи кальций-паратиреоидный гормон
При первичном гиперпаратиреозе нарушается нормальный контроль гомеостаза кальция по механизму отрицательной обратной связи; при этом усиливается секреция II ГГ, либо автономно, либо
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 731
в результате индуцированного изменения на той или иной ее стадии. Автономная секреция ПТГ не подавляется при перфузии паращитовидных желез повышенным количеством кальция. В отличие от этого, при вторичном гиперпаратиреозе увеличение концентрации кальция нормально ингибирует секреторную активность паращитовидных желез.
Тяжелая гиперкальциемия, резобция костей и почки
Кости. Процесс, приводящий к тяжелой гиперкальциемии, начинается с усиления костной резорбции в результате активации остеокластов в структурах скелета (Attie, 1989). Активация этих клеток ПТГ или ПрПТГ лежит в основе практически всех случаев выраженной гиперкальциемии. Избыточное всасывание кальция из желудочно-кишечного тракта не является важной причиной гиперкальциемии, однако вносит свой вклад в ее развитие при интоксикации витамином Д. Гиперкальциемия возникает в тех случаях, когда поступление кальция во внеклеточную жидкость (независимо от его источника) превосходит функциональные возможности механизмов, поддерживающих нормальный уровень кальция в крови. Один из этих механизмов состоит в подавлении секреции ПТГ; он не действует, если причиной гиперкальциемии является автономная секреция ПТГ. В случае гиперкальциемии, обусловленной злокачественным ростом, секреция ПТГ подавлена, а гуморальным фактором, активирующим остеокласты, является автономно секретируемый ПрПТГ. Как указывалось выше, биологическая активность ПрПТГ весьма сходна с активностью ПТГ (Sleeboom, Bijvoet, 1982; Harinck et al, 1987). В условиях усиленной костной резорбции защита от гиперкальциемии обеспечивается, главным образом, почками (Bilezikian, 1992а; Hruska, Teitelbaum, 1995).
В процессе рассасывания костной ткани осте-оцитами и остеокластами из нее выводятся минералы, и костная ткань замещается незрелой фиброзной соединительной тканью. У собак с фиброзной остеодистрофией происходит генерализованное поражение костей, которое особенно заметно в отдельных частях скелета, например, в губчатых костях черепа (Capen, Martin, 1983). Исследование биоптатов гребешка подвздошной кости почти у всех больных с первичным гиперпаратиреозом выявляет гистоморфометрические признаки воздействия избыточного количества ПТГ (Arnaud, Kolb, 1991; Hruska, Teitelbaum, 1995). К числу таких признаков относятся увеличение поверхности костной резорбции и числа остеокластов, усиление осте-оцитарного остеолиза и фиброза костного мозга. Гистоморфометрические изменения костной ткани у собак с первичным гиперпаратиреозом, в основном, такие же, как у человека (в частности, имеет место параллельное увеличение активности остеобластов и остеокластов). Повышение интенсив
ности формирования костной ткани у этих собак находит отражение в усилении скорости аппозиции минерального вещества и увеличении меченой тетрациклином поверхности формирующихся костей (Meuten et al, 1983а; Weir et al, 1986).
Почки. При нормальной функции почек и эндокринной системы любое повышение концентрации кальция в сыворотке компенсируется усилением его экскреции с мочой. Этот процесс подавляется избытком ПТГ, который и служит причиной первичного гиперпаратиреоза. Тяжелая гиперкальциемия (определяемая как концентрация кальция в сыворотке крови выше 14 мг/100 мл у человека и выше 15 мг/100 мл у собак) является следствием активности гуморальных факторов (ПТГ или ПрПТГ), которые индуцируют опосредуемую через остеокласты костную резорбцию, а также стимулируют всасывание кальция в желудочно-кишечном тракте и его резорбцию в почечных канальцах (Mundy, 1988; Hruska, Teitelbaum, 1995). Эти процессы снижают способность почек экскретировать повышенное количество фильтруемого кальция. Поэтому животные с избыточной продукцией ПТГ лишены первой линии защиты от гиперкальциемии.
При гиперкальциемии нарушаются также механизмы всасывания натрия и воды в почках, что приводит к полиурии вследствие приобретенной неспособности отвечать на антидиуретический гормон (АДГ, вазопрессин). Это состояние представляет собой обратимую форму нефрогенного несахарного диабета. При повышении концентрации кальция снижается содержание циклического аденозинмонофосфата (цАМФ) в клетках почечных канальцев либо в результате изменения рецепторов АДГ, либо путем инактивации аденилатциклазы -фермента, необходимого для образования внутриклеточного цАМФ. У человека развивающаяся при этом полирурия не компенсируется соответствующим увеличением потребления жидкости из-за индуцированной гиперкальциемией анорексии или рвоты. У собак и кошек с гиперкальциемией также имеют место полиурия и полидипсия. Хотя у собак гиперкальциемия может вызывать «потерю аппетита», анорексия обычно не развивается и животные не испытывают недостатка воды. У большинства таких собак полиурия и полидипсия выражены довольно слабо. Однако у некоторых особей удельный вес мочи не превышает 1,007, поэтому им условно ставится диагноз «тяжелая» полиурия.
Уменьшение объема внеклеточной жидкости и пониженная скорость клубочковой фильтрации (СКФ) в результате дегидратации могут вызвать дальнейшее увеличение концентрации кальция в крови (Bilezikian, 1991). Гиперкальциемия изменяет СКФ посредством (1) уменьшения объема внеклеточной жидкости вследствие ее потери, (2) изменения проницаемости клубочковых капилляров и/или (3) устойчивого сужения сосудов, которое может привести к ишемическому поражению почек в результате непосредственного токсического дейс
732 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
твия избытка кальция на клетки почечных канальцев. Кроме того, происходит минерализация ткани, начиная с базальных мембран восходящего отдела петли Генле, дистальных извитых канальцев и собирательных протоков. Минерализация приводит к повреждению базальных мембран и затрудняет репарацию почечных канальцев. На уровне органелл происходит минерализация митоходрий в эпителиальных клетках почечных канальцев, что может служить причиной нарушения клеточной функции, гибели клеток и слущивания минерализованных клеточных остатков в просвет почечных канальцев. Мочевые цилиндры, состоящие из мертвых клеток и их остатков, препятствуют прохождению мочи через поврежденные нефроны.
На ранних стадиях гиперпаратиреоза, когда тяжесть гиперкальциемии еще невелика, кальций выводится с мочой в относительно небольших количествах. Действие ПТГ на уровне почек усиливает его резорбцию в почечных канальцах. При концентрации кальция в крови выше 12-14 мг/100 мл почечные канальцы не в силах справиться с его реабсорбцией и тогда вступает в действие адаптивный механизм почек, осуществляющий коррекцию уровня кальция в условиях избыточной продукции ПТГ. Однако возникающая в результате этого гиперкальциурия недостаточна для нормализации уровня кальция или предотвращения развития нефрокальциноза.
Нефрокальциноз может быть легким и обратимым или протекать как тяжелое прогрессирующее расстройство и приводить к устойчивому поражению почек и уремии. Минерализация почек особенно интенсивно происходит на границе коркового и медуллярного слоев, где образуется белая разделительная полоса (Meuten, 1984). При гистологическом исследовании выявляются интерстициальная инфильтрация моноядерными клетками, разная степень атрофии почечных канальцев, обызвествление, некроз и слущивание эпителия. У человека почечная недостаточность может быть изначально обусловлена преренальными факторами, однако, при устойчивой гиперкальциемии она является следствием приобретенного поражения почек. Очень важно помнить, что все перечисленные процессы, столь характерные для людей, у собак с ПГПТ выражены слабее и причиняют гораздо меньше беспокойства. Почти у всех таких животных сохраняется нормальная концентрация азота мочевины (AM) и креатинина в крови. Мы имели возможность наблюдать большое число собак с ПГПТ, которые не получали никакого лечения на протяжении 12-18 месяцев, и можем с полным основанием утверждать, что у них отсутствовали признаки прогрессивно развивающегося заболевания почек. Напротив, создается впечатление, что почки таких собак «защищены» ПГПТ. Как и в отсутствие лечения у людей, биохимический профиль сывороток этих животных с течением времени существенно не изменялся (если не считать увеличения концентрации кальция и уменьшения концентрации фосфата) (Silverberg et al, 1999).
Мочевые камни и инфекции мочевого тракта
Гиперкальциемия при первичном гиперпаратиреозе способствует развитию мочекаменной болезни и инфекций мочевого тракта, «обычных» при этом заболевании. Частота таких инфекций достигает 25%, а их возникновение может быть связано с уменьшением удельного веса мочи. Это всего лишь предположение, так как в развитии инфекции могут принимать участие и другие факторы.
Мочевые камни были обнаружены примерно у 30% собак с ПГПТ (Berger, Feldman, 1987; Klausner et al, 1987). Мы считаем, что гиперкальциурия, являющаяся следствием повышенной скорости клубочковой фильтрации кальция, предрасполагает собак к мочекаменной болезни. В то же время мочевые камни не образуются при гиперкальциемии иного происхождения. Такая ситуация может быть связана с хроническим характером гиперкальциемии у собак с ПГПТ, поскольку у многих собак она слабо выражена или протекает бессимптомно. Этим она отличается от кратковременной гиперкальциемии у собак с новообразованиями, отравлением или в других условиях, когда вместо хронического течения заболевания быстро развиваются его явные и тяжелые клинические проявления. В образовании мочевых камней и насыщении мочи растворенными соединениями важную роль играют дополнительные факторы, такие как величина pH, ионная сила и ингибиторы агрегации кристаллов. Например, фосфат кальция значительно слабее растворяется в щелочной, чем в кислой моче.
Избыток и недостаток витамина Д
Когда гиперкальциемия не является следствием первичного почечного или эндокринного заболевания, то организм адаптируется к ней путем уменьшения содержания витамина Д в крови. Падение уровня витамина Д сопровождается понижением интенсивности всасывания кальция в кишечнике. Напротив, на небольшое снижение концентрации кальция в сыворотке крови организм отвечает одновременной секрецией ПТГ и витамина Д. Стимулирующее действие ПТГ на резорбцию костной ткани и действие витамина Д на всасывание кальция и фосфора в желудочно-кишечном тракте приводит к увеличению концентраций обоих этих элементов в сыворотке крови (см. рис. 16-1). Действие ПТГ на почечные канальцы способствует поддержанию минерального гомеостаза благодаря стимуляции биосинтеза и секреции 1,25(ОН)2Д3 (витамина Д) и, кроме того, усиливает экскрецию фосфора с мочой. Этот процесс важен для предотвращения гиперфосфатемии, которая может развиться в результате выведения фосфора вместе с кальцием из костной ткани и/или всасывания обоих элементов в желудочно-кишечном тракте.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 733
При ПГПТ тяжесть гиперкальциемии возрастает благодаря усилению продукции витамина Д и понижению количества фосфата, образующего комплексы с ионизированным кальцием. В результате уменьшается резорбция фосфора в почечных канальцах, развиваются гиперфосфатурия и гипофосфатемия. В конечном итоге, формируется классическая для первичного гиперпаратиреоза биохимическая триада: гиперкальциемия, гипофосфатемия и гиперфосфатурия.
Недостаточность витамина Д как следствие хронически повышенной утилизации его резерва под воздействием ПТГ, возможно, служит природным адаптивным механизмом для существования в условиях первичного гиперпаратиреоза. Этот механизм вряд ли имеется у собак с ПГПТ, поскольку у них, в отличие от людей с недостаточностью витамина Д, не наблюдается тяжелая остеомаляция в условиях хронического ПГПТ (Meuten et al, 1983а; Weir et al, 1986). Кроме того, исследование, включавшее четырех собак с ПГПТ, показало, что у трех их них концентрация кальцитриола была на верхнем пределе нормы или несколько выше (Rosol et al, 1992а). Если результаты, полученные на этих трех особях, правильно отражают физиологическую ситуацию у большинства других собак с ПГПТ, то размягчение костей следует считать редким явлением, а наличие упомянутой выше биохимической триады получает более убедительное объяснение.
Влияние гиперкальциемии на почки и минерализация мягких тканей
Постулируется несколько природных адаптивных механизмов для контроля и, возможно, коррекции гиперкальциемии при первичном гиперпаратиреозе. Один из них представлен ранее описанной гиперкальциурией. Другой механизм включается при чрезмерном усилении транспорта кальция в почечных канальцах. Когда произведение концентраций кальция (Са++) и фосфата (РО4) в сыворотке крови превышает 60-80 мг/100 мл, начинается отложение кальция в мягких тканях (Meuten et al, 1981). В результате такого механизма снижения концентрации кальция в сыворотке крови развивается прогрессирующая дисфункция ряда органов, в первую очередь почек, вследствие нефрокальцино-за. Обызвествление мягких тканей происходит в самых различных органах, но ни в одном из них этот процесс не вызывает таких внушающих опасение явлений, как в почках.
Как указывалось выше, для собак с гиперкальциемией при злокачественном росте, гипокортициз-ме, хронической почечной недостаточности (ХПН) и гипервитаминозе Д характерна азотемия (Kruger et al, 1996). Гиперкальциемия способствует развитию азотемии при любой комбинации следующих явлений: преренального уменьшения объема внеклеточной жидкости (анорексии, адипсии, рвоте и полиурии); сужения сосудов, пониженного коэффи
циента проницаемости почечных клубочков (Kf), острого некроза канальцев в результате токсического и ишемического эффектов гиперкальциемии; и ХПН, вызванной отмиранием нефронов, нефрокальцино-зом, тубулоинтерстициальным воспалением и интерстициальным фиброзом (Rosol et al, 2000).
Азотемия у собак, имеющих злокачественные образования, наблюдается чаще, чем у животных с ПГПТ (соответственно 71 и 11%) (Kruger et al, 1996). Однако у нас создается впечатление, что ПГПТ почти никогда не является причиной ХПН у собак. Частота ХПН среди собак с ПГПТ в обследованной нами группе составляла примерно 4%. Вероятно, с такой же частотой ХПН встречается в любой популяции собак со средним возрастом 10-11 лет. Чаще всего ХНП должна развиваться у собак с гиперкальциемией, при которой произведение концентраций кальция и фосфора в сыворотке крови превышает 60-80 мг/100 мл. Такое увеличение весьма нетипично для ПГПТ из-за низкой концентрации фосфора в крови вследствие индуцированного ПТГ избытка витамина Д. Концентрация общего кальция (Са) в сыворотке крови у обычной здоровой собаки составляет около 10,5 мг/100 мл, концентрация фосфата примерно 4,5 мг/100 мл, а их произведение равно 47. В то же время у типичной собаки с ПГПТ концентрация общего кальция составляет около 15 мг/100 мл, концентрация фосфата примерно 3,0 мг/100 мл, и их произведение равно 45. Эти показатели значительно отличаются от таковых у собак с ХПН или токсикозом вследствие избытка витамина Д, у которых концентрация общего кальция около 10,5 мг/100 мл (или выше), концентрация фосфата примерно 10,0 мг/100 мл (или выше), а произведение этих величин выше 100.
Быстрый обмен ПТГ
Стимулируемая гиперкальциемией быстрая деградация биологически активных форм ПТГ в тканях паратиреоидными и непаратиреоидными клетками представляет собой физиологический механизм, посредством которого предотвращается дальнейшее усиление тяжести гиперкальциемии при ПГПТ (Arnaud, Kolb, 1991). Присутствующий в плазме крови кальций регулирует секрецию ПТГ и определяет соотношение биологически активных молекул ПТГ и его неактивных фрагментов в циркуляции. Это явление имеет скорее теоретический, нежели практический интерес, поскольку скорость исчезновения ПТГ из крови собак после хирургического удаления паращитовидных желез в связи с паратиреоидной опухолью или в связи с заболеваниями других органов одинаковая.
Кальцитонин
Кальцитонин - это полипептидный гормон, состоящий из 32 аминокислотных остатков, который синтезируется в парафолликулярных или «С-клетках»
734 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
щитовидной железы и секретируется ими в ответ на повышение уровня кальция в крови (Mol et al, 1991). Основное действие этого гормона состоит в ограничении гиперкальциемии после приема пищи у здоровых млекопитающих. Кальцитонин подавляет резорбцию костей, уменьшая размер щеточной каемки остеокластов, количество этих клеток и их подвижность. Кальцитонин не действует на почки и кишечник, но влияет на центр сытости, уменьшая аппетит. Роль кальцитонина у собак с гиперкальциемией, обусловленной ПГПТ, неизвестна. Усиление его секреции в ответ на гиперкальциемию, по-видимому, является физиологическим ответом. Парафолликулярные клетки характеризуются высокой степенью гиперплазии и в щитовидной железе собак с первичным гиперпаратиреозом выглядят как небольшие светлые островки (Capen, Martin, 1983). Гиперплазированные парафолликулярные клетки могут вытеснять фолликулы, содержащие коллоид и выстланные тиреоидными фолликулярными клетками. Это предполагает способность парафолликулярных клеток к адаптивной реакции. Исследования на людях выявили непостоянный характер такого адаптивного механизма (Arnaud, Kolb, 1991).
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПАРАТИРЕОИДНОГО ГОРМОНА В СЫВОРОТКЕ КРОВИ
История разработки
Разработка методов определения ПТГ в сыворотке Берсоном и соавторами в 1963 году ознаменовала важный прорыв в диагностике заболеваний паращитовидных желез у человека. Непрямая оценка паратиреоидной функции, например, по скорости клиренса кальция, фосфата или цАМФ в почках не позволяла удовлетворительно дифференцировать паратиреоидные и непаратиреоидные причины гиперкальциемии или гипокальциемии. В 1960 - 1970-х годах стало очевидно, что иммунологическое определение ПТГ позволяет получить значительно более достоверную информацию, однако, разработка соответствующих методов оказалась гораздо труднее, чем рутинных иммунологических методов определения других пептидных гормонов.
В кровяном русле всех животных наряду с целой молекулой ПТГ, состоящей из 84 аминокислотных остатков, присутствует множество ее фрагментов. Интактный ПТГ и его пептидные фрагменты имеют разные периоды полужизни. Период полужизни целой молекулы ПТГ и его N-концевых фрагментов составляет несколько минут, тогда как участки, соответствующие средней части молекулы и ее карбоксильному С-концу сохраняются в крови в 10-20 раз дольше. Биологической активностью обладает целая молекула ПТГ, которая является основным продуктом секреции паращитовидных желез и присутствует в сыворотке кошек и собак в относительно низких концентрациях. Содержание N-концевого фрагмента, являющегося продуктом обмена ПТГ в печени и
почках, не влияет на результаты определения общего иммунореактивного ПТГ в крови. Фрагменты С-кон-цевой и средней последовательностей ПТГ не обладают биологической активностью, но присутствуют в крови в довольно больших количествах. Биологически неактивный материал выводится, главным образом, через почки, а при почечной недостаточности неактивные фрагменты накапливаются в сыворотке.
Системы определения ПТГ
«Двухсайтовый» метод определения ПТГ, который в настоящее время применяется в большинстве медицинских и ветеринарных учреждений, основан на использовании двух разных поликлональных антител. Показано, что двухсайтовый иммунорадиомет-рический метод (ИРМ) для определения нативного ПТГ человека (Allegro Intact РТН, Nichols Institute, San Juan Capistrano, США) можно использовать для определения концентрации ПТГ в крови собак и кошек (Torrance, Nachreiner, 1989а; Flanders, Reimers, 1991; Barbr et al, 1993). Антитела одного типа связываются только со средней областью человеческого ПТГ или его С-концевым участком 39-84, а другие антитела -толькосN-концевымучастком 1-34. Анализируемые пробы одновременно инкубируют с антителами обоих типов; в результате образуется «сэндвич», состоящий из антител к участку 1-34, интактного гормона, присутствующего в сыворотке, и антител к участку 39-84. Данный метод идентифицирует только такие сэндвичи, что исключает влияние на результаты определений средних и С-концевых фрагментов молекулы даже в случае их высокого содержания в сыворотке. В двухсайтовой иммунохемилюминометрической системе для определения интактного ПТГ у человека, которая также применяется в ветеринарии, используются антитела, сходные с описанными выше для ИРМ (Michelangeli et al, 1997).
Клиническое применение
Общие сведения. Определение концентрации ПТГ в сыворотке крови является важной составляющей диагностического обследования собак и кошек с подозрением на заболевание паращитовидных желез. Как и в любом другом случае, у ветеринара должна быть уверенность, что используемая методика годится для собак и кошек. Кроме того, каждая аналитическая лаборатория должна иметь собственные показатели нормальной концентрации гормона и ее типичные величины для большинства основных заболеваний. Получение независимых референтных показателей необходимо даже в тех случаях, когда метод надежно проверен в других лабораториях.
Имеется положительный опыт клинического применения нового двухсайтового метода определения ПТГ. Получаемые для этого анализа пробы следует хранить и транспортировать в замороженном виде, чтобы избежать разрушения ПТГ. Гормон
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 735
Слабые
Тяжелые
Первичный гиперпаратиреоз
Тяжелые
Слабые
Лим-фосарко-ма
Хроническая почечная недостаточность
го
h го s
I X 2 го
X со
Слабые
Тяжелые
Опухоли апокринных желез заднепроходной пазухи
Гипервита-минозД
Гипопаратиреоз
Норма
Тяжелые , k
Слабые
Норма
Тяжелые
Слабые
Норма
Слабые
Тяжелые ▼
Слабые
Тяжелые
Тяжелые
Слабые
Норма
Рис. 16-2 Диаграмма, иллюстрирующая концентрации паратиреоидного гормона (ПТГ), пептида, родственного паратиреоидному гормону (ПрПТГ), ионизированного кальция и витамина Д при наиболее распространенных формах гиперкальциемии у собак.
лучше всего сохраняется, если плазму крови собирают в пробирки с угилсндиаминтетрауксусной кислотой (ЭДТА), но сыворотки после отделения от эритроцитов следует хранить в замороженном виде. Нормальной считается концентрация ПТГ в интервале от 2 до 13 пмоль/л у собак и от 0 до 4 пмоль/л у кошек. Материал направляют в аналитическую лабораторию в двух или трех замороженных гелевых упаковках (Torrance, Nachreiner, 1989а и 1989b).
Концентрацию большинства гормонов следует оценивать в сопоставлении с другими биохимическими показателями. Имея это в виду, полученную концентрацию ПТГ следует интерпретировать в сравнении с общей концентрацией кальция в сыворотке крови и, в идеале, с концентрацией ионизированного кальция. Снижение концентрации кальция в сыворотке крови обычно связано с увеличением
уровня ПТГ, а повышение концентрации кальция -со снижением концентрации ПТГ (рис. 16-2). Как и при анализе любых биохимических показателей, однократное определение ПТГ может дать неверную информацию. Ветеринар должен провести исчерпывающее обследование собаки или кошки с гиперкальциемией. Если полученные результаты кажутся неубедительными, следует повторить соответствующие анализы, в том числе определение концентрации кальция, которая может сильно колебаться.
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ИОНИЗИРОВАННОГО КАЛЬЦИЯ В СЫВОРОТКЕ КРОВИ
Биологической активностью обладает ионизированная форма кальция. В настоящее время опреде-
736 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ление ионизированного кальция широко доступно и относительно недорого. В нашей лаборатории нормальными или «референтными» показателями считаются концентрации от 1,12 до 1,42 ммоль/л (см. табл. 16-1). Пробы для определения ионизированного кальция можно получать без соблюдения ранее описанных правил их сбора в анаэробных условиях. Тем не менее, сбор, хранение и работа с пробами с соблюдением требований анаэробности обеспечивает их стабильность в течение более длительного времени, в связи с чем предпочтение отдается именно этому способу (Schenck et al, 1995). При получении проб в анаэробных условиях не происходит повышения pH сыворотки в результате потери двуокиси углерода (СО2). Кислая реакция сыворотки способствует диссоциации комплексов кальция с белками и, тем самым, увеличению содержания его ионизированной фракции в пробе. Щелочная реакция является следствием потери СО2; она усиливает связывание кальция с белками, т.е. сопровождается уменьшением концентрации ионов кальция. При смешивании с воздухом pH сыворотки увеличивается, а концентрация ионизированного кальция уменьшается. Величина pH и, соответственно, концентрация ионизированного кальция в сыворотке более стабильны, чем в цельной или гепаринизированной крови. Использование сывороток для определения кальция позволяет избежать возможного воздействия гепарина на результаты анализа и обеспечивает более длительное хранение материала. Сыворотки можно использовать для последующего измерения концентрации ионизированного кальция все время, пока они хранятся в анаэробных условиях. Нельзя применять для их отделения силиконовые пробирки. Результаты определения ионизированного кальция в сыворотках собак не меняются при хранении проб при 23 °C на протяжении 72 часов или при 4 °C в течение 7 дней (Schenck et al, 1988).
Применение автоматического аппарата с ион-селективными электродами для определения кальция упрощает анализ, повышает его точность и уменьшает влияние магния, калия, гемолиза и других факторов (Gouget et al, 1988). Тем не менее, каждый анализатор имеет свои особенности, поэтому любая лаборатория должна иметь референтные показатели уровня кальция, полученные на имеющемся у нее аппарате (Hristova et al, 1995). Существуют аппараты, которые проводят математическую обработку результатов определения ионизированного кальция и pH и выдают «откорректированные» данные. Имеются также формулы для расчета концентрации кальция с «поправкой» на сбор и обработку проб в аэробных условиях, однако, они не адаптированы для оценки концентрации ионизированного кальция у собак и кошек и потому не рекомендуются для применения в ветеринарной практике (Rosol et al, 2000).
Описанный диагностический метод полезен для оценки гиперкальциемии и гипокальциемии, а так
же почечной недостаточности. Установлено влияние возраста на концентрацию ионизированного кальция в сыворотках собак и кошек: у молодых животных (до 2 лет) она несколько выше, чем у «взрослых» (Deniz, Mischke, 1995; Mischke et al, 1996).
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ВИТАМИНА Д
Определение продуктов превращения витамина Д редко используется в ветеринарии, но в отдельных случаях может быть полезно для диагностики нарушений гомеостаза кальция. Для выявления синдромов гипо- или гипервитаминоза Д, а также почечной недостаточности наибольший интерес представляют такие метаболиты, как 25(ОН)-вита-мин Д (кальцидиол) и 1,25(ОН)2-витамин Д (каль-цитриол) (Carothers et al, 1994). Эти соединения стабильны при хранении проб в холодильнике или в замороженном виде, однако их нельзя подвергать воздействию света. Оба метаболита химически идентичны у всех видов животных, поэтому методы их радиоиммунологического определения (РИА) у людей пригодны также для собак и кошек (Hollis et al, 1996). Концентрация кальцитриола у молодых, растущих особей выше, чем у взрослых.
Определение кальцитриола помогает установить генетические нарушения обмена витамина Д. При ПГПТ его концентрация бывает в норме или повышенной, а у пациентов с гиперкальциемией вследствие злокачественного заболевания может быть низкой, нормальной или высокой. У собак и кошек с подозрением на отравление содержащими витамин Д ядами для мышей и крыс (например, крысиным B-Gone, мышиным В-Gone, Rampage или Quintox) диагностика затруднительна. Концентрация витамина Д в сыворотке при этих токсикозах повышена (Dougherty et al, 1990).
ОПРЕДЕЛЕНИЕ ПЕПТИДА, РОДСТВЕННОГО ПАРАТИРЕОИДНОМУ ГОРМОНУ
Общие сведения
Пептид, родственный паратиреоидному гормону (ПрПТГ), был впервые обнаружен в 1980-х годах в опухоли как фактор, активирующий рецепторы ПТГ и вызывающий гиперкальциемию. ПрПТГ сходен с ПТГ как по последовательности кодирующих генов, так и по химической структуре (рис. 16-3). ПрПТГ является вторым членом гормонального семейства ПТГ (Broadus, Stewart, 1994). Первые данные о функции ПрПТГ были получены при исследовании его экспрессии в разных тканях. В отличие от ПТГ, он был обнаружен в самых различных тканях плодов и взрослых людей, включая эпителий, мезенхимальные ткани, эндокринные железы и ЦНС (табл. 16-2). Столь широкое распространение ПрПТГ предполагает многообразие его функций (рис. 16-4). Проводимые в настоящее время эксперименты на генном уровне и другие дают все больше мате-
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
737
IA
Последователь- IB
ность, Область
гомоло- птг_
Г1^УГЯ подобной
функцией
Уникальная последе вательность НВ
Область процессинга
III
Дивергентная область
Рис. 16-3. Структурные и функциональные домены пептида, родственною парагиреои тому гормону (ПрПТГ). Область 1-13 ПрН IT на 70% гомоюгична соответствующей области ПТГ и, как считается, участвует в активации адснилатцик-jaibi и друтх систем вторы? мессенджеров в тканях мигренях. Область 14-34 ПрП IT iici омологична области 14-34 ПТГ, но эффективно связывается с рецепторы ПТГ. Область 35-108 ПрПТГ уникальна и не имеет гомологии ни с одним из известных пептидов. Эта область чрезвычайно консервативна у разных видов животных, что свидетельствует о ее исключительно важных, но еще неизвестных функциях. Область 88-108 пептида содержит большое количество мест протеолитического расщепления и несколько сигналов для амидирования; по этой причине она может быть местом посттрансляционного процессинга, по крайней мере, в некоторых тканях. Область 112-114 пептида слабо консервативна. Предварительные данные свидетельствуют о том, что, по крайней мере в некоторых ситуациях, С-концевые фрагменты. образующиеся из этой области, поступают в кровяное русло. Функциональные последствия этого неизвестны. Из: Broadus АЕ et al: N Engl J Med 319:556, 1988.
риала для понимания роли ПрПТГ (Srewler, 2000). Уже сейчас ясно, что этот пептид играет ключевую роль в развитии синдрома гуморальной гиперкальциемии вследствие злокачественного роста (ГГЗР). Есть основания предполагать, что последовательность первых 36 аминокислотных остатков ПрПТГ влияет на хрящевую ткань, молочные железы и кожу, а его средняя область (аминокислотные остатки 38-94) - на гранспорг кальция и, возможно, бикарбоната в плаценте. Последовательность 1 ОТ-139 функционирует в мозге и участвует в резорбции костно! ткани (Strewler, 2000).
Системы определения ПрПТГ
Человеческий ПрПТГ определяют с помощью двухсайгового ИРМ и РИА, определяющего N-koh-цевую последовательность. Эти же методы годятся для определения ПрП ГГ у собак и кошек благодаря высокой гомологичности его структуры у разных видов млекопитающих (Brown et al 1987; Burtis, 1992). ПрПТГ легко разрушается присутствующими в сыворотке протеазами, поэтому для анализа следует использовать свежеполученную или замороженную плазму крови, используя ЭДТА в качестве антикоагулянта. ЭДТА образует комплексы с кальцием плазмы, ограничивая тем самым действие большинства протеаз. Защитным действием обла-
ТАБЛИЦА 16-2. ПРЕДПОЛАГАЕМОЕ ДЕЙСТВИЕ ПЕПТИДА, РОДСТВЕННОГО ПАРАТИРЕОИДНОМУ ГОРМОНУ (ПрПТГ), И МЕСТА ЕГО ПРИЛОЖЕНИЯ
Место Пре дно iai аемое де ci вис
Мезон х имяявные ткани
Хрящ
Кость
Гладкая мускулатура
Сосудистая система
Миометрий
Мочевой пузырь
Сердечная мышца
Скелетная мускулатура
Эпителиальные ткани
Молочная же юза
Эпидермис
Волосяные фолликулы Кишечник
Зубная эмаль
Усиливает пролиферацию хондроцитов, ингибирует терминальную дифференцировку и апоптоз хонхроцитов
Стимулирует или ингибирует резорбцию костей
Высвобождается при растяжении, вызывает расслабление гладких мышц
Эн цокринныс ткани Паращитовидные железы
Островки поджелу. хочной
железы
Гипофиз
Плацента
Центральная нервная
система
Положительная хронотропная стимуляция, опосредованная положительная ионотропная стимуляция
Неизвестно
Индуцирует морфогенез, секретируется с молоком, возможно, участвует в лактации
Неизвестно
Ингибирует анаген
Неизвестно
Индуцирует остеокласт ную резорбцию поверхностной ткани
Стимулирует транспорт кальция через плаценту?
Стимулирует секрецию инсулина и соматический рост
Неизвестно
3 ранспорт кальция?
Высвобождается из зернистых нейронов мозжечка в ответ на активацию кальциевых канатов L-типа, действует на рецепторы в мозжечке, гиппокампе и гипоталамусе
Из: Strew er, 2000.
дают также некоторые ингибиторы протеаз, например апротинин. В сыворотках определять ПрПТГ не рекомендуется (Rosol et al. 2000).
Клиническое применение
Одновременное определение ПТГ и ПрПТГ в плазме крови особенно полезно при дифференциальной диагностике ПГПТ и ГГЗР (Burtis et al, 1990). По данным некоторых исследовании, концентрация ПрПТГ повышена у большинства людей с ГГЗР в том числе у пациентов с метастазирующими опухолями. В то же время ПрПТГ обнаруживается лишь у небольшого числа лиц с первичным гиперпаратиреозом, у которых гиперкальциемия обусловлена повышенной концентрацией ПТГ. При нарушении почечной функции увеличено содержание иммуно-
738 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Нормальное/ эндокринное
• Паратиреоидные железы плода
• Плацента
Нормальное/ паракринное
• Кожа
• Молочные железы
• Эндокринные органы
• Мышцы
• Лимфатические органы
• Почки
• Кости
• Мозг
Аномальное/ эндокринное
• Гуморальная гиперкальциемия, вызванная злокачественным ростом
Рис. 16-4. Действие пептида, родственного паратиреоидному гормону (ПрПТГ). Из: Rosol TJ et al: In: DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders, 2000, p 108-162.
реактивных фрагментов ПрПТГ (Budayr et al, 1989; Henderson et al, 1990).
Нет сомнения, что у собак и кошек ПрПТГ тоже является достоверным маркером опухолевого роста. Иными словами, одновременное определение ПТГ и ПрПТГ у собак и кошек с гиперкальциемией может стать быстрым, надежным и недорогим неинвазивным способом дифференциальной диагностики злокачественной и незлокачественной гиперкальциемии. Однако у животных с почечной недостаточностью концентрация ПрПТГ может быть повышена и в отсутствие злокачественных новообразований (см. рис. 16-2).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПЕРКАЛЬЦИЕМИИ
См. табл. 16-3.
Первичный гиперпаратиреоз
См. следующий раздел.
Г иперкальциемия при злокачественном росте
Общие сведения. Гиперкальциемия, обусловленная развитием злокачественных опухолей, является самой частой причиной повышения концентрации кальция в сыворотке у собак и кошек. Злокачественные новообразования могут приводить к гиперкальциемии посредством трех физиологических процессов (рис. 16-5): (1) гуморальной гиперкальциемии злокачественного роста (ГГЗР), (2) гематологической злокачественной неоплазии, развивающейся из костного мозга, и (3) гиперкальциемии, индуцируемой метастазированием костей солидными опухолями (Rosol et al, 2000). Гиперкальциемия часто развивается у собак с лим-фосаркомой, карциномой апокринной железы заднепроходной пазухи и множественной миеломой. К числу опухолей, реже приводящих к гиперкальци
емии, относятся злокачественные новообразования в молочных железах, назальная аденокарцинома, карцинома щитовидной железы, тимома, желудочно-кишечная или влагалищная плоскоклеточная карцинома и меланома.
Синдром гуморальной гиперкальциемии вследствие злокачественного роста
Гуморальные «факторы». Отдаленная от костей опухолевая ткань может синтезировать ПрПТГ, который, поступая в кровяное русло, стимулирует резорбцию костей и индуцирует гиперкальциемию. Избыточная секреция биологически активного ПрПТГ играет ключевую роль в патогенезе гипер-
ТАБЛИЦА 16-3. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПЕРКАЛЬЦИЕМИИ
Частые причины
Лимфосаркома
Гипокортицизм
Первичный гиперпаратиреоз
Хроническая почечная недостаточность
Нечастые причины
Карцинома апокринных желез заднепроходной пазухи
Множественная миелома
Токсикоз, вызванный витамином Д
Нечастые до редких
Ложная гиперкальциемия
Гемоконцентрация
Карциномы: легких, молочных желез, носовой полости, поджелудочной железы, семенников, тимуса, щитовидной железы, влагалища
Меланома
Острая почечная недостаточность
Гипертиреоз
Алиментарный вторичный гиперпаратиреоз
Грануломатозная болезнь: бластомикоз, гистоплазмоз, шистосомоз
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 739
Гиперкальциемия, вызывае
мая злокачественным ростом
Рис. 16-5. Патогенез гиперкальциемии вследствие злокачественного роста. Гуморальные и локальные формы гиперкальциемии, вызванной злокачественным ростом, увеличивают концентрацию кальция в крови посредством стимуляции резорбции костей остеокластами и усиления всасывания кальция в почечных канальцах. Из: Rosol TJ et al: In: DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders, 2000, p 108-162.
Локальные формы
Солидные опухоли или Множественная миелома
Гематологические опухоли
кальциемии при большинстве форм ГГЗР. Действие ПрПТГ синергично или кооперативно усиливается цитокинами, такими как интерлейкин-1 (ИЛ-1), фактор некроза опухолей-а (ФНО-а), трансформирующий фактор роста-a (ТФР-а) и трансформирующий фактор роста-Р (ТФР-0), а также каль-цитриолом (рис. 16-6) (Rosol et al., 2000). ПрПТГ связывается с N-концевой последовательностью рецепторов ПТГ/ПрПТГ в костях и почках, но не дает перекрестной реакции с нативным ПТГ при радиоиммунологическом анализе. ПрПТГ стимулирует резорбцию костей остеокластами, усиливает реабсорбцию кальция в почечных канальцах
и уменьшает резорбцию в них фосфата. ИЛ-1 и трансформирующие факторы роста также стимулируют резорбцию костной ткани (McCauley et al, 1991; Rosol et al., 2000). Физиологическая активность ПрПТГ объясняет не только происхождение гуморальной гиперкальциемии, но и ее отсутствие при некоторых видах опухолей. Кроме того, ПрПТГ служит общепризнанным маркером опухолевого роста, поскольку его концентрация обычно нарушена только у пациентов, имеющих злокачественные новообразования или страдающих недостаточностью почечной функции (см. рис. 16-2).
У собак со злокачественными опухолями в сочетании с гиперкальциемией концентрация ПТГ в крови обычно низкая вплоть до неопределяемого уровня. Это является нормальной реакцией паращитовидных желез на гиперкальциемию. Однако у очень небольшого числа таких животных концентрация ПТГ может быть нормальной или повышенной, что затрудняет диагностику, поэтому необходимо тщательное обследование каждого животного с гиперкальциемией. Определение концентраций ПТГ и ПрПТГ не заменяет физикальное исследование, рентгенографию грудной клетки, УЗИ брюшной полости и другие важные методы выявления неоплазии, но является важным дополнением других необходимых диагностических процедур.
Гемопоэтическая неоплазия. Самой распространенной гемопоэтической опухолью и наиболее частой причиной гиперкальциемии у собак является лимфосаркома. Она поражает животных любого возраста и пола. Клинические проявления этой опухоли могут быть слабыми, умеренными или тяжелыми; некоторые собаки находятся в терминальном состоянии. Гиперкальциемия регистрируется при-
Гуморальные факторы и ГКЗР
Гуморальные факторы (ИЛ, ФИО, ТФР и др.)
Синергичное или
аддитивное действие
Рис. 16-6. Гуморальные факторы, такие как пептид родственный паратиреоидному гормону (ПрПТГ), интерлейкин-1, факторы некроза опухолей (ФИО) и трансформирующие факторы роста (ТФР), продуцируемые опухолями, индуцируют синдром гуморальной гиперкальциемии вследствие злокачественного роста (ГКЗР), действуя как системные гормоны и стимулируя резорбцию костной ткани остеокластами либо усиливая всасывание кальция в почечных канальцах. Из: Rosol TJ et al: In: DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders, 2000, p 108-162
740 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
мерно у 20-40% собак с лимфосаркомами (Weller et al, 1982; Matus et al,1986; Rosol et al, 2000). Она развивается и у кошек с этими опухолями, но значительно реже, чем у собак. Обследование больных собак выявило изменения, свидетельствующие о таких проявлениях активности ПрПТГ, как усиление фракционной экскреции фосфора, нефрогенной продукции цАМР и резорбции костной ткани остеокластами. В отличие от ПТГ, ПрПТГ не стимулирует образование 1,25(ОН)2-витамина Д в почках и не дает перекрестной реакции при анализе интактного ПТГ с помощью ИРМ. У многих собак с гематопоэтической неоплазией концентрация ПрПТГ в сыворотке крови повышена (рис. 16-7) (Weir et al, 1988а; 1988b, 1988с).
В лимфомах синтезируются как ПрПТГ, так и витамин Д, поэтому сыворотки собак с такими опухолями содержат повышенные количества обоих этих соединений (Seymour, Gagel, 1993). Некоторые лимфоциты содержат 1 а-гидроксилазу (сходную с ферментом из почечных канальцев), которая преобразует 25-гидроксивитамин Д в его активную форму 1,25(ОН)2-витамин Д (Rosol et al, 2000). В связи с этим лимфомы, сохраняющие эту способность, могут синтезировать избыточное количество
кальцитриола. Последний усиливает всасывание кальция в желудочно-кишечном тракте, что приводит к дальнейшему обострению гиперкальциемии, вызванной ПрПТГ (см. рис. 16-2).
В отличие от устойчивой гиперкальциемии при ПГПТ, у собак с гиперкальциемией, обусловленной злокачественным ростом, концентрация кальция в сыворотке крови подвержена значительным колебаниям и иногда может оставаться в норме. Несмотря на вариабельность клинических проявлений лимфомы, собаки, имеющие эту опухоль в сочетании с ГГЗР, в целом болеют тяжелее, чем животные с ПГПТ. Пока не доказано обратное, лимфома остается вероятной причиной гиперкальциемии у любой собаки или кошки. Лимфосаркома выявляется при физикальном исследовании у одних собак, но остается незамеченной у других. Почти у 40% животных с лимфомой и ГГЗР периферические лимфатические узлы, печень, селезенка и почки не увеличены. У большинства таких собак опухоль находится в переднем отделе средостения и обычно выявляется при рентгенографическом исследовании грудной клетки. Обнаружение такой опухоли на фоне гиперкальциемии предполагает наличие лимфомы, хотя нельзя исключить, что и само новообразование, и
емия емия емия
Рис. 16-7. Концентрация N-концевого фрагмента пептида родственного паратиреоидному гормону (ПрПТГ) в крови здоровых собак (контроль); собак с гиперкальциемией (концентрация кальция > 12 мг/100 мл) и аденокарциномой заднепроходной пазухи (АЗП), лимфомой или другими опухолями (ДрОП); и собак с нормокальциемией (< 12 мг/100 мл) и аденокарциномой заднепроходной пазухи, лимфомой или другими опухолями. Из: Rosol TJ et al: In: DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders, 2000, p 108-162.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 741
связанная с ним гиперкальциемия обусловлены неоплазией непаратиреоидного происхождения (например, тимомой) (Foley et al, 2000).
Аденокарцинома апокринных желез заднепроходной пазухи. Аденокарцинома апокринных желез заднепроходной пазухи представляют собой еще один классический пример раковой опухоли, ассоциирующейся с гиперкальциемией. Эта опухоль, подобно лимфосаркоме, синтезирует ПрПТГ (Matus, Weir, 1989). Она хорошо охарактеризована, но встречается относительно редко и обычно у старых собак (10-11 лет на момент установления диагноза), хотя возрастной диапазон достаточно широк - от 3 до 17 лет (Bennett et al, 2002). В ранних сообщениях аденокрацинома апокринных желез чаще регистрировалась у сук, чем у кобелей, однако это различие не подтвердилось в более поздних исследованиях. Среди 238 обследованных собак с данной опухолью были представители самых разных пород, но чаще всего она выявлялась у беспородных собак (Ross et al, 1991; Goldschmidt, Shofer, 1992; Bennett et al, 2002). Данные опросов владельцев животных показывают, что к числу наиболее частых клинических проявлений аденокарциномы апокринных желез относятся периректальные опухолевые массы, тенезмы, плохой аппетит или анорексия, полиурия, полидипсия, вялость и сонливость.
Полиурия и полидипсия при наличии аденок-рациномы апокринных желез у большинства собак связаны с гиперкальциемией. С другой стороны, не все собаки с гиперкальциемией страдают полиурией и полидипсией (Bennett et al, 2002). Частота гиперкальциемии по данным различных авторов составляет от 25 до 50% (Ross et al, 1991; Bennett et al, 2002). В одном из исследований концентрация кальция на момент выявления аденокарциномы апокринных желез заднепроходной пазухи составляла от 12,7 до 21,7 мг/100 мл (при верхней границе нормы 12,6 мг/100 мл) (Bennett et al, 2002). Удаление опухоли приводило к нормализации уровня кальция, а локальный рецидив опухоли или метастазирование сопровождались рецидивом гиперкальциемии. У собак с описываемой формой рака усиливались выведение цАМФ с мочой и фракционная экскреция фосфора. Концентрация ПТГ была низкой, а гистоморфомет-рическое исследование выявляло усиленную резорбцию костной ткани в отсутствие компенсаторного образования нового костного вещества. Эти изменения свидетельствуют о действии ПрПТГ (Meuten et al, 1983b). Исследования на клеточных линиях мышиной аденокарциномы апокринных желездтод-твердили, что из всех потенциальных патогенетических факторов ГГЗР повышалась только концентрация ПТГ (Grone et al, 1998). Успёшное лечение аденокарциномы цриводилбк быстрой нормализа-ции концептраций кальция, фосфора, кальцитриола иТПТ в сыворотке крови (Rosol et al, 1992b).
В случае обнаружения гиперкальциемии у любой собаки следует провести тщательное ректальное исследование и пальпацию заднепроходной па
зухи. Первое обычно выявляет обширную опухоль, которая может быть инвазивной или изъязвленной, а вторая необходима для выявления увеличенных сублюмбарных лимфатических узлов. Сублюмбар-ное пространство исследуют также рентгенологически, однако, более надежным методом считается УЗИ этой области. Рентгенографическое исследование грудной клетки и брюшной полости используется для поиска легочных и/или костных метастазов (литических зон).
Другие неопухолевые заболевания и солидные опухоли, синтезирующие ПрПТГ. Реже встречаются такие солидные новообразования, как опухоли интерстициальных клеток семенников, плоскоклеточная карцинома, тимома, меланома и аденокарцинома щитовидной железы, которые вызывают гиперкальциемию в отсутствие метастазирования костей (Grain, Waldfer, 1982; Meuten et al, 1983a; Pressler et al, 2002). Это лишний раз подчеркивает важность определения ПрПТГ у собак с гиперкальциемией. Ремиссия гиперкальциемии после удаления опухоли и ее возобновление после рецидива опухолевого роста или в результате метастазирования предполагают секрецию ПрПТГ опухолями, но эта проблема мало изучена. У человека к числу других опухолей, способных синтезировать ПрПТГ, относятся бронхогенная крупноклеточная карцинома, рак молочной железы, плоскоклеточный рак пищевода, карцинома почечных клеток и гепатома (Harris et al, 2002). Секреция ПрПТГ имеет место также при неопухолевых заболеваниях, таких как шистосомоз (Fradkin et al, 2001).
Гематологическая злокачественная неоплазия, развивающаяся из костного мозга: остеолитическая гиперкальциемия
Общие сведения. Некоторые формы гемолитической неоплазии в костном мозге вызывают гиперкальциемию, индуцируя местную резорбцию костной ткани (Rosol et al, 2000). Эта патология обычно связана с лимфомой и множественной миеломой. Еще одним ее примером служит рак молочной железы у женщин, однако, у собак и кошек ему редко сопутствует гиперкальциемия. Резорбция костной ткани у собак с указанными опухолями обусловлена действием разнообразных паракринных факторов или цитокинов. Чаще всего в патогенезе местной костной резорбции участвуют такие цитокины, как ИЛ-1и ИЛ-6, ФНО-а и ФНО-Р, ТФР-а и ТФР-|3, a также ПрПТГ (Black, Mundy, 1994). Продукция даже небольшого количества ПрПТГ в костной опухоли может стимулировать процесс локальной резорбции в отсутствие системного эффекта. Определенный вклад в патогенез резорбции костей вносят простагландины (особенно простагландин Е2) (Rosol et al, 2000). Цитокины вместе с простагландинами образуют группу факторов, активирующих остеокласты.
Множественная миелома. Множественная миелома представляет собой опухоль В-лимфоци-тов и клеток плазмы и может участвовать в остеолитическом разрушении костей, а иногда в разви
742 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
тии гиперкальциемии. Последняя развивается как следствие биосинтеза факторов, активирующих остеокласты. Кроме того, имеется корреляция между степенью разрушения костной ткани, количеством опухолевых клеток и количеством активирующих остеокласты факторов, продуцируемых клетками миеломы в культуре (Durie et al, 1981). Почти у 17% собак с этой формой рака была гиперкальциемия, а у 50% имелись рентгенографические признаки костного лизиса (Matus et al, 1986).
Боль в костях обычно ощущается в литических зонах. У таких собак часто увеличено содержание общего белка в сыворотке крови, обусловленное резким моноклональным увеличением фракции глобулина. Эта моноклональная гаммапатия специфически выявляется при электрофорезе белков сыворотки. Исследование биоптатов костного мозга в большинстве случаев подтверждает диагноз, выявляя инфильтрацию злокачественными плазматическими клетками. Анализ содержания легких цепей белка миеломы (белка Бенса-Джоунса) в моче мало информативен.
Гиперкальциемия индуцируемая метастазированием солидных опухолей в кости. Некоторые формы злокачественной неоплазии с метастазированием костей могут вызывать гиперкальциемию и гиперкальциурию. В отличие от этого, первичные костные опухоли обычно не индуцируют гиперкальциемию. В частности, она редко встречается у собак с остеосаркомой. Напротив, злокачественная аденокарцинома молочной железы и плоскоклеточная карцинома нередко приводят к метастазированию костей и гиперкальциемии. Разрушение кости в местах метастазирования происходит под воздействием нескольких типов клеток, включая остеокласты, опухолевые клетки, лимфоциты и моноциты. Накопление лимфоцитов и моноцитов является частью ответа иммунной системы на неоплазию (Mundy et al, 1984). Остеолиз является результатом механического разрушения костной ткани пролиферирующими опухолевыми клетками, но может индуцироваться цитокинами и простагландинами, которые стимулируют местную костную резорбцию (Garrett, 1993).
Эпителиальные опухоли, в первую очередь плоскоклеточная карцинома, чаще других новообразований служат источниками метастазирования костей у собак и кошек (Quigley, Leedale, 1983). У собак метастазы в первую очередь поражают бедренные и плечевые кости, а также позвонки, тогда как у кошек процессы локальной инвазии костей преобладают над отдаленным метастазированием. Известны также случаи гиперкальциемии, хотя обычно эти опухоли не сопровождаются нарушениями концентрации кальция (Green, Walder, 1982).
Гипервитаминоз Д и интоксикация, вызванная родентицидами
Общие сведения. Витамин Д обладает кумулятивной активностью, поэтому для проявления его
максимального действия на минеральный обмен требуется 1-2 недели. Однако очень часто потребление собаками больших количеств холекальцифе-рола вызывает острый токсикоз. Его естественным следствием являются гиперкальциемия и гиперфосфатемия, хотя описаны случаи нормофосфатемии и периодов временной нормокальциемии у собак с гипервитаминозом Д (рис. 16-8 и 16-9) (Harrington, Page, 1983). Гиперкальциемия развивается уже через 12-18 часов после потребления витамина Д, концентрация которого в крови достигает максимальной величины спустя 48-72 часа и совпадает с увеличением концентраций AM и креатинина (Rumbeiha, 2000). Эти изменения обусловлены интенсивной резорбцией костной ткани в сочетании с повышенным всасыванием кальция и фосфора в желудочно-кишечном тракте. Поражения скелета зачастую не распознаются при обычном рентгенологическом исследовании, возможно, из-за острого течения этой формы токсикоза. Остеокластная фаза костной резорбции развивается рано и сопровождается отложением остеоидов и гиперостеоидозом (Воусе, Weisbrode, 1983). Токсическое действие витамина Д нередко сопровождается минерализацией мягкой ткани эндокарда, кровеносных сосудов, сухожилий, почек и легких (Meuten, 1984).
Отравление родентицидами. Общеизвестно, что гиперкальциемия может быть следствием отравления родентицидами, содержащими холе-кальциферол (Gunther et al, 1988; Moore et al, 1988; Fooshee, Forrester, 1990; Dougherty et al, 1990). К числу содержащих холекальциферол ядовитых приманок для крыс относятся хинтокс, рампадж, мури-тан и другие коммерческие препараты (Rumbeiha, 2000; Morrow, 2001). У получавших эти яды собак уже на протяжении первых 48 часов отмечались общая слабость, вялость и анорексия. Спустя 60-70 часов все отравившиеся собак не могли стоять, у них начиналась кровавая рвота и, в конечном итоге, происходил шок, после которого они погибали или подвергались эвтаназии (Guntheret al, 1988). Хотя считается, что полулегальная доза холекаль-циферола для собак составляет 43-88 мг/кг, однако, в ряде исследований гибель животных наступала после его однократного перорального введения в дозе всего 10 мг/кг. При введении холекальциферо-ла в дозах от 4 до 6 мг/кг собаки заболевали. У клинически здоровых собак, получавших холекальциферол в дозе 2 мг/кг, развивалась гиперкальциемия (Rumbeiha, 2000).
У большинства собак и кошек под воздействием описываемых токсинов повышались концентрации кальция и фосфора в сыворотке крови (см. табл. 16-8). Одновременно отмечалось желудочное и кишечное кровотечение. Гистологическое исследование выявляло кровоизлияния и/или минерализацию тканей желудочно-кишечного тракта, почек и миокарда, а также кровеносных сосудов в самых различных органах (Gunther et al, 1988). В литературе приводятся разные данные о частоте развития
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
743
Рис. 16-8. Концентрации кальция (А) и фосфора (Б) в сыворотке крови собак, получавших витамин Д3 в дозе 10 мг/кг (кружки) и 20 мг/кг (треугольники). Из: Gunther Ret al: J Am Vet Med Assoc 193:211, 1988.
Тяжелые
Слабые
Нормальный диапазон
Слабые
Тяжелые
Тяжелые
Слабые
Нормальный диапазон
Слабые
Тяжелые
Пер- Гиперкаль- Почечная Токсикоз, Алимен- Болезнь вичный циемия, недоста- вызван- тарный Аддисона ГПТ вызванная точность ный вита- ВГПТ
Пер- Гиперкаль- Почечная Токсикоз, Алимен- Болезнь вичный циемия, недоста- вызван- тарный Аддисона
ГПТ вызванная точность ный вита- ВГПТ злокачествен- мином Д
ным ростом
Рис. 16-9. Диапазон концентраций кальция и фосфора в сыворотке крови при наиболее распространенных формах гиперкальциемии и/или гиперпаратиреоза у собак. ГПТ - гиперпаратиреоз, ВГПТ - вторичный ги
перпаратиреоз.
744 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
острой и/или тяжелой почечной недостаточности. Описан случай выживания трех отравившихся кошек (Moore et al, 1988).
Другие причины токсикоза при избытке витамина Д. Начиная с 1977 года, случаи отравления комнатных животных витамином Д чаще всего были связаны с поглощением лекарственных средств против псориаза у людей, содержащих аналоги витамина Д - кальципотриол или каль-ципотриен. Это, прежде всего, относится к таким средствам, как давионекс, довонекс и псоркутан. Дополнительным источниками поступавшего в организм собак и кошек витамина Д служили пищевые добавки, а также введение ветеринарами его избыточных количеств животным с гипопаратиреозом. Последняя проблема приобрела особую актуальность у кошек, перенесших операцию по поводу гипертиреоза. Опасность повреждения паращитовидных желез существует при любой обширной хирургической операции в области шеи, особенно при резекции щитовидной железы. Возможным источником отравления комнатных животных витамином Д служит цеструм, Cestrum diurnum, (цветущий днем жасмин) - излюбленное декоративное растение, содержащее активный метаболит витамина Д. Его не следует путать с жасмином - комнатным вьющимся растением, в котором этот метаболит отсутствует. Гликозиды витамина Д имеются также в таких растениях, как Solanum malacoxylon и Trisetum flavescens.
Диагностика. Диагностика отравления витамином Д основывается на данных анамнеза, а также на выявлении темных, кровянистых испражнений, азотемии, олигурии или полиурии, протеинурии и, иногда, глюкозурии. Дополнительным диагностическим признаком служит гиперфосфатемия у собак и кошек с гиперкальциемией. В большинстве других случаев гиперкальциемии наблюдается гипофосфатемия или концентрация фосфатов остается в норме. Индуцированную холекальциферолом почечную недостаточность можно отличить от отравления полиэтиленгликолем или растворимым оксалатом по наличию в двух последних случаях умеренной гипокальциемии, в отличие от тяжелой гиперкальциемии, обычно сопутствующей отравлению витамином Д. Тем не менее, анамнез и клиническая симптоматика токсикоза, вызванного витамином Д, очень напоминают картину гипокортицизма, а также острой и хронической почечной недостаточности.
Гипокортицизм
Гипокортицизм (болезнь Аддисона) лежит в основе 10-50% общего числа случаев гиперкальциемии (Uehlingeret al, 1998; Rosol et al, 2000). Концентрация кальция в крови повышена у 33% собак с недостаточностью функции коры надпочечников (Peterson, Feinman, 1982; Peterson et al, 1996) и у некоторых страдающих гипокортицизмом кошек (Johnessee et
al,1982; Peterson et al, 1989). У собак обследованной нами группы была установлена корреляция между тяжестью гиперкалиемии и гиперкальциемии (см. гл. 8). При концентрации калия выше 6,0-6,5 мэкв/ л концентрация кальция у многих животных возрастала до 12-13,5 мэкв/л. Гиперкальциемия развивается не только при очень тяжелом гипокортициз-ме. Тем не менее, концентрация общего кальция, как правило, не превышает 13,5 мг/100 мл и редко бывает выше 15—16 мг/100 мл. Несмотря на повышение общего кальция, концентрация ионизированного кальция обычно остается в нормальных пределах. Концентрация фосфата также коррелирует с концентрацией кальция, поэтому у животных с гиперфосфатемией весьма вероятно развитие гиперкальциемии (см. рис. 16-9).
Клинические симптомы и отклонения лабораторных показателей при гипоальдостеронизме (основном компоненте болезни Аддисона) обычно выражены настолько сильно, что опасения, связанные с гиперкальциемией, отступают на второй план (см. гл. 8). У большинства собак и кошек с гипоальдостеронизмом имеются также гиперкалиемия, гипонатриемия, азотемия, гиперфосфатемия и сопутствующие им расстройства. Это сочетание биохимических нарушений нуждается в дифференциальной диагностике только от гипокортицизма, почечной недостаточности и отравления родентицидами (витамином Д). Кроме того, гиперкальциемия быстро купируется после лечения надпочечниковой недостаточности, часто уже в течение нескольких часов после начала заместительного введения солевого раствора.
Патогенез гиперкальциемии, связанной с гипокортицизмом, вероятно, имеет многофакторную природу. В развитие гиперкальциемии может вносить вклад любое сочетание перечисленных ниже расстройств: (1) гипопротеинемии в результате дегидратации и гемоконцентрации, (2) повышения сродства связывания кальция с белками плазмы, (3) повышенной концентрации кальций-цитратных комплексов и (4) усиления резорбции кальция в почечных канальцах (Peterson, Feldman, 1982).
Хроническая почечная недостаточность
Патогенез гиперкальциемии. Патогенез гиперкальциемии, обусловленной хронической недостаточностью функции почек, отличается большой сложностью. Диффузная гиперплазия паращитовидных желез является характерным компонентом хронической почечной недостаточности. Паратиреоидэктомия у собак с гиперкальциемией и почечной недостаточностью приводит к уменьшению концентраций кальция и ПТГ в сыворотке крови (Meuten, Armstrong, 1989). Развитие гиперкальциемии у собак после экспериментальной нефрэктомии зависело от сохранности комплекса щитовидная желе-за-паращитовидные железы (Tuma, Mallette, 1983). Почки экскретируют ПТГ и продукты его превра-
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 745
щсния; пот процесс подавляется при нарушении почечной функции. Возможными дополнительными механизмами гиперкальциемии у животных с почечной недостаточностью служат: (1) снижение экскреции кальция вследствие уменьшения СКФ; (2) повышение концентрации ПТГ вследствие избыточной секреции и снижения скорости деградации гормона в почечных канальцах, что может усиливать резорбцию костей; (3) недостаточность почечной функции или индуцированное П ГГ увеличение концентрации органических катионов (например, цитратов), приводящее к повышению концентрации связанного кальция; (4) аномально высокая реакция на витамин Д, сопровождающаяся усилением всасывания кальция в кишечнике и (5) автономная активность паращитовидных желез (третичный гиперпаратиреоз), вызывающая увеличение секреции ПТГ (Mcuten, Armstrong, 1989). Неизвестно, существует ли на самом деле синдром, включающий «автономное функционирование» паращитовидных желез как следствие их хронической стимуляции при заболевании почек (третичном гиперпаратиреозе). Название третичный гиперпаратиреоз дано синдрому хронического почечного вторичного гиперпаратиреоза, при котором одна или несколько паращитовидных желез начинают автономно секретировать П ГГ («третичное» расстройство).
Преходящая гиперкальциемия может быть вызвана приемом внутрь препаратов, связывающих фосфаты, в результате чего кальций переходит из костей во внеклеточную жи (кость в ответ на быстрое понижение концентрации фосфора в крови (Сареп, Martin, 1983).
Патогенез почечного вторичного гиперпаратиреоза. Классическим объяснением этого синдрома служит прогрессирующая хроническая неспособность почек экскретировать фосфор. Задержка фосфора приводит к уменьшению концентрации внеклеточного кальция по закону действующих масс. В соответствии с этим законом произведение концентраций кальция и фосфора в крови должно оставаться постоянным. Поэтому при увеличении уровня кальция концентрация фосфора понижается и наоборот. В ответ на хроническую стимуляцию развивается гиперплазия паращитовидных желез, обеспечивающая поддержание нормальной концентрации внеклеточного кальция (почечный вторичный гиперпаратиреоз) (рис. 16-10; см. также рис. 16-2 и 16-9). Хотя никто не ставит под сомнение справедливость этого классического принципа, была выдвинута альтернативная гипотеза «обмена витамина Д». Согласно этой гипотезе, дефицит витамина Д при хронической почечной недостаточности обусловлен сокращением популяции клеток проксимапьных почечных канальцев которые синтезируют этот «гормон». Концентрация кальция во внеклеточной жидкости понижается из-за уменьшения его всасывания в кишечнике под действием витамина Д. У собак и кошек с хронической недостаточностью почечной функции снижение кон-
Почечная недостаточность
Время
Рис. 16-10. Схематическое изображение развития почечной недостаточности во времени. Обратите внимание на утрату способности декретировать фосфаты, слабые колебания концентрации кальция вплоть до поздней стадии заболевания и прогрессивное увеличение всех четыре параши говид-ны желез по мере ухудшения почечной функции (светлые кружки обозначают почечный вторичный гиперпаратиреоз).
центрации витамина Д предшествует увеличению уровня фосфатов в крови. На более поздних стадиях почечной недостаточности гиперфосфатемия начинает подавлять и без того пониженный синтез витамина Д. Последний непосредственно регулирует концентрацию ПТГ по механизму отрицательно^ обратной связи. Недостаток витамина Д приводит к нарушению этого регуляторного механизма и. таким образом к избытку П ГГ в крови (почечному вторичному гиперпаратиреозу) (Mattson et al, 1993).
Хотя вопросы патогенеза, диагностики и лечения хронической почечной недостаточности нс являются центральной темен данной главы, представляется уместным остановиться на основных теоретических предпосылках терапии этого заболевания. Не подлежит сомнению необходимость снижения аномально высокой концентрации фосфора у собак и кошек с нарушениями функции почек (посредством снижения содержания фосфатов в пищевом рационе, применения препаратов, связывающих фосфор в кишечнике и т.п.). Целесообразность терапии витамином Д с целью снижения концентрации ПТГ в крови остается предметом клинических исследовании. В принципе считается, что введение этого витамина необходимо, потому что ПТГ обладает нефротоксическим действием и поэтому способствует прогрессивному развитию хронической почечной недостаточности (Chew. Nagodc. 1990). В то же время результаты проведенных исследований свидетельствуют о том, что хирургическое удаление паращитовидных желез (источника П ГГ) у собак с почечной недостаточностью не гарантирует прекращения ее дальнейшего развития (Fine о et al, 1994 и 1995). В связи с этим проблема нефротоксичности избыточных количеств ПТГ нуждается в дополнительном изучении. Предлагалось включать в протокол терапии хронической почечной недостаточности у собак и кошек пероральное введение витамина Д (кальцитриола) в дозах 1,5-3,5 нг/кг/день в тех случаях, когда концентрация фосфора в крови не превышает 6,0 мг/100 мл (что обычно является
746 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
результатом использования корма с низким содержанием кальция или применения связывающих его добавок), а произведение концентраций кальция и фосфора в сыворотке меньше 60.
Диагностическая дилемма. Выявление гиперкальциемии и азотемии ставит диагностическую проблему, поскольку гиперкальциемия может быть следствием ХПН или, как полагают, гиперкальциемия может вызвать азотемию. Мы не думаем, что гиперкальциемия при ПГПТ представляет опасность для состояния почек, если не считать повреждений, вызываемых почечными или мочевыми камнями. Однако этот вопрос до конца не ясен. Есть основания утверждать, что при ПГПТ и ХПН концентрация ПТГ в сыворотке должна быть нормальной или повышенной. Следует, однако, отметить два момента: (1) азотемия была обнаружена менее чем у 4% из 168 обследованных нами собак с ПГПТ и (2) при ПГПТ концентрация ионизированного кальция в сыворотке повышена у большинства собак, тогда как при ХПН она была повышена только у 6% собак, а у остальных была в норме или ниже нормы (см рис. 16-2 и 16-9) (Rosol et al, 2000). У 10 -20% собак с ХПН отмечалось слабое или умеренное увеличение общего кальция (обычно до 11,5-12,5 мг/100 мл) (Chew, Meuten, 1982; DiBartola et al, 1987). В одной группе собак с нарушенной функцией почек и гиперкальциемией у большинства животных с повышенной концентрацией общего кальция содержание ионизированного кальция было в норме или ниже ее (Chew, Nagode, 1990). Таким образом, нормальная или низкая концентрация ионизированного кальция при недостаточности почечной функции встречается чаще, чем можно было бы ожидать, исходя из уровня общего кальция в сыворотке крови. Иными словами, клинически значимая гиперкальциемия при ХПН на самом деле относительно редкое явление. Поскольку, однако, общее число собак и кошек с ХПН весьма значительно, гиперкальциемия периодически встречается, несмотря на ее относительную редкость при этом заболевании.
Клинические синдромы и принятие решения. У большинства собак и кошек с первичной недостаточностью почечной функции одновременно имеются азотемия, гиперфосфатемия и изостенурия. Клиническая симптоматика обычно характеризуется наличием анорексии, полиурии, полидипсии и вялости, снижением аппетита и потерей веса. Эти симптомы дополняются рвотой и/или диареей. Заболеваемость ПГПТ не зависит от возраста, пола или породы животных и во всех случаях болезнь имеет сходные клинические проявления, причем мы постоянно сталкиваемся с тем, что симптомы заболевания у собак с первичным гиперпаратиреозом отсутствуют или выражены слабо по сравнению с животными, страдающими нарушениями почечной функции. Чем тяжелее протекает заболевание, тем больше вероятность наличия у собаки (или кошки) первичной почечной недостаточности. Кроме того,
у животных с гиперкальциемией, обусловленной почечной недостаточностью, концентрация кальция в сыворотке обычно находится в интервале от 11,0 до 12,5 мг/100 мл, тогда как при ПГПТ она превышает 13 мг/100 мл.
В заключение можно сказать, что у собак и кошек со слабыми клиническими проявлениями заболевания или в их отсутствие, с устойчивой гиперкальциемией, превышающей 13,0 мг/100 мл, и нормальной или низкой концентрацией фосфатов обычно имеет место ПГПТ. Животные, имеющие концентрацию кальция в крови ниже 12,5 мг/100 мл и гиперфосфатемию, скорее всего, страдают первичной почечной недостаточностью. Когда состояние животного не отвечает этим критериям и диагноз остается неясным, необходимо дополнительное обследование. Результаты измерения уровня ионизированного кальция в сыворотке помогают отличить первичную почечную недостаточность (нормальная или низкая концентрация) от первичного гиперпаратиреоза (высокая концентрация) (см. рис. 16-2). УЗИ области шеи может выявить увеличение размеров нескольких желез (т.е. почечный вторичный гиперпаратиреоз) или только одной паращитовидной железы (т.е. аденому). Если же и это исследование окажется недостаточным, чтобы окончательно установить природу заболевания, следует измерить концентрации ПТГ и ПрПТГ. Наконец, хирургическое вмешательство может дать как лечебный эффект, так и ключ к установлению окончательного диагноза.
Острая почечная недостаточность
Если острая, тяжелая гиперфосфатемия у собаки является компонентом синдрома острой почечной недостаточности, концентрация кальция обычно остается в норме или понижена. Слабая гиперкальциемия, иногда обусловленная острой недостаточностью почечной функции, чаще всего отмечается у собак во время перехода от олигурической к полурической фазе выздоровления. Как и в случае хронической почечной недостаточности, патогенез гиперкальциемии при острой форме этого заболевания до конца не выяснен. В олигурической фазе острой почечной недостаточности возможно отложение кальция и фосфора в мягких тканях. Во время полиурической фазы по мере улучшения почечной функции происходит мобилизация этих элементов, в результате чего могут развиться гиперкальциемия и гиперфосфатемия (Llach et al, 1981). По альтернативному сценарию, быстрая нормализация почечной функции и концентрации фосфатов может вызвать временную гиперкальциемию в соответствии с законом действующих масс.
Алиментарный вторичный гиперпаратиреоз
Усиление секреции ПТГ при алиментарном вторичном гиперпаратиреозе представляет собой
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 747
нормальную компенсаторную реакцию на гиперкальциемию, индуцированную недостаточным поступлением кальция с пищей. Нарушение минерального баланса, приводящее к данному синдрому, обусловлено низким содержания в корме кальция или витамина Д либо чрезмерно большим содержанием фосфора при нормальном количестве кальция (Crager, Nachreiner, 1993). Алиментарный вторичный гиперпаратиреоз чаще всего развивается при кормлении животных исключительно мясной пищей, особенно печенкой или говяжьим сердцем (Capen, Martin, 1983).
У получающих такой корм животных происходит небольшое снижение концентрации кальция в сыворотке, но обычно она остается выше нижней границы нормы. Однако столь небольшое уменьшение уровня кальция оказывается достаточным, чтобы стимулировать секрецию ПТГ паращитовидными железами. При длительной стимуляции развиваются гиперплазия главных клеток и вторичный гиперпаратиреоз. Наиболее серьезным нарушением при этом является уменьшение содержания кальция в скелете. Поскольку у таких животных сохраняется нормальная почечная функция, гиперпаратиреоз сопровождается уменьшением резорбции фосфата в почечных канальцах (гиперфосфатурией) и усилением всасывания в них кальция. Поэтому у собак и кошек с описываемым синдромом концентрация кальция в сыворотке обычно находится на нижней границе нормы, а концентрация фосфора остается нормальной. У таких животных часты патологические переломы костей, что и является основной причиной их поступления в клинику.
Септическое заболевание костей, сепсис, шистосомоз и системные микозы
Иногда причинами гиперкальциемии служат бактериальный и грибковый остеомиелит или первичные и вторичные костные опухоли. Другой редкой причиной гиперкальциемии является неонатальная септицемия у щенков с септической эмболией и лизисом костей. У собак установлена также связь гиперкальциемии с бластомикозом, гистоплазмозом, шистосомозом, аспергиллезом и кокцидиомикозом в отсутствие поражения костной ткани (Legendre et al, 1981; Dow et al, 1986; Troy et al, 1987; Meuten, Armstrong, 1989; Rohrer et al, 2000; Fradkin et al, 2001; Parker, 2001). У двух собак с шистосомозом причиной гиперкальциемии было увеличение концентрации ПрПТГ (Fradkin et al., 2001). Патогенез индуцируемой сепсисом гиперкальциемии неизвестен, хотя обусловленное им воспаление может вызвать заметное разрушение костной ткани и мобилизацию кальция, достаточную для индукции гиперкальциемии (Meuten, 1984). Известную роль в патогенезе может играть продукция моноцитами и лимфоцитами факторов, активирующих остеокласты и вызывающих резорбцию костей, таких как цитокины и проста
гландины (Mundy et al, 1984). Жизнеспособные моноциты обладают остеолитической активностью, которая может усиливаться под воздействием эндотоксинов (McArthur et al, 1980). Гиперкальциемия при гранулематозном заболевании может быть связана также с нарушениями обмена витамина Д (Lemann, Gray, 1984).
Иммобилизационный остеопороз/опухоли, метастазирующие в кости
Иммобилизационный остеопороз редко бывает причиной гиперкальциемии у животных, утративших подвижность из-за обширной костно-мышечной или нервной травмы. Эта форма гиперкальциемии протекает относительно легко и сопровождается резорбцией костей, усиленной экскрецией гидроксипролина с мочой, замедленным образованием новой костной ткани, гиперкальциурией и остеопенией (Chew, Meuten, 1982). У собак и кошек довольно часто встречаются опухоли, метастазирующие в кости, однако, это далеко не всегда сопровождается гиперкальциемией. Напротив, у людей с вторичными костными опухолями гиперкальциемия обычна.
Гемоконцентрация, инфузия бикарбоната натрия и переливание плазмы
Иногда гиперкальциемия развивается при сильном обезвоживании организма, хотя мы ни разу не сталкивались с этой клинико-патологической проблемой в нашей практике (исключением является гипокортицизм). Тяжесть такой гиперкальциемии невелика, а само расстройство обусловлено уменьшением объема жидкости и вторичной ги-перпротеинемией. Инфузионная терапия приводит к устранению гиперкальциемии. Инфузия бикарбоната натрия уменьшает концентрацию общего и ионизированного кальция в крови (Chew et al, 1989). После переливания плазмы возможно временное увеличение концентрации общего кальция и уменьшение концентрации ионизированного кальция, по-видимому, из-за избыточного образования кальций-цитратных комплексов (Mischke et al, 1996).
Гипотермия, задержка плода и эндометрит
Описаны одна собака и одна кошка с тяжелыми гипотермией и гиперкальциемией, индуцированными внешними факторами (Ross, Goldstein, 1981). Гиперкальциемия быстро исчезала после согревания животных и проведения инфузионной терапии. Патогенез этого явления не выяснен. Известен также случай гиперкальциемии у собаки с задержкой плода и эндометритом (Hirt et al, 2000). Предстоит выяснить целесообразность включения этой патологии в число клинических состояний, требующих дифференциальной диагностики от гиперкальциемии.
748 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Возраст
См. раздел «Концентрация общего кальция в сыворотке крови».
Лабораторные ошибки
См. раздел «Концентрация общего кальция в сыворотке крови».
ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ (ПГПТ) У СОБАК
ВСТРЕЧАЕМОСТЬ
Возраст
ПГПТ чаще всего встречается у старых собак и значительно реже или, по крайней мере, не так часто -у кошек. Возраст 168 собак с ПГПТ, обследованных в нашей клинике на протяжении последних 20 лет, колебался от 4 до 17 лет, а в среднем составлял 11,2 года (рис. 16-11). При этом 162 собаки (96%) были в возрасте 7 лет и старше. Заболеваемость не зависела от пола - в группу входило 94 кобеля (56%).
Порода
Для правильного суждения о предрасположенности животных определенных пород к тому или иному заболеванию необходимы тщательные эпидемиологические исследования. Насколько нам известно, такие исследования в отношении первичного гиперпаратиреоза у собак никогда не проводились. В общей популяции животных, поступающих в нашу клинику по разным поводам, кеесхонды явно уступают по численности таким породам, как пудель, немецкая овчарка, ретриверы и некоторые другие. В
Рис. 16-11. Распределение 78 собак с первичным гиперпаратиреозом по возрасту. Средний возраст на момент установления диагноза составлял 10,5 лет.
ТАБЛИЦА 16-4. РАСПРЕДЕЛЕНИЕ ПО ПОРОДАМ 187 СОБАК С ПЕРВИЧНЫМ ГИПЕРПАРАТИРЕОЗОМ ПО ПОРОДАМ
Порода Процент
Кеесхонд 26
Лабрадор-ретривер 10
Немецкая овчарка 7
Кокер-спаниель 7
Золотистый ретривер 6
Спрингер-спаниель 5
Пудель 4
Ши-тцу 4
Австралийская пастушья собака 4
Доберман-пинчер 3
Родезийский риджбек 3
Породы, представленные дважды 11
то же время среди 168 собак с ПГПТ 44 (26%) были кеесхондами, хотя это далеко не самая популярная порода в нашем регионе. По уточненным данным, заболеваемость ПГПТ среди этих собак ниже 36%, которые приводились во втором издании данной книги. Другие породы, представленные в описываемой группе тремя и более особями, включали лабрадоров-ретриверов, немецких овчарок, золотистых ретриверов, ши-тцу, пуделей, спрингер-спаниелей, австралийских пастушьих собак, кокер-спаниелей, родезийских риджбеков, доберман-пинчеров и беспородных собак (табл. 16-4). Присутствие в нашей группе некоторых из перечисленных пород объясняется просто их очень большой популярностью. Для выяснения истинной предрасположенности той или иной породы к заболеванию ПГПТ необходимы эпидемиологические исследования. Однако два момента заслуживают особого упоминания. Во-первых, среди собак с ПГПТ явно повышено число кеесхондов; во-вторых, ПГПТ встречается у собак любой породы и любого возраста, начиная с четырех лет.
Наследственное заболевание
Наследственный неонатальный первичный гиперпаратиреоз с вероятным аутосомно-рецессивным
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 749
типом наследования был описан у двух немецких овчарок (Thompson et al, 1984). По-видимому, частота этого синдрома у щенков и/или молодых собак достаточно низка, поскольку других подобных сообщений в литературе не появлялось. В находившейся под нашим наблюдением группе собак с ПГПТ не было животных моложе 4 лет.
АНАМНЕЗ: КЛИНИЧЕСКИЕ СИМПТОМЫ
Общие сведения
Клиническая симптоматика, обусловленная исключительно гиперкальциемией, выражена слабо, а у многих собак вообще отсутствует. ПГПТ представляет собой единственное заболевание, при котором существенное значение имеет только гиперкальциемия. Наиболее частые признаки, которые мы связываем с ПГПТ, - это полиурия, полидипсия, плохой аппетит, пониженная общая активность (мышечная слабость?), а также образование камней или инфекция мочевых путей. К числу признаков, обусловленных исключительно гиперкальциемией, относятся желудочно-кишечные расстройства в форме анорексии, рвоты, запоров и, в редких случаях, панкреатита. Нарушения почечной функции включают полиурию, полидипсию и иногда проявления мочекаменной болезни, а расстройства со стороны ЦНС - заторможенность психической деятельности, уменьшение болевой чувствительности и даже кому. Нам пришлось наблюдать собаку с атаксией и вертячкой, которые исчезли после излечения ПГПТ. Если у собаки с гиперкальциемией появляются тревожные симптомы, то, скорее всего, они вызваны не ПГПТ, а другим заболеванием. Обычно такие симптомы обусловлены не самой гиперкальциемией, а вызвавшими ее заболеваниями, например, раком, почечной недостаточностью, гипокортицизмом или токсикозом.
При очень легкой форме ПГПТ клиническая симптоматика может вообще отсутствовать, и гиперкальциемия выявляется только после рутинного биохимического анализа сыворотки крови. Такая ситуация характерна для человека, у которого скрытый первичный гиперпаратиреоз встречается чаще, чем симптоматичная форма заболевания (Heath, 1989; Potts, 1990; Concensus Development Conference Panel, 1991; Silverberg et al, 1999). Первые клинические симптомы у собак выражены слабо, скрыто и носят неспецифический характер. Большинство владельцев животных не имеют представления о специфических клинических проявлениях ПГПТ. Только после назначения собаке лечения по поводу ПГПТ ее хозяин осознает задним числом, что у животного и ранее имелись признаки заболевания. Именно это обстоятельство послужило поводом для публикации передовой статьи в Английском медицинском журнале (New England Journal of Medicine), в которой утверждается, что все пациенты с ПГПТ нуждаются в лечении (Utiger, 1999).
ТАБЛИЦА 16-5. ПРОДОЛЖИТЕЛЬНОСТЬ КЛИНИЧЕСКИХ СИМПТОМОВ У 168 СОБАК СО СПОНТАННЫМ ГИПЕРПАРАТИРЕОЗОМ
Продолжительность (месяцы) Процент собак
< 1 19
1-3 20
3-6 19
6-12 24
> 12 18
ТАБЛИЦА 16-6. ПРОСПЕКТИВНАЯ ИЛИ РЕТРОСПЕКТИВНАЯ ЧАСТОТА КЛИНИЧЕСКИХ СИМПТОМОВ У 168 СОБАК СО СПОНТАННЫМ ПЕРВИЧНЫМ ГИПЕРПАРАТИРЕОЗОМ
Симптом Процент собак
Полиурия/полидипсия 81
Апатия 53
Недержание мочи 47
Общая слабость/непереносимость физичес- 47
ких нагрузок Отсутствие аппетита 37
Нарушения со стороны мочевого тракта (напряженность, кровь в моче, частое моче- 29
испускание) Мышечное истощение 17
Рвота 12
Дрожь 10
Запоры 6
Скованная походка 5
В обследованной нами группе собак с ПГПТ, 35% особей имели клинические симптомы, обусловленные первичным гиперпаратиреозом, на протяжении более 6 месяцев, и все 100% ретроспективно или проспективно имели такие симптомы в течение, по меньшей мере, 1 месяца (табл. 16-5). Клиническая симптоматика ПГПТ и гиперкальциемии, обычно включает одно, два или все три из перечисленных ниже типов расстройств: почечное, желудочно-кишечное и нервно-мышечное (табл. 16-6).
Почки, мочевой пузырь, мочеиспускательный канал
Полидипсия и/или полиурия. Наиболее частыми клиническими симптомами у собак с ПГПТ (у 136 из 168 особей или 81%) были полиурия, полидипсия и/или недержание мочи (см. табл. 16-6). Эти симптомы развивались как следствие нарушенной реакции почечных канальцев на АДГ и пониженного всасывания в них натрия и хлорида. Взятые вместе, эти изменения нормальных физиологических механизмов обусловливают значительное увеличение объема мочи. Они являются прямым следствием гиперкальциемии и/или избыточной концентрации ПТГ. Приобретенная и обратимая форма нефрогенного несахарного диабета индуцирует продукцию относительно разбавленной,
750 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ТАБЛИЦА 16-7. КОНЦЕНТРАЦИИ AM, КРЕАТИНИНА И ФОСФАТОВ В КРОВИ И УДЕЛЬНЫЙ ВЕС МОЧИ ПРИ УСТАНОВЛЕНИИ ДИАГНОЗА ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА У 168 СОБАК
ДМ (мг/100 мл) Креатинин (мг/100 мл) Фосфа! (мг/100 мл) Удельный вес мочи
Норма 18-28 0.5-1.6 3,0-6,2 -
Среднее дзя 168 собак 17,1 <10 = 6 (3%) 10-17= 101 (62%) 18-22 = 37 (22%) 23-28= 16(10%) 29-47 = 7(5%) >47= 1 1,0 < 0,5 = 0 0.6-0,9 = 76 (45%) 1,0-1,6 = 88 (52%) 1,7-2,0 = 3 (2%) 2.0-3.1 = 1 >3,0 = 0 2 8 <2 = 20(12%) 2.0-2,9 = 88 (53%) 3,0-3,9 = 47 (28%) 4.0-4.9 = 9 (5%) 5.0-6.2 = 3 (2%) > 6,2 = 1 1,011 < 1,008 = 43 (26%) 1.008-1,012 = 65 (39%) 1,013-1,020 = 52 (31%) 0,021-0,030= 4(2%) 1,030-1,039 = 4(2%) >1,040 = 0
не содержащей растворенных веществ мочи. Для сохранения нормоволемии развивается компенсаторная полидипсия. Как ни странно, большинство владельцев животных не замечают полидипсию и полиурию или считают их слабо выраженными. Однако анализ рутинной базы данных четко выявляет эти расстройства.
Удельный вес исходных проб мочи, полученных вскоре после госпитализации собак, свидетельствовал о ее значительно большем разбавлении, нежели можно было ожидать на основании наблюдений владельцев за состоянием животных. Среди 168 обследованных нами собак с ПГПТ у 43 (26° о) удельный вес мочи был от 1,001 до 1, 007. У 65 (39° о) животных удельный вес мочи оставался в изостенурическом диапазоне (от 1,008 до 1,012). У 52 (31%) собак он равнялся 1,013-1,020. Только в четырех пробах удельный вес составлял от 1,021 до 1,030, а еще в четырех превышал 1,030. Таким образом, у 96°о собак с ПГПТ удельный вес мочи был 1,020 или ниже (табл. 16-7).
Калькули и инфекции в мочевых путях. Еще одной частой причиной беспокойства владельцев животных с ПГПТ, являются клинические расстройства, связанные с инфекцией мочевых путей или калькулями (см. стр. 757). Эти расстройства включают частые и неотложные позывы на мочеиспускание, недержание мочи, гематурию, стангурию или кажущуюся непроходимость мочевого пути. В течение года, предшествовавшего установлению диагноза, владельцы 123 (73°о) из 168, по меньшей мере, однажды замечали тот или иной из перечис
ленных симптомов. У 53 (32%) из 168 собак, имевших ПГПТ, были обнаружены мочевые камни (рис. 16-12). а у 41 (24°о) инфекции мочевых путей.
Апатия, депрессия и пониженная активность
Апатия или пониженная активность были отмечены у 89 (53%) из 168 собак с ПГПТ. Причиной этих явлений может быть повышенная концентрация кальция, которая подавляет возбудимость центральной и периферической нервной ткани. С другой стороны, они могут быть отражением мышечной слабости. У людей с аналогичными признаками возникают неспецифические неврологические расстройства, включающие нарушение умственной деятельности, депрессию, ослабление глубоких сухожильных рефлексов и утрату болевых ощущений (Silverberg et al, 1999). Возможно, что у собак апатия и или депрессия при ПГПТ объясняются такими же расстройствами.
Слабость и мышечное истощение
Слабость или непереносимость физических нагрузок отмечались у 79 (47° о) из 168 собак с ПГПТ. Повышение концентрации кальция в крови приводит к уменьшению проницаемости клеточных мембран в нервной и мышечной тканях и, тем самым, к понижению их возбудимости. Кроме того, слабость скелетной мускулатуры, особенно проксимальных мышечных групп, может быть следствием первичной
Рис. 16-12. Содержащие кальций камни из мочевого пузыря двух собак с первичным гиперпаратиреозом (Л и В) и отдельные раздробленные камни от каждой особи (Б и Г).
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 751
нейропатии, которая, в конечном счете, приводит к атрофии мышц. Мышечное истощение и уменьшение веса тела были зарегистрированы у 28 (17%) из 168 собак нашей группы.
Потеря аппетита
У 62 (37%) из 168 собак с ПГПТ владельцы отмечали разную степень снижения аппетита По-видимому, в большинстве случаев это было обусловлено пониженной возбудимостью гладкой мускулатуры желудочно-кишечного тракта под воздействием гиперкальциемии либо было результатом прямого действия кальция на ЦНС (Chew, Сареп. 1980; Parfitt, Kleerekoper, 1980). В отличие от людей, у собак гиперкальциемия не сопровождается возникновением язв желудка или двенадцатиперстной кишки. У человека гиперкальциемия вызывает увеличение секреции гастрина и избыточную секрецию кислоты париетальными клетками желудка (Aurbach et al, 1985а).
Согласно распространенному мнению, уменьшение аппетита у некоторых собак с ПГПТ обусловлено почечной недостаточностью, связанной с гиперкальциемией. Однако только у 9 (5° о) из 168 собак нашей группы была обнаружена азотемия, о которой сучили по увеличению концентрации AM в крови до 31 мг/100 мл и выше. У одной из этих собак концен-грация AM превышала 50 мг/100 мл. У четырех из девяти животных с азотемией концентрация креатинина в сыворотке крови составляла 1,4 мг/100 мл или менее. Эти данные свидетельствуют о том, что нарушения почечной функции не играют существенной роли в снижении аппетита у собак с ПГПТ.
Дрожь, подергивание мышц и судороги
У собак с гиперкальциемией наблюдаются дрожь и подергивание мышц (Chew, Сареп, 1980), и было сообщение о судорожной активности у одной собаки с ПГПТ (Ihlc et al, 1988). Механизм этих явлений не вполне понятен, но может быть связан с образованием микротромбов в сосудах мозга, спазмом сосудов или подавлением защитных процессов в
мозге, которые блокируют распространение вызывающих судороги нервных импульсов (Ihlc et al, 1988). По мере увеличения тяжести гиперкальциемии неврологические расстройства могут, в конце концов, привести к ступору или коме, хотя это случается чрезвычайно редко. Мы нс наблюдали мышечных подергиваний ни у одной из поступивших в нашу клинику собак с ПГПТ, но владельцы 16(10° о) животных сообщали об эпизодах «дрожи» у животных. Как указывалось выше, одна собака страдала вертячкой и атаксией.
Другие (редкие) симптомы
К числу других клинических симптомов, связанных с ПГПТ у собак, относятся рвота, запоры, скованная походка, и переломы (см. табл. 16-6). Считается, что рвота и запоры являются следствием индуцируемого гиперкальциемией уменьшения возбудимости гладкой мускулатуры желудочно-кишечного тракта (Chew, Сареп, 1980; Parfitt. Kleerekoper. 1980). Другими причинами рвоты у собак с гиперкальциемией, хотя и редкими, могут быть сопутствующие панкреатит, недостаточность почечной функции или язвы желудка и кишечника. Панкреатит развился у одной из наблюдавшихся нами 168 собак с ПГПТ.
Интенсивная резорбция костей остеокластами при хроническом гиперпаратиреозе приводит к замещению костного матрикса фиброзной тканью, истончению и ослаблению коркового вещества кости и повышенной частоте переломов даже под воздействием небольшой механической нагрузки. Значительное уменьшение толщины коркового слоя костей аксиального скелета может стать причиной хромоты. Компрессионные переломы тел позвонков приводят к нарушению периферической моторной функции (рис. 16-13). Одним из осложнений ПГПТ у людей являются неспецифические артралгии (Arnaud. Kolb. 1991). Метастатическое обызвествление сухожилий и суставных сумок приводит к нарушению походки и хромоте. Скованная походка была зарегистрирована у 7 (4%) из 168 собак с ПГПТ (см. табл. 16-6).
Рис. 16-13. Боковая рентгенограмма шейного отдела собаки с множественной миеломой и гиперкальциемией. Обратите внимание на тяжелый остеолиз нескольких позвонков. Рентгенологическая картина соответствует диа1 нозу гиперкальциемии, вызванной злокачественным ростом.
752 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Заключение
В тех случаях, когда ПГПТ у собак сопровождается клиническими проявлениями заболевания, они обычно связаны с нарушениями в одной из трех систем: в почках (полиурия, полидипсия и мочевые камни), нервно-мышечной системе (апатия, общая мышечная слабость) и/или желудочно-кишечном тракте (пониженный аппетит). Наличие хотя бы одного из этих симптомов вызывает подозрение на гиперкальциемию, хотя чаще всего ПГПТ случайно обнаруживается при просмотре рутинной базы данных, собранной совсем по другому поводу.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Общий осмотр
Физикальное исследование собак с ПГПТ обычно не выявляет существенных аномалий. Если же они имеются, то чаще всего обусловлены либо присутствием мочевых камней, либо некоторыми сопутствующими и не связанными с ПГПТ расстройствами, либо они выражены слабо и носят неспецифический характер. Это важно иметь в виду, поскольку для подтверждения ПГПТ у собак с гиперкальциемией необходима дифференциальная диагностика от таких заболеваний, как лимфосаркома, ХПН, карциномы апокринных желез заднепроходной пазухи, гипокортицизм, множественная миелома и токсикоз вследствие избытка витамина Д. Собаки с перечисленными расстройствами выглядят больными, иногда тяжело больными. Иными словами, если при наличии у старых собак гиперкальциемии, их состояние остается стабильным и они кажутся здоровыми, то, скорее всего, у них именно ПГПТ, а не более тяжелое заболевание, вызывающее вторичную гиперкальциемию.
Частые нарушения
К числу возможных нарушений (не связанных с наличием камней в мочевых путях), которые могут быть выявлены при физикальном исследовании собак с ПГПТ, относятся уменьшение веса тела, генерализованная мышечная атрофия и/или слабость. Степень мышечной слабости может быть разной, но обычно она выражена слабо или вообще не заметна. Среди костных дефектов отмечались деформации верхней и нижней челюстей и переломы длинных костей (Сареп, Martin, 1983), однако эти аномалии не были обнаружены ни у одной из наших 168 собак с ПГПТ.
Офтальмологические расстройства
У людей с ПГПТ офтальмологические расстройства включают «полосчатый кератит» и отложение кальция под конъюнктивой (Aurbach et al, 1985а). Полосчатый кератит является следствием отложения
кальция фосфата в роговице в форме параллельных непрозрачных полос на ее периферических участках. Лучше всего эти полосы видны при осмотре с помощью щелевой лампы.
Пальпируемые паращитовидные опухоли
Увеличение паращитовидных желез у собак при пальпации обнаружить практически невозможно. Мы не выявили его этим способом ни у одной из 168 собак с ПГПТ. Даже при подтвержденном диагнозе ПГПТ пальпируемый в шейной области узел, скорее всего, относится к щитовидной железе или другой структуре, а не к паращитовидным железам. Опухоли паращитовидных желез не удается пальпировать, потому что они локализованы дорсо-лате-рально по отношению к трахее, покрыты несколькими мышечными слоями, а их диаметр не превышает 4-10 мм (опухоль диаметром 20 мм считается очень большой). Хотя нам не удалось идентифицировать пальпируемое увеличение паращитовидных желез у наших собак, пальпируемые опухоли были обнаружены у четырех из восьми кошек с ПГПТ.
Важность тщательного физикального исследования
Тщательное физикальное исследование животных с подтвержденной гиперкальциемией обязательно. Обычно оно не выявляет серьезных изменений у собак с ПГПТ, а при наличии таковых они не связаны с ПГПТ. Обнаружение специфических расстройств при физикальном исследовании может дать материал для дифференциальной диагностики. Как указывалось ранее, весьма распространенными причинами гиперкальциемии у собак являются злокачественные опухоли и хроническая почечная недостаточность. Для постановки окончательного диагноза ПГПТ у животных с гиперкальциемией эти причины следует полностью исключить.
Для выявления опухоли необходимо тщательно пальпировать периферические лимфатические узлы, молочные железы и область промежности. Не менее важно исследовать прямую кишку и влагалище. Лимфосаркома в одних случаях выявляется очень легко, а в других - с большим трудом. Мы не исключаем эту опухоль из числа заболеваний, требующих дифференциальной диагностики, до тех пор, пока не будет установлен другой диагноз. Помимо малигнизации, физикальное исследование может указать на другие возможные причины гиперкальциемии. В частности, тщательная пальпация позволяет выявить аномальное состояние почек при нарушении их функции или «гуттаперчевую» челюсть, т.е. размягчение ткани нижней челюсти вследствие интенсивной резорбции ее костного компонента. У собак с гипокортицизмом (болезнью Аддисона) отмечаются брадикардия, слабая пульсация бедренной артерии, дегтеобразный стул и кровянистые выделения из прямой кишки.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 753
КЛИНИЧЕСКАЯ ПАТОЛОГИЯ
Гемограмма
У собак с ПГПТ отсутствуют характерные изменения гемограммы, тогда как у людей с этим заболеванием отмечаются нерегенеративная анемия и увеличение скорости осаждения эритроцитов. У собак с ПГПТ не найдены специфические изменения в аспиратах костного мозга или мазках периферической крови.
Биохимический профиль сыворотки
В связи с большим разнообразием факторов, которые влияют на концентрацию кальция в сыворотке крови (и помня о необходимости дифференциальной диагностики гиперкальциемии), важен каждый параметр биохимического профиля сыворотки. В частности, концентрацию кальция в сыворотке следует интерпретировать с учетом концентраций альбумина, фосфора, AM и креатинина.
Концентрация общего кальция в сыворотке крови
Результаты, полученные у людей и собак. Гиперкальциемия является главным отличительным признаком ПГПТ (см. рис. 16-2 и 16-9). Средняя концентрация кальция в сыворотках 168 собак с ПГПТ в обследованной нами группе составляла 14,3 мг/100 мл при ее колебаниях у отдельных особей от 12,1 до 23,0 мг/100 мл (табл. 16-8). Указанное среднее значение может быть и иным, так как мы считаем гиперкальциемическими только тех животных, у которых концентрация кальция в сыворотке выше 12,0 мг/100 мл (при верхней границе нормы 11,7 мг/100 мл). У большинства поступавших к нам животных гиперкальциемия была до этого зарегистрирована местным ветеринаром по меньшей мере дважды, а затем несколько раз подтверждена повторными измерениями в нашей клинике. У 92 (55%) из 168 собак с ПГПТ концентрация кальция при поступлении была 12-14 мг/10 мл, еще у 52 (31%) равнялась 14 - 16 мг/100 мл, у 16 (9%) - 16 - 18 мг/100 мл и только у 8 собак (5%) превышала
18 мг/100 мл (от 18 до 23 мг/100 мл). Интересно, что у восьми последних животных с тяжелой гиперкальциемией средняя концентрация AM в крови составляла 22 мг/100 мл и только у одной собаки превышала верхнюю границу нормы, равную 28 мг/100 мл.
Распространенное мнение о том, что в отсутствие лечения ПГПТ концентрация кальция в сыворотке крови прогрессивно нарастает, подтверждается не у всех больных людей. Одно из исследований включало группу из 60 пациентов с «асимптоматичным» ПГПТ, которые не получали никакого лечения на протяжении 10 лет. Средняя концентрация общего кальция в сыворотках их крови во время установления диагноза составляла 10,5 мг/100 мл (при индивидуальных колебаниях от 8,4 до 10,2 мг/100 мл). Спустя 5 лет она равнялась 10,6 мг/100 мл, а через 10 лет -10,3 мг/100 мл (Silverberg et al, 1999). У 8 больных на протяжении десятилетнего периода наблюдений появились мочевые камни, а у остальных 52 клинические проявления заболевания по-прежнему отсутствовали. У двух из этих 52 в течение того же времени развилась «выраженная гиперкальциемия» (определявшаяся как повышение концентрации кальция выше 12 мг/100 мл), у восьми - значительная гиперкальциурия, а у шести уменьшилась плотность костного вещества. У всех 52 пациентов болезнь протекала бессимптомно, и ни у одного не появились мочевые камни. У всех наших собак с ПГПТ имела место устойчивая гиперкальциемия. Мы предполагаем, что связанная с ПГПТ гиперкальциемия у собак остается стабильной или медленно возрастает со временем, однако, исследования, проводившиеся на произвольно выбранных нелеченых животных, не были завершены.
Факторы, влияющие на концентрацию кальция в сыворотке крови
Ошибки при работе с пробами. При определении концентрации общего кальция в сыворотке крови с помощью некоторых автоматических анализаторов при наличии выраженной липемии можно получить ложно завышенные результаты (до 20 мг/100 мл) из-за помутнения проб. Гемоконцентрация (дегидратация) вызывает слабое повышение
ТАБЛИЦА 16-8. КОНЦЕНТРАЦИИ ОБЩЕГО (168 СОБАК) И ИОНИЗИРОВАННОГО (117 СОБАК) КАЛЬЦИЯ И ПАРАТИРЕОИДНОГО ГОРМОНА (ПТГ) В СЫВОРОТКАХ 121 СОБАКИ И РАЗМЕР ОПУХОЛИ ПАРАТИРЕОИДНЫХ ЖЕЛЕЗ ПО ДАННЫМ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ У 77 СОБАК (ВОСЕМЬ ИЗ НИХ ИМЕЛИ ПО ДВЕ ОПУХОЛИ КАЖДАЯ) С ПЕРВИЧНЫМ ГИПЕРПАРАТИРЕОЗОМ (ПГПТ)
Общий кальций (мг/100 мл) Ионизированный кальций (мг/100 мл) ПТГ (пмоль/л) Размер опухоли на ультрасонограмме (мм)
Норма 9,6-11,7 1,12-1,42 2-13 <4
Среднее (собаки с ПГПТ) 14,3 1,72 11,9 7
Диапазон (собаки с 12,1-23,0 1,22-2,29 3,7-121 4-23
ПГПТ) 12-14 = 92 (55%) 14-16 = 52 (31%) 16-18 = 16 (9%) >18 = 8 (5%) 1,22-1,42 = 9 (8%) 1,43-1,65 = 31 (26%) 1,66-1,90 = 57 (49%) > 1,9 = 20 (17%) 3,7-7,9 = 54 (45%) 8,0-13,0 = 34(28%) 13,1-20,0=13(11%) > 20 = 20 (16%) 4-6 = 51 (60%) 7-10 = 22 (26%) 11-15 = 7 (8%) >15 = 5 (6%)
754 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
уровня сывороточного кальция (в типичном случае не более чем до 13 мг/100 мл). Гемолиз также приводит к завышению результатов при определении общего кальция с помощью автоматических анализаторов. У молодых особей уровень кальция несколько выше, чем у взрослых. Ложное увеличение уровня кальция отмечается также при анализе проб крови, полученных непосредственно после кормления животных. К таким же последствиям может привести введение в корм слишком большого количества соединений, связывающих фосфаты.
Обработка проб ЭДТА завышает результаты определения кальция методом атомной абсорбционной спектроскопии и занижает их при использовании других аналитических методов. Сбор и хранение проб в стеклянных или пластмассовых емкостях, вымытых с применением детергентов, также приводит к искажению (завышению или занижению) результатов анализа. Обычно в таких пробах ложно завышена или занижена концентрация и других электролитов (Meuten, 1984; Meuten, Armstrong, 1989). Даже простое длительное хранение проб может послужить причиной артефактов при анализе концентрации кальция, также как их загрязнение посторонним материалом (например, мелом для писания на доске). Повторный анализ свежеполученных проб крови помогает избежать этих ошибок.
Концентрация белка в плазме крови. Исчерпывающее обсуждение влияния общего белка и альбумина на результаты определения общего и ионизированного кальция содержится в гл. 17, стр. 798.
Кислотно-щелочное равновесие. При ацидозе уменьшается сродство белков плазмы к кальцию, что приводит к повышению концентрации ионизированного кальция и вызывает состояние слабой физиологической гиперкальциемии. При алкалозе имеет место противоположная ситуация, приводящая к физиологической гипокальциемии. Общая концентрация кальция изменяется с изменением кислотно-щелочного баланса приблизительно параллельно изменению концентрации ионизированного кальция (Meuten, 1984). В связи с этим, при ацидозе возрастают концентрации как общего, так и ионизированного кальция, а при алкалозе наблюдается обратная картина.
Возраст. При интерпретации результатов определения кальция, фосфора и щелочной фосфатазы в сыворотке следует принимать во внимание возраст животного. У молодых собак концентрация кальция в целом выше, чем у взрослых (Meuten, 1984). У первых нормальной считается концентрация общего кальция примерно 11,4 ± 0,4 мг/100 мл (от 10,5 до 11,5 мг/100 мл), тогда как у взрослых особей этот показатель ниже (8,8 - 11,0 мг/100 мл) (Meuten et al., 1982).
Концентрация ионизированного кальция в сыворотке крови. Как говорилось выше, биологически активной формой общего кальция является его ионизированная фракция. Этот факт, а также увеличение числа лабораторий, располагающих возможностями для определения ионизированного кальция, и накопление данных о том, что у собак с хронической почечной недостаточностью кон-
Методы, используемые для оценки гиперкальциемии
Токсикоз, вызванный витамином Д
Гиперкальциемия, вызванная злокачественным ростом
Определить [Витамин Д]
Рис. 16-14. Алгоритм диагностики, иллюстрирующий потенциальное значение и применение различных новых методов оценки гиперкальциемии у собак. [ ] - концентрация
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 755
(редко)
Гиперкальциемия, вызванная злокачественным ростом (увеличение ПрПТГ, концентрация ионизированного кальция должна быть повышена, провести повторное определение)
Повторное определение кальция (неадекватная проба?)
Первичная почечная недостаточность
Почечный вторичный гиперпаратиреоз
Кишечное заболевание
Внутривенное введение фосфата
или
Первичный гиперпаратиреоз (ионизированный кальций должен быть повышен - повторить измерение)
Рис. 16-15. Алгоритм установления причин снижения концентрации ионизированного кальция в сыворотке крови у собак.
центрация ионизированного кальция остается нормальной или понижается, тогда как в большинстве других случаев гиперкальциемии она увеличена, объясняет постоянно растущий интерес к его определению у собак с гиперкальциемей и гипокальциемией (рис. 16-14 и 16-15). Средняя концентрация ионизированного кальция у 117 собак с ПГПТ равнялась 1,72 ммоль/л при колебаниях от 1,22 до 1,29 ммоль/л (норма: 1,12-1,42 ммоль/л, см. табл. 16-8). У девяти из этих 117 животных (8%) концентрация ионизированного кальция оставалась в нормальных пределах, у 31 (26%) составляла от 1, 43 до 1,65 ммоль/л, у 57 (49%) - от 1,66 до 1, 9 ммоль/л, а у 20 (17%) она превышала 1,9 ммоль/л. В целом, имелась положительная корреляция между концентрациями общего и ионизированного кальция. В то же время у всех собак с ПГПТ концентрация общего кальция была выше нормы, тогда как концентрация ионизированного кальция оставалась нормальной у 8% особей. Мы подозреваем, что кажущееся сохранение нормальной концентрации ионизированного кальция связано с воздействием посторонних факторов (pH, получение и хранение проб в аэробных условиях), которые влияют на ионизированную фракцию, но не сказываются на концентрации общего кальция.
Концентрация фосфора в сыворотке крови. Концентрация фосфора в сыворотке крови у собак с ПГПТ, как правило, низкая или находится на нижней границе нормы (< 4 мг/100 мл) (см. рис. 16-9). Гипофосфатемия развивается в результате того, что ПТГ подавляет всасывание фосфора в почечных канальцах, что сопровождается усилением выведения фосфатов с мочой. У 168 собак с ПГПТ средняя концентрация фосфора в сыворотке крови была ниже минимальной нормальной величины и составляла 2,8 мг/100 мл. У отдельных животных она колебалась от 1,5 до 6,8 мг/100 мл (при норме 3,0-6,2 мг/100 мл, табл. 16-7). У 20 из 168 собак (12%) концентрация фосфатов в сыворотке была ниже 2,0 мг/100 мл, у 88 (53%) - 2-2,9 мг/100 мл, у 47 (28%) оставалась на нижней границе нормы (3,0-3,9 мг/100 мл), у 9 (5%) соответствовала среднему нормальному диапазону, а у 4 (2%) была 5,0 мг/100 мл или выше, но только у одной из них превышала нормальную величину (6,8 мг/100 мл). Интересно, что у пяти из 168 собак концентрация AM в крови была выше нормального уровня 28 мг/100 мл. Концентрация фосфора в сыворотках крови этих животных составляла соответственно 3,9, 3,9, 4,6, 4,8 и 6,8 мг/100 мл. Приведенные данные свидетельствуют о том, что концентрация фосфатов в сыворотке крови
756 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ТАБЛИЦА 16-9. ВОЗМОЖНЫЕ ПРИЧИНЫ ГИПОФОСФАТЕМИИ
Уменьшение кишечного всасывания
Пониженное потребление с кормом Нарушение всасывания/стеаторея Рвота/понос
Использование антацидов, связывающих фосфаты Недостаточность витамина Д
Усиление экскреции с мочой
Первичный гиперпаратиреоз Сахарный диабет ± кетоацидоз Гиперкортицизм (спонтанный/ятрогенный) Синдром Фанкони (дефект почечных канальцев) Введение диуретиков или бикарбоната Восстановление после гипотермии Г иперальдостеронизм
Интенсивная парентеральная инфузия жидкости Гиперкальциемия, вызванная злокачественным ростом (ранние стадии)
Межклеточные сдвиги
Введение инсулина
Парентеральное введение глюкозы
Перекармливание
Респираторный алкалоз
у собак с ПГПТ в большинстве случаев ниже нормы или соответствует минимальной нормальной величине. Только у 13 из 168 обследованных животных с ПГПТ концентрация сывороточного фосфора была 4 мг/100 мл или выше (см. табл. 16-7).
Результаты определения концентрации фосфора всегда необходимо рассматривать с учетом концентрации кальция и состояния почечной функции. Гипофосфатемия при нормальном содержании фосфора в корме и отсутствии в нем связывающих фосфор веществ служит показателем ПГПТ и гиперкальциемии вследствие злокачественного роста (см. рис. 16-9). Другие причины гипофосфатемии встречаются реже (табл. 16-9).
Гиперфосфатемия в отсутствие азотемии предполагает, что гиперкальциемия не обусловлена нарушением функции паратиреоидных желез. В случае гиперфосфатемии в сочетании с азотемией ветеринарный врач должен проанализировать анамнестические данные, результаты физикального исследования и других диагностических тестов, чтобы установить, имеется ли у собаки гиперкальциемия с вторичной почечной недостаточностью или почечная недостаточность с вторичной гиперкальциемией. Такой дифференциальный диагноз достаточно сложен. Важным подспорьем может оказаться определение концентрации ионизированного кальция. У собак с недостаточностью почечной функции и повышенной концентрацией общего кальция в сыворотке содержание ионизированного кальция обычно в норме или несколько понижено, а у животных с ПГПТ повышается концентрация как общего, так и ионизированного кальция.
При оценке результатов определения фосфора следует принимать во внимание возраст животных.
У молодых собак (в возрасте до года) концентрация фосфора в сыворотке обычно выше, чем у взрослых. У щенков концентрации фосфора и кальция одинаковы (примерно по 10 мг/10 мл), но концентрация фосфора постепенно снижается и к 9-12 месяцу жизни достигает величины, характерной для взрослых собак.
Азот мочевины в крови и креатинин в сыворотке крови. У собак с неосложненным первичным гиперпаратиреозом показатели почечной функции (концентрации AM и креатинина) обычно остаются в норме (см. табл. 16-7). Средняя концентрация AM в крови 168 собак с ПГПТ составляла 17,1 мг/100 мл (при норме 18-28 мг/100 мл). У шести особей (3%) концентрация AM не превышала 10 мг/100 мл, у 101 (60%) составляла 10-17 мг/100 мл, у 37 (22%) - 18-22 мг/100 мл, у 16 (10%) - 23-28 мг/100 мл, а у 8 (5%) была 29 мг/100 мл или выше. У восьми собак концентрация AM была аномально высокой - от 31 до 67 мг/100 мл.
У всех животных с нормальной или пониженной концентрацией AM в крови концентрация креатинина в сыворотке также была в норме. Нормальная концентрация креатинина (в диапазоне от 0,5 до 1,4 мг/100 мл) сохранялась и у четырех из восьми собак с аномально высокой концентрацией AM. Максимальная концентрация креатинина, зарегистрированная в группе из 168 собак с ПГПТ, составляла 2,3 мг/100 мл. Это наблюдение приобретает особый интерес, если принять во внимание средний возраст животных (11,2 года). Имеющиеся литературные данные показывают, что гиперкальциемия, особенно хроническая, может приводить к нарушению почечной функции. Однако у нас создается впечатление, что животные с ПГПТ защищены от поражения почек то ли в силу низкой величины произведения концентраций фосфора и кальция, то ли действия каких-то других факторов. Как бы то ни было, полученные показатели уровня AM и креатинина в крови этих животных представляют значительный интерес.
Наличие азотемии у собаки или кошки с гиперкальциемией при величине произведения концентраций кальция и фосфора более 80 служит показанием к назначению лечения для уменьшения содержания обоих элементов и улучшения почечной перфузии (см. раздел «Острая медикаментозная терапия гиперкальциемии», стр. 768). Комбинация азотемии, гиперкальциемии и гиперфосфатемии представляет собой сложную диагностическую дилемму, поскольку встречается как у собак с первичной почечной недостаточностью (часто), так и у животных с первичным гиперпаратиреозом (очень редко). Дифференциальная диагностика этих состояний в настоящее время облегчается благодаря доступности методов определения концентраций ионизированного кальция и ПТГ (см. рис. 16-14 и 16-15).
Щелочная фосфатаза в сыворотке крови (ЩФС). У человека активность ЩФС при ги
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 757
перкальциемии, обусловленной злокачественными опухолями, повышается чаще, чем при ПГПТ (Arnaud, Kolb, 1991). В ветеринарии увеличение концентрации ЩФС в крови оценивается как неспецифическое изменение. У собак с ПГПТ в обследованной нами группе такое увеличение было зарегистрировано только у 19% животных и было незначительным (в 2-6 раз), причем средняя концентрация ЩФС составляла 179 МЕ/л (52 - 866 МЕ/л). Повышение концентрации этого фермента, если оно имеет место, по-видимому, объясняется компенсаторным усилением активности остеокластов в перекладинах костей в ответ на механическую нагрузку на ослабленные интенсивной резорбцией кости (Сареп, Martin, 1983).
Аланинаминотрансфераза (АЛТ) в сыворотке крови. У собак с ПГПТ концентрация АЛТ в сыворотке крови обычно не отличается от нормальной. Ее слабое увеличение не имеет существенного клинического значения. Результаты обследования собак нашей группы не подтверждают предположение, согласно которому небольшое повышение активности АЛТ может быть отражением почечной ишемии в результате дегидратации. Альтернативное объяснение, состоящее в том, что изменение активности АЛТ у собак с ПГПТ происходит под воздействием метастатической кальцификации печени, также представляется маловероятным. Умеренное или сильное увеличение концентрации АЛТ может предполагать наличие гиперкальциемии, обусловленной злокачественной опухолью (например, лимфосаркомой), при сопутствующем поражении печени.
Концентрация хлоридов в сыворотке крови. Избыточная секреция ПТГ у человека приводит к уменьшению всасывания бикарбоната в проксимальных почечных канальцах, которое сопровождается усилением резорбции хлоридов и приводит к слабому гиперхлоремическому ацидозу канальцев. Увеличение концентрации хлоридов в сыворотке людей с гиперкальциемией и гипофосфатемией при повышении ее отношения к концентрации фосфатов выше 33 считается характерным признаком ПГПТ (Arnaud, Kolb, 1991). По мере совершенствования и большей доступности надежных методов определения ПТГ и ПрПТГ оценка уровня сывороточных хлоридов все больше утрачивает значение для клиники. Тем не менее, гиперхлоремия может усугублять гиперкальциемию, так как препятствует нормальному связыванию кальция с альбумином в крови и способствует растворению минерального вещества костей.
Липаза. Концентрацию липазы в крови оценивают с целью исключения сопутствующего панкреатита, хотя этот метод нельзя считать абсолютно достоверным. Описанная у человека комбинация хронического панкреатита и ПГПТ (Aurbach et al, 1985b) была обнаружена только у одной из 168 наших собак.
Анализ мочи
Удельный вес. Ни одно из нарушений, выявляемых при анализе мочи, не считается патогномоничным для ПГПТ у собак. Поражает, тем не менее, очень большое количество этих животных, имеющих разбавленную мочу. Ее удельный вес у 168 собак нашей группы составлял в среднем 1,011. При поступлении в клинику у 43 (26%) животных удельный вес мочи был ниже 1,008, 65 (39%) - от 1,008 до 1,012, у 52 (31%) - от 0,013 до 1,020 и у 4 (2%) - от 1,021 до 1,030. Еще у 4 собак этот показатель превышал 1,030 (см. табл. 16-7). В целом, эти цифры отражают влияние гиперкальциемии на активность АДГ и концентрирующую способность почек. Как указывалось ранее, гиперкальциемия индуцирует обратимую форму нефрогенного несахарного диабета.
Изостенурия (или гипостенурия) может развиться при гиперкальциемии любого происхождения. Поэтому считается, что сочетание гиперкальциемии и разбавления мочи представляет собой причинно-следственное явление, не специфичное ни для какого состояния. Вместе с тем, такая ситуация может приводить к путанице, поскольку прогрессирующая почечная недостаточность нуждается в дифференциальной диагностике от изос-тенурии. Для выявления причины изостенурии и гипостенурии необходим тщательный анализ биохимического профиля сыворотки и других параметров.
Мочевой осадок. При анализе мочевого осадка собак с ПГПТ нередко выявляют гематурию, пиурию, бактериурию и кристаллурию. Пятьдесят три (33%) из 168 собак с ПГПТ имели в анамнезе удаление мочевых камней в течение 12 месяцев, предшествовавших направлению в нашу клинику, либо такие камни были обнаружены у них при первичном рентгенографическом или ультразвуковом исследовании после поступления. У 41 из 168 собак (24%) первичное обследование выявило также инфекции мочевых путей в прошлом или настоящем. Возможно, что гиперкальциурия, ацидоз проксимальных почечных канальцев в сочетании с нарушенной резорбцией в них бикарбоната и продукцией щелочной мочи предрасполагают собак к развитию бактериального цистита, образованию камней в почках или мочевом пузыре. Все мочевые камни состояли из фосфата и оксалата кальция или их смеси (см. рис. 16-12).
Анализ газового состава крови
У людей с ПГПТ часто развивается слабый или умеренный гиперхлоремический метаболический ацидоз как следствие нарушения резорбции бикарбоната в проксимальных почечных канальцах. При этом усиливается выделение бикарбоната с мочой на фоне уменьшения экскреции водородных ионов и хлорида. Тяжесть ацидоза еще более
758 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Рис. 16-16. Латеральная рентгенограмма грудной клетки собаки с лимфосаркомой и гиперкальциемией. Обратите внимание на наличие грудинной лимфаденопатии (показана стрелкой).
повышается по мере продолжающегося ухудшения почечной функции. Указанные процессы у собак не описаны.
ЭЛЕКТРОКАРДИОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ
При экспериментальной гиперкальциемии усиливаются сокращения миокарда, уменьшается продолжительность механической желудочковой систолы и нарушается автоматичность миокарда. Потенциальные электрокардиографические изменения при гиперкальциемии включают удлинение интервала Р-R и уменьшение длины интервала Q-I в результате укорочения сегмента ST (Feldman, 1989). Теоретически, снижение скорости проведения в миокарде и уменьшение рефрактерного периода может предрасполагать к развитию сердечной аритмии. Однако у обследованных нами собак с ПГПТ тяжелая гиперкальциемия не ассоциировалась с изменениями на электрокардиограмме, если не считать случайных эпизодов преждевременного сокращения желудочков.
РЕНТГЕНОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ
Общие сведения
Рутинное рентгенографическое исследование является частью диагностического обследования собак и кошек с гиперкальциемией (см. раздел «Методы диагностики гиперкальциемии», стр. 762). Рентгенографию грудной клетки и брюшной полости проводят с целью выявления скрытой неоплазии, которая не диагностируется при физикальном исследовании. УЗИ брюшной полости более информативно, чем рентгенография, хотя оба метода дополняют друг друга. Отсутствие аномалий при
рентгено! раграфическом или ультразвуковом исследовании собаки или кошки с гиперкальциемией может свидетельствовать о наличии как ПГПТ, так и других заболеваний, требующих дифференциальной диагностики.
Рентгенография грудной клетки
Главная цель рентгенографического исследования собак и кошек с гиперкальциемией состоит в идентификации нарушений, которые могут помочь установить причину заболевания. В передней части средостения, перипортальной области и грудинных лимфатических узлах выявляют опухолевые массы или лимфаденопатию. Опухоль в переднем отделе средостения является классическим признаком гиперкальциемии у собак с лимфосаркомой (рис. 16-16). Необходимо оценить состояние видимых на снимке ребер, позвонков и длинных костей для выявления зон остеолиза, появление которых обусловлено миеломой или другими метастазирующими опухолями. Столь же тщательно оценивается состояние легочных полей с целью выявления возможных опухолей, возникновение которых обусловлено первичным и вторичным метастазированием.
Рентгенография брюшной полости и скелета
Сублюмбарная область и лимфатические узлы брыжейки осматриваются для выявления их увеличения, которое может подтвердить диагноз метастазирующей карциномы апокринных желез заднепроходной пазухи или лимфомы (табл. 16-17). Увеличение и изменение контуров печени и селезенки может быть обусловлено лимфомой. У собак с ПГПТ рентгенография редко выявляет существенные аномалии, если не считать камней в мочевом тракте. Как
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 759
Рис. 16-17. Латеральная рентгенограмма каудальной части брюшной полости собаки с аденокарциномой апокринной железы за шепроходной полости и гиперкальциемией. Обратите внимание на множественные опухолевые массы в сублюмбарноп области и таювом канале (показаны стрелками), пре (полагающие их инвазию в сублюмбарныс лимфатические узлы.
указывалось выше, мочевые камни, особенно в мочевом пузыре, обнаруживаются примерно у трети собак с ПГПТ. Калькули находили также в почках, мочеточниках и мочеиспускательном канале таких животных.
Паратиреоидная остеодистрофия, классическое костное заболевание у человека при первичном и вторичном гиперпаратиреозе, редко встречается у собак. Рентгенографически она проявляется как генерализованная остеопения, усиление костной резорбции, особенно на поднадкостничных поверхностях, и формирование кист или кистозоподоб-ных зон в костях. У лютей патологический процесс обычно захватывает фаланги пальцев и череп, а в тяжелых случаях также длинные кости, коленные чашечки и ребра. Клинически заболевание проявляется как боль в костях, патологические переломы. костные кисты и локальное разбухание костей (Hruska, Teitelbaum, 1995). К числу других изменений, которые могут обнаружиться при рентгенографическом исследовании животных с ПГПТ, относятся утрата твердой пластинки (lamina dura), переломы длинных костей и позвонков, обызвествление мягких тканей. Однако эти аномалии вс тречаются редко и имеют неепсцифический характер.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Ультразвуковое исследование шейной области
Общие сведения. УЗИ паращитовидных желез широко применяется в диагностике гиперкальциемии у человека. Этот метод позволяет дифференцировать первичный и вторичным гиперпаратиреоз, подтвердить наличие патологии выявленной при изучении биопсииного материала, полученного путем аспи
рации под контролем ультразвука, и установить местонахождение аденомы паращитовидных желез до операции. Чувствительность ультразвуковой диагностики одного или более нарушений со стороны паращитовидных желез у человека составляет 69-88%, что сопоставимо с чувствительностью радиосцинтиопэафии и ангиографии и несколько выше, чем при компьютерной (К Г) или магнитно-резонанснои (МРТ) томографии (Attie et al, 1988; Krubsack et al, 1989). По мере дальнейшего совершенствования ультразвуковой аппаратуры повышается и чувствительность метода. С помощью УЗИ легко визуализируются опухоли диаметром 2-3 мм. Точность ультразвуковой диагностики зависит о г опыта и квалификации оператора в большей степени, чем в случае большинства альтернативных методов (Lloyd et al, 1990).
Собаки. За последние годы мы имели возможность провести УЗИ шейной области у большого количества здоровых собак, животных с ПГПТ и вторичной гиперплазией паращитовидных желез (обычно вызванной хронической недостаточностью почечной функции). В ранних исследованиях часто не удавалось визуализировать нормальные паращитовидные железы (Wisner et al. 1991). Однако со временем повысились как чувствительность оборудования, так и квалификация работающего с ним персонала. В результате, ультразвуковая визуализация нормальных паращитовидных желез в настоящее время не вызывает больших затруднений (Reusch et al, 2000).
Размеры опухолей паращитовидных желез (обычно аденом) у собак с П' ПТ сильно варьируют - от 2 до 23 мм в диаметре. Большинство аденом имеет диаметр 4-10 мм и легко визуализируются (Wisner et al. 1993; Wisner, Nyland, 1994). Недавно было установлено статистически достоверное
760 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Рис. 16-18. А. Ультрасонограмма шейного отдела собаки с функционально активной аденомой паращитовидных желез. Обратите внимание на правую долю щитовидной железы, на краниальном полюсе которой хорошо видна четко очерченная гипоэхогенная опухоль (показана стрелкой). Б. Одиночная аденома паращитовидной железы, удаленная у собаки с первичным гиперпаратиреоизом (см. рис. 16-23, В) (Фото любезно предоставлено Dr. Tom Nyland и DR Eric Wisner).
различие между размерами пораженных областей в гиперплазированных паращитовидных железах (2-6 мм, в среднем 2,9 мм) и размерами аденом или аденокарцином в этих органах (от 4 до 20 мм, в среднем 7,5 мм) (Wisner et al, 1997). Несмотря на достоверность этих данных, мы не склонны делать вывод о гистологическом типе паратиреоидной ткани на основании УЗИ. С одной стороны, наши собственные наблюдения не вполне совпадают с результатами цитированного исследования. С другой стороны, что еще важнее, патологи не всегда полагаются на такой способ классификации подобных опухолей, когда последние доступны для микроскопического исследования. Поэтому, мы считаем, что приведенные выше данные интересны, но не бесспорны. Выбор метода лечения не может основываться на наблюдениях такого рода.
Наше недавнее исследование включало 77 собак с ПГПТ. Диаметр обнаруженной опухоли паращитовидных желез у 51 собаки(60%) составлял от 4 до 6 мм, у 22 (26%) животных равнялся 7-10 мм, у 7 (8%) он был 11-15 мм и у 5 (6%) - 16-23 мм (см. табл. 16-8). Восемь из 77 собак имели по два паратиреоидных узла, так что в общей сложности в данной группе было выявлено 85 узлов. Ии у одной из собак не было обнаружено более двух опухолей паращитовидных желез. Большинство новообразований имели округлую или овальную форму, хорошо очерченные контуры и гипо- или анэхоген-ную структуру, что позволяло легко отличать их от окружающей паренхимальной ткани щитовидной железы (рис. 16-18). Вместе с тем, не все опухоли легко поддавались визуализации. У нескольких собак, особенно имевших крупные паратиреоидные опухоли, рентгенологу не удалось с уверенностью идентифицировать пораженную ткань. Чаще всего было трудно установить ее принадлежность к щитовидной или паращитовидным железам. Важно также подчеркнуть субъективный характер оценки. В одном из наших исследований один специ
алист сумел правильно идентифицировать одиночную опухоль паращитовидных желез у всех 11 обследованных собак и две опухоли еще у одного животного, в то время как менее опытный оператор правильно идентифицировал опухоли только у четырех из семи животных (Feldman et al, 1977). Таким образом, результаты УЗИ достоверны в той мерс, в какой это допускает качество используемого оборудования и квалификация исследователя.
Точность диагностики посредством УЗИ шейной области у собак с ПГПТ примерно такая же, как у человека: метод позволяет визуализировать от 90 до 95% аденом паращитовидных желез и в меньшей степени гиперплазию желез (Wisner, Nyland, 1998). Как показывает наш опыт, оператор с помощью УЗИ чаще идентифицировал опухоли паращитовидных желез, чем хирург во время операции. Это объясняется тем, что такие опухоли, проникая в ту или другую долю щитовидной железы, нередко остаются невидимыми для хирурга и не поддаются пальпации. Принимая во внимание столь обнадеживающие результаты УЗИ шейной области, мы настоятельно рекомендуем использовать его при обследовании животных с гиперкальциемией. При этом, однако, следует учитывать квалификацию оператора и чувствительность оборудования. Кроме того, целесообразно использовать для исследования шейной области датчик с частотой 10 МГц, а не 7,5 МГц, как при сканировании брюшной полости.
Ультразвуковое исследование брюшной полости
Ультразвуковое сканирование органов брюшной полости также должно являться рутинным компонентом диагностического обследования собак и кошек с гиперкальциемией. В случае выявления аномальной эхографической структуры печени, селезенки, лимфатических узлов брыжейки и других органов настоятельно рекомендуется провести их чрескож-
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 761
злокачественным ростом
Рис. 16-19. Концентрация ПН в сыворотке крови здоровых собак и собак с различными нарушениями гомеостаза кальция. Обратите внимание, что результаты измерений частично перекрываются и что результаты, представленные на рисунке 16-20, легче поддаются интерпретации.
ную биопсию. Помимо прочего, УЗИ оказалось весьма эффективным способом выявления мочевых камней. Большинство их находится в мочевом пузыре. однако некоторые были обнаружены в почках, мочеточниках и мочеиспускательном канале.
ОПРЕДЕЛЕНИЕ ПТГ, ПрПТГ И ВИТАМИНА Д (КАЛЬЦИТРИОЛА)
У собак и кошек с первичным гиперпаратиреозом концентрация ПТГ в сыворотке крови обычно лежит в средней части нормального диапазона или значительно превышает его (рис. 16-19, см. также рис. 16-2). ПрПТГ часто не определяется, а концентрация кальцитриола остается нормальной или повышена. Концентрацию ПТГ необходимо всегда сопоставлять с концентрацией кальция. У здоровых животных концентрация ПТГ понижается с увеличением уровня кальция. Практически у всех
собак и кошек с ПГПТ концентрация ПТГ непропорционально высока для данного уровня гиперкальциемии (по результатам определения общего или, предпочтительно, ионизированного кальция), хотя при этом может оставаться в «нормальных» пределах. Это предполагает связь патологического процесса с автономной секрецией гормона (рис. 16-20). Правильность такого вывода подтверждается тем обстоятельством, что «нормальная» концентрация ПТГ не соответствует сопутствующей гиперкальциемии. Аналогично, у животных с гипокальциемией и аномально низкой концентрацией ПТГ в крови, по всей вероятности, имеется первичный гипопаратиреоз.
У нас накоплен очень большой опыт применения описанного выше нового иммунорадиометри-ческого метода (ИРМ) определения ПТГ в сыворотке крови собак с ПГПТ. Мы анализировали ПТГ, по меньшей мере, в одной пробе крови от каждой из 121 собаки с ПГПТ, используя двухсайтовый ИРМ (см. табл. 16-8). Во многих лабораториях приняты сходные показатели нормальной концентрации ПТГ (от 2 до 13 пмоль/л). У 88 (73°о) из 121 собаки концентрация ПТГ оставалась в нормальных пределах, у 54 (45° о) составляла от 3 до 7,9 пмоль/л, у 34 (28°о) - от 8 до 13 пмоль/л, у 13 (11°о) - от 13,1 до 20 пмоль/л и у 20 (16° о) собак превышала 20 пмоль/л. Таким образом, почти у 75° о собак с ПГПТ концентрация ПТГ оставалась в пределах нормального диапазона. Тем не менее, такую концентрацию нельзя считать «нормальной», так как у всех этих животных была гиперкальциемия.
Наличие высоко чувствительных методов диагностики позволяет выявлять специфические нарушения, приводящие к гиперкальциемии у большинства собак и кошек. Эти методы в настоящее время доступны практикующим ветеринарам. На рис. 16-2 представлены ожидаемые величины основных параметров при гиперкальциемии различного происхождения. У подавляющего большинства
50
45
40
35
30
25
20
15
10
5
0
• Норма
" V Первичный гиперпаратиреоз
“ □ Гиперплазия паратиреоидных желез
О Первичный гипопаратиреоз - А Гиперкальциемия, вызванная злокачественным
Общий кальций (мг/100 мл)
Рис. 16-20. Сравнение концентраций ПТГ и кальция, определявшихся одновременно, в сыворотке крови здоровых собак и собак с различными нарушениями гомеостаза кальция. Обратите внимание на более четкое различие между группами, чем при измерении концентрации только кальция или только ПТГ
7Ь1 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
собак и кошек гиперкальциемия диагностируется без применения столь изощренных методов. Тем не менее, мы время от времени сталкиваемся со значительными трудностями при постановке диагноза, несмотря на казалось бы логичный подход к решению стоящей задачи. Поэтому использование одного из указанных методов или их комбинации оказывается чрезвычайно полезным для правильной диагностики подобных трудных случаев.
РАДИОИЗОТОПНОЕ СКАНИРОВАНИЕ
Радиозотопные методы применяются для выявления и локализации аденомы паращитовидных желез у человека (Fine, 1987). Чаще всего для получения изображений используют метод двойного изотопного сканирования, комбинируя таллия хлорид (201Т1) либо с пертехнетатом (99тТс), либо с радиоактивным йодом (123I) (Picard et al, 1987). Однако ряд недостатков этого метода заставил перейти к использованию одного радионуклида - технеция 99ш-сестамиби -("“Тс-сестамиби) (O’Dougherty et al, 1992; Taillefer et al., 1992). Процедура сканирования с помощью этого изотопа и продолжительность госпитализации одинаковы для людей и кошек. Этот метод дает прекрасные результаты при локализации аденом паратиреоидных желез у человека.(О’Dougherty et al, 1992; Taillefer et al, 1992).
В двух сообщениях этот метод предлагался для сканирования аденом паращитовидных желез у собак с первичным гиперпаратиреозом (Wright et al, 1995; Matwichuk et al, 1996). Однако в следующей работе, в которой исследовали перспективность использования двухфазной сцинтиографии для локализации опухолей паращитовидных желез у собак с ПГПТ, только у одной из 10 собак результаты сканирования совпали с результатами хирургической диагностики опухоли. Низкая чувствительность и специфичность сцинтиографии паращитовидных желез побудила авторов исследования сделать вывод о нецелесообразности диагностического использования этого метода у собак (Matwichuk et al, 2000).
ИЗБИРАТЕЛЬНЫЙ АНАЛИЗ ПРОБ ВЕНОЗНОЙ КРОВИ
Предпринималась попытка определить, на какой стороне шеи локализована автономно функционирующая опухоль паращитовидных желез, на основании определения ПТГ в сыворотке крови. Предполагалось, что концентрация ПТГ в крови вены, дренирующей зону расположения опухоли, должна быть выше, чем в контралатеральной вене. Перед хирургической операцией были взяты пробы крови из обеих яремных вен собак с ПГПТ, вызванным автономно функционирующей аденомой. К сожалению, градиент концентраций ПТГ удалось получить только у одной из 11 собак. Неудача, скорее всего, была обусловлена взятием проб крови из слишком высоко расположенных сегментов шейных вен. Но
ТАБЛИЦА 16-10. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГУМОРАЛЬНОЙ ГИПЕРКАЛЬЦИЕМИИ ЗЛОКАЧЕСТВЕННОГО РОСТА
Гематологический рак
Лимфосаркома
Лимфоцитарная лейкемия
Миелопролиферативная болезнь Миелома
Солидные опухоли, метастазирующие в кости Аденокарцинома молочных желез
Назальная аденокарцинома Эпителиальные опухоли Аденосаркома поджелудочной железы Карцинома легких
Неметастазирующие в кости солидные опухоли
Аденокарцинома апокринных желез заднепроходной пазухи Опухоль интерстициальных клеток
Плоскоклеточная карцинома
Аденокарцинома щитовидной железы Карцинома легких
Аденокарцинома поджелудочной железы Фибросаркома
независимо от этого, селективный сбор проб венозной крови дает не очень надежные результаты.
МЕТОДЫ ДИАГНОСТИКИ ГИПЕРКАЛЬЦИЕМИИ
Общие сведения
Перечень клинических состояний, требующих дифференциальной диагностики при гиперкальциемии, не очень велик (табл. 16-3 и 16-10), что позволяет использовать логический подход к идентификации ее причин. Чаще всего у собак и кошек гиперкальциемия вызвана злокачественным ростом. Поэтому последовательная, практичная и рентабельная тактика диагностики должна быть, в первую очередь, направлена на выявление или исключение малиг-низации. Диагноз ПГПТ может обсуждаться только после того, как не удалось выявить опухоль.
Анамнестический анализ и физикальное исследование
Начальные действия. Подход к диагностике гиперкальциемии обычно довольно прост (см. табл. 16-3 и рис. 16-21). Прежде всего, подтверждают наличие этого расстройства посредством повторного измерения концентраций кальция и фосфора в сыворотке крови, хотя его результат, как правило, не отличается от результата первичного анализа. Дополнительно вносят поправку на изменения концентраций общего белка и альбумина (см. обсуждение в гл. 17). Мы согласны, что используемые для этой цели формулы неточны по своей сути. Поэтому, если возможно, следует направить пробы сыворотки в соответствующую лабораторию для определения концентрации ионизированного каль-
Рис. 16-21. Алгоритм клинической и диагностической оценки собак с устойчивой гиперкальциемией с явно выраженными (А) и слабо выраженными клиническими симптомами (Б) (см. продолжение).
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Б
Рис. 16-21 (продолжение). Алгоритм клинической и диагностической оценки собак с устойчивой гиперкальциемией с явно выраженными (А) и слабо выраженными клиническими симптомами (Б).
764 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
765
ция. Ее повышение подтверждает диагноз гиперкальциемии.
Если же концентрация ионизированного кальция остается нормальной или понижена на фоне подтвержденного увеличения концентрации общего кальция, можно предполагать наличие ХПН или лабораторной ошибки.
Анализ частоты заболевания, анамнестических данных и результатов физикального исследования позволяет ветеринару выяснить причину гиперкальциемии или, по крайней мере, составить список наиболее возможных причин. В сомнительных случаях следует повторно проанализировать анамнестические данные и результаты физикального исследования.
Встречаемость. Пол, возраст и породу собак следует учитывать отчасти из-за необычно высокой частоты гиперкальциемии у кеесхондов. Кроме того, она чаще развивается у животных 8 лет и старше. Почечная функция нарушается в любом возрасте, однако, некоторые породы явно предрасположены к семейной почечной недостаточности (например, ши-тцу, лхаса апсо, доберман-пинчер). Молодые собаки чаще страдают почечной недостаточностью, чем взрослые, у них чаще встречаются злокачественные опухоли (лимфосаркома) и гипокортицизм (особенно у сук). В то же время у взрослых собак чаще развиваются карциномы апокринных желез заднепроходной пазухи, лимфомы и другие злокачественные новообразования.
Анамнез. Необходимо расспросить владельца о режиме кормления животного, использовании витаминно-минеральных пищевых добавок, возможности контакта с родентицидами или комнатными растениями, содержащими витамин Д. Следует попытаться выяснить, страдает ли собака от боли (которая может свидетельствовать о процессе костного лизиса). Важное значение имеет выяснение (путем наводящих вопросов) наличия полуирии, полидипсии, снижения аппетита, физической активности и других возможных расстройств. Обычно чем хуже выглядит собака, тем меньше вероятность ПГПТ и тем сильнее подозрение на малигнизацию, почечную недостаточность, отравление витамином Д, грануломатоз или гипокортицизм.
Физикальное исследование. После оценки степени дегидратации животного и тяжести его заболевания, проводят физикальное исследование, включая тщательную пальпацию периферических лимфатических узлов и молочных желез (с целью выявления рака или лимфомы). Внимательное исследование прямой кишки и прилегающих тканей важно для идентификации неоплазии, в том числе затрагивающей апокринные железы заднепроходной пазухи. Опухоли заднепроходной пазухи нередко покрыты волосатой кожей и могут остаться незамеченными, если не проводится ректальный и периректальный осмотр. Опухоли влагалища также идентифицируют посредством пальпации. Ветеринар должен мягко пальпировать возможно большую
часть скелета, выявляя очаги костной боли, которые затем исследуются с помощью рентгенографии (таким способом выявляют множественные миеломы). Почки пальпируют для оценки их размеров и очертаний.
Исходная база данных
Кровь и моча. Исходная база данных должна содержать гемограмму или результаты общего клинического анализа крови (ОАК), биохимического анализа сыворотки, определения концентрации общего кальция, анализа мочи и рентгенографического исследования грудной клетки. Проводится также УЗИ брюшной полости и/или грудной клетки. При нормальной или пониженной концентрации фосфора в сыворотке крови почечная недостаточность или отравление родентицидами маловероятно (см. рис. 16-21). У собак с гипокортицизмом обычно развивается гиперфосфатемия. Весьма ценными показателями являются концентрации креатинина, натрия, калия и AM в крови. Определение отношения концентраций натрия и калия помогает исключить гипокортицизм. Величина этого отношения менее 27:1 согласуется с надпочечниковой недостаточностью, но не обязательно указывает на нее. Если наличие гипокортицизма представляется вероятным и даже возможным, проводят провокационную пробу с АКТГ. Повышенная концентрация фосфатов в сыворотке на фоне нормальной почечной функции вызывает подозрение на костный остеолиз под воздействием метастазирующей опухоли. Если же концентрация фосфатов нормальная, находится на нижней границе нормы или еще ниже, то можно предполагать первичный гиперпаратиреоз или гиперкальциемию, обусловленную злокачественной опухолью (см. рис. 16-9). Классическим признаком множественной миеломы является значительное увеличение концентрации общего белка вследствие его моноклонального выброса.
Первичное заболевание паращитовидных желез в сопоставлении с первичным заболеванием почек. Сочетание гиперфосфатемии и гиперкальциемии с азотемией является диагностической дилеммой. Ветеринар должен установить, является ли гиперкальциемия причиной или следствием почечного заболевания. Наличие в исходной базе данных других нарушений может подтверждать роль почечной недостаточности в качестве первичного расстройства. К числу таких нарушений относятся значительное увеличение в сыворотке крови концентрации фосфора и понижение концентрации общего кальция, нерегенеративная анемия, протеинурия и/или малый размер и неправильная форма почек, выявляемые посредством пальпации и/или рентгенографического исследования. Концентрация ионизированного кальция в сыворотках собак с ПГПТ выше нормы. Если гиперкальциемия исчезает под воздействием агрессивной инфузионной терапии и при усилении диуреза, диагноз первич-
7ЬЬ • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ной почечной недостаточности более вероятен, чем ПГПТ. Более того, у собак с нарушенной почечной функцией и гиперкальциемией концентрация общего кальция обычно ниже 12,5 мг/100 мл, тогда как у животных с ПГПТ и вторичным заболеванием почек она превышает 13 мг/100 мл (см. рис. 16-2, 16-14, 16-16 и 16-21).
Рентгенографическое и ультразвуковое исследование. Рентгенография грудной клетки и УЗИ брюшной полости могут выявлять опухоли и обызвествление мягких тканей, грибковые заболевания, органомегалию, остеолиз и/или остеопороз. Цель этих исследований состоит в идентификации пораженных зон и получении из них биоптатов, изучение которых может помочь установить причину гиперкальциемии. Опухоль в переднем отделе средостения рентгенографически была найдена у 40° о собак с гиперкальциемией и лимфосаркомой (см. рис. 16-16) (Greenlee et al, 1990). В случае обнаружения гепатомегалии или спленомегалии проводят чрескожную биопсию этих органов и исследуют полученный материал.
Аденома апокринных желез заднепроходной пазухи при рентгенографическом исследовании выглядит как тканевая масса в тазовом канале. Нередко обнаруживается также сублюмбарная лимфаденопатия, обусловленная метастазированием опухоли (см. рис. 16-17) (Meuten et al, 1983b; Meuten, 1984). Обызвествление мягких тканей чаще всего происходит при гипервитаминозе Д или хронической почечной недостагочности. хотя любое заболевание, протекающее с i иперкальциемией на фоне гиперфосфатемии при произведении концентраций кальция и фосфора более 60 - 80, может сопровождаться минерализацией тканей.
Дискретное литическое поражение позвонков или длинных костей предполагает наличие миеломы или гиперкальциемии, вызванной злокачественной опухолью, которая метастазирует в кости (см. рис. 16-13). В специализированных учреждениях проводится изотопное сканирование с целью выявления или исключения очагового поражения скелета, которое не идентифицируется при обычном рентгенографическом исследовании (рис. 16-22). Такое сканирование широко практикуется в медицине, но пока мало доступно в ветеринарии (Chew et al, 1991). У одной из обследованных нами собак
Рис. 16-22. С канировапие скелета собаки с гиперкальциемией, вызванной множественной миеломой. «Темные» зоны - области повышенной костной активности, характерные для Mei астатического поражения (Фото Dr. William Hornot).
с ПГПТ были выявлены рентгенопрозрачные зоны в длинных костях, но такие случаи чрезвычайно редки. Сопутствующая гиперпрогеинсмия предполагает наличие миеломы. Вероятность метастазирующей в кости солидной опухоли высока в том случае, когда имеет место костный лизис на фоне нормальной концентрации общего белка и особенно глобулиновой фракции в сыворотке крови. Для установления окончательного диагноза неоплазии требуется исследование биоптатов коркового вещества кости, подверженной лизису. Это, в первую очередь, относится к собакам со скрытой неоплазией. Слабый генерализованный остеопороз с трудом поддается диагностике с помощью обычной рентгенографии. Однако его наличие предполагает ПГПТ или гиперкальциемию в сочетании с гематологической неоплазией или солидной опухолью в отсутствие метастазирования костей (синдром гиперкальциемии, вызываемой злокачественным ростом).
УЗИ шейной области является простым и неинвазивным способом диагностики (см. рис. 16-18). Идентификация солидной опухоли в одной из долей щитовидной железы или вблизи нее подтверждает наличие автономно функционирующего новообразования паращитовидных желез при условии, что у собак отсутствует почечная недостаточность (Reusch et al, 2000). Однако, как отмечалось выше, необходим датчик с частотой 10 МГц, и, что более важно, получаемые с помощью УЗИ результаты весьма субъективны.
Оценка состояния лимфатических узлов и костного мозга
Если анализ базы данных не позволяет поставить окончательный диагноз, то проводя! оценку состояния лимфатических сосудов и/или костного мозга. Как неоднократно упоминалось, наиболее распространенным типом опухоли при гиперкальциемии у собак и кошек является лимфосаркома. Эта неоплазия может поражать периферические лимфатические узлы без увеличения их размеров, но это случается редко. Лучше всего провести гистологическое исследование самою крупного лимфатического узла (но не подчелюстною). Материал получают методом пункционной биопсии, однако окончательный диагноз на основании его цитологического анализа возможен далеко не всегда. Если выявлены какие-то аномалии, то для подтверждения или исключения диагноза проводят гистологическое исследование более крупного биопгата или ткани удаленного лимфатического узла. Этот этап диагностики можно опустить, когда при относительно хорошем состоянии животного имеющиеся данные указывают на отсутствие лимфосаркомы.
У собак и кошек с гиперкальциемией исследуют также аспираты костною мозга, поскольку лимфосаркома может инвазировать его неопластическими клетками (Meuten et al, 1938b). Однако такое исследование, как и исследование биоптатов не-
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
767
риферических лимфатических узлов, само по себе недостаточно для уверенного исключения диагноза лимфосаркомы. Поэтому мы обычно не проводим его, если клиническое состояние животного остается удовлетворительным, а ОАК не выявляет существенных отклонений от нормы.
Специальные анализы: ПТГ, ПрПТГ и кальцитриол
См. предшествующие разделы.
Операция на шее или химиотерапия (поисковая терапия)
Суть проблемы. Если логическим путем не удается установить причину гиперкальциемии, перед клиницистом встает проблема принятия диагностического решения. Большинство нарушений, приводящих к развитию гиперкальциемии, не представляют собой ничего «загадочного», но два диагноза иногда трудно подтвердить или дифференцировать: ПГПТ и синдром гиперкальциемии, вызванный злокачественным ростом (обычно лимфосаркомой). В настоящее время такая дилемма возникает все реже благодаря появлению разнообразных методов и инструментов, среди которых особой ценностью обладает сочетание УЗИ шейного отдела с определением концентраций ПТГ и ПрПТГ. Однако иногда эти анализы дают неопределенные результаты, и клиницисту приходится выбирать между химиотерапией и хирургическим вмешательством как более углубленными способами диагностики. У собак и кошек с «загадочным» происхождением гиперкальциемии прибегают к (1) хирургическому исследованию шеи для выявления опухоли паращитовидных желез или (2) поисковой терапии с использованием химиотерапевтических средств, эффективных при лимфосаркоме, чтобы выяснить, уменьшают они тяжесть гиперкальциемии или нет.
Медикаментозное лечение
Глюкокортикоиды. Если гиперкальциемия обусловлена лимфосаркомой (или другой гемопоэтической опухолью), то через 48 часов (иногда на следующий день) после начала глюкокортикоидной терапии происходит быстрое уменьшение концентрации кальция в сыворотке крови (Chew et al, 1991). Ингибирующее действие глюкокортикоидов на рост неопластической лимфоидной ткани и лимфоцито-лиз служит основой их терапевтического эффекта в большинстве случаев гематологического рака (лимфомы или множественной миеломы) (Goodwin et al, 1986). Одновременно глюкокортикоиды подавляют действие витамина Д, что объясняет их клинический эффект при вызванном избытком витамина токсикозе или грануломатозном заболевании (Sandler et al, 1984). Животные с негематологическими формами рака или с ПГПТ, как правило, не отвечают на глюкокортикоидную терапию (Bilezikian, 1992b). Поэтому, если уровень кальция не снижается, мож
но предполагать наличие ПГПТ. К сожалению, некоторые эффекты глюкокортикоидов в отношении гомеостаза кальция имеют неспецифический характер и могут вызвать слабое временное уменьшение уровня кальция у любого животного с гиперкальциемией. Нормализация концентрации кальция в крови после введения химиотерапевтических препаратов свидетельствует о наличии лимфосаркомы и необходимости дополнительного тестирования с целью подтверждения диагноза. Между тем, подтверждение лимфосаркомы у собак, получавших глюкокортикоиды, весьма затруднительно. Поэтому мы категорически против проведения «пробы с глюкокортикоидами», которая иногда только создает дополнительные проблемы.
L-Аспарагиназа. Альтернативой пробе с глюкокортикоидами при диагностике гиперкальциемии, обусловленной злокачественной опухолью, служит введение L-аспарагиназы, дифосфонатов или митрамицина. Наш опыт ограничивается пробой с L-аспарагиназой, которую мы вводим внутривенно в дозе 20000 МЕ/м2. Концентрацию кальция измеряем до и через каждые 12 или 24 часа после введения L-аспарагиназы на протяжении 72 часов. Уменьшение концентрации кальция и особенно ее нормализация свидетельствуют о наличии скрытой лимфосаркомы. Основным побочным эффектом действия L-аспарагиназы являются аллергические реакции, в связи с чем имеет смысл предварительно ввести антигистаминовый препарат. Возможны и другие побочные эффекты, такие как гепатопатия, нефропатия, нарушения свертываемости крови и функции ЦНС (Haemers, Rottiers, 1981; Haskell, 1981); к счастью, эти эффекты наблюдаются редко. Тем не менее, как и в случае с глюкокортикоидами, применение химиотерапии в диагностических целях является слишком грубым подходом по сравнению с более чувствительными и специфическими методами биохимического анализа (определение ПТГ, ПрПТГ и ионизированного кальция).
Хирургическое вмешательство. Еще одним методом диагностики гиперкальциемии неясного происхождения у собак является хирургическое исследование шейной области. Его эффективность значительно повышается в комбинации с одновременным ультразвуковым исследованием и определением ПТГ, ПрПТГ и ионизированного кальция. Обычно при хирургической операции выявляется одна увеличенная паращитовидная железа (рис. 16-23). Такая операция не представляет никакой трудности и не сопряжена с каким-либо серьезным риском для животного (см. стр. 773), и для собак старше 7 лет хирургическое обследование шейной области является вполне приемлемой диагностической и лечебной операцией. Если в процессе операции не удается обнаружить увеличенную паращитовидную железу, то возможны два варианта: либо опухоль находится в недоступном для обзора месте, либо гиперкальциемия обусловлена латентной опухолью. В этих случаях, после того как живот-
768 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Рис. 16-23. А. Операционное поле во время удаления одиночной аденомы паращитовидных желез (у кончика шжима). Б. Операционное поле во время удаления одиночной аденомы паращитовидных желез (Т - зрахея). Светлые стрелки показывают краниальный и каудальный полюса щитовидной железы, а черная стрелка -аденому паращитовидной железы. В. Операционное поле во время удаления «внутренней» аденомы паращитовидных желез (Т-трахея). Темные стрелки пока зывают краниальный и каудальный полюса щитовидной железы, которая отведена от трахеи, чтобы обеспечить доступ к аденоме (показана светлой стрелкой) на ее дорзальной поверхности.
ное оправится от операции, проводится дальнейшее диагностическое тестирование, а не поисковая терапия с применением глюкокортикоидов или L-аспарагиназы. Следует, однако, подчеркнуть, что любой «исследовательской» терапии следует предпочесть установление точного диагноза до начала медикаментозного или хирургического лечения.
Случаи эктопической локализации опухоли паращитовидных желез были зарегистрированы у людей, но не известны у собак или кошек. Эктопическую аномальную ткань паращитовидной железы трудно обнаружить. У человека для этой цели используют такие неинвазивные методы как КТ, эзофагоскопию и радиоизотопное сканирование. Инвазивные методы включают артериографию щитовидной железы, селективную катетеризацию вен шеи или средостения, а также хирургическое исследование переднего отдела средостения (Arnaud, Kolb, 1991).
Спонтанное излечение первичного гиперпаратиреоза. Описаны два случая острой гипокальциемии у собак, имевших в анамнезе хроническую гиперкальциемию. У обоих животных острая гипокальциемия, по-видимому, была обусловлена некрозом функционально активной аденомы паращитовидной железы после инфаркта. При этом остальные паращитовидные железы были атрофиро
ваны и не могли компенсировать недостаточность ПТГ (Rosol et al, 1988).
ОСТРАЯ МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ГИПЕРКАЛЬЦИЕМИИ
Первичный гиперпаратиреоз и другие заболевания
ПГПТ. Первичное лечение тяжелой гиперкальциемии должно быть направлено на устранение се главной причины. У собак и кошек с ПГПТ такое лечение состоит в хирургическом удалении аномальной паратиреоидной ткани. Однако у этих животных гиперкальциемия нс является острой проблемой, а произведение концентраций кальция и фосфата обычно нс превышает 60. По этой причине, несмотря на неблагоприятные последствия гиперкальциемии, обусловленные минерализацией нефронов, она не представляет серьезной проблемы у подавляющего числа собак с ПГПТ.
Почечная недостаточность или отравление витамином Д. Тяжесть клинических симптомов и степень поражения тканей, по-видимому, в первую очередь зависят от концентрации фосфора в сыворотке крови. Степень поражения почек вследствие метастатической минерализации коррелирует с
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
769
ТАБЛИЦА 16-11. ТИПИЧНЫЕ КОНЦЕНТРАЦИИ КАЛЬЦИЯ И ФОСФАТА В СЫВОРОТКЕ КРОВИ ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ СОСТОЯНИЯХ
Типичная концентрация кальция (мг/100 мл) Типичная концентрация фосфатов (мг/100 мл) Типичное произведение концентраций кальция и фосфора
Здоровые собаки 10 4,5 45
Первичный гиперпаратиреоз 15 3,0 45
Лимфосаркома 15 3,0 45
Карцинома апокринных клеток заднепроходной пазухи 15 3,0 45
Хроническая почечная недостаточность 11,5 10 115
Токсикоз, вызванный витамином Д 11,5 10 115
Обратите внимание, что интенсивная терапия рекомендуется, когда произведение концентраций кальция и фосфора превышает 60-80. В большинстве случаев гиперкальциемии нет необходимости в неотложной терапии с целью снижения концентрации кальция в сыворотке крови.
величиной произведения концентраций кальция и фосфора в сыворотке. Увеличение этого произведения выше 60 - 80 может быть связано с нефротоксичностью. Гиперкальциемия, обусловленная ПГПТ, вызывает меньше беспокойства и не столь опасна, как гиперкальциемия, связанная с недостаточностью почечной функции или гипервита-минозом Д - двумя расстройствами, которые почти всегда сопровождаются гиперфосфатемией, при которой повышается вероятность обызвествления тканей (табл. 16-11).
Показания
Источник болезни и необходимость лечения. Чисто внешне собаки и кошки с ПГПТ выглядят относительно здоровыми как в глазах владельца животного, так и ветеринара, проводящего физикальное исследование; болезненный вид животного указывает на наличие сопутствующего заболевания. Несмотря на значительное повышение уровня кальция, средняя концентрация которого превышает 14 мг/100 мл, состояние собак и кошек с ПГПТ обычно остается стабильным и они не нуждаются в экстренной терапии (см. табл. 16-11). В отличие от этого, у собак с лимфосаркомой и гиперкальциемией нередко возникают внушающие опасение клинические симптомы, скорее обусловленные злокачественным процессом, нежели гиперкальциемией. Лечение рака косвенно приводит к снижению концентрации кальция. Наконец, у собак со слабо выраженной гиперкальциемией и недостаточностью почечной функции также развивается выраженная клиническая симптоматика в сочетании с умеренной или тяжелой гиперфосфатемией. У таких животных повышен риск минерализации тканей; их состояние улучшается под воздействием специфической терапии, направленной на уменьшение произведения концентраций кальция и фосфора.
Показания к симптоматическому лечению. Неблагоприятные последствия гиперкальциемии порой диктуют необходимость симптоматического лечения животных с целью снижения концентрации
кальция в сыворотке, не дожидаясь завершения диагностических процедур и окончательного диагноза или хирургического удаления аномальной паращитовидной железы или желез. Решение о назначении симптоматической терапии принимают, исходя из тяжести клинических проявлений заболевания, а также состояния почечной, сердечной и нервной функций. Симптоматическое лечение следует начинать независимо от концентрации кальция в крови.
Симптоматическая терапия показана при наличии у животного дегидратации, азотемии, сердечной аритмии, тяжелых неврологических симптомов или общей слабости (Bilezikian, 1992b). Гиперкальциемия редко служит непосредственной причиной энцефалопатии или гибели животного, за исключением случаев тяжелого отравления родентицидами, содержащими большие количества витамина Д. Симптоматическая терапия (внутривенное введение жидкости, содержащей фуросемид или без него) может быть назначена животному в относительно стабильном состоянии при подозрении на прогрессирующую метастатическую кальцификацию мягких тканей. Такое подозрение появляется в тех случаях, когда произведение концентраций сывороточных кальция и фосфора превышает 60 - 80. При более низкой величине этого отношения и стабильном состоянии пациента нет необходимости в срочном снижении концентрации кальция в сыворотке, поскольку опасность минерализации мягких тканей невелика (Chew, Meuten, 1982).
Предложено несколько методов контроля острой или тяжелой гиперкальциемии (табл. 16-12 и 16-13). Чаще всего собакам и кошкам проводят коррекцию дефицита жидкости, солевой диурез, терапию диуретиками (фуросемидом или этакриновой кислотой) и кортикостероидную терапию. Как правило, терапию диуретиками и солевой диурез назначают, не дожидаясь окончания диагностических процедур. Напротив, глюкокортикоиды начинают вводить только после подтверждения специфического диагноза ввиду частого сочетания гиперкальциемии и лимфосаркомы.
770 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ТАБЛИЦА 16-12. ОБЩАЯ ТЕРАПИЯ ГИПЕРКАЛЬЦИЕМИИ
Окончательная
Устранение основной причины
Поддерживающая
Первичная
Инфузия жидкости (0,9% физиологический раствор)
Фуросемид
Натрия бикарбонат
Глюкокортикоиды
Вторичная
Бифосфонаты
Кальцитонин
Третичная
Митрамицин
Этлендиаминтетрауксусная кислота (ЭДТА)
Перитонеальный диализ
Перспективная
Блокаторы кальциевых каналов
Производные соматостатина
Агонисты рецепторов кальция
Негиперкальциемические аналоги кальцитриола
Жидкостная терапия
Коррекция дефицита жидкости. Главным показанием к проведению жидкостной терапии служит дегидратация. Самыми частыми причинами дегидратации являются уменьшение потребления жидкости в результате тошноты и рвоты и неспособность концентрировать мочу. Это приводит к нарушению экскреции кальция вследствие уменьшения СКФ и усилению его всасывания в почечных канальцах (Parfitt, Kleerekoper, 1980). Следствиями дегидратации являются также гемоконцентрация, гиперпротеинемия и относительное повышение концентрации общего и ионизированного кальция в сыворотке. Регидратация составляет важный начальный этап лечения тяжелой гиперкальциемии. Коррекция недостаточности жидкости в организме снижает тяжесть гиперкальциемии, хотя обычно не позволяет полностью нормализовать концентрацию кальция, за исключением собак с гипокортицизмом или животных, у которых на самом деле нет гиперкальциемии. У людей регидратация приводит к быстрому снижению концентрации общего кальция на 2-3 мг/100 мл (Aurbach et al, 1985а).
Солевой диурез. После устранения дефицита жидкости солевой диурез способствует продолжению выведения кальция через почки; он служит эффективным способом краткосрочной терапии при гиперкальциемии любого происхождения. Введение физиологического раствора стимулирует кальциурез благодаря тому, что большое количество фильтруемого натрия конкурирует с кальцием в процессе их всасывания в почечных канальцах (Parfitt, Kleerekoper, 1980). Усиленное выделение натрия сопровождается увеличением экскреции кальция. Введение нормального солевого раствора со скоростью в 2-3 раза выше ее нормально подде
рживающего уровня (120 - 180 мл/кг/день) обычно стимулирует кальциурез. Для предотвращения гипокалиемии зачастую приходится прибегать к заместительному введению калия. Одновременно следует внимательно отслеживать возможные побочные эффекты введения больших объемов жидкости (например, отек легких). Рекомендуется контролировать вес тела, продукцию мочи и центральное венозное давление, а также проводить аускультацию грудной клетки.
Терапия диуретиками (фуросемид)
Применение сильных диуретиков в сочетании с солевым диурезом обеспечивает максимальную экскрецию натрия с мочой и, как следствие, кальциурез. Введению фуросемида должно предшествовать увеличение внутрисосудистого объема. Фуросемид усиливает кальциурический эффект увеличения объема благодаря подавлению всасывания кальция в толстом восходящем колене петли Генле. Кроме того, фуросемид обеспечивает защиту в случае избыточного увеличения объема (Bielezikian, 1992b). Согласно обычно рекомендуемому протоколу, препарат сначала вводят внутривенно струйно в дозе 5 мг/кг, а затем два или три раза в день по 2 - 4 мг/кг (Chew et al, 1991). Тиазидные диуретики не рекомендуются, поскольку они снижают почечную экскрецию кальция и могут вызвать обострение гиперкальциемии (Parfitt, Kleerekoper, 1980). Кроме того, тиазиды усиливают всасывание кальция в дистальных почечных канальцах (Bielezikian, 1992b).
Глюкокортикоиды
Положительное действие глюкокортикоидов при симптоматическом лечении гиперкальциемии обсуждалось выше (см. разделе «Методы диагностики гиперкальциемии», стр. 762). Эти препараты снижают высвобождение кальция в процессе резорбции костной ткани и его всасывание в желудочно-кишечном тракте и усиливают экскрецию кальция с мочой. Глюкокортикоиды обладают цитотоксическим действием на опухолевые лимфоциты и подавляют рост опухолевой ткани, что объясняет их терапевтический эффект при лимфоме и множественной миеломе (Bielezikian, 1992b). Кроме того, они являются антагонистами витамина Д при токсикозах (например, после поедания приманки для грызунов) или грануломатозе. Глюкокортикоиды неэффективны при негематологических формах рака или у животных с ПГПТ (Percival et al, 1984).
Введение глюкокортикоидов следует отложить до установления окончательного диагноза. Одной из самых частых причин гиперкальциемии у собак является лимфосаркома, и введение глюкокортикоидов может в последующем помешать подтверждению диагноза. При симптоматическом лечении гиперкальциемии используют преднизон или преднизолон в дозах 1-2 мг либо дексаметазон в дозе
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
771
ТАБЛИЦА 16-13. СПЕЦИФИЧЕСКОЕ ЛЕЧЕНИЕ ГИПЕРКАЛЬЦИЕМИИ
Лечение Доза Показания Замечания
Увеличение объема
0,9% физиологический раствор, п/к * 75-100 мл/кг/день Слабая гиперкальциемия Противопоказано при наличии периферического отека
0,9% физиологический раствор, в/в* Диуретики 100-125 мл/кг/день Умеренная до тяжелой гиперкальциемия Противопоказано при застойной сердечной недостаточности и гипертензии
Фуросемид Подщелачивающие средства 2-4 мг/кг два или три раза в день, в/в, п/к или п/о Умеренная до тяжелой гиперкальциемия Перед началом терапии необходимо увеличение внутрисосудистого объема
Натрия бикарбонат Глюкокортикоиды 1 мэкв/кг в/в в форме медленной болюсной инъекции, затем в дозе 0,3 х дефицит оснований х вес в кг/день Тяжелая гиперкальциемия Необходим строгий мониторинг
Преднизон Дексаметазон Ингибиторы костной резорбции 1-2,2 мг/кг дважды в день, п/о, п/к, в/в 0,1-0,22 мг/кг дважды в день, в/в или п/к Умеренная до тяжелой гиперкальциемия Применение этих препаратов до выяснения этиологии заболевания может затруднить установление окончательного диагноза
Кальцитонин Бифосфонаты 4-6 ME /кг 2 или 3 раза в день, п/к Гипервитаминоз Д Эффект может быть кратковременным, возможна рвота
ЭГДФ-дидронел Клодронат Памидронат 15 мг/кг один или два раза в день 20-25 мг/кг, 4 ч в/в инфузия 1,3 мг/кг в 150 мл 0,9% физиологического раствора, 2 ч в/в инфузия с повторением через 1 неделю Умеренная до тяжелой гиперкальциемия Применение всех этих препаратов у собак ограничено из-за их высокой стоимости. Клодронат разрешен для медицинского применения в Европе; применение в США ограничено
Митрамицин Прочие 25 мкг/кг в/в в 5% растворе декстрозы каждые 2-4 часа раз в 2-4 недели Тяжелая гиперкальциемия, рефрактерная ГГЗР Применение у собак и кошек ограничено. Обладает нефротоксичным и гепатоток-сичным действием, вызывает тромбоцитопению
Натриевая соль ЭДТА 25-75 мг/кг/час Тяжелая гиперкальциемия Нефротоксичность
Перитонеальный диализ Диализат с низкой концентрацией кальция Тяжелая гиперкальциемия Кратковременный терапевтический эффект. Сведения о применении при гиперкальциемии отсутствуют
Необходимо заместительное введения калия в количестве 5 - 40 мэкв КС1/л в зависимости от концентрации калия в сыво-
ротке крови.
ГГЗР - синдром гуморальной гиперплазии вследствие злокачественного роста, в/в - внутривенно, п/к - подкожно, п/о - перорально.
0,1-0,2 мг/кг. Препараты вводят дважды в день перорально, подкожно или внутривенно.
Бифосфонаты
Бифосфонаты - это соединения, структурно родственные пирофосфату - побочному продукту нормальных обменных процессов. Основное свойство этих соединений состоит в ингибировании активности остеокластов, причем они не только подавляют функцию остеокластов, но и уменьшают их жизнеспособность (Fleisch, 1989). Бифосфонаты слабо всасываются в желудочно-кишечном тракте (<10%), однако, их внутривенное введение дает хороший терапевтический эффект у людей с гиперкальциемией (Bilezikian, 1992b). Принимая во внимание раннее начало резорбции костей и потерю костной ткани у больных с множественной миело
мой, клиническое действие этих препаратов выглядит весьма впечатляющим даже у пациентов, которые не имели остеолитического поражения костной ткани в начале терапии. Бифосфонаты не только благотворно действуют на состояние скелетных тканей, но также замедляют опухолевый рост, подавляя продукцию остеобластами интерлейкина-6, который является важным фактором роста клеток миеломы (Bataille, 1966).
В странах западного мира для лечения гиперкальциемии у людей разрешены три препарата группы бифосфанатов: этидронат, клодронат и памид-ронат. Появление новых мощных лекарственных средств этой группы (аминогексана, бифосфоната, ризедроната и алендроната) и других ингибиторов костной резорбции (галлия нитрата, паклитакселя) открывает широкие возможности для повышения эффективности лечения гиперкальциемии и болез
772 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ней костей. Так, например, клодронат с успехом использовался для лечения индуцируемой лимфомой гиперкальциемии у одной собаки и токсикоза витамином Д у другой (Petrie, 1996). Памидронат также эффективно использовался для лечения индуцированного витамином Д токсикоза у собак (Rumbeiha et al, 1999 и 2000).
Кальцитонин
Кальцитонин подавляет образование и активность остеокластов. Поэтому он может хотя бы временно снижать концентрацию кальция при гиперкальциемии, обусловленной избыточной активностью остеокластов (Parfitt, Kleerekoper, 1980). У человека кальцитонин не всегда обеспечивает одинаково эффективное снижение концентрации кальция в крови либо потому, что к нему нечувствительны процессы, вызывающие гиперкальциемию, либо потому что у пациентов развивается толерантность к этому гормону (Aurbach et al, 1985а). Кальцитонин считается «слабым», короткодействующим препаратом, дающим мало побочных эффектов (Bilezikian, 1992b).
Кальцитонин лосося (калцимар, производства USV Laboratories, США) является наиболее сильным препаратом. Человеку его назначают в самых разных дозировках (Arnaud, Kolb, 1991). Имеющиеся в ветеринарной литературе данные свидетельствуют о возможности его применения при отравлении собак родентицидами, содержащими холекальциферол. Кальцитонин применяют в различных дозах, однако, рекомендовать ту или иную из них в качестве наиболее эффективной не представляется возможным из-за слишком небольшого числа наблюдений за собаками и кошками, получавших этот препарат. Некоторым собакам его вводили подкожно в количестве 4,5 ЕД/кг с интервалами в 8 часов, другим - в дозе 8 ЕД/кг раз в сутки тем же способом, а третьим - по 5 ЕД/кг каждые 12 часов (Dougherty et al, 1990; Fooshee, Forrester, 1990). Кошки получали кальцитонин в дозе 4 ЕД/кг внутримышечно с интервалами в 12 часов (Peterson et al, 1991). У всех животных препарат снижал концентрацию кальция в сыворотке крови.
Пликамицин (митрамицин)
Пликамицин (прежнее название митрамицин) - это цитотоксическое соединение, которое изначально предназначалось для химиотерапии рака. Это сильный ингибитор биосинтеза РНК в остеокластах и эффективное средство для снижения гиперкальциемии. Мощное токсическое действие препарата приводит к тромбоцитопении, некрозу печени, поражению почек и гипокальциемии. У здоровых собак, получавших по две внутривенные инъекции пликамицина, серьезные клинические проявления токсичности отсутствовали.
Инфузия сопровождалась появлением мышечной дрожи с одновременным уменьшением активности остеокластов (Rosol et al, 1992а и 1992b). Для контроля гиперкальциемии у собак пликамицин вводили внутривенно в двух разных дозах: 0,5 и 0,25 мкг/кг один или два раза в неделю (Finco, 1982). Влияние пликамицина на концентрацию общего и ионизированного кальция в сыворотке оценивали у девяти собак с гиперкальциемией, обусловленной злокачественной опухолью, у одной с ПГПТ и у одной с токсикозом вследствие избытка витамина Д. Введение препарата в большой дозе (100 мкг/кг) у двух собак привело к острому гепатоцеллюлярному некрозу с фатальным исходом. Низкая доза (25 мкг/кг) нормализовала концентрации общего и ионизированного кальция через 24 - 48 часов после инъекции у шести из девяти животных, включая собаку с токсикозом, вызванным витамином Д. Однако у трех животных эффект был непродолжительным (1-3 дня), а у трех других сохранялся на протяжении 7 дней. Побочное действие препарата при его введении в низкой дозе ограничивалось слабыми желудочно-кишечными расстройствами у трех собак и уменьшением количества тромбоцитов еще у трех особей. Низкая доза пликамицина не влияла на функцию печени. Препарат не вызывал уменьшения размеров опухоли и не снижал концентрацию ПрПТГ (Rosol et al, 1994).
Этилендиаминтетрауксусная кислота (ЭДТА)
Внутривенное введение натриевой соли ЭДТА использовалось для быстрого снижения концентрации ионизированного кальция у людей с угрожающей жизни гиперкальциемией. ЭДТА образует комплексы с ионизированным кальцием, которые быстро выводятся через почки (Parfitt, Kleerekoper, 1980). Для лечения гиперкальциемии у собак была предложена начальная доза ЭДТА от 25 до 75 мг/кг/час (Rosol et al., 2000). К сожалению, ЭДТА обладает нефротоксическим действием, и ее инфузия может привести к острой почечной недостаточности.
Бикарбонат
Относительная доля ионизированного кальция в сыворотке отчасти определяется состоянием кислотно-щелочного равновесия. Коррекция ацидоза или индукция слабого алкалоза посредством введения бикарбоната сопровождается связыванием ионизированного кальция с белком и, тем самым, частично обезвреживает его (Chew, Meuten, 1982). Рекомендуемая доза бикарбоната составляет 1-4 мэкв/кг (Kruger et al, 1986). Эффект однократной внутривенной дозы у кошек сохраняется на протяжении 3 часов (Chew et al, 1989). Действие бикарбоната носит мягкий характер, и он может быть полезен при введении в сочетании с другими лекарственными средствами.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 773
Диализ
Гемодиализ или перитонеальный диализ с использованием растворов, не содержащих кальция, снижали концентрацию кальция у людей, когда другие методы оказывались неэффективными (Parfitt, Kleerekoper, 1980; Aurbach et al, 1985a). Этот метод дает особенно хорошие результаты при тяжелой почечной недостаточности, так как его успешность, в отличие от инфузионной терапии и лечения диуретиками, в меньшей степени зависит от усиления экскреции кальция с мочой. Во время диализа вместе с кальцием выводится большое количество фосфата. Поскольку недостаточность фосфора может усилить тяжесть гиперкальциемии, необходим мониторинг его концентрации и в случае необходимости заместительное введение этого элемента.
Агонисты рецепторов кальция
Средства медикаментозной терапии ПГПТ довольно ограничены, хотя в последнее время появились новые возможности благодаря обнаружению в паратиреоидных клетках рецепторов кальция, через которые осуществляется понижающая регуляция биосинтеза и секреции ПТГ. Соединения, имитирующие действие внеклеточного кальция, могут активировать его рецепторы и, таким образом, подавлять функцию паращитовидных желез. Одним из таких кальцимиметиков является (К)-М-(З-метокси-а-фе-нилэтил)-3-(2-хлорфенил)-1-пропиламин, или R568. Этот препарат уменьшает концентрацию ПТГ и ионизированного кальция в сыворотке крови у женщин с ПГПТ в постменопаузе (Silverberg et al, 1997).
Заключение
Для лечения гиперкальциемии у собак чаще всего применяются солевой диурез и терапия фуросемидом. В случае неэффективности такого лечения рекомендуется глюкокортикоидная терапия. В отличие от многих причин гиперкальциемии первичный гиперпаратиреоз редко нуждается в специализированном медикаментозном лечении, за исключением случаев сопутствующей почечной недостаточности.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА
Число пораженных желез
Хирургические операции на комплексе щитовидная железа-паращитовидные железы описаны достаточно хорошо (Bojrab, 1983; Slatter, 1985). Важно найти все четыре паращитовидные железы и оценить их состояние, прежде чем решать, какую или какие из них следует удалить. Нелишне повторить, что свыше 90% собак с ПГПТ имеют одну автономно функционирующую опухоль и практически все остальные - две аномальные железы. Мы не при
бегаем к хирургическому вмешательству, если УЗИ шейного отдела у собаки с ПГПТ не выявляет аномальную тканевую массу или массы. Обнаружение таких масс подтверждает диагноз и позволяет установить местонахождение опухоли, что необходимо для ее последующего удаления.
Оценка состояния паращитовидных желез во время операции без предварительного УЗИ может быть как очень легкой, так и весьма затруднительной. Обычно хирург быстро устанавливает увеличение одной или нескольких паращитовидных желез. Однако, как показывает наш опыт, иногда видна только одна железа или ни одной железы не удается обнаружить. Любую увеличенную или аномальную паращитовидную железу (либо две или даже три из них) необходимо удалить и гистологически исследовать, если при осмотре выявляется их увеличение и/или изменение окраски. Оставшиеся одна или более желез должны защитить животное от хронического гипопаратиреоза, хотя в ближайшем послеоперационном периоде возможна временная гипокальциемия вследствие их атрофии после хронического подавления автономно функционирующей аномальной железой или железами. Во всех случаях необходимо попытаться сохранить хотя бы одну паращитовидную железу для поддержания кальциевого гомеостаза и предотвращения устойчивой гипокальциемии. Если все железы имеют нормальный или небольшой размер, то диагноз ПГПТ ставится под сомнение. Если же все железы равномерно увеличены, возникает подозрение на вторичный гиперпаратиреоз.
Для облегчения идентификации гиперфункцио-нирующих паращитовидных желез во время операции предлагается использовать внутривенную инфузию нового метиленового синего из расчета 3 мг/кг. С помощью такой инфузии были обследованы три собаки с ПГПТ, и у всех трех была выявлена окрашиваемая опухоль. Однако у двух из них инфузия красителя привела к анемии, появлению телец Гейнца и везикуляции эритроцитов (Fingeroth, Smeak, 1988). Мы не сталкивались с необходимостью применения данной процедуры в нашей практике.
Единичная аденома, гиперпластический узел или карцинома
Почти у всех собак с ПГПТ имеется одиночная, легко идентифицируемая опухоль, чаще всего аденома паращитовидной железы. У 12 из 168 обследованных нами собак с ПГПТ при хирургическом исследовании была обнаружена опухоль, выглядевшая как типичная аденома, однако, при гистологическом исследовании она оказалась карциномой. Еще у 11 животных тканевая масса была следствием гиперплазии железы. Примерно половина исследованных нами опухолей локализовалась на вентральной поверхности щитовидной железы. Если опухоль не видна на вентральной поверхности, то внимательный осмотр дорсальной поверхности всех до
НА • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
лей щитовидной железы обычно выявлял ее в виде дискретной структуры на прилегающей ткани щитовидной железы или в ее толще (см. рис. 16-23). Паратиреоидные аденомы, имеющие «наружную» локализацию, легко удаляются без существенного повреждения окружающих тканей (см. рис. 16-18 и 16-23). У некоторых собак с «внутренней» паращитовидной аденомой приходилось односторонне удалять весь комплекс щитовидная железа-паращи-товидные железы. Примерно у 5% собак хирургу не удавалось обнаружить аномальную ткань, и он отказывался от резекции той доли щитовидной железы, в которой, по предварительным данным УЗИ должна была находиться опухоль. Последующие наблюдения подтвердили правильность такого решения во всех этих случаях. Необходимо подчеркнуть, что с технической точки зрения хирургическое удаление опухоли паращитовидных желез не представляет трудности.
Множественное увеличение паращитовидных желез
Только 13 (8%) из 168 собак нашей группы с ПГПТ имели более одной увеличенной паращитовидной железы. У 12 животных были увеличены две, а у одной все четыре железы. У трех собак имелось по две «гиперплазированных» паращитовидных железы, у трех других - по две аденомы плюс одна гиперплазированная железа, у двух - по одной гиперплазированной железе и карциноме и у одной особи - аденома и карцинома (их гистологические характеристики обсуждаются ниже). У одной из 168 были увеличены все четыре железы (DeVries et al., 1993), и в каждой имела место первичная гиперплазия (т.е. не удалось выявить иных причин патологии). Увеличение сразу четырех паращитовидных желез предполагает наличие множественных аденом или, что более вероятно, их гиперплазию.
В случаях увеличения более одной железы, скорее всего, имеет место первичный, а не вторичный (почечный или алиментарный) гиперпаратиреоз. В ходе предоперационного осмотра вторичный гиперпаратиреоз, как описано в данном разделе, обычно исключается. Если ветеринар не сомневается в первичной природе заболевания, само собой напрашивается решение об удалении двух желез. Если же поражены все четыре железы, для принятия решения необходимо оценить общее клиническое состояние животного и его почечную функцию, а также готовность хозяина проводить лечение устойчивого гипопаратиреоза.
Рецидивы первичного гиперпаратиреоза
У 14 из 168 наших собак с ПГПТ имелись одиночные опухоли паращитовидных желез, удаление которых приводило сначала к излечению заболевания, а потом к его рецидиву. В каждом из
этих случаев симптомы ПГПТ отсутствовали на протяжении, по меньшей мере, 6 месяцев, а у 12 из собак в течение от 12 до 30 месяцев. Затем у всех собак развивалась гиперкальциемия вследствие появления вторичной одиночной автономно функционирующей опухоли паращитовидной железы, которую приходилось удалять. У девяти собак первоначальным диагнозом была аденома, у трех - карцинома и у двух - гиперплазия паращитовидной железы. У восьми собак результаты гистологического исследования удаленной ткани после второй операции были такие же, как после первой. В то же время, у двух из трех собак с карциномой повторно развившаяся опухоль была классифицирована как аденома; у одной собаки с первичной аденомой вторая опухоль оказалась карциномой; а у одной с первичной гиперплазией при второй операции была удалена аденома. Эти данные свидетельствует о большой вероятности рецидивирования опухолей паращитовидных желез и указывают на необходимость периодического определения концентрации кальция после ее стабилизации. Шесть из 14 собак, описанных в данном разделе, были представлены кеесхондами, поэтому именно эта порода особенно нуэвдается в рутинном мониторинге после первичного лечения опухолей паращитовидных желез.
Отсутствие опухоли паращитовидных желез при хирургическом исследовании
В тех случаях, когда при самом тщательном исследовании обеих зон щитовидной железы опытному хирургу не удается обнаружить увеличение паращитовидных желез, наиболее вероятным диагнозом является гиперкальциемия, обусловленная скрытой неоплазией, биосинтезом ПТГ паратиреоидной опухолью, локализованной в краниальном отделе средостения, или наличием продуцирующей ПТГ опухоли непаратиреоидного происхождения (т.е. эктопического гиперпаратиреоза). Необходимо тщательно обследовать вентральную область шейного отдела и удалить любую опухоль. Может также потребоваться инфузия нового метиленового синего, как кратко описано выше (Fingeroth, Smeak, 1988). Ни одна из проведенных нами операций не позволила полностью излечить ПГПТ.
Мы не располагаем опытом хирургического исследования переднего отдела средостения с целью выявления опухолевой паратиреоидной ткани. Такое хирургическое вмешательство сопряжено с определенными трудностями. Вероятность обнаружения эктопической аномальной паратиреоидной ткани значительно ниже, чем неидентифицирован-ной злокачественной опухоли, вызывающей гиперкальциемию. Поэтому следует тщательно оценить целесообразность продолжения хирургического исследования. Лучше предпринять дальнейшее диагностическое тестирование, чтобы выявить скрытую опухоль.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 775
НОВЫЕ МЕТОДЫ ТЕРАПИИ ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА У СОБАК
Чрескожная обработка этанолом под контролем ультразвука
УЗИ является прекрасным средством выявления опухолей паращитовидных желез у собак с ПГПТ и вторичной гиперкальциемией. Исходя из нашего опыта использования УЗИ для диагностических целей и результатов исследований на людях с ПГПТ (Bennedbaek et al, 1997), мы оценивали эффективность обработки этанолом в качестве способа удаления опухоли паращитовидных желез (Long et al, 1999). Этанол вызывает коагуляционный некроз и тромбоз сосудов, питающих обрабатываемую ткань.
ПГПТ был диагностирован у 12 собак, клинические и биохимические характеристики которых были типичны для данного заболевания. При УЗИ шейной области у каждой из этих собак была обнаружена одиночная гипоэхогенная опухоль в виде тканевой массы округлой или овальной формы вблизи щитовидной железы. У восьми собак опухоль была расположена на правой стороне шеи, а у четырех - на левой стороне. Длина опухолей была от 4 до 10 мм. У шести животных они размещались на передней поверхности одной доли щитовидной железы, у трех - в пределах каудального полюса доли и еще у трех - в средней части тела щитовидной железы. Расчетный объем паращитовидных опухолей на щитовидной железе колебался от 0,06 до 0,16 см3. Все опухоли считались аденомами.
На вентральный отдел шейной области всех собак под общим наркозом накладывали зажимы и проводили ее асептическую обработку. Опухоль паращитовидной железы идентифицировали с помощью УЗИ и под контролем ультразвука в соответствующую железу вводили кончик иглы 27 калибра с прикрепленной к ней артериальной трубкой (рис. 16-24). Соединенный с трубкой шприц заполняли этанолом, объем которого примерно соответствовал объему опухолевой ткани, и медленно вводили его в опухоль, по-прежнему под ультразвуковым контролем, дабы обеспечить поступление этанола точно в нужную ткань. Цель этой процедуры состояла в том, чтобы, введя достаточное количество этанола, добиться его равномерной диффузии по всему объему опухоли. При этом использовался датчик с высокой разрешающей способностью (работающий на частоте 10 мГц), с помощью которого определяли толщину лежащих над опухолью шейных тканей. Ввиду малого размера опухолей паращитовидных желез необходим большой опыт работы с иглой под контролем ультразвука. Паращитовидные железы расположены в непосредственной близости к сонной артерии и вагосимпатическому стволу, что требует абсолютно точной локализации иглы до и во время введения этанола.
Этанол легко различим в ткани благодаря своей гиперэхогенности (см. рис. 16-24). Объем этанола,
введенного в каждую опухоль паращитовидных желез, составлял от 50 до 150% ее расчетного объема. Продолжительность анестезии во всех случаях не превышала 1 часа (в среднем 38 минут). Одиннадцати из 12 собак производили разовую инъекцию этанола и только одной собаке его вводили дважды с интервалом в 48 часов, поскольку первая доза не привела к снижению концентрации кальция до нормальной величины. У всех 12 собак уровень общего кальция в сыворотке крови снизился до нормы. У 11 животных нормализация происходила в течение 48 часов после введения этанола (у 10 после первой и у одной после второй инъекции). У оставшейся собаки гиперкальциемия сохранялась на протяжении 4 дней, но на 5-й день после инъекции концентрация кальция нормализовалась (рис. 16-25). У одной особи спустя 30 дней отмечался рецидив гиперкальциемии, что потребовало хирургического удаления опухоли. У остальных 11 собак уровень кальция оставался в норме на протяжении более 18 месяцев. Единственным побочным эффектом применения этанола было временное изменение звука лая у двух животных. Ретроспективно мы пришли к заключению, что у них имел место преходящий односторонний паралич гортани.
Результаты данного исследования свидетельствуют о том, что чрескожная обработка опухоли этанолом под контролем ультразвука является эффективным способом лечения ПГПТ у собак. Эта процедура гораздо дешевле хирургической операции. Эффективность устранения опухоли у собак путем ее химической обработки может быть выше, чем у людей благодаря тому, что объем их паратиреоидной ткани значительно меньше и, следовательно, требуется меньше этанола для полного разрушения опухоли. С помощью этого метода мы получили прекрасные результаты. Единственная причина, заставившая нас отказаться от его дальнейшего использования, состоит в том, что он не всегда эффективен при лечении кошек с гиперпаратиреозом. Поэтому мы исследовали другой новый метод терапии опухолей паращитовидных желез для кошек (тепловое облучение), используя в качестве модели наших собак с ПГПТ. Убедившись в очень высокой эффективности этого подхода, мы продолжаем использовать его вместо обработки опухолей этанолом.
Чрескожное тепловое облучение под контролем ультразвука
УЗИ дает прекрасную возможность идентифицировать опухоли паращитовидных желез у собак с ПГПТ и вторичной гиперкальциемией. На основании накопленного нами опыта и с учетом данных, полученных на людях и при чрескожной обработке опухолей этанолом у собак, мы оценивали эффективность разрушения опухолей тепловым излучением под контролем ультразвука (Pollard et al, 2001).
11b
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Рис. 16-24. Ультрасонограммы химического разрушения опухоли паращитовидной железы у собаки. А. Вид опухоли в сагиттальной плоскости до операции. Б. В опухоль введена игла 27 калибра. В. Пробная инъекция 96°и этанола для подтверждения правильности локализации иглы внутри опухоли. Обратите внимание на ги-пер )хогенность этанола в сравнении с паренхимальной тканью опухоли. Г. После инъекции требуемого количества этанола вся ткань опухоли становится эхогенной, (Long CD et al: J. Am. Vet. Med. Assoc. 215-217. 1999).
Пре День1 День2 ДеньЗ День4 Деньб 1 мес 3 мес 6 мес Пре День1 День2 ДеньЗ День4 День5 1 мес 3 мес 6 мес
Рис. 16-25. А. Концентрация общего кальция в сыворотках восьми собак до (Пре) и после химического разрушения опухоли паращитовидных желез. Черные горизонтальные линии ограничивают зону нормальных значении концентрации кальция. У собаки № 6 через 4 дня после разрушения опухоли развились клинические симптомы гипокальциемии. Собаке № 8 этанол вводили дважды (представлены данные, полученные после второй инъекции). У собаки № 7 опухоль была удалена хирургическим путем через 1 месяц после введения этанола. Собака № 5 погибла через 3 месяца после химического разрушения опухоли и вне свяш с ней. Б. Концентрация ПТГ в сыворотке крови у восьми собак до (Пре) и после химического разрушения опухоли паращитовидных желез. Черные горизонтальные линии ограничивают зону норма 1ьных значений концентрации. Из: Long CD et al: J Am Vet Med Assoc 215-217, 1999).
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 777
Тепловое излучение разрушает ткань, вызывая ее термический некроз вблизи кончика иглы. Этот метод имеет ряд преимуществ перед обработкой опухоли этанолом. Начать с того, что такое излучение вызывает лишь дискретное повреждение тканей, окружающих неизолированную часть иглы (т.е. отсутствует риск «утечки» как при использовании этанола). Дополнительным преимуществом облучения является отсутствие поражения регионарной сосудистой системы. Кровоток отводит тепло от стенок сосудов. У людей этот способ обеспечивает более эффективное удаление опухоли, чем ее разрушение этанолом, а для достижения ремиссии требуется меньшее число обработок. Тепловое облучение применяли для лечения пациентов с множественными опухолями печени, молочных желез и носовой полости, а также с гипертрофией простаты (Jiao et al, 1999; Livraghi et al, 1999). Недостатком метода является высокая стоимость необходимого оборудования.
Начиная с сентября 1999 по январь 2002, мы использовали чрескожное тепловое облучение для лечения 27 собак с ПГПТ. Все животные имели клинические и биохимические характеристики, типичные для данного заболевания. С помощью УЗИ шейной области у 22 животных был идентифицирован изолированный узел паращитовидных желез, а у пяти собак - по два таких узла. У трех из этих пяти оба узла были расположены на правой стороне шеи, а у двух оставшихся имелось по одному узлу на каждой доле щитовидной железы. Ультразвуковая картина 32 опухолей была весьма сходной. Все они имели сферическую или яйцевидную форму и были гипоэхогенными на фоне окружающей парен-химальной ткани щитовидной железы. Длина опухолей колебалась от 3 до 15 мм.
Каждую собаку с одиночной опухолью паращитовидных желез подвергали однократному облучению. Собак с двумя паратиреоидными узлами на одной стороне шее также обрабатывали однократно в начальном периоде анестезии. У двух собак с двумя узлами на разных сторонах шеи каждый узел
облучали однократно с интервалом в 30 дней. На вентральный отдел шейной области всех собак под общим наркозом накладывали зажимы и проводили ее асептическую обработку. Опухоль паращитовидной железы идентифицировали с помощью УЗИ и под контролем ультразвука в соответствующую железу вводили кончик иглы 27 калибра, находящейся (изолированной) внутри катетера. Удаляли втулку иглы и прикрепляли к ней изолированный провод, противоположный конец которого подсоединяли к источнику излучения (Radiotherapeutics Inc., США). Сначала ткань обрабатывали радиоволнами с энергией 10 Вт на протяжении 10 пли 20 секунд. Если в течение этого времени ультразвуковое наблюдение нс выявляло образования эхогенных пузырьков у кончика иглы, мощность излучения повышали на 2 Вт каждые 5-10 секунд до появления эхогенных очагов (рис. 16-26). При поступлении в ткань максимального количества тепла раздавались хлопающие звуки, служившие сигналом для прекращения дальнейшего увеличения мощности излучения. По мере необходимости многократно изменяли направление кончика иглы, добиваясь облучения всего объема опухоли. Средняя продолжительность анестезии составляла 47 минут, однако, прогрессивно уменьшалась по мере приобретения опыта работы.
У всех 27 собак были получены хорошие результаты. В 26 случаях через несколько дней после проведения описанной процедуры значительно снижалась концентрация ПТГ в сыворотке крови и нормализовались концентрации общего и ионизированного кальция (рис. 26-27). Концен грация кальция оставалась в нормальных пределах в течение года и более. Только у одной собаки через 1 месяц после лечения развился рецидив гиперкальциемии, и опухоль пришлось удалять хирургически. Сразу после теплового облучения односторонней опухоли у одной собаки изменился звук лая, который восстановился в течение пяти последующих дней. Неясно, было ли это изменение следствием интубации или самой процедуры облучения. Признаков боли, отека или нарушения дыхания не было
Рис. 16-26. Ультрасонограмма овального г и по эхогенного узла паращитовидной железы (вид сбоку, слева) у собаки перед тепловым облучением (А); видна игла, введенная в краниальную часть железы через покрывающие се ткани до (Б) и после (В) разрушения опухоли Обратите внимание на гиперэхогенные оча! и в паренхимальной ткани железы на рис. В. Из: Pollard RE et al: J Am Vet Med Assoc 218:1106, 2001.
77Ь • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Рис. 16- 27. А. Концентрация ПТГ' (пмоль/л) у каждой из восьми собак после успешного лечения первичного гиперпаратиреоза. Горизонтальными линиями показан диапазон нормальных концентраций Б. Концентрация ионизированного кальция в сыворотках (ммоль/л) у каждой из пяти собак после успешного лечения первично! о гиперпаратиреоза (в день 0), которым спустя 1-4 дня после операции потребовалось заместительное введение витамина Д. Горизонтальными линиями показан диапазон нормальных концентраций. Из: Pollard RE et al: J Am Vet Med Assoc 218:1106, 2001.
Дни
ни у одной собаки. Одиннадцати из 26 успешно вылеченных собак была назначена терапия витамином Д в связи с гипокальциемией развившейся после облучения (см. следующий раздел). В настоящее время в нашей клинике тепловое облучение является методом выбора для лечения собак с ПГПТ без инкапсулированных камней.
Во время работы под нашим наблюдением находились еще 18 собак с ПГПТ, которые не удовлетворяли критериям, требуемым для включения в данное исследование. Вначале мы пытались лечить двух из них, но не смогли проколоть окружавшую опухоль капсулу и отказались от использования теплового облучения. Однако впоследствии мы стали применять более острые иглы. У одной собаки опухоль была слишком мала для введения в нее иглы, а еще у четырех была расположена слишком близко к сонной артерии, что не гарантировало безопасности при проколе иглой. У одиннадцати животных имелись инкапсулированные камни, требовавшие хирургического удаления. У каждой из этих собак были одновременно произведены резекция опухоли паращитовидных желез и вскрытие брюшной полости.
ЛЕЧЕНИЕ ГИПОКАЛЬЦИЕМИИ ПОСЛЕ УСТРАНЕНИЯ ГИПЕРПАРАТИРЕОЗА
Вопросы заместительного введения витамина Д и кальция подробно обсуждаются в гл. 17.
Общие сведения
Длительное подавление функции нормальных паращитовидных желез приводит к их атрофии, которая является физиологической реакцией на продолжительное воздействие ПТГ при его автономной секреции аденомой и карциномой паращитовидных желез либо их первично гиперплазированной
тканью. Хирургическое удаление или чрескожное разрушение автономного источника ПТГ приводит к быстрому уменьшению его концентрации в кровяном русле (рис. 16-28, см. также рис. 16-27) и соответствующему снижению уровня кальция (см. рис. 16-25, 16-27 и 16-29). Эти изменения обычно происходят в течение 1-7 дней. Нет сомнения, что развивающаяся гипокальциемия коррелирует с длительностью и тяжестью гиперкальциемии до операции, т.е. чем выше у собаки концентрация кальция в крови и чем больше продолжительность гиперкальциемии в дооперационном периоде, тем больше риск развития гипокальциемии после удаления опухоли и излечения ПГПТ.
Некоторые ветеринары настаивают на необходимости документировать понижение концентрации кальция после хирургической операции. Хотя такой подход позволяет получить еще одно подтверждение существовавшего П1 ПТ и его исчезновения после операции, он создает опасность причинения
операции операции
Рис. 16-28. Концентрации ПТГ в сыворотке крови до и после хирургического удаления функционально активной аденомы паращитовидной железы у восьми собак
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
779
опе-
месмесмес
рации
рации
Дни
рации
Дни
Рис. 16-29. Результаты серийных определений концентрации кальция в сыворотке крови до и после удаления опухоли паращитовидных желез у собак с первичным гиперпаратиреозом. А. После возникновения гипокальциемии в послеоперационном периоде этим восьми собакам была назначена заместительная терапия кальцием и витамином ДБ. У этих грех собак до операции была слабая гиперкальциемия и они не получали витамин Д или кальций после удаления опухоли. В. Этим шести собакам витамин Д и кальций начинали вводить сразу после выхода из наркоза. 1'. Концентрация кальция у 34 собак, которым после выхода из анестезии начинали вводить дигидротахистерол.
Дни
До 1 2 3 4 5 6 7 14 21
операции
Дни после операции
боли собаке и возникновения угрожающей жизни гипокальциемии. В следующих двух разделах обсуждаются животные, у которых отсутствовала всякая терапия или терапия непосредственно после проведения операции. Как показывает наш опыт, начало терапии сразу после удаления опухоли, но до снижения концентрации кальция в сыворотке крови, не предотвращает падения его уровня до нормы или ниже се.
Предоперационная концентрация кальция в сыворотке крови ниже 14 мг/100 мл
При концентрации кальция в сыворотке крови в предоперационном периоде ниже 14 мг/100 мл риск послеоперационной гипокальциемии относительно невелик. Оперированная собака должна оставаться в стационаре на протяжении, по меньшей мере, 5 дней, в течение которых один или два раза в день проводится определение уровня общего кальция в
крови. Кроме того, содержание госпитализированного животного в клетке или вольере ограничивает его подвижность. У активного двигающегося животного с гипокальциемией вероятность возникновения клинически выраженной тетании значительно выше, чем у малоподвижного. Физическая нагрузка повышает риск клинической тетании во всех случаях гипокальциемии. Если концентрация общего кальция остается выше 8,5 мг/100 мл (при нижней границе нормы 9—10 мг/100 мл), то животное не нуждается в терапии. Следует, однако помнить, что эта рекомендация носит общий характер и не распространяется на все конкретные случаи. Если скорость снижения концентрации кальция внушает беспокойство или если ветеринар хочет предвосхитить возможные осложнения, следует начать терапию витамином Д.
Если концентрация кальция падает ниже 8,5 мг/100 мл или если у животного появляются клинические симптомы гипокальциемии (табл. 16-14),
780 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ТАБЛИЦА 16-14. КЛИНИЧЕСКИЕ СИМПТОМЫ, ХАРАКТЕРНЫЕ ДЛЯ ОСТРОГО НАЧАЛА ГИПОКАЛЬЦИЕМИИ
Затрудненное дыхание
Нервозность
Мышечная дрожь, подергивание мышц
Судороги и боль в конечностях
Атаксия
Скованная походка Растирание морды Локальные или генерализованные судороги
Покусывание ног
ему следует сразу же назначить витамин Д (в комбинации с кальцием или без него). Вопросы острой и хронической терапии гипокальциемии у собак и кошек всесторонне обсуждаются в гл. 17.
Предоперационная концентрация кальция в сыворотке крови выше 14 мг/100 мл
Как указывалось ранее, чем выше был уровень гиперкальциемии в предоперационном периоде и/ или чем дольше она продолжалась, тем выше вероятность возникновения клинически выраженной послеоперационной гипокальциемии после устранения ПГПТ. В то же время продолжительность предоперационной гиперкальциемии чаще всего остается неизвестной ветеринару. Мы исходим из предположения, что животное с ПГПТ страдает хронической гиперкальциемией, если концентрация кальция в его крови постоянно превышает 14 мг/100 мл. В этом случае во избежание гипокальциемии мы рекомендуем профилактически вводить витамин Д (хитакерол или кальцитриол) в сочетании с кальцием или без него утром в день операции или непосредственно после выхода животного из наркоза (см. гл. 17).
В отдельных случаях мы начинали вводить витамин Д за 24-36 часов до начала операции, поскольку его действие проявляется с некоторой задержкой. Такой подход имеет особенно важное значение для собак с тяжелой гиперкальциемией до операции (более 18 мг кальция/100 мл). Начало этой терапии не предотвращало снижения концентрации кальция в крови в послеоперационном периоде до нормы или ниже ее. Оперированной собаке создают спокойные условия, оставляя ее в клетке или вольере на срок не менее 5 дней. У находившихся в нашей клинике собак послеоперационная гипокальциемия развивалась в период от 12 часов до 20 дней после удаления опухоли. У большинства животных она имела место спустя 2-6 дней, а тетания (если она наблюдалась) - через 4—7 дней после операции. С целью послеоперационного мониторинга кальциемии концентрацию кальция определяют один или два раза в день.
Цель терапии витамином Д и кальцием состоит в поддержании концентрации последнего в сыворотке на уровне, близком к нижней границе нормы (т.е. 8-9,5 мг/100 мл). При такой концентрации кальция клинические признаки гипокальциемии отсутству
ют, а риск гиперкальциемии сведен до минимума; в то же время, она достаточна, чтобы стимулировать восстановление функции атрофированных паратиреоидных желез. При терапии витамином Д следует избегать увеличения концентрации кальция у собак до ее средних нормальных показателей и тем более до верхней границы нормы или еще выше. Обычно такое повышение сопровождается увеличением концентрации фосфата в крови и предрасполагает животное к минерализации мягких тканей.
По мере того как паратиреоидные железы снова приобретают способность контролировать гомеостаз кальция, его заместительное введение (и терапию витамином Д) постепенно прекращают. Процесс восстановления функции оставшихся паращитовидных желез носит предсказуемый характер, что позволяет постепенно понижать дозы кальция и витамина Д в процессе отмены терапии. Отмену начинают после стабилизации уровня кальция и возвращения животного владельцу. Обычно сначала прекращают введение витамина Д, постепенно увеличивая интервал между его последовательными приемами (например, переходя с двукратного на однократное введение в течение суток на протяжении 2 недель, затем к введению витамина через день на протяжении двухнедельного периода, потом раз в три или в четыре дня в течение 4 недель и, наконец, один раз в неделю в течение 2 или 4 недель). Перед каждой сменой режима введения витамина Д определяют концентрацию кальция в сыворотке крови с целью профилактики латентной гипокальциемии. Если уровень кальция падает ниже 8 мг/100 мл, снижение дозы витамина откладывают или даже увеличивают ее. Концентрация кальция должна постоянно оставаться выше 8 мг/100 мл, чтобы устранить опасность возникновения тетании. Витамин Д можно отменить через 2-4 недели после ограничения его введения до одного раза в неделю. Затем начинают постепенно отменять заместительное введение кальция, но при условии, что его концентрация в сыворотке остается в нормальных пределах. Процесс отмены обычно занимает 3 или 4 месяца. Важно помнить о значительной индивидуальной вариабельности реакции отдельных животных на заместительную терапию. Поэтому контрольные измерения концентрации кальция следует проводить как можно чаще.
Резистентность к витамину Д/время до проявления эффекта
Нам встречались собаки, а еще чаще кошки, резистентные к таблетированному витамину Д. Резистентность легко преодолевалась использованием витамина в жидкой форме. Обычно его действие проявлялось не ранее чем через 24 часа после введения. Эффект витамина постепенно нарастал на протяжении нескольких дней после начала терапии и практически всегда был хорошо заметен не позднее 7 дня. Тем не менее, у одной собаки с ПГПТ все же
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 781
сохранялась ярко выраженная, устойчивая резистентность к витамину Д. У этой особи была диагностирована вторичная недостаточность функции печени, обусловленная аномалией ее воротной системы, которая появилась десятью годами раньше. Помимо гиперкальциемии, собака имела все биохимические признаки тяжелой недостаточности печеночной функции, которые были впервые обнаружены в шестимесячном возрасте и не изменились со временем. По завершении лечения ПГПТ у нее развилась гипокальциемия. Не помогало ни пероральное введение дигидротахистерола и кальцитриола, ни внутривенные и подкожные инъекции кальцитриола. При столь необычной комбинации признаков трудно сказать, имело ли место их взаимное влияние.
ПАТОЛОГИЯ
Субъективность интерпретации гистологических данных
Автономно функционирующие паращитовидные железы человека, собак и кошек гистологически классифицировались как аденомы, карциномы или гиперплазии. К сожалению, контролируемые исследования продемонстрировали трудность интерпретации гистопатологических данных, в частности, уверенной дифференциации аденомы от гиперплазии; более того, доброкачественная паратиреоидная ткань иногда имеет множество гистологических признаков малигнизации (Aurbach et al, 1985а). Таким образом, гистологическая классификация заболеваний паращитовидных желез в определенной степени зависит от их макроскопических характеристик, выявляемых при хирургическом исследовании, в ходе которого хирург оценивает число, размер и внешний вид нормальных и измененных желез, после чего патолог подтверждает паратиреоидное происхождение удаленной ткани.
Примерно у 80% людей с гиперпаратиреозом поражена одна железа (аденомой, карциномой или гиперплазией), а у остальных 20% - две или более паращитовидных желез («гиперплазия») (Arnaud, Kolb, 1991). У собак с ПГПТ поражение одной железы встречается в 90% случаев и примерно у 10% поражено две железы. Диагностика карциномы основывается на соответствующей комбинации макроскопических характеристик, гистологического строения и биологической активности опухоли. У человека автономно функционирующие паращитовидные железы бывают злокачественными не более чем в 2% случаев. Среди обследованных нами собак карцинома была диагностирована у 5-10% особей, но ни у одной не было отдаленного метастазирования такой опухоли.
Одиночные паратиреоидные опухоли
Общие сведения. У людей, собак и кошек причиной ПГПТ чаще всего является функционально
активная аденома главных клеток, секретирующая избыточное количество ПТГ (Aurbach et al, 1985а; Berger, Feldman, 1987; Feldman, 1989; Henderson et al, 1990; Shane, 1990; Bilezikian, 1991; Kallet et al, 1991, Bruyette, 1992). Обычно такая аденома развивается в паращитовидной железе как одиночная опухоль светло-красно-бурого цвета и локализуется в шейной области в непосредственной близости от щитовидной железы (см. рис. 16-18 и 16-23). Ввиду трудности гистологической классификации новообразований в увеличенных паращитовидных железах как аденомы, карциномы или аденоматозной гиперплазии при хирургическом исследовании (когда выявляется одна аномально большая железа, а остальные железы нормальные, атрофированы или вообще отсутствуют) ставится предварительный диагноз «аденома». Столь же условно термин аденома применяется при гистологической характеристике такой ткани.
Аденома. Диагноз «аденома» ставится в тех случаях, когда легко различим единственный, хорошо очерченный узел диаметром более 5 мм, который сдавливает атрофированную, но во всех других отношениях нормальную паратиреоидную ткань (Сареп, Martin, 1983; DeVries et al, 1993). Аденомы обычно состоят из диффузных главных клеток паращитовидной железы. В группе обследованных нами собак с данным заболеванием примерно 85% животных имели одиночные аденомы, которые обнаруживались либо во время хирургической операции в шейной области, либо при вскрытии. У человека были описаны множественные аденомы паращитовидных желез (Aurbach et al, 1985а). Такие же опухоли были выявлены при первичном хирургическом обследовании у 3 - 5% собак нашей группы.
Почти у 5 - 8% наших собак с ПГПТ через 12 месяцев после успешного хирургического удаления одиночной аденомы паращитовидных желез развивался рецидив гиперкальциемии. У всех этих особей повторно удаляли вторую опухоль, которая в большинстве случаев также была классифицирована как аденома, хотя отдельные животные имели карциному или гиперлазию паращитовидной железы. Ни у одной из собак тщательное первичное хирургическое исследование не выявило присутствия сразу двух опухолей. Исходное отсутствие второй опухоли подтверждалось также полным, хотя и временным, прекращением гиперкальциемии после первой операции.
Карцинома. Карцинома главных клеток паращитовидных желез встречается у 3 - 4% людей с первичным гиперпаратиреозом (Shane, Bilezikian, 1982). По меньшей мере, у 50% таких больных злокачественное новообразование выявляется уже при пальпации шейной области. Во время операции опухоль обычно идентифицируется как твердая структура, прочно сросшаяся с окружающей тканью (Aurbach et al, 1985а). Характерным гистологическим признаком такой опухоли является
782 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
капсулярная или васкулярная инвазия. Карцинома паращитовидных желез отличается локальной ин-вазивностью и имеет тенденцию к распространению на регионарные лимфатические сосуды, в легкие, печень и кости.
У собак и кошек карциномы главных клеток паращитовидных желез встречаются редко (Berger, Feldman, 1987) и поэтому изучены недостаточно. Среди наших 168 собак с ПГПТ карцинома была гистологически диагностирована у семи животных (около 4%). При хирургическом обследовании все эти опухоли выглядели как типичные аденомы. Их локальная инвазия или отдаленное метастазирование не зарегистрированы.
Первичная гиперплазия. Гиперплазия предполагает поражение всей паратиреоидной ткани и обычно диагностируется в случае макроскопического и микроскопического изменения более одной паращитовидной железы. Видимое увеличение всех четырех паращитовидных желез, само по себе, не означает их гиперплазии; с другой стороны, микроскопические изменения могут развиваться в железах нормального размера (Aurbach et al, 1985а). К сожалению, точный патологический диагноз возможен только на основании четких критериев, позволяющих отличить аденому от гиперплазии и обе эти аномалии от нормального состояния паращитовидных желез. В настоящее время такие критерии еще не разработаны. В результате часто дифференциация условна и основана на числе пораженных желез. Так, поражение одной железы предполагает диагноз аденомы, а поражение большего числа желез говорит в пользу гиперплазии (Verdonk, Edis, 1981).
Мы опубликовали данные о шести собаках, у которых на основании вышеописанного условного критерия была диагностирована гиперплазия паращитовидных желез (DeVries et al, 1993). Они составляли 8% из общей группы из 72 собак с ПГПТ, находившихся на тот момент под нашим наблюдением. Такая частота встречаемости данной аномалии была подтверждена в наших более поздних исследованиях. Термины «узловая гиперплазия» и «аденоматозная гиперплазия» использовались для характеристики паращитовидных желез, содержащих множественные узлы диаметром менее 5 мм. Аденомами считались опухоли этих желез, каждая из которых представляла собой одиночный узел более 5 мм в диаметре.
Дифференциальная диагностика аденомы и гиперплазии важна с точки зрения выбора хирургического или медикаментозного лечения, а также установления долгосрочного прогноза заболевания. В принципе, излечение собаки или кошки возможно после полной хирургической резекции одиночной аденомы при условии сохранения трех нормальных желез (даже атрофированных в ближайшем послеоперационном периоде), которые необходимы для предотвращения перманентного гипопаратиреоза. В отличие от этого, при гиперплазии паращитовидных желез риск устойчивого или рецидивирующе
го гиперпаратиреоза может быть устранен только путем удаления всей аномальной паратиреоидной ткани. Однако такая строгая закономерность отсутствовала в группе наблюдавшихся нами собак с ПГПТ, которым производилась субтотальная резекция паратиреоидной ткани. У трех из шести упоминавшихся выше животных была удалена одна опухоль, а у двух улучшение состояния наступило после удаления более одной, но не всех четырех желез. Возможно, такая ситуация отражает несоответствие между гистологическим диагнозом и биологической активностью ткани. Только одной из шести собак потребовалась резекция всех четырех паращитовидных желез (DeVries et al, 1993).
Причина гиперплазии паращитовидных желез при ПГПТ неизвестна. У человека возможно участие генетических факторов, поскольку описано несколько семей, в которых это нарушение наследовалось по аутосомно-доминантному типу (Arnaud, Kolb, 1991). Потенциально наследственная природа первичного гиперпаратиреоза заслуживает особенно пристального внимания в свете данных, свидетельствующих о непропорционально высокой частоте его встречаемости у кеесхондов. Согласно другим предположениям, гиперплазия и аденома паращитовидных желез у человека могут развиваться вторично как результат изменения ответа главных клеток на воздействие таких нетипичных секрето-генов, как глюкагон, вазоактивный кишечный полипептид или гистамин (Brown, 1980, 1982).
Выводы. Среди находившихся под нашим наблюдением собак с ПГПТ, у которых хирургическим путем были удалены одиночные новообразования паращитовидных желез, 87% животных имели изолированную аденому, 8% - первичную гиперплазию одной железы, а 5% - карциному. Как показывает наш опыт, гистологическая диагностика представляет лишь академический интерес. Во всех случаях мы отмечали сходную отдаленную реакцию на проведенное лечение. Рецидивы развивались независимо от первоначального гистологического диагноза и имели место примерно у 10% животных. Результаты гистологического исследования ткани, удаленной во время повторной операции, с равной частотой совпадали с первоначальным диагнозом или отличались от него. Мы ни разу не наблюдали отдаленного метастазирования или локальной инвазии одиночной карциномы паращитовидных желез. Это не значит, что такие явления невозможны, но, по нашему мнению, должны быть очень редки.
Нелишне повторить, что примерно 10% собак с ПГПТ на момент установления первичного диагноза имеют в паращитовидных железах по два узла. Они с равной вероятностью могут принадлежать к одному или разным гистологическим типам (в последнем случае один представлен, например, аденомой, а другой карциномой либо один аденомой, а другой гиперплазией). Частота рецидивов у животных с двумя узлами вдвое ниже, чем у собак с одним одиночным новообразованием.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 783
Паратиреоидная ткань в средостении
Паратиреоидную ткань, вытесненную в передний отдел средостения вследствие увеличения размеров тимуса в процессе эмбрионального развития, часто считают «эктопической», поскольку в силу своей локализации она не связана со щитовидной железой. Такая ткань также подвержена неопластическому росту. У человека этот процесс является редкой, но достаточно хорошо известной причиной появления одиночной автономно функционирующей аденомы, секретирующей ПТГ и служащей причиной первичного гиперпаратиреоза (Heath, 1989). Случаи локализации паратиреоидной ткани, вызывающей первичный гиперпаратиреоз, в средостении собак или кошек не известны, хотя у одной кошки с нор-мокальциемией была диагностирована паратиреоидная киста средостения (Swainson et al, 2000).
Термин множественная эндокринная неоплазия (МЭН) используется для обозначения группы встречающихся у человека синдромов (часто семейных), характеризующихся наличием гиперплазии или неоплазии двух или более эндокринных желез. Известны две формы МЭН, включающие поражение паращитовидных желез: МЭН I типа (паратиреоидная гиперплазия в сочетании с аденомой/карциномой островковых клеток поджелудочной железы или аденомой/гиперплазией передней доли гипофиза) и МЭН Па типа (медуллярная карцинома щитовидной железы в сочетании с феохромоцитомой и/или паратиреоидной гиперплазией) (см. гл. 5). В обоих случаях гиперплазия паращитовидных желез развивается чаще, чем неоплазия. Несмотря на разную степень клинических проявлений отдельных составляющих МЭН, доминирующим расстройством при МЭН I типа является гиперпаратиреоз, а при МЭН Па типа - медуллярная карцинома щитовидной железы (Leshin, 1985). У собак и кошек описаны спорадические случаи множественных эндокринных расстройств.
Наследственный неонатальный первичный гиперпаратиреоз
У людей описана редкая форма наследственного неонатального первичного гиперпаратиреоза, обусловленная диффузной гиперплазией главных клеток паращитовидных желез. Имеется также сообщение о первичной паратиреоидной гиперплазии у двух щенков немецкой овчарки в выводке, состоявшем из четырех щенков-сук (Thompson et al, 1984). Клинические симптомы заболевания у щенков проявились уже к двухнедельному возрасту и включали задержку роста, мышечную слабость, полиурию и полидипсию. Предполагается наследование первичного гиперпаратиреоза по аутосомнорецессивному типу и его сходство с аналогичным заболеванием у детей.
Гистологическая картина паращитовидных желез у животных разных пород
Нет сомнения, что у кеесхондов существует предрасположенность к заболеванию ПГПТ. Ввиду явно выраженного семейного характера заболевания у этой породы, мы во всех случаях исходим из предположения о наличии у них гиперплазии паращитовидных желез или рецидива заболевания. В обследованной нами группе собак с ПГПТ кеесхонды составляли 40%, и половина собак с рецидивами заболевания также была представлена этой породой.
ПРОГНОЗ
Первичный гиперпаратиреоз у собак имеет вполне благоприятный прогноз. После лечения может развиться гипокальциемия, однако, она не влияет на прогноз и легко устраняется при условии адекватного мониторинга состояния животных и соответствующей заместительной терапии. Из лечившихся в нашей клинике собак только у 33% отмечались клинические проявления гипокальциемии. Рутинное применение витамина Д (дигидротахистерола или кальцитриола) и заместительное введение кальция позволяло значительно снизить частоту тетании. Во избежание поражения почек следует избегать передозировки витамина Д.
784 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ У КОШЕК
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПЕРКАЛЬЦИЕМИИ У КОШЕК
Есть основания утверждать, что подходы к дифференциальной диагностике гиперкальциемии у собак в целом пригодны и для кошек. В исследовании, включавшем 71 кошку с гиперкальциемией, средний возраст животных был около 9 лет, а средняя концентрация кальция в крови равнялась 12,2 мг/100 мл (т.е. была ниже, чем при гиперкальциемии у собак). Наиболее частыми клиническими симптомами заболевания были анорексия и вялость, отмечавшиеся у 70% животных. Рвота, диарея и/или запоры были зарегистрированы у 27% кошек, полиурия и/или полидипсия у 24%, а нарушения со стороны мочевой системы у 23%. Неврологическая симптоматика имела место у 14% кошек (Savary et al, 2000).
Неоплазия была диагностирована у 30% включенных в исследование животных. Наиболее обычными новообразованиями были лимфома и плоскоклеточная карцинома, реже встречались лейкемия, остеосаркома, фибросаркома, недифференцированная саркома и бронхогенная карцинома. У одной кошки было сочетание бронхогенной карциномы и гиперкальциемии (Andersen et al, 2000). Нарушение почечной функции диагностировалось у 25% кошек, причем у половины из них имелись мочевые камни. В другом исследовании у кошек с хронической почечной недостаточностью концентрация общего кальция в сыворотке крови обычно была в норме, а концентрация его ионизированной формы - на нижней границе нормы или еще меньше (Barber, Elliott, 1998). У нескольких кошек с гиперкальциемией имелись мочевые камни при сохранении нормальной функции почек. Четыре кошки (6%) имели ПГПТ, а одна - гиперкортицизм. У некоторых животных был гипертиреоз или сахарный диабет, однако, ни то, ни другое заболевание, по-видимому, не имело отношения к гиперкальциемии. Еще у четырех кошек (6%) были диагностированы инфекции или гранулематозное заболевание (в частности, инфекционный перитонит кошачьих (ИПК), токсоплазмоз, актиномикоз или криптококкоз). Таким образом, дифференциальная диагностика гиперкальциемии у кошек существенно не отличается от таковой у собак (Mealey et al, 1999; Savary et al, 2000). При дифференциальной диагностике следует учитывать и ряд других
заболеваний, таких как токсикоз, обусловленный избытком витамина Д, разнообразные неоплазии и множественные гранулемы.
ИДИОПАТИЧЕСКАЯ ГИПЕРКАЛЬЦИЕМИЯ У КОШЕК
Гиперкальциемия у кошек развивается реже, чем у собак, хотя в некоторых географических районах ее частота увеличилась после 1990 года (Barsanti, 1997; Refsal et al, 1998; Midkiff et al, 2000; Rosol et al, 2000). Поразительной чертой этого расстройства является его необъяснимый характер. Ветеринары, обнаруживающие слабую или средней тяжести гиперкальциемию у кошек молодого, среднего и старшего возраста, не могут установить ее причину (Rosol et al, 2000). У одних животных повышенная концентрация кальция в крови сохраняется на протяжении многих лет зачастую без каких-либо внешних проявлений, у других отмечается плохой аппетит, уменьшение веса тела или общая слабость. Концентрация ионизированного кальция у них также повышена, а иногда даже непропорционально высока по сравнению с концентрацией общего кальция (Rosol et al, 2000).
Рентгенографическое или ультразвуковое исследование выявляет у некоторых животных не-фрокальциноз или мочевые камни. Подсчитано, что до 35% кошек с оксалатными камнями имеют гиперкальциемию. Функция почек, оцениваемая по концентрации AM в крови и креатинина в сыворотке, вначале остается нормальной, но впоследствии у большинства животных развивается почечная недостаточность. У таких кошек отсутствуют признаки неопластического процесса (не обнаруживаемые даже при вскрытии), а тестирование на наличие вирусов лейкемии кошачьих (FeLV) и иммунодефицита кошачьих (FIV) дает отрицательные результаты. Концентрация ПТГ в сыворотке крови остается нормальной или понижена, ПрПТГ не определяется, а концентрация витамина Д находится в нормальных пределах. Предполагалось, что описанное состояние обусловлено хроническим ацидозом, однако, анализ газового состава венозной крови не выявил существенных отклонений от нормы. Неясно, отличаются ли патофизиологические механизмы идиопатической гиперкальциемии у кошек с мочевыми камнями и без них (Rosol et al, 2000).
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ • 785
Хирургическое обследование шейного отдела не выявляет существенных нарушений, а субтотальная паратиреоидэктомия не устраняет гиперкальциемию. Она сохраняется также после обогащения пищевого рациона кошек клетчаткой. Терапия преднизоном (обычно в дозах 5-10 мг/день на животное) у некоторых кошек вызывала длительное уменьшение концентрации кальция в крови. Кроме того, преднизон улучшал аппетит и вызывал прирост веса тела независимо от его действия на уровень кальция.
Можно с уверенностью сказать, что практически любая собака с гиперкальциемией имеет специфическое заболевание, объясняющее данное биохимическое расстройство. Точно так же можно утверждать, что у очень многих кошек гиперкальциемия необьянима. Есть предположение, что «проблемы» просто не существует: надо лишь принять более широкий диапазон нормальных концентраций кальция у кошек.
ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ У КОШЕК
В дополнение к 10 кошкам обследованной нами группы мы располагаем опубликованными данными еще о девяти животных с ПГПТ. Таким образом, обсуждение касается только 19 кошек, что гораздо меньше, чем в случае собак с ПГТП. Из 19 кошек с гиперкальциемией, обусловленной первичным гиперпаратиреозом, семь кошек были описаны в одном сообщении, четыре - в другом, еще в двух
- по две особи и, наконец, в одном - одна кошка (Kallet et al, 1991; Marquez et al, 1995; Den Hertog et al, 1997; Savary et al, 2000; Sueda, Stefanacci, 2000).
Средний возраст 19 кошек составлял примерно 13 лет (от 8 до 20 лет), они принадлежали к разным породам. Наиболее частыми клиническими симптомами, отмечавшимися их хозяевами, были анорексия, вялость, сонливость и рвота, реже регистрировались запоры, полиурия, полидипсия и уменьшение веса тела. Другие проявления расстройства встречались редко. Пальпируемые опухоли паращитовидных желез были выявлены у 11 из 19 кошек. Частота их диагностики и характер наблюдавшихся владельцами клинических симптомов заметно отличались от картины, имевшей место у собак, среди которых ни у одной не было пальпируемой опухоли, зато у многих развивались полиурия, полидипсия и мышечная слабость.
Гиперкальциемия была единственным устойчивым нарушением, выявлявшимся при ОАК и биохимическом анализе сывороток у обследованных нами кошек (табл. 16-15). У всех животных была постоянно повышена концентрация как общего, так и ионизированного кальция. У некоторых кошек имелись камни в мочевом пузыре, а у многих была нарушена концентрация AM в крови и креатинина в сыворотке (что нетипично для собак с тем же заболеванием). УЗИ шейной области у нескольких кошек не выявило никакой патологии, но у других животных визуализировались опухоли, которые считались бы очень крупными у собак. У
ТАБЛИЦА 16-15. КЛИНИЧЕСКАЯ, ЛАБОРАТОРНАЯ И ГИСТОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА 10 КОШЕК СО СПОНТАННЫМ ПЕРВИЧНЫМ ГИПЕРПАРАТИРЕОЗОМ (данные У.С.Дейвиса)
Кошка Клинические симптомы Концентрация кальция в крови (мг/100 мл) Концентрация (мг/1Ьо мл) AM в крови (мг/100 мл) Концентрация креатинина (мг/100 мл) Удельный вес мочи Гистологическая картина паращитовидных желез
15 лет, М, К, Анорексия, рвота 14,6 3,4 35 1,8 1,011 Одиночная
БДШ 14 лет, Ж, О Анорексия, рвота, 22,8 6,6 70 3,2 1,013 аденома Одиночная
сиамская 15 лет, М, К, подергивание мышц Отсутствуют 13,5 з,з 21 2,2 1,031 аденома Одиночная
сиамская 15 лет, Ж,О, Полидипсия, 13,3 2,2 31 2,7 1,010 аденома Одиночная
сиамская 8 лет, Ж, О, полиурия Анорексия, умень- 13,8 1,8 15 1,0 1,015 аденома Одиночная
БКШ 14 лет, Ж, О, шение веса Полидипсия, по- 15,4 2,5 30 1,2 1,010 аденома Одиночная
БКШ 9 лет, Ж, О, лиурия,вялость Анорексия 17,1 6,2 63 2,6 1,026 аденома Двусторонняя
сиамская 9 лет, М, К, Анорексия, рвота, 15,2 2,6 59 3,6 1,015 цистаденома Одиночная
БКШ 14 лет, М, К, вялость, дисурия Запоры 13,4 3,7 41 2,2 1,022 карцинома Одиночная
БКШ 12 лет, М, К, Уменьшение веса, 14,1 3,2 27 1,4 1,018 аденома Двусторонняя
БКШ Норма вялость, запоры 8,8-11,4 2,4-6,1 10-30 0,8-2,0 - карцинома
М - самец, Ж - самка, К - кастрированный, О - овариэктомированная или овариогистерэктомированная, ДДШ - беспородная длинношерстная, ДКШ - беспородная короткошерстная
786
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
двух особей имелось по одной опухоли паращитовидных желез размером соответственно 4,4 х 2 х 1 см и 1,7 х 1,1 х 1 см (Sueda, Stenafacci, 2000). В тех случаях, когда измеряли концентрацию ПТГ в сыворотке, она была либо в нормальных пределах (от 0 до 4 пмоль/л), либо повышена. У одной кошки концентрацию ПТГ определяли в семи разных пробах крови: в пяти случаях она была нормальной, а в двух остальных - повышенной.
У большинства из 19 кошек опухоль была удалена хирургическим путем, что позволило устранить ПГПТ. Тетания у кошек в послеоперационном периоде не описана, однако, у нескольких животных развилась гипокальциемия и потребовалось заместительное введение кальция и витамина Д. Все 9 кошек, за которыми мы наблюдали после хирургического лечения, прожили более года, хотя у одной через 1,5 года после резекции опухоли произошел рецидив гиперкальциемии, а на вскрытии были обнаружены аденома и карцинома паращитовидных желез. Гистологическое исследование удаленных тканей показало, что у 13 кошек имелась аденома, у трех - карцинома, у двух - гиперплазия всех четырех паращитовидных желез, а у одной - двусторонняя цистаденома.
ЛИТЕРАТУРА
Anderson ТЕ, et al: Probable hypercalcemia of malignancy in a cat with bronchogenic adenocarcinoma. J Am Anim Hosp Assoc 36:52, 2000.
Arnaud CD, Kolb FO: The calciotropic hormones and metabolic bone disease. In Greenspan FS (ed): Basic and Clinical Endocrinology. Los Altos, Calif, Lange Medical Publications, 1991, p 247.
Attie JN, et al: Preoperative localization of parathyroid adenomas. Am J Surg 156:323, 1988.
Attie MF: Treatment of hypercalcemia. Endocrinol Metab Clin North Am 18:807, 1989.
Aurbach GD, et al: Parathyroid hormone, calcitonin, and the calciferols. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 7th ed. Philadelphia, WB Saunders, 1985a, p 1137.
Aurbach GD, et al: Metabolic bone disease. In Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 7th ed. Philadelphia, WB Saunders, 1985b, p 1218.
Barber PJ, Elliott J: Feline chronic renal failure: Calcium homeostasis in 80 cases diagnosed between 1992 and 1995. J Small Anim Pract 39:108, 1998.
Barber PJ, et al: Measurement of feline intact parathyroid hormone: Assay validation and sample handling studies. J Small Anim Pract 34:614, 1993.
Barsanti JA: Hypercalcemia and urolithiasis in cats. Proc Am Coll Vet Intern Med Ann Forum 15:327, 1997.
Bataille R: Management of myeloma with bisphosphonates. N Engl J Med 334:529, 1996.
Bennedbaek FN, et al: Percutaneous ethanol injection therapy in the treatment of thyroid and parathyroid diseases. Eur J Endocrinol 136:240, 1997.
Bennett PF, et al: Canine anal sac adenocarcinomas: Clinical presentation and response to therapy. J Vet Intern Med 16:100, 2002.
Berger B, Feldman EC: Primary hyperparathyroidism in dogs. J Vet Med Assoc 191:350, 1987.
Bilezikian JP: Primary hyperparathyroidism. In Bardin CW (ed): Current Therapy in Endocrinology and Metabolism, 4th ed. Philadelphia, BC Decker, 1991, p 448.
Bilezikian JP: Hypercalcemic states. In Coe FL, et al (eds): Disorders of Bone and Mineral Metabolism. New York, Raven Press, 1992a, p 493.
Bilezikian JP: Management of acute hypercalcemia. N Engl J Med 326:1196, 1992b.
Black KS, Mundy GR: Other causes of hypercalcemia: Local and ectopic secretion syndromes. In Bilezikian JP, Marcus R, Levine MA (eds): The Parathyroids. New York, Raven Press, 1994, pp 341-358.
Bojrab MJ: Current Techniques in Small Animal Surgery, 2nd ed. Philadelphia, Lea a Febiger, 1983.
Boyce RA, Weisbrode SE: Effect of dietary calcium on the response of bone to l,25(OH) vitamin D3. Lab Invest 48:683, 1983.
Broadus AE, Stewart AF: Parathyroid hormone-related protein: Structure, processing, and physiologic actions. In Bilezikian JP (ed): The Parathyroids: Basic and Clinical Concepts. New York, Raven Press, 1994, pp 259-294.
Brown EM: Histamine receptors on dispersed parathyroid cells from pathological human parathyroid tissue. J Clin Endocrinol 51:1325, 1980.
Brown EM: Parathyroid secretion in vivo and in vitro: Regulation by calcium and other secretagogues. Miner Electrolyte Metab 8:130, 1982.
Brown EM, et al: Calcium ion-sensing cell surface receptors. N Engl J Med 333:234, 1995.
Brown EM, et al: G-protein-coupled, extracellular Ca2*-sensing receptor: A versatile regulator of diverse cellular functions. Vitam Horm 55:1, 1999.
Brown RC, et al: Circulating intact parathyroid hormone measured by a twosite immunochemiluminometric assay. J Clin Endocrinol Metab 65:407, 1987.
Bruyette D: Disorders of calcium metabolism. In Proceedings of the Tenth Annual Veterinary Medical Forum, 1992, p 161.
Budayr AA, et al: Increased serum levels of parathyroid hormone-like protein in malignancy-associated hypercalcemia. Ann Intern Med 111:807, 1989.
Burtis WJ: Parathyroid hormone-related protein: Structure, function, and measurement. Clin Chem 38:2171, 1992.
Burtis WJ, et al: Immunochemical characterization of circulating parathyroid hormone-related protein in patients with humoral hypercalcemia of cancer. N Engl J Med 322:1106, 1990.
Capen CC, Martin SL: Calcium-regulating hormones and diseases of the parathyroid glands. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1550.
Carothers MA, et al: 25-OH-cholecalciferol intoxication in dogs. Proc Am Coll Vet Intern Med Forum 12:822, 1994.
Chew DJ, Capen CC: Hypercalcemic nephropathy and associated disorders. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders, 1980, p 1067.
Chew DJ, Meuten DJ: Disorders of calcium and phosphorus metabolism. Vet Clin North Am 12:411, 1982.
Chew DJ, Nagode LA: Renal secondary hyperparathyroidism. Proceedings of the Society for Comparative Endocrinology, 1990, p 17.
Chew DJ, et al: Effect of sodium bicarbonate infusions on ionized calcium and total calcium concentrations in serum of clinically normal cats. Am J Vet Res 50:145, 1989.
Henderson JE, et al: Circulating concentrations of parathyroid hormone-like peptide in malignancy and in hyperparathyroidism. J Bone Miner Res 5:105, 1990.
Hirt RA, et al: Severe hypercalcemia in a dog with a retained fetus and endometritis. J Am Vet Med Assoc 216:1423, 2000.
Hollis BW, et al: Quantification of circulating 1,25-dihydroxyvitamin D by radioimmunoassay with an ,Z5l-labeled tracer. Clin Chem 42:586, 1996.
Hristova EN, et al: Analyzer-dependent differences in results for ionized calcium, ionized magnesium/sodium and pH. Clin Chem 41:1649, 1995.
Hruska KA, Teitelbaum SL: Renal osteodystrophy. N Engl J Med 333:166, 1995.
Ihle SL, et al: Seizures as a manifestation of primary hyperparathyroidism in a dog. J Am Vet Med Assoc 192:71, 1988.
Jiao LR, et al: Clinical short-term results of radio frequency ablation in primary and secondary liver tumors. Am J Surg 177:303, 1999.
Johnessee JS, et al: Primary hypoadrenocorticism in a cat. J Am Vet Med Assoc 183:881, 1982.
Kallet AJ, et al: Primary hyperparathyroidism in cats: Seven cases (1984-1989). J Am Vet Med Assoc 199:1767, 1991.
Klausner JS, et al: Calcium urolithiasis in two dogs with parathyroid adenomas. J Am Vet Med Assoc 191:1423, 1987.
Krubsack AJ, et al: Prospective comparison of radionuclide, computed tomography, and sonographic and magnetic resonance localization of parathyroid tumors. Surgery 106:639, 1989.
Kruger JM, et al: Treatment of hypercalcemia. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1986, p 75.
Kruger JM, et al: Hypercalcemia and renal failure: Etiology, pathophysiology, diagnosis, and treatment. Vet Clin North Am (Small Anim Pract) 26:1417, 1996.
Legendre AM, et al: Canine blastomycosis: A review of 47 clinical cases. J Am Vet Med Assoc 178:1163, 1981.
Lemann J, Gray RW: Calcitriol, calcium, and granulomatous disease. N Engl J Med 311:1115, 1984.
Leshin M: Multiple endocrine neoplasia. In Wilson JC, Foster DW (eds): Williams Textbook of Endocrinology, 7th ed. Philadelphia, WB Saunders, 1985, p 1274.
Livraghi T, et al: Small hepatocellular carcinoma: Treatment with radio frequency ablation versus ethanol ablation. Radiology 210:655, 1999.
Llach F, et al: The pathophysiology of altered calcium metabolism in rhabdomyolysis-induced acute renal failure. N Engl J Med 305:117, 1981.
Lloyd MNH, et al: Preoperative localization in primary hyperparathyroidism. Clin Radiol 41:239, 1990.
Long CD, et al: Percutaneous ultrasound-guided chemical parathyroid ablation for treatment of primary hyperparathyroidism in dogs. J Am Vet Med Assoc 215:217, 1999.
Marquez GA, et al: Calcium oxalate urolithiasis in a cat with a functional parathyroid adenocarcinoma. J Am Vet Med Assoc 206:817, 1995.
Martin TJ, Suva LJ: Parathyroid hormone-related protein in hypercalcemia of malignancy. Clin Endocrinol 31:631, 1989.
ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
787
Marx SJ: Hyperparathyroid and hypoparathyroid disorders. N Engl J Med 343:1863, 2000.
Mattson A, et al: Renal secondary hyperparathyroidism in a cat. J Am Anim Hosp Assoc 29:345, 1993.
Matus RE, Weir EC: Hypercalcemia of malignancy. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p988.
Matus RE, et al: Prognostic factors for multiple myeloma in the dog. J Am Vet Med Assoc 188:1288, 1986.
Matwichuk C, et al: Use of WmTc-sestamibi for detection of a parathyroid adenoma in a dog with primary hyperparathyroidism. J Am Vet Med Assoc 209:1733, 1996.
Matwichuk C, et al: Double-phase parathyroid scintigraphy in dogs using WmTc-sestamibi. Vet Radiol Ultrasound 41:461, 2000.
McArthur W, et al: Bone solubilization by mononuclear cells. Lab Invest 42:452, 1980.
McCauley LK, et al: In vivo and in vitro effects of interleukin-loc and cyclosporin Aon bone and lymphoid tissues in mice. Toxicol Pathol 19:1, 1991.
McClain HM, et al: Hypercalcemia and calcium oxalate urolithiasis in cats: A report of five cases. J Am Anim Hosp Assoc 25:297, 1999.
Mealey KL, et al: Hypercalcemia associated with granulomatous disease in a cat. J Am Vet Med Assoc 215:959, 1999.
Meuten DJ: Hypercalcemia. Vet Clin North Am (Small Anim Pract) 14:891, 1984.
Meuten DJ, Armstrong PJ: Parathyroid disease and calcium metabolism. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine: Diseases of the Dog and Cat, 3rd ed. Philadelphia, WB Saunders, 1989, p 1610.
Meuten DJ, et al: Hypercalcemia associated with an adenocarcinoma derived from the apocrine glands of the anal sac. Vet Pathol 18:454, 1981.
Meuten DJ, et al: Relationship of calcium to albumin and total proteins in dogs. J Am Vet Med Assoc 180:63, 1982.
Meuten DJ, et al: Hypercalcemia in dogs with lymphosarcoma: Biochemical, ultrastructural, and histomorphometric investigation. Lab Invest 49:553, 1983a.
Meuten DJ, et al: Hypercalcemia in dogs with adenocarcinoma derived from apocrine glands of the anal sacs: Biochemical and histomorphometric investigations. Lab Invest 48:428, 1983b.
Michelangeli VP, et al: Evaluation of a new, rapid, and automated immuno-chemiluminometric assay for the measurement of serum intact parathyroid hormone. Ann Clin Biochem 34:97, 1997.
Midkiff AM, et al: Idiopathic hypercalcemia in cats. J Vet Intern Med 14:619, 2000.
Mischke R, et al: The effect of the albumin concentration on the relation between the concentration of ionized calcium and total calcium in the blood of dogs. Dtsch Tierarztl Wochenschr 103:199, 1996.
Mol JA, et al: Elucidation of the sequence of canine (pro)-calcitonin: A molecular biological and protein chemical approach. Regul Pept 35:189, 1991.
Moore EM, et al: Hypercalcemia associated with rodenticide poisoning in three cats. J Am Vet Med Assoc 193:1099, 1988.
Morrow C: Cholecalciferol poisoning. Vet Med p. 905, 2001.
Mundy GR: Hypercalcemia of malignancy revisited. J Clin Invest 82:1, 1988.
Mundy GR, Martin TJ: Hypercalcemia of malignancy: Pathogenesis and management. Metabolism 31:1247, 1982.
Mundy GR, et al: The hypercalcemia of cancer: Clinical implications and pathogenic mechanisms. N Engl J Med 310:1718, 1984.
O’Dougherty MJ, et al: Parathyroid imaging with technetium-99m-sestamibi: Preoperative localization and tissue uptake studies. J Nucl Med 33:313, 1992.
Orloff JJ, Stewart AF: The carboxy-terminus of parathyroid hormone: Inert or invaluable. Endocrinology 136:4729, 1995.
Parfitt AM, Kleerekoper M: Clinical disorders of calcium, phosphorus, and magnesium metabolism. In Maxwell MH, Kellman CR (eds): Clinical Disorders of Fluid and Electrolyte Metabolism. New York, McGraw-Hill, 1980, p 947.
Parker, M: Personal communication, 2001.
Percival RC, et al: Role of glucocorticoids in the management of malignant hypercalcemia. BrMed J 289:287, 1984.
Peterson EN, et al: Cholecalciferol rodenticide intoxication in a cat. J Am Vet Med Assoc 199:904, 1991.
Peterson ME, Feinman JM: Hypercalcemia associated with hypoadrenocorticism in sixteen dogs. J Am Vet Med Assoc 181:804, 1982.
Peterson ME, et al: Primary hypoadrenocorticism in ten cats. J Vet Intern Med 3:55, 1989.
Peterson ME, et al: Pretreatment clinical and laboratory findings in dogs with hypoadrenocorticism: 225 cases (1979-1993). J Am Vet Med Assoc 208:85, 1996.
Petrie G: Management of hypercalcemia using dichloromethylene biphosphate (clodronate). Proceedings of the British Small Animal Veterinary Association Annual Congress, 1996, p. 80 (abstract).
Philbrick WM, et al: Defining the roles of parathyroid hormone-related protein in normal physiology. Physiol Rev 76:127, 1996.
Picard D, et al: Localization of abnormal parathyroid glands using201 thallium/ ,2!iodine subtraction scintigraphy in patients with primary hyperparathyroidism. Clin Nucl Med 12:61, 1987.
Pollard RE, et al: Percutaneous ultrasonographically guided radio frequency heat ablation for treatment of primary hyperparathyroidism in dogs. J Am Vet Med Assoc 218:1106, 2001.
Potts JT Jr: Management of asymptomatic hyperparathyroidism. J Clin Endocrinol Metab 70:1489, 1990.
Pressler BM, et al: Hypercalcemia and high parathyroid hormone-related protein concentration associated with malignant melanoma in a dog. J Am Vet Med Assoc 221:263, 2002.
Quigley PJ, Leedale AH: Tumors involving bone in domestic cats: A review of fifty-eight cases. Vet Pathol 20:670, 1983.
Rasmussen H: The cycling of calcium as an intracellular messenger. Sci Am 261:66, 1989.
Refsal KR, et al: Laboratory assessment of hypercalcemia. Proc Am Coll Vet Intern Med Forum 16:646, 1998.
Reusch CE, et al: Ultrasonography of the parathyroid glands as an aid in differentiation of acute and chronic renal failure in dogs. J Am Vet Med Assoc 217:1849, 2000.
Rohrer CR, et al: Hypercalcemia in a dog: A challenging case. J Am Anim Hosp Assoc 36:20, 2000.
Rosol TJ, et al: Acute hypocalcemia associated with infarction of parathyroid gland adenomas in two dogs. J Am Vet Med Assoc 192:212, 1988.
Rosol TJ, et al: Parathyroid hormone (PTH)-related protein, PTH, and 1,25-dihydroxyvitamin D in dogs with cancer-associated hypercalcemia. Endocrinology 131:1157, 1992a.
Rosol TJ, et al: Effects of mithramycin on calcium metabolism and bone in dogs. Vet Pathol 29:223, 1992b.
Rosol TJ, et al: Effect of mithramycin on hypercalcemia in dogs. J Am Anim Hosp Assoc 30:244, 1994.
Rosol TJ, et al: Disorders of calcium. In DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders, 2000, pp 108-162.
Ross LA, Goldstein M: Biochemical abnormalities associated with accidental hypothermia in a dog and in a cat. Proceedings of the Annual American College of Veterinary Internal Medicine Meeting, St Louis, 1981, p 66.
Ross JT, et al: Adenocarcinoma of the apocrine glands of the anal sac in dogs: A review of 32 cases. J Am Anim Hosp Assoc 27:349, 1991.
Rumbeiha WK: Nephrotoxins. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, pp 212-214.
Rumbeiha WK, et al: Use of pamidronate to reverse vitamin D3-induced toxicosis in dogs. Am J Vet Res 60:1092, 1999.
Rumbeiha WK, et al: Use of pamidronate disodium to reduce cholecalciferol-induced toxicosis in dogs. Am J Vet Res 61:9, 2000.
Sandler LM, et al: Studies of the hypercalcemia of sarcoidosis: Effect of steroids and exogenous vitamin D3 on the circulating concentration of 1,25-dihydroxy vitamin D3. 0 J Med 53:165, 1984.
Savary KCM, et al: Hypercalcemia in cats: A retrospective study of 71 cases (1991-1997). J Vet Intern Med 14:184, 2000.
Schenck PA, et al: Effects of storage on serum ionized calcium and pH values in clinically normal dogs. Am J Vet Res 56:304, 1995.
Seymour JF, Gagel RF: Calcitriol: the major humoral mediator of hypercalcemia in Hodgkin’s and non-Hodgkin's lymphomas. Blood 82:1383, 1993.
Shane E: Hypercalcemia: Differential diagnosis and management. In Savus MJ (ed): ASBMR Primer on Metabolic Bone Disease. Richmond, Va, William Byrd Press, 1990, p 107.
Shane E, Bilezikian JP: Parathyroid carcinoma: A review of 62 patients. Endocrinol Rev 3:218, 1982.
Silverberg SJ, et al: Short-term inhibition of parathyroid hormone secretion by a calcium receptor agonist in patients with primary hyperparathyroidism. N Engl J Med 337:1506, 1997.
Silverberg SJ, et al: A 10-year prospective study of primary hyperparathyroidism with or without parathyroid surgery. N Engl J Med 341:1249, 1999.
Slatter DH: Textbook of Small Animal Surgery. Philadelphia, WB Saunders, 1985.
Sleeboom HP, Bijvoet OL: Hypercalcemia due to malignancy: Role of the kidney and treatment. Contrib Nephrol 33:178, 1982.
Strewler GL: The physiology of parathyroid hormone-related protein. N Engl J Med 342:177, 2000.
Sueda MT, Stefanacci JD: Ultrasound evaluation of the parathyroid glands in two hypercalcemic cats. Vet Radiol Ultrasound 41:448, 2000.
Swainson SW, et al: Radiographic diagnosis: Mediastinal parathyroid cyst in a cat. Vet Radiol Ultrasound 41:41, 2000.
Taillefer R, et al: Detection and localization of parathyroid adenomas in patients with hyperparathyroidism using a single radionuclide imaging procedure with technetium-99m-sestamibi (double-phase study). J Nucl Med 33:1801, 1992.
Thompson KG, et al: Primary hyperparathyroidism in German Shepherd dogs: Adisorder of probable genetic origin. Vet Pathol 21:370, 1984.
Toribio RE, et al: Cloning and sequence analysis of the complementary DNA for feline preproparathyroid hormone. Am J Vet Res 63:194, 2002.
Torrance AG, Nachreiner R: Human parathormone assay for use in dogs: Validation, sample handling studies, and parathyroid function testing. Am J Vet Res 50:1123, 1989a.
Torrance AG, Nachreiner R: Intact parathyroid hormone assay and total calcium concentration in the diagnosis of disorders of calcium metabolism in dogs. J Vet Intern Med 3:86, 1989b.
Troy GC, et al: Heterobilharzia americana infection and hypercalcemia in a dog: A case report. J Am Anim Hosp Assoc 23:35, 1987.
Tuma SN, Mallette LE: Hypercalcemia after nephrectomy in the dog: Role of the kidneys and parathyroid glands. J Lab Med 102:213, 1983.
788 • ГИПЕРКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Uehlinger Р, et al: Differential diagnosis of hypercalcemia: A retrospective study of 46 dogs. Schweiz Arch Tierheilkd 140:188, 1998.
Utiger RD: Treatment of primary hyperparathyroidism. N Engl J Med 341:1301, 1999 (editorial).
Verdonk CA, Edis AJ: Parathyroid “double adenomas”: Fact or fiction? Surgery 90:523, 1981.
Weir EC, et al: Primary hyperparathyroidism in a dog: Biochemical, bone histo-morphometric, and pathologic findings. J Am Vet Med Assoc 189:1471, 1986.
Weir EC, et al: Humoral hypercalcemia of malignancy in canine lymphosarcoma. Endocrinology 122:602, 1988a.
Weir EC, et al: Adenyl cyclase stimulating, bone resorbing and (3-TGF-like activities in canine apocrine cell adenocarcinoma of the anal sac. Calcif Tissue Int 43:359, 1988b.
Weller RE, et al: Chemotherapeutic responses in dogs with lymphosarcoma and hypercalcemia. J Am Vet Med Assoc 181:891, 1982.
Weir EC, et al: Isolation of 16,000-dalton parathyroid hormone-like proteins from two animal tumors causing humoral hypercalcemia of malignancy. Endocrinology 123:2744, 1988c.
Wisner ER, Nyland TG: Clinical vignette. J Vet Intern Med 8:244, 1994.
Wisner ER, Nyland TG: Ultrasonography of the thyroid and parathyroid glands. Vet Clin North Am (Small Anim Pract) 28:973, 1998.
Wisner ER, et al: Normal ultrasonographic anatomy of the canine neck. Vet Radiol 32:185, 1991.
Wisner ER, et al: Ultrasonographic evaluation of the parathyroid glands in hypercalcemic dogs. Vet Radiol Ultrasound 34:108, 1993.
Wisner ER, et al: High-resolution parathyroid sonography. Vet Radiol Ultrasound 38:462, 1997.
Wright KN, et al: Diagnostic and therapeutic considerations in a hypercalcemic dog with multiple endocrine neoplasia. J Am Anim Hosp Assoc 31:156, 1995.
Глава 17
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ
ГИПОПАРАТИРЕОЗ
ОПРЕДЕЛЕНИЕ ПЕРВИЧНОГО ГИПОПАРАТИРЕОЗА...............789
ПАТОФИЗИОЛОГИЯ................790
Системный гомеостаз кальция...790
Гипопаратиреоз (гипокальциемия).792
КЛИНИЧЕСКАЯ КАРТИНА СПОНТАННОГО ГИПОПАРАТИРЕОЗА У СОБАК.......795
Встречаемость.................795
Анамнез.......................795
Физикальное исследование......797
КЛИНИЧЕСКАЯ КАРТИНА СПОНТАННОГО ГИПОПАРАТИРЕОЗА У КОШЕК.......798
ДИАГНОСТИКА: РУТИННЫЕ ИССЛЕДОВАНИЯ.........798
Кальций.......................798
«Откорректированные» значения концентрации кальция..........799
Фосфор в сыворотке крови......800
Другие параметры биохимического анализа крови.................801
Лабораторное тестирование кошек ....801
Электрокардиограмма...........801
Магний........................802
ДИАГНОСТИКА: КОНЦЕНТРАЦИЯ
ПАРАТИРЕОИДНОГО ГОРМОНА (ПТГ) 803
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ЭПИЗОДИЧЕСКОЙ СЛАБОСТИ........804
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОКАЛЬЦИЕМИИ................804
Гипокальциемия, обусловленная недостаточностью функции паращитовидных желез..........804
Хроническая почечная недостаточность...............806
Пуэрперальная тетания (эклампсия)...808
Синдром малабсорбции..........808
Алиментарный вторичный гиперпаратиреоз...............809
Острая почечная недостаточность и интоксикация этиленгликолем ....809
Непроходимость мочеиспускательного канала....809
Фосфатная клизма..............809
Другие причины................810
ЛЕЧЕНИЕ ГИПОПАРАТИРЕОЗА И ГИПОКАЛЬЦИЕМИИ..............811
Общие подходы.................811
Неотложная терапия при тетании.811
Поддерживающая терапия........813
ГИСТОЛОГИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
ПРИ ГИПОПАРАТИРЕОЗЕ.........817
ПРОГНОЗ.......................817
Список сокращений
AM - азот мочевины
цАМФ - циклический аденозин-3’-5’-моиофосфат
ВКЖ - внеклеточная жидкость
ДГТ - дигидротахистерол
ДКА - диабетический кетоацидоз
ПТГ - паратиреоидный гормон
ПрПТГ - пептид, родственный паратиреоидному гормону
СМЖ - спинномозговая жидкость
ХПН - хроническая почечная недостаточность
ЦНС - центральная нервная система
ЭКГ - электрокардиограмма
Для понимания природы гипокальциемии важно иметь в виду несколько ключевых моментов из истории физиологических исследований паращитовидных желез, механизмов гомеостаза и регуляции кальция. Рахит (гиповитаминоз Д) был впервые описан в 1645 году. По прошествии более 200 лет (в 1884 г.) была установлена связь между тиреоидэктомией и возникновением клинически выраженной гипокальциемии (тетании) у собак и кошек. В 1981 г. Глей доказал, что для индукции тетании паращитовидные железы должны быть удалены вместе со щитовидной железой. Вскоре после этого было показано, что введение солей кальция после паратиреоидэктомии эффективно предотвращает тетанию. Спустя почти век (в 1970 г) была установлена аминокислотная последовательность паратиреоидного гормона (ПТГ) (Терреппап, 1980), а еще через 20 лет расшифровали последовательность пептида человека и собаки, родственного паращитовидному гормону (ПрПТГ), который синтезируется некоторыми раковыми опухолями (Weir, 1988; Broadus et al, 1988; Yates et al, 1988).
ОПРЕДЕЛЕНИЕ ПЕРВИЧНОГО ГИПОПАРАТИРЕОЗА
В норме к каждой доле щитовидной железы прилегает по паре паращитовидных желез. Гипопаратиреоз - это довольно редкое эндокринное заболевание, возникающее в результате относительной недостаточности секреции ПТГ - единственного гормона, секретируемого четырьмя паращитовидными железами. Недостаток ПТГ порождает целый ряд физиологических расстройств, которые, в конце концов, проявляются в форме клинически выраженных неврологических и нерномышечных симптомов, в основе которых лежит гипокальциемия. Проявления гипокальциемии одинаковы, независимо от вызвавшей ее причины (табл. 17-1). Обнаружив гипокальциемию, клиницист должен попытаться выяснить ее патогенез (причину), чтобы разработать стратегию краткосрочной и долгосрочной терапии и оценить возможный исход лечения.
790 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
ТАБЛИЦА 17-1. НАРУШЕНИЯ, ОТМЕЧАЕМЫЕ ВЛАДЕЛЬЦАМИ СОБАК С ПЕРВИЧНЫМ ГИПОПАРАТИРЕОЗОМ
Частые
Тремор, непроизвольные сокращения и фасцикулярные подергивания мышц (очаговые или диффузные, нередко обостряются при повышенной активности или возбуждении)
Растирание морды лапами (парестезия?)
Генерализованные судороги (конвульсии, «припадки») Судороги или боль в мышцах задних ног
Очаговые мышечные сокращения и фасцикулярные подергивания
Скованная походка
Изменения поведения
беспокойство, нервозность, тревожное» состояние» агрессивность, укусы
гиперчувствительность (стремление избежать прикосновений)
Плохой аппетит
Пониженная активность, апатия
Энергичное покусывание или зализывание лап (парестезия?)
Нечастые
Слабость
Рвота, диарея
Анорексия
Потеря веса
Атаксия
Лихорадочное состояние
Пролапс третьего века (у кошек)
Усиленное слюноотделение (у кошек)
Редкие
Отсутствие признаков
Гипотензия
Полидипсия и полиурия
Остановка дыхания и смерть________________________
Обратите внимание, что почти все эти нарушения носят «эпизодический» характер
ПАТОФИЗИОЛОГИЯ
Системный гомеостаз кальция
Поддержание нормальной концентрации кальция в сыворотке крови
Паращитовидные железы чрезвычайно чувствительны к малейшим изменениям концентрации ионизированного кальция в крови. Тонкая регуляция концентрации ионов кальция в сыворотке обеспечивается суммарным эффектом стимуляции ПТГ резорбции кальция из костей и его реабсорбции в дистальных почечных канальцах и индукции 1,25(ОН)2-холекальциферолом (витамином Д) всасывания кальция в кишечнике. Точность такого интегрированного контроля столь высока, что колебания концентрации ионизированного кальция у животных в отдельные дни составляют не более 0,1 ммоль/л. «Острые» фазы костной резорбции кальция и его реабсрбции в дистальных почечных канальцах являются основными местами приложения ежеминутного регуляторного действия ПТГ, направленного на поддержание кальциевого гомеостаза. В
количественном отношении наиболее существенно действие ПТГ на дистальные почечные канальцы. Для максимального проявления корректирующего действия системы ПТГ-витамин Д на скорость всасывания кальция в кишечнике требуется от 24 до 48 часов (Broadus, 1981).
Защита против гипокальциемии
Эффекты гипокальциемии. Физиологические реакции на гипокальциемию включают разной степени адаптивные изменения минерального обмена (рис. 17-1). Классические эффекты гипокальциемии подразделяются на три категории: (1) слабые, преходящие эффекты, (2) умеренные эффекты и (3) выраженные, длительные эффекты. В ответ на гипокальциемию ПТГ и витамин Д индуцируют реакции, направленные на коррекцию гомеостаза. Острые эффекты длятся секунды или минуты, умеренные продолжаются несколько часов и даже дней, а продолжительность хронических эффектов достигает нескольких недель и более (Rosol, Capen, 1997; Rosol et al, 2000).
Слабые, преходящие эффекты. При голодании в течение 12-15 часов (или потреблении пищи, полностью лишенной кальция) потребность в гормональной регуляции у млекопитающих минимальна. Общее количество кальция, теряемого с мочой во время голодания, невелико, и его концентрация в плазме крови уменьшается незначительно, вызывая лишь слабое усиление секреции ПТГ. Последний полностью компенсирует падение уровня кальция, высвобождая его из дистальных почечных канальцев и стимулируя резорбцию из костной ткани. Выброс ранее синтезированного ПТГ обеспечивает поддержание его концентрации на нужном уровне на протяжении 1-1,5 часов гипокальциемии. Гипокальциемия подавляет деградацию ПТГ в главных клетках паращитовидных желез (паратиреоцитах), и в результате повышается количество доступного для секреции гормона. Этот эффект обычно развивается в течение 40 минут. Через несколько минут после увеличения секреции ПТГ происходит усиление реабсорбции кальция и экскреции фосфора в почках, а мобилизация этих элементов из костной ткани начинается спустя лишь 1-2 часа (Rosol et al, 2000). Биосинтез 1,25(ОН)2-витамина Д несколько усиливается только через 12 часов.
Умеренные эффекты. Резкое и значительное уменьшение потребления кальция с пищей (или другие причины гипокальциемии) индуцирует серию корректировок обмена кальция, которые завершаются установлением нового стабильного уровня секреции ПТГ и витамина Д. Устойчивая гипокальциемия на протяжении нескольких часов сопровождается усилением секреции ПТГ, который, в свою очередь, стимулирует биосинтез и секрецию витамина Д (кальцитриола). Высвободившийся кальцитриол усиливает транспорт кальция и фосфора из кишечника в кровяное русло, создавая, та-
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
791
А
Б
Рис. 17-1. А. Регуляция концентрации кальция во внеклеточной жидкости (ВКЖ) под действием паратиреоидного гормона (ПТГ) и кальцитриола (1,25-дигидроксивитамин Д3) на кишечник, почки, кости и паращитовидные железы. Главный эффект ПТГ состоит в повышении концентрации кальция в ВКЖ путем его мобилизации из костной ткани, усиления реабсорбции кальция в почечных канальцах, стимуляции биосинтеза кальцитриола и опосредованно - через действие на кишечник. Действие кальцитриола сводится, в основном к усилению всасывания кальция в кишечнике, однако, он также контролирует продукцию ПТГ по механизму отрицательной обратной связи и, затем, свой собственный синтез. Б. Нормальный баланс кальция и основные органы, обеспечивающие его поступление и выведение во внеклеточной жидкости: кости, кишечник и почки. Общее поступление кальция во внеклеточную жидкость эквивалентно его выведению. (Из: Rosol et al, 2000).
792 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
ким образом, еще один источник кальция в дополнение к его количеству, мобилизуемому из костной ткани. Стимулирующее действие гипокальциемии на транскрипцию гена и мРНК ПТГ приводит через несколько часов к усилению биосинтеза ПТГ в главных клетках паращитовидных желез (Rosol et al., 2000).
Умеренное повышение секреции ПТГ приводит к (1) усилению реабсорбции кальция в дистальных почечных канальцах, (2) его мобилизации (вместе с фосфором) из костной ткани и (3) увеличению биосинтеза 1,25-дигидроксивитамина Д (кальцитрио-ла), который, наряду с ПТГ, участвует в процессах костной резорбции и способствует более эффективному всасыванию кальция и фосфора из кишечника (см. рис. 17-1). Повышение концентрации ПТГ в крови сопровождается также увеличением почечной экскреции фосфора, которое компенсирует увеличение количества фосфора вследствие мобилизации из костной ткани и всасывания из кишечника. В создавшейся таким образом новой равновесной ситуации восстанавливается нормальная концентрация кальция в сыворотке, а концентрация фосфора не изменяется или несколько уменьшается на фоне слабого вторичного гиперпаратиреоза и повышенной эффективности всасывания минеральных веществ в кишечнике. Вместо мобилизации кальция из костной ткани, ранее удовлетворявшей потребность в этом элементе, начинает преобладать его всасывание из кишечника.
Выраженные, продолжительные эффекты. Интенсивная лактация и хроническая почечная недостаточность служат яркими примерами индуцируемых тяжелой гипокальциемией изменений гомеостаза кальция, которые не поддаются коррекции процессами, длящимися несколько минут или часов. При интактных и функционально активных паращитовидных железах сначала развиваются описанные выше реакции, вызванные «слабыми, преходящими» и «умеренными» эффектами гипокальциемии. Однако при продолжительном выведении кальция, например, с молоком в период лактации, полная компенсации его потерь обычным путем, т.е. через систему ПТГ-1,25-дигидроксивитамин Д, становится невозможной. Физиологическая компенсация в этих условиях осуществляется посредством (1) максимальной секреции ПТГ, скорость которой примерно в 5 раз превышает нормальную, (2) максимальной скорости биосинтеза 1,25-дигидроксивитамина Д и (3) максимальной скорости «быстрой» и «поздней» фаз костной резорбции в ответ на комбинированное воздействие ПТГ и 1,25-дигидроксивитамина Д.
В течение дней, недель и даже более длительных периодов гипокальциемии дальнейшее усиление секреции ПТГ, помимо вышеописанного, достигается, в основном, за счет гипертрофии и гиперплазии главных клеток паращитовидных желез (Roth, Сареп, 1974; Rosol et al, 2000). Гипокальциемия непосредственно стимулирует рост главных
паратиреоидных клеток, и этот эффект не зависит от концентрации продуктов превращения витамина Д (Li et al, 1998; Malloy et al, 1999; Marx, 2000). При гиперплазии паратиреоцитов скорость секреции ПТГ в 10-50 раз превышает нормальную. Столь высокая концентрация циркулирующего ПТГ способствует увеличению популяции остеокластов и вовлечению в процесс резорбции больших костных поверхностей. После установления окончательного равновесного состояния концентрация кальция в крови поддерживается благодаря его поступлению из скелетных тканей, что приводит к значительным потерям костного вещества. Иными словами, для компенсации системного дефицита кальция приносится в жертву минеральный гомеостаз скелета (Broadus, 1981).
Гипопаратиреоз (гипокальциемия)
Начальные физиологические изменения
Патологические и биохимические последствия удаления паращитовидных желез (наиболее частой причины первичного гипопаратиреоза) или потери критического числа главных клеток паращитовидной железы в результате их разрушения под воздействием иммунной системы (более редкая причина) можно оценить, обратившись к диаграмме в форме «бабочки», представленной на рис. 17-2. На этом рисунке доминирующими являются правые части трех петель обратной связи, иллюстрирующие (1) уменьшение костной резорбции, (2) уменьшение почечной экскреции фосфата, увеличение его концентрации в сыворотке, уменьшение биосинтеза кальцитриола и всасывания кальция в кишечнике и (3) усиление экскреции кальция с мочой относительно его концентрации в крови. Обычно, при нормальном поступлении фосфора с пищей, имеют место гипокальциемия и гиперфосфатемия.
Все эти изменения объясняются прекращением воздействия ПТГ на различные ткани. При этом отсутствуют следующие процессы: (1) мобилизация кальция и фосфора из костной ткани, (2) задержка кальция и усиление экскреции фосфора с мочой и (3) повышенная абсорбция кальция и фосфата из кишечника. При гипопаратиреозе усиливается также выделение магния с мочой, которое в первое время не сопровождается существенным снижением его концентрации в плазме крови. В отсутствие терапии, направленной на нормализацию уровня кальция в крови, его содержание в моче обычно невелико. После достижения эукальциемии оно становится выше, чем до возникновения гипопаратиреоза и иногда перерастает в гиперкальциурию (Arnaud, 1994).
Несмотря на значительные изменения концентраций кальция и фосфора в плазме крови, сохраняется нормальная минерализация костной ткани, скорость ее резорбции понижена, а процессы образования кости существенно не нарушены. В конеч-
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 793
4 Резорбция Са2*из костей
Рис. 17-2. Регуляция гомеостаза кальция. Три перекрывающиеся петли регуляции смыкаются и взаимосвязаны через концентрации ионизированного кальция, ПТГ и кальцитонина (КТ) в сыворотке крови. Каждая петля включает орган-мишень кальциотропного гормона (кости, кишечник и почки). Левые ветви иллюстрируют физиологические процессы, повышающие концентрацию кальция в сыворотке крови (КСа2+), а правые - процессы, приводящие к уменьшению его концентрации (ФМ - фосфор мочи, ФС - фосфор в сыворотке. (По: Arnaud UD, 1994).
ном итоге, у людей с гипопаратиреозом кости становятся более плотными, чем обычно, а при большой продолжительности заболевания развивается остеосклероз. Основные клинические проявления гипопаратиреоза непосредственно обусловлены уменьшением концентрации ионизированного кальция в крови, результатом которого является повышенная нервно-мышечная возбудимость.
Нервно-мышечная активность
Периферические нервно-мышечные расстройства. Как указывалось в гл. 16, ионы кальция необходимы для функционирования практически всех клеток организма. При недостаточности ионизированного кальция страдают все органы и ткани, однако клинические симптомы чаще всего связывают с нервно-мышечными нарушениями, просто потому, что они наиболее заметны. Ионизированный кальций участвует в высвобождении ацетилхолина в процессе нервно-мышечной передачи. Кроме того, он необходим для сокращения мышц и стабилизации мембран нервных клеток, так как уменьшает их проницаемость для натрия. Важная роль кальция в качестве стабилизатора клеточных мембран приобретает особое значение при тяжелой гипокальциемии, когда заметно возрастает их лабильность.
При снижении концентрации ионизированного кальция во внеклеточном пространстве ниже нормального уровня проницаемость мембран нейронов увеличивается, что приводит к прогрессивному усилению возбудимости нервной системы. Это касается как центральной нервной системы (ЦНС), так и периферических нервов, в которых возбуждение еще более выражено. Возбудимость нервных во
локон может достигать столь высокого уровня, что они начинают спонтанно продуцировать импульсы, которые поступают в периферические скелетные мышцы и индуцируют их судорожные сокращения («спазмы»). Иными словами, гипокальциемия служит причиной тетании или непроизвольной ригидности и напряжения отдельных мышечных групп. Эти острые, ярко выраженные и хорошо заметные явления свидетельствуют об особенно высокой чувствительности нервных волокон к недостаточности кальция. Более того, острая гипокальциемия часто приводит к смерти еще до проявления ее действия на другие важные органные системы. Классические признаки тетании у собак после перерезки спинного мозга в тораколюмбарном отделе заметны на уровне выше, а не ниже разреза (вялость задних конечностей во время судорожных эпизодов). Таким образом, тетания индуцируется в ЦНС, а не периферическими нервами (Arnaud, 1994).
Гипокальциемия представляет собой относительно «обычное» расстройство, которое, по данным одного исследования, выявляется более чем у 13% собак при биохимическом анализе крови (Chew, Meuten, 1982). Гипокальциемия определяется как концентрация общего кальция в сыворотке крови ниже 9,5 мг/100 мл у собак и ниже 9 мг/100 мл у кошек (Rosol et al. 2000). При определении ионизированного кальция показателем гипокальциемии обычно считают его концентрацию ниже 1,1 ммоль/л у собак и менее 1,0 ммоль/л у кошек. Однако клинически выраженная тетания, как правило, имеет место при значительно более низких уровнях кальция. Считается, в частности, что она возникает, когда концентрация общего кальция опускается до 6 мг/100 мл или ниже, а уровень ионизированного кальция падает ниже 0,7 ммоль/л. Эти значения
794 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
всего на 40% ниже нормальных. Падение концентрации общего кальция ниже 4 мг/100 мл может привести к фатальному исходу.
Хотя собаки с нелеченым гипопаратиреозом, как правило, имеют низкую концентрацию общего кальция в сыворотке крови, далеко не всегда удается прогнозировать начало клинически выраженной тетании. В исследованиях, проведенных на собаках, тетания развилась в течение 96 часов после полного удаления щитовидной и паращитовидных желез только примерно у половины животных, в то время как концентрация общего кальция в крови быстро снизилась уже в первые сутки после операции у всех собак. Так и не удалось понять, почему у части животных отсутствовали признаки тетании. Наш опыт показывает, что у собак с первичным гиперпаратиреозом, лечение которого хирургическим или иными методами привело к острому гипопаратиреозу, «клинические» симптомы гипокальциемии не всегда коррелируют с абсолютной концентрацией общего кальция в сыворотке крови. Мы склонны думать, что гипокальциемия клинически проявляется после падения концентрации общего кальция ниже 6-7 мг/100 мл и ионизированного кальция ниже 0,7-0,8 ммоль/л. В то же время у одних собак клиническая симптоматика имеет место и при более высоких концентрациях кальция, тогда как у других она отсутствует при концентрации кальция ниже нашего критического уровня. Нет сомнения, что развитие клинически выраженной тетании зависит от физической активности, и при любой низкой концентрации кальция у спокойных собак вероятность развития тетании значительно меньше, чем у более активных. Таким образом, это состояние в значительной степени определяется индивидуальными особенностями животных.
Концентрация кальция в спинномозговой жидкости (СМЖ) собак с гипопаратиреозом снижается медленнее, чем в сыворотке. В течение суток после операции содержание общего кальция в сыворотке снижается на 27%, а ионизированного кальция на 28%, тогда как в СМЖ оно уменьшается соответственно менее чем на 5 и 10%. Для достижения равновесия между концентрациями ионов кальция в плазме крови и СМЖ требуется время. Таким образом, концентрация кальция в СМЖ относительно постоянна, несмотря на ее значительные колебания в крови. Тем не менее, даже относительно слабые изменения концентрации кальция в СМЖ могут иметь клинически значимые последствия.
В случае уменьшения концентрации кальция в сыворотке крови до аномально низкой величины, но все же недостаточной, чтобы вызвать видимые судороги, развивается физическое состояние «латентной тетании». В этом состоянии у внешне нормального индивидуума тетания может возникнуть под воздействием малейшей стимуляции. Оно описано, в частности, у людей, у которых даже слабая нервная стимуляция способна спровоцировать неадекватную реакцию (см. раздел «Физикальное исследова
ние», стр. 797). У некоторых пациентов в состоянии латентной тетании гипервентиляция индуцирует щелочную реакцию биологических жидкостей, что приводит к повышению возбудимости нервных волокон и, как результат, к клиническим проявлениям тетании. Предполагается, что сходная ситуация имеет место у собак и кошек с гипокальциемией.
Латентная тетания бывает и у комнатных собак с гипокальциемией, однако, необходимо более документированное подтверждение этого явления. По словам владельцев, у этих животных неожиданно возникают эпизоды повышенного возбуждения, активности и общительности, которые непредсказуемо сменяются мышечными спазмами, хромотой, растиранием морды, болями, раздражительностью или агрессивным поведением. Эти явления быстро проходят, но могут эпизодически повторяться. Кроме того, хозяева собак, страдающих тяжелой гипокальциемией в отсутствие признаков тетании, отмечают такие изменения в поведении животных, как ослабление аппетита, повышенную раздражительность, замедленность движений, утрату живости и игривости. По мнению владельцев, эти животные «испытывают боль». Все перечисленные явления выражены недостаточно четко, однако, клинические симптомы подтвержденной гипокальциемии у таких собак соответствуют признакам латентной тетании. Все описанные изменения носят обратимый характер - они быстро и полностью исчезают после соответствующего лечения.
Сердце. В условиях эксперимента значительное уменьшение концентрации кальция в сыворотке крови может привести к заметному расширению сердца у собак, изменению внутриклеточной ферментативной активности и увеличению проницаемости оболочек клеток, не относящихся к нервной системе. Кальций оказывает как инотропное, так и хронотропное действие на сердце (Milnor, 1980). Гипокальциемия увеличивает продолжительность потенциала действия в сердечных клетках, что может приводить к ослаблению силы сокращения сердечной мышцы (отрицательный инотропный эффект) и вызывать эпизоды тяжелой брадикардии (отрицательный хронотропный эффект). Эти эффекты сопровождаются удлинением сегментов S-Т и Q-T на электрокардиограмме (ЭКГ) без изменения зубца Т. Описанные изменения физического состояния и электрокардиографической картины достаточно хорошо прослеживаются у человека, но значительно слабее выражены у собак с гипокальциемией (Kornegay et al, 1980; Sherding e al, 1980). Иногда гипокальциемия приводит к 2:1 блокаде сердца или сердечной недостаточности, которые у людей диктуют необходимость применения препаратов наперстянки или диуретиков (Arnaud, Kolb, 1983).
Другие эффекты гипокальциемии
Гипокальциемия теоретически может служить причиной коагулопатий, поскольку кальций является
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 795
кофактором системы свертывания крови как по внутреннему, так и по внешнему механизму. Кроме тетании, у людей с гипокальциемией развиваются и менее частые, но тяжелые расстройства, такие как (1) обызвествление базальных ганглиев и эпизодические экстрапирамидальные неврологические синдромы; (2) папилледема и повышенное внутричерепное давление; (3) психические расстройства; (4) заболевания кожи, волос и ногтей; (5) кандидоз; (6) торможение нормального развития зубов; (7) лентикулярная катаракта; (8) нарушение всасывания в кишечнике и (9) повышение концентраций креатинфосфокиназы и лактатдегидрогеназы в сыворотке крови (Arnaud, 1994).
КЛИНИЧЕСКАЯ КАРТИНА СПОНТАННОГО ГИПОПАРАТИРЕОЗА У СОБАК
Встречаемость
Обзор данных о 37 собаках со спонтанным первичным гипопаратиреозом, которые находились под нашим наблюдением (в том числе животных, включенных в сообщение Bruyette, Feldman, 1988) и еще о 13 собаках с тем же заболеванием, описанных в ветеринарной литературе (табл. 17-2), выявил ряд характерных особенностей рассматриваемого синдрома. Гипопаратиреоз развивается в любом возрасте: самая молодая собака заболела в возрасте всего 6 недель, а самой старой было 13,5 лет (рис. 17-3). Средний возраст обследованных животных составлял 4,8 года. Тридцать (60%) из 50 собак -суки. Чаще всего гипопаратиреоз диагностировался у той-пуделей, лабрадор-ретриверов, цвергшна-уцеров, немецких овчарок и терьеров.
Анамнез
Продолжительность заболевания. Клиническая картина гипопаратиреоза у 37 собак, поступавших в нашу клинику, характеризовалась внезапным началом перемежающихся неврологических и нервно-мышечных расстройств (см. табл. 17-1). Хозяева, по меньшей мере, 20 животных сообщали, что клинические проявления заболевания возникали или обострялись при возбуждении или физических нагрузках. У одних собак признаки гипокальциемии наблюдались в течение всего одного дня, тогда как у некоторых сохранялись на протяжении года. Только у восьми из 37 собак, включенных в данный обзор, продолжительность этих признаков до постановки диагноза и назначения терапии превышала 14 дней. У других восьми собак характерная клиническая симптоматика имела место на протяжении от 1 до 12 месяцев; их лечили по поводу неспецифических судорог, и лечение не привело к улучшению исходных показателей лабораторных тестов. У животных, имевших клинические признаки заболевания в течение нескольких дней, неизменно отмечались
ТАБЛИЦА 17-2. ПОРОДЫ СОБАК, У КОТОРЫХ ЗАРЕГИСТРИРОВАН ПЕРВИЧНЫЙ СПОНТАННЫЙ ГИПОПАРАТИРЕОЗ
Порода Число собак (всего 50) *
Той-пудель 10
Лабрадор-ретривер 6
Цвергшнауцер 5
Немецкая овчарка 5
Различные терьеры 5
Бигль 2
Такса 2
Золотистый ретривер 2
Английский пойнтер 1
Колли 1
Кеесхонд 1
Кокер-спаниель 1
Маламут 1
Ирландский волкодав 1
Сибирская лайка 1
Беспородные собаки 6
* Включены 37 собак нашей группы, 4 собаки из Kornegay et al, 1980, 6 из Sherding et al, 1980, 1 из Crawford, Dunstan, 1985, 1 из Meyer, Tyrrell, 1976 и 1 из Burk, Schaubhut, 1975.
<1 1 2 3 4 5 6 7 8 9 10 11 12 13
Возраст (годы)
Рис. 17-3. Возраст 38 собак при установлении диагноза гипопаратиреоза. В это число входят 25 собак нашей группы, 4 собаки из Kornegay et al,1980; 1 собака из Crawford, Dunstan, 1985; 6 собак из Sherding et al, 1980; одна из Meyer, Tyrrell, 1976 и одна из Burk, Schaubhut, 1975.
нервно-мышечные расстройства, тяжесть и частота которых увеличивались, несмотря на лечение противосудорожными препаратами.
Ранние признаки. Большинство владельцев собак вспоминали, что одним из первых их наблюдений было необычное «напряжение», «нервозность» или «беспокойство». Дополнительно они отмечали (тоже ретроспективно), что собаки интенсивно терли морду лапами или терлись ею о землю (см. ниже). Некоторые животные упорно вылизывали лапы и даже покусывали (жевали) их. Хотя эти особенности поведения являются общими, хозяева животных рассказывали о них только после наводящих вопросов специалиста или вспоминали о них, только когда они исчезали после начала лечения.
Симптомы, служившие непосредственной причиной обращения владельцев собак за ветеринар
796 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
ной помощью, были разными. Чаще всего это были эпилептические судороги (см. следующий раздел). Кроме того, имелись жалобы на мышечную скованность, тонические спазмы и боль в конечностях. У большинства владельцев вызывали беспокойство непроизвольные локальные сокращения мышц, генерализованный тремор, фасцикулярные подергивания и дрожь, а также напряженная, скованная («ходульная» или «приседающая») походка. Обычными были жалобы на потерю собакой аппетита, замедленность движений, утрату игривости или дружелюбия.
Повышенная нервозность, по-видимому, является проявлением тетании, усиленной адренергической секрецией. Агрессивное поведение может быть вызвано болевыми ощущениями при мышечных спазмах, которые могут быть вызваны даже простым поглаживанием собаки. Поэтому животное, ранее испытавшее острую боль при легком прикосновении, начинает избегать ласк хозяина, становится менее «дружелюбным». Те же причины могут лежать в основе других изменений поведения или индивидуальности собаки.
Судороги. Эпилептические судороги отмечались владельцами 32 из 37 собак со спонтанным первичным гипопаратиреозом. Как указывалось выше, у большинства этих животных имелись типичные эпилептические судороги, хотя в ряде случаев это явление носило необычный характер: в частности, во время приступов собаки оставались в сознании и у них не было недержания мочи (Peterson, 1986). Представляет интерес частота судорожной активности, отмеченная ветеринарами. У 32 из 37 собак наблюдались судороги (во многих случаях заставлявшие предполагать наличие идиопатической эпилепсии) или «состояние тетании». Такая частота нерно-мышечных нарушений значительно выше, чем при идиопатической эпилепсии. В ряде случаев эти расстройства были настолько тяжелыми, что собаки не могли стоять или ходить даже в отсутствие явной судорожной активности. Другие исследователи (Sherding et al, 1980) отмечали, что мышечный тремор, начавшийся в одной ноге, постепенно распространялся на другие конечности, интенсивность его прогрессивно возрастала и, в конце концов, он переходил в генерализованные судороги. У одних собак судорожные эпизоды длились всего 30-90 секунд, тогда как у других они продолжались в течение получаса и более. В большинстве, хотя и не во всех случаях генерализованные судороги ослабевали сами по себе.
Разные симптомы. Как следует из таблицы 17-1, многие владельцы собак отмечали перекрывание неврологических и нервно-мышечных симптомов. По всей видимости, у всех собак одним из первоначальных симптомов заболевания были приступы тяжелой гипокальциемической тетании. Слабо выраженные признаки включали затрудненное дыхание, атаксию, эпизодическую слабость, полную анорексию, рвоту, диарею и потерю веса. Ветери
нары отмечали также повышение температуры, на которое хозяева животных не обращали внимания. Вертячки и/или потери ориентации, о которых сообщалось ранее (Sherding et al, 1980), у наших 37 собак с гипокальциемией не было. Все владельцы животных замечали то или иное изменение состояния своих питомцев; у нас не было случаев, чтобы хозяин собаки не наблюдал хотя бы один из клинических симптомов, на которые жаловались другие владельцы. Выявляемая при лабораторных анализах гипокальциемия сама по себе обычно не вызывает тревоги, но «приобретает смысл» после появления ее клинических симптомов. В принципе, собака может погибнуть из-за нелеченой гипокальциемии, но это случается редко.
Растирание морды. Двадцать три из 37 собак нашей группы энергично растирали лапами глаза, уши и морду, либо терлись ею о землю. В других случаях хозяева собак сообщали о том, что животные вылизывали лапы или покусывали их. Считается, что эти элементы поведения обусловлены болевыми ощущениями, которые собаки испытывают при спазмах жевательных и/или височных мышц в результате гипокальциемии, либо болезненным «покалыванием» вокруг рта и в дистальных частях конечностей. У человека к числу классических признаков гипокальциемии относится «парестезия», определяемая как онемение или ощущение покалывания вокруг рта, в кончиках пальцев и, реже, в стопе (Arnaud, 1994). Нет сомнения, что собаки испытывают те же ощущения, от которых они пытаются избавиться, растирая морду или кусая лапы (см. табл. 17-1).
Гипервентиляция. Острое тревожное чувство или боль при тетании у людей (и, вероятно, у собак) с гипопаратиреозом могут служить причиной эпизодической гипервентиляции и избыточной секреции адреналина. Гипервентиляция вызывает гипокапнию и алкалоз, которые усугубляют тяжесть гипокальциемии в результате увеличения связывания ионов кальция с белками крови. У здоровых людей продолжительная гипервентиляция может приводить к уменьшению концентрации ионизированного кальция в сыворотке. Однако совершенно невероятно, чтобы гипервентиляция служила единственной причиной тетании (Arnaud, Kolb, 1983).
Эпизодический характер заболевания. Все неврологические и нервно-мышечные расстройства у обследованных нами собак имели эпизодический характер. Эпизоды кажущейся или подтвержденной гипокальциемической тетании перемежались асим-птоматическими периодами продолжительностью от нескольких минут до нескольких дней. Наступление приступов тетании было непредсказуемым, хотя согласно ретроспективным оценкам они чаще всего возникали при физической нагрузке (даже во время неторопливой или кратковременной прогулки «на поводке»), возбуждении, ласках хозяина («латентная тетания»?) или стрессорных воздействиях, таких как доставка в ветеринарную клинику.
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 797
Все собаки нашей группы страдали гипокальциемией, однако, тетания отмечалась у них лишь эпизодически. С одной стороны, это указывает на определенную адаптацию собак к гипокальциемии, но с другой, предполагает, что даже слабые изменения концентрации кальция в их крови могут иметь достаточно тяжелые клинические последствия. Одной собаке из нашей группы был поставлен диагноз первичный гипопаратиреоз, однако в течение целого года ее лечение не проводилось из-за нежелания владельца. Несмотря на устойчивую гипокальциемию, явные гипокальциемические эпизоды у этой собаки отмечались не чаще одного-двух раз в месяц. В этой драматической ситуации животное оставалось относительно здоровым и, в основном, страдало от плохого аппетита и потери веса.
Физикальное исследование
Общие наблюдения. При физикальном исследовании собак с первичным гипопаратиреозом у них не выявляется иных нарушений, кроме связанных с гипокальциемией. Результаты обследования 37 собак нашей группы варьировали (табл. 17-3). Многие собаки имели тетанию уже при первом поступлении. Часто это расстройство выявлялось после биохимического анализа сывороток. Тридцать три из 37 собак были доставлены в нашу клинику специально для обследования на наличие гипокальциемии, и проводившие физикальное исследование специалисты (обычно один из нас) «были настроены» на диагностику именно этой патологии. Сделанные наблюдения (почти все они приведены в табл. 17-3), хотя и впечатляющие для неосведомленных, но могли бы быть пропущены, если бы мы не располагали данными анамнеза.
ТАБЛИЦА 17-3. РЕЗУЛЬТАТЫ ПЕРВИЧНОГО ФИЗИКАЛЬНОГО ИССЛЕДОВАНИЯ 37 СОБАК СО СПОНТАННО РАЗВИВШИМСЯ ПЕРВИЧНЫМ ГИПОПАРАТИРЕОЗОМ
Симптомы Число собак
Судороги или «тетания» Первичное обследование 18
Через 4 дня после госпитализации 32
Повышенная температура 26
Напряженный, твердый живот 24
Скованная походка 23
Худоба 22
Генерализованные фасцикулярные 21
подергивания мышц Рычание 21
Сердечные расстройства Тахиаритмия 13
Глухие тоны сердца/слабый пульс 3
Трудность исчерпывающего 30/30
выявления и интерпретации неврологической симптоматики Катаракта 12
Отсутствие нарушений 5
Пять из этих собак выглядели здоровыми, несмотря на наличие в анамнезе неврологических и нервно-мышечных расстройств. Несколько особей были исхудалыми и еще несколько рычали во время осмотра. Согласно ретроспективной оценке, рычавшие собаки страдали от боли или боялись, что предстоящие манипуляции будут болезненными, так как после излечения гипокальциемии они вели себя вполне дружелюбно. У 16 собак первоначальное обследование выявило нарушения сердечной деятельности, в том числе подозрение на пароксизмальную тахиаритмию у 13 и глухие тоны сердца у 3 особей.
Спонтанные неврологические и нервно-мышечные симптомы. Первоначальное обследование 37 собак с первичным гипопаратиреозом выявило у 32 из них, по меньшей мере, одно нарушение, которое можно было приписать гипокальциемии. У 18 собак были судороги. Другие рычали, были чрезвычайно напряжены или «ригидны», имели твердый живот, скованную походку и/или фасцикулярные подергивания мышц. Почти всякий раз, когда та или иная собака начинала рычать, ее хозяин говорил, что это «новое поведение», которое он замечал и дома. У 26 собак из 37 обследованных была повышена температура.
У 32 из 37 собак в течение первых 48-96 часов госпитализации, по крайней мере, один раз наблюдали судороги. Было предпринято полное неврологическое обследование 30 животных, которое выявило самые разнообразные расстройства. Однако чаще всего мы сталкивались с ситуацией, когда «у собаки было слишком велико нервное напряжение, не позволявшее завершить тщательное обследование». Ретроспективно мы приходили к выводу о наличии у этих животных тетании. Другие нарушения включали ускоренную рефлекторную реакцию или отсутствие тех или иных рефлексов, быстрые ритмические мышечные сокращения и/или боль. Латентная или явная тетания затрудняла интерпретацию результатов неврологического исследования до подтверждения гипокальциемии данными лабораторных анализов.
Индуцированные неврологические или нервно-мышечные признаки. В качестве подспорья при диагностике латентной тетании (гипокальциемии) у людей используют два физических теста. Симптом Хвостека выявляют постукиванием в месте прохождения лицевого нерва впереди ушной мочки. Положительным результатом теста считается выраженное подергивание или сокращение лицевых мышц. Для выявления симптома Труссо манжетку для измерения кровяного давления накачивают до давления, превышающего систолическое, и держат не менее 2 минут. Показателем положительной реакции служит спазм запястья продолжительностью более 5-10 секунд при надутой манжете или после выпуска воздуха (Arnaud, 1994; Meininger, Kendler, 2000). У собак с гипокальциемией при оценке рефлексов возникали эпизоды
798 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
Рис. 17-4. Лентикулярная катаракта хрусталика у собаки с гипопаратиреозом.
сильных мышечных спазмов, хотя это явление у собак должным образом не описано.
Катаракта. Развитие задней лентикулярной катаракты - одно из наиболее частых последствий гипопаратиреоза у человека (Arnaud. 1994). У таких больных катаракта возникает и формируется на протяжении 5-10 лет, прежде чем начинает ухудшаться фен не. Полностью созревшие катаракты сливаются, что приводит к полному помутнению хрусталика. При успешном лечении гипокальциемии дальнейшее развитие катаракты обычно прекращается (Arnaud, 1994).
Катаракта была диагностирована у 12 из 37 собак нашей группы. Впервые она была описана у двух собак с гипопаратиреозом в 1980 году (Kornegay et al, 1980). Опубликованы также сообщения о выявлении катаракты у нескольких кошек; имелась она и у двух из 5 кошек с первичным гипопаратиреозом, которых мы обследовали. Стадии катаракты варьировали от точечных отложений до линейного помутнения молочного цвета в передней и задней субкапсулярной областях. Помутнение беспорядочно захватывало хрусталиковые волокна; участки помутнения отделялись от капсулы промежуточной зоной нормальной тонкой коры (рис. 17-4). Потери зрения не было ни у одной собаки. К числу других глазных заболеваний, ранее не зарегистрированных у собак, относятся папилледема. воспаление зрительного нерва, конъюнктивит, кератит, блефароспазм, выпадение ресниц, косоглазие, нистагм и анизокория (неравенство зрачков).
КЛИНИЧЕСКАЯ КАРТИНА СПОНТАННОГО ГИПОПАРАТИРЕОЗА У КОШЕК
В ветеринарной литературе описаны девять кошек со спонтанным первичным гипопаратиреозом. Мы имели возможность наблюдать пять особей с этим
заболеванием. Несмотря на относительную редкость данного расстройства, известно, что клинически и биохимически оно неотличимо от состояния. развивающегося в результате ятрогенного поражения или хирургического удаления паращитовидных желез у гипертиреоидных кошек. Это важная информация, потому что ветеринарам все чаще приходится иметь дело с гипопаратиреозом как ятрогенной патологией.
Клиническая симптоматика у 14 кошек со спонтанным гипопаратиреозом в целом напоминает таковую у людей и собак, если нс считать, что заболевание чаще встречается у котов (9 случаев).
Возраст больных кошек ко времени установления диагноза колебался от 6 месяцев до 7 лет; заболевание поражало животных разных пород. Его клиническое течение характеризовалось внезапной или медленной манифестацией перемежающихся неврологических и нервно-мышечных симптомов, в частности, очагового и генерализованного мышечного тремора, судорог, атаксии, скованной походки, потери ориентации и слабости. Другие часто встречавшиеся нарушения включали вялость, анорексию, затрудненное дыхание и поднятые мигательные перепонки. Дисфагия, зуд и усиленное слюноотделение отмечались реже и преимущественно хозяевами животных. При физикальном исследовании выявлялись депрессия, общая слабость, лихорадочное состояние, гипотермия, брадикардия, умеренная или тяжелая дегидратация. У нескольких кошек была обнаружена лентикулярная катаракта (Forbes et al, 1990; Parker, 1991; Peterson et al, 1991; Bassett, 1998; Ruopp, 2001).
ДИАГНОСТИКА: РУТИННЫЕ ИССЛЕДОВАНИЯ
Кальций
Гипокальциемия была диагностирована у всех 37 обследованных нами собак со спонтанным гипопаратиреозом. В анамнезе каждой из них имелись поведенческие, неврологические, мышечные и нервно-мышечные расстройства. Поэтому для индивидуальной характеристики отдельных особей приходилось проводить общий клинический анализ крови и мочи и биохимический анализ сыворотки. У всех собак была тяжелая и устойчивая гипокальциемия (табл. 17-4). Поскольку, однако, тяжелая гипокальциемия (концентрация кальция <6,5 мг/100 мл) в целом достаточно редко встречалась у поступавших в нашу клинику собак, мы во всех случаях подтверждали ее дополнительным анализом еще одной пробы крови. Всем собакам сразу же назначали соответствующую терапию и определяли уровень кальция в сыворотке крови 3-5 раз на протяжении первых 72 часов госпитализации. До проявления эффекта терапии концентрация кальция ни у одной собаки не превышала 6,5 мг/100 мл. Одновременно проводили рутинные определения концентрации ионизированного кальция. Как
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 799
ТАБЛИЦА 17-4. ХАРАКТЕРИСТИКА СОБАК С ПЕРВИЧНЫМ ГИПОПАРАТИРЕОЗОМ
Собака Возраст (годы) Пол Длительность клинических проявлений (дни) Концентрация кальция в сыворотке крови (мг/ 100мл) Концентрация фосфора в сыворотке крови (мг/100 мл) Концентрация магния в сыворотке крови (мг/100 мл) Концентра ция азота мочевины в крови (мг/100 мл) Концентра ция ионизированного Са (моли/л) Концентрация ПТГ (пмоль/л) Гистологическая картина пара щитовидных желез
1 5 Ж/О 3 5,7 7,3 - 14 -
2 5 Ж/О 30 4.1 5,4 1,9 31 - -
3 5 м 30 4,7 6,0 - 8 - -
4 4 ж 7 4,5 5,9 1,2 17 - -
5 10 Ж/О 1 5,2 7,0 2,1 15 - - Лимфоцитарный паратиреоидит
6 11 Ж/О 3 5,6 8,9 - 4 - -
7 1 ж 14 4,2 9,8 - 20 - -
8 5 м 180 5,7 10,2 - 12 - -
9 10 ж 3 5,5 7,2 1,9 9 - -
10 1 м 1 5,2 7,8 - 19 - -
11 10 м 11 4,9 5,9 1,8 10 - 1,0 Лимфоцитарный паратиреоидит
12 10 м 1 6,0 6,3 - 13 - 0,1 Лимфоцитарный паратиреоидит
13 4 Ж/О 14 3,9 4,9 1,9 16 - 0,1
14 7 Ж/О 10 6,0 8,3 2,3 12 - 1,0 Лимфоцитарный паратиреоидит
15 9 м 4 3,6 5,8 - 0 - 0,05 -
16 0,5 Ж/О 2 3,9 8,4 1,9 11 0,1
17 13 м 6 4,2 7,1 - 15 - 0,1 Лимфоцитарный паратиреоидит
18 1 Ж/О 7 5,1 8,7 1,2 14 - 0,1 Лимфоцитарный паратиреоидит
19 0,5 Ж/О 7 4,8 10,2 2,0 22 - - Лимфоцитарный паратиреоидит
20 2 м 45 4,4 7,4 2,1 16 - 0,1 -
21 3 Ж/О 9 5,1 6,8 - 25 - 0,5 -
22 6 Ж/О 360 5,1 8,8 2,2 23 0,4 0,1 Лимфоцитарный паратиреоидит
23 8 м 3 3,9 8,3 1,9 19 0,3 0,5 -
24 612 Ж/О 2 4,6 8,5 2,3 18 0,5 0,1
25 6 м 3 5,5 8,5 2,2 19 0,5 0,7 Фиброзная ткань
26 5 м 2 5,6 7,6 - 23 0,5 1,1 Фиброзная ткань
27 4 ж 28 4,6 6,1 2,1 27 0,4 0,8 -
28 11 м 1 5,5 7,1 1,5 20 0,7 1,1 -
29 5 м 60 5,6 10,1 1,9 22 0,5 0,1 Лимфоцитарный паратиреоидит
30 1 м 1 5,1 7,3 - 19 0,4 - -
31 10 м 9 5,9 6,1 2,0 26 0,5 0,1 Лимфоцитарный паратиреоидит
32 7 Ж/О 32 5,9 6,2 1,9 20 0,4 1,6 -
33 0,75 м 2 3,8 9,1 1,6 25 0,2 -
34 1 м 4 5,0 8,8 2,2 18 0,4 0,4 Фиброзная ткань
35 2 м 5 4,3 7,9 26 0,4 1,0 -
36 6 м 320 5,0 9,0 2,2 17 0,3 1,7 -
37 12 Ж/О 3 4,5 8,1 - 27 0,3 1,2 -
Среднее 9 - 30 4,8 7,6 1,9 15,6 0,3 0,4 -
Нормальные величины - - 8,9- 11,4 3,0-4,7 1,8-2,4 12-28 1,0-1,4 2-13
М - кобель, Ж - сука, О - овариэктомированная/овариогистерэктомированная.
следует из материалов таблицы 17-4, у всех собак с первичным гипопаратиреозом имелся сильный дефицит как общего, так и ионизированного кальция.
«Откорректированные» значения кальция
В плазме или сыворотке крови кальций находится в трех формах, или фракциях: ионизированной (свободный кальций), комплексированной, или хелированной (кальций, связанный с фосфатом, бикарбонатом, сульфатом, цитратом и лактатом), и связанной с белками (рис. 17-5). У здоровых животных в целом ионизировано от 50 до 60% общего кальция. На долю комплексированного, связанного с белком и ионизированного кальция приходится приблизительно 34, 10 и 56% общего кальция со
ответственно (Schenck et al, 1996). При лабораторных исследованиях обычно определяют суммарное количество всех фракций, т.е. содержание общего кальция в сыворотке крови. Ионизированный кальций представляет собой биологически активный компонент общего кальция, а связанная с белками фракция служит «резервуаром», или хранилищем его ионизированной формы. Изменения уровня альбуминов и глобулинов в сыворотке крови могут влиять на определение количества общего кальция, не изменяя концентрацию его ионизированной формы. Несмотря на изменения концентрации общего кальция в условиях гиперпротеинемии или гипопротеинемии, механизм гомеостаза обеспечивает сохранение нормальной концентрации его биологически активной формы. Любая собака или кошка
800 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
Внеклеточный кальций
Ионизированный кальций (Са2-)
Комплексирован-ный кальций:
Са-цитрат Са-лактат Са-бикарбонат Са-фосфат
Связанный с белком кальций
Рис. 17-5. Концентрация общего кальция в сыворотке крови складывается из фракций ионизированного (свободного), комплексированного и связанного с белком кальция.
л
с гипокальциемией подлежит тестированию на гипопротеинемию и или гипоальбуминемию (Chew, Meuten, 1983).
Для учета изменений концентрации кальция в сыворотке крови у собак в зависимости от уровня протеинемии были предложены две формулы (Meuten ei al, 1982). Они с успехом использовались до появления методов рутинного определения ионизированного кальция в крови. Эти формулы имеют следующий вид:
Откорректированная концентрация общего Са (мг/100 мл) =
Измеренная концентрация общего Са (мг/100 мл) - альбумин (г/100 мл) + 3,5
или
Откорректированная концентрация общего Са (мг/100 мл) =
Измеренная концентрация общего Са (мг/100 мл) - [0,4 х общий белок (г/100 мл)] + 3,3
Часто явную гипокальциемию объясняют наличием гипоальбуминемии. Между тем, роль ги-поальбуминемии минимальна, она не вызывает никаких клинически значимых изменений и весь
ма слабо влияет на отклонение уровня кальция от нормы. Хотя приведение к нормальному диапазону подразумевает нормальную концентрацию ионизированной фракции, на самом деле она может быть низкой. Приведенные формулы были предложены более 20 лет назад на основании концентраций альбумина, которые определялись аналитическими методами, вышедшими из употребления с появлением современных автоматических анализаторов. Считавшиеся в то время нормальными концентрации альбумина в сыворотке крови были значительно ниже принятых сегодня (Meuten et al, 1982). Позднее была установлена положительная корреляция между концентрациями альбумина и кальция, однако лишь 33% изменчивости уровня общего кальция можно объяснить колебаниями концентрации альбумина и только 17% - колебаниями содержания общего белка в сыворотке крови. У кошек нет связи между концентрациями общего белка и кальция, и только 18% колебаний уровня кальция объясняется изменениями концентрации альбумина (Flanders et al, 1989). В другом исследовании только 17% и 29% изменчивости общего кальция соответственно у собак и кошек было обусловлено колебаниями уровня альбумина в крови (Bienzle et al, 1993). По этой причине в настоящее время не рекомендуется использовать приведенные выше формулы для характеристики уровня кальция (Rosol et al, 2000).
У всех обследованных нами 37 собак с первичным гипопаратиреозом концентрация альбумина была в норме. Заключение о тяжелой гипокальциемии у этих животных оставалось в силе и после пересчета концентрации кальция по указанным формулам.
Фосфор в сыворотке крови
Обнаружение гипокальциемии в сочетании с гиперфосфатемией служит убедительным подтверждением диагноза гипопаратиреоза. Как видно из табл. 17-4, у всех собак с гипопаратиреозом, входивших в нашу группу, концентрация фосфора в сыворотке крови была выше концентрации общего кальция, и во всех случаях сохранялась нормальная концентрация азота мочевины (AM) в крови. Отсутствие абсолютной гиперфосфатемии у некоторых собак отчасти объясняется тем обстоятельством, что диапазон концентраций фосфора, принятый за «норму» в разных лабораториях, чрезвычайно широк. Нормальные показатели обычно рассчитываются по результатам определений у животных всех возрастов, тогда как у молодых собак нередко имеет место относительная гиперфосфатемия. Концентрация фосфора постепенно уменьшается ко времени полового созревания, после чего остается довольно стабильной. Кроме того, некоторые собаки с гипопаратиреозом могут испытывать некоторый недостаток фосфора из-за его пониженного содержания в корме или отсутствия аппетита.
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 801
Другие показатели биохимического анализа крови
Диагноз первичный гипопаратиреоз у собак ставится «методом исключения». Иными словами, сначала проводится полная дифференциальная диагностика гипокальциемии, а затем последовательно исключаются возможные причины ее тяжелой формы. В связи с этим для оценки состояния любой нелакти-рующей особи с гипокальциемией необходимо получить исчерпывающую базу данных. Было высказано предположение, что гипопаратиреоз является единственным возможным диагнозом для животных, у которых низкая концентрация кальция в сыворотке крови сочетается с высокой концентрацией фосфора, нормальной функцией почек и пониженной (относительно или абсолютно) концентрацией ПТГ (Rosol et al, 2000).
Как будет показано в разделе «Дифференциальная диагностика», существуют три возможные причины первичного гипопаратиреоза: подавление секреции ПТГ без разрушения паращитовидных желез (Dhupa, Proulx, 1998), резкая коррекция хронической гиперкальциемии, при которой сильно атрофируются оставшиеся паращитовидные железы, и отсутствие или разрушение паращитовидных желез. Наш опыт показывает, что причиной гипопаратиреоза у собак и кошек чаще всего является тяжелая атрофия или разрушение паращитовидных желез. Остальные рутинные лабораторные анализы не выявили никаких нарушений у собак с гипопаратиреозом. Единственным существенным изменением во всех случаях была гипокальциемия и в большинстве случаев гиперфосфатемия.
Лабораторное тестирование кошек
Лабораторное тестирование 14 кошек со спонтанным первичным гипопаратиреозом (9 описанных в литературе и 5 входивших в обследованную нами группу) во всех случаях выявило тяжелую гипокальциемию (от 2,5 до 4,2 мг кальция/100 мл). Также у всех животных была обнаружена непропорционально высокая концентрация фосфора в сыворотке крови (от 5,2 до 19 мг/100 мл). Концентрации общего белка, альбумина, AM, креатинина и магния были в норме (Forbes et al, 1990; Parker, 1991; Peterson et al, 1991, Bassett, 1998; Ruopp, 2001).
Электрокардиограмма
При гипокальциемии увеличивается продолжительность потенциала действия сердечных клеток, что приводит к удлинению сегментов S-Т и Q-T. Существует тесная корреляция между тяжестью гипокальциемии и длительностью сегмента S-T. У большинства наших собак с гипокальциемией отсутствовали признаки сердечного заболевания. Поэтому только у нескольких особей проводилось электрокардиографическое исследование. Выявленные при этом нарушения, наиболее вероятно связанные с гипокальциемией, включали (1) глубокий и широкий зубец Т. (2) удлиненные интервалы Q-T и (3) брадикардию. Сравнение ЭКГ, полученных во время гипокальциемии и после восстановления нормальной концентрации кальция, показало, что зубцы R были значительно выше в первом случае (рис. 17-6). Анализ ЭКГ не дал объяснения случаям аритмии, слабого пульса или глухих тонов
Рис. 17-6. ЭКГ, полученные на разных стадиях лечения собаки с гипока тьциемией, обусловленной первичным гипопаратиреозом. А. Концентрация кальция в сыворотке крови 4,0 мг/100 мл. На ЭКГ видны удлиненные сегменты S-Т и Q-T. Зубец Г расширенный и глубокий Концентрации калия (4,3 мэкв/л), натрия (147 мэкв/л) и хлорида (103 мэкв/л) в сыворотке крови были в норме. Концентрация неорганического фосфора составляла 4,9 мг/100 мл. Б. Концентрация кальция 6,2 мг/100 мл. На ЭКГ видны укороченные сегменты S-Т и Q-T и короткий зубец Т с уменьшенной амплитудой. В. Нормальная концентрация кальция 9,7 мг/100 мл. На ЭКГ видны нормальные зубец Т и сегменты S-Т и Q-T. Эти три ЭКГ иллюстрируют также уменьшение амплитуды зубца R по мерс повышения концентрации кальция в сыворотке крови до нормальной величины.
802 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
сердца, которые были выявлены при физикальном исследовании.
Магний
У людей с недостаточностью магния и гипомагниемией отмечаются гипокальциемия, гиперфосфатемия и состояние функционального гипопаратиреоза и/или резистентности к ПТГ. У некоторых лиц к тому же значительно снижена концентрация ПТГ в крови, иногда до неопределяемого уровня. Выраженные нарушения концентраций кальция и фосфора обычно наблюдаются при тяжелой гипомагниемии, когда концентрация магния в сыворотке не превышает 1,2 мг/100 мл. У человека гипомагниемия обусловлена разнообразными факторами, многие из которых хорошо известны (табл. 17-5). Эффективность реабсорбции магния в почечных канальцах такова, что у людей экспериментальное
ТАБЛИЦА 17-5. ИЗВЕСТНЫЕ ПРИЧИНЫ ГИПОМАГНИЕМИИ И НЕДОСТАТОЧНОСТИ МАГНИЯ У ЧЕЛОВЕКА
Пониженное потребление и/или всасывание магния
Белковое голодание и низкая калорийность пищи Инфузионная терапия с использованием не содержащих магний жидкостей
Парентеральное питание продуктами, не содержащими магний
Желудочно-кишечные расстройства
Продолжительная назогастральная аспирация
Хронический понос
Синдром малабсорбции
Резекция значительной части кишечника, кишечные
фистулы
Потери магния через почки
Хроническая парентеральная инфузионная терапия не
содержащими магний жидкостями
Неазотемическая дисфункция почечных канальцев (см.
текст)
Применение петлевых и осмотических диуретиков
Г иперкальциемия
Гипокалиемия
Потребление алкоголя
Нарушения обмена
Г иперкальциемия
Г ипофосфатемия
Эндокринные расстройства
Сахарный диабет, инсулинотерапия
Гипертиреоз
Первичный гиперпаратиреоз
Первичный и вторичный гиперальдостеронизм
Нарушение секреции антидиуретического гормона
Перераспределение
Панкреатит
Гиперадренергическое состояние
Массированное переливание крови
Гипотермия
Острый респираторный алкалоз
Сепсис
Другие причины
Ожоги
Избыточная лактация
Избыточное потение
ограничение потребления магния с пищей не приводит к синдрому его недостаточности (Broadus, 1981). Известные случаи недостаточности магния у детей при тяжелом белковом голодании и низкой калорийности пищи являются результатом действия множественных механизмов. Одним из них является значительная потеря содержащих магний кишечных жидкостей вследствие затяжной диареи или назогастральной аспирации, особенно если пациент получает парентеральное питание с низким содержанием магния или без него.
Недостаточность магния развивается также у людей с различными кишечными расстройствами, связанными с нарушением всасывания в тонком кишечнике и/или стеатореей. Механизмы такой недостаточности включают образование магниевого мыла с неабсорбированными жирными кислотами и выведение магния с кишечными жидкостями. Гипомагниемия с соответствующими клиническими проявлениями или без них отмечается у трети больных с нарушениями внутрикишечного всасывания. Первичная инфантильная гипомагниемия представляет собой редкое аутосомно-рецессивное заболевание, вызванное, по-видимому, специфическим дефектом всасывания магния в кишечнике.
У небольшого числа больных в диуретической фазе острого некроза почечных канальцев и у пациентов с ацидозом почечных канальцев, пиелонефритом, гидронефрозом и другими преимущественно неазотемическими нарушениями функции почек наблюдалось уменьшение реабсорбции магния в почечных канальцах и гипомагниемия. Оба эти явления отмечались также в качестве компонентов нефротоксического действия гентамицина и после химиотерапии цисплатином. Практически все диуретики усиливают экскрецию магния. Симптоматическая гипомагниемия развивается также у больных с первичным гиперальдостеронизмом и при различных состояниях вторичного гиперальдостеронизма.
Осмотический диурез при диабетическом кетоацидозе (ДКА) может сопровождаться значительными потерями магния с мочой. Динамика развития гипомагниемии, гипокалиемии и гипофосфатемии в ответ на терапию кетоацидоза одинаковая. Нормальная концентрация магния, отмечаемая до начала терапии, падает ниже 1 мг/100 мл через 24 часа после введения инсулина. Обусловленная инсули-нотерапией гипомагниемия наблюдается почти у 50% больных, поэтому в настоящее время заместительное введение магния является рутинным компонентом лечения ДКА.
Отрицательный баланс магния и тенденция к развитию гипомагниемии являются неотъемлемыми признаками гипопаратиреоза. Механизмы этих процессов до конца не выяснены, но, по-видимому, включают резорбцию костной ткани и изменение распределения магния в мягких тканях.
Концентрацию магния определяли у 23 из 37 собак с гипопаратиреозом, включенных в табл. 17-
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 803
4. У 19 из них концентрация магния была в норме, а у 4 собак была гипомагниемия. Значение этого наблюдения неясно, поскольку специфическая терапия с использованием препаратов магния не проводилась. Тем не менее, известно, что люди с гипокальциемией и сопутствующей гипомагниемией нередко не отвечают на терапию кальцием, если ей не предшествует заместительное введение магния (Hansen, 2000). Гипомагниемии у больных обычно не проявляется до тех пор, пока концентрация магния остается выше 1,5 мг/100 мл. Но даже после ее падения ниже 1,0 мг/100 мл клиническая симптоматика развивается не у всех пациентов.
Слабая количественная взаимосвязь между результатами анализов и их клинической значимостью обусловлена тем обстоятельством, что в сыворотке или плазме крови присутствует только 0,3% всего имеющегося в организме магния. Концентрация магния в крови может оставаться нормальной или высокой на фоне истощения его внутриклеточного резерва. Хотя обычно она понижается в условиях недостаточного поступления магния в организм, результаты измерения уровня магния в сыворотке крови остаются весьма ненадежным показателем общего содержания этого элемента. Большинство специалистов сходятся во мнении, что определение концентрации магния в сыворотках является наиболее удобным и дешевым методом, но при этом признают недостаточную достоверность такой оценки. Интерес к измерению концентрации ионизированного магния натолкнулся на необходимость дорогостоящей и не всегда доступной аппаратуры. Кроме того, неизвестно, как соотносятся результаты таких измерений с концентрацией общего магния в сыворотке крови у животных. Наконец, непонятно, как следует интерпретировать данные определения магния в различных тканях, включая кости, цельную кровь и эритроциты (Hansen, 2000).
Наиболее информативными методами определения концентрации магния в сыворотке крови следует считать масс-спектрометрию и метод изотопного разведения. Национальная система стандартов для клинических лабораторий Национального комитета по клинико-лабораторной стандартизации США установила в качестве референтного метода пламенную атомно-абсорбционную спектрометрию (ПААС) (Elin, 1994). Большинство коммерческих лабораторий работает колориметрическими методами, используя в качестве хромофоров преимущественно калмагит или метилтимоловый синий (Hansen, 2000).
ДИАГНОСТИКА: КОНЦЕНТРАЦИЯ ПАРАТИРЕОИДНОГО ГОРМОНА (ПТГ)
Клиническая значимость
Люди. Определение концентрации ПТГ в сыворотке крови имеет решающее значение для правильной диагностики нарушений функции па
ращитовидных желез у человека (Arnaud, 1994). Повышение концентрации ПТГ в сыворотке, отражающее соответствующую физиологическую реакцию на гипокальциемию, исключает первичный гипопаратиреоз и предполагает резистентность органа-мишени к ПТГ (псевдогипопаратиреоз или недостаточность витамина Д) либо вторичный гипопаратиреоз, вызванный такими явлениями, как недостаточное поступление кальция с пищей или нарушение его всасывания в кишечнике. Уменьшение концентрации ПТГ в сыворотке крови является показателем первичной дисфункции паращитовидных желез.
Собаки и кошки. Отсутствие ПТГ в сыворотках животных с тяжелой гипокальциемией подтверждает наличие первичного гипопаратиреоза при условии достоверности и надежности использовавшегося метода определения ПТГ. Такие методы для определения ПТГ у собак и кошек в настоящее время имеются в ряде ветеринарных учреждений. При достаточно высокой чувствительности метода в сыворотках некоторых животных с гипопаратиреозом удается определить концентрацию ПТГ, находящуюся на «нижней границе нормы». Однако такая концентрация (и даже более высокая - в пределах нормального диапазона) может быть недостаточной для животного с гипокальциемией, имеющего нормально функционирующие паращитовидные железы (см. рис. 16-2, 16-19 и 16-20). У всех 24 обследованных нами собак с первичным гипопаратиреозом концентрация ПТГ в сыворотке крови была очень низкой или ниже определяемого уровня (см. табл. 17-4 и рис. 16-19).
Реакция на терапию в сочетании с анализом и последовательным исключением всех дифференциальных диагнозов при гипокальциемии является относительно надежным и логичным методом диагностики первичного гипопаратиреоза. При таком подходе определение концентрации ПТГ представляет скорее академический интерес. Но поскольку спонтанный первичный гипопаратиреоз является перманентным состоянием, измерение уровня ПТГ в сыворотке крови вполне оправдано и полезно как для ветеринара, так и для владельца животного (Torrance, 1998). Понятно, что в первую очередь необходима дифференциальная диагностика гипокальциемии от лабораторных ошибок, гипоальбуминемии, паратиреоидэктомии, применения фосфатной клизмы, острой и хронической почечной недостаточности, эклампсии, нарушения всасывания в кишечнике и тяжелого панкреатита. Ветеринар обычно идентифицирует эти явления и расстройства, не прибегая к таким сложным анализам, как измерение концентрации ПТГ. В то же время, практикующие ветеринарные врачи постоянно сталкиваются с трудными случаями диагностики клинического состояния собак и кошек.
Обзор ранних публикаций показывает, что у некоторых собак с гипокальциемией концентрация
804 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
ПТГ соответствовала диагнозу первичного гипопаратиреоза, т.е. находилась на нижней границе нормы или была еще ниже (Kornegay et al, 1980; Sherding et al, 1980; Feldman, Krutzik, 1981). У одной собаки концентрация ПТГ была повышена, что предполагало секрецию биологически неактивного гормона или резистентность тканей к его действию (см. раздел «Дифференциальная диагностика гипокальциемии») (Kornegay et al, 1980). Еще у одной особи была обнаружена гипомагниемия, но определение ПТГ не проводилось (собака N 4 в табл. 17-4). Следует отметить, что в перечисленных исследованиях использовались аналитические методы, которые в настоящее время считаются недостоверными. С тех пор появились новые сообщения, авторы которых применяли современные способы («сэндвич-методы») для определения интактного ПТГ у собак и кошек, которые дают прекрасные результаты (Torrance, Nachreiner, 1989; Flanders, Reimers, 1991; Flanders et al, 1991; Barber et al, 1993; Chew et al, 1995).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ЭПИЗОДИЧЕСКОЙ СЛАБОСТИ
Тот факт, что клинические симптомы гипокальциемии проявляются эпизодически в форме приступов, говорит о большом разнообразии причин наблюдаемых рецидивов нервных и нерно-мышечных расстройств (гл. 14 содержит раздел, посвященный эпизодической слабости, поскольку гипогликемия вызывает похожее состояние). У нескольких собак нашей группы сначала предполагалась идиопатическая эпилепсия. Нередко возникало подозрение на интоксикацию (например, стрихнином, метальдегидом или свинцом). Предварительный диагноз по результатам первичного обследования собак с гипокальциемией включал также столбняк, травму, сердечное заболевание, злокачественную миастению, заболевание печени и гипогликемию.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОКАЛЬЦИЕМИИ (ТАБЛ. 17-6, РИС. 17-7)
Гипокальциемия, обусловленная недостаточностью функции паращитовидных желез
Первичный гипопаратиреоз: Причины
Спонтанное заболевание у собак и кошек. У собак и кошек гипопаратиреоз редко возникает спонтанно. В этих случаях тяжелые симптомы заболевания (тетания, судороги) обычно проявляются внезапно. Но неожиданными они являются только для владельцев животных. На самом деле болезнь длительное время развивалась в скрытой форме на фоне слабой гипокальциемии. Удивительно, но собаки и кошки со спонтанным симптоматичным гипопаратиреозом в течение нескольких месяцев до
ТАБЛИЦА 17-6. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ГИПОКАЛЬЦИЕМИИ
Гипокальциемия, обусловленная недостаточностью функции паращитовидных желез
Первичный гипопаратиреоз
Повреждение желез
Аутоиммунные процессы
Ятрогенный гипопаратиреоз: послеоперационное осложнение
Любое заболевание в шейной области, затрагивающее паращитовидные железы
Острая коррекция хронической гиперкальциемии Идиопатическая атрофия (аутоиммунный процесс?)
Псевдогипопаратиреоз
Хроническая почечная недостаточность
Г ипоальбу минемия Острый панкреатит Пуэрперальная тетания (эклампсия) Синдром малабсорбции
Алиментарный вторичный гиперпаратиреоз (редко) Противосудорожная терапия
Острая почечная недостаточность Интоксикация этиленгликолем Фосфатная клизма
Г ипомагниемия
Другие факторы
Лабораторная ошибка
Введение бикарбоната
Инфузия фосфатов
Использование проб крови, коагулированных ЭДТА Недостаточность витамина Д
Переливание крови, содержащей цитраты
Травма мягких тканей
Медуллярная карцинома щитовидной железы
Первичные и метастазирующие костные опухоли Химиотерапия рака
установления диагноза выживают без какой-либо терапии (в нашей группе одна особь жила в таких условиях более года).
Это показывает, что собаки и кошки способны «адаптироваться» к гипокальциемии. Заболевание обычно не распознается, пока концентрация общего кальция в сыворотке крови не опустится ниже 6,0-6,5 мг/100 мл (?). После этого даже ее относительно небольшое дальнейшее уменьшение приводит к появлению соответствующих клинических признаков. Так, например, снижение концентрации кальция в сыворотках собак и кошек на 0,3 мг/100 мл при ее базальной величине 10,5 мг/100 мл не оказывает никакого эффекта, и концентрация считается нормальной. В то же время, такое же понижение при уровне кальция 6,1 мг/100 мл может вызвать судороги.
Диффузный лимфоцитарный «паратиреоидит» описан у 7 собак с гипопаратиреозом (Kornegay, 1982). В обследованной нами группе было еще 10 собак со сходными гистологическими данными (см. табл. 17-4); у нескольких из них паращитовидная ткань была замещена фиброзной соединительной тканью. Мы считаем, что фиброзная ткань является «конечным результатом» лимфоцитарно-го/плазмацитарного воспаления, и обнаружение воспалительных инфильтратов или рубцовой тка-
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
805
Рис. 17-7. Алгоритм диагностики различных причин гипокальциемии.
ни зависит, скорее всего, от того, на какой стадии заболевания получен биопсийный материал. Обнаружение антител к паращитовидной ткани у людей с идиопатическим гипопаратиреозом привело к пониманию, что у многих таких больных имеет место аутоиммунное расстройство. Возможно, что иммунные механизмы лежат и в основе гипопаратиреоза у собак и кошек.
Редкие заболевания человека, не обнаруженные у собак и кошек. Синдром Ди Георге у человека состоит в отсутствии паращитовидных желез и аплазии тимуса (Rasmussen, 1981; Marx, 2000). Причиной его, по всей вероятности, является нарушение развития третьего глоточного кармана в процессе эмбриогенеза. Агенезия паращитовидных желез описана также у собак (Meuten, Armstrong, 1989). Другая форма идиопатического гипопаратиреоза у человека связана с аутоиммунным эндокринным синдромом, который включает угнетение функции коры надпочечников, дисфункцию яичников, злокачественное малокровие, тиреоидит, сахарный диабет, кандидоз и иногда нарушение всасывания в кишечнике (см. гл. 8). Это семейное
заболевание. При рецессивном наследовании сцепленного с Х-хромосомой дефекта он проявляется до шестимесячного возраста. У лиц, заболевающих в более старшем возрасте, имеет место аутосомнорецессивное наследование (Arnaud, 1994). Были идентифицированы также мутации рецепторов-анализаторов кальция (Pearce et al, 1996).
Заболевания, индуцированные хирургической операцией. Самой частой причиной первичного гипопаратиреоза у собак, кошек и человека является хирургическое удаление паращитовидных желез или их повреждение (непосредственное или опосредованное через нарушение кровоснабжения) (Marx, 2000). Гипопаратиреоз может возникнуть после хирургической операции на щитовидной и паращитовидных железах или других органах шейного отдела. Тиреоидэктомия весьма широко практикуется как у кошек, так и собак, потому что у первых высока частота гипертиреоза, а у вторых опухоли щитовидной железы нередко имеют злокачественную природу.
Было установлено, что почти у 10% гипертиреоидных кошек после хирургической операции
806 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
развивается преходящий или постоянный гипопаратиреоз (Peterson, 1986). После двусторонней тиреоидэктомии 41 кошки послеоперационная гипокальциемия (не всегда сопровождавшаяся клиническими проявлениями) имела место у 82% и 36% животных, перенесших соответственно экстракапсулярную и интракапсулярную операцию, и у 11% после двух последовательных операций с интервалом 3-4 недели (Flanders et al, 1987). Среди 106 кошек, описанных в одном из последующих сообщений, послеоперационная гипокальциемия развилась соответственно у 22%, 33% и 23% особей в зависимости от использовавшегося хирургического метода (Welches et al, 1989). Клинические проявления гипокальциемии отмечались только при очень тяжелой степени этого расстройства (концентрация кальция <7,0 мг/100 мл). Хотя в настоящее время частота хронического гипопаратиреоза значительно снизилась благодаря совершенствованию хирургической техники и большей осведомленности хирургов об этом осложнении, тем не менее, хирургическое вмешательство остается наиболее частой причиной гипопаратиреоза у собак и кошек (Henderson et al, 1992; Flanders, 1994; Graves, 1995; Klein et al, 1995). В связи с этим проводились исследования эффективности аутотрансплантации удаленной паращитовидной ткани. Такой подход с успехом применялся у человека и имеет хорошие перспективы для внедрения в ветеринарную практику (Padgett et al., 1998).
Природа преходящего послеоперационного гипопаратиреоза у кошек до сих пор не выяснена. В одной группе кошек тиреопаратиреоидэктомия приводила к значительному снижению концентрации ПТГ в сыворотке крови, которая не восстанавливалась спустя 12 недель после операции, но концентрация кальция постепенно возрастала. Было предположено, что повышение концентрации кальция у этих животных было обусловлено «приспособлением» системы регуляции кальция, которая в отсутствие ПТГ функционирует на субоптимальном уровне. Одним из примеров такого «приспособления» является изменение обмена витамина Д, обеспечивающее всасывание кальция в кишечнике, несмотря на дефицит ПТГ (Flanders et al, 1991). Биохимические или клинические признаки, свидетельствующие о недостаточности паращитовидной функции после операции на шее у собак и кошек, проявляются через несколько дней или недель после операции. Другими вероятными, хотя и редкими, причинами деструктивных изменений в паращитовидных железах являются травма шеи, опухоль в шейной области, облучение щитовидной железы и интоксикация аминогликозидами. Мы не наблюдали поражения паращитовидных желез под воздействием 131-йода.
Псевдогипопаратиреоз. Псевдогипопаратиреоз у человека представляет собой редкое семейное за
болевание, характеризующееся резистентностью тканей-мишеней к ПТГ. У таких больных развивается гипокальциемия, повышается концентрация ПТГ в сыворотке крови и имеются разнообразные врожденные пороки развития и скелетные аномалии. Увеличение концентрации ПТГ является нормальной физиологической реакцией на гипокальциемию. Если при вливании ПТГ концентрация кальция временно нормализуется, концентрация ПТГ в крови уменьшается. Поэтому диагноз резистентности органов-мишеней ставится на основании, во-первых, неспособности ПТГ усиливать экскрецию цАМФ и, во-вторых, повышения концентрации ПТГ в крови. Секретируемый у больных гормон, по-видимому, имеет нормальную структуру. Некоторые из них не имеют пороков развития (Arnaud, 1994). Недостаточность чувствительного к ПТГ цАМФ в почках служит причиной резистентности почечных канальцев к ПТГ и приводит к уменьшению фосфатурии. К числу других факторов, индуцирующих псевдогипопаратиреоз, относятся дефицит активного витамина Д и/или костного цАМФ.
У собак это специфическое заболевание не известно, если не считать одной особи, у которой явный гипопаратиреоз сочетался с повышенными концентрациями ПТГ в сыворотке и цАМФ в моче и плазме крови (Kornegay et al, 1980). Другая собака имела гипопаратиреоз и синдром Фанкони, который, по мнению автора, был обусловлен дефицитом 1,25-витамина Д (Freeman et al, 1994).
Ложный псевдогипопаратиреоз. У людей с этой патологией имеются характерные пороки развития (включая аномалии роста и формирования скелета), которые встречаются и при обычном псевдогипопаратиреозе. Однако у таких больных концентрации кальция, фосфатов и ПТГ в сыворотке крови находятся в норме (Marx, 2000). Этот синдром не обнаружен ни у собак, ни у и кошек.
Гипомагниемия. Недостаточность магния может приводить к гипокальциемии. Гипомагниемия и гипокальциемия как взаимосвязанные, но независимые синдромы до сих пор не описаны у собак и кошек. Имеется, однако, сообщение о собаках с вторичным гипопаратиреозом, обусловленным гипомагниемией, на фоне белок-теряющей энтеропатии и эклампсии (Aroch et al, 1999; Kimmel et al, 2000; Bush et al, 2001). Как следует из табл. 17-4, у четырех собак обследованной нами группы первичный гипопаратиреоз сочетался с гипомагниемией. Клиническая значимость этих состояний остается неясной.
Хроническая почечная недостаточность
Хроническая почечная недостаточность (ХПН) - весьма распространенное заболевание собак и кошек. Биохимически она обычно проявляется увеличением концентрации фосфора в сыворотке крови на фоне нормальной концентрации кальция. Тем не
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 807
менее, у отдельных животных с недостаточностью функции почек может развиться как гипокальциемия, так и гиперкальциемия. Поскольку ХГШ является очень частым заболеванием, то она служит и наиболее частой причиной гипокальциемии у собак и кошек. Прямым следствием нарушения почечной функции являются такие клинические симптомы, как рвота, снижение аппетита и потеря веса; вторично развивается костное заболевание. Концентрация общего кальция у 10° о собак с ХПН составляет 8,0 мг/100 мл или менее, а концентрация ионизированного кальция у 40% таких животных ниже нормы. Гипокальциемия, отмечаемая у 15° о кошек с ХПН, считается биохимической аномалией и редко (если вообще) имеет клиническое значение. Тяжесть ее невелика (концентрация кальция остается выше 8,0 мг/100 мл), а сопутствующий ХПН метаболический ацидоз обычно ассоциируется с повышенной концентрацией ионизированного кальция, что еще больше снижает риск тетании.
Уменьшение количества функционирующих нефронов на ранних стадиях прогрессирующей ХПН служит причиной пониженной почечной экскреции фосфора. Временная гиперфосфатемия индуцирует гипокальциемию, что приводит к стимуляции биосинтеза и секреции ПТГ. Таков классический механизм почечного вторичного гиперпаратиреоза (рис. 17-8, см. рис. 16-10). Почечный вторичный гиперпаратиреоз может приводит к ос-теоцитному остеолизу скелета, который способствует восстановлению нормальной концентрации кальция и фосфора в крови. Кроме того, гиперпаратиреоз усиливает экскрецию фосфора. Однако по мере прогрессирования ХПН вторичный гиперпаратиреоз больше не может компенсировать биохимические нарушения, вследствие чего развивается гиперфосфатемия в сочетании с гипокальциемией или без нее (Chew, Nagode, 1990). В нормальных почках неактивный витамин Д превращается в активную форму. С увеличением тяжести почечной патологии способность генерировать активный витамин Д уменьшается; одновременно понижается всасывание кальция в кишечнике и возрастает вероятность гипокальциемии. Усиливающееся выведение кальция с мочой в состоянии уремии еще более способствует развитию гипокальциемии при хронической почечной недостаточности.
Гипоальбуминемия. В ветеринарной практике с уменьшением концентраций общего белка и/или альбумина в сыворотке крови приходится сталкиваться при многих заболеваниях. Их далеко не полный перечень включает гепатопатии, гломерулопатии, синдромы малабсорбции (в частности, лимфангиэктазию) и потери крови. Как упоминалось выше, снижение уровня альбумина сопровождается уменьшением фракции связанного с белком кальция, хотя концентрация ионизированного кальция обычно остается нормальной. Во всех случаях эти изменения редко вызывают клинически значимые проявления у животных.
Прогрессирующее разрушение нефронов
Уменьшение образования
Усиление задержки в сыворотке
Усиление задержки фосфора
Снижение концентрации Са в сыворотке
I
Паращитовидные железы
I
Усиление биосинтеза и секреции ПТГ
Рис. 17-8. Патогенез гиперплазии паращитови цтых желез во время прогрессивного разрушения нефронов.
Острый панкреатит. Гипокальциемия у собак с острым панкреатитом в большинстве случаев протекает на слабом субклиническом уровне. Обычно сопутствующий панкреатиту ацидоз вызывает увеличение ионизированной фракции общего кальция и еще больше снижает вероятность характерных для гипокальциемии клинических проявлений (Hess et al, 1998). У кошек с панкреатитом гипокальциемия, возможно, развивается чаще, чем у собак. Как показывают результаты одного из исследований, для кошек с острым панкреатитом типично уменьшение концентрации общего и ионизированного кальция в крови соответственно на 41 и 61° о по сравнению с нормой. Более того, прогноз для кошек с низкой концентрацией ионизированного кальция, даже в отсутствие связанной с этим расстройством клинической симптоматики, менее благоприятен, чем в случае животных с его нормальной концентрацией. При сочетании острого панкреатита и очень низкой концентрации ионизированного кальция (менее 1.0 ммоль/л) прогноз крайне неблагоприятен, и для спасения животного необходима агрессивная терапия (Kimmel et al, 2001).
Согласно традиционной теории развития гипокальциемии при панкреатите кальций осаждается в форме нерастворимого мыла в процессе сапонифи-кации перипанкреатических жирных кислот, кою-рые образуются после секреции панкреатической липазы. Этот механизм общепризнан, однако, до
808 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
сих пор неясно, достаточен ли он для исчерпывающего объяснения гипокальциемии, поскольку из скелетных тканей потенциально может высвобождаться большое количество кальция. К числу других факторов, способствующих возникновению гипокальциемии, относятся гипомагниемия, пониженная секреция ПТГ, гипопротеинемия и стимулируемая глюкагоном секреция кальцитонина.
Диагноз панкреатит полностью подтвердить невозможно. Абсолютно надежных тестов не существует, и у собак этот диагноз обычно базируется на принадлежности животных к той или иной группе (старые и ожирелые особи, мелкие породы и самки), на типичной клинической симптоматике (рвота, анорексия, боли в животе) или на результатах клинического обследования (концентрация липазы в сыворотке крови, УЗИ). У таких собак отсутствует тяжелая гипокальциемия, а клинические проявления отражают расстройства со стороны желудочно-кишечного тракта в отсутствие выраженных нервно-мышечных симптомов, характерных для тяжелой гипокальциемии и гипопаратиреоза. Типичными клиническими проявлениями панкреатита у кошек являются анорексия, вялость, рвота, боли в животе и желтуха. Результаты УЗИ, подтверждающие наличие острого панкреатита у кошек, включают гипоэхогенную структуру паренхимальной ткани поджелудочной железы и гиперэхогенность перипанкреатической брыжеечной ткани (Kimmel et al, 2001).
Пуэрперальная тетания (эклампсия)
Эклампсия представляет собой острое, угрожающее жизни состояние, обусловленное тяжелой гипокальциемией у собак и кошек накануне родов и во время лактации (Fascetti, Hickman, 1999; Drobatz, Casey, 2000). В большинстве проведенных исследований у кошек и собак с эклампсией была выявлена тяжелая гипокальциемия (< 6,5 мг/100 мл). Эклампсия чаще всего встречается у мелких собак и реже у кошек и крупных собак. Признаки эклампсии, выявляемые во время ветеринарного обследования, зависят от того, насколько быстро владелец животного осознал проблему и обратился за профессиональной помощью. В большинстве случаев эклампсия развивается в течение 21 дня после начала кормления щенков, хотя описаны случаи этого заболевания в последние 2 недели беременности и спустя 45 дней после родов (см. гл. 21).
Физиологические механизмы эклампсии до конца не исследованы. Обычно она возникает с началом лактации и приводит к значительным потерям кальция, уменьшению его потребления с кормом (некоторые самки не могут есть или теряют аппетит в результате стрессорного эффекта вскармливания щенков) и, в конечном итоге, к гипокальциемии. К числу других факторов, способствующих развитию гипокальциемии, относятся атрофия паращитовидных желез, вызванная недостаточным содержанием
кальция в корме, а также его интенсивной утилизацией в процессе формирования скелета плодов. В одном из исследований у 44% собак эклампсия была обусловлена гипомагниемией. Уменьшение отношения концентраций магнй: кальций в нейромышечных синапсах может привести к тетании. Было высказано предположение, что состояние собак с эклампсией можно улучшить с помощью заместительной терапии магнием (Aroch et al., 1999).
Независимо от патофизиологического механизма эклампсии сопутствующая ей тяжелая гипокальциемия вызывает характерные клинические симптомы, обусловленные изменением мембранного потенциала клеток, спонтанными разрядами нервных волокон и индукцией тонических или тонико-клонических сокращений скелетных мышц. Скорость падения концентрации кальция в сыворотке крови и ее конечная величина влияют на начало проявлений тетании. Любое воздействие, вызывающее увеличение связанной с белком фракции кальция, способствует развитию тетании. К числу таких факторов относится, например, системный алкалоз, вызванный гипервентиляцией во время затрудненных родов. Другим потенциальным осложнением эклампсии является гипогликемия, внешние проявления которой сходны с таковыми при гипокальциемии (см. гл. 14).
Диагностика эклампсии чаще всего основывается на характере нервно-мышечной симптоматики у лактирующих собак и кошек. В большинстве случаев диагноз настолько очевиден, что нет необходимости определять концентрацию кальция в сыворотке. У трех из четырех описанных кошек с предродовой эклампсией была установлена гипотермия, а клинические симптомы включали вялый паралич вместо более типичных тонико-клонических фасцикулярных подергиваний мышц, наблюдающихся у собак (Fascetti, Hickman, 1999).
Синдром малабсорбции
Нарушенное всасывание в кишечнике - обычная причина гипокальциемии у человека (Rasmussen, 1981), но очень редко приводит к снижению уровня кальция у собак, у которых гипокальциемия обычно является следствием гипоальбуминемии. Ключевую роль в патогенезе гипокальциемии играют два фактора, причем их относительное значение зависит от природы основного заболевания. Первый фактор - это усиление экскреции кальция с калом вследствие пониженного связывания поступающего с пищей кальция в кишечнике. Это расстройство дополняется уменьшением резорбции эндогенного кальция, секретируемого в желудочно-кишечный тракт при таких заболеваниях, как лимфангиэктазия. Тяжесть нарушения всасывания коррелирует с тяжестью заболевания тонкого кишечника. Второй фактор состоит в слабом всасывании витамина Д при заболеваниях, сопровождающихся диффузным поражением тонкого кишечника.
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 809
Гипомагниемия также может играть важную роль в развитии гипокальциемии у людей и собак с синдромом малабсорбции. Результаты двух исследований показали, что гипомагниемия и гипокальциемия, возможно, имеют общие патогенетические механизмы, связанные со слабым всасыванием, потерями химических элементов через желудочно-кишечный тракт и нарушениями обмена витамина Д и ПТГ. Заместительное введение магния приводит к нормализации концентрации магния и ПТГ и повышению концентрации ионизированного кальция в сыворотке и ослабляет клинические проявления пареза (Kimmel et al, 2000; Bush et al, 2001).
Алиментарный вторичный гиперпаратиреоз
У собак и кошек, которых кормят только продуктами с низким отношением содержания кальция и фосфора, как, например, говяжье сердце и печень, может развиться тяжелая минеральная недостаточность. Низкое содержание кальция в корме приводит к временному уменьшению его концентрации в крови. Это, в свою очередь, усиливает секрецию ПТГ и вызывает уменьшение массы костной ткани, поскольку содержащийся в ней кальций расходуется на компенсацию недостаточного поступления этого элемента с кормом. Одновременно развиваются диффузные нарушения в скелете, сопровождающиеся болями в костях и патологическими переломами. Заболевания скелета являются следствием процессов, направленных на поддержание гомеостаза минеральных веществ в крови, и обычно у таких животных сохраняется нормальная концентрация кальция и фосфора в сыворотке крови. В то же время у некоторых кошек отмечается слабая до тяжелой гипокальциемия (Tomsa et al, 1999). Лечение состоит в подборе сбалансированного пищевого рациона и уменьшении физических нагрузок до завершения регенеративных процессов в скелете. Диагностика основывается на характере скелетных аномалий у собак и кошек в условиях неправильного кормления. Типичным анамнестическим признаком у таких животных служат нервно-мышечные расстройства (тетания).
Острая почечная недостаточность и интоксикация этиленгликолем
Острая почечная недостаточность, например, при отравлении полиэтиленгликолем, или нарушения на постренальном уровне, как при непроходимости мочеиспускательного канала, могут приводить к неожиданному и весьма значительному падению концентрации фосфора и вторичному уменьшению уровня кальция в сыворотке крови. Гипокальциемия при острой недостаточности почечной функции может быть очень тяжелой, потому что быстрое начало этого расстройства сопровождается нарушением соответствующих компенсаторных механизмов. У собак с острой почечной недостаточностью
средняя концентрация общего кальция составляет 9,8 мг/100 мл (Vaden et al, 1997). Интоксикация этиленгликолем приводит к тяжелой почечной недостаточности, ацидозу и смерти. Продукты превращения этого токсина являются хелаторами ионов сывороточного кальция и вызывают тетанию. Острая недостаточность почечной функции, также как обусловленные ею изменения концентраций AM и креатинина в сыворотке крови, легко отличимы от первичного гипопаратиреоза.
Непроходимость мочеиспускательного канала
Продолжительная (более 12 до 24 часов) непроходимость мочеиспускательного канала и тяжелая гиперфосфатемия у котов зачастую сопровождается гипокальциемей, гиперкалиемией, азотемией и нередко судорогами (Chew, Meuten, 1983). При первом обследовании котов с непроходимостью мочеиспускательного канала определение концентрации общего кальция в сыворотке крови выявило гипокальциемию у 26% особей, а концентрация ионизированного кальция была снижена у 75%. У 37,5% этих животных имела место слабая, у 25% умеренная и у 12,5% тяжелая гипокальциемия. Тяжелая форма этого расстройства может привести к нарушению сердечной функции. Хотя результаты внутривенной инфузии кальция не подвергались точной оценке, имеются данные о целесообразности его введения котам с непроходимостью мочеиспускательного канала (Drobatz, Hughes, 1997).
Фосфатная клизма
Кишечное всасывание растворов коммерческих фосфатных клизм может вызывать острую и тяжелую гиперфосфатемию, особенно если они вводятся сильно обезвоженным кошкам с атонией ободочной кишки и повреждениями ее слизистой оболочки. Всасывание содержащихся в этих растворах натрия и фосфора, также как выход внутрисосудистой воды в полость толстого кишечника (из-за гипертоничности раствора), служит причиной гипернатриемии и гиперфосфатемии. Острое повышение концентрации фосфатов индуцирует значительное снижение уровня кальция в сыворотке (Atkins et al, 1985; Jorgensen et al, 1985). В связи с этим не рекомендуется использовать фосфатные клизмы при лечении животных с тяжелыми запорами, маргинальным состоянием функции почек или нарушенным отношением концентраций кальция и фосфора. Все такие кошки предрасположены к гиперфосфатемии. Клинические признаки токсикозов, обусловленных применением фосфатных клизм (шок или повышенная нервно-мышечная раздражимость), являются следствием гипокальциемии и гипернатриемии. Для их устранения необходимо увеличение объема плазмы и введение кальция. Диагноз ставится на основании анамнестических данных (Peterson, 1992).
810 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
Другие причины
Лабораторные ошибки. Вероятно, самой распространенной причиной из категории «прочие» являются ошибки при проведении лабораторных исследований. Неправильный результат определения кальция в сыворотке может быть следствием ошибки или артефакта при сборе проб крови в пробирки, содержащие ЭДТА в качестве антикоагулянта, потому что ЭДТА является хелатором кальция. Присутствие в сыворотке воздуха значительно уменьшает концентрацию в ней ионизированного кальция. Свежеполученные пробы плазмы для определения кальция необходимо транспортировать в аналитическую лабораторию в соответствующей упаковке и в охлажденном виде. Если проведение анализа задерживается более чем на 3 дня, пробы следует заморозить (Schenck et al, 1995). Следует с большой осторожностью интерпретировать результаты измерения концентрации ионизированного кальция с помощью портативных автоматических анализаторов, потому что у собак и кошек они обычно получаются ниже, чем при использовании стандартных методов (Grosenbaugh et al, 1998). Во всех случаях, когда концентрация кальция слишком высока или слишком низка, следует провести повторный анализ.
Противосудорожная терапия. У больных людей, длительное время получающих противосудорожные лекарственные средства (в первую очередь, фенобарбитал и фенитоин), имеется тенденция к развитию гипокальциемии, гипофосфатемии и изменению активности щелочной фосфатазы в сыворотке крови. У таких пациентов развивается состояние, сходное с недостаточностью витамина Д. Исследование костных биоптатов и рентгенографических снимков выявляет размягчение костной ткани в отсутствие признаков нарушенного всасывания кальция или почечного заболевания. Концентрация ПТГ повышается, однако, сохраняется нормальный ответ гормона (понижение секреции) на инфузию кальция. Тяжесть изменений кальциевого обмена напрямую зависит от дозы медикаментозной терапии (Amoud, 1994).
Хотя в ветеринарной практике не приходится сталкиваться с подобной проблемой, она обсуждается здесь, дабы лишний раз напомнить, что любое лекарственное средство может вызвать неожиданный эндокринный ответ. Кроме того, часть собак с гипопаратиреозом поступила в нашу клинику из-за резистентности к противосудорожной терапии. Обнаружение гипокальциемии у собак, получающих относительно высокие дозы противосудорожных препаратов, может быть ошибочно истолковано как ятрогенное расстройство.
Гипертиреоз у кошек. У кошек с нелеченым гипертиреозом концентрация ионизированного кальция в сыворотке гораздо ниже, чем у здоровых животных, хотя только у 4 из 15 обследованных особей она была меньше нижней границы нормы.
Концентрация общего кальция во всех случаях оставалась нормальной, а концентрация ПТГ была значительно увеличена. Эти изменения, по всей вероятности, связаны с гиперфосфатемией, которая часто наблюдается у гипертиреоидных кошек. Клиническое значение этих изменений неизвестно (Barber, Elliott, 1996).
Недостаточность витамина Д. Недостаточность витамина Д - маловероятная причина клинически выраженной гипокальциемии (Henik et al. 1999).
Повышенная концентрация цитратов. Используемая для переливания кровь, в которую в качестве антикоагулянта добавлена соль лимонной кислоты, может индуцировать гипокальциемию, особенно когда объем донорской крови невелик по сравнению с количеством антикоагулянта.
Травма. Имеются сообщения о гипокальциемии, вызванной травмой, особенно травмой мягких тканей (Chew, Meuten, 1983), однако такие случаи редки.
Медуллярная карцинома. Сообщалось о тяжелой гипокальциемии и тетании, вызванной медуллярной карциномой щитовидной железы у одной собаки. У людей такие опухоли редко служат причиной аномально пониженной концентрации кальция в крови.
Первичные и метастазирующие костные опухоли. В ветеринарии мелких животных первичные и метастазирующие опухоли встречаются довольно часто. У людей, собак и кошек с метастазирующими в кости опухолями концентрация кальция в сыворотке крови обычно остается в норме. Наиболее частым следствием нарушений кальциевого обмена, вызванных метастазирующей опухолью, является гиперкальциемия. В то же время у некоторых людей развиваются гипокальциемия и гипофосфатемия. При наличии у человека остеобластических метастазов простое включение кальция в пораженную ткань может оказаться достаточным для индукции заметной гипокальциемии и даже ее клинических проявлений. У собак и кошек такое явление не наблюдалось.
Химиотерапия. Сидром опухолевого лизиса встречается при остром высвобождении внутриклеточного содержимого под воздействием химиотерапии высокочувствительных опухолей, таких как опухоли лимфоидных тканей и костного мозга (Persons et al, 1998). Среди множественных обменных расстройств, сопровождающих этот процесс, выделяется гипокальциемия, которая развивается в ходе взаимодействий по закону действующих масс, обусловленных острой и тяжелой гиперфосфатемией (Calia et al, 1996; Piek, Teske, 1996). В дополнение к гипокальциемии может возникнуть временная недостаточность ПТГ (Hom, Irwin, 2000). Преходящая гипокальциемия иногда сопутствует также сепсису и тяжелым воспалительным заболеваниям. У одной кошки, отравившейся салицилатом, была диагностирована гипокальциемия, обусловленная терапией бикарбонатом натрия (Abrams, 1987).
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 811
ЛЕЧЕНИЕ ГИПОПАРАТИРЕОЗА И ГИПОКАЛЬЦИЕМИИ
Общие подходы
Эклампсия (пуэрперальная тетания) представляет собой классическое гипокальциемическое состояние, при котором необходима срочная специфическая коррекция недостаточности кальция без последующей хронической терапии. Этим она отличается от гипопаратиреоза, который имеет устойчивый характер и требует как острого, так и хронического лечения для купирования или профилактики его клинических проявлений. Животным с гипокальциемией, обусловленной исключительно гипоаль-буминемией, при условии нормальной концентрации ионизированного кальция в крови терапия не показана.
Терапию гипокальциемии всегда планируют и проводят с учетом индивидуальных потребностей собаки или кошки. Характер лечения определяется тяжестью заболевания и скоростью снижения концентрации кальция, при этом принимают во внимание особенности динамики кальциемии, которая может быть стабильной, флуктуировать или быстро уменьшаться. При наличии у собаки или кошки выраженной клинической симптоматики показана агрессивная терапия; то же относится к животным со значительно пониженной концентрацией общего или ионизированного кальция и к другим случаям ожидаемой тяжелой гипокальциемии. Примером такой терапии является лечение животных после устранения первичного гиперпаратиреоза, у которых концентрация общего кальция превышала 14,5-15 мг/100 мл. Все рассуждения о том, что ветеринар должен воздерживаться от назначения терапии гипокальциемии до тех пор, пока не проявятся ее клинические симптомы, не имеют разумных оснований. В лучшем случае такой подход обрекает животное на сильнейшие боли, а в худшем - создает угрожающее жизни состояние.
Цель терапии (весьма трудно достижимая) состоит в плавном повышении концентрации кальция в сыворотке крови выше пороговой величины, которая ассоциируется с началом клинической симптоматики гипокальциемии. Такой величиной является концентрация общего кальция 6,0-7,0 мг/100 мл и концентрация ионизированного кальция в плазме крови 0,6-0,7 ммоль/л, хотя возможны ее значительные индивидуальные колебания. Клинические симптомы обычно улучшаются уже при небольшом повышении концентрации кальция. В большинстве случаев нет необходимости добиваться нормального уровня кальциемии. Более того, направленные на это усилия повышают риск гиперкальциемии, сопутствующей ей гиперфосфатемии, минерализации тканей и образования камней. При ожидаемой или выраженной постоперационной гипокальциемии (в том числе преходящей, как у животных с первичным гиперпаратиреозом) идеальным с физиологи
ческой точки зрения следует считать сохранение концентрации кальция на уровне ниже нормального, поскольку это способствует восстановлению функциональной способности атрофированных паращитовидных желез.
Неотложная терапия при тетании
Неясный диагноз. При необходимости лечить страдающую судорогами собаку или кошку в отсутствие точного диагноза препаратом выбора для первоначальной терапии обычно является диазепам. Его применение дает очень хорошие результаты даже у животных с гипокальциемией. Если же такая терапия не дает эффекта или же точный диагноз все еще не установлен, берут пробы крови для определения концентраций глюкозы, кальция и любых других параметров, знание которых может помочь диагностике. Одновременно проводят внутривенное вливание глюкозы и/или кальция.
Гипокальциемическая тетания: Внутривенное введение кальция
Общие сведения. При гипокальциемической тетании необходимо срочно ввести кальций. С этой целью используют 10%-ный раствор кальция глюконата для медленного внутривенного вливания. Его вводят в дозах от 0,5 до 1,5 мл/кг или 5-15 мг/ кг на протяжении 10-30 минут. Кальция глюконат в форме 10%-ного раствора (табл. 17-7) рекомендуется потому, что он легко доступен всем ветеринарам. Но еще важнее то обстоятельство, что этот раствор гораздо менее едок, чем раствор хлористого кальция, что весьма существенно в случае выхода жидкости из сосудов. Инфузию следует проводить под контролем ЭКГ. Если при наличии брадикардии выявляются преждевременные желудочковые комплексы и/или укороченные интервалы Q-T, то следует замедлить скорость внутривенной инфузии или прекратить ее (Peterson, 1992). Такая неотложная терапия неизменно дает хороший эффект. Судороги обычно прекращаются уже через несколько минут после начала инфузии кальция. В то же время, его конечная доза, необходимая для устранения тетании, непредсказуема. Кроме того, некоторые клинические симптомы исчезают не сразу. Так, например, нервозность, затрудненное дыхание и изменения поведения могут сохраняться на протяжении еще 30-60 минут после достижения эукальциемии, возможно, вследствие задержки установления равновесия между концентрациями кальция в крови и спинномозговой жидкости. Следует иметь в виду, что рекомендуемые дозы для введения кальция являются ориентировочными, так как общий объем инфузии диктуется реакцией на нее данной особи.
Содержание кальция в различных препаратах его солей сильно варьирует. Так, например, 10%-ные растворы кальция глюконата и хлорида выпускаются в ампулах одинаковым объемом 10 мл, каждая
812 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
ТАБЛИЦА 17-7. НЕКОТОРЫЕ ИМЕЮЩИЕСЯ ПРЕПАРАТЫ КАЛЬЦИЯ
Имеющиеся препараты Примерное содержание кальция Доза
Пероральные
Кальция карбонат/глюконат Таблетки 700 мг 250 мг Са/таблетка Кошки: 0,5-1,0 г/день
Кальция глюконат Таблетки: 325 мг 500 мг 650 мг 1000 мг 30 мг Са/таблетка 45 мг Са/таблетка 60 мг Са/таблетка 90 мг Са/таблетка Собаки: 1,0-4,0 г/день
Кальция лактат Таблетки: 325 мг 650 мг 42 мг Са/таблетка 85 мг Са/таблетка
Кальция карбонат Таблетки: 500 мг 650 мг 145 мг Са + 155 мг Р/капсула 190 мг Са+ 148 мг Р/капсула
Кальция глубионат Для инъекций Таблетки: 650 мг 1000 мг Сироп: 360 мг/мл 190 мг Са + 148 мг Р/таблетка 295 мг Са + 228 мг Р/таблетка 20 мг/мл
Кальция глюконат (внутривенно и подкожно) 10% раствор, ампулы по 10 мл 9,3 мг Са/мл 1,0-1,5 мл/кг, 5-15 мг/кг медленно
Кальция хлорид (внутривенно) 10% раствор, ампулы по 10 мл 27,2 мг Са/мл Не рекомендуется
Кальция глуцепат (внутривенно, внутримышечно) (кальция глюкогептонат) 22% раствор, ампулы по 5 мл 18 мг Са/мл -
Са - кальций; Р - фосфат
из которых содержит по 1 г исходного соединения. Однако концентрация кальция в растворе хлорида составляет 27 мг на миллилитр, а в растворе глюконата - только 9 мг на миллилитр. При выборе дозы для внутривенного введения на основании содержания в растворе элементного кальция эффективность коррекции гипокальциемии разными растворами существенно не отличается. Иными словами, доза кальция в миллиграммах должна быть одна и та же независимо от того, какой раствор используется для инфузии. Кальция хлорид, попавший вместо вены в окружающую ткань, вызывает не только ее гибель или образование струпа, но и тяжелый кожный кальциноз (Schick et al, 1987). По нашему мнению, растворы кальция хлорида вообще не должны храниться в ветеринарных лечебницах, где лечат мелких животных, чтобы исключить любую возможность его применения.
Следует с большой осторожностью производить внутривенное вливание обогащенных кальцием растворов собакам и кошкам с гиперфосфатемией, которая очень часто сопутствует гипокальциемии в силу закона действующих масс. Поэтому, несмотря на известный риск, увеличение концентрации кальция в крови должно сопровождаться понижением уровня фосфатов. При почечной недостаточности введение кальция на фоне гиперфосфатемии может приводить к минерализации мягких тканей. Это еще больше усугубляет поражение почек с уже нарушенной функциональной активностью или другими заболеваниями (Chew, Meuten, 1983).
Повышенная температура. При тетании у собак и кошек нередко повышается температура, и ректальная температура может превышать 105° по Фаренгейту. У ветеринара может появиться соблазн
лечить одновременно и гипокальциемию и гипертермию, используя ледяную либо спиртовую ванну и/или лекарственные средства для парентерального введения. Однако при инфузии кальция повышенную температуру не следует снижать, но ее нужно контролировать. Обычно она сама нормализуется вскоре после устранения тетании. Дополнительные меры, направленные на понижение температуры, могут вызвать гипотермию и индуцировать шок. Недавно появилось сообщение о гипотермии у трех из четырех кошек с предродовой эклампсией (Fascetti, Hickman, 1999).
Подострая терапия гипокальциемии (поддерживающая терапия после тетании)
Проблема. После устранения тетании внутривенным введением кальция эффект инфузии сохраняется в течение 1-12 часов. Действие долгосрочной поддерживающей терапии посредством заместительного перорального введения кальция и витамина Д обычно проявляется не раньше чем через 24-96 часов после ее начала. В первое время после купирования тетании животные с гипокальциемией нуждаются в поддерживающем введении кальция.
Альтернативные подходы. Повторное струйное внутривенное введение.
Один из методов поддерживающей терапии гипокальциемии сразу после устранения тетании состоит в повторном струйном введении кальция. Однако это рекомендуется только в неотложных случаях, поскольку конечная концентрация кальция в крови может оказаться самой разной.
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 813
Подкожное введение кальция. После купирования тетании у собаки или кошки струйным внутривенным введением раствора кальция глюконата требуемый уровень кальциемии поддерживают подкожными инъекциями кальция. Это простая, эффективная и недорогая процедура, в отличие от дорогостоящей непрерывной внутривенной инфузии, которая к тому же обычно требует госпитализации животных. В качестве альтернативного подхода определяют дозу кальция глюконата, необходимую для изначального контроля тетании и вводят ее подкожно каждые 6-8 часов. В типичных случаях общая суточная доза кальция составляет 60-90 мг/кг. При этом используют раствор, содержащий 1 часть кальция глюконата на 2, 3 или 4 части физиологического раствора. У некоторых наших собак описанный способ позволял эффективно поддерживать концентрацию кальция в сыворотке крови на протяжении нескольких месяцев, не вызывая воспаления кожи или образования струпов.
Следует помнить, что подкожные инъекции кальция глюконата безопасны для животных, тогда как хлористый кальций не пригоден для подкожного введения. Известны два случая кожного кальциноза (один у собаки, другой у кошки) после подкожного введения кальция глюконата.
Однако у кошки кальциноз не был подтвержден гистологически, что ставит под сомнение правильность диагноза (Ruopp, 2001). А собаке инъекции производились не авторами статьи, а другими лицами, поэтому вполне возможно, что был использован не глюконат, а более едкое соединение кальция (Schaer et al, 2001). Нельзя также исключить, что введение кальция глюконата, как и любого другого лекарственного средства, само по себе может приводить к неожиданным осложнениям. Тем не менее, имеющийся у нас опыт свидетельствует о терапевтической эффективности подкожных инъекций этого препарата.
После того как нормальный или почти нормальный уровень кальциемии остается стабильным на протяжении 48 часов, интервал между подкожными инъекциями кальция продлевают с 6 до 8 часов. При сохранении того же уровня кальция в течение еще 48-72 часов переходят на двукратные в течение суток инъекции. В последующем продолжают постепенно уменьшать дозу вводимого кальция до полной его отмены. Разумеется, процесс снижения дозы кальция не всегда проходит гладко, поскольку реакция отдельных животных на терапию может быть разной. В идеале, концентрация общего кальция в сыворотке крови должна оставаться на уровне выше 8 мг/100 мл. При его концентрации ниже
8 мг/100 мл необходимо увеличить дозу и/или частоту парентерального введения кальция. При концентрации общего кальция 8-9 мг/100 мл следует сохранять используемую дозу терапии, а при ее увеличении до 9 мг/100 мл или выше дозу нужно снизить. Нередко сначала используют высокую дозу и/или частоту парентерального введения каль
ция, прежде чем уменьшить ее, а потом и отменить без ущерба для состояния животного. Такой подход эффективен при любом протоколе заместительной терапии кальцием.
Непрерывная внутривенная инфузия. До того как станет возможным контроль кальциемии пероральными средствами, проводят непрерывную внутривенную инфузию кальция в дозе 60-90 мг/ кг/ день или 2,5-75 мг/кг/час в пересчете на элементный кальций. Первоначальные высокие дозы используются при тяжелой гипокальциемии. Растворы для инфузии элементного кальция со скоростью 1, 2 или 3 мг/кг/час готовят добавлением соответственно 40, 80 или 120 мл 10%-ного кальция глюконата на 1 литр жидкости для внутривенного введения. Необходимо иметь в виду, что соли кальция осаждаются при внесении в растворы, содержащие лактат, ацетат, бикарбонат или фосфаты. Кроме того, следует избегать внутривенного введения растворов, содержащих натрия бикарбонат, поскольку повышение щелочной реакции вызывает уменьшение концентрации ионизированного кальция в крови и может провоцировать возникновение клинических симптомов гипокальциемии у собак и кошек с пограничными значениями концентрации кальция (Rosol et al, 2000).
Поддерживающая терапия
Отсутствие коммерческих препаратов ПТГ
Теоретически самым подходящим видом терапии гипопаратиреоза является физиологическое заместительное введение ПТГ. Однако практически это невозможно из-за отсутствия соответствующих коммерческих препаратов. В связи с этим, в качестве основного средства лечения гипопаратиреоза применяют витамин Д. К сожалению, недостаточность эндогенного ПТГ приводит к относительной недостаточности фермента, который преобразует неактивный витамин Д (25-гидроксивитамин Д) в его активную форму (1,25-дигидроксивитамин Д). Поэтому введение физиологических доз одного витамина Д не позволяет эффективно лечить гипопаратиреоз. В основе терапии этого расстройства лежит применение фармакологических доз витамина Д в комбинации с приемом внутрь препаратов кальция. В отсутствие адекватного мониторинга концентрации кальция в сыворотке крови возможны осложнения в форме рецидивов гипокальциемии или возникновения гиперкальциемии.
Витамин Д
Общие сведения. Поддерживающая терапия гипопаратиреоза состоит в заместительном пероральном введении витамина Д и кальция. Собаки и кошки с первичной спонтанной недостаточностью паращитовидных желез испытывают постоянную
814 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
ТАБЛИЦА 17-8. ПРЕПАРАТЫ ВИТАМИНА Д
Препарат Доза, лекформа Коммерческое название (изготовитель) Суточная доза Время до проявления максимального действия Время до прекращения интоксикации
Витамин Д2 (эрго- Капсулы: кальци ферол) 25000 ЕД 50000 ЕД Сироп для приема внутрь 8000 ЕД/мл Для внутримышечных инъекций 50000 ЕД/мл Кальциферол (Roier) Дрисдол (Winthrop-Breon) Делталлин (Lilly) Дрисдол (Winthrop-Breon) Кальциферол (Rorer) Витаде (Gotham) Начальная: 4000-6000 ЕД/кг/день Поддерживающая: 1000- 2000 ЕД/кг раз в день еженедельно 5-21 день 1-18 недель
Дигидротахи-сте- Таблетки: рол 0,125 мг 0,2 мг 0,4 мг Капсулы: 0,125 мг Раствор для приема внутрь: 0,25 мг/мл Дигидротахистерол (Philips-Roxane) Хитакерол (Winthrop- Breon) Хитакерол (Winthrop-Breon) Начальная: 0,02-0,03 мг/кг/день Поддерживающая: 0,01-0,02 мг/кг/день каждые 24-48 часов 1-7 дней 1-3 недели
Витамин Капсулы: Д3(кальцитриол) 0,25 мкг 0,5 мкг Витамин Д3 для инъекций: 1,0 мкг/мл Рокатрол (Roche) Кальциджекс (Abbott Laboratories) Приблизительная: 0,03-0,06 мкг/ кг/день Приблизительная: 0,02 мкг/кг/день 1-4 дня 24 часа- 2 недели 1-7 дней/неделя
потребность в заместительной терапии витамином Д. В то же время, необходимость введения препаратов кальция может постепенно уменьшаться и, в конце концов, сходить на нет, если потребность животного в этом элементе удовлетворяется его поступлением с кормом. Тем не менее, введение консервативных доз кальция полезно в том отношении, что они обеспечивают субстрат для витамина Д, который повышает концентрацию кальция в крови посредством стимуляции его всасывания в кишечнике. Ятрогенный гипопаратиреоз у собак и кошек после хирургической операции часто имеет преходящий характер и животные не всегда нуждаются в пожизненной терапии.
В отличие от лечения тетании, которая направлена на предотвращение рецидивов нервно-мышечной симптоматики, задача долгосрочной терапии состоит в поддержании концентрации кальция в сыворотке крови на нормальном или несколько более низком уровне (от 8,0 до 9,5 мг/100 мл). Такая концентрация кальция превышает пороговую величину, связанную с риском возникновения клинически выраженной гипокальциемии. Слабая гипокальциемия активирует функцию атрофированных
паращитовидных желез и в то же время недостаточна для индукции гиперкальциурии (т.е. риска образования камней) или тяжелых гиперкальциемии и гиперфосфатемии (риска нефрокальциноза и почечной недостаточности).
Витамин Д2 (эргокальциферол). Витамин Д2 - это широко доступное и относительно дешевое лекарственное средство (40000 ЕД/мг согласно Фармакопее США, табл. 17-8). Для нормализации уровня кальциемии сначала необходимо вводить большие дозы препарата. Для собак и кошек они составляют от 4000 до 6000 ЕД/кг один раз в день. Столь значительные дозы нужны для компенсации снижения биологической активности витамина Д2 в условиях гипопаратиреоза, а также чтобы насытить им жировые отложения. Последнее необходимо для проявления биологического действия витамина Д2, потому что он растворим в жирах. Парентеральное введение кальция обычно прекращают через 1-5 дней после начала терапии витамином Д2, эффект которого становится заметен через 5-14 дней после начала лечения.
Для проведения терапии витамином Д2 собак и кошек необходимо держать в клинике до тех пор,
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 815
пока концентрация общего кальция не стабилизируется на уровне 8-10 мг/100 мл в отсутствие его парентерального введения. По достижении этой цели животное возвращают хозяину и назначают введение витамина Д2 через день. Концентрацию кальция измеряют раз в неделю, корректируя дозу витамина Д2 с целью сохранения уровня кальция 8-9,5 мг/100 мл. Задача терапии состоит в-предотвращении гипокальциемической тетании, а ее самым вероятным осложнением является индуцированная гиперкальциемия.
Даже после полной стабилизации состояния животного настоятельно рекомендуется измерить концентрацию кальция в сыворотке крови по истечении 6 месяцев после терапии, а затем постоянно повторять измерения с интервалом в 2 или 3 месяца. Мониторинг уровня кальция не может быть слишком частым. Индуцируемая терапией гиперкальциемия может вызывать тяжелое поражение почек и недостаточность их функции. Этого можно избежать или, по крайней мере, свести к минимуму правильной организацией мониторинга. Терапия витамином Д2 с успехом применяется для лечения собак и кошек, а стоимость ее относительно невысока. В нашей клинике некоторые собаки получают витамин Д2 нечасто (раз в неделю), тогда как другим необходимо его ежедневное заместительное введение.
Недостатком этого вида лечения является опасность индукции гиперкальциемии, о которой упоминалось выше. В случае возникновения гиперкальциемия с трудом поддается лечению. Учитывая растворимость витамина Д2 в жирах, может потребоваться прекращение его введения на период от 1 до 4 недель, прежде чем понизится концентрация кальция. Именно риск данного осложнения делает эргокальциферол наименее привлекательным средством для лечения гипокальциемии. Несвоевременная коррекция его избыточной дозы может стать причиной угрожающего жизни состояния. В случае возникновения гиперкальциемии необходима интенсивная терапия посредством внутривенного введения жидкости и фуросемида, особенно если произведение концентраций кальция и фосфата в сыворотке крови превышает 60. В некоторых случаях помогает дополнительное введение кортикостероидов. Мы рекомендуем применять эргокальциферол только владельцам животных, не имеющим достаточно средств для терапии ДГТ или кальцитриолом.
Дигидротахистерол (ДГТ). ДГТ - это синтетический аналог витамина Д. Его преимущество перед витамином Д2 состоит в том, что он быстрее повышает концентрацию (через 1-7 дней), и его стимулирующее действие быстрее прекращается после отмены терапии. Эти свойства препарата позволяют ветеринарам более эффективно контролировать его влияние на уровень кальция. ДГТ широко доступен, но стоит дороже, чем витамин Д2. Его биологическая активность выше: 1 мг ДГТ эквивалентен
Дигидротахистерол
Рис. 17-9. Химическая структура дигидротахистерола.
120000 ЕД витамина Д2. Быстрое начало действия ДГТ и высокая биологическая активность обусловлены стереохимическими характеристиками его молекулы, в которой А кольцо молекулы стерола повернуто на 180 градусов, так что гидроксильная группа в положении 3 становится псевдо-1-гидроксильной группой (рис. 17-9). По этой причине после 25-гидроксилирования в печени ДГТ приобретает биологическую активность, промежуточную между активностями 1,2 5-дигидроксивитамина Д и 25-гидроксивитамина Д (Peterson, 1982). Полярность и более низкие дозы вводимого ДГТ ограничивают его накопление в жировой ткани по сравнению с эргокальциферолом .
Мы считает ДГТ «препаратом выбора» для долгосрочного лечения гипокальциемии. Сочетание таких его характеристик, как широкая доступность, размер таблеток, наличие альтернативной жидкой лекарственной формы, разумная цена и высокая терапевтическая эффективность делает этот препарат идеальным средством для лечения подавляющего большинства собак и кошек с гипокальциемией. ДГТ начинают вводить в суточной дозе 0,03 мг/кг, поделив ее на два приема и давая животным в течение двух дней или до появления первых признаков терапевтического эффекта. После этого дозу снижают до 0,02 мг/кг/день, а спустя еще несколько дней до 0,01 мг/кг/день (всякий раз суточную дозу дают в два приема). Как и в случае менее активного витамина Д, дозы ДГТ значительно колеблются в зависимости от индивидуальных потребностей животных. В связи с этим рекомендуется начинать терапию в условиях стационара, где животное должно оставаться до тех пор, пока концентрация кальция в его крови не стабилизируется на уровне 8-9,5 мг/100 мл на протяжении нескольких дней. Нам приходилось наблюдать собак и кошек, которые не отвечали на терапию таблетками или капсулами ДГТ, содержавшими 0,125, 0,25 или 0,4 мг этого соединения, но лечение было успешным при использовании жидкой лекарственной формы (0,125 мг/мл). Вмес
816 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
те с тем к нам поступали собаки, не чувствительные к ДГТ в любой форме, но хорошо отвечавшие на кальцитриол. Повторный еженедельный анализ концентрации кальция обеспечивают своевременную коррекцию дозировок ДГТ и, таким образом, профилактику длительной гипер- или гипокальциемии. Как и в случае с витамином Д2, настоятельно рекомендуется постоянный мониторинг уровня кальция с интервалами в 2-3 месяца.
В случае концентрации кальция в сыворотке крови выше нижнего предела нормы или выше нормы (от > 10,5 до 11,0 мг/100 мл) необходимо снизить дозу витамина Д или отменить его, а затем (в зависимости от тяжести клинических проявлений и биохимических нарушений) начать внутривенное введение фуросемида и/или кортикостероидов (см. гл. 16). Период между отменой ДГТ и понижением концентрации кальция составляет 4-14 дней, т.е. гораздо меньше, чем в случае витамина Д2.
1,25-Дигидроксивитамин Д для перорального введения; кальцитриол. Как сказано выше, мы предпочитаем использовать ДГТ для лечения поступающих в нашу клинику собак с постоянным или преходящим первичным гипопаратиреозом. Другие ветеринары считают «препаратом выбора» кальцитриол. Кальцитриол является самой активной из известных форм витамина Д, стимулирующей транспорт кальция в кишечнике и активность остеобластов в скелетных тканях. Его максимальное действие проявляется быстрее действия других производных витамина Д при минимальной продолжительности биологической полужизни (Rosol et al, 2000; Chew, Nagode, 2000). Было высказано предположение, что при приме кальцитриола внутрь он оказывает непосредственное действие на кишечные рецепторы, благодаря чему стимулирует всасывание кальция сильнее, чем другие формы витамина Д, в том числе предназначенные для парентерального введения (Cobum, 1990).
В связи с быстрым и кратковременным эффектом кальцитриола его дозу приходится часто корректировать. В случае гиперкальциемии отмена препарата или уменьшение его дозы быстро приводит к прекращению стимулирующего действия. Максимальная концентрация кальцитриола в крови достигается спустя 4 часа после введения, период его полужизни составляет 4-6 часов, а полупериод биологической активности от 3 до 5 часов. В течение первых 2—4 дней терапии вводят нагрузочные дозы кальцитриола порядка 20-40 нг/кг ежедневно, а в последующем - поддерживающие дозы от 10 до 20 нг/кг/день, разделенные на два приема (обратите внимание, что дозы препарата назначаются в нанограммах). Препарат имеется в продаже как под исходным названием, так и под другими торговыми наименованиями. Кальцитриол выпускается в лекарственных формах, предназначенных для человека, поэтому может потребоваться их адаптация для собак и кошек.
Мы считаем единственным недостатком кальцитриола его высокую стоимость и необходимость
адаптации для применения в ветеринарии. Надежность такой адаптации внушает некоторые сомнения в виду особенностей технологии, используемой для этой цели изготовителями лекарственных форм. Дело в том, что перевод кальцитриола в жидкую или капсулированную форму не гарантирует, что все особи в процессе терапии получат одно и то же равно эффективное «соединение». У нас была собака, которая не отвечала ни на какие дозы кальцитриола при его пероральном введении. У нее имелась «недостаточность» функции печени с тех пор как десятью годами раньше были диагностированы сосудистые нарушения. В этой ситуации обращает внимание отсутствие ответа несмотря на «активность» кальцитриола.
Кальцитриол для парентерального введения. В тех случаях, когда кальцитриол нельзя вводить перорально или когда такое введение не дает желаемого результата, прибегают к парентеральной терапии. Эмпирически для этой цели используют такую же дозу препарата, как для приема внутрь (10-20 нг/кг ежедневно). Больным людям в условиях диализа кальцитриол обычно вводят внутривенно 3 раза в неделю сразу после проведения диализа (Selgas et al, 1993; Rolla et al, 1993). Возможны, однако, и подкожные, и внутрибрюшинные инъекции. Мы имеем положительный опыт внутривенного ведения кальцитриола трижды в день до получения терапевтического эффекта с последующим постепенным снижением дозы. Как и при использовании других препаратов на основе витамина Д, рекомендуется регулярный мониторинг уровня кальция в условиях стационара до его окончательной стабилизации. После этого животное возвращают хозяину с рекомендацией продолжать подкожные инъекции препарата.
Заместительное введение кальция
Начальная пероральная терапия кальцием. В процессе терапии гипопаратиреоза необходимо обеспечить адекватное потребление кальция с кормом, поскольку лечение основано на использовании витамина Д, механизм действия которого состоит в усилении всасывания кальция из просвета кишечника. Коммерческие корма для комнатных животных обычно содержат достаточное количество кальция для удовлетворения потребности в нем собак и кошек. Тем не менее, чтобы избежать катастрофических последствий гипокальциемии, настоятельно рекомендуется пероральное заместительное введения кальция животным с гипопаратиреозом, особенно на ранних стадиях терапии. После устранения тетании посредством струйного внутривенного введения кальция достигнутый уровень кальция необходимо поддерживать с помощью его медленной внутривенной инфузии или подкожных инъекций. Одновременно следует начать пероральное введение кальция и витамина Д. Через 24-96 часов парентеральное введение кальция обычно прекращают, но продолжают его пероральное вве
ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ • 817
дение. Такой протокол терапии обеспечивает непрерывный мягкий контроль гипокальциемии.
Препараты кальция для заместительной терапии. Для заместительной терапии гипокальциемии применяют глюконат, лактат, хлорид или карбонат кальция. Каждый из этих препаратов имеет свои недостатки. В таблетках кальция глюконата и лактата содержится слишком мало этого элемента, поэтому приходится вводить их в больших количествах. В таблетках хлористого кальция, напротив, его содержание достаточно высоко, однако, это соединение кальция вызывает раздражение желудка. Таблетки кальция карбоната с высоким содержанием элементного кальция вызывают алкалоз, который усиливает тяжесть гипокальциемии. Кальция карбонат на 40% состоит из кальция, а один его грамм эквивалентен 20 мэкв кальция. Под воздействием желудочной кислоты карбонат кальция превращается в хлорид кальция. Лактат кальция содержит 13% элементного кальция, а 1 грамм этого препарата равноценен 6,5 мэкв. Кальция глюконат содержит 9% кальция, а 1 грамм дает 4,5 мэкв кальция.
Разумеется, в продаже имеются самые разнообразные препараты кальция (см. табл. 15-7). Кальция карбонат является средством выбора для лечения гипопаратиреоза у людей благодаря высокому содержанию кальция, низкой стоимости и отсутствию раздражающего действия на желудок. Он продается во всех аптеках как антацид (Arnaud, 1994). Мы имеем прекрасный опыт терапии кальция карбонатом, хотя рекомендации по применению этого препарата для лечения собак и кошек не поддержаны никакими специальными исследованиями.
Протокол терапии. Кошкам кальций вводят дробными дозами по 0,5-1,0 г/день, а собакам - от 1,0 до 4.0 г/день. Эти цифры приводятся только в порядке информации, так как основным способом стабилизации уровня кальциемии у этих животных является терапия витамином Д. После достижения постоянной дозы витамина Д количество вводимого кальция постепенно снижают в течение 2-4 месяцев. Такой подход позволяет избежать излишней терапии, учитывая, что потребление кальция с кормом удовлетворяет потребность животного в этом элементе, и облегчает его владельцу задачу поддержания требуемого уровня кальциемии. Следует еще раз подчеркнуть, что в идеале концентрация кальция в сыворотке крови у этих животных должна составлять 8-9,5 мг/100 мл. Концентрация выше 10 мг/100 мл считается слишком высокой; она не требуется для устранения тетании и лишь повышает риск возникновения гиперкальциемии.
ГИСТОЛОГИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ ПРИ ГИПОПАРАТИРЕОЗЕ
В отсутствие физической или хирургической травмы, злокачественной опухоли или иных явных повреждений шейного отдела или паращитовидных желез гипопаратиреоз у животных считается идио
патическим заболеванием. При этом паращитовидные железы не обнаруживаются или обнаруживаются с трудом как визуально, так и при ультразвуковом исследовании, а микроскопирование выявляет признаки их атрофии. Почти 60-80% железистой ткани замещено зрелыми лимфоцитами и редкими плазматическими клетками, паратиреоциты претерпевают выраженную дегенерацию, а соединительная ткань приобретает волокнистую структуру. Отмечается неупорядоченная изоляция главных клеток в составе множественных мелких участков или периферических тяжей. На ранних стадиях аутоиммунной атаки паращитовидные железы подвергаются инфильтрации лимфоцитами и плазматическими клетками, а оставшиеся главные клетки - узловой регенеративной гиперплазии. На более поздних стадиях паращитовидные железы полностью замещаются лимфоцитами, фибробластами и вновь образовавшимися капиллярами; сохраняются лишь отдельные жизнеспособные главные клетки. Окончательный диагноз - лимфоцитарный паратиреоидит (Сареп, Marten, 1983; Sherding et al, 1980).
ПРОГНОЗ
Прогноз первичного гипопаратиреоза зависит, в первую очередь, от того, насколько владелец животного заинтересован в проведении требуемого лечения и готов в нем участвовать, и, в меньшей степени, от квалификации ветеринара. При правильной терапии прогноз вполне благоприятен. Тридцать три из 37 лечившихся в нашей клинике собак прожили более 5 лет после установления диагноза и проведения лечения. Следует, однако, помнить, что адекватная терапия предполагает тщательный мониторинг концентрации кальция в сыворотке крови, которую следует определять каждые 1-3 месяца после стабилизации животного. Чем чаще проводятся измерения, тем меньше вероятность существенных отклонений концентрации кальция от желаемой величины. Правильно поставленные лечение и уход за животным обеспечивают ему нормальную и продолжительную жизнь.
ЛИТЕРАТУРА
Abrams KL: Hypocalcemia associated with administration of sodium bicarbonate for salicylate intoxication in a cat. JAVMA 191:235, 1987.
Arnaud CD: The calciotropic hormones and metabolic bone disease. In Greenspan FS, Baxter JD (eds): Basic and Clinical Endocrinology, 4th ed. Norwalk, Conn, Appleton & Lange, 1983, p 227.
Aroch I, et al: Serum electrolyte concentrations in bitches with eclampsia. Vet Rec 145:318, 1999.
Atkins CE, et al: Clinical, biochemical, acid-base, and electrolyte abnormalities in cats after hypertonic sodium phosphate enema administration. Am J Vet Res 46:980, 1985.
Barber PJ, Elliott J: Study of calcium homeostasis in feline hyperthyroidism. J Sm Anim Pract 37:575, 1996.
Barber PJ, et al: Measurement of feline parathyroid hormone: Assay validation and sample handling studies. J Small Anim Pract 34:614, 1993.
Bassett JR: Hypocalcemia and hyperphosphatemia due to primary hypoparathyroidism in a six-month-old kitten. J Am Anim Hosp Assoc 34:503, 1998.
Bienzle D, et al: Relationship of serum total calcium to serum albumin in dogs, cats, horses, and cattle. Can Vet J 34:360, 1993.
Broadus AE: Mineral metabolism. In Felig P, et al (eds): Endocrinology and Metabolism. New York, McGraw-Hill, 1981, p 1056.
818 • ГИПОКАЛЬЦИЕМИЯ И ПЕРВИЧНЫЙ ГИПОПАРАТИРЕОЗ
Broadus АЕ, et al: Humoral hypercalcemia of cancer: identification of a novel parathyroid hormone-like peptide. N Engl J Med 319:556, 1988.
Bruyette DS, Feldman EC: Primary hypoparathyroidism in the dog: Report of 15 cases and review of 13 previously reported cases. J Vet Intern Med 2:7, 1988.
Burk RL, Schaubhut CW: Spontaneous primary hypoparathyroidism in a dog. J Am Anim Hosp Assoc 11:784, 1975.
Bush WW, et al: Secondary hypoparathyroidism attributed to hypomagnesemia in a dog with protein-losing enteropathy. JAVMA 219:1732,2001.
Сареп CC, Martin SL: Calcium-regulatory hormones and diseases of the parathyroid glands. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders Co, 1983, p 1581.
Chew DJ, Meuten DJ: Disorders of calcium and phosphorus metabolism. Vet Clin North Am 12:411, 1983.
Chew DJ, Nagode LA: Renal secondary hyperparathyroidism. Proceedings of the 4th Annual Meeting of The Society for Comparative Endocrinology, 1990, p 17.
Chew DJ, Nagode LA: Treatment of hypoparathyroidism. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders Co, 2000, p 340.
Chew DJ, Meuten DJ: Disorders of calcium and phosphorus metabolism. Vet Clin North Am Small Anim Pract 12:411, 1982.
Chew DJ, et al: Utility of diagnostic assays in the evaluation of hypercalcemia and hypocalcemia: Parathyroid hormone, vitamin D metabolites, parathyroid hormone-related peptide, and ionized calcium. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders, 1995, p 378.
Coburn JW: Use of oral and parenteral calcitriol in the treatment of renal osteodystrophy. Kidney Int 38(Suppl):S54, 1990.
Crawford MA, Dunstan RW: Hypocalcemia secondary to primary hypoparathyroidism in a dog. Calif Vet, May/June, 1985, p 21.
Dhupa N, Proulx J: Hypocalcemia and hypomagnesemia. Vet Clin North Am Small Anim Pract 28:587, 1998.
Drobatz KJ, Casey KK: Eclampsia in dogs: 31 cases (1995-1998). JAVMA 217:216, 2000. Drobatz KJ, Hughes D: Concentration of ionized calcium in plasma from cats with urethral obstruction. JAVMA 211:1392, 1997.
Elin RJ: Magnesium: The fifth but forgotten electrolyte. Clin Chem 102:616, 1994.
Fascetti AJ, Hickman MA: Preparturient hypocalcemia in four cats. JAVMA 215:1127, 1999.
Feldman EC, Krutzik S: Case reports of parathyroid hormone concentrations in spontaneous canine parathyroid disorders. JAAHA 17:393, 1981.
Flanders JA: Surgical therapy of the thyroid. Vet Clin N Am Small Anim Pract 24:607, 1994.
Flanders JA, et al: Feline thyroidectomy: A comparison of postoperative hypocalcemia associated with three different surgical techniques. Vet Surg 16:362, 1987.
Flanders JA, et al: Adjustment of total serum calcium concentration for binding to albumin and protein in cats: 291 cases (1986-1987). JAVMA 194:1609, 1989.
Flanders JA, et al: Functional analysis of ectopic parathyroid activity in cats. Am J Vet Res 52:1336, 1991.
Flanders JA, Reimers TJ: Radioimmunoassay of parathyroid hormone in cats. Am J Vet Res 52:422, 1991.
Forbes S, et al: Primary hypoparathyroidism in a cat. JAVMA 196:1285, 1990.
Freeman LM, et al: Fanconi’s syndrome in a dog with primary hypoparathyroidism. J Vet Int Med 8:349, 1994.
Graves TK: Complications of treatment and concurrent illness associated with hyperthyroidism in cats. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders Co. 1995, p 369.
Grosenbaugh DA, et al: Evaluation of a portable clinical analyzer in a veterinary hospital setting. J Am Vet Med Assoc 213:691, 1998.
Hansen B: Disorders of Magnesium. In DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders Co. 2000, p 175.
Henderson RA, et al: Development of hypoparathyroidism after excision of laryngeal rhabdomyosarcoma in a dog. J Am Vet Med Assoc 198:639, 1991.
Henik RA, et al: Rickets caused by excessive renal phosphate loss and apparent abnormal vitamin D metabolism in a cat. JAVMA 215:1644, 1999.
Hess RS, et al: Clinical, clinicopathologic, radiologic, and ultrasonographic abnormalities in dogs with fatal acute pancreatitis: 70 cases (1986-1995). JAVMA 213:665, 1998.
Horn B, Irwin PJ: Transient hypoparathyroidism following successful treatment of hypercalcemia of malignancy in a dog. Aust Vet J 78:690, 2000.
Jorgensen LS, et al: Electrolyte abnormalities induced by hypertonic phosphate enemas in two cats. JAVMA 187:1367, 1985.
Kimmel SE, et al: Incidence and prognostic value of low plasma ionized calcium concentration in cats with acute pancreatitis: 46 cases (1996-1998). JAVMA 219:1105, 2001.
Kimmel SE, et al: Hypomagnesemia and hypocalcemia associated with protein-losing enteropathy in Yorkshire Terriers: five cases (1992-1998). JAVMA 217:703, 2000.
Klein MK, et al: Treatment of thyroid carcinoma in dogs by surgical resection alone: 20 cases (1981-1989). JAVMA 206:1007, 1995.
Kornegay JN: Hypocalcemia in dogs. Comp Cont Ed Small Anim Pract 4:103, 1982.
Kornegay JN, et al: Idiopathic hypocalcemia in four dogs. JAAHA 16:723, 1980.
Li YC, et al: Normalization of mineral ion homeostasis by dietary means prevents hyperparathyroidism, rickets, and osteomalacia, but not alopecia in vitamin D-receptor ablated mice. Endocrinol 139:4391, 1998.
Malloy PJ, et al: The vitamin D receptor and the syndrome of hereditary 1,25-dihydroxyvitamin D-resistant rickets. Endocr Rev 20:156, 1999.
Marx SJ: Hyperparathyroid and hypoparathyroid disorders. N Engl J Med: 343:1863, 2000.
Meininger ME, Kendler JS: Trousseau’s Sign. N Engl J Med 343:1855, 2000.
Meuten DJ, Armstrong PJ: Parathyroid disease and calcium metabolism. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine. 3rd ed. Philadelphia, WB Saunders, 1989, p 1610.
Meuten DJ, et al: Relationship of serum total calcium to albumin and total protein in dogs. JAVMA 180:63, 1982.
Meyer DJ, Tyrrell TG: Idiopathic hypoparathyroidism in a dog. J Am Vet Med Assoc 168:858, 1976.
Milnor WR: Properties of cardiac tissues. In Mountcastle VB (ed): Medical Physiology. St Louis, CV Mosby Co, 1980, p 980.
Padgett SL, et al: Efficacy of parathyroid gland autotransplantation in maintaining serum calcium concentrations after bilateral thyroparathyroidectomy in cats. J Am Anim Hosp Assoc 34:219, 1998.
Parker JSL: A probable case of hypoparathyroidism in a cat. J Small Anim Pract 32:470, 1991.
Pearce SHS, et al: A familial syndrome of hypocalcemia with hypercalciuria due to mutations in the calcium-sensing receptor. N Engl J Med 335:1115, 1996.
Peterson ME: Treatment of canine and feline hypoparathyroidism. JAVMA 181:1434, 1982.
Peterson ME: Hypoparathyroidism: In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1986, p 1039.
Peterson ME: Hypoparathyroidism and other causes of hypocalcemia in cats. In Kirk RW, Bonagura JA (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders Co, 1992, p 376.
Peterson ME, et al: Idiopathic hypoparathyroidism in five cats. J Vet Intern Med 5:47, 1991.
Rasmussen H: Theoretical considerations in the treatment of osteoporosis. In De Luca HF (ed): Osteoporosis: Recent Advances in Pathogenesis and Treatment. Baltimore, University Park Press, 1981, p 383.
Rolla D, et al: Effects of subcutaneous calcitriol administration on plasma calcium and parathyroid hormone concentrations in continuous ambulatory peritoneal dialysis uremic patients. Peritoneal Dialysis Int 13:118, 1993.
Rosol TJ, Сареп CC: Calcium-regulating hormones and diseases of abnormal mineral (calcium, phosphorus, magnesium) metabolism. In Kaneko JJ, Harvey JW, Bruss ML (eds): Clinical Biochemistry of Domestic Animals. San Diego, Academic Press, 1997, p 619.
Rosol TJ, et al: Disorders of Calcium. In DiBartola SP (ed): Fluid Therapy in Small Animal Practice, 2nd ed. Philadelphia, WB Saunders Co, 2000, p 108.
Ruopp JL: Primary hypoparathyroidism in a cat complicated by suspect iatrogenic calcinosis cutis. J Am Anim Hosp Assoc 37:370, 2001.
Schaer M, et al: Severe calcinosis cutis associated with treatment of hypoparathyroidism in a dog. J Am Anim Hosp Assoc 37:364, 2001.
Schenck PA, et al: Effects of storage on normal canine serum ionized calcium and pH. Am J Vet Res 56:304, 1995.
Schenck PA, et al: Effects of storage on serum ionized calcium and pH from horses with normal and abnormal ionized calcium concentrations. Vet Clin Pathol 25:118, 1996.
Schick MP, et al: Calcinosis cutis secondary to percutaneous penetration of calcium chloride in dogs. JAVMA 191:207, 1987.
Selgas R, et al: The pharmacokinetics of a single dose of calcitriol administered subcutaneously in continuous ambulatory peritoneal dialysis patients. Peritoneal Dialysis Int 13:122, 1993.
Sherding RG, et al: Primary hypoparathyroidism in the dog. JAVMA 176:439, 1980.
Tepperman J: Metabolic and Endocrine Physiology. Chicago, Year Book Medical Publishers, 1980, p 297.
Tomsa K, et al: Nutritional secondary hyperparathyroidism in six cats. J Sm Anim Pract 40:533, 1999.
Torrance AG: Disorders of Calcium Metabolism. In Torrance AG and Mooney CT (eds): Manual of Small Animal Endocrinology, 2nd ed. British Small Animal Veterinary Association, 1998, p 129.
Torrance AG, Nachreiner R: Intact parathyroid hormone assay and total calcium concentration in the diagnosis of disorders of calcium metabolism in dogs. J Vet Intern Med 3:86, 1989.
Vaden SL, et al: A retrospective case-control study of acute renal failure in 99 dogs. J Vet Intern Med 11:58, 1997.
Welches CD, et al: Occurrence of problems after three techniques of bilateral thyroidectomy in cats. Vet Surg 18:392, 1989.
Weir EC, et al: Isolation of 16,000-dalton parathyroid hormone like proteins from two animal tumors causing humoral hypercalcemia of malignancy. Endocrinol 123:2744, 1988.
Yates AJ, et al: Effects of a synthetic peptide of a parathyroid-related protein on calcium homeostasis, renal tubular calcium reabsorption and bone metabolism in vivo and in vitro in rodents. J Clin Invest 81:932, 1988.
Часть VI
ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ
Глава 18 ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ
ПОЧКИ............................822 Ренин и ренин-ангиотензиновая Физиология.....................828
Гормоны, образующиеся в почках...822 система............t...............825 Методы исследования............828
Эритропоэтин.....................822 НАТРИУРЕТИЧЕСКИЙ ГОРМОН Натриуретический гормон предсердия
Калликреин-кининовая система.....825 ПРЕДСЕРДИЯ.........................828 при патологии..................828
Общие сведения..................828
Список сокращений КОЭ - колонииобразующие эритроидные НПП - натриуретический пептид
АКТГ - адренокортикотропный гормон клетки предсердия
ОФЭ - объем форменных элементов крови
ПОЧКИ
Гормоны, образующиеся в почках
Почки участвуют в деятельности четырех основных гормональных систем организма. Во-первых, они секретируют ренин - протеолитический фермент, запускающий последовательность процессов, которая завершается образованием пептида ангиотензина II, который поступает в кровь и играет важную роль в регуляции водно-солевого обмена, стимулирует биосинтез и секрецию альдостерона и контролирует кровяное давление. Во-вторых, в почках образуются кинины, которые усиливают действие альдостерона и вазопрессина на почечную функцию. Заболевания почек и синтезируемые ими гормоны являются патогенетическими факторами гипертензии. В-третьих, почки секретируют эритропоэтин - гликопротеин, участвующий в регуляции образования эритроцитов. В четвертых, в почках завершается активация витамина Д. Они выводят из крови 25-гидроксихолекальциферол и гидроксилируют его с образованием 1,25-дигид-роксихолекалъциферола. Последний вызывает повышение концентрации кальция в плазме крови, усиливая его всасывание в кишечнике, увеличивая реабсорбцию в почечных канальцах и стимулируя резорбцию костной ткани. Витамин Д и его действие подробно обсуждаются в гл. 16 и 17.
Эритропоэтин
Физиология. Уже давно известно, что гипоксия служит мощным стимулом образования эритроцитов. У человека через несколько часов после начала
гипоксии возрастает количество ретикулоцитов, что свидетельствует о появлении в кровяном русле новых эритроцитов. Эта реакция является следствием усиления продукции гликопротеинового гормона эритропоэтина. Его главным источником служат почки, хотя он образуется также в печени, особенно плодной. Повседневная продукция эритропоэтина зависит от парциального давления кислорода (РО2) в крови, перфузирующей почки. Клетками-мишенями эритропоэтина являются колонииобразующие эритроидные клетки (КОЭ) костного мозга. Эритропоэтин взаимодействует с рецепторами, локализованными на поверхности КОЭ- клеток, что приводит к усилению образования проэритробластов и поступления эритроцитов в кровяное русло (рис. 18-1) (Erslev, 1991).
У здоровых взрослых людей эритропоэтин секретируется непрерывно. Поскольку самым сильным стимулятором его продукции является гипоксия, скорость высвобождения эритропоэтина возрастает при самых разнообразных патологических состояниях, влияющих на почки, особенно тех, которые замедляют почечный кровоток. Это, в свою очередь, неизбежно усиливает образование эритроцитов. У нескольких собак с тяжелой полицитемией были обнаружены опухоли, секретирующие эритропоэтин.
Одно из объяснений возникновения нерегенеративной анемии у собак и кошек с хронической недостаточностью почечной функции состоит в том, что основное заболевание вызывает гибель клеток, продуцирующих эритропоэтин, что приводит к снижению его синтеза. Снижение скорости образования эритроцитов из-за недостатка эритропоэтина является главной проблемой при лечении больных
ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ • 823
Почечный кровоток Источник Сенсор
Потребление кислорода эритропоэтинами кислорода
Почки (перитубулярный) Печень (Купферовские клетки?) Макрофаги
Рнс. 18-1. Система обратной связи, регулирующая продукцию эритроцитов в соответствии с потребностью в кислороде. РЭП - ранний эритроидный предшественник, образующий взрывообразные колонии; КОЭ - колонииобразующая эритроидная клетка. (Из: Erslev AJ: N. Engl J Med, 324: 1339, 1991).
с тяжелой почечной недостаточностью. Пересадка почек не только восстанавливает их функцию, но и нормализует эритропоэз.
Преимущества синтетического эритропоэтина. Клонирование человеческого эритропоэтина служит одним из наиболее удачных примеров практического использования технологии рекомбинантной ДНК. Рекомбинантный человеческий эритропоэтин (гНиЕРО, или эпоэтин) в настоящее время применяется в медицине и уже произвел революцию в лечении анемии у больных с хронической почечной недостаточностью. Эпоэтин в целом идентичен эритропоэтину, выделяемому из человеческой мочи. Он имеет ту же аминокислотную последовательность, но несколько отличается от природного гормона степенью гликозилирования. У большинства получавших его больных была достигнута коррекция анемии, что значительно улучшило их состояние и качество жизни. У них существенно повысилась переносимость физических нагрузок, улучшился аппетит, возросли физическая сила и умственные способности. Высокая эффективность эпоэтина в сочетании с возможностью отказаться от переливания крови перевешивает риск осложнений, ассоциирующихся с введением рекомбинантного препарата больным людям.
Опыт работы с рекомбинантным эритропоэтином в ветеринарии связан с применением эпоэти-на-а (эпогеном). Эпоген суспендируют в человеческом сывороточном альбумине, чтобы избежать его адгезии на стекле, и суспензия не содержит консервантов. Структура эритропоэтина различных видов достаточно консервативна. Собаки и кошки одинаково хорошо отвечают на введение синтетического гормона. При лечении животных с хронической почечной недостаточностью эпоген дозо-зависимо повышает показатель гематокрита
и снижает тяжесть анемии (Cowgill, 1990, 1995). В течение первой недели терапии у большинства животных отмечается преходящий умеренный рети-кулоцитоз. В костном мозге снижается отношение миелоидных клеток к эритроидным клеткам, что отражает усиление эритропоэза. У некоторых животных на протяжении терапии имеет место преходящий тромбоцитоз. Такая же реакция наблюдается и у некоторых людей, однако неизвестно, является ли она прямым следствием действия эпоэтина на мегакариоциты или вторичным эффектом недостаточности железа (Polzin et al, 1995). Повышение гематокрита до нижней границы нормы происходит за 2-8 недель в зависимости от его значения в начале лечения и дозы препарата. По мере нормализации гематокрита владельцы животных, как правило, отмечают улучшение клинического состояния своих питомцев, у которых повышается аппетит, начинается прирост веса тела, они становятся более энергичными и общительными (Cowgill, 1990).
Дозы и способы введения эпоэтина. Эпоэтин эффективен как при внутривенном, так и подкожном введении. Частота образования антител у больных людей в обоих случаях одинакова. При подкожном введении препарат дольше сохраняется в крови, что позволяет использовать более низкие общие дозы. Разработка схемы лечения еще не завершена. В настоящее время лечение начинают с подкожного введения эпоэтина в дозах от 50 до 150 ЕД/кг три раза в неделю (Polzin et al, 1995). Еженедельный мониторинг продолжают до достижения желаемого гематокрита, т.е. объема форменных элементов крови (ОФЭ) 33-40% у собак и 30-35% у кошек. Собакам и кошкам с тяжелой анемией (ОФЭ < 14%), не требующей, однако, переливания крови, в течение первой недели ежедневно вводят препарат в дозе 150 ЕД/кг веса тела. При наличии гипертензии или ане
824 • ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ
мии в легкой форме доза 50 ЕД/кг, вводимая трижды в неделю, позволяет предотвратить прогрессивное повышение кровяного давления или развитие железо-дефицитного эритропоэза.
После достижения минимальной желаемой величины гематокрита переходят на введение препарата дважды в неделю. Для получения требуемых ОФЭ и количества эритроцитов большинству животных достаточно вводить эпоэтин в дозе 50-100 ЕД/кг два или три раза в неделю. Тем не менее, дозы эпоэтина сильно варьируют в зависимости от индивидуальных особенностей животных, поэтому необходим постоянный мониторинг ОФЭ для своевременной коррекции дозы препарата и/или частоты его введения. Если для достижения приемлемых показателей необходимо введение эпоэтина в дозах более 150 ЕД/кг трижды в неделю, не исключено, что данное животное резистентно к эритропоэтину. Между коррекцией дозы и соответствующим изменением ОФЭ проходит определенное время, поэтому следует запастись терпением, чтобы избежать слишком частого пересмотра дозы, так как это может привести к непредсказуемым флуктуациям ОФЭ и невозможности определить постоянную дозу эпоэтина. Важно также избежать ятрогенной полицитемии.
При стимуляции эритропоэза требуется повышенное количество железа, поэтому в процессе лечения существует опасность истощения резервов этого элемента. В связи с этим всем больным, получающим эпоэтин, рекомендуется заместительное пероральное введение железа, даже если концентрация трансферрина до начала терапии была нормальной.
Побочные эффекты рекомбинантного эритропоэтина
Известные побочные эффекты. Известны разные побочные эффекты эпоэтина, хотя непосредственная причинная связь между ними и введением препарата установлена не во всех случаях. К числу таких эффектов относятся рефракторная анемия, полицитемия, рвота, судороги и ощущение дискомфорта в местах инъекций. Отмечалось также преходящее поражение кожи и слизистых оболочек с повышением температуры или без него, гипертензия и сердечные расстройства (Cowgill, 1992).
Нейтрализующие антитела. Резистентность анемии к действию рекомбинантного эритропоэтина может быть связана с образованием антител, нейтрализующих его эффект. У многих собак и кошек белок эпоэтин вызывает образование таких антител, которые могут появиться как через 4 недели после начала лечения, так и через много месяцев. После отмены препарата титр антител снижается. Попытки предотвратить образование антител с помощью иммуносупрессорной терапии оказались безуспешными. Их концентрацию можно определять как непосредственно, так и по величине отношения миелоидных и эритроидных клеток
в костном мозге, которое отражает интенсивность продукции антител. После прекращения введения эпоэтина эритропоэз находится на уровне выше, чем до начала лечения, однако, этого может оказаться недостаточным для образования требуемого количества эритроцитов, поскольку препарат применяют при тяжелой анемии (Polzin et al., 1995).
Гипертензия. Было высказано предположение, что больные хронической анемией (как при хронической почечной недостаточности) страдают расширением периферических сосудов. Этот дефект устраняется введением эпоэтина, который, однако, повышает их резистентность и, таким образом, индуцирует гипертензию. Последняя является осложнением терапии, а не следствием непосредственного прессорного действия препарата (Nissenson et al, 1991; Cowgill, 1992).
Судороги и аллергические реакции. Судороги после начала терапии рекомбинантным эритропоэтином наблюдались у людей, собак и кошек с хронической недостаточностью почечной функции. Наиболее вероятным объяснением этого явления у собак и кошек является гипертензивная и уремическая энцефалопатия, поскольку чаще всего вызванные эпоэтином судороги наблюдаются у животных на поздних стадиях почечной недостаточности. Аллергические реакции, включая кожные и кожно-слизистые, у собак и кошек развиваются нечасто. Большинство сопутствующих им поражений спонтанно исчезают через несколько дней после прекращения введения препарата и не рецидивируют в случае возобновления терапии.
Химический состав сыворотки крови и сывороточное железо. Выявляемые нарушения химического состава крови не связаны с применением эпоэтина; многие из них обусловлены хронической недостаточностью почечной функции. Часто наблюдается снижение концентрации железа и насыщения трансферрином. Признаки влияния терапии рекомбинантным эритропотином на прогрессирование почечной недостаточности не обнаружены.
Слабый ответ на эпоэтин. Индивидуальные различия реакции на эпоэтин хорошо известны, но до сих пор не получили удовлетворительного объяснения. У собак и кошек существует несколько причин пониженной чувствительности к этому препарату или отсутствия его терапевтического эффекта при анемии. Среди них образование специфических антител у 20-30% животных, абсолютная или функциональная недостаточность железа, желудочно-кишечные кровотечения, гемолиз и сопутствующие воспалительные или злокачественные заболевания (Polzin et al, 1995).
Когда начинать терапию эпоэтином. В связи с частым образованием антител к рекомбинантному эритропоэтину поднимается важный вопрос о том, в каких случаях нужно начинать терапию. Большинство авторов рекомендуют проводить лечение только при крайней необходимости, так как после образования антител продолжение терапии теряет
ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ • 825
смысл. При показателе гематокрита менее 25% у собак и 20% у кошек анемия способствует возникновению клинически выраженных нежелательных явлении, связанных с хронической почечной недостаточностью. По величине ОФЭ обычно судят о тяжести анемии. Однако при сопоставлении рисков и преимуществ терапии следует учитывать и такие факторы, как степень азотемии, ожидаемая скорость дальнейшего развития хронической почечной недостаточности, аппетит, приемлемость для животного предписанного терапевтического рациона и темпы усугубления тяжести анемии (Polzin et al. 1995). Многие владельцы комнатных животных придают первостепенное значение качеству жизни своих питомцев. Поэтому прежде чем назначать лечение анемии рекомбинантным эритропоэтином, следует обсудить ее преимущества и недостатки с хозяевами собаки или кошки.
Калликреин-кининовая система
В почках имеются все элементы калликреин-кини-новой системы. Почечный калликреин представляет собой сериновую протеазу, которая синтезируется в дистальных канальцах и отличается от каллик-реина, присутствующего в плазме крови. В почках калликреин секретируется в жидкость метальных канальцев, где осуществляет превращение фильтрованного гепатического кининогена в кинин. Рецепторы кинина локализуются как в просвете, так и на наружных стенках собирательных канальцев коркового и медуллярного вещества почек. Кинины усиливают стимуляцию альдостероном задержки соли и подавление вазопрессином экскреции воды. Однако физиологическая значимость калликреин-кини-новои системы еще не ясна (Biglieri et al. 1994).
Ренин и ренин-ангиотензиновая система
Основные сведения. В 1947 году Гольдблатт (Goldblatt) обратил внимание, что уменьшение почечного кровотока у лабораторных животных сопровождается повышением кровяного давления.
Рис. 18-2. Схематическое изображение почечного клубочка с юкстогломерулярным аппаратом и плотным пятном (Из: Biglieri et al: bn Greenspan FS, Baxter JD (eds): Basic and Clinical Endocrinology, 4th ed. Norwalk, Conn, Appleton and Lange, 994, p 347).
Его эксперименты продемонстрировали участие почек в патогенезе гипертензии. Там, где афферентная артериола входит в почечный клубочек (рис. 18-2), гладкомышечные клетки модифицируются и приобретают способность выполнять секреторную функцию. Эти юкстагломерулярные клетки синтезируют и секретируют ренин - протеолитический фермент с молекулярной массой приблизительно 40000, который образуется в результате протеолиза его предшественника - проренина. Почки высвобождают в кровяное русло как проренин, так и ренин. Концентрация проренина (раньше его называли «неактивным ренином») в крови может быть равной ипи выше концентрации ренина. Существует много способов превращения прорснина в ренин в условиях in vitro; однако неизвестно, происходит ли подобное превращение вне почек в живом ор-
Ангиотензиноген
Ренин
Пепстатин
Ангиотензин I
Превращающий фермент
Каптоприл
Ангиотензин II
Ангиотензиназа
Пептидные фрагменты
Блокаторы рецепторов (например саралазин)
Рецепторы
Рис. 18-3. Процесс образования ангиотензина II. Препараты, используемые для блокады отдельных стадий биосинтеза у человека, выделены курсивом. (Из: Biglieri et al: In: Greenspan FS, Baxter JD (eds): Basic and Clinical Endocrinology, 4th ed Norwalk, Conn, Appleton and Lange, 994, p 347).
826 • ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ
ганизме. Субстратом ренина в кровяном русле служит ангиотензиноген, из которого образуется физиологически инертный декапептид ангиотензин I (рис. 18-3). Под воздействием преобразующего фермента этот пептид превращается в биологически активный ангиотензин II. Период полужизни ангиотензина II в плазме меньше 1 минуты, так как он расщепляется под действием множественных анги-отензиназ, присутствующих в большинстве тканей организма (Biglieri et al, 1994).
Ангиотензиноген. Ангиотензиноген (субстрат ренина) представляет собой а2-глобулин, секретируемый печенью. Он имеет молекулярную массу приблизительно 60000 и обычно присутствует в плазме крови в концентрации 1 мкмоль/л. Хотя скорость продукции ангиотензина II в норме зависит от изменений концентрации ренина в плазме, концентрация ангиотензиногена ниже Vmax данной реакции. Поэтому при повышении концентрации ангиотензиногена количество синтезируемого ангиотензина тоже повышается, хотя концентрация ренина остается неизменной. Продукция ангиотензиногена в печени усиливается под воздействием глюкокортикоидов и эстрогенов (Dzau et al, 1988; Kater et al, 1989; Biglieri, 1991).
При таких состояниях, как недостаточность натрия, которая сопровождается устойчивым повышением концентрации ангиотензина II в крови, скорость расщепления ангиотензиногена ренином значительно увеличивается. Поскольку при этом концентрация ангиотензиногена в плазме остается постоянной, его продукция в печени должна усилиться, чтобы компенсировать возросшую скорость деградации. Механизм такого усиления не установлен; известно, однако, что ангиотензин II сам по себе является стимулятором образования ангиотензиногена (Biglieri et al, 1994).
Превращающий фермент. Ангиотензин-пре-вращающий фермент имеется в большинстве тканей организма и в крови. Поэтому теоретически превращение ангиотензина I в ангиотензин II может происходить во всех отделах кровеносной системы. Однако самая высокая активность ангиотен-зин-превращающего фермента зарегистрирована в легких, где за время одного прохождения 70-80% ангиотензина I превращается в ангиотензин II.
Ангиотензин-превращающий фермент представляет собой дипептидилкарбоксипептидазу - гликопротеин с молекулярной массой 130000 - 160000, действие которого состоит в отщеплении дипептидов от разных субстратов. В число таких субстратов, помимо ангиотензина I, входят брадикинин, энкефалины и вещество Р. Ингибиторы ангиотензин-пре-вращающего фермента широко применяются для предотвращения образования ангиотензина II в кровяном русле при необходимости блокады его биологического действия (см. рис. 18-3). Поскольку этот фермент действует на разные субстраты, подавление его активности может сказываться не только на ре-нин-ангиотензиновой системе (Biglieri et al, 1994).
Периферическое действие ангиотензина II. Ангиотензин II является мощным прессорным агентом, который действует на периферические артериолы, вызывая сужение сосудов и, тем самым, усиливая общую периферическую резистентность. Сосудосуживающее действие ангиотензина II проявляется во всех тканях, включая почки, и играет роль в механизмах почечной ауторегуляции. Ангиотензин II повышает также скорость и силу сердечных сокращений. Ниже обсуждается возможное значение высоких концентраций ангиотензина II в крови в патогенезе гипертензии.
Ангиотензин II действует непосредственно на кору надпочечников, где стимулирует секрецию альдостерона. Во многих клинических ситуациях он является главным регулятором секреции альдостерона и потому играет ключевую роль в поддержании гомеостаза натрия. При недостаточном содержании натрия в пище осмотический транспорт воды, поступающей во внутриклеточную жидкость, приводит к уменьшению объема внеклеточной жидкости. Происходящая при этом стимуляция ренин-ангиотензиновой системы важна в двух отношениях. Ее сосудосуживающее действие поддерживает кровяное давление в условиях уменьшения объема внеклеточной жидкости, а стимулирующее действие на секрецию альдостерона и, следовательно, задержку натрия позволяет сохранить этот объем.
Активность ангиотензина II в почках также способствует задержке натрия. Ангиотензин II суживает преимущественно эфферентные артериолы, обеспечивая, таким образом, необходимую скорость клубочковой фильтрации во время гиповолемии и артериальной гипотензии. Последующее падение гидростатического давления в капиллярах, питающих проксимальные почечные канальцы, способствует резорбции в них воды и натрия. Ангиотензин II тоже стимулирует резорбцию натрия. Замедление тока жидкости в петле Генле вследствие уменьшения скорости клубочковой фильтрации и усиления проксимальной резорбции, наряду с его замедлением в vasa recta, способствует функционированию механизмов противоточной мультипликации и концентрации мочи. Ангиотензин II модулирует активность симпатических нервных окончаний в периферических кровеносных сосудах и в сердце. Он усиливает симпатическую активность, отчасти путем стимуляции высвобождения адренергических трансмиттеров, а отчасти повышая чувствительность гладких мышц к норадреналину. Наконец, ангиотензин II усиливает секрецию катехоламинов из медуллярного вещества надпочечников.
Блокада периферического действия ангиотензина II используется в терапевтических целях. Так, например, при застойной сердечной недостаточности и низких значениях минутного объема повышается концентрация ангиотензина II в крови, что способствует задержке воды и солей, тогда как сужение артериол усиливает резистентность периферических сосудов. В результате высокая концентрация
ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ • 827
ангиотензина II при сердечной недостаточности увеличивает нагрузку, преодолеваемую миокардом при сокращении. Лечение ингибиторами ан-гиотензин-превращающего фермента (например, каптоприлом) приводит к расширению периферических сосудов, что улучшает тканевую перфузию и работоспособность сердца, а также способствует выведению воды и солей через почки (Ulik, 1991; Biglieri et al, 1994).
Внепочечные ренин-ангиотензиновые системы. Компоненты ренин-ангиотензиновой системы содержатся во многих тканях, включая мозг, сердце, яичники, надпочечники, семенники и периферические кровеносные сосуды. В некоторых из этих тканей происходит локальный синтез ангиотензина, что может иметь определенное физиологическое значение. В частности, образующийся в мозге ангиотензин II участвует в патогенезе некоторых форм гипертензии (Biglieri et al, 1994).
Влияние на мозг и центральную нервную систему. Описаны многочисленные проявления действия ангиотензина II на ЦНС. Ангиотензин II представляет собой полярный пептид, не способный пересекать гематоэнцефалический барьер. Тем не менее, присутствующий в крови ангиотензин II действует на мозг через одну или несколько около-желудочковых структур. Эти специализированные области мозга лишены гематоэнцефалического барьера, а их рецепторные клетки чувствительны к составу плазмы. Особенно важное значение для проявления действия ангиотензина II на мозг имеют лежащий под его сводом organum vasculosum концевой пластинки и area postrema.
При введении системно или непосредственно в мозг ангиотензин II оказывает сильное дипсоген-ное действие. Основные рецепторы дипсогенных эффектов циркулирующего в крови ангиотензина II локализованы под сводом головного мозга. Кроме того, он стимулирует секрецию вазопрессина, особенно на фоне повышенной осмоляльности плазмы. Таким образом, ренин-ангиотензиновая система играет важную роль в регуляции водного баланса, значение которой еще более возрастает в периоды гиповолемии.
Наконец, ангиотензин II повышает кровяное давление в мозге, хотя его эффект в этом органе выражен слабее, чем когда он действует непосредственно в системной циркуляции. У большинства животных рецепторы ангиотензина II находятся в area postrema. Другими проявлениями центрального действия ангиотензина II являются стимуляция секреции АКТГ, подавление активности ренина в плазме крови и усиление потребления натрия, особенно при повышенной продукции минералокортикоидов. Предстоит выяснить клиническую значимость этих (и других) активностей ангиотензина II на уровне ЦНС (Biglieri et al., 1994).
Гипертензия. С тех пор как первые наблюдения показали, что ослабление перфузии почек индуцирует секрецию ренина и повышение кровяного
давления, ренин считается патогенетическим фактором гипертензии. Тем не менее, на протяжении многих лет связь ренина с развитием гипертензии оставалась недоказанной, и многие исследователи признавали участие ренин-ангиотензиновой системы в возникновении только некоторых ее форм. Известно, в частности, что ренин-продуцирующие опухоли могут вызывать тяжелую гипертензию. Ре-нин-зависимая гипертензия ассоциируется с коарктацией аорты выше места ответвления почечных артерий и со стенозом последних. Концентрация ренина в плазме повышается также при злокачественной гипертензии на конечных стадиях почечного заболевания.
Эссенциальная гипертензия. У большинства людей с гипертонией имеет место «эссенциальная гипертензия». Это - не один самостоятельный синдром, а целый спектр клинических состояний. На одном его конце - разнообразные формы гипертензии, общей чертой которых является сужение периферических сосудов («сухая гипертензия»). Усиление активности любого сосудосуживающего соединения (ангиотензина при почечной гипертензии или катехоламинов при феохромоцитоме) вызывает уменьшение просвета артериол и увеличение периферической резистентности, что приводит к повышению кровяного давления. На другом конце спектра - повышение кровяного давления, обусловленное увеличением объема внеклеточной жидкости («влажная гипертензия»). Иными словами, любая ситуация, сопровождающаяся задержкой натрия и воды, служит причиной повышения кровяного давления (Biglieri et al, 1994). Эссенциальная гипертензия - самое обычное заболевание человека, однако, до сих пор неизвестно, как часто она встречается у собак и кошек.
Реноваскулярная гипертензия. Одной из общепризнанных форм ренин-зависимой гипертензии у человека является реноваскулярная гипертензия. По данным различных авторов она составляет от 1 до 4% всех случаев гипертензии у людей. Реноваскулярная гипертензия обычно возникает как следствие атеросклероза или фибромышечной гиперплазии почечных артерий. Это расстройство приводит к уменьшению перфузии почечного сегмента, расположенного дистально по отношению к месту сужения сосуда, и усилению секреции ренина и продукции ангиотензина II. Повышение кровяного давления и высокая концентрация ангиотензина II подавляют высвобождение ренина из противоположной почки. В результате общая активность ренина в плазме может быть лишь не намного выше нормальной. Причинами гипертензии могут служить и другие анатомические нарушения, такие как почечный инфаркт, образование одиночных кист, гидронефроз или изменение структуры паренхимальной ткани (Krieger, Dzau, 1991; Pickering, 1990).
Не существует одного простого и надежного метода диагностики реноваскулярной гипертензии у человека. По этой причине, а также из-за относи
828 • ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ
тельно редкой встречаемости данного расстройства, поголовный скрининг больных с гипертензией для выявления ее реноваскулярной формы обычно не проводится. Большинство врачей, обнаружив необычное течение гипертензии, сначала выясняют показания к проведению такого исследования. В общем случае, таким показанием служит сочетание тяжелой гипертензии, ее ускоренного развития и начала до 20-летнего или после 50-летнего возраста, наличия абдоминального шума или гипокалиемии в отсутствие в анамнезе семейной гипертензии (Biglieri et al, 1994). Неизвестно, как часто реноваскулярная гипертензия встречается у собак и кошек.
НАТРИУРЕТИЧЕСКИЙ ГОРМОН ПРЕДСЕРДИЯ
Общие сведения
В 1981 году ДеБолд и его сотрудники обнаружили, что внутривенное введение экстрактов предсердия крысам индуцирует сильный диурез и натри-урез. Этот эффект был вызван пептидом, который синтезируется и хранится в миоцитах предсердия, поэтому его назвали натриуретическим пептидом предсердия (НПП). При соответствующей стимуляции от резервной формы НПП, состоящей из 126 аминокислотных остатков, отщепляется биологически активный НПП (аминокислотная последовательность 99-125), который поступает в кровяное русло. У большинства видов млекопитающих НПП хранится в интенсивно окрашиваемых гранулах кардиоцитов правого и левого предсердий, откуда он высвобождается при механическом растяжении их стенок. Поэтому многие сердечные расстройства сопровождаются повышением концентрации НПП в крови (Edwards et al, 1987). При застойной сердечной недостаточности желудочки также приобретают способность синтезировать НПП (Laragh, 1985; Atlas, Maack, 1987; Genest, Cantin, 1988; Mantero et al, 1990; Melby, 1991).
В ряде лабораторий была установлена аминокислотная последовательность НПП и были синтезированы натриуретические пептиды, содержащие от 22 до 28 аминокислотных остатков. Из предсердий крысы и человека были выделены и охарактеризованы кДНК, кодирующие натриуретические пептиды. В кровь, скорее всего, высвобождается пептид, состоящий из 28 аминокислотных остатков. Считается, что этот пептид участвует в регуляции гомеостаза объема, поскольку он обладает натриуретическим, диуретическим и сосудорасширяющим действием и подавляет секрецию ренина, альдостерона и вазопрессина (Cantin, Genest, 1985; Needleman et al, 1988).
Физиология
Основными эффектами введенного экзогенного НПП являются усиление натриуреза и снижение кровяного давления. Хотя этот пептид вызывает
релаксацию гладкой мускулатуры, падение кровяного давления у интактных животных обусловлено, в первую очередь, уменьшением обратного тока крови в венах и минутного объема сердца. НПП не только обладает сосудорасширяющим действием, но и способен уменьшать внутрисосудистый объем. Этот эффект обусловлен как натриуретическим действием пептида и его способностью ингибировать секрецию альдостерона, так и транспортом внутрисосудистой жидкости в интерстициальное пространство (DeBold et al, 1981; Atarashi et al, 1984; Sujimoto et al, 1989). Натриурез сопровождается значительным увеличением фильтруемой фракции в отсутствие устойчивого усиления почечного кровотока. Это предполагает сужение эфферентных артериол под воздействием НПП. Имеются также данные об увеличении проницаемости клубочковых мембран и снижении резорбции в почечных канальцах под действием НПП. Кроме того, НПП подавляет барорефлекторную стимуляцию частоты сердечных сокращений, а также секрецию АКТГ и вазопрессина (Biglieri et al, 1994).
Методы определения
В последнее время было разработано несколько методов радиоиммунологического определения НПП. Несмотря на сомнения относительно специфичности таких определений, их результаты неоспоримо свидетельствуют о присутствии НПП в нормальной плазме крови. Экспериментальное увеличение объема плазмы и повышение давления в предсердиях сопровождается увеличением концентрации натри-уретического пептида в крови (Edwardset al, 1987; Goetz, 1988).
Натриуретический гормон предсердия при патологии
Естественно, что внимание исследователей привлекло возможное участие НПП в патогенезе заболеваний, характеризующихся избыточным увеличением объема, таких как застойная сердечная недостаточность, хроническая почечная недостаточность и гипертензия. Было установлено, что у собак с хронической недостаточностью почечной функции концентрация НПП в плазме крови (16 фмоль/мл) вдвое выше, чем у здоровых животных (8 фмоль/мл) (Vollmar et al, 1991). Это повышение может быть следствием увеличения объема внеклеточной жидкости, которое постоянно наблюдается при хронической почечной недостаточности. В то же время почки являются основным местом деградации и обмена НПП. Таким образом, при заболевании почек или их недостаточности метаболизм НПП нарушается (Gerbes, Vollmar, 1990).
Еще более сильное увеличение концентрации НПП в плазме крови (до 53 фмоль/мл или более чем в 6 раз) отмечается у собак с застойной сердечной недостаточностью. Интересно, что у всех собак с
ПОЧЕЧНЫЕ ГОРМОНЫ И НАТРИУРЕТИЧЕСКИИ ГОРМОН ПРЕДСЕРДИЯ
829
этим заболеванием в дополнение к НПП (99-126) в крови присутствуют и другие молекулярные формы натриуретического пептида предсердия, включая прогормон, состоящий из 126 аминокислотных остатков (Vollmar et al, 1991). При застойной сердечной недостаточности действие НПП (концентрация которого возрастает по мере увеличения тяжести сердечного расстройства), направленное на усиление экскреции натрия и расширение сосудов, вступает в противоречие с действием ренин-ангиотензиновой системы, аргинин-вазопрессина и катехоламинов (Vollmar et al, 1994). Исследование застойной сердечной недостаточности у кавалер-кинг-чарлз-спаниеля показало, что концентрация НПП существенно не увеличивается до тех пор, пока не происходит декомпенсация хронической недостаточности двустворчатого клапана, обусловленной значительным увеличением размеров левых предсердия и желудочка (Haggstrom et al, 1994). Таким образом, повышение концентрации НПП в крови может быть следствием сердечной недостаточности, а не первичной причиной этого расстройства. В то же время НПП может способствовать сохранению заболеваний, связанных с нарушениями регуляции объема. Увеличение концентрации НПП в крови при застойной сердечной недостаточности не является неожиданностью, так как экспериментальные исследования показали, что основным стимулом для его секреции служит растяжение предсердий (Dietz, 1984). При обезвоживании собак концентрация НПП уменьшается (Vollmar et al, 1994).
У собак с гиперкортицизмом концентрация НПП в плазме крови не увеличивается и остается на уровне 5,5 фмоль/мл, хотя у многих из них кровяное давление повышено (Vollmar et al, 1991; Ortega et al, 1994). Наличие у этих животных полиурии указывает на сохранение нормального объема, а небольшое снижение концентрации НПП, возможно, отражает контррегуляцию усиленного диуреза (Vollmar et al., 1991).
Качественные и количественные изменения концентрации НПП у собак позволяют предполагать, что этот пептид участвует в развитии и/или поддержании заболеваний, связанных с нарушениями регуляции объема (Vollmaret al., 1991).
ЛИТЕРАТУРА
Atarashi К, et al: Inhibition of aldosterone production by an atrial extract. Science 224:992, 1984.
Atlas SA, Maack T: Effects of atrial natriuretic factor on the kidney and the renin-angiotensin-aldosterone system. Endocrinol Metab Clin North Am 16:107, 1987.
Biglieri EG: The spectrum of mineralocorticoid hypertension. Hypertension 18:251, 1991.
Biglieri EG, et al: Endocrine hypertension. In Greenspan FS, Baxter JD (eds): Basic and Clinical Endocrinology, 4th ed. Norwalk, Conn, Appleton & Lange, 1994, p 347.
Cantin M, Genest J: The heart and the atrial natriuretic factor. Endocrinol Rev 6:107, 1985.
Cowgill L: Efficacy of recombinant human erythropoietin for anemia in dogs and cats with renal failure. J Vet Intern Med 4:126, 1990 (abstract).
Cowgill L: Pathophysiology and management of anemia in chronic progressive renal failure. Semin Vet Med Surg 7:175, 1992.
Cowgill L: Medical management of the anemia of chronic renal failure. In Osborne C, Finco D (eds): Canine and Feline Nephrology and Urology. Philadelphia, Lea & Febiger, 1995.
DeBold AJ, et al: A rapid and potent natriuretic response to intravenous injection of atrial myocardial extract in rats. Life Sci 28:89, 1981.
Dietz JR: Release of atrial natriuretic factor from rat heart-lung preparation by atrial distension. Am J Physiol 247:R1093, 1984.
Dzau VJ, et al: Molecular biology of the renin-angiotensin system. Am J Physiol 255:F563, 1988.
Edwards BS, et al: Atrial natriuretic factor: Physiologic actions and implications in congestive heart failure. Cardiovasc Drugs Ther 1:89, 1987.
Erslev AJ: Erythropoietin. N Engl J Med 324:1339, 1991.
Genest J, Cantin M: The atrial natriuretic factor: Its physiology and biochemistry. Rev Physiol Biochem Pharm 110:1, 1988.
Gerbes AL, Vollmar AM: Degradation and clearance of atrial natriuretic factors. Life Sci 47:1173, 1990.
Goetz KL: Physiology and pathophysiology of atrial peptides. Am J Physiol 254:E1, 1988.
Haggstrom J, et al: Plasma concentration of atrial natriuretic peptide in relation to severity of mitral regurgitation in Cavalier King Charles Spaniels. Am J Vet Res 55:698, 1994.
Kater CE, et al: Stimulation and suppression of the mineralocorticoid hormones in normal subjects and adrenocortical disorders. Endocr Rev 11:149, 1989.
Krieger JE, Dzau VJ: Molecular biology of hypertension. Hypertension 18(Sup-pl):13,1991.
Laragh JH: Atrial natriuretic hormone, the renin-aldosterone axis, and blood pressure: Electrolyte homeostasis. N Engl J Med 313:1330, 1985.
Mantero F, et al: New aspects of mineralocorticoid hypertension. Horm Res 34:175, 1990.
Melby JC: Diagnosis of hyperaldosteronism. Endocrinol Metab Clin North Am 20:247, 1991.
Needleman P, et al: The biochemical pharmacology of atrial peptides. Annu Rev Pharmacol Toxicol 29:23, 1988.
Nissenson A, et al: Recombinant human erythropoietin and renal anemia: Molecular biology, clinical efficacy, and nervous system effects. Ann Intern Med 114:402, 1991.
Ortega T, et al: Evaluation of arterial blood pressure and urine proteinxreati-nine ratio in dogs with hyperadrenocorticism. J Vet Intern Med 8:164, 1994 (abstract).
Pickering TG: Renovascular hypertension: Medical evaluation and nonsurgical treatment. In Laragh JH, Brenner BM (eds): Hypertension: Pathophysiology, Diagnosis, and Management. New York, Raven Press, 1990.
Polzin DJ, et al: Chronic renal failure. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders, 1995, p1734.
Sujimoto EKS, et al: Effect of ANP in circulating blood volume. Am J Physiol 257:R127, 1989.
Ulick S: Two uncommon causes of mineralocorticoid excess: Syndrome of apparent mineralocorticoid excess and glucocorticoid-remediable aldosteronism. Endocrinol Metab Clin North Am 20:269, 1991.
Vollmar AM, et al: Atrial natriuretic peptide concentration in dogs with congestive heart failure, chronic renal failure, and hyperadrenocorticism. Am J Vet Res 52:1831, 1991.
Vollmar AM, et al: Atrial natriuretic peptide and plasma volume of dogs suffering from heart failure or dehydration. J Am Vet Med Assoc 41:548, 1994.
Часть VII
РЕПРОДУКЦИЯ СУК
ОВАРИАЛЬНЫЙ ЦИКЛ...............832
Начало полового созревания.....832
Сезонность и овариальный цикл...832
Интервалы между овариальными циклами............833
Фазы овариального цикла.........833
Проэструс......................833
Классификация клеток влагалища..839
Глава 19
ПОЛОВОЙ ЦИКЛ И
ЦИТОЛОГИЯ ВЛАГАЛИЩА
Цитология влагалища в проэструсе.... 840
Эструс..........................843
Диэструс........................848
Анэструс........................851
ЭКСФОЛИАТИВНАЯ ЦИТОЛОГИЯ ВЛАГАЛИЩА.......................852
Способы и методы приготовления влагалищных мазков..............852
Метод ватного тампона...........852
Красители.......................853
Клиническое значение эксфолиативной влагалищной цитологии............854
Ограничения применения цитологического исследования влагалища........................857
ОВАРИАЛЬНЫЙ ЦИКЛ
Начало полового созревания
Время наступления первой течки у сук зависит от породы. Обычно первый овариальный, или астральный, цикл начинается через несколько месяцев после того, как собака достигает роста и массы тела взрослых животных. Однако эти сроки не одинаковы у разных пород и значительно колеблются в пределах каждой породы. Например, у сук породы бигль первый проэструс (предтечковая стадия) обычно начинается в возрасте 7-10 месяцев. Но даже в контролируемых лабораторных условиях течка может начаться раньше (в 6 месяцев) или позднее (в 13 месяцев) (Concannon, 1987). Поэтому владельцы сук ряда мелких пород должны знать о возможном начале течки у их питомцев в 6-10-ме-сячном возрасте. У здоровых сук крупных пород первый проэструс иногда наступает в первый год жизни, но в ряде случаев задерживается до 18-24-месячного возраста. Имеется довольно много сообщений об индивидуальных и породных колебаниях этого срока. Такая естественная вариабельность в сочетании с наличием «скрытых течек» затрудняет точное определение времени наступления у сук первого эстрального цикла (Corman, 1980; Evans, White, 1988; Johnston et al, 2001).
«Скрытой» называют такую течку, которая проходит незамеченной из-за недостаточной выраженности изменения поведения суки, слабых увеличения вульвы и кровянистых выделений из половых органов, отсутствия привлечения кобелей. «Скрытой» течка чаще бывает у молодых сук. Личный опыт заводчика, длина волосяного покрова собаки (кровянистые выделения из наружных половых ор
ганов проще заметить у короткошерстных животных), чистоплотность суки (выделения из половых органов чаще остаются незамеченными у тех животных, которые тщательно вылизывают себя) и присутствие кобеля в том же доме - вот всего лишь несколько факторов, определяющих легкость установления начала течки у суки (Concannon, 1980). Мы не склонны рассматривать отсутствие течки у собак моложе 2-летнего возраста как нарушение нормального течения полового цикла (см. раздел «Бесплодие» в гл. 24). Сук лучше всего вязать в возрасте от 2 до 6 лет. Первую вязку рекомендуется проводить во время второй или третьей течки, т.е. после того, как владелец собаки проследит за нормальным течением, по меньшей мере, одного овариального цикла.
Сезонность овариального цикла
Половой цикл повторяется у сук 2-3 раза в год. Сезонность вязок зависит как от генетических факторов, так и от условий содержания собак. Предпочтительность вязок в конце зимы или ранней весной обоснована эволюционно, так как при этом щенение проходит в период года, когда и корм более доступен, и климатические условия лучше. Важны и субъективные факторы, определяющие выбор времени вязки сук. Очевидно, что щенение в октябре обеспечивает заводчика щенками для продажи на Рождество. Другие владельцы сук предпочитают, чтобы щенение произошло в конце зимы, что дает им возможность продать щенков весной. Сезонную приуроченность овариального цикла сук не следует отождествлять с сезонностью их вязок, которая определяется исключительно потребностями заводчиков. У собак течка, вязка и щенение возможны в
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 833
любой месяц года, но несколько чаще они происходят в конце зимы/начале весны, а также осенью.
Интервалы между овариальными циклами
«Среднестатистическая» сука вступает в фазу про-эструса с интервалом приблизительно в 7 месяцев. Если бы такая схема строго реализовалась, то на протяжении жизни сук их половой цикл приходился бы, по меньшей мере, один раз на каждый месяц года. Жизнь вносит в эту схему некоторые изменения. Межэстральный период (интервал между концом половой охоты и началом проэструса последующего овариального цикла) как правило, длится от 5 до 11 месяцев, хотя он может быть короче (до 3,5 месяцев) или длиннее (до 13 месяцев) (Concannon, 1987). Его слишком частое повторение (чаще, чем каждые 4 месяца) обычно связано с бесплодием, а чрезмерно большой межэстральный интервал - с бесплодием или пониженной плодовитостью. Продолжительность этого интервала в большой мере зависит от породы и индивидуальных особенностей собаки. Немецкая овчарка, например, относится к числу пород, у которых полноценный овариальный цикл происходит каждые 4-4,5 месяцев, и это не сказывается на ее плодовитости. Тем не менее, для упрощения мы обычно пренебрегаем индивидуальными колебаниями частоты повторения течек и считаем, что межэстральный период колеблется у здоровых сук от 5 до 11 месяцев, в среднем составляя 7 месяцев. Явным исключением из этого общего правила являются африканские породы собак, например, басенджи. У сук этих пород течка происходит один раз в год. В типичных случаях они щенятся в декабре, реже - в январе или ноябре.
У большей части сук в возрасте от 2 до 6 лет продолжительность эстральных циклов, а также их отдельных стадий относительно стабильна. По мере удаления от оптимального для вязок возраста (обычно к 7 годам) у сук обычно происходят различные изменения репродуктивных функций, включая прогрессирующее увеличение межэст-рального периода, уменьшение количества рождаемых щенков, повышение частоты врожденных уродств у приплода и возникновение проблем во время родов. По данным одного исследования, у сук породы бигль после достижения 8-летнего возраста межэстральный период продлевался в среднем с 240 до 330 дней, тем не менее, у здоровых сук овариальный цикл сохранялся на всем протяжении жизни (Anderson, Simpson, 1973).
Фазы овариального цикла
Овариальный цикл собак включает четыре фазы.
ПРОЭСТРУС. Эта фаза, считающаяся подготовительной, характеризуется усилением активности фолликулов яичника. Она предшествует течке. Кобели проявляют повышенный интерес к сукам,
находящимся в проэструсе, но те отказываются от вязки.
ЭСТРУС. В фазе эструса сука разрешают кобелю совершить садку и половой акт. Слово «эструс» заимствовано из греческого языка (pistrus) и означает «сильное желание», оно является синонимом термина «течка».
ДИЭСТРУС. Диэструс начинается сразу же после вязки. Он ассоциирован с активностью желтых тел яичников. У многих видов животных фазу полового цикла, следующую после течки (эструса), называют метэструсом, т.е. восстановительной фазой, подчеркивая тем самым ее физиологическое значение, состоящее в инволюции полового аппарата самки под влиянием желтых тел яичников. У сук, в отличие от самок многих других видов животных, стремление к повторным вязкам сохраняется несмотря на повышение в крови концентрации прогестерона. Этот гормон сначала синтезируется в лютеинизированных фолликулах, а затем в желтых телах яичников. Он оказывает доминирующее влияние во время эструса и диэструса. В фазе эструса сука стремится к вязке, а во время диэструса отказывается от нее. Поэтому термин «диэструс» в большей степени, чем название «метэструс», подходит для характеристики этой фазы уникального полового цикла суки, являющейся по своей сути фазой «физиологической беременности».
АНЭСТРУС. Период между концом прогестероновой фазы (диэструсом), когда активно функционируют желтые тела и проявляет свое влияние прогестерон, и следующей фазой (проэструсом), на которой формируются фолликулы яичников, называют анэструсом или фазой покоя. Последнее название подчеркивает, что на этой стадии падает активность оси гипофиз-яичники. Но хотя клинически фаза анэструса кажется неактивной, тем не менее, действие гормонов продолжается.
Проэструс
ПРОДОЛЖИТЕЛЬНОСТЬ. Наиболее надежным признаком начала проэструса служит появление кровянистых выделений из наружных половых органов суки. Этот период заканчивается, когда она начинает подпускать к себе кобелей, разрешая им совершать садки и половой акт. О начале и завершении проэструса можно судить также по такому дополнительному критерию, как изменение морфологии слизистой оболочки влагалища. Оценку ее морфологии проводят визуально посредством эндоскопии (рис. 19-1) или по результатам цитологического анализа влагалищных мазков (рис. 19-2). Значительно менее надежными признаками проэструса служат увеличение вульвы, привлечение кобелей и изменение поведения суки в отношении кобелей (рис. 19-3).
Время от начала проэструса до появления готовности суки к первой вязке обычно составляет 6-11 дней (в среднем 9 дней). Однако отклонения от такой
834 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Рис. 19-1. Влагалище суки, сфотографированное во время эндоскопии. V Краниальная часть влага шща в фазе анэструса. В центре виден каудальный бугорок дорсальной срединной складки влагалища. Б. Краниальная часть влагалища на стадии раннего проэструса. Дорсальная медиатьная складка влагалища ви ща в боковом ракурсе. В слизистой оболочке образуются новые складки. В проэструсс она становится более отечной. В. Краниальная часть влагалища в раннем проэструсс. Обратите внимание на отечные складки слизистой оболочки. Г. Краниальная часть влагалища в конце течки (вид сбоку). Во время эструса слизистая оболочка имеет «ребристую» морфологию. В конце эструса многие складки слизистой оболочки сморщиваются и приобретают «ребристый» внешний вид. Д. Краниальная часть влагалища в первый день диэструса (первый день после окончания течки). Е. Краниальная часть влагалища с полностью сформированной «розеткой», которую можно обнаружить при эндоскопии на стадии диэструса
«нормы» могут быть достаточно большими - в одних случаях проэструс сокращается до 2-3 дней, а в других увеличивается до 25 дней (рис. 19-4). Такие колебания продолжительности проэструса часто затрудняют определение стадии полового цикла. Чем это чревато, более детально будет обсуждаться при рассмотрении проблемы бесплодия сук в гл. 24.
Клинические признаки. Суки начинают привлекать к себе кобелей на начальной стадии проэструса. Отчасти это происходит благодаря секреции
феромона (Goodwin et al, 1979). В этот период суки заигрывают с кобелями, дразнят их, но не позволяют им делать садку (Jeffcoate el al, 1979). Предложение кобеля совершить половой акт отвергается уходом в сторону, рычанием, оскаливанием и щелканьем зубами. Сука старается плотнее прижать свой хвост к промежности между задними конечностями, прикрывая им наружные половые органы. По мере развития проэструса форма поведения постепенно меняется. Сука обычно становится бо-
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
835
Ранний
Середина среднего
Последний день эструса
Остальные дни
Парабазаль-ная клетка
Конец середины
Ватный тампон
ДИЭСТРУС 56-60 дней
Сходные результаты цитологического исследования на всем протяжении течки
Первые несколько дней
ЭСТРУС 5-9 дней
ПРОЭСТРУС 6-11 дней
АНЭСТРУС 4— несколько месяцев
Мелкая промежуточная клетка
9? с го • _
8 го и * £2 £
Часто без лейкоцитов
Безъядерная поверхностная клетка (чешуйка)
Ядерная поверхностная клетка
Рис. 2-19. Иллюстрация изменений толщины стенок влагалища, цитологии влагалища и концентрации эстрогена в плазме крови у среднестатистической суки в эстральном цикле. Обратите внимание на слущивание большого количества вагинальных клеток приблизительно в последнип день эструса.
Нейтрофил
Поверхностная промежуточная клетка
Крупная промежуточная клетка
Агрессивное । Избега- | Привлечение Позитив-негативное |^ассивное I ное поведение (коитус) поведение ‘поведение1
Привлечение----------------
Агрессивное “негативное поведение Привлечение “ отсутствует
Рис. 19-4. Время овуляции (или предполагаемого начала проявления характерного для эструса поведения) у 50 сук, рассчитанное по концентрации прогестерона в сыворотке крови. В обследованную группу входило более 20 пород. Из: Lohnston SD et al, 2001, публикуется с разрешения.
I-----Проэструс
Эструс-------Н Диэструс
Рис. 19-3. Схема изменений поведения, гормональных флуктуаций и цитологии влагалища у сук в проэструсе и эструсе.
лее отзывчивой к внешним раздражителям, связанным с кобелями. Она сама начинает искать встреч с кобелями, и, оказавшись рядом с ними, ведет себя игриво. Прежнее стремление избежать контактов с кобелями постепенно становится менее выраженным и активным: для избежания садки она отходит от кобеля, припадает к земле или ложится. В конце проэструса лове юние суки принимает пассивный характер, и она нередко продолжается спокойно сидеть, когда кобель делает садку. При этом сука часто (хотя и не всегда) прогибает спину и отводит хвост в сторону.
Обычно, но не всегда, в фазе проэструса начинаются разной интенсивности кровянистые выделения из наружных половых органов. Эти выделения являются результатом происходящего в эндометрии и субэпителиальных тканях матки диапедеза (вы
хода эритроцитов через неповрежденную стенку кровеносных сосудов). В дальнейшем этот процесс усиливается за счет разрушения стенок капилляров шдометрия. Кровь проникает через находящуюся в состоянии частичного расслабления шейку матки и попадает в просвет влагалища. Небольшое количество эритроцитов добавляется к кровянистым выделениям непосредственно из слизистой оболочки влагалища - об этом свидетельствует обнаружение эритроцитов во влагалищных мазках, сделанных у ранее гистерэктомированных сук, находящихся на стадии проэструса (Johnston et al. 2001). Быстрое изменение толщины слизистой оболочки влагалища и эндометрия, сопровождающееся активной пролиферацией клеточных элементов, регулируется эстрогенами, секретируемыми фолликулами яичников. Интенсивность кровотечения и объем
836 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
выделяющихся из влагалища кровянистых выделений у разных сук не одинаковы.
Основным клиническим признаком проэструса служат кровянистые выделения из наружных половых органов суки. Легкость их обнаружения зависит как от породы, так и от индивидуальных особенностей собаки. У короткошерстных и не имеющих длинного хвоста собак (например, у курцхаара) их заметить значительно проще, чем у длинношерстных сук с ниспадающим вниз хвостом (например, у ньюфаундленда). У животных, привыкших к поддержанию чистоплотности посредством вылизывания, установить проэструс бывает довольно сложно. Иногда появлению кровянистых выделений и набуханию вульвы предшествуют сероватые слизистые выделения. В классических случаях переход проэструса в эструс сопровождается постепенным переходом кровянистых выделений в прозрачные и имеющие соломенный цвет. Однако последовательность изменения цвета выделений из половых органов сук не носит постоянного характера, и у части из них истечения остаются кровянистыми на всем протяжении проэструса, эструса и начала диэструса, но бывают и такие случаи, когда необильные кровянистые выделения заметны только в самом начале проэструса.
Вульва. Во время проэструса наружные половые органы суки слегка увеличиваются в размере за счет аккумуляции жидкости в их тканях. Такой отек вульвы препятствует совершению кобелем полового акта. Однако по мере перехода проэструса в эструс вульва становится значительно мягче и препятствие для вязки устраняется.
Гормональные изменения и анатомия яичников. В проэструсе сука находится под доминирующим влиянием эстрогена (см. рис. 19-2), который синтезируется и секретируется развивающимися фолликулами яичников. В конце анэструса достигается сбалансированное высвобождение фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов. Переход анэструса в проэструс ассоциируется с повышением секреции ФСГ и последующим усилением секреции ЛГ (Kooistra, Okkens, 2000). Фолликулы яичников, которые развиваются в период интенсивной стимуляции гонадотропинами, созревают и начинают синтезировать и секретировать эстроген. Последний индуцирует появление выделений из влагалища, привлечение к суке кобелей и подготовку ее матки к плодоношению. Потенциальный эффект эстрогена можно продемонстрировать на овариогистерэкгомированных суках, которых посредством инъекций эстрогена легко удается перевести в состояние, характерное для типичного проэструса, но без выделений из влагалища (Concannon, 1987). Сам по себе эстроген обычно не индуцирует у собак активности, непосредственно связанной с репродукцией. Эта активность регулируется комбинированным снижением в сыворотке крови эстрогена и повышением концентрации прогестерона. Один только эстроген не
вызывает характерных для эструса изменений поведения суки (Leedy, 1988).
Состояние яичников на стадии проэструса можно контролировать с помощью ультразвукового исследования (УЗИ). Яичники суки в период анэструса выглядят, как структуры, имеющие эхогенность, приблизительно равную или слегка большую, чем корковая зона почек. Фолликулы яичников видны, как очаговые гипоэхогенные или вообще неэхогенные округлые образования. По мере развития фолликулов и соответствующего увеличения размеров яичников идентификация последних с помощью УЗИ во время проэструса облегчается (England, Allen, 1989; Wallace et al, 1992).
Интенсивное повышение концентрации эстрогена в плазме венозной крови на стадии проэструса коррелирует со значительными изменениями вульвы, матки и слизистой оболочки влагалища, а также с уровнем секреции гормонов фолликулами яичников и характером поведения суки. Во время анэструса концентрация эстрогена (эстрадиола) в циркулирующей крови обычно колеблется от 5 до 15 пг/мл, а в проэструсе она поднимается выше 15 пг/мл. В период раннего проэструса она обычно превышает 25 пг/мл, а в конце проэструса может превосходить уровень 60-70 пг/мл. Концентрация эстрадиола в плазме крови достигает своего максимального значения за 24-48 часов до окончания фазы проэструса и начала течки (фазы половой охоты).
Снижение концентрации эстрадиола в плазме крови влечет за собой начало фазы эструса. В течение последующих 5-20 дней концентрация эстрадиола в плазме крови постепенно уменьшается до исходного (базального) уровня. Поэтому проэструс можно считать такой фазой овариального цикла, на которой вначале происходит повышение, а затем стабилизация концентрации эстрогена в сыворотке крови, а эструс - периодом снижения концентрации эстрогена в сыворотке крови. В анэструсе и диэст-русе концентрация эстрогена в крови находится на базальном уровне, который у разных собак может быть неодинаковым (Olson et al, 1982). Концентрация тестостерона повышается в сыворотке крови сук в конце проэструса, достигая 0,3-1,0 нг/мл во время, когда активность ЛГ в крови животных снижается до уровня, который был в начале течки (Olson et al, 1984).
Концентрация прогестерона на всем протяжении проэструса (за исключением последних 24-72 часов) остается на низком базовом уровне, который не превышает 0,5 нг/мл. Окончание проэструса и начало течки связано с повышением концентрации прогестерона в плазме крови выше критического уровня (1,0 нг/мл), в то время как концентрация эстрогена снижается. Для развития у суки характерного для течки поведения и поддержания развития беременности необходимо, чтобы концентрация прогестерона в сыворотке крови превысила 1,0 нг/ мл. Прогестерон секретируется фолликулами яичников; его образование прогрессирующе усилива
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 837
ется по мере лютеинизации последних перед овуляцией и образованием желтого тела. Таким образом, фолликулы яичников постепенно превращаются из «фабрики» по производству эстрогена (в раннюю и среднюю фазы проэструса) в «фабрику» по производству, главным образом, эстрогена и лишь небольшого количества прогестерона (в конце проэструса). По мере развития течки синтез прогестерона прогрессирующе усиливается, а синтез эстрогена снижается.
Анатомия матки, яйцеводов и молочных желез. Повышение концентрации эстрогена в сыворотке крови в проэструсе приводит к изменениям ряда чувствительных к этому гормону тканей. Эти изменения включают рост протоков и канальцев молочных желез, пролиферацию фимбрий и утолщение стенок яйцеводов, удлинение рогов матки, утолщение эндометрия, повышение чувствительности мышечного слоя матки, расширение шейки матки, удлинение влагалища и утолщение его стенки за счет пролиферации, а также усиление синтеза гепатических ферментов, принимающих участие в метаболизме стероидов (Concannon, DiGregorio, 1986; Concannon, 1987). Подготовка к имплантации яйцеклеток в эндометрии включает значительное увеличение толщины стенки матки и активности желез ее слизистой оболочки, т.е. изменения, связанные с появлением выделений из наружных половых органов. Маточное кровотечение служит основным источником выделений из влагалища перед течкой, а у некоторых сук - и во время течки.
Анатомия влагалища и эндоскопия. Повышение концентрации эстрогена влечет за собой утолщение стенки влагалища, что защищает половые органы суки от травм во время вязки. На стадии анэструса влагалище в значительной степени подвержено травмам, поскольку изнутри выстлано всего лишь несколькими слоями клеток. Базальный (герминативный) слой образован самыми старыми клетками, а более молодые клетки располагаются в поверхностных частях слизистой оболочки этого органа в большем отдалении от кровеносных сосудов, которые находятся ниже герминтативного слоя. Повышение в крови концентрации эстрогена в фазе проэструса влечет за собой быстрое размножение клеток слизистой оболочки влагалища и увеличе-Ние количества их слоев, которое к концу проэструса достигает 20-30 (Johnston et al, 2001). Благодаря этому проникновение полового члена кобеля в выстланное многослойным эпителием влагалище суки не причиняет значительных повреждений.
Описанный процесс образования многослойной эпителиальной выстилки влагалища сопровождается постепенным отодвиганием клеток поверхностных слоев от кровеносных сосудов, что ведет к ускорению их гибели. Погибшие клетки снижают чувствительность слизистой оболочки влагалища и защищают подлежащие клеточные слои от механических воздействий. Это достигается не только утолщением слизистой оболочки влагалища, но
также аккумуляцией кератина в отмирающих клетках, аналогично тому, как это происходит при образовании когтевых пластинок. Утолщение слизистой оболочки влагалища легко устанавливается на основании результатов цитологического исследования влагалищных мазков (рис. 19-2). Его можно также определить с помощью вагиноскопии. Методика ее проведения проста и не требует применения седативных препаратов, если у суки нет значительных нарушений анатомического строения преддверия влагалища. Однако для этого требуются определенные, приобретаемые с опытом навыки. Перед введением вагиноскопа предварительно проводят пальпацию входа во влагалище с тем, чтобы исключить наличие в нем сужений - стриктур (см. гл. 25). Переднюю и среднюю части влагалища визуально обследуют с помощью жесткого педиатрического проктоскопа или гибкого эндоскопа. Более дешевый проктоскоп является прекрасным инструментом для вагиноскопии. Отоскопы абсолютно непригодны для этой цели - они позволяют осматривать только преддверие влагалища. Слизистая оболочка влагалища во время анэструса уплощена из-за того, что в этот период она образована относительно небольшим количеством слоев клеток (см. рис 19-1).
Во время проэструса слизистая оболочка влагалища обычно выглядит гладкой, ровной, отечной и блестящей (Jeffcoate, 1988). Ее складки окрашены в розовый цвет и волнообразно ниспадают в просвет влагалища вследствие задержки в них жидкости, что затрудняет осмотр просвета органа (Goodman, 2001).Снижение концентрации эстрогена и повышение концентрации прогестерона в крови в последние 1-3 дня проэструса (или в первые дни эструса у некоторых сук) вызывают набухание слизистой оболочки влагалища. Благодаря этому растянутая слизистая оболочка постепенно становится все более складчатой и как бы «зазубренной» (см. рис. 19-1). Данный феномен называют «кренуля-цией» (от английского «crenulate» - зазубренный). Первоначально (в течение 24 часов после начала предовуляторного повышения концентрации ЛГ в крови) происходит легкое сморщивание слизистой оболочки влагалища (Lindsay, Cocannon, 1986; Concannon, 1987; Jeffcoate, 1998).
Повышение концентрации ЛГ в крови, в свою очередь, начинается приблизительно за 24-48 часов до овуляции. В это время следует начинать вязки. Сочетание усиления кренуляции с уплощением складок слизистой оболочки, вызванной снижением ее отека, ведет к постепенному расширению просвета влагалища. Морщинистость слизистой оболочки влагалища наиболее выражена в течение 4-7 дней после пика ЛГ. Во время диэструса оболочка уплощается и приобретает неравномерную окраску. Затем вследствие прогрессирующего исчезновения многослойное™ выстилающего влагалище эпителия слизистая оболочка вновь становится легко травмируемой, в связи с чем при проведении в это время вагиноскопии нередко бывают поверхност-
838 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Б
Рис. 19-5. А. Парабазальные клетки (одна из них указана изогнутой стрелкой) и нейтрофилы (обозначены прямой и,редкой) во влагалищном мазке. Б. Парабазальные/мелкие промежузочные клетки во влагалищ-НОМ МЯЗКС.
Рис. 19-6. Промежуточные клетки во влагалищном мазке. Стрелка указывает на одну из наиболее типич ных крупных промежуточных клеток.
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 839
ные кровоизлияния (Goodman, 2001). По мере приобретения опыта и накопления информации об индивидуальных особенностях изменений цитологии влагалища у разных сук, вагиноскопия становится удобным способом определения оптимального времени проведения вязки.
Классификация клеток влагалища
Общие сведения. Во время проэструса и эструса под воздействием повышающейся концентрации циркулирующего в крови эстрогена происходят изменения в слизистой оболочке влагалища, а именно эксфолиация - отслоение клеток от эпителиальной выстилки. Предполагается, что это происходит исключительно из-за повышения уровня эстрогена. На этом основании результаты цитологического исследования влагалищных мазков могут служить хотя и весьма ориентировочным, но все-гаки приемлемым методом непрямой оценки концентрации эстрогена в крови сук.
Классификация клеток влагалища основана на их морфологии. В старой литературе их делили на кератинизированные и некератинизированные илли ороговевшие и неороговевшие клетки. У самок некоторых видов животных отчетливо прослеживается тенденция к образованию прочной кератиновой выстилки влагалища под влиянием повышающейся концентрации эстрогена в крови. Однако у сук формирования ороговевшей выстилки влагалища не происходит, и для них упомянутая выше система классификации клеток влагалища нс годится. Различные типы клеток, обнаруживаемые во влагалищных мазках сук, находятся на разных стадиях отмирания. При отмирании округлая эпителиальная клетка слизистой оболочки влагалища становится крупнее и приобретает менее правильную форму. Ядра в эпителиальных клетках влагалища также претерпевают при этом морфологические изменения, соответствующие процессу отмирания: они постепенно уменьшаются в размере и сморщиваются перед тем как подвергнуться окончательной дезинтеграции. В результате сначала остается «тень» ядра, а затем клетка превращается в безъядерную (см. рис. 19-2).
Парабазальные клетки. Парабазальные клетки являются наиболее жизнеспособными и мелкими клетками слизистой оболочки влагалища. Они имеют округлую или слегка овальную форму, относительно небольшое количество цитоплазмы и большое, содержащее многочисленные везикулы ядро. Эти клетки обычно хорошо окрашиваются красителем Райта-Гимза и другими быстро красящими красителями (например, дифф-квиком, производства American Scientific Products, США). Парабазальные клетки локализуются немного поверхностнее базального слоя клеток, что обеспечивает их близость к кровеносным сосудам (рис. 19-5).
Промежуточные клетки. Размер клеток этого типа весьма вариабелен - одни из них лишь слег-
Рис. 19-7. Поверхностные влагалищные эпителиальные клетки, имеющие угловатый контур и пикнотичное ядро Стрелка указывает на изгиб клетки, вызывающий изменение плотности се цитоплазмы
ка крупнее парабазальных клеток, но другие могут быть крупнее последних в 2 раза. Промежуточные клетки гладкие, овальные или округлые, имеют неровные очертания и содержащее везикулы ядро, которое, однако, меньше, чем у парабазальных клеток (рис. 19-6). Такие изменения морфологии указывают на начальные этапы процесса клеточного отмирания: клетки становятся крупнее за счет увеличения количества цитоплазмы, но при этом их ядра уменьшаются в размере. С целью упрощения описания морфологии клеток данного типа их принято делит ь на мелкие и крупные промежуточные клетки.
Поверхностные клетки. Поверхностные клетки представляют собой мертвые клеточные >ле-менты, которые выстилают влагалище сук в период эструса. Это самые крупные из обнаруживаемых во влагалищных мазках клетки. Поверхностные клетки уплощены, имеют весьма заостренную форму, угловатые контуры цитоплазмы и мелкие, сморщенные, частично лизированные ядра или вообще не содержат ядер (рис 19-7).
Поверхностные промежуточные клетки. У этих влагалищных клеток имеется относительно нормальное по морфологии ядро с везикулами, но в целом по внешнему виду (угловатым контурам, заостренности, уплощенности границ цитоплазмы) они являются типичными поверхностными клетками (Olson et al, 1984b; Olson, 1989) (рис. 19-8). Поверхностные промежуточные клетки - одно из подтверждений влияния эстрогена на шителиаль-ную выстилку влагалища. В еще большей степени на повышение активности эстрогена указывает увеличение количества поверхностных клеток и безъядерных клеток-чешуек. В период максимального проявления действия эстрогена при эксфолиативных цитологических исследованиях влагалища сук могут обнаруживаться только одни поверхностные
840 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Рис. 19-8. Влагалищный мазок, на котором видны мелкая промежуточная клетка (изогнутая стрелка) и две разные поверхностные промежуточные клетки, одна из которых мелкая (темная стрелка), а другая крупная (светлая стрелка). Наличие бактерий в мазке не считается отступлением от нормы.
промежуточные клетки. Ни в одном из проведенных до настоящего времени исследований не было выявлено связи между отсутствием поверхностных клеток во влагалищных мазках сук и проблемами, связанными с вязкой или способностью к воспроизведению потомства.
Безъядерные клетки-чешуйки. Эти крупные, мертвые, неправильной формы клетки не содержат ядер. Они представляют собой конечную фазу отмирания, которая начинается уже в парабазальных клетках. Их смерть запрограммирована утолщением эпителиальной выстилки влагалища. По мере того, как в ответ на воздействие высокой концентрации эстрогена в крови стенка влагалища утолщается за счет замены нескольких слоев эпителиальных клеток 20-30 слоями, поверхностные клетки все больше удаляются от кровеносных сосудов, что делает их гибель неизбежной (рис. 19-2). Они крупные, плоские с угловатыми контурами (рис. 19-9). Безъядерные клетки-чешуйки, или безъядерные поверхностные клетки, часто называют «полностью ороговевшими» или «полностью кератинизированными» клетками.
Метэстральные клетки. Метэстральные клетки обычно крупнее промежуточных вагинальных клеток. В их цитоплазме часто находят один или большее количество нейтрофилов (рис. 19-10). Как будет сказано ниже, метэстральные клетки, как правило, обнаруживают во влагалищных мазках в начале диэструса или в случаях вагинита. Значительно реже такие клетки встречаются в начале проэструса.
«Пенистые» клетки. Пенистыми называют парабазальные и промежуточные клетки, которые имеют многочисленные хорошо заметные цитоплазматические вакуоли. Такие клеточные элементы обычно появляются на стадиях диэструса и анэструса.
Цитология влагалища в проэструсе
Начало проэструса. Клеточный состав влагалищных мазков, сделанных у сук в начале проэструса и на стадии анэструса, очень сходен, за одним лишь исключением - в мазках, взятых в начале проэструса, присутствует кровь, которая попадает во влагалище из быстро пролиферирующего эндометрия (см. рис 19-2). Приготовленные на стадии проэструса влагалищные мазки, помимо эритроцитов, обычно содержат многочисленные парабазальные, мелкие и крупные промежуточные вагинальные эпителиальные клетки. Частой находкой являются нейтрофилы и бактерии, присутствующие в мазках в разных количествах (рис. 19-11, табл. 19-1). Мазки на пой стадии обычно имеют гранулярный пли «грязный» фон. что обусловлено наличием в них вязких секретов шейки матки и влагалища, которые слабо окрашиваются красителями.
Середина проэструса. Первые признаки продолжительного воздействия эстрогена на репродуктивный тракт сук могут быть выявлены при цитологическом исследовании влагалищных мазков. Эти изменения включают: (1) исчезновение нейтрофилов; (2) появление эритроцитов; (3) прогрессирующее повышение относительного количества поверхностных клеток при одновременном уменьшении количества мелких парабазальных и промежуточных клеток. Предполагается, что лейкоциты попадают в просвет влагалища из его слизистой оболочки. Нейтрофилы утрачивают способность преодолевать утолщенную под воздействием эстрогена стенку влагалища и мигрируют в просвет влагалища. В норме во влагалищных мазках, начиная с середины проэструса и до начала диэструса, нейтрофилы отсутствуют (рис. 19-12).
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
841
Рис. 19-9. Влагалищный мазок, на которой видны безъядерные поверхностные клетки-чешуйки Обратите внимание на угловатые контуры клеток и их слабую окрашиваемость. Бактерии часто обнаруживают во влагалищных мазках > хоровых сук.
Рис. 19-10. Вла1 алищный мазок, на котором видна о хна влагалищная шигслиальная клетка с нейтрофилом в цитоплахме (мстэстратьная клетка; указана изогнутой стрелкой). Также видны поверхностные промежуточные клетки (укаханы прямыми стрелками)
ТАБЛИЦА 19-1. ЦИТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ВЛАГАЛИЩА СУК НА РАЗНЫХ СТАДИЯХ ЭСТРАД ЬНОГО ЦИКЛА.
Фаза ’ОИТрОЦИ'Ы Нейтрофилы Бактерии Эпителиальные клетки
Начало про эструса Обычно присутствуют Часто присутствуют Много Парабазальные, промежуточные, поверхностные промежуточные, небольшое количество поверхностных клеток
Конец проэструса Обычно присутствуют В небольшом ко 1ИЧСС1-вс или отсутствуют Много Поверхностные промежуточные, поверхностные К JCTKH
Эструс Присутствуют, но иногда в низком количестве. Могут отсутствовать. Отсутствуют Много Свыше 80-90° о поверхностных клеток
Диэструс Обычно отсутствуют От небольшого до большого количества Могут отсутствовать Парабазальные и промежуточные эпителиальные клетки преобладают. Интенсивное повышение количества поверхностных клеток.
842 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Рис. 19-11. Влагалищный мазок, исследованный с помощью сканирующей микроскопии. Видны нейтрофилы (прямая стрелка), эритроциты (светлая стрелка) и вагинальные эпителиальные клетки, относящиеся преимущественно к промежуточному типу (загнутая стрелка). Этот мазок типичен для раннего проэструса.
Рис. 19-12. Влагалищный мазок, исследованный с помощью сканирующей микроскопии. Видны эритроциты (прямая стрелка) и вагинальные эпителиальные клетки, относящиеся к промежуточному типу (загнутая стрелка). Присутствие некоторого количества нейтрофилов (гарпунообразная стрелка) делает цитологическую картину похожей на наблюдаемую в середине проэструса.
Конец проэструса. В конце проэструса нейтрофилы во влагалищных мазках отсутствуют, фон мазков прозрачен, а количество эритроцитов в них вариабельно. Важно запомнить, что у одних сук кровянистые истечения выделяются из влагалища на протяжении всего лишь нескольких дней проэструса, а могуч вообще не появиться, у большей части выделения происходят на протяжении всего проэструса, у третьих - на стадиях проэструса и эструса, и, наконец, у небольшого количества сук выделения появляются в проэструсе, продолжаются в эструсе и сохраняются в диэструсе. Знание таких особенностей клинического проявления овариаль
ного цикла у здоровых сук позволяет их владельцам избежать лишних волнений.
Более 80% отслоившихся от слизистой оболочки влагалища клеток являются поверхностными. У части из них ядра вакуолизированы, сморщены или вообще отсутствуют (так называемые «безъядерные поверхностные клетки; рис. 19-13). Из-за сложности цитологической картины дифференцировать позднюю стадию проэструса (последние 1-8 дней проэструса) от эструса на основании исследования влагалищных мазков не представляется возможным (см. табл. 19-1). Кроме того, различная продолжительность проэструса (от 2 дней до 3 не-
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 843
Рис. 19-13. Влагалищный мазок, исследованным с помощью сканирующей микроскопии. Видны ядериые (светлая стрелка), и безъядерные (темная стрелка) поверхностные клетки. Этот мазок типичен для конца прозструса и начала течки.
дель) у здоровых сук может стать дополнительным затруднением для их владельцев, желающих определить, на какой стадии полового цикла находятся их питомцы.
Эструс (течка). Стадия ютруса соответствует периоду, в течение которого сука позволяет кобелю совершить садку и половой акт. Эструс начинается с того дня, когда становится возможной вязка, а заканчивается в день, когда сука перестает подпускать к себе кобелей. Определить окончание эструса можно также на основании результатов цитологического исследования влагалищных мазков (см. стр. 846).
Гирмональные изменения. За 1-2 дня до начала течки концентрация эстрогена в сыворотке крови достигает максимального уровня (см. рис. 19-1). В типичных случаях суки начинают проявлять признаки половой охоты только тогда, когда повышавшаяся до этого концентрация эстрогена в крови начинает снижаться. Снижение концентрация эстрогена отражает заключительный этап процесса созревания фолликулов я 1чников, что происходит за несколько дней до овуляции. Еще одним подтверждением значения снижения концентрация эстрогена служит тот факт, что парентеральное введение эстрогена овариогистерэктомированным сукам приводит к развитию у них в течение 3 дней поведенческих реакций характерных для проэструса, но не эструса. Из 9 овариогистерэктомированных сук, которым вводили эстроген на протяжении 9 дней, у трех типичное для эструса поведение появлялось за 1-2 дня до окончания курса гормона, а у большинства собак оно становилось выраженным только после последней дозы эстрогена. Другими словами, харакгсрнос для эструса поведение животных в этом эксперименте усиливалось по мере того, как концентрация эстрогена в их организме снижалась (Concannon, 1987).
Клетки фолликулов яичников за несколько дней до наступления проэструса начинают синтезировать прогестерон в чрезмерно большом количестве, превышающем необходимое для обеспечения нормального уровня образования эстрогена. На поздней стадии проэструса перед самым началом эструса в сочетании со снижением содержания эстрогена в крови происходит лютеинизация дополнительного количества фолликулярных клеток и секреция проюстерона постепенно увеличивается.
Одновременное повышение концентрации прогестерона и уменьшение концентрации эстрогена в сыворотке крови сук в последние дни проэструса стимулирует развитие двух важных событий. Первое заключается в изменении поведения: если в конце проэструса сука проявляла пассивное сопротивление вязке, то с наступлением течки она начинает стремиться к вязке. Второе, не менее важное событие, заключается в стимуляции гипоталамуса и гипофиза по механизму положительной обратной связи, что приводит к секреции ФСГ и. что имеет еще большее значение, секреции ЛГ в начале эструса (рис. 19-14).
Уровень прогестерона в сыворотке крови возрастает непосредственно перед повышением концентрации ЛГ в крови. Другими словами, способные синтезировать и секретировать прогестерон фолликулярные клетки активно функционируют в период, предшествующий появлению в яичниках желтых тел. Деятельность этих клеток приводит к первичному повышению концентрации прогестерона в последний день проэструса и проявлению сукой половой охоты. Такое повышение концентрации прогестерона (см. рис. 19-3) усиливает интенсивность и продолжительность проявления типичного для эструса поведения. В одном из экспериментов сукам вживляли содержащий прогестерон имплантат, а спустя 6 часов на протяжении 9 дней им вводили
844 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
о-гоицательная ° обратная
СВЯЗЬ
°°£вяэь ....
Проэструс
Эструс
Рис. 19-14. Влияние эстрогена и прогестерона на функцию гипоталамуса и гипофиза по механизму отрицательной и положительной обратной связи у здоровой собаки в проэструсе и эструсе.
эстроген. В результате у животных в течение 9 дней проявлялось характерное для течки поведение. Если собакам вводили эстроген без предварительного вживления содержащего прогестерон имплантата, то продолжительность проявления типичного для эструса поведения составляла всего 5 дней после прекращения парентерального введения эстрогена (Concannon, 1987). Результаты этого опыта свидетельствуют о том, что, как правило, для интенсивного проявления типичного для эструса поведения необходимо сочетание снижения концентрации эстрогена и повышения концентрации прогестерона в сыворотке крови (Olson et al, 1984с).
Снижение уровня эстрадиола на фоне повышения концентрации прогестерона также, по всей видимости, инициирует секрецию ЛГ у сук (Cocannon, 1987). Выброс ЛГ приводит в течение 24-48 часов к овуляции, после чего в яичниках формируются желтые тела. В первые дни эструса концентрация прогестерона в крови постоянно растет и после развития желтого тела продолжает повышаться еще на протяжении 1-3 недель.
Таким образом, с точки зрения гормональных изменений, эструс можно рассматривать, как период постепенного снижения концентрации эстрогена и прогрессирующего повышения концентрации прогестерона в крови, а также кратковременного (12-24-часового) всплеска секреции ЛГ (см. рис.19-3). В конце проэструса концентрация прогестерона в сыворотке крови обычно составляет 0,5-1,0 нг/мл, в то время как в анэструсе она ниже 0,5 нг/мл. Приблизительно за 24-48 часов до предовуляторного выброса ЛГ концентрация прогестерона в сыворотке крови поднимается выше 1,0 нг/мл, достигая уровня 2^4 нг/мл. В типичных случаях спустя 2 дня (во время овуляции) концентрация прогестерона в сыворотке крови составляет 4-10 нг/мл. Весь прогестерон, циркулирующий в крови сук в этот период, секретируется до развития желтых тел, о появлении которых в яичнике можно судить только через несколько дней после овуляции.
Концентрация прогестерона в сыворотке крови продолжает расти на всем протяжении эструса и затем в течение нескольких недель диэструса. Концентрация эстрогена (эстрадиола) в сыворотке за 1-3 дня до начала эструса достигает 70 пг/мл и выше, а на стадии эструса она постепенно снижается. Концентрация эстрогена, превышающая ее уровень в анэструсе, даже при снижении обеспечивает поддержание целого ряда типичных для стадии проэструса изменений. Когда концентрация эстрогена в сыворотке крови падает ниже базального уровня (< 15 нг/мл), эструс завершается. Это отражается на поведении суки, цитологических изменениях ее влагалищных мазков, толщине стенки влагалища, размере наружных половых органов и степени привлечения кобелей.
С точки зрения клиники, концентрация прогестерона в плазме крови здоровых сук и динамика ее изменения в период перехода проэструса в эструс имеют очень большое значение. В настоящее время доступны несколько коммерческих имму-ноферментных наборов, позволяющих проводить определение концентрации прогестерона в крови в лабораториях ветеринарных клиник. Порог чувствительности этих наборов составляет 1,2-5 нг/мл и выше 5 нг/мл (Synbiotics Corp., США). С их помощью ветеринарные лаборатории могут получать результаты анализов в течение короткого времени (менее суток). Как только у собак, находящихся в начале или середине проэструса, устанавливают снижение концентрации прогестерона в крови ниже уровня 1 нг/мл, у них начинают брать пробы крови для повторных анализов с интервалом в 1-3 дня, чтобы своевременно установить начало повышения концентрации этого гормона, что соответствует наступлению эструса. Чем чаще проводится отбор проб для анализов, тем более точную информацию получают о времени начала повышения концентрации прогестерона. На основании этой информации ветеринарные специалисты определяют оптимальные сроки проведения вязки и предполагаемую
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 845
дату родов (Hegstad, Johnston, 1989: Cain, 1991; Manothaiudom et al, 1995).
Было установлено, что у здоровых сук в проэст-русе происходит повышение концентрации тестостерона в сыворотке крови. Этот гормон достигает максимальной концентрации приблизительно к моменту преовуляторного выброса ЛГ и появления у сук первых признаков готовности к вязке. В последующем уровень тестостерона в крови снижается (Olson et al, 1984а). Оказывает ли тестостерон непосредственное воздействие на поведение сук, делая его типичным для течки, или он индуцирует секрецию ЛГ, пока не ясно. Возможно, этот гормон просто образуется из прогестерона в процессе стероидогенеза. Трансформация андрогенов в эстрогены в ЦНС может служить одним из механизмов, лежащих в основе проявления суками типичного для течки поведения (Olson et al, 1984а). Метаболизм андрогенов в ЦНС, ведущий к образованию эстрадиола, может также являться одним из механизмов регуляции высвобождения ЛГ, как это имеет место у самцов (Worgul et al, 1981; Olson et al, 1984a).
Яичники и матка. Описанные выше гормональные изменения во время эструса отражают характер одновременно происходящих анатомических изменений яичников. Начало эструса (проявление сукой половой охоты) связано с процессом окончательного созревания развивающихся фолликулов в яичниках. В этот период начинает снижаться синтез эстрогена при одновременном усилении образования прогестерона. Спонтанная овуляция происходит в течение 24 - 72 часов после выброса ЛГ. Количество высвободившихся из яичников и готовых к оплодотворению яйцеклеток во многом определяется породой собаки. Мелкие породы собак обычно дают небольшой приплод, поскольку у них овулирует относительно небольшое количество (от 2 до 10) яйцеклеток, в то время как у сук крупных пород овулирует от 5 до 15 яйцеклеток. Перед наступлением овуляции масса яичников достигает максимальной величины.
Увеличенные яичники с фолликулами можно визуально обследовать посредством УЗИ брюшной полости. При явной овуляции повторное с интервалом в сутки УЗИ позволяет установить снижение количества фолликулов в яичниках. Последние в этот период приобретают вместо присущей им овальной шарообразную форму. Через некоторое время после овуляции в яичниках обнаруживают цистозные, неэхогенные структуры, которые невозможно отличить от фолликулов даже при многократном повторном проведении УЗИ. Выявляемые в яичниках после овуляции структуры могут представлять собой неовулировавшие фолликулы, заполненные кровью или жидкостью желтые тела, а также кистозные лютеинизированные фолликулы. УЗИ позволяет точно определить, произошла ли овуляция (England, Allen, 1989а, 1989b; Wallace et al, 1992).
Считается, что все овулирующие фолликулы вскрываются в течение 24-96 часов (Jeffcoate,
1998). Хотя этот процесс происходит не одномоментно, тем не менее, все высвободившиеся яйцеклетки находятся на одной стадии развития, что обеспечивает в последующем одинаковые темпы развития всех эмбрионов (Johnston et al, 1982) (см. гл. 20). Овуляция является итогом исключительно чувствительного и сбалансированного каскада происходящих в организме процессов - снижения концентрации эстрогена, повышения концентрации прогестерона и ЛГ. Своевременно не достигшие зрелости фолликулы при повышении концентрации ЛГ не овулируют, а подвергаются атрезии. Это доказывает неверность предположения относительно того, что овулировавшие яйцеклетки суки способны ожидать своего оплодотворения более 4 дней.
Вскрывшиеся фолликулы быстро лютеинизируются. Разорвавшийся фолликул подвергается реорганизации, и из его клеточных компонентов формируется зрелое желтое тело, способное осуществлять синтез и секрецию прогестерона на протяжении 2 месяцев и более. Желтое тело в течение 10 дней после овуляции остается окрашенным в светлый оранжево-желтый цвет и его легко обнаружить на поверхности яичника.
Количество яйцеклеток в яичниках новорожденной суки приблизительно равно 700000. К моменту достижения животным половой зрелости оно снижается до 250000, к 5-летнему возрасту - до 30000, а к 10 годам остается всего лишь несколько сотен яйцеклеток. Плодовитость сук начинает закономерно снижаться после преодоления ими 7-летне-го рубежа. Однако полного прекращения половых циклов (менопаузы), как это бывает у женщин при климаксе, у сук обычно не происходит.
Для оценки сроков основных событий, происходящих у «среднестатистической» суки в период половой охоты, необходимо знать характер изменения ее гормонального статуса, время созревания фолликулов, наступления овуляции, развития желтого тела и динамику изменения поведения собаки. Изображенные на рис. 19-15 события наглядно показывают, что суки начинают проявлять типичное для половой охоты поведение, когда концентрация эстрогена снижается, а концентрация прогестерона возрастает (день 1). На следующий день происходит выброс ЛГ, а на третий день завершается процесс созревания фолликулов и продолжается секреция прогестерона лютеинизированными фолликулярными клетками. В период с 4 по 7 дни происходит овуляция. С 5 по 9 дни первичные ооциты превращаются во вторичные, которые могут быть оплодотворены. Таким образом, подготовка яйцеклеток к оплодотворению и их слияние со сперматозоидами происходит в период с 4 по 9 дни, а на 10-й день начинается стадия диэструса.
В течение всего этого периода матка продолжает готовиться к имплантации яйцеклеток. Выделение крови из сосудистой сети матки обычно, но не всегда, уменьшается или полностью прекращается, а развитие желез с повышенной васкуляризацией
846 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Проэструс
л Сперматозоиды способны оплодотворять яйцек-( летки в течение, по меньшей мере, 4-6 дней
(Отдельные яйцеклетки: оплодотворяются в течение 12-24 ч.) ПЕРИОД ОПЛОДОТВОРЕНИЯ
Первичные яйцеклетки высвобождаются из фолликулов в течение 24-48 ч _____________КАПАЦИТАЦИЯ____________
ОВУЛЯЦИЯ (продолжается 24-96 ч.) Т Т Т ---т ТГ— 4----------------------------5-6-7-8-9
Эструс (дни)
Диэструс
Рис. 19-15. Гормональные изменения и последовательность событий во времени при овуляции и оплодотворении у среднестатистической суки.
почти завершается. При тщательном обследовании матку можно прощупать через брюшную стенку; при этом определяют степень увеличения ее размера и толщины.
Продолжительность. Продолжительность течки обычно составляет 5-9 дней. Между тем, как и в случае проэструса, длительность этой стадии овариального цикла у здоровых сук весьма вариабельна. Течка может быть короткой (от 1 до 2 дней) или, наоборот, очень долгой (до 18-20 дней). У отдельных собак продолжительность эструса со второго по шестой годы жизни обычно не меняется от цикла к циклу. Однако из-за вариабельности внутри одной и особенно разных пород очень трудно предсказать, насколько длительным будет проэструс или эструс у определенного животного.
Клинические признаки. С приходом половой охоты у сук меняется поведение - они рефлекторно начинают разрешать кобелям совершать садку и вязку. В присутствии кобеля они часто припадают к земле, приподнимая промежность. Любое давление в области нижней части спины ведет к тому, что находящаяся в половой охоте сука отводит хвост в сторону и напрягает задние конечности настолько, чтобы выдержать массу тела кобеля во время садки. Сука может привлекать к себе кобелей, находящихся на значительном от нее расстоянии посредством выделения феромонов. В типичных случаях вульва, которая была увеличенной в период проэструса, становится мягкой и ненапряженной, что делает возможным введение в нее полового члена кобеля. В этот период выделения из наружных половых органов суки окрашены в соломенный или бледно-розовый цвет. Значительно реже они остаются кровянистыми.
В отдельных случаях влагалищные выделения содержат достаточно большое количество глюкозы и при исследовании с помощью диагностических полосок дают соответствующую положительную
реакцию. Причиной высокого содержания глюкозы в выделениях может быть повышенный уровень прогестерона, обусловливающий резистентность организма к инсулину, которая в свою очередь ведет к непереносимости углеводов (Ryan, Enns, 1988). Вагинальные выделения на стадии эструса образуются за счет экстрацеллюлярной жидкости матки, но тестирование последней осуществить технически сложно.
В период половой охоты сука может пассивно соглашаться на совершение вязки, но нередко она сама активно стремится к кобелям, привлекая к себе их внимание. Предполагается, что готовая к вязке сука отдает предпочтение доминантному кобелю, отвергая притязания других подчиняющихся ему кобелей. Поэтому совсем неплохой идеей является проведение вязки в доме, в котором живет кобель: в привычных условиях он будет чувствовать себя доминантным, а сука в непривычной обстановке станет более покорной и восприимчивой.
Цитологическое исследование влагалища. На всем протяжении половой охоты во влагалище не происходит заметных цитологических изменений (см. рис. 19-2). По результатам цитологического анализа влагалищных мазков не удается установить время пика ЛГ, овуляции или оплодотворения яйцеклетки.
Эксфолиативные цитологические изменения, происходящие во влагалище, скорее отражают изменение концентрации эстрогена в сыворотке крови, которая, хотя и снижается, но остается выше базального уровня. На долю поверхностных клеток и безъядерных клеток-чешуек приходится более 80% (иногда до 100° о) общего количества клеток, обнаруживаемых во влагалищных мазках. На этой стадии полового цикла нейтрофилов во влагалищных мазках обычно не обнаруживают, а эритроциты могут присутствовать, но не обязательно. Фон влагалищных мазков остается прозрачным из-за отсутс
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
847
твия гранулярного материала, который характерен для проэструса (рис. 19-16).
Имеются данные, что в фазе проэструса относительное количество поверхностных эпителиальных клеток во влагалищных мазках постепенно увеличивается, а промежуточные и парабазальные клетки исчезают. С началом половой охоты и в день выброса ЛГ практически все обнаруживаемые во влагалищных мазках клетки представлены безъядерными клетками-чешуйками. Эти безъядерные клеточные элементы сохраняются на всем протяжении половой охоты, оставаясь единственными эпителиальными клетками, обнаруживаемыми во влагалищных мазках в этот период.
Большинство исследователей, между тем, не наблюдали у здоровых сук столь простой и легко прогнозируемой цитологической картины По их
данным, в начале проэструса 40-60°о всех влагалищных эпителиальных клеток приходится на долю промежуточных клеток, а в середине проэс-груса 40-60° о клеток составляют поверхностные клетки. В последние 1-6 дней проэструса относительное количество поверхностных клеток (клеток со сморщенным ядром и/или безъядерных клеток-чешуек) возрастает до 60 80%. Что еще важнее, дальнейших изменений относительного количества поверхностных клеток (имеющих или нс имеющих ядра) в период с 3-4 дня перед началом половой охоты и до первого дня диэструса не происходит (см. рис. 19-2). Необходимо запомнить, что, как показали экспериментальные исследования, увеличение относительного количества поверхностных клеток до уровня 80-90° о всех клеток во влагалищных мазках, может произойти в любой день.
Рис. 19-16. Л. Влагалищный мазок, исследованный с помощью сканирующей микроскопии. Видны ядерные (изогнутая стрелка) и безъядерные (прямая стрелка) поверхностные клетки влагалища. Эритроциты и нейтрофилы отсутствуют. Фон чистый Такая цитологическая картина типична для течки сук. Б. Влагалищный мазок (увеличение х40). Видны ядерные (прямая стрелка) и безъядерные (изогнутая стрелка) поверхностные клетки влагалища, окруженные большим количеством эритроцитов (мелкая прямая стрелка) и бактерий (маленькая изогнутая стрелка). Сука пороты бигль, у которой были сделаны влагалищные мазки, находилась в фазе эструса. Ее вяжа произошла в день приготовления влагалищных мазков. В последующем она родила 11 здоровых щенков.
848 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
начиная с 6-го дня до и кончая 4-м днем после пика ЛГ (Olson, 1989).
Во время эструса происходят непредсказуемые минимальные колебания относительного количества поверхностных и безъядерных клеток (см. табл. 19-1). В последние дни проэструса и во время половой охоты относительное количество поверхностных клеток обычно не бывает ниже 60%, и, как правило, остается в пределах 90 -100%. Присутствие или отсутствие сморщенных ядер в поверхностных клетках не всегда коррелирует с изменениями концентрации гормонов в крови или наличием в яичниках фолликулов или желтых тел.
Цитологическое исследование влагалищных мазков является удовлетворительным методом косвенной оценки концентрации эстрогена в плазме крови. Влияние ранее имевшей место повышенной концентрации эстрогена на толщину стенок влагалища сохраняется, несмотря на снижение концентрации гормона до базального уровня, характерного для раннего диэструса. Можно предположить, что резкое изменение клеточного состава влагалищных мазков, наблюдаемое в первый день диэструса, совпадает с наступлением первых одного-двух дней снижения концентрации эстрогена в плазме крови до базального уровня.
Эндоскопия влагалища. Переключение фолликулов яичников в предовуляторном периоде с продукции эстрогена на продукцию прогестерона приводит к снижению отека и количества кровеносных сосудов слизистой оболочки влагалища, что становится причиной заметного изменения внешнего вида влагалища (Concannon, 1987). Выстилка просвета влагалища становится все более морщинистой или «зазубренной». Кренуляция может быть обнаружена опытным исследователем в течение 24 часов с момента начала пика ЛГ, который ассоциируется с началом течки (см. рис. 19-1).
Кренуляция - появление ребристых с острыми краями складок в слизистой оболочке влагалища, наиболее выражена в период между овуляцией и созреванием овоцитов или через 2-5 дней. Она начинается за 24 часа до выброса ЛГ и продолжается в течение 4-9 дней после пика ЛГ. Приблизительно к окончанию эструса слизистая оболочка влагалища становится более вялой и на ее поверхности появляются пятна белого и розового цвета (см. рис. 19-1). Таким образом, оптимальные сроки проведения вязки можно определять на основании вагинальной эндоскопии, цитологии влагалищных мазков, анализа изменения поведения суки и динамики секреции прогестерона. Это особенно важно в ситуациях, когда возможны только одна или две вязки с кобелем, или если проводится искусственное осеменение суки замороженной спермой (Lindsay, Concannon, 1986; Jeffcoate, 1998).
Диэструс
Определение. Диэструс - это следующая после эструса стадия овариального цикла, во время кото
рой влияние прогестерона проявляется в наибольшей степени. Диэструс начинается после прекращения половой охоты и заканчивается тогда, когда концентрация прогестерона в крови возвращается к базальному уровню (ниже 1,0 нг/мл). Альтернативным способом определения начала диэструса служит цитологическое исследование влагалищных мазков. Начало диэструса совпадает со значительными изменениями цитологии слизистой оболочки влагалища: если на стадии эструса относительное количество поверхностных эпителиальных клеток в мазке составляет 80-100%, то в диэструсе 80-100% клеток представлены парабазальными и промежуточными клетками.
Гормональные изменения. В начале эструса концентрация прогестерона в плазме крови поднимается выше 1-2 нг/мл, что значительно превышает базальный уровень ( >0,5 нг/мл), который имел место в конце проэструса. Такое повышение концентрации прогестерона вызвано активностью лютеинизированных клеток фолликулов яичников. После овуляции в яичниках в полостях вскрывшихся фолликулов образуются желтые тела, клетки которых способны синтезировать и секретировать прогестерон в течение всего периода беременности. Синтез гормона желтыми телами достигает максимума через 20-30 дней после овуляции, т.е. приблизительно через 2-3 недели после начала диэструса (Johnston, 1980). В течение последующих 1-2 недель концентрация прогестерона держится на уровне 15-90 нг/мл, который намного выше базального (Concannon et al, 1989).
Статистический анализ показывает, что у щен-ных сук концентрация прогестерона в крови становится выше, чем у нещенных, уже в первые несколько недель диэструса. Однако из-за значительных индивидуальных колебаний концентрацию прогестерона невозможно использовать для диагностики щенности. Это чрезвычайно важно. Все здоровые, не повязанные во время течки суки на каждом половом цикле проходят через стадию аналогичную ложной щенности, поскольку в их яичниках сформировались желтые тела, которые продолжают функционировать несмотря на отсутствие плодов (т.е. у них нет системы распознавания беременности). Желтые тела находятся в активном функциональном состоянии в течение всего нормально протекающего периода плодоношения и стадии диэструса - их сохранение в яичниках не зависит от наличия или отсутствия в матке плода (плодов). Более того, желтые тела в яичниках не забеременевших сук сохраняются дольше, чем во время плодоношения (Johnston et al, 2001).
После завершения диэструса, во время которого концентрация прогестерона в крови остается стабильно высокой, начинается постепенное и продолжительное снижение функциональной активности желтых тел. У щенных сук лютеальня фаза обрывается резко (приблизительно на 65 день после оплодотворения яйцеклеток), что является частью про
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 849
цесса подготовки организма к родам. Между тем у не ставших беременными собак лютеальная фаза угасает медленно и часто продолжается на 10-30 дней дольше, чем у щенных. Причины снижения лютеальной функции, как и ее неизбежного прекращения, остаются мало понятными. Желтые тела являются эндокринными железами с коротким жизненным ресурсом. С началом щенения под действием простагландинов они прекращают функционировать. Простагландины оказывают деструктивное воздействие только на дегенерирующие желтые тела, в то время как недавно сформировавшиеся желтые тела устойчивы к их лютеолитическому действию. Возможно, что простагландины являются единственным лютеолитическим фактором как у беременных, так и небеременных сук.
Было проведено несколько исследований по изучению механизмов гормональной регуляции цикличной активности желтых тел у собак. Поскольку уровень прогестерона в крови гистерэкгомирован-ных, щенных и невязанных сук на стадии диэструса приблизительно одинаков, то кажется маловероятным, что матка или маточные простагландины играют ключевую роль в физиологическом поддержании или регрессии желтых тел яичников (Olson et al, 1989; Johnston et al, 2001). Поскольку ЛГ обладает лютеотропным действием, функционирование желтых тел может зависеть от базального уровня секреции ЛГ в начальной стадии полового цикла (Concannon, 1980). Однако многие исследователи не считают ЛГ столь важным фактором регуляции активности желтых тел и отводят эту роль пролактину, на том основании, что он поддерживает желтые тела в функциональном состоянии во второй половине лютеальной фазы (Okkens et al, 1985а, 1985b, 1986, 1990; Concannon, 1987; Schaefers-Okkens, 1988).
Показано, что пульсирующий характер секреции гормона роста во время лютеальной фазы овариального цикла меняется, при этом его базальная концентрация в сыворотке крови повышается, а количество пульсов уменьшается. Предполагается, что это вызвано частичным угнетением секреции гипофизарного гормона роста в результате высвобождения этого гормона из молочной железы под действием прогестерона. Синтезируемый в молочной железе гормон роста инициирует пролиферацию и дифференцировку тканей молочной железы во время лютеальной фазы овариального цикла путем местного аутокринного/паракринного воздействия. Помимо этого, он может вызывать гиперпластические изменения эпителия матки и индуцировать состояние резистентности организма к инсулину (Kooistra et al, 2000).
Концентрация эстрогена в крови в начале диэструса обычно находится на базальном уровне, как и во время анэструса. Желтые тела на первых порах синтезируют только прогестерон. Однако в последние 1-2 недели плодоношения у сук наблюдается небольшое повышение концентрации эстрогена
(Concannon, 1987). Возможно, что некоторое усиление синтеза и секреции эстрогена происходит в соответствии со снижением концентрации прогестерона в крови собак - такое комплексное изменение гормонального статуса, по всей видимости, является подготовкой к началу щенения. В любом случае, столь невысокая концентрация эстрогена не может быть причиной привлечения кобелей к суке и развития других изменений (физиологических и поведенческих), происходящих на стадии проэструса. Не известно, имеют ли место сходные изменения концентрации эстрогена у небеременных сук.
Во время диэструса секреция гипофизарных ЛГ и ФСГ носит, по всей видимости, эпизодический характер и имеет минимальное значение. Средняя концентрация ЛГ слегка повышается в конце диэструса, но значение этого гормонального сдвига не ясно. Одним из важнейших гормонов на этой стадии является пролактин. Его концентрация в крови сук остается низкой во время анэструса, проэструса и эструса и начинает возрастать во второй половине диэструса по мере снижения концентрации прогестерона. По всей видимости, имеется обратно пропорциональная зависимость между концентрацией в сыворотке крови прогестерона и пролактина на всем протяжении беременности и в период, непосредственно предшествующий родам, у щенных сук, а также во время диэструса у небеременных сук. Предполагается, что увеличение молочной железы и повышение ее секреторной активности в диэстру-се вызваны действием пролактина (De Coster et al, 1983; Concannon, 1986).
В отличие от прогестерона, концентрация которого одинакова у невязанных, не забеременевших после вязки или гистерэкгомированных сук, активность иммунореактивного релаксина в сыворотке крови собак во время беременности и в ее отсутствие различна (Steinetz et al, 1989; Buff et al, 200). У небеременных сук на стадии диэструса концентрация релаксина в сыворотке крови не превышает 0,25 нг/мл, в то время как после 6-7 недель плодоношения она возрастает до максимального уровня и превышает 3 нг/мл. Если прогестерон у собак целиком образуется в яичниках, то основным местом синтеза релаксина является плацента (Tsutsui, Stewart, 1991).
Яичники и матка. На стадии диэструса желтые тела локализуются на поверхности яичников. Матка, независимо от того, была вязка или ее не было, отвечает на возрастание концентрации прогестерона пролиферацией железистых структур и расширением сети кровеносных сосудов, что необходимо для нормального течения беременности. Масса небеременной матки достигает максимальной величины приблизительно через 20-30 дней после начала половой охоты, когда концентрация прогестерона в крови максимальна. В раннем диэструсе различия между беременной и небеременной маткой незначительны. Через 17-21 день после оплодотворения в матке удается прощупать сферические тела пло-
850 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Рис. 19-17. А. Влагалищный мазок (увеличение х40). Видны бактерии, промежуточные клетки, нейтрофилы и метэстральная клетка (указана стрелкой), что позволяет предположить, что мазок сделан на стадии диэструса. Б. Влагалищный мазок (увеличение х40). Видны пласты крупных промежуточных эпителиальных клеток влагалища и несколько нейтрофилов. Скоп гения аналогичных клеток часто обнаруживают в первый день диэструса.
дов. По мере регрессии желтых тел и прекращения секреции прогестерона стадия диэструса заканчивается, и в матке начинаются процессы инволюции. Продолжительность инволюции матки у здоровых сук колеблется от 1 до 3 месяцев, что отражается на длительности мсжэстрального периода
Продолжительность. В диэструсс доминантное регулирующее действие оказывает прогестерон (его концентрация повышается). Диэструс продолжается 56-58 дней и 60-100 дней соответственно у щенных и нещенных сук. Желтые тела яичников быстрее перестают функционировать у щенных сук, чем у нещенных, что, по всей видимости, связано с действием простагландинов. Растущие в матке плоды стимулируют синтез простагландинов, в отсутствие плодов этого не происходит
Клинические признаки. Диэструс начинается тогда, когда сука, ранее проявлявшая склонность к вязкам, начинает отвергать притязания кобелей и
больше нс привлекает их к себе. Наружные половые органы суки перестают быть набухшими, и их размер возвращается к исходному, имевшему место во время анэструса. Наружные половые органы у нещенных сук, находящихся в анэструсе и диэструсс, практически не различаются. Диагностировать беременность по внешнему виду наружных половых органов сук в начале диэструса (первые 7-10 дней плодоношения) не представляется возможным.
Цитологическое исследование влагалищых мазков. Цитологическое исследование выявляет значительные различия в клеточной популяции во влагалищных мазках, сделанных во время диэструса и в различные периоды (начале, середине и конце) эструса. Мазки, приготовленные в последние дни половой охоты, существенно не отличаются от полученных в раннем эструсе (см. рис. 19-2). Поверхностные клетки составляют в них свыше 80% всей клеточной популяции, нейтрофилы отсутс-
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 851
твуют и фон остается светлым. В последние 24-48 часов эструса доля поверхностных клеток в мазках снижается приблизительно до 20%, а большая часть клеток представлена промежуточными и/или пара-базальными клетками (рис. 19-17), что указывает на резкие цитологические изменения во влагалище (см. табл. 19-1).
Иногда в мазках, сделанных непосредственно перед началом диэструса, обнаруживают пласты или скопления влагалищных эпителиальных клеток (см. рис. 19-7, Б). Это связано с единовременным интенсивным отслоением большого количества клеток от поверхности слизистой оболочки влагалища. Во влагалищных мазках вновь могут появляться нейтрофилы, а вид окрашенного фона говорит о наличии в таких препаратах большого количества дебриса. Значительные цитологические изменения (вытеснение поверхностных эпителиальных клеток промежуточными и парабазальными) обычно служат первым признаком начала диэструса. Присутствие или отсутствие нейтрофилов не является надежным критерием. Характер поведения суки и отношения к ней кобелей менее надежны при определении начала диэструса, чем цитологическое исследование влагалищных мазков (Olson, 1989).
Иногда во влагалищных мазках на стадии диэструса обнаруживают специфические «метэстральные» клетки. Такая находка помогает различить ранние фазы проэструса и диэструса. Это бывает важно при исследовании влагалищных мазков, полученных от не имеющих анамнеза сук, поскольку цитологическая картина в начале и середине проэструса бывает весьма похожа на таковую сразу после окончания эструса. Предполагается, что «метэстральные» и «пенистые» клетки появляются в мазках только во время диэструса. «Метэстральные» клетки (см. рис. 19-10) представляют собой эпителиальные клетки слизистой оболочки влагалища, содержащие в своей цитоплазме по 1-2 нейтрофила. К сожалению, мы находили эти клетки и на других стадиях овариального цикла всякий раз, когда присутствовало большое количество нейтрофилов. Если результаты цитологического исследования вызывают сомнения, необходимо протестировать серию влагалищных мазков, сделанных с интервалом в 2-3 дня, что позволит точно определить, в какой фазе цикла находится животное. В проэструсе в мазках прогрессирующе увеличивается относительное количество поверхностных эпителиальных клеток и одновременно у суки меняется поведение. В диэструсе таких изменений влагалищной цитологии и поведения не происходит.
Через несколько дней после начала диэструса цитологическая картина влагалищных мазков становится очень похожей на ту, которую наблюдают в анэструсе. Лейкоциты во влагалищных мазках могут отсутствовать, эритроциты отсутствуют или их количество невелико, а эпителиальные клетки представлены, в основном, мелкими промежуточными и парабазальными клетками. Эксфолиативная
влагалищная цитология не выявляет существенных различий у здоровых сук в диэструсе и анэструсе. Цитологическая картина очень медленно изменяется при переходе из анэструса в проэструс и из проэструса в эструс. Однако при переходе в диэструс морфология эпителиальных клеток влагалища меняется резко. При обследовании страдающих бесплодием собак или при необходимости определить срок наступления родов у щенных сук установление первого дня диэструса имеет чрезвычайно большое значение (см. гл. 24).
Молочные железы. Повышение в крови концентрации прогестерона в период половой охоты инициирует пролиферацию железистого эпителия молочной железы. Последствия этого становятся заметными по достижению животными последнего триместра диэструса. Концентрация пролактина, которая постепенно возрастает на протяжении последних недель плодоношения, вызывает образование молока перед появлением приплода.
Анэструс
Определение. Анэструс - это стадия овариального цикла, на которой происходит инволюция матки. Анэструс начинается родами и заканчивается проэструсом. У небеременных сук довольно сложно установить начало анэструса, так как у них нет выраженных клинических различий между этой фазой цикла и диэструсом.
Продолжительность. Как и другие фазы полового цикла, анэструс может иметь самую разную продолжительность, которая зависит от породы, здоровья и возраста собаки, а также от факторов внешней среды, времени года и других причин. Как правило, проэструс возобновляется у сук каждые 7 месяцев и длится 9 дней. Затем следуют 7-9-дневный эструс и 58-дневный диэструс, вслед за которым наступает черед 4,5-месячной фазы анэструса. Однако продолжительность фаз полового цикла вариабельна. Отчасти это связано с тем, что трудно определить окончание диэструса и начало анэструса у нещенных сук. Продолжительность периода секреции прогестерона в диэструсе, по всей видимости, является важнейшим фактором, определяющим интервал времени между овариальными циклами у нещенной суки. Сокращение лютеальной фазы вследствие индуцированного простагландином лю-теолиза (Vickery, McRae, 1980) или продолжительного введения бромокриптина (Okkens et al, 1985b) сокращает длительность межэстрального периода на несколько недель и даже месяцев (Concannon, 1987). Естественная вариабельность длительности межэстрального периода, а также ряд других факторов, в том числе беременность, затрудняют возможность точного предсказания времени наступления проэструса.
Клинические признаки. Анэструс не сопровождается какими-либо клиническими изменениями, на основании которых эту фазу цикла можно
852 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
было бы дифференцировать от диэструса у небеременных животных или отсутствия половых циклов у овариогистерэктомированных сук. При обследовании сук с неизвестным анамнезом невозможно установить, стерилизованы они или нет, без определения у них в крови концентрации ФСГ и ЛГ. Уровень этих гонадотропных гормонов значительно повышается в крови собак после стерилизации.
Концентрация гормонов. У собак, как и у других видов животных, во время анэструса происходят спорадические выбросы ЛГ. Такие кратковременные резкие повышения концентрации ЛГ в плазме крови обычно происходят в 2 этапа: первый пик секрециии ЛГ регистрируют непосредственно перед началом проэструса, а второй пик предшествует или совпадает с началом эструса и овуляции. Концентрация ФСГ в крови во время анэструса повышается и в конце этой фазы достигает пикового уровня, который бывает на предовуляторной фазе течки. Предполагается, что такие скачкообразные колебания секреции ФСГ не случайны. Наиболее вероятно, что они отражают тонкие механизмы подготовки фолликулов яичников к следующему овариальному циклу (Johnston et al, 2001). Вовлеченные в предовуляторный процесс, фолликулы посредством механизма отрицательной обратной связи избирательно регулируют секрецию гонадотропных гормонов гипофизом, что подготавливает организм суки к новому половому циклу (см. рис. 19-3).
Концентрация эстрогена в крови сук на стадии анэструса характеризуется значительными колебаниями. В этот период регистрируют эпизоды повышения уровня эстрогена, вызванные субклиническими и кратковременными волнами развития фолликулов яичников. Фолликулы синтезируют и секретируют эстроген, вызывая слабое повышение его концентрации в крови. Фолликулы яичников никогда не достигают полной зрелости: после кратковременного функционирования, в процессе которого в них не успевают появиться способные синтезировать прогестерон лютеинизированные клетки, они начинают дегенерировать. Концентрация эстрогена в сыворотке крови снижается перед наступлением проэструса (Olson et al, 1982). Концентрация прогестерона на всем протяжении анэструса, напротив, держится на очень низком уровне.
Остается неизвестным, какие именно факторы инициируют начало проэструса и нового овариального цикла. По всей видимости, это является результатом комплексного взаимодействия факторов внешней среды, общего состояния здоровья суки, состояния ее яичников и матки, а также возрастных изменений. Такая концепция приобретает клиническое значение, когда предпринимаются попытки избавления сук от бесплодия посредством парентерального применения гипофизарных и/или овариальных гормонов. Однако следует иметь в виду, что тонкие, хорошо скоординированные гормонально-физиологические изменения организма, ведущие к овуляции, очень трудно воспроизвести искусственно.
Матка. На стадии анэструса матка восстанавливается после перенесенных изменений во время беременности или ложной щенности (клинической или субклинической). Для полного восстановления эндометрия до исходного состояния обычно требуется приблизительно 120 дней с момента возвращения концентрации прогестерона в сыворотке крови к базальному уровню у нещенных или около 140 дней у щенных сук (Talwar et al, 1985; Johnston et al, 1985). При клиническом обследовании сук на стадии анэструса ветеринарные врачи с помощью пальпации выявляют лишь незначительные изменения состояния матки, которая по мере инволюции по своим размерам начинает напоминать петли кишечника. Дальнейшие изменения анатомии матки таким способом не выявляются, нося субклинический характер.
Цитологическое исследование влагалищных мазков. Цитологическая картина слизистой оболочки влагалища на стадии анэструса относительно стабильна. Во влагалищных мазках выявляются первичные парабазальные и промежуточные вагинальные эпителиальные клетки. Нейтрофилы могут присутствовать или отсутствовать, эритроциты не обнаруживаются. Выявляемые во влагалищных мазках бактерии обычно являются компонентами нормальной микрофлоры полового тракта сук. Фон мазков бывает чистым или гранулярным.
ЭКСФОЛИАТИВНАЯ ЦИТОЛОГИЯ ВЛАГАЛИЩА
Способы и методы приготовления влагалищных мазков
Разработаны разные методы получения эксфолиативных влагалищных мазков. Приготовленные с их помощью препараты могут дать ценную в диагностическом плане информацию. При выборе оптимального метода руководствуются следующими критериями: (1) простота в осуществлении и низкие финансовые затраты; (2)пригодность для сук независимо от их размера и темперамента; (3) безболезненность; (4) обеспечение получения качественных влагалищных мазков независимо от наличия вагинальных выделений; (5) возможность быстрого обучения владельцев собак. Наиболее популярным среди ветеринарных специалистов стал метод, основанный на использовании ватного тампона. Этот метод, который детально описывается ниже, мы рекомендуем для широкого применения, поскольку он отвечает всем вышеперечисленным требованиям.
Метод ватного тампона
Одной рукой осторожно разводят в стороны половые губы вульвы суки. Другой рукой берут стерильный аппликатор с ватным тампоном. Аппликатор должен иметь длину от 13 до 18 см. Мы часто пользуемся с этой целью смонтированными в стерильные пробирки ватными тампонами, которые
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 853
предназначены для выделения культур бактерий (Culturctte, производства Marion Scientific, США). Конец аппликатора с ватным тампоном вводят вдоль дорсального соединения половых губ.
Вначале ватный тампон слегка прижимают к каудо-дорсальной поверхности свода влагалища с тем. чтобы избежать его попадания в ямку клитора. Затем его продвигают в кранио-дорзальном направлении в сторону позвоночника до тех пор, пока он не пройдет седалищную дугу (рис. 19-18). Тампон вводят на расстояние необходимое для достижения пахового канала. Затем его поворачивают на 360° в обоих направлениях и извлекают. Описываемая процедура занимает всего лишь несколько секунд и крайне редко вызывает у животных болевые ощущения. Суки испытывают дискомфорт при ее проведении только в тех случаях, когда во влагалище отсутствуют выделения. Поэтому перед введением в половую щель собаки тампон целесообразно смочить несколькими каплями стерильного физиологического раствора: такая «смазка» облегчает и делает безболезненными манипуляции во влагалище. Необходимость избегания попадания тампона в ямку клитора обусловлена тем, что эта выемка представляет собой карман, из которого нет выхода во влагалище - попытки продвижения попавшего в него тампона ни к чему нс приведут, кроме сопряженной с болевой реакцией травмы тканей. Кроме
того, клетки, попавшие на тампон со стенок ямки клитора, могут стать причиной неправильной оценки результатов цитологического исследования, если их перепутают с поверхностными вагинальными эпителиальными клетками.
После извлечения из половой щели ватным тампоном делают мазки на предметном стекле. Для этого тампон просто прокатывают по стеклу от одного края до другого. Обычно на одном предметном стекле делают по 2-3 продольных отпечатка (рис. 19-19). На приготовление мазков с 1-2 тампонов требуется 2 предметных стекла. При изготовлении мазков ватный тампон не следует сильно прижимать к поверхности предметного стекла. Не стоит размазывать им собранный во влагалище материал или тереть по стеклу, что может привести к диагностическим ошибкам.
Приготовленные мазки необходимо быстро высушить на воздухе и ненадолго погрузить в 95° о или абсолютный метиловый спирт. Такая фиксация предотвращает изменения морфологии клеток. Мазки окрашивают немедленно или после хранения (Olson et al, 1984а).
Красители
Критерии выбора красителя. Выбор красителей для окраски влагалищных мазков имеет не
Рис. 19-18. Получение влагалищного мазка методом ватного тампона. А Раздвигают половые губы суки для введения тампона. Б. Тампон вводят в вульву вблизи от начала влагалища. В. Тампон вводят во влагалище по его своду. Г. Диаграмма, иллюстрирующая положение ватного тампона во влагалище. Из: Johnston SD: The Female. Vet Clin N Amer II: 543, 1981.
854 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Рис. 19-19. Два предметных стекла, по поверхности которых был прокатан ватный тамон, извлеченный из влагалища суки. На одном стекле видны два, а на другом три продольных ма жа.
меньшее значение, чем выбор метода их изготовления. Оптимальный способ окраски должен быть простым в осуществлении и недорогим. Готовый краситель должен сохранять свои свойства при хранении в течение определенного времени, а окрашенный им мазок не обесцвечиваться при хранении в течение нескольких лет. Наилучшие результаты при окраске влагалищных мазков дает применение нескольких описываемых ниже красок.
Краски Райта и Райта-Гимза. Эти краски представляют собой комбинацию рабочего раствора эозина с подщелоченным бикарбонатом натрия водным раствором полихроматического метиленового синего (краска Райта) или раствором азура II (краска Гимза). Краской Райта часто пользуются для окрашивания мазков крови. При се использовании для эксфолиативной вагинальной цитологии получают высококачественные мазки, которые долго не обесцвечиваются и в которых легко дифференцировать клеточные элементы. Такой метод окрашивания дает хорошо воспроизводимые результаты. Однако для достижения этого следует строго соблюдать инструкции по приготовлению красителей и проведению окраски мазков.
Дифф-Квик. Для рутинного окрашивания влагалищных мазков мы рекомендуем применять краситель Дифф-Квик (производства American Scientific Products,CIIIA), как это делается во многих ветеринарных клиниках. Этот краситель представляет собой модифицированный вариант красителя Райта-Гимза. Он легок в обращении и дешев. Краситель Дифф-Квик надежно окрашивает как эпителиаль
ные клетки влагалища, так и эритроци гы. Перед окраской мазки фиксируют погружением в метиловый спирт. Процедура окраски предусматривает последовательное выдерживание мазков в двух красящих растворах. Влагалищные мазки рекомендуется окрашивать в течение более продолжительного времени. чем мазки периферической крови (Olson et al, 1984b). Окрашенные этим методом влагалищные мазки можно хранить в течение нескольких дней до проведения их микроскопического исследования. Если мазки защитить сверху заливкой и покровным стеклом, то срок их хранения становится практически неограниченным.
Новый метиленовый синий. На влагалищный мазок наносят каплю раствора нового метиленового синего и сверху помещают покровное стеклышко. После этого препарат немедленно просматривают под микроскопом. Этот метод дает превосходные результаты при определении морфологии эпителиальных клеток влагалища, но не позволяет окрашивать клетки крови. Его считают одним из самых быстрых и простых методов окраски влагалищных мазков. Многие ветеринарные врачи любят им пользоваться и часто рекомендуют заводчикам собак для самостоятельного применения.
Трихромовый краситель и краситель Паиа-николаоу. Эти краски являются полихроматическими. Они позволяют выявлять многие изменения морфологии клеток, определять степень их зрелости и метаболическую активность. Их основное преимущество состоит в достижении надежной дифференциации эксфолиативных клеток влагалища: окрашенные ими кератинизированные клетки становятся оранжево-красными, а нскератинизирован-ные клетки - сине-зелеными. Кроме того, эти красители позволяют определять структурные детали ядер и цитоплазмы клеток. Однако, несмотря на перечисленные достоинства, широкое применение этих красителей для эксфолиативных цитологических исследований влагалища сук ограничено рядом недостатков, в том числе трудоемкостью, сложностью и непрактичностью.
Клиническое значение эксфолиативной влагалищной цитологии
Организация нормальной вязки. Эксфолиативные влагалищные цитологические исследования являются одними из наиболее распространенных клинических методов определения фазы эстрального цикла у сук. Предоставляемая ими информация помогает владельцам животных определить оптимальное время проведения вязки своих питомцев. Наблюдения за поведением суки и реакцией на нее кобелей является самым достоверным способом определения времени наступления у суки половой охоты. Ко1да у суки начинается половая охота, она начинает проявлять готовность к вязке, переставая отвергать попытки кобелей совершить садку и половой акт. Однако из-за нередких откло-
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА • 855
нений поведения сук во время эструса необходимо сочетать наблюдения за их поведением с цитологическим исследованием влагалища.
Как уже упоминалось в предыдущем разделе, эксфолиативная влагалищная цитология является прекрасным методом дифференцирования раннего проэструса, эструса и диэструса. Для получения более точной информации при ее проведении рекомендуется каждый раз тестировать, по меньшей мере, по 2-3 влагалищных мазка, взятых на протяжении 4-7 дней. Когда поверхностные клетки в мазках достигнут 80% от всего количества эпителиальных клеток, необходимо суку немедленно поместить с кобелем. Если их вязка не произойдет в течение 1-2 дней, делают повторный мазок влагалища. Получение результатов, аналогичных результатам первого исследования, при отсутствии наблюдений, позволяющих предположить, что сука находится в фазе диэструса, служит основанием для проведения повторной вязки или искусственного осеменения. Увеличение относительного количества поверхностных клеток во влагалищных мазках до 80% и выше часто происходит за 3-6 дней до начала течки. Результаты исследования влагалищных мазков приобретают особенно большое диагностическое значение всякий раз, когда имеют место проблемы бесплодия или проявления суками необычного поведения.
Рациональная организация вязок сук возможна лишь на основе результатов эксфолиативных цитологических исследований, анализа поведения животных и данных об уровне прогестерона в сыворотке крови. Установление дня, когда у суки начали увеличиваться наружные половые органы или появились кровянистые выделения, не может служить единственным критерием оптимального срока вязки, но облегчает выбор последнего. У одних сук половая охота с типичным повышением во влагалищных мазках относительного количества поверхностных эпителиальных клеток до 80% и выше начинается без клинически выраженного проэструса, а у других течка может начаться через столь продолжительный период времени, как 21 день после начала проэструса. Только суки, которых можно считать «среднестатистическими», достигают фазы охоты на десятый день после начала проэструса. Есть суки, которые никогда не проявляют в присутствии кобелей типичного для половой охоты поведения. Тем не менее, они часто фертильны, и только с помощью результатов эксфолиативного цитологического исследования их влагалищных мазков удается определить оптимальную дату вязки или искусственного осеменения.
Вязку или искусственное осеменение сук следует проводить тогда, когда во влагалищных мазках выявляют не менее 80% поверхностных клеток. Еще более точно дату вязки/искусственного осеменения можно определить, сопоставляя результаты цитологического исследования с моментом повышения концентрации прогестерона в сыворотке
крови до 1,0 нг/мл. После того, как результаты цитологического анализа влагалищных мазков дадут основание считать, что животное находится в фазе эструса, может пройти 3-6 дней, прежде чем собака согласится на естественную вязку, поскольку цитологическая картина влагалищного экссудата в конце проэструса чрезвычайно сходна с таковой в эструсе. Однако если начато проведение вязки, то следует ее повторять до тех пор, пока сука не начнет отказываться от вязки. Лучшей рекомендации заводчикам дать просто невозможно. Мы советуем проводить повторные вязки сук с интервалом в 2, 3 или 4 дня. Более частые вязки рекомендуются в тех случаях, когда суку до этого никогда не вязали или известно, что у нее короткая течка. Менее частый режим вязок показан для сук, у которых течка, наоборот, более длительная (9 дней и более).
Перевозка или прием суки для проведения вязки. Сук можно перевозить на значительные расстояния для проведения вязки. Это следует делать до того, как при эксфолиативном цитологическом исследовании их влагалищных мазков будет установлено высокое (80% и более) относительное количество поверхностных клеток. Продолжительность проэструса предсказать довольно сложно, поэтому целесообразно как можно раньше отправить суку на вязку. После доставки суки необходимо понаблюдать за ее поведением. Если она не проявляет в присутствии кобеля стремления к вязке, приступают к серийному цитологическому исследованию ее влагалищных мазков и определению концентрации прогестерона в сыворотке крови.
Нестандартные овариальные циклы. Любая сука, у которой овариальные циклы протекают нормально, хотя во время течки она не проявляет типичного для половой охоты поведения (влечения к кобелям), может иметь нормальный гормональный статус и способна к оплодотворению. У некоторых из них характерное для эструса поведение не проявляется из-за несвоевременного проведения вязки (это нередко происходит в тех случаях, когда половая охота начинается не в обычные 9-12-й дни полового цикла). Итак, по разным причинам половая охота может остаться нераспознанной владельцем суки или может вообще отсутствовать. Суки, которые отказываются от вязки, могут быть осеменены искусственно. Искусственное осеменение следует проводить в тот же день, когда во влагалищных мазках животных будет выявлено повышенное (80% и более) относительное количество поверхностных клеток. На протяжении этого периода искусственное осеменение можно повторять через день до тех пор, пока цитологический анализ не покажет наступления стадии диэструса.
Предсказание сроков наступления родов. Эксфолиативная влагалищная цитология является прекрасным способом определения ожидаемой даты родов. Расчеты проводят с учетом того, что роды у сук начинаются приблизительно на 57 день диэструса (Olson et al, 1983; Linde, Karlsson, 1984). Еже-
856 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Рис. 19-20. Мазок-отпечаток, полученный из трансмиссивной венерической опухоли влагалища суки.
дневное тестирование влагалищных мазков позволяет точно определить первый день диэструса. Этот способ значительно точнее, чем общепринятые расчеты, основанные на дате проведения вязки.
Проблемы бесплодия. Характер цитологических изменений, выявляемых во влагалищных мазках, отражает лишь в общих чертах динамику изменения концентрации эстрогена в плазме крови и, соответственно. функциональное состояние фолликулов яичников. Для установления причин бесплодия необходимо провести цитологическое исследование влагалищных мазков и измерить концентрацию прогестерона в сыворотке крови. Результаты этих исследований позволяют определить, было ли связано бесплодие суки с неверным определением времени вязки, гормональными нарушениями (недостатком эстрогена, вызванным нарушениями развития фолликулов яичников) или какими-либо еще причинами (например, заболеваниями).
Фолликулярная киста. По определению, фолликулярная киста яичника - это структура, синтезирующая и секретирующая эстроген. У суки с фолликулярной кистой происходит удлинение проэструса и/или эструса. Первыми признаками кисты являются слишком длительное проявление собакой поведения, характерного для проэструса и/или эструса, и продолжительные (свыше 2-3 недель) кровянистые выделения из половых органов. Фолликулярная киста яичника может быть также диагностирована на основании результатов цитологического исследования влагалищных мазков и абдоминального УЗИ.
Вагинит. При воспалении влагалища (вагините) во влагалищных мазках сук обычно обнаруживают большое количество нормальных и дегенерирующих нейтрофилов. Некоторые нейтрофилы содержат в своей цитоплазме бактерии, если воспалительный процесс имеет бактериальную этиологию. Нейтрофилы и бактерии часто обнаруживают так
же во влагалищных мазках здоровых животных, но в значительно меньшем количестве. Кратковременное увеличение количества нейтрофилов и бактерий во влагалищных мазках бывает в начале диэструса. Постоянное обнаружение большого количества нейтрофилов на протяжении длительного времени можно рассматривать в качестве диагностического критерия воспаления влагалища.
Опухоли влагалшца. Не удивительно, что развитие опухолей стенки влагалища сопровождается отторжением значительного количества эпителиальных клеток. Это может быть установлено посредством цитологического исследования влагалищных мазков. Наиболее часто таким методом удается диагностировать трансмиссивную венерическую опухоль (рис. 19-20) и псреходноклсточную карциному мочевого пузыря - мегастазы последней могут попадать во влагалище через мочеиспускательный канал.
Пиометра и острый метри г. Эти два серьезных заболевания часто сопровождаются нс только местными, но и системными нарушениями, включая лихорадку. У страдающих ими собак обычно выявляют значительные отклонения от нормы гематологических параметров и показателей, определяемых при анализе мочи В качестве методов диагностики этих заболеваний могут быть использованы рентген и УЗИ. Цитологическое исследование влагалищных мазков в этих случаях не дает достаточной для постановки диагноза информации. Однако следует иметь в виду, что пиометра открытого типа и метрит могут сопровождаться очень большим увеличением во влагалищных мазках количества дегенерировавших нейтрофилов и иногда появлением вакуолизированных клеток эндометрия (Olson et al, 1984с).
Определение необходимости прерывания беременности у сук. Владелец суки может «проглядеть» нежелательную вязку. О гом, что эго произошло, можно судить по обнаружению во влага-
ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
857
Рис. 19-21. Bnai алищный мазок, сделанный через 12 часов после вязки. Обратите внимание на поверхностные питсли-альные клетки влагалища (прямые с грелки) и сперматозоиды (загнутые стрелки).
лищных мазках сперматозоидов или их головок (рис. 19-21). Однако отсутствие сперматозоидов во влагалищных мазках не исключает возможности того, что в пре циествующий исследованию период имела место нежелательная вязка. Кроме того, если результаты цитологического исследования укажут на то, что сука находится в фазах проэструса или диэструса. то владельцу суки вообще не о чем беспокоиться (Более детально обсуждение проблемы нежелательной вязки обсуждаются в гл. 22).
Ограничения применения цитологического исследования влагалища
Метод цитологического исследования влагалищных мазков имеет очень большое значение для оценки репродуктивных качеств суки и определения фазы овариального цикла, на которой находится животное. Понимание клинически о значения резулы атов эксфолиативного цитологического исследования влагалища повышает их информативную ценность. Между тем, применение этого метода не всегда дает ответы на стоящие перед ветеринарным специалистом или заво щи ком вопросы. Этот метод не позволяет определить день овуляции или оплодотворения яйцеклеток, по >тому с его помощью невозможно установить оптимальный срок проведения вязки. Ретроспективно по установлению первого дня диэструса можно судить о том, что овуляция произошла приблизительно на 6 дней раньше. Исследование влагалищных мазков не позволяет определить наличие беременности. Наконец, несмотря на всю свою ценность, эксфолиативная цитология влагалища нс даст возможности полностью заменить наблюдения владельца относительно времени, когда его сука начала проявлять характерное для течки поведение. Оба критерия (цитологический и поведенческий) в своем сочетании дают возможность наиболее точного определения стадии овариального цикла, на которой находится сука, и установления оптимальных сроков ее вязки.
ЛИТЕРАТУРА
Anderson AC, Simpson ME: The genital system during maturity and senescence. In The Ovary and Reproductive Cycle of the Dog (Beagle). Los Altos, CA, Geron-X, 1973, p 195.
Buff S, et al: Serum relaxin concentrations in pregnant and pseudopregnant bitches: evaluation of performances of a new enzyme-immunoassay for the determination of pregnancy. The Fourth International Symposium on Canine and Feline Reproduction, Norway, 2000, p 101.
Cain J: Timing ovulation in the bitch. Symposium on Canine Reproduction, Eastern States Veterinary Conference, 1991, p 1.
Concannon PW. Effects of hypophysectomy and of LH administration on the luteal phase plasma progesterone levels in the Beagle bitch. J Reprod Fer-til 58:407, 1980.
Concannon PW: Canine pregnancy and parturition. Vet Clin North Am [Small Anim Pract] 16:453, 1986.
Concannon PW: The physiology of ovarian cycles, pregnancy and parturition in the domestic dog. Proceedings of the Society for Theriogenology, 1987, p159.
Concannon PW, DiGregorio GB: Canine vaginal cytology. In Burke T (ed): Small Animal Reproduction and Infertility. Philadelphia, Lea 6 Febiger, 1986, p 96.
Concannon PW, et al: Biology and endocrinology of ovulation, pregnancy and parturition in the dog. J Reprod Fertil Suppl 39:3, 1989.
Concannon PW; et al: Suppression of luteal function in dogs by luteinizing hormone antiserum and by bromocriptine. J Reprod Fertil 81:175, 1987.
De Coster R, et al: A homologous radioimmunoassay for canine prolactinplasma levels during the reproductive cycle. Acta Endocrinol 103:477, 1983.
England GCW, Allen WE: Ultrasonography and histological appearance of the canine ovary. Vet Rec 125:555, 1989a.
England GCW. Allen WE: Real-time ultrasonic imaging of the ovary and uterus of the dog. J Reprod Fertil 39(Suppl):91, 1989b.
Evans JM, White K: The Book of the Bitch: A Complete Guide to Understanding and Caring for Bitches. London, Henston Ltd, 1988.
Goodwin M, et al: Sex pheromone in the dog. Science 203:559, 1979.
Hegstad RL, Johnston SD: Use of a rapid, qualitative ELISA technique (Biome-tallics Inc) to determine serum progesterone concentrations in the bitch. Proceedings of the Society for Theriogenology, 1989, p 277.
Hoffman B, et al: Ovarian and pituitary function in dogs after hysterectomy. J Reprod Fertil 96:837, 1992.
Jeffcoate I: Physiology and endocrinology of the bitch. In Simpson G, editor: Manual of Small Animal Reproduction and Neonatology, London, British Small Animal Association, 1988, p 1.
Johnston SD: Diagnostic and therapeutic approach to infertility in the bitch. JAVMA 196:1335, 1980.
Johnston SD, Root Kustritz MV, Olson PNS: Canine and Feline Theriogenology. Philadelphia, Saunders, 2001.
Johnston SD, et al: Canine theriogenology. J Soc Theriogenol 11:1, 1982.
Johnston SD, et al: Cytoplasmic estrogen and progesterone receptors in canine endometrium during the estrous cycle. Am J Vet Res 46:1653, 1985.
Kooistra HS, Okkens AC: The role of follicle-stimulating hormone in the initiation of ovarian folliculogenesis in the bitch. The Fourth International Symposium on Canine and Feline Reproduction, Norway, 2000, p 44.
Kooistra HS, et al: Pulsatile secretion pattern of growth hormone during the luteal phase and mid-anoestrus in beagle bitches. The Fourth International Symposium on Canine and Feline Reproduction, Norway, 2000, p 46.
Leedy MG: Hormonal and neural control of sexual behavior in dogs and cats. In Sitsen JMA, editor: Handbook of Sexology. Vol. 6: The Pharmacology and Endocrinology of Sexual Function. Amsterdam, Elsevier, 1988, p 231.
Linde C, Karlsson I: The correlation between the cytology of the vaginal smear and the time of ovulation in the bitch. J Small Anim Pract 25:77, 1984.
Lindsay FEF: The normal endoscopic appearance of the caudal reproductive tract of the cyclic and non-cyclic bitch: post-uterine endoscopy. J Small Anim Pract 24:1, 1983.
Lindsay FEF, Concannon PW: Normal canine vaginoscopy. In Burke T (ed): Small Animal Reproduction and Infertility. Philadelphia, Lea & Febiger, 1986, p 112.
Manothaiudom K, et al: Evaluation of the ICAGEN-Target canine ovulation timing diagnostic test in detecting canine plasma progesterone concentrations. J Am Anim Hosp Assoc 31:57, 1995.
Okkens AC, et al: Evidence for the non-involvement of the uterus in the lifespan of the corpus luteum in the cyclic dog. Vet Q 7:169, 1985a.
Okkens AC, et al: Shortening of the interoestrous interval and the lifespan of the corpus luteum of the cyclic dog by bromocriptine treatment. Vet Q 7:193, 1985b.
Okkens AC, et al: Influence of hypophysectomy on the lifespan of the corpus luteum in the cyclic dog. J Reprod Fertil 77:187, 1986.
Okkens AC, et al: Evidence for prolactin as the main luteotrophic factor in the cyclic dogs. Vet Q 12:193, 1990.
Olson PN: Exfoliative cytology of the canine reproductive tract. Proceedings of the Society for Theriogenology, 1989, p 259.
Olson PN, et al: Concentrations of reproductive hormones in canine serum throughout late anestrus, proestrus, and estrus. Biol Reprod 27:1196, 1982.
858 • ПОЛОВОЙ ЦИКЛ И ЦИТОЛОГИЯ ВЛАГАЛИЩА
Olson PN, et al: Infertility in the bitch. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 925.
Olson PN, et al: Concentrations of testosterone in canine serum during late anestrus, proestrus, estrus, and early diestrus. Am J Vet Res 45:145, 1984a.
Olson PN, et al: Vaginal cytology. Part I. A useful tool for staging the canine estrous cycle. Comp Cont Ed Pract Vet 6:288, 1984b.
Olson PN, et al: Vaginal cytology. Part II. Its use in diagnosing canine reproductive disorders. Comp Cont Ed Pract Vet 6:385, 1984c.
Olson PN, et al: Endocrine regulation of the corpus luteum of the bitch as a potential target for altering fertility. J Reprod Fertil Suppl 39:27, 1989.
Ryan EA, Enns L: Role of gestational hormones in the induction of insulin resistance. J Clin Endocrinol Metab 67:341, 1988.
Schaefers-Okkens AC: Hormonal regulation to the cyclic corpus luteum in the dog. Thesis, Utrecht, 1988.
Steinetz BG, et al: Serum relaxin and progesterone concentrations in pregnant, pseudopregnant, and ovariectomized, progestin-treated pregnant bitches: detection of relaxin as a marker of pregnancy. Am J Vet Res 50:68, 1989.
Talwar G, et al: Bioeffective monoclonal antibody against the gonadotropin releasing hormone: Reacting determinant and action on ovulation and estrus suppression. Proc Natl Acad Sci 82:1228, 1985.
Thomas TN: Staining techniques for vaginal cytology evaluation. Proceedings of the Society for Theriogenology, 1987, p 262.
Tsutsui T, Stewart DR: Determination of the source of relaxin immuno- reactivity during pregnancy in the dog. J Vet Med Sci 53:1025, 1991.
Vickery B, McRae G: Effect of synthetic PG analogue on pregnancy in Beagle bitches. Biol Reprod 22:438, 1980.
Wallace SS, et al: Ultrasonic appearance of the ovaries of dogs during the follicular and luteal phases of the estrous cycle. Am J Vet Res 53:209, 1992.
Worgul TJ, et al: Evidence that brain aromatization regulates LH secretion in the male dog. Am J Physiol 241 :E246, 1981.
Г лава 20
ВЯЗКА, БЕРЕМЕННОСТЬ
И РОДЫ
СЕКСУАЛЬНОЕ ПОВЕДЕНИЕ.........859
Развитие сексуального поведения.859
Ухаживание....................859
Изменения сексуального поведения в проэструсе и эструсе........860
Нормальная вязка..............860
Замок.........................860
Факторы, влияющие на сексуальное поведение......862
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ:
ОБЩАЯ ИНФОРМАЦИЯ................862
Показания для искусственного осеменения.....862
Эффективность искусственного осеменения.....863
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ:
ИНТРАВАГИНАЛЬНЫЙ МЕТОД......863
Сбор спермы...................863
Процедура осеменения..........865
Влагалищное осеменение замороженной спермой..........866
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ: ТРАНСЦЕРВИКАЛЬНЫЙ МЕТОД.......866
Предпосылки.....................866
«Новозеландский» эндоскопический метод.........................866
ОПЛОДОТВОРЕНИЕ................869
Яйцеклетка....................869
Сперматозоиды.................870
ОРГАНИЗАЦИЯ ВЯЗКИ СУКИ........870
Большинство «бесплодных» сук здоровы.......................870
Возраст, скрытая течка, рецидивирующая течка, неопытность и отсутствие овуляции......................870
Интервалы между вязками во время эструса и выбор времени проведения вязки.........................871
Рекомендации по проведению программы вязки...............874
Вынашивание плодов разного возраста и разные отцы.................874
Борьба с паразитами и схемы вакцинации............874
БЕРЕМЕННОСТЬ....................875
Количество щенков в помете......875
Последовательность событий......875
Сука............................875
Эндокринология..................876
Прогестерон.....................876
Эстроген........................876
Щитовидная железа и кора надпочечников............877
Г люкоза........................877
Продолжительность плодоношения и определение предполагаемой даты родов......................877
Диагностика щенности............878
Терапия щенных сук..............883
Кормление и содержание суки во время беременности и лактации.886
РОДЫ............................890
Эндокринология родов............990
Содержание суки.................991
Этапы родов.....................992
Нормальная инволюция матки......993
СЕКСУАЛЬНОЕ ПОВЕДЕНИЕ
Организация вязок сук и кобелей основана на знании нормальных половых инстинктов и поведения этих животных. Нет сомнения, что люди оказывают значительное влияние на поведение собак, в том числе и на сексуальное поведение. Как правило, бывает трудно понять и оценить последствия влияния заводчика и многочисленных факторов внешней среды на проявление собакой инстинктивных форм поведения.
Развитие сексуального поведения
Сексуальное поведение кобели начинают проявлять с 3^4-недельного возраста. В этот период они часто делают садку на других щенков обоего пола, совершая при этом толчковые движения задней частью тела. Такое поведение вполне нормально, и его не следует прерывать, если в этом нет крайней необходимости (Farstadt, 1998). Суки в щенячьем возрасте лишь в редких случаях совершают имитирующее садку поведение, причем, вскочив на другого щенка, они обычно ведут себя пассивно. Такие действия также следует считать нормальным игровым
поведением. Собаки, которые направляют такую активность только на людей, могут неправильно себя повести во время вязки. В последние несколько десятилетий прочно укоренилась тенденция продажи щенков в раннем возрасте. Попав в новый дом в 5-7-недельном возрасте, щенок может оказаться лишенным «сексуального воспитания», которое мог бы получить, если бы дольше оставался со своими братьями и сестрами. Однако роль имитирующего садку поведения, которое щенки проявляют во время игры и общения с другими собаками, в формировании у них нормального сексуального поведения гипотетична.
Ухаживание
В проявляемой перед вязкой активности инициатива принадлежит кобелю, а сука отвечает на его действия. Кобеля привлекают выделяемые сукой феромоны. Многим кобелям присуща активная форма поведения, вынуждающая сук проявлять позитивные или негативные поведенческие реакции. Поведение ухаживания включает: обнюхивание кобелем носа, ушей, шеи, боков и наружных половых органов суки, в то время как она, в свою очередь,
860 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
ТАБЛИЦА 20-1. СИСТЕМА БАЛЬНОЙ ОЦЕНКИ ПОВЕДЕНИЯ
Категория поведения Формы поведения и их бальная оценка
Проявляемый кобелем интерес Отсутствие =0 Исследовательское = 1 Садка = 2 Совершение тазом толкательных движений = 3
Проявляемый сукой интерес Враждебность = 0 Отступление = 2 Пассивное = 2 Присутствует = 6
Поза суки Отступление = 0 Припадание к земле = 2 Неустойчивая = 4 Устойчивая = 6
Отведение сукой хвоста в Отсутствие = 0 Минимальное = 2 Нечастое = 4 Быстрое и постоянное = 6
сторону
Возможная суммарная бальная оценка= 21
Из: Concannon PW et al: LH release in ovaryohysterectomized dogs in response to estrogen withdrawal and its facilitation by progesterone. Biol Reprod 20:523, 1979.)
обнюхивает кобеля. Облизывание вульвы, преследование, борьба и совершение акта мочеиспускания кобелем влекут за собой соответствующую ответную реакцию находящейся на стадии проэструса суки. Если сука находится в проэструсе, последующие попытки кобеля сблизиться с ней, включая его приближение, постановку лап или опускание головы ей на спину, приводят к тому, что сука садится, припадает к земле, рычит, щелкает зубами или крутится на месте.
Изменения сексуального поведения в проэструсе и эструсе
По мере повышения концентрации эстрогена в плазме крови сука, как правило, начинает проявлять все больший интерес к другим собакам, становится более беспокойной или нервозной, у нее повышается или, наоборот, снижается аппетит, она начинает больше пить и/или чаще мочиться (Farstadt, 1998). Частое мочеиспускание способствует распространению находящегося в моче и влагалищном секрете феромона, метилгидроксибензоата, который и привлекает кобелей.
Для анализа изменений поведения сук и кобелей можно воспользоваться специальной балльной системой их оценки (табл. 20-1 и 20-2) (Concannon et al, 1979). Первоначально враждебное по отношению к кобелю поведение суки переходит в пассивное сопротивление, а в конце становится активно положительным. Очевидно, что сущность этих изменений поведения состоит в том, что сука начинает открыто проявлять влечение к кобелям. Находящаяся на стадии эструса сука замирает при приближении кобеля и отводит свой хвост в сторону («сигнализирует»), Некоторые суки приподнимают вульву во время ее обнюхивания кобелем. Часто у них происходят сокращения мускулатуры промежности и прямой кишки. Когда кобель помещает свои лапы на спину суки, она может прогибать спину. Если кобель робок, она может поворачиваться к нему, тыкаться носом ему в бок, помещать лапы на его спину и даже вскакивать на него. По мере развития эструса сука постепенно утрачивает интерес к вязке. Резких изменений ее поведения в конце эструса не происходит (Farsad, 1998).
В конце стадии эструса интерес суки к кобелям постепенно в течение 1-4 дней снижается. Ее пове
дение в конце эструса и начале диэструса заметно раличается. Сука, проявлявшая в начале эструса неприязнь к слишком активному или настойчивому кобелю, в конце эструса соглашается на вязку. Следует заметить, что кобели, в свою очередь, могут в той или иной мере не проявлять интереса к суке, половой цикл которой постепенно достигает начала диэструса.
Нормальная вязка
Нормальная вязка включает 6 этапов
(по Farstad, 1998):
1. Садка.
2. Совершение тазом толкательных движений и введение полового члена кобеля во влагалище суки.
3. Эрекция (набухание полового члена и луковиц его головки1) и выделение первой порции эякулята (свободного от спермы секрета предстательной железы).
4. Ротация (соскакивание или «поворот») и выделение второй порции эякулята (богатой сперматозоидами и имеющей белый цвет).
5. Замок; выделение третьей порции эякулята (свободного от сперматозоидов прозрачного секрета предстательной железы).
6. Выход из замка.
Замок
Как мы уже упоминали ранее, половому акту собак предшествует «ухаживание». Оно может быть весьма продолжительным, когда дополняется игрой или преследованием, или, наоборот, кратковременным, например, когда кобель вылизывает суке наружные половые органы, после чего сразу совершает садку. Садка представляет собой первую стадию нормальной вязки. Она заключается в том, что кобель вскакивает передними конечностями на суку и обхватывает ими ее бока (впереди от тазобедренных суставов). Он вводит половой член толкательными движениями в отверстие влагалища, достигая желаемого методом «проб и ошибок» (вторая стадия нормального полового акта).
1 Луковицы головки пениса - дистальная часть губчатого тела, образующего основу головки полового члена кобеля. Не следует путать это парное образование (bulbus glandis) с луковичными или бульбоуретральными железами (glandis bulbouretralis), которые у кобеля отсутствуют
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 861
ТАБЛИЦА 20-2. ТИПИЧНЫЙ ПРИМЕР МАКСИМАЛЬНОЙ БАЛЬНОЙ ОЦЕНКИ КАЖДОЙ КАТЕГОРИИ ПОВЕДЕНИЯ И ГРАНИЦЫ БАЛЛЬНОЙ ОЦЕНКИ ВСЕХ ФАЗ ПРОЭСТРУСА И НАЧАЛА ЭСТРУСА
Категория поведения Максимальная балльная оценка Начало проэструса Середина проэструса Конец проэструса Начало эструса
Проявляемый кобелем интерес Проявляемый сукой интерес Поза суки Отведение сукой хвоста в сторону Границы балльной оценки 1 2 3 3 0 2 4 6 0 02-46 0 0 0-2 4-6 0-1 2-4 5-12 16-21
Введение полового члена во влагалище суки (вторая стадия вязки, первая стадия коитуса; рис. 20-1) может совершаться и без эрекции, поскольку жесткость половому члену придает кость - os penis. Если эрекция произошла у кобеля до введения полового члена в половую щель, увеличившиеся луковицы пениса препятствуют его продвижению во влагалище. При нормальном течении вязки кобель вначале вводит половой член во влагалище суки, и лишь затем у него развивается эрекция (третья стадия вязки). В этот момент он начинает переступать задними конечностями. Синхронно с переступанием происходит набухание луковиц полового члена. Толкательные движения таза становятся более интенсивными, и в течение 15-60 секунд после введения полового члена во влагалище происходит выброс первой порции эякулята, которая представляет собой секрет предстательной железы, не содержащий сперматозоидов.
Затем кобель соскакивает с суки (четвертая стадия вязки; рис. 20-1). Для этого он переставляет обе передние конечности на одну сторону (сбоку от суки), переносит одну заднюю конечность над спиной суки и поворачивается. В результате животные оказываются прижатыми друг к другу задними поверхностями бедер и ягодиц (положение «хвост к хвосту») (четвертая стадия вязки; см. рис. 20-1). Значительное увеличение луковиц пениса делает невозможным извлечение его из влагалища, имеющего относительно узкий просвет. Таким образом, кобель с сукой оказываются сцепленными друг с другом (рис. 20-2). Обычно такое положение называют «внутренним замком». Если эрекция происходит до введения кобелем пениса в половую щель суки, то относительно большие луковицы пениса не позволяют половому члену достичь влагалища, что приводит к так называемому «наружному замку». При нормальном течении вязки внутренний замок обеспечивает «сцепление» кобеля с сукой на протяжении 5-60 минут. Находясь в таком положении, собаки могут передвигаться, волоча друг друга. В первые 1-5 минут замка у кобеля происходит выделение богатого сперматозоидами эякулята. Выделяемый в последующий период эякулят не содержит сперматозоидов и является обычным секретом предстательной железы.
Рис. 20-1. Три основные стадии вязки собак.
Шейка матки Прямая кишка
Мыс крестца Крестец
Препуций
Матка
Мошонка
Вульва
Луковица
Изгиб пениса
Мочевой пузырь
Влагалище и пара длинных долей губчатого
Луковмцы
пениса
тела головки преддверия пениса влагалища
Седалищнокавернозный мускул
Рнс. 20-2. Положение полового члена во влагалище при нормальной вязке собак.
862 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Факторы, влияющие на сексуальное поведение
Окружающая среда. Дифференцированное отношение к «своей» и «чужой» территории в большей степени присуще кобелям, чем сукам. На этом основании считается, что неудачный исход вязки заранее предрешен, если сука доминирует над кобелем. Такое положение можно изменить искусственно, проводя вязку на привычной для кобеля территории, где он чувствует свое превосходство, в то время как оказавшаяся в незнакомых условиях сука, напротив, начинает испытывать неуверенность. Вот почему для проведения вязки сук приводят к кобелям, а не наоборот (Farstad, 1998). Люди также могут влиять на сексуальное поведение собак. Для части собак присутствие их владельца во время вязки существенно не отражается на их сексуальном поведении. Однако многие животные активно реагируют на своих владельцев, причем реакция может быть как положительной, так и отрицательной. В ряде случаев кобели нуждаются в помощи людей во время вязки. Некоторые кобели чувствуют себя во время вязки более уверенно, когда рядом находятся другие кобели. Шум, свет, настил полов и многие другие факторы окружающей среды могут влиять на результат вязки собак.
Опытность. Молодые и неопытные взрослые кобели нередко испытывают перевозбуждение, оказавшись рядом с сукой, находящейся в эструсе. Перед тем как найти правильное положение для садки, они могут попытаться вскочить на бок или голову суки. Неопытность кобеля в таких случаях становится причиной того, что сука сбрасывает его с себя, и продолжение вязки становится невозможным. Сообщалось о том, что никогда не вязавшиеся суки, находившиеся на стадии эструса, значительно дольше демонстрировали в присутствии кобелей игровое поведение, чем более опытные. Таким образом, сексуальное поведение представляет собой комплекс врожденных и приобретенных рефлекторных реакций.
Предпочтения сук и доминантность. Не раз наблюдалось, что суки отдают предпочтение одним кобелям и отвергают сексуальные притязания других. Свою привязанность суки сохраняют на протяжении ряда половых циклов, причем она не зависит от ее социальной близости в период анэструса с окружающими кобелями. Значение доминантности, которая, возможно, является основным критерием, по которому сука выбирает кобеля для вязки, трудно объективно оценить. Кобели, между тем, редко бывают привередливыми, когда рядом имеется готовая к вязке сука. Поэтому можно предположить, что успех вязки зависит преимущественно от суки.
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ ОБЩАЯ ИНФОРМАЦИЯ
Показания для искусственного осеменения
Существует много причин, по которым владельцы собак могут предпочесть вязке проведение искусственного осеменения (ИО). Однако необходимость в ИО чаще всего возникает в двух случаях: во-первых, если сука и кобель, от которых желают получить потомство, живут на значительном расстоянии друг от друга, и, во-вторых, если имеются объективные причины, делающие невозможным вязку суки или кобеля. Последнее бывает, например, при наличии во влагалище суки стриктур, которые вызывают у нее сильную боль во время вязки и препятствуют проникновению полового члена кобеля (см. главу 25). Другими причинами, делающими невозможным проведение вязки, могут быть ортопедические проблемы, например, поражения межпозвоночных дисков или коленного сустава, а также слабость мускулатуры.
ИО предпочтительнее также в том случае, когда размеры запланированных для вязки суки и кобеля очень сильно различаются. Оно показано и тогда, когда скрещиваемые кобель и сука неопытны, или в прошлом у одного из них имела место неудачная вязка, или если они отказываются от вязки друг с другом. Естественно, что в ситуации, когда предназначенные для вязки кобель и сука в прошлом проявляли агрессивность по отношению друг к другу, их владельцы, опасаясь нежелательных последствий для своих питомцев, отдают предпочтение искусственному осеменению. Последнее может оказаться выходом из положения, если хотят получить потомство от суки, которая никогда не приходит в состояние половой охоты и отвергает попытки любого кобеля вступить с ней в половой контакт.
Значительно реже заводчики прибегают к ИО из опасений, что их питомцы во время вязки могут приобрести передающееся половым путем венерическое заболевание. Необходимость в таких мерах предосторожности отпадает при работе со свободными от бруцелл животными. Следует иметь в виду, что ИО не может защитить суку от передающихся половым путем инфекционных агентов, но кобель, будучи всего лишь донором спермы, лишен прямого контакта с потенциальным источником инфекции. У некоторых кобелей (особенно у доберманов-пинчеров) нежелательным последствием вязки становится кровотечение в предстательной железе (см. гл. 30). Предполагается, что это связано с болезнью Виллебрандта. В такой ситуации ИО, не требующее непосредственного контакта собак, позволяет избежать вышеупомянутой проблемы.
Свежеполученную и замороженную сперму кобелей используют для репродуктивных целей все чаще. Ею осеменяют сук, находящихся на значительном расстоянии от кобеля-донора. Процедура искусственного осеменения предельно проста
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 863
(Fontbonnc et al, 2000). Поэтому единственным фактором, ограничивающим масштабы его применения, является количество заготавливаемой от кобелей спермы.
Эффективность искусственного осеменения
При искусственном осеменении уровень оплодотворения и количество щенков в помете меньше, чем при вязке (Anderson, 1980), что объясняется рядом факторов. При вязке сперма должна пройти длинный путь и попасть в матку через ее шейку, а затем проникнуть в яйцеводы (см. рис. 20-2), в то время как при искусственном осеменении ее вводят непосредственно в матку. При вязке сперма продвигается по половым путям в результате сокращений матки. Проведение искусственного осеменения не индуцирует сокращений. На результаты вязки, помимо всего прочего, может оказывать влияние продолжительность нахождения спаривающихся собак в замке.
Анализ публикаций показывает, что уровень успешного оплодотворения при любом из применяемых в настоящее время способов искусственного осеменения ниже, чем при вязке. После вязки щен-ными становится от 80 до 100% сук. а в случаях искусственного осеменения всего лишь 62-100° о, 60-80° о и 52-60% при использовании соответственно свежей, охлажденной и замороженной спермы (Kusritz, Johnston, 2000b). Количество щенков, рождаемых искусственно осемененными суками, также обычно ниже, чем при вязке (Linde-Forsberg, Forsberg, 1989, 1993; Silva, 1996).
По нашему мнению, приведенные выше данные некорректны и занижают эффективность искусственного осеменения. В последнее десятилетие приобретен значительный опыт в данном вопросе, и каждый метод имеет свои преимущества. Нет сомнений, что вязка по целому ряду причин позволяет достичь большего уровня оплодотворения, чем искусственное осеменение. Между тем, в определенных ситуациях проведение вязки нецелесообразно или вообще невозможно, и необходимо использовать альтернативный метод осеменения. Однако не стоит переоценивать тот уровень репродукции собак, который может быть достигнут посредством известных в настоящее время способов искусственного осеменения.
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ ИНТРАВАГИНАЛЬНЫЙ МЕТОД
Сбор спермы
Приспособления. Сперму обычно собирают в искусственную вагину. Мы с этой целью пользуемся стерильной, мягкой, резиновой, конусовидной искусственной вагиной, предназначенной для сбора спермы быков. Предварительно ее укорачивают, отрезая нижнюю части. К противоположному кон-
Рис. 20-3. Приспособления для проведения искусственного осеменения: стерильные перчатки, стерильная, мягкая резиновая искусственная вагина, пластиковая пробирка, надеваемая на вагину, и мягкий пластиковый катетер для осеменения сук.
цу укороченной искусственной вагины прикрепляют чистую пластиковую пробирку длиной 12-15 мл, которая служит для сбора спермы (рис.20-3). Широкий конец вагины сгибают и скрепляют резиновым клеем с тем, чтобы его края стали ровными и не могли вызвать травм половых органов кобеля. Это необходимо, поскольку только этот конец вагины будет непосредственно контактировать с половым членом. На внутреннюю поверхность вагины наносят небольшое количество неспермицидного смазочного геля. Хотя считается, что стерилизация газом разрушает остатки спермы на стенках бывшей в употреблении вагины, тем не менее, ее повторное использование после такой обработки сопряжено с рядом проблем. Возможно, это связано с тем, что искусственная вагина выполняет роль воронки, в которую во время эякуляции попадает сперма, в последующем стекающая в чистую, новую пластиковую пробирку (Johnston et al, 2001).
Условия, в которых проводится сбор спермы. Сбор спермы у кобелей-доноров проводят в чистой тихой комнате с нескользкими полами и в отсутствие других собак. В то же время присутствие находящейся в эструсе суки облегчает сбор спермы у некоторых кобелей. Предполагается, что присутствие «дразнящей» суки или применение феромона собак может повысить качество собираемой спермы (Kustritz, Johnston, 2000b). Однако это мнение не имеет научного подтверждения.
Методика. Заводчик удерживает кобеля, успокаивая его и предотвращая возможность нанесения укусов специалисту, проводящему сбор спермы. Половой член массируют через препуций до тех пор, пока не начнут увеличиваться луковицы пениса. Оттягивают назад препуций, выводя наружу половой член вплоть до его луковиц. Если это не удается сделать, то обычно состояние полной эрекции не достигается, и эякуляция, предположительно из-за болевой реакции, может не произойти.
Как только пенис и его луковицы оказываются вне препуция, специалист, занятый сбором спермы,
864 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Рис. 20-4. А. Половой член кобеля в состоянии эрекции. Видны увеличенные луковицы пениса (изогнутая стрелка) и пробирка с собранным эякулятом. Б. Сбор спермы у кобеля при отведенном паза 1 между задними конечностями половом члене.
плотно захватывает пальцами основание пениса проксимальнее луковиц. Большим и указательным пальцами он сдавливает и массирует основание луковиц пениса (рис. 20-4). По мере наступления эрекции кобель начинает совершать интенсивные толкательные движения тазом, которые ассоциируются с началом эякуляции. В этот период трудно надеть искусственную вагину на половой член. Однако толкательные движения быстро прекращаются (в течение 5-15 секунд), а первые порции эякулята, выделяемые в течение 5-30 сек (об этом уже говорилось выше) представляют собой секрет предстательной железы, в котором сперматозоиды отсутствуют. Поэтому нет никакой необходимости в сборе такого эякулята, и нет ничего страшного в том, что его первые порции будут потеряны.
Выделение второй порции эякулята, в которой содержится большое количество сперматозоидов, начинается после завершения кобелем толкательных движений газом. В этот момент многие кобели переступают одной из своих задних конечностей через руку занятого сбором спермы специалиста, аналогично тому, как они это делают во время вязки при соскакивании с суки (на стадии ротации). Специалист позволяет кобелю инстинктивную смену позы и перемещает половой член животного с надетой на него искусственной вагиной таким образом, чтобы тот находился между задними конечностями (рис. 20-4, Б). Это необходимо для продолжения
получения спермы. Ее сбор обычно длится от 2 до 5 минут. В период начальной стимуляции вагина с надетой на ее свободный конец чистой пластиковой пробиркой должна находиться под ладонью специалиста, что обеспечивает их легкое нагревание. Сперма кобелей достаточно устойчива к охлаждению, поэтому нет необходимости прибегать при ее сборе к емкостям с теплой водой или другим специальным инкубаторам.
Применение чистых пластиковых пробирок позволяет визуально контролировать сбор спермы. Мы обычно собираем сперму в течение 2-4 минут, держа одну руку на пластиковой пробирке, чтобы защитить ее от света. Сбор спермы продолжается до тех пор, пока в пробирку поступает беловатый или непрозрачный эякулят, богатый сперматозоидами. Как только эякулят становится прозрачным, что говорит об отсутствии в нем сперматозоидов, его сбор прекращают. Если у специалиста нет уверенности, что выделение сперматозоидов с эякулятом прекратилось, то он продолжает сбор еще на 3-4 минуты (Farstadt, 1998). Слишком продолжительный сбор эякулята приводит к получению чрезмерно разбавленной секретом предстательной железы спермы, имеющей большой обьем, но низкую концентрацию сперматозоидов. В тех случаях, когда после сбора богатого сперматозоидами эякулята хотят получить чистый секрет предстательной железы, его собирают в другую пробирку.
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 865
Сбор спермы является наиболее сложным этапом искусственного осеменения. Проведение остальных этапов не вызывает особого труда. Суку искусственно осеменяют в течение 10-15 минут после получения спермы. Если собранная сперма имеет нормальный внешний вид, ее сразу же вводят в матку суки. При этом несколько капель спермы оставляют для последующего микроскопического исследования. Если возникают претензии к кобелю-донору или качеству его спермы (обычно поводом для этого служат ее ненормальные цвет и консистенция), собранный эякулят вначале подвергают микроскопическому исследованию, а искусственное осеменение проводят только после получения удовлетворительных результатов анализа. В течение всего времени, которое уходит на проведение исследований и искусственное осеменение, пробирку со спермой согревают и защищают от воздействия ультрафиолетового света, держа ее в руке.
Процедура искусственного осеменения
Кобеля выводят из комнаты, чтобы не отвлекал осеменяемую суку. Надев стерильные перчатки, ветеринар набирает собранную сперму в стерильный шприц емкостью 6 мл. Как только в шприц начинает поступать прозрачная жидкость (фракция секрета предстательной железы), набирание спермы в шприц следует прекратить. Это позволяет избежать введения суке чрезмерно большого объема спермы. Чем будет меньше объем вводимой в матку спермы (лучше всего, если он не превышает 4—6 мл), тем меньше будут ее потери, связанные с вытеканием из половых органов суки после завершения искусственного осеменения. После заполнения шприца спермой (в шприце должно оставаться около 1-2 мл воздуха) на него надевают новый, чистый пластиковый уретральный катетер (см. рис. 20-3). Владелец оказывает помощь специалисту при проведении ИО, удерживая голову собаки и отводя в сторону ее хвост.
Указательный палец руки, на которую надета резиновая перчатка, специалист вводит в половую щель, держа ладонь внутренней стороной вверх. В случае маленьких собак это осуществляют не указательным пальцем, а мизинцем. Обычно перчатки ничем не смазывают, но если у суки отсутствуют характерные для эструса влагалищные истечения, то пользуются небольшим количеством неспер-матоцидного геля. Затем по верхней поверхности введенного во влагалище пальца продвигают вперед пластиковый уретральный катетер. Его вводят до тех пор, пока не начинают испытывать сопротивление дальнейшему продвижению. Вследствие уникального анатомического строения шейки матки сук (рис. 20-5) возникают объективные трудности при продвижении катетера через нее в матку (Roszel, 1992). При этом перед ветеринаром должна стоять цель продвинуть уретральный катетер через шейку как можно дальше (краниальнее). Для
Влагалищная часть
Свод шейки матки
Канал шейки матки
Родовые пути
Рис. 20-5. Схема продольного разреза половых органов самок многих видов животных (верхний рисунок) и суки (нижний рисунок) в области шейки матки. Отличительными особенностями анатомической структуры половых органов суки являются вентральный поворот шейки матки на 90°, отсутствие крыши (дорсальной части) влагалища, образование дорсальной складки и дорсальная часть мускулатуры влагалища, переходящая в дорсальную складку. Вентральный участок свода влагалища образует краниальное слепое выпячивание (самую краниальную часть родовых путей). Канал шейки матки суки (с эпителиальными выпячиваниями) расположен в правом углу дна влагалища. Приблизительно в правом своем углу он переходит в тело матки через внутреннее отверстие шейки матки. Из: Roszel JF: Compend Contin Educ [Small Anim Pract] 14:751, 1992.
этого он должен предварительно оценить длину, на которую следует ввести катетер, посредством измерения расстояния от вульвы до краниального края дна тазовой полости. Введенный во влагалище указательный палец (или мизинец) помогает избежать попадания катетера в ямку клитора и уретру. Катетер продвигают вдоль дорзального изгиба влагалища. Выдавливают из шприца сперму, а затем находящийся в нем воздух. После этого катетер вытаскивают из половых органов суки.
Легким постукиванием указательным пальцем по дорзальной стенке влагалища или по клитору в ряде случаев удается вызвать сокращения влагалища и матки. Как только сокращения прекратятся, собаку поднимают за обе задние конечности так, что она принимает позу «тачки», что способствует переходу спермы через шейку в матку. Обычно собаку в таком положении держит 10-15 мин ее владелец (при этом он может удобно устроиться в кресле, поместив конечности животного себе на колени). В это время проводится микроскопическое исследование введенной животному спермы.
866 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Проведение искусственного осеменения обычно не вызывает у сук дискомфорта, боли или каких-либо осложнений. Эта процедура проста и осуществляется в течение короткого времени.
Влагалищное осеменение предварительно замороженной спермой
Опыт показывает, что влагалищный метод искусственного осеменения хранившейся в замороженном виде спермой очень часто дает отрицательные результаты, что отчасти может быть обусловлено утратой сперматозоидами способности мигрировать через шейку матки. Между тем, совсем недавно проведенное в Германии исследование показало, что влагалищное осеменение сук может быть успешным. если в сперму перед замораживанием добавлять пасту Эквуекс СТМ, а после размораживания секрет предстательной железы или модифицированную среду Гироде (TALP) (Nothling et al. 2000).
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ ТРАНСЦЕРВИКАЛЬНЫЙ МЕТОД
Предпосылки
История. Хотя методика замораживания спермы была разработана очень давно, ею стали часто пользоваться только в последнее время. Длительное забвение было связано в первую очередь с тем, что процесс замораживания спермы неизбежно ведет к снижению способности сперматозоидов преодолевать такой барьер на пути к яйцеклеткам, как шейка матки. Избежать этого удается с помощью альтернативных нсхирургических трансцервикальных методов (Farstad, Anderson-Berg, 1989; Wilson, 2001) и прямого хирургического маточного метода искусственного осеменения сук. Оперируют собак с целью осеменения обычно только 1 раз за всю жизнь; многие ветеринарные врачи вообще отказываются проводить ИО таким способом, считая неоправданным риск, которому подвергается животное во время наркоза и самой операции.
Анатомия. Принцип трансцервикального метода искусственного осеменения можно понять только на основании детального знания анатомической структуры органов репродукции суки. По длине се влагалище несколько превосходит влагалище самок других видов животных: длина влагалища у сук массой тела в 11 кг бывает от 10 до 14 см, а у крупных собак достигает 30 см (Pineda et al, 1973). При эндоскопии осмотр влагалища сук затруднен из-за его дорзальной срединной складки (рис. 20-6), которая простирается на 2-4 см в каудальном от шейки направлении. Эту краниальную часть влагалища называют «парацервикс» (Lindsay, 1983). Каудальная часть парацервикса заканчивается узким выпячиванием, которое и является той частью шейки матки, которая видна при осмотре сзади. Это объясняет, почему при эндоскопии ветеринарные вра-
Канал шейки
Рис. 20-6. Анатомическая структура парацервикса
чи часто ошибочно принимают его за саму шейку матки. В краниальной части парацервикс переходит в свод влагалища. Свод имеет щелевидную структуру, расположенную кранио-вентрально от истинной шейки матки и заканчивающуюся слепым выпячиванием (см. рис 20-5 и 20-6).
Шейка матки проходит по диагонали через маточно-влагалищное соединение в кранио-дорзальном направлении, соединяя матку с влагалищем. Таким образом, наружное отверстие шейки матки смотрит на дно влагалища и располагается в центре имеющейся у большей части сук розетки борозды. Этот загиб в сочетании с маленьким диаметром канала шейки матки создает естественное препятствие, мешающее прохождению катетера из влагалища в матку (Wilson, 2001). Особенно такая задача сложна в случае никогда не вязавшихся сук, у которых просвет шейки матки имеет среднюю степень узости.
«Новозеландский» эндоскопический метод
Введение. Описываемый в этом разделе метод (Wilson, 1992, 2001) требует много времени, большого опыта и терпения. Совершенно необходимо хорошее знание анатомии репродуктивного тракта сук. Отработка этого метода значительно облегчается, когда ее осуществляют совместно с опытным специалистом, а также при использовании видеокамеры для слежения за эндоскопом и катетером. Используемая аппаратура, которая описана ниже, легко очищается и дезинфицируется.
Оборудование. Для проведения этого метода пользуются жестким, имеющим достаточную длину цистоуретроскопом (Storz, Coleta, США). Он оснащен телескопической насадкой с 30-градусным углом обзора, футляром, параллельным соединением и холодным источником света. В смонтированном виде цистоуретроскоп имеет рабочую длину 29 см. (рис. 20-7). Им можно пользоваться для проведения искусственного осеменения собак практически всех пород, независимо от их размера. К нему
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 867
Рис. 20-7. Эндоскопическая аппаратура для трансцервикального искусственного осеменения Аппаратура включает источник света и кабель (А), телескопическую насадку с 30° углом обзора, цистоуретроскоп достаточной длины с футляром (Б) и видеомонитор, предназначенный для визуального контроля процедуры (В). Фо го любезно предоставлено A Davidson, Davis, США.
можно присоединить видеокамеру, но можно работать и без нее. Наконец, непосредственно для осуществления искусственного осеменения пользуются уретральным катетером (диаметром 2,0-2,7 мм; катетер с диаметром 2,0 мм бывает необходим при осеменении маленьких и ранее нерожавших сук). При проведении осеменения очень удобно пользоваться специально разработанным для этой цели столом с гидравлической платформой. Он позволяет фиксировать суку в нужном положении с помощью ошейника и брюшною ремня, нс давая ей садиться или совершать движения вбок. Стол перемещается вверх и вниз с тем, чтобы ветеринарный врач мог проводить данную процедуру в наиболее удобном положении (рис. 20-8).
Процедура. Эндоскоп помещают во влагалище. Под визуальным контролем его проводят через складки влагалища. Когда сука находится в проэструсе или начале эструса, у нее во влагалище имеются закругленные складки (см. гл. 19), которые, занимая
значительную часть просвета органа, мешают прохождению эндоскопа. Когда они спадают из-за потери избыточной жидкости, что происходит по мере развития течки, визуальный контроль за продвижением эндоскопа облегчается. Важным ориентиром служит каудальное выпячивание дорсальной срс-шннои складки влагалища (см. рис. 20-6). Просвет этой части влагалища может быть очень узким, из-за чего порой приходится изменять направление продвижения эндоскопа к более широкой части органа. Нежелательным последствием лого может быть отклонение эндоскопа вбок от оптимального продвижения по срединной линии влагалища. Найти шейку матки бывает сложно, поскольку она направлена своим наружным отверстием каудо-вентрально или вентрально. Для установления направления матки обычно приходится подводить эндоскоп по г выпячивание ее шейки. Направление просвета матки определяют по локализации центра розетки борозды или прослеживая траекторию тока ссрозно-кровя-
868
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Рис. 20-8. Эндоскопическое трансцервикальное искусственное осеменение. А. Сука, зафиксированная на специальной платформе. Брюшной ремень ограничивает ее возможность совершать боковые движения и садиться. Б и В. Под визуальным контролем просвета влагалища специалист продвигает шдоскоп между влагалищными складками. Г. Катетеризация канала шейки матки достигается прохождением выпячивания шейки матки с помощью жесткого эндоскопа и катетера. Фото любезно предоставлено A. Davidson, США.
нисто11 маточной жидкости через шейку матки. Следует иметь в виду, что направление просвета матки может значительно меняться по мере развития течки вследствие прогрессирующей дегидратации складок слизистой оболочки влагалища.
Большая часть сук, находящихся в фазе эструса, спокойно переносит описываемую процедуру трансцервикального искусственного осеменения без анестезии и применения седативных препаратов. Катетер осторожно с помощью эндоскопа вводят в шейку матки. Жесткость эндоскопа обеспечивает беспрепятственное преодоление выпячивания шейки матки и ее канала на всем протяжении, включая участок с измененным углом наклона. Осмотр находящихся во влагалище образовании проводят без нагнетания воздуха. Как только передний конец катетера оказывается в просвете шейки матки, его начинают последовательно продвшать вперед вращательными движениями. При этом не
прикладывают излишних усилий, чтобы не нанести механических повреждении половым органам суки. Достигнув катетером нужного места, через него вводят сперму. Нужно следить, чтобы сперма не вытекала из шейки матки во влагалище. Если такое случилось, введение спермы сразу же прекращают и меняют положение катетера, слегка выводя его наружу, а затем продвигая вперед.
У некоторых сук внутреннее пространство па-рацервикса недостаточно велико для введения в него эндоскопа. Особенно сложно это сделать при осеменении маленьких и никогда не рожавших сук. Проблему помогает решить применение эндоскопов с меньшим диаметром, но они часто имеют недостаточную длину и их можно использовать для осеменения только маленьких собак. Длинным эндоскопом при осеменении маленьких собак неудобно манипулировать; кроме того, в этом случае часто приходится прибегать к седативным среде-
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 869
твам. Даже тогда, когда эндоскоп удается беспрепятственно ввести в шейку матки, не всегда удается провести тем же путем катетер. Это связано как с отклонениями от нормы анатомического строения дистальной части влагалища и шейки матки у отдельных сук, так и с плохой видимостью из-за обильных влагалищных выделений или отсутствием достаточного опыта у проводящего осеменение ветеринарного врача.
Безопасность. Эндоскопический метод искусственного осеменения безопасен. Нанесение эндоскопом или катетером травм сукам, находящимся в эструсе, происходит исключительно редко. Причиной таких травм могут быть тяжелые нарушения анатомической структуры репродуктивного тракта осеменяемого животного или нетехничное, насильственное продвижение эндоскопа или катетера. Каждый раз, когда осеменяемая сука начинает испытывать дискомфорт, процедуру следует прерывать п менять положение эндоскопа. Поскольку по мере развития течки резистентность суки к инфекционным агентам возрастает, а риск заноса инфекций в ее половые органы при искусственном осеменении ничуть не выше, чем при вязке, данный метод искусственного осеменения можно считать безопасным и в »том отношении (Watts et al, 1996). Однако к очистке используемой для проведения процедуры аппаратуры следует относиться со всей ответственностью.
Результаты. Описанная выше процедура позволяет вводить сперму непосредственно в матку. В отличие от хирургического метода осеменения, ее можно повторять и в последующие периоды жизни животного. Эффективность эндоскопического метода искусственного осеменения зависит от того, была ли введена сперма в матку, было ли это сделано своевременно, от качества использованной спермы и репродуктивных качеств самой суки. Сообщалось, что данным методом удается достичь 80% уровня оплодотворения (Sirivaidyapong et al, 2000: Wilson. 2001).
ОПЛОДОТВОРЕНИЕ
Яйцеклетка
Понимание временной связи овуляции, оплодотворения и сексуального поведения сук может оказать помощь в обращении с предназначенными для вязки собаками, особенно с теми, которых подозревают в бесплодии. В организме среднестатистической суки наступлению беременности предшествует протекающий с постоянной закономерностью каскад изменений, который обеспечивает переход проэструса в эструс (половую охоту). Пик секреции Л Г происходит на второй день эструса (Concannon, Yeager, 1990). Спустя 24-96 часов (приблизительно на четвертый день эструса) начинается овуляция. Исследования показали, что в течение 72 часов после выброса ЛГ вскрывается около 75°о фолликулов яичников, а за последующие сутки этот показатель возрастает до 90% (Wildt et al, 1978). Выходящие из фолликулов яйцеклетки называют «первичными овоцитами». Для достижения стадии зрелости, на которой возможно оплодотворение, они должны пройти два мейотических деления в течение 48-72 часов. Созревшие яйцеклетки называют «вторичными овоцитами». Их жизнь коротка и составляет всего 24-72 часа (Phcmistcr et al. 1973). Таким образом, оплодотворение яйцеклеток становится возможным в среднем на седьмой день стадии эструса.
Яйцеклетки достигают зрелости у среднестатистической суки с середины 5 дня по 9 день половой охоты. Как показали результаты цитологического исследования влагалищных мазков (рис. 20-9), небольшое количество созревших яйцеклеток может быть оплодотворено сперматозоидами в первые два дня после наступления диэструса. Поскольку большинство сук не являются среднестатистическими, точное определение срока оплодотворения их яйцеклеток весьма затруднительно (Concannon
Рис. 20-9. Гормональные изменения и последовательность событии во время овуляции и оплодотворения яйцеклеток «среднестатистической» суки.
870 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Дни после наступления эструса (цитологический анализ)
Рис. 20-10. Процент зачатий в зависимости от дня единственной вязки (267 сук породы бигль). Из: Holst РА, Phemister RD: Am J Vet Res 35:401, 1974.
et al, 1989b), что не дает возможности установить оптимальный день для проведения вязки. Оплодотворение яйцеклеток обычно происходит даже после однократной вязки (рис. 20-9 и 20-10). В одном из экспериментов 21 суку вязали дважды (каждый раз с новым кобелем): первый раз за 36 часов до овуляции, а второй раз через 84 часа после нее. Только у двух сук оплодотворение яйцеклеток произошло после повторной вязки (Doak et al, 1967). Результаты этого опыта позволяют предположить, что наиболее эффективной является вязка, проводимая в самом начале течки. Оптимальный режим вязок предусматривает их проведение, по меньшей мере, один раз каждые 2-4 дня в течение всей фазы половой охоты. После оплодотворения дробление более зрелых овоцитов на две, а затем последовательно до 16 клеток происходит быстрее, чем менее зрелых. Это отчасти объясняет, почему продолжительность плодоношения приблизительно одинакова в случаях, когда вязка произошла до и после овуляции (Bysted et al, 2000; Concannon et al, 2000).
Сперматозоиды
Информация о продолжительности сохранения сперматозоидами жизнеспособности во время их пребывания в матке помогает понять, какой должны быть вязка суки, чтобы достичь максимального уровня оплодотворения яйцеклеток. Сперматозоиды во время вязки способны попасть в яйцеводы в течение 25 секунд после эякуляции. Еще более важно, что они могут относительно долго сохранять жизнеспособность в матке сук. Концентрация сперматозоидов не снижается в матке в течение 4-6-дней после однократной вязки, и они сохраняют жизнеспособность, по меньшей мере, 6-7 дней (Doak et al, 1967; Cocannon et al, 1983). Подвижные сперматозоиды в матке обнаруживали и в значительно более отдаленные от вязки сроки - через 11 дней. Сперматозоидам необходимо около 7 час пребывания в половых органах суки для достижения
способности к оплодотворению яйцеклеток (капа-цитации). По прошествии этого времени сперматозоиды могут проникать через блестящую оболочку яйцеклеток. In vitro сперматозоид проникает на желточную (вителиновую) оболочку и претерпевает ядерную деконденсацию в незрелой яйцеклетке (первичном овоците) (Mahi-Brown et al, 1982).
Продолжительность пребывания оплодотворенных яйцеклеток (первичных и вторичных овоцитов) в яйцеводах составляет несколько дней. С учетом способности длительного выживания сперматозоидов в половых путях суки можно предположить, что однократной вязки вполне достаточно для оплодотворения созревших яйцеклеток (см. рис. 20-9 и 20-10). Однократная вязка, проведенная в период между двумя днями до и пятью днями после выброса ЛГ, приводит к развитию беременности у 95% здоровых сук. Максимальное количество щенков бывает в пометах сук, однократно повязанных в период с 4 по 10 дни до начала диэструса. Эффективность оплодотворения снижается до 80% в тех случаях, когда однократная вязка произошла через 6 дней после пика ЛГ и падает до нуля, если вязку проводят через 10 дней после пика ЛГ. Это сопровождается и снижением количества щенков в пометах. Диэструс, как правило, наступает приблизительно на восьмой день после пика ЛГ. Влияние перечисленных выше факторов на результаты вязки иллюстрирует рис. 20-9; приведенная схема полностью соответствует результатам более ранних исследований (см. рис. 20-10).
ОРГАНИЗАЦИЯ ВЯЗКИ СУКИ
Большинство «бесплодных» сук здоровы
Самой частой проблемой, с которой сталкиваются ветеринарные врачи, занимающиеся репродукцией собак, является «потенциальное» бесплодие сук и кобелей. Обычно заводчики приводят своих собак для проведения обследования, когда начинают сомневаться в том, что их питомцы могут дать потомство. Важно иметь в виду, что большая часть этих собак абсолютно здорова и плодовита, а подозрение относительно их бесплодия возникло лишь на основании непонимания того, как следует правильно организовывать вязку собак. Поэтому до проведения специальных исследований, направленных на установление возможных причин бесплодия, необходимо предварительно ознакомиться с протоколами предшествовавших вязок.
Возраст, скрытая течка, расщепленная течка, неопытность и отсутствие овуляции
Возраст. Завершение полового созревания и первый овариальный цикла у сук обычно происходят в течение 1-6 месяцев после достижения размеров и массы тела взрослой собаки. Поэтому у карликового пуделя первый проэструс наступает значительно
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 871
раньше, чем у дога. Однако течение первых 1-2 половых циклов может иметь нерегулярный характер, что беспокоит владельцев, которые хотели бы как можно раньше получить потомство от своих питомцев. К числу основных причин возникновения данной проблемы относятся скрытая течка, дробная течка, особенности поведения сук и отсутствие у них овуляции.
Скрытая течка. Скрытой называют течку, которая остается незамеченной владельцем собаки. Во время скрытой течки отсутствуют выделения из влагалища или их количество мало; бывают случаи, когда выделения остаются незамеченными, поскольку животное тщательно их вылизывает или рядом нет кобеля. В таких случаях только опытный владелец собаки способен определить наступление проэструса или эструса. Чаще всего такой скрытый характер принимают первые 1-2 овариальных цикла.
Расщепленная течка. Расщепленная течка сопровождается появлением у сук на стадии проэструса кровянистых выделений из влагалища и набуханием вульвы. Это не остается незамеченным кобелями, которые начинают проявлять к суке повышенный интерес. В ее поведении до наступления стадии диэструса могут появляться типичные для половой охоты поведенческие реакции, но они могут и отсутствовать. Между тем, проэструс у таких сук несколько раз повторяется с интервалом в 2-10 недель. Исследования показали, что такие рецидивы проэструса вызваны развитием фолликулов яичников и секрецией эстрогена. Однако овуляции каждый раз не происходит, и фолликулы остаются атретическими (невскрывшимися). В последующий период развивается следующая партия фолликулов, что ведет к повышению концентрации циркулирующего в крови эстрогена и развитию признаков очередного проэструса (Okkens et al, 1992).
При полном созревании фолликулов и последующей овуляции овариальный цикл становится продуктивным (т.е. овулировавшие яйцеклетки могут быть оплодотворены), и начинается межэстраль-ный период, состоящий из диэструса и анэструса. Дробную течку часто принимают за нарушение поведения, принуждая суку к вязке или проводя ее искусственное осеменение. Но в отсутствие овуляции у нее нет никаких шансов забеременеть. Дробная течка может происходить у сук в разном возрасте, но наиболее часто она бывает у молодых животных. Этиологически она не связана ни с какими серьезными заболеваниями.
Неопытность и отсутствие овуляции. Совсем не удивительно, что бывают случаи, когда молодые суки, даже находясь на стадии эструса, не проявляют той адекватной реакции на кобелей, которую от них следовало бы ожидать. Неопытные кобель и сука могут оказаться не в состоянии войти в «замок», особенно если процесс вязки контролируют не имеющие соответствующего опыта владельцы собак. Примерно половина неудачных вязок объясняется этой причиной. Диагноз «неопытность»
поставить нельзя, но всегда следует иметь в виду такую возможность при анализе бесплодия молодых сук и кобелей. Помимо того, у некоторых сук основные этапы полового цикла и вязка протекают нормально, но овуляции не происходит. Это можно косвенно установить по отсутствию последующего типичного 60-90-дневного периода, во время которого проявляется доминирующее влияние прогестерона (см. гл. 19).
Выводы. Проблемы скрытой течки, дробной течки, отсутствия овуляции или неудачной вязки не должны служить поводом для беспокойства владельцев сук, возраст которых не достиг 24-30 месяцев. Если заводчики станут проводить вязку своих сук после первых двух половых циклов или достижения ими 24-месячного возраста, то поводов для беспокойства или разочарований станет значительно меньше. Такой подход позволяет также устранить влияние недостижения обычной половой зрелости суки или кобеля на результаты вязок.
Интервалы между вязками во время одного эструса и выбор времени проведения вязки
Цель вязки. Истинная цель любой программы вязок состоит в том, чтобы количество сперматозоидов, попавших в матку и яйцеводы, было достаточным для оплодотворения зрелых яйцеклеток. Яйцеклетки сук достигают зрелости обычно в течение 3-8 дней после пика ЛГ. Процесс созревания начинается через 24-48 часов после овуляции первичных (незрелых) овоцитов (см. рис. 20-9). В этой связи возникает необходимость в методах, позволяющих точно определить день выброса ЛГ. Об этом можно судить по изменениям поведения, цитологической картины влагалищных мазков, результатов вагиноскопии и концентрации прогестерона в сыворотке крови суки. Ни один из четырех перечисленных критериев не является идеальным, но когда ими пользуются в комплексе, то удается точно установить дату повышения концентрации ЛГ, что позволяет определить оптимальное время вязки. С этой же целью можно воспользоваться прямым определением концентрации ЛГ в сыворотке крови суки. Более того, известно, что нормальные сперматозоиды, находясь в половых органах суки, остаются жизнеспособными и сохраняют способность оплодотворять зрелые овоциты в течение, по меньшей мере, 4-6 дней, а в отдельных случаях до 11 дней. На основании этой информации заводчикам может быть рекомендована программа вязки сук, позволяющая достичь наибольшего успеха.
Критерий 1: поведение. Появление у суки характерных для течки изменений поведения, которые обычно называют «половой охотой», является критерием того, что можно начинать проведение вязки. Как правило, проявление признаков половой охоты свидетельствует о плодовитости суки. Позитивная поведенческая реакция суки на кобеля служит простым, надежным и не требующим материальных за
872 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
трат способом определения начала и завершения периода, когда следует проводить вязку. Нередко целесообразно при сведении суки с кобелем держать обоих животных на поводках. При этом каждым животным должен заниматься отдельный человек на случай возникновения между ними драки. Однако, если есть такая возможность, лучше предоставить собакам определенную свободу передвижений. Явные попытки суки привлечь к себе внимание кобеля служат основанием для незамедлительного проведения вязки независимо от того, какой цвет имеют влагалищные истечения, какой результат дало цитологическое исследование влагалищных мазков и как долго длится у суки течка.
На 5-6 дни проэструса следует организовать 10-20-минутную встречу суки с кобелем. В последующем контакты животных возобновляют каждый второй или третий дни. Вязку (или искусственное осеменение) начинают проводить, как только сука проявит половую охоту, а затем ее повторяют через день до тех пор, пока сука будет демонстрировать половую охоту. В случае ИО сперму вводят сукам во влагалище или матку с интервалом в сутки. Единственной сложностью является невозможность точно определить продолжительность периода половой охоты у каждой собаки, но в среднем он составляет 7-9 дней.
Мы рекомендуем вязать суку каждые 2-4 дня, начиная с первого дня и заканчивая последним днем периода половой охоты. Если не удается предсказать продолжительность этого периода, то целесообразно повторять вязку каждые 2-3 дня. Часто помогают наблюдения, сделанные в предыдущие половые циклы, поскольку у сук в возрасте от 2 до 6 лет продолжительность циклов и эструса носит, как правило, стабильный характер. Сук, у которых период половой охоты обычно длится более 12 дней, рекомендуется вязать каждый третий или четвертый день. В случаях кратковременного (3-4-дневного) периода охоты перерывы между повторными вязками сокращают до 24-48 часов.
Основной рекомендацией, которую можно было бы дать заводчикам, является продолжение вязок до тех пор, пока сука не станет отвергать кобеля или до первого дня диэструса, о наступлении которого можно судить по результатам цитологического анализа влагалищных мазков. Оплодотворение зрелых яйцеклеток наиболее успешно происходит в последние 4-5 дней периода охоты (независимо от его общей продолжительности) или за 4-5 дней до начала диэструса.
Критерий 2: цитологические изменения влагалищных мазков. Эксфолиативное цитологическое исследование влагалищных мазков прекрасно отражает изменения концентрации эстрогена в плазме крови. В период максимального действия эстрогена относительное количество поверхностных эпителиальных клеток во влагалищных мазках составляет 80% и выше при отсутствии или небольшом количестве нейтрофилов. Такая цитологичес
кая картина типична для периода половой охоты. Как только количество поверхностных эпителиальных клеток во влагалищных мазках превысит 60-80%, следует проследить за реакцией суки на кобеля. При выявлении у суки типичного для периода половой охоты поведения проводят ее вязку или искусственное осеменение. Как уже говорилось в главе 19, цитологическое исследование влагалищных мазков является простым, недорогим и надежным методом контроля течения овариального цикла. Рекомендуется продолжать контакты суки с кобелем или их вязку через день, а ИО ежедневно до тех пор, пока относительное количество поверхностных эпителиальных клеток во влагалищных мазках будет оставаться выше 80%. Как только этот показатель снизится до 60%, вязку или ИО прекращают. Таким образом, вязку/искусственное осеменение продолжают до тех пор, пока цитологические изменения слизистой оболочки влагалища не становятся типичными для диэструса. Чтобы не опоздать с проведением вязки, цитологическое исследование влагалищных мазков следует начинать на второй или третий день проэструса.
Критерий 3: эндоскопия влагалища. Эндоскопия влагалища может быть использована в качестве вспомогательного метода определения стадии полового цикла, что необходимо для установления времени вязки или искусственного осеменения. В главе 19 детально описаны морфологические изменения (отечность и сглаживание неровностей) слизистой оболочки влагалища сук во время проэструса. Легкое сморщивание слизистой оболочки (кренуляция) ассоциируется с предовуляторным выбросом ЛГ. Именно в этот период следует начинать проведение вязки или искусственного осеменения. Их повторяют на всем протяжении периода охоты, пока кренуляция, проявляющаяся наличием в слизистой оболочке влагалища ребристых складок с заостренными краями, выражена наиболее интенсивно. Вязку и/или искусственное осеменение прекращают, как только слизистая оболочка снова становится вялой и гладкой, а ее поверхность приобретает пятнисто-красный или белый цвет. Такое разглаживание, как правило, происходит на 6-10 дни после пика ЛГ (Lindsay, Concannon, 1986). В отличие от других критериев, по которым судят о сроках, в которые следует проводить вязку или искусственное осеменение сук, выявление крену-ляции слизистой оболочки влагалища носит субъективный характер и требует достаточного опыта у проводящего эндоскопию специалиста.
Критерий 4: концентрация прогестерона в сыворотке крови. В ветеринарных клиниках широко применяются диагностикумы для определения концентрации прогестерона в сыворотке крови собак. На основании динамики ее изменения устанавливают время овуляции. Определение прогестерона в сыворотке крови сук рекомендуется начинать через 3-4 дня после появления кровянистых выделений из половых органов или в течение первых
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 873
одного-двух дней после установления во влагалищных мазках повышенного (более 60%) количества поверхностных эпителиальных клеток. Идеально, если концентрация прогестерона в это время не превышает 1 нг/мл. Кровь у животных берут ежедневно или через день до тех пор, пока концентрация прогестерона не превысит 1 нг/мл, на основании чего можно будет предполагать, что выброс ЛГ произошел или начинается (Eckersall, Harvey, 1987; Hegstad, Johnston, 1992; Manothaiudom et al, 1995; Goodman, 2001). В это время следует начинать вязку или ИО, которые повторяют соответственно через день или ежедневно на протяжении 8 дней или до тех пор, пока по остальным критериям (цитологической картине влагалищных мазков или поведению) не будет установлен переход эструса в диэструс.
Повышение концентрации прогестерона и ЛГ в сыворотке крови начинается одновременно, при этом в день выброса ЛГ уровень прогестерона достигает 1,0-1,9 нг/мл (3,1-5,9 нмоль/л). На следующий день (т.е. за один день до овуляции) концентрация прогестерона в сыворотке крови составляет 2,0-3,9 нг/мл (6,2-12,1 нмоль/л), а в день овуляции она возрастает еще больше, достигая уровня 4,0-10,0 нг/мл (12,4-31,0 нмоль/л). В настоящее время в ветеринарных клиниках применяется несколько диагностикумов для определения концентрации прогестерона в сыворотке крови с помощью иммуноферментного метода (например, PreMate, производства Camelot Farms, или Status-Pro, производства Synobioticks, США). Сравнительная оценка результатов иммуноферментного и радиоиммуно-логического анализов выявила низкую корреляцию между ними, особенно при концентрации прогестерона в сыворотке крови в пределах 1,5-10,0 нг/мл, а именно такой уровень прогестерона указывает на начало овуляции. Поэтому по возможности следует пользоваться радиоиммунологическими наборами (Bouchard et al, 1993; Kustritz, Johnston, 2000a).
Критерий 5: концентрация ЛГ в сыворотке крови. Для определения концентрации ЛГ в сыворотке крови собак имеются коммерческие наборы (например, Status LH, производства Synbiotics Corp., США), однако неизвестно, насколько они точны (Kustritz, Johnston, 2000а и 2000b). Повышение концентрации ЛГ в сыворотке крови сук является наиболее точным маркером овуляции. Правильное установление дня выброса ЛГ особенно важно при проведении ИО охлажденной или хранившейся в замороженном виде спермой, а также при вязке сук, оставшихся бесплодными в предыдущие овариальные циклы, или кобелей, которых считают низко плодовитыми. Кровь для серологического исследования следует брать у сук ежедневно, поскольку повышение концентрации ЛГ в большинстве случаев происходит внезапно и носит быстротечный характер. Выброс ЛГ и затем резкое снижение его концентрации происходят, как правило, в течение суток, и если этот день пропустить, то эти изме
нения могут остаться незамеченными (Goodman, 2001). Однако многократное тестирование может быть неприемлемым для некоторых владельцев собак вследствие его слишком высокой стоимости.
Недостаточно надежные критерии. Для определения времени вязки сук имеются и другие, но менее надежные критерии. К ним относятся количество дней с начала проэструса (появление кровянистых выделений из половых органов), время изменения цвета выделений с кровянистого на соломенный, поведение кобеля и набухание у суки наружных половых органов.
Предполагаемая дата проведения вязки/ис-кусственного осеменения. Никогда не следует проводить вязку сук в срок, рассчитанный только на основании данных о времени начала проэструса. Широко распространенная практика начала проведения вязки по прошествии 10 дней с начала проэструса основана на том, что его средняя продолжительность у собак составляет 9 дней. Однако следует иметь в виду, что у здоровых сук продолжительность проэструса может варьировать в широких пределах - от нескольких дней до 3 недель. Более того, у одних собак бывают обильные кровянистые выделения, а у других проэструс может пройти незамеченным из-за низкой интенсивности выделений или их отсутствия. Таким образом, вязка или ИО через 9 и 11, или 10 и 13 дней после начала проэструса не очень надежны и не позволяют достичь такового же уровня оплодотворения, как при их проведении на основании рассмотренных выше критериев.
Цвет влагалищных выделений. Часто считают, что оптимальным временем начала проведения вязки/искусственного осеменения является день, когда кровянистые влагалищные выделения приобретают полупрозрачный желтый или соломенный цвет, или светлеют. Следование такой рекомендации нередко вводит в заблуждение. У части совершенно здоровых сук никогда не бывает кровянистых выделений из половых органов, а у других собак они сохраняются даже в период половой охоты. Таким образом, по цвету и консистенции влагалищных выделений нельзя надежно определить оптимальное время для начала проведения вязки/искусственного осеменения.
Набухание вульвы. Во время проэструса вульва у сук отекает, набухает и увеличивается в размере. По мере того как проэструс сменяется течкой, наружные половые органы становятся мягкими, спавшимися и пластичными. Выявление таких изменений требует определенного опыта и носит субъективный характер. Поскольку большая часть владельцев собак, обращающихся при возникновении необходимости вязки их питомцев за помощью к ветеринарным специалистам, достаточным опытом в данной области не обладают, то поощрять их в применении такого критерия не стоит.
Присутствие глюкозы во влагалищном секрете. Как правило, половая охота начинается у сук,
874 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
как только у них возрастает уровень прогестерона в плазме крови. Повышение концентрации прогестерона может сопровождаться появлением у животных непереносимости глюкозы вследствие его антагонизма с инсулином, что приводит к повышению концентрации внеклеточной глюкозы, в том числе к ее появлению во влагалищном секрете (Ryan, Enns, 1988). О наличии глюкозы в секрете можно судить по результатам экспресс-анализа, проводимого с помощью диагностических тест-полосок. Между тем, этот признак не имеет постоянного характера и не рекомендуется для определения сроков проведения вязки/искусственного осеменения.
Поведение кобеля. Обычно кобели всегда готовы к вязке с любой сукой, находящейся в половой охоте. Имеется мнение, что опытные кобели способны выбирать наилучшие дни для вязки суки. Между тем, возможность и срок вязки, как правило, определяет сама сука. В связи с этим более информативным является поведение суки, а не находящегося рядом с ней кобеля.
Рекомендации по проведению программы вязки
Добросовестным заводчикам можно дать ряд рекомендаций по организации проведения вязки здоровых сук. Эти рекомендации не вредят животным, а их выполнение обычно повышает эффективность любой программы вязки:
1. Необходимо регистрировать даты набухания наружных половых органов, начала кровянистых выделений и появления у кобелей повышенного интереса к суке.
2. Для определения первого дня половой охоты на 5-6 дни проэструса к суке приводят кобеля. Затем их контакты возобновляют с интервалом в один-два дня. Если раньше имели место неудачные вязки или искусственное осеменение, кобеля начинают приводить с первого дня проэструса.
3. Вязку следует проводить в тот же день, когда у суки появляется позитивное отношение к кобелям. Затем вязку повторяют каждые 2-4 дни до тех пор, пока сука не начнет от нее отказываться.
4. В случаях бесплодия, а также ненормального по продолжительности (слишком длинного или короткого) периода половой охоты необходимо обучить владельца собаки методике изготовления влагалищных мазков. Их делают ежедневно на протяжении предполагаемых стадий проэструса и эструса, а также нескольких первых дней диэструса. Подготовленные влагалищные мазки заводчик передает ветеринарному специалисту для микроскопического исследования. Влагалищные мазки красят и тестируют по мере их изготовления или анализируют сразу всю серию препаратов после окончания эструса. Результаты цитологического исследования сопоставляют с информацией о программе вязки и достигнутого с ее помощью уровня оплодотворения. Если воз
можно, определяют динамику изменения концентрации прогестерона в сыворотке крови суки (в сочетании с вагиноскопией или без нее), как это описано выше.
5. Собирают данные, касающиеся течения проэструса и проводившейся программы вязки и результатов цитологического исследования влагалищных мазков. Регистрируют, был ли замок у собак во время вязки, и если был, то какую он имел продолжительность, а также как себя вели сука и кобель во время вязки. Важна информация о том, каким был приплод, полученный после вязки этого кобеля с другими суками. Регистрируют дату и продолжительность родов, продолжительность интервалов времени между рождением щенков, их количество и здоровье, а также любую другую информацию, включая сведения о том, сколько живых щенков и по какой причине было уничтожено.
Вынашивание плодов разного возраста и разные отцы
Одной из причин отказа некоторых заводчиков проводить вязки каждые 2—4 дня, является опасение, что это приведет к одновременному развитию в матке плодов разного возраста. Однако их страх напрасен, поскольку созревание яйцеклеток происходит в течение короткого периода времени (24-96 часов), вследствие чего возрастные различия развивающихся плодов несущественны. Более того, после оплодотворения дробление более зрелых овоци-тов на две, а затем последовательно до 16 клеток происходит быстрее, чем менее зрелых овоцитов. Это объясняет, почему продолжительность плодоношения приблизительно одинакова в случаях, когда вязка произошла до или после овуляции (Bysted et al, 2000; Concannon et al, 2000).
Большие различия в размере, весе и степени развития новорожденных щенков определяются, в основном, временем имплантации овоцитов, здоровьем и наследственностью каждого из плодов, функциональным состоянием их плаценты и тех участков матки, в которых происходило их развитие. Важно не забывать о том, что при вязке суки разными кобелями в ее матке могут одновременно развиваться щенки от разных отцов, отличающиеся друг от друга по генотипу и фенотипу (цвету шерсти, размеру и т.д.). Повторные вязки не отражаются на синхронизации выброса ЛГ и процесса овуляции.
Борьба с паразитами и схемы вакцинации
Противопаразитарные обработки и вакцинации предназначенных для вязки сук проводят до наступления у них проэструса. В крайнем случае, их делают в самом начале проэструса. Прививать сук, которые могут оказаться щенными, не рекомендуется, но когда имеется такая необходимость,
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 875
вакцинацию проводят убитыми препаратами (против бешенства и парвовирусной инфекции). Антигельминтную обработку против Toxocara canis и Ancylostoma caninum проводят пероральной дачей фенбендазола в дозе 50 мг на 1 кг массы тела в период с 40 дня беременности до 14 дня после родов. Щенных сук обследуют на отсутствие дирофиля-риоза; в неблагополучных по этой инвазии районах проводят превентивную терапию. Ежемесячные противопаразитарные обработки ивермектином и мильбемицином оксимом безопасны для беременных сук.
БЕРЕМЕННОСТЬ
Количество щенков в помете
Существует закономерность, что чем крупнее порода собаки, тем больше средний размер ее помета. Суки карликовых пород обычно рожают от 1 до 4 щенков, а суки крупных пород - в среднем по 8, 10 и даже 12 щенков. Размер помета также зависит от концентрации сперматозоидов в сперме использованного для вязки кобеля (в норме этот показатель составляет 250-800 млн/эякулят), времени проведения вязки, здоровья суки, физиологического состояния ее матки и многих других факторов. Безусловно, уровень обмена веществ суки, наличие у нее гормональных нарушений и дача ей во время вязки и беременности ряда фармацевтических препаратов оказывают существенное влияние на ее плодовитость. Наибольшее количество щенков в помете бывает в тех случаях, когда вязку начали проводить за 2 дня до пика ЛГ и продолжили в течение 5 дней после пика. Предоставление суке возможности через день контактировать с кобелем до завершения периода половой охоты является самым дешевым и логичным способом получения от нее максимально возможного приплода. Использование обсуждавшихся выше критериев определения оптимального времени вязки (цитология и эндоскопия влагалища, определение прогестерона в плазме крови) может быть полезным, но необходимость в этом возникает не всегда.
Последовательность событий
Оплодотворение яйцеклеток завершается в яйцеводах. Эмбрионы на стадии морулы собираются в дистальных участках яйцеводов. Здесь они развиваются до стадии 32-64-клеточных бластоцитов, после чего мигрируют в матку. С момента предовуля-торного пика ЛГ и до попадания эмбрионов в матку проходит 16-20 дней. В течение 3 дней бластоциты свободно плавают в секрете ипсилатерального (т.е. расположенного с той же стороны) рога матки, а затем наступает 3-дневный период их распределения по соответствующим участкам матки. В это время они представляют собой структуры диаметром около 2 мм. На 17-19 дни после предовуляторного
пика ЛГ в эндометрии появляются локализованные участки отека, расположенные на приблизительно одинаковом расстоянии друг от друга. Они предназначены для прикрепления эмбрионов, однако последние пребывают в свободном состоянии до 21-22 дня после выброса ЛГ. Сердечные сокращения удается выявить с помощью УЗИ только через 1-2 дня после прикрепления эмбрионов (Concannon et al, 2000). Между количеством овоцитов, овулировавших в каждом из яичников, оплодотворенных в каждом из яйцеводов и имплантировавшихся в соответствующем роге матки, корреляция отсутствует. Наиболее вероятно, что происходит равномерное распределение оплодотворенных овоцитов между обоими рогами матки, независимо от того, из какого именно яичника они овулировали (Concannon, Yeager, 1990).
На 20 день после предовуляторного пика ЛГ очаги отека матки, представляющие собой места имплантации овоцитов, имеют диаметр около 1 см. После проникновения в них эмбриональных мембран начинает образовываться плацента. Эндотелий кровеносных сосудов матки оказывается в непосредственной близости от хориона плодов. В этом слое локализуются мезенхимальные и эндотелиальные ткани. Кровотоки матери и ее плодов разделяются четырьмя слоями клеток. Такой тип плаценты называют эндотелиохориальным, что отражает ее сосудистое происхождение. Плацента собак имеет анатомически зонарный характер и отделяется от стенки матки при родах, оголяя эндометрий.
Вокруг трофобласта в матке появляются содержащие кровь пограничные гематомы, из которых в последующем через кровеносные сосуды пуповины плоды сорбируют железо и другие необходимые им питательные вещества. Содержащий эмбрион амнион свободно плавает в полости аллантоиса, будучи прикрепленным к матке только пуповиной. Такая структурная связь матки и плодных оболочек полностью формируется на 23-й день беременности, а спустя одну неделю очаги отека достигают диаметра 3 см. На 35-й день беременности у эмбрионов становятся различимы тела. В 40-дневном возрасте их глаза прикрыты веками, на каждом пальце имеется коготь, видны шерсть и отметины. В этот период удается определить пол плодов. После 42—45 дней беременности рентгенологическое исследование выявляет образование костей скелета у плодов. В последующий период внутриутробного развития завершается полное формирование плодов (Concannon, Yeager, 1990).
Сука
Развитие беременности сопровождается происходящими в организме суки клиническими и биохимическими изменениями, которые могут иметь определенное значение. Масса ее тела повышается на 20-50%, т.е. в среднем на 3 6% (Arthur et al, 1984). Это увеличение особенно значительно во второй поло
876 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
вине беременности. На 30-40-й дни плодоношения матка может поворачиваться вокруг своей оси, что вызывает у щенной суки некоторый дискомфорт. У суки во время беременности может развиваться легкий лейкоцитоз - концентрация лейкоцитов колеблется от 17000 до 26000 клеток/мл. На 35-й день беременности уровень гематокрита не превышает 40%, а к концу беременности этот показатель снижается до 35% и ниже. У беременных сук обычно имеет место нормоцитная, нормохромная анемия, вызванная повышением объема плазмы крови и соответствующим снижением концентрации эритроцитов. Концентрация фибриногена повышается с 20 дня беременности, достигает максимального уровня в течение последующих 10 дней, снижается незадолго до родов, а во время последних вновь повышается (Gentry, Liptrap, 1981; Concannon et al, 1996). У беременных сук также описано небольшое снижение концентрации иммуноглобулинов G (IgG) в сыворотке крови (Fisher, Fisher, 1981) и интенсивный синтез простациклина, который циркулируя в крови, выполняет функции вазодилятатора (Gerber et al, 1981). В ряде случаев у беременных сук развиваются гиперхолестеринемия и гиперпротеинемия. Хотя повышения концентрации протромбинового или парциального тромбопластинового времени не происходит, тем не менее, во время щенности повышается активность коагуляционных факторов VII, VIII, IX и XI (Gentry, Liptrap, 1981).
Эндокринология
Гормоны гипофиза. Роль гипофиза в поддержании беременности у сук мало изучена. Концентрация циркулирующего в крови ЛГ в конце эструса и в первой половине беременности остается на низком уровне. Секреция ЛГ, как и других гормонов гипофиза, носит пульсирующий характер, и концентрация ЛГ может слегка повышаться во второй половине лютеальной фазы (Fernandez et al, 1987). ЛГ и пролактин считаются важными лютеотропны-ми гормонами, поскольку удаление гипофиза сразу прерывает беременность (Concannon, 1980). Концентрация ФСГ повышается во второй половине беременности, что может обусловливать слабое повышение уровня эстрогена в это время (Concannon, Yeager, 1990).
Во время проэструса и эструса концентрация пролактина, хотя и претерпевает определенные колебания, но все-таки остается низкой. Во второй половине беременности его секреция повышается приблизительно в 10 раз, достигая уровня, который значительно выше, чем обычно регистрируемый у нещенных сук во время диэструса (De Coster et al, 1983). Такое специфическое для беременности повышение концентрации пролактина предположительно связано с усилением секреторной активности гипофиза, однако, матка и плацента, возможно, также синтезируют пролактиноподобный белок (Concannon, Yeager, 1990). Концентрация пролакти
на в сыворотке крови резко повышается, достигая максимального уровня на короткое время непосредственно перед началом родов, и одновременно резко падает концентрация прогестерона (Concannon, Yeager, 1990). В течение первых одного-двух дней после родов концентрация пролактина снижается, а в последующий лактационный период вновь повышается в ответ на сосание щенками молока. Секрецию пролактина подавляет образующийся в гипоталамусе дофамин. Добиться снижения концентрации пролактина удается с помощью бромокриптина - агониста дофамина (Concannon, 1981).
Прогестерон
Для нормального течения беременности необходимо наличие в яичниках функционально активного желтого тела. Удаление у сук яичников на 30 день беременности приводит к аборту в течение 24-72 часов. Концентрация прогестерона в плазме крови в середине проэструса обычно выше 0,5 нг/мл, но ниже 1,0 нг/мл; перед началом половой охоты (до выброса ЛГ) она поднимается выше 1,0 нг/мл и продолжает увеличиваться на протяжении последующих 15-25 дней. В первый день стадии диэструса концентрация прогестерона в сыворотке крови всегда превышает 5 нг/мл; на 10-15 дни диэструса она обычно преодолевает уровень 25 нг/мл, достигая у некоторых сук 50-90 нг/мл. Поднявшись до максимального уровня, концентрация прогестерона, как правило, остается неизменной в течение 7-15 дней, после чего медленно снижается на всем протяжении оставшейся части беременности. За 36—48 часов до родов концентрация прогестерона в сыворотке крови сук ниже 2 нг/мл. Поддержание ее в этот период на уровне выше 2 нг/мл путем введения сукам содержащих прогестерон имплантатов может привести к полной остановке родов.
Считается, что прогестерон необходим для развития желез эндометрия и образования ими секрета, роста эндометрия, под держания плаценты в прикрепленном к эндометрию состоянии, подавлению лейкоцитарных реакций в матке и двигательной активности матки (Nelson et al, 1982). Многочисленные исследования показали отсутствие достоверных различий в средней концентрации прогестерона в сыворотке крови щенных сук и нещенных сук во время диэструса. Поэтому по концентрации этого гормона в сыворотке крови нельзя установить, щенна собака или нет (рис.20-11).
Эстроген
В первые 5-6 недель щенности концентрация эстрадиола (эстрогена) в плазме крови остается на базальном уровне (5-15 пг/мл), который наблюдается во время анэструса. На более поздней стадии щенности концентрация эстрогена может слегка повышаться, но всегда остается ниже того уровня, который был в проэструсе (ниже 20 пг/мл). Повы-
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 877
Недели после вязки
Рис. 20-11. Концентрация прогестерона в сыворотке крови во время щенности и при ложной щенности на стадии диэструса. В скобках указано количество животных. Из: Steinetz BG et al: Am J Vet Res 50:68, 1989).
шейный уровень эстрогена сохраняется на протяжении всего периода беременности и снижается, как и прогестерон, перед родами. Считается, что эстроген стимулирует развитие молочной железы и, возможно, способствует релаксации шейки матки.
Щитовидная железа и кора надпочечников
Щитовидная железа. Во время щенности гормональный статус меняется. В одной работе не было выявлено различий в концентрации тироксина (Т4) в сыворотке крови суки во время беременности и на стадии диэструса. Однако на других стадиях овариального цикла концентрация тироксина, как базальная, так и стимулированная тиреотропином, оказалась значительно ниже, чем у щенных собак. Концентрация трийодтиронина (Т3) у небеременных сук во время диэструса была выше, чем на других стадиях овариального цикла и во время беременности.
Кортизол. Концентрация кортизола в плазме крови остается постоянной в течение всего овариального цикла. Напротив, ответ кортизола на стимуляцию АКТГ различается и может быть выражен следующим соотношением: анэструс = диэструс > лактация = беременность >проэструс. Причина изменения синтеза гормонов в щитовидной железе и/ или надпочечниках во время беременности или диэструса у собак непонятна. Тем не менее, при оценке гормонального профиля необходимо принимать во внимание фазу эстрального цикла и щенность (Reimers et al, 1984).
Глюкоза
Гормональные изменения, происходящие во время беременности, могут обострить у некоторых собак течение сахарного диабета. У этих животных еще до вязки наблюдается субклиническая, но яв
ная непереносимость глюкозы. Резистентность к инсулину становится более выраженной в период плодоношения (McCann, Concannon, 1983; VcCann et al, 1988) и, по-видимому, обусловлена острым и хроническим воздействием повышенной концентрации прогестерона (Ryan, Enns, 1988). Возможность повышения резистентности к инсулину следует учитывать при лечении сахарного диабета у щенных сук.
Продолжительность периода плодоношения и определение предполагаемой даты родов
Вариабельность времени овуляции, проведение нескольких вязок и непостоянная продолжительность течки затрудняют определение даты оплодотворения яйцеклеток и, соответственно, срока начала родов. Общепринятое мнение о том, что период плодоношения у сук составляет 63-65 дней с момента первой вязки, далеко не всегда совпадает с реальным положением вещей (рис. 20-12 и 20-13). На самом деле роды у сук могут произойти на 55-72 дни после первой вязки. Точная информация о том, когда их следует ожидать, важна для любого заводчика, но особое значение это приобретает, если заранее планируется проведение кесарева сечения. Цитологическое исследование влагалищных мазков является наиболее точным, надежным и недорогим способом определения предполагаемого срока начала родов. С этой целью ветеринарный врач или владелец суки берут влагалищные мазки ежедневно на всем протяжении периода половой охоты вплоть до начала диэструса, т.е. до того дня, когда собака начинает противиться вязке. В этот день происходит снижение относительного количества поверхностных эпителиальных клеток с 80% до уровня ниже 40%. Помимо этого, начиная с 42^15 дней щенности с помощью рентгенологического исследования брюшной полости суки можно обнаружить
878 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Рис. 20-12. Соотношение количества щенков в приплоде и продолжительности периода их внутриутробного развития, началом которого считали окончание вязок. Учитывались только те суки, которых вязали в первый день течки (п = 108). ИзгНоЫ РА, Phemister RD, Am J Vet Res 35:401,1974.
Рис. 20-13. Соотношение количества щенков в приплоде сук и продолжительности периода внутриутробного развития, началом которого считали первый день диэструса. Учитывались только те суки, которых вязали в первый и седьмой дни течки (п = 108). Из: Holst РА, Phemister RD, Am J Vet Res 35:401, 1974.
и подсчитать количество плодов. При большом количестве плодов период плодоношения, как правило, укорачивается (до 55-56 дней), в то время как при вынашивании всего 1-2 плодов суки обычно щенятся позднее (на 58-59 день).
Имеются альтернативные методы определения первого дня диэструса и предполагаемой даты родов. Наиболее популярны два способа, но они весьма дорогостоящие, требуют значительных затрат времени и специальной подготовки как заводчика, так и ветеринарного врача. При нормальном течении беременности в подавляющем большинстве случаев с момента предовуляторного пика ЛГ до начала родов проходит 64-66 дней (Concannon et al, 1983). Дату пиковой концентрации ЛГ можно
установить путем серийного определения концентрации прогестерона, заметив день, когда она поднимается выше 1 нг/мл (детали описаны выше). На предовуляторный пик ЛГ указывает также начало кренуляции слизистой оболочки влагалища. Наконец, приближение родов может быть определено посредством термометрии - ректальная температура снижается за 12-36 ч до начала щенения.
Диагностика щенности
Пальпация. Определение беременности у сук посредством пальпации их брюшной полости -простой, недорогой и надежный способ. В период с 25 по 30 дни щенности (что приблизительно соответствует 20-30 дню после первой вязки) удается прощупать увеличение матки и локализовать отдельные плацентарные места. Первоначально матка щенной суки имеет грушевидную форму, но со временем она становится сферической. У суки, масса тела которой составляет 20 кг, на 28-30-й дни щенности ампулообразные расширения рогов матки имеют длину около 2 дюймов (Johnston et al, 1982). Предполагается, что поднимание тазовых конечностей суки ведет к смещению матки в каудальном направлении и облегчает проведение пальпации. Процесс пальпации матки через брюшную стенку суки легче описать, чем проводить. Нужно иметь достаточно большой опыт, чтобы дифференцировать матку с эмбрионами от наполненной перевариваемыми массами ободочной кишки. Пальпация матки у тощих и спокойных собак осуществляется значительно проще, чем у толстых или нервных животных.
На 30-35-й дни щенности матка диффузно увеличивается, ее рога опускаются в вентральном направлении, а передние концы оказываются краниальнее последних ребер. В этот период увеличенную матку без особых трудностей можно обнаружить посредством пальпации, но идентифицировать отдельные эмбрионы значительно сложнее. На 35 день щенности места имплантации овоцитов достигают диаметра 3 см и принимают вытянутую форму. Те из них, которые расположены близко друг от друга, могут сливаться. По консистенции они скорее мягкие, чем плотные, что затрудняет восприятие их при пальпации как отдельные образования (Concannon, 1983). С 50 дня щенности матка перестает быть диффузно вздутой и плоды удается пальпировать.
Рентгенологическое исследование. Рентгенологическое исследование предоставляет прекрасную возможность диагностики беременности сук. Оно является самым надежным способом определения количества развивающихся в матке плодов. В период с 21 по 42 дни после вязки с его помощью обнаруживают увеличенные, заполненные жидкостью рога матки. Плоды удается идентифицировать только после того, как в них начинает формироваться задерживающий рентгеновские
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 879
Рис. 20-14. Латеральная (А) н вентро-дорсальная (Б) рентгенограммы брюшной полости шейной собаки со здоровыми плодами на 50-й день диэструса. Количество плодов проще всего установить путем подсчета черепов или позвоночных столбов
лучи скелет (рис. 20-14). Элементы скелета появляются за 20 -21 день до родов, что соответствует 42-52 дням после вязки или 44-47 дням с момента предовуляторного пика ЛГ. Безошибочно диагностировать беременность у сук рентгенологическим методом удается в последние 17-20 дней щенности, что соответствует 43-54 дням после вязки или 46^49 дням с момента предовулторного пика ЛГ (Concannon, Rendano, 1983).
По результатам рентгенологического исследования можно составить относительное представление о процессе развития плодов в последние две недели беременности. У плодов череп с позвоночником становятся видимыми на рентгенограммах на 44-46, таз - на 53-57 и зубы - на 58-61 -й дни после предовуляторного выброса ЛГ. Информация о стадии развития плодов имеет большое практическое значение, поскольку позволяет определять сроки приближающихся родов или проведения кесарева сечения; последнее можно проводить только после того, как у плодов сформируются зубы.
Обычно рентгенологическое исследование применяют не только для диагностики беременности сук, но также для определения количества вынашиваемых ими плодов и для прогнозирования риска развития дистоции. Количество плодов лучше всего подсчитывать по их черепам Этот метод всегда дает отличные результаты за исключением тех случаев, когда в матке находится чрезмерно большое количество плодов или если формирование скелета плодов еще не завершено. Разрушение частей скелета плодов может указывать на их ги
бель (рис. 20-15). В процессе нормальных родов череп плода при прохождении по родовым путям подвергается сжатию (рис. 20-16). Рентгенологический метод прогнозирования дистоции на основании соотношения величины черепа плодов и ширины таза суки ненадежен, а поэтому применять его не рекомендуется. Это связано, в первую очередь, с невозможностью заранее предугадать степень расширения таза суки при его расслаблении во время родов.
Ультразвуковое исследование. УЗИ является исключительно ценным методом диагностики беременности. Оно позволяет обнаруживать имплантированные овоциты уже на 18-20-й день беременности, что приблизительно соответствует 11 дню с начала диэструса (рис 20-17). Срок беременности можно ориентировочно определить путем измерения у одного или нескольких плодов бипариетального диаметра (диаметра продольного среза головы. вытянутой вдоль оси тела) и диаметре! тела (поперечного диаметра тела на уровне желудка). Оба эти показателя коррелируют с возрастом плодов (England et al, 1990). Сроки, в которые могут быть определены различные структуры, приведены в таблице 20-3. Определение с помощью УЗИ возраста плодов может быть очень точным, если известно время предовуляторного повышения концентрации ЛГ. Если же отсчет начала беременности ведут с даты вязки, то точность определения значительно снижается. Например, УЗИ позволяет обнаружить плодные пузыри диаметром в 1 мм через 17-18 дней после пика ЛГ, что ориентировочно со-
880 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Рис. 20-15. Латеральная (А) и вентродорсальная (Б) рентгенография брюшной полости суки. Видны мертвые плоды. Обратите внимание на ненормальное вытяжение шеи плода (указано стрелкой на снимке А) и скопление газа вокру! плода (указано стрелкой на снимке Б).
Рис. 20-16. Ла1еральная (А) и вентродорзальная (Б) рентгенография брюшной полости суки, вынашивающей 1 плод. На снимке Б обратите внимание на соотношение величины черепа плода (указан стрелкой) и ширины таза суки. Степень растяжения связок таза предугадать сложно. Роды прошли благополучно, хотя и с некоторыми сложностями.
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 881
Рис. 20-17. Один плодный пузырь (указан стрелкой), обнаруженный с помощью УЗИ в матке суки на 20-й день после пика Л Г. (Фото любезно пре (оставлено Dr. Tom Nyland. Davis. США).
ответствует 10-23-дневному периоду, прошедшему после вязки. С помощью УЗИ выявляют полость хориона с 20 дня, эмбрионы и сокращения их сердца с 23-25-го дня и движения плодов с 34-36-го дня после пика ЛГ (Shille, Gontarek, 1985; Taveme et al, 1985; England et al, 1990; Yeager et al, 1992). О здоровье плодов обычно судят по частоте пульса - в норме этот показатель составляет 200-225 ударов мин (Vcstcgen et al, 1993; Gradil et al, 2000).
Необходимое для проведения УЗИ оборудование стоит довольно дорого, но оно стало доступным. Этот метод позволяет быстро, не нанося какого-либо ущерба здоровью суки и вынашиваемых сю плодов, проводить раннюю диагностику беременности, а также дифференцировать беременность от пиометры. При диагностике беременности оценку интенсивности отраженной ультразвуковой волны можно проводить в единицах Доплера, однако это не даст каких-либо преимуществ.
Дна! носзика беременноеги на основании результатов исследования крови и/или мочи. Методы диагностики беременности сук по результатам анализов крови и/или мочи не разработаны. Хотя концентрация прогестерона в сыворотке крови сук при ложной щенности ниже, чем при истинной беременности, однако, эти различия не столь велики, чтобы обеспечить диагностику беременности до или после имплантации овоцитов (см. рис. 20-11).
Единственным гормоном, который вырабатывается у сук только во время беременности, является релаксин. Его можно определять с помощью иммунологических методов, но такие коммерческие наборы пока нс выпускаются (Steinetz et al, 2000). В отличие от прогестерона, концентрация релаксина в сыворотке крови сук повышается во время беременности, но не при ложной щенности (Steinet/ et al, 1987; 1989). Уровень релаксина в сыворотке крови у щенных сук значительно выше, чем у щенных овариэктомированных животных. В то же время у тех и других концентрация релаксина в сыворотке крови выше, чем у небеременных сук (рис. 20-18 и 20-19). Это дает основания предполагать, что релаксин образуется в яичниках и, вероятно, в меньшем
ТАБЛИЦА 20-3. ВОЗРАСТ ПЛОДОВ, ПРИ КОТОРОМ ВПЕРВЫЕ УДАЕТСЯ ДИАГНОСТИРОВАТЬ БЕРЕМЕННОСТЬ СУК ПОРОДЫ БИГЛЬ ПО ОТДЕЛЬНЫМ ПРИЗНАКАМ, ВЫЯВЛЯЕМЫМ ПРИ УЗИ
Признаки беременное!и Срок после пика Л Г (дни) Количество обследованных щенных сх к
Плодный пузырь 20 7
Стенка матки Эхогенность плодных пузырей 20 -23 8
Слоев плаценты 22-24 7
Поясной (зональной) плаценты 27-30 8
Положение эмбрионов Напротив стенки матки 23-25 8
В области хориона 29 33 8
Плодные оболочки Желточный меток 25-28 7
Аллантоис 27-31 7
Желточный мешок трубчатой формы 27-31 8
Желточный мешок со складчатой (в поперечном сечении) стенкой 31-35 6
Эмбрион и плод Сокращения сердца 23-25 8
Биполярная форма 25-28 8
Неэхогенная зона головы 27-31 6
Хороидное сплетение 31-35 6
Зачатки конечностей 33-35 6
Движение плода 34-36 5
Дорсальная cai иттальная трубка 30-39 5
Скелет 33-39 6
Мочевой пузырь 35-39 4
Желудок 36-39 4
Большая эхогенность легких по сравнению с печенью 38 42 4
Большая эхогенность печени по сравнению с брюшной полостью 39 -47 4
Почки 39 47 3
Глаза 39-47 4
Пупочный канатик 40 46 5
Кишечник 57 63 4
Относительные размеры плодов Диаметр тела 2 мм > диаметра головы 38 -42 4
Отношение диаметра тела плота к диаметру по кости хориона > 1:2 38-42 4
Длина тела (включая голову) плода > плаценты 40 42 4
Отношение тиаметра тела плота к наружному диаметру матки > 1:2 46-48 5
Роды 63-65 5
Из: Yeager AE et al: Ultrasonographic appcarence of the uterus, placenta, fetus and fetal membranes throughout accurately timed pregnancy in Beagles. Am J Vet Res 53, 342, 1992.
количестве в плаценте беременных сук (Steinetz et al, 1989). Несмотря на то, что определение релаксина является довольно специфичным и надежным методом диагностики щенности, следует иметь в
882
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Недели после вязки
Рис. 20-18. Концентрация релаксина в сыворотке крови у сук при беременности и ложной щенности (небеременные суки на стадии диэструса). Направленные вниз стрелки соответствуют концентрации релаксина, которая ниже определяемого уровня (0,18 нг/мл). В скобках указано количество обследованных сук. Из: Steinetz BG et al: Am J Vet Res 50:68, 1989.
Рис. 20-19. Концентрация релаксина и прогестерона в сыворотке крови овариэктомированных беременных сук, у которых беременность поддерживалась ежедневным применением 17а-этил-19-нортестостерона в дозе 1 мг/кг массы тела. Направленные вниз стрелки соответствуют концентрации гормонов ниже определяемого уровня (прогестерон - 0,5 нг/мл и релаксин - 0,25 нг/мл); п=3. Из: Steinetz BG et al: Am J Vet Res 50:68, 1989.
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
883
виду, что концентрация этого гормона достигает определяемого уровня только на 28-ЗО-й дни беременности. В последующем она постепенно возрастает, достигая пика на 40-50-й дни беременности. УЗИ позволяет диагностировать беременность сук в более ранние сроки.
В настоящее время появился ряд коммерческих диагностикумов для определения беременности у сук, основанных на выявлении изменений концентрации в сыворотке крови фибриногена и/или С-реактивного белка. Концентрация этих белков, иногда называемых «белками острой фазы», повышается в сыворотке крови сук приблизительно с ЗО-го дня беременности, остается повышенной в течение последующих 20 дней, а затем снижается практически до исходного уровня (Gradil et al, 2000). Специфичность таких методов диагностики недостаточно высока, поскольку повышение концентрации белков острой фазы происходит также у небеременных сук при заболеваниях, сопровождающихся воспалительными процессами (например, при пиометре). Поэтому мы не рекомендуем пользоваться этими методами диагностики щенности.
Терапия щенных сук
Введение любых лекарственных препаратов щепным собакам в лечебных или профилактических целях всегда сопряжено с определенным риском. Такие опасения вполне обоснованы, поскольку во время беременности лекарственные препараты могут вызывать побочные эффекты, которые не проявляются у небеременных собак. Одни препараты могут привести к быстрому аборту, а другие вызывают пороки развития у плодов, которые могут проявиться сразу или спустя месяцы после рождения. Некоторые препараты оказывают обратимое побочное воздействие на сук, но необратимые изменения в организме развивающихся плодов. Следует иметь в виду, что действие многих лекарственных препаратов на щенных собак и их плоды никогда не проверялось.
Функция яичников в разной степени контролируется гипоталамусом и гипофизом. Поэтому препараты, которые воздействуют на высшие нейроэндокринные центры, способны косвенным путем влиять на функциональное состояние яичников. Кроме того, яичники интенсивно снабжаются кровью. Скорость тока крови в желтом теле достигает
20000 мл/мин/кг (Davis, 1983), вследствие чего яичники подвергаются воздействию высоких концентраций всосавшихся в кровь препаратов. Характер воздействия многих лекарственных препаратов на различные функции яичников остается неизвестным, но всегда следует принимать в расчет возможность негативных последствий их применения.
На протяжении десятилетий считалось, что плацента служит барьером, защищающим плоды от нежелательных побочных эффектов лекарственных препаратов. Взгляд на эту проблему коренным об-
ТАБЛИЦА 20-4. ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ОБЛАДАЮЩИЕ ТЕРАТОГЕННЫМ ЭФФЕКТОМ НА ПЛОДЫ ЖЕНЩИН.* *
Лекарственный Тератогенный эффект
______препарат_____________________________________
Аминоптерин* ме- Поражение центральной нервной сис-тотрексат темы и конечностей.
Ингибиторы ангио- Продолжительная почечная недоста-тензин-превраща- точность новорожденных, замедле-
ющего фермента ние окостенения черепной коробки,
нарушение формирования почечных
Антихолинэргичес-кие препараты
Противотиреоид-ные препараты (пропилтиоурацил и метимазол)
Карбамазепин
Циклофосфамид
Даназол и другие андрогенные препараты
Диэтилстиьлбэст-рол1
Препараты с гипогликемической активностью
Литий
Мизопростол
Нестероидные противовоспалительные препараты
Параметадион1
Фенитоин
Психотропные препараты (например, барбитураты, опиоиды и бензодиазепины)
Системные ретиноиды (изотретиноин и этретинат)
Тетрациклин Талидомид
Триметадион *
Вальпроевая кислота
Варфарин
канальцев.
Мекониевый илеус новорожденных.
Зоб и гипотиреоз плодов и новорожденных, врожденная аплазия кожи (при лечении метимазолом).
Нарушение развития нервной трубки плодов.
Нарушение формирования центральной нервной системы, образование вторичных злокачественных опухолей.
Маскулинизация плодов женского пола.
Карцинома влагалища и другие врожденные нарушения развития плодов обоего пола
Гипогликемия новорожденных.
Аномалия Эбштейна (врожденный порок сердца)
Синдром Мебиуса.
Сужение просветов артерий11 некротизирующий энтероколит.
Нарушения развития лица и центральной нервной системы.
Замедление роста, а также развития центральной нервной системы.
«Синдром отмены», развивающийся у новорожденных после приема препаратов на поздней стадии беременности.
Поражения центральной нервной системы, лицевой части черепа, сердечно-сосудистой системы и т.д.
Аномалии зубов и костей.
Формирование укороченных конечностей, поражение внутренних органов.
Поражения лица и центральной нервной системы.
Нарушение развития нервной трубки плодов.
Нарушения развития скелета и центральной нервной системы, синдром Денди-Уокера (сочетание гидроцефа-лии с атрезией отверстия Мажанди).
Из: Koren et.al., 1998
*) Перечислены только те лекарства, которые оказывают тератогенный эффект в рекомендуемых терапевтических дозах. В таблицу включены все препараты, воздействующие на морфологию и развитие мозга плода, а также обладающие токсическим действием.
f) Лекарственные препараты, которые в настоящее время не применяются в клинической практике.
t1) Салин дак, возможно, не дает такого эффекта.
884 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
ТАБЛИЦА 20-5. ШИРОКО ПРИМЕНЯЕМЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, КОТОРЫЕ ПЕРВОНАЧАЛЬНО СЧИТАЛИ ВЫЗЫВАЮЩИМИ ТЕРАТОГЕННЫЙ ЭФФЕКТ, НО В ПОСЛЕДУЮЩЕМ ПРИЗНАЛИ БЕЗОПАСНЫМИ
Лекарственный препарат Первоначальная информация о риске, сопряженном с применением препаратов Последующее доказательство безопасности применения
Диазепам* Нарушение формирования ротового отверстия. На основании исследования на большой группе животных показано отсутствие тератогенного действия.
Оральные контрацептивы Нарушения развития позвоночника, ануса, сердца, трахеи, пищевода, почек и конечностей; маскулинизация, ведущая к псевдогермафродитизму. В двух широких исследованиях показано отсутствие связи применения оральных контрацептивов в первом триместре беременности с нарушениями развития плодов, включая органы размножения. Широкомасштабное исследование показало отсутствие риска развития таких осложнений при применении спермицидов у животных.
Спермициды Нарушения развития конечностей, опухоли, синдром Дауна и гипоспадия.
Салицилаты Незаращение твердого неба и врожденное заболевания сердца Многочисленные эксперименты показали отсутствие риска развития этих осложнений.
Бенедектин (доксиламин в Нарушения развития сердца и конеч- Широкомасштабное исследование показало отсутс-
сочетании с пиридоксином) ностей. твие повышения риска развития этих осложнений
Из: Koren et al, 1998.
*) Диазепам при приеме в конце беременности может вызывать неонатальный «синдром отмены» или сердечную и респираторную нестабильность.
разом изменился после того, как было установлено, что прием беременными женщинами талидомида ведет к тяжелым поражениям их плодов (Koren et al, 1998). В течение последующих 40 лет было установлено, что около 30 других лекарственных препаратов при их применении в рекомендуемых дозах оказывают тератогенное действие на плоды женщин (табл. 20-4). В то же время некоторые препараты, которые считались тератогенными, после более глубокого изучения были признаны безопасными в этом отношении (табл. 20-5).
Все препараты, признанные тератогенными у человека, оказались способными оказывать подобное действие на животных, за исключением мизопростола, который опасен только для людей. Он вызывает комплекс морфологических изменений, известный под названием «синдрома Мебиуса» (табл. 20-6). По меньшей мере, в одном случае (имеется в виду препарат изотретионин) результаты проведенных на животных исследований, возможно, предотвратили нанесение ущерба здоровью людей (Koren et al, 1998). Между тем, имеются препараты (глюкокортикоиды, бензодиазепины, салицилаты), которые в высоких дозах проявляют тератогенное воздействие на животных, оставаясь безопасными для людей при соблюдении рекомендуемой дозировки.
Способность лекарственных препаратов преодолевать плаценту и попадать в организм плодов определяется многими факторами. Молекулярная масса препарата, его растворимость в жирах и способность связывать белки, а также скорость кровотока в плаценте и стадия беременности являются лишь частью факторов, от которых зависит концентрация препаратов в тканях. Некоторые из них связываются с белками, а другие быстро метаболизируются или экскретируются организмом суки, никогда не попадая в плоды в значительных количествах. Некоторые лекарственные препараты могут накапливаться в высокой концентрации в тканях плодов, но
не в организме матери. В целом, плоды обладают ограниченной способностью метаболизировать или экскретировать многие лекарственные препараты, что делает их в большей степени подверженными воздействию проникших через плаценту веществ (Davis, 1983).
Беременность представляет собой непрерывный процесс тщательно скоординированных событий. Поэтому невозможно выделить на всем ее протяжении какой-либо этап, на котором следует избегать применения лекарственных средств в большей степени, чем на остальных. Применение потенциально опасных лекарственных препаратов (или любых препаратов?) в начале беременности (в ее первые 20 дней у сук и 16 дней у кошек) сопряжено с риском проявления эмбриотоксического эффекта и/или изгнания плодов. Они могут ингибировать процесс имплантации бластоцитов, что ведет к быстрому прерыванию беременности. Побочные эффекты от применения лекарственных препаратов в середине беременности могут вызывать уродства у плодов, связанные с нарушениями формирования наружных покровов и/или внутренних органов. Свинец, ртуть, никотин и некоторые пестициды считаются наиболее частыми причинами морфологических нарушений развития органов; опасность такого их воздействия на поздней стадии беременности снижается (Davis, 1983). Лечение сук опасными препаратами на поздней стадии беременности (после 45 дня) сопряжено с риском возникновения у плодов проблем, связанных с развитием сердечно-сосудистой системы и ЦНС. Эндокринные заболевания, вызванные воздействием на плоды фармакологических средств, могут ничем не проявиться у собак до достижения ими взрослого возраста, в то время, как поражения нервной системы дают о себе знать уже вскоре после рождения щенков, хотя нередки случаи, когда они проявляются лишь слабо выраженными нарушениями поведения животных. Ле-
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
885
ТАБЛИЦА 20-6. ТЕРАТОГЕННЫЙ ЭФФЕКТ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ У ЖИВОТНЫХ И ЛЮДЕЙ
Лекарственный препарат Действие у животных Действие у людей
Ингибиторы Рост инцидентности гибели плодов и Продолжительная почечная недостаточность и гипотензия
ангиотензин- рождения овцами и кроликами мерт- новорожденных, снижение окостенения черепа, недоразвитие
превращающего фермента вого приплода. черепного свода, нарушение формирования почечных канальцев.
Карбамазепин Незаращение твердого неба, дилатация желудочков головного мозга и задержка роста у мышей. Нарушение развития нервной трубки плодов.
Кокаин Снижение кровоснабжения матки, гипоксемия плодов, гипертония и тахикардия у овец; снижение массы тела, отек и повышение инцидентности резорбции плодов крыс и мышей. Выраженность этих эффектов зависит от дозы препарата. Задержка роста плодов, включая вес, длину тела и окружность головы; преждевременное отслоение плаценты и разрыв матки.
Этиловый спирт Микроцефалия, замедление роста, аномалии развития конечностей у приплода собак, кур и мышей. Алкогольный синдром плодов: замедление роста в пренатальном и постнатальном периодах, аномалии развития ЦНС (микроцефалия, ненормальное поведение и задержка умственного развития), характерные нарушения развития лица (укорочение глазных щелей, гипоплазия носогубного желобка, уплощение верхней челюсти) и нарушение формирования и развития основных систем органов; с возрастом отклонения черт лица от нормы сглаживаются, но микроцефалия, низкий рост и нарушения поведения носят персистентный характер.
Изотретионин Нарушения развития ЦНС, головы, конечностей и сердечно-сосудистой системы у крыс и кроликов. Ретиноидная эмбриопатия, приводящая к части или всем перечисленным ниже нарушениям развития: ЦНС (водянка головного мозга, слепота, вызванная поражением зрительного нерва, недоразвитие сетчатки, микрофтальмия, нарушения развития коры и полушарий головного мозга); нарушения лицевой части черепа (микротия или анотия, низкий постав ушей, гипертелоризм1, вдавливание переносицы, микроцефалия, микрогнатия2, недоразвитие или стеноз ушных каналов); нарушения сердечно-сосудистой системы (смещение крупных кровеносных сосудов, тетрада Фалло3, дефекты перегородок желудочков и предсердий сердца); дефекты тимуса (эктопия в сочетании с гипоплазией или аплазией); другие аномалии, включая недоразвитие конечностей, снижение тонуса мышц, спонтанный аборт и нарушения поведения.
Литий Нарушения развития сердца у крыс. Аномалия Эбштейна и другие пороки сердца.
Метиловая ртуть Нарушения развития ЦНС у плодов крыс; задержка роста, моторные нарушения, микроэнцефалия и поражения головного у макак резус. Болезнь Минаматы плодов: диффузная дезинтеграция нейронов, сопровождающаяся глиозом, церебральный паралич, микроцефалия, косоглазие, слепота, нарушения речи, двигательной активности и рефлекторной деятельности, отставание в умственном развитии.
Фенитоин Незаращение твердого неба, микромелия4, дефекты почек и водянка головного мозга у кроликов, мышей и крыс. Гидантоиновый синдром плодов; пренатальное и постнатальное отставание в росте, замедленное умственное развитие, нарушения двигательной активности, короткий нос с широкой переносицей, микроцефалия, гипертелоризм, косоглазие, эпикантус5, широкий родничок, низко посаженные или имеющие неправильную форму уши, позиционные отклонения от нормы конечностей, гипоплазия ногтей и дистальных частей фаланг, гипоспадия, грыжа, «крыловидная шея»6, рост волос ниже нормального уровня, замедление развития нервной системы и низкий уровень интеллекта.
Талидомид f Укорочение конечностей у кроликов, являющихся самым чувствительным к препарату видом животных. Укорочение конечностей, потеря слуха, паралич отводящих и лицевых мышц, анотия7, микротия8, нарушения морфогенеза почек, врожденное поражение сердца. Дефекты нервной трубки.
Вальпроевая кислота Экзенцефалия9 у хомяков и мышей.
Варфарин Гипоплазия верхней челюсти и носовой кости крыс. Дефекты скелета (гипоплазия носовой кости, эпифизарная дисплазия), низкая масса тела при рождении (ниже 10% от нормы), потеря слуха, аномалии органов зрения; дефекты ЦНС, проявляющиеся по окончании первого триместра беременности; дорсальная осевая дисплазия (отсутствие мозолистого тела головного мозга и синдром Денди-Уокера) или вентральная осевая дисплазия (атрофия зрительных центров)
Из: Koren et al, 1998
^Первоначальные исследования на животных не выявили тератогенности препарата;
но впоследствии появилась информация о его тератогенном действии у людей.
1- Гипертелоризм - ненормально большое расстояние между парными органами.
2- Микрогнатия - врожденное недоразвитие челюстей.
3- Тетрада Фалло - врожденный порок сердца, включающий стеноз легочной артерии, дефект межжелудочковой перегородки, смещение аорты вправо и гипертрофию правого желудочка.
4- Микромелия - непропорционально короткие конечности.
5- Эпикантус - вертикальная складка кожи от корня носа до срединного края брови, закрывающая медиальный угол глаза.
6- Крыловидная шея - широкая из-за боковых складок кожи шея.
7- Анотия - врожденное отсутствие одной или обоих ушных раковин.
8- Микротия - чрезмерно маленькое наружное ухо.
9- Экезенцефалия - врожденное нарушение целостности черепа с обнажением мозга.
886 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
карственные препараты способны оказывать влияние на сроки наступления родов, причем ранние роды наиболее опасны (нередко смертельно) для плодов, а поздние - для сук (Papich, 1990). В таблице 20-7 приведен перечень ряда безопасных препаратов и тех лекарственных средств, применения которых во время беременности следует избегать (Papich, 1990).
Во время родов лекарственные препараты применяют не так уж часто. Анестетики, которыми пользуются в этот период чаще, чем другими фармакологическими средствами, оказывают на новорожденных щенков угнетающее действие. Ингаляционные анестетики вызывают меньше проблем, чем инъекционные. Кетамин накапливается в плаценте, вызывая длительное угнетение плодов, в то время как барбитураты задерживаются в организме плодов, поскольку требуют биотрансформации. Опиаты способны вызвать угнетение дыхания плодов и новорожденных щенков, которое снимается налоксоном или налорфином. Антихолинер-гическое действие меперидина может тормозить сужение просвета артерий, но значение этого эффекта неизвестно. Адренергические препараты не попадают в циркуляцию плодов, но они опасны, так как вызывают сужение кровеносных сосудов плаценты, что ведет к асфиксии плодов. Антихо-линэстеразные препараты, например фосфорорганические соединения, способные проникать через плацентарный барьер, вызывают у новорожденных щенков сильную слабость. Такие транквилизаторы, как диазепам, хлордиазепоксид и фенитоин, легко проникают в плоды, оказывая на них седативный эффект. Хлорпромазин может вызвать длительный седативный эффект и поражения сетчатки глаз (Davis, 1983).
Большой интерес представляет вопрос о влиянии на течение беременности и здоровье плодов кортикостероидных препаратов, часто применяемых ветеринарными врачами при самых разных заболеваниях. Назначать их щенным сукам противопоказано в первую очередь из-за риска аборта. Об этом должны знать не только врачи, но и владельцы животных. Известно также, что кортикостероидные препараты вызывают у мышей незаращение твердого неба («волчью пасть»). Однако не исключено, что мыши проявляют повышенную чувствительность к кортикостероидным препаратам (Papich, 1990). Нестероидные противовоспалительные препараты оказывают целый ряд побочных эффектов на плоды, что ставит под сомнение целесообразность лечения ими беременных животных. Эта группа лекарственных средств вызывает наиболее тяжелые осложнения на поздней стадии беременности. К числу таких осложнений следует отнести легочную гипертонию плодов, увеличение продолжительности беременности и нарушение свертывания крови (Moise et al, 1988). Салицилаты вызывают врожденные дефекты у лабораторных животных, но крупномасштабные исследования показали отсутствие
такого риска при их применении у беременных женщин (см. табл. 20-5) (Koren et al, 1998).
Антибиотики тоже следует применять щенным сукам с осторожностью. Бета-лактамовые препараты (пенициллины, аминопенициллины и цефалоспорины) избирательно действуют на клеточную стенку бактерий, вследствие чего их считают наиболее безопасными антибиотиками (при условии, что ими пользуются в терапевтических дозах) (Papich, 1990). Тетрациклины вызывают у собак поражения зубов, а инъекционные препараты этой группы - гепатит с молниеносным течением и часто летальным исходом. Применение стрептомицина сопряжено с риском развития у новорожденных щенков глухоты, а нитрофурантоина - с лизисом эритроцитов. Сообщалось о случаях гибели плодов при лечении беременных животных хлорамфениколом, а сульфаниламидные препараты пролонгированного действия вызывают атрофию печени и гипербиллирубинемию (Davis, 1983). Хинолоны могут вызывать значительные нарушения формирования хрящевой ткани (Papich, 1990).
Кормление и содержание суки во время беременности и лактации
Рацион. Рацион суки во время вязок и на протяжении первой половины или первых 2/3 беременности должен преимущественно или полностью состоять из качественного коммерческого корма для собак. В течение первых четырех недель после периода половой охоты им дают корм в обычном количестве, с 5-6-й недели его увеличивают на 20-25%, а на 8-9-й неделях беременности и в первую неделю после родов сукам надо давать приблизительно на 50% больше корма, чем до вязки. В конце беременности и во время лактации рацион суки должен быть богат белком, высококалорийными продуктами и минеральных веществами. Желательно, чтобы на этикетке даваемого щенной и лак-тирующей суке корма была отметка о его качестве - в США сертификат качества кормов подтверждает Американская Ассоциация контроля кормов (Ralston, 1990). На второй и третьей неделях лактации организм суки испытывает наиболее тяжелый стресс, и в это время его энергетические потребности возрастают почти в 2 раза по сравнению с периодом анэструса. На четвертой неделе лактации калорийность рациона суки начинают снижать до обычного уровня.
Целесообразно в последние несколько недель беременности собаку кормить чаще, давая ей меньшие порции. Это особенно важно при большом количестве вынашиваемых плодов, поскольку те, оказывая давление на желудок матери, значительно снижают его емкость. Кормить беременную и лак-тирующую суку следует в изолированном от других собак (включая ее собственных щенков) месте. В таких условиях она может спокойно, не спеша съесть свою еду. Недостаток корма во время лак-
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
887
ТАБЛИЦА 20-7. БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Лекарственный препарат Рекомендации Примечания
Антимикробные препараты
Аминогликозиды (например, гентамицин, амикацин, тоб- ППР Легко проникают через плаценту. Могут вызывать токсическое повреждение почек и нервной системы (слухового нерва) плодов.
рамицин, канамицин)
Пенициллины (например, пе- ПБП Преодолевают плаценту, но безопасны для плодов.
нициллин G, ампициллин, амоксициллин)
Цефалоспорины ПБП Безопасны при применении в рекомендуемых терапевтических дозах.
Хлорамфеникол ППР Может вызвать поражения костного мозга плодов.
Клиндамицин (антироб) ПБП Клиндамицин и линкомицин преодолевают плаценту, но безопасны для плодов.
Эритромицин ПБП Преодолевает плаценту, но документальных подтверждений проявления им нежелательных воздействий на плоды нет.
Метронидазол (флагил) ППР Тератогенен для лабораторных животных, но данных об аналогичном действии на плоды женщин, собак и кошек нет.
Хинолоны (например, энро-флоксацин, ципрофлоксацин) Сульфаниламиды ПНП Нарушают нормальное развитие хрящевой ткани у растущих животных, поэтому не рекомендуются при беременности.
ППР Преодолевают плаценту, вызывая нарушения развития плодов мышей и крыс. У собак могут вызывать поражения щитовидной железы.
Тетрациклины (например, доксициклин, окситетра- ПНП Вызывают у плодов нарушения формирования костей и зубов. Могут отрицательно влиять на здоровье беременных животных.
циклин)
Триметоприм/сульфанилами-ды (например, трибриссен, бактрим) ППР Производители этих препаратов утверждают, что они безопасны. Но поскольку в их состав входят сульфаниламидные компоненты (см. выше), к их применению у беременных животных следует относиться с осторожностью.
Противогрибковые препараты
Амфотерицин В ППР Нет данных о его тератогенном действии, однако препарат является чрезвычайно токсичным антибиотиком.
Гризеофульвин ПНП Вызывает нарушения морфогенеза органов и тканей плодов кошек, а также дает нежелательные побочные эффекты у собак.
Кетоконазол ППР Противопаразитарные препараты Тератогенен для лабораторных животных, снижает синтез кортикостероидов, вызывает импотенцию и в ряде случаев дистоцию.
Амитраза (митабан) ППР В аннотации производителей не предоставлено никакой информации относительно возможности и безопасности применения препарата у беременных животных.
Бунамид (сколобан) БПО Оказывает слабое действие на сперматогенез кобелей. О влиянии на течение беременности сук и кошек не сообщалось.
Диэтилкарбамазин ПБП Безопасен на всех стадиях беременности. Сообщалось, что при применении в соответствии с рекомендуемой производителями препарата схеме вызывает бесплодие у некоторых самцов. Это было, по всей видимости, связано, с индивидуальной непереносимостью препарата, так как его отмена приводила к восстановлению фертильности в течение суток.
Диэтазин иодид (дизан) ППР Информация о возможности применения препарата беременным животным отсутствует, но препараты йода могут вызывать врожденный зоб.
Ивермектин ПБП Исследования на многих видах животных не выявили каких-либо побочных эффектов1. У мыши, наиболее чувствительной лабораторной модели, ивермектин оказывает тератогенный эффект при введении в дозе 400 мкг/кг.
Левамизол ППР Нет доступной информации.
Мебендазол ПБП В экспериментальных условиях показана безопасность препарата для собак2.
Фосфорорганические соединения (например, дихлофос, ППР Опасны для щенков и котят. По возможности следует избегать их применения у беременных собак и кошек.
фентион, трихлорфон)
Пиперазин ПБП Безопасен.
Празиквантел ПБП Безопасен при тестировании у собак и кошек.
Тиацетарсемид (капарсолат ППР натрия) Противоопухолевые препараты Специальных исследований по оценке безопасности препарата не проводилось, но может оказывать токсическое действие на печень. По возможности обработку им собак против дирофиляриоза следует отложить на послеродовой период.
Циклофосфамид (цитоксан) ППР Может снижать плодовитость животных. С ним связан высокий риск нарушения эмбриогенеза, особенно если лечение проводится на ранних стадиях беременности.
Доксорубицин (адриамицин) ППР Токсичен для эмбринов, тератогенен и вызывает аборт. Следует избегать его применения, особенно на ранних стадиях беременности.
Винкристин ППР Специальных исследований на собаках и кошках не проводилось, но считается токсическим у плодов и может нарушать эмбриогенез.
Метотрексат ППР Обладает тератогенным и мутагенным действием, вызывает аборт.
888
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Обезболивающие и противовоспалительные препараты
Аспирин, салицилаты ППР Токсичны и вызывают нарушения эмбриогенеза у плодов лабораторных животных, но не у собак и кошек. При введении животным на поздних стадиях беременности может приводить к развитию у новорожденных легочной гипертензии.
Ацетаминофен (тиленол) ППР Токсичен для кошек. Токсичность у собак не исследовалась. Хроническая токсичность ацетаминофена проявляется в угнетении сперматогенеза.
Антигистаминные препараты БПО Исследования на лабораторных животных показали безопасность препарата.
(например, хлорфенирамин)
Диметилсульфоксид ПНП Тератогенен для лабораторных животных. В инструкции по применению препарата говорится, что его не следует вводить беременным животным.
Флуниксин меглумин (бана-мин) ППР Насколько препарат безопасен для собак и кошек, не установлено. При введении на поздних стадиях беременности у приплода может развиться легочная гипертензия. При введении стельным коровам в течение двух дней в дозе, превышающей рекомендуемую в 6 раз, побочных эффектов не наблюдалось.
Ибупрофен (мортин, адвил) ППР Насколько препарат безопасен для собак и кошек не установлено.
Фенилбутазон ППР Безопасность при беременности не установлена. Длительное введение отрицательно воздействует на костный мозг.
Анестетики и преанестетики
Ацепромазин, хлорпромазин, трифлупромазин ППР Следует избегать применения транквилизаторов группы фенотиазина на последней стадии беременности, поскольку они могут угнетать ЦНС. В высокой дозе могут снижать сперматогенез. Имеются сообщения о неврологической симптоматике и желтухе у младенцев, матерей которых лечили фенотиазинами.
Атропин ППР Легко преодолевает плаценту, вызывает у плодов тахикардию. Может подавлять секрецию гонадотропинов и овуляцию.
Гликопиролат БПО Преодолевает плаценту, вызывает у плодов тахикардию.
Опиаты (например, морфин, бутокфанол, кодеин, оксиморфон) БПО Безопасны при кратковременном применении во время беременности, но в конце беременности могут вызывать у плодов угнетение, которое снимается налоксоном.
Налоксон (наркан) ПБП Введение налоксона новорожденным животным в первые минуты жизни безопасно.
Галотан ППР Не следует применять при проведении кесарева сечения. Может вызывать угнетение ЦНС и сильное маточное кровотечение.
Изофлуран БПО По всей видимости, безопасен для беременных животных и их плодов. Однако при применении во время проведения кесарева сечения наблюдали временное угнетение новорожденных.
Метоксифлуран ППР Применение этого препарата во время проведения кесарева сечения вызывает временное угнетение новорожденных.
Кетамин ППР Возможно, безопасен, однако у новорожденных животных, матерям которых при проведении кесарева сечения вводили кетамин, наблюдали угнетение. Повышает внутриматочное давление, что может привести к преждевременным родам.
Местные анестетики (например, лидокаин, прокаин) ПБП Все предназначенные для местной анестезии препараты при использовании в небольших дозах безопасны.
Закись азота ПБП Возможно безопасна. Часто применяется при проведении кесарева сечения, при этом нежелательных побочных эффектов не регистрировали.
Пентобарбитал ПНП Применение сопряжено с высоким риском гибели вынашиваемых плодов.
Тиамилал, тиопентал ППР Преодолевают плаценту и могут вызывать угнетение плодов (особенно угнетение дыхания у новорожденных, полученных кесаревым сечением).
Ксилазин (рампун) ПНП Информация о тератогенности отсутствует, но может вызывать преждевременные роды и аборт.
Препараты, применяемые при заболеваниях органов пищеварения
Антациды (например, гидроокись магния, гидроокись ПБП Все эти препараты безопасны при применении в рекомендуемых терапевтических дозах.
алюминия)
Противорвотные препараты БПО По всей видимости, безопасны, что может быть обусловлено кратковременностью их применения.
Циметидин, ранитидин БПО Безопасность не установлена. При назначении беременным женщинам не вызывают нежелательных побочных эффектов.
Дифеноксилат (ломотил) БПО Оказывает побочные эффекты при даче беременным лабораторным животным, однако аналогичных сообщений, касающихся женщин, собак и кошек, нет.
Слабительные БПО Слабительные препараты, по всей вероятности, безопасны. Исключение составляет касторовое масло, которое индуцирует сокращения матки.
Лоперамид (имодиум) БПО Побочных эффектов при лечении лабораторных животных, собак, кошек и людей не наблюдали.
Метоклопрамид (реглан) БПО Безопасен при применении у лабораторных животных, однако информация о его безвредности у собак и кошек отсутствует.
Мизопростол (цитотек) ПНП Аналог простагландина, вызывает аборт.
Омепразол (лозек) ППР В высоких дозах тосичен для плодов кроликов и крыс. Информация о чувствительности к нему плодов людей, собак и кошек отсутствует.
Сакралфат (карафат, салкрат) ПБП Не всасывается из пищеварительного тракта, что обеспечивает его безопасность.
Сульфасалазин (азалфидин) Ы1О Сердечно-сосудистые препараты Салицилатный компонент этого препарата плохо всасывается из пищеварительного тракта, что предотвращает развитие нежелательных побочных эффектов. Сульфонамидный компонент, напротив, хорошо адсорбируется и может оказывать тератогенный эффект (см. сульфаниламиды)
Ингибиторы ангиотензин-превращающего фермента, например, каптоприл (капо- ППР Оказывают токсическое действие на эмбрионы лабораторных животных. Могут замедлять рост новорожденных животных, вызывать у них гипотонию и снижение почечной перфузии.
тен), эналаприл (вазотек)
▼ ▼
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
889
Блокаторы кальциевых кана- ППР В высоких дозах оказывают на лабораторных животных эмбриотоксический
лов (например, верапамил, эффект и вызывают гибель плодов.
дилтиазем)
Дигоксин ПБП Хотя проникает через плаценту, не сообщалось о нежелательных побочных эффектах при его применении в рекомендуемых терапевтических дозах.
Фуросемид (лазикс) ПБП О нежелательных побочных эффектах не сообщалось.
Гидралазин (апресолин) БПО У лабораторных животных вызывает нежелательные побочные эффекты, но лечение им беременных женщин проходит без осложнений.
Изопротеренол (изупрел) ППР Как и другие бета-адренергические препараты, ингибирует сокращения матки, может также вызывать тахикардию у плодов.
Лидокаин (ксилокаин) БПО Применение допускается только в том случае, если ожидаемый от этого лечебный эффект важнее потенциального риска осложнений.
Прокаинимид (пронестил) БПО Возможно, безопасен.
Пропранолол (индерал) ППР Может вызывать угнетение сердечной деятельности у плодов и гипогликемию у новорожденных. Следует избегать применения препарата на поздней стадии беременности.
Квинидин ППР Безопасность для беременных и их плодов не исследована. Однако известно, что его производное квинин вызывает уродства.
Теофиллин, аминофиллин ППР Противосудорожные препараты Легко преодолевают плаценту. В высоких дозах (превышающих терапевтическую в 30 раз) оказывает тератогенный эффект на мышей. О нежелательных побочных эффектах у собак и кошек не сообщалось.
Диазепам (валиум) ППР Вызывает врожденные нарушения развития у мышей, крыс и людей. В случае эпилепсии его применение оправдано, поскольку терапевтический эффект превосходит риск возможных осложнений.
Фенобарбитал БПО Может вызывать нарушение развития плодов и предрасположенность новорожденных животных к кровотечениям; при этом он, возможно, безопаснее других противосудорожных препаратов.
Фенитоин (дилантин) ПНП Может вызывать развитие гидантоинового синдрома у плодов. Тератогенен.
Примидон (милепсин) БПО Применение примидона сопряжено с тем же риском, что и фенобарбитала.
Вальпроевая кислота ППР Может вызывать врожденные нарушения развития.
Гормональные препараты
Стероидные анаболики (например, станозолол,тестостерон, нандролон деконат) ПНП Нельзя вводить беременным животным, поскольку могут вызывать врожденные нарушения развития и маскулинизацию плодов женского пола.
Глюкокортикоидные препараты (например, дексаметазон, преднизолон, преднизон) ППР Лечение беременных глюкокортикоидами сопряжено с уменьшением массы тела новорожденных, незаращением твердого неба и другими врожденными нарушениями развития, но у собак и кошек тератогенный эффект этих препаратов не описан. Они могут вызывать преждевременные роды и аборт.
Диэтилстильбестрол ПНП Вызывает нарушения развития органов размножения у плодов.
Эстрадиол ципионат ПНП Вызывает нарушения развития плодов и аборт.
Митотан ПНП Вызывает некроз коры надпочечников.
Тироксин БПО С трудом проникает через плаценту, сообщений о его негативном воздействии на развитие плодов не было.
Другие препараты
Хлористый аммоний БПО Может вызывать у плодов ацидоз. Следует избегать применения во время беременности.
Аспартам (НутраСвит) ПБП Безопасен.
Кофеин ППР Вызывает нарушения развития скелета у плодов лабораторных животных при применении в высоких дозах, эквивалентных суточному приему беременной женщиной 12-24 чашек кофе.
Эфедрин, псевдоэфедрин БПО Экспериментального изучения на собаках и кошках не проводилось, но результаты исследований на других видах животных свидетельствуют о безопасности препаратов.
Изотретиноин (акутан) ПНП Вызывает очень тяжелые поражения плодов; нельзя применять во время беременности.
1 Эта информация не точна: у ряда пород собак (например, борзых, мастино и др.) ивермектин вызывает неврологическую симптоматику и /или аллергическую реакцию (примеч. переводчика).
2 Эта информация также не соответствует действительности, поскольку мебендазол вызывает у собак тяжелый гепатит (примеч. переводчика).
По: Papich MG. Pharmacological considerations during pregnancy in small animals. Proceedings of the Society for Theriogenology, 1990.
ПБП - предположительно безопасные препараты. Хотя специальных исследований по определению безопасности всех этих препаратов у собак и кошек не проводилось, сообщения о наличии нежелательных побочных эффектов отсутствуют. Кроме того, нет сведений, указывающих на опасность их применения беременным женщинам и животным.
БПО - безопасные при осторожном применении препараты. Исследования, проведенные на лабораторных животных, могли выявить некоторые побочные эффекты, однако у собак и кошек побочных эффектов не выявлено. Эти препараты безопасны только при непродолжительном курсе их применения.
ППР - препараты, применение которых связано с определенным риском. Исследования, проведенные на лабораторных животных, показали, что они могут нанести ущерб здоровью, или имеется достаточно большое количество публикаций о нежелательных побочных эффектах, имевших место при их применении беременным женщинам, собакам и кошкам. Эти препараты следует назначать для лечения беременных животных только в том случае, когда все остальные средства лечения не дали ожидаемого результата или если польза от их применения будет превосходить по своей значимости риск нанесения ущерба здоровью беременной суки и ее потомству.
ПНП - препараты, не рекомендуемые к применению. Препараты, проявляющие токсичность в отношении плодов и матери. Их следует заменять альтернативными менее опасными лекарственными средствами.
890 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
тации (особенно при большом количестве щенков) может привести к значительному снижению веса собаки.
Кормовые добавки. При наступлении беременности или лактационного периода владельцы стремятся по мере возможности обогатить рацион своих питомцев. Готовые корма содержат необходимое и сбалансированное количество требующихся животным компонентов. Не будет большой ошибкой восполнить возрастающие во время беременности и лактации потребности суки в витаминах группы В содержащими их витаминными подкормками. Однако заводчиков следует предостеречь от добавления в готовые корма витамина Д, костной муки и других источников кальция. В готовых кормах соотношение концентрации кальция и фосфора составляет 1,2:1. Основываясь на том, что потребности организма суки в кальции в конце беременности и в начале лактационного периода могут возрасти втрое, многие заводчики вносят в рацион избыточное количество кальция. Нарушенный баланс минерального состава рациона приводит к ряду негативных последствий. Избыток кальция в рационе нарушает всасывание цинка, магния и других необходимых двухвалентных ионов неорганических веществ. Это ведет к повышению риска дистоции у суки, а у подсосных щенков, получающих рацион с избыточным содержанием кальция, возникает предрасположенность к завороту желудка и кишечника. При этом интересно, что народным средством профилактики дистоции является богатый кальцием малиновый чай. Содержащие кальций добавки следует применять только по рекомендации ветеринарного врача, который обычно назначает их в том случае, если у суки во время предшествующих родов имела место эклампсия. К сожалению, включение в рацион избыточного количества кальция может в значительной степени повысить риск гипокальциемии вследствие угнетения синтеза паратиреоидного гормона. Поэтому в первую очередь важно определить, имеется ли необходимость в обогащении рациона суки кальцием, а при ее установлении следует точно определить количество содержащей кальций подкормки, которое нужно давать животному.
Обследование суки в середине беременности. Многие практикующие ветеринарные врачи рекомендуют проведение обследования сук на 35-45-й дни беременности. Оно дает возможность проконсультировать владельцев животных по интересующим их вопросам, а также проверить, насколько рацион беременных сук соответствует их физиологическим потребностям, оптимальна ли переносимая животными физическая нагрузка, отсутствует ли у них глистная инвазия и т.д. Прививать сук лучше всего до вязки. Если щенную суку никогда раньше не прививали, ее можно иммунизировать во время обследования убитыми вакцинами, что снижает риск осложнений, которые могут возникать в период беременности или после родов при применении
живых вакцин. Если животное ранее прививали, но из-за вязки очередная иммунизация была пропущена, то вакцинацию обычно откладывают на более поздний период и проводят после отъема щенков. Лабораторные исследования на дирофиляриоз и паразитарные инвазии пищеварительного тракта, как правило, проводят до вязки, но при необходимости их осуществляют во время беременности. Микрофилярии способны проникать в плоды через плаценту. При установлении наличия инвазий A.caninum (анкилостоматоза) и T.canis (токсаска-ридоза) проводят антигельминтную обработку. Фенбендазол - эффективный антигельминтик, снижающий риск пренатального и постнатального заражения щенков упомянутыми выше гельминтами. Им обрабатывают сук ежедневно (начиная с 40 дня беременности до 14 дня после родов) в дозе 50 мг/ кг массы тела (Burke, Robertson, 1983). Фенбендазол безопасен как для беременных сук, так и для их плодов/щенков.
Желательно, но отнюдь не обязательно, определение концентрации общего белка и форменных элементов в крови. Это простые и недорогие анализы. Как уже было сказано в этой главе (стр. 876), легкая анемия, нередко встречающаяся у щенных сук, - нормальное явление. Ветеринарный врач может рекомендовать проведение на 45 день беременности рентгенологического исследования, которое позволит подтвердить беременность и определить количество и состояние здоровья вынашиваемых плодов.
Физическая нагрузка. Регулярные прогулки полезны как для беременных сук, так и для их владельцев. Собакам, привыкшим к прогулкам мелкой трусцой, можно разрешать такой тип физических упражнений до 4-6 недель беременности. Однако не следует подвергать беременное животное чрезмерно большим нагрузкам, особенно на поздней стадии плодоношения.
Масса тела. В первые 4 недели беременности масса тела собаки не должна сильно изменяться. В последующем она закономерно возрастает. В первое время после родов вес собаки должен быть на 10-15% больше, чем до вязки.
РОДЫ
Эндокринология родов
Начальные изменения. Процесс беременности у сук поддерживается прогестероном, который образуется в желтых телах яичников (Concannon et al, 1990). Время наступления родов в первую очередь определяется самими плодами, а точнее секреторной активностью их коры надпочечников. Гипофиз плодов в ответ на воздействие определенных стрессорных факторов секретирует АКТГ, который, в свою очередь, стимулирует секрецию глюкокортикоидов корой надпочечников. Секретируемые плодами глюкокортикоиды вызывают синтез эстро
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 891
генов в плаценте, которые, по-видимому, индуцируют ароматазы плаценты, что приводит к секреции простагландинов.
Простагландины. Возрастание концентрации эстрогена и кортизола и/или действие дополнительных факторов плодной плаценты ведет к усилению синтеза и высвобождения большего количества простагландина F2a как в плаценте, так и в миометрии (Concannon et al, 1989а). Простагландины представляют собой группу биологически активных липидов, которые синтезируются разными тканями в многочисленных формах. Это гормоны, действующие в том месте, где произошло их образование. Их инактивация происходит в легких после того, как они попадают туда с кровью. В предродовом периоде основным местом образования простагландина F2a, по всей видимости, является эндометрий, хотя во время беременности он синтезируется также в миометрии, шейке матки, плаценте и плодных оболочках. У эмбриона синтез простагландинов подавлен, и только на последних стадиях развития изменения физиологии эмбриона инициируют синтез и высвобождение этих гормонов.
Простагландины, прогестерон, эстроген и роды. Эстрогены усиливают синтез простагландинов, в то время как прогестерон оказывает противоположное действие. Сочетание возрастания секреции эстрогена со снижением концентрации прогестерона в предродовом периоде ведет к усилению синтеза простагландинов. Кроме того, окситоцин стимулирует высвобождение простагландина F2a непосредственно из матки. Установлено, что у овцематок эстрадиол усиливает эффект окситоцина, повышая количество его рецепторов в эндометрии, в то время как прогестерон действует противоположным образом. Это означает, что эстрадиол может вызывать повышение концентрации простагландинов путем прямой стимуляции их синтеза и секреции, а также косвенным путем через зависимый от окситоцина механизм. Таким образом, в предродовом периоде реализуются два пути повышения образования простагландинов, и оба связаны с возрастанием отношения концентрации эстрогена к концентрации прогестерона.
Простагландин F2a вызывает регресс желтых тел яичников, т.е. проявляет лютеолитическое действие. Концентрация прогестерона в плазме крови быстро снижается, что ведет к снятию блокировки сокращений миометрия. Одновременно возрастают синтез и высвобождение простагландина F2a, который усиливает сокращения матки. Роды могут начаться только тогда, когда значительно понизится концентрация прогестерона в плазме крови. Повышение концентрации простагландина F2a в венах матки предшествует окончательному снижению концентрации прогестерона. Этот процесс длится около 24 ч и завершается приблизительно за 48 ч до начала родов.
Введение АКТГ в плоды может инициировать преждевременные роды, что вполне согласуется с
известными гормональными механизмами данного процесса. Последующее увеличение отношения концентраций эстрогена и прогестерона ведет к высвобождению окситоцина из задней доли гипофиза, чему способствуют активные сокращения матки и расширение ее шейки в процессе родов (рефлекс Фергюсона). Воздействие окситоцина на активность миометрия в значительной степени регулируется простагландинами.
Пролактин. Концентрация пролактина в плазме крови беременных сук начинает постепенно повышаться приблизительно за 30-40 дней до начала родов, достигая максимального уровня за 1-2 дня до родов. В первые 1-2 дня после родов концентрация пролактина в крови снижается, а затем вновь происходит ее резкое рефлекторное повышение в ответ на сосание новорожденными щенками молока. Высокий уровень пролактина в плазме крови сохраняется на протяжении 10-14 дней, а затем начинает медленно снижаться, возвращаясь к базальному уровню через 45-55 дней после родов (De Coster et al, 1983). Отъем подсосных щенков от матери ведет к быстрому падению концентрации пролактина.
Релаксин. Релаксин был впервые открыт в 1926 г. Он уникален тем, что является единственным хорошо изученным пептидным гормоном фолликулов яичников и плаценты. Во время родов релаксин вызывает удлинение коллагеновой межлонной связки, что обеспечивает расхождение тазовых костей. Это необходимо для нормального течения родов, поскольку зрелые плоды имеют слишком большой размер, чтобы пройти через узкое тазовое отверстие. Возможно также, что релаксин способствует сохранению маткой спокойного состояния (особенно в период, непосредственно предшествующий началу родов) и повышению ее чувствительности к окситоцитну (благодаря индукции образования в миометрии специфических для окситоцина рецепторов). Предполагается, что после вязки релаксин принимает участие в контроле маточных сокращений, обеспечивая имплантацию бластоцитов (Bryant-Greenwood, 1982). Вместе с эстрогеном, прогестероном и простагландинами он играет основную роль в индукции изменений, которые претерпевает структурный коллаген шейки матки накануне и во время родов. Эти изменения необходимы для обеспечения повышенной растяжимости шейки матки (Porter, 1980).
Содержание суки
Ящик для проведения родов. Обеспечение суки местом, специально предназначенным для ее родов и последующего кормления щенков, позволяет избежать проблем, связанных с тем, что животное может выбрать себе для этих целей совершенно неподходящее место. Многие заводчики пользуются ящиком для проведения родов, который должен отвечать определенным требованиям (рис. 20-20). Чтобы убедиться, что ящик подходит собаке и она
892 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Рис. 20-20. А. Сука породы дог и ее помет в специальном ящике. Обратите внимание на подстилку и п 1анку (указана стрелкой), которая предотвращает раздавливание сукой своих щенков, случайно попавших между нем и бортом ящика. Ь. Желтый лабра дор в пластиковом ящике для родов. Этот изготовленный фабричным способом ящик легок и легко чистится.
чувствует себя в нем удобно, ее помещают в него за 7-14 дней до предполагаемых родов. Ящик устанавливают в привычном для животного, но в то же время относительно уединенном месте. Ящик должен быть достаточно большим, чтобы вместить суку, вытянувшуюся во всю длину своего тела, и одновременно служить «домом» для ее щенков.
Боковые стенки ящика делают достаточно высокими, чтобы щенки в возрасте 4-6 недель не могли их перепрыгнуть; однако они не должны препятствовать свободному передвижению суки в ящик и из него. На стенках ящика вблизи от дна крепят планку, предназначенную для предотвращения раздавливания сукой своих щенков, случайно попавших между ней и стенкой. На его дне (или на полу в том месте, где предполагается проведение родов) расстилают полотенца. По мере загрязнения их заменяют чистыми, стирают и вновь используют. Газеты недостаточно мягки и теплы; кроме того, их краской могут пачкаться щенки. Желательно, чтобы температура на дне ящика составляла приблизительно 24 С. Его обогрев можно обеспечить низковольтной лампой накаливания, но при этом необходимо следить за тем, чтобы температура в нем нс поднималась выше допустимого уровня. Применение с той же целью бутылей с горячей водой нежелательно, поскольку они занимают слишком много места и в них необходимо периодически менять остывшую воду на горячую. Во время родов заводчик должен иметь под рукой несколько небольших полотенец, ножницы, нитки, настойку йода и термометр для контроля ректальной температуры суки.
Последние 30 часов до родов. За 18-30 ч до начала родов концентрация прогестерона в плазме крови суки опускается ниже 2 нг/мл. Через 10-14 ч после столь резкого снижения концентрации прогестерона ректальная температура опускается ниже 37,8°С, а в ряде случаев даже ниже 37,2°С (рис. 20-21). Если суке в предродовом периоде ввести содержащий прогестерон имплантат, то ректальная температура у нее не снизится, и роды не начнут-
ся в положенный срок. Падение ректальной температуры обычно происходит за 10-24 ч до начала родовых схваток, а также при аборте, вызванном введением беременной суке простагландина F, (Concannon, Yeager, 1990).
Этапы родов
Этап 1. Эта стадия начинается с первыми маточными сокращениями и заканчивается полным открыванием канала шейки матки. Сокращения мускулатуры матки, хотя и создают в органе очень высокое давление, но обычно не заметны при наблюдении за сукой со стороны. Поэтому установить их начало бывает не так уж просто. Они происходят регулярно, но интервалы между ними постепенно уменьшаются. Сокращения матки сопровождаются укорочением мышечных клеток, которое носит не-
8-
ф — 6 о ™
го м
ф *-=г со 5 го
го
4 -
2
Ректальная температура (п = 13-14)
Мд
Роды
Концентрация прогестерона в плазме крови (п = 10-14)
У > I *Г !— Р" >
-2 0 2 4
Дни после родов
-102
-100
ф
(X го
L98 р ф
(D
ф Q ГО
Рис. 20-21. Изменения ректальной температуры и концентрации прогестерона в плазме крови сук до начала родов и после них. Из: Concannon PW Yeager AE: Endocrine, ultrasonographic, radiographic and clinical changes during pregnancy, parturition and lactation in dogs. Proceedings of the Society for Thenogcnology 1990, p 197.
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ • 893
обратимый характер, при расслаблении их первоначальная длина не восстанавливается. Этот феномен называют «брахистазом» (Johnston, Everitt, 1980).
У женщин первая стадия родов самая продолжительная. У сук она длится в среднем от 6 до 12 часов, но иногда может продолжаться 24 часа. В этот период животные выглядят обеспокоенными, нервозными, дрожат, часто и тяжело дышат, царапают пол, периодически перемещаются по комнате. У них нередко пропадает аппетит. Время от времени готовящиеся к родам собаки совершают глотательные движения. У них возможна рвота. Большинство сук на первой стадии родов пытаются найти себе тихое место или демонстрирует «норное» поведение: совершают копательные движения или разрывают тряпичные материалы, чтобы изготовить нору в выбранном для щенения месте. Единственную помощь, которую заводчик может оказать своей собаке в этот период, - это предоставить ей место для родов и возможность уединиться в нем.
Стадии 2 и 3. Вторая стадия родов начинается с момента полного открывания канала шейки матки и заканчивается выходом всех плодов из родовых путей. Затем следует третья стадия родов, которая завершается изгнанием из родовых путей плаценты. У вынашивавших несколько плодов сук стадии 2 и 3 сменяют друг друга несколько раз. Их продолжительность бывает разной - от нескольких часов до 24-36 часов. Родовые потуги заметны со стороны, при этом собаки обычно лежат на боку или сидят. При выходе каждого щенка происходит разрыв обволакивающей его хориоаллантоисной оболочки; в противном случае сука освобождает щенка, прокусывая зубами и/или вылизывая эту оболочку. Затем она должна удалить с рожденного щенка амниотическую оболочку.
Промежуток времени от начала второй стадии родов до рождения первого щенка может быть разным. Обычно он составляет всего лишь 10-30 минут. Если щенок не выходит из родовых путей после схваток, продолжающихся более 30 минут, это должно вызывать обеспокоенность и следует обратиться за консультацией к ветеринарному врачу. Промежутки времени между рождением щенков также весьма различны. Совсем не редкость, когда одновременно рождается несколько щенков, после чего собака отдыхает, а затем роды возобновляются. Если родовые схватки не возобновляются в течение 4—6 часов, это должно обеспокоить владельца собаки. Отсутствие выхода очередного щенка в течение 30-60 минут, несмотря на продолжающиеся родовые схватки, также служат основанием для обращения за помощью к ветеринару. Однако следует иметь в виду, что причины прекращения родов могут иметь субъективный характер и быть вызваны беспокойством, испугом или нервозностью рожающей суки.
Послед обычно выходит из родовых путей через 5-15 мин после рождения каждого щенка. Иногда щенок выходит из половых органов суки без пла
центы, а после рождения следующего щенка наружу выделяются сразу два последа.
Рождение щенков, как правило, следует в определенном порядке, предусматривающем поочередный их выход то из одного, то из другого рогов матки. В исследовании, проведенном на 14 беременных суках, один рог матки никогда полностью не освобождался от плодов до того, как щенки начинали выходить из другого рога. У 6 из 8 сук, в рогах матки которых находилось разное количество плодов, первый щенок всегда выходил из рога с большим количеством плодов. Почти в 80% случаев каждый новый щенок выходил из рога, в котором оставалось больше плодов (van Weyden et al, 1981). Приблизительно 40% щенков при рождении имели тазовое предлежание, которое является нормальным и не вызывает осложнений во время родов (Johnston et al, 1982).
Суке можно разрешить съедать выделившиеся при родах последы, хотя приносит ли эта широко распространенная практика какую-либо пользу, неизвестно, поэтому мы не считаем нужным ее рекомендовать. После поедания плаценты у собак часто происходит рвота. Сука должна тщательно вылизать каждого новорожденного щенка, чтобы освободить их морды от плодных оболочек, обеспечив тем самым возможность дыхания. Если она этого не сделала в течение 1-3 минут после выхода щенка из половых органов, то владелец собаки должен вмешаться. Каждого новорожденного он протирает концом чистого, мягкого полотенца, после чего заворачивает в него щенка. Владельцев следует заранее предупредить, что при рождении щенков выделяется большое количество плодных вод, и необходимо каждый раз пользоваться свежим сухим полотенцем. Жидкость, скопившуюся во рту новорожденного щенка, можно отсосать мягкой резиновой грушей с прямым концом. Для очистки респираторного тракта и инициации дыхания щенка берут на руки, удерживая его голову пальцами, а хвост запястьем, и начинают раскачивать вверх и вниз (почти так же, как при рубке топором дров).
Сука отгрызает пуповину зубами. Если она этого не сделала, то ее владелец должен сам перевязать пуповину ниткой в двух местах: на расстоянии, по меньшей мере, 2,5 см от щенка и приблизительно на 0,6 см дальше (рис. 20-22). Пуповину между этими узлами перерезают чистыми ножницами. Получившуюся после обрезания культю обрабатывают антисептиком, например, настойкой йода или бета-дином. Новорожденных щенков оставляют с сукой, стараясь прикасаться к ним как можно реже. Одни суки начинают кормить щенков еще до того, как закончатся роды, другие этого не делают.
Нормальная инволюция матки
После родов матка претерпевает период восстановления, называемый инволюцией. После завершения инволюции матка уменьшается в размере, вступая
894 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Рис. 20-22. А. Золотистый лабрадор-ретривер перекусывает пуповину у одного из новорожденных щенков. Б. Если собака не перекусила пуповину, ее нужно разрезать дистально от кровоостанавливающего зажима.
в стадию анэструса и готовясь к наступлению про-»струса. Большая часть процесса инволюции матки происходит в первые 4-6 недель после родов. В этот период у суки из наружных половых органов выделяются не имеющие запаха, зеленые, темные красно-коричневые или кровянистые истечения, называемые «лохиями». Количество этих выделений, которые следует считать вполне нормальными, после родов может быть довольно большим, но в последующие 4—6 недель постепенно уменьшается. Только в редких случаях лохии сохраняются более продолжительное время (в течение 8-12 недель после родое). Обычно сука слизывает их. До тех пор, пока сука здорова, не имеет признаков анемии или сепсиса, эти выделения не должны пугать заводчика. Но если у собаки появляется недомогание, то не иск лючено, что у нее начал развиваться метрит.
Обильные кровянистые выделения из влагалища также являются основанием для беспокойства. Если несмотря на их наличие, собака по-прежнему выглядит здоровой, то за ней просто следует еще немного понаблюдать. Но следует иметь в виду, что продолжительное выделение крови или кровянистых истечений из половых органов суки бывает вызвано нарушением свертывания крови (врожден
ным или приобретенным, например, в результате интоксикации), травмой родовых путей или нарушением процессов регенерации матки в местах прикрепления к ней плаценты. Проблему часто позволяет решить ежедневное подкожное введение природного простагландина в дозе 0,25 мг/кг массы тела на протяжении 2-3 дней, но иногда возникает необходимость в стерилизации животного.
Через 1 неделю после родов рога матки значительно уменьшаются в размере - их средняя толщина снижается до 33,5 мм. Участки рогов матки, к которым прикреплялась плацента, в первую неделю после родов, имеют диаметр 1,5-2 см, они неровные, гранулярные и покрыты слизью или кровью. На четвертой неделе после родов размер этих участков значительно уменьшается, они приобретают вид скоплений сероватых или желто-коричневых узелков, покрытых прозрачной слизью. На седьмой неделе после родов они становятся светло-коричневыми, а еще спустя 2 недели приобретают вид узких светлых полос. За трехмесячный послеродовой период морфология матки полностью восстанавливается (AllBassam et al, 1981; Johnston et al, 1982). При гистологическом исследовании в первую педелю после родов в участках матки, к которым при-
ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
895
креплялась плацента, выявляют поверхностные скопления эозинофильных некротизированных коллагеновых масс. Они исчезают на девятой неделе после родов (Wheeler, 1986).
Матка незабеременевших собак также подвергается инволюции в период диэструса. Однако в этом случае выделения из половых органов отсутствуют. Кроме того, инволюция матки нерожавших сук проходит приблизительно на 1 месяц быстрее, чем после родов.
ЛИТЕРАТУРА
AlBassam ЛАА, et al: Normal postpartum involution of the uterus in the dog. Can J Comp Med 45:217, 1981.
Andersen K: Artificial insemination and storage of canine semen. In Morrow DA (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders, 1980, p661.
Arthur G, et al: Veterinary Reproduction and Obstetrics (Theriogenology), 5th ed. London, Bailliere Tindall, 1984.
Bouchard GF, et al: Determination of ovulation in the bitch with a qualitative progesterone enzyme immunoassay in serum, plasma, and whole blood. J Reprod Fertil Suppl 47:517, 1993.
Bryant-Greenwood GD: Relaxin as a new hormone. Endocrinology 3:62, 1982. Burke TM, Robertson EL: Fenbendazole treatment of pregnant bitches to reduce prenatal and lactogenic infections of Toxocara cants and Ancylostoma caninum in pups. J Am Vet Med Assoc 183:987, 1983.
Bysted BV, et al: Embryonic development stages in relation to the LH peak in the bitch. In Farstad W, Steel C (eds): Proceedings, the Fourth International Symposium on Canine and Feline Reproduction, Oslo, Norway, 2000.
Concannon PW: Effects of hypophysectomy and of LH administration on luteal phase plasma progesterone levels in the Beagle bitch. J Reprod Fertil 58:407, 1980.
Concannon PW: Prolactin and LH: Two luteotrophic requirements in the dog. Program of the Annual Conference of the Society for the Study of Fertility, Edinburgh, 1981, p 19.
Concannon PW: Reproductive physiology and endocrine patterns of the bitch. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p 886.
Concannon P, Rendano V: Radiographic diagnosis of canine pregnancy: Onset of fetal skeletal radiopacity in relation to times of breeding, preovulatory luteinizing hormone release, and parturition. Am J Vet Res 44:1506, 1983.
Concannon PW, Yeager AE: Endocrine, ultrasonographic, radiographic, and clinical changes during pregnancy, parturition, and lactation in dogs. Proceedings of the Society for Theriogenology, 1990, p 197.
Concannon PW, et al: LH release in ovariohysterectomized dogs in response to estrogen withdrawal and its facilitation by progesterone. Biol Reprod 20:523, 1979.
Concannon PW, et al: Canine gestation length: Variation related to time of mating and fertile life of sperm. Am J Vet Res 44:1819, 1983.
Concannon PW, et al: Elevated concentrations of 13, 14-dihydro-15-keto-prostaglandin F2a in maternal plasma during prepartum luteolysis and parturition in dogs (Canis famlHaris). J Reprod Fertil 39:12, 1989a.
Concannon PW, et al: Biology and endocrinology of ovulation, pregnancy, and parturition in the dog. J Reprod Fertil 39:3, 1989b.
Concannon PW, et al: Termination of pregnancy and induction of premature luteolysis by the antiprogestagen, mifepristone, in dogs. J Reprod Fertil 88:99, 1990.
Concannon P, et al: Postimplantation increase in plasma fibrinogen concentration with increase in relaxin concentration in pregnant dogs. Am J Vet Res 57:1382, 1996.
Concannon PW, et al: Embryo development, hormonal requirements, and maternal responses during canine pregnancy. In Farstad W, Steel C (eds): Proceedings, the Fourth International Symposium on Canine and Feline Reproduction, Oslo, Norway, 2000.
Davis LE: Adverse effects of drugs on reproduction in dogs and cats. Mod Vet Pract 64:969, 1983.
De Coster R, et al: A homologous radioimmunoassay for canine prolactin plasma levels during the reproductive cycle. Acta Endocrinol 103:477, 1983.
Doak RL, et al: Longevity of spermatozoa in the reproductive tract of the bitch. J Reprod Fertil 13:51, 1967
Eckersall PD, Harvey MJA: The use of a bovine plasma progesterone ELISA kit to measure progesterone in equine, ovine, and canine plasmas. Vet Rec 120:5, 1987.
England GCW, et al: A comparison of radioimmunoassay with quantitative and qualitative enzyme-linked immunoassay for plasma progesterone detection in bitches. Vet Rec 125:107, 1989.
England GCW, et al: Studies on canine pregnancy using В-mode ultrasound: Development of the conceptus and determination of gestational age. J Small Anim Pract 31:324, 1990.
Farstad W: Mating and artificial insemination in the dog. In England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. British Small Animal Association, Cheltenham, United Kingdom, 1998, p 95.
Farstad W, Anderson-Berg K: Factors influencing the success rate of artificial insemination with frozen semen in the dog. J Reprod Fertil Suppl 39:289, 1989.
Fernandez PA, et al: Luteal function in the bitch: Changes during diestrus in pituitary concentration of and the number of luteal receptors for luteinizing hormone and prolactin. Biol Reprod 37:804, 1987.
Fisher T, Fisher D: Serum assay for canine pregnancy testing. Mod Vet Pract 62:466, 1981.
Fontbonne A, Badinand F: Canine artificial insemination with frozen semen: Comparison of intravaginal and intrauterine deposition of semen. J Reprod Fertil Suppl 47:325, 1993.
Fontbonne A, et al: Artificial insemination with frozen semen in the bitch: Influence of progesterone level, inseminating dose, and number of inseminations performed in the same bitch. In Farstad W, Steel C (eds): Proceedings, the Fourth International Symposium on Canine and Feline Reproduction, Oslo, Norway, 2000.
Gentry PA, Liptrap RM: Influence of progesterone and pregnancy on canine fibrinogen values. J Small Anim Pract 22:185, 1981.
Gerber JG, et al: Prostacyclin produced by the pregnant uterus in the dog may act as a circulating vasodepressor substance. J Clin Invest 67:632, 1981.
Goodman M: Ovulation timing. Vet Clin North Am (Small Anim Pract) 31:219, 2001.
Gradil CM, et al: Pregnancy diagnosis in the bitch. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p918. Hegstad RL, Johnston SD: Use of serum progesterone ELISA tests in canine breeding management. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XL Philadelphia, WB Saunders, 1992, p 943.
Johnson MH, Everitt BJ: Essential Reproduction. Oxford, UK, Blackwell Scientific Publications, 1980.
Johnston SD, Root Kustritz MV, Olson PNS: Canine and Feline Theriogenology. Philadelphia, WB Saunders, 2001, p 41.
Johnston SD, et al: Canine theriogenology. J Soc Theriogenol 11:1, 1982.
Koren G, et al: Drugs in pregnancy. N Engl J Med 338:1128, 1998.
Kustritz MVR, Johnston SD: Use of serum progesterone for ovulation timing in the bitch. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000a, p 914.
Kustritz MVR, Johnston SD: Artificial insemination in the bitch. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000b, p916.
Linde-Forsberg C, Forsberg M: Fertility in dogs in relation to semen quality and time and site of insemination with fresh and frozen semen. J Reprod Fertil Suppl 39:299, 1989.
Linde-Forsberg C, Forsberg M: Results of 527 controlled artificial inseminations in dogs. J Reprod Fertil Suppl 47:313, 1993.
Lindsay FEF: The normal endoscopic appearance of the caudal reproductive tract of the cyclic and noncyclic bitch: Postuterine endoscopy. J Small Anim Pract 24:1, 1983.
Lindsay FEF, Concannon PW: Normal canine vaginoscopy. In Burke T (ed): Small Animal Reproduction and Infertility. Philadelphia, Lea & Febiger, 1986,p112.
Mahi-Brown CA, et al: Infertility in bitches induced by active immunization with porcine zonae pellucidae. J Exp Zool 222:89, 1982.
Manothaiudom K, et al: Evaluation of the ICAGEN-Target canine ovulation timing diagnostic test in detecting canine plasma progesterone concentrations. J Am Anim Hosp Assoc 31:57, 1995.
McCann JP, Concannon PW: Effects of sex, ovarian cycles, pregnancy, and lactation on insulin and glucose response to exogenous glucose and glucagon in dogs. Biol Reprod 28:41, 1983.
McCann JP, et al: Pregnancy-specific alterations in the metabolic endocrinology of domestic dogs, including insulin resistance and modified regulation of growth hormone secretion. Proceedings of the Eleventh International Congress on Animal Reproduction, 1988.
Moise KJ, et al: Indomethacin in the treatment of premature labor. N Engl J Med 319:327, 1988.
Nelson RW, et al: Treatment of canine pyometra and endometritis with prostaglandin F21. J Am Vet Med Assoc 181:899, 1982.
Nothling JO, et al: Intravaginal insemination of bitches with semen frozen in Triladyl with Equex STM paste to which prostatic fluid or modified TALP was added prior to insemination. In Farstad W, Steel C (eds): Proceedings, the Fourth International Symposium on Canine and Feline Reproduction, Oslo, Norway, 2000.
Okkens AC, et al: Fertility problems in the bitch. Anim Reprod Sci 28:379, 1992.
Papich MG: Pharmacological considerations during pregnancy in small animals. Proceedings of the Society for Theriogenology, 1990, p 224.
Phemister RD, et al: Time of ovulation in the Beagle bitch. Biol Reprod 8:74, 1973.
Pineda MH, et al: Dorsal median postcervical fold in the canine vagina. Am J Vet Res 34:1487, 1973.
Porter DG: Relaxin and cervical softening. In Anderson AM, Ellwood DA (eds): The Cervix in Pregnancy and Labour. Edinburgh, Churchill Livingstone, 1980.
896 • ВЯЗКА, БЕРЕМЕННОСТЬ И РОДЫ
Ralston SL: Feeding for breeding. Proceedings of the Society for Theriogenology, 1990, p 236.
Reimers TJ, et al: Effects of reproductive state on concentrations of thyroxine, 3,5,3N-triiodothyronine and Cortisol in serum of dogs. Biol Reprod 31:148, 1984.
Roszel JF: Anatomy of the canine uterine cervix. Compend Contin Educ (Small Anim Pract) 14:751, 1992.
Ryan EA, Enns L: Role of gestational hormones in the induction of insulin resistance. J Clin Endocrinol Metab 67:341, 1988.
Shille VM, Gontarek J: The use of ultrasonography for pregnancy diagnosis in the bitch. J Am Vet Med Assoc 187:1021, 1985.
Silva LDM, et al: Comparison of intravaginal and intrauterine insemination of bitches with fresh and frozen semen. Vet Rec 138:154, 1996.
Sirivaidyapong S, et al: Successful pregnancy in bitches after transvaginal endoscope-guided intrauterine insemination. In Farstad W, Steel C (eds): Proceedings, the Fourth International Symposium on Canine and Feline Reproduction, Oslo, Norway, 2000.
Steinetz BG, et al: Plasma relaxin levels in pregnant and lactating dogs. Biol Reprod 37:719, 1987.
Steinetz BG, et al: Serum relaxin and progesterone concentrations in pregnant, pseudopregnant, and ovariectomized, progestin-treated pregnant bitches: Detection of relaxin as a marker of pregnancy. Am J Vet Res 50:68, 1989.
Steinetz BG, et al: Use of serum relaxin for pregnancy diagnosis in the bitch. In Bonagura JD (ed): Kirk’s Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p 924.
Taverne AAA, et al: Pregnancy diagnosis in the dog: A comparison between abdominal palpation and linear array real-time echography. Vet Q 7:249, 1985. van der Weyden GC, et al: Intrauterine position of canine fetuses and their sequence of expulsion at birth. J Small Anim Pract 22:503, 1981.
Verstegen J, et al: Echocardiographic study of heart rate in dog and cat fetuses in utero. J Reprod Fertil Suppl 47:175, 1993.
Watts JR, et al: Uterine, cervical, and vaginal microflora of the normal bitch throughout the reproductive cycle. J Small Anim Pract 37:54, 1996.
Wheeler SL: Subinvolution of placental sites in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders, 1986, p513.
Wildt DE, et al: Relationship of reproductive behavior, serum luteinizing hormone, and time of ovulation in the bitch. Biol Reprod 18:561, 1978.
Wilson MS: Some aspects of artificial insemination in the bitch using frozen semen. Master’s thesis. Palmerston North, New Zealand, Massey University, 1992.
Wilson MS: Transcervical insemination techniques in the bitch. Vet Clin North Am (Small Anim Pract) 31:291, 2001.
Yeager AE, et al: Ultrasonographic appearance of the uterus, placenta, fetus, and fetal membranes throughout accurately timed pregnancy in Beagles. Am J Vet Res 53:342, 1992.
Глава 21 ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
НОРМАЛЬНОЕ СОСТОЯНИЕ ОРГАНИЗМА СУКИ В ПРЕДРОДОВОМ И ПОСЛЕРОДОВОМ ПЕРИОДАХ.........897
Клиническое состояние..........897
Кровь и сыворотка крови........897
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ЛОЖНОЙ ЩЕННОСТИ...............897
Определение и клинические признаки897
Физиология.....................898
Диагностика/интерпретация результатов диагностических исследований..898
Лечение........................898
Заболевания, вызванные ложной [ценностью, и частота ее рецидивов 900
ВНЕМАТОЧНАЯ БЕРЕМЕННОСТЬ.......900
СПОНТАННЫЙ АБОРТ
И РЕЗОРБЦИЯ ПЛОДОВ...........900
Инцидентность..................900
Причины........................900
Клинические признаки...........904
Диагностика....................904
Лечение........................905
ДИСТОЦИЯ.......................907
Определение....................907
Практическое описание.........907
Классическое описание.........909
Частота дистоции у разных пород собак..........910
Диагностика...................910
Диагностические критерии......914
Лечение.......................914
ЧРЕЗМЕРНО ЗАТЯНУВШАЯСЯ
БЕРЕМЕННОСТЬ (ПЕРЕНАШИВАНИЕ) .917
ВЫДЕЛЕНИЯ ИЗ ПОЛОВЫХ ОРГАНОВ ЩЕННЫХ СУК....................918
Выделения зеленого цвета: отделение участков матки, к которой прикреплялась плацента........918
Водянистые/серозные выделения..919
Гнойные выделения.............919
Кровь: кровянистые выделения..919
СИСТЕМНЫЕ ЗАБОЛЕВАНИЯ ЩЕННЫХ СУК....................919
ВВЕДЕНИЕ ОКСИТОЦИНА ПОСЛЕ РОДОВ...................920
ПОСЛЕРОДОВОЙ ЭНДОМЕТРИТ (ОСТРЫЙ МЕТРИТ)...............920
СУБИНВОЛЮЦИЯ МАТКИ............921
Инволюция матки................921
Определение/клинические признаки .921
Дифференциальная диагностика...921
Лечение........................922
ЗАДЕРЖАНИЕ ПЛАЦЕНТЫ (ПОСЛЕДА)..922 ПОСЛЕРОДОВАЯ ТЕТАНИЯ - ЭКЛАМПСИЯ
- ГИПОКАЛЬЦИЕМИЯ.............922
Определение....................922
Этиология......................922
Клинические признаки...........923
Диагностика....................923
Первая помощь..................923
ДЛИТЕЛЬНЫЙ КУРС ЛЕЧЕНИЯ........924
Первая помощь сукам при неэф-
фективности кальциевой терапии...925
Лечение сук, у которых раньше уже была эклампсия.................925
МАСТИТ.........................925
Инфекционный мастит............925
Неинфекционный мастит/галактостаз 926
АГАЛАКТИЯ......................927
ГИПОГЛИКЕМИЯ У ЩЕННЫХ СУК.......927
АКРОМЕГАЛИЯ В ДИЭСТРУСЕ.........927
САХАРНЫЙ ДИАБЕТ У ЩЕННЫХ СУК....927
НОРМАЛЬНОЕ СОСТОЯНИЕ ОРГАНИЗМА СУКИ В ПРЕДРОДОВОЙ И ПОСЛЕРОДОВОЙ ПЕРИОД
Клиническое состояние
Организм суки может претерпевать различные изменения до родов, во время и после них. Порой неожиданно возникают достаточно серьезные проблемы, которые беспокоят владельцев собак. Однако некоторые из таких «проблем» являются нормальными изменениями организма, связанными с развитием беременности. Например, может меняться характер животного. У щенных сук часто повышается аппетит, но сдавленный маткой с растущими плодами желудок становится менее емким, чем до беременности; поэтому на поздней стадии беременности собакам нужно давать корм чаще и меньшими порциями. Снижение физических нагрузок и способности организма щен-ной суки к терморегуляции могут иметь серьезные последствия в конце периода плодоношения.
Кровь и сыворотка крови
При нормальном течении беременности уменьшается концентрация эритроцитов в крови суки,
о чем свидетельствует снижение гематокрита до 30-35%. Концентрация холестерина в сыворотке крови щенных сук может повышаться, в то время как содержание общего белка, альбумина и кальция снижается (Bebiak et al, 1987). Беременность сопровождается снижением общего тироксина (Т4) в сыворотке крови (Reimers et al, 1984), а также VII, VIII, IX и XI факторов свертывания крови (Olson, 1988). У некоторых пород собак изменения крови в период плодоношения носят особый характер. Знание индивидуальных и породных особенностей гематологических параметров позволяет определить необходимость проведения лечения щенной суки.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ЛОЖНОЙ ЩЕННОСТИ
Определение и клинические признаки
Все здоровые суки достигают фазы диэструса (лютеальная фаза), на которой доминирующее влияние оказывает прогестерон, и его действие продолжается до фазы эструса. Определение в крови концентрации прогестерона не позволяет диагностировать беременность у сук. С позиций физиологии всех
898 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
нещенных сук в фазе диэструса можно рассматривать, как находящихся в состоянии ложной щенности. Между тем, такое нормальное состояние следует дифференцировать от синдрома ложной щенности, который распознается ветеринарными врачами и заводчиками по характерным клиническим проявлениям, напоминающим истинную беременность. Сходство бывает столь большим, что владельцы животного часто оказываются в заблуждении, ожидая наступления родов, беспокоясь по поводу их задержки и предполагая необходимость родовспоможения. Синдром ложной щенности проявляется через 6-12 недель после эструса. Он может иметь слабо выраженный характер, включая только изменение аппетита, увеличение веса или живота. Иногда его сопровождают признаки, которые могли бы указывать на приближение родов: беспокойство, снижение активности, попытки сделать «нору», анорексия, рвота и/или принятие животным на себя роли матери несуществующих щенков (роль последних могут выполнять игрушки и другие неодушевленные предметы). Иногда симптоматика более выражена, что вводит в заблуждение относительно того, имеет место ложная или истинная беременность. Так, например, сука может начать лакгиро-вать, или у нее возникают сокращения брюшной стенки, как при родовых схватках. Не удивительно, что видя это, владельцы животных находятся в полной уверенности, что наступают роды, и часто обращаются к ветеринарным врачам с просьбой определить причину задержки родов у их сук, которые на самом деле страдают ложной щенностью. Феномен лактации нещенными суками мог развиться в процессе эволюции, позволяя взрослым небеременным самкам, например волчицам, выкармливать приплод другой волчицы (Voith, 1980).
Физиология
Из-за сходства физиологии щенных и нещенных сук во время диэструса синдром ложной щенности можно рассматривать как усиленный ответ организма на происходящие в нем в это время нормальные физиологические изменения. Синдром ложной щенности начинает проявляться после снижения концентрации прогестерона в сыворотке крови суки. Снижение прогестерона, в свою очередь, стимулирует синтез и секрецию пролактина. Некоторые нещенные суки проявляют более высокую чувствительность к таким гормональным изменениям, чем остальные, следствием чего становится развитие у них синдрома ложной щенности.
Лактация при синдроме ложной щенности контролируется пролактином. Однако пролактин секретируется и в организме нелакгирующих сук. Это позволяет предположить, что в основе патогенеза синдрома ложной щенности лежит чрезмерно высокая концентрация пролактина или повышенная чувствительность к нему организма некоторых животных (Harvey, 1998). Таким образом, синд
ром ложной щенности является следствием точно синхронизированных гормональных изменений в организме собаки. Высказывалось предположение, что сокращение рациона может предотвратить развитие синдрома ложной щенности, однако не ясно, может ли это иметь клиническое значение (Lawler et al, 1999). Для заводчиков значительно важнее понять, что ложная щенность представляет собой гиперболизированное нормальное физиологическое состояние собаки во время диэструса.
Диагностика/интерпретация результатов диагностических исследований
Ложную щенность диагностируют во всех случаях выявления у нещенной суки типичных для этого синдрома клинических проявлений. Если УЗИ или рентген показали отсутствие плодов в брюшной полости, то другие анализы (крови, мочи и другие тесты) не требуются. Обычно невозможно определить, была ли сука в предшествующий развитию синдрома ложной щенности период беременна и абортировала (или у нее произошла резорбция плодов). Хотя такой сценарий возможен, но синдром ложной щенности в подавляющем большинстве случаев развивается самостоятельно, а не как осложнение аборта или резорбции плодов.
Основная задача ветеринарного врача, по всей видимости, заключается в разъяснении заводчику того, что синдром ложной щенности у его собаки является всего лишь чрезмерно интенсивным проявлением ее нормального физиологического состояния и спонтанно исчезнет без всякого лечения. В отсутствие овуляции, заболевания яичников или дисфункции гипофиза синдром ложной щенности никогда не развивается - непременным условием его возникновения является наличие в яичниках нормально функционирующих желтых тел, находящихся на начальной стадии регрессии. В этот период снижение концентрации прогестерона стимулирует секрецию пролактина, что становится гормональной основой развития синдрома ложной щенности. С такой точки зрения, этот синдром можно рассматривать как нормальное состояние организма суки.
Синдром ложной щенности следует дифференцировать от гипотиреоза, который также в ряде случаев сопровождается образованием молока у сук. Предполагается, что лактация при гипотиреозе вызвана увеличением секреции пролактина, индуцированной повышением концентрации тиролибери-на. Это подтверждается сообщением о страдавшей гипотиреозом собаке, у которой на фоне повышения концентрации пролактина в крови наблюдали выделение молока (Cortese et al, 1997).
Лечение
Отказ от проведения лечения. В отсутствие тяжелой симптоматики лечение синдрома ложной щенности проводить не рекомендуется. В таких
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 899
случаях он спонтанно проходит в течение 1-3 недель по мере завершения диэструса. Владельцев сук обычно наиболее сильно беспокоят два проявления этого синдрома - «норное» поведение и лактация (в основном, из-за опасения порчи мебели). Увеличение молочных желез и выделение молока могут доставлять суке беспокойство. Кроме того, л актирующая молочная железа нередко становится воротами для тяжелых инфекций. Если нет на то серьезных оснований, следует избегать всякого лечения. Однако некоторые суки лактируют довольно долго.
Консервативная терапия. Лактация усиливается и приобретает продолжительный характер, когда на суку длительно воздействуют стимулы, способствующие образованию молока. Этому могут способствовать и сами заводчики, которые, пытаясь устранить у собак дискомфорт, прикладывают к их молочным железам теплые или холодные компрессы, промывают их холодной водой. Суки сами тоже могут усиливать образование молока, вылизывая лактиру-ющие железы или по-матерински заботясь о неодушевленных предметах или о щенках другой находящейся рядом собаки. Поэтому владельцу страдающего синдромом ложной щенности животного следует рекомендовать избегать любых стимулов, которые способствуют лактации. Надевание на шею суки «елизаветинского воротника» и удаление всех объектов, которые она могла бы считать своими щенками, ускоряет избавление ее от ложной щенности.
Если такие меры не дают ожидаемого результата, и есть желание предпринять что-то более радикальное, то может помочь следующее. В течение 3-7 суток в ночной период животное лишают воды на 6-10 ч. Ограничение в воде усиливает задержку жидкости в организме и быстро останавливает образование молока. В качестве альтернативы собаке можно перорально давать 3 раза в день фуросемид в дозе 0,25-0,5 мг/кг массы тела до прекращения лактации (обычно она прекращается меньше чем за 7 дней). При использовании мочегонного средства ограничивать потребление воды не нужно.
Может оказаться полезным применение в течение нескольких дней транквилизаторов, обеспечивающих легкий седативный эффект. Назначать с этой целью фенотиазины не рекомендуется, поскольку они нейтрализуют или ингибируют действие дофамина, который является пролактин-ингибирующим фактором, и его нейтрализация фенотиазинами, в конечном итоге, стимулирует синтез и/или секрецию пролактина. Поэтому следует пользоваться другими седативными препаратами или транквилизаторами (Voith, 1983). Вместо них можно прибегнуть к повышенным физическим нагрузкам на собаку, которые отвлекают ее от проявлений нежелательного поведения.
Интенсивная терапия. Прогестерон. Если консервативная терапия не дала желаемого результата и лактация продолжается, можно прибегнуть к более радикальным средствам. Прогестерон (ме-гестрол ацетат) вводят в течение 8 дней в дозе 2 мг/кг массы тела/день. Это возвращает организм суки к гормональному статусу диэструса и обычно снижает тяжесть клинических проявления ложной щенности. Однако как только прекращают вводить прогестерон, интенсивная секреция пролактина возобновляется и вновь появляются симптомы ложной щенности. Поэтому мы не рекомендуем пользоваться этим методом лечения (Concannon, Lein, 1989).
Эстроген и тестостерон. Лечение эстрогеном (диэтилстильбестролом), который дают собакам перорально 7 дней подряд в дозе 1 мг/день, может снять тяжесть синдрома ложной щенности, но при этом индуцирует наступление у животного проэструса или течки. Тестостерон вводят сукам внутримышечно в дозе 1-2 мг/кг массы тела. Андроген миболерон рекомендуется применять перорально в дозе 0,016 мг/кг массы тела на протяжении 5 дней (Brown, 1984). Эффективность этого препарата невысока, и при его введении 63 страдавшим ложной щенностью сукам устранить физиологические нарушения удалось меньше чем у 50% собак. Такой метод лечения в большей степени позволяет избавить животных от психических, чем от физиологических нарушений, характерных для синдрома ложной щенности.
Ингибиторы пролактина. Алкалоиды спорыньи (эрголины) и их производные являются сильными ингибиторами пролактина (Krulichet et al, 1981; Ferrari et al, 1982). Они действуют путем непосредственной стимуляции дофаминовых рецепторов в гипофизе. Бромокриптин, являющийся одним из производных алкалоидов спорыньи и агонистом дофамина, подавляет секрецию пролактина гипофизом. Его дают собакам перорально несколько раз в день в общей суточной дозе 0,01-0,1 мг/кг массы тела. Лечение бромокриптином проводят до тех пор, пока не прекратится лактация (Mialot et al, 1981, 1982; Janssens, 1986). Применение этого препарата обычно сопровождается такими побочными эффектами, как рвота, анорексия, угнетение и другие изменения поведения (Peterson, Drucker, 1981). Рвоту удается устранить противорвотными препаратами, которые дают собаке одновременно с бромокриптином. Мы считаем бромокриптин препаратом выбора в случаях необходимости интенсивной терапии ложной щенности, однако, в нашей практике такой необходимости никогда не возникало.
Такой же эффективностью обладает другой дериват алкалоидов спорыньи - каберголин, который лучше переносится собаками. Его дают сукам в дозе 5 мкг/мл один раз в сутки на протяжении 5-10 дней. Он быстро снижает концентрацию пролактина и прекращает лактацию в 95% случаев (Di Salle et al, 1984; Jochle et al, 1987; Arbeiter et al, 1988).
900 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Побочные эффекты при лечении каберголином не носят тяжелого характера и включают сонливость (у 25% собак), снижение аппетита и рвоту (менее чем у 5% животных). В более позднем исследовании терапевтическая эффективность каберголина при лечении ложной щенности у собак оказалась несколько меньшей, чем та, о которой сообщалось ранее (с его помощью удалось добиться нормального клинического состояния у 21 из 26 сук) (Harvey et al, 1997). Более того, по данным этих авторов, ка-берголин, хотя и подавляет секрецию пролактина, но его эффект может быть кратковременным.
Каберголин применяют также с целью проведения аборта у сук во второй половине беременности (Post et al, 1988). Сравнительная оценка терапевтического действия каберголина и бромокриптина при лечении женщин с гиперпролактинемической аменореей показала, что каберголин менее эффективен, но лучше переносится больными (Webster et al, 1994).
Овариогистерэктомия. Овариогистерэктомия, часто называемая стерилизацией, не рекомендуется для лечения синдрома ложной щенности ни в каких случаях. Она может обострить состояние собаки, так как удаляет из системы прогестерон и тем самым увеличивает секрецию пролактина. Иногда овариогистерэктомия приводит к развитию персистентного синдрома ложной щенности. Учитывая это, многие исследователи рекомендуют проводить ее не раньше, чем через 4-5-месяцев после окончания течки (Harvey, 1998).
Заболевания, вызванные ложной [ценностью, и частота ее рецидивов
Никакой связи между синдромом ложной щенности и последующим развитием у сук бесплодия, пиометры, отсутствия материнского инстинкта, включая нежелание кормить новорожденных щенков молоком, или других заболеваний, по всей видимости, не существует. С клинической точки зрения, ложная щенность представляет собой всего лишь слишком выраженное проявление нормального течения диэструса у собак. Если рецидивы синдрома ложной щенности беспокоят заводчика, то ему следует при очередной течке провести вязку суки либо согласиться на овариогистерэктомию. (Информацию о тех случаях, когда сука не беременеет после нескольких вязок, можно найти в разделе «Бесплодие суки и ассоциированные репродуктивные заболевания»), У некоторых сук ложная щенность возникает после каждой течки. Лучшим выходом из такой ситуации, если не планируется использовать собаку в племенных целях, служит овариогистерэктомия (Harvey, 1998).
ВНЕМАТОЧНАЯ БЕРЕМЕННОСТЬ
Развитие плодов вне матки, хотя и редко, но все-таки встречается у сук. Причиной этого может стать разрыв матки во время беременности, приводящий
к попаданию плодов из половых органов в брюшную полость. Такой разрыв может быть результатом травмы или местного некротического процесса в стенке органа, развившегося после гибели одного из плодов. Внематочная беременность может не иметь выраженных клинических признаков, но в ряде случаев регистрируют неспецифическую симптоматику во время беременности или после родов. Окончательный диагноз может быть поставлен только с помощью УЗИ или лапаротомии (Shamir, Shahar, 1996).
СПОНТАННЫЙ АБОРТ И РЕЗОРБЦИЯ ПЛОДОВ
Инцидентность
Диагностика преждевременного изгнания мертвых или неполностью развившихся живых плодов на поздней стадии беременности или резорбция (рассасывание) плодов представляет нелегкую задачу для ветеринарных врачей. Частоту абортов и резорбции плодов довольно трудно оценить, поскольку не существует надежного метода диагностики беременности у собак в первые три недели после имплантации бластоцитов, а также потому, что большую часть сук не подвергают УЗИ и рентгенологическому исследованию до тех пор, пока у тех не появляется проблем со здоровьем. Довольно часто подозрение, что у суки произошли аборт или резорбция плодов, возникает в тех случаях, когда она вообще не была беременной. Кроме того, собаки нередко съедают или закапывают свои абортированные плоды, что создает дополнительные трудности при постановке диагноза. Между тем, недавно с помощью УЗИ было показано, что резорбция одного-двух плодов происходит у сук приблизительно в 10% случаев беременности (England, 1998).
Причины
Общие. Огромное количество факторов может стать причиной абортирования сукой одного или нескольких вынашиваемых плодов. Даже тогда, когда факт аборта установлен обнаружением изгнанных плодов и/или последов, истинные причины этого часто остаются неизвестными. Они могут носить врожденный/наследственный, инфекционный, токсический, травматический или гормональный характер, а также возникать вследствие плохого кормления суки, побочного действия использованных для ее лечения лекарственных препаратов, болезней матки и системных заболеваний. Перечисленные этиологические факторы абортов сук принято делить на три большие категории: нарушения развития плодов, неблагоприятные внешние воздействия на щенную суку и инфекционные агенты (табл. 21-1).
Нарушения развития плодов. Любые несовместимые с дальнейшей жизнью нарушения развития плодов приводят к их гибели. Погибшие плоды изгоняются или рассасываются. Нарушения разви-
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
901
ТАБЛИЦА 21-1. ПРИЧИНЫ И МЕТОДЫ ДИАГНОСТИКИ АБОРТОВ У СУК
Этиологические факторы Клинические данные Результаты пато-морфологического исследования Тесты
Бактерии
Brucella canis Аборт произошел в последнем триместре беременности. Аутолиз абортированных плодов. Культивирование (на специальных питательных средах) образцов крови и влагалищных выделений . Серологические тесты: реакции агглютинации (ускоренный вариант на стекле и пробирочный вариант) и иммунодиффузии в агаровом геле
Другие виды бру- Аанамнестические данные о кон- Аутолиз абортирован- Серологическое исследование: обна-
целл: В.abortus, B.suis и B.melitensis такте собаки с инфицированными сельскохозяйственными живот- ными. ных плодов. ружение антител, специфичных к перечисленным видам бруцелл.
Сальмонеллы Системное заболевание суки. Наличие гнойных истечений из половых органов. Септицемия плодов. Культивирование на специальных питательных средах тканей плодов и влагалищных выделений.
Кампилобактерии Анамнестические данные о наличии у суки или контактировавших с ней людей диареи Воспаление плаценты. Культивирование на специальных питательных средах тканей плодов и влагалищных выделений.
Кишечная палочка или стрептококки Системное заболевание суки. Гнойные выделения из влагалища. Септицемия плодов. Культивирование на специальных питательных средах тканей плодов и влагалищных выделений.
Вирусы
Герпесвирус собак Аборт в последнем триместре беременности. Отсутствие у суки симптоматики заболевания, за исключением обнаружения везику-лов во влагалище. Рождение мертвых щенков. Бесплодие. Септицемия плодов. Множественные петехиальные кровоизлияния, некроз надпочечников, почек плодов, печени и легких. Серологическое исследование парных проб сыворотки крови суки, взятых с интервалом в 2 недели.
Вирусы собачьей чумы или аденови- Системное заболевание суки. Зависит от вызвавшего аборт вируса. Выбор диагностических тестов зависит от вызвавшего аборт вируса.
русы собак
Другие микроорганизмы Септицемия абортиро-
Молликуты (микоп- Содержание клинически здоровой Культивирование на специальных
лазмы и уреаплаз-мы) суки в помещении с высокой концентрацией животных. Выделения из наружных половых органов. Бесплодие. ванных плодов. питательных средах тканей плодов и влагалищных выделений.
Toxoplasma gondii Инфекция может протекать бес- симптомно или сопровождаться поражением разных органов. Гормональные факторы Воспаление плаценты. Поражения различных органов плода. Серологическое исследование парных проб сыворотки крови суки, взятых с интервалом в 2 недели (диагностически значимым считается 4-кратное повышение титра специфических антител).
Недостаток прогес- Отсутствие симптоматики инфекци- Признаков заболева- Серийное тестирование прогестерона
терона онных заболеваний. ния плодов нет в сыворотке крови суки на лютеальной стадии.
Гипотиреоз Ожирение, сонливость, симметричные очаги выпадения шерстного покрова. Признаков заболевания плодов нет Проба со стимуляцией тиреотропином
тия могут затрагивать половые клетки (сперматозоиды и яйцеклетки), хромосомы, а также органы развивающихся плодов. Рассасывание плодов обычно происходит при их гибели на ранней стадии беременности, а аборты - на поздней стадии.
Неблагоприятные внешние воздействия на щенную суку. Системные болезни. Любой фактор, вызывающий у беременной суки сильный стресс, повреждение матки или плода, может стать причиной гибели последнего. К числу таких факторов относятся тяжело протекающие болезни репродук
тивного тракта и других органов. Например, высока вероятность того, что тяжелое сердечное заболевание щенной суки может привести к недостаточному кровоснабжению матки и, как следствие, гибели плодов. Сходные проблемы могут вызвать болезни и других основных органов. Гипотиреоз считается потенциальной причиной абортов. Ветеринарные врачи должны помнить о том, что при ряде системных заболеваний животное остается эутиреоидным, но результаты функциональных тестов могут указывать на наличие гипотиреоза (эутиреоидный
902 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
синдром; см. гл. 3). Сахарный диабет, по всей видимости, самое распространенное эндокринное заболевание у собак, является серьезным препятствием для нормального вынашивания плодов и приводит к аборту. Поэтому всех страдающих диабетом сук следует подвергать овариогистерэктомии.
Заболевания матки. Заболевания матки, при которых становится невозможным нормальное течение беременности, являются еще одной большой категорией причин, приводящих к аборту. К числу таких заболеваний относятся эндометриоидная кистозная гиперплазия, хронические инфекции матки, новообразования и спайки матки.
Пониженная функциональная активность желтых тел (гиполютеоидизм). Состояние беременности поддерживается прогестероном, который образуется в желтых телах яичников. Снижение концентрации прогестерона ниже критического уровня (1,0-2,0 нг/мл) обычно приводит к изгнанию плодов из родовых путей. Описаны случаи спонтанного прерывания беременности у женщин, вызванные дисфункцией желтых тел, но такой диагноз рядом специалистов ставится под сомнение (Meis et al, 2003). Документальных подтверждений наличия данного синдрома у собак нет (Olson, 1988), за исключением только одного описанного случая (Purswell, 1991). Ко времени аборта может снижаться концентрация прогестерона в крови, но это скорее следствие, а не причина гибели плодов. Показано, что снижение концентрации прогестерона в сыворотке крови сук происходит в течение нескольких дней после гибели плодов (Concannon et al, 1990). Кроме того, патологическое состояние плодов, какой бы причиной оно не было вызвано, может вести к снижению концентрации прогестерона в сыворотке крови (Johnston et al, 2001). Пониженное содержание прогестерона в крови недавно абортировавшей суки не следует рассматривать как неопровержимое доказательство гиполютеоидизма.
Введение прогестерона предотвращает изгнание плодов даже в случае инфекционных заболеваний. Однако владельцев сук следует предупредить о том, что этим методом не следует злоупотреблять, поскольку вызываемое им отдаление сроков наступления родов ведет к чрезмерному росту плодов и, как следствие, затрудненным родам. Кроме того, применение прогестерона сопряжено с рядом его побочных тератогенных эффектов, в том числе с маскулинизацией плодов женского пола. Помимо всего прочего, нецелесообразно продлевать срок пребывания нежизнеспособного плода в родовых путях суки, поскольку это может повлечь за собой (например, в случае инфекционных заболеваний) гибель остальных плодов или матери.
Диагностика гипофункции желтого тела сложна. Для установления у сук беременности и контроля ее течения в обязательном порядке следует пользоваться УЗИ. Концентрацию прогестерона в их сыворотке крови определяют, по меньшей мере, два раза в неделю. В случае аборта проводят па-
томорфологическое, бактериологическое и другие исследования плодов и последов. Гиполютеоидизм предполагают только тогда, когда эти анализы не позволяют установить этиологию аборта, а во время последнего выявлено снижение концентрации прогестерона в сыворотке крови суки.
Принято считать, что для поддержания беременности уровень прогестерона в сыворотке крови сук должен превышать 2 нг/мл. Между тем, такая концентрация соответствует нижнему порогу чувствительности иммуноферментного метода, которая в разных коммерческих наборах составляет 1-5 нг/мл. Точное определение концентрации прогестерона является важнейшим условием правильной постановки диагноза, а ветеринар не может быть уверенным в результатах, полученных с помощью имеющихся в клинике наборов. У суки, о которой сообщает Purswell, могло и не быть пониженной активности желтых тел, поскольку по результатам повторного анализа ее сыворотки, полученной сразу же после аборта, концентрация прогестерона в сыворотке составляла 6,5 нг/мл (Purswell, 1991). Только лабораторные исследования могут выявить наличие или отсутствие гиполютеоидизма, но результата однократного определения концентрации прогестерона недостаточно для постановки такого диагноза. Существует ли у сук такой синдром? Может, и существует.
Лечение гиполютеоидизма может строиться на нескольких стратегиях. Прежде всего, следует знать, когда сук вступила в фазу диэструса, о чем можно судить по результатам цитологического исследования влагалищных мазков (см. гл. 19). Введение прогестерона следует прекратить с 50-53-го дня диэструса (роды у сук обычно происходят на 55-58-й день диэструса). Недавно было показано, что ежедневного внутримышечного введения масляного раствора прогестерона в дозе 3 мг/кг массы тела достаточно для поддержания его концентрации в сыворотке крови собак на уровне 10 нг/мл. Через 48-72 часа после последней инъекции препарата концентрация прогестерона в сыворотке крови сук опускалась ниже 2 нг/мл (Scott-Moncrieff et al, 1990). Но для поддержания нормального течения беременности достаточно вводить прогестерон в дозе 2 мг/кг массы тела каждые 48 часов (Eilts, 1992). Посредством ежедневного подкожного введения синтетического прогестерона (17а-этил-19-нор-тестос-терона, производимого Steraloids Inc, Denville, NJ) в дозе 1 мг/кг массы тела удавалось поддерживать беременность у овариогистерэктомированных сук (Steinetz et al, 1989). В доступной литературе отсутствуют описания профилактики гиполютеоидизма овабаном (производства Schering, США), но имеются неопубликованные данные об успешном применении этого препарата в дозе 5 мг/кг/день до наступления 55-го дня стадии диэструса.
Аллитренболон (регумат) - препарат прогестерона, разработанный фирмой «Hoechst» для перорального применения, был испытан в качестве средства поддержания беременности у овариэктомирован-
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 903
ных сук. Аллитренболон давали собакам с 30-32-го дня беременности до 54-го дня диэструса (время наступления диэструса определяли по результатам цитологического исследования влагалищных мазков). Ежедневная дача препарата в дозе 0,044 мг/кг позволила поддерживать нормальное течение беременности только у двух из 6 овариэктомирован-ных сук. Вдвое более высокая доза аллитренболона (0,088 мг/кг) дала 100% эффект - роды произошли в положенный срок у всех трех получавших препарат овариэктомированных сук. Однако только у двух роды проходили без осложнений и не требовали родовспоможения. Роды третьей суки были затрудненными и все новорожденные щенки оказались мертвыми. Применение аллитренболона оказывало нежелательный побочный эффект на лактацию. Пометы нескольких сук пришлось подсаживать к ощенившимся контрольным собакам, не получавшим этот препарат. У двух сук секреция молока на фоне приема аллитренболона началась только через 3 дня после родов, при этом одна из них могла выкармливать лишь часть помета. Предполагается, что этот препарат нарушает нормальное развитие лактации за счет торможения секреции пролактина. Таким образом, если решено применять аллитренболон, то заранее следует подготовиться к тому, что придется щенков подкармливать заменителем молока. В заключение напомним, что аллитренболоном нельзя пользоваться до тех пор, пока точно не будет определена дата предстоящих родов (для этого проводят серийные анализы концентрации прогестерона в сыворотке крови сук во время проэструса и в начале эструса, а также определяют первый день диэструса по результатам цитологического анализа влагалищных мазков) (Eilts, 1992).
Травма. Травма относится к числу крайне нежелательных причин аборта. Тем не менее, практически любой сильный удар по животу щенной суки может привести к повреждениям матки и плодов и стать причиной аборта.
Кормление, лекарственные препараты, вакцины. Эти факторы становятся причиной аборта сук лишь в спорадических случаях. Их характеристика приведена в гл. 20.
Инфекционные агенты. Множество микроорганизмов могут инфицировать матку, вызывая гибель, резорбцию и изгнание плодов (см. табл. 21-1). К их числу относятся бруцеллы, кишечная палочка, стрептококки, герпесвирус, парвовирус собак серотипа 1, вирус чумы плотоядных, микоплазмы, кам-пилобактерии, токсоплазмы и другие. Наш личный опыт свидетельствует о том, что установить роль инфекционных агентов в гибели или резорбции плода бывает достаточно трудно. Если возникло такое подозрение, рекомендуется сделать посевы влагалищных мазков суки, плаценты и тканей, а также содержимого желудка плодов или новорожденных щенков. Диагностика ряда инфекционных заболеваний, например, кампилобакгериоза, требует специальных приемов (Bulgin et al, 1984).
Инфекция Brucella canis. См. гл. 26.
Герпесвирусная инфекция собак. Герпесвирус собак широко распространен - многие популяции собак инфицированы им на 80-100%. Основную группу риска составляют животные, которые часто контактируют с другими собаками (на выставках, в питомниках и т.д.). Герпесвирус может персистировать в организме собак на протяжении всей их жизни. Иммунный ответ при такой латентной инфекции кратковременный и слабо выражен. Поэтому обнаружение даже невысокого титра антител, нейтрализующих этот вирус, служит при данной инфекции диагностическим критерием, особенно если налицо клинические признаки инфекции. Рецидивы клинических проявлений герпесвирусной инфекции возникают в результате стресса, переносимого сукой в период беременности и родов.
Герпесвирусная инфекция у новорожденных щенков протекает остро и завершается летальным исходом. Она сопровождается генерализованным образованием очагов некроза и кровоизлияний. У взрослых собак заболевание протекает субклинически или в легкой форме, проявляющейся конъюнктивитом, серозными или слизисто-гнойными выделениями из глаз и/или носа, а также поражениями влагалища, его преддверия и вульвы. Эти поражения в начале заболевания имеют везикулярный характер, становясь в последующем округлыми и оспоподобными. Они быстро исчезают, но могут вновь появиться после начала проэструса. В тех случаях, когда заражение произошло на ранней стадии беременности, инфекция может привести к резорбции и/или мумификации плодов, при заражении в середине беременности - к аборту, и, наконец, при попадании возбудителя в организм суки на поздней стадии беременности - к рождению недоношенных щенков (England, 1998). В одном помете инфицированной герпесвирусом суки могут быть мертвые и/или мумифицированные и здоровые живые щенки. Аборт, вызванный заражением суки герпесвирусом на 30-й день беременности, происходит спустя 14-21 день. Инфицированная сука может стать бесплодной или менее плодовитой, чем раньше, что проявляется рождением меньшего количества щенков. Плодная плацента у инфицированных сук, как правило, недостаточно развита и отечна. На ней видны серовато-белые очаги, размер которых варьирует от точечного до величины рисового зерна. Иногда скопления таких поражений образуют зональные структуры шириной в 2-3 мм. Гистологическое исследование выявляет в пораженных участках плаценты типичные изменения.
Передача герпесвируса собак может происходить от одного животного к другому половым путем, трансплацентарно, при контакте растущих плодов с вскрывшимися содержащими возбудитель везикулами, а также через органы дыхания. Диагностика этой инфекции базируется на выделении возбудителя из патологического материала.
904 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Для его выделения требуется изощренная техника получения образцов и культур из охлажденной в холодильнике, но не замороженной ткани (замораживания следует избегать, поскольку оно ведет к инактивации возбудителя). Несоблюдение методики вирусологического исследования может привести к получению ложноотрицательных результатов. Для предотвращения заражения герпесвирусом щенную суку, особенно в последние 3 недели беременности, и ее приплод в первые 3 недели после родов следует изолировать от потенциальных источников инфекции. Поскольку вакцин против этой инфекции не существует, ветеринарные врачи могут противопоставить ее распространению только тщательное физикальное исследование и анамнестический анализ предназначенных для племенного разведения собак (Hashimoto, Hirai, 1986; Evermann, 1989).
Токсоплазмоз. Токсоплазмы не относятся к частым причинам аборта у сук - собака является всего лишь промежуточным хозяином T.gondii. Единственный основной хозяин для этого простейшего - кошка. Инвазия передается половым путем, при проглатывании ооцист возбудителя, попадающих во внешнюю среду с фекалиями кошек, а также при поедании мяса животных, инвазированных этим агентом. Предположительный диагноз на токсоплазмоз ставят на основании выявления 4-кратного повышения титра специфических антител при исследовании парных проб сыворотки крови, взятых от собаки с интервалом в 3 недели. При оценке результатов серологического исследования следует учитывать, что причиной повышенного титра антител может быть ранее перенесенная инфекция T.gondii. Профилактика токсоплазмоза основана на недопущении контакта собак с экскрементами кошек и поедания сырого мяса.
Инфекция микоплазмой и уреаплазмой. Эти бактерии являются компонентами нормальной микрофлоры влагалища многих сук. Тем не менее, они могут стать причиной бесплодия, гибели эмбрионов на ранних стадиях развития и их резорбции, аборта, рождения мертвых щенков, а также заболеваний и смерти новорожденных. При нахождении собаки совместно с большим количеством других животных (например, в питомнике) может произойти ее заражение высокими дозами микоплазм и уреа-плазм. Постановка диагноза при заболеваниях, при которых возникло подозрение на этиологическую роль этих бактерий, всегда носит предположительный характер, поскольку эти микроорганизмы часто являются компонентами нормальной микрофлоры влагалища сук. Обычно основанием для подобного диагноза служит выделение из патологического материала, взятого от страдающей метритом и/или вагинитом собаки, чистых культур этих агентов при отсутствии других микроорганизмов. Аборты, вызываемые у сук микоплазмами и уреаплазма-ми, редки. Лечение предусматривает применение хлорамфеникола или тетрациклина на протяжении
10-14 дней. Эти антибиотики не следует назначать новорожденным щенкам и их матерям во время лактации. Беременных сук лечат эритромицином, хотя этот препарат недостаточно эффективен и может вызывать нарушения нормальной работы органов пищеварения (Lein, 1986; Purswell, 1992).
Клинические признаки
К числу клинических признаков, проявляющихся у сук перед началом аборта, относятся анорексия, беспокойство, рвота, лихорадка, абдоминальные боли, судорожные сокращения брюшной стенки, выделения из влагалища. Но единственным неопровержимым признаком аборта является преждевременное изгнание из родовых путей живых или погибших плодов. Прощупывание плодов через брюшную стенку суки носит субъективный характер, вследствие чего не позволяет с уверенностью судить о том, имел ли место аборт. Интенсивные сокращения мышц брюшной стенки щенной суки раньше 55-го дня плодоношения позволяют предположить начало аборта. Прозрачные, не имеющие запаха, похожие на яичный белок выделения из половых органов не должны вызывать беспокойство у владельца собаки. Однако появление бесцветных и зловонных влагалищных выделений ненормально и может указывать на резорбцию плодов или аборт. Перед вызванным инфекционными агентами абортом выделения из половых органов обычно становятся кровянистыми, черными, темно-зелеными или гнойными и зловонными. Следует иметь в виду, что такие же влагалищные выделения бывают при вагините, попадании во влагалище инородного тела, болезнях органов мочеиспускания и других не связанных с беременностью заболеваниях (см. раздел «Лечение»), Больная беременная сука в большей степени предрасположена к аборту как вследствие отрицательного воздействия на процесс плодоношения самого заболевания, так и побочных эффектов лечения последнего и проведения диагностических процедур.
У собак аборт может затрагивать не всех, а только часть вынашиваемых плодов - остальные нередко продолжают нормально развиваться вплоть до родов. Поэтому при преждевременном аборте одного или нескольких плодов следует помнить, что в матке могут оставаться другие живые плоды.
Диагностика (рис 21-1)
УЗИ является высоко чувствительным и надежным способом диагностики беременности. Оно позволяет выявить растущие в матке суки эмбрионы уже на 16-й день беременности и оценить жизнеспособность плодов по сокращениям сердец, начиная с 24-го дня беременности. Таким образом, с помощью УЗИ ветеринарный врач может выявить гибель отдельных или всех находящихся в матке суки плодов уже на начальной стадии беременности.
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 905
Рентгенологическое исследование также является одним из основных методов диагностики как беременности, так и аборта или резорбции плодов. Его показания менее надежны, чем результаты УЗИ, поскольку оно позволяет диагностировать беременность только после формирования у плодов скелета, т.е. с 42-45-го дня плодоношения. При определении с его помощью наличия в матке погибших или рассасываемых плодов, в первую очередь, обращают внимание на такие признаки, как коллапс или декальцификацию скелета, скопление газа в плодах, а также ненормальное положение последних (рис. 21-2).
При подозрении на аборт или другие заболевания беременной суки ветеринарный врач собирает подробный анамнез и проводит тщательное физикальное исследование животного. Анамнез должен включать сведения о результатах ранее проводившихся вязок собаки и о наличии у нее проблем, которые могут быть связаны с органами репродукции. Важны информация о репродуктивных качествах использованных для вязки кобелей и результаты исследований на бруцеллез, как суки, так и этих кобелей. Дополнительно собирают сведения о проводившихся суке вакцинациях и обработках против глистов, о ее пребывании в других местах, контактах с другими животными, случаях заражения инфекционными агентами, составе рациона
Рис. 21-1. Схема диагностики рецидивирующих резорбции и абортов сук.
и даче кормовых добавок, условиях содержания и проводившихся лечебных процедурах (см. гл. 20). Физикальное исследование суки должно включать тщательную пальпацию внутренних органов через брюшную стенку. Желательно провести осмотр влагалища и получить мазки для цитологического, бактериологического и вирусологического исследований. Рекомендуется провести УЗИ и/или рентгенологическое исследование. По результатам анамнеза и физикального исследования принимается решение о необходимости анализов крови и мочи животного. Определение концентрации прогестерона в сыворотке крови позволяет установить функциональную недостаточность яичников во время беременности. Низкая концентрация (ниже 2 нг/мл) этого гормона указывает на недостаточную активность желтых тел, которая может быть первичной или вызванной другими заболеваниями.
Если известно, что у суки произошел аборт, целесообразно проверить ее на наличие антител к бруцеллам. Полезную информацию может дать па-томорфологическое исследование плодов. Проводят бактериологическое и вирусологическое исследование плодов и последов, но при интерпретации результатов этих анализов следует учитывать возможность загрязнения патологического материала из внешних источников. Ветеринару всегда надо помнить, что существует множество факторов, способных вызвать аборт или резорбцию плодов, которые невозможно выявить описанными выше методами диагностики.
При проведении кесарева сечения детально обследуют матку и брюшную полость суки. Независимо от количества овулировавших яйцеклеток, а также того, из какого яичника они высвободились, бластоциты равномерно распределяются в обоих рогах матки. Если при обследовании в рогах матки установлено сильно различающееся количество плодов (например, в одном - один, а в другом - четыре), то это служит веским основанием для предположения относительно имевших место аборта или резорбции части плодов за время беременности. В таких случаях возникает необходимость в проведении биопсии матки. Биопсированный материал подвергают патоморфологическому, бактериологическому и вирусологическому исследованиям с целью выявления местных или генерализованных поражений матки и установления их причин.
Лечение
Предотвращение аборта/резорбции плодов. Возможности терапии при предполагаемой угрозе аборта очень ограничены и носят в лучшем случае «поверхностный» характер. Например, рекомендуется значительно сократить переносимые животным физические нагрузки, в случае явной или подозреваемой инфекции применять антибиотики, провести диагностические исследования, в том числе определить концентрацию прогестерона в плазме крови.
906 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Рис. 21-2. Рентгенограммы брюшной полости суки с мертвыми плодами в латеральной (А) и вентродорсаль-ной (Б) проекциях. Обратите внимание на аномально вытянутую шею плода (показано стрелкой на рентгенограмме А) и скопившийся газ, четко видный в вентродорсальной проекции (стрелка на рентгенограмме Б).
Ее снижение ниже уровня 2 нг/мл в период с 15 по 50-й дни беременности дает основания предпола-1ать наличие у собаки гиполютеоидизма (см. выше обсуждение данного вопроса). Однако прибегать к лечению препаратами прогестерона следует с большой осторожностью, даже если его концентрация в плазме крови беременной суки ниже 1 нг/мл.
Сука, у которой произошел аборт. После аборта суку, имевшую клинические признаки системного заболевания, необходимо обследовать с тем, чтобы исключить наличие у нее пиометры, задержания последа, а также сохранения в матке продолжающих расти или мумифицированных плодов. Иногда для этого достаточно одного лишь прощупывания матки через брюшную стенку. Характер выделений из влагалища облегчает постановку диагноза при ряде заболеваний матки. При ее инфекциях очень редко удается вылечить сук с помощью одних только антибиотиков. Если владелец собаки планирует в будущем использовать ее в племенных целях, антимикробную терапию следует сочетать с применением простагландинов (см. описание лечения пиометры в гл. 23). В тех же случаях, когда вязки больной собаки в будущем не предусмотрены, целесообразнее прибегнуть к овариогистерэктомии.
Уход за абортировавшей, но остающейся клинически здоровой сукой значительно легче. У нее следует определить титр антител к бруцеллам. Если аборт произошел у нее в первый раз, это не должно служить противопоказанием для проведения вязки
в последующую течку. Абортировавших несколько раз, но остающихся серонегативными к бруцеллам сук следует при наступлении очередной течки вязать с новыми кобелями. Если такая вяжа приведет к беременности, но угроза аборта повторится, проводят серийные определения концентрации прогестероне! в плазме крови суки во время беременности, что может помочь установить причину рецидивирующих абортов. При каждом случае аборта необходимо постараться в кратчайшие сроки доставить плод или несколько плодов в лабораторию для проведения патоморфологичсского, бактериологического и вирусологического исследовании.
Сука с мертвыми плодами в матке. Иногда при проведении рентгенологического исследования в матке обнаруживают погибшие плоды (см. рис. 21-2). Этот диагноз подтверждают результатами УЗИ или хирургическим путем. В таких случаях мертвые плоды удаляют посредством утсротомии или овариогистерэктомии. Если у суки имеется пиомст-ра открытого типа, а плоды подверглись аутолизу и в матке нет остатков скелетов, то можно попытаться избавиться от оставшихся плодов с помощью инъекций простагландина. Наличие мертвых плодов не только индуцирует развитие воспалительного процесса в матке, но может стать причиной других сопутствующих заболеваний. Например, сообщалось о случае тяжелой гиперкальциемии, вызванной мертвым плодом, оставшимся в родовых путях страдавшей эндометритом суки (Hirt cl al, 2000).
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 907
Рис. 21-3. Латеральная (А) и вентродорсальная (Б) рентгенография брюшной полости суки, вынашивающей один плод. Обратите внимание на соотношение размеров черепа плода (указан стрелкой) и ширины таза, видимые при вентро-дорсальной рентгенографии, которые могут стать причиной дистоции. Сгепень релаксации связок предугадать сложно. При родах имелись некоторые сложности, но они прош тм без родовспоможения.
ДИСТОЦИЯ
Определение.
Под дистоцией подразумевают затрудненные роды или невозможность прохождения созревших плодов по родовому пути. Хотя и нс часто, но дистоция встречается у собак, что делает необходимым приобретение ветеринарными врачами определенного опыта в ее распознавании и устранении. Однако последнее удается далеко не всегда. Основные причины дистоции перечислены в табл. 21-2 (Linde-Forseberg, Eneroth, 1998).
Таблица 21-2. ПРИЧИНЫ ДИСТОЦИИ У СУК И КОШЕК
Причина Частота (%)
Ci ки * Кошки
Связанные с матерью: 75,3 67,1
Первичная агония матки 48,9 36,8
Первичная гипотония матки 23,1 22,6
Узость ротовых путей 1.1 5,2
1 [ерекрут матки 1,1 -
Выпадение матки - 0.6
Стр нгуляция матки - 06
Гидроаллантоис 0,5 -
Образование влагалищных перемычек 0,5 -
Связанные с плодом: 24,7 29,7
Неправильное прилежание 15,4 15,5
Нарушения развития (уродства) 1,6 7,7
Чрезмерно большой размер плода 6.6 1,9
Гибель плота 1,1 1.1
Из: Linde-Forsberg, Lncroth, 1998.
Практическое описание
Матка. Одной из причин дистопии является слабость сокращений матки. Недостаточное давление, создаваемое стенками матки на плоды во время родов, делает невозможным их продвижение по родовым путям. Этот тип дистоции лучше других поддается медикаментозному лечению.
Таз. Частой причиной дистоции служит узость тазовой полости. Она может носить наследственный характер или приобретаться в процессе жизни суки, например, после перелома таза и неправильного сращения его обломков. Наиболее часто врожденную дистоцию регистрируют у пород собак, имеющих крупную голову и узкий таз (бульдогов, бостон- терьеров и др.). Обычно для ее устранения требуется хирургическое вмешательство.
Плод. Иногда нормальному течению родов препятствует слишком большой размер плода, превышающим просвет родового пути. Обычно такое случается при развитии в матке всего одного плода (рис. 21 -3). При его нормальном положении в родовых путях роды обычно проходят без осложнений (рис. 21-4, А, Б). В противном случае создается ситуация относительного несоответствия величины плода ширине тазовой полости, что мешает родам. Примерами неправильного положения пло ta являются головное предлежание с подгибанием передних конечностей, что приводит к значительному увеличению ширины плечей (рис. 21-4, В), тазовое
908 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Рис. 21-4. Предлежания, положения и позиции плодов. А. Нормальное головное предлежание. Б. Нормальное тазовое предлежание. В. Передние конечности согнуты под телом. Г. Задние конечности подогнуты под тело (тазовое предлежание). Д. Скручивание шеи вбок; Е. Скручивание шеи вниз. Ж. Поперечное положение. Из: Johnston SD, Root Kustritz MV, Olson PNS. Canine and feline theriogenology. Philadelphia, WB Saunders Co, 2001, p 111.
предлежание co сгибанием задних конечностей (рис. 21-4, Г), боковое предлежание со сгибанием одной передней конечности (рис. 21-4, Д), заворот головы вбок или вниз (рис. 21-4, Д, Е), поперечное положение (рис. 21-4, G) (Johnston et al, 2001). При таких неправильных положениях плода в родовых путях обычно возникает необходимость в хирургическом вмешательстве. Слишком крупные размеры плода, как правило, не являются следствием вязки крупного кобеля с мелкой сукой. Обычно именно сука «диктует» размер новорожденных щенков, в то время, как размеры потомства во взрослом возрасте определяют оба родителя.
Влагалище. Обследование сук при дистоции иногда выявляет плоды, застрявшие в своде влагалища. Такое может произойти в случае чрезмерно большой величины плода, узости таза, а также сужения просвета влагалища (см. гл. 25 и рис.21-5), вызванного рубцовыми стягиваниями, сращениями стенок или развитием соединительно-тканных перемычек (Johnston et al, 2001). Сужение просвета влагалища затрудняет прохождение по нему плода и делает необходимым проведение родовспоможения, в том числе применение хирургических приемов. Стриктуры во влагалище также препятствуют естественной вязке. Однако они не мешают
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 909
Рис. 21-5. Схематическое изображение влагалищной соединительнотканной перемычки (девственной плевы), ставшей причиной дистоции. Из: Johnston SD, Root Kustritz MV, Olson PNS. Canine and feline theriogenology. Philadelphia, WB Saunders Co, 2001, p 114.
искусственному осеменению и могут остаться незамеченными.
Классическое описание
Первичная гипотония матки. Слабость маточных сокращений, вызванная атонией мускулатуры матки, замедляет или делает невозможными роды даже в тех случаях, когда этому не мешают анатомическое строение родовых путей суки, количество плодов и их величина. Утрата маткой мышечного тонуса может быть полной (атония) и частичной (гипотония). В первом случае из-за отсутствия маточных сокращений роды вообще не происходят. При гипотонии матки рождается только часть щенков, а затем родовые схватки прекращаются, что делает невозможным прохождение родовых путей остальными плодами (Jones, Joshua, 1982).
Первичные атония и гипотония матки часто имеют врожденный характер и к ним особенно предрасположены различные породы терьеров. Слабости маточных сокращений способствует чрезмерное растяжение матки из-за слишком большого количества плодов, недостаточная стимуляция функциональной активности матки при вынашивании одного или двух плодов, перенесение ряда системных (гипокальциемии и инфекционных) и местных (выворот и травмы матки)
заболеваний, а также недостаточное кормление (Johnston et al, 2001).
Вторичная гипотония матки (закупорка матки плодом). При вторичной гипотонии матки происходят нормальные родовые схватки, но в силу невозможности дальнейшего продвижения одного из плодов по родовым путям сокращения матки не обеспечивают нормального течения родов. Это может происходить при слишком большой по сравнению с просветом родовых путей величине плода. Чаще всего такое случается при вынашивании маленькой сукой всего одного плода (Bennett, 1980). Но бывает и так, что плоды перерастают при чрезмерно длительной беременности. Возможен и другой вариант: величина плодов нормальна, но просвет родовых путей слишком узок для обеспечения их свободного прохождения при родах. Как отмечалось выше, узость тазовой полости суки может быть обусловлена предшествовавшими беременности переломами крестцовой, подвздошной или лонной костей, а также другими приобретенными нарушениями анатомического строения таза. Некоторые породы собак, имеющие узкий таз и крупную голову, генетически предрасположены к затрудненным родам. Кроме того, сужения просвета влагалища, наличие в нем новообразований, а также недостаточное раскрытие шейки матки могут стать причинами вторичной гипотонии матки. Неправильное положение плода в родовых путях - не менее значимая причина дистоции. Одним из иллюстрирующих это примеров служит такое положение плода, когда его голова и задние конечности находятся в разных рогах матки, что обусловливает поперечное положение тела плода в матке. Иногда голова плода заворачивается в сторону хвоста, вызывая проникновение одного из его плеч в тело матки. Продвижение плода в таком положении при родах затруднено, т.к. его поперечный диаметр становится больше просвета родовых путей при их максимально возможном расширении (см. предыдущее обсуждение и рис. 21-4). Погибшие плоды также часто занимают неправильное положение. Тазовое предлежание в данном случае в расчет не берется, поскольку оно не осложняет течение родов и встречается приблизительно у 40% плодов.
Другие причины. Нервозность и испуг могут становиться причинами отсутствия или прекращения у сук маточных сокращений (Shille, 1983). Для предотвращения этого готовящуюся к родам суку следует поместить в спокойное и знакомое ей место. Ветеринарная клиника является наименее подходящим местом для родов нервозных сук. Некоторые типы грыж (например, паховая) могут стать ловушкой для плода или даже всего рога матки. Сообщалось о прекращении родов у сук, вызванном выворотом матки. Иногда затруднения родов возникают вследствие ожирения суки (Donovan, 1980).
910 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Частота дистоции у разных пород собак
Брахицефалические породы. У таких пород собак (бульдог, мопс, бостон-терьер, силихем-терь-ер, скотч- терьер и другие) крупная голова с укороченной мордой и широкие плечи сочетаются с узким или небольшим тазом. Поэтому суки этих пород весьма предрасположены к вторичной гипотонии матки (Shile, 1983).
Карликовые и маленькие породы. Суки карликовых и мелких пород не только чаще вынашивают небольшое количество (1-2) плодов, но они в большей степени нервозны и пугливы. Психологическое состояние беременной суки отражается на течении родов, может привести к прерыванию родов и первичной гипотонии матки. Кроме того, единственный плод может оказаться слишком крупным и неспособным нормально пройти через родовые пути.
Крупные породы. У крупных пород собак частота дистоции наиболее низкая. Тем не менее, в отдельных случаях суки этих пород вынашивают чрезмерно большое количество плодов. В такой ситуации на фоне значительного растяжения матки может возникнуть вторичная гипотония
Диагностика (рис. 21-6)
Анамнез. Определение. Диагностика дистоции обычно основывается на наблюдениях владельца рожающей собаки. У заводчика должны возникнуть подозрения на затрудненное течение родов и необходимость обращения за помощью к ветеринарному специалисту в случаях, когда: (1) после 20-30 минут сильных схваток не произошло рождения щенка; (2) после появления на свет одного или части остававшихся в матке щенков проходит 4-6 часов, а новые щенки не рождаются; (3) не рождается ни одного щенка в течение 24-36 часов после снижения ректальной температуры суки ниже 37,8°С; (4) сука во время родов стонет и вылизывает (либо кусает) область наружных половых органов; (5) после 8-12-часовой первой стадии родов не начинается вторая их стадия; (6) беременность суки имеет чрезмерно большую продолжительность - свыше 70-72 дней после первой вязки или 60 дней с первого дня диэструса (Schweizer, Meyers-Wallen, 1999).
Общие положения. При диагностике дистоции сведения о возрасте собаки, ее репродуктивных качествах (по данным предыдущих вязок) и перенесенных в прошлом заболеваниях могут иметь большее значение, чем ее породная принадлежность. Возрастной фактор важен, поскольку двухлетние суки в меньшей степени предрасположены к первичной гипотонии матки, чем собаки в возрасте 6-7 лет. Заболевания сердца могут обостряться при усиленной работе мышц во время родов.
Анализ дат проведения вязок. При подозрении на дистоцию важное значение имеет подробный анамнез. Желательно знать, были ли затруднения у
суки во время предыдущих родов и не проводилось ли кесарево сечение. Если известны даты вязок или первого дня стадии диэструса, можно рассчитать приблизительное время начала родов. Обычно считают, что среднестатистическая сука рожает на 63-64 день после первой вязки. Поэтому многие неопытные заводчики начинают волноваться за исход беременности своих собак, когда роды не начинаются в указанный срок. Однако следует иметь в виду, что в норме роды могут начаться с 56-го по 72-й день плодоношения.
Цитологическое исследование влагалищных мазков и/или количество вынашиваемых плодов. Ежедневное цитологическое исследование влагалищных мазков позволяет точно установить первый день диэструса и в последующем контролировать продолжительность беременности. В норме она составляет 56-58 дней с начала диэструса. Сопоставляя результаты цитологического анализа влагалищных мазков или даты проведенных вязок с количеством вынашиваемых сукой плодов, устанавливают предполагаемое время наступления родов. При большом количестве плодов сроки их вынашивания сокращаются в среднем до 56 дней после начала диэструса, при небольшом количестве плодов они, напротив, увеличиваются приблизительно на 2 дня. Например, если владелец суки, вынашивающей два плода и имеющей массу тела в 20 кг, начинает волноваться из-за отсутствия начала родов на 64 день после вязки, ему следует объяснить, что период плодоношения в норме может продолжаться 65-70 дней. Вот почему не редкость, когда у суки подозревают первичную гипотонию матки, в то время как она просто находится на первой стадии родов.
Однократное определение концентрации прогестерона в сыворотке крови. Однократное определение концентрации прогестерона в сыворотке крови суки во время течки может помочь установить дату родов. Продолжительность беременности, считая от дня определения концентрации прогестерона во время диэструса, составит 65 дней при уровне прогестерона 1,0-1.9 нг/мл, 64 дня при концентрации 2,0-3,9 нг/мл и 62,4 дня при концентрации 4,0-10,0 нг/мл (Johnston et al, 2001). Следует, однако, иметь в виду, что получаемые этим методом данные носят ориентировочный характер и значительно менее точны, чем в случае определения сроков родов по результатам установления первого дня диэструса с помощью цитологического исследования влагалищных мазков (как обсуждалось выше)
Наблюдения владельца: ректальная температура. У большинства сук ректальная температура начинает снижаться за 12-24 часа (иногда за 48 часов) до начала второй стадии родов. Температура обычно снижается на 1-3°, падая ниже 37,8 °C, что связано с резким и окончательным снижением концентрации прогестерона в крови до базального уровня.
Роды. Заводчику необходимо отметить время начала у беременной суки первой (определяется
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
911
Прошло больше 70-72 дн после первой вязки
Прошло больше 68-70 дн после завершающей вязки
Прошло больше 58 дн с начала стадии диэструса
Рис. 21- 6. Схема диагностики и устранения дистоции.
912 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Рис. 21-7. А. Аппаратура для контроля родов, включающая датчик, магнитофон, модем и ручной аппарат Допплера. Ее можно использовать для крупных (Ь) и мелких собак (В), а также кошек. Фото доктора Davidson АР, публикуется с его разрешения.
по беспокойному поведению животного) и второй (по первым родовым схваткам) стадий родов. Первая стадия обычно продолжается от 3 до 24 часов, и только после этого начинаются родовые схватки. Поэтому в первые сутки владелец собаки не должен испытывать особого беспокойства, если у нес еще не начались схватки. Однако непоявление на свет новорожденного щенка через 20-30 минут после начала родовых схваток должно его насторожить. Он должен фиксировать частоту и интенсивность сокращений брюшной мускулатуры собаки, продолжительность времени между рождением щенков, количество последних и их состояние. Предоставление такой информации ветеринару облегчит диагностику дистоции и даст представление о том, насколько тщательно заводчик следил за родами.
Интересны времени между рождением щенков. Рождение щенков в норме происходит с интервалом в 30-60 минут. Иногда между появлением на свет двух щенков проходит всего несколько минут. В то же время, родив одного или несколько щенков, сука может периодически отдыхать на протяжении 4-6 часов. Во время отдыха родовых схваток у нее нс происходи! (Schweizer, Meyers-Wallen, 1999). Для того чтобы правильно оценить, нормально ли проходят роды, ветеринарному врачу необходимо иметь информацию о состоянии здоровья суки и о том, предпринимались ли ее владельцем какие-
либо попытки родовспоможения (в том числе и с помощью медикаментозных средств).
Размер кобеля. Данные о размерах кобеля, с которым вязали суку, не облегчают диагностику дистоции. Дело в том, что проведение вязки суки с более крупным по величине и массе тела кобелем не ведет к повышению инцидентности затрудненных родов. Величина плодов зависит только от суки и особенностей ее матки. Величина кобеля сказывается на величине его потомков лишь после достижения ими взрослого состояния.
Контроль состояния матки и плодов. Стандартный подход к определению времени наступления родов, основанный на дате проведения вязки, субъективных наблюдениях за поведением беременной суки, измерении ее ректальной температуры и анализе ветеринарным врачом течения беременности по информации, сообщаемой ему владельцем животного в телефонных беседах, по меньшей мере, далек от идеала. При непосредственном обследовании суки удается наладить контроль состояния ее матки и находящихся в ней плодов, а это, в свою очередь, позволяет своевременно установить начало родов и оказать в случае возникновения затруднений родовспоможение. В настоящее время доступна специальная аппаратура, предназначенная для определения наступления у сук родов и контроля их течения (Davidson, 2000; Barber, Coley, 2000; Davidson, 2001). На коммерческой основе организо
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 913
ваны службы. предназначенные для обучения акушерским приемам.
Применение автоматизированного контроля родов рекомендуется в тех случаях, когда: (1) у заводчика не имеется достаточного опыта в приеме ро дов у собак; (2) у суки в прошлом возникали затруднения во время родов; (3) сука старше 6 лет (такое случается редко, поскольку собак обычно вяжут в более молодом возрасте); (4) плодов слишком много или, наоборот, слишком мало. После 45 дня беременности следует определить размеры и количество плодов с помощью рентгенологического исследования. Ветеринарами специалист должен обучить владельца суки, как пользоваться оборудованием для мониторинга (рис. 21-7), задолго до наступления родов. Шерстный покров у животного на боках (на уровне нахождения в брюшной полости матки с плодами) слегка выстригают, а кожу обрабатывают акустическим гелем, чтобы обеспечить наиболее тесный контакт датчика с зелом животного.
Матка на завершающей стадии шснности и во время родов проявляет характерную активность, которую можно оценить по силе и частоте сокращений ее мышц. Автоматический мониторинг состояния матки рекомендуется начинать за I неделю до предполагаемого начала родов и проводить два раза в день. После того, как у животного начнется первая стадия родов, переходят на режим контроля, рекомендуемый ветеринарным врачом. При возникновении во время родов проблем следует обратиться за помощью к врачу. Система автоматического контроля состояния мазки сук состоит из датчика (чувствительного токодинамометра). дисплея, магнитофона и модема. Датчик улавливает изменения давления в матке и амнионе плодов. Его прикрепляют в каудо-латеральнои области брюшной стенки животного при помощи эластичного ремня. Магнитофон, вмонтированный в небольшой корпус, помещают у суки за плечами (рис. 21-8). Во время проведения автоматического контроля состояния матки собака должна находиться в предназначенном для родов ящике. Оценку сердечной деятельности плодов осуществляют с помощью ручного прибора Допплера, предварительно положив суку на бок. Датчик прибора направляют в перпендикулярном положению плодов направлении, что позволяет достичь характерной амплификации звуков, отличных от звуков сокращений сердца матери. Каждый раз записанную на магнитофон информацию передают через модем по телефону ветеринарному врачу. После ее расшифровки врач связывается с владельцем суки.
При установлении гипотонии матки для ее устранения наиболее часто пользуются препаратами кальция (чаще всего кальция глюконатом) и окситоцином. которые повышают силу и частоту сокращений лиометрия, соответственно. Препараты кальция применяют в случае слабых сокращений мазки, не приводящих к рождению щенков. Прибегать к инъекциям окситоцина можно только тогда,
Рис. 21-8. Монитор для контроля матки, помешенный на слегка выстриженную каудо-латеральную область живота, и магнитофон, расположенный на безволосой части над лопаткой. Фото доктора AP. Davidson публикуется с его ра 'решения.
корча частота сокращений матки ниже ожидаемой и сердечная деятельность плодов нормальна. При применении этих лекарственных препаратов следует соблюдать осторожность, чтобы не вызвать чрезмерной стимуляция матки — при отсутствии гипо-гонии это приводит к нарушению кровоснабжения плаценты; при застревании плодов в родовых путях дальнейшее применение окситоцина и кальция бесполезно. Об испытываемом плодами дистрессе можно судить по снижению частоты их сердечных сокращений. Следует иметь в виду, что при движениях плодов происходит кратковременное усиление их сердечной деятельности. Если установлено что плоды находятся в состоянии стресса, а попытки медикаментозного ускорения родов не дают ожидаемого результата, прибегают к кесареву сечению.
Физикальное исследование. Желательно до начала обследования репродуктивного тракта суки, у которой предполагается или установлена дистоция, провести ее полное физикальное исследование. Однако, в первую очередь, следует осмотреть и про-пальпировать влагалище животного с тем, чтобы убедиться в отсутствии в нем плода. Если плода нет, то проводят быстрое, но тщательное физикальное исследование суки акцентируя внимание на наличии у нее клинических нарушений (например, лихорадки, обезвоживания организма, сердечной недостаточности), которые могут повлиять на течение родов. Нередко сопутствующие заболевания имеют при родах большее значение, чем сама дистоция. Более того, своевременное устранение гипогликемии и гипокальциемии нередко ведет к исчезновению дистоции. Если поведение суки нервозно или она дрожит ветеринарному врачу необходимо определить, чек это вызвано - беспокойством, болью или гипокальциемией.
Обследование репродуктивного тракта суки должно включать тщательную пальпацию брюшной полости и полости влагалища. При отсутствии застрявших в матке или влагалище плодов суке дают возможность продолжить роды или предпола-
914 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
гают наличие у нее ложной щенности. При обнаружении плода во влагалище немедленно определяют его положение и жизнеспособность. Одновременно следует осмотреть влагалище на предмет наличия в нем рубцовых стяжек, стриктур, соединительнотканных перемычек и других нарушений нормального анатомического строения, которые могли стать препятствием для прохождения плода.
Обнаружение значительного количества крови во влагалище должно настораживать. Кровь нередко появляется в половых органах суки и во время нормально протекающих родов, но причиной кровотечения может стать также отделение участков матки, к которым прикреплялась плацента - такую патологию лучше всего лечить хирургическим путем. Не следует забывать и о других причинах, которые могут вызвать кровотечение в репродуктивном тракте рожающей суки (нарушениях свертывания крови, травмах выстилки влагалища и т.д.).
Рентгенологическое исследование и УЗИ. При подозрении на дистоцию наиболее ценную информацию могут дать рентгенологическое исследование и УЗИ брюшной полости. Рентген позволяет диагностировать беременность, а также очень точно определить, где и в каком положении находятся плоды, прохождение которых по родовым путям затруднено. УЗИ служит лучшим способом оценки жизнеспособности плодов. Эти исследования следует проводить после тщательного физикального исследования суки и анализа анамнестических данных.
Основной целью рентгенологического исследования является установление наличия или отсутствия беременности. Невозможность обнаружения плодов у суки свидетельствует о том, что роды уже закончились или что у животного ложная щенность. Если рентген подтверждает беременность, то перед ветеринаром встает вопрос - сколько плодов и живы ли они? С помощью аускультации можно прослушать сокращения сердец плодов и сделать вывод об их жизнеспособности, но это удается далеко не во всех случаях. Более надежным методом определения наличия и частоты пульса у плодов служит УЗИ. Нормальной частотой пульса у плодов считают 150-200 ударов/мин. Пульс ниже 150, а тем более 100 ударов/мин должен вызвать беспокойство. В таких случаях выжидают несколько минут и вновь определяют пульс - если его частота не повысится до нормального уровня, то это означает, что плоды находятся в состоянии дистресса (Schweizer, Meyers-Wallen, 1999). Если принято решение о применении лекарственных препаратов для коррекции возникшей проблемы, УЗИ повторяют каждый час.
Заключение о гибели плодов ветеринарный врач делает по следующим признакам, выявляемым при рентгенологическом исследовании: (1) разрушение позвоночника плодов; (2) скопление в плодах газа; (3) расхождение костей черепа или перекрывание их друг друга; (4) неправильное положение плода (см. рис.21-2). Рентгенологическое исследование
дает возможность определить присутствие единственного крупного плода, который не может выйти естественным путем, или нескольких нормальных плодов, не появившихся на свет из-за гипотонии матки или потому, что роды еще не начались. Наконец, оно позволяет исследовать структуру тазовой области собаки и, возможно, установить причину затруднения продвижения плодов по родовому пути (Rendando, 1983).
Анализы крови и/или мочи. При дистоции в распоряжении ветеринарного врача редко бывает достаточно времени для проведения лабораторных анализов. Между тем, в ветеринарных клиниках с помощью диагностических тест-полосок и простого центрифугирования (определение клеточной массы) быстро и без особого труда удается определить гематокрит, концентрацию глюкозы и азота мочевины в крови и провести общий анализ мочи. Концентрация кальция в сыворотке крови является одним из основных показателей, по которым можно судить о предрасположенности суки к дистоции, но в большинстве ветеринарных клиник не удается ее определить в достаточно короткие сроки.
Диагностические критерии
В таблице 21-3 приведены различные диагностические критерии, по которым можно судить о наличии у суки дистоции. Установление любого из этих признаков служит поводом для осуществления родовспоможения с применением мануальных, медикаментозных или хирургических методов.
Лечение
Мануальные методы родовспоможения (рис. 21-9). Пальпация шейки матки у суки невозможна (см. гл. 19). Поэтому нельзя пальцами расширить шейку или определить, не стало ли ее сужение причиной задержки выхода плода. Такая проблема встречается у сук, хотя и редко. Мануально можно только облегчить выход щенка из влагалища. В большинстве случаев пальцы человека служат наиболее безопасными и надежными «инструментами» родовспоможения. Для некоторых сук при дистоции, проявляющейся затруднениями выхода щенка из влагалища, смазка и осторожное вытягивание руками плода решают все проблемы. Часто, если рождаемый щенок очень слаб, бывает сложно определить, жив он или погиб. Использование марлевых тампонов облегчает удерживание новорожденного щенка. Во время родов желательно, чтобы сука оставалась в стоячем положении (Shille, 1983).
Просвет влагалища у большей части сук недостаточно велик, чтобы в нем можно было свободно манипулировать пальцами во время родов. Поэтому приходится прибегать к инструментам и смазке. Акушерские крючки, губчатые и плацентарные щипцы - инструменты, которые в наименьшей степени наносят травмы родовым путям суки и
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
915
Таблица 21-3. КРИТЕРИИ ДИАГНОСТИКИ ДИСТОЦИИ
Затянувшаяся беременность:
свыше 70-72 дней со дня первой вязки;
свыше 60 дней с первого дня стадии диэструса.
Плод, застрявший в тазовой области:
породная предрасположенность к дистоции;
новообразование или ранее имевший место перелом таза.
Сильные родовые схватки в течение более 45-60 мин, при отсутствии выхода щенков из родовых путей.
Слабые и нечастые родовые схватки, продолжающиеся более 4-6 ч при отсутствии выхода щенков из родовых путей.
Отсутствие начала родов в течение 24-36 ч после снижение ректальной температуры суки ниже 37,2° С.
Сильная болевая реакция у суки при отсутствии выхода щенков из родовых путей.
Выявление с помощью рентгенологического исследования проблем, связанных с плодами: неправильное положение плода в родовых путях;
скопление в плодах газа, что указывает на их гибель; чрезмерно большая величина плода/плодов (чаще при наличии в матке только одного плода);
гибель плодов.
Дистоция, ранее имевшая место у суки.
Наличие признаков заболевания или слабости у суки.
рождающимся щенкам. Бывает так, что простого поворачивания застрявшего в родовых путях щенка достаточно для его дальнейшего продвижения. Чтобы правильно направлять используемый акушерский инструмент, один палец руки все время должен находиться в просвете влагалища. Родовспоможение будет успешнее и безопаснее для суки и щенков, если последних тянуть бережно и не за дистальные части конечностей и других органов. Пальпация брюшной стенки и прямой кишки щенков облегчает наложение инструментов в нужные места. Рот животного идентифицируют по сосательным движениям, воспринимаемым введенным в него пальцем, а также по обнаружению краев твердого неба.
Щенка следует вытягивать в заднем и вентральном направлениях в соответствии с формой свода влагалища. Помогает осторожное раскачивание щенка из стороны в сторону. Хотя соблюдать стерильность рекомендуется на всех этапах родовспоможения, на практике это почти никогда не удается.
Следует избегать травматизации стенок влагалища, хотя это очень трудно. Поэтому после каждого приема родовспоможения необходимо тщательно осматривать влагалище (визуально или с помощью вагиноскопа, если есть такая возможность) для выявления нанесенных ему травм. В последующем перед подготовкой суки к вязке повторно обследуют ее влагалище, чтобы убедиться в отсутствии спаек и других анатомических изменений, которые могут стать причиной дистоции. Принятие решения о проведении мануального родовспоможения должно быть тщательно взвешенным, т.к. существует более простая альтернатива - кесарево сечение.
При проведении любых манипуляций по родовспоможению всегда следует придерживаться
следующих принципов. Во-первых, здоровье суки обычно имеет приоритетное значение. Во-вторых, проводимый прием родовспоможения должен быстро давать положительный результат. Если он не позволяет извлечь щенка из родовых путей в течение 5-10 мин, следует серьезно подумать о проведении кесарева сечения.
Медикаментозное лечение. Гипотония матки. Общие принципы. При своевременной диагностике атонии или гипотонии матки медикаментозное лечение обычно бывает успешным. Оно основано на применении фармакологических препаратов, стимулирующих сокращения матки. Поэтому перед применением соответствующих лекарственных средств следует убедиться в проходимости родовых путей. При наличии анатомических нарушений повышение интенсивности сокращений матки может стать причиной ее разрыва и гибели плодов (вследствие несвоевременного отделения плаценты, приводящего к гипоксии или аноксии плодов).
Окситоцин. Окситоцин применяется для стимуляции сокращений матки. При вызванной гипотонией матки дистоции его первоначально вводят суке внутримышечно в дозе 5-20 ЕД. Мы рекомендуем вводить 2-20 ЕД/кг (см. рис. 21-6). Рожающая сука должна находиться в тихом и теплом месте под наблюдением ветеринарного специалиста. При отсутствии усиления сокращений матки в течение 30-40 мин после первого введения окситоцина его вводят повторно. Перед повторной инъекцией окситоцина животному медленно внутривенно вводят 2-10 мл 10% раствора кальция глюконата. В случае возникновения сердечной аритмии скорость вливания раствора кальция глюконата снижают или его вообще перестают вводить. Если в течение 30 минут после повторной инъекции окситоцина не происходит рождения щенка или, по меньшей мере, не усиливаются сокращения матки, то его вводят в третий раз. Одновременно суке медленно внутривенно вливают 5-10 мл 50% раствора декстрозы (см. рис. 21-6).
Если 3-кратное введение окситоцина не привело к рождению хотя бы одного щенка, то рекомендуется проведение кесарева сечения. В случае рождения щенка на фоне инъекций окситоцина имеет смысл подождать 30-60 минут. Наблюдения за сукой в этот период позволяет определить целесообразность дополнительного введения окситоцина. При необходимости его можно многократно вводить с интервалом в один час.
Окситоцин широко применяется для ускорения родов у женщин. Роженицам медленно вливают внутривенно 5% раствор декстрозы, содержащий 10 ЕД окситоцина в 1 литре раствора. Постепенно скорость введения раствора повышают до тех пор, пока у женщины не наступают маточные сокращения. При слишком быстром введении окситоцина или его передозировке (независимо от того, как его вводили - внутримышечно или внутривенно), возникают бурные схватки (tetania uteri). Такие сокра-
916
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Рис. 21-9. А. Определение положения плода, голова которого показалась во влагалище. Сука при проведении данной процедуры должна стоять. Обозначения: 1 - правое крыло подвздошной кости, 2 - прямая кишка, 3 - просвет преддверия влагалища, 4 - правая половина лонного сращения, 5 - правое крыло седалищной кости; 6 - правое бедро. Б. Головное предлежание плода. Указательным и средним пальцами голове плода придают нужное для дальнейшего продвижения направление, одновременно ее вытягивают с приложением средней по величине силы. В. Вытягивание плода рукой при его тазовом предлежании. Для достижения максимальной эффективности такого приема пальцы руки следует поместить проксимальнее скакательных суставов извлекаемого плода. Из: Shille VM. Diagnosis and management of dystocia in the bitch and queen. In Bojrab MJ (ed): Current Techniques in Small Animal Surgery. Philadelphia, Lea & Febiger, 1983, p 338.
щения матки не ускоряют роды, а повышают риск нарушения кровоснабжения плаценты и разрыв стенки матки.
Мы накопили достаточный опыт внутримышечного и внутривенного введения окситоцина при дистоции сук. Нам кажется, что внутривенный метод более эффективен. С помощью капельницы для внутривенных вливаний детям ветеринарный врач может медленно вводить раствор окситоцина, повышая скорость вливания каждые 15 мин до тех пор, пока у животного не начнутся сокращения матки. В течение всего периода применения окситоцина не
обходимо тщательное клиническое наблюдение за беременной сукой.
Бурные схватки сук диагностировать не так просто. Они представляют собой плохо скоординированные, повторяющиеся сокращения миометрия, которые продолжаются несколько минут или дольше. Их можно принять за дистоцию, вызванную застреванием плода в родовых путях и проявляющуюся сильными схватками без рождения щенков. При возникновении бурных схваток введение окситоцина останавливают до тех пор, пока схватки полностью не прекратятся. Только после этого препарат снова
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 917
начинают вводить, снизив его дозу по меньшей мере в 2 раза, с тем, чтобы достичь координированных сокращений миометрия.
Возбужденная или нервозная сука. Чрезмерное перевозбуждение, нервозность суки (а порой и ее владельца) и испытываемое животным чувство страха могут существенно влиять на течение родов. Если владельцы суки не в состоянии справиться со своими эмоциями, для них будет лучше поручить прием родов квалифицированному специалисту. Иногда целесообразно снять нервное напряжение собаки, дав ей легкое успокоительное средство, чтобы она расслабилась. Весьма эффективным бывает использование ацепромазина в профилактической дозе. В ряде случаев этого вполне достаточно для нормального течения родов без прибегания к другим лекарственным препаратам и мануальному родовспоможению.
Кесарево сечение. Общие сведения. Кесарево сечение является относительно безопасным, простым и эффективным методом извлечения щенков из матки суки. К нему прибегают, когда другие способы родовспоможения оказались неэффективными (табл. 21-4). Современные способы проведения этой операции на суках и необходимой для этого анестезии описаны в многочисленных публикациях (Probst, Webb, 1983; Gaudet, Kitchell, 1985; Funkquist et al, 1997). Можно с уверенностью утверждать, что в США и Канаде уровень смертности сук и щенков при кесаревом сечении низок. Для наркоза лучше всего использовать один изофлуран или же пропофол для индукции анестезии и изофлуран для ее поддержания. Наиболее часто кесереву сечению подвергают сук следующих пород: бульдог, лабрадор-ретривер, корги и чихуахуа. В отдельных случаях кесарево сечение нередко требуется сукам лабрадора-ретривера, золотистого ретривера, бульдога, мастифа и йоркширского терьера (Moon et al, 1998). Следует отметить, что после кесарева сечения у женщин при очередной беременности чаще происходит разрыв матки (особенно если наступление родов ускоряют медикаментозными средствами), чем у сук (Lydon-Rochelle et al, 2001). Насколько часто у собак и кошек возникает необходимость в повторном осуществлении кесарева сечения, неизвестно.
Запланированное проведение кесарева сечения. Ряд пород собак особенно предрасположены к дистоции. Чтобы избежать неприятных неожиданностей и лишнего беспокойства, следует заранее точно определить предполагаемый срок наступления родов у
Таблица 21-4. ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ КЕСАРЕВА СЕЧЕНИЯ
Гипотония матки, которую невозможно устранить введением окситоцина.
Застревание плода в тазовой полости при прохождении им родовых путей.
Чрезмерно большой размер плода.
Неподдающееся устранению застревание плода во влагалище. Гибель плода(ов) в матке.
Запланированная хирургическая операция.
суки. О том, как это делается, говорилось выше (см. гл. 19). Заводчика, изъявившего желание провести своей собаке кесарево сечение, следует обучить приготовлению влагалищных мазков. Он должен их готовить, начиная с первого дня половой охоты и до окончания первой недели со дня, когда сука начнет отказываться от вязки. На каждом предметном стекле с мазком ставится дата взятия смыва из влагалища. Мазки подсушивают на воздухе. Полученную серию мазков отвозят ветеринарному специалисту для окрашивания и микроскопирования. По результатам цитологического исследования этих мазков определяется первый день стадии диэструса (см. гл. 19).
Приблизительно на 45-50 день диэструса проводят рентгенологическое исследование брюшной полости суки и подсчитывают количество находящихся в матке плодов. Наиболее вероятной датой родов у сук, вынашивающих один-два плода, является 58-59-й день диэструса. При большем количестве плодов продолжительность беременности сокращается и роды, как правило, начинаются на 55-56 день диэструса. Соответственно роды суки со средним количеством плодов в матке следует ожидать на 57-й день диэструса. Такие предполагаемые сроки родов не являются абсолютно точными, но ими удобно пользоваться как владельцам сук, так и ветеринарным врачам. Кесарево сечение следует проводить до начала родов, но только по достижении плодами стадии развития, на которой они могут остаться в живых, будучи извлеченными из утробы матери. Поэтому операцию проводят за 48 часов до ориентировочной даты родов, определенной описанным выше способом.
Незапланированное проведение кесарева сечения. Без достаточно точного определения даты родов суки (по результатам цитологического исследования влагалищных мазков и/или динамики изменения концентрации прогестерона в сыворотке крови) проведение кесарева сечения всегда сопряжено с определенным риском. Этот риск оправдан для собак, у которых каждая беременность сопровождается дистоцией. В такой ситуации при запоздалом осуществлении операции повышается вероятность гибели щенков. При отсутствии явных признаков дистоции слишком раннее проведение кесарева сечения сопряжено с извлечением из матки недостаточно развитых и еще неспособных к самостоятельному существованию щенков. Во избежание этого операцию проводят не ранее, по меньшей мере, 57-го дня после последней вязки суки. Некоторые ветеринарные врачи в качестве критерия для определения срока проведения кесарева сечения используют 63-65 дней после первой вязки, но такой подход ненадежен.
ЧРЕЗМЕРНО ЗАТЯНУВШАЯСЯ БЕРЕМЕННОСТЬ (ПЕРЕНАШИВАНИЕ)
Нельзя точно судить о продолжительности беременности сук, основываясь только на датах первой
918 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
или последней вязок. По таким расчетам можно ожидать ранних (начиная с 54-го дня после вязки) и поздних (до 72-го дня после вязки) родов. Это обусловлено как значительной вариабельностью продолжительности течки у здоровых сук, так и способностью сперматозоидов кобеля оплодотворять овулировавшие яйцеклетки на протяжении 4-11 дней после их попадания в половые органы суки. Между тем, о продолжительности беременности можно составить точное представление по результатам регулярной эндоскопии влагалища, серийных цитологических исследований влагалищных мазков и/или определения концентрации прогестерона в сыворотке крови (см. гл. 19). Затяжной характер беременности (перенашивание) начинают подозревать, если она продолжается свыше 60 дней после начала диэструса (его определяют по результатам цитологического исследования влагалищных мазков), 66 дней после предовуляторного пика ЛГ (устанавливается по результатам серийного определения концентрации ЛГ в сыворотке крови или многократной вагиноскопии) или 68 дней после первой вязки
Таким образом, при оценке продолжительности плодоношения следует учитывать, каким способом она была рассчитана. После проведения тщательного физикального исследования беременной собаки следует провести рентгенологическое исследование и/или УЗИ, что дает возможность подтвердить наличие в матке плодов и исключить ложную щен-ность. УЗИ более предпочтительно, поскольку оно позволяет также оценить жизнеспособность плодов. Рентгенологическое исследование может быть применено для ориентировочного определения возраста плодов (например, по обнаружению у них зубов, как это описано в гл. 20). Гибель плодов может сопровождаться явным увеличением продолжительности беременности. Это обусловлено тем, что развитие плодов перестает быть стресс-фактором для организма суки и не влечет за собой каскада событий, приводящих к родам. В случае гибели плодов для избежания развития инфекции часто возникает необходимость удаления их хирургическим путем.
Продолжительность беременности может увеличиваться при первичной атонии матки. В такой ситуации щенки своевременно не рождаются из-за недостаточно интенсивных сокращений матки. Причиной затянувшейся беременности может также стать вынашивание единственного плода. Задержка родов в таком случае, по всей вероятности, имеет тот же механизм, что и при гибели всех находившихся в матке плодов. Тяжелая гипокальциемия у сук в предродовом периоде бывает редко, поскольку лактация в этот период отсутствует или молоко только начинает образовываться. Однако даже небольшая гипокальциемия может привести к снижению количества и силы сокращений матки, что задерживает наступление первой стадии родов или ее перехода во вторую.
После тщательного физикального исследования и анализа анамнестических данных суки с затянувшейся беременностью следует в максимальной степени улучшить уход за ней. Как правило, ветеринарный врач, установив, что сука здорова, вынашиваемые ею плоды живы, а продолжительность беременности не превышает 70 дней со времени первой вязки, отправляет животное домой. Заводчику рекомендуют дважды в день измерять ректальную температуру суки, что поможет ему своевременно определить начало родов. Если вторая стадия родов не наступает в течение 48 ч после снижения ректальной температуры ниже 37,8 0 С или если беременность продолжается свыше 70 дней после первой вязки, рекомендуется проведение кесарева сечения.
ВЫДЕЛЕНИЯ ИЗ ПОЛОВЫХ ОРГАНОВ ЩЕННЫХ СУК
Выделения зеленого цвета: отделение участков матки, к которой прикреплялась плацента
Лохии (утеровердин) - это зеленые выделения из половых органов суки, наблюдающиеся после отделения плаценты. Цвет лохий обусловлен наличием в них пигмента, попадающего из краев зональной плаценты. Окружающая плоды плацента при родах отделяется от матки. Таким образом, появление зеленых выделений (с примесью небольшого количества крови или без нее) является индикатором того, что скоро наступит вторая стадия родов и уже началось движение плодов по родовым путям. Отсутствие родов через 2 часа после появления лохий может быть следствием дистоции и следует обратиться к ветеринарному специалисту.
Отделение плаценты у сук иногда начинается за несколько дней и даже недель до родов. В таких случаях для исключения нарушения свертывания крови, инородного тела во влагалище и других, не имеющих прямой связи с родами проблем, проводят тщательное физикальное исследование собаки и анализ анамнестических данных. В первую очередь ветеринар должен проверить, нет ли травм родовых путей. Определение формулы крови позволит исключить анемию и инфекции. Для оценки жизнеспособности плодов рекомендуется проведение УЗИ. Оба последних теста предоставляют важную информацию, позволяющую определить вероятность наличия у суки инфекции и воспаления матки, а также оценить необходимость хирургического вмешательства. Если не было выявлено подлежащих лечению расстройств, все процедуры прекращают и собаку помещают в спокойную обстановку до тех пор, пока у нее не прекратятся выделения из половых органов. Это может произойти в течение нескольких дней или после родов. Помните о том, что интенсивное отделение участков слизистой оболочки матки, к которым прикреплялась плацента, может быть сопряжено с угрозой
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 919
для жизни плодов, в то время как при умеренности и сбалансированности данного процесса плоды продолжают нормально развиваться и рождаются здоровыми (Olson, 1988).
Водянистые/серозные выделения
Появление водянистых или похожих на яичный белок выделений из половых органов суки на завершающей стадии беременности обычно указывает на начало родов. В ее половой щели может быть виден пузырь, наполненный прозрачной или водянистой аллантоисной или амниотической жидкостью. Если в течение 2 часов после этого не рождается щенок, то необходимо обследовать собаку на наличие у нее дистоции. До тех по пока этот вопрос не будет решен, заводчик должен считать, что с его сукой все в порядке и скоро начнутся роды.
Гнойные влагалищные выделения
При метрите у собак могут появиться гнойные выделения из половых органов в сочетании с лихорадкой и другими системными клиническими признаками. Если при этом сука выглядит здоровой, то наиболее вероятно, что у нее вагинит, хотя возможна и ранняя стадия метрита. Как и в любом другом случае, ветеринарный врач должен внимательно изучить анамнез и провести физикальное исследование собаки, после чего поставить необходимые диагностические тесты. Анализ крови и УЗИ брюшной полости позволяют подтвердить беременность и оценить жизнеспособность плодов, помогают установить причины появления гнойных выделений из половых органов и возможное участие инфекционных агентов в патологическом процессе.
Микроскопия влагалищных мазков в данной ситуации обычно не дает достаточной информации для определения причин заболевания, поскольку дегенерировавшие нейтрофилы, внеклеточные и фагоцитированные бактерии присутствуют во влагалищных мазках не только страдающих метритом или вагинитом, но и здоровых сук. В то же время при пиометре закрытого типа бактерии могут вообще отсутствовать во влагалищных мазках. Обнаружение в мазках скелетно-мышечных волокон - редкая находка, указывающая на возможность развития у суки вторичного метрита вследствие гибели и разложения находившихся в матке плодов. Бывают случаи, когда метритом или пиометрой поражается только один рог матки, в то время как в другом (нормальном) роге матки развиваются здоровые плоды. Такие редкие случаи описаны при пиометре как открытого, так и закрытого типа (Olson, 1988).
Кровь: кровянистые влагалищные выделения
Перед самым началом родов у сук возможно появление небольшого количества кровянистых или зе
леноватых выделений (лохий) из половых органов, что следует считать нормой. Иногда нам сообщают о сильном кровотечении из половых органов суки, находящейся на последней стадии беременности. Обычно такие сообщения делаются владельцами животных, которые в силу своей неопытности не могут правильно оценить ситуацию и «сгущают краски». Большая часть их собак совершенно здорова. Тем не менее, обильное выделение крови из половых органов - настораживающий клинический признак, который может быть индикатором дистоции, травмы матки или влагалища, выворота матки, нарушения свертывания крови или интенсивного кровотечения, возникающего при отделении плаценты. Выворот матки приводит к быстрому развитию у собаки вызванного сильной болью шокового состояния. Если ветеринарный врач принимает решение об обследовании суки с целью установления причин кровотечения, он должен, в первую очередь, внимательно изучить анамнез и провести физикальное исследование животного. С помощью вагиноскопии удается исключить наличие травматических повреждений влагалища. При выяснении причин кровотечения необходимо оценить возможность анемии у собаки и жизнеспособность ее плодов (с помощью УЗИ) и определить их местонахождение в родовых путях.
СИСТЕМНЫЕ ЗАБОЛЕВАНИЯ ЩЕННЫХ СУК
Лечение щенной суки при развитии у нее системного заболевания представляет довольно сложную задачу, поскольку ее владельцу и ветеринарному врачу хотелось бы оказать ей помощь, но при этом не нанести вреда ее плодам. К сожалению, это удается далеко не всегда. При проведении лечения в таких случаях необходим тесный и честный контакт ветеринарного специалиста с заводчиком. Ветеринарный врач, собрав анамнез, проведя физикальное исследование суки, диагностировав у нее беременность и оценив жизнеспособность плодов, должен объяснить владельцу, что происходит с его питомицей. Оставление в матке погибших плодов опасно из-за риска развития у суки септицемии или токсемии.
При токсемии у щенных сук снижается или полностью пропадает аппетит, развиваются сонливость, слабость, рвота и/или диарея. Возможны ке-тонурия без глюкозурии, гипогликемия, изменение концентрации печеночных ферментов в сыворотке крови. С помощью специальных тестов обычно устанавливают нарушение функционального состояния печени. Концентрация лейкоцитов в крови может значительно снизиться, что сопровождается сдвигом лейкоцитарной формулы влево. При сепсисе, наоборот, концентрация лейкоцитов в крови резко повышается.
Лечение системных заболеваний щенных сук должно включать проведение интенсивной жидкостной терапии содержащими декстрозу раство
920 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
рами, и парентеральное введение антибиотиков (ампициллина или клавамокса). Кесарево сечение может быть проведено после того, как клиническое состояние суки нормализуется в такой степени, чтобы животное могло без нежелательных последствий перенести анестезию. При назначении глюкокортикоидов для предотвращения развития или устранения шока и тяжелых иммунологических заболеваний следует помнить, что эти препараты могут вызвать у щенной суки преждевременные роды, которые обычно начинаются через несколько дней после проведения глюкокортикоидной терапии (Olson, 1988).
ВВЕДЕНИЕ ОКСИТОЦИНА ПОСЛЕ РОДОВ
Многие ветеринарные врачи рекомендуют применять окситоцин в конце родов для ускорения отделения плаценты или выхода из родовых путей последних щенков, инициирования инволюции матки и устранения послеродового кровотечения. Другие специалисты отрицают пользу и необходимость таких инъекций. По нашему мнению, внутримышечное введение окситоцина в дозе 2-20 ЕД/кг массы тела не сопряжено с каким-либо риском для здоровья собаки. Его можно вводить суке по просьбе ее владельца, хотя ожидать слишком значительного эффекта от этого не следует.
ПОСЛЕРОДОВОЙ ЭНДОМЕТРИТ (ОСТРЫЙ МЕТРИТ)
У многих здоровых сук в первые 24-48 ч после родов появляется легкая лихорадка (ректальная температура повышается не выше 40 °C). Однако в случаях, когда у суки в первые 7 дней после родов развивается заболевание, сопровождающееся лихорадкой, можно заподозрить, что у нее острый метрит. Воспаление матки возможно после нестерильного проведения искусственного осеменения, а после вязки метрит у собак возникает крайне редко. Острый метрит в послеродовом периоде обычно является следствием дистоции, акушерского родовспоможения, наличия в матке отмирающих тканей, а также задержания в ней плодов и последа. Бактериальные агенты проникают в матку, как правило, из влагалища и размножаются в эндометрии.
При развитии острого метрита заводчик обращает внимание на появление у суки коричневатых или красно-коричневых, имеющих неприятный запах истечений из половых органов (в норме цвет лохий зеленый, и они не обладают неприятным запахом), лихорадки, анорексии, беспокойства; хозяин отмечает также слабый или отсутствующий материнский инстинкт у своей собаки и уменьшение (вплоть до полного прекращения) образования молока. В отдельных случаях острый метрит сопровождается септическим полиартритом. Подсчет владельцем отделившихся во время родов последов облегчает диагностику задержки одного или нескольких из
них в родовых путях. Однако следует иметь в виду, что суки часто склонны поедать последы, когда заводчик перестает обращать на них внимание. Ветеринарный врач при клиническом обследовании собаки должен убедиться в том, что у нее имеются те самые выделения, которые вызвали беспокойство хозяина. При наличии у суки увеличенной матки или отвислого живота необходимо посредством пальпации выяснить, с чем это связано. Определяют наличие у собаки обезвоживания организма, шока и других угрожающих жизни симптомов.
При цитологическом анализе крови обычно выявляют лейкоцитоз со сдвигом лейкоцитарной формулы влево (в тяжелых случаях может иметь место лейкопения). Во влагалищных мазках при остром метрите обычно обнаруживают повышенное количество лейкоцитов, многие из которых дегенерировали, эритроциты, клеточный дебрис, слизь, бактерии (свободные и/или фагоцитированные) и в ряде случаев клетки эндометрия (Olson et al, 1984). Биохимические изменения крови указывают на обезвоживание организма и септицемию. При рентгенологическом исследовании обнаруживают увеличенную матку, но это имеет ограниченную диагностическую ценность, поскольку в первые дни после родов этот орган у всех сук остается увеличенным. Тем не менее, рентгенологическое исследование помогает обнаружить плоды, оставшиеся в матке после родов. Большую ценность представляют результаты УЗИ, которое позволяет не только установить увеличение матки, но и наличие в ней скоплений жидкости или гноя, плодов и плаценты. Для многих практикующих ветеринарных врачей основаниями для постановки диагноза на острый послеродовой метрит служат выделение из половых органов суки ненормальных истечений и наличие у животного клинических признаков системного заболевания в течение нескольких дней после родов.
При данной патологии крайне важно в кратчайшие сроки начать лечение антибиотиками. Целесообразно взятие смывов из влагалища суки для бактериологического исследования на присутствие бактерий, при этом выявление анаэробных бактерий может оказаться очень важным. При изоляции специфических возбудителей определяют их чувствительность к антимикробным препаратам. Однако не следует откладывать лечение до получения результатов бактериологического анализа. Больным сукам дают оксациллин, ампициллин (по 20 мг/кг массы тела 4 раза в день) или комплексные препараты, в состав которых входят триметоприм и сульфаниламиды. Оксациллин и ампициллин относительно безопасны для подсосных щенков. После получения данных бактериологического исследования (спектра выделенных микроорганизмов и их чувствительности к антимикробным препаратам) их сопоставляют с результатами первых дней лечения суки использованным антимикробным препаратом и подбирают наиболее эффективное средство для дальнейшего длительного лечения. Для
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 921
удаления породившихся плодов и задержавшихся последов может понадобиться хирургическое вмешательство. В случае некроза всей или части матки следует принять решение о проведении овариогистерэктомии (Johnston et al, 2001).
Прогноз при послеродовом остром метрите зависит от того, как скоро заболевание было замечено владельцем животного, как быстро суке была оказана терапевтическая помощь и какой эффект дало проведенное лечение антибиотиком. Если было принято решение о необходимости овариогистерэктомии, ее проводят после того, как клиническое состояние суки нормализуется в такой степени, чтобы она могла без нежелательных последствий перенести анестезию и саму операцию. Для удаления задержавшихся плодов, последа, скоплений гноя и некротизированных тканей из матки с успехом применяют простагландин F2a (см. гл. 23 «Медикаментозное лечение пиометры [Простагландины]). Природный простагландин F2a в дозе 0,25 мг/кг вводят собакам подкожно 1 раз в день на протяжении 5 последующих дней. Вместо него ряд ветеринарных врачей применяют окситоцин и эргоновин (их вводят внутримышечно в дозе 0,2 мг/15 кг 3 раза в день в течение 2-3 дней). У нас нет собственного опыта использования этих препаратов в указанных целях. При проведении «чистки» матки таким методом имеется риск ее разрыва, однако, о таком крайне нежелательном осложнении пока не сообщалось (Magne, 1986).
СУБИНВОЛЮЦИЯ МАТКИ
Инволюция матки
Считается, что в норме продолжительность послеродовой инволюции матки составляет примерно 12 недель (Al-Bassam et al, 1981а, 1981b). Однако с помощью УЗИ было установлено, что этот процесс полностью завершается в среднем на 3 недели позднее (Yeager, Concannon, 1990). После инволюции рога матки представляют собой равномерно гипоэхогенные, трубчатые структуры диаметром 0,3-0,6 см. Восстановление нормальной структуры (инволюция) эндометрия после родов, как правило, сопровождается выделением из половых органов серозно-кровянистой жидкости в течение 1-6 недель. При этом в последние несколько недель выделения бывают очень слабыми.
У здоровых собак в первые две недели после родов в верхних рыхлых слоях соединительной ткани эндометрия видны трофобласты плода или материнские децидуальные клетки. В норме они дегенерируют. Однако у собак с субинволюцией плацентарных мест трофобласты не погибают, а проникают глубже в железистые слои эндометрия и миометрия, что сопровождается разрушением кровеносных сосудов. Предполагается, что такая инвазия трофобластов лежит в основе патогенеза субинволюции плацентарных мест (Johnson et al, 2001).
Трофобластоподобные клетки могут присутствовать во влагалищных мазках пораженных сук.
Определение/клинические признаки
У некоторых здоровых сук (чаще всего тех, чей возраст не превышает 3 лет и у которых прошла первая или вторая беременность) в течение 6 недель после родов из половых органов выделяются не имеющие запаха кровянистые истечения. Каких-либо других клинических признаков, а также лихорадки у животных не наблюдают. Если в выделениях нет гноя, количество эритроцитов и лейкоцитов в крови в норме, а при УЗИ у этих животных не находят значительного скопления жидкости в матке, то лечения обычно не назначают. Приплод постепенно подрастает и щенков передают новым хозяевам, не дожидаясь результатов цитологического анализа персистирующих послеродовых выделений из влагалища. Суки остаются внешне клинически здоровыми, но у них сохраняются кровянистые выделения из половых органов.
Вульва сук при этом может быть немного увеличенной и мягкой, но слизистая оболочка влагалища остается нормальной. Изредка при пальпации внутренних органов через брюшную стенку в матке на всем ее протяжении обнаруживаются единичные или множественные, дискретные, сферические уплотнения. Эти структуры, описание которых было приведено ранее, представляют собой выступающие из эндометрия в просвет матки скопления эозинофилов вокруг трофобластов. Они могут кровоточить, что обусловливает персистентные кровянистые выделения из половых органов сук, но их наличие не сопровождается изменением концентрации эритроцитов или лейкоцитов в крови. Тем не менее, при цитологическом исследовании влагалищных мазков нередко обнаруживают синцитиальные трофобластоподобные клетки, присутствие которых подтверждает диагноз субинволюции плацентарных мест. Наличие таких клеточных элементов во влагалищных мазках служит основой клинической диагностики субинволюции матки.
Дифференциальная диагностика
Причинами продолжительных послеродовых кровянистых выделений из половых органов могут быть метрит, вагинит, гиперплазия эндометрия, развившаяся вследствие повышенной концентрации эндогенных или экзогенных эстрогенов, нарушение свертывания крови, наступление проэструса, цистит, травмы и опухоли родовых путей (Wheeler, 1986). При проведении дифференциальной диагностики субинволюции матки желательно проверить суку на бруцеллез. Для установления того, где находится источник кровотечения - в матке или влагалище, рекомендуется проведение вагиноскопии (Reberg et al, 1992). Однако это не всегда удается, и в случае присутствия крови во влагалище
922 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
бывает сложно установить ее источник. Ситуация упрощается, когда с помощью вагиноскопии во влагалище обнаруживают новообразования, травмы, инородные тела и очаги некроза. Для вагиноскопии удобно пользоваться отоскопом. Пальпация позволяет обнаружить опухоли, инородные тела и травмированные участки наружных половых органов и влагалища, которые могут быть причинами кровотечения. Бактериологическое исследование влагалищных смывов хотя и рекомендуется, но часто дает трудно интерпретируемые результаты, так как культуры обычно получаются смешанные и в них могут присутствовать как компоненты нормальной микрофлоры влагалища, так и инфекционные бактерии.
Лечение
Субинволюция матки не нуждается в лечении до тех пор, пока сука остается здоровой. Однако необходимо вести наблюдение на протяжении всего периода истечений из ее половых органов. Особое внимание обращают на появление признаков анемии и инфекций. Обычно достаточно обследовать собак один раз в 2-3 недели. Собаки, страдающие синдромом субинволюции матки, как правило, остаются здоровыми и не утрачивают плодовитости. Поэтому прогноз в обоих отношениях благоприятен.
При осложненном течении субинволюции матки рекомендуются терапия системными антибиотиками, гистерэктомия с выскабливанием или овариогистерэктомия. Антибиотики следует применять только при наличии бактериальных инфекций. Применение природного простагландина (в дозе 0,25 мг/кг массы тела 1 раз в день на протяжении 5 дней) не ведет к устранению выделений из половых органов. Медроксипрогестерон ацетат эффективен в этом отношении, но его применение не желательно. Высказывалось предположение о возможности предотвратить развитие синдрома посредством инъекций окситоцина ощенившимся собакам, но этот эффект окситоцина пока не подтвержден.
ЗАДЕРЖАНИЕ ПЛАЦЕНТЫ (ПОСЛЕДА)
Задержание плаценты после родов происходит у сук крайне редко. Плацента представляет собой отделившиеся от матки плодные оболочки, которые обычно выходят их родовых путей вместе со щенком или в течение последующих 15 мин. Диагностика задержания последа в родовых путях сопряжена с определенными трудностями. Прежде всего, бывает сложно подсчитать количество вышедших последов, поскольку суки часто их быстро съедают.
Наиболее предрасположены к задержанию последа суки карликовых пород, но диагностировать у них эту патологию часто не удается без помощи УЗИ (и даже в этом случае диагноз субъективен) или диагностической лапаротомии/гистерэктомии. Поэтому, если заводчик сомневается, все ли после
ды вышли при родах, проводят полное физикальное исследование собаки и делают ей инъекцию окситоцина. При отсутствии признаков ухудшения клинического состояния животного никакого другого лечения не проводят. Если сука остается здоровой, то считают предположение о задержании у нее последа необоснованным.
Оставшаяся в родовых путях плацента является очагом размножения бактерий, что ведет к развитию у собак послеродового эндометрита. Признаки эндометрита, наряду с общим недомоганием, включают гнойные, зловонные выделения из половых органов, лихорадку, потерю аппетита (вплоть до анорексии), беспокойство. В такой ситуации наиболее рациональным способом лечения является овариогистерэктомия, поскольку консервативная терапия не дает стабильного результата. Тем не менее, весьма эффективным способом лечения может быть сочетание системного применения антибиотиков и простагландина F2a.
ПОСЛЕРОДОВАЯ ТЕТАНИЯ - ЭКЛАМПСИЯ - ГИПОКАЛЬЦИЕМИЯ
Определение
Эклампсия - это остро протекающее, угрожающее жизни заболевание, вызванное значительным снижением концентрации кальция в крови. К ней в наибольшей степени предрасположены суки маленьких и средних пород. Эклампсия чаще поражает собак после родов в начале лактационного периода, но иногда она развивается в конце беременности, при этом чем больше плодов вынашивает сука, тем выше риск заболевания (Drobatz, Casey, 2000).
Этиология
Патофизиологические механизмы эклампсии пока еще недостаточно изучены и понятны. Заболевание возникает вследствие гипокальциемии, которая приводит к изменению электрических потенциалов клеточных мембран. Последнее ведет к спонтанному разряду нервных волокон и индукции тонических или тоноклонических сокращений скелетной мускулатуры. От скорости и степени снижения концентрации кальция в плазме крови зависят время проявления и тяжесть клинических признаков эклампсии. Активным электролитом является ионизированный кальций. Владельцы сук обычно замечают появление судорог после того, как концентрация общего кальция опустится ниже 7 мг/100 мл. У сук при послеродовой тетании концентрация ионов кальция в крови падает ниже 0,8 ммоль/л (Drobatz, Casey, 2000).
У лактирующих сук гипокальциемия развивается, в основном, из-за потери кальция с молоком в сочетании с плохим усвоением диетарного кальция или его дефицита в рационе. Кроме того, выкармливание приплода может быть для суки стресс-
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 923
фактором, приводящим к снижению аппетита, что, в свою очередь, ведет к снижению поступления в ее организм кальция. К числу дополнительных факторов, которые могут способствовать развитию гипокальциемии, относится атрофия паращитовидной железы. Она вызывается несбалансированным кормлением и значительным расходом кальция на формирование скелетов вынашиваемых плодов. В организме здоровых собак половина кальция находится в связанном с белками виде, а другая, биологически активная его половина - в ионизированной форме. Теоретически, любые факторы, способствующие связыванию кальция белками сыворотки крови, способствуют развитию послеродовой эклампсии. К числу таких факторов, в частности, относится системный алкалоз, возникающий вследствие гипервентиляции легких у суки при дистоции.
Гипогликемия часто развивается как осложнение гипокальциемии, при этом гипогликемия и гипокальциемия могут иметь сходные клинические проявления. Некоторые авторы предлагают при лечении гипокальциемии у кошек и собак делать им внутривенные вливания глюкозы (Linde-Forsberg, Eneroth, 1998).
В исследовании, проведенном на 27 собаках со спонтанной эклампсией, у всех животных были снижены концентрации общего и ионизированного кальция. Интересно, что у 12 из этих 27 сук была выявлена гипомагниемия - концентрация магния в их сыворотке крови варьировала от 0,3 до 1,0 ммоль/л (в среднем по группе она была равна 0,7 ммоль/л), в то время как в норме у здоровых собак она составляет 0,7-1,1 ммоль/л. Отношение общей концентрации магния к общей концентрации кальция в сыворотке крови сук с эклампсией было равно 0,32, а у здоровых собак оно было значительно выше и составляло 0,5. Из 27 больных эклампсией сук у 8 была обнаружена сопутствующая гипофосфатемия, у 2 - гиперфосфатемия и у 14 - гиперкалиемия (Aroch et al, 1999). Неизвестно, нуждаются ли перечисленные биохимические нарушения в специальной терапии.
Клинические признаки
Эклампсия наиболее часто развивается у собак мелких пород и значительно реже у сук крупных пород и кошек. Симптоматика болезни, которую может наблюдать ветеринарный врач, зависит от того, как быстро заводчик понял, что его сука заболела, и обратился за квалифицированной помощью. У большинства сук эклампсия проявляется в первые 3 недели лактационного периода, хотя бывают более ранние (начинающиеся за 20 дней до родов) и более поздние (до 45 дней после родов) случаи заболевания.
Первые проявления вызванной гипокальциемией эклампсии могут носить субклинический и неопределенный характер. Поэтому многие, особенно неопытные владельцы не сразу понимают, что их
собака заболела. Изменения в поведении во многом напоминают, те которые происходили у нее перед родами (например, беспокойство, безостановочные движения, частое и тяжелое дыхание, подвывание). Кроме того, она перестает реагировать на своих щенков и у нее проявляются ранние признаки гипокальциемической тетании: раздражительность, беспокойство, усиленное слюнотечение, ходульная походка, нарушение координации движений, тремор, боль, регулярно повторяемые попытки расчесывать лапами или об окружающие предметы морду и кусать лапы.
В течение нескольких минут или часов ранние признаки гипокальциемии могут перейти в тяжелое клиническое состояние. Эклампсия часто проявляется тонико-клоническими спазмами мускулатуры, подергиваниями и мышечной дрожью (тетанией), а также расчесыванием морды и кусанием лап, утратой способности стоять. Перечисленные клинические признаки обычно сопровождаются лихорадкой и тахикардией; периодически симптоматика становится менее выраженной. При отсутствии своевременного и правильного лечения у суки могут начаться эпилептиформные судороги, при которых у нее сохраняется сознание. Слуховые и тактильные раздражители часто становятся причиной возобновления у животного мышечных спазмов и судорог. Находясь в таком состоянии, собака может погибнуть из-за остановки дыхания, гипертермии или связанного с ними отека головного мозга.
Диагностика
Диагностика эклампсии основана на выявлении у лактирующей суки характерных клинических признаков (нервозности или неврологической симптоматики). Несмотря на то, что определение концентрации общего или ионизированного кальция в сыворотке позволяет поставить окончательный диагноз, практикующие ветеринарные врачи обычно приступают к лечению немедленно, не дожидаясь результатов лабораторных анализов. В такой ситуации выздоровление собаки служит наиболее надежным подтверждением поставленного диагноза.
Первая помощь
Вливание препаратов кальция. Основная цель первой помощи суке при эклампсии состоит в нормализации концентрации кальция в сыворотке крови посредством парентерального введения его препаратов (таблица 21-5). Обычно с этой целью пользуются 10% растворами глюконата или глюцептата кальция, реже хлористого кальция. Их медленно вводят внутривенно. Маленькой собаке может потребоваться всего 1-2 мл раствора, но бывают случаи, когда объем необходимо увеличить до 10-15 мл. Глюконат кальция предпочтительнее хлористого кальция, так как его раствор вызывает меньшее раздражение при случайном попадании в периваскулярные ткани.
924 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
ТАБЛИЦА 21-5. КОНЦЕНТРАЦИЯ КАЛЬЦИЯ В РАЗНЫХ КОММЕРЧЕСКИХ ФАРМАКОЛОГИЧЕСКИХ ПРЕПАРАТАХ
Форма кальциевого соединения Концентрация кальциевого соединения (г/100 мл) Содержание кальция в соединении (%) Концентрация элементарного кальция
(мг/ мл) (мэкв/мл)
Глюконат кальция * 23 9,3 21,4 1,07
10 9,3 0,46
Глицерофосфат кальция * 1 19,07 1,87 0,09
Лактат кальция раствор 18,37
Глицерофосфат кальция ** 10 19,07 1,87 0,09
Лактат кальция суспензия 18,37
Хлорид кальция*** 5 27,2 13,6 0,68
(не используется) 10 27,2 27,2 1,36
Глюцептат 22 9,0 19,8 0,99
кальция *
Левулинат кальция * 10 13,0 13,0 0,65
Концентрация элементарного кальция (мг/мл) =
Концентрация кальциевого соединения (г/100 мл) х Концентрация кальция в соединении (%): 10
*’ Вводится собаке внутривенно или внутримышечно.
Вводится собаке только внутривенно.
”’) Вводится собаке только внутримышечно.
Это особенно важно при лечении собак, у которых происходят тетанические сокращения мускулатуры или судороги, поскольку в такой ситуации довольно трудно ввести инъекционную иглу непосредственно в v.cephalic. Как уже упоминалось ранее, многие ветеринарные врачи одновременно с препаратами кальция вводят глюкозу, а в ряде случаев больным эклампсией сукам дополнительно вводят препараты, содержащие магний (Aroch et al, 1999).
Контроль сердечной деятельности. Во время введения кальция нужно контролировать сердечную деятельность на случай возникновения у собаки брадикардии и/или аритмии. При появлении признаков нарушения работы сердца введение кальция останавливают. После восстановления сердечного ритма при необходимости введение можно продолжить, но с небольшой скоростью.
Контроль температуры тела. Понизить температуру тела сук при вторичной гипертермии, сопровождающей эклампсию, можно с помощью льда или протирания спиртом. Однако еще быстрее температура снижается при введении препаратов кальция. При сочетании введения кальция с физическими методами устранения гипертермии необходимо строго контролировать температуру тела, поскольку при такой схеме лечения у животного часто возникает гипотермия. Измерения ректальной температуры прекращают только после ее стабилизации и исчезновения клинических проявлений эклампсии. Обычно это происходит в течение 30-45 мин или больше после инъекции препарата кальция. После нормализации температуры тела собака крайне редко нуждается в дополнительном лечении (см. описание гипокальциемии в гл. 17).
ДЛИТЕЛЬНЫЙ КУРС ЛЕЧЕНИЯ
В ряде случаев после исчезновения у суки клинических признаков эклампсии возникает необходи
мость в поддержании у нее концентрации кальция в сыворотке крови на нормальном уровне. Требуемое для этого количество глюконата или глицеп-тата кальция рассчитывают следующим образом. За основу берут объем препарата, который вводили животному внутривенно во время оказания первой помощи для снятия симптоматики эклампсии. Его смешивают с равным объемом физиологического раствора. Для профилактики рецидива эклампсии полученную смесь вводят подкожно 3 раза в день. Раствор хлористого кальция можно вводить собакам только внутривенно. Если клиническое состояние суки остается стабильным и у нее не повышается температура тела, ее возвращают из ветеринарной клиники владельцу. Его инструктируют относительно того, как давать собаке таблеточную форму карбоната или глюконата кальция. В период лактации 40-киллограмовая сука в среднем должна получать эти препараты 3 раза в день по 1 таблетке по 500 мг.
Помимо этого, заводчику следует предпринять дополнительные меры для предотвращения рецидивов эклампсии. Щенков после достижения ими трехнедельного возраста нужно постепенно отнимать от матери и выкармливать их заменителем молока. Можно так поступать и с еще более молодыми щенками, что, безусловно, послужит прекрасной мерой профилактики эклампсии у кормящей суки, но это очень хлопотно для владельца. Альтернативно можно изолировать щенков от матери на 24 ч, после чего их снова подпускают к матери. Еще лучше, если уже в первые 10 дней жизни щенки будут получать не только молоко матери, но и его заменитель. Можно также чередовать кормление приплода материнским молоком и его заменителем: день половина помета получает молоко, а остальные щенки - его заменитель, на другой день им меняют корм и т.д., или все щенки получают заменитель через день. Такой прием приводит к сниже
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 925
нию у суки молочной продуктивности и, соответственно, к снижению риска рецидива эклампсии. Во время рецидива этого заболевания щенков следует постепенно отнимать от матери и переводить на заменитель молока. Не рекомендуется промывать молочные железы суки холодной или теплой водой, поскольку это стимулирует секрецию молока. Рацион страдающих эклампсией сук должен быть высококачественным и хорошо сбалансированным, поэтому целесообразно пользоваться готовыми кормами.
Первая помощь сукам при неэффективности кальциевой терапии
В случае, когда у суки предполагается эклампсия, но внутривенное вливание препаратов кальция не дает ожидаемых результатов, можно прибегнуть к альтернативному методу лечения. Сначала животному внутривенно вводят глюкозу, поскольку гипогликемия и гипокальциемия часто протекают совместно и имеют сходную симптоматику. Если и такой способ не помогает, и у суки сохраняются неврологические признаки, следует определить у нее кислотно-щелочной баланс. Дело в том, что во время приступов эклампсии у собак повышается гипервентиляция легких, приводящая к развитию алкалоза, при котором большая часть депонированного в организме кальция находится в соединении с белками. В таком состоянии кальций не доступен для клеток и они не могут нормально работать, а дисфункция нервных клеток ведет к развитию характерной для эклампсии симптоматики. При длительных судорогах собаке внутривенно вводят диазепам (валиум), а при необходимости также фенобарбитал. Если описанные выше методы оказания первой помощи не дают терапевтического эффекта, следует провести дополнительные исследования для исключения заболеваний другой этиологии, сопровождающихся вторичным отеком головного мозга. Не следует также забывать о возможности длительного течения эклампсии.
Лечение сук, у которых раньше уже была эклампсия
У перенесших эклампсию сук очередная беременность может вновь привести к состоянию гипокальциемии. Специальных исследований, подтверждающих возможность профилактики эклампсии у сук пероральной дачей таблеток кальция в последнюю неделю беременности или в лактационный период, не проводилось. Основной рекомендацией по предотвращению развития эклампсии является кормление сук сбалансированными готовыми кормами высокого качества. Такие корма обеспечивают потребности собак в кальции, не вызывая его избыточного поступления в организм. У коров, получающих после отела рацион с высоким содержанием кальция, чаще развивается гипокальциемия. Предпола
гается, что аналогичная ситуация возможна у сук. Если это действительно так, то заводчики должны избегать не только дефицита, но и избыточного содержания кальция в рационе сук в последние недели беременности и в лактационном периоде. Следует соблюдать осторожность при скармливании собакам рациона с большим количеством бобовых, содержащих фитаты, которые связывают поступающий с пищей кальций и тем самым повышают предрасположенность животных к гипокальциемии (Olson, 1988).
Предполагается, что контроль ионного баланса рациона крупного рогатого скота может предотвратить развитие у коров послеродовой гипокальциемии (Oetzel et al, 1988). Имеются данные о снижении частоты возникновения гипокальциемии у коров, получавших в конце периода стельности в качестве кормовой добавки хлористый аммоний. Неизвестно, в какой мере это относится к собакам (Olson, 1988). Если сука ранее перенесла эклампсию, а при очередном щенении дала большой приплод, то в целях профилактики гипокальциемии, как уже отмечалось выше, следует ограничить количество подсосных щенков.
МАСТИТ
Инфекционный мастит
Клинические признаки. Инцидентность инфекционных маститов у лактирующих сук не велика. У заболевших маститом собак клинические признаки, связанные с воспалением молочной железы, могут быть явно выраженными, но могут и отсутствовать. При пальпации пораженной молочной железы обычно выявляют болезненность, повышенную местную температуру и наличие уплотненных или твердых участков. Молоко из этой молочной железы может становиться бесцветным. При инфекционном мастите собака испытывает общее недомогание, у нее появляется лихорадка, она может не подпускать к себе щенков. Аппетит в одних случаях пропадает, а в других сохраняется. Обычно источник инфекции установить не удается. Заражение суки часто происходит через соски, проникающие раны, но возможен занос патогенных бактерий и гематогенным путем. Щенки, выкармливаемые больной маститом сукой, иногда заболевают. При этом они слабеют и стонут. Возможна гибель как подсосных щенков, так и их матери.
Диагностика. Диагноз инфекционного мастита обычно ставится на основании данных анамнеза и результатов физикального исследования суки. До начала лечения желательно взять пробы молока для проведения цитологического и бактериологического анализа. При изоляции из секрета молочной железы патогенных бактерий определяют их чувствительность к антибиотикам. Если не удается выдоить молоко, то можно его отсосать с помощью шприца и иглы. Цитологическое исследование сек
926 • ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
рета воспаленной молочной железы часто выявляет бактерии и многочисленные дегенерировавшие нейтрофилы. В посевах секрета, как правило, отмечают обильный рост бактерий. Наиболее часто обнаруживают кишечную палочку, бета-гемолитический стрептококк и стафилококки (Wheeler et al, 1984). При цитологическом исследовании молока из здоровых молочных желез обнаруживают намного меньше клеток, но бактерии могут присутствовать (Olson, Olson, 1986; Olson, 1989).
Лечение. Лечение суки, больной инфекционным маститом, начинают еще до завершения лабораторных исследований. Лучше всего в данной ситуации использовать ампициллин и оксациллин. Их применяют до тех пор, пока не получат результатов лабораторных анализов; если выделенные бактерии оказались резистентными к этим антибиотикам, то вместо них назначают другие антимикробные препараты. Оксациллин и ампициллин зарекомендовали себя при инфекционных маститах сук как эффективные средства терапии. Кроме того, они не наносят вреда здоровью новорожденных щенков. Хлорамфеникол также считается препаратом выбора на начальной стадии лечения инфекционных маститов у сук (Olson, Olson, 1986). Поскольку молоко имеет несколько более кислую реакцию по сравнению с нормальной сывороткой крови, препараты, обладающие слабой щелочной реакцией, достигают в «нормальных условиях» более высокой концентрации в молоке, чем в сыворотке крови (Olson, 1988). Однако остаются ли условия распределения лекарственных препаратов в организме собак при мастите «нормальными», неизвестно.
К числу слабощелочных антибиотиков, проявляющих высокую терапевтическую эффективность при хронических маститах, относятся эритромицин, триметоприм, клиндамицин и линкомицин (Olson, 1988). Хотя аминогликозиды представляют собой слабые основания, они не могут концентрироваться в имеющем слабокислый pH молоке из-за плохой растворимости в жирах. Эта группа антибиотиков может также проявлять нефротоксический эффект. Тетрациклины достигают терапевтической концентрации в молоке, имеющем как кислую, так и щелочную реакцию, но они оказывают отрицательное воздействие на процесс формирования зубов у щенков, поэтому их не следует применять для лечения лактирующих сук.
Продолжение сосания щенками молока из пораженных маститом желез помогает дренировать железы, и заводчики должны за этим следить. Из-за болезненности пораженных маститом желез сука может не подпускать к ним своих щенков. С другой стороны, сосание молока из пораженных инфекционным маститом желез неизбежно вызовет заражение патогенными агентами щенков со всеми вытекающими отсюда последствиями, Гораздо безопаснее отсасывать молоко из больной железы, а недостаток молока щенкам компенсируют его заменителями, чтобы это не отразилось на их росте.
Применение согревающих компрессов и промывание больных желез теплой водой может ускорить их очистку от продуктов воспаления, но эти методы не очень эффективны.
Иногда тяжело инфицированные железы подвергаются некрозу. В такой ситуации щенков необходимо перевести на искусственное кормление и удалить некротизированные ткани. При появлении в молочной железе абсцесса может возникнуть необходимость в его вскрытии, дренировании и промывании 1% раствором йод-повидона. В свищи вскрывшихся абсцессов через молочные катетеры вводят растворы антисептиков или антибиотиков. Бывают случаи, когда наиболее целесообразно и безопасно и удалить пораженную молочную железу.
Неинфекционный мастит/Галактостаз
При застое молока (галактостазе) и неинфекционных маститах пораженные молочные железы увеличиваются в объеме и становятся болезненными. В первую очередь, как правило, поражаются самые продуктивные каудальные железы. Синдром галактостаза часто развивается после резкого отъема щенков от активно лактирующей суки. Состояние собак при галактостазе и неинфекционном воспалении молочной железы значительно лучше, чем при инфекционном мастите. При бактериологическом исследовании молока или аспирата из молочных цистерн страдающих галактостазом или неинфекционным маститом сук, бактерии обычно не обнаруживаются, но количество нейтрофилов, макрофагов и эозинофилов в секрете может быть увеличено. Тем не менее, лейкоцитоз отсутствует. Интенсивность воспалительного процесса в железах может меняться при лечении холодным или согревающим компрессами, а также при продолжении сосания из пораженных желез. При тяжелом течении мастита щенков следует перевести на кормление заменителем молока.
Проводят легкий массаж пораженных желез и ручное сдаивание молока из них. Это не дает молоку накапливаться в железе в больших количествах и снижает создаваемое им давление. С той же целью применяют компрессы с горячей водой. Альтернативный подход к лечению галактостаза и неинфекционного мастита направлен на прекращение лактации. Собаке назначают фуросемид (в дозе 1,0 мг/кг 2 раза в день) и/или глюкокортикоиды в течение 3 дней. Имеет также смысл не кормить ее в течение 24 ч, на следующий день дать только 25%, на третий день - 50% и затем ежедневно до прекращения образования молока скармливать по 75% обычного дневного рациона. Введение агониста дофамина каберголина в дозе 2,5-5 мкг/кг массы тела один раз в день на протяжение 4-6 дней приводит к снижению секреции пролактина и, как следствие, прекращению лактации. Агонисты дофамина следует применять только тем сукам, у которых погиб приплод или возраст их щенков достаточен для
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД • 927
перевода с молока на другие корма (Linde-Forsberg, Eneroth, 1998).
АГАЛАКТИЯ
Полное отсутствие лактации (агалактия) редко бывает у сук после родов и, как правило, связано с врожденным дефектом молочной железы. Значительно чаще приходится сталкиваться не с агалакти-ей, а с пониженной секрецией молока - гипогалак-тией. К гипогалактии наиболее предрасположены молодые и нервозные суки. Снижение молочной продуктивности отражается на поведении собаки, которая в той или иной степени перестает подпускать к молочной железе своих щенков. Разрешить подобную ситуацию позволяет правильное поведение заводчика, который должен без суеты и спешки предоставить новорожденным щенкам возможность сосать материнское молоко. Иногда при этом приходится давать суке транквилизаторы. Если сука раньше проявляла каннибализм, то оставлять щенков наедине с ней бывает опасно. В таких случаях единственным выходом становится перевод их на искусственное выкармливание. Но при этом следует сделать все возможное, чтобы щенки в первые 24 ч после рождения получили молозиво матери. Среди заводчиков распространен прием постепенного ограничения щенков в объеме получаемого в первые 1-2 дня материнского молока. Голодные щенки после кормления остаются беспокойными и продолжают пищать. Это облегчает их перевод на кормление заменителем молока.
ГИПОГЛИКЕМИЯ У ЩЕННЫХ СУК
Известен случай развития гипогликемии и кето-немии у суки на поздней стадии беременности (Jackson et al, 1980). Это крайне редкий синдром. Под влиянием прогестерона у сук чаще возникает гипергликемия, а не гипогликемия (см. ниже). Синдром гипогликемии у щенных сук удается быстро купировать внутривенным вливанием раствора глюкозы с последующим частым кормлением. После родов или кесарева сечения тяжесть синдрома спонтанно снижается.
Гипогликемию щенных сук следует дифференцировать от гипогликемии, развивающейся на фоне тяжелого сепсиса. В последнем случае более вероятно, что собака страдает пиометрой, хотя бывают ситуации, когда один рог матки поражен пиометрой, а в другом роге растут плоды. Провести дифференциальную диагностику этих синдромов удается по характеру лейкограммы крови и результатам УЗИ.
АКРОМЕГАЛИЯ В ДИЭСТРУСЕ
Повышение концентрации прогестерона в плазме крови на стадии диэструса может привести к спонтанному развитию у суки преходящей акромегалии. Мы наблюдали несколько таких случаев. По всей
видимости, в основе патогенеза лежит стимуляция прогестероном секреции гормона роста, который, в свою очередь, вызывает разрастание мягких тканей в оролингвальной, орофарингеальной и ороларин-геальной областях. Результатом этого становится респираторный стридор. Синдром сопровождается вялостью, увеличением объема живота, повышением массы тела, расширением промежутков между зубами, полидипсией/полиурией и появлением избыточного количества складок кожи у собаки в области морды и шеи. Многие из перечисленных клинических признаков могут остаться незамеченными ветеринаром, но для владельца изменения морды, характера и дыхания у его питомицы очевидны и вызывают беспокойство (рис. 21-10; Zimmerman et al, 2001).
При проведении дифференциальной диагностики синдрома принимают во внимание, что присущие ему полидипсия и полиурия могут быть следствием вторичного сахарного диабета. Лабораторные анализы могут выявить у щенных сук с акромегалией повышение концентрации щелочной фосфатазы в сыворотке крови, гипергликемию и небольшое уменьшение объема клеточной фракции крови (Eigenmann, Peterson, 1984). Лечение собак с данной патологией должно быть направлено на снижение концентрации прогестерона в плазме крови. Активность этого гормона спонтанно уменьшается в конце диэструса. Для ускорения снижения прогестерона проводят овариогистерэк-томию или применяют простагландины. У одной суки кистозная гиперплазия эндометрия сочеталась с наличием в яичниках многочисленных желтых тел (Zimmerman et al, 2001).
САХАРНЫЙ ДИАБЕТ У ЩЕННЫХ СУК
Сахарный диабет является распространенным эндокринным заболеванием у собак. Особенно трудно его лечить у нестерилизованных сук во время диэструса, когда повышение концентрации прогестерона в сыворотке противодействует эффекту инсулина (см. предыдущий раздел «Акромегалия»), Наладить контроль обмена углеводов у страдающих сахарным диабетом сук с помощью инсулина удается только в анэструсе. Во время диэструса (беременности) для снижения гипергликемии некоторым собакам требуются очень большие (иногда просто огромные) дозы инсулина. По-видимому, в этот период концентрация глюкозы в крови претерпевает значительные колебания в течение суток, и собака склонна к диабетическому кетоацидозу.
К сожалению, диабетическое состояние влияет на беременность. У страдающих диабетом щенных сук возрастает риск аборта вследствие хронической гипергликемии. Сопровождающие диабет изменения кровеносных сосудов распространяются и на кровеносную систему плаценты, что может повлечь за собой гибель плодов. Из-за недостаточного кровоснабжения плаценты могут рождаться
928
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
Рис. 21-10. Собаки одного помета У собаки слева развилась акромегалия, индуцированная и убытком прогестерона. Хотя с клинической точки зрения авторы нс видят значительной разницы между собаками, владельцев собаки эти изменения очень беспокоили. После овариогистерэктомии признаки акромегалии исчезли.
очень мелкие щенки. В то же время в условиях гипергликемии интенсивность роста некоторых плодов, напротив, возрастает, что ведет к достижению ими чрезмерно большого размера, несоизмеримого с родовыми путями матери. В результате при родах возрастает частота дистоции. После рождения поджелудочная железа у таких щенков продолжает усиленно секретировать инсулин и в течение нескольких первых недель жизни у них сохраняется состояние гипогликемии.
Что еще более важно, страдающие диабетом суки очень редко донашивают свой приплод до конца беременности. Большая часть плодов абордирует. Высокая частота абортов в сочетании с другими сопровождающими сахарный диабет проблемами здоровья собак подчеркивает необходимость проведения элективной овариогистерэктомии. Нужно также учитывать, что предрасположенность к сахарному диабету может передаваться по наследству потомству больных сук. Поэтому овариогистерэк-томию следует рекомендовать всем владельцам больных сахарным диабетом собак, даже в том случае, если заболевание удается контролировать медикаментозным и средствам и.
ЛИТЕРАТУРА
Al-Bassam МА, et al: Involution abnormalities in the postpartum uterus of the bitch. Vet Pathol 18:208, 1981a.
Al-Bassam MA, et al: Normal postpartum involution of the uterus in the dog. Can J Comp Med 45:217, 1981b.
Aroch I, et al: Serum electrolyte concentrations in bitches with eclampsia. Vet Rec 145:318, 1999.
Arbeiter K, et al: Treatment of pseudopregnancy in the bitch with cabergo-line, an ergoline derivative. J Small Anim Pract 29:781, 1988.
Barber JA, Coley CJ. Labor monitoring in the bitch. Proceedings, 4th International Symposium on Canine and Feline Reproduction. Oslo, Norway, 84, 2000.
Bebiak DM, et al: Nutrition and management of the dog. Vet Clin North Am Small Anim Pract 16:495, 1986.
Brown J: Efficacy and dosage titration study of mibolerone for treatment of pseudopregnancy in the bitch. JAVMA 184:1467, 1984.
Bulgin MS, et al: Abortion in the dog due to Campylobacter species. Am J Vet Res 45:555, 1984.
Concannon PW. et al: Termination of pregnancy and induction of premature luteolysis by the antiprogestagen, mifepristone, in dogs. J Reprod Fertil 88:99, 1990.
Concannon PW, Lein DH: Hormonal and clinical correlates of ovarian cycles, ovulation, pseudopregnancy, and pregnancy in dogs. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1269.
Cortese L, et al: Hyperprolactinemia and galactorrhea associated with primary hypothyroidism in a bitch. J Am Anim Pract 38:572, 1997.
Davidson AP. Uterine and fetal monitoring in the bitch. Vet Clin N Amer 31:305,2001.
Davidson AP. Uterine and fetal monitoring in the bitch. Proceedings, 4th International Symposium on Canine and Feline Reproduction. Oslo, Norway, 80, 2000.
Di Salle E, et al: Endocrine effects of the ergoline derivative FCE 21336, a new long lasting prolactin lowenng drug [abstract 2777]. 7th International Congress of Endocrinology, Quebec City, Canada, 1984.
Donovan EF: Dystocia. In Kirk RE (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders Co, 1980, p 1212.
Drobatz KJ, Casey KK. Eclampsia in dogs: 31 cases (1995-1998). J Am Vet Med Assoc 217:216, 2000.
Eigenmann JE, Peterson ME: Diabetes mellitus associated with other endocrine disorders. Vet Clin North Am [Small Anim Practl 14:837, 1984.
Eilts BE: Pregnancy maintenance in the bitch using Regumate. Proceedings of the Society for Theriogenology, 1992, p 144.
England GCW: Pregnancy diagnosis, abnormalities of pregnancy and pregnancy termination. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, BSAVA, 1998, pp 113-125.
Evermann JF: Diagnosis of canine herpetic infections. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia. WB Saunders Co, 1989, p 1313.
Ferrari C, et al: Clinical application of prolactin lowering drugs. In Agarwal MK (ed): Hormone Agonist. New York, Walter de Gruyter ft Co, 1982, p 503.
Funkquist PME, et al: Use of propofol-isoflurane as an anesthetic regimen for cesarean section in dogs. J Am Vet Med Assoc 211:313, 1997.
Gaudet DA, Kitchell BE: Canine dystocia. Comp Cont Ed Pract Vet 7:406, 1985.
Harvey M: Conditions of the non-pregnant female. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, BSAVA, 1998, pp 35-51.
Harvey M, et al: Effect and mechanisms of the anti-prolactin drug cabergo-line on pseudopregnancy in the bitch. J Am Anim Pract 38:336, 1997.
Hashimoto A, Hirai K: Canine herpesvirus infection. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, р516.
ЗАБОЛЕВАНИЯ СУК В ПОСЛЕРОДОВОЙ ПЕРИОД
929
Hirt RA, et al: Severe hypercalcemia in a dog with a retained fetus and endometritis. J Am Vet Med Assoc 216:1423, 2000.
Jackson RF, et al: Hypoglycemiaketonemia in a pregnant bitch. J Am Vet Med Assoc 177:1123, 1980.
Janssens LAA: Treatment of pseudopregnancy with bromocriptine, an ergot alkaloid. Vet Rec 119:172, 1986.
Jochle W, et al: Inhibition of lactation in the Beagle bitch with the prolactin inhibitor cabergoline (FCE 21336): Dose response and aspects of long term safety. Theriogenology 27:799, 1987.
Johnston SD, Root Kustritz MV, Olson PNS. Canine and feline theriogenology. Philadelphia, WB Saunders Co, 2001.
Jones DE, Josuha JO: Reproductive Clinical Problems in the Dog. London, Wright PSG Co, 1982.
Krulich L, et al: On the mode of prolactin release inhibiting action of the serotonin receptor blockers metergoline, methysergide and cyproheptadine. Endocrinology 108:1115, 1981.
Lawler DF, et al: Influence of restricted food intake on estrous cycles and pseudopregnancies in dogs. Am J Vet Res 60:820, 1999.
Lein DH: Canine mycoplasma, ureaplasma, and bacterial infertility. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders Co, 1986, p 1240.
Linde-Forsberg C and Eneroth A: Parturition. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, BSAVA, 1998, pp 127-142.
Lydon-Rochelle M, et al: Risk of uterine rupture during labor among women with a prior cesarean delivery. N Engl J Med 345:3, 2001.
Magne ML: Acute metritis in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p 505.
Meis PJ, et al: Prevention of recurrent preterm delivery by 17 alpha- hydroxyprogesterone caproate. N Engl J Med 348:2379, 2003.
Moon PF, et al: Perioperative management and mortality rates of dogs undergoing cesarean section in the United States and Canada. J Am Vet Med Assoc 213:365, 1998.
Oetzel GR, et al: Ammonium chloride and ammonium sulfate for prevention of parturient paresis in dairy cows. J Dairy Sci 41:291, 1988.
Olson PN: Periparturient diseases of the bitch. Proceedings of the Society for Theriogenology, 1988, p 19.
Olson PN: Exfoliative cytology of the canine reproductive tract. Proceedings of the Society for Theriogenology, 1989, p 259.
Olson JD, Olson PN: Disorders of the canine pulmonary gland. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p 506.
Olson PN, et al: Vaginal cytology. Part II. Its use in diagnosing canine reproductive disorders. Comp Cont Ed Pract Vet 6:385, 1984.
Peterson ME, Drucker WD: Advances in the diagnosis and management of canine Cushing’s syndrome. 31st Gaines Veterinary Symposium, Baton Rouge, LA, 1981, p 17.
Post K, et al: Effects of prolactin suppression with cabergoline on the pregnancy of the bitch. Theriogenology 29:1233, 1988.
Probst CW, Webb Al: Postural influence on systemic blood pressure, gas exchange, and acid/base status in the term pregnant bitch during general anesthesia. Am J Vet Res 44:1963, 1983.
Purswell BJ: Management of apparent luteal insufficiency in a bitch. JAVMA 199:902, 1991.
Purswell BJ: Differential diagnosis of canine abortion. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders Co, 1992, p 925.
Reberg SR, et al: Subinvolution of placental sites in dogs. Comp Cont Ed Pract Vet 14:789, 1992.
Reimers TJ, et al: Effects of reproductive state on concentrations of thyroxine, 3,5,3?-triiodothyronine and Cortisol in serum of dogs. Biol Reprod 31:148, 1984.
Rendano VT Jr: Radiographic evaluation of fetal development in the bitch and fetal death in the bitch and queen. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 947.
Schweizer CM, Meyers-Wallen VN: Medical management of dystocia and indications for cesarean section in the bitch. In Bonagura J (ed): Current Veterinary Therapy XIII. Philadelphia, WB Saunders Co, 2000, p 933.
Scott-Moncrieff JC, et al: Serum disposition of exogenous progesterone after intramuscular administration in bitches. Am J Vet Res 51:893, 1990.
Shamir M, Shahar R: Extrauterine fetuses in an asymptomatic dog. Canine Practice 21:25, 1996.
Shille VM: Diagnosis and management of dystocia in the bitch and queen. In Bojrab MJ (ed): Current Techniques in Small Animal Surgery. Philadelphia, Lea 6t Febiger, 1983, p 338.
Steinetz BG, et al: Serum relaxin and progesterone concentrations in pregnant, pseudopregnant, and ovariectomized, progestin-treated pregnant bitches: Detection of relaxin as a marker of pregnancy. Am J Vet Res 50:68, 1989.
Vdith VL: Functional significance of pseudocyesis. Mod Vet Pract 61:75, 1980.
Voith VL: Behavioral disorders. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1983, p 223.
Webster J, et al: A comparison of cabergoline and bromocriptine in the treatment of hyperprolactinemic amenorrhea. N Engl J Med 331:904, 1994.
Wheeler SL: Subinvolution of placental sites in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p513.
Wheeler SL, et al: Postpartum disorders in the bitch. Comp Cont Ed Pract Vet 6:493, 1984.
Yeager AE, Concannon PW: Serial ultrasonographic appearance of postpartum uterine involution in Beagle dogs. Theriogenology 34:523, 1990.
Zimmerman KL, et al: Challenging cases in internal medicine: What’s your diagnosis? Veterinary Medicine 602, August, 2001.
Глава 22
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
ПРОБЛЕМА: НЕЖЕЛАТЕЛЬНАЯ ЩЕННОСТЬ.....................930
ПРЕДВАРИТЕЛЬНОЕ ОБСЛЕДОВАНИЕ... 930
ЛЧЕНИЕ СУК, НЕ ПРЕДНАЗНАЧЕННЫХ
ДЛЯ ПЛЕМЕННОГО РАЗВЕДЕНИЯ....932
Овариогистерэктомия (ОГЭ).....932
ЛЕЧЕНИЕ СУК, ПРЕДНАЗНАЧЕННЫХ
ДЛЯ РАЗВЕДЕНИЯ..............932
Обзор.........................932
«Триместры» щенности..........932
Овариогистерэктомия...........932
Прерывание щенности до имплантации эмбрионов: эстрогены (не рекомендуются)....933
Простагландины. Общие сведения...935
Природные простагландины.........936
Простагландины: введение сразу после вязки (не рекомендуется)..938
Аналоги простагландинов.........938
Лечение антипрогестинами........939
Агонисты дофамина...............940
Комбинация простагландина и агониста дофамина.............940
Г люкокортикоиды................941
Антагонисты гонадотропин
рилизинг-гормона..............941
Тамоксифена цитрат..............941
Ведение суки после нежелательной вязки...........941
ПРЕДОТВРАЩЕНИЕ ЭСТРАЛЬНЫХ ЦИКЛОВ.............942
Хирургическая стерилизация (кастрация): овариогистерэктомия..942
Лапароскопическая стерилизация..943
Подавление циклической активности яичников стероидными гормонами .943
ПРОБЛЕМА: НЕЖЕЛАТЕЛЬНАЯ ЩЕННОСТЬ
У собак часто случаюся незапланированные вязки, и хозяева просят ветеринаров прервать щенность на ранней стадии, чтобы избежать трудностей, связанных со щенной собакой и нежелательным потомством. Такая проблема нередко возникает из-за того, что хозяева не заметили течки у своей собаки. С другой стороны, хозяин мог знать о том, что собака находится в эструсе, но недооценил ее влечения к противоположному полу. Даже самые опытные и осторожные владельцы иногда сталкиваются с тем, что их собака забеременела или могла забеременеть от несоответствующего кобеля.
Помимо спаривания с кобелем, явно не подходящим для сохранения чистоты породы, бывают и другие причины, по которым требуется аборт, - например, первый эструс у суки, или неправильное строение таза, препятствующее естественному разрешению от родов, или несоответствие размеров кобеля и суки. Причиной может служить и состояние здоровья собаки или просто нежелание владельцев, чтобы их собака щенилась в данное время.
Контрацептивные препараты, предотвращающие эстральный цикл путем задержки начала проэструса, вполне доступны, одобрены для применения у собак и эффективны. Однако эти препараты имеют свои ограничения, что мешает их широкому применению. Так, их нельзя давать собакам до первого эструса, нельзя применять в течение длительного времени, они могут влиять на поведение и активность животных, и, наконец, их не рекомен
дуется давать сукам, используемым в племенном разведении.
ПРЕДВАРИТЕЛЬНОЕ ОБСЛЕДОВАНИЕ (РИС. 22-1)
Прежде чем принимать меры в связи с незапланированной вязкой суки, следует тщательнейшим образом собрать анамнез. Видел ли сам владелец случку? Было ли это во время эструса? Когда у собаки была последняя течка? Не удалены ли у нее яичники? Хотя спаривание необязательно приводит к зачатию, сам факт спаривания говорит о том, что у собаки в это время была течка. Всегда остается вероятность того, что спаривания не было, если только хозяин сам не наблюдал его.
Наилучшим диагностическим методом, позволяющим оценить состояние неудачно повязанной собаки, является исследование влагалищного мазка. У подавляющего большинства собак через 24-36 часов после спаривания во влагалищном мазке выявляются сперматозоиды или их головки (рис. 22-2), а через 48 часов они просматриваются у половины собак (Olson, 1989). Наличие сперматозоидов или их головок в мазке подтверждает факт спаривания. В то же время их отсутствие еще не доказывает, что при спаривании не произошло оплодотворения.
По влагалищному мазку можно также установить стадию эстрального цикла. Если сука находится в диэструсе, анэструсе или в ранней или средней фазе проэструса (в мазке выявляются в основном
МЕРОПРИЯТИЯ В СЛУЧАЯХ НЕЖЕЛАТЕЛЬНОЙ ВЯЗКИ
СУКА СТАРШЕ 6 ЛЕТ?
ЕСТЬ ЛИ У НЕЕ СЕРЬЕЗНЫЕ ВРОЖДЕННЫЕ ПОРОКИ? ЯВЛЯЕТСЯ ЛИ ОНА ПОМЕСЬЮ (НЕЧИСТОПОРОДНОЙ)? ПРЕДСТАВЛЯЕТ ЛИ ЕЕ ПОМЕТ МАЛУЮ ЦЕННОСТЬ?
± УЗИ БРЮШНОЙ ПОЛОСТИ ЧЕРЕЗ 30 ДНЕЙ
в течение 2 дней, затем
0,2 мг/кг п/к 2 p/день до завершения аборта, подтверждаемого УЗИ
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
Рис. 22-1. Алгоритм дифференциальной диагностики и ведения сук, предположительно участвовавших в незапланированной (нежелательной для владельца) вязке
932 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
Рис. 22-2. Мазки из влагалища (А и Б) суки, взятые через 8 часов посте вязки. Обратите внимание на присутствие спср-матозои юв в мазках, подтверждающее факт вязки.
парабазальные и/или промежуточного типа клетки), оплодотворение маловероятно, и хозяевам не о чем беспокоиться. Однако если собака находится в эструсе, оплодотворение вполне возможно, так что собака может оказаться беременной. Присутствие в мазке более 80% поверхностных клеток, независимо о г наличия сперматозоидов, является веским аргументом в пользу стадии эструса (состояние течки). Однако если при этом концентрация прогестерона в плазме крови составляет менее 2 нг/мл, то. скорее всего, собака находится в стадии позднего проэструса, не имеет тяги к спариванию и нефер-тильна.
ЛЕЧЕНИЕ СУК, НЕ ПРЕДНАЗНАЧЕННЫХ ДЛЯ ПЛЕМЕННОГО РАЗВЕДЕНИЯ
Овариогистерэктомия (ОГЭ)
Существует несколько методов устранения последствий нежелательной вязки суки. Если сука не предназначена для племенного разведения, то наилучтим методом будет овариогистерэктомия (ОГЭ), и важно уговорить владельцев согласиться на нее, хотя порой это нелегко. ОГЭ навсегда исключит возможность нежелательной щенности. Эго безопасная недорогая операция, навсегда устраняющая все репродуктивные проблемы.
ЛЕЧЕНИЕ СУК, ПРЕДНАЗНАЧЕННЫХ ДЛЯ РАЗВЕДЕНИЯ
Обзор
При планировании аборта у суки нужно придерживаться следующих правил: 1) производить аборт только в том случае, если щенноегь подтверждена; 2) использовать препараты, которые при коротком или длительном введении безопасны для здоровья и будущей фертильности собаки; 3) применять надежные, легко вводимые препараты и только иод контролем ветеринара. За последние 10 15 лет в ветеринарную практику внедрен ряд препаратов, удовлетворяющих этим критериям.
«Триместры» щенности
Первый триместр. Первый период щенности начинается с момента оплодотворения яйцеклетки и заканчивается через несколько дней после имплантации плодов. В этом периоде щенность невозможно подтвердить, а индукция аборта затруднена из-за нечувствительности желтых тел к вводимым препаратам. На этой ранней стадии используют такие препараты, как эстрогены, простагландины и ингибиторы секреции или действия прогестерона. Однако делать этого не рекомец дуется, поскольку щенность еще окончательно не установлена и не исключено, что аборта нс требуется; более того, используемые в этот период препараты могут дать опасные побочные эффекты.
Второй триместр. Во втором триместре возможно подтвердить щенность и при необхо димости индуцировать аборт. Аборт происходит путем рассасывания либо изгнания плодов (рис.22-3); его можно вызвать простагландинами (природными или синтетическими), антипролактиновыми агентами (агонистами дофамина, такими, как бромокриптин и каберголин), антиссротонинергическими агентами (метерголин). комбинацией простагландинов с агонистами дофамина или же ингибиторами секреции (эпостан) или действия (мифепристон или агле-пристон) прогестерона. Индуцировать аборт после точного установления щенности намного предпочтительнее, чем делать это до ее подтверждения.
Третий гриместр. Третий триместр начинается с кальцификации скелетных структур плодов. Плоды уже достаточно развиты, и аборт производится путем их изгнания. Поскольку срок щенности может быть самым разным (например, при его расчете со дня вязки), индукция аборта иногда приводит к преждевременным родам живых щенков. Поэтому мы рекомендуем приступать к индукции аборта у собак между 30-м и 35-м днями после начала ди >ст-руса или после последнего спаривания (рис. 22-1).
Овариогистерэктомия
Сукам, помет которых предназначен для продажи или других целей. ОГЭ обычно не делают, так как
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 933
Агонисты дофамина Антагонисты серотонина Торможение секреции Прл
Агонисты ГнРГ
Антагонисты ГнРГ
Торможение секреции Л Г
Гипофиз
Простагландины
Блокада стероидогенеза
Сокращение гладких мышц
Антипрогестины
Блокада связывания прогестерона с рецепторами
Ингибиторы синтеза прогестерона
Блокада стероидогенеза
Пролактин
Яичник
ЖТ
ЖТ
Эстрогены
Влияние на мышечное сокращение
Изменение секреции маточных желез
Токсическое действие на
Изохинолоны
Блокада клеточного деления (антимитотическое действие)
эмбрионы
Рис. 22-3. Механизм индукции аборта у собак. Прл - пролактин; ГнРГ-гонадотропин рилизинг-гормон; Л1 -лютеинизирующий гормон; ЖТ - желтое тело. (Verstegen JPL: In Bonagura J [ed.]: Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p.947).
хозяева хотят сохранить их фертильность. Но и у таких сук следует принимать во внимание их возраст и репродуктивную способность а также возможные дефекты экстерьера, снижающие ценность их потомства. На самом деле, у многих сук репродуктивная способность оказывается сниженной из-за возраста, предыдущих болезней или других причин. Обсуждение этих вопросов поможет владельцу выбрать соответствующий способ лечения (Olson, Johnston, 1993).
Прерывание щенности до имплантации эмбрионов: эстрогены (не рекомендуются)
Физиология. Оплодотворение яйцеклеток и первые 6-10 дней развития эмбрионов происходят в яйцеводах (маточных трубах) (Jackson. Johnston, 1980). Спустя несколько дней развивающиеся эмбрионы мигрируют в матку и прикрепляются к эндометрию через плаценту для дальнейшего роста и питания. Задержка эмбрионов в яйцеводах в тот период времени, когда они должны мигрировать в магку и имплантироваться, приводит к их дегенерации и гибели. Именно в этом и состоит цель эстрогенной терапии: высокие дозы эстрогена продлевают время нахождения эмбрионов в яйцеводах (Post, 1995).
Эстрогены, введенные в достаточной дозе и в соответствующее время после нежелательной вязки, действуют по двум механизмам. Во-первых, эстро
ген сужает маточно-трубное соустье (место соединения яйцевода с маткой), тем самым предотвращая миграцию развивающихся эмбрионов в матку и продлевая время их нахождения в яицево ie. что приводит к прерыванию беременности (Soderberg, Olson, 1983). Во-вторых, эстроген может оказывать прямое разрушающее действие на яйцеклетку, а также вызывает изменения эндометрия, предотвращающие имплантацию плодов (рис. 22-3). Имеется несколько препаратов эстрогенов, которые традиционно используются для прерывания беременности у собак и кошек.
Диэтилстильбэстрол (ДЭС). Однократная или двукратная инъекция ДЭС в дозе от 2 до 25 мг/кг веса животного в пределах 5 дней после нежелательного спаривания успешно прерывает беременность. Однако сейчас инъекционный препарат ДЭС в продаже отсутствует. Было рекомендовано пероральное введение ДЭС в дозе 1-2 мг в день (Soderberg, Olson, 1983) или 75 мкг/кг веса в день (Bowen et al, 1985) в течение 7 дней после спаривания, но такая практика оказалась ненадежной: одиннадцать из 12 собак, получавших ДЭС во время проэструса, эструса и диэструса, забеременели (Olson et al, 1984; Bowen et al, 1985). Кроме того, ДЭС имеет ряд побочных >фФектов- которые будут обсуждены ниже.
Эстрадиола ципионат (ЭЦП). Эсл радиола ципионат (эстрадиол-17Р-циклопентнлпропионат) - производное эстрогена, обычно применяемое в ветеринарной практике для прерывания нежела-
934 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
тельной щенности (Jackson, Johnston, 1980). ЭЦП вводится внутримышечно однократно в период до трех дней после спаривания. При этом имеются три разные рекомендации относительно дозы ЭЦП: общая доза от 0,25 до 1 мг; 0,02 мг/кг веса, но при этом общая доза не должна превышать 1 мг; 0,04 мг/кг веса, но общая доза тоже не должна превышать 1 мг (Burke, 1986). ЭЦП обладает еще более тяжелыми побочными эффектами, чем ДЭС. При введении в дозе 0,02 мг/кг препарат предотвращал щенность только у 50% собак, находившихся в фазе проэструса или эструса, и у 75% собак, которые были в диэструсе. В дозе 0,04 мг/кг веса ЭЦП предотвращал щенность у всех собак, получавших его в фазах эструса и диэструса (Olson et al, 1984, Bowen et al, 1985).
ЭЦП обладает тяжелыми побочными эффектами, что ограничивает или даже исключает его применение, несмотря на обнадеживающие данные о способности препарата прерывать беременность. У двух из восьми собак, получавших ЭЦП в период диэструса, развилась пиометра (Bowen et al, 1985). Кроме того, известно, что ЭЦП способен вызвать длительное подавление функции костного мозга и/или его разрушение у собак, что приводит к тяжелой анемии, лейкопении, тромбоцитопении и гибели животного. Такой опасный для жизни синдром может развиться даже при введении ЭЦП в рекомендуемых дозах (Olson et al, 1984). Подавление функции костного мозга проявляется через 2-8 недель после введения препарата. В связи с этим производители препарата указывают, что ЭЦП противопоказан собакам, и мы также не рекомендуем его использовать.
Эстрадиола бензоат, эстрадиола валерат и эстрон. Эстрадиола валерат оказывает длительное действие, поэтому его рекомендуют вводить однократно в дозе от 3 до 7 мг в период с 4-го по 10-й день после вязки (Burk, 1986). Эстрадиола бензоат обладает более кратковременным действием, и рекомендуемая его доза составляет от 5 до 10 мкг/кг веса, при этом максимальная общая доза не должна превышать 1 мг/животное. Эту дозу разделяют на две или три подкожных инъекции, производимые с интервалами в 48 часов, начиная со 2-го по 4-й день после спаривания (Verstegen, 2000). Согласно другому протоколу, собаке делают три инъекции по 0,5-3,0 мг препарата через день в период с 4-го по 10-й день после спаривания (Burk, 1986). Предлагалось также использовать эстрон: его вводят однократно в дозе от 2,5 мг до 5,0 мг в пределах 5 дней после вязки (Burke, 1986).
Эффективность этих препаратов, а также эти-нилэстрадиола и даназола изучена недостаточно. Следует помнить, что на собак эстрогены могут оказывать опасное побочное действие. Другие методы терапии, как и сохранение щенности вплоть до родов, безопаснее введения эстроген-содержащих препаратов. Поэтому применение эстрогенов в ветеринарной практике не рекомендуется, а по
мнению большинства ветеринаров-териогенологов - недопустимо.
Пиометра, индуцированная эстрогенами. Считается, что препараты эстрогенов (ДЭС и ЭЦП) увеличивают частоту заболевания пиометрой. Эстрогены повышают связывание прогестерона с рецепторами, а тем самым и воздействие этого гормона на эндометрий, что предрасполагает к развитию у суки пиометры. Различают два синдрома пиометры у собак. Первый - это инфицирование матки у немолодых сук с приобретенной кистозной гиперплазией эндометрия (КГЭ). В этом случае пиометру можно рассматривать как осложнение хронической КГЭ. Вторым более частым и более неприятным синдромом пиометры является инфицирование матки у молодых сук, возникающее как следствие введения эстрогенов. Пиометра с открытой или закрытой шейкой матки развивается через 1-10 недель после введения эстрогена.
Механизм возникновения пиометры после введения эстрогенов до конца не понятен. При индукции аборта экзогенный эстроген вводится собаке, когда концентрация эндогенного эстрогена уменьшена (в эструсе) или низкая (в диэструсе). В результате собака подвергается воздействию эстрогена в таких концентрациях, которые не только выше физиологических, но и совершенно не характерны для данной стадии эстрального цикла. По-видимому, в этих условиях происходит стимуляция синтеза рецепторов прогестерона в эндометрии, что обеспечивает усиление действия прогестерона, выделяемого желтыми телами. Хроническая КГЭ не является следствием введения эстрогенов.
Наш клинический опыт показывает, что введение эстрогенов не приводит к длительному повреждению эндометрия. Однако возникающее на этом фоне преходящее заболевание матки (пиометра) не только представляет угрозу для жизни, но в большинстве клиник лечится посредством ОГЭ. В то же время, если пиометру, развившуюся после введения эстрогена, удавалось вылечить простагландинами, то в последующих циклах собаки благополучно донашивали беременность до родов (Nelson et al, 1982). Это указывает на отсутствие хронического повреждения эндометрия, хотя у части таких собак рецидивы пиометры все же имели место. Пиометру обнаруживали и у сук, никогда не получавших эстрогенов, но у молодых сук (моложе 6 лет) пиометра чаще всего возникает именно после введения эстрогенов. По указанным причинам (пиометра и деструкция костного мозга) применение эстрогенных препаратов для индукции аборта у собак решительно не рекомендуется.
Разрушение костного мозга под действием эстрогенов. Избыточное содержание эстрогена в сыворотке крови после введения экзогенного гормона нередко приводит к разрушению костного мозга у собак (Verstegen et al, 1981). Причины высокой чувствительности костного мозга к эстрогенам не совсем понятны. Разрушение костного мозга может
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 935
происходить и в результате сильного повышения в сыворотке крови содержания эстрогенов из эндогенных источников (например, при опухолевом перерождении клеток Сертоли или интерстициальных клеток у кобелей) (Suess et al, 1992). Но самым частым и опасным экзогенным источником избытка эстрогена является введение ЭЦП.
Вызванное эстрогенами разрушение костного мозга часто смертельно. Панцитопения приводит к подавлению иммунной системы, хроническим кровотечениям и анемии. Для сохранения жизни применяется традиционная поддерживающая терапия с многократным переливанием крови, которое обеспечивает временное улучшение. Но высокая стоимость и длительность лечения, неудовлетворенность его результатами и неутешительный прогноз заставляют большинство владельцев прибегнуть к эвтаназии их питомцев.
В качестве средства лечения гипоплазии костного мозга, обусловленной введением эстрогена, был предложен карбонат лития (11мг/кг перорально дважды в день в течение 6 недель) (Hall, 1992). Однако эффективность лечения карбонатом лития требует исследования на более представительных группах собак. Этот препарат дает целый ряд побочных эффектов, включая тремор, гипотиреоз, нефропатию почечных канальцев, отеки, сердечный синдром слабости синусового узла. Поэтому необходимо строжайшее наблюдение за больной собакой. Введение специфических для собак рекомбинантных колониестимулирующих факторов гранулоцитов может оказаться более действенным и безопасным средством, чем карбонат лития.
Лечение, вызывающее такой синдром, непростительно, и от него следует отказаться. Не вводите ЭЦП ни одной суке ни при каких условиях.
Влияние эстрогенов на поведение. Наименее серьезным побочным действием эстрогенотерапии является стимуляция или продление поведения, характерного для эструса (Jackson, Johnston, 1980). При этом суки обычно продолжают оставаться привлекательными для кобелей в течение 7-10 дней. У одних собак продлевается период течки, у других она начинается повторно.
Введение эстрогенов и будущая фертильность. Введение эстрогенов может привести к гибели животного вследствие деструкции костного мозга и пиометры с открытой или закрытой шейкой матки. Но даже собаки, избежавшие этих осложнений, иногда остаются бесплодными. Частота таких случаев плохо документирована. Бесплодие может быть следствием патологии яичников или матки, вызванной эстрогенами.
Простагландины. Общие сведения
Обоснование. Ветеринарные врачи испытывают необходимость в безопасном, надежном и сравнительно недорогом методе прерывания нежелательной щенности. Когда у породистых собак случается
незапланированная и нежелательная щенность, их владельцы предпочитают такие способы ее прерывания, которые не требуют хирургического вмешательства (кастрации) или чреватого тяжелыми осложнениями введения эстрогенов.
Ниже описан недорогой метод лечения, который можно использовать, пока не будут разработаны более эффективные методы прерывания беременности.
Физиология. Беременность у собак поддерживается секрецией прогестерона желтыми телами. Удаление яичников, ведущее к немедленной потере всего прогестерона, или торможение синтеза прогестерона на любой стадии щенности приводят к рассасыванию или изгнанию плодов. Неоднократно было показано, что введение простагландина F2a (ПГ F2a) или его аналогов успешно прерывает щенность у собак. В основе абортивного действия простагландинов лежат три механизма: 1) вызываемое этими агентами сужение сосудов приводит к снижению кровоснабжения желтых тел и, как следствие, к гибели их клеток; 2) действуя через специфические рецепторы, простагландины тормозят синтез прогестерона; 3) за счет воздействия непосредственно на миометрий они вызывают сокращение матки (Oettle et al, 1988; Lein et al, 1989; Romagnoli et al, 1991; Verstegen, 2000). Последний эффект оказывают только природные простагландины, но не их синтетические аналоги. Большинство исследований действия простагландинов было выполнено на лабораторных собаках в различных условиях эксперимента. Но имеется и несколько клинических сообщений, указывающих на перспективность применения ПГ F2a в ветеринарной практике для прерывания беременности у собак (Lein, 1983; Johnston, 1990; Feldman et al, 1993).
Обнаружено, что данное применение простагландинов имеет некоторые ограничения. Как показали наши исследования на больных пиометрой собаках, желтые тела относительно устойчивы к лю-теолитическому действию простагландинов в период с 14 по 28 дни беременности. После этого срока резистентность их падает, но все еще сохраняется. Поэтому в первые недели беременности щенные собаки не всегда поддаются действию простагландина, в отличие от второй половины беременности (начиная примерно с 30 дня после вязки).
Природные простагландины в сравнении с синтетическими. Природные простагландины (препараты Lutalyse, Dinolytic) обладают относительно краткосрочным действием и дают побочные эффекты, иногда весьма неприятные. В связи с этим понятен интерес к их синтетическим аналогам (таким, например, как клопростенол), которые лишены этих побочных эффектов и действуют в течение более длительного времени.
В настоящее время мы проводим клинические испытания, в которых оценивается эффективность ПГ F2a в качестве абортивного средства в обычных для ветеринарной практики условиях, т.е. примени
936 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
тельно к сукам-домашним питомцам, забеременевшим после нежелательного спаривания. На момент первичного обследования большинство собак находилось в стадии диэструса, так что точную дату начала этой стадии установить было невозможно.
Критерии для отбора собак. Начиная с 1986 г, в нашу клинику поступило свыше 120 сук, которых владельцы привели для прерывания щенности, после того как «видели» незапланированную, нежелательную вязку. Собак обследовали на 30-35 день после вязки. Прерывать щенность простагландинами можно только у здоровых сук моложе 7 лет. При ультразвуковом исследовании (УЗИ) брюшной полости оказалось, что более 60% этих сук не были беременны. Таким образом, ни наблюдения хозяев, ни проводимая ветеринаром пальпация не являются достаточным поводом для начала введения препаратов, прерывающих щенность.
Природные простагландины
Рекомендация к проведению лечения. УЗИ брюшной полости следует проводить приблизительно через 30 дней после последней (или нежелательной) вязки или на 30-й день после первого дня диэструса, установленного цитологическим исследованием влагалищного мазка. После подтверждения щенности метод проведения аборта следует обсудить с владельцем собаки. По нашему мнению, на этой стадии беременности простагландины являются наиболее эффективным и безопасным средством. Начинать лечение до 30-го дня не рекомендуется. Признаков напряжения или дистоции после введения простагландинов не наблюдалось ни у одной собаки. По-видимому, никаких затруднений для изгнания плодов и не должно быть, так как плоды еще настолько малы, что могут пройти через родовой канал, даже если находятся в неправильном положении.
Поскольку имеющийся в продаже препарат ПГ F2a не лицензирован для лечения собак, ветеринарам следует предварительно получить согласие клиентов на его введение. В ходе нашего исследования были испытаны три схемы введения ПГ F2a: 1) по 0,1 мг/кг подкожно каждые 8 часов; 2) по 0,25 мг/кг подкожно каждые 12 часов; 3) сначала по 0,1 мг/кг подкожно каждые 8 часов в течение двух дней и затем по 0,2 мг/кг подкожно каждые 8 часов. Сукам вводили природный ПГ F2a до полного изгнания всех плодов, что подтверждалось ультразвуковым исследованием брюшной полости. По причинам, указанным ниже, строго рекомендуется, чтобы суки находились в стационаре в течение всего периода введения простагландинов.
Мы рекомендуем третью схему лечения, а именно подкожное введение природного ПГ F2a сначала по 0,1 мг/кг каждые 8 часов в течение 2 дней и затем по 0,2 мг/кг веса каждые 8 часов ежедневно до полного завершения аборта, подтвержденного данными УЗИ. При использовании этой схемы отмечает
ся наименьшая выраженность побочных эффектов и аборт завершается в наиболее короткие сроки.
Контроль за проведением аборта. Мы проводили УЗИ брюшной полости каждые 48 часов до полного завершения аборта. Если наблюдаются схватки, изгнание плодов, кровянистые или темные выделения из влагалища, то мы рекомендуем проводить УЗИ с интервалом от 6 до 12 часов и перед сменой режима введения ПГ F2a. По крайней мере дважды в день нужно проводить физикальное исследование, включая пальпацию брюшной полости. После каждой инъекции ПГ F2a суку следует выводить на прогулку на 20-30 минут, тщательно наблюдая при этом за ней. Кормить ее нужно за 1-2 часа до введения простагландина во избежание рвоты перед инъекцией препарата. Время кормления тоже используется для наблюдения за собакой (Feldman et al. 1993).
До начало терапии у большинства сук со сроком щенности 30-35 дней в брюшной полости прощупываются амниотические пузырьки. У всех сук, взятых на лечение, УЗИ выявляло не менее двух живых плодов, хотя размеры плодов не всегда удавалось точно определить. Важно подчеркнуть, что после начала введения ПГ F2a пальпация уже не позволяет надежно определять ни начало аборта, ни его завершение; установить завершение аборта можно только с помощью УЗИ.
Необходимость повторных ультразвуковых исследований брюшной полости в процессе индукции аборта многих не устраивает, так как это дорогостоящая и требующая специального оборудования процедура. Однако это единственное надежное средство для оценки состояния щенности у суки. УЗИ легко выполнимо и дает немедленные результаты. Пальпация брюшной полости в этом отношении ненадежна, а в качестве единственного способа определения щенности или завершения аборта - неприемлема. Госпитализация сук рекомендуется, поскольку позволяет вести постоянное наблюдение за ними и избавляет хозяев от присутствия при аборте, если им этого не хочется.
Продолжительность лечения. У всех собак, получавших простагландин, полное изгнание плодов завершалось в течение 9 дней после начала введения ПГ F2a. Одним из веских аргументов в пользу госпитализации собак является резко отрицательная реакция многих хозяев на увиденные ими абортированные зародыши. Кроме того, в клинике обеспечивается уборка не съеденных собакой зародышей. Время, необходимое для завершения аборта, при данной схеме введения простагландина не сильно различается у разных сук; в среднем оно составляет 5-7 дней, колеблясь от 3 до 9 дней.
Окончание введения простагландина. У нас было несколько сук, у которых происходило изгнание одного или больше плодов, но при последующем УЗИ брюшной полости в матке просматривались оставшиеся живые плоды. В таких случаях требовалось вводить ПГ F2a еще от одного до трех дней для полного завершения аборта. Эти факты
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 937
показывают, что контроль за суками, получающими простагландины, без ультразвукового исследования ненадежен. Более того, у большинства сук невозможно было заметить, когда происходил выкидыш, - так быстро они съедали абортированные плоды. Те плоды, которые удавалось увидеть, выходили в плаценте и жили не более нескольких минут. Рассасывание плодов, хотя в принципе возможно, но маловероятно у сук, получавших простагландины, поскольку при УЗИ ни у одной из них в матке не было обнаружено остатков эмбриональных тканей (Feldman et al, 1993).
Концентрация прогестерона в крови. Предполагается, что щенность у собак прерывается при падении концентрации прогестерона в плазме крови ниже 2 нг/мл (Olson et al, 1986). У всех собак, находившихся в нашей клинике, концентрация прогестерона в плазме крови до начала лечения превышала 6 нг/мл. Как показано на рис. 22-4, эта концентрация снижалась после начала введения ПГ F2ay всех собак и уже через 24 часа составляла около 50% от первоначального уровня. Через 72 часа и при всех последующих взятиях крови концентрация прогестерона в плазме была ниже 2 нг/мл у всех собак. Изгнание плодов начиналось не ранее чем через 24 часа после снижения концентрации прогестерона до уровня ниже 2 нг/мл (Feldman et al, 1993). Определение прогестерона в плазме крови необязательно, но эти данные демонстрируют физиологический эффект простагландина и скорость его действия.
Побочные эффекты. Практически у всех собак отмечались побочные эффекты после каждой из нескольких первых доз простагландина. После первой инъекции ПГ F2a у всех собак проявлялся хотя бы один побочный эффект. Эти эффекты включали одышку, дыхательную недостаточность, избыточное слюноотделение, рвоту, дефекацию, затрудненное мочеиспускание и/или просто мочеотделение. У нескольких собак отмечалась тахикардия (свыше 180 ударов в минуту). Обычно побочные эффекты проявлялись через 30 секунд - 3 минуты после подкожной инъекции и продолжались от 4 до 55 минут, но чаще всего 5-20 минут.
Наиболее явные и тяжелые побочные эффекты наблюдались у сук, получавших первоначальную дозу 0,25 мг/кг. Постепенно собаки привыкали к ПГ F2 , и после каждой последующей инъекции выраженность побочных эффектов снижалась (Nelson et al, 1982). После 6-8 инъекций эти эффекты исчезали или сводились к минимуму независимо от схемы введения ПГ F2a.
В период от 24 до 48 часов до и после аборта у собак отмечались типичные признаки родов, включая слизистые выделения из влагалища, а также выделения от темнокрасного до черного цвета, схватки, беспокойство, «гнездовое» поведение, вылизывание промежности, падение ректальной температуры ниже 37,5 °C, дрожание и мышечные подергивания. Такие явления могут напугать хозяина или ветеринара, но редко бывают опасны для жизни собаки.
Рис. 22-4. Концентрации прогестерона (средние значения + SD [Стандартное отклонение]) в плазме крови собак в ходе индукции аборта подкожным введением простагландина (ПГ) F2a. Введение препарата проводили до полного завершения аборта, которое подтверждалось ультразвуковым исследованием брюшной полости. Собаки были разделены на три группы (по шесть щенных собак в каждой). Группе 1 (•—•) вводили 0,1 мг/кг каждые 8 часов; группе П (А—А) вводили 0,25 мг/кг каждые 12 часов; группе Ш (о—о) вводили 0,1 мг/ кг каждые 8 часов в течение двух дней и после этого 0,2 мг/ кг каждые 8 часов. Представлены данные, полученные перед началом лечения (день 0) и в последующие 1, 2, 3, 4, 5, 6, 7, 8 и 9-й дни лечения. Во всех случаях полное изгнание плодов завершалось не позже 9 дня лечения.
Слюноотделение, диарея, рвота и дыхательная недостаточность поддаются лечению атропином (0,5 мг/кг внутримышечно) (Lein et al, 1989).
Краткосрочные и отдаленные результаты. После выписки из клиники ни у одной из собак, леченных по указанным схемам, не отмечалось выделения каких-либо остатков плодного материала. Собаки оставались в клинике по крайней мере еще 24 часа после ультразвукового подтверждения окончания беременности. Физикальное исследование, проводившееся через 2 недели после лечения, показало, что все собаки были здоровы; у большинства из них не выявлялось влагалищных выделений. У нескольких собак были небольшие кровянистые выделения, но они полностью прекратились через 7-28 дней. У всех собак, которых наблюдали в течение 8 и более месяцев после аборта, восстановился нормальный эстральный цикл. У всех, кроме четырех, сук, повязанных после лечения простагландинами, родились здоровые щенки.
Выводы. ПГ F2a является безопасным и надежным средством для медицинского прерывания щенности. Побочные эффекты ПГ F2a преходящи и неопасны для жизни. До начала лечения щенность следует подтвердить. При использовании приведенной схемы лечения сук со сроком щенности 30-35 дней аборт завершается через 3-9 дней после начала введения препарата.
Комбинация простагландина и мизопростола
Имеется сообщение об успешной индукции аборта у 9 сук с помощью внутривлагалищного введения
938 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
мизопростола (производного простагландина Et) и инъекций природного простагландина. Мизопростол как компонент комбинированной схемы лечения успешно применялся для прерывания ранней беременности у женщин (Spritz et al, 1998). У всех 9 сук срок щенности превышал 30 дней. Средняя продолжительность лечения для индукции аборта составляла 5 дней в сравнении с семью днями при введении одного простагландина (Davidson et al, 1998).
Простагландины: введение сразу после вязки (не рекомендуется)
Схема введения. ПГ F2a был рекомендован для стимуляции у сук лютеолиза (дегенерации желтых тел) в раннем диэструсе с целью прерывания щенности. Лечение предложено начинать через 5 дней после начала диэструса, установленного цитологическим исследованием. В литературе приводятся различные дозы и схемы введения препаратов, включая подкожное введение природного простагландина по 0,25 мг/кг дважды в день в течение 4 дней. Лечение следует начинать не раньше чем на пятый день после цитологически подтвержденного начала диэструса (Romagnoli et al, 1991).
Недостатки. Эта схема лечения имеет несколько серьезных недостатков. Главная проблема - в том, что лечению подвергаются все «неудачно повязанные» суки, т.е. предполагается, что все они беременны. Однако в нашей практике после УЗИ брюшной полости выяснялось, что щенными были менее 40% таких сук. Вполне вероятно, что у большинства сук при естественной случке происходит оплодотворение. Однако очень часто хозяева только предполагают, что была случка, а на самом деле никто этого не видел, и случки могло не быть. Поскольку в настоящее время подтвердить щенность в первую неделю диэструса невозможно, то немедленное начало введения препарата по указанной схеме приводит к ненужному лечению нещенной собаки.
Вторым недостатком этой схемы лечения является необходимость определения первого дня диэструса с помощью цитологического исследования влагалищного мазка. Владелец собаки, спрашивающий у ветеринара совета по телефону, вряд ли может дать такую информацию и должен привести собаку на исследование. Если сука уже находится в фазе диэструса, то этот день можно считать за первый и начинать лечение через 5 дней. Но если она еще в фазе эструса, то придется каждые 24-72 часа брать вагинальные мазки, прокрашивать и описывать их, чтобы определить первый день диэструса.
Третьим недостатком является относительно высокая рекомендуемая доза препарата - 0,25 мг/ кг. Она необходима, поскольку в раннем диэструсе желтые тела устойчивы к действию простагландинов. Позже в диэструсе, когда резистентность желтых тел к простагландинам снижается, можно использовать более низкие дозы.
Наконец, авторы советуют примерно на 30-й день щенности провести УЗИ брюшной полости у всех сук, подвергнутых лечению, в целях определения успешности проведенного аборта. Предлагаемая схема представляется дорогой и неэффективной для лечения сук после нежелательной случки. Гораздо разумнее лечить только тех сук, у которых щенность установлена (по данным УЗИ на 30-й день после вязки), и продолжать лечение до полного завершения аборта.
Аналоги простагландинов
Обоснование. Аналогам простагландинов посвящено большое число исследований. Основными преимуществами аналогов перед природным ПГ F2a являются более высокая лютеолитическая активность в относительно низких дозах, меньшая тяжесть побочных эффектов и значительно более редкое возникновение маточных сокращений (Jackson et al, 1982). В зависимости от примененного аналога побочные эффекты варьируют от легких (Jackson et al, 1982) до тяжелых (Shille et al, 1984). Различные дозы и способы введения флупростено-ла и клопростенола стабильно обеспечивали абортивное действие при условии, что препарат вводили через 25 дней после первой вязки. Введение осуществлялось однократно подкожно или с помощью гибкого внутривлагалищного устройства; доза препарата - от 0,01 до 0,04 мг/кг. Эта единственная доза флупростенола или клопростенола вызывала аборт за счет длительного лютеолитического действия, приводившего к подавлению активности желтых тел. Постоянное поддерживание концентрации прогестерона на уровне ниже 2 нг/мл является, по-видимому, ключом к пониманию механизма индукции аборта простагландинами (Jackson et al, 1982). Временное падение концентрации прогестерона не приводит к аборту (Shille et al, 1984). Сообщалось, что мизопростол при внутривагинальном введении успешно прерывает беременность у женщин во втором триместре (Jain, Mishell, 1994). И флупросте-нол и клопростенол выпускаются для применения у крупных животных, но для лечения собак и кошек они не лицензированы.
Схема введения клопростенола. В ветеринарной литературе приводятся различные схемы введения аналогов простагландинов. Длительность действия клопростенола от 12 до 24 часов; он не вызывает сокращений матки и по сравнению с природными простагландинами оказывает меньше других побочных эффектов, связанных с сокращениями миометрия. Клопростенол рекомендуется вводить подкожно в дозе от 1 до 2 мкг/кг один раз в день в течение 5-7 дней, начиная не ранее чем с 30-го дня после вязки (Verstegen, 2000). У собак, леченных по этой схеме, концентрация прогестерона в плазме крови поддерживалась на уровне ниже 2нг/мл в течение более 24 часов после каждой инъекции. Одним из преимуществ как этой, так и
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 939
комбинированных схем лечения, описанных ниже, является то, что чаще происходит рассасывание плода, а не его изгнание. Однако это преимущество частично зависит от начала лечения в соответствующие сроки.
а-Простол. Недавно было опубликовано сообщение об использовании этого синтетического простагландина (фирменные названия - Gabbrostim; Centralvet-Vetem). Препарат вводили собакам по 20 мкг/кг один или два раза в день в течение 5 дней, начиная с 10-го дня диэструса, определенного путем цитологического исследования вагинального мазка (Romagnoli et al, 2000). Результаты оказались неудовлетворительными, но, возможно, лечение было начато слишком рано.
Лечение антипрогестинами
Обоснование. Введение антипрогестинов (антагонистов прогестерона) в эффективных дозах предупреждает наступление беременности или прерывает ее, если препараты вводятся до имплантации. Такой эффект отмечен у млекопитающих различных видов. Показано, что антипрогестины связываются с высоким сродством с рецепторами прогестерона и тормозят вызываемые прогестероном изменения транскрипции дезоксирибонуклеиновой кислоты (ДНК). Следует также заметить, что они сокращают интервалы между эстральными циклами (Galac et al, 2000).
Мифепристон (RU486). Мифепристон - блокатор рецепторов прогестерона, способный предотвращать беременность и/или вызывать начало менструаций у женщин (Spitz et al, 1998). Препарат активен при пероральном введении, и было показано, что он безопасно и эффективно прерывает щенность у собак при введении после 30-го дня беременности. В ходе клинических испытаний мифепристона его давали внутрь в дозе 2,5 мг/кг дважды в день в течение 4-5 дней, начиная с 32-го дня точно установленного срока щенности (Concannon et al, 1990). Концентрация прогестерона в сыворотке крови падала до уровня ниже 1 нг/мл к 40-45-му дню от преовуляторного пика лютеинизирующего гормона (ЛГ). Щенность прерывалась без побочных эффектов после 3^4 дней лечения.
Как и в случаях введения простагландинов в середине щенности, аборт происходил путем изгнания плодов, и собака съедала их, в противном случае их приходилось убирать. У всех собак аборт полностью завершался еще до того, как концентрация прогестерона в сыворотке крови падала ниже 2 нг/мл. Это показывает, что препарат действует на уровне матки как блокатор рецепторов прогестерона, независимо от какого-либо его дополнительного эффекта на функцию желтых тел. Преждевременное прекращение функции желтых тел может быть результатом либо прерывания беременности, либо прямого лютеолитического действия препарата. Какие дозы могли бы быть эффективны до имплан
тации или на ранней стадии беременности - пока не установлено (Concannon et al, 1990).
Действие однократного подкожного введения RU486 было испытано на восьми собаках со сроком беременности от 11 до 56 дней. RU486 вводили в дозах от 10 до 22,7 мг/кг. Аборт произошел у шести из восьми собак. Две оставшиеся собаки произвели на свет здоровых щенков; эти собаки получили самую низкую дозу препарата (10 мг/кг) и в срок близкий к родам (на 56-й день беременности). Ни у одной собаки не наблюдалось побочных эффектов (Sankai et al, 1991). Возможность стимулировать аборт у собак путем однократной подкожной инъекции представляет интерес. Но остается та же проблема, которая встречается и при других способах прерывания щенности, а именно невозможность предсказать, когда именно произойдет аборт. Поэтому госпитализация собак все равно требуется (Concannon, Meyers-Wallen, 1991).
Аглепристон (RU534). В нескольких европейских странах в продажу поступил новый анти-прогестероновый препарат для собак: RU534 под фирменным названием ализин (Alizin; произ-во Hoechst Roussel Vet, Франция). В трех проведенных исследованиях RU534 вводили в дозе 10 мг/кг два раза с интервалом в 24 часа. В одном из исследований препарат испытывали на 367 собаках со сроком щенности от 0 до 45 дней, в другом - на 124 собаках со средним сроком щенности 30 дней. В обеих группах препарат действовал в первый же день введения у 95% собак с установленной щенностью (Fieni et al, 2000а, 2000b; Verstegen 2000). Никаких генерализованных или местных побочных эффектов не наблюдалось, за исключением набухания молочных желез и лактации (Fieni 1995; Galac et al, 2000). В третьем исследовании двум группам собак давали RU534 по 0,15 мг/кг веса дважды с интервалом в 24 часа (Fieni et al, 2000а, 2000b). В одной группе собаки находились на раннем сроке щенности (в среднем 13 дней после овуляции), а в другой группе - в середине периода щенности (в среднем 32 дня после овуляции). В первой группе собак лечение привело к рассасыванию эмбрионов, а у собак второй группы происходило изгнание плодов. Надо надеяться, что этот препарат будет доступен во многих странах. Поскольку RU534 эффективен, безопасен и не дает побочных эффектов, он мог бы быть прекрасным альтернативным средством для собак и кошек.
Эпостан. Экспериментально показана способность эпостана тормозить синтез прогестерона. Препарат снижает продукцию этого гормона, действуя как конкурентный ингибитор ферментной системы дегидрогеназа-изомераза гидроксистероидов. У большинства видов эффект эпостана больше выражен в яичниках, чем в надпочечниках. Для прерывания щенности эпостан давали собакам перорально в дозе 50 мг/кг веса в течение 7 дней, начиная с первого дня диэструса, определенного цитологически (Keister et al, 1989). В последние
940 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
годы возрос интерес к коммерческому эпостану как средству прерывания нежелательной щенности. Однако необходимы дальнейшие испытания для определения его безопасности, эффективности и оптимальных доз для собак различных пород (Concannon, Meyers-Wallen, 1991).
Агонисты дофамина
Обоснование. Поскольку пролактин является основным лютеотропным гормоном у собак, торможение его синтеза и секреции подавляет функцию желтых тел и снижает секрецию прогестерона. Достаточно продолжительное лечение агонистами дофамина во время второго «триместра» щенности приводит к лютеолизу. Дело в том, что секреция пролактина регулируется путем прямого торможения дофамином на уровне гипофиза и опосредованной стимуляции серотонином на уровне гипоталамуса; при этом серотонин действует за счет того, что подавляет секрецию дофамина. У щенных сук секреция пролактина значительно возрастает в период с 25-го по 30-й день после пика ЛГ. В это время аборт можно индуцировать путем перорального или внутрибрюшинного введения агонистов дофамина. Такими агонистами являются бромокриптин и каберголин. Они подавляют секрецию пролактина, действуя непосредственно на рецепторы дофамина в гипофизе. Метерго-лин, один из антагонистов серотонина, подавляет секрецию пролактина на уровне гипоталамуса (Verstegen, 2000). При использовании этих препаратов обычно наблюдается сокращение интервала между эстральными циклами.
Бромокриптин. Бромокриптин (парлодел) - препарат одного из алкалоидов спорыньи, применяемый у людей для лечения, в первую очередь, гиперпролактинемии (Webster et al, 1994). Его использование в ветеринарии официально разрешено только в Италии. Бромокриптин оказался эффективным абортивным средством при его введении после 35-го дня и не ранее 30-го дня щенности. Описаны различные схемы введения. Согласно одной из схем, сукам давали бромокриптин перорально по 0,1 мг/кг в день ежедневно в течение 6 дней, начиная с 35-го дня щенности (Concannon et al, 1987); по другой схеме бромокриптин давали перорально в дозе 0,03 мг/кг два раза в день в течение 4 дней, начиная с 30-го дня щенности. Бромокриптин, как правило, вызывает потерю аппетита, рвоту и депрессию. Более того, при стимуляции аборта ранее 40-го дня щенности его эффективность ниже 100%. Поскольку бромокриптин оказывает более тяжелые и длительные побочные эффекты, чем простагландины, он используется редко.
Каберголин. Каберголин (Dostinex), как и бромокриптин, представляет собой синтетическое производное алкалоида спорыньи и является агонистом рецепторов дофамина длительного действия, подавляющим секрецию пролактина. Этот препа
рат высокоактивен при пероральном или парентеральном введении. Он выпускается в таблетках по 0,5 мг, но является дорогостоящим препаратом. Каберголин в дозе 5 мкг/кг, даваемой один раз в день ежедневно, вызывал у сук резкое падение концентрации пролактина в сыворотке крови и приводил к аборту без заметных системных побочных эффектов (Arbeiter et al, 1988; Post et al, 1988; Jochle et al, 1989). При лечении женщин с гиперпролактинемией препарат оказался более эффективным, чем бромокриптин, и легче переносился (Webster et al, 1994). В указанной дозе каберголин стимулировал аборт в 100% случаев, если его начинали вводить с 40-го дня после пика ЛГ, и только в 25% случаев, если лечение начинали с 30-го дня (Verstegen et al, 1993). При подкожном введении в дозе 1,65 мкг/кг через день в течение более 5 дней каберголин был более эффективен: он вызывал аборт в 100%, 66% и 25% случаев при начале введения, соответственно, через 40, 30 и 25 дней после пика ЛГ (Onclin et al, 1995). Однако инъекционный препарат каберголи-на малодоступен.
Комбинация простагландина и агониста дофамина
Обоснование. В литературе описано одновременное введение простагландина и агониста дофамина для стимуляции аборта. Целью комбинации двух препаратов было снизить концентрацию прогестерона и тем самым прервать беременность, действуя, во-первых, путем прямого локального угнетения синтеза прогестерона в желтых телах (простагландин) и, во-вторых, косвенным путем через подавление секреции пролактина (агонист дофамина). При этом используются более низкие дозы обоих препаратов, что ослабляет побочные эффекты, наблюдаемые при введении только простагландина.
Схема введения и результаты. Лечение рекомендуется начинать через 25 дней после пика ЛГ или в период с 25-го по 28-й дни после первой вязки. Клопростенол вводили подкожно в дозе 1,0 мкг/кг через день в течение 5 дней (три инъекции); кроме того, в течение 9 дней давали перорально каберголин (5 мкг/кг веса). Прерывание щенности произошло в 100% случаев у 5 биглей, получавших препараты по этой схеме в течение 5-8 дней (Onclin, Verstegen, 1996). Беременность прекращалась исключительно путем рассасывания плодов. Никаких побочных эффектов не наблюдалось, но у всех собак были небольшие кровянистые выделения из влагалища. Во всех случаях прерывание щенности сопровождалось снижением концентрации прогестерона в плазме крови до уровня ниже 1,0 нг/мл в течение 72 часов после начала лечения. Если препараты начинали давать позже 40-го дня после вязки, то происходило изгнание, а не рассасывание плодов. Лечение, начатое до 25-го дня, было менее эффективным (Verstegen, 2000).
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 941
Глюкокортикоиды
Встречаются случаи, когда у щенной суки развивается заболевание, требующее лечения глюкокортикоидами. К числу таких патологий относятся иммуно-опосредованные болезни, в частности тромбоцитопения, гемолитическая анемия, полиартрит, красная волчанка и другие. В таких ситуациях здоровье суки бывает важнее выживания ее плодов. Введение дексаметазона (5 мг внутримышечно 2 раза в день) в течение 10 дней вызывает внутриматочную гибель и рассасывание плодов, если лечение начато на 30-й день щенности, либо изгнание плодов, если лечение начато с 45-го дня (Jackson, Johnston, 1980). Поэтому рекомендуется, если возможно, избегать введения глюкокортикоидов щенным сукам. Во всяком случае хозяева собаки до начала лечения должны получить полную информацию о возможных побочных эффектах.
Дексаметазон может быть использован для прерывания щенности. У биглей этот эффект достигался после введения приблизительно 0,5 мг/кг внутримышечно два раза в день в течение 10 дней (Shille, 1985). Лабрадорам ретриверам вводили около 0,15 мг/кг внутримышечно один раз в день в течение 10 дней. Сейчас применение дексаметазона для прерывания щенности не рекомендуется, так как он подавляет иммунную систему, а аборт, если он происходит, менее предсказуем, чем при введении простагландина.
Антагонисты гонадотропин рилизинг-гормона
Антагонисты гонадотропин рилизинг-гормона (ГнРГ; гонадолиберин) действуют путем быстрого подавления гипофизарной секреции ЛГ и фолликулостимулирующего гормона (ФСГ). Падение уровня гонадотропных гормонов должно тормозить синтез и секрецию стероидов яичниками. И действительно, однократное введение антагониста ГнРГ в период середины беременности угнетает функцию желтых тел и прерывает щенность (Vickery at al, 1989). При введении в более ранние сроки беременности эффективность препарата ниже. Если антагонист ГнРГ вводить вместе с аналогом простагландина однократно на второй день диэструса, то люте-олитическое действие продлевается и повышается эффективность прерывания щенности. Антагонисты ГнРГ рассматриваются как экспериментальные средства; их применение еще недостаточно изучено и пока не рекомендуется (Concannon, 1991).
Тамоксифена цитрат
Цитрат тамоксифена, изомера трифенилэтилена, у женщин в пременопаузальном периоде действует как антиэстроген, но у собак проявляет эстрогенную активность. Он, по-видимому, препятствует транспорту зиготы и/или имплантации плода. При
начале лечения в проэструсе, эструсе или на 2-й день диэструса тамоксифена цитрат эффективно предотвращал или прерывал щенность (Bowen et al, 1988). При начале лечения на 15-й или 30-й день диэструса действие препарата было намного слабее: у 50% сук в обеих группах сохранилась нормальная беременность. Все собаки получали препарат перорально в дозе 1 мг/кг веса дважды в день в течение 10 дней. Из 20 собак, получавших тамоксифена цитрат, у пяти развился эндометрит с пиометрой или без пиометры и у четырех из них - кисты яичников. Хотя данный препарат может предотвращать или прерывать щенность, при введении по схеме, приведенной в рассмотренной работе, он недопустимо часто вызывал патологические изменения в репродуктивном тракте (England, 1998).
Ведение суки после нежелательной вязки
Как следует из рис. 22-1, клинический подход к ведению собаки после нежелательной вязки должен быть практичным и логически обоснованным. Если владельцы собаки обратились к ветеринару в первые 24-36 часов после спаривания, то следует начать с проведения обследования. Это позволит сделать цитологический анализ влагалища, чтобы определить, во-первых, стадию эстрального цикла и, во-вторых, присутствие сперматозоидов в вагинальном мазке. Если в мазке обнаружены сперматозоиды или если анализ мазка подтверждает, что собака была в стадии эструса, то она вполне может оказаться щенной, поэтому через 30 дней следует провести УЗИ брюшной полости. Если же сперматозоиды не обнаружены или же анализ мазка указывает скорее на ранний или средний проэструс или на диэструс, то щенность маловероятна. УЗИ брюшной полости можно рекомендовать, но результат, скорее всего, будет отрицательным.
Если УЗИ брюшной полости, проведенное через 30 дней после вязки, выявило, что сука щенная, то ее владельцу нужно разъяснить, что есть три варианта дальнейшей тактики: овариогистерэктомия, сохранение беременности или же лечение с целью индуцировать аборт. Специфические препараты для индукции аборта следует выбирать, основываясь на их доступности и опыте ветеринара.
Если для лечения выбран простагландин, то сука должна находиться в стационаре до полного завершения аборта. Природный ПГ F2ct вводится подкожно в дозе 0,1 мг/кг три раза в день в течение двух дней, а затем по 0,2 мг/кг веса дважды в день до завершения аборта. Следует помнить, что плоды, не съеденные собакой, должны быть ликвидированы. УЗИ повторяют, по крайней мере, каждые 48 часов, пока не подтвердится окончание аборта (обычно после 4-9 дней лечения). Можно провести УЗИ брюшной полости раньше намеченного по графику времени, если имеются признаки аборта (изгнание плодов, напряжение, «гнездовое» поведение, кровянистые или зеленоватые выделения из
942 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
влагалища). Нужно стараться вводить простагландин в количестве, не превышающем необходимое для окончания аборта.
После каждой инъекции суку следует выгуливать в течение 30-60 минут, чтобы заметить побочные эффекты (например, шок или тяжелую тахикардию) и оказать нужную помощь. При одышке, дыхательной недостаточности, рвоте или диарее можно ввести атропин (5 мг/кг внутримышечно). Если собака близка к шоку (что мы наблюдали только у двух из более чем 120 собак, получавших простагландины по поводу пиометры, и ни у одной из собак, у которых индуцировали аборт), бывает необходимо срочное внутривенное введение жидкости. В случаях сильной тахикардии или желудочковой аритмии используют соответствующие лекарства. Нужно подчеркнуть, что хотя побочные эффекты проявляются часто, но они, как правило, неопасны для жизни и редко бывают настолько тяжелы, что требуют медицинского вмешательства.
ПРЕДОТВРАЩЕНИЕ ЭСТРАЛЬНЫХ ЦИКЛОВ
Имеется несколько методов лечения, которые можно предложить владельцам для предупреждения течки у их собак. Самый радикальный и распространенный метод, обеспечивающий полную стерильность и прекращение циклической активности, - это овариогистерэктомия. Но иногда требуется обратимая контрацепция с помощью фармакологических средств; фармакологическая контрацепция предупреждает или задерживает наступление эструса, не влияя на фертильность животного в будущем. Контрацептивы обычно используют охотничий сезон или в период полевых испытаний и выставок собак, поскольку состояние эструса обычно мешает собакам участвовать в этих мероприятиях. Владельцы собак в Северной Америке, как правило, не хотят заниматься введением препаратов своим питомцам и потому предпочитают овариогистерэктомию.
Хирургическая стерилизация (кастрация): овариогистерэктомия
Рекомендуемая процедура. Для стерилизации (кастрации) сук рекомендуется овариогистерэктомия (ОГЭ). Эта операция широко применяется и не имеет недостатков. Она обладает явными преимуществами перед такими методами, как перевязка или удаление маточных труб или удаление только матки, которые приводят к стерилизации, но не устраняют овариальные циклы с соответствующим изменением поведения собаки во время эструса. Более того, поскольку яичники остаются, они могут стать местом образования опухоли, инфицирования или перекрута. При удалении только яичников (ова-риэктомия) остается матка, которая тоже является местом возможного инфицирования. В то же время овариэктомия как часть ОГЭ имеет то дополнительное преимущество, что значительно снижает риск
возникновения опухолей молочных желез, если операция проведена до первого эстрального цикла (Schneider, 1990).
Качество операции. Для проведения операции необходим опытный хирург. Хотя ОГЭ и считается рутинной процедурой, это серьезная хирургическая операция, чреватая различными осложнениями, в частности инфицированием раны, расхождением ее краев, образованием спаек; к числу возможных проблем относится и неполное удаление органов. При неполном удалении яичников у суки могут продолжаться эстральные циклы (см. гл. 24). Если ОГЭ включает удаление шейки матки и краниального свода влагалища, то осложнения после операции крайне редки. Однако сохранение шейки или хотя бы небольшой части ткани матки создает риск их инфицирования (см. гл. 23). Тщательное наложение лигатур дорсально-проксимально от яичников и проверка полного удаления тканей до наложения швов снижают вероятность осложнений.
Лактация после ОГЭ. Лактация, даже если она не сопровождается воспалением молочных желез, почти всегда воспринимается как неожиданная и досадная неприятность после удачно проведенной ОГЭ. Эта проблема чаще наблюдается у кошек, чем у собак. Владельцы в таких случаях обычно считают, что хирург сделал что-то неправильно. Однако чаще всего лактация представляет собой нормальный физиологический ответ на резкое падение концентрации прогестерона в крови после удаления яичников в фазе диэструса. Снижение уровня прогестерона стимулирует секрецию пролактина и окситоцина, как это происходит и при родах. Лечение этого неприятного, но нормального последствия операции такое же, как и при ложной беременности у собак (см. гл. 21).
ОГЭ в препубертатном возрасте. Вопрос о том, в каком возрасте сукам следует проводить ОГЭ, был предметом серьезных дискуссий. В настоящее время считается неправильным распространенное ранее мнение, что сук не следует кастрировать до шестимесячного возраста или до первых одного-двух эстральных циклов. Как было показано в ряде исследований, физическое и поведенческое развитие не различается у щенков (независимо от пола), кастрированных в возрасте 7 недель или 7 месяцев (Salmeri et al, 1991; Howe et al, 2001).
Главная цель кастрации сук (или кобелей) в возрасте до 5-6 месяцев -снижение количества ненужных щенков, создающих проблему для нашего общества (Theran, 1993). Ежегодно миллионы таких щенков и котят подвергаются эвтаназии. Кастрация щенков в препубертатном возрасте не устраняет этой проблемы, но все-таки уменьшает ее. Ранняя кастрация по крайней мере безвредна, тогда как цена, эмоциональная и финансовая, миллионов ежегодных эвтаназий действительно высока. Если в дальнейшем не выявится серьезный вред от кастрации 6-12-недельных щенков, то ветеринары должны приветствовать и поддерживать ее. В на
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 943
стоящее время проведение ранней кастрации одобрено Ассоциацией американских ветеринарных клиник, Британской ветеринарной ассоциацией и Американской коллегией ветеринаров-териогено-логов (Johnston et al, 2001).
Ожирение после ОГЭ. Считается, что ОГЭ может быть причиной ожирения. В ряде исследований было показано, что после кастрации у сук повышался аппетит и они прибавляли в весе (Concannon, Meyers-Wallen, 1991), но по другим данным ОГЭ не оказывает такого эффекта (Salmeri et al, 1991). Разумно предупредить владельцев, что некоторые собаки склонны к ожирению после ОГЭ, но прибавку веса можно контролировать с помощью физических нагрузок и ограничения в еде. Одно лишь ограничение в еде не всегда решает проблемы ожирения.
Владельцы иногда беспокоятся по поводу того, что собака лишается гормонов яичников и, соответственно, той пользы, которую они дают. Однако концентрация прогестерона и эстрогена у овариэк-томированных сук близка к таковой у сук в анэструсе, поэтому нет очевидных медицинских причин для отказа от ОГЭ или откладывания операции. Даже если после операции у суки проявится склонность к ожирению, ее вес и активность можно будет контролировать.
Лапароскопическая стерилизация
Для сук разработаны методы лапароскопической стерилизации, в ходе которых производят окклюзию рогов матки или маточно-трубных соустьев, используя с этой целью электрокоагуляцию либо пластиковые зажимы. Какой бы из этих методов ни применялся, ветеринар должен быть уверен в том, что проведена полная двусторонняя закупорка репродуктивного тракта. Лапароскопическая стерилизация - быстрая и безопасная операция, которую можно проводить у сук молодого и препубертатно-го возраста, и ее можно использовать для массовой стерилизации (Wildt, Lawler, 1985). Однако после операции суки продолжают циклировать, спариваться и привлекать кобелей, так что следует учитывать неудобства продолжающейся овариальной активности.
Подавление циклической активности яичников стероидными гормонами
Обоснование. Различные природные и синтетические стероидные гормоны тормозят циклическую активность яичников у собак. Как правило, это торможение обратимо и зависит от продолжительности воздействия гормона. Когда введение препарата прерывают и его эффект прекращается, эстральный цикл обычно, хотя и не всегда, возобновляется. Действие стероидов осуществляется на уровне гипофиза и/или гипоталамуса по механизму отрицательной обратной связи и приводит к подавлению синтеза и секреции гонадотропинов.
Следует учитывать, что стероидные препараты обладают побочным действием. Применение прогестагенов способствует развитию кистозной гиперплазии эндометрия (КГЭ), которая может сопровождаться развитием пиометры и/или увеличением молочных желез, причем в последнем случае возможна лактация после отмены препарата. Андрогены способны вызвать маскулинизацию поведения и экстерьера. Поэтому владельцев собак необходимо предупредить о возможных побочных эффектах. Нужно с особым вниманием отнестись к дозировке препаратов и введению их в соответствующей фазе эстрального цикла, а также учитывать медицинский анамнез собаки и результаты ее физикального обследования.
Мегестрола ацетат. Сведения о препарате. Прогестин мегестрола ацетат выпускается в США в форме таблеток, содержащих по 5 мг и 20 мг препарата, под фирменным названием Овабан (Ovaban). Ежедневная пероральная доза и режим введения зависят от того, начинается ли лечение во время анэструса или проэструса (табл. 22-1). Механизм действия препарата точно неизвестен, но предполагается, что он подавляет секрецию гонадотропинов гипофизом или секрецию гонадотропин рилизинг-гормона гипоталамусом либо оказывает оба эти эффекта. Мегестрола ацетат, возможно, имитирует действие эндогенных стероидов яичников, осуществляемое по механизму обратной связи.
Противопоказания. Основные противопоказания к применению мегестрола ацетата у собак включают любые заболевания репродуктивных органов и опухоли или увеличение молочных желез. Препарат противопоказан также щенным собакам или с предполагаемой щенностью, так как он может привести к маскулинизации плодов женского
ТАБЛИЦА 22-1. ИНФОРМАЦИЯ ПО ПРИМЕНЕНИЮ МЕГЕСТРОЛА АЦЕТАТА*
В КАЧЕСТВЕ КОНТРАЦЕПТИВА, ПРЕДОТВРАЩАЮЩЕГО ЭСТРУС
Продается в качестве контрацептива для собак Синтетический прогестин; в таблетках; пероральное введение
Низкая ежедневная доза в течение одного месяца (например, 0,55 мг/кг /день в течение 32 дней) в анэструсе задерживает следующий эстральный цикл на 2-8 месяцев,
Высокая доза (например, 2,2 мг/кг /день) в течение 8 дней применяется в раннем проэструсе для прерывания течки Рекомендуется не более двух последовательных курсов лечения
Необходимо предварительное исследование репродуктивных органов и влагалищного мазка для установления стадии анэструса или раннего проэструса, а также отсутствия щенности
Возможные осложнения: заболевание/гиперплазия матки или молочных желез; усугубление тяжести сахарного диабета или гепато-билиарных нарушений
При начале введения препарата в позднем проэструсе может начаться течка с сохранением фертильности____
'Овабан (Shering Corp.)
944 • ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
пола и, как и все прогестагены, вызывает задержку родов. Препарат не следует применять до или во время первого эстрального цикла. Если в первые 30 дней после отмены препарата начался эструс, нужно предотвратить вязку. Не следует проводить более двух последовательных курсов применения мегест-рола ацетата в связи с угрозой развития КГЭ. Препарат противопоказан также собакам с сахарным диабетом или с подозрением на сахарный диабет, поскольку прогестагены являются антагонистами инсулина.
Побочные эффекты. При применении мегест-рола ацетата побочные эффекты отмечаются редко. По данным клинических исследований, в отдельных случаях возникают преходящие прогестационные побочные эффекты, такие, как увеличение молочных желез, лактация, беспокойство, повышенный аппетит, изменение темперамента. Длительное применение препарата может предрасполагать к развитию сахарного диабета или акромегалии, или обоих заболеваний (Harding, 1981; Concannon, Meyers-Wallen, 1991). Ветеринары должны соблюдать дозы, предлагаемые производителями препарата. Пиометра развивается у относительно немногих сук (<1%). Было показано, что у кошек применение мегестрола ацетата подавляет функцию коры надпочечников (см. гл. 8).
Лечение в фазе анэструса. Для задержки наступления проэструса и эструса рекомендуется введение мегестрола ацетата в дозе 0,55 мг/кг перорально один раз в день ежедневно в течение 32 дней. После отмены препарата эстральный цикл может возобновиться в любое время: по данным клинических испытаний, эструс начинался через 1-7 месяцев после отмены (в среднем через 4-6 месяцев). Если препарат начать давать суке в самом начале анэструса, то его действие прекратится слишком рано, и какой-либо заметной задержки следующего цикла не произойдет. Если же к введению мегестрола ацетата приступить слишком поздно, у суки может начаться проэструс на фоне лечения или вскоре после его отмены, и тогда следует перейти на дозы, необходимые во время проэструса. Поэтому, прежде чем начинать лечение мегестрола ацетатом в фазе анэструса, рекомендуется определить интервалы между прошлыми эстральными циклами у суки. Лечение должно начинаться за 1-2 недели до ожидаемого начала проэструса (Concannon, 1983).
Лечение в фазе проэструса. Для того чтобы прервать или отсрочить проэструс, введение мегестрола ацетата начинают с первых трех дней этой фазы цикла. Схема лечения основана на предположении, что суке свойственна обычная (среднестатистическая) длительность проэструса. Если же проэструс у суки продолжается меньше 4 дней или больше 20 дней, применять данную схему лечения не рекомендуется (Harding, 1981). До начала введения препарата следует подтвердить раннюю стадию проэструса с помощью цитологического исследования влагалища.
Для сук в проэструсе рекомендуемая доза мегестрола ацетата составляет 2,2 мг/кг перорально один раз в день в течение 8 дней. Собаку нужно держать в изоляции, пока не прекратятся кровянистые выделения из влагалища, или в течение 1-2 недель - во избежание спаривания и последующей беременности, возможной в том случае, если лечение было начато слишком поздно. Отчетливое подавление проэструса происходит на 3-8-й день лечения, при этом цикл обычно задерживается на 4-6 месяцев. Однако если лечение начато слишком рано, то проэструс может наступить вскоре после отмены препарата. Если же препарат начинают давать на поздней стадии проэструса, то течка может начаться на фоне лечения.
В Великобритании используются и другие схемы введения мегестрола ацетата (Evans, 1988).
Миболерон. Сведения о препарате. Миболерон применяется для предотвращения эструса у взрослых собак, не предназначенных для племенного разведения. По сравнению с метилтестостероном миболерон в 41 раз активнее как анаболический агент и в 16 раз активнее как андроген. Он не обладает заметной прогестационной или эстрогенной активностью, но, по-видимому, подавляет секрецию ЛГ. Препарат под фирменным названием Чек (Cheque; произ-во Pharmacia & Upjohn) выпускается в форме раствора (100 мг/мл), который удобно добавлять в пищу.
Побочные эффекты. Миболерон не следует вводить щенным сукам или сукам с перианальной аденомой, аденокарциномой или другими андро-ген-зависимыми новообразованиями. Андрогенные эффекты препарата включают увеличение клитора, садки и появление мускусного запаха тела. Примерно у 10% леченных миболероном сук появились белесые вязкие выделения из влагалища, и у некоторых сук во влагалище, позади отверстия уретры образовались небольшие слизистые везикулы.
Миболерон не рекомендуется назначать собакам с болезнями печени или почек в анамнезе, поскольку препарат подвергается превращениям в печени и продукты его метаболизма выделяются с мочой и калом. Изредка в процессе лечения у собак развивается желтуха, что требует отмены препарата. При длительном лечении миболероном (более 8 месяцев) необходимо периодически проверять функцию печени. Препарат следует применять осторожно и не назначать сукам моложе 7 месяцев, так как он может вызвать преждевременное закрытие эпифизов.
Злоупотребление препаратом. Некоторые «побочные эффекты» миболерона таковы, что побуждают владельцев собак к его применению. Миболерон как мощный андроген увеличивает мышечную силу, выносливость и агрессивность у сук. Эти свойства требуются при полевых испытаниях, и такие побочные эффекты рассматриваются как положительные. Применение препарата в этих целях не рекомендуется, однако известно, что это делается.
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА • 945
ТАБЛИЦА 22-2. ДОЗЫ МИБОЛЕРОН А, РЕКОМЕНДУЕМЫЕ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ЭСТРУСА У СУК*
ВЕС СУ КИ ЕЖЕДНЕВНАЯ ДОЗА МИБОЛЕРОН К
кг МЛ MKI
0,5-12 0,3 30
13-23 0,6 60
24-45 1.2 120
>45 1,8 180
Немецкая овчарка или помесь немецкой овчарки
независимо о г веса 1,8 180
Введение препарата начинают в период анэструса; дают один раз в день ежедневно с пищей или непосредственно в рот.
Рис. 22-5. Два внутривлагалищных устройства, предназначенные для предотвращения щенности Ни одно из такого рода средств не оказалось достаточно надежным и практичным при испытании на группе собак, принад гсжащих частным владельцам.
Дозировка и введение. Введение миболерона следует начинать по крайней мере за 30 дней до ожидаемого начала проэструса. Доза зависит от породы и массы тела собаки (табл. 22-2). Раствор препарата дают один раз в день ежедневно с пищей или прямо в рот. Миболерон можно применять r течение двух лет, но он успешно действует и при более длительном применении (до 5 лет) (Concannon, 1983). Функциональная активность яичников обычно восстанавливается через 1-7 месяцев после отмены препарата. Если лечение начато на слишком поздней стадии анэструса то в период до 30 дней у суки может наступить проэструс, несмотря на продолжающееся введение препарата. В этом случае миболерон надо отменить.
Депо-npoi естерон для инъекций. После однократного внутримышечного введения медроксипрогестерона достаточный уровень этою прогестагена в крови поддерживается в течение нескольких месяцев. Препарат под фирменным названием депо-промон (Promone) был доступен в качестве контрацептива для собак до 1969 года. Хотя медроксипрогестерон >ффсктивно задерживал эст-ральный цикл, он считался небезопасным, так как у многих сук вызывал КГЭ и пиометру. Он надежно действовал при введении в середине анэструса. Причиной неблагоприятного действия препарата могла быть передозировка или несвоевременное введение: не в анэструсе, а в другие фазы цикла. Показано, что высокие дозы медроксипрогестерона способствуют развитию опухоли молочных желез и акромегалии, а также подавлению функции надпочечников (Concannon et al, 1980). Предлагаемые дозировки составляют 2 мг/кг один раз в 3 месяца или 3 мг/кг один раз в 4 месяца. Однако препарат не рекомендуется для применения у здоровых сук, поскольку недопустимо часто приводит к поражению матки (Von Berky, Townsend, 1993).
В Европе для лечения собак предлагается другая форма медроксипрогестерона для инъекции а именно депо-провера (DepoProvera).
Имплантация стероидных гормонов. Длительное подавление функции яичников обеспечивает имплантация силиконовых капсул, содержащих
медленно высвобождающиеся формы прогестагенов или андрогенов. Однако данный метод нс используется в ветеринарной практике, так как имплантация требует хирургического вмешательства, а сами капсулы большие и не рассасываются в организме. В целях долговременной кошрацепции у женщин разработаны импланты меньших размеров, которые вводятся путем инъекции (Shoupe, Mishell, 1989). но их применение у собак не исследовано (Concannon, Meyers-Wallen. 1991).
Введение тестостерона. Для подавления активности яичников грейхаундам в течение 5 лет еженедельно вводили внутримышечно тестостерона пропионат (110 мг) или перорально мстилтестосгерон (по 25 мг) (Burke, 1982). Полагают, что отчасти это делалось ради более успешного выступления собак на полевых испытаниях. Такое применение препаратов недопустимо, и непонятно, почему оно было разрешено.
Про лигестерон. Этот прогестин (14а, 17а-про-пилиден-диоксипрогестерон) в форме суспензии для инъекции продается в Европе в качестве контрацептива для собак. Он вводится подкожно (от 10 до 30 мг/кг), после чего инъекцию повторяют через 3 месяца затем через следующие 4 месяца и, наконец, через каждые 5 месяцев. При клинических испытаниях такая схема введения нс приводила к заболеваниям матки или развитию опухолей молочных желез. Более того, исследователи предлагают вводить препарат практически независимо от стадии астрального цикла. Они считают, что в качестве контрацептива для собак этот препарат безопаснее всех других прогестинов (Evans, Sutton, 1989).
Влагалищные и внутримагочныеустрсшства. Разработаны различные влагалищные устройства, препятствующие введению полового члена (рис. 22-5). Однако ни одно из них не получило широкого распространения из-за их низкой эффективности, непрактичности, сложности подгонки, риска травмирования суки и возражений со стороны владельцев. Что касается внутриматочных устройств, то их невозможно использовать из-за трудностей, связанных с канюляцией шейки матки у сук.
946
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
Иммунизация. Для обеспечения обратимой контрацепции у собак была исследована возможность применения иммунизации. Один из подходов состоял в иммунизации, направленной на выработку антител к блестящей оболочке (zona pellucida) яйцеклеток. Эти антитела либо предотвращают оплодотворение и разрушают яйцеклетки до оплодотворения, либо резко сокращают количество зрелых фолликулов в яичниках (Shivers et al, 1981; Mahi-Brown et al, 1982, 1985, 1988). Однако такая иммунизация пока не прошла широкого клинического испытания, и ее роль в будущем остается неясной.
Успешную контрацепцию у кобелей и сук может обеспечить иммунизация против эндогенного ЛГ. Имеются также данные о контрацептивном эффекте иммунизации против ГнРГ у собак. Однако полученные в одном из исследований титры антител оказались недостаточны для длительного подавления функции яичников (Gonzales et al, 1989).
Длительное введение агониста ГнРГ. Продолжительное введение высоких доз агониста ГнРГ приводит к уменьшению количества рецепторов ГнРГ в гипофизе по принципу понижающей регуляции, последующему снижению секреции ЛГ или ФСГ или обоих гонадотропинов и к подавлению эстрального цикла (Concannon et al, 1988; Vickery et al, 1989). Однако такое лечение требует хирургической имплантации мини-насосов или какого-то другого способа обеспечения постоянного и длительного воздействия препарата. О клинических испытаниях этого метода контрацепции не сообщалось (Concannon, Meyers-Wallen, 1991).
ЛИТЕРАТУРА
Arbeiter К, et al: Treatment of pseudopregnancy in the bitch with cabergoline, an ergoline derivative. J Small Anim Pract 29:781, 1988.
Bowen RA, et al: Efficacy and toxicity of estrogens commonly used to terminate canine pregnancy. J Am Vet Med Assoc 186:783, 1985.
Bowen RA, et al: Efficacy and toxicity of tamoxifen citrate for prevention and termination of pregnancy in bitches. Am J Vet Res 49:27, 1988.
Burke TJ: Pharmacologic control of estrus in the bitch and queen. Vet Clin North Am (Small Anim Pract) 12:79, 1982.
Burke TJ: Population control in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders, 1986, p 528.
Concannon PW: Fertility regulation in the bitch: Contraception, sterilization, and pregnancy termination. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p 901.
Concannon PW: New and proposed contraceptives for dogs. Proceedings of the Society for Theriogenology, 1991, p 221.
Concannon PW, Meyers-Wallen VN: Current and proposed methods for contraception and termination of pregnancy in dogs and cats. J Am Vet Med Assoc 198:1214, 1991.
Concannon PW, et al: Growth hormone, prolactin, and Cortisol in dogs developing mammary nodules and an acromegaly-like appearance during treatment with medroxyprogesterone acetate. Endocrinology 106:1173, 1980.
Concannon PW, et al: Suppression of luteal function in dogs by luteinizing hormone antiserum and by bromocriptine. J Reprod Fertil 81:175, 1987.
Concannon PW, et al: Suppression of LH secretion by constant infusion of GnRH agonist in ovariectomized dogs and prolonged contraception of prepubertal bitches by constant subcutaneous administration of GnRH agonist. Proceedings of the Eleventh International Congress of Animal Reproduction and Artificial Insemination 4:427, 1988.
Concannon PW, et al: Termination of pregnancy and induction of premature luteolysis by the antiprogestagen, mifepristone, in dogs. J Reprod Fertil 88:99, 1990.
Davidson A: Induction of abortion in bitches with intravaginal misoprostol and parenteral PGF . Proceedings of the Annual Meeting of the Society for Theriogenology, 1998, p 86.
England GCW: Pregnancy diagnosis, abnormalities of pregnancy, and pregnancy termination. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. United Kingdom, British Small Animal Veterinary Association, 1998, p 113.
Evans JM: Oestrus control in the bitch. J Small Anim Pract 29:535, 1988.
Evans JM, Sutton DJ: The use of hormones, especially progestagens, to control oestrus in bitches. J Reprod Fertil 39:163, 1989.
Feldman EC, et al: Prostaglandin induction of abortion in pregnant bitches after misalliance. J Am Vet Med Assoc 202:1855, 1993.
Fieni F: An original molecule to induce abortion in bitches: Aglepristone - A clinical study defining efficacy and absence of side effects. J Reprod Fertil Suppl 47:403, 1995.
Fieni F, et al: Midpregnancy termination in bitches with an antiprogestin: aglepristone (RU534). Proceedings: Advances in Dog, Cat and Exotic Carnivore Reproduction. Oslo, Norway, 2000a, p 111.
Fieni F, et al: Efficacy, safety, and hormonal kinetics in pregnancy termination in bitches with an antiprogestin: aglepristone (RU534). Proceedings: Advances in Dog, Cat and Exotic Carnivore Reproduction. Oslo, Norway, 2000b, p81.
Galac S, et al: Pregnancy termination in bitches with aglepristone, a progesterone receptor antagonist. Proceedings: Advances in Dog, Cat and Exotic Carnivore Reproduction. Oslo, Norway, 2000, p 103.
Gonzalez A, et al: Immunological approaches to contraception in dogs. J Reprod Fertil Suppl 39:189, 1989.
Hall EJ: Use of lithium for treatment of estrogen-induced bone marrow hypoplasia in a dog. J Am Vet Med Assoc 200:814, 1992.
Harding RB: The use of megestrol acetate in oestrus control in dogs. Post Acak Onderstepoort 13:30, 1981.
Howe LM, et al: Long-term outcome of gonadectomy performed at an early age or traditional age in dogs. J Am Vet Med Assoc 218:217, 2001.
Jackson PS, et al: A preliminary study of pregnancy termination in the bitch with slow-release formulations of prostaglandin analogs. J Small Anim Pract 23:287, 1982.
Jackson W, Johnston S: Pregnancy prevention and termination. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders, 1980, p1239.
Jain JK, Mishell DR: A comparison of intravaginal misoprostol with prostaglandin E2 for termination of second-trimester pregnancy. N Engl J Med 331:290, 1994.
Jochle W, et al: Effects on pseudopregnancy and interoestrous intervals of pharmacological suppression of prolactin secretion in female dogs and cats. J Reprod Fertil Suppl 39:199, 1989.
Johnston SD: Canine pregnancy termination with prostaglandin F2a. Proceedings of the Annual Meeting of the Society of Theriogenology, 1990, p264.
Johnston SD, Root Kustritz MV, Olson PNS: Canine and Feline Theriogenology. Philadelphia, WB Saunders, 2001, p 173.
Keister DM, et al: Efficacy of oral epostane administration to terminate pregnancy in mated laboratory bitches. J Reprod Fertil Suppl 39:241, 1989.
Lein DH: Prostaglandins in small animal reproduction. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders, 1983, p481.
Lein DH, et al: Termination of pregnancy in bitches by administration of prostaglandin F2ot. J Reprod Fertil Suppl 39:231, 1989.
Mahi-Brown CA, et al: Infertility in bitches induced by active immunization with porcine zonae pellucidae. J Exp Zool 222:89, 1982.
Mahi-Brown CA, et al: Fertility control in the bitch by active immunization with porcine zonae pellucidae: Use of different adjuvants and patterns of estradiol and progesterone level in estrous cycles. Biol Reprod 32:761, 1985.
Mahi-Brown CA, et al: Ovarian histology of bitches immunized with porcine zonae pellucidae. Am J Reprod Immunol Microbiol 18:94, 1988.
Nelson RW, et al: Treatment of canine pyometra and endometritis with prostaglandin Fla. J Am Vet Med Assoc 181:899, 1982.
Niskanen M, Thrusfield MV: Associations between age, parity, hormonal therapy, and breed, and pyometra in Finnish dogs. Vet Rec 143:493, 1998.
Oettle EE: Clinical experience with prostaglandin F2al ha THAM as a luteolyt-ic agent in pregnant and nonpregnant bitches. J S Afr Vet Assoc 53:239, 1982.
Oettle EE, et al: Luteolysis in early diestrous Beagle bitches. Theriogenology 29:757, 1988.
Olson PN: Exfoliative cytology of the canine reproductive tract. Proceedings of the Society for Theriogenology, 1989, p 259.
Olson PN, Johnston SD: New developments in small animal population control. J Am Vet Med Assoc 202:904, 1993.
Olson PN, et al: Evaluation of the efficacy and toxicity of estrogens used to terminate pregnancy in the bitch. Proceedings of the American College of Veterinary Internal Medicine, Washington, DC, 1984, p 35 (abstract).
Olson PN, et al: A need for sterilization, contraceptives, and abortifacients: Abandoned and unwanted pets. Part III. Abortifacients. Compend Contin Educ Prac Vet 8:235, 1986.
Onclin K, Verstegen JPL: Practical use of a combination of a dopamine agonist and a synthetic prostaglandin analogue to terminate unwanted pregnancy in dogs. J Small Anim Pract 37:211, 1996.
Onclin К et al: Termination of unwanted pregnancy in dogs with the dopamine agonist cabergoline in combination with synthetic analogue of either clo-prostenol or alphaprostol. Theriogenology 43:813, 1995.
ИНДУКЦИЯ АБОРТА, ПРЕДУПРЕЖДЕНИЕ И ПРЕРЫВАНИЕ ЩЕННОСТИ, НЕЗАПЛАНИРОВАННАЯ ВЯЗКА
947
Paradis М, et al: Effects of prostaglandin F2a on corpora lutea formation and function in mated bitches. Can Vet J 24:239, 1983.
Post K: Induced pregnancy termination in dogs. Theriogenology Handbook C2:l, 1995.
Post K, et al: Effects of prolactin suppression with cabergoline on the pregnancy of the bitch. Theriogenology 29:1233, 1988.
Romagnoli SE, et al: Use of prostaglandin F2a for early pregnancy termination in the mismated bitch. Vet Clin North Am (Small Anim Pract) 21:487, 1991.
Romagnoli SE, et al: Clinical use of a-prostol (synthetic PGF2ot analogue) to induce early abortion in mismated bitches: Comparison between single vs bid treatment. Proceedings: Advances in Dog, Cat and Exotic Carnivore Reproduction. Oslo, Norway, 2000, p 108.
Salmeri KR, et al: Gonadectomy in immature dogs: Effects on skeletal, physical, and behavioral development. J Am Vet Med Assoc 198:1193, 1991.
Sankai T, et al: Antiprogesterone compound RU486 administration to terminate pregnancy in dogs and cats. J Vet Med Sci 53:1069, 1991.
Schneider R: Epidemiological aspects of mammary and genital neoplasia. In Morrow D (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders, 1990, p 636.
Shille VM: Mismating and termination of pregnancy. Vet Clin North Am 12:99, 1985.
Shille VM, et al: Induction of abortion in the bitch with a synthetic prostaglandin analogue. Am J Vet Res 45:1295, 1984.
Shivers CA, et al: Pregnancy prevention in the dog: Potential for a immunological approach. JAmAnim Hosp Assoc 17:823, 1981.
Shoupe D, Mishell DR: Norplant: Subdermal implant system for long-term contraception. Am J Obstet Gynecol 160:1286, 1989.
Soderberg SF, Olson PN: Abortifacients. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p 945.
Spitz IM et al. Early pregnancy termination with mifepristone and misoprostol in the United States. N Engl J Med 338:1241, 1998.
Suess RP, et al: Bone marrow hypoplasia in a feminized dog with an interstitial cell tumor. J Am Vet Med Assoc 200:1346, 1992.
Theran P: Early-age neutering of dogs and cats. J Am Vet Med Assoc 202:914, 1993.
Tsutsui T, et al: Effects of prostaglandin F2al ha on implantation and maintenance of pregnancy in the dog. Jpn J Vet Sci 44:403, 1982.
Verstegen JPL: Overview of mismating regimens in the bitch. In Bonagura J (ed). Current Veterinary Therapy XIII. Philadelphia, WB Saunders, 2000, p947.
Verstegen JPL, et al: Influence of estrogens on blood parameters in bitches. Ann Med Vet 125:397, 1981.
Verstegen JPL, et al: Abortion induction in queens and bitches using cabergoline, a specific dopamine agonist. Ann Med Vet 137:251, 1993.
Vickery B, McRae G: Effect of a synthetic prostaglandin analogue on pregnancy in Beagle bitches. Biol Reprod 22:438, 1980.
Vickery B, et al: Use of potent LHRH analogues for chronic contraception and pregnancy termination in dogs. J Reprod Fertil Suppl 39:175, 1989.
Von Berky AG, Townsend WL: The relationship between the prevalence of uterine lesions and the use of medroxyprogesterone acetate for canine population control. Aust Vet J 70:249, 1993.
Webster J, et al: A comparison of cabergoHne and bromocriptine in the treatment of hyperprolactinemic amenorrhea. N Engl J Med 331:904, 1994.
Wildt DE, Lawler DF: Laparoscopic sterilization of the bitch and queen by uterine horn occlusion. Am J Vet Res 46:864, 1985.
Глава 23
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
ПАТОФИЗИОЛОГИЯ.................948
Влияние гормонов (прогестерон).948
Кистозная гиперплазия эндометрия ...949
Бактерии.......................949
Эстроген.......................950
ОБЩИЕ СВЕДЕНИЯ И АНАМНЕЗ.......950
Традиционные представления и клинический опыт.............950
Пиометра открытого типа........950
Пиометра закрытого типа........951
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ.......951
КЛИНИКО-ЛАБОРАТОРНЫЕ ДАННЫЕ ...951
Лейкоцитарная формула..........951
Количество эритроцитов.........951
Биохимический профиль сыворотки крови................951
Анализ и посевы мочи...........952
РЕНТГЕНОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ..................952
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ...952
ДИАГНОСТИКА И ОСЛОЖНЕНИЯ......954
Неосложненная пиометра........954
Полидипсия и полиурия как единственные симптомы.........954
Почечные осложнения...........955
Цитологическое исследование влагалища и посевы из влагалища.........955
Отсутствие увеличения матки...955
Пиометра культи...............956
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ.........957
Овариогистерэктомия...........957
Хирургическое дренирование....957
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ (ПРОСТАГЛАНДИНЫ)..............958
Выбор метода лечения..........958
Действие простагландинов........958
Клиническое применение простагландинов................958
Рекомендуемый простагландин и схема лечения................959
Побочные эффекты...............960
Необходимость повторного курса лечения..................961
Результаты лечения.............961
Пиометра открытого типа........961
Пиометра закрытого типа........962
Долгосрочный уход за собакой...963
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
(АЛЬТЕРНАТИВЫ ПРИРОДНЫМ ПРОСТАГЛАНДИНАМ).............963
Синтетические простагландины...963
Антипрогестагены...............963
ПОСЛЕРОДОВОЙ ЭНДОМЕНТРИТ.......963
ПАТОФИЗИОЛОГИЯ
Влияние гормонов (прогестерон)
Кистозная гиперплазия эндометрия. Пиометра у собак - это заболевание, опосредованное гормональным воздействием, возникающим во время диэструса. Причиной пиометры является бактериальное заражение матки, которое приводит к бактериемии и токсемии, выраженность которых варьирует от легкой до тяжелой и даже угрожающей жизни. Еще до инфицирования в матке могут происходить патологические изменения, предрасполагающие ее к микробному заражению; такое состояние матки называется кистозной гиперплазией эндометрия (КГЭ). Считается, что развитие КГЭ отчасти обусловлено аномальной реакцией матки на хроническое и повторяющееся воздействие прогестерона. Однако и другие факторы могут играть определенную роль. Состояние КГЭ удалось смоделировать простым внесением хирургической шелковой нити в просвет матки во время диэструса (Nomura, 1995). Эстроген усиливает действие прогестерона, ускоряя развитие КГЭ (Chen et al, 2000).
КГЭ не всегда предшествует пиометре. Тяжелая, угрожающая жизни пиометра может развиться и в отсутствие КГЭ. Однако она крайне редко отмечается у собак, не имевших к моменту инфицирования высокий уровень прогестерона. В
отдельных случаях пиометра, возникшая во время диэструса (фаза эстрального цикла, в которой доминирует прогестерон), прогрессирует медленно, - возможно, из-за слабого инфицирования. Бывает, что владельцы замечают признаки заболевания или тяжелое состояние собаки не сразу и обращаются к ветеринару тогда, когда собака находится уже в фазе анэструса. Однако это не значит, что болезнь не началась в диэструсе.
Концентрации прогестерона. У собак концентрация прогестерона в анэструсе низкая (ее базальный уровень <0,5 нг/мл). Она остается ниже 1,0 нг/ мл во время проэструса и начинает повышаться в начале эструса, обычно достигая уровня выше 2,0 нг/мл. Концентрация прогестерона в плазме крови продолжает расти во время всего эструса и первых нескольких недель диэструса, достигает плато, после чего постепенно снижается до базального значения. Возвращение концентрации прогестерона к уровню ниже 1,0 нг/мл означает завершение стадии диэструса.
Прогестерон и инфекция. У здоровых собак во время каждого эстрального цикла концентрация прогестерона в плазме крови растет в течение 9-12 недель после овуляции и часто превышает 40 нг/мл. В это время прогестерон стимулирует и под держивает рост эндометрия и секрецию маточных желез и одновременно подавляет активность миометрия, тем самым способствуя накоплению выделений из
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА • 949
желез. Эти выделения создают благоприятную среду для роста бактерий. Поскольку в подвергшейся действию прогестерона матке реакция лейкоцитов на инфицирование угнетена, рост бактерий прогрессивно усиливается, и, таким образом, матка становится мишенью бактериальной атаки. Инфицирование с развитием пиометры осуществляется теми же бактериями, которые всегда присутствуют в нормальной флоре влагалища; они могут проходить через шейку матки и часто обнаруживаются в матке в фазах проэструса и эструса. Однако должно быть какое-то сочетание фазы эстрального цикла (эффект прогестерона) и факторов или изменений во внутриматочной среде, которое приводит к избыточному росту этих бактерий именно в матке.
Кистозная гиперплазия эндометрия
У собак старше 6 лет развитию пиометры обычно предшествует гиперплазия эндометрия, индуцированная прогестероном. Хотя пиометра часто встречается и у собак моложе 6 лет, гиперплазия эндометрия у них маловероятна. Если же имеется патологическая прогрессирующая гиперплазия, то она, независимо от возраста собаки, становится кистозной, и таким образом развивается КГЭ. При этом происходит утолщение эндометрия в результате увеличения размеров и количества содержащихся в нем желез, способных к секреторной активности. Клетки слизистого эпителия приобретают, как правило, извитую форму и содержат гипертрофированную прозрачную цитоплазму. Строма становится отечной и всегда инфильтрирована воспалительными клетками. Иногда КГЭ приводит к накоплению водянистой или вязкой жидкости в полости матки. Такая стерильная, заполненная жидкостью матка называется гидрометрой или мукометрой в зависимости от степени гидратации муцина.
Пиометра - самое частое заболевание, связанное с КГЭ. Гораздо реже КГЭ приводит к бесплодию или хроническому эндометриту. Определить КГЭ трудно, так как клинические признаки чаще всего отсутствуют, если только не произошло инфицирования матки, но в этом случае ставится диагноз пиометра. Для диагностики неинфицированной КГЭ необходимо сделать биопсию матки. Способы лечения КГЭ пока неизвестны (Harvey, 1998).
Бактерии
Наличие бактерий в матке у собак в проэструсе и эструсе - вполне нормальное явление, и в норме их избыточный рост естественным образом предотвращается. Наиболее вероятно, что матку инфицируют бактерии, обитающие в своде влагалища (Baba et al, 1983). Во время проэструса и эструса эти бактерии поднимаются в матку через расширенную шейку (Noakes et al, 2000). Определение биохимических маркеров Escherichia coli (Е. coli) в посевах из матки, пораженной пиометрой, и в фекалиях тех же со
бак показало, что штаммы бактерий из этих источников идентичны или очень сходны между собой (Wadas et al, 1996).
Предполагались и другие источники бактерий, инфицирующих матку, включая сопутствующую инфекцию мочевых путей и преходящую бактериемию. Однако наиболее вероятным источником заражения матки представляется обычная флора влагалища. В посевах из зараженной матки преобладает Е. coli - обычный компонент нормальной флоры влагалища. Е. coli может прикрепляться к эндометрию и миометрию, связываясь своими специфическими антигенными сайтами со стимулированными прогестероном рецепторами.
Бактериальная флора постоянно присутствует во влагалище. Во время проэструса и эструса шейка матки расширяется, и считается, что бактериальное загрязнение матки происходит именно в эти фазы эстрального цикла (Baba et al, 1983). Однако инфекция матки, т.е. заболевание, возникает редко. По-видимому, у здоровой собаки это неизбежное «загрязнение» находится под контролем и быстро устраняется. Поэтому внутриматочные бактерии нельзя рассматривать как единственный фактор патогенеза пиометры. Какое-то серьезное заболевание матки или другие предрасполагающие факторы (введение прогестерона или эстрогена) делают суку предрасположенной к пиометре. В определенной мере таким фактором является и нормальное постовуляторное повышение концентрации прогестерона в крови, поскольку пиометра развивается только во время или сразу после диэструса. Введение экзогенного прогестерона тоже увеличивает риск заболевания. Таким образом, факторами, способствующими развитию пиометры, являются КГЭ, бактерии, повышение концентрации прогестерона в плазме крови во время диэструса и введение экзогенных прогестерона и эстрогена.
Обычно развитие пиометры связывают с Е. coli. В то же время из матки собак больных пиометрой выделяли стафилококки, стрептококки, Klebsiella, Pseudomonas, Proteus, Haemophilus, Pasturella, Serratia и другие бактерии (Stone, 1985, Whaton et al, 1989). Эти же бактерии находят и во влагалище здоровых собак. У большинства собак с пиометрой в посевах происходит рост только одного вида бактерий, но у некоторых обнаруживаются два или более вида (Memon, Mickelsen, 1993). У здоровых собак бактериальная флора влагалища состоит из одного или нескольких видов бактерий. Отсутствие бактерий во влагалище у собак наблюдается очень редко (Bjurstrom, LindeForsberg, 1992).
Е. coli - это грам-отрицательная бактерия, в клеточной мембране которой содержится химически стабильный, биологически активный липополисахаридный эндотоксин. Когда бактерия погибает и разрушается, эндотоксин выделяется в среду. Диагноз эндотоксемии ставится в случаях, когда концентрация эндотоксина в крови превышает 0,05 нг/мл. Клинические проявления эндотоксемии включают
950 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
гипотермию, дезориентацию и признаки септического шока. Минимальная летальная концентрация эндотоксина в сыворотке крови - приблизительно 0,7 нг/мл. При осмотре 92 сук с пиометрой эндотоксемия была обнаружена у семи. Лечение таких сук антибиотиками усиливает высвобождение эндотоксина и усугубляет клинические проявления эндотоксемии, так как антибиотики ускоряют гибель бактерий (Frannson et al, 1997; Johnston et al, 2001).
Эстроген
Экзогенные эстрогены, независимо от химической формы гормона, усиливают действие прогестерона на матку. Считается, что эстрогены сенситизируют прогестероновые рецепторы и тем самым повышают связывание прогестерона в матке (Niskanen, Thrusfield, 1998). Сверхфизиологические концентрации эстрогена, возникающие при введении экзогенного гормона во время эструса или диэструса (например, после нежелательной случки), резко повышают риск развития пиометры. Поэтому введение эстрогенов для предотвращения щенности решительно не рекомендуется.
Два синдрома пиометры: немолодые собаки. Суки старше 7-8 лет предрасположены к КГЭ и последующему развитию пиометры. По-видимому, это заболевание связано с возрастом и возникает как следствие повторяющегося воздействия прогестерона во время диэструса в каждом эстральном цикле. После многих лет овариальной активности предрасположенность к КГЭ и частота ее возникновения увеличиваются. Отсюда возрастает и риск развития пиометры у немолодых, вполне здоровых сук.
Два синдрома пиометры: более молодые собаки. Пиометра была выявлена у значительного числа молодых сук (моложе 6 лет). Маловероятно, что в основе этого заболевания матки у молодых и старых сук лежат одни и те же патофизиологические процессы. Молодые суки еще не подвергались длительному, периодически повторяющемуся воздействию прогестерона. В то же время у них наблюдается высокая корреляция между частотой заболевания пиометрой и введением экзогенного эстрогена для предотвращения щенности (Bowen et al, 1985; Wheaton et al, 1989). Поэтому применение эстрогена в этих целях не рекомендуется; если сука не представляет ценности как производительница, ее следует кастрировать (провести овариогистерэктомию); если же она представляет такую ценность, то лучше дать ей доносить нежелательную щенность до родов или прервать щенность (см. гл. 22), но не эстрогенами.
ОБЩИЕ СВЕДЕНИЯ И АНАМНЕЗ
Традиционные представления и клинический опыт
Традиционно пиометра считается заболеванием сук среднего возраста (старше 6 лет). Теоретичес
ки она развивается в результате многолетнего, повторяющегося во время каждого эстрального цикла воздействия прогестерона на матку. Однако мы наблюдали развитие пиометры как с открытой, так и с закрытой шейкой матки (открытого и закрытого типа) у молодых собак после общепринятого применения эстрогенов в случае нежелательной вязки. В число таких собак входили и суки моложе одного года, у которых пиометра возникла сразу после первой течки. Средний возраст 192 сук с пиометрой открытого и закрытого типов, прошедших в нашей клинике лечение простагландином F2a, составлял 2,4 года. Вероятность пиометры следует учитывать при обследовании сук любого возраста, если у них имеются соответствующие клинические признаки, появившиеся во время или сразу после диэструса.
Пиометра бывает у собак всех пород. Есть данные о повышенном риске заболевания у бородатых колли, кавалер-кинг-чарлз-спаниелей, золотистых ретриверов, бернских зенненхундов и английских кокер-спаниелей по сравнению с собаками других пород, включая помеси. К породам собак с низким риском заболевания пиометрой относятся древеры, немецкие овчарки, карликовые и стандартные таксы и шведские гончие (Egenvall et all, 2001).
Пиометра открытого типа
Признаки заболевания, замечаемые владельцами собак, зависят от открытого или закрытого состояния шейки матки (табл. 23-1). Явными признаками пиометры открытого типа являются кровянистые или слизисто-гнойные выделения из влагалища, которые обычно появляются через 4-8 недель после течки. Иногда пиометра диагностируется еще на ранней стадии в конце течки, а иногда лишь на поздней - через 12-14 недель после течки. Другие обычные признаки заболевания включают сонливость, депрессию, потерю аппетита/анорексию, полиурию, полидипсию, рвоту и диарею (Wheaton et al. 1989). Бывает, что опытные владельцы собак быстро обнаруживают пиометру с открытой шейкой. При этом собаки могут выглядеть здоровыми во всех отношениях, кроме необычных выделений из влагалища. В целом, здоровье суки с пиометрой зависит от того, насколько быстро владелец заметит заболевание и обратится за помощью к ветеринару.
ТАБЛИЦА 23-1. ХАРАКТЕРНЫЕ КЛИНИЧЕСКИЕ СИМПТОМЫ, НАБЛЮДАЕМЫЕ У СУК С ПИОМЕТРОЙ
Симптом________________________________Процен
Выделения из влагалища 85
Сонливость - депрессия 62
Потеря аппетита/анорексия 42
Полиурия и/или полидипсия 28
Рвота 15
Ночная полиурия 5
Диарея 5
Увеличение живота 5
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА • 951
Пиометра закрытого типа
К моменту установления диагноза пиометры с закрытой шейкой матки собаки часто находятся в гораздо более тяжелом состоянии, чем при пиометре открытого типа. Это происходит из-за отсутствия легко распознаваемых ранних признаков заболевания. В частности, при пиометре закрытого типа не бывает гнойных выделений из влагалища. Владельцы часто замечают постепенно развивающиеся признаки болезни, такие, как вялость, сонливость, потеря аппетита, полидипсия и/или полиурия, похудание. Эти проявления в сочетании с рвотой и/или диареей - следствия прогрессирующих сепсиса и токсемии - могут привести к тяжелому обезвоживанию, шоку, коме и гибели собаки, если хозяева вовремя не поймут, что она больна и нуждается в помощи.
Иногда владельцам удается заметить выделения из влагалища, которые продолжаются всего 1-2 дня и предшествуют развитию более серьезных системных признаков заболевания. Поскольку эти выделения кратковременны и собака на вид здорова, к ветеринару во многих случаях обращаются далеко не сразу. Поэтому тяжесть заболевания к моменту обследования в большой степени зависит от умения хозяев собаки вовремя заметить, что собака больна, и прибегнуть к ветеринарной помощи. У некоторых сук с пиометрой закрытого типа обнаруживаются признаки полиартрита, обусловленные бактериемией и инфицированием суставов.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Нарушения, выявляемые при физикальном исследовании, включают подавленное состояние, обезвоживание, лихорадку, пальпируемое увеличение матки и, если шейка открыта, кровянистые или слизисто-гнойные выделения из влагалища. Ректальная температура может быть повышенной или нормальной. Лихорадка обусловлена воспалением матки и вторичной бактериальной инфекцией, а также сепсисом или токсемией. Результатом сепсиса и токсемии может быть шок - с тахикардией, увеличением времени исчезновения белого пятна после нажатия, слабым бедренным пульсом, понижением ректальной температуры.
Увеличение матки иногда бывает явным, но в некоторых случаях ее пальпация затруднена, особенно если содержащая в ней жидкость в значительной степени излилась или если матка увеличена, но дряблая. Возможность пальпаторного определения размеров матки зависит также от величины и веса собаки и от степени расслабления брюшной стенки. Диагноз можно подтвердить с помощью абдоминального рентгенографического исследования, но при этом следует помнить, что у щенной суки в период, предшествующий кальцификации скелета плодов, матка тоже увеличена.
Во избежание повреждения матки не следует пальпировать ее слишком энергично. Выявленное
пальпацией увеличение матки у нещенной суки в ди-эструсе всегда считается признаком заболевания. Но даже если матка не прощупывается, она может быть сильно воспалена и инфицирована, что и приводит к появлению клинических признаков пиометры.
КЛИНИКО-ЛАБОРАТОРНЫЕ ДАННЫЕ
Лейкоцитарная формула
Лейкоцитарная формула у сук с пиометрой бывает различной. Иногда выявляется абсолютная нейтрофилия (обычно > 25000 клеток/мкл) с различной степенью сдвига формулы влево (т.е. >300 незрелых форм/мкл), что является следствием сильного инфицирования, воспаления и сепсиса. Тяжелая и/ или хроническая инфекция может приводить к «дегенеративному сдвигу влево» - нарастанию числа токсических нейтрофилов. Увеличение общего числа лейкоцитов наблюдается у 50-75% сук с пиометрой открытого типа, тогда как у остальных число лейкоцитов остается нормальным или даже понижено. У части таких сук инфицирование не столь тяжелое, как при пиометре закрытого типа. У 78 из 163 (48%) сук с пиометрой открытого типа, которым мы вводили ПГ F2a, общее число лейкоцитов до начала лечения соответствовало норме. У 20 из 80 (25%) оперированных сук с этой патологией содержание лейкоцитов тоже было в норме (Wheaton et al, 1989).
Процент собак как с повышенным, так и с аномально пониженным количеством лейкоцитов значительно выше при пиометре закрытого типа в сравнении с пиометрой открытого типа. Так, из 42 собак с пиометрой закрытого типа у 36 (86%), леченных в нашей клинике простагландинами, количество лейкоцитов в крови было увеличено, а у 5 (12%) - уменьшено (<5000 клеток/мкл).
Количество эритроцитов
Поскольку пиометра является хроническим воспалением, то неудивительно, что часто развивается умеренная нерегенеративная анемия1 (гематокрит на уровне 28-35%). Обусловленные пиометрой сепсис и токсемия подавляют функцию костного мозга; наиболее четкие свидетельства этого эффекта - нарастание числа незрелых нейтрофилов и гипопластическая природа анемии. После коррекции пиометры анемия должна пройти.
Биохимический профиль сыворотки крови
Обезвоживание и/или хроническая стимуляция иммунной системы чужеродными антигенами обычно
1 Одна из форм нормоцитарной нормохромной анемии, в основе которой лежит неспособность костного мозга отвечать на стимуляцию эритропоэза. В отечественной литературе это состояние определяется как гипопластическая (или парциальная гипопластическая) анемия. - Прим.ред.
952 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
приводят к гиперпротеинемии (содержание общего белка от 7,5 до 10,0 г/100 мл). При обезвоживании и преренальной уремии обычно повышен уровень азота мочевины в крови. Иногда наблюдается слабое или умеренное повышение активности аланинаминотрансферазы (АЛТ) и щелочной фосфатазы как следствие повреждения печени, вызванного сепсисом и/или уменьшением кровоснабжения печени, а также клеточной гипоксией у обезвоженных собак.
Анализ и посевы мочи
Удельный вес мочи у сук с пиометрой непредсказуем, так как на этот показатель влияют многие факторы. На ранней стадии заболевания удельный вес мочи может быть выше 1,030, что просто отражает физиологический ответ на обезвоживание, направленный на сохранение жидкости в организме. При вторичной бактериальной инфекции, особенно Е. coli, развивающаяся токсемия вызывает нарушение реабсорбции ионов натрия и хлора в петле Генле. Это приводит к падению осмотического давления в мозговом веществе почек, что отражается на способности почечных канальцев реабсорбировать воду. В результате развиваются полиурия и компенсаторная полидипсия.
Нечувствительность почечных канальцев к действию антидиуретического гормона, возникающая вследствие их повреждения эндотоксином Е. coli, может привести к развитию нефрогенного несахарного диабета, который тоже вносит вклад в потерю способности концентрировать жидкость. Еще один возможный механизм развития полиурии и полидипсии - отложение иммунных комплексов в почечных канальцах. Хотя и маловероятно, но все же можно предположить, что продолжительные полиурия и полидипсия вызывают вымывание растворенных веществ из мозгового вещества почек, в результате чего моча становится все более разбавленной. Изос-тенурия (удельный вес мочи от 1,008 до 1,015) и гипостенурия (удельный вес мочи <1,008) часто наблюдаются при пиометре. Если потребление воды недостаточно для компенсации полиурии, может наблюдаться также преренальная уремия.
Когда при анализе мочи выявляются пиурия, гематурия и/или протеинурия, возникает подозрение на инфекцию мочеполовых путей. Однако моча, взятая в середине процесса мочеиспускания, обычно загрязнена выделениями из влагалища. Мы не рекомендуем делать «вслепую» пункцию мочевого пузыря сукам с подозреваемой или установленной пиометрой из-за риска проколоть зараженную матку и угрозы вытекания ее содержимого в брюшную полость. Проведение пункции под контролем ультразвукового исследования (УЗИ) снижает риск прокола матки. Если необходимо получить незагрязненные образцы мочи, это допустимо делать только под контролем УЗИ. Если последнее недоступно, то не имеет смысла делать рутинные посевы мочи сук с пиометрой.
Иногда протеинурия при пиометре наблюдается в отсутствие пиурии и гематурии. Это объясняется тем, что отложение иммунных комплексов в клубочках приводит к мембранозно-пролиферативному гломерулонефриту и поступлению белков плазмы в клубочковый фильтрат. При коррекции пиометры протеинурия в таких случаях постепенно проходит.
РЕНТГЕНОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ
При щенности матка увеличивается, что облегчает ее идентификацию при рентгенографическом исследовании. Она просматривается, начиная с третьей-четвертой недели щенности по вторую-четвертую неделю после родов. В другое время матка не должна быть видна. Если матка легко идентифицируется у нещенной суки в диэструсе, это считается аномалией. При подозрении на пиометру сукам делают рентген брюшной полости для подтверждения диагноза и выявления каких-либо других нарушений. При пиометре в вентральной и каудальной областях брюшной полости обычно видны плотные, заполненные жидкостью трубчатые структуры с диаметром большим, чем у петель тонкой кишки, и смещающие кишечные петли дорсально и крани-ально (рис. 23-1, А и Б).
Кроме того, рентгенографическое исследование сук с пиометрой позволяет установить наличие или отсутствие перитонита - следствия возможного прободения матки, а также плодную ткань, которая могла остаться после последней или предыдущей щенности (рис. 23-1, В). Перитонит подозревают в случае исчезновения нормальной контрастности между абдоминальными структурами. Для усиления рентгеноконтрастности и лучшей визуализации матки имеет смысл сдавить живот с помощью бандажа или деревянной ложки, чтобы сместить кишки в сторону от матки. Если матка на рентгенограмме не видна, это не исключает относительно небольшой пиометры открытого типа и значительного оттока жидкости из матки.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Ультразвуковое исследование (ультрасонография) значительно облегчает диагностику пиометры и помогает оценить эффект лечения, особенно если результаты рентгенографического исследования неубедительны. С помощью УЗИ определяют размеры матки, толщину ее стенки и накопление жидкости в просвете. Иногда можно установить и характер жидкости в матке (серозная или мукоидная). Еще важнее, что этим методом нетрудно выявить остатки плодов и плацентарной ткани в матке, наличие которых препятствует успешному лечению простагландинами.
На эхограмме, полученной при ультразвуковом исследовании, эндометриты и пиометра легко отличимы от беременной матки, так как при этих
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА • 953
Рис. 23-1. А и Б -латеральнай и вентродорсальная рентгенограммы брюшной полости суки с большой пиометрой. Стрсчками показан диаметр рога матки. В и 1 - латеральная и вентродорсальная рентгенограммы брюшной полости суки с оставшимися мумифицированными плодами (стрелки).
954 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
Рис. 23-2. А - эхограмма брюшной полости суки; видна «жидкая линия», соответствующая пиометре. Б — эхограмма брюшной полости той же суки с пиометрой, демонстрирующая три секции матки, заполненные жидкостью.
заболеваниях матка растянута накопившейся жидкостью и плодов в ней нет. При пиометре матка имеет вид анэхогенной извитой трубки (рис. 23-2). Если смотреть в поперечном разрезе, то извилины видны как анэхогенные округлые структуры. Пиометра культи может выявляться как гипоэхоген-ный или средней эхогенности очаг, расположенный дорсально и каудально от мочевого пузыря (Wrigley, Finn, 1989).
ДИАГНОСТИКА И ОСЛОЖНЕНИЯ
Неосложненная пиометра
Обычно пиометра легко распознается. Ее можно подозревать у любой больной суки в диэструсе, а фактически у любой больной некастрированной суки. Диагноз устанавливается на основании соответствующих клинических признаков, замеченных владельцем собаки, и нарушений, выявленных при физикальном исследовании, рутинных анализах, рентгенографическом и ультразвуковом исследова
ниях. Однако постановка окончательного диагноза осложняется, если нет четких анамнестических данных (особенно в отношении эстрального цикла). если имеются выделения из вульвы, но матка не увеличена, если отсутствуют влагалищные выделения (Memon, Mickelsen, 1993) или если сука кастрирована, а клинические признаки и данные анализов позволяют подозревать пиометру.
Полидипсия и полиурия как единственные симптомы
Иногда владельцы собак, приводя своих питомцев к ветеринару, жалуются в первую очередь на полиурию и полидипсию. Причины этих нарушений бывают разными (см. гл. 1). Для дифференциальной диагностики необходимо сделать гемограмму, биохимический анализ крови, анализ мочи, при необходимости провести рентгенографическое исследование брюшной полости. Однако пиометра всегда остается одной из возможных причин полиурии и полидипсии у некастрированных сук.
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА • 955
Почечные осложнения
Отличить пиометру с сопутствующей почечной недостаточностью от пиометры с преренальной уремией бывает непросто. Если удельный вес мочи меньше 1,006, следует заподозрить вторичный нефрогенный несахарный диабет. Если удельный вес выше 1,030, то, скорее всего, у собаки преренальная уремия, а не первичная почечная недостаточность. В случаях, когда удельный вес мочи находится в пределах 1,008 - 1,020 и налицо обезвоживание, точный диагноз устанавливается на основании анамнеза, выявления биохимических нарушений (например, аномальных концентраций кальция и фосфора в сыворотке крови), данных рентгенографии и/или УЗИ брюшной полости (оценка состояния матки и почек), ответа на вливания жидкости и, возможно, результатов тестирования функции почек.
Цитологическое исследование влагалища и посевы из влагалища
Цитологическое исследование влагалища и посевов из влагалища не позволяет ни подтвердить, ни исключить диагноз пиометры (Olsen et al, 1986). В случае пиометры результаты этих тестов неспецифичны и ненадежны. Нейтрофилы и бактерии выявляются во влагалищных мазках как в норме, так и при пиометре, а также при вагините любого происхождения. В то же время при пиометре открытого типа во влагалищных мазках часто обнаруживаются дегенерировавшие нейтрофилы. Дифференциация деформированных, слабо очерченных эпителиальных клеток, вакуолизированных клеток эндометрия, макрофагов, клеток типа трофобластов и эпителиальных клеток влагалища, подвергшихся цитолизу, представляет обычно значительные трудности.
Усиленный рост бактерий в посевах из влагалища характерен как для вагинита (почти во всех случаях), так и для пиометры открытого типа, но может наблюдаться и в посевах из влагалища практически здоровых собак. Бактерии, как правило, обитают в своде влагалища (табл. 23-2). Рост бактерий в вагинальных посевах еще не означает, что эти же организмы присутствуют в матке, даже если шейка матки открыта (почти невозможный диагноз) и мазок был взят из области близкой к шейке стерильным тампоном со всеми предосторожностями. При взятии мазка вслепую практически нельзя гарантировать, что он взят из пришеечной области. При лечении сук с пиометрой открытого типа бывает целесообразно высеять флору из переднего отдела влагалища, чтобы проверить ее чувствительность к антибиотикам и подобрать соответствующие препараты. Однако мы редко проводим данное исследование у сук с подозреваемой или установленной пиометрой открытого или закрытого типа.
ТАБЛИЦА 23-2. АЭРОБНЫЕ БАКТЕРИИ, ВЫДЕЛЕННЫЕ ИЗ ВЛАГАЛИЩА 59 ЗДОРОВЫХ ФЕРТИЛЬНЫХ СУК*
Организм Процент
___________________________________________случаев
Pasturella multocida 98
P-Гемолитические стрептококки 90
Escherichia coli 85
Неклассифицированные грам-положитель-ные бактерии 90
Неклассифицированные грам-отрицатель-ные бактерии 86
Mycoplasma spp. 60
Стрептококк (а-гемолитический, негемолитический) 56
Pasturella spp. 68
Энтерококки 44
Proteus mirabilis 25
Staphylococcus intermedius 34
Коринебактерии 41
Коагулаза-отрицательные стафилококки 22
Pseudomonas spp.10
Из: Bjurstrom L., Linde-Forsberg C.: Long-term study of aerobic bacteria of the genital tract in breeding bitches. Am. J. Vet. Res. 53:665, 1992.
*У всех собак был обнаружен по крайней мере один вид бактерий. Всего было исследовано 826 вагинальных мазков.
Отсутствие увеличения матки
У практически здоровой суки обильные выделения из влагалища могут наблюдаться в отсутствие увеличения матки. В такой ситуации необходимо прежде всего дифференцировать сильное воспаление влагалища с инфекцией или без нее от пиометры с настолько обильными выделениями, что не возникло системной токсемии. У овариэктомированных собак следует принимать во внимание и возможность «пиометры культи». Для дифференцирования пиометры открытого типа от тяжелой очаговой инфекции влагалища используют данные тщательно собранного анамнеза, анализов крови, обследования влагалища, рентгенографии и, если возможно, УЗИ брюшной полости. При этом самым ценным дифференциально-диагностическим методом является УЗИ брюшной полости.
Системные признаки заболевания, такие, например, как сонливость, потеря аппетита, нездоровый вид собаки, могут быть слабо выражены при пиометре открытого типа. Однако если эти признаки налицо, то они указывают скорее на заболевание матки, а не влагалища; у сук с инфекцией только влагалища системные признаки заболевания наблюдаются редко. Точно так же на заболевание матки указывают лихорадка, нейтрофильный лейкоцитоз и гиперпротеинемия, так как и эти признаки нетипичны для изолированной инфекции влагалища.
Вагиноскопия с помощью 15-сантиметрового ректоскопа или гибкого эндоскопа позволяет визуально исследовать слизистую влагалища на предмет воспаления, инфекции, новообразований, наличия чужеродных тел и врожденных аномалий, а
956 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
Рис. 23-3. Эхограмма брюшной полости собаки, демонстрирующая пиометру культи, развившуюся через несколько лет после овариогистерэктомии.
также в какой-то мере определить и происхождение выделений. Если выделения присутствуют в переднем отделе влагалища, то следует заподозрить болезнь матки. Когда остаются сомнения в диагнозе, состояние суки нетяжелое и хозяева не соглашаются на хирургическое вмешательство, то собаку можно лечить по поводу вагинита и затем повторно обследовать. Однако прекрасным диагностическим средством в этом случае будет УЗИ, и не следует недооценивать результаты скрининга брюшной полости, полученные с его помощью. Если нужно сохранить фертильность собаки, то после того как будет установлено, что источником выделений является инфицированная матка, ее можно начинать лечить с помощью ПГ F, .
Пиометра культи
Пиометра культи редко встречается и трудно поддается диа! ностике. Это заболевание заключается в воспалении и бактериальном инфицировании ос-гатка тела матки, сохранившегося после овариогис
терэктомии. Если овариогистерэктомия была проведена так, что остались шейка и часть тела матки, то они становятся участком, легко поддающимся инфицированию. Культя матки расположена в области, благоприятной для роста бактерий, и здесь с легкостью формируется внутренний абсцесс. Если поели операции остается и часть ткани яичников, то могу! возобновиться эстральпыс циклы, секреция прогестерона и стимуляция матки, способствующая ее воспалению. Эти явления повышают риск последующего инфицирования. Однако пиометра культи развивается и в отсутствие остатков яичников, возникая за счет восходящей инфекции из влагалища.
В отсутствие выделений из влагалища диагноз «пиометра культи» поставить очень трудно. Если клинические симптомы, а именно сонливость, потеря аппетита, лихорадка, и отклонения лабораторных показателей те же, что обычно наблюдаются при пиометре, то изолированная инфекция влагалища маловероятна, так как обычно она не вызывает таких симптомов. Рснтгсног рафия каудального
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА • 957
отдела брюшной полости со сдавливанием живота может выявить больную культю матки. Наилучшим нсинвазивным методом диагностики пиомегры культи, дающим наиболее четкий ответ, является УЗИ (рис. 23-3). Однако, поскольку УЗИ не везде доступно, многим собакам для установления окончательного диагноза проводят лапароскопию. Если в ходе )того вмешательства выявлена инфицированная культя матки, то после ее удаления рекомендуется тщательно обследовать брюшную полость, чтобы исключить наличие сохранившейся ткани яичников.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Овариогистерэктомия
Овариогистсрэктомия - наиболее предпочтительный метод лечения пиометры. Единственной причиной отказа от нее может быть решительное требование хозяина сохранить репродуктивную активность собаки. Но даже и в этом случае ветеринары назначают медикаментозное лечение, только если сука не старше шести лет. Лучше всего проводить хирургическую операцию, когда сука относительно здорова Тяжелобольных сук сначала подвергают интенсивному лечению антибиотиками и внутривенным введением жидкости. Показано, что в случаях септического шока, обусловленного пиометрой, вливания гипертонического физиологического раствора с декстраном 70 более *ффскгивны, чем изотонического физиологического раствора (Fantoni el al, 1999). Необходимо применять противомикробныс препараты, активные в отношении Е. coli (амоксициллин, триметопримсульфаметоксазол, цефалоспорины), и все время контролировать их эффект.
У собаки следует определить содержание электролитов в сыворотке и кислотно-щелочное равновесие, а также оценить состояние водного баланса и возможные изменения сердечного ритма. Любые
выявленные нарушения требуют интенсивного лечения, и ветеринар должен помнить, что тяжелобольным сукам нельзя вводить простагландины для лечения пиометры. Частыми осложнениями пиометры являются сепсис, токсемия и уремия, а потому иногда приходится проводить овариогистсрэк-томию, не дожидаясь «стабилизации» состояния животного. Бывают случаи, когда операцию нельзя отложить больше чем на несколько часов. Вызванная инфекцией матки септицемия часто имеет тяжелые последствия, и только хирургическое удаление больного органа позволяет ее устранить.
Как только возникло подозрение на пиомстру, нужно сразу же начинать вводить внутримышечно антибиотики широкого спектра действия и внутривенно жидкость, содержащую соответствующие электролиты и бикарбонат. Немедленное начало лечения поможет собаке перенести оперативное вмешательство. Поддерживающую терапию следует продолжать во время и после операции. В течение 7-10 дней после удаления матки собаке даю г антибиотики перорально.
Хирургическое дренирование
Были попытки хирургйческого лечения пиометры с сохранением матки и яичников. Так, собак и кошек удавалось успешно лечить методом хирургического дренирования матки (Vasseur, Feldman, 1982). Хотя раньше мы проводили такое дренирование у сук и кошек в случаях, когда воспаление было вызвано сохранением плодов в матке или половых путях, наш опыт не позволяет рекомендовать этот метод для практического применения. В ходе дренирования нужно отсасывать гной и каждый poi матки промывать антисептическим раствором с помощью введенных трубок в течение нескольких дней пос ie операции (рис. 23-4). Успех этой процедуры зависит от умения и удачи. Еще раз повторяем, что она не рекомендуется.
Рис. 23-4. Схема размещения внутри маточных трубок при хирургическом лечении пиометры. (Из: Vasseur ВВ, Feldman ЕС: Pyometra associated with extrautcrine pregnancy in a cat. JAAHA 18:872, 1982).
958 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
Описан способ дренирования матки с помощью катетеров, вводимых через свод влагалища и шейку, что позволяет избежать хирургического вмешательства. Канюлирование матки у собак проводят под общим наркозом. Жесткую металлическую канюлю вводят под флуороскопическим контролем при постоянной инфузии вязкой контрастной среды. Два рентгеноконтрастных гибких катетера вставляют в матку через канюлю, после чего канюлю убирают. Гибкие катетеры оставляют в матке на несколько дней и используют для дренирования и введения антибиотиков. Эта процедура многоступенчатая и требует различного оборудования (Lagerstedt et al, 1987). Как и в случае хирургически вставляемых катетеров, метод непрактичен и может представлять угрозу для жизни животного, а потому не рекомендуется.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ (ПРОСТАГЛАНДИНЫ)
Выбор метода лечения
Результаты лечения пиометры эстрогенами, андрогенами, хинином и окситоцином противоречивы и редко бывают положительными. Использование системных антибиотиков как единственного средства терапии тоже обычно неэффективно. В то же время результаты, полученные с ПГ F2a, оказались очень хорошими, и теперь простагландины рассматриваются как достаточно надежное средство лечения пиометры. При этом овариогистерэктомия по-прежнему рекомендуется, но сук шести лет и моложе можно успешно лечить и медикаментозными средствами.
Действие простагландинов
К числу физиологических эффектов ПГ F2a на репродуктивную систему относятся стимуляция сокращений миометрия и снижение концентрации прогестерона в плазме крови. Другим, менее постоянным эффектом является расслабление шейки матки у собак и кошек. Сокращения миометрия приводят к выбросу экссудата из матки. Синтез и секреция прогестерона составляют основную функцию желтых тел. При введении ПГ F2a происходит лизис желтых тел либо временное торможение в них стероидогенеза. Эти эффекты частично зависят от дозы и способа введения ПГ F2a и от того, на какой стадии эстрального цикла было начато лечение (препарат оказывает лютеолитическое действие в позднем, но не в раннем диэструсе). Падение концентрации прогестерона в плазме крови снижает стимуляцию роста эндометрия и секрецию эндометриальных желез (рис.23-5).
Клиническое применение простагландинов
Общие принципы. Принимая решение об использовании ПГ F2a, клиницист должен учитывать
Рис. 23-5. Резкое снижение концентрации прогестерона в плазме крови сук с пиометрой при введении простагландина F2a в позднем диэструсе. Сплошная линия - изменение концентрации прогестерона у сук, которым потребовался лишь один 5-дневный курс лечения. Пунктирная линия - изменение концентрации прогестерона при начале введения простагландина на более ранней стадии диэструса. Снижение концентрации прогестерона до необходимого уровня (<1 нг/ мл) было достигнуто только после второго 5-дневного курса введения простагландина.
возраст суки, желание ее владельца сохранить репродуктивную способность животного, тяжесть заболевания на момент обследования, наличие или отсутствие сопутствующих заболеваний, а также тип пиометры (с раскрытой или закрытой шейкой матки). Лечение простагландинами не рекомендуется назначать сукам старше 6 лет, а также в тех случаях, когда хозяева не заинтересованы (или мало заинтересованы) в том, чтоб сохранить фертильность своей собаки. Препарат абсолютно противопоказан сукам с сердечными или респираторными заболеваниями; его также нельзя вводить животным, находящимся в критическом состоянии. Во всех этих случаях следует проводить овариогистерэктомию.
Тяжелобольные суки. Клинический ответ (уменьшение размеров матки и/или объема ее содержимого) наблюдается не раньше чем через 48 часов после начала лечения простагландином. Поэтому введение препарата тяжелобольным сукам, в отношении которых есть опасение, что они не перенесут наркоза, едва ли позволит получить какое-то время на вливания жидкости и «стабилизацию» критического состояния животного перед овари-огистерэктомией. Хотя мы редко сталкивались с такого рода случаями, но считаем, что побочные эффекты простагландинов могут ухудшить состояние и/или привести к гибели тяжелобольных собак. Препарат не следует вводить собакам, болезнь которых перешла в критическую стадию, пока не будут получены какие-то доказательства его эффективности в подобных ситуациях.
Пиометра закрытого типа. При пиометре закрытого типа использовать ПГ F2a нужно с осторожностью, так как его терапевтический эффект относительно низкий и шейка матки может не раскрыться. Если шейка будет закрыта, то в результа
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
959
те стимуляции маточных сокращений содержимое матки может быть вытеснено в брюшную полость через яйцеводы или через разрыв стенки матки. Этот экссудат способен вызвать тяжелый перитонит. Расслабление шейки матки могли бы обеспечить эстрогены, но вводить их с этой целью до начала лечения простагландином не рекомендуется, поскольку они усиливают действие прогестерона на матку.
Лицензирование препарата. Применение ПГ F2a у собак не лицензировано, но есть официальное разрешение на его использование у коров и кобыл. Владельцев следует проинформировать о том, что использование ПГ F2a является испытанным методом лечения пиометры у собак и кошек и что их питомцев будут лечить «стандартным» методом.
Предварительное обследование. До начала лечения простагландинами следует провести УЗИ, чтобы исключить наличие в матке плодов (живых или мертвых). Рентгенография для этой цели мало подходит. У нас было 11 собак с ошибочным диагнозом пиометры, которая была диагностирована на основании обильных слизисто-гнойных выделений из влагалища и «подтверждена» рентгенографией брюшной полости. Все эти собаки были направлены на лечение пиометры простагландином. Однако при УЗИ у всех собак была установлена щенность. Нужно помнить, что у щенной суки матка равномерно увеличена, и пока не станет явной кальцификация скелетов плодов, это увеличение может быть ошибочно принято за пиометру (Meyers-Wallen et al, 1986).
У этих 11 собак был тяжелый вагинит, который удалось вылечить путем орошений влагалища раствором фурацилина (нитрофуразона) или бетади-на. В результате все собаки удачно ощенились. Введение им простагландина привело бы к изгнанию плодов. Лечение простагландинами противопоказано сукам с мумифицированными плодами или скелетным материалом плодов в матке; наши попытки лечить таких сук ни разу не привели к успеху.
Рекомендуемый простагландин и схема лечения
Выбор. Применять следует только природный ПГ F2a (Lutalyse, Prostin) и в рекомендуемых дозах. Синтетические аналоги ПГ F2a (клопростенол [Estrumate], флупростенол [Equimate], простален [Synchrocept]) являются более сильными препаратами, чем ПГ F2a. Их применение в указанных нами дозах может вызвать шок и даже смерть. LD-50 (доза, приводящая к смерти в 50% случаев) природного ПГ F2a у собак составляет 5,13 мг/кг.
Лечение простагландином и время наблюдения. Для лечения пиометры рекомендуется следующая схема введения соли природного ПГ F 2а (препарат лютализ [Lutalyse]): 1-й день - 0,1 мг/кг подкожно однократно; 2-й день - 0,2 мг/кг подкожно однократно; с 3-го по 7-й день - 0,25 мг/кг один
ТАБЛИЦА 23-3. СХЕМА ЛЕЧЕНИЯ СУК С ПИОМЕТРОЙ ОТКРЫТОГО ТИПА
ПРОСТАГЛАНДИНОМ F2a
1. Установить точный диагноз
а. Анамнез и физикальное исследование
б. Общий клинический и другие анализы крови
в. Рентгенография (или - лучше - УЗИ)
2. Вводить природный простагландин (Lutalyse):
а. 1-й день: 0,1 мг/кг подкожно однократно
б. 2-й день: 0,2 мг/кг подкожно однократно
в. 3-7-й дни: 0,25 мг/кг подкожно один раз в день, ежедневно
3. Противомикробная терапия во время и в течение 14 дней после курса лечения простагландином
4. Повторные обследования
а. Через 7 дней после отмены ПГ F2a
б. Через 14 дней после отмены ПГ F2a
5. Повторный курс лечения через 14 дней, если:
а. Продолжаются гнойные выделения из влагалища
б. Наблюдается лихорадка, повышено содержание лейко-цитов в крови, матка наполнена жидкостью
раз в день ежедневно (табл. 23-3). Все инъекции нужно делать утром и наблюдать за сукой в течение всего дня. Низкая начальная доза нужна для ослабления побочных эффектов, тяжесть которых снижается при последующих введениях препарата.
Через семь дней после последнего введения простагландина суку надо обследовать, чтобы убедиться, что ее состояние не ухудшилось по сравнению с исходным (до начала лечения). Если ей стало хуже, настоятельно рекомендуется провести овариогис-терэктомию. Если же состояние суки стабильно, ее обследуют еще через семь дней (через 14 дней после последней дозы простагландина).
Согласно другой схеме, ежедневное введение ПГ F2a продолжают до прекращения выделений из влагалища (Johnston et al, 2001). Эта схема не представляется удачной, поскольку некоторые суки вылизывают себя настолько тщательно, что бывает трудно проследить за выделениями. Кроме того, по нашим наблюдениям, выделения из влагалища в большинстве случаев продолжаются в течение двух недель после прекращения введения препарата. Эти выделения постепенно из гнойных становятся прозрачными, пока не прекратятся. Нет никаких доказательств в пользу преимущества длительной терапии - до прекращения выделений. Кроме того, ее недостатком является введение потенциально токсичного препарата в период, когда животное в нем уже не нуждается.
Повторный курс лечения? При повторном осмотре собаки на 14-й день после седьмой (последней) инъекции простагландина обсуждается вопрос о необходимости второго курса лечения. Решение принимается на основании клинических данных, результатов физикального и ультразвукового исследований, а также анализа крови. Если все еще наблюдаются кровянистые или слизистогнойные выделения, нейтрофилия или увеличение матки, следует повторить подкожное введение про
960 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
стагландина F2a в дозе 0,25 мг/кг веса в течение еще 7 дней. Самым важным показанием для повторного курса лечения являются продолжающиеся гнойные выделения. Если нет беспокоящих симптомов, а выделения прозрачные или серозные, повторное лечение не требуется. Только семи сукам из 192, получавших ПГ F2a, пришлось провести три курса инъекций. У этих семи собак была пиометра закрытого типа со значительным увеличением матки, введение им ПГ F2a не давало клинического эффекта, и в конечном итоге их пришлось подвергнуть овариогистерэктомии.
Ежедневный мониторинг. В течение первого семидневного курса лечения простагландином необходимо два-три раза в день проводить физикальное исследование. При каждом курсе лечения несколько раз в день проводятся одни и те же процедуры: измерение ректальной температуры, пальпация брюшной полости, оценка состояния гидратации и общего состояния животного, а также каких-то других существенных для данного случая показателей.
Побочные эффекты, особенно после первой и второй инъекций простагландина, могут быть тяжелыми и неприятными. Как будет описано в следующем разделе, тяжесть побочных эффектов у каждой суки нужно оценивать индивидуально. После введения препарата суку рекомендуется выгуливать до тех пор, пока не пройдет побочное действие простагландина. Считается, что прогулка (движение) минимизирует нежелательные клинические проявления. У большинства сук они прекращаются через 20 минут, у других на это уходит от 5 минут до одного часа. После этого животные чувствуют себя хорошо, и их можно накормить. Во избежание рвоты кормить следует не позже чем за 2-3 часа до введения простагландина.
Строго рекомендуется вводить простагландины утром, чтобы иметь возможность наблюдать за животными в течение всего дня. Первую инъекцию обязательно надо делать утром. При соблюдении этого условия животных с пиометрой открытого типа не нужно оставлять на ночь в лечебнице. Мы советуем владельцам забирать собак и кошек на ночь домой. В то же время мы советуем оставлять животных в клинике по крайней мере на 4 часа после инъекции, что позволит заметить вызванные препаратом побочные эффекты и, если потребуется, принять соответствующие меры. Собаки с пиометрой закрытого типа должны находиться в стационаре на протяжении всего курса лечения.
Выделения из влагалища. При лечении сук с пиометрой открытого или закрытого типа вызываемые простагландином выделения из влагалища не всегда заметны. Реакция матки на простагландины развивается медленно, на протяжении периода, измеряемого днями и неделями, а не минутами и часами. Индуцированные простагландинами сокращения матки приводят к постепенному уменьшению ее диаметра и к постепенному вытеканию из нее жидкости. Считается, что отсутствие види
мого увеличения выделений у многих сук обусловлено как небольшим объемом выделений, так и тем, что сука их быстро поедает.
Если в процессе лечения выделения не заметны, то всегда возникает подозрение на перитонит вследствие прободения матки или вытекания ее содержимого из маточной трубы. В идеале, достаточно лишь тщательного наблюдения, чтобы обнаружить развивающийся перитонит, а значит, и быстро принять меры. Но на практике для исключения перитонита обычно требуется рентгенографическое или ультразвуковое исследование. При этом ультразвуковое исследование намного предпочтительнее рентгенографического для оценки содержимого и размеров матки и наличия жидкости в брюшной полости или перитонита. Из 192 сук, которых мы лечили, ни у одной не было перитонита.
Антибиотики. У 15% собак с пиометрой до начала лечения простагландинами в посевах крови были обнаружены бактерии, что потребовало лечения антибиотиками (Nelson et al, 1982, Feldman, Nelson, 1989). Таким собакам следует вводить в течение 7 дней противомикробные средства широкого спектра действия, эффективные против Е. coli. В этих случаях надежно действовали триметоприм-сульфаметоксазол и амоксициллин (Clavamox).
Побочные эффекты
Подкожное введение простагландинов обычно вызывает целый ряд побочных эффектов (табл. 23-4). Их отсутствие после первой инъекции препарата отмечается крайне редко. При повторном курсе лечения реакция организма на первую дозу, как правило, такая же, как при начальном курсе. Сначала собака становится беспокойной и начинает ходить. Затем появляется обильное слюноотделение и иногда одышка, после чего могут проявиться все или отдельные из следующих эффектов: спазмы или боли в животе, тахикардия, лихорадка, рвота и дефекация. Эти реакции организма проходят через 5-60 минут после введения простагландина. В среднем побочные эффекты длятся 20-30 минут. Опорожнение матки после инъекции у разных сук протекает по-разному.
ТАБЛИЦА 23-4. ЧАСТОТА ПОБОЧНЫХ ЭФФЕКТОВ У СУК ПРИ ЛЕЧЕНИИ
ПИОМЕТРЫ ПОДКОЖНЫМ ВВЕДЕНИЕМ ПРОСТАГЛАНДИНА
Эффект Процент случаев
Беспокойство 85
Хождение 85
Усиленное слюноотделение 82
Одышка 79
Рвота 73
Спазмы или боли в животе 61
Тахикардия 55
Дефекация 30
Опорожнение матки 30
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА • 961
Обычно побочные эффекты снижаются после каждой последующей дозы. Часто собака, у которой побочные эффекты после первого введения простагландина были тяжелыми, может вообще не реагировать или давать очень слабую реакцию на пятую-седьмую дозу. В течение первой минуты после подкожной инъекции побочные эффекты могут быть крайне выраженными. Мы обнаружили, что 20-40-минутная прогулка с собакой после введения простагландина не только снижает тяжесть побочных эффектов, но и дает возможность ветеринару или опытному техническому работнику неотступно наблюдать за собакой.
Наиболее опасная реакция на введение простагландина - быстро развивающийся шокоподобный синдром. Мы наблюдали это дважды; у сук возникли такие явления, как слабость, бледность слизистых, тахикардия в сочетании со слабым пульсом. Обеих сук лечили внутривенным введением жидкостей, и симптомы исчезли спустя примерно 45 минут от момента возникновения. Еще у двух сук через нескольких минут после введения простагландина возникла желудочковая пароксизмальная тахикардия. Ее проявления были сходны с наблюдавшимися при шоковом состоянии. Этим сукам немедленно ввели внутривенно лидокаин, и тахикардия прекратилась меньше чем через 60 минут. У одной из этих сук лечение простагландином было прервано, и ее подвергли овариогистерэктомии. Что касается трех остальных сук, то у двух из них отмечались сходные, хотя и менее тяжелые реакции после второй инъекции простагландина, но при последующих инъекциях серьезных проблем не возникало; всем трем собакам был проведен полный курс лечения простагландином. Когда врач сталкивается с такого рода тяжелым побочным эффектом, ему обычно хочется снизить последующую дозу препарата. При меньшей дозе негативное действие будет менее выраженным.
Имеется рекомендация по использованию атропина для снижения побочных эффектов простагландина (Lein et al, 1989). У нас такого опыта нет.
Необходимость повторного курса лечения
Было проведено сравнение протоколов лечения и результатов анализов у сук, прошедших один либо два курса терапии простагландином по поводу пиометры открытого типа. В обеих группах разрешение пиометры совпадало со снижением концентрации прогестерона в плазме крови до уровня ниже 1 нг/мл через 14 дней после пятого-седьмого дня лечения. Но в тех случаях, когда у сук продолжались гнойные выделения из влагалища, концентрация прогестерона в плазме крови была выше 1 нг/мл. Кроме того, если лечение пиометры было начато раньше чем через 5 недель после окончания течки, то одного курса лечения часто было недостаточно, тогда как сукам, у которых предшествующая течка закончилась больше чем за 5 недель до лечения, обычно хватало одного курса. Другими словами, у
большинства сук, прошедших два курса инъекций простагландина, лечение было начато в раннем диэструсе, а у сук, не нуждавшихся в повторном курсе лечения, оно было начато на более поздней стадии диэструса. Из этого следует, что по мере развития диэструса желтые тела становятся более чувствительны к «литическому» действию простагландина (см. рис. 23-5). Поэтому собаки, которых начали лечить позднее чем через 5 недель после прекращения течки, более чувствительны к действию простагландина, чем те, которых стали лечить в раннем диэструсе. Владельцы собак должны быть осведомлены о том, что результаты первого курса лечения пиометры зависят от стадии диэструса на момент начала введения препарата.
Почему для получения ответа на введение простагландина концентрация прогестерона в сыворотке крови должна снизиться до ее уровня в анэструсе, остается неясным. Прогестерон, по-видимому, поддерживает секреторную активность желез эндометрия, а их секрет подавляет активность лейкоцитов и тем самым способствует росту бактерий; в итоге это действие прогестерона приводит к персистированию пиометры. Соответственно, устранение прогестерона повышает вероятность излечения пиометры. Однако, в отличие от многих авторов, мы не советуем определять прогестерон до и во время терапии. Это представляется погоней за академичностью, поскольку результаты определения никак не влияют на рекомендуемую схему лечения.
Результаты лечения
На успешное лечение пиометры простагландином F2a указывают: исчезновение клинических признаков заболевания; появление серозных выделений из вульвы и затем полное прекращение выделений; уменьшение пальпируемого диаметра матки; восстановление нормальной лейкоцитарной формулы крови. После хирургической экстирпации пиометры количество лимфоцитов в периферической крови резко возрастает. Это, по-видимому, связано с тем, что «ямы», в которую потоком поступали лимфоциты, не стало, а костный мозг продолжает их продуцировать. При медикаментозном лечении пиометры «яма» остается, но инфицирование устраняется, а потому количество лимфоцитов в крови быстро снижается (рис. 23-6).
Пиометра открытого типа
Из 163 сук с пиометрой с открытой шейкой, прошедших через нашу клинику, у 153 (94%) произошло полное излечение матки. Восьми сукам лечение было прервано по разным причинам: у пяти сук в матке были скелетные остатки плодов, и полностью вылечить пиометру не удалось, несмотря на два курса терапии; у одной суки введение препарата вызвало преходящие мозговые нарушения; у одной развилась острая сердечная тахиаритмия
962 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
Рис. 23-6. Динамика изменений количества лейкоцитов в крови у сук после успешного лечения пиометры. Рисунок демонстрирует устойчивое снижение числа лейкоцитов в крови после лечения простагландином F2a (сплошная линия) и первоначальное повышение этого показателя после овариогис-терэктомии (пунктирная линия).
(желудочковая пароксизмальная тахикардия) и еще у одной был заподозрен перитонит. Всем этим восьми собакам провели овариогистерэктомию.
У 98 собак (64%) был получен хороший эффект после одного курса лечения, и 55 собакам (36%) понадобилось два курса лечения. Из 153 выздоровевших сук 135 (88%) впоследствии удачно ощенились и 109 из них дали более одного приплода. Пять собак успешно разрешились от щенности после первой течки после лечения, но затем у них повторно развилась пиометра.
После лечения простагландинами следующий эстральный цикл может начаться вскоре или с задержкой. Никакой закономерности здесь не выявлено, и хозяев следует предупредить о возможности скорого наступления цикла. Мы очень рекомендуем вязать суку в первый же цикл после лечения. Для этого имеется несколько причин: 1) матка у собаки может оставаться увеличенной, и всегда сохраняется вероятность рецидива пиометры, поэтому следует попытаться получить потомство при первой же возможности; 2) щенные суки бывают менее восприимчивы к инфекциям, чем нещенные; 3) собака ничего не выигрывает от пропуска цикла.
Многие из вылеченных сук были подвергнуты овариогистерэктомии после того, как они дали один или два помета. Гистологическое исследование их матки не выявило отклонений от нормы. Исходя из того, что неудача лечения простагландинами часто связана с наличием КГЭ, фертильность успешно
пролеченных сук, их способность доносить щенность до родов и нормальная гистология эндометрия говорят в пользу того, что у получавших эстрогены молодых собак заболевание пиометрой не сопровождается КГЭ.
Пиометра закрытого типа
Результаты. Результаты лечения простагландинами сук с пиометрой закрытого типа хуже, чем при пиометре открытого типа. Случаев пиометры закрытого типа в нашей клинике было относительно немного, поскольку этот синдром менее распространен, а собаки часто поступают в настолько тяжелом состоянии, что им необходима овариогис-терэктомия. Лечение простагландинами проводили пятидесяти трем собакам с пиометрой закрытого типа, но только у 16 (31%) из них оно прошло успешно. При этом 12 собакам пришлось провести два курса инъекций, и только 4 собаки выздоровели после одного курса. Эти 16 собак впоследствии дали здоровое потомство.
Из 37 сук, которых не удалось вылечить, 4 получили одну серию инъекций, 24 - две серии, а 9 - три курса инъекций. Ввиду отсутствия ответа на терапию 33 сукам была проведена овариогистерэк-томия; у этих сук лечение простагландином не вызвало ни улучшения, ни ухудшения состояния - оно осталось прежним. Одна сука погибла через 6 часов после первой инъекции. Она была среди первых десяти собак, которым мы вводили простагландины; первоначально возникшие побочные эффекты препарата были у нее устранены полностью. Лечение простагландинами в нашей клинике прошли более 200 собак и кошек, и это был единственный летальный исход в нашей практике. Вскрытие не выявило причин смерти.
Прогноз. Владельцам собак, имеющих пиометру закрытого типа, следует давать лишь осторожный прогноз относительно результатов лечения. Неэффективность терапии предположительно обусловлена тем, что матку с закрытой шейкой невозможно опорожнить. Если будет разработан надежный метод расширения шейки матки, вероятность успешного лечения пиометры закрытого типа возрастет. Все же, несмотря на один случай гибели собаки и низкий процент случаев излечения, мы пытаемся лечить медикаментозно некоторых сук с пиометрой закрытого типа. Допустимо попробовать провести медикаментозную терапию, а если она не поможет, то прибегнуть к овариогистерэктомии.
Мониторинг. В процессе лечения пиометры закрытого типа простагландинами тщательное наблюдение за животным является обязательным. Помимо физикального исследования, проводимого ежедневно по несколько раз, необходимо УЗИ брюшной полости до начала лечения и через каждые 2-3 дня во время лечения. Ультразвуковое исследование должно показывать, что размеры матки уменьшаются без признаков перитонита.
КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
963
Ежедневно или через день следует определять количество лейкоцитов в крови - при успешном ходе лечения оно должно снижаться. В первые два-три дня снижения не происходит, но затем число лейкоцитов должно постепенно вернуться к норме. С клинической точки зрения, состояние суки должно стабильно улучшаться, не считая быстрых и преходящих побочных эффектов после введения простагландина. Аппетит, внимание и активность должны быстро вернуться к норме. Однако во многих случаях клинические признаки заболевания сохраняются в течение недель, причем их выраженность не снижается, но и не нарастает. Выделения из матки, как следствие инъекций, не всегда удается заметить. Некоторые брезгливые собаки содержат себя в чистоте, тщательно вылизывая себя. Такое вылизывание может оказаться единственным признаком раскрытия шейки матки, сопровождающегося выделениями из влагалища.
Долгосрочный уход за собакой
После лечения пиометры простагландинами всегда сохраняется риск рецидива пиометры у суки. Владелец должен решить, сколько примерно щенков он хочет получить от такой суки, и вязать ее во время каждого цикла до тех пор, пока реалистически поставленная цель не будет достигнута. Помимо чисто практической цели, вязка рекомендуется и с медицинской точки зрения: щенность в определенной степени защищает от развития пиометры (Niskanen, Thrusfield, 1998). После последней щенности суке следует провести овариогистерэк-томию. Многие владельцы соглашаются с этими рекомендациями, чтобы по возможности избежать рецидива пиометры.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ (АЛЬТЕРНАТИВЫ ПРИРОДНЫМ ПРОСТАГЛАНДИНАМ)
Синтетические простагландины
Сообщалось, что в качестве средства лечения пиометры у собак можно использовать аналог простагландина - клопростенол (Fazale et al, 1955; Valocky et al, 1997). Мы вводили этот препарат сукам в дозе 10 мкг/кг дважды в день подкожно в течение 9-15 дней. Только у 60% сук наблюдалось полное выздоровление, а одна сука погибла от шока. Побочные эффекты были такими же, как при введении природных простагландинов. Необходимы дополнительные исследования, прежде чем можно будет рекомендовать синтетические простагландины для клинического применения.
Антипрогестагены
Имеются данные о лечении пиометры у собак с помощью антипрогестагена аглепристона (Breitkopf
et al, 1997; Fieni et al, 1999). Fieni и соавт. вводили пяти сукам препарат в дозе 10 мг/кг подкожно один раз в день в течение двух дней. У двух из этих сук развилась диссеминированная внутрисосудистая коагулопатия, и им провели овариогистерэктомию; у одной суки не было улучшения, и ее после этого успешно вылечили природным простагландином; у двух сук отмечалось улучшение (Onclin, Verstegen, 2000а). Как и в случае с синтетическим простагландином, этот метод терапии требует дальнейшего изучения и пока не может быть рекомендован.
ПОСЛЕРОДОВОЙ ЭНДОМЕТРИТ
Послеродовой эндометрит является самостоятельным заболеванием, отличным от пиометры, но он тоже поддается лечению простагландином. У 9 из И собак с послеродовым эндометритом, которых мы лечили простагландином, наблюдался хороший эффект терапии, инфекция матки была устранена, и впоследствии эти собаки были успешно повязаны и ощенились.
ЛИТЕРАТУРА
Baba Е, et al: Vaginal and uterine microflora of adult dogs. Am J Vet Res 44:606, 1983.
Bjurstrom L, LindeForsberg C: Long-term study of aerobic bacteria of the genital tract in breeding bitches. Am J Vet Res 53:665, 1992.
Bowen RA, et al: Efficacy and toxicity of estrogens commonly used to terminate canine pregnancy. JAVMA 186:783, 1985.
Breitkopf M, et al: Treatment of pyometra (cystic endometrial hyperplasia) in bitches with an antiprogestin. J Reprod Fert 51 (Suppl):327, 1997.
Chen YMM, et al: A model for the study of cystic endometrial hyperplasia in the bitch. In Proceedings: Advances in dog, cat, and exotic carnivore reproduction. Oslo, Norway 2000, p 30.
Egenvall A, et al: Breed risk of pyometra in insured dogs in Sweden. J Vet Intern Med 15:530, 2001.
Fantoni DT, et al: Intravenous administration of hypertonic sodium chloride solution with dextran or isotonic sodium chloride solution for treatment of septic shock secondary to pyometra in dogs. J Am Vet Med Assoc 215:1283, 1999.
Fazale A, et al: Comparative efficacy of hormonal and surgical treatment for pyometra in the dog. Int J Anim Sci 10:129, 1995.
Feldman EC, Nelson RW: Diagnosis and treatment alternatives for pyometra in dogs and cats. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1305.
Fieni F, et al: Use of prostaglandins and antiprogestins in the treatment of me-tritis/pyometra in the bitch. In Proceedings: European Veterinary Society for Small Animal Reproduction. Lyons, France, 1999, Mondial Vet, p63.
Frannson B, et al: Bacteriological findings, blood chemistry profile and plasma endotoxin levels in bitches with pyometra or other uterine diseases. J Vet Med Ser A 44:417, 1997.
Harvey M: Conditions of the non-pregnant female. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. United Kingdom, BSAVA, 1998, p 48.
Johnston SD, Root Kustritz MV, Olson PNS: Canine and Feline Theriogenology. Philadelphia, WB Saunders Co, 2001, p 210.
Lagerstedt AS, et al: Uterine drainage in the bitch for treatment of pyometra refractory to prostaglandin F2aipha. J Small Anim Pract 28:215, 1987.
Lein DH, et al: Termination of pregnancy in bitches by administration of prostaglandin F . J Reprod Fertil 39(Suppl):231, 1989.
Memon MA, Mickelsen WD: Diagnosis and treatment of closed-cervix pyometra in a bitch. JAVMA 203:509, 1993.
Meyers-Wallen VN, et al: Prostaglandin F2ai h treatment of canine pyometra. JAVMA 189:1557, 1986.
Nelson RW, et al: Treatment of canine pyometra and endometritis with prostaglandin F211pha. JAVMA 181:899, 1982.
Niskanen M, Thrusfield MV: Associations between age, parity, hormonal therapy, and breed, and pyometra in Finnish dogs. Vet Rec 143:493, 1998.
Noakes DE, et al: Cystic endometrial hyperplasia /pyometra in the dog: A review of the causes and pathogenesis. In Proceedings: Advances in dog, cat, and exotic carnivore reproduction. Oslo, Norway, 2000, p 28.
Nomura K: Histological evaluation of the canine deciduoma induced by silk suture. J Vet Sci 57:9, 1995.
964 • КОМПЛЕКС КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
Olson PN, et al: The use and misuse of vaginal cultures in diagnosing reproductive disease in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p 469.
Onclin K, Verstegen JP: Use of aglepristone (Alizine’) to treat pyometra in the canine and feline species. In Proceedings: Advances in dog, cat, and exotic carnivore reproduction. Oslo, Norway, 2000, p 114.
Stone EA: The uterus. In Slatter DH (ed): Textbook of Small Animal Surgery. Philadelphia, WB Saunders Co, 1985, p 1661.
Valocky I, et al: Experience with combined therapy with prostaglandin in bitches with the cystic endometrial/pyometra complex. Slovensky Vet Ca-sopis 22:79, 1997.
Vasseur BB, Feldman EC: Pyometra associated with extrauterine pregnancy in a cat. JAAHA 18:872, 1982.
Wadas B, et al: Biochemical phenotypes of Escherichia coli in dogs: Comparison of isolates isolated from bitches suffering from pyometra and urinary tract infections with isolates from faeces of healthy dogs. Vet Microbiol 52:293, 1996.
Wheaton LG, et al: Results and complications of surgical treatment of pyometra: A review of 80 cases. JAAHA 25:563, 1989.
Wrigley RH, Finn ST: Ultrasonography of the canine uterus and ovary. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989,p1239.
Г лава 24
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
НАЧАЛЬНЫЙ ЭТАП ИССЛЕДОВАНИЯ ....965
Оценка кобеля..................965
Анамнез........................966
Физикальное исследование.......966
Подходы владельцев к проведению вязки.............969
Общее состояние здоровья суки..969
БЕСПЛОДИЕ У BRUCELLA-
ОТРИЦАТЕЛЬНЫХ СУК, ИМЕЮЩИХ НОРМАЛЬНЫЙ ОВАРИАЛЬНЫЙ ЦИКЛ, НОРМАЛЬНЫЕ ИНТЕРВАЛЫ МЕЖДУ ТЕЧКАМИ И НОРМАЛЬНОЕ ПОЛОВОЕ
ПОВЕДЕНИЕ....................970
Первичный подход...............970
Бруцеллез......................973
Проблемы, связанные с инфицированием влагалища.....973
Хронический эндометрит: кистозная гиперплазия эндометрия.........975
Раннее рассасывание эмбрионов..975
Функциональная недостаточность желтых тел.....................976
Окклюзия матки или яйцеводов...976
Другие причины бесплодия.......976
СУКИ С УКОРОЧЕННЫМИ ИНТЕРВАЛАМИ
МЕЖДУ ТЕЧКАМИ (МЕНЬШЕ 4,5 МЕСЯЦЕВ).........977
Идиопатическое укорочение овариальных циклов.............977
Фолликулярные кисты............979
Патология матки................979
Расщепленная течка.............979
Отсутствие овуляции............980
Ятрогенные причины укороченного интервала между течками........980
СУКИ С УДЛИНЕННЫМИ ИНТЕРВАЛАМИ
МЕЖДУ ТЕЧКАМИ (БОЛЬШЕ 10 МЕСЯЦЕВ)..........980
Идиопатическое удлинение интервалов между течками..................980
Скрытая течка..................981
Овариальные кисты и опухоли....981
Лечение........................981
ОТСУТСТВИЕ ЦИКЛОВ: ПЕРВИЧНЫЙ
И ВТОРИЧНЫЙ АНЭСТРУС.........981
Определение понятий............981
Предшествующая овариогистерэктомия............982
Скрытая течка..................984
Анэструс, индуцированный лекарственными препаратами.....984
Наличие основного заболевания....985
Г ипотиреоз....................985
Избыток глюкокортикоидов.......985
Стресс.........................985
Преждевременное угасание функции яичников/аплазия яичников......985
Прогестерон-секретирующая киста яичника........................986
Иммуно-опосредованный оофорит....986
Хирургическая диагностика......986
ИНДУКЦИЯ ЭСТРУСА...............986
Переменный успех...............986
Мониторинг собаки, находящейся на лечении.........986
Доступность и надежность медицинских препаратов.........987
Применение хорионического гонадотропина из сыворотки жеребой кобылы (ХГЖК) или фолликулостимулирующего гормона........................987
Применение гонадотропин-рилизинг гормона (ГнРГ) или его агониста ....987
Применение каберголина.........988
СТОЙКИЙ ПРОЭСТРУС И/ИЛИ ЭСТРУС.988
Определение....................988
Клинические наблюдения.........988
Избыток экзогенного эстрогена..989
Избыток эндогенного эстрогена..989
ОПУХОЛИ ЯИЧНИКОВ...............991
Частота случаев................991
Гистология.....................991
Симптомы.......................991
СИНДРОМ КУЛЬТИ ЯИЧНИКА.........991
Определение....................991
Этиология......................991
Симптомы.......................991
Диагностика....................991
Лечение........................992
НАРУШЕНИЯ ПОЛОВОГО РАЗВИТИЯ ....992
Нормальное половое развитие....992
Аномальное половое развитие....992
Аномалии хромосомного пола.....993
Аномалии гонадного пола........994
Аномалии фенотипического пола: псевдогермафродитизм...........996
НЕУДАЧНЫЕ ПОПЫТКИ ВЯЗКИ........997
Неправильный подход............997
Поведенческий фактор...........998
НАЧАЛЬНЫЙ ЭТАП ИССЛЕДОВАНИЯ
Оценка кобеля
Прежде чем искать возможные причины бесплодия суки, надо проверить кобеля, потому что это значительно проще. Здоровый кобель продуцирует сперму постоянно, в то время как сука фертильна только в течение одной-трех недель в году. Самым простым и надежным методом определения производительности кобеля являются результаты его предыдущих вязок. Любой кобель, от которого за последние 1—4 месяца было получен хотя бы один помет, может рассматриваться как фертильный. Полезно также выяснить, проводилась ли - и насколь
ко успешно - вязка этого кобеля в то время, когда у данной собаки наступила течка и ее пытались повязать. Однако даже при положительных ответах на все эти вопросы надо провести анализ спермы кобеля.
Всех активных кобелей-производителей следует проверять на бруцеллез каждые 6 месяцев. Менее активных надо проверять ежегодно и непосредственно перед вязкой. Кобель, от которого ни разу не было получено потомства или оно было получено ранее чем в последние 6-12 месяцев, должен вызывать сомнения. Если фертильность кобеля сомнительна, владелец суки может выбрать одну из трех возможностей: 1) потребовать проведения анализа спермы и определения титра Brucella у ко
966 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
беля; 2) во время следующей течки выбрать другого, проверенного кобеля; 3) проверить свою собаку, понимая при этом, что несостоявшаяся щенность - это, может быть, и не ее вина.
Нормальные параметры спермограммы служат основным доказательством того, что вина лежит не на кобеле. Если же анализ спермы выявляет отклонения от нормы или невозможно получить эякулят, то подозрение падает на кобеля. У любого здорового самца могут быть получены один или два неудовлетворительных результата анализа спермы, однако каждый такой результат повышает вероятность его бесплодия. Кроме того, сперма может выглядеть морфологически нормальной, но при этом быть нефертильной. Тонкие методы исследования спермы мелких животных пока малодоступны. В то же время морфологический анализ спермы, как правило, прост в выполнении, надежен и недорог.
Анамнез
Определение. Проблема бесплодия или кажущегося бесплодия у сук широко распространена. За советом к ветеринарам обращаются, если собака не смогла забеременеть, если она не демонстрирует «нормального» полового поведения, если ее циклы необычны, а также при многих других нарушениях. Поэтому понятие «бесплодие» включает в себя длинный список анатомических, физиологических и поведенческих нарушений, а также целый ряд проблем, связанных с неправильным подбором партнера. Обращения владельцев бывают связаны еще и с тем, что если собака - чемпион породы или имеет другой важный титул, спрос на ее щенков, как и высокая их стоимость, гарантированы еще до всяких попыток вязки.
Сбор «полного» анамнеза. До начала обследования ветеринар должен свести многочисленные возможные причины бесплодия собаки к разумным пределам. Иными словами, дифференциальный диагноз большинства причин бесплодия устанавливается на основании подробного анамнеза, полученного от владельца. В первую очередь, надо выяснить, насколько хорошо владельцы знают собаку (например, живет ли она с ними в доме или за 200 км в охотничьем клубе). Находится ли она в доме одна или с другой сукой или суками, у которых недавно завершился овариальный цикл, или с одной или больше кастрированных сук, или с кобелями? Соответствуют ли ее рост и вес ее породе и линии разведения? Получает ли она какие-либо медицинские препараты, здорова она или больна?
Чтобы не тратить время на бесчисленные вопросы, помогающие уточнить список проблем и спланировать обследование, следует заранее предложить клиентам заполнить соответствующую анкету (табл. 24-1). Такой опросный лист может не дать всех сведений о собаке и не предоставить информации, достаточной для постановки диагноза, но он включает вопросы, необходимые для планиро
вания начала работы. Кроме того, при обсуждении анамнеза в суматохе рабочего дня всегда какие-то пункты забываются, а опросный лист позволит этого избежать.
Возраст и порода. Маленькие собаки достигают половой зрелости раньше, чем крупные. По имеющимся данным, пубертатный (первый) эструс у собак наступает в возрасте от 6 до 23 месяцев, в среднем у различных изученных популяций этот возраст составляет от 9,6 до 13,9 месяцев (Wildt et al, 1981; Johnston, 1991). Иными словами, к возрасту от 24 до 30 месяцев овариальные циклы начинаются у всех здоровых собак.
Поскольку первый и второй циклы могут быть нерегулярными, необычными, короткими или длинными (Wright, Watts, 1998), причины бесплодия в большинстве случаев исследуют у собак не моложе 24-30 месяцев. Сведения о возрасте и породе помогают ветеринару решить, насколько срочно надо проводить диагностику. Той- пуделю ее нужно начинать в более раннем возрасте, чем бульмасти-фу. У каждой породы свой средний промежуток времени между течками, но и внутри породы этот интервал варьирует. Как правило, почти у всех пород собак течка возникает один раз в каждые 4,5-10 месяцев. У африканских пород бывает один цикл в год. Остальные факторы, важные при оценке бесплодия, описаны ниже.
Физикальное исследование
Обследуйте репродуктивные органы в последнюю очередь! Как и при любой серьезной проблеме, те органы, которых она непосредственно касается, проверяются в последнюю очередь. Такой подход гарантирует, что в каждом случае общее состояние здоровья собаки будет оценено еще до обследования ее репродуктивной системы. Именно это обследование описано в данном разделе, но оно не должно идти в ущерб оценке общего состояния организма.
Вульва. Обследование репродуктивной системы обычно начинают с осмотра наружных половых органов, их размера и строения, наличия каких-либо выделений. Маленькая или незрелая вульва либо спрятанная в складках ткани из-за особенностей строения тела или ожирения может препятствовать нормальному спариванию. Тучные суки склонны к перивульварному дерматиту. Набухание и повышенный тургор вульвы характерны для фазы проэструса, а набухшая, но мягкая вульва отмечается при дерматите, во время течки и при приближающихся родах.
Выделения из влагалища. Во время анэструса или диэструса выделений из влагалища обычно не бывает. Кровянистые выделения наблюдаются в проэструсе, эструсе, при отделении плаценты или тяжелом вагините. Зеленовато-черные или темные кровянистые выделения связаны с отделением плаценты или относятся к «лохиям» - послеродовым
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
967
Таблица 24-1. АНКЕТА ДЛЯ ВЛАДЕЛЬЦА БЕСПЛОДНОЙ СУКИ
А. Порода________________________________________
Возраст________________________________________
Б. Общий медицинский анамнез (не включая репродуктивные проблемы)
1. Вакцинации?
2. Предыдущие серьезные заболевания, требовавшие госпитализации? Если были, кратко суммируйте
а.______________________________________________________________________________________________________
б.______________________________________________________________________________________________________
3. У Вашей собаки: а. Бывает ли рвота? Да Нет
б. Есть ли диарея? Да Нет
в. Пьет ли она сверх меры? Да Нет
г. Отмечается ли избыточное мочеотделение? Да Нет
д. Нормальна ли способность играть и переносить физические нагрузки? Да Нет
е. Нормальные ли вес и рост? Да Нет
ж. Есть проблемы с шерстным покровом? Да Нет
з. Есть другие проблемы? (Если да, опишите) Да Нет
4. Проверяли ли у собаки функцию щитовидной железы? Да Нет
5. Получала ли собака тиреоидные гормоны?
а. Раньше? Нет ___ Да Доза
б. Сейчас? Нет _Да Доза
6. Получает ли собака какие-либо медицинские препараты?
Нет Да Препарат и доза
7. Получала ли собака раньше и получает ли она сейчас препараты против блох или расчесов?
Нет Да Препарат и доза
8. Пожалуйста, перечислите все продукты питания и пищевые добавки, которые собака сейчас получает
В. Описание течек
1. Бывают у нее течки? Да Нет
2. Интервалы между течками _____________________________________________________________________________
3. Сколько всего было течек?____________________________________________________________________________
4. Сколько дней продолжаются кровянистые выделения? (в среднем за последние 2 или 3 течки)
5. В течение скольких дней она проявляет половую охоту? (в среднем за последние 2 или 3 течки)
6. Брал ветеринар влагалищный мазок во время течки?_____________________________________________________
7. Производились ли серийные анализы влагалищных мазков (т.е. несколько анализов во время одной течки)?
8. Проводилось ли определение каких-либо гормонов? Нет Да Опишите
9. Получала собака препараты с целью индукции течки (нет да) или повышения фертильности?
(нет да) Пожалуйста, объясните
Г. Описание вязки
1. Допускает ли собака садку кобеля и вязку? Нет Да
2. Как часто Вы вяжете собаку в период течки?___________________________________________________________
3. Как Вы выбираете даты вязки?_________________________________________________________________________
4. Была ли собака повязана с кобелем, давшим потомство в последние 6 месяцев? Нет Да
в последние 1-2 года? Нет Да
5. Наблюдали ли Вы «замок» во время вязки? Нет Да
6. Длительность замка при вязках (в среднем)
7. Входили ли луковицы при замке внутрь? оставались снаружи?
8. Давали ли собаке успокоительное средство до вязки или перед транспортировкой?Нет Да
9. Собаку вязали дома или везли к месту вязки? _________________________________________________________
Д. Описание беременностей
1. Давала собака потомство?
Даты: а. Число щенков в помете а.
б. б.
в. в.
г. г.
2. Были ли выкидыши? Нет Да Если «Да», то как Вы определили, что был выкидыш?
968 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
3. Происходило ли рассасывание зародышей? Нет Да
а. Если «Да», то как Вы об этом узнали?______________________________________________________________
б. Как было доказано наличие щенности?______________________________________________________________
в. Наличие щенности было проверено через
(1) 7 дней_________________
(2) 14 дней________________
(3) 21 день________________
(4) 28 дней________________
(5) 35 дней________________
(6) 45 дней________________
4. Прерывали ли у собаки когда-нибудь нежелательную щенность?
5. Выявлялась ли у нее бруцеллезная инфекция?__________________________________________________________
Дата и результаты последнего анализа_________________________________________________________________
6. Была ли у собака когда-нибудь:
пиометра? Да Нет
вагинит? Да Нет
Давали ли собаке когда-нибудь препараты для предотвращения или задержки течки? Нет Да_
Если «Да», то какие препараты?_________________________________________________________________________
Когда давали?__________________________________________________________________________________________
8. Есть ли у нее сейчас и были ли ранее аномальные выделения из влагалища?
Е. Данные о других собаках того же заводчика
Имеются ли у какой-либо другой суки того же заводчика
репродуктивные нарушения? Нет Да
Ж. Родословная собаки
Имеются у других сук данной линии репродуктивные нарушения? Нет Да
выделениям из матки. Красновато-коричневые, желтоватые или сероватые, густые, сметанообразные, дурно пахнущие выделения часто наблюдаются при пиометре открытого типа, метрите (воспаление матки) и тяжелом вагините. Иногда во время течки вагинальные выделения бывают соломенного цвета. Выделения в виде прозрачной слизи обычно предшествуют родам и редко вызывают беспокойство. Цитологический анализ влагалищного мазка должен быть обязательной составной частью обследования репродуктивных органов. Этот анализ легко провести, он недорогой, информативный и необходим при наличии любых выделений из влагалища
Пальпаторное исследование преддверия влагалища и влагалища. Пальпация свода влагалища должна проводиться при обследовании всех сук с подозреваемым бесплодием. Если нужно взять влагалищный мазок, это следует сделать до пальпаторного исследования. Последнее, как правило, легко выполнимо. Введя - обычно без каких-либо усилий - указательный палец в смазанной перчатке в свод влагалища, оценивают величину просвета влагалища, отверстие уретры, размеры и очертания клитора. Легкому и безболезненному проведению этой процедуры мешают опухоли, чужеродные тела, стриктуры, болезненный вагинит и аномальные тканевые тяжи.
Если при пальпаторном исследовании выявлены какие-то отклонения от нормы, но результат неопределенный, то для более тщательной проверки проводят вагиноскопию. Отоскоп или вагинальное зеркало дают очень ограниченный обзор свода влагалища и в большинстве клинических ситуаций
от них мало пользы. Лучше использовать педиатрические ректоскопы (рис. 24-1); они недороги, и их можно применять у всех сук, кроме самых мелких из миниатюрных пород. У эндоскопа диаметр меньше, но он более дорогой. Для большинства пород подходит педиатрический ректоскоп малого диаметра, который дает гораздо больший обзор, чем отоскоп. С помощью вагиноскопии клиницист может получить сведения о внешних изменениях свода влагалища, характерных для каждой фазы астрального цикла (табл. 24-2).
Молочные железы и живот. Молочные железы пальпируют с целью выявления возможных опухолей, лактации, мастита, вдавленных сосков, доброкачественных узлов. Стоит также проверить, нет ли на животе, по средней линии, рубца от хирургичес-
ТАБЛИЦА 24-2. ИЗМЕНЕНИЯ СЛИЗИСТОЙ ВЛАГАЛИЩА НА ПРОТЯЖЕНИИ ЭСТРАЛЬНОГО ЦИКЛА
АНЭСТРУС: Слизистая плоская и гладкая
ПРОЭСТРУС / ЭСТРУС ДО ПРЕОВУЛЯТОРНОГО ПИКА ЛГ! Слизистая отечная; вагинальные складки так растянуты и округлены, что закрывают вагинальный канал.
ПРЕОВУЛЯТОРНЫЙ ПИК ЛГ ± 24 ЧАСА: Начало кренуля-ции (образования складчатой поверхности) - появление на слизистой мелких морщинок по мере того, как начинает спадать отечность влагалища.
ПОСЛЕ ПИКА ЛГ / ПЕРИОД ФЕРТИЛЬНОСТИ: Кренуля-ция продолжается; слизистая становится складчатой, с зазубренным на вид профилем. Влагалище легко просматривается без инсуффляции.
ДИЭСТРУС: Слизистая неравномерно уплощается, покры-вается белыми и красными пятнами.
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 969
Рис. 24-1. А и Б. Вагиноскопию удобно выполнять с помощью пе диатрического ректоскопа. Инструмент легко проходит в свод влагалища и дает возможность провести тщательный осмотр. Несмотря на свою длину, педиатрический ректоскоп не всегда позволяет увидеть шейку матки, что свидетельствует и о бесполезности применения для этой цели отоскопа.
кого разреза-свидетельства возможной овариогистерэктомии.
Ректальное исследование. Это исследование позволяет выявить следы переломов тазового кольца и другие неожиданные отклонения от нормы. Сдавливание тазового кольца бывает иногда причиной дистоции и. реже, неспособности к спариванию. Можно попытаться пальпировать влагалище вентрально, но обнаружить таким путем что-то подозрительное удастся только при очень серьезных изменениях этого органа.
Подходы владельцев к проведению вязки
Определение. Подавляющее большинство случаев кажущегося бесплодия обусловлены неправильным подходом хозяев к проведению вязки. Сука, которую повязали или пытались повязать в несоответствующее время, может быть совершенно нормальной, но оказывается пропустовавшей только потому, что ее привели к кобелю, когда она была нефергильна.
Распространенные ошибки. Ниже приведены пять основных ошибок, допускаемых при попытках вязать суку (речь идет о суках с отрицательным результатом анализа на Brucella), 1. Многие владельцы кобелей, часто используемых в разведении, разрешают проводить только одну вязку на протяжении течки у суки. (Единственная вязка предполагает быстрое наступление оплодотворения, тогда как несколько повторных вязок на протяжении течки позволяют исключить ошибку, связанную с неправильно выбранным временем вязки. Кроме того, довольно рискованно полагаться только на одну порцию эякулята.)
2. Многие владельцы вяжут сук только в фиксированные дни цикла, например на И и 13-й дни течки (первый день кровотечения из влагалища принимается задень 1), или на 10 и 12-й дни, или же выбирают только один день (скажем, 14-й).
(Заранее определенные дни хороши, когда они срабатывают, но что если у абсолютно здоровой суки дительность фаз цикла соответствует не средним, а крайним значениям нормы, например проэструс продолжается 16 дней или же проэструс длится 4 дня и эструс - тоже 4 дня? )
3. Нередко считают, что вязку нужно проводить, начиная с того момента, как кровянистые выделения из влагалища во время проэструса сменились на прозрачные или соломенного цвета. (Такой подход годится не для всех сук. Встречаются суки, у которых кровянистые выделения появляются в начале проэструса и заканчиваются лишь спустя несколько дней после начала диэструса, т.е. продолжаются в течение всего эструса. У других сук кровянистые выделения прекращаются за несколько дней до начала эструса.)
4. Некоторые владельцы позволяют кобелю выбирать день вязки. (Реакция кобеля на суку не показательна. Одни кобели всегда готовы к вязке, в то время как другие такого желания никогда не проявляют, потому что занимают подчиненное положение по отношению к суке. Таким образом, кобель - ненадежный «гид» для определения времени вязки.)
5. Предполагается, что кобель всегда фертилен. (Однако любой кобель может быстро утратить свою фертильность - временно или навсегда. Если репродуктивная способность кобеля находится под вопросом, необходимо провести анализ его спермы.)
Эти и аналогичные подходы к проведению вязки бывают причиной того, что сука не беременеет. Они могут годиться для большинства собак, но не применимы к некоторым нормальным, фертильным сукам.
Общее состояние здоровья суки
При выяснении причин бесплодия всегда встает вопрос об общем состоянии здоровья суки. Одни
970 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
исследователи рекомендуют в качестве первых шагов сделать полный клинический и биохимический анализы крови и анализ мочи, а также исследовать функцию щитовидной железы и надпочечников (Johnston, 1980; Johnston et al, 1982; Lein, 1982). Другие считают, что «неэтично и непрофессионально назначать не слишком нужные анализы, не обсудив с владельцем собаки реальную значимость и стоимость этих исследований» (Wright, Watts, 1988).
Обычно мы проводим тщательную лабораторную диагностику только в тех случаях, когда ее необходимость диктуется анамнезом или результатами физикального исследования (или и тем, и другим). Если сука кажется здоровой хозяину, здорова по данным физикального исследования и имеет нормальные овариальные циклы, то у нее нет нарушений функции щитовидной железы или надпочечников и маловероятны другие серьезные органные заболевания. Поэтому можно ограничиться выполнением общего клинического анализа крови, анализа мочи и определения азота мочевины в крови. Однако такой подход зависит от полноты анамнеза и качества проведения физикального исследования. Если при изучении анамнеза или при осмотре выявлены какие-либо нарушения, то целесообразно провести соответствующие тесты, позволяющие выяснить природу заболевания или причину бесплодия.
БЕСПЛОДИЕ У flRL/CELM-ОТРИЦАТЕЛЬНЫХ СУК, ИМЕЮЩИХ НОРМАЛЬНЫЙ ОВАРИАЛЬНЫЙ ЦИКЛ, НОРМАЛЬНЫЕ ИНТЕРВАЛЫ МЕЖДУ ТЕЧКАМИ И НОРМАЛЬНОЕ ПОЛОВОЕ ПОВЕДЕНИЕ (РИС. 24-2)
Первичный подход
Общая стратегия. Поскольку в среднем проэструс у собак длится 9 дней, а эструс в среднем продолжается 7-9 дней, общепринятая стратегия вязки приводит к успеху у обычной, среднестатистической суки. У такой суки выделения из влагалища к началу эструса становятся прозрачными и приобретают соломенный цвет. Однако, если «традиционный» график вязки не приводит к зачатию, надо искать другой путь, который может оказаться успешным. В этом и состоит наш первичный подход к проблеме «бесплодия».
Наблюдение за поведением суки.
Рекомендация. В первую очередь, ветеринар должен порекомендовать владельцу очевидно здоровой, но не дающей приплода собаки подобрать надежный график вязки, основанный на тщательном наблюдении за функцией яичников и временем овуляции. Это должно решить проблему, если она заключается в неподходящем времени вязки. Но если причины проблемы носят физиологический характер, их надо выяснить и соответственно лечить.
Чтобы выбрать график вязки для суки с подозреваемым бесплодием, надо разобраться в ее астральном цикле. Важно понять, что у «нормальной» суки проэструс может быть как коротким (1-2 дня), так и очень продолжительным (25 дней). Правильная идентификация первого дня проэструса зависит от того, насколько точно владелец установит 1-й день выделений из влагалища. Эструс (течка) может длиться от двух до 20 дней. Поэтому, чтобы оценить поведение суки, рекомендуется приводить ее ежедневно или через день к доминантному кобелю, начиная со второго, третьего или четвертого дня проэструса и вплоть до наступления диэструса, определяемого как по ее поведению, так и по цитологии влагалища. Если кобель пытается делать садку на суку и та готова его принять, следует разрешить вязку независимо от того, как оценивается фаза овариального цикла.
Помощники. Имеет смысл, чтобы один человек держал кобеля, а другой занимался бы сукой. Взаимодействие собак разрешается на 5-15 минут; этого времени достаточно, чтобы проверить реакцию суки на кобеля. Один человек оценивает наличие половой охоты у суки. Если данный кобель - не тот производитель, от которого хотят получить потомство, оба присутствующих человека должны предотвратить спаривание. Помощники нужны также для предотвращения драки между собаками, которая иногда случается.
Половая активность. Суку следует вязать в день появления у нее половой охоты и затем через каждые 2—4 дня, пока она не начнет отказываться от вязки. В контексте данного обсуждения вязку рекомендуется проводить ежедневно или через день - это позволит исключить связь проблемы бесплодия с неправильным выбором времени вязки. Вязку по этому графику следует продолжать, невзирая на длительность течки, цвет выделений из влагалища, день цикла или результаты цитологического исследования вагинального мазка. Такая программа обеспечивает присутствие жизнеспособной спермы на момент, когда яйцеклетки будут готовы к оплодотворению. Если известно, что суке свойствен длительный период половой охоты, ее нужно вязать каждые четыре дня до тех пор, пока по ее поведению или по результатам цитологического анализа не станет ясно, что наступила стадия диэструса.
Фиксированные даты. Если суку вязать только в фиксированные дни цикла (отсчитывая с первого дня кровотечений), то могут возникнуть некоторые проблемы. Чаще всего вязку проводят на 10 и 12-й дни, 11 и 13-й или 11 и 15-й. Если проэструс длится 4 дня, а эструс - 5 дней, то вязка придется на то время, когда сука будет находиться в диэструсе и не будет проявлять половой охоты, а если даже и проявит ее, период фертильности будет уже упущен (некоторые здоровые суки допускают вязку в первые три дня цитологически установленного диэструса).
Если у суки проэструс продолжается 16 дней, а эструс 10 дней, то овуляция скорее всего начнется
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 971
Нормальный астральный цикл
1. Биопсия матки/посев
2. Проверить проходимость половых путей
Рис. 24-2. Схема обследования бесплодной суки с нормальными астральными циклами и отрицательным результатом теста на инфицирование Brucella.
на 19 или 20-й день, и оплодотворение наиболее вероятно с 22-го по 26-й дни. Если вязка или искусственное осеменение или то и другое были проведены на 10 и 12-й дни, то сперматозоиды вряд ли доживут до того времени, когда сука станет фертильной (см. рис. 24-6). Результатом насильственной вязки или искусственного осеменения, проведенных в фиксированные дни, может оказаться лишь то, что сука впоследствии будет считаться бесплодной, хотя на самом деле для ее осеменения были выбраны неподходящие дни. Насильственная вязка вообще недопустима и может быть ключом к разгадке «бесплодия».
Предпочтение определенного кобеля. Некоторые суки отказывают отдельным кобелям или, что бывает реже, любым кобелям, несмотря на правильно установленные сроки эструса. Случаи, когда суки оказывали предпочтение определенным кобелям, документально подтверждены (Freshman,
1991). Столь неудобное для владельца поведение собаки может объясняться тремя причинами: 1) кобеля привели к суке, а у себя дома она доминирует над ним (сука не спаривается с подчиненным кобелем); 2) кобель демонстрирует подчинение течной суке независимо от обстановки и их взаимоотношений в другое время (Freshman, 1991); 3) сука живет в одном доме с другой сукой, которая доминирует над ней и может мешать ее нормальному половому поведению.
Функционирование яичников в проэструсе и в эструсе.
Цитологическое исследование влагалища. Мониторинг функции фолликулов в яичниках, как и поведения собаки, не требует больших усилий и особых затрат. Владельца собаки надо научить брать мазки из влагалища, и он должен делать это, начиная с первого дня проэструса, и затем ежедневно по крайней мере до 4-5-го дня диэструса,
972 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
определяемого по поведению суки и результатам цитологического анализа мазка. Цитология влагалища зависит от уровня эстрогена в периферической крови, а этот уровень, в свою очередь, зависит от функциональной активности фолликулов. Анализ вагинальных мазков позволяет приблизительно определить дни эструса и точно установить начало диэструса (Olson et al, 1984). Отсчитав 6 дней назад от первого дня диэструса, можно с большой вероятностью определить первый день овуляции, а отсчитав 1 -4 дня назад - период максимальной фертильности (см. гл. 19).
Далее, основываясь на том, что сперматозоиды сохраняют свою жизнеспособность в половых путях суки в течение 4-7 дней, ветеринар может определить, были ли дни вязки оптимальными для оплодотворения. Если дни были выбраны неудачно, то в следующий раз нужно точнее координировать дни вязки с фертильностью суки. Если же были выбраны оптимальные дни, то следует искать физиологические причины бесплодия.
Прогестерон в плазме крови. Цитологическое исследование влагалища дает надежные и полезные результаты. Однако для более точного установления фазы цикла проводят серийные определения концентрации прогестерона в плазме крови суки в период перехода проэструса в эструс (см. гл. 19). Это позволяет установить первый день, когда концентрация прогестерона поднимется выше 2 нг/мл; этот день, как правило, точно совпадает с началом характерного для эструса поведения собаки и с выбросом ЛГ (Hegstad, Johnston, 1992). Если в клинике используются наборы для твердофазного иммуноферментного (ELISA) анализа прогестерона, то обычно определяют периоды, когда концентрация прогестерона ниже 1 нг/мл, когда она находится в пределах от 1 до 5 нг/мл и когда превышает 5 нг/ мл (Manothaiudom et al, 1995). Вязку рекомендуется проводить через 4 дня после того, как концентрация прогестерона в плазме крови, определяемая этим методом, превысила 1 нг/мл. Эндоскопическое исследование влагалища суки, выполняемое несколько раз во время проэструса и перехода в эструс, тоже дает полезную информацию (см. гл. 19 и 20) (Lindsay, 1990).
Овариальная функция в диэструсе: определение овуляции. Тесты, проводимые во время проэструса или эструса, не дают ответа на вопрос о времени овуляции. Как было сказано выше, цитологическое исследование влагалища, позволяющее установить первый день диэструса, дает лишь косвенное указание на приблизительную дату овуляции. Более точно эту дату можно определить путем измерения концентрации прогестерона в плазме крови, проводимого ежедневно или через день. Овуляция начинается через 2^4 дня после того, как уровень прогестерона поднимется выше 2 нг/мл (см. рис. 19-15). Последнее не говорит о том, что овуляция произошла, поскольку первичное повышение этого уровня происходит за счет прогестерона,
высвобождаемого из подвергшихся лютеинизации фолликулов. Таким образом, уровень прогестерона повышается до начала овуляции, и первичное повышение прогестерона не служит подтверждением овуляции в данном цикле.
Для того чтобы выяснить, произошла ли у суки овуляция, используют данные ежедневного цитологического анализа вагинальных мазков, позволяющие определить первый день диэструса, и затем в период между 10-м и 20-м днями диэструса измеряют концентрацию прогестерона в плазме крови. В течение первых нескольких недель диэструса концентрация прогестерона должна превышать 3 нг/мл и обычно составляет 10-50 нг/мл. Столь значительное повышение концентрации прогестерона обусловлено активной его секрецией желтыми телами, само образование которых является следствием овуляции. Таким образом, нормальная для диэструса концентрация прогестерона свидетельствует о произошедшей овуляции и нормальном функционировании желтых тел.
Перевозка суки как возможный стресс. Следует выяснить, как и где проводилась вязка, так как проблема может состоять именно в этом. Например, не исключено, что применявшиеся успокоительные средства или стресс при перевозке повлияли на процесс овуляции и раннюю беременность (Wright, Watts, 1988). Такие факторы могут стать причиной «приобретенного бесплодия», поэтому следует пропустить один цикл, чтобы проверить, разрешится ли эта проблема, если суку никуда не вывозить и вязать вблизи от дома.
Если хозяин сам никогда не наблюдал за вязкой, поскольку суку отвозили к кобелю, то вся информация будет только из вторых рук. Хозяина следует убедить в необходимости вязать суку дома или поблизости от дома и самому наблюдать за вязкой. Это самый надежный способ свести к минимуму стресс и обнаружить неожиданные проблемы. Например, если у суки имеются анатомические дефекты свода влагалища, препятствующие интромиссии, то, скорее всего, при всех вязках замок был внешним (без введения луковиц), но в отсутствие владельца это могло остаться незамеченным либо ему об этом не сообщали.
Медицинские препараты. Следует выяснить, какие медицинские препараты сука получала в прошлом или получает в настоящее время. Применение гонадотропинов может оказывать длительный негативный эффект на функцию гипофиза. Проводившееся ранее лечение прогестероном или эстрогенами могло привести к субклинической кистозной гиперплазии эндометрия (КГЭ), единственным заметным проявлением которой оказывается бесплодие.
Гипотиреоз. В большинстве обзоров, касающихся бесплодия у сук, обсуждается проблема гипотиреоза, который описывается как распространенное заболевание, приводящее к стойкому анэструсу, продолжительным интервалам между циклами и
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 973
длительному проэструсу. Однако у некоторых сук с гипотиреозом наблюдались нормальные репродуктивная активность, беременность и роды (Johnston, 1980). Более того, в ветеринарной литературе после 1989 года был описан только один случай, когда овариальная дисфункция у суки оказалась связанной с недостаточностью тиреоидных гормонов (Johnston, 1989).
Гипотиреоз - необоснованно частый диагноз в ветеринарной практике. К такому диагнозу следует всегда относиться с осторожностью, но не потому, что этого заболевания не существует как такового, а потому, что многие собаки не настолько больны, чтобы нуждаться в лечении. Если суку лечат по поводу гипотиреоза, ветеринар должен выяснить, насколько правильно был поставлен диагноз и не следует ли отменить заместительную терапию препаратами гормонов щитовидной железы (см. гл. 3).
Выводы. Неудачная практика проведения вязки - наиболее распространенная причина кажущегося бесплодия собак с нормальным астральным циклом (Johnston, 1980; Soderberg, 1989, Freshman, 1991). Ветеринар должен помнить, что прежде чем обследовать суку, надо оценить кобеля. После этого все вопросы, связанные с вязкой конкретной суки, можно решить на основе предлагаемого здесь относительно недорогого подхода, который заключается в следующем: тщательное составление анамнеза; внесение корректировок, если при проведении вязок были допущены ошибки; наблюдение за поведением суки; оценка результатов цитологического анализа влагалища; мониторинг уровня прогестерона в плазме крови. Такой подход позволит ответить на следующие вопросы: 1) как владелец суки организует вязку? 2) когда у суки возникает половая охота? 3) как долго это состояние продолжается? 4) когда наступает первый день проэструса? 5) в какие дни сука фертильна? 6) какие дни наиболее подходят для вязки? 7) происходит ли у суки овуляция? 8) когда у нее происходит овуляция? 9) функционируют ли у нее желтые тела, необходимые для поддержания беременности?
Бруцеллез
Инфицирование Brucella canis - классическая причина выкидыша на поздней стадии щенности (см. гл. 26). Кроме того, эта инфекция может привести к бесплодию или к рассасыванию эмбрионов на ранней стадии щенности, а также к появлению на свет больных или мертворожденных щенков (Olson et al, 1983). Всех сук, используемых в племенном разведении, следует регулярно обследовать на бруцеллез. Быстрым и прекрасным методом скрининга является агглютинационный тест на предметном стекле (Canine Brucellosis Diagnostic Test; произ-во Pitman-Moore). Данный тест не дает ложноотрицательных результатов, поэтому отрицательному результату можно вполне доверять. В то же время возможны ложноположительные результаты, так
что при получении положительного ответа следует проверить его агглютинационным методом в пробирках.
Проблемы, связанные с инфицированием влагалища
Сомнительное значение положительного результата микробиологического вагинального исследования.
Техника культивирования. Высказывалось мнение, что одной из причин бесплодия у сук бывают бактериальные инфекции (Johnston, 1980; Lein, 1983), причем, как предполагали, такие инфекции у бесплодных сук протекают на субклиническом уровне и лишь иногда приводят к вагиниту, метриту, пиометре или системному заражению. На этом основании было рекомендовано брать у бесплодных сук мазок из краниального участка влагалища, чтобы сделать посев, идентифицировать бактерии в культуре и определить их чувствительность к антибиотикам, после чего провести четырехнедельный курс лечения соответствующими антибиотиками (Johnston, 1980). Однако выяснить роль бактериального инфицирования в развитии бесплодия у сук оказалось трудно. Обнаружилось, что практически у всех здоровых сук имеется бактериальная флора в краниальном отделе влагалища, причем те же виды аэробных бактерий присутствуют в своде влагалища и у бесплодных сук (Olson et al, 1983; Okkens et al, 1992).
Бактерии. Аэробные бактерии обнаруживаются во влагалище у 95-100% здоровых сук (см. табл. 23-2; Bjurstrom, Linde-Forsberg, 1992а). Из влагалища здоровых сук были выделены самые разнообразные бактерии, и количество их обычно возрастает во время проэструса и эструса. Само по себе выявление бактерий во влагалище не является признаком заболевания, скорее оно подтверждает, что сука здорова. Однако самый патогенный микроорганизм, В. canis, довольно плохо растет в культуре. Поэтому отрицательный результат, полученный при культивировании, еще не дает гарантии, что у суки нет инфекционной болезни.
Видовой состав бактериальной флоры влагалища может меняться с возрастом; так, коагулаза-положи-тельные стафилококки встречаются у сук препубер-татного возраста чаще, чем у взрослых собак. По одним данным, виды бактерий не меняются в течение цикла, тогда как по другим - видовое разнообразие возрастает во время проэструса и эструса (Allen, Dagnail, 1982; Baba et al, 1983). Недавно было показано, что количество видов бактерий действительно меняется в зависимости от стадии цикла (рис. 24-3; Bjurstrom, Linde-Forsberg, 1992а). Соотношение различных грам-положительных и грам-отрицательных бактерий уникально у каждой суки.
Нормальная флора обычно дает смешанные культуры со слабым или умеренным ростом (см. табл. 23-2; Bjurstrom, Linde-Forsberg, 1992а). Если
974 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Рис. 24-3. Изменение частоты обнаружения пяти видов бактерий во влагалище 59 сук на протяжении эстрального цикла. (---) Pasteurella multocida; (□-□) 0-Гемолитический стрептококк; (ф ф) Escherichia
coli; (0—^) Staphylococcus intermedius; ( ▲—A ) Энтерококки. (Bjurstrom L, Linde-Forsberg C: Am J Vet Res 53:665, 1992)
какой-либо микроб является сильным патогеном, он, как правило, вызывает появление клинических признаков инфицирования, выделяется в больших количествах и существует в почти чистой культуре, так как в силу своих патогенных свойств вытесняет представителей нормальной флоры (Allen, Dagnail, 1982; Allen, 1986; Olson et al, 1986). При посевах 826 вагинальных мазков, взятых от 59 здоровых фертильных сук, в 18% полученных культур был выявлен только один микроорганизм, 77% культур были смешанными и в 5% случаев был получен полностью отрицательный результат (рис. 24-4) (Bjurstrom, Linde-Forsberg, 1992а).
Следовательно, когда некоторые из владельцев кобелей-производителей требуют, чтоб им был предъявлен отрицательный результат посева из влагалища суки, с которой предстоит вязка, - это требование лишено смысла (Watts et al, 1996; Wright, Watts, 1998). Более того, у большинства кобелей в препуции и мочеиспускательном канале присутс
твуют те же микроорганизмы, что и в нормальной флоре влагалища (Bjurstrom, Linde-Forsberg, 1992b). Наличие бактерий во влагалище не должно быть основанием для отказа от вязки.
Сейчас ясно, что нельзя рассматривать обнаружение бактерий во влагалище как причину бесплодия. Применение в этих случаях системных антибиотиков чревато развитием значительных побочных эффектов. Усиленный рост одного вида бактерий скорее нормальное, чем аномальное явление. Лечение вагинальным душем с добавлением системных антибиотиков или без них в течение 2-3 недель может быть полезным, но такую терапию следует применять лишь при наличии явных клинических признаков инфекции, таких, как гнойные выделения из влагалища (Bjurstrom, Linde-Forsberg, 1992a,b).
Наконец, матка собаки тоже может содержать небольшое число бактерий и оставаться здоровой (Baba et al, 1983). Чтобы получить культуру из мат
Рис. 24-4. Распределение числа вагинальных мазков по количеству обнаруживаемых в них видов бактерий. (Bjurstrom L, Linde-Forsberg С: Am J Vet Res 53:665, 1992.)
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 975
ки, нужно провести лапаротомию или трансцервикальное канюлирование матки во время проэструса, эструса или диэструса. Однако у здоровых фертильных собак в эти фазы эстрального цикла происходит раскрытие шейки матки и через нее - миграция бактерий из свода влагалища в матку (Watts, Wright, 1995).В отсутствие явных признаков вагинита или пиометры исследование вагинальных культур у бесплодных сук представляется бесполезным.
Инфицирование микоплазмой и уреаплаз-мой. Mycoplasma и Ureaplasma - микроорганизмы, обычно присутствующие в культуре из вагинального тракта здоровых собак. Тем не менее, предполагается, что эти мельчайшие из свободноживущих микробов снижают способность к зачатию (синдром малоплодия), вызывают гибель эмбрионов на ранней стадии развития, рассасывание эмбрионов или плодов, выкидыши, рождение мертвых или слабых щенков и неонатальную смерть. В настоящее время имеются лишь косвенные доказательства такого патогенеза этих нарушений (Doig et al, 1981; Lein, 1989). Если в чистой или почти чистой культуре из свода влагалища бесплодной собаки выявлены большие количества указанных микроорганизмов, то они могут быть причиной бесплодия. В то же время в одном из исследований Mycoplasma была обнаружена в посевах из влагалища у 59% здоровых фертильных собак (Bjurstrom, Linde-Forsberg, 1992а). Инфицированных собак рекомендуется изолировать и лечить тетрациклином или хлорамфениколом в течение 10—14 дней (Lein, 1986).
Вирусные инфекции. Вирусные инфекции, в частности вирус герпеса (см. гл. 25), были обнаружены у сук, имевших выкидыши и мертворожденных щенков в анамнезе. Однако данных о вирусных инфекциях как причине бесплодия очень немного. Кроме того, культивирование вирусов пока мало доступно для ветеринарных врачей.
Хронический эндометрит: кистозная гиперплазия эндометрия (КГЭ)
Основныесведения.Сукасхроническим заболеванием эндометрия скорее всего будет бесплодной. У таких сук могут быть нормальные овариальные циклы, овуляция и оплодотворенные яйцеклетки, но они не способны выносить беременность, поскольку аномальная среда в матке препятствует имплантации или способствует рассасыванию эмбрионов (Allen, Dagnail, 1982). Получив подтверждения фертильности кобеля и правильности проведения вязки, клиницист должен после этого выяснить, не нарушена ли у суки функция яичников. Если кобель фертильный, а у суки нормально функционируют яичники, у нее не выявлено бруцеллеза и время вязки выбрано правильно, то причиной бесплодия может быть патология эндометрия. Диагностировать КГЭ (стерильную или инфекционную) обычно очень трудно. КГЭ подозревают в случаях, ког
да небеременная матка утолщена или чрезмерно увеличена в анэструсе или диэструсе. Хотя в принципе утолщение стенки матки можно определить пальпаторно, никогда нельзя быть уверенным, что пальпируется именно матка. На рентгенограмме небеременная матка выявляется редко. Если же у бесплодной суки матка видна, то вполне вероятно поражение эндометрия. Аналогичным образом, отчетливая визуализация небеременной матки при УЗИ брюшной полости указывает на утолщение эндометрия или присутствие жидкости в просвете. Диагноз можно подтвердить только с помощью биопсии матки.
Трансцервикальная техника получения проб для микробиологического и цитологического исследований матки. В настоящее время проводят трансцервикальное канюлирование матки с инъекцией стерильной жидкости, которую затем аспирируют и используют для микробиологического (посев) и цитологического исследований (см. гл. 20). В норме в аспиратах определяются эндометриальные клетки, лейкоциты, эритроциты, цервикальные клетки, бактерии и сперматозоиды. В периоды диэструса и анэструса эндометриальные клетки выглядят дегенеративными. Во время проэструса и эструса среди лейкоцитов преобладают нейтрофилы (Watts et al, 1997, 1998). Данный метод помогает идентифицировать КГЭ и другие патологии эндометрия.
Раннее рассасывание эмбрионов
Раннее рассасывание эмбрионов воспринимается обычно и владельцем собаки, и ветеринаром как первичное бесплодие, поскольку выявить щенность на ранних сроках крайне трудно. Пальпаторно ее удается установить лишь начиная с 21-го дня, но и в этот срок диагноз сомнителен. Рентгенографическое подтверждение щенности возможно только после 42^45-го дня. Самую раннюю достоверную идентификацию щенности - примерно на 16-й день после первой вязки - обеспечивает УЗИ. Этот метод позволяет выявить и раннее рассасывание эмбрионов. Причиной рассасывания эмбрионов на ранней стадии развития могут быть болезни эндометрия (инфекция или КГЭ), неспособность желтых тел поддерживать беременность (лютеиновая недостаточность), инфекционные болезни (например, бруцеллез), дефекты самих эмбрионов (например, хромосомные аномалии) и другие менее распространенные нарушения. Однако ранняя гибель эмбрионов изучена слабо и в большинстве случаев диагностируется лишь предположительно. Только УЗИ позволяет точно установить щенность и определить факт гибели зародышей и их рассасывания. В случае постановки такого диагноза возможны два варианта дальнейших действий: либо нужно поменять кобеля при вязке в следующем овариальном цикле, либо сделать посевы из матки и биопсию матки путем лапаротомии или трансцервикального канюлирования (Wright, Watts, 1998).
Ч1Ь • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Функциональная недостаточность желтых тел
Концентрация прогестерона в плазме крови начинает повышаться перед началом течки и снижается до базального уровня перед родами. В первые 6-7 недель диэструса уровень прогестерона в плазме крови обычно составляет 5-50 нг/мл. Если у собаки есть проблемы с фертильностью, концентрацию прогестерона следует определять через 10-20 дней после окончания течки и затем один или два раза в неделю еженедельно. Эти исследования нужно сочетать с УЗИ брюшной полости.
Если во время диэструса концентрация прогестерона составляет менее 1 нг/мл, то либо у собаки не происходит овуляций, либо желтые тела не способны синтезировать и/или секретировать прогестерон. Для поддержания щенности концентрация прогестерона должна быть выше 5 нг/мл. При концентрации прогестерона от 1 до 5 нг/мл его количества недостаточно для сохранения беременности (лютеиновая недостаточность, или функциональная недостаточность желтых тел) и может произойти изгнание или рассасывание плодов. Если зародыши были выявлены с помощью УЗИ брюшной полости на ранней стадии беременности, то их изгнание или рассасывание можно установить при повторном ультразвуковом исследовании (подробное обсуждение функциональной недостаточности желтых тел см. в гл. 21).
В заключение следует сказать, что низкая концентрация прогестерона в диэструсе не всегда бывает первичной проблемой. Деструкцию незрелых желтых тел могут вызвать разнообразные факторы, например воспаление плаценты, глюкокортикоидная терапия или же фетальные факторы. В некоторых ситуациях противопоказано введение прогестерона, однако причины этого не совсем понятны. Лечение прогестероном требует большой осторожности.
Окклюзия матки или яйцеводов
В ходе физикального исследования невозможно оценить степень раскрытия шейки матки или проходимость яйцеводов из-за очень малых размеров этих структур. При билатеральной сегментарной аплазии или других причинах обструкции рогов матки, а также при окклюзии шейки или обоих яйцеводов у суки могут сохраняться нормальные циклы, овуляция, половая охота, но она не способна забеременеть (Olson et al, 1983). Двусторонняя окклюзия не позволяет сперматозоидам достичь яйцеклеток. Выявить этот редкий анатомический дефект крайне трудно из-за особенностей как местоположения, так и физиологии этих трубчатых структур.
Теоретически возможно ввести рентгеноконтрастное вещество из влагалища через шейку матки и матку в оба яйцевода и затем, проведя рентгеноскопию брюшной полости, оценить
проходимость репродуктивного тракта. Однако прогнать краситель через шейку матки даже под значительным давлением нелегко, за исключением периодов проэструса и эструса, когда шейка расширена. Однако во время проэструса и, возможно, раннего эструса сужено (закрыто) маточно-трубное соустье (под действием эстрогенов), а потому рентгеноконтрастное исследование матки и маточных труб (гистеросальпингография) может быть успешным только во время эструса. Этот теоретически прекрасный метод трудно выполним на практике (рис. 24-5) (Johnston, 1980; Buckrell, Johnson, 1988; Freshman, 1991). Сообщалось о случаях, когда попытки ввести рентгеноконтраст в яйцеводы привели к разрыву матки у здоровых собак (Freshman, 1991).
Вместо рентгенографии можно прибегнуть к прямой визуализации. Лапароскопия не годится, так как яйцеводы не видны с помощью лапароскопа, и единственным реальным средством остается лапаротомия. Для исследования матки и оценки проходимости яйцеводов в матку вводят физиологический раствор, зажимают тело матки и наблюдают вытекание раствора из яйцеводов. Некоторые исследователи предлагают использовать при лапаротомии краситель, но мы не видим в этом необходимости. Лапаротомия позволяет также сделать биопсию матки и получить материал для проведения микробиологического анализа (культивирования).
Мало чем можно помочь, если у суки выявлена двусторонняя окклюзия матки или яйцеводов. Односторонняя окклюзия не приводит к бесплодию. Восстановление проходимости закупоренных рогов матки или яйцеводов в литературе не описано, и суки с такими нарушениями навсегда остаются бесплодными.
Другие причины бесплодия
Работы, проведенные не на собаках, а на других видах млекопитающих, показали, что одной из причин бесплодия, наблюдаемого в ситуации, когда у самки нормальный цикл и самец фертилен, является продукция у самки антител против сперматозоидов и секреция шейкой матки веществ, разрушающих сперматозоиды. Продукция антиспермальных антител была описана у кобелей, инфицированных В. canis (George, Carmichael, 1984). Есть данные об индукции образования этих антител у собак в экспериментальных условиях (Rosenthal et al., 1984). Определение антител в крови и в шеечной слизи может в будущем стать составной частью исследования бесплодия у сук, однако пока эти находки носят спекулятивный характер. Сообщалось, что суки, у которых путем иммунизации индуцировали выработку антител против прозрачной зоны яйцеклетки, становились бесплодными (Mahi-Brown et al, 1982). Спонтанная продукция таких антител в принципе возможна, но пока не описана.
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 977
Рис. 24-5. Латеральная (Л) и вентро-дорсальная (Ь) рентгенограммы брюшной полости здоровой суки, которой пытались провести гистеросальнингог рафию, вводя под давлением контрастное вещество в свод влагалища. чтобы и (снтифипировать рога матки и яйцеводы Можно оценить, насколько трудно идентифицировать яйцеводы таким способом.
СУКИ С УКОРОЧЕННЫМИ ИНТЕРВАЛАМИ МЕЖДУ ТЕЧКАМИ (МЕНЕЕ 4,5 МЕСЯЦЕВ) (РИС. 24-6)
Идиопатическое укорочение овариальных циклов
Патофизиоло! ия. «Нормальная» сука входит в фазу эструса овариальною цикла каждые 5-9 месяцев. У некоторых сук интервал между фертильными циклами, завершающимися беременностью, составляет 4-4,5 месяца, тогда как у других -10-12 месяцев. Течки через каждые 4,5 месяца описаны у таких пород, как немецкие овчарки и ротвейлеры. После фазы воздействия высоких концентраций прогестерона (состояние «беременности») матка претерпевает период инволюции и восстановления, во время которого она подготавливается к следующему циклу. Считается, что восстановительный период продолжается 3 месяца (Al-Bassam et al, 1981; Shille et al, 1984a).
Полный 4,5-8,5-месячный овариальный цикл состоит из 2 4 недель проэструса и эструса, 2-2,5 месяцев диэструса и, наконец, 2-5 месяцев фазы восстановления матки (анэструс). Если проэструс начинается до полного восстановления матки, то сука, скорее всего, окажется бесплодной, и наиболее вероятной причиной бесплодия будет нарушение процесса имплантации, вызванное тем, что эндометрий еще нс восстановился после предыдущего воздействия прогестерона. Подтвердить эти
патофизиологические события трудно, но предположительный диагноз может быть поставлен на основании тщательного изучения анамнеза.
Задачи владельца собаки. Прежде чем поставить диагноз и назначить лечение, клиницист должен собрать и изучить полный анамнез собаки. В идеале, он должен получить даты начала каждого проэструса. Крайне важно, чтобы ветеринар и владелец собаки пользовались одинаковой терминологией при описании эстрального цикла, - это поможет исключить многие из наиболее очевидных причин бесплодия. Если возникают какие-то вопросы относительно практики проведения вязки или если суку до этого ни разу не обследовали, имеет смысл наблюдать ее на всем протяжении цикла, чтобы установить его даты, провести цитологическое исследование влагалища, определить концентрации прогестерона, провести в нужное время вязки и через 3-5 недель после вязки сделать УЗИ брюшной полости, как это описано в предыдущих разделах применительно к бесплодным сукам с нормальными интервалами между течками. Собака, у которой интервалы между циклами меньше 4 месяцев. как правило, нормальна во всех отношениях и бесплодна только потому, что ее матка не успевает полностью восстановиться.
По мере взросления собаки продолжительность ее циклов может измениться и приблизиться к норме. У молодых сук овариальные циклы нередко бывают нерегулярными, частыми или скрытыми Это создает трудности для хозяина, пытающего-
«о со
Цитологическое исследование влагалища, определение концентрации эстрогена в плазме, УЗИ брюшной полости
Отменить эстрогены и наблюдать
Определить концентрацию прогестерона в плазме во время 3-4-й недели эструса
1. Еженедельное цитологическое исследование влагалища
2. Использовать белую подстилку для определения проэструса
3. Содержать вместе со здоровым кобелем
______/
Получает эстрогенные препараты?
Исключить:
1. Физиологическое старение яичников
2. Оофорит
3. Нарушение половой дифференцировки
---------------!---------- Кариотип XX? Низкие ЛГ и ФСГ в плазме крови? Если да...
1. Сделать УЗИ брюшной полости
2. Исключить лютеальную кисту
1. ПГ F2a
2. * Удаление яичника
* Рекомендуется
Индукция эструса
Рис. 24-6. Алгоритм обследования суки с удлиненными интервалами между течками, укороченными интервалами между течками и с длительной фазой проэструса или эструса.
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 979
ся предсказать, когда начнется следующий цикл. К двум-трем годам овариальный цикл у сук устанавливается, и становится возможным предсказать приблизительную дату начала следующего цикла. Но нужно иметь в виду, что у одних сук созревание идет медленнее, чем у других. У некоторых сук продолжительность цикла стабилизируется только в возрасте старше трех лет.
Сук моложе 2,5-3 лет не рекомендуется лечить по поводу укороченных интервалов между течками. Кроме того, ветеринару должны разрешить наблюдать и обследовать суку в течение одного цикла. Физикальное исследование, цитологические исследования влагалища и по крайней мере однократное определение концентрации прогестерона в плазме крови во время диэструса (как это описано в предыдущем разделе) - помогут лучше разобраться в особенностях протекания цикла. Очень важно исключить расщепленную течку.
Лечение. Лечение сук старше трех лет со слишком частыми эстральными циклами заключается в медикаментозной индукции нормального периода анэструса. Обычно назначают миболерон в каплях (Cheque; произ-во Upjohn); курс лечения - 6 месяцев. Лечение начинают через 6-8 недель после окончания предыдущей течки. Препарат применяют в дозах, указанных производителем; для немецких овчарок требуется особая дозировка. До начала лечения миболероном ветеринар должен убедиться, что сука небеременна, поскольку этот сильный синтетический андроген вызывает пороки формирования мочеполовых путей у плодов женского пола (Johnston, 1980). У суки могут наблюдаться признаки маскулинизации, но они обратимы, и, как считается, препарат не влияет на будущую фертильность. Суку следует вязать в первом же эструсе после терапии. Он может начаться сразу после прекращения лечения, но может наступить и через 6-9 месяцев.
Фолликулярные кисты
Существует предположение, что одной из причин укороченного интервала между течками могут быть фолликулярные кисты яичников (Freshman, 1991). Этот синдром не описан здесь, поскольку нам не приходилось сталкиваться с такой проблемой. Однако известно, что наличие фолликулярных кист связано с удлинением проэструса и/или эструса. Если у суки с укороченными циклами этот синдром все же подозревается, то следует провести УЗИ брюшной полости, которое позволяет выявить большинство кист. Это простой, неинвазивный и надежный метод диагностики кист яичников (рис. 24-7). Лечение заключается в хирургическом удалении кисты или удалении всего яичника.
Патология матки
Заболевание матки тоже рассматривалось как одна из причин укороченного интервала между течками
(Olson et al, 1988; Freshman, 1991). Как и в случае фолликулярных кист яичников, мы не сталкивались с этим синдромом и считаем физиологически не обоснованным включать его в дифференциальную диагностику. Для подтверждения патологии матки требуется цитологическое исследование ткани, а следовательно, проведение биопсии матки.
Расщепленная течка
Определение. Расщепленные течки чаще всего встречаются у молодых половозрелых сук, но могут иметь место в любом возрасте. В начальной фазе расщепленной течки овариальные фолликулы нормально развиваются и секретируют эстроген. При этом количество секретируемого эстрогена достаточно, чтобы вызвать типичные признаки проэструса - набухание вульвы, влагалищное кровотечение, привлекательность для кобелей, характерные изменения поведения и, изредка, случку. Однако в системе гипоталамус-гипофиз-яичники возникает сбой, и исключительно строгая координация эндокринных событий во времени нарушается. В результате не происходит ни овуляции, ни формирования желтых тел. Владелец собаки видит кровянистые выделения из влагалища, типичные для нормального эстрального цикла, и считает, что все в порядке.
Фолликулы регрессируют, и все признаки проэс-труса/эструса исчезают. Через 2-10 недель развиваются новые фолликулы, секретирующие эстроген в количестве, достаточном для появления признаков проэструса (Okkens et al, 1992). Владелец собаки снова видит кровянистые выделения из влагалища и приходит к выводу, что случилось что-то ужасное. Однако если на этот раз проэструс у суки завершается, происходит овуляция и дальше цикл протекает нормально, то, значит, у нее была типичная расщепленная течка (т.е. фолликулы начали развиваться, появились признаки проэструса, после чего фолликулы регрессировали; через несколько недель фолликулы развиваются снова, и на этот раз цикл протекает нормально). При последней, или «настоящей» течке сука обычно фертильна, и вязка в это время приводит к рождению нормального потомства.
Наблюдения владельца. В совокупности эти события можно воспринять как два отдельных цикла с коротким интервалом. Но легко и предположить, что сука просто нездорова. Кроме того, кровянистые выделения во время проэструса, вызванного второй волной фолликулов, можно интерпретировать как выделения, наблюдаемые при изгнании плодов или их рассасывании. В итоге расщепленные течки обычно приводят владельцев в замешательство, особенно в тех случаях, когда завершенному цикла (с овуляцией) предшествуют несколько волн фолликулов. Таких независимых волн развития фолликулов, сопровождающихся внешними признаками секреции эстрогена, мо-
980 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
жет быть две, три или четыре, прежде чем наступит нормальный, полный цикл. При этом владелец едва ли поймет, что циклы у собаки были незавершенными, и скорее подумает, что течка происходит каждые 2-3 месяца.
Диагноз. Выявить расщепленную течку помогают данные цитологии влагалища, поскольку каждая фолликулярная волна сопровождается секрецией эстрогена, который вызывает типичные для проэструса изменения (см. рис. 19-2 и 19-3). Для подтверждения диагноза проводят серийные определения концентрации прогестерона в плазме крови: если данный показатель ни разу не превысил 2 нг/мл, это четко доказывает отсутствие овуляции. Концентрация прогестерона несколько повышается в фазе эструса (в это время его источником являются фолликулы), но в отсутствие овуляции возвращается к базальному уровню. Даже при расщепленной течке происходящие гормональные изменения часто приводят к демонстрации характерного для эструса поведения. Однако измерение концентрации прогестерона через 1-3 недели после исчезновения половой охоты или после наступления диэструса (по результатам цитологического исследования влагалища) позволит убедиться в том, что овуляции не произошло.
Клиническая точка зрения. Расщепленные течки не считаются опасным нарушением. Обычно они наблюдаются у молодых, еще не зрелых сук и никак не связаны ни с бесплодием в более зрелом возрасте, ни с патологией яичников или матки. Распознавание расщепленных течек требует очень внимательного наблюдения за собакой и полного взаимопонимания между владельцем и ветеринаром. Вероятность расщепленной течки служит причиной того, что до достижения трехлетнего возраста сук не следует лечить по поводу коротких интервалов между циклами. С наступлением зрелости расщепленные течки, как правило, прекращаются.
Отсутствие овуляции
В отсутствие овуляции не происходит формирования желтых тел и, соответственно, не синтезируется прогестерон. Таким образом, выпадает вся фаза диэструса овариального цикла, а потому последующая инволюция матки (анэструс) протекает быстро (Johnston, 1988). Диагноз ставится на основании серийных определений концентрации прогестерона в плазме крови, как описано в предыдущем разделе и в разделе «Функциональная недостаточность желтых тел». Остается неясным, чем этот диагноз отличается от диагноза расщепленной течки. Сукам моложе трех лет назначать лечение не рекомендуется. У сук старше трех лет можно попытаться стимулировать овуляцию введением ЛГ или хорионического гонадотропина человека (чХГ; 500 МЕ/кг, внутримышечно) за день до или на следующий день после первой вязки (Burke, 1986; Jones, Joshua, 1988).
Ятрогенные причины укороченного интервала между течками
Укороченные интервалы между течками наблюдались после введения агонистов дофамина - ка-берголина или бромокриптина (Cinone et al, 2000). Такой же эффект отмечался в отдельных случаях у сук, получавших простагландины или антагонисты рецепторов прогестерона (Galac et al, 2000). Согласно полученным данным, последующие циклы у этих сук протекали нормально и были фертильными.
СУКИ С УДЛИНЕННЫМИ ИНТЕРВАЛАМИ МЕЖДУ ТЕЧКАМИ (БОЛЬШЕ 10 МЕСЯЦЕВ)
См. рис.24-6.
Идиопатическое удлинение интервалов между течками
Наблюдения владельца суки и анамнез. Как и в случаях других проблем, связанных с репродукцией, тщательно составленный анамнез помогает избежать проведения лишних диагностических тестов. Прежде чем задавать вопросы, непосредственно относящиеся к репродуктивной активности суки в настоящее время и в прошлом, ветеринару следует выяснить у владельца, здорова ли она во всех других отношениях. С возрастом интервалы между течками у собак увеличиваются (Olson et al, 1988). Если суке больше 6-8 лет, то интервалы в 10-12 месяцев не должны вызывать беспокойство. Однако для сук 2-6 лет такие интервалы нетипичны.
Важно уточнить, как владелец определяет состояние проэструса и эструса (течку) у собаки и насколько внимательно он наблюдает за ней. Иногда владелец просто не замечает течку (так называемая скрытая течка). Если кобеля нет, а хозяин не проверяет состояние вульвы один-два раза в неделю, течка может пройти незамеченной. Если же и ветеринар и владелец собаки убеждены, что собака циклирует редко и что ее циклы бесплодны, то необходимо ее обследовать.
Физикальное исследование. Важнее тщательного и компетентного клинического обследования можно считать только сбор исчерпывающего анамнеза. Клиническое обследование не должно быть длительным, но и нельзя ничего упустить. Неожиданное обнаружение шумов в сердце, разрастания органов, опухолей и других нарушений поможет выбрать соответствующее лечение и понять вероятные причины задержки овариального цикла.
Порода. Для определенных пород собак длительные интервалы между циклами являются нормальным явлением. Классические примеры тому - басенджи и помеси с волками, у которых цикл бывает один раз в год (Barton, 1987). Собаки любой породы могут иметь длинные интервалы между циклами и при этом оставаться фертильными. Наибольшее беспокойство должны вызывать суки, у
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 981
которых циклы бывают реже чем один раз в 10 месяцев и они оказываются бесплодными.
Лабораторные исследования.
Общий подход. Удлинение интервалов между овариальными циклами может быть обусловлено каким-то заболеванием. У здоровых на вид сук серьезные нарушения выявляются редко, но тем не менее рекомендуется провести клинические анализы для получения основной базы данных (т.е. общий клинический анализ крови, биохимический анализ сыворотки крови, анализ мочи). Любое обнаруженное отклонение нужно затем исследовать.
Гипотиреоз. Удлинение интервалов между циклами чаще всего связано с гипотиреозом. Такие собаки, как правило, вялые, сонливые, с плохим аппетитом, скучные, с поредевшим шерстным покровом или эндокринной алопецией. У них обычно выявляется нерегенеративная анемия1 и гиперхолестеринемия. Даже при нормальных результатах анализа крови имеет смысл проверить функцию щитовидной железы. У здоровых на вид собак результаты функциональных тестов, как правило, свидетельствуют об отсутствии гипотиреоза. Но следует подчеркнуть, что анамнез и клиническое обследование надежнее тестирования функции щитовидной железы. Скрытый гипотиреоз редко встречается у собак, и создается впечатление, что диагноз гипотиреоза часто ставится собакам, у которых этого заболевания на самом деле нет.
Если диагноз гипотиреоза установлен, суке следует назначить заместительную терапию тиреоидными гормонами. Как правило, течка наступает через 4-6 месяцев после начала заместительной терапии. Нормальные циклы обычно возобновляются после успешного лечения любого заболевания, обусловливающего их нарушение. Если в течение 6 месяцев после начала терапии тиреоидными гормонами цикл не восстановился, то, возможно, диагноз был поставлен неправильно, или он неполный, и проводимое лечение неадекватно.
Скрытая течка
См. «Отсутствие циклов: Первичный и вторичный анэструс» в следущем разделе.
Овариальные кисты и опухоли
Причиной удлинения интервалов между течками могут быть прогестерон-секретирующие кисты яичников (лютеальные кисты) или, реже, прогесте-рон-секретирующая опухоль яичников (например, гранулозо-текаклеточная опухоль). Независимо от источника, прогестерон подавляет секрецию ЛГ и
1 Нерегенеративная анемия определяется как состояние, обусловленное недостаточностью физиологического ответа костного мозга на стимуляцию эритропоэза. Аналогичный термин в отечественной литературе - парциальная гипопластическая анемия. - Прим, ред
фолликулостимулирующего гормона (ФСГ), действуя на гипоталамус и гипофиз по механизму обратной связи, и, таким образом, угнетает овариальную активность. В такой физиологической ситуации сука остается в продолжительном «диэструсе», что может никак не проявляться клинически.
Диагноз ставится на основании повышенного уровня прогестерона в плазме крови в течение длительного времени (больше 9-10 недель; >2-5 нг/ мл) и выявления одиночной кистозной структуры в одном яичнике при УЗИ брюшной полости (см. рис.24-7). Иногда обнаруживается несколько кист в одном яичнике или по одной или несколько кист в обоих яичниках. Опухоль выявляют пальпатор-но или с помощью УЗИ, при этом УЗИ брюшной полости - наиболее надежное средство диагностики. Даже если кисты яичников не являются функциональными, т.е. гормонально-активными (судя по отсутствию повышения уровня эстрогена или прогестерона в плазме крови, что бывает при локализации кист в сосудистой сети яичников), они все же могут привести к прекращению эстральных циклов. Опять-таки и в этом случае УЗИ брюшной полости служит наиболее надежным инструментом диагностики.
Лечение
При нормальных результатах всех тестов будет вполне обоснованным заподозрить у суки скрытую течку. В этом случае хозяину собаки следует поместить ее или вместе с другой нормально циклирующей сукой (что обычно ускоряет наступление течки), или вместе с кобелем. Желательно еженедельно брать у собаки мазки из влагалища для оценки фолликулярной функции. При редких циклах особенно важно проводить такой мониторинг, чтобы удостовериться, что дни вязки были выбраны правильно. Наконец, эстральный цикл можно индуцировать медикаментозно. В случае прогестерон- секретирующих кист было предложено использовать простагландины, чтобы вызвать деструкцию лютеальной ткани, но в нашей практике такой способ терапии оказался неэффективным. Поэтому прогестерон-секретирующие кисты, нефункциональные кисты и возможные опухоли яичников следует удалять хирургическим путем.
ОТСУТСТВИЕ ЦИКЛОВ: ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ АНЭСТРУС (РИС. 24-8)
Определение понятий
Ветеринары редко сталкиваются с жалобами на отсутствие у собаки течек. Первичный анэструс - это состояние суки, у которой ни разу не было овариальных циклов. Вторичный анэструс - состояние суки, у которой был один или несколько циклов, но затем они прекратились. Как и при любых других нарушениях репродуктивной системы, прежде чем
982 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Рис. 24-7. УЗИ брюшной полости двух собак (А и Б) с овариальными кистами, вызвавшими длительный проэструс.
приступать к лабораторной диагностике, следует выяснить возраст собаки, породу, анамнез, лекарства, которые ей давали, и провести физикальное исследование. У некоторых собак крупных пород пубертатный (первый) эструс наступает в возрасте старше двух лет, в то время как у собак мелких пород сначала может быть несколько скрытых течек, и только после этого устанавливается отчетливый цикл. Поэтому мы не рекомендуем обследовать по поводу отсутствия циклов сук моложе двух лет. При вторичном анэструсе суки должны быть обследованы так, как это было описано в предыдущем разделе по поводу удлиненных интервалов между циклами.
Вторичный анэструс может быть обусловлен дисфункцией щитовидной железы или другими эндокринными или неэндокринными нарушениями. Нужно собрать подробный анамнез суки, провести физикальное исследование и необходимые лабораторные анализы (см. «Заболевания, приводящие к нарушению овариального цикла»). Если результаты всех исследований соответствуют норме, следует подождать по крайней мере 12-18 месяцев, считая от последнего цикла, на случай, если одна или две
течки были скрытыми и потому их не заметили. Все это время хозяин должен внимательно наблюдать за собакой, а ветеринар может рекомендовать проведение серийных определений, описанных ниже в разделе о скрытой течке. В качестве альтернативы можно попытаться вызвать течку.
Предшествующая овариогистерэктомия
Фолликулостимулирующий гормон и лютеинизирующий гормон. Если медицинский анамнез суки неизвестен, то следует проверить, не была ли ей ранее проведена овариогистерэктомия. что объясняло бы отсутствие циклов. Предварительным свидетельством предыдущего удаления яичников служит шрам от разреза по средней линии живота. Для более тщательного осмотра нужно выстричь шерсть в этом месте. Если шрам обнаружен, то для подтверждения того, что яичники были удалены, определяют уровень ЛГ и ФСГ в плазме крови. У овариэктомированных сук концентрации этих гормонов в крови постоянно повышены. По имеющимся данным, уровень ЛГ в плазме крови у интактных сук составляет в среднем (±SD) 1.2
Рис. 24-8. Алгоритм обследования суки, представленной по поводу отсутствия у нее астральных циклов
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
00
ио
984 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Группа
Рис. 24-9. Концентрации ЛГ (А) и ФСГ (Б) в плазме крови интактных и кастрированных собак. Графики показывают значимость определения этих гормонов для выявления собак, подвергнутых кастрации (Olson PN et al: Am J Vet Res: 53: 762, 1992; использовано с разрешения авторов). С- суки; С/К - суки кастрированные (овариогистерэктомия); Кб - кобели; Кб/К - кобели кастрированные.
± 0,9 нг/мл, а у овариэктомированных - 28,7 ± 25,8 нг/мл. Концентрация ФСГ в плазме крови составляет 98 ± 25,8 нг/мл у интактных сук и 1219 ± 763 нг/мл у овариэктомированных (рис. 24-9) (Olson et al, 1992). Наборы для определения ЛГ и ФСГ пока не всем доступны, но, вероятно, станут широко доступными в ближайшем будущем. Продажный набор для определения ЛГ у собак (ICG Status-LH canine ovulation timing test, произ-во Synbiotics Corp.) имеет чувствительность 98% и специфичность 78%, что позволяет достоверно различать интактных и овариэктомированных сук. Низкий уровень ЛГ при однократном определении указывает на то, что сука интактна (Lofstedt, Van Leeuwen, 2002).
Использование агонистов гонадотропин-ри-лизинг гормона (ГнРГ). Гонадотропин-рилизинг гормон контролирует синтез и секрецию ЛГ и ФСГ. Внутривенное введение ГнРГ интактным сукам вызывает увеличение уровня ЛГ и последующее повышение концентрации эстрогена в плазме крови. Последнее происходит только у сук с сохраненными яичниками (England, 1988). Для стимуляции выработки эстрогенов в яичниках вместо ГнРГ можно использовать человеческий (чХГ) или лошадиный (лХГ) хорионический гонадотропин. Так, в одной из работ (Jeffcoate et al, 2000) чХГ вводили внутривенно в дозе 200 ME (сукам весом от 9 до 15 кг) или 300 ME (сукам весом от 15 до 30 кг); лХГ вводили внутривенно в дозе 100 ME (сукам весом от 9 до 15 кг) и 150 ME (сукам весом от 15 до 30 кг). Концентрацию эстрадиола в плазме крови определяли до и через 90 минут после введения гормона. Если у интактных сук базальная концентрация эстрадиола была увеличенной, то она и оставалась увеличен
ной после введения гонадотропина, а если базальная концентрация была низкой, то она значительно повышалась после инъекции. У овариэктомированных сук концентрация эстрадиола была ниже определяемого уровня как до, так и после инъекции. Таким образом, стимуляция гонадотропином секреции эстрогена вполне может быть использована для выяснения вопроса о том, были ли у суки удалены яичники или она интактна.
Скрытая течка
Определение. Скрытую течку (определяемую как овариальный цикл, не замеченный хозяином) идентифицировать трудно. В состоянии скрытой течки может не наблюдаться набухания вульвы или кровянистых выделений из влагалища, сука может не привлекать кобелей или не проявлять половой охоты. Скрытую течку следует рассматривать как одну из возможных причин обращений по поводу первичного анэструса, особенно если у хозяина небольшой опыт или вовсе нет опыта обращения с интактной сукой, или если сука живет изолированно, не имея каких-либо контактов с кобелями, или если за ней не очень внимательно наблюдают.
Диагноз и обследование. При подозрении на скрытую течку целесообразно определить концентрацию прогестерона в плазме крови. Если она выше 2 нг/мл, то, по-видимому, в последние 60-70 дней течки у суки не было; на фоне такой концентрации прогестерона УЗИ брюшной полости может обнаружить наличие желтых тел в яичниках. Если концентрация прогестерона ниже 1 нг/мл, имеет смысл приводить суку к кобелю один раз в неделю еженедельно, что поможет выявить эструс.
Прекрасным методом определения скрытой течки является еженедельный однократный или двукратный осмотр вульвы у суки. Это позволит хозяину приобрести некоторый опыт в определении анэструса по внешнему виду вульвы. Небольшое увеличение вульвы или слабые кровянистые выделения заметить нетрудно, и хозяин, таким образом, сможет определить признаки раннего проэструса. Более агрессивные методы оценки состояния собаки с подозрением на скрытую течку - это еженедельное цитологическое исследование мазка из влагалища (для выявления признаков проэструса или эструса) или ежемесячное определение концентрации прогестерона в плазме крови до тех пор, пока она не достигнет уровня от >2 нг/мл до 5 нг/мл, соответствующего овуляции.
Анэструс, индуцированный лекарственными препаратами
Анэструс может быть вызван как специально предназначенными для этой цели препаратами (см. гл. 22), так и препаратами, у которых индукция анэструса является побочным эффектом. Специальные препараты, включающие андрогены, некоторые
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 985
владельцы используют для повышения силы и/или выносливости собаки, но при этом многие из них не знают о действии этих препаратов на ось гипота-ламус-гипофиз-яичники. Прогестагены, применяемые для лечения различных расстройств, вызывают продление анэструса (диэструса) в качестве побочного эффекта. Также и глюкокортикоиды, действуя на гипофиз по механизму обратной связи, подавляют секрецию гонадотропинов и тем самым предотвращают овариальный цикл.
Наличие основного заболевания
Значение анамнеза и клинического обследования. Любое легкое или тяжелое заболевание может повлиять на циклическую активность яичников у собак. Поэтому значение тщательного анамнеза и полного, компетентного физикального исследования трудно переоценить. Все выявленные при этом нарушения нужно рассматривать как возможную причину бесплодия, поскольку нельзя отделять репродуктивную систему от целого организма.
Обследование в клинике. Если такие причины видимого отсутствия овариальных циклов у собаки, как скрытая течка, ранее проведенная кастрация и ошибки владельца исключены, то рекомендуется сделать анализ мочи, общий клинический анализ крови и биохимический анализ плазмы крови. Другой составляющей скрининга возможных причин нарушения овариального цикла является УЗИ брюшной полости. С помощью этого неинвазивного метода исследования оценивают состояние абдоминальных структур, в первую очередь яичников - в них могут обнаружиться лютеальные (секретирующие прогестерон) кисты - и матки, утолщение стенки которой и/или наличие жидкости свидетельствует об эндометрите.
Гипотиреоз
Гипотиреоз стал «популярным» диагнозом, используемым как объяснение отсутствия овариальных циклов у собаки. Хотя гипотиреоз может быть причиной первичного или вторичного анэструса, у собаки должны проявляться и другие его признаки (например, ожирение, сонливость, плохой аппетит, поредевший шерстный покров, двусторонняя симметричная алопеция). Бодрая, активная, энергичная собака вряд ли страдает гипотиреозом. Как указывалось выше, мы считаем, что диагноз гипотиреоза необоснованно часто ставится как профессионалами, так и заводчиками и тренерами. В то же время у женщин при субклиническом гипотиреозе наблюдаются овариальная дисфункция и бесплодие (Lincoln et al, 1999).
Гипотиреоидные суки быстро отвечают на заместительную терапию тиреоидными гормонами и уже через несколько дней после начала лечения становятся более бодрыми и активными. Быстро улучшается аппетит, а вскоре суки худеют. Для нор
мализации шерстного покрова обычно требуются недели. Овариальные циклы обычно начинаются через 3-6 месяцев после начала лечения. Если ответа на заместительную терапию не наблюдается, значит, либо дозы тиреоидных гормонов неадекватны, либо существует еще одна медицинская проблема, либо был постановлен неправильный диагноз.
Избыток глюкокортикоидов
Глюкокортикоиды применяют для лечения многих заболеваний у мелких животных. Однако глюкокортикоиды подавляют (по механизму обратной связи) гипофизарную секрецию адренокортикотропного гормона (АКТГ), ФСГ и ЛГ. У суки, получающей глюкокортикоиды, овариальные циклы обычно отсутствуют до тех пор, пока дозировка стероидов не будет сведена к минимуму или не будет прервано их введение. Дозы глюкокортикоидов, вызывающие подавление активности яичников, варьируют в зависимости от препарата. Однако если у суки не наблюдается нормального повышения уровня кортизола в тесте с введением АКТГ, то, скорее всего, отсутствие у нее овариальных циклов вызвано подавлением секреторной активности гипофиза в результате терапии глюкокортикоидами (см. гл. 6 и 10).
Гиперкортицизму (синдрому Кушинга) у нециклирующих сук не уделяют большого внимания, так как это заболевание развивается в основном у собак старше 8 лет. Отсутствие овариальных циклов у таких собак их владельцы не считают проблемой, поскольку другие симптомы синдрома Кушинга более очевидны, серьезны и опасны.
Стресс
К числу возможных причин отсутствия циклов относятся стресс, тяжелые физические нагрузки и плохое питание. На некоторых сук отрицательно влияют большое скопление народа, экстремальные температуры, частые выставки и поездки. Все эти проблемы обычно выявляются при составлении анамнеза, и их коррекция обычно способствует восстановлению функции яичников.
Преждевременное угасание функции яичников / аплазия яичников
Определение. У суки, ни разу не имевшей течки (первичный анэструс), может не быть яичников. Врожденное отсутствие или недоразвитие одного или обоих яичников встречается крайне редко (Wright, Watts, 1998). Возможно, существуют иные причины их аплазии. При вторичной гипоплазии естественно предположить, что преждевременной утрате овариальной функции предшествовали один или несколько циклов. Продолжительность функциональной активности яичников у собак неизвестна. Предполагается, что в среднем функция яичников у них постепенно снижается, начиная с 7-летнего
986
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
возраста, и прекращается к 10 годам. Однако она может прекратиться раньше (например, из-за аплазии или гипоплазии яичников). Такая сука постоянно находится в состоянии анэструса.
Диагноз. Недостаточность функции яичников предполагают в том случае, когда все другие диагнозы были исключены и попытки индуцировать эструс оказались безуспешными. Однако подтвердить этот диагноз трудно. Одним их способов является определение концентраций ЛГ и ФСГ в плазме крови. При преждевременной недостаточности функции яичников содержание этих гормонов в плазме крови крайне высоко, поскольку отсутствует регуляция активности гипоталамуса и гипофиза по механизму обратной связи (рис. 24-9) (Olson et al, 1992). Другой способ верификации диагноза - провести лапароскопию или лапаротомию, чтобы обследовать репродуктивный тракт и взять образцы ткани матки и яичников на исследование. Наконец, если остались жизнеспособные яичники, введение чХГ или ГнРГ должно вызывать увеличение концентрации эстрадиола в плазме крови. Эти методы описаны в данной главе в разделах «Предшествующая овариогистерэктомия» и «Индукция эструса».
Прогестерон-секретирующая киста яичника
Прогестерон-секретирующая киста яичника - это известный, но редкий синдром, который приводит к стойкому диэструсу, хотя, по мнению владельца, сука находится в стойком анэструсе. По определению, у такой суки ранее была течка, так что ее состояние выглядит как вторичный анэструс. Но если это состояние наступило после скрытой течки, то длительный анэструс можно принять за первичный. В целях диагностики проводят УЗИ брюшной полости и определяют концентрацию прогестерона в плазме крови; при наличии прогестерон-секретиру-ющей кисты эта концентрация превышает 2 нг/мл (рис. 24-7). Лизировать такие кисты с помощью простагландинов обычно не удается, поэтому рекомендуется их хирургическое удаление.
Иммуно-опосредованный оофорит
За последние 20 лет был описан только один случай аутоиммунной деструкции яичников, которую наблюдали у 5-летней собаки с диффузным лимфоцитарным воспалением яичников (Johnston, 1989; 1991). Проведенное гистологическое исследование обнаружило также дегенерацию фолликулов, атрезию и некроз яйцеклеток, утолщение блестящей оболочки яйцеклеток и отсутствие желтых тел. Такой синдром встречается редко.
Хирургическая диагностика
Поставить диагноз взрослой суке, у которой никогда не было овариальных циклов, бывает очень
нелегко, поскольку это требует проведения тестов, редко применяемых в ветеринарной практике. Многие ветеринары считают целесообразным в целях диагностики проводить лапаротомию без предварительного обследования. Во время операции оценивается состояние органов брюшной полости, и можно взять образцы ткани яичников и матки для гистологического исследования и пробу из просвета матки для культивирования.
Хотя этот метод практически целесообразен, все же по внешнему виду не всегда удается отличить нормальную ткань от поврежденной, а в результате ветеринар может оказаться не в состоянии ответить на последующие вопросы владельца собаки или заводчика. Таким образом, применение лапаротомии ограничено тем, что даже визуальный осмотр органа не всегда позволяет поставить точный диагноз. Мы настойчиво рекомендуем проводить тщательное обследование суки (как это описано выше) до хирургического вмешательства. При необходимости собаку можно направить к опытному специалисту, способному дать четкую информацию о ее состоянии и, возможно, об особенностях данной линии собак.
ИНДУКЦИЯ ЭСТРУСА
Переменный успех
Еще один подход в случаях длинного интервала между течками либо первичного или вторичного анэструса у сук состоит в том, чтобы, помимо диагностического тестирования, попробовать индуцировать эструс. Такой подход можно рассматривать и как диагностический, и как терапевтический. Однако большинство исследований по стимуляции эструса были проведены на здоровых особях, причем успех был переменным. Применение аналогичной схемы индукции эструса у сук с нарушением оси гипоталамус-гипофиз-яичники не позволяет рассчитывать на блестящий результат. Неудача может объясняться либо несоответствующим методом индукции, либо анатомическими или физиологическими нарушениями у суки, вследствие которых она не способна ответить на стимуляцию.
Мониторинг собаки, находящейся на лечении
Цитологическое исследование влагалища следует проводить через день независимо от выбранного метода индукции эструса. Вязку или искусственное осеменение рекомендуется начинать после того, как поверхностные клетки составят не менее 60% от общего количества слущиваемых эпителиальных клеток влагалища и/или когда концентрация прогестерона в плазме крови превысит 1 нг/мл. Осеменение проводят через день до тех пор, пока не наступит диэструс.
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 987
Доступность и надежность медицинских препаратов
Гонадотропины ЛГ и ФСГ высвобождаются из передней доли гипофиза. ФСГ стимулирует развитие первичных фолликулов и вносит свой вклад в овуляцию. ЛГ тоже участвует в стимуляции роста фолликулов и запускает овуляцию. В качестве препаратов для лечения собак ни ФСГ, ни ЛГ не продаются. Но лХГ (обозначаемый также как ХГЖК - хорионический гонадотропин из сыворотки жеребой кобылы) и чХГ имеются в продаже. лХГ продуцируется лошадью во время беременности и обладает действием ФСГ и некоторыми эффектами ЛГ; чХГ выделяют из мочи беременных женщин, и он обладает действием ЛГ (England, 1988).
Различия в качестве, устойчивости и доступности выпускаемых гормональных препаратов, а также применение разных препаратов создают определенные проблемы и частично объясняют расхождение результатов исследований, проведенных по одной и той же схеме. Одни препараты коммерчески недоступны, а активность других сильно варьирует в зависимости от того, где они были куплены и как были изготовлены. Ветеринар должен с большой осторожностью подходить к этим препаратам, поскольку явные проблемы, связанные с их качеством, пока что не разрешены.
Применение хорионического гонадотропина из сыворотки жеребой кобылы (ХГЖК) или фолликулостимулирующего гормона
Хорионический гонадотропин из сыворотки жеребой кобылы. Были испытаны различные схемы введения ХГЖК (табл. 24-3); использовались препараты гестил (Gestyl, произ-во Diosynth, США), эквинекс (Equinex, произ-во Ayerst Laboratories, Канада) и фоллигон (Folligon, произ-во Intervet, Англия). В одном из исследований приблизительно у 50% собак произошла овуляция после 9 дней ежедневного подкожного или внутримышечного введения ХГЖК в дозе 44 МЕ/кг/день и последующего внутримышечного введения 500 ME чХГ на 10-й день (Archbald et al, 1980). Через 10-15 дней после начала лечения у собак появилось характерное для эструса поведение, но и оно отмечалось только у половины собак с состоявшейся овуляцией.
В другом исследовании зрелым сукам в фазе анэструса вводили подкожно сыворотку жеребой кобылы (СЖК) в дозах 500 МЕ/день, 250 МЕ/день или 20 МЕ/день ежедневно в течение 10 дней, после чего на 10-й день вводили подкожно 500 ME чХГ; используемые препараты: хорионический гонадотропин для инъекций (произ-во Bums Biotech, США) и хорулон (Chorulon, произ-во Intervet, Англия). Это воздействие привело к аномально высоким концентрациям эстрогена в плазме крови, аномальным овуляторным циклам с укороченной лютеиновой фазой и токсическим побочным эф
фектам, обусловленным, по-видимому, избытком эстрогенов. Побочные эффекты включали тромбоцитопению, заболевание матки и прерывание щенности (Arnold et al, 1989).
При иной схеме проведения подкожных инъекций, а именно: ХГЖК по 20 МЕ/ кг/день в течение только 5 дней и затем чХГ в дозе 25 МЕ/кг на 5-й день, - концентрация эстрогена в плазме крови была ближе к физиологической и 50% сук забеременели (Arnold et al, 1989; England, 1998). Однако в другой работе применение этой же схемы введения препаратов привело к избыточной концентрации эстрогена, который вызвал торможение имплантации, подавление функции костного мозга и гибель нескольких сук (England, Allen, 1991). Такое расхождение результатов может частично объясняться различной активностью использованных препаратов ХГЖК.
Применение ФСГ с предварительным введением эстрогена или без него. Использование одного ФСГ (FSH-P, произ-во Schering, США) для стимуляции эструса было менее успешным, чем применение одного ХГЖК (Olson et al, 1981; Shille et al, 1984a). Однако хорошие результаты были получены при введении ФСГ после «эстрогенизации» собак путем введения диэтилстильбэстрола (ДЭС; произ-во Eli Lilly, США) в дозе 5 мг ежедневно в течение 7 и более дней вплоть до появления признаков проэструса. Через 5 дней после индукции проэструса (набухание вульвы /кровянистые выделения из влагалища) вводили внутримышечно ЛГ в дозе 5 мг, а на 9 и 11-й дни после начала кровотечения - ФСГ по 10 мг, тоже внутримышечно. Все суки, получившие такое лечение, забеременели (Moses, Shille, 1988). Когда те же авторы в аналогичном исследовании вместо ЛГ использовали чХГ, результаты, оцениваемые по появлению у сук половой охоты и по их последующей фертильности, оказались гораздо хуже (Shille et al, 1989).
Была разработана успешная модификация этого метода, состоявшая в том, что ДЭС давали ежедневно по 5 мг в течение 4-10 дней, продолжая его давать в течение трех дней после появления признаков проэструса (кровянистые выделения из влагалища и привлечение кобелей). На 5, 9 и 11-й дни после первого дня проэструса вводили внутримышечно по 5 мг ФСГ (FSH-P). Характерное для эструса поведение наблюдалось у 70% сук через 5-10 дней после начала введения ДЭС. У 46% сук произошла овуляция, и 30% сук забеременели и дали потомство (Bouchard et al, 1991).
Использование гонадотропин-рилизинг гормона (ГнРГ) или его агониста
Условия успеха. Применение ГнРГ или его агониста для индукции фертильного овариального цикла возможно только в том случае, если не нарушена ось гипофиз-яичники. Эти препараты вызывают высвобождение из гипофиза гонадотропинов,
988 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
ТАБЛИЦА 24-3. МЕТОДЫ ГОРМОНАЛЬНОЙ ИНДУКЦИИ ЭСТРУСА У СУК, НАХОДЯЩИХСЯ В АНЭСТРУСЕ*
МЕТОД Эструс(%) Овуляция(%) Появление(%) Ссылка потомства(%)
ХГЖК (2-50 МЕ/кг) ежедневно в течение 50-100 50-100 0-20 (Arnold et al, 1989;
9-14 дней ХГЖК (20 МЕ/кг) ежедневно в течение 5 80-90 80-100 50 Archbald et al, 1980) (Arnold et al, 1980;
дней, затем чХГ ФСГ (1-10 мг/день) ежедневно 0-50 0-50 0 England, Allen, 1991) (Olson et al, 1981; Shille et
ДЭС перорально, затем ФСГ, затем чХГ 90 30 — al, 1984a) (Olson et al, 1984)
ДЭС перорально по 5 мг/день, пока не наступит проэструс, затем: а) ЛГ, затем ФСГ 100 100 100 (Moses, Shille,1988)
б) чХГ, затем ФСГ 40 20 0 (Shille et al, 1984a)
в) ФСГ (10 мг) каждые 2-4 дня 70 50 30 (Bouchard et al, 1991)
ГнРГ в/в импульсно, каждые 90 мин 60-100 50-80 40-80 (Cain et al, 1988; Vanderlip
Агонист ГнРГ подкожно в течение 14 дней 90 75 25-50 et al, 1987) (Concannon, 1989)
Агонист ГнРГ подкожно 3 раза в день 80 80 80 (Cain et al, 1990)
Из: Concannon PW: Methods for rapid induction of fertile estrus in dogs. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders Co, 1992, p 960.
ДЭС - диэтилстильбэстрол; ФСГ - фолликулостимулирующий гормон; ГнРГ - гонадотропин рилизинг-гормон; чХГ - хорионический гонадотропин человека; ХГЖК - хорионический гонадотропин жеребой кобылы
которые, в свою очередь, должны стимулировать яичники. Развитие фолликулов, секреция ими эстрогенов, характерное для эструса поведение и стимулируемая гипофизарным гормоном овуляция зависят от нормального физиологического ответа на «активацию» системы.
Протоколы. Согласно первому протоколу, сукам имплантировали инфузионный насос, который подавал небольшие дозы ГнРГ (40—400 нг/кг) каждые 90 мин в течение 6-12 дней. Проэструс у сук начинался через 3-6 дней, а фертильный эструс -через 7-14 дней. Фертильные циклы удавалось успешно вызвать у 37-85% сук, леченных таким способом (Vanderlip et al, 1987; Cain et al, 1988). Хотя сам по себе метод интересен, он не представляет ценности для ветеринаров из-за своей громоздкости и непрактичности, так как требует проведения микрохирургических процедур для имплантации и последующего удаления дорогостоящих инфузионных насосов.
По другому протоколу агонист ГнРГ инфузиро-вали постоянно в течение 14 дней. Это приводило к быстрой индукции проэструса и эструса, и цикл был фертильным у 25% сук, если препарат начинали вводить сразу после лактации, и у 50% сук, если агонист вводили в анэструсе после бесплодного цикла (Concannon, 1989,1992). Полученные результаты перспективны, однако использованного авторами агониста ГнРГ в продаже нет. Кроме того, маленькие осмотические насосы, хотя и недороги, но их нужно имплантировать под кожу и затем удалять микрохирургическим путем (Concannon, 1992).
Более простая схема включает подкожное введение агониста ГнРГ (D-Tpn-6-ГнРГ) в дозе 1 мкг/кг трижды в день ежедневно в течение 11 дней и затем в дозе 0,5 мкг/кг трижды в день в течение еще трех дней. Эструс наступал через 9-11 дней после начала лечения у 80% сук, и все они забеременели (Cain
et al, 1990). Несмотря на неудобство трехкратных ежедневных инъекций, эта схема представляется наиболее эффективной и практичной в сравнении с другими методами применения ГнРГ (Concannon, 1992).
Применение каберголина
Шести сукам с первичным или вторичным анэструсом давали перорально каберголин в дозе 5 мкг/кг ежедневно вплоть до второго дня после наступления проэструса. У 5 из 6 сук были индуцированы нормальные проэструс и эструс, после чего они забеременели естественным путем и дали нормальное потомство. Никаких неблагоприятных эффектов не наблюдалось (Gobello et al, 2002).
СТОЙКИЙ ПРОЭСТРУС И\ИЛИ ЭСТРУС
См. рис. 24-6.
Определение
Стойким эструсом называется состояние суки, при котором проявление ею половой охоты во время овариального цикла длится более 21-28 дней подряд. Другим, более косвенным показателем стойкого эструса служит присутствие свыше 80-90% поверхностных клеток в вагинальном мазке в течение более 21-28 последовательных дней. Последнее свидетельствует о стабильно высокой концентрации эстрогена в плазме крови.
Клинические наблюдения
У сук со стойким проэструсом увеличены наружные половые органы и не останавливаются кровянистые выделения из влагалища; такие суки при
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 989
влекают кобелей, и у них проявляются все признаки действия эстрогена на репродуктивный тракт. Хотя причины стойкого эструса/проэструса бывают разными, конечный эффект определяется непрерывным воздействием высоких концентраций эстрогена, присутствующего в крови.
Избыток экзогенного эстрогена
Внутрибрюшинное введение эстрогенных препаратов иногда применяется для предупреждения щенности (эстрогены препятствуют миграции эмбрионов из яйцеводов в матку) и в целях лечения недержания мочи у сук. Эстроген, вводимый во время эструса для предотвращения щенности, обычно продлевает проявление признаков эструса. В каждом случае стойкого проэструса/эструса у суки следует выяснять, не вводили ли ей эстроген после нежелательной вязки. Если эстроген вводили, надо уточнить, какой именно препарат и в какой дозе. Экзогенный эстроген может приводить не только к развитию пиометры и аплазии костного мозга, но и к образованию кист в яичниках (Olson et al, 1989b; Meyers-Wallen, 1992).
Избыток эндогенного эстрогена
Молодые суки и суки, получавшие гонадотропин. Встречаются (хотя и редко) случаи, когда у молодой суки первый или второй овариальный цикл протекает без овуляции и возникает стойкий проэструс или эструс под действием эстрогена, продолжающего высвобождаться из фолликулов. Отсутствие овуляции можно объяснить двояко: либо количества секретируемого эстрогена оказалось недостаточно для индукции выброса ЛГ, либо ЛГ не смог вызвать овуляцию. Описана сука, у которой признаки проэструса появились в возрасте 7,5 месяцев и продолжались более 7 месяцев; как выяснилось, у нее был генетический дефект - Х-хро-мосомная моносомия (77, ХО) (Lofstedt et al, 1992). Сходный физиологический и клинический эффект (отсутствие овуляции, приводящее к стойкому про-эструсу / эструсу) могут оказывать и экзогенные гонадотропины (Meyers-Wallen, 1992).
Фолликулярные кисты.
Частота случаев. В ветеринарной литературе имеется мало информации об этом нарушении. Большинство фолликулярных кист содержат гранулезные клетки, не способны к овуляции и секретируют большие количества эстрогена. Обычно кисты бывают одиночными, имеют в диаметре 1-1,5 см и встречаются у сук моложе 3 лет. Иногда они достигают 5 см в диаметре и, как правило, содержат прозрачную водянистую жидкость.
Клинические признаки и диагностика. Клинические симптомы у сук с фолликулярными кистами такие же, как при избытке эстрогена, т.е. наблюдаются признаки проэструса и/или эструса. Чаще всего владельцы таких сук обращаются к ветеринару
по поводу кровянистых выделений из влагалища, которые продолжаются неделями вместо ожидаемых 7-10 дней. Реже владельцы жалуются на длительное - в течение многих недель вместо ожидаемых 6-10 дней - проявление сукой половой охоты.
Кисты, секретирующие только прогестерон, относятся к «лютеинизирующим кистам». Они не вызывают ни повышения эстрогена в плазме крови, ни признаков проэструса/эструса. Однако у некоторых сук, которых мы лечили по поводу фолликулярных кист, был несколько повышен уровень прогестерона в плазме крови. При наличии кист, продуцирующих только эстроген, суки находятся в состоянии длительного проэструса, что неудивительно. Если же киста продуцирует эстроген и в небольших количествах прогестерон, то у суки, как правило, возникает стойкий эструс.
Диагноз «фолликулярные кисты» ставится на основании таких данных, как чрезмерная длительность кровотечений из влагалища, длительное проявление половой охоты, устойчивость цитологических изменений влагалища, присущих позднему проэструсу и эструсу, а также постоянно повышенный уровень эстрогена в плазме крови (>20 нг/мл). Последнее подтверждается и цитологической картиной влагалищного мазка, демонстрирующей выраженное преобладание поверхностных клеток (более 80-90%). Одним из важнейших диагностических средств является УЗИ брюшной полости. Обнаружение одной или более неэхогенных кистозных структур в одном или обоих яичниках у суки с подозрением на фолликулярную кисту однозначно подтверждает диагноз. Нормальные прео-вуляторные фолликулы имеют 4—9 мм в диаметре (Meyers-Wallen, 1992), а гормон-продуцирующие кисты обычно намного больше и их легче увидеть (рис. 24-7).
Дифференциальная диагностика. В случаях стойкого проэструса/эструса рассматривается несколько дифференциальных диагнозов. Самый частый из них - сука имеет нормальный проэструс или эструс, лишь более длительный, чем при средних значениях нормы,. Проэструс может продолжаться 3—4 недели, хотя обычно длится не больше 14 дней. Эструс тоже может продолжаться до трех недель, хотя чаще всего длится не больше двух недель. Никакого лечения не следует назначать до тех пор, пока не будет доказано, что имеющиеся клинические проявления отличаются от таковых у здоровых сук. Иными словами, лечение не рекомендуется, особенно для сук пубертатного возраста, пока признаки проэструса или эструса не будут продолжаться гораздо дольше одного месяца.
Бывает, что дробную течку ошибочно интерпретируют как стойкий проэструс или эструс. Аналогичным образом, этот диагноз иногда ошибочно ставят и в случаях коротких интервалов между течками. В целом, нужно иметь в виду, что любая причина как длительных кровянистых выделений из влагалища (например, инородное тело, опухоль
990 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
влагалища или матки), так и постоянного привлечения кобелей (например, вагинит, перивульварный дерматит) дает клиническую картину, похожую на стойкий проэструс или эструс.
Избыточная продукция половых гормонов может быть обусловлена опухолями яичников. При обследовании эти опухоли невозможно отличить от овариальных кист, но единственным средством лечения в этих случаях является операция. Предположительный диагноз неоплазии ставится на основании УЗИ брюшной полости, а окончательный - по данным гистологического исследования удаленной ткани.
Лечение. Некоторым сукам лечения не требуется, поскольку фолликулярные кисты могут подвергнуться спонтанной атрезии или лютеинизации. Мониторинг этих процессов осуществляют с помощью УЗИ брюшной полости, цитологии влагалища и определения концентрации прогестерона в плазме крови. Как при атрезии, так и при лютеинизации кист симптомы быстро исчезают.
Прогестерон. Сукам, нс предназначенным для разведения, в целях ослабления проявлений эструса рекомендовалось давать перорально мегестрола ацетат (Ovaban; произ-во Schering, США) в дозе 2 мг кг в течение 8 дней (Shille, 1986). После этого требуется провести овариогистерэктомию, так как этот препарат способен вызвать кистозную гиперплазию эндометрия и пиометру (Fayer-Hosken el aL 1992). Мы такой метод лечения не применяем и не рекомендуем его.
Гонадотропины. Для сук, чье потомство представляет ценность, было предложено несколько способов индукции овуляции или лютеинизации фолликулярных кист, а тем самым и устранения клинических признаков патологии. Так, рекомендуется использовать с этой целью либо ГнРГ (Cystorelin; произ-во Sanofi, США), вводя его один-три раза внутримышечно (50-100 мкг каждые 24-48 часов), либо - по той же схеме - чХГ (Follutein; произ-во Solvay Veterinary, США) в дозе 22 ЕД/кг внутримышечно каждые 24 48 часов (Olson et al, 1989b). Если после лечения концентрация эстрогене! в плазме крови снизилась, а концентрация прогестерона осталась ниже 2 нг/мл, то, по-видимому, киста регрессировала, и сука перешла в фазу анэструса. Если же концентрация ютрогена в плазме крови снизилась, но концентрация прогестерона возросла, у суки, видимо, начался диэструс, и необходимо ее наблюдать в связи с риском развития пиометры.
Указывалось также, что в случаях, когда индуцировать анэструс или диэструс указанными средствами не удалось (т.е. течка продолжается), наиболее вероятным диагнозом будет опухоль яичника (Olson et al, 1989b, Meyers-Wallen, 1992). Мы получали другие результаты Медикаментозное лечение фолликулярных кист у большинства собак было безуспешным, и только хирургическое вмешательство приводило к выздоровлению, причем фертильность после операции сохранялась, так как удаляли
Рис. 24-10. Яичник (прямая черная стрелка) с двумя фолликулярными кистами (пря мые белые стрелки) и матка (ф-.-’ооб-разная черная стрелка) у суки со стойким проэструсом.
только один яичник; диагностика опухоли яичника проводится после операции (см. ниже).
Хирургическое лечение. Как указано в предыдущем разделе, у большинства наших пациентов фолликулярные кисты не регрессировали спонтанно, и сук приходилось оперировать. Мы всегда пытаемся провести резекцию кисты без удаления яичника. Но чаще всего не удается отделить кисту от яичника, и приходится удалять обе структуры (рис. 24-10). Эффекг операции проявлялся быстро. Признаки проэструса и/или эструса исчезали в первые 1-4 дня после операции, и никаких проблем впоследствии не возникало. Подавляющее большинство сук оставались фертильными и после следующего эстрального цикла давали здоровое потомство.
Вместо удаления кист можно применить их хирургическое дренирование. Одной суке после дренирования мы ввели непосредственно в кисту чХГ в дозе 22 ME/ki (Brockus, 1998). Хотя этот опыт оказался успешным, данный метод все же представляется рискованным, так как в случае неудачи лечения придется проводить вторую, радикальную хирургическую операцию, а в промежутке между двумя операциями может произойти подавление функции костного мозга. В связи с этим необходимо, чтобы владелец собаки был осведомлен о возможных последствиях.
Гистология. Гистологическое исследование удаленной ткани обязательно. Оно должно показать и ветеринару и владельцу, что диагноз был поставлен правильно и проведенное лечение адекватно. Главное, может оказаться, что у суки была опухоль яичника, а не доброкачественная киста. В этом случае нужно проверить, не была ли опухоль злокачественной. Вся информация должна быть передана владельцу.
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 991
ОПУХОЛИ яичников
Частота случаев
Опухоли яичников встречаются редко. Такие опухоли могут развиться в любом возрасте, но средний возраст их обнаружения у сук - 8-10 лет. Исключение составляет тератома яичников, которая, по данным одного исследования, развивается в среднем к 4-летнему возрасту (Patnaik, Greenlee, 1987). Имеющиеся данные о частоте опухолей яичников несомненно занижены, поскольку у большинства сук, имеющих хозяев, к среднему возрасту яичники и матка уже удалены.
Гистология
Кистозные аденомы яичников (серозные или псевдомуцинозные) встречаются чаще, чем фибромы и аденокарциномы яичников. К наиболее распространенным первичным опухолям яичников относятся (в порядке частоты) эпителиомы, опухоли зародышевых тяжей и гермицитомы (последние образуются из зародышевых клеток). Опухоли зародышевых тяжей чаще всего представлены новообразованиями, состоящими из гранулезных клеток и клеток Сертоли-Лейдига, а среди опухолей типа гермицитом преобладают дисгерминомы и тератомы (Patnaik, Greenlee, 1987). Опухоли могут развиваться в одном или обоих яичниках и бывают как малых, так и больших размеров (Withrow, Susaneck, 1986).
Симптомы
Если опухоли яичников оказываются функциональными (гормон-продуцирующими), то могут возникнуть симптомы, характерные для избытка эстрогена, хотя в нашей практике это наблюдалось чрезвычайно редко. Сук с гранулезоклеточными опухолями приводят к ветеринару в связи с постоянным проэструсом/эструсом или по поводу КГЭ/пиометры. Ошибочно считается, что опухоли яичников крайне редко встречаются у сук, подвергнутых овариогистерэктомии в связи с пиометрой. Функциональные опухоли, постоянно секретирующие эстроген, могут приводить к нарушениям кроветворения (Olson et al, 1989b).
СИНДРОМ КУЛЬТИ ЯИЧНИКА
Определение
Синдром культи яичника выражается в том, что у кастрированных ранее сук и кошек возникают проэструс и/или эструс. Об этом судят не только по появлению поведенческих признаков, типичных для указанных фаз эстрального цикла, но и по изменению гормонального профиля, которое свидетельствует о наличии функционирующей ткани яичника.
Этиология
Возможны три причины развития синдрома культи яичника. Самая частая из них -неполное удаление одного или обоих яичников во время операции. Другая причина состоит в попадании кусочка ткани яичника в брюшную полость после полной резекции яичников. Такая ткань подвергается васкуляризации и впоследствии начинает функционировать. Это было показано на кошках в проспективном исследовании, в котором специально были смоделированы такие условия (DeNardo et al, 2001). Третьей причиной может быть существование «остаточной» овариальной ткани вне области непосредственного расположения яичников. Эта ткань может начать функционировать практически в любое время, и мы находили ее у нескольких сук внутри связки яичника на стыке с брюшной стенкой.
Симптомы
У сук с культей яичника проявляются типичные признаки проэструса или эструса. Как показывает наш опыт, владельцы таких сук обычно обращаются к ветеринару по поводу того, что сука, несмотря на проведенную кастрацию, привлекает кобелей (некоторые хозяева жаловались, что их дома буквально окружены кобелями). Порой владельцам трудно выходить из дома с такой собакой из-за агрессивного поведения кобелей и аналогичных демонстраций ею половой охоты. Важно помнить, что сохранившаяся ткань яичника функционирует так же циклически, как и нормальная. Хотя у некоторых сук при этом возникает стойкий эструс, но гораздо чаще продолжительность проэструса и эструса находятся в нормальных пределах.
Наружные половые органы у таких сук увеличены. При цитологическом исследовании мазка из влагалища видны типичные изменения, соответствующие высокой концентрации эстрогена. Сообщалось, что у сук с синдромом культи яичника наблюдали кровянистые выделения из влагалища (Wallace, 1992), но у тех, которых мы лечили, выделений не было. Трудно объяснить, откуда могут взяться кровянистые выделения, если полностью удалена матка - источник крови. У суки без матки таких выделений не должно быть. Однако если наряду с остатками яичника сохранились и остатки ткани матки, то кровотечение является результатом действия эстрогена на эндометриоидную ткань, и такие собаки предрасположены к «культе пиометры».
Диагностика
Диагностика синдрома культи яичника не представляет трудностей. После того как исключено введение экзогенного эстрогена, секрецию эндогенного эстрогена выявляют с помощью цитологического исследования влагалища, проведенного в то время, когда сука привлекает кобелей и сама готова к
992 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
случке. Сильным аргументом в пользу диагноза является присутствие более 80-90% поверхностных клеток в мазке.
Все же, поскольку данный синдром встречается нечасто, мы рекомендуем для подтверждения диагноза один или несколько раз определить концентрацию эстрогена (эстрадиола) в сыворотке крови. Концентрация эстрогена, превышающая 15 пг/мл, является аномальной и указывает на фолликулярную активность. У некоторых собак с явными признаками эструса немного повышена и концентрация прогестерона в сыворотке крови. Наборы для определения гормонов вполне доступны, и следует один или несколько раз проверить концентрацию прогестерона и эстрадиола. Тем не менее цитологическое исследование влагалища дает более надежные результаты, чем однократное определение концентрации эстрадиола в сыворотке крови, и обычно позволяет установить диагноз.
Лечение
Хирургическое лечение. Рекомендуется обзорная лапаротомия, причем ее должен выполнять опытный хирург. Опыт необходим для обнаружения остатков яичника. Лапаротомию разумно проводить, когда сука находится в фазе эструса или диэструса, так как наличие фолликулов или желтых тел повышает шансы увидеть ткань. Обычно она локализована на ножках или связках яичников. Любую подозрительную ткань нужно удалить, и ветеринар-патолог должен провести гистологический анализ. В области обеих ножек яичников ткань удаляют полностью независимо от ее внешнего вида и данных лапаротомии. Исчезновение симптомов и гистологический анализ удаленной ткани должны подтвердить диагноз.
Медикаментозное лечение. Медикаментозное лечение, хотя и не рекомендуется, может оказаться необходимым, если владелец собаки отказывается от лапаротомии или если предыдущие одна или несколько операций были безуспешными. В этих случаях назначают мегестрола ацетат или миболерон (см. гл. 22).
НАРУШЕНИЯ ПОЛОВОГО РАЗВИТИЯ
Нормальное половое развитие
У млекопитающих пол определяется той половой хромосомой, которую несет сперматозоид, оплодотворяющий яйцеклетку. Эмбрион развивается по мужскому пути, если этот сперматозоид содержит Y-хромосому. Если сперматозоид содержит Х-хро-мосому, развитие эмбриона пойдет по женскому пути. На ранних стадиях развития половая система не является ни мужской, ни женской. Со временем у эмбриона, не имеющего Y хромосомы, из первичной гонады развивается яичник, а из мюллерова протока - эпителий яйцеводов, матки и влагалища;
по женскому типу развиваются также мочеполовой синус и наружные половые органы.
Если у эмбриона есть Y-хромосома, из первичной гонады развивается семенник, который продуцирует тестостерон и субстанцию, ингибирующую мюллеров проток. Эта субстанция, секретируемая клетками Сертоли, вызывает регрессию мюллерова протока. Тестостерон, вырабатываемый клетками Лейдига, стимулирует образование эпидидимиса и семявыносящего протока из вольфова протока, а также формирование мужского мочеиспускательного канала, пениса, простаты и мошонки.
Нормальное половое развитие протекает в три стадии (рис. 24-11). Стадия 1 - детерминация хромосомного пола (XX либо XY). Стадия 2 - формирование гонадного пола (развитие яичников либо семенников). Если первые две стадии прошли нормально, то на третьей стадии формируется фенотипический пол (индивидуальный внешний вид мужского либо женского типа). Ошибка на любой из этих трех стадий приводит к нарушению полового развития животного, иногда явному, а иногда и незаметному для владельца и ветеринара (табл. 24-4). В норме общее число хромосом у собак равно 78. Они включают 38 пар неполовых хромосом и две половые хромосомы - XX у сук и XY у кобелей.
Аномальное половое развитие
Собак с явными аномалиями наружных половых органов распознать легко, но, как указано в предыдущем разделе, нарушения могут произойти на любом этапе развития. Многие едва различимые или скрытые дефекты полового развития не выявляются при физикальном исследовании. Аномалии хро-
ТАБЛИЦА 24-4. ПЕРЕЧЕНЬ НАРУШЕНИЙ ПОЛОВОГО РАЗВИТИЯ
Аномалии хромосомного пола
Аномальное число половых хромосом
Синдром XXY
Синдром Х0
Синдром XXX
Химеры и мозаики
Химеры - истинные гермафродиты
Химеры XX/XY с семенниками
Химеры XY/XY с семенниками
Аномалии гонадного пола
XX половая инверсия
XX истинный гермафродитизм
XX мужской синдром
Аномалии фенотипического пола
Женский псевдогермафродитизм
Воздействие экзогенных андрогенов Воздействие эндогенных андрогенов Мужской псевдогермафродитизм
Синдром сохранения мюллерова протока
Синдром нарушения зависимой от андрогенов маскулинизации
Гипоспадия
Резистентность к андрогенам
Крипторхизм
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 993
Нормальная половая дифференцировка
Генетический пол
Гонадный пол
Фенотипический пол
Остается открытой: <
Вульва
XX у
, Г. i
(Яичник| |Семенни1к|
Эмбрион
Яйцевод
Матка л.
Краниаль- \L ный отдел влагалища
Регрессия <—
Остаются открытыми:
Каудальный отдел вла-<— галища
Преддверие влагалища
Клитор <—
Рис. 24-11. Нормальная половая дифференцировка. СИМП - субстанция, ингибирующая мюллеров проток; ДГТ - дигидротестостерон. (Meyers-Wallen VN, Patterson DF: Disorders of sexual development in dogs and cats. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p 1261; использовано с разрешения авторов).
мосомного пола четко диагностируются по данным определения кариотипа. Обычно это определение проводят на культуре лимфоцитов периферической крови; такой метод считается наиболее простым и применяется в ряде ветеринарных клиник (Meyers-Wallen, Patterson, 1986).
Состояние, при котором пол особи неясен из-за врожденных аномалий полового тракта, определяют как интерсексуальность. Этот обобщенный термин охватывает ряд специфических нарушений полового развития, включая различные формы гермафродитизма. При истинном гермафродитизме у особи присутствуют одновременно и тестикулярная, и овариальная ткани, причем эти компоненты семенника и яичника либо объединены в одной гонаде (называемой «овотестис»), либо существуют в виде двух отдельных гонад. Псевдогермафродиты имеют гонады одного пола, а органы размножения - с признаками противоположного пола. У псевдогермафродитов мужского пола наряду с семенниками имеются такие женские признаки, как матка или наружные половые органы женского типа. У псевдогермафродитов женского пола яичники есть, но они в определенной степени вирилизованы (Patterson, 1983).
Нужно уточнить терминологию. Фенотип - это внешний вид, например, женский фенотип означает внешний женский вид. Генотип - это генетическая характеристика данной особи. Применительно к определению пола, генотипом называют набор
половых хромосом (например, XX, XY, XXY, ХО). Говоря о гонадном половом типе, имеют в виду присутствие яичников или семенников.
Половая принадлежность желез точнее всего определяется путем их гистологического исследования; материал для исследования получают с помощью биопсии. Однако иногда нужно обследовать всю гонаду, например если есть подозрение, что это овотестис. Фенотипический пол устанавливается путем осмотра как внутренних, так и наружных половых органов. При этом определяют прежде всего следующее: 1) имеет ли вульва или препуций правильную форму и положение; 2) имеет ли собака клитор или у нее пенис; 3) как расположено отверстие уретры; 4) есть ли у собаки предстательная железа либо каудальный отдел влагалища (Meyers-Wallen, Patterson, 1989).
Аномалии хромосомного пола
Определение. Собаки и кошки с аномальным набором половых хромосом внешне выглядят как нормальные самцы и самки, имеющие скорее недоразвитые, чем неопределенные (двойственные) половые органы. Исключение из этого правила могут составлять животные-мозаики и химеры. Большинство животных с аномальным набором половых хромосом стерильны, и никаких способов лечения этого нет (Meyers-Wallen, Patterson, 1989).
994 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Синдром XXY. Нарушения могут происходить во время мейоза, конечным результатом которого является образование гамет (сперматозоидов или яйцеклеток). Одним из таких нарушений является нерасхождение хромосом в ходе клеточного деления. В случае нерасхождения хромосом в процессе образования яйцеклеток в одной яйцеклетке оказывается две Х-хромосомы, а другая яйцеклетка не имеет половой хромосомы. Если яйцеклетка, содержащая две Х-хромосомы, будет оплодотворена сперматозоидом, содержащим Y-хромосому, то у развивающегося плода будет генотип XXY. В этом случае присутствие Y-хромосомы приведет к формированию семенников, которые будут продуцировать СИМП и тестостерон, что и определит развитие мужского фенотипа (особи с мужскими наружными половыми органами). В то же время наличие двух Х-хромосом вызовет стойкое угнетение процесса сперматогенеза, так что в результате мы получим особь с тестикулярной гипоплазией (Meyers-Wallen, Patterson, 1989). Состояние XXY описано у людей, мышей, лошадей, коров, овец, кошек и собак (Patterson, 1983).
Синдром ХО. Как сказано выше, возможен случай, когда яйцеклетка или сперматозоид не содержат половых хромосом. Если вторая гамета (яйцеклетка или сперматозоид), участвующая в оплодотворении, содержит Х-хромосому, то образуется зигота ХО. У людей носители ХО имеют женский фенотип (женские наружные половые органы), но отличаются низким ростом и наличием других аномалий развития, а также отсутствием полового хроматина. У эмбриона ХО первичные гонады начинают развиваться как яичники, но затем обычно дегенерируют, превращаясь в фиброзные тяжи, не содержащие половых клеток. Что касается собак с генотипом ХО, то у некоторых из них наблюдался продолжительный проэструс и, по-видимому, имелись нормальные яичники (Lofstedt et al, 1992). Синдром ХО следует учитывать при дифференциальной диагностике в случаях, когда у собаки 2^1 лет отсутствуют циклы либо когда собака демонстрирует стойкий проэструс.
Синдром XXX. Фертильный овариальный цикл наблюдался у самок с генотипом XXX, относящихся к различным видам млекопитающих. Причиной синдрома XXX является нерасхождение половых хромосом, подобное, но противоположное синдрому XXY. Была описана собака с первичным анэструсом, имевшая этот необычный синдром (Meyers-Wallen, Patterson, 1989). У людей данный синдром встречается с частотой 1 случай на 1000 женщин.
Химеры и мозаики. Химера - это особь, чьи клетки представлены двумя популяциями, различающимися по своему происхождению. Так, если источником происхождения одной популяции окажется организм XX, а другой - организм XY, то будет развиваться химера XX/XY. Такая особь, являющаяся как бы результатом развития из двух зигот, несет лишнюю пару хромосом.
Мозаик тоже характеризуется наличием по крайней мере двух генетически разных популяций клеток, но все его клетки имеют общий источник происхождения - одну и ту же зиготу. Нарушение возникает вследствие нерасхождения хромосом в процессе митоза, как правило, на стадии дробления зиготы. В результате этой ошибки клеточного деления образуются четыре популяции клеток - Y0, XXY, ХО, XYY, и достаточно одной из них выжить наряду с нормальными клетками, чтобы возник мозаицизм, например XY/XXY, XY/XYY или XY/X0. В конечном счете, химеры и мозаики - это особи, развившиеся из по меньшей мере двух популяций клеток, имеющих разный хромосомный набор (Meyers-Wallen, Patterson, 1989).
Гонадный пол у химер и мозаиков зависит от распределения клеточных популяций в ткани эмбриональной гонады. Если одна популяция клеток имеет Y-хромосому, а другая только Х-хромосомы, то сформируется комбинация тканей яичника и семенника, которая в конечном виде будет похожа на овариальную ткань, тестикулярную ткань или их комбинацию. В любом случае гистологическое исследование выявит оба типа тканей (Meyers-Wallen, Patterson, 1989). Внешний вид особи (фенотип) зависит от количества тестикулярной ткани, т.е. чем больше тестикулярной ткани, тем более выражен мужской фенотип, а чем больше овариальной ткани, тем выраженнее будут женские признаки. В результате у особи могут развиться как нормальные на вид, так и «двойственные» наружные половые органы.
Истинные гермафродиты. Истинным гермафродитом является особь, имеющая и овариальную и тестикулярную ткани. Одна гонада может оказаться яичником, а другая семенником, или обе - комбинацией и того и другого (овотестисы). Большинство собак - истинных гермафродитов имеют набор половых хромосом XX и относятся к особям с аномалией гонадного пола (см. следующий раздел), а не к химерам или мозаикам, которые встречаются гораздо реже (Randolf et al, 1988; Olson et al, 1989a; Sommers, Meyer-Wallen, 1991). Химеры имеют набор хромосом XX/XY или XX/XXY. Внешне такие собаки выглядят как нормальные самки, но с увеличенным клитором. Все они страдают зудом половых органов из-за выпяченной ткани клитора; овариальные циклы у них отсутствуют (Meyers-Wallen, Patterson, 1986). Собака, представленная на рис. 24-12, является химерой XX/XY; у нее обнаружены семенники, локализованные около почек, увеличенная, заполненная жидкостью матка, а также подобная вульве структура, хотя и смещенная краниально, и недоразвитый пенис на месте клитора. Последний был классифицирован как пенис на том основании, что внутри него проходила уретра, открывавшаяся на его дистальном конце.
Аномалии гонадного пола
XX половая инверсия. Половой инверсией называют состояние, при котором хромосомный пол
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 995
Рис. 24-12. А. Здоровая молодая немецкая овчарка с неопределенными половыми органами. Б. Гениталии находятся посередине между нормальным положением препуция у самца и вульвой у самки. В. Маленькая подобная пенису структура находится в складках кожи неопределенного полового органа.
не совпадает с гонадным. У собак встречается XX половая инверсия (наличие мужских половых признаков у особи с женским генотипом, т.е. с набором половых хромосом XX), но XY половая инверсия у них не описана. У кокер-спаниелей истинный гермафродитизм, как и XX мужской син ром, является наследственным аутосомно-рецессивным признаком. Половая инверсия была описана также у биглеи, китайских мопсов, керри-блю-терьеров, вейма-ранеров и немецких короткошерстных пойнтеров (Randolf et al, 1988; Olson et al, 1989a; Sommers, Meyer-Wallen, 1991).
XX истинный гермафродитизм. Особь с этим дефектом имеет и овариальную и тестикулярную ткань. В большинстве случаев обе ткани образуют овотестис (объединены в одной половой железе), причем чаще всего формируются два билатерально расположенных овотестиса. Однако были описаны собаки с одним яичником и одним овотестисом или с одним семенником и одним овотестисом. Если тестикулярной ткани мало, собака имеет внешний вид самки, имеет матку и часто (но не всегда) стерильна.
Если тестикулярная ткань присутствует в значительном количестве, у собаки развиваются придатки семенника, семявыносящий проток, матка и в ряде случаев яйцеводы. Внешне эти собаки выглядят как самки с признаками вирилизации или неопределенного пола; у них увеличен клитор, а форма и
положение наружных половых органов могут быть нормальными или с нарушениями (рис. 24-13). Некоторые XX истинные гермафродиты способны размножаться, как обычные суки, несмотря на присутствие тестикулярной ткани и аномальный клитор. Однако все их потомство несет этот признак.
Если при тщательном физикальном исследовании возникает подозрение на XX истинный гермафродитизм, проводится лапаротомия. Диагноз подтверждается, если при гистологическом исследовании полностью удаленной или взятой на биопсию ткани выявляются как овариальная, так и тестикулярная ткани. Выявление перед операцией повышенного уровня тестостерона в плазме крови - как базального, так и в тесте с введением Л Г или ГнРГ - у собак с женским фенотипом позволяет предположить наличие тестикулярной ткани, однако отрицательный результат этого исследования не исключает гермафродитизма. Окончательный диагноз XX гермафродитизма или XX мужского синдрома устанавливается на основании кариоти-пирования (Meyers-Wallen et al, 1987).
XX мужской синдром. Если у особи, имеющей хромосомный набор 78.ХХ, выявляются неопус-тившиеся семенники, простата и вся система вольфова протока то ее относят к XX мужскому типу. У такой особи не развита мошонка, а препуций есть, но либо неправильной формы, либо неправильно расположен. Как правило, наблюдаю гея аномалии
996 • БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Рис. 24-13. А. Здоровый на вид кокер-спаниель, оказавшийся истинным гермафродитом XX. Ь. Выбритый живо г. В. Кость клитора, выдвинутая из отверстия вульвы.
пениса, включая гипоспадию (порок развития, при котором отверстие уретры находится на нижней поверхности полового члена, обычно близко к его головке), гипоплазию или искривление (рис. 24-14). Такие особи стерильны, у них отсутствую! сперма-тогонии. Яйцеводов у них нет, но имеется матка. Регрессия яйцеводов пропорциональна продукции СИМИ (рис. 24-11), но постоянное присутствие матки юлает их нечувствительными к СИМИ. Таким особям рекомендуется удаление гонад и матки во избежание проблем, связанных с накоплением жидкости в матке или развитием новообразований в половых железах (Meyers-Wallen, Patterson, 1986).
Аномалии фенотипического пола: псевдогермафродиты
Определение. Псевдогермафродиты, как самки, так и самцы, характеризуются тем, что их гениталии имеют в какой-то мере двойственную половую принадлежность, тогда как гонады физиологически соответствуют набору половых хромосом, но по внешнему виду больше соответствуют противоположному полу, т.е. фенотипически аномальны.
Псевдогермафродигы женского пола. К пссв-догсрмафродитам женского пола относят особей
с женским генотипом (XX) и вирилизованными по внешнему виду яичниками. У многих собак с этим пороком развития выявляются умеренно или сильно увеличенный клитор и почти нормальные мужские наружные половые органы. Пенис, если он есть, обычно недоразвит, а препуций похож на вульву (см. рис. 24-12). Имеются также краниаль-но расположенное влагалище и матка. Таких собак часто принимают за кобелей и соответственно воспитывают, однако может обнаружиться, что они периодически привлекают других кобелей, поскольку у них бывает течка. Причину псевдогермафродитизма не всегда удается распознать, но известно, чю в некоторых случаях аномальное развитие плодов женского пола было спровоцировано введением андрогенов щенной суке. Источниками андрогенов бываю! некоторые комбинации витаминов и гормонов, прогестерон и препараты андрогенов, применяемые для подавления эструса (Patterson, 1983). Лечение этих собак заключается в удалении яичников и матки.
У женщин псевдогермафродитизм бывает обусловлен генетическими нарушениями стероидогенеза в надпочечниках, а именно дефицитом одного или нескольких ферментов, участвующих в биосинтезе глюкокортикоидов. Нарушение биосинтеза
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ • 997
Рис. 24-14. Щенок с 1 чносиадиеи Обратите внимание на аномальное расположение отверстии уретры.
кортизола (основного глюкокортикоида) приводит к тому, что его концентрация в плазме крови становится низкой. Из-за недостаточности кор1 изола нс происходит подавления гипофизарной секреции АКТГ по механизму отрицательной обратной связи, и активно продуцируемый АКТГ стимулирует синтез предшественников стероидных гормонов а в условиях торможения синтеза глюкокортикоидов эти предшественники превращаются в андрогены. Последние изменяют фенотип особи. В результате рождаются дети с недостаточностью надпочечников и двойственными гениталиями. У домашних животных подобное генетическое нарушение стероидогенеза не описано (Patterson, 1983).
Псевдогермафродиты мужского пола. Псев-догермафродиты мужского пола имеют Y-хромо-сому, семенники и либо женские гениталии, либо в различной степени деформированные пенис и мошонку. Возможны различные дефекты набора хромосом. Известны особи, имеющие и XX и XY клетки (химеры XX/XY) либо ХО и XY клетки (химеры X0/XY). У некоторых кобелей миниатюрного шнауцера сохраняются производные мюллерова протока вследствие недостаточности СИ МП или присутствия клеток-мишеней, нечувствительных к СИМП (Marshall et al, 1982). Такие собаки обычно страдают крипторхизмом и предрасположены к развитию рака клеток Сертоли, пиометры или му-кометры. Те из них, у кого произошло опущение одного пли обоих семенников, бывают фертильными или субфертильными. Лечение состоит в хирургическом удалении репродуктивных органов (Patterson, 1983).
Из других известных генетических дефектов, пока не описанных у собак, нужно отметить следующие: дефицит ферментов биосинтеза тестостерона, приводящий к недостаточной маскулинизации
наружных гениталий; низкая концентрация тестостерона в плазме крови; недостаточность глюкокортикоидов или минералокортикоидов, а также нечувствительность органов-мишеней к андрогенам приводящая к формированию женских наружных гениталий, наличию нсопустившихся семенников (крипторхизм), нормальному уровню тестостерона и отсутствию матки, яйцеводов или яичников (синдромы тестикулярной феминизации).
Гипоспадия. Это состояние (см. рис. 24-14) было определено в предыдущем разделе при описании самцов XX. Причины гипоспадии бывают разными, но все они приводят к тому, что в процессе формирования мужского мочеиспускательного канала происходит неполное срастание уретральных складок - по-видимому, из-за недостаточной продукции андрогенов у плода (Wilson et al. 1983; Meyers-Wallen. Patterson. 1989). У бостон-тсрьеров встречается наследственная предрасположенность к гипоспадии. Самым чаегым дефектом, выявляемым при гипоспадии, является крипторхизм (Hayes. Wilson. 1986).
НЕУДАЧНЫЕ ПОПЫТКИ ВЯЗКИ (РИС. 24-15)
Неправильный подход
Самая распространенная причина неудач при попытках вязки, когда сука не допускает садки кобеля, - это неправильный выбор хозяином сроков вязки. Например, если хозяин считает, что суку следует вязать на 11 и 13-ый дни после первого дня появления кровянистых выделении из вла1алища в прозеipyce, но у данной собаки проэструс продолжается 5 дней, а эструс - 4 дня, то все попытки ее повязать придутся на диэструс, и она откажется от вязки. Аналогично, если прозе i рус длится 14
998
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
Сука не допускает вязки
I
Подробно выяснить, как хозяин выбирает сроки вязки и берутся ли вагинальные мазки для определения фазы эструса... Находится ли сука е лолоаой охоте, когда ее приводят к кобелю?
Рис. 24-15. Схема обследования собаки, которая отказывается от вязки с кобелем, даже если она находится в эстральной фазе овариального цикла.
дней, то сука тоже откажется от вязки, поскольку будет находиться еще в проэструсе. Поэтому суки, не допускающие вязки, не всегда виноваты. Владельцы, лучше разбирающиеся в репродуктивном цикле своих собак, обычно выбирают сроки вязки правильно и чаще добиваются успеха. Тем не менее возможна и такая причина отказа суки от вязки, как дефект влагалища (см. гл. 25).
Поведенческий фактор
Даже при правильном подходе сука может постоянно отказывать определенному кобелю. Возможно, такое поведение обусловлено предпочтениями в выборе пары. Если других видимых причин нет, владельцу, прежде чем доискиваться до более сложных проблем, следует попытаться подобрать другого, более доминантного кобеля.
ЛИТЕРАТУРА
Al-Bassam /ЛА, et al: Normal postpartum involution of the uterus in the dog. Can J Comp Med 45:217, 1981.
Allen WE: Infertility in the bitch. In Practice 1:22, 1986.
Allen WE, Dagnall GJR: Some observations on the aerobic bacterial flora of the genital tract of the dog and bitch. J Small Anim Pract 23:325, 1982.
Archbald LF, et al: A surgical method for collecting canine embryos after induction of estrus and ovulation with exogenous gonadotropins. Vet Med Small Anim Clin 75:228, 1980.
Arnold S, et al: Effect of duration of PMSG treatment on induction of oestrus, pregnancy rates and the complications of hyperoestrogenism in dogs. J Reprod Fertil 39(Suppl): 115, 1989.
Baba E, et al: Vaginal and uterine microflora of adult dogs. Am J Vet Res 44:606, 1983.
Barton CL: Infertility in the bitch. Proceedings of the Annual Meeting of the Society for Theriogenology, 1987, p 198.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in breeding bitches. Am J Vet Res 53:665, 1992a.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in stud dogs. Am J Vet Res 53:670, 1992b.
Bouchard G, et al: Estrus induction in the bitch using a combination of diethylstilbestrol and FSH-P. Theriogenology 36:51, 1991.
Brockus CW: Endogenous estrogen myelotoxicosis associated with functional cystic ovaries in a dog. Vet Clin Pathol 27:55, 1998.
Buckrell BC, Johnson WH: Infertility in the cyclic bitch. In Binnington AG, Cockshuti JR (eds): Decision Making in Small Animal Soft Tissue Surgery. Toronto, BC Decker, 1988, p 120.
Burke TJ: Causes of infertility. In Burke TJ (ed): Small Animal Reproduction and Infertility: A Clinical Approach to Diagnosis and Treatment. Philadelphia, Lea & Febiger, 1986, p 227.
Cain JL, et al: Use of pulsatile intravenous administration of gonadotropin-releasing hormone to induce fertile estrus in bitches. Am J Vet Res 49:1993, 1988.
Cain JL, et al: Induction of ovulation in bitches using subcutaneous injection of gonadotropin-releasing hormone analog. Scientific Proceedings of the American College of Veterinary Internal Medicine, 1990, p 1126.
Cinone M, et al: Termination of pregnancy in the bitch by means of PGF2oc-gel and cabergoline administration. In Proceedings: Advances in Dog, Cat, and Exotic Carnivore Reproduction. Oslo, 2000, p 109.
Concannon PW: Induction of fertile oestrus in anoestrous dogs by constant infusion of GnRH agonist. J Reprod Fertil 39(Suppl):149, 1989.
БЕСПЛОДИЕ, ЕГО СВЯЗЬ С НАРУШЕНИЯМИ В РЕПРОДУКТИВНОЙ СИСТЕМЕ И ПОРОКИ ПОЛОВОГО РАЗВИТИЯ
999
Concannon PW: Methods for rapid induction of fertile estrus in dogs. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders, 1992, p 960.
DeNardo GA, et al: Ovarian remnant syndrome: Revascularization of free-floating ovarian tissue in the feline abdominal cavity. J Am Anim Hosp Assoc 37:290, 2001.
Doig RA, et al: The genital mycoplasma and ureaplasma flora of healthy and diseased dogs. Can J Comp Med 45:233, 1981.
England GCW, Allen WE: Repeatability of events during spontaneous and gonadotrophin-induced oestrus in bitches. J Reprod Fertil 93:443, 1991.
England GCW: Pharmacologic control of reproduction in the dog and bitch. In Simpson GM, England GWC, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. United Kingdom, British Small Animal Veterinary Association, 1998, p 197.
Fayrer-Hosken RA, et al: Follicular cystic ovaries and cystic endometrial hyperplasia in a bitch. J Am Vet Med Assoc 201:107, 1992.
Freshman JL: Clinical approach to infertility in the cycling bitch. Vet Clin North Am (Small Anim Pract) 21:427, 1991.
Galac S: Pregnancy termination in bitches with aglepristone, a progesterone receptor antagonist. In Proceedings: Advances in Dog, Cat, and Exotic Carnivore Reproduction. Oslo, 2000, p 103.
George L, Carmichael L: Antisperm responses in male dogs with chronic Brucella canis infections. Am J Vet Res 45:274, 1984.
Gobello C, et al: Use of cabergoline to treat primary and secondary anestrus in dogs. J Am Vet Med Assoc 220:1653, 2002.
Hayes HM, Wilson GP: Hospital incidence of hypospadias in dogs in North America. Vet Rec 118:605, 1986.
Hegstad RL, Johnston SD: Use of serum progesterone ELISA tests in canine breeding management. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders, 1992, p 943.
Jeffcoate IA, et al: Measurement of plasma oestradiol after an injection of a gonadotrophin as a test for neutered bitches. Vet Rec 146:599, 2000.
Johnston SD: Diagnostic and therapeutic approach to infertility in the bitch. J Am Vet Med Assoc 176:1335, 1980.
Johnston SD: Noninfectious causes of infertility in the dog and cat. In Laing JA, et al (eds): Fertility and Infertility in Veterinary Practice. London, Bail-liere Tindall, 1988, p 160.
Johnston SD: Premature gonadal failure in female dogs and cats. J Reprod Fertil 39(Suppl):65, 1989.
Johnston SD: Clinical approach to infertility in bitches with primary anestrus. Vet Clin North Am (Small Anim Pract) 21:421, 1991.
Johnston SD, et al: Canine theriogenology. J Soc Theriogenol 11:1, 1982.
Jones DE, Joshua JO: Infertility. In Reproductive Clinical Problems in the Dog, 2nd ed. London, Butterworths, 1988, p 187.
Lein DH: Examination of the bitch for breeding soundness. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p 909.
Lein DH: Canine mycoplasma, ureaplasma, and bacterial infertility. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1986, p1240.
Lein DH: Mycoplasma infertility in the dog: Diagnosis and treatment. Proceedings of the Annual Meeting of the Society for Theriogenology, 1989, p307.
Lincoln SR, et al: Value of screening infertile women for hypothyroidism. J Reprod Med 44:455, 1999.
Lindsay FEF: Postuterine endoscopy in the bitch. In Tarns TR (ed): Small Animal Endoscopy. St Louis, Mosby, 1990, p 327.
Loftstedt RM, Van Leeuwen JA: Evaluation of a commercially available luteinizing hormone test for its ability to distinguish between ovariectomized and sexually intact bitches. J Am Vet Med Assoc 220:1331, 2002.
Lofstedt RM, et al: Prolonged proestrus in a bitch with X chromosomal monosomy {77, XO). J Am Vet Med Assoc 200:1104, 1992.
Mahi-Brown CA, et al: Infertility in bitches induced by active immunization with porcine zonae pellucidae. J Exp Zoo 222:89, 1982.
Manothaiudom K, et al: Evaluation of the ICAGEN-target canine ovulation timing diagnostic test in detecting canine plasma progesterone concentrations. J Am Anim Hosp Assoc 31:57, 1995.
Marshall LS, et al: Persistent mullerian duct syndrome in Miniature Schnau-zers. J Am Vet Med Assoc 181:798, 1982.
Meyers-Wallen VN: Persistent estrus in the bitch. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XI. Philadelphia, WB Saunders Co, 1992, p963.
Meyers-Walien VN, Patterson DF: Disorders of sexual development in the dog. In Morrow DA (ed): Current Therapy in Theriogenology 2nd ed. Philadelphia, WB Saunders, 1986, p 567.
Meyers-Walien VN, Patterson DF: Disorders of sexual development in dogs and cats. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p 1261.
Meyers-Walien VN, et al: Mullerian inhibiting substance in sex-reversed dogs. Biol Reprod 37:1015, 1987.
Moses DL, Shille VM: Induction of estrus in Greyhound bitches with prolonged idiopathic anestrus or with suppression of estrus after testosterone administration. J Am Vet Med Assoc 192:1541, 1988.
Okkens AC, et al: Fertility problems in the bitch. Anim Reprod Sci 28:379, 1992.
Olson PN, et al: Induction of estrus in the bitch. Proceedings of the American Veterinary Medical Association Annual Meeting, 1981, p 96.
Olson PN, et al: Infertility in the bitch. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p 925.
Olson PN, et al: Vaginal cytology. I. A useful tool for staging the canine es-trous cycle. Compend Contin Educ Pract Vet 6:283, 1984.
Olson PN, et al: The use and misuse of vaginal cultures in diagnosing reproductive diseases in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders, 1986, p 469.
Olson PN, et al: Clinical evaluation of infertility in the bitch. In Ford RB (ed): Clinical Signs and Diagnosis in Small Animal Practice. New York, Churchill Livingstone, 1988, p 631.
Olson PN, et al: Female pseudohermaphroditism in three sibling Greyhounds. J Am Vet Med Assoc 194:1747, 1989a.
Olson PN, et al: Persistent estrus in the bitch. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 3rd ed. Philadelphia, WB Saunders, 1989b, p 1792.
Olson PN, et al: Concentrations of luteinizing hormone and folliclestimulating hormone in the serum of sexually intact and neutered dogs. Am J Vet Res 53:762, 1992.
Patnaik AK, Greenlee PG: Canine ovarian neoplasms: A clinicopathologic study of 71 cases, including histology of 12 granulosa cell tumors. Vet Pathol 24:509, 1987.
Patterson DF: Disorders of sexual development. American Animal Hospital Association Scientific Proceedings, San Antonio, 1983, p453.
Randolph JF, et al: H-Y antigen-positive XX true bilateral hermaphroditism in a German Short-haired Pointer. J Am Anim Hosp Assoc 24:417, 1988.
Rosenthal RC, et al: Detection of antisperm antibodies by indirect immunofluorescence and gelatin agglutination. Am J Vet Res 45:370, 1984.
Shille VM: Management of reproductive disorders in the bitch and queen. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders, 1986, p 1225.
Shille VM, et al: Efforts to induce estrus in the bitch using pituitary gonadotrophins. J Am Vet Med Assoc 184:1469, 1984a.
Shille VM, et al: Infertility in a bitch associated with short interestrous intervals and cystic follicles: A case report. J Am Anim Hosp Assoc 20:171, 1984b.
Shille VM, et al: Gonadotrophic control of follicular development and the use of exogenous gonadotrophins for induction of oestrus and ovulation in the bitch. J Reprod Fertil 39(Suppl): 103, 1989.
Soderberg SF: Chronic vaginitis. Proceedings of the American College of Veterinary Internal Medicine Forum, 1989, p 182.
Sommer MM, Meyers-Walien VN: XX true hermaphroditism in a dog. J Am Vet Med Assoc 198:435, 1991.
Vanderlip SL, et al: Ovulation induction in anestrous bitches by pulsatile administration of GnRH. Lab Anim Sci 27:459, 1987.
Wallace MS: Ovarian remnant syndrome. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XL Philadelphia, WB Saunders, 1992, p 966.
Watts JR, Wright PJ: Investigating uterine disease in the bitch: Uterine cannulation for cytology, microbiology, and hysteroscopy. J Small Anim Pract 36:201, 1995.
Watts JR, et al: The uterine, cervical and vaginal microflora of the normal bitch throughout the reproductive cycle. J Small Anim Pract 37:54, 1996.
Watts JR, et al: New techniques using transcervical uterine cannulation for the diagnosis of uterine disorders in the bitch. J Reprod Fertil (Suppl) 51:283, 1997.
Watts JR, et al: Endometrial cytology of the normal bitch throughout the reproductive cycle. J Small Anim Pract 39:2, 1998.
Wildt DE, et al: Behavioral, ovarian, and endocrine relationships in the pubertal bitch. J Anim Sci 53:182, 1981.
Wilson JD, et al: The androgen resistance syndromes: 5-oc-reductase deficiency, testicular feminization, and related disorders. In Stanbury JB, et al (eds): The Metabolic Basis of Inherited Disease, 5th ed. New York, McGraw-Hill, 1983, p Ю01.
Withrow SJ, Susaneck SJ: Tumors of the canine female reproductive tract. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders, 1986, p 52.
Wright PJ, Watts JR: The infertile female. In Simpson GM, England GWC, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. United Kingdom, British Small Animal Veterinary Association.
ВРОЖДЕННЫЕ АНОМАЛИИ ВЛАГАЛИЩА И ВУЛЬВЫ.....................1000
Эмбриональное развитие.......1000
Клинические признаки.........1001
Диагноз......................1003
Лечение......................1005
ГИПЕРПЛАЗИЯ ВЛАГАЛИЩА / ПРОЛАПС
ВЛАГАЛИЩА..................1005
Патогенез....................1005
Клинические признаки.........1005
Диагностика..................1007
Лечение......................1007
ВЫДЕЛЕНИЯ ИЗ ВУЛЬВЫ......... 1009
Глава 25
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Основные сведения.............1009
Перивульварный дерматит........1009
Здоровая сука моложе 6 месяцев .... 1009
Нещенная сука, имевшая по крайней мере один овариальный цикл..1011
Сука, повязанная в предыдущие 30-70 дней.....1013
Недавно ощенившаяся сука.......1013
Кастрированная сука...........1013
ТКАНЕВАЯ МАССА ВО ВЛАГАЛИЩЕ
ИЛИ ЕГО ПРЕДДВЕРИИ..........1013
Дифференциальная диагностика...1013
Неоплазия влагалища...........1013
Неоплазия уретры...............1014
Полипы влагалища...............1014
Пролапс матки..................1015
Увеличение клитора.............1015
ВАГИНИТ / ИНФЕКЦИИ ВЛАГАЛИЩА. 1015
Частота........................1015
Клинические признаки и диагноз .... 1015
Имеет ли значение положительный результат бактериологического исследования влагалища?......1016
Бактерии.......................1016
Mycoplasma и Ureaplasma........1017
Вирусные инфекции..............1017
ВРОЖДЕННЫЕ АНОМАЛИИ ВЛАГАЛИЩА И ВУЛЬВЫ
Эмбриональное развитие
У нормальной собаки наружные половые органы, преддверие влагалища, мочеиспускательный канал и мочевой пузырь развиваются из эмбрионального мочеполового синуса. Внутренние половые органы, включая передний отдел влагалища, образуются из двух мюллеровых протоков; в процессе развития эта внутренняя область соединяется с преддверием влагалища двумя слоями эпителия, между которыми находится тонкий слой мезодермы. Эта сходная с девственной плевой структура, расположенная на стыке наружных и внутренних гениталий, часто, хотя и не всегда, исчезает у сук перед половым созреванием (т.е. не видна и не пальпируется). Именно в этой области, т.е. непосредственно около уретрального отверстия, встречаются такие анатомические дефекты, как стриктуры. Эти дефекты внутри просвета влагалища и его преддверия относятся к самым частым аномалиям половых органов у сук.
Известно пять основных типов аномалий эмбрионального развития свода влагалища у собак, вызывающих сужение канала, называемое стриктурой влагалища (Wykes, Soderberg, 1983). К ним относятся: 1) полоска фиброзной ткани, пересекающая и сужающая просвет влагалища (рис. 25-1); 2) фиброзное кольцо, сдавливающее просвет влагалища (рис. 25-2); 3) гипоплазия вульвы (незрелая вульва),
сужающая вход в нее; 4) неполное срастание двух мюллеровых протоков, приводящее к «двойному» влагалищу (рис. 25-3); 5) гипоплазия свода влагалища (в противоположность гипоплазии вульвы).
Из приведенных пяти аномалий на стыке влагалища и его преддверия чаще всего встречаются два дефекта, и каждый из них может привести к обструкции канала и вызвать ряд клинических проявлений. Оба дефекта почти всегда выявляются во влагалище проксимально или краниально к отверстию мочеиспускательного канала, т.е. в месте срастания наружных и внутренних половых органов в процессе эмбриогенеза. Первый дефект - это наличие вертикальной перепонки или полоски фиброзной ткани, которая пересекает просвет свода влагалища (Root et al, 1995). Хотя фиброзная ткань не всегда расположена вертикально или центрально, все же чаще всего она протягивается от дорсальной средней линии к вентральной средней линии, разделяя просвет на две части и стягивая его (рис. 25-4). Вертикальные полоски, по-видимому, представляют собой остаток протока первичной почки (Harvey, 1998). Вторым распространенным дефектом является кольцевидная фиброзная структура, расположенная в той же области влагалища и охватывающая всю окружность просвета (рис. 25-2 и 25-4). Иногда это кольцо находится близко к входу в преддверие влагалища, почти что в складках вульвы (рис. 25-4). В этом случае обструкция может быть следствием гипоплазии генитального канала около входа во влагалище. Такой дефект называют также незрелой или инфантильной нуль-
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1001
Рис. 25-1. Эндоскопическая фотография вертикальной полоски (врожденный дефект), образовавшей стриктуру влагалища у собаки.
Рис. 25-2. Эндоскопическая фотография кольцеобразной фиброзной полоски (врожденный дефект; изогнутые стрел-ки), образовавшей стриктуру влагалища у собаки. Кольцо расположено на 1-2 мм проксимальнее отверстия уретры (прямая стрелка).
вой (Mathens, 2001). Независимо от названия, обе эти аномалии приводят к сужению просвета, хотя и возникают вследствие специфического для каждой из них нарушения эмбрионального развития (Holt. Say 1с, 1981).
Кроме этих наиболее распространенных дефектов, неполное срастание двух мюллеровых протоков может привести к образованию вытянутой вертикальной полоски, расположенной на различном расстоянии краниально о г отверстия мочеиспускательного канала. Эта перегородка может быть короткой или длинной, и она разделяет влагалище, шейку и матку (рис. 25-3 и 25-4). Такое состояние называют «двойным влагалищем» (Wykes, Soderberg, 1983, Root et al, 1995). Реже всего встречается гипоплазия в месте соединения преддверия влагалища и вульвы, приводящая к сужению
Рис. 25-3. Вснтро-дорсальпая рентгенограмма, полученная с введением контрастного материала в свод влагалища. Четко видно «двойное влагалище» (врожденный дефект) у собаки.
просвета свода влагалища, возможно, вследствие неполного соединения генитальных складок и набухания гениталий (рис. 25-4).
Клинические признаки
У многих собак стриктуры влагалища или вульвы не вызывают никаких проблем на протяжении всей жизни. Если же появляются проблемы, то хозяева обычно приводят своих собак к ветеринару по одному из трех поводов: 1) наличие вы [елений из вульвы; 2) постоянное лизание вульвы: 3) привлечение кобелей. Эти три признака являются следствием хронического или периодически повторяющегося вагинита, вызванного стриктурой. Воспаление слизистой влагалища приводит к увеличению вагинальной секреции (выделения), раздражение слизистой становится причиной лизания, и оба эти фактора, наряду с разрастанием бактериальной флоры влагалища. вызывают появление запахов, привлекающих кобелей (рис. 25-5). Кроме того, владельцы, как правило, отмечают у собак недержание мочи и рецидивирующую инфекцию мочевых путей (Kyles et al. 1996: Crawford. Adams, 2002).
Гораздо реже владельцы жалуются ветеринару на то, что сука не хочет вязаться, неспособна к вязке или явно испытывает боль при попытках кобеля к спариванию. Иногда жалобы касаются мочеиспускания - дизурии или недержания мочи. Бывает, что владельцы отмечают какую-то неправильность
1002 • ДЕФЕКТЫ ВЛАГАЛИЩА. ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Рис. 25-4. Причины обструкции влагалища у собак: 1) фокальная кольцевая стриктура, вертикальная и ла-геральная проекции; 2) стриктура в форме полоски ткани, вертикальная и латеральная проекции; 3) большее ио протяженности сужение свода влагалища, вертикальная и латеральная проекции; 4) двойное влагалище, или нарушение нормального срастания эмбриональных структур; 5) нормальное преддверие влагалища; 6) суженное преддверие. Звездочками помечено отверстие уретры.
в строении гениталий и совсем редко, но это самое неприятное, дистоцию (Root et al, 1995).
В США владельцы нечасто обращаются по поводу неспособности суки к вязке, так как большинство собак в стране кастрированы и их никогда нс вязали. Поэтому описанные здесь дефекты нам гораздо чаще приходилось определять у овариэк-томированных сук. чем у интактных. Тот факт, что большинство обследованных нами сук никогда нс вязались, вероятно, существенно повлиял на нашу оценку частоты дефектов, поскольку известно, что при спаривании кобель может разрушить некоторые из этих структур.
V интактной суки со стриктурой влагалища проэструс и эструс обычно протекают нормально, она демонстрирует половую охоту, принимает соответствующую позу и привлекает кобеля. Однако при попытках кобеля ввести пенис в суженный просвет влагалища сука испытывает боль, отстраняется от кобеля, нередко кусает его или того, кто ее держит. Стремление избавиться от кобеля бывает чрезвычайно выраженным. Кобель при попытке спаривания тоже может испытывать боль. Обычно при наличии такого дефекта у суки собаки не в состоянии стоять в «замке». Поскольку вязка ассоциируется с болью, сука начинает бояться ее. Во время течки она становится пугливой, раздражительной, может
рычать, и такое поведение сохраняется даже после хирургического устранения дефекта. Этот синдром является причиной отказа внешне здоровой собаки от вязки.
Следствием обструкции влагалища могут быть хронический вагинит или повторяющиеся инфекции мочевых путей - состояния, при которых суки иногда чрезмерно вылизывают область вульвы из-за чувства дискомфорта или боли. Вагинит может развиваться из-за хронической задержки небольшого количества нормального вагинального секрета (и, возможно, мочи), выделяющегося у любой суки. Если имеющийся дефект препятствует нормальному выведению секрета, он становится средой для избыточного роста бактерий. Таким образом, проблема заключается в том, что удерживаемые влагалищные выделения способствуют разрастанию нормальной бактериальной флоры и, как следствие, вызывают раздражение выстилки влагалища или инфицирование мочевых путей. Это приводит к лизанию наружных половых органов и увеличению объема влагалищного секрета. Последнее служит причиной выделений из влагалища и привлечения кобелей. Описанная проблема временами разрешается самостоятельно, — вероятно, за счет того, что при большом объеме выделений происходит естественное освобождение от избытка бактериальной
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1003
Признаки
Патогенез признаков, обусловленных дефектами влагалища
Неспособность к спариванию
а) Вылизывание
б) Боли
в) Дискомфорт
а) Выделения из влагалища
б) Привлечение кобелей
Рис. 25-5. Диаграмма, иллюстрирующая теоретические представления о патогенезе клинических проявлений, обусловленных стриктурами влагалища у собак.
флоры. В результате раздражение периодически проходит, но основная причина его остается (рис. 25-5). С избыточным ростом бактерий во влагалище часто связывают восходящую инфекцию нижнего отдела мочевого тракта.
Признаки вагинита, вызванные вагинальными стриктурами, обычно то усиливаются, то ослабевают, их трудно устранить, но они редко приводят к системным заболеваниям. Процесс, как правило, повторяется через каждые несколько недель или месяцев, порой учащается и переходит в более тяжелую форму, что заставляет хозяев обращаться за помощью к ветеринару. Иногда хозяин считает, что у его собаки течка, поскольку она привлекает кобелей. Однако причиной привлекательности суки
служит, скорее всего, возникший у нее запах, при этом она не подпускает к себе кобеля.
Диагноз
Кастрированные суки. Диагноз любой обструкции влагалища (стриктура вульвы или стеноз преддверия влагалища) лучше всего устанавливается с помощью пальпаторного исследования свода влагалища. Обычно указательный палец в смазанной перчатке проходит в свод влагалища, не причиняя боли и неудобства собаке, за исключением самых миниатюрных пород (Harvey, 1998). Следует помнить, что палец ветеринара меньше эрегированного пениса кобеля той же породы, поэтому пальпация свода влагалища должна осуществляться без усилий. Если же подозревается стриктура, то исследование надо проводить медленно и осторожно, чтобы не причинить собаке боль. Успокоительные средства или анестезия почти никогда не применяются, за исключением случаев, когда собака при исследовании ведет себя крайне агрессивно.
Использование отоскопа или вагинального зеркала. Стриктуры обычно сразу выявляются при пальпаторном исследовании, так как блокируют краниальное продвижение указательного пальца. Важно иметь в виду, что стриктуру можно пропустить, если исследование влагалища проводить с помощью отоскопа или вагинального зеркала, поскольку они тоньше пальца, нечувствительны и могут легко обойти любую стриктуру. Встречаются, хотя и редко, случаи, когда собака так велика, что ни пальцем, ни одним из этих инструментов достичь стриктуры не удается.
Суки в анэструсе и суки препубертатного возраста, не имевшие половых контактов. Применимость пальпаторного исследования в диагностических целях имеет два основных исключения. Во-первых, бывает трудно пальпировать интактных, но никогда не вязавшихся сук в возрасте близком к пубертату. У них могут сохраниться остатки девственной плевы, которая обычно разрывается при вязке или исчезает после релаксации свода влагалища. Такая релаксация протекает очень непросто, если собака находится под действием эстрогена. Во-вторых, трудность представляет и пальпация собак, находящихся в анэструсе, поскольку влагалище у них иногда сокращается в диаметре и становится неэластичным, а это препятствует продвижению пальца и может создать впечатление, что имеется стриктура. В любой из этих ситуаций, прежде чем назначать лечение, рекомендуется провести повторное исследование во время следующего эструса. Ветеринар может также посоветовать сделать одну или две попытки естественной вязки, а если они окажутся неудачными, провести повторную пальпацию. Некоторым собакам во время вязки или пальпаторного исследования необходимо надевать намордник из-за возможного появления у животного страха или боли.
1004 • ДЕФЕКТЫ ВЛАГАЛИЩА. ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Цитология влагалища. При цитологическом исследовании влагалища собак с вагинальной стриктурой и обусловленным ею слабо выраженным вагинитом обычно выявляются слизь, бактерии (в большом или малом количестве) и в разном количестве нейтрофилы, захватывающие бактерии. Часто попадаются дегенерировавшие нейтрофилы. Мазки, как правило, берутся легко. Но следует учитывать, что и нейтрофилы и бактерии присутствуют в мазках как здоровых сук, так и сук с вагинитом, так что их обнаружение неспецифично. Причины возникновения вагинита многочисленны; некоторые из них относятся к частым (например, стриктуры или инородные тела), другие встречаются реже (например, неоплазия или полипы). Поэтому до постановки диагноза и назначения лечения следует провести пальпаторное исследование.
Вагиноскопия. Превосходным диагностическим инструментом для визуализации дефектов влагалища служит волоконно-оптический педиатрический ректоскоп (см. рис. 25-1). Однако при всей полезности этого инструмента его применение не обеспечивает такой чувствительности, как пальпация. В случаях, когда назначается хирургическая коррекция дефекта влагалища, а вагиноскопия недоступна, рекомендуется получение вагинограммы (методом контрастной рентгенографии) (Wykes, Soderberg, 1983; Root et al, 1995; Mathews, 2001; Crawford, Adams, 2002). Данный метод был успешно применен при обследовании ряда сук: он позволяет подтвердить диагноз, а также идентифицировать и точно локализовать такой крупный дефект, как «двойное влагалище» (рис. 25-3), или менее обширный дефект - фиброзное кольцо (рис. 25-2).
Рентгенография. Альтернативой вагиноскопии, если она недоступна, является контрастная рентге
нография (получение вагинограммы). Этот метод используют, когда у суки подозревают стриктуру влагалища, нс поддающуюся пальпации из-за ее необычного расположения (что бывает крайне редко). Мы применяли контрастную рентгенографию в случаях гипоппазии вульвы, поскольку через обласг ь гипоплазии невозможно провести ни палец, ни инструмент из-за риска травмировать собаку или причинить ей боль. Другим показанием к применению данного метода является пальпируемая стриктура, препятствующая исследованию краниального отдела влагалища (рис. 25-6). До назначения хирургического или иного лечения целесообразно обследовать все влагалище, чтобы убедиться в отсутствии каких-либо других нарушений (полип, опухоль, чужеродное тело, серьезный врожденный дефект; см. рис. 25-3, 25-4 и 25-6). Нужно исключить и врожденные дефекты, например эктопию уретры или тазовое расположение мочевого пузыря. Следует также учитывать распределение давления в мочеиспускательном канале (Mathews, 2001).
Рентгенографию проводят под наркозом. Катетер-баллон Фолея вводят в преддверие влагалища. Баллон надувают, и ренз геноконтрастное вещество через катетер вводится в свод влагалища. Делают пробную рентгенограмму, чтобы выяснить, достаточно ли введено контрастного материала для проведения исследования. Заранее определить требуемый объем контраста трудно, поскольку неизвестно, какое его количество пройдет в мочевой пузырь. Был описан метод полуколичествснной оценки выраженности вестибуло-вагинального стеноза (стриктуры влагалища и его преддверия). При анализе рентгенографической цистоуретровагинограммы авторы проводили ряд измерений. Дорсо-вентральную высоту влагалища измеряли в его наивысшей точке, а
Рис. 25-6. Латеральная рентгенограмма тазовой области после заполнения свода влагалища рентгеноконтрастным веществом. Контрастное вещество, которое вводили катетером Фотея, четко выявляет преддверие влагалища (краниально к баллону катетера), свод влагалища (изогнутая жирная стре лка)у стриктуру, расположенную на стыке преддверия и свода (прямая стрелка), уретру (кривая контурная стрелка) и мочевой пузырь.
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1005
дорсо-вентральную высоту вестибуло-вагинального соединения - в его самом узком участке на латеральной рентгенограмме. Затем вычислялось отношение последней величины к высоте влагалища. Отношение >0,35 принято за норму. Отношение в пределах от 0,26 до 0,35 предложено классифицировать как «небольшой» вестибуло-вагинальный стеноз, от 0,29 до 0,25 как «умеренный» и <0,2 как «тяжелый» (Crawfold, Adams, 2002).
Лечение
Сука-производительница. Если у суки с обструкцией влагалища клинические проявления отсутствуют, никакого лечения не требуется. Такая сука может нормально забеременеть или быть искусственно осеменена. В случае искусственного осеменения нужно тщательно наблюдать за собакой во время родов, чтобы быть уверенным, что дефект влагалища не привел к затруднению родового акта (дистоции). Такие дефекты, как полоски фиброзной ткани, устранить проще всего, так как их можно идентифицировать и рассечь без особого труда и кровотечения. У суки с фиброзным кольцом роды могут протекать нормально, если расслабление стенок влагалища позволит новорожденным щенкам пройти сквозь суженную область или если это препятствие будет разрушено во время родов. Неизвестно, являются ли такие дефекты наследственными, и высказывалось мнение, что их хирургическая коррекция неэтична (Harvey, 1998).
Врожденная обструкция влагалища фиброзным кольцом устраняется хирургическим путем, если к этому есть показания. В большинстве случаев приходится проводить рассечение промежности, чтобы обеспечить визуализацию дефекта. После операции может потребоваться расширение свода влагалища в целях предотвращения рецидива стриктуры. Кроме того, коррекция дефекта влагалища не дает гарантии, что в последующем сука допустит вязку. (Интересующийся читатель может обратиться к ссылкам с описанием хирургической процедуры: Green, 1983; Wykes and Soderberg, 1983; Mathews, 2001.) Можно использовать орошения раствором антисептика, как это описано в следующем разделе.
Овариогистерэктомированная сука. Большинство сук, у которых выявлялась стриктура влагалища, ранее были кастрированы. До назначения лечения следует полностью ознакомить владельца собаки с проблемой и показать ему иллюстрации типа представленных на рис. 25-4, чтобы он оценил ситуацию и осознал, что единственным радикальным способом устранения болезни является хирургическое вмешательство. Однако многие владельцы отказываются от такого вмешательства, как только понимают, что проблема самокупирующая-ся, крайне редко приводит к системному заболеванию, а клинические признаки, то усиливающиеся, то затихающие, не представляют опасности для жизни и, возможно, не настолько серьезны, чтобы
требовалась хирургическая коррекция дефекта. Отрицательное отношение ветеринаров к этой операции основывается на том, что область, подлежащая оперированию, трудно доступна и всегда остается вероятность рецидива стриктуры. Например, рассечение таза считается крайне агрессивным вмешательством, и если хирург уверен, что это необходимо, ему следует подробно объяснить это владельцу. Кроме того, поскольку операция часто проводится в области мочеиспускательного канала, могут возникнуть проблемы с недержанием мочи, имеющие катастрофические последствия для собаки.
Если хирургическое лечение необходимо, то до принятия решения об операции стоит попробовать более мягкие, терапевтические методы. Их применяют, если сука находится в тяжелом состоянии и, похоже, испытывает сильные боли или если у нее постоянные и обильные выделения из влагалища. Таким собакам назначается ежедневный трехкратный вагинальный душ до тех пор, пока симптомы не ослабнут. Мы советуем владельцам купить несколько готовых наборов детских клизм. Содержащийся в клизме раствор выбрасывается, а сама бутылочка, представляющая собой мягкий пластиковый контейнер с коническим концом, идеально подходит для введения антисептического раствора во влагалище. Для душа используется раствор бета-дина (поливидон-йода) цвета слабого чая. Процедуру проводят, разместив собаку в таком месте, где не произойдет обесцвечивания поверхности неизбежно вытекающими каплями раствора. Собаку нужно держать за задние конечности, чтобы быть уверенным, что свод влагалища тщательно промоется во время или сразу после инфузии. Орошение влага-лиша раствором антибиотиков строго противопоказано, так как в этом случае обычно развиваются линии бактерий, устойчивые к антибиотикам.
ГИПЕРПЛАЗИЯ ВЛАГАЛИЩА / ПРОЛАПС ВЛАГАЛИЩА
Патогенез
Частой причиной обструкции влагалища служит выпячивание его отечной ткани в вагинальный просвет и в отверстие вульвы (пролапс), случающееся у интактных сук во время проэструса или эструса (рис. 25-7). По-видимому, это чрезмерный ответ выстилки влагалища на естественную стимуляцию эстрогеном, хотя у ряда таких сук были выявлены фолликулярные кисты (рис. 25-7, В-Е). Пролапс влагалища часто называют гиперплазией или гипертрофией влагалища. Пролабированные участки его стенки гистологически представляют собой сильно отекшую ткань.
Клинические признаки (табл. 25-1)
Сильный отек влагалища, с пролапсом или без него, обычно встречается у молодых (моложе 2-3 лет)
1006 • ДЕФЕКТЫ ВЛАГАЛИЩА. ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Рис 25-7. Тяжелая гиперплазия влагалища у молодой суки боксера до (А) и через I неделю после (Б) овариог ис-гсрэктомии. В. Фотография большой выпяченной гиперплазии влагалища у двухгодовалой суки бульмастифа непосредственно перед овариогистср жтомисй. Г. Через 4 дня после операции. Д. Через 6 недель после операции. Е. Фотография фолликулярных кист на обоих яичниках у гой же двухгодовалой суки бульмастифа.
сук крупных пород, и если отек тяжелый, он препятствует спариванию. Это нарушение отмечалось у многих пород собак. Согласно нашему опыту, ему наиболее подвержены боксеры и мастифы. Кроме них, пролапс влагалища описан у сенбернаров, немецких овчарок, английских бульдогов, лабрадор-ретриверов, кунхауидов Уолкера (енотовая гончая Уолкера), чесапик-бей-рстриверов, спрингер-спа-нпелей, веимаранеров и эрдельтерьеров (Johnston,
1989). Частая встречаемость этого нарушения у отдельных пород и линий предполагает наследственную предрасположенность к нему. Хотя пролапс влагалища бывает и у собак мелких пород, все вышеупомянутые собаки относятся к крупным.
Пролапс влагалища почти всегда происходит во время проэструса или эструса или сразу после завершения этих фаз овариального цикла (табл. 25-1). Существует не только временная, но и причинная
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1007
ТАБЛИЦА 25-1. ПРИЗНАКИ ОТЕКА / ГИПЕРПЛАЗИИ / ПРОЛАПСА ВЛАГАЛИЩА*
Ч 11СЛО СОБА
Средний возраст 2,0 года 65
Разброс возраста 0.6-11 лет 65
Фаза овариального цикла Проэструс/эструс 57/66 собак
Диэструс 4 66 собак
Роды конец ди )струса 5/66 собак
Анэструс 0
*) Из: Johnston SD: Vaginal prolapse. In Kirk RW (cd): Current Veterinary Therapy. Philadelphia, WB Saunders Co, 1989, p 1302.
связь между увеличением концентрации эстрогена в плазме крови и сильным отеком. У некоторых сук сильный отек или пролапс влагалища наблюдался незадолго до окончания диэструса после более слабого, но все-таки существенного повышения концентрации )стро! ена в плазме крови происходящего в этот период нормального овариального цикла. У таких сук часто отмечался пролапс влагалища и в фазах проэструса и эструса. Спадание отека обычно начинается в период между поздним эструсом и ранним диэструсом, когда концентрация эстрогена возвращается к базальному уровню. Отсюда понятен положительный эффект овариогистерэктомии. проведенной по поводу этого состояния.
О признаках пролапса обычно сообщают хозяева собак, заметив выпячивание ткани из вульвы. Иногда они также жалуются на то. что собака не может мочиться или что у нее имеются трудности с мочеиспусканием. Других владельцев беспокоит неспособность или нежелание суки вязаться. Многие суки вылизывают пролабированную ткань, но затрудненное мочеиспускание отмечается лишь в небольшом проценте случаев. Биохимический анализ сыворотки крови и определение гормонального профиля у сук с пролапсом влагалища не выявляют отклонений от нормы.
У некоторых сук гиперплазия влагалища - от слабой до тяжелой - развивается в каждом проэструсе. Обычно ‘го отмечается у молодых сук. но после нескольких первых овариальных циклов
серьезных проблем больше не возникает. Оварио-гистерэктомия - единственное надежное средство устранения этой патологии. Если же хозяин хочет получить потомство от суки с вагинальной гиперплазией, то необходимо искусственное осеменение. Во время родов гиперплазия наблюдается редко.
Диагностика
Диагноз устанавливается сразу по явному наличию у молодой суки в проэструсе или эструсе тканевой массы, выступающей из вульвы (см. рис. 25-7), либо по набуханию промежности. Основные дифференциальные диагнозы включают увеличение клитора, доброкачественный полип и опухоль типа лейомиомы, тучноклеточной опухоли или трансмиссивной венерической опухоли. Увеличение клитора может быть вызвано присутствием в нем кости (кость клитора), которая пальпируется как небольшая твердая структура. Полипы обычно имеют маленькие размеры и тонкую ножку или основание (рис. 25-8). Опухоли, как правило, имеют неровные очертания, развиваются у сук старшего возраста и не связаны с фазами проэструса или эструса овари । ibhoio цикла. Исключение составляет трансмиссивная венерическая опухоль, которая чаще всего встречается у молодых и сексуально активных сук.
Пролабированная ткань влагалища - это обычно относительно объемное мягкое образование, способное самопроизвольно уменьшаться, и его появление связано с эструсом. Оно имеет форму гладкой округлой массы со складками, переходящими в широкое основание у дна свода влагалища (рис. 25-7). Обычно пролапс возникает краниально от уретрального отверстия, но иногда бывает более обширным и может включать всю окружность стенки влагалища. В последнем случае пролапс имеет кольцеобразную форму.
Лечение
Лечение гиперплазии влагалища может пре (став-лять значительные трудности. Если, несмотря на
Рис. 25-8. Л. Полип влагалища, закрывающий поверхность вульвы. Б. Тот же полип в поднятом состоянии, под ним ви дна вульва. В. Тот же полип более крупным планом; видна маленькая ножка, соединяющую его со стенкой влагалища.
1008 • ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Рис. 25-9. А. Отечная ткань влагалища, выпячивающаяся через щель вульвы (вагинальный пролапс типа II). Б и В. Катетер, введенный в уретру вентрально к массе для предотвращения ятрогенной травмы уретрального бугорка во время иссечения ткани (Г), (из: Wykes, Olson, 1993; Приведено с разрешения).
пролапс, сука способна мочиться и не происходит некроза пролабированной ткани, то необходимости в срочной медицинской помощи нет. Если же мочеиспускание невозможно, то следует, определив местоположение уретрального бугорка, установить постоянный уретральный катетер. Практически всегда пролапс влагалища спадает и исчезает во время диэструса, после чего длительное время отсутствует. Поэтому основные усилия направлены на следующее: 1) очищение пролабированной ткани путем промывания физиологическим раствором; 2) смазывание ее соответствующими гелями и 3) принятие мер к тому, чтобы ткань не травмировалась. Травмирование можно предотвратить, держа собаку в доме и обеспечив ей мягкие, на толстой подкладке поверхности, а также надев на нее высокий «елизаветинский» воротник, который не позволит ей нанести себе травму. Можно приспособить «подгузники», чтобы свести к минимуму контакт выпяченной ткани с окружающей средой и защитить ее от самой собаки.
Было рекомендовано лечить пролапс влагалища путем индукция овуляции с помощью гонадотропин рилизинг-гормона (ГнРГ; Cystorelin, произ-во Abbott, США; 2,2 мкг/кг внутримышечно) или хорионического гонадотропина человека (чХГ; Pregnyl, произ-во Organon, США; 1000 ЕД внутримышечно) (Johnston, 1989). Теоретически овуляция должна сокращать фазы секреции эстрогена (проэструс и эструс) и ускорять регрессию отекшей ткани. Однако ни в одном исследования не было показано, что предложенные протоколы лечения действительно обеспечивают наступление овуляции, и даже если
овуляция произойдет, нет данных о том, что в результате сократится продолжительность эструса.
Некоторые наши клиенты смазывают пролаби-рованную ткань антигеморроидальными кремами и уверяют, что такие кремы уменьшают размеры пролапса. Некротическую ткань надо удалять хирургическим путем, иногда иссякают и отдельные складки (Pettit, 1983; Mathews, 2001). Можно удалить матку и яичники, что предотвратит рецидив пролапса, но необязательно ускорит сокращение массы выпяченной ткани. Пероральное введение миболерона или мегестрола ацетата для лечения этого нарушения не рекомендуется (Rushmer, 1980). Простагландины тоже не используются в терапии вагинальной гиперплазии.
В случаях чистопородных собак, предназначенных для разведения, некоторые исследователи рекомендуют хирургическое удаление пролабированной ткани. Операцию следует назначать, только если пролапс препятствует мочеиспусканию, если выпяченная масса ткани велика и есть угроза ее инфицирования или же если пролапс произошел повторно. Имеется сообщение, что после удаления такой ткани рецидивов не бывает (Johnston, 1989). Операцию осуществляют путем рассечения промежности (эпизиотомии) во время позднего эструса или после индукции овуляции, когда размеры массы ткани начинают уменьшаться. Сначала, чтобы четко видеть и в дальнейшем не повредить мочеиспускательный канал, в него вводят катетер, и затем делают эллиптический надрез в слизистой оболочке влагалища у основания массы, после чего массу ткани осторожно иссекают и удаляют (рис. 25-9). Слизистую
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1009
оболочку затем зашивают, используя рассасывающийся шовный материал (Johnston, 1989; Mathews, 2001). Операция может вызвать обильное кровотечение и осложнения. В нашей клинике ее проводят только в тех случаях, когда обнаруживается обширный некроз ткани влагалища, или если собака не может мочиться, или если имеется подозрение на нарушение кровоснабжения пролабированной ткани, матки или мочевого пузыря.
ВЫДЕЛЕНИЯ ИЗ ВУЛЬВЫ
Основные сведения
Владельцы собак обычно сразу замечают выделения из наружных половых органов и, если не могут понять причину выделений, приводят своих питомцев к ветеринару. Выделения могут быть следствием нормального процесса (проэструс или роды), но бывают и первыми признаками тяжелого мочеполового заболевания (пиометры, наличия чужеродного тела, развития опухоли). Как и в случае любой другой проблемы, до проведения каких-либо тестов следует составить подробный анамнез и провести физикальное исследование. Особое внимание обычно уделяют цвету и консистенции выделений. В этом разделе в качестве основы для проведения дифференциальной диагностики рассматриваются возраст и анамнез собаки (рис. 25-10, A-В; табл.25-2).
ТАБЛИЦА 25-2. ПРИЧИНЫ АНОМАЛЬНЫХ ВЫДЕЛЕНИЙ ИЗ ВЛАГАЛИЩА У СУК
Интактные препубертатные суки
1. Нормальный пубертатный эстральный цикл
2. Щенячий вагинит
3. Травма мочеполового тракта / неоплазия
4. Недержание мочи
Интактные постпубертатные нещениые суки
1. Нормальный эстральный цикл
2. Функциональная киста яичника / неоплазия яичника
3. Пиометра
4. Вагинит
5. Травма мочеполового тракта / неоплазия
6. Недержание мочи
Интактные, постпубертатные, щеиные или после ощене-ния суки
1. Гибель плодов (септическая/несептическая)
2. Нормальное выделение плацентарной жидкости при родах
3. Лохии
4. Субинволюция плацентарных мест
5. Метрит
6. Травма мочеполового тракта / неоплазия
7. Недержание мочи
Овариоэктомироваииые суки
1. Лечение экзогенным эстрогеном
2. Синдром культи яичника
3. Вагинит
4. Инфекция культи матки
5. Травма мочеполового тракта / неоплазия
6. Недержание мочи_________________________________
Из: Romagnoli SE: A diagnostic approach to vulvar discharge in the canine patient. Proceedings of the Society for Theriogenology, 1989, p 295; приведено с разрешения
Перивульварный дерматит
Перивульварный дерматит относится, видимо, к числу самых распространенных причин выделений из влагалища. Проблема большинства собак при этом заключается в том, что вульва у них «утоплена» вследствие ожирения. Развивающийся дерматит - одно из проявлений кожноскладчатой пиодермии, которая может возникнуть в самых разных местах. Тепло, влага и выделения (в данном случае моча и/или выделения из влагалища) накапливаются в складках, создавая условия для мацерации ткани, усиленного роста бактерий и воспаления. Постоянное образование микротравм кожи, вызываемое трением соприкасающихся поверхностей, в совокупности с мацерацией и воспалением подавляют нормальные защитные механизмы кожи и обусловливают развитие бактериальной инфекции.
Имеются данные о развитии перивульварного дерматита у ожиревших сук, а также у сук с инфантильной или подвергшейся атрезии вульвой. Похоже, что это заболевание может возникнуть и в отсутствие указанных нарушений, однако «утопленная» вульва явно предрасполагает к развитию перивульварного дерматита. Поверхностный дерматит обычно сопровождается появлением неприятного запаха и кожными выделениями. Собака может испытывать дискомфорт и боли. Имеются сообщения, что перивульварный дерматит приводит к развитию хронического вестибулита, вагинита и цистита.
Лечение перивульварного дерматита с помощью системных антибиотиков или же местного применения содержащих антибиотики мазей, дезинфицирующих средств, подсушивающих агентов или примочек, как правило, нерадикально и часто бесполезно. Показано, что эффективным средством лечения этого хронического и порой очень неприятного состояния является пластика вульвы, т.е. хирургическое удаление лишней перивульварной ткани. Эта операция эффективна, практически безопасна и позволяет устранить клинические проявления дерматита, вагинит и хроническую инфекцию мочеполовых путей (Lightner et al, 2001). Однако если у собаки дополнительно имеется вестибуло-вагинальный стеноз, пластика «утопленной» вульвы обычно не устраняет ни рецидивирующей инфекции мочеполового тракта, ни недержания мочи (Crawford, Adams, 2002).
Здоровая сука моложе 6 месяцев
Появление влагалищных выделений у здоровой неполовозрелой суки обусловлено обычно одной из следующих (немногочисленных) причин. Если выделения гнойные, то, скорее всего, у собаки «щенячий», или препубертатный вагинит. Это самоку-пирующееся нарушение, которое редко нуждается в лечении. При наличии вагинита было не рекомендовано проводить овариогистерэктомию до тех пор, пока заболевание не пройдет, чтобы это состо-
Выделения из наружных половых органов у кастрированной суки
2. Чужеродное тело
3. Травма
4. Полип
5. Рак
1010 • ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Рис. 25-10. А. Алгоритм обследования кастрированных сук по поводу выделений из вульвы. ПМЯ - полиморфноядерные нейтрофилы.
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1011
Рис 25-10. Б. Алгоритм обследования препубертатных интактных сук по поводу выделений из вульвы. ПМЯ полиморфноядерные нейтрофилы.
яние не перешло в хроническое (Romagnoli, 1989). Обычно это означает, что надо дождаться первого эстрального цикла. Никаких доказательств (кроме общих соображений) преимущества откладывания овариогистерэктомии не имеется. Мы не советуем этого делать, так как, по нашему опыту, препубер-татный вагинит проходит и после овариогистерэктомии. Если же ветеринар рекомендует отложить операцию, то он должен предупредить хозяина о возможности незапланированной щенности. Помимо вагинита, причиной влагалищных выделений у щенков может быть присутствие инородного тела или какое-то врожденное нарушение. Поэтому бывает необходимо провести тщательное пальпаторное исследование влагалища и вагиноскопию. Посев из влагалища редко оказывает помощь в диагностике (Harvey, 1998).
Если выделения кровянистые, то, возможно, собака находится в фазе проэструса, и для подтверждения диагноза следует провести цитологическое исследование влагалища. Другими причинами кровянистых выделений могут быть травма, чужеродные тела или нарушение свертывания крови. Выделения из влагалища могут оказаться мочой. В этом случае дифференциальный диагноз включает все причины недержания мочи, в частности эктопию мочеточника(ов), проблемы с мочевым пузырем, заболевания мочеиспускательного канала.
Нещенная сука, имевшая по крайней мере один овариальный цикл
Вскоре после эструса. Если у собаки недавно закончился цикл, а кровянистые выделения продолжаются в течение 1-8 недель (эструс), то можно предположить, что у нее дробная течка. Это
легко определить с помощью цитологического исследования влагалища, которое в этом случае выявит проэструс или эструс (действие эстрогена). К числу других основных причин 8-10-недельных выделений после эструса относятся пиометра, вызывающая появление кровянистых, гнойных или смешанных выделений, изгнание или рассасывание плодов, чужеродные тела, травма, опухоли или коагулопатия. У любой некастрированной собаки с выделениями из влагалища разумно предполагать - независимо от ее возраста - пиометру, пока не будет доказано иное.
Выделения в течение многих недель. Иногда кровянистые выделения из вульвы, которые связывали с проэструсом, не прекращаются в течение многих недель. Однако считается, что в норме общая продолжительность проэструса и эструса может достигать 7 недель. Исходя из этого, желательно знать точно, сколько времени длятся выделения. Если в мазке, взятом из влагалища, постоянно присутствуют поверхностные клетки, то можно подозревать наличие эстроген-продуцирующей фолликулярной кисты (реже опухоли); в таком случае проводят УЗИ брюшной полости.
Присутствие бактерий. У здоровых сук в период начала диэструса выделения из наружных половых органов обычно содержат большое количество бактерий. Само по себе наличие бактерий во влагалище вполне нормально, но постоянных выделений из вульвы быть не должно. Выделения, содержащие большое число бактерий, бывают обусловлены метритом/пиометрой или любой из причин вагинита (стриктура влагалища, увеличение клитора, чужеродное тело). Вагинит трудно поддается диагностике и обычно возникает как осложнение другой патологии.
Выделения из вульвы у взрослой интактной суки
Составляют ли поверхностные клетки > 50% спущенных эпителиальных клеток влагалища?
,--да-----X------нет-----------
В мазке мало ПМЯ?
Был у нее проэструс или эструс в предыдущие 60 дней?
Имеется ли > беременность?
Сделать УЗИ брюшной полости
Нет (нет ПМЯ)
Нет (много ПМЯ)
—Да, диэструс
Нет, неизвестно
Цитология мазка не меняется, >20 дней?
Цитология мазка не меняется, >20 дней?
Да
Да
Нет
Нет (анэструс)
Да i
Была вязка в предыдущие 58-71 дней?
---да----1— нет >
Нормальные роды или дистоция
Выделения содержат преимущественно ПМЯ?
,— Нет >— Да
Нормальный проэструс Функциональная киста или опухоль яичника i
Сделать УЗИ брюшной полости
Нормальный эструс
Потеря неинфициро-ванной плодной или амниотической жидкости или недержание мочи
Гибель плодов из-за инфекции (пиометра?)
Сделать УЗИ брюшной полости
В
Выделения бесклеточные с запахом мочи?
Выделения содержат пре- I имущественно ПМЯ? '-------------
— Да-----1— Нет----.
< кровь, продукты]
w распада у
Собака ощенилась < 6 недель назад?
Нет^
Метрит ± задержка плода ± задержу ппацеты Сделать УЗИ брюшной полости
Нормальные Субинволюция лохии плацентарных мест >
1012 • ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
▼ i
Выделения происходят из матки?
Да------1---Нет-----s
Пиометра? Рентгенография или УЗИ брюшной полости
Выделения содержат преимущественно ПМЯ?
^Да Нет, кровь
ПМЯ токсические, незрелые?
Вагинит, стриктура, чужеродное тело, травма, неоплазия влагалища
Нормальный диэструс (прогестерон в плазме крови?)
I
Выделения происходят из уретры?
Нет—1— Да----
Опухоль, воспаление, травма уретры?
Рис. 25-10. В. Алгоритм обследования интактных взрослых сук по поводу выделений из вульвы. ПМЯ- полиморфноядерные нейтрофилы.
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1013
Сука, повязанная в предыдущие 30-70 дней
Выделения из наружных половых органов у суки, которая была недавно повязана, всегда вызывают беспокойство. Иногда кровянистые выделения оказываются единственным признаком дробной течки. Такой диагноз должен быть подтвержден данными цитологического исследования влагалища, указывающими на повторное воздействие ютрогена (поверхностные клетки составляют более 60° л всех клеток). Однако внешне сходные выделения могут быть вызваны частичным или полным изгнанием плодов. В этом случае в вагинальном мазке выявляются клетки крови и парабазальные клетки (т.е. эффект эстрогена отсутствует), а бактерии могут как присутствовать в большом количестве, так и отсутствовать. В такой ситуации важным методом диагностики является ультразвуковое исследование. Гнойные выделения указывают на инфекцию матки либо на поражение влагалища (см. выше).
Если же со времени вязки прошло более 50-70 дней, то кровянистые выделения могут быть первым признаком наступающих родов. У некоторых сук непосредственно перед родами выделяется прозрачная слизь или имеют место серозные густые выделения.
Недавно ощенившаяся сука
Наличие кровянистых выделений из влагалища в первые дни после родов - явление нормальное. Они могут продолжаться до 6-8 недель и все еще рассматриваться как нормальные лохии. Если выделения нс заканчиваются и после этого срока, то их обычно связывают с субинволюцией плацентарных мест (СИМ; см. гл. 21). В любом случае, если собака выглядит здоровой, нс анемична, у нее нет лейкоцитоза и лихорадки, то выделения, по-видимому, не должны вызывать опасений, и лечение собаке не требуется.
Но как только выделения превращаются в гнойные либо сука заболевает и/или перестает ухаживать за щенками, проблема становится серьезной и суку нужно обсле ювать по поводу послеродового метрита (см. гл. 21). Это заболевание может быть следствием вмешательства при родах, аборта или бактериального инфицирования после нормальных родов. Следует учесть и возможность травмы влагалища при родах, хотя такая травма встречается редко. Необходимо срочно провести УЗИ брюшной полости, чтобы определить, не осталось ли плодов или плаценты, или, может быть, у суки пиометра или какое-то иное нарушение. Рентгенографическое исследование в этой ситуации тоже применяется, но оно менее информативно.
Кастрированная сука
У сук с удаленными яичниками гнойные выделения из наружных половых органов чаще всего связаны
с вагинитом, обусловленным вагинальной стриктурой (см. «Вагинит / инфицирование влагалища»). Однако следует рассмотреть и такие диагнозы, как присутствие инородных тел, наличие полипов, неоплазия, перивульварный дерматит и пиометра культи. Все эти нарушения могут вызывать кровянистые и/или гнойные выделения. Если при цитологическом исследовании влагалища обнаруживаются поверхностные клетки, то вполне вероятно, что собаке вводили эстрогены или у нее синдром культи яичника.
ТКАНЕВАЯ МАССА ВО ВЛАГАЛИЩЕ ИЛИ ЕГО ПРЕДДВЕРИИ
Дифференциальная диагностика
У собак известны различные типы образований во влагалище или наружных половых органах. Это может быть пролапс влагалища или магки, неоплазия влагалища, уретральная неоплазия, гипертрофия клитора, полипы или абсцесс влагалища, гематома. Обследование обычно включает осмотр выступающей из вульвы ткани и выяснение других проблем со здоровьем собаки, беспокоящих владельца (табл. 25-3).
Неоплазия влагалища
Опухоли влагалища редко бывают причиной обструкции влагалища или вульвы. Опухоли влагалища или наружных половых органов составляют 2-3% от всех новообразований у собак и встречаются у старых собак, в среднем в возрасте 10 лет (Tracher, Bradley, 1983). Доброкачественные опухоли - это, как правило, фибромы, лейомиомы, полипы и липомы (Harvey, 1998). Злокачественные опухоли включают лейомиосаркомы, опухоли тучных клеток и прорастающие во влагалище из уретры переходно-клеточные карциномы (рис. 25-11; Tracher, Bradley, 1983; Herron, 1983). Доброкачественные опухоли чаще всего встречаются у собак.
Рис. 25-11. Эндоскопия влагалища, демонстрирующая переходно-клеточную карциному в просвете влагалища.
1014 • ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
ТАБЛИЦА 25-3. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ, НАБЛЮДАВШИЕСЯ У 44 СУК С ВАГИНАЛЬНОЙ / ПРЕДДВЕРНОЙ МАССОЙ
Пролапс влагалища (п=18) Увеличение клитора (п=11) НЕОПЛАЗИЯ Всего
Влагалище/ Уретра (п=20) Преддверие (п=5)
Гениталии
Пролапс влагалища 10 6 1 17
Вагинальная масса/доброкачествен- 3 1 6 1 11
ная опухоль
Изъязвление влагалища 1 1
Выделения из вульвы 4 1 5 1 11
Кровотечение из вульвы 2 1 3
Вылизывание вульвы 1 1 3 5
Набухание вульвы 4 1 5
Мочевые пути
Гематурия 3 3
Недержание мочи 1 1
Полиурия 1 1 2
Дизурия 4 5 4 13
Поллакиурия 1 4 2 7
Не может мочиться 1 1
Желудочно-кишечный тракт
Рвота 2 1 3
Диарея 1 1 2
Напряжение при дефекации 3 1 5
Анорексия 4 4
Из: Manothaiudom К, Johnston SD: Clinical approach to vaginal/vestibular masses in the bitch. Vet Clin North Am Small Anim Pract 21:509, 1991. Приведено с разрешения.
не имевших половых контактов, а злокачественные опухоли - у кастрированных собак. Трансмиссивная венерическая опухоль может быть следствием повреждения гениталий (см. гл. 26).
Наиболее частыми признаками неоплазии влагалища, кроме выпяченной из вульвы массы ткани, являются выделения из влагалища, постоянное лизание вульвы и привлечение кобелей. Реже образовавшаяся опухоль механически воздействует на окружающие ткани, приводя к затрудненному мочеиспусканию, тенезмам (ложным болезненным позывам к дефекации), дизурии, недержанию мочи и кала или набуханию промежности (Weller, Park, 1983; Sahay et al, 1985; Withrow, Susaneck, 1986; Johnson, 1989b).
Диагноз ставится после составления подробного анамнеза и физикального исследования. Обязательно нужно снять отпечаток или сделать биопсию тканевой массы, чтобы определить тип клеток. Хотя операция бывает целесообразной, она может оказаться губительной для собаки. До операции нужно установить природу новообразования, выяснить, нет ли метастазов, и выбрать наилучший метод лечения. Источниками дополнительной диагностической информации служат данные вагиноскопии, УЗИ, бактериологического исследования (посев), вагинограммы и уретроцистограммы.
Неоплазия уретры
Уретральные опухоли у собак, как правило, имеют эпителиальное (переходно-клеточные карциномы)
или мезенхимальное (лейомиома) происхождение. Большинство уретральных опухолей являются злокачественными и локально инвазивными. Периферические метастазы бывают редко. Опухоли обычно развиваются у собак 8-10 лет или старше, и чаще у сук, чем у кобелей (Magne et al, 1985; Maxie, 1985; Davies, Read, 1990).
Большинство опухолей, включающих дистальную часть мочеиспускательного канала, представляют собой переходно-клеточную карциному или плоскоклеточную карциному. Общими признаками таких опухолей являются странгурия, дизурия и гематурия. Во многих случаях для подтверждения диагноза бывает достаточно пальпации влагалища и прямой кишки с последующим цитологическим исследованием этой области. Иногда диагностическую ценность представляет цитологический анализ мочи, причем с целью получения необходимого для исследования количества клеток проводят травмирующую катетеризацию мочевого пузыря. В то же время может понадобиться проведение УЗИ брюшной полости или контрастной рентгенографии, чтобы определить, насколько разрослась опухоль и есть ли надежда, что ее удастся полностью удалить. Окончательный диагноз ставится на основании гистологии материала биопсии (Manothaiudom, Johnston, 1991).
Полипы влагалища
У стареющих собак относительно часто встречаются фибропапилломы (полипы), представляющие
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА • 1015
собой небольшие, гладкие, твердые образования, которые могут изъязвляться в результате спонтанного травмирования. Обычно они сидят на тонкой ножке и редко вызывают осложнения. Их хирургическое удаление несложно и целесообразно.
Пролапс матки
Пролапс матки относится к редким осложнением родов. Чаще всего это происходит после выхода последнего щенка и может включать не только шейку, но и один или оба рога матки. Есть сообщения о частичном и полном пролапсе матки у сук. Признаками пролапса являются выпяченная из вульвы масса, выделения из влагалища, напряжение и лизание промежности (Wood, 1986; Johnson, 1989а). Диагноз основывается на анамнезе родов и появлении массы ткани. Пролабированную ткань можно удалить хирургическим путем или вправить руками, если она выглядит жизнеспособной и не травмирована (Manothaiudom, Johnston, 1991; Mathews, 2001).
Увеличение клитора
Увеличение клитора встречается у практически здоровых сук и у кобелей-гермафродитов. Введение щенным сукам андрогенов или анаболических стероидов может привести к развитию кости клитора у потомства женского пола. Увеличение клитора, хотя и не всегда распознаваемое, бывает у сук с гиперкортицизмом как результат вирилизации, обусловленной избыточной секрецией стероидов.
Признаки увеличения клитора включают, прежде всего, интенсивное лизание этой области и наличие выпяченной из вульвы массы. Реже наблюдаются выделения из вульвы, привлечение кобелей или гематурия. Присутствие кости клитора приводит к выпячиванию ткани, иссушению слизистой и, как следствие, к раздражению и воспалению с соответствующими клиническими проявлениями Диагноз ставится непосредственно на основании пальпаторного исследования преддверия влагалища. Кость клитора обычно имеет длину 2,5-3,8 см и в диаметре тоньше карандаша. Она легко пальпируется и причиняет боль только в том случае, если выпячивание ткани сопровождается вагинитом. У некоторых собак с увеличением клитора, выпячиванием ткани и проявлением всех клинических признаков кость в клиторе не обнаруживается.
Прежде чем назначать операцию, необходимо определить положение уретры. Удаление увеличенного клитора или его кости нс представляет трудности при условии, что уретра отделена от этого дефекта. Удаление кости или избыточной ткани быстро и без осложнений устраняет признаки заболевания. Если же мочеиспускательный канал проходит по кости клитора, то, скорее всего, это врожденное генетическое нарушение. В этом случае удаление кости значительно осложняется.
Рис. 25-12. Эндоскопия влагалища, демонстрирующая лимфоидные фолликулы у суки с вагинитом. Результаты биопсии интерпретированы как лимфоцитарно-плазмаклсточ-ный вагинит.
ВАГИНИТ / ИНФЕКЦИИ ВЛАГАЛИЩА
Частота
Вагинит и инфекции влагалища - относительно частые заболевания у сук любого возраста независимо от того, были у них удалены яичники и матка или не были удалены. Однако первичный неосложненный вагинит - мало распространенное заболевание, поскольку естественное разрастание бактериальной флоры во влагалище, нормальном во всех других отношениях, происходит редко. Хорошо известны такие формы вагинита, как чимфоидно-фол-ликулярный и лимфоцитарно-плазмаклеточный; их частота и причины не установлены (рис. 25-12).
Инфекции влагалища, как показывает наш опыт, обычно обусловлены стриктурами и реже травмой, чужеродными телами или новообразованиями. Требование владельцев кобелей сделать рутинные посевы из влагалища суки перед вязкой для доказательства того, что у нее отсутствует инфицирование, совершенно не обоснованны, и их целесообразность находится под большим вопросом (Bjurstrom, Linde-Forsberg, 1992а). Делать посевы из влагалища суки с гнойными выделениями имеет смысл лишь в том случае, если с помощью пальпаторного исследования и дополнительных тестов было исключено наличие вагинальных стриктур, пиометры, чужеродных тел и кости клитора.
Клинические признаки и диагноз
При вагините выделения из влагалища у большинства сук слизистые (мутные), слизисто-гнойные (мутные, от белого до желтого цвета) или гнойные (от желтого до желто-зеленого цвета) (Johnson. 1991). Возможно появление крови или кровянистых выделений. К сопутствующим признакам относятся лизание промежности, привлечение кобелей и частое мочеиспускание. В отсутс-
1016 • ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
твие выделений диагноз поставить трудно, и он сомнителен. Физикальное исследование может выявить самые разные нарушения, вызывающие вагинит, например такие, как врожденные аномалии, опухоли или чужеродные тела.
Диагноз подтверждается цитологическим исследованием влагалища и вагиноскопией. Цитология влагалища обычно выявляет воспалительный процесс - несептический, гнойный или септический с небольшим количеством эритроцитов или без них (Johnson, 1991). Основным типом клеток в мазке оказываются нейтрофилы, а среди эпителиальных клеток влагалища преобладают, как правило, парабазальные и промежуточные клетки. Прекрасным средством визуализации нарушений, вызвавших вагинит, может быть вагиноскопия с использованием ректоскопа (см. рис. 25-1).
Общий клинический анализ крови и биохимический анализ сыворотки крови не выявляют каких-либо специфических нарушений и не помогают в диагностике вагинита. Единственное отклонение, которое с разной частотой встречается при вагините, это эозинофилия. Однако данные этих анализов используются для исключения других проблем. Рекомендуется сделать анализ и посевы мочи, поскольку причиной вагинита может быть инфекция или неоплазия мочевого тракта. В некоторых случаях бывает показано проведение контрастной рентгенографии влагалища и/или мочевого тракта.
Имеет ли значение положительный результат бактериологического исследования влагалища?
(см. гл.24)
Существует мнение, что бактериальная инфекция влагалища служит одной из причин как бесплодия у сук, так и болезни кобелей, заражающихся в процессе спаривания (Johnston, 1980). При этом полагают, что у большинства сук инфекция протекает на субклиническом уровне и редко приводит к явному вагиниту, метриту, пиометре или системному инфицированию. Было рекомендовано брать мазки из переднего отдела влагалища бесплодной суки, делать посев, идентифицировать выросшие в культуре бактерии и, определив их чувствительность к антибиотикам, проводить 4-недельный курс лечения соответствующими антибиотиками (Johnston, 1980). Однако оценить вклад бактериальной инфекции в развитие бесплодия очень нелегко. Бактериальная флора присутствует в переднем отделе влагалища практически всех здоровых собак, и те же виды аэробных бактерий имеются в своде влагалища бесплодных собак (Olson et al, 1983; Bjurstrom, Linde-Forsberg, 1992a).
Бактерии
Основные сведения. Аэробные бактерии обитают во влагалище практически всех здоровых со
бак (табл. 25-4; Bjurstrom, Linde-Forsberg, 1992а). Само по себе выделение бактерий из влагалища не дает основания для постановки диагноза. Некоторые организмы, в частности Brucella, плохо растут в культуре. Поэтому отрицательный результат культивирования не дает гарантии, что у суки нет инфекционного заболевания.
Виды бактерий. Виды бактерий с возрастом могут меняться; так, коагулаза-положительные стафилококки обнаруживаются у сук чаще в пре-пубертатном возрасте, чем в постпубертате. По одним данным, число видов бактерий не меняется в зависимости от стадии эстрального цикла, но количество бактерий отдельных видов увеличивается во время проэструса и эструса (Allen, Dagnail, 1982; Baba et al, 1983). По другим данным, и количество и виды бактерий меняются в зависимости от стадии цикла (см. рис. 24-4; Bjurstrom, Linde-Forsberg, 1992а). Нормальная флора влагалища обычно представлена смешанной культурой со слабым или умеренным ростом (табл. 25-4; Bjurstrom, Linde-Forsberg, 1992а). Если какой-нибудь организм является сильным патогеном, то считается, что он вызывает появление клинических признаков, должен обнаруживаться в большом количестве и существует в практически чистой культуре, поскольку имеет преимущества как патоген и подавляет рост других бактерий в нормальной смешанной флоре (Allen, Dagnail, 1982; Allen, 1986; Olson et al, 1986). В то же время в посевах 826 мазков, взятых из влагалища 59 здоровых фертильных сук, чистые культуры, представленные одним видом бактерий, составляли 18%, в 77% случаев культуры были смешанными, и полностью отрицательный ответ был получен только в 5% посевов. У каждой суки в тот или иной период времени культивирование давало положительный результат (Bjurstrom, Linde-Forsberg, 1992а).
Некоторые владельцы кобелей требуют свидетельства «отрицательной» культуры бактерий влагалища у суки, с которой предстоит вязка. Но у большинства кобелей в препуции и уретре обитают те же микроорганизмы, что и в нормальной флоре влагалища (Bjurstrom, Linde-Forsberg, 1992b). Неоправданно отказываться от вязки кобеля с данной сукой только из-за того, что в ее влагалище обнаружены бактерии (Olson et al, 1986).
Также неоправданно связывать присутствие бактерий во влагалище с вагинитом или бесплодием. Системные антибиотики изменяют бактериальную флору, но бывает трудно определить, когда их введение необходимо. Усиленный рост какого-то одного вида бактерий скорее нормальное, чем аномальное явление.
В матке собаки может обнаруживаться небольшое количество бактерий, и это тоже нормально (Baba et al, 1983). Получение культуры из матки требует лапаротомии или умения проводить трансцервикальную эндоскопию. В период проэструса и эструса шейка «расслабляется», и это позволяет предполагать, что в это время результаты культи-
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
1017
ТАБЛИЦА 25-4. АЭРОБНЫЕ БАКТЕРИИ, ВЫДЕЛЕННЫЕ ИЗ ВЛАГАЛИЩА 59 СОБАК (826 ОБРАЗЦОВ ВАГИНАЛЬНЫХ МАЗКОВ)
Организм МАЗКИ, ИЗ КОТОРЫХ ИЗОЛИРОВАН ОРГАНИЗМ СУКИ, У КОТОРЫХ БЫЛ ВЫДЕЛЕН ОРГАНИЗМ
Число Процент Число Процент
Pasteurella multocida 492 59,6 58 98,3
Бета-гемолитические стрептококки 392 47,5 53 89,8
Escherichia coli 263 31,8 50 84,7
Грамположительные палочки (без классификации) 141 17,1 53 89,8
Грамотрицательные палочки (без классификации) 134 16,2 51 86,4
Микоплазма (разные виды) 73 8,8 35 59,3
Стрептококки (разные виды) (альфа-гемолитичес- 72 8,7 33 55,9
кие, негемолитические)
Pasteurella (разные виды) 60 7,2 40 67,8
Энтерококки 51 6,2 26 44,1
Proteus mirabilis 40 4,8 15 25,4
Staphylococcus intermedius 34 4,1 20 33,9
Коринеформы 25 3,0 24 40,7
Коагулаза-отрицательные стафилококки 17 2,1 13 22,0
Pseudomonas (разные виды) 6 0,7 6 10,2
Всего 1800 (2,3 изолята/сука)
Из: Bjurstrom L, Linde-Forsberg С: Long-term therapy of aerobic bacteria of the genital tract of breeding bitches. Am J Vet Res 53: 665, 1992. Приведено с разрешения.
вирования образцов из переднего отдела влагалища отражают рост бактерий в матке. В отсутствие явных признаков вагинита или пиометры исследование вагинальных культур у бесплодных собак считается бесполезным.
Лечение бактериального вагинита. Как указывалось выше в этой главе, полезно провести лечение вагинальным душем в течение 2-3 недель с добавлением системных антибиотиков или без них. Однако эту терапию следует назначать только при явных признаках инфекции (Bjurstrom, Linde-Forsberg, 1992a,b). Мы рекомендуем применять орошения раствором антисептика (например, бета-дина): они вполне эффективны и не приводят к развитию бактериальной резистентности.
Mycoplasma и Ureaplasma
Микоплазма и уреаплазма - это микроорганизмы, обычно обитающие во влагалище здоровых сук. Однако предполагается, что эти мельчайшие свободно живущие микробы могут вызывать вагинит, малоплодие, раннюю гибель эмбрионов, рассасывание эмбрионов или плодов, аборт, появление мертворожденных или слабых щенков и/или их неонатальную смерть. Доказательства такого патогенеза этих нарушений пока носят косвенный характер (Doig et al, 1981; Lein, 1989). Исходя из общего подхода к оценке результатов культивирования, следует признать: если при посеве образца из свода влагалища суки, повязанной, но оказавшейся бесплодной, данные микроорганизмы обнаруживаются в чистой или почти чистой культуре, то они могут быть причиной бесплодия. В то же время нельзя не учитывать, что микоплазма была найдена в мазках из влагалища 59% здоровых фертильных собак (Bjurstrom, Linde-Forsberg, 1992а). Терапия заключается в изоляции суки и лечении тетрацик
лином или хлорамфениколом в течение 10-14 дней (Lein, 1986).
Вирусные инфекции
Вирусные инфекции, особенно вирус герпеса (см. гл. 24), были обнаружены у сук с вагинитом, а также у имевших аборты и мертворожденных щенков. Однако доказательств того, что вирусные инфекции являются причиной вагинита, недостаточно. Получение вирусных культур мало доступно в широкой практике, поэтому диагноз вирусного вагинита пока трудно подтвердить, и его частота остается неизвестной.
ЛИТЕРАТУРА
Allen WE: Infertility in the bitch. In Practice 1:22, 1986. Allen WE, Dagnall GJR: Some observations on the aerobic bacterial flora of the genital tract of the dog and bitch. J Small Anim Pract 23:325, 1982.
Baba E, et al: Vaginal and uterine microflora of adult dogs. Am J Vet Res 44:606, 1983.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in breeding bitches. Am J Vet Res 53:665, 1992a.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in stud dogs. Am J Vet Res 53:670, 1992b.
Crawford JT, Adams WM: Influence of vestibulovaginal stenosis, pelvic bladder, and recessed vulva on response to treatment for clinical signs of lower urinary tract disease in dogs: 38 cases (1990-1999). J Am Vet Med Assoc 221:995,2002.
Davies JV, Read HM: Urethral tumors in dogs. J Small Anim Pract 31:131, 1990.
Doig PA, et al: The genital mycoplasma and ureaplasma flora of healthy and diseased dogs. Can J Comp Med 45:233, 1981.
Greene JA: Episiotomy and episiostomy. In Bojrab MJ (ed): Current Techniques in Small Animal Surgery. Philadelphia, Lea & Febiger, 1983, p357.
Harvey, M: Conditions of the non-pregnant female. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. United Kingdom, BSAVA, 1998, p 35.
Herron AAA: Tumors of the canine genital system. JAAHA 19:981, 1983.
Holt PE, Sayle B: Congenital vestibulovaginal stenosis in the bitch. J Small AnimPract 22:67, 1981.
Johnson C A: Uterine disease. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1989a, p 1801.
Johnson CA: Vaginal disorders. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1989b, p 1809.
Johnson CA: Diagnosis and treatment of chronic vaginitis in the bitch. Vet Clin North Am [Small Anim Pract] 21:523, 1991.
1018
ДЕФЕКТЫ ВЛАГАЛИЩА, ВАГИНИТ И ИНФИЦИРОВАНИЕ ВЛАГАЛИЩА
Johnston SD: Diagnostic and therapeutic approach to infertility in the bitch. JAVMA 176:1335, 1980.
Johnston SD: Vaginal prolapse. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1302.
Kyles AE, et al: Vestibulovaginal stenosis in dogs: 18 cases (1987-1995). J Am Vet Med Assoc 209:1889, 1996.
Lein DH: Examination of the bitch for breeding soundness. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p909.
Lein DH: Canine mycoplasma, ureaplasma, and bacterial infertility. In Kirk RW (ed): Current Veterinary Therapy IX. Philadelphia, WB Saunders Co, 1986, p 1240.
Lein DH: Mycoplasma infertility in the dog: Diagnosis and treatment. Proceedings of the Annual Meeting of the Society for Theriogenology, 1989, p307.
Lightner BA, et al: Episioplasty for the treatment of perivulvar dermatitis or recurrent urinary tract infections in dogs with excessive perivulvar skin folds: 31 cases (1983-2000). J Am Vet Med Assoc 219:1577, 2001.
Magne ML, et al: Urinary tract carcinoma involving the canine vagina and vestibule. JAVMA 21:767, 1985.
Manothaiudom K, Johnston SD: Clinical approach to vaginal /vestibular masses in the bitch. Vet Clin North Am [Small Anim Pract] 21:509, 1991.
Mathews KG: Surgery of the canine vagina and vulva. Vet Clin North Am (Small Anim Pract) 31: 271,2001.
Maxie MG: The urinary system. In Jubb KVF, et al (eds): Pathology of Domestic Animals, 3rd ed. San Diego, Academic Press, 1985, p 398.
Olson PN, et al: Infertility in the bitch. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 925.
Olson PN, et al: The use and misuse of vaginal cultures in diagnosing reproductive diseases in the bitch. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p 469.
Pettit GD: Hyperplasia of the vaginal floor. In Bojrab MJ (ed): Current Techniques in Small Animal Surgery. Philadelphia, Lea ft Febiger, 1983, p352.
Romagnoli SE: A diagnostic approach to vulvar discharge in the canine patient. Proceedings of the Society for Theriogenology, 1989, p 295.
Root MV, et al: Vaginal septa in dogs: 15 cases (1983-1992). J Am Vet Med Assoc 206:56, 1995.
Rushmer RA: Vaginal hyperplasia and uterine prolapse. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders Co, 1980, p 1222.
Sahay PN, et al: Urinary incontinence in a bitch caused by vaginal fibroma. Vet Rec 116:76, 1985.
Thacher C, Bradley RL: Vulvar and vaginal tumors in the dog: A retrospective study. JAVMA 183:690, 1983.
Weller RE, Park JF: Vaginal leiomyoma and polyps in a Beagle dog. Calif Vet 37:6, 1983.
Withrow SJ, Susaneck SJ: Tumors of the canine female reproductive tract. In Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p 526.
Wood DS: Canine uterine prolapse, /n Morrow DA (ed): Current Therapy in Theriogenology 2. Philadelphia, WB Saunders Co, 1986, p 510.
Wykes PM, Olson PN: Vagina, vestibule and vulva. In Slatter D (ed): Textbook of Small Animal Surgery, 2nd ed. Philadelphia, WB Saunders Co, 1993, pp 1308-1316.
Wykes PM, Soderberg SF: Congenital abnormalities of the canine vagina and vulva. JAAHA 19:995, 1983.
БРУЦЕЛЛЕЗ.....................1019
Инфекционные агенты...........1019
Передача Brucella cam's.......1019
Клинические признаки заражения Brucella canis................1020
Диагностика...................1020
Г лава 26
БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ
ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
Лечение......................1023
Профилактика и контроль заболевания.......1024
ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ......................1025
Определение..................1025
Этиология......................1025
Встречаемость..................1025
Клинические признаки...........1026
Диагностика....................1027
Лечение........................1027
БРУЦЕЛЛЕЗ
Инфекционные агенты
Виды. Brucella canis является одним из шести видов неподвижных грам-отрицательных коккоба-цилл, биологическими хозяевами которых служат домашние и дикие псовые. Показано, что собаки подвержены инфицированию четырьмя из шести видов Brucella: B.melitensis, В. abortus, В. suis, и В. canis. Изредка собаки заражают других животных и человека механическим или биологическим путем. За исключением В. canis, эти инфекции обычно са-мокупируются.
Инфицирование бактериями В. melitensis, В. abortus, и В. suis. Описано как естественное, так и экспериментальное инфицирование собак этими тремя видами Brucella. В естественных условиях инфицирование происходит в результате потребления молока, мяса, абортированных плодов или мембран плодов зараженного бруцеллезом скота. Похоже, что собаки относительно устойчивы к этой инфекции, так как после заражения признаки болезни нередко отсутствуют или слабо выражены. Бруцеллы могут существовать в организме собаки в течение различного времени после установления диагноза, не вызывая клинических проявлений (Pidgeon et al, 1987). Инфицированные собаки обычно дают положительную реакцию агглютинации на пластинке или в пробирке в том же рутинном тесте, что используется и в диагностике бруцеллеза у скота (Barr et al, 1986; Nicoletti, 1989). Естественно или экспериментально инфицированные собаки способны заражать домашний скот (Kormendy, Nagy, 1982), а иногда и людей, причем угроза передачи заболевания существует более длительное время, чем это предполагалось ранее (Johnston et al, 2001).
Инфицирование В. canis. Естественное инфицирование бактериями В. canis, по-видимому, ограничено семейством псовых. Иногда эта инфекция передается людям, но признаки заболевания при этом выражены слабее, чем при заражении другими видами бруцеллезных бактерий. Домашний скот, обезьяны, кошки и кролики весьма устойчивы к экспериментальному инфицированию (Green, George, 1984; Nicoletti, 1989).
Передача Brucella canis
Передача между собаками. Инфекция легко проникает через мембраны слизистой, так что собака заражается при попадании В. canis в нос, рот, на конъюнктиву и во влагалище. Передача инфекции происходит при спаривании неинфицирован-ной суки с зараженным кобелем; иногда и кобели заражаются от инфицированных сук (Green, George, 1984). Интересно, что когда в одном из исследований содержали вместе инфицированных и неинфи-цированных собак одного пола в течение 10 месяцев, трансмиссии не произошло (Hubbert et al, 1980). Это предполагает, что моча и слизистые выделения не играют существенной роли в естественной передаче этих бактерий. Однако в более поздней работе было показано, что при совместном содержании половозрелых кобелей трансмиссия имела место через 4—6 месяцев (Carmichael, Joubert, 1988).
Различные виды Brucella могут существовать в организме собак длительное время, не вызывая клинических признаков инфекции. Период между моментом заражения и развитием бактериемии обычно составляет 21 день. После начала бактериемии инфекция становится локализованной и служит источником постоянной или рецидивирующей бактериемии, которая продолжается от нескольких
1020 • БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
месяцев до 3-4 лет. Бактерии могут обитать в простате и/или в эпидидимисе кобеля, не имеющего каких-либо симптомов заболевания. Наличие таких очагов инфекции приводит к широкому распространению бруцеллеза, если кобель активно используется для воспроизводства. Во время спаривания трансмиссия происходит быстро, даже если лишь небольшое количество бактерий попадает в организм суки. По-видимому, передача инфекции при вязке инфицированного кобеля с восприимчивой сукой происходит несколько чаще, чем при вязке инфицированной суки с восприимчивым кобелем (Carmichael, Joubert, 1988).
В условиях собачьего питомника абортирование плодов у Brucella- инфицированной суки крайне опасно для содержащихся вместе с ней неинфици-рованных собак. В абортированной плацентарной ткани и жидкости может содержаться огромное количество бруцелл. Распространение инфекции по питомнику происходит быстро, а маточные выделения у инфицированной суки продолжаются до 4-6 недель. Кроме того, эти бактерии легко переходят в молоко инфицированной суки, которое становится дополнительным источником загрязнения окружающей среды. Результат бывает катастрофическим для питомника. Поскольку бактериемия может быть бессимптомной и длительной, еще одним фактором распространения бруцеллеза является переливание инфицированной крови (Zoha, Walsh, 1982).
Передача людям. За многие годы, прошедшие со времени выделения В. canis, наблюдались лишь единичные случаи инфицирования людей. В основном это были работники лабораторий и питомников, многократно подвергавшиеся массивному воздействию данных бактерий, хотя несколько человек заразились при контакте только с инфицированными щенками. Поэтому разумно осведомить владельцев собак о потенциально зоонозном характере заболевания, но пугать их не стоит (Johnston et al, 2001).
Клинические признаки заражения Brucella canis
Неспецифические признаки. Инфекция В. canis у собак не всегда протекает тяжело. О смертельных ее исходах не сообщалось. Лихорадка возникает редко - видимо, потому, что В. canis не содержит эндотоксинов. Обычно отмечается увеличение всех лимфатических желез вследствие диффузной гиперплазии лимфоидных и ретикулярных клеток. Иногда выявляется поражение селезенки: она увеличивается, становится твердой, в ней могут появиться узлы. Возможно воспаление печени.
Могут наблюдаться и другие системные заболевания, связанные с инфекцией В. canis. Так, сообщалось о спондилите грудных и поясничных позвонков (Smeak et al, 1987; Kerwin et al, 1992). C бруцеллезом связывают эндофтальмит и рецидивирующий увеит (Gwin et al, 1992; Johnson, Walker, 1992). У экспериментально инфицированных со
бак развивался слабо выраженный бессимптомный негнойный менингит. Иногда единственным проявлением бруцеллеза бывает артрит или полиартрит (Forbes 1990). У большинства собак инфекция протекает бессимптомно, или хозяева жалуются на такие незначительные отклонения, как плохой шерстный покров, непослушание, непереносимость физических нагрузок (Gordon et al, 1985).
Аборт и влагалищные выделения. Самый частый и очевидный признак бруцеллеза у сук, здоровых во всех других отношениях, - это изгнание плодов между 45 и 59 днями щенности. Возможно также рассасывание плодов, причем в этом случае суку обычно считают бесплодной, поскольку другие симптомы бруцеллеза отсутствуют. Изгнание плодов может произойти начиная с 30-го дня щенности, но бывает, что собака донашивает беременность почти до родов и даже рожает живых и мертвых щенков. Выжившие щенки страдают бактериемией в течение, по крайней мере, нескольких месяцев. В результате вызванных бруцеллезом абортов сука может потерять два-три помета подряд (Nicoletti, 1989).
Абортированные плоды обычно выглядят как частично аутолизированные. Влагалищные выделения после аборта могут быть коричневыми или зеленовато-серыми (Purswell, 1992). Как правило, они содержат большое количество бактерий, и необходима чрезвычайная осторожность, чтобы предотвратить контакт с ними людей и других собак. При бруцеллезе влагалищные выделения продолжаются длительное время после аборта. Секрет молочных желез, моча, слюна, выделения из носа и сперма тоже обычно содержат микроорганизмы В. canis и служат источником распространения инфекции (Carmichael, Greene, 1990).
Бесплодие. Бруцеллез может быть причиной кажущейся неспособности суки к зачатию. На самом деле в большинстве таких случаев зачатие происходит, но плоды рассасываются на ранней стадии или погибают и абортируются, что проходит незамеченным для хозяина собаки. При обследовании в плаценте обнаруживаются фокальный коагулирующий некроз ворсинок хориона и обилие патогенных бактерий в эпителиальных клетках трофобласта. Хотя ни одно из проявлений бруцеллеза у собак нельзя считать специфичным для данного заболевания, его всегда нужно иметь в виду при обследовании собак с репродуктивными проблемами.
Диагностика
Неспецифические показатели. У собак с бруцеллезом наблюдаются изменения клеточного состава крови и биохимического профиля плазмы, но все они неспецифичны, а результаты анализа мочи обычно соответствуют норме. Любое воспаление (яичек, межпозвоночных дисков, суставов и проч.) может быть следствием бруцеллеза, но следует учитывать, что он является относительно редким забо
БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ • 1021
леванием. Даже анализы спермы и влагалищных выделений у собак с установленным бруцеллезом выявляют лишь неспецифические изменения, например агглютинацию сперматозоидов (головка к головке) и наличие воспалительных клеток (Greene, George, 1984).
Серологические тесты.
Основные сведения. Надежным методом диагностики бруцеллеза считается анализ сыворотки крови на присутствие антител к клеточным мембранам и антигенам В. canis, но в течение первых 8-12 недель после заражения титр антител может быть ниже определяемого уровня. Аналогичным образом, и через 30-60 недель после инфицирования, когда бактериемия идет на спад, титр антител тоже нередко снижается, из-за чего результат может оказаться сомнительным (Johnson et al, 1991). Поэтому определение серологических титров, подобно многим другим тестам, имеет ограниченную диагностическую ценность. Титры меняются даже при хронической бактериемии, и их значение не отражает тяжести заболевания. Соответственно, снижение титров антител необязательно свидетельствует об успешном лечении (табл. 26-1). Таким образом, серологическое тестирование позволяет поставить предположительный, но не окончательный диагноз бруцеллеза у собак.
При скрининге собак на бруцеллез широко используются два серологических теста: агглютина-ционный тест на стекле (АТС) и агглютинацион-ный тест в пробирках (АТП). Реже применяют тест, основанный на иммунодиффузии в агаровом геле (ИДАГ), и модифицированный агглютинационный тест в пробирках с меркаптоэтанолом (АТП-МЭ). Выявление Brucella в культуре служит прямым доказательством инфицирования, но прокультивировать этот микроорганизм трудно.
Быстрые агглютинационные тесты на стекле или на планшете (БАТС; БАТПл). БАТС (Canine Brucellosis Diagnosis Test Kit, произв-во Pitman-
Moore, США; его вариант производит Synbiotics, США) является быстрым предварительным скрининговым тестом, который проводится в условиях клиники и применяется главным образом для достоверной идентификации 5гасе//а-отрицательных собак. Взятая на анализ сыворотка не должна быть гемолизирована. В качестве антигена используется В. ovis, так как этот вид бруцелл сходен с В. canis по антигенным свойствам. Тестируемую сыворотку смешивают на стекле с суспензией В. ovis, убитой нагреванием и прокрашенной бенгальским розовым. Если происходит агглютинация, это дает основание подозревать бруцеллез, но еще не позволяет поставить данный диагноз (Greene, George, 1984).
БАТС - высокочувствительный тест, и он редко дает ложноотрицательную реакцию. Однако если следовать прилагаемой к набору инструкции, то количество ложноположительных реакций может достигать 60%. Ложноположительные результаты, по-видимому, обусловлены перекрестной реакцией между антигенами В. ovis и антителами к Bordetella bronchiseptica, разным видам Pseudomonas, Morazella-noдобному микроорганизму и другим грам-отрицательным бактериям (Greene, George, 1984). Поэтому можно с уверенностью заключить, что животные, сыворотка которых не дает реакции агглютинации в БАТС, не имеют бруцеллеза, а в случае положительной реакции собаку нужно изолировать и проверить полученный результат с помощью АТП.
Разработан модифицированный метод БАТС с использованием 2-меркаптоэтанола, добавляемого для снижения гетерологичной агглютинации иммуноглобулина М (IgM) (Badakhsh et al, 1982). Показано, что эта модификация устраняет ложноположительные реакции (Nicoletti, 1989). Однако в первые несколько недель после инфицирования метод может давать ложноотрицательный ответ (Greene, George, 1984). Впоследствии для АТС был подобран более специфичный антиген: вместо В.
ТАБЛИЦА 26-1. СЕРОЛОГИЧЕСКИЕ ТЕСТЫ НА BRUCELLA CANIS
Серологический тест Сродство антител Сроки получения положительного результата Комментарии
БАТС-МЭ К клеточной мембране От 8-12 нед п/инф до 3 мес после абак-териемии Чувствительный; часто ложно +, редко (1%) ложно - ; быстрый и легкий
АТП К клеточной мембране От 10-12 нед п/инф до 3 мес после абактериемии Ложно +, как БАТС-МЭ; полуколичествен-ный
АТП-МЭ К клеточной мембране Как АТП, но дает результат + в более поздние сроки п/инф1 Несколько более специ фичен, чем АТП
ИДАГ К клеточной мембране 12 нед п/инф до 4 мес после абактериемии Более специфичен, чем БАТС-МЭ; чувствительный, сложный
ИДАГ К цитоплазме От 12 нед п/инф до 36 мес после абактериемии Наиболее специфичный, но не чувствительный; выявляет хронические случаи, когда другие тесты отрицательны
ИФМ К клеточной мембране Неизвестно; вероятно, подобен АТП Специфичный; менее чувствительный, чем АТП; ограниченно доступен
Из: Johnson СА et al: Diagnosis and control of Brucella canis in kennel situations. Proceedings of the Society for Theriogenology, 1991, p 236.
БАТС - быстрый агглютинационный тест на стекле; МЭ - 2-меркаптоэтанол; АТП - агглютинационный тест в пробирках; ИДАГ -иммунодиффузия в агаровом геле; ИФМ - иммуноферментный метод; п/инф - после инфицирования; знаки + и - означают, соответственно, положительные и отрицательные результаты; нед - недели; мес - месяцы.
1022 • БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
ovis стали использовать (М-)-клетки В. canis, и число ложноположительных ответов снизилось (Carmichael, Joubert, 1987).
Агглютинационный тест в пробирках. АТП стал основным серологическим тестом, используемым для проверки наличия антител к В. canis в сыворотках, давших положительную реакцию в БАТС. Как правило, АТП позволяет определить титры специфических антител к В. canis. Антитела выявляются через 2—4 недели после инфицирования и при сопутствующей бактериемии. Метод надежен, хотя процедура его проведения несколько различается в разных лабораториях.
В ходе определения к раствору антигена В. canis добавляют постепенно уменьшающиеся количества тестируемой сыворотки, чтобы получить различные разведения. Раствор антигена представляет собой суспензию убитых нагреванием и промытых бактерий В. canis. Титр антител 1:200 считается предварительным доказательством активной инфекции. Получена хорошая корреляция между титром 1:200 и выше и обнаружением бруцелл в культуре, полученной из образца крови (Nicoletti, Chase, 1987b). Если антитела определяются, но их титр меньше 1:200, следует провести повторное тестирование по крайней мере через 2 недели.
Агглютинационный тест в пробирке с использованием 2-меркаптоэтанола (АТП-МЭ) сходен с АТП, за исключением того, что к раствору антигена добавляется МЭ с целью увеличения специфичности теста. Модифицированный АТП выявляет антитела с запозданием на одну-две недели в сравнении с обычным АТП, но редко дает ложноположительные результаты (Greene, George, 1984, Nicoletti, 1989).
Тест с применением иммунодиффузии в агаровом геле (ИДАГ). В некоторых лабораториях антитела к В. canis определяют с помощью ИДАГ, причем в этом тесте используются один или больше антигенов, получаемых разными методами. Тест рекомендуется как вспомогательный для подтверждения диагноза, подозреваемого на основании положительных результатов, полученных в БАТС, БАТПл и АТП. Самый специфичный, но наименее чувствительный вариант проведения ИДАГ основан на использовании антигенного белка, экстрагированного из цитоплазмы В. canis (Zoha, Carmichael, 1987b). В данном варианте тест выявляет антитела через 4-8 недель после возникновения бактериемии, но положительный результат сохраняется не менее 12 месяцев после ее исчезновения, когда результаты других тестов становятся сомнительными. В то же время ИДАГ может дать отрицательный результат на ранней стадии инфицирования, когда другими методами антитела уже определяются (Nicoletti, Chase, 1987b). Однако рассматриваемый тест имеет то преимущество, что позволяет выявить быстрый переход сыворотки из положительной (по наличию специфических антител) в отрицательную при успешном лечении.
ИДАГ - относительно малодоступный тест, так как требует применения очищенных антигенов, а их нелегко освободить от перекрестно реагирующих липополисахаридов. Кроме того, само проведение иммунодиффузии возможно только в лабораториях, имеющих специальное оборудование и обученный персонал (Nicoletti, 1989). По решению Американской ассоциации ветеринарных диагностических лабораторий от 1993 года, все образцы сывороток собак, В. canis - положительных по данным БАТС, БАТПл и АТП, должны посылаться для дальнейшей проверки в референтную лабораторию (ею стала диагностическая лаборатория Корнелль-ского университета). В референтной лаборатории сыворотки повторно тестируют методом ИДАГ с использованием уникальных цитоплазматических белковых антигенов, более специфичных к отдельным видам Brucella, чем антигены клеточных мембран (Johnston et al, 2001). Однако ИДАГ все же иногда дает положительный результат у собак, инфицированных В. ovis, В. abortus или В. suis, так как некоторые из цитоплазматических антигенов, по-видимому, являются общими для разных видов Brucella (Johnston, Walker, 1992).
Недостаток ИДАГ состоит в том, что в отношении начального периода развития инфекции этот метод оказывается менее чувствительным, чем БАТС, БАТПл и АТП, и может не выявлять антитела вплоть до 4 недель после инфицирования, когда другие тесты уже дают положительный результат.
Выявление Brucella в посевах крови возможно уже на ранних сроках инфицирования, но отрицательный результат, полученный в культуре, ни в коем случае не исключает бруцеллеза.
Культура. Точный диагноз бруцеллеза у собак устанавливается на основании обнаружения возбудителя у животного. Хотя бактериемия у инфицированных собак может сохраняться в течение 1-3 лет, количество патогенных микроорганизмов в их крови часто бывает небольшим. Подтвердить наличие инфекции путем высевания образцов крови, взятой у живой собаки с хроническим заболеванием, удается далеко не всегда, так как возбудитель может отсутствовать в этих образцах. Однако если его удается выделить, это не только служит доказательством бруцеллеза у данной собаки, но и имеет большое значение для данного собачьего питомника (табл. 26-2).
В. canis можно выделить из разных тканей, но на практике для культивирования используют в основном образцы крови, так как они не только доступны, но и дают больше шансов на получение положительного результата при тестировании зараженных собак. Бактериемия выявляется не ранее чем через 2—4 недели после перорального заражения и может сохраняться на протяжении двух лет (Greene, George, 1984). Поскольку бактерии локализованы преимущественно в лейкоцитах, прямое высевание на твердую среду ненадежно. Вместо этого рекомендуется развести 5 мл периферической крови в 50 мл триптозного бульона и эту смесь
БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ • 1023
ТАБЛИЦА 26-2. ПОДТВЕРЖДЕНИЕ ИНФЕКЦИИ BRUCELLA CANIS
Материал для культивирования Время взятия на культивирование Ожидаемый результат
Пост-абортивный Когда имеется
материал Плацента Когда имеется ++
Плод Когда имеется Может быть -
Сперма 3-11 нед п/инф +++
12-16 нед п/инф Меньшее содер-
>60 нед п/инф жание бруцелл
Кровь 5-30 нед п/инф В 100% случаев
После 30 нед 4-
6-12 мес п/инф Переменчивый
24-48 мес п/инф >80% +
48-58 мес п/инф 50-80% +
>58 мес п/инф 25-50% +
Эпидидимис 35-60 нед п/инф <25% + 50-100% +
>100 нед п/инф —
Моча 8-30 и более нед п/инф У самцов выде-
Простата До 64 нед п/инф ляется больше бруцелл, чем у самок Обычно +
Лимфатические Во время бактериемии Обычно +
узлы, селезенка Спинной мозг Во время бактериемии +/-
Глаз Наличие увеита +++
Межпозвоночный Дискоспондилит +/-
ДИСК
Из: Johnson CA et al: Diagnosis and control of Brucella canis in kennel situations. Proceedings of the Society for Theriogenology, 1991, p 236. Использовано с разрешения.
Нед - недели; мес - месяцы; п/инф - после инфицирования. Знаками + и — обозначены положительный и отрицательный результаты, соответственно.
инкубировать при 37° в течение приблизительно 9 дней. На третий, шестой и девятый дни делают посевы на триптозном агаре и отрицательные культуры отбрасывают (Nicoletti, 1989). В. canis обычно идентифицируют по морфологии колоний (грубая или мукоидная, полупрозрачная) и по агглютинации со специфической антисывороткой.
Описано успешное высевание бруцелл на твердой среде из молока, мочи, влагалищных выделений, спермы и плацентарной и плодной тканей. Для ограничения роста загрязняющих организмов в культуральную среду добавляют антибиотики. Если исследуется трупный материал, то положительные культуры наиболее вероятно получить из ткани лимфатических узлов и селезенки; можно использовать также ткани предстательной железы, семенников, эпидидимиса, костного мозга и матки. Следует культивировать специфические участки инфицирования, а именно участки развития дискоспондилита или поражения глаз. Отрицательный результат, полученный в культуре, не исключает заболевания.
Лечение
Основные сведения. Многочисленные исследователи, пытавшиеся лечить собак, зараженных В.
canis, достаточно единодушны в сделанных выводах. Хотя бруцеллез, видимо, не представляет угрозы для жизни, инфицированную собаку нельзя использовать в племенном разведении, и она является потенциальным источником инфекции как для собак, так и для других видов, включая человека. В. canis чувствительна ко многим антибиотикам, но лечение ими часто оказывается безуспешным либо не исключает рецидивов заболевания (табл. 26-3). Неудовлетворительные результаты лечения, скорее всего, обусловлены тем, что бруцеллы имеют внутриклеточную локализацию, а антибиотики не способны проникать внутрь клеток. По этим причинам ветеринары не питают иллюзий относительно возможности полного излечения. Суки, у которых были выкидыши, нередко впоследствии приносят нормальный помет независимо от того, лечили их или нет, но могут и передать инфекцию своему потомству. У леченых кобелей бруцеллы обычно сохраняются в предстательной железе, и такие кобели способны распространять инфекцию (Greene, George, 1984). В то же время лечение многих собак антибиотиками по соответствующим схемам привело к успешным результатам, подтвержденным серологическими и бактериологическими исследованиями.
Перед владельцем собаки, у которой обнаружен бруцеллез, встает следующий выбор: обязательные повторные курсы терапии, кастрация или эвтаназия животного. Одни исследователи настойчиво рекомендуют эвтаназию как единственное надежное средство, но другие не столь агрессивны. Конечно, контакт с такой собакой небезопасен для людей с ослабленной иммунной системой, беременных женщины и маленьких детей, и это нужно учитывать при выборе дальнейшей тактики. Однако заражение бруцеллезом наблюдалось в основном у лабораторных работников, имевших дело именно с этой инфекцией. К симптомам инфицирования у людей относятся лихорадка, потливость, слабость, потеря веса, головные боли, лимфаденопатия и спленомегалия. Агглютинационные тесты с использованием в качестве антигена только В. abortus дают отрицательный результат у людей, инфицированных В. canis (Munford et al, 1975).
Тетрациклин и аминогликозиды. Наилучшие результаты лечения бруцеллеза дает комплексная антибиотикотерапия тетрациклинами и аминогликозидами. Аминогликозид гентамицин вводят по 2,2 мг/кг внутримышечно один раз в день в течение первой недели; доксициклин или миноциклин в высокой дозе (55 мг/кг дважды в день) дают в течение 2 недель. Тетрациклин или хлорамфеникол менее эффективны, но они дешевле и поэтому более практичны.
Тетрациклин per os и инъекции стрептомицина. Комбинацию этих препаратов предложено использовать для подавления вспышек бруцеллезной инфекции. Схема лечения включает пероральное введение тетрациклина (10мг/кг трижды в день)
1024 • БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
ТАБЛИЦА 26-3. РЕЗУЛЬТАТЫ РЯДА ИССЛЕДОВАНИЙ ПО ХИМИОТЕРАПИИ БРУЦЕЛЛЕЗА У СОБАК
Препарат Дневная доза Способ введения Длительность лечения Отношение вылеченных собак к не вылеченным Авторы
Тетрациклин 10 мг/кг перорально 14 дней 0:5 Flores-Castro, Carmicael, 1981
Одновременно:
Тетрациклин 10 мг/кг перорально 14 дней 0:6 Flores-Castro, Carmicael, 1981
Сульфадиметоксин 23 мг/кг перорально 14 дней
Одновременно:
Миноциклин 10 мг/кг перорально 14 дней 15:18 Flores-Castro, Carmicael, 1981
Стрептомицин 4,5 мг/кг в/м 7 дней
Миноциклин 10 мг/кг перорально 14 дней 3:11 Flores-Castro, Carmicael, 1981
Одновременно:
Окситетрациклин 20 мг/кг в/м 4 инъекции за 3 нед 19:24 Zoha, Walsh, 1982
Стрептомицин 30 мг/кг в/м Первые 7 дней
Последовательно:
Тетрациклин 60 мг/кг перорально 14 дней 0:6 Johnson et al, 1982
Стрептомицин 22 мг/кг в/м 14 дней
Триметоприм- 30 мг/кг перорально 14 дней
сульфадиазин
Одновременно:
Тетрациклин 10 мг/кг перорально 30 дней Nicoletti, Chase, 1987a
Стрептомицин 3,4 мг/кг в/м В дни 1-7, 24-30 15:20
нед - недели; в/м - внутримышечно
в течение 30 дней и внутримышечные инъекции стрептомицина (15 мг/кг один раз в день) с первого по седьмой и с 24-го по 30-ый дни. Данную схему опробировали на 20 из 28 собак с бруцеллезом, и 15 из этих 20 были признаны вылеченными после одного курса терапии. Четырем из пяти оставшихся собак провели повторный курс терапии, и две из них тоже выздоровели. Авторы считают оправданным одновременное лечение серонегативных и серопозитивных собак, когда речь идет о контроле над вспышкой инфекции. Кроме того, они считают, что серологические тесты полезны для оценки результатов терапии: по их наблюдениям, титры антител быстро снижаются при успешном лечении и снова возрастают в случаях рецидива (Nicoletti, Chase, 1987а; Nicoletti, 1989).
Инъекции тетрациклина и стрептомицина. Описана также следующая схема лечения бруцеллеза, опробированная на 24 инфицированных собаках: окситетрациклин (Liquamycin La200; произ-во Pfizer, США) - внутримышечное введение в дозе 20 мг/кг один раз в неделю в течение четырех недель; дополнительно в первые 7 дней лечения - внутримышечные инъекции стрептомицина по 15 мг/кг ежедневно (Zoha, Walsh, 1982). Через шесть месяцев после завершения терапии у 19 из 24 собак были получены отрицательные результаты серологических и культуральных тестов.
Миноциклин. В обширном исследовании, проведенном на 80 экспериментально инфицированных собаках, было опробировано 13 различных схем лечения, каждая из которых проверялась на группе из трех или более собак. Наиболее эффективным оказалось сочетание миноциклина гидрохлорида (10 мг/кг ежедневно в течение 14 дней) и стрептомицина (ежедневное введение в дозе 4,5 мг/ кг, разделенной на 2 инъекции, в течение 7 дней).
По данным культивирования крови и тканей, к моменту эвтаназии, проводившейся через 6-28 недель после завершения курса терапии, 83% собак были излечены. Лечение только миноциклином не давало эффекта (Flores-Castro, Carmichael, 1981).
Тетрациклин, стрептомицин и триметопримсульфадиазин. В одном из исследований щенных собак со спонтанной инфекцией В. canis лечили комбинацией тетрациклина, дигидрострептомицина и триметопримсульфадиазина. Лечение не устранило инфекции, но предотвратило аборт.
Выводы. Ветеринары должны быть откровенны при обсуждении этого заболевания с владельцами инфицированных собак. Терапия, вместе с необходимым мониторингом, может оказаться дорогостоящей, а результат ее непредсказуем. Более того, успех или неудачу лечения трудно подтвердить. Щенная собака, живущая в питомнике, должна быть полностью изолирована от других собак, чтобы предотвратить распространение инфекции. Если эвтаназия питомца для хозяина не приемлема, ему надо порекомендовать кастрировать животное. Однако после кастрации и лечения собака все еще может оставаться источником инфекции для человека. Владельцы собак должны быть осведомлены о зоонозной природе бруцеллеза, симптомах этого заболевания у человека и собак, а также о том, что мы мало знаем, как протекает заболевание у людей. Им также нужно посоветовать срочно обратиться к врачу, если есть подозрение, что они имели контакт с инфекцией.
Профилактика и контроль заболевания
В настоящее время не существует вакцины против собачьего бруцеллеза, поэтому во избежание заражения следует избегать контактов с любой инфицированной собакой. Новых собак, поступающих в
БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ • 1025
незаряженный питомник, нужно содержать в изоляторе не меньше месяца. За это время у них надо дважды, с интервалом в 1 месяц, проверить титры антител к Brucella, и только если оба результата будут отрицательными, животных можно поместить в питомник. При перевозке не обследованных указанным образом собак следует строго соблюдать гигиенические условия, чтобы избежать заражения.
В программы племенного разведения часто включают собак из отдаленных регионов. Важно, чтобы заводчики отбирали собак с отрицательным тестом на Brucella. Собак, активно используемых для разведения, нужно тестировать не реже одного раза в полгода, и желательно это делать перед каждой вязкой. 5гасе//а-положительных собак нельзя вязать даже путем искусственного осеменения, так как инфекция может распространяться через вагинальные выделения, молоко и выживших щенков.
Если в питомнике обнаружена инфекция, то ее источником не обязательно является собака, у которой выявлен бруцеллез. Нужно проверить всю колонию, и всех собак, давших положительный результат в серологическом тесте, изолировать и повторно проверить через месяц. Собаки должны оставаться в изоляции до получения отрицательного результата. Тех, у кого результат серологического теста постоянно положительный, надо удалить из питомника. Следует учитывать все способы инфицирования и помнить, что Brucella легко проникает через мембраны слизистой и заражение происходит через рот, конъюнктиву и половые пути. Главными источниками инфекции являются вагинальные выделения, абортируемый материал, сперма и моча. Возможна передача аэрозольным путем. Имеется сообщение, что бруцеллезные бактерии погибают при прямом воздействии аммиачных соединений и препаратов йода (Johnston et al, 1991).
Важно также помнить, что некоторые тесты дают положительный ответ лишь спустя недели и месяцы после инфицирования, а потому исследования нужно продолжать ежемесячно, пока все Brucella-поло-жительные животные не будут удалены. Бывает, что тестирование приходится проводить до бесконечности. В ситуации, когда нужно искоренить обнаруженную инфекцию, все собаки в питомнике должны находиться под одинаковым подозрением.
ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
Определение
Трансмиссивная венерическая опухоль (ТВО) - это естественно возникающее новообразование у собак, которое локализуется обычно в области наружных половых органов и передается при коитусе (Cohen, 1985). Наследственной предрасположенности у отдельных пород, по-видимому, не существует, и болезнь распространена по всему миру (Harmelin et al, 2001). Эндемичные области охватывают южные районы США, юго-восточную Европу, Централь
ную и Южную Америку, Японию, Дальний Восток, Средний Восток и часть Африки. Источником заболевания служат бродячие собаки, которых особенно много в регионах с умеренным климатом и в больших городах США (Brown et al, 1981).
Этиология
Клетки, из которых развивается ТВО, неизвестны, но предполагается, что недифференцированные округлые клетки новообразования имеют ретикулоэндотелиальное происхождение (Sandunsky et al, 1987; Mozos et al, 1996; Marcual et al, 1997). ТВО рассматривается как пример естественно встречающейся аллотрансплантации (т.е. переноса клеток между особями одного и того же вида). Передача ТВО осуществляется путем трансплантации жизнеспособных опухолевых клеток донора восприимчивой особи-реципиенту. Принято считать, что отшелушившиеся клетки донора «высеваются» на поврежденной слизистой гениталий реципиента. Предрасположенная к новообразованиям собака может получить ТВО в результате лизания сначала гениталий больной собаки, а затем собственных гениталий.
Впервые успешная экспериментальная трансплантация опухоли, включая ТВО, была проведена в 1876 году, а о первой трансмиссии опухоли путем коитуса было сообщено в 1898 году. Имеются многочисленные сообщения о гомотрансплантации ТВО через кожу или внутривенным путем. Высказывалось предположение о вирусном происхождении ТВО, но последующие работы не смогли доказать присутствие вирусных частиц. Осуществить трансмиссию опухоли с помощью ее бесклеточного инфильтрата (где должны были бы содержаться вирусы) удается не всегда. Дополнительным свидетельством против вирусного происхождения ТВО является отсутствие изоантигенов клеток хозяина на поверхности клеток опухоли (Harmelin et al, 2001).
Исследования на молекулярном уровне обнаружили специфичную для собачьей ТВО вставку транспозона (перемещающегося генетического элемента) вблизи 5’-конца с-тус онкогена. Стабильное выявление этой вставки указывает на то, что ТВО в различных географических зонах, скорее всего, имеет общее происхождение и постоянно передается путем клеточного переноса (Ameriglio et al, 1991). Другим доказательством аллотрансплантан-тной, а не вирусной природы трансмиссии является постоянное количество хромосом в клетках ТВО. Клетки, инфицированные онкогенным вирусом, имеют разное число хромосом, а клетки ТВО всегда содержат 50 хромосом и сходны между собой по содержанию ДНК (Brown et al, 1981).
Встречаемость
ТВО встречается преимущественно у бродячих собак. Поэтому неудивительно, что в США, например, большинство собак с этой опухолью прина-
1026 • БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
длежаг к довольно крупным породам. В одном из исследований вес 34 из 41 собак с ТВО превышал 20 кг, а в другом исследовании 26 из 29 собак весили больше 18 кг (Calvert et al, 1982; Rogers et al, 1998). Болезнь наиболее распространена среди не-кастрированных собак обоих полов. Средний возраст больных собак, по данным разных исследований, составляет 4-5 лет (Brown et al, 1980, Calvert et al, 1982; Rogers et al, 1998).
Клинические признаки
ТВО обычно обнаруживается на наружных половых органах самцов и самок (рис. 26-1 и 26-2). Опухоль состоит из нерегулярных, рыхлых и порой изъязвленных одиночных или множественных узлов. Рыхлость опухоли и ее локализация определяют и ее основные признаки, а именно: кровянистые выделения из наружных половых органов, выступающую наружу массу ткани и деформацию наружных гениталий (Boscos, 1988; Rogers, 1997). В исследовании, включавшем 29 собак, у 16 были деформированы пенис и препуций и у 11 собак - влагалище и вульва, а у двух собак была поражена носовая полость. Затрудненное мочеиспускание, вызванное ТВО, - явление крайне редкое (Rogers et al, 1998).
Поскольку у двух собак из указанной группы первичным участком поражения была носовая полость (в отличие от остальных 27 собак, у которых таким первичным участком были гениталии), дополнительные признаки у них включали геморрагические выделения из носа и необычный запах «изо рта». Признаки заболевания появлялись в среднем за 6,5 месяцев до постановки диагноза (медиана 2 месяца и разброс от двух недель до четырех лет).
Такие опухоли нередко имеют очертания цветной капусты, но бывают также и иной формы: узловые, сосковидные, многодольчатые или на ножке. Опухоль выявляли в разнообразных областях вне гениталий, при этом в гениталиях она могла при-
Рис. 26-1. Крупная трансмиссивная венерическая опухоль у основания пениса. (Любезно предоставлено д-ром Jane Turret)
сутствовать, но могла и отсутствовать. Разрастание опухоли отмечалось на коже, морде, в носовых ходах, ротовой полости, а также в глазах и вокруг глаз. Метастазы - явление редкое, но если они образуются, то преимущественно в поверхностных паховых и подвздошных лимфатических узлах, хотя возможны и в далеко отстоящих лимфоузлах, а также на коже, в подкожных клетчатке, селезенке, печени, головном мозге, глазах и легких. Если метастазы распространяются на глаза или головной мозг, прогноз в этих случаях плохой.
У сук ТВО обычно распознается как одиночная масса на стенке влагалища. Однако эта масса может распространяться на преддверие влагалища, вульву, половые губы, шейку матки и матку. Опухоль бывает серого или розовато-серого цвета. У кобелей,
Рис. 26-2. А. Крупная трансмиссивная венерическая опухоль, выпирающая из вульвы. Б. Вульва той же собаки после радиотерапии. (Любезно предоставлено д-ром Jane Turrel.)
БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ • 1027
Рис. 26-3. Мазок-отпечаток вагинальной массы, образованной трансмиссивной венерической опухолью у собаки.
помимо пениса и препуция, опухоли часто находят в ротовой и/или носовой полостях. Возникновение опухоли в этих полостях - результат лизания или обнюхивания кобелем наружных гениталий больной суки перед вязкой.
Диагностика
Предварительный диагноз трансмиссивной венерической опухоли ставится на основании анамнеза и физикального исследования. Точный диагноз устанавливается после исследования мазка-отпечатка опухолевой ткани. Для ТВО характерны большие гомогенные пласты крупных округлых или овальных клеток с крупными ядрышками в ядре, скудной цитоплазмой и множественными прозрачными цитоплазматическими вакуолями - часто в виде цепочек (рис. 26-3). Обнаруживаются также микроворсинки, которые соединяют отдельные клетки друг с другом, связывая их в пласты.
Ткань можно фиксировать формалином и затем прокрашивать гематоксилином или юзином. Однако высказывалось мнение, что фиксация формалином деформирует опухолевые клетки, что затрудняет диагностику Так, по гистологической картине ТВО можно спутать с гистиоцитомой, лимфомой, нейробластомой или саркомой ретикулярных клеток. Другие методы диагностики не получили широкого применения. Между тем, исследование ткани методом электронной микроскопии позволяет обнаружить типичные для опухоли клетки. Наконец, можно было бы попробовать пересадить опухоль восприимчивым собакам.
Лечение
Радиационная терапия. Радиотерапия служит эффективным средством воздействия на опухоль,
если доступна соответствующая аппаратура. Но данным одного из исследований, этим методом были успешно вылечены 18 из 18 собак с ТВО, причем большинству из них оказалось достаточно однократного облучения (Thrall, 1982). В более поздней работе радиационным методом лечили 15 собак с ТВО, при этом в качестве источника излучения использовали только кобальт-60. Все животные получали три дозы облучения в режиме понедельник-среда-пятница, средняя минимальная доза составляла 15 грей (от 10 до 18 Гр). У всех 15 собак произошла полная ремиссия. Неблагоприятных реакций на облучение выявлено не было. Ответ на терапию отмечался уже после первой дозы, и полное выздоровление наблюдалось у всех собак через месяц (Rogers et al. 1998). Радиотерапия оказалась эффективной в случаях как генитальных, так и экстрагенитальных опухолей и даже в случаях опухолей, устойчивых к химиотерапии. У 1алось излечить собак не только с одиночными опухолями, но также с метастазами и с опухолями, устойчивыми к химиотерапии винкристином и доксорубицином (Rogers et al, 1998).
Для лечения ТВО требуются относительно низкие дозы радиации. Возможно, это объясняется гибелью клеток, находящихся в интерфазе (т.е. в состоянии между двумя последовательными юле-ниями), как это имеет место в лимфоидных тканях. С другой стороны, присущая ТВО чувствительность к облучению может быть следствием высокого митотического индекса, характерного для этих опухолей. Средняя доза 15 Гр была вполне эффективной, однако авторы отмечают, что в ряде случаев бывают достаточными и более низкие дозы (Rogers et al, 1998). Единственный недостаток радиотерапии как «метода первого выбора» - это необходимость соответствующего оборудования; в США оно быстро становится почти повсеместно доступным.
1028 • БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
Лечение одним препаратом. Винкристина сульфат. В одной из первых работ применение винкристина в качестве единственного средства лечения было опробировано на 41 собаке с ТВО. Препарат вводили в дозе 0,025 мг/кг (максимальная доза - до 1 мг) внутривенно один раз в неделю. У 39 собак (из 41) опухоль полностью исчезла, у одной собаки объем опухоли уменьшился более чем на 90% и у одной собаки он снизился на 25%. Тридцати девяти собакам для полного излечения потребовалось от двух до семи еженедельных инъекций (в среднем 3,3 инъекции). У 9 собак наблюдались преходящие побочные эффекты (Calvert et al, 1982).
В двух последующих исследованиях 25 собак (суммарное число животных) лечили винкристи-ном, вводя его внутривенно в дозе 0,5 мг/м2 площади поверхности тела (ППТ) раз в неделю в течение 4-8 недель или вплоть до появления клинического ответа. У 24 собак из 25 лечение привело к полной ремиссии (Amber et al, 1990; Rogers et al, 1998). В одном случае после 8-месячного бессимптомного периода было обнаружено рецидивирование интра-назальной опухоли (Rogers et al, 1998). Таким образом, винкристин представляется прекрасным химиотерапевтическим средством, и его применение следует рассматривать при выборе метода лечения (методом первого выбора является облучение). Назначение химиотерапии наиболее целесообразно в случаях метастазирующей, мультифокальной ТВО.
Доксорубицин. В случаях, когда винкристин не действует, клиницистам следует попробовать лечение доксорубицином, введение которого - в дозе 30 мг/м2 ППТ внутривенно один раз в три недели -продолжают до тех пор, пока опухоль не исчезнет. В среднем требуется две инъекции доксорубицина.
Циклофосфамид и метотрексат. Различные схемы лечения этими препаратами недавно были испытаны на 48 собаках с ТВО. У четырех собак пероральное введение циклофосфамида (50 мг/м2 ППТ), проводившееся по 4 дня в неделю в течение 6 недель, не дало результата. Десяти собакам циклофосфамид вводили внутривенно - также по 50мг/м2 ППТ, 4 дня в неделю в течение 6 недель. В итоге только у двух собак из 10 наступила частичная ремиссия. Метотрексат, который давали восьми собакам в дозе 265 мг/м2 ППТ перорально через день в течение 6 недель, ни в одном случае не оказал терапевтического эффекта. В то же время циклофосфамид и метотрексат вызывали такие побочные эффекты, как анорексия, рвота, диарея и потеря веса (Amber et al, 1990).
Комбинированная химиотерапия. Такая терапия применялась в различных вариантах. В одном из исследований комбинированная химиотерапия 30 собак с ТВО включала введение винкристина (0,0125 или 0,025 мг/кг, внутривенно, еженедельно), циклофосфамида (1 мг/кг перорально, ежедневно либо 50 мг/м2 ППТ перорально по четным дням) и метотрексата (0,3-0,5 мг/кг внутривенно, еженедельно либо 2,5 мг/м2 ППТ перорально по не
четным дням). В среднем для полного исчезновения признаков заболевания требовалось от четырех до шести курсов лечения, состоявших из 4-6 недель. Из 30 собак у 28 (93%) наблюдалась полная ремиссия, у одной собаки (3,5%) ответ был частичным и у одной - минимальным. Преходящие побочные эффекты наблюдались у 6 из 30 собак и включали анорексию, рвоту, диарею и нейтропению (Brown etal, 1980).
Хирургическое лечение. Небольшие опухоли можно удалять хирургическим путем, но после операции часто наблюдаются рецидивы. Кроме того, к моменту диагноза большинство опухолей уже неоперабельны или требуют обширного вмешательства, при котором риск занесения опухолевых клеток в окружающие ткани сводит шансы успеха к нулю. Сообщалось, что после хирургического удаления естественно возникшей ТВО, проведенного у 35 собак, общая частота рецидивов составила 33%. В некоторых случаях опухоли возникали в отдаленных от прежней локализации местах и, по крайней мере у части собак, по-видимому, представляли собой метастазы (Amber, Henderson, 1982). В настоящее время хирургические методы лечения не рекомендуются (Boscos, 1988; Ogilvie, Moore, 1995).
Спонтанная ремиссия. Прежде чем приступать к лечению, ветеринар должен принять во внимание возможность спонтанной регрессии таких опухолей. В одном из исследований у 16% собак с экспериментально трансплантированной ТВО произошла спонтанная регрессия опухоли. У других собак чередовались периоды активного роста и регрессии опухоли. Если произошла полная регрессия, то повторный рост опухоли маловероятен, поскольку у собаки развился иммунитет против опухолевых клеток, и только при поступлении их в чрезвычайно больших количествах этот иммунитет может оказаться недостаточным. Однако на основании имеющихся литературных данных трудно установить общую частоту спонтанных регрессий ТВО; сообщалось, например, что из шести наблюдавшихся собак с ТВО спонтанной ремиссии не было ни у одной (Amber et al, 1990). Во всяком случае, поскольку ветеринар не может полагаться на спонтанное выздоровление, следует пытаться лечить животное с ТВО.
ЛИТЕРАТУРА
Amber El, Henderson RA: Canine transmissible venereal tumor: Evaluation of surgical excision of primary and metastatic lesions in Zaria-Nigeria. J Am Anim Hosp Assoc 18:350, 1982.
Amber El, et al: Single-drug chemotherapy of canine transmissible venereal tumor with cyclophosphamide, methotrexate, or vincristine. J Vet Intern Med 4:144, 1990.
Ameriglio EN, et al: Identity of rearranged LINE/c-MYC junction sequences specific for the canine transmissible venereal tumor. Proc Natl Acad Sci USA 88:8136, 1991.
Badakhsh FF, et al: Improved rapid slide agglutination test for presumptive diagnosis of canine brucellosis. J Clin Microbiol 15:286, 1982.
Barr SC, et al: Brucella suis biotype I infection in a dog. J Am Vet Med Assoc 189:686, 1986.
Boscos C: Canine transmissible venereal tumor: Clinical observations and treatment. Anim Familia 3:10, 1988.
БРУЦЕЛЛЕЗ И ТРАНСМИССИВНАЯ ВЕНЕРИЧЕСКАЯ ОПУХОЛЬ
1029
Brown NO, et al: Chemotherapeutic management of transmissible venereal tumors in 30 dogs. J Am Vet Med Assoc 176:983, 1980.
Brown NO, et al: Transmissible venereal tumor in the dog. Calif Vet 3:6, 1981.
Calvert CA, et al: Vincristine for treatment of transmissible venereal tumor in the dog. J Am Vet Med Assoc 181:163, 1982.
Carmichael LE, Greene CE: Canine brucellosis. In Greene CE (ed): Infectious Disease of the Dog and Cat. Philadelphia, WB Saunders, 1990, p 573.
Carmichael LE, Joubert JC: A rapid slide agglutination test for the sero- diagnosis of Brucella canis infection that employs a variant (M-) organism as antigen. Cornell Vet 77:3, 1987.
Carmichael LE, Joubert JC: Transmission of Brucella canis by contact exposure. Cornell Vet 78:63, 1988.
Cohen D: The canine transmissible venereal tumor: A unique result of tumor progression. Adv Cancer Res 43:75, 1985.
Ferreira AJA, et al: Brain and ocular metastases from a transmissible venereal tumour in a dog. J Small Anim Pract 41:165, 2000.
Flores-Castro R, Carmichael LE: Brucella canis infection in dogs. Rev Lati-noam Microbiol 23:75, 1981.
Forbes LB: Brucella abortus infection in 14 farm dogs. J Am Vet Med Assoc 196:911, 1990.
Gordon JC, et al: Canine brucellosis in a household. J Am Vet Med Assoc 186:695, 1985.
Greene CE, George LW: Canine brucellosis. In Greene CE (ed): Clinical Microbiology and Infectious Diseases of the Dog and Cat. Philadelphia, WB Saunders, 1984, p 646.
Gwin RM, et al: Ocular lesions associated with Brucella canis infection in a dog. J Am Anim Hosp Assoc 16:607, 1980.
Harmelin A, et al: Use of a murine xenograft model for canine transmissible venereal tumor. Am J Vet Res 62:907, 2001.
Hubbert NL, et al: Canine brucellosis: Comparison of clinical manifestations with serologic test results. J Am Vet Med Assoc 177:168, 1980.
Johnson CA, Walker RD: Clinical signs and diagnosis of Brucella canis infection. Compend Contin Educ Pract Vet 14:763, 1992.
Johnson CA, et al: Effect of combined antibiotic therapy on fertility in brood bitches infected with Brucella canis. J Am Vet Med Assoc 180:1330, 1982.
Johnson CA, et al: Diagnosis and control of Brucella canis in kennel situations. Proceedings of the Society for Theriogenology, 1991, p 236.
Johnston SD, Root Kustritz MV, Olson PNS: Canine and Feline Theriogenology. Philadelphia, WB Saunders, 2001, p 88.
Kerwin SC, et al: Discospondylitis associated with Brucella canis infection in dogs: 14 cases (1980-1991). JAm Vet Med Assoc 201:1253, 1992.
Kormendy B, Nagy GY: The supposed involvement of dogs carrying Brucella suis in the spread of swine brucellosis. Acta Vet Acad Hung 30:3, 1982.
Marchal T, et al: Immunophenotype of the canine transmissible venereal tumor. Vet Immunol Immunopathol 57:1, 1997.
Meyer ME: Update on canine brucellosis. Mod Vet Pract 64:987, 1983.
Mozos E, et al: Immunohistochemical characterization of canine transmissible venereal tumor. Vet Pathol 33:257, 1996.
Munford RS, et al: Human disease caused by Brucella canis. Journal of the American Medical Association 231:1267, 1975.
Nicoletti P: Diagnosis and treatment of canine brucellosis. In Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders, 1989, p 1317.
Nicoletti P, Chase A: The use of antibiotics to control canine brucellosis. Compend Contin Educ Pract Vet 9:1063, 1987a.
Nicoletti P, Chase A: An evaluation of methods to diagnose Brucella canis infection in dogs. Compend Contin Educ Pract Vet 9:1071, 1987b.
Ogilvie GK, Moore AS: Tumors of the reproductive system, /n Ogilvie GK, Moore AS (eds): Managing the Veterinary Cancer Patient. Trenton, NJ, Veterinary Learning Systems, 1995, p 415.
Pidgeon GL, et al: Experimental infection of dogs with Brucella abortus. Cornell Vet 77:339, 1987.
Purswell BJ: Differential diagnosis of canine abortion. In Kirk RW, Bonagura JD (eds): Current Veterinary Therapy XL Philadelphia, WB Saunders, 1992, p925.
Rogers KS: Transmissible venereal tumor. Compend Contin Educ Pract Vet 19:1036, 1997.
Rogers KS, et al: Transmissible venereal tumor: A retrospective study of 29 cases. J Am Anim Hosp Assoc 34:463, 1998.
Sandunsky GE, et al: Diagnostic immunohistochemistry of canine round cell tumors. Vet Pathol 24:495, 1987.
Smeak DD, et al: Brucella canis osteomyelitis in two dogs with total hip replacements. J Am Vet Med Assoc 191:986, 1987.
Thrall DE: Orthovoltage radiotherapy of canine transmissible venereal tumors. Vet Radiol 23:217, 1982.
Zoha SJ, Carmichael LE: Serological responses of dogs to cell wall and internal antigens of Brucella canis. Vet Microbiol 17:35, 1982.
Zoha SJ, Walsh R: Effect of a two-stage antibiotic regimen on dogs naturally infected with Brucella canis. J Am Vet Med Assoc 180:1474, 1982.
Часть VIII
РЕПРОДУКЦИЯ КОБЕЛЕЙ
Г лава 27
КЛИНИЧЕСКАЯ И
ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
АНАМНЕЗ.....................1032
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ......1032
ОЦЕНКА КАЧЕСТВА СПЕРМЫ........1034
Методика получения проб спермы ... 1036
Причины неудачных попыток получения спермы............1037
Макроскопическая оценка спермы... 1038
Микроскопическая оценка спермы... 1038
Бактериологическое исследование.. 1043
Факторы, влияющие на качество спермы.........1043
Окончательная интерпретация результатов оценки качества спермы.....1044
ЩЕЛОЧНАЯ ФОСФАТАЗА СПЕРМЫ....1045
БАКТЕРИОЛОГИЧЕСКИЙ АНАЛИЗ ОРГАНОВ РАЗМНОЖЕНИЯ........1045
ТЕСТИРОВАНИЕ НА НАЛИЧИЕ ИНФЕКЦИИ BRUCELLA CANIS.............1047
ОЦЕНКА ГОРМОНАЛЬНОГО СТАТУСА. 1048
УЗИ И РЕНТГЕНОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ..............1051
АСПИРАЦИОННАЯ БИОПСИЯ СЕМЕННИКОВ...............1053
АСПИРАЦИОННАЯ БИОПСИЯ ПРИДАТКОВ СЕМЕННИКОВ.....1054
НЕАСПИРАЦИОННЫЕ МЕТОДЫ БИОПСИИ СЕМЕННИКОВ.......1055
КАРИОТИПИРОВАНИЕ.........1057
Список сокращений
ГнРГ - гонадотропин рилизинг-гормон, гонадолиберин
ЛГ - лютеинизирующий гормон
ФСГ - фолликулостимулирующий гормон
ХГЧ - хорионический гонадотропин человека
АНАМНЕЗ
Даже в тех случаях, когда заводчика беспокоят только репродуктивные качества принадлежащего ему кобеля, ветеринарный врач всегда должен собрать как можно более полный анамнез, включающий сведения о состоянии всех органов собаки. Болезни других органов могут воздействовать на репродуктивную систему кобеля как путем непосредственного распространения из них инфекционных агентов или метастазов опухолей в половые органы, так и косвенно за счет изменения уровня секреции тестостерона, лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), а также гонадотропин рилизинг-гормона (ГнРГ). Кроме того, на функциональное состояние органов размножения собак могут оказывать влияние лекарственные препараты (например, глюкокортикоиды), хроническое воздействие стресс-факторов, травмы или предшествующее системное заболевание. Неполный анамнез нередко приводит к тому, что перечисленные факторы, отражающиеся на репродуктивных качествах кобелей, остаются нераспознанными. Своевременно невыявленные заболевания и функциональные нарушения могут постепенно приобрести хронический характер и стать причиной того, что в более или менее отдаленном будущем племенной кобель не оправдает ожидания своего хозяина. Здоровье кобеля может ухудшиться, а ветеринарный врач испытает разоча
рование из-за того, что вовремя не сумел диагностировать и устранить болезнь. Только имея представление обо всем комплексе потенциальных проблем у животного, можно рационально организовать его диагностическое обследование, а при выявлении заболеваний - их лечение.
При сборе анамнеза содержание типовых вопросов, касающихся органов размножения кобеля, зависит как от причин, по которым его владелец обратился к ветеринарному врачу, так и от результатов физикального исследования животного. Поэтому, например, спектр анамнестических данных, собираемых при подозрении на наличие у кобеля бесплодия или синдрома феминизации, вызванного опухолью клеток Сертоли, будет разным (более детальная информация по сбору анамнеза при заболеваниях органов размножения кобелей приведена в последующих главах книги).
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Тщательное физикальное исследование кобеля так же важно, как сбор анамнеза. Выявление патологических процессов в других органах необходимо для успешного лечения любого заболевания органов размножения. Детальное обследование репродуктивного тракта - это лишь составная часть тщательного физикального исследования. Оценка состояния половых органов кобеля занимает меньше времени, чем общее физикальное исследование.
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1033
Она включает обследование мошонки, семенников, их придатков, полового члена, препуция и завершается исследованием предстательной железы через стенку прямой кишки.
Мошонка. Мошонка кобеля в норме покрыта негустой шерстью, гладкая и мягкая на ощупь, безболезненна при пальпации, кожный покров легко сдвигается вдоль семенников, и она имеет по всей длине примерно одинаковую толщину. Для осмотра состояния мошонки с целью выявления признаков воспаления, травм или опухания собаку кладут на бок и слегка приццднимают ее заднюю конечность. При хроническом или тяжелом воспалении мошонки может нарушаться местная терморегуляция. что, в свою очередь ведет к нарушению процессов образования сперматозоидов и или их сохранения в придатках семенников. Пальпацией мошонки с отделением се от семенников можно установить наличие спаек, оставшихся в результате предшествующего или текущего воспаления. Обнаружение в мошонке узелков позволяет заподозрить наличие гранулемы или опухоли. Описаны чешуйчато-клеточная карцинома, меланома и тучноклсточные опухоли мошонки (Jones, Joshua, 1982). Ее утолщение может быть следствием воспаления, онкологического процесса, скопления жидкости (в том числе лимфедемы), увеличения семенников и их придатков, а также пахово-мошоночной грыжи.
Семенники. У кобелей семенники обычно полностью выходят из пахового канала в мошонку в первые 10-14 дней после рождения и должны легко пальпироваться у 6-8-недельных щенков. Невозможность обнаружить таким способом оба семенника, особенно у кобелей старше 16-недельного возраста, позволяет диагностировать крипторхизм (см. стр. 1068). Однако у щенков меньшего возраста отсутствие семенников в положенном месте бывает связано с их временной ретракцией в паховый канал или латеральным смещением к половому члену при испуге или в состоянии перевозбуждения. Этому нс придают большого значения, если семенни
ки возвращаются обратно в мошонку, когда собака оказывается в спокойной обстановке и расслабляется.
Пальпируя семенники, обращают внимание на их рашер, форму и плотность. Левый семенник обычно располагается каудальнсс правого. Длина семенников у кобелей бывает от 1 до 5 см. а ширина - от 1 до 3 см. однако размеры семенников зависят от породы и невозможно указать их нормальный средний размер. В целом, размер семенников приблизительно пропорционален размеру тела кобеля. Хотя по ширине мошонки можно объективно судить о размере и массе семенников, а также суточном количестве образуемых в них сперматозоидов (Olar et al, 1983), се измеряют редко. Ассимстричнос положение, симметричное увеличение или малые размеры семенников, служат субъективными признаками их патологических изменений. Возможными причинами увеличения половых желез кобеля могут быть перекрут семенного канатика, новообразования, острые инфекционные и воспалительные процессы, а также пахово-мошоночная грыжа. Потенциальными причинами снижения размеров семенников являются их гегенерация, хронические инфекционные или воспалительны! процессы, гипоплазия и гермафродитизм.
Семенники должны быть парными, иметь овальную форму и гладкую поверхность. В норме их толщина в дорсовентральной плоскости должна быть немного больше, чем в латеральной плоскости, а кожа мошонки должна без труда сдвигаться вокруг семенников. Обнаружение при пальпации семенников неровностей и узлов, а также спаек мошонки предполагает наличие хронического воспаления, инфекции или опухоли, а болезненность указывает на возможность острого орхита или на перекрут семенника (особенно если он увеличен). Семенники должны быть плотными, по не твердыми. Если же они мягкие, рыхлые или тестообразные, то следует заподозрить их дегенерацию, а если приобретают твердость, то опухоль или острый или хронический орхит.
Рис. 27-1. Трансмиссивная венерическая опухоль, распространившаяся на луковицы полового члена. Обратите внимание на внешнее сходство новообразования с цветной капустой и наличие серозно-кровянисты выделений из опухоли. Фото Richardson RC, Purdue University.
1034 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Придаток семенника (эпидидимис) и семенной канатик. Придаток прикрепляется к дорсолатеральной поверхности семенника, так что головная и хвостовая части придатка расположены соответственно краниально и каудально. Его хвостовой конец, находящийся дорсальнее и медиальнее семенника, переходит в семявыносящий проток, который в составе семенного канатика входит в паховый канал через его внутреннее отверстие. Помимо семявыносящего протока в семенном канатике находятся семенная артерия, лозовидное венозное сплетение, лимфатический сосуд, нервы и поднимающая семенник мышца (m.cremaster). Придаток семенника и семенной канатик каждого семенника подлежат пальпации (хотя это сделать не просто) для выявления участков утолщения или увеличения (что предполагает образование гранулемы), а также изменений, характерных для эпидидимита, аденомиоза придатков семенников или паховой грыжи. (Аденомиоз - диффузное расположение аденоматозной ткани в гладких мышцах). Относительное увеличение придатка может быть вызвано уменьшением соответствующего семенника. Посредством пальпации можно диагностировать также аплазию протока придатка семенника или семявыносящего протока. Однако эта патология чаще всего возникает при гранулеме сперматогенного эпителия и/или дегенерации семенника.
Половой член и препуций. В норме в отсутствие эрекции препуций полностью закрывает половой член. Небольшие препуциальные выделения обычно не имеют клинического значения (их причиной может быть легкий баланопостит). Беспокойство должны вызывать выделения, содержащие кровь или большое количество гноя. При легком («нормальном») баланопостите небольшие количества слизисто-гнойных выделений из препуция скапливаются на слизистой оболочке полового члена. Пенис в норме свободно перемещается внутри препуция и с легкостью выходит наружу при оттягивании препуция в каудальном направлении. Обычно пенис можно вывести из препуция вплоть до луковичных желез. Это не удается сделать при узком отверстии препуция (фимозе) или наличии спаек между ним и половым членом. Освобожденный от препуция половой член внимательно осматривают на наличие воспалительных изменений, травм, инородных тел и новообразований. При полном выдвижении пениса из препуция на нем в области луковиц иногда обнаруживают трансмиссивную венерическую опухоль (рис. 27-1). Слизистая оболочка полового члена в норме окрашена в беловато-розовый цвет, гладкая и прикосновение к ней не вызывает боли. Ее воспаление бывает обусловлено лимфоидной гиперплазией и развитием узелковых поражений (папул).
Путем тщательной пальпации определяют размер и форму кости полового члена. Ее врожденная деформация или перелом приводят к загибу пениса и невозможности его полной ретракции в пре
пуциальный чехол. Врожденное укорочение кости полового члена может привести к недостаточной твердости концевой части пениса, что затрудняет или делает невозможным осуществление кобелем полового акта.
Предстательная железа. Предстательная железа является единственной придаточной половой железой кобеля. В норме она расположена вблизи от краниального края тазовой кости, но при переполнении мочевого пузыря она может смещаться в брюшную полость в краниальном направлении. Предстательная железа окружает шейку мочевого пузыря, проксимальный отдел мочеиспускательного канала (уретры) и заднюю часть обоих семявыносящих протоков. Срединная перегородка делит эту железу на равные, гладкие и плотные доли, которые можно прощупать через стенку прямой кишки. У крупных собак прощупать удается только каудальную часть железы. Объем и масса предстательной железы вариабельны и зависят от возраста, породы и массы тела кобеля. Обнаружение при пальпации чрезмерного увеличения или уменьшения предстательной железы, асимметрии ее долей, аномальной плотности и болезненности указывает на наличие дисфункции железы и диктует необходимость ее тщательного диагностического обследования.
ОЦЕНКА КАЧЕСТВА СПЕРМЫ
Анализ спермы является составной частью диагностики бесплодия или пониженной фертильности кобелей. Его следует проводить в процессе рутинного обследования собак перед вязкой и искусственным осеменением или замораживанием спермы (см. гл. 32). При подозрении на простатит, орхит или эпидидимит показано также проведение бактериологического исследования (см. гл. 29 и 30). Поскольку в эякуляте содержатся живые сперматозоиды, с ним следует бережно обращаться, чтобы не допустить морфологических изменений и снижения подвижности половых клеток. Сперму необходимо исследовать сразу же после ее получения от животного - любая отсрочка увеличивает концентрацию в ней погибших сперматозоидов. По той же причине следует избегать резких колебаний температуры взятой пробы эякулята. Все используемое для работы со спермой оборудование желательно держать при температуре около 37° С. Пробирки и предметные стекла должны быть теплыми, чистыми, свободными от следов спирта, порошкообразных веществ или избыточного количества смазки.
Важно придерживаться одних и тех же методов сбора и анализа спермы. Макроскопическая и микроскопическая оценка качества спермы в большинстве случаев носит субъективный характер и поэтому должна проводиться квалифицированными специалистами. Однако уже выпускаются автоматические анализаторы, предназначенные для исследования спермы людей, быков, жеребцов и самцов ряда других видов животных. Появились
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
1035
Информацию об оценке племенных качеств кобелей можно найти в The Proceedings of the 1992 Annual Conference of the Society for Theriogenology.
ОЦЕНКА ПЛЕМЕННЫХ КАЧЕСТВ КОБЕЛЯ (формуляр разработан Обществом Териогенологии, РО.Вох 2118. Hastings, NE 88902-2118. Телефон (402J4SJ-0392 Факс (402)461-4103)
Случай №Дата
Клиент Адрес
Кличка собаки Порода и окрас
Дата рождения Регистрационный №Татуировка
Анамнез
Основания к проведению оценки Дата последней вязки
Дата получения Дата тестирования Использованный тест
последнего помета на бруцеллез__________________________________________________________
Имеющиеся данные о генеалогии___________________________________________________________
Генеалогические данные о случаях бесплодия______________________________________________
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Общее клиническое состояние Масса тела
Наличие других проблем со здоровьем_____________________________________________________
Пенис/препуций Семенной канатик
Мошонка Предстательная железа
Придатки семенников: (правый)(левый)(в целом)
Семенники: ширина (правый)(левый)(в целом)
Консистенция (твердый/нормальный/мягкий): (правый)(левый)
Наличие новообразований/жидкости/болезненности/других нарушений
Сбор спермы
Дата последнего сбора Либидо/легкость получения спермы
Использование пробной суки Стадия полового цикла Применение феромона
Использованное обордование (искусственная вагина/другие)
Оценка качества спермы Цвет Объем оН Концентрация сперматозоидов Общее количество сперматозоидов
(сперматозоиды/мл) (сперматозоиды/эякулят)
Фракция 1 __ ______________ _____________________________ _____________________________
Фракция 2 __ ______________ _____________________________ _____________________________
Фракция 3 __ ______________ _____________________________ _____________________________
ПОДВИЖНОСТЬ:
Относительное количество подвижных сперматозоидов (%)
Относительное количество сперматозоидов, совершающих поступательные движения (%)
Растворитель (если применялся)Скорость: медленная средняя высокая
МОРФОЛОГИЯ:
Метод (краситель): Фазово-контрастная микроскопия
% нормальных сперматозоидов__________________________________________________________
Общее количество нормальных сперматозоидов
(% нормальных сперматозоидов х Общее количество сперматозоидов)
Аномалии головки сперматозоидов______________________________________________________
Аномалии срединной части сперматозоидов______________________________________________
Аномалии хвоста сперматозоидов_______________________________________________________
ЦИТОЛОГИЯ (0-4 +) (эритроциты, лейкоциты, эпителиальные клетки, бактерии и другие):
Фракция 1 Фракция 2 Фракция 3
ЗАКЛЮЧЕНИЕ:
Подпись Занимаемая в клинике должность
Рис. 27-2. Анкета для оценки репродуктивной способности кобелей (рекомендована Обществом териогенологии США)
публикации с данными компьютерных анализов спермы кобелей (Smith, England, 2000; Verstegen et al, 2000). Переход на объективные методы исследования сперматозоидов, возможно, позволит установить целый ряд ранее неизвестных причин бесплодия (England, Plummer, 1993; Hewitt et al,
2000; Hoist et al, 2000), но пока такие методы еще не получили широкого распространения. Независимо от того, какой метод был использован для оценки качества спермы кобеля, ветеринарный специалист должен внести результаты ее анализов в специальный формуляр (рис. 27-2).
1036 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Рис. 27-3. Латексная искусственная вагина со стерильной пластиковой пробиркой, применяемая для сбора спермы кобелей.
Методика получения проб спермы
Пробу спермы кобеля можно получить во время его садки на течную суку, возбуждая его сукой или посредством мастурбации. Элсктроэякуляция не нашла широкого применения, так как ее приходится проводить под общим наркозом. Идеальным приспособлением для получения спермы у кобелей служит латексная искусственная вагина (например, искусственная вагина для собак, выпускаемая компанией Synbiotics), по которой сперма стекает в стерильную пластиковую пробирку (рис. 27-3). Сообщалось о том, что при контакте с теплым латексом активность сперматозоидов значительно снижается, однако в нашей практике такого не случалось. Наружный край искусственной вагины смазывают изнутри гелем во избежание его контакта со спермой. Много геля использовать нельзя, так как он влияет на жизнеспособность сперматозоидов. Сперму лучше собирать в пластиковые пробирки, поскольку стеклянные пробирки часто разбиваются при совершении кобелем интенсивных толчковых движений тазом. Следует пользоваться виниловыми, а нс латексными перчатками, так как латекс снижает подвижность сперматозоидов (Althouse et al, 1991).
Возбуждение сукой. Легче всего получить сперму от кобеля во время его садки на суку, находящуюся в проэструсе или эструсе. Можно воспользоваться также сукой в фазе анэструса, но интерес кобеля к таким сукам непостоянен и, соответственно, получить эякулят удается не всегда. Выходом из такой ситуации может стать нанесение на наружные половые органы и бедра находящейся в анэструсе суки феромона (метилового эфира
р-оксибензосвой кислоты; Eau d’Estrus, Synbiotics, Malvern, РА) (Keenan, 1998). К сожалению, нам только в отдельных случаях удавалось достичь успеха таким способом. Более эффективно вместо феромона наносить влагалищные выделения течной суки. Выделения собирают марлевыми тампонами и хранят в замороженном виде. По мере надобности эти тампоны размораживаю! и обрабатывают ими наружные половые органы суки, чтобы возбудить кобеля специфическим запахом (Keenan, 1998; Freshman, 2001). Во время сбора спермы кобель и сука должны находиться на привязи, причем суку фиксируют таким образом, чтобы у кобеля был доступ к ее бедрам и наружным половым органам. Иногда на суку надевают намордник (это бывает особенно важно, если она не находится в половой охоте) с тем, чтобы она нс покусала ветеринара, проводящего сбор спермы, его ассистента и кобеля. Если ветеринарный врач правша, то он встает слева от кобеля, удерживая искусственную вагину левой рукой, а препуций/половой член кобеля - правой рукой. Ассистент подводит кобеля к правому бедру суки. Неопытный кобель начинает с заигрывания и пробных садок, что занимает какое-то время. Пока кобель обнюхивает и облизывает промежность суки, ветеринар осторожно массирует его половой член через препуций. С ростом полового возбуждения кобель предпринимает попытку садки и начинает совершать тазом толчковые движения, что сопровождается увеличением пениса и его луковиц. При появлении у кобеля эрекции или увеличения луковиц полового члена ветеринар отводит рукой препуций в каудальном направлении за луковицы, полностью высвобождая половой член. В случае запаздывания увеличенные луковицы затрудняют выведения пениса из препуция. Если эрекция произошла еще до того, как луковицы увеличились, кобель может испытать неприятные ощущения и боль. В результате эрекция может прекратиться прежде, чем произойдет эякуляция, или в процессе последней. В момент, когда кобель делает попытку ввести пенис в вульву суки, ветеринар направляет пенис в приспособление для сбора спермы. Если с этой целью пользуются искусственной вагиной, то ее надевают на весь половой член, включая луковицы. Для сохранения эрекции пенис проксимальнее луковиц слегка сдавливают пальцами поверх искусственной вагины. Эякуляция начинается практически одновременно с совершением кобелем быстрых толчковых движений тазом. Следует быть внимательным, чтобы не травмировать половой член в результате слишком глубокого его погружения в искусственную вагину. С началом эякуляции вагину постепенно сдвигают с луковиц полового члена (если только не используется недостаточно мягкая и растяжимая конусовидная вагина). Это позволяет избежать травм луковиц, которые продолжают увеличиваться в процессе эякуляции.
Первую, бедную сперматозоидами фракцию эякулята собирают в течение 5-20 секунд во время
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1037
Рис. 27-4- Проба эякулята кобеля, в которой видны мутная, богатая сперматозои хами вторая фракция (ниже стрелки) и прозрачный секрет предстательной железы (третья фракция, выше стрелки).
совершения кобелем толчковых движений тазом, а в последующие 0,5-4 линуты после их прекращения получают вторую фракцию с высокой концентрацией сперматозоидов. После эякуляции этих фракций кобель обычно соскакивает с суки, переступая через нее и через руку ветеринара задней конечностью. При этом половой член животного оказывается повернут на 180° и вытянут в каудальном направлении. Такая смена позы у многих кобелей в течение нескольких минут сопровождается эякуляцией секрета предстательной железы; объем этой фракции эякулята зависит от продолжительности нахождения спаривающихся собак в положении «замка». Сдавливание пальцами полового члена проксимальнее его луковиц поддерживает состояние эрекции и обеспечивает сбор секрета. О том, что вместо богатой сперматозоидами второй фракции эякулята в пробирку начал поступать чистый секрет предстательной железы, судят по изменению внешнего вида эякулята, который из мутного становится прозрачным (рис. 27-4). Пробирку для сбора спермы сразу убирают или меняют на другую, если чистый секрет нужен для проведения цитологического и бактериологического анализов. Секрет предстательной железы не нужен ни для оценки подвижности и морфологии сперматозоидов, ни для искусственного осеменения. Чтобы снизить до минимума риск получения артефактов, первые две фракции спермы необходимо исследовать сразу после их получения, не дожидаясь окончания сбора секрета предстательной железы. Если собираемая сперма предназначена для искусственного осеменения секрет предстательной железы используют для доведения общего объема эякулята до 5-10 мл
что облегчает последующую работу с ним Однако и в такой ситуации количество собираемого вместе с остальными фракциями эякулята секрета предстательной железы ограничивают из-за опасений его отрицательного влияния на подвижность и жизнеспособность сперматозоидов.
После завершения сбора спермы специалист отпускает половой член кобеля и осторожно снимает с него искусственную вагину. Кобеля и суку разводят по разным комнатам. В большинстве случаев изолировать суку можно и раньше - сразу же после начала эякуляции. Эрекция пропадает у кобеля в течение нескольких минут после того, как ветеринар перестает сдавливать пальцами основание пениса и его луковицы. Перед тем, как заводчик уведет кобеля из ветеринарной клиники, необходимо уоедиться в том, что половой член животного занял нормальное положение в полости препуция.
Мастурбация. У большинства кобелей сперму можно получить без возбуждения сукой. Основные этапы сбора спермы обоими способами приблизительно одинаковы, с той лишь разницей, что в отсутствие суки у кобеля труднее вызвать эрекцию. С этой целью осторожно сдвигают препуций в каудальном направлении, высвобождая половой член вплоть до его проксимальной части и луковиц; сделать это необходимо до начала эрекции. С началом эрекции препуций сдвигается с луковиц пениса. Одновременно пенис легко сдавливают большим и указательным пальцами у основания вблизи луковиц и на вышедший из препуция половой член и луковицы надевают искусственную вагину. Кобель при этом рефлекторно совершает толкательные движения тазом, и у него начинается эякуляция. В случае преждевременного прекращения эрекции до начала или завершения эякуляции собаке на несколько минут дают передышку и вновь предпринимают попытку получения спермы.
Причины неудачных попыток получения спермы
Имеется много причин, по которым попытки получения спермы у кобелей заканчиваются неу ачей. Чаще всего это происходит из-за недостаточно хорошее техники проведения сбора спермы, нарушения репродуктивных функции, чрезмерной нервозности и перевозбуждения кобеля, а также из-за присутствия его владельца. Основными ошибками при взятии проб спермы являются оставление луковиц пениса в препуции, несвоевременность выведения пениса из препуциальной полости, приложение чрезмерной силы и сдавливания, использование холодной искусственной вагины и преждевременное ее надевание на пенис. По мере приобретения ветеринарным врачом опыта большая часть перечисленных технических проблем устраняется.
Часто затруднения возникают при взятии проб спермы в незнакомых кобелю условиях, например, в ветеринарной клинике. Будучи напуганным, он
1038 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
может не обращать никакого внимания даже на теч-ную суку. После пребывания в течение нескольких часов в новой обстановке у собак обычно пропадает чувство страха. При взятии спермы следует свести к минимуму воздействие на кобеля любых отвлекающих факторов. В комнате должно быть тихо, полы не должны быть скользкими. Следует избегать присутствия посторонних людей, которые отвлекают кобеля своими разговорами, смехом, фотографированием происходящего со вспышкой и т.п. Белые халаты на ветеринарном враче и ассистенте также могут вызывать у животного испуг или стресс. Присутствие хозяина влияет на сбор спермы по-разному. Попадаются кобели, которым необходимо, чтобы рядом был знакомый человек, а от некоторых можно получить сперму только в домашних условиях. Одни кобели позволяют сбор спермы только хозяину, а у других сбор возможен только в его отсутствие. Поэтому обычно владельца кобеля просят присутствовать на начальном этапе процедуры, а затем в зависимости от обстоятельств определяют необходимость его пребывания в той же комнате или принятия более активного участия во взятии спермы.
Наличие у кобеля заболеваний органов размножения может стать препятствием при получении его спермы. Чаще всего такое случается при слабом либидо у кобеля, испытывании им боли (например, из-за острых орхита или простатита, дегенеративного артрита и т.д.) или нарушении нормального полового поведения, связанного с предыдущим негативным опытом.
Макроскопическая оценка спермы
Объем. Объем получаемой спермы может быть самым различным, поскольку зависит от возраста, размеров кобеля, частоты его вязок, а также количества собранного секрета предстательной железы. От здорового кобеля при одной эякуляции удается получить от 1 до 40 мл спермы. Для оценки качества спермы важно полностью собрать богатую сперматозоидами вторую фракцию эякулята. Объем этой наиболее мутной фракции колеблется от 0,5 до 12 мл. Третья фракция эякулята (секрет предстательной железы) полупрозрачна (рис. 27-4). Как только при сборе эякулята в пробирку начнет поступать вместо мутной жидкости прозрачная, можно считать, что вторая фракция собрана полностью, и остановить процедуру сбора. Обычно этот момент наступает через 5 мин после того, как кобель прекращает совершать толчковые движения тазом. Между объемом эякулята и плодовитостью собак нет корреляции, хотя отсутствие эякулята служит явным признаком бесплодия.
Цвет. Сперма кобеля в норме имеет белый или матовый цвет. Степень ее прозрачности находится в обратно-пропорциональной зависимости от концентрации сперматозоидов. Прозрачность и бесцветность эякулята указывают на отсутствие в нем
сперматозоидов (азооспермию). Он может становиться желтым из-за примеси мочи или гноя. Зеленый цвет эякулята, содержащего или не содержащего конгломератов, сгустков или хлопьев, позволяет предположить наличие гнойного или инфекционного процессов в органах размножения. Красный цвет спермы обычно указывает на попадание в нее крови из предстательной железы или травмированного полового члена. Обнаружение крови в сперме не обязательно служит признаком патологического процесса в органах репродукции. У некоторых собак, слишком долго находившихся перед вязкой в состоянии полового возбуждения, в предстательной железе могут возникать быстро прекращающиеся кровотечения. В таких случаях изоляция кобеля от течной суки на 12-24 ч приводит к исчезновению крови из его спермы. Однако рецидив появления крови и других морфологических изменений спермы является тревожным сигналом и требует установления его причин. В целом, любое изменение нормального цвета спермы должно настораживать клинициста и в таких случаях необходимо проведение тщательного клинического обследования органов репродукции животного. Любой фактор (например, моча, гной и кровь), способный изменить цвет спермы, может повлиять на концентрацию, подвижность и жизнеспособность сперматозоидов.
pH. Нормальная величина pH спермы кобеля находится в пределах от 6,3 до 6,7. Этот показатель частично зависит от количества секрета предстательной железы в собранной пробе эякулята. В норме секрет предстательной железы имеет pH 6,0-7,4 (в среднем 6,8) (Nett, Olson, 1983). Предполагается, что его защелачивание приводит к повышению подвижности сперматозоидов и помогает нейтрализовать кислую среду влагалищной слизи во время вязки (Jones, Joshua, 1982). Повышение pH спермы может быть связано с незавершенным процессом эякуляции или воспалением семенников, их придатков и предстательной железы.
Микроскопическая оценка спермы
Подвижность. Определение подвижности сперматозоидов следует проводить в кратчайшие сроки после получения спермы. С этой целью каплю эякулята помещают на чистое предметное стекло и исследуют под световым микроскопом при увеличении х200-400 на наличие прямолинейно перемещающихся сперматозоидов и их агглютинацию. Сперматозоиды кобеля устойчивы к холодовому шоку, поэтому подогрев предметного стекла с исследуемой спермой не обязателен (Johnston et al, 2001). Относительное количество активных, поступательно двигающихся сперматозоидов в пробах спермы значительно быстрее снижается при комнатной температуре, чем при температуре тела. Оно уменьшается даже от нагревания тестируемых проб светом при просмотре препаратов под микроскопом. При микроскопировании проб эякулята при низким уве
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1039
личении нередко ошибочно принимают колебания сперматозоидов из стороны в сторону за прямолинейные движения, что создает видимость их высокой активности. Высокая концентрация сперматозоидов в эякуляте затрудняет оценку их активности, поэтому перед исследованием высококонцентрированную сперму разбавляют секретом предстательной железы того же кобеля, фосфатным буфером, 2,9% раствором цитрата натрия или специальным разбавителем спермы (Johnston et al, 2001).
Подвижность сперматозоидов оценивается визуально. При этом принимается во внимание характер подвижности, т.е. тип совершаемых сперматозоидами движений. Нормальным считается прямо-линейно-поступательное движение; оно отражает жизнеспособность сперматозоидов и их способность добраться до яйцеклетки и оплодотворить ее. В нормальной сперме свыше 70% сперматозоидов энергично двигаются прямолинейно. Следует оценивать характер подвижности каждого сперматозоида в отдельности. Колебательные (из стороны в сторону) или манежные (по маленькой круговой траектории) движения, считаются ненормальными. Относительное количество активно двигающихся сперматозоидов в пробах спермы меняется при значительных изменениях температуры, контакте с кислыми растворителями, водой, мочой, гноем, кровью или гелями, применяемыми для смазки искусственной вагины. Первый эякулят, полученный от кобеля после длительного отсутствия вязок, может содержать повышенное количество старых и погибших сперматозоидов, которые продолжительное время находились в придатках семенников. В такой сперме относительное количество подвижных сперматозоидов снижено. Но в эякулятах, полученных от тех же животных через несколько дней, двигательная активность половых клеток, как правило, восстанавливается. Неподвижные или с пониженной двигательной активностью живые сперматозоиды бывают в сперме кобелей при синдроме Картагенера, представляющего собой редкое аутосомно-рецессивное наследственное заболевание. Этот синдром сопровождается рецидивами инфекций респираторного тракта, стерильностью кобелей, транспозицией внутренних органов, глухотой и гидроцефалией (Edwards et al, 1986).
При обнаружении в пробе эякулята большого количества неподвижных и мертвых сперматозоидов проводят повторное взятие спермы у кобеля, уделяя особое внимание соблюдению правил ее получения и тестирования, чтобы до минимума снизить возможность артефактов. Контакт с латексом (например, с изготовленными из него перчатками) может оказать негативное влияние на подвижность сперматозоидов (Althouse et al, 1991), поэтому при сборе спермы изделиями из него лучше не пользоваться. Их можно заменить виниловыми аналогами, поскольку этот синтетический материал не влияет на подвижность сперматозоидов. Пониженная двигательная активность сперматозоидов в повторно
взятых пробах указывает на возможность заболевания семенников, их придатков или предстательной железы (см. стр. 999).
Концентрация. Концентрацию или количество сперматозоидов в эякуляте определяют умножением их количества в 1 мл спермы на общий объем полученного эякулята (в мл). Общий объем спермы в определенной степени зависит от объема попавшего в него секрета предстательной железы (третьей фракции эякулята) и поэтому может быть разным. Метод определения концентрации сперматозоидов в 1 мл неточен и им не стоит пользоваться. Вместо него проводят подсчет сперматозоидов в пробе эякулята с помощью калиброванного спектрофотометра, счетчика Каултера или гемоцитометра. Для гемоцитометрического подсчета сперматозоидов можно пользоваться гемоцитометром Нейбауера и коммерческими разбавителями лейкоцитов (например, набором реактивов 1/100 Unopette, изготавливаемым фирмой Becton-Dickinson and Со, США), что позволяет относительно быстро получить результат при минимальных затратах средств. Осторожно перемешивают пробу эякулята. С помощью одноканальной пипетки на 20 мкл отбирают 20 мкл пробы и переносят ее в специальную емкость, содержащую 2 мл разбавителя. Разведенную пробу вносят в обе камеры гемоцитометра Нейбауера, подсчитывают количество сперматозоидов в центральных квадратах (рис. 27-5) девяти больших квадратов с каждой камеры гемоцитометра и рассчитывают среднее арифметическое значение. Количество сперматозоидов в большом центральном квадрате соответствует их концентрации в сперме, выраженной в миллионах клеток/мл. Умножением полученной величины на объем эякулята определяют общее количество сперматозоидов. У здоровых кобелей общее количество сперматозоидов в эякуляте колеблется от 200 миллионов до 1 биллиона и выше. Оно отчасти зависит от таких факторов, как возраст, масса семенников, уровень половой активности кобеля и, возможно, даже сезона (см. стр. 1043). У кобелей крупных пород общее количество сперматозоидов в эякуляте выше, чем у кобелей маленьких пород (Amann, 1986).
Морфология. Препараты неразведенного эякулята исследуют под световым микроскопом для выявления сперматозоидов, имеющих морфологические отклонения. Наиболее часто с этой целью пользуются методом раздавленной капли. Небольшую каплю свежей неразведенной спермы помещают на предметное стекло и покрывают большим покровным стеклом. В результате сперма растекается между двумя стеклами в виде тонкой пленки, что дает возможность изучить структуру находящихся в ней сперматозоидов без проведения специальной окраски. Такой анализ лучше всего проводить с помощью фазово-контрастного микроскопа.
Можно также изучать морфологию сперматозоидов в мазках эякулята, которые готовят подобно мазкам крови. Мазки подсушивают на воз-
1040 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Рис. 27-5. Схематическое изображение гсмоцигометрической счетной камеры, ви х под микроскопом. На ней имеется 9 больших квадратов площадью 1 мм (А) и 25 маленьких квадратов внутри центрального большого квадрата (Б). В большинстве случаев для определения концентрации сперматозоидов в 1 мл эякулята их количество. подсчитанное в большом центральном квадрате (на рис. А обозначен цифрой 5), умножают на 106. При очень большом количестве сперматозоидов в поле зрения подсчитывают их количество в 5 маленьких квадратах (на рис. Б обозначены цифрами 1-5). Умножением полученной величины на 10 получаю! количество сперматозоидов в 1 мл эякулята.
духе, фиксируют и окрашивают. Для их окраски применяют разные красители. В большинстве ветеринарных лабораторий часто с этой целью пользуются ускоренным трехэтапным методом Гимза-Райта. Для его проведения можно воспользоваться готовыми красителями Harleco Hemacolor (ЕМ Diagnostic Systems, Gibbstown, США; DifT Quik, VWR International, США) или Cameo Stain Pack (Cambridge Diagnostic Products, CILIA). Это быстрый, простой и эффективный метод окраски. Однако он не позволяет окрашивать акросомальную часть сперматозоидов. Такие красители как тушь и эозин-нигрозин хорошо прокрашивают фон мазка, а не клетки. Это делает контуры сперматозоидов значительно более отчетливыми, чем при непосредственной их окраске. При окраске эозин-нигрозином на теплом предметном стекле осторожно смешивают по 1 капле рабочего раствора красителя и спермы. Из полученной смеси готовят мазок, который подсушивают на воздухе, фиксируют и микроско-пируют. Краситель Spermac (Fertility Technologies Inc. США) обеспечивает отличную дифференциальную окраску сперматозоидов. При этом их ядра окрашиваются в красный цвет, а акросома. средняя часть и хвост становятся зелеными, причем экваториальная часть акросомы окрашивается наиболее слабо (Oettle, 1995). Этот метод может быть применен для окрашивания разведенной спермы, поскольку на его результаты не влияет наличие в составе разбавителей яичного желтка, сыворотки крови или молока. Окраска этим красителем не позволяет дифференцировать лейкоциты. Kustritz и соавторы (1998) показали, что соотношение спер
матозоидов с нормальной и патологической морфологией в препаратах, приготовленных из одних и тех же проб спермы, может менял ься в зависимости от использованных методов окраски. Это позволяет предположить, что в процессе окрашивания мазков могут происходить изменения морфологии сперматозоидов. Результаты этого исследования подчеркивают необходимость придерживаться стандартных методов приготовления мазков спермы и их окрашивания при сравнительной оценке морфологии сперматозоидов в эякулятах разных собак, а также в разных пробах спермы, полученных от одного и того же животного.
Оценку морфологии сперматозоидов проводят при микроскопировании препаратов спермы под масляной иммерсией. Нормальный сперматозоид состоит из акросомы, головки, шейки, срединной части и хвоста (рис. 27-6). Акросома представляет собой подобную шапочке структуру, которая покрывает немногим более половины передней части головки сперматозоида. У нормального сперматозоида срединная часть приблизительно в 1,5 раза длиннее головки. При микроскопировании делают попытки обнаружить у отдельных сперматозоидов нарушения структуры головки, срединной части и хвоста (рис. 27-6).
Наиболее часто обнаруживаются такие патологические изменения сперматозоидов как отделение головки или акросомы, появление выпячивания на акросоме, наличие проксимальной или дистальной цитоплазматических капелек, искривление (например, загиб) срединной части, хвоста (загиб в проксимальном направлении или закручивание вокруг
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1041
Головка -
Шейка —
Рис. 27-6. Нормальный сперматозоид кобеля (препарат окрашен гсматоксилин-эсвином; увеличение хЮОО)
срединной части) (Kustrit/ et al, 1998). Изменения морфологии сперматозоидов можно подразделить на первичные и вторичные (табл. 27-1; рис. 27-7 и 27-8). Первичные нарушения возникают в процессе проходящего в семенниках сперматогенеза. Вторичные неспецифичсскис нарушения морфологии сперматозоидов появляются позднее - после попадания спсрмиев в систему семявыносящих канальцев и протоков, локализованных в придатках семенников, или в результате перенесения кобелем инфекций, лихорадочных заболеваний и травм, а также при взятии проб эякулята, их хранении и исследовании (Johnston, 1991). При анализе качества спермы кобе-
ТА БЛИЦА 27-1. ПЕРВИЧНЫЕ И ВТОРИЧНЫЕ СТРУКТУРНЫЕ ДЕФЕКТЫ СПЕРМАТОЗОИДОВ КОБЕЛЯ
Первичные нарушении морфологии
Головка
Все отклонения структуры от нормы
Срединная часть
Абаксиальное прикрепление
Раздвоенная срединная часть Истонченная срединная часть Утолщенная срединная часть Разорванная срединная часть Закрученная в узел или загнутая срединная часть Наличие проксимальных (в области шейки) цитоплазматических капелек
Хвост
Загиб хвоста
Наличие нескольких хвостов
Вюричные нарушения морфологии
Отделенные (изолированные) головка или хвост, имеющие нормальную структуру
Отделенная (изолированная) акросома Загиб хвоста
Наличие дистальной (локализованной в дистальной части срединной части) цитоплазматической капли
лей каждый раз необходимо оценить морфологию, по меньшей мере. 200 сперматозоидов. Отделение хвостов и головок от остальной части сперматозоидов не равнозначно - патологическими формами считают только отделившиеся головки, но не хвосты. Это обусловлено частым спонтанным отделением хвостов сперматозоидов в процессе изготовления и окрашивания препаратов, что не позволяет дифференцировать подобные артефакты от истинных патологических форм. Тем не менее, лишенные хвоста сперматозоиды не способны активно двигаться, что дает основание считать их патологическими. Более детальную информацию по классификации патологических форм сперматозоидов собак читатель может найти в статье Octtle (1995).
Так сложилось исторически, что сперму кобеля стали считать нормальной при наличии в ней свыше 70° о сперматозоидов без морфологических дефектов и не более 10 и 20% сперматозоидов с первичными и вторичными морфологическими изменениями, соответственно. У собак выявлены положительные корреляции между концентрацией морфологически нормальных сперматозоидов в сперме и фертильностью, а также между общим количеством морфологически нормальных сперматозоидов в эякуляте и эффективностью оплодотворения (Oettle, 1993; Mickelson et al, 1993). Установлено, что плодовитость собак достоверно снижается, если относительное количество морфологически нормальных сперматозоидов меньше 60% (Oettle, 1993). Так, в группе, состоявшей из 23 кобелей, у которых более 60% сперматозоидов были морфологически нормальными, фертильными оказались 61° о собак, в то время как в группе из 15 кобелей, у которых в сперме было меньше 60% нормальных сперматозоидов, фертильность составляла только 13° о. Еше более точным показателем для предсказания фертильности кобелей является общее количество морфологически нормальных и поступательно двигающихся сперматозоидов в их эякулятах (Mickelsen et al, 1993). В одном из экспериментов искусственное осеменение 27 сук более чем 250x106 морфологически нормальными сперматозоидами, привело к развитию беременное!и в 82% случаев. Очевидно, что как общее количество сперматозоидов в эякуляте, так и их качественные характеристики (в первую очередь, морфология и подвижность) являются факторами, определяющими плодовитость кобелей. Хотя и известно, что структурные дефекты сперматозоидов связаны с бесплодием кобелей, остается неясным, какое именно влияние они оказывают на фертильность. К специфическим патоморфологическим изменениям сперматозоидов, ассоциированным с бесплодием собак, относят нарушения прикрепления или ультраструктуры срединной части, уменьшение головки и появление в области шейки проксимальных цитоплазматических капель (Johnston et al, 2001).
Цитология. Для обнаружения в сперме бактерий и воспалительных клеток мазки неразбавленного
1042 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Рис. 27-7. Примеры певичных дефектов сперматозоидов (окраска гематоксилин-эозином, увеличение х 1000). А. Сперматозоиды с ненормальной головкой и многочисленными хвостами, а также свернутым в кольцо хвостом. Б. Сперматозоид со свернутым в кольцо хвостом. В. Сперматозоид с ненормальной головкой и сперматозоид с нормальной головкой, но имеющий изогнутые срединную часть и хвост. Фото DeNicola DB, Purdue University.
Рис. 27-8. Примеры вторичных дефектов сперматозоидов (окраска гематоксилин-эозином, увеличение чЮОО). А. Сперматозоид с загнутым хвостом. Б. Сперматозоиды с загнутым хвостом и дистальной цитоплазматической каплей. В. Сперматозоид с загнутым хвостом и отделенная головка сперматозоида. Фото DcNicola DB, Purdue University.
эякулята окрашивают методом Райта или метиленовым синим. Иногда здоровые воспалительные клетки (нейтрофилы, макрофаги, лимфоциты и плазмоциты), а также эритроциты и бактерии могут присутствовать в сперме кобелей, не имеющих патологий репродуктивных органов. Загрязнение спермы в таких случаях происходит при прохождении ею уретры. Эпителиальные клетки могут попадать в сперму как из уретры, так и с препуция, чему способствует продолжительное отсутствие у кобеля вязок. Тем нс менее, присутствие в эякуляте кобеля
большого количества эритроцитов и воспалительных клеток считается ненормальным. Обнаружение внутриклеточных бактерий и нейтрофилов с признаками токсической дегенерации подтверждает наличие инфекции у животного, однако, их отсутствие не исключает инфицирования. Большое количество эритроцитов в сперме указывает на кровотечение, которое у кобелей чаще всего происходит в предстательной железе и половом члене. При аутоиммунном орхите в сперме появляется много моноядерных клеток и в ряде случаев - нейтрофилов (рис. 27-9).
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1043
Рис. 27-9. Мазок спермы 4-летнего дога, страдавшего бесплодием. У собаки при физикальном обследовании обнаружили маленькие, «бугорчатые» семенники, при цитологическом исследовании спермы - о тгоспсрмию и воспаление, при биопсии семенников - лимфоцитарный орхит. Результаты бактериологического анализа спермы - отрицательные. Обратите внимание на наличие в мазке спермы моноядерных клеток и нейтрофилов.
Бактериологическое исследование
Бактериологическое исследование спермы является неотъемлемой частью экспертизы спермы кобелей. Детальная информация о методах бактериологического исследования и интерпретации их результатов приведена ниже.
Факторы, влияющие на качество спермы
Половая зрелое! ь. Первые эякуляты достигших половой зрелости кобелей часто содержат погибшие и имеющие патоморфологические изменения сперматозоиды. В последующем общая концентрация сперматозоидов и концентрация нормальных зрелых клеток в их сперме возрастает, а относительное количество половых клеток со структурными дефектами снижается (Tahaetal, 1981b).
Частота эякуляции. Частота эякуляции оказывает непосредственное влияние на объем спермы и общее количество сперматозоидов в каждом эякуляте. Если кобеля вяжут или берут у него сперму 1-2 раза в день вместо того, чтобы делать это 2-3 раза в неделю, происходит небольшое снижение общего количества сперматозоидов в эякулатах. Это связано с постепенным истощением запаса сперматозоидов в придатках семенников. Когда этот запас подходит к концу, снижение общего количества сперматозоидов в эякулятах прекращается и у большинства собак в дальнейшем количество сперматозоидов стабилизируется на уровне их дневной продукции в семенниках, которая составляет около 400 х 106 сперматозоидов/дснь (Olar et al, 1983). Таким образом, хотя количество половых клеток в эякулятах снижается по мере увеличения частоты эякуляции, общее их количество в сперме, продуцируемой кобелем за неделю, остается отно
сительно постоянным и даже может возрастать на фоне более частых вязок или сбора спермы. Общее количество сперматозоидов в эякуляте может увеличиваться после предоставления кобелю нескольких дней отдыха, за время которого половые клетки вновь накапливаются в придатках семенников. У здоровых кобелей либидо сохраняется даже при ежедневной эякуляции.
Заводчиков обычно интересует как часто можно использовать кобеля в племенных целях, чтобы это не сказалось отрицательно на его плодовитости? Нет общих рекомендаций по данному вопросу - для каждого животного они должны даваться с учетом его особенностей. Оптимальная частота эякуляции индивидуальна, а ее влияние на либидо и качество спермы у разных животных неодинаково. Наиболее распространенными режимами вязок племенных кобел ci . которые, как предполагается, не сказываются на качестве спермы, являются: (1) каждые 48 час, затем ежедневно в течение 3 дней с последующим 2-днсвным отдыхом или (2) 2 раза в день с последующим 2-дневныг । отдыхом. В то же время, большинство здоровых кобелей можно на протяжении длительного времени ежедневно вязать или использовать в качестве доноров спермы без риска развития у них олигоспермии или снижения продуктивноеги. Однако такой режим не подходил для самцов с нарушенным сперматогенезом, у которых при столь частых эякуляциях неизбежно появляется олигоспер-мия (количество сперматозоидов, выделяемое при каждой эякуляции, ниже 200 миллионов). В таких случаях частоту вязок или сбора спермы снижают до уровня, при котором сперматозоиды начинаю! накапливаться в придатках семенников, и продуктивность кобелей восстанавливается (Olar et al, 1983).
Сезон. Концентрация сперматозоидов в эякулятах кобелей может меняться в течение года, повышаясь, как правило, весной и в начале лета и снижаясь в конце лета и осенью (Taha et al, 1981а). Предполагается, что сезонные изменения количества сперматозоидов могут быть связаны с продолжительностью светового дня и/или температурой окружающей среды. Несмотря на сезонные колебания, общее количество сперматозоидов в якулатах большинства собак в целом остается в пределах нормы (выше 200 миллионов). Здоровый кобель должен быть фертильным независимо от времени года и температуры окружающей среды.
Размер и патологическое состояние предстательной железы. Предполагается, что имеется зависимость между общим количеством выделяемых с эякулятом сперматозоидов и величиной здоровой предстательной железы. Объем эякулята возрастает с увеличением размеров и массы простаты. У собак, страдающих кистозной гиперплазией предстательной железы, напротив, объем эякулятов значительно ниже, чем у здоровых собак, имеющих сопоставимую по величине предстательную железу.
Brendlcr и соавторы (1983) в течение нескольких лет исследовали у группы биглеи размер прсдсга-
1044 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
тельной железы, наличие в ней патоморфологичес-ких изменений, объем эякулята и концентрацию гормонов в плазме крови. Полученные ими результаты показали, что предстательная железа продолжает увеличиваться в размере в первые 6 лет жизни собаки, но с четвертого года жизни ее секреторная функция снижается и соответственно уменьшается количество сперматозоидов в эякуляте. Помимо этого была выявлена тесная связь между началом развития гиперплазии предстательной железы и снижением количества сперматозоидов в эякулятах. С возрастом у кобелей происходило умеренное снижение концентрации андрогена в плазме крови, но активность 17Р-эстрадиола практически не менялась. Авторы предполагают, что изменения секреторной функции предстательной железы могут быть вызваны воздействием на нее эстрогена, ведущего к торможению выделения секрета этой железы и/или ее патологическим изменениям. При доброкачественной опухоли простаты ее секреторная функция снижается, но плодовитость кобелей и общее количество сперматозоидов в их эякулятах существенно не меняются. Влияние бактериального простатита или новообразований предстательной железы на ее секреторную функцию не исследовали, но можно предполагать их негативное воздействие. При простатите подвижность и жизнеспособность сперматозоидов снижаются (см. стр. 1088).
Размер семенников. Показана прямая корреляция между массой паренхимы семенников и, соответственно, их размером и количеством образуемых в течение суток сперматозоидов (Olar et al, 1983; Amann, 1986). В группе, состоявшей из И здоровых кобелей, ежедневно проводили сбор спермы на протяжении двух 10-дневных периодов. Ежедневная продукция сперматозоидов у этих животных составила в среднем 11,7 ± 0,5 миллионов/г паренхимы семенников. У 7 других здоровых кобелей сперму брали ежедневно на протяжении двух 20-дневных периодов. В этой группе количество ежедневно получаемых сперматозоидов оказалось в среднем равным 16,7 ±1,4 миллионов/г паренхимы семенников. Полученные данные позволяют предположить, что по мере того как увеличивается масса/размер семенников, продукция сперматозоидов и их количество в эякуляте также повышаются. В целом, у кобелей маленьких пород образуется меньше сперматозоидов, чем у кобелей крупных пород, что соответствует размерам их семенников.
Ширина мошонки (или ее окружность) может служить показателем, объективно характеризующим размер семенников, а ее сопоставление с величиной животного - способом выявления кобелей с уменьшенными по сравнению с нормой семенниками (Woodall and johnstone, 1988). Однако ширину мошонки невозможно точно измерить. Этот показатель существенно различается даже у кобелей с одинаковой массой тела, что отчасти связано с породными различиями. Кроме того, наличие «нормальной» по размеру мошонки отнюдь не означает,
что у кобеля все обстоит благополучно со сперматогенезом. На основании серийных промеров ширины или окружности мошонки кобеля можно судить об изменении размера его семенников, например, об их уменьшении в результате дегенеративных процессов. Такой подход дает значительно больше информации о концентрации сперматозоидов в эякулятах кобелей, чем случайное проведение промеров ширины или окружности мошонки.
Окончательная интерпретация результатов оценки качества спермы
К сожалению, ни один из показателей, определяемых при оценке качества спермы, сам по себе не может служить точной мерой плодовитости кобелей, поскольку она зависит от многих факторов. Наиболее тесно коррелируют с плодовитостью кобелей общее количество сперматозоидов в эякуляте, относительное количество сперматозоидов, совершающих поступательные движения вперед, а также их морфология. Для того чтобы признать кобеля пригодным для использования в племенных целях, качество его спермы должно удовлетворять, по меньшей мере, трем критериям (таблица 27-2). Однако, даже отвечающий этим критериям кобель не обязательно плодовит. Точно так же, несоответствие этим требованиям не является признаком его низкой плодовитости. Рецидивы азооспермии (отсутствия сперматозоидов в сперме) или некроспер-мии (наличия в сперме только мертвых сперматозоидов) служат единственными признаками, по которым ветеринарный врач может диагностировать у собаки бесплодие. Но даже в таких случаях важно помнить о том, что результаты однократного исследования спермы далеко не всегда отражают реальное состояние сперматогенеза в извитых канальцах семенников животного в день получения его эякулята. Временное нарушение процессов образования и созревания сперматозоидов может становиться причиной обратимых, кратковременных
ТАБЛИЦА 27-2. КРИТЕРИИ ОЦЕНКИ НОРМАЛЬНОЙ СПЕРМЫ КОБЕЛЯ
Основные параметры, определяющие плодовитость Общее количество сперматозоидов в эякуляте превышает 200 миллионов.
Более 70% сперматозоидов совершают прямолинейно-поступательные движения.
Нормальную морфологию имеют свыше 70%, а первичные и вторичные дефекты структуры - менее 10 и 20% сперматозоидов, соответственно.
Дополнительные параметры
Объем спермы: колеблется в пределах от 1 до 40 мл/эякулят Цвет спермы: от белого до матового
pH спермы: от 6,3 до 6,7 (pH секрета предстательной железы - от 6,0 до 7,4)
Наличие в мазках спермы: единичных эпителиальных клеток, эритроцитов, лейкоцитов и бактерий
Активность щелочной фосфатазы спермы: выше 5000 ЕД/л
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1045
олигоспермии или азооспермии. Только повторное получение тех же результатов при проведении анализов спермы в течение последующих 6 месяцев может дать основания для постановки окончательного диагноза азооспермии и признания кобеля стерильным.
ЩЕЛОЧНАЯ ФОСФАТАЗА СПЕРМЫ
Определение активности щелочной фосфатазы спермы является одним из методов диагностики азооспермии кобелей (см. стр. 1105). Активность этого фермента в сперме и сыворотке крови определяют одним и тем же методом. Щелочная фосфатаза спермы образуется в придатках семенников (Frenette et al, 1986) и служит маркером присутствия секрета придатков семенников в эякуляте. У большинства собак с нормальным сперматогенезом активность щелочной фосфатазы в сперме превышает 5000 ЕД/л (Johnston, 1991). Пониженная активность фермента в сперме дает основание предполагать наличие непроходимости обоих семявыносящих путей, или эпидидимита. Пресперма образуется в предстательной железе (England et al, 1990) и содержит щелочную фосфатазу в низкой концентрации. Поэтому неполная эякуляция, при которой в сперму попадает мало секрета придатков семенников и большое количество секрета предстательной железы, приводит к снижению активности щелочной фосфатазы в эякуляте.
Отсутствие или низкая концентрация в сперме карнитина, образующегося, по всей видимости, в придатках семенников, так же как и низкая активность щелочной фосфатазы спермы, может служить маркером азооспермии (Olson et al, 1987). К сожалению, определение карнитина в сперме пока не доступно для рутинных исследований в ветеринарии.
БАКТЕРИОЛОГИЧЕСКИЙ АНАЛИЗ ОРГАНОВ РАЗМНОЖЕНИЯ
Диагностика бактериальных инфекций половых органов кобелей включает исследование их спермы, мочи, полученной посредством предтазового цистоцентеза, а также секрета предстательной железы или фрагмента ее паренхимы, полученных при аспирации или биопсии (см. стр. 1090). Посевы мочи позволяют выявить инфицирующие бактерии и подобрать антибиотики для лечения орхита, эпидидимита и простатита. Бактериологическое исследование спермы проводят для подтверждения инфицирования семенников и их придатков (посевы второй фракции эякулята) или предстательной железы (посевы третьей фракции эякулята). Бактериологический анализ спермы является неотъемлемой частью оценки ее качества, а также позволяет обнаружить при цитологическом исследовании воспалительные клетки и бактериальный орхит/эпиди-димит или простатит.
При интерпретации результатов бактериологического исследования органов размножения часто возникают сложности, особенно в случаях клинически здоровых кобелей и сук. В посевах из влагалища, полости препуция и спермы даже здоровых собак часто обнаруживаются различные бактерии. Подавляющее большинство выделенных бактерий, включая Р-гемолитический стрептококк и микоплазму, являются компонентами нормальной микрофлоры (Bjurstrom, Linde-Forsberg, 1992а; 1992b). Многие хозяева, предоставляя своего кобеля для вязки, требуют от другой стороны документальных подтверждений отрицательных результатов бактериологического исследования влагалищных смывов. Владельцы сук значительно реже требуют предоставления им результатов отрицательного бактериологического анализа спермы и смывов из препуциальной полости предназначенных для вязки кобелей. Объективных причин для подобных требований нет, особенно если речь идет о здоровых животных. Для проведения перед вязкой бактериологического исследования должны быть определенные предпосылки, например, наличие клинических или каких-либо еще признаков, указывающих на инфекцию половых органов.
Перед сбором эякулята ветеринарный врач должен предпринять все необходимые меры для снижения риска загрязнения спермы посторонней микрофлорой и принять решение о том, какую фракцию эякулята (вторую, третью или весь образец) следует отобрать для бактериологического исследования. Нормальная микрофлора препуция и дистального отдела уретры (таблица 27-3) может загрязнять пробы спермы. Чтобы избежать этого, перед сбором спермы необходимо дать возможность собаке опорожнить мочевой пузырь, удалить с препуция выделения, а затем очистить половой член и препуций влажными стерильными марлевыми тампонами. Также нужно сделать смыв для количественного анализа микрофлоры дистальной части уретры. Собирают сперму в искусственную вагину, как описано выше. Первую фракцию и первую порцию второй фракции эякулята отбрасывают и в чистую пробирку собирают его вторую и третью фракции. Все этапы взятия спермы должны проводиться с соблюдением правил асептики, с применением стерильных приспособлений и материалов. Количественное бактериологическое и цитологическое исследования проб спермы позволяют дифференцировать инфекции патогенных агентов от банальной микрофлоры.
Получение положительных культур от здоровых собак вполне возможно. В исследовании, проведенном на клинически здоровых кобелях, несмотря на принятие мер по предотвращению случайного загрязнения проб спермы во время их отбора и тестирования, бактериологическое исследование дало положительный результат в 30% случаев (Bjurstrom, Linde-Forsberg, 1992b). Допустимой концентрацией бактерий в эякуляте здоровых собак считается <104
1046 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
ТАБЛИЦА 27-3. АЭРОБНЫЕ БАКТЕРИИ, ИЗОЛИРОВАННЫЕ ИЗ ПРЕПУЦИЯ 15 ЗДОРОВЫХ КОБЕЛЕЙ (РЕЗУЛЬТАТЫ АНАЛИЗА 232 ПРОБ)
Микроорганизм Изолиты Количество собак, от которых выделена культура
количество % количество %
Пастерелла (Pasteurella mullocida) 123 55 15 100
0-гемолитический стрептококк 76 33 11 73
Кишечная палочка 42 18 8 53
Коагулазонегативные стафилококки 39 17 10 67
Микоплазмы 25 11 12 80
Коагулазопозитивный стафилококк (Staphylococcus intermedius) 22 10 9 60
Грамотрицательные палочки (неклассифицированные) 19 8 9 60
Грамположительные палочки (неклассифицированные) 11 5 7 40
Стрептококки (а-гемолитические, негемолитические) 7 3 4 27
Пастереллы 7 3 6 40
Кориноформные бактерии 4 2 3 20
Энтерококки 4 2 4 27
Псевдомонады 1 0,4 1 7
Протей (Proteus mirabilis) 1 0,4 1 7
Отсутствие бактериального роста 33 14
Из: Bjurstrom L, Linde-Forsberg С: Long-term study of aerobic bacteria of the genital tract in stud dogs. Am J Vet Res 53:670, 1992
ТАБЛИЦА 27-4. АЭРОБНЫЕ БАКТЕРИИ, ИЗОЛИРОВАННЫЕ ИЗ СПЕРМЫ 15 КОБЕЛЕЙ (РЕЗУЛЬТАТЫ АНАЛИЗА 232 ПРОБ)
Микроорганизм Изоляты Количество собак, от которого выделена культура
количество % количество %
Пастерелла (Pasteurella mullocida) 44 19 10 67
(3-гемолитический стрептококк 18 8 4 27
Кишечная палочка 9 4 2 13
Микоплазмы 8 3 4 27
Грамположительные палочки (неклассифицированные) 5 2 3 20
Грамотрицательные палочки (неклассифицированные) 5 2 4 27
Коагулазонегативные стафилококки 4 2 3 20
Пастереллы 1 0,4 1 7
Стрептококки (а-гемолитические, негемолитические) 1 0,4 1 7
Коагулазопозитивный стафилококк (Staphylococcus intermedius) 1 0,4 1 7
Отсутствие бактериального роста 162 70
Из: Bjurstrom L, Linde-Forsberg С: Long-term study of aerobic bacteria of the genital tract in stud dogs. Am J Vet Res 53:670, 1992
колонииобразующих единиц/мл (Таблица 27-4; Olson, 1984a). Наиболее часто инфекцию половых органов кобелей вызывают аэробные бактерии. Поэтому всегда необходимо культивирование в аэробных условиях. Основанием для подозрений у собаки инфекции органов размножения являются высокая концентрация колонииобразующих бактерий в посеве (>105/мл), рост только одного организма и обнаружение воспалительных клеток при цитологическом исследовании мазков спермы. Наличие в тестируемом материале лейкоцитов, само по себе, не обязательно указывает на развитие в половых органах животного инфекционного процесса; их можно обнаружить в пробах спермы, из которых не удается изолировать бактерии, но возможно и обратное (Bjurstrom, Linde-Forsberg, 1992b). При интерпретации результатов бактериологического анализа спермы необходимо принимать во внимание наличие у обследуемого кобеля соответствующей симптоматики, причину проведения бактериоло
гического исследования, метод получения спермы, результаты ее цитологического исследования, а также общее количество изолированных культур бактерий и число их видов. При получении сомнительных результатов бактериологический анализ проводят повторно.
Роль анаэробных бактерий в патологии репродуктивных органов кобелей нуждается в более детальном изучении. Однако наш собственный опыт и результаты других исследователей (Johnston, 1989) дают основания предположить, что частота инфицирования половых органов кобелей этими микроорганизмами не высока, вследствие чего необходимость получения анаэробных культур минимальна. Тем не менее, анаэробную инфекцию следует подозревать при наличии у собаки некротической, гангренозной ткани и обнаружении большого количества лейкоцитов и бактерий при цитологическом исследовании, при том что аэробная культура отрицательная. Для получения анаэробной культуры
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1047
сперму немедленно помещают в специальные пробирки, в которых создается атмосфера с пониженным содержанием кислорода (пробирки Anatrans) и немедленно транспортируют в лабораторию. Для получения более детальной информации о взятии патологического материала от инфицированных анаэробными бактериями животных и его транспортировке следует обратиться к сотрудникам микробиологической лаборатории.
Этиологическая роль микоплазм и уреаплазм в дисфункции органов воспроизводства у кобелей мало изучена. Эти бактерии входят в состав нормальной микрофлоры препуция и дистального отдела уретры собак (Bjurstrom, Linde-Forsberg, 1992b; Doig et al, 1981), и только некоторые их виды оказались патогенными. Их наиболее часто обнаруживают в препуциальных смывах и несколько реже в сперме здоровых собак. Сообщалось также об обнаружении микоплазм и уреаплазм в репродуктивном тракте кобелей, страдавших баланопоститом, орхитом, эпидидимитом, простатитом и бесплодием (Lein, 1989). Патогенетическое значение этих агентов остается неясным. Получать культуры этих микроорганизмов имеет смысл при бесплодии, орхите, эпидидимите и простатите собак, а также в случаях обнаружения в мазках спермы большого количества воспалительных клеток.
Микоплазмы и уреаплазмы весьма хрупкие организмы и требуют особых методов культивирования. Образцы спермы собирают в стерильный флакон, при этом первую фракцию эякулята не берут, поскольку она может быть загрязнена микрофлорой дистальной части уретры (Linde-Forsberg, Bolskc, 1995). Важно также избегать контакта спермы со слизистой оболочкой препуция. Стерильный культуральный ватный тампон (например, Culturette, производства Baxter Healthcare, США) погружают в пробу спермы и сразу же переносят его во флакон со специальной средой для транспортировки микоплазм и уреаплазм (например, транспортной средой Amies, производства Difco Laboratories, США или модифицированной средой Стюарта, производства Baxter Healthcare, США). Если лаборатория находится далеко, взятый материал пересылают в контейнере со льдом. Лабораторию следует предупредить о том, наличие какой инфекции Вы предполагаете у животного, поскольку микоплазмы и уреаплазмы выращивают на питательных средах разного состава.
Тестирование сывороток собак на инфекции микоплазм и уреаплазм обычно не проводят, так как диагностические наборы пока выпускают только для ограниченного количества видов этих бактерий. У собак титр антител к этим агентам обычно низкий и повышается медленно. Кроме того, положительный титр может быть и в случае нормальной микрофлоры. Тестирование микоплазм и уреаплазм в сперме, секрете предстательной железы и моче собак можно провести с помощью полимеразной цепной реакции (van Kuppeveld et al, 1994). Более
подробная информация о микоплазмах и уреаплаз-мах в органах размножения собак приведена в статье Linde-Forsberg и Bolske (1995).
ТЕСТИРОВАНИЕ НА НАЛИЧИЕ ИНФЕКЦИИ BRUCELLA CANIS
Бруцеллез является причиной снижения репродуктивных способностей как сук, так и кобелей (см. стр. 1019). Подозрение на эту инфекцию возникает в случаях бесплодия, орхита, эпидидимита, атрофии семенников, дискоспондилита, генерализованной лимфаденопатии и лихорадки неизвестной этиологии. Поскольку инфекция В.canis часто протекает субклинически, необходимо тестировать на ее наличие всех кобелей с пониженной репродуктивностью. Скрининг на бруцеллезную инфекцию должен быть одним из этапов обследования собак перед проведением их вязки.
Скрининг собак на бруцеллез наиболее часто проводят путем серологического тестирования. Антитела к антигенам клеточной стенки и цитоплазмы В. canis достигают определяемого уровня через 8-12 недель после заражения и, как правило, высокий титр (1:400 и выше) сохраняется на протяжении всего периода бактериемии (Carmichael et al, 1984; Carmichael, Greene, 1990). Для серологической диагностики инфекции применяют ускоренную реакцию агглютинации на стекле (с помощью диагностикума D-TecCB, производства Pitman-Moore,США), пробирочный вариант реакции агглютинации и метод иммунодиффузии в агаровом геле. В большинстве ветеринарных диагностических лабораторий пользуются последними двумя тестами. Все три теста позволяют обнаруживать антитела к антигенам стенки бруцелл, а метод иммунодифузии в агаровом геле выявляет еще антитела к цитоплазматическим антигенам. Антигены стенки В.canis являются общими для многих видов бруцелл и для ряда других бактерий, в том числе бордетелл (Bordetella bronchiseptica), синегнойной палочки и ряда видов стафилококков с выраженной способностью к образованию слизи. Поэтому перечисленные выше тесты недостаточно специфичны и часто дают ложноположительные результаты. Сыворотки крови, давшие положительную реакцию с антигенами клеточной стенки бруцелл, повторно проверяют методом иммунодиффузии в агаровом геле, в котором антигенным материалом служат цитоплазматические антигены В.canis, или же выделяют и идентифицируют бактерии из культур крови или спермы собак (см. гл. 26). Цитоплазматические или, как их еще называют, внутренние антигены В.canis специфичны для этого вида бактерий.
Частота ложноотрицательных результатов в серологических тестах у собак, инфицированных В.canis достаточно давно, чтобы у них выработались антитела к антигенам клеточной стенки возбудителя, низка. В первые 4-8 недель после заражения
1048
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
серологическое исследование обычно дает отрицательный результат, поскольку антитела к антигенам клеточной стенки В.canis достигают определяемого уровня только через 8-12 недель после заражения. Все отрицательные сыворотки повторно тестируют через 10 дней, чтобы снизить вероятность получения ложноотрицательных результатов. Когда бактериемия приобретает промежуточный характер или ее уровень снижается (например, если хроническая инфекция продолжается больше 30-60 недель или после терапии антибиотиками), титр антител в крови опускается до уровня, при котором серологические тесты дают сомнительный или отрицательный результат, несмотря на персистенцию возбудителя в тканях (Carmichael et al, 1984).
ОЦЕНКА ГОРМОНАЛЬНОГО СТАТУСА
Обзор. Сперматогенез и стероидогенез тесно связаны, но осуществляются в разных отделах семенников. Сперматозоиды появляются в извитых канальцах семенников, образованных первичными половыми клетками (сперматогониями) и клетками Сертоли. Синтез стероидов происходит в строме семенников, основным клеточным элементом которой являются интерстициальные клетки Лейдига. Либидо и процесс образования сперматозоидов зависят от функциональной активности оси семенники - гипоталамус - гипофиз. В репродуктивном тракте самцов действуют две гормональные системы. Гипоталамический ГнРГ стимулирует высвобождение ЛГ из гипофиза, а ЛГ, в свою очередь, стимулирует синтез тестостерона в семенниках. Другая система гормональной регуляции включает стимуляцию ГнРГ секреции ФСГ, который усиливает образование гормона ингибина в клетках Сертоли семенников (таблица 27-5; рис. 27-10; Hewitt, 1998). Для созревания сперматогониев до стадии зрелых сперматозоидов необходимы как ФСГ, так и андрогены (в первую очередь, тестостерон и дигидротестостерон). Тестостерон под воздействием 5а-редуктаз превращается в дигидротестостерон. Последний по активности превосходит тестостерон приблизительно в 2 раза, поскольку его молекула обладает более высоким сродством к рецептору и медленнее диссоциирует из комплекса с внутриклеточными рецепторами андрогенов (Wasmer, Rogers, 1996). Секретируемый интерстициальными клетками Лейдига тестостерон высвобождается в извитых канальцах семенников и стимулирует сперматогенез. Тестостерон также необходим для поддержания секреторной и абсорбционной активностей в семявыносящих канальцах, протоках придатков семенников и семяпроводах, роста и функциональной активности предстательной железы, проявления либидо и развития вторичных половых признаков.
ГнРГ стимулирует секрецию ЛГ, который инициирует образование тестостерона. Пролактин может действовать синергично с ЛГ, регулируя синтез тестостерона в клетках Лейдига (Hewitt, 1998). Высво
бождение ГнРГ из гипоталамуса в портальную систему гипофиза происходит пульсами (Kumar et al, 1980), поэтому секреция ЛГ и тестостерона также носит пульсирующий характер, и их концентрация в сыворотке крови то повышается, то понижается. Тестостерон, по всей видимости, совместно с эстрадиолом, ингибирует секрецию ГнРГ и ЛГ (Kumar et al, 1980; Falvo et al, 1982). Эстрадиол секретируется семенниками или образуется в результате ароматизации тестостерона.
ФСГ косвенно стимулирует сперматогенез в клетках Сертоли. Секреция ФСГ необходима для поддержания дифференцировки стволовых клеток и развития сперматозоев. Гормон также способствует окончательному созреванию сперматид благодаря стимуляции развития и активизации функционального состояния клеток Сертоли, а также синтеза андроген-связывающего белка (Ganong, 2001). Секреция ФСГ стимулируется ГнРГ и подавляется ингибином - нестероидным гликопротеином, который образуется в клетках Сертоли (de Kretser, Robertson, 1989) (рис. 27-10). Предполагается, что в последних синтезируются и другие биологически активные факторы (активины), которые стимулируют секрецию ФСГ (Hewitt, 1998). По уровню концентрации тестостерона и ФСГ в крови
ТАБЛИЦА 27-5. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ СПЕРМАТОГЕНЕЗА И СТЕРИОДОГЕНЕЗА У СОБАК
Гормон Место образования Основное действие
ГнРГ Гипоталамус Стимулирует секрецию ЛГ и ФСГ передней долей гипофиза
ЛГ Передняя доля гипофиза Стимулирует стероидогенез в клетках Лейдига
ФСГ Передняя доля гипофиза Стимулирует сперматогенез в клетках Сертоли
Пролактин Передняя доля гипофиза Действует синергично с ЛГ, стимулируя образование стероидов в клетках Лейдига
Тестостерон Клетки Лейдига Стимулирует сперматогенез в клетках Сертоли, а также подавляет секрецию ГнРГ в гипоталамусе и синтез ЛГ и ФСГ в передней доле гипофиза
Эстрадиол Предположительно клетки Лейдига Действует синергично с тестостероном, подавляя секрецию ГнРГ, ЛГ и ФСГ
Ингибин Клетки Сертоли Подавляет секрецию ФСГ передней долей гипофиза
Активин (гипотетически) Клетки Сертоли Подавляет секрецию ФСГ передней долей гипофиза.
По: Hewitt D: Physiology and endocrinology of the male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, British Small Animal Veterinary Association, 1998, p 61.
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1049
У
Центральная нервная система
Гипоталамус
Гипофизарные гонадотро-
пины
I Клетки Сертоли (?) \
Интерстициальные клетки Лейдига
— Ингибин
Тестостерон
ТАБЛИЦА 27-6. КОНЦЕНТРАЦИЯ ФСГ, ЛГ И ТЕСТОСТЕРОНА В СЫВОРОТКЕ КРОВИ КОБЕЛЕЙ С ПОВРЕЖДЕНИЯМИ СЕМЕННЫХ КАНАЛЬЦЕВ РАЗНОЙ СТЕПЕНИ ТЯЖЕСТИ И НАРУШЕНИЕМ СПЕРМАТОГЕНЕЗА
Степень повреждения семенных канальев ФСГ (нг/мл ± SEM) ЛГ (нг/мл ± SEM) Тестостерон (нг/мл ± SEM)
I 73 ±7 34 ±9 3 ± 0,5
II 84 ±9 35 ±32 3 ± 0,6
III 236 ± 49 96 ± 18 3 ± 0,7
IV 321 ±58 95 ±26 3±0,6
Степень I: во всех семенных канальцах происходит ак-
тивный сперматогенез.
Степень II угнетение (вплоть до полного прекращения) сперматогенеза в некоторых или всех семенных канальцах или уменьшение количества сперматогониев.
Степень III: в некоторых (но не всех) семенных канальцах полностью отсутствуют сперматогонии.
Степень IV: Во всех семенных канальцах отсутствуют _____________сперматогонии._______________________________ По: Soderberg SF: PhD Thesis, Colorado State University, 1981; as reported by Olson FN: Clinical approach to infertility in the stud dog. Proceedings of the Annual Society for Theriogenology, 1984, p33.
Рис. 27-10. Предполагаемые механизмы регуляции сперматогенеза и синтеза тестостерона по механизму положительной и отрицательной обратной связи.
собак можно судить о функциональном состоянии оси гипоталамус - гипофиз - гонады. Показаниями для определения активности этих гормонов в крови являются олигоспермия/азооспермия, слабое либидо, крипторхизм, наличие в семенниках новообразований и предполагаемый гермафродитизм.
Тестостерон. В крови собак циркулируют тестостерон и его предшественники, включая андростендион, дегидроэпиандростерон и 17-гидрокси-прогестерон (Boulanger et al, 1982). Тестостерон играет важную роль в проявлении либидо и регуляции сперматогенеза у кобелей. Легко предсказать, что у кобелей с низким либидо концентрация тестостерона в крови низкая. Так же у собак с нормальным либидо, но редко вяжущихся, она снижена до 0,4 нг/мл, несмотря на то, что животное остается плодовитым (Larsen, Johnston, 1980). Концентрация тестостерона в семенниках превышает его концентрацию в крови в 50-100 раз, поэтому по уровню гормона в крови невозможно судить об изменениях его продукции в семенниках или об интенсивности сперматогенеза (таблица 27-6) (Olson, 1984b). По этой причине мы обычно не определяем концентрацию тестостерона в крови собак, у которых предполагается бесплодие. Тем не менее, этот показатель помогает различить интактных собак, кастрированных и собак с двусторонним крипторхизмом (таблица 27-7).
В диагностических ветеринарных лабораториях концентрацию тестостерона в крови животных определяют радиоиммунологическим методом. Считается, что в норме этот показатель у собак составляет 0,4-10,0 нг/мл (Larsen, Johnston, 1980; Olson, 1984b), хотя по данным нашей лаборатории, у здоровых кобелей он обычно колеблется от 1 до 5 нг/мл. У крип-торхов содержание тестостерона в крови обычно понижено до 0,1-2 нг/мл, а у кастрированных кобелей оно ниже 0,02 нг/мл. Результаты однократного определения тестостерона имеют ограниченную диагностическую ценность из-за значительных и непредсказуемых флуктуаций его концентрации в
крови. Для оценки функционального состояния клеток Лейдига по содержанию тестостерона в крови рекомендуется проводить серийное исследование 3-6 проб крови, полученных от животного с 20-минутными интервалами (Kamolpatana et al, 1998). Средняя концентрация этого гормона в пробах крови кобелей в норме должна быть выше 2 нг/мл.
Для оценки функционального состояния клеток Лейдига можно воспользоваться тестами стимуляции гонадотропин рилизинг-гормоном (ГнРГ) и хорионическим гонадотропином человека (ХГЧ). Чаще используют тест с ГнРГ. Время взятия у кобелей проб крови, дозы и результаты теста зависят от используемого аналога ГнРГ (Purswell, Wilcke,
ТАБЛИЦА 27-7. ИЗМЕНЕНИЯ БАЗАЛЬНЫХ КОНЦЕНТРАЦИЙ ГОРМОНОВ, РЕГУЛИРУЮЩИХ ПРОЦЕССЫ
РЕПРОДУКЦИИ У СОБАК, ПРИ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ЗАБОЛЕВАНИЯХ
СЕМЕННИКОВ
Нарушение Тестостерон Эстроген ФСГ ЛГ
Норма 1-5 нг/мл <15 пг/мл н н
Односторонний крипторхизм 1-5 нг/мл <15 пг/мл н н
Двусторонний крипторхизм 0,1-2 нг/мл (100-2000 пг/мл) <15 пг/мл Н или 1" н
Кастрация <20 пг/мл <15 nr/ml
Опухоль клеток Сертоли 0,1-2 нг/мл 10-200 пг/мл Н или 4 Н или 4
Н - норма; 1" - повышение; 4 - снижение.
1050 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
1993). Важно проводить исследование в точном соответствии с протоколом, опробированным лабораториями, в которых проводятся анализы активности тестостерона и ЛГ. После внутримышечного введения ГнРГ в дозе 1,0-2,2 мкг/кг массы тела концентрации ЛГ и тестостерона в крови повышаются, достигая пика через 15 и 60 мин после инъекции соответственно. Пробы крови для определения концентраций ЛГ и тестостерона берут перед инъекцией ГнРГ и соответственно через 15 мин и 1 час после введения. У здоровых кобелей концентрация тестостерона в сыворотке крови через час после введения ГнРГ должна быть выше 3 нг/мл (Meyers-Wallen, 1991). Если повышения уровня тестостерона не произошло, то определение концентрации ЛГ в сыворотке крови позволит установить, поражен гипофиз или семенники. По данным Purswell и Wilcke (1993), после внутримышечного введения аналога ГнРГ (гонадорелин гидрохлорида, производства Factrel, США) 8 здоровым кобелям в дозе 0,7 мкг/кг концентрация ЛГ в сыворотке крови увеличилась через 15 мин в среднем на 947% (разброс 433% - 2708%), а содержание тестостерона повысилось через 60 мин в среднем на 189% (разброс 53% -518%). В другом исследовании внутримышечное введение ГнРГ в дозе 1 мкг/кг привело к повышению концентрации тестостерона в сыворотке крови у одного кобеля с 0,5 до 5 нг/мл, а у другого - с 3,7 до >5 нг/мл (Schille, Olson, 1989).
В тесте со стимуляцией секреции тестостерона хорионическим гонадотропином собакам вводят ХГЧ внутримышечного в дозе 40 МЕ/кг и кровь берут до и через 4 ч после инъекции. У здоровых кобелей после инъекции ХГЧ концентрация тестостерона в сыворотке крови должна быть выше 4,5 нг/мл (Meyers-Wallen, 1991; Schille et al, 1991).
Гонадотропные гормоны гипофиза (ФСГ и ЛГ). Определение уровня гипофизарных гонадотропинов в крови кобелей проводят для оценки состояния оси гипоталамус-гипофиз-гонады при пониженном либидо или олигоспермии/азооспермии, а также для выявления кастрированных животных. В норме концентрация ЛГ в сыворотке крови кобелей не превышает 20 нг/мл, но во время эпизодических выбросов ЛГ она может повышаться до > 90 нг/мл (Amann, 1986). Базальная концентрация ФСГ у здоровых животных не подвержена таким колебаниям, как концентрация ЛГ, и в большинстве случаев она ниже 250 нг/мл (Schille, Olson, 1989). Утрата у кастрированных собак механизма регуляции секреции ЛГ и ФСГ тестостероном по принципу отрицательной обратной связи приводит к повышению концентрации гонадотропинов в крови. В одном из исследований концентрация ЛГ в сыворотке крови у интактных и кастрированных кобелей составляла соответственно 6,0 ± 5,2 и 89 ± 28 нг/мл, а концентрация ФСГ 17,1 ± 9,9 и 858 ± 674 нг/мл соответственно (Olson et al, 1992). При этом концентрация ЛГ у части интактных и кастрированных кобелей была приблизительно одина
ковой, чего нельзя сказать о концентрации ФСГ, которая была ниже 150 нг/мл у всех интактных и выше 150 нг/мл у всех кастрированных собак. Не исключено, что перекрывание уровней ЛГ могло быть следствием взятия крови у здоровых собак в момент эпизодического выброса ЛГ.
Аналогичное повышение концентраций ЛГ и ФСГ может происходить у собак при олигоспермии/азооспермии и первичной дисфункции семенников. Концентрация ФСГ в сыворотке крови кобелей положительно коррелирует с тяжестью нарушений сперматогенеза (табл. 27-6; Olson, 1984b). Бесплодие на фоне тяжелой дисфункции семенников, как правило, сопровождается повышением концентрации ФСГ в сыворотке крови выше 250 нг/мл (Soderberg, 1986). Концентрация ЛГ в плазме крови может также возрастать (табл. 27-6), предположительно, в результате усиления секреции ГнРГ и/или недостаточной секреции тестостерона, обусловленной дисфункцией клеток Лейдига. Нормальная или пониженная концентрация ЛГ и ФСГ в сыворотке крови при олигоспермии/азооспермии, напротив, позволяет предположить наличие у собак ранних дегенеративных изменений в семенниках, непроходимость семявыносящих канальцев и протоков, ретроградную эякуляцию или дисфункцию гипо-физа/гипоталамуса (гипогонадотроный гипогонадизм). К интерпретации результатов однократного определения концентрации гонадотропных гормонов следует подходить с осторожностью. Их секреция носит пульсирующий характер, вследствие чего их концентрация в сыворотке крови здоровых собак может меняться в широких пределах.
Оценка ответа гипофиза на введение собаке ГнРГ облегчает дифференциацию дисфункций гипотала-муса/гипофиза и семенников (см. приведенное при описании тестостерона обсуждение данного вопроса) и позволяет выбрать наиболее эффективную схему лечения олигоспермии /азооспермии (см. стр. 1105). Falvo и соавторы (1982) показали, что концентрация ЛГ в плазме крови собак линейно возрастает при повышении вводимых внутривенно доз ГнРГ с 5 до 250 нг/кг. Повышение секреции ЛГ начинается в течение 10 мин после введения ГнРГ и достигает пика в течение 30 мин. У 6 здоровых кобелей средняя максимальная концентрация ЛГ в плазме крови после внутривенного введения 250 нг/кг ГнРГ составляла 18 нг/мл. Концентрация ЛГ в сыворотке крови 4 интактных кобелей породы грей-хаунд через 10 мин после внутривенного введения ГнРГ в дозе 250 нг/кг повышалась до 20,8-49,5 нг/ мл (в среднем 32 ± 11 нг/мл) (Freshman et al, 1987). В другом эксперименте через 15 мин после внутримышечного введения 8 здоровым кобелям ГнРГ в дозе 0,7 мкг/кг средний уровень ЛГ повысился на 947% (разброс 433-2708%) (Purswell, Wilcke, 1993). Отсутствие повышения секреции ЛГ и ФСГ в ответ на стимуляцию ГнРГ указывает скорее на дисфункцию гипоталамуса/гипофиза, чем на первичную патологию семенников.
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1051
Вследствие низкой перекрестной реактивности гонадотропных гормонов гипофиза разных видов животных для определения их концентрации можно пользоваться только наборами, предназначенными для данного вида. Интерпретация результатов строится на данных эндокринных лабораторий о нормальных границах концентрации гонадотропинов в крови собак. К сожалению, коммерческие наборы для определения ЛГ и ФСГ у собак не выпускаются.
Эстрадиол, прогестерон. Основными показаниями для определения концентрации эстрадиола и прогестерона в крови кобелей служат предположения о наличии гермафродитизма (см. стр 992) или секретирующих стероиды новообразований (особенно в семенниках, см. стр. 1075]).
Тиреоидные гормоны. Влияние дефицита тиреоидных гормонов на фертильность кобелей является спорным вопросом. В прошлом гипотиреоз относили к числу причин дегенерации семенников и олигоспермии, а также снижения либидо и плодовитости. У мужчин упомянутые патологические процессы могут развиваться вследствие вторичного снижения концентрации в плазме крови тестостерона, ЛГ и ФСГ, происходящего из-за недостатка тиреоидных гормонов (Johnson et al, 1999), но у собак такая взаимосвязь не подтверждается. Недавно были опубликованы результаты двухлетнего исследования (Johnston et al, 1999), целью которого было изучение репродуктивных качеств кобелей породы бигль в состоянии экспериментального гипотиреоза, вызванного введением радиоактивного йода (1311). Существенных различий ширины мошонки, общего количества ежедневно выделяемых во время эякуляции сперматозоидов, их морфологии и подвижности у животных опытной и контрольной (кобелей той же породы и возраста с нормально функционирующей щитовидной железой) групп не выявили. Хотя у собак опытной группы либидо было пони-женнным, но проблем с эякуляцией у них не было. Также не было выявлено значительных различий в концентрациях тестостерона и ЛГ в сыворотке крови собак опытной и контрольной групп до и после введения им ГнРГ. Участники Международного Симпозиума по гипотиреозу собак, проходившего в Калифорнийском Университете в 1996 г, пришли к единому мнению относительно того, что гипотиреоз не относится к числу явных причин снижения плодовитости собак. Это полностью согласуется с результатами вышеописанного исследования. Означает ли это, что нет необходимости определять функциональное состояние щитовидной железы собак при низкой фертильности? Вероятно, нет, но такая позиция позволяет предположить, что если концентрация тиреоидных гормонов в сыворотке крови кобеля нормальная, то правильнее будет заняться поиском других причин снижения его пониженной плодовитости и не заниматься гипотиреозом. Для оценки функционального состояния щитовидной железы мы рекомендуем определять концентрацию
в сыворотке крови собак свободного (посредством диализа) и общего тироксина (Т4), эндогенного тиреотропина и антитиреоглобулиновых аутоантител (информация о методах оценки функций щитовидной железы приведена в гл. 3 на стр. 122).
Кортизол. Повышение уровня кортизола в крови кобелей приводит к подавлению секреции гипофизарных гонадотропинов. В результате снижается концентрация тестостерона и ФСГ в плазме крови, что, в свою очередь, ведет к атрофии семенников, снижению либидо, развитию олигоспермии и бесплодия. С помощью радиоиммунологического анализа показано, что по утрам средний уровень тестостерона у 11 здоровых собак составлял 4,7 ±1,8 нг/мл. У 12 собак, страдавших гиперкортицизмом и атрофией семенников, этот показатель оказался значительно ниже - 1,2 ± 0,7 нг/мл (Feldman, Tyrrell, 1982). Подавление кортизолом синтеза тестостерона может происходить при продолжительном лечении собак глюкокортикоидами (как при пероральном введении, так и при местной обработке ими глаз, ушей и кожи), а также при спонтанном гиперкортицизме. Однако снижение репродуктивных качеств у кобелей при гиперкортицизме происходит довольно редко (детальная информация по тестированию надпочечников приведена в гл. 6).
УЛЬТРАЗВУКОВОЕ И РЕНТГЕНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Рентгенологическое исследование органов репродукции кобелей показано при подозрениях на наличие у них заболеваний предстательной железы, крипторхизма или опухоли семенников. Рентген позволяет диагностировать увеличение предстательной железы (простатомегалию). В этом случае латеральное рентгенологическое исследование выявляет заполнение предстательной железой более 70% расстояния от края тазовой кости до выступа седалищной кости (Feeney et al, 1987). Рентгенологическое исследование также проводят для получения представления о границах (являются ли они ровными или нет) и плотности простаты (наличия камней, минерализации паренхимы, скоплений газа и т.д.). При подозрении на аденокарциному предстательной железы собакам проводят абдоминальное рентгенологическое исследование, которое дает возможность обнаружить такие метастатические поражения как лимфаденопатия, пролиферативная периостальная реакция вентральной границы поясничных позвонков. В ходе этого исследования у крипторхов могут быть также обнаружены находящиеся вне мошонки семенники, которые бывают поражены метастазами злокачественных опухолей и увеличены, ретроперитонеальная лимфаденопатия подвздошных лимфатических узлов (частая находка у кобелей с метастазами опухолей семенников), а также дискоспондилит или остеомиелит (у собак с орхитом/эпидидимитом, вызванными бруцеллезной инфекцией или другими причинами).
1052
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Рис. 27-11. УЗИ нормальной предстательной железы (стрелки и крестики). Обратите внимание на грубую, гиперэхогенную структуру паренхимы органа.
Рис. 27-12. УЗИ нормального семенника (стрелки). Обратите внимание на гомогенную, грубую эхогенную структуру паренхимы органа.
После рентгенологического исследования для проверки состояния проксимальной части урегры (в области пениса и предстательной железы) и мочевого пузыря можно провести позитивную контрастную ретроградную уретроцистографию.
УЗИ проводят кобелям при подозрении на наличие заболеваний предстательной железы, семенников их придатков и семяпроводов. Оно позволяет определять внутреннюю структуру этих органов, а также размер предстательной железы. С его помощью проводя г аспирацию и биопсию обнаруженных в предстательной железе и семенниках поражении. В норме предстательная железа должна быть симметричной, иметь гладкие края и гомогенную паренхиму с тонкой или умеренно тонкой структурой. Эхогенность этого органа вариабельна - у большинства собак отмечают нормальную эхогенность, но бывают случаи гипер - и гипоэхогенности (рис. 7-11; Mattoon, Nyland, 1995). Часто посредством УЗИ удается определить состояние прилегающей к предстательной железе части уретры: в норме она гипо- или анэхогенна, имеет округлую структуру и проходит через центрально-дорсальную часть железы. В редких случаях удается обнаружить семяпроводы, которые выглядят как гипоэхогенные косо проходящие через дорсальную часть предстательной железы вытянутые образования. В одной работе была выявлена достаточная корреляция результатов определения длины предстательной железы при помощи рентгена и УЗИ, но рентгенологически удалось точно определить только длину, но не ширину этого органа (Atalan et al, 1999). В целом, с помощью УЗИ удается сделать более точные промеры предстательной железы, поскольку оно позволяет лучше определить контуры органа, а для проведения измерений применяется интегрированная электронная шкала, в то время как на рентгеновских снимках промеры делают вручную, причем это возможно только при достаточно большом увеличении. Величина предстательной железы у здоровых собак положительно коррелирует с их массой тела и возрастом, что следует учитывать
при интерпретации результатов определения размеров простаты (таблица 27-8; Ruel et al, 1998).
На эхограмме норма 1ьные семенники имеют грубую гомогенную паренхиму с узкими, удлиненными I иперэхогенными соединитсльно-зканными перегородками и легко идентифицируемой гиперэхогенной капсулой - белочной оболочкой (рис. 27-12) (Pugh et al, 1990; Mattoon, Nyland, 1995). Визуализация на эхограмме придатков семенников не всегда возможна. При УЗИ наиболее часто обнаруживают их хвостовую часть, прикрепленную к каудальному полюсу каждого семенника. Она, как правило, анэхогенна или гипоэхогенна по сравнению с паренхимой семенников. Головная часть придатков семенников меньше, но имеет те же ультразвуковые характеристики, что и его хвостовая часть. Проследить в них ход семявыносящих канальцев сложно, поскольку ио мере приближения к общему протоку придатка они прогрессирующе уменьшаются в диаметре. Изменения эхогенности паренхимы, эхографическая тень, а также патологические полости, имеющие определенные форму, размер и локализацию в паренхиме предстательной железы, семенников и их придатков дают ключ к
ТАБЛИЦА 27-8. ФОРМУЛЫ ДЛЯ РАСЧЕТОВ ОРИЕНТИРОВОЧНЫХ РАЗМЕРОВ
(М кКСИМАЛЬНОЙ ДЛИНЫ, ШИРИНЫ И ВЫСОТЫ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
ЗДОРОВЫХ СОБАК В ЗАВИСИМОС1 И ОТ ИХ МАССЫ ТЕЛ А И ВОЗРАСТА
Дл = (0,055 х МТ) + (0,143 х Вр) + 3,31
Ш = (0,147 х МТ) + (0,089 х Вр) + 3,45
Вс = (0,046 х МТ) + (0,069 х Вр) + 2,68
Вп = (0,044 х МТ) + (0,083 х Вр) + 2,25
Дл - максимальная длина; Ш - ширина; Вс - высота на изображении сагиттального среза;
Вп - высота на изображении поперечного среза; МТ - масса тела; Вр - возраст.________________________________________
Из: Ruel Y et al: Ultrasonographic evaluation of the prostate in healthy intact dogs. Vet Radiol Ultra 39: 212, 1998.
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
1053
ТАБЛИЦА 27-9. РУКОВОДСТВО ПО ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ УЗИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ У СОБАК
Заболевания предстательной железы Результаты УЗИ
Нормальная железа Нормальные размеры; симметричная форма; ровные края; гомогенность паренхимы, имеющей тонкую или умеренно тонкую структуру; вариабельная эхогенность - от гиперэхогенности до гипоэхогенности, но чаще - умеренная эхогенность.
Доброкачественная гиперплазия Нормальные или увеличенные размеры; симметричная или ассиметричная форма; обычно гладкие края; вариабельная эхогенность - от гипоэхогенности до гиперэхогенности; структура может быть гладкой или грубой; возможно наличие рассеянных по паренхиме
Острый простатит органа гиперэхогенных очагов и внутрипаренхимальных кист. Нормальные или увеличенные размеры; симметричная или ассиметричная форма; ровные или неровные края; гетерогенная эхогенность - наличие очага или многочисленных плохо очерченных гипоэхогенных очагов и гиперэхогенных очагов неровной формы, а также гипоэхогенных полостей, в глубине которых эхогенность повышается (в случае, если эти полости - кисты или абсцессы); при наличии скоплений газа в органе видны эхографические тени.
Хронический простатит Вариабельные размеры; симметричная или ассиметричная форма; ровные или неровные края; гетерогенная эхогенность - наличие очаговой или диффузной гиперэхогенности паренхимы, гипоэхогенных полостей, в которых эхогенность повышается (в случае, если эти полости - кисты); эхографические тени - при наличии минерализации или фиброза.
Карцинома Увеличение размеров; ассиметричность формы; неровные края; гетерогенная эхогенность - наличие многочисленных, плохо очерченных гиперэхогенных очагов, проявляющих тенденцию к слиянию друг с другом; в ряде случаев наличие полостей, кистоподобных поражений; при минерализации могут быть эхографические тени; признаки разрушения капсулы.
Абсцесс Нормальные или увеличенные размеры; симметричная или ассиметричная форма; ровные или неровные края; гипоэхогенность или анэхогенность, плохо очерченные полости с вариабельной гиперэхогенностью в глубине; паренхима - нормоэхогенная или гиперэхогенная.
Киста Нормальные или увеличенные размеры, симметричная или ассиметричная форма, ровные или неровные края, нормоэхогенность или гиперэхогенность паренхимы; наличие одного или нескольких гипоэхогенных или анэхогенных очагов с повышением гиперэхогенности в глубине.
ТАБЛИЦА 27-10. РУКОВОДСТВО ПО ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ УЗИ СЕМЕННИКОВ И ИХ ПРИДАТКОВ У СОБАК
Внетестикулярные заболевания Результаты ультразвукового исследования
Нормальный придаток Эпидидимит Эхогенность от анэхогенности до гипоэхогенности Увеличение придатков семенников, наличие в их паренхиме диффузно рассеянных бляшек с пониженной или смешанной эхогенностью.
Киста придатков семенников (сперма-тоцеле) Наличие очаговых анэхогенных кистозных структур с заостренными краями внутренних стенок и усилением эхогенности в глубине.
Водянка оболочек семенника (гидроцеле) Анэхогенное скопление жидкости вокруг семенника с возрастающей эхогенностью в глубине.
Мошоночная грыжа Обнаружение структуры, проходящей из брюшной полости по паховому каналу в мошонку.
установлению природы развивающегося у собаки заболевания (табл. 27-9 и 27-10; Johnston et al, 1991). Обобщая вышеизложенное, можно сделать заключение относительно того, что УЗИ органов размножения кобеля предоставляет более ценную в диагностическом плане информацию, чем их рентгенологическое исследование; кроме того, с его помощью проще обнаружить семенники, находящиеся у крипторхов в брюшной полости.
АСПИРАЦИОННАЯ БИОПСИЯ СЕМЕННИКОВ
Цитологический анализ материала, полученного посредством аспирационной биопсии, является
быстрым, простым и недорогим методом диагностики дискретных, очаговых новообразований семенников. Особую ценность этот метод представляет для дифференциации опухолей семенников (см. стр. 1072; Chapwanya et al, 2000). В меньшей степени он подходит для диагностики олигоспер-мии/азооспермии или дегенеративных изменений паренхимы семенников. Чем тяжелее дегенеративные изменения герминативного эпителия, тем больше вероятность того, что цитологический анализ аспирата не позволит диагностировать заболевание. С помощью этого метода можно установить наличие в исследуемой ткани воспалительного процесса (например, при плазмацитарно-лимфоци-
1054
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Рис. 27-13. Мазок материала, полученного методом аспирационной биопсии из опухшего и болезненного семенника кобеля, больного бластомикозным пиогранулсматозным орхитом Обратите внимание на крупную (гигантскую), многоядерную клетку, содержащую почкующуюся форму Blastomyces dennttilides (окраска по Райту, увеличение х400). Из: DeNicola DB et al: Cytology of the Canine Urogenital Tract Brochure, 1980.
Рис. 27-14. Мазок материала, полученного методом аспирационной биопсии из мелкого новообразования семенника, оказавшегося интерстициально-клеточной опухолью. Обратите внимание на скопление разных по размеру полигональных клеток, окружающих выстланное эндотелием капиллярное пространство (окраска Дифф Квиком, увеличение х250). Из: DeNicola DB et al: Cytology of the Canine Urogenital Tract Brochure, 1980.
тарном или нейтрофильном орхите), инфекционных агентов или сперматогенных клеток (рис. 27-13 и 27-14). В цитологических препаратах биоптатов семенников обнаруживают сперматогонии, сперматоциты, сперматиды, сперматозоиды и клетки Сертоли, но клетки Лейдига идентифицировать сложно (Dahlbom et al, 1997). Установление активного сперматогенеза в аспирате из тестикулов страдающего азооспермией кобеля дает основания предполагать наличие у животного билатеральной непроходимости семенных протоков железы или неполного восстановления функции семявыносящих канальцев после перенесенного тяжелого инсульта. Отсутствие сперматогенных клеток в аспирате при
азооспермии, напротив, указывает на прекращение сперматогенеза, но не позволяет прогнозировать, насколько обратимы происшедшие в половой железе нарушения. Оценить состояние базальной мембраны семявыносящих канальцев, герминативного эпителия и интерстициальной ткани семенников с помощью цитологического исследования аспирированного материала не представляется возможным из-за утраты связи между клеточными элементами. По той же причине сложно идентифицировать различные стадии дифференцировки сперматогониев.
Техника проведения аспирационной биопсии семенников принципиально ничем не отличается от таковой при взятии материала из новообразований и лимфатических узлов. Аспирацию проводят иглой диаметром 6,7-8,3 мм (в зависимости от размера семенника), надетой на шприц объемом 6 мл. Местная анестезия не обязательна, а необходимость в седативных препаратах возникает только при работе с непослушными собаками. При введении иглы необходимо избегать ее попадания в придатки семенников. Из аспирированного материала делают мазок на чистом предметном стекле, окрашивают его и микроскопируют. При просмотре препарата под световым микроскопом в первую очередь обращают внимание на наличие в нем сперматозоидов, воспалительных клеток, бактерий и грибков (DeNicola et al, 1980). Аспирационная биопсия сопряжена с минимальной травматизацией семенников и не оказывает отрицательного воздействия на сперматогенез (Dahlbom et al, 1997).
АСПИРАЦИОННАЯ БИОПСИЯ ПРИДАТКОВ СЕМЕННИКОВ
Цитологическое исследование полученного методом аспирационной биопсии материала показано при азооспермии (см. стр. 1105 и пальпируемых изменениях придатков семенников кобелей. Техника проведения аспирационной биопсии семенников и их придатков одинакова (см. выше). Аспираты из придатка семенника исследуют на наличие живых, подвижных сперматозоидов, воспалительных клеток и бактерий. Обнаружение сперматозоидов в аспирате при азооспермии свидетельствует о непроходимости семявыносящих путей, в то время как отсутствие сперматозоидов может быть связано с прекращением сперматогенеза или же с непроходимостью или разрушением семенных протоков, находящихся проксимальнее места проведения аспирационной биопсии. Определение концентрации щелочной фосфатазы в сперме (см. стр. 1045) и результаты цитологического исследования аспирата или биоптата семенников позволяет уточнить диагноз. Наличие воспалительных клеток и бактерий в аспирате придатка семенника служит основанием для диагностики эпидидимита. При получении достаточного большого количества биопсированного материала часть его может быть использована для проведения бактериологического исследования.
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ • 1055
Рис. 27-15. I истологический срез семенника здорового кобеля, позволяющий проследить процесс дифференцировки мужских половых клеток (от стадии сперматогониев до сперматозоидов). Черными стрелками указаны клетки Сертоли, контурными стрелками - сперма гогонии, сплошным овалом сперматоциты, сплошным квадратом - округлые и вытянутые сперматиды, пунктирным овалом - сперматозоид, сплошным треугольником - интерстициальные клетки Лейдига (окраска гематоксилин-эозином, увеличение х400).
НЕАСПИРАЦИОННЫЕ МЕТОДЫ БИОПСИИ СЕМЕННИКОВ
Показания. Неаспирационные методы биопсии паренхимы семенников применяют в тех случаях, когда необходимо оценить структуру семявыносящих канальцев, интенсивность сперматогенеза, количество интерстициальных клеток и клеток Сертоли, а также установить наличие воспаления или роста опухолей (рис. 27-15 и 27-16). Поскольку биопсию проводят с соблюдением правил асептики, то биоптат можно использовать для получения бактериальных структур. включая микоплазмы. Комплексный анализ биоптагов семенников нередко позволяет установить причину бесплодия кобелей с олигоспермией/азооспермией в случаях, когда менее инвазивные методы диагностики этого сделать не позволили. Неаспирационные методы биопсии семенников рекомендуются в случаях выявления пальпируемых дискретных новообразовании или щффузных изменений в семенниках.
Осложнения. Принимая решение о биопсии семенников, ветеринарный врач должен сопоставить ценность ожидаемых результатов исследования с риском возможных осложнений при проведении биопсии (таблица 27-11). К счастью, при осуществлении биопсии с соблюдением правил асептики осложнения бывают не часто. В соответствующих исследованиях при проведении серийном перкутанной биопсии семенников у кобелей иногда наблюдали лишь один вид тяжелых осложнений - одностороннюю атрофию семенника. Тем не менее, к перкутанной биопсии семенников следует прибегать только тогда, когда менее инвазивные методы не позволяют диагностировать заболевание. Цен-
Сперматогоний типа А
популяция Пролиферирующая популяция у Митоз
Сперматогоний типа В
Митоз
Сперматоцит первого порядка
Мейоз
Сперматоцит второго порядка
Мейоз
Округлая сперматида
i
Удлиненная сперматида
I
Сперматозоид
Рис. 27-16. Схема сперматогенеза. У кобеля период созревания мужских половых клеток от спсрматогония до сперматозоида длится приблизительно 55—70 дней
ным в племенном отношении кобелям с нормальной спермой ее проводить вообще не следует. В случаях же олигоспермии и азооспермии польза от нее несоизмеримо превышает потенциальный риск осложнении.
Фиксажи. Наиболее подходящими средствами фиксации тканей семенников являются фиксаторы Боуэна, Ценкера Карновского и изготовленные на основе глютарового альдегида. Перед взятием и обработкой патологического материала ветеринарному врачу следует получить в той лаборатории, где будут проводиться исследования, консультацию относительно методов и средств фиксации биоп-татов. Нельзя фиксировать биопгаты семенников в формалине, который вызывает сморщивание семявыносящих канальцев, делает невозможным различение структуры клеточных ядер и способствует появлению артефактов, что может стагь причиной ошибочного диагноза (Amann, 1982). Биоптат необходимо поместить в фиксаж сразу же после его
ТАБЛИЦА 27-11. ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ НЕАСПИРАЦИОННЫХ МЕТОДОВ БИОПСИИ СЕМЕННИКОВ
Кровоизлияние
Воспаление
Инфекция
Гипертермия мошонки и семенников
Аутоиммунный орхит
Отек мошонки
Фиброз
Мошоночно-тестикулярная спайка
Закупорка семенных канальцев
Гранулема из сперматогенного эпителия
Атрофия семенника
Временное или продолжительное снижение интенсивности сперматогенеза
1056 • КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Рис. 27-17. Перед проведением резекционной биопсии семенника выстригают и дезинфицируют кожу спереди от мошонки и делают разрез по срединной линии. А. Семенник сдвигают вперед и фиксируют. Последовательно разрезают подкожную клетчатку, серозную и белковую оболочки на его медиовснтральной поверхности. Отсекают часть opiaHa, вышедшую наружу через разрез белочной оболочки. Б. После завершения биопсии разрез оболочек зашивают тонким (№ 5 или 6) абсорбционным, нереактивным шовным материалом В, а затем наносят шов на разрез кожи.
получения. При резекционной биопсии взятый материал погружают в фиксатор вместе с лезвием, нс пытаясь отделить от него биоптат. Такой метод сводит к минимуму возможность артефактов, связанных с механическим повреждением клеток и тканей взятой пробы. Лучшие результаты получают при окраске тканей семенников гематоксилин-эозином, периодическим кислым красителем Шиффа или толуидиновым голубым.
Методика. К неаспирационным методам биопсии семенников относятся перкутанный и резекционный. Перкутанная биопсия проводится специальными иглами. Это быстрый, простой и недорогой метод. Ее проводят на животном, находящемся в состоянии кратковременного наркоза; с пои целью лучше воспользоваться быстродействующим анестетиком (например, пропофолом). Проведение процедуры под контролем УЗИ повышает эффективность метода, позволяя точно выбрать место биопсии, что особенно важно при наличии очаговых поражений семенников. Операция сопряжена с риском травматизации паренхимы и системы семенных канальцев семенника, а качество и коли
чество получаемого материала может оказаться недостаточным для проведения всестороннего гистологического исследования. Кроме того, как уже отмечалась выше, для перкутанной биопсии требуется, чтобы собака находилась в состоянии наркоза. Для проведения перкутанной биопсии используют несколько типов игл (Бард Ьиопти-Кат, мо щфици-рованной Вим-Силверман-Франклина, Вим ТруКаз, Джамшиди и Менджини). Мы предпочитаем пользоваться иглой Бард Биопти-Кат (производства CR Bard, Inc, США) и проводить операцию под контролем УЗИ. Размер игл подбирается в соответствии с размером семенников - обычно применяются иглы размером 6-7,3 мм. При введении иглы семенник фиксируют одной рукой в области семенного канатика. Этого вполне достаточно для сдавливания семенной артерии. Делается небольшой разрез мошонки на ее кранио-вентральной поверхности. Иглу направляют к каудо-вентральной части семенника, избегая се попадания в придаток семенника или семявыносящие канальцы. Рекомендуется все манипуляции проводить под контролем УЗИ, если имеется такая возможность. Необходимости нало-
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
1057
жения шва на разрез мошонки нет. Остановка кровотечения достигается сдавливанием краев разрезанных тканей.
Материал, полученный посредством резекционной биопсии, более пригоден для определения патологоанатомических и патогистологических изменений семенников, чем пробы тканей, полученные перкутанной биопсией (Lopate, 1989). При резекционной биопсии наиболее часто проводят иссечение клина семенника через разрез его белочной оболочки - такой биоптат лучше всего подходит для проведения гистологического исследования. Пользуясь этим методом, можно выбрать оптимальный размер иссекаемой ткани, свести к минимуму ее травматизацию, которая может стать причиной артефактов при гистологическом исследовании, и избежать повреждений кровеносных сосудов семенника. Поскольку резекционная биопсия проводится с соблюдением правил асептики, часть полученного ею материала может быть подвергнута бактериологическому исследованию. Недостатком метода является необходимость применения наркоза, что требует больших затрат времени и средств. Но все это окупается высоким качеством получаемого патологического материала.
Резекционную биопсию можно проводить через разрез мошонки, но лучше это делать через разрез кожи брюшной стенки по срединной линии в непосредственной близости от переднего края мошонки (рис. 27-17, А). Выбранное для разреза место предварительно обрабатывают так же, как и при других хирургических операциях (дезинфицируют после выбривания шерсти). Семенник сдвигают в краниальном направлении и скальпелем делают надрез кожи. Семенник фиксируют рукой, пережимая его кровеносные сосуды. Надрезают оболочки (серозную и белочную) на медиовентральной поверхности семенника. Из разреза наружу выходит часть паренхимы семенника (рис. 27-17, Б). Ее отсекают лезвием или острыми ножницами Метзенбаума. В первом случае ткань сразу же погружают в фиксатор, не снимая с лезвия, а во втором ее помещают на кусочек картона, который заливают фиксатором. В тех случаях, когда из разреза белочной оболочки наружу не выходит часть семенника, с поверхности последнего вырезают клин ткани. Разрез оболочек семенника зашивают тонким (№ 5 или 6) абсорбционным, нереактивным шовным материалом (рис. 27-17, В), после чего зашивают кожу. Семенник должен принять обычное для него положение в мошонке. В тех случаях, когда этого не происходит, следует предполагать, что семенник был случайно пришит к его оболочкам.
КАРИОТИПИРОВАНИЕ
Многие случаи врожденного бесплодия, а также гипоплазии семенников и пениса связаны с наличием у кобелей лишней половой хромосомы (XXY). Ее выявляют при кариотипировании. К сожалению, в
настоящее время это осуществимо лишь в нескольких институтах. (Более детальная информация по кариотипированию собак приведена в гл. 24).
ЛИТЕРАТУРА
Althouse GC, et al: Effect of latex and vinyl examination gloves on canine spermatozoal motility. JAVMA 199:227, 1991.
Amann RP: Use of animal models for detecting specific alterations in reproduction. Fundam Appt Toxicol 2:13, 1982.
Amann RP: Reproductive physiology and endocrinology of the dog. In Morrow DA (ed): Current Therapy in Theriogenology, 2nd ed. Philadelphia, WB Saunders Co, 1986, p 532.
Atalan G, et al: Comparison of ultrasonographic and radiographic measurements of canine prostate dimensions. Vet Radiol Ultra 40: 408, 1999.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in breeding bitches. Am J Vet Res 53:665, 1992a.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in stud dogs. Am J Vet Res 53:670, 1992b.
Boulanger P, et al: Androgen levels in the liquid of the canine vas deferens and peripheral plasma. J Endocrinol 93:109, 1982.
Brendler CB, et al: Spontaneous benign prostatic hyperplasia in the Beagle: Age-associated changes in serum hormone levels, and the morphology and secretory function of the canine prostate. J Clin Invest 71:1114, 1983.
Carmichael LE, Greene CE: Canine brucellosis. In Greene CE (ed): Infectious Diseases of the Dog and Cat, 2nd ed. Philadelphia, WB Saunders Co, 1990, p573.
Carmichael LE, et al: Problems with the serodiagnosis of canine brucellosis: Dog responses to cell-wall and internal antigens of Brucella canis. Dev Biol Standards 56:371, 1984.
Chapwanya A, et al: Diagnosing canine testicular neoplasia: Fine needle aspiration cytology and ultrasonography. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-Julyl, 2000, p 112.
Dahlbom M, et al: Testicular fine needle aspiration cytology as a diagnostic tool in dog infertility. J Sm Anim Pract 38: 506, 1997.
de Kretser DM, Robertson DM: The isolation and physiology of inhibin and related proteins. Biol Reprod 40:33, 1989.
DeNicola DB, et al: Cytology of the Canine Male Urogenital Tract. St. Louis, Ralston Purina Company, 1980.
Doig PA, et al: The genital Mycoplasma and Ureaplasma flora of healthy and diseased dogs. Can J Comp Med 45:233, 1981.
Edwards DF, et al: Immotile cilia syndrome - Primary cilia dyskinesia in the dog. Proceedings of the American College of Veterinary Internal Medicine, Washington, DC, 1986, p 1389.
England GCW, et al: An investigation into the origin of the first fraction of the canine ejaculate. Res Vet Sci 49:66, 1990.
England GCW, Plummer JM: Hypo-osmotic swelling of dbg spermatozoa. J Reprod Fert Suppl 47:261, 1993.
Falvo RE, et al: Testosterone pretreatment and the response of pituitary LH to gonadotropin-releasing hormone (GnRH) in the male dog. J Androl 3:193, 1982.
Feldman EC, Tyrrell JB: Plasma testosterone, plasma glucose, and plasma insulin concentrations in spontaneous canine Cushing’s syndrome. Proceedings of the American College of Veterinary Internal Medicine, Salt Lake City, 1982, p 81.
Feeney DA, et al: Canine prostatic disease - Comparison of radiographic appearance with morphologic and microbiologic findings: 30 cases (1981 -1985). JAVMA 190:1018, 1987.
Frenette G, et al: Origin of alkaline phosphatase of canine seminal plasma. Arch Androl 16:235, 1986.
Freshman JL, et al: Effects of methyltestosterone on reproduction in male greyhounds. Proceedings of the American College of Veterinary Internal Medicine Fifth Annual Forum, San Diego, CA, 1987, p 917.
Freshman JL: Clinical management of the subfertile stud dog. Vet Clin North Am 31: 259, 2001.
Ganong WF: The gonads: Development and function of the reproductive system. In Ganong WF (ed): Review of Medical Physiology, 20th ed. New York, Lange Medical Books/McGraw Hill, 2001, p 398.
Hewitt D: Physiology and endocrinology of the male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, British Small Animal Veterinary Association, 1998, p 61.
Hewitt DA, et al: Test of canine sperm function in vitro using primary homologous oocytes and confocal microscopy. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-July 1, 2000, p 69.
1058
КЛИНИЧЕСКАЯ И ДИАГНОСТИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ КОБЕЛЕЙ
Hoist BS, et al: Zona pellucida binding assay - A method for evaluation of canine spermatozoa. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-Julyl, 2000, p 67.
Johnson CA, et al: Effect of ,3,l-induced hypothyroidism on indices of reproductive function in adult male dogs. J Vet Int Med 13:104, 1999.
Johnston GR, et al: Diagnostic imaging of the male canine reproductive organs. Vet Clin North Am 21:553, 1991.
Johnston SD: New canine semen evaluation techniques for the small animal practitioner. Proceedings of the Society for Theriogenology, Coeur d’Alene, ID, September 29-30, 1989, p 320.
Johnston SD: Performing a complete canine semen evaluation in a small animal hospital. Vet Clin North Am 21:545, 1991.
Johnston SD, Root Kustritz MV, Olson PNS: Semen collection, evaluation, and preservation. In Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline Theriogenology. Philadelphia, WB Saunders Co, 2001, p 287.
Johnston SD, Root Kustritz MV, Olson PNS: Clinical approach to infertility in the male dog. In Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline Theriogenology. Philadelphia, WB Saunders Co, 2001, p 371.
Jones DE, Joshua JO: Reproductive Clinical Problems in the Dog. Bristol, England, John Wright and Sons, 1982, p 49.
Keenan LRJ: The infertile male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, British Small Animal Veterinary Association, 1998, p 83.
Kumar MSA, et al: Distribution of luteinizing hormone releasing hormone in the canine hypothalamus: Effect of castration and exogenous gonadal steroids. Am J Vet Res 41:1304, 1980.
Larsen RE, Johnston SD: Management of canine infertility. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders Co, 1980, p 1226.
Lein DH: Mycoplasma infertility in the dog: Diagnosis and treatment. Proceedings of the Society for Theriogenology, Coeur d’Alene, ID, September 29-30, 1989, p 307.
Linde-Forsberg C, Bolske G: Canine genital mycoplasmas and ureaplasmas. In Bonagura JD, Kirk RW (eds): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders Co, 1995, p 1090.
Lopate C: Histopathologic and gross effects of testicular biopsy in the dog. Theriogenology 32: 585, 1989.
Mattoon JS, Nyland TG: Ultrasonography of the genital system. In Nyland TG, Mattoon JS (eds) Veterinary Diagnostic Ultrasound. Philadelphia, WB Saunders Co, 1995, p 141.
Mickelsen WD, et al: The relationship of semen quality to pregnancy rate and litter size following artificial insemination in the bitch. Theriogenology 39: 553, 1993.
Meyers-Wallen VN: Clinical approach to infertile male dogs with sperm in the ejaculate. Vet Clin North Amer 21: 609, 1991.
Nett TM, Olson PNS: Reproductive physiology of dogs and cats. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1983, p 1698.
Oettle EE: Sperm morphology and fertility in the dog. J Reprod Fertil 47(Sup-pl):257, 1993.
Oettle EE: Sperm abnormalities and fertility in the dog. In Bonagura JD, Kirk RW (eds): Kirk’s Current Veterinary Therapy XII. Philadelphia, WB Saunders Co, 1995, p 1060.
Olar TT, et al: Relationships among testicular size, daily production and output of spermatozoa, and extragonadal spermatozoal reserves of the dog. Biol Reprod 29:1114, 1983.
Olson PN: Disorders of the canine prostate gland. Proceedings of the Annual Society for Theriogenology, Denver, CO, 1984a, p 46.
Olson PN: Clinical approach to infertility in the stud dog. Proceedings of the Annual Society for Theriogenology, Denver, CO, 1984b, p 33.
Olson PN, et al: Concentrations of carnitine in the seminal fluid of nor-mospermic, vasectomized, and castrated dogs. Am J Vet Res 48:1211, 1987.
Olson PN, et al: Concentrations of luteinizing hormone and folliclestimulating hormone in the serum of sexually intact and neutered dogs. Am J Vet Res 53:762, 1992.
Pugh CR, et al: Testicular ultrasound in the normal dog. Vet Radiol 31:195, 1990.
Purswell BJ, Wilcke JR: Response to gonadotrophin-releasing hormone by the intact male dog: Serum testosterone, luteinizing hormone and follicle-stimulating hormone. J Reprod Fert, 47(Suppl):335, 1993.
Root Kustritz MV, et al: The effects of stains and investigators on assessment of morphology of canine spermatozoa. J Am Anim Hosp Assoc 34: 348, 1998.
Ruel Y, et al: Ultrasonographic evaluation of the prostate in healthy intact dogs. Vet Radiol Ultra 39:212, 1998.
Smith SC, England GCW: Effect of technical settings and semen handling upon motility characteristics measured using computer-aided sperm analysis. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-July I, 2000, p 88.
Soderberg SF: Infertility in the male dog. In Morrow DA (ed): Current Therapy in Theriogenology, 2nd ed. Philadelphia, WB Saunders Co, 1986, p 544.
Taha MB, et al: The effect of season of the year on the characteristics and composition of dog semen. J Small Anim Pract 22:177, 1981a.
Taha MA, et al: Some aspects of reproductive function in the male Beagle at puberty. J Small Anim Pract 22:663, 1981b.
Van Kuppeveld, et al: Detection of mycoplasma contamination in cell cultures by a mycoplasma group-specific PCR. Appl Environ Micro 60: 149, 1994.
Verstegen J, et al: Objective evaluation of semen motility parameters in the dog: Comparison of Hamilton-Thorn Computer sperm assisted system and the Sperm quality analyser. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-Julyl, 2000, p 90.
Wasmer ML, Rogers KS: Pharmacologic androgen deprivation. Comp Cont Ed 18: 267, 1996.
Woodall PF, Johnstone IP: Scrotal width as an index of testicular size in dogs and its relationship to body size. J Small Anim Pract 29:543, 1988.
ВРОЖДЕННЫЕ ЗАБОЛЕВАНИЯ.........1059
Сохранение уздечки пениса......1059
Гипоплазия пениса..............1059
Гипоспадия.....................1060
Врожденная деформация кости пениса...................1060
Глава 28 ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ
Раздвоение пениса.............1061
ПРИОБРЕТЕННЫЕ ЗАБОЛЕВАНИЯ......1061
Фимоз.........................1061
Парафимоз.....................1061
Приапизм......................1062
Отсутствие эрекции............1063
Пролапс уретры.................1064
Препуциальные выделения........1064
Баланопостит...................1065
Травмы пениса..................1066
Новообразования пениса и препуция 1067
ВРОЖДЕННЫЕ ЗАБОЛЕВАНИЯ
Сохранение уздечки пениса
В период внутриутробного развития эпителиальные поверхности пениса и препуция плода остаются скрепленными одним слоем эктодермальных клеток, который разомкнут на вентральной поверхности полового члена. В этом участке формируется перемычка из соединительной ткани, которая связывает пенис с препуцием. Ее называют уздечкой полового члена, или уздечкой препуция. Под влиянием андрогенов, секретируемых развивающимися мужскими половыми железами плода, эктодермальный слой клеток между пенисом и препуцием расщепляется, что ведет к появлению препуциальной полости. Этот процесс завершается у одних видов животных в период внутриутробного развития, а у других - после рождения. Андрогены способны вызвать истончение, но не разрушение уздечки; последнее обычно происходит в результате возникающего у новорожденного механического натяжения. Однако в ряде случаев этого не происходит. Сохранившаяся соединительно-тканная спайка соединяет вентральную поверхность головки полового члена с препуцием или с вентральной поверхностью самого полового члена, в результате чего головка загибается в вентральном или боковом направлениях.
О том, что у щенка сохранилась уздечка полового члена, как правило, узнают во время его физикального исследования, проводимого при первичной вакцинации (рис. 28-1). Владельцы щенков с такой патологией часто жалуются, что у их питомцев при мочеиспускании моча выделяется в самых непредвиденных направлениях. При регулярном попадании мочи на кожу задних конечностей у животного
может развиться вторичный дерматит. Дополнительные диагностические признаки сохранения уздечки могут включать невозможность выведения полового члена из препуциального мешка во время эрекции и частое облизывание кобелем области препуция. Если своевременно не выявить и не устранить персистенцию уздечки полового члена, то у животного половое возбуждение будет ассоциироваться с болью, что, в свою очередь, неизбежно влечет за собой снижение либидо и отсутствие стремления к вязкам.
Диагностика данной патологии основана на обнаружении при визуальном обследовании полового члена и препуция аномального соединительнотканного тяжа, идущего от головки пениса. Уздечка обычно не имеет кровеносных сосудов, поэтому от нее легко и без осложнений можно избавиться разрезанием скальпелем под местной анестезией. Неизвестно, обусловлена ли эти аномалия генетически, но наиболее часто она встречается у кокер-спаниелей (Johnston et al, 2001).
Гипоплазия полового члена
Гипоплазия (недоразвитие) полового члена - редкое заболевание, описанное у кокер-спаниелей, колли, доберман-пинчеров и догов (Johnston, 1989). Выявление при физикальном исследовании недоразвития пениса рассматривается, как одно из проявлений гермафродитизма (см. стр. 992), и нарушения репродуктивных качеств кобеля. У некоторых животных с гипоплазией пениса был установлен аномальный кариотип. Уменьшение размера полового члена может также происходить после кастрации кобеля в раннем возрасте. Salmeri и соавторы (1991) сообщили о недоразвитии половых органов у помесных собак, которых кастрировали в 7-неде-
1060 • ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ
Рис. 28-1. Персистенция уздечки полового члена, вызвавшая расширение дистальной часш пениса у 3-месячного кобеля породы лхаса апсо. Обследование собаки проводили с целью установления причин и устранения мочеиспускания в не-п редсказусмом на п ра вл ен и и.
льном возрасте. У этих животных диаметр пениса, размер и выявляемая рентгеном плотность кости пениса, а также степень развития препуция были значительно меньше, чем у интактных или кастрированных в 7-месячном возрасте кобелей. Средний диаметр полового члена у интактных кобелей был почти вдвое больше, чем у кобелей, кастрированных в 7-недельном возрасте, и больше, чем у кастрированных в 7-месячном возрасте собак.
Гипоплазия пениса обычно протекает субклинически и почти всегда обнаруживается случайно во время физикального исследования. При данной патологии из-за узкого отверстия препуциальной полосги (препуциального кольца) происходи! ее регулярное загрязнение мочой, что, в свою очередь, может стазь причиной развития инфекционного процесса (см. ниже). Диагностика гипоплазии пениса основана на результатах физикального исследования. При постановке такого диагноза следует предполагаю возможность гермафродитизма животного, поэтому рекомендуется провести кариоти-пирование (см. стр. 992). Если гипоплазия полового члена протекает бессимптомно, лечение не ipe6y-ется. Если же возникают проблемы с мочеиспусканием и инфицированием, необходимо расширить препуциальное отверстие и укоротить препуций xnpypi ичсским путем.
Гипоспадия
Гипоспадия представляет собой врожденное нарушение разви I ия наружных половых органов кобеля, при ко юром наружное отверстие уретры смещается в заднем и вентральном направлении от места его нормальной локализации на головке полового члена Различают несколько типов гипоспадии в зависимости от того, где открывается наружное отверстие уретры (на головке или других частях полового члена, в мошонке и в промежности) (Hayes, Wilson, 1986). Промежностный тип гипоспадии у кобелей
встречается наиболее часто, и он может представлять собой проявление пссвдогсрмафродитизма (см. стр. 997). Гипоспадия развивается в результате неслияния генитальных складок или возвышений (или и тех и других) в период внутриутробного развития, что может также вызывать нарушения развития пениса, препуция и/или мошонки У кобелей с гипоспадией часто одновременно выявляют укорочение или загиб пениса, аномалии его кости, неполное смыкание стенок препуциальной полости, нарушения развития мошонки и другие врожденные пороки (см. рис. 24-14, стр. 997).
При данной патологии помимо внешних признаков нарушения развития наружных половых органов и мочеиспускательного канала у собак могут проявляться симптомы инфекций последнего (например, дизурия и гематурия), недержание мочи и раздражение кожи мочой. Гипоспадию диагностируют посредством визуального осмотра наружных половых органов кобеля и катетеризации мочеиспускательного канала. От локализации наружного отверстия уретры и тяжести тпоспадии зависит выбор метода ее хирургической коррекции. К лечению приступают только после полного завершения обследования мочеполового тракта, поскольку выявление дополнительных пороков развития может внести коррективы в схему операции. Бывают случаи, когда приходится прибегать к ампутации полового члена, резекции его кости, мошоночной или промежностной урстростомии, а также другим пластическим хирургическим приемам. Почти всегда кобеля одновременно кастрируют, поскольку есть все основания полагать, что гипоспадия имеет генетическую основу, особенно при наличии других пороков развития (например, гермафродитизма или крипторхизма). Случаи семейной гипоспадии наблюдались у бостон-тсрьсров (Hayes, Wilson, 1986).
Врожденная деформация кости пениса
Деформация кости пениса может стать причиной его загиба и, в зависимости от се тяжести, невозможности его ретракции в препуциальную полость. Некоторые кобели предрасположены к закупорке мочеиспускательного канала. Продолжительное воздействие факторов внешней среды на находящуюся вне пределов препуциальной полости часть головки пениса может вести к пересыханию ее поверхности, травмам и некрозу обнаженной ткани. Легкая деформация кости (например, ее загиб или укорочение) может стать препятствием для введения пениса в половую щель и влагалище суки во время вязки, что становился причиной «мнимого» бесплодия кобеля.
Необходимость лечения гипоспадии определяется тяжестью деформации кости полового члена и тем, предполагается ли в дальнейшем использовать кобеля в племенных целях. Хирургическая коррекция сильного загиба кости пениса может
ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ • 1061
включать ее перелом и выпрямление. Чрезмерно загнутый или очень короткий пенис затрудняет осуществление животным коитуса, но это не является препятствием для получения от него спермы для искусственного осеменения. Если кобеля не собираются использовать в племенных целях, и у него нет парафимоза или затрудненного и болезненного мочеиспускания (дизурии), необходимость в терапии отпадает.
Раздвоение пениса
Раздвоение пениса (дифалия) - чрезвычайно редко встречающееся у собак врожденное уродство. Оно описано у 5-месячного пойнтера, 6-месячного помесного пуделя и 5-месячного беспородного щенка с полимелией (наличие добавочных конечностей или их сегментов) (Johnston, 1989; Zucker et al, 1993). У всех этих собак дифалия сочеталась с многочисленными нарушениями развития мочеполовой системы (в том числе гидронефрозом, крипторхизмом, наличием двух мочевых пузырей и двух предстательных желез). Формирование у кобелей двух половых членов может быть результатом аномального продольного раздвоения клоачной мембраны плода. Последующая вентральная миграция первичной мезодермы вокруг двух клоачных мембран ведет к образованию пары генитальных туберкулов.
Дифалию диагностируют при визуальном осмотре кобеля. Лечения собак с этим уродством не проводят.
ПРИОБРЕТЕННЫЕ ЗАБОЛЕВАНИЯ
Фимоз
Фимозом называют неспособность кобеля выводить пенис из препуциального мешка вследствие слишком узкого отверстия последнего. Фимоз может быть врожденным и приобретенным. В первом случае он обычно развивается у кобелей с наследственной предрасположенностью к стенозу препуция и гермафродитизму. Приобретенный фимоз возникает как следствие воспаления, отека, новообразований, а также образования тканевых рубцов после травм, химического раздражения или перенесенной инфекции.
Симптоматика фимоза зависит от степени сужения кольца препуциального мешка. Полное врожденное заращение мешка становится причиной нарушения выделения мочи и, как следствие, гибели новорожденного щенка. При маленьком препуциальном кольце затрудняется акт мочеиспускания и в его полости скапливается моча. В таких случаях из препуция постоянно капает моча и могут развиться отек препуция, вторичные бактериальные инфекции и баланопостит. Как правило, фимоз препятствует выведению полового члена из полости препуция во время вязки. Неспособность к копуляции
легко обнаруживается и служит признаком фимоза. Боль, испытанная кобелем во время неудачных попыток совершения коитуса, становится причиной снижения у него либидо.
Ветеринары без труда диагностируют тяжелые случаи фимоза кобелей по невозможности выведения из препуциального мешка даже ненапряженного пениса. В менее тяжелых случаях диагноз удается поставить только тогда, когда кобель испытывает половое возбуждение.
В случае приобретенного фимоза следует устранять все факторы, способствующие его возникновению или усилению. Необходимость расширения препуциального кольца хирургическим путем зависит от тяжести фимоза и того, планируется ли в будущем использовать кобеля в племенных целях. Необходимость в проведении операции возникает, если кобель из-за фимоза испытывает затруднения во время совершения мочеиспускания и полового акта. Врожденный стеноз препуция описан в пометах золотистого ретривера и беспородных собак, что дает основание предполагать наследственную природу этого заболевания (Johnston, 1989).
Парафимоз
Парафимоз - ущемление в узком препуциальном кольце увеличенного или отечного полового члена, который кобелю не удается ввести обратно в полость препуция (рис. 28-2). Возникновение застоя венозной крови в кавернозных телах пениса, ущемление которого произошло во время эрекции, ведет к прогрессирующему увеличению его головки. В последней нарушается циркуляция крови, ее поверхность пересыхает, развивается ишемический некроз и, как следствие, закупорка уретры и гангрена. Парафимоз наиболее часто возникает во время вязки, когда окружающие препуциальное кольцо волосы опутывают основание головки пениса, образуя давящую манжету. Он также может возникнуть, когда эрекция начинается после выхода полового члена наружу и размер пениса становится значительно больше препуциального кольца, что делает невозможной его ретракцию в препуциальную полость после прекращения эрекции. К числу других причин парафимоза относятся легкий фимоз, инородные тела (например, резиновые кольца), перелом кости полового члена, хронический приапизм (т.е. увеличение пениса при отсутствии полового возбуждения), травмы, новообразования и хронический баланопостит (Greiner, Zolton, 1980).
При ряде других заболеваний у кобелей может обнажаться головка полового члена, что служит причиной ошибочной диагностики парафимоза. К числу таких патологий относятся паралич ретрактора пениса, врожденные деформации кости полового члена, чрезмерно большое препуциальное кольцо и врожденное укорочение препуция (рис. 28-3). Дифференциальная диагностика этих заболеваний основана на том, что в отличие от парафимо-
1062 • ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ
Рис. 28-2. Парафимоз, возникший у 4-летнего кобеля немецкой овчарки после вяжи. Причиной развития парафимоза стало опутывание головки полового члена собаки волосами препуция.
Рис. 28-3. Врожденное укорочение препуция, из-за которого головка половою члена продолжительное время находится вне полости препуциального мешка. Отсутствие постоянного увеличения головки пениса и хронический характер патологии позволяют дифференцировать ее ог парафимоза.
за при них отсутствует увеличение полового члена и они носят хронический характер.
Парафимоз - острое заболевание. Откладывание проведения его лечения или неудачная попытка лечения повышают риск развития непроходимости мочеиспускательного канала, ишемического некроза и гангрены пениса. В случаях, когда парафимоз не удалось устранить консервативными способами терапии в течение 24 часов после его возникновения, часто приходится прибегать к ампутации полового члена (Burke, 1983). Целью терапии парафимоза является восстановление оттока венозной крови из пениса. Для этого удаляют сжимающие пенис полоски ткани, волосы и инородные предметы, очищают и удаляют некротизированные ткани, проводя! санацию пораженных участков полового члена и вводят ею в полость препуциального мешка. Перед проведением лечения можно использовать транквилизаторы (например, ацепромазин) для релаксации животного и понижения у него давления крови, что облегчает мануальное введение пениса в препуциальную полость (Verstegen, 1998). После санации полового члена его можно обработать смазочными препаратами и холодным I ипертоническим раствором декстрозы, что ведет к уменьшению его размера. В тяжелых случаях, когда консервашвные методы лечения оказались безуспешными. приходится прибегать к хирургическому расширению препуциального кольца.
В случаях тяжелого травмирования полового члена, при котором могло произойти повреждение мочеиспускательного канала, для предотвращения появления стриктур уретры в нее вводят на 7—14 дней постоянный мягкий резиновый катетер. После того, как половой член удастся вернуть в препуциальный мешок, его ежедневно на протяжении 1-2 недель извлекают оттуда и вводят в полость препу
ция мазь, содержащую антибиотик и/или стероидный противовоспалительный препарат. Это помогает избежать образования спаек между пенисом и препуцием. При тяжелом некрозе или гангрене пениса может возникнуть необходимость в его ам-путации.
Принятие опреленных мер предосторожности перед вязкой и после нее позволяет предотвратить возникновение парафимоза. Прежде всего, выстригают волосы, растущие вблизи от препуциального кольца. После вязки половой член и препуций кобеля периодически обследуют до тех пор, пока он не займет свое место в полости препуциального мешка. В норме препуций ле! ко скользит вдоль полового члена и не заворачивается сам на себя. Если кобель, перенесший парафимоз, не предназначен для племенного разведения, его кастрация позволит избежать полового возбуждения и, соответственно, сведет к минимуму рецидивы заболевания. Разработано несколько хирургических методов лечения рецидивирующего парафимоза, в том числе суживание препуциального кольца, удлинение препуция (препуциопластия), ушивание препуциальной мышцы (миорафия) и искусственное создание постоянной спайки между поверхностью полового члена и слизистой оболочкой препуция (Fossum et al, 2002; Somerville, Anderson, 2001).
Приапизм
Приапизм - это постоянное увеличение полового члена в отсутствие полового возбуждения. Из-за продолжительного пребывания пениса вне полости препуциального мешка и застоя в нем крови могут развиться такие осложнения как пересыхание поверхности и ишемический некроз пениса. Эрекция происходит в результате поступления в пенис сти-
ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ • 1063
мулирующих импульсов по парасимпатическим волокнам нервов, иннервирующих таз. В ответ начинается приток артериальной крови к кавернозным телам полового члена и снижается отток из них венозной крови, что обеспечивается сокращением окружающей кавернозные тела гладкой мускулатуры (Carati et al, 1988). Стимуляция симпатической нервной системы, напротив, снимает эти эффекты. У людей приапизм обычно развивается как осложнение заболеваний, при которых нарушается нормальная регуляция эрекции за счет чрезмерно продолжительной или интенсивной парасимпатической стимуляции, а также как следствие снижения оттока венозной крови из полового члена, вызванного окклюзивной тромбоэмболией или сдавливанием вен растущей опухолью (Winter, McDowell, 1988). Сообщалось о развитии приапизма у кобелей из-за получения травм при вязке, инфекций мочеполовой системы, запора, поражений спинного мозга, хронической формы чумы, энцефаломиелита, тромбоэмболии кровеносных сосудов пениса. Ряд случаев заболевания отнесен к идиопатическому приапизму, поскольку причины болезни выяснить не удалось (Guilford et al, 1990; Root Kustritz, Olson, 1999). Приапизм развивается у котов после кастрации и, возможно, вследствие травм, полученных при попытке осуществления коитуса с кошкой, находящейся в фазе эструса (Orima et al, 1989; Swalec, Smeak, 1989; Gunn-Moore et al, 1995). Приапизм диагностируют на основании осмотра половых органов кобеля. Это заболевание следует в первую очередь дифференцировать от парафимоза, который сопровождается продолжительным пребыванием пениса вне полости препуциального мешка в отсутствие эрекции. Для установления этиологии болезни необходимо тщательное обследование мочеполовой системы, включающее рентгенологическое исследование брюшной полости и позвоночника, УЗИ брюшной полости и наружных половых органов, а также анализ крови и спинномозговой жидкости.
Хотя описано несколько случаев спонтанного выздоровления кобелей от приапизма, для успешного лечения патологии обычно необходимо определить и устранить вызвавшие ее причины с помощью симптоматической терапии, направленной на сведение к минимуму риска пересыхания поверхности и некроза полового члена. С этой целью пенис периодически очищают, смазывают препаратами, которые предотвращают пересыхание его поверхности, и надевают на животное «елизаветинский воротник», предотвращающий нанесение кобелем самому себе травм при облизывании полового члена. Кастрация при этом заболевании обычно неэффективна (Root Kustritz, 2001). Orima и соавторы (1989) успешно лечили приапизм собак и кошек нанесением надрезов на половой член в области его венозного и артериальных кавернозных тел, а также на белочную оболочку семенников. Последующее сдавливание пениса позволяло избавиться от застоя в нем крови и образования тромбов. Антигистаминовые и ан-
тихолинергические препараты бензтропин мезилат (когентин; Merck & Со., West Point, РА) и дифенгидрамин с успехом применяли для лечения приапизма соответственно у двух жеребцов и у мужчин. Однако такой метод лечения эффективен, если его начинают проводить в течение нескольких часов после начала заболевания (Wilson et al, 1991). Тербуталин (Р-адренергический агонист) также оказался эффективным средством лечения приапизма мужчин (Shantha et al, 1989). Случаи успешного медикаментозного лечения приапизма у собак не известны. Если не удается устранить причины, повлекшие за собой развитие заболевания, и повреждения пениса приобретают необратимый характер, прибегают к ампутации полового члена и промежностной уретростомии.
Отсутствие эрекции
Возможность эрекции зависит от ряда факторов, основными из которых являются правильное анатомическое строение, отсутствие нарушений циркуляции крови и иннервации полового члена, а также достаточный уровень секреции тестостерона интерстициальными клетками Лейдига. Кроме того, отсутствие эрекции у кобеля может быть обусловлено: (1) недостаточной стимуляцией его полового возбуждения; (2) проявлением им покорного поведения в присутствии доминантной, агрессивной суки; (3) боязнью испытать боль, которую он ощутил во время предыдущей вязки (из-за воспаления суставов, позвоночника, предстательной железы) или чувствует каждый раз во время эрекции (из-за наличия уздечки полового члена); (4) недостатком андрогенов; (5) наличием артериовенозного шунта (прохождение крови из артерий непосредственно в вены, а не в кавернозные тела), который препятствует нормальному увеличению полового члена во время эрекции (Johnston, 1989). Дефицит андрогенов может быть вызван гипоплазией семенников, нарушениями развития половых органов (например, при кариотипе XXY), рядом заболеваний, сопровождающихся снижением секреции ФСГ или приемом лекарственных препаратов (например, глюкокортикоидов), которые подавляют секрецию гонадотропинов. Если отсутствие эрекции вызвано недостатком андрогенов, то часто происходит одновременное снижение либидо.
Доскональный анамнез и тщательное физикальное исследование дают основание для постановки предварительного диагноза. При сборе анамнеза следует уделять особое внимание информации о том, как проводятся вязки кобеля, в каких условиях его содержат и какими лекарственными препаратами пользовались для лечения. При обследовании, в первую очередь, определяют размер и плотность семенников и предстательной железы, размер полового члена, занимаемое им положение, а также наличие отклонений его анатомического строения от нормы, которые могут быть обусловлены гер-
1064 • ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ
мафродитизмом или дефицитом андрогенов. Скелетно-мышечную систему обследуют на наличие признаков артритов - особенно важно убедиться в отсутствии поражений тазобедренных суставов. Функциональное состояние клеток Лейдига оценивают по концентрации тестостерона в крови до и после введения ГнРГ (см. стр. 1049). Кариотипи-рование полезно в случаях предполагаемого гермафродитизма. Наконец, анализы крови (например, подсчет форменных элементов, биохимический анализ сыворотки, определение концентрации тиреоидных гормонов) и мочи позволяют исключить эндокринные и другие системные заболевания.
Проводят лечение диагностированных заболеваний. При выявлении аномального кариотипа, низкой концентрации тестостерона в сыворотке крови или I ипоплазии семенников npoi ноз обычно небла-гоприятный. Однако ситуация меняется в лучшую сторону, когда оказывается, что отсутствие эрекции у кобеля вызвано сопутствующими поддающимися лечению эндокринными заболеваниями или является осложнением проводимой медикаментозной терапии. Если диагностические тесты не позволили установить причину отсутствия эрекции, необходимо предпринять попытку проведения вязки кобеля в привычной для него обстановке с другими точными суками. Обработка наружных половых органов и бе iep предназначенной для вязки течной суки феромоном (Eau d'Estrus; Synbioticks, Malvern. РА) или вагинальными тампонами, полученными от других сук, находящихся на стадии эструса, также могут способствовать половому возбуждению кобеля.
Пролапс уретры
Пролапс (выпадение) слизистой оболочки дистальной части уретры у кобелей происходит редко. Этиология этого заболевания пока остается неизвестной. Предполагается, что оно может вызываться чрезмерным половым возбуждением, стимуляцией возбуждения путем вылизывания собственных наружных половых органов или следствием снижения резистентности слизистой оболочки уретры к давлению во время мочеиспускания после перенесения мочекаменной болезни и инфекций мочеполового тракта. Пролапс уретры регистрируют исключительно у молодых некастрированных кобелей. Он сопровождается застоем крови в выпавшей части слизистой оболочки мочеиспускательного канала и ее отеком. Вследствие последующего опухания выпавшая часть слизистой оболочки приобретает вид темно-красной или пурпурной, невправ-ляемой массы, расположенной на головке полового члена (рис. 28-4). Вылизывание животным выпавшей оболочки в той или иной степени травмирует ее. Хозяева таких собак чаще всего обращаются в клинику по поводу периодических кровотечений из полового члена их питомцев (McDonald. 1989).
Оптимальным методом лечения пролапса уретры является хирургическая резекция выпавшего учас-
Рис. 28-4. Выпадение слизистой оболочки уретры у молодого помесного кобеля.
тка слизистой оболочки, особенно если выпавшая ткань некротизирована или сильно травмирована. Собак, у которых операция прошлг! без осложнений, в дальнейшем можно с успехом использовать в племенных целях (Root Kustritz, 2001). В тех случаях, когда выпавшая слизистая оболочка не повреждена и ее удастся вправить, можно прибегнуть к медикаментозному лечению. После вправления выпавшей ткани может понадобиться суживание наружного отверстия мочеиспускательного канала временным кисетным швом. Такой шов не препятствует мочеиспусканию. Для предотвращения рецидива пролапса шов снимают не ранее, чем через 3-5 дней. Применение транквилизаторов в первые дни после лечения сводит к минимуму возможность появления у кобеля полового возбуждения и последующего увеличения пениса. В случае рецидивов пролапса уретры, обусловленных частым половым возбуждением, кобеля целесообразно кастрировать. Пе известно, имеется ли генетическая предрасположенность к этому заболеванию, но у английских бульдогов, если судить по количеству публикаций, его частота наиболее высока (Johnston et al, 2001).
Препуциальные выделения
В норме у кобелей не должно быть препуциальных выделений. Лишь изредка у клинически здоровых собак вокруг препуциального кольца появляется небольшое количество желтовато-белой смегмы, которая состоит из эпителиальных и воспалительных клеток (преимущественно нейтрофилов), а также бактерий. Появление таких выделений не имеет клинического значения. В отличие от смегмы, выделения из препуция, содержащие мочу, кровь и большое количества гноя, считаются ненормальными.
Моча. Периодическое появление на препуциальном кольце кобелей капель мочи наиболее часто вызвано нарушениями развития (например, эктопическая уретра) или приобретенными заболеваниями - бактериальным циститом, наличием камней в мочевом пузыре и или уретре, нейрогенным недержанием мочи, тяжелой формой фимоза, а также
ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ • 1065
многочисленными поражениями сфинктора уретры. Выделение капель мочи во время сна может происходить у кобеля, страдающего полиурией/по-лидипсией. Тщательное физикальное исследование, клинический анализ крови, биохимический анализ сыворотки крови, бактериологический анализ мочи, абдоминальные УЗИ и рентгенологическое исследование обычно позволяют установить причину патологии. Иногда это удается сделать только с помощью дополнительных диагностических процедур - контрастной рентгенографии (например, внутривенной пиелограммы и позитивной контрастной цистограммы) и специальных нейрогенных тестов (например, получения цистометрограммы и определения колебаний давления в уретре).
Кровь. Капельное кровотечение из препуция или полового члена наиболее часто бывает при остром и хроническом простатите (см. стр. 1088). Оно также может быть обусловлено уретритом, прохождением камней по мочеиспускательному каналу, уретральным пролапсом, травмами препуция, пениса или его кости, опухолями препуция, пениса или уретры, попаданием инородного тела в полость препуциального мешка, а также нарушениями свертывания крови, например, дефицитом факторов свертывания крови, тромбоцитопенией и диссеминированной внутрисосудистой коагулопатией. Физикальное исследование больного животного, включая исследование выведенного из препуциального мешка полового члена и пальпацию предстательной железы через стенку прямой кишки, общий клинический анализ крови, оценка свертываемости крови, анализ мочи и ее бактериологическое исследование, а также абдоминальные рентген и УЗИ, как правило, позволяют ветеринарному врачу определить локализацию и причину кровотечения.
Гематурия может быть следствием дисфункции половой или мочевыводящей систем. Она может быть связана с заболеваниями почек, мочевого пузыря, предстательной железы, уретры, полового члена и препуция. О локализации поражения можно судить по тому, на какой стадии мочеиспускания возникает гематурия. Если кровь в моче появляется в конце акта мочеиспускания, следует предполагать наличие у собаки заболевание мочевого пузыря или предстательной железы, а обнаружение крови в первых порциях мочи говорит о том, что в патологический процесс вовлечены уретра, половой член или препуций. Присутствие крови в моче на протяжении всего акта мочеиспускания предполагает наличие у кобеля заболевания почек, мочевого пузыря, предстательной железы и, что бывает значительно реже, полового члена и препуция.
Слизисто-гнойные препуциальные выделения. Появление препуциальных выделений со значительным количеством слизи и гноя указывает на развитие у кобеля легкого воспаления или инфекции препуциального мешка. Такой тип выделений характерен для баланопостита, но в редких случа
ях выделения связаны с опухолями, попаданием в препуциальный мешок инородного тела и фимозом. Тщательное обследование полового члена и препуция обычно позволяет определить причины появления слизисто-гнойных выделений из препуциального мешка.
Баланопостит
Баланит - это воспаление головки пениса, а постит - воспаление препуция. Поскольку воспалительный процесс обычно захватывает одновременно и головку полового члена и препуций, то широкое применение для обозначения такой патологии нашел термин «баланопостит». Наличие баланопостита у кобеля следует предполагать всякий раз, когда владелец животного сообщает о появлении капель гноя на препуциальном кольце.
В состав нормальной микрофлоры препуциального мешка кобелей входят кишечная палочка, стрептококки, стафилококки, псевдомонады, про-теус, клебсиелла, микоплазмы и уреаплазмы (см. табл. 27-3, стр. 1046) (Keenan, 1998). Баланопостит обычно развивается на фоне изменения экосистемы препуциального мешка (например, при его травмировании или попадания в него инородного тела), в результате чего активизируется пролиферация нормальной микрофлоры и начинается инфекционный процесс. К числу вирусных агентов, вызывающих у кобелей баланопостит, относятся герпесвирус и ка-лицивирус собак (Crandall, 1988; Anvik, 1991). Баланопостит может быть также одним из клинических проявлений атопического дерматита или развивается как вторичный патологический процесс после нанесения животным самому себе травм (Root Kustritz, 2001). Mycoplasma canis и уреаплазмы также относятся к числу потенциальных этиологических агентов баланопостита; однако эти микроорганизмы примерно с равной частотой встречаются у нормальных и страдающих заболеваниями половых органов собак (Verstegen, 1998).
Анализ анамнестических данных свидетельствует о том, что развитию баланопостита обычно предшествует нанесение кобелем самому себе травм в результате частого облизывания и покусывания собственных препуция и полового члена. В результате у животного развивается воспалительный процесс, сопровождающийся появлением гнойных или геморрагических препуциальных выделений. Легкий баланопостит встречается у кобелей довольно часто и, по всей видимости, он не имеет серьезного клинического значения. В таких случаях у животных обычно не выявляют признаков воспаления слизистой оболочки головки пениса и препуция, а бактериологическое исследование проводят крайне редко. Тяжелый баланопостит, как правило, является следствием инфекции головки пениса и препуция и сопровождается значительным опуханием и воспалением пораженных тканей, обильными гнойными или гнойно-геморрагическими препу-
1066 • ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ
циаяьными выделениями, а также болью. Может происходить абсцедирование пораженных тканей, приводящее к появлению системных признаков заболевания (например, летаргии, снижения аппетита и лихорадки). Если заболевание остается нераспознанным и принимает хроническое течение, на препуции и головке пениса могут появляться рубцы, а между ними - спайки. Эти спайки нередко становятся причиной стеноза препуция, затруднений и болевых ощущений во время вязки, а также снижения у больных животных либидо.
Во всех случаях баланопостита необходимо тщательное обследование полового члена и препуция собак. При его проведении обращают особое внимание на наличие в препуциальном мешке или пенисе инородных тел, ран, новообразований и абсцессов. При баланопостите на слизистой оболочке препуция и луковиц пениса часто обнаруживают возникшие в результате скопления лимфоцитов фолликулярные или папулезные поражения, а также везикулы и изъязвления. Появление мелких папул и везикулов может быть вызвано герпесвирусной инфекцией; однако часто везикулоподобные поражения имеют совсем другое происхождение (Verstegen, 1998). Для выяснения причины баланопостита и в зависимости от тяжести заболевания может возникнуть необходимость в проведении эксфолиативного цитологического исследования препуциальных мазков, бактериологического исследования пораженных тканей, серологического исследования на инфекцию Brucella canis и полимеразной цепной реакции на герпесвирусную инфекцию (см. стр. 903 и 1020), а также биопсии необычных поражений препуция и пениса.
Лечение баланопостита зависит от его тяжести. Легкую форму заболевания лечат редко; в тех же случаях, когда для лечения баланопостита проводят промывание препуция и полового члена растворами антисептиков и топикально наносят на них препараты антибиотиков, достигается лишь временный успех. Более интенсивное лечение проводят
при появлении у собаки системных клинических нарушений, признаков воспаления, некроза, абсцессов или травм пениса и/или препуция, а также по настоятельному требованию владельца кобеля. Лечение тяжелых форм баланопостита предусматривает устранение факторов, вызвавших заболевание или способствовавших его развитию, очистку препуциального мешка и полового члена растворами антисептиков (например, хлоргексидином или разведенным бетадином) или стерильным физиологическим раствором, а также внесение мазей с антибиотиками в препуциальный мешок на протяжении 2-4 недель. Абсцессы вскрывают, дренируют и промывают. При наличии системных признаков заболевания рекомендуется пероральное введение антибиотиков широкого спектра, юйствия в течение 2-4 недель. Несмотря на проведение лечения, рецидивы баланопостита случаются очень часто, особенно если не были идентифицированы факторы, которые способствовали развитию болезни.
Травмы пениса
Травмирование полового члена происходит у кобелей во время вязки, при драках с собаками, ударах об изгородь или другие предметы во время прыжков. Последствиями таких происшествий у животных становятся ушиб, гематома, рваные и колотые раны пениса, а также переломы его кости, раны и непроходимость мочеиспускательного канала. Развивающиеся при этом клинические признаки зависят от типа и тяжести травмы. Часто имеют место кровотечения, отек и боль (рис. 28-5). При нарушении проходимости уретры у животных могут появляться признаки расстройства функций органов мочеиспускания (гематурия, дизурия, анурия) и постренальной уремии. При разрыве уретры моча может попадать в подкожную клетчатку и вызывать ее фиброзное воспаление, появление абсцессов и отека, распространяющегося по вентральной поверхности тела.
Рис. 28-5. А. Вызванное травмой кровотечение из пениса у 5-летнего кобеля немецкой овчарки. Б. Вьвван-ные травмой опухание и кровотечение пениса 3-летнего помесного кобеля.
ЗАБОЛЕВАНИЯ ПОЛОВОГО ЧЛЕНА И ПРЕПУЦИЯ
1067
При травме полового члена, в первую очередь, надо остановить кровотечение. Затем обследуют проходимость мочеиспускательного канала и состояние кости полового члена. С этой целью проводят катетеризацию уретры (вплоть до мочевого пузыря), рентген кости полового члена и, если в этом возникает необходимость, ретроградную урет-рографию. Обнаруженные раны очищают, санируют, а если они имеют достаточно большой размер, зашивают. Крем с антибиотиком наносят на пенис дважды в день до тех пор, пока его раны не заживут. Переломы кости могут потребовать хирургического лечения, особенно в случаях ее сильного загиба или нарушений проходимости уретры за счет сдавливания костными обломками (Kelly, Clark, 1995). При тяжелых травмах полового члена может возникнуть необходимость в его ампутации и проведении промежностной уретростомии. В период выздоровления животного необходимо ежедневно по 2 раза выводить его пенис из препуциального мешка для предотвращения появления между ними спаек. Одновременно на пенис наносят препараты антибиотиков. Необходимо принятие мер, предотвращающих половое возбуждение у кобеля в период реабилитации.
Иногда на месте перелома кости полового члена формируется чрезмерно большая мозоль или разрастается фиброзная ткань, что становится причинами закупорки уретры или загиба пениса (Bradley, 1985; Johnston et al, 2001). В таких случаях у кобеля появляются дизурия, растяжение стенок мочевого пузыря и искривление пениса. Одним из наиболее серьезных последствий непроходимости мочеиспускательного тракта является постренальная азотемия. Для постановки окончательного диагноза проводят рентгенологическое исследование полового члена и катетеризацию уретры. Лечение включает хирургическое удаление костной мозоли и разросшейся фиброзной ткани, придание кости пениса правильного положения и фиксацию ее в таком положении (Bennett et al, 1986; Kelly, Clark, 1995). В качестве альтернативы может быть проведена ампутация полового члена.
Новообразования пениса и препуция
Наиболее частым онкологическим заболеванием половых органов кобелей является трансмиссивная венерическая опухоль (см. стр. 1025 и рис. 27-1). Помимо нее у кобелей могут развиваться тучноклеточная опухоль, чешуйчатоклеточная карцинома, фиброма, лимфома и папилома полового члена и препуция. Сообщалось также о случае мезенхиаль-ной хондросаркомы кости полового члена (Patnaik et al, 1988). За исключением трансмиссивной венерической опухоли все перечисленные выше новообразования появляются, как правило, у стареющих собак. Онкологические заболевания пениса и препуция сопровождаются опуханием последнего, появлением выделений из препуциального мешка,
чрезмерным вылизыванием собакой своих наружных половых органов, пролапсом пениса, гематурией, дизурией, и, если нарушена проходимость уретры, соответствующими клиническими признаками и постренальной уремией (Michels et al, 2001). Для постановки окончательного диагноза проводят гистологическое исследование биопсированного участка новообразования. Терапия и прогноз зависят от типа опухоли.
ЛИТЕРАТУРА
Anvik JO: Clinical considerations of canine herpesvirus infection. Vet Med, 86:394, 1991.
Bennett D, et al: Wedge osteotomy of the os penis to correct penile deviation. J Small Anim Prac 27:379, 1986.
Bradley RL: Complete urethral obstruction secondary to fracture of the os penis. Compend Contin Educ Pract Vet 7:759, 1985.
Burke TJ: Reproductive disorders. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders, 1983, p 1711.
Carati CJ, et al: Vascular changes during penile erection in the dog. J Physiol 400:75, 188.
Crandall RA: Isolation and characterization of caliciviruses from dogs with vesicular genital disease. Arch Virol 98:65, 1988.
Fossum TW, et al: Surgery of the Reproductive and Genital Systems. In Fos-sum TW, et al (eds): Small Animal Surgery. St Louis, Mosby, 2002, p 610.
Greiner TP, Zolton GM: Genital emergencies. In Morrow DA (ed): Current Therapy in Theriogenology: Diagnosis, Treatment, and Prevention of Reproductive Diseases in Animals. Philadelphia, WB Saunders, 1980, p 614.
Guilford WG, et al: Fecal incontinence, urinary incontinence and priapism associated with multifocal distemper encephalomyelitis in a dog. J Am Vet Med Assoc 197:90, 1990.
Gunn-Moore DA, et al: Priapism in seven cats. J Small Anim Pract 36:262, 1995.
Hayes HM, Wilson GP: Hospital incidence of hypospadias in dogs in North America. Vet Rec 118:605, 1986.
Johnston SD: Disorders of the external genitalia of the male. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 3rd ed. Philadelphia, WB Saunders, 1989, p 1881.
Johnston SD, Root Kustritz MV, Olson PNS: Disorders of the canine penis and prepuce. In Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline Theriogenology. Philadelphia, WB Saunders, 2001, p. 356.
Keenan LRJ: The infertile male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, England, British Small Animal Veterinary Association, 1998, p83.
Kelly SE, Clark WT: Surgical repair of fracture of the os penis in a dog. J Small Anim Pract 36:507, 1995.
McDonald RK: Urethral prolapse in a Yorkshire Terrier. Compend Contin Educ 11:682, 1989.
Michels GM, et al: Penile prolapse and urethral obstruction secondary to lymphosarcoma of the penis in a dog. J Am Anim Hosp Assoc 37:474, 2001.
Orima H, et al: Surgical treatment of priapism observed in a dog and a cat. Jpn J Vet Sci 51:1227, 1989.
Patnaik AK, et al: Two cases of canine penile neoplasms: Squamous cell carcinoma and mesenchymal chondrosarcoma. J Am Anim Hosp Assoc 24:403, 1988.
Root Kustritz MV: Disorders of the canine penis. Vet Clin North Am 31:247, 2001.
Root Kustritz MV, Olson PN: Theriogenology question of the month: Idiopathic priapism in a dog. J Am Vet Med Assoc 214:1483, 1999.
Salmeri KR, et al: Gonadectomy in immature dogs: Effects on skeletal, physical, and behavioral development. J Am Vet Med Assoc 198:1193, 1991.
Shantha TR, et al: Treatment of persistent penile erection and priapism using terbutaline. J Urol 141:1427, 1989.
Somerville ME, Anderson SM: Phallopexy for treatment of paraphimosis in the dog. J Am Anim Hosp Assoc 37:397, 2001.
Swalec KM, Smeak DD: Priapism after castration in a cat. J Am Vet Med Assoc 195:963, 1989.
Verstegen JP: Conditions of the male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, England, British Small Animal Veterinary Association, 1998, p71.
Wilson DV, et al: Pharmacologic treatment of priapism in two horses. J Am Vet Med Assoc 199:1183, 1991.
Winter CC, McDowell G: Experience with 105 patients with priapism: Update review of all aspects. J Urol 140:980, 1988.
Zucker SA, et al: Diphallia and polymelia in a dog. Canine Pract 18:15, 1993.
ВРОЖДЕННЫЕ ЗАБОЛЕВАНИЯ........1068
Крипторхизм..................1068
Гипоплазия семенников........1071
Аплазия системы семенных протоков 1071
ПРИОБРЕТЕННЫЕ ЗАБОЛЕВАНИЯ.....1072
Опухоли семенников...........1072
Глава 29 ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
Синдром феминизации кобелей....1075
Перекрут семенника (семенного канатика)...........1078
Острый инфекционный орхит/ эпидидимит.....................1079
Хронический орхит/эпидидимит...1082
Лимфоцитарный орхит............1082
Дегенерация /атрофия семенников . 1084
Сперматоцеле, сперматогранулема.. 1085
Аденомиоз придатков семенников... 1085
Пахово-мошоночная грыжа.........1085
Болезни мошонки................1086
Список сокращений
ГКСФ - гранулоцитарные колонии-стимулирующий фактор
ГнРГ - гонадотропин рилизинг-гормон, гонадолиберин
ЛГ - лютеинизирующий гормон
ФСГ - фолликулостимулирующий гормон
ВРОЖДЕННЫЕ ЗАБОЛЕВАНИЯ
Крипторхизм
Нормальное опущение семенников. Половое различие плодов начинается с дифференцировки и развития гонад. Половые хромосомы X и Y в норме определяют пол. Дифференцировка семенников контролируется Y хромосомой, а при ее отсутствии развиваются яичники. Мужской пол определяется локализованным на хромосоме Y геном SRY, который кодирует фактор, обеспечивающий закладку и дифференцировку семенников (Sinclair et al, 1990; Goodfellow, Lovell-Badge, 1993). Раньше эту функцию ошибочно приписывали гену, расположенному на той же хромосоме и кодирующему образование антигена H-Y (Koopman et al, 1991). По окончании дифференцировки сформировавшиеся семенники мигририруют с каудальных полюсов почек эмбри-она/плода в мошонку, где и завершается процесс их развития. Мезенхимная структура, называемая тестикулярным губернакулом, простирается от каудального конца семенника через паховый канал к генитальному бугорку. Благодаря своему сокращению она направляет продвижение семенника в мошонку.
При рождении щенка семенники обычно все еще находятся в брюшной полости - приблизительно на середине расстояния между почками и паховым кольцом (Baumans et al, 1981). В течение 10 дней они продвигаются по паховому каналу, оказываясь в мошонке обычно через 10-14 дней после рождения щенка. Этот срок может меняться в широких пределах, и у некоторых щенков семенни
ки занимают свое положение в мошонке только в 6-8-недельном возрасте. У большинства собак паховые кольца сужаются к шестимесячному возрасту, и продвижение семенников по паховому каналу в мошонку становится невозможным (Johnston et al, 2001). Обнаружение семенников пальпацией у недавно родившихся щенков часто представляет собой трудную задачу из-за слишком маленьких размеров семенников и новорожденного щенка, слабого развития мошонки, вариабельного количества ее жировой клетчатки и периодического непроизвольного смещения семенников в область пахового канала. Тем не менее, в норме к 8-недельному возрасту они должны хорошо пальпироваться через стенку мошонки. У некоторых щенков в первые 10 недель жизни семенники могут периодически сдвигаться в паховый канал, оказываясь сбоку от полового члена. Это происходит после сокращения поднимающей семенник мышцы (m.cremaster). В таких случаях даже при легком надавливании пальцами семенники возвращаются в мошонку. Если для этого требуются значительные усилия или такие попытки оказываются безуспешными, то вполне вероятно, что имеет место крипторхизм.
Определение. Крипторхизмом называют отсутствие одного или обоих семенников в мошонке у кобелей старше 8-недельного возраста. Недоразвитие, неправильное положение или аномалия структуры тестикулярного губернакулума становятся причинами его неспособности сокращаться и втягивать за собой в мошонку семенники, что ведет к крипторхизму (Wensing, 1980). При крипторхизме семенники наиболее часто находятся в брюшной полости, но иногда они оказываются в паховом канале
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1069
Рис. 29-1. А и Б. Односторонний крипторхизм у взрослого бостон-терьера. Левый семенник расположен сбоку от полово! о члена, а правый семенник находится в мошонке.
или сбоку от полового члена (рис. 29-1). Могут не опуститься в мошонку оба семенника (двусторонний крипторхизм) или один из них (односторонний крипторхизм). В последнем случае смещенным чаще всего оказывается правый семенник (('ох. 1986). Двусторонний крипторхизм может ассоциироваться с псевдо гермафродитизмом и другими бисексуальными состояниями кобелей (см. стр. 992).
Частота и наследственность. Крипторхизм является частым врожденным пороком развития собак. По разным данным, его частота у собак составляет от 0,8 до 15°о (Romagnoli, 1991; Ruble, Hird, 1993). Хотя в патогенезе крипторхизма могут принимать участие негенетические факторы (например, несоответствие величины семенников просвету пахового канала), наследственность, без сомнения, играет важную роль в его развитии. Крипторхизм чаще встречается у чистопородных собак, чем у помесных, при этом отдельные породы собак и линии внутри породы наиболее предрасположены к нему. В настоящее время крипторхизм относят к аутосомно- рецессивным наследственным заболеваниям самцов, которое определяется одним или двумя генными локусами. Считается, что один из этих локусов контролирует процесс формирования самих семенников, их придатков и семяпроводов, а другой - опускание семенников по паховым каналам в мошонку.
Согласно аутосомно-рецессивной генетической модели, как кобели, так и суки несут ген крипторхизма и могут передавать его своему потомству. Крипторхизм развивается только у гомозиготных по этому гену кобелей. Гетерозиготные по гену крипторхизма кобели и суки, а также гомозиготные по нему суки имеют нормальный фенотип. О том, какой генотип имеют сука или клинически здоровый кобель, можно узнать только по их приплоду, а точнее по появлению в нем крипторхов. Отсутствие носителей гена крипторхизма трудно установить. поскольку для этого необходимо обследовать большое количество пометов собаки. Это хорошо
иллюстрируют результаты исследования, показавшего, что в потомстве разных родителей-носителей гена соотношение крипторхов и нормальных кобелей варьирует от 1:1 до 1:20. Исходя из этого, можно подсчитать, что для установления того, что сука не является носителем гена крипторхизма, нужно, чтобы она произвела на свет более 40 щенков и чтобы они дожили до 6-месячного возраста, в котором проявляется крипторхизм. Появление крипторхов среди собак определенной породы или породной линии может зависеть от случая или воздействия предрасполагающих факторов, не обязательно генетической природы. Тем нс менее, частота крипторхизма внутри одной линии предполагает наследственный характер патологии.
Диагностика. Крипторхизм диагностируют во время рутинного физикального исследования кобеля по обнаружению в мошонке только одно-
ТА БЛИЦА 29-1. ПОРОДЫ СОБАК.
ОТНОСЯЩИЕСЯ К ГРУППАМ ПОВЫШЕННОГО И НИЗКОГО РИСКА РАЗВИТИЯ КРИПТОРХИЗМА
Грл IIна повышенно! о риска
Карликовый пудель Померанский шпиц Йоркширский терьер Карликовая такса Ксрн-терьср Чихуахуа
Мальтийская болонка Боксер Пекинес
Гр\ нна пониженно! о риска
Бигль
Кокер-спаниель
Английский сеттер Золотистый ретривер Дог
Лабрадор-ретривер
Сенбернар
Беспородные
Английский бульдог
Староанглийская овчарка
Карликовый пудель
Цвср! шнауцер
Шотландская овчарка
Сибирская лайка
Пудель______________________________________________
По: Hayes НМ et al (1985). Hoskins, Taboada (1992). Johnston SD et al (2001).
1070 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
го семенника или отсутствию в ней обоих семенников. Иногда ветеринарные врачи диагностируют отсутствие семенников в мошонке у взрослых животных. Внимательное обследование мошонки и лонной области живота позволяет выявить рубцы, свидетельствующие о предыдущей операции и удалении семенников. Поскольку семенники сохраняют способность к стероидогенезу независимо от места их локализации, то пальпацией предстательной железы через стенку прямой кишки можно получить косвенное подтверждение образования в организме кобеля тестостерона, и, следовательно, определить имеются ли у него половые железы. Предстательная железа у кастрированных собак значительно меньше, чем даже при двустороннем крипторхизме (Johnston et al, 2001). Иногда послеоперационные рубцы визуально обнаружить не удается, или не ясно, остался ли в мошонке один из семенников. При подозрении на односторонний крипторхизм тщательная пальпация и УЗИ области пахового канала и брюшной полости позволяют обнаружить находящийся вне мошонки семенник. Абдоминальное рентгенологическое исследование при крипторхизме обычно неэффективно из-за небольшого размера крипторхических семенников и невозможности их отличить от окружающих мягких тканей. Если после пальпации и УЗИ вопрос о причинах отсутствия семенника в мошонке остался без ответа, то прибегают к определению базальной концентрации тестостерона в плазме крови, которая позволяет различить кастрированных собак и тех, у которых сохранились один или оба семенника (см. табл. 27-7). По данным нашей лаборатории, концентрация тестострона в плазме крови кастрированных взрослых кобелей, как правило, ниже 20 пг/мл, в то время как при двустороннем крипторхизме она составляет от 100 до 2000 пг/мл (0,1-2 нг/мл), а у взрослых кобелей с одним или обоими семенниками в мошонке - от 1 до 5 нг/мл. Никаких различий в концентрации тестостерона в плазме крови здоровых и страдающих односторонним крипторхизмом кобелей, независимо от локализации неопустившегося семенника, не выявлено (Mattheeuws, Comhaire, 1989).
При дифференциальной диагностике крипторхизма следует исключить монорхизм (наличие у животного только одного семенника) и анорхизм (отсутствие обеих половых желез). Однако эти патологии встречаются у собак крайне редко (Verstegen, 1998). Поэтому ветеринарные врачи, как правило, во всех случаях отсутствия одного или обоих семенников в мошонке диагностируют крипторхизм, и этот диагноз остается в силе до тех пор, пока не появятся основания считать, что половые железы у кобеля вообще отсутствуют.
Лечение. Поскольку крипторхизм в большинстве случаев имеет генетическую природу и высок риск перекрута крипторхического семенника или развития в нем новообразований, рекомендуется удалить обе половые железы. С владельцем собаки
следует обсудить генетические проблемы и меры, предпринимаемые для снижения инцидентности передачи крипторхизма по семейной линии. Это достигается исключением носителей гена крипторхизма (явных и скрытых) из программ племенного разведения. Если устанавливают крипторхизм у родителей кобеля, то его самого и всех его однопометников относят к носителям гена крипторхизма и не проводят их вязок.
Хирургическую коррекцию положения крипторхических семенников не следует проводить из этических соображений. Возможность лечения крипторхизма медикаментозными средствами полностью отрицать нельзя, но их эффективность крайне вариабельна, и лечение обычно оказывается безуспешным. С этой целью наиболее часто собакам делают инъекции препаратов тестостерона, ХГЧ и ГнРГ. Считается, что процесс опускания семенников в мошонку регулируется андрогенами, которые секретируются семенниками. Несмотря на то, что образование тестостерона клетками Лейдига происходит и в крипторхических семенниках, его концентрация в плазме крови крипторхов обычно ниже, чем у здоровых кобелей. Поэтому предполагается, что крипторхизм можно лечить с помощью препаратов тестостерона или стимулирующих его синтез гормонов (ХГЧ или ГнРГ).
Однако многочисленные попытки вернуть в мошонку крипторхические семенники у кобелей посредством введения им тестостерона или его аналогов были неэффективными. Поэтому мы не станем рекомендовать такой способ лечения крипторхизма. Значительно чаще с той же целью проводят курс внутримышечных инъекций ХГЧ в дозах 100 -
1000 МЕ/собака (4 раза в течение 2 недель) и подкожных или внутривенных инъекций ГнРГ в дозе 50-100 мкг (2 раза с интервалом в 7 дней). Результаты лечения крипторхизма этими гормонами вариабельны и непредсказуемы, в отдельных успешных случаях могло быть просто совпадение лечения со спонтанным опущением подвижных семенников. На успех гормональной терапии крипторхизма оказывает влияние целый ряд факторов, в том числе локализация (паховый канал или брюшная полость) крипторхических половых желез и возраст собаки. Чаще всего медикаментозное лечение оказывается успешным при нахождении подвижных семенников в паховом канале или если возраст кобеля не превышает 16 недель. Чем моложе щенок-крипторх, тем больше шансов успешного лечения его препаратами гормонов. Нам никогда не удавалось вылечить консервативным методом крипторхизм у собак старше 16-недельного возраста. Уместно ли проведение медикаментозного лечения крипторхизма, должны решить владелец животного и ветеринарный врач. Однако следует подчеркнуть, что даже успешная терапия не избавляет кобеля от гена крипторхизма, который животное передаст по наследству своему потомству. К счастью, собаки с двусторонним крипторхизмом стерильны вследс
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1071
твие деструкции герминативного эпителия семенников, которая вызвана продолжительным воздействием на половые железы более высокой, чем в мошонке, температуры тела брюшной полости. Многие кобели с односторонним крипторхизмом, напротив, остаются фертильными, хотя количество сперматозоидов в их эякулятах может быть существенно снижено. Либидо у кобелей с односторонним и двусторонним крипторхизмом, как правило, сохраняется из-за продолжения секреции тестостерона интерстициальными клетками Лейдига.
Возможными осложнениями крипторхизма могут быть перекрут семенника (скручивание семенного канатика, см. стр. 1078), развитие опухолей половых желез (см. стр. 1072), синдром феминизации (см. стр. 1075) и дискразия крови (нарушение гомеостаза). Из-за высокого риска передачи крипторхизма по наследству страдающих им кобелей следует кастрировать до достижения ими половой зрелости.
Гипоплазия семенников
Гипоплазия семенников - врожденное, возможно, наследственное заболевание, развивающееся вследствие полного исчезновения или значительного снижения количества сперматогониев в гонадах кобеля. Причиной гипоплазии семенников может быть нарушение развития первичной половой клетки в желточном мешке, невозможность миграции половых клеток в недифференцированные гонады или размножения в них, а также раннее разрушение половых клеток в процессе развития плода. Гипоплазия семенников может быть также частью некоторых бисексуальных состояний кобелей (см. стр. 992). Поскольку 50-70% паренхимы семенников образуется в семявыносящих канальцах, отсутствие герминативных эпителиальных клеток сопровождается снижением размеров половых желез. Гипоплазия семенников бывает одно- и двусторонней и обычно дает о себе знать тогда, когда кобель достигает половой зрелости. Этим она отличается от приобретенной дегенерации семенников, поражающей взрослых собак (см. стр. 1084).
Гипоплазия семенников приводит к олигоспермии или азооспермии, а также к стерильности. Количество интерстициальных клеток Лейдига у страдающих этим заболеванием собак, как правило, в норме, поэтому сохраняются нормальный уровень секреции тестостерона и либидо. Тяжесть олигоспермии зависит от количества вовлеченной в патологический процесс ткани семенников. Билатеральная гипоплазия семенников обычно сопровождается азооспермией и стерильностью. При гистологическом исследовании биоптатов, полученных из пораженных семенников, обнаруживают недоразвитые семявыносящие канальцы, отсутствие герминативного эпителия и вариабельное количество клеток Лейдига. Диагностировать гипоплазию семенников не удается до наступления
у кобеля половой зрелости, т.е. до достижения им одно-двухлетнего возраста. Лечения данной патологии не разработано. Применение ГнРГ, ФСГ и ХГЧ не имеет смысла, поскольку у страдающих гипоплазией семенников собак отсутствуют сперма-тогонии, несущие чувствительные к этим гормонам рецепторы. Прогноз развития стерильности зависит от тяжести гипоплазии семенников и вызываемой ею олигоспермии.
Аплазия системы семенных протоков
Нарушение формирования любой части системы канальцев семенников приводит к снижению количества попадающих в уретру сперматозоидов, их скоплению проксимальнее места непроходимости, а также возрастанию риска развития сперматогра-нулемы и дегенерации половых желез (см. стр. 1084 и 1085]). Передается ли это заболевание у собак по наследству неизвестно, поскольку соответствующих исследований не проводилось. Однако его наследственный характер установлен у крупного рогатого скота, свиней и норок. Сегментная аплазия обычно носит односторонний характер, поражая только один семенник. Кобели с односторонней аплазией не утрачивают фертильности, вследствие чего заболевание у них обычно остается нераспознанным. При двусторонней сегментной аплазии семенников животное рано или поздно попадает на обследование к ветеринарному врачу для выяснения причин его бесплодия. Подтверждением диагноза служит выявление при анализе его спермы азооспермии. Концентрация щелочной фосфатазы в сперме может оставаться в пределах нормы или быть низкой, что зависит от локализации апластических поражений (см. стр. 1045).
Аплазированный участок семенных протоков можно обнаружить посредством пальпации в тех случаях, когда патологический процесс затрагивает придатки семенников или проксимальные отделы семявыносящих протоков. Размеры пораженных семенников и их придатков зависят от локализации аплазии. Если аплазия и, соответственно, непроходимость семенных протоков находятся дистальнее головки придатка семенника, образуемый в семявыносящих канальцах секрет продолжает абсорбироваться эпителиальными клетками семявыносящих протоков головки и вероятность аккумуляции секрета семявыносящих канальцев и вторичной дегенерации семенников не высока. Если же участки аплазии распространяются на головку придатка семенника, то секреты семявыносящих канальцев не абсорбируются, а накапливаются, что приводит к повышению внутреннего давления и отека семенника, дегенерации семявыносящих канальцев и атрофии семенника. Размер пораженного семенника вариабелен - он может быть меньше, таким же или слегка больше, чем в норме, что зависит от возраста собаки, количества накопившегося секрета и степени дегенерации семенника.
1072 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
Исследование биоптатов показывает, что до тех пор, пока нет тяжелой вторичной дегенерации се-Мечников, у азооспермических кобелей продолжается активный сперматогенез. Окончательный диагноз аплазии ставится на основании визуального исследования системы протоков во время хирургического рассечения семенника, но такой метод диагностики сложен и большинство ветеринарных хирургов предпочитают не пользоваться им.
Поскольку предполагается, что это заболевание имеет наследственный характер, восстанавливать систему семенных протоков хирургическим путем не рекомендуется. Об эффективности такой операции у собак информация отсутствует, но следует ожидать, что она чрезвычайно низкая. Вероятность восстановления плодовитости у кобелей при сегментной аплазии семенников, сопровождающейся азооспермией, близка к нулю.
ПРИОБРЕТЕННЫЕ ЗАБОЛЕВАНИЯ
Рис. 29-2. Абдоминальное УЗИ 16-летнего кунхаунда, страдавшего односторонним крипторхизмом. В правой части каудальной области брюшной полос ги видна эхогенная масса размером 6 х 4 см (обведена точечной линией). При i истоло-гическом исследовании уставов юно, чю это новообразование является сертолномой.
Опухоли семенников
Типы. Опухоли семенников часто встречаются у собак. Наиболее распространены три типа опухолей - семинома, лейдигома и сертолиома. Значительно реже в семенниках обнаруживают другие типы опухолей - эмбриональную карциному, гранулезоклеточную опухоль, гемангиому, фибросаркому, нейрофибросаркому, а также недифференцированные карциному и саркому.
Опухоль клеток Сертоли (Сертолиома). Этот тип опухолей возникает из клеток Сертоли - трофических клеток семявыносящих канальцев семенников. Сертолиома - неинвазивная опухоль и растет медленно, обычно достигая в диаметре 0,1-5 см. В тех случаях, когда опухоль образуется у кобсля-крипторха в находящемся в брюшной полости семеннике, она может достигать значительно больших размеров (до 10 см в диаметре) (рис. 29-2). При пальпации опухолей этого типа ощущают их твердость и узловатость. Приблизительно 10-20° о ссртолиом трансформируются в злокачественные опухоли и дают метастазы в паховые, подвздошные и сублюмбарные лимфатические узлы, а также в легкие, печень, селезенку, почки и поджелудочную железу (Crow, 1980). Частым последствием серто-лиом становится синдром феминизации кобелей (см. стр. 1075).
Семинома (синонимы: спермапюгониома. спермацитома}. Семинома развивается из сперматогенных клеток семявыносящих канальцев семенников. Диаметр опухолей этого типа колеблется от менее 1 до 10 см. При пальпации они мягкие. Семинома обычно носит доброкачественный характер, и только приблизительно в 5-10° о случаев она становится злокачественной (DeVico et al, 1994). Метастазы семином обнаруживают в тех же органах, в которых могут появляться метастазы сертолиом. У кобелей с семиномой секреция андрогенов может
быть повышена и синдром феминизации развивается реже, чем при сер гол поме.
Опухоли интерстициальных клеток (синонимы: лейдигома, иптерстициома). Эта опухоль образуется из интерстициальных клеток Лейдига. Из-за маленькой величины (ее диаметр составляет 0,1-2 см) ее невозможно обнаружить пальпацией. Она представляет собой дискретные скопления гормонально неакт ивных клеток. Как правило, лейдигому случайно выявляют в семенниках кобелей при некроскопии (Crow, 1980). В одном из исследований только у 25% собак с этим типом опухолей было выявлено увеличение семенников. Опухоли интерстициальных клеток почти всегда доброкачественные. Паранеопластические синдромы (клинические изменения у онкологических больных, непосредственно не связанные с ростом опухолей и их метастазов) при лейдигоме редки и являются еле ютвием гиперэстрогенизма и гиперан (рогениз-ма. (Medleau, 1989; Suess et al, 1992).
Частота. Хотя в отдельных публикациях приводятся разные цифры, в среднем, по данным литературы, частота семиномы, сертолиомы и лейдигомы у кобелей составляет 31, 44 и 25°о соответственно (Johnston et al, 2001). Почти у 35° о собак с новообразованиями в семенниках одновременно развиваются два или три типа этих опухолей. Опухоли семенников появляются у собак в возрасте oi 3 до 19 лет (в среднем в 10 лет). У крипторхов в находящихся вне мошонки половых железах онколо! ичес-кий процесс начинается раньше. Некоторые породы собак проявляют пре расположенность к развитию опухолей семенников (таблица 29-2).
В крипторхических семенниках опухоли развиваются приблизительно в 10 раз чаще, чем в семенниках, имеющих нормальную локализацию (Hayes et al, 1985). У крипторхов вне мошонки в большинстве случаев оказывается правый семенник, поэтому в нем чаще развиваются опухоли, чем в левом се-
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1073
Рис. 29-3. 16-летний курцхаар с выраженной ассимстрнсй семенников Увеличение icboi о семенника вы звано ссминомои (изогнутая стрелка). Обратите внимание на атрофированный правый семенник (прямая стрелка).
мениикс. Опухоли крипторхических семенников в 60% случаев являются сертолиомами, а в 40% случаев - семиномами. В семенниках, находящихся в паховом канале, опухоли возникают чаще, чем в семенниках, локализованных в брюшной полости. Лейдигому почти всегда находят только в семенниках, расположенных в мошонке. Различия в частоте развития разных типов опухолей в семенниках, находящихся в мошонке или за ее пределами, могут бьпь обусловлены различиями температуры в брюшной полости, паховом канале и мошонке, поскольку температурный фактор оказывает значительное влияние на жизнеспособность сперматогониев, клеток Сертоли и Лейдига (Wallace, Сох, 1980). Температура мошонки в наибольшей степени обеспечивает жизнеспособность и функциональную активность всех трех типов клеток, что уравнивает шансы развития всех соответствующих типов опухолей в опустившихся в мошонку семенниках.
Клинические признаки. Симптоматика опухолей может быть различной и зависит от гормональной активности опухолевых клеток. В целом, она определяется двумя основными факторами:
ТАБЛИЦА 29-2. ПОРОДЫ СОБАК, ОТНОСЯЩИЕСЯ К ГРУППАМ ПОВЫШЕННОГО И ПОНИЖЕННОГО РИСКА РАЗВИТИЯ ОПУХОЛЕЙ СЕМЕННИКОВ
I руппа повышенного риска Группа пониженного риска
Боксер Бигль
Чихуахуа Лабрадор-ретривер
Немецкая овчарка Беспородные собаки
Померанский шпиц
Карликовый пудель
Пудель
Цвсргшнауцер
Колли
Сибирская хаски
Йоркширский герьер
вытеснением растущей опухолью нормальных структурных элементов половых желез и секрецией образующими ее клетками эстрогенов или андрогенов. Клинические проявления во многом определяются размером новообразований и локализацией пораженных семенников Поводами для обращения владельцев кобелей с опухолями семенников к ветеринарному врачу обычно служат увеличение мошонки или семенника, разный размер семенников (рис. 29-3), отвислый живот, а также появление признаков, позволяющих предположить перекрут семенника (см. стр. 1078). По поводу бесплодия племенных кобелей с новообразованиями половых желез к врачу обращаются редко. Бесплодными кобели становятся из-за некроза нормальной паренхимы семенников, вызванного давлением со стороны растущей опухоли, вторичных аутоиммунных реакции направленных на сперматогонии и развивающихся после разрушения опухолями гсматотсс-тикулярного барьера, или из-за атрофии семенников вследствие интенсивного синтеза опухолевыми клетками эстрогенов или андрогенов. По данным Peters и соавторов (2000), у кобелей с опухолями семенников значительно снижается сперматогенез. Grootenhuis и соавторы (1990) сообщили о том, что у кобелей-крипторхов секреторные продукты серто-лиом подавляют синтез гонадотропинов в гипофизе и снижают ответ гипофиза на введение экзогенного ГнРГ. Секретирующие эстрогены новообразования могут вызывать развитие у кобелей синдрома феминизации (см. стр. 1075), в то время как рост опухолей, секретирующих андрогены, обычно сопровождается нарушениями функций предстательной железы.
Секреция андрогенов и их влияние на предстательную железу. Опухоли семенников могут секретировать андрогены, которые могут быть причиной частого возникновения дисфункций предстательной железы и околоанальных опухолей. Андрогены участвуют в регуляции развить и предстательной железы собак и поддерживают се функциональное состояние. Предполагается, что у людей они играют важную роль в стимуляции доброкачественной гипертрофии предстательной железы. Кроме того, андрогены непосредственно стимулируют рост опухолей околоанальных желез. В одном исследовании заболеваний предстательной железы у 33% кобелей, имевших семиному iuiii лейдигому семенников, диагностировали опухоли околоанальных желез, что, по-видимому, было следствием интенсивной секреции андрогенов опухолями семенников. Эстрогены, напротив, индуцируют чешуйчатоклеточную метаплазию предстательной железы, приводящую к уменьшению ее размера (метаплазия - патологическая трансформация полностью дифференцированной ткани одного вида в 1иффсренцированную ткань другого вида). Кроме того, эстрогены тормозят рост опухолей околоанальных желез. Предполагается, что низкая инцидентность новообразований околоанальных же-
1074 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
Рис. 29-4. V УЗИ правого семенника (стречка) 9-летнего кобеля породы маламут, страчающего односторонним крипторхизмом. Правый семенник увеличен и юкачизован в правой паховой области. Его паренхима гипо »хогенна. В ней рассеяно большое количество маленьких кистозных участков.
Ь. Абдоминальное УЗИ того же кобеля. Вблизи от левого надпочечника видна гипоэхогенная масса (стрелка). Гипоэхогснные структуры обнаружены также в брыжейке и сублюмбарной области. Гистологическое исследование показало, что опухоль в семеннике является семиномой, а выявленные УЗИ гипоэхогснные структуры - ее метаста зам и.
лез и гиперплазии предстательной железы у собак с ссртолиомами обусловлена интенсивной секрецией эстрогенов.
С опухолями семенников связан целый ряд патологических изменений предстательной железы, включая кисты, гиперплазию, абсцессы, чешуйчатоклеточную метаплазию, воспаление и атрофию. Клинически эти заболевания предстательной железы проявляются капельным кровотечением из полового ч юна, дизурией, гематурией, запором, слабостью тазовых конечностей и нарушением походки животных, а также системными признаками (лихорадкой, потерей аппетита, снижением массы тела, абдоминальными болями; см. гл. 30). Развитие опухолей семенников, в которых синтезируются андрогены, сопровождается нс только заболеваниями предстательной железы, но также аденомой околоанальных желез, аденокарциномой и промежностными грыжами.
Диагностика. Предварительный диагноз на наличие опухоли в семенниках обычно ставится на основании комплекса определенных клинических признаков и результатов физикального исследования животного. Типичными признаками таких опухолей являются асимметричные размеры семенников и синдром феминизации. Увеличение пораженного семенника может быть диффузным или представлять собой пальпируемый дискретный узел. Следует учитывать, что даже кажущиеся нормальными при пальпации семенники могут быть поражены опухолью. Существует еще целый ряд менее специфичных клинических нарушений, которые могут сопровождать развитие опухолей семенников - дисфункция предстательной железы, новообразования околоанальных желез, крипторхизм, олигоспсрмия, азооспермия, системные клинические признаки и кровоизлияние, вызванное панцитопенией или воспалением предстательной железы.
Абдоминальные УЗИ и рентгенологическое исследование могут быть применены для обнаружения и локализации пораженных опухолями семенников и метастазов у кобелей-крипторхов (рис. 29-4). Семенники в диаметре вдвое меньше тонкого отдела кишечника, что затрудняет их обнаружение с помощью рентгенографии. Ультразву-кововая оценка состояния семенников, проводимая опытным специалистом, оказывает шачительную помощь в обнаружении опухолей, наличие которых предполагается, но не удастся подтвердить пальпацией. Этот метод позволяет локализовать в половых железах новообразования и облегчает проведение биопсии. Опухоли семенников имеют разную по эхогенности структуру. Мелкие (диаметром менее 3 см) дискретные опухоли обычно гипоэхо-генны, в то время как крупным опухолям, особенно тем, диаметр которых превосходит 5 см, присуща смешанная эхогенность (рис. 29-5; Johnston et al,
Рис. 29-5. УЗИ левого семенника 9-летнего карликового пуделя. В паренхиме семенника ви ien i ипоэхогенный узел диаметром в 1см (отмечен крестиком). Гистологическое исследование показало, ч го данное новообразование семинома.
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1075
1991; Pugh, Konde, 1991). Причинами смешанной эхогенности являются участки кровоизлияний, некроза, инфарктов и кальцификации в опухолях. На основании результатов УЗИ бывает сложно определить тип обнаруженной опухоли. В целом, сертоли-омы характеризуются вариабельной эхогенностью, очаговые семиномы и лейдигомы диаметром менее 3 см - гипоэхогенностью, а очаговые семиномы и лейдигомы диаметром более 3 см - смешанной эхогенностью.
Иногда ветеринарные врачи для подтверждения предварительного диагноза эстроген-секретирую-щей опухоли определяют концентрацию эстрогена в плазме крови. Наш опыт свидетельствует о том, что в плазме крови собак с сертолиомами семенников не происходит значительного повышения концентрации эстрогена (эстрадиола) (см. стр. 1075). Альтернативным и, возможно, более чувствительным маркером сертолиомы служит концентрация ингибина в сыворотке крови. Этот гликопротеиновый гормон образуется в клетках Сертоли (de Kretser, Robertson, 1989). Его основная физиологическая роль состоит в специфическом подавлении секреции ФСГ гипофизом. Сообщалось, что при сертолиоме концентрация ингибина в сыворотке крови выше, чем у здоровых собак (de Jong et al 1990; Grootenhuis et al, 1990). Эксфолиативное цитологическое исследование мазков слизистой оболочки препуция также может дать ценную в диагностическом плане информацию о наличии у кобеля гиперсекреции эстрогенов. В мазках здоровых собак при таком исследовании обнаруживают неороговевшие клетки, в то время как в мазках кобелей с повышенным уровнем секреции эстрогенов преобладают ороговевшие эпителиальные клетки, морфологически сходные с эпителиальными клетками влагалища сук во время течки (Johnston et al, 2001).
Окончательный диагноз ставится на основании гистологического исследования биоптатов опухоли, полученных посредством аспирационной биопсии, (см. стр. 1054) или удаленного семенника.
Лечение. Основным способом лечения опухолей семенников является хирургическое удаление пораженной половой железы. Перед операцией проводят рентгенологическое исследование грудной и брюшной полостей, а также УЗИ брюшной полости с целью выявления возможных метастазов, которые наиболее часто обнаруживают в сублюм-барных лимфатических узлах, печени и селезенке. При крипторхизме целесообразно одновременно удалить оба семенника (пораженный опухолью и нормальный). Если непораженная половая железа находится в мошонке, то собака после операции сохранит фертильность, однако, проводить вязки кобелей-крипторхов не рекомендуется.
Индуцированное опухолью иммунное разрушение семенников редко прекращается после удаления самой опухоли. Вызванная гормонами атрофия семенников, напротив, может остановиться, поскольку после удаления опухоли прекращается
интенсивная секреции эстрогена, который по механизму отрицательной обратной связи тормозил секрецию ГнРГ, ЛГ и ФСГ. Наличие в семеннике, который считали непораженным, гормонально активных новообразований (первичных или метастатических) может препятствовать восстановлению фертильности кобеля.
При обнаружении метастазов опухолей семенников показаны химиотерапия или лучевая терапия. Для проведения химиотерапии пользуются несколькими средствами. Сообщалось об эффективности комбинированного применения винбластина, циклофосфамида и метотрексата (Madewell, Theilen, 1987). Обнадеживающие результаты дала попытка применения цисплатина (Dhaliwal et al, 1999). Химиотерапия может уменьшить объем опухоли и на несколько месяцев улучшить состояние собаки, но окончательного излечения с ее помощью пока достичь не удается. Прогноз при метастазах опухолей семенников - от осторожного до неблагоприятного.
Семинома чувствительна к лучевой терапии у людей и, возможно, у собак. Для лечения 4 кобелей с региональными метастазами семиномы была апробирована лучевая терапия цезием-137 в дозах от 17 до 40 Гр. Курс лечения включал 8-10 сеансов облучения (по 3 сеанса в неделю) (McDonald et al, 1988). Опухоль и ее метастазы после облучения разрушились у всех 4 собак, и они прожили после завершения лечения еще от 6 до 57 месяцев (в среднем 36 месяцев). Все собаки умерли по причинам, не связанным с ранее перенесенным ими онкологическим заболеванием. При некроскопии следов семиномы обнаружено не было.
Синдром феминизации кобелей
Этиология. Причинами развития синдрома феминизации у кобелей могут быть увеличенная продукция эстрогенов опухолевыми клетками семенников, повышение интенсивности превращения тестостерона и андростендиона в эстрогены в клетках семенников или в периферических тканях (печени, жировой клетчатке, волосяных фолликулах, нервной и мышечной тканях) или нарушение баланса половых гормонов вследствие снижения образования андрогена на фоне нормальной продукции эстрогена. Однако относительно роли эстрогенов в развитии синдрома феминизации у кобелей, как показывает анализ опубликованных материалов, нет единого мнения. Некоторые авторы сообщают об увеличенной концентрации эстрогенов в крови (периферической и дренирующих опухоли вен) и моче кобелей с явными признаками синдрома феминизации. Другим исследователям, напротив, не удалось обнаружить повышения концентрации эстрогенов в плазме крови, моче или непосредственно в опухолевой ткани больных животных. Как показывает наш личный опыт, развитие у собак сертолиомы в одних случаях сопро-
1076
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
Рис. 29-6. А и Б. 8-летний карликовый пудель с дерматологическими признаками синдрома феминизации. В его находящемся в мошонке семеннике обнаружена сертолиома. Обратите внимание на характерные симметричные очаги алопеции в промежности, на животе, боках, груди и шее. (Фото Blakemore JC, Purdue University)
В. Та же собака через 2 месяца после кастрации.
вождается умеренным повышением активности эстрадиола в плазме крови, а в других случаях его концентрация остается в пределах нормы. У здоровых кобелей концентрация этого гормона в плазме крови не превышает 15 пг/мл. У кобелей с ссрго-лиомой концентрация эстрадиола в плазме крови составляет от 10 до 150 пг/мл.
Тип клеток. Наиболее часто с синдромом феминизации кобелей ассоциирована сертолиома, хотя его также могут вызывать семинома и лейдигома. Синдромом феминизации страдают приблизительно 25° о собак с сертолиомой (Crow, 1980). Имеется явная связь между развитием этого синдрома и наличием пораженных опухолями крипторхических семенников. Синдром феминизации регистрируют приблизительно у 70, 50 и 17° о собак, у которых пораженные опухолями семенники находятся соответственно в брюшной полости, паховом канале и мошонке. Опухоли в опустившихся в мошонку семенниках, которые не всегда выявляются пальпацией, также могут приводить к развитию синдрома феминизации (рис. 29-6).
Клинические признаки. Наиболее явным признаком синдрома феминизации кобелей является
появление симметричных эндокринных очагов алопеции сначала в промежности и на наружных половых органах, а затем на вентральной части живота, груди, боках и шее (рис. 29-6). Зуда в этих областях больное животное нс испытывает. Кроме того, синдром феминизации сопровождается гиперпигментацией, гинекомастией, i алактореей. отвислым препуцием, привлечением других кобелей, принятием во время мочеиспускания присущей сукам позы (рис. 29-7). Торможение секреции ГнРГ гипоталамусом и ЛГ и/или ФСГ гипофизом по механизму отрицательной обратной связи приводит к атрофии непораженной опухолью ткани семенников, снижению либидо и развитию олигоспермии. Наблюдающиеся при синдроме феминизации признаки нарушения функций предстательной железы могут быть следствиями простатита и простатомегалии, которая вызвана чешуйчато клеточной метаплазией эпителиальных клеток.
Нарушения функций костного мозга. При опухолях семенников и синдроме феминизации у некоторых кобелей развиваются тяжелая гипоплазия костного мозга и панцитопения, которые считаются следствием постоянно высокого уровня эстрогенов
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1077
Рис. 29-7. Л и Б. 9-летний кобель (помесь немецкой овчарки) с односторонним крипторхизмом, сертолиомой в брюшной полости и клиническими признаками синдрома феминизации. Обратите внимание на интенсивную гиперпигментацию и гинекомастию.
В. Поперечный срез сертолиомы, удаленной у той же собаки из брюшной полости.
в крови. Аналогичное нарушение функции костного мозга наблюдается у сук с секретирующими эстроген фолликулярными кистами или получавшими инъекции эстрогена для предотвращения беременности после нежелательной вязки. Хотя патогенетические механизмы негативного воздействия эстрогенов на функцию костного мозга до конца не ясны, установлено, что они нарушают дифференцировку стволовых клеток, снижают способность предшественников эритроцитов утилизировать железо и, возможно, подавляют образование циркулирующего эритроцит-стимулирующего фактора.
Токсическое воздействие эстрогена на костный мозг сначала приводит к кратковременному усилению гранулоцитопоэза и нейтрофильному лейкоцитозу. Затем развиваются гипоплазия всех клеточных линий и панцитопения. Клинические признаки поражения костного мозга при синдроме феминизации кобелей включают апатию, слабость, тромбоцитопенические и петехиальные кровоизлияния, потерю аппетита, лихорадку, бледность видимых слизистых оболочек и рвоту. Подсчет общего количества клеток крови показывает наличие у боль
ного животного нсрегенсративной анемии разной степени тяжести, лейкопении в сочетании с лимфоцитозом и тромооцитопении. 1 истологичсскос исследование полученного аспирационной биопсией материала выявляет гипоплазию костного мозга, при этом уменьшено количество предшественников лейкоцитов и эритроцитов и снижено количество мегакариоцитов. Это позволяет предположить, чго при синдроме феминизации кобелей полностью прекращается процесс созревания всех трех шний стволовых клеток костного мозга. Поддерживающая терапия (см. ниже) позволяет добиться только временного улучшения клинического состояния и собака, в конечном итоге, погибает.
Диагностика. Диагностика синдрома феминизации основана на анализе симптоматики, наблюдающейся у имеющих опухоли семенников собак, с учетом того, что это заболевание наиболее часто поражает кобелей-крипторхов. Дополнительными диагностическими критериями служат панцитопения, повышение концентрации ютрогена в плазме крови выше 20 пг/мл, а также обнаружение opoio-вевших клеток слизистой оболочки при цитологи-
1078 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
ческом исследовании мазков препуция. Правильность поставленного диагноза подтверждается результатами гистологического исследования опухоли семенника и исчезновением симптоматики заболевания после удаления семенника.
Собак с синдромом феминизации, обусловленным опухолями семенников, обычно приводят на обследование к ветеринарному врачу для установления причин билатеральных, симметричных, не вызывающих кожного зуда очагов эндокринной алопеции. В тех случаях, когда кобель не является крипторхом и при пальпации его семенников не удается обнаружить никаких отклонений от нормы, поставить диагноз сразу не удается. К счастью, общепринятая схема диагностики эндокринных алопеций позволяет правильно диагностировать данное заболевание (см. гл. 2, стр. 70).
Лечение. Основным методом лечения синдрома феминизации кобелей является хирургическое удаление опухоли семенника. Перед операцией проводят рентгенологическое исследование грудной и брюшной полостей, а также УЗИ брюшной полости для исключения наличия метастазов. Клинические признаки синдрома феминизации начинают пропадать через 4-6 недель после удаления пораженного семенника. Если этого не происходит, следует предположить, что у животного имеются невыявленные метастазы или диагноз был поставлен неправильно. В случае обнаружения метастазов с помощью УЗИ, рентгенологического и гистологического исследований проводят химиотерапию или лучевую терапию (см. стр. 1075).
При панцитопении обычно необходимо интенсивное лечение анемии, кровоизлияний и вторичных инфекций. Первоначальный курс терапии зависит от тяжести анемии и тромбоцитопении. Стабилизировать клиническое состояние собаки часто удается путем внутривенных вливаний кровезаменителей, свежей цельной крови или обогащенной тромбоцитами плазмы крови собак-доноров и проведения курса терапии антибиотиками широкого спектра действия для подавления вторичных бактериальных инфекций. После того как состояние животного удастся стабилизировать и кровотечения прекратятся, собаку кастрируют, чтобы удалить источник эстрогенов, вызывающих токсическое повреждение костного мозга. Ряд авторов рекомендуют применять для лечения вызванных эстрогеном токсических поражений костного мозга препараты, повышающие количество гемоглобина в крови, анаболические стероиды (например, окси-метолон, нандролон деканоат) и глюкокортикоиды. Однако эффективность этих препаратов при синдроме феминизации кобелей не имеет достаточного подтверждения, а применение глюкокортикоидов при вторичных инфекциях и лейкопении проблематично.
Перспективными средствами лечения вызванной эстрогеном панцитопении являются гематопоэтические ростовые факторы, особенно гранулоци
тарные колонии-стимулирующий фактор (ГКСФ) и эритропоэтин. Рекомбинантный ГКСФ ускоряет восстановление костного мозга после химиотерапии, нормализует количество нейтрофилов в крови при хронической идиопатической нейтропении у людей и циклической нейтропении у собак (Obradovich et al, 1991; Ogilvie et al, 1992). Рекомбинантный человеческий эритропоэтин нашел широкое применение для лечения нерегенерагивной анемии при хронической почечной недостаточности собак и кошек (Cowgill, 1992). Применение рекомбинантного собачьего ГКСФ не ведет к развитию клинически выраженного токсикоза (Obradovich et al, 1991); однако, рекомбинантный человеческий ГКСФ вызывает у здоровых собак сначала нейтрофилию, а затем хроническую нейтропению (Hammond et al, 1991). За развитие нейтропении ответственны циркулирующие антитела к рекомбинантному человеческому ГКСФ и эндогенному собачьему ГКСФ. Под действием этих антител у собак, получавших человеческий рекомбинантный ГКСФ, развивается рефрактерная анемия (Cowgill, 1992). Тем не менее, для лечения панцитопении у страдающих синдромом феминизации кобелей рекомендуется пользоваться этими препаратами. Рекомбинантный человеческий эритропоэтин вводят подкожно в дозе 100 ЕД/кг 3 раза в неделю, а рекомбинантный ГКСФ (желательно собачий) - подкожно в дозе 5 мкг/кг/день (Ogilvie, 1995).
В процессе лечения собак с синдромом феминизации может потребоваться переливание крови для поддержания концентрации эритроцитов, лейкоцитов и тромбоцитов в крови. Переливание регулярно повторяют до тех пор, пока не нормализуется активность костного мозга. Для контроля эффективности лечения и определения времени проведения очередного переливания крови периодически определяют формулу крови, включая количество ретикулоцитов и тромбоцитов.
Прогноз при гипоплазии костного мозга собак неблагоприятен. Гипоплазия и прогрессирующе усиливающаяся панцитопения обычно не исчезают даже после удаления опухоли семенников. У тех собак, кастрация которых в сочетании с поддерживающей терапией оказались эффективными, признаки регенерации костного мозга обычно начинают появляться через 3-6 недель после завершения лечения. Для нормализации общего количества клеток крови у собак в таких случаях может потребоваться несколько месяцев.
Перекрут семенника (семенного канатика)
Этиология. Поворот семенника вокруг его горизонтальной оси приводит к перекруту семенного канатика, блокированию венозного дренажа семенника, застою в нем крови и развитию некроза. У собак перекрут семенника происходит редко. Наиболее часто он бывает у кобелей-крипторхов, у которых поражены опухолями находящиеся в брюшной
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
1079
Рис. 29-8. А. Обнаружение с помощью рентгенологического исследования новообразования в брюшной полости (стрелка) у 6-летнсго пекинеса с острой манифестацией летаргии, рвоты и абдоминальных болей. Б. УЗИ по ггвердизо наличие в брюшной полости этого животного крупной многокамерной структуры, имевшей смешанную эхогенность (стрелка). При удалении опухоли выявили перекрут находящегося в брюшной полости семенника. При гистологическом исследовании новообразования его и зентифипировалн как сертолиому.
полости семенники (рис. 29-8). Опухоль увеличивает массу подвешенного в брюшной полости на семенном канатике семенника, что повышает риск его поворота при резких движениях животного или получении травм.
При локализации семенника в мошонке корреляции между развитием в нем опухоли и риском перекручивания семенного канатика не отмечается. В случаях псрекрута находящегося в мошонке семенника его гистологическая струкгура не меняется. Причины, по которым происходит такой перекрут, неизвестны, хотя к данной патологии может предрасполагать разрыв мошоночной связки, происходящий при повышенной физической активности собаки или получении травмы.
Клинические признаки и физикальное исследование. Перекрут семенника в мошонке сопровождается острой болью, отеком мошонки и утратой животным способности находиться в стоячем положении и двигаться. При физикальном обследовании обнаруживают отек мошонки, увеличенную и твердую половую железу, попытки дотронугься до которой или изменить ее положение причиняют собаке сильную боль.
Перекрут семенника, находящегося в брюшной полости, характеризуется острым началом заболевания, абдоминальной болью и беспокойством. В зависимости от того, сколько времени прошло с момента скручивания семенного канатика, у животного развивается сонливость, утрачивается аппетит, появляется рвота и происходит шок. Наиболее постоянным признаком данной патологии служат абдоминальные бо ти. Заболевание сопровождается также вздутием живота, асцитом, лихорадкой и шоком. При отсутствии асцита посредством пальпации можно обнаружить новообразование в срединно-каудальной области брюшной полости. Помимо перечисленных выше симптомов, заболевание мо
жет сопровождаться клиническими проявлениями, обусловленными присутствием гормонально активной опухоли семенника (см. стр. 1073 и 1075).
Дифференциальная диагностика. При диагностике перскрута семенника необходимо исключить острый эпидидимит и орхит, сопровож деющиеся отеком находящихся в мошонке половых желез, а также панкреатит, перитонит, заворот селезенки и непроходимость мочевыводяшего тракта или кишечника, при которых собаки испытывают острую боль в животе. Ценную диагностическую информацию при завороте семенника дает УЗИ, которое проводят перед началом хирургической операции. УЗ? Г при скручивании семенного канатика выявляет увеличение половой железы, гомогенное снижение ‘Хогенности ее паренхимы, увеличение семенного канатика и придатка семенника, а также смещение в краниальном направлении хвоста последнего (Mattoon, Nyland, 1995; Pinto et al, 2001). Цветное Допплеровское УЗИ позволяет выявить нарушение кровотока в пораженном семеннике.
Лечение. Перекрут семенника является опасным заболеванием и требует экстренного лечения - удаления пораженной половой железы и поддерживающей терапии, направленной на устранение сопутствующих скручиванию семенного канатика нарушении (например, шока). Если нет метастаюв, прогноз благоприятный. Все удаленные ткани необходимо подвергать гистологическому исследованию поскольку имеется тесная связь между скручиванием семенного канатика и ростом опухоли в семеннике.
Острый инфекционный орхит/эпидидимит
Поскольку семенники и их придатки тесно связаны между собой посредством системы семенных канальцев, развитие воспалительного или инфекци-
1080 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
ohhoi о процесса в одном из них почти всегда влечет за собой поражение другого (хотя бывают случаи изолированного орхита и эпидидимита). Одновременно с семенниками и их придатками обычно поражается и семенной канатик.
Этиология. Орхиэпидидимит обычно вызывается бактериями, проникшими в семенники и их придатки в результате их травмирования (например, при колотом ранении), ретроградного прохождения через семенной канатик инфицированных мочи или секрета предстательной железы, бактериемии или миграции патогенных агентов из инфицированного ими регионарного лимфатического узла. Наиболее часто из пораженных семенников и их придатков у кобелей выделяют стафилококки, стрептококки, кишечную палочку и протеи. От нескольких больных орхиэпидидимитом собак были также изолированы микоплазмы (Lein, 1989). Инфекция Brucella canis в типичных случаях вызывает острый болезненный отек семенников и/или их придатков. Эта инфекция может также протекать у собак в бессимптомной форме, при которой происходит медленное разрушение паренхимы семенников и их при датков, что сопровождается развитием негнойного фиброзного воспалительного процесса и олигоспсрмии/азо-оспермии. Сообщалось о том, что вирус собачьей чумы вызывал у кобелей негнойное воспаление и фиброз половых желез и их придатков (Dahlbom, Andersson, 2000). Ассоциированные с этой инфекцией зельца-включения можно обнаружить в эпителии придатков семенников и клетках Сертоли кобелей. Наконец, диссеминированные системные микозы (например, бластомикоз и кокцидиомикоз), эрлихиоз и пятнистая лихорадка Скалистых Гор могут вызывать у собак развитие острого орхита эпидидимита (см. рис. 27-13).
Клинические признаки. Острый орхиэпидидимит сопровождается острой болью, отеком мошонки и утратой животным способности стоять и
Рис. 29-9. Односторонний нсгнойный эпидидимит, ставший причиной диффузного увеличения придатка семенника у 7-летнего ротвейлера. Вла хетец собаки обратился за помощью в свя ш с острым отеком и болешеиностью мошонки у своего питомца. Семенник не пострадал
передвигаться Могут также развиваться летаргия и анорексия. Из-за испытываемой боли такие животные обычно оказывают сопротивление при попытках провести их физикальное исследование. Поэтому в ряде случаев приходится применять транквилизаторы. У больных животных выявляют отек семенников и или их придатков различной степени тяжести (рис. 29-9), гиперемию, повышение местной температуры и болевую реакцию при дозрагивании до пораженных половых желез. Чаще всего воспаление охватывает только один семенник и его придаток. В результате облизывания собакой мошонки может развиться дермагит. Осложнение дерматита бактериальной инфекцией влечет за собой появление слизисто-гнойного экссудата или абсцессов в пораженных участках. Острый орхиэпидидимит обычно сопровож шстся лихорадкой. При пальпации через стенку прямой кишки у больных собак часто обнаруживают увеличение и болезненность предстательной железы, что в совокупности с соответствующими клиническими признаками позволяет диагностировать острый простатит.
Диагностика. При наличии у собаки острой боли и отека мошонки в первую очередь необходимо исключить перекрут семенника. УЗИ мошонки помогает дифференцировать эд и два заболевания (см. табл. 27-8) и выявить абсцессы в семенниках и их придатках (рис. 29-10). При появлении подозрения на острый орхиэпидидимит предпринимают попытку определить этиологию болезни с помощью бактериологического исследования крови, мочи и спермы (см. стр. 1089), а также смывов из мошонки. В ветеринарную лабораторию направля-
Рис. 29-10. УЗИ правого семенника 7-лстнсго ротвейлера, у которого в течение 3 дней наблю. хали сонливость, снижение аппетита и появление болезненного отека в области правого семенника. Обратите внимание на общее увеличение придатка семенника (прямая стрелка). Паренхима придатка семенника гипоэхогенна, а паренхима половой же тезы (изогнутая стрелка) — без изменений. Проведена односторонняя орхиэктомия (см. рис. 29-9). При гистологическом исследовании выявили изменения, характерные для тяжелого гнойного эпидидимита неизвестной этиологии при отсутствии гисто-югических изменений в семеннике. Аэробных иди ана »роб-ных бактерий в культурах ткани пораженного придатка семенника не выявлено.
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1081
ют цельную неконсервированную кровь или сыворотку крови животного для серологического исследования на инфекцию B.canis (см. стр. 1020).
Следует попытаться получить пробу спермы больного острым орхиэпидидимитом кобеля, хотя обычно это трудно сделать из-за испытываемой животным боли. Если получить эякулят удалось, то при его микроскопическом исследовании обычно обнаруживают воспалительные клетки (в первую очередь нейтрофилы), повышенное количество сперматозоидов с первичными и вторичными нарушениями морфологии, снижение общего количества сперматозоидов и в ряде случаев - эпителиальные клетки семявыносящих канальцев. Агглютинация сперматозоидов головками позволяет предположить инфекцию B.canis.
При обнаружении во время ректального исследования нарушений со стороны предстательной железы (см. стр. 1089) целесообразно проведение ее дополнительных исследований - ультразвукового, цитологического и бактериологического (в последних двух случаях тестируется биопсированный или полученный массажем материал). Для цитологического и бактериологического исследований получают также образцы увеличенных семенников и их придатков с помощью аспирационной биопсии (см. стр. 1054). Биопсия семенников не относится к числу обязательных диагностических процедур. Если все-таки ее провели, то делают посевы полученного биоптата на питательные среды с целью выявления патогенных бактериальных агентов, в том числе микоплазм.
Лечение. Терапию острого орхиэпидидимита начинают сразу же после взятия патологического материала для бактериологического исследования. Выбор схемы лечения во многом зависит от желания владельца собаки. Если того не волнуют проблемы фертильности его кобеля, клиническое состояние последнего стабилизируют жидкостной внутривенной терапией, проводят курс лечения антибиотиками широкого спектра действия и затем кастрируют. Антимикробными препаратами выбора в такой ситуации являются комбинации триметоприма с сульфаниламидом и клавулановой кислоты с амоксициллином, а также энрофлоксацин. Эффективность этого этапа лечения значительно повышается при использовании вместо антибиотиков широкого спектра действия тех антимикробных препаратов, к которым выделенная от данного животного культура бактерий наиболее чувствительна.
В случаях, когда заводчик хотел бы в будущем использовать заболевшего кобеля в племенных целях, кастрацию не проводят, если только инфекция не принимает неконтролируемый характер. Поддерживающую жидкостную терапию и введение антибиотиков следует начинать с самого начала болезни. В дополнение рекомендуется прикладывать к мошонке холодные компрессы или воду, что сводит к минимуму вызванное повышенной местной температурой повреждение герминативного эпи
телия семявыносящих канальцев и предотвращает развитие атрофии семенников и азооспермии. Для контроля воспалительной реакции, снижения местной температуры и предотвращения сенсибилизации иммунной системы антигенами сперматозоидов (последняя происходит вследствие нарушения целостности гематотестикулярного барьера) могут быть применены противовоспалительные препараты (например, кортикостероиды или аспирин).
При одностороннем орхите может поражаться и другой семенник в результате воздействия повышенной температуры мошонки, аутоиммунных механизмов разрушения собственных сперматозоидов, а также распространения инфекции с пораженной половой железы на здоровую. По этой причине имеющим племенную ценность кобелям для сохранения неповрежденного семенника показано проведение односторонней орхиэктомии. Кобели, у которых сохранился один нормальный семенник, остаются фертильными, хотя общее количество сперматозоидов в их эякулятах может снизиться. Хозяин собаки должен знать, что кобель с одним семенником может быть не допущен к участию в выставках; относительно возможности использования кобеля в племенных целях положения в разных кинологических клубах могут быть разными.
Прогноз. Прогноз сохранения фертильности после перенесения острого орхиэпидидимита осторожный. Кобель может стать бесплодным из-за необратимого повреждения герминативного базального эпителия семявыносящих канальцев, вызванного воспалением, дегенерации канальцев вследствие гипертермии, аутоиммунного разрушения сперматоцитов и сперматозоидов, происходящего после нарушения целостности гематотестикулярного барьера, а также закупорки семенных протоков некротическим дебрисом или фиброзной тканью. Частичная непроходимость протоков семенников и их придатков, как и образование в этих протоках слепых карманов могут стать причинами развития сперматоцеле или сперматогранулем (см. стр. 1085). Многие последствия орхита/эпидиди-мита развиваются в течение месяцев. Хотя в первое время после острого орхиэпидидимита кобель может сохранять плодовитость и анализ его спермы часто не выявляет отклонений от нормы, но в конечном итоге у него могут развиться олигоспермия, азооспермия и бесплодие.
Если базальный герминативный эпителий остается неповрежденным и непроходимости системы протоков семенников и их придатков не возникает, то через несколько месяцев после перенесения заболевания у кобеля восстанавливаются сперматогенез и фертильность. Обычно полный цикл развития первичного сперматогония (типа А) до стадии зрелого сперматозоида занимает 55-70 дней. Поэтому при получении неудовлетворительных результатов анализов спермы в первые 3 месяца после перенесения острого орхоэпидидимита кобеля не считают бесплодным. Ветеринарный врач не может дать точ
1082 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
ного прогноза относительно восстановления сперматогенеза и плодовитости у перенесшего острую форму заболевания животного в течение 6 месяцев после его выздоровления. Но и после этого срока у собаки необходимо периодически брать пробы эякулята для оценки продукции и качества спермы.
Хронический орхит/эпидидимит
Этиология. Хронические орхит и эпидидимит могут развиваться как осложнения острого орхиэпидидимита, но бывают случаи, когда ни владелец кобеля, ни курирующий его ветеринарный врач в предшествующий заболеванию период никогда не наблюдали у него признаков воспаления половых желез. Острый и хронический орхиэпидидимит вызывают одни и те же возбудители. Наиболее часто инфекция распространяется из предстательной железы, пораженной хроническим субклиническим бактериальным простатитом. Хронический орхиэпидидимит представляет собой медленно прогрессирующее, неинтенсивное, негнойное воспаление семенников и их придатков, сопровождающееся их фиброзным перерождением, что в конечном итоге ведет к утрате семявыносящими канальцами своих функций и прекращению сперматогенеза.
Клинические признаки. Наиболее характерным для данного заболевания симптомом является утрата фертильности внешне здоровым кобелем. Перенесение собакой в предшествующий период острых орхита, эпидидимита, простатита или рецидивирующих инфекций мочевыводящей системы возможно, но не обязательно. При пальпации семенников больного хроническим орхиэпидиди-митом кобеля часто обнаруживают атрофию, фиброз, узлы или их фиброзные спайки с мошонкой. При пальпации придатков семенников выявляют их уплотнение и/или увеличение, особенно если развиваются сперматоцеле или сперматогранулема. Исследование предстательной железы необходимо, так как болезнь может сопровождаться хроническим орхитом и простатитом. При хроническом воспалении предстательная железа при пальпации через стенку прямой кишки ощущается как мягкая или плотная, асимметричная, временами болезненная структура, имеющая неправильную форму и отличный от обычного для этого органа размер.
Диагностика. Подозрение на хронический орхиэпидидимит появляется, если кобель бесплоден, а при пальпации его семенников и их придатков отмечают нарушение их размера и структуры при отсутствии болезненности. Для подтверждения диагноза, установления возбудителя болезни и оценки состояния предстательной железы проводят дополнительные исследования (см. стр. 1089). Инфекцию Brucella canis исключают на основании отрицательных результатов серологического исследования и бактериологического анализа спермы, а для оценки состояния половых желез и их придатков проводят гистологическое и бактериологичес
кое исследования их биоптатов. Цитологическое исследование спермы больных хроническим орхи-эпидидимитом кобелей позволяет выявить азооспермию, олигоспермию с нарушением морфологии сперматозоидов и присутствие в эякуляте лейкоцитов. Для локализации инфекции в семенниках и их придатках исследуют вторую фракцию эякулята, а при подозрении на инфекцию предстательной железы - его третью фракцию. При гистологическом исследовании биоптата пораженного семенника выявляют характерные для хронического воспаления изменения, в том числе дегенерацию семявыносящих канальцев, фиброз и атрофию. Обнаружение плазмоцитарного лимфоцитарного инфильтрата может служить признаком аутоиммунного разрушения семявыносящих канальцев вследствие нарушения целостности гематотестикулярного барьера (см. «Лимфоцитарный орхит»). При азооспермии определение активности в сперме щелочной фосфатазы (см. стр. 1045) облегчает дифференциацию непроходимости системы семенных протоков при нормальном сперматогенезе от первичной дегенерации семявыносящих канальцев.
Лечение. Лечить хронический орхиэпидидимит сложно, поскольку этиология заболевания обычно остается неустановленной, и к моменту проведения лечения в семенниках и их придатках развиваются тяжелые необратимые изменения (например, фиброз). При положительных результатах бактериологического исследования проводят курс терапии антибиотиками, которые вводят не менее трех недель. Повторное бактериологическое исследование спермы кобеля проводят через 7-14 дней и через 3 месяца после завершения лечения антибиотиками, чтобы убедиться, что инфекция отсутствует. Если при гистологическом исследовании выявили плазмацитарно-лимфоцитарную инфильтрацию паренхимы семенников и их придатков, собаке назначают иммунодепрессанты (см. «Лимфоцитарный орхит»).
Прогноз. Прогноз относительно восстановления фертильности у перенесших хронический орхиэпидидимит кобелей должен быть от осторожного до неблагоприятного. Фиброзные изменения паренхимы семенников и утрата герминативных эпителиальных клеток извитых канальцев приобретают при этом заболевании перманентный характер. Остановить иммуное разрушение семявыносящих канальцев, не вызвав при этом их атрофии, очень сложно. При хроническом орхиэпидидимите часто происходит полная закупорка системы канальцев и протоков семенников и их придатков, что не удается восстановить доступными методами лечения. В итоге остается в силе правило, согласно которому «приобретя азооспермию, кобель с ней никогда не расстанется».
Лимфоцитарный орхит
Лимфоцитарный орхит является иммунным заболеванием, при котором в семенниках развиваются
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1083
лимфоцитарная и плазмацитарная воспалительные реакции. Гематотестикулярный барьер образован соединенными друг с другом клетками Сертоли, которые изолирую' созревающие герминативные клетки семявыносящих канальцев от воздействия иммунной системы (Amann, 1989). Иммунная атака может бы гь инициирована разрушением гематотес-тикулярного барьера в резульгате его травматического повреждения, инфекции, воспаления и действия ряда других факторов; она может быть также компонентом системного, возможно даже наследственного аутоиммунного забо гевания, поражающего целый ряд желез внутренней секреции (см. стр. 102); иногда се этиология остается нераспознанной. Нарушение це. юстности гематотести куляр-ного барьера приводит к сенсибилизации иммунной системы кобеля антигенами сперматозоидов, которые воспринимаются иммунной системой как чужеродные. Таким образом, причинами развития лимфоцитарного орхита становятся серьезные повреждения гсматотестикулярного барьера и продолжительный контакт антигенов сперматозои юв с факторами иммунитета. При этом заболевании происходит проникновение плазматических клеток и лимфоцитов в паренхиму семенников, отложение иммуноглобулинов в семявыносящих канальцах, разрушение канальцев, потеря клеток Лейдига и образование аутоантител к сперматозоидам (рис. 29-11; Olson et al, 1992). У заболевших собак оли-госпермия постепенно переходит в азооспермию, что сопровождается в той или иной степени утратой либидо. Пораженные семенники часто уменьшаются в размере и размягчаются, что может быть установлено их пальпацией. При цитологическом исследовании биоптатов в паренхиме семенников обнаруживают иммуноцитарные инфильтраты. Прогноз в отношении возможности восстановле
ния продуктивности у больных лимфоцитарным орхитом кобелей плохой, что связано с прогрессирующим характером этого заболевания.
Для контроля иммунных реакций у больных лимфоцитарным орхитом собак могут быть применены глюкокорт икон 1Ы в вызывающих иммунодепрессию дозах (например, преднизолон в суточной дозе от 2 до 4 мг/кг массы тела, которую первоначально дают собаке в 2 приема). К сожалению, длительное введение или применение высоких доз глюкокортикоидных препаратов, что необходимо для обеспечения эффективности лечения, сопряжено с подавлением сперматогенеза и становится причиной бесплодия. Поэтому ветеринарные врачи вынуждены контролировать иммунные реакции относительно низкими дозами глюкокортикоидов и давать их как можно реже, чтобы избежать нежелательного побочного эффекта. Однако такая терапия, как правило, безуспешна, так как в большинстве случаев подавить иммунные реакции удается только очень высокими дозами глюкокортикоидов, которые могут привесги к утрате фертильности. Химиотерапевтические препараты, используемые в качестве иммунодепрессантов, также могут оказывать отрицательное воздействие на фертильность кобелей и вызывать дегенеративные поражения их семенников (таблица 29-3). Их эффективность при использовании в дозах, при которых не происходит повреждения половых желез кобелей (например, азатиоприиа в юзе 2 мг/кг/день), требует подтверждения.
Лимфоцитарный орхит может также возникать спонтанно на фоне аутоиммуного разрушения других желез внутренней секреции. Например, сообщалось о наследственном заболевании кобелем породы бшль, сопровождавшемся сочетанием лимфоцитарного орхита и аутоиммунного тиреоидита. Мы наблюдали поражения семенников у собак,
Рис. 29-11. Гистологические срезы биоптата, полученного из семенника 4-летнсго кобеля породы бородатая колли, у которого азооспермия сочеталась с нормальным либидо.
А. Умеренная инфильтрация интерстициальной ткани семенника плазматическими клетками и лимфоцитами (изогнутая стрелка) и выраженная диффузная дегенерация канальцев; некоторые семявыносящие канальцы (светлая стрелка) содержат только один слой первичных сперматогониев и клеток Сертоли (окраска гематоксилин-эозином, увеличение х100). Б. Лимфоцитарная инфильтрация (стрелка) интерстициальной ткани семенника, видимая под большим увеличением (х450, окраска гематоксилин-эозином). Крупное белое пятно - артефакт. Результаты гистологического исследования позволили диагностировать лимфоцитарный орхит и дегенерацию канальцев.
1084 • ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
ТАБЛИЦА 29-3. ХИМИОТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА СПЕРМАТОГЕНЕЗ У ЧЕЛОВЕКА И, ВОЗМОЖНО, У СОБАКИ.
Бусульфан
Хлорамбуцил
Цисплатин
Циклофосфамид
Глюкокортикоиды
Метотрексат
Винбластин
Винкристин
страдавших первичным гипокортицизмом, что, по всей вероятности, было вызвано опосредованным иммунной системой разрушением надпочечников и семенников. Поражение семенников мужчин описано также при полигландулярном аутоиммунном синдроме типа I (Neufeld et al, 1981) (см. стр. 102). Предполагать заболевание кобеля лимфоцитарным орхитом следует в случаях, когда поражения семенников развиваются одновременно с другим аутоиммунным эндокринным заболеванием (например, гипотиреозом, гипокортицизмом и сахарным диабетом). Как упоминалось выше, вылечить кобеля, больного лимфоцитарным орхитом, очень сложно, а поскольку в патогенезе этого заболевания, по всей видимости, участвуют генетические факторы, то и предпринимать такие попытки не имеет смысла.
Дегенерация/атрофия семенников
Дегенерация семенников происходит после повреждения клеток внутри или вокруг извитых канальцев (сперматогониев, клеток Сертоли и интерстициальных клеток Лейдига). Она может развиваться как вторичный патологический процесс на фоне воспалительных и невоспалительных повреждений половых желез (табл. 29-4). Дегенерация семенников бывает идиопатической, когда ее причины не установлены. Она обычно развивается у кобелей в возрасте от 3 до 6 лет, носит невоспалительный прогрессирующий характер и в конечном итоге приводит к атрофии семенников и стерильности кобелей. Способы ее лечения, как и этиология, неизвестны.
Симптоматика заболевания и результаты физикального исследования зависят от причины, вызвавшей дегенерацию семенников, типа поврежденных клеток, тяжести дегенеративного процесса к моменту первичного обследования животного. В типичных случаях дегенерация семенников характеризуется повреждением сперматогониев, развитием олигоспермии/азооспермии, изменением морфологии и снижением подвижности сперматозоидов. Владельцев кобелей с такой патологией в первую очередь беспокоит бесплодие собак. В тех случаях, когда заболевание не вызвано ростом опухолей или закупоркой семенных канальцев/прото-ков, семенники могут быть нормальными по плот-
ТАБЛИЦА 29-4. ВОЗМОЖНЫЕ ПРИЧИНЫ ДЕГЕНЕРАЦИИ СЕМЕННИКОВ.
Перегрев
Действие гормонов
Гипотиреоз
Г иперкортицизм
Нарушение функций гипофиза/гипоталамуса
Введение экзогенных гормонов
Гормоны, синтезируемые в опухолях семенников
Травмы
Инфекции
Старение (>10 лет)
Опухоли семенников
Химические вещества, токсины, лекарственные препараты
Рацион
Поражения кровеносных сосудов, инфаркт
Облучение
Закупорка протоков половых желез
Идиопатическая дегенерация
пости и величине, мягкими или уменьшенными. При хронической дегенерации, вызванной воспалением, дистрофическая кальцификация и фиброз усиливаются, и семенники становятся твердыми, бугорчатыми и неэластичными. При идиопатической и хронической дегенерации, развившейся на почве невоспалительных повреждений, семенники постепенно размягчаются, уменьшаются и атрофируются. При тяжелой атрофии (например, на конечной стадии идиопатической дегенерации) в мошонке удается нащупать только придатки семенников.
При большинстве форм дегенерации семенников остается достаточно большое количество нормально функционирующих интерстициальных клеток, вследствие чего в начале заболевания либидо у кобелей сохраняется. Исключение составляет дегенерация семенников, обусловленная другими эндокринными заболеваниями. Сохранение либидо у собак часто вводит в заблуждение их владельцев, которые отождествляют его с фертильностью и не могут понять, как их питомец может сохранять нормальное либидо и при этом быть бесплодным.
Подозрение на дегенерацию семенников у бесплодных кобелей должно возникать при явных изменениях консистенции и размера половых желез. Анализы спермы в таких случаях обычно подтверждают наличие проблем, связанных с семенниками. При диагностическом исследовании необходимо выяснить, вызвана ли дегенерация семенников воспалительными или невоспалительными повреждениями, а затем попытаться исключить возможные вторичные причины болезни. Схема проведения диагностических исследований при дегенерации/ атрофии семенников такая же, как при олигоспер-мии и азооспермии (см. стр. 1105).
Лечение страдающих дегенерацией семенников кобелей и прогнозирование восстановления у них репродуктивности зависят от причины заболевания, тяжести поражений первичного эпителия семявыносящих канальцев и клеток Сертоли, а также от интенсивности фиброза пораженных по
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ • 1085
ловых желез. Если разрушены первичные (типа А) сперматогонии и клетки Сертоли, восстановление фертильности невозможно. В тех случаях, когда поражаются более дифференцированные половые клетки, но первичные сперматогонии и клетки Сертоли незатронуты, а вызвавшие заболевание причины быстро перестают действовать или их можно устранить, утрата фертильности может быть временной. Аналогично, если сохранились функционирующие клетки Лейдига, изменений секреции тестостерона и либидо не происходит.
Первичные сперматогонии превращаются в зрелые сперматозоиды в течение приблизительно 55-70 дней; поэтому диагностировать необратимую азооспермию можно, по меньшей мере, только через 3-6 месяцев после выявления дегенерации семенников и устранения вызвавшей ее причины.
Сперматоцеле и сперматогранулема
Сперматоцеле является следствием вызванного разными причинами заращения протоков придатков семенников. Сперматоцеле представляет собой кистозное расширение придатка семенника, в котором проксимальнее места заращения протоков накапливается концентрированная сперма. Накопление спермы в конечном итоге вызывает хронический воспалительный процесс и индуцирует развитие в придатках семенников узлов грануляционной ткани — сперматогранулемы. Причинами развития сперматоцеле и сперматогранулемы могут быть слепо заканчивающиеся рудиментарные участки канальцев сети семенников (rete testis) или семявыносящих канальцев, в которых также может происходить аккумуляция спермы.
Сперматогранулемы бывают односторонними и двусторонними. Кобели с односторонней сперма-тогранулемой сохраняют репродуктивность, и заболевание у них может оставаться незамеченным. Если поражены оба семенника, то обычно возникают проблемы с плодовитостью собаки, что служит причиной обращения ее владельца за помощью к ветеринару. При исследовании спермы такого животного устанавливают азооспермию. Концентрация щелочной фосфатазы в сперме при сперматог-ранулеме может быть нормальной или пониженной в зависимости от места заращения семенных протоков (см. стр. 1045). Сперматогранулему иногда случайно обнаруживают при пальпации семенников и их придатков во время физикального исследования; однако это удается не всегда. При проведении УЗИ сперматоцеле выглядит как находящаяся в мошонке экстратестикулярная, очаговая, имеющая острые внутренние края стенок кистозная структура. Она неэхогенна, но в глубоких ее слоях эхогенность повышается. При гистологическом исследовании биоптатов пораженных семенников может быть обнаружен активный сперматогенез или дегенерация канальцев, степень которой зависит от места непроходимости семенных протоков и способ
ности головки придатка семенника абсорбировать секрет семявыносящих канальцев. Лигирование хвоста придатка семенника вызывает дегенерацию семявыносящих канальцев в течение 1-3 месяцев (Larsen, 1980). Чем ближе место обструкции семенных протоков к головке придатка семенника, тем тяжелее дегенеративные изменения семенников. Подозрение на закупорку протока придатка семенника возникает в тех случаях, когда при исследовании биоптатов семенника кобеля с азооспермией выявляют нормальный сперматогенез.
Лечение двусторонней сперматогранулемы невозможно; прогноз в отношении восстановления фертильности и избавления от азооспермии в этом случае плохой. Пластическое восстановление проходимости семенных протоков бывает эффективным только в отдельных случаях, и в настоящее время эта операция редко проводится.
Аденомиоз придатков семенников
Аденомиозом придатков семенников называют патологический процесс, при котором происходит инвазия клеток эпителиальной выстилки в мышечные слои придатка семенника (Larsen, 1980). В результате могут образовываться слепые карманы. В таких карманах возможна аккумуляция сперматозоидов, что ведет к развитию сперматоцеле и сперматогранулемы. Аденомиоз придатка семенника может также стать причиной непроходимости общего протока придатка семенника и олигоспермии/азооспермии. Обычно этот патологический процесс развивается вследствие избытка эндогенных или экзогенных эстрогенов.
Пахово-мошоночная грыжа
Попадание органов брюшной полости в паховый канал, приводящее к образованию грыжи, у кобелей происходит реже, чем у сук. Однако если это случается у кобелей, то содержимое грыжи по паховому каналу может попасть в мошонку. Предрасполагающими факторами возникновения пахово-мошоночной грыжи могут быть анатомические нарушения, особенно затрагивающие внутреннее паховое кольцо. Повышенное внутрибрюшинное давление (например, у страдающих ожирением собак или возникающее при травмах) способно сдвинуть содержимое брюшной полости в паховый канал и тем самым стать причиной возникновения грыжи.
Владельцев кобелей с пахово-мошоночной грыжей обычно беспокоит увеличение мошонки. Обнаружение у этих животных мягких, утолщенных, но безболезненных при пальпации семяпроводов служит веским основанием для предварительного диагноза паховой грыжи. Реже владельцы жалуются на появление чувства боли у кобеля при пальпации мошонки вследствие сдавливания сосудов семенных канатиков, атрофию семенников, бесплодие и рвоту при непроходимости желудочно-кишечного
1086
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
тракта. Пахово-мошоночную грыжу часто выявляют при очередном физикальном исследования собак. Если грыжа клинически никак не проявляется. но нарушает кровоснабжение семенников и герморсгулирующую функцию мошонки, у кобеля развиваются разной степени тяжести дегенерация и атрофия семенников, а также олигоспермия.
Для подтверждения диагноза можно провести УЗИ. Основным методом лечения служит хирургический - хрыжссечение с суживанием внутреннего пахового кольца. При этом необходимо проявлять осторожность во избежание создания препятствий для прохождения семенных кровеносных сосудов через внутреннее паховое кольцо. При нарушении циркуляции крови в семенном канатике может развиться болезненный острый отек мошонки и семенника, что часто кончается кастрацией. Сама по себе кастрация является одним из основных способов течения нахово-мошоночной грыжи собак, поскольку это заболевание может быть наследственным, особенно если в анамнезе нет данных о других причинах грыжи (например, травмы).
Болезни мошонки
Первичные нарушения функций мошонки происходят у кобелей довольно редко. По всей видимости, основной проблемой является дерматит мошонки. Он во шикает в результате воздействия раздражающих химических веществ, травм, бактериальных инфекций, паразитов и причинения собаками себе травм при интенсивном облизывании мошонки. Последнее чаще всего происходит в результате ал-лерт ического дерматита, вызванного укусами блох (рис. 29-12). Лечение дерматита мошонки строится с учетом вызвавшей его причины и обычно включает комбинацию тщательных ежедневных промы-
Рис. 29-12. Дерматит мошонки у двухлетнего метиса немецкой овчарки. Дерматит развипся вследствие нанесения животным самому себе травмы при вылизывании мошонки, что могло быть вызвано инвазией блох.
вания и очистки мошонки, осмотрительного применения мазей и системных антибиотиков. Надевание собаке елизаветинского воротника и применение в редких случаях транквилизаторов позволяет предотвратить самотравмированис в области мошонки.
Опухоли мошонки редки. Имеются сообщения о случаях чешуйчатоклеточной карциномы, меланомы и тучноклеточных опухолей у кобелей. Меланомы мошонки у собак обычно носят злокачественный характер и их следует удалять хирургическим путем.
ЛИТЕРАТУРА
Amann RP: Structure and function of the normal testis and epididymis. J Am Coll Toxicol 8:457, 1989.
Baumans V, et al: Testicular descent in the dog. Zbl Vet Med C Anat Histol Embryol 10:97, 1981.
Cowgill L: Pathophysiology and management of anemia of chronic progressive renal failure. Semin Vet Med Surg 7:175, 1992.
Cox VS: Cryptorchidism in the dog. In Morrow DA (ed): Current Therapy in Theriogenology, 2nd ed. Philadelphia, WB Saunders Co, 1986, p 541.
Crow SE: Neoplasms of the reproductive organs and mammary glands of the dog. In Morrow DA (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1980, p 640.
Dahlbom M, Andersson M: Long term effects of canine distemper on seminal characteristics and testicular tissue. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-July 1, 2000, p. 94.
de Jong FH, et al: Inhibin immunoreactivity in gonadal and non-gonadal tumors. J Steroid Biochem Molec Biol 37:863, 1990.
de Kretser DM, Robertson DM: The isolation and physiology of inhibin and related proteins. Biol Reprod 40:33, 1989.
DeVico G, et al: Number and size of silver stained nucleoli (AgNOR clusters) in canine seminomas: Correlation with histological features and tumour behavior. J Comp Pathol 110:267, 1994.
Dhaliwal RS, et al: Treatment of aggressive testicular tumors in four dogs. J Amer Anim Hosp Assoc 35: 311, 1999.
Goodfellow PN, Lovell-Badge R: SRY and sex determination in mammals. Annu Rev Genet 27:71-92, 1993.
Grootenhuis AJ, et al: Inhibin, gonadotrophins and sex steroids in dogs with Sertoli cell tumors. J Endocrinol 127:235, 1990.
Hammond WP, et al: Chronic neutropenia: A new canine model induced by human granulocyte colony-stimulating factor. J Clin Invest 87:704, 1991.
Hayes HM, et al: Canine cryptorchidism and subsequent testicular neoplasia: Case-control study with epidemiologic update. Teratology 32:51, 1985.
Johnston GR, et al: Ultrasonographic features of testicular neoplasia in dogs: 16 cases (1980-1988). JAVMA 198:1779, 1991.
Johnston SD, Root Kustritz MV, Olson PNS: Disorders of the canine testes and epididymes. In Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline Theriogenology. Philadelphia, WB Saunders Co, 2001, p 312.
Koopman P, et al: Male development of chromosomally female mice transgenic for Sry. Nature (London) 351:117, 1991.
Larsen RE: Infertility in the male dog. In Morrow DA (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1980, p 646.
Lein DH: Mycoplasma infertility in the dog: Diagnosis and treatment. Proceedings of the Society for Theriogenology, Coeur d’Alene, ID, September 29-30, 1989, p 307.
Madewell BR, Theilen GH: Tumors of the urogenital tract. In Theilen GH, Madewell BR (eds): Veterinary Cancer Medicine, 2nd ed. Philadelphia, Lea and Febiger, 1987, p 583.
Mattheeuws D, Comhaire FH: Concentrations of oestradiol and testosterone in peripheral and spermatic venous blood of dogs with unilateral cryptorchidism. Dorn Anim Endocr 6:203, 1989.
Mattoon JS, Nyland TG: Ultrasonography of the genital system. In Nyland TG, Mattoon JS (eds) Veterinary Diagnostic Ultrasound. Philadelphia, WB Saunders Co, 1995, p 141.
McDonald RK, et al: Radiotherapy of metastatic seminoma in the dog. J Vet Intern Med 2:103, 1988.
Medleau L: Sex hormone-associated endocrine alopecias in dogs. J Am Anim Hosp Assoc 25:689, 1989.
Neufeld M, et al: Two types of autoimmune Addison’s disease associated with different polyglandular autoimmune (PGA) syndromes. Medicine 60:355, 1981.
Obradovich JE, et al: Evaluation of recombinant canine granulocyte colonystimulating factor as an inducer of granulopoiesis. J Vet Intern Med 5:75, 1991.
ЗАБОЛЕВАНИЯ СЕМЕННИКОВ И ИХ ПРИДАТКОВ
1087
Ogilvie GK, et al: Use of recombinant canine granulocyte colony-stimulating factor to decrease myelosuppression associated with the administration of mitoxantrone in the dog. J Vet Intern Med 6:44, 1992.
Ogilvie GK: Hematopoietic growth factors: Frontiers for cure. Vet Clin North Am Small Anim Pract 25:1441, 1995.
Olson PN, et al: Clinical and laboratory findings associated with actual or suspected azoospermia in dogs: 18 cases (1979-1990). JAVMA 201:478, 1992.
Peters MAJ, et al: Spermatogenesis and testicular tumours in the ageing dog. Advances in Dog, Cat and Exotic Carnivore Reproduction - Book of Abstracts. The 4th International Symposium on Canine and Feline Reproduction and the 2nd Congress of the European Veterinary Society for Small Animal Reproduction. Oslo, Norway, June 29-July 1, 2000, p 35.
Pinto CRF, et al: Theriogenology question of the month. JAVMA 219:1343, 2001.
Pugh CR, Konde LJ: Sonographic evaluation of canine testicular and scrotal abnormalities: A review of 26 case histories. Vet Radiol 32:243, 1991.
Romagnoli SE: Canine cryptorchidism. Vet Clin North Am 21:533, 1991.
Ruble RP, Hird DW: Congenital abnormalities in immature dogs from a pet store: 253 cases (1987-1988). JAVMA 202:633, 1993.
Sinclair AH, et al: A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature 346:240, 1990.
Suess RP, et al: Bone marrow hypoplasia in a feminized dog with an interstitial cell tumor. JAVMA 200:1346, 1992.
Verstegen JP: Conditions of the male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, British Small Animal Veterinary Association, 1998, p 71.
Wallace LJ, Cox VS: Canine cryptorchidism. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders Co, 1980, p 1244.
Wensing CJG: Developmental anomalies, including cryptorchidism. In Morrow DA (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1980, p 583.
МЕХАНИЗМ БЕСПЛОДИЯ, ВЫЗВАННОГО ЗАБОЛЕВАНИЕМ
ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.......1088
ОСТРЫЙ БАКТЕРИАЛЬНЫЙ ПРОСТАТИТ....................1088
Этиология и патофизиология....1088
Клинические симптомы.........1089
Глава 30 ПРОСТАТИТ
Диагностика...................1090
Терапия.......................1093
Последствия острого бактериального простатита......1095
ХРОНИЧЕСКИЙ БАКТЕРИАЛЬНЫЙ ПРОСТАТИТ.....................1095
Клинические признаки..........1096
Диагностика.....................1096
Терапия.........................1096
Последствия хронического бактериального простатита.....1098
Основными заболеваниями предстательной железы являются доброкачественная гиперплазия (с сопутствующим кистозом разной степени тяжести), инфекции, абсцесс, парапростатические кисты и неоплазия (Krawiec, Heflin, 1992). Кисты и новообразования простаты редко приводят к нарушению репродуктивной функции и потому не обсуждаются в этой главе.
МЕХАНИЗМ БЕСПЛОДИЯ, ВЫЗВАННОГО ЗАБОЛЕВАНИЕМ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Бактериальный простатит - наиболее значимое заболевание предстательной железы, приводящее к бесплодию. Это всегда следует иметь в виду при обследовании животного, поступившего в ветеринарную клинику в связи с бесплодием. Бактериальный простатит вызывает бесплодие разными путями, в том числе вследствие распространения инфекции на семенники и их придатки (Wallace, 1991). Повышение температуры при простатите угнетает сперматогенез, одновременно изменяется морфологическое строение и уменьшается подвижность сперматозоидов, а либидо понижается из-за местного воспаления, болей и/или системных расстройств. При простатите возможна механическая непроходимость семявыносящих протоков, проходящих через воспаленную и распухшую предстательную железу. Наконец, простатит может служить причиной кровоизлияний в эякулят.
Самой серьезной проблемой, связанной с бесплодием при простатите, является распространение инфекции на семенники и их придатки, Из инфицированной предстательной железы возбудитель инфекции поступает в семенники и их придатки через семявыносящие протоки или, реже, с током крови. В результате возникает орхиэпидидимит и опосредуемый иммунной системой орхит. Бактери
альный простатит влияет на состояние семени даже в тех случаях, когда не вызывает гистологических изменений в семенниках. В одном из исследований инфекция простаты, индуцированная Escherichia coli у шести собак, в двух случаях приводила к значительному уменьшению количества нормальных сперматозоидов (до 65% и ниже от их общего содержания по сравнению с более 90% в норме), т.е. повышала частоту их первичных и вторичных морфологических изменений, несмотря на то что гистологическая картина семенников оставалась нормальной (Barsanti et al, 1986). В то же время хронический простатит, индуцированный E.coli, не вызывал видимых изменений количества или подвижности сперматозоидов, но известно, что для проявления такого воздействия необходима очень высокая концентрация бактерий (> 106/мл).
Доброкачественная гиперплазия простаты нечасто встречается у собак, но если развивается, то приводит к бесплодию. Первичная причина индуцируемого гиперплазией бесплодия неизвестна, хотя предполагается, что ею может служить кровоизлияние в эякулят. Кровь обладает спермицидной активностью и в случае постоянного поступления в эякулят может вызвать бесплодие. Влияние доброкачественной гиперплазии простаты на объем спермы (см. стр. 1045), по-видимому, не сказывается на фертильности. У собак, в отличие от человека, доброкачественная гиперплазия простаты обычно не сопровождается окклюзией просвета мочеиспускательного канала.
ОСТРЫЙ БАКТЕРИАЛЬНЫЙ ПРОСТАТИТ
Этиология и патофизиология
Дистальный отдел мочеиспускательного канала собак содержит природную микрофлору, состоя
ПРОСТАТИТ
1089
щую, в основном, из грамположительных бактерий (Barsanti, Finco, 1983). Предстательная железа представляет собой половой орган, наиболее близко расположенный к месту концентрации микрофлоры в мочеиспускательном канале. В норме предстательная железа и проходящий через нее отдел мочеиспускательного канала стерильны. Миграции бактерий вверх по мочеиспускательному каналу к предстательной железе и мочевому пузырю препятствует целый ряд защитных механизмов. К их числу относятся вымывание микроорганизмов свободным током мочи и секрета простаты, перистальтика мочеиспускательного канала, наличие в нем зоны повышенного давления и особенности строения выстилающей его слизистой оболочки, которая обладает способностью захватывать бактерии. Известную роль играют также локальная продукция IgA и активность антибактериального фактора простаты (Klausner, Osborne, 1983; Dorfman, Barsanti, 1995). Антибактериальный фактор простаты представляет собой низкомолекулярное соединение цинка, тормозящее рост бактерий, особенно грамотрицательных кишечных микроорганизмов. Нарушение любого из этих защитных механизмов позволяет бактериям перемещаться вверх по мочеиспускательному каналу, внедряться в предстательную железу и колонизировать ее.
Патологические процессы, сопровождающиеся увеличением количества бактерий в проходящем через предстательную железу отделе уретры (такие как бактериальный цистит, формирование камней в мочеиспускательном канале, неоплазия), угнетают локальную иммунную систему или изменяют структуру предстательной железы (вызывая, например, плоскоклеточную метаплазию или гиперплазию). В результате возрастает риск инфекционного поражения железы. Рост простаты регулируется андрогенами, среди которых наибольшее значение имеют 5а-дигидротестостерон, образующийся из тестостерона под воздействием фермента а-редуктазы (Rhodes, 1996). Эстрогены индуцируют метаплазию плоского эпителия и непроходимость протоков, а также понижают интенсивность превращения тестостерона в дигидротестостерон в клетках предстательной железы. Гипертрофия и гиперплазия простаты возможны только в присутствии большого количества как эстрогенов, так и андрогенов (Cochran et al, 1981; Winter, Liehr, 1996).
Возбудители инфекций предстательной железы в основном те же самые, что инфицируют мочевые пути. Весьма вероятно, что бактериальный простатит в большинстве случаев является следствием инфекции мочевого тракта, откуда возбудитель проникает в предстательную железу. Вместе с тем, почти у трети собак с инфекцией простаты ее возбудители отсутствовали в мочевом тракте как в момент обследования, так и согласно анамнестическим данным (Ling, 1995). Чаще всего бактериальный простатит у собак обусловлен инфекцией E.coli. Другими возбудителями (в порядке частоты
встречаемости) являются положительные по коагулазе стафилококки, стрептококки, Klebsiella sp., Proteus mirabilis, Enterobacter sp. и Pseudomonas aeruginosa (Ling, 1995). Инфекция только одним организмом регистрируется приблизительно у 70% собак с острым простатитом (Dorfman, Barsanti, 1995). Микоплазмы были обнаружены у 15% собак с бактериальным простатитом и только у 3% собак с инфекциями мочевого тракта (Ling, 1995). Brucella canis также иногда бывает причиной острого и хронического простатита.
Клинические симптомы
Клиническая симптоматика острого простатита обычно включает вялость, уменьшение аппетита, выделения (кровь и гной) из мочеиспускательного канала и препуция и боли в животе. В зависимости от тяжести поражения предстательной железы могут развиться дополнительные симптомы, например, абсцессы и сопутствующая инфекция мочевого пузыря, семенников и их придатков (табл. 30-1). В одном из исследований у 26% собак с диагнозом простатит имелись признаки заболевания мочевых путей, 37% имели желудочно-кишечные расстройства, а 48% системные заболевания (Krawiec, Hefland, 1992).
Физикальное исследование обычно выявляет повышенную температуру и неспецифическую боль в заднем отделе брюшной полости. У таких животных ректальная пальпация нередко выявляет болезненность простаты. Пораженная инфекцией предстательная железа может сохранять нормальные размеры и форму, оставаясь симметричной, но может иметь неправильную форму и нарушенную структуру наружной поверхности. Срединная борозда не всегда хорошо различима, зато появляются флуктуирующие зоны, особенно при наличии абсцесса. У более старых собак бактериальный простатит может дополняться доброкачественной гиперплазией простаты и связанным с ней увеличением размеров железы. При сближении предстательной железы с семенниками и их придатками развиваются признаки острого сочетанного воспаления семенников и их придатков (см. стр. 1079).
ТАБЛИЦА 30-1. ВОЗМОЖНЫЕ КЛИНИЧЕСКИЕ СИМПТОМЫ ПРИ ОСТРОМ БАКТЕРИАЛЬНОМ ПРОСТАТИТЕ
Выделения из крайней плоти и мочеиспускательного канала Кровь Гной
Вялость, отсутствие аппетита, рвота, лихорадочное состояние
Дизурия, гематурия, пиурия
Боли в задней части брюшной полости
Тенезмы и запоры
Неестественная походка
Потеря веса
Болезненные, припухшие семенники и их придатки
Отсутствие либидо
Бесплодие
1090 • ПРОСТАТИТ
Диагностика
Предварительный диагноз острого простатита обычно ставится на основании результатов анамнестического анализа и физикального исследования. Общий клинический анализ крови (ОАК) может выявит ь лейкоцитоз и нейтрофилию с разной степенью сдвига в сторону преобладания незрелых или токсических клеток. Эти изменения более выражены при абсцессе предстательной железы (Barsanti, Finco, 1984). Результаты измерения концентрации белков, поступающих в кровь из предстательной железы (кислой фосфатазы, специфического антигена простаты, специфической эстеразы простаты собак) не дают материала для дифференциальной диагностики животных с бактериальным простатитом и здоровых особей либо собак с другими заболеваниями предстательной железы (Bell et al, 1995). Анализ мочи может выявить или не выявить гематурию, пиурию и бактериурию. Пробы мочи, получаемые посредством надлобковой пункции мочевого пузыря, используют для посева. Считается, что предстательная железа чаще всего инфицируется геми же микроорганизмами, которые растут в посевах мочи (Black et al, 1998). В то же время были обнаружены смешанные инфекции, возбудители которых (и чувствительность к ним) в мочевом пузыре и мочеиспускательном канале отличаются от бактерий, инфицирующих предстательную железу (Ling et al, 1990). В таких случаях терапия антибиотиками, предназначенная для лечения инфекций мочевого тракта, может оказаться неэффективной в отношении инфекции предстательной железы, поэтому при подозрении на наличие у собаки простатита рекомендуется культивировать пробы жидкости и ткани, взятые именно из предстательной железы (см. ниже).
Получение спермы у собак затруднительно, и ее состояние обычно оценивают только при необходимости культивирования эякулята для подтверж
дения бактериального простатита. Чаще всего при исследовании спермы от животных с острым простатитом выявляются нейтрофилы, в той или инои степени обладающие токсичностью, переваренные в процессе фагоцитоза бактерии, сперматозоиды с пониженной подвижностью и повышенной частотой первичных и вторичных морфологических дефектов.
Рентгенографическое исследование собак с острым простатитом редко бывает информативным. Обычно предстательная железа располагается в передне-нижней части малого таза, однако ее положение может менят ься в зависимости о г степени растяжения мочевого пузыря. Рентгенологически нормальная предстательная железа представляет собой скопление мягкой ткани равномерной плотности с ровным, четко очерченным контуром. При остром простатите при рентгенографии можно выявить увеличение размеров, минерализацию и утра-гу четкого контура предстательной железы (Feeney et al, 1987а). Присутствие газа в железе обусловлено ятрогенными факторами, в частности, предшествовавшей катетеризацией мочевого пузыря, или может служить показателем абсцесса. Уретрогра-фия с применением контрастного вещества может выявить его рефлюкс в строму предстательной железы и изменение диаметра мочеиспускательного канала, однако, эти явления не специфичны для заболеваний простаты.
УЗИ является наиболее безопасным и информативным методом для характеристики состояния предстательной железы (см. стр. 1051). У собак с острым простатитом УЗИ выявляет нормальный или увеличенный размер железы, ее симметричную или асимметричную форму, ровные или неровные границы. Паренхима простаты имеет гетерогенную эхогенную структуру, характеризующуюся наличием очаговых и многоочаговых гипоэхогенных зон с неясными очертаниями, которые перемежаются с гиперэхогенными участками неправильной фор-
Рис. 30-1. А. Улырасонограмма предстательной железы 10-летнего стаффордширского терьера, страдающего хроническим простатитом. Обратите внимание на диффузное узловое усиление эхогенности паренхимы и наличие неэхогенной кисты (показана стрелкой). Ь. Ультрасонограмма предстательной железы 12-летнего родезийского риджбека с увеличенной предстательной железой и острым простатитом Обратите внимание на множественные неэхогенные кисты в паренхиме.
ПРОСТАТИТ
1091
мы (Matton, Nyland, 1995). Иногда в паренхиме заметны гипоэхогенные или неэхогенные полости, заполненные жидкостью, которые представляют собой очаги абсцесса или кисты (рис. 30-1) (Feeney et al, 1987b). Пункционная биопсия гипоэхогенных и неэхогенных полостей под контролем ультразвука (см. ниже) позволяет получить жидкость простаты для культивирования и цитологического исследования, а также пробы паренхимальной ткани предстательной железы.
Техника взятия проб. Для подтверждения диагноза простатита и выбора антибактериальной терапии необходимо выделить и идентифицировать присутствующие в предстательной железе микроорганизмы и определить их чувствительность к антибиотикам. С этой целью обычно проводят культивирование мочи, жидкости или ткани простаты. Пробы жидкости и ткани предстательной железы, в первую очередь, берут у собак с подозрением на острый простатит и у животных, не отвечающих на антибактериальную терапию, назначенную на основании результатов посева мочи. Имеется несколько методов получения жидкости и ткани предстательной железы для цитологического исследования и культивирования: пункционная биопсия под контролем ультразвука, сбор проб жидкости во время эякуляции и массаж простаты с использованием уретрального катетера или уретральной щетки.
Независимо от избранного метода при оценке полученных результатов следует принимать во внимание число и вид микроорганизмов в среде культивирования, их количественное соотношение, присутствие или отсутствие нейтрофилов и клеток плоского эпителия, содержащих бактерии (Barsanti et al, 1980). В случаях небольшого количества нейтрофилов, обнаружения только грамположительных бактерий, роста сразу многих видов микроорганизмов либо выявления клеток плоского эпителия, содержащих бактерии из мочеиспускательного канала, весьма вероятно, что проба была загрязнена. О наличии инфекции можно говорить, когда культура содержит большое количество микроорганизмов (> 105/мл), особенно если они представлены грамот-рицательными бактериями или видами, растущими в чистых культурах, а также когда обнаруживается большое число нейтрофилов (Ling, 1990).
Культивирование спермы. Культивирование третьей фракции эякулята является эффективным методом идентификации микроорганизмов, особенно если пробы из мочеиспускательного канала и мочевого пузыря получены одновременно и культивируются вместе (Ling, 1990). Вторую фракцию эякулята культивируют при подозрении на орхит в сочетании с эпидидимитом или когда затруднено дальнейшее фракционирование спермы. Жидкость простаты выходит во всех трех фракциях (Johnson et al, 2001). К сожалению, у собаки с болезненным острым простатитом трудно получить эякулят. Кроме того, в эякуляте здоровых особей иногда присутствуют лейкоциты и эритроциты, а при культи
вировании эякулятов в 30% случаев наблюдается рост бактерий (см. табл. 27-4, стр 1046) (Bjurstrom, Linde-Forsberg, 1992). Достоверная интерпретация результатов бактериологического исследования возможна только при условии количественного культивирования мочи, мазков из мочеиспускательного канала и эякулята и сопоставления полученных данных. Диагноз простатит ставится в том случае, когда общее количество бактерий в эякуляте по меньшей мере в 10, а лучше в 100 раз или более превосходит число любого одного вида в мочеиспускательном канале (Ling, 1990). Показателем инфекции является обнаружение большого количества бактерий (>105/мл) и лейкоцитов. Интерпретация затрудняется при наличии сопутствующего бактериального цистита. Повторное культивирование после медикаментозного излечения цистита и уменьшения числа бактерий в мочеиспускательном канале помогает интерпретировать результаты посева эякулята.
Пункционная биопсия. Пункционная биопсия под контролем ультразвука является наилучшим способом получения образцов из простаты собак для культивирования и цитологического исследования. В предстательной железе собак с бактериальным простатитом обычно имеется одна или несколько кист, диаметр которых может достигать 4 см (см. рис. 30-1) (Ling, 1990). Взаимосвязь между возникновением кист и бактериальным простатитом неизвестна, однако они служат источником жидкости предстательной железы для культивирования и цитологического исследования; биопсия под контролем ультразвука позволяет легко получать пробы этого материала. При асептической трансабдоминальной биопсии пораженных участков полостной паренхимы размером более 0,75 см используют стерильную иглу-стилет 22-го калибра для пункции спинного мозга. Под ультразвуковым контролем пункционно-биопсийную иглу длиной от 6 до 15 см проводят в намеченное место железы (рис. 30-2). Пробы берут из кист в правой и/или левой долях простаты. Результаты культивирования получаемой таким образом жидкости точно указывают на наличие или отсутствие инфекции предстательной железы (Ling, 1990; Black et al, 1998). Интерпретировать результаты культивирования не сложно. Любая обнаруженная в культуре бактерия считается патогенной, если гарантировано отсутствие загрязнения пробы в процессе ее получения и работы с ней. Отсутствие бактериального роста свидетельствует об отсутствии инфекции, или о взятии пробы из неинфицированного участка предстательной железы, либо об инфекции организмами, требующими специальных методов культивирования (например, микоплазмами).
Осложнения при пункционной биопсии предстательной железы бывают редко; они включают преходящую гематурию, обычно продолжающуюся не больше 48 часов, и случайное прободение абсцесса простаты. Подозрение на абсцесс основывается,
1092
ПРОСТАТИТ
Рис. 30-2. Пункционная биопсия кисты предстательной железы под контролем ультразвука у 12-летнего родезийского риджбска с увеличенной предстательной железой, острым простатитом и множественными кистами простаты. Аспирация одной из кист проводилась в асептических условиях с использованием грансабдоминального подхода и стерильной иглы 22-го калибра для пункции спинного мозга (показано стрелкой).
главным образом, на результатах УЗИ (см. табл. 27-9, с гр. [948]). Следует также избегать прокола мочеиспускательного канала, проходящего через предстательную железу, чтобы не вызвать перитонит. Столь же редки осложнения, обусловленные распространением инфекции по пул и прохождения пункционной иглы. Во всяком случае, опасение такой инфекции не юлжно служить препятствием для использования пункционной биопсии с целью получения материла из предстательной железы.
Массаж и промывание предстательной железы. Массаж простаты служит альтернативным методом получения ее жидкости и ткани для культивирования и цитологического исследования. Методика массажа и промывания предстательной железы предусматривает получение проб до и после процедуры массажа. После очередного мочеиспускания производят катетеризацию мочевого пузыря в асептических условиях. Его опорожняют, затем промывают 5-10 мл стерильного физиологического раствора, который отсасывают и хранят в качестве «нредмассажной» пробы. После этого мочевой катетер отводят дистально (под контролем ректальной пальпации) в направлении предстательной железы, которую массируют пальцами в течение 1-2 минут (рис. 30-3). Затем через катетер медленно вливают 5-10 мл стерильного физиологического раствора, закрыв пальцем наружное отверстие уретры. По мерс медленного и плавного продвижения катетера через мочеиспускательный канал в мочевой пузырь продолжают аспирацию, а получаемые при этом образцы жидкости маркируют и хранят в качестве «постмассажной» пробы. Пред- и постмассажные пробы используют для бактериального культивирования и цитологических исследований.
Сопоставление результатов изучения пред- и постмассажных проб позволяет клиницисту установить наличие или отсутствие патологии предста-
Рис. 30-3. Схематическая иллюстрация массажа и промывания предстательной железы с целью получения ее жидкости для культивирования и цитологического исследования. Железу массируют пальцами через прямую кишку, причем кончик мочевого катетера располагается в отделе мочеиспускательного канала, проходящего через простату. Через катетер медленно вливают 5-10 мл стерильною физиологического раствора и собирают пробы для анализа.
тельной железы. У здоровых собак постмассажная проба не должна содержать бактериальную флору. Микроскопически в ней могут обнаруживаться отдельные эритроциты и лейкоциты, клетки плоского и переходного эпителия (Barsanti, Finco, 1995а). Культивирование обычно дает отрицательные результаты, либо количество выявляемых микроорганизмов не превышает 100 на миллилитр (в результате загрязнения мочеиспускательного канала во время его катетеризации). Мутная или содержащая кровь постмассажная проба, повышенное содержание в ней воспалительных клеток или бактерий подтверждают диагноз простатит.
Одна из проблем, связанных с интерпретацией результатов массажа предстательной железы, обусловлена трудностью определения увеличения количества бактерий в постмассажных пробах в случаях инфицированной мочи. При подозрении на бактериальный цистит описанную методику следует применять только после устранения инфекции мочевого пузыря с помощью соответствующих антибиотиков. Альтернативно можно за 1 день до массажа ввести антибиотик, который поступает в мочу, но не в жидкость предстательной железы (например, ампициллин) (Barsanti, Finco, 1995а). Получаемые при этом пробы следует сразу же использовать для культивирования, пока присутствующий в моче антибиотик нс убил бактерии, содержащиеся в жидкости простаты.
Методика массажа и промывания предстательной железы не гарантирует получения простатической жидкости в постмассажной пробе. Отсутствие роста бактерий в такой пробе нс исключает хронического простатита. В одном из исследований, культивирование полученных описанным методом
ПРОСТАТИТ
1093
проб жидкости простаты от 9 из 11 собак не сопровождалось ростом бактерий, несмотря на наличие у всех этих животных подтвержденного простатита (Barsanti, Finco, 1984).
Массаж предстательной железы и взятие проб с помощью щетки. Получение проб жидкости предстательной железы с помощью уретральной щетки существенно не отличается от их получения с помощью массажа и промывания железы, если не считать, что вместо уретрального катетера используется щетка в чехле для взятия образцов микробиологического материала (рис. 30-4). Щетку используют, чтобы снизить риск попадания бактерий из мочеиспускательного канала и мочевого пузыря в пробу жидкости простаты. Такой метод особенно полезен при получении проб для цитологического исследования.
Результаты культивирования представляют диагностическую ценность только в тех случаях, когда пробы из уретры и мочевого пузыря получают непосредственно перед взятием пробы жидкости предстательной железы. Уретральную щетку в чехле проводят через мочеиспускательный канал, пока ее кончик нс достигнет каудального полюса простаты. Вслед за этим в течение 1 мин трансректаль-но массируют предстательную железу, после чего внутренний катетер продвигают на 1 см в проходящем через простату отделе мочеиспускательного канала. Щетку продвигают в мочеиспускательный канал примерно на 1 см, затем отводят назад, снова продвигают вперед и повторяют эти движения 5-6 раз. В результате на щетке остается небольшое количество жидкости, которая выделилась в мочеиспускательный канал во время массажа предстательной железы. После сбора пробы щетку и внутренний катетер отводят в наружный катетер и все приспособление извлекают наружу. Материал, находящийся во внутреннем катетере и на щетке мочу и пробы из мочеиспускательного канала используют для культивирования и цитологического исследования. Результаты культивирования жидкости предстательной железы, полученной описанным методом,
точно отражают наличие или отсутствие инфекции в этом органе, поскольку вероятность загрязнения пробы экзогенными бактериями очень мала.
Терапия
Терапия острого и хронического бактериального простатита основана на применении бактерицидных антибиотиков широкого спектра действия. В качестве дополнительных способов лечения были предложены кастрация, введение эстрогенов, ингибиторов 5а-редуктазы и антиандрогенов, а также заместительное пероральное введение цинка.
Терапия антибиотиками. Выбор антибиотиков для лечения острого простатита зависит от результатов бактериального культивирования и чувствительности бактерий. При остром простатите нарушается барьер, создаваемый жидкостью предстательной железы, что позволяет использовать весьма широкий набор антибиотиков. В сомнительных случаях рекомендуется применять не-ионизированные. растворимые в жирах основные антибиотики (Klausner, Osborne, 1983). После введения хлорамфеникола, триметоприм-сульфона-мида, эритромицина, тетрациклина гидрохлорида, доксициклина, миноциклина и фторхинолонов (в частности, энрофлоксацина или ципрофлоксацина) их концентрация в предстательной железе собак достаточна для проявления терапевтического эффекта. Пенициллины, цефалоспорины, окситетрациклин. нитрофрантоин, большинство супьфо-ниламидов и аминогликозидов плохо растворимы в жирах и не так легко проникают в жидкость простаты здоровых собак (Ling et al, 1995). Вероятно, эти антибиотики нс следует использовать для лечения простатита. Способ введения того или иного препарата в начале терапии зависит от тяжести системного заболевания. Помимо антибиотиков необходима соответствующая поддерживающая терапия, чтобы добиться стабилизации состояния животного, восстановления нормального пищевого поведения и потребления воды.
Рис. 30-4. А. Щетка для взятия образцов микробиологического материала из жидкости предстательной железы с целью последующего культивирования и цитологического исследования. Б. Изображение крупным планом щетки, выдвинутой из чехла и вытеснившей тампон катетера (показан стрелкой).
1094 • ПРОСТАТИТ
Антибиотики вводят до тех пор, пока тестирование жидкости предстательной железы на наличие бактерий не перестанет давать положительные результаты. Минимальная продолжительность антибактериальной терапии составляет 3 недели. В случае ее положительного эффекта через 3 недели проводят повторное культивирование проб жидкости простаты, полученных на фоне продолжающегося лечения антибиотиками. В отсутствие эффекта повторное культивирование проводят, не дожидаясь конца трехнедельного периода, особенно если его не проводили перед началом терапии. При этом пробы жидкости получают во время эякуляции или посредством пункционной биопсии под контролем ультразвука. Если это невозможно, для получения проб используют уретральную щетку. Если после 3 недель введения антибиотиков инфекция сохранилась, следует продолжить антибактериальную терапию и раз в три недели проводить культивирование проб жидкости до получения отрицательного ответа. Это может занять от 6 до 9 недель. Когда культивирование жидкости больше не выявляет патогенных микроорганизмов, терапию прекращают и проводят контрольный посев жидкости предстательной железы, чтобы окончательно подтвердить излечение инфекции. Ее рецидив после прекращения терапии указывает на наличие у собаки хронического простатита, и ей назначают соответствующее лечение (см. стр. 1096). При подозрении на абсцесс предстательной железы проводят хирургическое исследование и, в случае необходимости, прибегают к ее дренированию и/или оперативному удалению.
Кастрация. Кастрация является эффективным вспомогательным способом лечения бактериального простатита, поскольку устраняет источник андрогенов, определяющих размер предстательной железы и, тем самым, уменьшает объем ткани, доступной для поражения микроорганизмами. Одновременно кастрация уменьшает содержание бактерицидного цинка в простате, но это, по-видимому, не сказывается на клинической эффективности кастрации (Cowan et al, 1991а). В одном из исследований кастрация, проведенная через 2 недели после инфицирования предстательной железы E.coli, сократила длительность инфекции и снизила количество бактериальных колониеобразующих единиц, приходящихся на 1 миллилитр мочи, по сравнению с ложно оперированными животными (Cowan et al, 1999b). К сожалению, кастрация неприемлема для лечения простатита у ценных собак-производителей, владельцы которых прежде всего озабочены сохранением их репродуктивной способности.
Терапия эстрогенами. Введение экзогенных эстрогенов подавляет секрецию гонадотропинов гипофизом, что, в свою очередь, приводит к снижению продукции тестостерона в клетках Лейдига. Снижение количества тестостерона и 5а-дигид-ротестостерона вызывает уменьшение клеточной
массы предстательной железы и ее размера, хотя не всегда сказывается на состоянии кист в парен-химальной ткани. Эстрогены тоже могут индуцировать рост фибромышечной стромы простаты, метаплазию ее железистого эпителия и секреторный стаз. Более того, они предрасполагают к развитию абсцесса (Lausner, Osborne, 1983; Barsanti, Finco, 1995b). Наконец, эстрогенная терапия вызывает апластическую анемию. По указанным причинам эстрогены не используют для лечения простатита.
Ингибиторы 5а-редуктазы. 5а-редуктаза 2 типа катализирует превращение тестостерона в 5а-дигидротестостерон в наиболее чувствительных к андрогенам тканях, включая ткань простаты. Все ингибиторы 5а-редуктазы (например, азастероиды) ингибируют преобразование тестостерона в 5а-дигидротестостерон и, таким образом, подавляют действие андрогенов в тканях-мишенях. В предстательной железе такое ингибирование приводит к уменьшению ее объема и интенсивности гиперплазии (Gormley et al, 1992). Финастерид (проскар, производства Merck & Со., США) был первым ингибитором 5а-редуктазы, разрешенным Управлением по контролю за качеством пищевых продуктов, лекарственных и косметических средств США (FDA) для лечения доброкачественной гиперплазии простаты у человека. У взрослых кобелей с нормальной репродуктивной функцией финастерид в дозах от 0,1 до 0,5 мг/кг/день значительно уменьшал диаметр и объем предстательной железы, снижал продукцию сперматозоидов и концентрацию дигидротестостерона в сыворотке крови, но при этом не влиял на качество спермы и концентрацию тестостерона в сыворотках (Kamolpatana et al, 1998; Sirinarumitr et al,2001). В дозах 1-5 мг/кг/день фи-настерин вызывал атрофию железистого компонента предстательной железы и уменьшал ее вес и объем у собак с гиперплазией простаты (baroque et al, 1994 и 1995; Cohen et al, 1995). Сокращение объема простаты достигается благодаря уменьшению количества не только железистой ткани, но и стромы. Максимальная степень атрофии отмечается спустя 6-9 недель после начала терапии (Cohen et al, 1995; Iguer-Ouada, Verstegen, 1997). Через 8 недель после ее прекращения размер простаты полностью восстанавливается.
В настоящее время рекомендуется использовать финастерид в форме таблеток по 5 мг, которые вводят собакам весом от 5 до 50 кг раз в день перорально (Kamolpatana et al, 1998). Оптимальная продолжительность лечения не установлена. К числу нежелательных эффектов терапии финастеридом у человека относятся снижение либидо, потенции и объема эякулята (Gormley et al, 1992). У собак финастерид снижает секреторную активность предстательной железы и объем эякулята, но не влияет на вес семенников, их гистоморфо-логическое строение, суточную продукцию спермы, подвижность сперматозоидов или либидо. По данным одного из исследований, забеременели все
ПРОСТАТИТ
1095
суки после вязки с кобелями, которые ежедневно на протяжении 21 недели получали финастерин в дозе 1,0 мг/кг (Iguer-Ouada, Verstegen, 1997). У человека финастерид вызывает аномалии внутриутробного развития плода (Medical Laetter, 1992). Его тератогенное действие у собак не изучали, но сообщалось о рождении нормальных щенков от получавших финастерид кобелей (Iguer-Ouada, Verstegen, 1997). Несмотря на возможную перспективность применения ингибиторов 5а-редуктазы для лечения доброкачественной гиперплазии простаты, роль этих препаратов в качестве вспомогательной терапии хронического простатита требует дальнейшего изучения.
Антиандрогены. Флутамид и гидроксифлута-мид являются антиандрогенами, которые ингибируют поглощение андрогенов и/или их связывание с ядром в тканях-мишенях (Neri, 1989). В дозе 2,5-5,0 мг/кг/день, вводимой перорально, они значительно уменьшали размер простаты в течение 6 недель (Neri, 1989, Cartee et al, 1990). В одном из исследований размер простаты у собак, по данным УЗИ, значительно уменьшился после 10 дней лечения флутамидом (Cartee et al, 1990). Эти препараты не вызывали изменения либидо, общей продукции спермы и не влияли на фертильность, но у 30-60% собак снижали диаметр семенников. Значение этих препаратов как вспомогательных средств для лечения простатита еще предстоит выяснить.
Пероральное введение цинка. Некоторые авторы для лечения заболеваний предстательной железы рекомендуют заместительное пероральное введение цинка, хотя его положительный эффект у собак не доказан. Низкая концентрация цинка может приводить к нарушению или снижению секреции антибактериального фактора простаты у человека, но не у собак. Статистически достоверных различий между концентрациями цинка в жидкости простаты у 36 собак с бактериальным простатитом и у 42 здоровых животных не выявлено (Branam et al, 1984). Кроме того, при пероральном введении цинка его концентрация в жидкости простаты не увеличивалась (Barsanti, Finco, 1983).
Экстракты Serenoa repens. В Европе одним из наиболее часто используемых природных продуктов для лечения мужчин с симптомами затруднения мочеиспускания вследствие гиперплазии предстательной железы является липостерольный экстракт из плодов пальмы сереноа (Serenoa repens) (Lowe, Fagelman, 1999). Считается, что активными ингредиентами этого препарата являются стероиды, сходные по своей химической структуре с холестерином, причем основная роль принадлежит ситостеролам. Механизм действия этого экстракта при гиперплазии простаты не установлен; некоторые авторы считают, что он блокирует цитозольные рецепторы андрогенов и активность 5а-редуктазы и/ или проявляет эстрогенное действие (Barsanti et al, 2000). Данных о положительном или отрицательном эффекте экстрактов S. repens у собак с доброка
чественной гиперплазией предстательной железы нет. При введении 12 собакам с доброкачественной гиперплазией в дозе 100 или 500 мг через каждые 8 часов на протяжении 91 дня экстракты существенно не влияли на вес, объем и гистологическое строение ткани простаты, либидо, характеристики спермы, рентгенологическую картину каудального отдела брюшной полости, эхогенную структуру железы или концентрацию тестостерона в крови (Barsanti et al., 2000). Побочных эффектов также не наблюдалось.
Последствия острого бактериального простатита
К числу потенциальных последствий острого простатита относятся острое воспаление семенников и их придатков, хронический простатит, орхит и эпидидимит. Важное значение для их профилактики имеют своевременная диагностика и соответствующая антибактериальная терапия с обязательной повторной оценкой состояния животных после ее завершения.
ХРОНИЧЕСКИЙ БАКТЕРИАЛЬНЫЙ ПРОСТАТИТ
Клинические признаки
Хронический простатит может развиться как следствие неудачного лечения острого простатита или появиться неожиданно у собаки, у которой ранее не было признаков заболевания простаты. В отсутствие абсцесса хронический простатит обычно протекает без симптомов системного заболевания. Чаще всего показателем хронического простатита служит рецидивирующая инфекция мочевого тракта у здоровых в иных отношениях кобелей. К числу других типичных клинических проявлений этого заболевания относятся выделение капель крови или кровянистой жидкости из препуция или полового члена в отсутствие мочеиспускания, гематурия, неправильная постановка задних ног при ходьбе или ощущение дискомфорта при вставании животного на ноги; все эти проявления, однако, неспецифичны (Ling, 1995). Реже хозяева жалуются на воспаление семенников и их придатков и бесплодие у собак. В то же время почти у 35% собак хронический простатит протекает без каких-либо клинических признаков инфекции предстательной железы, включая лихорадочное состояние или повышение количества лейкоцитов в крови.
Пальпация предстательной железы дает весьма неоднозначные результаты, что отчасти обусловлено разной степенью сопутствующей гиперплазии и фиброза. Пальпация выявляет либо нормальную железу, либо ее неправильную форму, асимметрию и отвердение. Кроме того, при наличии кист или абсцесса иногда пальпируются подвижные мягкие зоны. Обычно при пальпации предстательная железа безболезненна.
1096 • ПРОСТАТИТ
Диагностика
Результаты клинико-лабораторных исследований могут быть разными, но могут оставаться в норме. Ветеринар никогда не должен упускать из виду вероятность хронического простатита при наличии у животного определенных клинических симптомов, обнаруживаемых при физикальном исследовании. Наиболее частыми нарушениями, выявляемыми при ОАК, биохимическом анализе сыворотки и анализе мочи, являются пиурия, гематурия и бакте-риурия. В отсутствие абсцесса ОАК зачастую дает нормальные результаты, а при наличии абсцесса может быть нейтрофильный лейкоцитоз со сдвигом в сторону незрелых клеток; кроме того, результаты ОАК отражают воздействие на организм бактериальных токсинов (Barsanti, Finco, 1984).
Бактериологические исследования с культивированием проб мочи, получаемых посредством надлобковой пункции мочевого пузыря, более чем у половины собак с хроническим простатитом дают положительные результаты (Barsanti, Finco, 1984). В случае отрицательных результатов культивирования мочи возбудителей инфекции идентифицируют с помощью цитологических методов и культивирования жидкости предстательной железы, желательно полученной во время эякуляции или посредством пункционной биопсии под контролем ультразвука (см. стр. 1045).
Рентгенологическая картина предстательной железы обычно остается нормальной несмотря на хроническую инфекцию. Может быть выявлена минерализация простаты, однако это явление носит неспецифический характер. При абсцессе предстательная железа может быть увеличена и иметь неровный контур; при этом происходит сужение проходящего через нее отдела мочеиспускательного канала (Feeney et al, 1987а). Сходные изменения наблюдаются при неоплазии или кистозной гиперплазии предстательной железы. УЗИ при хроническом простатите выявляет гетерогенную или смешанную эхогенную структуру простаты с очаговым или диффузным усилением эхогенности паренхимы, включающей заполненные жидкостью гипоэхогенные или неэхогенные полости (Feeney et al, 1987b; Mattoon, Nyland, 1995). Такие наполненные жидкостью гипоэхогенные или неэхогенные полости могут быть очагами абсцесса или кистами. В случае обызвествления, фиброза или присутствия газа на сонограмме предстательной железы возможно появление теней.
Результаты анализа спермы весьма вариабельны и отчасти зависят от продолжительности и тяжести инфекции, а также от наличия или отсутствия бактериального орхиэпидидимита либо индуцированного иммунными механизмами орхита. У собак с бесплодием, обусловленным хроническим бактериальным простатитом, в сперме, как правило, присутствуют нейтрофилы, макрофаги и фагоцитированные бактерии; одновременно увеличи
вается количество сперматозоидов с первичными или вторичными морфологическими дефектами и нарушенной подвижностью и уменьшается общее содержание сперматозоидов в эякуляте. В тяжелых случаях развивается азооспермия.
Терапия
У собак с хроническим бактериальным простатитом гематопростатический барьер сохраняется, поэтому следует подбирать антибиотики, которые не просто эффективны в отношении данного микроорганизма, но и способны проникать через этот барьер в жидкость предстательной железы. Гематопростатический барьер отчасти обусловлен разными величинами pH крови (pH 7,4), интерстициальных компонентов простаты (pH 7,4) и ее жидкости (pH 6,4), а также специфическими свойствами ацинарного эпителия простаты и особенностями связывания того или иного антибиотика с белками плазмы (Klausner, Osborne, 1983; Branam et al, 1984). Терапевтически эффективные антибиотики (например, норфлоксацин) должны обладать низкой способностью связываться с белками крови и хорошо растворяться в жирах. Двуслойная липидная мембрана клеток эпителия простаты образует структурный и функциональный барьер, через который могут проникать только жирорастворимые антибиотики (например, хлорамфеникол, тримето-прим-сульфонамид и энрофлоксацин). Препараты, слабо растворимые в жирах, такие как ампициллин, цефалоспорины, НС1 окситетрациклин или аминогликозиды, с трудом проходят через эпителий предстательной железы.
Растворимость лекарственных препаратов в жирах зависит от величины их рКа и pH той жидкости организма, в которой находятся эти препараты. Показатель рКа - это величина pH, при которой имеет место равновесие между содержанием ионизированной и неионизированной форм фармацевтического продукта. Ионизированное соединение, в отличие от неионизированного, легко проходит через клеточную оболочку. У большинства собак с инфекционным простатитом жидкость предстательной железы имеет кислую реакцию (Barsanti, Finco, 1995а). В идеале, антибиотики, способные пересекать гематопростатический барьер, должны обладать основными свойствами и высоким рКа (к числу таких препаратов относятся триме-топрим-сульфонамид, эритромицин и клиндамицин). В кислой жидкости предстательной железы щелочные антибиотики с высоким рКа в большей степени подвергаются ионизации, нежели в плазме крови; они захватываются этой жидкостью, вследствие чего их концентрация в жидкости достигает такого же уровня, как в крови, либо превышает его (рис. 30-5) (Dorfman, Barsanti, 1995). Всем или части перечисленных критериев (т.е. высокий рКа, хорошая растворимость в жирах и слабое связывание с белками крови) отвечают следующие анти-
ПРОСТАТИТ
1097
Рис. 30-5. Влияние разницы pH жидкости и интерстиция предстательной железы на ионный захват антибиотиков. Щелочные антибиотики скапливаются в ацинарных структурах простаты (А), а кислые не проникают в них (Б). Из: Barsanti JA., Finco DR. In: Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Medicine, 4th ed. Philadelphia, WB Saunders, 1995 p 1662.
биотики: хлорамфеникол, триметоприм-сульфона-мид, эритромицин, клиндамицин и энрофлоксацин (табл. 30-2) (Dorfman et al, 1995). Выбор антибиотиков для лечения бактериального простатита у собак определяется также результатами бактериального исследования и оценки чувствительности обнаруженных микроорганизмов к тому или иному пре
парату. В качестве общего правила можно принять, что до получения результатов оценки чувствительности инфекцию грамположительными бактериями следует лечить триметоприм-сульфонамидом, хлорамфениколом, тетрациклином НС1, циндамици-ном или эритромицином (Barsanti, 1990). Если же инфекция вызвана грамотрицательным микроорганизмом, используют триметоприм-сульфонамид, хлорамфеникол, тетрациклин НС1, энрофлоксацин и ципрофлоксацин.
Лечение хронического простатита антибиотиками продолжается не менее 6 недель. Если при первичном обследовании животного культивирование проб мочи дает положительные результаты, его следует повторить через 7-10 дней после начала антибактериальной терапии с целью оценки ее эффективности и подтверждения отсутствия микроорганизмов. Еще через 6 недель снова делают посевы мочи и жидкости простаты на фоне продолжающейся терапии. При сохранении бактериального роста назначают повторный курс терапии соответствующим антибиотиком продолжительностью 6 недель, после которого повторяют бактериологическое исследование. Если оно опять дает положительный результат, лечение продлевают еще на 4-6 недель. Повторное культивирование спустя 1 неделю и 1 -2 месяца после завершения терапии должно подтвердить ее благоприятный исход. В случае рецидива инфекции в эти сроки цикл антибактериальной терапии полностью повторяют.
При сохранении у собаки устойчивой инфекции предстательной железы, несмотря на повторные курсы антибиотиков, их приходится вводить до конца жизни животного, чтобы предотвратить проникновение возбудителя в мочевые пути. Выбирая препарат для проведения долгосрочной терапии рецидивирующего инфекционного простатита, следу
ТАБЛИЦА 30-2. ФАРМАКОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ НЕКОТОРЫХ АНТИБИОТИКОВ
Антибиотик Кислый или основный Растворимость в липидах рк Диффузия в простату
Эритромицин основный да 8,8 хорошая
Олеандомицин основный да 8,5 хорошая
Полимиксин В основный нет 8,0-9,0 слабая
Канамицин основный нет 7,2 слабая
Гентамицин основный нет 7,9-8,2 слабая
Триметоприм основный да 7,3 хорошая
Клиндамицин * основный да 7,6 хорошая
Линкомицин основный частично 7,6 слабая
Норфлоксацин основный да высокий хорошая
Налидиксовая кислота * кислый да 6,7 слабая
Энрофлоксацин кислый да цвиттер-ион хорошая
Ципрофлоксацин кислый да цвиттер-ион хорошая
Пенициллин G кислый нет 2,7 слабая
Ампициллин кислый нет 2,5 слабая
Цефалотин кислый нет 2,5 слабая
Сульфисоксазол кислый да НИЗКИЙ слабая
Сульфаметоксазол кислый да НИЗКИЙ слабая
Окситетрациклин амфотерный нет 3,5; 7,6; 9,2 слабая
Тетрациклин НС1 амфотерный да 3,5; 7,7; 9,7 хорошая
Хлорамфеникол* не применяется Да - хорошая
По: Barsanty JA, Finco DR: Vet Clin North Am, 9:679, 1979.
*) Антибиотики с высокой способностью к связыванию с белками крови
1098
ПРОСТАТИТ
ет принимать во внимание возможность возникновения нежелательных явлений (например, нитчатого кератоконъюнктивита при хроническом введении триметоприм-сульфонамида). Для длительного лечения хронического простатита рекомендуется использовать хлорамфеникол, тетрациклин НС1, триметоприм-сульфонамид, энрофлоксацин и норфлоксацин (Barsanti, 1990; Ling, 1995).
В качестве дополнительного способа устранения хронической инфекции предстательной железы возможна кастрация. При экспериментальном хроническом простатите собак кастрация через 2 недели после индукции инфекции ускоряла ее спонтанное прекращение (Cowan et al, 1991b). Об аналогичных результатах кастрации у животных с естественно развившимся хроническим простатитом данных нет.
Последствия хронического бактериального простатита
К числу возможных последствий хронического бактериального простатита относятся орхит, эпидидимит и бесплодие. Последнее развивается в результате гипертермии, иммунного разрушения сперматогенных клеток с последующим орхитом или гибели сперматозоидов под воздействием бактериальных токсинов.
ЛИТЕРАТУРА
Barsanti JA: Male genital infections. In Greene CE (ed): Infectious Diseases of the Dog and Cat, 2nd ed. Philadelphia, WB Saunders, 1990, p 171.
Barsanti JA, Finco DR: Treatment of bacterial prostatitis. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders, 1983, p1101.
Barsanti JA, Finco DR: Evaluation of techniques for diagnosis of canine prostatic diseases. J Am Vet Med Assoc 185:198, 1984.
Barsanti JA, Finco DR: Prostatic diseases. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine, 4th ed. Philadelphia, WB Saunders, 1995a, p1662.
Barsanti JA, Finco D: Medical management of canine prostatic hyperplasia. In Bonagura J, Kirk R (eds): Current Veterinary Therapy XII. Philadelphia, WB Saunders, 1995b, p 1033.
Barsanti JA, et al: Evaluation of diagnostic techniques for canine prostatic diseases. J Am Vet Med Assoc 177:160, 1980.
Barsanti JA, et al: Effect of induced prostatic infection on semen quality in the dog. Am J Vet Res 47:709, 1986.
Barsanti JA, et al: Effects of an extract of Serenoa repens on dogs with hyperplasia of the prostate gland. Am J Vet Res 61:880, 2000.
Bell FW, et al: Evaluation of serum and seminal plasma markers in the diagnosis of canine prostatic disorders. J Vet Intern Med 9:149, 1995.
Bjurstrom L, Linde-Forsberg C: Long-term study of aerobic bacteria of the genital tract in study dogs. Am J Vet Res 53:670, 1992.
Black GM, et al: Prevalence of prostatic cysts in adult, large- breed dogs. J Am Anim Hosp Assoc 34:177, 1998.
Branam JE, et al: Selected physical and chemical characteristics of prostatic fluid collected by ejaculation from healthy dogs and from dogs with bacterial prostatitis. Am J Vet Res 45:825, 1984.
Cartee RE, et al: Evaluation of drug-induced prostatic involution in dogs by transabdominal В-mode ultrasonography. Am J Vet Res 51:1773, 1990.
Cochran RC, et al: Serum levels of follicle-stimulating hormone, luteinizing hormone, prolactin, testosterone, 5a-dihydrotestosterone, 5a-androstane-3oc, 17p-diol, and 17p-estradiol from male Beagles with spontaneously induced benign prostatic hyperplasia. Invest Urol 19:142, 1981.
Cohen S, et al: Comparison of the effects of new specific azasteroid inhibitors of steroid 5a-reductase on canine hyperplastic prostate: Suppression of prostatic dihydrotestosterone correlated with prostate regression. Prostate 26:55, 1995.
Cowan LA, et al: Effects of bacterial infection and castration on prostatic tissue zinc concentration in dogs. Am J Vet Res 52:1262, 1991a.
Cowan LA, et al: Effects of castration on chronic bacterial prostatitis in dogs. J Am Vet Med Assoc 199:346, 1991b.
Dorfman M, Barsanti J: CVT Update: Treatment of canine bacterial prostatitis. In Bonagura J, Kirk R (eds): Current Veterinary Therapy XII. Philadelphia, WB Saunders, 1995, p 1029.
Dorfman M et al: Enrofloxacin concentrations in dogs with normal prostates and dogs with chronic bacterial prostatitis. Am J Vet Res 56:386, 1995.
Feeney DA, et al: Canine prostatic disease: Comparison of radiographic appearance with morphologic and microbiologic findings: 30 cases (1981-1985). J Am Vet Med Assoc 190:1018, 1987a.
Feeney DA, et al: Canine prostatic disease: Comparison of ultrasonographic appearance with morphologic and microbiologic findings: 30 cases (1981 -1985). J Am Vet Med Assoc 190:1027, 1987b.
Gormley GJ, et al: The effect of finasteride in men with benign prostatic hyperplasia. N Engl J Med 327:1185, 1992.
Iguer-Ouada M, Verstegen J: Effect of finasteride (Proscar MSD) on seminal composition, prostate function and fertility in male dogs. J Reprod Fertil Suppl 51:139, 1997.
Johnston SD, Root Kustritz MV, Olson PNS: Disorders of the canine prostate. In, Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline Theriogenology Philadelphia, WB Saunders, 2001, p 337.
Kamolpatana K, et al: Effect of finasteride on serum concentrations of dihydrotestosterone and testosterone in three clinically normal sexually intact adult male dogs. Am J Vet Res 59:762, 1998.
Klausner JS, Qsborne CA: Management of canine bacterial prostatitis. J Am Vet Med Assoc 182:292, 1983.
Krawiec DR, Heflin D: Study of prostatic disease in dogs: 177 cases (1981-1986). J Am Vet Med Assoc 200:1119, 1992.
Laroque P, et al: Effects of chronic oral administration of a selective 5a- reductase inhibitor, finasteride, on the dog prostate. Prostate 24:93, 1994.
Laroque P, et al: Quantitative evaluation of glandular and stromal compartments in hyperplastic dog prostates: Effect of 5a-reductase inhibitors. Prostate 27:121, 1995.
Ling GV: Diagnosis and medical management of prostatic infections in dogs. Proceedings of the Society for Theriogenology, Toronto, Canada, 1990, p 254.
Ling GV: Disorders of the prostate. In Ling GV (ed): Lower Urinary Tract Diseases of Dogs and Cats: Diagnosis, Medical Management, Prognosis. St Louis, Mosby, 1995, p 129.
Ling GV, et al: Canine prostatic fluid: Techniques of collection, quantitative bacterial culture, and interpretation of results. Am J Vet Res 183:201, 1983.
Ling GV, et al: Comparison of two sample collection methods for quantitative bacteriologic culture of canine prostatic fluid. J Am Vet Med Assoc 196:1479, 1990.
Lowe FC, Fagelman E: Phytotherapy in the treatment of benign prostatic hyperplasia: An update. Urology 53:671, 1999.
Mattoon JS, Nyland TG: Ultrasonography of the genital system. In Nyland TG, Mattoon JS (eds): Veterinary Diagnostic Ultrasound. Philadelphia, WB Saunders, 1995, p 141.
Medical Letter: Finasteride for benign prostatic hypertrophy. Med Lett Drugs Ther 34:83, 1992.
Neri R: Pharmacology and pharmacokinetics of flutamide. Urology 34(sup-pl):19, 1989.
Rhodes L: The role of dihydrotestosterone in prostate physiology. In Proceedings of the Annual Meeting of the Society of Theriogenology, Kansas City, Mo, 1996, p 288.
Sirinarumitr K, et al: Effects of finasteride on size of the prostate gland and semen quality in dogs with benign prostatic hypertrophy. J Am Vet Med Assoc 218:1275, 2001.
Wallace MS: The diagnosis of infertility and subfertility secondary to prostatic disease in the dog. Proceedings of the Society for Theriogenology, San Diego, 1991, p 229.
Winter M, Liehr J: Possible mechanism of induction of benign prostatic hyperplasia by estradiol and dihydrotestosterone in dogs. Toxicol Appl Pharmacol 136:211, 1996.
КЛАССИФИКАЦИЯ................1099
ДИАГНОСТИКА..................1100
Первичное обследование.......1100
Бесплодие и пониженное либидо .... 1002 Приобретенное бесплодие
и нормальное либидо........1104
Глава 31
БЕСПЛОДИЕ
Врожденное бесплодие
и нормальное либидо........1115
ЛЕЧЕНИЕ БЕСПЛОДИЯ............1115
Идиопатическая тестикулярная дегенерация.................1115
Лимфоцитарный орхит..........1116
Ретроградная эякуляция.........1116
Дисфункция клеток Лейдига и утрата либидо................1116
Гипогонадотропный гипогонадизм... 1116
Список сокращений
АКТГ - адренокортикотропный гормон ГнРГ - гонадотропин рилизинг-гормон
ЛГ - лютеинизирующий гормон
ОАК - общий клинический анализ крови ТТГ - тиреотропный гормон, тиреотропин
ФСГ - фолликулостимулирующий гормон
Диагностика и лечение бесплодия у кобелей является, возможно, самой сложной и неблагодарной задачей в области репродукции собак. К сожалению, справедливо замечание, что «собаку с азооспермией исправит только могила». Тем не менее, коррекция некоторых расстройств может вернуть фертильность. Углубленный, системный диагностический подход к бесплодным собакам дает наибольшие шансы разрешить проблему. Важнейшее значение для диагностики бесплодия имеет исследование спермы. При этом следует помнить, что свойства эякулята могут меняться день ото дня, и окончательный диагноз ставится после выявления устойчивого характера нарушения. Лечение следует начинать только после установления окончательного диагноза, который позволяет ветеринару разработать рациональную схему терапии и прогнозировать ее исход. Бессистемное назначение андрогенов, других гормонов и лекарственных средств с целью устранения бесплодия обычно не дает желаемого результата, потенциально опасно и лишь еще больше запутывает ситуацию как в глазах владельца животного, так и для самого ветеринара.
КЛАССИФИКАЦИЯ
Использование анамнестических данных для классификации форм и причин бесплодия позволяет ограничить число патологических расстройств, требующих дифференциальной диагностики, и облегчает выбор процедур для первоначального обследования животных. Классификация, основанная на оценке предыдущих вязок кобеля и текущего состояния либидо, не вызывает затруднений. Беспло
дие может быть врожденным или приобретенным, а либидо - нормальным или пониженным. Нам чаще всего приходилось сталкиваться с приобретенным бесплодием племенных кобелей, у которых это расстройство отсутствовало в анамнезе. Либидо в большинстве случаев оставалось нормальным, но затем постепенно уменьшалось. Приобретенное бесплодие может быть обусловлено самыми разными причинами (табл. 31-1). Когда кобель, несмотря на многочисленные попытки, не дает потомства, говорят о врожденном бесплодии, пока не доказано обратное. Однако у некоторых таких животных бесплодие может быть приобретенным, если вызвавшая его причина появилась еще до начала их использования в качестве производителей. Помимо расстройств, приведших к приобретенному бесплодию, ветеринар должен попытаться выявить врожденные дефекты, которых не должно быть у собаки с нормальной репродуктивной функцией в прошлом (табл. 31-1).
Нормальное либидо у бесплодного кобеля предполагает нарушение функции семенников, их придатков или предстательной железы на фоне нормального функционирования клеток Лейдига и нормальной концентрации тестостерона в плазме крови. Напротив, уменьшение полового влечения у бесплодного кобеля может быть результатом разрушения клеток Лейдига в семенниках. Не следует также упускать из виду возможность эндокринопа-тий, гормон-секретирующей опухоли семенников и воздействия введенных экзогенных гормонов, а также эмоциональных расстройств, обусловленных травмой, или болевых ощущений во время полового возбуждения.
1100 • БЕСПЛОДИЕ
ТАБЛИЦА 31-1. КЛАССИФИКАЦИЯ БЕСПЛОДИЯ КОБЕЛЕЙ НА ОСНОВАНИИ АНАМНЕСТИЧЕСКИХ ДАННЫХ О НАЛИЧИИ ПОТОМСТВА
Врожденное бесплодие Приобретенное бесплодие
Гормональное Гормональное
Г ипопитуитаризм Г ипопитуитаризм
Гипотиреоз Гипотиреоз
Хромосомная аберрация Г иперкортицизм
Связанное с дефектами Метаболическое
развития Уремия
Крипторхизм Гепатопатия
Аномалии развития пе- Опухоль
ниса, препуция или кости Сдавливание
пениса Гормональная секреция
Тестикулярная гипоплазия Стресс
и аплазия Инфекция
Аплазия семенных про- Лихорадочное состояние
ТОКОВ Непроходимость протоков
Нарушение подвижности Индуцированный иммунной
сперматозоидов системой орхит
Синдром Картагенера Медикаментозная и гормо-
Ретроградная эякуляция нальная терапия Ретроградная эякуляция Идиопатическая тестикулярная дегенерация Слишком частое участие в вязках? Эмоциональные факторы?
ДИАГНОСТИКА
Первичное обследование
Анамнез. Подходы к диагностике потенциального бесплодия у собак и дифференциальная диагностика должны основываться на результатах анамнестического анализа и физикального исследования. Тщательный анамнез имеет исключительно важное значение при оценке бесплодного кобеля. Он позволяет, в частности, выяснить состояние репродуктивной функции животного в прошлом и охарактеризовать либидо в настоящем. Дополнительно выясняются условия жизни кобеля, его использование в качестве производителя, предыдущие заболевания и травмы (табл. 31-2). Следует принимать во внимание возраст животного, частоту вязок, практику племенной работы в питомнике, наличие или отсутствие нарушений репродуктивной функции в прошлом, применение гормональных препаратов и других лекарственных средств раньше и в настоящее время. Установлена роль некоторых фармацевтических продуктов в развитии бесплодия у собак (табл. 31-3). В принципе, любая медикаментозная терапия может привести к бесплодию. Генетические факторы также могут вносить свой вклад в развитие бесплодия, и их следует иметь ввиду, особенно в случаях инбридинга, бесплодия у родственных
ТАБЛИЦА 31-3. ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ЭКЗОГЕННЫЕ ГОРМОНЫ ВЛИЯЮЩИЕ НА СПОСОБНОСТЬ К ВОСПРОИЗВОДСТВУ У ЧЕЛОВЕКА И, ВОЗМОЖНО, У СОБАК
Химиотерапевтические Гормоны
препараты Анаболические стероиды
Бусульфан Метилтестостерон *
Хлорамбуцил Эфиры тестостерона *
Цисплатин Эстрогены
Циклофосфамид 17р-эстрадиол *
Винбластин Диэтилстильбестрол *
Метотрексат KABI 1774 *
Винкристин Прогестогены
Медроксипрогестерона
Прочие лекарственные ацетат *
средства Мегестрола ацетат *
Амфотерицин В * Делмадинона ацетат *
Аллоксан Глюкокортикоиды *
Циметидин * Тамоксифена цитрат *
Кломипрамин Госсипол *
Кетоконазол * Антагонисты ГнРГ *
Спиронолактон Сульфасалазин Агонисты ГнРГ *
*) Эффект документирован у собак
данному кобелю особей или выявления ряда эндокринных нарушений, например, лимфоцитарного тиреоидита (Olson et al, 1992). Наконец, необходим тщательный анализ организации вязок и плодовитости сук, с которыми вязали кобеля. Во многих случаях проблема обусловлена неправильным выбором сроков вязки, техническими ошибками при проведении искусственного осеменения или репродуктивными проблемами у суки, а не у кобеля.
Физикальное исследование. Важнейшее значение для оценки бесплодия имеет полное физикальное исследование. Либидо и сперматогенез изменяются при нарушениях не только в репродуктивном тракте, но и в других органах. Если все другие органы и системы функционируют нормально, то следует тщательно обследовать половые пути (см. стр. 1032). При осмотре бесплодных собак необходимо определить форму, размер и локализацию кости пениса относительно конца головки полового члена, состояние препуция, степень выдвижения из него полового члена, размер, форму и консистенцию семенников, размер и форму их придатков и семенного канатика, размер, симметричность и плотность предстательной железы. Все выявляемые аномалии подлежат соответствующей оценке.
Заключение. Тщательная оценка общего состояния кобеля имеет важнейшее значение для характеристики бесплодия. Иногда анамнестический анализ или физикальное исследование выявляют расстройства, которые, на первый взгляд, не связаны с бесплодием, но при более внимательном изучении оказываются его причинами. После оценки результатов анамнестического анализа и нарушений, выявленных в ходе физикального исследования, ко-
БЕСПЛОДИЕ
1101
ТАБЛИЦА 31-2. АНКЕТА ДЛЯ ВЛАДЕЛЬЦЕВ БЕСПЛОДНЫХ КОБЕЛЕЙ
А. Возраст Порода_____________________________________________________________________________________________
Б. Общий клинический анамнез (без учета нарушений репродуктивной функции)
1. Текущая вакцинация?_____________________________________________________________________________________
2. Серьезные заболевания в предшествовавшем периоде, потребовавшие госпитализации:
Да Нет Если «да», предоставьте, пожалуйста, краткое описание:
3. Травма в предшествовавшем периоде:
Да Нет Если «да», предоставьте, пожалуйста, краткое описание:
4. Имеются ли у Вашей собаки:
а. эпизоды рвоты? Да Нет
б. диарея? Да Нет
в. избыточное потребление воды? Да Нет
г. избыточное мочеиспускание? Да Нет
д. нормальные игривость и готовность выполнять физические упражнения? Да Нет
е. нормальные вес и рост? Да Нет
ж. нарушение состояния шерстяного покрова? Да Нет
з. любые другие нарушения (если «да», предоставьте краткое описание)? Да Нет
5. Оценивалась ли когда-нибудь у вашей собаки функция щитовидной железы? Да Нет
6. Получала ли Ваша собака тиреоидные гормоны?
а. в прошлом? Нет Да Доза
б. в настоящее время? Нет Да Доза
7. Получает ли Ваша собака какие-либо лекарственные препараты?
Нет Да Название и доза_________________________________________________________________________________
8. Проходила ли Ваша собака в последнее время дрессировку на послушание или нападение?
Нет Да Когда___________________________________________________________________________________________
9. Участвует ли Ваша собака в выставках?
Нет Да
Если «да», укажите, пожалуйста, частоту, способ транспортировки, последнюю выставку
10. Пожалуйста, перечислите все корма и пищевые добавки, которые Ваша собака получает в настоящее время:
В. Репродуктивный анамнез
1. Подтверждена ли репродуктивная способность Вашей собаки? Нет Да Если «да», укажите, пожалуйста, дату появления последнего приплода
2. Имеется ли у Вашей собаки выраженное половое влечение в присутствии суки в эструсе?
Да Нет Если «нет», имелось ли оно в прошлом?
Да Нет Если «да», то когда ? __________________________________________________________________________
3. Способна ли Ваша собака:
а. к эрекции Да Нет
б. к интромиссии Да Нет
в. к замку Да Нет
Если «да», то укажите, пожалуйста, его продолжительность
4. Имеется ли у Вашей собаки эякуляция? Да Нет
Если «да», то до интромиссии или после нее?____________________________________________________________
5. Наблюдали ли Вы выделение спермы? Да Нет
Если «да», то какого цвета?____________________________________________________________________________
6. Как часто используется Ваша собака для вязки?__________________________________________________________
7. Когда Ваша собака в последний раз использовалась для вязки?
8. Как Вы определяете срок вязки?_________________________________________________________________________
9. Сколько раз Вы допускаете вязку своей собаки?____________________________________________________________
10. Проводилась ли проба на наличие Brucella у Вашей собаки?
Да Нет Если «да», то укажите дату последней пробы
1102 • БЕСПЛОДИЕ
11. Проводилось ли исследование спермы Вашей собаки?
Да Нет Если «да», то укажите дату самого последнего исследования
Опишите результаты исследования____________________________________________________________________________
12. Имелись ли когда-нибудь у Вашей собак выделения из препуция?
Да Нет Если «да», то дайте краткое описание, укажите дату и способ лечения
13. Имелись ли когда-нибудь у вашей собаки: Нет
а. набухание мошонки? Да
б. болезненность мошонки? Да Нет
в. покраснение мошонки? Да Нет
г. дерматит мошонки? Да Нет
14. Замечали ли Вы когда-нибудь изменение размера или консистенции семенников у вашей собаки?
Да Нет Если «да», предоставьте краткое описание:
Г. Данные о питомнике
Имеются ли у Ваших собак обоего пола нарушения репродуктивной функции?
Да Нет Если «да», предоставьте краткое описание
Д. Родословная
Имеются ли нарушения репродуктивной функции у родственников вашей собаки (особи обоего пола)?
Да Нет Если «да», предоставьте краткое описание:
беля с подозрением на бесплодие относят к одной из следующих четырех категорий: нормальные особи, особи с пониженным либидо, с приобретенным бесплодием и нормальным либидо, с врожденным бесплодием и нормальным либидо.
Бесплодие и пониженное либидо
Либидо может быть нарушено в разной степени - от полного отсутствия полового влечения и неспособности к вязке до медленного проявления половой активности или его задержки, а также прогрессирующей утраты полового влечения, способности или желания делать садку и достижения коитуса (Keenan, 1998). Пониженное либидо предполагает уменьшение концентрации тестостерона в плазме крови или наличие приобретенного психического расстройства, которое и служит причиной отсутствия интереса к вязке (рис. 31-1). На либидо отрицательно влияют такие факторы, как строгое принуждение к садке неподготовленного к этому кобеля, вязка с агрессивно настроенной или доминирующей сукой, перемещение кобеля в непривычные для него условия либо непоследовательные действия владельца.
Неблагоприятное влияние этих факторов особенно сильно сказывается, если кобель испытал их действие в относительно раннем возрасте. Вязка в неподходящие сроки эстрального цикла у суки,
чересчур частое их повторение или болезненные ортопедические явления также отрицательно сказываются на половом поведении собак. Некоторые животные испытывают повышенное влечение к определенному половому партнеру, что также может служить причиной неадекватного либидо в присутствии другой особи. Иногда оно остается пониженным из-за нарушения обоняния, в результате чего снижается способность кобеля воспринимать феромоны (Freshman, 2001).
Концентрация тестостерона в плазме крови уменьшается вследствие разрушения клеток Лейдига в семенниках или подавления функции системы гипофиз-клетки Лейдига. Последнее чаще всего имеет место при гипотиреозе, гиперкортицизме, введении экзогенных гормональных препаратов (особенно глюкокортикоидов) или наличии опухолей семенников, продуцирующих эстроген. Для диагностики этих явлений проводят оценку функции щитовидной железы (по результатам определения концентраций Т4, свободного тироксина и ТТГ в сыворотке крови), надпочечников (с помощью провокационной пробы с АКТГ) и клеток Лейдига (в провокационной пробе с ГнРГ), а также УЗИ семенников и их пункционную биопсию с целью получения материала для цитологического исследования (в случае опухоли семенников).
Большинство нарушений, служащих причиной приобретенного бесплодия при нормальном либи-
Пониженное либидо
Рис. 31-1. Диагностика пониженного либидо.
БЕСПЛОДИЕ • 1103
1104 • БЕСПЛОДИЕ
до (см. ниже), могут также приводить к разрушению клеток Лейдига и утрате либидо. В типичном случае сначала развивается бесплодие, а затем начинает пропадать половое влечение. При этом семенники могут сохранять нормальные размеры и консистенцию, или размягчаться при сохранении нормальных размеров, или уменьшаться в размерах и пальпироваться как мягкие образования. К сожалению, уменьшение размеров или размягчение семенников наблюдается и при нарушении функции системы гипофиз-клетки Лейдига. Поэтому обнаружение этих изменений не обязательно означает наличие первичной дисфункции семенников у кобелей с пониженным либидо.
У кобелей с пониженным либидо получить эякулят нелегко, но пытаться следует. Если эякулят удалось получить, проводят его тщательное цитологическое исследование и микробиологическое культивирование (см. стр. 1034 и 1045). Результаты этих тестов могут дать ключ к пониманию причин бесплодия. Если же они мало информативны или не удалось получить эякулят, то проводят цитологическое исследование аспирата либо гистологическое исследование биоптата семенников с целью оценки состояния семенных канальцев и клеток Лейдига (см. стр. 1054 и 1055). Прежде чем проводить тестикулярную биопсию, следует исключить возможные вторичные причины пониженного либидо.
Разрушение клеток Лейдига сопровождается увеличением концентрации лютеинизирующего гормона (ЛГ) в плазме крови, поэтому его определение можно использовать для диагностики при подозрении на наличие первичного нарушения функции семенников (см. стр. 1050).
Приобретенное бесплодие и нормальное либидо
Эта форма бесплодия чаще всего встречается у кобелей. Сохранение нормального полового влечения указывает на нормальную функцию системы гипофиз-клетки Лейдига и адекватную концентрацию тестостерона в плазме крови. Поскольку эта форма бесплодия требует дифференциальной диагностики от большого числа других расстройств (см. табл. 31-4), рекомендуется разработать схему оценки, начиная с использования относительно простых и недорогих диагностических процедур до более сложных и трудоемких методов. При анализе анамнестических данных следует сконцентрировать внимание на следующих трех аспектах: (1) тщательном изучении практики племенной работы, включая, прежде всего, критерии, по которым владелец судит о готовности суки к вязке; число вязок на протяжении эструса; был ли «замок» во время вязки; плодовитость суки; частоту использования кобеля и его сексуальный опыт; (2) внимательном анализе медикаментозной терапии кобеля в прошлом и настоящем и (3) подробной характеристике прежних и текущих заболеваний, травм и стрессор-
ных воздействий. Стресс, при всей расплывчатости этого понятия, отрицательно сказывается на репродуктивной функции (Rivier, Rivest, 1991). Тем не менее, любое его проявление, от серьезного заболевания до поведения животного, не укладывающегося в привычные рамки, заслуживает пристального внимания. Так, например, чрезмерная подвижность или активность в стрессовых ситуациях (например, во время дрессировки), могут приводить к временному бесплодию. Выявленные в ходе анамнестического анализа факторы, отрицательно влияющие на репродуктивную функцию, следует, по возможности, устранить.
Независимо от выявленных в анамнезе фактов для исключения других возможных причин бесплодия необходимо провести тщательное физикальное исследование животного, пробу на наличие инфекции Brucella canis и анализ спермы. Во время физикального исследования ветеринар должен обращать особое внимание на размер, симметричность и консистенцию семенников. Выявляемые путем пальпации аномалии семенников могут дать ключ к определению причин бесплодия (см. раздел «Физикальное исследование» на стр. 1032). Пальпация предстательной железы через прямую кишку позволяет обнаружить изменения, обусловленные хроническим простатитом. Всех собак с проблемами бесплодия необходимо проверять на инфекцию В. canis с помощью экспресс-метода агглютинации в пробирке или на стекле (см. стр. 1020).
Исследование спермы имеет первостепенное значение для диагностической оценки кобелей с приобретенным бесплодием и нормальным либидо. (Вопросы получения и исследования эякулятов подробно обсуждаются на стр. 1034). Обнаруженные при анализе спермы аномалии помогают установить причину бесплодия и указывают направление дальнейшего диагностического обследования. Ниже рассматриваются методы диагностики не-
ТАБЛИЦА 31-4. ВОЗМОЖНЫЕ ПРИЧИНЫ ПРИОБРЕТЕННОГО БЕСПЛОДИЯ ПРИ НОРМАЛЬНОМ ЛИБИДО
Частые причины Редкие причины
Здоровый кобель Слишком частые вязки
Неправильное использова- Травма семенников
ние в качестве производи- Повышение температуры
теля семенников
Нарушения техники искус- Опухоль семенников
ственного осеменения Ретроградная эякуляция
Лекарственные средства, фак- Двусторонняя непроходи-
торы окружающей среды мость протоков
Воспаление мошонки Хронический тяжелый
Системное заболевание (в про- стресс
шлом или настоящем) Синдром Картагенера
Инфекционный орхит Brucella canis
Лимфоцитарный орхит Гемоспермия
Идиопатическая тестикуляр- Астенозооспермия
ная дегенерация
Старческий возраст
БЕСПЛОДИЕ • 1105
которых наиболее распространенных нарушений свойств спермы, выявляемых при первичном исследовании эякулятов. Более подробные сведения об этих диагностических тестах приведены в гл. 27.
Азооспермия (рис. 31-2)
Термином азооспермия обозначают полное отсутствие сперматозоидов в эякуляте. Обычно при азооспермии сохраняется нормальная семенная жидкость. Нормальная концентрация щелочной фосфатазы в сперме подтверждает присутствие в эякуляте жидкости из придатков семенников (см. стр. 1045). Во всех случаях необходимо проводить анализ семенной жидкости, поскольку его результаты проливают свет на возможные причины бесплодия (см. ниже). Как показывает наш опыт, азооспермия обычно является приобретенным расстройством, которое возникает как следствие дисфункции половых желез, чаще всего в форме идиопатической тестикулярной дегенерации (табл. 31-5).
Наличие азооспермии необходимо обязательно подтвердить анализом нескольких эякулятов, прежде чем переходить к более углубленному исследованию ее причин и тем более, прежде чем делать окончательное заключение о стерильности кобеля. При неполной эякуляции возможна «кажущаяся» олигоспермия, а иногда и азооспермия. Такая ситуация особенно часто имеет место у молодых, робких кобелей, попавших в непривычные условия, или у испытывающих болезненные ощущения при сборе эякулята (например, при попытке вывести луковицу из препуция). Неполную эякуляцию подтверждают анализом нескольких эякулятов, уделяя повышенное внимание правильной технике их получения.
Азооспермия может быть вызвана медицинскими препаратами, воздействием факторов окружающей среды (включая тяжелые металлы, соединения ртути и другие токсичные соединения), системными заболеваниями, двусторонней непроходимостью семявыносящих протоков и/или придатков семенников, ретроградной эякуляцией, тестикулярной дисфункцией и генетическими дефектами (Olson, 1991). Во всех случаях необходимо выяснить характер медикаментозной терапии в прошлом и настоящем (см. табл. 31-3), возможные контакты собаки с бытовыми или промышленными химикалиями и токсинами. Подозрение на генетическую природу азооспермии возникает в случаях инбридинга, при наличии бесплодия у родственных собак или выявлении эндокринных расстройств, таких как лимфоцитарный тиреоидит (Olson et al, 1992). Для выявления системных заболеваний, оказывающих неблагоприятное воздействие на сперматогенез, проводят следующие тесты: ОАК, биохимический анализ сыворотки и определение концентраций общего Т4, свободного Т4 (модифицированным методом равновесного диализа) и эндогенного ТТГ, а также анализ мочи.
Идиопатическая тестикулярная дегенерация Лимфоцитарный орхит Brucella canis Непроходимость протоков Двустороння тестикулярная неоплазия
Врожденный дефект
ТАБЛИЦА 31-5. ВОЗМОЖНЫЕ ПРИЧИНЫ АЗООСПЕРМИИ
Азооспермия может быть Обычно устойчивая
преходящей______________азооспермия___________
Лекарственные средства, гор-
моны * * (см. табл. 31-3) Факторы окружающей среды Системное заболевание (в прошлом или в настоящем)
Травма или повышенная температура семенников
Инфекционный орхит и простатит
Ретроградная эякуляция Гипотиреоз * Гипопитуитарзм * Гиперкортицизм * Эстроген-секретирующая опу-
холь клеток Сертоли *___
*) Эти расстройства часто ассоциируются с пониженным либидо
Непроходимость системы протоков может быть вызвана воспалением, новообразованиями, сегментной аплазией, гранулемой сперматозоидов, кистой семенника или предшествовавшей вазэктомией (Olson, 1991). Тщательное пальпирование семенников и их придатков помогает обнаружить болезненность, припухлость или наличие посторонней тканевой массы. УЗИ семенников, их придатков, семявыносящих протоков и предстательной железы выявляет аномалии их структуры. Дополнительным методом оценки проходимости семенных протоков служит измерение концентрации щелочной фосфатазы в сперме (см. стр. 1045).
Под ретроградной эякуляцией понимают поступление спермы в мочевой пузырь во время эякуляции. При нормальной антеградной эякуляции события происходят в следующей последовательности: выделение спермы, затем перекрывание шейки мочевого пузыря и изгнание спермы наружу через мочеиспускательный канал полового члена; эти процессы контролируются, в основном, симпатическим компонентом вегетативной нервной системы (Root et al, 1994). Искусственная денервация либо поражение нервов или мышц системы эякуляции нарушают эту последовательность событий. В случае неполного закрытия шейки мочевого пузыря сперма поступает в него по пути наименьшего сопротивления (Fenette et al, 1986). У кобелей обратный ток части спермы происходит и при нормальной эякуляции (Dooley et al, 1990). Полная ретроградная эякуляция встречается редко, однако, может быть одной из причин бесплодия. При частичной ретроградной эякуляции возможно появление олигоспермии. Диагноз устанавливается по повышению количества сперматозоидов в пробах мочи, полученных после эякуляции, по сравнению с их содержанием до эякуляции.
У молодых половозрелых кобелей и у кобелей, никогда не дававших потомства, несмотря на многочисленные попытки вязок, возможны врожден-
Рис. 31-2. Диагностика азооспермии при нормальном либидо. А. Первичное диагностическое обследование перед проведением биопсии семенников или определением гипофизарных гонадотропинов (см. продолжение).
1106 • БЕСПЛОДИЕ
Б
Рис. 31-2 (продолжение). Б. Интерпретация результатов тестикулярной биопсии и определения гипофизарных гонадотропинов у кобелей, у которых первичное диагностическое обследование (А) не выявило этиологию заболевания.
БЕСПЛОДИЕ
1108 • БЕСПЛОДИЕ
ные аномалии развития семенников и нарушения сперматогенеза. Интерсексуальные состояния (такие как синдром XXY хромосомы) весьма часто служат причиной врожденной азооспермии (Nie et al, 1998). Тщательное физикальное исследование зачастую помогает выявить дефекты формирования половых желез и нарушение их функции (например, тестикулярную гипоплазию). При подозрении на интерсексуальность необходимо провести кариотипирование. Проблема интерсексуальности рассматривается в гл. 24.
Приобретенные пороки половых желез, служащие потенциальными причинами азооспермии у собак с нормальным либидо, включают идиопатическую тестикулярную дегенерацию, лимфоцитарный орхит, разнообразные инфекции, гипертермию, травмы и опухоли. Эндокринные расстройства, большинство половых гормонов и глюкокортикоиды также влияют на интенсивность полового влечения и характер сперматогенеза; исключение составляют андрогены (см. стр. 1116). Почти все перечисленные нарушения сначала приводят к оли-госпермии. С течением времени те из них, которые вызывают прекращение сперматогенеза (в частности, идиопатическая тестикулярная дегенерация), начинают оказывать отрицательное воздействие и на либидо, поскольку способствуют разрушению клеток Лейдига. Приобретенные расстройства часто вызывают аномалии, которые выявляются уже при физикальном исследовании. Нарушения могут быть обнаружены при анализе семенной жидкости (например, наличие в ней воспалительных клеток или бактерий). Однако при идиопатической тестикулярной дегенерации и других формах патологии семенная жидкость часто остается нормальной.
У собак с подозрением на приобретенную дисфункцию семенников следует посредством посева мочи и спермы исключить бактериальную инфекцию, а с помощью УЗИ - наличие кист в предстательной железе. УЗИ семенников и их придатков должен проводить опытный специалист, и в случае обнаружении в них кист или посторонних тканевых масс необходимо получить аспираты для цитологического и бактериологического исследования. Результаты культивирования следует интерпретировать с большой осторожностью, поскольку выделяемые бактерии могут быть как первичными возбудителями инфекции, вызывающей бесплодие, так и вторичными организмами, поступающими извне или загрязняющими анализируемый материал и не играющими роли в возникновении инфекции. Кроме того, бактерии, изолируемые из спермы, могут отличаться от выделяемых из ткани семенников или кист предстательной железы (Olson et al, 1992). Несмотря на это, при положительных результатах бактериального культивирования кобелям с азооспермией показана терапия антибиотиками.
Если возможно, следует определить концентрацию фолликулостимулирующего гормона (ФСГ) в сыворотке крови, что позволит оценить состоя
ние семенных канальцев. Базальная концентрация ФСГ у здоровых кобелей обычно не превышает 130 нг/мл. При бесплодии на фоне выраженной тестикулярной дисфункции концентрация ФСГ нередко возрастает до 250 нг/мл и более (Soderberg, 1986). Причиной увеличения концентрации ФСГ, скорее всего, является снижение продукции ин-гибина клетками Сертоли в ответ на нарушение сперматогенеза и соответствующая утрата подавления секреции гипофизарного ФСГ по механизму обратной связи. Напротив, нормальная или низкая концентрация эндогенного ФСГ у собак с азооспермией предполагает полную двустороннюю непроходимость системы семявыносящих протоков, наличие ретроградной эякуляции, нарушение секреции гипофизарного ФСГ (т.е. гипогонадотроп-ный гипогонадизм) либо ошибку при получении и/или обработке проб (см. стр. 1050).
В тех случаях, когда с помощью описанных выше диагностических подходов не удается установить причину бесплодия, прибегают к исследованию тестикулярных биоптатов или аспиратов из придатков семенников. В аспиратах из каудальных отделов придатков выявляют присутствие жизнеспособных и подвижных сперматозоидов, воспалительных клеток и бактерий. Наличие сперматозоидов в аспиратах из придатков семенников собак с азооспермией свидетельствует об окклюзии семявыносящих протоков, тогда как отсутствие сперматозоидов отражает либо непроходимость протоков, либо резорбцию сперматозоидов проксимальнее места взятия аспирата, либо полное прекращение сперматогенеза.
Тестикулярная биопсия позволяет получить конкретные данные о характере патологического процесса (например, о наличии лимфоцитарного орхита или дегенерации семенных канальцев), состоянии гематотестикулярного барьера, клеточном строении семенных канальцев и возможности восстановления сперматогенеза, и может послужить основанием для выбора терапии (Olson et al, 1992). Полученную посредством пункционной биопсии ткань семенников используют также для микробиологического анализа. При исследовании тестикулярных биоптатов важно помнить, что полученная ткань является репрезентативной только для одной области семенника, и ее состояние не всегда отражает характер патологического процесса во всей железе. Кроме того, на основании исследования биоптата, полученного из одного участка семенника, особенно если в нем отсутствует воспалительный процесс, часто бывает трудно установить, имеет ли место дегенерация или регенерация семенных канальцев, (рис. 31-3).
Вместо проведения тестикулярной биопсии можно прибегнуть к тактике выжидания. В случае азооспермии неясной этиологии следует прекратить вязку кобеля, по меньшей мере, на 2 месяца, и в это время по возможности снижают до минимума или полностью устраняют любые факторы, кото-
БЕСПЛОДИЕ • 1109
Рис. 31-3. Гистологическое исследование тестикулярных биоптатов, полученных у 4-лстнего всльш-корги во время первичною дна! носгического обследования по поводу бесплодия (А) и спустя 8 месяцев (Б) (окраска гематоксилином и эозином, х250). Обратите внимание на выраженную дегенерацию семявыносящих протоков и исчезновение интерстициальных клеток Лейдига с течением времени. На момент первичного обследования либидо оставалось нормальным, но в последующем постепенно уменьшалось. Поставлен диа-I поз идиопатическая тестикулярная дегенерация.
рыс могут нов шягь на сперматогенез (в частности, лекарственные препараты, пищевые добавки или тяжелые физические нагрузки). По истечении 2 месяцев проводят физикальное исследование собаки, обращая особое внимание на изменения размеров, формы и консистенции семенников. Одновременно проводят анализ спермы. Если азооспермия сохраняется, а состояние семенников остается нормальным, то проводят повторные оценки состояния животного еще через 2 и 4 месяца. Наги опыт показывает, что спустя 6 месяцев у большинства кобелей сперматогенез восстанавливается. В течение этого времени проявляются различные дефекты, особенно касающиеся семенников.
Олигоспермия
При олигоспермии общее количество сперматозоидов в эякуляте обычно ниже 100 х 106. При этом их морфологическое строение может оставаться нормальным или нарушаться. Наиболее распространенными причинами олигоспермии являются неполная эякуляция, частые вязки и недавнее поражение семенников. В целом, появление олигоспермии обусловлено теми же факторами, которые вызывают азооспермию. Развитие олигоспермии или азооспермии определяется тяжестью болезнетворного процесса, масштабами поражения половых путей (например, полной или частичной непроходимостью мелких эфферентных протоков) и временем, прошедшим с момента возникновения расстройства до проведения обследования. С течением времени олигоспермия может перейти в азооспермию.
Диагностика олигоспермии проводится так же, как и азооспермии (рис. 31-2). Дополнительно следует учитываг ь возраст кобеля и частоту эякуляции, которая непосредственно влияет на концентрацию сперматозоидов (см. стр. 1044). Общее количество сперматозоидов в эякуляте уменьшается с увеличе
нием частоты эякуляции, что обусловлено уменьшением резерва спермы в придатках семенников. После его истощения количество сперматозоидов в эякуляте остается на постоянном уровне и определяется только интенсивностью их образования в семенниках. Большинство здоровых кобелей могут участвовать в вязках один раз в день ежедневно на протяжении длительного времени (нескольких месяцев) без проявления признаков олигоспермии или снижения плодовитости. Однако это не относится к собакам с нарушенным сперматогенезом, у которых, в конечном счете, может развиться олигоспермия. Особенно это касается старых кобелей, поскольку с возрастом ежедневная про 1укция спермы постепенно снижается. При возникновении олигоспермии из-за чрезмерно частого использования кобеля в качестве производителя, уменьшение числа вязок сопровождается накоплением спермы в придатках семенников (Olar et al, 1983).
Тератозооспермия (нарушение морфологического строения сперматозоидов, рис. 31-4)
При тератозооспермии в эякуляте увеличивается относительная доля сперматозоидов, имеющих аномальное морфологическое строение. Общее содержание сперматозоидов, их подвижность и количество семенной жидкости при этом могут оставаться в норме или изменяться в зависимости от характера патологического процесса. Различают первичные и вторичные дефекты строения сперматозоидов (см. стр. 1039). Считается, что первичные дефекты обусловлены нарушениями сперматогенеза, т.е. возникают на уровне семенников. Вторичные нарушения являются неспецифическими и возникают во время транспорта сперматозоидов по половым путям (например, в придатках семенников), либо вследствие инфекции, травмы или повышения
1110 • БЕСПЛОДИЕ
температуры, либо в процессе взятия, обработки и анализа проб (Johnston, 1991). В эякуляте здоровых кобелей обычно более 70% сперматозоидов имеют нормальное морфологическое строение, количество сперматозоидов с первичными нарушениями составляет меньше 10%, а количество сперматозоидов с вторичными нарушениями - меньше 20%. Установлена положительная корреляция между относительным количеством морфологически полноценных сперматозоидов и плодовитостью кобелей, а также между общим количеством нормальных сперматозоидов и частотой беременности у покрытых ими сук (Oettle, 1993; Mickelsen et al, 1993). В группе из 23 кобелей, имевших в эякулятах более 60% морфологически нормальных сперматозоидов, плодовитость составляла 61%, тогда как в группе из 15 кобелей, имевших менее 60% нормальных сперматозоидов, она не превышала 13% (Oettle, 1993). На основании этих данных можно сделать вывод, что нарушение морфологического строения более чем 40% сперматозоидов является клинически значимым показателем, свидетельствующим о повышенном риске бесплодия. Сообщения о влиянии конкретных нарушений морфологического строения сперматозоидов на плодовитость кобелей немногочисленны. К числу специфических аномалий, ассоциирующихся с бесплодием, относятся дефекты ультраструктуры или слипания шейки, микроцефалия сперматозоидов и наличие проксимально локализованных цитоплазматических капель (Johnston et al, 2001).
Причинами нарушений морфологического строения сперматозоидов служат факторы окружающей среды, лекарственные препараты, системные заболевания, инфекции или иммунный орхит, эпидидимит, простатит или врожденные расстройства сперматогенеза. Среди последних хорошо охарактеризован только фукозидоз - заболевание лизосомального происхождения, сопровождающееся нарушением функции эпителиальных клеток придатков семенников и приводящее к задержке цитоплазматических капель (Taylor et al, 1989). В случае преобладания вторичных нарушений морфологии сперматозоидов, выявляемых при анализе спермы, их причиной может быть неправильная процедура взятия и обработки мазков, а также пониженная половая активность кобеля (Johnston et al, 1991). Прежде чем приступать к углубленному диагностическому обследованию, следует проанализировать несколько эякулятов. В случае устойчивой тератозооспермии, причины которой не удается установить на основании анамнестических данных или физикального исследования, следует провести ОАК, анализ биохимического профиля сыворотки и мочи с целью выявления системного заболевания. Одновременно проводят УЗИ семенников, их придатков и простаты для выявления возможных аномалий. Необходимо также исключить инфекцию посредством культивирования проб мочи, спермы и содержимого кист простаты при их наличии.
Если же все эти исследования не помогают установить причину тератозооспермии, то проводят биопсию семенников. Мы, однако, исходим из предположения, что данное расстройство имеет преходящий характер, и освобождаем кобеля от вязок на 2 месяца, после чего проводим повторное обследование. В течение этого времени следует постараться сократить до минимума или полностью устранить факторы, которые могут повлиять на характер сперматогенеза. В случае дальнейшего усиления тяжести тератозооспермии (по результатам оценки спустя 2 месяца) предпринимается более тщательный анализ анамнестических и ранее полученных клинических данных, которые до этого не привлекли внимания ветеринара. Одновременно проводят физикальное исследование, чтобы выявить изменения в репродуктивном тракте за истекшие 2 месяца. В случае необходимости исследуют биоптаты семенников. Если концентрация сперматозоидов с нарушениями морфологического строения не увеличивается или снижается, а физикальное исследование не выявляет явных изменений в репродуктивном тракте, то состояние собаки снова оценивают через 2 и 4 месяца.
Плодовитость кобелей при тератозооспермии зависит от характера морфологического нарушения и его влияния на функцию сперматозоидов, относительного количества дефектных клеток и общего содержания сперматозоидов в эякуляте (Oettle, 1993; Mickelsen et al, 1993). Кобель может оставаться фертильным несмотря на тератозооспермию, если в эякуляте сохраняется достаточно большое количество неизмененных половых клеток и создаются условия для их накопления в результате правильного режима вязок (Wilson, 1993; Nothling et al, 1995). Вероятность бесплодия возрастает, если морфологические нарушения отрицательно сказываются на функции сперматозоидов, при уменьшении общей продукции сперматозоидов и в случае нерационального использования кобеля в качестве производителя. Вместе с тем, многие морфологические дефекты, нарушающие функцию сперматозоидов, приводят к бесплодию независимо от количества половых клеток в эякуляте (Plummer et al, 1987).
Астенозооспермия (пониженная подвижность сперматозоидов, рис. 31-5)
Астенозооспермия означает пониженную подвижность сперматозоидов в эякуляте. Прогрессивное поступательное движение является нормальной формой активности сперматозоидов, отражающей их жизнеспособность и обеспечивающей оплодотворение яйцеклетки. В пробах нормальной спермы содержится более 70% сперматозоидов, характеризующихся энергичным перемещением в прямом направлении. Необходимо внимательно оценивать характер подвижности индивидуальных сперматозоидов. Перемещение клеток небольшими кругами или из стороны в сторону без продвижения вперед
В случае сохранения тератозооспермии
Рис. 31-4. Диагностика тератозооспермии (аномальная морфология сперматозоидов).
БЕСПЛОДИЕ
1112
БЕСПЛОДИЕ
Астенозооспермия и нормальное либидо
Повторный анализ нескольких эякулятов
Рис. 31-5. Диагностика астенозооспермии (пониженная подвижность сперматозоидов).
считается аномальным. Неизвестно, какое количество аномально перемещающихся сперматозоидов (в процентах) приводит к бесплодию кобеля. Диагноз астенозооспермии у страдающих бесплодием мужчин ставится в тех случаях, когда в эякуляте присутствует нормальное количество сперматозоидов, но лишь менее 25% из них сохраняют нормальную подвижность (Meyers-Wallen, 1991). По-видимому, можно считать, что нарушение подвижности более чем 50% сперматозоидов в сперме собак ассоциируется с бесплодием.
Прежде чем приступать к углубленному диагностическому обследованию кобеля с подозрением на астенозооспермию, следует проанализировать несколько эякулятов. Первый эякулят, взятый у кобеля, который на протяжении длительного периода не участвовал в вязках, содержит повышенное количество старых и нежизнеспособных сперматозоидов, хранившихся в придатках семенников. В результате в пробе понижено число сперматозоидов,
обладающих нормальной подвижностью. Пробы спермы, получаемые в последующие дни, должны иметь состав, близкий к нормальному.
Самыми частыми причинами астенозооспермии, особенно в отсутствие других существенных изменений спермы, являются ошибки при взятии и подготовке к анализу ее проб. Относительное число подвижных сперматозоидов уменьшается при контакте с латексной выстилкой искусственного влагалища, а также под воздействием кислых растворителей, воды, мочи, гноя, крови и избыточного количества смазки, при слишком низкой или высокой температуре (< 25°С и > 40°С). Чтобы получить надежные результаты, следует придерживаться соответствующих методов получения и обработки проб спермы (см. стр. 1034).
Устойчивая астенозооспермия может отражать проблемы, связанные с семенниками, их придатками и/или простатой. В целом, причины астенозооспермии и тератозооспермии сходны. Кроме
БЕСПЛОДИЕ • 1113
того, астенозооспермия может быть обусловлена первичными морфологическими дефектами половых клеток и ферментативной недостаточностью (Gagnon et al, 1982). Классическим первичным дефектом сперматозоидов является синдром Карта-генера, или синдром неподвижных ресничек; этот дефект наследуется по аутосомно-рецессивному типу. У собак он включает заболевание дыхательных путей, стерильность (у кобелей), situs invertus и гидроцефалию (Edwards et al, 1986). При этом сперматозоиды остаются жизнеспособными, но утрачивают подвижность. Для диагностики синдрома Картагенера необходимы функциональные и уль-траструктурные исследования ресничек, включая оценку методом ядерной сцинтиографии скорости мукоцилиарного клиренса, осуществляемого трахеобронхиальным реснитчатым эпителием, изучение образования ресничек в условиях in vitro и выявление их строения посредством трансмиссионной электронной микроскопии (Clercx et al, 2000).
Приобретенные заболевания, вызывающие нарушения морфологического строения сперматозоидов (см. выше), также могут влиять на их подвижность. Для поступательного движения сперматозоидов необходимо нормальное функционирование шейки и хвоста. Дефекты этих структур, а также факторы окружающей среды, лекарственные препараты, воспаление или изменения температуры отрицательно сказываются на подвижности сперматозоидов (Johnston, 1989). Не менее существенная роль принадлежит нарушениям морфологического строения сперматозоидов и свойств семенной жидкости. К примеру, инфекция В.canis сопровождается агглютинацией головок сперматозоидов (George, Carmichael, 1984), что снижает их подвижность. В то же время, расстройства, затрагивающие только придатки семенников, могут приводить к аномалиям в сперматозоидах, не влияя на другие характеристики спермы (Amann, 1982).
В случае устойчивой астенозооспермии, причины которой не удается установить на основании анамнестических данных, физикального исследования или анализа спермы, следует провести ОАК, биохимический анализ крови и мочи с целью выявления системного заболевания. Одновременно проводится УЗИ семенников, их придатков и предстательной железы для выявления возможных аномалий этих органов. Необходимо также исключить инфекцию посредством культивирования проб мочи, спермы и, при наличии кист простаты, их содержимого.
Если же все эти исследования не помогают установить причину астенозооспермии, то необходимо освободить кобеля от вязок на период до 2 месяцев, по прошествии которого провести повторное обследование. В течение этого времени следует по возможности устранить факторы, которые могут повлиять на характер сперматогенеза. В случае дальнейшего усиления тяжести астенозооспермии (по результатам оценки спустя 2 месяца) предпри
нимается более тщательный анализ полученных ранее анамнестических и клинических данных. Одновременно проводят физикальное исследование, чтобы выявить изменения в репродуктивном тракте, упущенные из виду при прежних оценках и выявить нарушения, появившиеся за истекшие 2 месяца. Если тяжесть астенозооспермии не увеличилась или уменьшилась, а физикальное исследование не выявило явных изменений в репродуктивном тракте, то состояние кобеля повторно оценивают через 2 и 4 месяца. Если сохраняется слабая астенозооспермия, а анализ спермы не выявляет иных аномалий, то кобеля можно использовать в качестве производителя при условии рациональной постановки племенной работы.
Изменения свойств семенной жидкости
Изменения свойств семенной жидкости могут быть выявлены уже во время получения проб спермы либо при ее микроскопическом исследовании. Прежде всего, бросается в глаза изменение цвета и прозрачности жидкости. Обычный цвет спермы собак белый или палевый, и она непрозрачна. Бесцветная, прозрачная сперма свидетельствует об азооспермии, которая подтверждается микроскопическим исследованием.
Моча. Желтый цвет спермы служит показателем ее загрязнения мочой. Случайное загрязнение, очевидно, не может привести к бесплодию, чего нельзя сказать о хроническом загрязнении, поскольку моча оказывает токсичное действие на сперматозоиды. В случае постоянного присутствия мочи в сперме необходимо провести тщательную оценку состояния нижних отделов мочевой системы, включая анализ мочи, ее культивирование, УЗИ, контрастную урет-роцистографию и, если возможно, определение градиента давления в мочеиспускательном канале. При подозрении на дисфункцию сфинктера мочеиспускательного канала проводят пробную терапию альфа-адренергическими средствами, такими как фенилпропаноламин или псевдоэфедрин.
Гемоспермия. Красный или бурый цвет спермы свидетельствует о кровотечении. Это необязательно указывает на патологический процесс и в слабой форме не может быть причиной бесплодия. Гемоспермия иногда отмечается у кобелей, длительное время находящихся в состоянии полового возбуждения в результате задержки вязки. Полагают, что в этом случае кровь поступает в сперму из предстательной железы. С целью профилактики гемоспермии следует держать суку вне поля зрения кобеля до момента вязки.
Причинами устойчивой гемоспермии могут служить доброкачественная гиперплазия простаты, простатит, опухоль простаты, коагулопатии и повреждения урогенитального тракта, включая мочеиспускательный канал. Состояние предстательной железы оценивают путем пальпации через прямую кишку и с помощью УЗИ. Берут пробы аномальной
1114
БЕСПЛОДИЕ
ткани и содержимого кист простаты для цитологического исследования и культивирования. Кроме того, проводят ОАК, анализ и посев проб мочи, получают коагулограмму и контрастную уретрограм-му. В случае необходимости прибегают к визуальному осмотру мочеиспускательного канала через гибкий уретроскоп.
Воспаление. В пробах спермы здоровых собак нередко встречаются отдельные воспалительные клетки и бактерии вследствие загрязнения эякулята во время прохождения по мочеиспускательному каналу. Однако присутствие большого количества таких клеток и бактерий в сперме должно восприниматься как тревожный сигнал, особенно если это носит устойчивый характер. Загрязненная таким образом сперма может внешне выглядеть нормальной либо в случае интенсивного воспалительного процесса приобретать зеленоватую окраску; в ней появляются комки, сгустки или хлопья. Обычно признаки воспаления в сперме появляются при наличии у собаки инфекционных простатита, орхита и/или эпидидимита либо воспаления семенников, вызванного иммунными процессами.
При воспалении всегда возникает подозрение на наличие инфекции, особенно если среди воспалительных клеток преобладают нейтрофилы. Основной задачей диагностики является локализация инфекции и выделение возбудителя(ей), в частности, с использованием серологических тестов на присутствие В.canis. Проводится УЗИ предстательной железы, семенников и их придатков, а также пункционная биопсия выявленных кист простаты с целью получения материала для культивирования и цитологического анализа. Производится посев проб мочи и спермы. При получении отрицательных результатов культивирования в аэробных условиях проводят анаэробное культивирование, позволяющее выявить инфекцию микоплазмой и уреаплазмой (см. стр. 1045). Если и в этом случае получают отрицательный результат, то целесообразно назначить собаке терапию антибиотиками широкого спектра действия и спустя 3 недели повторить бактериологическое исследование. Нельзя исключать наличие иммунного орхита и/или эпидидимита, особенно когда среди воспалительных клеток в сперме преобладают моноядерные клетки. Диагностика иммунного орхита весьма затруднительна, однако ряд признаков облегчает его идентификацию, в частности, обнаружение воспалительного процесса с участием моноядерных клеток в семенниках, устойчивый отрицательный результат бактериологических исследований и отсутствие улучшения после терапии антибиотиками. При подозрении на иммунный орхит и отсутствии реакции кобеля на антибактериальную терапию показана тестикулярная биопсия с последующим культивированием и гистологическим исследованием полученного материала.
Агглютинация. Микроскопическое исследование спермы иногда выявляет агглютинацию спер
матозоидов, которая обычно обусловлена воспалением семенников и/или их придатков, как правило, вследствие инфекции В. canis (George, Carmichael, 1984). Считается, что вызванный инфекцией воспалительный процесс приводит к разрушению гема-тотестикулярного барьера и, таким образом, делает возможным контакт сперматозоидов с иммунной системой. В результате образуются антитела к сперматозоидам и они агглютинируют. Наиболее сильная агглютинация сперматозоидов происходит в содержащей преимущественно IgA семенной жидкости собак, инфицированных В.canis. Одновременно в ней присутствуют цитофильные факторы, способствующие слипанию сперматозоидов и макрофагов (George, Carmichael, 1984). В случае агглютинации сперматозоидов следует учитывать возможность индуцированного иммунной системой орхита/эпидидимита, а также инфицирования другими микроорганизмами, помимо В.canis. У человека также возможна агглютинация спермы вследствие присутствия в ней аморфного материала и белков, которые не являются антителами (Bronson etal, 1984).
Нормальное количество сперматозоидов и семенной жидкости
Бесплодие кобеля при нормальном либидо и нормальном количестве сперматозоидов является одним из наиболее сложных для понимания случаев. Чаще всего такая ситуация обусловлена неправильной постановкой работы по воспроизводству либо бесплодием суки. Прежде всего, следует тщательно проанализировать тактику использования кобеля в качестве производителя и оценить репродуктивный статус суки. Практические вопросы организации работы в питомниках и проведения обследования с целью выявления бесплодия сук более подробно рассматриваются соответственно в гл. 20 и 24.
Эффективность сперматогенеза с возрастом снижается, вследствие чего количество сперматозоидов в эякуляте постоянно остается на нижней границе нормы (т.е. примерно 200 х 106 на эякулят; см. выше раздел «Олигоспермия»). Частая эякуляция, особенно у собак с пониженной интенсивностью сперматогенеза, приводит к дальнейшему уменьшению количества сперматозоидов. Конечным результатом является субфертильность. Для улучшения репродуктивной функции таких кобелей следует рационализировать племенную работу, в частности реже использовать их для вязки, чтобы увеличить время накопления спермы в придатках семенников. Другой причиной бесплодия кобелей могут быть ультраструктурные или функциональные аномалии сперматозоидов, препятствующие оплодотворению яйцеклетки, несмотря на внешне нормальный вид и состав спермы. Ультраструктурные изменения можно выявить с помощью электронной микроскопии, однако такие исследования проводятся редко. Методы оценки функциональных свойств спермы
БЕСПЛОДИЕ • 1115
собак также малодоступны, хотя в будущем они, возможно, будут использоваться чаще (Plummer, 1993).
Врожденное бесплодие и нормальное либидо
Когда кобель, несмотря на многочисленные попытки, не дает потомства, говорят о врожденном бесплодии (если не доказано обратное). Однако у некоторых таких животных бесплодие может быть диагностировано как приобретенное, если вызвавшая его причина появилась еще до начала их использования в качестве производителей. Помимо расстройств, связанных с приобретенным бесплодием, ветеринар должен попытаться выявить врожденные дефекты, которых не должно быть у кобеля с подтвержденной репродуктивной функцией в прошлом и приобретенным бесплодием в настоящем (см. табл. 31-1). Методы диагностики врожденного и приобретенного бесплодия в целом одинаковые (см. стр. 1104), однако, в первом случае большее внимание уделяется нарушениям полового развития (например, XXY синдрому), анатомическим дефектам (таким как двусторонний крипторхизм или аплазия протоков придатков семенников) и дисфункции сперматозоидов (например, синдрому Картагенера). Краеугольным камнем диагностики врожденного бесплодия является тщательный анализ анамнеза животного и его физикальное исследование. Нельзя также упускать из виду возможность интерсексуальности. У фенотипически нормального кобеля возможны хромосомные аномалии или дефекты половой дифференцировки, такие как женский псевдогермафродитизм либо 79, XXY и XX реверсивный кариотип (см. стр. 992; Johnston et al, 2001). Дальнейшая диагностика зависит от характера аномалий, выявленных при первичном обследовании животного. Дополнительные сведения можно найти в разделе, посвященном кобелям с приобретенным бесплодием и нормальным либидо.
ЛЕЧЕНИЕ БЕСПЛОДИЯ
Выбор специфической терапии зависит от причины бесплодия. Вопросы лечения таких расстройств, как орхит, эпидидимит, простатит или тестикулярная неоплазия рассматриваются в соответствующих разделах данной главы. Важно помнить, что процесс формирования сперматозоидов из спер-матогоний и их появления в эякуляте занимает у собак от 55 до 70 дней. Поэтому терапию любыми лекарственными средствами, предназначенными для повышения количества половых клеток в сперме, следует проводить на протяжении, по меньшей мере, 3 месяцев, прежде чем приступать к оценке ее эффективности. Важным вспомогательным элементом терапии бесплодия является сексуальный покой. Иногда это единственное, что нужно кобелю
после временных проблем семявыносящих протоков. К числу таких проблем относятся стресс, частое участие в вязках, повышенная температура и некоторые лекарственные средства. При наличии у кобеля олигоспермии или азооспермии его необходимо повторно обследовать через 3-6 месяцев; только в случае подтверждения ранее полученных данных можно говорить об устойчивом нарушении сперматогенеза.
Идиопатическая тестикулярная дегенерация
Идиопатическая тестикулярная дегенерация характеризуется утратой функции семявыносящих протоков и различной степенью поражения клеток Лейдига (см. стр. 1084). Одновременно на фоне очень слабого воспаления происходит дегенерация клеток протоков. Либидо уменьшается или остается нормальным, хотя со временем, по мере уменьшения количества клеток Лейдига, в конце концов, понижается (см. рис. 31-3). Функция гипофиза не нарушается, однако секреция ФСГ усиливается из-за отсутствия ее подавления ингибином. Секреция ЛГ может быть нормальной или повышенной в зависимости от состояния клеток Лейдига. Введение таким животным экзогенных гонадотропинов не дает желаемого улучшения сперматогенеза, поскольку ткани и клетки-мишени (например, сперматогонии) либо отсутствуют, либо не отвечают на стимуляцию. Столь же мало эффективна терапия андрогенами. Собаки с описываемым расстройством практически не реагируют ни на один из известных видов терапии. Чтобы удостовериться в том, что в процессе обследования животного не был упущен из виду тот или иной фактор, оказывающий временное неблагоприятное воздействие на сперматогененную функцию семенников, рекомендуется обеспечить собаке сексуальный покой, а затем провести повторное обследование. Прогноз восстановления фертильности у таких кобелей неблагоприятный.
У некоторых кобелей с олигоспермией сохраняется нормальная концентрация ФСГ в плазме крови. Такая ситуация встречается на ранних стадиях идиопатической тестикулярной дегенерации или является следствием нарушения системы обратной связи между ингибином плазмы и секрецией гипофизарных гонадотропинов. Если причиной является нарушение обратной связи, собаки, теоретически, должны отвечать на инъекции ГнРГ или антиэст-рогенов (которые усиливают высвобождение ГнРГ из гипоталамуса) увеличением секреции гипофизарных ЛГ и ФСГ и соответствующим усилением биосинтеза тестостерона в семенниках. У человека олигоспермию лечат такими антиэстрогенами, как кломифена цитрат и тамоксифен (Howards, 1995). Результаты многих неконтролируемых исследований свидетельствуют об улучшении качества семени и увеличении частоты беременностей после терапии
1116
БЕСПЛОДИЕ
мужского бесплодия антиэстрогенами, однако, большинство контролируемых исследований не подтверждает действия этих препаратов на олигоспер-мию и фертильность (Sokol et al., 1988; WHO, 1992). Подобных исследований на собаках не проводили.
Тестолактон представляет собой ингибитор ароматазы, блокирующий превращение тестостерона в эстрадиол (Howards, 1995). Это соединение используют для лечения идиопатической олигоспермии у мужчин, но результаты весьма противоречивы. Одни авторы сообщают об увеличении концентрации сперматозоидов и излечении бесплодия (Vigersky, Glass, 1981), тогда как по данным других исследователей препарат неэффективен (Clark, Sherins, 1989). О действии препарата у собак неизвестно.
Местеролон - это синтетический андроген, который используется в европейских странах для лечения идиопатического мужского бесплодия. К сожалению, двойное слепое исследование эффективности этого препарата, проводившееся под эгидой Всемирной Организации здравоохранения, не выявило достоверного увеличения частоты беременности у женщин после его применения по сравнению с плацебо (WHO, 1989). На примере трех здоровых кобелей и одного с олигоспермией было показано, что местеролон улучшает качество семени у этих животных (England, Allen, 1991). Так, у здоровых собак продукция сперматозоидов была значительно увеличена через 3 недели после введения местеролона в дозе 0,75 мг/кг через каждые 12 часов на протяжении 4 недель. Его введение кобелю с олигоспермией в дозе 1,5 мг/кг также 2 раза в сутки в течение 8 недель достоверно снижало общую продукцию спермы, но при этом относительное количество в ней сперматозоидов, выявляемых методом прижизненного окрашивания, увеличивалось. К сожалению, медикаментозная терапия с целью нормализации сперматогенеза обычно малоэффективна, а при наличии эффекта не всегда понятно, что больше способствовало улучшению качества семени - применявшееся лекарственное средство или фактор времени.
Лимфоцитарный орхит
Основной характеристикой лимфоцитарного орхита является лимфоцитарное воспаление семенников. Этот аутоиммунный процесс индуцируется при нарушении гематотестикулярного барьера в результате травмы, инфекции, воспаления и тому подобных факторов либо возникает спонтанно у собак с соответствующей генетической предрасположенностью (см. стр. 1083). Заболевание носит прогрессирующий характер, и прогноз восстановления фертильности неблагоприятный. Учитывая возможное участие генетических факторов в возникновении спонтанного лимфоцитарного орхита, попытки его лечения часто безуспешны.
Для контроля иммунных реакций применяют иммуносупрессорные дозы глюкокортикоидов (на
пример 2-4 мг преднизона/кг, разделенные пополам для введения дважды в день). К сожалению, продолжительное введение большого количества глюкокортикоидов, которое зачастую необходимо для лечения данного заболевания, отрицательно сказывается на состоянии сперматогенеза и может привести к бесплодию. Поэтому ветеринар должен пытаться контролировать иммунные реакции минимальными дозами глюкокортикоидов, вводя их как можно реже с целью минимизации нежелательных эффектов терапии. Это, однако, возможно далеко не всегда, потому что лечение индуцированного иммунными процессами орхита требует применения больших доз глюкокортикоидов, способных вызвать нарушение сперматогенеза и последующее бесплодие. Для оценки эффективности других иммуносупрессорных лекарственных средств (в частности, азатиоприна в дозе 2 мг/кг/день), обладающих менее выраженным побочным действием на половой тракт, необходимы специальные исследования.
Ретроградная эякуляция
Во время эякуляции у здоровых кобелей небольшое количество сперматозоидов направляется с ретроградным током жидкости в мочевой пузырь (Dooley et al, 1990). В случае неполного смыкания внутреннего сфинктера мочеиспускательного канала во время эякуляции количество сперматозоидов, поступающих вместо полового члена в мочевой пузырь, значительно возрастает (см. стр. 1105). Результатом является олигоспермия или, реже, азооспермия, хотя при этом у собаки сохраняются нормальные либидо и половое поведение (Post et al, 1992; Root et al, 1994).
Ретроградная эякуляция может быть врожденным или приобретенным дефектом. Ее диагностика основывается на выявлении повышенного числа сперматозоидов в мочевом пузыре после эякуляции по сравнению с их количеством до эякуляции. Терапия данного расстройства включает введение симпатомиметиков со свойствами альфа-агонистов (псевдоэфедрина или фенилпропаноламина), которые стимулируют сокращение внутреннего сфинктера мочеиспускательного канала и усиливают антеградную эякуляцию. Описан случай устранения ретроградной эякуляции у кобеля, получавшего псевдоэфедрин в дозе 4 мг/кг перорально за 1 и 3 часа до вязки и взятия проб спермы. У покрытой этим кобелем суки развилась беременность, и она родила 5 щенков (Post et al, 1994). Симпатомиме-тики с активностью альфа-агонистов обеспечивают антеградный ток семени только при условии их введения перед каждой очередной эякуляцией.
Дисфункция клеток Лейдига и утрата либидо
Нарушение функции клеток Лейдига приводит к снижению концентрации тестостерона в плазме
БЕСПЛОДИЕ • 1117
крови, увеличению концентрации ЛГ, утрате либидо и нарушениям сперматогенеза разной тяжести. Подавление или потеря функции клеток Лейдига обычно сопровождается прекращением сперматогенеза и, как правило, обусловлена гормональными расстройствами, инфекцией, воспалением, неоплазией или тестикулярной дегенерацией. Случаи первичной патологии семенников с поражением только клеток Лейдига и не затрагивающей семявыносящие протоки крайне редки.
Лечение, направленное на нормализацию либидо, следует применять с осторожностью из-за его возможного отрицательного воздействия на сперматогенез. Традиционно для коррекции либидо используются андрогены. В норме концентрация тестостерона в семенниках в 50-100 раз выше, чем в плазме крови (Olson, 1984). Для получения таких концентраций приходится вводить очень большие количества экзогенного тестостерона. Согласно одному из протоколов, пероральная доза метилтестос-терона составляет 0,1 мг/кг ежедневно на протяжении 3 месяцев, после чего проводится повторный анализ проб спермы. Хотя терапия тестостероном может приводить к улучшению либидо, она оказывает относительно слабое положительное действие на сперматогенез, а в ряде случаев значительно ухудшает качество спермы, возможно, из-за вторичного подавления секреции ГнРГ и ФСГ. В одном из исследований подкожное введение здоровым кобелям смеси эфиров тестостерона в дозе 5 мг/кг приводило к значительному ухудшению качества спермы, включая увеличение количество первичных аномалий сперматозоидов спустя 3 недели после инъекции; индуцированные таким образом расстройства сохранялись на протяжении последующих 3 месяцев (England, 1997). Применение андрогенов в избыточных количествах может спровоцировать агрессивное поведение собаки и гепатопатию, а также вызвать подавление функции системы гипо-таламус-гипофиз-половые железы. Как показывает наш опыт, терапия андрогенами не приводит к полному излечению бесплодия кобелей.
Некоторые синтетические андрогены усиливают функцию семявыносящих протоков, не вызывая одновременного подавления системы гипота-ламус-гипофиз-половые железы. Они назначаются мужчинам с олигоспермией, недостаточностью андрогенов и бесплодием. Местеролон не обладает побочным токсическим действием на печень, которое свойственно другим активным андрогенным препаратам для приема внутрь. Введение местеролона увеличивает концентрацию и подвижность сперматозоидов примерно у 30% мужчин с олигоспермией. Доза препарата обычно составляет от 25 до 75 мг в день. В одном из исследований этот препарат вводили кобелям в дозах 0,75-1,5 мг/кг через каждые 12 часов (см. стр. 1116; England, Allen, 1991). Флуоксиместерон также с успехом применялся для увеличения объема спермы и подвижности сперматозоидов при лечении олигоспермии у некоторых
мужчин. В настоящее время в литературе отсутствуют сведения об использовании этих синтетических андрогенов у собак.
Гипогонадотропный гипогонадизм
Причиной гипогонадотропного гипогонадизма у мужчин является врожденная или приобретенная недостаточность ГнРГ. Приобретенное расстройство может быть следствием недостаточных биосинтеза и/или секреции ГнРГ, инфильтрации или диффузного поражения тканей, гранулематозного заболевания или лимфоцитарного гипофизита (Nachtigall et al, 1997). В зависимости от этиологии гипогонадотропного гипогонадизма у мужчин введение экзогенного ГнРГ может нормализовать функцию гипофиза и устранить бесплодие. У собак не зарегистрированы случаи недостаточности ГнРГ, приводящей к бесплодию. В ветеринарной литературе имеются отдельные сообщения о заболеваниях гипофиза, сопровождающихся уменьшением секреции ФСГ и ЛГ, нарушением либидо и сперматогенеза, а также тестикулярной гипоплазией, однако документированное подтверждение этих расстройств отсутствует. Теоретически, врожденная аномалия гипофиза может быть причиной нарушения секреции ЛГ и ФСГ. Однако значительно более важную роль в клинических проявлениях у собак играет недостаточность других гипофизарных гормонов (в частности, гормона роста и ТТГ, см. стр. 55). Аналогично причиной ослабления секреции ЛГ и ФСГ может служить приобретенная дисфункции гипофиза в результате травмы, инфильтрации или неоплазии. Тем не менее, клиническая картина обусловлена, в первую очередь, избытком или недостатком других гипофизарных гормонов (например, избытком АКТГ или недостатком вазопрессина) или дисфункцией гипоталамуса и таламуса (см. раздел «Гипофизарные макроопухоли», стр. 309).
Утрата гипофизарных гонадотрофов может служить причиной бесплодия у кобелей с пониженной концентрацией в крови ФСГ, ЛГ и тестостерона, нарушенным либидо и тестикулярной гипоплазией при наличии клеток Лейдига и нефункционирующих семявыносящих протоков на фоне минимального воспаления или его отсутствия (по данным биопсии семенников). Не следует также исключать воздействие лекарственных средств или сопутствующих заболеваний, угнетающих функцию гонадотрофов (например, глюкокортикоидов или гипотиреоза). В зависимости от возраста собаки дисфункция гипофиза может быть вызвана дефектом развития, травмой или опухолью (Olson et al., 1992). Для окончательного установления причины данного расстройства и планирования его лечения необходимо провести полную диагностическую оценку состояния гипофиза. Прогноз у кобелей зависит от первичной причины гипофизарного гипогонадизма.
1118
БЕСПЛОДИЕ
Документированные свидетельства успешного лечения бесплодия у собак с первичной гипофизарной недостаточностью ЛГ и ФСГ отсутствуют. Точно так же отсутствует документальное подтверждение эффективности заместительной терапии гипофизарной недостаточности, хотя соответствующие рекомендации имеются в ветеринарной литературе. Лечение должно быть направлено на стимуляцию либидо и сперматогенеза. К сожалению, периодические инъекции гонадотропинов не позволяют адекватно имитировать нормальную пульсирующую секреторную активность гипофиза, что вызывает сомнение относительно эффективности такой заместительной терапии. Подкожное введение экзогенного ГнРГ в дозе 1-2 мкг/кг за 2-3 часа до планируемой вязки может усилить либидо (Purswell, 1994). Для стимуляции активности клеток Лейдига показаны подкожные инъекции человеческого хорионического гонадотропина в дозе 500 ME дважды в неделю. Для стимуляции либидо можно рекомендовать пероральное введение метилтестос-терона, однако, он не всегда оказывает благотворное действие на сперматогенез по причинам, указанным в предыдущем разделе. Надежным средством усиления либидо и сперматогенеза является синтетический андроген местеролон. Для стимуляции сперматогенеза рекомендуются инъекции ФСГ в дозе 25 мг раз в неделю подкожно (Larsen, Johnson, 1980) или в дозе 1 мг/кг внутримышечно (Burke, 1983). Хорионический гонадотропин лошади обладает активностью ФСГ и также рекомендуется для нормализации нарушенного сперматогенеза. Его доза для подкожных инъекций три раза в неделю должна составлять 20 МЕ/кг. Инъекции ГнРГ не усиливают секрецию эндогенных ЛГ и ФСГ у собак с первичной (гипофизарной) недостаточностью этих гонадотропинов, но могут оказаться полезными, если дефект имеет место не на гипофизарном, а на гипоталамическом уровне. Оценку эффективности гормональной терапии следует проводить не ранее 3 месяцев после ее начала. Излечение бесплодия заместительным введением гонадотропных гормонов имеет осторожный прогноз.
ЛИТЕРАТУРА
Amann RP: Use of animal models for detecting specific alterations in reproduction. Fund Appl Toxicol 2:13, 1982.
Bronson R, et al: Sperm antibodies: Their role in infertility. Fertil Steril 42:171, 1984.
Burke TJ: Reproductive disorders. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine, 2nd ed. Philadelphia, WB Saunders Co, 1983, p 1711.
Clark RV, Sherins RJ: Treatment of men with idiopathic oligozoospermic infertility using the aromatase inhibitor, testolactone: Results of a doubleblinded, randomized, placebo-controlled trial with crossover. J Androl 10:240, 1989.
Clercx C, et al: Use of ciliogenesis in the diagnosis of primary ciliary dyskinesia in a dog. J Am Vet Med Assoc 217:1681, 2000.
Dooley MP, et al: Retrograde flow of spermatozoa into the urinary bladder of dogs during ejaculation or after sedation with xylazine. Am J Vet Res 51:1574, 1990.
Edwards DF, et al: Immotile cilia syndrome - Primary cilia dyskinesia in the dog. Proceedings of the American College of Veterinary Internal Medicine, Washington, DC, 1986, p 1389.
England GCW: Effect of progestogens and androgens upon spermatogenesis and steroidogenesis in dogs. J Repro Fertil Suppl 31:123, 1997.
England GCW, Allen WE: Effect of the synthetic androgen mesterolone upon seminal characteristics of dogs. J Small Anim Pract 32:271, 1991.
England GCW, Plummer JM: Hypo-osmotic swelling of dog spermatozoa. J Reprod Fert Suppl 47:261, 1993.
Frenette MD, et al: Effect of flushing the vasa deferentia at the time of vasectomy on the rate of clearance of spermatozoa from the ejaculate of dogs and cats. Am J Vet Res 47: 463, 1986.
Freshman JL: Clinical management of the subfertile stud dog. Vet Clin North Am 31:259, 2001.
Gagnon D, et al: Deficiency of protein carboxyl methylase in immotile spermatozoa of infertile men. N Engl J Med 306:821, 1982.
Ganong WF: The gonads: Development and function of the reproductive system. /n Ganong WF (ed): Review of Medical Physiology, 10th ed. Los Altos, CA, Lange Medical Publications, 1981, p 331.
George L, Carmichael L: Antisperm responses in male dogs with chronic Brucella canis infections. Am J Vet Res 45:274, 1984.
Howards SS: Treatment of male infertility. N Engl J Med 332:312, 1995.
Johnson C, et al: Diagnosis and control of Brucella canis in kennel situations. Morphology-stain induced spermatozoal abnormalities. Proceedings of the Society for Theriogenology, San Diego, CA, August 16-17, 1991, p 236.
Johnston SD: New canine semen evaluation techniques for the small animal practitioner. Proceedings of the Society for Theriogenology, Coeur d’Alene, Idaho, September 29-30, 1989, p 320.
Johnston SD: Performing a complete canine semen evaluation in a small animal hospital. Vet Clin North Am 21:545, 1991.
Johnston SD, Root Kustritz MV, Olson PNS: Clinical approach to infertility in the male dog. In Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline Theriogenology. Philadelphia, WB Saunders Co, 2001, p. 371.
Keenan LRJ: The infertile male. In Simpson GM, England GCW, Harvey M (eds): BSAVA Manual of Small Animal Reproduction and Neonatology. Cheltenham, British Small Animal Veterinary Association, 1998, p 83.
Larsen RE, Johnston SD: Management of canine infertility. In Kirk RW (ed): Current Veterinary Therapy VII. Philadelphia, WB Saunders Co, 1980, p 1226.
Meyers-Wallen VN: Clinical approach to infertile male dogs with sperm in the ejaculate. Vet Clin North Am 21:609, 1991.
Mickelsen WD: Maximizing fertility in stud dogs with poor semen quality. Proceedings of the Society for Theriogenology, San Diego, CA, August 16-17, 1991, p 244.
Mickelsen WD, et al: The relationship of semen quality to pregnancy rate and litter size following artificial insemination in the bitch. Theriogenology 39:553, 1993.
Nachtigall LB: Adult-onset idiopathic hypogonadotropic hypogonadism - A treatable form of male infertility. N Engl J Med 336:410, 1997.
Nie GJ, et al: Theriogenology question of the month. J Am Vet Med Assoc 212:1545, 1998.
Nothling JO, et al: Success with intravaginal insemination of frozen-thawed dog semen - A retrospective study. J South African Vet Assoc 66:49, 1995.
Oettle EE: Sperm morphology and fertility in the dog. J Reprod Fertil 47(Sup-pl):257, 1993.
Olar TT, et al: Relationships among testicular size, daily production and output of spermatozoa, and extragonadal spermatozoal reserves of the dog. Biol Reprod 29:1114, 1983.
Olson PN: Clinical approach to infertility in the stud dog. Proceedings of the Society for Theriogenology, Denver, CO, 1984, p 33.
Olson PN: Clinical approach for evaluating dogs with azoospermia or asper-mia. Vet Clin North Am 21:591, 1991.
Olson PN, et al: Clinical and laboratory findings associated with actual or suspected azoospermia in dogs: 18 cases (1979-1990). JAVMA 201:478, 1992.
Plummer JM, et al: A spermatozoal midpiece abnormality associated with infertility in a Lhasa Apso dog. J Small Anim Pract 28:743, 1987.
Post K, et al: Retrograde ejaculation in a Shetland sheepdog. Can Vet J 33:53, 1992.
Purswell BJ: Pharmaceuticals used in canine reproduction. Semin Vet Med Surg 9: 54, 1994.
Rivier C, Rivest S: Effect of stress on the activity of the hypothalamic-pituitary- gonadal axis: Peripheral and central mechanisms. Biol Reprod 45:523, 1991.
Root MV, et al: Concurrent retrograde ejaculation and hypothyroidism in a dog: case report. Theriogenology 41:593, 1994.
Soderberg SF: Infertility in the male dog. In Morrow DA (ed): Current Therapy in Theriogenology, 2nd ed. Philadelphia, WB Saunders Co, 1986, p 544.
Sokol RZ, et al: A controlled comparison of the efficacy of clomiphene citrate in male infertility. Fertil Steril 49:865, 1988.
Taylor RM, et al: Reproduction abnormalities in canine fucosidosis. J Comp Pathol 100:369, 1989.
Vigersky RA, Glass AR: Effects of delta Itestolactone on the pituitary-testicular axis in oligospermic men. J Clin Endocrinol Metab 52:897, 1981.
Wilson MS: Non-surgical intrauterine artificial insemination in bitches using frozen semen. J Reprod Fert Suppl 47:307, 1993.
World Health Organization Task Force on the Diagnosis and Treatment of Infertility: Mesterolone and idiopathic male infertility: A double-blind study. Int J Androl 12:254, 1989.
World Health Organization: A double-blind trial of clomiphene citrate for the treatment of idiopathic male infertility. Int J Androl 15:299, 1992.
Глава 32
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
ПОКАЗАНИЯ К ИСКУССТВЕННОМУ ОСЕМЕНЕНИЮ...............1119
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕПОЛУЧЕННОЙ СПЕРМОЙ..1120
Получение спермы..............1120
Процедура осеменения..........1121
Успешность искусственного осеменения
свежеполученной спермой......1124
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ
ОБОГАЩЕННОЙ СПЕРМОЙ.......1124
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ
ЗАМОРОЖЕННОЙ СПЕРМОЙ......1125
Список сокращений
ИО - искусственное осеменение
Сбор спермы вручную и ее последующее введение во влагалище суки в период эструса (течки) широко применяется заводчиками и ветеринарами. В связи с этим заводчики и владельцы собак часто обращаются с просьбой об искусственном осеменении (ИО). Для этой цели используют свежеполученную неразбавленную сперму, сперму, смешанную с наполнителем, или замороженную сперму. Успех ИО зависит от хорошего знания ветеринаром особенностей эстрального цикла собак, процедуры получения спермы и техники ИО, а также возможных трудностей и причин неудач.
ПОКАЗАНИЯ К ИСКУССТВЕННОМУ ОСЕМЕНЕНИЮ
Искусственное осеменение используется в ряде определенных ситуаций. Самой очевидной причиной применения ИО является неспособность собак к естественному размножению. У сук она может быть обусловлена сужением влагалища, дефектами его строения, слабостью задних ног, болью при совокуплении или психическими расстройствами. ИО применяют при необходимости осеменения на ранних стадиях эструса сук с бесплодием неизвестного происхождения. ИО используют также в случаях общей слабости, артрита, болей в спине, преждевременной эякуляции у кобелей или при наличии у кобелей физических дефектов, препятствующих введению полового члена во влагалище или «замку». При очень большой разнице размеров спариваемых собак также прибегают к ИО. Еще одна ситуация, в которой целесообразно применять ИО, это наличие психических проблем, таких как эмоциональная несовместимость, робость, отсутствие сексуального опыта или неудачная вязка в предшествовавшем периоде.
Некоторые владельцы собак опасаются заражения своих питомцев инфекционным (в том числе венерическим) заболеванием при непосредственном половом контакте и поэтому предпочитают ИО. Это соображение не имеет смысла, когда речь идет об опасности передачи возбудителя от кобеля к суке, поскольку при искусственном введении семени во влагалище по сути половой контакт между особями сохраняется. Любой возбудитель, который может быть передан от кобеля суке при естественном спаривании, точно так же передается при ИО. В то же время ИО исключает передачу инфекции кобелю от зараженной суки. Во всех случаях животные обоего пола не должны быть носителями Brucella canis, наличие которых проверяется с помощью соответствующих тестов (см. гл. 26).
У некоторых кобелей, особенно доберман-пинчеров, после зрительного контакта с сукой «в охоте» (в эструсе, см. стр. 1113) возможны кровотечение из предстательной железы и гемоспермия. Кровотечения могут быть следствием болезни фон Виллебранда (БВД), но иногда случаются и в ее отсутствие. В любом случае проблема снимается применением ИО, которое осуществляется без какого-либо контакта между собаками.
Для ИО все чаще используется свежеполученная обогащенная и замороженная сперма. Сбор свежей спермы представляет собой нелегкую задачу, тогда как осеменение обогащенной или предварительно замороженной спермой - это относительно простая техническая процедура. Транспортировка свежеполученной обогащенной или замороженной спермы позволяет уменьшить расходы и избежать опасностей, связанных с перевозкой предназначенной для вязки суки.
1120 • ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
Рис. 32-1. Оснащение для искусственного осеменения: стерильные перчатки, стерильное искусственное влагалище из мягкой резины, стерильная пластмассовая пробирка присоединяемая к искусе гвенному влагалищу, и мягкий гибкий пластмассовый катетер для проведения осеменения.
Рис. 32-2. Половой член кобеля в состоянии эрекции с налитой кровью луковицей и оттянутым назад препуцием.
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ
СВЕЖЕПОЛУЧЕННОЙ СПЕРМОЙ
Получение спермы
( перму обычно собирают в искусственное влагалище. Мы используем для этой цели стерильное конусообразное искусственное влагалище из мягкой резины, применяемое для получения бычьей спермы, отрезав один его конец и прикрепив к оставшейся части пластмассовую пробирку объемом 12-15 мл (рис. 32-1; см. также рис. 27-3, стр. 1036). Кромку широкого отверстия конуса подворачиваем и промазываем резиновым клеем, формируя гладкий, неабразивный край. На внутренние стенки резинового конуса наносится тонкий слой неспермицидной гелевой смазки. Это единственная поверхность, с которой половой член контактирует во время сбора спермы.
Самой трудной задачей при ИО является индукция эякуляции. После достижения эякуляции все остальные процедуры достаточно просты. В большинстве случаев сбор спермы проводится в спокойной обстановке, в чистой комнате с нескользким иолом. Присутствие суки требуется далеко нс всегда. Гем нс менее, получение спермы от сексуально опытного кобеля, привыкшего к естественной вязке, значительно облегчается, а качество спермы улучшается, если в том же помещении находится точная сука. Вместо нее в качестве раздражителя можно использовать суку, не находящуюся в эстру-се, нанеся на ее шерсть препарат феромонов (сан (Гestrus, производства Synbiotics, Malvern, США). Во время сбора спермы хозяин кобеля удерживает его, чтобы максимально ограничить подвижность и защитить оператора, который слегка массирует половой член и луковицу, еще находящиеся в препуции. Когда луковица начинает увеличиваться в размерах, ее вместе с половым членом выдвигают
из препуция (рис. 32-2). Невозможность выведения луковицы и полового члена из препуция приводит к слабой эрекции, неполной эякуляции или ее отсутствию, возможно, из-за сопутствующего болевого ощущения.
После выдвижения пениса и его луковицы наружу оператор сильно сжимает половой член у основания проксимальнее луковицы (рис. 32-3), большим и указательным пальцем делает легкие массирующие и одновременно направленные книзу движения вокруг основания луковицы. С началом эрекции и во время нее кобель производит сильные толчковые движения газом, которые затрудняют помещение полового члена в искусственное влагалище. К счастью, такие движения, как правило, непродолжительны (от 5 до 30 секунд), а в начале эякуляции выделяется преимущественно семенная жидкость, не содержащая сперматозоиды. Эякуляция обогащенной сперматозоидами фракции начинается, когда движения газа ослабевают. Поэтому не стоит беспокоиться, если не удалось собрать жидкость, выделившуюся на первом этапе эякуляции. Сразу после прекращения движений тазом многие кобели пытаются «переступить» через руку оператора, как через круп суки при соскакивании с нее. Оператор не должен препятствовать >тому движению, которое приводит к повороту налитою кровью полового члена на 180 градусов, в результате чего он выдается назад между задних ног (рис. 32-4). Все это время оператор продолжает сдавливать луковицу полового члена, пока не убедится в завершении эякуляции (см. рис, 27-4, стр. 1036).
Получение спермы обычно занимает от 2 до 5 минут, что соответствует продолжительности второй фазы эякуляции (т.е. выделению обогащенной сперматозоидами спермы). В это время прозрачная
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ • 1121
Рис. 32-3. Опер пгор, удерживающей напряженный половой член кобеля на начальной стадии получения спермы.
пластмассовая пробирка уже должна быть подсоединена к искусственному влагалищу, а вся система во время начальной стадии стимуляции эякуляции должна находиться в руке оператора которой он согревает пробирку Сперма собак относительно устойчива к холоду, что устраняет необходимость использования теплой водяной бани или термостата. Использование прозрачной пластиковой пробирки обеспечивает визуальный контроль состояния спермы. Удерживая пробирку в одной руке, оператор одновременно защищает ее от чрезмерного воз действия света. Пока в пробирку поступает непрозрачная (богатая сперматозоидами) сперма беловатого или кремового цвета, следует продолжать сбор эякулята. Когда эякулят становится прозрачным (нс содержит сперматозоидов), процедуру сбора можно прервать. Если оператор не уверен в том, что эякуляция бо! атой сперматозоидами спермы прекратилась, сбор следует остановить через 5 минут. Продолжение сбора только приведет к разбавлению и ненужному увеличению объема спермы, так как в третьей фазе эякуляции снова выделяется прозрачная не содержащая сперматозоидов жидкость предстательной железы.
Третья фракция эякулята не требуется для успеха искусственного осеменения. Однако часть ее можно использовать, когда конечный объем полученного материала недостаточен для проведения ИО. Количество спермы зависит от размеров суки: чем она крупнее, тем больший объем спермы необходим для ее осеменения. Адекватный объем спермы колеблется от 2 ю 10 мл. При этом для осеменения суки весом до 10 кг требуется 3 мл спермы или меньше, а для суки весом свыше 20 кг - 5 мл и больше. Если для того или иного анализа нужно дополнительное количество жидкости предстательной железы, то систему, уже содержащую богатую сперматозоидами сперму, следует заменить новой системой для сбора спермы.
Собранный материал нсобхо имо использовать для осеменения в течение ближайших 5-10 минут. После окончания сбора спермы кобеля удаляют из помещения, чтобы он не отвлекал внимание. Пе-
Рис. 32-4. Посчс прекращения сильны < толчковых движении таза кобель обычно переступает через руку оператор-, что приводит к повороту полового члена на 180 градусов, в результате которого он оказывается направленным назад. Оператор продолжает надавливать на проксимальную часть налитой кровью луковицы большим и указательным пальцами для поддержания »рекции (показано стрелкой). (Снимок любезно предостав ich F. Davidson, Davis, СА).
ред проведением осеменения еще раз проверяют цвет и консистенцию спермы. Небольшую кашпо спермы помещают на теплое предметное стекло и под микроскопом быстро оценивают содержание в ней сперматозоидов и их подвижность. Все эго время оператор должен держать пробирку со спермой в руке, не давая ей охладиться и защищая се от небезопасного воздействия ультрафиолетового излучения. По другой методике, пока лаборант оценивает состояние спермы, основное ее количество переносится в емкость ля осеменения. Не\ юв-летворителъный цвет или консистенция спермы, олигоспермия или присутствие мертвых половых клеток должны быть установлены до проведения ИО, чтобы заводчик мог поменять производителя. Выявление этих проблем после осеменения исключает возможность использования другого кобеля, если помет подлежит регистрации в Американском клубе собаководства (АКС).
Процедура осеменения
Описаны процедуры внугривлагалищного и виут-риматочного осеменения сук. В первом случае сперму с помощью специальной длинном пипетки вводят в краниальную часть влагалища, ближе
1122 • ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
к шейке матки. Этот метод обычно используют при осеменении свежеполученной и охлажденной спермой. При внутриматочном осеменении сперму вводят непосредственно в полость матки. Это обеспечивает повышенную частоту беременности и больший размер помета, чем при внутривлага-лищном осеменении, по-видимому, благодаря тому, что большее число введенных сперматозоидов достигает маточно-трубного соустья (Thomassen et al, 2000). Для внутриматочного осеменения необходимо специальное оборудование или хирургическая операция. К нему рекомендуется прибегать при использовании замороженной/размороженной спермы, поскольку оттаявшие сперматозоиды обладают пониженной жизнеспособностью.
Внутривлагалищное осеменение с использованием мочеточникового катетера или пипетки для осеменения. Хотя имеется много «инструментов» для внутривлагалищного осеменения, мы чаще всего используем шприц объемом 12 мл, гибкий одноразовый мужской мочеточниковый катетер или жесткую пластмассовую пипетку для осеменения (производства Synbiotics, США) и хирургические перчатки. Катетер или пипетка должны быть достаточно длинными, чтобы достигать краниального отдела влагалища, расстояние до которого равно половине длины от половых губ до реберной дуги (Root Kustritz, Johnston, 2000). Все инструменты должны быть стерильными. Надев перчатки, оператор заполняет шприц спермой, подсоединяет его к стерильному катетеру и дополнительно набирает в шприц 1 “3 мл воздуха. Во время и сразу после введения спермы во влагалище задняя часть туловища суки должна быть приподнята выше ее головы. Обычно мы просим делать это хозяина, который сидит на стуле, накрыв колени салфеткой и положив на них задние ноги собаки (рис. 32-5). Оператор отводит ее хвост в сторону и вводит во влагалище указательный палец в несмазанной перчатке (за исключением очень маленьких собак) ладонью вверх. Перчатку можно смазать мазью, но она не должна обладать спермицидными свойствами. Катетер проводят вдоль указательного пальца в свод влагалища, следя за тем, чтобы случайно не ввести его в мочеиспускательный канал. Такой способ проведения катетера позволяет также миновать ямку клитора. Катетер проходит вдоль дорсального свода влагалища до упора; это означает, что он достиг краниальной стенки свода влагалища или просто уперся в одну из его складок. В этом случае катетер мягко проталкивают как можно дальше вперед до тех пор, пока не появится уверенность, что его локализация обеспечит высвобождение сперматозоидов вблизи шейки матки. Катетеризация шейки вслепую весьма затруднительна из-за ее груд недоступности, обусловленной особенностями анатомического строения (Roszel, 1992).
После опорожнения содержащего сперму шприца его отсоединяют от катетера, заполняют несколькими миллилитрами воздуха, опять соединяют с
Рис. 32-5. Хозяин собаки сидит на стуле, удерживая суку на коленях во время процедуры осеменения и обеспечивая, таким образом, перемещение спермы в матку под действием силы тяжести. Собаку продолжают удерживать в указанном положении в течение 20 минут после осеменения.
катетером и снова опоражнивают, добиваясь, таким образом, выведения во влагалище всей остающейся в катетере спермы. Необходимо избегать введения во влагалище слишком большого количества воздуха, так как он может вытеснить часть семени наружу через вульву.
После введения семени катетер извлекают из влагалища: заднюю часть тела собаки продолжают удерживать в приподнятом состоянии как минимум в течение 20 минут, чтобы введенная сперма продолжала перемещаться по половым путям в матку. Одновременное введение во влагалище пальца в перчатке и легкое («нежное») поглаживание дорсальной слепки влагалища стимулирует сокращение мышц репродуктивного тракта, способствуя продвижению сперматозоидов в сторону яичников. К сожалению, специальные исследования для оценки эффективности или необходимости згой процедуры не проводились.
По окончании процедуры собаку переводят в нормальное положение и обеспечивают ей полный покой примерно в течение часа, чтобы предотвратить вытекание семени из влагалища. Следует также избегать надавливания на живот собаки (например, не приподнимать ее, положив руку под живот).
Обычно суки юстаточно легко переносят процедуру осеменения, не испытывая ни дискомфорта, ни болезненных ощущений. Процедура весьма
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ • 1123
проста в техническом отношении и занимает немного времени.
Резиновое искусственное влагалище является единственным повторно используемым элементом системы сбора эякулята. Несмотря на утверждения. что газовая стерилизация оборудования может приводить к повреждению сперматозоидов, мы не сталкивались с такой проблемой при повторном использовании искусственного влагалища. Возможно, это связано с тем, что резиновый конус выполняет, в основном, роль воронки, а получаемая сперма всякий раз поступает в новую, чистую пробирку для одноразового применения
Вкутривла! алшцнос осеменение с помощью специального баллонного катетера. Чтобы обеспечить надежное продвижение сперматозоидов через шейку в полость матки можно использовать специально разработанный баллонный катетер (зонд Osiris, производства LM.V., Франция). Катетер состоит из двух частей: наружного чехла с баллончиком Фолея на конце и второго (внутреннего) катетера с боковым выпускным отверстием, который вставляется в наружный чехол. Катетер вводят во влагалище до шейки матки, после чего в баллончик нагнетают воздух и он перекрывает влагалище прижимаясь к его стенкам. После этого продвигают внутренний катетер, содержащий сперму, и после ее высвобождения катетер втягивают обратно в чехол Фолея, вследствие чего его боковое отверстие закрывается (England, 2000). Устройство оставляют во влагалище примерно на 15 минут, чтобы вся введенная сперма оказалась вблизи шейки матки. Все это время задняя часть тела собаки должны оставаться приподнятой выше ее головы, что способствует перемещению сперматозоидов через шейку в полость матки. После извлечения катетера из влагалища и возвращения собаки в нормальное положе
ние ей должен быть обеспечен покой примерно на протяжении часа, чтобы предотвратить вытекание семени из влагалища. Следует также избегать надавливания на живот собаки (например, нс приподнимать ее, положив руку под живот).
Внутриматочное осеменение через шейку. Описаны методы трансцервикальной катетеризации для внутриматочного осеменения. Один из них состоит во введении жесткого катетера вслепую через влагалище и шейку матки, которая фиксируется пальцем через брюшную стенку (Andersen, 1980). Чаще, однако, катетер вводят через шейку под контролем эндоскопической визуализации наружного цервикального канала (см. рис. 32-6; Wilson. 1993). Эндоскопическая методика трансцервикального внутриматочного осеменения завоевывает все большую популярность, особенно при использовании за-мороженной/размороженной спермы. Жесткий или гибкий эндоскоп, желательно снабженный механизмом поворота катетера на конце, вводят во влагалище и продвигают до шейки матки. Сопутствующее расширение влагалища облегчает нахождение цервикального канала. Содержащий сперму катетер вводят через эндоскоп и с помощью поворотного механизма направляют его в наружный цервикальный канал. Во время выполнения этой процедуры собака должна быть максимально неподвижна, что может потребовать применения седативных средств. После извлечения катетера и эндоскопа задняя часть се тела должна оставаться приподнятой выше головы в течение, по меньшей мере. 20 минут, чтобы облегчить перемещение сперматозоидов от шейки к маточно-трубному соустью.
Внутриматочное осеменение хирургическим путем. Для доступа к телу матки через брюшную полость делают каудальный разрез вдоль вентральной срединной линии. Используют внутривенный
Рис. 32-6. Трансцервикальное осеменение сук немецкой овчарки (А) и лабрадора-ретривера (Б) с помощью гибкого катетера (показан стрелками) при непосредственной визуализации шейки через оптоволоконный эндоскоп.
1124 • ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
игольчатый катетер калибра 22, который вводят в полость матки, а выход из нее перекрывают, чтобы предотвратить истечение спермы во влагалище. После этого сперму медленно высвобождают в полость таким образом, чтобы она перемещалась в рога матки. По завершении этой процедуры извлекают катетер, а место его введения обрабатывают пальцами для ускорения гемостаза; наложение шва обычно не требуется (England, 2000). Разрез брюшной стенки закрывают обычным способом. Недостатками этого метода являются необходимость общего наркоза, возможность послеоперационных осложнений и ограничения этического характера, допускающие только однократное осеменение в попытке добиться беременности. Кроме того, метод может быть рекомендован лишь при использовании замороженной/размороженной спермы.
Успешность искусственного осеменения свежеполученной спермой
Успешность ИО (т.е. наступление беременности) зависит от целого ряда факторов, в том числе характеристик спермы производителя, соблюдения правил получения и подготовки спермы для осеменения, состояния репродуктивной функции суки и введения спермы в переднюю часть влагалищного свода в нужные сроки эструса. Важность временного фактора трудно переоценить. При выборе сроков всегда следует исходить из сопоставления особенностей поведения суки, результатов повторных цитологических анализов влагалищных мазков, определения концентрации прогестерона в плазме крови (твердофазным иммуноферментным методом) и, по возможности, данных эндоскопического исследования влагалища (см. гл. 19 и 20). Серийный цитологический анализ влагалищных мазков и повторные определения концентрации прогестерона в сочетании с наблюдением за поведением собаки не вызывают затруднений, относительно недороги и дают достаточно точное представление об оптимальных сроках осеменения суки.
Коль скоро принято решение о целесообразности ИО, следует проводить его ежедневно или через день до тех пор, пока цитологическое исследование влагалищных мазков не подтвердит наступление диэструса. Ввиду невозможности точно предсказать время овуляции, повторное осеменение повышает вероятность зачатия, обеспечивая присутствие сперматозоидов в половых путях самки как на начальных, так и на поздних стадиях эструса.
При искусственном осеменении частота зачатия может быть ниже, а размер помета меньше, чем при естественном оплодотворении (Andersen, 1980; Linde-Forsberg, Forsberg, 1993). Это, по-видимому, обусловлено несколькими причинами. В естественных условиях сперматозоиды проходят через шейку матки в ее полость и яйцеводы под воздействием давления, тогда как при ИО сперма вводится не
посредственно в матку. Половой член в состоянии эрекции практически заполняет влагалище и сдавливает отверстие мочеиспускательного канала, а его луковица препятствует обратному току семени. Большое количество эякулята, обычно образующееся в продолжительной третьей фазе, проталкивается через шейку, поскольку отрезаны другие пути его распространения. При естественном оплодотворении сокращения матки способствуют дальнейшему транспорту сперматозоидов, тогда как при ИО этот механизм не функционирует. Большая продолжительность «замка» в естественных условиях также повышает вероятность зачатия, так как в течение всего этого времени продолжается эякуляция, и общий объем образующейся спермы превышает вместимость влагалища.
При правильном проведении ИО с использованием свежеполученной спермы частота зачатия составляет 60-90% (Linde-Forsberg, Forsberg, 1993). Наши результаты сопоставимы с показателями, достигнутыми вышеописанными методами. Хотя введение спермы непосредственно в полость матки может повысить частоту зачатия, для выполнения этой процедуры необходимо специальное оборудование. Кроме того, введение катетера через шейку матки затруднено в силу особенностей ее анатомического строения. Согласно одному из сообщений (Andersen, 1980), частота зачатия при внутриматоч-ном осеменении 17 собак составила 76%, что сопоставимо с его частотой при внутривлагалищном осеменении. Применение эндоскопической техники должно повысить эффективность ИО по сравнению с традиционными методами, но пока эта техника еще мало доступна.
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ
В 1986 году Американский клуб собаководства начал регистрировать щенят, полученных в результате искусственного осеменения свежей обогащенной спермой. Правильно обогащенная и охлажденная сперма может храниться в холодильнике в течение нескольких дней, а после подогревания и осеменения сохраняет способность оплодотворять яйцеклетку. Наполнитель помогает сохранить целостность оболочек сперматозоидов, защищая их от повреждения при изменениях температуры или встряхивании во время транспортировки; одновременно он служит источником необходимых питательных веществ, стабилизирует pH, осмоляльность и ионную силу среды (Linde-Forsberg, 1991). Наиболее широко используемые наполнители для хранения спермы при низкой температуре перечислены в табл. 32-1 (Concannon, Battista, 1989; Johnston et al, 2001). После приготовления наполнитель можно аликвотировать и хранить в замороженном виде на протяжении примерно 1 года (Held, 1997). Помимо указанных в таблице, на рынке имеются патентованные наполнители для спермы
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
1125
ТАБЛИЦА 32-1. НАЗВАНИЕ И СОСТАВ НАПОЛНИТЕЛЕЙ, ИСПОЛЬЗУЮЩИХСЯ ДЛЯ ХРАНЕНИЯ ФРАКЦИИ СПЕРМЫ КОБЕЛЕЙ С ВЫСОКИМ СОДЕРЖАНИЕМ СПЕРМАТОЗОИДОВ ПРИ ПОНИЖЕННОЙ ТЕМПЕРАТУРЕ НА ПРОТЯЖЕНИИ 1-4 ДНЕЙ*
Цитратно-бикарбонатный наполнитель с яичным желтком 100 мл водного раствора, содержащего моногидрат лимонной кислоты (0,07 г), бикарбонат натрия (0,17 г), дигидрат цитрата натрия (1,16 г), хлорид калия (0,03 г), глицин (0,75 г), глюкозу (0,24 г) и яичный желток (20 мл); pH 6,8, 308 мОсм/кг (Province et al, 1984)
Цитратно-декстрозый наполнитель с яичным желтком 100 мл водного раствора, содержащего цитрат натрия (1,45 г), декстрозу (1,25 г), яичный желток (250 мл) (Held, 1997)
Наполнитель с капроновой кислотой и яичным желтком 100 мл водного раствора, содержащего дигидрат цитрата натрия (1,56 г), глицин (0,78 г), глюкозу (0,23 г), N-капроновую кислоту (1,0 мл 2,5%-ного раствора), каталазу (1,0 мл раствора, содержащего 45 мг/100 мл) и яичный желток (20 мл); pH 7,0, 326 мОсм; барботируется газообразным азотом непосредственно перед использованием (Province et al, 1984)
ТРИС-буферный наполнитель с яичным желтком
100 мл водного раствора, содержащего 2,4 г ТРИС-основания (Трис-аминометана), 1,3 г моногидрата лимонной кислоты, 1 г фруктозы, 3,8 мл глицерина и 20% яичного желтка (Gill et al, 1970)
Наполнитель на снятом молоке
Снятое молоко, прогретое при 95°С в течение 10 мин, а затем охлажденное; pH 6,5, 277 мОсм (Province et al, 1984)
Наполнитель на обезжиренном молоке
Стерилизованное гомогенизированное молоко 2%-ной жирности (Christiansen, 1985)
Наполнитель на сливках и яичном желтке
800 г сливок (12% жирности) и 200 г яичного желтка (Linde-Forsberg, 1991)
Цитратно-желточный наполнитель
Раствор цитрата натрия (80%) и яичный желток 20% (Christiansen, 1984)
Из: Concannon PW, Battista М: In: Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1248 и Johnston SD, Root Kustritz MV, Olson PNS: Semen collection, evaluation, and preservation. In: Johnston SD, Root Kustritz MV, Olson PNS (eds): Canine and Feline theriogenology. Philadelphia, WB Saunders Co, 2001, p 287.
♦) Разведение: 1 часть спермы на 3-10 частей наполнителя при 23-37°С с последующим охлаждением до 5°С в течение 2-3 часов. В качестве антибиотиков чаще всего используются пенициллин (1000 ME) или дигидрострептомицин (1 мг/мл).
собак, состав которых не раскрывается. Они производятся компаниями Synbiotics (США) и Camelot Farms (США), а также Международным Банком спермы собак (International Canine Semen Bank, США). Для сохранения спермы собак пригодны также наполнители спермы жеребцов (Piccamonti, 1997). Молочные белки защищают сперму от воздействия низкой температуры, а яичный желток обеспечивает целостность акросомальных и митохондриальных мембран и тоже защищает клетки от
холодового стресса. Прежде чем вводить наполнитель в полученную сперму, его небольшое количество смешивают с несколькими каплями спермы, чтобы выявить возможное отрицательное действие на жизнеспособность половых клеток. После обогащения наполнителем сперму медленно в течение 30-60 минут охлаждают до 5°С и в последующем хранят при этой температуре. Следует избегать резких перепадов температуры. При правильном приготовлении обогащенной спермы сперматозоиды остаются жизнеспособными на протяжении суток, а при определенных условиях до 5 дней.
Методика кратковременного сохранения спермы позволяет за ночь доставить самолетом свеже-обогащенный материал в нужное место и избежать затрат на его замораживание или транспортировку собаки. Для этого в эякулят вводят наполнитель, помещают его в небольшую емкость и перевозят в контейнере типа термоса. Во время перевозки и хранения он должен оставаться охлажденным (примерно до 5°С). Перед употреблением эякулят медленно подогревают на водяной бане до 37°С, после чего проводят микроскопирование небольшой фракции для подтверждения жизнеспособности сперматозоидов. Техника осеменения обогащенной спермой не отличается от вышеописанной при использовании свежей спермы. Обычно прибегают к внутривлагалищному осеменению, особенно если сперма была получена не более чем за 24 часа до начала ИО. В идеале проводят множественное осеменение, начиная с 3-4 дня после первого увеличения концентрации прогестерона в плазме крови суки, что позволяет максимально повысить вероятность оплодотворения.
Частота зачатия после внутривлагалищного осеменения обогащенной свежеполученной спермой составляет 50-80% (Farstad, 1984; Linde-Forsberg, Forsberg, 1989; Goodman, Cain, 1997; England, 2000). Обычно она выше, чем при использовании замороженной спермы. Обогащенная свежая сперма не повреждается при замораживании, она легче проходит через шейку матки, в полость которой, в результате, поступает больше сперматозоидов. Кроме того, свежеполученные сперматозоиды дольше остаются жизнеспособными в половых путях суки, а выбор сроков осеменения не столь ограничен, как при использовании замороженной спермы.
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ ЗАМОРОЖЕННОЙ СПЕРМОЙ
Длительное хранение спермы с использованием техники глубокого замораживания практикуется уже на протяжении нескольких лет. Еще в 1981 году Американский клуб собаководства разрешил регистрацию потомства, получаемого в результате осеменения замороженной/размороженной спермой. Это решение основывается на практике регистрации, закрепленной в «Указаниях по регистрации пометов, полученных путем искусственного осеме
1126 • ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
нения» (постановление АКС R198-1). Начиная с января 1999 г., АКС требует идентификации ДНК всех кобелей, от которых получают сперму для замораживания. Пробы для этой цели предоставляют владельцы животных, делая соскобы слизистой ротовой полости (Edwards et al, 1997). На протяжении последнего десятилетия значительно возросло число центров, производящих замораживание спермы. В известной степени это объясняется появлением новых частных компаний, которые проводят обучение пользователей замороженной спермой и выдают соответствующие «лицензии» (например, CLONE, International Canine Semen Bank (Международный банк спермы собак) или Synbiotics, США). Подобные учреждения должны быть признаны АКС. Такая сертификация направлена на упорядочение регистрации сбора и хранения спермы, но не является гарантий ее качества (Paccamonti, 1997).
Преимущества применения замороженной спермы состоят в возможности более широкого распространения ценных генетических признаков, профилактике заболеваний, уменьшении числа кобелей-производителей в экспериментальном питомнике, сохранении спермы собак, имеющих заболевания, которые могут служить моделями аналогичных патологических состояний у человека, и устранении необходимости транспортировки собак к месту вязки. Вместе с тем, несмотря на все эти преимущества, одобрение АКС и относительную доступность источников замороженной спермы, она до сих пор недостаточно широко используется заводчиками и ветеринарами. Это частично объясняется необходимостью затрат на транспортировку кобеля к месту взятия спермы и на ее замораживание и хранение, а также недостаточно высокой частотой зачатия при использовании замороженного материала. Наилучшие результаты при использовании замороженной спермы получают при ИО молочных коров, а наихудшие - при осеменении собак. Средняя частота беременности после ИО коров и собак замороженной спермой составляет соответственно 90 и 40-60% ее частоты при естественном оплодотворении (Concannon, Battista, 1989; Linde-Forsberg, Forsberg, 1993). Разный процент оплодотворения у отдельных видов животных обусловлен разными условиями этого процесса, которые зависят, помимо прочего, от формы, размера и биохимических характеристик сперматозоидов.
Методы применения замороженной спермы описаны в работах Smith, (1984), Concannon, Battista (1989), England (1993) и Johnston et al (2001). Процедура замораживания спермы, предназначенной для ИО, включает ее получение от кобеля-производителя, обогащение соответствующим наполнителем, уравновешивание при пониженной температуре, замораживание в виде удобных для практического использования аликвот, хранение, размораживание и оплодотворение суки в оптимальные сроки ее репродуктивного цикла (Concannon, Battista, 1989). В состав наполнителей спермы обычно входят про
текторы, такие как яичный желток, молочные белки или сывороточный альбумин крупного рогатого скота, которые защищают сперматозоиды во время охлаждения, замораживания и оттаивания, а также поддерживают необходимую величину pH. Кроме того, они включают криопротекторы (глицерин, рибозу и арабинозу), которые уменьшают вероятность повреждения клеток во время замораживания и последующего оттаивания, сахара (глюкозу, фруктозу и маннозу) в качестве источников энергии и антибиотики, предотвращающие рост бактерий. Необходим тщательный анализ спермы, полученной от любого кобеля и предназначенной для замораживания (см. стр. 1034). В процессе криогенного сохранения происходит повреждение сперматозоидов, поэтому при исходно низком содержании половых клеток в полученном материале оно становится еще меньше после замораживания и оттаивания и в результате сперма может оказаться непригодной для искусственного осеменения. Замораживание спермы - сложный и тонкий процесс. Успешность осеменения зависит от жизнеспособности сперматозоидов после размораживания и от правильного соотношения между составом наполнителя, продолжительностью уравновешивания, скоростью замораживания и оттаивания. Методы криопреципитации более подробно описаны в работах Smith (1984), Concannon, Battista (1989) и England (1993).
Сперму замораживают в форме таблеток, в капиллярах или стеклянных ампулах. Таблетки образуются, когда аликвоты обогащенной и охлажденной спермы по 50-100 мкл помещают в углубления в сухом льде, а затем хранят в перфорированных нейлоновых стаканчиках в жидком азоте (Concannon, Battista, 1899; Jonston et al, 2001). Капилляры из поливинилхлорида (ПВХ) объемом 0,25-0,5 мл заполняют охлажденной обогащенной спермой, вводят пузырек воздуха, укупоривают с одного конца ватным тампоном, а с другого порошкообразным ПВХ пирролидоном, затем подвешивают в парах жидкого азота, а после замораживания помещают в жидкий азот (Concannon, Battista, 1989; Held, 1997). Качество спермы собак после размораживания таблеток и капилляров может отличаться (Battista et al, 1988). Кроме того, оно зависит от природы наполнителя и других факторов.
Замороженную сперму сохраняли на протяжении 9 лет без существенного уменьшения подвижности сперматозоидов после оттаивания. Сперму, хранившуюся более 4 лет, после оттаивания использовали для осеменения. В отдельных центрах используются разные процедуры размораживания, а также разное количество таблеток или капилляров для одного искусственного осеменения. Обычно такие центры предоставляют образцы спермы вместе с указаниями по размораживанию, которые необходимо строго выполнять. Фаза оттаивания является важным компонентом процесса замораживания-размораживания спермы и столь же существенна для выживания сперматозоидов, как и фаза
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ • 1127
заморозки. Непосредственно перед осеменением следует оценить жизнеспособность и подвижность сперматозоидов посредством микроскопирования небольшой капли размороженной спермы.
Количество сперматозоидов, совершающих поступательное движение, является наиболее важным фактором, влияющим на успешность оплодотворения (Nothling et al, 1997). Одной из самых трудных задач, связанных с искусственным осеменением собак, является сохранение подвижности сперматозоидов во время инкубации при 37°С после размораживания спермы (рис. 32-7). Подвижность сперматозоидов кобелей может резко понизиться уже через 30-60 минут после оттаивания спермы (Olar, 1984; Battista et al, 1988). В одном из исследований она обычно не превышала 10%, а часто и вовсе отсутствовала после одного часа инкубации при 37°С (Olar, 1984). Это отчасти объясняет тот факт, что после введения замороженной/размороженной спермы в краниальную часть влагалищного свода частота зачатия ниже, чем при ее введении непосредственно в полость матки (Linde-Forsberg, Forsberg, 1989; Fontbonne, Badinand, 1997).
Вероятность получения потомства после искусственного осеменения зависит от способа обработки спермы, количества подвижных сперматозоидов на одно осеменение, локализации введенной спермы в половых путях самки, сроков оплодотворения и количества осеменений. Количество доз осемене-
Время после оттаивания (часы) при 23-37°С.
Рис. 32-7. Среднее содержание подвижных сперматозоидов в процентах от общего числа клеток после замораживания и оттаивания в сперме отдельных видов, включая быков, людей, баранов, кабанов и жеребцов, во время инкубации при 37°С и в сперме кобелей во время инкубации при (1) 37°С и (2) при 23°С. По: Concannon PW, Battista М: In: Kirk RW (ed): Current Veterinary Therapy X. Philadelphia, WB Saunders Co, 1989, p 1247.
ния, которое можно получить из одного эякулята, зависит от качества спермы и составляет от 1 до 20 на эякулят. Истинная минимальная доза, необходимая для достижения беременности неизвестна. Традиционно таковой считается 100-200 х 106 сперматозоидов на одно осеменение (Nuthling et al, 1997), хотя имеются сообщения о частоте беременности до 80% после повторных трансцервикальных внутриматочных осеменений аликвотами, содержавшими по 30 х 106 сперматозоидов (Wilson, 1993; Xhjthling et al, 1995). Для внутриматочного осеменения требуется меньше сперматозоидов, чем для внутривлагалищного.
Вероятность беременности и нормального размера помета после ИО замороженной/размороженной спермой в значительной степени зависит от проведения ИО в течение тех 2-3 дней, когда здоровые, способные к оплодотворению яйцеклетки находятся в яйцеводах суки. У собак овуляция происходит на стадии незрелого (первичного) ооцита, оплодотворение которого возможно только после полного созревания, экструзии полярного тельца и завершения первого мейотического деления. Эти процессы происходят в течение, по меньшей мере, 48 часов после овуляции. Способные к оплодотворению яйцеклетки остаются жизнеспособными в яйцеводах на протяжении последующих 4-5 дней, а способность свежих сперматозоидов оплодотворять яйцеклетки сохраняется не менее 6-7 дней. Продолжительность жизни замороженных сперматозоидов собак меньше, чем у свежевыделенных клеток, они быстро погибают после размораживания. В связи с этим их лучше всего использовать для ИО, когда все яйцеклетки вышли из яичника и созрели (т.е. с 4 по 7 день после пика концентрации ЛГ). Для выбора оптимального срока осеменения время выброса ЛГ нередко определяют по началу повышения концентрации прогестерона в сыворотке крови суки. Наиболее благоприятный для оплодотворения период начинается через 4 дня после начала увеличения концентрации прогестерона. Начав осеменение, его повторяют ежедневно или через день, как минимум 3 раза. Повторное осеменение умеренными дозами повышает вероятность беременности по сравнению с однократным осеменением большим количеством спермы (Fontbonne et al, 2000). Техника внутривлагалищного и внутриматочного осеменения замороженной/размороженной спермой такая же, как при использовании свежеполученного материала.
В целом, средняя частота беременности после внутривлагалищного осеменения собак замороженной/размороженной спермой в правильно выбранные сроки составляет от 30 до 60%. Большинство коммерческих центров, поставляющих замороженную сперму, гарантируют частоту оплодотворения 60-70%, рассчитанную на основании количества пометов на одну суку или на суку, осемененную в подходящее время (не считая осеменений в неправильно выбранные сроки, проведенных прежде времени по настоянию владельца собаки) (Concannon, 1991;
1128
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ СВЕЖЕЙ ОБОГАЩЕННОЙ СПЕРМОЙ И ЗАМОРОЖЕННОЙ СПЕРМОЙ
Fontbonne et al, 2000; Thomassen et al., 2000). Столь высокие показатели не подтверждаются опубликованными данными об успешности искусственного внутривлагалищного осеменения, которая колеблется от 0 до 60% (Andersen, 1980; Smith, 1984; Fontbonne, Badinand, 1993). При внутриматочном осеменении с использованием трансцервикального пути или хирургического метода оплодотворение имело место в 45-85% случаев (Smith, 1984; Farstad, Andersen-Berg, 1989; Linde-Forsberg, Forsberg, 1989 и 1993; Fontbonne, Badinand, 1993).
Более низкий процент зачатия при внутривла-галищном осеменении по сравнению с внутри-маточным объясняется, вероятно, значительным снижением подвижности сперматозоидов и продолжительности их жизни после замораживания и оттаивания, что отрицательно сказывается на эффективности транспорта клеток через шейку матки. Осеменение через каннюлированную шейку лучше, чем введение спермы в краниальный отдел влагалищного свода. Однако эта процедура технически сложна из-за относительно трудной доступности шейки (ее наружное отверстие направлено вкось и обращено к днищу влагалища, передняя часть влагалища перекрыта выдающейся внутрь дорсо-медиальной складкой, а его полость чересчур мала) или особенностей ее анатомического строения (например, наличия складок, рис. 32-6) (Concannon, 1991; Wilson, 1993). Тем не менее, каннюлиривание можно осуществить с помощью гибкого катетера в сочетании с прямой визуализацией его введения через оптоволоконный эндоскоп либо с помощью жесткой канюли с определением положения шейки путем пальпации через брюшную стенку (Battista et al, 1988; Wilson, 1993).
ЛИТЕРАТУРА
Andersen К Artificial insemination and storage of canine semen In Morrow DA (ed) Current Therapy in Thenogenology Philadelphia, WB Saunders, 1980, p 661
Battista M, et al Canine sperm post-thaw survival following freezing in straws or pellets using pipes, lactose, tns or test extenders Proceedings of the Eleventh International Congress on Animal Reproduction (Dublin) 3 229, 1988
Concannon PW Frozen semen artificial insemination in dogs Proceedings, Society for Thenogenology, San Diego, 1991, p 247
Concannon PW, Battista M Canine semen freezing and artificial insemination In Kirk RW (ed) Current Veterinary Therapy X Philadelphia, WB Saunders, 1989, p1247
Edwards J, et al DNAand the АКС AKC Gazette 114 55, 1997
England GCW Cryopreservation of dog semen A review } Reprod Fertil Suppl47 243, 1993
England GCW Semen evaluation, artificial insemination, and infertility in the male dog In Ettmger SJ, Feldman EC (eds) Textbook of Veterinary Internal Medicine, 5th ed Philadelphia, WB Saunders, 2000, p 1571
Farstad W Bitch fertility after natural mating and after artificial insemination with fresh or frozen semen J Small Anim Pract 25 561, 1984
Farstad W, Andersen-Berg К Factors influencing the success rate of artificial insemination with frozen semen in the dog J Reprod Fertil 39(Suppl) 289, 1989
Fontbonne A, Badmand F Canine artificial insemination with frozen semen Comparison of mtravagmal and intrauterine deposition of semen J Reprod Fertil Suppl 47 325, 1993
Fontbonne A, et al Artificial insemination with frozen semen in the bitch Influence of progesterone level, inseminating dose and number of inseminations performed in the same bitch Advances in Dog, Cat and Exotic Carnivore Reproduction Book of Abstracts The Fourth International Symposium on Canine and Feline Reproduction and the Second Congress of the European Veterinary Society for Small Animal Reproduction Oslo, June 29-July 1, 2000, p 58
Goodman MF, Cam JL Retrospective evaluation of artificial insemination with chilled extended semen in the dog J Reprod Fertil Suppl 51 554, 1997
Held JJ Critical evaluation of the success and role of chilled and frozen semen in today’s veterinary practice In Proceedings of the Canine Male Reproductive Symposium, Annual Meeting of the Society for Thenogenology, Montreal, September 17-20, 1997 Nashville, Society for Thenogenology, 1997, p49
Johnston SD, Root Kustntz MV, Olson PNS Semen collection, evaluation, and preservation In Johnston SD, Root Kustntz MV, Olson PNS (eds) Canine and Feline Thenogenology Philadelphia, WB Saunders, 2001, p 287
Lmde-Forsberg C Achieving canine pregnancy by using frozen or chilled extended semen Vet Clin North Am 21 467, 1991
Linde-Forsberg C, Forsberg M Fertility in dogs in relation to semen quality and the time and site of insemination with fresh and frozen semen J Reprod Fertil 39(Suppl) 299, 1989
Linde-Forsberg C, Forsberg M Results of 527 controlled artificial inseminations in dogs J Reprod Fertil Suppl 47 313, 1993
Nothlmg JO, et al Success with mtravagmal insemination of frozen-thawed dog semen A retrospective study J S Afr Vet Assoc 66 49, 1995
Nothlmg JO, et al Semen quality after thawing Correlation with fertility and fresh semen quality m dogs J Reprod Fertil Suppl 51 109, 1997
Olar TT Cryopreservation of dog spermatozoa Doctoral dissertation Fort Collins, Colo, 1984, Colorado State University
Paccamonti D Technical aspects of using fresh cooled or frozen canine semen In Proceedings of the Canine Male Reproductive Symposium, Annual Meeting of the Society for Thenogenology, Montreal, September 17-20, 1997 Nashville, Society for Thenogenology, 1997, p 81
Root Kustntz MVR, Johnston SD Artificial insemination in the bitch In Bonagura JD (ed) Kirk’s Current Veterinary Therapy XIII Philadelphia, WB Saunders, 2000, p 916
Roszel JF Anatomy of the canine uterine cervix Compend Contm Educ 14 751, 1992
Smith FO Update on freezing canine semen Proceedings of the Annual Society for Thenogenology, Denver, 1984, p 61
Smith FO Cryopreservation of canine semen Proceedings of the Society of Thenogenology, Austin, Texas, 1987, p 249
Thomassen R, et al Artificial insemination with frozen semen m the dog Results from 1994 to 1998 Advances in Dog, Cat and Exotic Carnivore Reproduction Book of Abstracts The Fourth International Symposium on Canine and Feline Reproduction and the Second Congress of the European Veterinary Society for Small Animal Reproduction Oslo, June 29-July 1, 2000, p 59
Wilson MS Nonsurgical intrauterine artificial insemination in bitches using frozen semen J Reprod Fertil Suppl 47 307, 1993
Часть IX
РЕПРОДУКЦИЯ КОШЕК
Глава 33
РЕПРОДУКЦИЯ КОШЕК
КОШКА-САМКА
АНАТОМИЧЕСКИЕ ОСОБЕННОСТИ......1130
ЭСТРАЛЬНЫЙ ЦИКЛ...............1130
Наступление половой зрелости и возраст, оптимальный для размножения.... 1130
Сезонность эстрального цикла...1131
Фазы эстрального цикла........1131
ФИЗИОЛОГИЯ ОВУЛЯЦИИ...........1137
Индукция овуляции в результате коитуса..........1137
Варианты индукции.............1138
Индукция овуляции без коитуса..1138
ЛОЖНАЯ БЕРЕМЕННОСТЬ.......... 1139
Определение...................1139
Причины.......................1139
Физиология....................1139
Поведение.....................1139
ПОЛОВОЕ ПОВЕДЕНИЕ В ЭСТРУСЕ .... 1140
ИСКУСТВЕННОЕ РАЗМНОЖЕНИЕ.......1142
Индукция эструса...............1142
Искусственное осеменение.......1142
Перенос эмбрионов.............1142
БЕРЕМЕННОСТЬ................. 1143
Продолжительность беременности.. 1143
Имплантация и развитие зародышей 1143
Гормональный статус...........1143
Поведение.....................1143
Диагностика беременности.......1143
Возобновление эстральных циклов ..1144
Уход за беременной кошкой......1144
РОДЫ..........................1144
Эндокринология................1144
Родовой акт...................1144
Создание благоприятных для родов условий........................1145
ОСЛОЖНЕНИЯ БЕРЕМЕННОСТИ И РОДОВ........................1145
Внематочная беременность........1145
Предродовое вагинальное кровотечение...................1146
Дистоция......................1146
Смертность среди котят........1147
Послеродовое вагинальное кровотечение...................1147
Субинволюция плацентарных мест... 1147
Задержание последа............1148
Острый метрит.................1148
Пролапс матки.................1148
Отсутствие заботы о потомстве...1148
Выращивание котят-сирот.
Использование кошки-кормилицы /
Искусственное вскармливание...1148
Гиперплазия молочных желез......1149
Мастит и эклампсия............1150
СПОНТАННАЯ РЕЗОРБЦИЯ ПЛОДОВ /РАННЕЕ ПРЕРЫВАНИЕ БЕРЕМЕННОСТИ /ВЫКИДЫШ...................... 1150
Частота возникновения.........1150
Анамнез и клинические признаки.... 1150
Причины.......................1150
Лечение.......................1152
КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА.....................1152
Патофизиология................1152
Общие сведения, анамнез, физикальное исследование..................1153
Диагностика...................1153
Лечение.......................1154
БЕСПЛОДИЕ.....................1156
Общие замечания...............1156
Бесплодие у кошек с нормальными
полиэструсным циклом (рис. 33-9) 1156 Отсутствие эстральных циклов..1158
Затяжной интерэструсный интервал. 1159 Фолликулярные кисты...........1159
Отказ от спаривания...........1159
Эструс у кошек с удаленными яичниками
и маткой....................1160
ПРЕДОТВРАЩЕНИЕ ЭСТРАЛЬНЫХ
ЦИКЛОВ. КОНТРАЦЕПЦИЯ........1160
Хирургическая контрацепция....1160
Химическая контрацепция.......1160
Неплановая вязка.
Предотвращение имплантации...1161
КОТЫ
АНАТОМИЯ И ФИЗИОЛОГИЯ........1161
Половой член.................1161
Семенники....................1162
ОБСЛЕДОВАНИЕ.................1162
Мошонка, семенники, препуций и половой член.................1162
Получение, хранение и консервация спермы.......................1162
БЕСПЛОДИЕ....................1163
Список сокращений
ГнРГ - гонадотропин-рилизинг гормон
КГЭ - кистозная гиперплазия эндометрия
ЛГ - лютеинизирующий гормон ПГ F2a - простагландин F2a УЗИ - ультразвуковое исследование
ФСГ - фолликулостимулирующий гормон
ХГл - хорионический гормон лошади ХГч - хорионический гормон человека
КОШКА-САМКА
АНАТОМИЧЕСКИЕ ОСОБЕННОСТИ
Половые губы кошки относительно нечувствительны к эстрогену и во время проэструса и эструса остаются небольшими и покрытыми шерстью. Это отличает кошку от суки, у которой размеры половых губ в указанных фазах цикла резко увеличиваются. Другое различие состоит в том, что преддверие влагалища, влагалище и шейка матки у кошки расположены горизонтально по прямой линии. Преддверно-влагалищное соединение у кошки узкое и неэластичное, поэтому его исследование проводят под анестезией, используя довольно небольшой эндоскоп (3 мм), снабженный приспособлением для
инсуффляции (раздувания) просвета влагалища (Shille, Sojka, 1995).
ЭСТРАЛЬНЫЙ ЦИКЛ
Наступление половой зрелости и возраст, оптимальный для размножения
Принято считать, что половая зрелость у домашней кошки наступает тогда, когда к соответствующему фотопериоду ее вес достигает по меньшей мере 80% от веса взрослого животного (2,3-3,2 кг). Многие кошки становятся половозрелыми в возрасте от 6 до 9 месяцев. Половая зрелость и первая течка у
РЕПРОДУКЦИЯ КОШЕК • 1131
нормальной кошки могут наступить уже через 5 месяцев после рождения и обычно не позднее 12 месяцев. Существует мнение, что породистые кошки достигают половозрелости позднее, чем беспородные и метисы, а кошки, которых не выпускают из дома, - позднее, чем те, что живут на свободе.
Оптимальный для размножения возраст кошки - от 1,5 до 7 лет. После 7-8 лет течки начинают становиться нерегулярными, снижается численность потомства, чаще наблюдаются выкидыши и врожденные пороки у котят. У молодых кошек (моложе года) течки тоже могут быть нерегулярными и половое поведение менее предсказуемо.
Сезонность астрального цикла
У взрослой кошки эструсы следуют один за другим многократно (полиэструс) на протяжении всего сезона размножения, и эту циклическую активность прерывают лишь беременность, ложная беременность или заболевания. В зонах умеренного климата сезон размножения начинается спустя 1-2 месяца после зимнего солнцестояния и продолжается до летнего солнцестояния и дольше. Хотя начало и продолжительность активности яичников зависят от географической широты местности и породы кошек, тем не менее определяющим фактором является продолжительность светового дня.
Недостаточная интенсивность или длительность освещения служит главной причиной затянувшегося периода полового покоя (анэструса) у кошек, содержащихся в помещении. В районах умеренного климата северных широт сезон размножения кошек обычно начинается в январе-феврале, пик половой активности наступает в феврале-марте, а завершение сезона размножения возможно в любое время между июнем и ноябрем. Обычно течки прекращаются в сентябре, и анэструс продолжается с октября до конца декабря.
Не только естественное, но и искусственное освещение влияет на активность яичников кошки. У животных, содержащихся при искусственном освещении (эквивалентном освещенности, создаваемой 100-ваттной лампой в помещении размером 4 х 4 м) не менее 10 часов в сутки, циклическая активность может сохраняться на протяжении всего года (Shille, Sojka, 1995). В то же время влияние освещения на эстральный цикл кошек, постоянно находящихся в помещении, оценить довольно сложно. Вариабельный характер этого освещения - то искусственного, то естественного - обычно делает его недостаточным для кошки. Однако и искусственный свет в доме не всегда приводит к ожидаемой циклической активности яичников, хотя, как показывают наблюдения, у большинства кошек в этих условиях период полового покоя наступает лишь в октябре, ноябре или декабре.
По некоторым данным, интервалы между эстру-сами удлиняются при сравнительно высокой температуре воздуха (Concannon, Lein, 1983). Это мы
наблюдали и в нашем питомнике. Однако эффект тепла и/или влажности на активность яичников подвержен индивидуальным колебаниям и в определенной степени зависит от адаптации конкретного животного к резким изменениям этих факторов в среде обитания. По-видимому, длинношерстные кошки более зависимы от фотопериода, чем короткошерстные: анэструс в зимний период наблюдается у 90 и 40% из них, соответственно (Banks, 1986; Shille, Sojka, 1995).
Фазы астрального цикла
Эстральный цикл у кошек, так же, как у собак, включает четыре основные фазы: проэструс, эструс, диэструс и анэструс. Однако различие в циклической активности этих животных заключается в том, что кошкам свойственны сезонные полиэс-трусные циклы и индуцированная овуляция. Кроме того, у нормальной кошки существует еще и пятая фаза циклической активности - так называемый интерэструс, или интерэструсный интервал.
Проэструс
Определение. Проэструс обычно определяют как период, когда кошка привлекает котов, но не подпускает их к себе. В это время у нее начинают активно функционировать яичники, фолликулы синтезируют и секретируют эстроген, изменяется эксфолиативная вагинальная цитология - идет подготовка к спариванию и беременности. Эта фаза заканчивается садкой кота и спариванием.
Клинические признаки и продолжительность. Проэструс наблюдается у кошек нерегулярно. Чаще происходит прямой переход из анэструса или интерэструса в фазу эструса. В одном из наблюдений проэструс удалось зарегистрировать лишь в 27 из 168 эстральных циклов (Shille, Sojka, 1995). Начало проэструса характеризуется изменением поведения кошки - она постоянно трется головой и шеей о любые доступные предметы, непрерывно мяукает, прогибает спину (лордоз), катается по полу.
Отличить кошку, находящуюся в фазе проэструса, от кошки в эструсе можно по ее отношению к коту. В проэструсе половое поведение кошки обычно менее выражено, чем в фазе эструса, но даже если оно сходно в обеих фазах, тем не менее в проэструсе кошка не позволяет коту делать садку. Распознать проэструс трудно, так как его признаки бывают неотчетливыми (например, ограничиваются лишь повышенной ласковостью животного); кроме того, продолжительность проэструса составляет лишь 0,5-2 дня (Shille, Sojka, 1995). У кошек не обнаруживаются многие изменения, свойственные проэструсу у собак (у последних он длится от 5 до 9 дней и сопровождается кровянистыми вагинальными выделениями, припухлостью вульвы и стойкими изменениями вагинальной цитологии).
1132 • РЕПРОДУКЦИЯ КОШЕК
Гормональные изменения. В яичниках наблюдается увеличение фолликулов, диаметр которых в раннем проэструсе составляет менее 1 мм, а к началу эструса достигает 1,5 мм. Концентрация эстрогена в плазме крови во время анэструса или в интерэструсе обычно ниже 15 пг/мл. Содержание эстрогена (17а-эстрадиола) во время фолликулярной фазы превышает 20 пг/мл. Наступление проэструса сопровождается быстрым ростом фолликулов и резким подъемом концентрации циркулирующего эстрогена. Менее чем за 24-48 часов концентрация эстрогена часто увеличивается вдвое и достигает уровня, превышающего 40 пг/мл. Такое быстрое начало роста фолликулов, а также демонстраций полового поведения у кошек отличается от более постепенного, последовательного появления соответствующих признаков у собак. Изменения со стороны наружных половых органов у кошек значительно менее выражены, чем у собак, и это служит еще одной из причин того, что кратковременный период проэструса у кошек может остаться незамеченным.
Цитология влагалища. Методика исследования. Вагинальное цитологическое исследование кошкам проводится редко. Это обусловлено главным образом тем, что состояние проэструса у кошки быстро сменяется эструсом и не всегда удается четко разграничить цитологическую картину, свойственную каждой из этих фаз. Мазки для цитологи
ческого исследования у кошек берут практически так же, как у сук (см. гл. 19). Обычно поступают следующим образом. Одной рукой ассистент берет кошку за загривок и прижимает ее локтевые суставы к поверхности стола, а другой рукой удерживает хвост, приподнимая заднюю часть тела так, чтобы была видна вульва. Ветеринар раздвигает половые губы, одновременно немного приподнимая промежность. Ватный тампон (намотанная на тонкую палочку стерильная, смоченная физиологическим раствором вата) вводят в преддверие влагалища и продвигают вдоль свода влагалища по дорсальной поверхности. Тампон слегка вращают в обоих направлениях и осторожно извлекают.
Вся процедура обычно занимает несколько секунд и редко бывает болезненной. Описаны и другие методы, применяемые у собак, однако метод увлажненного ватного тампона прост, быстр, надежен и недорог. Ветеринару следует помнить, что кошка является индуцированным овулятором (т. е. овуляцию у нее индуцирует половой контакт), а потому любая процедура получения влагалищного мазка может привести к овуляции.
Как только ватный тампон удален из влагалища, его осторожно прокатывают 2-3 раза по поверхности предметного стекла, которое затем окрашивают. Но сначала мазок просто подсушивают на воздухе или фиксируют 90% метанолом и потом высушива
ТАБЛИЦА 33-1. ВАГИНАЛЬНАЯ ЦИТОЛОГИЯ ВО ВРЕМЯ ФОЛЛИКУЛЯРНОЙ ФАЗЫ И ПОВЕДЕНЧЕСКОГО ЭСТРУСА (ПО ДАННЫМ ИССЛЕДОВАНИЯ СЕРИИ КОШЕК)*
Дни фол- Процент Процент Вагинальные эксфолиативные эпителиальные клетки
ликуляр-ной фазы кошек с типичным для эструса поведением «ЧИСТЫХ» вагинальных мазков парабазальные промежуточные поверхностные безъядерные поверхностные Эритроциты Лейкоциты
-5 0 0 <10 40-50 40-60 <10 Нет Единичные или более
-4 0 0 <10 40-50 40-60 <10 Нет Единичные или более
-3 0 0 <10 40-50 40-60 <10 Нет Единичные или более
-2 0 10-20 <10 40-50 40-60 <10 Нет Единичные или более
-1 0 15-25 <5 30-40 40-60 <10 Нет Единичные или более
Ф1 <10 30-50 <5 20-30 50-60 ~10 Единичные или более Нет
Ф2 30-40 60-80 <5 10-30 ~60 10-15 Единичные или более Нет
ФЗ 40-60 80 <5 10-20 ~60 15-35 Нет Нет
Ф4 70-90 80 — <10 ~60 ~40 Нет Нет
Ф5 80-90 80 — <10 ~60 ~40 Нет Нет
Ф6 90-100 80 — <10 ~60 ~40 Нет Нет
Ф7 80-90 80 — <10 ~60 ~40 Нет Нет
И1 40-60 60-80 — 10-20 30-60 ~40 Нет Единичные или более
И2 30-50 40-60 <5 20-40 30-60 15-30 Нет Единичные или более
ИЗ 10-30 20-40 <5 20-40 30-60 10-20 Нет Единичные или более
И4 <10 10-30 <5 30-60 30-60 ~10 Нет Нет
И5 <10 10-30 <5 30-60 30-60 ~10 Нет Нет
* По: Shille VM. et al.: Follicular function in the domestic cat as determined by estradiol-17a concentrations in plasma: Relation to estrous behavior and cornification of exfoliated vaginal epithelium. Biol. Reprod., 1979, 21:953.
Ф - фолликулярная фаза; И - Интерэструс
ют. Для окрашивания мазков можно использовать различные красители, как это описано для собак. Рекомендуется краситель Diff-Quik ввиду его надежности и простоты применения.
Терминология. Окрашенный мазок исследуют под микроскопом при малом увеличении, чтобы оценить степень «чистоты» приготовленного препарата. Чистоту определяют как отсутствие неклеточного загрязнения, эозинофильных и базофильных полос слизи, а также агрегации влагалищных клеток в виде пластов. У кошек эстроген вызывает разжижение влагалищной слизи. Детальное изучение клеток влагалища проводят при большом увеличении. Исследуемые эксфолиативные (слущивающиеся) клетки классифицируют на категории, как это описано в гл. 19. Согласно классификации, выделяют следующие категории клеток: парабазальные, промежуточные, поверхностные (ороговевшие) и безъядерные поверхностные.
Интерпретация результатов. Предполагается, что наиболее чувствительным и адекватным показателем эстрогенной активности у кошки служит чистота влагалищных мазков (Shille, Sojka, 1995) (табл. 33-1). Распознать эпителиальные клетки влагалища значительно легче, если их не слишком много и отсутствуют остатки разрушенных клеток.
Вагинальные мазки становятся чистыми примерно у 10% кошек за 2 дня до начала фолликулярной фазы; кроме того, мазки становятся чистыми в одной трети эстральных циклов до начала демонстраций полового поведения и более чем в 90% эстральных циклов во время фолликулярной фазы. Если мазок стал чистым до появления поведенческих признаков эструса, это показывает, что он взят в коротком периоде проэструса.
Цитологически и клинически начало проэструса можно определить по чистоте влагалищных мазков, а его окончание - по поведению кошки: с наступлением эструса она допускает садку кота и спаривание. Последовательные морфологические изменения эпителиальных клеток влагалища соответствуют повышению секреции эстрогена фолликулами. Возрастает относительное количество безъядерных поверхностных клеток: к первому дню фолликулярной фазы оно поднимается до 10% и выше. Процентное содержание в мазке ядерных поверхностных клеток остается относительно стабильным, тогда как доля промежуточных и парабазальных клеток снижается (см. табл. 33-1). Иногда во влагалищных мазках обнаруживаются и другие клетки - эритроциты на раннем этапе фолликулярной фазы и изредка лейкоциты в ее конце.
Эструс и фолликулярная фаза
Определение эструса. Эструс («течка») у кошки определяется как период спаривания, а значит, единственным признаком, позволяющим распознать эту фазу, является поведенческая реакция кошки на кота. Эструс начинается, когда кошка до
РЕПРОДУКЦИЯ КОШЕК • 1133
пускает садку кота и коитус, и заканчивается, когда такая реакция исчезает. Изменение поведения кошки при переходе от анэструса к эструсу происходит очень быстро, обычно меньше чем за 12-24 часа.
Определение фолликулярной фазы. Поведение кошки во время эструса связано с синтезом и секрецией эстрогена фолликулами. Яичники увеличиваются, а созревающие в них полупрозрачные фолликулы достигают 2-3 мм в диаметре. Однако признаком эструса служит только половая активность кошки, тогда как «фолликулярная фаза», или фаза активной функции фолликулов, - это физиологическое состояние, которое выявляют биохимически по концентрации эстрогена в плазме крови. В периоды анэструса и интерэструса эта концентрация у большинства кошек составляет менее 12-15 пг/мл. Признаком фолликулярной активности служит концентрация эстрогена в плазме, превышающая 20 пг/мл.
Продолжительность фолликулярной фазы составляет в среднем приблизительно 7,5 дня и колеблется в пределах от 3 до 16 дней. Половой контакт не влияет на длительность фолликулярной фазы вне зависимости от того, вызвал ли он овуляцию или ее не было. Так, если коитус индуцировал овуляцию, фолликулярная фаза длится в среднем 7,0 дней, а если овуляции не произошло, то в среднем 7,2 дня; в отсутствие половых контактов средняя продолжительность этой фазы - 7,7 дня (Shille et al, 1979).
Концентрация эстрогена в плазме во время фолликулярной фазы быстро нарастает, остается на повышенном уровне в течение 3-4 дней, а затем начинает круто снижаться. За день до наступления фолликулярной фазы содержание эстрогена в плазме составляет менее 12-15 пг/мл. В первый день фолликулярной фазы концентрация гормона достигает приблизительно 25 пг/мл, на третий день увеличивается примерно до 45 пг/мл, на пятый день - несколько превышает 50 пг/мл, на 7-й день составляет 20-25 пг/мл и на 8-й день обычно снижается до 10 пг/мл. Поскольку уровень эстрогена на 8-й день ниже 15 пг/мл, этот срок по существу можно рассматривать как первый день интерэструса (при условии, что овуляция не произошла). Пик уровня эстрогена во время фолликулярной фазы в среднем немного превышает 50 пг/мл, но может колебаться от 25 до 80 пг/мл и более (Shille et al, 1979).
Окончание фолликулярной функции характеризуется резким падением концентрации эстрогена в плазме, причем это падение от максимума до уровня ниже 20 пг/мл происходит за 2-3 дня. Снижение уровня эстрогена начинается независимо от коитуса или индукции овуляции.
Полиэструс и фолликулярная фаза. Кошки относятся к полиэструсным животным. Это означает, что на протяжении сезона размножения кошка многократно демонстрирует переход к типичному для эструса поведению. Периоды эструса связаны с возобновлением фолликулярной фазы, однако соотношение между этими событиями не всегда рав-
1134 • РЕПРОДУКЦИЯ КОШЕК
Рис. 33-1. Возможные варианты динамики эстрогенной секреции у циклирующей кошки (схематическое изображение). Показаны выраженные, быстрые циклические флуктуации уровня эстрогена в плазме крови, отражающие функцию овариальных фолликулов. Точками (...) обозначены пери-
оды эструса, совпадающие с повышением уровня эстрогена в плазме. Продолжительность эструса в норме обычно составляет 2-10 дней, в среднем приблизительно 7 дней (а). Обратите внимание на то, что иногда период эструса захватывает две или более фолликулярных фазы. Часто это происходит в результате того, что концентрация эстрогена в плазме крови до наступления очередной фолликулярной фазы не падает ниже уровня 20 пг/мл (б), однако это бывает не всегда (в). Показаны также периоды интерэструса (---), которые продолжаются
от 3 до 15 дней, в среднем - 8 дней (г).
но 1 : 1. В целом, вслед за каждым периодом, когда концентрация эстрогена достигает пика, происходит ее снижение до исходного уровня (рис. 33-1). Это показывает, что многократно повторяющееся развитие, созревание и дегенерация фолликулов у кошек носит четкий волнообразный характер.
Связь поведенческих проявлений эструса с фолликулярной фазой. Выраженность характерного для эструса поведения кошки коррелирует с повышением концентрации эстрогена в плазме, которое происходит в каждой фолликулярной фазе. У 10% кошек такое поведение наблюдается в первый день фолликулярной фазы. По мере развития фолликулярной фазы этот процент постепенно увеличивается, и за день до ее окончания почти все кошки демонстрируют половую охоту (рис. 33-2). Это поведение наблюдается у многих кошек и после окончания фолликулярной фазы. Исследования показали, что спустя 1, 2, 3 и 4 дня после завершения фолликулярной фазы оно сохраняется примерно у 60, 40, 20 и 5% кошек, соответственно (Shille et al, 1979).
Продолжительность эструса. Усредненные данные. В среднем кошка проявляет половую охоту на протяжении примерно 7 дней цикла. Однако здесь существуют значительные колебания, и у здоровых фертильных кошек это поведение может длиться и 1 день, и 21 день. В тех случаях, когда произошел коитус (независимо от того, наступила или не наступила вслед за ним овуляции), эструс
длится приблизительно 8,5 дней, а в отсутствие полового контакта - в среднем только 6 дней (Shille et al, 1979).
Влияние полового контакта на продолжительность эструса. Предполагается, что факторы, запускающие овуляторный выброс лютеинизирующего гормона (ЛГ), влияют также на центры, регулирующие половое поведение кошки. Стимулирующий сигнал из влагалища передается по афферентным нервным путям через спинной мозг в гипоталамус, где преобразуется в гормональный сигнал, а именно - повышает секрецию гонадотропин рилизинг-гормона (ГнРГ). Секретируемый после коитуса ГнРГ способен усиливать или продлевать поведенческие проявления эструса. Нет сомнения в том, что половой контакт не сразу ведет к выходу кошки из эструса и не сокращает период влечения к котам, даже если коитус индуцировал овуляцию.
Влияние индивидуальных особенностей кошки на половое поведение в эструсе. Отсутствие соответствующего эструсу поведения либо слишком длительное проявление такого поведения неоднократно наблюдались у здоровых кошек во время регулярно повторяющихся, «нормальных» фолликулярных фаз. Описано несколько кошек, которые не проявляли характерного для эструса поведения в ожидаемый срок (определявшийся по концентрации эстрогена в плазме) предположительно потому, что были боязливы и занимали нижнюю ступень «социальной лестницы» (Shille et al, 1979). Однако явно выраженные страх и подчиненность не всегда отмечаются у кошек, не проявляющих полового поведения в фолликулярной фазе цикла. Вряд ли правильно называть таких кошек ненормальными. Многие кошки, у которых в течение одного сезона отсутствует половое поведение, начинают вести себя нормально в последующие сезоны.
Затяжной эструс. Это еще одно отклонение, иногда наблюдаемое у кошек, которые позже могут оказаться плодовитыми и нормальными в иных отношениях. В отдельных случаях затянувшееся проявление половой охоты обусловлено перекрыванием эффектов постоянно повышенных концентраций эстрогена и периодов (волн) созревания фолликулов (см. рис. 33-1). Однако затяжной или непрерывный поведенческий эструс встречается у кошек и на фоне раздельных, повторяющихся фолликулярных фаз. По концентрации эстрогена в плазме эти кошки не отличаются от тех, у которых отмечаются более типичные формы полового поведения. Пока остается неясным, почему у небольшого процента кошек отсутствует координация полового поведения и концентрации эстрогена в плазме.
Клинические признаки эструса. Кошка в эструсе ластится к своему хозяину подобно тому, как она ведет себя в проэструсе. Однако она более интенсивно трется о предметы, мяукает и катается по полу. При поглаживании спины и почесывании у основания хвоста кошка припадает к полу передней
РЕПРОДУКЦИЯ КОШЕК • 1135
Дни - заштрихованная область соответствует фолликулярной фазе
Рис. 33-2. Зависимость между уровнем эстрогена в плазме крови (выше 20 пг/мл) и числом кошек, демонстрирующих характерное для эструса поведение в каждый из дней фолликулярной фазы.
частью тела, поднимает таз и отводит хвост в сторону. Она допускает садку кота и спаривание. Детальнее поведение кошки в эструсе описано ниже (см. «Половое поведение в эструсе»).
Вагинальная цитология. Интерпретация результатов. При изучении влагалищных мазков, взятых у кошки во время эструса, обнаруживаются две основные особенности. Одна относится к «чистоте» мазка, другая состоит в изменении процентного соотношения между различными типами эпителиальных клеток влагалища. Чистота мазка определяется как отсутствие в нем неклеточного детрита, а также эозинофильных и базофильных полосок слизи, что позволяет отчетливо видеть вагинальные эпителиальные клетки. Частично очищение мазка обусловлено тем, что эстроген вызывает разжижение влагалищной слизи. Приблизительно у 10° о кошек мазки начинают осветляться до наступления фолликулярной фазы, и у одной трети исследованных самок цитологическая чистота регистрируется до появления каких-либо поведенческих признаков эструса. Во время фолликулярной фазы до 90% вагинальных мазков выглядят чистыми. То же самое отмечается у некоторых кошек после завершения фолликулярной фазы, а в 20% случаев картина чистого мазка сохраняется в течение последующих 5 дней (Shille et al. 1979). Исследуя мазок, легко распознать очищение влагалища, а это - наряду с изменениями уровня эстрогена - один из наиболее характерных признаков циклической активное ги у кошки.
О развивающихся во влагалище изменениях можно судить по относительному содержанию эпителиальных клеток разных типов (см. табл. 33-1). В первый день фолликулярной фазы число безъядерных поверхностных клеток возрастает до 10% от
общего числа клеток и продолжает увеличиваться, достигая 40°о в период с 4-го по 7-ой дни цикла: затем следует медленный спад, и на 12-13-й дни (5-6-й дни после завершения фолликулярной фазы) относительное содержание этих клеток становится меньше 10%. Доля промежуточных клеток, составляющая во время метэструса приблизительно 40-50%, падает ниже 10% на 4-7-й дни фолликулярной фазы. Парабазальные клетки в течение фолликулярной фазы исчезают, но через 5 дней после ее окончания их число возвращается к уровню 5-10°о от общего числа клеток. Ядерные поверхностные клетки на всем протяжении фолликулярной фазы составляют 40-60°о от всех вагинальных эпителиальных клеток (см. табл. 33-1) (Shille et al. 1979).
Практическое значение анализа вагинальной цитологии. Иногда к ветеринару приходят за консультацией по поводу отсутствия у кошки течек. У ряда таких кошек фолликулярные фазы следуют одна за другой и происходят соответствующие колебания концентрации эстрогена в плазме. Однако если кошка запугана и занимает последнее место в иерархии кошек в доме, эструс у нее может и не проявляться. Циклические изменения гормонального статуса кошки можно установить, исследуя вагинальные мазки, получаемые 1 или 2 раза в неделю на протяжении 1-2 месяцев, особенно в течение февраля и марта.
Получать материал и готовить из него мазки нетрудно научить самого владельца кошки. Высушенные на воздухе мазки владелец доставляет затем в лабораторию для окрашивания и анализа. Это простой и недорогой метод исследования практически здоровых, но не циклирующих кошек. На практике вагинальные цитологические исследования у кошек проводят редко, но они имеют большую ценность в
1136 • РЕПРОДУКЦИЯ КОШЕК
случаях субклинического протекания эстральных циклов. Данный способ применяют также в случае транспортировки кошек для вязки, особенно если они не проявляют типичного для эструса поведения, будучи помещены в новые условия.
Исследование вагинальных мазков проводится также после коитуса, чтобы выяснить, произошла ли у кота эякуляция и способен ли он к оплодотворению. Об этом судят просто по наличию спермы, однако даже если она присутствует, невозможно сказать, индуцировал ли коитус выброс ЛГ и тем самым овуляцию.
Интерэструс
Определение. Кошки - полиэструсные животные, т.е. фаза половой активности (эструс) у них многократно повторяется на протяжении сезона овариальной активности (см. рис. 33-1). Чередование фаз половой активности и коротких периодов полового, или репродуктивного покоя обусловлено волнообразным характером активации фолликулов. Период между волнами функционирования фолликулов, когда, как считается, яичники гормонально неактивны, называют интерэструсным интервалом, интерэструсным периодом или интерэструсом.
Гормональные изменения и продолжительность интерэструса. Эффект концентрации эстрогена в плазме крови. Интерэструс наступает после затухания фолликулярной функции, приводящего к резкому падению концентрации эстрогена в плазме до уровня ниже 20 пг/мл. Этот низкий (базальный) уровень эстрогена сохраняется на протяжении всего интерэструса, средняя продолжительность которого составляет 8 дней с колебаниями от 2 до 19 дней (Shille, Sojka, 1995).
Влияние коитуса. Спаривание, если оно не индуцирует овуляцию, вероятно, не влияет на длительность интерэструса. Показано, что в тех случаях, когда кошки имели коитус без последующей овуляции, интерэструс у них был короче (8 дней), чем у кошек, не имевших полового контакта (10 дней).
Эструс, захватывающий две фолликулярные фазы или более. Встречаются (изредка) кошки, у которых, судя по их поведению, интерэструс отсутствует, т.е. эструс (течка) продолжается на протяжении двух или более фолликулярных фаз, несмотря на типичную циклическую функцию фолликулов (см. рис. 33-1). Изменение гормонального статуса, характерное для интерэструсного периода, у этих кошек происходит, однако их поведение не соответствует ожидаемому в интерэструсе. В некоторых случаях поведенческий эструс перекрывает интерэструсные интервалы, несмотря на низкую концентрацию эстрогена в этот период (менее 20 пг/мл). Как правило, у таких животных выброс эстрогена во время фолликулярной фазы такой же, как и у кошек с поведенческим проявлением интерэструса. Однако у других кошек наблюдались цикли
ческие колебания уровня эстрогена, при которых его минимальная концентрация оставалась выше 20 пг/мл. В этих случаях затянувшиеся поведенческие проявления течки, без перерыва на интерэструс, можно объяснить тем, что кошка постоянно находится под эстрогенным воздействием.
Интерэструс длится гораздо дольше среднего 8-дневного срока, если была индуцирована овуляция (ложная беременность или беременность). Овуляция приводит к развитию желтых тел, которые секретируют прогестерон. Поскольку фазы полового цикла, когда доминирует влияние прогестерона, относятся к фазам диэструса, они обсуждают ниже, в разделе «Диэструс».
Поведение. В интерэструсном периоде кошка возвращается к нормальному состоянию. Она не спаривается, не привлекает котов, утрачивает свою любвеобильность к людям, т. е. отсутствуют признаки, характерные для эструса. Кошка не трется о предметы, не катается и не издает криков.
Вагинальная цитология. Во время интерэструса в вагинальном мазке вновь начинают преобладать ядерные поверхностные и промежуточные эпителиальные клетки. На протяжении всей этой фазы процент клеток различных типов остается постоянным (см. табл. 33-1). В одном из исследований было определено соотношение клеток всех типов в интерэструсе: парабазальные клетки - 2%, промежуточные - 48%, поверхностные - 46% и безъядерные - 4% (Shille et al, 1979). Наблюдались некоторые колебания этих величин, однако, как правило, не слишком выраженные, что позволяло с уверенностью исключить состояние эструса. Кроме того, во время интерэструса в мазках присутствует хорошо различимый детрит (неклеточный материал), который иногда затрудняет распознавание вагинальных эпителиальных клеток.
Диэструс
Диэструс у кошки (и у суки) определяют как фазу, при которой преобладает действие прогестерона. Для развития желтых тел и начала секреции прогестерона у кошки необходимо, чтобы произошло спаривание, индуцирующее овуляцию (такой же эффект дает механическая стимуляция влагалища). В течение 24—48 часов после овуляции образовавшиеся желтые тела приобретают способность секретировать прогестерон. В том случае, если овуляция у кошки произошла, но беременность не наступила, концентрация эстрогена в плазме падает до базального уровня, а содержание прогестерона возрастает (овуляция и беременность обсуждаются в специальных разделах этой главы). На диэструс указывает концентрация прогестерона выше 1-2 нг/мл, причем к 14-18-му дню после овуляции она уже превышает 20 нг/мл.
Яичники содержат несколько плотных желтых тел, цвет которых близок к оранжевому. Желтые
РЕПРОДУКЦИЯ КОШЕК • 1137
тела функционируют от 35 до 37 дней, и падение концентрации прогестерона до базального уровня свидетельствует о прекращении их функции. После этого может пройти дополнительно еще 35 дней, прежде чем у кошки вновь начнется эструс; почему сроки возобновления эструса варьируют, остается не совсем понятным. Во время диэструса матка увеличивается в результате очень сильного утолщения эндометрия. Рога матки набухают и изгибаются в серозной оболочке, образуя штопорообразные выпячивания, которые можно прощупать. Влагалище, его преддверие и вульва сохраняют свой обычный вид.
Анэструс
Определение и клинические признаки. Анэструсом называют период репродуктивного покоя. В это время кошка не привлекает котов, не демонстрирует полового поведения и не имеет признаков активного функционирования яичников. Кошку в анэструсе трудно отличить от кастрированной.
Сезонность и продолжительность. Обычно анэструс начинается в октябре и заканчивается в конце декабря. Описаны случаи, когда у кошек в некоторых питомниках (или у отдельных кошек) начало анэструса приходилось на середину лета (от июня до августа) и он продолжался вплоть до января. Индивидуальные колебания длительности анэструса - часто наблюдаемое явление, хотя начало анэструса могут индуцировать и такие внешние факторы, как укорочение светового дня и летняя жара. Обычно анэструс заканчивается после зимнего солнцестояния, с увеличением долготы дня.
Начало анэструса у кошки можно отдалить, если содержать животное в условиях по крайней мере 10-часового искусственного освещения (эквивалентного освещению, которое создает лампа в 100 вт в помещении размером 4 х 4 м). При таком содержании эстральный цикл у некоторых кошек продолжается в течение всего года (Concannon, Lein, 1983). Однако в отдельных случаях анэструс все же возникает в ноябре-декабре, несмотря на дополнительное искусственное освещение. Влияние искусственного освещения на домашних кошек, постоянно содержащихся в помещении, оценить трудно.
Концентрации гормонов и вагинальная цитология. В гормональном отношении анэструс сходен с затянувшимся интерэструсом. Концентрации эстрогена и прогестерона находятся на базальном уровне, концентрации гормонов гипофиза подвержены лишь незначительным колебаниям. Данные вагинальной цитологии совпадают с результатами исследования в интерэструсном периоде. Слущивающиеся вагинальные эпителиальные клетки включают менее 10% парабазальных, 40-70% промежуточных и 30-40% ядерных поверхностных клеток. В мазках отчетливо виден детрит.
ФИЗИОЛОГИЯ ОВУЛЯЦИИ
Индукция овуляции в результате коитуса
Стимуляция влагалища половым членом кота немедленно индуцирует у кошки активность ядер гипоталамуса, которые содержат большие количества ГнРГ. Высвобождение ГнРГ, происходящее при стимуляции влагалища у индуцируемых овулято-ров, каковыми являются кошки, вызывает выброс в кровь гипофизарного ЛГ. Показано, что выброс ЛГ у кошек происходит в пределах 15 минут после коитуса (Concannon et al, 1980; Johnson, Gay, 1981).
Количество выделенного в кровь ЛГ коррелирует с числом коитусов. Уровень гормона достигает максимума через 4 часа после начала множественных копуляций (от 8 до 12). Через 24 часа после этого пика уровень ЛГ в сыворотке крови возвращается к исходному. Показано, что максимальные концентрации ЛГ в сыворотке были существенно ниже у тех кошек, которым на протяжении 4 часов позволяли спариваться лишь 4 раза, а если допускалась только одна копуляция, то пик секреции ЛГ был еще ниже. От высоты этого пика зависит наступление овуляции: при ее индукции выявляются более высокие концентрации ЛГ, чем в случаях отсутствия овуляции (Concannon et al, 1980).
Каждое спаривание ведет к высвобождению ЛГ, однако его количество не всегда достаточно, чтобы вызвать овуляцию. После однократного спаривания овуляция происходит менее чем у половины кошек, явно находящихся в эструсе. В отличие от этого, 4 и более коитусов вызывают овуляцию у большинства кошек. Вязки могут продолжаться в течение нескольких дней, и массивный выброс ЛГ происходит изо дня в день. В каждый такой 24-часовой период выброс ЛГ прекращается через 2-4 часа после коитуса. Овуляция наступает приблизительно через 24 часа после пика секреции ЛГ (Concannon, Lein, 1983). У некоторых кошек концентрация ЛГ оказывается недостаточно высокой, чтобы вызвать овуляцию, несмотря на повторные спаривания с фертильным котом. Однако через несколько дней, т.е. в том же периоде эструса, спаривание с тем же котом может привести к овуляции.
Даже массивный выброс ЛГ, вызванный стимуляцией влагалища, не всегда приводит к овуляции. По-видимому, для эффективности овуляторного стимула необходима определенная степень зрелости развивающихся фолликулов. Это может быть одним из объяснений, почему спаривание не всегда индуцирует овуляцию. У некоторых кошек половая охота может возникнуть до того, как фолликулы достигли достаточной степени зрелости, обеспечивающей ответ на выброс ЛГ. С другой стороны, копуляция и выброс ЛГ во время данного цикла могут произойти слишком поздно, чтобы наступила овуляция. И, наконец, различие в интервалах времени между коитусом и овуляцией, произошедшей после одиночной серии спариваний, отражает, видимо,
1138 • РЕПРОДУКЦИЯ КОШЕК
Рис. 33-3. Варианты протекания репродуктивного цикла кошки.
вариабельный характер взаимосвязи между половым поведением и зрелостью фолликулов.
Варианты индукции
Обычно, хотя и не всегда, протекание эстрального цикла у кошки зависит от ее контактов с котом. Существуют 4 возможных варианта (рис. 33-3): 1) цикл может быть ановуляторным из-за отсутствия в период эструса половых контактов с котом; 2) цикл может быть ановуляторным из-за недостаточности половых контактов с котом (слишком мало копуляций или они происходят в слишком ранней или слишком поздней фазе цикла); 3) цикл может завершиться ложной беременностью, если после коитуса, индуцировавшего овуляцию, не произошло оплодотворения яйцеклеток; 4) происходят овуляция и оплодотворение с последующим развитием плодов.
Индукция овуляции без коитуса
Иногда овуляция наступает спонтанно (самопроизвольно) без полового контакта с котом и введения полового члена во влагалище. Достаточным для овуляции стимулом может быть поглажива
ние задней части туловища кошки или основания ее хвоста (Lofstedt, 1982). Выброс ЛГ может произойти, когда кот делает садку без совокупления (Concannon et al, 1980). Высвобождение ЛГ с последующей овуляцией удается также индуцировать путем искусственной стимуляции влагалища и/или шейки матки, например введениями ватного тампона во влагалище (как при процедуре получения вагинальных мазков).
При попытке индуцировать овуляцию ветеринар должен вводить во влагалище палочку или ватный тампон по крайней мере 4-8 раз с интервалами от 5 до 20 минут. Продолжительность каждого введения не должна превышать 2-5 секунд. Повторная стимуляция индуцирует овуляцию не у всех кошек, как это бывает и при естественном спаривании. У некоторых кошек эффект удается получить, повторив стимуляцию спустя несколько дней после первой попытки. Результат искусственной стимуляции во многом зависит от того, в какой момент эструса предпринимается попытка вызвать овуляцию. Успешная индукция овуляции не сокращает период эструса.
Овуляцию можно индуцировать или усилить с помощью лекарственных средств. С этой целью используют хорионический гонадотропин человека
РЕПРОДУКЦИЯ КОШЕК • 1139
(ХГч), который вводят внутримышечно в дозе 250 ME в 1 и 2-й дни течки (Lein, Concannon, 1983).
ЛОЖНАЯ БЕРЕМЕННОСТЬ
Определение
Ложная беременность, или псевдобеременность, представляет собой особое физиологическое состояние, обычно возникающее у кошки, когда у нее произошла овуляция, но не наступила беременность. Индукция овуляции сопровождается образованием желтых тел, синтезирующих и секретирующих прогестерон. Этот гормон угнетает секрецию ГнРГ гипоталамусом, что, в свою очередь, приводит к снижению гипофизарной секреции ЛГ и ФСГ (фолликулостимулирующего гормона). Продолжительность существования желтых тел у кошки составляет примерно 35 дней. На протяжении всего периода, что кошка находится под влиянием прогестерона, плюс в последующий более короткий период, необходимый для возникновения новой волны развития фолликулов, циклическая активность яичников у нее отсутствует. В итоге псевдобеременность обычно длится 40-50 дней.
Причины
Отсутствие оплодотворения после состоявшейся овуляции может быть обусловлено самыми разными факторами, как естественными, так и искусственными. К их числу относятся бесплодие кота, с которым спаривалась кошка, нарушение контакта сперматозоида с яйцеклеткой, искусственная индукция овуляции (с помощью ватного тампона или ХГч), заболевания полового тракта кошки, вызывающие гибель сперматозоидов, а также множество других причин. Все эти факторы сходны в том, что они не препятствуют ни коитусу, ни стимуляции им выброса ЛГ в количестве, индуцирующем овуляцию; однако независимо от индуцирующего стимула беременность у кошки не развивается.
Физиология
Овуляция всегда сопровождается образованием желтых тел. У некоторых видов плотоядных (собака, лисица, хорек) желтые тела функционируют в течение одного и того же времени независимо от наличия или отсутствия беременности. Кошка относится к тем нескольким видам, у которых - в отличие от других плотоядных - срок функционирования желтых тел (лютеиновая фаза) в отсутствие беременности примерно вдвое короче, чем при нормальной беременности. Это обеспечивает кошке явное репродуктивное преимущество перед другими плотоядными, поскольку более короткая лютеиновая фаза в случае несостоявшейся беременности позволяет быстрее вернуться к потенциально фертильному состоянию.
Более того, восстановление активности яичников у кошки может начаться уже через 7-10 дней после ложной беременности, тогда как у собаки овариальная активность появляется в среднем не ранее чем спустя 4,5-5 месяцев. На протяжении репродуктивного сезона у кошки может быть 4 или 5 ложных беременностей.
Концентрация прогестерона ниже 0,5 нг/мл (базовый уровень) указывает на отсутствие функционирующих желтых тел. Активная продукция этого гормона у кошек с ложной беременностью начинается приблизительно через 4 дня после 1-го дня копуляции и спустя примерно 1-2 дня после овуляции. Началом функционирования желтых тел считают тот день, когда концентрация прогестерона в плазме становится выше 1 нг/мл. Далее синтез и секреция гормона образовавшимися желтыми телами быстро нарастают. Как правило, его концентрация в плазме на 3-й день уже превышает 5 нг/мл, а на 16-25-й дни обычно достигает своего пика - более 20 нг/мл. Вслед за этим уровень прогестерона непрерывно падает и к 35-му дню функционирования желтых тел становится относительно низким. Период активности желтых тел у кошек с ложной беременностью составляет в среднем 36,5 дня (диапазон 30-50 дней) (рис. 33-4; Concannon, Lein, 1983).
Поведение
При ложной беременности кошки не проявляют половой активности на протяжении 35-70 дней, в среднем 45 дней (Concannon, Lein, 1983). Фаза активного функционирования желтых тел длится приблизительно 36-37 дней, за ней следует 7-10-
Рис. 33-4. Средние значения концентраций прогестерона и эстрадиола у беременных кошек и кошек с ложной беременностью. (Из: Christiansen IJ: Reproduction in the Dog and Cat. London, Bailliere Tindall, 1984).
1140 • РЕПРОДУКЦИЯ КОШЕК
Дни эструса
Рис. 33-5. Схематическое изображение поведенческого эструса у кошки (горизонтальная шкала), продолжающегося несмотря на повышение концентрации прогестерона в плазме крови, которое происходит в результате коитуса, овуляции и образования желтых тел. Обратите внимание, что эструс длится в среднем 7 дней, захватывая период нарастания секреции прогестерона.
дневный интерэструсный интервал. Следовательно, в случае ложной беременности промежуток времени между двумя последовательными эстру-сами у кошек значительно длиннее по сравнению с интервалами, которые не прерываются овуляцией и секрецией прогестерона. Постепенное снижение концентрации прогестерона в плазме крови, начинающееся примерно на 21-й день после коитуса, по-видимому, свидетельствует о том, что при ложной беременности желтые тела прекращают функционировать не потому, что подвергаются быстрому лизису, а потому, что срок их существования предетерминирован уже при овуляции и при этом их активность не поддерживается лютеотропными факторами, вырабатывающимися при нормальной беременности.
Одним из важных физиологических эффектов прогестерона у некоторых видов (лошадь, свинья и овца) является подавление эструса. Однако кошки и собаки в период возрастания концентрации прогестерона сохраняют половую активность. Как показано на рис. 33-5, поведенческий эструс у кошки продолжается на протяжении тех 3 дней цикла, когда уже происходит повышение концентрации прогестерона.
ПОЛОВОЕ ПОВЕДЕНИЕ В ЭСТРУСЕ
Первоначальные признаки. С наступлением эструса поведение кошки обычно сильно меняется. Как и в период проэструса, кошка, как правило, постоянно трется головой и шеей о различные предметы, катается и трет спину о землю или
Рис. 33-6. А и Б. Типичная поза кошки в эструсе. Обратите внимание на согнутые задние лапы, лордоз и отведенный в сторону хвост. В. Кот удерживает кошку во время интромиссии. Г. После спаривания кошка катается по полу. (По: Scott PP: In Hafez ESE (ed.): Reproduction and Breeding Techniques for Laboratory Animals. Philadelphia, Lea & Febiger, 1970).
пол, чаще, чем обычно, мяукает, нередко издавая громкий стонущий крик. Возможно учащение мочеиспускания, животное беспокоится и стремится покинуть помещение. Многие кошки становятся чрезвычайно ласковыми со своими хозяевами, но встречаются и такие, которые делаются агрессивными. Неопытный владелец может подумать, что кошка нездорова. Владельцы обычно замечают, что вокруг дома появляется больше котов.
Когда кошка, находящаяся в эструсе, видит кота или ее ласкает человек, она перестает кататься и тереться о предметы, а припадает к полу передней частью тела, прижимая локти, сильно изгибается (лордозная поза), так что поднимается таз и становится видна промежность. Нередко в присутс-
РЕПРОДУКЦИЯ КОШЕК • 1141
твии кота или в ответ на поглаживание она отводит хвост в сторону и топчется задними лапами на одном месте.
Отличия «нормального» поведения от поведения в эструсе. Многие кошки, которым уделяют достаточное внимание (любимицы), очень ласковы. Кошка наслаждается общением с хозяином и обычно трется об него или какие-нибудь предметы, ожидая, когда ее приласкают или возьмут на руки. При поглаживании спины и почесывании у основания хвоста она, скорее всего, будет поднимать таз и начнет топтаться задними лапами, причем так себя ведут даже кастрированные кошки. Иногда эструс у обычно ласковой кошки удается распознать только по каким-то несвойственным ей в другое время половым демонстрациям или по поведению в присутствии кота (рис. 33-6). Некоторые ласковые кошки, будучи в эструсе, проявляют свое «дружелюбие» гораздо сильнее и чаще, что и дает возможность распознать этот период (Voith, 1980).
Спаривание. Поведение кошки. Инициатором спаривания является кошка. Во время проэструса наступает момент, когда кошка принимает типичную для эструса лордозную позу. Кот эту позу быстро распознает (независимо от наличия или отсутствия других факторов). В таком положении кошка позволяет коту схватить себя сбоку за загривок (табл. 33-2; см. рис. 33-6), после чего в большинстве случаев поднимает таз, отводит в сторону хвост и топчется на месте задними лапами. Это может произойти не сразу, а после садки, когда кот передними лапами обхватывает партнершу за бока и в свою очередь начинает перебирать задними лапами. По-видимому, такое поведение кошки (топтание на месте задними лапами) стимулирует последующие действия кота - толкательные движения тазом и введение полового члена. Однако лордозная поза и перебирание задними лапами наблюдаются у кошек не всегда (Voith, 1980).
Копуляция. После нескольких толкательных движений кот вводит половой член во влагалище (пенетрация). Вслед за этим быстро происходит семяизвержение. При этом кошка издает характерный пронзительный вопль. Начиная с момента, когда кот захватывает загривок кошки, до введения полового члена проходит от 30 секунд до 5 минут. Пенетрация длится лишь 1-5 секунд и редко продолжается до 20 секунд (Concannon, Lein, 1983). В отличие от животных большинства видов, у котов пенетрация и эякуляция протекают так быстро, что наблюдателю редко удается установить, произошла ли нормальная копуляция. То, что она совершилась, обычно определяют по типичной последующей реакции кошки.
Поведение кота. Если последовательные копуляции оказались прерваны, то спаривание обычно возобновляется лишь через несколько часов или дней. Коту необходимо время, чтобы заново пометить (мочой) свою территорию. Если на его территории произведена слишком тщательная уборка
ТАБЛИЦА 33-2. ПРОДОЛЖИТЕЛЬНОСТЬ И ХАРАКТЕРИСТИКИ ПЕРИОДОВ ДО, ВО ВРЕМЯ И ПОСЛЕ СПАРИВАНИЯ
Продолжительность Кот Кошка
Перед спари- Подходит к кошке Лордозная поза
ванием Обнюхивает ее тени- Катается по полу
(10 с - 5 мин) талии Ходит вокруг кошки Призывно мяукает Подходит к кошке Призывно мяукает Топчется задними лапами
Спаривание (1-3 мин) Прикусывает кошке шею Обхватывает кошку за бока передними лапами Обхватывает кошку задними лапами Скребет передними лапами Перебирает задними лапами Выгибает спину Припадает к полу Топчется задними лапами
(5-10 с) Толкательные движения таза Эрекция Интромиссия Эякуляция Извлечение полового члена из влагалища Отводит хвост в сторону Поднимает таз Издает пронзительный крик Сбрасывает кота
После спари- Вылизывает пенис Вылизывает гени-
вания Вылизывает передние талии
(30 с-10 мин) лапы Катается по полу Вылизывает передние лапы Следит за котом Вновь привлекает кота
(особенно с применением ароматического спрея), кот может игнорировать присутствие кошки в эструсе и даже быть агрессивным по отношению к ней, пока не восстановит свой территориальный статус. Именно территориальное поведение котов заставляет проводить вязку, привозя кошку к коту, а не кота к кошке. Однако нужно учитывать, что изменение окружающей обстановки способно повлиять и на кошку, в частности на ее поведение и гормональный статус. Поэтому рекомендуется привозить кошку заранее, чтобы она побыла несколько недель в новой обстановке и привыкла к ней. Содержание кота в одном помещении с кошкой способствует наступлению эструса.
Поведение кошки после коитуса (пост-реакция). Во время пенетрации или сразу же после нее кошка издает пронзительный крик или вой и вслед за этим пытается прервать контакт с котом, выкатываясь из-под него и нанося удары когтями. Освободившись от кота, она интенсивно трется о пол, перекатываясь с одного бока на другой (см. рис. 33-6), прерывая это занятие лишь для того, чтобы вылизать область гениталий. Такая пост-реакция продолжается от 30 секунд до 9 минут, и в это время кошка активно пресекает всякую попытку кота приблизиться к ней.
1142 • РЕПРОДУКЦИЯ КОШЕК
Поведение кота после коитуса. На протяжении пост-реакции у кошки кот ведет себя на удивление пассивно. Обычно он располагается на расстоянии нескольких шагов от кошки и как будто не замечает ее. Опытный кот умело избегает любой попытки кошки запустить в него когти, что характерно для ее пост-реакции. Кот либо стоит, либо сидит, по временам вылизывая область гениталий. Спустя несколько минут он начинает осторожно приближаться к кошке и, если она его отгоняет, опять садится на расстоянии и выжидает. Эти попытки повторяются, пока кот, набравшись храбрости, не схватит кошку за загривок (см. рис. 36-6). И даже в этот момент кошка может его отогнать. Повторные спаривания - обычное явление у кошек, и они повышают вероятность индукции овуляции.
Повторные спаривания. Как только пост-реакция у кошки проходит, она вновь начинает заигрывать с котом: тянется к нему, трогает его лапой или просто подходит к нему. Более активные кошки принимают лордозную позу и перебирают задними лапами (Voith, 1980). Следующее спаривание может произойти сразу же по окончании пост-реакции у кошки, однако интервалы между этими событиями увеличиваются после каждого коитуса. Сообщалось, что кошка способна спариваться до 30 раз на протяжении 24 часов и 36 раз в течение 36 часов. О среднем числе спариваний на протяжении одного эструса данных нет (Concannon, Lein, 1983).
Аномальное поведение при спаривании. У крайне боязливых или запуганных кошек характерное для эструса поведение иногда бывает подавлено; в результате эструс, или «сезон», для такой кошки целиком пропадает, причем это случается даже у опытных владельцев. Поэтому полезно содержать кошку до появления явных признаков эструса в привычной, комфортабельной обстановке. Затем, по традиции, кошку для вязки привозят к коту. Кошка, которая не подпускает к себе кота, может быть напугана новой, непривычной обстановкой. В этом случае ее следует оставлять в помещении, предусмотренном для спаривания, на несколько часов каждый день, прежде чем пускать туда кота. За это время кошка привыкает к новому окружению, а поскольку она все же находится на территории кота, то вероятность благоприятного исхода встречи обоих партнеров увеличивается.
Если кошка, доставленная для спаривания в состоянии эструса, неопытна или боязлива, желательно использовать опытного кота. Такого кота ей не так легко отпугнуть, что повышает шансы на спаривание и сводит к минимуму проблемы, связанные с избеганием контакта с котом.
В случаях, когда кошка, отвергая кота, проявляет агрессию, было предложено вручную стимулировать ее половую активность, а потом удерживать до садки кота (Voith, 1980). Осуществить это непросто, и для этого нужен достаточно «благовоспитанный» кот. Владелец, применяющий такой способ, должен быть готов к тому, что по отношению к нему
кошка или кот будут вести себя агрессивно. Если вязка кошки с одним котом не удается, то разумнее, видимо, использовать второго кота. Хорошо известно, что кошка может предпочесть одного партнера другому и, отвергая одного кота, подпустит к себе другого (Voith, 1980).
ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ
Индукция эструса
Искусственную индукцию эструса в ветеринарной практике применяют редко. Такой подход можно использовать с целью синхронизации эстрального цикла у нескольких кошек. Вместе с тем индукция эструса представляет собой важный компонент процедур экстракорпорального оплодотворения и переноса эмбрионов. Индуцируя эструс у кошек-доноров эмбрионов, добиваются стимуляции их овариальной активности и синхронизации ее с эстраль-ным циклом кошек-реципиентов. Пока не удалось подобрать такую схему индукции эструса, которая полностью соответствовала бы естественному процессу - как по частоте возникновения беременности, так и по качеству плодов. Наилучший результат дало внутримышечное введение 150 ME хорионического гонадотропина лошади (ХГл), а затем - не ранее чем через 80 и не позднее чем через 88 часов - внутримышечное введение 100 ME ХГч. Такой способ обеспечил возникновение беременности у 80% кошек (Donoghue et al, 1992). Согласно другому протоколу, кошке вводят внутримышечно ФСГ по 2 мг в день в течение 5-6 дней; инъекции осуществляют в период индуцированного эструса и на фоне ежедневных спариваний (Shille, Sojka, 1995).
Искусственное осеменение
Эту процедуру часто используют при разведении животных разных видов, включая собак, однако у кошек применяют редко. Даже в тех немногих случаях, когда у кота удается успешно получить сперму, возникают две трудности: 1) введенная во влагалище сперма слабо проникает через шейку матки, 2) не всегда удается индуцировать овуляцию. Внутриматочное осеменение кошек после овуляции, выполнявшееся с использованием анестезии и лапароскопии, приводило к зачатию в 50% случаев (Howard et al, 1992; см. далее в этой главе раздел «Получение и хранение спермы»). Сперму вносят в краниальную треть рога матки с помощью катетера № 17. В будущем эта процедура может получить практическое использование, однако сейчас она применяется лишь в исследовательской работе.
Перенос эмбрионов
Хотя этот метод описан в литературе, он, как и искусственное осеменение, в частной ветеринарной практике не используется. Эмбрионы можно по
РЕПРОДУКЦИЯ КОШЕК • 1143
лучить с помощью лапаротомии от кошек-доноров через 7-8 дней после вязки. Для этого в каждый рог матки вплоть до места его соединения с маточной трубой вводят катетер. Затем эмбрионы вымывают в каудальном направлении, собирая их через катетер, подведенный к бифуркации матки, и помещают в чашки для культивирования тканей. После этого хирургическим путем эмбрионы переносят кошке-реципиенту, находящейся в той же стадии репродуктивного цикла (Goodrow et al, 1988).
БЕРЕМЕННОСТЬ
Продолжительность беременности
Беременность, определяемая как период от успешной вязки до родов, продолжается от 56 до 69 дней. В одном из кошачьих питомников средний срок беременности составлял 66 дней (Lein, Concannon, 1983). Более точно продолжительность беременности (63-66 дней) можно установить, если определять срок ее наступления по первоначальному подъему концентрации прогестерона в сыворотке крови. Возможно, что колебания интервала между коитусом и родами объясняются тем, что первые коитусы не всегда индуцируют овуляцию.
Имплантация и развитие зародышей
Высвободившиеся в результате овуляции яйцеклетки остаются в яйцеводах в течение 3^1 дней, и там же, по-видимому происходит оплодотворение. Спустя 4-5 дней после оплодотворения образовавшиеся зиготы проникают в матку. Бластоцисты выявляются как локализованные в матке округлые образования (зародышевые узелки) на 13-14-й дни беременности, а возможно, и позднее в случаях искусственно индуцированного эструса (Thatcher et al, 1991). Прикрепление посредством трофобласта (производного наружной стенки бластоцисты) происходит приблизительно на 15-й день после коитуса.
Переход от эмбриональной к фетальной стадии развития определяют по появлению у зародыша характерных видовых признаков (примерно на 4-й неделе беременности). В это время длина плодов от темени до крестца составляет 2,4 см. На 5-й неделе беременности эта длина достигает 4,7 см, у плодов уже имеются глаза и уши (они закрыты) и можно различить коготки на пальцах. Тонкий волосяной покров без окраса обнаруживается на 7-й неделе, а на 8-й неделе развития все тело плодов покрывается окрашенной шерсткой.
Гормональный статус
Концентрация прогестерона в плазме крови кошек в первые 14-20 дней беременности примерно такая же, как и при ложной беременности. Затем у беременных кошек концентрация этого гормона нарастает (см. рис. 33-4; Concannon, Lein, 1983),
что указывает на продолжающееся функционирование желтых тел. Кроме того, после 30 дней беременности прогестерон начинает вырабатываться и плацентой.
Концентрация прогестерона у беременных кошек значительно варьирует (от 5 до 50 нг/мл) (Shille, Sojka, 1995). Желтые тела продуцируют прогестерон приблизительно 40-50 дней, однако после 40-го дня - в минимальном количестве. Если спустя 40-50 дней после начала беременности у кошки удалить яичники, беременность не прерывается, поскольку ее сохранение обеспечивает прогестерон, продуцируемый плацентой. Удаление яичников до 40-го дня приводит к прерыванию беременности у кошки. К концу беременности в плазме повышаются концентрации эстрогена (см. рис. 33-4) и пролактина.
Поведение
Сравнительно небольшое повышение концентрации эстрогена в плазме к концу беременности способно вызвать изменение поведения кошки. Еще до родов или вслед за ними у нее может появиться свойственное эструсу поведение, и в это время возможна вязка. Подобное случается редко, и оплодотворение в таких случаях не происходит. Наступающая после родов лактация, видимо, подавляет нормальный эстральный цикл, поэтому беременность в этот период относится к редким явлениям.
Диагностика беременности
Определение срока беременности. Точный срок начала беременности у кошки лучше всего установить с помощью серийного определения концентрации прогестерона в плазме крови. Начало беременности определяют как первый день подъема концентрации прогестерона в плазме выше уровня 2,5 нг/мл. Эту дату можно считать истинной при условии, что наличие беременности впоследствии подтверждается данными УЗИ или рентгенографии.
Пальпация живота. Беременность у кошек чаще всего диагностируют путем пальпации живота. Начиная с 17-го дня беременности, развивающиеся зародыши прощупываются как отдельные, плотные, округлые образования, а последующий 7-8-дневный интервал (до 25-го дня) - это лучший период для диагностики беременности путем пальпации. В более поздние сроки (35-й день) прощупать отдельные плоды удается реже. С 25-го дня беременности и до наступления родов пальпируется увеличенная матка. Кошки, в отличие от многих собак, процедуру пальпации обычно переносят спокойно.
Ультразвуковое исследование (УЗИ). Без сомнения, самым чувствительным и надежным методом ранней диагностики беременности служит УЗИ. С помощью этого метода развивающиеся плоды можно обнаружить уже на 11-13-й дни беременности,
1144 • РЕПРОДУКЦИЯ КОШЕК
а сердцебиение плодов - на 22-24-й дни (Davidson et al, 1986). Как и у собак, точно определить число плодов у кошки не всегда возможно, особенно если их больше четырех. Метод не требует применения анестезии или успокаивающих средств; после удаления ножницами шерсти на животе исследование занимает всего несколько минут и безболезненно. Кроме того, ультразвуковое определение диаметра головки плода и тела представляет собой практичный и точный способ установления срока беременности, а отсюда - и примерной даты родов (табл. 33-3; Beck et al, 1990).
Рентгенография. Возможность диагностики беременности с помощью рентгенографии зависит от степени кальцификации скелета плодов. Выявить беременность удается после 38-го дня, однако более надежный результат получают после 43-го дня беременности. Увеличение размеров матки, обнаруживаемое до начала кальцификации скелета у плодов, не является специфическим показателем, поскольку оно может быть обусловлено пиометрой, гидрометрой и другими причинами. Чтобы надежно установить беременность рентгенографически, владельцу рекомендуют принести кошку на исследование через 45 дней после вязки.
Возобновление астральных циклов
Эструс у кошки наступает через 2-8 недель, в среднем через 4 недели, после прекращения вскармливания котят. Если же у кошки отнимают 3-дневных котят, то эструс может начаться уже через 6-8 дней (Concannon, Lein, 1983). Прерывание беременности может быть следствием (или причиной) укороченной лютеиновой фазы. Эстральный цикл обычно начинается спустя неделю после абортирования плодов.
Уход за беременной кошкой
Питание беременной кошки должно быть хорошо сбалансированным и состоять из размолотых консервированных продуктов, выпускаемых для кошек. Такой корм содержит необходимые питательные вещества и легко доступен для приобретения.
Потребность в калориях во время беременности обычно возрастает на 25-50%. В период лактации кошка часто съедает вдвое больше корма, чем до беременности. Кошек, предназначенных для племенного разведения, перед эструсом необходимо вакцинировать, провести противоглистное лечение и исследовать на присутствие вируса кошачьей лейкемии.
Гематограммы беременных кошек, полученные в период с 3-ей по 9-ую недели беременности, указывают на развитие у них нормоцитарной нормохромной анемии со снижением гематокрита или количества эритроцитов на 20%. Во время беременности следует избегать применения любых лекарств. Перечень лекарственных препаратов и возможных осложнений при их назначении беременным животным приведен в гл. 20. Когда подходит время родов, необходимо найти для кошки подходящее теплое, сухое, изолированное место и приготовить материал для устройства гнезда (например, нарезанные одноразовые детские пеленки).
РОДЫ
Эндокринология
Считается, что гормональный статус в конце беременности и при родах сходен у большинства видов животных (см. гл. 20 о родах у собак). Кошка отличается от собаки тем, что в течение последних двух недель беременности источником прогестерона у нее служит плацента. Существенным фактором для наступления родов является падение концентрации этого гормона в плазме ниже определенного критического уровня. Как только это происходит, ректальная температура обычно снижается (ниже 37,2 °C). Снижение температуры свидетельствует о том, что роды начинаются и в ближайшие 12-36 часов нужно ожидать отчетливо выраженных маточных сокращений.
Родовой акт
Стадия I. Первая стадия родов (маточные сокращения и расширение шейки матки) продолжа
Таблица 33-3. ПРОГНОЗИРОВАНИЕ СРОКА РОДОВ С ПОМОЩЬЮ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ
Кошка ДГ (см) ДТ (см) Предсказанный срок до родов (дни) Действительный срок до родов (днн) Разница между предсказанным и действительным сроками (дни) Число котят
1 0,6 — 46 36 10 5
2 0,8 — 41 40 1 4
3 1,3 — 29 29 0 7
4 1,6 1,8 22 (ДГ) 24 (ДТ) 22 0(ДГ) 2(ДТ) 4
5 1,6 2,0 22 21 1 3
6 1,6 2,2 22 (ДГ) 19 (ДТ) 21 1 (ДГ) -2 (ДТ) 3
7 2,1 — 9 9 0 4
8 2,4 — 2 4 -2 3
Из: Beck К. A. et al: Ultrasound prediction of parturition in queens. Vet. Radiol, 1990, 31:32.
ДГ - диаметр головы; ДТ - диаметр тела.
РЕПРОДУКЦИЯ КОШЕК • 1145
ется от 2 до 24 часов. В это время кошка становится беспокойной, ее дыхание учащается, она часто чистится (груминг), мечется, мяукает, возможна рвота. Сокращения матки и стенки живота бывают незаметными, хотя на вульве может появляться небольшое количество прозрачной слизи. Непосредственно перед началом стадии II (родоразрешения) кошка начинает усиленно искать укромное место (гнездовой инстинкт), становится агрессивной по отношению к чужим людям, а иногда и к хозяину. У некоторых кошек во время родов снижается или пропадает аппетит, тогда как другие едят как обычно. В конце стадии I кошка располагается в «гнезде» и громко мурлычит.
Стадии II и III. Стадия II - это появление на свет новорожденных котят. Во время стадии III происходит изгнание плаценты. Переход плодов в тело матки, а затем и их продвижение через шейку матки и влагалище сопровождаются сильными, отчетливыми сокращениями матки. Весь процесс рождения потомства обычно завершается в течение 2-6 часов после появления на свет первого котенка, но может продолжаться и до 12 часов. Иногда роды протекают быстро, и котята выходят один за другим с интервалами в несколько минут, но порой эти интервалы составляют 3-60 минут. Родовой акт считается нормальным независимо от того, как выходит котенок из родовых путей - головой или тазом вперед.
Кошка начинает искать место для устройства гнезда за 12-48 часов до родов. Рождению котят обычно предшествует падение ректальной температуры, которое происходит не менее чем за 12 часов до появления первого котенка, однако это весьма ненадежный показатель начала родового акта. Первый котенок может появиться, когда сокращения матки еще малозаметны, или рождается после 30-60-минутного периода схваток. Рождение первого котенка подчас сопровождается громким мяуканьем кошки.
В интервалах между появлением котят кошка поедает послед, перегрызает пупочный канатик, чистит котят и вылизывает им область вульвы. Некоторые кошки приступают к кормлению котят, когда роды еще продолжаются (молочные железы начинают выделять молоко за 24—48 часов до родов).
В отличие от описанной выше быстрой последовательности событий, бывают случаи, когда роды прерываются и продолжаются от одного до нескольких дней. Это может произойти по разным причинам, например, под влиянием беспокоящих кошку внешних факторов, побуждающих ее переносить родившихся котят на другое место. После рождения первого котенка (или котят) родовая активность и сокращения матки могут приостановиться на 12-24 часа. В этот период кошка кормит и вылизывает котят, ест, отдыхает, т. е. ведет себя так, как будто роды закончились. Когда процесс родов возобновляется, кошка без труда рожает оставшихся (обычно живых) котят. Это явление не считается
аномалией, и его следует отличать от дистоции (см. далее раздел «Дистоция»), (Christiansen, 1984).
Плодные оболочки, как правило, изгоняются вслед за рождением каждого котенка (стадия III), но иногда одновременно два последа выходят после рождения двух котят. Многие кошки поедают последы сразу же после их появления. Скорее всего, самой кошке это не приносит ни особой пользы, ни вреда, поэтому вполне допустимо осторожно удалять последы из коробки или ящика, где находится кошка с котятами.
Создание благоприятных для родов условий
Обычно весь процесс родов не представляет для кошки особой трудности. Большинство кошек ищут для этой цели укромное место. Поэтому рекомендуется за 4-7 дней до ожидаемых родов подобрать для кошки сухое, спокойное и теплое место и заготовить необходимый материал для устройства гнезда (например, нарезанные детские одноразовые пеленки); тогда у кошки будет возможность освоиться в новой обстановке. Во многих случаях в качестве «родильного отделения» используют коробку или клетку. Выбранное место должно находиться поодаль от других кошек, люди тоже не должны тревожить кошку понапрасну. Если кошка еще не привыкла к «своему» месту или ее беспокоят, начало родов может затянуться, а если они уже наступили, то в интервалах между появлением котят кошка может заняться поисками другого места. В этих случаях она обычно переносит туда родившихся котят, реже - перестает обращать на них внимание. Чтобы создать нужную для кошки изоляцию (визуальный барьер), достаточно отгородить место ее нахождения во время окота простыней или полотенцем, картонным листом или даже крышкой от унитаза (Voith, 1980).
Встречаются кошки, которые во время родов тянутся к своему хозяину, и он в таких случаях должен оставаться с кошкой до тех пор, пока ее внимание не будет отвлечено новорожденными котятами. Как только это произойдет, хозяин обычно уже может отойти от кошки, не вызывая у нее беспокойства.
ОСЛОЖНЕНИЯ БЕРЕМЕННОСТИ И РОДОВ
Внематочная беременность
Внематочная (эктопическая) беременность возникает в тех случаях, когда яйцеклетки оплодотворяются вне маточных труб или же оплодотворенные яйцеклетки выталкиваются из сумки яичника. В результате развитие зародыша происходит не в матке, а в брюшной полости. Внематочная беременность иногда протекает бессимптомно, а иногда в брюшной полости прощупывается новообразование (зародыш), живот увеличивается, и в ряде случаев наблюдаются неопределенные признаки заболевания.
1146 • РЕПРОДУКЦИЯ КОШЕК
Лучшим методом диагностики этого редко встречающегося состояния является УЗИ. Рентгенография имеет меньшее диагностическое значение. Устраняют внематочную беременность хирургическим путем, удаляя зародыш (Olson et al, 1996).
Предродовое вагинальное кровотечение
Если у беременной кошки появились кровянистые выделения из влагалища, ее нужно тщательно наблюдать. Кровотечение, возникшее между 2-й и 8-й неделями беременности, следует расценивать как патологию; оно может оказаться единственным признаком резорбции плодов или выкидыша (менее частые признаки этих состояний - необычная вялость кошки и/или потеря аппетита). Трудно рекомендовать что-либо определенное для лечения таких кошек; их нужно держать дома в спокойной обстановке, оградить от контактов с другими животными или детьми и предоставить самую вкусную пищу.
Пристального внимания заслуживают также кошки с кровянистыми вагинальными выделениями, появляющимися после 8-й недели беременности. Рожденные в этот срок котята имеют по меньшей мере 50% шансов на выживание. В данном случае речь идет не о выкидыше, а о преждевременных родах. Кошек с небольшими кровянистыми выделениями (несколько капель в день) следует держать в помещении, в спокойной, комфортной обстановке. При более выраженном кровотечении существует реальная опасность потерять потомство. В обеих ситуациях появление крови скорее всего связано с отслоением плаценты, ее преждевременным отделением от эндометрия. Значительное отслоение серьезно нарушает жизненно важное кровоснабжение плода. Поэтому сильное кровотечение (15 мл или более) служит серьезным показанием к проведению кесарева сечения.
Дистоция
Диагностика. Когда речь идет о дистоции (длительных патологических родах, дискоординации родовой деятельности), важнейшим фактором, определяющим все дальнейшие действия, является состояние здоровья кошки. Прежде чем принимать какие-либо диагностические и терапевтические меры, настоятельно необходимо получить полный анамнез данной кошки и провести физикальное исследование. Дистоция у кошек встречается редко, однако ее следует подозревать, если сильные сокращения матки, продолжающиеся более часа, не приводят к ожидаемому результату. О дистоции нужно думать и в тех случаях, когда котенок уже виден в своде влагалища, но не выталкивается, или когда во время родов у кошки наблюдаются обильные кровянистые выделения. Переношенная беременность или прекращение родовой деятельности тоже бывают результатом дистоции. Если котенок
виден в своде влагалища, ветеринар может извлечь его вручную. При подозрении на дистоцию очень важно провести рентгенографию брюшной полости кошки. Если размеры плодов и их расположение нормальны и родовой канал не имеет анатомических дефектов, можно прибегнуть к медикаментозной терапии. Если же при рентгенографии обнаружены нарушения, то необходимо кесарево сечение.
Фетальная дистоция. При фетальной дистоции причиной патологических родов служит плод (плоды). Так, неправильное положение плода может препятствовать его прохождению через родовые пути. Если у кошки только 1 или 2 плода, то один из них или оба могут оказаться слишком крупными в сопоставлении с размерами таза кошки. К затруднению родов приводят также деформации плода или плодов. Во всех этих случаях наилучшим средством диагностики служит рентгенография брюшной полости, а способом лечения - кесарево сечение.
Материнская дистоция. Причины. К числу факторов, обусловливающих материнскую дистоцию, относится узкий таз, что может быть врожденной особенностью или же следствием перенесенного перелома костей таза. Известны и такие причины материнской дистоции, как перекрут 1) матки, 2) одиночного рога матки или 3) сегмента одного рога, а также паховая грыжа и выпадение матки. В литературе по ветеринарии перекрут матки, обычно диагностируемый при лапаротомии, описан у 8 кошек (Johnston, 1983). И в этих случаях наилучшим методом лечения является кесарево сечение.
Еще одна причина материнской дистоции - атония матки, которая может быть первичной (не рождается ни один котенок) или вторичной (рождается только часть потомства). Чаще всего она бывает у старородящих ожиревших кошек и гораздо реже у кошек с многоплодием. Если ветеринар считает, что у кошки атония матки, то целесообразно назначить медикаментозную терапию, которая обычно дает хороший результат (Laliberte, 1986).
Медикаментозная терапия. Чтобы вызвать маточные сокращения, вводят внутривенно окситоцин в дозе от 2 до 4 ЕД. При отсутствии эффекта инъекцию окситоцина повторяют спустя 20 минут, после медленного внутривенного введения 1-2 мл 10% раствора глюконата кальция. В том случае, если и это не помогает, через 20 минут вновь вводят окситоцин, произведя предварительно медленную внутривенную инъекцию 2 мл 50% раствора декстрозы (D-глюкозы). Отсутствие стимуляции родов после этой (третьей) попытки вынуждает прибегнуть к кесареву сечению.
Инструментальные методы. Применение инструментария и манипуляции в прямой кишке и брюшной полости дают неудовлетворительные результаты. Кошка слишком мала для таких процедур, которые успешно выполняются на более крупных животных. Радикальным и общепринятым методом лечения является кесарево сечение, которое менее травматично, чем чрезмерные мануальные
РЕПРОДУКЦИЯ КОШЕК • 1147
или инструментальные вмешательства. Обычно их оставляют на крайний случай, когда рождающийся котенок \же виден или легко пальпируется во влагалище, но кошка нс в состоянии вытолкнуть его из родовых путей.
Смертность среди котят
1 ибель новорожденных котят вызывается разными причинами. Если несколько котят рождаются за столь короткий промежуток времени, что кошка не успевает освобождать их от амниотических оболочек и перегрызать пупочный канатик, то котята могут задохнуться (рис. 33-7, А). Случается, что несколько котят имеют общий пупочный канатик, который легко может обвиться вокруг них, вызвав ущемление конечности (рис. 33-7, Б) или гибель котенка и даже нескольких котят. Чтобы избежать таких последствий, требуется своевременное вмешательство владельца кошки.
Поскольку причины гибели новорожденных котят мноючисленны, не представляется возможным выявить такую причину в каждом конкретном случае только на основании простого осмотра погибших котят. Для постановки диагноза необходимо тщательно исследовать влагалищные выделения, плацентарную ткань, мертворожденных котят, мумифицированные плоды, а также погибших котят, родившихся ослабленными. Все доступные объекты (образцы) передают в иагностическую ветеринарную лабораторию для анализа (патологоанатомического, цитологического, гистологического и бактериологического) в надежде, что полученные данные позволят установить окончательный диагноз, а значит, и рекомендовать специфические лечебные и профилактические мероприятия. Поскольку причиной мертворождения могут быть инфекционные агенты, кошку и оставшихся в живых котят следует строго изолировать от других котят и кошек. Безусловно необходимо принять
все меры для ащиты беременных кошек и имеющихся котят.
Послеродовое вагинальное кровотечение
Незначительные кровянистые выделения из влагалища (их цвет бывает от красного до красновато-черного) - обычное явление как после нормальных, так и после патологических родов. Эти выделения обычно продолжаются от нескольких дней до 3 недель; наблю гаемое их количество отчасти зависит от чистоплотности кошки. Если кошка и котята здоровы, а кровянистые выделения продолжаются, необходимо держать кошку под наблюдением, не прибегая к лечебным мероприятиям. Если же количество выделений представляется избыточным, нужно определить число эритроцитов и гематокрит. В случае снижения этих показателей следует рассмотреть возможность нарушения свертываемости крови. Если такое нарушение не выявлено, а кровотечение не прекращается, ветеринар будет вынужден рекомендовать овариогистерэктомии). Альтернативой хирургическому вмешате льству служит лечение простагландином (см. раздел этой главы, посвященный пиометре). Предупредить послеродовое кровотечение можно с помощью инъекций окситоцина через 24 48 часов после завершения родов.
Субинволюция плацентарных мест
Затянувшееся послеродовое вагинальное кровотечение может быть следствием субинволюции (замедленного обратного развития) мест прикрепления плаценты в эндометрии, известных как плацентарные места или плацентарные площадки. Обычно эта аномалия со временем проходит и нс требует лечения. Предположительный диагноз субинволюции плацентарных мест ставят на основании не прекращающегося более 3 недель после родов
Рис. 33-7. Л. Котята, связанные опутавшим их пупочным канатиком. Б. Травма задней лапы котенка, перетянутой пупочным канатиком. (Фото Anthony Buffington)
1148
РЕПРОДУКЦИЯ КОШЕК
вагинального кровотечения. Применение антибиотиков, препаратов спорыньи или простагландинов не дает эффекта. Терапия необходима лишь в тех случаях, когда у кошки либо развивается анемия, либо возникает метрит / пиометра. В этих случаях лечение состоит в переливании крови и/или удалении матки и яичников.
Задержание последа
Задержание последа (плаценты) у кошек и собак обычно вызывает повышение температуры тела, потерю аппетита, вялость и отсутствие материнского инстинкта. Однако диагностировать задержание последа крайне трудно. Наблюдения владельца кошки и/или результаты пальпации живота во многом субъективны и не могут служить основанием для постановки диагноза. Рентгенографическую картину после родов тоже трудно интерпретировать, поскольку матка всегда увеличена, часто имеет неправильную форму, что создает ложное впечатление наличия в ней тканевой массы. Опыт применения УЗИ для диагностики у кошек этой патологии очень невелик. Большинство кошек с признаками задержания последа остаются здоровыми, несмотря на присутствие в матке потенциально чужеродного объекта. У некоторых кошек послед выходит самопроизвольно спустя несколько дней после родов. Другие со временем вступают в половые контакты, вынашивают здоровое потомство, и задержанный послед выходит при очередных родах. Таким образом, задержание последа у кошек редко становится причиной послеродовых расстройств и далеко не всегда ведет к возникновению метрита.
Острый метрит
Острый метрит (воспаление матки) обнаруживается через 12-96 часов после родов. Его причиной является инфекция, вторичная по отношению к таким нарушениям, как задержка плода и плаценты, а также травмы, в том числе вызванные применением инструментов. Диагноз ставят по наличию бесцветных, дурно пахнущих вагинальных выделений и увеличению матки, определяемому при пальпации живота. Кошка обычно угнетена, апатична, теряет аппетит и не обращает внимания на своих котят. Ректальная температура может быть нормальной, немного сниженной или повышенной. Общий клинический анализ крови обычно выявляет сдвиг лейкоцитарной формулы влево, в сторону незрелых нейтрофилов, на фоне нормального или повышенного общего числа лейкоцитов; лишь в редких случаях количество лейкоцитов бывает пониженным.
Лечение острого метрита включает внутривенное введение жидкости и антибиотикотерапию. По нашим данным, отличный эффект дает применение такого антибактериального средства, как тримето-прим-сульфа. Методом выбора является оварио-гистерэктомия. Сообщалось, что в случаях, когда
владельцы не давали согласия на проведение этой операции, кошек успешно лечили простагландинами (подкожные инъекции в течение 3-5 дней).
Пролапс матки
Описано множество случаев пролапса (выпадения) матки во время родов или в последующие 48 часов. Обычно он возникает после рождения всех котят. Если произошло выпадение только одного, опорожненного рога матки, тогда как другой все еще содержит плоды, это указывает на существование какого-то препятствия, которое мешает выталкиванию оставшихся котят несмотря на энергичные сокращения матки.
В тех случаях, когда матка не повреждена и функционирует, ее вправляют вручную под общей или эпидуральной анестезией (Christiansen, 1984). Иногда приходится прибегать к лапаротомии, и матку возвращают в нужное положение, манипулируя внутри и снаружи. Если имеются обширные повреждения тканей, рекомендуется произвести овариогистерэктомию.
Отсутствие заботы о потомстве
Особое внимание должно быть уделено кошкам, не заботящимся о своих котятах. Некоторые кошки выглядят беспокойными, лишь недолго остаются с котятами или даже могут стать агрессивными по отношению к ним. Такое необычное поведение кошки часто возникает из-за неспокойной окружающей обстановки, поэтому бывает полезно переместить кошку вместе с котятами в тихое, изолированное место. Применение легких успокоительных средств тоже может улучшить отношение кошки к котятам (Christiansen, 1984). Однако известны случаи, когда кошки были нетерпимы к котятам в любых условиях.
Выращивание котят-сирот. Использование кошки-кормилицы / искусственное вскармливание
Использование приемной матери - идеальный способ выращивания котят, по тем или иным причинам лишившихся своей матери. Лактирующая кошка может принять посторонних котят, сходных по размерам с ее собственными, и заботиться о них. Однако чем больше чужие котята отличаются от своих по возрасту и величине, тем меньше шансов на то, что они будут приняты. После завершения родов кошка обычно остается с котятами в течение 24-48 часов и кормит их, расходуя приблизительно 1 мл молока в час. На протяжении периода вскармливания состав молока меняется (табл. 33-4).
На второй неделе жизни котята потребляют 5-7 мл молока за одно кормление, и их вес удваивается по сравнению с имевшимся при рождении. В возрасте 8-10 дней у них открываются глаза. После
РЕПРОДУКЦИЯ КОШЕК • 1149
Таблица 33-4. СРЕДНЕЕ СОДЕРЖАНИЕ ЖИРОВ, БЕЛКОВ И ЛАКТОЗЫ В МОЛОКЕ КОШКИ*
Содержание (%) Дни после родов
1-10 11-60
Жиры 3,7 3,3
Белки 6,5 8,7
Лактоза 3,6 4,0
* По: Hwini Н, Montalta J: Z. Versuchstierk, 1980, 22:32.
каждого кормления кошка чистит котят, вылизывает им живот и область прямой кишки, стимулируя мочеиспускание и дефекацию. Затем кошка поедает фекалии вместе с мочой (Christiansen, 1984). В 3-недельном возрасте котята уже более активны и приучаются отправлять естественные потребности поодаль от гнезда. На 4-й неделе жизни котят начинают прикармливать твердой пищей, а в возрасте 5-8 недель отнимают от матери.
Выращивание котят-сирот без приемной матери - дело значительно более сложное и трудоемкое. В этом случае котят следует содержать вместе, группой. Они нуждаются в тепле, поэтому их накрывают электроодеялом или обогревают электролампой так, чтобы температура окружающей среды составляла 23,8-26,6 °C. Их можно кормить через желудочный зонд, из бутылочки с маленькой соской или с помощью шприца, снабженного адаптером. Можно использовать цельное молоко или готовить корм по следующему рецепту: 20 г сухого обезжиренного молока, 90 мл воды и 10 мл оливкового масла (Christiansen, 1984). В первые несколько дней к молоку следует добавлять 80 мкг витамина А, а затем - 50 мкг. Перед кормлением молоко должно быть нагрето до 37,2 °C (Christiansen, 1984). Использовать для кормления желудочный зонд просто и безопасно, поскольку у котят очень выражен гортанный рефлекс и это предупреждает ошибочное введение зонда в трахею. Длина зонда должна точно соответствовать расстоянию от рта до желудка. Если котят кормят из бутылочки, в соске на ее горлышке следует проделать отверстие диаметром 1 мм; лучше всего это сделать раскаленной иглой, что позволяет получить отверстие нужного размера с гладкими краями (Voith, 1980).
Новорожденных котят необходимо кормить каждый час при разовом объеме пищи 1 мл. Каждый день добавляют по 0,5 мл, пока объем пищи на одно кормление не достигнет 10 мл (максимум). Котят в возрасте 4-5 недель можно кормить 4-6 раз в день, и они уже начинают самостоятельно есть мягкую пишу и пить из блюдечка (табл. 33-5). После кормления необходимо протирать анальную область и гениталии котенка мягким теплым влажным полотенцем, чтобы стимулировать мочеиспускание и дефекацию.
Гиперплазия молочных желез
Определение и клинические признаки. Массивное увеличение молочных желез может возникнуть вскоре после беременности, ложной беременности и в любое время на протяжении года после овариогистерэктомии. По-видимому, это состояние связано с быстрым падением содержания прогестерона в организме. Предполагается, что снижение концентрации прогестерона в плазме стимулирует секрецию гипофизом пролактина, который, в свою очередь, стимулирует разрастание ткани молочных желез. В типичных случаях наблюдается уплотнение этих желез, и они легко прощупываются, не будучи спаяны со стенкой живота. Иногда они увеличиваются настолько быстро, что на приподнятых участках кожи образуются язвы. Если ткань инфицируется, это может иметь катастрофические последствия, так как инфекция быстро преодолевает иммунную защиту и возникает системная септице-пия (бактериемия).
Лечение. Лечение гиперплазии молочных желез состоит в радикальном их удалении (мастэктомия) или назначении препаратов, подавляющих секрецию пролактина. Хирургическое вмешательство бывает невозможно в случаях чрезмерного увеличения желез, когда требуется удалить так много ткани, что представляется нереальным закрыть раневую поверхность. Из лекарственных средств рекомендуется бромокриптин, который дают перорально один раз в день по 0,25 мг в течение 5-7 дней. Однако этот препарат может вызвать рвоту, потерю аппетита и угнетенное состояние. При консервативном лечении необходимо следить за чисто
Таблица 33-5. ЧАСТОТА КОРМЛЕНИЯ КОТЯТ И КОЛИЧЕСТВО КОРМА *
Срок после родов (недели) Корм Число кормлений в сутки Разовое количество корма (мл) Потребность в калориях (ккал) Ожидаемый вес тела (г)
1 Молочная смесь 9-12 1-7 40-80 100-200
2 Молочная смесь 9 7-9 80-100 200-300
3 Молочная смесь 9 10 112 300-360
4 Молочная смесь 7 10 115 350-420
5 Введение в рацион твердого корма, снижение объема молока, повышение объема твердого корма 7 8-10 120 400-500
6 Молоко в блюдце + твердый корм 6 125 450-600
7 Прекращение дачи молока 3 130 500-700
* По: Scott PP: Cats. In Hafez ESE (ed.): Reproduction and Breeding Techniques for Laboratory Animals, Philadelphia, Lea & Febiger, 1970, p. 192
1150 • РЕПРОДУКЦИЯ КОШЕК
той кожи на животе, не допускать ее вылизывания другими кошками и предупреждать повреждения, которые может нанести сама больная кошка (елизаветинский воротник). Применение миболерона или мегестрола ацетата не всегда эффективно.
Мастит и эклампсия
Диагностика и лечение этих заболеваний описаны в гл. 21.
СПОНТАННАЯ РЕЗОРБЦИЯ ПЛОДОВ / РАННЕЕ ПРЕРЫВАНИЕ БЕРЕМЕННОСТИ / ВЫКИДЫШ
Частота возникновения
О частоте выкидышей или резорбции (рассасывания) плодов у кошек можно говорить только предположительно, поскольку УЗИ для подтверждения беременности у кошек проводится редко. Между тем даже с помощью УЗИ беременность не всегда удается установить. Владелец чаще всего определяет ее по изменению поведения кошки и/или увеличению размеров живота. Реже владелец кошки или ветеринар ставят диагноз беременности с помощью пальпации живота. Все эти способы диагностики субъективны и ненадежны.
Анамнез и клинические признаки
Признаки выкидыша или резорбции плодов разнообразны. Анамнез может свидетельствовать о том, что и в прошлом кошка не всегда приносила котят, несмотря на нормальные случки или «положительный» диагноз беременности. Тревожным симптомом являются вагинальные выделения (кровянистые или гнойные) во время беременности, которые нередко сопровождаются повышением температуры, отказом от пищи, вялостью, рвотой или диареей. В такой ситуации можно не сомневаться в том, что у кошки произошло преждевременное изгнание плодов, и даже если абортированные плоды не обнаружены, это означает только, что кошка успела их незаметно съесть. Некоторые кошки легко переносят резорбцию плодов или выкидыш всего помета, оставаясь практически здоровыми.
Причины
Инфекция. Панлейкемия кошек. Установлено, что вирус панлейкемии поражает клетки, обладающие высокой митотической активностью, в частности эмбриональные и быстро делящиеся клетки тканей плода. В организме кошки обычно имеются антитела к этому вирусу, обеспечивающие ее собственную защиту от инфекции, однако их недостаточно для защиты зародышей. В зависимости от стадии развития зародышей к моменту инфицирования кошка либо остается бесплодной вследствие незаметной гибели и рассасывания эмбрионов, либо
«выкидывает» мертвых котят (мумифицированных Я или мацерированных). В тех случаях, когда инфи- Я цирование происходит на поздних сроках беремен- Я ности, вирус способен вызвать у котят слепоту, гид- Я роцефалию и/или атаксию в результате поражения Я соответственно сетчатки глаза, головного мозга Я и/или мозжечка. Если кошка не приносит котят, но Я признаки заболевания отсутствуют, диагностиро- Я вать инфекцию трудно, так как серологическое ис- Я следование дает надежный результат лишь на ста- Я дии острой виремии (присутствия вируса в крови) Я (Shille, Sojka, 1995). Я
Лейкемия кошек. Вирус лейкемии кошек спо- Я собен вызвать незаметную для владельца гибель Я эмбрионов на ранней стадии развития, резорбцию Я плодов или выкидыш внешне нормальных плодов. Я В поздние сроки беременности источником зараже- Я ния плодов оказываются инфицированные вирусом Я лимфоциты матери, проникающие через плаценту. Я Вирус лейкемии проникает также в слюну и молоко Я матери, и через эти жидкости происходит инфици- Я рование новорожденных котят. Заболевшие котята Я перестают сосать мать, у них развивается обезво- Я живание, и они погибают в первые недели жизни. Я Что касается самой кошки, то, поскольку вирус Я подавляет иммунную систему, у нее может возник- Я нуть пиометра. С целью предотвращения распро- Я странения инфекции необходимо выявить всех ин- Я фицированных кошек с помощью серологического Я исследования и удалить их из питомника. Посколь- Я ку существуют серонегативные здоровые носители Я инфекции, для их выявления рекомендуются пов- Я торные исследования, проводимые с 90-дневными Я интервалами до тех пор, пока в двух последова- ж тельных тестах не будет обнаружено отсутствие се- ® ропозитивных животных. Серонегативных кошек g целесообразно вакцинировать. Поскольку вирус ж относительно нестоек во внешней среде, прервать t его распространение удается с помощью обычных мер по поддержанию чистоты.
Другие инфекции. Патология беременности у кошек может быть вызвана и другими инфекцион- $ ными агентами. Так, вирус ринотрахеита кошек бывает причиной выкидышей, мумификации плодов и рождения мертвых котят. Показано, что у кошек с признаками заболевания верхних дыхательных путей часто наблюдаются аборты и рождение мертвых котят (Colby, 1980а). То же самое вызывает вирус лейкемии кошек (Colby, 1980а). Обнаружена также связь абортов с токсоплазмозом. У абортирующих кошек среди многочисленных микробов были найдены бактерии группы кишечной палочки, стрептококки, стафилококки и сальмонеллы (Christiansen, 1984).
Дефекты плодов. Многочисленные нарушения, возникающие у плодов, приводят к их гибели или к рождению котят с врожденными пороками, причем в последнем случае другие котята того же помета остаются нормальными. Эти пороки, обнаруживаемые у маленьких котят, обычно не слишком тяже
РЕПРОДУКЦИЯ КОШЕК • 1151
лые, так как в случае более серьезных нарушений внутриутробного развития зародыши погибают и подвергаются резорбции или происходит ранний выкидыш.
Болезни матери / Кистозная гиперплазия эндометрия. К числу причин прерывания беременности, обусловленного состоянием кошки, относятся плохое питание, травмы и болезни полового тракта. В последнем случае распознавание и диагностика крайне затруднительны. Если на рентгенограмме у кошки видна матка, это дает основание подозревать кистозную гиперплазию эндометрия (КГЭ), эндометрит или инфекцию эндометрия. Более информативный метод диагностики - УЗИ, которое позволяет выявить утолщение стенки матки и/или присутствие в ней жидкости. Иногда удается обнаружить задержанный или мумифицированный плод, внематочную беременность, остатки плода (скелет) или плодные оболочки. В любом из этих случаев рекомендуется провести диагностическую лапаротомию для постановки окончательного диагноза.
Лапаротомия позволяет взять биопсию матки или образец ее содержимого для последующего бактериологического исследования и/или удалить все патологически измененные ткани. Кроме того, можно определить проходимость рогов матки и яйцеводов. Для этого отводят рога от тела матки и в каждый рог вводят физиологический раствор. Вводимая жидкость должна равномерно заполнить каждый рог и вытекать наружу через яйцеводы. Следует помнить, что во время проэструса место соединения матки с маточными трубами непроницаемо (закрыто). Для введения жидкости в просвет матки используют иглу небольшого калибра; процедура инфузии отнимает немного времени и безопасна.
Многие из нарушений, диагностируемых описанными выше способами, с трудом поддаются лечению. В случае обнаружения инфекции необходимо провести длительный (2-4 месячный) курс ан-тибиотикотерапии. Специальных методов терапии КГЭ не существует, хотя индукция затяжного анэструса может привести к полной инволюции матки, что и обусловливает выздоровление. При этом для индукции анэструса рекомендуется назначать андрогены, например миболерон, а не прогестагены, которые нередко усугубляют проблему. Аплазию яйцеводов или матки, приводящую к их непроходимости, вылечить невозможно, так что в этом случае следует рекомендовать овариогистерэктомию.
Факторы внешней среды, вызывающие стресс. Во многих случаях прерывание беременности является результатом «стресса». К числу внешних факторов, способных вызвать стресс, относятся транспортировка кошки (воздушным или наземным путем), пребывание ее в непривычной обстановке, появление новых животных в доме, плохое питание, содержание в грязном помещении, паразиты, инфекционные болезни, а также многие другие факторы. Все они могут привести к прерыванию беременности (Voith, 1980).
Эндокринные расстройства. Недостаточность лютеиновой фазы. Определение. Прерывание беременности может быть следствием различных эндокринных расстройств, в том числе недостаточности лютеиновой фазы (гиполютеинизации). Суть этого расстройства состоит в нарушении продукции прогестерона, необходимого для поддержания беременности. У кошек, как и у собак, недостаточность лютеиновой фазы не рассматривается как отдельная нозологическая форма. Тем не менее общеизвестны способы ее диагностики и предлагаемой терапии. Поскольку недостаточность лютеиновой фазы впервые была описана как потенциальная причина бесплодия и самопроизвольного аборта у женщин, по этому вопросу накоплена обширная информация, подтверждающая положение о том, что данный синдром (если он существует) относится к категории сложных и гетерогенных расстройств.
Физиология. Недостаточность лютеиновой фазы характеризуется неполной или замедленной секреторной трансформацией эндометрия вследствие низкой секреции прогестерона желтыми телами. Это делает эндометрий неподходящим субстратом для имплантации бластоцисты. В таких случаях владельцы кошек обычно говорят о «бесплодном цикле» у животного (Taubert, 1984). В более поздние сроки беременности дефицит прогестерона (следствие недостаточного синтеза гормона желтыми телами или плацентой) приводит к резорбции плодов или выкидышу, которые часто остаются незамеченными, что опять-таки заставляет говорить о бесплодии. Помимо обыкновенной первичной дисфункции яичников, описаны и другие причины недостаточности прогестерона во время беременности, а именно: задержка наступления лютеинизации; слабое стимулирующее действие ЛГ; угнетение функции желтых тел, вызванное периодически возникающей умеренной гиперпролактинемией; гиперандрогенемия; наконец, нарушение созревания фолликулов вследствие относительного дефицита ФСГ в начале фолликулярной фазы (Di Zerega, Hodgen, 1981). Большинство исследований, посвященных этому последнему, весьма сложному расстройству, касаются в первую очередь людей, а не животных.
Диагностика. Основой диагностики гиполютеинизации является обнаружение аномально низких концентраций прогестерона в диэструсе (менее 1 нг/мл). Однако одновременно с этим необходимо установить, что беременность действительно имеет место, и, таким образом, исключить ложную беременность, при которой у всех кошек происходит естественное (нормальное) сокращение продолжительности лютеиновой фазы. Следовательно, крайне важна ранняя диагностика беременности с помощью УЗИ брюшной полости. Исследование проводят уже через 2 недели после вязки и повторяют каждые 4-7 дней. Одновременно с этим всякий раз определяют концентрацию прогестерона
1152 • РЕПРОДУКЦИЯ КОШЕК
в плазме (это можно делать дома, используя коммерческий набор для иммуноферментного анализа, или в лаборатории). Если у кошки обнаружена беременность, но концентрация прогестерона низкая или снижается, нужно быть готовым к тому, что произойдет рассасывание или выкидыш плодов. В этих случаях при следующей беременности у кошки целесообразно предусмотреть введение ей прогестерона.
Лечение. Терапия состоит в пероральном применении медроксипрогестерона ацетата в дозе 10 мг в неделю. Лечение начинают за неделю до того срока, на котором у кошки произошел выкидыш во время предыдущей беременности, и продолжают до тех пор, пока до ожидаемых родов не останется одна неделя (Christiansen, 1984). Можно использовать другой способ - еженедельные внутримышечные инъекции репозитолпрогестерона в дозе 1-2 мг/кг (Christiansen, 1984). Однако к лечению прибегают лишь в редких случаях, поскольку недостаточность лютеиновой фазы у кошек не относится к числу частых причин бесплодия, резорбции плодов или аборта. Применение прогестерона при данной патологии повышает риск развития пиометры (Colby, 1980а; Christiansen, 1984) и, кроме того, может привести к маскулинизации наружных половых органов у котят-самок (Johnston, 1983).
Лечение
Лучшим способом избежать возникновения большинства описанных в этом разделе расстройств служит профилактика. Кошки, используемые в разведении, должны быть своевременно вакцинированы, и существенным моментом является их правильное содержание. Этих кошек нужно проверить на наличие кишечных паразитов и - при положительном ответе - провести дегельминтизацию, периодически исследовать их на носительство вируса лейкемии кошек и оберегать от нежелательных контактов с больными или не прошедшими обследования котами. Беременных кошек вакцинировать нельзя. При использовании различных лекарств нужно иметь в виду, что все они потенциально вредны для плодов.
КИСТОЗНАЯ ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ / ПИОМЕТРА
Патофизиология
Патофизиология кистозной гиперплазии эндометрия (КГЭ) у собак и кошек сходна (подробное обсуждение см. в гл. 23). Сам термин «кистозная гиперплазия эндометрия» отражает изменения, происходящие в эндометрии: он становится аномально утолщенным за счет образования кистозных структур, заполненных жидкостью. Если не присоединяется инфекция, жидкость остается прозрачной и исходно находится внутри кистозных структур в
Таблица 33-6. БАКТЕРИИ, ВЫДЕЛЕННЫЕ ИЗ ПОЛОВОГО ТРАКТА КОШЕК ТРЕХ ГРУПП
Число случаев обнаружения бактерий
Выделенные бактерии Группа 1* (n = 13) Группа 2** (n = 10) Группа j*** (n = 30)
Вагинальные аэробы
Staphylococcus
(коагулазонегативный) 7(54) 7(70) 10(33)
S. aureus 0(0) 1(10) 0(0)
S. intermedius 0(0) 1(10) 0(0)
Streptococcus canis 9(69) 8(80) 6(20)
Str. uberis 0(0) 0(0) 4(13)
Str. agalactiae 0(0) 0(0) 2(7)
Str. dysgalactiae 0(0) 0(0) 2(7)
Str. faecalis 1(8) 0(0) 0(0)
Str. mitis 1(8) 0(0) 1(3)
Streptococcus
(неидентифицированный) 1(8) 0(0) 8(10)
Aerococcus sp. 2(15) 0(0) 1(3)
Micrococcus sp. 0(0) 1(10) 0(0)
Bacillus sp. 1(8) 0(0) 0(0)
Corynebacterium sp.
(негемолитический) 5(38) 3(30) 7(23)
Actinomyces pyogenes 0(0) 0(0) 4(13)
Подобные Gardnerella sp. 1(8) 0(0) 0(0)
Escherichia coli 6(46) 2(20) 20(66)
Klebsiella ozaenae 0(0) 0(0) 2(7)
Flavobacterium sp. 1(8) 0(0) 2(7)
CDC IU 1(8) 1(10) 3(10)
Moraxella sp. 2(15) 2(20) 3(10)
Acinetobacter sp. 2(15) 1(10) 5(16)
Pasteurella haemolytica 0(0) 1(10) 1(3)
P. multocida 2(15) 0(0) 0(0)
Pseudomonas sp. 0(0) 0(0) 1(3)
Haemophilus paracuniculus 0(0) 0(0) 4(13)
Haemophilus sp. 2(15) 0(0) 0(0)
Подобные Haemophilus sp.
(неидентифицированные) 0(0) 2(20) 8(26)
Simonsiella sp. 0(0) 0(0) 1(3)
Вагинальные анаэробы
Bacteroides fragilis H.O. H.O. 1(3)
B. oralis H.o. H.O. 1(3)
B. asaccharolyticus H.O. H.O. 1(3)
Peptococcus sp. H.O. H.O. 2(7)
Бактериальная флора матки
Lactobacillus sp. (анаэроб) H.O. H.O. 1(3)
Acinetobacter sp. H.O. H.O. 1(3)
E. coli H.O. H.O. 1(3)
Из: Clemetson LL, Ward ACS: Bacterial flora of the vagina and uterus of healthy cats. JAVMA, 1990, 196 : 902.
* Многорожавшие взрослые кошки (возраст 3 года и более), находившиеся в питомнике не менее 2 лет.
** Котята в возрасте 5-7 месяцев, родившиеся в том же питомнике.
*** Кошки в возрасте 6-16 месяцев, принадлежащие частным лицам, некастрированные.
В скобках - процент инфицированных кошек в каждой группе; н.о. - не определялось
слизистой оболочке матки. Однако попав в просвет матки, та же самая жидкость оказывается отличной средой для роста бактерий. Бактериальное загрязнение жидкости ведет к разрушению кистозных структур, распространению инфекции и развитию пиометры. Наиболее вероятным источником бак
РЕПРОДУКЦИЯ КОШЕК • 1153
териального загрязнения служит флора влагалища, откуда бактерии проникают в матку через ее шейку. У нормальных здоровых кошек, как и у сук, вагинальный тракт всегда содержит различные бактерии (табл. 33-6; Clemetson, Ward, 1990).
Как правило, при пиометре обнаруживается Escherichia coli, хотя выделяют также и другие бактерии (Davidson et al, 1992). Появление кистозных структур частично обусловлено влиянием прогестерона на эндометрий. По-видимому, чувствительность к бактериям возрастает при совместном действии прогестерона и эстрогена. Эстроген расширяет шейку матки, вследствие чего и происходит первичное загрязнение содержимого матки. Кроме того, пиометра и метрит иногда возникают в результате задержания плода или последа, травмы при родах или инструментального вмешательства в случае дистоции. Сообщалось о развитии пиометры у кошек с внематочной беременностью (Vasseur, Feldman, 1982) и у кошки с маскулинизированной маткой (Schulman, Levine, 1989).
Общие сведения, анамнез, физикальное исследование
Анамнез. Комплекс КГЭ/пиометра может возникнуть у кошек любого возраста. Интересно отметить, что заболевание чаще всего встречается у кошек старше 5 лет, как никогда не имевших котят (Lein, Concannon, 1983), так и приносивших потомство один или несколько раз (Colby, 1980а). Наш опыт говорит о том, что предшествующие беременности и роды не влияют на заболеваемость пиометрой. КГЭ, как правило, имеет субклиническое течение или приводит к затяжному анэструсу, пока в конце концов не возникает бактериальная инфекция. Признаками пиометры (табл. 33-7) являются обильные вагинальные выделения, снижение или потеря аппетита, угнетенное состояние, вялость, потеря веса, неряшливый вид, кошка часто мочится и много пьет, иногда бывают рвота и/или диарея. Явные вагинальные выделения, водянистые или густые, наблюдаются лишь у кошек с пиометрой открытого типа. В большинстве случаев выделения имеют кремовый, розовый или коричневый цвет. У некоторых кошек потеря аппетита и угнетение проявляются слабо. В далеко зашедших случаях увеличивается живот (Lawler et al, 1991; Potter et al, 1991).
Физикальное исследование. Вагинальные выделения обычно обнаруживаются у кошек с умеренной степенью вялости, признаками обезвоживания и нормальной либо повышенной ректальной температурой; при этом у них удается прощупать увеличенную матку. При тяжелой интоксикации кошка выглядит явно больной, температура падает ниже нормы. При пиометре закрытого типа вагинальные выделения отсутствуют, но матка сильно растягивается, вызывая увеличение живота, и заболевание приобретает тяжелый характер.
Таблица 33-7. КЛИНИЧЕСКИЕ ПРИЗНАКИ ПИОМЕТРЫ (ПО ДАННЫМ ОБСЛЕДОВАНИЯ 21 КОШКИ)
Обильные выделения из влагалища 21/21 100%
Пальпируемая матка 21/21 100%
Лихорадка 5/21 24%
Потеря аппетита 5/21 24%
Сонливость 5/21 24%
Потеря веса 3/21 14%
Неряшливый вид 2/21 9%
Полидипсия/полиурия 2/21 9%
Диагностика
Кистозная гиперплазия эндометрия. При физикальном исследовании кошки с КГЭ отклонений от нормы обычно не выявляется. В отдельных случаях удается прощупать матку. Данные анализов крови и мочи соответствуют норме. Если при рентгенографии брюшной полости небеременной кошки видна матка, это подтверждает диагноз КГЭ, хотя рентгенограмма часто дает отрицательный результат. В отличие от рентгенографии УЗИ брюшной полости оказалось чувствительным и надежным методом визуализации небеременной матки, увеличенной вследствие утолщения эндометрия, причем матка видна независимо от наличия или отсутствия жидкости в ее просвете. Подтвердить диагноз можно только с помощью лапаротомии и гистологического исследования биоптата матки.
Пиометра. Это заболевание диагностировать легче, чем КГЭ. Пиометру следует подозревать при наличии аномальных выделений из влагалища. Для установления диагноза требуются дальнейшие исследования. Диагноз подтверждается, если при рентгенографии обнаруживается увеличение матки. С помощью УЗИ - при проведении его не ранее 21-го дня после последней вязки - легко дифференцировать беременность и пиометру. У многих (но не у всех) кошек с пиометрой увеличено число лейкоцитов в крови (в среднем 35 000 клеток в 1 мл) и/или наблюдается сдвиг лейкоцитарной формулы в сторону незрелых нейтрофилов (Davidson et al, 1992). В тех случаях, когда вагинальные выделения у кошки появились в фазе диэструса, либо по завершении диэструса, либо вскоре после родов, то, исключив другие возможные причины таких выделений (проэструс, наличие чужеродного тела или опухоли во влагалище, вагинит, травма), следует приступить к лечению пиометры.
До начала терапии и в ходе ее проведения необходимо контролировать ряд дополнительных показателей; в частности, у тяжелобольных кошек следует регулярно измерять ректальную температуру, содержание азота мочевины в крови, диурез и концентрации калия и натрия в сыворотке крови. Отклонения этих параметров от нормы относятся к числу факторов, усугубляющих тяжесть заболевания. Успех любого вида лечения зависит от коррекции как первичных, так и вторичных нарушений.
1154 • РЕПРОДУКЦИЯ КОШЕК
Лечение
По одерживающая терапия: антибиотики и внутривенное введение жидкости. Бактериемия обнаруживается у 10-15% сук с пиометрой. Предполагается, что и у кошек с пиометрой бактериемия возникает примерно в таком же проценте случаев. Отсюда следует, что все больные кошки должны получать антибиотики. Поскольку при пиометре чаще всего выделяют Е. coli. препаратами первоначального выбора следует считать триметоприм/сульфади-азин (трибибриссин, произ-во Burroughs Wellcome Со., США) или амоксициллина тригидрат/клавула-нат калия (клавамокс, произ-во Beecham Inc, США). Культивирование микроорганизмов из материала, полученного из переднего свода влагалища, и определение их чувствительности к антибиотикам позволило бы подобрать наиболее эффективный препарат, однако при лечении кошек такие исследования практически не проводятся. Применение антибиотиков в качестве единственного средства терапии редко приводит к успеху. Не менее важно тщательно следить за состоянием водного обмена (гидратации) кошек с подозрением на пиометру и в нужном случае принять соответствующие меры.
Хирургическое лечение. Овариогистерэкпю-мия (ОГЭ). Удаление матки и яичников считается средством выбора для лечения пиометры и, как правило, дает хороший результат: полностью ликвидируется очаг инфекции, и большинство кошек быстро выздоравливают.
дренирование матки. В литературе описана техника дренирования и промывания матки с использованием лапаротомии и утеротомии (Vasscur, Feldman, 1982). Процедура состоит в следующем. Вскрывают брюшную полость, обнажают матку и производят небольшой продольный разрез стенки матки с вентральной стороны, после чего отсасывают гнойное содержимое. Затем матку промывают сбалансированным по составу электролитов
раствором. Чтобы обеспечить послеоперационное орошение полости матки, в каждый рог помещают фенестрированную (с отверстиями в стенке) дренажную трубку, выводя ее свободный конец наружу через шейку матки и влагалище (рис. 33-8). Таким образом, это серьезная, полостная операция на инфицированном органе, проводимая к тому же у сильно ослабленных кошек. Хотя в ограниченном числе случаев она проходила успешно, производить ее не рекомендуется.
Лечение простагландинами. Показания. Для лечения пиометры были предложены различные лекарственные средства, однако ни одно из них не получило такого распространения и не оказалось столь эффективным, как простагландины. В своей практике лечения кошек с послеродовым метритом и пиометрой открытого типа мы использовали проста!ландин F2q (ПГ F ) и получили отличные результаты. Более сильно действующие синтетические аналоги нами не применялись. ПГ F^a назначают в тех случаях, когда владелец предпочитает отказаться от ОГЭ, чтобы сохранить репродуктивную способность кошки. При этом кошка должна быть не старше 6 лет и не иметь задержанного последа (что крайне важно установить с помощью УЗИ брюшной полости). С учетом mix критериев мы провели лечение 32 кошек с пиометрой открытого типа и 8 кошек с послеродовым метритом, тоже протекавшим с открытой шейкой матки и естественным дренированием. Предпосылкой служило отсутствие у кошек критического состояния.
Лечение и немедленная реакция. Мы рекомендуем вводить кошкам динопрост-трометамин (лю-тализ, произ-во The Upjohn Со., США) в дозе 0,1 мг кг подкожно дважды в день в течение 5 дней. Один из основных эффектов ПГ F на репродуктивный тракт - стимуляция сокращений миометрия, которые приводят к нарастающему на протяжении нескольких дней выбросу содержимого матки. Концентрация прогестерона в плазме у большинства
Рис. 33-8. Расположение дренирующих трубок, введенных внутриматочно при хирургическом лечении пиометры. (Из: Vasscur РВ„ Feldman ЕС.: Pyometra associated with extrauterine pregnancy in a cat. JAAHA, 1982, 18:870).
РЕПРОДУКЦИЯ КОШЕК • 1155
(но не у всех) кошек с пиометрой открытого типа превышала 1 нг/мл, что указывало на активное функционирование желтых тел. Из этого следует, что ПГ F2a не вызывает стойкого угнетения синтеза прогестерона или лизиса желтых тел. Способность ПГ F2a расширять шейку матки не определялась.
У сук простагландин довольно редко вызывает выраженные маточные сокращения. В отличие от этого у кошек мы часто наблюдали резкое повышение количества вагинальных выделений сразу же после введения ПГ F2a, что свидетельствовало о явном действии гормона на миометрий.
Лечение простагландином рекомендуется сочетать с антибиотикотерапией. В ходе лечения кошку следует тщательно наблюдать, проводя полное физикальное исследование как минимум дважды в день. После первой инъекции простагландина кошку госпитализируют на один день для наблюдения, но содержать ее в клинике в течение всего курса лечения нет необходимости. Если у животного усилилась лихорадка, появились боли в животе или другие тревожные симптомы, следует повторно определить число лейкоцитов в крови и провести УЗИ. Ни у одной из леченных нами кошек мы не наблюдали развития системной инфекции или перитонита, однако такие осложнения не исключены. Если проявления заболевания нарастают и/или подозревается перитонит, владельца кошки нужно известить о сложившейся ситуации и порекомендовать овариогистерэктомию (с промыванием брюшной полости или без него). До настоящего времени не потребовалось оперировать ни одну из кошек, которых мы лечили простагландинами.
Побочные эффекты. Многие из побочных эффектов ПГ F2a, развивающихся у кошек, напоминают таковые у сук (Nelson et al, 1982; Davidson et al., 1992; см. гл. 23). Через 30-120 секунд после инъекции простагландина у кошки могут отмечаться следующие явления: одышка и голосовая активность; беспокойство; интенсивный груминг; тенезмы, слюнотечение, диарея, мидриаз (расширение зрачков), кошка «месит» лапами; рвота, мочеиспускание, дефекация и/или кошка принимает лордозную позу (табл.. 33-8). Если кошка стала заниматься грумингом, то вылизывает бока и/или вульву. Еще один побочный эффект - кошка начинает размахивать хвостом и рвать когтями бумажную подстилку в клетке. Обычно эти явления продолжаются от 2 до 20 минут. Практически у всех кошек с каждой последующей инъекцией ПГ F2a реакция ослабевает. На 5-й день побочные эффекты, если и проявляются, то незначительны и быстро проходят.
Последующее наблюдение. Состояние кошек, получавших ПГ F2a, следует проконтролировать спустя 1 и 2 неделю после последней инъекции препарата. Присутствие чистых, серозных вагинальных выделений через 7 дней после завершения лечения указывает на то, что лечение пиометры прошло удачно, и дальнейшие инъекции простагландина, как правило, не нужны. Такие выделения
ТАБЛИЦА 33-8. ФИЗИЧЕСКИЕ РЕАКЦИИ НА ПОДКОЖНОЕ ВВЕДЕНИЕ ПГ F2 , НАБЛЮДАВШИЕСЯ У 21 КОШКИ,“ ЛЕЧЕННЫХ ПО ПОВОДУ ПИОМЕТРЫ
Вокализация 13/21 82%
Одышка 8/21 38%
Беспокойство 7/21 33%
Груминг 5/21 24%
Тенезмы 5/21 24%
Обильное слюноотделение 5/21 24%
Диарея 4/21 19%
Мидриаз 3/21 14%
Рвота 2/21 9%
Мочеиспускание 2/21 9%
Лордозная поза 2/21 9%
продолжаются у кошек недолго, от 2 до 10 дней. Число лейкоцитов в крови приходит к норме обычно спустя 7 дней после проведенного лечения, а через 14 дней наверняка должно быть нормальным. Если же при проверке на 14-й день наблюдаются кровянистые или слизисто-гнойные выделения, матка увеличена, число лейкоцитов в крови повышено и кошку лихорадит, то можно рекомендовать проведение второго 5-дневного курса лечения.
Вязка. Во многих случаях эструс у кошек возобновляется через 1-6 недель после лечения. Мы рекомендуем провести в это время вязку с целью получения потомства и снижения вероятности рецидива инфекции.
Результаты. Как мы уже упоминали, лечение 32 кошек с пиометрой открытого типа и 8 кошек с послеродовым эндометритом дало прекрасные результаты. Все кошки отвечали на лечение ПГ F2a. К моменту его завершения у всех животных улучшился аппетит, нормализовалась ректальная температура, уменьшились или исчезли вагинальные выделения. При обследовании на 14-й день все кошки были практически здоровыми, у них отсутствовали вагинальные выделения и при пальпации не выявлялось увеличения матки. После лечения простагландином у 39 кошек из 40 возобновился нормальный эстральный цикл. Эструс наступил через 0,5-12 месяцев после лечения, в среднем через 4 месяца. У одной кошки спустя 1 месяц после завершения терапии вновь появились гнойные вагинальные выделения; было проведено повторное лечение, которое прошло удачно, без осложнений.
Вязка прошла успешно у 39 из 40 кошек в сроки от 2 недель до 5 лет после лечения, и 37 кошек родили живых котят. Одна кошка трижды рожала мертвых котят, одна кошка была кастрирована год спустя после лечения вследствие рецидива пиометры (она никогда не приносила котят), а у одной кошки вязок не было, несмотря на нормальные течки. Из 37 кошек, принесших здоровое потомство, у трех позднее снова развилась пиометра. Одну из них пришлось кастрировать, однако двум другим вновь было назначено лечение простагландином, после чего у них была нормальная беременность, завершившаяся рождением здоровых котят.
1156 • РЕПРОДУКЦИЯ КОШЕК
БЕСПЛОДИЕ
Общие замечания
Термин бесплодие в широком смысле относится к любой ситуации, когда кошка не приносит потомства. Бесплодие - это не диагноз, а, скорее, признак какого-то расстройства. Бесплодие возникает под влиянием самых разнообразных факторов, и чтобы установить его причину, важно тщательно изучить индивидуальные особенности кошки. Список вопросов, на которые необходимо ответить при оценке состояния бесплодия у собак, легко адаптировать применительно к кошкам (см. гл. 24), однако в него нужно включить и некоторые дополнительные вопросы, в частности, издает ли кошка пронзительный крик после копуляции, обнаруживается ли у нее характерная последующая реакция, сколько раз в день она спаривается, на протяжении скольких дней происходят спаривания за время течки и т. д.
Бесплодие у кошек с нормальным полиэструсным циклом (рис. 33-9)
Общее состояние здоровья кошки. Прежде чем приступать к поиску нарушений со стороны репродуктивной системы кошки (он может оказаться ненужным), следует обратиться к более очевидным расстройствам. Бесплодие могут обусловить заболевания печени, почек и других жизненно важных органов. Ветеринарный врач должен собрать полный анамнез кошки и провести тщательное физикальное исследование. Все отклонения от нормы должны быть подробно изучены. Кроме того, в большинстве случаев бесплодия требуется провести общий клинический анализ крови, биохимический анализ сыворотки крови, анализ мочи, тест на зараженность вирусом лейкемии кошек, а если речь идет о худых кошках - определение концентрации тироксина в сыворотке. Может понадобиться также определение титров антител к возбудителям инфекционного перитонита кошек и токсоплазмоза. При подозрении на болезнь сердца кошке необходимо снять электрокардиограмму и провести рентгенографию грудной клетки, а также, если возможно, УЗИ или эхокардиографическое исследование.
Настоятельно рекомендуется проведение УЗИ брюшной полости. К числу достоинств этого метода относится возможность исследовать матку, ее содержимое (если оно имеется) и яичники (например, обнаружить опухоли или кисты), а кроме того, оценить состояние других структур брюшной полости. Рентгенография не является столь ценным методом, тем не менее ее следует выполнить после 12-24-часового голодания кошки и постановки 1-2 клизм. Эта подготовка облегчает визуализацию почек, печени, желудочно-кишечного тракта, мочевого пузыря и позвоночника. Обнаружение плодных структур, неидентифицированных новообразова
ний или матки (которая в норме на рентгенограмме не выявляется) позволяет установить диагноз.
Кот-производитель. В отличие от кобеля, фертильность кота установить непросто. Однако во всех случаях, когда у практически здоровой кошки зачатие не происходит, следует подумать, фертилен ли кот. Если в течение 6-12 месяцев использования кота в качестве производителя покрытые им кошки не приносят потомства, то вполне вероятно, что он и является причиной бесплодия. Поэтому, прежде чем приступать к трудоемкому исследованию внешне здоровой кошки, нужно использовать кота с доказанной фертильностью.
Анализ практики проведения вязок. При рассмотрении каждого случая бесплодия необходимо собрать сведения о питании кошки, условиях ее содержания, мерах по дегельминтизации, проведенных вакцинациях, тестировании на вирус лейкемии кошек; важно также выяснить, как происходит прием новых кошек в питомник, а именно помещают ли их предварительно на карантин. Кошки должны получать предназначенный для них высококачественный коммерческий корм. Это особенно важно, когда в домашних условиях или в питомнике наблюдается более одного случая бесплодия.
Владельца кошки нужно подробно расспросить о практике проведения вязки. Как уже было указано в этой главе, при спаривании кошки только по одному разу в день на протяжении эструса (или всего только один раз) вероятность наступления у нее овуляции значительно ниже, чем у кошек, спаривающихся от 4 до 8 раз через день. Спаривание в слишком ранние или поздние сроки эструса тоже снижает вероятность овуляции. Владельцу нужно разъяснить, что кошка в период течки должна иметь возможность спариваться с котом не менее 4 раз каждый день или через день. Такой режим наиболее благоприятен для индукции овуляции и зачатия.
Владелец должен также наблюдать за ходом спаривания, чтобы выяснить, позволяет ли кошка садку кота, издает ли она характерный крик при коитусе, проявляется ли у нее пост-реакция. Если ни крика, ни пост-реакции не замечено, то, скорее всего, спаривания не произошло. В этом случае нужно заменить кота. Если же это не поможет, нужно проверить, допускает ли кошка вязку. Владелец, никогда не наблюдавший за вязкой, не в состоянии ответить на эти крайне важные вопросы. Очевидно, что причины бесплодия у кошек, которые отказываются вязаться с котом, и кошек, у которых не происходит зачатия, совершенно различны (см. рис. 33-9).
Интерэструсные интервалы. Владелец кошки и ветеринар должны обсудить все данные о сроках проведения вязок. Ветеринару это дает возможность ознакомиться с системой регистрации, применяемой владельцем, и оценить правильность его наблюдений. Нормальная кошка допускает вязку в среднем в течение 7 последовательных дней (от 4 до 9 дней). Если число совокуплений достаточ-
Неинфекционные причины бесплодия кошки
Затяжной анэструс
--- f----------
Регулярные циклы, вязки, беременности нет
ZZZi______
Затяжной или непрерывный эструс
Вагинальная кератинизация...
Фолликулярные кисты
Эструс возобновляется через...
Фолликулярные кисты или гранулезоклеточная опухоль
Рис. 33-9. Алгоритм определения причин бесплодия у кошки (самки), не имеющей какой-либо инфекции.
РЕПРОДУКЦИЯ КОШЕК
1158 • РЕПРОДУКЦИЯ КОШЕК
но, чтобы вызвать овуляцию, у незабеременевшей кошки должна возникнуть ложная беременность, и интерэструсный интервал должен продолжаться от 35 до 70 дней. Наступление ложной беременности означает, что либо кошка оказалась неспособной к зачатию или же вынашиванию плодов, либо кот оказался стерильным. Состояние ложной беременности можно подтвердить путем определения концентрации прогестерона в плазме через 1-3 недели после окончания периода спаривания. Если же индукции ложной беременности не произошло, необходимо установить, действительно ли спаривания имели место и если да, то достаточно ли их было в нужное время (см. рис. 33-9).
Отсутствие имплантации. Резорбция плодов. Выкидыш. Обсуждение этих вопросов см. выше в данной главе, в разделах, посвященных кистозной гиперплазии эндометрия, спонтанной резорбции плодов и выкидышу.
Отсутствие астральных циклов
Ранее проведенная овариогистерэктомия. Если у кошки вообще не наблюдается периодов половой активности, ветеринар должен выяснить, не подверглась ли она ранее овариогистерэктомии. Чтобы убедиться в этом, достаточно бывает найти при осмотре кошки следы разреза брюшной стенки, характерного для этой операции (см. рис. 33-9).
Общее состояние здоровья. Состояние здоровья кошки следует оценить со всей тщательностью. Для этого необходимо собрать подробный анамнез, провести полное физикальное исследование и сделать стандартные анализы крови и мочи. Причиной прерывания или прекращения эстральных циклов может быть состояние стресса, развивающееся у животного вследствие плохого питания, скученности в месте содержания или заболеваний, а также в условиях экстремальных температур или неправильного светового режима. На эстральный цикл может повлиять и стресс, возникающий при транспортировке или пребывании в обстановке выставочного ринга. Прерывание циклической активности яичников вызывают некоторые лекарственные средства, в первую очередь прогестагены и глюкокортикоиды, подавляющие секреторную функцию гипофиза по механизму обратной связи. Описаны также различные опухоли яичников и матки; самые частые из которых - гранулезо-текаклеточные опухоли и дисгер-минома (эмбриональная карцинома) яичников (Loar, 1989); эти опухоли могут вызвать затяжной анэструс, КГЭ или длительный эструс (Herron, 1986).
Скрытая течка. Вероятно, лучшим примером такого состояния служит кошка, которую содержат вместе с другими кошками. Если она занимает низшие ступени в социальной иерархии или если животных содержат в тесном помещении, то эструс у нее может пройти совершенно незаметно (скрытый цикл, или скрытая течка) не только для людей, но, видимо, и для других кошек. Распознать этот синд-
ром трудно, хотя для этого существует ряд простых диагностических приемов (см. рис. 33-9). Проще i всего научить владельца кошки брать вагинальные мазки; эту процедуру нужно проводить один или два раза в неделю с января до марта. Мазки подсушивают на воздухе и доставляют в ветеринарную лабораторию для окрашивания и просмотра. Фолликулярная фаза определяется по увеличению процента поверхностных клеток. Другой способ заключается в определении концентрации эстрогена в плазме (1 или 2 раза в неделю). Если тем или иным способом удается установить, что яичники функционируют нормально, кошку следует полностью изолировать и содержать 14 часов в сутки при свете и 10 часов в темноте. При таком световом режиме и в отсутствие других кошек овариальная активность обычно становится более заметной. Можно также ’ попытаться индуцировать эструс с помощью медикаментов (см. ниже). ;
Раннее угасание функции яичников. Продолжительность функционирования яичников у кошек не определялась, но известно, что у многих кошек старше 11-13 лет эстральные циклы отсутствуют. । Кошек старше 8 лет в разведении обычно не ис- | пользуют. Встречается аномально раннее угасание | функции яичников - состояние, которое владельцы 1 обычно интерпретируют как затяжной анэструс. '
Подозревать преждевременное угасание функции -
яичников следует тогда, когда исключены все дру- | гие возможные причины отсутствия овуляции и ее не удается индуцировать искусственно. Однако подтвердить диагноз трудно. Для этого клиницисту придется определить концентрацию ЛГ и ФСГ в плазме крови. Стойкое повышение уровня этих гормонов свидетельствует о том, что яичники не функционируют (см. рис. 33-9).
Нарушения полового развития. У фенотипически нормальных кошек яичники могут не функционировать вследствие хромосомных аномалий. Такие случаи описаны в литературе (Nicolas et al, 1980; Johnston et al, 1983). Диагностирование нарушений, рассмотренных в гл. 24, осуществляют с помощью кариотипирования. Такие анализы проводятся в ряде научных центров, например в Калифорнийском университете. Возможен иной подход - диагностическое оперативное вмешательство с целью исследования полового тракта кошки и взятия биопсии или же удаления всех патологически измененных тканей. Чтобы исключить всякую вероятность порока полового развития, можно также попытаться индуцировать эструс медикаментозными средствами.
Индукция эструса. Показания. Если ветеринар исключил такие причины отсутствия эстральных циклов, как анатомический порок, органическое заболевание или применение лекарственных средств, то целесообразно попытаться индуцировать эструс при помощи медикаментов. Этот подход применяют в тех случаях, когда у кошки никогда не было течки, или возникло состояние затяжного анэст
РЕПРОДУКЦИЯ КОШЕК • 1159
руса, или течка возникает нерегулярно. Поскольку овуляция у кошки является индуцируемым процессом, то, как только под влиянием терапии у нее наступил эструс, нужно провести вязку (для индукции овуляция) либо вызвать овуляцию с помощью лекарственных средств.
Коррекция светового режима. Прежде чем применять гормоны, следует сделать попытку индуцировать у кошки эструс путем изменения светового режима. В течение недели кошка должна находиться при освещении от 8 до 10 часов и в темноте от 14 до 16 часов в сутки, после чего на протяжении 4-8 недель освещение продлевают до 12-14 часов, а темный период соответственно сокращают до 10-12 часов. Чтобы индуцировать эструс, такую схему светового режима можно использовать повторно (Humi, 1981).
Совместное содержание с кошками, находящимися в состоянии течки. Кошку, находящуюся в анэструсе, полезно подсадить к нескольким кошкам, у которых эстральные циклы протекают нормально. Имеются сообщения об удачной индукции эструса подобным способом, особенно у домашних кошек, долгое время содержавшихся изолировано от других кошек (Christiansen, 1984).
Использование гормонов для индукции эструса. Обсуждение этого вопроса см. в разделе «Искусственное размножение» в данной главе.
Затяжной интерэструсный интервал
Ложная беременность. Если эструс у кошки обычно наступает лишь каждые 30-60 дней, то вполне вероятно, что у нее происходят овуляции и возникают повторные ложные беременности. Это наблюдалось у кошек, которые никогда не спаривались. У некоторых кошек овуляцию индуцируют ласка, процедура получения мазков для вагинальной цитологии, а также другие, менее очевидные факторы. Обычно такие кошки здоровы и оказываются фертильными после вязки. Подтвердить диагноз ложной беременности помогает определение концентрации эстрогена, которая повышается спустя 1-3 недели после эструса (обсуждение см. стр. 1139).
Рекомендации по уходу. Чтобы у кошки был нормальный эстральный цикл, ей нужно создать все необходимые для этого условия: правильные питание и содержание, соответствующие уход и световой режим. Владельцу следует наблюдать за кошкой, чтобы выяснить, насколько регулярно у нее возникают течки. Важно также по данным осмотра и лабораторных анализов оценить общее состояние здоровья кошки, учитывая, что циклическая активность яичников может прерываться из-за болезни.
Фолликулярные кисты
Диагностика. Причиной как затяжного эструса, так и затяжного интерэструсного интервала бывают фолликулярные кисты. Диагностировать
эту патологию трудно, хотя в случае непрерывного эструса, который вызывается секрецией эстрогена функционирующими фолликулами, эту секрецию можно выявить, определяя уровень эстрогена в плазме крови. Однако самым простым и надежным методом диагностики фолликулярных кист служит УЗИ брюшной полости. Обнаружить кистозные структуры этим методом обычно легко, их размеры и форма остаются относительно постоянными. Подтверждает диагноз постоянно повышенная концентрация эстрогена (более 20 пг/мл) в плазме крови (см. рис. 33-9).
Затяжная половая активность - нимфомания. Кошки способны проявлять затяжную половую активность, несмотря на сохранность у них нормальной волнообразной функции фолликулов. Иными словами, свойственное эструсу поведение перекрывает интерэструсные интервалы, что дает картину непрерывной течки (Colby, 1980b). У большинства кошек это считается нормальным явлением, не требующим терапевтического вмешательства. Идеальным способом лечения (если это называть лечением) является индукция овуляции путем спаривания с нормальным или вазэктомированным котом. Овуляцию можно вызвать также искусственной вагинальной стимуляцией и тем самым прервать непрерывный поведенческий эструс.
Фолликулярные кисты часто приводят к затяжному эструсу, поскольку персистирующий фолликул служит постоянным источником эстрогена. Характерное для затяжного эструса поведение демонстрируют все кошки, находящиеся под непрерывным воздействием эстрогена. У кошек с кистозной структурой, выявленной в одном из яичников с помощью УЗИ, диагноз ставят на основании определения повышенной концентрации эстрогена в плазме на протяжении более 3 недель при отсутствии признаков нормального цикла.
У кошек старше 5 лет непрерывный эструс указывает на развитие гранулезоклеточной опухоли. Это наиболее часто встречающаяся опухоль яичников у кошки. Такие опухоли у кошек чаще, чем у других видов, носят злокачественный характер (McEntee, 1990).
Лечение. Можно попытаться вызвать овуляцию кистозного фолликула спариванием. Ветеринарный врач может попытаться индуцировать разрыв фолликула (или фолликулов) внутримышечным введением 250 ME ХГч один раз в день в течение 2 дней (обсуждение см. ниже). Рекомендуемым методом лечения является хирургическое удаление кисты (изолированно или вместе с яичником). Обычно хирургу не удается удалить только кисту, сохранив при этом яичник. Такие кошки остаются фертильными, так как у них остается другой, здоровый яичник.
Отказ от спаривания
Эта проблема обсуждается в соответствующих разделах глав 24 и 25, посвященных отказу от спа
1160 • РЕПРОДУКЦИЯ КОШЕК
ривания у сук. Причины проблемы у кошек и сук сходны. К их числу относятся неправильное проведение вязки, поведенческие отклонения у кошки, дефекты наружных половых органов или влагалища и разного рода обструктивные изменения, препятствующие совокуплению. В нашей практике встречались случаи атрезии вульвы и влагалища. Стриктура влагалища - явление редкое, однако этот дефект необходимо учитывать, если кошка отказывается от спаривания.
Эструс у кошек с удаленными яичниками и маткой
У овариогистерэктомированных кошек, привлекающих котов, могли сохраниться остатки ткани яичников вследствие их неполного удаления при операции. О присутствии таких остатков свидетельствуют повышение концентрации эстрогена в плазме и кератинизация (ороговение) слущивающихся вагинальных клеток. Однако избыток эстрогена бывает обусловлен и поражением коры надпочечников. Сообщалось, что пероральное введение преднизолона (2,2 мг/кг один раз в день в течение 5 дней) приводит к стойкому исчезновению признаков эструса через 3-5 дней (Shille, Sojka, 1995).
Наличие остатков яичников подтверждается лютеинизацией фолликулов, возникающей после однократной внутримышечной инъекцией ХГч (250 ME) или ГнРГ (25 мкг) и выявляемой по повышению уровня прогестерона - гормона, продуцируемого желтыми телами. Если спустя 5-7 дней после такой стимуляции концентрация прогестерона в плазме поднимается выше 2,5 нг/мл, следует произвести диагностическую операцию для обнаружения и удаления оставшейся овариальной ткани. Рекомендуется делать это во время эструса, так как в этой фазе легче распознать сильно васкуляризированную ткань яичника (Shille, Sojka,. 1995)
ПРЕДОТВРАЩЕНИЕ ЭСТРАЛЬНЫХ ЦИКЛОВ. КОНТРАЦЕПЦИЯ
Хирургическая контрацепция
Чтобы навсегда сделать кошку стерильной, производят овариогистерэктомию. Эта операция безопасна, не требует больших расходов и дает надежный результат. Отсутствуют сколько-нибудь убедительные данные о том, что овариогистерэктомия наносит вред здоровью кошки. Удаление только яичников не рекомендуется, так как в матке может развиться инфекция. Стерилизация кошки путем перевязки маточных труб или гистерэктомии редко бывает приемлема для владельца, поскольку у кошки при этом сохраняются эстральный цикл, проявления эструса и привлекательность для котов.
Существует также метод лапароскопической стерилизации кошек. Путем электрокоагуляции или наложения зажимов из пластика закрывают рога
матки либо место ее соединения с трубами. В обоих случаях необходимо удостовериться в полной двусторонней окклюзии репродуктивного тракта. Лапароскопическая стерилизация выполняется быстро и безопасно, пригодна для молодых кошек, не достигших половой зрелости, и может использоваться для массовой стерилизации (Wildt, Lawler, 1985). Однако следует иметь в виду, что яичники при этом продолжают функционировать и соответственно эстральные циклы, привлечение котов и спаривания у кошки не прекращаются.
Химическая контрацепция
Прогестагены. Общие положения. Использование прогестагенов подробно обсуждалось в гл. 22. Начинать их применение у кошек следует во время истинного анэструса (т. е. в отсутствие половой активности, обычно в течение октября, ноября и декабря). Это сводит к минимуму риск возникновения заболеваний матки. Если речь идет о только что родившей кошке, то введение прогестагенов нужно начать сразу же после родов, чтобы предупредить первый послеродовый эструс. Длительное применение любого прогестагена может привести к развитию КГЭ, пиометры или гиперплазии молочных желез. Поскольку данная форма терапии не безвредна (см. ниже), ее не рекомендуется назначать ценным породистым кошкам, от которых в дальнейшем предполагается получить потомство.
Предупреждение эструса с помощью мегестрола ацетата. Мегестрола ацетат представляет собой относительно безвредный прогестаген, применяемый для предотвращения эструса. Его побочные эффекты немногочисленны (см. ниже), и процент кошек, способных к зачатию после отмены препарата, очень высок. Метаболизм мегестрола ацетата происходит в печени, в связи с чем при наличии у животного дисфункции печени применение препарата не рекомендуется (Henik et al, 1985). Чтобы предупредить наступление эструса, препарат вводят в дозе 2,5 мг в день в течение 8 недель или по 2,5 мг в неделю до 18 месяцев (Christiansen, 1984). После каждого курса введений следует делать перерыв на 2-3 месяца. Если намереваются провести вязку, это нужно делать во время второй течки после отмены препарата (Christiansen, 1984).
Мегестрола ацетат можно применять даже во время эструса. Согласно одной из рекомендуемых схем, препарат вводят в дозе 5 мг ежедневно 3 дня, а затем по 2,5-5 мг в неделю на протяжении 10 недель. В первые несколько дней терапии кошку следует изолировать от котов. Сообщалось, что у 41% кошек поведенческие признаки эструса (мяуканье, характерные движения и поза, поиск кота) исчезли спустя 3 дня после начала терапии; у 47% кошек анэструс наступил на 5-й день; в целом, 90% кошек находились в анэструсе к концу первой недели (Christiansen, 1984).После отмены терапии можно ожидать быстрого возобновления эструса.
РЕПРОДУКЦИЯ КОШЕК • 1161
Побочные эффекты мегестрола ацетата. Прогестагены могут вызывать у кошек разнообразные побочные эффекты (Romantowski, 1989). К ним относятся повышенная дружелюбность по отношению к людям, сонливость, угнетенное состояние, усиленный аппетит, прибавка веса, полидипсия и полиурия (Henik et al, 1985). Продолжительный прием мегестрола ацетата способен вызвать у кошек атрофию эпидермиса (Henik et al, 1985); описан также один случай развития ксантоматоза кожи (Kwochka, Short, 1984). У некоторых кошек, получавших мегестрола ацетат, наблюдалась гиперплазия молочных желез (Chen, Bellenger, 1987; Shille, Sojka, 1995).
Избыток прогестерона (как результат введения прогестагена) стимулирует секрецию гормона роста, что ведет к появлению у кошек и собак признаков акромегалии и резистентности к инсулину (Eigenmann, 1985). В ряде случаев введение мегестрола ацетата вызывало у кошек сахарный диабет, обычно транзиторный, исчезающий после отмены препарата. Однако иногда развивалось стойкое диабетическое состояние. Показано, что применение мегестрола ацетата в обычных дозах заметно подавляет у кошек функцию коры надпочечников, не вызывая при этом появления клинических признаков недостаточности глюкокортикоидов (Chastain et al, 1981). Такое состояние следует относить к ги-покортицизму; соответственно, если у кошки, получающей мегестрола ацетат, развивается тяжелый стресс (в результате болезни, травмы или хирургического вмешательства), ей следует назначить глюкокортикоидную терапию.
Использование мегестрола ацетата в США. Применение этого препарата в ветеринарной медицине лицензировано, но только для лечения собак. Однако его очень часто назначают и кошкам, что отражено в различных публикациях по ветеринарии.
Андрогены. Миболерон (Cheque, произ-во The Upjohn Со., США) - анаболический андроген, ис
пользование которого для лечения кошек не лицензировано Управлением по контролю качества пищевых продуктов и медикаментов США. Однако показано, что этот препарат предупреждает наступление эструса у большинства кошек. С этой целью его назначают в дозе 50 мкг в день, начиная по меньшей мере за 30 дней до начала ожидаемого эструса. Миболерон подавляет активность яичников только в период его применения, не оказывая заметного влияния на последующие течки, спаривание, зачатие, роды и численность потомства (Christiansen, 1984). Если кошка находится в состоянии проэструса или эструса, применять миболерон не следует. Препарат часто вызывает увеличение клитора и утолщение дермы шейки матки. Считается, что миболерон противопоказан кошкам, так как есть сообщения о его токсическом действии на печень и развитии тиреотоксикоза после его применения (Shille и Sojka, 1995).
Неплановая вязка.
Предотвращение имплантации
С этой проблемой у кошек ветеринарные врачи сталкиваются редко. Однако если она возникла, то, как и в аналогичной ситуации с суками, нужно попытаться определить, действительно ли случка имела место; об этом можно судить по данным анамнеза, картине вагинальных мазков (определение стадии эструса и/или присутствия спермы), а также по результатам осмотра кошки (царапины, следы укусов, отсутствие шерсти на загривке). Как и в случае сук, можно провести лечение эстрогенами, но их применение не рекомендуется. Сообщалось, что имплантацию удается предотвратить с помощью мегестрола ацетата, назначаемого перорально в дозе 2 мг один раз во время эструса. Чтобы прервать 30-35-дневную беременность, используют простагландины в тех же дозах, что и при лечении пиометры.
Коты
АНАТОМИЯ И ФИЗИОЛОГИЯ
Половой член
Пенис кота расположен вентрально по отношению к мошонке, направлен назад и заключен в свободно облегающий его препуций. Поверхность полового члена на две трети, начиная от основания, покры
та ороговевшими шипиками длиной 0,75- 1 мм. Их число составляет 100-200, и они направлены к основанию пениса. Полностью эти шипики развиваются по достижении котом половой зрелости (примерно в возрасте 9 месяцев). Раздражение стенок влагалища, вызываемое шипиками, способствует, видимо, усилению стимула, необходимого для индукции овуляции (Christiansen, 1984).
1162 • РЕПРОДУКЦИЯ КОШЕК
Семенники
Концентрация андрогена в тестикулярной вене превышает его содержание в периферической крови почти в 70 раз. Введение экзогенного тестостерона подавляет высвобождение ГнРГ из гипоталамуса и ЛГ из гипофиза, прерывая синтез тестостерона клетками Лейдига. В результате этого клетки, из которых образуются сперматозоиды, испытывают недостаток в необходимом для их развития тестостероне (несмотря на его введение), что может привести к стерильности.
К моменту рождения семенники обычно находятся в мошонке. Ко времени первой вакцинации и обследования кота ветеринарным врачом (т.е. в возрасте 6-8 недель) они, как правило, легко прощупываются. Клетки Лейдига созревают к 5-месячному возрасту, и вскоре после этого сперматозоиды появляются в семенных канальцах. Наблюдаемая иногда врожденная гипоплазия (недоразвитие) яичек может быть следствием фетальной или неонатальной панлейкемии (Lein, Concannon, 1983) либо хромосомных аномалий; последние чаще всего встречаются у котов черепахового окраса.
ОБСЛЕДОВАНИЕ
Мошонка, семенники, препуций и половой член
Осмотр. Кота осматривают примерно так же, как и кобеля. Семенники должны быть округлыми, гладкими, плотными, симметричными по форме и размерам и безболезненными. Головка придатка семенника направлена дорсокраниально (в сторону спины и вперед), тело придатка расположено дорсо-латерально от каждого семенника, семявыносящий проток проходит по медиальному краю придатка.
Орхит. Одной из причин возникновения орхита служат травматические повреждения семенника. Для лечения используют антибиотики, а также влажные теплые компрессы для поддержания чистоты. Иногда орхит возникает вторично как осложнение различных инфекционных заболеваний, как вирусных, так и бактериальных.
Крипторхизм. Крипторхизм, одно- или двусторонний, встречается нечасто, менее чем у 2% котов (Millis et al, 1992), однако он бывает наследственным признаком. Котов с крипторхизмом рекомендуется кастрировать. Опухоли семенников возникают редко.
Пенис и препуций. Нарушения, затрагивающие половой член и препуций, немногочисленны. Основные из них - травматические повреждения пениса и препуция и сужение/непроходимость уретры. Обструкция мочеиспускательного канала - довольно распространенная патология, причем она часто сопряжена с травмой пениса, поскольку в этом состоянии кот чрезмерно его вылизывает, а кроме того, источником травмы становится проце
дура по устранению обструкции. Лечение травмы состоит в осторожной гигиенической обработке полового члена, и со временем повреждение обычно проходит.
Неудачное спаривание, когда коту, несмотря на садку и движения таза, не удается ввести половой член во влагалище, может быть обусловлено скоплением волос вокруг основания головки пениса. Это волосяное кольцо легко удалить, предварительно сместив препуций кзади.
Получение, хранение и консервация спермы
Ручной способ получения. По оценкам, примерно 20% котов можно приучить эякулировать в искусственную вагину (Shille, Sojka, 1995). Искусственная вагина представляет собой маленький резиновый «палец» емкостью 1 мл с обрезанным концом, надетым на небольшую пробирку. Это устройство обычно помещают в.пластиковый сосуд емкостью 60 мл, наполненный теплой (52°С) водой; при этом закругленный конец резинового «пальца» должен находиться над краем пластикового сосуда. Когда кот делает садку на готовую к спариванию кошку и происходит эрекция, смазанную искусственную вагину надвигают на пенис и в течение короткого времени (несколько секунд) собирают эякулят. В норме объем семени составляет 0,2-0,8 мл.
Электроэякуляция. Процедуру проводят под общей анестезией, используя тефлоновый ректальный зонд размером 10 мм х 12 см, снабженный тремя расположенными по его длине электродами из нержавеющей стали длиной 5 см каждый. Электростимуляцию проводят при напряжении от 1 до 8 В и силе тока от 5 до 250 мА (Christiansen, 1984). В одной из опубликованных работ (Pineda et al, 1984) смазанный зонд вводили в прямую кишку, направляя его вентрально, на глубину 6 см. Каждая процедура электроэякуляции состояла из нескольких серий по 60 стимулов. Использовали переменный ток частотой 30 Гц. Первые 40 стимулов производили при напряжении 2,0 В и силе тока 20-30 мА и сразу же вслед за этим - 20 стимулов при 3,0 В и 30^40 мА. В каждой серии интервалы между стимулами составляли приблизительно 2 секунды.
Анализ спермы. Эякулят, полученный с помощью искусственной вагины, обычно имеет объем 0,02-0,12 мл и содержит 0,15-13,0 х 106 сперматозоидов, из которых 60-95% подвижны. Для исследования достаточно 5 мкл спермы. Число сперматозоидов с морфологическими дефектами составляет, как правило, менее 10%. Эякулят, полученный путем электроэякуляции, имеет примерно такое же качество, но его объем обычно больше (0,05-0,14 мл; Pineda et al, 1984). Электроэякуляцию производят не чаще чем один раз в неделю, тогда как при использовании искусственной вагины эякулят можно получать несколько раз в неделю. Исследование
РЕПРОДУКЦИЯ КОШЕК
1163
спермы у котов проводят так же, как это описано для кобелей (см. гл. 32).
Анализ спермы после естественного спаривания. Сразу же после естественного спаривания в свод влагалища кошки вводят палочку, обмотанную увлажненной ватой, как это делается при получении мазка для вагинальной цитологии. Затем прокатывают палочку по предметному стеклу и используют этот образец для исследования сперматозоидов.
Хранение спермы. Непосредственно после получения сперму можно успешно сохранять в течение ночи в буферном растворе TEST, содержащем 20% желтка, при 4°С. При необходимости длительного хранения спермы ее замораживают. Для этого к разбавленной буферным раствором сперме добавляют 5% глицерина, суспензию помещают в соломки (пайетты), осторожно охлаждают, замораживают и хранят в жидком азоте (Dooley et al, 1983, 1986; Howard et al, 1986; Pope et al, 1991).
Искусственное осеменение. См. стр. 1142.
БЕСПЛОДИЕ
Сведения о бесплодии у котов немногочисленны. Дифференциальная диагностика сходна с таковой у кобелей. Среди кошек попадаются гермафродиты, особенно среди животных пятнистого окраса (калико). Диагноз бесплодия ставят редко, однако следует иметь в виду, что у кота, оказавшегося в новой, непривычной обстановке, половое влечение нередко бывает сниженным в течение 1-2 месяцев. Неопытный кот может не решиться подойти к агрессивной или своенравной кошке; то же самое случается, когда кот малоподвижен вследствие долгого содержания в клетке (Christiansen, 1984). У котов, как и у животных любого другого вида, либидо и фертильность во многом зависят от питания, уровня физической нагрузки, условий среды, наличия паразитов или заболеваний, жары или холода, обстановки выставочного зала и многих других факторов, вызывающих стресс.
Роль котов в передаче инфекционных заболеваний половым путем остается невыясненной. Разумным будет убедиться в том, что у кота нет явных инфекционных болезней и он надлежащим образом вакцинирован. Для вязки следует использовать содержащихся в домашних условиях здоровых котов, а после каждого контакта за пределами питомника кота необходимо выдерживать на карантине не менее двух недель.
ЛИТЕРАТУРА
Banks DR: Physiology and endocrinology of the feline estrous cycle. In Morrow DE (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1986, p 795.
Beck KA, et al: Ultrasound prediction of parturition in queens. Vet Radiol 31:32, 1990.
Chastain CB, et al: Adrenocortical suppression in cats given megestrol acetate. Am J Vet Res 42:2029, 1981.
Chen JC, Bellenger CR: Obese appearance, mammary development and retardation of hair growth following megestrol acetate administration to cats. J Small Anim Pract 28:1161, 1987.
Christiansen IJ: Reproduction in the Dog and Cat. London, Bailliere Tindall, 1984.
Clemetson LL, Ward ACS: Bacterial flora of the vagina and uterus of healthy cats. JAVMA 196:902, 1990.
Colby ED: Infertility and disease problems. In Morrow DE (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1980a, p 869.
Colby ED: The estrous cycle and pregnancy. In Morrow DE (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1980b, p 832.
Concannon PW, et al: Reflex LH release in estrous cats following single and multiple copulations. Biol Reprod 23:111, 1980.
Concannon PW, Lein DH: Feline reproduction. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 932.
Davidson AP, et al: Pregnancy diagnosis with ultrasound in the domestic cat. Vet Radiol 27:109, 1986.
Davidson AP, et al: Treatment of pyometra in cats, using prostaglandin F2al ha: 21 cases (1982-1990). JAVMA200:825, 1992.
Di Zerega GS, Hodgen GD: Luteal phase dysfunction: A sequel to aberrant folliculogenesis. Fertil Steril 35:489, 1981.
Donoghue AM, et al: Influence of gonadotropin treatment interval on follicular maturation, in vitro fertilization, circulating steroid concentrations, and subsequent luteal function in the domestic cat. Biol Reprod 46:972, 1992.
Dooley MP, et al: An electroejaculator for the collection of semen from the domestic cat. Theriogenology 20:297, 1983.
Dooley MP, et al: Effect of method of collection on seminal characteristics of the domestic cat. Am J Vet Res 47:286, 1986.
Eigenmann JE: Growth hormone and insulin-like growth factor in the dog: Clinical and experimental investigations. Domest Anim Endocrinol 2:1, 1985.
Goodrow KL, et al: A comparison of embryo recovery, embryo quality, estra-diol-17 beta and P4 profiles in domestic cats (Felis catus) at natural and induced oestrus. J Reprod Fertil 82:553, 1988.
Henik RA, et al: Progesterone therapy in cats. Compend Cont Educ 7:132, 1985.
Herron MA: Infertility from noninfectious causes. In Morrow DA (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1986, p829.
Howard JG, et al: Semen collection, analysis and cryopreservation in nondomestic animals. In Morrow DE (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1986, p 1047.
Howard JG, et al: The effect of preovulatory anaesthesia on ovulation in laparoscopically inseminated domestic cats. J Reprod Fertil 96:175, 1992.
Hurni H: Day length and breeding in the domestic cat. Lab Anim 15:229, 1981.
Johnson LM, Gay VL: Luteinizing hormone in the cat. II. Mating-induced secretion. Endocrinology 109:247, 1981.
Johnston SD: Management of pregnancy disorders in the bitch and queen. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 952.
Johnston SD, et al: X-Chromosome monosomy (37, XO) in a Burmese cat with gonadal dysgenesis. JAVMA 182:986, 1983.
Kwochka KW, Short BG: Cutaneous xanthomatosis and diabetes mellitus following long-term therapy with megestrol acetate in a cat. Compend Cont Educ 6:185, 1984.
Laliberte L: Pregnancy, obstetrics, and postpartum management of the queen. In Morrow DE (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1986, p 812.
Lawler DF, et al: Histopathologic features, environmental factors and serum estrogen, progesterone and prolactin values associated with ovarian phase and inflammatory uterine disease in cats. Am J Vet Res 52:1747, 1991.
Lein DH, Concannon PW: Infertility and fertility treatments and management in the queen and tomcat. In Kirk RW (ed): Current Veterinary Therapy VIII. Philadelphia, WB Saunders Co, 1983, p 936.
Loar AS: Tumors of the genital system and mammary glands. In Ettinger SJ (ed): Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders Co, 1989, p 1814.
Lofstedt RM: The estrous cycle of the domestic cat. Compend Cont Educ 4:52, 1982.
McEntee K: Reproductive Pathology of Domestic Animals. New York, Academic Press, 1990.
Millis DL, et al: Cryptorchidism and monorchism in cats: 25 cases (1980-1989). JAVMA 200:1128, 1992.
Nelson RW, et al: Treatment of canine pyometra and endometritis with prostaglandin F2 alpha. JAVMA 181:899, 1982.
Nicholas FW, et al: An XXY male Burmese cat. J Hered 71:52, 1980.
Olson PN, et al: A need for sterilization, contraceptives and abortifacients: Abandoned and unwanted pets. Part II. Contraceptives. Compend Cont Educ 98:173, 1986.
Pineda MH, et al: Long-term study on the effects of electroejaculation on seminal characteristics of the domestic cat. Am J Vet Res 45:1038, 1984.
Pope CE, et al: Semen storage in the domestic felid: A comparison of cryopreservation methods and storage temperatures [abstractl. Biol Reprod 44:117, 1991.
1164 • РЕПРОДУКЦИЯ КОШЕК
Potter К, et al: Clinical and pathologic features of endometrial hyperplasia, pyometra, and endometritis in cats: 79 cases (1980-1985). JAVMA 198:1427, 1991.
Romantowski J: Use of megestrol acetate in cats. JAVMA 194:700, 1989.
Schulman J, Levine SH: Pyometra involving uterus masculinus in a cat. JAVMA 194:690, 1989.
Shille VM, et al: Follicular function in the domestic cat as determined by estradiol-17D concentrations in plasma: Relation to estrous behavior and cornification of exfoliated vaginal epithelium. Biol Reprod 21:953, 1979.
Shille VM, Sojka NJ: Feline reproduction. In Ettinger SJ, Feldman EC (eds): Textbook of Veterinary Internal Medicine. Philadelphia, WB Saunders Co, 1995, p 1690.
Taubert HD: Luteal phase inadequacy: A quest for new insights. In Taubert HD, Kuhl H (eds): The Inadequate Luteal Phase. Lancaster, England, MTP Press Ltd, 1984, pi.
Thatcher MJD, et al: Characterization of feline conceptus proteins during pregnancy. Biol Reprod 44:108, 1991.
Vasseur PB, Feldman EC: Pyometra associated with extrauterine pregnancy in a cat. JAAHA 18:870, 1982.
Voith VL: Female reproductive behavior. In Morrow DE (ed): Current Therapy in Theriogenology. Philadelphia, WB Saunders Co, 1980, p 839.
Wildt DE, Lawler DF: Laparoscopic sterilization of the bitch and queen by uterine horn occlusion. Am J Vet Res 46:864, 1985.
предметный указатель
А
Абдоминальные схватки при угрозе аборта 904
Аборт
индуцированный 930-942
агонистами дофамина 940
аналогами простагландинов 938
антагонистами гонадотропин рилизинг-гормона 941
антипроге стиновой терапией 939
глюкокортикоидами 941
до имплантации 933-934
комбинацией простагландинов и агонистов
дофамина 940
овариогистерэктомия 932
первичное обследование 930-932, 931р, 932р
после незапланированной вязки 941-942
простагландинами 935-939, 937р
триместры беременности и 932
цитратом тамоксифена 941
спонтанный 811-816, 812т, 814-815р, 900-906, 901т,
905-906р
инфекция Brucella canis 1020
при введении глюкокортикоидов 520
у кошек 1150-1152
Абсорбция
глюкокортикоидов 507-508, 508т,
инсулина 525-526, 525р
левотироксина натрия 147
Абсцесс
при баланопостите 1065
тестикулярный 1053т
АВП, см. аргинин-вазопрессин
Агалактия 927
Агглютинационный тест в пробирках для определения
Brucella canis 1021т, 1022
Аглепристон
для индукции аборта 939
для лечения пиометры 963
Агонисты гонадотропин рилизинг-гормона
для индукции эструса у сук 987-988
для предотвращения овариального цикла 946
при определении фертильности сук 984
Агонисты дофамина
при индукции аборта 940
укороченный межэстральный интервал и 980
Агонисты рецепторов кальция 773
Агрессивное поведение
при гипертиреозе у кошек 168
при гипопаратиреозе у собак 795
Аддисоновый криз 431
лечение 454-461, 455т
ацидоза 459
гиповолемии и гипотензии 455-457, 456р
глюкокортикоидная терапия 460 дисбаланса электролитов 457-459 реакция на 459-460 сопутствующих болезней 460-461 АДГ, см. Антидиуретический гормон Аденокарцинома околоанальной железы 759р Аденома А клеток промежуточной доли гипофиза 271 Аденома В клеток промежуточной доли гипофиза 269,271 Аденома паращитовидной железы контроль после лечения 781 ультразвуковое исследование шейной области 760р хирургическое лечение 773-774
Аденоматозная гиперплазия 196, 782
Аденомиоз семенника 1034
Адипонектин 594
Адреналин
гипогликемия и 679-680, 679т диабетический кетоацидоз и 637, 639, 637р метаболизм 486р феохромоцитома и 473-476
Адреналин, концентрация в плазме крови и моче в норме и при феохромоцитоме 485т
Адреналэктомия
при гиперкортицизме у собак 342-349
при случайно обнаруженной опухоли надпочечников 492-494
при феохромоцитоме 487-491
Адренокортикотропный горомон (АКТГ) недостаточность 427, 436 регуляция секреции глюкокортикоидов 263-266, 264р, 424-425 синдром эктопического АКТГ 273 узловая гиперплазия коры надпочечников 273
Адреномегалия при феохромоцитоме 479р, 480
Азатиоприн 1116
Азооспермия
нормальное либидо у собак и 1104-1109, 1105т, 1106р,1107р
при лимфоцитарном орхите у собак 1083
при сперматогранулеме у собак 1085
при тестикулярной гипоплазии у собак 1071 синдром аплазии системы семенных протоков у собак 1071-1072
1166
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Азот мочевины, концентрация в крови при вторичном гипокортицизме 434т при гиперкортицизме у собак 291 при гипертиреозе у кошек 175, 176-177 при гипокортицизме 433т, 439 при гипопаратиреозе у собак 799т при диабетическом кетоацидозе 646, 646р при несахарном диабете 23 при первичном гиперпаратиреозе 750т, 756 при пиометре 952 при синдроме Кушинга у кошек 385, 385т Азотемия
гиперкальциемия и 733, 746 при акромегалии у кошек 83 при гипертиреозе у кошек 177 при диабетическом кетоацидозе 643 при феохромоцитоме 479
при центральном несахарном диабете 23
Акарбоза
для лечения сахарного диабета у кошек 613 для лечения сахарного диабета у собак 548, 548р у собак 89-91, 312т
Акромегалия, индуцированная прогестероном 89-91 Акромегалия у кошек 78-89 диагностика 86-87 диагностическая визуализация 83-84, 83р, 84р, 83т клиническая патология 82-83 клинические признаки 80-82, 80т, 81р лечение 87-89, 87р патофизиология 80 порода 80 прогноз 89 эндокринологическая оценка 84-86, 85р этиология 78, 78р, 79р
Акромегалия у собак 89-91, 312т во время диэструса 927, 928р
АКТГ, см. Адренокортикотропный гормон Активин 1048, 1048т
Активность липазы в сыворотке крови при диабетическом кетоацидозе 649 у собак при сахарном диабете 537 Активность ренина в сыворотке крови 827 Активность щелочной фосфатазы в сыворотке крови при гиперкортицизме у собак 291-292, 292р при гипертиреозе у кошек 175 при первичном гиперпаратиреозе 756-757 при синдроме Кушинга у кошек 384, 385т при феохромоцитоме 479
Аланинаминотрансфераза, активность в сыворотке крови при гиперкортицизме у собак 291 при первичном гипопаратиреозе 757 при пиометре 952 при синдроме Кушинга у кошек 384 при феохромоцитоме 479
Алиментарный вторичный гиперпаратиреоз 746-747, 809 Алкалоз 753
Алкогольный синдром плодов 885т Аллергическая реакция
при глюкокортикоидной терапии 513 при инсулиновой терапии 570-571 при лечении эпоэтином 824
Аллоксан 703, 706
Алопеция дифференциальная диагностика гиперкортицизма и гипотиреоза 141
обусловленная половыми гормонами 72, 73т после облучения опухоли щитовидной железы у собак 249
при гиперкортицизме у собак 281, 282р
при гипертиреозе у кошек 169
при гипотиреозе у кошек 153
при гипотиреозе у собак 109, 1 Юр
при гипофизарной карликовости 59
при приобретенном дерматозе, чувствительном к
гормону роста 68-69
при синдроме Кушинга у кошек 382-383, 383р
Альбумин
гипоальбуминемия
при гипокортицизме 443
при гипопаратиреозе у кошек 800
при синдроме Кушинга у кошек 384, 385т, 386
при феохромоцитоме 479
при гипертиреозе у кошек 177
при гипокортицизме 433т, 443, 443т
Альдостерон
биосинтез 266-268, 266р, 266т
влияние катехоламинов 475т
гипокортицизм и 449р, 450-452, 451р
первичный гипоальдостеронизм и 369-371
плазма крови 313
регуляция ангиотензином II 826
Альдостерон, определение в сыворотке крови 313 концентрация при гипокортицизме 450-452, 450р, 451р
Альдостерон-секретирующая опухоль надпочечников 412-413
Альфа-агонисты с симпатомиметическим действием 1116
Альфа-глюкозидаза, ингибиторы 548-549
Альфа-меланоцитстимулирующий гормон 265, 265р
Альфа-метилметатирозин 491
Альфа-простол 938
5-Альфа-редуктаза, ингибиторы 1094-1995
Амилаза 293
Амилин 591-592
Амилоид 591-592
Амилоидоз, панкреатический 590-593, 591р
Аминоглюкозиды
безопасность при беременности 887т
при бруцеллезе у собак 1024
Аминоглютетимид
при гиперкортицизме у собак 366
при опухоли коры надпочечников, секретирующей
прогестерон 415
при синдроме Кушинга у кошек 407-408
Амитрац 887т
Аммоксициллин 960
Аммоксицилина тригидрат 1154
Аммония хлорид 889т
Ампициллин
при мастите 926
при послеродовом эндометрите 920
фармакологические характеристики 1097т
Ампутация пениса
при парафимозе 1062
при приапизме 1063
при травме пениса 1067
Амфотерицин 887т
Анаболические стероиды 887т
Анализ газового состава крови
при легочной тромбоэмболии 307-308
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1167
при мониторинге жидкостной терапии657
при первичном гиперпаратиреозе у собак 757 Анализ мочи
при гиперкортицизме у собак 294-295
при гипертиреозе у кошек 175
при гипокортицизме 439
при гипотиреозе у собак 117
при диабетическом кетоацидозе 642-643
при дистоции 914
при инсулин-секретирующей опухоли 685
при несахарном диабете 22-23
при опухоли щитовидной железы у собак 237
при первичном гиперпаратиреозе 757
при пиометре 952
при полиурии и полидипсии 15, 15т
при сахарном диабете у собак 536
при синдроме Кушинга у кошек 385т
Аналоги вазопрессина 41-43
Аналоги инсулина 540
Аналоги простагландинов для индукции аборта 938-939
Анальгетики 887т
Анальгетики 887т
Анамнез
перед лечением сук после незапланированной вязки 930
при бесплодии кобелей 1100, 1101т, 1102т
при бесплодии сук 966, 967-968т
при гиперкотицизме у собак 277-287, 278т
атрофия семенников 286-287, 288
кожные маркеры 281-284, 282-284р
миотония 287,287р
мышечная слабость, сонливость, хромота 280-281
лицевой паралич 287
ожирение 285
отсутствие эструса 286
полиурия и полидипсия 279
полифагия 279
респираторные нарушения 284-287
увеличение живота 279-280, 281р
при гипокортицизме 429, 430т
при диабетическом кетоацидозе 640-641
при дистоции 910-913, 911р, 912р, 915т
при инсулин-секретирующей опухоли 683-684
при кистозной гиперплазии эндометрия 950, 950т
при легочной тромбоэмболии 307
при обследовании репродукции у кобелей 1032
при первичном гиперпаратиреозе у собак 762, 763р,
764р
при пиометре у кошек 1153, 1153т
при сахарном диабете у собак 552-553
Андрогены
гипертрофия простаты и 1089
действие катехоламинов 475т
для контрацепции у кошек 1161
для повышения либидо 1116
секреция опухолью семенников у собак 1073
Андростендион 475т
Анемия
при болезни Аддисона 461
при гипертиреозе у кошек 175
при гипокортицизме 431
при феохромоцитоме 479
терапия эпоэтином 822
у щенных сук 876
Анестезия
безопасность при беременности 888т
перед удалением феохромоцитомы 489-490, 489р, 490т
при тереоидэктомии у кошек 211
Аномалия Эбштейна 885т
Аномальная семенная жидкость 1113-1114
Анорексия
при гастриноме 714, 714т
при диабетическом гиперосмолярном некетоновом синдроме 673
при лечении митотаном 351
при пиометре открытого типа 950, 950т
при угрозе аборта у собак 904
Антагонисты гонадотропин рилизинг-гормона 941
Антагонисты рецепторов прогестерона 980
Антациды 716т, 888т
Антиандрогены 1095
Антибиотики
безопасность при беременности 887т
в комбинации с глюкокортикоидами 512
при баланопостите 1066
при инфекционном простатите 1093
при мастите 926
при остром орхите 1081
при пиометре у собак 957
при пиометре у кошек 1154
при послеродовом эндометрите 920
при хроническом орхиэпидидимите 1082
при хроническом простатите 1096-1097
Антигистамины 888т
Антидиуретический гормон
биосинтез, транспорт и обмен 3-4, 4р
действие на клетки 4-6, 5р, 7р
клинические эффекты 6-7, 6т
недостаточность альдостерона и 424
регуляция секреции 7-9
синдром нарушенной секреции антидиуретического гормона 47-48, 47т
Антиинсулиновые антитела 541, 568-570, 569р, 570р
Антипрогестагены 963
Антипрогестиновая терапия при индуцированном
аборте 939
Антиспермальные антитела 976
Антитела
антиинсулиновые 541, 568-570, 569р, 570р, 626
нейтрализующие антитела против эпоэтина 824
при болезни Аддисона 419-421,421т
при лимфоцитарном тиреоидите 101-102
против сперматозоидов 886
Антитиреоглобулиновые аутоантитела в сыворотке
крови 99-100, 134
Антитиреоидные аутоантитела в сыворотке крови 134-135
Антитиреоидные препараты 204-210,204р, 205р, 207т
Анурия при болезни Ад дисона 439-440
Анэструс 833
кошки 1137
собаки 851-852
влияние простагландинов и бромокриптина на продолжительность 851
во время введения мегестролацетата 944 изменения слизистой влагалища 968т индуцированный медицинскими препаратами 984-985
1168
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
концентрация гонадотропинов 852
первичный и вторичный 981-986, 982р, 983р
при гиперкортицизме 276-277
Апатичный гипертиреоз 169
Аплазия системы семенных канальцев 1071-1072
Аплазия яичника 985-986
Аппетит
гиперкортицизм у собак и 279
гипертиреоз у кошек и 166,169
гипотиреоз у кошек и 153
инсулинотерапия и 562
первичный гиперпаратиреоз и 751
перекрут семенника у собак и 1079
пиометра открытого типа и 950, 950т
терапия митотаном и 350-351
АПУДома 712-713, 713т
Арахидоновая кислота 506-507
Аргинин-вазопрессин 3-7
гиподипсическая гипернатриемия 48-49
модифицированная проба с лишением жидкости 24-39
дегидратированная собака 38-39
используемая терминология 24-25 неправильный диагноз 36-37, 36р, 37т определение вазопрессина в плазме крови 37-38, 38р, 39р
осложнения 33-36, ЗЗр, 35т
ответ на пробу 29-32, 30-32р
противопоказания 24
протокол тестирования 25-29, 26р, 26т, 27т
синдром нарушенной секреции вазопрессина 47-48, 47т
Аритмия
при гипертиреозе у кошек171-172
при феохромоцитоме 491
Артериография при феохромоцитоме 482
Артериола, действие катехоламинов 474т
Артефактная гипогликемия 691
L-аспарагиназа 767
Аспартам 889т
Аспирационная биопсия
придатка семенника 1054-1055
семенников 1053-1054, 1054р
Аспирин 308, 888т
Астенозооспермия 1110-1113, 1112р
диагностика 1112
причины 1112-1113
Асцит 312т
Атаксия
при гипертиреозе у кошек 170
при гипогликемии 682
при эклампсии 923
Атенолол
после удаления феохромоцитомы 491
при гипертиреозе у кошек 223
Атропин 888т
Атрофия
семенников 286-287, 1084-1085, 1084т
щитовидной железы 102-104, ЮЗр
Аутоантиген при болезни Аддисона 419-421, 421т
Аутоантитела
при гипотиреозе у собак 143
при лимфоцитарном тиреоидите 101-102, 101т, 134-135
при сахарном диабете типа 1 527
Аутоантитела против тиреоидного гормона влияние на тестирование функции щитовидной железы у собак 143 при лимфоцитарном тиреоидите 134-135
Аутоантитела против глутаматдекарбоксилазы 527 Аутоиммунный гипоталамит 18
Аутотрансплантация паращитовидной железы 213-214 Ацепромазин
безопасность при беременности 888т
перед тиреоидэктомией у кошек 211
Ацетаминофен 888т
Ацетоацетат 635
Ацетон 635
Ацидоз
при гиперкальциемии у собак 754 при гипокортицизме 442,459, 459р терапия бикарбонатом и 459, 459р
Б
Базальная концентрация гормона роста в сыворотке крови 61
при акромегалии у собак 90
при приобретенном во взрослом возрасте дерматозе, чувствительном к гормону роста 68
Базальная концентрация инсулиноподобного ростового фактора I в сыворотке крови 64
при чувствительном к гормону роста дерматозе 70 Базальная концентрация кортизола в в сыворотке крови при гиперкортицизме у собак 315 при гипокортицизме 447
Базальная концентрация общего тироксина у кошек при гипертиреозе в сыворотке крови 184-187, 184-186р Базальная концентрация общего трийодтиронина в сыворотке крови у кошек при гипертиреозе 187 Базальный уровень свободного тироксина в сыворотке крови при гипертиреозе у кошек 187-188,188р Базофилы, влияние глюкокортикоидов 506 Бактериальная инфекция
при аборте у собак 901т
при баланопостите у кобелей 1065-1066
при вагините у сук 1016-1017
при гипотиреозе у собак 110 при диабете у собак 575-576 при диабетическом кетоацидозе 666 при пиелонефрите Ют
Бактериемия при пиометре 951
Бактерии
в матке сук 949-950
в нормальной уретре кобелей 1045, 1046т
в сперме собак 1045-1046, 1046т во влагалище
кошек 1150, 1152т
сук 973, 974р, 1016-1017, 1017т
Балано постит 1065
Баллонный катетер для осеменения влагалища 1123
Барорецептор 3, 9
Безъядерные клетки-чешуйки 838р, 840
Безъядерные поверхностные клетки 839р, 841 Белок
в кормах собак с высоким содержанием клетчатки 544т в кошачьем молоке 1149т
гипертиреоз у кошек и 177
сахарный диабет у кошек и 603-606, бОЗр, 603т, 605т синтез 53
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1169
G белок 165
Бенедектин 884т
Беременность
глюкокортикоиды и 520
заболевания сук до, во время и после родов 897-928
акромегалия в диэструсе 927, 928р
внематочные плоды 900
выделения из половых органов 918-919
гипогликемия 927
дистоция 907-917, 907-908р, 907т, 911-912р, 915т
задержка плаценты 922
затянувшаяся беременность 917-918
клиническая ложная беременность 897-900
мастит 925-927
нормальное состояние 897
отсутствие молока 927
послеродовое введение окситоцина 920
послеродовой эндометрит 920
сахарный диабет 927-928
системные заболевания 919-920
спонтанный аборт и рассасывание плодов 900-906, 901т, 906р
субинволюция плацентарных мест 921-922 эклампсия 922-925, 924т
индукция аборта 930-939
агонистами дофамина 940
аналогами простагландина 938-939
антагонистами гонадотропин рилизинг-гормона 942
антипрогестинами 939-940
глюкокортикоидами 941
до имплантации 933-935
комбинацией простагландина и агонистов
дофамина 940
лечение простагландинами 935-938
овариогистерэктомия 932
первичная оценка 930-932, 931р, 932р
после незапланированной вязки 941-942
тамоксифена цитратом 941
триместры беременности и 932, 933р
кошки 1143-1144, 1144т
суки 874-890
диагностика 878-883, 879-882р, 881т
изменения уровня глюкозы 877
изменения функции щитовидной железы и коры надпочечников 877
клинические и биохимические изменения 875-
876
медикаментозное лечение во время 883-886, 883т, 884т
питание 886, 890
последовательность событий 875
прогестерон 876, 877р
продолжительность 877, 878р
размер помета 875
релаксин 881, 882р
рентгенологическое исследование 878-879, 880р
роды 890-895
ультразвуковое исследование 879-881, 881р, 881т эндокринологические изменения 876-877, 877р эстроген и 876-877
Бесплодие
кобель 1099-1018
азооспермия 1105-1109, 1105т, 1106-1109р
аномальная морфология сперматозоидов 1043
аномальная семенная жидкость 1113-1114 астенозооспермия 1110-1113, 1112р бруцеллез 1020
врожденное бесплодие и нормальное либидо 1115
гипотиреоз 112
дегенерация семенников 1084-1085
классификация 1099, 1100т
лечение 1115-1118
лимфоцитарный орхит 1082-1084, 1082р, 1084т нормальные количество сперматозоидов и семенной жидкости 1114
олигоспермия 1109
острый орхиэпидидимит 1079-1082 первичная оценка 1100, 1101-1102т сниженное либидо 1102-1104, 1103т сперматогранулема 1085
тератозооспермия 1109-1110, 11 Ир хронический орхиэпидидимит 1082 кошки
самки 1156-1160, 1157р
самцы 1163
суки 965-990
Brucella canis 973
анамнез 966, 967-968т
анэструс, индуцированный медицинскими препаратами 984-985
аутоиммунный оофорит 980
гипотиреоз 985
заболевание матки 979
идиопатическое сокращение овариальных циклов 977-979, 978р
идиопатическое удлинение межэстрального интервала 980-981
избыток глюкокортикоидов 985
индукция эструса 986-988, 988т
инфекция 973-975, 974р
киста яичника, секретирующая прогестерон 986 недостаточность функции желтого тела 976 общее состояние здоровья 969-970 овариальные кисты или неоплазия 981 окклюзия матки или яйцеводов 976, 977р отсутствие овуляции 980 оценка кобеля 965-966
первичные подходы 970-973, 971р
предшествующая овариогистерэктомия 982-984, 983р
преждевременное угасание яичников 985-986
проведение вязок владельцем 969
раннее рассасывание плодов 975
расщепленная течка 979
скрытая течка 984
стойкий проэструс 988-990, 990р, 968т
физикальное исследование 966-969, 967т, 969р
фолликулярные кисты 979, 982р
хирургическая диагностика 986
хронический эндометрит 975
ятрогенное сокращение межэстрального интервала 980
цитология влагалища 854-855
Бесплодие при гипоплазии семенников у кобелей 1071 Бессимптомная гипогликемия 563-564
Бета-антагонисты 211
Бета-гидроксимасляная кислота 635 Бета-липотропин 265-266, 265р
1170
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Бета-меланоцитстимулирующий гормон 265-266, 265р Бетаметазон 511т
период биологической полужизни 507
препарат и дозы 521т
Бета-рецептор 475
Бета-эндорфин 265-266, 265р
Бигуаниды 611-612, 612р
Бикарбонат, концентрация в плазме крови при
диабетическом кетоацидозе 660
Бикарбонат, терапия
при гиперкальциемии 772
при диабетическом кетоацидозе 660-661, 661р
при надпочечниковой недостаточности 442 Биологический период полужизни лекарственных препаратов 507 Биопсия
кожи
при гипотиреозе у собак 118, 118т
при синдроме подобном врожденной
гиперплазии надпочечников 77
при чувствительном к гормону роста дерматозе 70 печени 328-329
при гиперкортицизме у кошек 402
семенников 1053-1057, 1053р, 1055р, 1055т
при аномальной семенной жидкости 1115
при бесплодии у кобелей 1104, 1106р, 1108, 1109р
при лимфоцитарном орхите у кобелей 1083,
1083р
при тератозооспермии у кобелей 1110
при хроническом орхите/эпидидимите у кобелей 1083
щитовидной железы
при гипотиреозе у собак 143
при опухоли щитовидной железы у собак 246-247 Биопсия при гиперкортицизме у кошек под контролем ультразвука 402 Биохимия крови
при гипотиреозе у собак 117
при первичном гиперпаратиреозе у собак 753-757, 753т, 754р, 755р, 756т
при пиометре 951-952
при сахарном диабете у собак 535-537, 535т
при синдроме Кушинга у кошек 384-387, 385т Биофосфонаты
при гиперкальциемии 771т
при первичном гиперпаратиреозе у собак 771
Блокаторы кальциевого канала 888т
Болезнь Аддисона 418-469
азот мочевины, креатинин и анализ мочи 439-440
анамнез 429-430
ацидоз 459, 459р
встречаемость 428-429, 429т
гипергликемия 440, 441т, 688
гиперкальциемия 440-442, 441т, 744-745
гипонатриемия и гиперкалиемия 432-440, 433-434т, 434-435р
глюкокортикоиды 517-518
исторические сведения 394-395
кислотно-щелочной статус 442
концентрация альдостерона в сыворотке крови 450-452, 451р
концентрация кортизола в сыворотке крови 447-450, 448т, 449-450р
концентрация эндогенного АКТГ в сыворотке крови 452-454, 453р
кровяное давление 442
лечение 454-466, 455т
вторичного гипокортицизма 466
гиповолемии и гипотензии 455-457, 456р
глюкокортикоидами 457, 465-466
дисбаланса электролитов 457-459
длительная терапия 461-465,462т, 462-463р
заместительная солевая терапия 466
ответ на 459-460
сопутствующие болезни и 460-461
параметры лейкоцитов 431, 431т
параметры эритроцитов 431
патофизиология 423-428, 425-426р
полидипсия и полиурия 13-14
прогноз 466
рентгенография 444, 445р
у кошек 466-469, 467р, 468р
физикальное исследование 430-431, 431т
функция печени 442-443, 443т
электрокардиография 444-447, 446р
этиология 419-423, 420р, 420т
Болезнь Виллебранда 113
Болезнь Гирке 686
Болезнь Грейвса 253
Болезнь Минаматы плодов 885т
Боли в животе
при диабетическом кетоацидозе 640
при остром простатите 1089, 1090
при перекруте семенников у собак 1078
при угрозе аборта у собак 904
Боль
после удаления опухоли надпочечника 347
при диабетическом кетоацидозе 641
при невропатии 550т
при остром орхиэпидидимите у собак 1080
при остром простатите 1089
у бесплодных сук 968
Борьба с паразитами у племенных сук 874-875
Брахистаз 893
Брахицефалические породы 910
Бромид 135т, 142
Бромокриптин
при акромегалии 88
при гиперкортицизме у собак 365
при индуцированном аборте 940
при ложной беременности у собак 899
при укороченном межэстральном интервале 980
Бронхиальные гладкие мышцы, действие катехоламинов 474т
Brucella abortus 901т, 1019
Brucella canis 1019-1025
агглютинация спермы 1114
клинические признаки 1020
культивирование 1022-1023, 1023т
лечение 1023-1024, 1024т
определение методом иммунодиффузии в агаровом
геле 1022-1023, 1021т
при аборте у собак 901т
при остром орхиэпидидимите 972
профилактика и контроль 1024-1025
серологические тесты 1021-1022, 1021т
тестирование сук 973
тестирование кобелей 1047-1048
трансмиссия 1019-1020
Brucella melitensis 901т, 1019
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1171
Brucella suis 901т, 1019
Будесонид 512
Бунамид 887т
Быстрый агглютинационный метод определения Brucella canis на пластинках 1021, 1021т
Быстрый механизм обратной связи 266
В
Вагинальные культуры при бесплодии у сук 973 при кистозной гиперплазии эндометрия 955, 955т
Вагинальные мазки
в конце проэструса 842, 843р в начале проэструса 840, 841т, 842р в середине проэструса 840, 842р методология 852-853
перед лечением сук после незапланированной вязки 930-932, 932р
Вагинальные стриктуры 1000-1005 диагностика 1003-1005, 1004р дистоция и 908-909, 908р клинические признаки 1001-1003, ЮОЗр лечение 1005 эмбриональное развитие 1000-1001, 1001р, 1002р
Вагинит 1015-1017, 1015р, 1017т стриктура во влагалище 1000-1003, 1001р, 1002р у щенков 1009-1011 цитология влагалища 855
Вагиноскопия 968, 968т, 968р
для выяснения причины выделений из вульвы 1016 при вагинальной стриктуре 1003 при вагините 1016
при субинволюции матки 921-922
Вазоактивный кишечный полипептид 711т Вазопрессин
биосинтез, транспорт и метаболизм 3-4, 4р в плазме крови 37-38, 39р
введение при модифицированной пробе с лишением жидкости 28-29
действие на клеточном уровне 4-6, 5р, 7р дефицит 17-19, 17р, 18т, 19р клинические эффекты 6, 6т ответ на стимуляцию гипертоническим солевым раствором 20
регуляция секреции 7-9, 9т синдром нарушенной секреции вазопрессина 47-48, 47т
Вакцинация глюкокортикоидная терапия и 519 племенных сук 874-875
Вальпроевая кислота
безопасность при беременности 889т тератогенное действие 885т
Ванадий
при сахарном диабете у кошек 613
при сахарном диабете у собак 547
Варфарин 885т
Варфариновый синдром плодов 907
Васкулезный орган терминальной пластинки 88
Ватный тампон для получения влагалищных мазков 852-853, 854р
Введение пероральных препаратов 508, 508т Вегетативная нервная система, ответ на гипогликемию 679-680, 679 т
Величина К при гипотиреозе у собак 133
Величина pH в артериальной крови при диабетическом кетоацидозе 645, 645т
Венография 482
Вены, действие катехоламинов 474т
Визуальная оценка спермы 1038
Винкристин
безопасность при беременности 887т
при трансмиссивной венерической опухоли 1028
при феохромоцитоме 492
ВИПома 722
Вирусная инфекция
при аборте у собак 901т
при баланопостите 1065-1066
при вагините у собак 1017
у бесплодных сук 975
Витамин Д
активация в почках 822
гипервитаминоз Д 742-744, 743р, 770т метод определения 736, 760, 760р первичный гиперпаратиреоз и 732-733 перед операцией на паращитовидной железе 780-781 при гипокальциемии 813-815, 814т при гипопаратиреозе 813-816, 814т, 815р тиреоидэктомия кошек и 214
Витамины при контроле гликемии 550, 550т Влагалище
врожденные нарушения 1000-1005 диагностика 1003-1005, 1004р исследование с помощью зеркала 1003 клинические признаки 1001-1003, ЮОЗр лечение 1005
эмбриональное развитие 1000-1001, 1001р, 1002р гиперплазия и пролапс 1005-1009, 1006-1008р, 1007т дистоция и 908 изменения во время проэструса 835р, 836-837 инфекция 1015-1017, 1015р, 1017т кровотечение во время проэструса 835-836 нормальная флора 973-974, 974р, 1016, 1017т опухоль 856 пальпация 968
тканевые массы 1013-1015, 1013р, 1014т
эндоскопия 1013р
во время эструса 848
для определения времени вязки 872 Влагалищный полип 1007, 1007р, 1015-1016 Влияние голодания на тестирование функции щитовидной железы 141 Влияние суточного ритма на тестирование функции щитовидной железы у собак 137 Влияние температуры тела на тестирование щитовидной железы у собак 141 Внематочная беременность 900
у кошек 1146-1147
Внепочечная система ренин-ангиотензин 827 Внутрибрюшинное кровотечение 348 Внутривенная проба на толерантность к аргинину 596т Внутривенная проба на толерантность к глюкагону 596т Внутривенная проба на толерантность к глюкозе 598т Внутривенная урография 482 Внутривлагалищное осеменение 1122-1123, 1122р Внутривлагалищный метод искусственного осеменения 863-866, 864р, 865р Внутриматочное приспособление 945, 945р Внутримышечное введение препаратов 508, 508т
1172
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Водная интоксикация 40
Водные растворы растворимых эфиров стероидов 510-511, 510р, 510т
Водный баланс 828
Водный диурез 5-6
Водный обмен 2-10
вазопрессин
биосинтез, транспорт и метаболизм 3-4, 4р действие на клеточном уровне 4-6, 5р, 7р клинические эффекты 6, 6т регуляция 7-9, 9т
объем крови 9т
питьевой центр 7
регуляция жажды и секреция вазопрессина 7-8 утоление жажды 9-10
Возбуждающая сука 1036-1037
Возбуждение
при гипертиреозе у кошек 168
при феохромоцитоме 476
Возраст
зависимость результатов тестирования тиреоидной функции от 136, 136р гиперкортицизм у собак и 276, 276р, 277р гипертиреоз у кошек 165, 165р гипокортицизм и 428
кистозная гиперплазия эндометрия и 950 изменения концентрации фосфора в сыворотке крови 756
изменения концентрации общего кальция в сыворотке крови 754
оптимальный для размножения кошек 1130-1131 первичный гиперпаратиреоз у собак и 748, 748р репродукция у сук и 870 феохромоцитома и 476, 476р
Воспаление
аномальная семенная жидкость 1113-1114 глюкокортикоидная терапия 504-507, 513 мошонка 1033
Волосяной покров
действие пептида, родственного паратиреоидному гормону 737
ответ на терапию левотироксином натрия 147, 147р при гипотиреозе у кошек 152 при гипотиреозе у собак 109-11, 11р
Врожденная недостаточность гормона роста 55-67 встречаемость 58-59 гистопатология кожи 60-61, 61т дифференциальная диагностика 64, 65т, 66р клиническая патология 60 клинические признаки 59-60, 59р, 59т, 60р лечение 65-67 патофизиология 58 эндокринологическая оценка 61-64, 61т, 62р, 62т, 63т этиология 55-58, 56р, 57р
Врожденное бесплодие у кошек 1115
Врожденные нарушения
влагалища и вульвы 1000-1005 диагностика 1003-1005, 1004р клинические признаки 1001-1003, ЮОЗр лечение 1005 пороки эмбрионального развития 1000-1001, 1001р, 1002р
пениса 1059-1061, 1060р семенников
аплазия системы протоков семенников 1071-1072
гипоплазия 1071
крипторхизм 1068-1071, 1069р, 1069т
Врожденный гипотиреоз 106-107
кошки 153
собаки
диагностика 145
кретинизм 114-115, 115т, 116р
Врожденный нефрогенный несахарный диабет 19-20
Врожденный портосистемный шунт 313
Встречаемость заболевания
гастринома 713
гиперкортицизм у кошек 378, 378т, 379т
гиперкортицизм у собак 276-277, 276р, 276т, 277р
гипертиреоз у кошек 165, 165р
гипокортицизм у собак 428-429,429т
гипопаратиреоз у собак 795, 795р, 795т
гипотиреоз у собак 107, 107т
диабетический кетоацидоз 640
инсулин-секретирующая опухоль 683, 683т кистозная гиперплазия эндометрия 950, 950т легочная тромбоэмболия 307
опухоль щитовидной железы у собак 235-236, 235р, 235т
первичный гиперпаратиреоз у собак 748, 748р, 748т
пиометра у кошек 153-1154т
сахарный диабет у кошек 597
сахарный диабет у собак 533
трансмиссивная венерическая опухоль 1025-1026
феохромоцитома 476, 476р, 476т
Вторичная гипотония матки 909
Вторичный анэструс 981-986, 983р, 984р
Вторичный гипокортицизм 422-423, 436
длительное лечение 466
концентрация эндогенного АКТГ в сыворотке крови 452
проба со стимуляцией АКТГ 452
Вторичный гиперпаратиреоз 745
Вторичный гипотиреоз 99
клинические признаки 119
прогноз 151-152
этиология 105-106
Вторичный сахарный диабет у собак 532
Вторичный нефрогенный несахарный диабет 11-12
Вульва
время вязки и 873
врожденные дефекты 1000-1005
диагностика 1003-1005, 1004р
клинические признаки 1000-1003, ЮОЗр
лечение 1005
эмбриональное развитие 1000-1001, 1001р, 1002р
культя яичника и 991
опухоли 1013-1014, 1013р, 1014т
проэструс и 836
скрытая течка и 984
физикальное исследование 966
Выделения из влагалища
в проэструсе 833
во время эструса у сук 846
время для вязки и 873
индуцированные простагландинами 959
инфекция Brucella canis 1020
кровотечение 919
отсутствие увеличения матки и 955
послеродовые 893-894
при вагините 1015
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1173
при наступлении эструса 970
при пиометре открытого типа 950, 950т
при синдроме культи яичника 991
при стриктурах влагалища 1005
при угрозе аборта у сук 904
у щенной суки 918
физикальное исследование 966, 968
Выделения из вульвы 918,1009-1013,1009т, ЮЮ-Ю12р Вымывание веществ из мозгового слоя почек 14 Высоковольтное облучение опухоли щитовидной железы 247-249
Г
Газовый состав артериальной крови
при легочной тромбоэмболии 307-308
при оценке жидкостной терапии 657-658
при первичном гиперпаратиреозе у собак 757-758
Галакторея 1076
Галотан 887т
Гамма-камера для визуализации надпочечников 340
Гастрин 711т
влияние катехоламинов 475т
концентрация в сыворотке крови 716
Гастрин-высвобождающий пептид 711т
Гастринома 713-720
встречаемость 714
диагностическая визуализация 715
клиническая патология 715
клинические признаки 714, 714т
концентрация гастрина в сыворотке крови 716 множественная эндокринная неоплазия 1 и 495-496 проба со стимуляцией гастрина 716-717
проба со стимуляцией секретином 717 провокационная проба с кальцием 717-718, 717р терапия 719-720
тестирование секреции желудка 718
физикальное исследование 714-715
хирургическое удаление 718-719, 719т
эндоскопия 715, 715р
Гастродуоденоскопия 715, 715р
Гематокрит
при гипертиреозе у кошек 174
при терапии эпоэтином 823
при щенности у сук 897
Гематопоэтические ростовые факторы 1078
Гемато простатический барьер 1096 Гематотестикулярный барьер 1083 Гематоэнцефалический барьер 8
Гематурия
при пиометре 952
у кобелей 1065
Гемограмма
при опухоли щитовидной железы у собак 237-238
при первичном гиперпаратиреозе 753
Гемодиализ при гиперкальциемии 773
Гемолитическая анемия 671
Геморрагический шок 514
Гемоспермия 1113
Гемоцитометр 1039, 1040р
Генетические синдромы резистентности к инсулину 578 Генотип 993т
Гентамицин 1097т
Гепатоцеллюлярная карцинома 688
Герпесвирусная инфекция 901т, 903
Гестационный диабет 532
Гидантоиновый синдром плодов 885т
Гидралазин 889т
Гидрокортизон 511т
период биологической полужизни 507
препарат и дозы 521т
при болезни Аддисона 458
при нарушениях ЦНС 515
17-Гидроксипрогестерон в сыворотке крови,
концентрация 326-328, 328т
Гидроксифлутамин 1095
Hydrometra 949
Гидрохлоротиазид 704
Гидроцеле 1053т
Гинекомастия 1076
Гиперактивность при гипертиреозе у кошек 168, 173
Гиперальдостеронизм, первичный 369-371
кошки 412-413, 414т
полидипсия и полиурия Ют, 10
Гипервентиляция при гипопаратиреозе у собак 794
Гипервитаминоз Д 735р, 742-744, 743р
Гипергликемия
гипонатриемия и 438
индуцированная стрессом 534, 621-622, 622р
периоперативный период 562
при акромегалии у кошек 81
при глюкагономе 720
при сахарном диабете у сук 927-928
при диабетическом гиперосмолярном некетоновом
синдроме 672-674
при диабетическом кетоацидозе 639т, 643-644
при лечении гормоном роста 65
при синдроме Кушинга у кошек 386-397
при транзиторном сахарном диабете у кошек 594-
595, 596р
причины 534, 534т
травы, добавки и витамины 550т
Г ипергло бул инемия
при акромегалии у кошек 82
при пиометре 951-952
Гиперглюкагонемия 720
Гиперкалиемия
влияние на сердце 444
дифференциальная диагностика 434т, 436-438, 437т при гипокортицизме 424, 432-436, 433т, 434р, 434т, 435р
при диабетическом кетоацидозе 437
при центральном несахарном диабете 23
электрофизиологические изменения 651,652р, 652т
Гиперкальциемия 729-748
глюкокортикоиды и 514
дифференциальная диагностика 738т
концентрация ионизированного кальция в сыворотке
крови 735-736
кошки 785-786, 785т
нормальная концентрация кальция в сыворотке
крови 729т
паратиреоидный гормон, определение в сыворотке
крови 734-735, 735р
патофизиология 730-734
пептид родственный паратиреоидному гормону,
определение 736-738, 737р, 737т, 738р
полидипсия и полиурия Ют
при алиментарном вторичном гиперпаратиреозе 746-747
1174
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
при гипервитаминозе Д и отравлении родентицидами 742-744, 743р при гипокортицизме 440-442, 441т, 744 при гипотермии 747
при гипотиреозе у собак 117
при дегидратации 747
при злокачественности 738-742, 739р, 740р
при иммобилизационном остеопорезе 747
при острой почечной недостаточности 746
при септическом заболевании костей и грибковой инфекции 747
при хронической почечной недостаточности 745, 745р
синдром Кушинга у собак и 312т
этиология 730
Гиперкальциурия 733
Гиперкетонемия 639
Гиперкортизолемия 295
Гиперкортицизм зависимый от гипофиза 322, 324-325, 327-328, 331-332, ЗЗЗр
Гиперкортицизм, обусловленный опухолью коры надпочечников 322-326, 331, 332
Гиперкортицизм
алопеция 70-71, 71т
глюкокортикоиды при диагностическом
тестировании 520
диабетический кетоацидоз 668-669
кошки 377-413
натриуретический пептид предсердия 828
опухоль коры надпочечников, секретирующая прогестерон 73
полидипсия и полиурия Ют, 12
резистентность к инсулину 574
собаки 252-357
удельный вес мочи 15т
Гиперкортицизм у кошек 376-417
акромегалия и 86-87
анализ мочи 386-387
биопсия под контролем ультразвука 402 биохимический анализ крови 384-388, 385т встречаемость 378, 379т
гипофизэктомия 404-406
двусторонняя адреналэктомия 408-410
загибание кончиков ушей 382
ингибирующая проба с подавлением высокими дозами дексаметазона 397-399, 397т, 399т
история вопроса 376
клинический анализ крови 384, 384т
кожные нарушения 382-383, 383р
компьютерная и магнитно-резонансная томография 403-404, 404р, 404т
медикаментозная терапия 407-408
мышечная слабость, отвислый живот, кровоточивость 382
облучение гипофиза 406
определение концентрации эндогенного АКТГ в плазме крови 399-401
основные жалобы владельцев 379, 379т, 380
отношение кортизол:креатинин в моче 388-390, 390т 391т
полиурия и полидипсия 381-382
потеря веса 382
проба с низкими дозами дексаметазона 393-396 провокационная проба со стимуляцией АКТГ 390-393
продолжительность клинических проявлений 378, 379т
рентгенологическое исследование брюшной области 401
сахарный диабет и 387-388
слабость, сонливость, отвислый живот,
кровоподтеки 382
терапия 407-408
ультразвуковое исследование брюшной полости 401-402, 402тфизикальное исследование 380-382, 380т, 381р
хирургическое лечение опухоли надпочечников 410-411
этиология 377-378
Гиперкортицизм у собак 262-375
анамнез 277-287, 278т
атрофия семенников 288
кожные маркеры 281-284,282-284р
лицевой паралич 287
миотония 287, 287р
мышечная слабость, сонливость и хромота 280-
281, 281р
ожирение 285
отсутствие эструса 286-287
полиурия и полидипсия 279
полифагия 279
респираторные признаки 284-285
увеличение живота 279-280, 281р
встречаемость 276-277, 276р, 276т
дифференциальная диагностика 312-313, 312т
лечение
бромокриптин 365
кетоконазол 362-364, 362т, ЗбЗр
L-депренил 366
метирапон и аминоглютетимид 365-366
облучение гипофиза 367-368
RU486 365
трилостан 364-365
хирургическое лечение 342-349, 344р
ципрогептадин 365
этомидат 366
макроопухоли гипофиза 310-312, ЗЮр, ЗНр, 311т
медицинские осложнения 302-312
гипертензия 302-303
застойная сердечная недостаточность 304 легочная тромбоэмболия 305-309, ЗОбр, 306т, 309р
макроопухоли гипофиза 309-312, ЗЮр, ЗПр, 311т
мочевые камни 304
панкреатит 304
пиелонефрит 303
сахарный диабет 305
модифицированная проба с лишением жидкости 24
оценка 289-295, 290т
азот мочевины в сыворотке крови 291
аланинаминотрасфераза 292
амилаза и липаза 293
анализ мочи 294-295
глюкоза и инсулин в сыворотке крови 290
желчные кислоты 293
клинический анализ крови 289-290
тестирование функции щитовидной железы 295,
295р
фосфаты в сыворотке крови 293
холестерин, триглицериды и липемия 281,281р, 292
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1175
щелочная фосфатаза в сыворотке крови 291-292, 292р
электролиты в сыворотке крови 293
оценка оси гипофиз-надпочечники 313, 314р
патология 274-275
патофизиология 268-274
одновременные опухоли гипофиза и надпочечников 274
опухоль гипофиза 268-272, 269-271р
опухоль надпочечников 272-273
синдром эктопического АКТГ 273
узловая гиперплазия коры надпочечников 273
рентгенография 295-297, 296р, 297р
регуляция секреции глюкокортикоидов 263-268 адренокортикотропный гормон 265-266, 265р биосинтез стероидов 266-268, 266р, 266т, 267р кортикотропин рилизинг-гормон 263, 264р
скрининговые тесты
биопсия печени 328-329
компьютерная томография 335-338, 336-338р
концентрация 17-гидроксипрогестерона в сыворотке крови 326-328
концентрация кортизола в сыворотке крови 315 концентрация эндогенного АКТГ в сыворотке крови 330-332, 331р
магнитно-резонансная томография 338-340, 328т, 339р, 341р
отношение кортизолжреатинин в моче 315-318, 334
проба с высокими дозами дексаметазона 332-333, 332-334р
проба с дексаметазоном 322-323, 323р
проба с метирапоном 335
проба с низкой дозой дексаметазона 329-330, 329р пробы с кортикотропин рилизинг-гормоном и вазопрессином 335
радиоизотопное сканирование 340
стимуляция АКТГ 318-321, 319р, 319т, 320р
чувствительность и специфичность 315, 316т
спонтанная ремиссия 369
терапия митотаном 349-362
адреналэктомия 355
глюкокортикоидная терапия 353, 355
динамика улучшения состояния 356-358, 356р, 357р
информация для владельцев собак 350т мониторинг 352-353
начальное лечение 349-355
опухоль коры надпочечников 359-360
отсутствие ответа на лечение 358 поддерживающая терапия 360-361 прогноз 361-362
терапия сахарного диабета 358-359 фаза нагрузочной дозы 351-353, 352р цели терапии 353, 354р
физикальное исследование 287, 287т
ультразвуковое исследование брюшной полости 298-
302, 299т, 301р, 302р
Гиперлипидемия
при гипотиреозе у собак 113
при диабете у собак 536
при диабетическом кетоацидозе 650-651
травы, добавки и витамины 550т
Гипернатриемия
гиподипсическая 48-49
лечение диабетического кетоацидоза и 670-671 после модифицированной пробы с лишением жидкости 33-36, 34р, 35р, 35т
при центральном несахарном диабете 23
причины 35, 35т
эссенциальная 48-49
Гиперо смоляльность
при диабетическом гиперосмолярном некетоновом синдроме 672
при диабетическом кетоацидозе 647-648
Гиперосмолярный некетоновый сахарный диабет 672-674
Г иперпаратиреоз
кошки 177, 785-786, 785т
при множественной эндокринной неоплазии 1, 496 собаки 748-783
анализ мочи 757
анамнез 749
биохимический анализ крови 753-757, 753т, 754т, 755р, 756т
встречаемость 748, 748р, 748т
газовый анализ крови 757-758
избирательный анализ образцов венозной крови 762
изотопное сканирование 762
исходная база данных 765-766
клинические признаки 749-752, 749-750т, 750-751р
контроль возможной гипокальциемии после лечения 778-781, 778-779р,780т
множественная эндокринная неоплазия и 783 наследственный неонатальный 783 неотложная терапия 768-773, 769-771т, одиночная паратиреоидная опухоль 781-782 определение паратиреоидного гормона в сыворотке крови 735р
оценка лимфатических узлов и костного мозга 766-767
паращитовидная ткань в средостении 783 прогноз 783
рентгенография 758-759, 758р, 759р тестирование 761, 761р
ультразвуковое исследование 759-761, 760р
физикальное исследование 752
химиотерапия 767
хирургическое лечение 767-768, 768р, 773-774 чрескожная термокоагуляция ткани под контролем ультразвука 775-778, 777р чрескожное разрушение опухоли этанолом под контролем ультразвука 775, 776р электрокардиография 758
Гиперпаратиреоз, первичный
кошки 785-786, 785т
собаки 748-783
Гиперпигментация
при гиперкортицизме у собак 287
при гипотиреозе у собак НО, 11р
при гипофизарной карликовости 59
при синдроме феминизации у кобелей 1076
при чувствительном к гормону роста дерматозе у взрослых животных 69
Гиперплазия
аденоматозная 163, 783
влагалища 1005-1009, 1006-1008р, 1007т
гипофиза 274-275
1176
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
доброкачественная простаты 1053т, 1088
кистозная эндометрия 934, 948-964
антипрогестагены 963
встречаемость и анамнез 950-951, 950т
долгосрочное лечение 963
индуцированная медикаментозными средствами 972
клиническая патология 951-952
осложнения на почки 955
патофизиология 948-951
пиометра закрытого типа 962-963
пиометра культи 956-957, 956р
пиометра открытого типа 961-962
полидипсия и полиурия 954
простагландины 958-961, 958р, 959т, 960т
рентгенография 952, 953р
ультразвуковое исследование 952, 954р
физикальное исследование 951
хирургическое лечение 957-958, 957р
цитология влагалища и культивирование 955, 955т
молочной железы 1149-1150
узловая коры надпочечников 273, 275
фолликулярных клеток 104
Гиперпротеинемия 951-952
Гипертензия
ангиотензин II 827
во время удаления феохромоцитомы 490
вызванная глюкокортикоидами 520
натриуретический пептид предсердия 828
при акромегалии у кошек 82
при гиперкортицизме у собак 302-303
при гипертиреозе у кошек 178-179
при лечении эпоэтином 824
при первичном гиперальдостеронизме 412
при сахарном диабете у собак 581-582
при синдроме Кушинга у кошек 388
при феохромоцитоме 477, 483, 484т, 490
реноваскулярная 828
эссенциальная 827
Гипертиреоз
гипермагниемия и 802
кошки 161-227
азот мочевины и креатинин в крови 176-177 активность ферментов печени 175-176 алопеция 169
анализ мочи 175
атенолол 223
базальный уровень общего тироксина в
сыворотке крови 184-187, 184-187р
базальный уровень общего трийодтиронина в
сыворотке крови 187
базальный уровень свободного тироксина в
сыворотке крови 187-188, 189р
встречаемость 165, 165р
гипокальциемия 810
глюкоза в крови 176
глюкокортикоидная терапия 224
диарея и рвота 168-169
дифференциальная диагностика 183, 183т
йодид 223
йодированные контрастные агенты для рентгенографии 223-224
карбимазол 210
клинический анализ крови 174-175, 174т
концентрация общего белка и альбумина в
сыворотке крови 178
кровяное давление и гипертензия 178-179
непереносимость тепла и стресса 170
нервозность, гиперактивность, агрессивное
поведение и тремор 173
патология 162-164,163р
полидипсия и полиурия 168
потеря веса и полифагия 166-168, 167р, 167т
проба с подавлением трийодтиронином 188-189, 189т, 190р, 191р
проба с тиреотропин рилизинг-гормоном 192-193, 182р, 193р
проба со стимуляцией тиреотропином 190-192
прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р
рентгенография 179, 180р
респираторные расстройства 169
сахарный диабет и 627, 628р
сканирование щитовидной железы 193-199, 194т, 194-199р
слабость и сонливость 170
снижение аппетита 169-170
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210, 205р, 207т, 208р
тиамин 224
ультразвуковое исследование шейной области
199-201, 200р, 201т
уровень кортизола в сыворотке крови 178
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного
гормона в сыворотке крови 177
уровни натрия и калия в сыворотке крови 178 физикальное исследование 170-174, 171р, 171т фруктозамин, концентрация в сыворотке крови 178
функция почек 201-204
хирургическое лечение 210-216, 212р, 213р, 214т чрескожная термокоагуляция под контролем ультразвука 221-222, 222р
чрескожные инъекции этанола под контролем
ультразвука 220-221, 221р
электрокардиография 179-182, 179т, 181р, 182р
этиология 164-165
полидипсия и полиурия 10, 13
после тиреоидэктомии у кошек 216, 219-220
собаки 253-257, 255р
Гипертоническая дегидратация 34, 34р
Г ипертриглицеридемия
при гипотиреозе у собак 117
при диабетическом кетоацидозе 645
при сахарном диабете у собак 536-537, 577-578
Гипертрихоз 80т, 90
Гипертрофия клитора 287, 1015
Гиперфосфатемия
при акромегалии у кошек 82
при гиперкальциемии 755-756
при гипертиреозе у кошек 177
при гипопаратиреозе у собак 800
при диабетическом кетоацидозе 649
Г иперхолестеринемия
при гипотиреозе у собак 111, 117
при феохромоцитоме 479
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1177
Гиперэстрогенизм 71т
Гипоальбуминемия
при гипокальциемии 807
при гипокортицизме 442-443
при гипопаратиреозе у собак 800
при синдроме Кушинга у кошек 385т, 386
при феохромоцитоме 479
Гипоаминоацидемия 721
Гипоандрогенизм 71т
Гиповолемия
при гипокортицизме 455-457, 456р
секреция вазопрессина и 7
Гипогликемия
артефактная 691
индуцированная инсулином 681
как побочное действие глипизида 607-608, 609т
при болезни Аддисона 687
при врожденной болезни печени 685-686, 687р
при гипокортицизме 440, 441т
при гипопитуитаризме 688
при лечении диабетического кетоацидоза 670
при не-бета-клеточной опухоли 688-689, 688т
при недостаточности глюкагона 687
при неоплазии бета-клеток 707-708
анамнез 683-684
встречаемость 683, 683т
диагностика 691-695, 692р
диагностическая визуализация 695-696, 696р дифференциальная диагностика 685-691, 686т, 687р 688т
клиническая патология 681-682
клинические признаки 681-682, 681т, 682р
контррегуляторный ответ 679-680, 679т
лечение хронической гипогликемии 703-707 определение инсулина в сыворотке крови 693-695, 694р
острый гипогликемический криз 702-703, 703р
прогноз 706-707
секреция инсулина 680
у кошек 707-708
физикальное исследование 684, 684т
хирургическое лечение 697-702, 697т, 698р, 701т этиология 677
эугликемия и 678, 678р
при полицитемии 691
при почечной недостаточности 690
при сахарном диабете у кошек 622-623
при сахарном диабете у собак
индуцированная инсулином 563
пероральные сахарапонижающие средства 547-550, 549р
при сердечном заболевании 690
при синдроме Кушинга у кошек 387
при эклампсии 922-923
у щенных сук 927
феномен Сомоги 565-567, 565р, 566р
ятрогенная 691
Гипогонадизм 60
Гипогонадотропный гипогонадизм 1117-1118
Гиподипсическая гипонатриемия 48-49
Гипокалиемия
полиурия и полидипсия Ют, 12
при гипертиреозе у кошек 173
при диабетическом кетоацидозе 646, 648т
при лечении диабетического кетоацидоза 671
при первичном гиперальдостеронизме 413
при синдроме Вернера-Моррисона 722
при центральном несахарном диабете 23
причины 13т
электрофизиологические изменения 651, 652р, 652т
Гипокальциемическая тетания
неотложная терапия 811-813
при медуллярном раке щитовидной железы у собак 297
при эклампсии 922
Гипокальциемия 789-817
биохимический анализ крови 801
встречаемость 795, 795т
дефицит магния и 802-803, 802т
дифференциальная диагностика 804-810, 804т, 805р
кальциевая терапия 811-813, 816-817
контроль после лечения 778-781, 778р, 779р, 780т
концентрация паратиреоидного гормона и 803-804
неотложная терапия тетании 811-813
патофизиология 790-795, 790т, 791р
после операции на щитовидной железе у кошек 213-214
при синдроме Кушинга у кошек 385т, 386
при эклампсии 922
прогноз 817
синдром Золлингера-Эллисона 714-715
слабость 795-796
терапия витамином Д 813-816, 814т, 815р
уровень кальция в сыворотке крови 798-800, 799т,
800р
физикальное исследование 797-798, 797т
фосфор в сыворотке крови 800
электрокардиография 801, 801р
Гипокортицизм 418-469
азот мочевины и креатинин в сыворотке крови и анализ мочи 439-440
анамнез 429-430
встречаемость 428-429, 429т
гиперкальциемия 440-442, 441т
гипогликемия 440, 441т, 688
гипонатриемия и гиперкалиемия 432-440, 433-434т,
434-435р
историческая справка 418-419
кислотно-щелочной статус 442
концентрация альдостерона в сыворотке крови 450-
452, 451р
концентрация кортизола в сыворотке крови 447-450, 448т, 449р, 450р
концентрация эндогенного АКТГ в сыворотке крови
452-454, 453р
кровяное давление 442
лечение 454-466, 455т
ацидоза 459, 459р
вторичного гипокортицизма 466
гиповолемии и гипотензии 455-457, 456р
глюкокортикоидное 457, 465-466
дисбаланса электролитов 457-459
долгосрочное 431-434, 431т, 432р, 433р
заместительная солевая терапия 466
ответ на 459-460
сопутствующие проблемы и 460-461
параметры лейкоцитов 431,431т
параметры эритроцитов 431
патофизиология 423-428, 425-426р
полидипсия и полиурия 13-14
1178
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
прогноз 466
рентгенография 444,445р
тестирование функции печени 442-443, 443т
у кошек 466-469, 467р, 468р
физикальное исследование 430-431, 431т
электрокардиография 444-447, 446р
этиология 419-423, 420р
Гипоксия 703, 822
мозга 702
Г иполютеоидизм
кошки 1151-1152
собаки 976
спонтанный аборт и рассасывание плодов 902-903
Гипомагниемия
гипокальциемия и 806
при гипокальциемии 802-803, 802т
при диабетическом кетоацидозе 650
при эклампсии 922
Гипонатриемия
дифференциальная диагностика 435р, 437, 437т
полидипсия и полиурия Ют, 20
при гипокортицизме 432-436, 433-434т, 434-435р
при диабетическом кетоацидозе 645
при недостаточности функции коры надпочечников 423-424
при синдроме нарушенной секреции
антидиуретического гормона 47
Гипопаратиреоз 789-819
биохимический анализ крови 801
встречаемость 795, 795т
дефицит магния 802-803, 802т
дифференциальная диагностика 804-810, 804т, 805р
кальциевая терапия 812-813, 812т, 816
концентрация паратиреоидного гормона в сыворотке крови 803-804
концентрация фосфора в сыворотке крови 800
неотложная терапия тетании 811-812 патофизиология 790-795, 790т, 791р, 793р после удаления опухоли щитовидной железы 251-
252
прогноз 817
слабость 804
терапия витамином Д 813-816, 814т, 815р
уровень кальция 798-800, 799т, 800р
физикальное исследование 797-798, 798р
электрокардиография 801-802, 801р
Гипопитуитаризм 688
Гипоплазия
гипофиза 56
пениса 1059-1060
семенников 1071
Гипоспадия 997, 997р, 1060
Гипостенурия
гиперкальциемия и 757
при пиометре 952
Гипотензия
при гипокортицизме 442-443, 455-456, 456р
при удалении феохромоцитоимы 490
Гипотермия и гипокальциемия 747
Гипотиреоз, приобретенный во взрослом возрасте 152
Гипотиреоз у кошек 152-157
диагностика 156-157
клинические признаки 153, 153т
лечение и прогноз 157
после тиреоидэктомии 215, 219
тестирование щитовидной железы 153-156, 154р, 156т
этиология 152-153
Гипотиреоз у собак 99-152
аборт и 901т
алопеция 70-71, 71т
возраст 136, 136р
встречаемость 107, 107т
вторичный 115
гистопатологические нарушения кожи 109-110, 109р, 118, 118т
грубые гормональные препараты животного
происхождения 151
диагностика 144-145
дифференциальная диагностика от синдрома
Кушинга 312т
желудочно-кишечные расстройства 113
изменение поведения 114
классификация 99
клинико-патологические нарушения 115-118, 118т
коагулопатии 113-114
кожные болезни 140
комбинированные препараты тироксина-
трийодтиронина 151
кретинизм 114-115, 115т, 116р
лекарственные препараты 141-143, 142т левотироксин натрия, лечение 145-150, 146-148т, 147р, 149р
лиотиронин натрия, лечение 150-151
микседема 114
мониторинг лечения 148-150
нарушения обмена веществ 107-109
нервномышечные расстройства 111-112
окружающая среда и температура 141
офтальмологические расстройства 113
пол и репродукция у сук 137
порода и размер тела 136-137, 136р
постановка диагноза 144-145
прогноз 151-152
радиоизотопное сканирование 119-120, 121р
рентгенография 118, 118р
репродуктивные нарушения 112
сахарный диабет и 576-577
сердечно-сосудистые нарушения 112-113 сопутствующие заболевания 137-139, 139р суточный ритм гормональной секреции 137 тестирование функции щитовидной железы 120-143
антитела к тиреоидным гормонам 133-135, 143 базальный уровень общего тироксина в сыворотке крови 122-125, 122р, 124т, 125т базальный уровень общего трийодтиронина в сыворотке крови 125-126
базальный уровень реверсивного триодтиронина в сыворотке крови 127-128
базальный уровень свободного тироксина в сыворотке крови 126-127, 126р, 127р
базальный уровень свободного трийодтиронина в сыворотке крови 127-128,127р
базальный уровень тиреотропного гормона 128-130, 128р, 129р
проба с поглощением трийодтиронина смолой 130 проба со стимуляцией тиреотропин рилизинг-гормоном 131-133, 132р, 132т, 133р
проба со стимуляцией тиреотропином 130-131, 130р, 131р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1179
сопутствующие заболевания 137-139, 139р
суточный ритм 137
физическая нагрузка 141
флуктуации 137, 138р
тиреотоксикоз и 150
тироксин-трийодтиронин, комбинированный
препарат 151
ультразвуковое исследование 118-119, П9р, 120р
этиология 99-107, 99т, ЮОр, 100т, 102т, ЮЗр
Гипотоническая дегидратация 34, 34р
Гипотония матки 915
Гипофиз 1-94
акромегалия у кошек 78-89
диагноз 86-87
диагностическая визуализация 83-84, 83р, 83т, 84р клиническая патология 82-83
клинические признаки 80-82, 80т, 81р
лечение 87-89, 87р
патофизиология 80
породы 80
прогноз 89
эндокринологическая оценка 84-86, 85р
этиология 78, 78р, 79р
акромегалия у собак 89-91
влияние избытка глюкокортикоидов 272
водный обмен 2-10
биосинтез, транспорт и обмен вазопрессина 3-4, 4р
действие вазопрессина на клеточном уровне 4-6, 5р,7р
клинические эффекты вазопрессина 6, 6т
объем крови 8-9
питьевой центр 7
регуляция жажды и секреция вазопрессина 7-8
регуляция секреции вазопрессина 7-9, 9т
утоление жажды 9-10
врожденная недостаточность гормона роста 55-67 гистопатология кожи 60-61, 61т дифференциальная диагностика 64, 65т, 66р клиническая патология 60
клинические признаки 59-60, 59р, 59т, 60р
лечение 65-67
патофизиология 58
породы 58-59
эндокринологическая оценка 61-64, 61-63тт, 62р
этиология 55-58, 56р, 57р
гиперплазия 274-275
действие петида, родственного паратиреоидному
гормону 737т
киста 56
компьютерная томография 336-338, ЗЗбр, 337р
несахарный диабет и 2-50
инфузия солевого раствора 41, 41р
клинические признаки 21-24, 21р, 23р
лечение 41-46, 42т, 45т
модифицированная проба с лишением жидкости 24-39
полидипсия и полиурия 10-17, Ют, 13-15т, 16р
проба с десмопрессином 40
прогноз 46-47
рандомизированное определение осмоляльности
плазмы 39-40, 40р
этиология 17-20, 17р, 18т, 19р, 20т
отношение осмоляльности в плазме крови и моче 41
пороки развития при гипотиреозе у собак 105
приобретенная недостаточность гормона роста 67-68 чувствительный к гормону роста дерматоз, приобретенный во взрослом возрасте 68-77
алопеция 70-72, 71т
гистопатология кожи 70
клиническая патология 69
клинические признаки 68-69, 69р
лечение 76р, 77, 77р
породы 68
прогноз 77
сходные заболевания 72-77, 73т, 75т
эндокринологическая оценка 70
этиология и патофизиология 68
Гипофизарная карликовость 55-67
алопеция 71т
гистопатология кожи 60-61, 61т
дифференциальная диагностика 64, 65т, 66р
клиническая патология 60
клинические признаки 59-60, 59р, 59т, 60р
лечение 65-67
патофизиология 58
породы 58-59
эндокринологическая оценка 61-64, 61-63т, 62р
этиология 55-58, 56р, 57р
Гипофизарные гормоны 876
Г ипофизэктомия
при акромегалии 88
при зависимом от гипофиза гиперкортицизме у
кошек 404-405
при зависимом от гипофиза гиперкортицизме у
собак 348-349
Гипофосфатемия
гемолитическая анемия и 671
при гиперкортицизме у собак 293
при диабетическом кетоацидозе 649-650
при первичном гиперпаратиреозе 755-756, 756р
прогноз 817
Гипохлоремия 423-424
Гипохолестеринемия 443
Гипоэстрогения 71т
Гистология
при гипопаратиреозе 817
при кисте яичника 990
при опухоли щитовидной железы у собак 232-233,
233т, 252
при первичном гиперпаратиреозе у собак 781
Гистопатология кожи
при акромегалии у собак 90
при гипотиреозе у собак 118, 118т
при недостаточности гормона роста 60, 61т
при чувствительном к гормону роста дерматозе 70
Гладкая мышца
действие катехоламинов 474т
действие пептида родственного паратиреоидному
гормону 737т
опухоль при гипогликемии 689
Глаз
гиперкортицизм у собак и 289
гипертиреоз у кошек и 174
гипотиреоз у собак и 113
действие катехоламинов 474т
первичный гиперпаратиреоз и 752
Глибурид 611
Гликемический контроль
при сахарном диабете у кошек
1180
ПРЕДМЕТНЫЙ указатель
анамнез и физикальное исследование 614-615 гликозилированный гемоглобин, концентрация в сыворотке крови 616-617, 617т
гликозурия 617
концентрация фруктозамина в сыворотке крови
615-616, 615т, 616р, 620
серийная гликемическая кривая 617-620, 618р, 619р
при сахарном диабете у собак 552-562
анамнез и физикальное исследование 552-553 гликозилированный гемоглобин, концентрация в сыворотке крови 555-556, 556т
концентрация фруктозамина в сыворотке крови
553-555, 554р, 554т
первичная корректировка при инсулиновой
терапии 551-552, 552р
серийная гликемическая кривая 556-562, 557-
561р
Гликогеноз 686
Гликогенолиз 678
Гликозилированный гемоглобин в сыворотке крови
при сахарном диабете у кошек 616-617, 617т
при сахарном диабете у собак 555-556, 556т
Гликозурия
мониторинг глюкозы в моче 556
полидипсия и полиурия Ют
при гиперкортицизме у собак 290, 294
при диабетическом кетоацидозе 642-643
при сахарном диабете у собак 532, 535
Гликопирролат 888т
Глипизид 607-611, 607т, 608р, 609т, 6 Юр
Глобулин в сыворотке крови при синдроме Кушинга у
кошек 385т, 386
Гломерулонефропатия 83
Гломерулосклероз 581
Глюкагон
влияние катехоламинов 475т
гипогликемия и 679-680, 679т
глюкагонома 720-722
дефицит 687-688
при диабетическом кетоацидозе 637, 637р
Глюкагонома 577, 720-722
ультразвуковое исследование 711
Глюкоза
в крови
во время хирургической операции 700
метод взятия крови из ушной вены 618-620, 618р
нарушение контррегуляции глюкозы 563
при введении инсулина короткого действия 567
при гиперкортицизме у собак 290
при гипертиреозе у кошек 176
при диабетическом гиперосмолярном
некетоновом синдроме 673
при диабетическом кетоацидозе 643-644, 644р,
644т, 645р
при индуцированной стрессом гипергликемии у кошек 621-622, 622р
при инсулин-секретирующей опухоли 683-684, 692р, 693-695, 694р, 694т
при сахарном диабете у кошек 617-620, 618р,
619р
при сахарном диабете у собак 532, 552, 556-562,
557-561р
при синдроме Кушинга у кошек 386-387
при феохромоцитоме 479-480
утилизация в тканях 681 введение при эклампсии 925 изменения у щенных сук 877 метаболизм 687р при болезни Аддисона 458 уровень в сыворотке крови при гипокортицизме 433т, 434т, 440, 441т утилизация тканями 680
Глюкоза в моче
при гиперкортицизме у собак 294 при сахарном диабете у кошек 617 при сахарном диабете у собак 556 Глюкокортикоидная терапия 499-523 абсорбция препаратов 507-508, 508т безопасность при беременности 888т влияние на эндокринную функцию 503-504, 503т, 504р действие на ткани 502-503 дозы, ингибирующие секрецию АКТГ 397-398 источники 507 комбинированные препараты 512 концентрация тиреоидных гормонов и 142 молекулярные механизмы действия 500-502, 501р новые стероиды 512 овариальный цикл и 985 первичный гиперпаратиреоз и 767 пероральные препараты 508 побочные эффекты 515-520, 518р показания к терапии 512-515, 51 Зт после удаления опухоли надпочечников 345,410-411 препараты для парентерального введения 508-512, 5 Юр, 5Ю-511Т препараты и дозы 520-522, 521т при болезни Аддисона 457, 460 при гиперкальциемии 771т при гипертиреозе у кошек 224 при диабетическом кетоацидозе 668 при индукции аборта 941 при лимфоцитарном орхите у собак 1083, 1116 при опухоли бета-клеток 697т при первичном гиперпаратиреозе у собак 770 при терапии митотаном 355-356 при хронической гипогликемии 703-704 продолжительность действия 507 промежуточный обмен 502 противовоспалительное действие 504-507
Глюкокортикоиды
избыток у бесплодных собак 985 изменения тиреоидных гормонов и 142, 142т регуляция секреции 263-268 адренокортикотропный гормон 265-266, 265р биосинтез стероидов 266-268, 266р, 266т кортикотропин рилизинг-гормон263, 264 применение в диагностических тестах 520 рецепторный белок 500 физиологическое действие 424-425 химия 499-500, 500р
Глюкокортикоиды для парентерального введения 510-512, 510р, 5Ют, 511р Глюконеогенез 678
Глюкорегуляторные гормоны 679-680 Гонадный пол 994-995
Гонадотропин 990
Гонадотропин из сыворотки жеребой кобылы 987, 988т
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1181
Гонадотропин рилизинг-гормон
гипогонадотропный гипогонадизм 1116-1117 действие на сперматогенез и стероидогенез у собак 1048, 1048т
при индукции эструса у сук 989
при комбинированном тестировании функции
аденогипофиза 63
при пролапсе влагалища 1008
функция клеток Лейдига и 1049-1050
Гормон роста
базальная концентрация в сыворотке крови 61
биосинтез 51-52
в диэструсе 849
влияние на обмен 52-53, 53р
гипогликемия и 679-680, 679т, 688
концентрация в плазме крови при акромегалии у
собак 90
регуляция секреции 53-55, 53р, 54т, 55т
Гормон роста рилизинг-гормон 53
акромегалия у кошек и 78
в комбинированном тестировании функции
аденогипофиза 63
Гормон роста свиньи 65
Гормон роста связывающие белки 51
Гормональные исследования
при гипокортицизме 447-454
концентрация альдостерона в сыворотке крови
450-452, 451р
концентрация кортизола в сыворотке крови 447-450,449р, 449т, 450р
концентрация эндогенного АКТГ в сыворотке крови 452-454, 453р
при недостаточности гормона роста 61-64, 61т-62т, 62-63р
при синдроме Кушинга у кошек 388-396
отношение кортизол:креатинин в моче 388-390,
390т, 391т
проба с низкими дозами дексаметазона 393-396
проба со стимуляцией АКТГ 390-393
при феохромоцитоме 485-487, 485т, 486т собаки
при акромегалии 90-91
при гиперкортицизме 313
при дерматозе, чувствительном к гормону роста 70
при проблемах репродукции у кобелей 1048-
1051,1048т, 1049р, 1049т
Гормоны
влияние катехоламинов на 475т
вызывающие полиурию и полидипсию 14т
действие на секрецию вазопрессина 9т
при индукции эструса 987-988
Гормоны желудочно-кишечного тракта 710, 711т,
712р
Горячий узел щитовидной железы 241
Гранулезоклеточная опухоль 991
Гранулома, сперма 1085
Грелин 55, 711т
Грибковая инфекция при гиперкальциемии 747
Гризеофулвин 801т
Грубая клетчатка в обогащенном клетчаткой корме для собак 544т
Грубые гормональные препараты животного
происхождения 151
Грыжа пахово-мошоночая 1085-1086
Гуморальная гиперкальциемия вследствие злокачественного роста опухоли 738-739, 739р Гуттаперчивая челюсть 752
д
Дакарбазин 492
Двойное влагалище 1000, 1002р
Двусторонняя адреналэктомия 408-410
Двухсайтовый иммунорадиометрический метод 734 о,р’- ДДД, см. Митотан
Дегенеративная артропатия
при акромегалии у кошек 82
при акромегалии у собак 90
Дегенерация семенников 1084-1085, 1084т
Дегидратация
гиперкальциемия и 747
недостаточность альдостерона и 424
после модифицированной пробы с лишением
жидкости 33-36, ЗЗр, 35т
при гипертиреозе у кошек 173
при диабетическом гиперосмолярном некетоновом
синдроме 673
при диабетическом кетоацидозе 641
при пиометре закрытого типа 951
при центральном несахарном диабете 24
увеличение осмоляльности плазмы крови 9
Дезоксикортикостерон
после удаления опухоли надпочечников 345
препарат и дозы 521т
при болезни Аддисона 461-464, 462р, 462т, 463р
Дексаметазон 511т
желудочно-кишечные осложнения 515-516
период биологической полужизни 507
препарат и дозы 521т
при аутоиммунных заболеваниях 514
при болезни Аддисона 457, 460
при геморрагическом шоке 514
при гиперкальциемии 771т
при гиперкортицизме у кошек 469
при индукции аборта 941
при нарушениях центральной нервной системы 515
при отеке мозга 703
при прерывании беременности у сук 520
снижение дозы 522
структура 500
Декстроза в водном растворе
при гипернатриемической гипертонической дегидратации 35-36
при остром гипогликемическом кризе 702-703, 703р
Демеклоциклин 48
Демиелинизация 461
Демодикоз 283-284
Депо-проге стерон для инъекций 945
L-Депренил 366
Депрессия
при диабетическом кетоацидозе 640, 647
при первичном гиперпаратиреозе 750
при пиометре открытого типа 950, 950т
Дерматит
мошонки 1086, 1086р
перивульварный 1009
поверхностный некротический 720-721
Дерматоз, индуцированный половыми гормонами надпочечников 71-72, 71т
1182
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Дерматоз чувствительный к гормону роста, приобретенный в зрелом возрасте
алопеция 70-72, 71т
гистопатология кожи 70
клиническая патология 69
клинические признаки 68-69, 69р
лечение 76-77
порода 68
прогноз 77
сходные заболевания 72-77, 74р, 75т
эндокринологическая оценка 70
этиология и патофизиология 68
Деструкция костного мозга, индуцированная эстрогеном 934-935
Детская вульва 1000
Дефекты нервных трубок 885т
Дефицит аланина 689
Диабетическая невропатия
у кошек 630-631, 631р
у собак 580-581
Диабетическая нефропатия 581
Диабетическая ретинопатия 580
Диабетический кетоацидоз 635-675
анамнез и физикальное исследование 640-641 встречаемость 640
гиперкалиемия 436
диагностика 641-642, 642р
диагностическая оценка в клинике 642-652
азот мочевины и креатинин в крови 646-647, 647р
анализ мочи и посевы 642-643
анионная разница 648, 648т
диагностическая визуализация 651 калий в сыворотке крови 646, 646р кальций и фосфор в сыворотке крови 649-650 кислотно-щелочной статус 644-645, 645р, 645т клинический анализ крови 648-649 концентрация глюкозы в крови 643-644, 643р, 644р, 644т
магний в сыворотке крови 650
натрий в сыворотке крови645-646, 645р осмоляльность сыворотки крови 647-648 панкреатические ферменты 649 тестирование функции печени 649
уровень холестерина и триглицеридов 650-651, 651т
электрокардиография 651, 652р, 652т
осложнения 669-671,669т
патогенез и патофизиология 635-640, 636-638р прогноз 671-672
сопутствующие заболевания 665-669
терапия 652-665
жидкостная терапия 653-656, 654т, 655р, 656т, 657р
заместительная терапия калием 658, 658т заместительная терапия магнием 659 заместительная терапия фосфатом 658 инсулиновая терапия 661-665, 662р, 663р осложнения 669-671, 669т
терапия бикарбонатом 660-661, 661р
Диагностическая визуализация
опухоли бета-клеток 695-696, 696р
при акромегалии у кошек 83-84, 83р, 84р, 83т
при гастриноме 715
при гиперкортицизме у кошек 403-404, 404р, 404т
при гиперкотицизме у собак 335-339, 336-339р
при диабетическом кетоацидозе 651
при феохромоцитоме 480-483,481-483р
Диазепам
безопасность 884т
при эклампсии 925
применение при беременности 889т
Диазоксид
при опухоли бета-клеток 697т
при хронической гипогликемии 703-704
Диализ при гиперкальциемии 773
Диарея
при гастриноме 714, 714т
при гипертиреозе у кошек 168
при гипотиреозе у собак 113
при карциноидном синдроме 724
при медуллярной карциноме щитовидной железы у собак 257-258
при пиометре открытого типа 950, 950т
при синдроме Вернера-Моррисона 722
при терапии митотаном 352
1,25-Дигидроксивитамин Д 822
при гипокальциемии 814т, 816
нормальная концентрация в сыворотке крови 729т
Дигидротахистерол
после тиреоидэктомии 214-215
при гипокальциемии 815-816, 814т
Дигоксин 889т
Диета
для племенных сук 886, 890
с низким содержанием натрия 45т
с ограничением натрия 45т
Диетарный жир
гипертриглицеридемия и 577-578
гликемический контроль у собак и 544
Диетарная клетчатка
при гликемическом контроле 542-544
при сахарном диабете у кошек 604-605, 603т, 605р
Диетотерапия
при сахарном диабете у кошек 603-606, 603т, 605р, 605т
при сахарном диабете у собак 542-547, 543р, 544т, 546р, 547р
Диета с высоким содержанием клетчатки при контроле гликемии 542-544, 543т, 543р, 544т, 603, 603т
Диета с очень низким содержанием белка Ют
Диетарный белок при гликемичесом контроле 544
Дизурия 1014т
Дилатационная кардиомиопатия 112
Диметилсульфоксид 887т
Динопрост-трометамин 1154
Дистоция
кошки 1146-1147
собаки 907-917
вагинальная стриктура 1001
диагностика 910-914, 911р, 912р, 915т
инерция матки 910
лечение 914-917, 916р, 917т
практическое описание 907-910, 906-908р
причины 907, 907т
частота у разных пород 910
Дистрофическая кальцификация 288
Диурез с увеличенной концентрацией солей в моче 6
Диуретики
при гиперкальциемии 771т
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1183
при первичном гиперпаратиреозе у собак 770, 771т при почечной недостаточности у собак с кетоацидозом 666
Дифалия 1061
Дифеноксилат 888т
Дифф-Квик, краситель 854
Диффузный лимфоцитарный паратиреоз 804
Диэструс 833
влияние на тестирование функции щитовидной железы 137
диабетический кетоацидоз во время диэструса 668 кистозная гиперплазия эндометрия и 948-964
антипрогестагены 963
встречаемость и анамнез 950-951, 950т длительное лечение 963 клиническая патология 951-952 осложнения на почки 955
патофизиология 948-950
пиометра закрытого типа 962-964 пиометра культи 956-957, 956р пиометра открытого типа 961-962 полидипсия и полиурия 954 простагландины 958-961, 958р, 959т, 962р рентгенография 952, 95Зр ультразвуковое исследование 952, 954р физикальное исследование 951 хирургическое лечение 957-958, 957р
цитология влагалища и культивирование 955-956, 955т
кошки 1136-1137
собаки 848-851, 850р
изменения слизистой влагалища 968т индукция транзиторного диабета 532 резистентность к инсулину во время 574 функция яичников 971-972 щенность и 897-898
Диэтазин йодид 887т
Диэтилкарбамазин 887т
Диэтил стилбэстрол
безопасность при беременности 889т при индуцированном аборте после незапланированной вязки 933
при чувствительном к эстрогену дерматозе у овариэктомированных сук 73т
Добавки в корм
для племенных сук 890
при контроле гликемии у собак 550, 550т Доброкачественная гиперплазия простаты 1053т, 1089 Доброкачественная опухоль щитовидной железы 163, 163р
у кошек 163, 163р
у собак 229, 232, 252-253
Доксазоцин 488-489
Доксорубицин
безопасность при беременности 887т
при опухоли щитовидной железы у собак 250
при трансмиссивной венерической опухоли 1028 Допплеровский мониторинг сердечной деятельности 912-913, 912р
Дофамин
при почечной недостаточности у собак с кетоацидозом 666
феохромоцитома 473-476
Е
Esherichia coli
полидипсия и полиурия и Ют
при аборте у собак 901т
при инфекции матки 949
при мастите 925
при пиометре у кошек 1153
при простатите 1088
Ж
Жажда 7-8
Железо, лечение эпоэтином 823-824 Желудочно-кишечная болезнь гиперкалиемия и 436-437 гипокортицизм и 443т
Желудочно-кишечное кровотечение
при болезни Ад дисона 461
при гипокортицизме 431
Желудочно-кишечные пептиды 710-712, 711т, 712р Желудочно-кишечные признаки
при гипотиреозе у собак 113
при опухоли влагалища у собак 1014т Желудочно-кишечные средства 888т Желудочные кровотечения и глюкокортикоиды 515-516 Желчные кислоты и гиперкортицизм у собак 293 Женский псевдогермафродитизм 994, 996-997 Жидкости для внутривенного введения
при болезни Аддисона 455-457
при пиометре у кошек 1154
Жидкостная терапия
при первичном гипопаратиреозе у собак 770р
при диабетическом гиперосмолярном некетоновом синдроме 674
при диабетическом кетоацидозе 653-661, 654т, 655р при гипернатриемической гипертонической дегидратации 35
при операции на поджелудочной железе 700 Жировая ткань, действие катехоламинов 474т Жиры
в кормах для собак с высоким содержанием клетчатки 544т
в кошачьем молоке 1149т
3
Заболевание печени
гипокортицизм и 443т
при болезни Аддисона 461
при гипогликемии 686-687
при диабетическом кетоацидозе 667
при полидипсии и полиурии Ют, 12
синдром Кушинга у собак и 312т
Заболевание почек
гипокортицизм и 443т
первичное заболевание паращитовидной железы и 765-766
при болезни Ад дисона 461
при синдроме Кушинга у собак 312
Заболевания суки до и после родов 897-928
акромегалия в диэструсе 927, 928р
внематочные плоды 900
выделения из половых органов щенных сук 918-919 гипогликемия 927
1184
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
дистоция 907-917, 907р, 907т, 908р, 911-912р, 915т
задержка плаценты 922
затянувшаяся беременность 917-918
инъекции окситоцина после родов 920
клиническая ложная беременность 897-900
мастит 925-927
нормальное состояние 897
отсутствие молока 927
послеродовой эндометрит 920
сахарный диабет 927-928
системное заболевание 919-920
спонтанное изгнание и рассасывание плодов 900-
906, 901т, 906р
субинволюция плацентарных мест 920-921
эклампсия 922-925, 924т
Забрюшинное кровотечение 348
Зависимое от надпочечников нарушение баланса
половых гормонов 73-78, 75т
Зависимый от половых желез дисбаланс половых
гормонов 72
Загибание кончиков ушей у кошек при синдроме
Кушинга 382
Задержка плаценты
у кошек 1148
у собак 922
Заменитель капроген-яичный желток 1125т
Заместительное введение фосфата
при диабетическом гиперосмолярном некетоновом
синдроме 674
при диабетическом кетоацидозе 658-659
Замок во врямя вязки собак 860-861, 861р
Запор
при гипотиреозе у собак 113
при первичном гиперпаратиреозе 751
Застой молока 926
Застойная сердечная недостаточность
натриуретический пепетид предсердия и 828-829
при гиперкортицизме у собак 304
Затрудненное продвижение плода 907
Затяжной межэстральный интервал у кошек 1159
Затянувшаяся беременность 917-918
Злокачественная миастения (myasthenia gravis) 113
Злокачественная опухоль бета-клеток 677-678
Злокачественная опухоль щитовидной железы
кошки 161-224
азот мочевины и креатинин в крови 176-177
активность ферментов печени 175-176
алопеция 169
анализ мочи 175
атенолол 223
базальный уровень общего тироксина в
сыворотке крови 184-187, 184т, 186р
базальный уровень общего трийодтиронина в
сыворотке крови 187
базальный уровень тироксина в сыворотке крови 187-188,188р
встречаемость 165, 165р
глюкоза, уровень в крови 176
глюкокортикоидная терапия 224
дифференциальная диагностика 183, 183т йодид 223
йодированные контрастные агенты для
радиографии 223
карбимазол 210
клинический анализ крови 174-175, 174т
кровяное давление и гипертензия 178-179 непереносимость тепла и стресса 170 нервозность, гиперактивность, агрессивное поведение, тремор 168
патология 162-164,163р
полидипсия и полиурия 168
понос и рвота 158-169
потеря веса и полифагия 166-168, 167р
проба с подавлением трийодтиронином 188-192, 189т, 190р, 191р
проба со стимуляцией тиреотропин рилизинг-гормоном 192-193
проба со стимуляцией тиреотропином 191-192
прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р
рентгенография 179, 180р
респираторные нарушения 169
сканирование щитовидной железы 193-199, 194-199р
слабость и сонливость 170
снижение аппетита 169
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210,205р, 207т, 208р
тиамин 224
ультразвуковое исследование шейной области 199-201, 201р
уровень кортизола в сыворотке крови 178
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного гормона в сыворотке крови 177
уровни натрия и калия в сыворотке крови 178 уровни общего белка и альбумина в сыворотке крови 177
физикальное исследование 170-174, 171р, 171т фруктозамин, концентрация в сыворотке крови 178
функция почек 201-204
хирургическое лечение 210-216,212-213р, 214т чрескожная термокоагуляция опухоли 221-222, 222р
чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182, 179т, 181р, 182р этиология 164
эхокардиография 182-183, 183р
собаки 232-258
биопсия щитовидной железы 246-247 встречаемость 234, 235, 235р
гистология 232-234, 233т
дифференциальная диагностика 247 иммуногистохомия 233-234
клинические признаки 235-236, 236т
медуллярная карцинома 257-258
оценка в клинике 237
при синдроме множественной эндокринной неоплазии 234-235, 234т
прогноз 252-253
рентгенография 238
сканирование щитовидной железы 240-244,241-246р
тестирование функции щитовидной железы 244-246, 246р
ультразвуковое исследование 238-239, 239р, 240р физикальное исследование 236-237
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1185
частота 234
электрокардиография и эхокардиография 238 Злокачественный рост опухоли и гиперкальциемия Зоб 230
врожденный гипотиреоз у кошек 152-153
многоузловой аденоматозный 163, 163р
при гипертиреозе у кошек 171, 171р
Зобогенные вещества 164
Зубная эмаль, действие пептида родственного паратиреоидному гормону 737т
Зуд при гиперкортицизме у собак 281-282
И
Ибупрофен 888т
Ивермектин 887т
Идиопатическая атрофия щитовидной железы 103р, 104
Идиопатическая гиперкальциемия 784-785
Идиопатическая дегенерация семенников 1115-1116
Идиопатическая недостаточность надпочечников 419
Идиопатическое сокращение овариального цикла 977-979
Идиопатическое удлинение межэстрального интервала 980-981
Избирательный анализ образцов венозной крови при
первичном гиперпаратиреозе 762
Избыток гормона роста, индуцированный
прогестероном 91
Изменения поведения, индуцированные эстрогеном 935
Изопротеренол 889т
Изостенурия
гиперкальциемия и 757
при болезни Аддисона 439
при пиометре 952
Изотоническая дегидратация 34, 34р
Изотретиноин
безопасность при беременности 889т
тератогенные эффекты 885т
Изофан 539, 539т
Изофлуран 888т
Изофлюпредон ацетат 511т
Иммобилизационный остеопороз 747
Иммунизация, контрацептивы 945
Иммунные расстройства 514
деструкция надпочечников 419-422
оофорит 986
орхит 1116
Иммуноглобулины 505
Имплантаты стероидных гормонов 945
Инволюция матки у собак 893-895
Ингибин 1048т, 1049р
Ингибиторы альфа-глюкозидазы 548-549
Ингибиторы 5-альфа-редуктазы 1094-1095
Ингибиторы костной резорбции 771т
Ингибиторы пролактина 899-900
Индекс свободного тироксина 130
Индукция аборта 930-939
агонистами дофамина 940
аналогами простагландина 938-939
антагонистами гонадотропин рилизинг-гормона 942
антипроге становой терапией 939-940
введением простагландинов 935-938
глюкокортикоидами 941
до имплантации 933-935
индукция аборта в первом триместре 932
индукция аборта в третьем триместре 932
индукция аборта во втором триместре 932, 933р комбинацией агонистов дофамина и простагландина 940
овариогистерэктомия 932
первичная оценка 930-932, 931-932р
после незапланированной вязки 941-942
тамоксифена цитратом 941
триместры беременности 932, 933р
Индукция гипергликемии при стрессе 621-622, 622р
Индукция дерматоза половыми гормонами надпочечников 71-72, 71т
Индукция овуляции путем коитуса у кошек 1137
Индукция щелочной фосфатазы кортикостероидами 291-292
Индуцированный прогестероном избыток гормона роста 91
Инсулин
в сыворотке крови
при гиперкортицизме у собак 290
при гипогликемии 694, 694р
при сахарном диабете у кошек 600
при сахарном диабете у собак 537-538, 538т
прогностическая информация 532
влияние катехоламинов 475т
глюкокортикоиды и 519
дефицит при диабетическом кетоацидозе 635-636,
636р, 639т
концентрация глюкозы в крови и 681
ответ на гипогликемию 679т, 680
Инсулин аспарт 540
Инсулин гларгин 540, 602
Инсулин крупного рогатого скота 541-542
Инсулин ленте 538-539, 539т
при сахарном диабете у кошек 601
пролонгированное действие 558
Инсулин лиспро 540
Инсулин свиньи 541-542
Инсулин ультраленте
для кошек 601, 602р
для собак 539, 539т
Инсулиновая терапия
после удаления инсулин-секретирующей опухоли
701
при акромегалии у кошек 80
при болезни Аддисона 459
при диабетическом гиперосмолярном некетоновом
синдроме 673-674
при диабетическом кетоацидозе 661-665, 662р, 663р
при кетонурии 652-853
при сахарном диабете у кошек 601-603, 602р, бОЗр, 617-629
антиинсулиновые антитела в циркуляции 626 гипогликемия и 622-623
индуцированная стрессом 621-622
изменяющаяся потребность в инсулине 629-630 кратковременное действие инсулина 624 неадекватная или нарушенная абсорбция инсулина 625-626, 625р
недостаточная доза инсулина 623-624 пролонгированное действие инсулина 624-625 сопутствующие заболевания, вызывающие резистентность к инсулину 626-629, 628р феномен Сомоги 623, 624р
при сахарном диабете у собак 538-542, 53 8р, 538т
1186
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
аллергические реакции 570-571 анамнез и физикальное исследование 552-553 антиинсулиновые антитела в циркуляции 568-570, 568р, 569р во время хирургической операции 562-563 гликемическая кривая 556-562, 557-559р гликозилированный гемоглобин, концентрация в крови 555-556, 556т индуцированная инсулином гипогликемия 563 контроль глюкозы в моче 565-567, 565р концентрация фруктозамина в сыворотке крови 553-555, 554р, 554т, 562 кратковременное действие инсулина 567-568 неадекватная абсорбция инсулина 568 недостаточная доза 565 первоначальный подбор доз 550-552, 552р пролонгированное действие инсулина 568 устойчивость или рецидив клинических признаков 564-565 феномен Сомоги 565-567, 565р
Инсулинозависимый сахарный диабет 529-530, 529т инсулинонезависимый сахарный диабет и 596-597, 597т у кошек 590, 591р у собак 140, 529-530, 529т
Инсулинома 677-707 анамнез 683-684 встречаемость 683, 683т гипогликемия и контррегуляторный ответ 678-680, 679т диагностика гипогликемии 691-695, 692р диагностическая визуализация 695-696, 696р дифференциальная диагностика от гипогликемии натощак 685-691, 686т, 687р,688т индуцированная инсулином гипогликемия 681 клиническая патология 678, 684-685 клинические признаки 681-682, 681т, 682р, 682т кошки 707-708 множественная эндокринная неоплазия 495-496 определение инсулина в сыворотке крови 693-695, 694р острый гипогликемический криз702-703, 703р прогноз 706-707 секреция инсулина 680 физикальное исследование 684, 684т хирургическое лечение 697-702, 697т, 698р, 701т хроническая гипогликемия 703-706, 705р этиология 677 эугликемия и 678, 678р
Инсулинонезависимый сахарный диабет 528-529 инсулинозависимый сахарный диабет и 596-597 пероральные сахаропонижающие средства 607-614 акарбоза 613-614 бигуаниды 611-612, 612р ванадий 613 меглитиниды 611 сульфонилмочевинные препараты 607-611, 606т, 607т, 608-610р тиазолидиндионы 612-613 хром 613
у кошек 590-594, 591-593р у собак 528-529
Инсулиноподобный ростовой фактор I базальный уровень в сыворотке крови 64 биосинтез 51-52
при акромегалии у кошек 84-85, 85р
при акромегалии у собак 90
при дерматозе чувствительном к гормону роста 70 Инсулиноподобный ростовой фактор II 688-689 Инсулиноподобный ростовой фактор-связывающие белки 51
Инсулинорезистентность
при акромегалии у кошек 80
при гиперкортицизме у собак 305
при диабетическом кетоацидозе 669
при сахарном диабете у кошек 589, 590, 626, 628р при сахарном диабете у собак 571-578, 572р, 573т, 574т
при транзиторном диабете у кошек 595-596, 596р при феномене Сомоги 565
у щенных сук 877
Инсулины разных видов 541-542
Интерлейкин-1 739, 739р
Интерлейкин-3 506
Интерсексуальное состояние 993-994 Интерэструс
кошки 1136, 1159
собаки 833
гипотиреоз и 112
удлиненный 980-981
укороченный 977-979, 978р
Инфекционный мастит 925-926 Инфекция
Brucella canis 1019-1025
агглютинация спермы 1114 клинические признаки 1020 культивирование 1022-1023 лечение 1023-1024, 1024т передача 1019-1020
при остром орхиэпидидимите 972 профилактика и контроль 1024-1025 серологические тесты 1021-1022, 1021т тестирование при оценке репродуктивности кобелей 1047-1048
тестирование сук 973
значение кортикостероидной терапии 516-517
при аборте у кошек 1150
при диабетическом кетоацидозе 666
при пиелонефрите 10т
собаки
аномальная семенная жидкость 1113-1114 бесплодие у сук и 973-975, 974р
влагалище 1015-1017, 1015р, 1017т
при аборте 901т, 903-904
при баланопостите 1065-1066
при гипотиреозе 110-111
при сахарном диабете 575-576
прогестерон и 948-949
Инфекция мочевого тракта
при вагините 1002
при гиперкортицизме у собак 294-295, 303-304
при гипоспадии 1060
при диабете у собак 536
при диабетическом кетоацидозе 643
при первичном гиперпаратиреозе 732, 750
при пиометре 952
при синдроме Кушинга у собак 386
хронический простатит и1096
Инфузия гипертонического солевого раствора 20 Инфузия метиленового синего 699
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 1187
Инфузия солевого раствора 41,41т
Ионизированное облучение при раке щитовидной
железы 219
Ионизированный кальций
нормальная концентрация в сыворотке крови 729т определение в сыворотке крови 735-736
при гиперкальциемии у собак 754-755, 754р, 755р
при первичном гиперпаратиреозе 753т
Искусственное влагалище для сбора спермы 1036, ЮЗбр, 1120, 1121р
Искусственное освещение, овариальная активность у
кошек 1131
Искусственное осеменение
кошки 1142
собаки 862-865, 863р, 864р
внутривлагалищный метод 863-866, 863р, 864р замороженной спермой 1125-1128, 1127р обогащенной свежей спермой 1124-1125, 1125т показания 862, 1119
свежей спермой 1120-1124, 1122р
степень успеха 863
трансцервикальный метод 866-869, 866-868р
Истинные гермафродиты 994
Ишемическая болезнь сердца 550т
Й
Йод
гипотиреоз у собак и 107
при гипертиреозе у кошек 223
рак щитовидной железы и 230
Йодированные контрастные агенты для радиографии 223
К
Каберголин
при застое молока 926
при индуцированном аборте 940
при лактации во время ложной беременности 899
укороченный межэстральный интервал и 980
Калий
гиперкалиемия и
гипокортицизм 424, 432-438
диабетический кетоацидоз 437
дифференциальная диагностика 434р, 436-438, 437т
сердце 444-445
центральный несахарный диабет 23 электрофизиологические нарушения 444-447, 446р
гипокалиемия
при гипертиреозе у кошек 174
при диабетическом кетоацидозе 646, 646р
при лечении диабетического кетоацидоза 671
при первичном гиперальдостеронизме 412
при полиурии и полидипсии Ют, 12
при синдроме Вернера-Моррисона 722
при центральном несахарном диабете 23
причины 13т
электрофизиологические нарушения 651-652,
652р, 652т
заместительная терапия
при диабетическом гиперосмолярном некетоновом синдроме 674
при диабетическом кетоацидозе 658, 658т
при болезни Ад дисона 433, 433т
при гипертиреозе у кошек 173-174, 178
при диабетическом кетоацидозе 646, 646р
при синдроме Кушинга у кошек 385т, 386
Калий, регуляция секреции альдостерона 423
Каликреин-кининовая система 825
Калия йодид 210-211
Кальций
влияние глюкокортикоидов на обмен 502 гиперкальциемия и 729-748
алиментарный вторичный гиперпаратиреоз 746 гипервитаминоз Д и отравление родентицидами 742-744, 743р
гиперкортицизм 744
гипотермия 747
глюкокортикоиды 514
дегидратация 747
дифференциальная диагностика 738т злокачественность 738-742, 739р, 740р иммобилизационный остеопороз 747 концентрация витамина Д 736
концентрация ионизированного кальция в сыворотке крови 735-736
нормальная концентрация в сыворотке крови 729т
острая почечная недостаточность 746
паратиреоидный гормон в сыворотке крови 734-
735, 735р
патофизиология 730-734
пептид родственный паратиреоидному гормону
736-738, 737р, 737т, 738р
полидипсия и полиурия 10, Ют
при гипотиреозе у собак 117
при сепсисе и грибковой инфекции костей 747
синдром Кушинга у собак 312т
хроническая почечная недостаточность 744-745, 745р
этиология 730
гиперкальциурия 732
гипокальциемическая тетания
неотложная терапия 811-813
при медуллярной карциноме щитовидной железы у собак 297
при эклампсии 922
гипокальциемия 789-817
биохимия крови 801
встречаемость 795, 795т
дефицит магния 802-803, 802т
дифференциальная диагностика 804-810, 804т, 805р
концентрация кальция 798-800, 799т, 800р
концентрация паратиреоидного гормона 803-804
концентрация фосфора в сыворотке крови 800 неотложная терапия тетании 811-813 нервозность 795-796
патофизиология 790-795, 790т, 791р
после операции на щитовидной железе у кошек 213-214
при синдроме Кушинга у кошек 385т, 386
при эклампсии 922
прогноз 817
синдром Золлингера-Эллисона 714, 715
терапия витамином Д 813-816, 814т, 815р терапия кальцием 811-813, 816-817
1188
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
физикальное исследование 797-798, 797т электрокардиография 801, 801р
гомеостаз 790, 791р, 793р
заместительная терапия после тиреоидэктомии у кошек 214-215
концентрация в сыворотке крови нормальные концентрации 729т поддержание 790-792, 791р, 793р после операции на щитовидной железе у собак 252
после тиреоидэктомии у кошек 214
при гипокальциемии793-794
при гипокортицизме 433т, 440-442,441т
при гипопаратиреозе у собак 799т
при синдроме Кушинга у кошек 385т, 386
при гипопаратиреозе у собак 798-799
при диабетическом кетоацидозе 649
при отсутствии маточных сокращений 914
при первичном гиперпаратиреозе у собак 779-780, 780т
проба с введением кальция
при гастриноме 717, 718, 717р
при гипопаратиреозе 790-791, 718р
Кальциноз при гиперкортицизме у собак 288, 298 Кальцитонин
влияние катехоламинов 475т
медуллярный рак щитовидной железы у собак и 257 при гиперкальциемии 733-734, 771т
при первичном гиперпаратиреозе у собак 772
Кальцитонин лосося 772
Кальцитриол
метод определения 736, 761
нормальная концентрация в сыворотке крови 729т
после тиреоидэктомии у кошек 215
при гипокальциемии 813-814, 814т
Кальцификация мягких тканей при первичном гиперпаратиреозе 733
Кальцифицирующая лентовидная кератопатия 288
Кальция глицерофосфат 924т
Кальция глюконат
коммерческие препараты 924
при болезни Аддисона 458
при гипокальциемии 813
при эклампсии 923
Кальция глюцептат 924т
Кальция иподат 223
Кальция карбонат 817
Кальция лактат 924т
Кальция левулинат 924т
Кальция хлорид
коммерческие препараты 924т
при эклампсии 923
Campilobacter при аборте у собак 901т
Канамицин 1097т
Каптоприл 888т
Карбамазепин
при центральном несахарном диабете 44
тератогенный эффект 888т
Карбимазол 210
Кардиомиопатия
при акромегалии у собак 90
при гипертиреозе у кошек 182, 183р
при гипотиреозе у собак 112
Кариотипирование
при гипоплазии пениса 1057
при отсутствии эрекции 1063
при оценке репродуктивности кобеля 1057 Карликовость
гипофизарная 55-67
гистопатология кожи 60, 61т дифференциальная диагностика 64, 64р, 65т клиническая патология 60
клинические признаки 59-60, 59р, 59т, 60р лечение 65-67 патофизиология 58
породы 58-59
эндокринологическая оценка 61-64, 61-63т этиология 55-58, 56р, 57р
при гипотиреозе у кошек 153
Карликовость Ларона 58
Карман Ратке 55
Карнитин в семенной жидкости как маркер азооспермии 1045
Карциноидный синдром 723-724, 724т
Карциноиды 723-724, 724т
Карцинома
влагалища 1013, 1013р гепатоцеллюлярная 688 главных клеток 781-782 заднепроходной пазухи 741, 769т определение паратиреоидного гормона в сыворотке крови 735р при гиперкальциемии 740, 740р
надпочечников 275 сквамозных клеток метастазирование в кости 742 пениса у собак 1067
щитовидной железы
медуллярная 232-233, 257, 496, 810 фолликулярная 163-164
Кастрация
при гипоспадии 1060
при инфекционном простатите 1094
при остром орхиэпидидимите 1079
при пахово-мошоночной грыже 1086
при пролапсе уретры 1064
при синдроме феминизации кобелей 1077р, 1078 при хроническом простатите 1098
Катаракта
при гипопаратиреозе у собак 798, 798р при сахарном диабете у собак 533, 533р, 579-580 травы, добавки и витамины 550т
Катетер для влагалищного осеменения 1122 Катехоламины биосинтез 474р влияние на гастрин 475 диабетический кетоацидоз и 637, 637р ингибирующие и провокационные пробы 486-487 концентрация в сыворотке крови 485 продукты превращения в моче 485-486,486р феохромоцитома и 473-476,485-486
Катехол-О-метилтрансфераза 476
Кашель при опухоли щитовидной железы у собак 235,236т Кахексия
влияние на тестирование функции щитовидной железы у собак 141
при гипертиреозе у кошек 173
КГЭ см. Кистозная гиперплазия эндометрия
Кесарево сечение кошки 1146-1147
предметный указатель
1189
собаки 917, 917т
Кетамин 888т
Кетоацидоз 642-652
азот мочевины и креатинин в крови 646-647, 647р
анионная разница 648, 648т
диагностическая визуализация 651 калий в сыворотке крови 646, 646р кальций и фосфор в сыворотке крови 649-650 кислотно-щелочной статус 644-645, 645р, 645т клинический анализ крови 648-649
концентрация глюкозы в крови 643р, 644, 644р
концентрация магния в сыворотке крови 650 концентрация натрия в сыворотке крови 645-646, 645р
осмоляльность сыворотки крови 647-648
панкреатические ферменты 649
тестирование функции печени 649
уровни холестерина и триглицеридов 650-651, 651т электрокардиография 651, 652р, 652т
Кетоконазол
безопасность при беременности 887т
при гиперкортицизме у собак 362-364, 362т, ЗбЗр
при синдроме Кушинга у кошек 407
при ятрогенной недостаточности кортизола 427
Кетонемия 927
Кетоновые тела 635, 639-640
Кетонурия
контроль мочи 536
лечение 652
при акромегалии у кошек 82
при диабетическом кетоацидозе 640
Кинины 828
Кислотно-щелочной статус
при диабетическом кетоацидозе 588-589, 588р, 589т, 644-645, 644р, 645т
при гиперкальциемии у собак 754
при гипокортицизме 442
Киста
гипофиза 49
семенника 1053т
фолликула 1159
яичника 979, 981, 982р, 986
Кистозная аденома яичника 991
Кистозная гиперплазия эндометрия
кошки 1151, 1152-1155, 1152т, 1153т, 1154р
собаки 934, 948-964
антипрогестагены 963
бесплодие 975
встречаемость и анамнез 950-951, 950т
долгосрочное лечение 963
индуцированная медикаментозными средствами 972
клиническая патология 951-952
осложнения на почки 955
патофизиология 948-949
пиометра закрытого типа 962-963
пиометра культи 956-957, 956р
пиометра открытого типа 961
полидипсия и полиурия 954
простагландины 958-961, 958р, 959т, 960т рентгенография 952, 953р
спонтанный аборт и рассасывание плодов 900 ультразвуковое исследование 952, 954, 954р физикальное исследование 951 хирургическое лечение 957-958, 957р
цитология влагалища и культивирование 955, 955т
Кишечник
абсорбция левотироксина натрия 146
ганглионейрома 497
действие катехоламинов 475т
действие пептида родственного паратиреоидному
гормону 737т
зависимое от глюкокортикоидов кровотечение 515 лейомиосаркома Ют
Кишечный ингибирующий полипептид 272
Клавамокс 1154
Клавуланат калия 1154
Клеточный иммунитет 101
Клетчатка
корм для собак с высоким содержанием клетчатки 544т
при сахарном диабете у кошек 604-605, 603т, 605р
Клиндамицин
безопасность при беременности 887т
фармакологическая характеристика 1097т
Клиническая ложная беременность 897-900
Клинический анализ крови
при гиперкортицизме у собак 289, 289т
при гипокортицизме 431т
при гипотиреозе у собак 115
при диабетическом ацидозе 648-649
при инсулин-секретирующей опухоли 685
при несахарном диабете 22
при опухоли щитовидной железы у собак 237
при послеродовом эндометрите 920
при сахарном диабете у собак 535, 535т
при синдроме Кушинга у кошек 384, 384т
Клодронат 771, 771т
Клопростенол 935, 959
Клофибрат 44
Клубочковая зона 266,423,424р, 475т
Кобальтовая дистанционная лучевая терапия 629
Кожа
гиперпигментация
при гиперкортицизме у собак 287
при гипотиреозе у собак ПО, Пр
при гипофизарной карликовости 59т, 60
при синдроме феминизации у кобелей 1076
при чувствительном к гормону роста дерматозе у взрослых животных 68
действие пептида родственного паратиреоидному
гормону 737т
нарушения после облучения 249
при акромегалии у собак 91
при гиперкортицизме у собак 281-284, 282-284р
при гипертиреозе у кошек 169
при глюкагономе 720
при синдроме Кушинга у кошек 382-383, 383р
при синдроме эутиреоидной патологии 137 чувствительный к гормону роста дерматоз у взрослых животных 68-77
алопеция 70-72, 71т
гистопатология кожи 70
клиническая патология 69
клинические признаки 68-69, 69р
лечение 76р, 77, 77р
породы 68
прогноз 77
сходные заболевания 72-77, 73т, 74р, 75т
1190
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
эндокринологическая оценка 70
этиология и патофизиология 68
Кожное матапластическое окостенение 284, 286р
Кожноскладчатая пиодермия 1009
Кожные расстройства
гиперпигментация
после облучения 249
при гиперкортицизме у кошек 382-383, 387р
при гиперкортицизме у собак 287
при гипотиреозе у собак 109-111, 109р, ПОр
при гипофизарной карликовости 59-60
при синдроме феминизации у кобелей 1076
при приобретенном в зрелом возрасте чувствительном к гормону роста дерматозе 68-69, 69р
Кожный кальциноз (calcinosis cutis) 284, 285, 286р
Кокаин 885т
Количество лейкоцитов
при гипертиреозе у кошек 175
при гипокортицизме 431-432,432т
при гипотиреозе у собак 115
при пиометре 951
Количество тромбоцитов при гипертиреозе у кошек 175
Количество эритроцитов
при гипертиреозе у кошек 174
при пиометре 951
Колониеобразующая эритроидная клетка (КОЭ) 822 Кома
при гипогликемии 682
при диабетическом гиперосмолярном некетоновом синдроме 672
при пиометре закрытого типа 951
Комбинация инсулинов 539-540, 539р
Комбинация нейрофизин-вазопрессин 4
Комбинация препаратов тироксина-трийодтиронина 151 Комбинированная проба с подавлением дексаметазоном и стимуляцией кортикотропином 328
Комбинированная химиотерапия
опухоли щитовидной железы у собак 250
при индукции аборта 940
трансмиссивной венерической опухоли 1028
феохромоцитомы 492
Комбинированное тестирование функции передней доли гипофиза 63-64
Компульсивное потребление воды 20, 20т
Компьютерная томография
при акромегалии у кошек 83-84, 84р
при гиперкортицизме у кошек 403-404, 404р
при гиперкортицизме у собак 336-338
при феохромоцитоме 482,483р
Контрацепция
кошки 1160-1161
собаки 943-945, 943т, 945р, 945т
Контроль температуры при введении кальция 924
Контроль уровня глюкозы в крови
взятие крови путем прокола ушной вены 608р, 618-
619, 618р
кратковременное действие инсулина 567
мониторинг во время операции 700
нарушение контррегуляции глюкозы 563
при гиперкортицизме у собак 290
при гипертиреозе у кошек 176
при гипокортицизме 433т, 440, 441т
при диабетическом гиперосмолярном некетоновом синдроме 673
при диабетическом кетоацидозе 640, 643-644, 643р, 644р, 644т
при индуцированной стрессом гипергликемии у кошек 621-622, 622р
при инсулин-секретирующей опухоли 684-685, 691 -694, 694р, 694т
при сахарном диабете у кошек 617-620, 618р, 619р при сахарном диабете у собак 532, 552, 556-562, 557-560р, при синдроме Кушинга у кошек 386-387 при феохромоцитоме 479-480
Контррегуляторные гормоны
диабетический кетоацидоз637, 637р, 639
продукция глюкозы 678
Контррегуляция глюкозы
во время действия инсулина 558, 560
концентрация фруктозамина в сыворотке крови 553 при сахарном диабете у кошек 622-623, 622р при сахарном диабете у собак 565-567, 565р, 566р
N-концевой фрагмент проопиомеланокортина 265, 265р Концентрация альбумина в сыворотке крови при гипертиреозе у кошек 177 при гипокортицизме 433т, 442-443,443т при гипопаратиреозе у собак 800 при синдроме Кушинга у кошек 385т, 386
Концентрация белка в сыворотке крови при гипертиреозе у кошек 177
Концентрация вазопрессина в плазме крови 37-38, 38-40р, 41
Концентрация 17-гидроксипрогестерона в сыворотке крови 326-328, 328т
Концентрация гормона роста в сыворотке крови при гипотиреозе у собак 117 при чувствительном к гормону роста дерматозе 70
Концентрация железа в сыворотке крови при лечении эпоэтином 824
Концентрация инсулина в сыворотке крови
при гиперкортицизме у собак 290 при гипогликемии 693-694, 694р при сахарном диабете у кошек 600 при сахарном диабете у собак 537-538, 538т прогностическая информация 532
Концентрация ионизированного кальция при гиперкальциемии у собак 754-755, 754р, 755р Концентрация калия в сыворотке крови при болезни Аддисона 433, 433т при вторичном гипокортицизме 434т при гипертиреозе у кошек 174,178 при диабетическом кетоацидозе 646, 646р при синдроме Кушинга у кошек 385т, 386
Концентрация кальция в сыворотке крови нормальный уровень 729т определение 735-736 поддержание 790-792, 791р, 793р после тиреоидэктомии у кошек 214 после удаления опухоли щитовидной железы у собак 251-252
при гипокальциемии 792
при гипокортицизме 433т, 440-441, 441т
при гипопаратиреозе у собак 799т
при диабетическом кетоацидозе 649 при первичном гиперпаратиреозе у собак 779-780,780т при синдроме Кушинга у кошек 385т, 386
Концентрация креатинина в сыворотке крови при болезни Аддисона 439
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 1191
при гипокортицизме 433т
при диабетическом кетоацидозе 646-647
при первичном гиперпаратиреозе 750т, 756
при синдроме Кушинга у кошек 385, 385т Концентрация натрия в сыворотке крови
при болезни Аддисона 433, 433т
при вторичном гипокортицизме 434т
при гипертиреозе у кошек 178
при диабетическом кетоацидозе 645-646, 645р
при синдроме Кушинга у кошек 385т, 386
Концентрация натрия и осмоляльность плазмы крови 2 Концентрация магния в сыворотке крови при гипопаратиреозе у собак 799т, 802-803 при диабетическом кетоацидозе 650
Концентрация общего кальция в сыворотке крови у кошек
после химического разрушения опухоли паращитовидной железы 775, 776р при гипопаратиреозе у собак 799, 800р при первичном гиперпаратиреозе 753-754, 754т Концентрация паратиреоидного гормона в сыворотке крови
определение 803, 805р после лечения первичного гиперпаратиреоза 778р, 779р
при гипокальциемии 803-804
Концентрация прогестерона в сыворотке крови измерение для определения времени вязки 873 измерение для определения срока родов 910 при кисте яичника 981, 986 при лечении простагландинами для индукции аборта 937, 937р при недостаточности функции желтого тела 902, 976 при расщепленной течке 979-980 при скрытой течке 984 у кошек
в начале родов 1144
во время беременности 1143
при ложной беременности 1139, 1139р у собак
в диэструсе 848
в эструсе 844
влияние простагландинов 958р во время щенности 876, 877р у бесплодных сук 972
Концентрация свободного тироксина в сыворотке крови заместительная терапия тироксином 148-150 при гиперкортицизме у собак 295 при гипотиреозе у кошек 154-155, 154р при гипотиреозе у собак 126-127, 126р, 127р
Концентрация тироксина в сыворотке крови 97-98 Концентрация тестостерона в сыворотке крови у кобелей в норме и при патологии 1070 у сук во время проэструса 845
Концентрация тиреоидных гормонов в сыворотке крови при опухоли щитовидной железы у собак 244-246, 246р, 251 при гипотиреозе у кошек 155-156, 156т
Концентрация тиреотропного гормона в сыворотке крови 128-130, 128р, 129р
при гипотиреозе у кошек 155
при гипотиреозе у собак 128-130, 128р, 129р при заместительной терапии тиреоидными гормонами 148-150
Концентрация тироксина в сыворотке крови после лечения гипертиреоза радиоактивным йодом у кошек 217р, 218 после чрескожной инъекции этанола 220, 221р при гиперкортицизме у собак 295, 295р при гипотиреозе у кошек 153 при заместительной терапии левотироксином 148-150
при опухоли щитовидной железы у собак 244-246, 246р, 251
при сахарном диабете у кошек 599, 627
при сахарном диабете у собак 537
у щенных сук 877
Концентрация трийодтиронина в сыворотке крови при гипотиреозе у кошек 153-154 при опухоли щитовидной железы у собак 244, 246
Концентрация фолликулостимулирующего гормона при азооспермии 1107р, 1108
Концентрация фосфата в сыворотке крови
при гиперкортицизме у собак 293
при гипопаратиреозе у собак 799т, 800
при диабетическом кетоацидозе 649-650
при первичном гиперпаратиреозе 750т, 755-756, 756т
Концентрация фруктозамина в сыворотке крови при гипертиреозе у кошек 178 при сахарном диабете у кошек 615-616, 615т, 616р при сахарном диабете у собак 553-555, 554р, 554т при феномене Сомоги 565-566
Концентрация холестерина в сыворотке крови во время щенности у собак 897 при гипокортицизме 433т, 442-443,443т при первичном гипертиреозе у кошек 177 у кошек с синдромом Кушинга 385, 385т у собак с диабетом 536-537
Концентрация электролитов в сыворотке крови при гиперкортицизме у собак 293 при гипокортицизме 432-438, 433т, 434р, 435р при несахарном диабете 23-24
Концентрация эндогенного АКТГ в сыворотке крови при гиперкортицизме у кошек 399-401 при гиперкортицизме у собак 330-332, 331р при гипокортицизме у кошек 452-454, 453р при гипокортицизме у собак 468
Концентрация эстрогена в плазме крови во время эструса у сук 843-845, 844р кошки
в анэструсе 1137
в интерэструсе 1136
в проэструсе1132
в фолликуляной фазе эструса 1133 у щенных сук 876-877
Кора надпочечников, действие катехоламинов 475т
Кормление щенных сук 886, 890
Коробка для родов и помета 891-892, 892р
Коровье молоко и инсулинозависимый сахарный диабет 527
Кортизол
биосинтез 266-268, 266т, 266р, 267р
в плазме крови ЗЮр, ЗПр
при гиперкортицизме у собак 268-269, 269р, 315
при гипертиреозе у кошек 178
при гипокортицизме у кошек 467-468
при гипокортицизме у собак 447-450, 448т, 449-450р
влияние катехоламинов 475т
1192
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
врожденные портосистемные шунты и 312 гипогликемия и 679-680, 679т
дефицит 427
диабетический кетоацидоз и 637, 637р
забор проб крови 313
оценка репродуктивных свойств у кобелей 1051
секреция АКТГ и 265
секреция опухолью коры надпочечников 300 структура 499-500, 500т
у щенных сук 877
физиологическое действие 424-425
Кортизон
период биологической полужизни 507
препарат и дозы 521т
Кортикостероиды 499-524
безопасность при беременности 889т
влияние на эндокринную функцию 503-504, 503т, 504р
всасывание 507-508, 508т
действие на ткани 502-503
дозы, ингибирующие АКТГ 422
источники 507
комбинированные препараты 512
молекулярные механизмы действия 500-502, 501р
новые стероиды 512
пероральные препараты 509-510 побочные эффекты 515-520, 518р показания к терапии 512-515, 513т препараты для парентерального введения 510-512, 5 Юр, 510т, 511т
препараты и дозы 520-522, 521т
при диагностическом тестировании 520
продолжительность действия 507
промежуточный обмен 502
противовоспалительные свойства 504-507 химия 499-500, 500р
Кортикотропин рилизинг-гормон
АКТГ и 425
в комбинированном тестировании функции передней доли гипофиза 63
в регуляции секреции глюкокортикоидов 263, 264р Кости
действие пептида родственного паратиреоидному гормону 737т
действие глюкокортикоидов 502
гипертиреоз у кошек и 175-176
гиперкальциемия и 731-732, 742
множественные миеломы и 741-742
Костная опухоль
при гиперкальциемии 742
при гипокальциемии 810
Костные изоферменты при гипертиреозе у кошек 175-176 Костный мозг
гипоплазия при синдроме феминизации у кобелей 1076-1077
деструкция, индуцированная эстрогенами 934-935 оценка при первичном гиперпаратиреозе у собак 766-769
Кость пениса
врожденная деформация 1060
мезенхимальная хондросаркома 1067
перелом 1066
физикальное исследование 1034
Кот 1161-1163
индукция овуляции во время коитуса 1138
оценка фертильности 1156
поведение во время вязки 1141-1142, 1141т
Котята
искусственное вскармливание сирот 1148, 1149, 1149т
неадекватная материнская забота 1148
пороки плодов 1150
смертность 1147, 1147р
Кофеин 889т
Кошачье молоко 1149
Кошка
акромегалия 78-89
диагностика 86-87
диагностическая визуализация 83-84, 83р, 83т клиническая патология 82-83
клинические признаки 80-82, 80т, 81р, 82р лечение 87-89, 87р
патофизиология 80
порода 80
прогноз 89
эндокринологическая оценка 84-86, 85р этиология 78-79, 78р, 79р
аномалии хромосомного пола 993-994
гиперкортицизм 376-417
биопсия под контролем ультразвука 402 биохимический анализ сыворотки крови 384-388, 385т
встречаемость 378, 378т, 379т
гипофизэктомия 404-406
двусторонняя адреналэктомия 408-410
загибание кончиков ушей 382
клинический анализ крови 384, 384т кожные расстройства 382-383, 383р компьютерная и магнитно-резонансная томография 403-404,404р, 404т лечение опухоли надпочечников 410-412 медикаментозная терапия 407-408 облучение гипофиза 406
определение эндогенного АКТГ в плазме крови 399-401
основные жалобы 379-380, 379т
отношение кортизолжреатинин в моче 389-390, 390т, 391т
полиурия и полидипсия 381-382
потеря веса 382
проба с высокими дозами дексаметазона 396-399, 397т, 399т
проба с низкими дозами дексаметазона 393-396 проба со стимуляцией АКТГ 390-393
продолжительность клинических признаков 378
рентгенография брюшной полости 401
слабость, сонливость, отвислый живот, кровотечения 382
ультразвуковое исследование брюшной полости 401-402,402т
физикальное исследование 380-381, 380т, 381р этиология 377-378
гипертиреоз 161-226
азот мочевины и креатинин в крови 176-177
активность ферментов печени 175-176
алопеция 169
анализ мочи 175
атенолол 223
базальный уровень общего тироксина в сыворотке крови 184-187, 184р, 185-187р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1193
базальный уровень общего трийодтиронина в
сыворотке крови 187
базальный уровень свободного тироксина в
сыворотке крови 187-188, 188р
встречаемость 165, 165р
глюкокортикоидная терапия 224
дифференциальная диагностика 1183, 183т
йодид 223
карбимазол 210
клинический анализ крови 174-175, 174т
контрастные йодированные агенты для
рентгенографии 223-224
кровяное давление и гипертензия 178-179
непереносимость жары и стресса 170 нервозность, гиперактивность, агрессивное поведение и тремор 173
патология 162-164, 163р
плохой аппетит 169-170
полидипсия и полиурия 168
понос и рвота 168-169
потеря веса и полифагия 166-168, 167р, 167т
проба с подавлением трийодтиронином 188-189, 189т, 190р
проба с тиреотропин рилизинг-гормоном 192-
193, 192р, 193р
проба со стимуляцией тиретропином 190-192
прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р
рентгенография 179,180
респираторные растройства 169
сканирование щитовидной железы 193-199, 194т, 194-199р
слабость и сонливость 170
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210, 205р, 207т, 208р
тиамин 224
ультразвуковое исследование шейной области
199-201, 200р, 201т
уровень глюкозы в крови 176
уровень кортизола в сыворотке крови 178
уровень общего белка и альбумина 178
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного
гормона в сыворотке крови 177
уровни натрия и калия в сыворотке крови 178
физикальное исследование 170-174, 171р, 171т фруктозамин, концентрация в сыворотке крови 178
функция почек 201-204
хирургическое лечение 210-216, 212р, 21 Зр, 214т, чрескожная термокоагуляция опухоли 221-222, 222р
чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182, 179т, 181р, 182р этиология 164-165
эхокардиография 182-183, 183р
гипокортицизм 466-469, 467т, 468т
гипопаратиреоз 798, 801
гипотиреоз 152-157
диагностика 156-157
клинические признаки 153, 153т
лечение и прогноз 157
после тиреоидэктомии 214-219
тестирование функции щитовидной железы 153-156, 154р, 156т этиология 152-153
гипофизарная карликовость 58-59 карциноидная опухоль 723-724, 724т лейкемия 1150
множественная эндокринная неоплазия 497 опухоль бета-клеток 707-708
панлейкопения 1150
первичный гиперальдостеронизм 412-413, 414т репродукция см. Кошка, репродукция сахарный диабет 588-633
акарбоза 613-614
анамнез 597-598
бигуаниды 611-612, 612р
ванадий 613
встречаемость 597
гипергликемия при стрессе 621-623 гипогликемия 622-623
гликозилированный гемоглобин, концентрация в плазме крови 616-617, 617т
глюкозурия 617
диагноз 598
диетотерапия 603-606, 603т, 605р, 605т идентификация и контроль сопутствующих проблем 606
изменения потребности в инсулине 629-630 ИЗСД и ИНЗСД 596-597, 596т инсулинозависимый 590, 591р
инсулинонезависимый диабет 590-594, 592-594р клиническая патология 599-600, бООр кратковременный эффект инсулина 624 меглитиниды 611
начальная инсулинотерапия 601-603, 602р, бОЗр неадекватная или нарушенная абсорбция инсулина 625-626, 625р
недостаточная доза инсулина 623-624 патофизиология 597
препараты сульфомочевины 607-611, 606т, 607т, 608р, 609т, 6 Юр
прогноз 632
пролонгированный эффект инсулина 624-625 сахарная кривая 617-620, 618р, 619р сопутствующие болезни, вызывающие резистентность к инсулину 626-629, 628р тиазолидиндионы 612-613 тип 1 и тип 2 589-590
транзиторный 594-595, 596р
феномен Сомоги 623, 624р
физикальное исследование 598, 614-615 фруктозамин, концентрация в плазме крови 615-616, 615т, 616р, 620
хром 613
хронические осложнения 630-631, 631р
циркулирующие антиинсулиновые антитела 626 среднее суточное потребление воды 14-15 феохромоцитома 472-498
артериальное кровяное давление 483-484, 484т встречаемость 476,476р, 476т
диагноз 487
клиническая патология 479-480, 479р клинические признаки 476-478
компьютерная и магнитно-резонансная томография 482,483р
лечение 491-492
1194
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
опухоль коры надпочечников и 274 патофизиология 473-476, 474р, 474т, 475т при множественной эндокринной неоплазии 2А 496
прогноз 492
рентгенография брюшной и грудной полостей 481-482
сцинтиография 482-483
тестирование гормонов 485-487, 485т, 486р
у собак с диабетом 577
ультразвуковое исследование брюшной полости
480-481, 481р, 482р
физикальное исследование 478
хирургическое лечение 487-491,489р, 490т этиология 472-473
Кошка, репродукция 1130-1161
анатомические особенности ИЗО
анэструс 1137
беременность 1143-1144, 1144т
бесплодие 1115-1160, 1157р
внематочная беременность 1145-1146
гиперплазия молочных желез 1149-1150
дистоция 1146-1147
диэструс 1136-1137
задержка плаценты 1148
индукция овуляции 1137-1138, 1138р
искусственное оплодотворение 1142-1143
кистозная гиперплазия эндометрия 1152-1155, 1152т, 1153
контрацепция 1160-1161
ложная беременность 1139-1140, 1139р, 1140р
материнский уход и ручное вскармливание котят-сирот 1148-1149, 1149т
межэстральный период 1136
наступление половой зрелости и оптимальный
возраст для репродукции 1170-1171
незапланированная вязка 1161
острый метрит 1148
плохая забота о котятах 1148
послеродовое вагинальное кровотечение 1147, 1147р предродовое вагинальное кровотечение 1146 причины дистоции 907т
пролапс матки 1148
проэструс 1131-1132,1132т
роды 1144-1145
смертность котят 1147, 1147р
спонтанный аборт 1150-1152
субинволюция плацентарных мест 1147-1148
эклампсия 808
эструс
половое поведение 1140-1142, 1140р, 1141р
после овариогистерэктомии 1160
сезонность 1131
фолликулярная фаза 1133-1136, 1134р, 1135р
Краниофарингеальный проток 55
Краска Райта 854
Краска Райта-Гимзы 854
КРГ, см. Кортикотропин рилизинг-гормон
Креатинин
при болезни Аддисона 439
при гипертиреозе у кошек 176-177
при гипокортицизме 433т, 439
при диабетическом кетоацидозе 646-647, 647р
при первичном гиперпаратиреозе 750т, 756
при синдроме Кушинга у кошек 385, 385т
при случайно обнаруженной опухоли надпочечника 494
Креатининкиназа в плазме крови 117
Кренуляция 837
Кретинизм 114-115, 115т, 116р
Крипторхизм
кобели 1068-1071, 1069р, 1069т, 1074р
коты 1162
Кровеносные сосуды, влияние глюкокортикоидов 506-
507
Кровоизлияние в сетчатку при феохромоцитоме 478
Кровотечение
при отравлении родентицидами 742
при разрыве опухоли надпочечника 348
при травме пениса у кобелей 1066-1067, 1066р
Кровоточивость
при гиперкортицизме у собак 284, 284р, 285р
при синдроме Кушинга у кошек 382
Кровянистые выделения из влагалища 919
Кровяное давление
гиперкортицизм и 442
гипертензия и
акромегалия у кошек 82
ангиотензин II 827
вызванная глюкокортикоидами 520
натриуретический пептид предсердия 828
при гиперкортицизме у собак 302-303
при гипертиреозе у кошек 178-179
при первичном гиперальдостеронизме 412
при синдроме Кушинга у кошек 388
при феохромоцитоме 477, 483, 484т, 490
реноваскулярная 828
терапия эпоэтином 824
гипотензия
во время удаления феохромоцитомы 490
при гипокортицизме 426р, 455
секреция вазопрессина и 8-9
феохромоцитома и 483-484,484т
Ксилазин
безопасность при беременности 888т
стимулирующая проба 61т, 62-63
Культивирование
аномальной семенной жидкости 1114
жидкости простаты 1090
при азооспермии 1108
при бруцеллезе у собак 1022-1023, 1023т
при кистозной гиперплазии эндометрия 955, 955т при оценке репродуктивности кобеля 1045-1047, 1046т
при пиометре 955, 955т
у бесплодных сук 973
Л
Лактация
агалактия 927
мастит 925-926
после овариогистерэктомии 942
при ложной щенности у сук 897-898
уход за сукой 886, 890
Лапароскопическая стерилизация
кошек 1160
собак 943
Лапаротомия
при дренировании матки 1154
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1195
при закупорке яйцеводов 976
Левамизол 887т
Левотироксин натрия
при гипотиреозе у кошек 157
при гипотиреозе у собак
мониторинг лечения 148-150
начальная терапия 145-148, 146т, 147р
при микседематозной коме 114
при тиреотоксикозе 150
синдром эутиреоидной патологии 138
улучшение сердечной деятельности 113
Лейкемия у кошек 1150
Лейкоцит
влияние глюкокортикоидов 503
гипокортицизм и 431-432,431т, 432т
Лейомиома 688
Лейомиосаркома 1013
Лептин 593-594
Лёгочная тромбоэмболия
при гиперкортицизме у собак 297, 305-309, ЗОбр, 306т, 307р, 309р
при диабетическом кетоацидозе 669
Либидо
нормальное 1104-1115, 1104т
азооспермия и 1105-1109, 1105т, 1106-1107р, 1109р
аномальная семенная жидкость и 1113-1114 астенозооспермия и 1110-1113, 1112р бесплодие при нормальном количестве и качестве сперматозоидов 1114-1115 врожденное бесплодие 1115
сниженное
бесплодие у кобелей и 1099, 1102-1104, ПОЗр
гипотиреоз у собак и 112
нефункционирование клеток Лейдига 1116-1117 Лидокаин
безопасность при беременности 888т
при операции на щитовидной железе у кошек 211
Лизин-8-вазопрессин 43
Лизодрен, см. Митотан
Лимфоидно-фолликулярный вагинит 1015
Лимфома
пениса кобелей 1067
при гиперкальциемии 740-741, 740р
у собак с сахарным диабетом 577
Лимфосаркома
глюкокортикоиды при диагностическом тестировании 520
концентрации кальция и фосфата в сыворотке крови 769т
определение паратиреоидного гормона в сыворотке крови 735р
при гиперкальциемии 740-741, 740р
рентгенография грудной полости 758р
Лимфоциты
влияние глюкокортикоидов 505
при гипокортицизме 432, 432т
Лимфоцитарный тиреоидит
тестирование 133-135
у кошек 155-156
у собак 99-102, 100т, 101т
Лимфоцитарно-плазмацитарный вагинит 1015, 1015р Лимфоцитарный орхит 1082-1084, 1083р, 1084т, 1116 Линкомицин 1097т
Лиотиронин натрия 150-151
Липаза
при гиперкортицизме у собак 293
при диабетическом кетоацидозе 649
при первичном гиперпаратиреозе 757
при сахарном диабете у собак 536
Липемия
гипонатриемия и 438
при гиперкортицизме у собак 292-293, 293р
при диабетическом кетоацидозе 650-651, 651т
Липокортины 506
Липома 494
Лития карбонат
при вызванной эстрогенами деструкции костного мозга 935
тератогенное действие 885т
Лицевой паралич при гиперкортицизме у собак 287
Ложная беременность
кошки 1139-1140, 1139р, 1159
собаки 897-900
Ложный псевдогипопаратиреоз 806
Лоперамид 888т
Лохии 918, 1013
Лютеинизирующий гормон
в анэструсе 852
в диэструсе 848-849
в эструсе 843-845, 846р
действие на сперматогенез и стероидогенез у собак 1048т, 1049т
для стимуляции овуляции 980
изменения во время проэструса 836-837 изменения при заболеваниях семенников 1049т недостаточность функции яичников и 986 оплодотворение и 870
определение при оценке репродуктивности кобелей 1048-1049
предшествующая овариогистерэктомия и 982-984, 984р
при индукции овуляции во время коитуса у кошек 1137
М
Магний
гипомагниемия и
гипокальциемия 802-803, 802т, 806
диабетический кетоацидоз 650 эклампсия 923
уровень при гипопаратиреозе у собак 799т, 802-803 уровень при диабетическом кетоацидозе 650, 659-660
Магнитно-резонансная томография при акромегалии у кошек 83-84, 84р при гиперкортицизме у кошек 403-404, 404р, 404т при гиперкортицизме у собак 338-340, 339р, 341р при феохромоцитоме 482
Магния сульфат 659-660
Магния хлорид 659-660
Мазок Папаниколау 854
Макроаденома 274, 309-311, 310-312р, 312т
Макроскопическая оценка спермы 1038
Макрофаги, влияние глюкокортикоидов 506
Макроцитоз 175
Малабсорбция
при гипертиреозе у кошек 169 при гипокальциемии 808-809
1196
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Маннитол
при отеке мозга 670, 703
при почечной недостаточности при кетоацидозе у собак 667
Мануальная терапия при дистоции у собак 914-915, 916р
Массаж предстательной железы и взятие проб 1092-1093, 1092р
Мастит 925-926
Мастурбация при сборе спермы 1037 Матка
в анэструсе 851-852
в диэструсе 849-850
в эструсе 845
действие катехоламинов 474т
дистоция и 907
изменения во время проэструса 837
кистозная гиперплазия эндометрия 934, 948-964 антипрогестагены 963
встречаемость и анамнез 950-951, 950т долгосрочное лечение 963
индуцированная медикаментозными препаратами 972
клиническая патология 951-952
осложнения на почки 955 патофизиология 948-951 пиометра закрытого типа 962-963 пиометра культи 956-957, 956р пиометра открытого типа 961-962 полиурия и полидипсия 954 простагландины 958-961, 958р, 959т, 960т рентгенография 952, 953р у кошек 1152-1155, 1153т, 1155т ультразвуковое исследование 952, 954р физикальное исследование 951 хирургическое лечение 957-958, 957р цитология влагалища и культивирование 955, 955т
нормальная инволюция у сук 893-895 окклюзия у бесплодных сук 976, 977р после родов 895
при XX синдроме у кобелей 995-996 пролапс
кошки 1148
собаки 1015
Мебендазол 887т
Мегестрола ацетат 943-944, 943т
для контрацепции кошек 1160-1161
при кисте яичника 990
при лактации при ложной беременности 899
при эндокринной алопеции у кошек 73т Меглитиниды 606 Медицинские препараты
влияние на секрецию и действие вазопрессина 5р, 9т влияние на фертильность у собак 1100т
влияние на функцию щитовидной железы у собак 142т
действие у щенных сук 883-889, 887-889т характеристика абсорбции 507-509, 508т
Медленный механизм обратной связи 265
«Медовый месяц» при сахарном диабете 531 Медроксипрогестерон ацетат 945 при гиполютеидизме у кошек 1152
Медуллярная карцинома щитовидной железы гипокальциемия и 810
при множественной эндокринной неоплазии 2А 496 у собак 233, 257-258
Мезенхимальная ткань 737т
Мезенхимальная хондросаркома кости пениса 1067 Мелатонин
влияние катехоламинов 475т
при синдроме подобном врожденной гиперплазии надпочечников 77
Местеролон 1116
Местная анестезия 888т
Метаболиты катехоламинов 485-486,486р
Метаболический ацидоз
при гипокортицизме 424, 459
при диабетическом кетоацидозе 644-645, 645р, 645т
Метанефрин 485, 485т
Метастазы
при инсулиноме 677
при карциноме коры надпочечников 297
при опухоли надпочечника 342-343, 342р, 343р
при раке щитовидной железы 232
лечение 252, 253р
после облучения 249
прогноз 257
при феохромоцитоме 473
Метиленовая ртуть 888т
Метилпреднизолон 511т
период биологической полужизни 507
препарат и дозы 521т
при болезни Аддисона 457
при геморрагическом шоке 514
при нарушениях центральной нервной системы 515
при ятрогенном синдроме Кушинга у кошек 518
суспензия 511
Метилтестостерон 73т
Метирапон
при гиперкортицизме у собак 335, 365-366
при синдроме Кушинга у кошек 407-408
Метод получения влагалищных мазков с помощью
ватного тампона 852-853, 854р
Методы определения
ванилилминдальной кислоты в сыворотке крови 485-486,485т
витамина Д в сыворотке крови 736
ионизированного кальция в сыворотке крови 735-736
натриуретического пептида предсердия в сыворотке крови 828
паратиреоидного гормона в сыворотке крови 734-735, 735р
пептида родственного паратиреоидному гормону в сыворотке крови 736-738, 736р, 737т
первичного гиперпаратиреоза у собак 761р, 762
Методы оценки фертильности у собак 1035р
Метоклопрамид 888т
Метоксифлюран 888т
Метотрексат
безопасность при беременности 887т
при трансмиссивной венерической опухоли 1028
Метрит
выделения из влагалища 894
у кошек 1148
у собак 920
Метронидазол 887т
Метформин 611-612, 612р
Метэстральные клетки 840, 841
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1197
Механизм обратной связи
в продукции эритроцитов при гипоксии 823р
в секреции АКТГ 265
кальций - паратиреоидный гормон 730-731 Миболерон 944-945, 945т
для контрацепции у кошек 1161
при идиопатическом укороченном овариальном
цикле у собак 979
при ложной беременности у собак 899 Мизопростол
безопасность при беременности 888т
для индукции аборта 937-938
Микоз, при гиперкальциемии 747
Микоплазма
аборт у сук и 901т, 904
культивирование 1047
при вагините у сук 1017
при простатите 1089
у бесплодных сук 975
Микроаденома 274
Микробиологическая оценка репродуктивной активности кобелей 1045-1047, 1046т
Микрокапсулирование 583-584
Микрокардия при гипокортицизме 444, 445р Микроскопическая оценка спермы 1038-1043, 1040-1042т
Микседема НО
Микседематозная кома 114
Минерализация при гиперкортицизме у собак 297
Минералокортикоиды 499
дефицит 423-424
избыток 369-371
после удаления опухоли надпочечника 345-347
препарат и дозы 521т
при болезни Аддисона 461-464, 462р, 462т, 463р
физиологическое действие 423-424, 424р, 425р
Миноциклин 1024, 1024т
Миотония при гиперкотицизме у собак 287, 287р
Митрамицин 771т, 772
Мифепристон
при гиперкортицизме у собак 366
при индукции аборта 932
Многоузловой аденоматозный зоб 163, 163р Множественная миелома 741-742
Множественная эндокринная неоплазия 494-497,496т
гастринома и 713
злокачественная опухоль щитовидной железы у собак и 234-235, 234т
при первичном гиперпаратиреозе у собак 783 Множественные аутоиммунные расстройства 421-422 Модифицированная проба с лишением жидкости 24-39 определение вазопрессина в плазме крови 37-38, 38р, 39р
осложнения 33-36, ЗЗр, 34р, 35т
ответ 29-32, 29-32р
ошибочный диагноз 36-37, 36р, 37т
противопоказания 24
протокол 25-29, 26т, 26р, 27т
терминология 24-25
у дегидратированных собак 38
Модифицированная проба Торна 432
Мозаик 994
Мозг
ангиотензин II 826
влияние глюкокортикоидов 503
опухоль мозга как причина несахарного диабета 18,19р отек при лечении диабетического кетоацидоза 670 повреждение при гипогликемии 682
Молочные железы
гиперплазия у кошек 1149
действие пептида родственного паратиреоидному
гормону 737т
диэструс и 851
застой молока 926-927
изменения в проэструсе 837
мастит 925-926
физикальное исследование 968
Мониторинг
жидкостной терапии у собак при кетоацидозе 656-
658
матки 912-914, 912р
плодов 912-914, 912р
после тиреоидэктомии кошек 219
после удаления опухоли щитовидной железы у собак 251-252
при заместительной терапии тиреоидными
гормонами 146т, 148-150
при лечении кошек метимазолом 207, 207т
при лечении простагландином пиометры закрытого
типа 962-963
при митотановой терапии 352-353
при терапии дезоксикортикостерона пивалатом 463-464
сахарного диабета у кошек 614-620
анамнез и физикальное исследование 614-615
гликемическая кривая 617-620, 618р, 619р
концентрация гликозилированного гемоглобина в сыворотке крови 616-617, 617т
концентрация фруктозамина в сыворотке крови
615-616, 615р, 620
Мониторинг сердечной деятельности при введении
кальция 923-924
Моноаминоксидаза 476
Монорхизм 1070
Моноциты, влияние глюкокортикоидов 506
Морфология сперматозоидов собак 1039-1043, 1041-
1043р, 1041т
Мотилин 711т
Моча
водный баланс и 2-3
образование 4-6, 7р
подтекание у кобелей 1064-1065
Мочевой пузырь
действие катехоламинов 474т
действие пептида родственного паратиреоидному
гормону 737т
первичный гиперпаратиреоз у собак и 749-750, 749т,
750р
разрыв 436
Мочевые камни 304
Мочекаменная болезнь
при гиперкальциемии у кошек 784
при гиперкортицизме у собак 304
при первичном гиперпаратиреозе 732, 750, 750т
Мочеполовая пазуха 1000
Мочеточниковый катетер для искусственного
осеменения 1122-1123, 1122р
Мошонка
кобели
биопсия семенников 1057
1198
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
взаимосвязь с объемом семенной жидкости 1044 грыжа 1053т
набухание при остром орхиэпидидимите 1080
нарушения 1086, 1086р
пахово-мошоночная грыжа 1085
физикальное исследование 1033
коты 1162
Мужской псевдогермафродитизм 993-994, 997
Мукометра 949
Мышечная слабость
во время митотановой терапии 352
при гиперкортицизме у собак 280-281, 282р, 289
при гипертиреозе у кошек 170, 173
при гипогликемии 682
при гипокальциемии 804
при гипопаратиреозе 804
при диабетическом гиперосмолярном некетоновом
синдроме 673
при диабетическом кетоацидозе 382
при первичном гиперальдостеронизме 413
при первичном гиперпаратиреозе 750-751
при синдроме Кушинга у кошек 382
при феохромоцитоме 477т
Мышечное истощение
при гипертиреозе у кошек 170
при первичном гиперпаратиреозе 750-751
Мышца
действие катехоламинов 474т
судороги при гипопаратиреозе у собак 796
Н
Надпочечники 262-371
биосинтез стероидов 266-268, 266р, 266т, 267р
болезнь Аддисона и
азот мочевины в крови, креатинин и анализ мочи 439-440
анамнез 429-430
ацидоз 459, 459р
встречаемость 428-429, 429т
вторичная 466
гиперкальциемия 440-442, 441т, 744-745
гиповолемия и гипотензия 455-457, 456р
гипогликемия 440, 441т, 683
гипонатриемия и гиперкалиемия 432-440, 433т,
434т, 434р, 43 5р
глюкокортикоидная терапия 465-466
глюкокортикоиды 517-518
долгосрочное лечение 461-465, 462-463р, 462т
заместительная солевая терапия 466
исторические сведения 418-419
кислотно-щелочной статус 442
концентрация альдостерона в сыворотке крови
450-452, 451р
концентрация кортизола в сыворотке крови 447-
450, 448т, 449р, 450р
концентрация эндогенного АКТГ в сыворотке
крови 452-454, 453р
кровяное давление 442
нарушение электролитного баланса 457-459
ответ на лечение 459-460
параметры лейкоцитов 431, 431т
параметры эритроцитов 431
патофизиология 423-428, 425р, 426р
полидипсия и полиурия 11-12, 13-14
прогноз 466
рентгенография 444, 445р
сопутствующие заболевания 460-461 тестирование функции печени 442-443, 443т у кошек 435-438, 435т, 436т, 466-469, 467р, 468р физикальное исследование 430-431,431т электрокардиография 444-447, 446р этиология 419-423,420р, 420т
гиперкортицизм у кошек акромегалия и 86-87 биопсия под контролем ультразвука 402 биохимический анализ крови 384-388, 385т встречаемость 378, 379т
гипофизэктомия 404-406
двусторонняя адреналэктомия 408-410 загибание кончиков ушей 382
клинический анализ крови 384, 384т кожные нарушения 382-383, 383р компьютерная и магнитно-резонансная томография 403-404, 404р, 404т
концентрация эндогенного АКТГ в сыворотке крови 399-401
лечение опухоли надпочечников 410-411 облучение гипофиза 406
основные жалобы владельцев 379, 379т отношение кортизол:креатинин в моче 388-390, 390т, 391т
полиурия и полидипсия 381-382
потеря веса 382
проба с низкими дозами дексаметазона 393-396 проба с подавлением высокими дозами дексаметазона 397-399, 397т, 399т
проба со стимуляцией АКТГ 390-393 продолжительность клинических проявлений 378, 379т
рентгенография брюшной полости 401 слабость, сонливость, отвислый живот, кровоподтеки 382
терапия 407-408
ультразвуковое исследование брюшной полости 401-402, 402т
физикальное исследование 380-382, 380т, 381р этиология 377-378
гиперкортицизм у собак 263-374
азот мочевины в крови 291
аланинаминотрансфераза 292
амилаза и липаза 293 анализ мочи 294-295 атрофия семенников 286-287, 288 биопсия печени 328-329
бромокриптин 365
гепатомегалия 287-288
гипертензия 302-303
глюкоза и инсулин, концентрация в сыворотке крови 290
L-депренил 366
дифференциальная диагностика 312-313, 312т желчные кислоты 293
застойная сердечная недостаточность 304 кетоконазол 362-364, 362т, ЗбЗр
клинический анализ крови 289-290 кожные маркеры 281-284, 282-284р компьютерная томография 335-338, 336-338р концентрация 17-гидроксипрогестерона в плазме крови 326-328, 328т
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1199
концентрация кортизола в плазме крови 315 концентрация эндогенного АКТГ 330-332 легочная тромбоэмболия 305-309, ЗОбр, 306т, 307р, 309р
лечение митотаном 349-362, 350т, 352р, см.
также Терапия митотаном
лицевой паралич 287
магнитно-резонансная томография 338-340, 339р, 341р
макроопухоли гипофиза 310-312, 31 Ор, ЗПр, 311т метирапон и аминоглютетимид 365-366 миотония 287, 287р
мочевые камни 304
мышечная слабость, сонливость, хромота 280-
281
облучение гипофиза 367-368
ожирение 285
отношение кортизолжреатинин в моче 315-318, 334
отсутствие эструса 286-287
оценка оси гипофиз-кора надпочечников 313, 314р
панкреатит 304
патология 274-275
патофизиология 268-274, 269р, 270р
пиелонефрит 303-304
полиурия и полидипсия 279
полифагия 279
проба с дексаметазоном 322-326, 323р
проба с кортикотропин рилизинг-гормоном и вазопрессином 335
проба с метирапоном 335
проба с подавлением высокими дозами дексаметазона 332-333, 332-334р
проба с подавлением низкими дозами дексаметазона 329-330, 329р
проба со стимуляцией АКТГ 318-321, 319р, 320р
радиоизотопное сканирование 340
регуляция секреции глюкокортикоидов 263-268, ЗОбр, 306т, 307р, 309р
рентгенография 295-297,296р, 297р
респираторные признаки 284-287
RU486 365
сахарный диабет 305
спонтанная ремиссия 369
тестирование функциии щитовидной железы 295, 295р
трилостан 364-365
увеличение живота 279-280, 281 р
ультразвуковое исследование брюшной полости
298-302, 299т, 301р, 302р
физикальное исследование 287, 287т
фосфат, концентрация в сыворотке крови 293
функционально-активные опухоли 359 хирургическое лечение 342-349, 344р холестерин, триглицериды и липемия 292, 292р ципрогептадин 365
чувствительность и специфичность скрининговых тестов 315, 316т щелочная фосфатаза, активность в сыворотке крови 291-292, 292р
электролиты в сыворотке крови 293
этомидат 366
глюкокортикоидная терапия 499-522
влияние на эндокринную функцию 503-504, 503т
всасывание лекарственных препаратов 507-508,508т действие на ткани 502-503
дозы, подавляющие секрецию АКТГ 422 источники 508
комбинированные препараты 512
концентрация тиреоидного гормона в сыворотке крови и 142
молекулярные механизмы 500-502, 501р
новые стероиды 512
первичный гиперпаратиреоз и 767
пероральные препараты 508, 509
побочные эффекты 515-520
показания к терапии 512-515, 513т
после удаления опухоли надпочечников 409 препараты для инъекций 508, 510-512, 511т препараты и дозы 520-522, 521т
при болезни Ад дисона 457-458
при гиперкальциемии 771т
при диабетическом кетоацидозе 668
при индуцированном аборте 941
при лимфоцитарном орхите у собак 1082-1083
при опухоли бета-клеток 697т
при хронической гипогликемии 703-704 продолжительность действия 507-508 промежуточный обмен 502
противовоспалительные свойства 504-507
радиоизотопное сканирование 340-341
случайно обнаруженные опухоли надпочечников 492-494,492р, 493т
узловая гиперплазия 273
феохромоцитома 473-497
встречаемость 476,476р, 476т
гормональные тесты 485-487, 485т, 486р клиническая патология 479-480, 479р клинические проявления 476-478, 477т, 478т компьютерная и магнитно-резонансная томография 482, 483р
медикаментозное лечение 491-492
определение артериального кровяного давления 483-484, 484т
патофизиология 473-476, 474т, 474р, 475т
постановка диагноза 487
прогноз 492
рентгенография брюшной и грудной полостей 481-482
сцинтиография 482-483
ультразвуковое исследование брюшной полости 480-481, 481р, 482р
физикальное исследование 478, 478т хирургическое лечение 487-491, 489р, 490т этиология 472-473
Надпочечники, гиперплазия 178
Надпочечники, недостаточность 418-469
анализ мочи 439-440
анамнез 429-430
встречаемость 428-429, 429т
гиперкальциемия 440-442, 441т, 744-745
гипогликемия 440,441т, 688
гипонатриемия и гиперкалиемия 432-440, 433т, 434т, 434р, 435р
глюкокортикоиды 517-518
исторические сведения 418-419
кислотно-щелочной статус 442
концентрация азота мочевины и креатинина в сыворотке крови 439
1200
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
концентрация альдостерона в сыворотке крови 450-452, 451р
концентрация кортизола в сыворотке крови 447-450, 448т, 449р, 450р
кровяное давление 442
лечение 454-466,455т
ацидоза 459, 459р
вторичного гипокортицизма 466
гиповолемии и гипотензии 455-457,456р глюкокортикоиды 457, 465-466 заместительная солевая терапия 466
нарушения электролитного баланса 457-459 ответ на лечение 459-460
продолжительное 431-434, 431т, 432р, 433р
сопутствующих болезней 460-461
параметры лейкоцитов 431, 431т
параметры эритроцитов 431
патофизиология 423-428, 425р, 426р
полидипсия и полиурия 13-14
прогноз 466
рентгенография 444, 445р
у кошек 466-469, 467р, 468р
физикальное исследование 430-431, 431т
функция печени, тестирование 442-443, 443т
электрокардиография 444-447, 446р
эндогенный АКТГ в плазме крови 452-454, 453р
этиология 419-423,420р
Надпочечники, тестирование функции
при акромегалии у кошек 86
при гипофизарной карликовости 64
при дерматозе, чувствительном к гормону роста 70 Налидиксовая кислота 1097т
Налоксон 888т
Наполнитель снятого молока 1125т
Наполнитель цитрат-декстроза-яичный желток 1125т
Наполнитель цитрат-яичный желток 1125т
Нарушение эрекции 1063-1064
Нарушения зрения у кошек с гипертиреозом 174
Нарушения полового развития
кошки 1158
собаки
аномалии гонадного пола 994-996, 995р, 996р аномалии фенотипического пола 996-997
аномалии хромосомного пола 993-994, 992т, 993р
Нарушения продукции и секреции гормона роста 51-94 акромегалия у кошек 78-89
диагностика 86-87
диагностическая визуализация 83-84, 83р, 83т клиническая патология 82-83
клинические признаки 80-82, 80т, 81р, 82р
лечение 87-89, 87р
патофизиология 80
породы 80
прогноз 89
эндокринологическая оценка 84-86
этиология 78-79, 78р, 79р
акромегалия у собак 89-91
врожденная недостаточность гормона роста 55-67 гистопатология кожи 60-61, 61т дифференциальная диагностика 64, 65т, 66р клиническая патология 60
клинические признаки 59-60, 59р, 59т, 60р лечение 65-67
патофизиология 58
породы 58-59
эндокринологическая оценка 61-64, 61-63т, 62р этиология 55-58, 56р, 57р
приобретенная недостаточность гормона роста 67-68 чувствительный к гормону роста дерматоз взрослых животных 68-77
алопеция 70-72, 71т
гистопатология кожи 70
клиническая патология 69
клинические признаки 68-69, 69р
лечение 77, 76р, 77р
породы 68
прогноз 77
сходные заболевания 72-77, 73т, 74р, 75т
эндокринологическая оценка 70
этиология и патофизиология 68
Нарушения, противодействующие инсулину 532
Нарушения репродуктивной активности у сук 965-998
анамнез 967-968
аномалии половых желез 994-996, 996р
аномалии фенотипического пола 996-997 аномальное половое поведение 992-993 аномальный хромосомный пол 993-994, 995 анэструс, индуцированный медикаментозными средствами 984-985
аутоиммунный оофорит 980
Brucella canis 973
гипотиреоз 985
заболевание матки 979
идиопатическое сокращение овариального цикла
977-979, 978р
идиопатическое увеличение межэстрального интервала 980-981
избыток глюкокортикоидов 997
индукция эструса 986-988, 988т
инфекция 973-975, 974р
киста яичника, секретирующая прогестерон 986
недостаточность функции желтого тела 976
неоплазия яичников 981
нормальное половое развитие 992-993, 992т, 993р общее состояние здоровья 969-970
окклюзия матки или яйцеводов 976, 977р
опухоль яичника 991
отказ от вязки 997-998, 998р
оценка кобеля 965-966
первичные подходы 970-973, 971р
предшествующая овариогистерэкгомия 982,984,984р преждевременное угасание яичников 985-986 проведение вязок владельцем 969
раннее рассасывание плодов 975
расщепленная течка 979
синдром культи яичника 991-992
скрытая течка 984
стойкий проэструс 988-990, 990р
стресс 985
физикальное исследование 966-969, 968т, 969р
фолликулярные кисты 979, 982р
хирургическая диагностика 986
хронический эндометрит 975
ятрогенное сокращение межэстрального интервала 980
Наследственный неонатальный первичный
гиперпаратиреоз 748-749, 783
Наследственный центральный несахарный диабет 19 Натриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) 771т
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1201
Натрий
водный баланс и 2
гипернатриемия
гиподипсическая 48-49
лечение диабетического кетоацидоза и 670-671 после модифицированного теста с лишением жидкости 33-36, 35т
при центральном несахарном диабете 23
причины 35, 35т
гипонатриемия
дифференциальная диагностика 435р, 437, 437т
полидипсия и полиурия Ют, 21-22
при гипокортицизме 432-433
при диабетическом кетоацидозе 645-646
при избытке антидиуретического гормона 47-48 при недостаточности функции коры надпочечников 423-424
при центральном несахарном диабете 23
задержка в организме
при глюкокортикоидной терапии 520
при первичном гиперальдостеронизме 412
концентрация в сыворотке крови
при болезни Аддисона 433, 433т
при вторичном гипокортицизме 434т
при гипертиреозе у кошек 178
при диабетическом кетоацидозе 645-646, 646р
при синдроме Кушинга у кошек 385т, 386
реабсорбция в почках 6
роль баланса ангиотензина II 827
стимуляция жажды и секреции вазопрессина 7
Натрийжалий отношение 434т
Натриурез и натриуретический пептид предсердия 828 Натриуретический пептид предсердия 475т, 828-829 Натрия бикарбонат
при болезни Аддисона 459
при гиперкальциемии 747, 771т
Натрия хлорид
заместительная терапия при гипонатриемии 466 ограничение при центральном несахарном диабете 45, 45т
Неадекватная лютеальная фаза и отсутствие
беременности у кошек 1151-1152
Не-бета-клеточная опухоль 688-689, 688т
Неврологические признаки
при акромегалии у кошек 82
при гиперкортицизме у собак 310, 311р, 311т
при гипопаратиреозе у собак 796
при гипотиреозе у собак 111
при феохромоцитоме 479
при центральном несахарном диабете 22
Невропатия
диабетическая
кошки 630-631, 631р
собаки 580-581
при акромегалии у кошек 82
при инсулин-секретирующей опухоли 684
Недостаточность гипофизарного
адренокортикотропного гормона 436
Недостаточность глюкозо-6-фосфатазы 686
Недостаточность гормона роста
врожденная 55
гистопатология кожи 60, 61т
дифференциальная диагностика 64, 65т, 66р
клиническая патология 60
клинические признаки 59-60, 59т, 59р, 60р
лечение 65-67
патофизиология 58
породы 58-59
эндокринологическая оценка 61-63, 61-63т, 62-63р
этиология 55-58, 56р, 57р
приобретенная 67-68
Недостаточность желтого тела
кошки 1151-1152
собаки 976
спонтанный аборт и рассасывание плодов 902-903 Недостаточность экзокринной поджелудочной железы основы диеты 546, 547т при диабете у собак 571
Незапланированная вязка
у кошек 1161
у собак 941-942
Незрелая вульва 1000
Неинфекционный мастит 926
Нейрогипофиз 3
Нейрома слизистой 497
Нейропептид Y 711т
Нейросекреторный материал 4
Нейротензин 711т
Нейрофизины 4
Нейтрализующие антитела к рекомбинантному эритропоэтину 824
Нейтрофилия 951
Нейтрофилы, действие глюкокортикоидов 505
Некетоновый гиперосмолярный сахарный диабет 672-674
Неонатальная гипогликемия 689-690
Неонатальная септицемия 747
Неоплазия
бета-клеток 677-707, 713
анамнез 683-684
встречаемость 683-683т
гипогликемия и контррегуляторный ответ 678-680, 679т
гипогликемия, индуцированная инсулином 681 диагностика гипогликемии 691-695, 692р диагностическая визуализация 695-696, 696р дифференциальная диагностика гипогликемии натощак 685-691, 686т, 687р, 688т клиническая патология 678, 684-685 клинические признаки 681-682, 681т, 682р, 682т медикаментозное лечение острого гипогликемического криза 702-703, 703р
медикаментозное лечение хронической гипогликемии 703-705, 705р
определение инсулина в сыворотке крови 693-695, 694р
прогноз 706-707
секреция инсулина 680
у кошек 707-708
физикальное исследование 684, 684т хирургическое лечение 697-702, 697т, 698р, 701т этиология 671
эугликемия и 678, 678р
влагалище 1013-1014
глюкокортикоиды, лечение 514
опухоль щитовидной железы у кошек 161 -224
азот мочевины и креатинин в крови 176-177 активность ферментов печени 175-176 алопеция 169
1202
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
анализ мочи 175
атенолол 223
базальный уровень общего тироксина в плазме
крови 184-187, 184-186р,
базальный уровень общего трийодтиронина в
плазме крови 187
базальный уровень свободного тироксина в
плазме крови 187-188,188р
встречаемость 165, 165р
глюкоза в крови 176
глюкокортикоидная терапия 224
дифференциальная диагностика 183, 183т
йодид 223
йодированные контрастные агенты для
рентгенографии 223
карбимазол 210
клинический анализ крови 174-175, 174т
кровяное давление и гипертензия 178-179
непереносимость тепла и стресса 170
нервозность, гиперактивность, агрессивное
поведение и тремор 168
патология 162-164, 163р
полидипсия и полиурия 168
понос и рвота 158-159
потеря веса и полифагия 166-168, 167р
проба с подавлением трийодтиронином 188-192, 189т, 190р, 191р
проба со стимуляцией тиреотропин рилизинг -
гормоном 192-193
проба со стимуляцией тиреотропином 190-192
прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р
рентгенография 179, 180р
респираторные нарушения 169
сканирование щитовидной железы 193-199, 194-
199р
слабость и сонливость 170
снижение аппетита 169
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210, 205р, 207т, 208р
тиамин 224
у собак в сравнении 228, 229т
ультразвуковое исследование шейной области
199-201, 200р
уровень кортизола в сыворотке крови 178
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного
гормона в сыворотке крови 177
уровни натрия и калия 178
уровни общего белка и альбумина в сыворотке
крови 177
физикальное исследование 170-174, 171р, 171т фруктозамин, концентрация в сыворотке крови 178
функция почек 201-204
хирургическое лечение 210-216, 212р, 21 Зр, 214т чрескожная термокоагуляция опухоли 221-222, 221р
чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182,179т, 181р, 182р этиология 164
эхокардиография 182-183, 183р
опухоль щитовидной железы у собак 228-258
биопсия щитовидной железы 246-247 встречаемость 234, 235, 235т гипертиреоз и 253-257, 255р гистология 232-234, 233т дифференциальная диагностика 247 доброкачественная 232 иммуногистохимия 233-234 классификация 219-230 клинические признаки 235-236 лечение 247-252, 248р, 253р медуллярный рак 257-258 оценка в клинике 237 патогенез 230-231,231р патология 231 прогноз 252-253 рентгенография 238
синдромы множественной эндокринной неоплазии 234-235, 234т
сканирование щитовидной железы 240-244, 241 -246р
тестирование щитовидной железы 244-246, 246р у кошек в сравнении 228, 229т
ультразвуковое исследование 238-239, 239р, 240р физикальное исследование 236-237 частота заболевания 234
эктопическая 258
электрокардиография и эхокардиография 238 пенис 1067
уретра 1014
Неопущение семенника 1068-1071, 1069р, 1069т Непереносимость тепла 170
Непроходимость мочеиспускательного канала гиперкалиемия и 436 гипокальциемия и 809 при парафимозе 1061-1062
Нервномышечные признаки
при гипокальциемии 793-794
при гипотиреозе у собак 111
Нервозность
при гипертиреозе у кошек 168
при гипопаратиреозе у собак 795
при эклампсии 923
Несахарный диабет 2-50
диагностическая проба с десмопрессином 40 дифференциальная диагностика от синдрома Кушинга у собак 312т инфузия водного раствора 41,41р клинические признаки 21-24,21р, 23р модифицированная проба с лишением жидкости 24-39 дегидратация собак 38 определение вазопрессина в плазме крови 37-38, 38р, 39р
осложнения33-36, ЗЗр, 34р, 35т ответ 29-32, 29-32р ошибочный диагноз 36-37, 36р, 37т противопоказания 24 протокол 25-29, 26р, 26т, 27т терминология 24-25
отношение осмоляльности в моче и плазме 41 полидипсия и полиурия 9т
дифференциальная диагностика 10-14, 10т, 14т методы диагностики 14-17, 15т, 16р
прогноз 46-47 рандомизированное определение осмоляльности плазмы крови 39-40,40р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1203
физиология водного обмена 2-10
биосинтез, транспорт и метаболизм вазопрессина 3-4, 4р
действие вазопрессина 4-6, 5р, 7р
клинические эффекты вазопрессина 6-7, 6т
объем крови 8-9, 9т
питьевой центр 7
регуляция жажды и секреции вазопрессина 7-8
удовлетворение жажды 9
этиология 17-20,17р, 18т, 19р
Неспособность достичь эрекции 1063
Нестероидные противовоспалительные средства 143
Нефрогенный несахарный диабет 19-20 гиперкальциемия 731
инфузия солевых растворов 41,41р модифицированная проба с лишением жидкости 24-39
дегидратированные собаки и 38 определение вазопрессина в плазме крови 37-38, 38р, 39р
осложнения 33-36, ЗЗр, 34р, 35т
ответ 29-32, 29-32р
ошибочный диагноз 36-37, 36р, 37т
противопоказания 24
протокол 25-29, 26т, 26р, 27т
терминология 24-25
определение осмоляльности в рандомизированных пробах плазмы крови 39-40, 40р
отношение осмоляльности в моче и плазме 41
при пиометре 952
Нефрокальциноз 732, 784
Нефрон, действие вазопрессина 6-7, 7р
Ниацин 578
Низкий рост при гипофизарной карликовости 59-60
Низорал, см. Кетоконазол
Нимфомания у здоровых кошек 1159
Ново-Зеландский эндоскопический метод искусственного осеменения 866-869, 867р, 868р
Новые стероиды 512
Новый метиленовый синий 854
Норадреналин
концентрация в плазме крови 485т
метаболизм 486р
при феохромоцитоме 473-476
Нормальная флора в мочеиспускательном канале кобелей 1045-1047, 1046т
влагалища 973-974, 974р, 1016-1017, 1017т
Норметанефрин 485, 485т
Норфлоксацин 1097т
НПП, см. Натриуретический пептид предсердия
НПХ - инсулин (нейтральный протамин Хагедорна) короткого действия 567-568, 567р при сахарном диабете у кошек 601 пролонгированного действия 568
О
Облучение гипофиза
при гиперкортицизме у кошек 406
при гиперкортицизме у собак 367-368
Обогатитель молока с низким содержанием жира 1125т
Обогатитель сливки-яичный желток 1125т
Оборудование
для искусственного осеменения 866-867, 867р
для сбора спермы у кобелей 863, 863р
Образцы венозной крови 762
Обследование прямой кишки
у бесплодных сук 968
у собак при гиперкальциемии 741
Обследование сук в середине беременности 890
Обструкция плода 907
Общее содержание воды в организме 2, ЗЗр
Общее содержания магния в организме 650
Общий белок в сыворотке крови
при гипертиреозе у кошек 177
при гипокортицизме 433т
при синдроме Кушинга у кошек 385т, 386
Общий кальций в сыворотке крови 729т
после химического разрушения паращитовидной
опухоли 775, 776р
при гипокальциемии 793
при гипопаратиреозе у собак 799-800, 800р
при первичном гиперпаратиреозе 753-755, 753т
Общий тироксин в сыворотке крови
при беременности у собак 897
при гипертиреозе у кошек 184-188, 184-186р
Общий билирубин в сыворотке крови при
диабетическом кетоацидозе 649
Общий тироксин у кошек в сыворотке крови 122-124, 122р, 124т, 125т
Общий трийодтиронин в сыворотке крови 125-126, 125т
Общий трийодтиронин в сыворотке крови 187
Объем внеклеточной жидкости 8
Объем крови и секреция вазопрессина 8-9
Объем форменных элементов крови, терапия эпоэтином 823-824
Овариальный цикл
кошки
анэструс 1137
диэструс 1136-1137
затяжной интерэструс 1159
индукция овуляции 1138
интерэструс 1136
отсутствие овариальных циклов 1158-1159
полиэструс 1134
половое созревание 1130-1131
предотвращение овариальных циклов 1160-1161
проэструс 1131-1133
сезонность 1131
цитология влагалища 1132-1133, 1132т, 1135-
1136, 1137
эструс и фолликулярная фаза 1133
суки 832-852
анэструс 851-852
диэструс 848-851, 850р
идиопатически укороченные циклы 977-979
интервалы между циклами 833
классификация клеток влагалища 839-843, 838-
841р
отсутствие овуляции 980
отсутствие при гиперкортицизме 286
первичный и вторичный анэструс 981-985, 982р,
983р
половое созревание 832
предотвращение 942-946, 943т, 945р, 945т
проэструс 833-839, 834р, 835р
сезонность 832
цитология влагалища 839-842, 842р, 843р, 852-
853р, 856-857р
1204
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
эструс 843-848, 843р, 846р
Овариогистер эктомия
кошки 1154
суки
в целях стерилизации 942-943 отсутствие циклов и 982-984, 984р после незапланированной вязки 932 последующие выделения из вульвы 1013 появление стриктуры во влагалище 1003 при диабете 928
при задержке плаценты 922
при кисте яичника 990
при ложной беременности 900
при пиометре 957
при пиометре культи 956р, 957
при пролапсе влагалища 1007
Овуляция
кошки 1138-1139, 1138р
собаки
концентрация прогестерона в сыворотке крови 972
отсутствие 870-871, 980
эструс и 845
Одиночная опухоль паращитовидной железы 781-783
Односторонняя адреналэктомия 410-411
Ожирение
влияние на тестирование щитовидной железы у собак 141
гликемический контроль у собак и 545-546
после овариогистерэктомии 943
при гиперкортицизме у собак 284
при гипотиреозе у кошек 153
резистентность к инсулину и 573, 589
у кошек с диабетом 603-604
Окись азота 888т
Окклюзия
мочеиспускательного канала гиперкалиемия и 436 гипокальциемия и 809 матки 976, 977р
при парафимозе 1061
плодов 909
Окрашивание
при цитологии влагалища 853-854
спермы кобелей 1039-1040
Окружающая среда
влияние температуры на функцию щитовидной
железы у собак 141
гипертиреоз у кошек и 164-165
половое поведение у собак и 862
при сборе семенной жидкости у собак 863
Оксацилин
при мастите 926
при послеродовом эндометрите 920
Окситетрациклин
при бруцеллезе у собак 1023, 1024т
фармакологическая характеристика 1097т
Окситоцин
влияние катехоламинов 475т
для предупреждения послеродового кровотечения у кошек 1147
для усиления сокращений матки 915-917
инъекции после родов 920
при дистоции у кошек 1146
при задержке плаценты 921
химическая структура 4,4р
Октреотид
при акромегалии 88
при избыточной секреции желудочной кислоты 720
при карциноидах 724
при синдроме Вернера-Моррисона 722
при хронической гипогликемии 704, 705
Олеандомицин 1097т
Олигоспермия
нормальное либидо и 1109
при гипоплазии семенников у собак 1071
при лимфоцитарном орхите у собак 1082-1083
Олигурия
при болезни Аддисона 439
при диабетическом кетоацидозе 666-667
Омепрол
безопасность при беременности 889т
при избыточной секреции желудочной кислоты 719-720
Онкоген 231, 231р
Опиаты 888т
Оплодотворение
кошки 1142
собаки 869-870, 870р
Определение ванилилминдальной кислоты 485-486, 485т
Определение начала родов по ректальной температуре 910
Опухолевый маркер 737т
Опухоль
влагалища 1013-1014, 1013р, 1014т
гастринома 713-720
встречаемость 714
диагностическая визуализация 715
клиническая патология 715
клинические признаки 714, 714т
концентрация гастрина в сыворотке крови 716 медикаментозное лечение 719-720
проба со стимуляцией гастрина 716
проба со стимуляцией секретином 717
провокационная проба с кальцием 717-718, 717р тестирование секреторной активности желудка 718
физикальное исследование 714-715 хирургическое удаление 718-719, 719т эндоскопия 715, 715р
гипофиза
АКТГ-секретирующая 376
вторичный гипопаратиреоз и 105
множественная эндокринная неоплазия 1 и 495-496
при акромегалии у собак 89
инсулин-секретирующая 677-707, 713
анамнез 683-684
встречаемость 683, 683т
гипогликемия и контррегуляторные гормоны 678-680, 679т
диагностика гипогликемии 691-695, 692р диагностическая визуализация 695-696, 696р дифференциальная диагностика от гипогликемии натощак 685-691, 686-688т
индуцированная инсулином гипогликемия 681 клиническая патология 670, 684-685
клинические признаки 681-682, 681р, 682р, 682т медикаментозное лечение острого гипогликемического криза 702-703, 703р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1205
медикаментозное лечение хронической гипогликемии 703-705, 705р
определение инсулина в сыворотке крови 693-695, 694р
прогноз 706-707
секреция инсулина 680
у кошек 707, 708
физикальное исследование 684, 684т
хирургическое лечение 697-702, 697т, 698р, 701т этиология 677
эугликемия и 678, 678р
карциноид 723-724, 724т
клеток промежуточной доли гипофиза 269-271 костная
при гиперкальциемии 742, 747
при гипокальциемии 610
надпочечников 492-494,492р, 493т
паращитовидной железы
послеоперационное лечение 778-781
удаление 773
при первичном гиперпаратиреозе 752 ультразвуковое исследование 759-761, 759р, 760р уход после лечения 781
при акромегалии у кошек 78, 78р
при гиперкортицизме у кошек 397т, 398т, 404-410 гипофизэктомия 404-405
двусторонняя адреналэктомия 408-410 медикаментозное лечение 407-408 облучение гипофиза 406-407
определение концентрации эндогенного АКТГ в сыворотке крови 399-401
проба с подавлением высокими дозами дексаметазона 396-399, 397т, 398т трансфеноидальная криотерапия 88
при гиперкортицизме у собак
встречаемость 276, 276р, 276т, 277р гипофизэктомия 348-349
компьютерная томография 335-338, 336-338р концентрация 17-гидроксипрогестерона в сыворотке крови 326-328, 328т
концентрация эндогенного АКТГ в сыворотке крови 330-332
магнитно-резонансная томография 338-340, 339р, 341р
нарушения центральной нервной системы 309-311,310-311р
облучение 367-368
опухоль надпочечника 272-273
отношение кортизолжреатинин в моче 334 патология 274-275
патофизиология 268-274, 269р, 270р
проба с кортикотропин рилизинг-гормоном и вазопрессином 335
проба с метирапоном 335
проба с низкими дозами дексаметазона 322-324, 329-330, 329р
проба с подавлением высокими дозами дексаметазона 332-333, 332-334р
проба со стимуляцией АКТГ 319-320 радиоизотопное сканирование 340 терапия митотаном 349-362, 350т, 352р, 354р, 356р
ультразвуковое исследование брюшной полости 299
хирургическое лечение 348-349
продуцирующая панкреатический полипептид 723 семенников 1072-1075, 1072-1074р, 1073т трансмиссивная венерическая 1025-1028, 1026-1027р
влагалища 856, 856р
пениса 1033, 1067
трансфеноидальное селективное удаление 89
уретральная 1014
феохромоцитома 473-497
встречаемость 476,476р, 476т
гормональные тесты 485-487,485т, 486р диагностика 487
измерение артериального кровяного давления 483-484, 484т
клиническая патология 479-480,479р клинические признаки 476-478, 477т, 478т компьютерная и магнитно-резонансная томография 482, 483р
медикаментозное лечение 491
опухоль коры надпочечников и 274 патофизиология 473-476, 474р, 474т, 475т при множественной эндокринной неоплазии 2А 496-497
прогноз 492
рентгенография брюшной и грудной полостей
481-482
сцинтиография 482-484
у собак с диабетом 577
ультразвуковое исследование брюшной полости 480-481,481р, 482р
физикальное исследование 478-479,478т хирургическое удаление 487-491,489р, 490т этиология 472-473
щитовидной железы 163, 219-232, 240, 242, 252-254
щитовидной железы у собак 228-258
биопсия щитовидной железы 246-247
встречаемость 234-235, 235т
гипертиреоз и 253-257, 255р
гипотиреоз и 104
гистология 232-234, 233т
дифференциальная диагностика 247
доброкачественная 232
иммуногистохимия 233-234
классификация 229-230
клинические признаки 235-236, 236т
лечение 247-252, 248р, 253р
медуллярный рак 257-258
обследование в клинике 237
патогенез 230-231, 231р
патология 231
прогноз 252-253
рентгенография 238
синдромы множественной эндокринной
неоплазии и 234-235,234т
сканирование щитовидной железы 240-244, 241 -246р
тестирование функции щитовидной железы 244-246,246р
у кошек 228, 229т
ультразвуковое исследование 238-239, 239р, 240р физикальное исследование 236-237
частота 234
эктопическая 258
электрокардиография и эхокардиография 236
яичников 991
1206
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Опухоль бета-клеток 677-708
анамнез 683-684
встречаемость 683, 683т
гипогликемия и контррегуляторный ответ 678-680, 679т
гипогликемия, индуцированная инсулином 681 диагностика гипогликемии 691-695, 692р диагностическая визуализация 695-695, 696р дифференциальная диагностика гипогликемии натощак 685-691, 686т, 687р, 688т
клиническая патология 670, 684-685
клинические признаки 681-682, 681т, 682р, 682т медикаментозная терапия острого
гипогликемического криза 701т, 702-703, 703р медикаментозная терапия хронической гипогликемии 703-705, 705р
определение инсулина в сыворотке крови 693-695, 694р
прогноз 706-707
секреция инсулина 680
у кошек 707-708
физикальное исследование 684, 684т
хирургическое лечение 697-702, 697т, 698р, 701т
этиология 671
эугликемия и 678, 678р
Опухоль гипофиза
АКТГ-секретирующая 376-377
вторичный гипотиреоз и 105
множественная эндокринная неоплазия 1 и 495-496
при акромегалии у кошек 78, 78р, 79р
при акромегалии у собак 89
при гиперкортицизме у кошек 397т, 399р, 404-410 гипофизэктомия 404-406
двусторонняя адреналэктомия 408-409 медикаментозное лечение 407-408
облучение гипофиза 406
определение концентрации эндогенного АКТГ в сыворотке крови 399-401
проба с подавлением высокими дозами дексаметазона 396-399, 397р, 399т радиотерапия 406
трансфеноидальная криотерапия 88
при гиперкортицизме у собак
встречаемость 276, 276р, 276т, 277р гипофизэктомия 348-349
и опухоль надпочечника 274
компьютерная томография 336-338, 336-338р
концентрация 17-гидроксипрогестерона в сыворотке крови 326-328, 328т
концентрация эндогенного АКТГ 330-332 магнитно-резонансная томография 338-340, 339р, 341р
нарушения центральной нервной системы 309-311, ЗЮр, ЗПр, 311т
облучение 367-368
отношение кортизолжреатинин в моче 334
патология 274-275
патофизиология 268-274, 269р, 270р
проба с кортикотропи рилизинг-гормоном и вазопрессином 335
проба с метирапоном 335
проба с низкими дозами дексаметазона 322, 325, 329-330, 329р
проба с подавлением высокими дозами дексаметазона 332-333, 332-334р, 329-330, 329р
проба со стимуляцией АКТГ 320 радиоизотопное сканирование 340 терапия митотаном 349-362, 350т, 352р, 354р, 356р
ультразвуковое исследование брюшной полости 299
хирургическое лечение 342-343
Опухоль задней доли гипофиза 269, 271
Опухоль интерстициальных клеток 1072
Опухоль клеток Сертоли 1072, 1072р
синдром Кушинга у собак и 312т
синдром феминизации у кобелей и 1075, 1076р Опухоль С-клеток щитовидной железы 257-258 Опухоль надпочечников
альдостерон-секретирующая 412-413,414т классификация 275
нетравматический разрыв у собак 289 при гиперкортицизме у кошек
биопсия под контролем ультразвука 402 концентрация эндогенного АКТГ 399-401 лечение 410-411
проба с подавлением высокими дозами дексаметазона 397-399, 397т, 399т рентгенография брюшной полости 401 ультразвуковое исследование брюшной полости 401-402, 402т
при гиперкортицизме у собак
встречаемость 276-277, 276р, 276т, 277р компьютерная томография 335-338, ЗЗбр, 337р концентрация 17-гидроксипрогестерона в сыворотке крови 326-328, 328т
концентрация эндогенного АКТГ 330-332 магнитно-резонансная томография 338-340, 339р, 341р
опухоль гипофиза 274
отношение кортизолжреатинин в моче 334 патология 274-275
патофизиология 272-273
проба с кортикотропин рилизинг-гормоном и вазопрессином 335
проба с метирапоном 335
проба с подавлением высокими дозами дексаметазона 332-334, 332-334р проба с подавлением низкими дозами дексаметазона 322-326, 323р, 329- 330, 329р проба со стимуляцией АКТГ 320-321, 320р радиоизотопное сканирование 340 рентгенография брюшной полости 295-297, 296р, 297р
терапия митотаном 349-362
ультразвуковое исследование брюшной полости 298-302, 299т, 301р, 302р
хирургическое лечение 342-349, 344р прогестерон-секретирующая 413 случайное обнаружение 492-494,492т феохромоцитома 473-497
артериальное кровяное давление, определение 483-484, 484т
встречаемость 476, 476р, 476т
гормональное тестирование 485-487, 485т, 486р клиническая патология 479-480,479р клинические признаки 476-478
компьютерная и магнитно-резонансная томография 482, 483р
опухоль коры надпочечников и 274
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1207
патофизиология 473-476, 474р, 474т, 475т постановка диагноза 487
при множественной эндокринной неоплазии типа 2А 496
прогноз 492
рентгенография брюшной и грудной полостей 481-482
сцинтиография 482-483
терапевтическое лечение 491-492
у собак с диабетом 577
ультразвуковое исследование брюшной полости 480-481,481р, 482р
физикальное исследование 478
хирургическое лечение 487-491, 489р, 490т этиология 472-473
Опухоль, продуцирующая панкреатический полипептид 723
Опухоль промежуточной доли гипофиза 269, 271 Опухоль, секретирующая адренокортикотропный гормон при гиперкортицизме у собак 268-272, 269р, 270р
при множественной эндокринной неоплазии 494 Опухоль семенника, секретирующая эстроген 1073 Опухоль, секретирующая гормон роста 78р, 496 Опухоль, секретирующая гормон роста рилизинг-гормон 78р
Опухоль тучных клеток
влагалища 1013
пениса у собак 1067
у собак с сахарным диабетом 577
Опухоль шеи при гипертиреозе у кошек 171
Опухоль щитовидной железы
кошки 161-224
азот мочевины и креатинин в крови 176-177 активность ферментов печени 175-176 алопеция 169
анализ мочи 175
атенолол 223
базальный уровень общего тироксина в сыворотке крови 184-187, 184-186р
базальный уровень общего трийодтиронина в сыворотке крови 187
базальный уровень свободного тироксина в сыворотке крови 187-188, 188р
встречаемость 165, 165р
глюкокортикоидная терапия 224 дифференциальная диагностика 183, 183т йодид 223
йодированные контрастные агенты для рентгенографии 223
карбимазол 210
клинический анализ крови 174-175, 174т
кортизол в плазме крови 178
кровяное давление и гипертензия 178-179 непереносимость тепла и стресса 170 нервозность, гиперактивность, агрессивное поведение и тремор 168
патология 162-164, 163р
полидипсия и полиурия 168
понос и рвота 158-159
потеря веса и полифагия 166-168, 167р
проба с подавлением трийодтиронином 188-192, 189т, 190р, 191р
проба со стимуляцией тиреотропин рилизинг-гормоном 192-193
проба со стимуляцией тиреотропином 190-192
прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р
рентгенография 179, 180р
респираторные расстройства 169
сканирование щитовидной железы 193-194, 194-199р
слабость и сонливость 170
снижение аппетита 169
собаки и 228, 229т
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210, 205р, 207р, 208р
тиамин 224
ультразвуковое исследование шейной области
199-201, 200р
уровень глюкозы в крови 176
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного
гормона 177
уровни натрия и калия 178
уровни общего белка и альбумина 177
физикальное исследование 170-174, 171р, 171т фруктозамин, концентрация в сыворотке крови 178
функция почек 201-204
хирургическое лечение 210-216, 212р, 213р, 214т чрескожная термокоагуляция опухоли 221-222, 222р
чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182, 179р, 181р, 182р этиология 164
эхокардиография 182-183, 183р
собаки 228-258
биопсия щитовидной железы 246-247
встречаемость 234, 235, 235т
гипертиреоз и 253-257, 255р
гипотиреоз и 104
гистология 232-234, 233т
дифференциальная диагностика 247
доброкачественная 232
злокачественная 232-258
биопсия щитовидной железы 246-247 встречаемость 235, 235р, 235т
гистология 232, 233т
дифференциальная диагностика 247
иммуногистохимия 233-234
клинические признаки 235-236, 236т
лечение 247-252, 248р, 253р
медуллярная карцинома 257-258
оценка в клинике 237-238
прогноз 252-253
рентгенография 238
синдромы множественной эндокринной
неоплазии 234, 234т
сканирование щитовидной железы 240-245, 241-246р
тестирование функции щитовидной железы 244, 246, 246р
ультразвуковое исследование 238-240, 23 8р, 239р
физикальное исследование 236-237
частота 234
электрокардиография и эхокардиография 238
1208
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
иммуногистохимия 233-234
классификация 229-230
клинические признаки 235-236, 236т
лечение 247-252, 248р, 253р
медуллярный рак 257-258
оценка в клинике 237
патогенез 230-231, 231р
патология 231
прогноз 252-253
рентгенография 238
синдром множественной эндокринной неоплазии и 234-235, 234т
сканирование щитовидной железы 240-244, 241-
246р
тестирование функции щитовидной железы 244-
246, 246р
у кошек и 228, 229т
ультразвуковое исследование 238-239, 239р, 240р
физикальное исследование 236-237
частота 234
эктопическая 258
электрокардиография и эхокардиография 238
при множественной эндокринной неоплазии 2А 496-
497
Опухоль яичника 991
Органический фосфат 887т
Ортоэндокринный синдром 713
Орхит
кобели
лимфоцитарный 1082-1084, 1О83р, 1084т
ультразвуковое исследование 1053т
хронический 1079-1082
коты 1162
Орхиэктомия (удаление семенника) 1079
Орхиэпидидимит 1079-1082,1080р
Осадок в моче 757
Осеменение матки хирургическим методом 1123-1124
Осмоляльность плазмы крови
взаимосвязь с объемом крови 9
водный баланс и 2
нормальный уровень 25
после пробы с лишением жидкости 37т
при диабетическом гиперосмолярном некетоновом
синдроме 673
при диабетическом кетоацидозе 647-648
при инфузии гипертонического солевого раствора
41,41р
рандомизированные определения 24, 39-40, 40р
секреция вазопрессина и 8, 8р
Осмоляльность, изучение водного баланса 24-25
Осмоляльность мочи 8
влияние лишения воды 29-30, ЗОр
после дегидратации 36р
после пробы с лишением жидкости 37т
при несахарном диабете 23
реабсорбция натрия 76
Осморецептор 8
Осмотический диурез 10-11
Осмотическое давление 25
Остеокальцин 175
Остеолитическая гиперкальциемия 741-742
Остеомиелит 747
Остеопения 297
Острая почечная недостаточность
при гиперкальциемия 746-747
при гипокальциемия 809
Островковый амилоидный полипептид 590-592, 591р, 592р
Острый инфекционный простатит 1089-1095, 1089т,
1090р,
Острый метрит
у кошек 1148
у собак 920
цитология влагалища 857
Острый панкреатит 807
Острый простатит 1053т
Ось гипоталамус-гипофиз-надпочечники 503-504, 503т
Ось гипофиз-надпочечники 268, 269р
гипокортицизм и 419, 420р
оценка при гиперкортицизме у собак 313, 314р
Ось мозг-желудок 710
Ответ на пробу с кортикотропин рилизинг-гормоном и вазопрессином 335
Отек мозга 670
Отек мозга 670
Отношение белок/креатинин в моче 294
Отношение кортизол/креатинин в моче
при гиперкортицизме у кошек 388-390, 390т, 391т
при гиперкортицизме у собак 315-316, 334
Отношение осмоляльности моча:плазма 42
Отношение концентраций инсулина и глюкозы 694-695
Отравление родентицидами 742
Отсутствие циклов
у кошек 1158
у собак 286-287
Оценка лимфатических узлов 766
Оценка спермы
кобель 1034,1038-1043
до оценки фертильности сук 965-966 макроскопическое исследование 1038 микроскопическое исследование 1038-1043, 1040-1043р, 1041т
окончательная интерпретация результатов 1044-1045, 1044т
при астенозооспермии 1110-1113
при бактериальном простатите 1088-1090
при бесплодии кобелей 1102-1104
при дегенерации семенников 1085
при остром орхиэпидидимите 1081
при остром простатите 1090-1091
при синдроме аплазии семенных протоков 1071-1072
сбор спермы 1036-1038, 1 ОЗбр
факторы, влияющие на качество эякулята 1043-1044
кот 1163
П
Р53 супрессорный ген 231, 231р
Паллиативная терапия 253р
Пальпация
при гипертиреозе у кошек 171
для определения беременности у собак 878
Пальпация влагалища
при стриктуре влагалища 1003
при уретральной неоплазии 1014
Памидронат 771, 771т
Панкреатит
ассоциация с глюкокортикоидами 517
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1209
гиперкалиемия и 437
гипокальциемия и 807-808
после удаления опухоли бета-клеток 700
при гиперкортицизме у собак 293, 304-305
при диабетическом кетоацидозе 649, 665-666
при сахарном диабете
основы диеты 546-547, 547т
у кошек 589
у собак 530, 537
Панкреатические островки
действие катехоламинов 475т
действие пептида, родственного паратиреоидному
гормону 737т
неоплазия 496
трансплантация 582-584, 583р
Панкреатические ферменты
при акромегалии у кошек 85-86
при диабетическом кетоацидозе 649
при сахарном диабете у кошек 599-600, бООр
при сахарном диабете у собак 537
Панкреатический амилоидоз 591-593, 591р, 592р
Панкреатический полипептид 475т, 713т
Панлейкопения у кошек 1150
Панцитопения 1077, 1078
Папиллома пениса у собак 1067
Папиллярный рак щитовидной железы 164
Парабазальные клеки влагалища 838р, 839
Параганглиома 472, 476
Паралич сократительной мышцы пениса 1061
Параметазон
период биологической полужизни 503т, 507
препарат и дозы 521т
Паранеопластические заболевания Ют
Паратиреоидная остеодистрофия 759
Паратиреоидный гормон 729, 729т
быстрый метаболизм 733
влияние катехоламинов 475т
гипокальциемия и 803
гипопаратиреоз у собак и 799т, 804-806
гомеостаз кальция и 790-792, 791р
метод определения 734-735, 735р, 761-762, 761р
первичный гиперпаратиреоз и 753т, 778-779р
Парафимоз 1061-1062, 1062р
Парафолликулярный рак 257
Парацервикс 866
Паращитовидная железа 728-820
гиперкальциемия 729-748
глюкокортикоиды и 514
дифференциальная диагностика 738т дифференциальная диагностика от синдрома Кушинга у собак 312
концентрация ионизированного кальция в сыворотке крови 735-736
концентрация паратиреоидного гормона в сыворотке крови 734-735, 735р
нормальная концентрация кальция в сыворотке крови 729т
определение концентрации витамина Д в
сыворотке крови 736
патофизиология 730-734
полидипсия и полиурия Ют
при алиментарном вторичном гиперпаратиреозе 746-747
при гипокортицизме 440-442,441т, 744
при гипотермии 747
при гипотиреозе у собак 117
при дегидратации 747
при злокачественной опухоли 738-742, 739-740р
при иммобилизационном остеопорозе 747
при острой почечной недостаточности 746 при септическом и грибковом заболевании костей 747
при хронической почечной недостаточности 745, 745р
токсикоз при гипервитаминозе Д и отравлении родентицидами 742-744,743р этиология 730
гиперпаратиреоз у кошек 784-786, 785т
гипокальциемия и первичный гипопаратиреоз 789-817
биохимический анализ крови 801 встречаемость 795, 795т дефицит магния 802-803, 802т дифференциальная диагностика 804-810, 804т, 805р
концентрация паратиреоидного гормона в сыворотке крови 803-804
неотложная терапия тетании 811-813 нервозность 795, 796 определение 789-790, 790т
патофизиология 790-795, 790т, 791р
терапия витамином Д 813-816, 814р, 815т терапия кальцием 811-813, 816-817 уровень кальция 798-800, 799т, 800р физикальное исследование 797-798, 797т фосфор, концентрация в сыворотке крови 800 электрокардиография 801, 801р
действие катехоламинов 475т
действие пептида, родственного паратиреоидному гормону 737т
опухоль
послеоперационный уход 781
при первичном гиперпаратиреозе 752
ультразвуковое исследование 759-760, 760р, 776р первичный гиперпаратиреоз у собак 748-783
анализ мочи 757
анамнез 749-752, 763-764р
биохимический анализ сыворотки крови 753-757, 753т, 754р, 755р, 756т
газовый анализ крови 757-758
гормональные тесты 761, 761р
избирательный анализ образцов венозной крови 762
множественная эндокринная неоплазия 783 наследственный неонатальный 783
неотложная терапия 768-773, 769т, 770-771т одиночная опухоль паращитовидной железы 781-782
оценка лимфатических узлов и костного мозга 766-767
паращитовидная ткань в средостении 783 первичная база данных 765-766
послеоперационный контроль возможной гипокальциемии 778-781, 778р, 779р, 780т прогноз 783
радиоизотопное сканирование 762 рентгенография 758-759, 758р, 759р ультразвуковое исследование 759-761, 760р физикальное исследование 752
химиотерапия 767
1210
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
хирургическое лечение 761-768, 768р, 773-774 чрескожная инъекция этанола под контролем ультразвука 775, 776р
чрескожная термокоагуляция под контролем
ультразвука 775-778, 776р, 777р
электрокардиография 758
Паращитовидная ткань в средостении 783
Пахово-мошоночная грыжа 1085-1086
Пегвисомант 88
Пенис
кобель 1059-1067
баланопостит 1065-1066
врожденная деформация кости пениса 1060-1061
выделения из препуция 1064-1065
гипоплазия 1059-1060
гипоспадия 1060
коитус 860-861, 861р
неоплазия 959
отсутствие эрекции 1063-1064
парафимоз 955-956, 955р
приапизм 1062-1063
пролапс уретры 1064-1065, 1064р
раздвоение 1061
сбор семенной жидкости для искусственного
осеменения 1120-1121, 1121р
стойкая уздечка пениса 1059, 1060т
травма 1066-1067, 1066р
физикальное исследование 1032-1034, ЮЗЗр
фимоз 1061
XX синдром 994-995
кот 1161
Пенистая клетка 840
Пенициллин G 1097т
Пенициллины 887т
Пентобарбитал 888т
Пептид YY 711т
Пептид родственный гену кальцитонина 771т
Пептид родственный паратиреоидному гормону 729
метод определения 737-738, 737т, 737р, 738р
нормальная концентрация в сыворотке крови 729т
Первичная гиперкальцитонинемия 257-258
Первичная гипотония матки 909
Первичная недостаточность коры надпочечников 419-
422,420р, 421т
Первичная полидипсия 14
лечение 41-46, 42т, 45т
модифицированная проба с лишением жидкости 33, ЗЗр
отношение осмоляльности мочи и плазмы 41
этиология 17-20, 21р
Первичная почечная гликозурия 11
Первичный анэструс 981-986, 984р
Первичный гиперальдостеронизм 369-371
кошки 412-413, 414т
полидипсия и полиурия 10т, 10
Первичный гиперпаратиреоз
кошки 785-786, 785т
собаки 748-783
анализ мочи 757
анамнез 749-752, 763р, 764р
биохимический анализ крови 753-757, 753т, 754р,
755р, 756т
встречаемость 748-749, 748р, 748т
газовый анализ крови 757-758
гормональное тестирование 761, 761р
избирательный анализ образцов венозной крови 762
клинические признаки 749-752, 749т, 750р, 751р, 750т
контроль возможной гипогликемии после удаления опухоли 778-781, 778р, 779р множественная эндокринная неоплазия и 783 наследственный неонатальный 783 неотложная терапия 768-773, 769т, 770т одиночная опухоль паращитовидной железы 781-782
определение паратиреоидного гормона в сыворотке крови 735р
оценка лимфатических узлов и костного мозга 766-767
паращитовидная ткань в средостении 783 первичная база данных 765-766
прогноз 783
радиоизотопное сканирование 762 рентгенография 758-759, 758р, 759р ультразвуковое исследование 759-761, 760р физикальное исследование 752
химиотерапия 767
хирургическое удаление 767-768, 768р, 773-774 чрескожная термокоагуляция опухоли под контролем ультразвука 775-778, 776р, 777р чрескожное разрушение опухоли этанолом под контролем ультразвука 775, 776р электрокардиография 758
Первичный гипокортицизм
тестикулярная недостаточность у кобелей 1083-1084 у кошек 466-469,467т, 468т
Первичный гипопаратиреоз 789-819
биохимический анализ сыворотки 801 встречаемость 795, 795т
дефицит магния 802-803, 802т
дифференциальная диагностика 804-810, 804т, 805р кальциевая терапия 812-813, 812т, 816
концентрация паратиреоидного гормона 803-804 лечение витамином Д 813-816, 814т, 815р неотложная терапия тетании 811-812 определение 789, 790т
патофизиология 790-795, 790т, 791р, 793р
слабость 804
уровень кальция в сыворотке крови 798-800, 799т, 800р
уровень фосфора в сыворотке крови 800 физикальное исследование 797-798, 798р электрокардиография 801-802, 801р
Первичный гипотиреоз 99-105, 99-102т, ЮОр
Первичный нефрогенный несахарный диабет 19-20
клинические признаки 21-22
полидипсия и полиурия 10
Передача Brucella canis половым путем 1019-1020 Передозировка инсулина
концентрация фруктозамина в сыворотке крови и 553-554
при сахарном диабете у кошек 623, 624р
при сахарном диабете у собак 565-566, 565р, 566р продолжительность действия инсулина и 560
Перекрут
матки 907т
семенника 1078-1079, 1079р
Перелом кости пениса 1066
Перенос эмбриона у кошек 1142-1143
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1211
Переходноклеточная карцинома 1014, 101 Зр Перивульварный дерматит 1009
Период биологической полужизни препаратов 507 Перитонеальный диализ при гиперкальциемии 771т, 773
Перитонит 960
Периферическая невропатия
при акромегалии у кошек 82
при опухоли, секретирующей инсулин 684 Пероральная терапия цинком 1095 Пероральные антитиреоидные препараты 203т, 256 Пероральные глюкокортикоиды 510 Пероральные контрацептивы 883т Пероральные сахаропонижающие средства
акарбоза 613-614
бигуаниды 611-612, 612р
ванадий 613
меглитиниды 611
при сахарном диабете у собак 547-550, 548р, 549р, 550т
сульфонилмочевинные 607-611, 606т, 607т, 608-6 Юр триазолидиндионы 612-613
хром 613
Пероральный тест на толерантность к глюкозе 596т Печень
биопсия 328
гиперкортицизм у собак и 287-288, 296
действие катехоламинов 474т
продукция глюкозы 678
синтез инсулиноподобного ростового фактора-1 51 Пиелонефрит
полидипсия и полиурия 12
при гиперкортицизме у собак 303-304
синдром Кушинга у собак и 312т
удельный вес мочи 15т
Пиодерма 283-284, 283р
Пиометра
кошки 1151-1155, 1152т, 1153т собаки 948-964
антипрогестагены 963
встречаемость и анамнез 950-951, 950т долгосрочное лечение 963
индуцированная медикаментозными средствами 972
индуцированная эстрогеном 934 клиническая патология 951-952 культя пиометры 956-957, 956р осложнение на почки 955 патофизиология 948-950
пиометра закрытого типа 962-963 пиометра открытого типа 961-962 полидипсия и полиурия 10, Ют, 954 простагландины 958-961, 958р, 959т, 960т рентгенография 952, 953р ультразвуковое исследование 952, 954р физикальное исследование 951 хирургическое лечение 957-958, 957р цитология влагалища и культивирование 857, 955, 955т
Пиометра закрытого типа
лечение 958
лечение простагландинами 962-963
Пиометра культи 956-957, 956
Пиометра открытого типа 950, 950т, 954р, 955, 959-962, 959т
Пиометра, индуцированная эстрогеном 934
Пиперазин 887т
Питьевой центр 7
Пиурия 052
Пламенные фолликулы 70
Пластика вульвы 1009
Плацента
кошки
задержка после родов 1148
субинволюция плацентарных мест 1147-1148
собаки
выход после родов 893
действие катехоламинов 475т
действие пептида родственного паратиреоидному
гормону 737т
задержка после родов 922
субинволюция плацентарных мест 920-921
Плевральный выпот 437
Пликамицин 772
Плод
кошки
дистоция 1146
раннее рассасывание 1150-1152
собаки
внематочные 900
дистоция 907-910, 907р
затянувшаяся щенность 917-918
раннее рассасывание 975
смерть вследствие задержки 906
спонтанный аборт и рассасывание 900-906, 901т,
905-907р
Плоды пальмы сереноа 1095
Поведение
у кошек
во время беременности 1143
половое 1140-1142, 1140р, 1141т
при ложной беременности 1139
у собак
гипотиреоз и 114
изменение при первичной полидипсии 46
изменения, индуцированные эстрогеном 935
половое 859-862, 860т, 861т, 861р
при гипогликемии 681
Поведение собак перед вязкой 859-860
Поверхностно-промежуточные клетки влагалища 839-
840, 840р
Поверхностные клетки влагалища 839, 839р
Поверхностный некролитический дерматит 720-722
Повышение температуры
при остром простатите 1089
при приближающемся аборте у собак 904
при тетании 812
Поджелудочная железа 526-726
глюкагонома 720-722
действие катехоламинов 474т
диабетический кетоацидоз 635-675
азот мочевины и креатинин в крови 646-647,
647р
анализ мочи и культивирование 642-643
анамнез и физикальное исследование 640-641
анионная разница 648, 648т
встречаемость 640
гиперкалиемия 436
диагностическая визуализация 651 жидкостная терапия 653-656, 655р, 657р
1212
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
заместительное введение калия 658, 658т заместительное введение магния 659 заместительное введение фосфатов 658 инсулиновая терапия 661-665, 662р, 663р кальций и фосфор в сыворотке крови 649-650 кислотно-щелочной статус 644-645, 645р, 645т клинический анализ крови 648-649 концентрация глюкозы в крови 643-644, 643р, 644р, 644т
концентрация калия в сыворотке крови 646, 646р концентрация магния в сыворотке крови 650 концентрация натрия в сыворотке крови 645-646, 645р
осложнения 669-671, 669т
осмоляльность сыворотки крови 647-648
панкреатические ферменты 649
патогенез и патофизиология 635-640, 636-63 8р постановка диагноза 641-642, 642р
прогноз 671-672
сопутствующие заболевания 665-669
терапия бикарбонатом 660-661, 661р тестирование функции печени 649 уровень холестерина и триглицеридов 650-651, 651т
электрокардиография 651, 652р, 652т инсулинома 713 неоплазия бета-клеток 677-707
анамнез 683-684
встречаемость 683, 683р
гипогликемия и контррегуляторный ответ 678-680, 679т
гипогликемия, индуцированная инсулином 681 диагностика гипогликемии 691-695, 692р диагностическая визуализация 695-696, 696р дифференциальная диагностика от гипогликемии натощак 685-691, 686т, 687р, 688т клиническая патология 684-685
клинические признаки 681-682, 681т 682р, 682т медикаментозная терапия острого гипогликемического криза 702-703, 703р медикаментозная терапия хронической гипогликемии 703-705, 705р
определение инсулина в сыворотке крови 693-695, 694р
прогноз 706-707
секреция инсулина 680
у кошек 707-708
физикальное исследование 684, 684т хирургическое лечение 697-702, 697т, 698р, 701т этиология 677
эугликемия и 678, 678р
сахарный диабет у кошек 588-633
акарбоза 613-614
анамнез 597-598
антиинсулиновые антитела в циркуляции 626 бигуаниды 611-612, 612р
ванадий 613
вариации в потребности инсулина 629-630 встречаемость 597
выявление и контроль сопутствующих проблем 606 гипергликемия при стрессе 621-623 гипогликемия 622-623
гликемическая кривая 617-620, 618р, 619р гликозилированный гемоглобин, концентрация в крови 616-617, 617т
гликозурия 617 диагноз 598 диетотерапия 603-606, 603т, 605р, 605т ИЗСД и ИНЗСД 596-597, 596т инсулинозависимый 590, 591р инсулинонезависимый 590-594, 592-594р клиническая патология 599-600, бООр кратковременный эффект инсулина 624 меглитиниды 611
начальная инсулинотерапия 601-603, 602р, бОЗр неадекватная или нарушенная абсорбция инсулина 625-626, 625р недостаточная доза инсулина 623-624 патофозиология 597 прогноз 632
пролонгированное действие инсулина 624-625 сопутствующие заболевания, приводящие к резистентности к инсулину 626-629, 628р сульфомочевинные препараты 607-611, 606т, 607т, 608р, 609т, 6 Юр тиазолидиндионы 612-613 тип 1 и тип 2 589-590 транзиторный 594-595, 596р феномен Сомоги 623, 624р физикальное исследование 598, 614-615 фруктозамин, концентрация в сыворотке крови 615-616, 615т, 616р, 620 хром 613 хронические осложнения 630-632, 631р сахарный диабет у собак 526-586
аллергические реакции на инсулин 570-571 анамнез 533-534, 552-553 встречаемость 533 вторичный 531
гиперкортицизм и 290, 305 гипертензия 581-582 гипотиреоз 140 гликемическая кривая 556-562, 557-559р гликозилированный гемоглобин, концентрация в крови 555-556, 556т
диабетическая невропатия 580-581 диабетическая нефропатия 581 диабетическая ретинопатия 580 диетотерапия 542-547, 542т, 543р, 543т, 544т дифференциальная диагностика 312т индуцированная инсулином гипогликемия 563 инсулин короткого действия 567-568 инсулинозависимый сахарный диабет 529-530, 529т инсулинонезависимый сахарный диабет 530 инсулинорезистентность 571-578, 572р, 573т, 574т
инсулинотерапия 538-542, 539р, 542т, 550-552, 552р
во время операции 562 катаракта 579-580 клиническая патология 535-538, 535т, 538т контроль глюкозы в моче 556 неадекватная абсорбция инсулина 568 недостаточная доза инсулина 565 патофизиология 532-533
пероральные сахаропонижающие средства 547-550, 548р, 549р, 550т
после удаления инсулин-секретирующей опухоли 700-701
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1213
проба со стимуляцией АКТГ 318
прогноз 584
пролонгированное действие инсулина 568
сопутствующие проблемы 550-552
тип 1 527, 527т
тип 2 527-528
транзиторный 530-531, 531р
трансплантация панкреатических островков 582-584, 583р
у щенных сук 927-928
увеит вследствие помутнения хрусталика 580 установление диагноза 534-535, 535т феномен Сомоги 565-567, 565р физикальное исследование 534, 552-553 физическая нагрузка 547
фруктозамин, концентрация в сыворотке крови 553-555, 554р, 554т, 562
циркулирующие антиинсулиновые антитела 568-570, 568р, 569р
трансплантация 582-584
Подкожное введение препаратов
характер абсорбции 507-508, 508т
эпоэтин 823-824
Пол
влияние на тестирование функции щитовидной железы у собак 137
гиперкортицизм у собак и 276
гипокортицизм и 428
состояние интерсекса 994
Полигландулярный аутоиммунный синдром 102-104, 102т, 1084
Полидипсия
врожденные портосистемные шунты и 312 дифференциальная диагностика 10-14, 10т, 13т, 14т лечение 41-46, 42т, 45т
методы диагностики 14-17, 15т, 16р
модифицированная проба с лишением жидкости 24-39
дегидратированная собака 38
определение вазопрессина в плазме крови 37-38,
38р, 39р
осложнения 33-36, ЗЗр, 34р, 35т
ответ 29-32, 29-32р
ошибочный диагноз 36-37, 36р, 37т
противопоказания 24
протокол 25-29, 26т, 26р, 27т
терминология 24-25
при акромегалии в диэструсе 927
при акромегалии у кошек 80
при гиперкальциемии 731
при гиперкортицизме у собак 279
при гипертиреозе у кошек 168
при первичном гиперпаратиреозе 749-750, 749т,
750р
при пиометре 952, 954
при пиометре открытого типа 950т
при сахарном диабете у собак 532-533
при синдроме Кушинга у кошек 381-382
при синдроме Кушинга у собак 312т
при феохромоцитоме 476
при центральном несахарном диабете 21-22, 21р
Полимиксин В 1097т
Полип во влагалище 1007, 1007р, 1015-1016
Полиурия
дифференциальная диагностика 10-14, Ют, 13т, 14т
лечение 41-46,42т, 45т
методы диагностики 14-17, 15т, 16р
при акромегалии в диэструсе 927
при акромегалии у кошек 80
при врожденных портосистемных шунтах 312
при гиперкальциемии 731
при гиперкортицизме у собак 279
при гипертиреозе у кошек 168
при первичном гиперпаратиреозе 749-750, 749т,
750р
при пиометре 952-954
при пиометре открытого типа
при сахарном диабете у собак 532-533
при синдроме Кушинга у кошек 381-382
при феохромоцитоме 476
при центральном несахарном диабете 21-22, 21р
Полиурия и полидипсия, индуцированные
медикаментозными средствами 14
Полифагия
при акромегалии у кошек 80
при гиперкортицизме у собак 279
при гипертиреозе у кошек 166-167, 167р, 167т
при сахарном диабете у собак 533
Полицитемия
гипогликемия и 691
полидипсия и полиурия при Ют, 13
Полиэстральные циклы размножения у кошек 1133-1134 Половое поведение
кошки 1140-1142, 1140р, 1141т
собаки 859-862, 860т, 861т, 861р
Половое созревание
кошки 1130-1131
собаки
наступление 843
характеристика семенной жидкости 1043
Половой акт у кошек 1141
Половые гормоны 75т, 427
Полосчатый кератит 752
Поперечное предлежание плода 908
Портосистемный шунт 12
Посевы мочи
при диабетическом кетоацидозе 642-643
при пиометре 952
Послеоперационный уход
после операции на поджелудочной железе 700-701
после тиреоидэктомии у кошек 214-216,214т
после удаления феохромоцитомы 490-491
Послеродовая тетания 808, 922-924, 924т
Послеродовое вагинальное кровотечение 1147
Послеродовой эндометрит 920-921, 963
Послеродовые инъекции окситоцина 920
Постобструкционный диурез Ют, 11
Потеря аппетита
инсулиновая терапия и 562
при гиперкортицизме у собак 279
при гипотиреозе у кошек 152
при первичном гиперпаратиреозе у собак 751
при перекруте семенников у собак 1079
при пиометре открытого типа 950, 950т
терапия митотаном и 350-351
Потеря веса
при акромегалии у кошек 80
при гастриноме 714, 714т
при гипертиреозе у кошек 166-168, 167р, 167т, 173
при опухоли щитовидной железы у собак 236т, 237
1214
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
при сахарном диабете у собак 533, 545
при синдроме Кушинга у кошек 382
Потребление воды
в норме 10
контроль при терапии митотаном 351
ограничение при первичной полидипсии 46
Потребление калорий при контроле гликемии у собак
544т, 545-546
Почечная недостаточность
гиперкалиемия и 437
гипогликемия и 690
индуцированная холекальциферолом 742
натриуретический пептид предсердия 828-829
при акромегалии у кошек 83
при диабете у собак 576
при диабетическом гиперосмолярном некетоновом
синдроме 674
при диабетическом кетоацидозе 643, 666-667
при пиометре 955
удельный вес мочи при 15т
Почечная функция
влияние глюкокортикоидов 503
при гиперкальциемии 731-732
при гиперкортицизме у собак 291
при гипертиреозе у кошек 201,203-205
при первичном гиперпаратиреозе у собак 749-750, 750р, 750т
Почечные гормоны 822-828, 823р, 825р
Почечный вторичный гиперпаратиреоз 744-745
Почечный клубочек 825р
Почки
гиперкальциемия и 731
гипертиреоз у кошек и 173
гормональный синтез 822-828, 823р, 825р
действие глюкокортикоидов 503
действие катехоламинов 474т
действие катехоламинов на секрецию гормонов 475т
кистозная гиперплазия эндометря и 952 натриуретический пептид предсердия 828-829 первичный гиперпаратиреоз у собак и 749-750, 749т, 750т
продукция глюкозы 678
Празиквантел 887т
Превращающий фермент 826-827, 825р
Прегненолон 267,267р
Преднизолон 511т
препарат и дозы 521т
при воспалениях 513
при нарушениях центральной нервной системы 515 при нарушениях, индуцированных иммунной системой 514
снижение дозы 522
структура 500
Преднизон 511т
период биологической полужизни 507
препарат и дозы 521т
при болезни Ад дисона 460,465
при воспалениях 513
при геморрагическом шоке 514
при гиперкальциемии 771т
при инсулин-секретирующей опухоли 703
при лимфоцитарном орхите 1116
при лимфоцитарном орхите у собак 1082-1083
при нарушениях центральной нервной системы 515
при нарушениях, индуцированных иммунной системой 514
при опухоли бета-клеток 697т
при отеке мозга 703
при хронической гипогликемии 703
применение после нейрохирургического лечения 516
Предоперационные мероприятия
при гипертиреозе у кошек 210-211
при инсулин-секретирующей опухоли 697-698
при феохромоцитоме 488-489
Предродовое вагинальное кровотечение 1146
Предсердно-желудочковая блокада 112
Предсказание срока родов 877-878, 878р
Предстательная железа
доброкачественная гиперплазия 1053т, 1088
зависимость объема эякулята от массы железы 1043-1044
изменения при опухоли семенников 1073-1074
инфицирование 1088-1098
бесплодие и 1088
острое бактериальное 1088-1095, 1089-1093т
хроническое бактериальное 1095-1098, 1097р, 1097т
рентгенографическое и ультразвуковое исследование 1051-1053,1052р, 1052т,
физикальное исследование 1034
хронический орхиэпидидимит 1082, 1053т
Преждевременное угасание функции яичников
кошки 1158
собаки 985-986
Препараты для инъекций 508, 508т
Препараты для приема внутрь 508, 508т, 509-510
Препараты для топического применения 509, 508т
Препубертатный вагинит 1009-1011
Препуциальная смазка (смегма) 1064
Препуций
кобели
баланопостит 1065-1066
врожденное укорочение 1061-1062,1062р
выделение капель крови 1064-1065
неоплазия 1067
физикальное исследование 1032-1034, ЮЗЗр
XX синдром 994-995
коты 1161
Пресперма 1045
Приапизм 1062-1063
Прибавка в весе
при акромегалии у кошек 80-81
при гипотиреозе у собак 108, 108т
при инсулин-секретирующей опухоли 684
у щенных сук 890
Придатки семенников
аденомиоз 1085
киста 1053т
острая инфекция 1079-1082, 1080р
пункционная биопсия 1054
сперматоцеле 1085
ультразвуковое исследование 1052, 1053т
физикальное исследование 1034
хроническая инфекция 1082
Признак Труссо 797
Признаки коагулопатии при гипотиреозе у собак 113-
114
Признаки нарушения центральной нервной системы глюкокортикоиды и 515
предметный указатель
1215
при акромегалии у кошек 82 при гиперкортицизме у собак 309-311, ЗЮр, 311р, 311т
при гипотиреозе у собак 111-112
при центральном несахарном диабете 21-22
Примидон 889т
Приобретенная недостаточность гормона роста 67-68 Приобретенный в зрелом возрасте чувствительный к гормону роста дерматоз 68-77 алопеция 70-72, 71т гистопатология кожи 70 клиническая патология 69 клинические признаки 68-69, 69р лечение 77, 76р, 77р породы 68 прогноз 77 сходные заболевания 72-73, 73т, 74р, 75т эндокринологическая оценка 70 этиология и патофизиология 68
Приобретенный нефрогенный несахарный диабет 11 Проба с введением кальция при гастриноме 717, 718, 717р при гипопаратиреозе 790-791, 718р
Проба с гормон роста рилизинг-гормоном 63, 70
Проба с лишением жидкости 24-39 дегидратированная собака и 38 используемая терминология 24-25 определение вазопрессина в плазме крови 37-38, 38р, 39р осложнения 33-36, ЗЗр, 34р, 35т ответ 29-32, 29-32р ошибочный диагноз 36-37, 36р, 37т противопоказания 24 протокол 25-29, 26т, 26р, 27т
Проба с подавлением низкими дозами дексаметазона при гиперкортицизме у собак 322-326, 323р, 329-330, 329р при секретирующей прогестерон опухоли надпочечников 415 при синдроме Кушинга у кошек 393-396 при случайно обнаруженной опухоли надпочечника 494
Проба с поглощением трийодтиронина смолой 130
Проба с подавлением высокими дозами дексаметазона при гиперкортицизме у кошек 396-399, 397т, 399т при гиперкортицизме у собак 332-333, 332-334р
Проба с подавлением при феохромоцитоме 486
Проба с подавлением трийодтиронином 188-190, 188р, 190р, 189т
Проба со стимуляцией адренокортикотропным гормоном
при гиперкортицизме у собак 318-321
при гипокортицизме 448-450, 449р, 449т, 450р
при дерматозе, чувствительном к гормону роста 75т при неоплазии бета-клеток 693 при первичном гиперпаратиреозе 765 при резистентности к инсулину 573т, 574-575 при сахарном диабете у собак 321-322 при синдроме Кушинга у кошек 390-393 при случайном обнаружении опухоли надпочечников 494
при ятрогенном синдроме Кушинга 518, 518т
Проба со стимуляцией гастрина 716-717
Проба со стимуляцией клонидином
при гипофизарной карликовости 61т, 62, 62р
при чувствительном к гормону роста дерматозе 72
Проба со стимуляцией секретином при гастриноме 717
Проба Хики-Хейра 41,41р
Пробы со стимуляцией гормона роста
при гипофизарной карликовости 61-64, 61т, 62т, 62р при дерматозе, чувствительном к гормону роста у взрослых животных 68
Проблемы репродукции у сук 832-1028 аномалии половых желез 994-996, 996р аномалии фенотипического пола 996-997 аномалии хромосомного пола 993-994, 995р беременность 874-890
введение медицинских препаратов 883-886 диагностика 878-881, 879-882р, 881т изменения уровня глюкозы 877
изменения функций щитовидной железы и надпочечников 877
питание 886, 890
последовательность событий 875 прогестерон 876, 877р
продолжительность беременности 877, 878р
размер помета 875 эстроген и 876-877 бесплодие 965-990
Brucella canis 973
анамнез 966, 967т, 968т
аутоиммунный оофорит 980
гипотиреоз 985
заболевание матки 979
идиопатическое сокращение овариальных циклов 977-979, 978р
идиопатическое удлинение межэстрального интервала 980-981
избыток глюкокортикоидов 985 индукция эструса 986-988, 988т индуцированный медикаментами анэструс 984-985
инфекция 973-975, 974р
киста яичника, секретирующая прогестерон 986 кисты или неоплазия яичников 981
недостаточность функции желтого тела 976 общее состояние здоровья 969-970
окклюзия матки или яйцеводов 976-977р отсутствие овуляции 980 оценка кобеля 965-966
первичные мероприятия 970-973, 971р предшествующая овариогистерэктомия 982-984, 983р
преждевременное угасание яичников 985-986 проведение вязок хозяином 969
раннее рассасывание плода 975
расщепленная течка 979
скрытая течка 984
стойкий проэструс 968т, 988-990, 990р стресс 985
физикальное исследование 966-969, 967т, 969р фолликулярные кисты 979, 982р хирургическая диагностика 986 хронический эндометрит 975
ятрогенное сокращение межэстрального интервала 980
вагинит 1015-1017, 1015р, 1017т
врожденные пороки развития влагалища и вульвы 1000-1005
диагностика 1003-1005, 1004р
1216
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
клинические признаки 1001-1002, 10002р лечение 1005
эмбриональное развитие 1000-1001, 1001р
выделения из влагалища 1009-1013, 1009т, 1010-1012р
гиперплазия влагалища и пролапс 1007т
заболевания перед, во время и после родов 897-928 агалактия 927
акромегалия в диэструсе 927, 928р
внематочные плоды 900
выделения из влагалища 918-920
гипогликемия и 927
дистоция 907-917, 907-908р, 907т, 911-912р, 915т
задержка плаценты 922
затянувшаяся беременность 917-918
инъекции окситоцина в конце родов 920 клиническая ложная беременность 897-900 мастит 925-927
нормальное состояние 897
послеродовой эндометрит 920
сахарный диабет и 927-928
системные заболевания 919-920
спонтанный аборт и рассасывание плодов 900-906, 901т, 906р
субинволюция плацентарных мест 921-922 эклампсия 922-925, 924т
индукция аборта 930-939
агонистами дофамина 940
аналогами простагландинов 938-939
антагонистами гонадотропин рилизинг-гормона 942
глюкокортикоидами 941
до имплантации 933-935
комбинацией простагландина и дофамина 940
лечение простагландинами 935-938
овариогистерэктомия 932
первичная оценка 930-932, 931р, 932р
после незапланированной вязки 941-942
тамоксифена цитратом 941
терапия антипрогестинами 939-940
триместры щенности 932, 933р
инфекция brucella canis 919-924
клинические признаки 1020
культивирование 1022-1023, 1023т
лечение 1023-1024, 1024т
передача 1019-1020
профилактика и контроль 1024-1025
серологические тесты 1020-1023, 1021т
искусственное осеменение 862-869 внутривлагалищное 863-866, 864р, 866р показания 862
степень успеха 863
трансцервикальное 866-869, 866-868р
кистозная гиперплазия эндометрия 948-964
антипрогестагены 963
встречаемость и анамнез 950-951, 950т
долгосрочное лечение 963
индуцированная медикаментозными средствами 972
клиническая патология 951-952
осложнения на почки 955
патофизиология 948-951
пиометра закрытого типа 962-963
пиометра культи 956-957, 956р
пиометра открытого типа 961-962
полидипсия и полиурия 954
простагландины 958-961, 958р, 959т, 960т
рентгенография 952, 953р
ультразвуковое исследование 952, 954р
физикальное исследование 951
хирургическое лечение 957-958, 957р
цитология влагалища и культивирование 955, 955т
массы во влагалище и входе во влагалище 1013-1015, 1013р, 1014р
невозможность провести вязку 997-998, 998р нормальное половое развитие 992, 992т, 993р овариальный цикл 832-852
анэструс 851-852
диэструс 848-851, 850р
интервалы между циклами 833
классификация клеток влагалища 839-843, 838-
841р
наступление половой зрелости 832 предотвращение 942-946, 943т, 945р, 945т проэструс 833-839, 834р, 835р
сезонность 832
цитология влагалища 839-842, 842р, 843р, 852-
857, 853р, 856р, 857р
эструс 843-848, 843р, 848р
оплодотворение 869-870, 869р, 870р
опухоль яичника 991
половое поведение 859-862, 860т, 861р, 861т
пороки полового развития 993-994, 995р
проведение вязок 870-875
роды и 890-895
коробка для родов и помета 891-892, 892р
нормальная инволюция матки 893-895
эндокринология 890-891
этапы родов 892-893, 894р
синдром культи яичника 991-992
трансмиссивная венеричеческая опухоль 1025-1028, 1026р, 1027р
Прободение желудка и кишечника, вызванное глюкокортикоидами 515
Проведение вязок суки 870-874
Провокационные тесты
при инсулин-секретирующей опухоли 695
при феохромоцитоме 486-487
Прогестагены
применение для химической контрацепции 1160-1161
усиление инсулинорезистентности при сахарном диабете у собак 574
Прогестерон
кошки
в начале родов 1144
изменения концентрации в процессе беременности 1143
при инициации родов 1144
при ложной беременности 1139р, 1143
при недостаточной функции желтого тела 1151-1152
при развитии сахарного диабета 627-628
собаки
влияние катехоламинов 475т
влияние на тестирование функции щитовидной
железы 137
влияние простагландинов 958р
дефицит 901т
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1217
киста яичника и 981, 986
кистозная гиперплазия эндометрия 948
концентрация в диэструсе 848-849
концентрация в проэструсе 836-837 концентрация в эструсе 843-844, 844р определение времени вязки 873 определение срока родов 910
при индукции аборта простагландинами 937, 937р
при недостаточной функции желтого тела 902, 976
при оценке репродуктивности кобелей 1051
при расщепленной течке 979-980
при родах 891
при скрытой течке 984
при укороченном межэстральном интервале 980
у бесплодных сук 972
у щенных сук 876, 877р
Прогестерон-секретирующая киста яичника 986
Прогестерон-секретирующая опухоль надпочечника 413-416
Прогестины 65, 67
Прогнатия нижней челюсти 81, 82р
Продление жизни после лечения инвазивных опухолей
247528р
Продолжительность беременности
кошки 1143
собаки 877-878, 878р
затянувшаяся беременность 917-918
Продукция мочи
в норме 10
при кетоацидозе у собак 656-657
Проинсулин 528р
Прокаинамид 889т
Пролактин
влияние на сперматогенез и стероидогенез 1048, 1048т
концентрация в сыворотке крови во время щенности 876
концентрация в сыворотке крови при родах у сук 891
Пролактинома 496
Пролапс
влагалища 1005-1009, 1006-1008р, 1007т
матки 1015
уретры 1064, 1064р
Пролежень 281
Пролигестерон 945
Пролигестон 79
Промежуточные клетки влагалища 838рЮ 839
Промежуточный обмен, влияние глюкокортикоидов 502
Проопиомеланокортин 265, 265р
Пропилтиоурацил 204
Пропранолол
безопасность при беременности 888т
перед операцией на щитовидной железе у кошек 211
при гипертиреозе у кошек 222-223
при гипогликемии 706
при феохромоцитоме 489
Проренин 825
Простагландины
аналоги 938-939
при индукции аборта 936-938, 937р
при кистозной гиперплазии эндометрия 958-963,
959т, 960т
при пиометре у кошек 1037-1038
при послеродовом эндометрите 920-921
при родах у сук 891
природные и синтетические 935-936
Простата, доброкачественная гиперплазия 1053т, 1089
Простатит 1088-1098
бесплодие и 1088
индуцированный инфицированием Klebsiella 1089 индцуированный инфицированием Enterobacteres 1089
острый бактериальный 1088-1095, 1089-1093т ультразвуковое исследование 1053т
хронический бактериальный 1095-1098, 1097р, 1097т
Протамин-цинк-инсулин 539, 539т, 601-603, 602р, бОЗр Протеинкиназная система 5
Протеинурия
при гиперкортицизме у собак 294
при пиометре 952
при сахарном диабете у собак 536
при синдроме Кушинга у кошек 385т, 386
при феохромоцитоме 480
Proteus mirabilis при простатите 1089
Противовоспалительные свойства глюкокортикоидов 504-506
Противовоспалительные средства 888т
Противогрибковые препараты 887т Противорвотные средства 888т Противосудорожные препараты безопасность при беременности 889т влияние на тестирование функции щитовидной железы 142 гипокальциемия и 810
дифференциальная диагностика синдрома Кушинга у кошек и 312т
Проэструс 833
кошки 1131-1132, 1132т
собаки 833-839, 834р
введение мегестрола ацетата 943-944 гиперплазия влагалища 1005, 1006р гормональные изменения 835р, 836-837 изменения полового поведения 860, 860т изменения слизистой влагалища 968т синдром культи яичника 991-992
стойкий 988-991, 990р
цитология влагалища 971-972
Псевдогермафродитизм 993
Псевдогипопаратиреоз 806
Псевдомиотония 287, 287р
Псевдоэфедрин
безопасность при беременности 889т
при ретроградной эякуляции 1116
Pseudomonas aeruginosa при простатите 1089 Психогенная полидипсия 14, 20, 20т инфузия солевой жидкости 41, 41р клинические признаки 21-24, 21р, 23р лечение 41-46, 42т, 45 модифицированная проба с лишением жидкости 24-39
дегидратированная собака 38
определение вазопрессина в плазме крови 37-38, 38р, 39р
осложнения 33-36, ЗЗр, 34р, 35т
ответ 29-32, 29-32р
ошибочный диагноз 36-37, 36р, 37т
противопоказания 24
1218
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
протокол 25-29, 26р, 26т, 27т
терминология 24-29
полидипсия и полиурия Ют
рандомизированное определение осмоляльности
плазмы крови 39-40, 40р
удельный вес мочи 15т
Пункционная аспирация
опухоли надпочечников 413
предстательной железы 1091-1092, 1092р
придатков семенников 1054
семенников 1054-1055, 1054-1055р
Пуповина у собак 893, 894р
Пучковая зона 266-267, 475т
Равновесный диализ 187
Радиоактивный йод 249
при гипертиреозе у кошек 203т, 216-220, 217р
при облучении опухоли щитовидной железы 256-257
Радиоизотопное сканирование
при визуализации щитовидной железы 193-195, 194т
при гиперкортицизме у собак 340
при первичном гиперпаратиреозе у собак 762
Радиоиммунологический анализ
определение антиинсулиновых антител 570
определение инсулина 537-538
при гипотиреозе у собак 122
при сахарном диабете у кошек 600
Радиотерапия
акромегалии у кошек 87-88, 87р
гиперкортицизма у собак 367-368
опухоли гипофиза 406-407
опухоли щитовидной железы у собак 247-249
тестикулярной неоплазии у собак 1075
трансмиссивной венерической опухоли 1027 феохромоцитомы 491-492
Раздвоение пениса 1061
Разрыв
мочевого пузыря 434р, 436
опухоли надпочечника 289, 348
Рак
как причина несахарного диабета 18
опухоль щитовидной железы у кошек 161-224 активность ферментов печени 175-176 алопеция 169 анализ мочи 175 атенолол 223
базальный уровень общего тироксина в сыворотке крови 184-187, 184-186р
базальный уровень общего трийодтиронина в
сыворотке крови 187
базальный уровень свободного тироксина в сыворотке крови 187-188, 188р
встречаемость 165, 165р
глюкокортикоидная терапия 224 дифференциальная диагностика 183, 183т затрудненное дыхание и респираторные расстройства 169 йодид 223
йодированные контрастные агенты для рентгенографии 223 карбимазол 210
клинический анализ крови 174-175, 174т концентрация холестерина 177
концентрация кальция и фосфора в сыворотке крови 177
концентрация кортизола в сыворотке крови 178 концентрация натрия и калия в сыворотке крови 178
концентрация общего белка и альбумина в сыворотке крови 177
концентрация паратиреоидного гормона в сыворотке крови 177
кровяное давление и гипертензия 178-179 непереносимость тепла и стресса 170 нервозность, гиперактивность, агрессивное поведение и тремор 168 патоморфология 162-164, 163р полидипсия и полиурия 168 понос и рвота 158-159
потеря веса и полифагия 166-168, 167р
проба с подавлением трийодтиронином 188-192, 189т, 190р, 191р
проба с тиреотропным гормоном 190-192 прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р рентгенография 179, 180р
сканирование щитовидной железы 193-199, 194-199р
слабость и сонливость 170
снижение аппетита 169
сопутствующие заболевания 224
стеаторея 178
стимуляция тиреотропин рилизинг-гормоном 192-193, 192р
тиамазол 204-210, 205р, 207р, 208р тиамин 224
ультразвуковое исследование шейной области 199-201, 200р
уровень азота мочевины и креатинина в крови 176-177
уровень глюкозы в крови 176
физикальное исследование 170-174, 171р, 171т фрукгозамин в сыворотке крови 178 функция почек 201-204
хирургическое лечение 210-216, 212р, 213р, 214т чрескожная термокоагуляция опухолевой ткани 221-222, 222р
чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182, 179т, 181р, 182р этиология 164
эхокардиография 182-183, 183р
опухоль щитовидной железы у собак 228-258 биопсия щитовидной железы 246-247 встречаемость 234, 235, 235т гипертиреоз и 253-257, 255р гистология 232-234, 233т дифференциальная диагностика 247 доброкачественная 232 иммуногистохимия 233-234 классификация 229-230 клинические признаки 235-236, 236т лечение 247-252, 248р, 253р медуллярная карцинома 257-258 обследование в клинике 237 патогенез 230-231, 231р патология 231
прогноз 252-253
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1219
рентгенография 238
синдромы множественной эндокринной неоплазии 234-235, 234т
сканирование щитовидной железы 240-244, 241-
246р
тестирование функции щитовидной железы 244-246,246р
у кошек и 228, 229т
ультразвуковое исследование 238-239, 239р, 240р
физикальное исследование 236-237
частота 234
эктопическая 258
электрокардиография и эхокардиография 238
тестикулярный 1072-1075, 1072-1074р, 1073т синдром феминизации у кобелей 1075-1078 ультразвуковое исследование 1053т
феохромоцитома 472-497
встречаемость 476, 476р, 476т
гормональные тесты 485-487,485т, 486р
диагностика 487
измерение артериального кровяного давления
483-484,484т
клиническая патология 479-480,479р клинические признаки 476-478, 477т, 478т компьютерная и магнитно-резонансная томография 482-483,483р
опухоль коры надпочечников и 274 патофизиология 473-476,474р, 474т, 475т
при множественной эндокринной неоплазии 2А
496-497
прогноз 492
радиоизотопное сканирование 482-484 рентгенография грудной и брюшной полостей 481-482
терапия 491
у собак с диабетом 577
ультразвуковое исследование брюшной полости
480-481,481р, 482р
физикальное исследование 478-479, 478т хирургическое лечение 487-491, 489р, 490т этиология 472-473
Рак апокринных желез заднепроходной пазухи 769т гиперкальциемия и 740т, 741 определение паратиреоидного гормона в плазме крови при 735т
Рак главных клеток 781-782
Рак надпочечников 275
Рак семенников 10782-1075, 1072-1074р, 1072т
синдром феминизиции кобелей и 1075
ультразвуковое исследование 1053т
Рандомизированное определение осмоляльности
плазмы крови 39-40, 39р
Ранитидин
безопасность при беременности 888т
при высокой секреции желудочной кислоты 718
Раннее рассасывание плодов
кошки 1150-1152
собаки 975
Рассасывание плодов
у кошек 1150-1152
у собак 900-906, 901т, 905р, 906р
Расстройства печени
гипогликемия и 685-687
гипокортицизм и 443т
полидипсия и полиурия Ют, 10
при болезни Аддисона 461
при диабетическом кетоацидозе 667
при синдроме Кушинга у кошек 384, 385т
при синдроме Кушинга у собак 312т
Растворимые эфиры стероидов 510, 510т
Растворы свободных стероидных спиртов 510-511, 511т
Расщепленная течка 870-871, 979-980, 1011
Рвота
при введении глипизида 607, 609т
при гастриноме 713, 714т
при гипертиреозе у кошек 168
при диабетическом кетоацидозе 640
при митотановой терапии 352
при первичном гиперпаратиреозе 751
при перекруте семенника у собак 1079
при пиометре открытого типа 950, 950т
при угрозе аборта у собак 904
Реверсивный трийодтиронин в сыворотке крови 127-128
Регидратация при гиперкальциемии 771т
Регуляторные пептиды желудка 710, 711т, 712р
Регуляторные элементы глюкокортикоидов 500
Регуляция секреции АКТГ по механизму отрицательной обратной связи 265
Режим кормления
во время инсулиновой терапии 545
кошек с диабетом 604
Резекционная клиновидная биопсия семенников 1056р, 1057
Резистентность к инсулину 527
при акромегалии у кошек 80
при гиперкортицизме у собак 305
при диабетическом кетоацидозе 669
при сахарном диабете у кошек 589, 590, 626, 628р
при сахарном диабете у собак 571-578, 572р, 573т, 574т
при транзиторном диабете у кошек 595-596, 596р
при феномене Сомоги 565
у щенных сук 877
Рекомбинантный гормон роста человека 65
Рекомбинантный инсулин человека 540
короткого действия 567, 567р
Рекомбинантный человеческий эритропоэтин 823-825 Релаксин
роды у собак и 891
у щенных собак 881-883, 882р
Ренин 822, 825-828, 825р
влияние катехоламинов 475т
усиление биосинтеза и секреции при первичном
гиперальдостеронизме 412
Ренин-ангиотензиновая система 825-828, 825р
секреция альдостерона и 423,425р
секреция вазопрессина и 8-9
Реноваскулярная гипертензия 827
Рентгенография
кошки
при акромегалии 83, 83р
при гиперкортицизме 401
при гипертиреозе 180, 181р
при гипокортицизме 467
при диагностике беременности 1144
при диабетическом кетоацидозе 651
при инсулин-секретирующей опухоли 695
при феохромоцитоме 482-483
собаки
при аборте 905, 906р
1220
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
при гиперкальциемии 766
при гиперкортицизме 295-297, 296р, 297р
при гипокортицизме 444, 445р
при гипотиреозе 118, 119р
при диагностике беременности 878-879, 879р
при дистоции 914
при затянувшейся беременности 918
при злокачественной опухоли щитовидной железы 238
при опухоли семенника 1074
при оценке репродуктивности кобелей 1051-1052, 1052т
при первичном гиперпаратиреозе 758-759, 758р, 759р
при пиометре 952, 953р
при планировании кесарева сечения 917
при послеродовом эндометрите 920
Рентгенография брюшной полости
при аборте у собак 905, 906р
при гиперкортицизме у кошек 401,
при гиперкортицизме у собак 295-296, 296р
при диабетическом кетоацидозе 651
при диагностике беременности у собак 878-879,
880р
при затянувшейся беременности 914
при опухоли семенников у собак 1074, 1074р
при опухоли, секретирующей инсулин 695
при пиометре 952, 953р
при планировании кесарева сечения 914
при феохромоцитоме 481
Рентгенография грудной полости
при гиперкортицизме у собак 296-297
при гипертиреозе у кошек 179
при диабетическом кетоацидозе 651
при легочной тромбоэмболии 307, 307р
при опухоли щитовидной железы у собак 238
при первичном гиперпаратиреозе у собак 758, 758р при феохромоцитоме 481-482
Репаглинид 611
Репродукция, см. Репродукция сук, Репродукция кобелей, Репродукция кошек
Репродукция кобелей 1032-1128
бесплодие 1099-1118
азооспермия 1105-1109, 1105т, 1106р, 1107р, 1109р
аномальная семенная жидкость 1113-1114 астенозооспермия 1110-1113,1112р
врожденное бесплодие и нормальное либидо 1115
классификация 1099, 1100т
лечение 1115-1118
нормальное количество сперматозоидов и семенной жидкости 1114
олигоспермия 1109
оценка кобеля до оценки суки 965-966
первичная оценка 1099-1102, 1101-1102т пониженное либидо 1102-1104, 1103т приобретенное бесплодие и нормальное либидо 1104-1105, 1104т
тератозооспермия 1109-1110, 11 Пр
гипотиреоз 112
искусственное осеменение 1119-1128
замороженная сперма 1125-1128, 1127р
показания 1119
свежая обогащенная сперма 1124-1125, 1125т
свежая сперма 1120-1124, 1120-1123р клиническая и диагностическая оценка 1032-1058
анамнез 1032
аспирационная биопсия придатков семенников 1054-1055
аспирационная биопсия семенников 1053-1054, 1054р
биопсия семенников 1055-1057,1055т, 1056р кариотипирование 1057
микробиологические исследования 1045-1047, 1046т
оценка гормонального статуса 1048-1051, 1048т, 1049р, 1049т
оценка спермы 1034-1045, 1035-1037р, 1040-1043р, 1041т, 1044т
проба на Brucella canis 1047-1048 рентгенографическое и ультразвуковое исследование 1051-1054, 1052р, 1053т, 1054т физикальное исследование 1032-1034, ЮЗЗр щелочная фосфатаза в сперме 1045
нарушения пениса и препуция 1059-1067 баланопостит 1065-1066
врожденная деформация кости пениса 1060-1061 выделения из препуция 1064-1065
гипоплазия пениса 1059-1060
гипоспадия 1060 неоплазия 1067 неспособность достичь эрекции 1063-1064 парафимоз 1061-1062, 1062р приапизм 1062-1063
пролапс уретры 1064-1065, 1064р раздвоение пениса 1061
сохранение уздечки пениса 1059, 1060т травма пениса 1066-1067, 1066р фимоз 1061
нарушения семенников
аденомиоз придатков семенников 1085 аплазия протоков 1071-1072
болезни мошонки 1086, 1086р гипоплазия семенников 1071 дегенерация семенников 1084-1085, 1084т крипторхизм 1068-1071, 1069р, 1069т лимфоцитарный орхит 1082-1084, 1082р, 1084т опухоли 1072-1075, 1073р, 1073т, 1074р, 1075р острый инфекционный орхит 1079-1082, 1080р пахово-мошоночная грыжа 1085-1086 перекрут семенников 1078-1079, 1078р синдром феминизации 1075-1078, 1076р, 1077р сперматоцеле 1085
хронический орхит 1082
простатит 1088-1098
бесплодие и 1088
острый бактериальный 1088-1095, 1089т, 1090р, 1092р, 1093р
хронический инфекционный 1095-1098, 1097р, 1097т
Репродукция кошек 1130-1163
коты 1161-1163
кошки 1130-1161
анатомические особенности ИЗО
анэструс 1137
беременность 1143-1144, 1144т
бесплодие! 156-1160, 1157р
внематочная беременность 1145-1146 гиперплазия молочных желез 1149-1150
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 1221
дистоция 1146-1147
диэструс 1136-1137
задержка плаценты 1148
индукция овуляции 1137-1138, 1138р
искусственное осеменение 1142-1143
кистозная гиперплазия эндометрия 1152-1155,
1152т, 1153т
контрацепция 1160-1161
ложная беременность 1139-1140, 1139р, 1140р материнский уход и ручное вскармливание котят-сирот 1148-1149, 1149т
межэстральный период 1136
неадекватная забота о котятах 1148
незапланированная вязка 1161
острый метрит 1148
половая зрелость и оптимальный возраст для
размножения 1130-1131
половое поведение во время течки 1140-1142,
1140р, 1141т
послеродовое вагинальное кровотечение 1147, 1147р
предродовое вагинальное кровотечение 1146
пролапс матки 1148
проэструс 1131-1132, 1132р
роды 1144-1145
сезонность эстральных циклов 1131
смертность котят 1147, 1147р
спонтанный аборт 1150-1152
субинволюция плацентарных мест 1147-1148
эструс и фолликулярные фазы 1133-1136, 1134р, 1135р
эструс у кастрированных кошек 1160
Репродукция сук 832-1030
аномалии половых желез 994-996, 996р
аномалии фенотипического пола 996-997
аномальное половое развитие 992-993
аномальный хромосомный пол 993-994, 995р
безуспешные вязки 997-998, 998р
беременность и 874-890
диагноз 878-883, 879-882р, 881т
изменение функции щитовидной железы и коры надпочечников 877
изменения уровня глюкозы 877
кормление 886, 890
последовательность событий 875
применение медикаментозных препаратов 883-886
прогестерон 876, 877р
продолжительность беременности 877, 878р
размер помета 875
эстроген и 876-877
бесплодие 965-990
Brucella canis 973
анамнез 966, 967-968т
анэструс, индуцированный медицинскими
препаратами 984-985
аутоиммунный оофорит 980
гипотиреоз и 985
заболевание матки 979
идиопатическая пролонгация межэстрального интервала 980-981
идиопатическое сокращение овариальных циклов
977-979, 978р
избыток глюкокортикоидов 985
индукция эструса 986-988, 988т
инфекция 973-975, 974р
киста яичников, секретирующая прогестерон 986 кисты яичников или неоплазия 981
недостаточность функции желтого тела 976 общее состояние здоровья 969-970
окклюзия матки или яйцеводов 976, 977р
отсутствие овуляции 980
оценка кобеля 965-966, 967т
первичные подходы 970-973, 971р
предшествующая овариогистерэкгомия 982-984, 983р
преждевременное угасание яичников 985-986
проведение вязок владельцем 969
раннее рассасывание плода 975
расщепленная течка 979
скрытая течка 984
стойкий проэструс 988-990, 968т
стресс и 985
физикальное исследование 966-969, 967т, 969р
фолликулярные кисты 979, 982р
хирургическая диагностика 986
хронический эндометрит 975
ятрогенное сокращение межэстрального интервала 980
вагинит 1015-1017, 1015р, 1017т
врожденные дефекты влагалища и вульвы 1000-1005
диагностика 1003-1005, 1004р
клинические признаки 1001-1002, 1002р
лечение 1005
пороки эмбрионального развития 1000-1001,
1001р
выделения из влагалища 1009-1013, 1009т, 1010-
1012р
гиперплазия и пролапс влагалища 1007т заболевания в предродовом, во время родов и послеродовом периодах 897-928
агалактия 927
акромегалия в диэструсе 927, 928р
введение окситоцина в конце родов 920
внематочные плоды 900
выделения из половых органов 918-919
гипогликемия 927
дистоция 907-917, 907р, 907т, 908р, 911р, 912р,
915р
задержка плаценты 922
затянувшаяся беременность 917-918
клиническая ложная беременность 897-900
мастит 925-927
нормальное состояние 897
послеродовой эндометрит 920
сахарный диабет 927-928
системное заболевание 919-920
спонтанный аборт и рассасывание плодов 900-
906, 901т, 906р
субинволюция плацентарных мест 1147-1148
эклампсия 922-925, 924р
индукция аборта 930-939
агонистами дофамина 940
аналогами простагландинов 938-939
антагонистами гонадотропин рилизинг-гормона 942
антипрогестиновой терапией 939-940
введением простагландинов 935-938
глюкокортикоидами 941
до имплантации 933-935
1222
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
комбинацией агонистов дофамина и простагландинов 940 овариогистерэктомия 932
первичное обследование 930-932, 931р, 932р
после незапланированной вязки 941-942
тамоксифенацитратом 941
триместры беременности и 932, 933р инфекция Brucella canis 1019-1028
клинические признаки 1020 культивирование 1022-1023, 1023т лечение 1023-1024,1024т
профилактика и контроль 1024-1025 серологические тесты 1020-1023, 1021т трансмиссия 1019-1020
искусственное осеменение 862-869 внутривлагалищное 863-866, 864р, 866р показания 862
трансцервикальное 866-869, 866-868р успешность 862
кистозная гиперплазия эндометрия 948-964 антипрогестагены 963
встречаемость и анамнез 950-951, 950т
долгосрочное лечение 963
индуцированная медикаментозными средствами 972
клиническая патология 951-952
осложнения на почки 955
патофизиология 948-951
пиометра закрытого типа 962-963
пиометра культи 956-957,956р
пиометра открытого типа 961-962
полидипсия и полиурия 954 простагландины 958-961 рентгенография 952, 953р ультразвуковое исследование 952, 954р физикальное исследование 951 хирургическое лечение 957-958, 957р цитология влагалища и культивирование 955, 955т
нормальное половое развитие 992, 992т, 993р овариальный цикл 832-852
анэструс 851-852
диэструс 848-851, 850р
интервалы между циклами 833
классификация клеток влагалища 839-843, 838-841р
начало полового созревания 832 предотвращение овариального цикла 942-946, 943т, 945р, 945т
проэструс 833-839, 834р, 835р
сезонность 838
цитология влагалища во время 839-842, 842р, 843р, 852-857, 853р, 856-857р
эструс 843-848, 843р, 846р
оплодотворение 869-870, 869р
опухоли влагалища и входа во влагалище 1013-1015, 1013р,1014т
опухоль яичника 991
половое поведение 859-862, 861р, 861т
проведение вязок 870-875
роды 890-895
коробка для родов и помета 891-892, 892р нормальная инволюция матки 893-895
стадии родовой деятельности 892-893, 894р эндокринология 890-891
синдром кисты яичника 991-992 трансмиссивная венерическая опухоль 1025-1028, 1026р, 1027р
Респираторные расстройства при акромегалии у собак 90 при гиперкортицизме у собак 284-285 при гипертиреозе у кошек 169
Ретикулоцитоз 823
Ретинопатия
при гипертиреозе у кошек 174 травы, добавки и витамины 550т
Ретроградная эякуляция 1105, 1116
Рецептор вазопрессина 4
Рецептор глюкокортикоидов 500-501
Рецептор кинина 825
Рецептор минералкортикоидов 501
Ритм галопа 172
Роды
кошки 1144-1145
собаки 890-895
коробка для родов и помета 891-892, 892р нормальная инволюция матки 894-895 фазы родов 892-893, 894р эндокринология 890-891
Ростовые факторы В клеток 469
Ростовые факторы в щитовидной железе 230
RU486
при гиперкортицизме у собак 366-367
при индукции аборта 939
RU534 при индукции аборта 939
С
Салицилаты 883т, 888т
Сальмонелла при аборте у собак 901т
Сахарный диабет 1 типа 527, 527т
кошки 589-590
собаки 527, 527т
Сахарный диабет 2 типа
кошки 589-590
собаки 527-528
Сахарный диабет у кошек 588-635
акарбоза 613-614
алопеция 71т анамнез 597-598
антиинсулиновые антитела в циркуляции 626 бигуаниды 611-612, 612р
ванадий 613
вариации потребности в инсулине 629-630 встречаемость 597
выявление и контроль сопутствующих проблем 606 гипергликемия при стрессе 621-623 гиперкортицизм у кошек и 380, 380т гиперосмолярный некетоновый 672-674 гипогликемия 622-623
гликемическая кривая 617-620, 618р, 619р гликозилированный гемоглобин, концентрация в крови 616-617, 617т
глюкозурия 617
глюкокортикоиды 520-522
диагноз 598
диетотерапия 603-606, 603т, 605р, 605т
длительное действие инсулина 624-625
задачи терапии 601
изменения в потребности инсулина 629-630
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 1223
ИЗСД и ИНЗСД 596-597, 596т инсулинозависимый 590, 591р инсулинонезависимый 590-594, 592-594р клиническая патология 599-600, бООр контроль гликемии 614-620 кратковременный эффект инсулина 624 меглитиниды 611 начальная инсулиновая терапия 601-603, 602р, бОЗр неадекватная или нарушенная абсорбция инсулина 625-826, 625р недостаточная доза инсулина 623-624 патофозиология 597 полидипсия и полиурия 10, Ют при акромегалии 80, 81р при синдроме Кушинга 386-387 прогноз 632 сопутствующие заболевания, приводящие к резистентности к инсулину 626-629, 628р сульфомочевиновые препараты 607-611, 606т, 607т, 608-6 Юр, 609т тиазолидиндионы 612-613 тип 1 и тип 2 589-590 транзиторный 594-595, 596р феномен Сомоги 623, 624р физикальное исследование 598, 614-615 фруктозамин, концентрация в сыворотке крови 615-616,615т, 616р, 620 хром 613 хронические осложнения 630-632, 631р
Сахарный диабет у собак 526-586
аллергические реакции на инсулин 570-571
анамнез 552-553
антиинсулиновые антитела в циркуляции 568-570, 568р, 569р
встречаемость 533
вторичный 531
гиперкортицизм и 290, 305
гипертензия 581-582
гипогликемия, индуцированная инсулином 563
гипотиреоз 140
гликемическая кривая 556-562, 557-559р гликозилированный гемоглобин в крови 555-556, 556т
диабетическая невропатия 580-581
диабетическая нефропатия 581
диабетическая ретинопатия 580
диетотерапия 542-547, 542т, 543р, 543т дифференциальная диагностика 312т индуцированная инсулином гипогликемия 563 инсулинзависимый 529-530, 529т инсулинонезависимый диабет 530 инсулинорезистентность 571-578, 572р, 573р, 574т инсулинотерапия 538-542, 539р, 542т, 550-552, 552р аллергическая реакция на инсулин 570-571 во время хирургической операции 562-563 контроль глюкозы в моче 565-567, 565р кратковременное действие инсулина 567-568 неадекватная абсорбция инсулина 562 недостаточная доза 565
пролонгированное действие инсулина 568 феномен Сомоги 565-567, 565р
катаракта 579-580
клиническая патология 535-538р, 535т, 538т
мониторинг уровня глюкозы в моче 556 патофизиология 532-533
пероральные гипогликемические средства 547-550, 548р, 549р, 550т
после удаления инсулин-секретирующей опухоли 700-701
проба со стимуляцией АКТГ 318
прогноз 584
при гиперкортицизме 290, 305
резистентность к инсулину 571-578, 572р, 573Т, 574т сопутствующие заболевания 660-552 тип 1 527, 527т тип 2 527-528
транзиторный 530-531, 531р
трансплантация панкреатических островков 582-
584, 583р
увеит, индуцированный помутнением хрусталика 580
у щенных сук 927-928
установление диагноза 534-535, 535т
феномен Сомоги 565-567, 565р
физикальное исследование 534, 552-553
физическая нагрузка 547
фруктозамин в сыворотке крови 553-555, 554р, 554т, 562
циркулирующие антиинсулиновые антитела 568-570, 568р, 569р
Сахаропонижающие средства 611-613
акарбоза 613-614
бигуаниды 611-612, 612р
ванадий 613
меглитиниды 611
при сахарном диабете у собак 547-550, 548-549р, 550т
сульфонилмочевинные 607-611, 607т, 608р, 609т,
6 Юр
тиазолидиндионы 612-613
хром 613
Свежая обогащенная сперма для искусственного
осеменения 1124-1125, 1125т
Свежая сперма для искусственного осеменения 866, 1125-1128, 1127р
Свободные жирные кислоты, кетоновые тела 635
Свободные стероидные спирты 510-511,511т
Свободный тироксин
заместительная терапия тироксином 148, 150
при гиперкортицизме у собак 295
при гипертиреозе у кошек 187-188, 187р
при гипотиреозе у собак 126-127,127р
Свободный трийодтиронин в сыворотке крови 127
Себорея 283, 283р
Сегментная аплазия 1071
Сезонность
влияние на свойства семенной жидкости у собак 1043
овариальный цикл у собак 832
эстральный цикл у кошек 1131
Секретин 711т
Селегилин 366
Селен 164-165
Семейный нефрогенный несахарный диабет 19-20
Семенная жидкость, аномальная 1113-1114
Семенники
кобель
абсцесс 1053т
аденомиоз придатка семенника 1085
аплазия семенных протоков 1071-1072
1224
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
атрофия при гиперкортицизме 286-287, 288 взаимосвязь с объемом спермы 1044 врожденные дефекты 1115 гипоплазия 1071-1072 дегенерация 1084-1085, 1084т действие катехоламинов 475т
изменения половых гормонов при заболеваниях 1049т
киста 1053т
крипторхизм и 1068-1071, 1069р, 1069т лимфоцитарный орхит 1082-1084, 1083р, 1084т нарушения мошонки 1085-1086, 1086р опухоли 1072-1075, 1072-1074р, 1073т острый инфекционный орхит 1079-1082, 1080р пахово-мошоночная грыжа 1085-1086 перекрут 1053т, 1078-1079, 1079р синдром феминизации кобелей и 1075-1078, 1076р, 1077р сперматоцеле и 1085
ультразвуковое исследование 1051-1053, 1052-1053т
физикальное исследование 1032-1034 хронический орхит 1082
кот 1161-1163
Семенники, биопсия 1053-1054, 1054р, 1055р при аномальной семенной жидкости 1114 при бесплодии кобелей 1104, 1107р, 1108, 1109р при лимфоцитарном орхите 1083, 1О83р при тератозооспермии 1110 при хроническом орхиэпидидимите 1082
Семенной канатик 1034
Семинома 1072, 1073р
Сепсис
гиперкальциемия и 741 гипогликемия и 690 при глюкокортикоидной терапии при диабетическом кетоацидозе 666
Септицемия
при дифференциальной диагностике полидипсии и полиурии Ют
при пиометре 957
Септический шок 515
Сердечная аритмия
при гипертиреозе у кошек 171-172
при феохромоцитоме 491
Сердечная недостаточность натриуретический пептид предсердия 828-829 при гипотиреозе у собак 112-113
Сердечно-сосудистые средства 888-889т
Сердечный шум у кошек при гипертиреозе 171-172 Сердце
гиперкалиемия и 444
гипогликемия и 690
гипокальциемия и 794
действие глюкокортикоидов 503 действие катехоламинов 474, 475т действие пептида, родственного паратиреоидному гормону 737т
мониторинг при введении кальция 924
при акромегалии у кошек 82 при гипертиреозе у кошек 171-172 при гипокортицизме 444, 445р при гипотиреозе у собак 112-113
Серийная сахарная кривая
при сахарном диабете у кошек 617-620, 618р, 619р
при сахарном диабете у собак 556-562, 557р, 558р, 559р
Серологические тесты
на Brucella canis 1021-1023, 1022т, 1023т
на микоплазму и уреаплазму 1047
Сетчатая зона 267
Симптом Хвостека 797-798
Синаптофизин 473
Синдром Вернера-Моррисона 722
Синдром Ди Георге 805
Синдром Золлингера-Эллисона 713-720
встречаемость 714
диагностическая визуализация 715
клиническая патология 715
клинические признаки 714, 714т
концентрация гастрина в сыворотке крови 716 медикаментозное лечение 719-720
проба со стимуляцией гастрином 716
проба со стимуляцией секретином 717 провокационная проба с кальцием 717-718, 717р тестирование секреторной функции желудка 718 физикальное исследование 714-715 хирургическое удаление 718-719, 719т эндоскопия 715, 715р
Синдром инсулинорезистентности, тип А 578
Синдром инсулинорезистентности, тип В 578
Синдром Картагенера 1113
Синдром Кушинга
кошки 376-414
биопсия под контролем ультразвука биохимия сыворотки крови 384-388, 385т встречаемость 378, 379т гипофизэктомия 404-406
двусторонняя адреналэктомия 408-410 загибание кончиков ушей 382 клинический анализ крови 384, 384т кожные расстройства 382-383, 383р компьютерная и магнитно-резонансная томография 403-404,404р, 404т концентрация эндогенного АКТГ в плазме крови, определение 399-401
лечение опухоли надпочечника 410-411 медикаментозное лечение 407-408 модифицированная проба с лишением жидкости 33
облучение гипофиза 406
основные жалобы 379, 379т
отношение кортизол:креатинин в моче 388-390, 390т, 391т
полидипсия и полиурия 13
полиурия и полидипсия 381-382
потеря веса 382
проба с высокими дозами дексаметазона 397-399, 397т, 399т
проба с низкими дозами дексаметазона 393-396 проба со стимуляцией АКТГ 390-393 продолжительность клинических признаков 378, 379т
рентгенография брюшной полости 401 слабость, сонливость, отвеслый живот, кровотечения 382
ультразвуковое исследование брюшной полости 401-402, 402т
физикальное исследование 380-382, 380т, 381р собаки 262-374
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1225
атрофия семенников 286-288
биопсия печени 328-329
бромокриптин 365
встречаемость 276-277, 276р, 276т, 277р
гипертензия 302-303
L-депренил 366
дифференциальная диагностика 312-313, 312т
застойная сердечная недостаточность 304 кетоконазол 362-364, 362т, ЗбЗр
кожные маркеры 281-284, 282-284р
компьютерная томография 335-338, 336-337р
концентрация 17-гидроксипрогестерона в плазме крови 326-328, 328т
концентрация кортизола в плазме крови 315 концентрация эндогенного АКТГ 330-332 легочная тромбоэмболия 305-309, ЗОбр, 306т, 307р, 309р
лицевой паралич 287
магнитно-резонансная томография 338-340, 339р, 341р
макроопухоли гипофиза 310-312, ЗЮр, ЗПр, 311т
метирапон и аминоглютетимид 365-366
миотония 287, 287р
митотан 349-362, 350т, 352р, 354р, 356р
мочевые камни 304
мышечная слабость, сонливость и хромота 280-281
облучение гипофиза 367-368
ожирение 285
отношение кортизол:креатинин в моче 315-318, 334
отсутствие эструса 286-287
оценка оси гипофиз-надпочечники 313, 314р
панкреатит 304
патология 274-275
патофизиология 268-274, 269р, 270р
пиелонефрит 303-304
полиурия и полидипсия 279
полифагия 279
проба с высокими дозами дексаметазона 332-333, 332-334р
проба с дексаметазоном 322-326, 323р
проба с метирапоном 335
проба с низкими дозами дексаметазона 329-330, 329р
проба со стимуляцией АКТГ 318-321, 319-320р, 319т
пробы с кортикотропин рилизинг-гормоном и вазопрессином 335
радиоизотопное исследование 340
расстройства дыхания 284-287
регуляция секреции глюкокортикоидов 263-268, 264р, 267р
рентгенография 295-297, 296р, 297р
RU486 365
сахарный диабет и 305
спонтанная ремиссия 369
трилостан 364-365
увеличение живота 279-280, 280р
ультразвуковое исследование брюшной полости 298-302, 299т, 301р
физикальное исследование 287, 287т хирургическое лечение 342-349, 344р ципрогептадин 365
чувствительность и специфичность скрининговых
тестов 315, 316т
этомидат 366
Синдром культи яичника 991-992
Синдром лизиса опухолей 810
Синдром нарушенной секреции антидиуретического
гормона 47-48,47т
Синдром неожиданно приобретенной дегенерации
сетчатки 289
Синдром неподвижных ресничек 1113
Синдром нечувствительности к гормону роста 58
Синдром, подобный врожденной гиперплазии
надпочечников 73
Синдром, подобный синдрому Фанкони 11
Синдром феминизации у самцов 1075-1078, 1076р,
1077р
Синдром Шмидта 102,421
Синдром эктопического АКТГ 273
Синдром эутиреоидной патологии
мегаэзофагус и 113
у кошек 155
Синтетические кортикостероиды 500р, 507
Синтетические простагландины 963
Синусовая брадикардия 112
Синусовая тахикардия 182
Системное заболевание
синдром эутиреоидной патологии 137-138
спонтанный аборт и рассасывание плодов 900
Сканирование легких
при гиперкортицизме у собак 285-286
при легочной тромбоэмболии 307, 307р
Сканирование с метайодбензилгуанидином 482
Сканирование щитовидной железы
при гипертиреозе у кошек 193-199, 194т, 194-199р
при гипотиреозе у собак 119, 121
при опухоли щитовидной железы у собак 240-244,
241-246р
Скелетная мышца
действие пептида родственного паратиреоидному
гормону 737т
миотония при гиперкортицизме у собак 287, 287р
Склонение головы при гипертиреозе у кошек 173
Скорость клубочковой фильтрации
при гиперкальциемии 731
при гипертиреозе у кошек 203-204
при диабетическом кетоацидозе 643, 644т
Скрининговый тест с дексаметазоном
при гиперкортицизме у собак 322-325, 323р
при синдроме Кушинга у кошек 393-396
Скрытая течка
кошки 1158
собаки 832, 981, 984
Слабительные средства 888т
Слабость
при гиперкортицизме у собак 280-281, 281р
при гипертиреозе у кошек 170, 173
при гипогликемии 682
при гипокальциемии 804
при гипопаратиреозе 798
при диабетическом гиперосмолярном некетоновом
синдроме 673
при диабетическом кетоацидозе 641
при митотановой терапии 352
при первичном гиперальдостеронизме 413
при первичном гиперпаратиреозе 750-751
1226
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
при синдроме Кушинга у кошек 382
при феохромоцитоме 476
Слепота
при феохромоцитоме 477, 479
у собак при диабете 533, 533р, 580
Слизистогнойные выделения из препуция 1065
Смерть котят 1147, 1147р
Смерть плодов 914
Сперма
микробиологическая оценка 1045
наполнители для хранения на холоду 1125-1126
сбор
у кобелей 863-865, 863р, 864р, 1036-1038, 1036р
у котов 1162
Собаки
акромегалия 89-91
бесплодие у кобелей 1099-1118
азооспермия 1105-1109, 1105т, 1106р, 1107р, 1109р
аномальная семенная жидкость 1113-1114 астенозооспермия 1110-1113,1112р гормональная оценка 1048-1051, 1048т, 1049р, 1049т
кариотипирование 1057
классификация 1109, 1100т
лечение 1115-1118
микробиологическое исследование 1045-1047, 1046т
нормальные количество сперматозоидов и семенной жидкости 1114
олигоспермия 1109
оценка спермы 1034-1045, 1035-1037р, 1040-1044р
первичная оценка 1100, 1100-1102т
пониженное либидо 1102-1104, 1103т приобретенное бесплодие и нормальное либидо 1104-1105, 1104т
тератозооспермия 1109-1110, 11 Пр рентгенологическое и ультразвуковое исследование 1051-1053, 1052р, 1052т, 1053т тест на Brucella canis 1047-1048
физикальное исследование 1032-1034, ЮЗЗр
щелочная фосфатаза в сперме 1045
бесплодие у сук 965-990
Brucella canis 973
анамнез 966, 967-968т
анэструс, индуцированный медицинскими препаратами 984-985
аутоиммунный оофорит 980
гипотиреоз 985
заболевание матки 979
идиопатическое сокращение овариальных циклов 977-979, 978р
идиопатическое удлинение межэстрального интервала 980-981
избыток глюкокортикоидов 985
индукция эструса 986-988, 988т
инфекция 973-975, 974р
киста яичника, секретирующая прогестерон 986 недостаточность функции желтого тела 976 общее состояние здоровья 969-970 овариальные кисты или неоплазия 981 окклюзия матки или яйцеводов 976, 977р отсутствие овуляции 980
оценка кобеля 965-966
первичные подходы 970-973, 971р предшествующая овариогистерэктомия 982-984, 983р
преждевременное угасание яичников 985-986 проведение вязок владельцем 969 раннее рассасывание плодов 975
расщепленная течка 979
скрытая течка 984
стойкий проэструс 988-990, 990р, 968т физикальное исследование 966-969, 967т, 969р фолликулярные кисты 979, 982р хирургическая диагностика 986
хронический эндометрит 975
ятрогенное сокращение межэстрального интервала 980
гастринома 713-720
встречаемость 714
диагностическая визуализация 715
клиническая патология 715
клинические признаки 714, 714т
концентрация гастрина в сыворотке крови 716 медикаментозное лечение 719-720 определение секреции гастрина 716 проба на стимуляцию гастрина 716-717 проба со стимуляцией секретином 717 провокационная проба с кальцием 717, 717р физикальное исследование 714-715 хирургическое удаление 718-719, 719т эндоскопия 715-716, 715р
гиперкортицизм 262-375
азот мочевины в крови 291
аланинаминотрансфераза 292
амилаза и липаза 293
анализ мочи 294-295
атрофия семенников 286-287, 288
биопсия печени 328-329
встречаемость 276-277, 276р, 276т, 277р гипертензия 302-303
L-депренил 366
дифференциальная диагностика 312-313, 313т желчные кислоты 293
застойная сердечная недостаточность 304 кетоконазол 362-364, 362т, ЗбЗр клинический анализ крови 289-290 кожные маркеры 281-284, 282-284р компьютерная томография 335-338, 336-338р концентрация 17-гидроксипрогестерона в плазме крови 326-328, 328т
концентрация глюкозы и инсулина в сыворотке крови 290
концентрация кортизола в сыворотке крови 315 концентрация эндогенного АКТГ в сыворотке крови 330-332
легочная тромбоэмболия 306т
лицевой паралич 287
магнитно-резонансная томография 338-340, 339р, 341р
макроопухоли гипофиза 310-312, 310-311р, 311т метирапон и аминоглютетимид 365-366 миотония 287, 287р
митотан 349-362, 350т, 352р, 354р, 356р
мочевые камни 304
мышечная слабость, сонливость и хромота 280-281
облучение гипофиза 367-368
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1227
ожирение 285
отношение кортизол:креатинин в моче 315-318
отсутствие эструса 286-287
оценка оси гипофиз-надпочечники 313, 314т
панкреатит 304
патология 274-275
патофизиология 268-274, 269р, 270р
пиелонефрит 303-304
полифагия 279
проба с дексаметазоном 322-326, 323р
проба с кортикотропин рилизинг-гормоном и
вазопрессином 335
проба с метирапоном 335
проба с подавлением высокими дозами
дексаметазона 332-333, 332-334р
проба с подавлением низкими дозами
дексаметазона 329-330, 329р
провокационная проба с АКТГ 318-321, 319р,
319т, 320р
радиоизотопное сканирование 340
расстройства дыхания 284-287
регуляция секреции глюкокортикоидов 263-268,
264р, 267р
рентгенография 295-297, 296р, 297р
RU486 365
сахарный диабет при 305
спонтанная ремиссия 369
тестирование щитовидной железы 295, 295р
трилостан 364-365
увеличение живота 279-280, 280р
ультразвуковое исследование брюшной полости
298-302, 299т, 301р, 302р
физикальное исследование 287, 287т
фосфат в сыворотке крови 293
хирургическое лечение 342-349, 344р
холестерин, триглицериды и липемия 292, 292р
ципрогептадин 365
чувствительность и специфичность скрининговых тестов 315, 316т
щелочная фосфатаза в сыворотке крови 291-292, 292р
электролиты в сыворотке крови 293
этомидат 366
гипокортицизм 418-469
азот мочевины и креатинин в крови и анализ мочи 439-440
анамнез 429-430,430т
ацидоз и 459, 459р
встречаемость 428-429, 429т
вторичный 466
гиперкальциемия 440-442, 441т
гипогликемия 440,441т
гипонатриемия и гиперкалиемия 432-440,433т, 434р, 434т, 435р лечение гиповолемии и гипотензии 455-457,456р
глюкокортикоидная терапия 457, 465-466 долгосрочное лечение 461-465,462т, 462р, 463р заместительная солевая терапия 466 исторические сведения 418-419
кислотно-щелочной статус 442
концентрация альдостерона в сыворотке крови 450-452,451р
концентрация кортизола в сыворотке крови 447-450,448т, 449р, 450р
концентрация эндогенного АКТГ 452-454, 453р
кровяное давление 442
лечение электролитного дисбаланса 457-459
ответ на лечение 459-460
параметры лейкоцитов 431, 431т
параметры эритроцитов 431
патофизиология 423-428, 425р, 426р
прогноз 406
рентгенография 444, 445р
сопутствующие проблемы 460-461
тестирование функции печени 442-443, 443т
физикальное исследование 430-431, 431т
электрокардиография 444-447, 446р
этиология 419-423,420р, 420т
гипопаратиреоз 795-798, 795р, 795т, 797т
гипотиреоз 99-152
аутоантитела к тиреоидным гормонам 133, 135, 143
базальный уровень общего тироксина в сыворотке крови 122-125, 122р, 124т, 125т базальный уровень общего трийодтиронина в
сыворотке крови 125-126, 125р
базальный уровень реверсивного
трийодтиронина в сыворотке крови 126-127,
126р, 127р
базальный уровень свободного тироксина в
сыворотке крови 126-127, 126р, 127р
базальный уровень свободного трийодтиронина в
сыворотке крови 127
базальный уровень тиреотропина в сыворотке крови 128-130, 129р
величина К 133
возраст 136,136р
встречаемость 101т, 107
вторичный 115
гистопатологические изменения кожи 118, 118т
голодание и кахексия 141
грубые препараты животного происхождения 151
желудочно-кишечные признаки 113
изменение поведения 114
классификация 99
клинико-патологические нарушения 115-118,
118т
коагулопатии 113-114
кожные признаки 109-110, 109р
комбинация препаратов тироксин-трийодтиронин 151
контроль лечения 148-150
кретинизм 114-115, 115т, 116р
левотироксин натрия 145-150, 146-148т, 147р, 149р
лекарственные препараты 141-143,142т
лиотиронин натрия 150-151
метаболические нарушения 108-109
микседема 114
нервномышечные нарушения 111-112
ожирение 141
окружающая среда и температура тела 141
офтальмологические нарушения 113
пол и репродуктивный статус у сук 137
порода и размер тела 136-137, 136р
постановка диагноза 144-148
проба с поглощением трийодтиронина смолой 130
проба со стимуляцией тиреотропин рилизинг-гормоном 131-133, 132р, 132т, 133р
1228
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
проба со стимуляцией тиреотропином 130-131, 130р, 131р
прогноз 151-152
радиоизотопное сканирование 119-120, 121р
рентгенография 118, 118р
репродуктивные нарушения 112 сердечно-сосудистые нарушения 112-113 сопутствующие заболевания 137-139, 139р суточный ритм 137
тиреотоксикоз и 150
ультразвуковое исследование 118-119, 119р, 120р физическая нагрузка 141
флуктуации 137, 138р
этиология 99-107, 99т, ЮОр, 102т, 1 ОЗр глюкагонома 720-721
заболевания семенников и их придатков 1068-1087 аденомиоз придатков семенников 1085 аплазия системы протоков 1071-1072 гипоплазия семенников 1071
дегенерация семенников 1084-1085, 1084т заболевания мошонки 1086, 1086р крипторхизм 1068-1071, 1069р, 1069т лимфоцитарный орхит 1082-1084, 1083р, 1084т опухоли 1072-1075, 1073р, 1073т, 1074р острый инфекционный орхит 1079-1082, 1080р пахово-мошоночная грыжа 1085-1086 перекрут 1078-1079, 1079р
синдром феминизации кобелей 1075-1078, 1076-1078р
сперматоцеле 1085
хронический орхит 1082
инфекция Brucella canis 1019-1028
агглютинация спермы 1114
клинические признаки 1020 культивирование 1022-1023 лечение 1023-1024, 1024т оценка репродуктивности кобелей 1047-1048 передача 1019-1020
при остром орхиэпидидимите 1080 профилактика и контроль 1024-1025
серологические тесты 1020-1023
искусственное осеменение 1119-1128 замороженная сперма 1125-1128, 1127р показания 1119
свежая обогащенная сперма 1124-1125, 1125т свежая сперма 1120-1124, 1120-1123р
опухоль бета-клеток 677-707
анамнез 683-684
встречаемость 683, 683т
гипогликемия и контррегуляторный ответ 678-680, 679т
гипогликемия, вызванная инсулином 681 диагностика гипогликемии 691-695, 692р диагностическая визуализация 695-696, 696р дифференциальная диагностика гипогликемии натощак 685-691, 686т, 687р, 688т клиническая патология 670, 684-685 клинические признаки 681-682, 681т, 682т, 682р определение инсулина в сыворотке крови 693-695, 694р
прогноз 706-707
секреция инсулина 680
терапия острого гипогликемического криза 702-703,703р
терапия хронической гипогликемии 703-705, 705р
физикальное исследование 684, 684т
хирургическое лечение 697-702, 697т, 698р, 701т этиология 677
эугликемия 678, 678р
карциноиды 723-724, 724т
множественная эндокринная неоплазия 497
нарушения пениса и препуция 1059-1067
баланопостит 1065-1066
врожденная деформация кости пениса 1060-1061 гипоплазия пениса 1059-1060
гипоспадия 1060
опухоль 1067
отсутствие эрекции 1063-1064
парафимоз 1061-1062, 1062р
препуциальные выделения 1064-1065
приапизм 1062-1063
пролапс уретры 1-64-1065, 1064р
раздвоение пениса 1061
сохранение уздечки пениса 1059, 1060т
травма пениса 1066-1067
фимоз 1061
опухоль щитовидной железы 228-258
биопсия щитовидной железы 246-247
встречаемость 234, 235, 235р
гипертиреоз и 253-257, 255р
гистология 232-234, 233т
дифференциальный диагноз 247
доброкачественная 232
иммуногистохимия 233-234
классификация 229-230
клинические признаки 235-236, 236т
лечение 247-250, 248р, 253р
медуллярная карцинома 257-258
обследование в клинике 237
патогенез 230-231, 231р
патология 231
прогноз 252-253
рентгенография 238
синдром множественной эндокринной неоплазии и 234-235, 234т
сканирование щитовидной железы 240-244, 241-
246р
тестирование функции щитовидной железы 244-
246, 246р
у кошек и 228, 229р
ультразвуковое исследование 238-239, 239р, 240р физикальное исследование 236-237
частота 234
эктопическая 258
электрокардиография и эхокардиография 238
оценка репродуктивного тракта у кобелей 1032-1058
анамнез 1032
аспирация придатков семенников 1054
аспирация семенников 1053-1054, 1054р
биопсия семенников 10-53-1054, 1055т, 1056р
первичный гиперальдостеронизм 371
первичный гиперпаратиреоз 748-783
анализ мочи 757
анамнез 749-752, 763р, 764р
биохимический анализ сыворотки крови 753-757, 753т, 754-755р, 756т
газовый анализ крови 757-758
гормональное тестирование 761, 761 р избирательный анализ образцов венозной крови 762
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1229
исходная база данных 765-766
лечение возможной послеоперационной гипокальциемии 778-771, 778р, 779р, 780т множественная эндокринная неоплазия 783 наследственный неонатальный 783 неотложная терапия 768-773, 769-771т одиночная паратиреоидная опухоль 781-782 оценка лимфатических узлов и костного мозга 766-767
паратиреоидная ткань в средостении 783
прогноз 783
радиоизотопное сканирование 762 рентгенография 758-759, 758р, 759р ультразвуковое исследование 759-761, 760р физикальное исследование 752
химиотерапия 767
хирургическое лечение 767-768, 768р, 773-774 чрескожная термокоагуляция ткани под контролем ультразвука 775-778, 776-777р чрескожное разрушение опухоли этанолом под контролем ультразвука 775, 776р электрокардиография 758
приобретенная недостаточность гормона роста 67 простатит 1088-1098
бесплодие и 1088
острый бактериальный 1088-1095, 1089т, 1090р, 1092р, 1093р
хронический инфекционный 1095-1098, 1097р, 1097т
сахарный диабет 526-586
аллергические реакции на инсулин 570-571 анамнез 533-534, 552-553
антиинсулиновые антитела в циркуляции 568-570, 568р, 569р
встречаемость 533
вторичный 531
гиперкортицизм и 290, 305
гипертензия 581-582
гипогликемия, индуцированная инсулином 563
гипотиреоз 140
гликемическая кривая 556-562, 557-559р гликозилированный гемоглобин, концентрация в крови 555-556, 556т
диабетическая ретинопатия 580
диабетическая невропатия 580-581
диабетическая нефропатия 581
диетотерапия 542-547, 542т, 543р, 543т, 544р дифференциальная диагностика 312т
увеит, индуцированный помутнением хрусталика 580
инсулинозависимый диабет 529-530, 529т инсулинонезависимый диабет 530
инсулинотерапия 538-542, 539р, 542т, 550-552, 552р
инсулинотерапия во время хирургической операции 562-563
катаракта 579-580
клиническая патология 535-538, 535т, 538т
контроль глюкозы в моче 565-567 кратковременный эффект инсулина 567-568 неадекватная абсорбция инсулина 568 недостаточная доза инсулина 565 патофизиология 532-533
пероральные сахаропонижающие средства 547-550, 548р, 549р, 550т
после удаления инсулин-секретирующей опухоли 700-701
постановка диагноза 534-535, 535т
прогноз 584
пролонгированное действие инсулина 568 резистентность к инсулину 571-578, 572р, 573т, 574т
сопутствующие проблемы 550-552
стимуляция АКТГ 318
тип 1 527, 527т
тип 2 527-528
транзиторный 530-531, 531р
трансплантация панкреатических островков 582-
584, 583р
у щенных сук 927-928
феномен Сомоги 565-567, 565р
физикальное исследование 534, 552-553
физические нагрузки 547
фруктозамин, концентрация в сыворотке крови
553-555, 554т, 554р, 562
среднесуточное потребление воды 14-15
феохромоцитома 472-497
встречаемость 476, 476р, 476т
гормональное тестирование 485-487, 485т, 486р
диагноз 487
измерение артериального кровяного давления
483-484, 484т
клиническая патология 479-480,479р
клинические признаки 476-478,477т компьютерная и магнитно-резонансная томография 482-483,483р
медикаментозное лечение 491
опухоль коры надпочечников и 274 патофизиология 473-476,474р, 474т, 475т
при множественной эндокринной неоплазии 2А
496-497
прогноз 492
радиоизотопное сканирование 482-484
рентгенография брюшной и грудной полостей
481-482
у собак с диабетом 577
ультразвуковое исследование брюшной полости
480-481, 481р, 482р
физикальное исследование 478-479, 478т хирургическое лечение 487-491, 489р, 490т этиология 472-473
чувствительный к гормону роста дерматоз взрослых собак 68-77
алопеция 70-72, 71т
гистопатология кожи 70
клиническая патология 69
клинические признаки 68-69
лечение 76р, 77, 77р
порода 68
прогноз 77
сходные заболевания 72, 73т, 74р
эндокринологическая оценка 70
этиология и патофизиология 68
Собачий аденовирус 901
Собачья чума 901т
Соевые бобы 164
Соединительная ткань, влияние глюкокортикоидов 502
Солевой диурез 769
Солевой раствор
при болезни Аддисона 457
1230
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
при гипернатриемической гипертонической дегидратации 35-36
при синдроме недостаточности антидиуретического гормона 48
Соль
заместительное введение при гипонатриемии 466 ограничение при центральном несахарном диабете 45, 45т
Соматокринин 53
Соматомедин С 51
Соматостатин 53-54, 54т, 55т, 475т, 711т
Соматостатинома 722-723
Соматотропин 51
Сонливость, вялость
при гиперкортицизме у кошек 382
при гиперкортицизме у собак 280-281
при гипертиреозе у кошек 170
при гипогликемии 682
при гипотиреозе у кошек 153
при гипотиреозе у собак 108
при диабетическом гиперосмолярном некетоновом
синдроме 673
при остром простатите 1089
при перекруте семенников у собак 1079
при пиометре открытого типа 950, 958т
при терапии митотаном 352
Сопутствующие заболевания
влияние на тестирование функции щитовидной
железы у собак 137-141,139р, 140т
при гипертиреозе у кошек 166, 224
при гипокортицизме 460-461
при диабетическом кетоацидозе 665-669
при сахарном диабете у кошек 606
при сахарном диабете у собак 550-551
при феохромоцитоме 477, 478т
Сосудистые нарушения в воротной вене 686
Сохранение уздечки пениса 1059, 1 ОбОр
Сочетанная инфекция при пиометре закрытого типа 951
С-пептид 528р
С-пептид в плазме крови 290
Сперма
аномальная морфология 1109, И Пр
кратковременное сохранение для искусственного
осеменения 1125, 1125т
морфология 1039-1042, Ю41р, 1041т, 1042р
окрашивание 1039-1040
олигоспермия
подвижность 1038-1039
при азооспермии 1105-1109, 1105т, 1106р, 1107р,
1109р
репродукция у сук и 870
сниженная подвижность 1110-1113, 1112р
Сперматогенез 1048-1051, 1048т, 1049р, 1049т
Сперматогранулема 1085
Сперматоцеле 1053т, 1085
Спермициды (средства, убивающие сперматозоиды) 883т
Специфичность скрининговых тестов 312, 316т
Спонтанная овуляция у кошек 1138
Спонтанный аборт и рассасывание плодов
кошки 1150-1152
собаки 900-906, 901т, 905р, 906р
Средства против паразитов 887т
Средства против рака 887т
Стадии опухоли щитовидной железы у собак 233т
Стеаторея 178
Стерилизация
кошек 1160
собак 942-943
Стероидная терапия 499-523
абсорбция препаратов 507-508, 508т
влияние на эндокринную функцию 503-504, 503т,
504р
действие на ткани 502-503
источники 507
комбинированные препараты 512
молекулярные механизмы действия 500-502, 501р
новые стероиды 512
пероральные препараты 508
побочные эффекты 515-520, 518р
показания к применению 512-515, 513т
препараты для парентерального введения 508-512,
5 Юр, 510т, 511т
препараты, дозы, схемы введения 520-522, 521т
при диагностическом тестировании 520
продолжительность действия 507
промежуточный метаболизм 502
противовоспалительные свойства 504-507
химия глюкокортикоидов 499-500, 500р
Стероидогенный острый регуляторный белок 268
Стимулирующая проба с тиреотропным гормоном 192-ЮЗ
при гипотиреозе у кошек 155-156, 156т
при гипотиреозе у собак 130-131,1 ЗОр
Стрептозоцин
при карциноидной опухоли 724
при опухоли бета-клеток 697т
при синдроме Вернера-Моррисона 722
при хронической гипогликемии 705-706
Стрептококки при аборте у собак 901т
Стрептомицин 1023-1024, 1024т
Стресс
гипертиреоз у кошек и 170
неспособность забеременеть у кошек и 1151
секреция АКТГ при 265
у бесплодных сук 985
Стридор при акромегалии у собак 90
Стриктура во влагалище 1000-1005
диагностика 1003-1005, 1004р
дистоция 908-909, 908р
клинические признаки 1001-1003, ЮОЗр
лечение 1005
пороки эмбрионального развития 1000-1002, Ю01р, Ю02р
Субинволюция плацентарных мест
кошки 1147-1148
собаки 918-920, 1009
Субкапсулярная тиреоидэктомия 212-213, 213р
Субстанция Р (вещество Р) 711т
Субстанция, ингибирующая мюллеров проток 992
Субтотальная тиреоидэктомия 215
Субфорникальный орган 8
Судороги
при гипогликемии 701-702, 701т
при гипопаратиреозе у собак 795
при первичном гиперпаратиреозе 751
при терапии эпоэтином 824
Сука 832-1028
аномалии гонадного пола 994-996, 996р
аномальный хромосомный пол 993-994, 995р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1231
беременность 874-890
диагностика 878-883, 879-881р, 881т, 882р
изменения уровня глюкозы 877
изменения функции щитовидной железы и
надпочечников 877
кормление 886, 890
медикаментозная терапия 883-886
последовательность событий 875
прогестерон 876, 877р
продолжительность беременности 877, 878
размер помета 875
эстроген и 876-877
бесплодие 965-990
анамнез 966, 967-968т
анэструс, индуцированный медицинскими
препаратами 984-985
аутоиммунный оофорит 980
Brucella canis и 973
гиполютеоидизм 976
гипотиреоз 985
заболевание матки 979
идиопатическое сокращение овариальных циклов
977-979, 978р
идиопатическое увеличение межэстрального
интервала 980-981
избыток глюкокортикоидов 985
индукция эструса 986-988, 988т
инфицирование и 973-975, 974р
киста яичника, секретирующая прогестерон 986
кисты яичников или неоплазия 981
общее состояние здоровья 969-970
окклюзия матки или яйцеводов 976, 977р
отсутствие овуляции 980
оценка кобеля 965-966, 967т
первоначальный подход 970-973, 971р
предшествующая овариогистерэктомия 982-984,
983р
преждевременное угасание яичников 985-986
проведение владельцем вязок 969
раннее рассасывание плода 975
расщепленная течка 979
скрытая течка и 981
стойкий проэструс 968т, 988-990, 990р
стресс и 985
физикальное исследование 966-969, 967т, 968т,
969р
фолликулярные кисты 979, 982р
хирургическая диагностика 986
хронический эндометрит 975
ятрогенное сокращение межэстрального
интервала 980
вагинит 1015-1017, 1015р, 1017т
врожденные дефекты влагалища и вульвы 1000-1005
диагностика 1003-1005, 1004р
клинические признаки 1001-1002, 1002р
лечение 1005
эмбриональное развитие 1000-1001, 1001р выделения из вульвы 1009-1013, 1009т, 1010-1012р гиперплазия и пролапс влагалища 1007т заболевания до и после родов 897-928
агалакгия 927
акромегалия во время диэструса 927, 928р
введение окситоцина в конце родов 920
внематочные плоды 900
выделения из влагалища 918-919
гипогликемия 927
дистоция 907-917, 907р, 907т, 908р, 911р, 912р, 915т
задержка плаценты 922
затянувшаяся беременность 917-918
клиническая ложная беременность 897-900
мастит 925-927
нормальное состояние 897
послеродовой эндометрит 920
сахарный диабет 927-928
системное заболевание 919-920
спонтанный аборт и рассасывание плодов 900-
906, 901т, 906р
субинволюция матки 921-922
эклампсия 922-925, 924 т
индукция аборта 930-939
агонистами дофамина 940
аналогами простагландина 938-939
антагонистами гонадотропин рилизинг-гормона 942
антипрогестиновой терапией 939-940
глюкокортикоидами 941
до имплантации 933-935
комбинацией простагландинов и агонистов
дофамина и 940
лечение простагландинами 935-938
овариогистерэктомия 932
первичная оценка 930-932, 931р, 932р
после незапланированной вязки 941-942
тамоксифена цитратом 941
триместры беременности 932, 933р
инфекция Brucella canis 1019-1028
клинические признаки 1020
культивирование 1022-1023, 1023т
лечение 1023-1024, 1024т
передача 1019-1020
профилактика и контроль1024-1025
серологические тесты 1020-1023, 1021т
искусственное осеменение 862-869, 1120-1128 внутривлагалищный метод 863-866, 864р, 866р замороженной спермой 1010-1013, 1127р показания 862, 1119
свежей обогащенной спермой 1124-1125, 1125т свежей спермой 1120-1124, 1120р, 1121р, 1122р трансцервикальный метод 866-869, 866-868р успешность 863
кистозная гиперплазия эндометрия 934, 948-964
антипрогестагены 963
встречаемость и анамнез 950-951, 950т
долгосрочное лечение 963
индуцированная медикаментозными средствами 972
клиническая патология 951-952
осложнения на почки 955
патофизиология 948-951
пиометра закрытого типа 962-963
пиометра культи 956-957, 956р
пиометра открытого типа 961-962
полидипсия и полиурия 954
простагландины 958-961, 958р, 959т, 960т
рентгенография 952, 953р
ультразвуковое исследование 952, 954р
физикальное исследование 951
хирургическое лечение 957-958, 957р
цитология влагалища и культивирование 955, 955т
1232
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
нарушения полового развития 992-993
нарушения фенотипического пола 996-997
неудачные вязки 997-998, 998р
нормальное половое развитие 992, 992т, 993р
овариальный цикл 832-852
анэструс 851-852
диэструс 848-851, 850р
интервалы между циклами 833
классификация клеток влагалища 839-843, 838-
841р
отсутствие овуляции 980
отсутствие при гиперкортицизме 286
половое созревание 832
профилактика 942-946, 943т, 945т, 945р
проэструс 833-839, 834р, 835р
сезонность 832
цитология влагалища 839-842, 842р, 843р, 852-
857, 853р, 856р, 857р
эструс 843-848, 843р, 846р
опухоли во влагалище и входе во влагалище 1013-
1015, 1013р, 1014т
опухоль яичника 991
режим вязок 870-875
роды и 890-895
коробка для родов и потомства 891-892, 892р
нормальная инволюция матки 893-895
эндокринология 890-891
этапы родов 892-893, 894р
синдром культи яичника 991-992
трансмиссивная венерическая опухоль 1025-1028,
1026р, 1027р
транспортировка к месту вязки 855
эклампсия 808
Сукрафат 888т
Сульфадиметоксин 1024т
Сульфаметоксазол 1097т
Сульфасалазин 889т
Сульфонамидные антибиотики 142-143, 887т
Сульфонилмочевина 606т, 607-611, 608-6 Юр
Суспензии нерастворимых стероидных эфиров 511-512
Суспензии нерастворимых эфиров стероидов 511-512
Сцинтиография 482
опухоли бета-клеток 696
опухоли щитовидной железы у собак 240-244, 241-
244р
паращитовидной железы 762
при гиперкортицизме у собак 340
при гипотиреозе у собак 119, 121р
при легочной тромбоэмболии 308, 309р
при первичном гиперпаратиреозе у собак 762
рецепторов соматостатина 696
феохромоцитомы 482
щитовидной железы 194-195, 194т
Т
Тазовое предлежание плода 907-908, 908р
Талидомид 885т
Тамоксифен субстрат 941
Тапазол, см. Тиамазол
Тахикардия 171-172
Тахипноэ
при гиперкортицизме 284-285
при диабетическом кетоацидозе 641
при феохромоцитоме 476
Твердофазный иммуноферментный метод 123 Теофиллин 889т
Терапия гормоном роста 77, 76р, 77р
при врожденной недостаточности гормона роста 65-67 при дерматозе, чувствительном к гормону роста у взрослых животных 77, 76р, 77р
Терапия йодом-131 216-220, 217р
Терапия митотаном
безопасность при беременности 889т вторичного гипокортицизма 436 гиперкортицизма у собак 349-362 адреналэктомия 355
в сочетании с глюкокортикоидами 353, 355 динамика развития терапевтического эффекта 356-358, 356р, 357р
информация от клиента 350т
лечение сахарного диабета и 358-359 мониторинг 352-353 начало лечения 349-355
опухоль коры надпочечников 359-360
отсутствие ответа 358
поддерживающая терапия 360-361 прогноз 361-362
фаза нагрузочной дозы 351-353, 352р
цель терапии 353, 354р
передозировка 466
синдрома Кушинга у кошек 407
ятрогенный дефицит кортизола и 427
Терапия соматостатином
опухоли бета-клеток 679т
хронической гипогликемии 704, 705р
Терапия тиамазолом 204-210
аномальные показатели функции почек 206-207 дозы 205-206
долгосрочное лечение 208 мониторинг 207, 207т наружное применение 206 недостатки 209-210 показания 204-205, 205р преимущества 205
развитие ответа во времени 207-208, 208р
сахарный диабет и 627
Терапия эстрогеном
при бактериальном простатите 1094
при ложной беременности у собак 899 Тератозооспермия 1109-1110, 11 Пр Тест на толерантность к глюкозе 90-91 Тестирование секреции желудка 718 Тестирование функции щитовидной железы
при акромегалии у кошек 86
при гиперкортицизме у собак 295, 295р
при гипертиреозе у кошек 188-192, 189т, 190р, 191р при гипотиреозе у кошек 153-156, 154р, 156т при гипотиреозе у собак 120-143
аутоантитела к тиреоидным гормонам 143 базальный уровень общего тироксина в сыворотке крови 122-125, 122р, 124т, 125т базальный уровень общего трийодтиронина в сыворотке крови 125-126, 125р базальный уровень реверсивного трийодтиронина в сыворотке крови 127-128 базальный уровень свободного тироксина в сыворотке крови 126-127, 126р, 127р величина К 133 возраст 136, 136р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1233
голодание и кахексия 141
лекарственные препараты 141-143, 142т
нерегулярные флуктуации 137, 138р
ожирение 141
пол и репродуктивная активность у сук 137 порода и размер тела 136-137, 136р
проба с поглощением трийодтиронина смолой 130
сопутствующие заболевания 137-139, 139р стимуляция тиреотропином 130-131, 130р, 131р суточный ритм 137
температура окружающей среды и тела 141
физическая нагрузка 141
при дерматозе чувствительном к гормону роста 71
при недостаточности гормона роста 64
при опухоли щитовидной железы у собак 244, 246, 246р
Тестолактон 1116
Тестостерон
влияние катехоламинов 475т
влияние на сперматогенез и стероидогенез 1048-
1049, 1048т, 1049т
влияние на тестирование функции щитовидной железы 137
для повышения либидо 1116-1117
для предотвращения овариального цикла у сук 945 изменения при заболевании семенников 1049т концентрация в плазме крови в норме и при
патологии 1070
оценка при исследовании репродуктивной
активности кобелей 1048-1049, 1049т
при ложной беременности у сук 900
уровень во время проэструса 845
Тетания
матка 916
неотложная терапия 811
при гипокальциемии 793-784
при медуллярной карциноме щитовидной железы у собак 257
при эклампсии 922-925
Тетрациклин
безопасность при беременности 887т
при бруцеллезе у собак 1023, 1024т
фармакологическая характеристика 1097т
Течка
оплодотворение и 869-870, 870р
поведение 871-872
Тиазиды 44
Тиазолидиндионы 612-613
Тиамилал 888т
Тиамин при гипертиреозе у кошек 224
Тиацетарсемид 887т
Тиокарбамиды 204-210, 204т
Тиопентал 888т
Тиреоглобулин 96-97
Тиреоидные антигены 101, 143
Тиреоидные гормоны
влияние температуры тела и окружающей среды 141 действие 98
добавление при терапии гормоном роста 65
метаболизм 98
опухоль щитовидной железы у собак и 244-246, 246р, 251-252
оценка при исследовании репродуктивных качеств кобелей 1051
при гипотиреозе у кошек 155-156, 156т
при микседематозной коме 114
регуляция продукции и секреции 97-98, 98р
синтез 96-97, 97р
Тиреоидный гормон-связывающий глобулин 97
Тиреоидэктомия 210-216, 212-213р, 214т
Тиреотоксикоз у кошек 161-226
азот мочевины и креатинин в крови 176-177
активность ферментов печени 175-176
алопеция 169
анализ мочи 175
атенолол 223
базальный уровень общего тироксина в сыворотке
крови 184-187, 184-187р,
базальный уровень общего трийодтиронина в
сыворотке крови 187
базальный уровень свободного тироксина в
сыворотке крови 187-188, 188р
встречаемость 165, 165р
гипокальциемия 811
глюкокортикоидная терапия 224
дифференциальная диагностика 183, 183т
затрудненное дыхание и респираторные нарушения 169 йодид 223
йодированные контрастные агенты для
рентгенографии 223-224
карбимазол 210
клинический анализ крови 174-175, 174т
кровяное давление и гипертензия 178-179
непереносимость тепла и стресса 170
нервозность, гиперактивность, агрессивное
поведение и тремор 173
патология 162-164,163р
полидипсия и полиурия 168
понос и рвота 168-169
потеря веса и полифагия 166-168, 167р, 167т
проба с подавлением трийодтиронином 188-189,
189-191р
проба со стимуляцией тиреотропным гормоном 190-192
прогноз 224
пропранолол 222-223
радиоактивный йод 216-220, 217р
рентгенография 179, 180р
сканирование щитовидной железы 193-199, 194-
199р, 194т
слабость и сонливость 170
снижение аппетита 169-170
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210, 205р, 207т, 208р
тиамин 224
ультразвуковое исследование шейной области 199-
201,200р, 201т
уровень глюкозы в крови 17р
уровень кортизола в в сыворотке крови 178
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного
гормона в сыворотке крови 177
уровни натрия и калия в сыворотке крови 178
уровни общего белка и альбумина в сыворотке крови 178
физикальное исследование 170-174, 171р, 171т
фрукгозамин в сыворотке крови 178
функция почек 201-204
1234 • ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
хирургическое лечение 210-216, 212р, 213р, 214т чрескожная термокоагуляция ткани 221-222, 222р чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182, 179т, 181р, 182р этиология 164-165
эхокардиография 182-183, 183р
Тиреотоксикоз у собак 150, 253-257, 255р
Тиреотропин см. Тиреотропный гормон
Тиреотропный гормон 97
влияние глюкокортикоидов 504, 504р
влияние окружающей среды и температуры тела 141 дефицит при гипофизарной карликовости 64 при вторичном гипотиреозе 105-106
при гипертиреозе у кошек 192-193, 192р
при гипотиреозе у кошек 155-156, 156т
при гипотиреозе у кошек 155
при гипотиреозе у собак 128-130, 128р, 129р
при заместительной терапии тиреоидным гормоном 148-150
при раке щитовидной железы 230
проба со стимуляцией тиреотропин рилизинг-гормоном 131-133, 132т
тиреотропин рилизинг-гормон 63-64
Тироксин
безопасность при беременности 889т
в сыворотке крови
заместительная терапия тиреоидными гормонами 148-150
после лечения радиоактивным йодом гипертиреоза у кошек 217р, 218
после чрескожной инъекции этанола 220-221, 221р
при гиперкортицизме у собак 295, 295р
при гипотиреозе у кошек 153
при опухоли щитовидной железы у собак 244-246, 246р
при сахарном диабете у кошек 599, 627
при сахарном диабете у собак 537
у беременных сук 877
влияние глюкокортикоидов 504
влияние катехоламинов 475т
при микседематозной коме 114
синтез 96-97, 97р
Тироксин-связывающий преальбумин 97
Токсемия 951, 952
Токсоплазмоз и аборт у собак 901т, 904
Тоничность раствора 25
Топическое применение антибиотиков
при баланопостите 1066
при травме пениса у кобелей 1067
Топическое применение глюкокортикоидов 509
Топическое применение тиамазола 206
Тотальная тиреоидэктомия 215
Тошнота
после введения глипизида 607, 609т
при гастриноме 713, 714т
при гипертиреозе у кошек 168
при диабетическом кетоацидозе 640
при митотановой терапии 352
при первичном гиперпаратиреозе 751
при перекруте семенника у собак 1079
при пиометре открытого типа 950, 950т
при угрозе аборта у собак 904
Травма
аборт у сук и 903
пениса 1066-1067, 1066р
Травма головы
как причина гиподипсической гипернатриемии 48-49
как причина центрального несахарного диабета 18
Травы для контроля гликемии у собак 550, 550т Транзиторная акромегалия у сук в диэструсе 927, 928р Транзиторная индуцированная стрессом гипергликемия 598
Транзиторная резистентность к инсулину 565
Транзиторный гипопаратиреоз 215
Транзиторный сахарный диабет
кошки 594-595, 596р
собаки 530-532, 531р
Транзиторный тромбоцитоз 823
Трансмиссивная венерическая опухоль 1025-1028, 1026-1027р
влагалища 856, 856р
пениса 1 ОЗЗр, 1067
Трансплантация островков с защитой от иммунной системы 583-584
Трансплантация целой поджелудочной железы 582
Транспортеры глюкозы 681-682, 681т, 682р
Трансфеноидальное селективное удаление аденомы 88
Трансформирующие факторы роста 738-739, 739р Трансцервикальное искусственное осеменение 866-869, 866-868р
Трансцервикальное микробиологическое исследование матки 975
Трансцервикальное осеменение матки 1123
Тремор
при гипертиреозе у кошек 168
при эклампсии 922-923
Третичный гиперпаратиреоз 745
Третичный гипотиреоз 99, 106
Триамцинолон 511т
период биологической полужизни 507
препарат и дозы 521т
Триамцинолон ацетонид, суспензия 511
Триамцинолон диацетат, суспензия 511
Трибибриссин 1154
Триглицериды
при гиперкортицизме у собак 292, 293р
гипертриглицеридемия
при гипотиреозе у собак 117
при диабете у собак 536-537, 577-578
при диабетическом кетоацидозе 645
при диабетическом кетоацидозе 650-651, 651т
Трийодтиронин
влияние глюкокортикоидов 504
влияние катехоламинов 475т
при гипертиреозе у кошек 188-189,189т, 188р, 190р
при гипотиреозе у кошек 153
при гипотиреозе у собак 125-126, 125р, 127
при опухоли щитовидной железы у собак 244, 246
синтез 96-97, 97р
Трилостан 364-365
Триметопримсульфадиазин 1024, 1024т, 1154
Триметопримсульфаметоксазол
при пиометре 960
фармакологическая характеристика 1097т
Триметопримсульфонамид
безопасность при беременности 887т
при послеродовом эндометрите 920
Трипсиноподобная иммунореактивность 535, 537, 649
у кошек 599
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1235
Трис-буферный наполнитель с яичным желтком 1125т
Трифлюпромазин 888т
Трихромовый краситель 854
Троглитазон 612-613
Тромбоцитопения 479
Тучные клетки, влияние глюкокортикоидов 506 Тяжелая гиперкальциемия 731-732
У
Увеит у собак с сахарным диабетом 580
Увеличение живота
при гиперкортицизме у собак 279
при синдроме Кушинга у кошек 382
Увеличение пищевода
при гипокортицизме 444
при гипотиреозе у собак 113
Углеводы
в обогащенных клетчаткой кормах для собак 544т
влияние гормона роста на обмен 52, 53р
при сахарном диабете у кошек 603-606, бОЗр, 603т
Удельный вес мочи 25
интерпретация при пробе с лишением жидкости 27т
при болезни Аддисона 439
при гипертиреозе у кошек 175
при гипокортицизме 433т
при диабетическом кетоацидозе 643
при несахарном диабете 22, 23р
при первичном гиперпаратиреозе 750т, 757
при полиурии и полидипсии 15, 15т, 16-17
при сахарном диабете у собак 535т, 536
при синдроме Кушинга у кошек 385, 385т
при феохромоцитоме 480
Узловая гиперплазия
коры надпочечников 273, 275
паращитовидной железы 782
Укороченная конечность 885т
Ультразвуковое исследование брюшной полости
у кошек
при акромегалии 83
при бесплодии 1156
при гиперкортицизме 401, 402т
при глюкагономе 721
при диагностике беременности 1143-1144, 1144т
при опухоли надпочечников 492, 493, 492р
при сахарном диабете 599-600, бООр
при феохромоцитоме 480
у собак
для подтверждения индуцированного аборта 936
при выделениях из влагалища у щенной суки 918
при гиперкортицизиме 298-299, 301р, 302р
при диабетическом кетоацидозе 651
при затянувшейся беременности 918
при кисте яичника 986
при неоплазии уретры 1014
при опухоли надпочечников 492-493, 492р, 495р
при первичном гиперпаратиреозе 759-761
при пиометре 953-954, 954р
при пиометре культи 955, 956р
при постоянных кровянистых выделениях из
влагалища 1013
при феохромоцитоме 480, 481р, 482р
при фолликулярной кисте 857
Ультразвуковое исследование паращитовидной железы 759-760
Ультразвуковое исследование шейной области при гиперкальциемии у кошек 785-786 при гипертиреозе у кошек 199-201, 200р при опухоли щитовидной железы у собак 238-240, 23 9р при первичном гиперпаратиреозе 759-761, 760р случайное обнаружение опухоли щитовидной железы 229-230
Уреаплазма
аборт у собак и 901т, 904 культивирование 1047 при вагините у собак 1017 у бесплодных сук 975
Уретомия при дренировании матки 1154
Уретра
гипоспадия и 1060 опухоль 1014 первичный гиперпаратиреоз у собак и 749, 749т, 750р
пролапс у кобелей 1064, 1064р
Уровень гастрина в сыворотке крови натощак 716
Уровень инсулина в крови при инсулин-секретирующей опухоли 693-695, 694р, 694т
Усталостный перелом 281, 281 р
Утеровердин 918
Утоление жажды 9-10
Ухаживание в репродукции у собак 859-860
Ф
Фагоцитоз 505-506
Фактор некроза опухолей
влияние глюкокортикоидов 506 гуморальная злокачественная гиперкальциемия 738-739, 739р
Фактор, стимулирующий колонии гранулоцитов 1078 Факторы роста 165
Фамотидин 718
Фенилбутазон 888т
Фенилпропаноламин 1113
Фенитоин
безопасность при беременности 889т при гипогликемии 706
тератогенное действие 885т
Фенобарбитал
безопасность при беременности 889т влияние на тестирование функции щитовидной железы 142
при гиперкортицизме у собак 312-313 Феноксибензамин
перед адреналэктомией 488 при феохромоцитоме 488 Феномен Сомоги 542
в процессе инсулинотерапии 560 концентрация фруктозамина в сыворотке крови и 554
при сахарном диабете у кошек 623, 624р при сахарном диабете у собак 565-567, 565р, 566р Фенотип 993
Фентоламин 490
Феохромоцитома 472-497, 713 встречаемость 476, 476р, 476т диагностика 487 клиническая патология 479-480, 479р клинические признаки 476-478, 477т
1236
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
компьютерная и магнитно-резонансная томография
482-483, 483р
медикаментозное лечение 491
определение артериального кровяного давления 483-
484, 484т
определение гормонов 485-487,485т, 486р
опухоль коры надпочечников и 274
патофизиология 473-476, 474р, 474т, 485т
при множественной эндокринной неоплазии 2А 496-
497
прогноз 492
рентгенография брюшной и грудной полостей 481-
482
сцинтиография 482-484
у собак с диабетом 577
ультразвуковое исследование брюшной полости 480-
481,481р, 482р
физикальное исследование 478-479,478т хирургическое удаление 487-491, 489р, 490т этиология 472-473
Ферменты, участвующие в стероидогенезе 266-267,
266т, 267р
Фертильность, глюкокортикоидная терапия 520
Фибрилляция предсердия 112
Фиброзная остеодистрофия 731
Фиброма пениса у кобелей 1067
Фибропапиллома 1014-1015
Физикальное исследование
кошки
при гиперкортицизме 380-381, 380т, 381р
при гипертиреозе 170-174, 171р, 171т
при пиометре 1053, 1053т
при сахарном диабете 598
при гипокортицизме 430-431,431т
при диабетическом кетоацидозе 640-641
при инсулин-секретирующей опухоли 684, 684т
при полиурии и полидипсии 15
при синдроме Золлингера-Эллисона 714-715
при феохромоцитоме 478-479,478т
при центральном несахарном диабете 22
собаки
бесплодных кобелей 1100
бесплодных сук 966-968, 968т
при гипопаратиреозе 797-798, 798р
при дистоции 913-914
при идиопатическом удлинении межэстрального интервала 980
при кистозной гиперплазии эндометрия 951
при крипторхизме 1069-1070
при легочной тромбоэмболии 307
при опухоли щитовидной железы 229, 236-237
при первичном гиперпаратиреозе 752
при перекруте семенника 1079
при сахарном диабете 534, 552-553
при тиреотоксикозе 254
репродуктивного тракта кобелей 1032-1034, ЮЗЗр
Физиология щитовидной железы 96-98, 97р, 98р
Физическая нагрузка
влияние на тестирование функции щитовидной
железы у собак 141
при сахарном диабете у собак 547
щепные суки и 890
Фимоз 1061
Финастерид 1094-1095
Флуметазон 507, 511т
Флуороурацил
при карциноидах 724
при синдроме Вернера-Моррисона 722
Флупростенол 959
Флутамид 1095
Флюдрокортизон ацетат
после удаления опухоли надпочечника 347
препарат и дозы 521т
при болезни Аддисона 458,461,464
при гипокортицизме у кошек 469
Флюниксин меглумин 888т
Флюоцинолон 511т
Фолликулостимулирующий гормон
в анэструсе 852
в диэструсе 849
действие на сперматогенез и стероидогенез 1048, 1048т, 1049т
изменения при тестикулярных расстройствах 1049т определение при оценке репродукции кобелей 1050-1051
предшествующая овариогистерэктомия и 982-984,
984р
при азооспермии 1108
при индукции эструса у сук 987
при овариальной недостаточности 986
Фолликулярная киста
у кошек 1159
у собак 979, 982р, 989
цитология влагалища 856
Фолликулярные клетки, гиперплазия 104
Фолликулярный рак щитовидной железы 163-164
Фосфатная клизма 809
Фосфор
гиперфосфатемия
при акромегалии у кошек 82
при гиперкальциемии 755-756
при гипертиреозе у кошек 177
при гипопаратиреозе у собак 799т, 800
при диабетическом кетоацидозе 649
гипосфатемия
при гемолитической анемии 671
при гиперкортицизме у собак 293
при диабетическом кетоацидозе 649-650
при первичном гиперпаратиреозе 750т, 755-756, 756т
прогноз 817
Фрукгозамин
в сыворотке крови
при гипертиреозе у кошек 178
при сахарном диабете у кошек 615-616, 615т,
616р, 620
при сахарном диабете у собак 553-555, 554р, 554т
при феномене Сомоги 565-566
ФСГ, см. Фолликулостимулирующий гормон
Функция печени
глюкокортикоидная терапия и 519
при гипертиреозе у кошек 175-176
при гипокортицизме 443-444
при диабетическом кетоацидозе 649
при неоплазии бета-клеток 691
при синдроме Кушинга у кошек 385, 385т
Функция половых желез, влияние глюкокортикоидов 504
Фуросемид
безопасность при беременности 889т
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 1237
при гиперкальциемии 771т
при застое молока 926
при лактации при ложной беременности 899
при отеке мозга 703
при первичном гиперпаратиреозе у собак TI1-TI2, 771т
при синдроме нарушенной секреции антидиуретического гормона 48
Химера 993
Химиотерапия
гипокальциемия и 811
при опухоли семенников у собак 1075
при опухоли щитовидной железы у собак 249
при первичном гиперпаратиреозе у собак 767
при феохромацитоме 491
Химическая контрацепция у кошек 1160-1161
Химия сыворотки крови
при гипертиреозе у кошек 175-178
при несахарном диабете 23
при опухоли щитовидной железы у собак 237
при терапии эпоэтином 824
Хинидин 889т
Хинолоны 887т
Хирургическое лечение
акромегалии 88
кошки
во время инсулиновой терапии 562
при гастриноме 718-719, 719т
при гиперкальциемии неясного происхождения
767-768
при гипертиреозе 203т, 210-216, 212р, 21 Зр, 214т
при глюкагономе
при пиометре 1154
при феохромоцитоме 487-491,489р, 490т неоплазии бета-клеток 696-702, 697т, 698р собаки
при гиперкортицизме 342-349, 342-344р, 346р
при кисте яичника 990
при кистозной гиперплазии эндометрия 957-958,
957р
при опухоли семенника 1075
при опухоли щитовидной железы 250-252
при осеменении матки
при первичном гиперпаратиреозе 767-768, 768р,
773-774
при пиометре 957-958
при пролапсе влагалища 1008-1009
при синдроме культи яичника 992
при синдроме феминизации у кобелей 1078
при трансмиссивной венерической опухоли 1028 Хлорамфеникол
безопасность при беременности 801т
при мастите 925
фармакологическая характеристика 1097т
Хлорид
гиперхлоремия 670
гипохлоремия 423-424
концентрация при первичном гиперпаратиреозе 757
Хлоротиазиды 44-45
Хлорпромазин 888т
Хлорпропамид
при идиопатической гипернатриемии 49
при центральном несахарном диабете 43-44
ХО синдром 994
Холангиогепатит 667
Холекальциферол 742
Холестерин
гиперхолестеринемия гипохолестеринемия 443 при гипокортицизме 442-443, 434т, 443т при гипотиреозе у собак 117 при феохромоцитоме 479 у щенных собак 897
при гиперкортицизме у собак 292, 293р
при гипертиреозе у кошек 177
при диабетическом кетоацидозе 651-652, 651т
при сахарном диабете у собак 536-537
при синдроме Кушинга у кошек 384-385, 385т
Холецистокинин 711т
Холодный узел щитовидной железы 243-244
Хондросаркома кости пениса 1067
Хорионический гонадотропин лошади
для индукции эструса кошки 1142 собаки 987
при определении фертильности у сук 984
Хорионический гонадотропин человека для стимуляции овуляции 980 при индукции эструса у кошек 1142 при крипторхизме у собак 1070 при определении фертильности у сук 984 при пролапсе влагалища 1008 функция клеток Лейдига и 1050
Хром и гликемический контроль 549-550, 613
Хромогранин А 473
Хромосомный пол 993-994
Хромота при гиперкортицизме у собак 280
Хроническая гипогликемия 703-706, 705р
Хроническая почечная недостаточность гиперкальциемия и 731, 744-746, 745р гипокальциемия и 806-807, 807р концентрации кальция и фосфата в сыворотке крови 769т
натриуретический пептид предсердия и 828 определение концентрации паратиреоидного гормона в сыворотке крови 735р полидипсия и полиурия 9т, 11 при гипертиреозе у кошек 201
эритропоэтин и 822
Хронический бактериальный простатит 1095-1098, 1097р, 1097т
Хронический орхит 1082
Хронический панкреатит 576
Хронический простатит 1053т
Хронический эндометрит 975
Хрящ, действие пептида родственного паратиреоидному гормону 737т
XX истинный гермафродит 995, 996р
XX мужской синдром 995-996
XX половая инверсия 994-995
XXX синдром 994
XXY синдром 994
ц
Цвет семенной жидкости у собак 1038
Цветущий днем жасмин 744
Центральная нервная система
ангиотензин II 826
действие глюкокортикоидов 503
1238
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
действие пептида родственного паратиреоидному гормону 737т
нарушения при гипогликемии 682
Центральный несахарный диабет 17-20, 18т, 19т, 21р
гиперкортицизм у собак и 268
инфузия солевого раствора 41, 41р
клинические признаки 20-22
лечение 41-46,42т, 45т
модифицированная проба с лишением жидкости 24-39
дегидратированная собака 38
определение вазопрессина в плазме крови 37-38, 38р, 39р
осложнения 33-36, ЗЗр, 34р, 35т
ответ на 29-32, 29-32р
ошибочный диагноз 36-37, Збр, 37т
противопоказания 24
протокол 25-29, 26т, 26р, 27т
терминология 24-25
отношение осмоляльности мочи и плазмы крови 41 прогноз 46-47
рандомизированное определение осмоляльности плазмы 39-40, 40р
удельная плотность мочи 15т, 25
Цефалоспорины 887т
Цефалотин 1097т
Циклический аденозинмонофосфат 5, 5р
Циклофосфамид
безопасность при беременности 887т
при трансмиссивной венерической опухоли 1028
при феохромоцитоме 491
Циметидин
безопасность при беременности 888
при гиперсекреции желудочной кислоты 719
Ципрогептадин 365
Ципрофлоксацин 1097т
Цисплатин 248р, 1100т
Цистаденома яичника 991
Цитокины 739
Цитологическое исследование влагалища
кошки 1132-1133, 1132т
в анэструсе 1137
в интерэструсе 1132т, 1136
в проэструсе
в эструсе 1135-1136 собаки
в анэструсе 852
в диэструсе 850-851, 850р
в проэструсе 840-843, 841-843р, 841т, 971-972
в эструсе 971-972
во время нормальной течки 846-848, 847р
для определения времени вязки 872
для определения овуляции 972
для определения предполагаемого срока родов 877-878, 910
классификация клеток влагалища 839-840, 838-
843р, 841т
клиническое применение 854-857, 856р метод ватного тампона 852-853, 853р, 857р ограничения 857 при вагините 1016
при выделениях из влагалища 968
при диагностике расщепленной течки 979
при затянувшейся беременности 918
при искусственном осеменении 1124
при кистозной гиперплазии эндометрия 975
при пиометре 955, 955т
при послеродовом эндометрите 920
при постоянных кровянистых выделениях из
вульвы 1011
при синдроме культи яичника 991
при стриктурах влагалища 1004
прокрашивание 853-854
Цитология
аспирата семенников 1053-1054
влагалища
во время анэструса 852
во время диэструса 850-851, 850р
во время нормальной течки 846-848, 847р
во время проэструса 840-843, 840-843р, 971-972
во время эструса 971-972
для определения времени вязки 872
для определения даты родов 877
для определения овуляции 972
классификация клеток влагалища 839-840, 838-
840р
клиническое применение 854-857, 856р
метод ватного тампона 852-853, 854р
ограничения 857
при вагините 1015-1016
при выделениях из влагалища 966
при диагностике расщепленной течки 979
при затянувшейся беременности 918
при искусственном осеменении 1124
при кистозной гиперплазии эндометрия 975
при пиометре 955, 955т
при послеродовом эндометрите 920
при синдроме культи яичника 991
при стойких кровянистых выделениях из
влагалища 1013
при стриктуре влагалища 1003
прокрашивание цитологических образцов 853-
854
кошки 1132-1133, 1132т
во время анэструса 1137
во время интерэструса 1132т, 1136
во время проэструса 1132, 1132т
во время эструса1135-1136
семенной жидкости собак 1041-1043, 1042р
Частичный центральный несахарный диабет 17 Чешуйчатоклеточная карцинома метастазирование в кость 742 пениса у кобелей 1067
Чрескожная инъекция этанола под контролем ультразвука 220-221, 221р
Чрескожная пункционная биопсия семенников 759р Чрескожная термокоагуляция опухоли под контролем ультразвука 221-222, 222р, 775-778, 777р Чрескожное разрушение опухоли этанолом под контролем ультразвука 220-221,221р, 775, 776р Чувствительность скрининговых тестов 315, 316т Чувствительный к гормону роста дерматоз, приобретенный во взрослом возрасте 68-77 алопеция 70-72, 71т гистопатология кожи 70 клиническая патология 69 клинические признаки 68-69, 69р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1239
лечение 76р, 77р
порода 68
прогноз 77
сходные нарушения 72, 73т, 74р
эндокринологическая оценка 70
этиология и патофизиология 68
Чувствительный к кастрации дерматоз 71т
Шея
дифференциальная диагностика опухолей 238
опухоль при гипертиреозе у кошек 171
случайно обнаруженная опухоль щитовидной
железы 229-230
ткань щитовидной железы 199
ультразвуковое исследование паращитовидной
железы 759-760, 760р
хирургическое лечение при первичном
гиперпаратиреозе 760р
Шистосомоз 747
Шишковидное тело 475т
Шок
при перекруте семенника у собак 1079
при пиометре закрытого типа 951
при терапии простагландинами 961
септический 515
щ
Щелочная фосфатаза
в сперме 1045
при гиперкортицизме у собак 291-292, 292р
при гипертиреозе у кошек 175
при первичном гиперпаратиреозе 756-757
при пиометре 952
при сахарном диабете у собак 535
при синдроме Кушинга у кошек 384, 385т
при феохромоцитоме 479
Щелочная фосфатаза, индуцированная стероидами 291-
292, 292р
Щенность
глюкокортикоиды и 520
диагностика 878-883, 879-882р, 881т
заболевания сук до, во время и после родов 897-928
акромегалия в диэструсе 927, 928р
внематочные плоды 900
выделения из половых органов 918-919
гипогликемия 927
дистоция 907-917, 907-908р, 907т, 911-912р, 915т
задержка плаценты 922
затянувшаяся беременность 917-918
клиническая ложная беременность 897-900
мастит 925-927
нормальное состояние 897
отсутствие молока 927
послеродовое введение окситоцина 920
послеродовой эндометрит 920
сахарный диабет 927-928
системные заболевания 919-920
спонтанный аборт и рассасывание плодов 900-
906, 901т, 906р
субинволюция плацентарных мест 921-922
эклампсия 922-925, 924т
изменения уровня глюкозы 877
изменения функции щитовидной железы и коры
надпочечников 877
индукция аборта 930-939
агонистами дофамина 940
аналогами простагландина 938-939
антагонистами гонадотропин рилизинг-гормона 942
антипрогестинами 939-940
глюкокортикоидами 941
до имплантации 933-935
комбинацией простагландина и агонистов
дофамина 940
лечение простагландинами 935-938
овариогистерэктомия 932
первичная оценка 930-932, 931р, 932р
после незапланированной вязки 941-942
тамоксифена цитратом 941
триместры беременности и 932, 933р
медикаментозное лечение во время 883-886
питание 886, 890
последовательность событий 875
прогестерон 876, 877р
продолжительность 877, 878р
размер помета 875
роды 890-895
эстроген и 876-877
Щитовидная железа 96-259
биопсия
при гипотиреозе у собак 143
при опухоли щитовидной железы у собак 246-247
влияние глюкокортикоидов 504
влияние катехоламинов 475т
гипертиреоз у кошек 161-226
азот мочевины и креатинин в крови 176-177
активность ферментов печени 175-176
алопеция 169
анализ мочи 175
атенолол 223
базальный уровень общего трийодтиронина в
сыворотке крови 187
базальный уровень свободного тироксина в
сыворотке крови 187-188, 188р
базальный уровень тироксина в сыворотке крови
184-187, 184р, 185-187р
встречаемость 165, 165р
глюкоза в крови 17р
глюкокортикоидная терапия 224
дифференциальная диагностика 183, 183т
йодид 223
йодированные контрастные агенты для рентгенографии 223-224 карбимазол 210
клинический анализ крови 174-175, 174т
кровяное давление и гипертензия 178-179
непереносимость тепла и стресса 170 нервозность, гиперактивность, агрессивное поведение, тремор 173 патология 162-164, 163р
полидипсия и полиурия 168
понос и рвота 168-169
потеря веса и полифагия 166-168, 167р, 167т
проба с подавлением трийодтиронином 188-189,
189-191р
проба со стимуляцией тиреотропин рилизинг-гормоном 192-193, 192р, 193р
проба со стимуляцией тиреотропином 190-192
прогноз 224
пропранолол 222-223
1240
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
радиоактивный йод 216-220, 217р
рентгенография 179, 180р
респираторные расстройства 169
сахарный диабет и 627, 628р
сканирование щитовидной железы 193-199, 194-199р, 194т
слабость и сонливость 170
снижение аппетита 169-170
сопутствующие заболевания 224
стеаторея 178
тиамазол 204-210, 205р, 207т, 208р
тиамин 224
ультразвуковое исследование шейной области
199-201, 200р, 201т
уровень кортизола в сыворотке крови 178
уровень холестерина 177
уровни кальция, фосфора и паратиреоидного
гормона в сыворотке крови 177
уровни натрия и калия в сыворотке крови 178 уровни общего белка и альбумина в сыворотке крови 178
физикальное исследование 170-174, 171р, 171т фруктозамин, концентрация в сыворотке крови 178
функция почек 201-204
хирургическое лечение 210-216, 212р, 21 Зр, 214т чрескожная термокоагуляция опухоли 221-222, 222р
чрескожные инъекции этанола 220-221, 221р электрокардиография 179-182, 179т, 181-182р этиология 164-165
эхокардиография 182-183, 183р
гипертиреоз у собак Ют, 13, 253-257, 255р
гипотиреоз у кошек 152-157
алопеция 70-71, 71т
диагностика 156-157
клинические признаки 153, 153т
лечение и прогноз 157
тестирование функции щитовидной железы 153-
156, 154р, 156т
этиология 152-153
гипотиреоз у собак 99-152
алопеция 70-72, 71т
аутоантитела к тиреоидным гормонам 133-135, 143
базальный уровень общего тироксина в сыворотке крови 122-125, 122р, 124т, 125т
базальный уровень общего трийодтиронина в
сыворотке крови 125-126, 125р
базальный уровень реверсивного
трийодтиронина в сыворотке крови 127-128
базальный уровень свободного тироксина в сыворотке крови 126-127, 126р, 127р
величина К 133
возраст 136, 136р
встречаемость 101т, 107
вторичный 115
гистопатология кожи 118, 118т
голодание и кахексия 141
грубые гормональные препараты животного
происхождения 151
желудочно-кишечные признаки 113
изменение поведения 124
классификация 99
клинико-патологические нарушения 115-118, 118т
коагулопатии 113-114
кожные признаки 109-110, 109р
комбинации тироксина-трийодтиронина 151
контроль лечения 148-150
кретинизм 114-115, 115т, 116р
левотироксин натрия 145-150, 146-148т, 147р, 149р
лекарственные препараты 141-143, 142т
лиотиронин натрия 150-151
метаболические признаки 108-109
микседема 114
нервномышечные признаки 111-112 нерегулярные флуктуации 137, 138р ожирение 141
опухоль щитовидной железы 241
офтальмологические признаки 113
пол и репродуктивный статус у сук 137
породы и размер тела 136-137, 1 Збр
постановка диагноза 144-145
проба со стимуляцией тиреотропин рилизинг-гормоном 131-133, 132р, 132т, 133р
проба со стимуляцией тиреотропином 130-131,
130р, 131р
прогноз 151-152
рентгенография 118,118р
репродуктивные признаки 112
сахарный диабет и 576-577
сердечно-сосудистые нарушения 112-113 сопутствующие заболевания 137-139, 139р суточный ритм 137
сцинтиография 119-120, 121р
температура окружающей среды и тела 141
тиретоксикоз и 150
ультразвуковое исследование 118-119, 119р, 120р физическая нагрузка 141
этиология 99-107, 99т, 1 ООр, 102т, ЮЗр
опухоль щитовидной железы
биопсия щитовидной железы 246-247
встречаемость 234, 235, 235т
гипертиреоз и 253-257, 255р
гипотиреоз и 104
гистология 232-234, 233т
дифференциальная диагностика 247
доброкачественная 232
иммуногистохимия 233-234
классификация 229-230
клинические признаки 235-236, 236т
медуллярный рак 257-258
оценка в клинике 237
патогенез 230-231, 231р
патология 231
прогноз 252-253
рентгенография 238
синдром множественной эндокринной неоплазии и 234-235, 234т
тестирование функции щитовидной железы 244-
246, 246р
у кошек 228, 229т
ультразвуковое исследование 238-239, 239р, 240р физикальное исследование 236-237
частота 234
эктопическая 258
электрокардиография и эхокардиография 238 случайно обнаруженная опухоль 229-230 физиология 96-98, 97р, 98р
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
1241
Щитовидная ткань в средостении 196, 198р
ЭДТА, см. Этилендиаминтетрауксусная кислота
Эклампсия 808, 922-925, 924т
Экскреция катехоламинов с мочой 485-486, 485т
Экскреция кортизола с мочой 315-316
Экскреция стероидов с мочой 448
Экстракапсулярная тиреоидэктомия 212-213, 21 Зр
Экстрасистола 171-172
Эктопическая опухоль щитовидной железы у собак 258 Эктопический кальциноз при гиперкортицизме у собак 288, 297
Электрокардиография
при гипертиреозе у кошек 179-180, 179т, 181р, 182р
при гипокортицизме 444-446, 446р
при гипокортицизме у кошек 467
при гипопаратиреозе у собак 801-802, 801р
при диабетическом кетоацидозе 651, 652р, 652т
при опухоли щитовидной железы у собак 238
при первичном гиперпаратиреозе у собак 758
Электролиты
влияние на секрецию и действие вазопрессина 5р
гиперкотицизм у собак и 293
гипокортицизм и 432-438, 433т, 433-434р, 437р
нарушение баланса при гипокортицизме 457
несахарный диабет и 23-24
Электроэякуляция для сбора семени у котов 1162
Эмбриональная ретинопатия 885т
Эналаприл 889т
Эндогенный АКТГ в плазме крови 452-454,453р
при гиперкортицизме у кошек 399-401
при гипокортицизме у кошек 468-469
Эндокринные препараты 889т
Эндокринологическая оценка
кошки при синдроме Кушинга 388
отношение кортизол:креатинин в моче 388-390, 390т, 391т
проба с низкими дозами дексаметазона 393-396
проба со стимуляцией АКТГ 391-393
при гипокортицизме 447-454
альдостерон в сыворотке крови 450-452,451р кортизол в сыворотке крови 447-450, 449р, 449т, 450р
эндогенный АКТГ в сыворотке крови 452-454, 453р
при недостаточности гормона роста 61-64, 61-63т
при феохромоцитоме 485-487,485т, 486р собаки
при акромегалии 90-91
при гиперкортицизме 313
при чувствительном к гормону роста дерматозе 70
репродуктивной функции у кобелей 1048-1051, 1048т, 1049р, 1049т
Эндокринологические тесты 313
Эндометрит
гипокальциемия при 748
послеродовой 920-921, 963
хронический 975
Эндоскопическое трансцервикальное осеменение 866-869, 866-868р
Эндоскопия
влагалища 101 Зр
во время эструса 848
для определения времени вязки 872
при гастриноме 715, 715р
Эндотоксическая индуцированная гипогликемия 690
Энкефалины 711т
Энрофлоксацин 1097т
Энтероглюкагон 711т
Эозинофилия 432, 432т
Эозинофилы, подсчет 432, 432т
Эпидидимит
острый 1079-1082, 1080р
хронический 1082
Эпителиальная опухоль 742
Эпителиальная ткань, действие пептида, родственного паратитиреоидному гормону 737т
Эпостан 932
Эпоэтин 822-825
Эргокальциферол 814, 814т
Эритромицин
безопасность при беременности 887т
фармакологическая характеристика 1097т
Эритропоэтин 822-825, 823р
влияние катехоламинов 975т
при панцитопении при синдроме феминизации у
кобелей 1078
Эритроцитоз 691
Эритроциты
влияние глюкокортикоидов 503
гипокортицизм и 432
количество при гипертиреозе у кошек 174
количество при пиометре 951
морфология при гипотиреозе у собак 115
эритропоэтин и 822
Эссенциальная гипернатриемия 48-49
Эссенциальная гипертензия 827
Эстрадиол
действие на сперматогенез и стероидогенез у собак
1048, 1048т
при оценке репродуктивной способности кобелей 1051
проэструс и 836
Эстрадиола бензоат 934
Эстрадиола валерат 934
Эстрадиола ципионат
безопасность при беременности 888т
для индукции аборта после незапланированной
вязки 933-934
Эстроген
кошки
в анэструсе 1137
в интерэструсе 1136
в проэструсе 1132
в фолликулярной фазе эструса 1133
собаки
в анэструсе 851-852
в диэструсе 848-849
в проэструсе 835р, 836
в эструсе 843-845, 844р
для индукции аборта после незапланированной
вязки 933-935
изменения при заболеваниях семенников 1049т
при гипертрофии простаты 1090
при стойком проэструсе 988-990, 990р
риск развития пиометры 950
роды и 891
1242
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
у щенных сук 877-878
Эстрон 934
Эструс 843
кошки 1130-136
искусственная индукция 1142, 1158-1159
контрацепция 1160-1161
овариогистерэктомия 1160
половое поведение при 1140-1142, 1140р, 1141т
половое созревание и оптимальный возраст для репродукции 1130-1131
сезонность 1131
фолликулярная фаза 1133-1136, 1134р, 1135р
собаки 843-848
гормональные изменения 843-845, 844р, 846р изменения в яичниках и матке 845-846 изменения полового поведения 860, 860т изменения слизистой влагалища 968т индукция 986-988, 988т
интервалы между вязками 871-874
клинические признаки 846
отсутствие при гиперкортицизме 286-287
продолжительность 846
синдром культи яичника 991-992
стойкий 988-990, 990р
цитологическая характеристика 841т
цитология влагалища 846-848, 847р
эндоскопия влагалища 848
Этанол 888т
Этидронат при гиперкальциемии 771, 771т
Этиленгликоль, токсичность 809
Этилендиаминтетрауксусная кислота при гиперкальциемии 772 Этомидат
при гиперкотицизме у собак 366
при синдроме Кушинга у кошек 407
Эугликемия 678, 678р
Эфедрин 889т
Эффект Вольффа-Чайкова 98
Эхокардиография
при гипертиреозе у кошек 182, 183р
при легочной тромбоэмболии 307
при опухоли щитовидной железы у собак 238
Эякуляция, характеристика семенной жидкости 1043
Ю
Ювенильная гипогликемия 689-690 Юкстагломерулярная клетка 825, 825р
Я
Яичник
в диэструсе 849
действие катехоламинов 475т
в эструсе 843-844
в проэструсе 836
Яйцевод
изменения во время проэструса 837
окклюзия у бесплодных сук 976, 977р
Ятрогенная гипогликемия 691
Ятрогенное сокращение межэстрального интервала 980
Ятрогенный гиперкортицизм 377-378
Ятрогенный гипокортизолизм 466
Ятрогенный гипокортицизм 454, 517-518, 518р
Ятрогенный гипотиреоз 152
Эдвард Фелдмен, профессор факультета медицины и эпидемиологии Калифорнийского университета, США.
Область научных исследований: заболевания поджелудочной, щитовидной и паращитовидных желез, надпочечников у кошек и собак.
Один из основателей Общества сравнительной эндокринологии, рецензент журнала JAVMA.
Ричард Нелсон, профессор, декан факультета медицины и эпидемиологии Калифорнийского университета, США.
Область научных исследований: репродукция животных, заболевания поджелудочной и щитовидной желез, надпочечников.
Врач-консультант по эндокринным нарушениям и внутренним болезням кошек и собак.
Предлагаемая книга Фелдмена и Нелсона - это практически первое изданное на русском языке подробное описание эндокринологических и репродуктивных заболеваний собак и кошек. В книге даны самые современные представления о причинах заболеваний, включая молекулярно-генетические и наследственные, представлены сведения о частоте встречаемости разных патологий у различных пород животных, подробно разбираются методы диагностики и лечения эндокринных и репродуктивных нарушений, препараты и дозы, использование современной аппаратуры. Немалое внимание уделяется этическим и практическим вопросам взаимоотношений ветеринарного персонала и владельцев животных.
Особый интерес представляет параллельное рассмотрение аналогичных заболеваний у человека и животных, их сходства и различия, приведены медицинские препараты, применяемые для лечения человека при соответствующих болезнях, но не приемлемые для животных.
«В соответствии с современными представлениями авторы не ограничиваются рассмотрением работы классических желез внутренней секреции, но дополнительно обсуждают паракринно и экзокринно действующие гормоны и биологически активные пептиды, вырабатываемые в сердце, печени, почках и других органах и тканях организма».
Книга богато иллюстрирована рисунками, графиками и таблицами, в которых представлены нормальные показатели и их отклонения при различных заболеваниях.
Именно благодаря обилию современных данных и их подробному описанию, которые трудно найти в других разрозненных изданиях, книга является неоценимым пособием не только для ветеринарных врачей и студентов ветеринарных вузов, но и для врачей и студентов любой медицинской специальности.
Первоначально издано как Canine and Feline Endocrinology and Reproduction Этот перевод опубликован по контракту с Elsevier.