Text
Г. Е. Рудзитис
Ф. Г. Фельдман
ХИМИК ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК ТАБЛИЦАСЫ
Периодлар
S
£
ЭЛЕМЕНТЛАРНЫ! ТӨРКЕМНӘРЕ
А I Б
A Il Б
A Ill Б
A IV Б
AVE A Vl Б
A Vll Б
A Vlll Б
1
1
H '
ВОДОРОД
1,00794
(H)
Не ’
ГЕЛИЙ
4,002602
Атом
номеры
I
Элементны^
символы
-г • а
“I
2
Li ’
ЛИТИЙ *
6,941
Be ‘
БЕРИЛЛИЙ
9,01218
B ‘
БОР
.10,811
C
УГЛЕРОД
12,011
N '
АЗОТ
14,0067
О
КИСЛОРОД
15,9994
F
ФТОР
18,998403
Ne "
НЕОН
20,179
L
ЛИЛ
Jl
6,941
3
<3
Na "
НАТРИЙ
22,98977
Mg "
м^ний 24i305
Al ”
АЛЮМИНИЙ
26,98154
Si “
КРВАНИЙ
28,0855
P 15
ФОСФОР
30,97376
S
КҮКЕРТ
32,066
Cl "
ХЛОР
35Л53
Ar "
АРГОН
39,948
Ата
Чагыштырма
атом массасы
масы
4
4
K 8
КАЛИЙ
39,0983
Ca ”
КАЛЬЦИЙ
40,078
” Sc
” Ti
ТИТАН
47,88
23 V
ВАНАДИЙ
50,9415
8 Cr
51 9961
□ 1,330 1
8 Mn
MAPTve;
54,9380
8V Fe
ТИМЕР
55,847
’ Со
КОБАЛЬТ
58,9332
8 Ni
НИКЕЛЬ
58,69
5
” Cu
“кыр
8 Zn
и.» “““
Ga ’
ГАЛЛИЙ
69,723
Ge 8
ГЕРМАНИЙ
72,59
As "
““ 7«ш.
Se ”
СЕЛЕН 78,96
Br 8
БРОМ
79,904
Kr 8
™ .....
5
6
Rb ’
РУБИДИЙ
85,4678
Sr ”
СТРОНЦИЙ
87,62
39 ү
л ИТТРИЙ
88,9059
8 Zr
ЦИРКОНИЙ
91,22
• Nb
НИОБИЙ
92,9064
* Mo
МОЛИБДЕН
95,94
• Tc
м]
" Ru
РУТЕНИЙ
101,07
8 Rh
РОДИЙ
102,9055
* Pd
ПАЛЛАДИЙ
106,42
7
" Ag
КӨМЕШ
107,8682
8 Cd
КАДМИЙ
112,41
In 8
индий
114,82
Sn 8
““ ю.
Sb ”
Се,“ »ws
Те 8
ТЕЛЛУР
127,60
I
иод
126,9045
Xe “
КСЕНОН
131,29
6
8
Cs 8
ЦЕЗИЙ
132,9054
Ba “
БАРИЙ
137,33
57 Л
La-Lu
★
8 Hf
ГАФНИЙ
178,49
” Та
TAHWI
180,9479
8 W
ВОЛЬФРАМ
183,85
“ Re
DCUjQ
V LJ Wl
186,207
8 Os
ОСМИЙ
190,2
” Ir
ИРИДИЙ
192,22
8 Pt
АГАЛТЫН
195,08
9
79 Au
АЛТЫН
196,9665
8 Hg
ТЕРЕКӨМЕШ
200,59
Tl 8
ТАЛЛИЙ
204,383
Pb ”
КУРГАШ
207,2
Bi ”
ВИСМУТ
208,9804
Po “
ПОЛОНИЙ
[209]
At 8
АСТАТ
[210]
Rn "
РАДОН
[222]
7
10
Fr 87
ФЯАНЦНЙ [из]
Ra ”
тч
A М T 103
Ac-Lr
★★
" Rf
РЕЗЕРФОРДИЙ
[261]
“ Db
ДУБИИЙ
[262]
" Sg
[266] СИБ0Р™Й
" Bh
[267]
- Hs
ХДССИЙ
[269]
" Mt
, МЕЙТНЕРИЙ
[268]
ЮГАРЫ
ОКСИДЛАР
R2O
RO
R2O4
о
RO2
R2O5
RO3
R2O7
RO4
ОЧУЧАН
ВОДОРОДЛЫ
КУШЫЛМАЛАР
RH4
RH3
RH2
RH
I I - МЕТАЛЛАР
I I - НЕМЕТАЛЛАР
[98] - АЕРУЧА ТОТРЫКЛЫ
ТӨРЛӘРНЕҢ
МАССА САННАРЫ
* лантаноидлар
Las7
Ce8
ЦЕРИЙ
140,12
Pr8
ПРАЗЕОДИМ
140,9077
Nd"
НЕОДИМ
144,24
Pm0
ПРОМЕТИЙ
[145]
Sma
САМАРИЙ
150,36
Eu63
Gd"
ГАДОЛИНИЙ
157 25
Tb8
ТЕРБИЙ
158,9254
Dy8
ДИСПРОЗИЙ
162,50
Но"
гольмий
164,9304
Er68
ЭРБИЙ
167,26
Tm"
ТУЛИЙ
168,9342
Yb"
ИТТЕРБИЙ
173,04
Lu”
ЛЮТЕЦИЙ
174,967
ЛАНТАН
138,9055
ЕВРОПИЙ
151,96
Ас”
Th"
Ра"
U ”
Np"
Pu"
Am"
С’п"
Bk"
Cf 8
Es99
Fm'"
Md"
No1"
]
Lr'"
★★ аггиноидлар
АКТИНИЙ
[227]
ТОРИЙ
232,0381
ПРОТАКТИНИЙ
[231]
УРАН
238,0289
НЕПТУНИЙ
[237]
ПЛУТОНИЙ
[244]
АМЕРИЦИЙ
[243]
БЕРКЛИЙ
[247]
КАЛИФОРНИЙ
[251]
ЭЙНШТЕЙНИЙ
[252]
ФВ>МИЙ
[257]
МЕНДЕЛЕВИЙ
[258]
НОБЕЛИЙ
[259]
ЛОУРЕНСИЙ
[260]
Г. Е. РУДЗИТИС, Ф. Г. ФЕЛЬДМАН
ХИМИЯ
НЕОРГАНИК ХИМИЯ
ОРГАНИК ХИМИЯ
ТАТАР УРТА ГОМУМИ БЕЛЕМ БИРҮ МӘКТӘБЕНЕҢ
9 НЧЫ СЫЙНЫФЫ ӨЧЕН ДӘРЕСЛЕК
Россия Федерациясе
Мәгариф һәм фән министрлыгы,
тарафыннан тәкъдим ителгән
Казан • «Мәгариф» нәшрияты
Москва ♦ «Просвещение»
2009
УДК 373.167.1:54*09
ББК 24 я721
Р71
Рудзитис Г. Е.
Химия: неорган. химия. Орган, химия : учеб, для 9 кл. общеоб-
разоват. учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман.— 12-е изд.,
перераб.— M.: Просвещение, 2008.
Дәреслеккә Россия фәннәр академиясе һәм Россия мәгариф академиясе
тарафыннан уңай бәяләмәләр бирелде.
Переводное издание учебника выпущено в свет по Сублицензионному договору
№3/18 от 10 марта 2009 года. Экземпляры переводного издания подлежат рас¬
пространению исключительно в Республике Татарстан, а также среди татарской
диаспоры на территориях других субъектов Российской Федерации.
Охраняется действующим законодательством об авторских и смежных
правах (Гражданский кодекс РФ, ч. 4, гл. 70). Воспроизведение всей книги или
ее части на любых видах носителей запрещается без письменного разрешения
издательства.
Д Кабатлау барышында
өйрәнелә торган материал
Өстәмә материал
[7 Сораулар һәм күнегүләр
O Мәсьәләләр
Рудзитис Г. Е.
Р71 Химия: неорган. химия. Орган, химия: Татар урта гомуми белем
бирү мәкт. 9 нчы с-фы өчен д-лек / Г. Е. Рудзитис, Ф. Г. Фельдман;
Русча 12 нче басмадан Ф.Г. Иштирәкова тәрҗ.— Казан: Мәгариф,
2009.— 191 б.: рәс. б-н.
ISBN 978-5-7761-2021-3
ISBN 978-5-7761-2021-3
© Издательство «Просвещение», 2008
© Художественное оформление.
Издательство «Просвещение», 2008
Все права защищены
© Татарчага тәрҗемә. «Мәгариф» нәшрияты, 2009
Электролитик диссоциация
I БҮЛЕК
8 нче сыйныф дәреслегеннән химик бәйләнешләрнең төрләре: ковалент (поляр һәм
поляр булмаган), ионлы (§ 41) бәйләнешләр; кристаллик челтәрләрнең типлары: ионлы,
атомлы һәм молекуляр челтәрләр (§ 42) турындагы уку материалын кабатлагыз.
Төрле матдәләрнең суда эрү процессларын һәм аларның судагы эремәлә¬
ренең кайбер үзлекләрен сез инде өйрәндегез (8 нче сыйныф, § 28). Бу бүлектә
без ионлы бәйләнешле матдәләрнең суда эрү процессларын тикшерербез һәм
электролитик диссоциация процессы белән танышырбыз.
§ 1. Электролитик диссоциация процессының асылы
Төрле төр химик бәйләнешле матдәләрнең суда эрү үзенчәлекләре белән
эксперименталь рәвештә, бу матдәләр эремәләренең электр үткәрүчәнлеген
1 нче рәсемдәгечә җыелган прибор ярдәмендә тикшереп (23 нче битне
карагыз) танышырга мөмкин.
Приборның электродларын, мәсәлән, коры аш тозына батырсак,
лампочка янмас. Электродларны дистиллирланган суга төшергәндә дә
нәтиҗә шул ук булыр. Ә менә электродларны натрий хлоридының судагы
эремәсенә төшергәндә лампочка яна башлый. Димәк, натрий хлориды
эремәсе электр тогын үткәрә икән. Эрүчән башка тозлар, селтеләр һәм
кислоталар белән дә шул ук хәл күзәтелә. Тозлар һәм селтеләр электр
тогын судагы эремәләрендә генә түгел, эретелмәләрендә дә үткәрәләр. Ши¬
кәр, глюкоза, спирт, кислород, азотның судагы эремәләре электр тогын
үткәрмиләр.
Төрле характердагы химик бәйләнешле матдәләрнең суда эрү меха¬
низмы. Без тикшергән мисаллардан күренгәнчә, ни өчен нәкъ менә тозлар,
селтеләр һәм кислоталарның судагы эремәләре электр
тогын үткәрәләр? Бу сорауга җавап бирү өчен, мат¬
дәләрнең үзлекләре аларның төзелешенә бәйле булуын
искә төшерергә кирәк. Мәсәлән, натрий хлориды
кристалларының төзелешен тикшерик. Бу — ионлы
кушылма, аның кристаллик челтәре төеннәрендә кати¬
оннар (уңай корылган натрий ионнары) һәм анионнар
(тискәре корылган хлор ионнары) була (2 нче рәсем).
Ионлы бәйләнешле матдәләрнең суда эрү механиз¬
мын дөрес аңлау өчен, су молекулаларындагы водород
һәм кислород атомнары арасында көчле поляр бәйлә¬
нешләр булуын исәпкә алырга кирәк. Шуңа күрә су
молекуласы поляр (кислород атомы молекуланың —
1 нче рәсем. Эре¬
мәләрнең электр
тогын үткәрүчән¬
леген тикшерү при¬
боры
3
тискәре, водород атомы уңай полюсын тәшкил итә). Шул сәбәпле, мәсәлән,
натрий хлориды эрегәндә, су молекулалары үзләренең тискәре полюслары
белән — уңай корылган натрий ионнарына, ә уңай полюслары белән тискәре
корылган хлорид-ионнарга тартыла. Нәтиҗәдә ионнар арасында бәйләнеш
йомшый һәм кристаллик челтәр җимерелә (2 нче рәсем, a). By процесска
шулай ук суның диэлектрик үткэрүчэнлеге зур булуы (20 oC та 81 гә тигез)
булышлык итә. Бу — суда ионнар арасында химик бәйләнеш вакуум белән
чагыштырганда 81 тапкырга йомшый дигән сүз.
Көчле поляр ковалент бәйләнешле матдәләр, мәсәлән хлороводород HCl,
суда эрегәндә, химик бәйләнешнең характеры үзгәрүе күзәтелә, ягъни суның
поляр молекулалары йогынтысында эри торган матдәдә поляр ковалент
бәйләнеш ионлы бәйләнешкә әверелә һәм аннан соң кисәкчекләрнең аерылу
процессы 2 нче рәсемдә күрсәтелгәнчә уза.
Электролитларны кыздырып эреткәндә, кисәкчекләрнең тирбәнүле
хәрәкәтләре көчәя, бу исә алар арасында бәйләнешләр йомшаруына китерә.
Нәтиҗәдә шулай ук кристаллик челтәр җимерелә. Димәк, тозлар, селтеләр,
кислоталар суда эрегәндә һәм тозлар, шулай ук селтеләрне кыздырып
эреткәндә, бу матдәләр ионнарга таркалалар. Судагы эремәдә ионнар
гидратлашкан (су молекулалары белән чолганып алынган) була (2 нче
рәсем, б).
Барлык матдәләрне электролитларга һәм неэлектролитларга (электролит
булмаганнарга) аерып күрсәтергә мөмкин (1 нче схема).
2 нче рәсем. Натрий хлоридының суда эрү механизмы: а — суның поляр молекулалары
натрий хлоридының кристаллик челтәренә тартылуы һәм'тәэсир итүе; б — натрийның
гидратлашкан ионнары һәм хлорид-ионнар хасил булу (төсле түгәрәкләр белән күр¬
сәтелгән)
4
1 нче схема
3 нче рәсем. Суль¬
фат кислотасын суда
эреткәндә җылыну
процессы
4 нче рәсем. Кай¬
бер матдәләрне су¬
да эреткәндә суыну
процессы
Эрү — ул физик-химик процесс. Матдәләрнең суда эрүенә химиклар
озак вакыт физик процесс итеп кенә карадылар. Чынлап та, эремәнең
суын парга әйләндереп яңадан башлангыч матдәне табарга була. Әгәр суда
тоз, селте яки кислотаны эретсәк, электр үткәрүчән эремә барлыкка килә,
ә эрү процессы җылылык эффекты (җылыну яки суыну) һәм төс үзгәрү
белән бара.
Мәсәлән, каты хәлдәге натрий
гидроксидын NaOH яки куертыл¬
ган сульфат кислотасын H2SO4
суда эреткәндә нык җылыну күзә¬
телә (3 нче рәсем.). Бигрәк тә суль¬
фат кислотасын эреткәндә сак эш
итәргә кирәк, чөнки температура
күтәрелүдән суның бер өлеше пар¬
га әйләнергә һәм аның басымы ас¬
тында кислота савыттан атылып
чыгарга мөмкин. Моны булдырмас
өчен, болгатып торган хәлдә, кис¬
лотаны нечкә агынты белән суга
(суны кислотага түгел!) агызырга
кирәк.
5
Каблуков
Иван
Алексеевич
(1857-1942)
Pyc галиме, академик. В. А. Кистяковскийдан
бәйсез рәвештә 1889—1891 елларда фәнгә
ионнар гидратациясе турындагы күзаллау¬
ларны кертә. Эремәләрнең физик һәм химик
теориясенә башлангыч бирә.
Әгәр, мәсәлән, аммиак селитрасын (аммоний нитратын NH4NO3) юеш
тактага утыртылган юка стеналы стакандагы суда эретсәң, бик көчле суыну
күзәтелә, хәтта стакан тактага ябышып ката (4 нче рәсем).
Болар барысы да химик реакция баруын, ягъни эретелә торган матдәнең
су белән үзара тәэсир итешүен дәлилли.
Моннан түбәндәге нәтиҗәне ясарга мөмкин:
г
Эру — ул физик-химик процесс.
Pyc галимнәре И. А. Каблуков һәм В. А. Кистяковский берен-
челәрдән булып электролитлар эрегәндә барлыкка килгән ионнарга су
молекулалары кушылуын — ионнар гидратлашуын фаразлыйлар.
Гидратация (гидратлашу) — суның ионнарга, атомнар яки молеку¬
лаларга кушылуы ул. Мондый процесста барлыкка килгән продуктларны
гидратлар дип атыйлар.
й~||1и..п Iill.... I I . - . 1Г ‘7Г . ... ,
Каты матдә эрегәндә, аның кристаллик челтәре җимерелә һәм барлыкка
килгән кисәкчекләр эреткеч молекулалары арасында бүленешәләр. Әгәр
гидратация нәтиҗәсендә аерылып чыккан энергия матдә кристаллары
җимерелүгә тотылганга караганда артыграк булса, ул вакытта эрү
процессы — җылыну белән, әгәр киресенчә булса суыну белән бара.
A Эремәне парга әйләндергәндә, эрегән матдә еш кына үзендә химик
бәйләнешкә кергән суы булган кристаллар рәвешендә аерыла. Әйтик,
мәсәлән, бакыр (II) сульфатына CuSO4 (ак төстәге порошок) су салсаң,
җылыну күзәтелә һәм зәңгәрсу төстәге эремә хасил була. Бу эремәне парга
әйләндергәндә, зәңгәр төстәге кристаллик матдә — CuSO4 • 5Н2О составлы
бакыр купоросы аерылып чыга. Бакыр (II) сульфатыннан бакыр купоросы
хасил булу түбәндәге реакция тигезләмәсе белән күрсәтелә:
6
Pyc галиме, физик-химик, академик.
1888 елда Д. И. Менделеев иҗат иткән
эремәләрнең химик теориясен C. Appe-
ниусның электролитик диссоциациясе
турындагы тәгълиматы белән берләштерү
идеясен әйтә.
Кистяковский
Владимир
Александрович
(1865-1952)
CuSO4 + 5Н2О * CuSO4 • 5Н2О
бакыр (II) бакыр (II) сульфаты
сульфаты кристаллогидраты
(ак төстә) (зәңгәрсу төстә)
Биредә күзәтелгән төс үзгәрү бакыр (II) сульфатындагы ионнарның су
молекулалары белән реакциягә керүеннән, ягъни аларның гидратлашуыннан
килеп чыга.
Сусызландырылган бакыр (II) сульфаты төссез, сусыз Cu2+ һәм SO4-
ионнары да шулай ук төссез. Бакыр (II) сульфатын суда эреткәндә, ионнар
гидратлаша. Андый эремәне парга әйләндергәндә, кристаллар барлыкка
килә, аларның кристаллик челтәрләре төеннәрендә зәңгәрсу төстәге
Cu(H2O)2+ ионнары һәм гидратлашкан төссез сульфат-ионнар [SO4 • H2O]2-
була. Бу ионнар бакыр купоросы CuSO4 • 5Н2О кристалларын барлыкка
китерәләр дә инде.
Бакыр купоросын кыздырганда, су аерылып чыга — дегидратлаша:
CuSO4 • 5Н2О CuSO4 + 5Н2О
бакыр (II) сульфаты бакыр (II)
кристаллогидраты сульфаты
(зәңгәрсу төстә) (ак төстә)
Составында химик бәйләнештәге суы булган кристаллик матдәләр
кристаллогидратлар дип атала. Кристаллар составына кергән суны
кристаллизацион су дип йөртәләр.
Күп кенә матдәләр кристаллогидратлар барлыкка китерә, мәсә¬
лән FeSO4 • TH2O — тимер (II) сульфаты кристаллогидраты (тимер
купоросы), CaSO4 • 2Н2О — кальций сульфаты кристаллогидраты (гипс),
Na2CO3 • IOH2O — натрий карбонаты кристаллогидраты (кристаллик сода).
7
Аррениус
Сванте
Август
(1859-1927)
Швед галиме, академик. 1887 елда электро¬
литик диссоциациянең төп положениеләрен
тәгъбир итә. 1903 елда «электролитик диссо¬
циациянең химияне үстерүдәге аерым
әһәмиятен тану хөрмәтенә» Нобель премиясе
белән бүләкләнә. Башка күп кенә фәнни
тикшеренүләр үткәрә.
Электролитик диссоциация теориясенең төп положениеләре 1887 елда
швед галиме С. Аррениус тарафыннан тәгъбир ителә. Хәзерге вакытта
аларны түбәндәгечә әйтергә мөмкин:
1. Электролитлар — суда эрегәндә яки эретелмә хәлендә ионнарга
таркалучы матдәләр. Ионнар — уңай (катионнар) яки тискәре (анионнар)
j«5pbinMara ия атомнар яисә атомнар группасы.
Судагы эремәләрдә ионнар су молекулалары белән химик бәйләнгән,
ягъни алар гидратлашкан була. Ионга кушыла торган су молекулаларының
саны, күпчелек очракта билгесез булганлыктан, электролитик диссоциация
процессларының тигезләмәләрен гадиләштереп болай язалар, мәсәлән:
KCl >К+ + СГ
калий хлорид-
ионы ион
Na2SO4—>2Na+ + SO2"
натрий сульфат-
ионы ион
2. Ионнар атомнардан төзелеше белән дә, үзлекләре белән дә аерыла:
+11Na° Is2 12s22p6| 3s1
натрий атомының
электронлы формуласы
+11Na° 2е~, 8е~, 1е~
натрий атомы
төзелешенең схемасы
Натрий атомнары тышкы Зз1-элект-
роннарын җиңел бирәләр, шуңа күрә
химик яктан бик активлар: гадәти
шартларда һавада оксидлашалар, су
белән реакциягә керәләр һ. б.
+11Na+ Is2 |2s22p6
натрий ионының
электронлы формуласы
+11Na+ 2е~, 8е~
натрий ионы
төзелешенең схемасы
Натрий ионнары электроннарын
бирмиләр, шуңа күрә оксидлаша ал¬
мыйлар һәм су белән дә реакциягә
кермиләр.
8
Катион Анион
5 иче рәсем. Эремәләрдә һәм
эретелмәләрдә ионнарның
хаотик хәрәкәте
6 нчы рәсем. Электролит эремәсе яки
эретелмәсе аша даими электр тогын
үткәргәндә ионнарның хәрәкәте
3. Электролит эремәләрендә һәм эретелмәләрендә ионнар хаотик хәрә¬
кәттә булалар (5 нче рәсем). Әлеге эремә яки эретелмә аша даими электр
тогын уздырганда, уңай корылган ионнар (катионнар) — катодка таба,
ә тискәре корылган ионнар (анионнар) анодка таба хәрәкәт итәләр (6 нчы
рәсем).
Сорауларга җавап бирегез һәм 1—6 нчы күнегүләрне үтәгез (13 нче бит).
§ 2. Кислоталар, селтеләр һәм тозлар диссоциациясе
Кислота молекулалары диссоциацияләшкәндә водородның ирекле
ионнары түгел, ә бәлки аларның гидратлары — гидроксоний ионнары.
барлыкка килүе беленгән:
H+ + H2O * H4O+
Z O
▲ Кислота молекулалары диссоциациясен өстәмә ковалент бәйләнеш
барлыкка килү белән аңлатырга мөмкин. Ул ике атомның да уртак
бәйләүче пар электроннар бирмәвен, ә бәлки бер генә атомның бирүе
белән характерлана. Уртак бәйләүче пар электроннар бирүче атом донор
дип; аны алучы атом акцептор дип атала. Бу реакция механизмын
донорлы-акцепторлы дип йөртәләр. Хлорид кислотасы молекулалары
диссоциацияләшкәндә гидроксоний ионы барлыкка килү схемасын болай
сурәтлиләр: ң
H = Cl: + H=O=H—»[H=O=H ]++=Cl="
яки
HCl + H2O * H3O+ + СГ
Схемадан күренгәнчә, кислород атомы уртак пар электроннарын бирә,
ягъни донор булып тора, ә H+ ионы — акцептор. Ковалент бәйләнешнең
мондый төрен кайчак ук белән күрсәтәләр:
H
[н-о-н]+
9
Ионнар гидратлашуын исәпкә алып, кислоталарның, мәсәлән нитрат
кислотасының HNO3, диссоциациясе процессын түбәндәгечә күрсәтеп булыр
иде:
HNO3 + пН2О > H4O+ + NO4 • ZnH9O
OZ O OZ
Әмма бу процессны гадиләштереп болай язалар:
HNO3 > H+ + NO3
Башка электролитларның да диссоциациясе процессын шулай гадиләш¬
тереп язалар. Мондый схемалардан файдаланганда, шуны истә тотарга кирәк:
электролитларның судагы эремәләрендә ионнар гидратлашкан була.
Кислоталар, нигезләр һәм тозлар диссоциациясе процессын тикшерик.
Барлык эрүчән кислоталар да судагы эремәләрендә водород һәм кислота
калдыгы ионнарына диссоциацияләшә.
Күп нигезле кислоталар баскычлап диссоциацияләшә:
H2SO4 —* H+ + HSO4 __
Hso; <=* н+ + SO^
HSO; ионнары тулысынча диссоциацияләшми, шуңа күрә <—* билгесе
куела, бу исә барлыкка килгән H+ һәм SO4 ионнарының бергә кушылып,
башлангыч HSO4 ионнарын хасил итә алуларын күрсәтә. Мондый процесс¬
лар кайтма процесслар дип аталалар (14 нче параграфны карагыз). Әгәр
ионнарга таркалу тизлеге, башлангыч ионнар хасил булу тизлегенә кара¬
ганда зуррак булса, диссоциация процессы уңга авыша, ә киресенчә булса,
сулга дип әйтү гадәткә кергән.
Электролитик диссоциация теориясеннән чыгып, кислоталарга мондый
билгеләмә бирергә мөмкин:
Кислоталар — судагы эремәләрендә диссоциацияләшкәндә катион¬
нар сыйфатында водород ионнары гына аерып чыгара торган катлаулы
матдәләр.
Кислоталарга хас уртак билгеләрне нәкъ менә водород ионнары бирә
дә инде.
Барлык эрүчән нигезләр судагы эремәләрендә тискәре корылган гидрок-
сид-ионнарга һәм уңай корылган металл ионнарына диссоциацияләшә,
мәсәлән:
NaOH —» Na+ + OH
Нигезләр — судагы эремәләрендә диссоциацияләшкәндә анионнар
сыйфатында гидроксид-ионнар гына аерып чыгара торган катлаулы
матдәләр.
10
Нигезләргә хас уртак үзлекләр эремәләрдә гидроксид-ионнар булу белән
аңлатыла.
Барлык эрүчән тозлар судагы эремәләрендә металл катионнарына һәм
кислота калдыклары анионнарына диссоциацияләшә:
KNO4 —> K+ + N0:
O O
CaCl2 * Ca2+ + 2СГ
Al2(SO4)3 * 2А13+ + 3SO2’
Тозлар — судагы эремәләрендә металл катионнарына һәм кислота
калдыгы анионнарына диссоциацияләшә торган катлаулы матдәләр.
Электролитларның характерлы химик үзлекләре 1 нче таблицада
күрсәтелә.
1 нче таблица. Электролитик диссоциация теориясеннән чыгып
караганда кислоталар, нигезләр һәм тозларның химик үзлекләре
Электролитлар
Характерлы уртак
ионнары
Характерлы үзлекләре
Кислоталар
Нигезләр
Тозлар
H+
0Н“
Уртак ионнары юк
Индикаторларга тәэсир итәләр һәм
OH- ионнары белән реагирлашып, су ха¬
сил итәләр:
H+ + 0Н“ * H2O
Индикаторларга тәэсир итәләр һәм
H+ ионнары белән реагирлашып, су ха¬
сил итәләр:
OH- + H+ * H2O
Уртак ионнары булуы белән бәйле
уртак үзлекләре юк
7—8 нче сорауларга җавап бирегез. 1 нче мәсьәләне чишегез (13 нче бит).
§ 3. Көчсез һәм көчле электролитлар.
Диссоциация дәрәҗәсе
Әлегә кадәр без судагы эремәләрендә тулысынча ионнарга таркалган
электролитларны тикшердек.
Шундый сораулар туа: барлык электролитлар да ионнарга бер үк дәрәҗәдә
таркаламы? Төрле электролитларның диссоциацияләшкән молекулалары
11
күпме өлеш тәшкил итә? Диссоциация процессы нинди шартларда — уңга,
ә нинди шартларда сулга авыша?
Бу сорауларга җавапны түбәндәге тәҗрибәләрне үткәреп табарга була.
Әгәр натрий хлоридының куертылган эремәсенә электр үткәрүчәнлекне
билгеләү приборының электродларын төшерсәк (1 нче рәсемне карагыз),
анда лампочканың яктырып януын күрербез, ә серкә кислотасының
куертылган эремәсендә тонык янар. Серкә кислотасы эремәсенә су өстәгәндә,
лампочка яктырак яна башлый. Натрий хлориды эремәсенә су өстәгәндә
исә, лампочканың яктылыгы үзгәрмәс. Электр үткәрүчәнлек эремәдәге
ионнар санына бәйле, димәк, натрий хлориды хәтта куертылган эремәләрдә
дә ионнарга тулысынча диссоциацияләшә, ә серкә кислотасы молекула¬
лары куертылган эремәләрдә диссоциацияләшми диярлек. Серкә кислотасы
эремәсенә су өстәгәндә диссоциацияләшкән молекулалар саны арта.
Тәҗрибәләрдән чыгып, түбәндәге нәтиҗәләрне ясарга мөмкин:
1. Кайбер электролитлар судагы эремәләрендә концентрациясенә
бәйсез рәвештә ионнарга тулысынча диссоциацияләшә. Андый электро-
литларга ионлы кристаллик челтәрле матдәләр, мәсәлән, натрий хлориды
керә.
2. Өлешчә диссоциацияләшә торган электролитлар да бар. Бу
матдәләрнең эремәләрен сыегайтканда, диссоциация тигезләнеше — уңга,
ә концентрациясен арттырганда, сулга авыша.
3. Диссоциацияләшкән молекулалар санының эремәдәге молекулаларның
гомуми санына чагыштырмасы диссоциация дәрәҗәсе дип атала һәм
а (альфа) белән билгеләнә.
Әгәр диссоциацияләшкән молекулаларның санын — п хәрефе, ә эрегән
молекулаларның гомуми санын N белән билгеләсәк, диссоциация дәрәҗәсен
a = -^ формуласы белән исәпләп чыгарырга мөмкин.
Әйтик, 1 моль нитрат кислотасы суда эрегәндә, барлык молекула¬
ларның яртысы ионнарга таркалды, ди. Югарыда китерелгән формуладан
файдаланып, диссоциация дәрәҗәсен исәпләп чыгарабыз:
a = а = 3,01 • IO23 : 6,02 • IO23 = 0,5
Кайчак диссоциация дәрәҗәсен процентларда күрсәтергә кирәк була:
0,5 • 100 = 50, яки а = 50%
п зурлыгы 0 дән N га кадәр кыйммәтләргә ия була ала. Шуңа тиңдәшле
рәвештә а зурлыгы да 1) 0 дән (диссоциация юк) 1 гә (тулы диссоциация)
кадәр; 2) процентларда 0 дән (диссоциация юк) 100% ка (тулы диссоциация)
кадәр үзгәрергә мөмкин.
Электролитларны аларның диссоциация дәрәҗәсенә карап төркемләү
2 нче таблицада китерелә.
12
2 нче таблица. Диссоциация дәрәҗәсенә карап
электролитларның шартлы классификациясе
Электролитларның
классификациясе һәм аларның
характерлы үзлекләре
Мисаллар
Көчле электролитлар —
суда эреткәндә тулысынча
ионнарга таркала торган
химик кушылмалар.
Көчсез электролитлар —
ионнарга аз диссоциация-
ләшә торган химик кушыл¬
малар.
Барлык диярлек эрүчән тозлар, кислоталар —
хлорид, нитрат, сульфат һ. б. кислоталар; эрү¬
чән нигезләр (селтеләр — селтеле металлар гид-
роксидлары, барий һәм кальций гидроксидлары).
Серкә, карбонат, борат һ. б. кислоталар. Су¬
ның да көчсез электролит булуын һәм (аз гына
булса да) ионнарга диссоциацияләшүен истә
тотарга кирәк:
H2O ?=± H+ + OH
9, 10 нчы сорауларга җавап бирегез һәм күнегүләрне үтәгез. 2 нче мәсьәләне
чишегез.
1. Шикәр эремәсе ни өчен электр то¬
гын үткәрми, ә натрий хлориды эремәсе
үткәрә, аңлатып бирегез.
2. Кайбер матдәләрне суда эреткәндә
яки кыздырып эреткәндә, аларның ион¬
нарга таркалуын китереп чыгаручы төп
сәбәпләрне әйтеп бирегез.
3. Түбәндә саналган матдәләрнең эре¬
мәләре һәм эретелмәләре арасында элект¬
ролит булганнарын күрсәтегез:
1) калий гидроксиды эремәсе
2) спирт эремәсе
3) шикәр кристаллары
4) шикәр суы
4. Бакыр (II) сульфаты — ак поро-
шоксыман матдә, аны суда эреткәндә,
эремә зәңгәрсу төскә керә. Моның сәбәбе
нәрсәдә?
5. Ионнар һәм атомнар төзелешендәге
һәм үзлекләрендәге аерымлыкларны каль¬
ций һәм фтор мисалында күрсәтегез.
O 1. 5 моль бакыр (II) сульфаты һәм ар¬
тыгы белән алынган сероводород (күкертле
водород) кислотасы тәэсир итешкәндә
барлыкка килгән бакыр (II) сульфидының
массасын исәпләп чыгарыгыз.
6. Гидроксоний ионы нәрсә һәм ул
ничек барлыкка килә? Бу ионда бәйлә¬
нешнең нинди төре?
7. Ортофосфат кислотасы, калий гид¬
роксиды һәм алюминий сульфатының
диссоциациясе процессларын чагылдыр¬
ган тигезләмәләр языгыз.
8. Судагы эремәләрендә бертөрле
анионнар барлыкка китерүче матдәләрне
күрсәтегез:
1) FeCl3 һәм Fe(OH)3
2) BaSO4 һәм Na2SO4
3) Ba(OH)2 һәм Cu(OH)2
4) AgNO3 һәм HNO3
9. «Диссоциация дәрәҗәсе» төшен¬
чәсен кулланып, «көчле кислота» һәм
«көчсез кислота» төшенчәләренең мәгъ¬
нәләрен аңлатып бирегез.
10. Көчле һәм көчсез электролитларга
мисаллар китерегез. Электролитларның
көчен практикада кайсы өлкәдә исәпкә
алырга кирәк?
2. Сульфат кислотасы белән реакциягә
кергән калий гидроксиды матдәсенең
микъдарын исәпләп чыгарыгыз.
13
§ 4. Ионнар алмашу реакцияләре
Ионнар алмашу реакцияләренең узу шартларын аңлау өчен, ионнарның
иң мөһим үзлекләре белән танышыйк.
Ионнарның үзлекләре. Ионнар төзелеше һәм үзлекләре белән атомнардан
аерылып торуын сез инде беләсез. Кайбер ионнар төссез, ә икенчеләре исә
билгеле бер төскә ия. Аларның һәркайсы өчен үзләренә генә хас химик
үзлекләр характерлы. 3 нче таблицада ионнарга характерлы реакцияләр
һәм реактивлар күрсәтелгән.
3 нче таблица. Ионнарны билгеләү
Билгеләнергә
тиешле ион
Реактивтагы ион
Реакция нәтиҗәсе
H+
Ag+
Cu2+
Fe2+
Fe3+
Zn2+
Al3+
NHt
Ba2+
Ca2+
Na+
K+
CF
Вг~
I-
Индикаторлар
СГ
OH
S2"
ОК¬
ОН"
ОН"
S2"
ОН"
OH"
SOt
С0|"
Hfso4*
H2SO4*
Ag+
H2SO4*
Төсе үзгәрә
Ак төстәге утырым
Зәңгәр төстәге утырым
Kapa төстәге утырым
Ялкынны яшькелт-зәңгәр төскә кертә
Яшькелт төстәге утырым, вакыт узу белән,
көрән төскә керә
Көрән төстәге утырым
Ак төстәге утырым, ОН" артып киткәндә эри
Ак төстәге утырым
Ак төстәге желесыман утырым, OH- артып
киткәндә эри
Аммиак исе килә
Ак төстәге утырым
Ялкынны саргылт-яшел төскә кертә
Ак төстәге утырым
Ялкынны кызыл кирпеч төсенә кертә
Ялкын сары төстә
Ялкын (кобальт пыяла аша) шәмәхә төстә
Ак төстәге утырым
Зәһәр исле төссез газ (HCl) аерылып чыга
Саргылт утырым
SO2 һәм Br2 (көрән төстә) аерылып чыга
Сары утырым
H2S һәм I2 (шәмәхә төстә) аерылып чыга
14
Дәвамы
Билгеләнергә
тиешле ион
Реактивтагы ион
Реакция нәтиҗәсе
so|-
СО|-
CH3COO-
NO3
SO2-
POt
OH-
H+
H+
H2SO4
H2SO4 (куерт.)
һәм Cu
Ba2+
Ag+
Индикаторлар
Фуксин эремәсен һәм шәмәхә язу карасын
төссезләндерүче, зәһәр исле газ — SO2 аеры¬
лып чыга
Известьле суны болганчыкландыручы, иссез
газ аерылып чыга
Серкә кислотасы исе килә
Көрән газ аерылып чыга
Ак төстәге утырым
Сары төстәге утырым
Индикаторлар төсен үзгәртә
* Галогенид-ионнарны сульфат кислотасы ярдәмендә билгеләгәндә, каты тоз кулла¬
налар.
Ионнар алмашу реакцияләре. Белгәнегезчә, судагы эремәләрендә
барлык электролитлар да күпмедер дәрәҗәдә ионнарга таркалалар һәм
ионнар арасында реакцияләр бара. Бу реакцияләрнең узу шартлары белән
тәҗрибәләр ясап танышырга мөмкин.
1 нче тәҗрибә. Натрий хлориды эремәсенә көмеш (I) нитраты яки
кургаш (II) нитраты эремәсен агызалар. Реакция нәтиҗәсендә утырым
төшә.
2 нче тәҗрибә. Натрий карбонаты эремәсенә хлорид кислотасы
эремәсе агызалар. Реакция нәтиҗәсендә газ аерылып чыга.
3 нче тәҗрибә. Нитрат кислотасы эремәсенә калий гидроксиды
эремәсе агызалар. Реакция нәтиҗәсендә җылылык аерылып чыга.
4 нче тәҗрибә. Эремәләрне, мәсәлән магний хлориды һәм натрий
сульфаты эремәләрен кушып болгатканда бернинди химик реакция бил¬
геләре сизелми.
СЕЗ
БЕЛӘСЕЗМЕ?
Матдәләрнең диссоциациясе мөмкинлеге турындагы
С. Аррениус теориясен шул заманның күп кенә күренекле
галимнәре аңламаган һәм аны танымаган. Мәсәлән,
С. Аррениус үзенең диссертациясен яклаганда, академик
П.-Т. Клеве: «Бу чын фантазия!» Эремәдә калийның мөс¬
тәкыйль була алуы мөмкинме соң? Калийның су белән
көчле реакциягә керүен һәр укучы белә бит...» — дип
кычкырып җибәрә. ...Әмма С. Аррениус идеяләре өстен
чыга, һәм 1903 елда аңа Нобель премиясе бирелә.
15
Әлеге реакцияләрнең узуында нинди дә булса закончалыклар бармы
соң? Бу сорауга җавап табу өчен, әлеге реакцияләрнең тигезләмәләрен без
моңа кадәр язып килгән молекуляр тигезләмәләр рәвешендә генә түгел,
ә ионлы һәм кыскартылган ионлы тигезләмәләр рәвешендә дә язарбыз
(4 нче таблица). Ионлы реакцияләр өчен «молекуляр рәвештә» дип
әйтү, язылуы кебек үк шартлы. 4 нче таблицада китерелгән реакция
тигезләмәләрен анализлаганда, ионнар алмашу реакцияләренең түбәндәге
очракларда: 1) утырым барлыкка килсә; 2) газ аерылып чыкса; 3) аз диссо-
циацияләшә торган матдә, мәсәлән, су барлыкка килсә, азаккача узуы
ачыклана. Әгәр инде эремәдә үзара бәйләнешкә керә торган ионнар булмаса,
алмашу реакциясе ахырга кадәр бармый, ягъни кайтма реакция була. Ан¬
дый реакцияләрнең тигезләмәләрен төзегәндә, көчсез электролитларның
диссоциациясе тигезләмәләрен төзегәндәге шикелле, кайтмалыкны аңлата
торган билге («=*) куела (14 нче параграфны карагыз).
Ионнар алмашу реакцияләренең азаккача узуы турында нәтиҗә чыгару
өчен, тозлар, нигезләр һәм кислоталарның суда эрүчәнлеге таблицасы
мәгълүматларыннан файдаланырга кирәк (180 нче бит).
Әйтик, мәсәлән, магний хлориды һәм суда эрүчән башка матдәләр
катнашында мөмкин булган барлык реакцияләрнең тигезләмәләрен төзү
өчен болай фикер йөртәләр:
1. Реакция өчен алынган матдәнең, бу очракта магний хлоридының
MgCl2, таблицадан карап, суда эрүчәнлеген ачыклыйлар.
2. Магний хлориды MgCl2 я Mg2+ ионнарын, я хлорид-ионнарны СГ
утырымга төшерергә сәләтле суда эрүчән матдәләр белән генә реакциягә
керә алачак дигән нәтиҗәгә киләләр.
3. Mg2+ ионнарын түбәндәге очракларда утырымга төшерергә мөмкин:
a) OH ионнары белән, ягъни теләсә кайсы селте белән тәэсир итеп, бу аз
эрүчән магний гидроксиды Mg(OH)2 хасил булуга китерә; б) составында
СОз“, PO2 , S2- анионнарының берсе булган суда эрүчән тозлар белән тәэсир
итеп. Моның өчен составында әлеге анионнар булган натрий, калий, аммоний
тозларын кулланырга мөмкин, чөнки болар — суда эрүчән тозлар.
4. Хлорид-ионнарны (СГ) Ag+ һәм Pb2+ катионнары белән утырымга
төшерергә мөмкин. Шуңа күрә реакцияне уздыру өчен, составында әлеге
катионнары булган тозларны сайлап алырга кирәк.
Газсыман матдәләр хасил булу белән бара торган ионнар алмашу реак¬
цияләренең тигезләмәләрен төзегәндә CO2’, SO2- һәм S2- анионнарының,
кислоталар белән реакциягә кереп, тиешле газ барлыкка китерә алуларын
исәпкә алырга кирәк, мәсәлән:
SO2’ + 2Н+ > H9O + SO9
Кислоталар, нигезләр һәм тозларның электролитик диссоциациясе турын¬
дагы күзаллаулардан чыгып караганда, бу матдәләрнең гомуми үзлекләре
ал арның составында уртак ионнар булу белән аңлатыла (1 нче таблица).
Сорауларга җавап бирегез һәм 1—5 нче күнегүләрне үтәгез (22 нче бит).
16
4 н ч е таблица. Ионлы реакцияләр тигезләмәләре
Реагирлашучы
матдәләр
Реакция тигезләмәсе
молекуляр
тулы ионлы
кыскартылган ионлы
Натрий хло¬
риды һәм
кургаш (II)
нитраты
Натрий
карбонаты
һәм хлорид
кислотасы
Калий
гидроксиды
һәм нитрат
кислотасы
Магний
хлориды
һәм натрий
сульфаты
1. Реакция нәтиҗәсен¬
дә утырым барлыкка
килә:
2NaCl +Pb(NO3)2 *
> PbCl91 + 2NaNO3
2. Реакция нәтиҗәсен¬
дә газ аерылып чыга:
Na9CO3 + 2НС1 >
* 2NaCl +
—»co2t
+ H2CO3
—*н2о
3. Реакция нәтиҗәсен¬
дә аз диссоциациялә-
шә торган матдә бар¬
лыкка килә:
KOH + HNO3 »
» KNO3 + H2O
4. Реакция билгеләре
күзәтелми:
MgCl2 + Na2SO4
2Na+ + 2СГ+ Pb2+ +
+ 2NO3 * PbCl2I +
+ 2Na+ + 2NO3
2Na+ + СОз’+ 2H+ +
+2СГ >2Na++ 2СГ+
+ H2O+ CO21
K++ OH- + H+ +
+NO3 * K+ +
+NO3 + H2O
Mg2++ 2СГ+ 2Na++
+ SO2-
Pb2+ + 2СГ *
* PbCl2I
СОз+2Н+ *
* H2O+ CO2 t
H+ + OH- —♦
—*н2о
(су — аз дис-
социацияләшә
торган матдә)
§ 5. Оксидлашу-кайтарылу реакцияләре
Оксидлашу-кайтарылу реакцияләре турындагы уку материалын кабатлагыз (8 нче
сыйныф, § 43).
Оксидлашу-кайтарылу процессларының электроннар теориясенә нигез¬
ләнеп, алмаштыру реакцияләренең ионнар алмашу реакцияләреннән нәрсә
белән аерылуын тикшерик.
Бакыр (II) сульфаты белән натрий гидроксиды һәм тимер, ә алюминий
белән хлорид кислотасы арасындагы реакцияләрнең тигезләмәләрен моле¬
куляр, ионлы һәм кыскартылган ионлы рәвештә язабыз. Химик элементлар
17
өстенә аларның оксидлашу дәрәҗәләрен куеп чыгабыз һәм уклар белән
электроннар күчешен күрсәтәбез:
1) CuSO4 + 2NaOH ♦ Cu(OH)21 + Na2SO4
Cu2+ + SO2 + 2Na+ + 20Н“ —♦ Cu(OH)21 + 2Na+ + SO4-
Cu2+ + 20Н- > Cu(OH)21
0+2 +2 O
2) Fe + CuSO4 —* FeSO4 + Cu I
Fe + Cu2+ + SO2- —* Fe2+ + SO2- + Cu I
I—2е —1 о
Fe0 + Cu2+ * Fe2+ + Cul
3) 2А1 + 6НС1 * 2А1С1., + ЗН, t
0+1 3 4+ 2 O
2А1 + 6Н + 6СГ » 2А13+ + 6СГ+ ЗН91
O . 4+ 0
2А1 + 6Н+ * 2А13+ + ЗН21
Бу реакция тигезләмәләреннән күренгәнчә, оксидлашу дәрәҗәсе икенче
һәм өченче реакцияләрдә үзгәрә.
Оксидлашу дәрәҗәсен язганда «+» яки «-» тамгаларын — цифр алдына,
ә ионнарның корылмаларын билгеләгәндә цифрдан соң куялар.
Тимер белән бакыр (II) сульфаты арасындагы реакциядә: а) тимер
атомнары тимер ионнарына оксидлаша; б) бакыр ионнары бакыр атом¬
нарына кайтарыла; в) оксидлаштыргычлар булып тимер атомнарын
оксидлаштыручы, ә үзләре кайтарылучы бакыр ионнары тора; г) кайтар¬
гычлар булып бакыр ионнарын кайтаручы, ә үзләре оксидлашучы тимер
атомнары тора.
Алюминий белән хлорид кислотасы арасындагы реакциядә: а) алюминий
атомнары алюминий ионнарына оксидлаша; б) водород ионнары водород
атомнарына кайтарыла, ә алардан водород молекулалары хасил була;
в) оксидлаштыргычлар булып алюминий атомнарын оксидлаштыручы,
ә үзләре кайтарылучы водород ионнары тора; г) кайтаргычлар булып водород
ионнарын кайтаручы, ә үзләре оксидлашучы алюминий атомнары тора.
Элементларның оксидлашу дәрәҗәләре үзгәрү белән уза торган
реакцияләр оксидлашу-кайтарылу реакцияләре дип атала.
Димәк, алмаштыру реакцияләре ионнар алмашу реакцияләреннән аер¬
малы буларак оксидлашу-кайтарылу реакцияләре булып тора.
Оксидлашу-кайтарылу реакцияләренең тигезләмәләрен төзү. Оксид¬
лашу-кайтарылу реакцияләренең тигезләмәләрен төзегәндә, шуны истә
тотарга кирәк: кайтаргыч биргән электроннар саны оксидлаштыргыч
китереп кушкан электроннар санына тигез булырга тиеш.
18
Мисалга хлорид кислотасының калий перманганаты белән реакциясен
тикшерик.
1. Реагирлашучы матдәләрнең формулаларын язабыз, ук куябыз, уктан
соң реакция вакытында хасил булган матдәләрнең формулаларын язабыз:
HCl + KMnO4 > KCl + MnCl2 + Cl21 + H2O
2. Оксидлашу дәрәҗәләре үзгәргән элементларның өстенә оксидлашу
дәрәҗәсен язып куябыз:
-1 +7 +2 O
HCl + KMnO4 * KCl + MnCl2 + Cl2 f + H2O
3. Атомнары яки ионнары оксидлашу дәрәҗәсен үзгәрткән элемент¬
ларның химик билгеләрен аерып язабыз:
-1 о
2С1 * Cl2
+7 +2
Mn * Mn
4. Әлеге атомнар яки ионнарның ничә электрон бирүен яки китереп
кушуын табабыз:
-1 о
2С1 - 2е- * Cl2
+7 _ +2 -
Mn + 5е > Mn
5. Биргән яки китереп кушкан электроннар санының (аларның саны
бертөрле булырга тиеш) иң кечкенә уртак кабатлысын табабыз:
-1 о
2С1 - 2е“—* Cl2
+7 _ +2
Mn + 5е * Mn
1 о
IOCl - IOe-—* 5С12
+7 +2
2Mn + IOe » 2Мп
5
2
6. Табылган коэффициентларны тигезләмәнең уң өлешендәге тиешле
формулалар алдына язып куябыз:
HCl + KMnO4 * KCl + 2МпС12 + 5С12 + H2O
7. Тигезләмәнең уң өлешендәге табылган коэффициентларга туры
китереп, калган барлык матдәләрнең формулалары өчен коэффициентлар
табабыз:
16НС1 + 2КМпО4 —* 2КС1 + 2МпС12 + 5С121 + 8Н2О
8. Тигезләмәнең уң өлешендәге барлык элементлар атомнарының саны
тигезләмәнең сул өлешендәге атомнар санына тәңгәл килүен тикшерәбез.
6—8 нче күнегүләрне үтәгез (22 нче бит).
СЕЗ
БЕЛӘСЕЗМЕ?
Кайбер тозлар судагы эремәләрендә индикаторларның
төсен үзгәртәләр. Уйлап, сәбәбен әйтегез.
19
□ §6. Тозлар гидролизы
Тозлар гидролизының асылына төшенү өчен, тозларның суга карата
мөнәсәбәтен индикаторлар белән сынап анализлыйк (5 нче таблица).
Индикаторның төсе үзгәрүе буенча кайбер тозларның су белән реагирлашуы
турында нәтиҗә ясарга мөмкин. Ни рәвешле?
5 нче таблица. Тозларның суга карата мөнәсәбәте
Тозларның
эремәләре
Индикаторның төсе
Лакмус
Фенолфталеин
Метилоранж
Натрий хлориды
Алюминий
хлориды
Натрий
карбонаты
Төсен үзгәртми
Кызара
Зәңгәр төскә керә
Төсен үзгәртми
Төсен үзгәртми
Kypa җиләге төсенә
керә
Төсен үзгәртми
Алсу төскә керә
Сары төскә керә
Тәҗрибәләрнең 6 нчы таблицада бирелгән нәтиҗәләре югарыда куелган
сорауга җавап бирә. Тозларның су белән үзара тәэсир итешү процессы
гидролиз (грекча «гидро» — су, «лизис» — таркалу) дип атала. Билгеле
булганча, су молекулалары аз гына булса да H+ һәм OH- ионнарына
диссоциацияләшә. Көчле нигез һәм көчле кислотадан хасил булган тозлар
су белән реагирлашмый, чөнки андый тозларның ионнары H+ һәм ОН”
ионнары белән бәйләнешкә керә алмый. Көчсез нигез һәм көчле кислотадан
яки көчле нигез һәм көчсез кислотадан хасил булган тозлар су белән
реакциягә керә. Бу андый тозларның составында H+ һәм OH- ионнары белән
бәйләнешкә керә ала торган ионнар булу белән аңлатыла.
,
Тозлар гидролизы ул — тоз ионнарының су белән реакциягә кереп,
аз диссоциацияләшә торган электролитлар барлыкка китерүе.
Көчсез кислота һәм көчсез нигездән хасил булган тозлар судагы эремәдә
була алмый, чөнки алар я утырымга төшә, я суда таркала:
ALSo + 6Н..0 = 2А1(0Н)о I + 3H9S f
ZO Z vzO Z
Тоз гидролизы ул — кайтма реакция. Эремәне җылытканда һәм
нык сыегайтканда, гидролиз көчәя.
I Ц—J
Сорауларга җавап бирегез һәм 9—10 нчы күнегүләрне үтәгез. 1—3 нче мәсьәләләрне
чишегез (22 нче бит).
20
to
6 нчы таблица. Тозларның су белән үзара тәэсир итешүе
Cy белән
реагирлашучы
тоз
Аңлатмалар
Реакция тигезләмәсе
Гидролиз нәтиҗә-
сендә барлыкка
килгән матдәләр
тулы ионлы
кыскартылган ионлы
Натрий
хлориды
Алюминий
хлориды
Натрий
карбонаты
Реакция бармый.,
чөнки эремәдә H+ яки
OH- ионнары белән
бәйләнешкә керә
торган ионнар юк.
Көчле кислота һәм
көчсез нигездән хасил
булган тоз гидролизы
күзәтелә: гидроксид-
ионнар һәм алюминий
ионнары тотрыклы
AlOH2+ ионнары бар¬
лыкка китерәләр. H+
ионнары тупланган¬
лыктан, тирәлек әче
була.
Көчсез кислота һәм
көчле нигездән хасил
булган тоз гидролизы
күзәтелә: H+ ионнары
2-
CO3 ионнары белән
тотрыклы HCO3
ионнары хасил итә.
OH ионнары туплан¬
ганлыктан, тирәлек
селтеле була.
Na+ + CF + H2O -+->
Al3+ +ЗСГ + H2O
I 1
OH- + H+
?=± AlOH2++ ЗСГ +H+
2Na+ + COi + H2O ?=±
I 1
— H+ + ОН"
<=е 2Na+ + HCO3+ ОН"
Al3+ + H2O <=±
AlOH2+ + H+
COl"+ H2O
з=± HCO3+ ОН"
AlOHCl2 — нигез
тоз һәм HCl —
хлороводород,
яки хлорид кис¬
лотасы
NaHCO3 — әче
тоз
һәм NaOH —
натрий гидрок¬
сиды
1. Ионнар алмашу реакциясе кайсы
матдәләрнең эремәләре арасында була
ала:
1) Na2CO3 һәм HNO3
2) CuCl2 һәм NaNO3
3) KCl һәм NaNO3
4) Ca(OH)2 һәм KNO3?
2. Составында Ag+, SO4 , H+, Г ион¬
нары булган эремәләр бирелгән. Бу эре¬
мәләрне нинди реакцияләр ярдәмендә
танып белергә мөмкин? Реакцияләрнең
тигезләмәләрен языгыз.
3. а) Цинк сульфаты һәм барий нит¬
раты; б) бакыр (H) сульфаты һәм калий
гидроксиды; в) цинк сульфаты, магний
хлориды һәм натрий ортофосфаты; г) ти¬
мер (III) хлориды һәм магний сульфаты
эремәләре бирелгән. Кайсы эремәләрне
кушканда алмашу реакцияләре азаккача
бара һәм ни өчен? Бу реакцияләрнең ти¬
гезләмәләрен молекуляр, тулы һәм кыс¬
картылган ионлы рәвештә языгыз.
4. Схемасы
K2CO3 + HNO3 ♦ KNO3 + H2O-I-CO21
рәвешендә бирелгән химик реакция тигез¬
ләмәсенә түбәндәге кыскартылган ионлы
тигезләмәләрнең кайсысы туры килә:
1) H+ + OH- = H2O
2) CO3 + 2Н+ = H2O + CO21
3) H2O + CO2 * 2Н+ + CO3
4) K2CO3 » 2К+ + CO3 ?
5. а) 2Н+ + CO3- »
б) 2Н+ + S2- ♦
в) 2Н+ + SO3- ♦
схемалары бирелгән.
O 1. Составында 40 г бакыр (П) сульфаты
булган эремәгә 10 г тимер вагы салалар.
Реакция нәтиҗәсендә хасил булган
матдәләрнең массаларын исәпләгез?
2. 5% бакыр (H) сульфаты булган
20 г эремәгә натрий гидроксиды өстиләр.
Хасил булган утырымның массасын
исәпләп чыгарыгыз.
Тиешле реакцияләрнең тигезләмәләрен
молекуляр рәвештә языгыз.
6. Реакция тигезләмәләре бирелгән:
а> 2Н2О—*2H2t +02f
б) Cu(OH)2--* CuO + H2O
ң) N2O5 + H2O » 2HNO3
г) CQSO4 + Fe ♦ FeSO4 + Cu
д) 2Fe + SCl2 > 2FeCl3
Бу реакцияләрнең кайсылары оксид-
лашу-кайтарылу реакцияләре һәм ни
өчен? Оксидлаштыргычны һәм кайтар¬
гычны күрсәтегез.
7. Реакция тигезләмәләре бирелгән:
а) Zn + Cl2 * ZnCl2
б) Zn + 2НС1 ♦ ZnCl2 +H2T
Тиешле химик элементларның бил¬
геләре өстенә оксидлашу дәрәҗәләрен
куеп чыгыгыз һәм электроннар күчешен
күрсәтегез.
\Г 8. Реакция тигезләмәләренең схема¬
лары бирелгән:
а) CuS + HNO3 (сыег.) ♦
> Cu(NO3)2 + S + NO + H2O
б) K2SO3 + H2SO4 + KMnO4 >
'ZO Z 2I 4
* K9SO4 + MnSO4 4- ...
Z 4 4
19 нчы биттә китерелгән үрнәктән
файдаланып, оксидлашу-кайтарылу реак¬
цияләренең тигезләмәләрен төзегез.
9*. Нинди тозлар гидролизлаша һәм
ни өчен? Цинк нитраты, калий сульфаты
һәм натрий сульфиды мисалында аңлатып
бирегез.
10*. Түбәндә китерелгән тозларның:
калий карбонаты, бакыр (II) хлориды,
кургаш (II) нитраты, натрий фосфатының
гидролизы тигезләмәләрен языгыз.
3. Составында 10% катышмалары
булган техник соданы хлорид кислотасы
белән эшкәрткәннәр. Бу вакытта 4 моль
углерод (IV) оксиды аерылып чыккан.
Кислота белән реакциягә кергән тех¬
ник соданың массасын исәпләп чыга¬
рыгыз.
22
Лаборатор тәҗрибәләр
1. Матдәләрнең электр үткәрүчәнлеген сынау
Эремәләрнең электр үткәрүчәнлеген сынау. Матдәләрнең электр үткәрүчәнлеген
күзәтү приборыннан файдаланыгыз (1 нче рәсем). (Приборның электродлары зур резин
бөкегә кертелгән металл чыбыктан ясалган булырга тиеш.)
Приборның электродларын (алдан дистиллирланган суда юып), чиратлаштырып,
түбәндәге матдәләр салынган стаканнарга төшерегез: а) дистиллирланган су салынган
стаканга 0,5-1,0 см тирәнлеккә; б) 0,1 масса өлеше натрий гидроксиды булган эремәгә;
в) 0,1 масса өлеше хлороводород булган эремәгә.
Кристаллик матдәләрнең коры һәм эретелмә хәлендә электр үткәрүчәнлеген
сынау. Приборның коры электродларын: а) коры тозга (натрий хлоридына); б) крис¬
таллик натрий гидроксиды салынган фарфор чашкага; в) натрий гидроксиды эретелмәсе
салынган фарфор чашкага төшерегез.
Куертылган һәм сыегайтылган эремәләрнең электр үткәрүчәнлеген сынау.
Приборның электродларын стаканнардагы:
а) сусыз серкә кислотасына;
б) сыегайтылган серкә кислотасына төшерегез.
Биремнәр. 1. Ни өчен дистиллирланган су, коры натрий хлориды һәм крис¬
таллик натрий гидроксиды электр тогын үткәрми, ә бу матдәләрнең эремәләре һәм
эретелмәләре үткәрә? 2. Ни өчен сусыз серкә кислотасы электр тогын үткәрми, ә су
белән сыегайтылганы үткәрә?
2. Электролитлар эремәләре арасындагы алмашу реакцияләре
Утырым хасил итү белән бара торган реакцияләр. Бер пробиркага —
3—4 мл бакыр (II) сульфаты эремәсе, икенчесенә — шундый ук күләмдә кальций
хлориды эремәсе, ә өченчесенә алюминий сульфаты салыгыз. Беренче пробиркага —
аз гына натрий гидроксиды эремәсе, икенчесенә — натрий ортофосфаты эремәсе,
ә өченчесенә барий нитраты эремәсе өстәгез. Өч пробиркада да утырым хасил була.
Бирем. Реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган
ионлы рәвештә языгыз. Ни өчен утырым хасил булуын аңлатыгыз. Утырымнар төшсен
өчен, пробиркаларга тагын нинди матдәләрнең эремәләрен салырга мөмкин? Бу
реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы рәвештә
төзегез.
Газ аерылып чыгу белән бара торган реакцияләр. Бер пробиркага — 3—4 мл
натрий сульфиты эремәсе, икенчесенә шундый ук күләмдә натрий карбонаты эремәсе
салыгыз. Аларның һәрберсенә шундый ук күләмдә сульфат кислотасы өстәгез. Беренче
пробиркада — зәһәр исле газ, икенчесендә иссез газ аерылып чыгар.
Бирем. Реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган
ионлы рәвештә төзегез. Боларга охшаш нәтиҗәләргә ирешү өчен, бирелгән эремәләргә
тагын нинди кислоталар белән тәэсир итеп булыр иде, уйлап әйтегез. Бу реакцияләрнең
тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы рәвештә языгыз.
Аз диссоциацияләшүчән матдә барлыкка килү белән бара торган реак¬
цияләр. Бер пробиркага 3—4 мл натрий гидроксиды эремәсе салыгыз һәм аңа ике-
өч тамчы фенолфталеин өстәгез. Эремә кура җиләге төсенә керер. Аннан соң эремә
төссезләнгәнче хлорид яки сульфат кислотасы өстәгез.
Икенче пробиркага 10 мл чамасы бакыр (II) сульфаты салыгыз һәм аз гына натрий
гидроксиды эремәсе өстәгез. Зәңгәрсу төстәге бакыр (II) гидроксиды утырымга төшәр.
Утырым эреп беткәнче пробиркага сульфат кислотасы агызыгыз.
23
Бирем. Әлеге реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскар¬
тылган ионлы рәвештә төзегез. Беренче пробиркада ни өчен эремәнең төссезләнүен,
ә икенчесендә утырымның эрүен аңлатыгыз. Эрүчән һәм эремәүчән нигезләр нинди
уртак үзлеккә ия?
Хлорид-ионга сыйфат реакциясе. Беренче пробиркага — 1—2 мл сыегайтылган
хлорид кислотасы, икенчесенә — шундый ук күләмдә натрий хлориды, ә өченчесенә
кальций хлориды эремәсе салыгыз. Һәр өч пробиркага да берничәшәр тамчы кө¬
меш (I) нитраты AgNO3 өстәгез. Барлыкка килгән утырым куертылган нитрат кислота¬
сында эриме, тикшереп карагыз.
Бирем. Тиешле химик реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм
кыскартылган ионлы рәвештә языгыз, а) Хлорид кислотасын башка кислоталардан;
б) хлоридларны башка тозлардан; в) хлоридларның эремәләрен хлорид кислотасыннан
ничек аерырга мөмкин булуын уйлап әйтегез. Ни өчен көмеш (I) нитраты эремәсе
урынына кургаш (II) нитраты эремәсен файдаланырга мөмкин?
1 нче практик эш
Эксперименталь мәсьәләләр чишү.' K Пробиркага 1—2 мл куертылган сульфат
кислотасы агызыгыз, аңа бер кисәк цинк салыгыз. Бу реакциянең тигезләмәсен
молекуляр, ионлы һәм кыскартылган ионлы'рэвештэ төзегез, электроннарның күчешен
күрсәтегез, бу реакциядә кайсысы оксидлаштыргыч булып тора?
i 2. Алты пробиркага магний хлориды эремәсе салып куелган. Пробиркаларның
һәрберсенә бер-бер артлы түбәндәге эремәләрне агызыгыз: а) натрий гидроксиды;
б) калий сульфаты; в) натрий карбонаты; г) цинк нитраты; д) калий ортофосфаты;
е) натрий сульфиды. Азаккача барган реакцияләрнең тигезләмәләрен молекуляр, ионлы
һәм кыскартылган ионлы рәвештә төзегез.
3. а) Калий карбонаты һәм хлорид кислотасы; б) натрий сульфиды һәм сульфат
кислотасы; в) цинк хлориды һәм нитрат кислотасы; г) натрий сульфиты һәм сульфат
кислотасы; д) бакыр (II) сульфаты һәм нитрат кислотасы эремәләре бирелгән. Бу
эремәләрне пар-пар кушыгыз, аз гына җылытыгыз, сак кына иснәп карагыз һәм нинди
очракларда реакцияләрнең азаккача баруын билгеләгез. Тиешле реакцияләрнең
тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы рәвештә төзегез.
4. Түбәндә схемалары бирелгән реакцияләрне башкарыгыз:
Ja) Ca2+ + CO^ —> CaCO31
б) SOf + 2Н+ —* SO2 f + H2O
fe) OH* + H+ —* H2O
S) Al0 —* Al3+
д) Cu2+ —* Cu0
е) 2Н+ —* Н° f
5. Түбәндә күрсәтелгән матдәләр арасында реакцияләр башкарыгыз: а) сероводород
һәм хлорлы су; б) калий иодиды эремәсе һәм хлорлы су; в) хлорид кислотасы һәм
алюминий; г) куертылган сульфат кислотасы һәм бакыр (җылытканда). Реакцияләрнең
тигезләмәләрен төзегез, электроннар күчешен күрсәтегез. Кайсысы оксидлаштыргыч
һәм кайсысы кайтаргыч булып тора?
6. Бирелгән эремәләрдән файдаланып: а) тимер (III) гидроксиды; б) бакыр (II)
сульфиды; в) күкерт (IV) оксиды; г) кальций карбонаты табыгыз. Тиешле реакцияләрнең
тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы рәвештә төзегез.
24
Кислород һәм күкерт
Il БҮЛЕК
Уку материалын кабатлагыз (8 нче сыйныф, § 36, 43).
§ 7. Химик элементларның периодик таблицасында
кислород һәм күкертнең урыны, аларның
атом төзелеше
Кислород һәм күкерт атомнары төзелешенең схемалары 7 нче таблицада
бирелгән.
7 нче таблица. Кислород һәм күкерт атомнары
төзелешенең схемалары
Химик
билгесе
Электроннарның энергетик
дәрәҗәләрдә урнашуы
A Электронлы формуласы
O
+8О 2ё~, 6е~
Is2 I 2s22p4
S
+16S 2е~, 8е~, 6е~
Is2 I 2s22p6 I 3s23p4
Электроннарның орбитальләрдә урнашуы
VTA-төркемдә, кислород һәм күкерттән тыш, алар белән охшаш тагын ике
элемент — селен Se һәм теллур Te бар. Бу элементлар атомнарының тышкы
энергетик дәрәҗәсендә алтышар электрон урнашкан. Атомның, затлы
газларга хас булганча, тотрыклы энергетик торышына кадәр 2 электрон
җитми. Шуңа күрә бу элементларның атомнары җитмәгән ике электронны
китереп кушарга сәләтле. Шул сәбәптән кислород көчле оксидлаштыргыч¬
ларның берсе булып тора:
0 -2
O + 2е~ —* 0
25
Кушылмаларда кислород, гадәттә, -2 оксидлашу дәрәҗәсен күрсәтә.
Аның оксидлашу дәрәҗәсе -1 дә булырга мөмкин (пероксидлар,
мәсәлән H—O—O—H составына кергәндә). Фтор белән кушылмаларында
кислородның оксидлашу дәрәҗәсе +1 (O2F2) һәм +2 (OF2), чөнки фтор —
электртискәрерәк элемент (кислородның электртискәрелеге 3,5 кә, фторның
4,0 гә тигез).
Күкерт атомнарының өченче энергетик дәрәҗәдә тулы булмаган биш
d-орбитале бар. Шунлыктан электроннарның аерылуы ихтимал. Нәтиҗәдә
күкерт атомнарында, электртискәрерәк элемент белән кушылмалар ха¬
сил иткәндә, аның ягына авышучы я дүрт, я алты парсыз электроннар
барлыкка килә (8 нче таблица). Күкертнең кислород белән кушылмаларында
+4 +6
оксидлашу дәрәҗәсе SO2 һәм SO3 булуы шуның белән аңлатыла.
8 нче таблица. Күкертнең мөмкин саналган оксидлашу дәрәҗәләре
Күкерт
атомнарының
халәте
Электроннарның орбитальләрдә урнашуы
Оксидлашу
дәрәҗәсе
Нормаль
халәте
Ярсынулы
халәте
1—2 нче күнегүләрне үтәгез (31 нче бит).
§8. Гади матдәләрнең төзелеше. Аллотропия
Кислород атомнары ике гади матдә — кислород һәм озон барлыкка китерә
ала. Кислород молекулалары, билгеле булганча, поляр булмаган ковалент
бәйләнештә торган ике атомнан хасил була. Кислородның электронлы
формуласын болай сурәтлиләр:
:0- + О: —> -.0::(3:
Кислородның кайбер үзлекләрен әлеге электронлы формула белән генә аңлатып
булмый. Кислород молекуласының төзелеше турында җентекләбрәк югары мәктәп
курсларында тикшерелә.
26
Кислород O2 молекуласы кислородның өч атомыннан торган озонга O3 кә
әверелә ала.
O
O 1"16°8' O
Озонны озонатор приборында табалар (7 нче рәсем). Ул тышкы ягына
металл чыбык уралган пыяла көпшәдән гыйбарәт. Көпшә эченнән икенче
бер металл чыбык уза. Озонаторның пыяла көпшәсенә кислород тутыралар,
ә чыбык очларын, югары көчәнешле ток табу өчен, индукцион кәтүк
полюсларына тоташтыралар. Чыбыклар арасыннан һәм, димәк, кислород
аша электр корылмасы уздыралар. Нәтиҗәдә кислород озонга әверелә:
электр
бушануы
ЗО2 * 2О3
кислород озон
Табигатьтә озон я яшен вакытында электр бушануы нәтиҗәсендә,
я ылыслы агачларның сумаласы оксидлашканда барлыкка килә. Ылыслы
урманнарда һәм яшеннән соң озон һавага хуш ис бирә.
Гадәти шартларда озон — үзенә бертөрле исле, кислородтан 1,5 тапкыр
авыррак газ. Ул суда кислородка караганда яхшырак эри.
Озон һәм кислород бер үк химик элемент атомнарыннан торсалар да,
алар — икесе ике төрле матдә.
Озон — химик яктан кислородка караганда шактый актив матдә. Әйтик,
мәсәлән, кайбер матдәләр (фосфор, спирт) озонда кабынып китә, каучук
уалучанлана, ә буягыч матдәләр озон тәэсирендә төссезләнә. Озонның аерата
химик активлыгы аның молекулалары җиңел таркалуы белән аңлатыла:
O4 * O9 + O
о Z
озон кислород атомар
кислород
Барлыкка килгән атомар кислород башка матдәләр
белән молекуляр кислородка караганда көчлерәк
реагирлаша. Кислород атомнары, пар-пар кушылып,
молекула хасил итә:
0 + 0 * O2
Шуңа күрә озонның кислородка әверелешен түбән¬
дәге тигезләмә белән күрсәтәләр:
2О3 * ЗО2
7 нче рәсем. Озонатор
Бер үк химик элементның берничә гади матдә хасил итә алу күре¬
нешен аллотропия дип атыйлар. Бер үк химик элементтан хасил булган
гади матдәләрне бу элементның аллотропия төрләре дип йөртәләр.
27
СЕЗ
БЕЛӘСЕЗМЕ?
Озон күп кенә тере организмнарга, шул исәптән судагы
авыру кузгатучы организмнарга да үтергеч тәэсир итә.
Шуңа күрә эчә торган суны озон белән эшкәртәләр,
ягъни озонлыйлар. Озонланган суның, хлорланган судан
аермалы буларак, исе һәм тәмсез тәме булмый. Безнең
илдә эчә торган суны табуда бу ысул көннән-көн киңрәк
кулланыла бара.
Кислород һәм озон — бер үк химик элементның — кислородның
аллотропик төрләре.
§ 9. Күкерт. Аллотропия. Физик үзлекләре
Табигатьтә күкерт ирекле хәлдә дә, төрле кушылмалар хәлендә дә
очрый. Ирекле хәлдә ул, гадәттә, башка тау токымнары белән бергә була.
Андый ятмалар Украинада, Идел буе районнарында, Урта Азия һәм башка
урыннарда бар.
Күкертнең иң әһәмиятле табигый кушылмалары 2 нче схемада күрсә¬
телгән.
Күкертне ирекле хәлендә башка тау токымнарыннан аерып алу өчен,
аның җиңел эретелүчән булуыннан файдаланалар. Әйтик, мәсәлән, ком
белән күкерт катнашмасын җылытканда, күкерт җиңел эретелә. Ком төпкә
утыра, ә эретелгән күкертне агызып алырга мөмкин.
Күкерт — сары төстәге каты кристаллик матдә. Барлык неметаллар
кебек үк, күкерт тә җылылыкны начар үткәрә һәм электр тогын үткәрми.
Күкерт кисәкләре суда бата (аның тыгызлыгы 2 гә якын), ә күкерт поро¬
шогы йөзеп йөри, чөнки ул суда чыланмый.
СЕЗ
БЕЛӘСЕЗМЕ?
Озон атмосфераның өске катлавында (15—30 км биек¬
лектә) бар. Атмосфераның бу катлавын озон катлавы дип
атыйлар; ул Җирдәге барлык тереклекне саклаучы үзенә
бертөрле калкан булып тора. Озон Кояшның куркынычлы
ультрашәмәхә нурларын йота.
Соңгы елларда озон катлавының юкара баруы күзәтелә.
Җир өстендә озон микъдары бик аз калган өлкәләр (озон
тишекләре) барлыкка килде. Бу хәл галимнәрне бик бор¬
чый. Халыкара бергәлек атмосферага озонны җимерү
куркынычы булган матдәләрне чыгаруны чикләү буенча
чаралар күрә.
28
Күп кенә табигый кушылмалар, күкерт кебек үк, вакланган хәлдә суда
чыланмыйлар. Бу үзлектән күкертле рудаларны «буш токым»нан аеру өчен
файдаланалар. Рудаларны баетуның бу ысулы флотация дип атала, һәм ул
практикада киң кулланыла.
Күкерт суда практик яктан эреми. Аның өчен яхшы эреткечләр булып
сероуглерод, толуол һәм кайбер башка матдәләр тора.
112,8 °C та күкерт җиңел агучан сары төстәге сыеклыкка әверелеп эре¬
телә. Тагын да җылытканда, ул кара-кучкыллана һәм куера. 444,6 oC та
кайный башлый. Кайнау температурасына кадәр җылыткан күкертне
салкын суга агызганда, резин кебек җиңел сузылучан пластик күкерт
барлыкка килә.
Кислород элементы ике аллотропик төр — кислород һәм озон барлыкка
китерә алуын сез инде беләсез. Кристаллик һәм пластик күкерт — шулай
ук күкерт химик элементының аллотропик төрләре.
Кристаллик күкерт җиңел эретелә: бу аның кристаллик челтәре мо¬
лекуляр булырга тиешлеген раслый. Рентгенографик һәм башка тикше¬
ренүләр шуны күрсәтә: күкертнең кристаллик челтәре, чыннан да, боҗра
молекулалардан төзелгән (8 нче рәсем, а). Җылытканда, күкерт молеку¬
лаларының сигез буынлы боҗралары өзелеп сузыла һәм кыскара да ала
торган озын чылбырларга әверелә (8 нче рәсем, б). Бу — пластик күкерт.
(Химик реакцияләр тигезләмәләрен төзегәндә, күкертнең бер атомлы
молекулаларын язарга рөхсәт ителә.)
3—4 нче сорауларга җавап бирегез (31 нче бит).
8 нче рәсем. Күкертнең кристаллик челтәре: күкерт молекуласының сигез буынлы
боҗраларыннан тора (а); җылытканда күкерт молекуласының сигез буынлы боҗрасы
өзелеп, озын чылбыр барлыкка килү (б)
1 Химик формула белән руданың төп состав өлеше билгеләнгән.
29
§10. Күкертнең химик үзлекләре. Күкертнең
кулланылышы
Күкертнең атом радиусы кислородныкына караганда зуррак булу
сәбәпле, аның оксидлаштыру үзлекләре шактый көчсезрәк. Шунлыктан
кислород белән реакцияләрдә күкерт — кайтаргыч һәм аның оксидлашу
дәрәҗәсе +4 һәм +6 (8 нче таблица).
Күкертнең оксидлаштыру үзлекләре — мәсәлән, металлар һәм водород
белән реакцияләрдә, ә кайтару үзлекләре кислород һәм галогеннар (йод
белән күкерт кушылмый) белән реакцияләрдә чагыла (9 нчы таблица).
9 нчы таблица. Күкертнең химик үзлекләре
Оксидлаштыру үзлекләре
Кайтару үзлекләре
1. Җылытканда күкерт барлык ме¬
таллар белән диярлек реакциягә керә:
I—1
0 0 f +3 -2
2А1 + 3S^-> Al2S3
2. Кайбер металлар, мәсәлән Na, К,
Hg белән күкерт хәтта җылытмыйча да
тәэсир итешә:
|—
0 0 +1-2
2Na + S >Na2S
3. Күкерт парлары белән водород кат¬
нашмасын 150—200 oC ка кадәр җы¬
лытылган көпшә аша уздырганда, серо¬
водород хасил була:
I
0 0 t +1 -2
H2 + S >H2S
1. Күкерт һавада күкерт диокси¬
ды (күкерт (IV) оксиды) барлыкка
китереп яна:
Г~4е~~I
0 Of +4-2
S + O2-l^SO2
2. Гадәттәге шартларда күкерт фтор
белән реакциягә кереп, тотрыклы SF6
кушылмасы хасил итә:
I—1
0 0 +6-1
S + 3F, >SFfi
Z о
күкерт
гексафториды
Күкерт гади матдә хәлендә киң кулланыла. Аның кулланылу өлкәләре
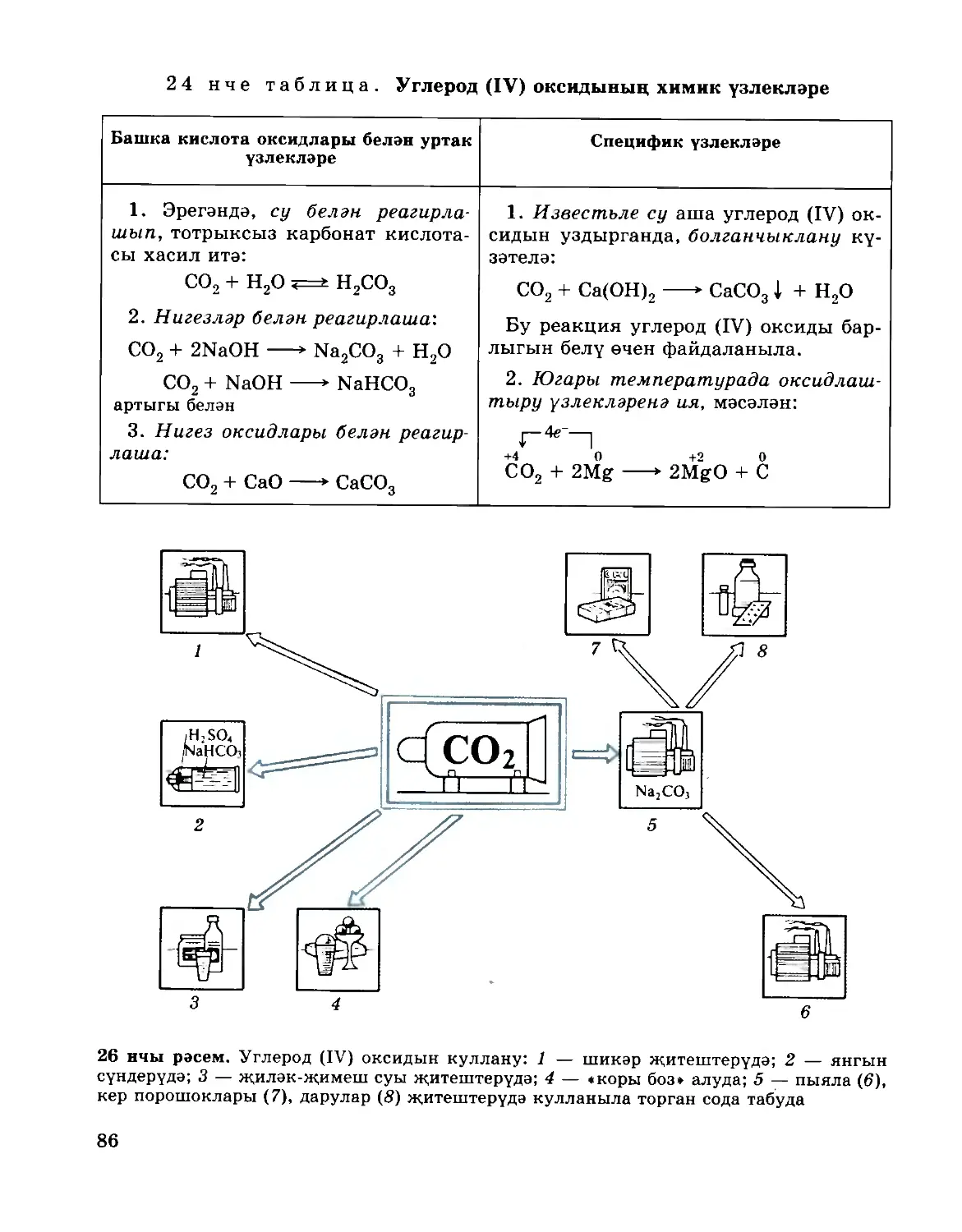
3 нче схемада күрсәтелә.
3 нче схема
5—6 нчы күнегүләрне үтәгез. 1—2 нче мәсьәләләрне чишегез (31 нче бит).
30
1. Электртискәрлелеге иң зур булган
химик элемент:
1) кислород 3)теллур
2) селен 4) күкерт
2. Кислород уңай оксидлашу дәрә¬
җәсен күрсәткән кушылма:
1) SO3 2) CaO 3) OF2 4) H2O
3. Кислород һәм озонның, кристаллик
һәм пластик күкертнең үзлекләрен чагыш¬
тырыгыз. Бу мисалларга нигезләнеп,
аллотропиянең асылын аңлатыгыз.
4. Күкертнең табигый кушылмала¬
рын санап чыгыгыз, аларның химик
формулаларын языгыз һәм бу кушылма¬
ларда күкертнең оксидлашу дәрәҗәләрен
билгеләгез.
5. Гади матдәләрдән Li2S, ZnS, SO2, CS2
формулалары белән күрсәтелгән катлаулы
матдәләр хасил булу реакцияләренең ти¬
гезләмәләрен төзегез. 8 нче таблицадагы
"""'V >
C 1. Кушылма 0,27928 масса өлеше, яки
27,928%, фосфордан һәм 0,72072 мас¬
са өлеше, яки 72,072% күкерттән тора.
Аның иң гади формуласын табыгыз.
мәгълүматлардан файдаланып, бу реак¬
цияләрдә күкерт нинди үзлекләр (ок¬
сидлаштыру яки кайтару) күрсәтүен
аңлатыгыз.
6. Химик реакциянең биредә ките¬
релгән схемасы белән аны чагылдырган
мисал арасындагы тәңгәллекне билге¬
ләгез:
о
DS
+4
2) S —> S
0 +4
3) S—* S
X. 2H2S + ЗО2 2SO2 + 2Н2О
Б. H2+ S-l^ H2S
B. 2S0, + О,-*— 2SO4
Т. S+O2 SO2
Д. 2H2S + SO2 * 3S + 2Н2О
-2
S
2. Гади матдәләрдән 1 моль күкерт (IV)
оксиды барлыкка килгәндә, 332,8 кДж
энергия аерылып чыга. 1 г күкерт ян¬
ганда күпме җылылык аерылып чыгар?
§11. Сероводород. Сульфидлар
Сероводород (водород сульфиды) сасыган йомырка исе килә торган,
төссез газ, һавадан авыррак. Ул бик агулы. Сероводородның һавадагы 0,1%
күләме җитди агуланулар китереп чыгара. Ләкин аз микъдарда ул файдалы
да: кайбер авыруларны дәвалау өчен медицинада сероводород ванналарын
файдаланалар.
Сероводород күп кенә табигый органик матдәләр һавасыз шартлар¬
да таркалганда барлыкка килә, вулкан газларында, минераль сулар чы¬
ганакларында (мәсәлән, Кавказда Мацеста һәм Пятигорск чыганакларында)
бар.
Сероводород белән барлык тәҗрибәләрне суыру шкафларында үткәрергә
кирәк!
Сероводородны лабораториядә тимер (II) сульфидына сульфат кислотасы
белән тәэсир итеп табарга мөмкин:
FeS + H2SO4 * FeSO4 + H2S t
Бу реакция водород табу өчен файдаланыла торган Кипп аппаратында
үткәрелә.
31
Сероводород һавада зәңгәрсу ялкын белән яна, бу вакытта күкерт диок¬
сиды (күкерт (IV) оксиды) хасил була:
-2 +4
2H2S + ЗО2 > 2Н2О + 2SO2
Кислород җитмәгәндә су парлары һәм күкерт барлыкка килә:
-2 0
2H2S + O2 > 2Н2О + 2S
Сероводород кайтаргыч үзлекләренә ия. Әгәр берникадәр микъдарда
сероводородлы су салынган пробиркага бромлы су агызсаң, эремә төссезләнә.
Эремә өстендә күкерт күренә:
-2 0 0 -1
H2S + Br2 *S + 2НВг
Сероводород суда аз эри. 20 0C та бер күләм суда 2,4 күләм сероводород
эри (чагыштырыгыз: бер күләм суда 500 күләм хлороводород эри). Серово¬
дородның судагы эремәсе көчсез кислота үзлекләрен күрсәтә:
H2S 5=* HS + H+
HS" ?=± S2- + H+ (икенче баскычта диссоциация практик
яктан бармый)
Сульфид кислотасы селтеләр белән нейтральләшү реакциясенә керә:
H2S + NaOH * NaHS + H2O
артыгы
белән
H2S + 2NaOH > Na2S + 2Н2О
артыгы
белән
Сульфид кислотасының урта тозларын — сульфидлар, ә әче тозларын
гидросулъфидлар дип атыйлар. Селтеле металл сульфидлары һәм күпчелек
гидросульфидлар суда эрүчән.
1, 2 нче күнегүләрне үтәгез (34 нче бит).
СЕЗ
БЕЛӘСЕЗМЕ?
Көмеш әйберләр озак ятканда каралалар:
4Ag + 2H2S + O2 » 2Ag2S! + H2O
Каралган предметларны ялтыратып була. Моның өчен
аларны эмальләнгән савытта сода эремәсе һәм алюминий
фольга белән кайнаталар. Алюминий оксидлашкан кө¬
мешне металлга кадәр кайтара, ә сода эремәсе күкерт
ионнарын тотып тора.
32
§12. Күкерт (IV) оксиды. Сульфит кислотасы
Уку материалын кабатлагыз (8 нче сыйныф, § 30).
Күкерт һавада янганда, күкерт (IV) оксиды (күкерт диоксиды) SO2
хасил була. Бу — үзенчәлекле кискен исле төссез газ, һавадан 2 тапкырдан
артыгракка авыррак, суда яхшы эри, агулы.
Күкерт (IV) оксиды кислота оксиды үзлекләренә ия. Әгәр аны лакмусның
шәмәхә төстәге эремәсе аша уздырсаң, эремә кызыл төскә керә — кислота
барлыкка килә:
H9O + SO9 ?=* H9SO4
Z Z ZO
( «=> ) тамгасы реакциянең кайтма булуын аңлата.
Сульфит кислотасы — тотрыксыз кушылма, күкерт (IV) оксидына һәм
суга җиңел таркала, шуңа күрә ул судагы эремәләрдә генә була. Сульфит
кислотасы — уртача көчлелектәге кислота. Ул тозларның ике рәтен: урта
тозлар — сульфитлар (K2SO3) һәм әче тозлар — гидросульфитлар (KHSO3)
хасил итә.
Сульфитларга сыйфат реакциясе булып тозның көчле кислота белән
үзара тәэсир итешүе тора, бу вакытта кискен исле газ (SO2) аерылып чыга:
K2SO3 + H2SO4 —» K2SO4 + H2O + SO21
ZO Ztx Zj Zj
2Н+ + SO3" —* H2O + SO21
OZZ
Күкерт (IV) оксиды, кислота оксиды буларак, селтеләр һәм нигез
оксидлары белән реакциягә керә:
SO2 + 2NaOH * Na2SO3 + H2O
SO2 + 20Н" > S0| + H2O
SO9 + CaO > CaSO3
Z о
Күкерт (IV) оксиды составына кергән күкертнең оксидлашу дәрә-
-2 O +4 +6
җәсе +4. Бу — оксидлашу дәрәҗәсенең (S, S,S, S) арадаш кыйммәте.
Шуңа күрә күкерт (IV) оксиды оксидлаштыргыч үзлекләрен дә, кай¬
таргыч үзлекләрен дә күрсәтә.
СЕЗ
БЕЛӘСЕЗМЕ?
Күкерт (IV) оксиды (яки күкерт диоксиды) — әйләнә-тирә¬
лек өчен бик зарарлы кушылма. Атмосферага эләккән газ
күкерт (IV) оксиды, су парлары һәм һавадагы кислород
белән реакциягә кереп, составында сульфит һәм сульфат
кислоталары булган әче эремә хасил итә. (Атмосферага
бер ел эчендә барлыгы 150 млн т га якын SO2 чыга!) Бу —
табигатькә, кеше сәламәтлегенә, шулай ук известьташ
һәм мәрмәрдән эшләнгән сәнгать әсәрләренә зарарлы
йогынты ясый торган кислоталы яңгырларның сәбәбе.
33
Оксидлаштыру үзлекләре:
+4 -2 0
SO2 + 2H2S —* 3Sl + 2Н2О
Кайтару үзлекләре:
+4 O +6 -1
SO2 + Cl2 + 2Н2О —> H2SO4 + 2НС1
Күкерт (IV) оксиды дезинфекцияләү һәм агарту үзлекләренә ия. Аны,
микробларны бетерү максатында, яшелчә саклагычлар һәм складларны
төтенләү, шулай ук җиләк-җимешләрне консервлау өчен файдаланалар.
Күкерт (IV) оксидын кәгазь, салам, йон һәм ефәк агартуда киң кулла¬
налар.
3—5 нче күнегүләрне үтәгез. 1, 2 нче мәсьәләләрне чишегез.
1. Сероводородның тулы һәм тулы
булмаган януы процессында барган ок-
сидлашу-кайтарылу реакцияләренең ти¬
гезләмәләрен төзегез. Оксидлаштыргычны
һәм кайтаргычны күрсәтегез.
2. Сероводород һәм кургаш (II) нит¬
раты эремәсе арасында барган химик
реакция тигезләмәсен кыскартылган
ионлы рәвештә языгыз. Бу реакциянең
билгеләрен әйтегез.
3. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен языгыз:
CuS * H2S ► SO2 ♦ SO3
O !• Сероводородны 200 г бакыр (II)
сульфаты эремәсе (CuSO4 нең масса өлеше
18% ка тигез) аша уздырганнар. Бу реак¬
ция нәтиҗәсендә барлыкка килгән уты¬
рымның массасын исәпләп чыгарыгыз.
4. Түбәндәге реакцияләрнең схемала¬
рында коэффициентлар куегыз:
а) SO2 + Br2 + H2O *
б) PbS + O2 —♦
Оксидлаштыргычны һәм кайтаргычны
күрсәтегез.
5. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен языгыз:
S—* H2S—-SO2—> Na2SO3—-
* BaSO3 » SO2
Ионнар алмашу реакцияләре тигезлә¬
мәләрен тулы һәм кыскартылган ионлы
рәвештә языгыз.
2. Хлорид кислотасы белән составында
10% катышмалар булган 2 кг тимер (II)
сульфиды үзара тәэсир итешкәндә хасил
булган сероводородның күләмен (н. ш.)
билгеләгез.
§13. Күкерт (VI) оксиды. Сульфат кислотасы
Уку материалын кабатлагыз (8 нче сыйныф, § 32).
Практик максатлар өчен күкертнең икенче кислота оксиды — кү¬
керт (VI) оксиды SO3 нең әһәмияте зур. Аны күкерт ангидриды дип тә
атыйлар. Ул күкерт (IV) оксиды оксидлашканда хасил була:
+4 O +6
2SO2 + O2 «=* 2SO3
Күкерт (VI) оксиды — төссез майсыман сыеклык, озак сакланганда озын
энәсыман кристаллардай торган каты матдәгә әверелә.
34
Күкерт ангидридының эретелү температурасы 17 0C, кайнау темпера¬
турасы 44,7 °C. Ул, суны тиз йотып, сульфат кислотасын хасил итә:
SO3 + H2O ♦ H2SO4 + Q
Бу — экзотермик реакция һәм күп микъдарда җылылык аерылып чыгу
белән бара.
Сульфат кислотасы — химия промышленностеның төп продуктларыннан
берсе. Ул бик киң кулланыла (9 нчы рәсем).
Молекула төзелеше. Сульфат кислотасының структур формуласы:
И— о\ .о
H-Oz N)
Табу. Промышленностьта сульфат кислотасын күкерттән яки металл
сульфидларыннан контакт ысулы белән табалар.
Беренче стадия:
S + O9 -—*■ SO9 яки 4FeS9 + IlO9 2Fe9O, + 8S0,
Ct L Ct Ct COC
Икенче стадия:
t,V2O5
2SO2 + O2 2SO3
Өченче стадия:
SO3 + H2O —* H2SO4 + Q
Промышленностьта күкерт ангидридын йоттыру өчен чиста суны түгел,
ә бәлки куертылган (97—98% лы) сульфат кислотасын файдаланалар. Әгәр
100% лы сульфат кислотасын алсалар, анда күкерт (VI) оксиды эри һәм
олеум барлыкка килә.
СЕЗ
БЕЛӘСЕЗМЕ?
Алхимиклар сульфат кислотасын X гасырда ук кайбер суль¬
фатларны (купоросларны) кыздырганда табалар. Купорос
мае дигән тарихи атамасы да шуннан килеп чыккан.
XV гасырда алхимиклар сульфат кислотасын күкерт белән
селитра катнашмасын кыздырып табарга өйрәнгәннәр.
Kapa-Бугаз-Гол култыгындагы суда 30% глаубер тозы бар
һәм +5 0C та бу тоз, кар кебек, ак утырым рәвешендә төпкә
утыра, ә җылыта башлауга, ул яңадан эри. Бу култыкта
глаубер тозы әле күренеп, әле югалып торганга күрә, аны
мирабилит, ягъни «гаҗәеп тоз» дип атаганнар.
35
Физик үзлекләре. Сульфат кислотасы — төссез, авыр (р = 1,84 г/см3),
очмаучан сыеклык. Ул суда эрегәндә бик көчле җылына. Куертылган
сульфат кислотасына су агызырга ярамавын истән чыгармагыз!
Куертылган сульфат кислотасы һавадан су парларын йота. Куертылган
сульфат кислотасы салынган ачык савытны үлчәүдә тигезләп, моңа ансат
ышанып була: берникадәр вакыттан соң үлчәүнең кислоталы ягы басар.
Химик үзлекләре. Сыегайтылган сульфат кислотасы барлык кислоталарга
хас үзлекләргә ия. Шулай да сульфат кислотасының специфик үзлекләре
дә бар (10 нчы таблица).
10 нчы таблица. Сульфат кислотасының химик үзлекләре
Башка кислоталар белән уртак үзлекләре
Специфик үзлекләре
1. Судагы эремәсе индикаторларның
төсен үзгәртә.
2. Сыегайтылган сульфат кислотасы
металлар белән реагирлаша:
H2SO4 (сыег.) + Zn » ZnSO4 + H21
2Н++ SO2 + Zn0 > Zn2+ + SO2- + H2T
2Н+ + Zn0 > Zn2+ + H2 t
3. Нигез һәм амфотер оксидлар белән
реагирлаша:
H2SO4 + MgO > MgSO4 + H2O
2Н+ + SO2’ + MgO ♦ Mg2+ + SO4 + H2O
2Н+ + MgO » Mg2+ + H2O
4. Нигезләр белән тәэсир итешә:
H2SO4 + 2К0Н * K2SO4 + 2Н2О
2Н+ + SO4 + 2К+ + 20Н" *
> 2К+ + SO2 + 2Н2О
2Н+ + 20Н“ * 2Н2О
Әгәр кислота артыгы белән алынса,
әче тоз хасил була:
H2SO4 + NaOH * NaHSO4 + H2O
5. Тозлар белән реагирлашып, алардан
башка кислоталарны этеп чыгара:
SH2SO4 + Ca3(PO4)2 *
* SCaSO4 + SH3PO4
1. Куертылган сульфат кислота¬
сы — көчле оксидлаштыргыч: җы¬
лытканда ул барлык металлар белән
диярлек реагирлаша (Au, Pt һәм
башка кайберләре чыгарма). Бу реак¬
цияләрдә металлның активлыгына
һәм шартларга бәйле рәвештә SO2,
H2S, S аерылып чыга, мәсәлән:
0+6 t
Cu + SH2SO4 (куерт.) —*
+2 +4 А
» CuSO4 + S O2T + 2Н2О
2. Куертылган сульфат кислотасы,
су белән бик көчле реакциягә кереп,
гидратлар хасил итә:
H2SO4 + ZiH2O * H2SO4 • пН20 + Q
Ct Ч Ct
Куертылган сульфат кислотасы ор¬
ганик матдәләрдән, аларны күмер¬
ләндереп, водород һәм кислородны
су рәвешендә аерып ала.
3. Сульфат кислотасына һәм аның
тозларына сыйфат реакциясе — ба¬
рийның эрүчән тозлары белән тәэсир
итешү:
H2SO4 + BaCl2 * BaSO4 J + 2НС1
2Н+ + SO4 + Ba2+ + 2СГ *
* BaSO4 J + 2Н+ + 2СГ
Ba2+ + SO4 * BaSO41
Суда да, куертылган нитрат кисло¬
тасында да эреми торган ак утырым
төшә.
36
9 нчы рәсем. Сульфат кислотасының кулланылышы: 1 — буягыч матдәләр табуда;
2 — минераль ашламалар җитештерүдә; 3 — нефть продуктларын чистартуда; 4 —
бакырны электролитик ысул белән табуда; 5 — аккумуляторларда электролит сый¬
фатында; 6 — шартлаткыч матдәләр ясауда; 7 — ясалма ефәк җитештерүдә; 8 — глюкоза;
9 — тозлар; 10 — кислоталар табуда
Куллану. Сульфат кислотасының әлеге үзлекләре (суны йотучанлыгы,
оксидлаштыру үзлекләре, очмаучанлыгы) аны киң кулланырга мөмкинлек
бирә (9 нчы рәсем).
Сульфат кислотасы тозларның ике рәтен — урта (сульфатлар) һәм әче
тозларны (гидросулъфатлар) барлыкка китерә:
Na2SO4 NaHSO4
натрий сульфаты натрий гидросульфаты
(урта тоз) (әче тоз)
Сульфат кислотасы тозларын, мәсәлән, Na2SO4-IOH2O — натрий
сульфаты кристаллогидратын (глаубер тозын) сода, пыяла җитештерүдә,
медицинада һәм ветеринариядә киң кулланалар. CaSO4-2Н2О — кальций
сульфаты кристаллогидраты (табигый гипс) төзелештә кирәкле
ярымсулы гипс табуда, ә медицинада гипс бәйләвечләр салуда кулланыла.
CuSO4 • 5Н2О — бакыр (II) сульфаты кристаллогидратын (бакыр купоросы)
үсемлек корткычлары һәм авыруларына каршы көрәштә кулланалар.
37
4 иче схема
A Күкерт һәм аның әһәмиятле кушылмалары арасындагы генетик бәйлә¬
неш 4 нче схемада күрсәтелә.
Сорауларга җавап бирегез һәм 1—4 нче күнегүләрне үтәгез. 1—2 нче мәсьәләләрне
чишегез.
1. Куертылган сульфат кислотасы
җылытканда терекөмеш һәм көмеш
белән, бакыр белән реакциягә кергәндәге
кебек реагирлаша. Бу реакцияләрнең
тигезләмәләрен төзегез һәм оксидлаштыр¬
гычны һәм кайтаргычны күрсәтегез.
2. Түбәндә бирелгән схемалардан
файдаланып, практикада башкару мөм¬
кинлеген биргән реакцияләрнең тигез¬
ләмәләрен төзегез:
CuSO4 + HCl —♦
Hg + H2SO4 (куерт.) *
Cu + HCl ♦
NaNO3 + HCl »
O 1. а) 3,4 кг сероводородны; б) 6500 м3
сероводородны яндыру өчен күпме күләм
кислород (н. ш.) кирәк булыр?
MgCl2 + H2SO4 (куерт.) *
Na2SO4 + H2SO4 *
Zo Z 4
NaOH + H2SO4 *
Al(OH)3 + H2SO4 —*
Реакция тигезләмәләрен төзегәндә
ал арның узу шартларын күрсәтегез. Мөм¬
кин булган очракларда тигезләмәләрне
тулы ионлы һәм кыскартылган ионлы
рәвештә төзегез.
3. а) Сыегайтылган сульфат кисло¬
тасының металлар белән реакциясендә;
б) куертылган сульфат кислотасының
металлар белән реакциясендә оксидлаш¬
тыргычны әйтегез.
4. 4 нче схемага туры китереп, реак¬
цияләрнең тигезләмәләрен төзегез.
2. 4,5 г алюминий белән 0,2 масса
өлеше сульфат кислотасы булган эремәнең
күпме массасы реакциягә керер?
38
§14. Химик реакцияләрнең тизлеге һәм аның
реакцияләрнең узу шартларына бәйлелеге.
Химик тигезләнеш
Химик реакцияләрнең тизлеге турындагы төшенчә. Сезгә билгеле
булганча, кайбер химик реакцияләр, мәсәлән водородның хлорда
януы, бик тиз бара, икенчеләре, мәсәлән тимернең тутыгуы — акрын.
Химия промышленностеның җитештерүчәнлеген арттыру өчен, химик
процессларны тизләтүгә булышлык итүче шартлар тудырырга кирәк. Tere
яки бу химик реакция никадәр тизрәк барса, вакыт берәмлегендә кирәкле
продукт шулкадәр күбрәк барлыкка киләчәк. Кайбер химик реакцияләр
зыян китерәләр (тимернең тутыгуы, азык продуктларының бозылуы).
Мондый кирәксез реакцияләрнең тизлеген акрынайтырга кирәк.
Химик реакцияләрнең тизлеге нәрсә ул, һәм ул ничек билгеләнә, ничек
үзгәрә? Реакция тизлеге вакыт берәмлегендә реакциягә кергән яки хасил
булган матдәнең концентрациясе үзгәрүе белән билгеләнергә тиешлеге ансат
аңлашыла. Матдәнең концентрациясен еш кына 1 литрдагы мольләр саны
белән билгелиләр.
Әйтик, күкерт (IV) оксидының күкерт (VI) оксидына кадәр оксидлашу
реакциясендә аның баштагы концентрациясе 2 моль/л, ә 50 секундттан соң
0,5 моль/л булды, ди. Бу очракта әлеге реакциянең тизлеге (и):
V = (2-0,5) : 50 = 1,5 : 50 = 0,03 моль (л • с)
Бу — һәр секунд саен 1 л газ катнашмасында 0,03 моль күкерт (IV)
оксиды күкерт (VI) оксидына әверелә дигән сүз.
Әгәр матдәнең баштагы концентрациясен C1, ә күпмедер вакыттан (Z)
соңгысын C2 дип билгеләсәк, реакциянең тизлеген гомуми рәвештә болай
язарга мөмкин:
V = (C1 - с2) : (t2 - Z1), яки Ac : AZ,
биредә Ac = C1 - C2 һәм AZ = Z2 - Z1.
Димәк,
Химик реакциянең тизлеге реагирлашучы матдәләрнең берсенең
вакыт берәмлегендә концентрациясе үзгәрүе белән билгеләнә.
СЕЗ
БЕЛӘСЕЗМЕ?
Cy да катализатор була ала. Моңа ышану өчен, 1—2 г
кристаллик йодтан һәм 0,1-0,2 г порошоксыман алюми¬
нийдан торган катнашма әзерлиләр һәм керамик плас¬
тинкага урнаштыралар. Катнашмага пипеткадан берничә
тамчы су тамызалар. Көчле химик реакция башлана.
39
Бертолле
Клод Луи
(1748-1822)
Француз химигы, академик. Беренче булып
химик реакцияләр барышының төп закон¬
чалыкларын эшләгән. Неорганик химия өлкә¬
сендә шактый хезмәтләре бар.
Химик реакцияләр тизлегенең аларның узу шартларына бәйлелеге.
Химик реакцияләрнең тизлеген билгеләүче шартлар 11 нче таблицада
аңлатыла.
11 нче таблица. Химик реакцияләрнең тизлегенә
йогынты ясаучы шартлар
Шартлар
Мисаллар
1. Химик реакцияләрнең тизлеге
реагирлашучы матдәләрнең табига¬
тенә бәйле.
2. Эрегән хәлдәге матдәләр һәм
газлар өчен химик реакцияләрнең
тизлеге реагирлашучы матдәләрнең
концентрациясенә бәйле.
3. Каты хәлдәге матдәләр өчен реак¬
ция тизлеге реагирлашучы матдәләр¬
нең өслегенә туры пропорциональ.
4. Температура һәр 10 oC ка күтә¬
релгәндә күпчелек реакцияләрнең
тизлеге 2—4 тапкырга арта.
Металлар (калий, натрий) бер үк
матдә — су белән төрле тизлектә реа-
гирлаша.
Матдәләр саф кислородта, кислород¬
ның концентрациясе биш тапкыр ким¬
рәк булган һавада януга караганда ин¬
тенсиврак яналар.
Тимер һәм күкерт каты хәлдә, ал арны
башта ваклап, аннары катнаштырганда
гына җитәрлек тиз реагирлаша.
Кислород күп матдәләр белән гадәт¬
тәге температурада ук сизелерлек тиз¬
лектә реагирлаша башлый (акрын ок¬
сидлашу). Температура күтәрелгәндә,
оксидлашу тизлеге кинәт арта һәм көч¬
ле реакция башлана (яну).
5. Химик реакцияләрнең тизле¬
ге кайбер матдәләр катнашуына
бәйле.
Химик реакцияләрне тизләтә, лә¬
кин үзләре бу вакытта сарыф ителми
торган матдәләр катализаторлар
дип атала. Химик реакцияләрнең
тизлеген акрынайтучы матдәләр
ингибиторлар дип атала.
Бертолле тозының һәм водород пе¬
роксидының таркалуы марганец (IV)
оксиды катнашында тизләшә, күкерт (IV)
оксидының күкерт (VI) оксидына ок¬
сидлашуы ванадий (V) оксиды белән
тизләтелә. Ингибиторлар катнашында
сульфат кислотасы металларга карата
инерт кислотага әверелә, аның бу үзле¬
ге сульфат кислотасын корыч цистерна¬
ларда ташырга мөмкинлек бирә.
Сорауларга җавап бирегез һәм 1—3 нче күнегүләрне үтәгез (42 нче бит).
40
Химик тигезләнеш. Күп кенә химик реакцияләр билгеле бер шартларда
берьюлы ике юнәлештә: уңнан сулга һәм сулдан уңга узалар.
Мәсәлән:
2SO2 + O2 < * 2SO3
H2O + SO2 < * H2SO3
N2 + ЗН2 <=* 2NH3
Андый реакцияләрнең тигезләмәләрендә тигезлек билгесе урынына
кайтмалыкны белгертә торган тамгасы куялар. Бу тамга реакциядә
бер үк вакытта ике — туры һәм кире процесслар баруын аңлата.
Бер үк вакытта капма-каршы ике — туры һәм кире юнәлешләрдә уза
торган химик реакцияләрне кайтма реакцияләр дип атыйлар.
Кайтма реакцияләрдә туры реакциянең тизлеге башта максималь була,
ә аннары, реакциягә кергән матдәләрнең концентрациясе кимегәнлектән,
ул акрыная. Шул ук вакытта кире реакциянең тизлеге башта минималь,
аннары реакция продуктлары концентрациясе арткан саен арта бара.
Ниндидер бер вакыт мизгелендә туры һәм кире реакцияләрнең тизлеге
тигезләшә: V1 = V2, ягъни вакыт берәмлегендә ничә молекула реакция
продукты барлыкка килсә, ул шул ук санда башлангыч матдәләр молеку¬
лаларына таркала. Мондый халәтне химик тигезләнеш дип атыйлар.
Системаның туры реакция тизлеге кире реакция тизлегенә тигез¬
ләшкән халәтен химик тигезләнеш дип атыйлар.
Химик тигезләнеш халәте реакция шартлары: концентрация, температура,
басым үзгәргәнчегә кадәр саклана. Шартлар үзгәрүгә, тигезләнеш теге
яки бу якка авыша, ягъни химик тигезләнеш — динамик процесс. Күп
кенә химик кушылмалар кайтма реакцияләр нәтиҗәсендә табыла торган
производствода химик тигезләнешне реакция продуктлары хасил булу ягына
авыштыру шартларын белү бик мөһим. Химик тигезләнешнең авышуы
JIe Шателъе принцибы дип йөртелә торган гомуми кагыйдәгә буйсына. Бу
принципны сез югары сыйныфларда тулырак өйрәнерсез.
JIe Шателье принцибы: тышкы шартлар үзгәргәндә химик тигезлә¬
неш бу тышкы йогынтыны йомшарткан реакция (туры яки кире) ягына
авыша.
Башкача әйткәндә, тигезләнеш системасын җылыту тигезләнешне
эндотермик процесс ягына авыштыра; басымның күтәрелүе күләмнең
41
кимүе белән бара торган процесска булышлык итә; реакциягә керүче бер
матдәнең концентрациясе артуы туры реакциянең тизлеге артуына, ә реак¬
ция продуктының концентрациясе арту кире реакция тизлеге артуына
китерә.
Сезнең игътибарны шуңа юнәлтәбез: катализаторлар химик тигезлә¬
нешнең авышуына йогынты ясамый. Алар туры реакцияне дә, кире реак¬
цияне дә тизләтә, ягъни тигезләнешнең тизрәк урнашуына булышлык итә.
4—5 нче сорауларга җавап бирегез.
1. Химик реакция тизлеге нәрсә ул
һәм аны ничек билгелиләр?
2. Тизлеген арттыру яки киметү про¬
изводствода яисә көнкүрештә уңай яки'
тискәре әһәмияткә ия реакцияләргә ми¬
саллар китерегез. Аңлатып бирегез.
3. 11 нче таблицада (40 нчы бит) хи¬
мик реакцияләрнең тизлегенә йогынты
ясаучы шартлар күрсәтелгән һәм мисал¬
лар бирелгән. Ьәрбер шарт өчен тагын
бер-ике мисал китерегез, реакция тигез¬
ләмәләрен төзегез һәм аларны тормышка
ашыруны нигезләгез.
4. 2SO2 + O2 » 2SO3 + Q
N2 +ЗН2 * 2NH3 + Q
-PN2 + O2 * 2NO2 - Q
реакцияләрендә а) реакциягә кергән
матдәләрнең берсенең концентрациясен
арттырганда; б) температура күтәрелгәндә;
в) басымны арттырганда, тигезләнешнең
кайсы якка авышуын ачыклагыз.
5. Кайсы химик реакция тигезләмә¬
сендә температураны түбәнәйтү химик
тигезләнешнең реакция продуктлары
ягына авышуына йогынты ясый?
ЗО2 » 2О3 - Q
2Н2О * 2Н2 + O2-Q
C3Hfi + H9 * CoHo + Q
OQ Z OO*'
Лаборатор тәҗрибәләр
3. Озон табу һәм аның үзлекләре
Озон табу, а) 7 нче рәсемдәге (27 нче бит) кебек прибордан файдаланып, озон
табыгыз, б) Бер пробиркага аз гына порошоксыман барий пероксиды BaO2 салыгыз,
ә икенчесенә 2 мл куертылган сульфат кислотасы агызыгыз.
Ике пробирканы да салкын сулы савытка (яки кар һәм натрий хлоридыннан торган
суыткыч катнашмага) утыртып суытыгыз. Аннан соң барий пероксиды салынган
пробиркага сульфат кислотасын пыяла таякчык белән болгата-болгата һәм шул ук
вакытта суытып агызыгыз.
Бу процессны түбәндәге реакция тигезләмәсе белән күрсәтергә мөмкин:
SBaO2 + SH2SO4 —> SBaSO4I + ЗН2О + O3T
Озонның үзлекләре. Ике тәҗрибәдә дә барлыкка килгән озонны аның үзенчәлекле
исе буенча танып беләләр. Озонны аның ачык беленеп торган оксидлаштыру үзлек¬
ләреннән файдаланып та танып белергә мөмкин. Моның өчен: а) суда чылатылган
зәңгәр яки кызыл лакмус кәгазен озон чыгып торган пробирка авызында тотыгыз;
б) калий иодиды Kl эремәсендә һәм крахмал җилемендә чылатылган фильтр кәгазе
кисәген озон агынтысына куегыз.
Озонның калий иодиды белән реакциясе тигезләмәсе:
2KI + O3 + H2O —* 2К0Н +I2 + O2 T
Биремнәр. 1. Лакмус кәгазенең төссезләнүе озонның нинди үзлекләре турында
сөйли? 2. Соңгы тәҗрибәдә ни өчен зәңгәр төс барлыкка килә?
42
4. Күкерт һәм аның табигый кушылмалары үрнәкләре белән танышу
Бирелгән күкерт һәм аның табигый кушылмалары үрнәкләрен җентекләп карагыз.
Дәфтәрегезгә түбәндәге схема буенча җавап языгыз:
1. Атамасы
2. Химик формуласы
3. Агрегат халәте
4. Төсе
5. Катылыгы
5. Эремәдәге сульфид- һәм сульфит-ионнарны танып белү
1. Натрий сульфиды эремәсе салынган пробиркага берничә тамчы бакыр (II) нитраты
яки кургаш (II) нитраты тамызыгыз.
2. Натрий сульфиты эремәсе салынган пробиркага 1 мл сульфат кислотасы
өстәгез.
Биремнәр. 1. Үзегез үткәргән химик реакцияләрнең билгеләрен әйтегез.
2. Реакция тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы рәвештә
языгыз.
6. Эремәдәге сульфат-ионнарны танып белү
Бер пробиркага — 1—2 мл натрий сульфаты эремәсе, икенчесенә — шулкадәр үк
цинк сульфаты эремәсе, өченчесенә шулай ук сульфат кислотасының сыегайтылган
эремәсен агызыгыз. Һәр өч пробиркага берәр гранула цинк салыгыз, аннан соң
берничәшәр тамчы барий хлориды яки барий нитраты эремәсе өстәгез.
Биремнәр. 1. Сульфат кислотасын аның тозларыннан ничек аера белергә
мөмкин? 2. Сульфатларны башка тозлардан ничек аерып танып була? Үзегез башкарган
реакцияләрнең тигезләмәләрен молекуляр, ионлы, кыскартылган ионлы рәвештә
төзегез.
2 нче практик эш
«Кислород төркемчәсе» темасы буенча эксперименталь мәсьәләләр
1 нче мәсьәлә, а) Натрий сульфаты; б) натрий хлориды; в) сульфат кислотасы
эремәләре салынган өч пробирка бирелгән. Тәҗрибә ясап, кайсы пробиркада нинди
матдә булуын билгеләгез.
2 нче мәсьәлә. Бакыр (II) сульфаты эремәсе бирелгән. Аннан бакыр (II) хлориды
эремәсе табыгыз.
3 нче мәсьәлә. Номерлар сугылган дүрт пробиркага калий тозлары: иодид, сульфат,
хлорид, бромид салынган. Бирелгән матдәләрнең һәркайсын аларга характерлы реак¬
цияләр ярдәмендә танып белегез.
4 нче мәсьәлә. Түбәндәге әверелешләрне башкару буенча тәҗрибәләр
үткәрегез:
а) цинк -» цинк сульфаты -» цинк гидроксиды
б) бакыр (II) оксиды -» бакыр (II) сульфаты
в) цинк -» цинк хлориды -» цинк гидроксиды
5 нче мәсьәлә. Сульфат кислотасы, цинк, стронций нитраты, натрий хлориды, каль¬
ций хлориды, бакыр (II) хлориды эремәләре бирелгән. Сульфат кислотасының нинди
матдәләр белән реакциягә керүен тәҗрибә ярдәмендә тикшерегез. Нинди реакцияләр
оксидлашу-кайтарылу реакцияләренә керә? Җавабыгызны дәлилләгез.
6 нчы мәсьәлә. Сульфат һәм хлорид кислоталарының сыйфат составын раслаучы
реакцияләр уздырыгыз.
43
Азот һәм фосфор
III БҮЛЕК
дач»мннммя1
§15. Химик элементларның
периодик таблицасында азот һәм фосфорның
урыны, аларның атом төзелеше
Уку материалын кабатлагыз (8 нче сыйныф, § 36).
Сез периодик таблицаның VII һәм VI төркемнәренең төп төркемчәләренә
(VIIA- һәм VIA-төркемнәргә) кергән иң әһәмиятле химик элементларны
өйрәндегез инде. Хәзер V төркемнең төп төркемчәсе (VA-төркем) элемент¬
ларын өйрәнүгә күчәбез. Аларга азот N, фосфор Р, мышьяк As, сөрмә Sb һәм
висмут Bi керә. Арада иң әһәмиятлеләре — азот һәм фосфор. Бу элементлар
белән якыннанрак танышырбыз. Аларның атомнарының төзелеше 12 нче
таблицада бирелгән.
12 нче таблица. Азот һәм фосфор атомнары төзелешенең схемалары
Химик билгесе
Электроннарның энергетик
дәрәҗәләрдә урнашуы
Zk Электронлы формуласы
N
P
+7N 2е, 5е”
+15Р 2е, 8е~, 5е~
Is2 I 2s22p3
Is2 I 2s22p6 I Зз2Зр3
Электроннарның орбитальләрдә урнашуы
Is2 2s2
3s2 Зр3 3d»
Азот, фосфор һәм бу төркемчәнең башка элементлары атомнарының
соңгы энергетик дәрәҗәләрендә бишәр электрон урнаша. Инерт элементлар
өчен характерлы булган атомнарның тотрыклы халәтенә кадәр өч электрон
җитми. Бу элементларның атомнары җитмәгән өч электронны үзләренә
китереп куша алалар. Атом биш электронын биреп тә тотрыклы халәткә
44
ия була ала. Шуңа күрә азот төркемчәсе элементларының югары уңай
оксидлашу дәрәҗәсе +5, тискәре оксидлашу дәрәҗәсе -3, оксидларының
+5 -2
гомуми формуласы R2O5, ә водородлы кушылмаларының гомуми форму-
-3+1
ласы RH3.
VA-төркем элементларының охшашлыклары булу белән беррәттән, шак¬
тый аерымлыклары да бар. Азот RH3 тибындагы кушылманы чагыштыр¬
мача җиңел хасил итә, ләкин аның R2O5 тибындагы кушылмасын турыдан-
туры табып булмый. Ә фосфорның югары оксиды фосфор янганда барлыкка
килә.
A Бу аерымлык фосфор атомының (12 нче таблица) соңгы энергетик дәрә¬
җәсендә буш d-орбитальләр булуы белән аңлатыла. Шунлыктан Зз2-элект-
роннар аерылырга һәм аларның берсе Зd-opбитaльгә күчәргә мөмкин. Бу
очракта фосфор атомының өченче энергетик дәрәҗәсендә парсыз биш
электрон булып чыга, аларның башка элементка күчү яки электртискәрерәк
элементка, мәсәлән P2O5 оксиды хасил итеп, кислород ягына авышу
ихтималы бар. Азот атомының (12 нче таблица) буш орбитальләре юк.
Аның 2з2-электроннарын аеру өчен, шуларның берсен өченче энергетик
дәрәҗәгә күчерергә кирәк. Әмма моның өчен зур энергия таләп ителә.
1 нче күнегүне үтәгез (52 нче бит).
§16. Азот. Азотның физик һәм химик үзлекләре
Уку материалын кабатлагыз (8 нче сыйныф, § 41).
Молекула төзелеше. Азот молекуласы ике атом¬
нан тора, химик формуласы N2, структур форму¬
ласы N=N, электронлы формуласы
:N::N:
Электрон болытларының аралашуы юлы белән
ковалент химик бәйләнешләр ясалуы турындагы
тәгълимат нигезендә, азот молекуласында бер
о-бәйләнеш һәм ике л-бәйләнеш барлыкка килә
(10 нчы рәсем).
Табигатьтә очравы. Азот һавада ирекле хәлдә
(күләме буенча =78%) була. Берникадәр микъ¬
дарда нитратлар рәвешендә азот туфракта бар. Ул
аксым матдәләрнең состав өлешен тәшкил итә.
Табу. Техник максатлар өчен азотны һавадан
кислородны аерып алгандагы кебек җайланмаларда
табалар (8 нче сыйныф, § 19). Сыек һаваны парга
10 нчы рәсем. Азот моле¬
куласында электрон бо¬
лытларының аралашуы
белән ковалент бәйләнеш¬
ләр ясалу
45
әйләндергәндә, азот беренче булып оча (азотның £кайн -196 °C, ә кислород¬
ның £кайн -183 °C). Саф азотны аның кайбер кушылмаларын таркатканда
табалар.
Физик үзлекләре. Азот — төссез һәм иссез газ, һавадан җиңелрәк. Суда
эрүчәнлеге зур түгел (кислородныкыннан да кимрәк). Каты хәлдә азот
молекуляр кристаллик челтәр хасил итә, шуңа күрә аның эретелү һәм
кайнау температуралары түбән.
Химик үзлекләре. Гадәти шартларда азотның активлыгы түбән. Бу
аның молекуласында химик бәйләнешләрнең ныклыгы белән аңлатыла.
Югары температурада атомнар арасындагы бәйләнешләр йомшара һәм азот
реакциягә керергә сәләтле булып әверелә. Әйтик, мәсәлән, электр дугасы
температурасында азот кислород белән реагирлаша:
2000oC
N2 + O2 «=* 2NO - Q
Яшен вакытында атмосферада электр бушанганда да шундый ук реакция
бара. Билгеле бер шартларда азот водород белән реагирлаша:
-3+1
N2 + ЗН2 2NH,
Л Л о
аммиак
■ Югарырак температурада азот кайбер металлар белән реакциягә керә:
|—3 ■ 2е—|
о о +2-3
3Mg + N2 Mg3N2
Бу реакция нәтиҗәсендә хасил булган магний нитридын аммиак моле¬
куласындагы водород атомнарын металл атомнарына алмаштыру продукты
дип карарга була. Мондый кушылмаларны нитридлар дип атыйлар.
СЕЗ
БЕЛӘСЕЗМЕ?
Беренче булып азотны инглиз галиме Д. Резерфорд
1772 елда ача. Аның үзлекләрен галимнәр К. Шееле,
Г. Кавендиш, Дж. Пристли, А. Лавуазье тикшерә.
Танылган галим А. Лавуазье башка галимнәр белән бер¬
лектә 1787 елда азот терминын тәкъдим итә. Бу термин
грекчадан тәрҗемә иткәндә «терек булмаган» дигәнне
аңлата. Ләкин ярты гасыр да узмый, «терек булмаган»
азотның тереклек элементларының берсе булуы ачыклана:
ул аксымнар һәм нуклеин кислоталары составына керә.
Туфракта атмосфера азотын үзләштерергә сәләтле ирекле
яшәүче бактерияләр дә бар. Кайбер азот фиксацияләүче
бактерияләрне бактериаль ашламалар җитештерү өчен
файдаланалар.
46
Куллану. Азотны башлыча аммиак NH3 синтезлауда, ә аммиакны нитрат
кислотасы һәм башка азотлы кушылмалар җитештерүдә кулланалар. Сыек
азотны химик процесслар үткәргәндә инерт тирәлек булдыру өчен фай¬
даланалар. Сыек азотны шулай ук суыткыч системаларда кулланалар.
Сорауларга җавап бирегез һәм 2-—5 нче күнегүләрне үтәгез (52 нче бит).
§17. Аммиак
Уку материалын кабатлагыз (8 нче сыйныф, § 41).
Молекула төзелеше. Аммиакның химик формуласы NH3. Азот водородка
караганда электртискәрерәк элемент булганлыктан, аммиак молекуласында
поляр ковалент химик бәйләнеш. Аммиакның электронлы формуласы:
HWH
H
аммиакның структур формуласы:
H-N-H
H
A Аммиак молекуласында химик бәйләнеш ясалу процессын аңлау өчен,
азот атомында электроннарның орбитальләрдә урнашуы схемасын төзергә
кирәк (12 нче таблица). Азот атомында парсыз өч р-электрон бар, аларның
болытлары үзара перпендикуляр урнашалар. Аммиак молекуласы хасил
булганда, азот атомының р-электрон болытлары белән s-электрон болытлары
аралашу 11 нче рәсемдә күрсәтелгән.
Табу. Биология курсыннан билгеле булганча, азот
аксымнар составына керә, барлык тере организмнарда
иң мөһим тереклек процесслары аксымнар катнашында
бара. Ләкин атмосфера азотын хайваннар да, үсемлек¬
ләр дә (тамырларында атмосфера азотын үзләштерергә
сәләтле бактерияләре булган кузаклыларны исәпләмәгән¬
дә) турыдан-туры бәйли алмыйлар. Күпчелек үсемлекләр
азотны аның кушылмаларыннан (нитрат кислотасы тоз¬
ларыннан, аммиаклы су, аммоний тозларыннан), ә хай¬
ваннар үсемлек азыклардан үзләштерәләр.
Озак еллар авыл хуҗалыгы культураларының бәйле
азотка булган ихтыяҗы туфракка чили селитрасын
(натрий нитраты) кертү белән канәгатьләндерелеп ки-
ленде, ә аның запасы чикләнгән. Шуңа күрә галимнәр
11 нче рәсем. Ам¬
миак молекуласында
р- һәм s-электрон
болытларының ара¬
лашуы
47
СЕЗ
БЕЛӘСЕЗМЕ?
Аммиакны каталитик синтезлау буенча дөньяда беренче
завод 1913 елда Германиядә төзелә.
алдына атмосфера азотын промышленность ысулы белән бәйләүнең икъти¬
сади яктан отышлырак ысулын табу бурычы килеп баса. Аммиакны азот
һәм водородтан синтезлау шундый ысул булып тора:
N2 + ЗН2 <=t 2NH3 + Q
NH3
12 нче рәсем.
Аммиакны лаборато¬
риядә табу
Ca(OH)9
пәм
NH4Cl
13 нче рәсем.
Аммиакның суда эрүе
Бу — кайтма реакция; ул температура якынча 300 °C, басым 20—30 МПа
булганда һәм катализатор — вак куышлы тимер катнашында бара.
Лабораториядә аммиакны аммоний тозларының селтеләр белән катнаш¬
масын җылытып табалар (18 нче параграфны карагыз). Бу максатта ешрак
аммоний хлоридын NH4Cl һәм сүндерелгән известь
(кирәгеннән артык алып) кулланалар. Әлеге матдәләр¬
не бик яхшылап катнаштыралар һәм колбага салып
җылыталар (12 нче рәсем). Түбәндәге реакция уза:
2NH4C1 + Ca(OH)2 > CaCl2 + 2NH,t + 2Н2О
Физик үзлекләре. Аммиак — үзенә бертөрле зәһәр
исле төссез газ, һавадан ике тапкыр диярлек җиңелрәк,
суда бик яхшы эри. Гадәти шартларда бер күләм суда
700 күләм чамасы аммиак эри (13 нче рәсем).
Басымны арттырганда аммиак сыеклана. Сыек
аммиакның парга әйләнү җылылыгы зур. Шуңа күрә
аны суыткычларда кулланалар.
Химик үзлекләре. Аммиак — актив матдә. Аммиак
катнашындагы реакцияләр я азотның оксидлашу
дәрәҗәсе үзгәрү белән, яисә ковалент бәйләнешнең
аерым төре ясалу белән уза (13 нче таблица).
Аммиак суда эрегәндә, аммиаклы су барлыкка килә. Бу
процесста аммиак молекулаларының берникадәр өлеше
су белән реакциягә керә. Нәтиҗәдә аммоний ионнары
NH4 һәм гидроксид-ионнар OH- барлыкка килә.
A Аммоний ионнары барлыкка килү механизмы
гидроксоний ионнары H3O+ барлыкка килү процессы
белән охшаш (§2). Аммиак молекуласында азот
атомының бүленмәгән бер пар электроны, ә водород
ионының ирекле s-орбитале бар. Аммиак водород
ионы белән тәэсир итешкәндә, азот атомы үзенең
бүленмәгән пар электронын бирүе белән — донор,
ә водород ионы аны алуы белән акцептор булып тора;
48
донорлы-акцепторлы механизм буенча дүртенче ковалент бәйләнеш шулай
ясала.
Бу процессны схема рәвешендә болай сурәтләргә мөмкин:
H
HW + H+
H
I
H-N-H
I
H
Аммоний ионында дүртенче бәйләнеш калган өч бәйләнештән аерылып
тормаганлыктан, аларны бертөрле итеп сурәтлиләр.
Аммиакта һәм аммоний ионында азотның оксидлашу дәрәҗәсе бертөрле
һәм ул -3 кә тигез. Ләкин азотның валентлыгы аммиак молекуласында
3 кә, ә аммоний ионында 4 кә тигез.
Аммиакның төп химик үзлекләре 13 нче таблицада бирелгән.
Куллану. Аммиакны нитрат кислотасы һәм азотлы ашламалар
җитештерүдә кулланалар. Аны шулай ук авыл хуҗалыгында (ашлама
сыйфатында), медицинада һәм көндәлек тормышта файдаланыла торган
аммиаклы су (аммиакның судагы эремәсе) табу өчен дә кулланалар.
13 нче таблица. Аммиакның төп химик үзлекләре
Азотның оксидлашу дәрәҗәсе үзгәрүгә
бәйле реакцияләр
Донорлы-акцепторлы механизм
буенча ковалент бәйләнеш ясалуга
бәйле реакцияләр
1. Аммиак су белән реакциягә керә:
H
H:N: + H2O <=
H
яки NH3 + H2O
H
H:N:H
H
i NH4 + OH-
+ OH-
1. Аммиак — тотрыксыз кушылма
һәм җылытканда таркала:
-3+1 f о о
2NH3 N2 + ЗН2
2. Аммиак кислородта яна:
-3+1 0 0 -2
4NH3 + ЗО2 > 2N2 + 6Н2О
-з о
2N - 6е" » N2
0 с?
O2 + 4е * 20
3. Катализатор катнаш^щда (пла¬
тина һәм родий эретмәсе) аммиак,
һава кислороды белән оксидлашып,
азот (II) оксиды хасил итә:
-3 O Pt1Rh +2-2 7?
4NH3 + 502 »4N0 + 6Н20
-3 +2
N - бе“ * N
O -2
O2 + 4е- * 20
2. Аммиак кислоталар белән реак¬
циягә керә:
NH3 + HCl » NH4Cl
аммоний хлориды
Күп нигезле кислоталар белән ам¬
миак ике төрле реагирлаша:
NH3 + H2SO4 * NH4HSO4
аммоний
гидросульфаты
2NH3 + H2SO4 * (NH4)2SO4
аммоний
сульфаты
2
3
4
5
49
14 нче рәсем. Аммиакны һәм аммоний тозларын куллану: 1—4, 8, 10, 11 — минераль
ашламалар җитештерүдә; 5 — эретеп ябыштыруда; 6 — медицинада; 7 — көнкүрештә;
9 — шартлаткыч матдәләр табуда; 12 — нитрат кислотасы җитештерүдә
Аммиакның берникадәр өлеше суда эреп кенә калмыйча, аның белән реак¬
циягә дә кергәнлектән, аммиаклы суны кайвакыт — аммоний гидроксиды,
ә көнкүрештә нашатырь спирты дип тә атыйлар. Аммиаклы су көчсез селте
тәэсиренә ия, чөнки аммиак су белән үзара тәэсир итешкәндә гидроксид-
ионнар OH- хасил була.
Аммиакның кулланылышы белән 14 нче рәсемнән танышырга мөмкин.
Сорауларга җавап бирегез һәм 6—12 нче күнегүләрне үтәгез (52 нче бит).
§18. Аммоний тозлары
Аммоний тозлары — составына кислота калдыклары белән бәйләнгән
аммоний ионнары NHt кергән катлаулы матдәләр.
Аммоний тозларына мисаллар:
NH4 Cl
аммоний
хлориды
+1 -3
(NH1)11PO4
аммоний
ортофосфаты
50
Күп нигезле кислоталар шулай ук аммонийның әче тозларын хасил итә
алалар, мәсәлән:
+1 -2 +1 -1
(NH4)2HPO4 NH4H2PO4
аммоний гидроортофосфаты, аммоний дигидроортофосфаты,
яки ике алмаштырылган яки бер алмаштырылган
аммоний ортофосфаты аммоний ортофосфаты
Табу. Аммоний тозларын 1) аммиакка кислоталар белән тәэсир итеп
һәм 2) аммиаклы суны кислоталар белән нейтральләштереп табалар. Ьәр
ике очракта да күп нигезле кислоталарны кирәгеннән артык алганда әче
тоз хасил була.
Физик үзлекләре. Барлык аммоний тозлары — каты кристаллик
матдәләр һәм, селтеле металл арның тозлары кебек, суда яхшы эриләр.
Химик үзлекләре. Аммоний тозлары барлык тозлар өчен уртак
үзлекләргә һәм кайбер специфик үзлекләргә ия (14 нче таблица).
Аммоний тозларының кулланылышы 14 нче рәсемдә күрсәтелгән.
Сорауларга җавап бирегез һәм 13—14 нче күнегүләрне үтәгез. 1—2 нче мәсьәләләрне
чишегез (52 нче бит).
14 нче таблица. Аммоний тозларының химик үзлекләре
Башка тозлар белән уртак үзлекләре
1. Көчле электролитлар, судагы
эремәдә ионнарга диссоциацияләшә:
NH4NO3 * NH4 + NO3
2. Кислоталар белән реагирлаша:
(NH4)2CO4 + 2НС1 > H2O +
+ CO2T+ 2NH4C1
2NH4C1 + H2SO4 *
♦ (NH4)2SO4+ 2НС1 t
3. Башка тозлар белән реагирлаша:
(NH4)2SO4 + BaCl2 ♦
* BaSO41 + 2NH4C1
2NH4 + SO4 + Ba2+ + 2СГ ♦
♦ BaSO41 + 2NH4 + 2СГ
Ba2+ + SO2- > BaSO41
4. Аммоний тозлары гидролизла¬
та (§ 6).
Специфик үзлекләре
1. Югары температурада таркала:
NH4Cl NH3T+ HClt
Суытканда, NH3 яңадан хлороводород
белән реагирлаша, һәм пробирканың
салкын стенасында NH4Cl хасил була:
Аммоний хлоридын таркату
2. Селтеләр белән реагирлаша:
NH4Cl + NaOH —
* NaCl + NHot+ H2O
By реакцияне аммоний тозларын та¬
нып белү өчен файдаланалар. Реакция
бара торган пробирка авызына суда чы¬
латылган кызыл лакмус кәгазен якынай¬
тып тоталар — ул зәңгәр төскә керә.
51
1. Атомнар төзелеше теориясеннән
чыгып аңлатыгыз: а) азот һәм фосфор
элементларының охшашлыгы нәрсәдә
чагыла; б) бу элементлар бер-берсеннән
нәрсәсе белән аерыла?
2. Азот молекуласының төзелеше
нинди? Азот молекуласының электронлы
формуласын сурәтләгез.
3. Азотның химик үзлекләрен харак¬
терлаучы химик реакцияләрнең тигез¬
ләмәләрен төзегез.
4. Бер цилиндрда — азот, икенчесен¬
дә — кислород, өченчесендә — угле¬
род (IV) оксиды. Бу газларны ничек та¬
нып белергә?
5. Кайбер янучан газларда катышма
хәлендә ирекле азот була. Мондый газны
гадәттәге газ плиталарында яндырганда
азот оксиды хасил булырга мөмкинме?
Ни өчен?
6. Реакция нәтиҗәсендә аммиак бар¬
лыкка килү белән бара торган дүрт химик
реакция тигезләмәсе языгыз.
-3 0
7. N * N әверелеше схемасына кай¬
сы реакция тигезләмәсе туры килә:
1) 2NH3 + H2SO4 » (NH4)2SO4
2) 4NH3 + 5О2 * 4N0 + 6Н2О
3) 4NH3 + ЗО2 ♦ 2N2 + 6Н2О
4) NH3 + HCl » NH4CI
8. Аммиакны кызган бакыр (П) оксидлы
көпшә аша уздырганда металлик бакыр
хасил була. Бу реакциянең тигезләмәсен
языгыз һәм оксидлаштыргычны — бер
сызык, ә кайтаргычны ике сызык бе¬
лән күрсәтегез. Электроннар күчешен
күрсәтегез.
9. Ни өчен аммиак кислоталар белән су
белән реагирлашканга караганда көчлерәк
реагирлаша? Бу химик реакцияләрнең
асылы нәрсәдә?
10. 14 нче рәсемдә күрсәтелгән про¬
дуктларны табу аммиакның нинди хи¬
мик үзлекләренә нигезләнгән, аңлатып
бирегез.
11. Аммиакның судагы эремәсен
аммиаклы су һәм аммоний гидроксиды дип
атыйлар. Бу атамаларны дәлилләгез.
12. а) Аммоний дигидроортофосфаты;
б) аммоний гидроортофосфаты һәм в) ам¬
моний ортофосфаты хасил булу белән бара
торган реакцияләрнең тигезләмәләрен
төзегез.
13. Аммоний гидрокарбонатын кай¬
вакыт кондитер ризыклары пешергәндә
кулланалар. Монда аммоний гидрокарбо-
натының нинди үзлекләре файдаланыла?
14. Дәфтәрегезгә таблица сызыгыз
һәм тиешле графаларга формулалары
таблицада бирелгән тозларның харак¬
терлы химик үзлекләрен аңлаткан реак¬
цияләрнең тигезләмәләрен молекуляр һәм
ионлы рәвештә языгыз.
Тозлар
Башка тозлар белән уртак
химик үзлекләре
Специфик үзлекләре
NH4Cl
(NH4)2CO3
(NH4)2S
(NH4)2SO4
• 1. 10,7 г аммоний хлоридын кальций
гидроксиды белән катнаштырып, кат¬
нашманы җылытканнар. Нинди газ һәм
массасы, күләме буенча күпме аерылып
чыгар (н. ш.)?
2. 5 т аммоний нитратын табу өчен
күпме күләм һәм күпме масса аммиак ки¬
рәк булыр?
52
§19. Нитрат кислотасы
Уку материалын кабатлагыз (8 нче сыйныф, § 32).
A Молекула төзелеше, Ковалент бәйләнеш турындагы тәгълиматка
нигезләнеп, нитрат кислотасының электронлы һәм структур формулала¬
рын болай сурәтләргә кирәк булыр иде:
•• :О:
h:ckn;„. h-o-n^
xO
Болай сурәтләнгәндә азот атомы тирәли тотрыклы сигез электрон¬
лы катлау урынына 10 электронлы катлау булып чыга (азот атомы¬
ның йолдызчыклар белән тамгаланган биш электроны һәм кислород
атомының нокталар белән тамгаланган биш электроны). Әмма 2 нче период
элементларының атомнары тирәли сигез генә электрон урнаша ала, чөнки
аларда d-орбиталь булмый. Әгәр азот атомы белән кислород атомнарының
берсе арасында донорлы-акцепторлы механизм (9 нчы бит) буенча барлыкка
килгән бәйләнеш бар дип уйласак, әлеге каршылык бетә. Шуны исәпкә
алып, нитрат кислотасының электронлы һәм структур формулаларын болай
язарга мөмкин булыр иде:
+5 :б: +5
Н:О* N " H-O-N4
IQ: 4O
Әмма тәҗрибә юлы белән нитрат кислотасы молекуласында азот атомы
һәм кислородның ике атомы арасындагы химик бәйләнешләрнең бертөрле
булуы, ягъни икеле һәм берле бәйләнешләрнең булмавы расланган. Шуңа
күрә нитрат кислотасы молекуласын болай сурәтләргә кирәк:
^O
H-O-N^
Пунктир сызыклар кислородның ике атомы арасында икеле бәйләнешнең
бүленешен күрсәтә. Нитрат кислотасы молекуласында азотның оксидлашу
дәрәҗәсе +5 кә тигез, чөнки азот атомыннан кислород атомына таба биш
электрон авышкан. Уртак дүрт пар электроннары булганлыктан, азотның
валентлыгы дүрткә тигез.
Табу. Лабораториядә нитрат кислотасын кристаллик натрий яки калий
нитратына куертылган сульфат кислотасы белән тәэсир итеп, аз гына
җылытып табалар:
NaNO3 + H2SO4 NaHSO4 + HNO3T
Ныграк җылытканда натрий сульфаты хасил була, ләкин бу шартларда
нитрат кислотасы таркала.
53
Промышленностьта нитрат кислотасын аммиакны һава кислороды
белән катализатор катнашында оксидлаштырып табалар.
Катализатор сыйфатында платина-родий челтәрләр файдаланалар:
-3 0 +2-2 -2
4NH, + 5О2 = 4N0 + 6Н„0 + Q
OZ Zv
Бу реакция экзотермик булганлыктан, кирәкле температура реакция
вакытында аерылып чыккан җылылык исәбенә саклана.
Азот (II) оксидының азот (IV) оксидына оксидлашуы гадәттәге темпе¬
ратурада уза:
2N0 + O2 * 2NO2
Алга таба реакция болай бара:
+4 +5 +2
3NO2 + H9O —» 2HN04 + NO
ZZ о
Кислород артыграк булганда реакция азот (II) оксиды аерылып чыкмыйча
гына бара:
+4 О +5-2
4NO2 + 2Н2О + O2 <=> 4 HN О.. + Q
ZZZ Ow
Азот (IV) оксидының су белән реакциясе экзотермик һәм кайтма. Бу —
нитрат кислотасының җылытканда таркалуы белән аңлатыла. Тигезләнешне
уңга авыштыру өчен басымны арттыралар.
Физик үзлекләре. Саф нитрат кислотасы — буылдыргыч зәһәр исле,
төссез, төтенләүчән сыеклык. Куертылган нитрат кислотасы, гадәттә, сары
төстә була. Бу төсне аңа нитрат кислотасы өлешчә таркалудан барлыкка
килгән һәм анда эрегән азот (IV) оксиды бирә.
Нитрат кислотасының химик үзлекләре 15 нче таблицада бирелгән.
Куертылган һәм сыегайтылган нитрат кислотасының бакыр белән реак¬
циясе бик тә үзенчәлекле:
O +5 +2 +4
Cu + 4HNO3 (куерт.) —* Cu(NO3)2 + 2NO2t+ 2Н2О
O +2
Cu - 2е > Cu 1
+5 +4
N + е~ —» N 2
O +5 +2 +2
3Cu + SHNO3 (сыег.) > SCu(NO3)2 + 2N0t + 4Н2О
O +2
Cu - 2е —» Cu
+5 +2
N + Зе~ > N
3
2
СЕЗ
БЕЛӘСЕЗМЕ?
Нитрат кислотасын Vlll гасырда гарәп химигы Джабир
ибн Хайян (Гебер) үзенең хезмәтләрендә телгә ала,
ә производство максатларында аны XV гасырда таба баш¬
лыйлар.
54
15 нче таблица. Нитрат кислотасының химик үзлекләре
Башка кислоталар белән уртак
үзлекләре
1. Тулысынча диярлек диссо-
циацияләшүе аркасында
HNO3 * H+ + NO3
нитрат кислотасы (хлорид һәм
сульфат кислоталары кебек үк)
көчле кислота санала.
2. Нигез оксидлары белән реа¬
гирлаша:
CuO + 2HNO3 *
» Cu(NO3)2 + H2O
CuO + 2Н+ + 2NO3 —*
* Cu2+ + 2NO3 + H2O
CuO + 2Н+ * Cu2+ + H2O
3. Нигезләр белән реагирлаша:
Fe(OH)3 + 3HNO3 *
—* Fe(NO3)3 + ЗН2О
Fe(OH)3 + ЗН+ + 3NO3 —*
—* Fe3+ + 3NO3+ ЗН2О
Fe(OH)3 + ЗН+ * Fe3+ + ЗН2О
Специфик үзлекләре
1. Җылытканда һәм яктылык тәэсирендә
куертылган нитрат кислотасы таркала:
t, ЯКТЫЛЫК
4HNO3 > 2Н2О + 4NO2t + O2T
Шул сәбәпле нитрат кислотасы көчле ок¬
сидлаштыргыч булып тора: а) пыскып тор¬
ган чыра җылытылган куертылган нитрат
кислотасында янып китә; б) скипидар һәм
пычкы чүбе куертылган нитрат кислота¬
сында кабына:
Җылытылган куертыл¬
ган нитрат кислота¬
сында пыскып торган
чыраның кабынуы
Куертылган нитрат
кислотасында скипи¬
дарның кабынуы
4. Көчсезрәк һәм очучанрак
кислоталарның тозлары белән
реагирлаша (кислоталарның этеп
чыгаручанлыгы рәтен карагыз —
8 нче сыйныф, § 32):
Na2CO3 + 2HNO3 *
* 2NaNO3 + H2O + CO21
2Na+ + CO3 + 2Н+ + 2NO3 —♦
—* 2Na+ + 2NO3 + H2O + CO21
CO2’ + 2H+ * H2O + CO91
0 ZZ
2. Куертылган нитрат кислотасы аксым¬
нар белән тәэсир итешкәндә ачык сары
төстәге матдә хасил була. Шуңа күрә әгәр
тирегә нитрат кислотасы тисә, сары таплар
барлыкка килә.
3. Нитрат кислотасы металлар белән
төрлечә реагирлаша. Бу реакцияләрдә кис¬
лотаның концентрациясенә һәм металлның
кайтару сәләтенә бәйле рәвештә азотның
төрле оксидлары, кайвакыт азот һәм хәтта
аммиак аерылып чыга.
55
4
5
6
15 нче рәсем. Нитрат кислотасының кулланылышы: 1 — буягыч матдәләр табуда;
2 — дарулар; 3 — фотопленкалар; 4 — шартлаткыч матдәләр ясауда; 5, 6 — минераль
ашламалар җитештерүдә
Нитрат кислотасы көмеш һәм терекөмеш белән бакыр белән реагир-
лашкандагы кебек тәэсир итешә. Алтын, платина, осмий, иридий һәм
кайбер башка металлар бернинди шартларда да нитрат кислотасы белән
реакциягә кермиләр.
Куертылган нитрат кислотасы белән эш иткәндә бик сак булырга: аның
тирегә һәм киемгә тиюенә юл куймаска кирәк!
Нитрат кислотасының кулланылышы 15 нче рәсемдә күрсәтелгән.
Сорауларга җавап бирегез һәм 1—7 нче күнегүләрне үтәгез (59 нчы бит). 1—2 нче
мәсьәләләрне чишегез (60 нчы бит).
§ 20. Нитрат кислотасының тозлары
Нитрат кислотасының тозларын нитратлар дип атыйлар. Селтеле
металларның, кальций һәм аммонийның нитратларын селитралар дип
тә атыйлар, мәсәлән: NH4NO3 — аммиак селитрасы, NaNO3 — натрий
селитрасы.
56
Эретелгән
Күмер
кисәге
16 нчы рәсем. Кызган кү¬
мернең эретелгән натрий
нитратында януы
Табу. Нитратлар 1) металлар, нигез оксид¬
лары, нигезләр, аммиак һәм кайбер тозлар
нитрат кислотасы белән; 2) азот (IV) окси¬
ды селтеләр белән тәэсир итешкәндә хасил бу¬
лалар.
Техникада нитратларны (селитраларны)
башлыча селтеле һәм селтеле-җир металларның
карбонатларына нитрат кислотасы яки азот (IV)
оксиды белән тәэсир итеп табалар. Нитрат
кислотасы аммиак белән реакциягә кергәндә
аммоний нитраты табыла:
NH3 + HNO3 * NH4NO3
Физик үзлекләре. Барлык нитратлар — каты
кристаллик матдәләр, суда яхшы эриләр.
Химик үзлекләре. Нитрат кислотасы кебек үк, нитратлар да җылыт¬
канда таркала һәм кислород аерылып чыга. Әгәр эретелгән селитрага
кызган күмер кисәге ташласаң, күмер яктырып кабына һәм яна башлый
(16 нчы рәсем).
Тоз составындагы металлның химик активлыгына бәйле рәвештә,
нитратларның таркалуы төрлечә уза. Әгәр бер яки ике валентлы металлны
Me дип билгеләсәк, җылытканда нитратларның таркалу процессын,
металларның стандарт электродлар потенциаллары рәтен («этеп чыгару
рәтен») исәпкә алып, болай сурәтләргә мөмкин булыр иде:
t
MeNO3
Me Cu дан уңдарак урнашкан
Me Mg дан сулдарак урнашкан MeNQ2 + O2T
Me Mg һәм Cu арасында урнашкан
MeO + NO2T + O21
Me + NO2T+ O2T
Мисаллар:
2NaNO3 2NaNO2 + O21
натрий
нитриты
2Cu(NO3)2 2CuO + 4NO2t + O2T
2AgNO3 2 Ag + 2NO2t + O2T
Аммоний нитраты азот (I) оксиды һәм су хасил итеп таркала:
NH4NO3 N2Ot + 2Н2О
57
Нитрат кислотасы һәм аның тозларында нитрат-ионнар NOj була.
Нитрат-ионнарны NOj танып белү өчен, пробиркага аз гына микъдарда
тикшерелә торган матдәне салалар, аңа бакыр чүбе өстиләр, куертылган
сульфат кислотасы агызалар һәм җылыталар:
NaNO3 + H2SO4 * NaHSO4 + HNO3
4HNO3 + Cu Cu(NO3)2 +2NO2t + 2Н2О
Көрән төстәге газ хәлендә азот (IV) оксиды NO2 аерылып чыгу нитрат-
ионнар NO3 барлыгын күрсәтә.
Куллану. Нитратларны башлыча ашламалар итеп кулланалар.
Табигатьтә азот әйләнеше. Органик матдәләр черегәндә һәм янганда,
бәйле азот өлешчә аерылып атмосферага чыга. Әмма табигый шартларда
бәйле азотның туфрактагы микъдары кимеми. Ирекле азотның массасы
атмосферада шулай ук артмый да.
Моны нәрсә белән аңлатып була соң?
Туфракта ирекле яши торган һәм кузаклы үсемлекләрнең тамыр¬
ларында яши торган бактерияләр атмосфера азотын үзләштереп,
аны органик кушылмалар составына күчерәләр. Атмосфера азотының
бераз микъдары яшен вакытында бәйле хәлгә күчә: азот (II) оксиды,
ә аннан азот (IV) оксиды хасил була. Соңгысы, су белән реакциягә кереп,
17 иче рәсем. Табигатьтә азот әйләнеше
58
Француз галиме, академик. Аның төп фән¬
ни хезмәтләре табигатьтә матдәләр әй¬
ләнешен өйрәнүгә багышланган. Ул барлык
үсемлекләрнең дә туфрактан азот үзләш¬
терүен, ә кузаклыларның туфракны азотка
баетуын ачыклый.
Буссенго
Жан Батист
(1802-1887)
нитрат кислотасы барлыкка китерә, ә нитрат кислотасы исә туфракта
нитратларга әверелә. Бу процесслар нәтиҗәсендә табигатьтә өзлексез азот
әйләнеше бара. 17 нче рәсемдә әлеге процесс ачык күрсәтелгән. Уңышны
җыеп алганда, кырлардан азотның шактый өлеше уңыш белән китә.
Кырларга азотлы ашламалар керткәндә, бу югалу кире кайта.
8—9 нчы күнегүләрне үтәгез. 3 нче мәсьәләне чишегез (60 нчы бит).
1. Сыегайтылган нитрат кислотасы
кайбер металлар (Mg, Zn) белән тәэсир
итешкәндә, азот (I) оксиды яки азот
аерылып чыгарга мөмкин. Оксидлашу-
кайтарылу реакцияләренең тиешле
тигезләмәләрен языгыз.
2. Тирес кертелгән туфракта — ам¬
моний карбонаты, ә яшен вакытында
аммоний нитраты хасил була. Бу нәрсә
белән аңлатыла? Реакцияләрнең тигез¬
ләмәләрен языгыз.
3. Аммиактан нитрат кислотасын табу
реакцияләренең тигезләмәләрен төзегез.
- 4. Башлангыч матдәләр белән реакция
продуктлары арасындагы тәңгәллекне
билгеләгез:
1) HNO3 >
2) NH4NO3 + KOH ♦
3) Cu(NO3)2 + KOH *
4) Zn(NO3)2 (каты) + H2SO4 (куерт.) ♦
A. NH3T + KNO3+ H2O
Б. HNO3 + ZnSO4
B. ZnSO4 + H2T
Г. NO2T + O2T + H2O
Д. Cu(OH)21 + KNO3
i 2 3 4
^о. Хлорид, сульфат һәм нитрат кис¬
лоталарын танып белү реакцияләренең
тигезләмәләрен молекуляр, ионлы һәм
кыскартылган ионлы рәвештә языгыз.
6. а) Нитрат кислотасына гына хас;
б) нитрат кислотасы һәм башка кисло¬
талар өчен уртак реакцияләрнең тигез¬
ләмәләрен китерегез.
7. Көмеш белән сыегайтылган нитрат
кислотасы һәм куертылган нитрат кис¬
лотасы арасында баручы реакцияләрнең
тигезләмәләрен языгыз. Электроннар кү¬
чешен күрсәтегез һәм оксидлаштыргыч¬
ны — бер сызык, кайтаргычны ике сызык
белән күрсәтегез.
8. Ике пробиркага ак төстәге ике
төрле нитрат салынган. Бер тозны җы¬
лытканда пыскып торган чыраны кабы¬
зып җибәрүче төссез газ аерылып чыга.
Икенче тозны җылытканда көрән төстәге
газ аерылып чыга. Болар нинди нитрат¬
лар? Оксидлашу-кайтарылу реакциялә¬
ренең тиешле тигезләмәләрен языгыз.
9. Яшен вакытында туфракта кайчак
кальций нитраты хасил булырга мөмкин.
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
59
1. Нитрат кислотасының масса өлеше
0,5 булган 50 т эремә табу өчен, күпме
күләм аммиак (н. ш.) кирәк булыр?
2. Составында 0,1 масса өлеше калий
гидроксиды булган 300 г эремәгә нитрат
кислотасы агызганнар. Ничә грамм тоз
хасил булган?
3. Нитрат кислотасының 200 г эремәсе
белән магний карбонаты арасында үткә¬
релгән реакция нәтиҗәсендә 11,2 л (н. ш.)
углерод (IV) оксиды табылган булса, нит¬
рат кислотасының масса өлешен (про¬
центларда) исәпләп чыгарыгыз.
§ 21. Фосфор
Уку материалын кабатлагыз (8 нче сыйныф, §42).
A Ирекле хәлендә фосфор берничә аллотропик үзгәрешле төрләр барлыкка
китерә: кызыл, ак һәм кара фосфор. Бу шуның белән аңлатыла: фосфор
атомнары, үзара тоташып, төрле типтагы кристаллик челтәрләр барлыкка
китерергә сәләтле. Азот молекуласындагы кебек үк, фосфор атомнары да
өч ковалент бәйләнеш хасил итә, әмма аннан аермалы буларак фосфор
атомнары, пар-пар булып, фәкать бер ковалент бәйләнеш белән генә бәйләнә.
Валентлыкның калган ике берәмлеге фосфорның өченче һәм дүртенче
атомнарын тоташтыру өчен файдаланыла. Фосфорның өченче һәм дүртенче
атомнары ничек тоташуга бәйле рәвештә, я молекуляр, яисә атомлы
кристаллик челтәр барлыкка килә (18 нче рәсем).
Табигатьтә фосфор. Химик активлыгы зур булу сәбәпле, табигатьтә
фосфор кушылмаларда гына очрый. Фосфорлы минералларның иң әһә-
миятлеләре — составына кальций ортофосфаты Ca3(PO4)2 кергән фосфорит¬
лар һәм апатитлар. Апатитка иң бай чыганак Кола ярымутравында, Хибин
таулары районында урнашкан. Фосфорит ятмалары Мәскәү, Калуга, Брянск
18 нче рәсем. Төзелеш схемасы: а — ак фосфор молекуласы; б — кара фосфорның
кристаллик челтәре; в — кызыл фосфорның кристаллик челтәре
60
СЕЗ
БЕЛӘСЕЗМЕ?
Гади металларны, янәсе алтынга әйләндерергә сәләт¬
ле «философия ташын» табу ысулларын эзләп, Гамбург
алхимигы X. Бранд 1669 елда, бәвелне парга әйләнде¬
рүдән калган коры калдыкны кудырып, беренче булып
ак фосфор тапкан. Башта моны алхимик эзләнә торган
«философия ташы» дип уйлаган, чөнки табылган матдә
караңгыда зәңгәрсу төс биргән.
өлкәләрендә бар. Фосфор үсемлекләр күзәнәкләрендәге, хайван һәм кешенең
нерв һәм сөяк тукымаларындагы нуклеин кислоталары һәм кайбер башка
матдәләр составында була. Фосфорга бигрәк тә ми күзәнәкләре бай.
H Табу. Фосфорны фосфорит һәм апатитлардан, электр мичләрендә һава
кертмичә, кремний (IV) оксиды һәм күмер катнашында җылытып таба¬
лар:
+5 0 + 0+2
Ca4(PO4)9 + 5С + 3SiO9 —SCaSiO4 + 2Р + 5C0f
o' 4' Z Z о
+5 O
P + 5е“ —> P 2
O +2
C - 2е" » C 5
Фосфор парлары су астында конденсатлата, һәм шул вакытта кристаллик
челтәр төеннәрендә P4 молекулалары булган ак фосфор барлыкка килә.
Физик үзлекләре. Фосфорның аллотропии үзгәрешле төрләре физик
үзлекләре белән аерыла (16 нчы таблица).
Югары басым астында ак һәм кызыл фосфор бу элемент атомнарыннан
барлыкка килгән катламнардан торган кара фосфорга әверелә. Kapa фосфор¬
ның структурасы графит структурасына охшаш, тик кара фосфорда атомнар
катламнары сырланган кебек була. Kapa фосфорның җиңелчә металлик
ялтыравыгы бар, һәм ул ярымүткәргеч булып тора; аның тыгызлыгы
2,85 г/см3. Химик реакцияләргә ул авыр керә.
Химик үзлекләре. Ак фосфорны һавасыз шартларда озак җылытканда,
ул сары төскә керә һәм акрынлап кызыл фосфорга әверелә.
Кызыл фосфорны шул ук шартларда җылытканда ул парга әйләнә,
аннан исә конденсатлашканда ак фосфор хасил була.
Ак фосфор үтә химик актив булуы белән аерылып тора. Кислород белән
40 oC та ук реакциягә кереп (ялкынланып яна башлый), фосфор (V) оксиды
хасил итә: 20е-—
0 0 +5-2
4Р + 5О2—>2Р2О5
61
16 ич ы таблица. Фосфорның физик үзлекләре
Фосфорның үзлекләре
ак фосфорның
кызыл фосфорның
Физик халәте
Катылыгы
Төсе
Исе
Тыгызлыгы
Суда эрүчәнлеге
Сероуглеродта
эрүчәнлеге
Эретелү температу¬
расы
Яну температурасы
Яктыруы
Организмга тәэсире
Кристаллик матдә
Бик каты түгел — пы¬
чак белән кисеп була (су
астында)
Саргылт төсмерле, төссез
Сарымсак исе килә
1,8 г/см3
Эреми
Яхшы эри
44 oC
40 °C. Вакланган хәлендә
гадәти температурада ук
яна башлый
Караңгыда яктыра
Көчле агу
Аморф яки кристаллик матдә
Kye кызыл
Иссез
2,3 г/см3
Эреми
Эреми
Нык җылытканда ак
фосфор парына әверелә
260 °C чамасы
Яктырмый
Агусыз
Кызыл фосфор да кислород белән нәкъ шулай реагирлаша, тик реакция
260 oC та гына башлана.
Фосфор шулай ук водород белән кушылма — фосфин PH3 хасил итә. Бу
кушылма үзенең формасы белән аммиакка охшый, ләкин аңа караганда
тотрыксызрак. Фосфор, күп металлар белән реагирлашып, фосфидлар,
мәсәлән кальций фосфиды Ca3P2 хасил итә.
I I Куллану. Кызыл фосфорны шырпы ясауда кулланалар. Аны, бик нык
вакланган пыяла һәм җилем белән бергә кушып, шырпы тартмасының ян
өслегенә сылыйлар. Составына калий хлораты KClO3 һәм күкерт кергән
шырпы башы ышкылганда кабынып китә:
0 +5 -1 +5
6Р + SKClO4 —» 5КС1 + ЗР,ОЯ
O ZD
+5 -1
Cl + 6е“ > Cl 5
0 +5
P - 5е —> P 6
Ак фосфорны сугыш вакытында яндыра торган бомбаларда һәм төтен
пәрдәсе булдыру өчен файдаланганнар.
Сорауларга җавап бирегез һәм 1—4 нче күнегүләрне үтәгез (70 нче бит).
62
л §22. Фосфор (V) оксиды. Ортофосфат кислотасы.
Ортофосфатлар
Фосфор (V) оксидының химик формуласын, гадәттә, P2O5 рәвешендә
сурәтлиләр, әмма чынбарлыкта аның составы катлаулырак һәм ул P4O10
формуласы белән күрсәтелә.
Фосфор (V) оксиды фосфор артыгы белән булган һавада янганда барлыкка
килә:
4Р + 5О2 —* 2Р2О5
Физик үзлекләре. Фосфор (V) оксиды — ак төстәге көпшәк порошок,
гадәттән тыш гигроскопик матдә. Шуңа күрә аны герметик ябык савытларда
сакларга кирәк.
Химик үзлекләре. Фосфор (V) оксиды химик үзлекләре белән башка
кислота оксидларына охшаш. Температурага бәйле рәвештә су белән реак¬
циясе төрлечә уза:
P2O5 + H2O » 2НРО3
метафосфат
кислотасы
P9O. + ЗН9О 2НЧРО.
A □ А о 4
ортофосфат
кислотасы
Куллану. Фосфор (V) оксидын сусызландыргыч матдә сыйфатында, мәсә¬
лән газларны киптерү өчен, киң кулланалар.
Ортофосфат кислотасы. Составында фосфор булган берничә кислота
билгеле. Аларның иң әһәмиятлесе — ортофосфат кислотасы H3PO4.
Табу. Ортофосфат кислотасын 1) фосфор (V) оксидын су белән җылыт¬
канда реакциягә кертеп:
P9O5 + ЗН9О 2НчР04
A Ә A O 4 7
2) табигый тозны — кальций ортофосфатын сульфат кислотасы
белән җылытканда реакциягә кертеп табалар:
Ca3(PO4)2 + 3H2SO4 SCaSO4 + 2Н3РО4
Физик үзлекләре. Ортофосфат кислотасы — каты, төссез, суда яхшы
эрүчән кристаллик матдә.
Химик үзлекләре. Ортофосфат кислотасының химик үзлекләре 17 нче
таблицада бирелгән.
Куллану. Ортофосфат кислотасын башлыча минераль ашламалар җитеш¬
терү өчен кулланалар (23 нче параграфны карагыз).
Ортофосфатлар. Ортофосфат кислотасы өч рәт тозлар хасил итә. Әгәр
металл атомнарын Me хәрефләре белән билгеләсәк, аның тозларының
составын гомуми рәвештә сурәтләп була (18 нче таблица).
63
17 нче таблица. Ортофосфат кислотасының химик үзлекләре
Башка кислоталар белән уртак үзлекләре
Специфик үзлекләре
1. Кислотаның судагы эремәсе ин¬
дикаторларның төсен үзгәртә. Дис¬
социация баскычлап уза:
H3PO4 » H+ + H2PO;
н2ро; ?=± н+ + Hpo4"
HPO; ?=> H+ + PO*"
Диссоциация беренче баскычта —
җиңел, өченче баскычта барыннан да
авыррак уза.
2. Стандарт электродлар потенциал¬
лары рәтендә водородка кадәр ур¬
лашкан металлар белән реагирлаша:
6Na + SH3PO4 * SNa3PO4 + ЗН2 f
3. Нигез оксидлары белән реагир¬
лаша:
ЗСаО + 2Н3РО4 > Ca3(PO4)2 + ЗН2О
4. Нигезләр һәм аммиак белән реа¬
гирлаша; кислота кирәгеннән артыг¬
рак алынган очракта әче тозлар хасил
була:
H3PO4 + 3NaOH > Na3PO4 + ЗН2О
H3PO4 + 2NH3 » (NH4)2HPO4
H3PO4 + NaOH * NaH2PO4 + H2O
5. Көчсез кислоталарның тозлары
белән реагирлаша:
2Н3РО4 + SNa2CO3 *
> SNa3PO4 + 3CO2t+ ЗН2О
1. Җылытканда акрынлап метафос¬
фат кислотасына әверелә:
SH3PO4H4P2O7 +H2O
«3*4 *1 Xi I Xi
дифосфат
кислотасы
H4P2O7 SHPO3 + H2O
метафосфат
кислотасы
2. Көмеш (I) нитраты эремәсе белән
тәэсир иткәндә сары утырым бар¬
лыкка килә:
H3PO4+3AgNO3 * Ag3PO41 + SHNO3
сары
утырым
ЗН+ + PO*" + 3Ag+ + 3N0; —*
* Ag3PO41 + ЗН+ + 3N0;
PO* + 3Ag+ > Ag3PO41
3. Ортофосфат кислотасының әһә¬
мияте хайваннар һәм үсемлекләрнең
тереклеге эшчэнлегендэ гаять зур.
Аның калдыклары аденозинтрифос-
фат кислотасы АТФ составына керә.
АТФ таркалганда күп микъдарда
энергия аерылып чыга (АТФ белән сез
гомуми биология һәм органик химия
курсында тулырак танышырсыз).
18 нче таблица. Ортофосфат ларның химик формулалары
Составына металл кергән ортофосфатлар
бер валентлы
ике валентлы
өч валентлы
Me3PO4
Me2HPO4
MeH2PO4
Ортофосфатлар Me3(PO4)2
Гидроортофосфатлар MeHPO4
Дигидроортофосфатлар Me(H2PO4)2
MePO4
Me2(HPO4)3
Me(H2PO4)3
64
Ортофосфатларның молекуласы составына бер валентлы металл
урынына аммоний ионы керергә мөмкин: (NH4)3PO4 — аммоний орто¬
фосфаты; (NH4)2HPO4— аммоний гидроортофосфаты; NH4H2PO4 — аммоний
д игидроортофосфаты.
Кальций һәм аммоний ортофосфатларын һәм гидроортофосфатларын —
ашламалар сыйфатында, натрий ортофосфатын һәм гидроортофосфатын
судан кальций тозларын утырымга төшерү өчен кулланалар.
5, 6 нчы күнегүләрне үтәгез. 1, 2 нче мәсьәләләрне чишегез (70 нче бит).
§23. Минераль ашламалар
Үсемлекләр составына 70 кә якын элемент керүе ачыкланган. Аларның
кайберләре — макроэлементлар — үсемлекләргә күп микъдарда кирәк;
икенчеләре — микроэлементлар — бик аз гына микъдарда да җитә.
1. Макроэлементлар — углерод, кислород, водород, азот, фосфор, кү¬
керт, магний, калий, кальций.
2. Микроэлементлар — тимер, марганец, бор, бакыр, цинк, молибден,
кобальт һ. б.
Иң кирәкле өч элемент — азот N, фосфор P һәм калий K — үсемлек¬
ләргә күп микъдарда таләп ителә. Шуңа күрә составына бу элементлар
кергән ашламаларны промышленность масштабларында табалар.
Азот аксымнар һәм нуклеин кислоталары составына керә. Ул җитеш¬
мәгәндә яшел масса ясалу тоткарлана, үсемлекләр начар үсә, ә яфраклары
аксыл яшелгә әйләнә һәм хәтта саргая да. Азотлы ашламалар үсемлекләргә
аеруча язын кирәк.
Фосфор үсемлек, хайван һәм гөмбә күзәнәкләренең төшләрендәге,
бактерияләрнең цитоплазмасындагы нуклеин кислоталары составына керә.
Фосфор бигрәк тә үсемлекләрнең репродуктив органнары (чәчәк, җимеш)
үскәндә кирәк.
Калий фотосинтез процессын тизләтә һәм углеводлар (шикәр чөгендерен¬
дә — шикәр, бәрәңгедә — крахмал) туплануга ярдәм итә. Кыяклы үсемлек¬
ләрне сабакка ныгыта һәм шуның белән аларның сөрлегүен булдырмый.
Тимер, марганец, бор һәм башка микроэлементлар үсемлекләр терекле¬
гендә билгеле бер рольне башкара. Әйтик, мәсәлән, бор микроэлементы
булганда үсемлекләр азот, фосфор һәм калийны яхшырак үзләштерә.
Бакыр, марганец һәм цинк оксидлашу-кайтарылу процессларын тизләтә
СЕЗ
БЕЛӘСЕЗМЕ?
1825 елда Көньяк Америкадан Гамбургка пароходта ките¬
релгән чили селитрасын (NaNO3) сатып алучы табылмый
һәм аны диңгезгә ташлыйлар.
65
Либих Юстус Немец химигы, академик. Агрохимиягә нигез
(1803—1873) салучыларның берсе. 1840 елда үсемлекләрнең
минераль туклануы теориясен тәкъдим итә.
Күп санлы анализлар нигезендә ул һәр үсем¬
леккә аның нормаль тереклек эшчәнлеге
өчен ун элемент: C, H, O, N, Ca1 K, P, S, Mg
һәм Fe кирәклеген ачыклый. Ул шулай ук бу
элементлардан иң әһәмиятлеләре өчесе — N, K1
P — икәнлеген билгели.
һәм шуның белән үсемлекләрнең үсүенә булышлык итә. Тимер хлорофилл
синтезында катнаша.
Макро- һәм микроэлементларны үсемлекләр туфрак эремәсеннән ионнар
(NH4, NO3, K+, H2PO4, Fe3+, Cu + һ.б.) рәвешендә үзләштерәләр.
Г =
Составында иң әһәмиятле өч туклыклы элемент N, P, K булган һәм
туфрак эремәсендә ионнарга диссоциацияләшергә сәләтле матдәләр
минераль ашламалар сыйфатында кулланыла.
L Z ___I
Күп кенә минераль ашламаларның (КС1, NaNO3, NH4NO3) составында
төп бер генә туклыклы элемент була. Андый ашламалар гади ашламалар
дип атала. Составында ике яки өч туклыклы элемент булган минераль
ашламалар, әлбәттә, яхшырак булып санала. Болары комплекслы ашла¬
малар дип атала. Минераль ашламаларны белеп файдалану авыл ху¬
җалыгы культураларыннан югары уңыш үстерергә мөмкинлек бирә.
Ләкин шуны истән чыгармаска кирәк: минераль ашламаларны, мәсәлән
нитратларны, туфракка артык дозада кертү аларның үсемлек органнарында
туплануына китерә. Андый үсемлекләрдән алган продуктлар туклану өчен
яраксыз була. Әһәмиятле минераль ашламалар турында мәгълүматлар
19 нчы таблицада бирелгән.
Авыл хуҗалыгының алга китүенә минераль ашламаларны җитештерүнең
үсүе һәм аларның сыйфатын яхшырту гына түгел, ә бәлки авыл хуҗалыгы
производствосын тулаем химияләштерү дә булышлык итә. Моңа минераль
ашламаларны, үсемлекләрне саклауның химик чараларын, азык өстәмәләрен
һәм консервантларны агротехник яктан дөрес файдаланып ирешелә.
Азот һәм аның иң әһәмиятле кушылмалары арасындагы генетик бәй¬
ләнеш 5 нче схемада күрсәтелгән.
Фосфор һәм аның иң әһәмиятле кушылмалары арасындагы генетик
бәйләнеш 6 нчы схемада күрсәтелгән.
7—11 нче сорауларга җавап бирегез. 3, 4 нче мәсьәләләрне чишегез (70 нче бит).
66
19 нчы таблица. Минераль ашламалар
Ашламаның
исеме
Химик составы
Төсе һәм тышкы
күренеше
Промышленностьта табу һәм
табигатьтә очравы
Натрий
нитраты
(натрий
селитрасы)
Калий
нитраты
(калий
селитрасы)
Аммоний
нитраты
(аммиак
селитрасы)
Аммоний
сульфаты
1. Аз
NaNO3
(15—16% N)
KNO3
(12,5—13% N)
NH4NO3
(15—16% N)
(NH4)2SO4
(20,5—21%N)
этлы ашлама
Ак яки соры
төстәге,
гигроскопик
үзлекле крис¬
таллик матдә
(соры төсне
катышмалары
бирә)
Ак төстәге
кристаллик
матдә
Ак төстәге
кристаллик,
гаять гигроско¬
пик матдә
«
Ак төстәге (ка¬
тышмалары ар¬
касында соры
яки яшькелт)
кристаллик по¬
рошок, гигро¬
скопиклыгы
түбән
лар
Нитрат кислотасын җитеш¬
тергәндә табалар. Суда йотыл¬
маган нитроз газларны (N0,
NO2) сода эремәләре аша уз¬
дыралар:
Na2CO3 + 2NO2 *
» NaNO3+ NaNO2+ CO21
Натрий нитриты натрий
нитратына оксидлаша.
KNO3HeH1 чагыштырмача
зур булмаган ятмалары Урта
Азиядә бар. Аны промыш¬
ленностьта түбәндәгечә таба¬
лар:
IOO 0C
KCl+ NaNO3
NaCl + KNO3
NaClHbiH; аз эрүчәнлеге ар¬
касында тигезләнешне уңга
авыштырып була.
48—60% лы нитрат кисло¬
тасын аммиак белән нейт¬
ральләштереп табалар:
NH3 + HNO3 » NH4NO4
о O 4 O
Табылган эремәне куертып,
махсус башняларда кристал¬
лаштыралар.
Аммиак белән сульфат кис¬
лотасы тәэсир итешкәндә та¬
была:
2NH3 + H2SO4 ^(NH4)2SO4
67
Дәвамы
Ашламаның
исеме
Химик составы
Төсе һәм тышкы
күренеше
Промышленностьта табу һәм
табигатьтә очравы
Карбамид
Гади
суперфосфат
Икеле
суперфосфат
Калий
хлориды
Аммоний
дигидроорто-
фосфаты
Аммоний
гидроорто¬
фосфаты
CO(NH2)2
(46% N)
2. Фосс
Ca(H2PO4)9 • 2Н9О
CaSO4 • 2Н2О
(20% ка кадәр
P2O5)
Ca(H2PO4)2 H2O
(40% P2O5)
3. Кал
KCl
(52—60% K2O)
4 . Kai
NH4H2PO4
(катышмалар
белән)
(NH4)2 HPO4
(NH4)2 SO4 һәм
башка катыш¬
малар белән
Ак төстәге вак
кристаллик,
кайчак бөртек¬
ле гигроскопик
матдә
)орлы ашлан
Соры төстәге
вак бөртекле
порошок
Гади суперфос¬
фатка охшаш
ийлы ашлам
Ак төстәге вак
кристаллик
матдә
’наш ашлама
Ак төстәге (ка¬
тышмалары
аркасында сор¬
гылт) кристал¬
лик порошок
Аммоний
дигидроор-
тофосфаты
шикелле
Углерод (IV) оксиды белән
аммиак реакциягә кергәндә
(югары басымда һәм югары
температурада) табыла:
CO2 + 2NH3 >
♦ CO(NH2)2 + H2O
[алар
Фосфоритлар яки апатит¬
ларга сульфат кислотасы бе¬
лән тәэсир итеп табалар:
Ca3(PO4)2 + 2H2SO4 *
—* Ca(H2PO4)2 + 2CaSO4
Җитештерү ике стадиядә
алып барыла:
а) Ca3(PO4)2 + 3H2SO4 *
* 2Н3РО4 + 3CaSO4
CaSO4 төпкә утыра, һәм
аны фильтрлап аералар;
б) Ca3(PO4)2+ 4Н3РО4 >
* SCa(H2PO4)2
алар
Калий хлориды табигатьтә
сильвинит минералы
(NaCl • KCl) рәвешендә очрый.
лар
Ортофосфат кислотасы бе¬
лән аммиак реакциягә кер¬
гәндә табыла:
NH3 + H3PO4 > NH4H9PO4
о о 4 4 2 4
Аммоний дигидроортофос-
фатын тапкан кебек табалар:
2NH3 + H3PO4 >
о о 4
— (NH4)2HPO4
68
5 нче схема
нчы схема
СЕЗ
БЕЛӘСЕЗМЕ?
Суперфосфат һәм преципитат, калийлы һәм азотлы аш¬
ламаларга караганда, суда начаррак эри, шуңа күрә
аларны басуга көзен туфракны эшкәрткәнгә кадәр сибеп
чыгалар.
Бәрәңге җиренә калийны кирәкле микъдарда таркалган
тирес белән бергә гектарга 35—40 т кертәләр. Шикәр
чөгендере җиренә исә калий хлоридын вегетация (үсү)
чорында берничә тапкыр кертү яхшы.
69
1. Табигатьтә азот — кушылмаларда
һәм ирекле хәлдә, ә фосфор кушылмаларда
гына очрый. Бу нәрсә белән аңлатыла?
£. Фосфор түбәндәге кушылмаларның
кайсысында уңай оксидлашу дәрәҗәсе
күрсәтми:
1) P2O5 3) H3P
2) Pgl5 3) P2O3
B. Ак Һәм кызыл фосфорның үзлек¬
ләрен тасвирлагыз. Ак һәм кызыл фосфор
бер үк элементның үзгәргән төрләре
буЯуын нинди тәҗрибәләр белән расларга
мөмкин?
4. Фосфор түбәндәге матдәләрнең кай¬
сысы белән реакциягә керми:
1) кислород белән 3) су белән
2) водород белән 4) кальций белән?
5. Нитрат кислотасы фосфорга тәэсир
иткәндә, ортофосфат кислотасы хасил
була. Әгәр реакциядә су катнашуы һәм
азот (II) оксиды аерылып чыгуы билгеле
булса, әлеге реакциянең тигезләмәсен
языгыз.
6. Ортофосфат кислотасының а) каль¬
ций белән; б) кальций оксиды белән;
в) кальций гидроксиды белән артыграк
һәм җитәрлек итеп алынмаган очраклар
өчен реакцияләрнең молекуляр һәм ионлы
тигезләмәләрен төзегез. Формулалар
астына исемнәрен язып куегыз.
7. Үсемлекләр тереклегендә төп тук¬
лыклы элементларның (N, К, Р) ролен
тасвирлап бирегез.
8. Иң әһәмиятле азотлы ашламаларны
санап чыгыгыз. Бу ашламаларны җитеш¬
терүнең нигезендә яткан реакцияләрнең
тигезләмәләрен төзегез.
9. Иң әһәмиятле фосфорлы ашлама¬
ларны табуда кулланыла торган химик
реакцияләрнең тигезләмәләрен языгыз.
10. Авыл хуҗалыгы культуралары¬
ның уңышын арттыруда химиянең роле
нинди?
11. 5 һәм 6 нчы схемаларга туры ки¬
тереп, реакцияләрнең тигезләмәләрен
төзегез.
• 1. 20% катышмалары булган 31 т
кальций ортофосфатыннан күпме орто¬
фосфат кислотасы табып була?
2. Әгәр нитрат кислотасының 200 г
эремәсе 4 г натрий гидроксиды белән
тулысынча реакциягә кереп бетсә, эремә¬
дәге нитрат кислотасының масса өлешен
(%) исәпләп чыгарыгыз.
3. 2 моль натрий карбонаты белән
реакциягә керү өчен, кирәкле нитрат
кислотасы эремәсенең массасын (анда
НҺЮ3нең масса өлеше 14% ка тигез)
исәпләп чыгарыгыз.
4. Н3РО4нең масса өлеше 50% тәш¬
кил иткән 49 кг массалы ортофосфат
кислотасы эремәсен кальций гидроксиды
белән нейтральләштергәннәр. Хасил
булган кальций фосфатының массасын
билгеләгез.
СЕЗ
БЕЛӘСЕЗМЕ?
Үсемлекләрнең яңа, шул исәптән генетик модификация-
ләнгән сортларын китереп чыгару, агротехниканың камил¬
ләшкән ысулларыннан файдалану ясалма ашламалар кул¬
лану кирәклеген кире какмый. Һәр җыеп алынган уңыштан
соң кырлар шактый микъдарда туклыклы матдәләрен
югалта: үсемлекләр бу матдәләрне туфрактан күп микъ¬
дарда ала, һәм алар кырдан җыелган уңыш белән китә.
70
Лаборатор тәҗрибәләр
7. Аммоний тозларының селтеләр белән үзара тәэсир итешүе (аммоний
тозларын танып белү)
1. Бер пробиркага бераз аммоний сульфаты (NH4)2SO4 кристаллары, икенчесенә
аммоний нитраты NH4NO3 салыгыз. Hep ике пробиркага 1—2 шәр мл натрий гидроксиды
эремәсе агызыгыз һәм җиңелчә җылытыгыз.
2. Аерылып чыккан газ агымына дистиллирланган суда чылатылган кызыл лакмус
кәгазен урнаштырыгыз.
Биремнәр. 1.Бу тәҗрибәдә нинди газ аерылып чыга? Тиешле реакцияләрнең
тигезләмәләрен языгыз. 2. Аммоний тозларын башка тозлардан ничек аерып була?
8. Азотлы һәм фосфорлы ашламалар белән танышу
Нитратларны танып белү. Пробиркага 0,5 г натрий нитраты (яисә башка нитрат)
салыгыз, тоз күмелерлек итеп, куертылган сульфат кислотасы агызыгыз, шуңа аз гына
бакыр йомычкасы өстәгез һәм җылытыгыз.
Биремнәр. 1. Нинди газ аерылып чыга? 2. Ни өчен пробиркадагы эремә зәңгәр
төскә керә? 3. Реакцияләрнең тигезләмәләрен төзегез һәм тиешле элементларның
оксидлашу дәрәҗәләре үзгәрүен күрсәтегез. 4. Оксидлашу-кайтарылу реакциясендә
нәрсә оксидлаша һәм нәрсә кайтарыла? 5. Нитрат-ионнар һәм аммоний ионнары булган
азотлы ашламаларны ничек танып белергә мөмкин?
Фосфорлы минераль ашламаларны танып белү, а) Суда эрүчәнлекләренә карап
ортофосфатларны, гидроортофосфатларны һәм дигидроортофосфатларны танып белү.
Өч пробиркага (1 әр см3) кальций ортофосфаты, кальций гидроортофосфаты һәм
дигидроортофосфаты салыгыз. Аларга бераз су агызып болгатыгыз. Кальций дигид-
роортофосфаты — барыннан да яхшырак, кальций гидроортофосфаты начаррак эри.
Кальций ортофосфаты бөтенләй эреми.
б) Ортофосфат-ионлы минераль ашламаларны танып белү. PO4 ионнары булган
суперфосфат яки башка минераль ашлама эремәсенә натрий ацетатының 10% лы
эремәсен һәм бераз көмеш (I) нитраты эремәсен өстәгез.
Биремнәр. 1. PO^, HPO4 һәм H2PO4 ионнары булган фосфорлы минераль
ашламаларны ничек танып белергә була? PO4- ионын билгеләү өчен реактив булып нәрсә
тора? Тиешле реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган
ионлы рәвештә языгыз.
СЕЗ
БЕЛӘСЕЗМЕ?
Тирестәге азотның тәэсир итү көчен саклау өчен, бу аш¬
ламаны өемнәргә өеп, вакланган торф катламы белән
15—20 см калынлыкта каплыйлар. Җиргә тигез катлам
итеп таратылган тиресне культиватор яки башка меха¬
низмнар ярдәмендә туфракка күмдерәләр. Уйлагыз әле:
ни өчен бу шулай эшләнә?
Арыштан яхшы уңыш алу өчен, иген басуының һәр гекта¬
рына 40—50 т тирес кертергә кирәк.
Ел саен 1 гектарга 80—100 т исәбеннән тирес керткән
очракта алмагачлар ел да уңыш биреп килә.
71
3 нче практик эш
Аммиак табу һәм аның белән тәҗрибәләр үткәрү. Аммиакның судагы
эремәсенең үзлекләре белән танышу
Аммиак табу һәм аны суда эретү. 1. Фарфор килегә чама белән тигез күләмдә
итеп аммоний хлориды NH4CI кристаллары һәм кальций гидроксиды Ca(OH)2 порошогын
(дымлырак известь белән тәҗрибә яхшырак уза) салып, яхшылап болгатыгыз. Әзер
катнашманы пробирканың 1/3 е булырлык итеп салыгыз. Пробирканы газүткәргеч
көпшәле бөке белән каплап, көпшәнең очын авызы белән аска каратып штативка
беркетелгән пробиркага кертегез (19 нчы рәсем). Пробиркадагы катнашманы җылы¬
тыгыз.
2. Газ исе сизелә башлауга (бик саклык белән иснәргә!), газ тулган пробирканы,
әйләндермичә, бөке белән каплагыз һәм сулы савытка төшереп, бөкесен алыгыз.
3. Пробиркага су тулгач, авызын бөке белән каплап, аны судан алыгыз. Табылган
эремәгә кызыл лакмус кәгазе төшерегез — ул зәңгәр төскә керер. Аннан соң эремәгә
берничә тамчы фенолфталеин эремәсе тамызыгыз.
Биремнәр. 1. Сезнең күзәтүләрегез буенча нинди газ чыгуы турында әйтеп
була? Тиешле реакция тигезләмәсен языгыз. 2. Табылган газ суда эрегәндә нинди
матдә хасил була? Бу нәтиҗәне нинди күзәтүләр раслый? Әлеге реакция тигезләмәсен
языгыз.
Аммиакның кислородта януы. Газ табу өчен прибор җыегыз. Пробиркага аммоний
хлориды һәм кальций гидроксиды катнашмасы салып, җиңелчә җылытыгыз. Газүткәргеч
көпшәне кислородлы пыяла цилиндрга кертегез һәм чыра ярдәмендә газга ут кабы¬
зыгыз (20 нче рәсем).
Биремнәр. 1. Аммиак янганда нинди матдәләр хасил була? Аммиак кислородта
янганда ирекле азот аерылып чыгуы билгеле булса, тиешле реакция тигезләмәсен
языгыз. 2. Тигезләмәдә оксидлаштыргычны — бер сызык белән, ә кайтаргычны ике
сызык белән күрсәтегез.
Аммиак белән кислоталарның үзара тәэсир итешүе. Алдагы тәҗрибәдәге кебек
прибор җыегыз. Пробиркага аммоний хлориды һәм кальций гидроксиды катнашмасы
салып, җиңелчә җылытыгыз. Газүткәргеч көпшәне 1 әр мл куертылган нитрат, хлорид
һәм сульфат кислоталары салынган пробиркаларга бер-бер артлы кертегез. Газүткәргеч
көпшәнең очы кислота өслегеннән 5—6 мм ераклыкта булырга тиеш.
19 нчы рәсем. Аммиак табу
20 нче рәсем. Аммиакның
кислородта януы
72
Биремнәр. 1. «Ак төтен» барлыкка килү нәрсә белән аңлатыла? Тиешле реак¬
цияләрнең тигезләмәләрен языгыз. 2. Ни өчен газүткәргеч көпшәнең очын кислотага
батырырга ярамый, ә бары тик якынайтырга гына ярый?
Аммиакның судагы эремәсенең үзлекләре. Ике пробиркага аммиакның судагы
эремәсен агызыгыз. Аларның берсенә кызыл лакмус кәгазе төшерегез. Икенче про¬
биркага берничә тамчы фенолфталеин эремәсе, аннан соң бераз сыегайтылган хлорид
кислотасы өстәгез.
Биремнәр. 1. Аммиакның индикаторларга тәэсире аның судагы эремәсенең
нинди үзлекләрен раслый? Моны электролитик диссоциация карашыннан чыгып ничек
аңлатып була? 2. Аммиакның судагы эремәсенә кислота белән тәэсир иткәндә нәрсә
күзәтелә? 3. Тиешле химик реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыс¬
картылган ионлы рәвештә төзегез.
U 4 нче практик эш
Минераль ашламаларны танып белү. Пробиркаларда түбәндәге минераль
ашламаларның үрнәкләре бирелгән: 1) суперфосфат, аммоний нитраты, аммоний
сульфаты; 2) аммоний хлориды, натрий нитраты, калий хлориды. 20 нче таблицадан
файдаланып, кайсы пробиркада нинди ашлама икәнен белегез. Химик реакцияләрнең
тигезләмәләрен төзегез. (Судагы эремәдә барган реакцияләрнең тигезләмәләрен ион¬
лы һәм кыскартылган ионлы рәвештә төзегез.)
Эксперименталь мәсьәләләр чишү. 1. Аммиак табыгыз һәм аның өчен характерлы
химик реакцияләрне ясагыз.
2. Ике төрле ысул белән бакыр (II) нитратын табыгыз.
3. Аммоний сульфатын, аммоний нитратын, аммоний хлоридын һәм аммофосны
известь белән катнаштырырга ярамавын тәҗрибә юлы белән раслагыз. Тиешле
аңлатмалар китерегез.
4. Пробиркаларда кристаллик матдәләр: натрий сульфаты, аммоний хлориды
һәм натрий нитраты бирелгән. Бу матдәләрнең һәрберсе кайсы пробиркада икәнен
билгеләгез.
5. Бер пробиркада — ортофосфат кислотасы эремәсе, икенчесендә сульфат
кислотасы эремәсе бирелгән. Кайсы пробиркада нинди кислота эремәсе икәнен
билгеләгез.
6. Бер пробиркада — натрий ортофосфаты, икенчесендә кальций ортофосфаты
бирелгән. Кайсы пробиркада нинди тоз икәнен билгеләгез.
20 н ч е таблица. Минераль
Ашламаның
исеме
Тышкы күренеше
Суда
эрүчәнлеге
сульфат кислотасы һәм
бакыр белән
1. Аммоний
нитраты
Ак төстәге кристаллик
масса
Яхшы
Көрән газ аерылып чыга
2. Аммоний
хлориды
Ак төстәге кристаллик
масса
Яхшы
—
3. Калий
нитраты
Ачык соры төстәге вак
кристаллар
Яхшы
Көрән газ аерылып чыга
4. Аммоний
сульфаты
Төссез эре кристаллар
Яхшы
Көрән газ аерылып
чыкмый
5. Супер¬
фосфат
Ачык соры порошок яки
гранула
Начар
Көрән газ аерылып
чыкмый
6. Сильви¬
нит
Тозда алсу төстәге
кристаллар бар
Яхшы
Көрән газ аерылып
чыкмый
7. Калий
хлориды
Төссез кристаллар
Яхшы
Көрән газ аерылып
чыкмый
74
ашламаларны танып белү
Бирелгән тоз эремәсенең тәэсир итешүе
барий хлориды
эремәсе һәм серкә
кислотасы белән
селте эремәсе
белән (җылыт¬
канда)
көмеш (I) нитра¬
ты эремәсе белән
Ялкынның төсе
—
Аммиак исе
килә
—
Сары төстә (катышма¬
лардан)
—
Аммиак исе
килә
Ак утырым
төшә
Сары төстә (катышма¬
лардан)
—
Аммиак исе
килми
Эремәнең аз
гына болган¬
чыклануы
күзәтелә
Зәңгәр пыяла аша ка¬
раганда ялкын шәмәхә
төстә
Серкә кислотасын¬
да эреми торган ак
төстәге утырым
хасил була
Аммиак
аерылып
чыга
Аз гына уты¬
рым хасил
була (катышма¬
лардан)
Серкә кислотасында
өлешчә эри торган
ак төстәге утырым
хасил була
Аммиак исе
килми
Сары утырым
төшә
Сары төстә (катышма¬
лардан)
—
Аммиак исе
килми
Ак утырым
төшә
Сары төстә. Зәңгәр
пыяла аша караганда
ялкын шәмәхә төстә
—
Аммиак исе
килми
Ак утырым
төшә
Сары төстә. Зәңгәр
пыяла аша караганда
ялкын шәмәхә төстә
75
Углерод һәм кремний
-ШММННММ» MM
IV БҮЛЕК
§ 24. Химик элементларның периодик таблицасында
углерод һәм кремнийның урыны, аларның атом
төзелеше
Д. И. Менделеевның периодик таблицасында IV төркемнең төп төркемчәсе
(IVA-төркем) элементлары — углерод С, кремний Si, германий Ge, аккур¬
гаш Sn һәм кургаш Pb. Д. И. Менделеев тарафыннан алдан ук әйтелгән гер¬
маний хәзерге вакытта ярымүткәргеч сыйфатында кулланылыш тапты.
IVA-төркем элементлары арасында барлык тере организмнар составына
кергән углеродның һәм Җир кабыгының иң әһәмиятле элементы — крем¬
нийның тоткан урыны гаять зур. Бу элементлар белән тулырак таны¬
шырбыз. Аларның атомнарының төзелеше 21 нче таблицада бирелгән.
21 нче таблица. Углерод һәм кремний атомнары
төзелешенең схемалары
Химик билгесе
Электроннарның энергетик
дәрәҗәләрдә урнашуы
A Электронлы формуласы
C
Si
+6С 2е~, 4е~
+14Si 2е~, 8е~, 4е“
Is2 I 2s22p2
Is2 I 2s22p6 I 3s23p2
Электроннарның орбитальләрдә урнашуы
+6с
3s2
Is2
2s2
2р2
+i4Si...
Зр2
3d°
Углерод һәм кремний атомнары төзелешенең схемаларыннан күрен¬
гәнчә, бу элементларның тышкы энергетик дәрәҗәсендә дүрт электрон
урнашкан. Шуңа күрә углерод һәм кремнийның, оксидларында CO2 һәм
SiO2, водородлы кушылмаларында CH4 (метан) һәм SiH4 (силан), оксидлашу
76
дәрәҗәсе дүрткә тигез. Кислородлы кушылмаларында бу элементлар уңай
оксидлашу дәрәҗәсен ала (кислород электртискәрерәк элемент); водородлы
кушылмаларында углерод һәм кремний тискәре оксидлашу дәрәҗәсен ала:
+4-2 +4-2 -4+1 -4+1
CO2, SiO2, CH4, SiH4.
▲ 21 нче таблицадан күренгәнчә, углерод һәм кремний атомнары¬
ның икешәр парлашмаган электроннары бар. Углерод һәм кремнийның
+2 оксидлашу дәрәҗәсенә дә ия була алуы шуның белән аңлатыла. Мәсәлән,
+2-2
мондый оксидлашу дәрәҗәсен углерод CO кушылмасында күрсәтә. Энергия
килеп торганда s-электроннарның берсе буш р-орбитальгә күчәргә мөмкин.
Ул вакытта бу элементларның атомнарында дүрт парлашмаган электрон
ясала:
2р2
Углерод атомында нормаль халәттә
электроннарның урнашуы
Энергия килеп торганда пар элект¬
роннарның аерылу процессы
2s1 2р3
Углерод атомында (тәэсирләнгән халәттә)
пар электроннарның аерылуы нәтиҗәсендә
электроннарның урнашуы
Мондый процесс углерод +4 һәм -4 оксидлашу дәрәҗәләрен күрсәткән
барлык кушылмалар хасил булганда күзәтелә.
Сорауларга җавап бирегез һәм 1—3 нче күнегүләрне үтәгез (90 нчы бит).
§ 25. Углерод
Уку материалын кабатлагыз (8 нче сыйныф, § 42).
□ Табигатьтә углерод ирекле хәлдә дә, кушылмаларда да була. Ирекле
хәлдә ул графит һәм алмаз рәвешендә очрый. Графит — шактый еш, алмаз
бик сирәк очрый. Углеродлы кушылмалар гаять киң таралган: барлык тере
организмнарда, шулай ук ташкүмер, торф, нефтьтә һ. б. да углерод бар.
Углерод күп кенә неорганик матдәләр (известьташ, акбур, мәрмәр, доломит,
углерод (IV) оксиды һ. б.) составына керә.
77
21 иче рәсем. Углерод атомында S- һәм р- электроннар орбитальләренең тигезләшү
(гибридлашу) схемасы: 1 — бер S- һәм өч р-электрон орбитальләренең үзара тәэсир
итешүе; 2 — дүрт гибрид орбитальләр хасил булу; 3 — гибрид электрон орбитальләренең
пространствода урнашуы
Кристаллик челтәрләрнең төзелеше. Аллотропия. Графит һәм алмазның
кристаллик челтәрләре төзелешен без инде 8 нче сыйныфта (§ 42) тикшергән
идек.
A Энергия килеп тору нәтиҗәсендә, углерод атомында пар электроннар¬
ның аерылуы һәм дүрт парлашмаган электрон: бер S- һәм өч р-электрон
хасил булуы күзәтелә. Химик бәйләнешләр ясалганда электрон орби¬
тальләре бертөрле форманы ала дип әйтү кабул ителгән (21 нче рәсем).
Бер үк формадагы сузынкы электрон орбитальләре, үзара бер-берсеннән
этелеп, пространствода шундый торыш алалар ки, аларның күчәрлә¬
ре тетраэдр түбәсенә юнәлгән булып чыга. Бу орбитальләрнең түбәләре
башка атомнарның электрон орбитальләре белән аралашырга мөмкин.
Ул, мәсәлән, тетраэдр төзелешле метан молекуласында күзәтелә. Әгәр
дә бу орбитальләрнең түбәләре углерод атомнарының шундый ук башка
СЕЗ
БЕЛӘСЕЗМЕ?
Инглиз химигы С. Теннант 1796 елда шундый тәҗрибә
ясый: бертөрле микъдардагы алмаз һәм күмерне яндыра.
Ул бу вакытта бертөрле күләмдә углерод (IV) оксиды
хасил булуына ышана. Моның белән алмаз углеродның
аллотропик үзгәргән төре булуы раслана.
Билгеле булган барлык алмазларның иң зурысы —
«Кулинан» 1905 елда Көньяк Африкада табыла. Аның
массасы 621 г, ә зурлыгы 10 х 6,5 х 5 см. Илебезнең алмаз
фондында дөнья күләмендәге иң зур һәм иң матур алмаз¬
ларның берсе — «Орлов» (37,92 г) саклана.
78
орбитальләре белән аралашса, алар арасында 109°28' почмак ясап ковалент
бәйләнешләр барлыкка килә һәм алмазга хас булган атомлы кристаллик
челтәр хасил була. Графитка икенче формадагы кристаллик челтәр хас. Бу
шуның белән аңлатыла: углерод атомнары арасында ковалент о-бәйләнеш
ясалуда өч валентлык электроны катнаша, ә дүртенче электрон тупланмаган
л-бәйләнеш ясалуда катнаша. Бу электрон хәрәкәтчәнрәк һәм графитның
электр үткәрүчәнлеге дә шуның белән аңлатыла.
Алмаз һәм графит — бу углеродның ике аллотропик үзгәрешле төрләре.
Сез алмазның — бик каты, ә графитның йомшак матдә булуын инде беләсез.
Шулай булгач, мондый сорау туарга мөмкин: углерод элементының бөтенләй
капма-каршы үзлекле матдәләр — графит һәм алмаз хасил итә алуын ничек
аңлатырга? Алмазның бик каты булуы аның кристаллик челтәрендәге һәр
атом үз тирәсендәге тигез ераклыкта урнашкан башка дүрт атом белән
ковалент бәйләнешләр аша тоташудан килә. Бу бәйләнешләр барлык юнә¬
лешләрдә бер үк төрле нык. Графитта исә атомнар катламлап урнашкан
сыман һәм төрле яссылыкта урнашкан атомнар арасындагы ераклык, бер
үк яссылыкта яткан атомнар арасындагы ераклыкка караганда, шактый
зур. Графитның физик үзлекләре алмазның физик үзлекләреннән кискен
аерылып торуы шуның белән аңлатыла да.
Графит һәм алмазның бер үк элемент — углерод атомнарыннан торуына
ал арны яндырып карап ышанырга мөмкин. Яну нәтиҗәсендә углерод (IV)
оксиды гына хасил була. Шулай ук билгеле бер шартларда алмазның —
графитка, ә графитның алмазга әверелүе расланган. Әйтик, мәсәлән, ал¬
мазны һава кертмичә IOOOoC тан югарырак температурада җылытканда,
ул акрынлап графитка әверелә. Киресенчә, әгәр графитны катализатор
катнашында 1200 дән алып 1600 oC ка кадәр температурада IO4 МПа басым
астында җылыталар икән, ул алмазга әверелә. Бу — ясалма алмазлар табу
ысулы.
Физик үзлекләре. Алмаз һәм графитның физик үзлекләре аларның
төзелешләре белән аңлатыла, аларның төп үзлекләре 22 нче таблицада
күрсәтелгән.
22 нче таблица. Алмаз һәм графитның физик үзлекләре
Алмаз
Графит
Бик каты
Төссез, үтә күренмәле
Электр тогын үткәрми
Йомшак. Аерым вак пластинкаларга җиңел
аерыла
Үтә күренмәле түгел, металл ялтыравыклы
соры төстә
Электр тогын чагыштырмача яхшы үткәрә
79
Сб0 C70
22 нче рәсем. Фуллереннар (C60 һәм C70) молекулалары
Углеродның, алмаз һәм графиттан тыш, башка аллотропии төрләре дә
бар: болар — карбин һәм фуллереннар.
Карбин сызыкча төзелешле, анда углерод атомнары чылбырда я икеле
бәйләнешләр (=C=C=C=C=C=) белән, я чиратлашкан өчле һәм берле
бәйләнешләр (—C-C—C=C—) белән тоташкан. Карбин үзенә бертөрле
үзлеккә — кеше организмы тукымалары белән үзара ярашу үзлегенә
ия. Аның бу үзлегеннән медицинада файдаланалар: карбин япмалы
җепселләрдән ясалма кан тамырлары ясыйлар.
XX гасырның 80 нче еллары ахырында углеродның тагын бер ал¬
лотропии төре — фуллерит барлыгы ачыклана. Графит һәм алмаздан
аермалы буларак, фуллерит молекуляр кристаллик челтәргә ия. Андый
челтәрнең төеннәрендә углерод атомнарыннан торган куыш сферик яки
эллипссыман молекулалар — фуллерен молекулалары урнаша. Аеруча C60
һәм C70 молекулалары тотрыклы (22 нче рәсем). Фуллерит, графит кебек,
кулга йомшак һәм шома тоела, органик эреткечләрдә ачык төстәге эремәләр
барлыкка китереп эри.
Углерод атомнары шулай ук куыш көпшәләр — нанокөпшэлэр ясарга
мөмкин. Хәзерге вакытта фуллереннар һәм нанокөпшэлэр, киләчәк
технологияләр өчен нигез сыйфатында, физиклар, химиклар, энергетиклар,
материал белгечләре, медик һәм биологлар игътибарын җәлеп итә.
Адсорбция. Агач күмере, һава кертмичә җылытканнан соң, үзагачның
вак куышлы төзелешен саклый (23 нче рәсем) һәм зур өслеккә ия була.
СЕЗ
БЕЛӘСЕЗМЕ?
Фуллереннар чит ил галимнәре Ричард Смолли һәм Ро¬
берт Керл (АКШ) һәм Гарольд Крото (Бөекбритания) тара¬
фыннан ачыла. Бу ачышлары өчен алар 1996 елда Нобель
премиясе белән бүләкләнә.
Углеродның яңа аллотропик төрен беренче булып ачучылар
аны, футбол тубына охшатып, биш- һәм алтыпочмаклыктан
торган гөмбәзсыман түбә конструкциясен («геодезик гөм¬
бәз») эшләгән Америка архитекторы Ричард Бакминстер
Фуллер хөрмәтенә фуллерен дип атыйлар.
80
Шуның аркасында аның үзенә бертөрле үзлекләре бар.
Бу үзлекләр белән тәҗрибәдә танышырга мөмкин.
Әгәр көрән газ — азот (IV) оксиды тутырылган
колбага күмер кисәкләре төшерсәң, газ төссезләнә.
Лакмус эремәсенә яки язу карасына күмер порошогы
салып болгатканда да шундый ук хәл күзәтелә. Бу
тәҗрибәләр агач күмеренең гадәти шартларда үзенә
төрле газларны һәм эрегән матдәләрне йотуын
раслый. Газның чагыштырма молекуляр массасы
никадәр зур булса, ул шулкадәр яхшырак йотыла.
Җылытканда кире процесс күзәтелә.
23 иче рәсем.
Үзагачның вак
куышлы төзелеше
Газсыман яки эрегән матдәләрнең каты матдә өслеге тарафыннан
йотылуы — адсорбция, ә йотылган матдәләрнең аерылып чыгуы десорб¬
ция дип атала.
Күмер никадәр ваккуышлырак булса, аның өслеге шулкадәр зуррак
була һәм адсорбция шулкадәр яхшырак уза. Йоту сәләтен арттыру өчен,
күмер аша су пары уздырып, аны кабат җылыталар. Бу вакытта күмердәге
куышлар пиролиз продуктларының калдыкларыннан чистарып кала.
Шулай активлаштырылган күмер табалар.
Химик үзлекләре. Гадәттәге шартларда алмаз, графит һәм агач
күмерендәге углерод — химик инерт матдәләр, әмма югары температура¬
ларда алар активлаша. Химик реакцияләрдә углерод кайтаргыч үзлекләрен
дә, оксидлаштыргыч үзлекләрен дә күрсәтергә мөмкин. Углерод катнашында
уза торган характерлы реакцияләр 23 нче таблицада бирелгән.
23 нче таблица. Углеродның химик үзлекләре
Кайтару үзлекләре
Оксидлаштыру үзлекләре
F4eU
0 0 t +4-2
C + O2 = CO2 + 402 кДж
0 +2-2 +4-2 0
C + 2CuO —U CO2 + 2Си
F4eU
C + CO2 -U 2СО
F2eU
0+1 +2 0
C + H2O -Uco + H2
синтез-газ
г4м
0 0 . -4+1
с + 2¾-Uch4
_ метан
г2<п
0 0 +2-1
2С + Ca—UCaC2
кальций
карбиды
F12eT
0 0 +3-4
зс + 4А1—Uaic
4 э
алюминий
карбиды
81
3 4 5 6 7 8
24 нче рәсем. Углеродның кулланылышы: 1 — ясалма алмаз табуда; 2 — медицинада;
3 — аяк киемнәре кремы составына керә; 4 — адсорбент; 5 — шикәр, 6 — кара буяу,
7 — метил спирты, 8 — синтетик бензин, 9 — резин, 10 — кальций карбиды табуда
Углерод водород белән углеводородлар дип йөртелә торган кушылмалар
хасил итә. Углеводородлар органик химия курсында өйрәнелә. Аларның
иң гади вәкиле — метан CH4.
Углеродның кулланылышы схема рәвешендә 24 нче рәсемдә күрсә¬
телгән.
Сорауларга җавап бирегез һәм 4—9 нчы күнегүләрне үтәгез (90 нчы бит).
§ 26. Углерод (II) оксиды
A Молекула төзелеше. Ковалент бәйләнеп!ләр турындагы күзаллауларга
нигезләнеп, углерод (II) оксидының электронлы һәм структур формулаларын
болай сурәтләп булыр иде (углерод атомы электроннары йолдызчыклар
белән тамгаланган):
:C:;Q C=O
Ләкин болай сурәтләгәндә углерод атомы тирәсендә алты электрон
гына урнаша. Билгеле булганча, атомнар кушылмаларда тотрыклы сигез
электронлы структура алырга омтылалар. Хәзер исә углерод (II) оксиды
молекуласында, азот молекуласындагы кебек (52 нче бит), өчле бәйләнеш
барлыгы расланды. Өченче ковалент бәйләнеш, фараз итүләренчә, донорлы-
акцепторлы механизм буенча барлыкка килә. Күрәсең, бу болай була:
кислород атомы ирекле электроннарының бер парын углерод атомына
бирә, ягъни кислород атомы — донор, ә углерод атомы акцептор була. Бу
очракта углерод (II) оксидының электронлы һәм структур формулаларын
болай сурәтләргә кирәк:
:С; !O C^O
82
Күмер тутыру
25 нче рәсем. Газ генераторы схемасы
□ Табу. Углерод (II) оксидын промышленностьта газ генераторы дип
аталган махсус мичләрдә, бер-бер артлы уза торган ике реакция нәтиҗә¬
сендә табалар (25 нче рәсем). Газ генераторының кислород җитәрлек
булган аскы өлешендә күмер тулысынча яна һәм углерод (IV) оксиды
хасил була:
C (к.) + O2 (г.) = CO2 (г.) + 402 кДж
Углерод (IV) оксиды астан өскә күтәрелә барган саен, ул кызган күмергә
орынып килә:
CO2 (г.) + C (к.) = 2С0 (г.) - 175 кДж
Барлыкка килгән газ ирекле азот һәм углерод (II) оксидыннан тора.
Мондый катнашманы генератор газы дип атыйлар. Газ генераторларында
кайчак кызган күмер аша су пары өрдерәләр:
C + H2O = CO + H2 - Q
синтез-газ
Каты ягулыкны газсыман ягулыкка әверелдерү ягулыкны газификация¬
ләү дип атала.
Лабораториядә углерод (II) оксидын кырмыска кислотасына суны бәй¬
ләүче куертылган сульфат кислотасы белән тәэсир итеп табу җиңелрәк:
Z0 H2SO4, t
H-C ч » H2O + co t
xOH
83
Углерод (II) оксиды, яки сөрем (ис) газы мичтә һәм эчке янулы дви¬
гательләрдә ягулык тулысынча янып бетмәгәндә хасил булырга мөмкин.
Шуңа күрә мичкә якканда, андагы кызган күмерләрне тартмыйча торып,
морҗаны ябарга ярамый, чөнки мичтә ^газ генераторындагы кебек үк
процесслар барырга мөмкин. Гаражларда вентиляция начар булганда да
анда углерод (II) оксиды җыелырга мөмкин.
Углерод (II) оксиды — көчле агу! Бу аның гемоглобин белән, кислородка
караганда, тотрыклырак кушылма хасил итүе һәм канның кислородны
күчерми башлавы белән аңлатыла. Баш авыртуына, аңны югалтуга китерә
торган кислород ачлыгы туа. Агулану бик көчле булганда кеше үләргә
мөмкин. Ашыгыч ярдәм күрсәтү өчен, агуланган кешене саф һавага алып
чыгарга һәм аңа ясалма сулыш алдырырга кирәк.
Физик үзлекләре. Углерод (II) оксиды — төссез, саф хәлендә иссез,
һавадан бераз җиңелрәк, суда начар эри торган газ, кайнау температурасы
бик түбән (-191,5 0C).
Химик үзлекләре. Углерод (II) оксиды — көчле кайтаргыч. Кислородта
һәм һавада углерод (II) оксиды зәңгәрсу ялкын белән яна һәм күп җылылык
аерып чыгара:
|-4е—
+2 0 +4 2
2СО + O2 = 2СО2 + 577 кДж
кайтар- оксидлаш-
гыч тыргыч
Углерод (II) оксиды күпчелек металларны аларның оксидларыннан
кайтара, мәсәлән:
+2 +2/0 +4
CO + CuO —* Cu + CO2
кайтар- оксидлаш-
гыч тыргыч
Куллану. Углерод (II) оксиды газсыман ягулык сыйфатында, шулай ук
күпчелек органик синтез реакцияләрендә кулланыла.
Сорауларга җавап бирегез һәм 10—13 нче күнегүләрне үтәгез (90 нчы бит).
§ 27. Углерод (IV) оксиды
Уку материалын кабатлагыз (8 нче сыйныф, § 30).
▲ Молекула төзелеше. Углерод (IV) оксидының электронлы һәм структур
формулалары болай языла:
QiCiQ O=C=O
Барлык дүрт ковалент бәйләнеш тә поляр. Әмма сызыкча төзелешле
булуы аркасында молекула, тулаем алганда, поляр түгел.
84
СЕЗ
БЕЛӘСЕЗМЕ?
Кайбер вулканлы урыннарда CO2 Җир кабыгындагы ярыклар
аша өскә чыга һәм күп микъдарда тау куышларында һәм
үзәннәрдә туплана. Неаполь тирәсендәге «Эт мәгарәсе»
һәм Ява утравындагы «Үлем үзәнлеге» шуның белән
данлыклы. Хайваннар, мәсәлән этләр, шундый урыннарга
тап булганда үләләр. Ни өчен мондый урыннарда угле¬
род (IV) оксиды тәбәнәк хайваннарга гына буылдыргыч
тәэсир итүен уйлап әйтегез.
Углерод (IV) оксидын табуның промышленность, лаборатория ысулы
һәм аның төрле оксидлашу процессларында хасил булуы 7 нче схемада
күрсәтелгән.
Физик үзлекләре. Углерод (IV) оксиды, яки углекислый газ — төссез
газ, һавадан 1,5 тапкыр авыррак, суда чагыштырмача яхшы эри (1:0,878
күләм нисбәтендә). Ьәркайсыбызга таныш булган газлы су — углерод (IV)
оксидының судагы эремәсе ул. Гадәттәге температурада һәм чагыштырмача
югары басым астында углерод (IV) оксиды сыегая. Ул парга әйләнгәндә
шундый күп җылылык йотыла ки, углерод (IV) оксидының бер өлеше хәтта
кар сыман массага («коры боз»га) әверелә.
Химик үзлекләре. Углерод (IV) оксиды кислота оксиды булып исәпләнә,
аның химик үзлекләре 24 нче таблицада бирелгән.
Углерод (IV) оксидының кулланылышы 26 нчы рәсемдә күрсәтелгән.
14—17 нче сорауларга җавап бирегез (90 нчы бит). 1 нче мәсьәләне чишегез
(91 нче бит).
7 нче схема
85
24 нче таблица. Углерод (IV) оксидының химик үзлекләре
Башка кислота оксидлары белән уртак
үзлекләре
Специфик үзлекләре
1. Эрегәндә, су белән реагирла-
шып, тотрыксыз карбонат кислота¬
сы хасил итә:
CO2 + H2O «=* H2CO3
2. Нигезләр белән реагирлашах
CO2 + 2NaOH * Na2CO3 + H2O
CO2 + NaOH » NaHCO3
артыгы белән
3. Нигез оксидлары, белән реагир-
лаша:
CO2 + CaO ♦ CaCO3
1. Известьле су аша углерод (IV) ок¬
сидын уздырганда, болганчыклану кү¬
зәтелә:
CO2 + Ca(OH)2 > CaCO31 + H2O
Бу реакция углерод (IV) оксиды бар¬
лыгын белү өчен файдаланыла.
2. Югары температурада оксидлаш¬
тыру үзлекләренә ия, мәсәлән:
+4 O +2 0
CO2 + 2Mg * 2MgO + C
26 нчы рәсем. Углерод (IV) оксидын куллану: 1 — шикәр җитештерүдә; 2 — янгын
сүндерүдә; 3 — җиләк-җимеш суы җитештерүдә; 4 — «коры боз» алуда; 5 — пыяла (6),
кер порошоклары (7), дарулар (S) җитештерүдә кулланыла торган сода табуда
86
§ 28. Карбонат кислотасы һәм аның тозлары
Уку материалын кабатлагыз (8 нче сыйныф, § 32).
Молекула төзелеше. Карбонат кислотасының электронлы һәм структур
формулалары болай языла:
Н:О- ...
" С;О
НЮ* •••
C=O
Карбонат кислотасы молекуласында барлык химик бәйләнешләр —
поляр ковалент бәйләнеш.
Табу. Карбонат кислотасын углерод (IV) оксидын суда эретеп табалар. Карбо¬
нат кислотасы бик тотрыксыз кушылма булганлыктан, бу реакция кайтма:
CO9 + H9O < > H9CO4
ZZ Zo
Бу реакция газлы су тапканда уза. Табигый шартларда шундый ук
процесс нәтиҗәсендә, составында CO2 дән башка тагын төрле тозлар эрегән,
минераль сулар (мәсәлән, нарзан) хасил була.
Карбонат кислотасы — бик көчсез кислота: газлы су эчкәндә, без аның
әчкелт тәмен бөтенләй диярлек тоймыйбыз.
Карбонат кислотасының тозлары. Карбонат кислотасы ике нигезле
буларак ике рәт тозлар — карбонатлар һәм гидрокарбонатларны хасил итә.
Мәсәлән, Na2CO3 — натрий карбонаты, NaHCO3 — натрий гидрокарбонаты,
CaCO3 — кальций карбонаты, Ca(HCO3)2 — кальций гидрокарбонаты.
Кайбер карбонатлар, мәсәлән кальций карбонаты (известьташ, акбур,
мәрмәрнең төп состав өлеше), күп микъдарда табигатьтә очрый. Икенчеләрен
исә, мәсәлән натрий һәм калий карбонатын, промышленностьта һәм
лабораториядә табалар.
Лабораториядә карбонатларны тозлар өчен характерлы гомуми ысул¬
лар белән табарга мөмкин (8 нче сыйныф, § 33), әмма карбонат кислота¬
сының тотрыксызлыгы аркасында, бу максатларда углерод (IV) оксидын
файдаланалар.
Промышленностьта күп микъдарда натрий карбонаты Na2CO3 (кальци¬
нирланган сода), натрий карбонаты кристаллогидраты Na2CO3 • IOH2O
(кристаллик сода) һәм натрий гидрокарбонаты NaHCO3 (чәй содасы.)
җитештерәләр.
Натрий гидрокарбонатын кыздырганда кальцинирланган сода хасил була:
2NaHCO3 Na9CO3 + H9O + CO9T
O ZoZ Z
Натрий гидрокарбонатының эремәсен кайнатканда да ул натрий карбо¬
натына әверелә.
Кальцинирланган соданы суда эретеп, шуннан соң эремәне парга әйлән¬
дергәндә, кристаллик сода аерылып чыга. Аны кыздырганда кристаллиза-
цион су очып бетә һәм яңадан кальцинирланган сода барлыкка килә:
Na9CO3 • IOH9O Na9CO3 + IOH9O
Zo Z Zo Z
87
Чәй содасын кальцинирланган содадан табу өчен, соңгысын суда эретәләр
һәм барлыкка килгән эремәне углерод (IV) оксиды белән туендыралар:
Na2CO3 + H2O + CO2 * 2NaHCO3
Физик үзлекләре. Барлык карбонатлар да — каты кристаллик мат¬
дәләр. Ал арның күпчелеге суда бөтенләй эреми. Натрий, калий, аммоний
карбонатлары һ. б. болардан чыгарма булып тора.
Гидрокарбонатлар суда чагыштырмача яхшы эри. Натрий гидрокарбо-
наты аз эри.
Карбонатларның химик үзлекләре 25 нче таблицада бирелгән. Специфик
үзлекләреннән карбонатларның кислоталар белән тәэсир итешүен җентек¬
ләбрәк тикшерик. Чөнки бу реакцияләрдә үзенчәлекле «кайнау» күзәтелә
һәм аларны карбонат-ионнарны танып белү өчен файдаланалар:
K2CO3 + 2НС1 * 2КС1 + H2O + CO2T
2К+ + СО*' + 2Н+ + 2СГ —* 2К+ + 2СГ + H2O + CO2T Z
2Н+ + CO* —> H2O + CO21
O Z Z
25 нче таблица. Карбонатларның химик үзлекләре
Башка тозлар белән уртак үзлекләре
Специфик үзлекләре
1. Башка тозлар белән алмашу
реакциясенә керәләр:
Na2CO3 + CaCl2 * CaCO31 + 2NaCl
2. Җылытканда таркалалар:
CaCO3 CaO + CO21
Чыгарма — селтеле металлар карбо¬
натлары.
3. Гидрокарбонатлар җылытканда
карбонатларга әвереләләр:
Mg(HCO3)2 MgCO31 + H2O + CO2T
яисә селтеләр тәэсирендә карбонат¬
ларга әвереләләр:
NaHCO3 + NaOH * Na2CO3 + H2O
4. Карбонатлар судагы эремәдә уг¬
лерод (IV) оксиды катнашында гид-
рокарбонатларга әвереләләр:
MgCO3 + CO2 + H2O ♦ Mg(HCO3)2
1. Көчле кислоталар тәэсирендә
углерод (IV) оксиды аерылып чыгудан
үзенчәлекле «кайнау» күзәтелә:
Na2CO3 +2НС1 ♦ 2NaCl+H2O+CO2t
KHCO3 + HCl * KCl + H2O + CO2T
A 2. Гидролиз булганлыктан, карбо¬
натларның эремәләре селтеле реак¬
циягә ия:
2Na+ + COjj + H2O «=*
1 — H+ + ОН
3=t HCO3 + 2Na+ + OH"
CO* + H2O HCO3 + OH-
СЕЗ
БЕЛӘСЕЗМЕ?
Атмосферада углерод (IV) оксидының микъдары акрынлап
арта бара: 1860 елда ул 0,028% булса, хәзерге вакытта
0,036% (күләме буенча) тәшкил итә.
88
Кыскартылган ионлы тигезләмәдән күренгәнчә, карбонат-ионга
(CO3 ) характерлы сыйфат реакциясе булып, аның водород ионнары (H+)
белән тәэсир итешүе тора.
Иң әһәмиятле карбонатлар һәм гидрокарбонатларның кулланылышы
35 нче рәсемдә (86 нчы бит) күрсәтелгән.
18—21 нче сорауларга җавап бирегез (90—91 нче битләр). 2—4 нче мәсьәләләрне
чишегез (91 нче бит).
§ 29. Табигатьтә углерод әйләнеше
Табигатьтә бертөрле углеродлы матдәләрнең таркалуы һәм икенчеләренең
хасил булу процессы өзлексез бара. Органик матдәләр ягулык янганда,
сулаганда һәм черегәндә таркала. Алардан гадирәк матдәләр, шул исәптән
углерод (IV) оксиды хасил була. Углерод (IV) оксиды шулай ук кайбер
неорганик матдәләрнең таркалу процессларында, мәсәлән известьташны
яндырганда да аерылып чыга. Әмма аның атмосферадагы микъдары акрын
27 нче рәсем. Табигатьтә углерод әйләнеше
89
арта. Бу углерод (IV) оксидының фотосинтезда катнашуы һәм углерод
атомнарының кабат үсемлекләрнең органик матдәләре составына күчүләре
белән аңлатыла. Органик матдәләрнең күпчелеген хайваннар һәм кеше
азык итеп куллана. Табигатьтә әнә шулай углеродның өзлексез әйләнеше
бара (27 нче рәсем).
Сорауларга җавап бирегез һәм 22—23 нче күнегүләрне үтәгез (91 нче бит). 5 нче
мәсьәләне чишегез (91 нче бит).
1. Углерод һәм кремний атомнарының
төзелеше схемаларын сызыгыз. Ал арның
атомнары төзелеше нигезендә бу элемент¬
ларның гомуми һәм аермалы үзлекләрен
санап чыгыгыз.
2. C » Si * Ge * Sn * Pb рә¬
тендә химик элементларның һәм алардан
барлыкка килгән гади матдәләрнең неме¬
талл үзлекләре
1) көчәя
2) йомшара
3) үзгәрми
4) башта арта, аннары үзгәрми
3. Метан силаннан нәрсә белән аерыла
(молекула төзелеше һәм үзлекләре буен¬
ча)? Ни өчен?
4. Графит һәм алмаз бер үк химик
элементның аллотропик үзгәрешле төр¬
ләре икәнен ничек раслап була? Ни өчен
аларның үзлекләрендә шулкадәр аерым¬
лык күзәтелә?
5. Агач күмере нинди процессларда
хасил була? Аның төзелеше, үзлекләре
һәм кулланылышы нинди?
6. Сез тормышта күзәтә торган нинди
күренешләр ярдәмендә икмәктә, сөттә,
иттә углерод барын раслый аласыз?
7. Алмаз һәм графитны нинди максат¬
ларда кулланалар?
8. Күмерне 1) тимер (IH) оксиды;
2) аккургаш (IV) оксиды белән җылыткан¬
да уза торган реакцияләрнең тигезләмә¬
ләрен төзегез. Электроннарның күчешен
күрсәтегез һәм оксидлаштыргычка — бер
сызык, кайтаргычка ике сызык сызыгыз.
9. Углерод үзлекләренә нигезләнеп һәм
24 нче рәсемнән файдаланып, углеродның
нинди максатларда кулланылуын аңла¬
тыгыз.
10. Электроннарга бәйләп, углерод (II)
оксиды молекуласы, аммоний һәм гид-
роксоний ионнары хасил булу процессын
тасвирлагыз. Бу процессларда нинди ур¬
таклык бар?
11. Углерод (II) оксидын лабораториядә
һәм промышленностьта ничек табалар?
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
12. Конкрет мисалларда углерод (II)
оксидының химик үзлекләрен тасвирла¬
гыз.
13. Нинди газ яхшырак ягулык булып
санала: генератор газымы яки су газымы?
Ни өчен?
14. Табигатьтә, көнкүрештә, лаборато¬
риядә һәм промышленностьта углерод (IV)
оксиды хасил булу белән бара торган реак¬
цияләрнең тигезләмәләрен төзегез.
15. Этикеткасыз ике ябык цилиндрга
углерод (IV) оксиды һәм водород туты¬
рылган. Газларны белергә була:
1) төсе буенча
2) исе буенча
3) янып торган чыра ярдәмендә
4) фенолфталеинның спирттагы эремәсе
белән чылатылган фильтр кәгазе ярдә¬
мендә.
16. Метан тулысынча янганда бар¬
лыкка килә:
1) углекислый газ һәм водород
2) углерод һәм су
3) углекислый газ һәм су
4) сөрем (ис) газы һәм су.
17. Углерод (IV) оксидын кальций
гидроксиды эремәсе аша уздырганда
башта йөзмә хасил була, соңыннан ул эри.
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
18. Карбонат кислотасының химик
үзлекләрен өйрәнү өчен, углерод (IV) ок¬
сиды белән туендырылган бер эремәгә —
аккургаш, икенчесенә — магний, ә өчен¬
чесенә натрий төшергәннәр. Карбонат
кислотасы үзе актив булмаса да, аның
металлар белән реагирлашуын кайсы оч¬
ракта раслый алганнар? Ни өчен?
90
19. Карбонат кислотасы нитрат кис¬
лотасыннан көчсезрәк, әмма борат кис¬
лотасыннан көчлерәк. Моны нәрсә белән
аңлатып була?
20. Ни өчен янгын сүндергечләрдә
натрий карбонатын түгел, ә натрий гидро-
карбонатын файдаланалар?
21. Түбәндәге схемага туры китереп,
реакцияләрнең тигезләмәләрен төзегез:
Na2CO3 s=± Na9CO4 • IOH9O
NaHCO3 ♦ Na2CO3
О 1. 0,1 масса өлеше катышмалары
булган 500 т известьташны яндырганда
күпме күләм углерод (IV) оксиды аерылып
Чыгар (н. ш.)?
2. 196 г сульфат кислотасын тулы-
сынча нейтральләштерү өчен күпме
кристаллик сода кирәк була?
3. 11,2 г натрий карбонаты белән
реакциягә керү өчен, составында 0,05 мас¬
са өлеше, яки 5% хлороводород булган
эремә күпме кирәк?
22. 27 нче рәсемнән файдаланып,
табигатьтә углерод әйләнеше барганда
уза торган химик реакцияләрнең тигез¬
ләмәләрен төзегез.
23. Кальцинирланган соданың юу
үзлекләре нәрсә белән аңлатыла? Сез
ничек уйлыйсыз, өй шартларында со¬
даны алюминий савытта сакларга
ярыймы?
4. 365 г суда 135 г кристаллик сода
эреткәннәр. Табылган эремәдәге сусызлан-
дырылган тозның (Na2CO3) масса өлешен
(берәмлек өлешләрендә һәм процентлар¬
да) исәпләгез.
5. Натрий карбонаты һәм натрий гид-
рокарбонатыннан торган 146 г катнаш¬
маны бик нык кыздырганнар. Кыздыр¬
ганнан соң калдыкның авырлыгы 137 г
булган. Катнашманың составын масса
өлешләрендә күрсәтегез.
§ 30. Кремний һәм аның үзлекләре
Табигатьтә очравы. Кремний — Җир кабыгында, кислородтан кала, иң
күп таралган элемент (якынча 26%).
Кремний кушылмаларыннан иң таралганнары — кремний (IV) оксиды
SiO2 (кремнезем) һәм каолинит Al2O3 • 2SiO2 • 2Н2О. Кремний (IV) ок¬
сиды — комның төп состав өлеше, ә каолинит — балчыкның төп состав
өлеше. Табигатьтә силикат — ортоклаз (кыр шпаты) K2O • Al2O3 • 6SiO2
гаять киң таралган.
■ Табу. Промышленностьта кремнийны ком һәм
җылытып табалар:
күмер катнашмасын
0 +4 tO +2
2С + SiO2 > Si + 2СО
Кайтарылган кремний өлешчә артык углерод белән реагирлаша һәм кар¬
борунд SiC (кремний карбиды) хасил була. Бу бик каты матдә һәм шуңа
күрә кайрау һәм шомарту җайланмалары эшләүдә кулланыла.
Лабораториядә кремнийны чиста ком белән магний порошогын реак¬
циягә кертеп табалар:
I I
0 +4/+2 0
2Mg + SiO2 > 2MgO + Si
Физик үзлекләре. Аморф һәм кристаллик кремнийның булуы билгеле.
Кремнийны аның кушылмаларыннан металлар яки кокс (C) белән кайтарып
91
тапканда, эретелгән металл арда ул өлешчә эри. Кремнийның металл ардагы
эремәсен акрынлап суытканда, аның алмазныкы кебек кристаллик челтәрле
кристаллик модификациясен табалар. Кристаллик кремнийның металлик
ялтыравыгы бар, авыр эретелә, бик каты, электр тогын бик аз үткәрә.
Химик үзлекләре. Аморф кремний гадәти шартларда гади матдәләрдән
бары тик фтор белән генә реагирлаша. Югары температурада кремний
активлаша һәм кислород, хлор, бром, күкерт белән реагирлаша:
I- 4e^
0 Ot +4"2
Si + O2 * SiO2
Кислоталар (фторид кислотасыннан башкалары) кремнийга тәэсир
итмиләр, әмма селте эремәләре аның белән реагирлаша.
Куллану. Кремний күп микъдарда югары температурага һәм кислотага
чыдам кремнийлы корычлар табу өчен тотыла. Кремний — германий
кебек үк ярымүткәргеч, һәм шунлыктан аны төрле җайланмаларда, шул
исәптән электронлы техникада киң кулланалар. Кремний кристалларын
фотоэлементларда куллануның киләчәге гаять зур, алар ярдәмендә кояш
нурланышы энергиясе электр энергиясенә әверелә.
1—2 нче сорауларга җавап бирегез (100 нче бит).
§31. Кремний (IV) оксиды
Уку материалын кабатлагыз (8 нче сыйныф, § 42).
▲ Кристаллик челтәренең төзелеше. Каты кремний (IV) оксидының төзе¬
лешен ачыклау өчен, түбәндәге закончалыкны искә төшерергә кирәк:
молекуляр челтәрле матдәләрнең эретелү температурасы түбән, ә атомлы
челтәрле матдәләрнең — югары.
Углерод (IV) оксидының эретелү температурасы бик түбән (-56,6 °C),
ә кремний (IV) оксидының — бик югары (кварц 1728 oC та эретелә).
Үзлекләренә нигезләнеп, каты кремний (IV) оксиды атомлы челтәргә ия
булырга тиеш дип уйлый алабыз. Бу — күп тикшеренүләр белән расланды.
Кремний (IV) оксидының кристаллик челтәренең төзелеше түбәндәгечә:
I I I
- O -Si- O-Si-O -Si- O -
I I I
OOO
I I I
- O -Si- O -Si- O -Si- O -
Г I I
92
Димәк, SiO2 кристалы бер гигант молекуладан (SiO2)n тора сыман,
ләкин гадиләштереп язу өчен, кремний (IV) оксидын SiO2 формуласы белән
сурәтлиләр, бу, әлбәттә, төгәл түгел.
Табигатьтә очравы. Кремний (IV) оксиды
табигатьтә ком рәвешендә очрый. Кагыйдә
буларак, ком катышмалар (тимер оксиды) бе¬
лән катнашкан була, бу аңа сары төс бирә. Саф
кремний (IV) оксиды кристалларын кварц дип
атыйлар. Алар үтә күренмәле һәм төссез. SiO2
кристаллары тупланмалар рәвешендә гранитта
һәм башка төр тау токымнарында була, алар
җимерелгәндә ком хасил була. Табигатьтә шулай
ук зур төссез кварц, тау хрустале (28 нче рәсем) 28 нче рэсем‘ ТаУ хрустале
кристаллары да очрый.
Физик үзлекләре. Саф хәлендәге кремний (IV) оксиды — каты крис¬
таллик матдә.
Химик үзлекләре. Кремний (IV) оксиды — кислота оксиды булып тора.
Аның химик үзлекләре 26 нчы таблицада күрсәтелгән.
26 нчы таблица. Кремний (IV) оксидының химик үзлекләре
Башка кислота оксидлары беләи уртак
үзлекләре
Специфик үзлекләре
1. Җылытканда селтеләр белән реа-
гирлаша:
2SiO2 + 2NaOH Na2SiO3+ H2O
2. Җылытканда нигез оксидлары
белән реагирлаша:
SiO2 + CaO —CaSiO3
1. Күп кенә башка кислота оксид¬
ларыннан аермалы буларак, су белән
реагирлашмый.
2. Югары температурада тозлардан
тагын да очучанрак кислота оксид¬
ларын этеп чыгара:
SiO9 + CaCO3 * CaSiO3 + CO91
ZO OZ
СЕЗ
БЕЛӘСЕЗМЕ?
Кайчак гаять зур тау хрустале кристаллары очрый.
1958 елда Казахстанда массасы 70 тонналы кристалл
табыла.
93
8 нче схема
Кремний (IV) оксидының кулланылышы 8 нче схемада күрсәтелгән.
3—4 нче сорауларга җавап бирегез (100—101 нче бит). 1 нче мәсьәләне чишегез
(101 нче бит).
§ 32. Силикат кислотасы һәм аның тозлары
Молекула төзелеше. Силикат кислотасы шартлыча H2SiO3 формуласы
белән күрсәтелә. Чынында исә аның составы катлаулырак:
O-H O-H O-H
I I I
••• - O - Si- O - Si- O - Si- O - яки (H2SiO3)n
I I I
O-H O-H O-H
Гомуми формуласы ZiSiO2 • ZnH2O булган төрле силикат кислоталары
билгеле.
Табу. Башка күп кенә кислоталардан аермалы буларак, силикат кисло¬
тасын кремний (IV) оксидын гидратлаштырып табып булмый, чөнки ул
су белән реакциягә керми. Силикат кислотасын аның тозлары эремәсенә
кислота белән тәэсир итеп табалар. Бу вакытта ул койкасыман утырым
рәвешендә барлыкка килә:
Na2SiO3 + 2НС1 > 2NaCl + H2SiO3 J
2Na+ + SiO3 + 2Н+ + 2СГ —> 2Na+ + 2СГ + H2SiO31
2H+ + SiO3 > H2SiO31
Физик үзлекләре. Башка күп кенә неорганик кислоталардан аермалы
буларак, силикат кислотасы суда эреми диярлек. Cy белән ул коллоид
эремәләр дип йөртелә торган аерым төр системалар барлыкка китерә,
аларны сез 11 нче сыйныфта өйрәнерсез.
Химик үзлекләре. Силикат кислотасы суда бөтенләй эремәгәнлек-
тән, водород ионнары аның молекуласыннан аерылмый. Шунлыктан
кислоталарга хас, индикаторларга тәэсир итү кебек, уртак үзлек силикат
94
кислотасында күзәтелми: ул карбонат кислотасыннан да көчсезрәк.
Силикат кислотасы тотрыксыз һәм җылытканда акрынлап таркала:
H2SiO3 H2O + SiO2
Силикат кислотасының тозлары. Силикат кислотасының тозларын
силикатлар дип йөртәләр. Силикат кислотасының формуласы шартлыча
булган кебек, аның тозларының формулалары да (Na2SiO3, CaSiO3 һ. б.)
шартлыча. nSiO2 • TnH2O составлы кислота молекулаларында водород
атомнары тулысынча яки өлешчә металл атомнарына алмаштырылудан
барлыкка килгән күп төрле силикатлар була.
Силикат кислотасының тозларын, ягъни силикатларны табу крем¬
ний (IV) оксидының химик үзлекләрен өйрәнгәндә тикшерелде.
Физик үзлекләре. Күп кенә силикатлар авыр эретелә һәм суда бөтенләй
эреми. Зур практик әһәмияткә ия булган силикатлардан натрий һәм калий
силикатлары гына эрүчән. Бу силикатларны сыек пыяла дип атыйлар.
Химик үзлекләре. 1. Силикатлар барлык кислоталар белән диярлек,
шул исәптән карбонат кислотасы белән дә реагирлашалар:
Na2SiO3 + H2O + CO2 * Na2CO3 + H2SiO31
2. Эрүчән силикатлар башка тозлар белән алмашу реакцияләрендә
катнаша алалар:
Na2SiO3 + CaCl2 * CaSiO31 + 2NaCl
2Na+ + SiO3 + Ca2+ + 2СГ > CaSiO31 + 2Na+ + 2СГ
о о
Ca2+ + SiO2 > CaSiO31
О <5
2Na+ + 20Н" + H2SiO31
£ a
A 3. Судагы эремәләрендә силикатлар гидролизлашалар һәм селтеле
реакция күрсәтәләр:
2Na+ + SiO3" + 2Н,0
fl
!•- — 2Н+ + 20Н"
SiO2 + 2Н2О «=> H2SiO31 + 20Н‘
4. Минераллар составына кергән силикатлар (аларның формулаларын
оксидлар рәвешендә күрсәтәләр) табигать шартларында су һәм углерод (IV)
оксиды тәэсирендә таркалалар:
K2O • Al2O3 • 6SiO2 + CO2 + 2Н,0 >
ортоклаз
* Al2O4 • 2SiO9 • 2Н9О + 4SiO9 + K9CO4
каолинит кремнезем
Мондый силикатлар таркалганда, балчык һәм ком ятмалары барлыкка
килгән, ә алар нигезендә үсемлек һәм хайван калдыклары таркалудан
туфрак ясалган.
95
Куллану. Эрүчән силикатлардан иң күп кулланыла торганы — натрий
силикаты. Аның судагы эремәсен силикат җилеме сыйфатында агачка һәм
тукымага сеңдерү, шуның белән аларны утка чыдам һәм су үткәрмәүчән
итү өчен файдаланалар. Составына берничә төрле металл, шул исәптән алю¬
миний да кергән катлаулырак силикатларны (алюмосиликатлар) силикат
промышленностенда киң кулланалар.
5—6 нчы сорауларга җавап бирегез (101 нче бит).
§ 33. Силикат промышленносте
Силикат промышленностена табигый силикатлардан төрле төзелеш
материаллары, пыяла һәм керамика җитештерү керә.
Силикат промышленносте җитештерә торган әһәмиятле төзелеш мате¬
риаллары 9 нчы схемада күрсәтелгән. Аларның кайберләрен җитештерү
белән тулырак танышыйк.
Керамика әйберләрен җитештерүдә төп чимал булып балчык санала
(грекча «керамон» — балчык). Керамика әйберләрен ясау балчыкның
аз гына су кушып болгатканда пластик масса барлыкка китерү үзлегенә
нигезләнгән. Бу массага теләсә нинди форма биреп була, һәм ул, киптереп,
югары температурада яндырганнан соң саклана. Ак балчыктан фаянс һәм
фарфор әйберләр ясыйлар.
9 нчы схема
96
СЕЗ
БЕЛӘСЕЗМЕ?
Пыяла ясаучылык һөнәре күп гасырлардан бирле яшәп
килә. Борынгы Египетта (Мисырда) ул б.э. га кадәр
3000 ел элек барлыкка килгән. Б. э. га кадәр 3 нче мең-
еллык уртасында эшләнгән пыяла цилиндр Багдадка
якын Тель-Асмарда табыла.
Россиядә беренче пыяла заводы 1635 елда пыяла җи¬
тештерә башлый.
Россиядә беренче химия лабораториясендә М. В. Ломо¬
носов 4000нән артык сынау пыяласы ясый. Аның бу
эшләре завод ысулы белән төсле пыяла табуның ниге¬
зенә салына. Үзе ясаган төсле пыяладан М. В. Ломоносов
шәкертләре белән бергә «Полтава баталиясе» дип исем¬
ләнгән зур (42 м2) мозаик картина җыя.
Пыяла җитештерү. Гади пыяланы җитештерүдә төп чимал булып саф
кварц комы, сода һәм известъташ тора. Бу матдәләрне бик яхшылап
катнаштыралар һәм нык җылыталар (1500 °C):
Na2CO3 + SiO2 Na2SiO3 + CO2 J
CaCO3 + SiO2 CaSiO3 + CO2 t
Барлыкка килгән натрий һәм кальций силикатлары артыгы белән алын¬
ган ком белән бергә эретелә. Пыяла — ул аерым матдә түгел, ә бәлки берничә
матдәнең эретмәсе. Гади тәрәзә пыяласының (натрийлы пыяланың)
якынча составын Na2O • CaO • 6SiO2 формуласы белән күрсәтергә мөмкин.
Сода урынына поташ K2CO3 кулланганда, авыр эретелучән пыяла
(химик, яки калийлы пыяла) табыла. Бу пыяланың якынча составын
K2O • CaO ■ 6SiO2 формуласы белән күрсәтергә мөмкин.
Әгәр чимал сыйфатында поташ, кургаш (II) оксиды һәм ком алынса,
хрусталь пыяла табыла. Бу пыяла яктылык нурларын нык сындыра һәм
шуңа күрә аны оптикада линза һәм призма ясау өчен файдаланалар. Аннан
шулай ук хрусталь савытлар да ясыйлар.
Саф комнан кварц пыяла табалар. Эретелгән ком, суынганда, пыяла-
сыман масса хасил итә. Гади пыяладан аермалы буларак, кварц пыяла
температура үзгәргәндә күләмгә аз үзгәрә. Мондый пыяладан эшләнгән
савытны агарганчы кыздырып, салкын суга төшергәндә дә ул чатнамый.
Кварц пыяладан лаборатория савытлары ясыйлар. Аның үзенә хас икенче
үзлеге — ультрашәмәхә нурларны үткәрә алу сәләте, шуңа күрә аннан
медицинада файдаланыла торган кварц лампалары ясыйлар.
Төсле пыяла табу өчен, чималга тиешле металлның оксидын өс¬
тиләр. Әйтик, мәсәлән, кобальт (II) оксиды өстәгәндә зәңгәр пыяла табыла.
Хром (III) оксиды пыялага яшел төс бирә — яшел пыяла табыла. Бакыр (II)
97
29 нчы рәсем. Табаклы
пыяла ясау машинасы
оксиды зэңгэрсу-яшел төс бирә. Аз гына микъ¬
дарда вакланган алтын өстәгәндә рубин пыяла
табыла.
Эретелгән пыяла, суытканда, тиз генә катып
китми, башта үзле масса барлыкка китереп,
акрынлап куера. Пыяланың бу үзлеге әлеге
массаны формага кертергә мөмкинлек бирә —
җылы хәлендә аңа теләсә нинди форманы биреп
була. Пыяла әйберләргә тиешле форманы бирү
өчен, өрдерү (шешә, электр лампалары), пресс¬
лау (төймә, сәдәп), прокатлау (көзге пыяласы),
тарттырып сузу (табаклы пыяла, пыяла көпшәләр
һәм таякчыклар) ысулларыннан файдаланалар.
Табаклы пыяла махсус машиналар ярдәмендә
тарттырып сузу юлы белән ясала (29 нчы рәсем).
Аларда ярымсыек пыяла ярык аша кысып чыга¬
рыла, һәм махсус валлар ярдәмендә табаклы пыяла
ясала.
Пыяладан шулай ук пыяла сүсләр һәм тукымалар җитештерү өчен
кирәкле нәзек пыяла җепләр дә әзерлиләр. Пыяла тукымалар җылылык
һәм электр үткәрмәүчән материал сыйфатында кулланыла. Пыяла сүстән
һәм пластмассадан пыяла-пластиклар җитештерәләр, алар ныклыгы белән
корычтан калышмый.
Цемент җитештерү. Цементның берничә төре билгеле. Портланд-
цементны җитештерү өчен төп чимал булып известьташ һәм крем¬
ний (IV) оксидлы балчык исәпләнә. Бу матдәләрне яхшылап болгаталар һәм
аларның катнашмасын 200 м озынлыктагы, диаметры 5 м чамасы булган
авыш цилиндр мичләрдә яндыралар (30 нчы рәсем). Яндыру процессында
30 нчы рәсем. Цемент җитештергәндә известьташ белән балчык катнашмасын яндыру
өчен цилиндрик мич
98
СЕЗ
БЕЛӘСЕЗМЕ?
1824 елда ташчы Д. Аспдин Англиядә Портланд шәһәре
янында чыгарыла торган портланд ташына охшаган це¬
мент (портландцемент) җитештерүгә патент ала. Аңа
бәйсез рәвештә 1825 елда инженер Е. Г. Челиев (Че¬
лидзе) Мәскәүдә төзекләндерү эшләре өчен балчык һәм
известьташтан цемент табу ысулын таба. Бу цемент үз¬
лекләре белән портландцементка якын була.
мич акрын гына әйләнеп тора һәм башлангыч матдәләр мичкә кергән
газсыман яки тузан хәлендәге каты ягулык янганда барлыкка килгән
продуктлар — кызган газлар агымына каршы мичнең аскы өлешенә таба
хәрәкәтләнә (каршы агым принцибы).
Югары температурада балчык һәм известьташ арасында катлаулы химик
реакцияләр бара. Шулардан иң гадиләре — каолинитның сусызлануы,
известъташның таркалуы һәм кальций силикатлары һәм алюминатлары
хасил булу.
Al9O4 • 2SiO9 • 2Н9О Al2O4 • 2SiO2 + 2Н2О t
Л O Z Л 4 0 4 4
CaCO3 CaO + CO21
CaO + SiO2 —CaSiO3
Реакция нәтиҗәсендә хасил булган матдәләр аерым кисәкләр рәве¬
шендә укмашалар. Суытканнан соң аларны вак порошок хәленә кадәр
тарттыралар.
Цемент измәнең кату процессы цемент составындагы төрле силикатлар
һәм алюминатларның су белән реагирлашып ташсыман масса хасил итүе
белән аңлатыла (9 нчы схеманы карагыз).
Цемент, бетон, шлаклы бетон һәм тимер-бетон — төп төзелеш ма¬
териаллары.
Бетон — вакташ һәм комның цемент белән катнашмасы. Цементны
шлак белән кушып шлаклы бетон табалар. Бетонга тимер стерженьнардан
каркаслар куеп калдырганда бетон корылмалар тагын да ныграк була. Мон¬
дый төзелеш материалы тимер-бетон дип атала. Алардан капиталь төзелеш
объектлары: завод корпуслары, плотиналар һәм башка корылмалар төзиләр.
Төзү материалларын (аерым алганда, цемент һәм бетон) җитештерү һәм
аларның сыйфаты буенча илдә төзелеш индустриясенең үсеш дәрәҗәсен
билгеләргә мөмкин.
7—8 нче сорауларга җавап бирегез (101 нче бит). 2 нче мәсьәләне чишегез
(101 нче бит).
Д Углерод һәм аның иң әһәмиятле кушылмалары арасындагы генетик
бәйләнеш 10 нчы схемада күрсәтелгән.
Кремний һәм аның иң әһәмиятле кушылмалары арасындагы генетик
бәйләнеш 11 нче схемада күрсәтелгән.
99
10 нчы схема
11 нче схема
9 нчы күнегүне үтәгез (101 нче бит).
1. Ирекле кремнийны промышлен¬
ностьта һәм лабораториядә ничек табалар?
Бу реакцияләрнең тигезләмәләрен язы¬
гыз, оксидлаштыргычны һәм кайтаргычны
күрсәтегез.
2. Кремнийның физик һәм химик
үзлекләре нинди? Тиешле реакцияләрнең
тигезләмәләрен китерегез. Кремнийның
нинди үзлекләрен техникада файдала¬
нулары турында аңлатыгыз.
3. Углерод һәм кремнийның югары
оксидларының охшашлыгы һәм аерым¬
лыгы нәрсәдә?
100
4. Кремний (IV) оксиды реакциягә
керә:
1) кислород белән 3) селте белән
2) су белән 4) кислота белән
5. Силикат кислотасын кремний (IV)
оксидыннан ничек табып була? Реак¬
цияләрнең тигезләмәләрен языгыз.
6. Бу тозларның кайсысы көчлерәк
гидролизлата: силикатлармы әллә карбо¬
натлармы? Ни өчен?
7. Нәтиҗәдә а) гади пыяла; б) калийлы
пыяла; в) хрусталь барлыкка килә тор¬
ган реакцияләрнең тигезләмәләрен тө¬
зегез.
8. а) Цемент; б) бетон һәм тимер-
бетон; в) пыяла җитештерүнең асылын
аңлатыгыз.
9. 10 һәм 11 нче схемаларга туры
китереп, реакцияләрнең тигезләмәләрен
төзегез.
U 1. 6,1 кг натрий силикаты табу өчен,
составында 0,2 масса өлеше катышма
булган кремний (IV) оксиды күпме кирәк
булыр?
2. 1 т пыяла ясау өчен күпме чимал
кирәк?
Лаборатор тәҗрибәләр
9. Ягулык төрләре (ягулык коллекциясе) белән танышу
Сезгә бирелгән ягулык үрнәкләрен җентекләп карагыз һәм тышкы билгеләренә карап
исемнәрен әйтегез.
10. Карбонатлар һәм гидрокарбонатларның үзлекләре һәм үзара әвере¬
лешләре белән танышу
1. Яңа әзерләнгән 2—3 мл кальций гидроксиды эремәсе (известьле су) аша угле¬
род (IV) оксиды уздырыгыз.
2. Эремә аша углерод (IV) оксидын уздыруны дәвам итегез.
3. Пробиркадагы үтә күренмәле эремәне кайнатып чыгарыгыз.
Биремнәр. 1. Известьле су аша углерод (IV) оксидын уздырганда, эремә ни өчен
болганчыклана? 2. Углерод (IV) оксидын уздыруны дәвам иттергәндә, эремә ни өчен
үтә күренмәлегә әйләнә? 3. Бу үтә күренмәле эремәне җылытканда утырым барлыкка
килүнең сәбәбен аңлатыгыз. 4. Тиешле реакцияләрнең тигезләмәләрен молекуляр,
ионлы һәм кыскартылган ионлы рәвештә языгыз.
Карбонат-ионга сыйфат реакциясе. Бер пробиркага — бераз акбур, ә икенчесенә
магний карбонаты салыгыз. Беренче пробиркага 1—2 мл сыегайтылган хлорид
кислотасы, ә икенчесенә шулкадәр үк сыегайтылган сульфат кислотасы өстәгез. Һәр
ике пробирканың авызын газүткәргеч көпшәле бөке белән каплагыз һәм очларын из¬
вестьле су салынган пробиркага төшерегез.
Биремнәр. Үткәргән тәҗрибәләргә нигезләнеп, кайсы реакциянең карбонат-ионга
характерлы булуы турында нәтиҗә чыгарыгыз. 2. Тиешле реакцияләрнең тигезләмәләрен
молекуляр, ионлы һәм кыскартылган ионлы рәвештә языгыз.
11. Табигый силикатларның үрнәкләре белән танышу
Табигый силикатларның үрнәкләрен җентекләп карагыз. Аларның тышкы билгеләренә
игътибар итегез һәм катылыгын тикшерегез.
Биремнәр. 1. Таблица төзегез һәм аңа күзәтү нәтиҗәләрен язып куегыз.
2. Күзәтүләрегездән чыгып, бирелгән минералларның исемнәрен әйтегез.
101
12. Пыяла төрләре белән танышу («Пыяла һәм пыяла әйберләр» коллекциясе
белән эшләү)
Төрле пыяла һәм пыяла әйберләр үрнәкләрен карагыз.
Биремнәр. 1. Сезгә бирелгән үрнәкләр пыяланың нинди төрләренә керүен
билгеләгез. 2. Сез караган пыяла әйберләрне ясаганда пыяланың нинди характерлы
үзлекләреннән файдалануларын аңлатыгыз.
5 нче практик эш
Углерод (IV) оксидын табу һәм аның үзлекләрен өйрәнү. Карбонатларны
танып белү
Углерод (IV) оксидын табу һәм аның үзлекләрен билгеләү. 1. Пробиркага
берничә кисәк акбур яки мәрмәр салыгыз һәм аңа бераз сыегайтылган хлорид кислотасы
өстәгез.
2. Пробирканы тиз генә газүткәргеч көпшәле бөке белән каплагыз. Көпшәнең очын
2—3 мл известьле су салынган пробиркага төшерегез.
3. Газ уздыруны берничә минут дәвам иттерегез.
4. Газүткәргеч көпшәнең очын эремәдән чыгарып, аны дистиллирланган суда
чайкатыгыз. Шуннан соң көпшәне 2—3 мл дистиллирланган су салынган икенче пробиркага
төшерегез һәм аның аша газ уздырыгыз. Берничә минуттан көпшәне эремәдән алып,
табылган эремәгә берничә тамчы зәңгәр лакмус эремәсе тамызыгыз.
5. Пробиркага 2—3 мл натрий гидроксидының сыегайтылган эремәсен салыгыз һәм
аңа берничә тамчы фенолфталеин өстәгез. Әлеге эремә аша газ уздырыгыз.
Биремнәр. 1. Акбур яки мәрмәргә хлорид кислотасы белән тәэсир иткәндә нәрсә
күзәтелә? 2. Ни өчен известьле су аша газ уздырганда башта ул болганчыклана, аннан
соң йөзмә эри? 3. Углерод (IV) оксидын дистиллирланган су аша уздырганда нәрсә
күзәтелә? Тиешле реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган
ионлы рәвештә языгыз.
Карбонатларны танып белү. Дүрт пробиркада кристаллик матдәләр: натрий суль¬
фаты, цинк хлориды, калий карбонаты, натрий силикаты бирелгән. Һәр пробиркада
нинди матдә булуын билгеләгез.
Биремнәр. 1. Үткәргән тәҗрибәләргә нигезләнеп, карбонат-ионга характерлы
реакция турында нәтиҗә чыгарыгыз. 2. Реакцияләрнең тигезләмәләрен молекуляр,
ионлы һәм кыскартылган ионлы рәвештә төзегез.
Металларның гомуми үзлекләре
V БҮЛЕК
Билгеле булган элементларның күпчелеге (80 нән артыгы) — метал¬
лар. Металларның бик күп уртак үзлекләре бар, алар белән сез бу бүлектә
танышырсыз.
§ 34. Периодик таблицада металларның урыны
һәм аларның атом төзелешенең үзенчәлекләре
Уку материалын кабатлагыз (8 нче сыйныф, § 36).
Химик элементларның Д. И. Менделеев периодик таблицасында ме¬
таллар нинди урынны алып тора? Бу сорауга җавап биргәнче, башта
алардан шактый кимрәк булган неметалларның ничек урнашуын исегезгә
төшерегез.
27 нче таблицадан күренгәнчә, неметаллар башлыча периодик табли¬
цаның уң өлешендә өстә урнашканнар.
27 нче таблица. Химик элементларның периодик таблицасында
неметалларның урнашуы
^\Төркемнәр
ПериодларГ\_
I
II
III
IV
V
VI
VII
VIII
1
H
He
2
B
C
N
O
F
Ne
3
Si
P
S
Cl
Ar
4
As
Se
Br
Kr
5
Te
I
Xe
6
At
Rn
7
Металлар, нигездә, периодик таблицаның сул ягында һәм түбәнге өле¬
шендә, ягъни I, II һәм III төркемнәрдә урнашканнар.
Металл атомнарының тышкы энергетик дәрәҗәләрендә, гадәттә, бердән
алып өчкә кадәр электрон була. Аларның атомнары, кагыйдә буларак, зур
радиуслы. Металл атомнары, неметалл атомнарыннан аермалы буларак,
тышкы электроннарын җиңел бирәләр, ягъни көчле кайтаргычлар булып
торалар. Шуңа күрә металл атомнары уңай корылмалы ионнарга әвереләләр.
103
31 нче рәсем. Кристаллик челтәрләрнең төзелеше белән тиешле матдәләрнең механик
ныклыгы арасындагы бәйләнеш: 1 — атомлы челтәр; 2 — ионлы челтәр; 3 — металлик
челтәр
Атомнардан аерылып киткән электроннар металларның уңай корылмалы
ионнары арасында иркен күчәләр. Бу кисәкчекләр арасында бәйләнеш
туа, ягъни электроннар кристаллик челтәр төеннәрендәге уңай корылган
ионнарның аерым катламнарын цементлап куйган кебек итә. Электроннар
өзлексез хәрәкәттә булганга, алар уңай корылган ионнар белән бәрелеш¬
кәндә, ионнар нейтраль атомнарга, ә аннары яңадан ионнарга әвереләләр
һәм шулай дәвам итә.
Төеннәрендә уңай корылган ионнар һәм берникадәр санда нейтраль
атомнар булган һәм алар арасында чагыштырмача ирекле электроннар
хәрәкәт иткән кристаллик челтәрләр металлик кристаллик челтәрләр
дип атала (31 нче рәсем). Кристаллик челтәрне барлыкка китергән металл
ионнары арасында чагыштырмача ирекле электроннар барлыкка китергән
бәйләнешне металлик бәйләнеш дип атыйлар.
1—4 нче сорауларга җавап бирегез (112 нче бит).
§ 35. Металларның табигатьтә очравы һәм аларны
табуның гомуми ысуллары
Табигатьтә очравы. Җир кабыгында киң таралган металл булып алю¬
миний исәпләнә. Аннан соң тимер, кальций, натрий, калий, магний һәм
титан килә. Башка металларның микъдары күп түгел. Әйтик, мәсәлән,
СЕЗ
БЕЛӘСЕЗМЕ?
■
Борынгы заманда һәм Урта гасырларда нибарысы җиде
генә металл билгеле була. Бу сан ул вакытта билгеле
булган планеталар саны белән тәңгәл килә: Кояш (ал¬
тын), Юпитер (аккургаш), Ай (көмеш), Mapc (тимер),
Меркурий (терекөмеш), Сатурн (кургаш), Венера (бакыр).
Алхимиклар, әлеге металлар планеталарның нурлары
йогынтысында Җир астында хасил була, дип уйлаганнар.
104
1 2 нче схема
Җир кабыгында хром массасы буенча нибары 0,3%, никель — 0,2%, ә ба¬
кыр — 0,01% кына. Табигатьтә металлар ирекле хәлдә дә, шулай ук төрле
кушылмаларда да очрый (12 нче схема).
Табу ысуллары. Актив металларны (Na, K, Ca, Mg) электролиз белән
табалар (бу процесс 11 нче сыйныфта өйрәнелә). Активлыгы түбәнрәк
булган металларны аларның оксидларыннан күмер, углерод (II) оксиды
яки алюминий белән кайтаралар, ә металларның сульфидларын башта
яндыралар.
Берничә мисал китерик.
1. Металларны оксидларыннан ку мер яки углерод (II) оксиды белән
кайтару: . _
—I
+4 0 f +4 0
SnO2 + C —* CO2I1 + Sn
1
+3 +2 + +4 0
/ Fe2O3 + ЗСО 3CO2t + 2Fe
105
2. Металл сульфидларын яндырып, барлыкка килгән оксидларны кай-
таРУ: |—12е’^
2ZnS + ЗО2—^*2ZnO + 2SO2
У2<г I
+2 0++2. О
ZnO + C COt +Zn
3. Металларны оксидларыннан активрак металлар белән кайтару
(алюминотермия)'. 12е-
I I
+4 О t +3 О
3MnO2 + 4А1 2А12О3 + ЗМп
5—7 нче күнегүләрне үтәгез (112 нче бит). 1—2 нче мәсьәләләрне чишегез
(112 нче бит).
§36. Металларның физик үзлекләре
Металларның гомуми үзлекләре аларның кристаллик челтәрләре үзенә
бертөрле төзелешле булуы белән аңлатыла.
Металлик ялтыравык. Барлык компактлы металлар үзләренә хас ме¬
таллик ялтыравыкка ия. Бу үзлек металларның үз өслекләреннән яктылык
нурларын яхшы кайтаруы белән аңлатыла. Металлар шулай ук радио¬
дулкыннарны да кайтаралар. Бу күренеш самолетларны ерактан белүче
радиолокаторларда файдаланыла.
Электр үткәрүчәнлек һәм җылы үткәрүчәнлек. Металлар электрны
һәм җылыны яхшы үткәрәләр. Бу металлик челтәрләрдә ирекле хәрәкәт
итүче электроннар булуга бәйле, әлеге электроннар электр кырында
юнәлешле хәрәкәт алалар. Металларның электр үткәрүчәнлеге һәм җылы
үткәрүчәнлеге Hg нан Ag га кадәр арта:
Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag
Арзанлы металлардай электр тогын бакыр һәм алюминий яхшы үткәрә,
шуңа күрә ал арны электр үткәргечләр сыйфатында файдаланалар.
Чүкелүчәнлек һәм пластиклык. Күп кенә металлар пластик һәм яхшы
чүкелә, бу шулай ук металлик бәйләнешнең үзенчәлеге белән аңлатыла.
Металлик челтәрдә ионнар бер-берсе белән турыдан-туры бәйләнмәгән,
шуңа аларның аерым катламнары бер-берсенә карата ирекле күчә ала
(31 нче рәсем, 3). Металларның бу үзлегеннән аларны механик эшкәрткәндә
файдаланалар. Чагыштыру өчен 31 нче рәсемдә (1 һәм 2) атомлы һәм ионлы
кристаллик челтәрләр күрсәтелгән.
Күп кенә металларның (селтеле металлар, алтын, көмеш, бакыр) чүкелү-
чәнлеге нәрсә белән аңлатыла һәм аларның кайберләре (хром, марганец,
сөрмә) ни өчен бик уалучан? Иң уалучан металлар Д. И. Менделеев периодик
106
таблицасының V, VI, VII төркемнәрендә урнашкан. Бу элементларның
атомнарында биштән алып җидегә кадәр ирекле электроннар бар. Ирекле
электроннарның саны күп булу, ионнарның аерым катламнарының
ныклыгын тәэмин итә, аларның ирекле шуучанлыгына каршылык тудыра,
һәм, шул рәвешле, металларның пластиклыгы кими.
Металларның тыгызлыгы, катылыгы һәм эретелү температурасы
гаять тә төрле.
Мәсәлән, селтеле металлар — иң түбән тыгызлыкка, ә осмий иң югары
тыгызлыкка ия. Тыгызлыгы биштән түбәнрәк металларны шартлы рәвештә
җиңел металлар дип, ә тыгызлыгы биштән югары металларны авыр метал¬
лар дип йөртү кабул ителгән.
Катылыгы буенча металларны (катылыгы 10 итеп кабул ителгән) алмаз
белән чагыштыралар. Иң йомшаклары — селтеле металлар, ә иң катысы —
хром.
Иң түбән температурада эретелүчән металл — терекөмеш, ә иң югары
температурада эретелүчән металл — вольфрам.
8—9 нчы сорауларга җавап бирегез (112 нче бит).
§ 37. Металларның характерлы химик үзлекләре
Металларның иң уртак химик үзлекләре булып химик реакцияләрдә
аларның атомнары, валентлык электроннарын биреп, уңай корылган
ионнарга әверелә алулары исәпләнә, ягъни металлар реакцияләрдә
кайтаргычлар булып торалар.
Металлар электртискәрелекләре зур булган галогеннар, кислород һәм
күкерт белән көчле реагирлаимг.
п2е’~г
0 0 +2-1
Ca + Cl2—> CaCl2
I- 4e^
0 0 +2-2
2Mg + O2 * 2MgO
Г"4^
0 0 +1-2
2Na + S—>Na2S
Бу реакцияләрдә оксидлаштыргыч булып тиешле неметалл тора.
Металлар шулай ук водород ионнары һәм башка металларның ионнары
белән оксидлаша ала. Мәсәлән, сезгә металларның су, кислоталар һәм тоз
эремәләре белән реакцияләре таныш:
П2е’^
0+1 +1 0
2Na + 2НОН —» 2NaOH + H21
Zn + 2НС1 > ZnCl2 + H21
107
J—2e-~l
Zn + 2H+ * Zn2+ + H2 t
Fe + CuSO4 —* FeSO4 + Cu I
0 94- 94. 0 ,
Fe + Cu2+ * Fe2+ + Cu I
Реакцияләр тигезләмәләреннән күренгәнчә, оксидлаштыргычлар — во¬
дород ионнары һәм металл ионнары, ә кайтаргычлар — металл атомнары.
Ләкин барлык металл арның да кайтару сәләте бертөрле булмый. Әйтик,
мәсәлән, цинк водород ионнарын кайтара ала, ә бакыр кайтара алмый
(бакыр кислоталардан водородны этеп чыгара алмый).
Тимер бакыр ионнарын Cu2+ кайтара, әмма бакыр тимер ионнарын
Fe2+ кайтармый (бакыр тимерне аның тозларыннан этеп чыгармый).
Металларның нинди реакцияләрдә һәм нинди шартларда катнашуын алдан
белеп әйтү өчен, аларның кайтару сәләтләрен белергә кирәк.
Әгәр валентлык электроннарының кайбер изоляцияләнгән атомнар¬
дан аерылу энергиясен (ионлашу энергиясен) генә исәпкә алып эш итсәк,
металларны билгеле бер тәртиптә урнаштырырга мөмкин. Металларның
1865 елда рус галиме H. Н. Бекетов тәкъдим иткән мондый урнашуы,
ул заманда әле периодик закон да, атом төзелеше дә билгеле булмаса да,
аларның периодик таблицадагы урыннарына туры килә. Әйтик, мәсәлән,
селтеле металлардай иң зур ионлашу энергиясе литий атомнарында (ягъни
литийның активлыгы иң түбәне булырга тиеш), ә иң кечкенә ионлашу
энергиясе франций атомнарында.
Әгәр ионлашу энергиясен генә түгел, ә бәлки кристаллик челтәр¬
нең җимерелүенә тотылган энергияне дә, шулай ук ионнар гидратлаш-
канда аерылып чыккан энергияне дә исәпкә алсаң, металларны, алар¬
ның гидратлашкан ионнар хасил итү сәләтенә карап, түбәндәге тәртиптә
урнаштырырга кирәк:
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Pt, Au
Бу рәт металларның электрохимик көчәнешләр рәте, яки металлар¬
ның стандарт электродлар потенциаллары рәте дип атала. Бу рәттә иң
актив металл — литий. Металларның болай урнашуы периодик таблица
закончалыкларына каршы килмиме соң? Бу сорауга җавап бирү өчен,
шуны истә тотарга кирәк: металларны электрохимик көчәнешләр рәтендә
урнаштырганда исәпкә алынган өч фактордан берсе генә, ягъни ионлашу энер¬
гиясе генә металларның периодик таблицадагы урыны белән билгеләнә.
Шуңа күрә металларның электрохимик көчәнешләр рәтендәге урыны
һәрвакытта аларның периодик таблицадагы урынына туры килергә тиеш
дип уйларга нигез юк.
Ионлашу энергиясенең кыйммәтенә бәйле рәвештә, селтеле металлардай
литийның активлыгы иң түбәне булырга тиешлеге сезгә билгеле инде.
108
13 нче схема
109
Li
K
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Ni
Sn
Pb
(H2)
Cu
Hg
Ag
Pt
Au
Ирекле хәлдә
метилларның
кайтару сәләте
Арта
Нава кислороды
белән тәэсир
итешүе
Гадәти темпера¬
турада тиз
оксидлашалар
Гадәти температурада яки җылытканда
акрын оксидлашалар
Оксидлаш¬
мыйлар
Cy белән тәэсир
итешүе
Гадәти температу¬
рада H2 аерылып
чыга һәм гидрок¬
сид хасил була
Җылытканда H2 аерылып
чыга һәм
оксидлар хасил була
Судан H2 не этеп
чыгармыйлар
Кислоталар
белән тәэсир
итешүе
Сыегайтылган кислоталардан водородны
этеп чыгаралар (HNO3 тән башкалары)
Сыегайтылган
кислоталардан водород¬
ны этеп чыгармыйлар
Җылытканда
куерт, һәм
сыегайт. HNO3
һәм куерт.
H2SO4 белән
реагирла-
шалар
Кислота¬
лар белән
реагир-
лашмый-
лар,
«патша
аракы¬
сы »нда
эриләр
Табигатьтә
очравы
Кушылмаларда гына
Кушылмаларда һәм
ирекле хәлдә
Башлыча
ирекле
хәлдә
Табу ысуллары
Эретелмәләр
электролизы
Күмер, углерод (II) оксиды белән кайтару, алюмино¬
термия; тозларның судагы эремәләренең электролизы
Металл
ионнарының
оксидлаштыру
сәләте
Li+
K+
Ca2+
Na+
Mg2+
Al3+
Mn2+
Zn2+
Cr3+
Fe2+
Ni2+
Sn2+
Pb2+
(H)+
Cu2+
Hg2+
Ag+
Pt2+
Au3+
Арта
>
Әмма литий ионының радиусы натрий һәм калий ионнарыныкына
караганда, шактый кечерәк. Шуңа күрә литий ионнары тирәсендә барлыкка
килгән электр кыры натрий һәм калий ионнары янындагыга караганда
көчлерәк. Шуның аркасында литий ионнарының гидратлашуы натрий
һәм калий ионнары гидратлашуына караганда көчлерәк узачак. Нәтиҗәдә
литий ионнарының эремәгә күчү процессы интенсиврак бара, һәм аның
электрохимик көчәнешләр рәтендәге урыны шуның белән аңлатыла да.
Электрохимик көчәнешләр рәтендә сулдарак торган металл тозлар¬
ның эремәләреннән яки эретелмәләреннән үзеннән уңдарак урнашкан ме¬
таллны этеп чыгара. Бу рәттән файдаланып, мәсәлән, тимер бакырны аның
тозының судагы эремәсеннән этеп чыгара дип алдан ук әйтергә мөмкин.
Электрохимик көчәнешләр рәтенә шулай ук водород та кертелгән.
Бу нинди металлар кислота эремәләреннән водородны этеп чыгара алуы
турында нәтиҗә ясарга мөмкинлек бирә. Әйтик, мәсәлән, тимер кислота
эремәләреннән водородны этеп чыгара, чөнки ул аннан сулдарак урнаш¬
кан; бакыр исә водородны этеп чыгара алмый, чөнки ул аннан уңдарак
урнашкан.
13 нче схемада металларның электрохимик көчәнешләр рәтенә аңлатма
бирелгән. Мәсәлән, бу рәттән файдаланып, активрак металлар (Li, Na, К,
Ca) активлыгы түбәнрәк металларны тозларының судагы эремәсеннән этеп
чыгара ала дип еш кына, ялгыш фикер йөртәләр. Ләкин 13 нче схемадан
күренгәнчә, Li, Na, K, Ca металлары гадәти шартларда су белән реагирлаша.
Шулай булгач, тозларының судагы эремәсеннән металларны этеп чыгару
өчен әлеге металларны файдаланырга ярамый.
Бу схемада чагылдырылган закончалыклар шартлы. Әмма схема кайбер
химик процессларда ориентлашырга ярдәм итә.
Схема буенча реакцияләрнең узу шартларын гына түгел, бәлки
аларның характерын да белеп була. Мәсәлән, цинк су белән фәкать
югары температурада гына реагирлаша һәм нәтиҗәдә цинк оксиды хасил
була:
Zn + H2O ZnO + H2T
10—12 нче сорауларга җавап бирегез (112 нче бит) һәм 3 нче мәсьәләне чишегез
(112 нче бит).
§ 38. Эретмәләр
Эретелгән хәлдә металлар үзара җиңел катнашалар. Суытканда мондый
катнашма ката һәм аны барлыкка китергән металларда булмаган үзлекләргә
ия була. Металларның мондый каты катнашмаларын эретмәләр дип
атыйлар.
Эретелгән металларда шулай ук кайбер неметаллар да эрергә мөмкин,
мәсәлән, тимер эретелмәсендә углерод һәм кремний эри. Суытканда җиңел
110
Pyc химигы, академик. Эремәләрнең һәм
металлар эретмәләренең физик-химик ана¬
лизын эшли. Эретмәләр составын анализлау
өчен, ул яңа приборлар һәм яңа методлар
булдыра.
Курнаков
Николай
Семенович
(1860-1941)
эретелүчән, кыздыруга, кислотага чыдам һ. б. кирәкле үзлекләре булган
эретмә хасил була.
Эретмәләр составы һәм төзелеше белән аерылалар. Шуларның иң
әһәмиятлеләрен карап китик.
1. Эретелмәне суытканда беришле кристаллар хасил була. Аларның
кристаллик челтәрләренең төеннәрендә төрле металларның атомнары урна¬
ша. Бу очракта каты эремәләр хасил була.
2. Эретелмәне суытканда аерым металларның кристаллары аерылып
чыга. Бу очракларда эретмә металларның механик катнашмасын тәшкил
итә, шуның белән бергә, каты эремә хасил булмый.
3. Металлар бер-берсендә эрегәндә аларның атомнары үзара реагир-
лаша: интерметалл кушылмалар барлыкка килә. Эретелгән металларда
неметаллар эрегәндә шулай ук химик реакцияләр барырга мөмкин. Мәсәлән,
тимер атомнары углерод атомнары белән реагирлаша һәм чуенга катылык һәм
уалучанлык үзлеге бирүче тимер карбиды Fe3C — цементит хасил була.
Эретелгән хәлдә металларның, механик катнашып кына калмыйча, үзара
бер-берсе белән (һәм неметалл атомнары белән дә) төрле кушылмалар хасил
итә алу сәләте — нәкъ менә эретмәләрнең физик үзлекләре ни өчен үз
составындагы металларның үзлекләреннән нык аерылып торуын аңлаткан
сәбәпләрнең берсе. Әйтик, мәсәлән, бер өлеш кургаштан һәм ике өлеш
аккургаштан (припой) торган эретмә 180 oC температурада эретелә, ә шул
ук вакытта кургаш 328 0C та, ә аккургаш 2310C та эретелә.
Иң әһәмиятле эретмәләрнең берсе булган дюралюминий составына
95% Al, 4% Cu, 0,5% Mn һәм 0,5% Mg керә. Дюралюминий җиңел,
әмма алюминий һәм бакырдан шактый катырак. Аны самолет төзүдә
киң кулланалар. Тагын бик күп башка эретмәләр дә билгеле. Аларның
кайберләренең үзлекләре белән алга таба танышырбыз.
13—15 нче сорауларга җавап бирегез һәм 4 нче мәсьәләне чишегез (112 нче
бит).
Ill
1. Д. И. Менделеевның периодик таб¬
лицасында металлар ничек урнашканнар?
Ни өчен? Металларның атом төзелеше
неметалларның атом төзелешеннән нәрсә
белән аерыла?
2. Металл үзлекләре иң ачык чагыл¬
ган гади матдә атомнарының электрон
катлавының төзелеше:
1) 2,1 2) 2,2 3) 2,3 4) 2,4
3. Неметалл үзлекләре иң ачык ча¬
гылган гади матдә атомнарының элект¬
рон катлавының төзелеше:
1) 2,2 3)2,8,8,2
2) 2,8,2 4)2,8,18,8,2
4. Металларның кристаллик челтәре
төзелеше һәм үзлекләре буенча ионлы
һәм атомлы кристаллик челтәрләрдән
нәрсә белән аерыла?
5. Калий, магний, хром һәм цинк
металлары табигатьтә нинди кушылмалар
рәвешендә очрый? Бу кушылмаларның
химик формулаларын языгыз. Бу метал-
ларны ирекле хәлдә ничек табып була?
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
6. Төрле кайтаргычларны файдаланып,
тимер рудасыннан Fe2O3 өч ысул белән
тимер табыгыз. Реакцияләрнең тигез¬
ләмәләрен языгыз.
7. Тимер реакция нәтиҗәсендә кайта¬
рыла:
1) тимер (III) оксиды белән углерод
арасындагы реакциядә
2) бакыр (II) сульфаты белән тимер
арасындагы реакциядә
3) тимер (III) хлориды белән натрий
гидроксиды арасындагы реакциядә
4) тимер белән күкерт арасындагы
реакциядә.
8. Металларның гомуми физик үзлек¬
ләре ниндиләр? Бу үзлекләрне металлик
бәйләнеш турындагы күзаллауларга ни¬
гезләнеп аңлатыгыз.
9. Ни өчен кайбер металлар пластик
(мәсәлән, бакыр), ә икенчеләре — уалучан
(мәсәлән, сөрмә)?
10. Атомнар төзелеше турындагы күз¬
аллауларга нигезләнеп, металлар химик
үзлекләре буенча неметаллардан нәрсә
белән аерылуын аңлатыгыз.
11. Химик яктан бу ике металлның
кайсысы активрак: литиймы әллә нат¬
риймы? Металларның электрохимик кө¬
чәнешләр рәтендә литийны натрийдан
сулдарак урнаштыруны нәрсә белән аңла¬
тырга мөмкин?
12. Дәфтәрегезгә түбәндәге таблицаны
сызыгыз һәм тиешле графаларга прак¬
тик яктан узарга мөмкин булган реак¬
цияләрнең тигезләмәләрен языгыз; алар-
ның узу шартларын күрсәтегез (13 нче
схеманы карагыз).
Реагирлашучы
матдәләр
Металлар белән
гамәлдә узарга мөмкин
булган реакцияләрнең
тигезләмәләре
Na
Ca
Zn
Cu
Ag
O2
H2O
Pb(NO3)2 эре¬
мәдә
HCl
H2SO4
•
13. Эретмәләр барлыкка килү про¬
цессының асылын ачып бирегез. Ни
өчен эретмәләр үзләренең составындагы
металларга караганда катырак була?
14. Техникада ни өчен саф тимерне
түгел, ә аның эретмәсен киң кулланалар?
Производствода һәм көнкүрештә тимернең
нинди эретмәләрен кулланалар?
15. Төсле металларның үзегез белгән
эретмәләренең үзлекләрен һәм кулланы¬
лышын тасвирлагыз.
O 1. Бакыр һәм цинктан торган 12,9 г
эретмәне хлорид кислотасында «эреткән¬
дә» 2,24 л водород (н. ш.) табылган. Бу
эретмәдәге цинк һәм бакырның масса
өлешләрен (%) исәпләп чыгарыгыз.
2. Бакыр-алюминий эретмәсен 60 г
хлорид кислотасы белән (HCl ның масса
өлеше 10 % тәшкил итә) эшкәрткәннәр.
Аерылып чыккан газның массасын һәм
күләмен (н. ш.) исәпләп чыгарыгыз.
112
3. 34% аккургаш һәм 66% кургаштан
торган 500 г ябыштыргыч эретмә (при¬
пой) табу өчен, кургаш һәм аккургаш
оксидлары нинди массада кирәк булыр?
4. Алюминий һәм бакыр порошок¬
ларыннан торган 6 г катнашманы ар¬
тыграк алынган хлорид кислотасы белән
эшкәрткәннәр, бу вакытта 3,7 л водород
(н. ш.) аерылып чыккан. Катнашмадагы
һәр металлның масса өлешен (%) исәпләп
чыгарыгыз.
Лаборатор тәҗрибәләр
13. Металл үрнәкләрен карау. Сезгә бирелгән металл үрнәкләрен тышкы билгеләре
буенча тикшерегез. 1. Белешмә таблицалардан аларның эретелү температурасын һәм
катылыгын табыгыз.
2. Кыскыч ярдәмендә бер үк зурлыктагы кургаш һәм аккургаш кисәген утта тотыгыз
һәм бу металларның ничек эрүен күзәтегез. Ике металлның, мәсәлән тимер һәм
бакырның, җылы үткәрүчәнлеген чагыштыру өчен, бер үк зурлыктагы ике пластинка
алыгыз. Һәр ике пластинканың бер башына парафин кисәге урнаштырыгыз. Шуннан
соң бу пластинкаларны икенче башлары белән бер үк вакытта горелка ялкынына
кертегез.
Биремнәр. 1. Сезгә бирелгән металл үрнәкләрен тикшерегез һәм аларның исем¬
нәрен әйтегез. 2. Үзегез тикшергән металларны катылыгы, эретелү температурасы һәм
җылы үткәрүчәнлеге арта бару тәртибендә урнаштырыгыз.
14. Металларның тоз эремәләре белән тәэсир итешүе. Бер пробиркага
2—З.мл көмеш (I) нитраты эремәсе, икенчесенә — 2—3 мл бакыр (II) сульфаты эремәсе,
ә өченчесенә шул ук микъдарда алюминий нитраты эремәсе агызыгыз. Беренче
пробиркага — нечкә бакыр чыбык, икенчесенә — тимер вагы, ә өченчесенә бакыр вагы
салыгыз.
Биремнәр. 1. Һәр пробиркада нинди матдәләр хасил була? 2. Бу процессларда
нинди закончалык күренә? 3. Тиешле реакцияләрнең тигезләмәләрен молекуляр, ионлы
һәм кыскартылган ионлы рәвештә языгыз.
Химик элементларның
Д. И. Менделеев
периодик таблицасында
IA-ША-төркемнәр металлары
Vl БҮЛЕК
§ 39. Селтеле металларның характеристикасы
Периодик таблицада селтеле металларның урыны һәм аларның атом
төзелеше. Селтеле металлар литий Li, натрий Na, калий К, рубидий Rb,
цезий Cs һәм франций Fr Д. И. Менделеевның периодик таблицасында
I төркемнең төп төркемчәсендә (IA-төркемдә) урнашкан. Аларның практик
яктан иң әһәмиятлеләре — натрий һәм калий. Бу металларның атомнары
төзелешенең схемалары 28 нче таблицада бирелгән.
28 нче таблица. Натрий һәм калий атомнары
төзелешенең схемалары
Химик билгесе
Электроннарның энергетик
дәрәҗәләрдә урнашуы
Д Электронлы формуласы
Na
K
+11Na 2е~, 8е~, 1е~
+19К 2е“, 8е", 8е“, Ie-
Is2 I 2s22p6 I 3s1
...3s23p63d° I 4s1
Электроннарның орбитальләрдә урнашуы
Is2 2s2 2р6 3s1
3s2 Зр6 3d° 4s1
Башка селтеле металларның да атомнарының төзелеше шуңа охшаш.
Алар бары тик атом радиусының зурлыгы белән генә аерыла. Селтеле
металлар арасында литий Li атомы иң кечкенә радиуслы. Аның тышкы
s-электроны икенче энергетик дәрәҗәдә урнашкан. Франций атомы иң
зур радиуслы. Аның тышкы s-электроны җиденче энергетик дәрәҗәдә
урнашкан.
114
Инглиз галиме. 1808 елда тозларны һәм
селтеләрне электролизлау юлы белән калий,
натрий, барий, кальций, стронций һәм маг¬
ний амальгамаларын таба. Башка күп кенә
фәнни хезмәтләре бар.
Дэви Хэмфри
(1778-1829)
Химик реакцияләрдә селтеле металларның атомнары тышкы элект¬
ронын бирә һәм барлык кушылмаларда +1 оксидлашу дәрәҗәсен күрсәтә.
Атомнарының зурлыгы арта баруга бәйле рәвештә литийдан алып фран-
цийга кадәр атомнарның ионлашу энергиясе кими һәм, кагыйдә буларак,
аларның химик активлыклары арта.
1—2 нче күнегүләрне үтәгез (118 нче бит). 1 нче мәсьәләне чишегез (119 нчы
бит).
Табигатьтә очравы. Селтеле металларның кушылмаларыннан табигатьтә
натрий һәм калий кушылмалары гына киң таралган (29 нчы таблица).
29 нчы таблица. Натрий һәм калийның иң әһәмиятле
табигый кушылмалары
Минералның исеме
Химик формуласы
Төп чыганаклары
Натрий хлориды
Натрий сульфаты
(мирабилит, глаубер
тозы)
Сильвинит
Карналлит
NaCl
Na2SO4 • IOH2O
NaCl • KCl
KCl • MgCl2 • 6Н2О
Эльтон һәм Баскунчак тозлы күл¬
ләре, Соликамск
Кара-Богаз-Гол култыгы (Төрек-
мәнстан), Зур Тозлы күл (AKIII)
Соликамск һ. б.
Соликамск, Штасфурт (ГФР) һ. б.
Калий тозлары үсемлекләр үсешендә гаять зур әһәмияткә ия (66 нчы
бит).
Башка селтеле металларның кушылмалары сирәк очрый. Франций
ясалма рәвештә төш реакцияләре вакытында табыла.
Табу. Натрий һәм калийны эретелгән хлоридларны яки гидроксидларны
электролизлау юлы белән табалар (11 нче сыйныф).
Физик үзлекләре. Барлык селтеле металлар да бик аз гына икенче
төсмерләр сизелеп торган көмешсыман-ак төстә, җиңел, йомшак һәм ансат
эретелүчән. Аларның катылыгы һәм эретелү температурасы литийдан
цезийга таба закончалыклы рәвештә кими бара.
115
Химик үзлекләре. Селтеле металлар — көчле кайтаргычлар. Алар
барлык неметалл ар белән, водородны да кертеп, көчле реагирлашалар. Бу
реакцияләрнең схемаларын тикшерик (селтеле металл Me хәрефләре белән
күрсәтелгән):
+ Cl +1 -1
рЦр >2 Me Cl
+ S+i i > Me2 S
2 Me0 -=^- +2НС1 > 2 Me Cl + H21
+ 2^oh > 2 Me OH + H21
O 2
I тт +1-1
>2 Me H
Янганда, кислород белән реакциягә кереп, литий гына оксид хасил
итә:
р4е--^ •
O O +1-2
4Li + O2 —> 2Li2O
литий
оксиды
Калган селтеле металлар пероксидлар хасил итәләр, мәсәлән:
Г2е~~1
0 0 +1-1
2Na + O2 —» Na2O2
натрий
пероксиды
+1 -1
Пероксидлар — водород пероксидының H9O9 тозлары булып торалар. Пе-
+1-1 -1 +1
роксидларда кислородның оксидлашу дәрәҗәсе -1 гә тигез (Na—O—O—Na).
Натрий һәм калий кушылмаларын танып белү өчен, 3 нче таблицадан
файдаланырга мөмкин (14—15 нче битләрне карагыз).
Селтеле металларның активлыгын исәпкә алып, аларны керосин астында
саклыйлар, чөнки керосин белән алар реагирлашмый.
Куллану. Натрий, мәсәлән, төсле металлургиядә кайтаргыч сыйфатында,
төш реакторларында җылыйөрткеч сыйфатында кулланыла. Натрийны
шулай ук кайбер органик матдәләрне синтезлаганда (синтетик каучук
тапканда) катализатор итеп тә файдаланалар.
Селтеле металлар, аеруча цезий, хәтта яктылык тәэсиреннән дә уңай
корылган ионнарга әверелергә сәләтле. Бу үзлек яктылык энергиясен электр
энергиясенә әверелдерү приборларында — фотоэлементларда һәм автоматик
аппаратлар җитештерүдә файдаланыла. Яктыртканда цезийның өслегеннән
электроннар аерылып китә, чылбыр йомыла һәм аппарат үзеннән-үзе эшли
башлый.
3—9 нчы сорауларга җавап бирегез (118 нче бит) һәм 2—3 нче мәсьәләләрне чишегез
(119 нчы бит).
116
14 нче схема
Селтеле металларның промышленностьта табыла торган иң әһәмиятле
кушылмалары. Гидроксид лар. Гидроксидларның гомуми формуласы ROH.
Алар тиешле хлоридларның судагы эремәләрен электролизлау нәтиҗәсендә
табыла (И нче сыйныф). Болар — ак кристаллик матдәләр, суда яхшы
эрүчән, типик селтеләр. Аеруча натрий һәм калий гидроксидларының
практик әһәмияте зур (14 нче схема).
I Оксидлар һәм пероксидлар. Оксидлар һәм пероксидларның гомуми
формулалары R2O һәм R2O2. Натрий пероксиды практик әһәмияткә ия.
Аны металлик натрийны яндырып табалар. Натрий пероксиды угле¬
род (IV) оксидын йота:
2Na9O, + 2С0, * 2Na9CO, + О,
Бу үзлекне су асты көймәләрендә һәм космик корабльләрдә һаваны
регенерацияләү өчен файдаланалар.
117
Әгәр натрий пероксидына салкын сульфат кислотасы белән тәэсир итсәң,
водород пероксиды хасил була:
Na2O2 + H2SO4 > Na2SO4 + H2O2
Л Натрий һәм аның әһәмиятле кушылмалары арасындагы генетик
бәйләнеш 15 нче схемада күрсәтелгән.
15 нче схема
Сорауларга җавап бирегез, 10—11 нче күнегүләрне үтәгез һәм 4 нче мәсьәләне
чишегез (118—119 нчы битләр).
1. Рубидий Rb атомы төзелешенең схе¬
масын сызыгыз. Аны натрий һәм цезий
атомнары төзелешенең схемалары белән
чагыштырыгыз.
2. Атом массасы 23, ә төшендәге нейт¬
роннар саны 12 булган химик элементның
периодик таблицадагы урыны:
1) 3 нче периодта, 1Б-төркемдә
2) 4 нче периодта, ША-төркемдә
3) 4 нче периодта, УПБ-төркемдә
4) 3 нче периодта, 1А-төркемдә
3. Сез натрий һәм калий кушылмала¬
рының иң әһәмиятле нинди чыганакларын
беләсез?
4. Биология һәм химия курсларыннан
алган мәгълүматлардан файдаланып, ка¬
лийның үсемлекләр тереклегендәге ролен
тасвирлагыз.
5. Ни өчен барлык селтеле металлар
көчле кайтаргычлар?
6. Нинди элементларның атомнары
көчлерәк кайтаргычлар: селтеле метал-
ларныкымы әллә водородныкымы? Җава¬
быгызны дәлилли торган реакцияләрнең
тигезләмәләрен төзегез.
7. Фотоэлементларда ни өчен цезий¬
ны литийга караганда күбрәк куллана¬
лар?
8. Селтеле металларның су белән
һәм кислоталар белән реакцияләрен ча¬
гыштырыгыз. Тиешле реакцияләрнең
тигезләмәләрен төзегез һәм электроннар
күчешен күрсәтегез.
9. * Нинди үзлекләренә нигезләнеп,
пероксидларның — водород пероксидының
тозлары булуы турында нәтиҗә ясарга
мөмкин?
10. Селтеле металларның гидроксид-
ларыннан кайсысы — иң көчсез, ә кай¬
сысы иң көчле электролит? Ни өчен?
11. 15 нче схемага туры килгән реак¬
цияләрнең тигезләмәләрен языгыз.
118
9 1. 0,1 масса өлеше, яки 10%, сульфат
кислотасыннан торган 196 г эремәне
нейтральләштерү өчен 0,1 масса өлеше,
яки 10% натрий гидроксидыннан торган
эремә ничә грамм кирәк?
2. 15 г техник аш тозын куертылган
сульфат кислотасы белән эшкәрткәндә
5,6 л газ (н. ш.) аерылып чыккан. Аш
тозындагы катышмаларның масса өлешен
(%) исәпләп чыгарыгыз.
3. 0,32 масса өлеше, яки 32%, калий
гидроксидыннан торган 100 мл эремә аша
(р = 1,32 г/см3), 18 л метанны яндырганда
(н. ш.) аерылып чыккан барлык угле¬
род (IV) оксидын уздырганда, нинди тоз
табыла һәм күпме?
4. Һәр 20 молекула суга бер молекула
натрий гидроксиды туры килгән эремә
табу өчен, натрий гидроксиды белән
суны нинди масса чагыштырмаларында
катнаштырырга кирәк?
§ 40. Химик элементларның периодик таблицасында
магний һәм кальцийның урыны, аларның атом
төзелеше
Магний һәм кальций периодик таблицада II төркемнең төп төркемчәсендә
(ПА-төркемдә) урнашкан. Аларның атомнары төзелешенең схемалары
30 нчы таблицада бирелгән.
30 нчы таблица. Магний һәм кальций атомнары төзелешенең
схемалары
Химик билгесе
Электроннарның энергетик
дәрәҗәләрдә урнашуы
A Электронлы формуласы
Mg
Ca
+12Mg 2е~, 8е~, 2е
+20Са 2е , 8е , 8е~, 2е~
Is2 I 2s22P6 I 3s2
...3s23p63d° I 4s2
Электроннарның орбитальләрдә урнашуы
Is2 2s2 2р6 3s2
U2Mg
3s2 Зр6 3d°
4s2
119
СЕЗ
БЕЛӘСЕЗМЕ?
Табигатьтә кальций тозларының әйләнеше нәтиҗәсендә
карст мәгарәләре ясала, ә аларның гөмбәзләрендә хик¬
мәтле сталактитлар асылынып төшә. Андый мәгарәләрнең
мисалы — Яңа-Афон мәгарәсе. Сезнең төбәктә андый
мәгарәләр юкмы?
Схемадан күренгәнчә, магний һәм кальцийның соңгы электроннары
тышкы энергетик дәрәҗәләрдә урнашалар. Магний һәм кальцийның бар¬
лык кушылмаларда да +2 оксидлашу дәрәҗәсен күрсәтүе шуның белән
аңлатыла.
1—2 нче сорауларга җавап бирегез (125 нче бит).
§ 41. Кальций һәм аның кушылмалары
Табигатьтә очравы. Кальций зур химик активлыкка ия, шуңа күрә
табигатьтә кушылмалар хәлендә генә очрый (31 нче таблица).
31 нче таблица. Кальцийның иң әһәмиятле табигый кушылмалары
Минералның исеме
Төп состав өлешенең химик формуласы
Известьташ, мәрмәр, акбур
Гипс
Фосфорит һәм апатит
Доломит
CaCO3
CaSO4 • 2Н2О
Ca3(PO4)2
CaCO3 • MgCO3
Табу. Кальцийны аның эретелгән хлоридыннан электролиз юлы белән
табалар.
Физик үзлекләре. Кальций — көмешсыман-ак төстәге металл, селтеле
металлар кебек үк бик җиңел (р = 1,55 г/см3), әмма алардан күпкә катырак
һәм эретелү температурасы шактый ук югары, 851 oC ка тигез.
Химик үзлекләре. Селтеле металл кебек кальций да — көчле кайтаргыч,
схемада аны болай күрсәтергә мөмкин:
120
+2 -1
CaCl2
+2 -2
CaS
+2-1 О
CaCl2 + H2T
+2 О
Ca(OH)2+ H2T
+2 -1
CaH2
+2 -2
CaO
Кальцийның кушылмалары ялкынны кызыл кирпич төсенә кертә.
Селтеле металлар кебек, металлик кальцийны, гадәттә, керосин астында
саклыйлар.
Куллану. Металлик кальцийның химик активлыгы зур булу сәбәпле,
аны кайбер авыр эретелүчән металларны (титан, цирконий һ. б.) аларның
оксидларыннан кайтару өчен кулланалар. Кальцийны шулай ук корыч һәм
чуен кою производствосында, аларны кислородтан, күкерт һәм фосфордан
чистарту өчен, кайбер эретмәләрне, мәсәлән подшипниклар ясауда кирәкле
кургаш-кальций эретмәсен табу өчен кулланалар.
3—7 нче сорауларга җавап бирегез (125 нче бит). 1—2 нче мәсьәләләрне чишегез
(125 нче бит).
Кальцийның промышленностьта табыла торган әһәмиятле кушыл¬
малары. Промышленностьта кальций оксидын известьташны кыздырып
табалар: t
CaCO4 > CaO + CO91
«5 Z
Кальций оксиды — ак төстәге, авыр эретелә торган (2570 oC та эретелә)
матдә, актив металларның нигез оксидларына хас химик үзлекләргә ия
(8 нче сыйныф, § 30).
Кальций оксидының су белән реакциясе күп микъдарда җылылык
аерылып чыгу белән бара:
CaO + H2O = Ca(OH)2 + Q
Кальций оксиды — сүндерелмәгән известьнең, ә кальций гидроксиды
сүндерелгән известьнең төп состав өлешен тәшкил итә.
Кальций оксидының су белән реакциясе известьне сүндерү дип атала.
Кальций оксиды башлыча сүндерелгән известь табу өчен кулланыла.
Кальций гидроксиды Ca(OH)2 зур практик әһәмияткә ия. Ул сүндерелгән
известь, известь сөте һәм известьле су рәвешендә кулланыла.
Сүндерелгән известь — бик вак көпшәк порошок, гадәттә, соры төстә
була (аның состав өлеше — Ca(OH)2), суда аз эри (1 л суда 20 oC та 1,56 г
121
эри). Сүндерелгән известьнең цемент, су һәм ком белән камырсыман измәсе
төзелештә кулланыла. Әлеге катнашма акрынлап ката:
Ca(OH)2 + CO2 —♦ CaCO3 J + H2O
Известь сөте — сөткә охшап торган йөзмә (суспензия). Ул артыгы белән
алынган сүндерелгән известькә су катнаштырганда хасил була. Известь
сөтен шикәр җитештергәндә, үсемлек авыруларына каршы көрәшү һәм агач
кәүсәләрен агарту өчен кирәкле катнашмалар әзерләгәндә, хлорлы известь
табуда кулланалар.
Известьле су — кальций гидроксидының үтә күренмәле эремәсе, известь
сөтен фильтрлаганда табыла. Аны лаборатория шартларында углерод (IV)
оксиды барлыгын белү өчен файдаланалар:
Ca(OH)2 + CO2 > CaCO31 + H2O
Углерод (IV) оксидын озаклап уздырганда эремә үтә күренмәлегә
әйләнә:
CaCO3 + CO2 + H2O > Ca(HCO3)2
Әгәр табылган кальций гидрокарбонатының үтә күренмәле эремәсен
җылытсаң, ул яңадан болганчыклана:
Ca(HCO3)2 CaCO31 + H2O + CO21
Мондый процесслар табигатьтә дә бара. Әгәр эрегән углерод (IV) ок¬
сиды булган су, известьташка тәэсир итсә, бу вакытта кальций кар¬
бонатының берникадәр өлеше кальций гидрокарбонаты эремәсенә әверелә.
Өске катламнарда эремә җылына, һәм аннан яңадан кальций карбонаты
утырымга төшә.
I Хлорлы известьнең практик әһәмияте зур. Ул сүндерелгән известь хлор
белән реакциягә кергәндә табыла:
O +1 -1
2Са(ОН)2 + 2С12г—* Ca(ClO)2 + CaCl2 + 2Н2О
кальций
гипохлориты
Хлорлы известьнең тәэсир итүче состав өлеше — кальций гипохло¬
риты.
Гипохлоритлар гидролизга дучар ителә. Гидролиз нәтиҗәсендә гипо¬
хлорит кислотасы аерылып чыга. Гипохлорит кислотасын аның тозыннан
хәтта карбонат кислотасы да этеп чыгара ала:
Ca(ClO)2 + H2O + CO2 ♦ CaCO31 + 2НС10
Хасил булган гипохлорит кислотасы тотрыксыз һәм ул җиңел тар¬
кала: +1 2 j 0
2НС10 > 2НС1 + O21
Хлорлы известьнең бу үзлеген агарту, дезинфекцияләү өчен киң кул¬
ланалар.
122
Гипс. Гипсның түбәндәге төрләре бар: табигый гипс — CaSO4 • 2Н2О,
яндырылган гипс — (CaSO4)2 • H2O, сусыз гипс — CaSO4.
Яндырылган (ярымсулы) гипсны, яки алебастрны, (CaSO4)2 • H2O таби¬
гый гипсны 150—180 oC ка кадәр җылытып табалар:
2[CaSO4 • 2Н2О] -U (CaSO4)2 • H2O + ЗН2О t
табигый гипс яндырылган гипс
Әгәр алебастр порошогын су белән катнаштырсаң, тиз катучан ярым-
сыек пластик масса барлыкка килә. Кату процессы су кушылу белән
аңлатыла:
(CaSO4)2 • H2O + ЗН2О —* 2[CaSO4 • 2Н2О]
Яндырылган гипсның кату үзлегеннән практикада файдаланалар. Әйтик,
мәсәлән, алебастрның известь, ком һәм су белән катнашмасын штукатурка
сыйфатында кулланалар. Чиста алебастрдан сәнгать әйберләре ясыйлар,
ә медицинада гипслы бәйләвечләр салу өчен файдаланалар.
Табигый гипсны CaSO4 • 2Н2О югарырак температурада җылытканда суы
тулысынча аерылып чыга:
CaSO4 • 2Н2О -U 180 °с» CaSO4 + 2Н2О T
Барлыкка килгән сусыз (коры) гипс CaSO4 үзенә суны башка куша
алмый, һәм шуңа күрә аны үле гипс дип атыйлар.
8—12 нче сорауларга җавап бирегез (125 нче бит). 3 нче мәсьәләне чишегез
(125 нче бит).
Суның катылыгы һәм аны бетерү ысуллары. Яңгыр суында сабын¬
ның яхшы күбекләнүен һәркайсыбыз белә (йомшак су), ә чишмә суын¬
да начар күбекләнә (каты су). Каты суны анализлау аның составында
шактый микъдарда кальций һәм магнийның эрүчән тозлары булуын
күрсәтә. Бу тозлар, сабын белән кушылып, эреми торган кушылмалар хасил
итәләр. Мондый су эчке янулы двигательләрне суыту һәм пар казаннарына
бирү өчен яраксыз, чөнки каты суны җылытканда суыту һәм җылыту
системаларының стеналарына юшкын утыра. Юшкын җылыны начар
үткәрәч шул сәбәпле моторлар һәм пар казаннары артык нык кызарга
мөмкин; шуның өстенә алар тизрәк туза.
Суның катылыгының нинди төрләре була соң?
Карбонатлы, яки вакытлы катылык кальций һәм магний гидрокар-
бонатлары булуга бәйле. Аны түбәндәге ысуллар белән бетереп була:
1) кайнатып:
Ca(HCO3)2 CaCO3 ! + H2O + CO21
Mg(HCO3)2 -U MgCO31 + H2O + CO2 Г
2) известь сөте яки сода белән тәэсир итеп:
Ca(OH)2 + Ca(HCO3)2 * 2СаСО31 + 2Н2О
123
Ca(HCO3)2 + Na2CO3 —* CaCO31 + 2NaHCO3
Ca2+ + 2HCO3 + 2Na+ + CO^ > CaCO3 ! + 2Na+ + 2HCO3
Ca2+ + CO3- —> CaCO31
Карбонатсыз, яки даими катылык кальций һәм магний сульфатлары
һәм хлоридлары булуга бәйле. Аны сода кушып бетерәләр:
CaSO4+ Na2CO3 —> CaCO31 + Na2SO4
MgSO4+ Na2CO3 * MgCO31 + Na2SO4
Mg2+ + SO2- + 2Na+ + С0|- —> MgCO31 + 2Na+ + SO2-
Mg2+ + со|- —* Mgco3;
Суның катылыгын махсус реагентлар — ионалмаштыргыч сумалалар
(ионитлар) ярдәмендә дә бетерәләр. Бу вакытта кальций һәм магний
ионнары — сумала составына, ә сумаладан H+ яки Na+ ионнары эремәгә
күчә һәм, шулай итеп, су йомшара, аның катылыгы кими.
Карбонатлы һәм карбонатсыз катылык бергә суның гомуми катылыгын
тәшкил итә.
13—14 нче сорауларга җавап бирегез (125 нче бит). 4 иче мәсьәләне чишегез
(125 нче бит).
▲ Кальций һәм аның мөһим кушылмалары арасындагы генетик бәйләнеш
16 нчы схемада күрсәтелгән.
16 нчы схема
15 нче күнегүне үтәгез (125 нче бит).
124
1. Периодик таблицага һәм атом төзе¬
леше турындагы күзаллауларга нигезлә¬
неп, магний һәм кальцийның нинди үз¬
лекләре уртак булуын аңлатыгыз. Тиешле
реакцияләрнең тигезләмәләрен төзегез.
2. Периодик таблицада кальций калий
белән янәшә урнашса да, аның химик үз¬
лекләре башка период элементы булган
натрий үзлекләренә якын. Ни өчен? Аң¬
латып бирегез.
3. Составында кальций булган нинди
минералларны беләсез? Аларны ничек
файдаланалар?
4. Түбәндәге табигый минералларны:
известьташ, гипс һәм фосфоритны бер-бер-
сеннән ничек аерып була? Реакцияләрнең
тигезләмәләрен төзегез.
5. Магний һәм хлорид кислотасы ара¬
сындагы реакция:
1) кушылу реакциясе
2) алмашу реакциясе
3) таркалу реакциясе
4) алмаштыру реакциясе
6. Металлик кальций литийдан ка¬
тырак, әмма бериллийдан йомшаграк.
Моны аларның металлик челтәрләренең
төзелешенә нигезләнеп ничек аңлатырга
мөмкин?
7. Тышкы тирәлек тәэсирендә метал¬
лик кальций кальций карбонатына әве¬
релә. Тиешле реакцияләрнең тигезләмә¬
ләрен төзегез.
8. Сүндерелгән известьне төзелештә
файдаланганда, ул нинди әверелешләр уза?
1. 50 кг саф кальций карбонатын
кыздырганда, аның массасы 4,4 кг га
кимегән. Кальций карбонатының ничә
проценты таркалган?
2. Оксидлашу дәрәҗәсе +2 булган 8 г
металл су белән реагирлашканда 4,48 л
водород (н. ш.) аерылып чыга. Металлның
чагыштырма атом массасын табыгыз һәм
аның исемен әйтегез.
3. Массасы 2,76 г булган поташны
(техникада кулланыла торган калий
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
9. Дәфтәрегезгә түбәндәге таблицаны
сызыгыз һәм аңа тиешле реакцияләрнең
тигезләмәләрен языгыз:
Реактив
Химик үзлекләре
CaO
Ca(OH)2
CO2
N2O5
HCl
H3PO4
10. Кальций оксидыннан известьле
суны ничек әзерлиләр? Ни өчен яңа
әзерләнгән известьле суны гына кулла¬
нырга киңәш ителә? Җавабыгызны реак¬
цияләрнең тигезләмәләре белән аңла¬
тыгыз.
11. Алебастр белән су катнашмасының
кайчак начар катуын ничек аңлатырга?
12. Кальций карбонаты суда эреми.
Шуңа да карамастан известьташлар су
белән юыла. Моны нәрсә белән аңлатып
була? Тиешле реакцияләрнең тигезлә¬
мәләрен төзегез.
13. Ни өчен каты суны машина дви¬
гательләрен суыту өчен кулланырга яра¬
мый? Җавабыгызны реакция тигезләмәсе
белән дәлилләгез.
14. Суның катылыгын бетерү ысул¬
лары ниндиләр? Тиешле реакцияләрнең
тигезләмәләрен языгыз.
15. 16 нчы схема буенча реакция¬
ләрнең тигезләмәләрен төзегез.
карбонаты) 2000 г сүндерелгән известь
эремәсе белән эшкәрткәннәр. Поташны
эшкәртүгә тотылган сүндерелгән из-
вестьнең массасын һәм эремәдәге
Ca(OH)2 нең масса өлешен (%) исәпләп
чыгарыгыз.
4. Каты суның бирелгән үрнәге сос¬
тавында 100 мг/л кальций гидрокар-
бонаты һәм 30 мг/л кальций сульфаты
бар. 1 м3 шундый суны йомшарту өчен,
күпме натрий карбонаты кирәк булыр?
125
§ 42. Алюминий
Периодик таблицада алюминийның урыны һәм аның атом төзелеше.
Алюминий III төркемнең төп төркемчәсендә (ША-төркемдә) урнашкан.
Электроннарның энергетик дәрәҗәләрдә урнашу схемасы түбәндәгечә:
+1,А1 2е~, 8е~, Зе~
Алюминий атомнарының тышкы дәрәҗәсендә өч электрон булганлыктан,
кушылмаларда алюминий +3 оксидлашу дәрәҗәсен күрсәтә.
▲ Атомнарда электроннар хәрәкәтенең характеры һәм аларның энергетик
дәрәҗәләрдә генә түгел, бәлки, кече дәрәҗәләрдә дә урнашуы турындагы
күзаллауларга таянып та шундый ук нәтиҗәгә киләбез. Алюминий ато¬
мында 3§2-электроннар аерылып, бер электрон Зр-орбитальгә күчә:
Нәтиҗәдә өч парлашмаган электрон барлыкка килә.
1 нче күнегүне үтәгез (130 нчы бит).
Алюминийның табигатьтә очравы, аны табу һәм аның үзлекләре. Алю¬
миний Җир кабыгында таралуы буенча өченче урында тора. Ул кушылмаларда
гына очрый. Аларның иң әһәмиятлеләре 17 нче схемада күрсәтелгән.
Табу. Алюминийны немец химигы Ф. Вёлер 1827 елда алюминий хлори¬
дын селтеле металлар K яки Na белән һава кертмичә җылытканда таба:
+3 O f +1 O
AlCl3 + ЗК ЗКС1 + Al
Алюминийны промышленность максатында бу метод белән табу икъти¬
сади яктан файдасыз, шуңа күрә алюминийны бокситлардан табуның
электрохимик методы эшләнә.
Физик үзлекләре. Алюминий — көмешсыман-ак төстәге җиңел металл
(р = 2,7 г/см3), 660 oC та эретелә. Ул бик пластик, аны чыбык итеп сузып
та, табаклы һәм фольга итеп җәеп тә була. Электр үткәрүчәнлеге буенча
алюминий көмеш һәм бакырдан гына калыша (ул бакырның электр үткә-
рүчәнлегенең 2/^ сен тәшкил итә).
Галлий 30 0C тан аз гына түбәнрәк температурада эри,
шуңа күрә аны уч төбендә дә эретеп була.
Кытай фәннәр академиясенең гамәли физика институты
б. э. кадәр 297 елда күмелгән полководец Чжоу-Чжу төр¬
бәсен (бина сыман эшләнгән зиннәтле кабер) тикшерү
нәтиждләрен игълан итте. Спектраль анализ күрсәтүенә
караганда, аның орнаменты составында 10% бакыр,
5% магний һәм 85% алюминий булган эретмәдән тора.
СЕЗ
БЕЛӘСЕЗМЕ?
126
17 нче схема
* Al2O3 нең кызыл төстәге кристаллары — рубин, зәңгәр төстәгесе — сапфир.
32 нче рәсем. Амаль¬
гамаланган алюминий
чыбык: 1 — һавада;
2 — суда
Химик үзлекләре. Металларның электрохимик көчәнешләр рәтендә
алюминий иң актив металлардай соң урнаша. Әмма көндәлек тормыштан
шунысы билгеле: алюминий әйберләргә (савыт-сабалар һ. б. га) кислород
та, су да хәтта кайнау температурасында да тәэсир
шулай ук куертылган салкын нитрат кислотасы да
тәэсир итми. Бу исә алюминийның өслегендә аны
оксидлашудан саклый торган юка оксид элпәсе булуы
белән аңлатыла. Әгәр алюминий өслегенә терекөмеш
тозы сөртсәң, мондый реакция бара:
0+2 +3 O
2А1 + SHgCl2 —> 2А1С13 + 3Hg
Аерылып чыккан терекөмеш алюминийны эретә,
һәм алюминий белән терекөмеш эретмәсе — алюминий
амальгамасы барлыкка килә. Амальгамаланган
өслектә элпә тормый, шуңа күрә алюминий су белән
гадәти шартларда реагирлаша (32 нче рәсем):
0+1 +3 0 .
2А1 + 6Н0Н > 2А1(ОН)3 I + ЗН2 t
итми. Алюминийга
СЕЗ
БЕЛӘСЕЗМЕ?
Алюминийны табуның хәзерге ысулы америкалы Ч. Холл
һәм француз П. Эру тарафыннан 1886 елда уйлап табыла.
Ачыш көнендә Ч. Холл, 22 яшьлек химик, кулына унике
кечкенә алюминий шар тотып, лабораториягә килеп керә
һәм бу металлны күп итеп арзанлы җитештерү ысулын
табуы турында белдерә.
1854 елда 1 кг алюминийның бәясе 1200 сум, ягъни кө¬
мештән 270 тапкыр кыйммәтрәк, ә 1899 елда 1 сум була.
Моны нәрсә белән аңлатырга мөмкин, уйлап карагыз әле.
127
Югарырак температурада алюминий күп кенә неметаллар һәм катлаулы
матдәләр белән амальгамаланмыйча реакциягә керә:
о
2 Al
+3(0]
6е-
+ЗС12
O
+3S
+1 -1
+6НС1
+2
+SCuSO4
+ 2NaOH + 6H2O
+3 -2
Al2O3
+3 -1
2 AlCl3
+3 -2
■ Al2 S3
2 AlCl3+3 H2T
+з о
Al2CSO4 )3 + ЗСи!
2 NalAl(OH)4] + 3H2t
натрий тетра-
гидроксоалюминаты
Куллану. Алюминий төрле эретмәләр җитештерү өчен кулланыла. Иң
күп кулланыла торган эретмә — составында бакыр һәм магний булган
дюралюминнар, һәм алюминийның кремний белән эретмәсе — силуминнар.
Бу эретмәләрнең төп өстенлекләре — аларның җиңел һәм бик нык бу¬
луында. Әле искә алынган эретмәләр авиациядә, автомобиль, суднолар һәм
приборлар төзүдә, ракета техникасында һәм төзелештә киң кулланыла. Саф
металл хәлендә алюминий электрүткәргечләр һәм төрле химик аппарату¬
ралар җитештерүгә китә.
Алюминийны шулай ук алитирлау, ягъни коррозиядән саклау макса¬
тында, корыч һәм чуен әйберләрнең өслеген алюминий белән туендыру
өчен файдаланалар.
Практикада еш кына термит (тимер оксиды Fe3O4 белән алюминий
порошогы катнашмасы) кулланыла. Әгәр бу катнашманы яндырсаң (маг¬
ний тасма ярдәмендә), бик көчле реакция бара. Реакция вакытында күп
микъдарда җылылык аерылып чыга:
8А1 + SFe3O4 —♦ 4А12О3 + 9Fe
Бу процессны термит белән эретеп ябыштырганда, шулай ук кайбер
метал ларны ирекле хәлдә табу өчен файдаланалар.
2—6 нчы сорауларга җавап бирегез (130 нчы бит). 1—2 нче мәсьәләләрне чишегез
(131 нче бит).
Алюминийның әһәмиятле кушылмалары. Алюминий оксидын Al2O3
түбәндәге ысуллар белән табарга мөмкин:
1. Металлик алюминий порошогын турыдан-туры яндырып (алюминий
порошогын горелка ялкынына өрдереп):
4А1 + ЗО2 * 2А12О3
128
2. Түбәндә китерелгән схема буенча әверелешләр үткәреп:
. НС1якиН28О, NaOH яки KOH t . , „
Al —+ тоз » Al(OH)3 * Al2O3
Алюминий оксиды — каты, авыр эретелә торган (эретелү температурасы
2050 °C), ак төстәге матдә.
Химик үзлекләре буенча, бу — амфотер оксид (8 нче сыйныф, § 34). Ул,
нигез оксидлары үзлекләрен күрсәтеп, кислоталар белән реагирлаша:
Al2O3 + 6НС1 2А1С13 + ЗН2О
Al2O3 + 6Н+ + 6СГ 2А13+ + 6СГ + ЗН2О J
Al2O3 + 6Н+ 2А13+ + ЗН2О
Алюминий оксиды, кислота оксидлары үзлекләрен күрсәтеп, селтеләр
белән реагирлаша. Бергә эреткәндә метаалюминат кислотасының HAlO2
тозлары, ягъни метаалюминатлар хасил була:
ALO3 + 2NaOH 2NaA10, + H9O t V
z и ZZ
Cy катнашында реакция икенче төрле уза:
Al9O3 + 2NaOH + ЗН9О > 2Na[ Al(OH) J
натрий тетра-
гидроксоалюминаты
Алюминий гидроксидын Al(OH)3 селте эремәсе белән алюминий тозла¬
рының эремәләре үзара тәэсир итешкәндә табалар (селте эремәсен артыгы
белән алырга ярамый):
AlCl3 + 3NaOH —* Al(OH)3 ! + 3NaCl v
Al3+ + ЗСГ + 3Na+ + ЗОН' —> Al(OH)3 ! + 3Na+ + ЗСГ'
Al3+ + ЗОН" > Al(OH)31
Әгәр алюминий гидроксидының койкасыман ак массасын, эремәдән
аерып киптерсәң, суда практик яктан эреми торган ак кристаллик матдә
табыла.
Алюминий гидроксиды (аның оксиды кебек үк) амфотер үзлекләргә ия.
Барлык нигезләр кебек үк, алюминий гидроксиды да кислоталар белән
реагирлаша:
Al(OH)3 + ЗНС1 > AlCl3 + ЗН2О
Al(OH)3 + ЗН+ > Al3+ + ЗН2О
Алюминий гидроксиды селтеләрнең судагы эремәләре белән тәэсир
итешкәндә гидроксоалюминатлар хасил була:
Al(OH)3 + NaOH > NatAl(OH)J + H2O
натрий тетра-
гидроксоалюминаты
Алюминий тозларын башлыча металлик алюминий кислоталар белән
тәэсир итешкәндә табалар.
Физик үзлекләре буенча, алар — каты кристаллик, суда яхшы эрүчән
матдәләр. Алюминий тозларының химик үзлекләре башка тозларның
129
18 нче схема
үзлекләренә охшаш. Алюминий тозлары көчсез нигез һәм көчле кислотадан
хасил булганлыктан, алар судагы эремәләрендә гидролизлата (20 нче
бит).
7—10 нчы сорауларга җавап бирегез. 3 нче мәсьәләне чишегез (131 нче бит).
A Алюминий һәм аның әһәмиятле кушылмалары арасындагы генетик
бәйләнеш 18 нче схемада күрсәтелгән.
11 нче күнегүне үтәгез.
■
1. Периодик системадан файдаланып
һәм атомнар төзелеше турындагы күзал¬
лауларга нигезләнеп, Na » Mg *А1
рәтендәге элементларның үзлекләре ничек
үзгәрүен аңлатыгыз.
2. Ни өчен табигатьтә алюминий ку¬
шылмаларда гына очрый?
3. Алюминийның әһәмиятле табигый
кушылмаларына характеристика бирегез.
4. Алюминийны AlCl3 тән табу өчен,
кайтаргыч сыйфатында металлик кальций
файдаланылырга мөмкин. Бу процессны
тасвирлагыз һәм реакция тигезләмәсен
төзегез, электроннар күчешен күрсәтегез.
Ни өчен бу реакцияне судагы эремәдә
уздырырга ярамый?
5. Алюминийның а) галогеннарны;
б) тимерне; в) водород ионнарын; г) кү¬
кертне; д) кислородны кайтаруы белән
уза торган реакцияләрнең тигезләмәләрен
төзегез. Электроннар күчешен күрсәтегез.
6. Тигезләмәсе 2Al + 6НС1 * 2AlCl3 +
+ SH2I рәвешендә языла торган химик
реакциянең тибы:
1) кушылу реакциясе
2) алмашу реакциясе
3) таркалу реакциясе
4) алмаштыру реакциясе
7. а) Алюминий атомнары; б) алюми¬
ний ионнары оксидлаштыргычлар булырга
мөмкинме? Җавабыгызны реакцияләрнең
тигезләмәләре белән дәлилләгез.
8. Al3+ + ЗОН” = Al(OH3) I кыскартыл¬
ган ионлы тигезләмәсенә химик реакция
схемасының туры килгән фрагменты:
1) Al2O3 + HCl >
2) Al2(SO4)3 + NaOH (артыгы белән) —
3) AlCl3 + NaOH (җитәрлек түгел) *
4) Al + CuSO4 »
9. Алюминий сульфаты эремәсенә
аз-азлап селте эремәсе (артыгы белән
булганчы) агызганнар. Нәрсә күзәтелер?
Тиешле реакцияләрнең тигезләмәләрен
төзегез.
10. Натрий хлориды һәм алюминий
хлоридының судагы эремәләренә зәңгәр
лакмус кәгазе төшергәннәр. Аларның төсе
ничек үзгәрер һәм ни өчен?
11. 18 нче схемага туры килгән реак¬
цияләрнең тигезләмәләрен төзегез.
130
О 1. Хлорид кислотасы белән реакциягә
кергәндә, 1 моль натрий су белән тәэсир
итешкәндә аерылып чыккан кадәр во¬
дород табу өчен, күпме алюминий ки¬
рәк?
2. Алюминий һәм бакыр эретмәсенә
артыграк алынган натрий гидроксидының
куертылган эремәсе белән җылытканда
тәэсир иткәннәр. 2,24 л ниндидер газ
(н. ш.) аерылып чыккан. Эретмәнең гому¬
ми массасы 10 г булуы билгеле булса,
аның составын процентларда исәпләп
чыгарыгыз.
3. Составында 5% алюминий хлориды
булган 40 г эремә бирелгән. Алюминий
хлоридын тулысынча натрий тетрагид-
роксоалюминатына әверелдерү өчен,
0,2 масса өлеше, яки 20%, натрий гидрок-
сидыннан торган ничә миллилитр эремә
(р = 1,2 г/см3) кирәк булыр?
Лаборатор тәҗрибәләр
15. Натрий, калий һәм кальций тозларының әһәмиятле үрнәкләре белән
танышу. 1. Натрий, калий һәм кальций тозларының сезгә бирелгән үрнәкләрен карагыз.
Аларның тышкы күренешләренә игътибар итегез.
2. Чистартылган (хлорид кислотасында юдырып һәм кыздырып) никелин (нихром)
чыбык яки кыздырылган графит кисәге ярдәмендә газ горелкасы ялкынына а) натрий
хлоридының; б) калий хлоридының; в) кальций хлоридының берничә химик саф крис-
талын кертегез. Калий ялкынны нинди төскә кертүен зәңгәр (кобальт) пыяла аша
карарга кирәк.
Бирем. Натрий, калий һәм кальций тозларын башка тозлардан ничек аерырга
мөмкин?
16. Кальцийның табигый кушылмалары белән танышу. 1. Кальцийның табигый
кушылмаларының үрнәкләрен карагыз һәм аларның тышкы күренешенә игътибар
итегез.
2. Тиешле реагентлар ярдәмендә сезгә бирелгән минералларның кайсылары
карбонатлар, ә кайсылары сульфатлар икәнлеген билгеләгез.
Биремнәр. 1. Төрле табигый карбонатларны, сульфатлар һәм ортофосфатларны
нинди билгеләре буенча белеп була? 2. Табигый карбонатларны табигый сульфатлардан
нинди химик реакцияләр ярдәмендә аерырга мөмкин?
17. Алюминий һәм аның эретмәләре үрнәкләре белән танышу. Бирелгән
алюминий һәм аның эретмәләре үрнәкләрен карагыз. Бу үрнәкләрнең катылыгын һәм
пластиклыгын тикшерегез.
Бирем. Алюминийны аның эретмәләреннән ничек аерып була?
6 нчы практик эш
Эксперименталь мәсьәләләр чишү. 1. Дүрт пробиркада ике вариант өчен
түбәндәге кристаллик матдәләр бирелгән: А. а) кальций хлориды; б) натрий гидроксиды;
в) калий карбонаты; г) стронций хлориды. Б. а) кальций карбонаты; б) стронций нитраты;
в) натрий сульфаты; г) калий хлориды. Кайсы пробиркада нинди матдә булуын тәҗрибә
юлы белән билгеләгез. 3 нче таблицадан (14—15 нче битләр) файдаланып, тиешле реак¬
цияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы рәвештә языгыз.
2. Түбәндәге әверелешләрне башкарыгыз:
а) CaCI2 » Ca(OH)2 > CaCO3 * Ca(HCO3)2 * CaCO3 > CaCI2
б) MgCO3 > MgCI2 » Mg(OH)2 * MgSO4
Тиешле реакцияләрнең тигезләмәләрен молекуляр, ионлы һәм кыскартылган ионлы
рәвештә төзегез.
131
Тимер
Vll БҮЛЕК
§ 43. Химик элементларның периодик таблицасында
тимернең урыны һәм аның атом төзелеше.
Тимернең үзлекләре
Тимер VIII группаның ян төркемчәсендә (ҮШБ-төркемдә) урнашкан.
Тимер атомында электроннар энергетик дәрәҗәләрдә түбәндәгечә
урнаша:
+26Fe 2е~, 8е~, 14е~, 2е~
Схемадан күренгәнчә, тимер атомнарының тышкы энергетик дәрәҗә¬
сендә ике электрон, шуңа күрә күп кушылмаларында тимер +2 оксидлашу
дәрәҗәсен күрсәтә. Соңгысыннан алдагы энергетик дәрәҗә тулы булма-
ганлыктан, реакцияләрдә, тышкы дәрәҗәнең ике электроныннан тыш,
еш кына соңгысыннан алдагы дәрәҗәнең бер электроны да катнаша. Ул
вакытта тимер +3 оксидлашу дәрәҗәсен күрсәтә.
Табигатьтә очравы. Таралуы буенча тимер металлар арасында алюминий¬
дан кала икенче урында. Тимернең әһәмиятле минералларының составы
һәм гомуми характеристикасы 32 нче таблицада бирелгән.
Кайбер урыннарда сидерит минералы очрый, аның төп состав өлешен
тимер (II) карбонаты FeCO3 тәшкил итә. Аны шулай ук чуен һәм корыч
җитештерү өчен файдаланалар. Сирәк кенә метеорит (саф диярлек) тимере
очрый.
Күп кенә минераль су чыганакларында тимер гидрокарбонаты Fe(HCO3)2
һәм тимернең кайбер башка тозлары була. Тимернең тере организмнар
өчен әһәмияте гаять зур булуын сез инде биология курсыннан беләсез.
Ул кандагы гемоглобинның, башка катлаулы аксымнарның, шул исәптән
ферментларның да, мөһим состав өлешен тәшкил итә.
СЕЗ
БЕЛӘСЕЗМЕ?
Кайбер борынгы телләрдә тимер «күк ташы» дип атала.
Ни өчен, уйлап әйтегез.
1749 елда Себер тимерчесе Енисейдан ерак та түгел бер
урында табигый тимернең зур кисәген таба. Бу тимер
кисәгенең даны бөтен дөньяга тарала һәм ул, һичшиксез,
беренче метеорит булып таныла.
132
32 нче таблица. Тимернең әһәмиятле табигый кушылмалары
Минералның исеме
Төп состав өлешенең химик формуласы
Магнетит
Гематит
Лимонит
Пирит
Fe3O4(FeC) • Fe2O3) (Fe 72% ка кадәр)
Fe2O3 (Fe 65% ка кадәр)
Fe2O3 • иН2О (Fe 60% ка кадәр)
FeS2 (Fe 47% чамасы)
33 нче таблица. Тимернең химик үзлекләре
Тимер реакциягә керә
бүлмә температурасында
җылытканда
1. Дымлы һавада кислород бе¬
лән кушылып, Fe2O3 • пН20 хасил
итә
2. Сыегайтылган HCl һәм H2SO4
кислоталары белән:
Fe + 2НС1 > FeCl2 + H2 t
0
Fe + 2Н+ + 2С1- >
0 *
* Fe2+ + 2С1- + H2 T
3. Судагы эремәдә тозлар бе¬
лән:
Fe + CuSO4 » FeSO4 + Cul
O
Fe +Cu2+ + SOjj »
—* Fe2+ + SOS' + c°u I
1. Кислород белән:
Г~ 8е “I
0 Of +2-2 +3 -2
3Fe + 2О2FeO-Fe2O3
2. Хлор белән:
Г“6е “I
0 Of +3-1
2Fe + 3CL 2FeCl3
L о
3. Күкерт белән:
|—2е'“1
о 0 / +2-2
Fe + S-^FeS
4. Cy парлары белән:
0 +1 t +2 +3 0 .
3Fe + 4Н2О —> FeO • Fe2O3 + 4Н21
5. Җылытканда, куертылган H2SO4 һәм
HNO3 кислоталары белән:
0 +6 J. +3 +4
2Fe + 6H2SO4 Fe2(SO4)3 + 3SO21 +6Н2О
о +5++3 +2
Fe + 4HNO3 > Fe(NO3)3 + NO t +2H9O
(ябык
савытта)
133
Табу. Тимерне 1) аның оксидларыннан кайтарып, мәсәлән Fe2O3 тән,
җылытканда, водород белән кайтарып;
2) аның оксидларыннан Fe2O3 һәм Fe3O4 тән алюминотермии метод
белән кайтарып;
3) тимер (II) тозларының эремәләрен электролизлап табалар.
Физик үзлекләре. Саф тимер — көмешсыман-ак төстәге гаять пластик
металл. Тимернең тыгызлыгы 7/87 г/см3, эретелү температурасы 1539 °C.
Башка күп кенә металлардай аермалы буларак, тимер магнитлану үзлеклә¬
ренә ия.
Химик үзлекләре. Саф тимер — һавада тотрыклы. Практикада тимерне
катышмалар белән файдаланалар. Андый тимер коррозиягә җиңел бирелә.
Тимернең химик үзлекләре 33 нче таблицада күрсәтелгән.
Куллану. Саф тимер тиз магнитлануга һәм магнитсызлануга сәләтле, шуңа
күрә аны электромотор трансформаторларының кендеген, электромагнитлар
һәм микрофон мембраналарын эшләү өчен кулланалар. Практикада күбрәк
тимернең эретмәләрен — чуен һәм корычны файдаланалар.
1—5 нче сорауларга җавап бирегез (135 нче бит). 1—2 нче мәсьәләләрне чишегез
(136 нчы бит).
§44. Тимернең кушылмалары
Тимернең аеруча +2 һәм +3 оксидлашу дәрәҗәләрен күрсәткән кушыл¬
малары таралган. Катнаш оксиды Fe3O4 (Fe2O3 • FeO) — шактый танылган
оксид.
Тимер һәм аның әһәмиятле кушылмалары арасындагы генетик бәйләнеш
10 нчы күнегүдә күрсәтелгән. Бу күнегүне үтәгәндә түбәндәгеләрне искә
тотарга кирәк:
1. Тимер кислородта һәм һавада янганда, нигездә, катнаш тимер оксиды
Fe3O4 хасил була, шуңа күрә тимер (II) һәм (III) оксидларын читләтелгән
юл белән табалар.
2. Тимер (II) тозлары тимер белән кислота эремәләре (НС1, H2SO4) тәэсир
итешкәндә табыла.
3. Тимер (III) тозларын тимерне хлорда яндырганда һәм тимер
җылытканда куертылган сульфат һәм нитрат кислотасы белән тәэсир итеш¬
кәндә табалар.
4. Тимер (III) оксиды һәм гидроксиды (алюминийның охшаш кушыл¬
малары кебек) амфотер үзлекләргә ия (гомуми закончалык күзәтелә: оксид¬
лашу дәрәҗәләре үсү белән нигез үзлекләре йомшара, ә кислота үзлекләре
көчәя).
5. Ике һәм өч корылмалы тимер ионнарына сыйфат реакциясе булып
аларның гидроксид-ионнар OH- белән тәэсир итешүе тора:
FeCl2 + 2NaOH —> Fe(OH)2 J + 2NaCl
134
Fe1 2+ + 2СГ + 2Na+ + 20H“ > Fe(OH)21 + 2Na+ + 2С1"
Fe2+ + 20H > Fe(OH)21
Fe2(SO4)3 + 6K0H * 2Fe(OH)31 + SK2SO4
2Fe3+ + 3S0^ +6K+ + 60H- > SFe(OH)31 + 6K+ + 3SO2
2Fe3+ + 60H- * SFe(OH)31
Fe3 4+ + ЗОН" * Fe(OH)31
Fe(OH)2 һәм Fe(OH)3 утырымнары төсләре белән аерылалар (14—15 нче
битләрдәге 3 нче таблицаны карагыз).
6. Fe2+ ионының үзенчәлекле үзлеге булып аның тиз оксидлашу сәләте
исәпләнә:
а) һавада:
4е~—
+2 о +3 -2
4Fe(OH)2 + O2 + 2Н2О —* 4Fe(0H)3
б) оксидлаштыргычлар катнашында:
I 2 —ф
SFe(OH)2 + H2O2 * SFe(OH)3
-1 -1
Водород пероксиды H—O—O—H молекуласында кислород атомнарының
оксидлашу дәрәҗәсе -1. Бу атомнарның һәрберсе, бик көчле рәвештә, үзенә
берәр электрон китереп куша һәм кислород өчен характерлы -2 оксидлашу
дәрәҗәсен ала. Шул сәбәпле водород пероксиды көчле оксидлаштыргыч
булып санала.
Сорауларга җавап бирегез һәм 6—11 нче күнегүләрне чишегез (136 нчы бит).
1. Табигатьтә тимер нинди хәлдә оч¬
рый? Кушылмаларының формулаларын
һәм аларның исемнәрен языгыз.
2. Биологиядән алган белемнәрегезгә
нигезләнеп, кеше организмында тимер
элементының ролен тасвирлагыз.
3. Кайбер минераль су чыганакларында
тимер (II) гидрокарбонаты була. Тимернең
бу эрүчән тозы нинди шартларда һәм нин¬
ди химик процессларда табигый сидерит
минералыннан FeCO3 хасил була ала.
4. Кайтаргыч сыйфатында а) водо¬
род; б) алюминий; в) углерод (II) оксидын
файдаланып, Fe2O3 һәм Fe3O4 оксидларын¬
нан металлик тимер табылу белән уза
торган реакцияләрнең тигезләмәләрен
төзегез. Электроннар күчешен, оксидлаш¬
тыргыч һәм кайтаргычны күрсәтегез.
5. Тимернең: а) кислоталар; б) тоз¬
лар; в) югары температурада су белән
реагирлашу реакцияләренең тигезлә¬
мәләрен төзегез. Электроннар күчешен,
оксидлаштыргыч һәм кайтаргычны күр¬
сәтегез.
6. а) Тимер (П) тозлары һәм тимер (Ш)
тозлары; б) тимер (II) гидроксиды һәм
тимер (III) гидроксиды; в) тимер оксид¬
лары хасил булу белән уза торган реак¬
цияләрнең тигезләмәләрен төзегез.
7. Fe2(SO4)3 кушылмасында тимернең
оксидлашу дәрәҗәсе:
1) +2 2) +3 3) +4 4) +8
8. Тимер оксидлары һәм гидроксидлары
нинди уртак һәм специфик үзлекләргә ия?
Тиешле реакцияләрнең тигезләмәләрен
төзегез.
9. Тимер тозларының уртак һәм спе¬
цифик үзлекләрен тасвирлагыз. Реакция¬
ләрнең тигезләмәләрен төзегез.
135
10. Оксидлашу дәрәҗәсе үскән саен,
тимер кушылмаларының үзлекләре ничек
үзгәрә?
11. Түбәндәге әверелешләрне тормыш¬
ка ашырырга ярдәм итүче реакцияләрнең
тигезләмәләрен төзегез:
а) Fe * Fe(OH)3 * Fe2O3 * Fe
б) Fe > FeCl4 » Fe9O4 * Fe(NO4)4
' «5 Z O ' 0'0
> Fe(OH)2 > Fe(OH)3 »
в) Fe
> Fe2O3 > FeCl3 *
* FeOHCl2 ► Fe2O3 » Fe
* Fe(OH)3 > Fe(OH)2Cl »
* Fe2(SO4)3 *
* Fe2O3 * Fe
Q 1. 0,1 масса өлеше, яки 10%, катыш¬
мадан торган магнитлы тимер рудасының
Fe3O4 нинди массасында 2 т тимер була?
2. Төп состав өлеше FeCO3 булган
сидерит үрнәгендә 40% тимер бар. Бу
үрнәктә ничә процент FeCO3 барлыгын
исәпләп чыгарыгыз.
3. Кислород агымында 0,2 г корыч
яндырганда, 0,04 г углерод (IV) оксиды
табылган. Корычның бу үрнәгендәге
углеродның масса өлешен (%) һәм масса¬
сын билгеләгез.
4. Тимер (II) сульфиды 130 г хлорид
кислотасы (HCl ның масса өлеше 20%)
белән тәэсир итешкәндә күпме микъдарда
сероводород матдәсе барлыкка килүен
билгеләгез.
Лаборатор тәҗрибәләр
18. Тимер (II) гидроксидын табу һәм аның кислоталар белән реакциягә керүе.
1. Пробиркага 2—3 мл яңа әзерләнгән тимер (II) сульфаты эремәсе агызыгыз һәм аңа
бераз натрий гидроксиды эремәсе өстәгез. 2. Пробирка төбенә төшкән утырымга бераз
хлорид кислотасы өстәгез.
19. Тимер (III) гидроксидын табу һәм аның кислоталар белән реакциягә
керүе. 1. Пробиркага 2—3 мл тимер (III) гидроксиды агызыгыз һәм бераз натрий
гидроксиды эремәсе өстәгез. 2. Пробирка төбенә төшкән утырымга бераз сульфат
кислотасы өстәгез.
Биремнәр. 1. Тимер (II) гидроксидын һәм тимер (III) гидроксидын ничек табалар?
2. Табылган утырымнар нинди төстә? 3. Утырымнарга кислоталар белән тәэсир иткәндә
нинди матдәләр хасил була? 4. Тиешле реакцияләрнең тигезләмәләрен молекуляр,
ионлы һәм кыскартылган ионлы рәвештә языгыз. 5. Тимер ионнарын Fe2+ һәм Fe3+
ничек танып белергә?
7 нче практик эш
Эксперименталь мәсьәләләр чишү. 1. Дүрт пробиркада түбәндәге матдәләр
бирелгән: а) магний хлориды; б) натрий гидроксиды; в) натрий карбонаты; г) натрий
нитраты. Химик реакцияләр ярдәмендә кайсы пробиркада нинди матдә булуын
ачыклагыз.
2. Дүрт пробиркада түбәндәге каты матдәләр бирелгән: а) кальций ксрбонаты;
б) стронций нитраты; в) натрий сульфаты; г) натрий сульфиды. Кайсы пробиркада
нинди матдә булуын билгеләгез.
136
3. Сезгә бирелгән матдәнең алюминий сульфаты икәнлеген характерлы реакцияләр
ярдәмендә раслагыз.
4. Бер пробиркада — натрий хлориды, икенчесендә — стронций хлориды, ә өчен¬
чесендә алюминий хлориды эремәләре бирелгән. Кайсы пробиркада нинди матдә
булуын билгеләгез.
5. Тимер (II) сульфаты кристалларының өлешчә оксидлашуын һәм анда Fe3+ ионнары
катышмалары булуын исбат итегез.
6. Ике савытта су бирелгән. Бер савыттагы суда — магний сульфаты, икенчесендә
кальций гидрокарбонаты эрегән. Даими һәм вакытлы катылыкны бетерергә мөмкинлек
бирүче тәҗрибәләрне ясагыз.
7. Түбәндәге әверелешләрне практикада тормышка ашырыгыз:
а) Fe > FeCI2 > Fe(OH)2 * Fe(OH)3 * Fe(NO3)3
б) Al * AI2(SO4)3 » AI(OH)3 » NaIAI(OH)4]
Металлургия
Vlll БҮЛЕК
§ 45. Металлургия турында төшенчә. Хәзерге заман
техникасында металлар
Металлургия — металлар табуның промышленность ысуллары
турында фән.
J
Kapa һәм төсле металлургия бар. Kapa металлургиягә тимер һәм
аның эретмәләрен җитештерү керсә, төсле металлургиягә калган барлык
металларны һәм аларның эретмәләрен җитештерү керә.
Металлургия процесслары берничә стадиядә уза:
1. Табигый рудаларны баеталар (төрле ысуллар белән катышмалардан
арындыру).
2. Химик әверелешләр процессында металл һәм аның эретмәсен
табалар.
3. Табылган металлны яки аның эретмәсен механик эшкәртәләр (басым
астында яисә коеп металлга тиешле форма бирәләр).
Хәзерге заман техникасында иң күбе тимер эретмәләре кулланыла.
Әйтик, мәсәлән, машина төзүдә кулланыла торган металл эретмәләренең
гомуми массасыннан 90% тан артыграгы тимер эретмәләренә туры килә.
Тимер эретмәләренең иң әһәмиятлеләре чуен һәм корыч.
Чуен — составында 2—4% углерод, шулай ук кремний, марганец һәм
берникадәр микъдарда күкерт һәм фосфор булган тимер эретмәсе.
Корыч — составында 0,3—2% ы углерод һәм берникадәр микъдарда
кремний, марганец, фосфор, күкерт булган тимер эретмәсе.
Хром, никель, марганец, кобальт, ванадий, молибден, вольфрам, титан
һ. б. кушылган легирланган корычлар киң кулланыла. Хром-никельле
корыч аеруча зур әһәмияткә ия: хром корычка — тиешле катылык,
ә никель сыгылмалылык бирә.
Төсле металлар арасында җитештерү күләме һәм кулланылышы буенча
беренче урында — алюминий һәм аның эретмәләре, икенче урында бакыр
тора. Бакыр, бик яхшы электр үткәрүчәнлеге, коррозиягә чыдамлыгы, кою
үзлекләре яхшы булуы аркасында, электрүткәргечләр, төрле электротехник
җиһазлар җитештерү өчен һәм химия аппаратлары төзүдә файдаланыла.
1—4 нче сорауларга җавап бирегез (147 нче бит). 1—3 нче мәсьәләләрне чишегез
(147 нче бит).
138
§ 46. Чуен җитештерү
Чуенны тимер рудаларыннан домна мичләрендә коеп табалар (33 нче
рәсем).
Домна мичләрендә бара торган химик реакцияләр. Домна миченә
өстән эзлекле рәвештә шихта: флюслар катнаштырылган тимер рудасы,
аның артыннан кокс, тагын тимер рудасы тутыралар һәм шул эзлеклелектә
дәвам итәләр. Астан кислородка баетылган җылы һава өрдерәләр; кокс
яна:
C + O2 = CO2 + 402 кДж
Бу экзотермик реакция нәтиҗәсендә температура 1850 °C ка җитә.
Хасил булган углерод (IV) оксиды, өскә күтәрелгәндә, кызган күмергә
орына һәм, газ генераторындагы кебек үк, аның белән реагирлаша (25 нче
рәсемне карагыз):
CO2 + C 2С0
Углерод (II) оксиды — тимерне аның оксидларыннан кайтаручы төп
кайтаргыч, бу процесста шулай ук кокс составындагы каты углерод та
катнаша. Тимернең углерод (II) оксиды тарафыннан кайтарылуы эзлекле
рәвештә уза: +3 +2 +3 +2
Fe9O, —* Fe4O .(FeO • Fe9O4) > FeO —> Fe
Zo о Z o'
33 нче рәсем. Домна миче: 1 — тутыру җайланмасы; 2 — колошник; 3 — шахта;
4 — распар; 5 — горн; 6 — регенератор
139
Әгәр чимал сыйфатында кызыл тимер рудасы кулланылса, тимернең
кайтарылу процессы түбәндәгечә уза:
SFe9O4 + CO ——* SFe4O4 + CO9
Fe3O4 + CO 3FeO + CO2
FeO + CO Fe + CO2
Тигезләмәне суммар рәвештә болай язарга була:
Г6еП
+3 +2 + O +4
Fe9O4 + ЗСО * 2Fe + ЗСО9
Л O &
+3 O
Fe + 3<г > Fe 2
+2 +4
C - 2е- > C 3
Тимерне магнитлы тимер рудасыннан кайтаруны суммар тигезләмә белән
түбәндәгечә күрсәтергә мөмкин:
I— %е~—I
* +2/0+4
Fe3O4 + 4С0 > 3Fe + 4СО2
Оксидлардан өлешчә шулай ук марганец, кремний, фосфор, күкерт тә
кайтарыла. Кайтарылган тимер сыек хәлдә бу матдәләрне эретә, һәм сыек
чуен хасил була.
Тимер рудасында авыр эретелүчән катышмалар була. Аларны эретү һәм
рудадан аерып алу өчен, домна миченә тутырыла торган тимер рудасына һәм
кокска флюслар яки эреткеч матдәләр (плавни) өстиләр. Алар рудадагы
катышмалар белән җиңел эретелүчән кушылмалар — шлаклар хасил
итәләр. Руда составында, гадәттә, кремний (IV) оксиды була, шуңа күрә
флюслар сыйфатында известьташ яки доломит кулланалар:
CaCO3 CaO + CO2 f
CaO + SiO2 —CaSiO3
(җиңел эретелүчән кальций силикаты — шлакның состав өлешләреннән
берсе).
Чуен һәм шлак катнашмый: тыгызлыгы зуррак булган чуен аскы кат¬
ламны барлыкка китерә, ә шлак өскә чыга.
Домна миченең төзелеше һәм эшләве. Домна миче нигезләре белән
тоташкан, кисеп кыскартылган ике конус формасында (33 нче рәсем).
Хәзерге домна мичләренең биеклеге 60 метрга җитә, ә диаметры 10 метрдан
артык. Домна миченең стеналары утка чыдам кирпеч белән түшәлә һәм
тышкы яктан корыч тышча белән беркетелә. Домна миченең өске өлеше —
колошник, уртасы — шахта, ә киңәебрәк торган өлеше распар дип атала.
Домна миченең аскы өлешендә цилиндр формасындагы горн урнашкан.
Горнның аскы өлешендә ике катлам булып чуен һәм шлак җыела, аннан
140
СЕЗ
БЕЛӘСЕЗМЕ?
Домна процессының хәзерге теориясенә нигез салучы¬
ларның берсе — рус галиме М. А. Павлов (1863—1958).
Домна миче янында эшләп, ул һәрдаим чуен кою про¬
цессында бара торган күпләгән аңлатып булмаслык күре¬
нешләрне күзәтә. Бервакыт ул домна каршында «Юк, мин
моны болай калдырмам! Сереңә төшенермен!» дигән
уйны башыннан кичерә.
алар тишемнәр аша чыгарыла: өске тишемнән — шлак, аскы тишемнән
чуен ага. Горнның өске өлешендә һава өрдерү тишеме була.
Домна миченең өске өлешендә берсе өстенә икенчесе урнашкан, ике
бүрәнкәдән торган автомат тутыру җайланмасы бар. Руда һәм кокс башта
өске бүрәнкәгә керә, ә ул төшкәндә аскыга күчә.
Аскы бүрәнкә төшкәндә руда һәм кокс мичкә эләгә. Өске һәм аскы конус¬
ларның эзлекле эшләве нәтиҗәсендә, тутыру вакытында мич ябык килеш
тора. Шуның аркасында газлар атмосферага чыкмый, ә регенераторлар дип
йөртелгән махсус мичләргә китә, алар анда яналар. Регенератор стеналары
югары температурага кадәр кызганнан соң, домна газын һәм аны яндыру
өчен кирәкле һаваны икенче регенераторга кертәләр. Бу вакытта беренче
(кызган) регенератор аша домна миченә өрдереләчәк салкын һаваны
уздыралар. Ул анда җылына. Домна газы һәм һава агымы юнәлешләре
автомат рәвештә көйләнә.
Домна мичендә химик реакцияләрне тизләтүче шартлар. Домна миче¬
нең җитештерү куәте аның зурлыгына гына түгел, ә бәлки анда баручы
химик реакцияләрнең тизлегенә дә бәйле. Шуңа күрә химик реакцияләрнең
тизлеген арттыручы төп факторларны искә төшерик (14 нче параграфны
карагыз).
1. Химик реакцияләрнең тизлеге реагирлашучы матдәләрнең концент¬
рациясен арттырганда көчәя. Моның өчен тимер рудасын баеталар,
ә домна миченә өрдерелә торган һавага кислород өстиләр. Реагирлашучы
матдәләрнең концентрациясен шулай ук домна миченә башлыча метаннан
торган табигый газ биреп тә арттыралар. Метан янганда углерод (IV) оксиды
һәм су хасил була:
CH4 + 2О2 —» CO2 + 2Н2О + Q
Углерод (IV) оксиды һәм су парлары кызган күмер белән реагирлаша:
CO2 + C -U 2С0
H2O + C CO + H2
Нәтиҗәдә углерод (II) оксидының концентрациясе арта һәм тагын бер
өстәмә кайтаргыч — водород хасил була.
141
2. Химик реакцияләрнең тизлеге реагирлашучы матдәләрнең орыну
өслекләренә бәйле. Моны исәпкә алып, домна миченә тутырыла торган руда,
кокс һәм флюслар билгеле бер оптималь зурлыктагы кисәкләрдән торырга
тиеш. Эре кисәкләрне ваклыйлар, ә артык вакларын, алар газ юлларын
капламасын өчен, укмаштырып эреләтәләр.
3. Химик реакцияләрнең тизлеге температурага бәйле. Температураны
күтәрү өчен, домна миченә өрдереләчәк һаваны башта регенераторларда
җылыталар. Бу максатта экзотермик реакцияләр җылысыннан файдала¬
налар: домна миченең аскы өлешендә кызган газлар, өскә күтәрелгәндә,
өстән бирелгән эретү материалларын тиешле температурага кадәр җылы¬
талар (каршы агым принцибы буенча).
5—10 нчы сорауларга җавап бирегез (147 нче бит) . 4—5 нче мәсьәләләрне чишегез
(147 нче бит).
§ 47. Корыч җитештерү
Корычны чуеннан һәм тимер-томыр ватыкларыннан коеп табалар. Бу
максат өчен өлешчә тимер рудасыннан да файдаланалар.
Белгәнегезчә, чуен корычтан углерод һәм кремнийның микъдары
күбрәк булуы белән аерыла. Чуенда шулай ук күкерт һәм фосфорның да
микъдары шактый була. Бу катышмаларның булмавы яхшырак, чөнки
күкерт корычны кайнар вакытта уалучан итә (кайнар килеш механик
эшкәрткәндә анда ярыклар ясала), ә фосфор исә корычны салкында
уалучан итә (нормаль шартларда эшкәрткәндә уала). Димәк, чуеннан
корыч табу өчен, андагы углерод һәм кремнийның микъдарын киметергә,
ә күкерт һәм фосфорны мөмкин кадәр тулырак чыгарырга кирәк. Моңа
катышмаларны һава кислороды белән оксидлаштырып ирешелә. Әмма бу
вакытта эретелгән корычта азот эри, ул аның механик үзлекләрен киметә.
Шуңа күрә катышмаларны оксидлаштыру өчен, соңгы вакытта кислород
кулланыла башлады. Нәтиҗәдә катышмаларның оксидлашу процессы
тизләшә (реагирлашучы матдәләрнең концентрациясе арта, температура
күтәрелә) һәм эрегән азотсыз, сыйфатлы корыч алуга ирешелә.
Корыч җитештергәндә бара торган төп реакцияләр. Чуен составындагы
катышмаларның оксидлашу процессы шактый катлаулы. Бу — кислород
белән сыек чуен аралашканда катышмаларның гына түгел, бәлки тимернең
дә оксидлашуы белән аңлатыла. Оксидлашу реакцияләре башта түбәндәгечә
уза:
20 + O2 > 2СО 2Mn + O2 2Мп0
Si + O2 SiO2 4Р + 50, 2Р,0.
ZZ ZZO
S + O2 SO2
2Fe + O2 -*-> 2FeO
142
Барлыкка килгән тимер (II) оксиды да катышмаларны оксидлаштыруда
катнаша. Бу ике сәбәп белән аңлатыла. Беренчедән, тимернең концентрациясе
зур булуга бәйле рәвештә, тимер (II) оксиды чагыштырмача күп микъдарда
хасил була; икенчедән, чуен составына кергән катышмалар (C, Si, Mn, S)
кислород белән тимергә караганда көчлерәк реагирлаша:
C + FeO -- Fe + CO2 J
Si + 2FeO 2Fe + SiO2
Mn + FeO * Fe + MnO
2Р + 5FeO 5Fe + P2O5
Кремний һәм фосфор оксидларыннан арындыру өчен, эшкәртелә торган
чуенга известь өстиләр:
CaO + SiO2 —CaSiO3
ЗСаО + P9O5 Ca4(PO4)9
Барлыкка килгән силикат һәм кальций ортофосфаты — җиңел эретелүчән
матдәләр, алар шлак рәвешендә эретелгән корыч өстенә чыгалар.
Оксидлашу реакцияләре булып узганнан соң да, гадәттә, корычта
аның үзлекләрен начарайтучы тимер (II) оксиды берникадәр микъдарда
кала. Аны чыгару өчен, эретелгән корычка раскислителълэр (кислород -
сызландыргычлар), мәсәлән ферромарганец өстиләр. Марганец тимер (II)
оксиды белән реагирлаша:
FeO + Mn —MnO + Fe
Марганец (II) оксиды кремний (IV) оксиды белән реагирлаша:
MnO + SiO2 > MnSiO3
Марганец (II) силикаты шлак рәвешендә чыгарыла.
Чуенны корычка эшкәртүнең берничә ысулы бар. Алар барысы да без
алда тикшереп үткән оксидлашу-кайтарылу реакцияләренә нигезләнә.
Кислородлы-конвертор ысулы. Конвертор ысулы белән корыч табуга
инглиз галиме Г. Бессемер (1813—1898) нигез сала. Бу метод белән чуеннан
корыч тапканда катышмаларның оксидлашу процессы конверторлар дип
СЕЗ
БЕЛӘСЕЗМЕ?
Корыч кою Борынгы Египеттан ук килгән. Безнең эрага
кадәр 2900 ел элек төзелгән Хуфу пирамидасында та¬
былган борау моның ачык дәлиле булып тора. Корыч кою
осталары борынгы заманнарда ук булсалар да, корыч
табуның фәнни нигезләмәсе беренче тапкыр 1841 елда
рус металлургы П. П. Аносов тарафыннан бастырылып
чыгарылган. Аның хезмәтләре шунда ук немец һәм фран¬
цуз телләренә тәрҗемә ителгән.
143
аталып йөртелә торган груша формасындагы зур металлик савытларда
бара (34 нче рәсем). Кислородлы конвертор эчтән утка чыдам материал
белән түшәлгән. Аның авызы аша эретелгән чуен коялар, бераз известь
кушып, гомуми массасы 100 т чамасы булырлык итеп металл ватыклары
тутыралар. Конвертерга басым астында кислородка баетылган һава, яки саф
кислород тутырыла. Бу вакытта катышмаларның оксидлашуы бара.
Бу ысулның төп өстенлеге — аның икътисади яктан отышлы булуында.
Конверторда тиешле температураны тоту өчен, ягулык яндыруның кирәге
юк. Тиешле температурага (1700 oC чамасы) катышмалар оксидлашуның
экзотермик реакцияләре нәтиҗәсендә ирешелә. Ьава урынына кислород
файдаланганда катышмалар оксидлашуы бик тиз уза. Процесс тәмамлан¬
ганнан соң, конверторны авыштырып, шлакны агызалар һәм әзер корычны
чыгаралар.
Мартен ысулы. Корычны мартен ысулы белән җитештергәндә
катышмаларның оксидлашуы төп ике өлештән: катышмаларның оксид¬
лашу урыны булган ванналардан һәм регенераторлардан торган мичтә
тормышка ашырыла (35 нче рәсем). Ванна утка чыдам кирпеч белән
Кислород
34 нче рәсем. Конвертор: 1 — аудару җайланмасы механизмы; 2 — конвертор; 3 — фур¬
ма; 4 — чуен кою өчен мәйданчык
144
түшәлгән һәм өстән гөмбәз белән капланган. Шихтаны (чуен, тимер-то¬
мыр) тутыру тәрәзәләре аша салалар, тәрәзәләр, процессны күзәтү өчен,
тишекле итеп ясалган капкач белән ябыла. Арткы стенасында корычны
чыгару өчен махсус тишек була.
Һава һәм янучан газны башта регенераторларда җылыталар. Мартен
мичендә шундый дүрт регенератор була. Шуларның икесе аша ягулык
яну нәтиҗәсендә хасил булган газларны уздыралар. Регенераторларның
стеналары нык җылына. Аннан соң газлар агымының юнәлешен үзгәр¬
тәләр: җылынган регенераторлар аша — яндыру өчен билгеләнгән һава һәм
газны, ә салкын регенераторлар аша исә ягулык яну нәтиҗәсендә барлыкка
килгән кызган газларны уздыралар. Җылынган регенераторлар үзләренең
җылысын яндыру өчен мичкә кергән газга һәм һавага бирә. Мичтә тем¬
пература 1700—1750 oC ка кадәр күтәрелә. Мартен мичендә, кислород¬
лы конвертордан аермалы буларак, һаваны (яки кислородка баетылган
һаваны) эретелгән чуен аша түгел, бәлки аның өстеннән уздырганлыктан,
чуен өслегендәге катышмалар гына оксидлаша. Эретелгән массаның эчендә
катышмаларның оксидлашуы тимер ватыкларының тимер оксидын¬
дагы кислород исәбенә уза. Кайчакта эретелгән чуенга тимер рудасы өс¬
тиләр.
Мартен ысулының өстенлеге — чуенның корычка эшкәртелү процессын
контрольдә тотып, төрле маркалы корыч алып булуда. Мартен мичләрендә
тимер ватыкларын эшкәртү дә уңайлы. Ләкин бу ысулның җитештерүчәнлеге
кислородлы-конвертор ысулыныкына караганда түбәнрәк.
Электр мичләрендә корыч кою. Электр мичләрендә тиешле температура
(2000 oC чамасы) дугалы метод ярдәмендә булдырыла (36 нчы рәсем). Әлеге
ысул белән бик югары температура булдыруга ирешелә. Бу исә эретелү
35 иче рәсем. Мартен миче
36 нчы рәсем. Электр мичләрендә
корыч кою
145
температуралары югары, яхшы сыйфатлы легирланган корыч алырга
мөмкинлек бирә. Өстәвенә электр мичләрен кору, мартен мичләрен коруга
караганда, шактый арзанга төшә.
Корычны калыпларга агызу. Кислородлы конверторларда да, мартен
мичләрендә һәм электр мичләрендә дә корычны сыек хәлдә табалар.
Эшләнмәләр ясау өчен күп кенә операцияләр башкарырга кирәк. Эретелгән
корычны мичтән утка чыдам кирпеч белән түшәлгән махсус чүмечләргә
агызалар. Чүмечләрдән аны калыпларга бүлеп салалар, аларда корыч ката.
Табылган коелмаларны калыплардан чыгаралар һәм, җылытып, кысу
станокларында (блюмингларда) прокатлыйлар.
Галимнәр фикеренчә, лабораторияләрдә рудалардан бик югары темпе¬
ратурада плазма хәлендә корыч табу методы әлегә перспективалы. Бу
метод белән эшләгәндә домна да, конвертор да, электр миче дә кирәкми,
тик производствога бу методны кертергә энергиянең гаять күп тотылуы
комачаулык итә.
Металлургиядә калдыксыз производстволар проблемасы һәм әйлә¬
нә-тирәлекне саклау. Металлургия производствосын үстерү өчен, эшкәр¬
телә торган чималдан әһәмиятле продуктларны максималь күләмдә
алып, табигать ресурсларыннан нәтиҗәле файдалану, ягъни калдыксыз
производство булдыру кирәк. Төсле металлургия — моның ачык миса¬
лы. Сезгә билгеле булганча, төсле металларны (бакыр, цинк, кургаш)
яндырганда составында күкерт (IV) оксиды SO2 булган газлар чыга. SO2
әйләнә-тирәлекне пычратканлыктан, күп кенә заманча җиһазландырылган
производстволарда бу газ махсус җайланмалар ярдәмендә тотылып калына
һәм сульфат кислотасы җитештерү өчен файдаланыла. Нәтиҗәдә әйләнә-
тирәлек пычранмый, һәм илебез хуҗалыгы өстәмә табыш ала. Әйтик,
мәсәлән, 1 т бакыр тапканда тотылып калган күкерт (IV) оксидыннан SO2
10 т сульфат кислотасы табарга мөмкин.
Сульфат кислотасы җитештерү өчен, төп чималларның бер төре — пирит
FeS2. Пирит составында, күкерттән тыш, бакыр, цинк, кургаш, никель,
кобальт, висмут һәм, алтын белән көмешне дә кертеп, башка металлар
кушылмаларының катышмалары да була. Калдыксыз производствога күч¬
кәндә, бу металларны аерып алуга, ә барлыкка килгән шлакны төрле төр
цементлар җитештерү өчен файдалануга ирешелә.
11 —14 нче сорауларга җавап бирегез (147 нче бит). 6 нчы мәсьәләне чишегез
(147 нче бит).
СЕЗ
БЕЛӘСЕЗМЕ?
Галимнәр һәм конструкторлар двигательләрдә нефть
продуктлары урынына экологик саф ягулык — водород
файдалану идеясен тормышка ашыру өстендә эшлиләр.
146
2
1. Металлургия нәрсә ул?
2. Түбәндәге дөрес фикерне күрсә¬
тегез.
1) Чуен һәм корыч составлары буенча
аерылып тормый.
2) Чуен һәм корыч — углерод микъ¬
дары һәм үзлекләре белән аерылып торган
тимер һәм углерод эретмәләре.
3) Чуен — ул катнашма, ә корыч —
эретмә.
4) Чуен һәм корыч үзлекләре буенча
аерылып тормый.
3. Fe3O4 + ... > Fe + H2O реакциясе
тигезләмәсендә күп нокталар урынына
формуласы язылырга тиешле матдә:
1) углерод
2) тозлар
3) водород
4) углерод (II) оксиды
4. Ни өчен алюминийны аның окси¬
дыннан күмер белән дә, углерод (II) ок¬
сиды һәм водород белән дә кайтарырга
ярамый?
5. Домна мичендә рудалардан тимер
кайтарылу процессында нинди химик ре¬
акцияләр уза? Моны магнитлы тимерташ
рудасыннан тимер кайтарылу мисалында
аңлатыгыз.
6. Домна процессында коксның роле
нинди? Ни өчен домна мичләрендә саф
тимер табып булмый?
7. Домна процессында химик произ¬
водстволарның нинди гомуми принцип¬
лары саклана? Домна процессын өзлексез
процесс дип әйтеп буламы һәм ни өчен?
8. Домна процессында флюсларның
роле нинди? Эшкәртелә торган тимер ру¬
дасында доломит булса, флюс сыйфатында
нәрсәне файдаланырга кирәк?
9. Химик реакцияләрнең тизлеге нинди
шартларда арта? Домна процессында алар
ничек исәпкә алына?
10. Производствоның оптималь шарт¬
лары нәрсә ул? Домна процессында алар
ничек саклана?
11. Корыч җитештергәндә нинди хи¬
мик процесслар уза? Тиешле реакция¬
ләрнең тигезләмәләрен төзегез.
12. Корыч табуның сезгә билгеле
ысулларын бәяләгез. Аларда нинди уртак
принциплар саклана? Корыч җитештерү
процессы өзлексез процесс булып сана¬
ламы һәм ни өчен?
13. Домна һәм мартен процессларын¬
дагы регенераторларны чагыштырыгыз.
14. Калдыксыз производство оештыру
принципларын конкрет мисалларда аңла¬
тыгыз.
O 1. Тимер рудасында 0,9 масса өлеше,
яки 90%, Fe3O4 һәм 0,1 масса өлеше, яки
10% , SiO2 бар. Әлеге рудада тимер һәм
кремнийның микъдарын процентларда
исәпләп чыгарыгыз.
2. Әгәр алюминий оксиды барлыкка
килгәндә 1671 кДж, ә тимер (III) оксиды
барлыкка килгәндә 741 кДж җылылык
аерылып чыкса, 112 г тимерне аның ок¬
сидыннан алюминотермик ысул белән
кайтарганда күпме җылылык аерылып
чыгар?
3. 960 т Fe2O3 составындагы тимерне
кайтару өчен, күпме күләм углерод (II)
оксиды (н. ш.) кирәк?
4. Әгәр табылган чуен составында
0,95 масса өлеше тимер булса, 0,1 масса
өлеше катышмалардан торган 100 т тимер
рудасыннан Fe2O3 күпме чуен табарга
була?
5. Составында 0,93 масса өлеше тимер
булган 2 т чуен табу өчен 0,9 масса өлеше
Fe3O4 булган күпме магнитлы тимер руда¬
сы кирәк?
6. 200 г корычны кислород агымында
яндырганда 4 г углерод (IV) оксиды хасил
булган. Әлеге корычта ничә процент угле¬
род булган?
Иң әһәмиятле органик матдәләргә
кыскача күзәтү
IX БҮЛЕК
§ 48. Органик химия
XIX гасырга кадәр барлык матдәләрне, аларның чыгышына бәйле
рәвештә, ике төркемгә аерып йөртәләр: минераль матдәләргә һәм органик
матдәләргә. Ул чорда күп галимнәр органик матдәләр фәкать тере орга¬
низмнарда гына барлыкка килә ала дип исәплиләр. Ләкин неорганик
матдәләрнең — органик матдәләргә һәм, киресенчә, органик матдәләрнең
неорганик матдәләргә әверелә алуын сез инде биология курсыннан
беләсез. Бу исә органик һәм неорганик матдәләр арасында билгеле бер
бәйләнеш барлыгын һәм алар арасында кискен чик булмавын дәлилли.
Органик матдәләр кайбер үзенчәлекләре белән генә аерылып тора. Неорга¬
ник матдәләрнең күпчелеге молекуляр төзелешле түгел, һәм шуңа күрә
аларның эретелү һәм кайнау температуралары югары. Күпчелек органик
кушылмалар молекуляр төзелешле һәм аларның эретелү һәм кайнау тем¬
пературалары югары түгел. Органик матдәләрнең барысы да диярлек яна
һәм кыздырганда җиңел таркала.
Органик матдәләрне химиянең махсус курсында карау зарурлыгы турында
дәлилләр күп, бу курсны традиция буенча органик химия дип атыйлар. Иң
мөһим дәлил — барлык органик матдәләрнең дә молекулаларында углерод
элементы булуы, ә барлык неорганик матдәләрнең дә составына кергән
элементның булмавы.
Органик химия — химия фәненең углерод кушылмаларын һәм
аларның әверелешләрен өйрәнә торган бүлеге.
Ләкин органик химиянең бу билгеләмәсен бөтенләй үк төгәл дип әйтеп
булмый. Әйтик, мәсәлән, углерод (IV) оксидын, углерод (II) оксиды, карбонат
кислотасы, карбонатлар һәм углеродның кайбер башка кушылмаларын
үзлекләренең характеры буенча неорганик матдәләргә кертәләр.
Углеродлы матдәләрне (углеродның алда санап үтелгән һәм башка кайбер
кушылмаларыннан тыш), алар кайда һәм ничек барлыкка килүләренә
карамастан (тере организмнарда барлыкка килгәнме яки синтетик ысул
белән табылганмы) органик матдәләр дип атыйлар.
148
СЕЗ
БЕЛӘСЕЗМЕ?
Безнең илнең иң күренекле химикларыннан берсе —
Н. Д. Зелинский, яшьләргә мөрәҗәгать итеп: «Бер киңәш
тә кешенең үз тәҗрибәсен алыштыра алмый, ләкин аз
югалтулар белән уңышка ирешергә ярдәм итә, ялгыш
адымнан, хаталардан саклый...» — дип әйткән булган.
«Органик химия» термины иң беренче 1808 елда Й. Бер-
целиусның «Химия дәреслеге»ндә күренә. 1827 елда ул
беренче органик химия дәреслеген бастырып чыгара.
25 млн га якын органик матдә билгеле һәм аларның саны һаман арта
бара. Ә безгә билгеле неорганик матдәләрнең саны 1 млн га да җитми.
Органик матдәләрнең саны шулкадәр күп булуы, шулай ук аларның
үзлекләре неорганик матдәләр үзлекләреннән аерылып торуы да, органик
химияне неорганик химиядән аерып карарга мәҗбүр итә.
Күп кенә органик матдәләр, табигатьтә очрый торган һәм хәтта очрамый
торганнары да, мәсәлән төрле буягычлар, дару матдәләре, пластмасса
җитештерүдә кулланыла торган төрле полимерлар, ясалма һәм синтетик
сүсләр һ. б. синтезланды.
XIX гасыр башында этанда C2H6, пропанда C3H8 һәм башка күп кенә
кушылмаларда углеродның валентлыгын аңлатырга мөмкин булмады.
Кайбер галимнәр этанда углерод өч валентлы, ә пропанда углеродның
валентлыгы вакланмалы санга тигез дип исәпләделәр.
Галимнәр шулай ук молекуляр формулалары бер үк төрле берничә
матдә булуын да аңлатып бирә алмадылар. Әйтик, мәсәлән, глюкозаның
молекуляр формуласы — C6H12O6. Балда һәм җиләк-җимештә була торган
фруктозаның да молекуляр формуласы шундый ук. Этил спирты һәм диме-
тил эфирының молекуляр формуласы бер үк төрле: C2H6O. Химиклар ни
өчен ике элемент — углерод һәм водород — үзара бер-берсе белән шулкадәр
күп кушылма, мәсәлән метан CH4, этан C2H6, пропан C3H8, бутан C4H10,
бензол C6H6 һ. б.ны барлыкка китерүен аңлата алмадылар. Гомумән,
органик матдәләрнең ни өчен шулай күп булуын аңлату да мөмкин бул¬
мады.
Бу сорауларга фәнни яктан дәлилләнгән җавапларны рус галиме
А. М. Бутлеров тарафыннан иҗат ителгән органик кушылмаларның
төзелеше теориясе генә бирде. Элементларның валентлыгы, углерод атомна¬
рының үзара бер-берсе белән тоташып углерод чылбыры барлыкка китерү
сәләте турында Э. Франкленд (1825—1899), Ф.-А. Кекуле (1829—1896),
А. Купер (1831—1891) һ. б. галимнәр үстергән идеяләр һәм күзаллауларга
нигезләнеп, Бутлеров 1861 елда органик кушылмалар төзелеше теориясенең
төп тезисларын тәгъбир итә.
149
Вёлер
Фридрих
(1800-1882)
Немец химигы. Петербург фәннәр академия¬
сенең чит ил әгъзасы (1853 елдан). Аның
тикшеренүләре неорганик химиягә дә, ор¬
ганик химиягә дә багышлана. Циан кисло¬
тасын (1822) ача, алюминий (1827), бериллий
һәм иттрийны (1828) таба.
А. Бутлеров галимнәр арасында беренче булып молекуланың химик
төзелеше, ягъни молекулада атомнарның үзара бер-берсе белән тоташу
эзлеклелеге төшенчәсен куллана. Ул матдәнең химик төзелешен белү
матдәнең үзлекләрен алдан әйтергә һәм, киресенчә, әгәр матдәнең үзлек¬
ләре билгеле булса, аның молекуласы төзелешен алдан күрә белергә ярдәм
итүен күрсәтә. Бутлеров иҗат иткән органик матдәләр төзелеше теориясе
моңа кадәр билгеле булмаган матдәләрнең булуын алдан күрергә һәм
аларның күбесен синтезларга мөмкинлек бирә. Бу теорияне галимнәр
бүгенге көндә дә уңышлы кулланалар.
Молекула төзелешенең схемадагы сурәтен төзелеш формуласы яки
структур формула дип йөртәләр. Структур формуладагы сызыкча атомнар
арасындагы бер бәйләнешне билгели. Мәсәлән, метанның структур
формуласы болай сурәтләнә: ң
I
н-с-н
I
H
Шуны исәпкә алырга кирәк: органик кушылмаларда углерод һәрвакыт
дүрт валентлы.
Углеводородлар молекулаларында углерод атомнары арасында берле,
икеле һәм өчле бәйләнешләр булырга мөмкин, мәсәлән:
H H
I I
H H
H-C-C-H
4C = Cz H-C=C-H
I I
H H
этан
ң ң ацетилен
этилен
§49. А. М. Бутлеровның органик кушылмаларның
төзелеше теориясенең төп положениеләре
1. Молекулаларда атомнар үзара билгеле бер эзлеклелектә тоташ¬
каннар. Бу эзлеклелекне үзгәрткән очракта, башка үзлекләргә ия булган
яңа матдәләр табыла.
150
Pyc химигы, Петербург фәннәр академиясе
академигы (1874 елдан). Органик матдәләр¬
нең химик төзелеше теориясен иҗат итүче
(1861). Күп кенә органик кушылмаларның
изомериясен алдан әйтә һәм өйрәнә. Күп
кенә матдәләрне синтезлый.
Бутлеров
Александр
Михайлсзич
(1828-1886)
2. Атомнар үзара валентлыкларына туры китереп тоташа, шуның
белән бергә, углерод атомнары дүрт валентлы. Молекулаларда барлык
атомнарның валентлыгы үзара туенган була. Молекулаларда ирекле ва¬
лентлыкл ар булмый.
3. Матдәләрнең үзлекләре молекулаларда атомнарның тоташу эз-
леклелегенә бәйле. Молекулаларда бер-берсе белән турыдан-туры бәйлә¬
нештә торган атомнарның бер-берсенә йогынтысы көчлерәк. Шуңа күрә
атом төркемнәре (группировкалары) бертөрле булган матдәләрнең үзлек¬
ләре охшаш.
4. Углерод атомнары үзара углерод атомнары чылбырын (моле¬
куланың углерод скелетын) барлыкка китереп тоташу үзлегенә ия.
Кайбер гади органик матдәләрнең структур формулаларына мисал-
лар:
H H
H
HHH
HHHH
I I
I
I I I
Illl
H-C—C—
-с-н
н-с-с-с-н
H-C-C-C-C-H
I I
I
I I I
Illl
H н-с—н
H
HHH
HHHH
I
н
пропан C3H8
бутан C4H10
изобутан C4H
10
Молекулаларда атомнарның төрле эзлеклелектә тоташуы — изомер¬
лар булуның сәбәбе.
Изомерия — бер үк молекуляр формулага үзенең төзелеше һәм үзлеге
белән аерылып торган берничә матдә (изомерлар) туры килү күре¬
неше ул.
СЕЗ
БЕЛӘСЕЗМЕ?
А. М. Бутлеров органик матдәләрнең химик төзелеше
турында төп идеяләрне беренче тапкыр 1861 елда Шпей-
ерда үткәрелгән табигать фәннәре белгечләре съез¬
дында «Матдәләрнең химик төзелеше турында» ясаган
чыгышында ачып бирә.
151
Мәсәлән:
Br H H
H Br H
н-с-с-с-н
I I I
I I I
н-с-с-с-н
I I I
HHH
HHH
бромпропан C3H7Br
tK 70,9 0C
бромпропан C3H7Br
tK 59,4 0C
Бу изомерларның составлары һәм молекуляр формулалары бертөрле:
C3H7Br, ә төзелешләре һәм үзлекләре төрле.
Органик химиядә изомерия күренеше еш очрый. Әйтик, мәсәлән, икесе
ике төрле матдәнең молекуляр формуласы бер үк — C2H6O:
H H
I
H H
н-с-с-он
I I
H-C-O-C-H
I I
H H
I I
H H
этил спирты
сыеклык, tK 78,3 °C, суда
чиксез эрүчән, натрий белән
реакциягә керә
диметил эфиры
газ, tK 23,6 °C, суда аз эри,
натрий белән реакциягә керми
1—4 нче сорауларга җавап бирегез (163 нче бит).
§ 50. Органик кушылмаларның гадиләштерелгән
классификациясе
Органик кушылмаларның барлык күптөрлелеген тәртипкә китерү
өчен, аларны классификацияләргә (төркемләргә) кирәк. Теләсә нинди
классификация билгеле бер билгеләргә нигезләнә.
Органик кушылмаларның хәзерге классификациясе ике әһәмиятле
билгегә нигезләнә:
• молекуланың углерод скелетының төзелеше;
• молекулада функциональ группаларның булуы.
СЕЗ
БЕЛӘСЕЗМЕ?
Органик химиягә беренче билгеләмә XIX гасырның 50 нче
елларында Ф.-А. Кекуленың органик химия дәреслегендә
бирелә.
XIX гасыр уртасында ук инде швед химигы Й. Берцелиус
100 дән артык төрле кушылмаларны синтезлый.
152
153
Органик химиядә башлангыч кушылмалар булып углеводородлар, ягъни
углерод һәм водородтан гына торган матдәләр исәпләнә (19 нчы схема).
Әгәр органик кушылмаларның классификациясе функциональ
группаларга нигезләнсә, схема түбәндәгечә булачак:
20 нче схема
Функциональ группа — матдәнең үзлекләрен билгели торган атом яки
атомнар төркеме (группасы). Функциональ группалар буенча бирелгән
кушылманың матдәләрнең теге яки бу классына керүен билгелиләр. Бу
курста органик кушылмаларның иң билгеле класслары тикшерелә.
5 нче сорауга җавап бирегез. 1 нче мәсьәләне чишегез (163 нче бит).
Углеводородлар
§ 51. Чикле (туендырылган) углеводородлар
Халыкара номенклатурада кабул ителгәнчә чикле углеводородларны
алканнар дип атыйлар.
Аларның иң гади вәкиле — метан CH4. Бу — суда эремәүчән диярлек,
төссез, янучан, иссез газ. Метан — табигый газның төп состав өлеше. Ул
ташкүмер шахталарында җыела, һәм шуңа күрә аны шахта газы дип тә
йөртәләр. Сазлыкларда клетчатка әчешүе нәтиҗәсендә дә метан барлыкка
килә, шуңа күрә аны әле саз газы дип тә атыйлар.
Метан аксыл-зәңгәрсу, күренер-күренмәс ялкын белән яна:
CH4 + 2О2 —> CO2 + 2Н2О
Бер күләм метан белән ике күләм кислород яки ун күләм һава
катнашмасы гадәттән тыш шартлау куркынычлыгына ия.
Метанны 1200 0C тан югарырак температурада җылытканда, ул корымга
һәм водородка таркала. Бу процесс пиролиз дип атала:
CH4 C + 2Н21
154
СЕЗ
БЕЛӘСЕЗМЕ?
Мотор ягулыгының детонациягә тотрыклылыгы максималь
булырга тиеш. Нормаль төзелешле углеводородлар бик
тиз детонацияләнә (шартлый), тармакланган углеводород¬
ларның детонациясе бик кечкенә. Ягулыкның детонациягә
тотрыклылыгын аңа антидетонаторлар өстәп арттырырга
мөмкин.
Ташкүмерне һава кертмичә кыздырганда кокс газы барлыкка килә,
аның төп состав өлешләренең берсе шулай ук метан.
Чикле углеводородлар шактый ук инерт кушылмалар, бу C—C һәм C—H
бәйләнешләренең бик нык булуы белән аңлатыла. Алар актив матдәләр —
кислород, галогеннар белән тәэсир итешәләр. Чикле углеводородларга
алмаштыру реакцияләре хас.
Метан яктыда хлор белән реагирлаша. Бу вакытта хлор атомнары угле¬
водород молекуласындагы водород атомнарын акрынлап алмаштыра:
яктылык
CH4 + Cl2 * HCl + CH3Cl
хлорметан
яктылык
CH3Cl + Cl2 >НС1 + CH2Cl2 һ. б.
дихлорметан
Башка чикле углеводородларның углерод атомнары арасында гади берле
бәйләнешләр генә була. Бу түбәндәге структур формулаларда күренә:
H H
HHH
I I
HHHH
I
н-с-с-н
I I
H-C-C-C-H
I I I
н-с-с-с-с-н
Illl
H H
HHH
HHHH
этан
пропан
бу™ һ. б.
Моны кыскартып күрсәтергә мөмкин:
H3C- CH3, H3C-CH2-CH3, CH3-CH2-CH2-CH3
O O O Z O O Z Z O
Метан, этан һәм пропанны гомологлар дип атыйлар; алар чикле углево¬
дородларның (алканнарның) гомологик рәтенә керәләр.
T т
Төзелешләре һәм химик үзлекләре буенча охшаш, ләкин бер-берсеннән
бер яки берничә CH2 группасы белән аерылып торган матдәләрне гомо¬
логлар дип атыйлар. CH2 группасын гомологик аерма дип йөртәләр.
Моннан чыгып, чикле углеводородларның (алканнарның) гомуми
формуласын чыгарырга мөмкин: СпН2га+2, биредә п — углерод атомнары
саны.
155
37 иче рәсем. Метанны һәм аның кушылмаларын куллану: 1 — синтетик каучук табу;
2 — эчке янулы двигательләр өчен ягулык; 3 — синтетик бензин табу; 4 — эреткечләр
табу; 5 — металларны кискәндә һәм эретеп ябыштырганда куллану; 6 — ягулык;
7 — типография буявы табу; 8 — резин табу
Табигый газда этан, пропан һәм бутан да бар, ләкин метан белән чагыш¬
тырганда шактый аз микъдарда.
Табигатьтә сыек, каты һәм газсыман углеводородлар нефть һәм нефть
газлары катнашмасын барлыкка китерәләр. Каты углеводородлар нефть
һәм ташкүмердән табыла торган парафинда, вазелинда һәм төрле майлар
һәм мазьларда була.
Метанның кайбер галогенлы кушылмаларын — фреоннарны CF2Cl2,
CFCl3, CHFCl2 суыткычларда һәм аэрозоль препаратлар җитештерүдә тиз
очучан компонентлар сыйфатында файдаланалар. Ләкин фреоннарның
атмосферага үтеп керүе 25 км чамасы биеклектәге озон катлавы җимере¬
лүнең сәбәбе булырга мөмкин. Бу катлау безне тереклек өчен куркынычлы
космик нурлардан саклый.
Метанны куллану 37 нче рәсемдә сурәтләнә.
6—8 нче сорауларга җавап бирегез (163 нче бит).
§ 52. Чиксез (туендырылмаган) углеводородлар
Чиксез углеводородлар чикле углеводородлар белән чагыштырганда
реакциягә керергә сәләтлерәк. Мәсәлән, алар калий перманганатының
KMnO4 судагы эремәсе һәм бромлы су белән җиңел оксидлаша. Калий
перманганаты эремәсе һәм бромлы суны төссезләндерү — икеле һәм өчле
бәйләнешкә сыйфат реакцияләре.
156
1. Этилен рәте углеводородларының (Халыкара номенклатура буенча
аларны алкеннар дип атыйлар) молекулаларында бер генә икеле бәй¬
ләнеш. Бу рәтнең иң әһәмиятле вәкиле — этилен (этен) H2C=CH2.
Бу — бөтенләй диярлек иссез, суда начар эри торган газ. һавада яктырып
яна. Икеле бәйләнеше булуы сәбәпле, этилен кушылу реакциясенә җиңел
керә, мәсәлән:
H-C=C-H
I I
H H
Br Br
I I
+ Br-Br —> H-C-C-H
I I
H H
дибромэтан
H-C=C-H + H-H
I I
H H
Г, Ni Il
—> H-C-C-H
I I
H H
этан
Молекулаларында бер яки берничә икеле яки өчле бәйләнешләр булган
башка чиксез углеводородлар өчен дә кушылу реакцияләре характерлы.
Икеле бәйләнеш аркасында этилен молекулалары үзара тоташа, ягъни
полимерлаша ала:
WH2C=CH2
TiCl4, Al(C2H5)3
H H
I I
-C-C-
I I
полиэтилен
Пропилен H2C=CH—CH3 полимерлашканда полипропилен табалар.
Полиэтилен һәм полипропиленны электротехникада электр изоляцияләү
материалы сыйфатында, теплица һәм парникларда пыяла урынына, шулай
ук төрү материалы итеп файдаланалар.
Чикле углеводородлар кебек үк, этилен рәте углеводородлары да һавада
яналар:
C2H4 + ЗО2 * 2СО, + 2Н2О
Этиленны һәм аннан табылган матдәләрне куллану 38 нче рәсемдә су¬
рәтләнә.
2. Чиксез углеводородларның ацетилен рәтенең (Халыкара номенкла¬
тура буенча аларны алкиннар дип атыйлар) иң әһәмиятле вәкиле — ацети¬
лен. Ацетилен молекуласында углерод атомнары арасында өчле бәйләнеш:
H-C=C—Н. Ацетилен — төссез газ, саф хәлендә иссез диярлек.
157
Техник ацетиленнан төрле катышмалар, мәсәлән аммиак NH3, фосфин
PH3 яки арсин AsH3 биргән начар ис килә.
Лабораториядә һәм промышленностьта ацетиленны кальций карбидыннан
CaC2 табалар. XX гасырның 60 нчы елларына кадәр безнең илдә ацетиленны
шушы ысул белән табалар:
CaC2 + 2Н2О —> Ca(OH)21 + H-C=C-H
(Барлыкка килгән Ca(OH)2 аз эри.)
1970 елдан башлап промышленностьта ацетиленны углеводород чима¬
лыннан пиролиз методы белән табалар:
2СН4 -5—-С » H-C=C-H + ЗН2
Ацетиленга, этиленга кебек үк, кушылу реакцияләре хас:
t, Ni
H-C=C-H + 2Н2 * H3C-CH3
этан
Ацетиленны ацетилен-кислород горелкаларында металларны эретеп
ябыштыру һәм кисү өчен кулланалар. Ацетилен яну реакциясенең бик
мөһим үзенчәлеге бар: горелкага кислород өрдергәндә, ялкынның тем¬
пературасы 2800 oC ка җитәргә мөмкин:
2С?Н„ + 5О„ > 4СО, + 2Н,0 + Q
ZZZ Z Z
38 нче рәсем. Этиленны һәм аның кушылмаларын куллану. Табу: 1 — октан саны югары
булган ягулык; 2 — пластмассалар; 3, 4 — шартлаучан матдәләр; 5 — антифризлар;
6, 8 — эреткечләр; 7 — җиләк-җимешләрнең өлгерүен тизләтү өчен; 9 — ацетальдегид
табу өчен; 10 — синтетик каучук табу өчен
158
СЕЗ
БЕЛӘСЕЗМЕ?
Резин промышленносте өчен чимал базасы булдыру
кирәклеге Совет хөкүмәтен 1926 елның башында синтетик
каучук табуның иң яхшы ысулына конкурс игълан итәргә
мәҗбүр итә. Тәкъдимнәрне (һәм бер үк вакытта синтетик
каучукның 2 кг үрнәген дә) кертүнең соңгы срогы итеп
1928 елның 1 гыйнвары билгеләнә.
С. В. Лебедев, хөкүмәт чакыруына җавап итеп, җиде ке¬
шедән торган тикшеренүчеләр төркемен оештыра. Эшнең
беренче нәтиҗәсе 1927 елның уртасында күренә. Һәм
фәкать 1927 елның 30 декабрендә генә 2 кг дивинил
каучук С. В. Лебедев ысулының тасвирламасы белән бергә
конкурс комиссиясенә җибәрелә.
Ацетиленны шулай ук серкә кислотасы табу, ясалма каучук, пласт¬
массалар һ. б. җитештерү өчен файдаланалар.
3. Диен углеводородларның (алкадиеннарның) типик мисалы булып
бутадиен-1,3 тора: R с=с_с=сн
2 II 2
H H
Диен углеводородларның молекулаларында ике икеле бәйләнеш бар.
Бутадиен-1,3 атамасындагы цифрлар углеродның беренче һәм өченче атом¬
нары янында икеле бәйләнешләр булуын күрсәтә.
Изопрен, яки 2-метилбутадиен-1,3 H2C=C—C=CH2 табигый каучук1
төзелешенең нигезен тәшкил итә. тт 1 Jt
-ElgK-y Г1
Диен углеводородларны башлыча автомобиль покрышкалары, камералары
һәм башка резин әйберләр җитештерүдә гаять зур әһәмияткә ия булган
синтетик каучук табу өчен файдаланалар.
9—13 нче сорауларга җавап бирегез. 2, 3 иче мәсьәләләрне чишегез (163 нче бит).
□ § 53. Циклик углеводородлар
19 нчы схемадан күренгәнчә, циклик углеводородларны циклопарафин-
нарга һәм ароматик углеводородларга аерып күрсәтергә мөмкин.
1. Циклопарафиннар (циклоалканнар, нафтеннар) табигатьтә күп
чыганакларда чыгарылган нефтьнең төп состав өлешләре буларак очрый.
Характерлы вәкилләре сыйфатында түбәндәгеләрне күрсәтергә мөмкин:
1 Изопренның полимерлашуы нәтиҗәсендә табигый каучук барлыкка килә:
ZjH2C = C-C=CH2 —♦ (-H2C-C = C-CH2-),,
H3C H H3C H
159
СЕЗ
БЕЛӘСЕЗМЕ?
Бензолны беренче булып 1851 елда П. Э. Бертло таба.
Ф.-А. Кекуле 1865 елда бензолның циклик формуласын
тәкъдим итә һәм шуның белән А. М. Бутлеров иҗат иткән
органик матдәләрнең химик төзелеше турындагы тео¬
рияне ароматик кушылмаларга карата куллана.
H2C-CH2
I I
H2C-CH2
циклобутан,
tK 11,3 0C
H2C-CH2
I I
H2C CH2
CH2
циклопентан,
tK 49,3 oC
CH2
H2C CH2
H2C CH2
CH2
циклогексан,
tK 80,7 oC
Физик үзлекләре буенча циклопарафиннар чикле углеводородларны
хәтерләтә. Ләкин нафтеннарның кайнау һәм эретелү температуралары
ал арга туры килгән чикле углеводородларныкына караганда югарырак.
Циклопарафиннарның химик активлыклары түбән, аларның үзлекләре
чикле углеводородларныкы белән охшаш.
2. Ароматик углеводородларның (ареннарның) иң характерлы вәкиле —
бензол C6H6. Бензол һәм ароматик углеводородларның билгеле беренче
вәкилләре үзенчәлекле хуш исле. Бу рәт кушылмаларына әлеге исем шуңа
бәйле рәвештә бирелгән.
Бензол молекуласында углеродның алты атомы йомык боҗра (цикл)
барлыкка китерә, анда алты берле бәйләнеш бар, структур формулада алар
алты сызыкча белән билгеләнә. Моннан тыш, бу циклда углеродның барлык
атомнары үзара бер уртак бәйләнеш белән тоташкан, структур формулада
аны углерод атомнарының алтыпочмаклыгы эчендә түгәрәк рәвешендә
сурәтлиләр:
CH
Барлык ароматик углеводородларның молекулаларында бензол боҗ¬
расы бар. Мондый углеводородларны нефть крекингы вакытында (161 нче
битне карагыз) һәм ташкүмерне кокслаганда, ягъни аны һавасыз тирәлектә
югары температураларга кадәр җылытканда барлыкка килгән ташкүмер
сумаласыннан табалар.
Бензол — буягычлар, дарулар, үсемлекләрне саклау чаралары, шарт¬
лагыч матдәләр һәм синтетик сүсләр җитештерү өчен кыйммәтле чимал.
Бензол органик матдәләрне яхшы эреткеч буларак та кулланыла.
160
§ 54. Углеводородларның табигый чыганаклары
Табигый газ башлыча метаннан тора. Ул янганда чиста дип әйтерлек
углерод (IV) оксиды һәм су парлары хасил була. 1 м3 табигый газның
җылылык аерып чыгару сәләте 35 600 кДж гә тигез.
Химия промышленностенда табигый газдан этилен һәм ацетилен табалар,
ә алардан үз чиратында этил спирты, синтетик каучук, пластмассалар,
буягычлар, медикаментлар һ. б. җитештерәләр.
Нефть — туендырылган, ароматик һәм нафтен углеводородларның
табигый катнашмасы. Нефтьне җылытканда башта кайнау температурасы
иң түбән булган матдәләр, ә аннары югарырак температурада кайный
торганнары парга әйләнә. Гадәттә, төп өч фракция алалар, соңыннан бу
фракцияләрне кудыру юлы белән тагын аералар (34 нче таблица.)
Нефтьне куганда 20% ка кадәр бензин чыга. Нефтьтән бензинның чы¬
гышын крекинг процессында, ягъни углерод чылбыры озын углеводород¬
ларны кечерәк молекуляр массалы углеводородларга термик яки каталитик
34 нче таблица. Нефть куганда табылган әһәмиятле продуктлар
һәм аларны куллану
Нефть кууның төп
фракцияләре
Төп фракцияләрне тагын
куып табылган продуктлар
Kyy продуктларын
куллану
1. Бензин фракциясе
150 0C ка кадәр темпе¬
ратурада табалар. Мо¬
лекуласы 5—9 углерод
атомыннан торган угле¬
водородлар
1) Пентан (tK 38 °C)
2) Газолин
(сыек, tK 40—70 0C)
3) Бензин
(сыек, tK 70—120 °C)
4) Лигроин
(сыек, tK 120—140 °C)
Органик синтез
Эреткеч; органик син¬
тез
Автомобиль һәм само¬
летлар өчен ягулык
Тракторлар өчен ягу¬
лык
2. Керосин фракциясе
150—300 oC та табалар.
Молекуласы 9—16 угле¬
род атомыннан торган
углеводородлар
1) Керосин
(сыек, tK 150—300 °C)
2) Соляр майлары
(tK 270 oC тан югары)
Тракторлар һәм реак¬
тив самолетлар өчен
ягулык
Дизель двигательләре
өчен ягулык
3. Мазут
Нефтьне куганнан соң
калган углеводородлар
катнашмасы.
Зур молекуляр массалы
углеводородлардан тора.
Мазутны алга таба 360 0C
та тагын куалар
1) Соляр майлары
2) Майлагыч майлар
3) Вазелин
4) Парафин
5) Гудрон
Дизель двигательләре
ягулыгы
Төрле механизмнарны
майлау
Фармакология
Шәм һәм шырпы җи¬
тештерү
Юлларны асфальтлау
161
39 нчы рәсем. Нефть крекингы процессында табылган продуктларны куллану. Табу:
1 — шартлагыч матдәләр; 2, 7 — антифризлар; 3 — дару мазьлары; 4 — парфюмерия
әйберләре әзерләү өчен мазьлар; 5 — лавсан җепселләре; 6, 8,11 — эреткечләр; 9 — бута¬
диен каучук; 10 — бутадиен-стирол каучук; 12 — эчке янулы двигательләр өчен ягулык
таркату юлы белән 70% ка кадәр арттырырга мөмкин. Нефть крекингы
вакытында табылган туендырылган, туендырылмаган һәм ароматик углево¬
дородларны химия промышленностенда киң кулланалар (39 нчы рәсем.)
Ташкүмерне башлыча ягулык итеп кулланалар, ләкин әгәр аны һава
кертмичә 1000—1400 0C та җылытуга — кокслауга дучар итсәң, аннан кокс
(башлыча углеродтан тора), кокс газы (башлыча водород һәм метаннан тора)
һәм химия промышленносте, металлургия ихтыяҗлары өчен кирәкле башка
продуктлар табалар (21 нче схема).
21 нче схема
Кокс — 75%
Кокс газы — 20%
Дегет — 3%
Ароматик углеводородлар — 1%
Аммиак — 0,3%
Башка кушылмалар — 0,7%
14—17 нче сорауларга җавап бирегез (163 нче бит).
162
1. Органик химия нәрсәне өйрәнә?
Составында углерод булган углерод (IV)
оксиды, углерод (II) оксиды, карбонатлар,
карбидлар нинди матдәләргә керә?
2. Этил спирты һәм диметил эфиры¬
ның молекуляр формулалары бертөрле бу¬
луның сәбәбен ничек аңлатырга мөмкин?
Изомерия дип нәрсәне атыйлар?
3. Органик кушылмаларның төзеле¬
ше теориясенең төп положениеләре нин-
диләр?
4. Пентан C5H12 һәм гексанның C6H14
структур формулаларын төзегез.
5. Органик кушылмаларның хәзерге
классификациясе нинди билгеләргә ни¬
гезләнеп төзелгән? Мисаллар китерегез.
6. Метанның гомологы булган угле¬
водород: 1) C2H2 2) C3H8 3) C3H6 4) C2H4.
7. Метанга кыскача характеристика
бирегез һәм аның кайда файдаланылуы
турында сөйләгез. Фреоннар турында сез
нәрсә беләсез?
8. Изомерлар:
1) этан һәм пропан —
2) метан һәм пропан
3) метан һәм этан
4) бутан һәм изобутан J
9. Этиленсыман углеводородларның
(алкеннарның) гомологик рәте этиленнан
башлана. Этиленның ике гомологының
формулаларын һәм алкеннарның гомуми
формуласын языгыз.
10. Этиленның үзлекләрен һәм аның
кулланылышын тасвирлагыз. Полиэти¬
лен һәм полипропиленны кайда файда¬
ланалар?
11. Ацетиленсыман углеводородларның
(алкиннарның) гомологик рәте ацетилен¬
нан башлана. Ацетиленның ике гомо¬
логының формулаларын һәм алкиннарның
гомуми формуласын языгыз.
12. Ацетиленны ничек табалар? Аны
куллануны тасвирлап бирегез.
13. Диеннарны кайда кулланалар?
14. Табигый газны химия промыш¬
ленностенда ничек файдаланалар? Метан¬
ны хлорлау реакциясенең тигезләмәсен
(тулысынча) төзегез.
15. Нефть куу продуктларын тасвир¬
лагыз. Нефтьне куганда ничә процент
бензин табалар һәм крекинг вакытында
күпме?
16. Атмосфера һавасын пычранудан
ничек сакларга?
17. Углеводородларның кушылма¬
ларының гадиләштерелгән классифика¬
циясен тикшерегез. Органик кушылма¬
ларның һәр классына кергән матдәләрнең
формулаларын языгыз.
O 1. 94% метаннан (н. ш.) торган
150 дм3 табигый газның тулысынча янып
бетүе өчен кирәкле кислород һәм һава
күләмен исәпләп чыгарыгыз. Ьавада
кислород (күләме буенча) 20% ка якын.
2. 80 г дибромэтан табу өчен кирәкле
3% лы бромлы суның массасын исәпләп
чыгарыгыз.
3. 160 г техник кальций карбиды
(CaC2 нең масса өлеше 80%) һәм артыгы
белән алынган су тәэсир итешкәндә табыл¬
ган ацетиленның күләмен (н. ш.) исәпләп
чыгарыгыз.
163
Углеводородларның кушылмалары
§ 55. Спиртлар
Спиртлар дип углеводородларның молекулаларында бер яки берничә
водород атомы бер валентлы гидроксил группаларына алмаштырылган
кушылмаларны атыйлар.
Бер атомлы чикле спиртлар. Матдәләрнең бу классына кергән иң гади
вәкиле — метил спирты, яки метанол, CH3OH һәм этил спирты, яки этанол,
C2H5OH.
Метанол — төссез сыеклык (th 65 °C). Бик агулы. Аның бер йоты¬
мы — сукырайтырга, ә күбрәк микъдары үлемгә китерергә мөмкин. Бу
спирт агачны корылай куып (агач пиролизы ярдәмендә) табылганлыктан,
аны башта агач спирты, дип йөрткәннәр. Метанолны эреткеч, автомобиль
ягулыгына өстәлмә сыйфатында, серкә кислотасы, пластмасса һәм башка
матдәләр җитештерү өчен кулланалар.
Этанолны (шәраб спиртын) этиленнан җитештерәләр һәм химия про¬
мышленностенда киң кулланалар. Әле борынгы заманнарда ук шикәрле
матдәләрнең әчешүе вакытында этанол табуның түбәндәге схемасы билгеле
булган:
C6H12O6 ферментлар >2С2Н5ОН + 2С0Л
Этанолны шулай ук катализатор катнашында этиленны гидратлашты-
рып та табалар:
H2C=CH2 + H-OH —> CH3-CH2OH
Этанол синтетик каучуклар җитештерүдә, шулай ук эреткеч, лаклар,
медикаментлар, хуш исле матдәләр һәм алкогольле эчемлекләр җитештерү
өчен башлангыч материал сыйфатында файдаланыла. Спирт бензин белән
теләсә нинди нисбәттә катнаша, шуңа күрә аны кайчак ягулыкка өстәмә
сыйфатында кулланалар. Шуны онытырга ярамый: этанол — агулы нарко¬
тик матдә!
Углеводородлар кебек үк, спиртлар да кислородта һәм һавада яна:
2С9Н5ОН + 6О9 * 4СО9 + 6Н9О
ZO Z ZZ
Этанолны сульфат кислотасы катнашында җылытканда, этилен газы
хасил була:
t, H9SO,
C9H5OH 2 4 > CH9=CH91 + H9O
ZO ZZZ
O Кире реакцияне — сульфат кислотасы катнашында этилен гидратла-
шуны — беренче булып 1854 елда П.-Э. Бертло тормышка ашыра. Хә¬
зерге вакытта бу реакция — производствода этил спиртын табуның төп
методларыннан берсе.
164
СЕЗ
БЕЛӘСЕЗМЕ?
Этиленгликольгә глицерин өстәү автомашиналарда су
насосларының эшләү срогын арттыра.
Күп атомлы спиртлар
Этиленгликоль. Аның молекуласын, водородның ике атомы ике
гидроксил группасына алмаштырылган этан молекуласы итеп карарга
мөмкин: Tj ГЕГ
11.24--' V/11.2
OH OH
Этиленгликоль — татлы сиропсыман сыеклык, 197,6 oC та кайный, бик
агулы.
Этиленгликольнең су белән кушылган катмый торган катнашмаларын
антифризлар җитештерү өчен файдаланалар. Кышкы шартларда ал арны
автомашиналар радиаторына су урынына салалар. 52,6% этиленгликольдән
торган антифриз -40 °C та, ә 63,1% лысы -60 °C та ката.
Глицерин — тәмгә татлы, шулай ук төссез сиропсыман сыеклык. Аның
молекуласында өч гидроксил группасы:
H2C -CH- CH2
I I I
OH OH OH
Глицеринны антифризлар, тире йомшарткыч матдәләр, күп кенә меди¬
каментлар җитештерүдә файдаланалар. Аннан, тау эшләрендә шартлаткыч
матдәләр сыйфатында һәм нефть янгыннарын сүндерүдә файдаланыла
торган нитроглицерин җитештерәләр.
1—3 нче сорауларга җавап бирегез (173 нче бит). 1 нче мәсьәләне чишегез
(173 нче бит).
§ 56. Карбон кислоталары. Катлаулы эфирлар.
Майлар
Карбон кислоталары дип углеводородларның молекулаларында
ХО
-Cx атомнар группасы (карбоксил группасы) булган кушылмаларны
O-H
атыйлар.
Карбон кислоталарының иң гади вәкилләре — кырмыска һәм серкә
кислоталары. O
Кырмыска кислотасы H-Cx кырмыскаларның агу бизләрендә,
O-H
кычытканда, чыршы ылысында була. Ул йон һәм тирене буяу алдыннан
165
40 нчы рәсем. Серкә кислотасын куллану. Табу: 1 — дарулар; 2 — тозлар; 3 — ацетат
ефәк; 4 — аш тәмләткеч һәм консервлау өчен; табу: 5 — җиләк-җимеш эссенцияләре;
6 — лаклар өчен эреткечләр; 7 — бөҗәкләр һәм үсемлекләрнең авыруларына каршы
көрәшү өчен төрле матдәләр; 8 — үсемлекләр үсешен тизләтүче матдәләр; 9 — тукымалар
өчен буяулар; 10 — кинопленкалар
эшкәртү өчен протрава сыйфатында, промышленностьта көчле кайтаргыч
сыйфатында, ревматизмнан дару буларак (кырмыска кислотасының
спирттагы 1,25% лы эремәсе, яки «кырмыска спирты»), шулай ук эреткечләр
сыйфатында кулланыла торган катлаулы эфирлар табу өчен файдала¬
налар.
Серкә кислотасы CH4-C4 безгә аш серкәсе (судагы 5—9% лы эре-
OH
мәсе) буларак таныш. Серкә эссенциясендә серкә кислотасы 70% тәшкил
итә, шуңа күрә аның белән бик сак эш итәргә кирәк. Серкә кислотасын
куллану схематик рәвештә 40 нчы рәсемдә күрсәтелгән. Карбон кислоталары
кислоталарның уртак үзлекләренә ия. Алар водород ионы барлыкка китереп
д иссоциация л әшә:
HCOOH <=* HCOO- + H+
кырмыска формиат-
кислотасы ион
CH3COOH «=> CH3COO- + H+
серкә ацетат-
кислотасы ион
Карбон кислоталары түбәндәге матдәләр белән реакциягә керә:
актив металлар белән:
2СН3СООН + Mg —* (CH3COO)2Mg + H21
магний ацетаты
166
СЕЗ
БЕЛӘСЕЗМЕ?
Дөньяның барлык илләрендә бал кортлары Varroa талпан¬
нарыннан күпләп кырыла. Алар бал кортларының хитин
япмаларын кимереп тишә, гемолимфасын суыра һәм
бөҗәк үлә. Талпаннарга каршы кузгалак, кырмыска һәм
сөт кислоталарын файдаланалар.
нигез оксидлары белән:
2СН3СООН + CaO > (CH3COO)2Ca + H2O
кальций ацетаты
нигезләр белән:
CH3COOH + NaOH > CH3COONa + H9O
O OZ
натрий ацетаты
көчсезрәк кислота тозлары белән:
2СЩС00Н + K2CO3 * 2СН3СООК + CO2 t + H2O
O ZO о Z Z
калий ацетаты
Серкә һәм кырмыска кислоталарыннан тыш, башка табигый карбон
кислоталары да билгеле.
Лимон кислотасы (өч нигезле оксикарбон кислотасы)
OH
O. I .0
/C-CH2-C-CH2-Cf
HO I O OH
с\
OH
Бу кислота лимонда, кура җиләге, карлыган, крыжовник, миләш,
виноградта бар. Азык-төлек промышленностенда салкын эчемлекләр,
кондитер әйберләре җитештерү өчен һәм медицинада киң файдаланыла. Ул
тере организмнарда матдәләр алмашы процессында мөһим роль уйный.
Сөт кислотасы CH3—CHOH—COOH сөт әчегәндә, кәбестә тозланганда,
терлек азыгы силосланганда шактый микъдарда барлыкка килә. Ул —
яхшы консервант.
Кузгалак кислотасы HOOC-COOH кузгалакта һәм башка кайбер үсем¬
лекләрдә бар. Кеше организмында матдәләр алмашы бозылганда, кузгалак
кислотасының тозы — кальций оксалаты бөерләрдә таш булып утыра.
Кузгалак кислотасын буягычлар җитештерүдә, шулай ук тутыкны бетерү
өчен файдаланалар.
Югары, яки югары молекуляр төзелешле карбон кислоталарына (май
кислоталарына) мисал — пальмитин һәм стеарин кислоталары. Аларның
молекуласында 16 һәм 18 углерод атомы бар. Бу кислоталарның карбоксил
группаларындагы водород атомнарын натрий яки калийга алмаштырганда
сабын, мәсәлән натрий стеараты C17H35COONa хасил була.
167
Карбон кислоталары спиртлар белән тәэсир итешкәндә катлаулы
эфирлар барлыкка килә:
O O
CH3-C; +CH3CH2OH си,-с( + н2о
OH xO-CH2CH3
серкә этил этилацетат
кислотасы спирты (катлаулы эфир)
Әгәр катлаулы эфирларның молекулаларында углерод атомнарының
саны зур булмаса, алар хуш исле була. Андыйларны парфюмериядә һәм
азык-төлек промышленностенда файдаланалар. Чәчәк, җиләк-җимешләрнең
хуш исе аларда төрле катлаулы эфирлар булуга бәйле.
Глицеринның һәм югары төзелешле карбон кислоталарының катлаулы
эфирлары сыек һәм каты майларның төп состав өлеше булып тора.
Майларның гомуми формуласы:
CH2-O-CO-R'
CH -O-CO-R"
I
CH2-O-CO-R'",
биредә R', R'', R"' — югары төзелешле карбон кислоталарының углеводород
калдыклары. Каты майларда башлыча югары төзелешле чикле кислота кал¬
дыклары, ә сыек майларда югары төзелешле чиксез кислота калдыклары
була.
Майлар организмда бара торган матдәләр алмашы процессында мөһим
роль уйный, алар энергия чыганакларының берсе булып тора: 1 г май
оксидлашканда 39 кДж аерылып чыга. Майлар — биологик актив матдәләр,
мәсәлән А, Е, Ввитаминнары өчен яхшы эреткечләр.
4—7 нче сорауларга җавап бирегез (173 нче бит). 2—4 нче мәсьәләләрне чишегез
(173 нче бит).
§ 57. Углеводлар
Углеводларның иң әһәмиятле вәкилләре — глюкоза һәм фруктоза.
Аларның молекуляр формулалары бертөрле: C6H12O6. Һәр ике матдә җиләк-
җимешләрдә була. Фруктоза — балның әһәмиятле состав өлеше. Глюкоза
үсемлекләрдә фотосинтез процессында барлыкка килә:
6СО2 + 6Н2О
яктылык
хлорофилл
C6H19О6 + 6О9
O IZ O Z
Глюкоза һәм фруктоза — тере организмнар өчен җиңел үзләштерелә
торган энергия чыганагы. Глюкозаны кондитер һәм туку промышленнос¬
тенда, көзгеләр ясауда һәм аскорбин кислотасы (С витамины) җитештерүдә
киң файдаланалар. Виноград һәм башка җиләк-җимешләр суы әчегәндә,
168
СЕЗ
БЕЛӘСЕЗМЕ?
Хәзерге вакытта авыл хуҗалыгында тәэсир итү спектры
төрле булган 100 гә якын гербицид кулланыла. Гербицид¬
ларны кулланганда табигатькә зыян китермәслек эш
итәргә кирәк. Чүп үләннәргә каршы көрәштә төп чара
булып туфракны югары сыйфатлы итеп эшкәртү икәнен
онытырга ярамый.
Яран исе — дифенил эфирына C6H5-O-C6H5, ә розалар
исе фенилэтил спиртына C6H5-CH2-CH2-OH бәйле.
Борынгы заманнардан ук кешеләр зарарлы бөҗәкләргә
каршы төрле чаралар кулланганнар. Киптерелгән ромашка
чәчәге порошогын Борынгы Мисырда ук инде инсектицид
сыйфатында кулланганнар.
Безнең эрага кадәр 200 ел элек шикәр камышының татлы
суын кытайлылар һәм индуслар азык итеп кулланганнар.
глюкоза этил спиртына әверелә. Бу максатлар өчен глюкозаны шулай ук
крахмалдан һәм целлюлозадан табалар. Шулай итеп, глюкоза шәраб һәм
башка химия производстволарында киң кулланыла торган этил спиртын
җитештерүдә зур әһәмияткә ия.
Сахароза C12H22O11 шикәр чөгендерендә (16—22%), шикәр камышында
(14—26%) һәм өрәңге, каен, пальма суында, күп кенә башка үсемлекләрнең
җимешләрендә бар. Сахароза — шикәрнең төп состав өлеше.
Катлаулырак төзелешле углеводлар — крахмал һәм целлюлоза; аларны
төзелешләре буенча югары молекуляр төзелешле кушылмаларга — поли¬
мерларга (172 нче бит) кертергә мөмкин.
Крахмалның молекуляр формуласы: (C6H10O5)n, биредә п саны бер¬
ничә меңгә җитә. Крахмал — табигый полимер. Әгәр крахмал молеку¬
ласының C6H10O5 һәр буынына уйдан гына берәр молекула су өстәсәк,
глюкоза барлыкка килер. Крахмал гидролизының мондый реакцияләрен
практикада тормышка ашырып була.
Крахмал башлыча бөртекле ашлыкта, җиләк-җимешләрдә һәм тамыр¬
азыкларда була. Бәрәңге бүлбесендә сортына карап 20—30%, ә бодай, арыш
һәм башка бөртеклеләрдә 70—80% крахмал булырга мөмкин.
Крахмал үсемлекләрдә фотосинтез процессында барлыкка килә, башта
глюкоза, ә аннан крахмал хасил була:
ZiCfiH19Ofi—»(CfiH10O5)n + пН9О
O IZ O v O IU Z
Крахмалны күбрәк бәрәңгедән алалар. Моның өчен башта бәрәңгене
яхшылап юалар, аннары угычтан уалар, барлыкка килгән массаны юдыралар,
бу суларны тондыралар, төпкә утырган крахмалны киптерәләр һәм бәрәңге
оны алалар. Крахмалны азык-төлек, туку, кәгазь һәм фармацевтика про¬
мышленностенда файдаланалар. Аннан сироплар, техник глюкоза, этанол,
f
169
Данилевский
Александр
Яковлевич
(1838-1923)
Академик. Безнең ил биохимиясенә нигез салу¬
чыларның берсе. 1888 елда аксым молекуласы
төзелеше теориясен тәкъдим итә. Ашказаны
асты бизе сыекчасының аксымнарга тәэсире
гидролиз булуын эксперименталь юл белән
раслый. Мускул аксымын (миозинны) өйрәнә,
антипепсин һәм антитрипсинны ача.
ситсыга бизәк төшерүдә һәм җилем җитештерүдә кулланыла торган
декстрин табалар.
Целлюлоза, яки клетчатка — үсемлекләрдә күзәнәк тышчасының төп
состав өлеше (латинча cellula — күзәнәк). Үзагачта якынча 50% целлюлоза
һәм гади салфеткалар җитештерү өчен нигез булып хезмәт иткән лигнин
20—30%. Мамык саф целлюлоза диярлек. Целлюлозаның молекуляр
формуласы крахмалныкы кебек үк: (C6H10O5)n, бары тик целлюлозада
буыннар саны п күбрәк.
Үзагачны ягулык һәм төзелеш материалы сыйфатында гына файда¬
ланмыйлар. Аннан целлюлоза — кәгазь, метанол, этанол, каучук, серкә
кислотасы, ясалма ефәк җитештерү өчен әһәмиятле чимал — һәм тагын
күп кенә башка кыйммәтле продуктлар алалар.
8—10 нчы сорауларга җавап бирегез (173 нче бит). 5 нче мәсьәләне чишегез
(173 нче бит).
§ 58. Аминокислоталар. Аксымнар
Аминокислоталарның молекуляр формулаларын карбон кислоталары¬
ның молекуляр формулаларыннан китереп чыгарырга мөмкин. Әгәр
карбон кислотасы молекуласының углеводородлы өлешендәге кимендә
бер атом водородны аминогруппага (-NH2) алмаштырсаң, аминокислотаның
молекуляр формуласы килеп чыга.
Аминокислоталарның молекуласында ике функциональ группа: карбок¬
сил -COOH һәм аминогруппа -NH2 бар.
Мәсәлән, аминосеркә кислотасының (глицинның) төзелеше мондый:
.O
H2N-CH2-Cf
4OH
Барлык тере организмнарда аксымнар аминокислоталардан барлык¬
ка килә. Аминокислоталарны аксымнар таркалганда яки карбон кисло¬
таларыннан аларга аминогруппа (-NH2) кертеп табарга мөмкин.
170
Аминокислоталар — кристаллик матдәләр. Ал арның күбесе тәмгә тат¬
лы. Эретелү температурасы 22 0C тан югары.
Аксымлы матдәләрнең кеше һәм хайваннар туклануында әһәмияте
чиксез зур. Аминокислоталарның бер өлешен хайваннар үзләре синтезлый
алмый һәм алар хайваннар организмына азык белән генә керә. Организмда
синтезланмый торган аминокислоталар, мәсәлән, валин, лейцин, изолейцин,
метионин һ. б. алыштыргысыз аминокислоталар рәтенә керәләр.
Аминокислоталар синтетик сүсләр (капрон һәм лавсан) җитештерүдә
бик мөһим роль уйный.
Аксымнар — төрле аминокислоталар калдыклары күп төрле ком¬
бинацияләр ясап тоташканда барлыкка килгән бик катлаулы югары
молекуляр төзелешле органик матдәләр.
Аксымнар гидролизы (су белән тәэсир итешүе) вакытында 20 дән артык
аминокислота аерып алынган. Бу калдыкларның төрле эзлеклелектә
тоташуы нәтиҗәсендә төрле аксымнарның 2,4 • IO18 молекуласы барлыкка
килергә мөмкин. Кайбер аксымнарның чагыштырма молекуляр массасы
300 000 һәм аннан да артыграк. Аксым матдәләрнең күптөрлелеген алар
составына күкерт, фосфор, тимер, магний һәм башка элементлар керү
дә арттыра. Шуңа күрә тереклек ияләренең һәр төренә һәм хәтта һәр
индивидка үз аксымнары хас.
Аксымнар тере күзәнәкләр һәм тукымалар составына керә. Аксым¬
нарның функцияләре гаять күптөрле. Организмда меңәрләгән төр аксым
була, һәм аларның һәрберсе билгеле бер функцияне үти. Мәсәлән, бертөрле
аксымнардан — мускул тукымасы, икенчеләреннән — япма тукыма,
өченчеләреннән терәк-хәрәкәт системасы тукымалары һ. б. барлыкка килә.
Гемоглобин дип аталган катлаулы аксым төрле тукыма күзәнәкләрен кис¬
лород белән тәэмин итә һәм организмнан углерод (IV) оксидын чыгара.
Ферментлар һәм гормоннар да — аксым табигатьле матдәләр. Фермент¬
ларны биохимик процессларның катализаторлары буларак тикшерергә
мөмкин. Гормоннар — билгеле бер органнар яки органнар системасы эшчән-
легенә йогынты ясаучы һәм матдәләр алмашын көйләүче бик актив матдәләр.
Аксымнар туклануда алыштыргысыз булганлыктан, галимнәр аларны
промышленность ысулы белән җитештерү юлларын табу максатында нык
тикшеренүләр алып баралар. Акрын уза торган катлаулы һәм кыйммәтле
процесслар нәтиҗәсендә ясалма рәвештә берничә төр аксым синтезлауга
ирешелде. Tepe күзәнәкләрдә бу процесслар бик тиз — берничә секунд
эчендә уза. Хәзер күп кенә аксым матдәләрне — гормоннар, ферментлар,
антибиотикларны — микроорганизмнарны үзенә бертөрле фабрика буларак
файдаланып, биотехнологик методлар белән табалар.
11—13 нче сорауларга җавап бирегез (173 нче бит).
171
§ 59. Полимерлар
Полимерлар — молекулалары күп сандагы бертөрле буыннар — по¬
лимер молекуласының состав өлешләре тоташу нәтиҗәсендә барлыкка
килгән югары молекуляр төзелешле кушылмалар.
Полиэтилен һәм полипропилен турында башлангыч мәгълүматлар белән
сез инде таныштыгыз (52 нче параграфны карагыз).
Полиэтилен (—CH2—CH2—)п — полимер (грекча «поли» — куп), ә баш¬
лангыч матдәсе (этилен) — мономер (грекча «моно» — бер). Полимерлар¬
ның молекулалары бертөрле, күп тапкыр кабатланган атомнар группа¬
ларыннан — элементар буыннардан тора. Полиэтиленда элементар
буын — (—CH2—CH2—), п — полимерлашу дәрәҗәсе, полимер молекула¬
сына берләшкән мономер молекулаларының санын күрсәтә; п никадәр зур
булса, полимерның молекуляр массасы шулкадәр зуррак була.
Югары молекуляр төзелешле кушылмаларның массасы берничә
меңнән алып миллионга кадәр җитә. Шуңа күрә полимерның бик зур
молекулаларын макромолекулалар (грекча «макрос» — зур,озын) дип
атыйлар.
Полиэтиленга охшаш полимер — поливинилхлорид. Әгәр ацетилен¬
га хлороводород кушсаң, газсыман матдә винилхлорид, яки хлорвинил
барлыкка килә:
Н—C=C-H + H-Cl * H2C=CHCl
винилхлорид
Винилхлорид этилен кебек үк полимерлаша:
H2C=CHCl + H2C=CHCl + ... * (-CH2-CH-In
Cl
поливинилхлорид
Поливинилхлоридтан химик һәм механик яктан чыдам пластмасса1
табалар, аннан төрле савытлар, суүткәргеч торбалар, электр чыбыклары өчен
изоляция материаллары, төрле пленкалар, линолеум һ. б. ны ясыйлар.
СЕЗ
БЕЛӘСЕЗМЕ?
Хәзерге вакытта полимерларның әһәмияте турында сөйләп
торуның кирәге бармы икән. Шуны гына искә төшерү дә
җитә: барча тереклек полимерлардан—полисахаридлардан
(целлюлоза, крахмал) һәм аксымнан — тере организмнар
өчен төзелеш материалыннан тора. Көндәлек тормышта
да һәр адымыбызда без төрле синтетик материаллар
белән очрашабыз.
1 Пластмассаны полимерлардан һәм төрле тутыргычлар, буяу һ. б. дан табалар.
172
Диеннар белән танышып, сез шулай ук табигый каучук һәм синтетик
каучук (52 нче параграфны карагыз) турында башлангыч белемнәр алдыгыз.
Табигый полимерлар — крахмал, целлюлоза һәм аксымнар турында да
беренче мәгълүматларны үзләштердегез.
Полимерларның бер төренең — фенопластларның гына да әһәмияте ни¬
кадәр зур булуын күзаллау өчен, 35 нче таблицаны карагыз.
Сорауларга җавап бирегез һәм 14—15 нче күнегүләрне башкарыгыз.
1. Метанол, этанол, этиленгликоль
һәм глицеринга кыскача характеристика
бирегез. Аларны кайда файдаланалар?
2. Нинди органик кушылма этанолның
гомологы булып тора?
1) CH4 3) C6H5OH
2) CH3OH 4) C2H4(OH)2
3. Этанолны кислородта яндыру нәти¬
җәсендә барлыкка килә:
1) C һәм H2O 3) CO2 һәм H2O
2) CO һәм H2O 4) C2H2 һәм H2O
4. Кырмыска, серкә, лимон кислота¬
ларына характеристика бирегез. Алар
табигатьтә кайда очрыйлар һәм аларны
ничек файдаланалар?
5. Карбон кислоталарының химик
үзлекләрен пропион кислотасы C2H5COOH
мисалында тикшерегез. Тиешле химик
реакцияләрнең тигезләмәләрен языгыз.
6. Нинди матдәләрнең үзара тәэсир
итешүе катлаулы эфирлар барлыкка ки¬
лүенә китерә? Нинди катлаулы эфирлар¬
дан хуш ис килә?
7. Нәрсә ул сабын һәм нәрсә ул май¬
лар?
8. Табигатьтә глюкоза ничек барлыкка
килә? Глюкозаны кайда файдаланалар?
9. Сахароза нинди үсемлекләрдә бар?
10. Крахмал һәм глюкоза молекула¬
ларының төзелешен тасвирлагыз. Бу
матдәләр кайда файдаланыла?
11. Аминокислоталар молекулала¬
рының төзелешен тасвирлагыз. Кеше
һәм хайваннар тереклегендә аминокис¬
лоталарның роле нинди?
12. Аминокислота молекулалары тө¬
зелешенең катлаулылыгын, аларның күп¬
төрлелеген һәм мөһим биологик ролен
тасвирлап бирегез?
13. Ферментлар дип һәм гормоннар
дип нәрсә атала?
14. Полиэтилен, полипропилен, по¬
ливинилхлорид, фенопластка кыскача
характеристика бирегез. Алар кайда кул¬
ланыла?
15. Органик химиядән сезгә билгеле
булган барлык материалга нигезләнеп,
түбәндәге схема буенча таблица төзегез:
Кушылмаларның
классы
Типик
вәкиле
Куллану
өлкәсе
1. 80 г этил спиртыннан (этил спир¬
тының масса өлеше 96%) табылган эти¬
ленның күләмен (н. ш.) исәпләп чыга¬
рыгыз.
2. 2 моль магний серкә кислотасы
белән тәэсир итешкәндә, массасы 300 г
булган эремә хасил була. Эремәдәге
магний ацетатының масса өлешен (%)
исәпләп чыгарыгыз.
3. 28,4 г стеарин кислотасын сода
белән эшкәрткәндә массасы 50 г булган
сабын эремәсе хасил була. Эремәдәге нат¬
рий стеаратының масса өлешен (%) исәп¬
ләп чыгарыгыз.
4. Аш серкәсен нейтральләштерү
өчен натрий гидроксидының 200 г 30%
лы эремәсе кирәк була. Реакциягә кергән
серкә кислотасының массасын һәм матдә
микъдарын исәпләп чыгарыгыз.
5. Реакция барышында 7,2 г глюкоза
аерылып чыгуы билгеле булса, гидролизга
дучар ителгән сахароза эремәсенең масса¬
сын (сахарозаның масса өлеше 20%)
исәпләп чыгарыгыз.
173
35 нче таблица. Иң әһәмиятле ФФС1 фенопластлар
Фенопластларга
характеристика
Фенопластларның төрләре
Текстолит
Волокнит
Гетинакс
Пыяла-пластик
Карболит
Югары темпе¬
ратурада
прессланган
башлангыч
материаллар
ФФС сең¬
дерелгән
киҗе-ма¬
мык тукы¬
ма
ФФС сең¬
дерелгән
киҗе-
мамык
тукыма
кисен¬
теләре
ФФС сең¬
дерелгән
кәгазь
ФФС сеңде¬
релгән пыяла
тукыма һәм
пыяла сүс
ФФС сең¬
дерелгән
агач оны
Үзлекләре
Авырлык
тәэсиренә
чыдам,
эшкәртүгә
җиңел
бирелә
Озакка
чыдый
(тузмый)
Бик яхшы
электр
изоля¬
цияләү
мате¬
риалы
Механик
яктан нык
материал,
коррозиягә
бирешми
Яхшы
электр
изоля¬
цияләү
материа¬
лы, корро¬
зиягә
бирешми
Кулланылышы
Машина¬
лар һәм
аппарат¬
лар де¬
тальләре
(тешле
тәгәрмәч¬
ләр, шар¬
чыклы
подшип¬
никлар)
ясыйлар
Автомо¬
бильләр
өчен
тоташтыр¬
гыч
дисклар,
тормоз
җәяләре,
эскалатор
баскыч¬
лары һ. б.
Яхшы
электр
изоляция¬
ләү мате¬
риалы
буларак
электро-
һәм
радиотех¬
никада
кулланыла
Зур үлчәмле
детальләр (авто¬
мобильләр өчен
өскорма, авто¬
цистерналар,
көймәләр һ. б.)
җитештерәләр
Телефон
аппарат¬
лары,
электр-
өзгечләр,
контакт
оялары
һ. б.
ясыйлар
1 ФФС — фенолформальдегид сумалаларны фенол һәм формальдегидны поли-
конденсатлаштыру нәтиҗәсендә табалар:
Югары температурада, охшаш бәйләнешләр ФФСның сызыкча молекулаларын
тегүе аркасында, сумаласыман матдә ката.
174
§ 60. Дарулар
Кешеләр элек-электән үлән, агач кайрысы, бал, шәрабны дару итеп
файдаланганнар. Тора-бара алар дару чималыннан шифасы тия торган
компонентларын аерып алырга өйрәнгәннәр. Кешеләр дару препаратларын
синтезлый, ягъни аларны химик реакцияләр ярдәмендә таба башлагач,
медицина яңа этапка аяк баса.
Мәсәлән, борын заманда ук инде, йогышлы авырулар һәм подаграны
дәвалау өчен, авыртуны басу һәм тән температурасын төшерү өчен, тал
кайрысының экстрактын (сыгынтысын) файдаланганнар. 1838 елда
аның актив компоненты салицил кислотасы (латинча salix — тал) булуы
ачыклана. 1860 елда бу кислотаны беренче тапкыр ясалма юл белән
табалар. Ләкин бу матдә бик әче, ул ашказанының лайлалы тышчасын
тынычсызлый һәм күңелне болгата. Химиклар, салицил кислотасына серкә
кислотасы калдыгын кушып, хәзерге көнгә кадәр киң кулланыла торган
дару — ацетилсалицил кислотасын (аспирин) табалар.
Даруларны синтезлау һәм җитештерү башлыча органик химия һәм
биотехнология казанышы булып тора. Биотехнология — ул биологик
агентлар (микроорганизмнар, күзәнәк культуралары һ. б.) ярдәмендә кеше
өчен файдалы продуктлар табу методлары һәм алымнары җыелмасы. Геннар
һәм күзәнәкләр инженериясе дә биотехнологиягә керә.
Даруларны классификацияләү. Хәзерге заман медицинасы карамагында
төрле авыруларны кисәтү һәм дәвалау өчен югары нәтиҗәле бик күп дару
препаратлары бар.
Дарулар дөньясында ориентлашуны ансатлаштыру өчен, аларны, ничек
тәэсир итүләренә һәм нинди авыруларны дәвалауларына карап, төркем¬
нәргә аералар. Даруларның ешрак файдаланыла торган төркемнәрен тик¬
шерик.
Анальгетиклар (грекча «ан» — инкарь итү, «алгос» — авырту) — авыр¬
туны баса яки киметә торган препарат. Авырту кисәтү билгесе булып тора,
һәм аның саклагыч роле организм өчен гаять мөһим. Ләкин көчле һәм
озакка сузылган авырту организмның тереклек функцияләрен — сулыш
һәм кан йөрешен бозарга мөмкин.
Анальгетикларны ике төркемгә — наркотик һәм наркотик булмаганнар-
га бүләләр.
Наркотик анальгетиклар теләсә нинди авыртуны баса, шуңа күрә
аларны нык авырту биргән җәрәхәтләнүләр һәм операция вакытында
файдаланалар. Ләкин авыртуны басудан тыш, бу препаратлар шулай
ук эйфория дә (шатлану, канәгатьлек алу тойгысын) китереп чыгара;
эйфория халәтенә тагын да керү теләге кешене наркотик белән (медицина
күрсәтмәләреннән тыш) кабат контактлар эзләргә мәҗбүр итә һәм бу
препаратка психик һәм физик бәйлелек — наркоманияне китереп чыгара.
Наркомания дәвалауга бик авыр бирелә. Наркотик анальгетикларның тагын
175
бер өстәмә тәэсире — сулыш алуны авырайтуы. Наркотик анальгетиклар¬
ның классик вәкиле — морфинны артык дозада кабул итүдән үлү сулыш
туктаудан була.
Наркотик булмаган аналъгетиклар башлыча ялкынсынуга бәйле
авыртуларны баса һәм даруга бәйлелекне булдырмый. Анальгетик
тәэсиренең көче буенча алар авыртуны баса торган наркотик чаралардан
шактый калыша. Бу препаратлар шулай ук тән температурасын төшерү
һәм ялкынсынуны дәвалау тәэсиренә дә ия. Өстәмә тәэсире башлыча кан
ясалуны киметү (анальгин, парацетамол) һәм ашкайнату трактына тәэсир
итүе (аспирин, ибупрофен, диклофенак, мелоксикам һ. б. ашказанының
лайлалы тышчасын ялкынсындыруы) белән бәйле.
Ингаляция наркозы өчен препаратлар, мәсәлән трихлорэтилен
C2H2Cl3, азот (I) оксиды N2O һәм аерым урынны авырту сызландыру
(авыртуны сизмәсләндерү) препаратлары (новокаин, анестезин) шулай
ук авырту тойгысын киметә.
Йокы дарулары. Йокы — ул физиологик тоткарлануның бер төре, бу
вакытта баш миенең гипноген (йокы өчен җаваплы) структураларының
активлыгы көчәя. Бу дарулар физиологик йокыга якын халәтне китереп
чыгара, аны тизләтә, тирәнлеген һәм вакытын нормальләштерә. Алар үзәк
нерв системасы эшчәнлеген сүлпәнләндерүче препаратларга керә, табигате
белән наркоз препаратларына якын, ләкин активлыклары түбәнрәк. Аз
дозада йокы дарулары тынычландыргыч тәэсир итә, уртача дозасы йоклата,
ә зур дозалары сулыш үзәге параличына сәбәп булырга һәм үлемгә ките¬
рергә мөмкин. Шуңа күрә күпчелек йокы даруларын табиб рецептыннан
башка сатмыйлар. Йокы дарулары — нитразепам, фенобарбитал, до¬
нор мил.
Антибиотиклар — тере күзәнәкләрнең (бактерия, гөмбә һ. б.ның)
тереклек эшчәнлеге продуктлары (яки аларның синтетик аналоглары);
алар башка күзәнәкләрнең (микроорганизмнар, төрле шеш күзәнәкләре һ. б.
ның) эшчәнлегенә сайланма тәэсир итәләр. «Антибиоз» («тереклеккә каршы
тереклек») терминын Л. Пастер тәкъдим итә, ә антибиозны тормышка
ашыручы матдәләрне антибиотиклар дип атый. Бу төркем тәэсир итү
спектры һәм механизмы белән, өстәмә тәэсире һ. б. белән бер-берсеннән
аерылып торган төрле химик структуралы дистәләгән һәм йөзләгән
препаратны үз эченә ала. Антибиотикларны бактерияләр яки гөмбәләр
кузгаткан йогышлы авыруларны һәм төрле табигатьле шеш авыруларын
дәвалау өчен кулланалар. Антибиотикларга пенициллин, тетрациклин,
амоксициллин, эритромицин һ. б. керә.
Hoompon препаратлар (грекча «ноос» — фикерләү, акыл һәм «тро-
пос» — якынлык, юнәлеш) баш мие эшчәнлеген (зиһен, фикерләү, кабул
итү) яхшырта, уң һәм сул ярымшарлар арасындагы бәйләнешне җиңеләйтә,
минең энергетик һәм башка алмашу процессларын көйли, шулай ук аның
кислород кытлыгына тотрыклылыгын арттыра, үзәк нерв системасының
176
кан белән тәэмин ителүен стимуллаштыра. Аларның күбесе көзән җыеруга
каршы активлыкка ия. Ноотроплар — пирацетам (ноотропил), аминалон,
натрий оксибутираты, фенибут һ. б. — аз токсинлы һәм озак кулланганда
гына нәтиҗәле. Аларны уку процессында үзләштерүне җиңеләйтү өчен,
оператив һәм озак вакытлы хәтерне активлаштыру, инсульт яки травма¬
дан соң баш миенең кан белән тәэмин ителешен торгызу өчен файдала¬
налар.
Аллергиягә каршы (антиаллергик) дарулар. Аллергия — ул организм¬
ның кайбер матдәләргә карата югары сизүчәнлек халәте. Аллергик реак¬
цияләр бик тиз (берничә минут эчендә) башланырга һәм сәгатьләр буена
дәвам итәргә (анафилактик шок, сыворотка авыруы, Квинке шешенүе,
поллиноз (үсемлекләр серкә очырганда була торган авыру), кычыткан
бизгәге), сәгатьләр һәм тәүлекләр буена көчәя барып, атналарга сузылырга
мөмкин (тире кычытуы, аутоиммун реакцияләр, күчереп утырткан тере
тукымаларның ялганмау реакциясе һ. б.). Аллергик реакцияләрнең
башлану сәбәбе булып организмның югары сизүчәнлек халәтен китереп
чыгаручы аллергеннар (антигеннар) исәпләнә. Аларга дару препаратлары,
кайбер азык компонентлары, үсемлек серкәләре, көнкүреш химиясе продукт¬
лары, йогышлы агентлар һ. б. керә. Билгеле бер шартларда алар организмда
антитәнчекләр барлыкка килүенә сәбәп була, ә кабат контактта антиген —
антитәнчек, үзара тәэсир итешеп, аллергик реакция китереп чыгара.
Аллергик реакцияләр башлануда төп рольне, аллергеннар керүенә җавап
итеп, организмда бүленеп чыккан гистамин уйный. Ул капиллярларны
киңәйтә һәм аларның үткәрүчәнлеген арттыра. Нәтиҗәдә әйләнештәге
канның күләмен киметә, бу исә артериаль басым төшүенә һәм аң югалтуга
китерергә мөмкин.
Аллергик авыруларны дәвалау (терапиясе) өчен аллергеннар белән
контактны булдырмаска, ә аннары антигистамин препаратлар (гистамин
аерылып чыгуын тоткарлаучы матдәләр) файдаланырга кирәк. Аларга та-
вегил, супрастин, фенкарол, диазолин, кларитин һ. б. керә. Кайчак гор¬
мональ препаратлар (мәсәлән, йөрәк эшчәнлеген стимуллаштыру өчен адре¬
налин, ялкынсынуны бетерү өчен гидрокортизон) файдаланалар. Күп кенә
антигистамин препаратлар (мәсәлән, тавегил һәм супрастин) йоклаткыч
буларак тәэсир итә, шуңа күрә аларны нык игътибар сорый торган эштә
эшләүче кешеләргә (машина йөртүчеләргә, авиадиспетчерлар һ. б. га) кабул
итәргә ярамый.
Дару препаратларын куллануга бәйле проблемалар. Соңгы вакытта
даруларның тискәре йогынтысы кискен артты. Бу берничә сәбәптән:
медицина практикасына кертеләсе даруларның җитәрлек сынау-тикшерү
узмавыннан; билгеләнгән даруларның үзара тәэсир итешеп бер-берсенә
тискәре йогынты ясавын исәпкә алмыйча, берьюлы берничә төрле препарат
билгеләүдән; һәм, ниһаять, үзеңчә дәвалану белән шөгыльләнү нәтиҗәсендә
авыруның катлаулануыннан булырга мөмкин. Табиб булу өчен никадәр
177
озак укырга кирәклеген кешеләр онытып җибәрәләр. Авыруның хәлен
һәм теге яки бу даруның каршы күрсәтмәләрен исәпкә алып, дәваны табиб
кына билгели ала. Ә каршы күрсәтмәләре һәм өстәмә тискәре тәэсире һәр
даруның бар!
Даруларны куллануның өстәмә тискәре нәтиҗәсе бүгенге көндә үлемгә
китерүче сәбәпләр исемлегендә беренче урынга чыкты. Даруларның өстәмә
тәэсире аның дозасын арттырганда да, аларны терапия дозаларында куллан¬
ганда да күренергә мөмкин.
Әлбәттә, дарудан башка дәваланып булмаган очраклар да була. Дарулар
миллионлаган кешенең гомерен саклап калды һәм яшәү сыйфатын тәэмин
итте. Әгәр кеше физик яктан актив булса, спиртлы эчемлекләр кулланмаса
һәм тәмәке тартмаса, үзенең авырлыгын контрольдә тотса, дөрес тукланса,
аның даруны мөмкин кадәр озак кулланмаска яки бик аз куллануга ыша¬
нычы шактый зур. Сәламәт булыгыз!
Лаборатор тәҗрибәләр
18. Этилен, аны табу һәм үзлекләре
1. Бер пробиркага 2—3 мл этил спирты агызыгыз һәм аңа акрын гына 6 — 9 мл
куертылган сульфат кислотасы өстәгез. Кайнаганда, сикереп чыгуны булдырмас
өчен, бер чеметем кыздырылган ком салыгыз. Пробирканы газүткәргеч көпшәле бөке
белән каплагыз һәм сак кына җылытыгыз. Температура 140 °C тан күтәрелмәскә тиеш.
Газүткәргеч көпшәне бромлы су салынган икенче пробиркага төшерегез.
Күзәтү. Аерылып чыккан газ, бромлы су аша үтеп, аны төссезләндерә.
2. Өченче пробиркага калий перманганатының нык сыегайтылган ачык-шәмәхә
төстәге эремәсен, бер тамчы сульфат кислотасы эремәсе өстәп, 1—2 мл агызыгыз һәм
аның аша табылган этиленны уздырыгыз.
Күзәтү. Калий перманганаты эремәсе төссезләнә.
3. Бу тәҗрибәләрне эшләп бетергәч, янып торган шырпыны газүткәргеч көпшә
очына китерегез.
Күзәтү. Этилен яна башлый һәм, метанга караганда, яктырак ялкын белән яна.
Биремнәр. 1. Этил спирты һәм куертылган сульфат кислотасы катнашмасын
җылытканда нинди газ чыга? 2. Моны нинди тәҗрибәләр дәлилли? 3. Тиешле реак¬
цияләрнең тигезләмәләрен языгыз. 4. Ни өчен этиленның ялкыны метанныкына
караганда яктырак? 5. Этиленның үзлекләренә карата нинди гомуми нәтиҗә ясарга
мөмкин?
19. Ацетилен, аны табу һәм үзлекләре
1. Пробиркага берничә кисәк кальций карбиды салыгыз һәм аңа 1 —2 мл су агызы¬
гыз. Пробирканы газүткәргеч көпшәле бөке белән каплагыз.
Күзәтү. Көчле реакция башланып, газ аерылып чыга.
2. Газүткәргеч көпшәне 2 —3 мл бромлы су салынган икенче пробирканың төбенә
кадәр төшерегез.
Күзәтү. Бромлы су акрынлап төссезләнә.
178
3. Аннары барлыкка килгән газны калий перманганатының нык сыегайтылган
2—3 мл эремәсе аша уздырыгыз.
Күзәтү. Эремә акрынлап төссезләнә.
4. Бу тәҗрибәләрне эшләп бетергәч, көпшәләрдән чыккан газны кабызыгыз.
Күзәтү. Газ бик корымлап яна.
5. Ялкынга һава өрдерегез.
Күзәтү. Газ яктырып яна башлый, корымламый.
Биремнәр. 1. Ни өчен ацетилен бромлы су һәм калий перманганатын төссез¬
ләндерә? 2. Ни өчен ацетилен бик корымлап яна? 3. Ни өчен ацетилен ялкынына
һава өрдергәндә корым барлыкка килми? 4. Тиешле реакцияләрнең тигезләмәләрен
языгыз.
180
Кушымта
ТОЗЛАР, КИСЛОТАЛАР ҺӘМ НИГЕЗЛӘРНЕҢ СУДА ЭРҮЧӘНЛЕГЕ
Ионнар
H+
NHl
K+
Na+
Ag+
Ba2+
Ca2+
Mg2+
Zn2+
Cu2+
Pb2+
Fe2+
Fe3+
Al3+
он-
Э
э
Э
—
Э
A
A
Ю
Ю
A
Ю
Ю
Ю
NO3
Э
э
э
э
э
Э
Э
Э
э
э
Э
Э
Э
э
СГ
Э
э
э
э
ю
Э
Э
Э
э
э
A
Э
Э
э
I-
Э
э
э
э
ю
э
Э
Э
э
—
A
э
—
э
S2-
Э
э
э
э
ю
э
—
—
ю
ю
Ю
ю
ю
—
so*-
Э
э
э
э
A
A
A
э
A
—
Ю
A
—
—
sol
э
э
э
э
A
Ю
A
э
Э
э
A
Э
э
э
CO*
э
э
э
э
A
Ю
Ю
A
A
—
Ю
Ю
—
—
SiO*'
ю
—
э
э
—
Ю
Ю
Ю
Ю
—
Ю
Ю
—
—
РОГ
э
—
э
э
ю
Ю
Ю
Ю
Ю
ю
Ю
Ю
ю
ю
HCO3
э
—
э
э
—
Э
Э
Э
—
—
—
—
—
—
H2PO4
э
э
э
э
э
Э
Э
Э
э
э
—
—
—
—
Э — эрүчән (100 г суда 1 г нан артыграк)
A — аз эрүчән (100 г суда 0,001 дән алып 1 г га кадәр)
Ю — эремәүчән (100 г суда 0,001 г нан кимрәк)
«-» — суда таркалучан яки андый кушылма бөтенләй юк
КҮРСӘТКЕЧ1
Авогадро A. 1,154
Адреналин II, 177
Адсорбция II, 81
Азот II, 44—47, 65
Азотлы ашламалар II, 49
Акрын оксидлашу I, 63
Аксымнар II, 171
Акцептор II, 9
Аллергия II, 176
Алитирлау, алюминлау II, 128
Алкадиеннар II, 159
Алканнар II, 155
Алкеннар II, 157
Алкиннар II, 157
Аллотропия(се) II, 27
кислородның — II, 27
күкертнең — II, 29
углеродның — II, 79, 80
Алмаз II, 80
Алюминий II 125
Алюминий гидроксиды II, 129
Алюминий оксиды II, 128
Алюминотермия II, 106
Алюмосиликатлар II, 96
Алюминий амальгамасы II, 127
Аминалон II, 177
Аминокислоталар II, 170
алыштыргысыз — II, 171
Аммиак I, 76, II, 47—50
Аммиаклы су (аммоний гидроксиды)
II, 48
Аммоний гидроксиды (нашатырь
спирты) II, 50
Амоксициллин II, 176
Амфотер оксидлар һәм гидроксид-
лар I, 117
Анальгетик лар II, 175
наркотик — II, 175
наркотик булмаган — II, 176
Анальгин II, 176
Антибиотиклар II, 176
Антифризлар II, 165
Аспирин II, 176
Аргон I, 61
Ареннар II, 160
Аррениус С. А. II, 8
Атом I, 15, II, 8
Атомның масса берәмлеге I, 21
Ацетилен (этин) II, 157
Бакыр купоросы II, 37
Бәрәңге оны II, 169
Бекетов H. H. I, 103
Беккерель A. A. I, 128
Бензин II, 161
Бензол II, 160
1 Күрсәткечтә I цифры 8 нче сыйныф өчен дәреслек булуын аңлата (Рудзи-
тис Г. E., Фельдман Ф. Г. Химия: неорганик химия: Татар урта гомуми белем бирү
мәкт. 8 нче с-фы өчен д-лек. Русча 11 нче яңартылган басмадан тәрҗемә.— Казан:
Мәгариф, 2008); II цифры — 9 нчы сыйныф дәреслеге.
181
Бертолле К.-Л. II, 40
Берцелиус Й. Я. I, 23
Бетон II, 99
Биотехнология II, 175
Бойль P. I, 20
Боксит II, 127
Буссенго Ж. Б. II, 59
Бутлеров А. М. II, 149, 151
Вазелин II, 156
Валентлык I, 32, 148
Вёлер Ф. II, 149
Винилхлорид (хлорвинил) II, 172
Водород I, 71—76
Водород пероксиды I, 54, II, 117,135
Газның моляр күләме I, 153
Газның тыгызлыгы I, 155
Газогенератор II, 83
Галогеннар I, 157
Гелий I, 61
Генератор газы II, 83
Генетик бәйләнеш I, 110
Гидратация II, 6
Гидратлар I, 78, II, 6
Гидрокарбонатлар II,87
Гидрокортизон II, 177
Гидролиз(ы)
аксымнар — II, 171
крахмал — II, 169
тозлар — II, 20
Гидросульфатлар II, 37
Гидросульфидлар II, 32
Гидросульфитлар II, 33
Гипохлорит кислотасы II, 122
Гипс II, 123
Глаубер тозы II, 37
Глицерин II, 165
Глюкоза II, 168
Гомологлар II, 15
Гомологик аерма II, 155
Гомологик рәт II, 155
Гормоннар II, 171
Графит II, 80
Дальтон Дж. I, 22
Данилевский А. Я. II, 171
Демокрит I, 13
Десорбция II, 81
Диазолин II, 177
Диклофенак II, 176
Дистилляция I, 10
Домна миче II, 140
Донор II, 9
Донорлы-акцепторлы механизм II,
9,49
Дюралюминий II, 111, 128
Закон(ы)
Авогадро — I, 153
матдәләрнең массасы саклану —
I, 38
периодик — I, 121, 132
состав даимилеге — I, 26
Ибупрофен II, 176
Известь сөте II, 122
Известьле су II, 122
Изомерия II, 151
Изомерлар II, 151
Изопрен II, 159
Изотоплар I, 127
Ингибиторлар I, 167
Индекс I, 28
Индикаторлар I, 96
Интерметаллик кушылмалар (метал-
лидлар) II, Ill
Ионлашу энергиясе II, 108
Ионнар I, 144
Йөзмә I, 78
182
Каблуков И. А. II, 6
Кавендиш Г. I, 72
Кайтаргыч I, 150
Кайтарылу I, 74, 150
Калий II, 66
Кальций II, 119—120
Кальций гидроксиды II, 121
Кальций оксиды II, 121
Катлаулы эфирлар II, 168
Катнашмалар I, 7
Кекуле Ф. A. II, 149
Керамика II, 96
Керосин II, 161
Кислород I, 53—59, II, 25—26
Кислота(сы) I, 86, 100, II, 10
кузгалак — II, 165
нитрат — II, 53—56
силикат — II, 94
лимон — (өч нигезле оксикар-
бон —) II, 165
кырмыска — II, 165
ортофосфат — II, 63
пальмитин — II, 165
серкә — II, 165
стеарин — II, 165
сульфат — II, 35
сульфит — II, 33
сульфид (сероводород) — II, 32
сөт — II, 165
хлорид — I, 166
Кистяковский В. А. II, 7
Кларитин II, 176
Кокс II, 162
Кокслау II, 162
Кокс газы II, 155, 162
Колошник II, 140
Конденсатлашу I, 171
Корунд II, 127
Корылай куу (сублимация) I, 171
Корыч II, 138
Корычлар(ның)
— кыздырганда уалучанлыгы II,
142
— суыкта уалучанлыгы II, 142
Корыч җитештерү
— Мартен ысулы II, 144
— дугалы ысул II, 145
— кислородлы-конвертор ысулы II,
143
Коэффициентлар I, 24
Крахмал II, 169
Кремний II, 76, 91—92
Кремний (IV) оксиды II, 92
Криптон I, 61
Кристаллизацион су I, 109, II, 7
Кристаллик челтәр I, 146
атомлы — I, 147
ионлы — I, 146
металлик — II, 104
молекуляр — I, 147
Ксенон I, 61
Купер А. II, 149
Курнаков H. С. II, Ill
Күкерт II, 25, 28—30
Күкерт (IV) оксиды II, 34
Кыр шпаты II, 127
Лавуазье А. I, 63
Легирланган корыч II, 138
Ле Шателье принцибы II, 41
Либих Ю. II, 66
Лигнин II, 170
Ломоносов М. В. I, 14
Магний II, 119
Мазут II, 161
Майлар II, 168
Макромолекулалар II, 172
Масса саны I, 127
183
Матдәләр
аморф — 1,146
гади — I, 18, 21
ионлы төзелешле — 1,145
катлаулы — I, 18, 21
кристаллик төзелешле — 1,146
минераль — II, 148
молекуляр төзелешле — I, 15
органик — II, 148
саф — I, 8
Матдәләрнең үзлеге I, 5
Мелоксикам II, 176
Менделеев Д. И. I, 119, 137
Металлар(ның) I, 115, II, 103—Ill
авыр — II, 107
җиңел — II, 107
селтеле — II, 114
— периодик таблицада урыны II,
103
— табу ысуллары II, 105
— физик үзлекләре II, 106
— химик үзлекләре II, 107
Металл гидридлары I, 76
Металларның электрохимик көчә¬
нешләр рәте (стандарт электродлар
потенциаллары рәте) II, 108
Металлургия II, 138
кара — II, 138
төсле — II, 138
Метан (шахта, яки саз, газы) II,
154
Метанол (метил, яки агач, спирты)
II, 164
Минераль ашламалар II, 66
Молекула I, 15
поляр — I, 144
Молекуланың химик төзелеше II,
149
Моль I, 42
Моляр масса I, 42
Мономер II, 172
Морфин II, 176
Наркоз өчен препаратлар II, 176
Наркомания II, 175
Нейтроннар I, 127
Неметалл ар I, 115
Нефелин II, 127
Нефть II, 161
Неэлектролитлар II, 5
Нигезләр I, 86, 93, II, 10
Нитратлар II, 56
Нитридлар II, 46
Ноотроп препаратлар II, 176
Оксидлашу I, 74, 150
Оксидлаштыргыч 1,150
Оксидлар(ы) I, 57, 89
нигез — I, 90
кислота — I, 90
селте — II, 117
Оксидлашу дәрәҗәсе I, 151
Олеум II, 35
Орбиталь I, 132
Ортофосфатлар II, 63
Парафин II, 156
Парацетамол II, 176
Парландыру II, 140
Пенициллин II, 176
Периодик таблица 1,124
Пероксидлар(ы)
селтеле металлар — II, 117
Пирацетам (ноотропил) II, 177
Поливинилхлорид II, 172
Полимерлар II, 172
Полимерлашу дәрәҗәсе II, 172
Полимерның элементар буыны II,
172
Портландцемент I, 98
184
Протоннар I, 127
Пруст Ж. Л. I, 27
Пыяла II, 96
Пыяла-пластиклар II, 98
Радиоактивлык I, 126
Реакцияләр(е)
алмаштыру — II, 155
алмашу — I, 95
гидратация — II, 164
ионнар алмашу — II, 15
кире — II, 41
кушылу — II, 158
нейтральләшү — I, 96
оксидлашу-кайтарылу — I, 149,
II, 18
химик — I, II, 41
чылбыр — I, 162
экзотермик — I, 64
эндотермик — I, 64
Регенераторлар II, 141,144
Резерфорд Э. I, 126
Сахароза II, 169
Селитралар II, 56
Сероводород I, 75, II, 31
Селтеле металларның гидроксидлары
II, 117
Сидерит II, 132
Силикат җилем II, 96
Силикатлар II, 95
Силуминнар II, 128
Склодовская-Кюри М. 1,129
Спиртлар II, 164
бер атомлы чикле — II, 162
күп атомлы — II, 164
Спин I, 132
Структур формула II, 150
Cy I, 82—86
Сульфатлар II, 37
Сульфидлар II, 32
Сульфитлар II, 33
Суның катылыгы
— гомуми II, 124
— карбонатлы (вакытлы) II, 123
— карбонатсыз (даими) II, 124
Суның диэлектрик үткәрүчәнлеге
П,4
Супрастин II, 177
Суспензия I, 78
Сүндерелгән известь II, 121
Сыйфат реакцияләре II, 157
икеле һәм өчле бәйләнешләргә —
II, 157
Табигый газ II, 161
Ташкүмер II, 162
Теория(се)
органик кушылмаларның төзеле¬
ше — II, 150—151
Термит II, 128
Термохимик тигезләмәләр I, 65
Тетрациклин II, 176
Тимер II, 66, 132
Тимер-бетон II, 99
Тимер гидрокарбонаты II, 132
Тозлар(ы) I, 106, II, 11
алюминий — II, 129
аммоний — II, 50
әче — I, 106
икеле — II, 107
нигез — I, 107
урта — I, 106
Төш корылмасы 1,131
Төш реакцияләре I, 126
Углеводородлар (ы) II, 154
ароматик — II, 160
ацетилен рәте — II, 157
диен — II, 159
185
чикле (туендырылган) — II, 155
чиксез (туендырылмаган) — II,
156
циклик — II, 159
этилен рәте — (алкеннар) II, 157
Углеводлар II, 168
Углерод II, 76—82
Углерод (II) оксиды (ис газы) II, 82
Углерод (IV) оксиды (углекислый
газ) II, 84
Фарфор II, 96
Фаянс II, 96
Фенибут II, 177
Фенкарол II, 177
Ферментлар II, 171
Флотация II, 29
Флюслар (плавни) II, 140
Фосфидлар II, 61
Фосфин II, 62
Фосфор II, 44, 60—62, 65
Фосфор (V) оксиды II, 61, 63
Франкленд Э. I, 33, II, 149
Фреоннар II, 156
Фруктоза II, 168
Химик бәйләнеш
— берле II, 150
— л-бәйләнеш 1,143
— а-бәйләнеш I, 143
— ионлы 1,145
— икеле II, 150
— ковалент 1,142
— поляр ковалент I, 142
— металлик II, 104
— өчле II, 150
Химик реакциянең җылылык эф¬
фекты I, 65
Химик реакциянең тизлеге II, 39
Химик тигезләмәләр I, 39
Химик тигезләнеш II, 41
Химик элемент I, 20, 128
Химия I, 6
органик — II, 148
Хлор I, 158—163
Хлороводород I, 75, 165
Хлорлы известь II, 122
Хроматография I, 10
һава I, 60
Целлюлоза (клетчатка) II, 170
Цемент II, 98
Цементит II, 111
Циклопарафиннар II, 159
Чагыштырма атом массасы I, 22
Чагыштырма молекуляр масса II, 29
Чуен II, 138
Шахта II, 140
Шлаклар II, 140
Шлаклы бетон II, 99
Шихта II, 139
Электролитик диссоциация II, 5
Электролитлар II, 5, 13
Электроннар(ы)I, 125
валентлык — I, 131
Электртискәрелек I, 140
Элементның тәртип (атом) номеры
1,128
Эмульсия I, 78
Энергетик дәрәҗә I, 129
Эремәләр I, 78
каты — II, Ill
куертылган — I, 80
186
сыегайтылган — I, 80
туендырылган — I, 79
туендырылмаган — I, 79
Эретмәләр II, 110
Эритромицин II, 176
Эрү II, 6
Эрүчәнлек I, 79
Этанол (этил спирты, яки шәраб
спирты) II, 164
Этилен (этен) II, 157
Этиленгликоль II, 165
Ягулыкны газлаштыру II, 83
Яну I, 57, 62
МӘСЬӘЛӘЛӘРГӘ ҖАВАПЛАР
I бүлек
§ 3. 1. 480 г CuS. 2. 2 моль КОН.
§ 6. 1. 16 г Cu; 38 г FeSO4. 2. 0,61 г Cu(OH)2. 3. 642,4 г Na2CO3.
II бүлек
§ 10. 1. P9S5. 2. 10,4 кДж.
§ 12. 1. 21,6 г CuS. 2. 458 л H9S.
§ 13. 1. а) 3,36 м3; б) 9750 м3.“2. 122,5 г.
III бүлек
§ 18. 1. 2,76 г NH3; 3,63 л NH3. 2. 1400 м3; 1,0625 т.
§ 20. 1. 8888,89 м3. 2. 54,11 г KNO3. 3. 31,5%.
§ 23. 1. 15,68 т. 2. 3,15% 3. 1800 г. 4. 38,75 г.
IV бүлек
§ 29. 1. 100 800 м3. 2. 572 г. 3. 154,2 г. 4. 0,1001 (10,01%). 5. 0,8329
(83,29%) Na9CO3 һәм 0,1671 (16,71%) NaHCO3.'
§ 33. 1. 3,75 кг. 2. 221,76 кг Na9CO3, 209,205 кг CaCO3 һәм 753,14 кг
SiO9.
V бүлек
§ 38. 1. 49,6% Cu, 50,4% Zn. 2. 1,9 л H2; -0,17 г H9. 3. 355,51 г PbO һәм
215,71 г SnO9. 4. 50,7% Cu, 49,3% Al.
VI бүлек
§ 39. 1. 160 г. 2. 1,2%. 3. 75,43 г KHCO3. 4. 1: 9.
§ 41. 1. 20%. 2. 40; кальций. 3. 1,48 г Ca(OH)9; 0,07%. 4. 88,81 г Na2CO3.
§ 42. 1. 9 г. 2. 18% Al һәм 82% Cu. 3. 10 мл?
VII бүлек
§ 44. 1. 3,069 т. 2. 82,86%. 3. 0,01 г С; 5%. 4. 0,36 моль.
VIII бүлек
§ 47. 1. 65,17% Кеһәм 4,67% Si. 2. 930 кДж. 3. 403 200 м3. 4. 66,32 т.
5. 2,854 т. 6. 0,545%.
IX бүлек
§ 54. 1. 282 дм3 O2; 1410 дм3 һава. 2. 227 г. 3. 44,8 л C9H2.
§ 59. 1. 37,4 л C9H4. 2. 94,6% (CH3COO)2Mg. 3. 61,2% натрий стеараты.
4. 90 г; 1,5 моль CH3COOH. 5. 68,5 г.
188
ЭЧТӘЛЕК
I бүлек. Электролитик диссоциация
§ 1. Электролитик диссоциация процессының асылы 3
§ 2. Кислоталар, селтеләр һәм тозлар диссоциациясе 9
§ 3. Көчсез һәм көчле электролитлар. Диссоциация дәрәҗәсе 11
§ 4. Ионнар алмашу реакцияләре 14
§ 5. Оксидлашу-кайтарылу реакцияләре 17
§ 6. Тозлар гидролизы 20
Лаборатор тәҗрибәләр 23
1 нче практик эш 24
II бүлек. Кислород һәм күкерт
§ 7. Химик элементларның периодик таблицасында кислород һәм
күкертнең урыны, ал арның атом төзелеше 25
§ 8. Гади матдәләрнең төзелеше. Аллотропия 26
§ 9. Күкерт. Аллотропия. Физик үзлекләре 28
§ 10. Күкертнең химик үзлекләре. Күкертнең кулланылышы 30
§11. Сероводород. Сульфидлар 31
§ 12. Күкерт (IV) оксиды. Сульфит кислотасы 33
§13. Күкерт (VI) оксиды. Сульфат кислотасы 34
§ 14. Химик реакцияләрнең тизлеге һәм аның реакцияләрнең узу
шартларына бәйлелеге. Химик тигезләнеш 39
Лаборатор тәҗрибәләр 42
2 нче практик эш 43
III бүлек. Азот һәм фосфор
§15. Химик элементларның периодик таблицасында азот һәм
фосфорның урыны, ал арның атом төзелеше 44
§16. Азот. Азотның физик һәм химик үзлекләре 45
§17. Аммиак 47
§ 18. Аммоний тозлары 50
§19. Нитрат кислотасы 53
§20. Нитрат кислотасының тозлары 56
§21. Фосфор 60
§22. Фосфор (V) оксиды. Ортофосфат кислотасы. Ортофосфатлар .... 63
§23. Минераль ашламалар 65
Лаборатор тәҗрибәләр 71
189
3 нче практик эш 72
4 нче практик эш 73
IV бүлек. Углерод һәм кремний
§ 24. Химик элементларның периодик таблицасында углерод һәм
кремнийның урыны, аларның атом төзелеше 76
§ 25. Углерод /7
§ 26. Углерод (II) оксиды 82
§ 27. Углерод (IV) оксиды 84
§ 28. Карбонат кислотасы һәм аның тозлары 87
§ 29. Табигатьтә углерод әйләнеше 89
§ 30. Кремний һәм аның үзлекләре 91
§31. Кремний (IV) оксиды 92
§ 32. Силикат кислотасы һәм аның тозлары 94
§ 33. Силикат промышленносте 96
Лаборатор тәҗрибәләр 101
5 нче практик эш 102
V бүлек. Металларның гомуми үзлекләре
§ 34. Периодик таблицада металларның урыны һәм аларның атом
төзелешенең үзенчәлекләре 103
§35. Металларның табигатьтә очравы һәм ал арны табуның гомуми
ысуллары 104
§ 36. Металларның физик үзлекләре 106
§ 37. Металларның характерлы химик үзлекләре 107
§ 38. Эретмәләр 110
Лаборатор тәҗрибәләр 113
VI бүлек. Химик элементларның Д. И. Менделеев периодик
таблицасында IA-ША-төркемнәр металлары
§ 39. Селтеле металларның характеристикасы 114
§ 40. Химик элементларның периодик таблицасында магний һәм
кальцийның урыны, аларның атом төзелеше 119
§41. Кальций һәм аның кушылмалары 120
§ 42. Алюминий 126
Лаборатор тәҗрибәләр 131
6 нчы практик эш 131
VII бүлек. Тимер
§ 43. Химик элементларның периодик таблицасында тимернең урыны
һәм аның атом төзелеше. Тимернең үзлекләре 132
§ 44. Тимернең кушылмалары 134
190
Лаборатор тәҗрибәләр 136
7 нче практик эш 136
VIII бүлек. Металлургия
§ 45. Металлургия турында төшенчә. Хәзерге заман техникасында
металлар 138
§ 46. Чуен җитештерү 139
§47. Корыч җитештерү 142
IX бүлек. Иң әһәмиятле органик матдәләргә кыскача күзәтү
§ 48. Органик химия 148
§ 49. А. М. Бутлеровның органик кушылмаларның төзелеше
теориясенең төп положениеләре 150
§ 50. Органик кушылмаларның гадиләштерелгән классификациясе . . . 152
Углеводородлар 154
§51. Чикле (туендырылган) углеводородлар 154
§ 52. Чиксез (туендырылмаган) углеводородлар 156
§ 53. Циклик углеводородлар 159
§ 54. Углеводородларның табигый чыганаклары 161
Углеводородларның кушылмалары 164
§ 55. Спиртлар 164
§ 56. Карбон кислоталары. Катлаулы эфирлар. Майлар 165
§ 57. Углеводлар 168
§ 58. Аминокислоталар. Аксымнар 170
§ 59. Полимерлар 172
§ 60. Дарулар 175
Лаборатор тәҗрибәләр 178
Кушымта 180
Күрсәткеч 181
Мәсьәләләргә җаваплар 188
Учебное издание
Рудзитис Гунтис Екабович
Фельдман Фриц Генрихович
ХИМИЯ
Неорганическая химия
Органическая химия
Учебник для 9 класса татарской средней
общеобразовательной школы
Казань. Издательство «Магариф». 2009
Перевод с русского на татарский язык
Уку-укыту басмасы
Рудзитис Гунтис Екабович
Фельдман Фриц Генрихович
ХИМИЯ
Неорганик химия
Органик химия
Татар урта гомуми белем бирү мәктәбенең
9 нчы сыйныфы өчен дәреслек
Редакция мөдире Л. X. Мөхәммэтҗанова
Редакторы Р. 3. Закирова
Корректоры С. 3. Гыймалетдинова
Компьютерда биткә салучысы Г. Р. Галимҗанова
Рәсемнәрне компьютерда эшкәртүчесе Э. Ф. Нурмөхэммэтова,
Г. Р. Галимҗанова, Л. Р. Вафина
Оригинал-макеттан басарга кул куелды 29.07.2009.
Форматы TOxgO1Zie. Офсет кәгазе. «Школьная» гарнитурасы.
Офсет басма. Шартлы басма табагы 14,04+ форз.0,29.
Нәшер-хисап табагы 11,69 + форз.0,46. Тиражы 5 300 д. Заказ В-1049.
«Мәгариф» нәшрияты. 420059. Казан, Оренбург тракты, 20а.
Тел./факс (843) 277-52-62; 277-52-88.
E-mail: magarif@mail.ru
http://www.magarif.com
«Идел-Пресс» полиграфия-нәшрият комплексы» ААҖ.
420066. Казан, Декабристлар урамы, 2.
КИСЛОТАЛАР, НИГЕЗЛӘР ҺӘМ <ЮЗЛАРЧЫҢ СУДА ЭРҮЧӘНЛЕГЕ
'^\Катион
Анион4^^
H+
nh4+
Na+
K+
Be2+
Mg2+
Ca2+
Ba2+
Al3+
Sn2+
Pb**
'1
Cu2*
Ag+
Zn2+
Cd2
Hgi
Cr2+
Cr3+
Mn +
Fe2+
Fe3+
Co2+
Ni2+
OH
—
—
Э
э
Ю
Ю
A
Э
ю
Ю
ю
Ю
—
Ю
ю
—
Ю
Ю
Ю
Ю
Ю
Ю
ю
F'
э
э
Э
э
э
Ю
Ю
A
A
Э
ю
Ю
э
Э
э
—
Ю
Э
Ю
Ю
Э
Э
э
сг
э
э
Э
э
э
Э
Э
Э
Э
э
A
э
ю
э
э
э
Э
э
Э
Э
Э
Э
э
Br'
э
э
э
э
э
э
Э
Э
э
э
A
э
ю
э
э
A
Э
э
Э
Э
Э
э
э
I
э
э
э
э
э
э
э
Э
э
э
ю
—
ю
э
э
Ю
Э
э
э
Э
э
э
э
S2
э
—
э
э
—
‘ -
ю
э
—
ю
ю
ю
ю
ю
ю
Ю
—
—
ю
Ю
—
ю
ю
NO3
э
э
э
э
э
э
э
э
э
—
э
э
э
э
э
э
э
э
э
Э
э
э
э
SO3
э
э
э
э
ю
ю
ю
ю
—
—
ю
ю
аЮ
A
ю
ю
—
—
ю
Ю
—
ю
ю
SO2
э
э
э
э
э
э
A
ю
э
э
ю
э
A
Э
э
э
э
э
э
Э
э
э
э
PO43
э
э
э
э
ю
ю
Ю
ю
ю
ю
ю
ю
Ю
ю
ю
ю
ю
ю
ю
Ю
ю
ю
ю
со32\
э
э
э
э
—
—
ю
ю
—
—
ю
—
ю
ю
ю
—
—
—
ю
Ю
—
ю
ю
SiO32
ю
—
э
э
—
—
ю
ю
—
—
ю
—
ю
ю
ю
—
ю
—
ю
Ю
—
ю
ю
CH3COO'
э
э
э
э
э
э
э
э
э
э
э
э
э
э
э
э
ю
ю
э
Э
э
э
э
O -эрүчән
___J (100 г суда Ir нан артык);
A
-аз эрүчән
(100 г суда 0,1 г нан 1 г га кадәр
I;
ю
-эремәүчән
_ (100 г суда 0,1 г нан ким);
—
-матдә суда таркала
_ яки бөтенләй булмый
МЕТАЛЛАРНЫҢ ЭЛЕКТРОХИМИК КӨЧӘНЕШЛӘР РӘТЕ
Кайтару сәләте ◄
Li
K
Ba
Ca
Na
La
Mg
Al
Mn
Zn
Cr
-3,04
-2,92
-2,90
-2,87
-2,71
-2,52
-2,36
-1,66
-1,18
-0,76
-0,74
Li+
K+
Ba2+
Ca2+
Na+
La3+
Mg2+
Al3+
Mn2+
Zn2+
Cr3+
Fe
Cd
Co
Ni
Sn
Pb
H2
Cu
Ag
Hg
Au
-0,44
-0,40
-0,28
-0,26
-0,14
-0,13
0,00
+0,34
+0,80
+0,85
+1,52
Fe2*
Cd2+
Co2+
Ni2+
Sn2+
Pb2+
H+
Cu2+
Ag+
Hg2+
Au3+
Оксидлаштыру сәләте
ISBN 978-5-7761-2021-3
785776"!202 13